👍 2566 ปีทองแห่งการท่องเที่ยวจังหวัดเพชรบูรณ์
ปี 2566 นี้ ถือว่าเป็นปีทองแห่งการท่องเที่ยวจังหวัดเพชรบูรณ์ ได้อย่างสมบูรณ์ จากข่า่วดีด้านการท่องเที่ยวและวัฒนธรรม ที่จ.เพชรบูรณ์ได้รับแบบรัวๆ ที่ใหญ่ระดับโลกเลย คือ 1. การได้รับการประกาศเป็นมรดกโลก ของ ศรีเทพเมืองมรดกโลก ตามด้วย 2. หอโบราณคดีเพ็ชรบูรณ์อินทราชัย Hall of fame อุตสาหกรรมท่องเที่ยวไทยมาตราฐานสากล จาก ททท. 3.น้ำตกตาดใหญ่ ได้รับการโหวตเป็น แหล่งท่องเที่ยวใหม่ Unseen New Chapter อันดับ 1 ภาคเหนือ อันดับ 2 ของเมืองไทย เมื่อใครได้มาเห็นน้ำตกแห่งนี้ ต้องบอกเลยว่าสมศักดิ์ศรี เป็นที่สุด และปิดท้าย ด้วย 4.อุทยานแห่งชาติน้ำหนาว ได้รับรางวัล อุทยานมรดกอาเซียน Asean Heritage Park
ทั้ง 4 รางวัล คือสุดยอดแห่งความภูมิใจของชาวจังหวัดเพชรบูรณ์ และคนไทยทุกคน ขอสดุดีทุกคนทุกหน่วยงานทุกภาคส่วน ที่ขับเคลื่อนผลักดัน หนุนเนื่องให้เกิดความสำเร็จเหล่านี้ขึ้นได้ ไม่เพียงแต่ระดับประเทศ แต่เป็นระดับนานาชาติและระดับโลก ขอขอบคุณด้วยใจจริง
👍 แนะนำการไปเที่ยว "ภูลมโล" ชมนางพญาเสือโคร่ง
เที่ยว "ภูลมโล" ชมนางพญาเสือโคร่ง เดินทางยังไง!
1.ข้อมูลเดินทางเข้าพื้นที่ชุมชนกกสะทอน เพื่อเตรียมขึ้นภูลมโล ชมนางพญาเสือโคร่ง ที่ "ภูลมโล" / พิกัด GPS ที่ตั้งชมรมท่องเที่ยวกกสะทอน (ข้าง อบต.กกสะทอน) โทร 062-5570912 ติดตาม
เพจชมรมท่องเที่ยวกกสะทอน
4.
ข้อมูลเดินทางโดยรถสารประจำทาง👍 4 จุดเช็คอินทะเลหมอกเบตง
4 จุดเช็คอินทะเลหมอกเบตง เมื่อมาเบตงต้องไปชม ❤️ ทะเลหมอกอัยเยอร์เวง ทะเลหมอกฆูนุงซีลีปัต ทะเลหมอกจาเราะกางา ทะเลหมอกกาแป๊ะฮูลู อากาศดีเย็นสบาย ดูหมอกได้ทั้งปี (
ททท.นราธิวาส)
👍 พิกัดเที่ยวอุทยานแห่งชาติ 3 จังหวัดภาคใต้
พิกัดเที่ยวอุทยานแห่งชาติ 3 จังหวัดภาคใต้ ชวนเพื่อนๆ ออกเดินทางไปโอบหมอก กอดป่า เที่ยวทะเล
👍 มาสุพรรณ เที่ยวไหนดี คำถามนี้ตอบง่าย
คำถามนี้ตอบง่าย เพราะสุพรรณมีที่น่าเที่ยวเยอะ ได้แก่ วัดเขาทำเทียม เขื่อนกระเสียว อ่างเก็บน้ำลำตะเพิน หอคอยบรรหารแจ่มใส หมู่บ้านอนุรักษ์ควายไทย อุทยานแห่งชาติพุเตย (ชมหมอก เดินป่า) บึงฉวาก พิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี
👍 ถนนคนเดิน ตลาดกลางคืน ร้านเด็ดคาเฟ่เด่นใน ปทุมธานี
รู้กันดีว่าปทุมธานีคึกคักสนุกสนานตลอดปี ปทุมฯคนเยอะเลยมีกิจกรรมเยอะไม่เหงาเรย
- เทศบาลนครรังสิต ขอเชิญชวนเที่ยวงาน..."เดิน กิน ชิม เที่ยว" ถนนคนเดินรังสิต Walking Street @Rangsit ช้อปสินค้าหลากหลาย ของกินมากมาย ฟังเพลงชิวชิว...กับวงดนตรี วันที่ 30 - 31 สิงหาคม 2567 และ วันที่ 1 - 3 กันยายน 2567 ตั้งแต่เวลา 17.00 - 23.00 น. ณ บริเวณริมเขื่อนหน้าโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร
- งาน "BIZ CLUB FAIR ครั้งที่9" 16 - 25 ส.ค. 67 ลานโปรโมชั่น ชั้น 2 ศูนย์การค้าเซียร์ รังสิต มีครบจบทีเดียว ทั้งชิม ช้อป เดินเล่น จากผู้ประกอบการกว่า 90 บูธ มีโซนมากมายให้ท่านเดินชม ไม่ว่าจะเป็นโซนของกิน โซนสมุนไพรสุขภาพและความงาม โซนเสื้อผ้า โซนเครื่องประดับ โซนสินค้าเกษตร โซนของตกแต่ง จัดกันไปเต็มๆ 10 วันจุกๆ กิจกรรมภายในงาน การแสดงดนตรี คูปองส่วนลด กิจกรรมชิงโชคลุ้นรับของรางวัล
- ตลาดนัดสีเขียว ปิ่นฟ้าฟาร์ม ในวันที่ 10 - 12 สิงหาคม 2567 ณ ปิ่นฟ้าฟาร์ม อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี บรรยากาศร่มรื่น ของกินเนืองแน่น ต้นไม้หลากหลาย
- งานตลาดเศรษฐกิจพอเพียง “รสมือแม่ รสเด็ดเจ็ดย่านน้ำ” 3 – 4 สิงหาคม 2567 ตั้งแต่เวลา 08.00 - 17.00 น. ณ พิพิธภัณฑ์การเกษตรฯ ปทุมธานี ชมนิทรรศการพิเศษ “รสมือที่แม่แกง รสแกงที่แม่ทำ” ลิ้มรสความอร่อยอาหารจานโปรดในความทรงจำ ที่เต็มไปด้วยความรักจากแม่ นิทรรศการ “ครบเครื่องเรื่องเครื่องปรุงรสไทย” สารพัดเมนูน้ำพริกประจำถิ่น 4 ภาค ชม ช้อปผลผลิตสินค้าจากทางเครือข่ายพิพิธภัณฑ์เกษตรฯ
- งาน มหกรรม “สืบสานงานพ่อ พัฒนา ส่งต่ออาชีพที่ยั่งยืน Agri Museum” เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ในวันที่ 12 – 14 กรกฎาคม 2567 ระหว่างเวลา 08.00 - 17.00 น. ณ พิพิธภัณฑ์การเกษตรฯ ปทุมธานี
- 11 - 20 กรกฎาคม 2567 "เดิน กิน ชิม เที่ยว" ถนนคนเดินรังสิต ช้อปสินค้าหลากหลาย ของกินมากมาย สนุกสนาน...กับสวนสนุก ตั้งแต่เวลา 17.00 - 23.00 น. ณ ริมเขื่อนโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร ส่วนหนึ่งของงานแข่งขันเรือยาวรังสิต ประจำปี 2567 ชิงถ้วยพระราชทาน
- งาน เดิน กิน ชิม เที่ยว 13-16 มิถุนายน 2567 หลังโรงเรียนเสริมมิตร เทพกุญชร 8 ต.คลองหนึ่ง อ.คลองหลวง ปทุมธานี
- งานถนนคนเดิน " เดิน กิน ชิม เที่ยว " Walking Street @Rangsit 7-9 มิถุนายน 2567 เวลา 17.00 - 23.00 น. บริเวณถนนเฉลิมพระเกียรติ เลียบคลองรังสิตประยูรศักดิ์ (ตรงข้ามโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร) - เวทีลานกิจกรรมกลางแจ้ง พบกับกิจกรรม การแสดงความสามารถ เด็ก นักเรียน นักศึกษา - พักผ่อนเพลิดเพลินไปกับอาหาร รถฟู้ดทรัค สินค้าหลากหลาย- ฟังเพลงดนตรีเปิดหมวก สนุกสนานเวทีชมรมร้องเพลง บรรยากาศยามเย็นคลองรังสิตประยูรศักดิ์
- 10 พฤษภาคม 2567 งานกาชาดและของดีเมืองปทุมธานี ประจำปี 2567
- 5 พฤษภาคม 2567 งานเทศกาลมนต์รักลำไทร ณ ตลาดเก่า ๑๐๐ ปี คลอง ๑๒ หกวา อำเภอลำลูกกา
👍 ++ งานประเพณีทิ้งกระจาด ประจำปี 2567 ทั่วประเทศ ++
ข้อมูลเรียงตามวันที่จัดงานก่อนหลัง เว้นแต่งงานประเพณีทิ้งกระจาด มูลนิธิป่อเต็กตึ๊ง จะแสดงเป็นลำดับแรก 👍 ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ฟรี 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬา
เนื่องในกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก 2567 คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา จัดกิจกรรมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงโดยไม่มีค่าใช้จ่าย (ฟรี) ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย [facebook]👍 ไหว้พระ 9 วัดดัง จ.ระยอง เสริมสิริมงคลรับปีใหม่ 2567
1. วัดวังหว้า อ.แกลง [
แผนที่]
สักการีสรีระสังขารหลวงปู่คร่ำ พระเกจิอาจารย์ชื่อดัง มีอายุ 100 ปีบริบูรณ์ พรรษา 80 นับเป็นพระเถระที่มีพรรษาสูงสุดของเมืองไทย
วัดเก่าแก่ตั้แต่สมัยอยุธยา มีโบสถ์และเจดีย์ให้กราบไหว้รวมถึงมีสรีระสังขารของหลวงปู่บุญสุสมโณหรือพระครูสุทธิวัตรสุนทร อีกหยึ่งพระเกจิอาจารย์ชื่อดังของจ.ระยองให้ไหว้เคารพ
3. วัดตะเคียนทอง อ.เมืองระยอง [
แผนที่]
วัดเก่าแก่อีกแห่งหนึ่งของระยองที่เป็นที่ศรัทธาและเลื่อมใสของชาวระยอง มีหลวงปู่ก๋วนพระเกจิอาจารย์ชื่อดังละกายสังขาร ซึ่งเป็นหนึ่งในพระวิปัสสนากรรมฐานชื่อดัง
4. วัดปิปผลิวนาราม อ.บ้านค่าย [
แผนที่]
วัดเล็กๆ ใจกลางหุบเขาถูกสร้างขึ้นโดยหลวงพ่อกัสสปมุนี หลวงพ่อกัสสปมุนี เป็นพระเถราจารย์สายวิปัสสนาเป็นที่เคารพเลื่อมใสของสาธุชนในจังหวัดระยอง ภายในมีสถานที่ให้เที่ยวชมสักการะเพื่อความเป็นสิริมงคล เช่น รูปหล่อองค์หลวงพ่อกัสสปมุนี, ศาลเจ้าแม่จำปากะสุนทรี, หลวงพ่อทันใจ เป็นต้น
5. วัดหนองกรับ อ.บ้านค่าย [
แผนที่]
วัดเก่าแก่แห่งหนึ่งในจังหวัดระยอง มีพระครูมนูญธรรมวัตร หรือ หลวงพ่อสาคร มนุญโญ เกจิชื่อดังเมืองระยองและยังเป็นศิษย์เอกผู้สืบทอดพุทธาคมจากหลวงปู่ อิสริโก
6. วัดละหารไร่ อ.บ้านค่าย [
แผนที่]
วัดละหารไร่ ชื่อเดิมวัดไร่วารี เป็นวัดราษฎร์สังกัดคณะสงฆ์ฝ่ายมหานิกาย เป็นอีกหนึ่งวัดที่มีชื่อเสียงมากๆแห่งหนึ่งและยังเป็นวัดของ หลวงปู่ทิม อิสริโก เกจิอาจารย์ดังแห่งภาคตะวันออก ภายในมีรูปหล่อของหลวงปู่ทิมองค์ใหญ่ให้ได้สักการะ ส่วนภายในวิหารเองก็มีอัฐิธาตุหลวงปู่ทิม ที่ประดิษฐานอยู่ในศาลา
7. วัดป่าประดู่ อ.เมืองระยอง [
แผนที่]
เป็นวัดเก่าแก่ของเมืองระยอง สันนิษฐานว่าสร้างขึ้นในสมัยกรุงศรีอยุธยา สิ่งที่โดดเด่นที่อยู่ภายในวัดป่าประดู่แห่งนี้คือ "พระพุทธรูปนอนตะแคงซ้าย" ที่เก่าแก่ประดิษฐานอยู่ นอกจากนี้ยังมีอุโบสถหลังเก่าอายุกว่า 100 ปี เป็นลักษณะศิลปกรรมที่นิยมในยุคต้นกรุงรัตนโกสินทร์ กรมศิลปากรได้ขึ้นทะเบียนเป็นโบราณสถานที่มีหน้าบันสวยที่สุดในภาคตะวันออก
8. วัดถ้ำเขาประทุน อ.เขาชะเมา [
แผนที่]
เป็นวัดและสถานปฏิบัติธรรม รวมไปถึงแหล่งเรียนรู้ทางธรรมชาติ มีสภาพแวดล้อมเป็นภูเขาหินสูง มีถ้ำให้ชมความสวยงามของหินงอกหินย้อยด้านใน จุดน่าสนใจของที่นี้คือในช่วงหน้าฝนนั้นจะทำให้ภายในมีน้ำฝนขังอยู่ในเส้นทาง ทำให้ต้องนั่งเรือลอดถ้ำเข้าไป กลายเป็นกิจกรรมพิเศษดึงดูดนักท่องเที่ยว
9. วัดลุ่มมหาชัยชุมพล อ.เมืองระยอง [
แผนที่]
วัดลุ่มมหาชัยชุมพล หรือชื่อเดิมคือวัดลุ่มมหาชัยชุมภูพล โดยด้านในมีพระบรมรูปสมเด็จพระเจ้าตากสินมหาราชขนาดเท่าองค์จริงและศาลที่ประทับ เป็รอีกหนึ่งจุดสำคัญบนหน้าประวัติศาสตร์ บริเวณด้านหน้าศาล มีบอร์ดนิทรรศการ แสดงอัตชีวประวัติและเส้นทางยาตราทัพสมัยดำรงพระยศเป็นพระยาตาก
👍 Skywalk วัดดอยติ “สกายวอล์คลำพูน” เปิดตัวแล้ว
“สกายวอล์คลำพูน” Skywalk วัดดอยติ เปิดให้เข้าชมได้ตามวันและช่วงเวลาดังนี้
1.) วันจันทร์ - พฤหัสบดี เปิดให้เข้าชม เวลา 06.00 - 17.00 น.
2.) วันศุกร์ - อาทิตย์ และวันหยุดนักขัตฤกษ์ เปิดให้เข้าชม เวลา 06.00 - 19.30 น.
บนสกายวอร์คสามารถเห็นดอย 11 ดอย ได้แก่ 1. ดอยไซ จ.ลำพูน 2. ดอยพระบาทตากผ้า จ.ลำพูน 3. ดอยอินทนนท์ จ.เชียงใหม่ 4. ดอยช้าง สันป่าตอง จ.เชียงใหม่ 5. ดอยคำ พระธาตุดอยคำ จ.เชียงใหม่ 6. ดอยสุเทพ จ.เชียงใหม่ 7. ดอยหลวง เชียงดาว จ.เชียงใหม่ 8 ดอยนางแก้ว ดอยสะเก็ด จ.เชียงใหม่ 9. ดอยงุ้ม จ.ลำพูน 10. ดอยขะม้อ (น้ำทิพย์ศักดิ์สิทธิ์) จ.ลำพูน 11. ดอยติ จ.ลำพูน
การเข้าชม “สกายวอล์คลำพูน” ณ วัดดอยติ อ.เมือง จ.ลำพูน มีรายละเอียดดังนี้
- บุคคลทั่วไปค่าบริการคนละ 50 บาท
- พระภิกษุสงฆ์ แม่ชี สามเณร ผู้พิการ เด็กส่วนสูงไม่เกิน 120 cm. เข้าฟรี
- นักเรียน ตั้งแต่อนุบาล-ม.6 (ทัศนศึกษา)ให้นำหนังสือขอความอนุเคราะห์มา(เฉพาะวันจันทร์ - ศุกร์ เท่านั้น)
- ผู้สูงอายุ 75 ปีขึ้นไป แสดงบัตรประชาชน เข้าชมฟรี
การเดินทาง : จอดรถบริเวณลานด้านล่างของวัด จะมีรถรับส่งให้บริการนำขึ้นไปด้านบนของวัดมี ราคาค่าบริการท่านละ 20 บาท หรือสามารถเดินขึ้นไปเองชมเองได้
👍 งานประเพณีทิ้งกระจาด มูลนิธิป่อเต็กตึ๊ง ประจำปี 2567 วันที่ 14 กรกฎาคม - 30 สิงหาคม LINK
ขอเชิญร่วมงานประเพณีทิ้งกระจาด ประจำปี พ.ศ. 2567 มูลนิธิป่อเต็กตึ๊ง ขอเชิญทำบุญบริจาคซื้อข้าวสาร เนื่องในงานประเพณีทิ้งกระจาด ประจำปี 2567 "ทำบุญให้ผู้ล่วงลับ ทำทานให้ผู้ยากไร้" ระหว่างวันที่ 14 กรกฎาคม - 30 สิงหาคม พ.ศ. 2567 กำหนดการบริการข้าวสารทิ้งกระจาด
วันที่ 14 กรกฎาคม - 3 สิงหาคม 2567 เวลา 07.00 - 18.00 น.
วันที่ 4 สิงหาคม - 29 สิงหาคม 2567 เวลา 07.00 -19.00 น.
วันที่ 30 สิงหาคม 2567 เวลา 07.00 -16.00 น.
เฉพาะช่องทางออนไลน์เริ่ม 10 กรกฎาคม - 30 สิงหาคม 2567 ผ่านเว็บไซต์
กำหนดแจกเครื่องอุปโภคบริโภค
7 สิงหาคม พ.ศ. 2567 ณ สุสานมูลนิธิป่อเต็กตึ๊ง อำเภอบ้านแพ้ว จังหวัดสมุทรสาคร
10 สิงหาคม พ.ศ. 2567 ณ คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีนหัวเฉียว สาขาโคราช จังหวัดนครราชสีมา
24 สิงหาคม พ.ศ. 2567 ณ คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีนหัวเฉียว สาขาศรีราชา จังหวัดชลบุรี
31 สิงหาคม พ.ศ. 2567 ณ มูลนิธิป่อเต็กตึ๊ง พลับพลาไชย กรุงเทพฯ
👍 28 ก.ย.66 ปศุสัตว์นนทบุรี ทำหมันหมาแมว ฟรี หน้า 7-11 นนทบุรี-รัตนาธิเบศร์ LINK
สนง.ปศุสัตว์จังหวัดนนทบุรี เชิญชวนนำสุนัขและเมวเข้ารับบริการผ่าตัดทำหมัน/ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! วันพฤหัสบดีที่ 28 กันยายน พ.ศ. 2566 ตั้งแต่เวลา 09.00 น. เป็นต้นไป
สำนักงานปศุสัตว์จังหวัดนนทบุรี ร่วมกับ บริษัท ซี พี ออลล์ จำกัด (มหาชน) เชิญร่วมกิจกรรม "วันป้องกันโรคพิษสุนัขบ้าโลก 2566" (World Rabies Day 2023) การสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าตามพระปณิธานศาสตราจารย์ ดร.สมเด็จพระ ฟ้าจุฬาภรณาลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี และกิจกรรม "ชุมชนคนรักหมา 4 ขา หน้าเขเว่น" ณ ลานหน้าเซเว่น อีเลฟเว่น สาขา 18555 (แยกนนทบุรี-รัตนาธิเบศร์) ตำบลบางกระสอ อำเภอเมืองนนทบุรี จังหวัดนนทบุรี
กิจกรรมภายในงาน
- หน่วยสัตวแพทย์เคลื่อนที่ให้บริการผ่าตัดทำหมันสุนัขและแมว
- ฉีดวัคซีนป้องกันโรคพิษสนัขบ้า ให้กับสนัขและแมว
- ให้ความรู้ คำแนะนำ เกี่ยวกับการป้องกันโรคพิษสุนัขบ้า และการดูแลสัตว์หลังผ่าตัดทำหมัน
- แจกอาหารสุนัขและแมวสำหรับผู้เข้าร่วมงานฟรี อาทิ สมาร์ทฮาร์ท มีโอ ฯลฯ
การเตรียมตัวสัตว์ก่อนผ่าตัดทำหมัน
- อายุตั้งแต่ 6 เดือนขึ้นไป
- งดน้ำ งดอาหารสัตว์ อย่างน้อย 8 ชั่วโมง
- สัตว์ต้องมีสุขภาพที่ดี แข็งแรง ไม่อยู่ระหว่างการเจ็บป่วย
- สัตว์ที่นำมาทำหมันต้องไม่อยู่ระหว่างการเป็นสัด หรือผสมพันธ์
- สัตว์ต้องไม่อยู่ระหว่างการตั้งท้อง
- แม่สุนัขหรือแมวสามารถทำหมันได้หลังจากลูกหย่านมแล้ว
👍 Vimut Hospital วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ราคาพิเศษ
วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ราคาพิเศษ 790 บาท ติดต่อสอบถามรายละเอียดได้ที่
ศูนย์อายุรกรรม ชั้น 5 เวลาทำการ 7.00 - 20.00 น. โทร 02-079-0030 ติดต่อเราเพื่อปรึกษาปัญหาสุขภาพ Call center : 02-079-0000
👍 ถนนคนเดิน ตลาดกลางคืน ร้านเด็ดใน สมุทรปราการ
- 8 -9 สิงหาคม 2567 ชม ชิม ช็อป ผลิตภัณฑ์ OTOP ของกลุ่มผู้ผลิต ผู้ประกอบการ OTOP จังหวัดสมุทรปราการ ตามโครงการพัฒนาผลิตภัณฑ์ OTOP กลุ่ม QD ประจำปี 2567 กิจกรรมทดสอบการตลาด ณ ห้างโรบินสัน สมุทรปราการ ชั้น 3
- ถนนคนเดิน ตลาดหน้าท่าเรือข้ามฟากปากน้ำ ทุกวันที่ 1 - 2 ของเดือน ตั้งแต่เวลา 16:00 - 21:00 น.
- ถนนคนเดินแพรกษา Stree Food Good Health วันศุกร์-เสาร์ 18.00-22.00 น. อาทิตย์ 17.00-22.00 น. [facebook]
- ตลาดเลียบคลองสำโรง ตลาดนัดเปิดใหม่ ซอยสุขุมวิท 113 (วัดด่านสำโรง) ตลาดนัดกลางคืน สไตล์ถนนคนเดิน ตลาดคลองถม ตลาดพระ พื้นที่กว่า 10 ไร่ [facebook]
- ตลาดแบล็ค มาร์เก็ต ติดรถไฟฟ้าสถานีแพรกษา เปิดทุกวัน 16.00 - 24.00 น.[facebook]
- ตลาดนัดเรือบิน กิน เที่ยว ช้อป ครบจบในที่เดียว ระหว่างถนนเทพารักษ์ และถนนนบางนา-ตราด เปิดบริการทุกวัน เวลา 16:00 - 22:00 น. โซนเรือบิน 1 เปิดบริการทุกวัน โซนเรือบิน 2 เปิดศุกร์, เสาร์-อาทิตย์ คลองถมเรือบิน เปิด เสาร์-อาทิตย์ [facebook]
👍 หน่วยตรวจกุมารเวชกรรม ศูนย์การแพทย์กาญจนาภิเษก เปิดให้บริการวัคซีนมือ เท้า ปาก LINK
หน่วยตรวจกุมารเวชกรรม ศูนย์การแพทย์กาญจนาภิเษก เปิดให้บริการวัคซีนมือ เท้า ปาก ราคา 2,697 บาท/เข็ม ป้องกันโรคมือ เท้า ปาก ชนิดรุนแรงจากการติดเชื้อไวรัส EV 71 ประสิทธิภาพ
ป้องกันมือเท้าปากจากการติดเชื้อ EV71 89.7%
ป้องกันการนอนโรงพยาบาล 88 %
ป้องกันภาวะแทรกซ้อนรุนแรง 100%
สามารถฉีดได้ใน
เด็กอายุ 6 เดือน – 5 ปี 11 เดือน
ฉีดวัคซีน 2 เข็ม ห่างกัน 1 เดือน
เป็นวัคซีนชนิดเชื้อตาย สามารถให้ร่วมกับวัคซีนชนิดอื่นได้
ผู้มีภูมิคุ้มกันบกพร่องสามารถฉีดได้
ผลข้างเคียงที่พบได้ - บวม แดง เจ็บ บริเวณที่ฉีด ไข้ ยังไม่มีรายงานภาวะแทรกซ้อนรุนแรง
อย่างไรก็ตามโรคมือ เท้า ปาก สามารถเกิดจากการติดเชื้อไวรัสชนิดอื่นได้
การฉีดวัคซีนสามารถป้องกันโรคมือ เท้า ปาก ได้โดยรวมประมาณ 50%
โทรสอบถาม โทร 02 849 6600 ต่อ 1120-1121
*ราคาที่ระบุเป็นราคาโดยประมาณ อาจมีการเปลี่ยนแปลงได้ตามราคาวัคซีนในท้องตลาด
** ราคายังไม่รวมค่าบริการโรงพยาบาล
👍 บอกรัก “คุณแม่” ให้ดังถึงหัวใจ ด้วย Bumrungrad Personalized Digital Gift Card
บอกรัก “คุณแม่” ให้ดังถึงหัวใจ ด้วย Bumrungrad Personalized Digital Gift Card กับดีไซน์ล่าสุด Mother’s Edition! ????
บัตรวงเงินสุขภาพแด่คุณแม่ ผู้หญิงแสนวิเศษ เพื่อใช้แทนเงินสดที่ รพ.บำรุงราษฎร์
✅ หลากหลายมูลค่าทางเลือก
✅ พร้อมรังสรรค์ข้อความแทนใจ
👍 โรงพยาบาลบางโพ วัคซีนป้องกันไข้เลือดออก ชนิดใหม่ 1 เข็ม / 2 เข็ม
วัคซีนป้องกันไข้เลือดออก ชนิดใหม่ ฉีด 2 เข็ม ห่างกัน 3 เดือน ลดอัตราการนอนโรงพยาบาลและลดความรุนแรง 90.4% ป้องกันการติดเชื้อไข้เลือดออก 4 สายพันธุ์ 80.2% สามารถฉีดได้อายุตั้งแต่ 4 ปี - 60 ปี ฉีดได้ทั้งคนที่เคยเป็น และไม่เคยเป็นโรคไข้เลือดออก
1 เข็ม 3,000 บาท
2 เข็ม 4,777 บาท
รวมค่าแพทย์และคาบริการโรงพยาบาล ปรึกษาปัญหาสุขภาพ คลินิกอายุรกรรม 02-5870144 ต่อ 2200
👍 โรงพยาบาลธนบุรี บำรุงเมือง 2 เข็ม
โรงพยาบาลธนบุรี บำรุงเมือง พร้อมให้บริการ แพ็กเกจวัคซีนไข้เลือดออก (Qdenga Vaccine)
จำนวน 2 เข็ม ราคา 4,200 บาท (ราคานี้ยังไม่รวมค่าแพทย์)
✅ฉีดได้ตั้งแต่อายุ 4-60 ปี
✅ฉีด 2 เข็มห่างกัน 3 เดือน
✅สามารถฉีดได้ทั้งผู้ที่เคยเป็น และไม่เคยเป็นไข้เลือดออกมาก่อน
✅ช่วยลดความรุนแรงของโรค
✅ช่วยลดภาวะแทรกซ้อนที่รุนแรงถึงขั้นเสียชีวิต
สอบถามข้อมูลเพิ่มเติมได้ที่ Call center : 02-220-7999
👍 โปรแกรมคลินิก KKSEHR ทดลองใช้ 90 วันฟรี LINK
โปรแกรมคลินิก KKSEHR สำหรับ คลินิกเวชกรรม คลินิกเวชกรรมโรคไต คลินิกความงาม คลินิกทั่วไป ที่มีระบบเวชระเบียนผู้ป่วย เช่น จัดการคิวผู้ป่วย ประวัติการรักษา ข้อมูลบ่งชี้เฉพาะบุคคล การค้นหา การควบรวมชื่อผู้ป่วยที่ซ้ำกัน การเปรียบเทียบการรักษากับครั้งก่อน และส่วนอื่นๆเช่น การแจ้งเตือนการแพ้ยา การสั่งยาซำ้ การกำหนดบทบาทให้กับเจ้าหน้าที่ตามสิทธิต่างๆ การเชื่อมเข้าระบบ สปสช ปฏิทินนัดสำหรับผู้ป่วยและเชื่อมตารางนัดให้กับเจ้าหน้าที่ไปยัง Google Calendar การแจ้งเตือนการนัดผ่านไลน์และอีเมลล์ การเข้าถึงข้อมูลสุขภาพคุณ
จุดเด่นของโปรแกรมคลินิก KKSEHR
- Clinic Management ที่ออกแบบฟอร์มการตรวจ เปรียบเทียบการรักษา เชื่อมเข้าระบบ สปสช(e-claim) ระบบเข้าถึงสุขภาพคุณ ระบบค้นหาด้วยเงื่อนไข
- Inventory Management จัดการคลังยาเวชภัณฑ์ได้หลายตำแหน่ง หรือคลังสินค้า(Location/Warehouse) และสร้างเป็นส่วนย่อยลำดับชั้น (main-sub stacking warehouses)
- Course Management สำหรับคลินิกความงามในการสร้างคอร์ส การตัดคอร์สการใช้ การโอนคอร์ส การสะสมแต้ม รายงานสรุปค่าใช้จ่ายต่อคอร์ส
- ระบบแจ้งเตือนการแพ้ยา ระบบแจ้งเตือนการแพ้ยาของผู้ป่วย - Drug allergy alert system เป็นการป้องกันและให้ความปลอดภัยกับผู้ป่วยในการใช้ยา ซึ่งโปรแกรมคลินิกทำงานด้วยการค้นหายาที่ต้นทาง และ subtype และตรวจสอบยาที่กำลังจะจ่ายให้กับผู้ป่วยถ้าพบจะทำการแจ้งเตือนให้ทราบ พร้อมยกตัวอย่างการแพ้ยา Penicillin
คงก้าซอฟท์ ให้บริการซอฟต์แวร์ในรูปแบบคลาวด์ (Online) ที่สามารถทำงานได้หลายสาขาและไม่จำกัดจำนวนผู้ใช้
รูปแบบแพคเกจบริการ KKSEHR 15,000 บาท/ปี
ติดต่อขอทดลองใช้ 90 วันฟรี
สอบถามเพิ่มเติม โทร 066-1502487
facebook.com/KongkaSoft
👍 หลังสงกรานต์ตรวจโควิด19 หากมีอาการเสี่ยง
ช่องทางติดต่อรับการรักษาตามสิทธิ
สปสช. (สิทธิ 30 บาท) 1330 กด 14 / ไลน์ @nhso
ประกันสังคม 1506
สิทธิข้าราชการ 02-2706400
ศูนย์เอราวัณ 1669
👍 เริ่มแล้ว 1 พฤษภาคม 66 นี้ LINK
เริ่มแล้ว 1 พฤษภาคม 66 นี้ สำนักงานประกันสังคม บริการฉีดวัคซีนไข้หวัดใหญ่ (Influenza Vaccine) ให้กับผู้ประกันตน มาตรา 33 และ มาตรา 39 ที่มีอายุตั้งแต่ 50 ปีขึ้นไป ให้บริการระหว่างวันที่ 1 พฤษภาคม - 31 สิงหาคม 2566 ติดต่อนัดหมายการฉีดวัคซีนกับสถานพยาบาลตามสิทธิของท่านก่อนเข้ารับบริการ หากผู้ประกันตนมีโรคประจำตัวหรือ มีประวัติการแพ้วัคซีน ควรปรึกษาแพทย์ก่อนการเข้ารับบริการ ในกรณีสถานพยาบาลตามสิทธิของผู้ประกันตนไม่มีวัคซีนไข้หวัดใหญ่ ท่านสามารถติดต่อ สำนักจัดระบบบริการทางการแพทย์ สำนักงานประกันสังคม โทรศัพท์ 02-956-2502, 2509-10 จะดำเนินการประสานหาสถานพยาบาล ที่ผู้ประกันตนสะดวกเข้ารับบริการ สอบถามข้อมูลเพิ่มเติมได้ที่ www.sso.go.th หรือโทรสายด่วน 1506 ให้บริการ ทุกวันตลอด 24 ชั่วโมง
• ดู
รายชื่อรพ.ประกันสังคม ทั่วประเทศที่ให้บริการฉีดวัคซีนไข้หวัดใหญ่ ม.33 ม.39
👍 สำนักอนามัย กรุงเทพมหานคร รับสมัครบุคคล
ประกาศสำนักงานคณะกรรมการข้าราชการกรุงเทพมหานคร เรื่อง รับสมัครคัดเลือกเพื่อบรรจุและแต่งตั้งบุคคลเข้ารับราชการเป็นข้าราชการกรุงเทพมหานครสามัญ สังกัดสำนักอนามัย ครั้งที่ 2/2566
เปิดรับสมัครตั้งแต่วันที่ 19 - 30 มิ.ย. 2566
ณ ฝ่ายการเจ้าหน้าที่ สำนักงานเลขานุการ สำนักอนามัย ชั้น 4
อาคารธานีนพรัตน์ ศาลาว่าการกรุงเทพมหานคร ดินแดง
ติดต่อสอบถามเพิ่มเติมได้ที่ 0 2203 2811 ในวันและเวลาราชการ
รายละเอียดการรับสมัคร คลิก https://shorturl.asia/pgQKX
หรือที่เว็บไซต์ สำนักอนามัย กรุงเทพมหานคร หัวข้อ ข่าวประชาสัมพันธ์
• ตำแหน่งพนักงานช่วยงานการถ่ายภาพและโสตทัศนูปกรณ์ จำนวน 1 อัตรา
• ตำแหน่งพนักงานช่วยงานด้านสารสนเทศ จำนวน 2 อัตรา
• ตำแหน่งพนักงานช่วยงานด้านธุรการ จำนวน 2 อัตรา
เปิดรับสมัครระหว่างวันที่ 13 - 26 ก.ค. 2566 ในวันและเวลาราชการ
ผู้ประสงค์จะสมัครสอบ ให้ขอรับและยื่นใบสมัครสอบด้วยตนเองได้ที่
ฝ่ายบริหารงานทั่วไป สำนักงานพัฒนาระบบสาธารณสุข สำนักอนามัย ชั้น 11 อาคารธานีนพรัตน์ ศาลาว่าการกรุงเทพมหานคร 2
ถนนมิตรไมตรี เขตดินแดง กรุงเทพมหานคร
ติดต่อสอบถามเพิ่มเติมได้ที่ 0 2203 2857 ในวันและเวลาราชการ
รายละเอียดการรับสมัคร คลิก https://shorturl.asia/0BcCu
หรือที่เว็บไซต์ สำนักอนามัย กรุงเทพมหานคร หัวข้อ ข่าวประชาสัมพันธ์
👍 แนะนำกินเที่ยวร้านอาหารคาเฟ่ในจ.ชลบุรี
👍 เปิดฤดูกาลท่องเที่ยวน้ำตกทีลอซู ตั้งแต่ วันที่ 1 กันยายน 2566
วันที่ 1 กันยายน 2566 เปิดฤดูกาลท่องเที่ยวน้ำตกทีลอซู ติดต่อสอบถามเพิ่มเติมได้ที่..
เขตรักษาพันธุ์สัตว์ป่าอุ้มผาง - Umphang Wildlife Sanctuary หรือ 065 002 7637 (เขตรักษาพันธุ์ฯ)
www.facebook.com👍 งานบุญบั้งไฟ เมืองร้อยเอ็ด
งานบุญบั้งไฟ เมืองร้อยเอ็ด ปี 2567 วันไหนที่ไหน ดังนี้
- งานประเพณีบุญบั้งไฟ อ.อาจสามารถ 13-19 พ.ค.67
- งานประเพณีบุญบั้งไฟ อ.หนองพอก 27 พ.ค. - 2 มิ.ย.67
- งานประเพณีบุญบั้งไฟ อ.พนมไพร 16-26 มิ.ย.67
- งานประเพณีบุญบั้งไฟ อ.สุวรรณภูมิ 25 พ.ค. - 2 มิ.ย.67
- งานประเพณีบุญบั้งไฟ อ.โพนทราย 4-11 มิ.ย.67
👍 ททท.เชียงราย เพิ่มจุดเช็คอินชมดอกพญาเสือโคร่ง ชมได้ถึงปลายมกราคมนี้นะ
ตอนนี้ดอกพญาเสือโคร่งบานแล้ว สีชมพูสวยฉ่ำ ททท.สำนักงานเชียงราย เลยเพิ่มจุดเช็คอินชมดอกพญาเสือโคร่งอีกหนึ่งสถานที่ และสะดวกมาก เพราะ ใกล้ตัวเมือง นั่นคือ สถานีพัฒนาการเกษตรที่สูง ตามพระราชดำริฯ บ้านปางขอน อำเภอเมืองเชียงราย สามารถเข้าชมไปจนถึงปลายเดือนมกราคม 2567 นักท่องเที่ยวสามารถใช้รถส่วนตัวขึ้นไปยังจุดชมดอกพญาเสือโคร่ง ได้ตั้งแต่ 05:00 น. เป็นต้นไป สามารถนำเต็นท์มากางได้ที่ ณ จุดลานกางเต็นท์ สอบถามโทร 085-7158521 จุดชมวิวอื่นๆ ที่ ททท.ชี้เป้า ดังนี้
- หน่วยจัดการต้นน้ำหงาว-งาว อ.เวียงแก่น ดอกพญาเสือโคร่งบานแล้ว 100% สามารถชมไปจนถึงปลายเดือนมกราคม 2567 มีรถบริการของกลุ่มชุมชนพานักท่องเที่ยวขึ้นไปยังจุดชมดอกพญาเสือโคร่ง คนละ 80 บาท (ราคานี้รวมไป-กลับ) ให้บริการตั้งแต่เวลา 05.00 น. เป็นต้นไป โทร. 086-1178183 กลุ่มรถบริการชุมชน
- โรงเรียนบรรพตวิทยา อ.เวียงแก่น ดอกพญาเสือโคร่งบานแล้ว 80% สามารถชมไปจนถึงปลายเดือนมกราคม 2567 มีรถบริการของกลุ่มชุมชนพานักท่องเที่ยวขึ้นไปยังจุดชมดอกพญาเสือโคร่ง คนละ 20 บาท (ราคานี้รวมไป-กลับ) ให้บริการตั้งแต่เวลา 05.00 น. เป็นต้นไป โทร. 097-9731530 กลุ่มรถบริการชุมชน
- ดอยผาตั้ง อ.เวียงแก่น
- ดอยปางขอน อ.เมืองเชียงราย
- ดอยช้าง อ.แม่สรวย
- ดอยแม่สลอง อ.แม่ฟ้าหลวง
👍 ถนนคนเดิน ตลาดกลางคืน น่าเดิน ร้านเด็ดมีโปรฯในจ.นนท์
ข้อมูลกินเที่ยวเด็ดๆ จากเพจ
Check in เที่ยวนนทบุรี
ถนนคนเดิน ตลาดกลางคืน น่าเดิน
- ถนนคนเดิน รื่นรมย์ ชมตลาด @ตรงข้ามสถานี MRT บางซ่อน 16-25 สิงหา เริ่ม 15:00-24:00 น.
- งานบางใหญ่ไนท์แฟร์ ณ ตลาดบางใหญ่ซิตี้ 3-12 สิงหา เวลา 17:00 เป็นต้นไป
- ตลาดนัดแบบใหม่ งาน Playland Playyard Art&Music 30 ก.ค. 67 งานเริ่มเวลา 19.00-23.00 น. ลานกิจกรรมหน้าศูนย์การค้า เซ็นทรัล แจ้งวัฒนะ
- งานใหญ่แสง สี 475 ปี เมืองนนทบุรี 26-29 ก.ค. 67 เวลา 17:00 - 23:00 น.
กินไรดีที่เมืองนนท์
- ก๋วยเตี๋ยวขาหมูเมืองทอง ติดถนนป๊อบปูล่า ตรงข้ามวัดผาสุขมณีจักร เปิดทุกวัน เวลา 07:30-19:30 น.
- เตี๋ยวเรือโกแบ๋น เตี๋ยวในสวน เปิดพุธถึงจันทร์ 08:30-17:30 หยุดทุกวันอังคาร
- Midnight Cafe Halal ร้านอาหารฮาลาลย่านบางบังทอง เปิดวันพุธ-จันทร์ เวลา 17:00-23:00 น. (หยุดวันอังคาร)
- หมูแฮม กะ หนูแดง คาเฟ่ อยู่ในซอยงามวงศ์วาน 23 ตรงข้าม แยก 19 เปิดทุกวัน เวลา 09:00-20:00 น.
- Happy Hippie ซอยบ้านไทรม้า เมืองนนทบุรี เปิดทุกวัน เวลา 14:30-24:00 น.
- Ginmai Sushi Donburi & Donburi อยู่ในโครงการ The Twelve ซ.แก้วอินทร์ บางใหญ่ นนทบุรี เปิดวันอังคาร-อาทิตย์และวันหยุดนักขัตฤกษ์ เวลา 11:30-22:00 น. (หยุดวันจันทร์)
- กินข้าวบ้านเพื่อน สาขานนทบุรี อยู่ในซอยบางไผ่พัฒนา ถนนนครอินทร์ เปิดทุกวัน เวลา 11:00-21:30 น.
- กินผักกัน Salad Cafe พุทธมณฑลสาย 2 เปิดทุกวัน เวลา 11:00-21:00 น.
👍 แนะนำ 8 เส้นทางศรัทธาน่าเที่ยว แห่งจ.พังงา
ททท.สำนักงานพังงารวบรวมจุดไหว้พระขอพร รับโชค เสริมสิริมงคลในชีวิตตามความเชื่อชาวจีน ไม่ว่าจะเป็นด้านการเงินการงาน โชคลาภ และด้านสุขภาพ จำนวน 8 แห่งดังนี้
⛩️ ศาลเจ้าม่าจ๋อโป๋ อ.เมืองพังงา
⛩️ ศาลเจ้าบุ๋นเถ้าก๋ง (ถ้ำน้ำผุด) อ.เมืองพังงา
⛩️ ศาลเจ้ากระโสมต่าวโบเก้ง อ.ตะกั่วทุ่ง
⛩️ ศาลเจ้าฮกเหลงเก้ง (โคกกลอย) อ.ตะกั่วทุ่ง
⛩️ ศาลเจ้าเล่งสั้นเก้ง อ.ท้ายเหมือง
⛩️ศ าลเจ้าบุ๋นเถ้าก๋ง (คึกคัก) อ.ตะกั่วป่า
⛩️ ศาลเจ้าพ่อกวนอู (ซินฉ่ายตึ๋ง) อ.ตะกั่วป่า
⛩️ ศาลเจ้าแม่กวนอิมบางไทร อ.ตะกั่วป่า
👍 ปักหมุด | งานมหกรรมหุ่นฟางนกและงานกาชาดจังหวัดชัยนาท 2567 (8-18 กุมภาพันธ์ 2567)
งานใหญ่ระดับประเทศ ต้องปักหมุด | งานมหกรรมหุ่นฟางนกและงานกาชาดจังหวัดชัยนาท การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานลพบุรี ขอเชิญร่วมงานมหกรรมหุ่นฟางนกและงานกาชาดจังหวัดชัยนาท ในระหว่างวันที่ 8 - 18 กุมภาพันธ์ 2567 ณ บริเวณเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท. ภายในงานพบกับกิจกรรมมากมาย อาทิ สักการะศาลหลักเมือง นมัสการรูปหล่อหลวงปู่ศุข วัดปากคลองมะขามเฒ่า ชมขบวนแห่หุ่นฟางนกสุดอลังการ ชมหุ่นฟางนกไฮเทคและหุ่นฟางนกสวยงามท่ามกลางสวนป่าอันงดงามประกอบ แสง สี เสียง. โมบายนก เลือกซื้อสินค้า OTOP ของดีจังหวัดชัยนาท สอบถามข้อมูลด้านการท่องเที่ยวเพิ่มเติมได้ที่ : ททท.สำนักงานลพบุรี โทร. 036-770096-7
👍 งานนมัสการองค์พระธาตุพนม ประจำปี 2567 (17 - 25 กุมภาพันธ์ 2567)
ททท. สำนักงานนครพนม ขอเชิญ ข้าโอกาสลูกพระธาตุพนม ร่วมงาน “นมัสการองค์พระธาตุพนม ประจำปี ๒๕๖๗” (งานบุญเดือน ๓) ระหว่างวันที่ 17 - 25 กุมภาพันธ์ 2567 ณ วัดพระธาตุพนม อำเภอธาตุพนม จังหวัดนครพนม ภายในงานประกอบไปด้วยกิจกรรม • ร่วมขบวนแห่อันเชิญพระอุปคุตจากริมแม่น้ำโขง (17 ก.พ. 2567) • การถวายผ้าห่มพระธาตุพนม • ตักบาตรคู่อายุ ถวายข้าวพีชภาค เสียค่าหัว • พิธีเจริญพระพุทธมนต์ • การแสดงพระธรรมเทศนาและพิธีเวียนเทียน • การออกร้านจำหน่ายสินค้าพื้นเมือง และการแสดงมหรสพสมโภชตลอดงาน ๙ วัน ๙ คืน
👍 โคราช คว้าสิทธิ์เป็นเจ้าภาพจัดงานพืชสวนโลก โคราช เอ็กซ์โป2029
6 มีนาคม 2567 กรุงโดฮาร์ ประเทศกาตาร์ สมาคมพืชสวนระหว่างประเทศ (The International Association of Horticultural Producers – AIPH) ประกาศให้สิทธิ์ประเทศไทยเป็นเจ้าภาพจัดงานมหกรรมพืชสวนโลก (International Horticultural Expo) หรือ “โคราช เอ็กซ์โป 2029” การได้รับสิทธิ์จัดงานระดับโลกครั้งนี้ จะช่วยยกระดับจังหวัดนครราชสีมาให้เป็นศูนย์กลางด้านนวัตกรรมและความยั่งยืนในอุตสาหกรรมพืชสวน ภายใต้แนวคิด “ธรรมชาติและพรรณพืชเขียวขจี อนาคตแห่งโลกสีเขียว” (Nature & Greenery: Envisioning the Green Future)
“
โคราช เอ็กซ์โป 2029” หรือ งานมหกรรมพืชสวนโลกนครราชสีมา พ.ศ. 2572 กำหนดจัดขึ้นระหว่างวันที่ 10 พฤศจิกายน 2572 ถึง 28 กุมภาพันธ์ 2573 ถือเป็นงานมหกรรมระดับโลก ประเภท A1 คาดว่าจะมีผู้เข้าร่วมชมงานจำนวน 2.6 – 4 ล้านคน
การจัดงานครั้งนี้จะนำเสนอแนวคิด “ธรรมชาติและพรรณพืชเขียวขจี อนาคตแห่งโลกสีเขียว” (Nature and Greenery: Envisioning the Green Future) สะท้อนความมหัศจรรย์ทางธรรมชาติ ความหลากหลายทางวัฒนธรรม และความเชี่ยวชาญด้านเทคโนโลยีพืชสวนและการเกษตรที่ยั่งยืนของประเทศไทย
👍 งานเทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทศรีสะเกษ ปี 2567
งานเทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทศรีสะเกษ ปี 2567 วันที่ 6-10 มีนาคม 2567 บริเวณสวนสมเด็จพระศรีนครินทร์ ช่วงเดือนมีนาคม ดอกลำดวน ดอกไม้ประจำจังหวัดศรีสะเกษ จะออกดอกบานสะพรั่งกว่า ส่งกลิ่นหอมอบอวลทั่วสวนสมเด็จพระศรีนครินทร์ศรีสะเกษ ทำให้บรรยากาศของงานยังรื่นรมย์ไปกับความหอมเย็นละมุนอ่อนนุ่มของดอกลำดวน ที่เบ่งบานผลิดอกจากต้นลำดวนกว่า 5 หมื่นต้น พร้อมเลือกลิ้มชิมรสอาหารพื้นเมืองศรีสะเกษของชนเผ่า ลาว เขมร ส่วย เยอ ให้บริการแก่ผู้เข้าชมงาน
“เทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทศรีสะเกษ” เป็นประเพณีของชนสี่เผ่าไทศรีสะเกษ อันได้แก่ ชาวเขมร ชาวลาว ชาวส่วยและชาวเยอ ชนเผ่าพื้นเมือง “เขมร-ป่าดง” ผ่านรูปแบบการจำลองหมู่บ้านวิถีชีวิตชนสี่เผ่าโบราณอย่างใกล้ชิด จัดขึ้นในช่วงเดือนมีนาคมของทุกปี โดย จังหวัดศรีสะเกษ องค์การบริหารส่วนจังหวัดศรีสะเกษ ร่วมกับการท่องเที่ยวแห่งประเทศไทย (ททท.)
กิจกรรมภายในงานได้แก่ การแสดงประเพณี ศิลปะ วัฒนธรรม วิถีชีวิตของชนเผ่า 4 เผ่า (ลาว เขมร ส่วย เยอ) การแสดงนิทรรศการภาพเขียน งานศิลปะ ของศิลปินท้องถิ่น การแสดงภาพวาด และสาธิตการวาดภาพของศิลปินท้องถิ่น การแสดงและจำหน่ายผลิตภัณฑ์ OTOP ของอำเภอต่างๆ บริเวณลานทางเข้าสวนสมเด็จพระศรีนครินทร์ศรีสะเกษ และกิจกรรมถ่ายภาพติดแสตมป์ที่ระลึกโดยไปรษณีย์จังหวัดศรีสะเกษ
👍 ประกาศกรมอุทยานแห่งชาติ สัตว์ป่า และพันธุ์พืช เรื่อง ปิดการท่องเที่ยวและพักแรมในอุทยานแห่งชาติและวนอุทยาน ประจำปี พ.ศ.2567
ประกาศกรมอุทยานแห่งชาติ สัตว์ป่า และพันธุ์พืช
เรื่อง ปิดการท่องเที่ยวและพักแรมในอุทยานแห่งชาติและวนอุทยาน ประจำปี พ.ศ.2567
อุทยานเเห่งชาติ ที่อยู่ในจังหวัดสตูล มีที่ไหนกันบ้าง
แอดมินรวบรวมข้อมูลไว้ให้แล้วจ้าาาาาาาาา
อุทยานแห่งชาติตะรุเตา Tarutao National Park, Satun Thailand
074-783-485 ศูนย์บริการนักท่องเที่ยว
074-783-597 ที่ทำการอุทยานแห่งชาติตะรุเตา
อุทยานแห่งชาติหมู่เกาะเภตรา-Mu ko phetra national park
062-264-0801 ศูนย์บริการนักท่องเที่ยว
074-740-272 ที่ทำการอุทยานแห่งชาติหมู่เกาะเภตรา
อุทยานแห่งชาติทะเลบัน - Thaleban National Park
083-533-1710 ศูนย์บริการนักท่องเที่ยว
074-750-758 ที่ทำการอุทยานแห่งชาติทะเลบัน
👍 เปิดฤดูกาลท่องเที่ยว ถ้ำนาคา บึงกาฬ 1 มิถุนายน 2567
ประกาศเปิดฤดูกาลท่องเที่ยว ถ้ำนาคา จ.บึงกาฬ ประจำปี 2567 ตั้งแต่ 1 มิถุนายน 2567 นี้ เป็นต้นไป บึงกาฬดินแดนมรกตแห่งธรรมชาติของภาคอีสาน พร้อมต้อนรับนักท่องเที่ยวจากทั่วประเทศ
👍 เปิดฤดูกาลท่องเที่ยวบึงกาฬ 2567 ตั้งแต่ 1 มิถุนายน 2567
นับถอยหลัง เปิดฤดูกาลท่องเที่ยวบึงกาฬ 2567 ตั้งแต่ 1 มิถุนายน 2567 ททท.สำนักงานอุดรธานี ชวนสัมผัสประสบการณ์ มหัศจรรย์แห่งสีเขียว ชวนเที่ยวหน้าฝน ในดินแดน “มรกตแห่งธรรมชาติ” #บึงกาฬ “Hidden Gems Of Isan” กิจกรรมพิเศษวันเปิดฤดูกาล ตั้งแต่ 1 มิถุนายน 2567 ททท.สำนักงานอุดรธานี ขอมอบของที่ระลึกพิเศษ สายรัดข้อมือรุ่นพิเศษ เฉพาะนักท่องเที่ยวที่เดินทางร่วมกิจกรรมเปิดฤดูกาลท่องเที่ยวบึงกาฬ ประจำปี 2567 #สำหรับ100ท่านแรก ผู้ร่วมเปิดฤดูกาลในครั้งนี้* *ผู้ร่วมกิจกรรมตั้งแต่เวลา 7:00 น. เป็นต้นไป มาก่อนมีสิทธิ์ก่อน ณ บริเวณทางขึ้นถ้ำนาคา อ.บึงโขงหลง จ.บึงกาฬ
👍 โปรโมชั่น บัตรเดียว...เที่ยวอุทัย ลด 10% ตั้งแต่ 1 กรกฎาคม - 31 ธันวาคม 2567
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานอุทัยธานี
ร่วมกับผู้ประกอบการโรงแรม/ที่พัก ร้านอาหาร ร้านขายของที่ระลึก และ คาเฟ่ ในพื้นที่จังหวัดอุทัยธานี จัดกิจกรรม โปรโมชั่นครั้งยิ่งใหญ่แห่งปี ‼️ บัตรเดียว...เที่ยวอุทัย โปรโมชั่นลด 10% จากร้านค้าที่ร่วมรายการมากกว่า 80 ร้านค้า
ตั้งแต่ 1 กรกฎาคม - 31 ธันวาคม 2567
เงื่อนไขและวิธีการใช้บัตร
1.สแกน QR Code ตรวจสอบรายชื่อร้านค้าที่เข้าร่วมกิจกรรมฯ
2.สแกน QR Code ที่ป้ายตั้งโต๊ะ ณ ร้านค้าและบริการที่เข้าร่วมกิจกรรมฯ พร้อมตอบแบบสอบถาม โดยใส่ข้อมูลให้ครบถ้วน
3.จำกัด 1 สิทธิ์ / 1 ใบเสร็จ เท่านั้น !!
เงื่อนไขการขอรับบัตร
1.ขอรับบัตร ได้ที่ ททท.สำนักงานในประเทศ ทุกสำนักงาน และร้านค้าที่เข้าร่วมกิจกรรมฯ
2.ร้านค้าและบริการที่เข้าร่วมกิจกรรมมากกว่า 80 แห่ง
• โรงแรม/ที่พัก 37 แห่ง
• คาเฟ่ 23 แห่ง
• ร้านอาหาร 14 แห่ง
• ร้านขายของที่ระลึก 6 แห่ง
• บริษัททัวร์ 1 แห่ง
• อื่นๆ 1 แห่ง
สอบถามข้อมูลเพิ่มเติมได้ที่ Facebook page : ททท.สำนักงานอุทัยธานี
เบอร์โทรศัพท์ : 056-514651-2
👍 ปฏิทินกิจกรรมท่องเที่ยวเมืองพัทยา สิงหาคม 2567
สิงหาคมนี้ อัดแน่นเต็มอิ่มไปด้วยกิจกรรมการแข่งขันกีฬาดีๆ ที่เมืองพัทยา ตอกย้ำการเป็นเมืองกีฬา! Sports City & Sports Tourism
- 3-8 ส.ค.67 : การแข่งขันฟุตบอลเกาะล้านคัพ ครั้งที่ 2 ณ สนามฟุตบอลหญ้าเทียม ชุมชนเกาะล้าน
- 3-8 AUGUST 24 : 2nd KOH LARN CUP FOOTBALL COMPETITION @Koh Larn Community Artificial Grass Football Field
- 18 ส.ค.67 : การแข่งขันวิ่งเทรลพัทยา 2567 ณ แหลมบาลีฮาย
- 18 AUGUST 24 : PATTAYA TRAIL 2024 @Bali Hai Pier, Pattaya
- 21-25 ส.ค.67 : เทศกาลภาพยนตร์พัทยา 2567 ณ เมืองพัทยา
- 21-25 AUGUST 24 : PATTAYA FILM FESTIVAL 2024 @Pattaya City
- 22-25 ส.ค.67 : การแข่งขันเซปักตะกร้อพัทยาคัพ ครั้งที่ 21 ณ โรงเรียนเมืองพัทยา 7 (บ้านหนองพังแค)
- 22-25 AUGUST 24 : 21st SEPAK TAKRAW PATTAYA CUP 2024 @Pattaya City School 7 (Ban Nong Pang Kae)
- 30 ส.ค.-1 ก.ย.67 : การแข่งขันกีฬาชายหาดเมืองพัทยา ประจําปี 2567 ณ ชายหาดจอมเทียน
- 30 AUG-1 SEP 24 : PATTAYA BEACH SPORTS COMPETITION 2024 @Jomtien Beach
👍 ตารางกิจกรรม พิพิธภัณฑ์วิทยาศาสตร์ คลอง5
พิพิธภัณฑ์วิทยาศาสตร์ อพวช. เปิดบริการ วันอังคาร - วันศุกร์ เวลา 09.30 - 15.00 น. วันเสาร์ - อาทิตย์ และวันหยุดนักขัตฤกษ์ เวลา 09.30 - 17.00 น (หยุดทุกวันจันทร์) กิจกรรมหลักของพิพิธภัณฑ์วิทยาศาสตร์ • กิจกรรม Science Walk Rally • การแสดงทางวิทยาศาสตร์ Science Show • การทดลองทางวิทยาศาสตร์ (Science Lab) • โลกของหนูน้อยนักประดิษฐ์ (Enjoy Maker Space) • Science Dome • กิจกรรมฟรีอีกมากมาย __ กิจกรรมใหม่ๆ ประจำเดือน
- 16 - 18 สิงหาคม 2567 เวลา 9.30 - 17.00 น. กิจกรรม Wind Turbine พลังงานสะอาด...เพื่ออนาคต สนุกกับการออกแบบใบพัดและทดสอบการหมุนของกังหันลม โดยใช้กระบวนการ Engineering Design Process เพื่อสร้างความตระหนักในการส่งเสริมการใช้พลังงานสะอาดอย่างยั่งยืน
- 27 มิถุนายน 2567 เวลา 10:00 - 11:30 น. กิจกรรม Cosmic Classroom Online by NSM ครั้งที่ 3 ตอน "รู้จักยานอวกาศและภารกิจการสำรวจจักวาลอันน่าทึ่ง" วิทยากรโดย: กรทอง วิริยะเศวตกุล นักสื่อสารดาราศาสตร์ เจ้าของช่อง KornKT
- 8 มิถุนายน 2567 Enjoy Maker Space ตอน I Love NSM ร่วมประดิษฐ์แบบจำลองตึกลูกเต๋า เพื่อเป็นของที่ระลึกสุดสร้างสรรค์ รอบเวลา 10.00 น. / 11.00 น. / 13.00 น. / 14.00 น.
- กิจกรรม Cosmic Classroom Online by NSM. ตอน "กำเนิดเอกภพและจุดเริ่มต้นของการศึกษาดาราศาสตร์ " วันที่ 23 พฤษภาคม 2567 (สำหรับกลุ่มผู้สนใจทั่วไป อายุ 13-18) วันที่ 31 พฤษภาคม 2567 (สำหรับกลุ่มนักเรียนจากโรงเรียน ระดับชั้น ม.1-6) เวลา 10:00 - 11:30 น. ผ่านช่องทางออนไลน์ Microsoft Team กิจกรรมร่วมหาคำตอบ เอกภพเกิดขึ้นได้อย่างไร เอกภพกว้างใหญ่แค่ไหน โลกของเราแบนจริงหรือไม่ ใครคือผู้พลิกโฉมวงการดาราศาสตร์
- เฉลิมฉลองเดือนแห่งพิพิธภัณฑ์สากล International Museum Day 2024 และ รู้จักผึ้งความสำคัญของประชากรผึ้งในวันผึ้งโลก (World Bee Day) พบกับกิจกรรมพิเศษ ที่คั่นหนังสือทำมือ ที่คุณสามารถรังสรรค์ ออกแบบ ได้ด้วยตัวเอง ณ พิพิธภัณฑ์วิทยาศาสตร์ ชั้น 1 Resource Center ทุกวันเสาร์ เริ่ม 4 พฤษภาคม 2567 ตั้งแต่เวลา 09.30 -16.30 น.
- ประกาศ! ปิดให้บริการ 4 พิพิธภัณฑ์ อพวช. และ 2 จัตุรัสวิทยาศาสตร์ อพวช. วันเสาร์ที่ 27 - วันจันทร์ที่ 29 เมษายน 2567
- 19 เมษายน 2567 กิจกรรมวันห้องปฏิบัติการโลก หรือ World Laboratory Day (23 เมษายน) โดย ตึกลูกเต๋า จะมีกิจกรรม Collection Talk พูดคุยเกี่ยวกับความสำคัญ ห้องปฏิบัติการต่างๆ ทั้งทางเคมี และ ชีววิทยา พร้อมชมนิทรรศการ Collection เครื่องมือ ห้องปฏิบัติการ
👍 การประกวดคัดเลือกอาหารพื้นถิ่นจังหวัดร้อยเอ็ด “10 เมนู แซ่บเกินร้อย ที่เมืองร้อยเกิน”
สำนักงานการท่องเที่ยวและกีฬาจังหวัดร้อยเอ็ด ขอเชิญชวนผู้ประกอบการร้านอาหาร/เจ้าของร้านอาหาร ที่มีสถานที่ตั้ง อยู่ในพื้นที่จังหวัดร้อยเอ็ด ร่วมส่งผลงานเมนูอาหารเข้าร่วมรับการประกวดคัดเลือกอาหารพื้นถิ่นจังหวัดร้อยเอ็ด “10 เมนู แซ่บเกินร้อย ที่เมืองร้อยเกิน” เพื่อให้เป็นอาหารพื้นถิ่นประจำจังหวัดร้อยเอ็ด และเข้าร่วมกิจกรรมส่งเสริมการท่องเที่ยวเชิงอาหาร มหกรรมอาหารอัตลักษณ์พื้นถิ่น กลุ่มจังหวัดร้อยแก่นสารสินธุ์ (ROI-KAEN-SARA-SIN GASTRONOMY FESTIVAL) ณ จังหวัดมหาสารคามและจังหวัดร้อยเอ็ด โดยกำหนดจัดกิจกรรมจำนวน 2 ครั้ง คือ ครั้งที่ 1 ณ จังหวัดมหาสารคาม ระหว่างวันที่ 1 – 5 สิงหาคม 2567 ณ อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 มหาวิทยาลัยมหาสารคาม อำเภอเมืองมหาสารคาม จังหวัดมหาสารคาม และครั้งที่ 2 ณ จังหวัดร้อยเอ็ด ระหว่างวันที่ 14 – 18 สิงหาคม 2567 ณ ROI ET TOWER หรือหอโหวด 101 อำเภอเมืองร้อยเอ็ด จังหวัดร้อยเอ็ด *สมัครเข้าร่วมได้ถึง 25 มิถุนายน 67 นี้เท่านั้น
👍 กิจกรรมเด็ดๆใน จ.ชลบุรี เดือนกันยายน 2567
ปฏิทินกิจกรรมเด็ดๆใน จ.ชลบุรีเดือนกันยายน 2567
- Amazing Music Festival Over The Horizon
- งานมหกรรมสตรีทฟู้ด Chonburi Street Food Festival
- Pattaya Food & Hospitality Show 2024
- งานรำลึกวันคล้ายวันพระราชสมภพสมเด็จพระปิยมหาราช
- Chonburi International Music Festival in the Rain
- Pattana Pet Run 2024 ครั้งที่ 2
- LOMA RUN On The Beach 2024
👍 ไม่ตกเทรนด์ ต้องโหลด วอลเปเปอร์ เมืองโบราณศรีเทพ มรดกโลก
วอลเปเปอร์ เมืองโบราณศรีเทพ มรดกโลก
ภาพคนแคระจากฐานรอบเขาคลังใน ทั้ง 5 หน้า 5 รูปแบบ สัญญลักษณ์เมืองทวาราวดีศรีเทพนคร
นอกจากนี้ เพื่อเป็นศิริมงคล สร้างขวัญกำลังใจ สายมูทุกท่านเรามีการจัดทำวอลเปเปอร์
•องค์สุริยเทพ เทพแห่งการเริ่มต้นใหม่
•เทพชัมภระ เทพแห่งความมั่งคั่ง
•พระกฤษณะ เทพผู้ยิ่งใหญ่และชัยชนะ ให้ดาวน์โหลดฟรี
ของขวัญพิเศษจากจังหวัดเพชรบูรณ์ มอบให้ประชาชนทั่วโลก เพื่อร่วมเฉลิมฉลองในโอกาสที่เมืองโบราณศรีเทพ จังหวัดเพชรบูรณ์ ได้รับการรับรองและขึ้นทะะเบียนจากยูเนสโก เป็นมรดกโลกทางวัฒนธรรม
สนับสนุนโดย
• นายกฤษณ์ คงเมือง
ผู้ว่าราชการจังหวัดเพชรบูรณ์
•นายชัชวาลย์ เบญจสิริวงศ์
•นายสุเมธ ธีรนิติ
•นายชนก มากพันธ์ุ
รองผู้ว่าราชการจังหวัดเพชรบูรณ์
ออกแบบโดย
คุณเทพทินกร มาทา
คุณกฤชพล พงษ์นภารัตน์
👍 ปฏิทินกิจกรรมจ.อุดรธานี ประจำเดือน ตุลาคม 2567
👍 ปฏิทินกิจกรรม จ.หนองคาย เดือนตุลาคม 2567
👍 ททท.อุดร แนะนำเส้นทางท่องเที่ยว ตามรอยศรัทธาพญานาค ช่วงเทศกาลออกพรรษาบั้งไฟพญานาค ปี 2567
ททท.สำนักงานอุดรธานี แนะนำ เส้นทาง “ตามรอยศรัทธาพญานาค” ช่วงเทศกาลออกพรรษาบั้งไฟพญานาค ปี 2567 ครอบคลุมเส้นทางในพื้นที่ 3 จังหวัด ได้แก่ จ.อุดรธานี - จ.หนองคาย - จ.บึงกาฬ
จังหวัดอุดรธานี
1. คำชะโนด อ.บ้านดุง จ.อุดรธานี
2. วัดป่าดงหนองตาล อ.เมือง จ.อุดรธานี
3. วัดป่าสว่างธรรม อ.พิบูลย์รักษ์ จ.อุดรธานี
4. วัดภูตะเภาทอง อ.หนองวัวซอ จ.อุดรธานี
5. วัดศรีดาราม อ.ทุ่งฝน จ.อุดรธานี
จังหวัดหนองคาย
1. ศาลาแก้วกู่ อ.เมือง จ.หนองคาย
2. ถ้ำดินเพียง อ.สังคม จ.หนองคาย
3. พระธาตุบังพวน อ.เมือง จ.หนองคาย
4. วัดไทย อ.โพนพิสัย จ.หนองคาย
จังหวัดบึงกาฬ
1. วัดอาฮงศิลาวาส อ.เมือง จ.บึงกาฬ
2. ถ้ำนาคา อ.บึงโขงหลง จ.บึงกาฬ
3. วัดป่าเมืองเหือง อ.เมือง จ.บึงกาฬ
4. เกาะดอนโพธิ์ อ.บึงโขงหลง จ.บึงกาฬ
5. สำนักสงฆ์ห้วยหินแหบ อ.บึงโขงหลง จ.บึงกาฬ
👍 11 จุดชมบั้งไฟพญานาค จังหวัดหนองคาย ประจำปี 2567 นี้ วันที่ 17 ตุลาคม 2567
ศูนย์บริการข้อมูลข่าวสารการท่องเที่ยวจังหวัดหนองคาย ประกาศ จุดชมบั้งไฟพญานาคจังหวัดหนองคาย บริเวณริมแม่น้ำโขง ซึ่งปีนี้ปรากฏการณ์ 15 ค่ำ เดือน 11 ตรงกับคืนวันที่ 17 ตุลาคม 2567
ทุกๆ ปี จะมีปรากฏการณ์ในแม่น้ำโขง ที่เราเรียกกันว่า #บั้งไฟพญานาค ซึ่งมีความเชื่อที่ว่าลูกไฟที่ขึ้นจากน้ำเกิดจากพญานาคที่อยู่ในเมืองบาดาลนั่นเอง ในทุกปีจะมีประชาชนมารอชมปรากฎการณ์บั้งไฟพญานาคตลอดแนวริมโขง สำหรับปีนี้ จุดชมบั้งไฟพญานาคจังหวัดหนองคาย มีที่ไหนบ้าง
1.ริมโขงวัดไทย อ.โพนพิสัย
2.ริมโขงบ้านหนองกุ้งเหนือ-บ้านหนองกุ้งใต้ อ.โพนพิสัย
3.ริมโขงพุทธอุทยาน อ.โพนพิสัย
4.ริมโขงบ้านน้ำเป อ.รัตนวาปี
5.ริมโขงบ้านท่าม่วง อ.รัตนวาปี
6.ริมโขงบ้านตาลชุม อ.รัตนวาปี
7.ริมโขงบ้านหนองแก้ว อ.รัตนวาปี
8.ริมโขงบ้านโพนแพง อ.รัตนวาปี
9.ริมโขงบ้านอาญา อ.รัตนวาปี
10.ริมโขงบ้านเปงจาน อ.รัตนวาปี
11.ริมโขงบ้านต้อนน้อย-บ้านต้อนใหญ่ อ.รัตนวาปี
👍 ปรากฏการณ์บั้งไฟพญานาค คืนวันออกพรรษา ขึ้น 15 ค่ำเดือน 11 วันที่ 17 ตุลาคม 2567
จังหวัดหนองคายขอเชิญร่วมพิสูจน์ปรากฏการณ์บั้งไฟพญานาค คืนวันออกพรรษา ขึ้น 15 ค่ำเดือน 11 ปีนี้ตรงกับวันที่ 17 ตุลาคม 2567 ในพื้นที่ 6 อำเภอริมฝั่งแม่น้ำโขง จ.หนองคาย งานเทศกาลบุญใหญ่ประจำปีสุดอลังการของจังหวัด ตระการตากับการแสดงแสงสีเสียง การแสดงศิลปะวัฒนธรรมลุ่มน้ำโขงและอื่นๆ มากมาย
👍 งานสัปดาห์สะพานข้ามแม่น้ำแควและงานกาชาดจังหวัดกาญจนบุรี 2567 ตั้งแต่ 28 พฤศจิกายน - 8 ธันวาคม 2567
งานสัปดาห์สะพานข้ามแม่น้ำแคว และงานกาชาดจังหวัดกาญจนบุรี 2567 ตั้งแต่ 28 พฤศจิกายน - 8 ธันวาคม 2567 ช่วงเวลาแห่งความสุขสนุกสนาน 10 วัน 10 คืนเต็ม ณ สะพานข้ามแม่น้ำแคว จังหวัดกาญจนบุรี มาเดินเที่ยวชมงาน แสงสีเสียง ย้อนรอยประวัติศาสตร์ อลังการ ท่ามกลางสัมผัสลมหนาวเดือนธันวาคม ร่วมสนุกกับคอนเสริ์ตศิลปินดังทุกคืน กับศิลปินบิ๊กเนมปีนี้ ได้แก่ คาราบาว BIG ASS COCKTAIL บ่าววี อาร์สยาม และอีกเพียบ ชมเชียร์การประกวดนางงามสันติภาพ ประกวดร้องเพลงลูกทุ่งไทย ชิมชอมช็อปสินค้าราคาถูก อาหารอร่อย เครื่องดื่มขนมเพียบตลอดงาน
👍 5 วัดดังในจังหวัดระยอง ไปไหว้พระขอพรเสริมสิริมงคล
สายมูห้ามพลาด ! 5 วัดดังในจังหวัดระยอง หยุดยาวออกไปไหว้พระขอพรเสริมสิริมงคลรับวันเข้าพรรษา
1. วัดละหารไร่ อ.บ้านค่าย พิกัด
2. วัดถ้ำเขาประทุน อ.เขาชะเมา พิกัด
3. วัดป่าประดู่ อ.เมืองระยอง พิกัด
4. วัดราชบัลลังก์ประดิษฐาราม บ้านทะเลน้อย อ.แกลง พิกัด
👍 ปฎิทินท่องเที่ยวฉะเชิงเทรา ประจำปี 68
ปฎิทินท่องเที่ยวฉะเชิงเทรา ประจำปี 68
จัดทำโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดฉะเชิงเทรา MOTS Chachoengsao
👍 ปฏิทินฟูลมูนปาร์ตี้ ปี 2025 เกาะพะงัน (Full Moon Party Koh Phangan 2025)
กิจกรรมท่องเที่ยวที่ปฏิเสธไม่ได้ของสุราษฎร์ธานี คือ
กิจกรรมฟูลมูนปาร์ตี้ (Full Moon Party Koh Phangan 2025) เกาะพะงันซึ่งในปี 2025 มีปฏิทินกำหนดการจัดงานไว้ชัดเจนตั้งแต่ต้นปี จำนวน 13 ครั้ง (รวม countdown ส่งท้ายปี 2025-2026) งานฟูลมูนปาร์ตี้เกาพะงัน ของแท้ มีกำหนดจัดขึ้นในทุกคืนวันพระจันทร์เต็มดวง ที่หาดริ้น เกาะพะงัน ประเทศไทย. ในกรณีที่วันพระจันทร์เต็มดวงรอบนั้นตรงกับวันพระใหญ่ (อันได้แก่ มาฆบูชา วิสาขบูชา อาสาฬหบูชา เข้าพรรษา ออกพรรษา) จะทำการเลื่อนไปจัดวันถัดไป สาเหตุที่เลื่อนเนื่องจากกฏหมายปัจจุบันกำหนดให้ห้ามจำหน่ายสุราในวันดังกล่าว
ปฏิทินฟูลมูนปาร์ตี้ เกาะพะงัน 2025 วันจันทร์ที่ 13 มกราคม 2025 วันพฤหัสบดีที่ 13 กุมภาพันธ์ 2025 วันพฤหัสบดีที่ 13 มีนาคม 2025 วันเสาร์ที่ 12 เมษายน 2025 วันจันทร์ที่ 12 พฤษภาคม 2025 วันอังคารที่ 10 มิถุนายน 2025 วันเสาร์ที่ 12 กรกฎาคม 2025 วันเสาร์ที่ 9 สิงหาคม 2025 วันอาทิตย์ที่ 7 กันยายน 2025 วันพุธที่ 8 ตุลาคม 2025 วันพุธที่ 5 พฤศจิกายน 2025 วันศุกร์ที่ 5 ธันวาคม 2025 วันพุธที่ 31 ธันวาคม 2025 Countdown
👍 ท่องเที่ยวชุมชนยลวิถี จังหวัดสระแก้ว
สนง.การท่องเที่ยวและกีฬาจังหวัดสระแก้ว ชวนท่องเที่ยวชุมชนยลวิถี น่าสนใจหลายชุมชนในสระแก้ว ได้แก่
👍 นมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ระหว่างวันที่ 29 มกราคม ถึง 29 มีนาคม 2568
ปี 2568 นี้ อุทยานแห่งชาติเขาคิชฌกูฏ จังหวัดจันทบุรี ได้เปิดนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ระหว่างวันที่ 29 มกราคม ถึง 29 มีนาคม 2568 เป็นเวลา 2 เดือนเต็ม ที่คาดว่าปีนี้จะมีผู้มาเดินขึ้นเขาหลายแสนคน แนะผู้มานมัสการศึกษา
วิธีการจองคิวและกำหนดการให้ดี👍 ศูนย์ส่งเสริมและพัฒนาอาชีพเสริมนอกภาคการเกษตร (ศูนย์ศิลปาชีพบางไทร เดิม) เปิดให้ เข้าเยี่ยมชมได้ทุกวัน ฟรี
ศูนย์ส่งเสริมและพัฒนาอาชีพเสริมนอกภาคการเกษตร (ศูนย์ศิลปาชีพบางไทร เดิม) ต.ช้างใหญ่ อ.บางไทร
[facebook] จ.พระนครศรีอยุธยา เปิดให้ เข้าเยี่ยมชมได้ทุกวัน ฟรี ตั้งแต่เวลา 08.30 – 16.30 น.
ปักหมุดกิจกรรมที่น่าสนใจ • ชมสถาปัตยกรรมบ้านทรงไทย 4 ภาค ณ หมู่บ้านศิลปาชีพ 4 ภาค • ชมผลิตภัณฑ์ศิลปหัตถกรรมงานฝีมือ • สักการะบูชาพระโพธิสัตว์กวนอิมพันพระหัตถ์ • ชมนิทรรศการ “เล่าเรื่องสืบสานงานศิลปหัตถกรรม” • เพลิดเพลินไปกับพันธุ์ปลาน้ำจืด ณ วังปลา
👍 งานสมโภชพระพุทธชินราช ประจำปี 2568 วันที่ 3 - 9 กุมภาพันธ์ 2568
งานสมโภชพระพุทธชินราช ครบ ๖๖๘ ปี ประจำปี 2568
วัดพระศรีรัตนมหาธาตุวรมหาวิหาร จังหวัดพิษณุโลก ระหว่างวันที่ 3 - 9 กุมภาพันธ์ 2568 พระบูชาพระพุทธชินราช ขนาดหน้าตัก ๙ นิ้ว สร้าง ๑๖๘ องค์ พิธีพุทธาพิเษก ณ พระวิหารพระพุทธชินราช วันที่ ๒๘ มกราคม ๒๕๖๘
👍 งานมหกรรมท่องเที่ยวปัตตานีอาเซียน กตัญญูคู่ฟ้า มหาสมโภชเจ้าแม่ลิ้มกอเหนี่ยว ประจำปี 2568 วันที่ 9 – 15 กุมภาพันธ์ 2568
ททท. สำนักงานนราธิวาส เชิญร่วมอนุรักษ์และสืบสานประเพณี วัฒนธรรมพลังแห่งศรัทธา สู่การท่องเที่ยวจังหวัดปัตตานี ขอเชิญทุกท่านเที่ยวงานมหกรรมท่องเที่ยวปัตตานีอาเซียน กตัญญูคู่ฟ้า มหาสมโภชเจ้าแม่ลิ้มกอเหนี่ยว ประจำปี 2568 ระหว่างวันที่ 9 – 15 กุมภาพันธ์ 2568 ณ ศาลเจ้าเล่งจูเกียงปัตตานี อ.เมือง จ.ปัตตานี
กำหนดการ
วันที่ 11 กุมภาพันธ์ 2568 เวลา 13.38 น. เป็นต้นไป พิธีอัญเชิญองค์เจ้าแม่ลิ้มกอเหนี่ยว ประทับเกี้ยวใหญ่มหามงคล (เกี้ยวที่ใหญ่ที่สุดในประเทศไทย) และหามเกี้ยวรอบเมืองปัตตานี เวลา 19.00 น. พิธีเปิดงานมหาสมโภชเจ้าแม่ลิ้มกอ เหนี่ยว ประจำปี 2568
วันที่ 12 กุมภาพันธ์ 2568 เวลา 00.08 น. ปิดประตูศาลเจ้า พิธีทอดเบี้ยถามองค์พระ เวลา 05.09 น. อัญเชิญองค์พระออกจากศาลเจ้า เวลา 07.00 น. เป็นต้นไป พิธีลุยน้ำ ณ แม่น้ำปัตตานี เชิงสะพานเดชานุชิต เวลา 17.00 น. เป็นต้นไป พิธีลุยไฟ ณ ศาลเจ้าเล่งจูเกียง จังหวัดปัตตานี
14 กุมภาพันธ์ 2568 เวลา 18.08 น. เป็นต้นไป การแข่งขันเชิดสิงโตบนเสาดอกเหมย (รอบแรก)
15 กุมภาพันธ์ 2568 เวลา 18.08 น. เป็นต้นไป การแข่งขันเชิดสิงโต บนเสาดอกเหมย (รอบชิงชนะเลิศ) ภายในงานชมนิทรรศการ การแสดง และกิจกรรมอื่นๆ มากมาย
สอบถามข้อมูลเพิ่มเติม 073-333316 , 073-542343
👍 งานแผ่นดินสมเด็จพระนารายณ์มหาราช ครั้งที่ 37/2568
งานแผ่นดินสมเด็จพระนารายณ์มหาราช ครั้งที่ 37/2568 - หนึ่งปี พบกัน หนึ่งครั้ง - 14-23 กุมภาพันธ์ 2568 จังหวัดลพบุรีเปิดวังให้เที่ยว 10 วัน 10 คืน แต่งไทยไปเที่ยว งานเดียวที่ต้องห้ามพลาด!!!
สอบถามข้อมูลเพิ่มเติมได้ที่ ... TOURISM AUTHORITY OF THAILAND การท่องเที่ยวแห่งประเทศไทย (ททท.) สนง.ลพบุรี Facebook แฟนเพจ : ททท. สำนักงานลพบุรี : TAT Lopburi Office โทร : 036-770096 036-770097 ( เวลา 8.30-16.30) ทุกวัน
King Narai the Great Fair 37th 2025 14 - 23 February 2025 @.King Narai’s Palace
👍 กาญจนบุรี แจ้งเลื่อน งานเทิดพระเกียรติ สมเด็จพระนเรศวรมหาราช ประจำปี 2568 ออกไปอย่างไม่มีกำหนด
นายสิทธิวีร์ วรรณพฤกษ์ รองผู้ว่าราชการจังหวัดกาญจนบุรี
เปิดเผยว่า คณะกรรมการจัดงานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2568 ได้ประชุมเมื่อวันที่ 23 ธันวาคม 2567 เวลา 15.30 น. ณ ห้องประชุมแควใหญ่ ชั้น 5 ศาลากลางจังหวัดกาญจนบุรี กำหนดจัดงานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2568 ในระหว่างวันที่ 14 - 23 กุมภาพันธ์ 2568 ณ บริเวณ พระบรมราชานุสาวรีย์ สมเด็จพระนเรศวรมหาราช อำเภอพนมทวน จังหวัดกาญจนบุรี นั้น
จังหวัดกาญจนบุรี ขอเรียนว่า เนื่องจากมีเหตุผลบางประการทำให้ไม่สามารถดำเนินการจัดงานในเวลาที่กำหนดได้ จึงขอแจ้งเลื่อนการจัดงานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2568 ออกไปอย่างไม่มีกำหนด ทั้งนี้ จังหวัดจะแจ้งกำหนดการจัดงานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ให้ทราบอีกครั้ง
👍 ประเพณีแห่ผ้าขึ้นพระธาตุเจดีย์วัดเขาสุวรรณประดิษฐ์ 15 กุมภาพันธ์ 2568
แห่ผ้าขึ้นพระธาตุเจดีย์วัดเขาสุวรรณประดิษฐ์ ปิดทอง สรงน้ำรูปเหมือนพ่อหลวงจ้อย วันที่ 15 กุมภาพันธ์ 2568 ณ วัดเขาสุวรรณประดิษฐ์/สนามพระกิตติมงคลพิพัฒน์ (หลวงพ่อจ้อย) อำเภอดอนสัก จังหวัดสุราษฎร์ธานี
เวลา 15.00 น. - ผู้เข้าร่วมพิธีแห่ผ้าห่มพระธาตุ ตั้งขบวนพร้อมกัน ณ สนามพระกิตติมงคลพิพัฒน์ เวลา 15.30 น. - พิธีปล่อยขบวนแห่ผ้าขึ้นพระธาตุเจดีย์วัดเขาสุวรรณประดิษฐ์
เวลา 15.59 น. - เคลื่อนขบวนแห่ผ้าห่มพระธาตุเจดีย์ออกจากสนามพระกิตติมงคลพิพัฒน์ ไปตามถนนหน้าเมือง สู่พระธาตุเจดีย์วัดเขาสุวรรณประดิษฐ์
หมายเหตุ : 1. การแต่งกายผ้าไทย/ผ้าโทนสีขาว 2. กำหนดการอาจมีการเปลี่ยนตามความเหมาะสม
👍 งานวันสถาปนาและกาชาดจังหวัดบึงกาฬ ครั้งที่ 14 วันที่ 20-30 มีนาคม 2568
จังหวัดบึงกาฬ ขอเชิญเที่ยวงานวันสถาปนาและกาชาดจังหวัดบึงกาฬ ครั้งที่ 14 วันที่ 20-30 มีนาคม พ.ศ.2568 ณ บริเวณถนนข้าวเม่าริมโขง อ.เมืองบึงกาฬ จ.บึงกาฬ
ในงานท่านจะได้ร่วมกิจกรรมสุดยิ่งใหญ่แห่งปี พิธีเปิดงานสุดอลังการ การออกร้านสินค้าท้องถิ่น สินค้าเกษตร งานมหกรรมเครื่องเล่น และสวนสนุกขนาดใหญ่ งานเหล่ากาชาด สอยดาว กิจกรรมเด่นแต่ละอำเภอ งานพิธีพุทธาภิเษกพระใหญ่ พร้อมคอนเสิร์ตจากศิลปินชื่อดังทุกคืน!! 20 มีนาคม 68 เล็กสเร็น, สายแนน, วงน้ำพุ 21 มีนาคม 68 ครูเต้ย 23 มีนาคม 68 SPRITE 27 มีนาคม 68 บิวบอง จ่าลอด 28 มีนาคม 68 มนต์แคน แก่นคูน 29 มีนาคม 68 บัวผัน ศรีจันทร์ 30 มีนาคม 68 Fiixd x 1Mill x SNB 4Bang x Birdman
👍 MotoGP 2025 PT Grand Prix of Thailand 2025 (พีที กรังด์ปรีซ์ ออฟ ไทยแลนด์)
ศึกรถจักรยานยนต์ทางเรียบชิงแชมป์โลก “โมโตจีพี” ที่ประเทศไทยเป็นเจ้าภาพ สนามที่ 1 ของฤดูกาล รายการ PT Grand Prix of Thailand 2025 (พีที กรังด์ปรีซ์ ออฟ ไทยแลนด์) ระหว่างวันที่ 28 กุมภาพันธ์ - 2 มีนาคม 2568 ที่สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จ.บุรีรัมย์ โดยประเทศไทยเป็นเจ้าภาพปีที่ 6
👍 เทศกาลดอกเสี้ยวบาน ณ บ้านป่าเหมี้ยง วันที่ 28 กุมภาพันธ์ - 2 มีนาคม พ.ศ. 2568
พบกับเทศกาลดอกเสี้ยวบาน ณ บ้านป่าเหมี้ยง วันที่ 28 กุมภาพันธ์ - 2 มีนาคม พ.ศ. 2568
ดอกเสี้ยวเป็นดอกไม้ที่ปรากฏในวัฒนธรรมมากมาย โดยเฉพาะในเอเชียตะวันออกเฉียงใต้ โดยในบางวัฒนธรรม ดอกไม้นี้มักใช้ในพิธีกรรมที่เกี่ยวข้องกับความรักและระลึกถึงผู้ที่เราถูกใจ และในบางกรณีก็ใช้ในการเฉลิมฉลองนากรือความสำเร็จในด้านต่างๆ ดอกเสี้ยวนั้นถือเป็นสัญลักษณ์ของความรักที่บริสุทธิ์และยั่งยืน สอบถามข้อมูลเพิ่มเติม โทร.054-222214
👍 โปรแกรมภาพยนตร์หอภาพยนตร์ เดือนมีนาคม 2568
โปรแกรมหนังเดือนมีนาคม หอภาพยนตร์จัดโปรแกรมฉลองเดือนสตรีสากล และเชิดชู “กิตติศักดิ์ สุวรรณโภคิน” เนื่องในวาระ 80 ปี
ในเดือนมีนาคมอันเป็นวาระเดือนสตรีสากล หอภาพยนตร์เสนอโปรแกรม “Women Who Ran - หญิง วิ่ง!” เป็นการรวบรวมภาพยนตร์ที่มีฉากผู้หญิงวิ่งเป็นฉากสำคัญ รวมทั้งภาพยนตร์ที่พูดถึงการต่อสู้และไม่ยอมแพ้ของตัวละครหญิง การวิ่งของพวกเธอเหล่านี้สร้างทั้งอารมณ์ฮึกเหิม ชวนฝัน ลุ้นระทึก หรือแม้แต่อารมณ์ขัน เพราะบางครั้งเป็นผู้หญิงเองที่วิ่งไล่ตามตัวละครอื่น
นอกจากนี้ เดือนมีนาคมนี้ หอภาพยนตร์ (องค์การมหาชน) กับ ชมรมวิจารณ์บันเทิง ได้ร่วมจัดงานเชิดชูเนื่องในวาระ 80 ปีของ “กิตติศักดิ์ สุวรรณโภคิน” นักวิจารณ์และครูของคนรักภาพยนตร์ ตลอดจนบุคคลในวงการบันเทิงไทยมากมายหลายรุ่น ในวันที่ 9 มีนาคมนี้ และยังได้จัดโปรแกรมที่น่าสนใจดังนี้ .
10 หนังจาก กิตติศักดิ์ สุวรรณโภคิน โปรแกรมหนังจากการคัดเลือกของ กิตติศักดิ์ สุวรรณโภคิน ที่นำเสนอหนังประทับใจทั้งไทยและต่างประเทศอย่างละ 5 เรื่องมาจัดฉาย พร้อมจะมาร่วมสนทนากับผู้ชมที่หอภาพยนตร์
ละครเวทีจากบทดัดแปลงของ กิตติศักดิ์ สุวรรณโภคิน นอกจากศาสตร์ด้านภาพยนตร์ กิตติศักดิ์ สุวรรณโภคิน ยังสนใจในศาสตร์ละครเวที และมีบทบาทในการดัดแปลงบทภาพยนตร์จากต่างประเทศเป็นภาษาไทย เพื่อนำไปแสดงละครเวทีเรื่องดังหลายเรื่อง ซึ่งยังคงได้รับการนำมาแสดงโดยนักศึกษาการละครอยู่เป็นประจำ โปรแกรมนี้ได้นำตัวอย่าง 4 เรื่องมาจัดฉาย โดยทั้งหมดเป็นบันทึกการแสดงละครเวทีของบริษัท แดส เอ็นเทอร์เทนเม้นท์ ในช่วงทศวรรษ 2530 (ปัจจุบันคือ บริษัท ดรีมบอกซ์ จำกัด)
โปรแกรมภาพยนตร์โลกที่น่าสนใจ จากเยอรมัน ฝรั่งเศส สเปน อิหร่าน และญี่ปุ่น
👍 ดนตรีในสวนกรุงเทพมหานคร มีนาคม 2568
วันเสาร์ที่ 1 มีนาคม 2568 สวนเบญจกิติ เขตคลองเตย กลับมาอีกครั้งกับวงดนตรีสุดชิลล์ ในแนวเพลงสายแคมป์วง IN & Out เริ่ม 17.00 น.
วันอาทิตย์ที่ 2 มีนาคม 2568 สวนลุมพินี เขตปทุมวัน เทศกาลดนตรีในสวน วง Royal Bangkok Symphony Orchestra วาทยากร ดร. วานิช โปตะวนิช ศิลปินรับเชิญ คุณกิตตินันท์ ชินสำราญ และ คุณแนท บัณฑิตา ประชามอญ เริ่ม 17.30 น.
วันเสาร์ที่ 8 มีนาคม 2568 สวนเบญจกิติ เขตคลองเตย จัดเต็มกับ 4 วงดนตรีเยาวชน วง Diana Band วง Joe’s Kids วง Perfect Pitch วง Apollo Band เริ่ม 16.30 น.
วันอาทิตย์ที่ 9 มีนาคม 2568 สวนวชิรเบญจทัศ ไปเชียร์วงดนตรีเยาวชนกันครับ วง Sonic Bloom วง Dream High วง Zelestia เริ่ม 16.30 น.
Museum Siam เทศกาลดนตรีกรุงเทพมหานคร ๒๕๖๘ วง Bangkok Big Band ศิลปินรับเชิญ ทศพล หิมพานต์ และ ดวงตา คงทอง เริ่ม 17.00 น.👍 งาน “ฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี 198 ปี เมืองหนองคาย และงานกาชาด พ.ศ. 2568” วันที่ 5-13 มีนาคม 2568
งาน “ฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี 198 ปี เมืองหนองคาย และงานกาชาด พ.ศ. 2568” ระหว่างวันที่ 5-13 มีนาคม 2568 ณ บริเวณลานเฉลิมพระเกียรติฯ
กิจกรรมภายในงาน - พิธีบวงสรวงอนุสาวรีย์ปราบฮ่อ, สักการะสถานที่สำคัญ ชม “การแสดงประกอบแสงเสียง ตำนานสงครามปราบกบฏฮ่อ - การออกร้าน/การจัดแสดงนิทรรศการผลงานของส่วนราชการ และภาคเอกชน - งานแสดงแสง สี เสียง - กิจกรรมศิลปวัฒนธรรม/การบันเทิง - ถนนอาหาร - การจำหน่ายสินค้าราคาโรงงาน - การประกวดร้องเพลง - การประกวดตามโครงการ To be number one - การแข่งขันกีฬาประเภทต่างๆ ฯลฯ
คอนเสิร์ต 5 มีนาคม พงษ์สิทธิ์ คำภีร์ 6 มีนาคม บิว จิตรฉรีญา 7 มีนาคม มนต์แคน แก่นคูน 8 มีนาคม ใหม่ พัชรี 9 มีนาคม เบิ้ล ปทุมราช 10 มีนาคม saran 11 มีนาคม Fiixd + 1Mill 12 มีนาคม เบียร์ พร้อมพงษ์ 13 มีนาคม Youngohm
👍 งานประเพณีหกเป็งนมัสการพระมหาธาตุเจ้าภูเพียงแช่แห้ง ประจำปี 2568 วันที่ 7-13 มีนาคม 2568 ณ วัดพระธาตุแช่แห้ง
ขอเชิญร่วมงานประเพณีหกเป็งนมัสการพระมหาธาตุเจ้าภูเพียงแช่แห้ง ประจำปี 2568 วันที่ 7-13 มีนาคม 2568 ณ วัดพระธาตุแช่แห้ง พระอารามหลวง อ.ภูเพียง จ.น่าน
ร่วมเฉลิมฉลอง “672 ปี งานประเพณีหกเป็ง นมัสการพระมหาธาตุเจ้าภูเพียงแช่แห้ง ประจำปี 2568” ยกระดับการจัดงานระดับชาติและระดับนานาชาติ ปีที่ 3 (2566-2570)
• วันที่ 7 มีนาคม 2568 ชมขบวนแห่หลวง พิธีเปิดงาน การแข่งขัน นักร้อง หางเครื่องของกำนัน - ผู้ใหญ่บ่าน
• วันที่ 8 มีนาคม 2568 การแข่งขันรำวงม่ะเก่า
• วันที่ 9 มีนาคม 2568 กิจกรรม TO BE NUMBER ONE
• วันที่ 10 มีนาคม 2568 การแข่งขันตีกลองยาว
• วันที่ 11 มีนาคม 2568 การประกวดหนูน้อยวัฒนธรรม
• วันที่ 12 มีนาคม 2568 ขบวนแห่สักการะ 15 อำเภอ การแข่งขันนักร้อง หางเครื่อง โรงเรียนมัธยม ( ชมการแสดงแสง สี เสียง )
• วันที่ 13 มีนาคม 2568 พิธีสรงน้ำสรงพระราชทาน ( ชมการแสดงแสง สี เสียง )
นอกเหนือจากนั้น ภายในงาน จะได้พบกับ การสาธิตภูมิปัญญาท้องถิ่นชุมชนยลวิถีวัดพระธาตุแช่แห้ง ขัวศิลปหัตถกรรมและละอ่อนน่าน ถนนคนเดิน, กิจกรรมสอยดาว และประกวดบอกไฟดอก ขอเชิญร่วมเป็นเจ้าภาพถวายน้ำปานะ คณะสงฆ์เจริญพระพุทธมนต์สมโภช วันละ จำนวน 100 รูป ทุกวัน ผ่าน ธนาคารกรุงไทย เลขที่บัญชี 695-039-049-1 ชื่อบัญชี โครงการบูรณะพระมหาธาตุเจ้าภูเพียงแช่แห้ง หรือ ธนาคารกสิกรไทย เลขที่บัญชี 076-1-69237-2 ชื่อ โครงการบูรณะพระมหาธาตุเจ้าภูเพียงแช่แห้ง
👍 งานสดุดีท้าวเทพกระษัตรี ท้าวศรีสุนทร ประจำปี 2568 ระหว่างวันที่ 13 -15 มีนาคม 2568
ขอเชิญเที่ยวงานสดุดีท้าวเทพกระษัตรี ท้าวศรีสุนทร (ย่าจัน ย่ามุก) ประจำปี 2568 ระหว่างวันที่ 13 -15 มีนาคม 2568 ณ ทุ่งถลางชนะศึก (โคกชนะพม่า) อำเภอถลาง จังหวัดภูเก็ต ชมการแสดงแสง สี เสียง ละครอิงประวัติศาสตร์ น้อมสดุดีสองวีรสตรีศรีถลาง การแสดงวิถีชีวิตพื้นบ้าน ลานวัฒนธรรม และการออกร้านจำหน่ายอาหารกว่า 200 ร้านค้า และกิจกรรมอื่นๆ อีกมากมาย
👍 SRICHUM Enlightening Faith วัดศรีชุม@เส้นแสงแห่งแรงศรัทธา วันที่ 21-23 มีนาคม 2568
SRICHUM Enlightening Faith วัดศรีชุม @ เส้นแสงแห่งแรงศรัทธา วันที่ 21-23 มีนาคม 2568 (วันศุกร์ - วันเสาร์- วันอาทิตย์) เวลา 17.00 น. - 22.00 น. ณ วัดศรีชุม อุทยานประวัติศาสตร์สุโขทัย
Projection Mapping หรือ การสร้างผลงานทางศิลปะด้วยการสาดแสง สีและฉายภาพด้วย Projector ลงบนพื้นผิววัตถุ ให้ออกมาเป็นรูปทรงอย่างๆไร้ขีดจำกัด ผ่านการเล่าเรื่องราวประวัติศาสตร์ที่เกี่ยวกับสุโขทัย ความศรัทธาในพระพุทธศาสนา และลวดลายศิลปะของสุโขทัย เที่ยวชมกาดนัด “มู Market “ เสี่ยงเซียมซีลุ้นรับของมงคลเสริมดวง ช้อปสินค้าของที่ระลึก ชิมอาหารพื้นถิ่น พิเศษ ช้อปปิ้งในงาน สะสมยอดครบตามจำนวน ลุ้นรับของที่ระลึกจาก ททท.กลับบ้านได้อีกต่อ
👍 งานวันฉลองวันแห่งชัยชนะ ท้าวสุรนารี ประจำปี 2568 วันที่ 23 มีนาคม - 3 เมษายน 2568
งานวันฉลองวันแห่งชัยชนะ ท้าวสุรนารี ประจำปี 2568 วันที่ 23 มีนาคม - 3 เมษายน 2568 ณ บริเวณสนามหน้าศาลาการเปรียญ วัดสุทธจินดาวรวิหาร จังหวัดนครราชสีมา และจุดอื่นๆรอบๆบริเวณ พบกับกิจกรรมอัดแน่น เฉลิมฉลองกัน 12 วัน 12 คืน ด้วยคอนเสิร์ตจากศิลปินบิ๊กเนมแน่นๆ การแสดงรำวงย้อนยุค และการแสดงลิเก เลือกชมตามชอบตามวัย สนุกได้เต็มที่
คอนเสิร์ตศิลปินดัง งานย่าโมโคราช สุดอลังการ จัดยิ่งใหญ่ 12 วันเต็ม 23 มีนาคม : เสก โลโซ 24 มีนาคม : Only Monday 25 มีนาคม : PUN / เล็ก รัชเมศฐ์ 26 มีนาคม : Tilly Birds 27 มีนาคม : ตั๊กแตน ชลดา / ติ๊ก ชิโร่ 28 มีนาคม : บิ๊กแอส 29-30 มีนาคม : กิจกรรมพิเศษจากจังหวัด 31 มีนาคม : มนต์แคน แก่นคูณ / ไรอัล กาจบัณฑิต 1 เมษายน : Three Man Down 2 เมษายน : พงษ์สิทธิ์ คัมภีร์ 3 เมษายน : ศิลปินเซอร์ไพรส์ (รอยืนยัน)
กิจกรรมไฮไลต์ภายในงาน การแสดงแสงสีเสียงตำนานย่าโม – ถ่ายทอดเรื่องราวความกล้าหาญของวีรสตรีโคราชผ่านการแสดงสุดอลังการทุกคืน โซนร้านอาหารชื่อดังจากทั่วประเทศ – คัดสรรเมนูเด็ดจากร้านยอดนิยมมาให้ทุกคนได้ลิ้มลอง ตลาดท้องถิ่น – สนับสนุนสินค้าและของดีจากชุมชนในพื้นที่
👍 งานหนังสือทับแก้วบุ๊คแฟร์ ครั้งที่ 17 วันที่ 24 กุมภาพันธ์ - 2 มีนาคม 2568
งานหนังสือที่ ม.ศิลปากร-ทับแก้ว ทับแก้วบุ๊คแฟร์ ครั้งที่ 17 วันที่ 24 กุมภาพันธ์ - 2 มีนาคม 2568 เวลา 09:00 – 20:30 น. ณ หอสมุดพระราชวังสนามจันทร์ มหาวิทยาลัยศิลปากร จ.นครปฐม ขอเชิญทุกท่านร่วมเดินทางสู่โลกแห่งการเรียนรู้ พบปะพูดคุย แลกเปลี่ยน และค้นพบแรงบันดาลใจใหม่ ๆ ในบรรยากาศอบอุ่นและเป็นกันเอง
พบกับ… • ร้านค้า/ สำนักพิมพ์: ที่มาร่วมจำหน่ายทั้งหนังสือใหม่ หนังสือทรงคุณค่า สื่อการเรียนการสอน และสื่อพัฒนาสมอง พร้อมโปรโมชั่นพิเศษเฉพาะในงานฯ • ร้านอาหารและเครื่องดื่ม: เติมพลังด้วยอาหาร ทั้งของทานเล่น อาหารจานหลัก และเครื่องดื่ม • งาน D.I.Y.: ร่วมสร้างสรรค์ชิ้นงาน D.I.Y. สุดเก๋ไม่ซ้ำใครกับทีมอาจารย์จากโรงเรียนสาธิตฯ มหาวิทยาลัยศิลปากร • คลินิกหนังสือ: ดูแลรักษาหนังสือเล่มโปรดของคุณกับผู้เชี่ยวชาญที่จะมาให้คำแนะนำและสาธิตวิธีการดูแลรักษาหนังสือทั้งใหม่และเก่า ให้กลับมาอยู่ในสภาพดี • SANAM Small Green: ร่วมรักษ์สิ่งแวดล้อมกับ SANAM Small Green พลังเล็ก ๆ เพื่อโลกสีเขียว เริ่มต้นได้ด้วยสองมือเรา • ลานปล่อยของ: พื้นที่สำหรับนักเรียน นักศึกษามหาวิทยาลัยศิลปากร ได้แสดงฝีมือและไอเดียสร้างสรรค์อย่างอิสระ • กิจกรรมเวที: ตั้งแต่เวลา 16.00 น. เป็นต้นไป เพลิดเพลินกับกิจกรรมหลากหลายบนเวที การพูดคุยกับนักเขียนที่ชื่นชอบ การแสดงศิลปะวัฒนธรรมพื้นบ้าน และปิดท้ายค่ำคืนให้ชุ่มชื่นหัวใจด้วยเสียงดนตรี
ข้อมูลเพิ่มเติมสามารถติดต่อ Tel : 081-3272881
👍 ประกาศวันเก็บเกี่ยวทุเรียนภาคตะวันออก ปี 2568
สำนักงานส่งเสริมและพัฒนาการเกษตรที่ 3 จังหวัดระยอง
ประกาศวันเก็บเกี่ยวทุเรียนภาคตะวันออก ปี 2568
- พันธุ์กระดุม วันที่ 4 เมษายน 2568
- พันธุ์พวงมณี และพันธุ์ชะนี วันที่ 10 เมษายน 2568
- พันธุ์หมอนทอง วันที่ 30 เมษายน 2568
เกษตรกรที่ต้องการเก็บเกี่ยวก่อนวันที่ประกาศ สามารถนำ
ตัวอย่างทุเรียนลูกที่อ่อนที่สุดในรุ่นที่ต้องการเก็บเกี่ยว ส่งตรวจวัดเปอร์เซ็นต์น้ำหนักแห้ง ได้ที่สำนักงานเกษตรอำเภอ สำนักงานเกษตรจังหวัด หรือจุดรับตัวอย่างที่ได้รับอนุญาตจากจังหวัดในพื้นที่ เพื่อออกใบรับรองความแก่ของทุเรียน แนบกับรถขนส่งทุเรียนไปจำหน่าย ณ ที่ล้งหรือโรงคัดบรรจุ
* ทั้งนี้จังหวัดระยอง จันทบุรี และตราด ดำเนินการออกประกาศ กำหนดเปอร์เซ็นต์น้ำหนักแห้งในเนื้อทุเรียนแต่ละพันธุ์ต่อไป ติดตามรายละเอียดเพิ่มเติมได้ที่ สำนักงานเกษตรจังหวัดระยอง สำนักงานเกษตรจังหวัดจันทบุรี และสำนักงานเกษตรจังหวัดตราด
👍 งาน Maha Songkran World Water Festival 2025


ประเทศไทยเตรียมยกระดับ เทศกาลสงกรานต์ สู่การเป็นเฟสติวัลระดับโลกในงาน Maha Songkran World Water Festival 2025 กระทรวงการท่องเที่ยวและกีฬาโดยการท่องเที่ยวแห่งประเทศไทย ชวนทุกคนมาร่วมเฉลิมฉลองและตอกย้ำความเป็น "มรดกภูมิปัญญาทางวัฒนธรรมที่จับต้องไม่ได้ของมนุษยชาติ" วันที่ 11-15 เมษายน 2568 ถนนราชดำเนิน & ท้องสนามหลวง กรุงเทพฯ 10 ไฮไลต์ห้ามพลาด! ลานสงกรานต์ 5 ภาค – สัมผัสอัตลักษณ์ประเพณีสงกรานต์จากทั่วไทย ขบวนพาเหรดสุดอลัง – ตระการตาด้วยสีสันและความสนุก เวทีดนตรี & ศิลปินดัง – สนุกไปกับคอนเสิร์ตสุดมันส์ ลานเล่นน้ำ x EDM Festival – สาดความมันส์ไปกับบีทสุดเร้าใจ โดรนโชว์แปรอักษร – ชมการแสดงสุดล้ำกลางฟ้า เทศกาลงานวัด – ก่อพระเจดีย์ทราย ชิงช้าสวรรค์ สายไหม และเกมสุดคลาสสิก ทำบุญ-สรงน้ำพระ – เสริมสิริมงคลต้อนรับปีใหม่ไทย รดน้ำดำหัวผู้สูงอายุ – สืบสานวัฒนธรรมอันงดงาม ตลาดของกินทั่วไทย – รวมเมนูเด็ดจากทุกภูมิภาค 5 Must Do in Thailand – สัมผัสกิจกรรมที่ห้ามพลาดเมื่อมาไทย สงกรานต์ทั่วไทยก็จัดเต็ม นอกจากกรุงเทพฯ ยังสามารถร่วมสนุกกับสงกรานต์อัตลักษณ์ เชียงใหม่ หนองคาย ขอนแก่น ชลบุรี นครศรีธรรมราช หาดใหญ่ และอีกมากมาย ตลอดเดือนเมษายน 2568 -
ครม.อนุมัติงบกลางสำหรับจัดงานนี้ ภายใต้กรอบวงเงิน 153 ล้านบาท👍 งาน ประเพณีบุญบั้งไฟ จังหวัดยโสธร ประจำปี 2568 วันที่ 16 -18 พฤษภาคม 2568
ขอเชิญเที่ยวงาน ประเพณีบุญบั้งไฟ จังหวัดยโสธร ประจำปี 2568 ระหว่างวันที่ 16 -18 พฤษภาคม 2568 (Rocket Festival in Yasothon, Thailand (Bun Bang Fai) 2025)
== กิจกรรม บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ==
รวมข่าวประกาศการให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยหน่วยงานต่างๆ ในหลายๆ จังหวัดทั่วประเทศไทย 1.ขอบเขตการใช้บังคับ พรบ.ข้อมูลส่วนบุคคล
สิทธิสวัสดิการบุคลากรและครอบครัวบุคลากรมหาวิทยาลัย
สิทธิสวัสดิการบุคลากรและครอบครัวบุคลากรมหาวิทยาลัย
- บุคลากร และครอบครัวบุคลากรมหาวิทยาลัยเทคโนโลยีสุรนารี รักษาพยาบาลที่โรงพยาบาลมหาวิทยาลัยเทคโนโยโลยีสุรนารีโดยใช้สิทธิสวัสดิการของมหาวิทยาลัย
- การรักษาด้านทันตกรรม บุคลากรในวงเงิน 5,000 บาท/ปี 3. การรักษาด้านทันตกรรม ครอบครัวบุคลากรในวงเงิน 3,000 บาท/ปี 4. บุคลกรและบุคคลในครอบครัวต้องชำระเงินเอง กรณี ศัลยกรรมความงาม, การตรวจครรภ์และการฝากครรภ์, การทำร้ายตนเอง,ดื่มสุรา, ยาเสพติด, กามโรค
สิ่งที่ต้องนำมาด้วย : นำบัตรประชาชน หรือบัตรพนักงาน หรือ บัตรสวัสดิการ มาแสดงสิทธิทุกครั้ง
ติดต่อสอบถามข้อมูลโรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี 044-376555
ลิงค์หน้าสมัครงาน รพ.ต่างๆ
รวมลิงค์ไปยังประกาศรับสมัครงาน ของรพ.รัฐต่างๆ รพ.ศูนย์ รพ.ศูนย์การแพทย์ รพ.มหาวิทยาลัย และอื่นๆ (ไม่รวมรพ.เอกชน สำหรับรพ.เอกชนคลิกที่นี่)
* สำหรับรายละเอียดงาน/การสมัคร โปรดติดต่อสอบถามกับรพ.แต่ละแห่งโดยตรง
ฟังดนตรีในสวนดีๆ ฟังฟรีๆ ในกรุงเทพและทั่วประเทศ
ตารางอบรม ปี 2566
*แนะนำสอบถาม/ตรวจสอบกับผู้จัดอีกครั้งเพื่อความถูกต้องและประโยชน์สูงสุดของท่านในการเข้าร่วมกิจกรรม/รับบริการรายชื่อแอปอันตราย 200 แอป ที่ต้องระวัง ห้ามโหลด
รอประกาศวันจัดงานอย่างเป็นทางการ
รอประกาศวันจัดงานอย่างเป็นทางการ
- งานประจำปี งานทำบุญคล้ายวันมรณภาพและปิดทองรูปหล่อหลวงพ่อรุ่ง ติสสโร วัดท่ากระบือ
- งานประจำปีปิดทอง ทำบุญหลวงปู่รอด วัดบางน้ำวน
- งานประจำปีปิดทอง นมัสการองค์หลวงพ่อแดง หลวงปู่สุด วัดกาหลง
- งานประจำปีปิดทอง หลวงพ่อโต หลวงพ่อเฮง รอยพระพุทธบาทจำลอง (วัดบ้านขอม)
- งานประจำปีปิดทอง นมัสการองค์หลวงพ่อสัมฤทธิ์ วัดนาโคก
- งานประจำปีปิดทอง หลวงพ่อพุทธกัสปและหลวงพ่อทองอยู่ ณ วัดท่าเสา อ.กระทุ่มแบน
- งาน ประจำปีปิดทอง หลวงพ่อคุ้ม วัดยกกระบัตร อ.บ้านแพ้ว
- งาน ประจำปีปิดทอง วัดบางปิ้ง ต.นาดี อ.เมือง
-
- งานประจำปีนมัสการ ปิดทองวัดหนองนกไข่ ต.หนองนกไข่ อ.กระทุ่มแบน
ผลิตภัณฑ์เสริมอาหาร Bluzone Fish Oil Plus โฆษณาคุณประโยชน์คุณภาพของอาหารอันเป็นเท็จหรือ หลอกลวง LINK
27 มกราคม 66 ผลิตภัณฑ์เสริมอาหาร Bluzone Fish Oil Plus ตามโฆษณา ฉลากระบุ Bluzone Fish Oil Plus+ 500 EPA/ 250 DHA Omega 960 Capsule ทั้งนี้ จากการตรวจสอบข้อมูลในระบบสืบค้นข้อมูลการอนุญาต ผลิตภัณฑ์ของสำนักงานคณะกรรมการอาหารและยาในชื่อ ผลิตภัณฑ์เสริมอาหาร ฟิชออย พลัส (ตรา บลูโซน)/Fish Oil Plus Dietary Supplement Product (BLUZONE Brand) พบผลิตภัณฑ์ได้รับ อนุญาตในเลขสารบบอาหาร 13-2-03555-5-0134 และเลขสารบบอาหาร 12-1-13353-5-0662 ซึ่งการ แสดงข้อความ ช่วยบรรเทาการอักเสบของร่างกายและหลอดเลือด ช่วยลดคอเลสเตอรอล ช่วยลดไตรกลีเซอไรด์ เพิ่ม HDL ดังกล่าว เป็นการโฆษณาคุณประโยชน์คุณภาพของอาหารอันเป็นเท็จหรือ หลอกลวงให้เกิดความหลงเชื่อโดยไม่สมควร เนื่องจากผลิตภัณฑ์อาหารไม่มีผลในการ บำบัด บรรเทา หรือรักษาโรค ซึ่ง อย. จะดำเนินการทางกฎหมายกับผู้กระทำการฝ่าฝืน พรบ. อาหาร พ.ศ. 2522 ต่อไป
ผลิตภัณฑ์ฉลากระบุ นาเมทีส ผลิตภัณฑ์เสริมอาหาร อย.ตรวจสอบแล้ว เป็นข้อมูลเท็จ LINK
9 มกราคม 66 ผลิตภัณฑ์ฉลากระบุ นาเมทีส ผลิตภัณฑ์เสริมอาหาร (Nametis Dietary Supplement Product) ทั้งนี้ จากการตรวจสอบข้อมูลในระบบสืบค้นข้อมูลการอนุญาตผลิตภัณฑ์ของ สำนักงานคณะกรรมการอาหารและยาในชื่อ นาเมทีส (ผลิตภัณฑ์เสริมอาหาร) พบผลิตภัณฑ์ได้รับ อนุญาตในเลขสารบบอาหาร 13-1-15859-5-0024 และเลขสารบบอาหาร 13-1-15859-5-0359 สถานะผลิตภัณฑ์: ยกเลิกโดยผู้ประกอบการ และเลขสารบบอาหาร 13-1-15859-5-0768 สถานะผลิตภัณฑ์: คงอยู่ ซึ่งการแสดงข้อความ ลดอัตราการเสี่ยงเป็นโรคหลอดเลือดหัวใจและ สมอง โรคสมองเสื่อม โรคเบาหวาน โรคมะเร็ง เข้าข่ายเป็นโฆษณาคุณประโยชน์ คุณภาพ หรือ สรรพคุณของอาหารอันเป็นเท็จ หรือเป็นการหลอกลวงให้เกิดความหลงเชื่อโดยไม่สมควร เนื่องจากผลิตภัณฑ์เสริมอาหาร ไม่มีผลในการบำบัด บรรเทา หรือรักษาโรค และต้องแสดงคำ เตือนดังกล่าวบนฉลาก ทั้งนี้ อย. จะดำเนินการทางกฎหมายกับผู้กระทำผิดต่อไป
เส้นทางท่องเที่ยว 7 อำเภอ….ในจังหวัดอ่างทอง LINK
สำนักงานการท่องเที่ยวและกีฬาจังหวัดอ่างทอง จัดทำคู่มือเส้นทางท่องเที่ยว 7 อำเภอ….ในจังหวัดอ่างทอง ล้ำค่าสุดๆ สำหรับการทำความรู้จักอ่างทองให้มากขึ้น ข้อดีเด่นคือสามารถไปเที่ยวแบบวันเดย์ทริปได้ง่ายๆ สถานที่ท่องเที่ยวสำคัญที่ต้องห้ามพลาด ได้แก่ ศาลหลักเมือง พิพิธภัณฑ์ตำนานเมืองอ่างทอง บ้านหุ่นเหล็ก วัดม่วง วัดเขียน อนุสาวรีย์ขุนรองปลัดชู วัดขุนอินทรประมูล วัดท่าอิฐ วัดจันทราราม วัดไชโย วัดทองครุ อนุสาวรีย์พันท้ายนรสิงห์ ศูนย์ตุ๊กตาชาววังบางเสด็จ วัดท่าสุธาวาส หมู่บ้านทำกลองเอกชา วัดสระแก้ว วัดป่าโมก วัดสามโก้ ตลาดน้ำสามโก้ เยอะมาก เห็นมะ
ห้องตรวจอายุรกรรม
อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 3 เบอร์โทรศัพท์ติดต่ออายุรกรรม 044-615002 ต่อ 4304
คลินิกเบาหวาน ความดันโลหิตสูง โทร.044-615002 ต่อ 4318
คลินิกพิเศษเฉพาะสาขา ต้องผ่านการตรวจอายุรกรรมทั่วไปก่อน จึงจะสามารถส่งเข้าคลินิกเฉพาะสาขาได้ ยกเว้นคลินิกผนัง คลินิกสูงอายุ
อบรมฟรี
ขอขอบคุณ ข่าวและภาพเหตุการณ์และความดีของเจ้าหน้าที่พยาบาลวิชาชีพทั่วประเทศ จาก
เพจสภาการพยาบาล และเชิญชวนติดตามข่าวสารความดีของเจ้าหน้าที่พยาบาลน้ำใจงามเหล่านี้อย่างต่อเนื่อง และเป็นกำลังใจให้กับพวกเขา ได้ที่
เพจสภาการพยาบาล++ กิจกรรมที่ผ่านไป ++
ผู้สนใจแนะนำตรวจสอบ-สอบถามกับผู้ให้บริการคอร์สอีกครั้ง บางคอร์สอาจเต็ม/มีเงื่อนไข/เปลี่ยนแปลง ฯลฯ
10 พิกัด ดำน้ำดูปะการัง ทะเลชุมพร
ททท.ชุมพร แนะนำ 10 จุดดำน้ำดูปะการัง ทะเลชุมพร
1.เกาะร้านไก่ ไฮไลท์ที่ห้ามพลาด คือ ปลาการ์ตูนอินเดียนแดงที่อาศัยตามดอกไม้ทะเล
2.เกาะร้านเป็ด???? ขึ้นชื่อว่าเป็นหนึ่งในเกาะของทะเลชุมพรที่มีดงดอกไม้ทะเลใหญ่และสวยงามที่สุด
3.เกาะง่ามใหญ่ จุดเด่นใต้น้ำที่จะเจอคือ ฝูงปลาการ์ตูนอินเดียนแดงที่ซ่อนตัวอยู่ในดอกไม้ทะเล หากโชคดีก็มีโอกาสเจอปลาฉลามวาฬ
4.เกาะง่ามน้อย เป็นจุดดำน้ำอีกจุดหนึ่งที่นิยมของนักดำน้ำ หากโชคดีก็มีโอกาสเจอปลาไหลมอร์เร่ย์ขนาดใหญ่และฉลามวาฬด้วย
5.เกาะกะโหลก เป็นจุดที่มีแนวปะการังหนาแน่นมาก สามารถพบปะการังฟองน้ำครก ปะการังสมอง ปะการังเขากวาง และชมฝูงปลาต่าง ๆ
6.เกาะทะลุ ลักษณะเด่นของเกาะทะลุก็คือมีโพรงถ้ำขนาดใหญ่หลายถ้ำคร่อมอยู่บนเกาะ หากโชคดีมีโอกาสเจอฉลามหูดำด้วย
7.เกาะมาตรา มีหาดทรายขาวนวลสลับกับโขดหิน จะมีปะการังน้ำตื้นที่เราสามารถไปดำน้ำดูความสวยงามของธรรมชาติที่อุดมสมบูรณ์แห่งหนึ่งของหมู่เกาะทะเลชุมพร
8.เกาะหลักแรด เป็นอีกจุดหนึ่งที่คนมักจะนิยมมาดำน้ำตื้นกัน จะพบกับฝูงปลานานาชนิดและดอกไม้ทะเลที่ยังคงความอุดมสมบูรณ์
9.เกาะละวะ เป็นเกาะหินขนาดใหญ่ที่มีความสูงชัน ไม่มีหาดทราย แต่สามารถดำน้ำตื้นมองทัศนียภาพใต้น้ำได้อย่างสวยงาม ไม่ว่าจะเป็นแนวปะการังน้ำตื้น ภูเขาดอกไม้ทะเล
10.เกาะลังกาจิว เป็นเกาะที่เราสามารถเดินขึ้นหาดเพื่อไปเดินชมบรรยากาศรอบ ๆ ได้ จุดสำคัญของเกาะลังกาจิวคือเป็นเกาะที่มีการสัมปทานรังนก เพราะมีนกนางแอ่น และค้างคาวจำนวนมากทำรังอาศัยอยู่
ปฏิทินท่องเที่ยวกาญจนบุรี มกราคม - มีนาคม 2567
ทีมทำหมัน LOVE DOG สนับสนุนโดย SOIDOG
ทีมทำหมัน LOVE DOG สนับสนุนโดย SOIDOG มูลนิธิเพื่อสุนัขในซอย ประจำจังหวัดชุมพร หน่วยทำหมันเคลื่อนที่เข้าพื้นที่จังหวัดชุมพรตั้งแต่ต้นปี 2566 มดงานเหล่านี้ทำหน้าที่ควบคุมจำนวนสุนัขจรและป้องกันการแพร่ระบาดของโรคพิษสุนัขบ้า
หน่วยบริการทำหมันสุนัขแมว และกิจกรรมของแต่ละเทศบาล
กรมอนามัยเดินหน้ากิจกรรมรณรงค์
กรมอนามัยเริ่มต้นการรณรงค์ โครงการแล้ว โดยออกเดินสายตรวจการและมอบรางวัล ณ พื้นที่ต่างๆ ที่อยู่ในเป้าหมาย เช่น จุดที่มี street food ที่ได้รับความนิยม ตลาดอาหาร ทั้งในพื้นที่กรุงเทพ และต่างจังหวัด [
ติดตามข่าวสารได้จากเพจกรมอนามัย]
9 สิงหาคม 2567 ชนะเหรียญทอง มวยสากลฯหญิง รุ่น 66kg
9 สิงหาคม 2567 Imane KHELIF คว้าเหรียญทอง มวยสากลฯหญิง รุ่น 66kg รอบชิงชนะเลิศ ชกชนะ คู่ชกจากจีน YANG Liu ได้สำเร็จ ด้วยคะแนน 5-0
ไฮไลท์จังหวัดสิงห์บุรี
พิพิธภัณฑสถานแห่งชาติ อินทร์บุรี มีโบราณวัตถุที่สำคัญ และเป็นที่รวมความรู้ด้านประวัติศาสตร์ วัดสว่างอารมณ์ เป็นวัดที่สืบทอดวิชาปั้นพระพุทธรูปมาจากตระกูลบ้านช่างหล่อธนบุรี วัดโพธิ์เก้าต้น อยู่ในค่ายบางระจัน เป็นสถานที่ที่วีรชนชาวบ้านบางระจันในสมัยปลายกรุงศรีอยุธยาใช้เป็นที่มั่นในการต่อต้านข้าศึก อุทยานแม่ลามหาราชานุสรณ์ แม่ลา เป็นชื่อลำน้ำธรรมชาติที่อุดมสมบูรณ์ไปด้วยอาหารของปลา วัดหน้าพระธาตุ มีพระปรางค์ที่สร้างขึ้นในสมัยอยุธยาตอนต้น สูงประมาณ 8 วา
ตัวอย่างกิจกรรมอบรมหมอหมู่บ้านในพระราชประสงค์ ที่จัดขึ้นในท้องถิ่น
คุณประภาศรี ทองกิ่งแก้ว มอบชุดสายล้างไต แก่หน่วยไตเทียม
26 มกราคม 2565 ในนามคณะผู้บริหารและบุคลากร โรงพยาบาลตากสิน ขอกราบขอบพระคุณ คุณประภาศรี ทองกิ่งแก้ว มอบชุดสายล้างไต แก่หน่วยไตเทียม มูลค่า 10,000 บาท พร้อมร่วมอนุโมทนาบุญในจิตศรัทธาของท่าน ขออำนวยพรให้สิ่งศักดิ์สิทธิ์ ที่ท่านเคารพสักการะโปรดดลบันดาล ให้ท่านและครอบครัวมีสุขภาพกาย สุขภาพจิตแข็งแรง เจริญรุ่งเรืองในกิจการที่ประกอบ มา ณ ที่นี้ ขอขอบคุณทุกน้ำใจที่มีให้โรงพยาบาลตากสิน
สัปดาห์ที่ 1 ระหว่างวันที่ 1 - 7 มกราคม 2566
ผู้ป่วยรักษาตัวในโรงพยาบาล (รายสัปดาห์)
จำนวน 997 ราย : เฉลี่ยรายวัน จำนวน 142 ราย/วัน
ผู้เสียชีวิต (รายสัปดาห์)
จำนวน 58 ราย : เฉลี่ยรายวัน จำนวน 8 ราย/วัน
หายป่วยสะสม 2,501,481 ราย (ตั้งแต่ 1 มกราคม 2565)
เสียชีวิตสะสม 12,934 ราย (ตั้งแต่ 1 มกราคม 2565)
10 HOURS NAKHONSAWAN 2023-2024 วันที่ 31 ธันวาคม 2566 - 1 มกราคม 2567
10 HOURS NAKHONSAWAN 2023-2024 วันที่ 31 ธันวาคม 2566 - 1 มกราคม 2567 อุทยานสวรรค์ (หนองสมบุญ/หนองสมบูรณ์) จ.นครสวรรค์ ระยะทาง 10 ชม.
4 มกราคม 2566 ผลกระทบหลังสูบกัญชา “กัญชาไม่ทำให้ใครตาย” ไม่เป็นเรื่องจริง
พ.ร.บ.กัญชา
- วันนี้เป็นการประชุมสภาผู้แทนราษฎรนัดแรกหลังเทศกาลปีใหม่ มีการพิจารณาเห็นชอบให้เลื่อนระเบียบวาระการประชุม 3 เรื่อง คือ ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. ... ร่าง พ.ร.บ.คู่ชีวิต พ.ศ. ... และ ร่าง พ.ร.บ.แก้ไขเพิ่มเติมประมวลกฎหมายแพ่งและพาณิชย์ (ฉบับที่ ...) พ.ศ. ... เรื่องที่คณะกรรมาธิการพิจารณาเสร็จแล้ว จำนวน 5 เรื่อง อาทิ ร่าง พ.ร.บ.การเข้าชื่อเพื่อถอดถอนสมาชิกสภาท้องถิ่นหรือผู้บริหารท้องถิ่น พ.ศ. ... ร่าง พ.ร.บ. ขนส่งทางราง พ.ศ. ... ร่าง พ.ร.บ.อาหาร (ฉบับที่ ...) พ.ศ. ... ฯลฯ และเรื่องด่วน จำนวน 10 เรื่อง
คู่มือกัญชา
- นพ.ณรงค์ อภิกุลวณิช รองปลัด สธ. กล่าวถึง ข้อกังวลกรณีนักท่องเที่ยวต่างชาติได้รับกัญชาจากเมนูอาหารเค้กกัญชา ส่วนมากเพราะใส่ช่อดอก ทั้งนี้ ประเทศไทยเป็นประเทศแรกในเอเชียที่ปลดล็อกกัญชาออกจากรายการยาเสพติดให้โทษ ทำให้ได้รับความสนใจจากนักท่องเที่ยวเกี่ยวกับผลิตภัณฑ์ที่มีกัญชาเพิ่มมากขึ้น ขอย้ำว่า สธ.มีนโยบายนำกัญชามาใช้ทางการแพทย์ สุขภาพและเศรษฐกิจ ไม่สนับสนุนการนำไปใช้เพื่อสันทนาการ ระหว่างรอ พ.ร.บ.กัญชา กัญชงฯ ได้ออกประกาศ สธ.หลายฉบับมาควบคุมการใช้กัญชาในทางที่ถูกต้อง และจัดทำคู่มือสื่อสารเกี่ยวกับกัญชาเพื่อทำความเข้าใจกับนักท่องเที่ยว เบื้องต้นจัดทำเป็นฉบับออนไลน์ภาษาอังกฤษชื่อ “10 Things Tourists need to know about cannabis in Thailand” และกำลังจัดทำภาษาอื่นๆ เพิ่มเติม เช่น จีน เกาหลี ญี่ปุ่น รัสเซีย เป็นต้น เพื่อให้นักท่องเที่ยวกลุ่มหลักได้เข้าถึงข้อมูลที่ถูกต้อง
ผลกระทบหลังสูบกัญชา
- นพ.สมิทธิ์ ศรีสนธิ์ โพสต์ว่า “กัญชาไม่ทำให้ใครตาย” ไม่เป็นเรื่องจริง เพราะงานวิจัยระดับโลกให้กัญชามีผลสัมพันธ์กับการตายกะทันหันได้ และในไทยมีเคสยืนยันชัดเจนว่ามีศพที่ตายจากกัญชาแล้วจากการผ่าศพและผลการตรวจเลือด เป็นชายไทยวัย 40 ปี มีประวัติใช้กัญชาก่อนเสียชีวิต ผ่าศพพบพยาธิสภาพที่สำคัญ คือ เส้นเลือดแดงเลี้ยงหัวใจตีบประมาณ 50% เพียงเส้นเดียว และผนังหัวใจห้องล่างซ้ายหนากว่าปกติเล็กน้อย ต่อมาผลทางพิษวิทยาพบ delta9-THC (สารที่เกิดจากการเสพกัญชา) ในเลือด 7.10 นาโนกรัม/มิลลิลิตร แต่ไม่พบในปัสสาวะ แสดงให้เห็นว่าผู้ตายเพิ่งใช้กัญชาก่อนเสียชีวิต และพบ carboxy-delta9-THC ทั้งในเลือดและปัสสาวะเป็นจำนวนมาก แสดงให้เห็นว่าผู้ตายใช้กัญชาเป็นประจำ และยังพบสาร mitragynine จากการเสพพืชกระท่อม สรุปสาเหตุการตายได้ว่า “โรคหัวใจขาดเลือดกำเริบจากการได้รับสารอนุพันธ์ของกัญชา” ซึ่งการตายสัมพันธ์กับการใช้กัญชาแบบนี้ เกิดจากการใช้กัญชาโดยการสูบครั้งเดียวก็เป็นไปได้ โดยไม่ต้องมีโรคประจำตัวใด ๆ หากนำมาเทียบกับเหล้าบุหรี่ กัญชาจะรุนแรงกว่า ส่วนประเด็นการตรวจกัญชา THC ในเลือดก็สำคัญมาก กรณีนี้พบ 7 นาโนกรัม/มิลลิลิตร ซึ่งบางห้องปฏิบัติการอาจตรวจไม่เจอ ทำให้แพทย์แปลผลผิดว่าไม่มีกัญชาในเลือด ต้องการให้กรมวิทยาศาสตร์การแพทย์ยืนยันว่า ทุกห้องปฏิบัติการสามารถตรวจพบ THC ได้ถึง 1 นาโนกรัมต่อมิลลิลิตร เพราะจากงานวิจัยนี้ THC เพียง 2 นาโนกรัม/มิลลิลิตร ก็สัมพันธ์กับการตายในกรณีแบบนี้ได้
- ผู้ใช้เฟซบุ๊กชื่อ จาด้า จาด้า โพสต์กรณีพาเพื่อนชาวอิตาลีไปเที่ยวถนนข้าวสาร เพื่อนแอบไปซื้อเค้กกัญชากิน ผ่านไป 20 นาทีปากเบี้ยว ตาลอย หายใจไม่ออก มือเท้าชา ต้องรีบนำส่ง รพ.ปิยะเวทการุณ ซึ่งไม่ให้คนไข้แอดมิท ไม่มีแพทย์ผู้เชี่ยวชาญดูแลไม่ได้ ต้องย้ายไปที่อื่น ขนมก้อนละ 200 บาท ค่ารักษา 3 หมื่น ล่าสุดปลอดภัยแล้ว แต่ยังปากเบี้ยว มือเท้าชาอยู่
- เด็กนักเรียนหญิงชั้น ม.2 โรงเรียนแห่งหนึ่งใน อ.นางรอง จ.บุรีรัมย์ ถูกรุ่นพี่ชั้น ม.6 มอมกัญชาด้วยการสูบแล้วพ่นควันใส่หน้าหลายครั้งจนมีอาการเบลอ ก่อนจับขืนใจต่อหน้าเพื่อนที่นั่งดูดปุ๊นเกือบ 10 คนบริเวณกระท่อมกลางนา ครอบครัวได้ลงบันทึกประจำวันไว้เป็นหลักฐาน และแจ้งความร้องทุกข์เพื่อดำเนินการตามกฎหมาย
- กลุ่มวัยรุ่น 13-15 ปี เกือบ 10 คน นั่งจับกลุ่มสูบกัญชา จากนั้นเด็กหนุ่มวัย 16 นักดัดแปลงปืนแบลงก์กัน เล่นรัสเซียนรูเล็ตต์ ใช้ปืนจ่อศีรษะเหนี่ยวไก ปืนลั่นดับคาบ้านร้างย่านหนองจอก แต่ครอบครัวไม่เชื่อ คาดเป็นฆาตกรรม เนื่องจากบาดแผลถูกยิงจากท้ายทอยขวาด้านหลัง แต่เด็กถนัดใช้มือซ้าย ขณะนี้อยู่ระหว่างผลตรวจพิสูจน์จากหน่วยงานที่เกี่ยวข้อง
- รับแจ้งเหตุทะเลาะวิวาทใช้อาวุธปืนยิงกันภายในสวนผลไม้ บ้านหนองมาตร อ.บ่อไร่ จ.ตราด ตำรวจเข้าตรวจสอบพบชายรายหนึ่งมีพฤติกรรมเมาสุราและเสพกัญชาเป็นประจำ ทำร้ายร่างกาย-ใช้อาวุธปืน แต่ผู้เสียหายกลับไม่เอาเรื่องแต่อย่างใด
สงกรานต์ กรุงเทพมหานคร
กรุงเทพมหานครเชิญชวนประชาชนร่วมใส่เสื้อลายดอก เที่ยวงานสงกรานต์กรุงเทพมหานคร ประจำปี 2566 สรงน้ำพระพุทธสิหิงค์และพระประจำวันเกิด ประพรมน้ำพระพุทธมนต์ เสริมสิริมงคลรับปีใหม่ไทย ในวันที่ 12 ถึง 14 เมษายน 2566 ณ ลานคนเมือง ศาลาว่าการกรุงเทพมหานคร (เสาชิงช้า)
5 มกราคม 2566 ข่าวลือย้าย นพ.สุภัทร
ข่าวลือย้าย นพ.สุภัทร
- มีกระแสลือว่าผู้ใหญ่ในรัฐบาลและผู้บริหารระดับสูงใน สธ. จะมีการสั่งย้าย นพ.สุภัทร ฮาสุวรรณกิจ ผอ.รพ.จะนะ และ ประธานชมรมแพทย์ชนบท ออกนอกพื้นที่ซึ่งทำงานอยู่มานานกว่า 20 ปี เนื่องจากการวิพากษ์วิจารณ์นโยบายกัญชาเสรี และ การมีส่วนร่วมกับชุมชนในการคัดค้านโครงการใหญ่ของรัฐบาลที่จะสร้างนิคมอุตสาหกรรมจะนะ และต่อต้านอำนาจรัฐ ชาวบ้านต้องการถามผู้มีอำนาจใน สธ. ถึงสาเหตุที่ต้องโยกย้าย ชาวจะนะไม่ยอมเด็ดขาด รมว.สธ.ต้องรับฟังเสียงของ ประชาชน
ด้าน นพ.สุภัทร กล่าวขอบคุณกำลังใจ เชื่อว่าผู้ใหญ่ในกระทรวงฯ จะดูแลเรื่องนี้อย่างดีที่สุด อาจจะถูกย้ายได้ แต่ตนเป็น ข้าราชการตัวเล็กๆ อยู่ชายแดนไกลๆ คาดว่าจะได้รับความเป็นธรรมและการได้อยู่ทำงานร่วมกับชุมชนที่นี่
กระทำผิดกฎหมาย
- จับชายวัย 21 ปี ขนกัญชาแท่งอัดแห้ง 3 ห่อใหญ่ น้ำหนักราว 200 กก. แหกด่าน ตร.ทางหลวงสี่แยกบ้านธาตุ อ.เมือง จ.สกลนคร เบื้องต้นแจ้งข้อหาความผิดตาม พ.ร.บ.ศุลกากร พ.ร.บ.กักพืช และ พ.ร.บ.จราจร6 มกราคม 2566 พ.ร.บ.กัญชาฯ
พ.ร.บ.กัญชาฯ
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึงการตั้งข้อสังเกตว่าพรรคฯ ต้องการให้ร่าง พ.ร.บ.กัญชาฯ ไม่ ผ่านในสภาฯ ชุดนี้ เพราะต้องการนำไปใช้หาเสียงว่า เป็นการพูดกระทบพรรค เราเป็นคนเสนอจะไม่อยากให้ผ่านได้อย่างไร นอกจากนี้ยังย้ำว่ากัญชาทางการแพทย์หากมีการใช้อย่างถูกต้อง ในเรื่องที่ถูกกฎหมายก็จะเกิดความปลอดภัย แต่หากนำไปใช้ ในทางที่ผิด แน่นอนว่ามีกฎหมายต่างๆ รองรับเรื่องนี้อยู่ มีทั้งค่าปรับและจำคุก เชื่อว่าหลายคนไม่อยากเสี่ยง ฉะนั้น ขอให้ ประชาชนใช้กัญชาให้เป็นไปตามเจตนารมณ์ของกฎหมายเพื่อให้เกิดประโยชน์สูงสุด
นายชินวรณ์ บุณยเกียรติ ส.ส.พรรคประชาธิปัตย์ กล่าวถึง ข้อเสนอให้เลื่อนร่างกฎหมายอื่นขึ้นพิจารณาแทนร่าง พ.ร.บ. กัญชาฯ ว่าเป็นร่างกฎหมายที่คณะกมธ.พิจารณาเสร็จแล้ว ไม่สามารถเลื่อนวาระอื่นขึ้นมาซ้ำได้ หากร่าง พ.ร.บ.กัญชาฯ พิจารณาไม่เสร็จหรือเกิดอุบัติเหตุทางการเมืองร่างก็ต้องตกไป ซึ่งเข้าใจว่าวุฒิสภาก็สนใจอยู่หลายประเด็น อาจต้องใช้เวลา ไม่ น่าทันที่จะประกาศใช้ในสมัยประชุมนี้
นายสมชาย แสวงการ วิปวุฒิสภา เผย สภาฯ พิจารณาร่าง พ.ร.บ.กัญชาฯ ผ่านไปได้เพียง 18 มาตรา จาก 95 มาตราว่า ไม่เห็นโอกาสที่วุฒิสภาจะได้พิจารณาร่างกฎหมายฉบับดังกล่าวให้เป็นกฎหมายบังคับใช้ได้ มีความเป็นไปได้สูงที่จะไม่ผ่านมา ให้วุฒิสภาพิจารณา หากเป็นเช่นนั้นจะทำให้เกิดช่องว่างของสุญญากาศกัญชาเสรี
นายพิพัฒน์ นนทนาธรณ์ นายกสมาคมนักวิจัยแห่งประเทศไทย เผย การถกเถียงในสภายังไม่ทำให้สังคมกระจ่างชัดถึง อนาคตของกัญชาไทยที่เป็นทั้งความมั่นคงทางด้านยาและสุขภาพทุกระดับ การคงไว้และการพัฒนาภูมิปัญญาไทยในการใช้ กัญชา การใช้เป็นทางออกของยาเสพติด เช่น ยาบ้า และโอกาสในการสร้างเศรษฐกิจ
นายประสิทธิ์ชัย หนูนวล กรรมาธิการพิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... และเครือข่ายเขียนอนาคตกัญชาไทย กล่าวว่า ภาพอนาคตสำคัญยิ่งต่อการออกแบบกัญชาไทยว่ากัญชาในประเทศนี้จะดำเนินบนเส้นทางใด การสร้างทิศทางของ กัญชาย่อมเกิดขึ้นจากการจุดประกายและการแสวงหาความรู้ การเสนอภาพลบของสื่อทำให้ประชาชนยิ่งห่างไกลจากความ เข้าใจกัญชาที่แท้จริง นำมาสู่ความลังเลสงสัย ทำให้เกิดความกลัว และเป็นอุปสรรคสำคัญของการกำหนดกลไกและภาพ อนาคตที่ถูกต้องของกัญชา
วอนแยกแยะข้อเท็จจริง
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึง กรณีต่างๆ ที่เกิดขึ้นในสังคมที่ถูกเชื่อมโยงถึงกัญชา ย้ำว่า จะต้องมีการวิเคราะห์ แยกแยะข้อมูล พิจารณาข้อเท็จจริงอย่างถี่ถ้วน เมื่อมีการสอบสวนข้อมูลชัด ๆ ก็กลายเป็นอีกเรื่อง ทำให้ประชาชนเกิดความสับสน ขาดความเชื่อมั่นในนโยบายกัญชาทางการแพทย์ได้ 3. งานวิจัยกัญชาในสหรัฐฯ สื่อที่นำเสนอ : เว็บไซต์ไทยรัฐ - งานวิจัยในสหรัฐฯ พบว่า เด็กอเมริกันอายุต่ำกว่า 6 ขวบที่กินกัญชาเข้าไปโดยไม่ได้ตั้งใจเพิ่มขึ้นนับพัน ผ่านการ ออกแบบผลิตภัณฑ์ผสมกัญชาให้ดูน่าดึงดูดใจ เช่น เยลลี่ ช็อกโกแลต มันฝรั่งทอด โดยที่รัฐบาลกลางยังไม่มีการออกกฎหมาย ควบคุมเรื่องนี้การแสดงดนตรี “Thai Japan Friendship Concert #3” วันเสาร์ที่ 6 มกราคม 2567 LINK
กรุงเทพมหานคร โดย กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว ขอเชิญชมการแสดงดนตรี ???? “Thai Japan Friendship Concert #3” โดยความร่วมมือของ Bangkok Metropolitan Orchestra, Thailand Trombone Ensemble และ AE Friendship Trombone Ensemble ???? ในกิจกรรมสานความร่วมมือทางด้านดนตรี วันเสาร์ที่ 6 มกราคม 2567 เวลา 14.00 น. ณ ห้องออดิทอเรียม ชั้น 5 หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร เข้าชมฟรี
Program
- Paul Dukas : Fanfare La Peri
- Mogens Andersen : Svenske Bas Nogle
- Gordon Jacob : Trombone Octet
- Ricardo Mollá : Song for Nurya
- Steven Verhelst : Pearl of the Orient
- ลาวดวงเดือน : Arr. by Thanapak Poonpol
Coffee IN FARM สระแก้ว ครั้งที่ 1 วันที่ 6 - 7 มกราคม 2567
Coffee IN FARM สระแก้ว ครั้งที่ 1 วันที่ 6 - 7 มกราคม 2567 พบกับ - ออกร้านสุดยอดกาแฟ สระแก้ว Barista S.K - การแสดงดนตรีในฟาร์ม - โคขุนไทยวากิว - อาหาร & เครื่องดื่ม S.K. Country Farm สระแก้ว Tel. 098-268-4076
Thailand International Half Marathon 2024 ครั้งที่ 10 วันอาทิตย์ที่ 7 มกราคม 2567
ไทยแลนด์อินเตอร์เนชั่นแนลฮาล์ฟมาราธอน ครั้งที่ 10 (10th Thailand International Half Marathon 2024 ) งานวิ่งแห่งปีของธรรมศาสตร์! เช้าวันอาทิตย์ที่ 7 มกราคม 2567 ณ ธรรมศาสตร์ ศูนย์รังสิต มี 2 ระยะ คือ มินิมาราธอน 10K และ ฟันรัน 5K จุดเริ่มต้นและเส้นชัยในธรรมศาสตร์สเตเดียม
POCARI SWEAT RUN THAILAND 2024 อาทิตย์ที่ 7 มกราคม 2567
POCARI SWEAT RUN THAILAND 2024 Time To Prove Yourself กับงานวิ่งสุดยิ่งใหญ่ต้อนรับปีใหม่ 2024 ที่รวมพลคน POCARI SWEAT มาปล่อยพลัง Run, Sweat and Smile ไปพร้อมกัน ในวันอาทิตย์ที่ 7 มกราคม 2567
Thailand International Half Marathon 2024 - January 7, 2024
The 10th Thailand International Half Marathon 2024, Thammasat’s running event of the year! Sunday morning, January 7, 2024 at Thammasat University, Rangsit Center. There are 2 stages: Mini Marathon 10K and Fun Run 5K, starting point and finish line at Thammasat Stadium.
www.facebook.com/tusportsเทศกาลดนตรีกรุงเทพ BANGKOK Music Fest 2024 Big Band & Jazz Sound 7 มกราคม 2567
เทศกาลดนตรีกรุงเทพมหานคร ๒๕๖๗ (BANGKOK Music Fest 2024) #BKKMusicFest5 “Big Band & Jazz Sound” ????
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว โดย กองการสังคีต ร่วมมอบความสุขจากเสียงดนตรี ในสไตล์แจ๊ส ต้อนรับปีใหม่ 2024 ในบรรยากาศสบาย ๆ วันอาทิตย์ที่ 7 มกราคม 2567 เวลา 17.00 น. @Museum Siam (ลานมิวเซียมสยาม) เขตพระนคร บรรเลงโดย วง Bangkok Big Band ศิลปินรับเชิญ จูเลี่ยน แครีย์ (Julian Cary) หรือ จูเลี่ยน ณ ตลิ่งชัน นักดนตรีแจ๊สหนุ่ม จากเดนเวอร์ โคลาราโด
น้องบาร็อก - ชลธาร เซ็นเชาวนิช (เยาวชนผู้เข้าร่วม “การประกวดขับร้องเพลงพระราชนิพนธ์ของพระบาทสมเด็จพระเจ้าอยู่หัว รัชกาลที่ ๙” และ กิจกรรม “เยาวชนคนดนตรี” โดย กองการสังคีต) พร้อมด้วย… นักร้องจากกลุ่มงานดุริยางค์สากล กองการสังคีต เข้าชมฟรี … ไม่มีค่าใช้จ่าย
Ayutthaya Morning Drip ครั้งที่ 2 วันอาทิตย์ 7 มกราคม 2567
มาชิมกาแฟดีๆ ในจังหวัดพระนครศรีอยุธยา ในงาน Ayutthaya Morning Drip ครั้งที่ 2 วันอาทิตย์ 7 มกราคม 2567 เวลา 06.00 - 13.00 น. ณ โบราณสถานป้อมเพชร ชิมกาแฟ อาหาร เบเกอรี่ อร่อยในบรรยากาศเช้าริมแม่น้ำ
สัปดาห์ที่ 2 ระหว่างวันที่ 8 - 14 มกราคม 2566
ผู้ป่วยรักษาตัวในโรงพยาบาล (รายสัปดาห์)
จำนวน 969 ราย : เฉลี่ยรายวัน จำนวน 138 ราย/วัน
ผู้เสียชีวิต (รายสัปดาห์)
จำนวน 65 ราย : เฉลี่ยรายวัน จำนวน 9 ราย/วัน
หายป่วยสะสม 1,966 ราย (ตั้งแต่ 1 มกราคม 2566)
เสียชีวิตสะสม 123 ราย (ตั้งแต่ 1 มกราคม 2566)
8 มกราคม 2566 จับร้านกัญชาพัทยา
สนธิกำลังจับร้านกัญชาพัทยา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ ร่วมกับ พ.ต.อ.กุลชาต กุลชัย ผกก.สภ.เมืองพัทยา นายพร ชัย สังข์เอียด ปลัดอำเภอบางละมุง พ.ต.ท.พิชญะ เขียวเปลื้อง สารวัตรสถานีตำรวจท่องเที่ยว 4 กองกำกับการ 2 กองบังคับ การตำรวจท่องเที่ยว 1 เจ้าหน้าที่สาธารณสุขจังหวัดชลบุรี ลงพื้นที่เมืองพัทยา ตรวจใบอนุญาตประกอบกิจการ ร้านค้าต่าง ๆ ว่าจำหน่ายกัญชาได้ถูกต้องตามกฎหมายหรือไม่ พบร้านภายในถนนคนเดินวอกกิ้งสตรีทพัทยาไม่มีใบอนุญาตจำหน่ายกัญชา 1 ร้าน และภายในซอยบัวขาวพัทยาใต้อีก 4 ร้าน จึงดำเนินคดีตามกฎหมาย สงกรานต์ กรุงเทพ 2566
- งานสงกรานต์ ไอคอนสยาม 2023 มหัศจรรย์เจ้าพระยามหาสงกรานต์ 11 – 17 เมษายน 2566
- เทศกาลเย็นทั่วหล้า มหาสงกรานต์ 2566 13 - 15 เมษายน 2566
- งานสงกรานต์ Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย 13-16 เมษายน 2566
- งานสงกรานต์ 2566 ถนนข้าวสาร 12-15 เมษายน 2566
- งานสงกรานต์ สยามสแควร์ 2566 13-15 เมษายน 2566
- งานเทศกาลมหาสงกรานต์ กรุงเทพมหานคร 2566 12-14 เมษายน 2566
9 มกราคม 2566 ตรวจร้านขายกัญชา / ผลักดันตั้งสมาพันธ์กัญชาไทย
ตรวจร้านขายกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ ร่วมกับ สสจ.ชลบุรี สภ.เมืองพัทยา ลงพื้นที่กวดขันจับกุม ผู้ประกอบการ รถเร่ แผงลอย กรณีจำหน่ายช่อดอกกัญชาย่านถนน walking street และย่านซอยบัวขาว อ.เมืองพัทยา จ.ชลบุรี พบผู้กระทำผิดกฎหมายจำนวน 8 ราย ส่ง จนท.ตร.ดำเนินการจับกุมดำเนินคดีตามขั้นตอนกฎหมาย - นางญาดา พรเพชรรัมภา ประธานชมรมผู้ค้าแผงลอย กทม.และถนนข้าวสาร กล่าวว่า หากรัฐไม่เข้ามาควบคุมดูแลให้ เป็นระเบียบจะทำให้มีการค้าแบบผิดกฎหมายมากขึ้น เกิดปัญหาสุขภาพและอันตรายถึงชีวิตหากมีการสูดดมอย่างเสรี
โฆษณากัญชา
- นายธสรณ์อัฑฒ์ ธนิทธิพันธ์ เลขาธิการ สคบ. เผย คณะอนุกรรมการป้องกันหรือระงับยับยั้งความเสียหาย/อันตรายที่ เกิดขึ้นแก่ผู้บริโภคกำลังศึกษาเพิ่มเติมและรอร่าง พ.ร.บ.กัญชา หรือรอให้นิ่ง เพื่อพิจารณาเรื่องการออกมาตรการควบคุมการ โฆษณาสินค้าและบริการที่เกี่ยวข้องกับกัญชากัญชงเพื่อการนันทนาการ
ผลักดันตั้งสมาพันธ์กัญชาไทย
- สมาคมนักวิจัยแห่งประเทศไทยร่วมกับเครือข่ายเขียนอนาคตกัญชาไทย จัดสัมมนาหัวข้อ “เขียนอนาคตกัญชาไทยจาก วิชาการและการปฏิบัติจริง” โดยเสนอให้ตั้งสมาพันธ์กัญชาไทยเพื่อเป็นเครือข่ายร่วมกันพัฒนา อาจเริ่มจากแพลตฟอร์ม เฟซบุ๊ก มีแพทย์ ผู้ปลูกกัญชาในพื้นที่ต่างๆ - ด้านหมอยาเกาะพะงันโมเดล จ.สุราษฎร์ธานีได้นำจดหมายเรียกร้องของชาวพะงันเตรียมยื่นให้ นายชวน หลีกภัย ประธานรัฐสภา ขอให้มีการพิจารณา พ.ร.บ.กัญชาฯ ให้เสร็จทันสมัยประชุมนี้ และเสนอให้มีการรวมสายพันธุ์กัญชาเด่น ทั่วประเทศ วิจัยต่อยอดปรุงยาเป็นสูตรตำรับของประเทศไทย10 มกราคม 2566 กัญชา Herbal Champion
Herbal Champion
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมต.ประจำสำนักนายกฯ เป็นประธานการประชุม คกก.นโยบายสมุนไพรแห่งชาติ ระบุที่ประชุมมีมติเห็นชอบแผนปฏิบัติการด้านสมุนไพรแห่งชาติฉบับที่ 2 พ.ศ.2566-2570 รวม 5 แผน 5 ยุทธศาสตร์ 73 โครงการ และเห็นชอบรายการสมุนไพรแชมเปี้ยน 15 สมุนไพร โดยกรมการแพทย์แผนไทยฯ ได้คัดเลือก Herbal Champion เป็น 2 กลุ่ม คือ กลุ่มสมุนไพรที่มีความพร้อมตามห่วงโซ่อาหารการพัฒนาสมุนไพร 3 รายการ ได้แก่ ฟ้าทะลาย โจร ขมิ้นชัน และกระชายดำ และกลุ่มสมุนไพรที่มีศักยภาพในการผลักดันให้เป็นสมุนไพร Herbal Champion 12 รายการ ได้แก่ กระชายขาว มะขามป้อม ไพล กวาวเครือขาว ขิง กระท่อม ว่างหางจระเข้ บัวบก มะระขี้นก กัญชง กัญชา และ เพชรสังฆาต โดยจะจัดทำประกาศ คกก.นโยบายสมุนไพรแห่งชาติ เรื่อง สมุนไพร Herbal Champion และจัดทำแผนพัฒนา ต่อยอดสร้างมูลค่าเพิ่มสมุนไพร Herbal Champion ต่อไป
ผลกระทบหลังสูบกัญชา
- นายเอ วัย 25 ปี จ.ตราด สูบกัญชาแบบใช้บ้องสูบ สูบไป 4 ครั้ง โดยครั้งที่ 4 ใส่คีฟ (ผงกัญชา) เข้าไปด้วย จากนั้น หายใจไม่ออก เวียนศีรษะ จึงรีบโทร. แจ้งกู้ภัยให้มารับไปส่ง รพ. โดยเผยว่าหลังรัฐบาลปลดล็อกกัญชา ได้หาต้นกัญชามาปลูก ไว้เพื่อใช้เป็นยา เพราะเป็นโรคนอนไม่หลับ ต้องกินยานอนหลับตลอด แต่วันนี้ลองใส่คีฟไปด้วยจึงเกิดอาการดังกล่าว11 มกราคม 66 ซื้อช่อดอกกัญชาต้องแสดงบัตรประชาชน
ซื้อช่อดอกกัญชาต้องแสดงบัตรประชาชน
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึง การพัฒนาผลิตภัณฑ์ทางการแพทย์กรณีสมุนไพรกัญชา กัญชง อยู่ในลิสต์สมุนไพร Herbal Champion 15 รายการ ว่า ยังต้องการงานวิจัยพอสมควรเพราะยังขาดข้อมูลทางวิชาการ หากนำกัญชากลับไปเป็นยาเสพติดจะเป็นอุปสรรคและปัญหามาก คนที่บอกว่าเป็นยาเสพติดก็ยังทำได้ไม่เป็นปัญหา ขอยืนยันว่าทำไม่ได้ เพราะที่ผ่านมาพิสูจน์แล้วว่าทำไม่ได้ ยากมาก เพราะหากทำได้เราทำมาตั้งนานแล้ว เมื่อต้นเดือน ม.ค. ได้ลงนามในประกาศกำหนดให้ผู้ซื้อช่อดอกกัญชาต้องแสดงบัตรประชาชน อยู่ระหว่างรอประกาศให้มีผลบังคับใช้ในราชกิจจานุเบกษา จากนั้นจะมีการสื่อสารทำความเข้าใจ และส่งรายงานการซื้อขายกัญชามาให้กรมฯ พร้อมจ้างบริษัทเขียนโปรแกรม
ลิงก์ข้อมูลการซื้อขาย เมื่อมีคนมาซื้อ เพียงเสียบบัตรประชาชนและกรอกข้อมูลว่าใครซื้อ จำนวนเท่าไร หากไม่ส่งรายงานก็จะยึดใบอนุญาตคืน ขณะนี้มีการขออนุญาตมากกว่า 7 พันรายแล้ว
ลักลอบขายช่อดอกกัญชา
- สสจ.ปทุมธานี พร้อมตำรวจและทหาร สนธิกำลังบุกจับผู้ลักลอบขายช่อดอกกัญชาแห้งและต้มน้ำใบกระท่อมขายแบบผิดกฎหมายริมถนน จำนวน 3 ราย ข้อหาจำหน่ายโดยไม่ได้รับอนุญาต
สถิติผู้ป่วยติดกัญชาเพิ่มขึ้น
- แม้กัญชาจะมีศักยภาพในฐานะพืชเศรษฐกิจที่อาจทำรายได้ให้กับประเทศจำนวนมาก แต่สถิติจำนวนผู้ป่วยจากการเสพติดกัญชาเพิ่มขึ้นอย่างรวดเร็วมากเช่นกัน จาก 72 เคส/เดือน ก่อนการปลดล็อก เป็น 282 เคส/เดือน ทันที สถิติเหล่านี้ สะท้อนให้เห็นว่าทางการไทยยังไม่สามารถควบคุมให้ปริมาณการบริโภคกัญชาของประชาชนบางส่วนให้อยู่ในระดับที่เหมาะสมได้ และหากไม่มีการดำเนินการควบคุมรัดกุม กัญชาอาจกลายเป็นพืชที่ทำลายมากกว่าส่งเสริมเศรษฐกิจ
29 พฤศจิกายน 2566 สัตว์แพทย์จุฬาฯ ชวนพาหมาแมว ไปฉีดวัคซีน ฟรี วาระ 100 ปี งานกาชาด LINK
เนื่องในโอกาสครบรอบ 100 ปีงานกาชาด ทางคณะสัตวแพทยศาสตร์ จุฬาฯ จึงขอเชิญชวนประชาชนที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีน ฟรี !! ไม่เสียค่าใช้จ่าย 29 พฤศจิกายน 2566 เวลา 9.00-12.00 น. วันเดียวเท่านั้น ในวันที่ 29 พฤศจิกายน 2566 เวลา 9.00-12.00 น. ณ ชั้น 1 อาคารสัตววิทยวิจักษ์ โรงพยาบาลสัตว์เล็ก จุฬาฯ วันเดียวเท่านั้น !!
*โดยผู้สนใจเข้ารับบริการสามารถ walk-in เข้ามารับบริการได้ในช่วงวันและเวลาที่กำหนดไว้*
ทั้งนี้รายได้จากการฉีดวัคซีน ในระหว่างวันที่ 1 พฤศจิกายน 2566 ถึงวันที่ 18 ธันวาคม 2566 ทางคณะสัตวแพทยศาสตร์ จุฬาฯ ทูลเกล้าฯ ถวายสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง เพื่อสมทบทุนสภากาชาดไทย
Music in the Park สวนหลวงพระราม 8 (สถาบันกัลยานิวัฒนา) 13,20,27 มกราคม 67 LINK
การแสดงดนตรี Music in the Park สวนหลวงพระราม 8 โดย สถาบันกัลยานิวัฒนา เดือนมกราคม 2567 ดังนี้
• 13 มกราคม 67
• 20 มกราคม 67 กลุ่ม Bangkok Big Band จัดเต็มอิ่มกับบทเพลงชื่อดัง อาทิ นิยามรัก, ดินแดนแห่งความรัก, Close to you, All about that bass, Our love is here to stay
• 27 มกราคม 67 - Supak Alliance Time Soul. Ask Real
สอบถามข้อมูล โทร 02-447-8597
14 มกราคม 2566 ลุยตรวจร้านขายกัญชาหาดใหญ่ / ผลวิจัยพบว่าอาหารผสมกัญชาเป็นอันตราย
ลุยตรวจร้านขายกัญชา
-สสจ.สงขลา ตรวจร้านค้าจำหน่ายกัญชากลางเมืองหาดใหญ่ หลังนักท่องเที่ยวต่างชาติเข้าใช้บริการต่อเนื่อง พร้อมย้ำให้ติดฉลากแสดงส่วนผสมในอาหารหรือเครื่องดื่มให้ชัดเจน ขณะที่ล่าสุดมีผู้ประกอบการในพื้นที่ยื่นขอใบอนุญาตแล้วมากกว่า128 แห่งแต่ได้ใบอนุญาตประมาณ 100 แห่ง ที่เหลืออยู่ระหว่างการตรวจสอบ แต่มีร้านขนาดเล็กที่ยังไม่ยื่นใบอนุญาต จึงต้องเร่งรณรงค์ดำเนินการให้ถูกต้องตามกฎหมาย
ผลวิจัยพบว่าอาหารผสมกัญชา เป็นอันตราย
-สำนักข่าวเอพี อ้างผลวิจัยพบผู้ป่วยเด็กโดยเฉพาะอย่างยิ่งเด็กต่ำกว่าหกขวบป่วยหนัก ต้องรีบส่งโรงพยาบาลเพราะเผลอกินอาหารผสมกัญชาโดยไม่รู้ตัวสูงขึ้นอย่างน่าตกใจ ในช่วงห้าปีตั้งแต่ประเทศสหรัฐอเมริกาเปิดให้มีพื้นที่ใช้กัญชามากขึ้น เป็นการอนุญาตให้ใช้กัญชาเพื่อการแพทย์ 17 รัฐ และ 21 รัฐ ใช้กัญชาทางสันทนาการโดยมีการตรวจสอบ ข้อมูลศูนย์ควบคุมสารพิษแห่งชาติปี 2564 พบผู้ป่วยเด็กเพิ่มจากประมาณ 200คน เป็น 3,000คนต่อปีและหนึ่งในสี่มีอาการหนักมากผู้วิจัยเตือนให้ผู้ปกครองเพิ่มความระมัดระวังและเรียกร้องเพิ่มกฎหมายและมาตรการควบคุมการใช้ผลผลิตผสมกัญชามากขึ้น โดยเฉพาะอาหารผสมกัญชาที่มีกล่องหรือซองบรรจุคล้ายกับขนมหวานและของว่างสำหรับเด็ก
บางนา RUNNING วิ่งเพื่อโรงพยาบาล ครั้งที่ 1 อาทิตย์ ที่ 14 มกราคม 2567 LINK
สมาคมกีฬาแห่งจังหวัดกรุงเทพมหานคร มูลนิธิโรงพยาบาลบางนากรุงเทพมหานคร สำนักงานเขตบางนา สถานีตำรวจนครบาลบางนา โรงพยาบาลบางนา กรุงเทพมหานคร และหน่วยงานภาคเอกชนในพื้นที่ ได้ร่วมกันจัดกิจกรรมวิ่งการกุศล “บางนา RUNNING วิ่งเพื่อโรงพยาบาล ครั้งที่ 1” งานวิ่งเพื่อการกุศล สมทบทุนเพื่อพัฒนาการให้บริการผู้ป่วยของโรงพยาบาลบางนากรุงเทพมหานคร (จัดซื้อเครื่องมือเเพทย์ จ้างเเพทย์บุคลากรสาธารณสุขฯ)
วันที่ 14 มกราคม 2567 เวลา 04.00-08.00 น.สถานที่วิ่ง : ไบเทค - ใต้ทางด่วนบูรพาวิถี
เปิดรับสมัครผ่านช่องทางออนไลน์ เว็บไซต์ https://race.thai.run/bangnarunning2024
มาร่วมวิ่งในระยะ 5, 10 หรือ 21.1 กม. หรือจะเลือกบริจาคโดยไม่ร่วมวิ่งก็ได้เช่นกันค่ะ โดยเริ่มสมัครได้ตั้งแต่วันนี้ จนถึงวันที่ 15 ธันวาคม 2566 สอบถามข้อมูล ขอเชิญเพิ่มเพื่อนทางไลน์ @bangnarunning หรือกดเพิ่มทางลิ้งค์ https://lin.ee/0ignrnl สำหรับช่องทางวอล์คอินสมัคร สามารถติดต่อโรงพยาบาลบางนากรุงเทพมหานคร รับสมัครทุกวัน จันทร์-ศุกร์ เวลา 09.00-16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
ติดต่อสอบถามโทร 02-1800201 ต่อ 103
16 มกราคม 66
พรบ.กัญชา กัญชง พ.ศ. ...
นายประสิทธิ์ชัย หนูนวล เครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทย โพสต์ระบุว่า หากสภาไม่ผ่านร่าง พ.ร.บ.กัญชาฯ นอกจากเป็นประเด็นทางการเมืองแล้วยังเป็นประเด็นของผลประโยชน์ โดยจะทำให้ภาวะการควบคุมเชิงระบบนั้นไม่มี ซึ่งภาวะดังกล่าวมีบางกลุ่มได้ประโยชน์ขณะนี้การพิจารณา พ.ร.บ. ในวันหนึ่งพิจารณาได้ 4 มาตรา มีเวลาสัปดาห์ละวันเดียว อาจทำให้ พ.ร.บ.ไม่ทันในสมัยสภาชุดนี้พร้อมเรียกร้องให้ประธานสภาเปิดเผยรายชื่อ สส.ที่ไม่เข้าร่วมประชุมให้ประชาชนได้รับทราบ เป็นข้อมูลสำหรับการเลือก ส.ส.ที่กำลังจะมาถึง ทั้งนี้ เครือข่ายฯยังคงติดตามการทำงานของสภาผู้แทนราษฎรต่อไปเพื่อทำให้ ส.ส.ผ่านร่าง พ.ร.บ.กัญชาในสภาสมัยนี้และจะสื่อสารเผยแพร่ข้อเท็จจริงเรื่องกัญชาให้กับประชาชนอย่างต่อเนื่องเพื่อการเข้าใจกัญชาอย่างครบถ้วน
Chiangmai Coffee Week 2024 วันที่ 18 – 21 มกราคม 2567
Chiangmai Coffee Week 2024 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคเหนือ หลากหลายความสุข ของคอกาแฟ ในธีม Shade of Happiness วันที่ 18 – 21 มกราคม 2567 นี้ ณ จริงใจ มาร์เก็ต เชียงใหม่ วันธรรมดา 09.00-21.00 น. เสาร์-อาทิตย์ 06.30-21.00 น. พบกับกิจกรรมมากมายภายในงาน ได้แก่ การแข่งขัน Latte Art Smackdown #6 กิจกรรม Workshop Coffee Table สุดพิเศษกับบาริสต้ามือเก๋า Coffee Talk ความสุขของคนทำกาแฟ
ผลิตภัณฑ์ฉลากระบุ THAnOS ไม่ใช่ผลิตภัณฑ์ที่ ได้รับอนุญาตจาก อย. และมีการปลอมเลข อย. LINK
ผลิตภัณฑ์ฉลากระบุ THAnOS อย. 24-1-09957-1-0107 ดังกล่าว ไม่ใช่ผลิตภัณฑ์ที่ ได้รับอนุญาตจาก อย. และมีการปลอมเลข อย. ของผลิตภัณฑ์อื่นซึ่งถูกยกเลิกไปตั้งแต่วันที่ 22 มีนาคม 2562 ทั้ง นี้ข้อความ “เพิ่ม สมรรถภาพ เพิ่มขนาด แข็งตัวได้เต็มที่ ทำให้คุณอึดได้ดั่งใจ มี อย. รับรอง” เป็นการโฆษณาคุณประโยชน์ คุณภาพ หรือสรรพคุณของ อาหารอันเป็นเท็จ หรือหลอกลวงให้เกิดความหลงเชื่อโดยไม่สมควร ซึ่ง อย. จะดำเนินการทางกฎหมายกับผู้กระทำการฝ่าฝืน พรบ. อาหาร พ.ศ. 2522 ต่อไป...
การแข่งขัน Latte Art Smack Down ครั้งที่ 6 (งาน Chiangmai Coffee Week 2024) 19 มกราคม 2567
Latte Art Smack Down ครั้งที่ ???? ในงาน Chiangmai Coffee Week 2024 ณ จริงใจมาร์เก็ต เชียงใหม่ วันที่แข่งขัน 19 มกราคม 2567
งาน ลานเพลิน ร้อยดี วิถีบ้านลาด ประจำปี 2567
งาน ลานเพลิน ร้อยดี วิถีบ้านลาด ประจำปี 2567 ตอน ลานวัฒนธรรมสร้างสุข รุกขมรดกยางนา ภูมิปัญญาสร้างสรรค์ วันที่ 19-21 มกราคม 2567 ณ บริเวณทุ่งถ้ำรงค์ ริมถนนเพชรเกษมฝั่งขาเข้า หมู่ที่ 4 ตำบลถ้ำรงค์ อำเภอบ้านลาด จังหวัดเพชรบุรี พบกับกิจกรรม เวทีการแสดงวัฒนธรรมท้องถิ่น นิทรรศการส่งเสริมวัฒนธรรมท้องถิ่น ประเพณีท้องถิ่น ครัวพื้นบ้าน อาหารท้องถิ่น เล่าขานตำนานรุกขมรดกยางนา และกิจกรรมอื่น ๆ อีกมากมาย
Bangsaen Koff Fest 20 - 21 มกราคม 2024
เทศกาลของคนรักกาแฟ Bangsaen Koff Fest กลับมาอีกครั้งกับงานเทศกาลของคนรักกาแฟ Bangsaen Koff Fest วันที่ 20 - 21 มกราคม 2024 เวลา 09.00 - 19.00 น. ณ หาดบางแสน บริเวณศาลเจ้าพ่อแสน พบกับบูธร้านกาแฟ คาเฟ่ ชา โกโก้ เบเกอรี่ อุปกรณ์ร้านกาแฟครบวงจร เมล็ดหลากหลายสายพันธ์ุ และโปรโมชั่นสุดพิเศษ มานำเสนอในช่วงเวลาแห่งความสุข กับบรรยากาศสุดชิลบนชายหาดบางแสน กว่า 80 ร้านค้า พร้อมอัพเดตเทรนด์ใหม่ๆของปี 2024 กับผู้เชี่ยวชาญ วิทยากร ตัวจริงสายกาแฟ ที่จะมาแบ่งปันความรู้ให้ทุกท่าน และ กิจกรรม workshop สำหรับคนรักกาแฟทุกท่าน พิเศษกับกิจกรรมการแข่งขันกาแฟ ร่วมสนุกกับกิจกรรมกีฬาทางน้ำ งานศิลปะ ตลาดแฮนด์เมด และการแสดงดนตรีสด ได้ตลอดทั้งวัน
Mae Hong Son Coffee Trip & Drip Battle Championship 2024
การแข่งขันดริปกาแฟในงาน Mae Hong Son’s Coffee Trip & Drip Battle Championship 2024 ณ. บริเวณลานโพธิ์ร่มรื่น สวนสาธารณะเวียงใต้ อำเภอปาย จังหวัดแม่ฮ่องสอน วันที่ 20 - 21 มกราคม 2567
Music in the park สวนสาธารณะวงแหวน-ถนนพุทธมณฑลสาย2 วันเสาร์ที่ 20 มกราคม 2567
งานดนตรีในสวน Music in the park ร่วมสนุกกับดนตรีและร้านค้าร้านอาหารมากมาน ณ สวนสาธารณะวงแหวน-ถนนพุทธมณฑลสาย2 วันเสาร์ที่ 20 มกราคม 2567 เริ่ม 16:30 -21:00 น
World of Coffee 2024 21-23 January 2024 Dubai
World of Coffee 2024 21-23 January 2024 | Za’abeel Hall 4-5-6 World of Coffee Dubai 2024 engages an audience from the United Arab Emirates and beyond. Designed to connect coffee producers, manufacturers, retailers, traders, and the broader industry, #WOCDubai is tailored for the UAE’s coffee businesses and those who wish to break into the Middles East’s emerging coffee industry
BROTHER BEAT CANCER RUN 2024 วันที่ 21 มกราคม 2567 LINK
วิ่ง BROTHER BEAT CANCER RUN 2024 วันที่ : 21 มกราคม 2567 สถานที่ : ใต้สะพานพระราม 8 (ฝั่งอรุณอัมรินทร์) กรุงเทพฯ ระยะทาง : 6, 12, 24k
Brother Beat Cancer Run 2024 วิ่งด้วยกัน สู้ด้วยกัน บราเดอร์ขอเชิญชวนทุกท่านมาร่วม Beat ไปกับเรา กับงาน Brother Beat Cancer Run 2024 วิ่งด้วยกัน สู้ด้วยกัน ในระยะวิ่งแบบพลัส 6, 12 และ 24 กิโลเมตร เพื่อจุดมุ่งหมายเดียวกันในการช่วยเหลือผู้ป่วยโรคมะเร็งยากไร้ โดยรายได้ทั้งหมดจาการสมัครไม่หักค่าใช้จ่าย มอบให้กับ มูลนิธิรามาธิบดี กองทุนมะเร็งโลหิตวิทยาผู้ใหญ่ โรงพยาบาลรามาธิบดี สมัครออนไลน์ได้ที่
https://bit.ly/3ueMQH2TUN RUN 2024 งานวิ่ชาวฟ้า-ชมพู โรงเรียนเตรียมอุดมศึกษาน้อมเกล้า รามคำแหง 21 มกราคม 2567 LINK
งาน TUN RUN 2024 งานวิ่งดีๆ ของเรา ชาวฟ้า-ชมพู โรงเรียนเตรียมอุดมศึกษาน้อมเกล้า รามคำแหง งานวิ่งเส้นทางสวย ปลอดภัย เป็นมิตรกับชุมชน วัตถุประสงค์ของการจัดงาน
- เพื่อสนับสนุนการศึกษาและกิจกรรมต่างๆของโรงเรียนเตรียมอุดมศึกษา น้อมเกล้า และศิษย์ปัจจุบัน
- เพื่อสมทบกองทุนสวัสดิการช่วยเหลือบุคลากรโรงเรียนเตรียมอุดมศึกษาน้อมเกล้า เพื่อดูแลครูอาจารย์ บุคลากรทั้งอดีตและปัจจุบัน
- เพื่อให้ศิษย์ปัจจุบัน ศิษย์เก่า ครู อาจารย์ บุคลากร ผู้ปกครอง ผู้เข้าร่วมกิจกรรมมีสุขภาพอนามัยที่แข็งแรง
- เพื่อสานความสัมพันธ์ระหว่างศิษย์ปัจจุบัน ศิษย์เก่า ครู อาจารย์ บุคลากร ผู้ปกครอง และชุมชนใกล้เคียง
- เพื่อสร้าง Community ให้ศิษย์เก่ากลับมาพบปะกัน
หมายเหตุ : มอบเงินรายได้ทั้งหมดโดยไม่หักค่าใช้จ่าย
Age Friendly Run by Samitivej 2024 วันที่ 21 มกราคม 2567 LINK
Age Friendly Run by Samitivej :วิ่งละ YOUNG ณ สวนสาธารณะบึงหนองบอน กรุงเทพฯ วันอาทิตย์ที่ 21 มกราคม 2567 ฟิตร่างกายกันให้พร้อมแล้วมาพบกัน ขยายเวลารับสมัครถึงวันที่ 10 มกราคม 2567 ใครยังไม่สมัคร ยังพอมีเวลาตัดสินใจ รายได้สมทบกองทุนสมิติเวช เพื่อชีวิตใหม่ (New Life)
งานกระต่ายขาชง ชิมกาแฟและเครื่องดื่มจากฝีมือนักชงในจันทบุรี 21 มกราคม 2567
กิจกรรมชิมกาแฟและเครื่องดื่มจากฝีมือนักชงในจันทบุรี ให้ชาวจันทบุรีได้มาร่วมกันเรียนรู้ เปิดประสบการณ์สัมผัสรสชาติและความซับซ้อนในกลิ่นของกาแฟ #สายแคมป์ #สายสโลบาร์ พกอุปกรณ์ส่วนตัวมาให้พร้อมแล้วเจอกัน (ที่งานมีไฟฟ้าอำนวยความสะดวก) วันที่ 21 มกราคม 2567 เวลา 06.00-09.00 น สถานที่ : ลานแอโรบิค ทุ่งนาเชย จันทบุรี ฟรี ไม่มีค่าใช้จ่ายใดๆ
Thai Festival 2023 in Christchurch - Sunday 22nd January 2023
Experience the Touch of Thainess at Thai Festival 2023 on Sunday 22nd January 2023 at Victoria Square, Christchurch Central corner of Armagh and Colombo Street, New Zealand. From 9am to 8pm to enjoy the Thai food, culture, tourism, boxing, and more...
FREE Entry!!!
Proudly supported by Christchurch City Council, RATA Foundation, Ministry of Ethnic Communities, Royal Thai Embassy, Tourism Authority of Thailand, Singha Corporation, Wat Buddhasamakhee, Titan Training Ground, Thai Society of Canterbury and ChristchurchNZ.
ประเพณีนมัสการรอยพระพุทธบาทพลวงเขาคิชฌกูฏ 22 ม.ค.-22 มี.ค.66
พิธีบวงสรวงปิดป่า-เปิดงาน ประเพณีนมัสการรอยพระพุทธบาทพลวงเขาคิชฌกูฏประจำปี 2566 งานใหญ่ประจำปีของ จ.จันทบุรี ที่ทั่วประเทศเฝ้ารอ ปีนี้ กำหนดการเปิดให้ขึ้นไปนมัสการ ระหว่างวันที่ 22 ม.ค.-22 มี.ค.66 มีการจำกัดจำนวนนักท่องเที่ยวต่อช่วง 6,000 คน/ช่วงเวลา แบ่งเป็น 4 ช่วงเวลา
1) ช่วงเวลา 00.00-06.00 น.
2) ช่วงเวลา 06.00-12.00 น.
3) ช่วงเวลา 12.00-18.00 น.
4) ช่วงเวลา 18.00-24.00 น.
ระบบการจองผ่านแอพฯ KCKQue (พระบาทเขาคิชฌกูฏ)
-กำหนดให้มีการจอง จำนวน 4,500 คน/ช่วงเวลา และ Walk-in จำนวน 1,500 คน/ช่วงเวลา
-เดินขึ้นทางหน่วย คก.1 (พระบาทพลวง) จำนวน 350 คน/วัน
-เดินขึ้นทางบ้านแกลง จำนวน 150 คน/วัน
ดังนั้น ในแต่ละวันจะมีนักท่องเที่ยวจำนวน 24,000 คน/ วัน
สอบถามข้อมูล
วัดพลวง โทร. 09 7954 1650
อุทยานแห่งชาติเขาคิชฌกูฏ โทร. 0 3960 9666, 0 3960 9672 ,08 4232 8159
ททท.สำนักงานจันทบุรี โทร.0 3948 0220 Line OA: @tatchanthaburi
ภาพจาก ททท.สำนักงานจันทบุรี 25-28 มกราคม 2567 Esan Bakery Chocolate & Tea ห้างเซ็นทรัลโคราช
Esan Bakery Chocolate & Tea งานมหกรรมแสดงสินค้าเบเกอรี่ ขนมหวาน ช็อกโกแลต เครื่องดื่มชา กาแฟ ไอศกรีม แบบครบครันที่ใหญที่สุดในภาคอีสาน ระหว่างวันที่ 25-28 มกราคม 2567 ห้างเซ็นทรัลโคราช โอกาสโชว์สินค้าและพบปะกลุ่มเป้าหมายกว่า 25,000 คน/วัน เหมาะกับผู้ประกอบการ - ร้านเบเกอรี่โฮมเมดเล็กๆ ขายแพ็คเกจจิ้งและบรรจุภัณฑ์ ขายอุปกรณ์และวัตถุดิบทำเบเกอรี่ สถาบันสอนทำอาหารและขนม ธุรกิจให้คำปรึกษาเกี่ยวกับอุตสาหกรรมเบเกอรี่. บริการด้านธุรกิจแบบครบวงจร
ดนตรีในสวน ลานน้ำพุช้าง บึงพระราม พระนครศรีอยุธยา 25-26 มกราคม 2567
เทศบาลนครพระนครศรีอยุธยาขอเชิญชม "ดนตรีในสวน" ลานน้ำพุช้าง บึงพระราม พระนครศรีอยุธยา 25-26 มกราคม 2567 เวลา 16.30-21.00 น. ดนตรีหลากหลายแนว ดนตรีสากล ดนตรีไทย แตรวง ชมดนตรีจากวงดนตรีเด็กและเยาวชน จากโรงเรียนหลายแห่ง ในจ.พระนครศรีอยุธยา อิ่มอร่อยกับอาหารเครื่องดื่มที่จำหน่ายในงาน
ผลิตภัณฑ์ ENEL ARED ไม่มีการยื่นข้อมูลประสิทธิผลตามที่ กล่าวอ้างแต่อย่างใด
26 มกราคม 66 ผลิตภัณฑ์ ENEL ARED ช่วยบำรุงสายตา ลดความเสี่ยงจอประสาทตาเสื่อม ลด ความเสี่ยงต้อกระจก และช่วยกรองแสงสีฟ้าได้ ข้อเท็จจริง : ...ผลิตภัณฑ์ดังกล่าว ขออนุญาตเป็นผลิตภัณฑ์เสริมอาหาร ในชื่อ เอเนล เอเรด (ผลิตภัณฑ์เสริมอาหาร)/ENEL ARED (Dietary supplements product) เลขอย. 11-1-01757-5-0140 ซึ่งในการยื่นขออนุญาต ไม่มีการยื่นข้อมูลประสิทธิผลตามที่ กล่าวอ้างแต่อย่างใด ทั้งนี้ ผลิตภัณฑ์เสริมอาหารไม่มีผล ในการบำบัด บรรเทา หรือ รักษาโรค และต้องแสดงคำเตือนดังกล่าวบนฉลาก และการแสดงข้อความ ช่วยบำรุง สายตา ลดความเสี่ยงจอประสาทตาเสื่อม ลดความเสี่ยงต้อกระจก และช่วยกรองแสงสี ฟ้า เป็นการโฆษณาคุณประโยชน์ คุณภาพ หรือสรรพคุณ ของอาหารอันเป็นเท็จ หรือ หลอกลวงให้ เกิดความหลงเชื่อโดยไม่สมควร ซึ่ง อย. จะดำเนินการทางกฎหมายกับ ผู้กระทำการฝ่าฝืน พรบ. อาหาร พ.ศ. 2522 ต่อไป
ดนตรีในสวน: เสพศิลป์พฤกษา x ผิงไฟ ม.เทคโนโลยีสุรนารี 26 - 28 มกราคม 2567
อีเว้นท์ดูหนังฟังเพลงที่ทุกคนรอคอย “
ดนตรีในสวน: เสพศิลป์พฤกษา x ผิงไฟ” 26 - 28 มกราคม 2567 เวลา 17.00 น. เป็นต้นไป จัดโดย องค์การบริหาร องค์การนักศึกษามหาวิทยาลัยเทคโนโลยีสุรนารี ภายในงานมีกิจกรรม การแสดงดนตรีสดจากวง Sompordee SUT Band Folk song สุดชิลล์ หนังกลางแปลง โซนแสดงงานศิลปะสุดปัง ตลาดนักศึกษา
ถนนดนตรีไลฟ์#3 ครบรอบ 50ปี คาราวาน ฟังบทเพลงและเรื่องเล่าโดย สุรชัย จันทิมาธร
ถนนดนตรีไลฟ์#3 "ครบรอบ 50ปี คาราวาน" ฟังบทเพลงและเรื่องเล่าโดย สุรชัย จันทิมาธร ในวันศุกร์ที่ 26 ม.ค.2567 เวลา 18.00 น.เป็นต้นไป ห้องแสดง ชั้น 4 ณ อาคารใหม่ห้อง ออดิทอเรี่ยม ตึกปฏิบัติการหลังใหม่ สถานีวิทยุกระจายเสียงแห่งประเทศไทย ถ.วิภาวดีรังสิต ดินแดงกทม. ฟรี!! โดยไม่เสียค่าใช้จ่าย
The Camping Trips #EP2 “มนต์รัก เพลงร็อค” 26-27 มกราคม 2567
The Camping Trips #EP2 “มนต์รัก เพลงร็อค” 26-27 มกราคมนี้ ณ BASECAMP-B/C อ.แปลงยาว จ.ฉะเชิงเทรา พกเก้าอี้แคมป์ปิ้งไปนั่งฟังเพลงเพราะๆ จากวงร็อคขวัญใจใครหลายๆ คน นำทัพโดยศิลปินชื่อดังคับคั่ง อาทิ Zeal / Pause / Lham Sompol / Indigo / Whatfalse และ Scootslande บอกเลยว่าบรรยากาศตอนนี้ ชิลล์มากๆ ครับ อากาศกำลังเย็นสบาย หรือใครอยากจะกางเต็นท์แคมป์ปิ้ง ต้องเข้ามาจองกับทางเพจ จองก่อนได้ก่อน พื้นที่มีจำกัดเช่นกันครับ
งาน Palm Street Art ถนนต้นตาล ครั้งที่ 3 ตอน เด็กเลี้ยงวัว 26-28 ม.ค. 67
ชวนเที่ยวงาน Palm Street Art ถนนต้นตาล ครั้งที่ 3 ตอน เด็กเลี้ยงวัว 26-28 ม.ค. 67 ต.ไร่สะท้อน บ้านลาด เพชรบุรี กิจกรรมคืนวันที่ 26 มกราคม 2567 เวลา 20.00 น. เป็นต้นไป การแข่งขันเต้าตาลยักษ์ การแข่งขันกินเต้าตาล วัวเทียมไถ รำวง 2 คณะ กิจกรรมคืนวันที่ 27 มกราคม 2567 เวลา 19.00 น. เป็นต้นไป วัวประกวด การแข่งขันหนูน้อยคาวบอย หญิง การแข่งขันหนูน้อยคาวบอย ชาย รำวง 2 คณะ กิจกรรมคืนวันที่ 28 มกราคม 2567 เวลา 20.00 น. เป็นต้นไป การแข่งขันคนลาน การแข่งขัน Miss Queen cowboy night การมอบรางวัลการแข่งขัน felfie นับยอดไลค์
BURIRAM MARATHON 2024 วันที่ 27 มกราคม 2567 LINK
BURIRAM MARATHON 2024 ( ปิดถนน 100% ) สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต อ.เมือง จ.บุรีรัมย์ งานวิ่งที่ไม่ต้องพูดเยอะกับคำว่ามาตรฐาน งานวิ่งมาราธอนที่ผู้ชื่นชอบการวิ่งรอคอย มาราธอนมาตรฐานโลกระดับ Elite Label วิ่งวันที่ 27 มกราคม 2567 บริเวณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต ระยะวิ่ง 42.195 / 21.1 / 10 / 4.554 กิโลเมตร
โปรแกรมดนตรีในสวนต่างๆในกรุงเทพ เดือนมกราคม
14 ม.ค.67
17.00 น. ณ มิวเซียมสยาม : วง Bangkok Metropolitan Orchestra
17.30 น. ณ ลานสวนปาล์ม สวนลุมพินี : วง Royal Bangkok Symphony Orchestra
20 ม.ค.67
16.30 น. ณ สวนสาธารณะทางต่างระดับพรานนก - พุทธมณฑลสาย 4 : วงดนตรีกรุงเทพมหานคร
16.30 น. ณ สวนเบญจกิติ : Joke Bandwagon & Friend
17.30 น. ณ สวนหลวงพระราม 8 : BKK Jazz Group
21 ม.ค.67
16.30 น. ณ สวนปทุมวนานุรักษ์ : Bangkok String Ensemble
17.00 น. ณ มิวเซียมสยาม : ลิเกรวมดาว และวงดนตรีไทยกรุงเทพมหานคร
17.30 น. ณ ลานสวนปาล์ม สวนลุมพินี : วง Royal Bangkok Symphony Orchestra
27 ม.ค.67
16.30 น. ณ สวนเบญจกิติ : วง neofolk
17.30 น. ณ สวนหลวงพระราม 8 : สถาบันดนตรีกัลยาณิวัฒนา
28 ม.ค.67
16.30 น. ณ สวนปทุมวนารักษ์ : Bangkok Woodwind Quintet
17.00 น. ณ ห้องกันตัง การยางแห่งประเทศไทย เขตบางกอกน้อย : วงบางกอกลีลาศ
17.30 น. ณ ลานสวนปาล์ม สวนลุมพินี : วง Royal Bangkok Symphony Orchestra
ดนตรีในสวนกรุงเทพมหานคร 27-28 ม.ค. 2567
เสาร์ที่ 27 ม.ค. 2567
ศิลปิน วง neofolk สวนเบญจกิติ เวลา 16:30 น.
ศิลปิน การแสดงจากนักศึกษาปัจจุบัน ศิษย์เก่า อาจารย์ และพนักงาน สถานบันดนตรีกัลยาณิวัฒนา สวนหลวงพระราม 8 เวลา 17:30 น.
อาทิตย์ที่ 28 ม.ค. 2567
ศิลปิน วงบางกอกลีลาศ สถานที่ ห้องกันตัง การยางแห่งประเทศไทย เขตบางกอกน้อย เวลา 13:00 น.
ศิลปิน Bangkok Woodwind Quintet สวนปทุมวนารักษ์ เวลา 16:30 น.
ศิลปิน วง Royal Bangkok Symphony Orchestra ลานสวนปาล์ม สวนลุมพินี เวลา 17:30 น.
Kamphaengphet Cup & Craft Fest 2024 วันที่ 27-28 มกราคม 2567
ททท.สำนักงานสุโขทัยกำแพงเพชร ขอเชิญนักท่องเที่ยวที่ชื่นชอบกาเเฟ โกโก้ และงานคราฟท์ มาเที่ยวงานดีๆ บรรยากาศชิลๆ สไตล์แคมป์ปิ้ง...ริมแม่น้ำปิง ในงาน Kamphaengphet Cup & Craft Fest 2024 วันที่ 27-28 มกราคม 2567 10:00-18:00 น. ณ เข้าท่าแคมป์ปิ้ง & ลานเพลิน อ.เมือง จ.กำแพงเพชร
ในงานยังมีการ workshop กาแฟ และโกโก้ ดริป ชง ชิมเมล็ดกาเเฟชั้นนำจากนักดริปทั่วเมืองกำแพงเพชร นอกจากเครื่องดื่มแล้ว ยังมีร้านอาหาร ร้านสินค้างานคราฟท์ให้ได้ชม ได้ช็อป กิจกรรม D.I.Y. ให้น้องๆ หนู ได้มีส่วนร่วม พร้อมชิลกับดนตรีสบายๆ เเถมยังมีกิจกรรมพาย Sup Board ให้ได้เล่นกันแบบฟรีๆ ริมน้ำปิงอีกด้วย Kamphaengphet cup & craft fest 2024 ถือเป็นจุดกำเนิดเทศกาลกาเเฟในกำแพงเพชร เราอยากให้นักท่องเที่ยวทุกๆ ท่านได้มีส่วนร่วมในกิจกรรมครั้งนี้
ดนตรีในสวน Igor Butman Concert 27 ม.ค. 67 ศาลาภิรมย์ภักดี สวนลุมพินี
ขอเชิญชมดนตรีในสวน "Igor Butman Concert" วันที่ 27 ม.ค. 67 เวลา 18.30 - 20.00 น. ณ ศาลาภิรมย์ภักดี สวนลุมพินี ในวาระเฉลิมฉลองปีแห่งการแลกเปลี่ยนวัฒนธรรมและการท่องเที่ยวไทย-รัสเซีย และเทศกาลงานออกแบบกรุงเทพฯ 2567 (Bangkok Design Week 2024) งานนี้เข้าชมฟรี‼ ไม่มีค่าใช้จ่าย
ตารางกิจกรรม Tak Coffee Team LINK
ตารางกิจกรรม Tak Coffee Team วันที่ 18 พฤศจิกายน 2566 กิจกรรม One Day Trip. Coffee Camp..."From Seed To Sip" (ดอยมูเซอ)- ชวนมาเปิดโลกกาแฟด้วยกันสำหรับผู้สนใจเข้าชมกระบวนการแปรรูปกาแฟ ตั้งแต่การปลูก เก็บ ตาก รวมไปถึงการคั่ว ชง ชิมกาแฟ กิจกรรม Morning Drip (เมืองตาก) วันที่ รอประสานงาน วันที่ 09 ธันวาคม 2566 Winter Nan Coffee Lover 2023 (จ.น่าน) - แข่งขัน Nan Drip Smack Down X Hario ครั้งที่ 2 กิจกรรม Morning Drip (แม่สอด) วันที่ รอประสานงาน วันที่ 27-28 มกราคม 2567 Coffee Brewer Charity - กิจกรรมจากเหล่า Brewer ทั่วประเทศ ที่จะมาแบ่งปันประสบการณ์ดีๆ และอุปกรณ์การชง คั่ว และ ออกแบบ ให้กับน้องๆโรงเรียนบ้านห้วยปลาหลด
ชิม ช็อป เที่ยว "ตลาดชุมชน ของดีศรีพันท้าย" ครั้งที่ 1 วันที่ 28 - 31 มกราคม พ.ศ.2566
ขอเชิญ ชิม ช็อป เที่ยว "ตลาดชุมชน ของดีศรีพันท้าย" ครั้งที่ 1 วันที่ 28 - 31 มกราคม พ.ศ.2566 เวลา 17.00 น. เป็นต้นไป ครั้งแรกของการรวมกลุ่มชุมชน ชาวตำบลพันท้ายนรสิงห์ กว่า 50 ร้าน นำสินค้าชุมชน ที่ร่วมผลิต ร่วมสร้าง มาจัดแสดงและจำหน่าย สินค้าคุณภาพ ราคาประหยัด มากมาย มาร่วมเดินชม ช็อปสินค้า ชิมอาหารอร่อย ณ ศาลพันท้ายนรสิงห์ (ข้างอาคารเรือนไทย) อ.เมือง จ.สมุทรสาคร กัน
งานประจำปีปิดทองหลวงโต วัดโพธิ์เเจ้ 28-30 มกราคม 2566 LINK
งานประจำปีปิดทองหลวงโต และรอยพระพุทธบาทจำลอง ณ วัดโพธิ์เเจ้ ในวันที่ 28-30 มกราคม 2566 ถนนเอกชัย ต.บางน้ำจืด อ.เมือง สมุทรสาคร ในงานพบกับกิจกรรมเทศน์มหาชาติ โดย คณะพระอาจารย์ธนวัฒน์ ธฯวฒฆโน เพื่อหารายได้สมทบสร้างศาลาการเปรียญ
การแสดง 3 วัน จัดเต็ม 28 ม.ค. หมอลำ ขวัญใจแฟน แซม จักรพันธ์ 29 ม.ค. ใบปอ รัตติยา 30 ม.ค. บัวผัน ทังโส
NITADE FUND RUN 2024 วันที่ 28 มกราคม 2567
วิ่ง : NITADE FUND RUN 2024 จัดวันที่ : 28 มกราคม 2567 สถานที่ : อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย, กรุงเทพมหานคร ระยะทาง : 6k
งานวิ่งการกุศล CBD We Run 2023 วันที่ 28 มกราคม 2567
CBD We Run 2023 มีกำหนดแข่งขันในวันอาทิตย์ที่ 28 มกราคม 2567 ณ อาคาร เอ็มไพร์ ในเวลา 04.00 น. และสิ้นสุดการแข่งขันภายในเวลา 07.00 น. จำนวนผู้เข้าร่วมการแข่งขัน 3,000 คน โดยมีให้เลือก 3 เส้นทาง Half Marathon 21 กม. / Mini Marathon 10.5 กม. / Fun Run 4.2 กม. CBD We Run งานวิ่งการกุศลครั้งยิ่งใหญ่ใจกลางกรุง ชวนนักวิ่งร่วมสร้างพลังสีเขียวให้กรุงเทพฯ และแบ่งปันสิ่งดีๆ กลับสู่สังคม ภายใต้แนวคิด CBD We Run ยืนหนึ่งงานวิ่งฮาล์ฟมาราธอนกลางเมืองรักสิ่งแวดล้อม CBD We Run 2023 งานวิ่งการกุศลซิตี้รันแบบไม่สร้างขยะ ที่จัดขึ้นด้วยความร่วมมือของมูลนิธิ แอสเสท เวิรด์ เพื่อการกุศล หรือ AWFC ภายใต้ บริษัท แอสเสท เวิรด์ คอร์ป จำกัด (มหาชน) หรือ AWC ร่วมกับ กรุงเทพมหานคร และองค์กรพันธมิตรชั้นนำ ซึ่งจัดต่อเนื่องเป็นครั้งที่ 10 ในปีนี้
Amway Health & Wellbeing 28 มกราคม 2567
Amway Health & Wellbeing การมีชีวิตยืนยาวต้องมาพร้อมกับการมีสุขภาพดีที่ยั่งยืน มาร่วมเรียนรู้และไขกุญแจสู่หนทางการมีสุขภาพและความเป็นอยู่ที่ดีกับแอมเวย์ ในการฝึกอบรมพิเศษ “Amway Health & Wellbeing ที่สุดของสุขภาพและความเป็นอยู่ที่ดี" พบกันวันอาทิตย์ที่ 28 มกราคม 2567 เวลา 16.00 – 19.30 น. ณ ห้องบอลรูม 1-4 ชั้น 1 ศูนย์การประชุมแห่งชาติสิริกิติ์
งานประจำปีพิธีบวงสรวงพ่อพันท้ายนรสิงห์ 319 ปี วันที่ 29 - 31 มกราคม 2566
ขอเชิญเที่ยวงานประจำปีพิธีบวงสรวงพ่อพันท้ายนรสิงห์ 319 ปี
วันที่ 29 - 31 มกราคม 2566 ณ ศาลพันท้ายนรสิงห์ ต.พันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร
กิจกรรมสำคัญในงาน ได้แก่
- กิจกรรมการรำบวงสรวงพ่อพันท้ายนรสิงห์ เวลา 09.09 น.
- พิธีบวงสรวงพ่อพันท้ายนรสิงห์ วันที่ 31 มกราคม 2566 เวลา 18.00 น.
- ประมูลเครื่องบวงสรวง
- ขอเชิญชม ละครเวที พันท้ายนรสิงห์เทพเเห่งความซื่อสัตย์ เพื่อสืบสานตำนานคลองโคกขามสายน้ำแห่งความซื่อสัตย์ 319 ปี
ศาลพันท้ายนรสิงห์ หมู่ 3 ตำบลพันท้ายนรสิงห์ อำเภอเมืองฯ จังหวัดสมุทรสาคร [
แผนที่]
งานดนตรีในสวน Food Fun Fair มมส. มหาสารคาม
ชาวมหาสารคามพบกันอีกครั้งนะครับ
กับงานดนตรีในสวน Food Fun Fair 21.10 - 22.10 น.
ข้างสวนไดโนเสาร์ ใจกลาง มมส.
มีเพื่อนชวนเพื่อน
มีแฟนชวนแฟน
ไม่มีใครก็ชวนตัวเองมานะคร้าบบ
งานนี้ชมฟรี
งานประจำปี วัดแหลมใต้ 30 มกราคม - 1 กุมภาพันธ์ 2567
งานประจำปี
วัดแหลมใต้ ต หน้าเมือง อ เมือง จ ฉะเชิงเทรา 30 มกราคม - 1 กุมภาพันธ์ 2567 ไหว้พระนอนตาหวาน ปิดทองบูรพาจารย์วัดแหลมใต้ ลุ้นรางวัลกับไปทองพาโชค มีการแสดงทั้ง 3 คืน
•. 30-31 มกรา (ลุ้นรางวัลไหทองพาโชค) มอเตอร์ไซดิ์ จักรยานไฟฟ้า ทีวีสี ตู้เย็น หม้อหุงข้าวไฟฟ้า เครื่องซักผ้า พัดลม จักรยาน และรางวัลอีกมากมาย
•. 30 มกรา 67 เวลา 16.00 น. พบกับ เทศน์มหาชาติทรงเครื่องพระเวสสันดร-พระนางมัทรี-ชูชก-กัญหา-ชาลี รำวงย้อนยุคคลองเขื่อนสุดมันส์ มวยมันส์ๆอิกกลายคู่
•. 31 มกรา พบกับ ประกวดธิดาจำแลง(เงินรางวัลสูงสุด 10,000 บาท) รำวงย้อนยุคคลองเขื่อนสุดมันส์
•. 1 กุมภาพันธ์ พิธีทำบุญให้อดีตบูรพาจารย์วัดแหลมใต้ มอบทุนการศึกษาแก่พระภิกษุ-สามเณร และ นักเรียน ถวายภัตตาหารพระภิกษุและสามเณร ร่วมรับประทานอาหาร
บึงกาฬ ประกาศผลผู้ชนะประกวดออกแบบและตั้งชื่อ MASCOT ประจำจังหวัด
- รางวัลชนะเลิศ จำนวน 1 รางวัล ได้แก่ นายนพดล อนันต์ถาวร ชื่อผลงาน น้องบึงกาฬ ได้รับเงินรางวัล 10,000 บาท พร้อมประกาศนียบัตร
- รางวัลรองชนะเลิศ จำนวน 1 รางวัล ได้แก่ นายยศพล อ่วมทอง ชื่อผลงาน น้องบูบู้ (BuBu)ได้รับเงินรางวัล 5,000 บาท พร้อมประกาศนียบัตร
- รางวัล รางวัลรองชนะเลิศอันดับ 2 จำนวน 1 รางวัล ได้แก่ นางสาววราภรณ์ มามีชื่อผลงาน น้องบึงกาฬ ได้รับเงินรางวัล 3,000 บาท พร้อมประกาศนียบัตร
- รางวัลชมเชย จำนวน 3 รางวัล ได้แก่
1.นางสาวอคีราห์ ดรากันต์ ชื่อผลงาน น้องนาเคนทร์ ได้รับเงินรางวัล 1,000 บาท พร้อมประกาศนียบัตร
2.นางสาวณัฎฐิมา สมบัติบูรณ์ ชื่องผลงาน น้อง Good Thing ได้รับเงินรางวัล 1,000 บาท พร้อมประกาศนียบัตร
3.นางสาวอชิรญา มากสวัสดิ์ ชื่อผลงาน น้องบึงงาม ได้รับเงินรางวัล 1,000 บาท พร้อมประกาศนียบัตร
ผลงานที่ได้รับรางวัลชนะเลิศจะถูกนำไปพัฒนาดัดแปลงให้เหมาะสมในการนำไปสร้างเป็นมาสคอตประจำจังหวัดบึงกาฬ ต่อไป การตัดสินของกรรมการถือเป็นอันสิ้นสุด ภาพที่ได้รับการคัดเลือกทั้งหมด จะตกเป็นกรรมสิทธิ์ของจังหวัดบึงกาฬ ซึ่งมีสิทธิ์ที่จะปรับปรุงแก้ไขเปลี่ยนแปลงรายละเอียดต่างๆ ของภาพตามความเหมาะสม ตลอดจนมีสิทธิ์จะทำการเผยแพร่ในรูปแบบต่าง ๆ ได้
ผลิตภัณฑ์เสริมอาหาร LUTA ไม่มีการยื่นข้อมูล ประสิทธิผล ในการขออนุญาต LINK
31 มกราคม 66 ผลิตภัณฑ์ฉลากระบุ Luta ดังกล่าว ขออนุญาตเป็นผลิตภัณฑ์เสริมอาหาร ในชื่อ ผลิตภัณฑ์เสริมอาหาร ลูต้า (ตราแท็พ) / Luta Dietary Supplement Product (TaaP Brand) เลขอย. 74-1-18761-5-0264 ซึ่งในการยื่นขออนุญาตไม่มีการยื่นข้อมูล ประสิทธิผลตามที่กล่าวอ้างแต่อย่างใด ทั้งนี้ ผลิตภัณฑ์เสริมอาหารไม่มีผลในการบำบัด บรรเทา หรือรักษาโรค และต้องแสดงคำเตือนดังกล่าวบนฉลาก และการแสดงข้อความ ช่วยบำรุงอาการตาบอดกลางคืน ช่วยอาการเมื่อยล้าของดวงตา ชะลอความเสื่อมของ จอประสาทตา ต้านอาการอักเสบ บรรเทาอาการตาแห้ง และช่วยกรองแสงสีฟ้าได้ เป็น การโฆษณาคุณประโยชน์ คุณภาพ หรือสรรพคุณ ของอาหารอันเป็นเท็จ หรือ หลอกลวงให้เกิดความหลงเชื่อโดยไม่สมควร ซึ่ง อย. จะดำเนินการทางกฎหมายกับ ผู้กระทำการฝ่าฝืนพรบ. อาหาร พ.ศ. 2522 ต่อไป
ครีมหน้าใสพีวาย P.Y. Facial Skin cream พบสารประกอบของปรอทและสารสเตียรอยด์ เป็นสารห้ามใช้ LINK
สำนักงานคณะกรรมการอาหารและยา (อย.) ได้ดำเนินการตรวจสอบและทำการซื้อเครื่องสำอางจากร้านค้าออนไลน์ บัญชีเฟซบุ๊ก ชื่อ “P.Y. Shop - ครีมหน้าใสพีวาย” เมื่อวันที่ 22 เมษายน 2565 และส่งตรวจวิเคราะห์ที่กรมวิทยาศาสตร์การแพทย์ พบสารที่ห้ามใช้เป็นส่วนผสมในการผลิตเครื่องสำอาง จึงขอประกาศผลการตรวจสอบหรือผลวิเคราะห์เครื่องสำอางให้ประชาชนทราบ ดังนี้
ครีมหน้าใสพีวาย P.Y. Facial Skin cream
ไม่ระบุเลขที่ใบรับจดแจ้ง
ไม่ระบุ เลขที่ผลิต และ ครั้งที่ผลิต
ไม่ระบุ เดือนปี ที่ผลิตและเดือนปีที่หมดอายุ
สารห้ามใช้ ที่ตรวจพบ
1.สารประกอบของปรอท (Mercury compounds)
2.สารสเตียรอยด์ (Glucocorticoids ชนิดBetamethasone 17-valerate)
อันตรายของเครื่องสำอางข้างต้น ได้แก่
1. ผลิตภัณฑ์ที่ผสมสารประกอบของปรอท อาจทำให้เกิดการแพ้ ผื่นแดง ผิวหน้าดำ ผิวบางลง เกิดพิษสะสมของสารปรอท ทำให้ทางเดินปัสสาวะอักเสบ และไตอักเสบ
2. ผลิตภัณฑ์ที่ผสมสารสเตียรอยด์ (Glucocorticoids ชนิด Betamethasone 17-valerate) อาจทำให้ผิวบาง เกิดรอยแตก เส้นเลือดใต้ผิวหนังผิดปกติ หน้าแดงตลอดเวลา เกิดผื่นแพ้ เกิดสิวผด ผิวหนังมีสีจางลง หากใช้เป็นเวลานานจะเกิดด่างขาว
ข้อแนะนำ
ขอเตือนให้ประชาชนเลือกซื้อเครื่องสำอางด้วยความระมัดระวัง ซื้อจากร้านค้าที่มีหลักแหล่งแน่นอน ฉลากภาษาไทยมีข้อความตามที่กฎหมายกำหนดอย่างครบถ้วน ได้แก่ ชื่อเครื่องสำอาง ชื่อทางการค้า ประเภทเครื่องสำอาง ชื่อของสารที่ใช้เป็นส่วนผสม วิธีใช้ ชื่อและที่ตั้งของผู้ผลิต ผู้นำเข้า ปริมาณสุทธิ ครั้งที่ผลิต เดือนปีที่ผลิตหรือปีเดือนที่ผลิต คำเตือน (ถ้ามี) และเลขที่ใบรับจดแจ้ง สำหรับร้านค้าที่ซื้อเครื่องสำอางเพื่อจำหน่าย จะต้องซื้อจากผู้มีหลักแหล่งน่าเชื่อถือ และมีหลักฐานการซื้อขายที่ระบุชื่อและที่ตั้งของผู้ขายอย่างชัดเจน
กรณีที่พบผลิตภัณฑ์ ที่สงสัยว่าจะเป็นอันตราย สามารถสอบถามหรือแจ้งร้องเรียนได้ที่ สายด่วน อย. 1556 หรือผ่าน Line@FDAThai, Facebook: FDAThai หรือ E-mail: 1556@fda.moph.go.th ตู้ปณ. 1556 ปณฝ. กระทรวงสาธารณสุข จ.นนทบุรี 11004 หรือสำนักงานสาธารณสุขจังหวัดทั่วประเทศ
DECAAR by SCG x Café Amazon ชวนประกวดแบบฟาซาดร้านกาแฟ
DECAAR by SCG x Café Amazon ขอเชิญชวนสถาปนิก นักออกแบบ และน้อง ๆ นักศึกษา มาร่วมกันปลดปล่อยความคิดสร้างสรรค์ออกแบบฟาซาดสำหรับ Café Amazon ชิงเงินรางวัลรวม 232,500 บาท พร้อมโอกาสที่ผลงานของคุณจะได้สร้างจริง! ในการประกวดนี้ ทุกท่านจะต้องออกแบบฟาซาด Café Amazon โฉมใหม่ด้วยผลิตภัณฑ์คอลเล็กชั่นพิเศษ ผนังตกแต่ง เอสซีจี รุ่น โมดิน่า คอฟฟ์ (Modeena Coff) ที่ผลิตจากกากกาแฟของคาเฟ่อเมซอนและวัสดุรีไซเคิลอื่นๆ ร่วมกับผลิตภัณฑ์ตกแต่งฟาซาดของ DECAAR by SCG (เดการ์ บาย เอสซีจี)
ลงทะเบียนร่วมโครงการประกวดได้ตั้งแต่วันนี้
https://bit.ly/3Na3put ส่งผลงานภายในวันที่ 15 ก.พ. 67 เวลา 18.00 น.
ภายใต้คอนเซปต์ “Taste of Nature” ในบรรยากาศเป็นกันเอง เข้าถึงได้ง่าย อบอุ่น สื่อถึงการผจญภัย และความยิ่งใหญ่ของธรรมชาติ โดยในปี 2024 Café Amazon มาพร้อมแนวโน้มการออกแบบในสไตล์ Modern Minimal ที่ให้ความรู้สึก สว่าง บางเบา และการสอดแทรกแนวคิดความยั่งยืนไปพร้อมกัน ข้อมูลเพิ่มเติม
facebook.com/DECAARbySCGมันส์โคตร FOOD โรบินสัน ไลฟ์สไตล์ ฉะเชิงเทรา 31 มกราคม - 4 กุมภาพันธ์ 2567
มันส์โคตร FOOD โรบินสัน ไลฟ์สไตล์ ฉะเชิงเทรา 31 มกราคม - 4 กุมภาพันธ์ 2567 เริ่ม 17.00น.-24.00 น. เข้าฟรี 100% ไม่จำกัดอายุ งด จำหน่ายเครื่องดื่มแอลกอฮอล์ให้แก่เด็กอายุต่ำกว่า 20 ปีบริบูรณ์ มันโคตรฟู๊ด งานเทศกาลอาหารที่จัดเต็มทั้งรสชาติและบรรยากาศสุดชิค พร้อมศิลปินฟรีคอนเสิร์ต มันโคตรฟู๊ดมีโปรแกรมจัดในหลายจังหวัด ดังนี้ 31 มค - 4 กพ โรบินสัน ไลฟ์สไตล์ ฉะเชิงเทรา / 7-11 กพ โรบินสัน ไลฟ์สไตล์ จันทบุรี / 14-18 กพ โรบินสัน ไลฟ์สไตล์ ดอนหัวฬ่อ ชลบุรี / 21-25 กพ โรบินสัน ไลฟ์สไตล์ บ้านฉาง ระยอง
ตารางท่องเที่ยว SRT Royal Blossom ปี 2568
โปรแกรมขบวนรถท่องเที่ยว Royal Blossom จะพานักท่องเที่ยวเข้าสู่โลกแห่งความหรูหราและสะดวกสบาย ท่ามกลางทิวทัศน์สองข้างทางรถไฟที่สวยงาม ผ่านกระจกกว้างแบบ 180 องศา ให้บริการแบบไปเช้าเย็นกลับ ราคาท่านละ 1,799 บาท ต่อท่าน
นอกจากนี้ ยังมอบความเป็นส่วนตัวด้วยห้อง VVIP ในราคาห้องละ 15,999 บาท (แบบห้องละ 4-6 ท่าน) ซึ่งเป็นราคาที่รวมบริการอาหารเช้า กลางวัน อาหารว่าง และเครื่องดื่ม บริการนำเที่ยว ประกันอุบัติเหตุ ค่ารถบัสปรับอากาศ จำนวน 2 โปรแกรม ประกอบด้วย
เดือนมกราคม 2568
โปรแกรมเดือนมกราคม 4 ทริป เที่ยวทุ่งทานตะวัน ชมเขื่อน นั่งรถไฟลอยน้ำ ชมพระอาทิตย์ตกดิน
ทุกวันเสาร์อาทิตย์ วันที่ 18, 19, 25, 26 ราคาตั๋ว 1,799 บาท
- เช็กอิน ทุ่งทานตะวันที่ ไร่จำปี ที่บานสะพรั่ง
- แวะ บ้านกล้วย & ไข่คาเฟ่ มีมุมถ่ายรูปให้สัมผัสธรรมชาติ ทุ่งดอกไม้ นานาพรรณ พร้อมใกล้ชิดกับสัตว์ต่าง ๆ เช่น แพะ กระต่าย วัว หมูแคระ ให้บริการอาหารคาว - หวาน และเครื่องดื่ม รวนทั้งโขนร้านขาย ของฝากและพืชผลทางการเกษตรจากไร่
- เยี่ยมชม พิพิธภัณฑ์ลุ่มน้ำป่าสัก แหล่งเรียนรู้ที่จะทำให้รู้จักลุ่มน้ำป้าสักสัก แห่งนี้ได้อย่างหลากหลายมิติ ซึ่งแสดงมรดกทางวัฒนธรรมในพื้นที่ กักเก็บน้ำในเขื่อนป้าสักชลสิทธิ์ เป็นหลักฐานที่สำคัญในด้านโบราณคดี ประวัติศาสตร์ และวัฒนธรรมของพื้นที่โครงการฯ รวมทั้งการดำรง ชีวิต สภาพแวดล้อม ตลอดจนความรุ่งเรื่องของชมชน
- พานั่งรถไฟลอยน้ำ "ทอดผ่านผืนน้ำกลางเขื่อนป่าสักชลสิทธิ์ ในบรรยากาศยามเย็น ชมทัศนียภาพพระอาทิตย์ตกดินที่สุดแสนประทับใจ (Romantic Route)
เดือนกุมภาพันธ์ 2568
โปรแกรมเดือนกุมภาพันธ์ One Day Trip 8 ทริป ในธีม "กุมภา เทศกาลแห่งความรัก ชวนเที่ยวรถไฟสายโรแมนติก เส้นทางเพลินเพชรบุรี" ทุกวันเสาร์อาทิตย์ ที่ 1,2,8,9,15,16, 22,23 กุมภาพันธ์ 2568 ราคา 1,799 บาท
- กิจกรรมพิเศษคู่รักชวนเที่ยว สำหรับคู่รักที่ร่วมเดินทางบนขบวนรถ กับการท่องเที่ยวฯ เพชรบุรี
- กราบสักการะพระพุทธไสยาสน์องค์ใหญ่ ณ วัดพระพุทธไสยาสน์ พระพุทธรูปก่ออิฐถือปูนลงรักปิดทอง นับเป็นองค์ใหญ่อีกองค์ของไทย
- ชม Wall Art สายน้ำวิถี ชีวีเมืองเพชร แลนด์มาร์คใหม่แห่งเพชรบุรี
- ชมพระรามราชนิเวศน์ (วังบ้านปืน) ชวนจิบน้ำชายามบ่าย ฟังเพลงบรรเลง เคล้าบรรยากาศที่ร่มรื่น ในบรรยากาศสุดคลาสสิค และเป็นที่ประทับแปรพระราชฐาน ที่ ร.5 โปรดเกล้าให้สร้างขุ้นเมื่อเสด็จประพาสเพชรบุรี
- แวะช็อปที่ บ้านขนมนันทวัน เลือกซื้อขนมหวานเมืองเพชร เป็นของฝากก่อนกลับ
ตลอดการเดินทางจะไม่เหงาไม่เบื่อ แต่จะพบกับความสุขที่มีได้ระหว่างการเดินทาง กับอาหาร เครื่องดื่ม ขนมที่พร้อมเสิร์ฟได้ตลอด อาหารกล่องน้องๆ เบนโตะสไตล์ญี่ปุ่น เครื่องดื่มโซดาซ่ารสหวานหอมสีแดงชมพู Blossom ธีมเดียวกับขบวนรถ รวมถึงการออกแบบกล่องบรรจุภัณฑ์ ก็เช่นเดียวกัน
คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา ฉีดวัคซีน ฟรี 28 กันยายน 2567 ในกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก 2567
เนื่องในกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก 2567 คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา จัดกิจกรรมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงโดยไม่มีค่าใช้จ่าย (ฟรี) ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย [facebook]
อัพเดต เปิดลงทะเบียนเพื่อรับสิทธิในการทำหมัน, ฉีดวัคซีนโรคพิษสุนัขบ้าและวัคซีนโรคติดเชื้อ สามารถลงทะเบียนได้ใน Google form ตาม QR Code ในภาพ หรือในลิ้งค์ด้านล่าง
โดยเปิดลงทะเบียนตั้งแต่วันนี้ ถึง 16 กันยายน 2567 เวลา 16.00 น.หรือจนกว่าสิทธิจะเต็ม
***ผู้ลงทะเบียนที่ได้รับสิทธิ จะต้องนำสัตว์เลี้ยงมารับบริการในงาน "วันป้องกันโรคพิษสุนัขบ้าโลก" ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัยเท่านั้น***
กทม.จัดเทศกาลลอยกระทง 2 จุด บริเวณสะพานพระราม 8 และ คลองโอ่งอ่าง
งานลอยกระทงกรุงเทพมหานคร ประจำปี 2565 ชูแนวคิดลอยกระทงรักษ์โลก ควบคู่ไปกับการสืบสานประเพณีวิถีไทยและวิถีชีวิตของชุมชนที่มีต่อสายน้ำ รวมทั้งรณรงค์ให้ประชาชนใช้วัสดุธรรมชาติในการทำกระทง เพื่อลดปริมาณขยะและร่วมกันรักษาสิ่งแวดล้อม
ในปีนี้กรุงเทพมหานครกำหนดจัดงานลอยกระทงในพื้นที่หลักสองจุด
จุดที่หนึ่ง บริเวณสะพานพระราม 8 ฝั่งธนบุรี เขตบางพลัด โดยมีกิจกรรมต่าง ๆ ได้แก่ การแสดงศิลปวัฒนธรรมไทย เช่น การแสดงลำตัด เพลงเรือ และการแสดงจากศิลปิน เช่น วิด ไฮเปอร์ ภายในงานได้จำลองตลาดโบราณย้อนยุค สัมผัสกับของเล่นโบราณ และการจำหน่ายผลิตภัณฑ์กรุงเทพมหานคร (Bangkok Brand) ของดี 50 เขต ทั้งสินค้าหัตถกรรมและอาหารพื้นบ้าน
จุดที่สอง คือบริเวณคลองโอ่งอ่าง เขตพระนคร ในวันที่ 6-7 พฤศจิกายน 2565 โดยมีกิจกรรมการแสดง ดนตรีไทย ดนตรีประยุกต์ การแสดงศิลปวัฒนธรรมร่วมสมัย การแสดงจากศิลปินนักร้องนักดนตรี ฉายหนังกลางแปลง จุดถ่ายภาพ จุด Check in จำหน่ายสินค้า ของดีของเขตและชุมชน นอกจากนี้ กรุงเทพมหานครยังเปิดสวนสาธารณะ 33 แห่งทั่วกรุงเทพฯ ให้ประชาชนเข้าไปลอยกระทงด้วย
2 พ.ย. 65 พิจารณา ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ….
พิจารณา ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ….
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า นายกฯ กำชับโหวต กม.ในสภาให้เป็นไปในทิศทางเดียวกัน ส่วนกรณีพรรคประชาธิปัตย์แสดงจุดยืนจะสนับสนุนกัญชาในทางการแพทย์แต่ไม่สนับสนุนกัญชาเสรีซึ่งกฎหมายไม่มีคำว่า สันทนาการแม้แต่คำเดียว ไม่มีกัญชาเสรีมีแต่กัญชาทางการแพทย์ กัญชาเพื่อสุขภาพ กัญชาเพื่อเศรษฐกิจ แต่ในชั้นคณะกมธ. วิสามัญพิจารณาร่างพ.ร.บ.กัญชา กัญชง พรรคอื่นๆ และตัวแทนของฝ่ายค้านหลายพรรค ยังมีคำว่าสันทนาการและ นันทนาการ แต่ร่างแรกของพรรคภูมิใจไทยไม่มีคำว่าสันทนาการ ซึ่งสันนิษฐานได้ว่าเป็นการขัดแข้งขัดขา หรือไม่ได้อ่าน กฎหมาย แต่พูดไปตามความคิดที่เวลาไม่ได้ทำการบ้าน พอออกมาพูดก็เหมือนเป็นการปล่อยไก่
- นายศุภชัย ใจสมุทร ประธานคณะกมธ.วิสามัญพิจารณา ร่าง พ.ร.บ.กัญชา กัญชง (ฉบับที่…) พ.ศ. ….... โพสต์มีความ พยายามที่จะทำให้เข้าใจผิดว่า หากสภาผู้แทนราษฎรเห็นชอบกับร่างพ.ร.บ.กัญชา กัญชง จะทำให้เกิดกัญชาเสรี จึงมีการ คัดค้านการพิจาณาร่างกฎหมายฉบับนี้ ซึ่งเป็นเจตนาที่จะทำให้ป ชช.เข้าใจผิด เพราะกฎหมายกัญชา กัญชง คือ การสร้างมาตรการควบคุมการใช้กัญชาให้เป็นไปตามที่กฎหมายกำหนดไว้ เป็นไปตามนโยบายรัฐบาล ไม่ใช่เพื่อให้ใช้กัญชาเสรี การไม่มีกฎหมายทำให้เกิดกัญชาเสรีใช้กันตามใจ เยาวชนเข้าถึงกัญชาได้โดยง่าย รวมถึงเรียกร้องสมาชิกพรรคร่วมรัฐบาล ยึดถือนโยบายรัฐบาลเป็นแนวทางในการพิจารณาร่างกฎหมายกัญชา กัญชง
- นายปานเทพ พัวพงษ์พันธ์ กมธ.วิสามัญ พิจารณา ร่าง พ.ร.บ. กัญชา กัญชง พ.ศ.สภาผู้แทนราษฎร โพสต์จม.เปิดผนึกถึงสมาชิกสภาผู้แทนราษฎร ระบุ ร่างของ กมธ.ในขณะนี้ไม่ใช่ร่างเดิมของพรรคภท. แต่เป็นร่างของ กมธ. ที่มีส่วนประกอบของทั้งส.ส.ฝ่ายรัฐบาล และฝ่ายค้าน ตลอดจนตัวแทนหลายภาคส่วนของสังคม ดังนั้น ส.ส.ควรสนับสนุนให้มีการนำวาระดังกล่าวเข้าสู่การประชุมสภาฯ ให้เร็วที่สุด เพื่อที่จะได้มีโอกาสเปิดเผยร่างของ กมธ.สู่สาธารณะ รวมถึงขอให้ส.ส.พิจารณาลงมติรายมาตรา เพื่อให้ได้ข้อยุติในเรื่องกัญชา กัญชง โดยยึดเอาประโยชน์ของปชช.และประเทศชาติเป็นที่ตั้ง
- นายประสิทธิ์ชัย หนูนวล ประธานเครือข่ายเขียนอนาคตกัญชาไทย ตัวเเทนจากพรรคก้าวไกล โพสต์ ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. ... ที่จะเข้าสู่การพิจารณาของสภาผู้แทนราษฎร ในวาระที่ 2 ขอให้ ส.ส.ตระหนักถึงความจำเป็นของการมีกฎหมาย โดยหากพิจารณาสาระของ พ.ร.บ. จะพบว่า เป็น พ.ร.บ.เพื่อการควบคุม ไม่ใช่ พ.ร.บ.ที่ทำให้กัญชาเสรี
แลกโหวตพ.ร.บ.กัญชากัญชง - สุราก้าวหน้า
นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวปฏิเสธถึงกระแสข่าวการแลกโหวตระหว่างพรรคภูมิใจไทยกับพรรคก้าวไกล ต่อร่าง พ.ร.บ.กัญชา กัญชง และร่าง พ.ร.บ.สุราก้าวหน้า โดยยืนยันว่าไม่มีรวมถึงนโยบายกัญชา เป็นนโยบายเร่งด่วนของรัฐบาล ที่จะนำมาใช้ทางการแพทย์ เน้นใช้เรื่องสุขภาพ เป็นทางเลือกในการสร้างรายได้ และออกกฎหมายเพื่อควบคุมการใช้ให้อยู่ในกรอบทางการแพทย์
รอบชิงชนะเลิศ
18 ธันวาคม 2565
เวลา 22.00 น. อาร์เจนตินา - ฝรั่งเศส (True4U, 7HD, True Sports 2)
17 ธันวาคม 2565
รอบชิงที่ 3 เวลา 22.00 น. โครเอเชีย - โมร็อกโก (True4U, PPTV 36)
เขตคันนายาว 13-17 มีนาคม และ 20-24 มีนาคม 2566 LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว ร่วมกับ ศูนย์บริการสาธารณสุข 69 คันนายาว สำนักอนามัย ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยง ให้บริการฟรี (free) 13-17 มีนาคม และ 20-24 มีนาคม 2566 เวลา 9-12 น.
สอบถามข้อมูลเพิ่มเติม ▫️ศูนย์บริการสาธารณสุข 69 คันนายาว โทร 02-3798911 ถึง 2 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว โทร 02-3799945
ห้องตรวจทั่วไป
ห้องตรวจทั่วไป อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 1 เบอร์โทรศัพท์ 044-615002 ต่อ 4102-4103
ห้องตรวจโรคทั่วไป (นอกเวลาราชการ)
อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 1 เบอร์โทรศัพท์ 044-615002 ต่อ 4102-4103 (ไม่คิดค่าบริการ SMC)
ก้าวไกลประกาศพรรคร่วมรัฐบาล 308 เสียง
นายพิธา ลิ้มเจริญรัฐ หัวหน้าพรรคก้าวไกล แถลงข่าว การจัดตั้งรัฐบาล เสียงข้างมาก รวม 308 เสียง ประกอบด้วย พรรคก้าวไกล (112) พรรคเพื่อไทย (112) พรรคไทยสร้างไทย (5) พรรคประชาชาติ (7) พรรคเสรีรวมไทย เป็นจำนวนที่เพียงพอแล้วในการจัดตั้งรัฐบาล
*วงเล็บคือจำนวนสส.เขต
ผลการแข่งขัน Toyota Gazoo Racing Motorsport 2023 สนามที่ 1 บางแสน สตรีทเซอร์กิต จ.ชลบุรี
ผลการแข่งขัน Toyota Gazoo Racing Motorsport 2023 สนามที่ 1 บางแสน สตรีทเซอร์กิต จ.ชลบุรี
▪️ รุ่น Yaris One Make Race D1
อันดับที่ 1 หมายเลข 66 ศริทธนา มิตรอารี
อันดับที่ 2 หมายเลข 39 นิพิฐพนธ์ วัฒนานิตย์
อันดับที่ 3 หมายเลข 3 เกียรติพรรณ ไผ่เจริญ
อันดับที่ 4 หมายเลข 78 อภิชัจจ์ วิวัฒน์สุรกิจ
อันดับที่ 5 หมายเลข 57 อเล็กซ์ โกรคอทท์
▪️ รุ่น Yaris One Make Race D2
อันดับที่ 1 หมายเลข 41 สหรัฐ กั้วนามน
อันดับที่ 2 หมายเลข 54 อรรถพล อิทธิรัตนะโกมล
อันดับที่ 3 หมายเลข 8 คมกฤษ งามพิเชษฐ์
อันดับที่ 4 หมายเลข 36 ฐิติณัฎฐ์ ภุมรินทร์
อันดับที่ 5 หมายเลข 33 Clement Leung
▪️ รุ่น Yaris Ativ Lady One Make Race
อันดับที่ 1 หมายเลข 135 ปิยะวดี พฤฒิสาร
อันดับที่ 2 หมายเลข 115 อลิสา ขุนแขวง
อันดับที่ 3 หมายเลข 128 ปัณฑ์นลิน ทวยเดช
อันดับที่ 4 หมายเลข 114 ไอริส ฮอฟชมิดท์
อันดับที่ 5 หมายเลข 168 ศิริภากรณ์ แยบยนต์
▪️ รุ่น Collora Altis GR Sport One Make Race
อันดับที่ 1 หมายเลข 9 อะกิ จิตรานุวัฒน์
อันดับที่ 2 หมายเลข 25 นรรัศมิ์ อภิวาท
อันดับที่ 3 หมายเลข 45 ทยาพล คงสุวรรณ
อันดับที่ 4 หมายเลข 19 สุรศักดิ์ ดาเก็ง
อันดับที่ 5 หมายเลข 89 สิตาวีร์ ลิ้มนันทรักษ์
▪️ รุ่น Hilux Revo One Make Race
อันดับที่ 1 หมายเลข 2 เอกสิทธิ์ นามแสงผา
อันดับที่ 2 หมายเลข 44 อรุณพงศ์ ศรีฤทธิ์
อันดับที่ 3 หมายเลข 98 เมฆรัชคีฏาก์ กะลันตานนท์
อันดับที่ 4 หมายเลข 4 นฤชิต เกียรติมณีศรี
อันดับที่ 5 หมายเลข 22 ธีรพันธ์ พรมขำ
*ผลการแข่งขันอย่างไม่เป็นทางการ จาก Toyota Gazoo Racing
ติดตามความสนุกกับ Toyota Gazoo Racing Motorsport Thailand 2023 สนามถัดไปที่จังหวัดภูเก็ต 5-6 สิงหาคม นี้
ปฏิทินการจ่ายเงินอุดหนุน ประจำปีงบประมาณ พ.ศ.2566
ปฏิทินการจ่ายเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด ประจำปีงบประมาณ พ.ศ. 2566 (ตุลาคม 2565 - กันยายน 2566) ดังนี้
- เดือนตุลาคม 2565 วันจันทร์ที่ 10 ตุลาคม 2565
- เดือนพฤศจิกายน 2565 วันพฤหัสบดีที่ 10 พฤศจิกายน 2565
- เดือนธันวาคม 2565 วันศุกร์ที่ 9 ธันวาคม 2565
- เดือนมกราคม 2566 วันอังคารที่ 10 มกราคม 2566
- เดือนกุมภาพันธ์ 2566 วันศุกร์ที่ 10 กุมภาพันธ์ 2566
- เดือนมีนาคม 2566 วันศุกร์ที่ 10 มีนาคม 2566
- เดือนเมษายน 2566 วันจันทร์ที่ 10 มีนาคม 2566
- เดือนพฤษภาคม 2566 วันจันทร์ที่ 10 เมษายน 2566
- เดือนมิถุนายน 2566 วันศุกร์ที่ 9 มิถุนายน 2566
- เดือนกรกฎาคม 2566 วันจันทร์ที่ 10 กรกฎาคม 2566
- เดือนสิงหาคม 2566 วันพฤหัสบดีที่ 10 สิงหาคม 2566
- เดือนกันยายน 2566 วันศุกร์ที่ 8 กันยายน 2566
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ศูนย์ปฏิบัติการโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด
- โทรศัพท์หมายเลข 08 2091 7245, 08 2037 9767, 08 3431 3533, 06 5731 3199 (ในวันเวลาราชการ จันทร์ - ศุกร์ ระหว่างเวลา 08.30 - 17.00 น.)
- ศูนย์ช่วยเหลือสังคม กระทรวง พม. โทร. 1300 ตลอด 24 ชั่วโมง
ข้อมูลจากเพจตรวจสอบสถานะสิทธิ
https://csgcheck.dcy.go.thติดต่อตำรวจ PCT
มีปัญหาถูกหลอก ต้องรีบติดต่อตำรวจโดยเร็ว ติดต่อพี่ๆ ตำรวจ PCT POLICE ที่ทางช่องทางเหล่านี้
ปฎิทินเที่ยวกาญจนบุรี เดือนกุมภาพันธ์ 2567
กิจกรรมท่องเที่ยวกุมภาพันธ์อัดแน่นตลอดทั้งเดือน
- 2-4 ก.พ. 67 งานศิลป์อาหารถิ่นกาญจน์ (KAN Paper Mill 2024 : The Moment of Arts & Local Flavours) สถานที่ : โรงงานกระดาษไทยกาญจนบุรี อ.เมือง จ.กาญจนบุรี
- 2 - 3 ก.พ. 67 งานหนาวนี้ที่ชะแล ครั้งที่ 7 สถานที่ : ไร่ปราถนา บ้านทุ่งนางครวญ หมู่ที่ 6 ตำบลชะแล อำเภอทองผาภูมิ จังหวัดกาญจนบุรี
- 2-4 ก.พ. 67 งาน The Rhythm Balloon Festival #2 สถานที่ : The Village Farm To Café ริมถนนสาย 323 (กาญจนบุรี-ไทรโยค) ต.หนองบัว อ.เมือง จ.กาญจนบุรี
- 9 ก.พ. 67 เทศกาลความรัก ณ เขื่อนศรีนครินทร์ ปี 2567 "ความรักซื่อตรง มั่นคงดั่งตัวเขื่อน" สถานที่ : สันเขื่อนศรีนครินทร์ อ.ศรีสวัสดิ์ จ.กาญจนบุรี (บริการรถรับ-ส่ง บริเวณสวนเวลารำลึก)
- 10-14 ก.พ. 67 หอมกลิ่นกาญจน์ เทศกาลพฤกษาและพรรณไม้กาญจนบุรี สถานที่ : โรงงานกระดาษไทยกาญจนบุรี อ.เมือง จ.กาญจนบุรี
- 14 ก.พ. 67 พรหมลิขิตพิชิตใจ จามจุรียักษ์ใหญ่เป็นพยาน สถานที่ : ต้นจามจุรียักษ์ ต.เกาะสำโรง อ.เมือง จ.กาญจนบุรี
- 17-26 ก.พ. 67 งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2567 สถานที่ : พระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช ต.ดอนเจดีย์ อ.พนมทวน จ.กาญจนบุรี
- 29 ธ.ค. 66 – 19 ก.พ. 67 บ้านไร่นายรุ่ง ซีซั่น 8 สถานที่ : บ้านไร่นายรุ่ง ต.กลอนโด อ.ด่านมะขามเตี้ย จ.กาญจนบุรี
- 1 ธ.ค. 66 – 26 ก.พ. 67 บุฟเฟ่ต์ลำไยและสวนดอกไม้ สถานที่ : สวนเมเปิ้ล ริมถนนสาย 323 เลยแยกบ้านเก่า ยูเทิร์นที่ 2 ทางขวามือ ต.ลาดหญ้า อ.เมือง
ดนตรีในสวนกรุงเทพมหานคร กุมภาพันธ์ 2567
กิจกรรมดนตรีในสวนกรุงเทพมหานคร กุมภาพันธ์ 2567 ดังนี้
วันเสาร์ที่ 3 กุมภาพันธ์ 2567
ท่าน้ำภาณุรังษี เขตสัมพันธวงศ์ ศิลปิน วงดนตรีมหาวิทยาลัยกรุงเทพธนบุรี และ วง In & Out เริ่ม 16.00 น.
สวนสาธารณะเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา ศิลปิน วง BMA Band เริ่ม 16.30 น.
วันอาทิตย์ที่ 4 กุมภาพันธ์ 2567
ท่าน้ำภาณุรังษี เขตสัมพันธวงศ์ ศิลปิน วง Bangkok Trio เริ่ม 16.00 น.
สวนปทุมวนานุรักษ์ ศิลปิน วง Bangkok String Ensemble เริ่ม 16.30 น.
อุทยานเบญจสิริ (ลานเหรียญ) ศิลปิน วงดนตรีไทยร่วมสมัย กรุงเทพมหานคร เริ่ม 17.00 น.
สวนลุมพินี (ศาลาภิรมย์ภักดี สวนปาล์ม) ศิลปิน Royal Bangkok Symphony Orchestra เริ่ม 17.30 น.
เสาร์ที่ 10 กุมภาพันธ์ 2567
สวนลุมพินี วงคอนเทม กรุงเทพมหานคร เริ่ม 16.30 น.
อาทิตย์ที่ 11 กุมภาพันธ์ 2567
สวนธนบุรีรมณ์ วง บางมดสตริงออร์เคสตรา (Bangmod String Orchestra) เริ่ม 16.30 น. [
map]
สวนปทุมวนานุรักษ์ วง Bangkok Trio เริ่ม 16.30 น.
สวนเบญจกิติ วง Bangkok Metropolitan Orchestra เริ่ม 17.00 น.
เสาร์ที่ 17 กุมภาพันธ์ 2567
สวนเบญจกิติ วง Paramount เริ่ม 16.30 น.
อาทิตย์ที่ 18 กุมภาพันธ์ 2567
สวนปทุมวนานุรักษ์ วง Bangkok Trio เริ่ม 16.30 น.
สวนสันติชัยปราการ ชมการบรรเลงบทเพลงพื้นบ้านจากภาคอีสาน โดย วงโปงลางกรุงเทพมหานคร และศิลปินรับเชิญ คุณเต๋า ภูศิลป์ เริ่ม 17.00 น.
สวนลุมพินี (ลานสวนปาล์ม) วง Royal Bangkok Symphony Orchestra มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้าฯ เริ่ม 17:30 น.
ศุกร์ที่ 23 ก.พ. 2567
สวนหลวงพระราม 8 กิจกรรม Thailand International Percussion Festival 2024 : Music in the Park โดยสถาบันดนตรีกัลยาณิวัฒนาและกรุงเทพมหานคร
- Oh! Percussion Ensemble
- Einschlag Ensemble Studio
- Kana Omori
- Ratwinit Bangkaeo Percussion Ensemble
- Ektra Percussion Ensemble
- Horwang Percussion Ensemble
- TIME SOUL Percussion Group
เสาร์ที่ 24 ก.พ. 2567
สวนเบญจกิติ พบกับศิลปินอิสระ วง Sourdough เริ่ม 16:30 น.
สวนลุมพินี ดนตรีแนวพื้นเมืองและนาฏศิลป์ วงโปงลางกรุงเทพมหานคร เริ่ม 16:30 น.
อาทิตย์ที่ 25 ก.พ. 2567
สวนปทุมวนานุรักษ์ พบกับความชิลล์กับดนตรี 3 ชิ้น วง Bangkok Trio เริ่ม 16:30 น.
สวนเบญจกิติ เทศกาลดนตรีกรุงเทพมหานคร พบกับวง Bangkok Metropolitan Orchestra (BMO) และศิลปินรับเชิญ โน้ต ศรัณย์ คุ้งบรรพต และ ใบพลู ภาวิดา พรวัฒนานุกูล พร้อมด้วยศิลปินมากมาย Vocal : พัทธนันท์ อาจองค์ Violin : พงศ์สิต การย์เกรียงไกร Trumpet : ศุภวันชัย ประกายกิจ Chorus : มิตรไมตรีคอรัส เริ่ม 17:00 น.
สวนลุมพินี (ลานสวนปาล์ม) เทศกาลดนตรีในสวน วง Royal Bangkok Symphony Orchestra มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้าฯ เริ่ม 17:30 น.
ปฏิทินกิจกรรมน่าเที่ยว จ.หนองคาย เดือนกุมภาพันธ์ 2567


- วันที่ 8 - 12 กุมภาพันธ์ 2567 ชมการแข่งขันร่มร่อนบินลงเป้าแม่นยำชิงแชมป์แห่งประเทศไทยและนานาชาติ สานสัมพันธ์อาเซียน ครั้งที่ 8 - เอเอฟเอ เนชั่นลีก ณ ผาตากเสื้อ จ.หนองคาย
- วันที่ 15 - 18 กุมภาพันธ์ 2567 ชมการแข่งขันร่มร่อนบินลงเป้าแม่นยำเวิลด์คัพ ประจำปี 2567 ณ ผาตากเสื้อ จ.หนองคาย ได้ชม ได้เชียร์แล้ว ต้องได้เที่ยว เพราะแหล่งท่องเที่ยวบริเวณใกล้เคียงสวยมากก -ชมวิวโขงบนสกายวอล์ค วัดผาตากเสื้อ -ชมหมอก ภูห้วยอีสัน -สัมผัสถ้ำพญานาค “ถ้ำเพียงดิน” -ชมโขง ล่องเรือชมพันโขดแสนไคร้ -และอีกมากมาย
- 20 - 24 กุมภาพันธ์ 2567 งานนมัสการพระบรมสารีริกธาตุองค์พระธาตุบังพวนประจำปี2567 ณ วัดพระธาตุบังพวน อ.เมือง จ.หนองคาย มหรสพตลอด 5 วัน 5 คืน 20 ก.พ. 67 เชิญพระอุปคุต/พิธีเปิดงาน/พิธีบวชชีพราหมณ์ 21 ก.พ. 67 หมอลำใจเกินร้อย บอย ศิริชัย แอน อรดี 22 ก.พ. 67 ศึกมวยไทย 15 คู่ 23 ก.พ. 67 คอนเสิร์ตวาไรตี้ ต้อมมิวสิค 24 ก.พ. 67 (กลางวัน)ฟังลำกลอนประยุกต์ แม่บุญช่วง เด่นดวง 24 ก.พ. 67 (กลางคืน)ใหม่ พัชรี ไชยเลิศ
- วันที่ 22-24 กุมภาพันธ์ 2567 งานประเพณีสมโภชพระธาตุหล้าหนอง ประจำปี 2567 ณ พระธาตุหล้าหนอง พระธาตุกลางน้ำ เทศบาลเมืองหนองคาย วันที่ 22 กุมภาพันธ์ 2567 -พิธีบวงสรวงเจ้าพ่อพระธาตุกลางน้ำ -พิธีบวงสรวงพระธาตุกลางน้ำ -พิธีบายศรี/รำบวงสรวงพระธาตุหล้าหนอง -พิธีบวชชีพราหมณ์ วันที่ 23 กุมภาพันธ์ 2567 -เปิดรับบริจาคจตุปัจจัย ดอกไม้ ธูป เทียน ตักบาตรประจำวันเกิด ผ้าป่าลอยฟ้า ตักบาตร108 -ทำบุญผ้าห่มพระธาตุหล้าหนอง -ชมมหรสพ หมอลำย้อนยุค วันที่ 24 กุมภาพันธ์ 2567 -พิธีทำบุญตักบาตรริมโขงหน้าพระธาตุหล้าหนอง พระสงฆ์ 73รูป -ร่วมแห่ผ้าขึ้นห่มพระธาตุหล้าหนอง -ร่วมเวียนเทียน - การแสดงมหรสพ วงนกยูงทอง
- 23 กุมภาพันธ์ ถึง 1 มีนาคม 2567 งานมหกรรมข้าวพันธุ์ดีฉลอง 30 ปีและของดีอำเภอสระใครประจำปี 2567 ณ สนามหน้าที่ว่าการอำเภอสระใคร จังหวัดหนองคาย ไฮไลท์ของงาน เจดีย์รวงข้าวขนาดใหญ่ที่ถูกมัดรวมกันประดับตกแต่งไฟสวยงาม นอกจากจะได้ชมศิลปะจากรวงข้าวแล้ว กิจกรรมภายในงานประกอบด้วย - นิทรรศการหุ่นไม้ไผ่สานยักษ์ - นิทรรศการของหน่วยงานราชการ - การเวียนเทียนข้าวเปลือก - การประกวดธิดาข้าวหอม - การประกวดหนุ่มหล่อข้าวพันธุ์ดี - การประกวดร้องเพลง - การประกวดเต้นแอโรบิค - การประกวดเมล็ดข้าวพันธุ์ดี - การประกวดตำข้าวลีลา - การจัดจำหน่ายเมล็ดพันธุ์ข้าว - การจำหน่ายผลิตภัณฑ์ OTOP - การจำหน่ายสินค้าเกษตร และสินค้าจากโรงงาน โดยพิธีเปิดงานมีพิธีบวงสรวงสู่ขวัญข้าว และพิธีรำบวงสรวงพระเเม่โพสพ นางรำกว่า 600 คน มีมหรสพตลอดคืน 23 ก.พ. 67 ลำเพลิน วงศกร 24 ก.พ. 67 ฮันนี่ นิชาดา 25 ก.พ. 67 ดอกเหมย เพ็ญนภา สมสุข 26 ก.พ. 67 ยองบ่าง 27 ก.พ. 67 เนสกาแฟ ศรีนคร 28 ก.พ. 67 ตรี ชัยณรงค์ 1 มี.ค. 67 ประถมบันเทิงศิลป์
หน่วยเคลื่อนที่กทม. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ก.ค.-ธ.ค. 2567
กำหนดการหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จุดต่างๆ ดังนี้ (จากเพจ
กลุ่มควบคุมโรคพิษสุนัขบ้า)
- วันอังคารที่ 2 กรกฎาคม 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 6 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 3 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองคู้บนพัฒนา แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 4 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองยายชุ่มอุทิศ แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ประจำปีงบประมาณ พ.ศ. 2567
กรมปศุสัตว์ กรมส่งเสริม การปกครองท้องถิ่น และกรมควบคุมโรค ได้จัดทำโครงการความร่วมมือการรณรงค์ป้องกันโรคพิษสุนัขบ้า ประจำปีงบประมาณ พ.ศ. 2567 ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธานศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี โดยกำหนดให้ องค์กรปกครองส่วนท้องถิ่นทุกแห่ง ดำเนินการฉีดวัคซีนเพื่อสร้างภูมิคุ้มกันต่อโรคพิษสุนัขบ้าในสุนัขและแมว พร้อมกันทั้งประเทศ ระหว่างวันที่ 2 มีนาคม - 31 สิงหาคม 2567 ซึ่งเป็นไปตามข้อกำหนดขององค์การ อนามัยโลก (WHO) และองค์การโรคระบาดสัตว์ระหว่างประเทศ (OIE) ที่ได้กำหนดเป้าหมายของการฉีดวัคซีน ที่จะทำให้เกิดภูมิคุ้มกันต่อโรคพิษสุนัขบ้าอย่างมีประสิทธิภาพ โดยสุนัขและแมวจะต้องได้รับการฉีดวัคซีน อย่างน้อยร้อยละ ๗- ของจำนวนสุนัขและแมวในพื้นที่ แต่เนื่องจากในหลายพื้นที่ของประเทศยังพบการเกิด โรคพิษสุนัขบ้าในสัตว์ จึงขอความร่วมมือให้ดำเนินการฉีดวัคนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมว ให้ครอบคลุมมากกว่าร้อยละ 80 เพื่อป้องกันโรคในพื้นที่และเตรียมความพร้อมในการสร้างพื้นที่ปลอดโรค นอกจากนี้ในพื้นที่พบโรคขอให้เร่งดำเนินการควบคุมโรคอย่างเร่งด่วนกำหนดการกิจกรรมเก็บให้เกลี้ยง ไม่เลี้ยงลูกน้ำยุง ปี 2567
ข้อมูลอ่านเพิ่มเติมเรื่องโรคลมร้อน ฮีทสโตรค
ข้อมูลอ่านเพิ่มเติมเรื่องโรคลมร้อน ฮีทสโตรค
4 อาการของสัตว์ที่ติดโรคแอนแทรกซ์
โรคแอนแทรกซ์ (ANTHRAX) เป็นโรคติดต่อจากสัตว์สู่คน เกิดจากเชื้อแบคทีเรีย Bacilus Anthracis พบในสัตว์เลี้ยงลูกด้วยนม โดยเฉพาะสัตว์เคี้ยวเอื้องที่กินหญ้าเป็นอาหาร ได้แก่ โค กระบือ แพะ แกะ โดยสัตว์ที่ป่วยจะมีอาการเฉียบพลัน ดังนี้
- ตายกะทันหัน
- พบเลือดไหลออกจากปาก จมูก และรูทวาร อวัยวะเพศ เลือดมีลักษณะเป็นสีดำๆ ไม่แข็งตัว กลิ่นเหม็นคาวจัด ซากสัตว์จะนิ่ม และเน่าอืดเร็ว
- หายใจลำบาก
- ยืนโซเซ กล้ามเนื้อกระตุก ชัก
ข้อแนะนำสำหรับประชาชน ควรบริโภคเนื้อสัตว์ที่ผ่านการปรุงสุก และเลือกซื้อจากแหล่งที่เชื่อถือได้
โครงการทำหมันสุนัขจ.ชุมพร กุมภาพันธ์ 2567
ตารางทำหมันเดือน กุมภาพันธ์ 2567
- 6 ก.พ. วัดบางลึก
- 7 ก.พ. โรงเรียนชุมชนวัดหาดพันไกร
- 8 ก.พ. อบต.นาทุ่ง
- 9 ก.พ. บ้านบางเจริญ ท่ายาง
- 10 ก.พ. หน่วยทำหมัน love dog บ้านถั่วเขียว ถั่วคั่ว
- 11 ก.พ. หมู่ 5 ต.พระรักษ์ อ.พะโต๊ะ
- 12 ก.พ. วัดหูรอ
กำหนดการให้บริการทำหมันในเขตนครปฐม ประจำปี 2567
กำหนดการให้บริการทำหมันโดย
เทศบาลนครนครปฐม ประจำปี 2567
- วันอังคารที่ 31 มกราคม 2567 เวลา 09.00 - 12.00 น. ณ ศาลาสุขาวดี ตำบลบ่อพลับ ลงทะเบียนจองคิวในวันที่ 17 - 27 มกราคม 2566 เวลา 09.00 - 16.00 น. เว้นวันหยุดราชการ โทรศัพท์ (สายตรง) 034-966439, 034-966440 ถึง 4 ต่อ 119
- วันจันทร์ที่ 19 กุมภาพันธ์ 2567 เวลา 09.00 - 10.30 น. ณ อาคารจอดรถหลังโรงยิม 4,000 ที่นั่ง ศูนย์กีฬาเทศบาลนคนครปฐม เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 8 - 15 กุมภาพันธ์ 2567 (จำกัดจำนวน 100 ตัว)
- วันจันทร์ที่ 18 มีนาคม 2567 เวลา 09.00 - 10.30 น. ณ หน้าศาลาพระปริยัติธรรม วัดไผ่ล้อม สอบถามข้อมูล : สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครนครปฐม โทร. 034-242199 และ 034-966440 ถึง 4 ต่อ 21 (ในวันและเวลาราชการ)
- วันจันทร์ที่ 13 พฤษภาคม 2567 เวลา 9.00-10.30 น. ณ โดมโรงเรียนเทศบาล 1 วัดพระงาม (สามัคคีพิทยา) เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 30 เมษายน - 8 พฤษภาคม 2567
- วันศุกร์ที่ 5 กรกฎาคม 2567 เวลา 09.00 - 10.30 น. ณ ศาลเจ้าพ่อปู่ (ชุมชนลำพยา) เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 25 มิถุนายน - 2 กรกฎาคม 2567 ฟรี‼ (จำกัดจำนวน 100 ตัว) สามารถลงทะเบียนได้ 2 ช่องทาง 1. ลงทะเบียนได้ที่เบอร์โทรศัพท์ 034-242199 และ 034-966440 ถึง 4 ต่อ 22 เวลา 09.00 - 15.00 น. เว้นวันหยุดราชการ 2. ลงทะเบียนผ่าน QR - Code ในภาพ
- วันจันทร์ที่ 9 กันยายน 2567 เวลา 09.00 - 10.30 น. ณ สมาคมตระกูลแซ่ลิ้มแห่งประเทศไทย จังหวัดนครปฐม เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 28 สิงหาคม - 5 กันยายน 2567 ฟรี ‼ (จำกัดจำนวน 100 ตัว) สามารถลงทะเบียนได้ 2 ช่องทาง 1. ลงทะเบียนได้ที่เบอร์โทรศัพท์ 034-242199 และ 034-966441 ถึง 4 ต่อ 22 เวลา 09.00 - 15.00 น. เว้นวันหยุดราชการ 2. ลงทะเบียนผ่าน QR - Code ในภาพ
ศ.ดร.ปาริชาต สถาปิตานนท์ รักษาการรองอธิการบดีจุฬาลงกรณ์มหาวิทยาลัย และ ศาสตราจารย์ ศาสตราจารย์ ดร.เอียน เฟนวิค (Prof. Ian Fenwick, Ph.D.) ผู้อำนวยการศศินทร์ BREAKING นักมวยหญิงชาวอิตาลีล้มลงคุกเข่าและร้องไห้ขณะที่เธอยุติการชกกับคู่ต่อสู้โอลิมปิกที่ถูกมองว่าเป็นชายโดยกำเนิด หลังจากชกเข้าที่ใบหน้าอย่างแรงถึงสองครั้งจนหมวกกันน็อคหลุดออก
นักมวยที่มีลักษณะทางชีวภาพเป็นชาย (biological male) เอาชนะนักมวยหญิงชาวอิตาลี ในวันนี้ ซึ่งถือเป็นการชกที่ก่อให้เกิดความขัดแย้งมากที่สุดครั้งหนึ่ง
การชกใช้เวลา 46 วินาที และคู่ต่อสู้ชาวอิตาลีของเธอโยนหมวกกันน็อคของเธอลงพื้น หลังการชกยุติลง
เธอปฏิเสธการจับมือ ล้มลงไปบนพื้นผ้าใบ ร้องไห้ออกมา หลังจากชกไปเพียงสองหมัด
อิมาน เคลิฟ นักมวยชาวแอลจีเรีย วัย 25 ปี ขึ้นชกกับแองเจลา คารินี นักมวยชาวอิตาลี วัย 25 ปี แม้จะถูกห้ามชกมวยรายการใหญ่ก่อนโอลิมปิกจะเริ่มขึ้น
หลังจากการแข่งขันยุติลง กรรมการยกมือของเคลิฟขึ้น แต่คารินีโกรธอย่างเห็นได้ชัด จึงดึงมือของเธอออกจากกรรมการก่อนออกจากเวทีโดยไม่จับมือคู่ต่อสู้ นักสู้ชาวอิตาลีไม่สนใจนักชกชาวแอลจีเรีย จากนั้นก็คุกเข่าลงและร้องไห้ออกมา เธอบอกว่าเธอไม่เคยรู้สึกถูกโจมตีอย่างรุนแรงเช่นนี้มาก่อนในการแข่งขัน
หลังการแข่งขัน นักสู้ชาวอิตาลีที่หัวใจสลายกล่าวว่า "ฉันให้เกียรติประเทศของฉันด้วยความจงรักภักดีเสมอมา ครั้งนี้ฉันไม่ประสบความสำเร็จเพราะไม่สามารถต่อสู้ได้อีกต่อไป ดังนั้น ฉันจึงยุติการแข่งขัน"
เธอกล่าวว่าเธอไม่ได้เดินออกจากการแข่งขันเพื่อประท้วงการเข้าร่วมของคู่ต่อสู้ แต่เป็นการตัดสินใจของโอลิมปิกที่จะต้องพิจารณา
เธอถูกนำตัวไปตรวจร่างกายเพื่อตรวจสอบความรุนแรงของอาการบาดเจ็บที่ใบหน้า ซึ่งรวมถึงจมูกฟกช้ำ
เคลิฟถูกขับออกจากการแข่งขันชิงแชมป์โลกเมื่อปีที่แล้ว หลังจากไม่ผ่านการทดสอบฮอร์โมนเทสโทสเตอโรนเพื่อยืนยันคุณสมบัติทางเพศ
แต่ถึงแม้เธอจะมีปัญหาในการทดสอบเพศ แต่เธอก็ได้รับการยอมรับให้เข้าร่วมการแข่งขันโอลิมปิกท่ามกลางความโกลาหลครั้งใหญ่
พิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี กิจกรรมปี 2567
พิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี ปี 2567 มีกิจกรรมน่าสนใจต่อเนื่อง
- 28 มีนาคม 2567 กิจกรรม Thailand Creative Cities Network (TCCN 2024) : นวัตกรรมเมือง (Cities Innovation) ณ โรงละครแห่งชาติภาคตะวันตก จังหวัดสุพรรณบุรี
- เชิญชมนิทรรศการหมุนเวียน "Object of the Month" วัตถุจากคลังพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี ประจำเดือน "เมษายน" เชิญพบกับ "แม่พิมพ์ต่างหูสมัยทวารวดี" ณ ห้องโถง พิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี
- เชิญชมนิทรรศการหมุนเวียน เดือนพฤษภาคม "Object of the Month" "ตะข้องเป็ด" หัตถกรรมพื้นบ้านภูมิปัญญาโบราณ ณ ห้องโถงพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี
- ศิลปากรสัญจร ครั้งที่ ๔ พบกับกิจกรรม "ท่องเที่ยวแหล่งวัฒนธรรมภาคตะวันตก : ต้นธารแห่งอารยธรรมไทย" โดยจัดขึ้นระหว่างานที่ ๖ - ๗ กรกฎาคม ๒๕๖๗นี้ สนใจร่วมกิจกรรม สำรองที่นั่ง และสอบถามเพิ่มเติม ติดต่อได้ที่ คุณสุภาภรณ์ ปัญญารัมย์ โทร. ๐ ๒๑๖๔ ๒๕๐๑-๒ ต่อ ๖๐๐๘ และ ๖๐๑๐ โทร. ๐ ๙๒๖๓๔ ๘๕๘๓ (มีค่าใช้จ่าย)
- วันศุกร์ที่ 28 มิถุนายน 2567 กิจกรรมจิตอาสาพัฒนาพิพิธภัณฑ์: กิจกรรมทำความสะอาดพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี และอาคารประติมากรรมขุนหลวงพะงั่วและประวัติศาสตร์สุพรรณบุรี ซึ่งเป็นกิจกรรมที่จัดขึ้นเป็นประจำทุกเดือน สำหรับเดือนมิถุนายน 2567 ดำเนินการทำความสะอาดบริเวณห้องคลัง 2 ห้องเพลงพื้นบ้าน ห้องวรรณกรรมพื้นบ้าน ห้องสุพรรณวันนี้ โถงต้อนรับ และบำรุงรักษาต้นไม้ภายในอาคาร
- นิทรรศการหมุนเวียน เดือนกรกฎาคม 2567 "Object of the Month" วัตถุจากคลังพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี "เรื่องเล่าจากเต่าปูนปั้น" ณ ห้องโถงพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี
- เชิญชมนิทรรศการหมุนเวียน ประจำเดือนสิงหาคม 2567 "Object of the Month" วัตถุจากคลังพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี "นางปรัชญาปารมิตา" ณ ห้องโถงพิพิธภัณฑสถานแห่งชาติ สุพรรณบุรี
- Art Activities เดือนมีนาคม "ตะกร้าจิ๋วจากแก้วกระดาษ" ณ ห้องกิจกรรมพิเศษ ชั้น 2
- Art Activities เดือนเมษายน ขอเชิญน้อง ๆ ร่วมกิจกรรมต้อนรับซัมเมอร์ พบกับ "กังหันสายรุ้ง" พิเศษทุกวันเสาร์ - อาทิตย์
- Art Activities เดือนพฤษภาคม "Towel Bunny" พับกระต่ายน้อยจากผ้าขนหนู ทุกวันเสาร์ - อาทิตย์ ณ ห้องกิจกรรมพิเศษ ชั้น 2
- Art Activities" เดือนมิถุนายนนี้ ขอเชิญน้อง ๆ ประดิษฐ์ "โมบาย" ใต้ทะเล พิเศษทุกวันเสาร์ - อาทิตย์
- Art Activities" เดือนสิงหาคมนี้ ขอเชิญน้อง ๆ ประดิษฐ์ "มาลัยบอกรักแม่" พิเศษทุกวันเส???ร์ - อาทิตย์ ณ ห้องกิจกรรมชั้น ๒
@@ งานปีที่ผ่านมา @@
1 กุมภาพันธ์ 2566 ปริมาณ PM2.5 เกินค่ามาตรฐาน 49 จังหวัด LINK
ศูนย์แก้ไขปัญหามลพิษทางอากาศ (ศกพ.) รายงานการติดตามตรวจสอบคุณภาพอากาศ 1 กุมภาพันธ์ 2566 ณ 07:00 น สรุปดังนี้ ภาพรวมปริมาณ PM2.5 ในประเทศพบเกินค่ามาตรฐานใน จ.ปทุมธานี กรุงเทพฯ จ.นนทบุรี จ.นครปฐม จ.สมุทรสาคร จ.สมุทรปราการ จ.เชียงราย จ.น่าน จ.แม่ฮ่องสอน จ.เชียงใหม่ จ.ลำปาง จ.แพร่ จ.ลำพูน จ.อุตรดิตถ์ จ.สุโขทัย จ.พิษณุโลก จ.ตาก จ.กำแพงเพชร จ.พิจิตร จ.เพชรบูรณ์ จ.นครสวรรค์ จ.อุทัยธานี จ.สิงห์บุรี จ.ลพบุรี จ.สระบุรี จ.อ่างทอง จ.พระนครศรีอยุธยา จ.ราชบุรี จ.สมุทรสงคราม จ.ประจวบคีรีขันธ์ จ.สระแก้ว จ.ฉะเชิงเทรา จ.ชลบุรี จ.ระยอง จ.บึงกาฬ จ.หนองคาย จ.เลย จ.อุดรธานี จ.นครพนม จ.หนองบัวลำภู จ.สกลนคร จ.มุกดาหาร จ.ขอนแก่น จ.กาฬสินธุ์ จ.ร้อยเอ็ด จ.ชัยภูมิ จ.อุบลราชธานี จ.นครราชสีมา และ จ.บุรีรัมย์
- ภาคเหนือ เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 38 – 95 มคก./ลบ.ม.
- ภาคตะวันออกเฉียงเหนือ เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 48 – 112 มคก./ลบ.ม.
- ภาคกลางและตะวันตก เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 37 – 127 มคก./ลบ.ม.
- ภาคตะวันออก เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 36 – 61 มคก./ลบ.ม.
- ภาคใต้ ภาพรวมอยู่ในเกณฑ์ดีมาก ตรวจวัดได้ 13 – 34 มคก./ลบ.ม.
- กรุงเทพมหานครและปริมณฑล โดยสถานีตรวจวัดของ คพ. ร่วมกับ กทม. เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 53 – 97 มคก./ลบ.ม.
ทั้งนี้ ประชาชนทั่วไป ควรเฝ้าระวังสุขภาพ ลดเวลาการทำกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น ผู้ที่ต้องดูแลสุขภาพเป็นพิเศษ ควรลดระยะเวลาการทำกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น ถ้ามีอาการทางสุขภาพ ควรปรึกษาแพทย์
สำหรับประชาชนที่อยู่บริเวณพื้นที่มีผลกระทบต่อสุขภาพ (พื้นที่สีแดง) ควรหลีกเลี่ยงกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น หากมีอาการทางสุขภาพควรปรึกษาแพทย์ โดยท่านสามารถติดตามสถานการณ์ผ่านทางเว็บไซต์ Air4Thai.com และ airbkk.com แอปพลิเคชัน Air4Thai และ AirBKK
อย่าหลงเชื่อ ผลิตภัณฑ์เสริมอาหารน้ำมันมะพร้าว (ตรา คุณพลอย) LINK
น้ำมันมะพร้าวสกัดเย็น ช่วยปรับสมดุลร่างกาย หลับง่ายขึ้น และช่วยให้ไม่ปวดตามเนื้อตามตัว หรือกระดูก.. ผลิตภัณฑ์ดังกล่าว ขออนุญาตเป็นผลิตภัณฑ์เสริมอาหาร ในชื่อ ผลิตภัณฑ์เสริมอาหาร น้ำมัน มะพร้าว (ตรา คุณพลอย)/COCONUT OIL DETARY SUPPLEMENT PRODUCT (KHUNPLOY BRAND) เลข อย.70-1-27160-5-0101 ซึ่งในการยื่นขออนุญาตไม่มีการยื่นข้อมูลประสิทธิผลในการ ปรับสมดุลร่างกาย ลดอาการปวดเมื่อย และปวดกระดูก ตามที่กล่าวอ้างแต่อย่างใด ทั้งนี้ ผลิตภัณฑ์เสริม อาหารไม่มีผลในการบำบัด บรรเทา หรือรักษาโรค และต้องแสดงคำเตือนดังกล่าวบนฉลาก
เทศกาล แกล๊ะ_ยีโดะระ. ครั้งที่2 ระหว่าง วันที่ 1-4 กุมภาพันธ์ 2024
เทศกาล แกล๊ะ_ยีโดะระ. ครั้งที่2 ระหว่าง วันที่ 1-4 กุมภาพันธ์ 2024 เทศกาลกาแฟ และ วัฒนธรรมปวาเก่อ (แหม่โลคี กิจกรรมของการ เดินทาง เพื่อมาพบเจอกัน มาชม มาชิม สินค้า ผลผลิตในชุมชน วิถีวัฒนธรรมของมนุษย์ ที่มีความสัมพันธ์ และพึ่งพาอาศัย อยู่กับป่า ลวดลาย ความสวยงามบนผืนผ้า ที่ประดับบนร่างกาย เสียงดนตรีที่ขับกล่อมบรรเลง ชีวิตและจิตใจ ของคนในชุมชน.บ้านขุนแม่รวม (แหม่โลคี) และ มาร่วม แบ่งปัน แชร์เรื่องราว ของกาแฟ ในชุมชน จาก TOKI Organic FARM และเพื่อนๆ กิจกรรม 3 คืน 4 ระหว่างวัน 1-4 กุมภาพันธ์ 2024 รับเป็น จำนวน 20 คน ค่าใช้จ่าย 4,000 / คน
กิจกรรม
- ศึกษา แบ่งปัน แชร์เรื่องราวของกาแฟ ที่ปลูกร่วมกับป่า และขั้นตอน กระบวนการ Process ต่างๆ
- รับชมขบวน เครื่องแต่งกาย และ วิถีวัฒนธรรม ของชาวบ้าน
- รับฟังเสียงเครื่องดนตรี /บทเพลง /เรื่องราวของชนเผ่า จากศิลปินและ นักปราชญ์ ปวาเก่อญอ.
Pet Variety 2024 วันที่ 1-4 กุมภาพันธ์ 2567
งาน SmartHeart presents Thailand International Pet Variety Exhibition @CNX ครั้งที่ 11 มาในคอนเซ็ป Pet Pilot วันที่ 1-4 กุมภาพันธ์ 2567 11.00 - 20.00 น. เชียงใหม่ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต ไฮไลท์กิจกรรมสุดน่ารักตลอดทั้งงาน การแข่งขันหมาเลีย แมวเลีย การแข่งขันมาหาแม่มา การประกวดสุนัขแบบทั่วไป [open show] และการประกวดแมวสวยงาม แข่งขันพิทบูลลากน้ำหนัก และการประกวดพิทบูล บูลลี่สวยงาม รวมพลคนรักสัตว์เลี้ยง และกิจกรรมอื่นๆอีกมากมาย
พิธีบูชาดาวนพเคราะห์ วัดเขตร์นาบุญญาราม ประจำปี 2566 วันที่ 2-6 ก.พ.66 LINK
พิธีบูชาดาวนพเคราะห์ 3 กิจกรรม สำคัญบูชาดาวนพเคราะห์ - จุดเทียนอายุวัฒนะ ทำพะเก่ง เสริมสิริมงคล ไหว้ไท้ส่วยเอี้ย แก้ปีชงประจำนักษัตร สะเดาะเคราะห์เสริมดวง และอื่นๆ อีกมากมาย ประจำปี 2566 วันที่ 2-6 ก.พ.2566 ณ วัดเขตร์นาบุญญาราม อ.เมือง จ.จันทบุรี งานประเพณีอันศักดิ์สิทธิ์ของพระสงฆ์อนัมนิกายหนึ่งเดียวในประเทศไทยที่ถือปฏิบัติมายาวนานกว่า 189 ปี
2 กุมภาพันธ์ 2566 กทม. และทั่วประเทศ เว้นภาคใต้ ส่วนใหญ่ เกินค่ามาตรฐาน LINK
ศูนย์แก้ไขปัญหามลพิษทางอากาศ รายงานการติดตามตรวจสอบคุณภาพอากาศ ประจำวันที่ 2 กุมภาพันธ์ 2566 ณ 07:00 น สรุปดังนี้
- ภาคเหนือ เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 43 – 119 มคก./ลบ.ม.
- ภาคตะวันออกเฉียงเหนือ เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 57 – 158 มคก./ลบ.ม.
- ภาคกลางและตะวันตก เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 48 – 110 มคก./ลบ.ม.
- ภาคตะวันออก เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 40 – 79 มคก./ลบ.ม.
- ภาคใต้ ภาพรวมอยู่ในเกณฑ์ดีมาก ตรวจวัดได้ 17 – 28 มคก./ลบ.ม.
- กรุงเทพมหานครและปริมณฑล โดยสถานีตรวจวัดของ คพ. ร่วมกับ กทม. เกินค่ามาตรฐานเป็นส่วนใหญ่ ตรวจวัดได้ 62 – 139 มคก./ลบ.ม.
โดยประชาชนทั่วไป ควรเฝ้าระวังสุขภาพ ลดเวลาการทำกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น ผู้ที่ต้องดูแลสุขภาพเป็นพิเศษ ควรลดระยะเวลาการทำกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น ถ้ามีอาการทางสุขภาพ ควรปรึกษาแพทย์
สำหรับประชาชนที่อยู่บริเวณพื้นที่มีผลกระทบต่อสุขภาพ (พื้นที่สีแดง) ควรหลีกเลี่ยงกิจกรรมกลางแจ้ง หรือใช้อุปกรณ์ป้องกันตนเองหากมีความจำเป็น หากมีอาการทางสุขภาพควรปรึกษาแพทย์ โดยท่านสามารถติดตามสถานการณ์ผ่านทางเว็บไซต์ Air4Thai.com และ airbkk.com แอปพลิเคชัน Air4Thai และ AirBKK
กรมควบคุมมลพิษ ขอรายงานผลการคาดการณ์สถานการณ์ฝุ่นละอองขนาดเล็กในพื้นที่กรุงเทพและปริมณฑล ระหว่างวันที่ 3 – 9 กุมภาพันธ์ 2566 ดังนี้ วันที่ 3-4 กุมภาพันธ์ 2566 พื้นที่กรุงเทพและปริมณฑลควรเฝ้าระวังการสะสมของฝุ่นละออง เนื่องจากสภาพอากาศที่นิ่ง และปิด โดยพื้นที่ที่ควรเฝ้าระวัง ได้แก่พื้นที่กรุงเทพกลาง กรุงธนเหนือ และใต้ (พื้นที่ท้ายลม)
สำหรับในพื้นที่ 17 จังหวัดภาคเหนือมีแนวโน้มคุณภาพอากาศอยู่ในเกณฑ์มาตรฐานช่วง 6 -8 กุมภาพันธ์ 2566 แต่ควรเฝ้าระวังบริเวณภาคเหนือตอนบนและล่าง โดยเฉพาะช่วงวันที่ 3 – 4 กุมภาพันธ์ 2566
ผลิตภัณฑ์เสริมอาหาร ฮัล์ค (Hulx) โฆษณาสรรพคุณอาหารเป็นเท็จ LINK
2 ก.พ. 66 อย.เตือน ผลิตภัณฑ์เสริมอาหาร ฮัล์ค (Hulx) นวัตกรรมหนึ่งเดียวของการใช้สมุนไพรที่เทียบเท่า Viagra ช่วยฟื้นฟูระบบร่างกายของเพศชายให้กลับมาสมดุลได้อีกครั้ง อย. ตรวจสอบแล้วพบ " ข้อมูลอนุญาตโฆษณา เลขที่ ฆอ.2271/2565 เพื่อเผยแพร่ทางอินเทอร์เน็ตและวีดิทัศน์ไม่ใช่ตามคลิปเสียงการมอบรางวัลที่กล่าวอ้าง " เตือนประชาชนอย่าหลงเชื่อ โฆษณาสรรพคุณอาหารเป็นเท็จ
ลักษณะการโฆษณาแฝงมาในรูปแบบทำเป็นคลิปการรับรางวัล Product Innovation Awards 2022 พร้อมเสียงประกาศว่า “ผลิตภัณฑ์เสริมอาหาร Dr.X Hulk นวัตกรรมหนึ่งเดียวของการใช้สมุนไพรที่เทียบเท่า Viagra เจ้าแรกและเจ้าเดียวในไทยที่ใช้การศึกษาการระบาด ศาสตร์สมุนไพรจีนกับ สมุนไพรไทย ซึ่งสามารถช่วยฟื้นฟูระบบร่างกายของเพศชายให้กลับมาสมดุลได้อีก ครั้ง” คลิปดังกล่าว มีเนื้อหาที่สื่อแสดงให้เข้าใจคุณประโยชน์ คุณภาพของอาหารอัน เป็นเท็จหรือหลอกลวง ให้เกิดความหลงเชื่อโดยไม่สมควร เนื่องจากผลิตภัณฑ์เสริม อาหารไม่มีผลในการบำบัด บรรเทา หรือรักษาโรค
WestKoff2024 Localburi โลคอลบุรี Back To The Origins 2-4 กุมภาพันธ์ 2567
WestKoff2024 Localburi โลคอลบุรี Back To The Origins เทศกาลกาแฟและศิลปะ ครั้งที่ 2 ของจังหวัดราชบุรี RATCHABURI COFFEE & ART FESTIVAL 2-4 กุมภาพันธ์ 2567 @155 Camp หนองกลางนา จังหวัดราชบุรี
งานเทศกาลกาแฟและศิลปะ ของจังหวัดราชบุรี ที่รวบรวมเรื่องราวมากมายของคนกาแฟทั่วภูมิภาคตะวันตก และเพื่อนๆที่มีใจรักในเรื่องของศิลปะ วัฒนธรรม และการใช้ชีวิต ผ่านตัวกลางที่เชื่อมโยงเราเข้าด้วยกันอย่าง ‘กาแฟ’ พบกับงานศิลปะ-หัตถกรรมพื้นถิ่น ศิลปะรวมสมัย สไตล์โลคอล บูทร้านค้า กาแฟ ขนม และอาหารมากมายในบรรยากาศสวนสวยติดริมน้ำแม่กลอง ชมการแข่งขัน และกิจกรรมเวิร์คช้อปกาแฟ กระทบไหล่ Coffee Celebrity พูดคุย-เสวนา ภาษากาแฟ...เข้าใจง่าย ตกเย็นชมอาทิตย์ตกดิน ฟังดนตรีจาก ‘ศิลปินโลคอล’ ตลอด 3 วัน
งานศิลป์ อาหารถิ่นกาญจน์ 4 กุมภาพันธ์ 2567
“งานศิลป์ อาหารถิ่นกาญจน์” ที่จะจัดขึ้นระหว่างวันที่ 2 - 4 กุมภาพันธ์ 2567 ณ โรงงานกระดาษไทยกาญจนบุรี จัดโดย องค์การบริหารส่วนจังหวัดกาญจนบุรี
Japan Coffee Festival In Bangkok มิวเซียมสยาม กรุงเทพ 2-4 กุมภาพันธ์ 2567
มิวเซียมสยาม จัดกิจกรรม Japan Coffee Festival In Bangkok วันที่ 2-4 กุมภาพันธ์ 2567 ณ มิวเซียมสยาม กรุงเทพฯ กิจกรรมการชงกาแฟแบบญี่ปุ่นโดยเอกลักษณ์เฉพาะตัว พร้อมกับการได้ชิมฝีมือการชงจากร้านกาแฟไทยที่ใช้อุปกรณ์การชงที่แตกต่างกัน โดยใช้เมล็ดกาแฟไทยเป็นสื่อกลางในการชงกาแฟ
งานเทศกาล “Japan Coffee Festival in Bangkok” ด้วยความร่วมมือระหว่างผู้จัดงาน Japan Coffee Festival (ญี่ปุ่น) และ Mother Roaster (ประเทศไทย) ในการแลกเปลี่ยนวัฒนธรรมกาแฟ ภายใต้แนวคิด “กาแฟไทยญี่ปุ่นทำ” โดยทาง Mother Roaster เป็นผู้ส่งกาแฟไทยสายพันธุ์อาราบิก้าจากทุกภูมิภาคของประเทศ อาทิ จันทบุรี เชียงใหม่ ตาก เชียงราย และกาแฟโรบัสต้าจากชุมพร กระจายไปยังร้านกาแฟในประเทศญี่ปุ่นรวม 10 ร้าน เพื่อคั่วเมล็ดตามสไตล์ของแต่ละร้าน ก่อนนำกลับมาชงให้ผู้ร่วมงานได้ชิมภายในงาน
The Rhythm Balloon Festival #2 วันที่ 2-4 กุมภาพันธ์ 2567
งาน The Rhythm Balloon Festival #2 วันที่ 2-4 กุมภาพันธ์ 2567 The Village & Keeree Mantra จังหวัดกาญจนบุรี เพลิดเพลินกับการโชว์บอลลูนหลากสี พร้อมสนุกไปกับคอนเสิร์ตที่ขนศิลปินมามากมาย พื้นที่จัดแสดงกว้างขวาง มีที่จอดรถเพียบ
หนาวนี้ที่ ชะแล ครั้งที่ 7 (2 - 3 กุมภาพันธ์ 2567)
งานส่งเสริมการท่องเที่ยวเชิงอนุรักษ์ตำบลชะแล "หนาวนี้ที่ ชะแล" ครั้งที่ 7 วันที่ 2 - 3 กุมภาพันธ์ 2567 ณ ไร่ปราถนา บ้านทุ่งนางครวญ หมู่ที่ 6 ตำบลชะแล อำเภอทองผาภูมิ จังหวัดกาญจนบุรี กิน เที่ยว นอนเต็นท์ ดูดาว สัมผัสอากาศหนาว ตำบลชะแล -ชมการประกวดร้องเพลงลูกทุ่งชะแล ครั้งที่ 2 -ชมการแสดงวัฒนธรรมชนเผ่า 9 ภาษา -จัดจำหน่ายสินค้าทางการเกษตรพืชผักเมืองหนาว -การแสดงมหรสพ แสง สี เสียง ชมฟรี ตลอดงาน
ไตวายไม่ตายไว แค่ปรับใจและปรับตัว
พญ. ชัญชนา บุญญไกร หัวหน้ากลุ่มงานอายุรกรรม และหน่วยไตเทียม โรงพยาบาลตากสิน เดินรณรงค์พร้อมให้ความรู้ภายใต้ คำขวัญ “ ไตวายไม่ตายไว แค่ปรับใจและปรับตัว ” ในกิจกรรมสัปดาห์วันไตโลกและสัปดาห์ลดการบริโภคเค็ม ประจำปี 2564 เพื่อให้เกิดความรู้ความเข้าใจเรื่องโรคไต และกระตุ้นให้ประชาชนตื่นตัวในการดูแลสุขภาพไต ณ บริเวณห้องตรวจผู้ป่วยนอกชั่วคราว ชั้น 2 และ 3 อาคารสมเด็จพระเจ้าตากสินมหาราช
BANGKOK HAPPY GARDEN 2024 เทศกาลการแสดงในสวนสุขสันต์ @อุทยานเบญจสิริ 3 ก.พ. 67
Bangkok Street Performer ร่วมกับ Urban Street Bangkok, Act It House และ Bangkok Design week 2024 จัดงาน "
BANGKOK HAPPY GARDEN 2024 เทศกาลการแสดงในสวนสุขสันต์" เทศกาลการแสดงแห่งความสุขและรอยยิ้ม ที่จะมอบเสียงหัวเราะ พร้อมชวนทุกคนจินตนาการไปกับการแสดงไร้ภาษา ร่วมสนุกไปกับการแสดงมากมายทั้งละครใบ้ มายากล Juggling ละครหุ่น ฯลฯ จากศิลปิน Bangkok Street Performer ทั่วกรุงเทพฯ
งานจัดที่อุทยานเบญจสิริ (BTS พร้อมพงษ์) วันเสาร์ที่ 27 ม.ค. และ 3 ก.พ. 67 เวลา 15.30 - 18.30 น. เข้าร่วมฟรีตลอดทั้งงาน ! *กิจกรรมนี้เป็นส่วนหนึ่งของเทศกาลงาน Bangkok Design Week 2024
พิเศษ! ในปีนี้ นอกจากจะมี 16 โชว์ที่จะยกความสุขมามอบให้ทุกคน ทางเทศกาลขอร่วมมอบของขวัญปีใหม่เป็นเวิร์กช็อปแสนสนุกอีกกว่า 7 หัวข้อที่เปิดให้ทุกคนได้มาร่วมสนุกกันแบบฟรี ๆ ! ไม่ว่าจะเป็น Hoola Hoop, ละครใบ้, ละครหุ่น, Juggling ฯลฯ เรียกได้ว่ามางานเดียวได้ทั้งประสบการณ์ดี ๆ และความสุขกลับบ้านไปแบบเต็มอิ่มแน่นอน สำหรับผู้ที่สนใจเข้าร่วมเวิร์กช็อปสามารถลงทะเบียน และ
อ่านข้อมูลเพิ่ม (เฉพาะกิจกรรมเวิร์กช็อปที่จะต้องลงทะเบียนก่อนเข้าร่วม)
ฤดูกาลกาแฟ ครั้งที่ 3 น้ำตกพาเจริญ 3-4 กุมภาพันธ์ 2567
“ฤดูกาลกาแฟ ครั้งที่ 3” วันที่ 3-4 กุมภาพันธ์ 2567 อุทยานแห่งชาติน้ำตกพาเจริญ อ.พบพระ จ.ตาก กิจกรรมและของที่น่าสนใจอีกมากมาย ในบรรยากาศชิวๆริมน้ำตกพาเจริญ งานที่รวบรวมคนรักกาแฟ งานศิลปะ งานคราฟท์ การแคมป์ และเสียงดนตรี ได้ร่วมแบ่งปันประสบการณ์ดีๆ ท่ามกกลางธรรมชาติและเสียงน้ำตก ในเดือนแห่งความ ......
ครั้งนี้พวกเราทีมงาน TAK COFFEE TEAM มาพร้อมกิจกรรมเวิร์คช็อปพิเศษ จากเกษตรกรต้นน้ำที่ปลูกกาแฟดีๆให้เราได้ดื่ม พร้อมพาทุกท่านไปสัมผัสกาแฟตากจากแหล่งเพาะปลูกที่สำคัญอาทิเช่น
• กาแฟทีลอซู Teelorsu coffee farm แม่กลองน้อย อุ้มผาง
• กาแฟมูเซอ Muser Coffee กาแฟสดมูเซอ ห้วยปลาหลด แม่สอด
• กาแฟห้วยเหลือ Jaru Coffee ตาก
4 กุมภาพันธ์ วันมะเร็งโลก World Cancer Day
วันที่ 4 กุมภาพันธ์ 2000 เป็นวันที่ได้มีการลงนามในกฎบัตรปารีสต้านมะเร็ง (The Charter of Paris Against Cancer) โดยนายโคอิชิโร มัทซุอุระ ผอ.ยูเนสโก และนายฌัก ชีรัก ปธณ.ฝรั่งเศส ในงาน World Cancer Day ที่จัดขึ้น ณ กรุงปารีส ที่จัดขึ้นเพื่อสร้างการรับรู้ กระตุ้นให้ตระหนักต่อการป้องกันและพัฒนการดูแลรักษาให้กับผู้ป่วยมะเร็งที่มีจำนวนมากทั่วโลก องค์การอนามัยโลก (WHO) และองค์การสหภาพต่อต้านมะเร็งระหว่างประเทศ (UICC) ได้กำหนดให้วันที่ 4 กุมภาพันธ์ ของทุกปี เป็นวันมะเร็งโลก ต่อเนื่องมาจนถึงปัจจุบัน
Fact : มะเร็งเป็นสาเหตุการตายอันดับหนึ่งของชาวโลก เกือบครึ่งของจำนวนผู้ป่วยมะเร็งทั่วโลกอยู่ในทวีปเอเชีย
WHO ระบุว่าปี 2020 มีผู้เสียชีวิตจากมะเร็ง 10 ล้านรายทั่วโลก อันดับ 1 คือมะเร็งเต้านม อันดับสองคือมะเร็งปอด ทุกปีมีเด็กที่ป่วยมะเร็งเพิ่มขึ้นราว 400,000 ราย
เทศกาลดนตรีตีนเขามิวสิคเฟสติวัล 2 เสาร์ที่ 4 กุมภาพันธ์ 2566 LINK
เทศกาลดนตรีตีนเขามิวสิคเฟสติวัล 2 เสาร์ที่ 4 กุมภาพันธ์ 2566
@ตีนเขาคาเฟ่ #ทางขึ้นเขาใหญ่ปราจีนบุรี ต.เนินหอม อ.เมือง จ.ปราจีนบุรี - Campercar สามารถมาจอดในพื้นที่จัดงานได้
ฟรีคอนเสิร์ต!! ฟรี Camping!! สำหรับ
1️⃣ #ผู้มีสายรัดข้อมือ หรือ #รหัสบัตรเข้างาน #เทศกาลดนตรีตีนเขามิวสิคเฟสติวัล 2
2️⃣ #ผู้เข้าพักโรงแรมที่เข้าร่วมกิจกรรม ใน จ.ปราจีนบุรี และ นครนายก 16 แห่ง รายชื่อด้านล่าง
#ศิลปิน : T_047, เขียนไขและวานิช, อิศญา,
MEAKAI KOOK KOOK, DJ DAOKANONG AKA STARGAZER
❄️ @ตีนเขาคาเฟ่ #ทางขึ้นเขาใหญ่ปราจีนบุรี ต.เนินหอม อ.เมือง จ.ปราจีนบุรี
RBSO Concert in the Park #31 สวนลุมพินี เดือนมกราคม - มีนาคม 2567 LINK
กำหนดการแสดง Royal Bangkok Symphony Orchestra RBSO Concert in the Park #31 คอนเสิร์ตในสวนครั้งที่ 31 การแสดงทุกวันอาทิตย์ ณ ศาลาภิรมย์ภักดี สวนลุมพินี เวลา 17.30 น. ดังนี้
วันศุกร์ที่ 15 ธันวาคม 2023
วันอาทิตย์ที่ 14 มกราคม 2024
วันอาทิตย์ที่ 21 มกราคม 2024
วันอาทิตย์ที่ 28 มกราคม 2024
วันอาทิตย์ที่ 4 กุมภาพันธ์ 2024
วันอาทิตย์ที่ 18 กุมภาพันธ์ 2024
วันอาทิตย์ที่ 25 กุมภาพันธ์ 2024
วันอาทิตย์ที่ 3 มีนาคม 2024
วันอาทิตย์ที่ 10 มีนาคม 2024
Thai Sikh Run 2024 ครั้งที่ 28 วันที่ 4 กุมภาพันธ์ 2567 LINK
28th Thai Sikh Run 2024 จัดวันที่ : 4 กุมภาพันธ์ 2567 สถานที่ : ถนนบูรพา (ดิโอลด์สยาม) กรุงเทพฯ วิ่งผ่านสถานที่สวยงามบนเกาะรัตนโกสินทร์ วัดพระแก้ว สนามหลวง สะพานปิ่นเกล้า และสะพานคู่ขนานลอยฟ้าบรมราชชนนี ระยะทาง : 5k, 10k, 21.1k ชิงหมอนตุ๊กตา Top 50 อาหารหลังเส้นเต็มที่
ONE WHA Run 2024 วันที่ 4 กุมภาพันธ์ 2567
ONE WHA Run 2024 จัดวันที่ : 4 กุมภาพันธ์ 2567 สถานที่ : นิคมอุตสาหกรรม ดับบลิวเอชเอ อีสเทิร์นซีบอร์ด 2 อ.บ้านบึง จ.ชลบุรี ระยะทาง : 3, 5, 10k
งานกาแฟแปดริ้ว 8Riew Feel แฟ Coffee&Friends 2-4 กุมภาพันธ์ 2567
เชิญชวนแวะชมงานเทศกาลสำหรับคนรักกาแฟ ครั้งแรกในพื้นที่ฉะเชิงเทรา “8Riew Feel แฟ Coffee&Friends” ณ สวนสมเด็จพระศรีนครินทร์ จังหวัดฉะเชิงเทรา วันที่ 2-4 กุมภาพันธ์ 2567 เวลา 09.00 – 20.00น. ณ สวนสมเด็จพระศรีนครินทร์ อําเภอเมืองฉะเชิงเทรา จังหวัด ฉะเชิงเทรา จัดโดย ภาคีเครือข่ายจังหวัดฉะเชิงเทรา ได้แก่ การท่องเที่ยวแห่งประเทศไทย (ททท.) สํานักงานฉะเชิงเทรา เทศบาลเมืองฉะเชิงเทรา ท่องเที่ยวและกีฬาจังหวัดฉะเชิงเทรา มหาวิทยาลัยราชภัฏราชนครินทร์ จังหวัดฉะเชิงเทรา และกลุ่มนักธุรกิจรุ่นใหม่ ฉะเชิงเทรา (YEC)
งาน 8Riew Feel แฟ Coffee&Friends
ชวนเที่ยวงาน 8Riew Feel แฟ Coffee&Friends วันที่ 2 - 4 กุมภาพันธ์ 2567 เวลา 09.00 - 20.00 น. ณ สวนสมเด็จพระศรีนครินทร์ ฉะเชิงเทรา งาน Coffee Festival ครั้งแรกของเมืองฉะเชิงเทรา กำลังจะเริ่มต้นขึ้นแล้ว.. ใครไม่มาถือว่าพลาด!!! เพราะงานนี้ได้รวบรวมร้านกาแฟ Speed Bar Slow Bar และร้านเบเกอรี่ ชื่อดังของแปดริ้วมารวมไว้ที่งานนี้..งานเดียว
กิจกรรมภายในงาน :
- การออกร้านจำหน่ายกาแฟ และเบเกอรี่ อาหาร เครื่องดื่ม ชื่อดังของแปดริ้ว กว่า 70 ร้าน มีเมนูสร้างสรรค์จากวัตถุดิบท้องถิ่น อาทิ มะม่วง มะพร้าว เมล่อน น้ำตาลโตนด มาเป็นเมนูเครื่องดื่ม และเบเกอรี่ ที่คุณจะหาลิ้มลองชิมรสได้เฉพาะงานนี้เท่านั้น!!!!
- พบกับวงดนตรี จากศิลปิน “ปลานิลเต็มบ้าน” จะมาสร้างบรรยากาศด้วยเพลงฟังสบายๆ สไตล์ชาวแคมป์
- ทอล์คโชว์ จาก เจมส์ 500 influencer Camping x Coffee ที่จะมาเล่าเรื่องราวและประสบการณ์สำหรับสายแคมป์ x กาแฟ
- การสาธิต Latte Art จากคุณตี๋ Rosetta บาริสต้า (ชาวแปดริ้ว) ดีกรีแชมป์ประเทศไทย และเรื่องราวที่กว่าจะมาถึงวันนี้ ..จะแค่เทรนด์ หรือฝีมือ!! ต้องลองฟัง..
- การแสดงวาดภาพด้วยเทคนิคสีกาแฟ ประกอบดนตรี RRU Jazz
- กิจกรรม DiY และกิจกรรม Workshop สุดชิค อาทิ การทำสบู่ การสอนดริปกาแฟ การทำผ้ามัดย้อมกิจกรรมย้อมด้ายฝ้ายประกอบพวงกุญแจ กิจกรรมวาดภาพด้วยสีกาแฟ การแต่งหน้าคัพเค้ก กิจกรรมนั่งเรือคายัค และอื่นๆ อีกมากมาย มีแต่ฟรี!!! ไม่มีค่าใช้จ่าย
- การแสดงดนตรีของเยาวชน.. จากโรงเรียนชื่อดังของเมืองแปดริ้ว
- Photo Booth ถ่ายภาพเก๋ๆ Theme Coffee : รับภาพกลับไปเป็นของที่ระลึก จาก ททท.
- ซื้อสินค้าภายในงาน.. ลุ้นรับของรางวัลกับ ททท. **ของมีจำนวนจำกัด
- Birthday Gift สำหรับคนเกิดวันที่ 29 กุมภาพันธ์เท่านั้น รับฟรี!! ของที่ระลึกจาก ททท. ง่ายๆๆ
- Happy Hour ช่วงขอบคุณที่.. พกแก้ว เพียงพกแก้วมาใช้ในงาน ..นำมารับน้ำเก๊กฮวย ฟรี!!!
- กิจกรรมแข่งขันเมนูสร้างสรรค์กาแฟXวัตถุดิบท้องถิ่น ‘เมนูที่ใช่กับวัตถุดิบที่ชอบ’ : ฉ่ำว้าววว!! แค่ไหนต้องติดตาม
- กิจกรรมคูล ๆ เสื้อไม่เก่า.. เพราะเราย้อมใหม่ พกเสื้อเก่า มาย้อมสีกาแฟ พาน้องเสื้อกลับบ้านแบบเก๋ ๆ
- อื่นๆ อีกมากมาย
งานวิ่ง Kaengkrachan Explorer Run 2024 วันที่ 4 กุมภาพันธ์ 2567
ททท. สำนักงานเพชรบุรี ร่วมกับสภาอุตสาหกรรมจังหวัดเพชรบุรี และ KRSC Thailand จัดกิจกรรมงานวิ่ง Kaengkrachan Explorer Run 2024 วันที่ 4 กุมภาพันธ์ 2567 ณ แก่งกระจานริเวอร์ไซด์รีสอร์ท แอนด์ แค้มป์ปิ้ง อ.แก่งกระจาน จังหวัดเพชรบุรี
งาน Ayutthaya Morning Drip ครั้งที่ 3 วันที่ 4 กุมภาพันธ์ 2567
งาน "Ayutthaya Morning Drip" ครั้งที่ 3 วันที่ 4 กุมภาพันธ์ 2567 ตั้งแต่ 06.00 น. เป็นต้นไป ณ โบราณสถานป้อมเพชร จังหวัดพระนครศรีอยุธยา ไปชิมกาแฟมากกว่า 20 ร้าน ในบรรยากาศสุดชิลริมแม่น้ำเจ้าพระยา สาย Slowbar สายเบเกอรี่ขนมโฮมเมด ห้ามพลาด !! มีเมล็ดกาแฟและขนมอร่อยๆ ให้เลือกทานซื้อเลือกชิมเพียบ
4 กุมภาพันธ์ 2567 THAI Contemporary Music@อุทยานเบญจสิริ
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว โดย กองการสังคีต ร่วมมอบความสุขด้วยเสียงดนตรี ที่ผสมผสานสำเนียงของตะวันออกและตะวันตกเข้าด้วยกัน THAI Contemporary Music บรรเลงโดย วงดนตรีไทยร่วมสมัยกรุงเทพ Bangkok Thai Contemporary (BTC) ในวันอาทิตย์ที่ 4 กุมภาพันธ์ 2567 เวลา 17.00 น. @อุทยานเบญจสิริ (BTS สถานีพร้อมพงษ์) เขตคลองเตย
…พบกับศิลปินรับเชิญ
ครูเบิ่ง (ระนาดโหมโรง) - ทวีศักดิ์ อัครวงษ์
ร่วมด้วย
ครูโอปอล์ - พัชรพล ไขแสง (นักร้อง/นักดนตรี และผู้นำกิจกรรมดนตรี กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว)
นายอัยยะ แซ่แต้ ชั้น ม.6 - รร.เตรียมอุดมศึกษา และ นายสวิตต์ แซ่แต้ ชั้น ม.4 - รร.บดินทรเดชา (สิงห์ สิงหเสนี) [น้องๆ จากโครงการโรงเรียนหลักสูตรการดนตรีกรุงเทพมหานคร โดยกองการสังคีต]
นส.ยุภาภรณ์ พูลสวัสดิ์ (คีตศิลปินปฏิบัติงาน กลุ่มงานดุริยางค์สากล กองการสังคีต)
และนักร้อง นักแสดง จากกลุ่มงานดุริยางค์ไทย กองการสังคีต
มหาดไทยภิรมย์ ชมดนตรีในสวน 15 ธันวาคม 2566 - 23 กุมภาพันธ์ 2567
กิจกรรม "มหาดไทยภิรมย์ ชมดนตรีในสวน" โดยกระทรวงมหาดไทย ทุกวันศุกร์ ตั้งแต่ 15 ธ.ค. 2566 จนถึงวันที่ 23 ก.พ. 2567 เวลา 18.00 - 19.00 น. บริเวณสวนมหาดไทย ภายในกระทรวงมหาดไทย สามารถเดินทางโดยรถประจำทาง ขสมก. สาย 60, 2, 47 และสาย 12 หรือรถไฟฟ้า MRT สถานีสามยอด หรือสถานีสนามไชย หากนำรถยนต์ส่วนตัวมา สามารถจอดได้บริเวณริมถนนราชบพิธ ด้านข้างวัดราชบพิธสถิตมหาสีมาราม จัดขึ้นโดยกระทรวงมหาดไทย กรมส่งเสริมการปกครองท้องถิ่น เพื่อเป็นการสร้างบรรยากาศส่งเสริมการท่องเที่ยวย่านพระนคร พื้นที่เมืองเก่าโดยรอบกระทรวงมหาดไทย และเป็นการเปิดพื้นที่ให้กับนักเรียนในสถานศึกษาสังกัดองค์กรปกครองส่วนท้องถิ่น ได้แสดงออกทางด้านศิลปวัฒนธรรม นันทนาการ และการแสดงความสามารถพิเศษ
9 กุมภาพันธ์ 2566 เทศบาลตำบลบางเลน ทำหมันสุนัข ฟรี LINK
เทศบาลตำบลบางเลน ร่วมกับ สำนักงานปศุสัตว์อำเภอบางใหญ่ จังหวัดนนทบุรี ขอเชิญประชาชนในพื้นที่เทศบาลตำบลบางเลน นำสัตว์เลี้ยงมารับบริการ ทำหมัน "ฟรี" ในวันพฤหัสบดีที่ 9 กุมภาพันธ์ 2566 เวลา 08.30 - 16.00 น. ณ สำนักงานเทศบาลตำบลบางเลน อ.บางใหญ่ จ.นนทบุรี หมายเหตุ : รับเฉพาะสุนัขและแมวสายพันธุ์ไทย จำนวน 80 ตัว เท่านั้น!!! **สามารถลงทะเบียนได้ตั้งแต่วันที่ 9 มกราคม 2566 เป็นต้นไปหรือจำนวนครบ ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลบางเลน โทร.02-147-1700-2 ต่อ 122,124, หรือ 087-699-0318 นำบัตรประชาชน หรือหลักฐานแสดงตนว่าอยู่พื้นที่เทศบาลตำบลบางเลน ด้วยความปรารถนาดีและความห่วงใย จาก..ดร.วรพจน์ พวงแย้ม นายกเทศมนตรีตำบลบางเลน
เทศกาลความรัก ณ เขื่อนศรีนครินทร์ ปี 2567 (9 กุมภาพันธ์ 2567)
เทศกาลความรัก ณ เขื่อนศรีนครินทร์ ปี 2567 "ความรักซื่อตรง มั่นคงดั่งตัวเขื่อน" วันศุกร์ที่ 9 กุมภาพันธ์ 2567 1 วัน ( เท่านั้น ) ณ สันเขื่อนศรีนครินทร์ เริ่มตั้งแต่เวลา 17.00 – 00.00 น. การแสดงดนตรีจากวง The Palace และเพลิดเพลินกับอาหารและเครื่องดื่มอีกมากมาย สนุกฟรี ไม่มีค่าใช้จ่าย มีบริการรถรับ-ส่ง บริเวณสวนเวลารำลึก
เทศกาลดนตรีในสวน MUSIC IN THE PARK ในงานเชียงรายดอกไม้งาม 2567
เทศกาลดนตรีในสวน MUSIC IN THE PARK ในงานเชียงรายดอกไม้งาม 2567 ดนตรีในสวนมีศิลปินมายมาย ที่มามอบความสนุกในเรา ตั้งแต่ธันวาคม 66 – กุมภาพันธ์ 67 Line up ศิลปินมีดังนี้
เดือนธันวาคม 2566 – วันที่ 28 : ตู่ ภพธร – วันที่ 29 : แอม เสาวลักษณ์ – วันที่ 30 : พิงค์แพนเตอร์ ผิงผิง โกลเด้นซอง
เดือนมกราคม 2567 – วันที่ 1 : ป๊อบ ปองกูล – วันที่ 6 : ก้อยศรัณย่า – วันที่ 13 : จ๊ะ อาร์สยาม – วันที่ 20 : ปาน ธนพร – วันที่ 27 : ซาร่าห์ ซาโลล่า
เดือนกุมภาพันธ์ 2567
– วันที่ 3 : No One Else
– วันที่ 10 : ไม้เมือง
– วันที่ 17 : นิวคันทรี่
หอมกลิ่นกาญจน์ 10 – 14 กุมภาพันธ์ 2567
หอมกลิ่นกาญจน์ “Kanchanaburi Flower Festival” ระหว่างวันที่ 10 – 14 กุมภาพันธ์ 2567 จ.กาญจนบุรี ที่ที่ ความงดงามของจักรวาลดอกไม้จะมาหยุดโลกให้ทุกท่านได้ชมกัน จัดโดย องค์การบริหารส่วนจังหวัดกาญจนบุรี เปิดโอกาสในการสร้างประสบการณ์ที่แสนพิเศษในช่วงเทศกาลตรุษจีนต่อเนื่องเทศกาลวาเลนไทน์ ยกระดับภาพลักษณ์ด้านการท่องเที่ยวจังหวัดกาญจนบุรีสู่การเป็น “World Class Destination” งานได้รวบรวมรูปแบบการท่องเที่ยวที่หลากหลายไว้ด้วยกัน (Mixing Event) ได้แก่ การจัดแสดงสวนดอกไม้ ดนตรีในสวน ตลาดสินค้าทางการเกษตร สินค้า OTOP อาหารร้านดังของจังหวัดกาญจนบุรี การจัดนิทรรศการและการประกวด สอดคล้องกับนโยบายของรัฐบาลในการผลักดัน Soft Power ที่เป็นหน้าเป็นตาให้กับประเทศ พัฒนาการท่องเที่ยวอัตลักษณ์คุณค่าสูงและเติบโตอย่างยั่งยืนการสร้างรายได้จากการท่องเที่ยวให้เพิ่มสูงขึ้น มีแหล่งท่องเที่ยวและโครงสร้างพื้นฐานที่ได้มาตรฐาน สอดคล้องกับยุทธศาสตร์การพัฒนาด้านเศรษฐกิจขององค์การบริหารส่วนจังหวัดกาญจนบุรี ด้วยการยกมาตรฐานการท่องเที่ยวให้เป็นที่รู้จักทั่วโลก
ยังแจ่ม แม่แจ่มคอฟฟี่คราฟ : มิวสิค แอนด์ อาร์ตเฟสติวัล 2024 วันที่ 10-11ก.พ.2567 LINK
ขอเชิญเที่ยว ชม ชิม ชอป กาแฟชั้นนำ ผลิตภัณฑ์วัฒนธรรม แวะมาแคมป์ปิ้งกันที่แม่แจ่ม ในงาน "ยังแจ่ม แม่แจ่มคอฟฟี่คราฟ : มิวสิค แอนด์ อาร์ตเฟสติวัล 2024" "Young Chaem Mae Chaem Craft Coffee : Music & Arts Festival 2024" พบกันวันเสาร์-อาทิตย์ที่ 10-11ก.พ.67 ณ ข่วงกิจกรรมแจ่มจริง ตลอดงาน ชม ชิม ชอป กาแฟชั้นนำกว่า 10 บูธ/ร่วมผลักดันกาแฟและการท่องเที่ยวแม่แจ่มให้ก้าวหน้าก้าวไกลในเวทีเสวนา "กาแฟแม่แจ่มสู่กาแฟโลก"/ "เที่ยวแม่แจ่มทั้งปี แม่แจ่มมีดีอะไรให้เที่ยว" นอกนั้น ยังมีการแสดงศิลปะวัฒนธรรม 4 ชนเผ่า/ประกวด "ส้าผัก" เมนูสุขภาพหนึ่งเดียวในแม่แจ่ม แต่ที่ขาดไม่ได้คือ "ดนตรีแม่แจ่มจากโรงเรียนในพื้นที่" ตั้งแต่ 18.00 น. จนถึง 21.00 น. จัดโดยทีมงานคุณภาพ กลุ่มเยาวชนแม่แจ่มกรีนมิวสิค โรงเรียนแม่แจ่ม ร่วมกับโครงการแม่แจ่มเมืองวัฒนธรรมสร้างสรรค์ มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา และภาคีเครือข่าย
คณะอนุกรรมการการเยี่ยม มาตรฐานการรักษาโดยการฟอกเลือดด้วยเครื่องไตเทียม
19 พฤศจิกายน 2564 โรงพยาบาลตากสิน ยินดีต้อนรับ คณะอนุกรรมการการเยี่ยมสำรวจเพื่อรับรองมาตรฐานการรักษาโดยการฟอกเลือดด้วยเครื่องไตเทียม
พญ.ชัญชนา บุญญไกร หัวหน้ากลุ่มงานอายุรกรรม นพ.กุลชน ลีละสิริ และคณะทำงานหน่วยไตเทียม โรงพยาบาลตากสิน ร่วมนำเสนอผลงานและนำคณะอนุกรรมการการเยี่ยมสำรวจเพื่อรับรองมาตรฐานการรักษาโดยการฟอกเลือดด้วยเครื่องไตเทียม นำโดย นพ. วุฒิเดช โอภาศเจริญสุข และ พญ. สุขฤทัย เลขยานนท์ เข้าเยี่ยมสำรวจเพื่อรับรองมาตรฐานตามที่ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทยได้กำหนด
Moonlight Ensemble Thai Classical Music Concert
Moonlight Ensemble
proudly presents
“ Thai Classical Music Concert ”
Composers
Nora-ath Chanklum
Numpark Sribanditmongkol
วันเสาร์ที่ 11 กุมภาพันธ์ 2566 เวลา19.00น.
ณ CRK Recital Hall วิทยาลัยดุริยศิลป์ มหาวิทยาลัยพายัพ( เขตแก้วนวรัฐ )
Saturday 11.02.2023 07.00 pm
at CRK Recital Hall ,The College of Music Payap University, Kaew Nawarat Campus
ADULT 500 THB / CHILDREN 300 THB
For more information please contact
Tel. 061-2955500, 082-6943252
เที่ยวงาน ราชมงคล รักษ์เหลืองจันท์ วันดอกไม้บาน ครั้งที่ 21 จ.จันทบุรี 11-19 ก.พ.66
เที่ยวสนุกสุขภาพดี วิถีธรรมชาติ วิถีราชมงคลจันท์ กิจกรรมบันเทิงสนุกสนานสุดมัน 9 วัน 9 คืน จัดเต็ม ศิลปิน ลิเก รำวงย้อนยุค มรกตคอมโบ้ ลูกทุ่งดัง อาทิ ต้นอ้อ สะบัดช่อ ยุ้ย ญาติเยอะ มนต์สิทธิ์ คำสร้อย อ้อยใจ แดนอีสาน พิมพา พรศิริ และอีกเพียบ
สอบถามโทร. 039-307261 ถึง 4
สตูลไบค์วีค ครั้งที่ 2 วันที่ 11 กุมภาพันธ์ 2566
สตูลไบค์วีค ครั้งที่ 2 วันที่ 11 กุมภาพันธ์ 2566 ณ จุดชมวิวปากบารา อ.ละงู สตูล ลงทะเบียน 200 บาท พร้อมอาหารและเครื่องดื่ม ฟรี รายได้ส่วนหนึ่งช่วยเหลือกลุ่มเปราะบางจังหวัดสตูล และนักเรียนดีแต่ขาดทุนทรัพย์โรงเรียนกำแพงวิทยา พิธีเปิดและแจกของที่ระลึก 20.00 น. การแสดงคอนเสิร์ต เสือเอ Buddy Love ไก่ กะละมัง วงแจกัน รำวงเวียนครก
เฮง เฮง มินิมาราธอน 2024 วิ่งฉลองตรุษจีน วันอาทิตย์ที่ 11 กุมภาพันธ์ 2567 LINK
เฮง เฮง มินิมาราธอน 2024 วิ่งฉลองตรุษจีน วันอาทิตย์ที่ 11 กุมภาพันธ์ 2567 งานวิ่งจะเสริมดวงชะตา โชคลาภ และสุขภาพให้กับคุณ จัดขึ้นในวันอาทิตย์ที่ 11 กุมภาพันธ์ 2567 สถานที่ : สนามวชิรเบญจทัศ (สวนรถไฟ) กิจกรรมเริ่ม 05.30 น. / ปล่อยตัวนักวิ่ง เวลา 06.00 น. ( วิ่งเช้า ) วัตถุประสงค์ เพื่อหารายได้ส่วนหนึ่งมอบให้กับมูลนิธิศุภนิมิตแห่งประเทศไทย ประเภทของการแข่งขันวิ่ง 1. ชาย - หญิง ระยะ Mini Marathon 10 km. 2. ชาย - หญิง ระยะ Fun Run 5 km.
กรีนมิวสิค ฟรีคอนเสิร์ต 12 กุมภาพันธ์ 2566
"กรีนมิวสิค” มหกรรมบทเพลงเพื่อชีวิต "ฟรีคอนเสิร์ต"
เพื่อการอนุรักษ์ธรรมชาติ สิ่งแวดล้อม และส่งเสริมการท่องเที่ยวของชุมชน
ในวันอาทิตย์ที่ 12 กุมภาพันธ์นี้ ณ ลานกิจกรรมเขื่อนขุนด่านปราการชล
"เที่ยงวันยันเที่ยงคืน"
ตื่นตาตื่นใจไปกับการแสดงคอนเสิร์ตของ 6 ศิลปินวงดัง ระดับตำนาน แสง สี เสียง สุดอลังการ
- หงาคาราวาน
- สีเผือกคนด่านเกวียน
- ซูซู
- แฮมเมอร์
- บรรพชน
- ต่อ อุทก
พร้อมกันนี้ท่านจะได้
พบกับการแสดง ????ว่าวบินสวยงามนานาชาติโดยสมาคมนักบินว่าวแห่งประเทศไทย ที่จะมาร่วมสร้างสีสรรตลอดทั้งงาน นอกจากนี้ยังมีการออกร้านชุมชนของดีนครนายก และสินค้าโอทอป อีกมากมาย
ห้วยโสมง มาราธอน 2023 วันที่ 12 กุมภาพันธ์ 2566 LINK
ห้วยโสมง มาราธอน 2023 12 กุมภาพันธ์ 2566 อ่างเก็บน้ำนฤบดินทรจินดา (เขื่อนห้วยโสมงอันเนื่องมาจากพระราชดำริ) จ.ปราจีนบุรี วิ่งบนสันอ่างเก็บน้ำทีมีความยาวถึง 3,800 เมตร ชมทิวทัศน์อันสวยงามของอ่างเก็บน้ำนฤบดินทรจินดา ซึ่งเป็นโครงการอันเนื่องมาจากพระราชดำหริ พร้อมๆไปกับการชมวิวทิวทัศน์ที่มีความสวยงามของการวิ่งในเส้นทางของทุกระยะการวิ่ง
กุมภาพันธ์ 65 ธนบุรี เฮลท์แคร์ กรุ๊ป เปิดบริษัทย่อย ดําเนินกิจการด้านเทคโนโลยีในธุรกิจการแพทย์
15 กุมภาพันธ์ 2565 ธนบุรี เฮลท์แคร์ กรุ๊ป จํากัด (มหาชน) แจ้งการจัดตั้งบริษัท ธิ้งค์ อีโวลูชั่น จํากัด เป็นบริษัทย่อย ทุนจดทะเบียน 100 ล้านบาท เพื่อดําเนินกิจการด้านเทคโนโลยีระบบสารสนเทศ ในธุรกิจการแพทย์โดยมุ่งเน้นให้บริการให้คําปรึกษาและปรับโครงสร้างธุรกิจให้เป็นระบบดิจิทัล สําหรับองค์กรด้านการดูแลสุขภาพ ซึ่งคาดว่าจะเริ่มมีรายได้ในปี 2565 นี้
พรหมลิขิตพิชิตใจ จามจุรียักษ์ใหญ่เป็นพยาน ประจำปี 2567 (14 ก.พ. 2567)
พรหมลิขิตพิชิตใจ จามจุรียักษ์ใหญ่เป็นพยาน อำเภอเมืองกาญจนบุรี ขอเชิญชวนคู่รักร่วมกิจกรรมจดทะเบียนสมรสในวันแห่งความรัก ณ ต้นจามจุรียักษ์ สัญลักษณ์แห่งความรักที่มั่นคง ยืนยาว ในวันที่ 14 ก.พ. 2567 ต้นจามจุรียักษ์ ต.เกาะสำโรง อ.เมือง จ.กาญจนบุรี เปิดรับสมัครจำนวน 20 คู่รัก สนใจติดต่อสอบถามรายละเอียดได้ที่ ที่ว่าการอำเภอเมืองกาญจนบุรี โทรศัพท์ 034521359
งาน Cafe in the Garden อุดรธานี 16-18 กุมภาพันธ์ 2567
ททท. สำนักงานอุดรธานี ชวนมาร่วมเป็นส่วนหนึ่งในกิจกรรม ครั้งแรก‼️ ของงาน Cafe in the Garden ในอุดรธานี ที่ต้องห้ามพลาด งาน “Udon Coffee Family” At บุญถาวร (อุดรคอฟฟี่แฟมีลี่) วันที่ 16-18 ก.พ 2567 เวลา 09:00-18:00 น. สถานที่ บุญถาวร สาขาอุดรธานี กิจกรรมในงาน จิบกาแฟ แลงานคราฟต์ เพลินงานศิลป์ ???? เคล้าเสียงดนตรี ตะลุยชิมเบเกอรี่ home maded จากร้านค้าทั้งในจังหวัดและจังหวัดข้างเคียง กิจกรรม workshop เท่ ๆ ให้ได้สนุกกันทั้งครอบครัว เมนูสุดเอ็กซ์คลูซีฟที่รังสรรค์ขึ้นเป็นพิเศษและจำหน่ายเฉพาะในงานนี้เท่านั้น ร่วมลุ้นของรางวัลได้ทุกวัน Save the date และเตรียมตัวให้พร้อมกับเทศกาลชิลๆ ของคนชิคๆ ที่ บึงบุญถาวร
สมุทรสาครไบค์วีค ครั้งที่ 7 วันที่ 17 – 18 กุมภาพันธ์ 2566 LINK
งาน “สมุทรสาครไบค์วีค ครั้งที่ 7” ระหว่างวันที่ 17 – 18 กุมภาพันธ์ 2566 ณ บริเวณลานจัดงานด้านหน้าศาลพันท้ายนรสิงห์ ต.พันท้ายนรสิงห์ อ.เมือง จ.สมุทรสาคร
งานสมุทรสาครไบค์วีค เป็นงานประจำปีชาวไบค์เกอร์ สมุทรสาครและจ.ใกล้เคียง จัดขึ้นเพื่อสร้างความสัมพันธ์และความสามัคคีของพี่น้องชาวไบค์เกอร์ทุกคน เป็นการสร้างความสุข สนุกสนาน แถมยังได้ร่วมกันสร้างบุญ โดยรายได้หลังจากหักค่าใช้จ่ายจะมอบให้เพื่อเป็นสาธารณะกุศลประโยชน์แก่ศาลพันท้ายนรสิงห์ และ วัดศาลพันท้ายนรสิงห์ เพื่อทำนุบำรุงศาสนสถานที่สำคัญ อีกทั้งยังได้มอบให้กับโรงพยาบาลสมุทรสาคร เพื่อจัดซื้ออุปกรณ์ทางการแพทย์อีกด้วย
ภายในงานก็จะมีกิจกรรมที่น่าสนใจอาทิ เช่น การแสดงดนตรีสุดมันส์จากพี่แมว จีรศักดิ์ ปานพุ่ม และ วงแบล็คเฮด (เต็มวง) ความสนุกสนาน ความบันเทิง ความมันส์ และยังได้ร่วมสร้างบุญกุศลด้วย
กิจกรรม ศุกร์(สุข)กายสบายใจ Freestyle Sabaiday @อนันตราปุระรีสอร์ท ศุกร์ที่ 17 กุมภาพันธ์ 2566. LINK
กิจกรรม ศุกร์(สุข)กายสบายใจ Freestyle Sabaiday @อนันตราปุระรีสอร์ท รวบรวมกิจกรรมเพื่อสุขภาพ
⭐กิจกรรมตลาดกรีน Market
⭐กิจกรรมสอนทำกิมจิ
⭐กิจกรรมทำสอนหมักไวน์Homemadeเพื่อสุขภาพ
⭐การทำคอมบูชา
⭐กิจกรรม Cystal Singing Bolw ที่กำลังเป็นที่นิยม
⭐กิจกรรมศิลปะบำบัด
⭐รับชมการแสดงผลงาน Wall story กำแพงเล่าเรื่อง
⭐กิจกรรมพายเรือลำน้ำใสใหญ่ Water Zone
และอื่นๆอีกมากมาย รวมไปถึงการรับชมดนตรีในสวน ณ ลานจามจุรี
แคมป์ปิ้งบรรยากาศสุดชิลล์วิวริมแม่น้ำใสใหญ่ ณ ลานสมอแคมป์ปิ้ง
กำหนดการกิจกรรมโภายในงาน
ศูนย์การแพทย์อนันตราปุระรีสอร์ท อ.นาดี จ.ปราจีนบุรี 17-19 กุมภาพันธ์ นี้
ลงทะเบียนสมัครเข้าร่วมกิจกรรม และปักสมอลานแคมป์ปิ้งได้แล้ววันนี้
**จำนวนจำกัด กิจกรรม Camping 50 Tent เพียงเท่านั้น
ค่าใช้จ่ายคนละ 200 บาท เด็ก 100 บาท ต่อ 1 คืน
รายละเอียดเพิ่มเติมโทร : 087-6644423
งานวิ่ง 65 UNT ROCK & RUN 2024 วันที่ 17 กุมภาพันธ์ 2567 LINK
งานวิ่ง 65 UNT ROCK & RUN 2024 วันที่ 17 กุมภาพันธ์ 2567 ณ มหาวิทยาลัยมหิดล ศาลายา (วิ่งกันตอนเย็นๆ) วิ่งจบอย่าพึ่งรีบกลับ ‼️ ไปกระโดดกันต่อกับคอนเสิร์ตจาก Bodyslam และ Cocktail รายได้จากการขายบัตรทั้งหมดไม่หักค่าใช้จ่ายมอบให้มูลนิธิรามาธิบดี เพื่อโครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี
ซาว สื่น Coffee and Music Fest. 2024 เทศกาลกาแฟและดนตรีครั้งแรกของศรีสะเกษ 17 - 18 กุมภาพันธ์ 2567
เตรียมพบกับ...เทศกาลกาแฟและดนตรีครั้งแรกของศรีสะเกษ "ซาว สื่น Coffee and Music Fest. 2024" ในวันที่ 17 - 18 กุมภาพันธ์ 2567 ณ ลานกางเต๊นท์ เกาะกลางน้ำ ห้วยน้ำคำ จ.ศรีสะเกษ มาดื่มด่ำบรรยากาศ จิบกาแฟดีๆ ในสวนร่มๆ ฟังดนตรีเบาๆสบายๆ พร้อมร่วมกิจกรรมสำหรับคอกาแฟและศิลปะอีกมากมาย จัดโดย เทศบาลเมืองศรีสะเกษ หอการค้าศรีสะเกษ ศรีสะเกษ
NSN Music In The Park ดนตรีชิลล์ๆ นครสวรรค์ มกราคม-กุมภาพันธ์ 2567
เทศบาลนครนครสวรรค์ จัด
กิจกรรมดนตรี ดีๆ NSN Music In The Park งานดนตรีดีๆเพื่อคนรักในเสียงเพลง เพื่อชาวนครสวรรค์ พิกัดแห่งความสุข "ลานดนตรี (สนามวู้ดบอล) สะพานเกาะกลาง อุทยานสวรรค์ ชมฟรี..!! ไม่มีเงื่อนไข
กิจกรรมดนตรีในสวนในปีงบประมาณนี้ มี 3 ครั้ง
เสาร์ที่ 13 มกราคม 2567 - Anna , Pumi, Soft Sweet, Near
เสาร์ที่ 27 มกราคม 2567 1 7:00 - 21:00 น. - Anna , Jarn First, MR.Laika, The Garden
เสาร์ที่ 17 กุมภาพันธ์ 2567
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2567 (17-26 ก.พ. 67)
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2567 จัดขึ้นวันที่ 17-26 ก.พ. 2567 พระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช ต.ดอนเจดีย์ อ.พนมทวน จ.กาญจนบุรี ชมการแสดง แสง เสียง ย้อนรอยประวัติศาสตร์สมเด็จพระนเรศวรมหาราช พระมหากษัตริย์ผู้กอบกู้เอกราชของชาติไทย และการแสดงทางศิลปวัฒนธรรม รำวงย้อนยุค การละเล่นพื้นบ้าน การจำหน่ายสินค้าชุมชนในรูปแบบตลาดย้อนยุค เที่ยวชมฟรีตลอดงาน
17 กุมภาพันธ์ 2567 มหกรรมบรรเลงกีต้าร์ บทเพลงแห่งรัก Music for Love
โรงเรียนไทยนิยมสงเคราะห์ เขตบางเขน กรุงเทพมหานคร จัดกิจกรรม "มหกรรมบรรเลงกีต้าร์ บทเพลงแห่งรัก Music for Love“ BMA Music Station 17 กุมภาพันธ์ 2567 ร่วมเป็นส่วนหนึ่งของการรวมพลคนรักกีตาร์ สร้างสถิติมากที่สุดของกรุงเทพมหานคร เปิดโอกาสให้กับครู นักเรียน ผู้ปกครองและบุคคลทั่วไปที่สนใจเข้าร่วมกิจกรรม สแกน QR Code ลงทะเบียนร่วมงาน ณ โรงเรียนไทยนิยมสงเคราะห์ เขตบางเขน กรุงเทพมหานคร ** ฟรี ไม่มีค่าใช้จ่าย
รายละเอียดโรงเรียนไทยนิยมสงเคราะห์ เขตบางเขนSingha Corporation Presents Music Breath Run งานวิ่งการกุศลส่งต่อลมหายใจด้วยเสียงเพลง 17 กุมภาพันธ์ 2567 LINK
วิ่งเพื่อสุขภาพที่ดีพร้อมได้บุญกับงาน งาน Singha Corporation Presents Music Breath Run งานวิ่งการกุศลส่งต่อลมหายใจด้วยเสียงเพลงไปกับศิลปินบ้าน Muzik Move ออกสตาร์ท ณ centralwOrld ในวันเสาร์ที่ 17 กุมภาพันธ์ 2567 ลงทะเบียนเวลา 04.00 น. ปล่อยตัวตั้งแต่เวลา 05.00 น.เป็นต้นไป พร้อมกับ Earth Patravee, Seriousbaconband, Bean Napason, Copter, กัปตัน OneOne Band, FLIRT, Ae Jirakorn, ป๊อก ZEAL, WEEED BOMB, หนู มิดด้าม(ตัวจริง), Bell Warisara, miteennn, PAE SAX, Methane, The Publish, Lost chips, Boss, Folksong และศิลปินท่านอื่น ๆ อีกมากมาย รายได้ทั้งหมดจะมอบให้กับผู้ป่วยมะเร็งยากไร้ สถาบันมะเร็งแห่งชาติ
มีสองระยะให้ได้เลือกวิ่งกัน Fun Run 5.5 กิโลเมตร / Run More 10.8 กิโลเมตร พิเศษ! ลงทะเบียนรูปแบบ VIP Package Fun Run / Run More จะได้รับขวดน้ำดีไซน์เก๋ ๆ จากงานไปด้วยนะ
17-18 กุมภาพันธ์ 2567 เทศกาลดนตรีอยุธยา Love Love
เทศกาลดนตรีอยุธยา Love Love 17-18 ก.พ. 2024 ณ ป้อมเพชร เวลา 16.00 – 22.00 น. พบกับ วง The Gravity วง Orbit วง 4Times วง Re-Lize วง SixStrings และวงดนตรีอื่นๆ อีกมากมาย
Somewhere in Klaeng Coffee Market at Bake and More 17-18 กุมภาพันธ์ 2567
Somewhere in Klaeng Coffee Market at Bake and More 17-18 กุมภาพันธ์ 2567 ร้าน Bake and More งานสำหรับเหล่าสาวกคนรักกาแฟ งานที่รวบรวมร้านกาแฟกว่า 14 ร้าน พร้อมการ Work Shop เกี่ยวกับการคั่วกาแฟและการเรียนรู้เรื่องการสกัดกาแฟ การแก้ไขปัญหาเบื้องต้นในการสกัดกาแฟ ไปจนถึงกิจกรรมมากมายให้เข้าร่วมตลอดทั้งสองวัน
ดนตรีในสวนของคนอยุธยา 17-18 กุมภาพันธ์ 2567
ดนตรีในสวนของคนอยุธยากลับมาอีกครั้ง พร้อมกลิ่นอายเทศกาลแห่งความรัก อยุธยายามเย็น ครั้งที่ 16 Love Love เจอกันสองวันรวด 17-18 กุมภาพันธ์นี้ ที่ป้อมเพชร อยุธยา ดนตรีสนุกๆจากหลากหลายวง อาหารทานเล่นในบรรยากาศริมแม่น้ำ และไฟประดับสวยๆยามค่ำ กิจกรรมเริ่ม 16.30 เป็นต้นไป
งาน ชงโขง - ชง ชิค ปิคนิคริมโขง วันเสาร์ที่ 17 กุมภาพันธ์ 2567
งาน ชงโขง - ชง ชิค ปิคนิคริมโขง วันเสาร์ที่ 17 กุมภาพันธ์ 2567 เริ่มตั้งแต่เวลา 9:00 น. เป็นต้นไป
Mothers Class ครั้งที่ 1 วันเสาร์ ที่ 17 กุมภาพันธ์ 2567
"Mothers Class" ครั้งที่ 1 ในวันเสาร์ ที่ 17 กุมภาพันธ์ 2567 เวลา 9.30 - 12.00 น.ณ ห้องประชุมนายแพทย์สมชัย ตั้งพร้อมพันธ์ ชั้น 2 อาคารศูนย์การแพทย์เฉพาะทางเกษมราษฎร์ ศรีบุรินทร์ **(ไม่เสียค่าใช้จ่าย)** “เตรียมความพร้อมเข้าสู่การเป็นคุณแม่คุณภาพ” ร่วมรับฟังการบรรยายในหัวข้อ พัฒนาการดี เริ่มที่ลูกน้อยในครรภ์ โดย แพทย์หญิงอรสุดา สมประสิทธิ์ กุมารแพทย์เฉพาะทางพัฒนาการและพฤติกรรมเด็ก ร่วม Workshop สอนการอุ้มและอาบน้ำเด็กแรกเกิด โดยเจ้าหน้าที่แผนก Nursery
THAI Music Festival live in Melbourne 2023 LINK
Melbourne Thai Music Festival Tour 2023
Non Stop Music – 6 Bands from Thailand.
GATE OPEN 10 AM
Where: Event Address : Caribbean Gardens 1280 Ferntree Gully Rd,
Scoresby VIC 3179
Event Dates : 18th & 19th February 2023
Tickets
2 Days Pass Kids Free / age under 12
1 Day Pass Kids $25 / age 12 -17
2 Day Pass Kids $50 / age 12 -17
1 Day Pass Adult $199 / age 18+
2 Day Pass Adult $259 / age 18+
อำนาจไบค์วีค Amnat Bike week 2023 วันที่ 18 กุมภาพันธ์ 2566
อำนาจไบค์วีค Amnat Bike week 2023 วันที่ 18 กุมภาพันธ์ 2566 ณ โรงสีข้าวเกษตรธัญญรุ่งเรือง กำหนดการ เวลา 16.30 น. ร่วมขบวนขับขี่ปลอดภัย เปิดไฟ ใส่หมวก สวมหมวกกันน็อค เริ่มงาน 18.00-24.00 น.
วิ่งมหาสนุกเพื่อมหาสมุทรของเรา@แสมสาร 2024 วันที่ 18 กุมภาพันธ์ 2024 LINK
RUN FOR THE OCEAN @แสมสาร : วิ่งมหาสนุกเพื่อบ้านแสนสุขของปลาการ์ตูน วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567 Start & Finish บริเวณอ่างเก็บน้ำ ตำบลแสมสาร อำเภอสัตหีบ จังหวัดชลบุรี เพื่อสร้างบ้านให้ปลาการ์ตูนภายใต้โครงการ "พานีโม่กลับบ้าน" รายได้ส่วนหนึ่งสมทบทุนสร้างห้องน้ำให้กับโรงเรียนชุมชนบ้านช่องแสมสารและเป็นการส่งเสริมการท่องเที่ยวแบบยั่งยืนให้กับชุมชนบ้านช่องแสมสาร
รายละเอียดการแข่งขันประเภทระยะทางวิ่ง. ซุปเปอร์ มินิ มาราธอน ระยะ 15 กิโลเมตร2 มินิ มาราธอน ระยะ 10 กิโลเมตร2 วิ่งเพื่อสุขภาพ ระยะ 6 กิโลเมตร (ไม่มีการแข่งขัน) 2 VIP (ไม่มีการแข่งขัน สามารลงวิ่งระยะใดก็ได้) *** มีของที่ระลึกพิเศษ
ปิดตลาด เปิดเมืองวิ่ง2024 นครน้อยมินิมาธอน วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567 LINK
นครน้อยมินิมาธอน ปิดตลาด เปิดเมืองวิ่ง2024 ชวนนักท่องเที่ยวที่ชอบเที่ยวตลาดเก่า วิ่งดู Street Art ส่งเสริมสนบสนุนการท่องเที่ยววัฒนธรรมชุมชน ยลถิ่นกำเนิดหลวงพ่อโต แวะชิมอาหารอร่อยในชุมชนตลาดเก่าท่าเรือ จ.พระนครศรีอยุธยา พบกับงานถนนคนเดิน นครน้อย 2460 ศิลปและวัฒนธรรม วันที่ 16-18 กุมภาพันธ์ 2567 พบกับ คาราวานร้านค้าและกิจกรรมที่น่าสนใจ แต่งกายย้อนยุคเที่ยวตลาดวัฒนธรรม ก่อนลงแข่งขันมินิมาราธอน ในวันอาทิตย์ที่ 18 กุมภาพันธ์ 2567 จุดปล่อยตัว ณ ตลาดสุวรรณเกลียวทอง อ.ท่าเรือ จ.พระนครศรีอยุธยา รายได้จากค่าสมัคร หักค่าใช้จ่ายมอบให้โรงพยาบาลท่าเรือ อ.ท่าเรือ ประเภทการสมัคร เปิดรับสมัคร 1 พฤษศจิกายน 2566 - 30 ธันวาคม 2566
นครสวรรค์ ดราก้อน รัน 2024 วันที่ 18 กุมภาพันธ์ 2567 LINK
นครสวรรค์ ดราก้อน รัน 2024 วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567 จัดโดย เทศบาลนครนครสวรรค์ ระยะวิ่ง ฮาล์ฟมาราธอน 21.1 กิโลเมตร / มินิมาราธอน 10.5 กิโลเมตร / ฟันรัน 5 กิโลเมตร /วีไอพี 21.1/10.5 / 5 กิโลเมตร วัตถุประสงค์ โครงการขยายพื้นที่อาคารเรียน โรงเรียนเทศบาลวัดพรหมจริยาวาส (ท.3) ส่งเสริมการพัฒนาการศึกษาโรงเรียนในสังกัดเทศบาลนครนครสวรรค์
นัดพบแรงงาน งานที่มั่นคงกับคนมีคุณภาพ 21 กุมภาพันธ์ 2566 บิ๊กซี สุพรรณบุรี
งานมากมายรอคุณอยู่! ที่บิ๊กซี สุพรรณบุรี เชิญร่วมงานนัดพบแรงงาน "งานที่มั่นคงกับคนมีคุณภาพ" วันอังคารที่ 21 กุมภาพันธ์ 2566 ณ บริเวณห้างสรรพสินค้า บิ๊กซี ซูเปอร์เซ็นเตอร์ สาขาสุพรรณบุรี
21 กุมภาพันธ์ 2566 ออกหน่วยรับบริจาค บริษัทเอกชน
งานดนตรีในสวน “Mill ไม่ Mute พุธนี้ไม่เงียบ” โรงงานกระดาษไทย กาญจนบุรี
อบจ.กาญจนบุรี ขอเชิญเที่ยวงานดนตรีในสวน “Mill ไม่ Mute พุธนี้ไม่เงียบ” ทุกวันพุธ เริ่มพุธที่ 21 กุมภาพันธ์เป็นต้นไป ตั้งแต่เวลา 17.00 - 21.30 น. ณ โรงงานกระดาษไทยกาญจนบุรี. พบกับกิจกรรม ดนตรีในสวน ประกวดดนตรีโฟล์คซอง ดูหนังกลางแปลง ชิล ช้อป สินค้า vintage DIY
21 กุมภาพันธ์ 2567 ดนตรีในสวน ณ สนามทุ่งศรีเมือง จังหวัดอุดรธานี
องค์การบริหารส่วนจังหวัดอุดรธานี ขอเชิญชวน…ทุกท่าน มาเพลิดเพลินไปกับเสียงเพลง “ดนตรีในสวน” ณ สนามทุ่งศรีเมือง จังหวัดอุดรธานี เริ่มตั้งแต่วันที่ 21 กุมภาพันธ์ 2567 นี้ เป็นต้นไป ถึง วันที่ 31 พฤษภาคม 2567 ตั้งแต่เวลา 17.00-22.00 น. (ทุกวัน) ตามโครงการดนตรีในสวนเพื่อนันทนาการและการท่องเที่ยวของจังหวัดอุดรธานี
กุมภาพันธ์ 65 โรงพยาบาล ลาดพร้าว ลงทุนเพิ่มในบริษัทย่อย
22 กุมภาพันธ์ 2565 โรงพยาบาล ลาดพร้าว จํากัด (มหาชน) มีมติอนุมัติลงทุนเพิ่มใน วงเงินไม่เกิน 50 ล้านบาท ใน บ.ศูนย์บริหารจัดการธุรกิจแห่งเอเซีย จํากัด (บริษัทย่อย) เพื่อขยายธุรกิจที่เกี่ยวเนื่องกับสถานพยาบาล ศูนย์สุขภาพ ทั้งทางตรง และทางอ้อม
22-26 กุมภาพันธ์ 2566 งานประจำปีวัดโคกขาม ปิดทองหลวงพ่อสัมฤทธิ์ (พระพุทธสิหิงค์) LINK
ขอเชิญเที่ยวงานประจำปีวัดโคกขาม อำเภอเมือง สมุทรสาคร ปี 2566 นี้ จัดในวันที่ 22-26 กุมภาพันธ์ 2566 (5 วัน 5 คืน) ร่วมนมัสการปิดทอง หลวงพ่อสัมฤทธิ์ (พระพุทธสิหิงค์) คู่วัดโคกขามแห่งนี้ ร่วมชมคอนเสิร์ตจัดเต็มทุกคืน ตามตารางข้างล่าง เลือกซื้อสินค้า กินอาหารเครื่องดื่มขนมสารพัดในงาน
ตารางการแสดง 22 ก.พ. แอ้ม ชลธิชา 23 ก.พ. น้ำแข็ง ทิพวรรณ 24 ก.พ. ตรี ชัยณรงค์ & เวียง นฤมล 25 ก.พ. เบลล์ นิภาดา 26 ก.พ. พี สะเดิด
22 กุมภาพันธ์ 2566 รับบริจาคอวัยวะและดวงตา
งานประจำปี กลางเดือน3 "ขึ้นเขาเผาข้าวหลาม" อ.แปลงยาว 23-25 กุมภาพันธ์ 2567
✅เชิญเที่ยวงานประจำปี กลางเดือน3 "ขึ้นเขาเผาข้าวหลาม" วันที่ 23-25 กุมภาพันธ์ 2567 วัดหัวสำโรง อ.แปลงยาว จ.ฉะเชิงเทรา ณ สนามโรงเรียนวัดหัวสำโรง มีมหรสพ: ลิเก ภาพยนตร์ รำวงย้อนยุค ลุ้นไหทองพาโชค ชมฟรีตลอดงาน มหกรรมร้านค้ามากมายหลากหลาย
23 กุมภาพันธ์ 2567 ตลาดปัฐวิกรณ์ เขตบึงกุ่ม
ทำหมันหมาแมวฟรี ในงานกิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 23 กุมภาพันธ์ 2567 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ตลาดปัฐวิกรณ์ เขตบึงกุ่ม
เกาะลันตาไบค์วีค 24-25 กุมภาพันธ์ 2566
Coffee In The Garden @Rise Park หลังเซ็นทรัลชลบุรี 24-25 กุมภาพันธ์ 2024
Coffee In The Garden @Rise Park หลังเซ็นทรัลชลบุรี 24-25 กุมภาพันธ์ 2024 เวลา 09:00-19:00 น. เปิดรับร้านค้าทุกรูปแบบ ลงพื้นที่ฟรี!! (
Link สมัคร) - อาหาร -เบเกอรี่ -กิ๊ปชอป -งานเซรามิก -ชา,เครื่องดื่ม - ของแฮนเมด -น้ำหอม -เมล็ดกาแฟ -ศิลปะ -Food Truck น่าสนใจในงานนี้ - พบกับเหล่าร้านกาแฟชื่อดังย่านชลบุรี ลิ้มลองรสชาติและสัมผัสกลิ่นอันหอมกรุ่น - กิจกรรม Workshop "Slow Bar" - นั่งสวนชิลล์ฟังดนตรีสด - อิ่มเอมกับเบเกอรี่และอาหารอีกมากมาย #สายแค้มป์ #สายดริป #สายสุขภาพ ไม่ควรพลาด
กิจกรรม Tak Morning Drip ครั้งที่ 3 วันเสาร์ ที่ 24 กุมภาพันธ์ 2567
ขอเชิญร่วมกิจกรรม Tak Morning Drip ครั้งที่ 3 วันเสาร์ ที่ 24 กุมภาพันธ์ 2567 เวลา 07:00 น. บริเวณเกาะทานตะวัน อ.บ้านตาก จ.ตาก ณ เกาะทานตะวันตากตก บ้านตาก กิจกรรมครั่งนี้ ไม่มีค่าใช้จ่าย พบกับกิจกรรมกาแฟดริป กาแฟยามเช้า จากแหล่งปลูกจังหวัดตาก ชมทัศนียภาพแม่น้ำปิง ที่บ้านตาก ความสวยงามและบรรยากาศที่สวยงาม ร่วมพูดคุย แลกเปลี่ยนประสบการณ์ และแบ่งปันกาแฟดีๆ นำเมล็ด หรืออุปกรณ์มาให้กัน พบกับ กาแฟจังหวัดตากจากหลายเขตอำเภอ : อาทิเช่น (เมืองตาก) ห้วยเหลือง (บ้านตาก) ห้วยทู่ (แม่สอด) ห้วยปลาปลาหลด (อุ้งผาง) แม่กลองน้อย , แม่กลองใหญ่ (ท่าสองยาง) เลอตรอโกร มอโก้คี วะเบอลลู่ (แม่ละมาด) ดอยภูกา
TENMEE 10K : Pride of SURIN 2024 อบต.เทนมีย์ อำเภอเมืองสุรินทร์ อาทิตย์ ที่ 25 กุมภาพันธ์ 2567 LINK
TENMEE 10K : Pride of SURIN 2024 ครั้งที่ 3 นแข่งขัน อาทิตย์ ที่ 25 กุมภาพันธ์ 2567 ปล่อยตัว 06.00 น. องค์การบริหารส่วนตำบลเทนมีย์ อ.เมืองสุรินทร์ จ.สุรินทร์ ระยะทาง : 10k ความมันส์ ความสนุก ความประทับใจ ที่ยังตราตรึงใจ นักวิ่งทุกคน ที่เคยได้มาสัมผัสสนาม 10K ที่ร่ำลือกันว่าเผ็ดแซ่บ⚡️ ที่สุดในสุรินทร์ จับเวลาด้วยระบบ Chip time มาตรฐานสนามรับรองโดย สมาคมกีฬากรีฑาแห่งประเทศไทย ในพระบรมราชูปถัมภ์ ยินดีต้อนรับนักวิ่ง ทุกระดับฝีเท้า ทั้งขาแรง ขาแซ่บ หรือขาสวย ???? มาเถอะอยากเจอ คิดถึง แล้วพบกันครับ
25 กุมภาพันธ์ 2567 The Voices Concert เทศกาลดนตรีกรุงเทพมหานคร 2567 (BANGKOK Music Fest 2024)
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว โดย กองการสังคีต ร่วมส่งมอบความสุขจากเสียงดนตรี ขับขานบทเพลง เรียงร้อยทำนองอันไพเราะ จากบทเพลงร้องและบรรเลงหลากหลายสไตล์ อิ่มเอม ไปกับเสียงดนตรี
The Voices Concert วันอาทิตย์ที่ 25 กุมภาพันธ์ 2567 เวลา 17.00 น. @สวนเบญจกิติ (เวทีริมน้ำ) เขตคลองเตย อำนวยเพลง โดย สรพจน์ วรแสง บรรเลงโดย วงดุริยางค์กรุงเทพมหานคร (Bangkok Metropolitan Orchestra) ศิลปินรับเชิญ โน้ต - ศรัณย์ คุ้งบรรพต น้องใบพลู - ภาวิดา พรวัฒนานุกูล ร่วมด้วยศิลปิน นักร้องจากกองการสังคีต… Vocal - พัทธนันท์ อาจองค์ Violin - พงศ์สิต การย์เกรียงไกร Trumpet - ศุภวันชัย ประกายกิจ
และมิตรไมตรีคอรัส ชมฟรี … ไม่มีค่าใช้จ่าย
Chiang Mai Toy Ride 2023 อาทิตย์ที่ 26 กุมภาพันธ์ 2566 LINK
Chiang Mai Toy Ride 2023 สุขใจทั้งผู้ให้ถูกใจทั้งผู้รับ
ร่วมสนับสนุนปรับปรุงอาคารเรียนคอมพิวเตอร์และจัดซื้อคอมพิวเตอร์
ที่โรงเรียนบ้านห้วยบง ตำบลเขื่อนผาก อำเภอพร้าว จังหวัดเชียงใหม่
ในวันอาทิตย์ที่ 26 กุมภาพันธ์ 2566
เด็กๆ และโรงเรียนยังต้องการสิ่งของจำเป็นที่ขาดแคลน
ไบค์เกอร์ องค์กร ห้างร้านใดสนใจร่วมนำสิ่งของมาบริจาคหรือบริจาคเงินสนับสนุนกิจกรรมนำไปแปรเปลี่ยนเป็นสิ่งของที่โรงเรียนและเด็กๆต้องการ
สิ่งของที่โรงเรียนขาดแคลน
- เงินสนับสนุนในการปรับปรุงอาคารเรียนคอมพิวเตอร์ ห้องสมุดและอาคารชั้นประถม 2
- คอมพิวเตอร์ใหม่ คอมพิวเตอร์มือสองสภาพดี อะไหล่คอมพิวเตอร์
- เสื้อผ้า เครื่องนุ่งห่มกันหนาว ผ้าห่ม ของใช้ส่วนตัว
- ชุดนักเรียน รองเท้านักเรียน อุปกรณ์การเรียน
- ตู้ ชั้นวาง เก็บอุปกรณ์วิทยาศาสตร์
- เวชภัณฑ์ยา ยาสามัญประจำบ้าน หน้ากากอนามัย
- อาหาร ของว่าง เครื่องดื่ม
- ของเล่นและตุ๊กตา สำหรับเด็กช่วงอายุ 5-12 ปี
- เงินสนับสนุนในด้านอื่นๆ รวมทั้งการสนับสนุนตามที่ท่านประสงค์
นำสิ่งของมาบริจาคได้ที่ ริชโค่ ฮาร์ลีย์-เดวิดสัน เชียงใหม่
ทุกวันเวลา 10.00 น.-18.00 น. ตั้งแต่วันนี้จนถึง 25 กุมภาพันธ์ 2566
เสื้อยืดกิจกรรม Chiang Mai Toy Ride 2023
จำหน่ายตัวละ 350 บาท ไซส์ S M L XL
จำหน่ายตัวละ 400 บาท ไซส์ 2XL 3XL 4XL
(รายได้ไม่หักค่าใช้ให้โรงเรียนทั้งหมด)
สามารถร่วมบริจาค สั่งจองเสื้อ และร่วมทริป ติดต่อได้ทาง
23-26 กุมภาพันธ์ 2567 งาน Song by The River@Krabi Season 2 ลานปูดำ จังหวัดกระบี่
งาน "Song by The River@Krabi Season 2" ️23-26 กุมภาพันธ์ 2567 เวลา 18.00-22.00 น. ณ ลานปูดำ จังหวัดกระบี่ งานดนตรีชิลล์ๆ ริมน้ำ รับสายลม ชมพระจันทร์ ดนตรีหลากหลายสไตล์ พิเศษสุดๆ พบกับศิลปินชื่อดังคุณ John Nuvo แสดงวันที่ 24 ก.พ.
เทศกาลมาฆปูรมีศรีปราจีน ประจำปี 2566 วันที่ 27 กุมภาพันธ์ -7 มีนาคม 2566
งานเทศกาลมาฆปูรมีศรีปราจีน ประจำปี 2566 ระหว่างวันที่ 27 กุมภาพันธ์ - 7 มีนาคม 2566 ณ บริเวณโบราณสถานสระมรกต ต.โคกไทย อ.ศรีมโหสถ จ.ปราจีนบุรี มีจัดกิจกรรม เช่น กิจกรรมเดินธุดงค์และปฏิบัติธรรม กิจกรรมบวชเนกขัมมะ และศีลจาริณี กิจกรรมเวียนเทียนรอบรอยพระพุทธบาทคู่ กิจกรรมประกวดสวดมนต์หมู่ฯ และบรรยายธรรม
หน่วยเคลื่อนที่กทม. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า มค-มิย 2567
กำหนดการหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จุดต่างๆ ดังนี้ (จากเพจ
กลุ่มควบคุมโรคพิษสุนัขบ้า) มค-มิย 2567
- วันอังคารที่ 27 กุมภาพันธ์ 2567 ชุมชนอุมาร์ 2 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 28 กุมภาพันธ์ 2567 ชุมชนแผ่นดินทองสะฟีรุสซาลาม แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 29 กุมภาพันธ์ 2567 ชุมชนทิวไผ่พัฒนา แขวงลำปลาทิว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันจันทร์ที่ 18 มีนาคม 2567 ชุมชนวัฒนานันท์ แขวงดอนเมือง เขตดอนเมือง เวลา 9.00 - 11.00 น.
- วันอังคารที่ 19 มีนาคม 2567 กรมสรรพาวุธทหารบก แขวงถนนนครไชยศรี เขตดุสิต เวลา 9.30 - 11.30 น.
- วันพุธที่ 20 มีนาคม 2567 ชุมชนรามอินทรา 83 , 85 แขวงรามอินทรา เขตคันนายาว เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 22 มีนาคม 2567 ชุมชนหมู่บ้านพัฒนา หมู่ 12-13 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 26 มีนาคม 2567 ชุมชนแผ่นดินทองดารุ้ลฮาซานัย แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 27 มีนาคม 2567 ชุมชนก้าวใหม่พัฒนาบึงปรง แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 28 มีนาคม 2567 ชุมชนทิวสนร่วมจิตมณียา แขวงทับยาว เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 29 มีนาคม 2567 ชุมชนแผ่นดินทองดารุ้ลฮาซานัย แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 2 เมษายน 2567 ชุมชนสะพานปูน แขวงดอนเมือง เขตดอนเมือง เวลา 9.30 - 11.30 น.
- วันพุธที่ 3 เมษายน 2567 เคหะชุมชนบางนา 2 เขตบางนา
- วันพฤหัสบดีที่ 4 เมษายน 2567 ชุมชนเคหะรามอินทรา กม.4 แขวงท่าแร้ง เขตบางเขน เวลา 9.30 - 11.30 น.
- วันพุธที่ 10 เมษายน 2567 ชุมชนหลังวัดลานบุญ แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 10 เมษายน 2567 ณ วัดปรินายกวรวิหาร เขตพระนคร
- วันพฤหัสบดีที่ 18 เมษายน 2567 ชุมชนอัลฟาลาห์ แขวงคลองสิบ เขตหนองจอก
- วันศุกร์ที่ 19 เมษายน 2567 ที่ชุมชนก้าวไกลพัฒนา แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 23 เมษายน 2567 ที่ชุมชนหมู่บ้านพัฒนา หมู่ 12-13 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 เมษายน 2567 ที่ชุมชนแผ่นดินทองดารุ้ลนาฮีม แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 30 เมษายน 2567 ที่หมู่บ้านเคหะธานี 4 แขวงราษฎร์พัฒนา เขตสะพานสูง เวลา 9.00 - 11.30 น.
- วันพุธที่ 1 พฤษภาคม 2567 ที่ชุมชนพ้ฒนาศาลาร่วมใจ แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 2 พฤษภาคม 2567 ที่ชุมชนซอยพระธรรมนูญ แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 3 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองอัรเราะห์มาน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 4 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 3 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 5 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองอัลฮุดา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 6 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองฮาซานุดดีน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันจันทร์ที่ 10 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 4 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 11 มิถุนายน 2567 ที่ชุมชนกิตติชัย 2 แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 13 มิถุนายน 2567 ที่ลานกีฬาแสงทิพย์ ท้ายซอยปรีดีพนมยงค์ 2 ถนนสุขุมวิท 71 แขวงพระโขนงเหนือ เขตวัฒนา เวลา 9.00 - 12.00 น.
- วันจันทร์ที่ 17 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 5 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 18 มิถุนายน 2567 ที่ชุมชนหมู่บ้านธันยพฤกษ์ แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 19 มิถุนายน 2567 ที่ชุมชนผดุงพันธ์พัฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 20 มิถุนายน 2567 ที่ชุมชนหมู่บ้านสมนึก แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 25 มิถุนายน 2567 ที่หมู่บ้านจัดสรรอาร์เค พาร์ค รามอินทรา-ซาฟารี 2 แขวงบางชัน เขตคลองสามวา เวลา 9.30 - 11.30 น.
- วันพุธที่ 26 มิถุนายน 2567 ที่ชุมชนเลียบคลองสิบสาม แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 27 มิถุนายน 2567 ที่ชุมชนนันทวัน เซ็นท์ 2 แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
Thailand Coffee Hub 2024 @เซ็นทรัลนครสวรรค์ 28 ก.พ. - 3 มี.ค. 2567
Thailand Coffee Hub 2024 ภาคเหนือ @เซ็นทรัลนครสวรรค์ วันที่ 28 ก.พ. - 3 มี.ค. 2567 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคเหนือ ไฮไลต์ภายในงาน ได้แก่ การแข่งขันดริปกาแฟสุดมันส์ และกิจกรรมดีๆตลอดงาน แบรนด์กาแฟ Specialty Coffee ครบที่สุดของภาคเหนือ คาเฟ่ชื่อดังจากทั่วภาคเหนือ เมล็ดกาแฟดีกรีแชมป์ และอุปกรณ์กาแฟ รวมไว้ให้ครบจบในงานเดียว กูรูกาแฟ และไอดอลของชาวกาแฟ ร้านเบเกอรี่ โกโก้ และชา ชื่อดัง สำหรับคนไม่กินกาแฟ
ดนตรีในสวนภิรมย์ธาร บริเวณสะพานแขวน ลำปาง ทุกวันศุกร์ เสาร์ อาทิตย์ เวลา 15.00-20.30 น.
ขอเชิญ ผู้รักสุขภาพที่มีดนตรีในหัวใจ มาม่วน เต้น ระบำ รำ ฟ้อน เพื่อสุขภาพ พบกับ ดนตรีในสวนภิรมย์ธาร บริเวณสะพานแขวน ทุกวันศุกร์ เสาร์ อาทิตย์ เวลา 15.00-20.30 น.
“
สวนภิรมย์ธาร” สวนสาธารณะที่หลากหลาย และมีความสวยงาม เกิดจากการปรับปรุงสวนสาธารณะเขื่อนยาง โดยเทศบาลนครลำปาง เพื่อให้เป็นจุดเช็คอินแห่งใหม่ ภายใต้ชื่อ “สวนภิรมย์ธาร” บริเวณเขื่อนยางฝั่งบ้านดงไชย บนพื้นที่เกือบ 20 ไร่ ความยาวประมาณ 1.5 กิโลเมตร โดยแบ่งเป็น 4 โซนใหญ่ ๆ ได้แก่ โซนค้าขาย โซนลานอนุสาวรีย์พญาพรมโวหาร โซนเครื่องออกกำลังกาย และโซนสปอร์ตคอมเพล็กซ์ ไม่ว่าจะเป็น ลานสเก็ตบอร์ด ลานกีฬาต่าง ๆ เป็นต้น เชื่อว่า สถานที่แห่งนี้ จะเป็นจุดเช็คอินแห่งใหม่ของคนทุกเพศ ทุกวัย ที่สามารถมาใช้พื้นที่ได้อย่างสะดวก ปลอดภัย และเกิดประโยชน์สูงสุด
Thailand Coffee Hub 2024 @เซ็นทรัลนครสวรรค์ 28 ก.พ. - 3 มี.ค. 2567
Thailand Coffee Hub 2024 ภาคเหนือ @
เซ็นทรัลนครสวรรค์ วันที่ 28 ก.พ. - 3 มี.ค. 2567 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคเหนือ ไฮไลต์ภายในงาน ได้แก่ การแข่งขันดริปกาแฟสุดมันส์ และกิจกรรมดีๆตลอดงาน แบรนด์กาแฟ Specialty Coffee ครบที่สุดของภาคเหนือ คาเฟ่ชื่อดังจากทั่วภาคเหนือ เมล็ดกาแฟดีกรีแชมป์ และอุปกรณ์กาแฟ รวมไว้ให้ครบจบในงานเดียว กูรูกาแฟ และไอดอลของชาวกาแฟ ร้านเบเกอรี่ โกโก้ และชา ชื่อดัง สำหรับคนไม่กินกาแฟ
ICONIC CRAFT COFFEE FEST 29 ก.พ. - 10 มี.ค.67
ICONIC CRAFT COFFEE FEST เทศกาลงานกาแฟระดับพรีเมียม Specialty Coffee⭐️ คัดสรรทุกความอร่อยโดย ICONCRAFT ในบูธของ POUR OVER LAB จะมีทั้งเมล็ดกาแฟ และเมนูต่างๆ ให้ได้ลิ้มลองและช้อปปิ้งกลับบ้านกันแบบจุใจไปเลย ปักหมุด ไปเจอกัน 29 ก.พ. - 10 มี.ค.67 เจริญนคร ฮอลล์ ชั้น M , ICONSIAM
เขตบางกอกน้อย ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีน 2-13 กันยายน 2567
เขตบางกอกน้อย กิจกรรมการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 2 ประจำปี 2567 ระหว่างวันที่ 2 - 13 กันยายน 2567 ฟรี ณ ชุมชนในพื้นที่จำนวน 10 แห่ง โดยนำสัตว์เลี้ยงมารับบริการตามวัน เวลา และสถานที่ที่แจ้งไว้ ทั้งนี้ เพื่อเป็นการป้องกันไม่ให้เกิดอันตรายต่อประชาชน และเป็นการระงับการแพร่ระบาดของโรคพิษสุนัขบ้าในสัตว์ในพื้นที่เขตบางกอกน้อย ขอเชิญชวนประชาชนนำสัตว์เลี้ยง สุนัขหรือแมวอายุ 3 เดือนขึ้นไป มารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนเคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่ายใดๆ (#ฟรี) พร้อมทั้งให้เจ้าของนำบัตรประชาชนมาเพื่อทำทะเบียนด้วย สอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมฯ โทร.0 2424 7880
3 พ.ย. 65 ชี้แจงงบวิจัยกัญชา
ชี้แจงงบวิจัยกัญชา
- นพ.โอภาส การย์กวินพงศ์ ปลัด สธ. ชี้แจงกรณีชมรมแพทย์ชนบทโพสต์ระบุกัญชาทางการแพทย์เป็นเพียงวาทกรรม ไม่ได้รับความสำคัญและการสนับสนุนอย่างจริงจัง เนื่องจากไม่มีงบประมาณการวิจัยจากสำนักงบฯ ว่า ขณะนี้ได้มอบหมาย นพ.พงศ์เกษม ไข่มุกด์ รองปลัด สธ. ดูแลเรื่องนี้ และสอบถามไปยัง นพ.สสจ. ว่า การสื่อสารดังกล่าวออกมาจากแหล่งใด ได้ ข้อมูลไม่ครบถ้วนหรือไม่ เพื่อตรวจสอบอีกครั้ง และขอย้ำว่า สธ.ให้ความสำคัญกับการพัฒนาหลักฐานทางวิชาการเพื่อ สนับสนุนให้เกิดการใช้ยากัญชาที่เหมาะสม ที่ผ่านมามีการขับเคลื่อนเรื่องการวิจัยตั้งแต่ปี 2562-ปัจจุบัน ทำให้เกิดผลงานวิจัย ราว 60 เรื่อง และในปี 2566 ยังมีนโยบายศึกษาวิจัยกัญชา กัญชง ครบวงจร ภายใต้งบวิจัยมากกว่า 80 ล้านบาท ซึ่งจะเน้น ให้น้ำหนักกับการวิจัยเพื่อใช้ประโยชน์ทางการแพทย์นอกจากนี้ ยังให้ความสำคัญกับการวิจัยจากงานประจำ โดยในแผน บริการสุขภาพ (Service Plan) สาขากัญชา ปีนี้ได้เพิ่มเติมให้ทุกเขตสุขภาพมีการวิจัยหรือจัดการความรู้อย่างน้อยปีละ 2 เรื่อง นอกเหนือจากตัวชี้วัดเรื่องการเข้าถึงยากัญชาของผู้ป่วยด้วย
- นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ กล่าวว่า เวลาทำวิจัยในคนไม่ใช่เรื่องง่าย ต้องมีการขอจริยธรรม ต้องผ่าน กระบวนการจำนวนมาก ต้องใช้เวลา แต่ในกรมการแพทย์ รพ. มีเงินบำรุง มีเงินกองทุนวิจัย มีสถาบันวิจัยอยู่ในกรมการ แพทย์ มีหน้าที่ดูวิจัยทั้งหมด เพราะเราเป็นกรมวิชาการ มีกองทุนวิจัยในการให้เงินทำวิจัยอยู่แล้ว และในระบบมีการ ศึกษาวิจัยกัญชาทางการแพทย์อยู่แล้ว เพราะเรื่องนี้เป็นความมั่นคงทางยาด้วย เนื่องจากบริษัทยาปัจจุบันไม่ค่อยวิจัยยาจาก พืช ส่วนใหญ่จะเป็นหน่วยงานรัฐที่ศึกษาเรื่องนี้ อาทิรพ.ธัญญารักษ์ขอนแก่น ศึกษาเรื่อง CBD มาช่วยผู้ป่วยติดยาเสพติดชนิด รุนแรง นอกจากนี้ ยังร่วมกับเอกชนวิจัย CBD ต่อสู้กับมะเร็ง ซึ่งกำลังศึกษาเช่นกัน
ประชุมสภาฯ พิจารณาร่าง พ.ร.บ.กัญชาฯ
- 2 พ.ย.65 ประชุมสภาฯ นัดแรก สถานการณ์ในสภาฯ มีความขัดแย้งหากทวีความรุนแรง อาจนำไปสู่การยุบสภาก่อนชุด ปัจจุบันจะครบวาระ สัญญาณเริ่มต้นชัดเจน จากกรณี รมว.อนุทิน เสนอร่าง พ.ร.บ.กัญชาฯ เข้าสู่สภา ให้พรรคร่วมรัฐบาลลง มติเห็นชอบตาม กมธ. แต่พรรคร่วมบางพรรคไม่สนับสนุนร่าง กม.เพื่อควบคุมกัญชา ถือว่าไม่เป็นผลดีต่อบ้านเมือง และเป็น ปัญหาของคนไม่เคารพกติกา ทำให้ นายสาทิตย์ วงศ์หนองเตย ส.ส.พรรคประชาธิปัตย์ แถลงจะลงมติไม่รับร่างกฎหมาย กัญชาฯ และยื่นคำขาดให้นายอนุทินทบทวนกฎกระทรวงที่เกี่ยวกับกัญชาโดยให้นำกลับไปเข้าบัญชียาเสพติด เพื่อไม่ให้ไทย เป็นสังคมอุดมยาเสพติด ทั้งนี้ นายอนุทิน กล่าวว่า คนที่แถลงข่าวไม่เคยทำการบ้าน หากอยากจะให้กลับมาเป็นยาเสพติดอีก ครั้ง คงต้องมานั่งเป็น รมว.สธ.ก่อน
- นายสุทิน คลังแสง ประธานวิปฝ่ายค้าน เผย คาดว่าสัปดาห์หน้าจะได้พิจารณาร่าง พ.ร.บ.กัญชากัญชง แนวโน้มจะล้ม หรือไม่ขึ้นอยู่กับรัฐบาล เพราะฝ่ายค้านยืนยันว่าต้องเป็นกัญชาทางการแพทย์เท่านั้น ไม่จำเป็นต้องปลดล็อก การให้กัญชาเป็น ยาเสพติดประเภทที่ 5 สามารถใช้ทางการแพทย์ได้ เป็นที่น่าสังเกตว่า ร่าง พ.ร.บ.ฯ เพิ่มสาระขึ้นมาใหม่จำนวนมากจนเหมือน เป็นร่างใหม่ ดังนั้นจึงจะต้องผ่านกระบวนการฟังความเห็นจากประชาชนหรือไม่ โอกาสจะผ่านมี 50-50
สนับสนุน พ.ร.บ.กัญชาฯ
- นายประพัฒน์ ปัญญาชาติรักษ์ นำเครือข่ายสนับสนุนการใช้กัญชาทางการแพทย์ยื่นหนังสือต่อนายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. เพื่อขอให้ผลักดันร่าง พ.ร.บ.กัญชา กัญชง ให้มีผลบังคับใช้โดยเร็ว
ทำร้ายร่างกายหลังเสพกัญชา
- เกิดเหตุ นายธีระวัฒน์ ชายวัย 31 ปี อ.กู่แก้ว จ.อุดรธานี เสพยาบ้าผสมเหล้าขาวและกัญชาอาละวาดคลุ้มคลั่งใช้จอบไล่ ทำร้ายชาวบ้าน ขู่ฆ่าทุกคนทั้งหมู่บ้าน หวั่นเกิดเหตุซ้ำรอยโศกนาฏกรรมหนองบัวลำภู สุดท้ายตำรวจควบคุมตัวไว้ได้
- เกิดเหตุที่ อ.บ้านดุง จ.อุดรธานี นายทองคูณ ชายวัย 55 ปี บังคับให้ภรรยาและลูกสาววัย 12 ปี เดินเท้าเปล่าระยะทาง 6 กม. ไปนำห่อกัญชาที่บ้านพ่อแม่มาให้ภายใน 1 ชม. ไม่เช่นนั้นจะฆ่าให้ตาย โดยก่อนเดินทางภรรยาถูกทำร้ายร่างกายเกือบ สลบ ด้านลูกชายเผยเคยถูกทำร้ายร่างกายผลักล้มจนต้องผ่าตัดสมองและพิการ ต้องการให้เจ้าหน้าที่พาพ่อไปบำบัดรักษา
รอบ 4 ทีมสุดท้าย
13 ธันวาคม 2565
เวลา 2.00 น. อาร์เจนตินา 3 - 0 โครเอเชีย (True4U True Sports 2)
14 ธันวาคม 2565
เวลา 2.00 น. ฝรั่งเศส 2 - 0 โมร็อกโก (ONE31 True Sports 2)
วัยที่มากขึ้นส่งผลต่อการตั้งครรภ์
เภสัชกรหญิง อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ ให้ภาพรวมว่า ปัจจุบันประเทศไทยกำลังประสบปัญหาเรื่องของโครงสร้างประชากร จากอัตราเกิดที่ลดลงอย่างต่อเนื่อง จัดว่าเป็นวาระแห่งชาติ สาเหตุอาจจะเกิดจากกลุ่มประชากรที่มีความพร้อม เช่น กลุ่มหนุ่มสาว ที่แต่งงานช้าลง แต่เมื่อมีความต้องการจะมีบุตร ความพร้อมอาจลดลง ยิ่งโดยเฉพาะกับสตรีแล้ว เมื่อวัยที่มากขึ้น สิ่งที่อาจคิดไม่ถึงคือ เซลส์ของไข่ย่อมเสื่อมสภาพลง และส่งผลต่อการตั้งครรภ์ ทำให้ตั้งครรภ์ยากขึ้น เกิดภาวะครรภ์เสี่ยง เป็นต้น บำรุงราษฎร์ โดยศูนย์การเจริญพันธุ์และคลินิกรักษาผู้มีบุตรยาก (Fertility Center and IVF Clinic) เข้าใจปัญหาลักษณะนี้เป็นอย่างดี ด้วยทีมแพทย์ผู้เชี่ยวชาญมากประสบการณ์ ผสานกับเทคโนโลยีเจริญพันธุ์ ที่ครบถ้วน ยืนยันด้วยหลักฐานเชิงประจักษ์ที่ชัดเจน ที่เป็นตัวเลขตัวชี้วัดความสำเร็จที่ระดับ 90% บำรุงราษฎร์และทีมแพทย์ มีความยินดีและพร้อมให้ข้อมูลการเตรียมตัวและการวางแผน เพื่อการมีบุตรอย่างมีคุณภาพ เพื่อการมีทายาทตัวน้อย มาเติมเต็มความสุขในครอบครัว ทำให้บ้านสมบูรณ์และอบอุ่นตลอดไป
โครงการ "ทวิศึกษา" หรือ "Dual Education" LINK
"ทวิศึกษา" หรือ "Dual Education"
อีก 1 นโยบายดีๆ ของ ศธ.
เพื่อสร้างโอกาสทางการศึกษา
สำหรับผู้เรียนที่มีฐานะยากจน ด้อยโอกาส
และกลุ่มเปราะบาง
เรียนพร้อมกัน จบแล้วได้ 2 วุฒิ
ทั้งสายสามัญ และสายอาชีพ
ห้องตรวจศัลยกรรม
ห้องตรวจศัลยกรรม อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 2 เบอร์โทรศัพท์ 044-615002 ต่อ 4202-4203
น่าสนใจจากการเลือกตั้ง 2566
ผู้มาใช้สิทธิ 39,319,301 คน จากผู้มีสิทธิ52,238,594คน คิดเป็น 75.27%
จังหวัดที่พรรคการเมืองเดียวกวาดยกจังหวัด (จำนวนที่นั่ง)
- นนทบุรี ก้าวไกล (8)
- สมุทรปราการ ก้าวไกล (7)
- จันทบุรี ก้าวไกล (3)
- ระยอง ก้าวไกล (5)
- ตราด ก้าวไกล (1)
- สมุทรสงคราม ก้าวไกล (1)
- สมุทรสาคร ก้าวไกล (3)
- ภูเก็ต ก้าวไกล (3)
- น่าน เพื่อไทย (3)
- อุตรดิตถ์ เพื่อไทย (3)
- สุโขทัย เพื่อไทย (4)
- พะเยา พลังประชารัฐ (3)
- กำแพงเพชร พลังประชารัฐ (4)
- เพชรบูรณ์ พลังประชารัฐ (6)
- ชุมพร รวมไทยสร้างชาติ (3)
- บุรีรัมย์ ภูมิใจไทย (10)
- กระบี่ ภูมิใจไทย (3)
- ยะลา ประชาชาติ (3)
- สุพรรณบุรี ชาติไทยพัฒนา (5)
Big Surprise การเลือกตั้งครั้งนี้ คือม้ามืด 2 ท่าน จากพรรคเพื่อไทรวมพลัง ในเขต 3 และ เขต 10 จ.อุบลราชธานี
- เขต 3 เพื่อไทรวมพลัง นางพิมพกาญจน์ พลสมัคร 31,218
- เพื่อไทรวมพลัง นายสมศักดิ์ บุญประชม 62,754
และคุณ นายสมศักดิ์ บุญประชม ติดกลุ่มนำผู้สมัครที่ได้คะแนนสูงสุดของประเทศ ที่ 62,754
รายชื่อผู้ได้คะแนนสูงสุด (เกิน 50,000 คะแนน)
- เพื่อไทย นายครูมานิตย์ สังข์พุ่ม 68,300 เขต 5 สุรินทร์
- พลังประชารัฐ นายทวี สุระบาล 63,185 เขต 2 ตรัง
- ภูมิใจไทย นายถิรเดช ตั้งมั่นก่อกิจ 62,976 เขต 2 กระบี่
- เพื่อไทรวมพลัง นายสมศักดิ์ บุญประชม 62,754 เขต 10 อุบลราชธานี
- ประชาธิปัตย์ นางสาวสุณัฐชา โล่สถาพรพิพิธ 62,644 เขต 3 ตรัง
- เพื่อไทย นายอาทิตย์ หวังศุภกิจโกศล 60,320 เขต 11 นครราชสีมา
- ก้าวไกล นางสาวนิตยา มีศรี 60,282 เขต 5 สมุทรปราการ
- ก้าวไกล นางสาวพุธิตา ชัยอนันต์ 62,009 เขต 4 เชียงใหม่
- ก้าวไกล นายวิทวิสิทธิ์ ปันสวนปลูก 60,127 เขต 1 ลำพูน
- เพื่อไทย นายชลน่าน ศรีแก้ว 56,746 เขต 2 น่าน
- เพื่อไทย นางสาวปิยะรัฐชย์ ติยะไพรัช 55,778 เขต 2 เชียงราย
- ภูมิใจไทย นายวรศิษฎ์ เลียงประสิทธิ์ 55,612 เขต 2 สตูล
- รวมไทยสร้างชาติ นายอัครเดช วงษ์พิทักษ์โรจน์ 54,815 เขต 4 ราชบุรี
- เพื่อไทย นายสรวงศ์ เทียนทอง 53,989 เขต 3 สระแก้ว
- พลังประชารัฐ นายธรรมนัส พรหมเผ่า 53,963 เขต 1 พะเยา
- ประชาชาติ นายซูการ์โน มะทา 51,946 เขต 2 ยะลา
- ภูมิใจไทย นายสฤษฏ์พงษ์ เกี่ยวข้อง 51,845 เขต 3 กระบี่
- เพื่อไทย นางสาวปิยะนุช ยินดีสุข 51,348 เขต 7 นครราชสีมา
- เพื่อไทย นายอภิชา เลิศพชรกมล 51,206 เขต 10 นครราชสีมา
- ก้าวไกล นางสาวการณิก จันทดา 51,181 เขต 2 เชียงใหม่
- ก้าวไกล นายภัทรพงษ์ ลีลาภัทร์ 50,878 เขต 8 เชียงใหม่
- เพื่อไทย นายศรัณย์ ทิมสุวรรณ 50,421 เขต 2 เลย
- ก้าวไกล นายพิชัย แจ้งจรรยาวงศ์ 50,177 เขต 3 สมุทรปราการ
- ก้าวไกล นายศุภณัฐ มีนชัยนันท์ 50,132 เขต 9 กรุงเทพ
- ภูมิใจไทย นายสุรศักดิ์ พันธ์เจริญวรกุล 50,080 เขต 4 พระนครศรีอยุธยา
- ก้าวไกล นายณัฐชา บุญไชยอินสวัสดิ์ 50,035 เขต 27 กรุงเทพ
ชนะกันฉิวเฉียดที่สุด (ไม่เกิน 1,500 คะแนน)
- เขต 20 กรุงเทพ ห่างกัน 4 คะแนน
อันดับ 1 เพื่อไทย นางสาวธีรรัตน์ สำเร็จวาณิชย์ 34,749
อันดับ 2 ก้าวไกล นายชุมพล หลักคำ 34,745
- เขต 2 พังงา ห่างกัน 109 คะแนน
อันดับ 1 พลังประชารัฐ นายฉกาจ พัฒนกิจวิบูลย์ 21,506
อันดับ 2 เพื่อไทย นายกฤษ ศรีฟ้า 21,397
- เขต 2 สงขลา ห่างกัน 168 คะแนน
อันดับ 1 รวมไทยสร้างชาติ นายศาสตรา ศรีปาน 20,553
อันดับ 2 ก้าวไกล นางสาววชิราภรณ์ นิรันตราภรณ์ 20,385
- เขต 5 เชียงใหม่ ห่างกัน 277 คะแนน
อันดับ 1 เพื่อไทย นายจุลพันธ์ อมรวิวัฒน์ 38,015
อันดับ 2 ก้าวไกล นายสมชิด กันธะยา 37,738
- เขต 9 อุบลราชธานี ห่างกัน 460 คะแนน
อันดับ 1 ไทยสร้างไทย นางรำพูล ตันติวณิชชานนท์ 31,311
อันดับ 2 เพื่อไทย นายประภูศักดิ์ จินตะเวช 30,851
- เขต 2 สกลนคร ห่างกัน 718 คะแนน
อันดับ 1 ประชาธิปัตย์ นายชาตรี หล้าพรหม 27,405
อันดับ 2 เพื่อไทย นายนิยม เวชกามา 26,687
- เขต 5 ปทุมธานี ห่างกัน 1,094 คะแนน
อันดับ 1 เพื่อไทย นายมนัสนันท์ หลีนวรัตน์ 35,074
อันดับ 2 ภูมิใจไทย นายพิษณุ พลธี 33,980
- เขต 6 สงขลา ห่างกัน 1,187 คะแนน
อันดับ 1 ประชาธิปัตย์ นางสาวสุภาพร กำเนิดผล 34,835
อันดับ 2 พลังประชารัฐ นายอนุกูล พฤกษานุศักดิ์ 33,648
- เขต 1 ประจวบคีรีขันธ์ ห่างกัน 1,229 คะแนน
อันดับ 1 ภูมิใจไทย นายสังคม แดงโชติ 34,445
อันดับ 2 ประชาธิปัตย์ นายมนตรี ปาน้อยนนท์ 33,216
- เขต 4 พิษณุโลก ห่างกัน 1,316 คะแนน
อันดับ 1 เพื่อไทย นางสาวพิมพ์พิชชา ชัยศุภกิจเจริญ 25,626
อันดับ 2 ภูมิใจไทย นายนิยม ช่างพินิจ 24,310
- เขต 1 อุบลราชธานี ห่างกัน 1,356 คะแนน
อันดับ 1 เพื่อไทย นายวรสิทธิ์ กัลป์ตินันท์ 32,468
อันดับ 2 ก้าวไกล นายวิศรุต สวัสดิ์วร 31,112
- เขต 1 ปัตตานี ห่างกัน 1,491 คะแนน
อันดับ 1 ประชาชาติ ผู้ช่วยศาสตราจารย์วรวิทย์ บารู 13,938
อันดับ 2 ภูมิใจไทย นางสาวเพชรดาว โต๊ะมีนา 12,447
ตารางการแข่งขัน Toyota One Make Race วันศุกร์ที่ 30 มิถุนายน - วันอาทิตย์ที่ 2 กรกฎาคม 2566
ตารางการแข่งขัน Toyota One Make Race และมีถ่ายทอดสด แบบ Full HD ผ่าน Live Streaming ทาง Youtube (TH/ENG) และ Facebook
Thailand Super Series และ
Toyota Gazoo Racing หรือ ทาง Truesports 2 ช่อง 667
และยังสามารถรับชมถ่ายทอดสดผ่านทาง Truevisions ช่อง True Sport 2 (667) ในวันศุกร์ถึงอาทิตย์ รวมถึง TrueID ช่องทาง IDStation : onelink
สำหรับการไปชม ณ สนามจริง จะมีรถ Mini Bus รอรับส่งจากด้านนอกเพื่ออำนวยความสะดวกมาถึงช่วงสนามแข่ง ตลอดทั้ง เสาร์-อาทิตย์นี้ #ฟรี #ฟรี #ฟรี #free #minibus
8.30 น. - 8.50 น. : Yaris One Make Race (Qualify)
9.00 น. - 9.20 น. : Corolla Altis GR Sport One Make Race / Yaris Ativ Lady One Make Race (Qualify)
9.30 น. - 9.50 น. : Hilux Revo One Make Race (Qualify)
10.55 น. - 11.45 น. : พิธีเปิดการแข่งขัน
12.00 น. - 12.25 น. : Yaris One Make Race (Race Round)
12.50 น. - 13.15 น. : Corolla Altis GR Sport One Make Race / Yaris Ativ Lady One Make Race (Race Round)
วันอาทิตย์ที่ 2 กรกฎาคม 2566
09.25 น. - 09.50 น. : Hilux Revo One Make Race (Race Round)
10.00 น. - 11.00 น. : มอบรางวัลการแข่งขัน Toyota One Make Race ทุกรุ่น
*ภาพจาก Thailand Super Seriesวันธงชัย วันอธิบดี วันอุบาทว์ วันโลกาวินาศ ปี 2567
วันธงชัย และ วันอธิบดี และวันอุบาทว์ ปี 2567
ดังนี้
เดือนมกราคม 2567
วันธงชัย เสาร์ที่ 6, 13, 20 และ 27
วันอธิบดี พุธที่ 3, 10, 17, 24 และ 31
วันอุบาทว์ ศุกร์ที่ 5, 12, 19 และ 26
เดือนกุมภาพันธ์ 2567
วันธงชัย เสาร์ที่ 3, 10, 17 และ 24
วันอธิบดี พุธที่ 7, 14, 21 และ 28
วันอุบาทว์ ศุกร์ที่ 2, 9, 16 และ 23
เดือนมีนาคม 2567
วันธงชัย เสาร์ที่ 2, 9, 16, 23 และ 30
วันอธิบดี พุธที่ 6, 13, 20 และ 27
วันอุบาทว์ ศุกร์ที่ 1, 8, 15, 22 และ 29
เดือนเมษายน 2567
วันธงชัย เสาร์ที่ 6, 13, อังคารที่ 16, อังคารที่ 23 และ อังคารที่ 30
วันอธิบดี พุธที่ 3, 10, พฤหัสบดีที่ 18 และ พฤหัสบดีที่ 25
วันอุบาทว์ ศุกร์ที่ 5, 12, จันทร์ที่ 22 และ จันทร์ที่ 29
วันโลกาวินาศ วันเสาร์ที่ 20 และ 27
เดือนพฤษภาคม 2567
วันธงชัย อังคารที่ 7, 14, 21 และ 28
วันอธิบดี พฤหัสบดีที่ 2, 9, 16, 23 และ 30 (วันอัฎฐมีบูชา)
วันอุบาทว์ จันทร์ที่ 6, 13, 20 และ 27
วันโลกาวินาศ วันเสาร์ที่ 4, 11, 18 และ 25
เดือนมิถุนายน 2567
วันธงชัย อังคารที่ 4, 11, 18 และ 25
วันอธิบดี พุธที่ 6, 13, 20 และ 27
วันอุบาทว์ จันทร์ที่ 3, 10, 17 และ 24
วันโลกาวินาศ วันเสาร์ที่ 1, 8, 15, 22 และ 29
เดือนกรกฎาคม 2567
วันธงชัย อังคารที่ 2, 9, 16, 23 และ 30
วันอธิบดี พฤหัสบดีที่ 4, 11, 18 และ 25
วันอุบาทว์ จันทร์ที่ 1, 8, 15, 22 และ 29
วันโลกาวินาศ วันเสาร์ที่ 6, 13, 20 และ 27
เดือนสิงหาคม 2567
วันธงชัย อังคารที่ 6, 13, 20 และ 27
วันอธิบดี พฤหัสบที่ 1, 8, 15, 22 และ 29
วันอุบาทว์ จันทร์ที่ 5, 12, 19 และ 26
วันโลกาวินาศ วันเสาร์ที่ 3, 10, 17, 24 และ 31
เดือนกันยายน 2567
วันธงชัย อังคารที่ 3, 10, 17 และ 24
วันอธิบดี พฤหัสบดีที่ 5, 12, 19 และ 26
วันอุบาทว์ จันทร์ที่ 2, 9, 16, 23 และ 30
วันโลกาวินาศ วันเสาร์ที่ 7, 14, 21 และ 28
เดือนตุลาคม 2567
วันธงชัย อังคารที่ 1, 8, 15, 22 และ 29
วันอธิบดี พฤหัสบดีที่ 3, 10, 17, 24 และ 31
วันอุบาทว์ จันทร์ที่ 7, 14, 21 และ 28
วันโลกาวินาศ วันเสาร์ที่ 5, 12, 19 และ 26
เดือนพฤศจิกายน 2567
วันธงชัย อังคารที่ 5, 12, 19 และ 26
วันอธิบดี พฤหัสบดีที่ 7, 14, 21 และ 28
วันอุบาทว์ จันทร์ที่ 2, 9, 16, 23 และ 30
วันโลกาวินาศ วันเสาร์ที่ 2, 9, 16, 23 และ 30
เดือนธันวาคม 2567
วันธงชัย อังคารที่ 3, 10, 17, 24 และ 31
วันอธิบดี พฤหัสบดีที่ 5, 12, 19 และ 26
วันอุบาทว์ จันทร์ที่ 4, 11, 18 และ 25
วันโลกาวินาศ วันเสาร์ที่ 7, 14, 21 และ 28
งานวัดชัยนาท
งานวัดในชัยนาท ปีนี้ มีหลายงานในหลายอำเภอ มีดังนี้ [ข้อมูลจากเพจ
งานวัดชัยนาท แนะนำไปติดตาม]
- งานประจำปี ปิดทองหลวงสระปลาแดง ณ วัดดอนตาล ต.หนองน้อย อ.วัดสิงห์จ.ชัยนาท วันที่ 26 มกราคม 2567
- งาน อายุวัฒนมงคล 60 ปี พระมงคลกิจโกศล รองเจ้าคณะจังหวัดชัยนาท เจ้าอาวาสวันเทพหิรัณย์ อ.หันคา จ.ชัยนาท ณ วัดเทพหิรัณย์ (หนองทาระภู) อ.หันคา จ.ชัยนาท วันที่ 28 มกราคม 2567 กลางคืนชมลิเก พรเทพพรทวี
- งานบำเพ็ญกุศล เนื่องในพิธีพระราชทานเพลิงศพ พระครูโกศลชัยการ อดีตเจ้าอาวาส วัดหลวงสิริบรูณาราม ????ณ วัดหลวงสิริบรูณาราม สรรพยา ชัยนาท ????️วันที่ 28 มกราคม 2567 กลางคืนชมลิเก วาวกังวาน
- ลิเกงานแก้บน ณ พีนัดดาฟาร์ม บ้านหนองกระทุ่ม ต.อู่ตะเภา อ.มโนรมย์ จ.ชัยนาท วันที่ 29 มกราคม 2567 กลางคืนชมลิเก โย่งไชโย
- งาน บวงสรวงดวงวิญญาณขุนสรรค์ครั้งที่ 42 ประจำปี 2567 และงานเล่าขานตำนานเมืองแพรก ระหว่างวันที่ 18-21 มกราคม 2567 ณ สนามหน้าที่ว่าการอำเภอสรรคบุรี จ.ชัยนาท วันที่ 18 ม.ค. ชมโขนจาก วิทยาลัยนาฏศิลป์สุพรรณบุรี วันที่ 19 ม.ค. ชมลิเกคณะ กุ้งสุธิราชวงศ์เทวัญ
- งานประจำปี ปิดทองรูปหล่อ หลวงพ่อพุทธเศรษฐี หลวงปู่ศุข หลวงปู่จำปา และงานวันคล้ายวันมรณภาพหลวงปู่จำปา ฐิตธมฺโม ครบรอบ 34ปี ณ วัดวังน้ำขาว ต.วังตะเคียน อ.หนองมะโมงจ.ชัยนาท ระหว่างวันที่ 20 - 21 มกราคม 2567
- พิธีวางศิลาฤกษ์ วิหารหลวงพ่อรอด ณ วัดสุขเดือนห้า อ.เนินขาม จ.ชัยนาท วันที่ 13 - 17 ม.ค. 67
- งานประจำปีปิดทอง ครบรอบวันมรณภาพ 32 ปี หลวงปู่เล็ก อินทสะระ ระหว่างวันที่ 11-12 มกราคม 2567 ณ วัดบ้านหนอง ต.ตลุก อ.สรรพยา จ.ชัยนาท
- งานครบรอบวันมรณภาพ หลวงปู่ผาด ฐิติปัญโญ ระหว่างวันที่ 4-5 มกราคม 2567
- งานประจำปีปิดทองหลวงพ่อขาว ณ วัดศรีเจริญธรรม อ.หันคา จ.ชัยนาท ระหว่างวันที่ 1-2 ม.ค. 67
- งานผูกพัทธสีมาปิดทองฝังลูกนิมิต บุญใหญ่ ส่งท้ายปีเก่า ต้อนรับปีใหม่ ณ วัดห้วยซุง หันคา ชัยนาท ระหว่างวันที่ 29 ธ.ค.66 - 6 ม.ค. 67
- งานผูกพัทธสีมาปิดทองฝังลูกนิมิต บุญใหญ่ ส่งท้ายปีเก่า ต้อนรับปีใหม่ ณ วัดป่าสุปฏิปันโน อ.เนินขาม จ.ชัยนาท ระหว่างวันที่ 28 ธ.ค.66 - 5 ม.ค. 67
- งานผูกพัทธสีมาปิดทองฝังลูกนิมิต บุญใหญ่ ส่งท้ายปีเก่า ต้อนรับปีใหม่ ณ วัดชัฎฝาง หนองแซง หันคา ชัยนาท ระหว่างวันที่ 28 ธ.ค.66 - 3 ม.ค. 67
- งานผูกพัทธสีมาปิดทองฝังลูกนิมิต บุญใหญ่ ส่งท้ายปีเก่า ต้อนรับปีใหม่ ณ วัดทุ่งโพธ์ ต.กะบกเตี้ย อ.เนินขาม จ.ชัยนาท ระหว่างวันที่ 27 ธ.ค.66 - 4 ม.ค. 67
- งานผูกพัทธสีมาปิดทองฝังลูกนิมิต บุญใหญ่ ส่งท้ายปีเก่า ต้อนรับปีใหม่ ณ วัดใหม่ศรีสุทธาวาส อ.พยุหะคีรี จ.นครสวรรค์ ระหว่างวันที่ 25 ธ.ค.66 - 3 ม.ค. 67
กุมภาพันธ์นี้!!! สุขทันที ที่เที่ยวอุ้มผาง ตั้งแต่วันที่ 1 กุมภาพันธ์ - 31 มีนาคม 2567 LINK
ททท.สำนักงานตาก x ชมรมส่งเสริมการท่องเที่ยวอุ้มผาง เพียงซื้อแพ็กเกจท่องเที่ยว อ.อุ้มผาง ที่ท่านสนใจจะไปท่องเที่ยว รับไปเลย!!! "หมวกบักเก็ต Amazing Thailand" ระยะเวลากิจกรรม ตั้งแต่วันที่ 1 กุมภาพันธ์ - 31 มีนาคม 2567 ✅เช็ครายชื่อผู้ประกอบการที่ร่วมโครงการ ✅ ซื้อแพ็กเกจท่องเที่ยว“น้ำตกทีลอซู”หรือ แพ็กเกจอื่นๆ ✅ รับหมวกบักเก็ต Amazing Thailand แบบพับได้ไปเลย!! (1 คน/1 สิทธิ์) ✅สามารถเข้าไปรับของที่ระลึกได้ ณ โรงแรมที่พัก ที่ท่านเข้าพักในวันเช็คอิน เดินทางท่องเที่ยวก่อนมีสิทธิ์ก่อน ‼️ ของมีจำนวนจำกัดน้าา ติดต่อสอบถามเพิ่มเติม โทร. 055-514-341 หรือทาง
inbox เพจ ททท.สำนักงานตากคำแนะนำการบริการ
คำแนะนำการบริการ
ไม่แนะนำกรณีเป็นสุนัขที่มีหน้าสั้น หรือสัตว์ที่อายุมากกว่า 6 ปี เนื่องจากที่ศูนย์ฯใช้การวางยาแบบฉีดยามิใช่แบบดมยา
ขั้นตอนการรับบริการ
- ลงทะเบียนผ่านระบบอิเล็คทรอนิกส์/หรือผ่านแบบลงทะเบียนที่งานสัตวแพทย์ หรือหน่วยบริการเทศบาลฯเคลื่อนที่
- เจ้าหน้าที่จะดำเนินการนัดวันและเวลาให้บริการทางโทรศัพท์ หรือ e-mail ตามที่ได้ระบุไว้ในข้อมูลการลงทะเบียน ท่านต้องนำสัตว์มาตามวันและเวลานัดหมายเท่านั้น
- ก่อนวันรับบริการเจ้าของต้องดำเนินการดังนี้
3.1 ตรวจสุขภาพสัตว์เลี้ยง ที่สถานพยาบาลสุขภาพสัตว์เลี้ยงเทศบาลนครเชียงใหม่ หรือตามสถานพยาบาลสัตว์เอกชน การตรวจเลือดก่อนผ่าตัดจะลดความเสี่ยงในการสูญเสียขณะวางยา(สามารถติดต่อตรวจเลือดได้ในสถานพยาบาลเอกชน หรือที่ศูนย์สุขภาพสัตว์) โดยผลเลือดต้องนำมา ณ วันผ่าตัด
3.2 "อดน้ำและอาหารก่อนทำหมันอย่างเคร่งครัด อย่างน้อย 12 ชั่วโมง" ก่อนมารับบริการ
- วันรับบริการเจ้าของสัตว์ต้องปฏิบัติดังนี้
4.1 นำเอกสารรับรองการฉีดวัคซ๊น การตรวจตรวจสุขภาพก่อนผ่าตัด มาแสดงต่อเจ้าหน้าที่(ถ้ามี)
4.2 แสดงบัตรประจำตัวประชาชนตามที่ลงทะเบียนไว้ หากไม่สามารถนำสัตว์มารับบริการได้ด้วยตนเองต้องมีใบมอบฉันทะ พร้อมแนบสำเนาบัตรประจำตัวประชาชนของผู้ลงทะเบียน
4.3 เจ้าของต้องดำเนินการจับบังคับสัตว์
4.3.1 สุนัขต้องใส่สายจูง หรือกรง หรืออุปกรณ์ที่เจ้าของสามารถจับบังคับได้
4.3.2 แมวต้องใส่กรง หรือตระกร้า
4.4 เจ้าของต้องอยู่รอจนกว่าสัตว์จะพื้นสลบ ห้ามทิ้งสัตว์ไว้ ณ สถานที่รับบริการ
4.5 เจ้าของสัตว์ต้องลงรายมือชื่อ และกรอกรายละเอียดในแบบอนุญาตวางยาสลบและทำศัลยกรรม
4.6 เจ้าของต้องปฎิบัติตามที่นายสัตวแพทย์ หรือเจ้าหน้าที่ของงานสัตวแพทย์อย่างเคร่งครัด
หมายเหตุ เมื่อสัตว์มีปัญหาหลังผ่าตัด กรุณางานสัตวแพทย์ เพื่อดำเนินการเก็บข้อมูลเพื่อนำไปพัฒนาการให้บริการต่อไป
งานสัตวแพทย์ สำนักการสาธารณสุขและสิ่งแวดล้อม เทศบาลนครเชียงใหม่ โทร 053-259136
ดนตรีในสวนกรุงเทพมหานคร มีนาคม 2567
กรุงเทพมหานคร เชิญชวนไปชมดนตรีในสวน ตลอดเดือนมีนาคม
เสาร์ที่ 2 มีนาคม 2567
- สวนวชิรเบญจทัศ เริ่ม 16:30 น.เชิญไปสนุกสนานกับดนตรีไทยร่วมสมัยและการแสดงนาฏศิลป์ วงคอนเทมกรุงเทพมหานคร
อาทิตย์ที่ 3 มีนาคม 2567
- สวนวชิรเบญจทัศ เริ่ม 16:30 น. พบกับความชิลล์ของการบรรเลงบทเพลงไพเราะมากมายร่วมนักร้องสายละครเวทีจากเวทีศาลาเฉลิมกรุง วง Bangkok String Ensemble feat. กองปราบ ปณิธาน
- สวนปทุมวนานุรักษ์ เริ่ม 16:30 น. พบกับวงดนตรี 3 ชิ้น กับแนวเพลงสบายๆ พร้อมนักร้องคุณภาพ วง Bangkok Trio
- สวนลุมพินี (ลานสวนปาล์ม) เริ่ม 17:30 น. เทศกาลดนตรีในสวน วง Royal Bangkok Symphony Orchestra มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้าฯ
เสาร์ที่ 9 มีนาคม 2567
- สวนเบญจกิติ เริ่ม 17.00 น. ไปชม ไปเชียร์น้องๆเยาวชนนักดนตรีจากโรงเรียนนานาชาตินิสต์ที่จะมามอบความสุนกสนานพร้อมกัน 4 วง - No name band - Rockster - Childhood Trauma - Electrolytes
อาทิตย์ที่ 10 มีนาคม 2567
- อุทยานเบญจสิริ เริ่ม 16.30 น. ไปมันส์กันกับการแสดงดนตรีพร้อมนาฏศิลป์จากอีสาน วงโปงลาง กรุงเทพมหานคร
- สวนปทุวนานุรักษ์ เริ่ม 17.00 น. พบกับการบรรเลงสุดไพเราะและสนุกสนานจาก วง Bangkok Brass Quintet
- สวนลุมพินี (ลานสวนปาล์ม ) เริ่ม 17.30 น. พบกับการแสดงจาก วง Royal Bangkok Symphony Orchestra
เสาร์ที่ 16 มีนาคม 2567
- สวนเบญจกิติ เวลา 17.00 น. ศิลปินอิสระ ที่เดินทางมาจากจังหวัดชลบุรี เพื่อมาร่วมแสดงดนตรีในสวนโดยเฉพาะ กับชาวคณะ JERGUNTEE
อาทิตย์ที่ 17 มีนาคม 2567
- อุทยานเบญจสิริ 16.30 น. Let’s Jazz in the Park กับวงดนตรีและนักร้องมากความสามารถ วง BKK JAZZ GROUP
- สวนปทุวนานุรักษ์ 17.00 น.ไปร่วมสมัยกับการผสมผสานของดนตรีไทยและสากล วงคอนเทม กรุงเทพมหานคร
- สวนเบญจกิติ 17.30 น. วง RAINYROOM กับศิลปินวัยมันสสสส์ ที่มาพร้อมกับความสามารทางดนตรีอันล้นเหลือ
เสาร์ที่ 23 มีนาคม 2567
- สวนเบญจกิติ พบกับการบรรเลงของวงออร์เคสตร้าในบรรยากาศสวนสวย บนเวทีริมบึงใจกลางเมืองหลวงของเรา วง Bangkok Metropolitan Orchestra Conductor : สรพจน์ วรแสง ศิลปิน : พัทธนันท์ อาจองค์ วิภาวี วงษ์ดี Violin : พงศ์สิต การย์เกรียงไกร Cello : ธีรเกียรติ เกิดลาภ เริ่ม 17.00 น.
- สวนลุมพินี เชิญไปชมดนตรีในสไตล์ Swing Jazz และชวนมาเต้น Swing Dance บน floor พื้นหญ้า ในกิจกรรมดนตรีในสวน : Swing Danceโดยนักศึกษาจากคณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร เริ่ม 17.00 น.
อาทิตย์ที่ 24 มีนาคม 2567
- สวนปทุมวนานุรักษ์ เชิญไปชิลล์กับแนวดนตรีฟังสบายๆ วง Bangkok Trio เริ่ม 16.30 น.
- สวนเบญจกิติ พบกับ วง Painkiller เริ่ม 17.00 น.
พฤหัสบดีที่ 28 มีนาคม 2567
- สวนเบญจกิติ เชิญชวนไปเพลิดเพลินเสียงเพลงอันไพเราะ กับบรรยากาศสวนสวย "ดนตรีในสวน" เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ครั้งที่ 1 โดยนักร้อง นักดนตรีจากวงดนตรีกรมประชาสัมพันธ์ และศิลปินจาก The Golden Song แอ็ค โชคชัย, พลอย ทิพย์ปริญา เริ่ม 17:00 น.
เสาร์ที่ 30 มีนาคม 2567
- สวนเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิม พระชนมพรรษา 7 รอบ เขตบางบอน พบกับการบรรเลงสุดชิลล์ โดย วงดนตรีกรุงเทพมหานคร เริ่ม 16:30 น.
- สวนเบญจกิติ พบกับวงดนตรีเยาวชนที่มีผลงานการแสดงทั้งในไทยและต่างประเทศมากมาย ในแบบฉบับการผสมผสานระหว่างดนตรีไทยและสากล ได้อย่างลงตัว วงมรดกใหม่ผลิใบ Bigband เริ่ม 17:00 น.
อาทิตย์ที่ 31 มีนาคม 2567
- สวนเทียนทะเลพัฒนาพฤกษาภิรมย์ วงดนตรีกรุงเทพมหานคร เริ่ม 16:30 น.
- สวนเบญจกิติ "Cappy Lofi in the Garden" พี่โป้ โยคี เพลย์บอย (Poe Yokee Playboy) วง Bangkok String Quartet กรุงเทพมหานคร และวง Tuesday Brass จากวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล เริ่ม 17:00 น.
- สวนปทุมวนานุรักษ์ วง Bangkok Woodwind Quintet เริ่ม 17:00 น.
- สวนหลวงพระราม 8 วง Eddiewalkingman & Fin Music School เริ่ม 17:00 น.
ลักษณะอาการ โรคลมแดด (Heat Stroke)
เดือนมีนาคม โปรแกรมทำหมันฟรี
โปรแกรมทำหมันฟรี เดือนมีนาคม
- วันอาทิตย์ ที่ 17 องค์การบริหารส่วนตำบลหาดพันไกร
- วันจันทร์ ที่ 18 หน่วยทำหมัน LOVE DOG บ้านถั่วเขียวถั่วคั่ว
- วันอังคาร ที่ 19 ศูนย์พัฒนาเด็กเล็กบ้านทับโตนด นาทุ่ง
- วันพุธ,พฤหัส ที่ 20-21 อาคารอเนกประสงค์ ท่ายาง หมู่ 10
พิพิธภัณฑ์ลูกหลานพันธุ์มังกร จังหวัดสุพรรณบุรี LINK
พิพิธภัณฑ์ลูกหลานพันธุ์มังกร จังหวัดสุพรรณบุรี จัดแสดงเรื่องราวประวัติศาสตร์จีน ตั้งแต่ลำดับราชวงศ์สมัยหวงตี้ถึงราชวงศ์ชิงซึ่งเป็นราชวงศ์สุดท้าย สมัยเปลี่ยนแปลงการปกครอง และการแสดงประวัติความเป็นมาของพี่น้องชาวไทยเชื้อสายจีนในประเทศไทย นำเสนอในรูปแบบสื่อจัดแสดงที่ทันสมัย แสงสีเสียงหุ่นจำลองห้องฉายภาพยนตร์มีครบ มีวิทยากรบรรยายเวลาในการเข้าชม นอกจากนี้ มีสิ่งอำนวยความสะดวกต่าง ๆ เช่น ห้องรับฝากของ จำหน่ายหนังสือ และห้องจำหน่ายของที่ระลึก
เปิดวันพุธ-วันศุกร์ และวันนักขัตฤกษ์ เวลา 10.00-16.00 น. และวันเสาร์-วันอาทิตย์ เวลา 09.00-16.20 น. (ปิดวันจันทร์-วันอังคาร) รอบเข้าชมนิทรรศการทุก ๆ 30 นาที อัตราค่าเข้าชม 99 บาท สอบถามข้อมูล โทร. 035526212
สิทธิข้าราชการ รักษาต้อกระจก ไม่ต้องจ่ายส่วนต่างเพิ่ม
หมดปัญหาสาย ตาพร่ามัว มองไม่ชัด แสงฟุ้งกระจายเวลาขับรถกลางคืน โดยการผ่าตัด ต้อกระจก ด้วยเทคโนโลยีทันสมัยแผลเล็ก ไม่ต้องพักฟื้น สิทธิข้าราชการ ไม่ต้องจ่ายส่วนต่างเพิ่ม สิทธิการรักษาอื่นๆสามารถสอบถมได้ที่ 063-8722461 063-8728143 043-811757 089-6996393
กำหนดการเดือนมีนาคม 2566
เดือนมีนาคม 2566 กำหนดวันเปิดบริการให้คำปรึกษาออนไลน์ ดังนี้
อังคารที่ 7, 14, 21 และ 28
พุธที่ 1, 8, 15, 22 และ 29
พฤหัสบดีที่ 2, 9, 16, 23 และ 30
วันละ 2 รอบๆ ละ 1 คน
รอบที่ 1 เวลา 13-15 น.
รอบที่ 2 เวลา 15-17 น.
สอบถามโทร. 086-1289299 (9-17 น.)
ขนส่งสุพรรณบุรี ขอเชิญประมูลทะเบียนรถเลขสวย
สำนักงานขนส่งจังหวัดสุพรรณบุรี
ขอเชิญประมูลทะเบียนรถเลขสวย
ผ่านทาง www.tabienrod.com
ตั้งแต่วันนี้ - 17 มิถุนายน 2566 เท่านั้น
เขตดินแดง บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 1-15 มีนาคม 2567
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตดินแดง ร่วมกับศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ประจำปี 2567 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยงในพื้นที่เขตดินแดง ครั้งที่ 1/2567 ระหว่างวันที่ 1 - 15 มีนาคม 2567 เวลา 10.00 - 12.00 น. ประชาชนผู้ที่สนใจทุกท่านนำสุนัขและสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาดังกล่าวได้เลย สอบถามโทร 02-2468546
เขตคลองเตย บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 1-15 มีนาคม 2567
สำนักงานเขตคลองเตย โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุขที่ 41 คลองเตย และศูนย์บริการสาธารณสุขที่ 10 สุขุมวิท จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ครั้งที่ 2 ประจำปี 2567 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ฟรี‼️ไม่มีค่าใช้จ่ายใดๆ
หากท่านใดสนใจสามารถนำสัตว์เลี้ยง น้องหมาน้องแมวที่มีสุขภาพแข็งแรง อายุตั้งแต่ 3 เดือนขึ้นไป ไปรับวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯเคลื่อนที่ใกล้บ้านท่านได้ โดยเริ่มออกหน่วยเคลื่อนที่ฯ ตั้งแต่วันที่ 1 - 29 มีนาคม 2567 เวลา 09.30-12.00 น.
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคลองเตย โทร.02-2495532
เขตหนองจอก ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสัตว์เลี้ยง ฟรี 1-24 มีนาคม 2567
เขตหนองจอก โดย ศูนย์บริการสาธารณสุข 44 ลำผักชี หนองจอก ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 1-14 มีนาคม 2567 เวลา 10.00-12.00 น. ติดต่อสอบถาม ผู้ประสานงานแต่ละจุดตามที่ระบุ
ยะลาเมืองกาแฟ.....Coffee park 2024 วันที่ 1-2-3 มีนาคม 2567
ยะลาเมืองกาแฟ.....Coffee park 2024 กลับมาพบกันอีกครั้ง กาแฟในสวนครั้งที่ 2 ในงานเทศกาลอาหารจานเด็ด วันที่ 1-2-3 มีนาคม 2567 ณ สนามช้างเผือก เทศบาลนครยะลา
The crystal wonder zoo 1-10 มีนาคม 2567
The crystal wonder zoo 1-10 มีนาคม 2567 ลานกิจกรรม ชั้น 1 The Crystal SB ราชพฤกษ์ ในงานจะได้ชม สัตว์แปลกมากมาย Capybara ชมความน่ารักของ "น้องมงคล" คาปิบาร่าน้อย ที่ถูกเดบิวต์มาเพื่อให้ชมความน่ารักแบบใกล้ชิดสุด Exclusive
Mini Pygmy Goats แพะแคระจิ๋ว ตัวเล็กปุ๊กลุก ฉลาดและขี้อ้อน
Rabit Cafe ใกล้ชิดกับน้องกระต่ายปุกปุยสุดน่ารัก
Jerboa เจอร์บัว หนูน้อยตัวจิ๋ว แต่แจ๋ว นักกระโดดสูงสุดแปลก ที่มีหน้าตารูปร่างคล้ายจิงโจ้
Pet Zone รวมสัตว์เลี้ยงน่ารักหลากสายพันธุ์กว่า 20 ชนิด อาทิ เมียร์แคท , หมูแคระ , ไก่ซิลกี้ , นกฮูก White Face
Work shop Mask Animals สำหรับน้องๆหนูๆ เพียงสแกนลงทะเบียน
Balloon ถ่ายรูปน่ารักๆกับบอลลูนสัตว์ยักษ์กว่า 10 ชนิด
กิจกรรมนี้จะจัดโรดชัวร์ไปหลายครั้ง ดังนี้
The Scene 12 -17 มีนาคม 2567
The Crystal Chaiyapruek 23 - 31 มีนาคม 2567
Plearnary 18-24 เมษายน 2567
The Crystal Ekamai-Ramindra 25 เมษายน - 2 พฤษภาคม 2567
Im Park Chula 4 - 12 พฤษภาคม 2567
Sammakorn Place Ratchapruek 18 - 26 พฤษภาคม 2567
Korat 30 CAFE 30 ARTISTS วันที่ 1-31 มีนาคม 2567 งานจัดแสดงศิลปะในร้านกาแฟ! 30 ศิลปินโคราช
Korat 30 CAFE 30 ARTISTS งานจัดแสดงศิลปะในร้านกาแฟ! ของ 30 ศิลปินโคราช ในร้านคาเฟ่ 30 ร้านทั่วอ.เมือง จังหวัดนครราชสีมา ตั้งแต่วันที่ 1-31 มีนาคม 2567 จัดกิจกรรมโดย สมาคมศิลปะ และสื่อสร้างสรรค์โคราช
COFFEE MANIA#6 1-3 มีนาคม 2567 โครงการบ้านโบราณเชียงใหม่


COFFEE MANIA#6 1-3 มีนาคม 2567 เวลา 9.00-19.00 น. ณ โครงการบ้านโบราณเชียงใหม่ งาน COFFEE MANIA นับเป็นกิจกรรมประจำปี ของโครงการบ้านโบราณ ซึ่งจะจัดทุกปี ปีละ 2 ช่วง ช่วงต้นปี และปลายปี และนับเป็นงานที่คอกาแฟทุกท่านรอคอย ซึ่งมุ่งหวัง เพื่อส่งเสริมการท่องเที่ยว สร้างภาพลักษณ์ และสร้างการรับรู้เพื่อมุ่งสู่เชียงใหม่เมืองกาแฟและยังเป็นการสนับสนุนส่งเสริมอุตสาหกรรมกาแฟภาคเหนือให้เติบโตและยั่งยืน เราเดินทางมาถึงครั้งที่ 6 ใน คอนเซปต์ Coffee Journey การเดินทางของกาแฟ ครั้งนี้เราจะพาท่านมาร่วมเดินทางไปพร้อมกับกาแฟ การเดินทางของกาแฟ กว่าจะมาเป็นกาแฟแต่ละแก้วที่เราได้ดื่มกัน ที่มาของกาแฟแต่ละแก้วเป็นยังไงบ้าง ต้องผ่านกระบวนการอะไรบ้าง จากต้นอ่อน นำไปปลูก ก็จะค่อยๆเติบโตจนมีเมล็ดออก ผ่านการบ่ม และหมักเมล็ดกาแฟ นำเมล็ดกาแฟมาสู่การ Process ขบวนการก่อนนำไปคั่ว การสีเปลือก เพื่อคัดแยกเมล็ดกาแฟ ขั้นตอนการคั่วกาแฟ จนเป็นเมล็ดกาแฟส่งออกมาขาย ทั้งหมดนี้รวมเป็นการเดินทางของกาแฟที่เราจะมาค้นหาที่มาต่างๆ ได้ที่งาน Coffee Mania#6 ในครั้งนี้ ร่วมไปกับผู้ประกอบการร้านกาแฟแบรนด์ชั้นนำของจังหวัดเชียงใหม่ มากกว่า 30 ร้านค้า คุณจะได้สัมผัสกลิ่นและรสชาติของกาแฟ รวมไปถึงเบเกอรี่ และอาหาร ที่จะมาร่วมเป็นส่วนหนึ่งของงานในครั้งนี้ ภายในงานเรายังได้เพลิดเพลินกับ กิจกรรม Workshop การคั่ว การดริป และความรู้เกี่ยวกับการเดินทางของกาแฟ ตลอดทั้ง 3 วัน จาก Onetwothreecoffeefarm ดอยแม่มอญ จังหวัดเชียงราย งานนี้ อยากชวนคอกาแฟมาอัพเดทเทรนด์ใหม่ๆ ที่อาจจะตอบโจทย์ที่คุณหาคำตอบอยู่ หรืออาจช่วยสร้าง Inspiration หรืออาจจะเป็นโอกาสที่จะก้าวเข้าสู่ธุรกิจกาแฟสำหรับ Cafe Hopper, นักธุรกิจ หรือผู้ที่สนใจอยากเปิดธุรกิจกาแฟ บอกเลยว่างานนี้ พลาดไม่ได้!!!
ปิดทองฝังลูกนิมิต จันทบุรี ปี 2566
ปิดทองฝังลูกนิมิต จันทบุรี ปี 2566 รับอานิสงส์ผลบุญที่ยิ่งใหญ่ ต้อนรับปีกระต่ายทอง
อ.เมืองจันทบุรี
วัดเนินโพธิ์ ต.หนองบัว อ.เมือง จ.จันทบุรี
วันที่ 20-29 ม.ค.66
วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต ร่วมพิธีเวลา 17.00 น.
วัดพลับพลา ต.พลับพลา อ.เมือง จ.จันทบุรี
วันที่ 19-27 ม.ค.66
วันที่ 27 ม.ค.66 ตัดหวายลูกนิมิต
อ.ท่าใหม่
วัดตะพง ต.เขาแก้ว อ.ท่าใหม่ จ.จันทบุรี
วันที่ 20-29 ม.ค.66
วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
อ.ขลุง
วัดกมลธรรมาราม (ทุ่งเสาธง) ต.ซึ้ง อ.ขลุง จ.จันทบุรี
วันที่ 20-29 ม.ค.66
วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
อ.แหลมสิงห์
วัดเขาแหลมสิงห์ อ.แหลมสิงห์ จ.จันทบุรี
วันที่ 20-29 ม.ค.66
วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
.
อ.สอยดาว
วัดโพธิ์ศรี ต.ทุ่งขนาน อ.สอยดาว จ.จันทบุรี
วันที่ 20-29 ม.ค.66
วันที่ 29ม.ค.66 ตัดหวายลูกนิมิต
2 มีนาคม 2566 ออกหน่วยรับบริจาคดวงตา อวัยวะ ณ ม.เทคโนโลยีราชมงคลสุวรรณภูมิ วาสุกรี
จิบกาแฟแลวัง ครั้งที่ 3 เสาร์ อาทิตย์ 2-3 มีค 67
จิบกาแฟแลวัง ครั้งที่ 3 เสาร์ อาทิตย์ 2-3 มีค 67 เวลา 10.00 - 21.00 น. ณ พระราชวังจันทน์ พิษณุโลก งานกาแฟที่มีมากกว่าเรื่องกาแฟ จัดโดย อบจ.พิษณุโลก
ชุมพรไบค์วีค 3 - 4 มีนาคม 2566
ชุมพรไบค์วีค ครั้งที่ 11 วันที่ 3 - 4 มีนาคม 2566
มหกรรมมะม่วงแปดริ้ว ครั้งที่ 18 วันที่ 3 – 12 มีนาคม 66 ศูนย์การค้าแฟชั่นไอส์แลนด์
สำนักงานเกษตรจังหวัดฉะเชิงเทรา นำโดยนายดนัย ปัญจพิทยากุล เกษตรจังหวัดฉะเชิงเทรา พร้อมด้วยเจ้าหน้าที่สำนักงานเกษตรจังหวัดฉะเชิงเทรา เข้าร่วมพิธีเปิดงาน “มหกรรมมะม่วงแปดริ้ว ครั้งที่ 18” โดยมีนายขจรเกียรติ รักพานิชมณี ผู้ว่าราชการจังหวัดฉะเชิงเทรา เป็นประธาน พร้อมด้วยหัวหน้าส่วนราชการในสังกัดกระทรวงเกษตรและสหกรณ์ ผู้ช่วยกรรมการผู้จัดการ ศูนย์การค้าแฟชั่นไอส์แลนด์ ผู้แทนชมรมชาวสวนมะม่วงจังหวัดฉะเชิงเทรา จำกัด ผู้แทนวิสาหกิจชุมชนผู้ผลิตมะม่วงส่งออกจังหวัดฉะเชิงเทรา และแขกผู้มีเกียรติเข้าร่วมพิธีเปิดงาน ณ ลานกิจกรรมด้านหน้า Food Island ชั้น 3 ศูนย์การค้าแฟชั่นไอส์แลนด์ แขวงคันนายาว เขตคันนายาว กรุงเทพมหานคร โดยงาน “มหกรรมมะม่วงแปดริ้ว ครั้งที่ 18” กำหนดจัดขึ้นระหว่างวันที่ 3 – 12 มีนาคม 2566 ณ ศูนย์การค้าแฟชั่นไอส์แลนด์ เพื่อส่งเสริมและสนับสนุนให้เกษตรกรชาวสวนได้จำหน่ายผลผลิตมะม่วงและผลิตภัณฑ์แปรรูปแก่ผู้บริโภคโดยตรง ซึ่งมีเกษตรกรร่วมจำหน่ายสินค้า จำนวน 34 บูธ
พี่วิ่งด้วยใจ ให้น้องด้วยรัก 3 มีนาคม 2567
กิจกรรมวิ่งการกุศลเพื่อสมทบเข้ากองทุนเฉพาะกิจคุ้มครองและช่วยเหลือเด็กนักเรียน สำนักงานเขตพื้นที่การศึกษามัธยมศึกษานครสวรรค์ วันที่ 3 มีนาคม 2567 บริเวณหน้าอาคารแสดงพันธุ์สัตว์น้ำบึงบอระเพ็ด (Aquarium)
กิจกรรมเดินวิ่ง บางกระสั้น รัน ฟอร์ คิส Bangkrasun run for kid วันอาทิตย์ที่ 3 มีนาคม 2567 LINK
กิจกรรมเดินวิ่ง บางกระสั้น รัน ฟอร์ คิส Bangkrasun run for kid วันอาทิตย์ที่ 3 มีนาคม 2567 เดินวิ่ง ได้สุขภาพและทำบุญให้โรงเรียนอีกด้วยครับ โรงเรียนบ้านบางกระสั้น(โรงงานกระดาษอุปถัมภ์) อ.บางปะอิน จ.พระนครศรีอยุธยา จัดกิจกรรมเดินวิ่ง Banbangkrasun Run For Kid บางกระสั้นวิ่งเพื่อน้องนักเรียน ในวันอาทิตย์ที่ 3 มีนาคม 2567 ณ โรงเรียนบ้านบางกระสั้นฯ ประชาสัมพันธ์กิจกรรมเดินวิ่ง Banbangkrasun Run For Kid ให้กับพี่ น้อง นักเดิน วิ่ง ในจังหวัดพระนครศรีอยุธยา หรือจังหวัดใกล้เคียง
ชงโขง Morning Drip หนองคาย งานดริปกาแฟริมโขงในยามเช้า 3 มีนาคม 2567
ชงโขง Morning Drip งานดริปกาแฟริมโขงในยามเช้า จัดโดย ชาว”
หนองคาย Coffee Club” เช้าวันอาทิตย์ที่ 3 มีนาคม 2567 เวลา 6.30 น. เป็นต้นไป บริเวณ เยื้องหน้าวัดศรีบุญเรือง ใกล้กับแลนด์มาร์คพญานาค งานดริปกาแฟเพื่อให้สหายกาแฟ ได้พบปะ พูดคุย แลกเปลี่ยน เรื่องราวของการดริปกาแฟในวิธีต่างๆ แลกเปลี่ยนเรื่องราวของเมล็ดกาแฟในแบบต่างๆ หรือจะเป็นการแลกเปลี่ยนเรื่องราวอื่นๆ ที่สหายกาแฟอยากพูดอยากคุยอยากรู้ ก็สามารถ ถาม ทำ ทดลอง
Banchang Bikeweek 2023 วันที่ 4-5 มีนาคม 2566 LINK
พบกัน Banchang Bikeweek 2023 #1 วันที่ 4-5 มีนาคม 2566 พื้นที่ชายหาดพลา ต.พลา
รายได้หลังหักค่าใช้จ่ายทั้งหมดแล้วนำไปซื้ออุปกรณ์ทางการแพทย์มอบให้กับชุมชนบ้านฉางและหน่วยงานที่เกี่ยวข้อง จัดขบวนรถเปิดงาน 14.30 น. ล้อหมุน 15.00 น.รวมตัวบริเวณหน้าตลาดกลางอำเภอบ้านฉาง (มีสติ๊กเกอร์งานแจกสำหรับผู้ร่วมขบวน) เวทีเริ่ม 16.00 น.
ปั่นกินลม ชมเมืองพัทยา 4 มีนาคม 66
เชิญชวน “ปั่นกินลม ชมเมืองพัทยา” กิจกรรมปั่นจักรยานท่องเที่ยวเพื่อการกุศล มัสยิดดารุ้ลอิบาดะห์ พัทยา จัดกิจกรรมปั่นจักรยานท่องเที่ยวเพื่อการกุศล “ปั่นกินลม ชมเมืองพัทยา” ในวันเสาร์ที่ 4 มี.ค. 2566 เริ่มตั้งแต่เวลา 07.00 น. - 09.00 น. เพื่อส่งเสริมการท่องเที่ยวในเขตเมืองพัทยา ระยะทาง 28 กิโลเมตร จุดเริ่มต้น/สิ้นสุด ที่มัสยิดดารุ้ลอิบาดะห์ (พัทยากลาง) สอบถามรายละเอียดเพิ่มเติม ได้ที่ ฝ่ายกิจกรรมปั่นจักรยาน หมายเลขโทรศัพท์ 089-2520815
เขตดุสิต ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตดุสิต หน่วยเคลื่อนที่ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ตามชุมชนต่างๆ ในพื้นที่เขตดุสิต ระหว่างวันที่ 4-15 มีนาคม 2567 นี้ ใครใกล้ที่ไหน ไปที่นั่น...พาน้องๆ ไปฉีดวัคซีนกันนะ งานนี้จัดให้ฟรีๆ ไปเลยจ้า สอบถามโทร 022435311
เขตทุ่งครุ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4-8 มีนาคม 2567
ศูนย์บริการสาธารณสุข 59 ทุ่งครุ ประชาสัมพันธ์หน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-8 มีนาคม 2567 เวลา 9.00-11.00 น. สอบถามโทร 02-4643057 ต่อ 206
เขตดอนเมือง ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4-15 มีนาคม 2567
สำนักงานเขตดอนเมือง ร่วมกับศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร จัดกิจกรรมออกหน่วยรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1 ประจำปี 2567 ระหว่างวันที่ 4 - 8 และ 11-15 มีนาคม 2567 และเวลา 10.00 - 12.00 น. ฟรี!!!! ไม่มีค่าใช้จ่าย
เพื่อเป็นการป้องกันและควบคุมการแพร่ระบาดของโรคพิษสุนัขบ้า โดยมีกำหนดออกหน่วยรณรงค์ ดังนี้
4 มีนาคม 2567 ชุมชนปิ่นเจริญ 2
5 มีนาคม 2567 ชุมชนบูรพา 18
6 มีนาคม 2567 ชุมชนโกสุมรวมใจ 1
7 มีนาคม 2567 ชุมชนพิพรพงษ์ 1
8 มีนาคม 2567 ชุมชนโกสุมรวมใจ 3
11 มีนาคม 2567 ชุมชนร่วมใจพัฒนา กรป.กลาง
12 มีนาคม 2567 ชุมชนดอนเมืองวิลล่า
13 มีนาคม 2567 ชุมชนหลังวัดไผ่เขียว
14 มีนาคม 2567 ชุมชนศรีดอนเมือง
15 มีนาคม 2567 ชุมชนดาวทอง
เขตฯ จึงขอเชิญชวนประชาชนในพื้นที่ พาสัตว์เลี้ยงที่เป็นสัตว์เลี้ยงลูกด้วยนม เช่น สุนัข แมว กระต่าย กระรอก ฯลฯ ที่มีอายุตั้งแต่ 3 เดือนขึ้นไป และยังไม่เคยได้รับวัคซีนประจำปี มาขอรับวัคซีนได้ฟรี ไม่มีค่าใช้จ่าย ที่หน่วยรณรงค์ฯ ใกล้บ้านท่าน ตามวันและเวลาดังกล่าว สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 02565 9424 ต่อ 5341 ในวันและเวลาราชการ
เขตปทุมวัน ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4-8 มีนาคม 2567
ศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์ ขอเชิญชวนประชาชนนำสัตว์เลี้ยงมารับบริการหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4 – 8 มีนาคม 2567 สอบถามเพิ่มเติมโทร 02-2141057
เขตบางรัก ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4-15 มีนาคม 2567
สำนักงานเขตบางรัก ร่วมกับ ศูนย์บริการสาธารณสุข 23 สี่พระยา และ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้านให้กับน้องหมา-แมว ในพื้นที่เขตบางรัก ระหว่างวันที่ 4-15 มีนาคม 2567 ตั้งแต่เวลา 10.00 - 12.00 น. กำหนดการบริการ ณ จุดต่างๆ ดังนี้
4 มี.ค. 67 ชุมชนศรีเวียง
5 มี.ค. 67 ชุมชนซอยสองพระ
6 มี.ค. 67 ชุมชนตรอกขุนนาวา
7 มี.ค. 67 ชุมชนพระนคเรศ
8 มี.ค. 67 ชุมชนตรอกห้านาย
11 มี.ค. 67 ชุมชนซอยหลังวัดแก้วแจ่มฟ้า
12 มี.ค. 67 ชุมชนสมบูรณปัญญา
13 มี.ค. 67 ชุมชนซอยพิพัฒน์ 2
14 มี.ค. 67 ชุมชนซอยสันติภาพ
15 มี.ค. 67 ชุมชนซอยหลังวัดหัวลำโพง
สอบถามเพิ่มเติม: ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02-2361395 ต่อ 6215
เขตพระนคร บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตพระนคร ร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ จัดหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4 - 15 มีนาคม 2567 (ในวันราชการ) เวลา 10.00 - 12.00 น. ไม่เสียค่าใช้จ่าย
สัตว์เลี้ยงที่เข้ารับวัคซีนจะต้องมีสุขภาพแข็งแรง ไม่ป่วย และมีอายุ 3 เดือนขึ้นไป จึงขอประชาสัมพันธ์เชิญชวนประชาชนนำสัตว์เลี้ยง มาฉีดวัคซีนฯ ตามวัน เวลา และสถานที่ที่กำหนด ตารางออกหน่วยเคลื่อนที่
4 มี.ค. 67 ชุมชนตรอกบ้านพานถม (ฝั่งวัดปรินายก)
5 มี.ค. 67 ชุมชนท่าเตียน
6 มี.ค. 67 ชุมชนตรอกบ้านพานถม (ซอยบ้านหล่อ)
7 มี.ค. 67 ปากคลองตลาด
8 มี.ค. 67 วัดราชประดิษฐสถิตมหาสีมาราม
11 มี.ค. 67 ท่าพระจันทร์
12 มี.ค. 67 วัดมกุฏกษัตริยาราม
13 มี.ค. 67 ชุมชนท่าวัง
14 มี.ค. 67 ชุมชนแพร่งนรา
15 มี.ค. 67 ชุมชนมัสยิดบ้านตึกดิน
สอบถามเพิ่มเติม โทร. 02-2818125 02-2815370 ต่อ 6566 หรือ 02-2818921
เขตวังทองหลาง บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ผู้ที่สนใจอยากพาสัตว์เลี้ยงไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ทางศูนย์บริการสาธารณสุข 15 ลาดพร้าว ได้จัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าประจำปี 2567 วันที่ 4-15 มีนาคม 2567 ณ จุดให้บริการตามภาพ หากมีข้อสงสัยสามารถสอบถามได้ที่ เพจ Facebook ศูนย์บริการสาธารณสุข 15 ลาดพร้าว โทร 02-5418380 02-5140512
เขตสะพานสูง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ประชาสัมพันธ์ฉีดวัคซีนพิษสุนัขบ้า ประจำปีงบประมาณ 2567 ระหว่างวันที่ 4 -15 มีนาคม 2567 เวลา 08:00 - 11:30 น.
เขตราชเทวี ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4-15 มีนาคม 2567
สำนักงานเขตราชเทวี ร่วมกับ ศูนย์บริการสาธารณสุข 2 วัดมักกะสัน ออกหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4 - 18 มีนาคม 2567 เวลา 9.00-11.30 น. จึงขอเชิญชวนประชาชน นำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ‼️ โดยไม่เสียค่าใช้จ่าย ข้อมูลเพิ่มเติม โทร 02-2517735 02-2517736 02-2517737
เขตลาดพร้าว บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ศูนย์บริการสาธารณสุข 15 ลาดพร้าว ได้จัดหน่วยบริการฉีดวัคซีนป้องกันพิษสุนัขบ้าประจำปี 2567 ฟรี 4-15 มีนาคม 2567 ณ จุดต่างๆ ตามกำหนด หากมีข้อสงสัยสามารถสอบถามได้ที่ เพจ Facebook ศูนย์บริการสาธารณสุข 15 ลาดพร้าว โทร 02-5418380 02-9399538 ในวันและเวลาราชการนะคะ
เขตภาษีเจริญ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตภาษีเจริญ ร่วมกับศูนย์บริการสาธารณสุข 47 คลองขวาง และศูนย์บริการสาธารณสุข 62 ตวงรัชฎ์ ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ทุกจุด เวลา 09:00-12:00 น. วันที่และสถานที่ดังนี้
4 มีนาคม 2567 ชุมชนวัดจันทร์ประดิษฐาราม เขต 3 หมู่ 12
5 มีนาคม 2567 ชุมชนริมคลองราชมนตรี ม.10
6 มีนาคม 2567 ชุมชนหลังวัดปากน้ำฝั่งใต้
7 มีนาคม 2567 ชุมชนราชมนตรีร่วมใจ
8 มีนาคม 2567 ชุมชนหลังวัดคูหาสวรรค์
11.มีนาคม 2567 เพชรเกษม 44. เพชรเกษม 40 เพชรเกษม 42 . วัดกำแพงทอง
12 มีนาคม 2567 วัดนิมมานรดี , ม.15 ริมคลอง คานเรือ, แสงหิรัญ
13 มีนาคม 2567 วัดรางบัว, หลังวัดรางบัว , คลองตาแป้น ม.6 ร่วมใจ ม.7 พัฒนา
14 มีนาคม 2567 วัดโคนอน วัดอ่างแก้ว, ม.4 กัลปพฤกษ์ สุภัทรภิบาล
15 มีนาคม 2567 มบ.ดวงทอง 2 , มบ.อินทราวิลล่า มบ.สราญรมย์ , มบ.กิจเจริญ
สัตว์เลี้ยง(สุนัข และแม2) ที่สามารถนำมารับ บริการได้
1.สัตว์เลี้ยงต้องมีสุขภาพดี แข็งแรงไม่เจ็บป่วย
2.อายุของสัตว์เลี้ยง ต้องมีอายุเกิน 2 เดือนขึ้นไป หากฉีดวัดซีนครั้งแรกต้องได้รับการฉีดอีก 1 ครั้งห่างจากเข็มแรก 1 เดือน (เจ้าหน้าที่จะทำการนัดวัน) หลังจากฉีดครบ 2 เข็มให้มาฉีดกระตุ้น ห่างจากเข็มล่าสุด 6 เดือนถึง 1 ปี
3.หลังจากฉีดวัดซีนไปแล้ว งดอาบน้ำให้ลัตว์เลี้ยง เป็นเวลา 7 วัน(อย่าน้อย)
4.นำบัตรประชาชนตัวจริง ของเจ้าของสัตว์เลี้ยงมาด้วย
เขตบางเขน ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4 - 15 มีนาคม 2567
ศุนย์บริการสาธารณสุข 24 บางเขน กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าประจำปี 2567 ระหว่างวันที่ 4 - 15 มีนาคม 2567 กำหนดการดังนี้
4 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนชมรมหมู่บ้านพหลโยธิน 48
5 มีนาคม 2567 เวลา 08.00 -12.00น. ชุมชนอยู่รวย
6 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนทิมเรืองเวช
7 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนร่วมพัฒนา 33
8 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนวัดไตรรัตนาราม
11 มีนาคม 2567 เวลา 08.00 -12.00น. ชุมชนหมู่บ้านปั้นทอง
12 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนร่วมใจพัฒนาใต้
13 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนหมู่บ้านเก้าแสนสอง
14 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนลำชะล่า (โคกบ่าวสาว)
15 มีนาคม 2567 เวลา 08.00 - 12.00น. ชุมชนหมู่บ้าน เฉลิมอุขนิเวศน์
สอบถามโทร 02-5791342 ต่อ 30 นำบัตรประชาชนเจ้าของสัตว์เลี้ยงมาด้วยนะ
เขตคันนายาว บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยง ฟรี 4-15 มีนาคม 2567
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว ร่วมกับ ศูนย์บริการสาธารณสุข 69 คันนายาว สำนักอนามัย ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยง ให้บริการฟรี (free) วันที่ 4-8 และ 11-15 มีนาคม 2567
4 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชนหมู่บ้านแสงอรุณ
5 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชน สน. คันนายาว
6 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชน สน. บางชัน
7 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชนหมู่บ้านชื่นกมลนิเวศน์ 5
8 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชนซอยประสิทธิชัย
11 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชนอมรพันธ์ 135
12 มี.ค. 67 เวลา 09.00 -12.00 น. ชุมชนหมู่บ้านอมรพันธ์นคร เสรีไทย
13 มี.ค. 67 เวลา 09.00 -12.00 น. ชุมชนหมู่บ้านอมรพันธ์นคร สวนสยาม
14 มี.ค. 67 เวลา 09.00 -12.00 น. ชุมชนหมู่บ้านเฉลิมสุขนิเวศน์ 11
15 มี.ค. 67 เวลา 09.00 - 12.00 น. ชุมชนหมู่ 3 ร่วมใจพัฒนา
สอบถามข้อมูลเพิ่มเติม
▫️ ศูนย์บริการสาธารณสุข 69 คันนายาว โทร 02-3798911 02-3798912
▫️ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว โทร 02-3799945
เขตคลองสาน บริการฉีดวัคซีนพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตคลองสาน ร่วมศูนย์บริการสาธารณสุข 28 กรุงธนบุรีเชิญชวนทุกท่านนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนพิษสุนัขบ้า ฟรี!!! ระหว่างวันที่ 4-15 มีนาคม 2567 นี้ ณ จุดให้บริการสถานที่ ตามที่ระบุในภาพ สอบถามเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เขตคลองสาน โทร 028631664
เขตวัฒนา ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง(สุนัขและแมว) 4-15 มีนาคม 2567
เขตวัฒนา ประชาสัมพันธ์เชิญชวนทุกท่านนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า(ฟรี) โดยทางฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 21(วัดธาตุทอง) กำหนดการออกหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง(สุนัขและแมว) ประจำปี 2567 ระหว่างวันที่ 4-15 มีนาคม 2567 เวลา 10.00-12.00 น.ตามกำหนดการ สอบถามโทรติดต่อผู้ประสานงานแต่ละจุดตามระบุในภาพ
เขตตลิ่งชัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตตลิ่งชัน โดยสำนักงานเขตตลิ่งชัน ร่วมกับศูนย์บริการสาธารณสุข 49 วัดชัยพฤกษมาลา จัดหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ฟรี ประจำปี 2567 ระหว่างวันที่ 4-15 มีนาคม 2567 ณ จุดต่างๆตามกำหนด ทุกจุดบริการเวลา 9.00-11.30 น. สอบถามเพิ่มเติมโทร 02-4241561 ฝ่ายสิ่งแวดล้อมฯ เขตตลิ่งชัน
เขตสายไหม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตสายไหม ร่วมกับ ศูนย์บริการสาธารณสุข 61 ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง เชิญชวนชาวสายไหม เจ้าของสัตว์เลี้ยง นำสุนัขและแมว มาฉีดวัคซีน ตามวันเวลา และสถานที่ที่แจ้งในรูปด้านล่าง เพียงนำบัตรประชาชนเจ้าของสัตว์เลี้ยงมายื่น สามารถรับบริการฉีดวัคซีนได้ ฟรี ไม่มีค่าใช้จ่ายใดใด ระหว่างวันที่ 4-15 มีนาคม 2567 ทุกจุดให้บริการเวลา 10.00-12.00 น. ณ จุดให้บริการตามที่กำหนดไว้ สอบถามเพิ่มเติม โทร. 02-1587366 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสายไหม
เขตคลองสามวา ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตคลองสามวา ร่วมกับศูนย์บริการสาธารณสุข 64 แจ้งกำหนดการออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ปี2567 ระหว่างวันที่ 4 - 8 และ 11 - 15 มีนาคม 2567 เวลา 09.00 น.-11.30 น. รณรงค์ 10 วัน วันละ 1 แห่ง รวม 10 แห่ง แจ้งผู้ที่จะนำสัตว์เลี้ยงเข้ารับบริการทุกท่าน ให้นำบัตรประชาชนหรือเอกสารที่แสดงเลขบัตรประชน 13 หลัก เพื่อลงทะเบียนเข้ารับบริการ สอบถามเพิ่มเติม โทร 02-5480495 ต่อ 22
เขตบางกะปิ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตบางกะปิ โดยศูนย์บริการสาธารณสุข35 หัวหมาก ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า เคลื่อนที่ในชุมชน วัคซีนป้องกันโรคพิษสุนัขบ้า ประจำเดือนมีนาคม ระหว่างวันที่ 4-15 มีนาคม 2567 เวลา 08.30 - 11.30 น. ณ ชุมชนต่างๆ ตามกำหนดการ ขอเชิญชวนท่านใดที่มีสัตว์เลี้ยง เช่น สุนัข แมว หนู กระต่าย สามารถมารับบริการได้ตามสถานที่วันเวลาที่ออกหน่วย ดังกล่าว หรือใกล้บ้านของท่าน
เขตสัมพันธวงศ์ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ประชาสัมพันธ์จากเขตสัมพันธวงศ์ ศูนย์บริการสาธารณสุข 13 ไมตรีวานิช ระหว่างวันที่ 4-15 มีนาคม 2567 เวลา 9.00 - 11.00 น. เจ้าของสัตว์เลี้ยงนำบัตรประชาชนมาแสดงด้วยนะ สอบถามโทร 02-2227875
เขตจอมทอง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตจอมทอง และศูนย์บริการสาธารณสุข 29 (ช่วง นุชเนตร) สำนักอนามัย ร่วมจัดกิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในพื้นที่กรุงเทพมหานคร เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัข แมวและสัตว์เลี้ยงลูกด้วยนมอื่นๆ ระหว่างวันที่ 4 - 15 มีนาคม 2567 ยกเว้นวันหยุดราชการ ตั้งแต่เวลา 10.00 - 12.00 น. ประชาชนที่สนใจสามารถสอบถามรายละเอียดเพิ่มเติม โทร ฝ่ายสิ่งแวดล้อมฯเขตจอมทอง 02-4276671 ศูนย์บริการสาธารณสุข 29 (ช่วง นุชเนตร) 02-4766493
เขตสาทร ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
สำนักงานเขตสาทร กำหนดให้บริการฉีดวัคซีนพิษสุนัขบ้า ในชุมชน พื้นที่เขตสาทรตั้งแต่วันที่ 4-15 มีนาคม 2567 เวลา 9.00-12.00 น. โดยไม่มีค่าใช้จ่ายใดๆ ทั้งสิ้น สอบถามโทร 095-8328220 กลุ่มงานป้องกันและควบคุมโรค ฝ่ายสิ่งแวดล้อมฯเขตสาทร
เขตบางบอน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ร่วมกับ สำนักงานเขตบางบอน ให้บริการออกหน่วยฉีดวัคซีนป้องกันพิษสุนัขบ้าในสัตว์เลี้ยง ฟรี ในวันที่ 4-15 มีนาคม 2567 เวลา 10.00 - 12.00 น. ตามวันและสถานที่ดังนี้
4 มี.ค. ชุมชนหมู่บ้านรางไผ่
5 มี.ค. ชุมชนกำนันแม้น 13
6 มี.ค. หมู่บ้านภาสกร 1
7 มี.ค. หมู่บ้านบางบอนวิลล่า
8 มี.ค. หมู่บ้านเอสเค ซอยเอกชัย 76
11 มี.ค. หมู่บ้านดีเค
12 มี.ค. โครงการเคหะบางบอน
13 มี.ค. หมู่บ้านทองภูมิวิลล่า
14 มี.ค. บจก.ทีโอ อุตสาหกรรมเครื่องชั่ง / ศาลเจ้าซอยเอกชัย 56
15 มี.ค. สมฤทัยคอนโดมิเนียม
สอบถามโทร ฝ่ายสิ่งแวดล้อมฯ เขตบางบอน 02-4503272 ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน 02-4530526
เขตพญาไท ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตพญาไท ประชาสัมพันธ์ เชิญชวนประชาชนนำสุนัขมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าโดยหน่วยสัตวแพทย์เคลื่อนที่ ฉีดฟรี ระหว่างวันที่ 4-15 มีนาคม 2567 เริ่มตั้งแต่เวลา 09.00 -12.00 น. ตามวันและสถานที่ที่กำหนด สอบถามโทร 02-2794141 (ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพญาไท )
เขตพระโขนง บริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4 - 15 มีนาคม 2567
สำนักงานเขตพระโขนง ร่วมกับ ศูนย์บริการสาธารณสุข 34 โพธิ์ศรี จัดกิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า เพื่อเสริมสร้างภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยงในพื้นที่เขตพระโขนง ประจำปี 2567 โดยได้กำหนดให้มีการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าระหว่างวันที่ 4 - 15 มีนาคม 2567 ตั้งเเต่เวลา 09.00-11.00 น. ติดต่อสอบถามฝ่ายสิ่งเเวดล้อมและสุขาภิบาล สำนักงานเขตพระโขนง โทร 02-3113538
สุนัขและแมวควรได้รับวัคซีนครั้งแรกเมื่ออายุ 2 เดือน หลังจากได้รับวัคซีนประมาณ 3 - 4 สัปดาห์ ร่างกายจะเริ่มสร้างภูมิคุ้มกัน เพราะการฉีดวัคซีนเหมือนเป็นตัวช่วยในการป้องกันโรคพิษสุนัขบ้า และลดโอกาสการเกิดโรคติดต่ออื่น ๆ ของสุนัขและแมวได้อีกด้วย นอกจากนี้การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมวที่โตแล้วควรได้รับการฉีดวัคซีนปีละ 1 ครั้ง
เขตลาดกระบัง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
เขตลาดกระบัง ร่วมกับศูนย์บริการสาธารณสุข 45 ร่มเกล้า ลาดกระบัง ออกหน่วย ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ระหว่างวันที่ 4-19 มีนาคม 2567 ตามชุมชนที่กำหนด (ทุกจุด ให้บริการเวลา 9.00-12.00 น.) เจ้าของนำบัตรประชาชนไปแสดงด้วยนะ ใครอยู่ใกล้ที่ใดเตรียมตัวได้เลยนะคะ เมื่อพบเห็นหน่วยของเรา สามารถเรียกได้เลยค่ะ เราจะไปให้บริการฉีดวัคซีนสัตว์เลี้ยงท่านถึงที่เลยค่ะ
เขตยานนาวา ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4 - 15 มีนาคม 2567
สำนักงานเขตยานนาวา ร่วมกับ ศูนย์บริการสาธารณสุข เจ็ด บุญมี ปุรุราชรังสรรค์ และ ศบส ห้าสิบห้า เตชะสัมพันธ์ จัดกิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในพื้นที่เขตยานนาวา โดยออกหน่วยเคลื่อนที่ ระหว่างวันที่ 4 - 15 มีนาคม 2567 ตั้งแต่เวลา 09.00 - 12.00 น. ท่านสามารถนำสัตว์เลี้ยงมารับบริการได้ โดยไม่ต้องเสียค่าใช้จ่าย สัตว์เลี้ยงที่สามารถนำมาฉีดวัคซีนได้ เช่น สุนัข แมว กระต่าย โดยสัตว์ต้องมีอายุเฉลี่ย 3 เดือนขึ้นไป สามารถสอบถามข้อมูลเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตยานนาวา โทร 022942397
เขตมีนบุรี รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4- 15 มีนาคม 2567
เขตมีนบุรี ร่วมกับศูนย์บริการสาธารณสุข 43 มีนบุรี หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4- 15 มีนาคม 2567 ผู้ที่จะมารับบริการ โปรดนำบัตรประชาชนมาด้วยและสัตว์เลี้ยงที่มาฉีดวัคซีนป้องกันพิษสุนัขบ้าต้องมีอายุ 3 เดือนขึ้นไป ไม่มีอาการป่วยและไม่ท้อง สอบถามโทร 02-5405615 ต่อ 407
เขตหลักสี่ ออกหน่วยให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตหลักสี่ ออกหน่วยให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!! แก่สัตว์เลี้ยง ระหว่างวันที่ 4-15 มีนาคม 2567 ตั้งแต่เวลา 09.30 - 11.30 น. ดังนี้
????4 มี.ค. ชุมชนเปรมสุขสันต์
????5 มี.ค. ชุมชนมีสุข
????6 มี.ค. ชุมชนยิ้มสยาม
????7 มี.ค. ชุมชนพงษ์เพชรแจ้งวัฒนะ 14
????8 มี.ค. ชุมชนแฟลตตำรวจส่วนกลาง
????11 มี.ค. วัดหลักสี่
????12 มี.ค. หมู่บ้าน กฟภ. นิเวศน์ 1
????13 มี.ค. ชุมชนร่วมพัฒนา
????14 มี.ค. ชุมชนเคหะบางบัว
????15 มี.ค. ชุมชนก้าวหน้า
เจ้าของสัตว์เลี้ยง โปรดนำสัตว์เลี้ยง เช่น หมา หรือ แมว
✅อายุเกิน 3 เดือนขึ้นไป
✅สุขภาพแข็งแรงสมบูรณ์
✅ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
✅ปีนี้ยังไม่ได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าหรือฉีดวัคซีนเกิน 6 เดือนขึ้นไป
เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ตามวันและเวลาข้างต้น
สำคัญ!! นำบัตรประจำตัวประชาชนเจ้าของสัตว์เลี้ยงมาลงทะเบียนเพื่อขอรับบริการ
สอบถามรายละเอียดเพิ่มเติมได้ที่...
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล
โทร. 0 2982 2081ต่อ 7423-4 หรือ
โทร. 0 2982 2090
ในวันและเวลาราชการ
เขตบึงกุ่ม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
ติดต่อสอบถาม โทร 02-3647385
เขตบางขุนเทียน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
เขตลาดกระบัง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตลาดกระบัง ร่วมกับ ศบส.สี่สิบหก กันตารัติอุทิศ หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4-15 มีนาคม 2567 เวลา 9.00-12.00 น.
เขตประเวศ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-15 มีนาคม 2567
เขตประเวศ ร่วมกับ ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ ขอประชาสัมพันธ์ตารางออกหน่วยฉีดวัคซีนพิษสุนัขบ้านอกสถานที่ ประจำปี 2567 ฟรี 4-15 มีนาคม 2567 เวลา 9.00-10.20 และ 10.45-12.00 น. ณ สถานที่ตามระบุ
เขตบางซื่อ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วันที่ 4- 15 มีนาคม 2567
ฝ่ายสิ่งแวดล้อมฯ เขตบางซื่อ ร่วมกับ ศูนย์บริการสาธารณสุข สาม บางซื่อ และศูนย์บริการสาธารณสุข 19 วงศ์สว่าง จัดทำแผนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1 ปี 2567 ระหว่างวันที่ 4- 15 มีนาคม 2567 ฝ่ายสิ่งแวดล้อมฯ เขตบางซื่อ ขอเชิญชวนนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ได้ฟรี ❗️ตามสถานที่ที่กำหนด ข้อควรระวัง ‼️ แมวหรือสุนัขเพศเมีย ต้องไม่อยู่ในระหว่างให้นมลูก โดยสัตว์เลี้ยงต้องมีอายุตั้งแต่ 3 เดือนขึ้นไป
เขตบางคอแหลม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 4-8 มีนาคม 2567
ศูนย์บริการสาธารณสุข12 จันทร์เที่ยง เนตรวิเศษ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 4 - 8 มีนาคม 2567 เวลา 10.00-12.00 น. สอบถาม โทร 02-2917637 02-2917638 ต่อ 20
เขตป้อมปราบศัตรูพ่าย ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
สำนักงานเขตป้อมปราบศัตรูพ่าย เชิญชวน พาน้องหมา น้องแมวว ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี วันที่ 4 - 15 มีนาคมนี้
เขตราษฎร์บูรณะ ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 4 - 15 มีนาคม 2567
เขตราษฎร์บูรณะ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับ(น้องหมา, น้องแมว) ระหว่างวันที่ 4 - 15 มีนาคม 2567 เวลา 09.00 - 12.00 น. สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0-2428-4884 ต่อ 6820
เขตบางนา ฉีดวัคซีนพิษสุนัขบ้า ฟรี 4 – 25 มีนาคม 2567
เขตบางนาจะออกให้บริการหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1/2567 ระหว่างวันที่ 4 – 25 มีนาคม 2567 เวลา 9.00 – 11.00 น. โดยสำนักงานเขตบางนา ร่วมกับศูนย์บริการสาธารณสุข 8 บุญรอด และศูนย์บริการสาธารณสุข 32 มาริษ ตินตมุสิก
???? วันจันทร์ที่ 4 มีนาคม 2567 ณ ชุมชนเคหะบางนา
???? วันพุธที่ 6 มีนาคม 2567 ณ ชุมชนโรงหวาย และ ชุมชนพูนสิน
???? วันพฤหัสบดีที่ 7 มีนาคม 2567 ณ ชุมชนบ้านมุฑิตา
???? วันอาทิตย์ที่ 10 มีนาคม 2567 ณ ชุมชนทองใบ
???? วันพุธที่ 13 มีนาคม 2567 ณ ชุมชนรุ่งเรือง
???? วันจันทร์ที่ 18 มีนาคม 2567 ณ ชุมชนเรวัติ และ ชุมชนโปษยานนท์
???? วันอังคารที่ 19 มีนาคม 2567 ณ ชุมชนอยู่เย็น
???? วันพุธที่ 20 มีนาคม 2567 ณ ชุมชนซีพี
???? วันพฤหัสบดีที่ 21 มีนาคม 2567 ณ ชุมชนทิมเรืองเวช
???? วันจันทร์ที่ 25 มีนาคม 2567 ณ ชุมชนศานติ
จึงขอประชาสัมพันธ์และเชิญชวนประชาชนที่พักอาศัยอยู่ในชุมชนดังกล่าวนำสัตว์เลี้ยง (สุนัขและแมว) มารับบริการได้โดยไม่เสียค่าใช้จ่าย ทั้งนี้ ผู้ขอรับบริการมีข้อปฏิบัติ ดังนี้
- สัตว์เลี้ยงที่จะฉีดวัคซีนต้องมีอายุ 3 เดือนขึ้นไป
- นำบัตรประตัวประชาชนมายื่นกับเจ้าหน้าที่
- นำสมุดประจำตัวสุนัข-แมวมาด้วย (ถ้ามี)
หากมีข้อสงสัยประการใดโปรดสอบถามได้ที่ ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตบางนา หมายเลขโทรศัพท์ 02-173-5270 ต่อ 6065-6
เขตบางนา ฉีดวัคซีนพิษสุนัขบ้า ฟรี 4 – 25 มีนาคม 2567
เขตบางนาจะออกให้บริการหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1/2567 ระหว่างวันที่ 4 – 25 มีนาคม 2567 เวลา 9.00 – 11.00 น. โดยสำนักงานเขตบางนา ร่วมกับศูนย์บริการสาธารณสุข 8 บุญรอด และศูนย์บริการสาธารณสุข 32 มาริษ ตินตมุสิก
???? วันจันทร์ที่ 4 มีนาคม 2567 ณ ชุมชนเคหะบางนา
???? วันพุธที่ 6 มีนาคม 2567 ณ ชุมชนโรงหวาย และ ชุมชนพูนสิน
???? วันพฤหัสบดีที่ 7 มีนาคม 2567 ณ ชุมชนบ้านมุฑิตา
???? วันอาทิตย์ที่ 10 มีนาคม 2567 ณ ชุมชนทองใบ
???? วันพุธที่ 13 มีนาคม 2567 ณ ชุมชนรุ่งเรือง
???? วันจันทร์ที่ 18 มีนาคม 2567 ณ ชุมชนเรวัติ และ ชุมชนโปษยานนท์
???? วันอังคารที่ 19 มีนาคม 2567 ณ ชุมชนอยู่เย็น
???? วันพุธที่ 20 มีนาคม 2567 ณ ชุมชนซีพี
???? วันพฤหัสบดีที่ 21 มีนาคม 2567 ณ ชุมชนทิมเรืองเวช
???? วันจันทร์ที่ 25 มีนาคม 2567 ณ ชุมชนศานติ
จึงขอประชาสัมพันธ์และเชิญชวนประชาชนที่พักอาศัยอยู่ในชุมชนดังกล่าวนำสัตว์เลี้ยง (สุนัขและแมว) มารับบริการได้โดยไม่เสียค่าใช้จ่าย ทั้งนี้ ผู้ขอรับบริการมีข้อปฏิบัติ ดังนี้
- สัตว์เลี้ยงที่จะฉีดวัคซีนต้องมีอายุ 3 เดือนขึ้นไป
- นำบัตรประตัวประชาชนมายื่นกับเจ้าหน้าที่
- นำสมุดประจำตัวสุนัข-แมวมาด้วย (ถ้ามี)
หากมีข้อสงสัยประการใดโปรดสอบถามได้ที่ ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตบางนา หมายเลขโทรศัพท์ 02-173-5270 ต่อ 6065-6
เขตบางนา ฉีดวัคซีนพิษสุนัขบ้า ฟรี 4 – 25 มีนาคม 2567
เขตบางนาจะออกให้บริการหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1/2567 ระหว่างวันที่ 4 – 25 มีนาคม 2567 เวลา 9.00 – 11.00 น. โดยสำนักงานเขตบางนา ร่วมกับศูนย์บริการสาธารณสุข 8 บุญรอด และศูนย์บริการสาธารณสุข 32 มาริษ ตินตมุสิก
???? วันจันทร์ที่ 4 มีนาคม 2567 ณ ชุมชนเคหะบางนา
???? วันพุธที่ 6 มีนาคม 2567 ณ ชุมชนโรงหวาย และ ชุมชนพูนสิน
???? วันพฤหัสบดีที่ 7 มีนาคม 2567 ณ ชุมชนบ้านมุฑิตา
???? วันอาทิตย์ที่ 10 มีนาคม 2567 ณ ชุมชนทองใบ
???? วันพุธที่ 13 มีนาคม 2567 ณ ชุมชนรุ่งเรือง
???? วันจันทร์ที่ 18 มีนาคม 2567 ณ ชุมชนเรวัติ และ ชุมชนโปษยานนท์
???? วันอังคารที่ 19 มีนาคม 2567 ณ ชุมชนอยู่เย็น
???? วันพุธที่ 20 มีนาคม 2567 ณ ชุมชนซีพี
???? วันพฤหัสบดีที่ 21 มีนาคม 2567 ณ ชุมชนทิมเรืองเวช
???? วันจันทร์ที่ 25 มีนาคม 2567 ณ ชุมชนศานติ
จึงขอประชาสัมพันธ์และเชิญชวนประชาชนที่พักอาศัยอยู่ในชุมชนดังกล่าวนำสัตว์เลี้ยง (สุนัขและแมว) มารับบริการได้โดยไม่เสียค่าใช้จ่าย ทั้งนี้ ผู้ขอรับบริการมีข้อปฏิบัติ ดังนี้
- สัตว์เลี้ยงที่จะฉีดวัคซีนต้องมีอายุ 3 เดือนขึ้นไป
- นำบัตรประตัวประชาชนมายื่นกับเจ้าหน้าที่
- นำสมุดประจำตัวสุนัข-แมวมาด้วย (ถ้ามี)
หากมีข้อสงสัยประการใดโปรดสอบถามได้ที่ ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตบางนา หมายเลขโทรศัพท์ 02-173-5270 ต่อ 6065-6
Adventure Dash Series 2022 วิ่งครอสคันทรี่ + ปั่นจักรยานเสือภูเขา 3 สนาม LINK
เดอะแอดเวนเจอร์แดช กลับมาแล้ว พร้อมกับประสบการณ์ความตื่นเต้นของการแข่งขันเอาท์ดอร์ที่ได้สัมผัสกับธรรมชาติอย่างแท้จริง ประสบการณ์การผจญภัยที่ตื่นเต้นและน่าจดจำครั้งนี้มีให้ร่วมสนุกกันทุกระดับความสามารถ
การแข่งขันครั้งที่ 1 จะจัดขึ้นวันที่ 6 มี.ค. 65 ที่สวนละไม อ.วังจันทร์ จังหวัดระยอง สถานที่สำหรับครอบครัวมาพักผ่อน โอบล้อมไปด้วยทัศนีย์ภาพของภูเขาที่เขียวขจี ไม่ไกลจากอุทยานกอล์ฟวังจันทร์ สถานที่ที่มีกวางนับร้อยมาเดินเล่นได้อย่างมีอิสระ
การแข่งขันครั้งที่ 2 จะจัดขึ้นวันที่ 2 เม.ย. 65 ที่ Wisdom valley อ.บางละมุง จ.ชลบุรี สวรรค์แห่งกีฬาบนพื้นที่ 1,400 ไร่ของชนบทไทย ประตูสู่เส้นทางธรรมชาติและกิจกรรมกลางแจ้ง วิ่ง ปั่นจักรยานเสือภูเขา แพดเดิลบอร์ด สเกตบอร์ด และเซิร์ฟสเก็ต มีสิ่งอำนวยความสะดวกที่ยอดเยี่ยม เช่น ร้านค้า คาเฟ่ บาร์ ร้านอาหาร ห้องสุขา และตลาดวันหยุดสุดสัปดาห์
การแข่งขันครั้งที่ 3 จะจัดขึ้นวันที่ 22 พ.ค. 65 ที่เขาอีโต้ จังหวัดปราจีนบุรี ป่าในเมืองที่ยังคงความอุดมสมบูรณ์ทั้งที่มีระยะทางเพียงแค่ 2 ชั่วโมงจากกรุงเทพฯ
การแข่งขันประกอบไปด้วย 2 ส่วนหลัก การวิ่งครอสคันทรี่ และการปั่นจักรยานเสือภูเขา รวมทั้งการข้ามอุปสรรคและสิ่งกีดขวางบ้างเพื่อความท้าทาย
วิ่งครอสคันทรี่ระยะทางประมาณ 9-13 ก.ม.
ปั่นจักรยานเสือภูเขาระยะทางประมาณ 13- 20 ก.ม.
สถานที่จัดงาน
สนามที่ 1 สวนละไม อ.วังจันทร์ จังหวัดระยอง 6 มี.ค. 65
สนามที่ 2 Wisdom valley อ.บางละมุง จังหวัดชลบุรี 2 เม.ย. 65
สนามที่ 3 เขาอีโต้ จังหวัดปราจีนบุรี 22 พ.ค. 65
THAIFEX – HOREC Asia 6-8 March 2024
6 – 8 March 2024 IMPACT MUANG THONG THANI, BANGKOK, THAILAND
The must-attend event, tailor-made for the Hotel, Restaurant, and Catering industries, invites you to fully immerse yourself in the present and future landscape of the HORECA industry. Discover a plethora of fresh insights on the most current market trends and have the opportunity to meet industry heavyweights.
This all-inclusive event boasts a complete overview of the sector’s most sales-generating and future-forward products and services across 9 HORECA segments: Bakery and Ice Cream, Café and Bar, Cleaning and Laundry, Dining, Furnishing, Kitchen, Services, Tech and Wellness.
เขตธนบุรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 6-29 มีนาคม 2567
เขตธนบุรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี เวลา 9.00-11.30 น. **สัตว์เลี้ยงต้องมีอายุ 3 เดือนขึ้นไป ไม่ตั้งครรภ์ ไม่อยู่ในช่วงให้นมลูกและไม่ป่วย สอบถามโทร 02-4685297
เขตบางแค บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ประจำเดือน มี.ค. 2567
สำนักงานเขตบางแค ร่วมกับศูนย์บริการสาธารณสุข 40 (บางแค) จะดำเนินการออกหน่วยรณรงค์บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชนต่างๆของพื้นที่เขตบางแค ตลอดเดือนมีนาคม นี้ ...ฟรี‼️ โดยมีรายละเอียดตามวันและสถานที่ ดังนี้
• 07 มีนาคม 2567 - 09.00 -11.00 น. : ชุมชนเศรษฐกิจร่วมใจ
• 14 มีนาคม 2567 - 09.00 -11.00 น. : ชุมชนร่วมใจพัฒนา
• 21 มีนาคม 2567 - 09.00 -11.00 น. : ชุมชนเกษตรรุ่งเรือง
• 28 มีนาคม 2567 - 09.00 - 11.00 น. : ชุมชนศิริเกษม 1
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมฯ เบอร์โทรติดต่อ 02-454-6001 แล้วพาสัตว์เลี้ยงสุนัขหรือแมวที่มีอายุ 3 เดือนขึ้นไป มาฉีดวัคป้องกันโรคพิษสุนัขบ้ากันนะ
มีนาคม 65 รามคำแหง ร่วมลงทุนในโครงการโรงพยาบาลธนบุรี รังสิต
8 มีนาคม 2565 โรงพยาบาลรามคำแหง จำกัด (มหาชน) มีมติให้ร่วมลงทุนใน โครงการโรงพยาบาลธนบุรี รังสิต มูลค่าลงทุน 1,080,000,000 บาท เป็นการร่วมลงทุนเพื่อประกอบกิจการโรงพยาบาลเอกชน ขนาด 250 เตียง ตั้งอยู่บริเวณโครงการ Jin Wellbeing Country ติดถนนพหลโยธิน บริเวณ กม. 36+550 ต. คลองหนึ่ง อ. คลองหลวง จ. ปทุมธานี บนเนื่อที่ 20-0-08 ไร่ งบประมาณในการลงทุนประมาณ 2,700 ล้านบาท
ประโยชน์ที่คาดหวังจากการลงทุน บริษัท มีความประสงค์จะร่วมลงทุนในธุรกิจโรงพยาบาลที่คาดว่าจะให้ผลตอบแทนที่ดี บริษัทคาดว่า โครงการนี้จะให้ผลตอบแทนประมาณ 10 % ซึ่งมากกว่าอัตราดอกเบี้ยในท้องตลาด บริษัทจะได้รับผลตอบแทน กลับ มาในรูปเงินปันผลในอัตราที่น่าพอใจ
มูลนิธิ ฟูจิฟิล์ม บิสซิเนส อินโนเวชี่น (ประเทศไทย) มอบอุปกรณ์ทางการแพทย์ เครื่องเอกซเรย์เคลื่อนที่ LINK
วันพุธที่ 8 มีนาคม 2566 นายแพทย์ยุทธ โพธารามิก เลขาธิการมูลนิธิ พอ.สว. นายแพทย์พิษณุ มณีโชติ รองเลขาธิการมูลนิธิพอ.สว.และทันตแพทย์สมนึก ชาญด้วยกิจ ผู้อำนวยการสำนักงานมูลนิธิ พอ.สว. ร่วมรับมอบอุปกรณ์ทางการแพทย์ เครื่องเอกซเรย์เคลื่อนที่แบบมือถือจำนวน 1 เครื่องและเครื่องตรวจอวัยวะภายในด้วยคลื่นเสียงความถี่สูงแบบหิ้วถือจำนวน 3 เครือง รวมมูลค่า 5,600,000 บาท จากมูลนิธิ ฟูจิฟิล์ม บิสซิเนส อินโนเวชี่น (ประเทศไทย) โดยมี มร.มาซาอากิ ยานากย่า เป็นผู้มอบ เพือใช้ในกิจกรรมของมูลนิธิ พอ.สวต่อไป ณ ห้องประชุม 1 สำนักงานมูลนิธิ พอ.สว.
งาน THAILAND CAT SHOW 2024 (8-10 มีนาคม และ 28-30 มิถุนายน 2567)
งานสำหรับคนรักแมว THAILAND CAT SHOW 2024 งาน Thailand Cat Show 2024 ที่จัดขึ้นในวันที่ 8-10 มีนาคม เซ็นทรัลลาดพร้าว และ 28-30 มิถุนายน 2567 เซ็นทรัลเวสต์เกต
24th Thailand Cat Show 2024 วันที่ 8 - 10 มีนาคม นี้ ที่ BCC Hall ชั้น 5 เซ็นทรัลลาดพร้าว พบกับ...
- กิจกรรมการประกวดแมว CFA Thailand Cat Show 2024 4 Rings
- กิจกรรมการประกวดแมว Fun Show 1 Ring
- การประกวด แมววัวตัวลาย ปี 2
- การประกวด แมวดำ ดำดีสีไม่ตก ปี 6
- กิจกรรมทำหมันสัญจร ร่วมทำบุญกับสอยดาว ผ้าป่าแมวจร กับ มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร
- โซนหาบ้านให้แมวจร โดยอาสาสมัครจากมูลนิธิรักษ์แมว และเพจหมากระสอบ
- Work shop สนุกๆ ทำของเล่นแมว ผ้าพันคอน้องแมว และโซน ใครอยากเป็นศิลปิน ฉันน่ะสิๆ จากโครงการยืมมือ
- โซนก็แมวดิคราฟ รวมศิลปินและสารพัดร้านค้ากุ๊กกิ๊กลายแมว
- ตรวจสุขภาพฟรี กับโรงพยาบาลสัตว์ทองหล่อ
- อาหารและสินค้าของใช้ไว้บริการแมวในบ้านอีกเพียบ
มาเจอกันนะคะ 8-10 มีนาคม นี้ BCC Hall ชั้น5 เซ็นทรัลลาดพร้าว
Pet a potter 8 – 14 มีนาคม 67 เซ็นทรัลชลบุรี
Pet a potter งานดีๆ ที่คนรักสัตว์เลี้ยงต้องมา พบกับสัตว์สุดน่ารัก ที่มาใน Theme Harry Potter สุดแฟนตาซี ทั้งปราสาทเวทย์มนต์ยักต์สูงกว่า 5 เมตร พร้อมกิจกรรมต่าง ๆ ในงานนี้ ที่คุณไม่ควรพลาด‼️ 8 – 14 มีนาคม 67 ลานกิจกรรม ชั้น 1 หน้า เซ็นทรัลชลบุรี
งานกาแฟ Amazing Robusta@Chumphon ปี 2567 วันที่ 8 - 10 มี.ค.
งานกาแฟ Amazing Robusta@Chumphon ปี 2567 สัมผัสความเข้มถึงใจของกาแฟโรบัสต้า ชิมอาหารถิ่น ช้อปสินค้าพื้นบ้าน ตั้งแต่วันที่ 8 - 10 มี.ค. นี้ เวลา 11.00 - 21.00 น. ณ สวนสาธารณะอาภากรเกียรติวงศ์ อ.เมือง จ.ชุมพร
งานกาแฟ Sip & Chill Phuket 8-10 มีนาคม 2567
งานกาแฟ Sip & Chill Phuket งานที่รวมคาเฟ่ไว้เยอะที่สุด ปิคนิคริมทะเลสะพานหิน ภูเก็ต 8-10 มีนาคม 2567 เวลา 10.00 – 18.00 น. ณ สวนสาธารณะ สะพานหิน พบกับกิจกรรมมากมายภายในงาน เครื่องดื่ม อาหาร ดนตรีสด แพ็กเกจทัวร์ กิจกรรม Suntainable Workshop Board Game
17 กุมภาพันธ์ - 16 มีนาคม 2567 Bangkok Street Performer Mini Show อุทยานเบญจสิริ
การแสดงในสวนสุขสันต์รอบใหม่! "Bangkok Street Performer Mini Show" ทุกวันเสาร์ที่ 17 ก.พ. - 27 เม.ย. 67 พบกันที่อุทยานเบญจสิริ (BTS พร้อมพงษ์) เวลา 16.40 - 18.00 น. เข้าร่วมฟรีตลอดทั้งงาน การแสดงที่จะมอบเสียงหัวเราะ พร้อมชวนทุกคนจินตนาการไปกับการแสดงไร้ภาษา ร่วมสนุกไปกับการแสดงมากมายทั้งละครใบ้ มายากล Juggling ละครหุ่น ฯลฯ จากศิลปิน Street Performer ตารางการแสดง
วันเสาร์ที่ 17 กุมภาพันธ์ การแสดง Magic , Beatbox Mime
วันเสาร์ที่ 24 กุมภาพันธ์ การแสดง Juggling , Object Theatre
วันเสาร์ที่ 2 มีนาคม การแสดง Mime , Magic
วันเสาร์ที่ 9 มีนาคม การแสดง Object Theatre , Mime
วันเสาร์ที่ 16 มีนาคม การแสดง Juggling Mime
งานเมืองกาแฟ แลดอกเสี้ยว เที่ยวเทพเสด็จ ครั้งที่ 10 วันที่ 9-10 มีนาคม 2567
เชิญร่วมงานเมืองกาแฟ แลดอกเสี้ยว เที่ยวเทพเสด็จ ครั้งที่ 10 “กาแฟชั้นหนึ่ง น่าทึ่งดอยลังกา สวนยาม่อนฤษี ชากาแฟดี มีธรรมชาติสวยงาม มาลิ้มรสกาแฟชั้นเลิศ สัมผัสธรรมชาติอันแสนงดงาม” วันที่ 9-10 มีนาคม 2567 ที่ ลานอเนกประสงค์ บ้านปางไฮ อ.ดอยสะเก็ด จ.เชียงใหม่
ภายในงาน •. ชมช้อป สินค้าโอทอป ร้านกาแฟ สินค้าผลิตภัณฑ์จากกาแฟ •. สัมผัสกับบรรยากาศดอกเสี้ยวบาน •. ร่วมชิมกาแฟสายพันธ์อาราบิก้าของดีตำบลเทพเสด็จ •. อิ่มอร่อยกับอาหารและเครื่องดื่มมากมาย •. พร้อมร่วมสนุกสนานกับการสาธิตโหนสลิง พร้อมโหนสลิงฟรี!!!เพลิดเพลิน กับรำวงย้อนยุคและรำวงประยุกต์ พร้อมกิจกรรมมากมาย
จัดโดย องค์การบริหารส่วนตำบลเทพเสด็จ ร่วมกับ อำเภอดอยสะเก็ด องค์การบริหารส่วนจังหวัดเชียงใหม่ ชมรมกำนันผู้ใหญ่บ้านเทพเสด็จ และองค์กรภาคเอกชนในพื้นที่
วันไตโลก World Kidney Day วันพฤหัสบดีที่ 2 ของเดือนมีนาคม ทุกปี
วันพฤหัสบดีที่ 2 ของเดือนมีนาคมของทุกปี เป็นวันที่ International Federation of Kidney Foundation และInternational Society of Nephrology ได้กำหนดให้เป็น “วันไตโลก” (World Kidney Day) เพื่อ รณรงค์ให้ประชาชนตระหนักถึงความสำคัญของโรคไต ซึ่งเป็นปัญหาสาธารณสุขที่สำคัญทั่วโลก และสัปดาห์ที่ 2 ของเดือน มีนาคมตรงกับสัปดาห์รณรงค์ลดการบริโภคเค็มสากล สำหรับในประเทศไทย
สมาคมโรคไตแห่งประเทศไทย เป็นเจ้าภาพในการจัดกิจกรรมทุกปี ร่วมกับ สถานพยาบาล และแพทย์ผู้เกี่ยวข้อง เพื่อร่วมสร้างความตระหนักและการป้องกันโรคไตแก่ประชาชนทั่วไป
ประกาศสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ
ประกาศ สถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ เปิดศูนย์พักพิงชั่วคราวแห่งใหม่ เพื่อคนไทยที่ต้องการกลับประเทศ ตั้งแต่วันที่ 15 ตุลาคม 2566 เป็นต้นไป ณ โรงแรม Intercontinenal Tel Aviv ที่อยู่ Kaufmann St 12, Tel Aviv-Yafo, 61501 [โลเคชั่น:
maps.app.goo.gl/]
จึงขอแจ้งพี่น้องคนไทยที่ประสงค์จะเดินทางกลับไทยและสามารถเดินทางมาด้วยตนเอง ให้เดินทางมาที่ศูนย์พักพิงดังกล่าว หากใครมีปัญหาการเดินทาง ขอให้ติดต่อ ฮอตไลน์หรือหมายเลขศูนย์พักพิง โทร. 055-271-2201 • 053-245-2826 • 054-636-8150
งานวิ่งฉลามพลารัน PALA RUN 4 Rhythm on Pala beach วันที่ 10 มีนาคม 2567 LINK
PALA RUN 4 Rhythm on Pala beach วันที่ 10 มีนา 2567 ชายหาดพลา ต.พลา อ.บ้านฉาง จ.ระยอง งานวิ่งชายหาดพลาที่ฟินและสนุกที่สุด รวมพลฉลามพลารัน สายแข่ง สายชิลล์ มี 2 ระยะการแข่งขัน Mini Marathon 10 KM / Fun Run 5 KM / FANCY (ค่าสมัครตามระยะการแข่งขัน) ลุ้นโล่รางวัล และตุ๊กตา BABy SHARK 4 เพราะงานวิ่ง PALA RUN ไม่ได้ให้มาวิ่งอย่างเดียว เราให้มาสนุกด้วย...กับกิจกรรมมากมาย สไตล์ Rhythm on Pala Beach อาทิ ▶️ Music on the Beach ▶️ โชว์สกิล...สกิมบอร์ด ▶️ Cafe ในสวนสนสุดชิค ▶️ ลุ้นรางวัลพิเศษมากมาย
อบรมเชิงปฏิบัติการออกแบบและตัดชิ้นงานด้วยเครื่อง CNC Laser
อบรมเชิงปฏิบัติการออกแบบและตัดชิ้นงานด้วยเครื่อง CNC Laser
อบรมระหว่างวันที่ 11-12 มีนาคม 2566 เวลา 09.00-16.30 น.
เครื่องตัดเลเซอร์ คือ อุปกรณ์ที่ใช้ในการตัดวัสดุที่มีคุณภาพสูงมากซึ่งมักจะมีความรวดเร็วในการตัด โดยเฉพาะวัสดุที่มีรูปร่างซับซ้อน การใช้เลเซอร์ในการตัดจะได้ผลลัพธ์ที่น่าพึงพอใจและแม่นยำ โดยระบบการตัดด้วยเลเซอร์นี้จะใช้ความร้อนผ่านไปบนวัตถุ และถูกตัดออกมาเป็นชิ้นอย่างสวยงาม อีกทั้งเครื่องตัดเลเซอร์ดังกล่าวถูกติดตั้งกับระบบ CNC ที่ควบคุมการตัดด้วยคอมพิวเตอร์ หลักสูตรนี้จะทำให้ผู้อบรมสามารถใช้คอมพิวเตอร์ในการออกแบบชิ้นงานในรูปแบบต่างๆ เพื่อนำมาตัดหรือแกะสลักได้ตามความต้องการ
ตรวจสอบคุณสมบัติ และยื่นอุทธรณ์ โครงการลงทะเบียนเพื่อสวัสดิการแห่งรัฐ ปี 2565
สำนักงานคลังจังหวัดสุพรรณบุรี เปิดให้บริการ ตรวจสอบคุณสมบัติ และยื่นอุทธรณ์ “โครงการลงทะเบียนเพื่อสวัสดิการแห่งรัฐ ปี 2565”
เริ่มวันเสาร์ที่ 11 มีนาคม - วันอาทิตย์ที่ 26 มีนาคม 2566
ตั้งแต่เวลา 08.30 - 16.30 น. “เปิดบริการทุกวันไม่เว้นวันหยุดราชการ”
เขตทุ่งครุ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 11-15 มีนาคม 2567
ชศูนย์บริการสาธารณสุข54 ทัศน์เอี่ยม จัดหน่วยให้บริการฉีดวัคซีนป้องกันพิษสุนัขบ้าให้แก่สัตว์เลี้ยง สุนัขและแมวในชุมชนตั้งแต่ 11-15 มีนาคม 2567 ฟรี ไม่เสียค่าใช้จ่าย
เขตจตุจักร เชิญชวนพาสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 11-15 มีนาคม 2567
สำนักงานเขตจตุจักร เชิญชวนนำสุนัข-แมว เข้ารับบริการ ฉีดวัคซีนพิษสุนัขบ้า ฟรี สอบถามโทร 02-5133444.
•. 11 มีนาคม 2567
เวลา 9.00-11.00 น. ชุมชนซีเมนต์ไทย และชุมชนรัชดาประชาชื่น จุดตั้ง ศาลารวมใจซิเมนต์ไทย
เวลา 13.30 - 15.00 น. ชุมชนประชาร่วมใจ 1 ชุมชนประชาร่วมใจ 2 จุดตั้ง ลานอเนกประสงค์ ชุมชนประชาร่วมใจ 1
•. 14 มีนาคม 2567
เวลา 8.30-9.30 น. ชุมชนบ่อฝรั่งริมบึงบางซื่อ จุดที่ 1 อาคารสหกรณ์บ่อฝรั่ง
เวลา 10.00 - 11.30 น. หมู่บ้านไพรฑูรย์นิเวศน์ จุดตั้ง ลานกีฬาใต้ทางด่วนหน้าชุมชน
•. 15 มีนาคม 2567 เวลา 9.00-11.30 น. ชุมชนเคหะสถานเจริญชัย ชุมชนภักดี ชุมชนไทรคู่ ชุมชนสวนผัก ชุมชนพร้อมใจพัฒนา จุดตั้ง ศาลารวมใจชุมชนเคหะสถานเจริญชัย
Pho3nix Kids Triathlon 2022 จูเนียร์ ไตรแดช 5 สนาม ปี 2565 LINK
จูเนียร์ ไตรแดช ฟีนิกส์ไตรกีฬาคิดส์ ซีรีส์ (Pho3nix Kids Triathlon) 5 ครั้ง
ครั้งที่ 1 - วันเสาร์ที่ 12 มีนาคม 2565
ครั้งที่ 2 - วันเสาร์ที่ 23 เมษายน 2565
ณ สนามกอล์ฟ บางปู กอล์ฟ แอนด์ สปอร์ต คลับ สมุทรปราการ
ครั้งที่ 3 - วันที่ 28 พฤษภาคม 2565 ณ พัฒนา สปอร์ต รีสอร์ท จังหวัดชลบุรี ใน
ครั้งที่ 4 - วันที่ 25 กันยายน 2565 ณ โรงเรียนนานาชาติกรุงเทพฯ
ครั้งที่ 5 - วันเสาร์ที่ 19 พฤศจิกายน 2565 ณ ลากูน่า ภูเก็ต - ผนวกรวมกับการแข่งขันระดับตำนานแห่งภูมิภาค “ลากูน่า ภูเก็ต ไตรกีฬา”
การแข่งขันฯ จะแบ่งออกเป็นรายการและประเภทแข่งหลากหลายชนิด เช่น ไตรกีฬา, ทวิกีฬา และ ฟันรัน เป็นต้นซึ่งจะแบ่งเป็นระดับพื้นฐานและแอดวานซ์ ในระยะแข่งขันทีเหมาะสมกับรุ่นอายุและสมรรภาพ เปิดลงทะเบียนแล้ววันนี้ [
สมัครได้ที่นี่]
Brazilian Jazz night @สระบุรี 12 มีนาคม 2566
Brazilian Jazz night อาทิตย์ที่ 12 มีนาคม 2566 20:00 - 21:00 น.
Collaboration with Saraburi Jazz Community
Granny’s
Drinks and Deli
Wine / Cocktail / Cheeses / Tapas
Health & Nutrition Asia 2024 - 12-14 มีนาคม 2567 LINK
งานแสดงสินค้าและสัมมนาด้านสุขภาพสัตว์ โภชนาการสัตว์ และกระบวนการผลิตอาหารสัตว์แห่งภูมิภาคเอเชีย ที่จะจัดขึ้นในระหว่างวันที่ 12-14 มีนาคม 2567 ณ ศูนย์นิทรรศการและการประชุมไบเทค Health & Nutrition Asia 2024 - TOTAL ANIMAL FEED AND HEALTH EVENT FOR ASIA
งานประกาศรางวัล Asian Animal Health Award 2024 ให้รางวัลแก่บุคคลและหน่วยงานที่มีส่วนร่วมในอุตสาหกรรมสุขภาพสัตว์ โดยมีสองประเภทรางวัล ได้แก่ผู้ประกอบวิชาชีพ และนักวิชาการ/นักวิจัย
TRI DASH BANGKOK 2022 SERIES 6 สนาม LINK
TRI DASH BANGKOK 2022 SERIES ไตรแดช เป็นสนามทดสอบสมรรถภาพสนามแรกที่เหมาะสมที่สุดสำหรับนักกีฬาไตรกีฬามือใหม่ สำหรับนักกีฬาสมัครเล่นเริ่มก้าวแรกในสนามและฝึกฝนประสบการณ์จากสนามแห่งนี้ เพื่อสร้างความแกร่งบนสนามทางไกลในระดับสูงขึ้นต่อไป ไตรแดช แบ่งเป็น 2 ระดับ คือรุ่นผู้ใหญ่ และ รุ่นจูเนียร์
1) รุ่นผู้ใหญ่ ซีรีส์ ไบค์โซน ไตรแดช กรุงเทพ ปี 2565
3 สนามการแข่งขัน
สนามกอล์ฟ บางปู แอนด์ สปอร์ต วันแข่ง 13 มีค 24 เมย 03 กค
สนาม Stage Find the Real U วันแข่ง 23-24 กค
สนามพัฒนา สปอร์ต รีสอร์ท วันแข่ง 28-29 พค 1-2 ตค
ข้อมูลเพิ่มเติม
tridashthailand.com
2) รุ่นจูเนียร์ ซีรีส์ ฟีนิกส์ คิดส์ ปี 2565
(ดู Pho3nix Kids Triathlon 2022 จูเนียร์ ไตรแดช 5 สนาม ปี 2565)
หลักสูตร Drone for Kids เพื่อปฏิบัติภารกิจ อบรมวันที่ 13 มีนาคม 2566
สำหรับน้องๆ ที่สนใจ ใช้เวลาว่างช่วงปิดเทอมให้เกิดประโยชน์ ศูนย์ฯ ICT เทศบาลนครขอนแก่น ขอเสนอหลักสูตร "Drone for Kids เพื่อปฏิบัติภารกิจ" น้องๆจะเรียนรู้การทำงานของโดรน รวมถึงการฝึกปฏิบัติเบื้องต้น มาเรียนรู้ และสนุกไปด้วยกันนะคะ เปิดรับสมัครน้องๆที่มีอายุ 11 ปีขึ้นไป อบรมวันที่ 13 มีนาคม 2566 เวลา 09.00-16.30 น.
มีนาคม 65 พริ้นซิเพิล เฮลท์แคร์ เข้าซื้อหุ้น ผิวดีคลินิก เอสเธติคส์
14 มีนาคม 2565 พริ้นซิเพิล เฮลท์แคร์ จำกัด (เครือโรงพยาบาลพริ้นซ์) ประกาศการเข้าซื้อหุ้นสามัญของบริษัท ผิวดีคลินิก เอสเธติคส์ จำกัด ของบริษัท P.D.Cosmed Company Limited และบริษัท สกินด็อกเตอร์ส จำกัด มูลค่าลงทุน 302.5 ล้านบาท โดยวัตถุประสงค์ในการลงทุน เพื่อขยายธุรกิจให้บริการด้านผิวพรรณ ศัลยกรรมความงามและการดูแลสุขภาพแบบองค์รวม
THAI COFFEE PARADISE 2024 วันที่ 14 - 18 มีนาคม 2567
THAI COFFEE PARADISE 2024 วันที่ 14 - 18 มีนาคม 2567 เวลา 10.00 - 22.00 น. ศูนย์การค้าฟิวเจอร์พาร์ค Alive park hall ชั้น G งานกาแฟภาคเหนือ สวรรค์ของเมืองกาแฟ พบกับ - สุดยอดกาแฟ 17 จังหวัดภาคเหนือ - กาแฟอาราบิก้าที่ดีที่สุดของไทย - กาแฟ GI แต่ละพื้นที่ - จำหน่ายเมล็ดกาแฟ - อุปกรณ์การทำกาแฟ - การแข่งขันนักชิม,นักชง ชิงถ้วย พระราชทาน สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วนขัตติยราชนารี - บูธออกงานกว่า 100 ร้านค้า - ประกวดสุดยอดกาแฟ - นิทรรศการ 10 สุดยอดกาแฟภาคเหนือ - การเจรจาการค้า - เวทีแลกเปลี่ยนเรียนรู้ - ลดแลกแจกแถม รวมมูลค่า 250,000 บ. - แจกต้นกาแฟ(จำนวนจำกัด) - สาธิตเทคนิคการทำกาแฟ
Thailand International Health Expo 2022 - 17-20 มีนาคม 2565 LINK
ไทยแลนด์ อินเตอร์เนชั่นแนล เฮลท์ เอ็กซ์โป 2022 (Thailand International Health Expo 2022) วันที่ 17-20 มีนาคม 2565 รอยัลพารากอนฮอลล์ ชั้น 5 สยามพารากอน จะเป็นงานใหญ่ที่เกี่ยวการบริการสุขภาพสาธารณสุขงานแรกประจำปี 2565 เป็นงานที่จัดโดย กระทรวงสาธารณสุข ร่วมกับ ส่งเสริมการจัดประชุมและนิทรรศการ (องค์การมหาชน) หรือ ทีเส็บ และอีก 2 องค์กรร่วมจัด ได้แก่การท่องเที่ยวแห่งประเทศไทย และ สสส.
งานมะม่วงพิษณุโลก ครั้งที่ 3 วันที่ 17-21 มีนาคม 2566 LINK
งานเทศกาลมะม่วงที่สำคัญของจ.พิษณุโลก ปีนี้ จัดระหว่างวันที่ 17-21 มีนาคม 2566 ณ ศูนย์การค้าเซ็นทรัล พิษณุโลก ได้รวบรวมมะม่วงน้ำดอกไม้สีทองพรีเมียม เกรดส่งออกของดีจังหวัดพิษณุโลก และเพิ่มช่องทางการจัดจำหน่ายให้แก่เกษตรกร จังหวัดพิษณุโลก
ภายในงานเตรียมพบกับ
- มะม่วงเกรดส่งออกจากสวน
- ผลิตภัณฑ์แปรรูปมะม่วงกว่า 50 ประเภท
- พร้อมบริการจัดส่งทั่วประเทศไทยจาก Kerry
- ฟังการเสวนาพิเศษ “ชี้ช่องทางการตลาดมะม่วงน้ำดอกไม้สีทอง”
หลักสูตรการเขียนโปรแกรมควบคุมหุ่นยนต์เตะฟุตบอล (Robot Soccer) อบรมวันที่ 17 มีนาคม 2566
หลักสูตรการเขียนโปรแกรมควบคุมหุ่นยนต์เตะฟุตบอล (Robot Soccer)
อบรมวันที่ 17 มีนาคม 2566 เวลา 09.00-16.30 น.
น้องๆจะได้เรียนรู้การเขียนโปรแกรมควบคุมการทำงานของหุ่นยนต์ โดยทำงานผ่านชุดบังคับ เพื่อให้หุ่นยนต์เคลื่อนไหวในคำสั่งที่ได้ออกแบบไว้
เปิดรับสมัครน้องๆที่มีอายุ 11 ปีขึ้นไป
ประดู่รัน มหาปราบแห่งอัมพวา วันแผลงฤทธิ์ 17 มีนาคม 2567 LINK
มหาปราบแห่งอัมพวา ผู้กำชัยในทุกพื้นที่ งานวิ่งที่อลังโดนใจสุดๆ เสื้อ 7สี 7วัน เสื้อVIPสวยมาก ประดู่รัน มหาปราบแห่งอัมพวา ขยายเวลารับสมัคร ตั้งแต่วันนี้ถึง 15 มกราคม 6 7 จ้า เว็บสมัครคลิ๊ก www.wpdrun.com. มหาปราบแห่งอัมพวา ผู้กำชัยในทุกพื้นที่ งานวิ่งที่อลังโดนใจสุดๆ เสื้อ 7สี 7วัน เสื้อVIPสวยมาก ประดู่รัน มหาปราบแห่งอัมพวา วันแผลงฤทธิ์ 17 มีนาคม 2567 ณ วัดประดู่ พระอารามหลวง อ.อัมพวา จ.สมุทรสงคราม
เดิน-วิ่ง เภสัชวลัยลักษณ์ 2024 วันที่ 17 มีนาคม 2567 LINK
เดิน-วิ่ง เภสัชวลัยลักษณ์ 2024 การกลับมาอีกครั้งอย่างยิ่งใหญ่ “ Pharmasun Running เดิน-วิ่ง เภสัชวลัยลักษณ์ ครั้งที่ 5 ” เพื่อสมทบทุนสนับสนุนโรงพยาบาลศูนย์การแพทย์ มหาวิทยาลัยวลัยลักษณ์ วันที่ 17 มีนาคม 2567 ณ มหาวิทยาลัยวลัยลักษณ์ นครศรีธรรมราช ระยะ 11.5/5.0 km
หลักสูตรการสร้างรายงานแบบ Dashboard ด้วยโปรแกรม Microsoft Excel อบรมระหว่างวันที่ 18-19 มีนาคม 2566
"หลักสูตรการสร้างรายงานแบบ Dashboard ด้วยโปรแกรม Microsoft Excel"
อบรมระหว่างวันที่ 18-19 มีนาคม 2566 เวลา 09.00-16.30 น.
Dashboard คือการนำข้อมูลที่สำคัญมาสรุปให้เห็นภาพในหน้าเดียว เพื่อให้ดูง่ายและสามารถตีความสั้นๆในพริบตา โดยจะเป็นข้อมูลจากการทำรายงาน หรือที่อื่นๆ มักเป็นข้อมูลที่อ้พเดทสม่ำเสมอจนไปถึง real-time ทำให้เราสามารถเห็นความเป็นไปของธุรกิจหรือสิ่งที่เราสนใจได้ง่ายขึ้น เหมาะกับยุคสมัยนี้ที่มีปริมาณข้อมูลที่มากมายหลากหลาย Dashboard จึงเป็นตัวช่วยในการตัดสินใจอย่างมีประสิทธิภาพ สำหรับผู้ที่สนใจอยากจะเรียนรู้การจัดการข้อมูล พลาดไม่ได้จริงๆ
งานประเพณี ไหว้พระธาตุช่อแฮ เมืองแพร่แห่ตุงหลวง วันที่ 18-24 มีนาคม 2567
งานประเพณี ไหว้พระธาตุช่อแฮ เมืองแพร่แห่ตุงหลวง วันที่ 18-24 มีนาคม 2567 (ขึ้น9-15 ค่ำ เดือน 6) ณ วัดพระธาตุช่อแฮ พระอารามหลวง จังหวัดแพร่. กำหนดการสำคัญ 16 มีนาคม พิธีอาราธนาพระมหาอุปคุต 17 มีนาคม ขบวนชุมชนยลวิถีฯ สิ่งน่าสนใจอื่นๆ ในงาน ชมขบวนข้างเจ้าหลวง ขบวนแห่เครื่องสักการะ และผ้าห่มพระธาตุ จาก 8 อำเภอของจังหวัดแพร่ ขบวนเฉลิมพระเกียรติพระบาทสมเด็จพระวชิรเกล้าเจ้าอยู่หัว, สมโภชครบรอบ 100 ปี ครูบำาศรีวิชัยบูรณะพระธาตุช่อแฮ บุญประเพณีขึ้นธาตุเดือน 6 เป็ง ไหว้พระขอพรเสริมสิริมงคล ชมการแสดงแสงสีเสียง เชิดมังกรเงินมังกรทองต้อน ซื้อสินค้พื้นเมือง กาดหมั้วครัวแลง สินค้าOTOP ตลาถนัดสินค้าราคาถูกจากโรงาน เที่ยวสวนสนุกเครื่องเล่นชุดใหญ่ และมหรสพสมโภชตลอดงาน
Bike For Zero Trash 2023 ปั่นลดขยะ วันอาทิตย์ที่ 19 มีนาคม 2566 LINK
เส้นทางปั่นสวยงาม 60K ลานมหาราช ปราณบุรี จ.ประจวบคีรีขันธ์ สัมผัสความสวยงามและเพลิดเพลินกับวิวทะเลอ่าวไทย ชมวิว ชมภูเขา ร่วมสร้างจิตสำนึกให้ตระหนักถึงความสำคัญ ตลอดจนทราบถึงปัญหาและผลกระทบต่างๆที่เกิดจากขยะ รายได้ส่วนหนึ่งสนับสนุนโครงการของ Trash Hero
วันเสาร์ที่ 18 มีนาคม 2566 เวลา 13.00 น. - 19.00 น.
และ วันอาทิตย์ที่ 19 มีนาคม 2566 เวลา 5.00 น - 6.00 น.
ปล่อยตัวเวลา 7.00 น.
สถานที่จัดงาน ลานมหาราช/ปราณบุรี
ระยะปั่น 60 กิโลเมตร
ลานมหาราช – ถ้ำพระยานคร
เส้นทางปั่น
เส้นทางปั่นสวยงาม 60K / เส้นทางสวยงามและสัมผัสความสวยงามของทะเลอ่าวไทยตลอดเส้นทางปั่น ชมวิว ชมภูเขา
รายละเอียดเส้นทางปั่น
- start : ลานมหาราช/ปราณบุรี
- กลับตัว : วัดบางปู/ถ้ำพระยานคร
- Finish : ลานมหาราช/ปราณบุรี
20 มีนาคม วันอาสาสมัครสาธารณสุขแห่งชาติ อสม.
มติครม. 21 ธันวาคม พ.ศ.2536 กำหนดให้ใช้วันจัดตั้ง อสม. 20 มีนาคม (2537) เป็นวันอาสาสมัครสาธารณสุขแห่งชาติ เพื่อยกย่อง อสม.ทั่วประเทศที่ทำหน้าที่ดูแลสุขภาพอนามัยประชาชนไทย เป็นกำลังสนับสนุนกระทรวงสาธารณสุขมาอย่างยาวนาน นับตั้งแต่เริ่มโครงการเมื่อปี พ.ศ.2520 ในนาม "อาสาสมัครสาธารณสุขประจำหมู่บ้านในปี" ครั้งนั้นเป็นเพียงโครงการทดลองนำร่องใน 20 จังหวัด
กระทรวงสาธารณสุขบริหารจัดการอสม. อาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) และอาสาสมัครสาธารณสุข กรุงเทพมหานคร (อสส.) มีจำนวนประมาณ 1,054,729 คน [
มติชน] แบ่งเป็นจำนวน 1.04 ล้านคนทั่วประเทศ และกว่า 15,000 คนในกรุงเทพฯ อสม.แต่ละคนได้รับเงิน 1,000 บาทต่อเดือน และได้รับอีก 500 บาทเพิ่มในช่วงสถานการณ์การแพร่ระบาดของโรคโควิด 19 [
WHO]
อบรมหลักสูตร ช่างสมาร์ทฟาร์ม วันที่ 20 -22 มีนาคม 2566 LINK
ขอเชิญเข้าร่วมการอบรมหลักสูตร ช่างสมาร์ทฟาร์ม วันที่ 20 -22 มีนาคม 2566 ณ ศูนย์พัฒนาวิชาชีพ คณะครุศาสตร์อุตสาหกรรม ศูนย์สุพรรณบุรี
รับจำนวนจำกัด 20 คน สนใจ สมัครด่วน โครงการดีๆ อบรมฟรี ได้รับความรู้จากวิทยากรผู้เชี่ยวชาญ ชำนาญเฉพาะด้าน
ติดต่อสอบถาม
ผศ.สุธี ลี้จงเพิ่มพูน เบอร์โทรศัพท์ 094-342-7755
อาจารย์เอกชัย รัตนบรรลือ เบอร์โทรศัพท์ 084-217-0279
มีนาคม-เมษายน 2566 เทศบาลเมืองบางคูรัด ทำหมันสุนัขฟรี‼️‼️ (เฉพาะสุนัขเท่านั้น)
ทำหมันสุนัขฟรี‼️‼️ (เฉพาะสุนัขเท่านั้น) "เทศบาลเมืองบางคูรัด" โดย ดร.พิมพ์พัชชา หยิมการุณ นายกเทศมนตรีเมืองบางคูรัด ร่วมกับ มูลนิธิเพื่อสุนัขในซอย SOI DOG Foundation จัดโครงการ "การจัดการประชากรสุนัขจรจัดประเทศไทย" สามารถลงทะเบียนได้ตั้งแต่บัดนี้ (โทรเท่านั้น)ได้ที่ คุณบอล 087-552-6305 ,คุณแก่น 094-720-0009 ฟรี ไม่มีค่าใช้จ่าย ทำหมันได้วันละ 44 ตัว เท่านั้น‼️ กำหนดการรับทำหมันสุนัข
ช่วงที่ 1 วันที่ 20 -24 มีนาคม 2566 เวลา 09.00 - 16.00 น.
ช่วงที่ 2 วันที่ 27 -31 มีนาคม 2566 เวลา 09.00 - 16.00 น.
ช่วงที่ 3 วันที่ 3 -7 เมษายน 2566 เวลา 09.00 - 16.00 น.
สถานที่ทำหมันสุนัข บริเวณอาคารอเนกประสงค์ด้านหน้าศูนย์พัฒนาเด็กเล็กเทศบาลเมืองบางคูรัด
หมายเหตุ การทำหมันสุนัข ต้องมีอายุ 2 เดือนครึ่งขึ้นไป สามารถทำหมันได้ทั้งสุนัขมีเจ้าของ และสุนัขจรจัด ***รายละเอียดหน่วยทำหมันสุนัข Soi Dog***(หมา) - รับทำหมันสุนัข อายุตั้งแต่ 3 เดือน ขึ้นไป (ไม่เกิน10ปี) ทำได้ทั้งเพศผู้ และเมีย - งดให้อาหารสุนัขก่อนรับการทำหมัน อย่างน้อย 8 ชั่วโมง (กรณีหมามีเจ้าของเลี้ยงระบบปิด) - สามารถนำสุนัขมาที่หน่วยทำหมันได้เอง(แนะนำให้ติดต่อล่วงหน้า1วัน) - ไหมที่ใช้เป็นไหมละลาย ไม่ต้องตัดไหมหรือทำแผลเพิ่มเติม(กรณีสุนัขมีเจ้าของแนะนำให้ซื้อลำโพงใส่กันเลียแผล) - ท่านที่ไม่สามารถนำสุนัขมาเองได้ ทางหน่วยมีรถบริการรับส่งให้ฟรี ไม่เสียค่าใช้จ่ายไดๆทั้งสิ้น - สุนัขที่มาทำหมันทุกตัวจะได้รับวัคซีนพิษสุนัขบ้า และวัคซีนรวมฟรีทุกตัว - สามารถติดต่อสอบถามเพิ่มเติมได้ที่เบอร์ 0875526305 บอล (เจ้าหน้าที่จับสุนัข) สายตรงนายกเอ๋ โทร 084-789-3991
งานดนตรีในสวน Mill ไม่ Mute พุธนี้ไม่เงียบ 21 ก.พ. - 3 เม.ย.67
อบจ.กาญจนบุรี ขอเชิญเที่ยวงานดนตรีในสวน Mill ไม่ Mute พุธนี้ไม่เงียบ ณ โรงงานกระดาษไทยกาญจนบุรี ตั้งแต่เวลา 17.00 - 21.30 น. พบกับกิจกรรม ดนตรีในสวน ประกวดดนตรีโฟล์คซอง ดูหนังกลางแปลง ชิล ช้อป สินค้า vintage DIY
อบรมเชิงปฏิบัติการ "ติดปีก SMEs ขับเคลื่อนธุรกิจด้วยดิจิทัล" วันอังคารที่ 21 มีนาคม 66
ขอเชิญผู้สนใจร่วมอบรมเชิงปฏิบัติการเพื่อพัฒนาทักษะแก่ผู้ประกอบการ ในหัวข้อ "ติดปีก SMEs ขับเคลื่อนธุรกิจด้วยดิจิทัล"
(drive in)(nine o clock) วันอังคารที่ 21 มีนาคม 2566 เวลา 09.00 - 12.30 น. ณ ห้องประชุม ชั้น 6 บมจ. โทรคมนาคมแห่งชาติ (NT) สุพรรณบุรี
(thumbtack)พบกับ
• Workshop แบบจับมือทำ ให้รู้จักและใช้เครื่องมือดิจิทัล อาทิ สร้างคอนเทนต์บนโซเชียลมีเดียด้วย Canva และตัดต่อคลิป TikTok ให้ปังด้วย CapCut
• แนะนำเครื่องมือติดปีกดิจิทัลด้วย 6 ระบบจัดการธุรกิจ
• รับคำปรึกษาฟรีจากนักการตลาดดิจิทัลและการเข้าถึงแหล่งทุน
• รับสิทธิ์ depa mini Transformation Voucher เพื่อใช้งานเครื่องมือดิจิทัล (จำกัด 50 ท่านแรก)
ลงทะเบียนได้ทาง www.transformmarket.com/matching.php
(bell)(hourglass done)ลงทะเบียนสุพรรณบุรีเพื่อรับของที่ระลึกได้ฟรี https://forms.gle/Q9C5S4m3Z2uvRGrT9
สอบถามข้อมูลเพิ่มเติมได้ที่ (LINE messenger)@transformmarket (smartphone) 064 870 6193
21 มีนาคม 2024 งาน Once present : Language of Flowers งานคอนเสิร์ตฟรี ในบรรยากาศของอุทยานจุฬา 100 ปี LINK
งาน Once present : Language of Flowers งานคอนเสิร์ตฟรีที่จะนำเสนอเรื่องราวของดนตรีและศิลปะไปควบคู่กันในบรรยากาศของอุทยานจุฬา 100 ปีที่รอทุกคนมาเต็มให้สมบูรณ์ โดยภายในงานจะมีทั้งโซนถ่ายรูปธีมดอกไม้ พร้อมทั้งกิจกรรมสุดน่ารักให้ทุกคนมาร่วมสนุกกัน! พบกับโชว์พิเศษจากศิลปิน LANDOKMAI รวมถึง Paiiinntt และ Praesun ที่จะเล่าเรื่องราวภาษาดอกไม้ออกมาผ่านเสียงเพลง ให้ได้ฟินกันอย่างเต็มที่ แล้วมาเจอกันที่งาน Language of Flowers วันที่ 21 มีนาคม 2024 ที่ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย ตั้งแต่เวลา 16.00 น. เป็นต้นไป Once อยากให้ครั้งหนึ่งเราได้มาร้องเพลงและร่วมสร้างความทรงจำดี ๆ ด้วยกัน
งานบ้านและสวนแฟร์ 2024 วันที่ 23-31 มีนาคม 2567
งานบ้านและสวนแฟร์ 2024 วันที่ 23-31 มีนาคม 2567 ไบเทค บางนา
Mega Pet Day 2024 วันที่ 23–24 มีนาคม 67
Mega Pet Day 2024 วันที่ 23–24 มีนาคม 67 เมกา บางนา มาในตอน Little Monsters at The Museum งานนี้เตรียมตัวชวนคนที่รักสัตว์เลี้ยง มาเสพงานศิลป์ พร้อมพาเจ้าสี่ขามาป่วนงานอาร์ต ที่สวนเมกา พาร์ค กันได้เลย! และพบกับหลากหลายกิจกรรมที่จะมาทำให้วันหยุดสุดสัปดาห์นี้สนุกกว่าที่เคยบ ถูกใจทั้งสายช้อป สายชิลล์ แน่นอน! งานนี้ร่วมสนุกได้ฟรี!
24 มีนาคม วันวัณโรคโลก World Tuberculosis Day (World TB Day)
วันวัณโรคโลก ตรงกับวันที่ 24 มีนาคม ของทุกปี ตั้งขึ้นเพื่อให้ประชาชนตระหนักถึงปัญหาวัณโรคที่ยังคงระบาดอยู่ในหลายส่วนของโลก ซึ่งเป็นสาเหตุการเสียชีวิตของประชาชนราว 1.6 ล้านคนต่อปีโดยเฉพาะในประเทศโลกที่สาม สาเหตุที่ตรงกับวันที่ 24 มีนาคมเนื่องจากในวันนี้เมื่อปี ค.ศ. 1882 (พ.ศ. 2425) ดร.โรเบิร์ต คอคได้ประกาศการค้นพบสาเหตุของวัณโรค คือเชื้อแบคทีเรียไมโคแบคทีเรียม ทูเบอร์คิวโลซิส การค้นพบของคอคถือเป็นการบุกเบิกวิธีการรักษาและวินิจฉัยวัณโรค ในปี ค.ศ. 1982 (พ.ศ. 2525) ซึ่งเป็นวาระครบ 100 ปีของการประกาศความสำเร็จของ ดร.คอค สหพันธ์นานาชาติเพื่อต่อต้านวัณโรคและโรคปอด (International Union Against Tuberculosis and Lung Disease;
IUATLD) จึงประกาศให้วันที่ 24 มีนาคมเป็นวันวัณโรคโลก -
WHO World TB Day 2022วิ่งเทรลเพื่อเพื่อนสัตว์ป่า ซีรีส์ 2567 วันอาทิตย์ที่ 24 มีนาคม 2567 LINK
วิ่งเทรลเพื่อเพื่อนสัตว์ป่า วันอาทิตย์ที่ 24 มีนาคม 2567 ณ จุดปล่อยตัวและเส้นชัย วัดพระพุทธบาทเขาลูกช้าง ตำบลท่าไม้รวก อำเภอท่ายาง จังหวัดเพชรบุรี ใกล้ศูนย์กู้ภัย WFFT ระยะวิ่ง 8 / 15 / 22 กม.
วิ่งเทรลเพื่อเพื่อนสัตว์ป่า การแข่งขันวิ่งเทรลที่จะพาคุณไปสัมผัสธรรมชาติอันซีนอันงดงามของจังหวัดเพชรบุรี และสนับสนุนการดำเนินงานของมูลนิธิเพื่อนสัตว์ป่า (Animal Rescue Centre: WFFT) การแข่งขันแบ่งออกเป็น 3 ระยะ ประกอบด้วย วิ่งสั้น 8 กม. วิ่งกลาง 15 กม. และวิ่งไกล 22 กม. บนเส้นทางเทรลในป่าชุมชน จุดปล่อยตัว/เส้นชัย ณ วัดพระพุทธบาทเขาลูกช้าง ร่วมสร้างประสบการณ์วิ่งที่มีเป้าหมายเพื่อหลายชีวิตเพื่อนสัตว์ป่า ซึ่งทรงคุณค่าของความหลากหลายทางชีวภาพและส่งต่อมรดกชีวิตสัตว์ในอนาคต รายละเอียดการจัดกิจกรรมมีดังต่อไปนี้
Doraemon Run Thailand 2024 by MCOT 5 สนามทั่วประเทศ LINK
ครั้งแรก!! ในไทย กับงานวิ่งจากการ์ตูนขวัญใจของคนทุกเพศ ทุกวัย "Doraemon Run Thailand 2024" by MCOT บริษัท อสมท จํากัด (มหาชน) (บมจ.อสมท) ผู้ได้รับสิทธิ์ในการออกอากาศการ์ตูนโดราเอมอน ทางสถานีโทรทัศน์ในประเทศไทย ซึ่งได้มีการออกอากาศในรายการช่อง 9 การ์ตูนทางช่อง 9 MCOT HD มายาวนานถึง 42 ปี โดยเป็นประเทศเดียวในโลก ที่มีการออกอากาศยาวนานต่อเนื่อง รองจากประเทศญี่ปุ่นเจ้าของลิขสิทธิ์ และเพื่อเป็นการเฉลิมฉลองโอกาสพิเศษที่คนไทยได้เรียนรู้จินตนาการของเด็ก ผ่านโดราเอมอนและผองเพื่อน บมจ.อสมท จึงได้จัดกิจกรรม DORAEMON RUN THAILAND 2024 BY MCOT ซึ่งเป็นการจัดกิจกรรม DORAEMON RUN เป็นประเทศที่ 3 ของโลก โดยกิจกรรม DORAEMON RUN THAILAND 2024 BY MCOT จะมีการจัดขึ้นทั้งหมด 5 จังหวัด ประกอบไปด้วย กรุงเทพมหานคร, เมืองพัทยา จังหวัดชลบุรี, จังหวัดนครราชสีมา, จังหวัดภูเก็ต และจังหวัดเชียงใหม่
• กิจกรรมนัดแรก กรุงเทพมหานคร วันอาทิตย์ที่ 24 มีนาคม 2567
• วันเสาร์ที่ 11 พฤษภาคม 2567 พัทยา
วิ่ง ฉาย แสง 2567 - CHARITY RUN FOR FIRST PHUKET CANCER CENTER 2024 วันอาทิตย์ที่ 24 มีนาคม 2567
วิ่ง ฉาย แสง 2567 - CHARITY RUN FOR FIRST PHUKET CANCER CENTER 2024 วันอาทิตย์ที่ 24 มีนาคม 2567 เริ่มตั้งแต่ 05.00 น. เป็นต้นไป ณ เขื่อนบางวาด จังหวัดภูเก็ต ระดมทุนในการสร้างศูนย์มะเร็งแห่งแรกของอันดามัน ในจังหวัดภูเก็ต “อาคารรังสีรักษา” โดยมูลนิธิน้อมเกล้า โรงพยาบาลวชิระภูเก็ต ประชาชนเข้าถึงบริการสาธารณสุขได้สะดวก รวดเร็ว ทั่วถึง และลดภาระค่าใช้จ่าย
Thai Festival Adelaide 2023 Siam Carnival - 25th March 2023 LINK
You are invited to join The Thai Festival 2023 Siam Carnival, which will be held on Saturday 25th March 2023 at King Reserve, Torrensville, South Australia.
Thai Festival 2023 will showcase the long tradition of Thai temple fair - a fun event with loads of finger food, unique costume and the old-school fun games!
Next year festival will bring back fond childhood memories with family friendly activities and rides, and tons of Thai-style street food.
Gather your friends and family to discover the best of Thailand at the Thai Festival 2023!
Pet healthcare 28–31 มีนาคม 2567
ผนึกกำลังพันธมิตร จัดงาน Pet Healthcare 2024 มหกรรมสุขภาพสัตว์เลี้ยงครั้งแรกของไทย วันที่ 28 – 31 มีนาคม 2567 เวลา 10.00 – 20.00 น. ณ MCC Hall ชั้น 3 เดอะมอลล์ไลฟ์สโตร์ บางกะปิ พบบริการตรวจสุขภาพสัตว์เลี้ยงฟรี โดยคณะสัตวแพทย์ชั้นนำของไทย เวทีเสวนา เวิร์กชอป ชอปปิ้งสินค้าเพื่อสัตว์เลี้ยง กระทบไหล่คนดังกับเหล่าสัตว์เลี้ยงแสนรัก พร้อมแคมเปญสุดพิเศษ สอยดาวช่วยเหลือสัตว์เจ็บป่วย
28 มีนาคม 2567 ดนตรีในสวนเฉลิมพระเกียรติ 6 รอบ
"ดนตรีในสวน" เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ครั้งที่ 1 ณ สวนเบญจกิติ กรุงเทพมหานคร วันพฤหัสบดีที่ 28 มีนาคม 2567 เวลา 17.15 น. เป็นต้นไป
กิจกรรมแสดงเทคโนโลยีพลังงานทดแทนเพื่อลดต้นทุนการผลิตสำหรับผู้ประกอบการ 29 มีนาคม 66
สำนักงานพลังงานจังหวัดสุพรรณบุรี ขอเชิญเยี่ยมชมกิจกรรมแสดงเทคโนโลยีพลังงานทดแทนเพื่อลดต้นทุนการผลิตสำหรับผู้ประกอบการ 29 มีนาคม 2566 ณ อาคารโดม 70 ปี วิทยาลัยเทคนิคสุพรรณบุรี
The Birds & Friends of Paradise สยามสแควร์ 29 - 31 มีนาคม 2567
The Birds & Friends of Paradise งานที่รวบรวมนกหลากหลายสายพันธุ์ พร้อมกับเหล่าผองเพื่อน มาให้ทุกคนได้ชมความน่ารักใจกลางสยามสแควร์ ตลอดเส้น Walking Street ตั้งแต่วันที่ 29 - 31 มีนาคม 2567 เดินเล่นชิล ๆ สัมผัสอย่างใกล้ชิดทั้ง ถ่ายรูป ป้อนอาหาร กับนกแก้วมาคอว์ นกกระตั้ว นกซันคอนัวร์, นกค๊อกคาเทล, นกฟอพัส, เป็ด Call Duck, ไก่ยักษ์ นกหายากเช่น นกอีมู, นกพิราบแฟนซี, นกพิราบหางแพน, นกพิราบลาฮอร์ และอื่นๆอีกมากมายหลากหลายสายพันธุ์กว่า 100 ตัว เพลิดเพลินกับสัตว์เลี้ยง Exotic หายาก Fennec fox, Bushbaby, กิ้งก่าเตกู, งูหลาม, อีกัวน่า และภายในงานมีบูทตรวจสุขภาพสัตว์เลี้ยงฟรี !! และสัตว์ที่นำมาแสดงมีคุณหมอผู้เชี่ยวชาญคอยดูแลอย่างใกล้ชิด
เทศกาลมะม่วงมัน หน้องแซง จ.สระบุรี 30 มี.ค.-3 เม.ย. 66
ขอเชิญเที่ยวงานเทศกาลมะม่วงมัน หน้องแซง 30 มี.ค.-3 เม.ย. ประจำปี 2566 ณ บริเวณหน้าเทศบาลหนองแซง อ.หนองแซง จ.สระบุรี น่าสนใจในงาน
- ประกวดธิดามะม่วง
- ประกวดสาว2
- สินค้าโอทอปภาครัฐและเอกชน
- สวนสนุกชุดใหญ่
กิจกรรมบนเวที
- วันที่ 30 มี.ค. แข่งขัน ทาบกิ่งต่อตา / ประกวดผลมะม่วง / ตำมะม่วงลีลา / ชมขบวนแห่ การแสดง เจน ไทรถแห่
- วันที่ 31 มี.ค. การประกดธิดามะม่วงตลับนาค (ธิดาช้าง) (โอเพ่นทั่วประเทศ) การแสดง วง Back Stage
- วันที่ 1 เม.ย. การประกวดธิดามะม่วงมันหนองแซง (โอเพ่นทั่วประเทศ) การแสดง วง Back Stage
- วันที่ 2 เม.ย. การแสดง วงวันดรีม เดอะคอมเมเดี้ยน
- วันที่ 3 เม.ย. การประกวดธิดามะม่วงมันหนองแซง (จำแลง) (โอเพ่นทั่วประเทศ) การแสดง กิมกลอย
งานกาแฟ Uttaradit Coffee Craft 2024 วันที่ 30-31 มีนาคม 2567
SOCOF x Ministry of Roasters (MoR) ร่วมกับ หอการค้าจังหวัดอุตรดิตถ์ การแข่งขัน แข่งชิมแบบแยกแยะ (Distingish)(cup tasters) และ แข่งดมกลิ่นจำแนก (Recognized) (Aromaster) ครั้งแรกกับงาน กาแฟ Craft Craft "Uttaradit Coffee Craft 2024" วันที่ 30-31 มีนาคม 2567 ณ สวนสาธารณะเทศบาลเมืองอุตรดิตถ์ นอกจากนี้ ยังมีกิจกรรมพิเศษ Coffee Sensory Master สำหรับ ผู้เข้าร่วมแข่งขัน
Uttaradit Coffee Craft อุตรดิตถ์คอฟฟี่คราฟต์ 30-31 มีนาคม 2024
UTTARADIT Coffee CRAFT 2024 วันที่ 30-31 มีนาคม 2024 @ สวนสารารณะเทศบาลเมืองอุตรดิตถ์ • รวมร้านกาแฟมากที่สุดในอุตรดิตถ์ • การแข่งขันชิงชนะเลิศ Cup Testers จากกระทรวงการคั่ว • Coffee Business Talk พี่หมู Bottomless ตัวท็อปวงการกาแฟไทย • รวมงาน Craft สุดติสต์ของอุตรดิตถ์ • รวมอุปกรณ์ วัตถุดิบ และเครื่องชงกาแฟ • รวมอาหารและเบเกอรี่ จากเพจดัง YouTube TikTok ของชาวอุตรดิตถ์
งานดนตรีอยุธยายามเย็น Blues Rock Pop Jazz 30-31มีนาคม 2567
งานดนตรีอยุธยายามเย็น Blues Rock Pop Jazz 30-31มีนาคม 2567 ณ.ลานสนามหญ้าหน้าคุ้มขุนแผน 17.00น.-22.30น. จัดมาทีเดียว 4 แนวดนตรี Blues แบบลุ่มลึก Rock แบบ90s Pop แบบน่ารักสบายๆ Jazz แบบโยกตามกันได้ เข้าชมฟรี ห้องน้ำดี ที่จอดรถเพียบบบบ นำเก้าอี้สนามหรือเสื่อปูนั่งมาด้วยนะ มีร้านค้าอร่อยๆ มากมายอีกด้วย ตารางการแสดง
30.03.2024
17-18.00 Annie Piano Studio (Classic Jazz Pop Rock)
18-19.30 Teddy (Jazz Swing)
19.30-21.00 More Than 15 (Pop rock)
21-22.30 VRU Bigband (Jazz swing)
31.03.2024
17-18.00 Mr.Noi & Friend (Psychedelic folksong)
18-19.30 Chara Band (Blues)
19.30-21.00 4Times (pop)
21-22.30 The Rock (Rock 90s)
Care Asia 2022 - 31 มีนาคม - 3 เมษายน 2565 ไบเทค บางนา LINK
โอกาสเชื่อมต่อธุรกิจกับคู่ค้าในตลาด Healthcare and Wellness (การดูแลสุขภาพและความเป็นอยู่) ในงาน Care Asia 2022 – งานแสดงสินค้า นวัตกรรม ที่ตอบโจทย์ความต้องการด้านการดูแลสุขภาพ และความเป็นอยู่อย่างครบวงจรแห่งเอเชีย งานมีกำหนดจัดระหว่างวันที่ 31 มีนาคม - 3 เมษายน 2565 ณ ฮอลล์ 101 ไบเทค บางนา
Art Of Salt เทศกาลประติมากรรมเกลือ ครั้งที่ 8
มาชิม•ช็อป•แชะ•เช็ค•แชร์ ด้วยกันที่ Art Of Salt เทศกาลประติมากรรมเกลือ ครั้งที่ 8 ตอน หลงเกลือหวานจนเกินต้าน วันที่ 31 มี.ค. - 2 เม.ย. 2566 เวลา 16.00 น. เป็นต้นไป ณ จุดชมวิวตำบลบางแก้ว พบกับกิจกรรมมากมายภายในงาน
• ชมงานศิลป์ ประติมากรรมเกลือแห่งเดียวในไทย
• อิ่มสุข/โอทอป ตลาดอาร์ตมาเช่
• ปิ้งย่างริมทะเล
• นิทรรศกาลเกลือบ้านแหลม
• เพลิดเพลินกับการแสดงดนตรีสด
Cha-am Under The Sea 31 มี.ค. - 2 เม.ย. 2566
เตรียมพบกับ Cha-am Under The Sea เทศกาลอาบแดด รับลม ชมดนตรี ริมชายหาดชะอำเหนือ ตลอดวันที่ 31 มี.ค. - 2 เม.ย. 2566 ณ ชายหาดชะอำเหนือ จังหวัดเพชรบุรี ฟรีคอนเสิร์ตที่จะเพิ่มดีกรีความร้อนแรงริมชายหาด
31 มี.ค. 2566 Burin และ Only Monday
1 เม.ย. 2566 Your Mood
2 เม.ย. 2566 Getsunova
We can Run Fund For Legs วันที่ 31 มีนาคม 2567
กิจกรรม เดิน-วิ่งการกุศล
We can Run Fund For Legs วันที่ 31 มีนาคม 2567 ณ ท้องสนามหลวง ระยะวิ่ง 2 ระยะ ได้แก่ Mini Marathon 10 KM / Micro Marathon 5 KM ร่วมเป็นส่วนหนึ่งของการบริจาคเงินรายได้จากการจัดกิจกรรมให้กับ มูลนิธิขาเทียม ในสมเด็จพระศรีนครินทราบรมราชชนนี เพื่อใช้ในการผลิตขาเทียมจำนวน 100 ขา มอบแก่คนพิการขาขาด ให้ได้มีคุณภาพชีวิตที่ดีขึ้น และสามารถใช้ชีวิตประจำวันได้อย่างมีความสุข จัดโดย กรมการเปลี่ยนแปลงสภาพภูมิอากาศและสิ่งแวดล้อม ร่วมกับ บริษัท ไทยเบเวอร์เรจแคน จำกัด บริษัท ไทยน้ำทิพย์ คอร์ปอเรชั่น จำกัด บริษัท หาดทิพย์ จำกัด (มหาชน) บริษัท ที.ซี.ฟาร์มาซูติคอล อุตสาหกรรม จำกัด
Sukreep Thailand Run Minimarathon 2024 วันที่ 31 มีนาคม 2567
การแข่งขันเดิน – วิ่งการกุศล "SUKREEP THAILAND RUN MINIMARATHON 2024" ครั้งที่ 1 วันที่ 31 มีนาคม 2567
เขตราษฎร์บูรณะ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีน 2-12 กันยายน 2567
เขตราษฎร์บูรณะ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า????ให้กับ(น้องหมา, น้องแมว) ระหว่างวันที่ 2 - 12 กันยายน 2567 เวลา 09.00 - 12.00 น. สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0-2428-4884 ต่อ 6820
รายชื่อ 108 หน่วยบริการ ที่ถูกยกเลิกสัญญา LINK
รายชื่อหน่วยบริการที่ถูกยกเลิกสัญญาระบบบัตรทอง
รอบที่ 1 จำนวน 18 แห่ง + 2 คลินิกทันตกรรม
1. เรือพระร่วงสหคลินิก
2. คลินิกเวชกรรมปิยะมินทร์ สาขาราม 2
3. คลินิกเวชกรรมปิยะมินทร์อุดมสุข
4. เพชรเกษม 54 คลินิกเวชกรรม
5. คลินิกเวชกรรมเพชรเกษม 102
6. เรือพระร่วงคลินิกเวชกรรม สาขาราม 39
7. คลินิกเวชกรรมรดาวุฒิ สาขาบางบอน1
8. เรือพระร่วงคลินิกเวชกรรม สาขา 2
9. เรือพระร่วงคลินิกเวชกรรม สาขา 3
10. เรือพระร่วงคลินิกเวชกรรม สาขา 4
11. เรือพระร่วงคลินิกเวชกรรม สาขาปฐวิกรณ์
12. คลินิกเวชกรรมหนองค้างพลู 1
13. สหคลินิกรดาวุฒิบางแวก
14. เรือพระร่วงคลินิกเวชกรรม สาขา 5
15. รักสุขภาพคลินิกเวชกรรม
16. คลินิกเวชกรรมท่าพระ
17. คลินิกเวชกรรมตลิ่งชัน
18. นิมิตใหม่คลินิกเวชกรรม
19. คลินิกทันตแพทย์อนุสรณ์
20. คลินิกทันตแพทย์สมรัก
รายชื่อหน่วยบริการที่ถูกยกเลิกสัญญาระบบบัตรทอง
รอบที่ 2 จำนวน 61 แห่ง + 3 คลินิกทันตกรรม
1. โรงพยาบาลบางไผ่โรงพยาบาลทั่วไปขนาดใหญ่
2. โรงพยาบาลปิยะเวทโรงพยาบาลทั่วไปขนาดใหญ่
3. โรงพยาบาลทั่วไปขนาดเล็กนันอา
4. โรงพยาบาลทั่วไปขนาดกลางโรงพยาบาลวิชัยเวช แยกไฟฉาย
5. โรงพยาบาลทั่วไปขนาดใหญ่ พระราม 2
6. โรงพยาบาลสุขสวัสดิ์โรงพยาบาลทั่วไปขนาดใหญ่
7. โรงพยาบาลทั่วไปขนาดเล็กบางขุนเทียน1
8. เทียนทะเลคลินิกเวชกรรม
9. บางขุนเทียน 2 คลินิกเวชกรรม
10. บางบอนคลินิกเวชกรรม
11. คลินิกเวชกรรมลาซาล
12. ธนารมย์สหคลินิก
13. คลินิกเวชกรรมทุ่งครุ
14. 15196 เพชรทองคำคลินิกเวชกรรม สาขาพระราม 2
15. 15196 เพชรทองคำคลินิกเวชกรรม สาขาพระราม 2
16. รื่นฤดีสหคลินิก
17. โรงพยาบาลบางปะกอก 9 โรงพยาบาลทั่วไปขนาดใหญ่
18. สหคลินิกกล้วยน้ำไท สาขาเดอะช็อปปส์แกรนด์พระราม 9
19. มิตรชุมชนคลินิกเวชกรรม สาขาลาดพร้าว 111
20. คลินิกเวชกรรมวิภาวดี ซอย 2
21. ธราวรรณสหคลินิก(เวชกรรมและการแพทย์แผนไทย)
22. คลินิกเวชกรรมลาดพร้าว 122
23. พระยาสุเรนทร์คลินิกเวชกรรม สาขาแกรนด์ออคิด
24. คลินิกเวชกรรมวิภาวดี 60
25. โพธิ์สุวรรณคลินิกเวชกรรม สาขาบางเขน
26. สายหยุดโรงพยาบาลทั่วไปขนาดเล็ก
27. คลินิกเวชกรรมเยนเนอรัลธนินทร
28. พหลฯ 58 คลินิกเวชกรรม
29. คลินิกเวชกรรมทวิมาศ สาขารามคำแหง 36/1
30. คลินิกเวชกรรมทวิมาศ สาขารามคำแหง 53
31. เจริญนครธนบุรีคลินิกเวชกรรม
32. สี่แยกประเวศคลินิกเวชกรรม
33. เมืองมีนบุรีคลินิกเวชกรรม
34. คลินิกเวชกรรมซอยนวลจันทร์
35. เจริญราษฎร์คลินิกเวชกรรม
36. สหคลินิกถนนนวมินทร์
37. คลินิกเวชกรรมสายสัมพันธ์
38. การแพทย์เทอดไทคลินิกเวชกรรม
39. คาเมราตาคลินิกเวชกรรม
40. คาเมราตาคลินิกเวชกรรม สาขาหลักสี่
41. คาเมราตาคลินิกเวชกรรม สาขาทุ่งสองห้อง
42. คาเมราตาคลินิกเวชกรรม สาขาเคหะร่มเกล้า
43. ลภาราม 1 คลินิกเวชกรรม
44. ลาดพร้าวการแพทย์คลินิกเวชกรรม
45. คลินิกเวชกรรมวังหิน
46. สร้างสุขคลินิกเวชกรรม
47. คลินิกเวชกรรมรวินท์มาศ
48. ศิริกัญญาคลินิกเวชกรรม
49. โรงพยาบาลทั่วไปขนาดใหญ่เพชรเกษม 2
50. จันทร์ 16 คลินิกเวชกรรม
51. มิตรไมตรีสหคลินิก สาขาลาซาล
52. สะพานสูงคลินิกเวชกรรม
53. สุขะวิทยาสหคลินิก
54. มิตรไมตรีสหคลินิก สาขาอุดมสุข
55. กานพัชทวีคลินิกเวชกรรม
56. เมืองธรรมคลินิกเวชกรรม (สาขาพัฒนาการ)
57. เมืองธรรมคลินิกเวชกรรม (สาขาพระโขนง)
58. เมืองธรรมคลินิกเวชกรรม
59. เมืองเพชรคลินิกเวชกรรม
60. เพชรเกษม 69 คลินิกเวชกรรม
61. คลินิกเวชกรรม ม.เศรษฐกิจ
62. คลินิกทันตกรรมยิ้มพราว
63. คลินิกทันตกรรมวี-เด็นทัลแคร์
64. คลินิกทันตกรรมวี-เด็นทัลแคร์
รายชื่อหน่วยบริการที่ถูกยกเลิกสัญญาระบบบัตรทอง
รอบที่ 3 จำนวน 108 แห่ง
1. คลินิกเวชกรรมอนันต์พัฒนา
2. สหคลินิกแพทย์ปัญญา 2
3. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาประชาอุทิศ
4. คลินิกเวชกรรมแพทย์ศรีนครินทร์
5. นวมินทร์การแพทย์คลินิกเวชกรรม สาขาหน้านิคมอุตสาหกรรมลาดกระบัง
6. นวมินทร์คลินิกเวชกรรม สาขาเคหะร่มเกล้า
7. นวมินทร์คลินิกเวชกรรม สาขาหัวตะเข้
8. คลินิกเวชกรรมแพทย์ฉัตรลดา
9. คลินิกเวชกรรมกล้วยน้ำไท สาขาสาทร
10. คลินิกเวชกรรมกล้วยน้ำไท สาขาชุมชน 70 ไร่
11. คลินิกเวชกรรมคลองเตย
12. คลินิกเวชกรรมกล้วยน้ำไท สาขาราม 2
13. คลินิกเวชกรรมกล้วยน้ำไท สาขาสุภาพงษ์ 3
14. คลินิกเวชกรรมกล้วยน้ำไท สาขาสุขุมวิท 56
15. คลินิกเวชกรรมกล้วยน้ำไท สาขาอ่อนนุช
16. สหคลินิกกล้วยน้ำไท สาขาสุขุมวิท 93
17. สหคลินิกกล้วยน้ำไท สาขาอโศก
18. นวมินทร์คลินิกเวชกรรม สาขาม.มหานคร
19. สหคลินิกกล้วยน้ำไท สาขาทุ่งสองห้อง
20. เตาปูนสหคลินิก
21. บางมด 3 คลินิกเวชกรรม
22. สหคลินิกแพทย์เวชกรรมและแพทย์แผนไทย
23. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาเจริญกรุง
24. คลินิกเวชกรรมแพทย์ปัญญา สาขาอ่อนนุช 39
25. สหคลินิกแพทย์ปัญญา 3
26. คลินิกเวชกรรมจันทน์สะพาน 4
27. วัชรพลเวชกรรมคลินิก
28. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาตลิ่งชัน
29. ว.พ.คลินิกการแพทย์
30. คลินิกเปรมประชาการแพทย์
31. คลินิกเวชกรรมบางไผ่
32. คลินิกเวชกรรมอนันต์พัฒนา สาขาทวีวัฒนา
33. คลินิกเวชกรรมอนันต์พัฒนา สาขาบางอ้อ
34. นวมินทร์คลินิกเวชกรรม สาขารัตนบัณฑิต
35. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาราษฎร์บูรณะ
36. นวมินทร์คลินิกเวชกรรม สาขาเคซีรามอินทรา
37. คลินิกเวชกรรมพุทธบูชา
38. คลินิกเวชกรรมอนันต์พัฒนา สาขาบางซื่อ
39. ทับสุวรรณคลินิกเวชกรรม
40. อินทัชเมดิแคร์คลินิกเวชรรม สาขาคลองสาน
41. คลินิกเวชกรรมบางไผ่-กระโจมทอง
42. นวมินทร์คลินิกเวชกรรม สาขาลำผักชี
43. สหคลินิกบางขุนเทียน 5
44. วิภาวดี 49 คลินิกเวชกรรม
45. ศิริพัฒน์สหคลินิก
46. นวมินทร์สหคลินิก สาขา รามอินทรา กม.8
47. สายไหมคลินิกเวชกรรม สาขาออเงิน
48. ธรรศวรรณสหคลินิก
49. มิตรชุมชนคลินิกเวชกรรม สาขาจันทรุเบกษา
50. มิตรชุมชนคลินิกเวชกรรม สาขารามอินทรา กม.2
51. โพธิ์สุวรรณคลินิกเวชกรรม สาขาถนนลาดปลาเค้า
52. พัฒนเวชสหคลินิก
53. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาบางเขน
54. ภานพคลินิกเวชกรรม
55. สายไหมคลินิกเวชกรรม สาขาตลาดวงศกร
56. เสนานิเวศน์คลินิกเวชกรรม
57. พหลโยธิน 65 คลินิกเวชกรรม
58. นวมินทร์คลินิกเวชกรรม สาขา มีนบุรี
59. สหคลินิกกล้วยน้ำไท สาขาตลาดยิ่งเจริญ
60. คลินิกเวชกรรมเพชรบุรี 12
61. งามเจริญคลินิกเวชกรรม
62. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาบางแค
63. จรัญ44คลินิกเวชกรรม
64. อิสรภาพคลินิกเวชกรรม
65. คลินิกเวชกรรมแพทย์ศรีนครินทร์ สาขาสี่แยกศรีนุช
66. พิบูลวัฒนาสหคลินิก
67. สุขกมลคลินิกเวชกรรม
68. อินทัชเมดิแคร์คลินิกเวชกรรม สาขาดินแดง
69. ธมวรรณสหคลินิก (เวชกรรมและการแพทย์แผนไทย)
70. เพชรคลินิกเวชกรรม
71. สหคลินิกบางชัน
72. มิตรชุมชนคลินิกเวชกรรม สาขาจอมทอง
73. จันทรเกษมคลินิกเวชกรรม
74. คลินิกเวชกรรมอยู่สุข
75. คลินิกเวชกรรมใกล้บ้าน
76. คลินิกเวชกรรมเจริญแพทย์ปิ่นเกล้า
77. คลินิกเวชกรรมเจริญแพทย์ดุสิต
78. นวมินทร์คลินิกเวชกรรม สาขาคันนายาว
79. นวมินทร์คลินิกเวชกรรม สาขาสะพานสูง
80. นาหลวงคลินิกเวชกรรม
81. สายไหมคลินิกเวชกรรม สาขาลาดกระบัง
82. สายไหมคลินิกเวชกรรม สาขาเสรีไทย (สายไหมสหคลินิก สาขาเสรีไทย)
83. สายไหมคลินิกเวชกรรม สาขาหทัยราษฎร์
84. สายไหมสหคลินิก สาขาหมู่บ้านนักกีฬา
85. โรงพยาบาลเวชกรรมเฉพาะทางอาชีวเวชศาสตร์อินเตอร์เมดขนาดเล็ก
86. ประชาสุขคลินิกเวชกรรม
87. ประชาสุขคลินิกเวชกรรม สาขาอินทามระ4 (ประชาสุขคลินิกเวชกรรม)
88. สุขเจริญสหคลินิก
89. สหคลินิกซอยเพชรบุรี 35
90. ดินแดงคลินิกเวชกรรม
91. สี่แยกมหานาคคลินิกเวชกรรม
92. สุนันทาคลินิกเวชกรรม
93. สุขผลินคลินิกเวชกรรม
94. เจริญกรุง 56 คลินิกเวชกรรม
95. บางจากคลินิกเวชกรรม
96. คลินิกเวชกรรมแพทย์ศรีนครินทร์ สาขาประเวศ
97. เจริญกรุง 91 คลินิกเวชกรรม
98. คลินิกเวชกรรมแพทย์ศรีนครินทร์ สาขาพัฒนาการ
99. บางกอกใหญ่คลินิกเวชกรรม
100. คลินิกเวชกรรมฉัตรลดา
101. ศิริพัฒน์เมดดิคัลคลินิกเวชกรรม
102. ศิริพัฒน์เมดดิคัลสหคลินิก
103. ธนารมย์สหคลินิก(ราชพฤกษ์-สวนผัก)
104. รพ.เกษมราษฎร์ รามคำแหงโรงพยาบาลทั่วไปขนาดใหญ่
105. รังสิยาเมดิคัลคลินิกเวชกรรม
106. สิทธิเวชร่มเกล้าคลินิกเวชกรรม
107. สหคลินิกตลาดบัว
108. พญาไทสิทธิเวชสหคลินิก
4 พ.ย.65 วิวาทะพรรคการเมือง พ.ร.บ.กัญชา
พ.ร.บ.กัญชา
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ตอบคำถามว่าหาก ร่าง พ.ร.บ.กัญชาฯ เสร็จไม่ทันไม่มีปัญหา เพราะภารกิจของ สธ. คือการปลดกัญชาออกจากการเป็นยาเสพติด ประเภทที่ 5 ซึ่งได้ทำสำเร็จลุล่วงแล้ว ไม่ใช่การออกฎหมายหากสมาชิก ส.ส.เห็นว่ากฎหมายกัญชายังไม่มีความสมบูรณ์ก็พิจารณาได้ในขั้นตอนการพิจารณากฎหมาย แต่เรื่องการควบคุมไม่มีอะไรที่ต้องเป็นกังวล
- นายสาทิตย์ วงศ์หนองเตย ส.ส.พรรค ปชป. กล่าวถึงกรณีนายอนุทินกล่าวหาว่า การออกมาคัดค้านร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... รับงานของใครมาหรือไม่ ว่า แปลกใจกับท่าทีของนายอนุทินมาก แต่ย้ำจุดยืนของพรรคว่ากัญชามีทั้งประโยชน์และโทษที่มีการนำไปใช้นันทนาการ เพราะขณะนี้กลายเป็นกัญชาเสรีสุดขั้วที่มีการปลดล็อกออกจากยาเสพติดประเภท 5 จึงเรียกร้องให้มีกฎหมายที่ดีรองรับ แต่ปัญหาคือกฎหมายที่ กมธ.จัดทำอยู่ ไม่เน้นเรื่องประโยชน์ทางการแพทย์ แต่เปิดช่องให้นำไปใช้นันทนาการ และบิดเบือนใช้ในด้านอื่นได้อีกมาก ยอมรับว่ากฎหมายที่อยู่ในสภาขณะนี้มีโอกาสที่จะพิจารณาไม่ทันในยุครัฐบาลนี้ หากไม่ทันมีทางเดียวคือการทำกฎหมายให้ดีที่สุดและปิดสุญญากาศการใช้กัญชา ขอให้นายอนุทินไปถามความรู้สึกของคนใน สธ. ที่กำลังหนักใจกับผู้ป่วยจิตเวช
- นายจุรินทร์ ลักษณวิศิษฏ์ รองนายกฯ และรมว.พณ. กล่าวว่า จุดยืน ปชป.สนับสนุนกัญชาทางการแพทย์แต่ไม่สนับสนุนกัญชาเสรี ที่สำคัญประชาธิปไตยต้องเคารพความเห็นต่างและไม่ระรานคนที่มีความเห็นต่าง ปชป.มีจุดของพรรค ไม่ได้เป็นลูกจ้างส่วนตัวของใครที่จะมาใช้อำนาจ ยิ่งทางการเมืองต้องเคารพเสียงประชาชนฟังเสียงประชาชน เรื่องนี้พรรคต้องฟังเสียง
ประชาชนเช่นเดียวกัน ถามว่าพรรครับงานก็ใครก็รับงานประชาชน
รอบ 8 ทีมสุดท้าย
9 ธันวาคม 2565
เวลา 22.00 น. โครเอเชีย 1 (4) - 1 (2) บราซิล (True4U True Sports 2)
10 ธันวาคม 2565
เวลา 2.00 น. เนเธอร์แลนด์ 2 (3) - 2 (4) อาร์เจนตินา (JKN18 True Sports 2)
เวลา 22.00 น. โมร็อกโก 1 - 0 โปรตุเกส (True4U True Sports 2)
11 ธันวาคม 2565
เวลา 2.00 น. อังกฤษ 1 - 2 ฝรั่งเศส (Thairath TV True Sports 2)
กิจกรรมในช่วงเทศกาล
เทศกาลมหกรรมงานมะม่วง ที่ปีที่ผ่านมา
เทศกาลกินมะม่วงโคราช วันที่ 13-17 เมษายน 2565 ณ ศาลากลางจังหวัดนครราชสีมา โดยจังหวัดนครราชสีมา
เทศกาลมะม่วง คุณภาพดีส่งตรงจากสวน ตัวจริง สดจริง ต้องที่แม็คโคร 9 - 15 มี.ค. 2565
มหกรรมวันมะม่วงน้ำดอกไม้ สมุทรปราการ วันที่ 11 - 13 มีนาคม 2565 ณ ศูนย์การค้ามาร์เก็ตวิลเลจ สุวรรณภูมิ อ.บางพลี
Phitsanulok Mango Fest 2021 เทศกาลมะม่วงน้ำดอกไม้สีทองสุดยิ่งใหญ่ วันที่ 24 - 29 มี.ค. 2564
Mango of SIAM ที่สุดแห่งมะม่วงไทย ถูกใจทั่วโลก วันที่ 2 – 6 เม.ย. 2564 นี้ ณ ห้างสรรพสินค้า ICONSIAM
Juicy Mangoes Week 2021 เทศกาลรวมมะม่วงที่ใหญ่ที่สุดในอุดรฯ 29 มี.ค. - 4 เม.ย. 2564 เซ็นทรัล อุดรธานี ร่วมกับสำนักงานเกษตรจังหวัดอุดรธานี
มหกรรมมะม่วงโคราช 8-13 เม.ย. 64 ชั้น G-Paris ศูนย์การค้าเทอร์มินอล21 โคราช ร่วมกับ สมาคมชาวสวนมะม่วงไทย
Mango Festival เทศกาลมะม่วงสามร้อยยอด ครั้งที่ 1 วันที่ 27-28 กุมภาพันธ์ 2564 นี้ณ ลานด้านหน้าศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน
งานวันมะม่วงและของดีเมืองเชียงใหม่ ครั้งที่ 10 ประจำปี 2562 ซึ่งจัดขึ้นระหว่างวันที่ 12–14 มิถุนายน 2562 ครบรอบ 10 ปี ของการจัดงานวันมะม่วงและของดีเมืองเชียงใหม่
งานมหกรรมมะม่วง ชวนชม มะยงชิด กินปลาชมบึงและของดีเมืองพิจิตร วันที่ 19-22 มีนาคม 2563 บึงสีไฟ จ.พิจิตร
มหกรรมมะม่วงปากช่อง วันที่ 4 - 10 เมษายน 2562 ณ เทอร์มินอล21 โคราช
อ.พิมพ์ใจ นัยโกวิทและ นพ. พีรพัฒน์ ต่างใจ ผอ.คลีนิคพานาซี เอกมัย 2 ผู้เชี่ยวชาญด้านสเต็มเซลล์ร่วมบรรยายให้ความรู้แก่ผู้เข้าฟัง ห้องตรวจศัลยกรรมกระดูก
ห้องตรวจศัลยกรรมกระดูก อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 2 เบอร์โทรศัพท์ 044-615002 ต่อ 4212
คาดการณ์ ส.ส. แบ่งเขต@16 พฤษภาคม 16.00 น. LINK
อันดับ 1 ก้าวไกล 113 ที่นั่ง
อันดับ 2 เพื่อไทย 112 ที่นั่ง
อันดับ 3 ภูมิใจไทย 67 ที่นั่ง
อันดับ 4 พลังประชารัฐ 39 ที่นั่ง
อันดับ 5 รวมไทยสร้างชาติ 23 ที่นั่ง
อันดับ 6 ประชาธิปัตย์ 22 ที่นั่ง
อันดับ 7 ชาติไทยพัฒนา 9 ที่นั่ง
อันดับ 8 ประชาชาติ 7 ที่นั่ง
อันดับ 9 ไทยสร้างไทย 5 ที่นั่ง
อันดับ 10 เพื่อไทรวมพลัง 2 ที่นั่ง
อันดับ 11 ชาติพัฒนากล้า 1 ที่นั่ง
คลินิกพิเศษนอกเวลาระดับรพ.ศูนย์ ภาคกลาง
คุยเรื่องมะเร็งรังไข่กับสถาบันมะเร็งแห่งชาติ โดย พญ.อุไรวรรณ คมไพบูลย์กิจ
คุยเรื่องมะเร็งรังไข่กับสถาบันมะเร็งแห่งชาติ โดย พญ.อุไรวรรณ คมไพบูลย์กิจ แพทย์ผู้เชี่ยวชาญด้านมะเร็งนรีเวช
1. การลง Content ในเว็บไซต์
Content ในรูปแบบบทความยาว-สั้น, Advertorial ประชาสัมพันธ์ ความรู้ทั่วไป ความรู้เรื่องราวเฉพาะด้าน (ทั้งไทยและอังกฤษ) หรือข้อมูลสถานบริการสุขภาพ บริการสุขภาพ ฯลฯ สามารถมีภาพประกอบได้ แทรกลิงค์ ไปยังภายนอก (เว็บไซต์ social media หรือ app) ได้ ทั้งนี้เนื้อหาจะต้องผ่านการพิจารณา
- ขอรับ Rate card การลง content (individual/agency) / ขอรับใบเสนอราคา อีเมล์มาที่ healthserv.net@gmail.com หรือ โทร. 081-6969454 (คุณธนพรรณ Sale MKT)
*เนื้อหาที่ไม่สามารถให้บริการได้ ได้แก่ สินค้าหรือบริการที่ผิดต่อหลักศีลธรรม จรรยาบรรณ หรือต่อหลักกฎหมาย การเมือง การพนัน ยาเสพติด ความรุนแรง หรืออื่นๆ ตามดุลพินิจของบริษัทฯ เป็นสำคัญ
สถาบันทันตกรรม ทำฟันฟรี 300 คน 20 ตุลาคม 2566
สถาบันทันตกรรมให้บริการตรวจฟัน-อุดฟัน-ขูดหินปูน-ถอนฟัน ฟรี 300 ราย เพื่อถวายเป็นพระราชกุศลแด่สมเด็จพระศรีนครินทราบรมราชชนนี เนื่องในวันทันตสาธารณสุขแห่งชาติ ในวันที่ศุกร์ที่ 20 ตุลาคม 2566 เริ่มลงทะเบียนได้วันที่ 9 ตุลาคม 2566 !!! (จนกว่าจะเต็มจำนวน) ลงทะเบียนที่ 02-1505787 หรือ Line : @iodforfun (ในวันและเวลาราชการ)
ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ บริการผู้ถือบัตรหลักประกันสุขภาพ
ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ เปิด-ปิด ตามวันและเวลาราชการ โทร. 02-4277949 บริการผู้ถือบัตรหลักประกันสุขภาพ
คลินิกตรวจรักษาโรค หรือคลินิกทันตกรรม สำหรับ บัตรที่ระบุชื่อสถานพยาบาล ดังนี้
1. ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ
ส่งต่อ - โรงพยาบาลสุขสวัสดิ์
- โรงพยาบาลเจริญกรุงประชารักษ์
- โรงพยาบาลตากสิน
- วชิรพยาบาล
facebook
ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะสรุปจำนวนนักท่องเที่ยวสะสม ปี 2566 (วันที่ 1 มกราคม - 31 ธันวาคม 2566)
สรุปจำนวนนักท่องเที่ยวสะสม ปี 2566 (วันที่ 1 มกราคม - 31 ธันวาคม 2566)
- นักท่องเที่ยวสะสม 28,042,131 คน (เติบโต 151% YOY)
- จำนวนนักท่องเที่ยวมากที่สุดจาก อันดับ 1) ประเทศมาเลเซีย 4,563,020 คน อันดับ 2) จีน 3,519,735 คน อันดับ 3) เกาหลีใต้ 1,658,688 คน อันดับ 4) อินเดีย 1,626,720 คน อันดับ 5) รัสเซีย 1,481,878 คน
มาเป็นเพื่อนกับโรงพยาบาลปทุมธานีกันเถอะ Line ID: @pathumhos
"มาเป็นเพื่อนกับโรงพยาบาลปทุมธานีกันเถอะ" เพื่อรับรู้ข่าวสารและการให้บริการและอื่นๆอีกมากมาย.... ผ่านไลนด์ โรงพยาบาลปทุมธานี Line ID: @pathumhos หรือสแกน คิวอาร์โค๊ด ในภาพ ก็ได้นะ อยากรู้อะไร อยากได้ข้อมูลใดจากรพ.ปทุมธานี หรือสอบถามเกี่ยวกับบริการ เรามีให้ผ่านไลน์ได้เลย
โรงพยาบาลสัตว์แม่ออน
โรงพยาบาลสัตว์แม่ออน บริการตรวจรักษา และให้คำปรึกษาเกี่ยวกับสุขภาพปศุสัตว์และสัตว์เลี้ยง แก้ไขปัญหาทางระบบสืบพันธุ์ คลอดยาก ฯลฯ บริการตรวจเช็คซ่อมบำรุงอุปกรณ์เครื่องรีดนม ตรวจรักษา ทำวัคซีน ตรวจทางห้องปฏิบัติการ พร้อมบริการ 24 ชม.
ติดต่อ Phone: .053-037071 / Mobile: 081-8846119
วันเวลาบริการ
- วันจันทร์ - ศุกร์ เวลา 08.30 - 12.00 น. และ 13.00 - 16.30 น.
- วันเสาร์ และวันหยุดนักขัตฤกษ์ เวลา 08.30 - 12.00 น. และ 13.00 - 16.30 น.
- วันอาทิตย์หยุดให้บริการ
- ฉุกเฉิน - ตลอด 24 ชั่วโมง ( โทรศพท์ 053-037071 , โทรศัพท์มือถือ 081-8846119 )
[
อัตราค่าบริการ]
-
- ค่าบริการทางการแพทย์
วันจันทร์-วันศุกร์ เวลา 9.00-17.30 น. ครั้ง/ตัว 50
วันจันทร์-วันศุกร์ เวลา 17.30-19.00 น. ครั้ง/ตัว 150
วันเสาร์และนักขัตฤกษ์ เวลา 9.00 - 17.30 น. ครั้ง/ตัว 150
-
- ค่าทำหมันสุนัขเพศเมีย เริ่มต้น 1000
- ค่าทำหมันสุนัขเพศผู้ เริ่มต้น 700
- ค่าทำหมันแมวเพศเมีย เริ่มต้น 800
- ค่าทำหมันแมวเพศผู้ เริ่มต้น 500
-
- ค่าตรวจอัลตร้าซาวด์ ครั้งละ 250
- ยากำจัดเห็บหมัด เริ่มต้น 50
- Vaccine เริ่มต้น 60
หมายเหตุ :
ค่าบริการนอกสถานที่ (ไป-กลับ) เริ่มต้นที่ 50 บาท
วัดไม่คิดค่าบริการนอกสถานที่
หยุดทุกวันอาทิตย์
หน่วยบริการสาธารณสุขวิถีใหม่
หน่วยบริการสาธารณสุขวิถีใหม่ ตามแผนจะมีคลินิกต่างๆ 7 ประเภท ดังนี้
- ร้านยาชุมชนอบอุ่น ดูแลเจ็บป่วยเล็กน้อย 16 อาการ ปรึกษาเภสัชกรและรับยา
- คลินิกพยาบาลชุมชนอบอุ่น รับบริการทำแผล ล้างตา ล้างจมูก เปลี่ยนสายให้อาหาร ฉีดยาตามแผนการรักษาของแพทย์ ตรวจรักษาโรคเบื้องต้น 32 กลุ่มอาการ เช่น เป็นไข้ตัวร้อน ปวดศีรษะ ปวดท้อง เป็นต้น
- คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น ตรวจแล็บ 22 รายการตามใบสั่งตรวจจากแพทย์
- คลินิกกายภาพบำบัดชุมชนอบอุ่น บริการฟื้นฟูผู้ป่วย 4 กลุ่มโรค ได้แก่ โรคหลอดเลือดสมอง สมองได้รับบาดเจ็บ กระดูกสะโพกหัก โดย รพ.ที่ให้การรักษาส่งตัวผู้ป่วยไปรับบริการที่คลินิกฯ
- คลินิกทันตกรรมชุมชนอบอุ่น อุดฟัน ถอนฟัน ขูดหินปูน เคลือบหลุมร่องฟัน เคลือบฟูลออไรด์
- คลินิกเวชกรรมชุมชนอบอุ่น ให้บริการตรวจรักษาโรคแบบผู้ป่วยนอก
- คลินิกแพทย์แผนไทยชุมชนอบอุ่น นวด ประคบ อบสมุนไพร เพื่อการรักษา
รถจักรไอน้ำออกวิ่งปีละ 6 ครั้ง
การรถไฟฯ นำหัวรถจักรไอน้ำแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลกครั้งที่ 2 ผลิตโดยบริษัท นิปปอน ชาร์เรียว จำกัด ซึ่งปัจจุบันเก็บรักษาและซ่อมบำรุงอยู่ที่โรงรถจักรธนบุรี โดยนำมาจัดเดินขบวนรถพิเศษนำเที่ยว เนื่องใน 6 วันสำคัญของทุกปี ประกอบด้วย
- วันที่ 26 มีนาคม วันคล้ายวันสถาปนากิจการรถไฟ เส้นทางกรุงเทพ – อยุธยา – กรุงเทพ
- วันที่ 3 มิถุนายน วันเฉลิมพระชนมพรรษาสมเด็จพระนางเจ้าสุทิดา พัชรสุธาพิมลลักษณ พระบรมราชินี เส้นทางกรุงเทพ – ฉะเชิงเทรา – กรุงเทพ
- วันที่ 28 กรกฎาคม วันเฉลิมพระชนมพรรษาพระบาทสมเด็จพระเจ้าอยู่หัว เส้นทางกรุงเทพ – อยุธยา – กรุงเทพ
- วันที่ 12 สิงหาคม วันเฉลิมพระชนมพรรษาสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง เส้นทางกรุงเทพ – ฉะเชิงเทรา – กรุงเทพ
- วันที่ 23 ตุลาคม วันปิยมหาราช เส้นทางกรุงเทพ – อยุธยา – กรุงเทพ
- วันที่ 5 ธันวาคม วันคล้ายวันพระบรมราชสมภพพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร เส้นทางกรุงเทพ – ฉะเชิงเทรา – กรุงเทพ
การป้องกัน โรคฮีทสโตรก (Heat Stroke)
อากาศร้อน ระวัง...โรคฮีทสโตรก (Heat Stroke) สังเกตอาการ ตัวร้อนจัด ผิวหนังแดงและแห้ง เหงื่อไม่ออก สับสน มึนงง
การป้องกัน
- ติดตามข่าวสาร พยากรณ์อากาศ อุณหภูมิสูงสุดรายวัน
- ดื่มน้ำสะอาดบ่อย ๆ วันละ 6-8 แก้ว
- ใส่เสื้อผ้าที่มีสีอ่อน ไม่หนา ระบายความร้อนได้ดี
- หลีกเลี่ยงเครื่องดื่มแอลกอฮอล์
- อยู่ในห้องที่อากาศระบายได้ดี
- หลีกเลี่ยงกิจกรรมกลางแดดเป็นเวลานาน
ตารางบริการคลินิกแพทย์ทางเลือก วันจันทร์ถึงวันศุกร์ และวันเสาร์
คลินิกแพทย์ทางเลือก ให้บริการแพทย์แผนไทย และแพทย์แผนจีน มีทั้งในเวลาราชการและนอกเวลาราชการ ดังนี้
แพทย์แผนไทย เปิดบริการทุกวันจันทร์ถึงวันศุกร์ เวลา 8.30น -15.00 น.
• มีนอกเวลาราชการ วันอังคาร 16.00-19.00 น
• วันเสาร์ เวลา 8.30-11.30น .
แพทย์แผนจีน เปิดบิการ ทุกวันจันทร์ และวันศุกร์ เวลา 8.30 -15.00 น
***และยังไม่มีคลินิกนอกเวลาราชการ**
การดูแลคุณแม่หลังคลอดด้วยศาสตร์ทางแพทย์แผนไทย ศาสตร์ทางแพทย์แผนไทยเปิดดูแลคุณแม่หลังคลอดดังนี้
• เปิดบริการอยู่ไฟหลังคลอด
• เปิดท่อน้ำนมให้น้ำนมไหลมากขึ้น
ทุกวันพุธและวันพฤหัส
สามารถสอบถามและนัดได้ ที่แผนกผู้ป่วยนอกโรงพยาบาลปากเกร็ดข้างเทศบาลนครปากเกร็ด
โทร 02-9609900 ต่อ 300 หรือ 080-5752970
การดูแลผู้ป่วยติดเตียงในช่วงฤดูร้อน
การดูแล ผู้สูงอายุติดเตียงในช่วงฤดูร้อน
- จัดห้องให้สะอาด อากาศถ่ายเทสะดวก สามารถเคลื่อนย้ายผู้ป่วยได้สะดวก กรณีเกิดเหตุฉุกเฉิน
- เปิดเครื่องปรับอากาศในช่วงที่สภาพอากาศร้อนจัดในตอนกลางวัน หากไม่มี ให้เปิดหน้าต่าง เปิดพัดลมเพื่อช่วยระบายอากาศ ไม่ควรเปิดพัดลมจ่อใส่ผู้สูงอายุเพราะจะทำให้เป็นไข้หวัดได้ง่าย
- ระวังเรื่องแผลกดทับ พลิกตัวทุกๆ 2 ชั่วโมงและเปลี่ยนท่านอนสลับกันไป เพื่อป้องกันการเกิดแผลกดทับและความอับชื้น
- ใช้ผ้าชุบน้ำบิดหมาดๆ เช็ดตัวผู้สูงอายุเพื่อระบายความร้อน
- ดูแลให้ผู้สูงอายุดื่มน้ำสะอาดอย่างเพียงพอ โดยไม่ต้องรอให้กระหายน้ำ
- เตรียมยารักษาโรคประจำตัว ให้พร้อม หากมีเหตุฉุกเฉิน ให้รับติดต่อสถานพยาบาลใกล้ที่สุด หรือ โทร. 1669
เดือนเมษายน Love Dog โครงการทำหมันสุนัขจังหวัดชุมพร
Love Dog โครงการทำหมันสุนัขจังหวัดชุมพร โปรแกรมทำหมันสุนัขฟรี
เดือนเมษายน
- วันอังคาร ที่ 2 หน่วยทำหมัน LOVE DOG บ้านถั่วเขียวถั่วคั่ว
- วันพุธ ที่ 3 ศาลาหมู่ 6 นาทุ่ง
- พฤหัส ศุกร์ ที่ 4-5 อาคารอเนกประสงค์ ท่ายาง หมู่ 1
- เสาร์ ที่ 6 (นอกเขตพื้นที่) ท่าแซะ สมาคมกาแฟดวงดี
- วันอาทิตย์ ที่ 7 ศาลาหมู่ 10 เขากล้วย ตำบลหาดพันไกร
ฟรี สำหรับสุนัข
- คิวเปิด 09:00 น.
- กรุณานำสุนัขของท่านมาพร้อมกับท่านเพื่อต่อคิว
- นำบัตรประจำตัวประชาชนมาด้วยสำหรับการลงทะเบียน
- ผู้ที่มาก่อนจะได้รับสิทธิ์ก่อน
มีบริการรับส่งฟรี (เฉพาะในเขตบริการ)
มีบริการจับ/ยิงลูกดอก ฟรี
ดนตรีในสวน เมษายน 67
- เสาร์ที่ 6 เมษายน 2567 สวนปทุวนานุรักษ์ วง Bangkok Trio เริ่ม 16.30 น. / สวนวชิรเบญจทัศ วง Bangkok Brass Quintet feat. กองปราบ ปณิธาน เริ่ม 17.00 น. / สวนลุมพินี (ลานสวนปาล์ม) วง Plutonium เริ่ม 17.00 น.
- อาทิตย์ที่ 7 เมษายน 2567 สวนธนบุรีรมณ์ วง Bangmod String Orchestra เริ่ม 16.30 น. /. สวนลุมพินี วงดนตรีกรุงเทพมหานคร เริ่ม 16.30 น. / สวนวชิรเบญจทัศ วงโปงลาง กรุงเทพมหานคร เริ่ม 16.30 น. / อุทยานเบญจสิริ วง Bangkok String Ensemble feat. กองปราบ ปณิธาน เริ่ม 17.00 น.
- อาทิตย์ที่ 7 เมษายน 2567 สวนธนบุรีรมณ์ วง Bangmod String Orchestra เริ่ม 16.30 น. /. สวนลุมพินี วงดนตรีกรุงเทพมหานคร เริ่ม 16.30 น. / สวนวชิรเบญจทัศ วงโปงลาง กรุงเทพมหานคร เริ่ม 16.30 น. / อุทยานเบญจสิริ วง Bangkok String Ensemble feat. กองปราบ ปณิธาน เริ่ม 17.00 น.
- เสาร์ที่ 20 เมษายน 2567 สวนลุมพินี กลุ่มศิลปินเยาวนชน Good time (ไทม์) เริ่ม 17.00 น. / สวนปทุมวนานุรักษ์ วง Bangkok Trio เริ่ม 17.00 น. / สวนเบญจกิติ วง hot เริ่ม 17.00 น.
- อาทิตย์ที่ 21 เมษายน 2567 สวนเบญจกิติ กลุ่มวงดนตรี Music House - วง Mercury - วง Red Ribbon - วง Grade up เริ่ม 17.00 น. /. สวนลุมพินี วงคอนเทม กรุงเทพมหานคร เริ่ม 17.00 น. / อุทยานเบญจสิริ วงดนตรีกรุงเทพมหานคร เริ่ม 17.00 น.
22-24 มีนาคม 2567 ตรวจสุขภาพตา ฟรี
แจ้งข่าวประชาสัมพันธ์ สำหรับประชาชน ผู้ที่สนใจตรวจสุขภาพตา ตรวจเช็ดสายตา ตรวจหาต้อกระจกพร้อมรักษาได้ที่โรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ ในวันที่ 22-24 มีนาคม 2567 สามารถเข้ามาตรวจสุขภาพตาที่โรงพยาบาลธีรวัฒน์ ได้เลยนะคะ ไม่มีค่าใช้จ่ายใดใดค่ะ ตั้งแต่เวลา 07:30 น. ถึง 15:00 น. สอบถามเพิ่มเติมได้ที่ 063-872-2461 หรือ 043-811-757สายด่วนฉุกเฉินในจ.น่าน
สายด่วนฉุกเฉิน ในพื้นที่ น่าน แจ้งขอความช่วยเหลือกับศูนย์บรรเทาสาธารณภัยมณฑลทหารบกที่ 38 ได้ตามเบอร์โทร 054-774083 054-774084 054-774085 ต่อ 71237 หรือ ต่อ 71266
แจ้งเหตุประสบภัย สายด่วน 1784
สำนักงานปภ.น่าน 054-716174
การไฟฟ้าส่วนภูมิภาคในพื้นที่หรือสายด่วน PEA โทร.1129
การไฟฟ้าส่วนภูมิภาคจังหวัดน่าน 054-718120
กรมทางหลวง 1586 054-741379
เจ็บป่วยฉุกเฉิน. 1669.
มณฑลทหารบกที่ 38. 054-775557
ศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 เขตดินแดง
เขตดินแดง ประชาสัมพันธ์ การออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ครั้งที่ 2 / 2567 ร่วมกับศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ประจำปี 2567 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัข แมว และสัตว์เลี้ยงในพื้นที่เขตดินแดง ครั้งที่ 2/2567 ระหว่างวันที่ 2-13 กันยายน 2567 เวลา 10.00 - 12.00 น. ขอเชิญประชาชนผู้ที่สนใจทุกท่านนำสุนัข แมว และสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาดังกล่าวได้เลย
โปรโมชั่น ศูนย์เลสิก @ เมตตา LINK
ทำเลสิก ศูนย์เลสิก @ เมตตา โดยแพทย์เฉพาะทางด้านกระจกตา และการแก้ไขสายตาผิดปกติ โรงพยาบาลเมตตาประชารักษ์ (วัดไร่ขิง)
ประเภทของการแก้ไขสายตา
PRK พีอาร์เค
Blade LASIK เลสิกใบมีด SBK
Femto LASIK เฟมโตเลสิก
ReLEx SMILE รีเลกส์สมายล์
จะตรวจและผ่าตัดวันเดียวกันก็ได้ (เพื่อประหยัดเวลาในการเดินทาง) หรือ จะตรวจอย่างเดียวก่อน และทำนัดภายหลังก็ได้
เพื่อความสะดวกในการเข้ารับบริการกรุณานัดหมายล่วงหน้าอย่างน้อย 3-5 วันทำการ ก่อนวันที่ท่านต้องการตรวจ
สอบถามข้อมูลเพิ่มเติม
Tel : 061-413-8860 หรือ 034-388-700 ต่อ 9236,9985 (ในเวลาราชการ)
Line ID : @lasikmetta
นนทบุรีไบค์วีค 1 เมษายน 2566 LINK
นนทบุรีไบค์วีค ฉลองครบ 12 ปี (Nonthaburi Bike Week 12 Anniversary) 1 เมษายน 2566 ศิลปินคาราบาว คนด่านเกวียน เต็มวง โดย Bikeweek เมืองนนท์
ป๋าเวณีปี๋ใหม่เมืองเจียงใหม่ สงกรานต์เชียงใหม่ 2566 วันที่ 12-16 เมษายน 2566 LINK
เทศบาลนครเชียงใหม่ ชวนเที่ยวเทศกาลงานประเพณีสงกรานต์เชียงใหม่ “ป๋าเวณีปี๋ใหม่เมืองเจียงใหม่ ประจำปี 2566” ตั้งแต่วันที่ 12-16 เมษายน 2566 ณ ข่วงประตูท่าแพ ลานอนุสาวรีย์สามกษัตริย์ จังหวัดเชียงใหม่ - พิธีทำบุญตักบาตร เมืองเจียงใหม่ งานประเพณีสมโภชพระพุทธสิงหิงค์ ขบวนแห่การประกวดแม่หญิงขี่รถถีบกางจ้อง พิธีหุงน้ำศักดิ์สิทธิ์ สวดพุทธมนต์ กิจกรรมตานตุงไชย 726 ปีเมืองเชียงใหม่ การแสดงศิลปะพื้นบ้านล้านนา กิจกรรมสืบสานฮีตฮอย ย้อนรอยปี๋ใหม่เมือง
4 มีนาคม 2566 ออกหน่วยรับบริจาคดวงตา อวัยวะ โลหิต ณ วัดมเหยงคณ์ ต.หันตรา
ผลการดำเนินการ ได้ยอดบริจาคโลหิต 50 ยูนิต 22,500 ซีซี
ผู้แจ้งความจำนงบริจาคอวัยวะ 53 ราย
ผู้แจ้งความจำนงบริจาคดวงตา 50 ราย
อนโมทนาบุญร่วมกัน
งานประเพณีก่อพระทรายวันไหลบางแสน 16-17 เมษายน 2566 LINK
เทศบาลเมืองแสนสุข ร่วมกับองค์การบริหารส่วนจังหวัดชลบุรี และจังหวัดชลบุรี ได้กําหนดจัดงานประเพณีก่อพระทรายวันไหลบางแสน ประจําปี พ.ศ. 2566 ในระหว่างวันที่ 16-17 เมษายน 2566 ณ บริเวณชายหาดบางแสน ตําบลแสนสุข อําเภอเมืองชลบุรี จังหวัดชลบุรี เพื่อเป็นการอนุรักษ์และส่งเสริมประเพณีท้องถิ่นให้เป็นที่รู้จักแพร่หลายสืบต่อไป ในการจัดงานครั้งนี้มีกิจกรรมต่างๆ ประกอบด้วย ร่วมปิดทอง - สรงน้ำพระพุทธรูป ร่วมทำบุญตักบาตรภัตตาหารคาว รดน้ำขอพรผู้สูงอายุ การประกวดก่อพระทรายวันไหลบางแสน การแข่งขันกีฬาพื้นบ้าน การแสดงวัฒนธรรมบนเวที และชมนิทรรศการทางวัฒนธรรม การแสดงดนตรีของเหล่าศิลปิน นักร้อง นักแสดง ทั้งสตริงและลูกทุ่งชื่อดัง ติดต่อสอบถาม กองการศึกษา เทศบาลเมืองแสนสุข หมายเลขโทรศัพท์ 038-193585 (ในวันและเวลาราชการ)
Thailand Coffee Hub 2024 @เซ็นทรัลพัทยา วันที่ 3 - 8 เม.ย. 2567
Thailand Coffee Hub 2024 ภาคตะวันออก @เซ็นทรัลพัทยา วันที่ 3 - 8 เม.ย. 2567 @เซ็นทรัล พัทยา เทศกาลกาแฟที่ใหญ่ที่สุดในภาคตะวันออก เข้มข้นถึงใจชุดใหญ่ไฟกระพริบ กับการรวมคอมมูนิตี้ของคนรักกาแฟตัวจริง ทั้งบาริสต้า ร้านกาแฟ เกษตรกร โรงคั่วกาแฟ ให้มาเอนจอยกับสิ่งที่เรารักไปพร้อม ๆ กัน แล้วเตรียมตัวไปเจอกันได้ที่งาน
Thailand Coffee Hub 2024 @เซ็นทรัลพัทยา วันที่ 3 - 8 เม.ย. 2567
Thailand Coffee Hub 2024 ภาคตะวันออก @
เซ็นทรัลพัทยา วันที่ 3 - 8 เม.ย. 2567 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคตะวันออก เข้มข้นถึงใจชุดใหญ่ไฟกระพริบ กับการรวมคอมมูนิตี้ของคนรักกาแฟตัวจริง ทั้งบาริสต้า ร้านกาแฟ เกษตรกร โรงคั่วกาแฟ ให้มาเอนจอยกับสิ่งที่เรารักไปพร้อม ๆ กัน แล้วเตรียมตัวไปเจอกันได้ที่งาน
งานประเพณีวันไหลนาเกลือ พัทยา 18-20 เมษายน 2566 LINK
เมืองพัทยามีวาระงานประเพณีเฉลิมฉลองช่วงเทศกาลสงกรานต์ ช่วง 18-20 เมษายน ณ ลานโพธิ์นาเกลือ พัทยา เป็นประจำทุกปี
งานประเพณีวันไหลนาเกลือ (18 เมษายน) ณ สวนสาธารณะลานโพธิ์นาเกลือ มีการทำบุญตักบาตรข้าวสารอาหารแห้ง พระสงฆ์ จำนวน 99 รูป สรงน้ำพระพุทธรูปและรดน้ำขอพรจากผู้สูงอายุ จากนั้นจะมีการเคลื่อนขบวนแห่พระพุทธรูปออกจากสวนสาธารณะลานโพธิ์ไปรอบตลาดนาเกลือเพื่อให้ผู้คนที่อยู่โดยรอบได้สรงน้ำพระเพื่อเป็นศิริมงคลในงานวันไหล พัทยา
สำหรับรายละเอียดกิจกรรมงานประเพณีวันไหลนาเกลือ ประจำปี 2566 นี้ ติตตามข้อมูลอย่างต่อเนื่องหรือสอบถาม เมืองพัทยา โทร. 038-253100 ต่อ 4091 หรือเพจ PR Pattaya
4 เมษายน 2566 ทำหมันสุนัขและแมว ตำบลละหาร LINK
ประชาสัมพันธ์เชิญเจ้าของสัตว์เลี้ยง ลงทะเบียนทำหมันสุนัขและแมว ตามโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ประจำปี 2566 ในวันที่ 4 เมษายน 2566 ณ องค์การบริหารส่วนตำบลละหาร #สนใจลงทะเบียนผ่าน QR code ดังรูป
สิ่งที่ต้องเตรียมสุนัขและแมวก่อนทำหมัน
✅งดน้ำและอาหาร อย่างน้อย 8-12 ชั่วโมง
✅ทำหมันสุนัขและแมว อายุ 4 เดือนขึ้นไป
✅สุนัขและแมวมีสุขภาพแข็งแรง ไม่มีอาการป่วย
✅ไม่อยู่ในระหว่างตั้งท้อง และไม่เป็นสัด
✅นำบัตรประชาชนของเจ้าของสุนัขและแมวมายื่นในที่ดำเนินการ
หมายเหตุ‼️
จำกัดจำนวนสัตว์เลี้ยงที่ประสงค์ทำหมัน 2 ตัว ต่อราย
สงวนสิทธิ์เฉพาะประชาชนตำบลละหาร เท่านั้น
ติดต่อสอบถามข้อมูลเพิ่มเติม โทร. 0 2157 0116-8 ต่อ 132 กองส่งเสริมการเกษตร
ประเพณีสงกรานต์ ชาวปากน้ำ ประจำปี 2566
ประเพณีสงกรานต์ประจำปี2566 ขอเชิญชวนพี่น้องชาวปากน้ำ สมุทรปราการทุกท่านร่วมงานประเพณีสงกรานต์ ประจำปี 2566 #เทศบาลนครสมุทรปราการ จัดงานโครงการส่งเสริมการท่องเที่ยวเชิงวัฒนธรรมและประเพณีสงกรานต์ ประจำปี 2566 วันพฤหัสบดีที่ 13 เมษายน 2566 ณ ตลาดเชิงท่องเที่ยว ถนนท้ายบ้าน และบริเวณหน้าศาลากลางจังหวัดสมุทรปราการ
ณ ตลาดเชิงท่องเที่ยว มีกิจกรรมดังนี้ เวลา 08.00 น. กิจกรรมทำบุญตักบาตร (ข้าวสารอาหารแห้ง) เนื่องในวันสงกรานต์ (ปีใหม่ไทย) เวลา 09.00 น. กิจกรรมสรงน้ำพระพุทธรูป เวลา 09.00 น. กิจกรรมประกวดผู้สูงอายุอนุรักษ์แต่งกายไทย เวลา 10.30 น. กิจกรรมรดน้ำขอพรผู้สูงอายุ
ณ บริเวณหน้าศาลากลางจังหวัดสมุทปราการ มีกิจกรรมดังนี้ เวลา 11.00 น. ลงทะเบียนขบวนแห่จากหน่วยงานต่างๆ เวลา 12.00 น. เคลื่อนขบวนแห่ออกจากศาลากลางฯ
5 เมษายน 2566 เทศบาลตำบลบางม่วง บริการทำหมันสุนัขและแมวฟรี(พันธุ์ไทย) LINK
เทศบาลตำบลบางม่วงร่วมกับปศุสัตว์อำเภอบางใหญ่ บริการทำหมันสุนัขและแมวฟรี(พันธุ์ไทย)
ในวันที่ ๕ เมษายน ๒๕๖๖ ณ ศาลาประชาคมเทศบาลตำบลบางม่วง
***โดยมีรายละเอียดและการเตรียมตัวก่อนการผ่าตัดทำหมันสุนัขและแมว ดังนี้
๑. มาลงทะเบียนรับบัตรคิวทำหมันสุนัขและแมว ได้ที่กองสาธารณสุขฯเทศบาลตำบลบางม่วง(ตั้งแต่บัดนี้เป็นต้นไป ถึงวันที่ ๓๑ มีนาคม ๒๕๖๖) ตามวันและเวลาราชการ
๒. สุนัข – แมว พันธุ์ไทยต้องมีสุขภาพดีแข็งแรงอายุตั้งแต่ ๖ เดือนขึ้นไป
๓. งดน้ำ – งดอาหาร อย่างน้อย ๘ - ๑๒ ชั่วโมง
๔. ทำความสะอาด อาบน้ำให้ล่วงหน้า ๑ วัน
๕. สุนัข –แมว แม่ลูกอ่อน สามารถทำหมันได้ หลังจากลูกอายุ ๒ เดือนขึ้นไป
๖. มีกรง หรือปลอกคอสายจูงป้องกันสุนัข – แมว หลุดหาย
๗. สุนัข – แมว เพศเมีย จะต้องไม่อยู่ในช่วงของการเป็นสัด
ประเพณีสงกรานต์ นครปฐม ประจำปี 2566
เทศบาลนครนครปฐม ขอเชิญร่วมงานประเพณีสงกรานต์ ประจำปี 2566 เพื่อเป็นการส่งเสริมและอนุรักษ์ไว้ซึ่งขนบธรรมเนียมประเพณีและวัฒนธรรมอันดีงามของไทยให้คงอยู่สืบไป
วันพฤหัสบดีที่ 13 เมษายน 2566 เวลา 08.30 น. พิธีสรงน้ำพระ และรดน้ำขอพรผู้สูงอายุ บริเวณอาคารอเนกประสงค์ ศูนย์เยาวชนเทศบาลนครนครปฐม (สนามจันทร์)
วันอาทิตย์ที่ 16 เมษายน 2566 เวลา 13.00 น. ร่วมสรงน้ำพระ และเล่นน้ำสงกรานต์ พร้อมทั้งชมดนตรีจากเด็กรุ่นใหม่ชาวนครปฐม จากมหาวิทยาลัยศิลปากร มหาวิทยาลัยมหิดล มหาวิทยาลัยราชภัฏนครปฐม และโรงเรียนสาธิตมหาวิทยาลัยศิลปากร ณ บริเวณถนนราชดำเนิน (ถนนต้นสน)
"สืบสานสงกรานต์วิถีไทย ร่วมสานใจ สู่สากล"
** งดขบวนแห่งานประเพณีสงกรานต์ ประจำปี 2566 ตามมติที่ประชุมคณะกรรมการจัดงาน ประเพณีสงกรานต์ประจำปี 2566 วัดพระปฐมเจดีย์ ราชวรมหาวิหาร **
พัทลุงคอฟฟี่ คราฟท์ มิวสิค 2024 งานกาแฟใหญ่สุดในพัทลุง 6-7 เมษายน 67
พัทลุงคอฟฟี่ คราฟท์ มิวสิค 2024 งานกาแฟใหญ่สุดในพัทลุง 6-7 เมษายน 67 "ทุ่งหญ้าเขียว เคล้ากลิ่นกาแฟ แลงานคราฟท์ งดงามวิจิตรด้วยวัฒนธรรมเมืองลุง“ ณ สวนเขาเจียก ภายในงานพบกับกิจกรรมมากมาย ร้านกาแฟชื่อดังในพัทลุง ร้านขนมเบเกอรี่ มากมาย งานคราฟท์ งานศิลปะทำมือจากทั่วทุกมุมพัทลุง ดนตรีในสวนที่จะสร้างบรรยากาศสุดวิเศษตลอดทั้งงาน และการแสดงท้องถิ่นของจังหวัดพัทลุง เครื่องดื่มคราฟท์ท้องถิ่นหลากหลายชนิด แกลลอรี่ อาร์ตของพัทลุงและเรื่องราวความเป็นมา ที่จอดรถสะดวกมากมาย
7 เมษายน วันอนามัยโลก World Health Day
7 เมษายน 1948 เป็นก่อตั้งองค์การอนามัยโลก (WHO) จึงถือเอาวันก่อตั้งองค์กรที่มีหน้าที่ด้านการอนามัยของโลกหลังยุคสงครามโลกครั้งที่ 2 ให้เป็นวันอนามัยโลกของทุกปี (
World Health Day) ความสำคัญของวันอนามัยคือ เป็นวันที่องค์การสหประชาชาติใช้เป็นโอกาสรณรงค์กับสมาชิกทุกประเทศ ให้ประชาชนและทุกภาคส่วนของสังคมตระหนักถึงความสำคัญของสุขภาพ ทั้งในเรื่องการควบคุม ป้องกัน แก้ปัญหาสุขภาพ และส่งเสริมด้านสุขภาพประชาชนอย่างทั่วถึงและเท่าเทียมกัน
งานสงกรานต์ขอนแก่น ถนนข้าวเหนียว สาดซิ่ง สาดศิลป์ 8 – 15 เมษายน 66
เทศบาลนครขอนแก่น จัดงานสงกรานต์ปีนี้ “งานประเพณีสุดยอดสงกรานต์อีสาน เทศกาลดอกคูนเสียงแคนและถนนข้าวเหนียว ” ประจำปี 2566 ในธีม สาดซิ่ง สาดศิลป์ รวม 8 วันเต็ม ระหว่างวันที่ 8-15 เมษายน 2566 ณ บริเวณเวทีลาน 200 ปี บึงแก่นนคร แบ่งพื้นที่จัดงาน 2 จุด
- พื้นที่บริเวณบึงแก่นนคร ช่วง 8 – 12 เม.ย. 66
- พื้นที่บริเวณศาลหลักเมืองขอนแก่น และถนนข้าวเหนียว (ถนนศรีจันทร์) ช่วง 12 – 15 เม.ย. 66
มาสนุกให้เต็มที่กับประเพณีร่วมสมัยหัวใจวัฒนธรรมอีสาน
สงกรานต์พิษณุโลก ถนนรดน้ำสงกรานต์สองแคว 12-15 เมษายน 2566
งานประเพณีสงกรานต์ ประจำปี 2566 มีการสาธิตการก่อเจดีย์ทราย สรงน้ำพระพุทธรูป เล่นน้ำสงกรานต์แบบไทย การละเล่นเด็กไทย รำมังคละ และกลองยาว ณ สวนกลางเมือง เทศบาลนครพิษณุโลก ในวันที่ 12 เมษายน 2566 เวลา 17.30 น. พิธีสรงน้ำพระสงฆ์ทรงสมณศักดิ์ ณ พระวิหารพระอัฏฐารส วัดพระศรีรัตนมหาธาตุวรมหาวิหาร วันที่ 13 เมษายน เวลา 07.30 น. เนื่องในวันสงกรานต์ มีพิธีทำบุญตักบาตรข้าวสารและอาหารแห้ง การปล่อยนกปล่อยปลาและการถวายผ้าห่มและสรงน้ำพระพุทธชินราช ณ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร การเล่นน้ำตามประเพณีสงกรานต์ ในกิจกรรม “ถนนเล่นน้ำสงกรานต์วิถีไทยสองแคว” ณ บริเวณสวนกลางเมืองพิษณุโลก และถนนสายต่างๆ ในเขตเทศบาลนครพิษณุโลก จัดน้ำพลุลีลา บริเวณวงเวียนสถานีรถไฟ ขบวนแห่อัญเชิญพระพุทธชินราชจำลอง และขบวนแห่นางสงกรานต์ ของการท่องเที่ยวแห่งประเทศไทย สำนักงานพิษณุโลก เทศบาลนครพิษณุโลก สภาวัฒนธรรม-เทศบาลนครพิษณุโลก และเครือข่ายชุมชนในเขตเทศบาลนครพิษณุโลก ช่วงค่ำมีพิธีเปิดงานประเพณีสงกรานต์ ประจำปี 2566 ณ เวทีสวนชมน่านเฉลิมพระเกียรติภายในงานมี การประกวดนางสงกรานต์
ช่วงกลางวันถึงช่วงค่ำระหว่างวันที่ 13-15 เมษายน มีกิจกรรมถนนเล่นน้ำสงกรานต์วิถีไทยสองแคว น้ำพุอุโมงค์น้ำตก และน้ำพลุลีลา บริเวณวงเวียนสถานีรถไฟ และบริเวณถนนสายต่าง ๆ ภายในเขตเทศบาลนครพิษณุโลก ซึ่งปีนี้ทางเทศบาลจัดเตรียมน้ำให้ประชาชนได้เล่นน้ำคลายร้อนกันอย่างชุ่มฉ่ำ หลังจากงดการเล่นน้ำสงกรานต์เนื่องสถานการณ์โควิดที่ผ่านมา
เทศกาลดนตรีในสวน ลานดูเพลิน "Do Play Learn in the Park" โบราณสถานวัดสนามชัย อ.เมืองสุพรรณบุรี
ขอเชิญเที่ยวงาน เทศกาลดนตรีในสวน ลานดูเพลิน "Do Play Learn in the Park" วันที่ 10-11 เมษายน 2567 ณ โบราณสถานวัดสนามชัย อ.เมืองสุพรรณบุรี จ.สุพรรณบุรี
วันที่ 10 เมษายน 2567 ตั้งแต่เวลา 18.00 - 22.00 น. พบกับเพลงรำวงสนามชัย โดย สมหญิง ศรีประจันต์ ศิลปินเพลงพื้นบ้านสุพรรณบุรี วงดุริยางค์เครื่องลม (ผสาน) โดย โรงเรียนกาญจนาภิเษกวิทยาลัย สุพรรณบุรี และมหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา ร่วมกันแสดงดนตรีแนวลูกทุ่ง และแนวร่วมสมัย
วันที่ 11 เมษายน 2567 ตั้งแต่เวลา 17.00 - 22.00 น. ชมการแสดงดนตรีร่วมสมัย และแนวโฟล์คแบรด์ อาทิเช่น วง Sunset วงเดอะเลฟทิสต์ (The Leftism) และวงอี๊ด ฟุตบาท
วันสงกรานต์ปทุมธานี ประจำปี 2566 วันที่ 13-16 เมษายน 2566
เทศบาลเมืองปทุมธานี ???? ขอเชิญประชาชนร่วมงานสืบสานประเพณี เนื่องในวันสงกรานต์ ประจำปี ๒๕๖๖ เพื่อส่งเสริมให้ประชาชนและนักท่องเที่ยวมีส่วนร่วมในการอนุรักษ์ สืบสานวัฒนธรรมประเพณีสงกรานต์ ???? โดยขอเชิญร่วมกิจกรรมดังนี้ ???? ขอเชิญร่วมสรงน้ำพระพุทธรูป ระหว่างวันที่ ๑๓ - ๑๖ เมษายน ๒๕๖๖ และ ขอเชิญร่วมพิธีรดน้ำดำหัวขอพร ผู้สูงอายุในชุมชน คณะผู้บริหาร และสมาชิกสภาเทศบาลเมืองปทุมธานี ในวันที่ ๑๓ เมษายน ๒๕๖๖ ตั้งแต่เวลา ๘.๓๐ น. เป็นต้นไป ณ สำนักงานเทศบาลเมืองปทุมธานี
11 เมษายน 2566 อุบัติเหตุ 278 ครั้ง เสียชีวิต 27 ราย
วันที่ 11 เมษายน 2566 ซึ่งเป็นวันแรกของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ” เกิดอุบัติเหตุ 278 ครั้ง ผู้บาดเจ็บ 287 คน ผู้เสียชีวิต 27 ราย
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็ว ร้อยละ 35.25 ตัดหน้ากระชั้นชิด ร้อยละ 24.82
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 79.37
ส่วนใหญ่เกิดบนเส้นทางตรง ร้อยละ 87.41 ถนนกรมทางหลวง ร้อยละ 48.20 ถนนใน อบต./หมู่บ้าน ร้อยละ 28.78
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ เวลา 19.01 – 20.00 น. ร้อยละ 7.91
ผู้บาดเจ็บและเสียชีวิตสูงสุดอยู่ในช่วงอายุ 50 – 59 ปี ร้อยละ 16.56
จัดตั้งจุดตรวจหลัก 1,871 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,487 คน
เรียกตรวจยานพาหนะ 306,166 คัน
มีผู้ถูกดำเนินคดี รวม 48,176 ราย มีความผิดฐานไม่มีใบขับขี่ 15,152 ราย ไม่สวมหมวกนิรภัย 14,302 ราย ไม่คาดเข็มขัดนิรภัย 4,759 ราย ขับรถเร็วเกินอัตราที่กฎหมายกำหนด 4,270 ราย
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ พัทลุง (14 ครั้ง)
จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ ปทุมธานี เพชรบูรณ์ และเลย (จังหวัดละ 2 ราย)
จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ พัทลุง (18 คน)
Hadyai Midnight Songkran 2023
สนุกทั้งวัน มันส์กระจายทั้งคืน เตรียมพบกับ 3 เวที 30 ดีเจ ที่จะมาสร้างสีสันให้เมืองหาดใหญ่ฮอตยิ่งกว่าเดิม การันตีความสนุกตั้งแต่เที่ยงวันยันเที่ยงคืน! พร้อมพบกับปาร์ตี้โฟม และ Water Tower ใจกลางเมือง วันที่ 12-13 เมษายน 2566 (เวลา 12.00 - 00.00 น.) ถนนเสน่หานุสรณ์ อ.หาดใหญ่ จ.สงขลา
12 เมษายน 2565 อุบัติเหตุ 339 ครั้ง ผู้เสียชีวิต 36 ราย
วันที่ 12 เมษายน 2566 ซึ่งเป็นวันที่สองของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
เกิดอุบัติเหตุ 339 ครั้ง ผู้เสียชีวิต 36 ราย ผู้บาดเจ็บ 330 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 41.30 ตัดหน้ากระชั้นชิด ร้อยละ 22.12
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 83.97 ส่วนใหญ่เกิดบนถนนใน อบต./หมู่บ้าน ร้อยละ 37.17 ถนนกรมทางหลวง ร้อยละ 36.28 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 81.42
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 19.01 – 20.00 น. ร้อยละ 11.75
ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 20 – 29 ปี ร้อยละ 19.13
จังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ สุราษฎร์ธานี (14 ครั้ง)
จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ นครศรีธรรมราช และสุราษฎร์ธานี (จังหวัดละ 14 คน)
จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ กรุงเทพมหานคร (6 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,874 จุด เจ้าหน้าที่ปฏิบัติงาน 54,594 คน เรียกตรวจยานพาหนะ 338,612 คัน
มีผู้ถูกดำเนินคดี รวม 56,566 ราย
มีความผิดฐานไม่มีใบขับขี่ 17,371 ราย
ไม่สวมหมวกนิรภัย 16,968 ราย
สรุปสถิติอุบัติเหตุทางถนนสะสม 2 วัน (วันที่ 11 – 12 เมษายน 2566) เกิดอุบัติเหตุรวม 618 ครั้ง ผู้เสียชีวิต 63 ราย ผู้บาดเจ็บ 618 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ (25 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (7 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ เชียงใหม่ (27 คน)
สรุป 2 วัน (11-12 เมษายน)
สรุปสถิติอุบัติเหตุทางถนนสะสม 2 วัน (วันที่ 11 – 12 เมษายน 2566) เกิดอุบัติเหตุรวม 618 ครั้ง ผู้เสียชีวิต 63 ราย ผู้บาดเจ็บ 618 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ (25 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (7 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ เชียงใหม่ (27 คน)
13 เมษายน วันผู้สูงอายุแห่งชาติ
วันผู้สูงอายุแห่งชาติ กำหนดขึ้นตามมติคณะรัฐมนตรี รัฐบาล พล.อ.เปรม ติณสูลานนท์ เมื่อวันที่ 14 ธันวาคม 2525 อนุมัติให้วันที่ 13 เมษายนของทุกปีเป็นวันผู้สูงอายุ เพื่อรณรงค์ให้ประชาชนทุกกลุ่มเห็นถึงคุณค่าและตระหนักถึงความสำคัญของผู้สูงอายุ สอดคล้องกับเทศกาลสงกรานต์ที่เป็นวันที่สมาชิกในครอบครัวจะกลับมาเยี่ยมบ้าน รดน้ำดำหัวผู้ใหญ่ตามขนบประเพณีอันดีงามสืบกันมา และยังได้กำหนดให้ใช้ "ดอกลำดวน" เป็นสัญลักษณ์ของผู้สูงอายุด้วยสงกรานต์ เฟสติวัล 2023 @กาญจนบุรี 13 - 14 เมษายน 2566 LINK
องค์การบริหารส่วนจังหวัดกาญจนบุรี ขอเชิญเที่ยวงาน สงกรานต์ เฟสติวัล 2023 @กาญจนบุรี 13 - 14 เมษายน 2566 ชุ่มฉ่ำกับอุโมงค์น้ำ ยาว 40 เมตร ชมการแสดงคอนเสิร์ตศิลปินชื่อดัง กิจกรรมสืบสานประเพณีไทย ชิมอาหารอร่อยในมหกรรมอาหารร้านเด็ด กว่า 600 ร้านค้า ร่วมสืบสานความสนุก ปลุกความครื้นเครงที่กาญจนบุรี ณ บริเวณถนนสองแควริมน้ำหน้าเมืองกาญจนบุรี (สกายวอร์คสองแควกาญจนบุรี) ตำบลบ้านเหนือ อำเภอเมืองฯ จังหวัดกาญจนบุรี
สงกรานต์ ร้อยเอ็ด 13 เมษายน 2566
กิจกรรมสงกรานต์ ร้อยเอ็ด วันที่ 13 เมษายน 2566 บริเวณถนนข้าวหอมมะลิ หน้าบึงพลาญชัย ร่วม ทำบุญตักบาตร พระสงฆ์ 101 รูป ประกวดอาหารอีสาน ขบวนแห่ กำแพงม่านน้ำ มีแสดงดนตรี ประกวดผู้สูงอายุ
13 เมษายน 2566 อุบัติเหตุ 437 ครั้ง ผู้เสียชีวิต 49 ราย
วันที่ 13 เมษายน 2566 ซึ่งเป็นวันที่สามของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ” เกิดอุบัติเหตุ 437 ครั้ง ผู้เสียชีวิต 49 ราย ผู้บาดเจ็บ 448 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 37.30 ดื่มแล้วขับ ร้อยละ 29.29
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 79.51 ส่วนใหญ่เกิดบนถนนใน อบต./หมู่บ้าน ร้อยละ 37.76 ถนนกรมทางหลวง ร้อยละ 35.24 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 81.69
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 17.01 – 18.00 น. ร้อยละ 9.05
ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 30 - 39 ปี ร้อยละ 16.10
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ นครศรีธรรมราช (19 ครั้ง)
จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ นครศรีธรรมราช (19 คน)
จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ นครศรีธรรมราช (3 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,867 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,374 คน
เรียกตรวจยานพาหนะ 351,984 คัน มีผู้ถูกดำเนินคดี รวม 53,617 ราย มีความผิดฐานไม่มีใบขับขี่ 15,914 ราย ไม่สวมหมวกนิรภัย 15,584 ราย
สรุปสถิติอุบัติเหตุทางถนนสะสม 3 วัน (วันที่ 11 – 13 เมษายน 2566) เกิดอุบัติเหตุรวม 1,055 ครั้ง ผู้เสียชีวิต 114 ราย ผู้บาดเจ็บ 1,064 คน
โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ (38 ครั้ง)
จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (9 ราย)
จังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ เชียงใหม่ และนครศรีธรรมราช (40 คน)
จังหวัดที่ไม่มีผู้เสียชีวิต 19 จังหวัด
สำหรับประชาชนที่ประสบหรือพบเห็นอุบัติเหตุ สามารถแจ้งเหตุได้ทางสายด่วนนิรภัย 1784 หรือแจ้งเหตุทางไลน์ “ปภ.รับแจ้งเหตุ1784” โดยเพิ่มเพื่อน Line ID @1784DDPM เพื่อประสานให้การช่วยเหลือต่อไป”
สรุป 3 วัน (11-13 เมษายน)
สรุปสถิติอุบัติเหตุทางถนนสะสม 3 วัน (วันที่ 11 – 13 เมษายน 2566) เกิดอุบัติเหตุรวม 1,055 ครั้ง ผู้เสียชีวิต 114 ราย ผู้บาดเจ็บ 1,064 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ (38 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (9 ราย) จังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ เชียงใหม่ และนครศรีธรรมราช (40 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 19 จังหวัด
14 เมษายน วันครอบครัว Family Day
คณะรัฐมนตรีรัฐบาล พลเอก ชาติชาย ชุณหะวัณ มีมติเมื่อวันที่ 31 ตุลาคม พศ. 2532 กำหนดให้วันที่ 14 เมษายน ของทุกปี เป็น "วันครอบครัว" ซึ่งตรงกับวันสงกรานต์ของไทย เพราะโดยส่วนใหญ่ในวันนี้เป็นวันที่สมาชิกในครอบครัวมีโอกาสพบปะกันได้โดยสะดวก จึงให้ถือโอกาสเดียวกันนี้เป็นวันแห่งการรวมญาติ รวมครอบครัว ทำบุญอุทิศส่วนกุศลให้กับบุพการี รดน้ำดำหัว ตลอดจนการขอพรผู้ใหญ่ตามประเพณีไทยที่เคยปฏิบัติกันมา [
Kapook]
สงกรานต์ อบจ.ราชบุรี เฟสติวัล เล่นน้ำบนถนนภูเขามังกร Dragon Mountain Street 14 เมษายน 2566
เชิญเที่ยวงาน สงกรานต์ อบจ.ราชบุรี เฟสติวัล ถนนยอดเขาแก่นจันทน์ เล่นน้ำบนถนนภูเขามังกร Dragon Mountain Street วันที่ 14 เมษายน 2566 ณ เขาแก่นจันทน์ จังหวัดราชบุรี . เย็นฉ่ำวิถีไทย ร่วมสรงน้ำพระ และเล่นน้ำสงกรานต์ ถ่ายภาพเช็คอินกับเจดีย์ทรายขนาดใหญ่ ชมการแสดงคอนเสิร์ตจากศิลปินชื่อดัง แดนซ์สุดมันส์ไปกับดนตรี EDM
14 เมษายน 2566 อุบัติเหตุ 368 ครั้ง ผู้เสียชีวิต 44 ราย
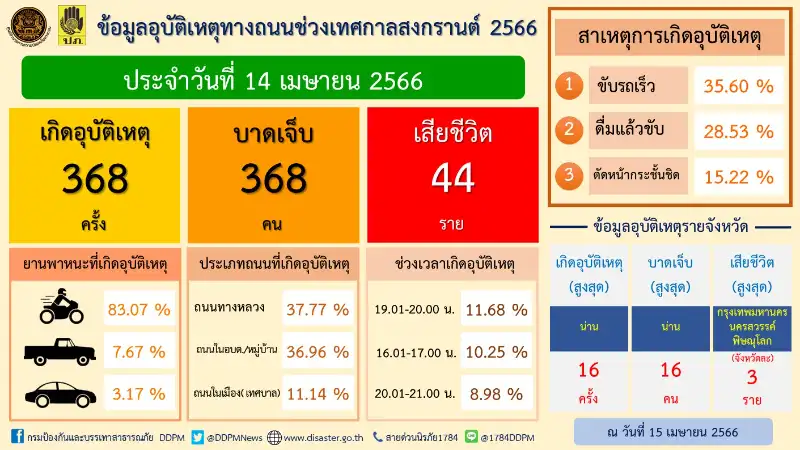

สถิติอุบัติเหตุทางถนนประจำวันที่ 14 เมษายน 2566 ซึ่งเป็นวันที่สี่ของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
เกิดอุบัติเหตุ 368 ครั้ง ผู้เสียชีวิต 44 ราย ผู้บาดเจ็บ 368 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 35.60 ดื่มแล้วขับ ร้อยละ 28.53
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 83.07 ส่วนใหญ่เกิดบนถนนกรมทางหลวง ร้อยละ 37.77 ถนนใน อบต./หมู่บ้าน ร้อยละ 36.96 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 78.80
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 19.01 – 20.00 น. ร้อยละ 11.68
ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 30 - 39 ปี ร้อยละ 17.96
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ น่าน (16 ครั้ง)
จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ น่าน (16 คน)
จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ กรุงเทพมหานคร นครสวรรค์ และพิษณุโลก (จังหวัดละ 3 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,862 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,368 คน
เรียกตรวจยานพาหนะ 351,228 คัน มีผู้ถูกดำเนินคดี รวม 52,422 ราย มีความผิดฐานไม่มีใบขับขี่ 15,467 ราย ไม่สวมหมวกนิรภัย 15,144 ราย
สรุปสถิติอุบัติเหตุทางถนนสะสม 4 วัน (วันที่ 11 – 14 เมษายน 2566) เกิดอุบัติเหตุรวม 1,422 ครั้ง ผู้เสียชีวิต 158 ราย ผู้บาดเจ็บ 1,431 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ นครศรีธรรมราช และน่าน (จังหวัดละ 45 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (12 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ นครศรีธรรมราช (48 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 12 จังหวัด
สรุป 4 วัน (11 – 14 เมษายน 2566)
สรุปสถิติอุบัติเหตุทางถนนสะสม 4 วัน (วันที่ 11 – 14 เมษายน 2566) เกิดอุบัติเหตุรวม 1,422 ครั้ง ผู้เสียชีวิต 158 ราย ผู้บาดเจ็บ 1,431 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงใหม่ นครศรีธรรมราช และน่าน (จังหวัดละ 45 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (12 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ นครศรีธรรมราช (48 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 12 จังหวัด
15 เมษายน 2566 อุบัติเหตุ 311 ครั้ง ผู้เสียชีวิต 31 ราย
วันที่ 15 เมษายน 2566 ซึ่งเป็นวันที่ห้าของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ” เกิดอุบัติเหตุ 311 ครั้ง ผู้เสียชีวิต 31 ราย ผู้บาดเจ็บ 304 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 35.37 ดื่มแล้วขับ ร้อยละ 25.72
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 78.93 ส่วนใหญ่เกิดบนถนนกรมทางหลวง ร้อยละ 42.77 ถนนใน อบต./หมู่บ้าน ร้อยละ 34.41 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 79.74
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 15.01 – 16.00 น. และช่วงเวลา 18.01 – 19.00 น. ร้อยละ 8.36
ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 20 - 29 ปี ร้อยละ 21.19
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ น่าน และประจวบคีรีขันธ์ (จังหวัดละ14 ครั้ง) จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ น่าน (14 คน) จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ กระบี่ ขอนแก่น เลย และสระแก้ว (จังหวัดละ 2 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,873 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,495 คน
เรียกตรวจยานพาหนะ 345,368 คัน
มีผู้ถูกดำเนินคดี รวม 51,180 ราย มีความผิดฐานไม่มีใบขับขี่ 14,774 ราย ไม่สวมหมวกนิรภัย 14,593 ราย
สรุปสถิติอุบัติเหตุทางถนนสะสม 5 วัน (วันที่ 11 – 15 เมษายน 2566) เกิดอุบัติเหตุรวม 1,744 ครั้ง ผู้เสียชีวิต 197 ราย ผู้บาดเจ็บ 1,738 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ น่าน (59 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (15 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ น่าน (59 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 7 จังหวัด
สรุป 5 วัน (11 – 15 เมษายน 2566)
สรุปสถิติอุบัติเหตุทางถนนสะสม 5 วัน (วันที่ 11 – 15 เมษายน 2566) เกิดอุบัติเหตุรวม 1,744 ครั้ง ผู้เสียชีวิต 197 ราย ผู้บาดเจ็บ 1,738 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ น่าน (59 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (15 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ น่าน (59 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 7 จังหวัด
16 เมษายน 2566 อุบัติเหตุ 263 ครั้ง ผู้เสียชีวิต 36 ราย
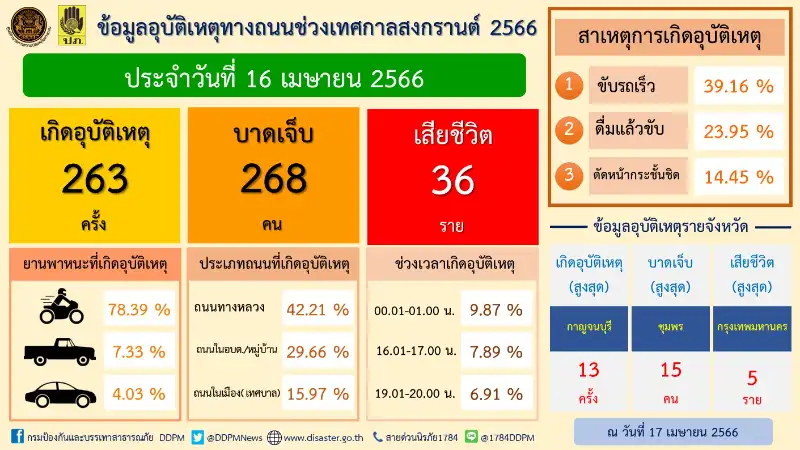

วันที่ 16 เมษายน 2566 ซึ่งเป็นวันที่หกของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ” เกิดอุบัติเหตุ 263 ครั้ง ผู้เสียชีวิต 36 ราย ผู้บาดเจ็บ 268 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 39.16 ดื่มแล้วขับ ร้อยละ 23.95
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 78.39 ส่วนใหญ่เกิดบนถนนกรมทางหลวง ร้อยละ 42.21 ถนนใน อบต./หมู่บ้าน ร้อยละ 29.66 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 81.37
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 00.01 – 01.00 น. ร้อยละ 9.87 ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 20 - 29 ปี ร้อยละ 22.37
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ กาญจนบุรี (13 ครั้ง) จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ ชุมพร (15 คน) จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ กรุงเทพมหานคร (5 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,857 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,238 คน
เรียกตรวจยานพาหนะ 322,570 คัน
มีผู้ถูกดำเนินคดี รวม 48,067 ราย มีความผิดฐานไม่มีใบขับขี่ 14,177 ราย ไม่สวมหมวกนิรภัย 13,127 ราย
สรุป 6 วัน (วันที่ 11 – 16 เมษายน 2566)
สรุปสถิติอุบัติเหตุทางถนนสะสม 6 วัน (วันที่ 11 – 16 เมษายน 2566) เกิดอุบัติเหตุรวม 2,008 ครั้ง ผู้เสียชีวิต 236 ราย ผู้บาดเจ็บ 2,005 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ น่าน (62 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (20 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ น่าน (63 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 2 จังหวัด
17 เมษายน 2566 วันสุดท้ายของการรณรงค์ เกิดอุบัติเหตุ 183 ครั้ง ผู้เสียชีวิต 16 ราย
17 เมษายน 2566 ซึ่งเป็นวันสุดท้ายของการรณรงค์ “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ” เกิดอุบัติเหตุ 183 ครั้ง ผู้เสียชีวิต 16 ราย ผู้บาดเจ็บ 202 คน
สาเหตุที่ทำให้เกิดอุบัติเหตุสูงสุด ได้แก่ ขับรถเร็วเกินกำหนด ร้อยละ 45.36 ตัดหน้ากระชั้นชิด ร้อยละ 16.94
ยานพาหนะที่เกิดอุบัติเหตุสูงสุด ได้แก่ รถจักรยานยนต์ ร้อยละ 80.10 ส่วนใหญ่เกิดบนถนนกรมทางหลวง ร้อยละ 45.90 ถนนใน อบต./หมู่บ้าน ร้อยละ 29.51 บริเวณจุดเกิดเหตุเป็นทางตรง ร้อยละ 83.61
ช่วงเวลาที่เกิดอุบัติเหตุสูงสุด ได้แก่ ช่วงเวลา 15.01 – 16.00 น. ร้อยละ 9.63 ผู้บาดเจ็บและเสียชีวิตอยู่ในช่วงอายุ 20 - 29 ปี ร้อยละ 21.56
โดยจังหวัดที่เกิดอุบัติเหตุสูงสุด ได้แก่ กาญจนบุรี (11 ครั้ง)
จังหวัดที่มีผู้บาดเจ็บสูงสุด ได้แก่ กาญจนบุรี (13 คน)
จังหวัดที่มีผู้เสียชีวิตสูงสุด ได้แก่ จันทบุรี นครปฐม น่าน ราชุบรี และลำพูน (จังหวัดละ 2 ราย)
ทั้งนี้ เจ้าหน้าที่ได้จัดตั้งจุดตรวจหลัก 1,869 จุด
เจ้าหน้าที่ปฏิบัติงาน 54,274 คน
เรียกตรวจยานพาหนะ 279,837 คัน
มีผู้ถูกดำเนินคดี รวม 39,611 ราย มีความผิดฐานไม่มีใบขับขี่ 11,013 ราย ไม่สวมหมวกนิรภัย 10,530 ราย
สรุป 7 วัน (วันที่ 11 – 17 เมษายน 2566)
สรุปสถิติอุบัติเหตุทางถนนสะสม 7 วัน (วันที่ 11 – 17 เมษายน 2566) เกิดอุบัติเหตุรวม 2,203 ครั้ง ผู้เสียชีวิต 264 ราย ผู้บาดเจ็บ 2,208 คน โดยจังหวัดที่เกิดอุบัติเหตุสะสมสูงสุด ได้แก่ เชียงราย (68 ครั้ง) จังหวัดที่มีผู้เสียชีวิตสะสมสูงสุด ได้แก่ กรุงเทพมหานคร (22 ราย) และจังหวัดที่มีผู้บาดเจ็บสะสมสูงสุด ได้แก่ นครศรีธรรมราช (70 คน) จังหวัดที่ไม่มีผู้เสียชีวิต 2 จังหวัด ได้แก่ พัทลุง พังงา
สงกรานต์พระประแดง ประจำปี 2566 วันที่ 20-22 เม.ย. 2566
สงกรานต์พระประแดงเป็นหนึ่งในงานเทศกาลสงกรานต์ของไทยที่มีเสน่ห์และคงเอกลักษณ์ของเทศกาลที่สูงค่ามาต่อเนื่องยาวนาน เป็นความภูมิใจของชาวพระประแดงและคนไทยทั้งมวล ประเพณีสงกรานต์พระประแดง เดิมเรียกว่า สงกรานต์ปากลัด เป็นประเพณีเก่าแก่ที่มีศิลปวัฒนธรรมซึ่งสืบทอดกันมา หัวใจของงานคือการจัดขบวนแห่นางสงกรานต์ ขบวนแห่รถปุปผาชาติ การประกวดนางสงกรานต์และหนุ่มลอยชาย การฟื้นฟูสืบสานการละเล่นพื้นบ้าน สะบ้ามารัญ วัฒนธรรมการแต่งกายและวิถีชีวิตของชาวมอญ (ชาวไทยเชื้อสายรามัญ) งานปีนี้จัด วันที่ 20 เม.ย. 2023 - 22 เม.ย. 2023 ณ บริเวณหน้าที่ว่าการอำเภอพระประแดง บริเวณอุทยานประวัติศาสตร์ป้อมแผลงไฟฟ้า พระอารามหลวงวัดโปรดเกศเชษฐาราม ชุมชน/หมู่บ้านชาวรามัญภายในเขตเทศบาลเมืองพระประแดง จ.สมุทรปราการ *ภาพจาก Museum Thailand
ประจำเดือนเมษายน 2566
ประจำเดือนเมษายน 2566
•จำนวนประชากรในประเทศ 67.258 ล้านคน
•จำนวนประชากรที่มีสิทธิหลักประกันสุขภาพ 66.938 ล้านคน
•สิทธิหลักประกันสุขภาพแห่งชาติ (สิทธิบัตรทอง 30 บาท) 47.0483 ล้านคน
•สิทธิประกันสังคม 12.806 ล้านคน
•สิทธิข้าราชการ/รัฐวิสาหกิจ 5.286 ล้านคน
•สิทธิพนักงานท้องถิ่น 0.678 ล้านคน
•สิทธิครูเอกชน 0.088 ล้านคน
เฮฮามหาสงกรานต์ @สระสีเสียด จังหวัดตราด 11-13 เมษายน 2566
สงกรานต์จังหวัดตราด ปีนี้กลับมาพร้อมบรรยากาศดีๆ รอบริมเขื่อนสระสีเสียด ชมการแสดงบนเวทีทั้ง 3 คืน ช็อป ชิม บู้ทร้านอาหารและสินค้ากว่า 50 ร้าน กิจกรรมเพื่อสุขภาพ ปั่น เดิน วิ่ง ครบได้สุขภาพ ตั้งแต่วันที่ 11-13 เมษายนนี้ เวลา 15.00-22.00 น. เสริมความเป็นสิริมงคล พรมน้ำมนต์ 9 วัดดังในจังหวัดตราด - 11 เมษา ออกกำลังกายสร้างร่างกายให้แข็งแรง กิจกรรมเดิน - วิ่ง - ปั่นจักรยาน ต่อด้วยดนตรี จาก “คณะขวัญใจ” จากนั้นมารำวงย้อนยุค เต้นสนุกย้อนวัย - 13 เมษา เล่นน้ำคลายร้อน รอบริมเขื่อน ดนตรีสนุก จากวงดนตรีดังมากมาย เวลา 19.00 น. เป็นต้นไป
21 เมษายน 2567 เขตห้วยขวาง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตห้วยขวาง และสมาชิกสภากรุงเทพมหานคร เขตห้วยขวาง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันอาทิตย์ที่ 21 เมษายน 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนประชาราษฎร์บำเพ็ญ เขตห้วยขวาง (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.) สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
• ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ เบอร์โทรศัพท์ 063-779-0047
• รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตห้วยขวาง กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
Mothers Class ครั้งที่ 2 วันเสาร์ ที่ 22 เมษายน 2566
"Mothers Class" ครั้งที่ 2 ในวันเสาร์ ที่ 22 เมษายน 2566 เวลา 09.00 - 11.30 น. ณ บริเวณ ห้องประชุมนายแพทย์สมชัย ตั้งพร้อมพันธ์ ชั้น 2 อาคาร ศูนย์การแพทย์เฉพาะทางเกษมราษฎร์ ศรีบุรินทร์ **(ไม่เสียค่าใช้จ่าย)** “เตรียมความพร้อมเข้าสู่การเป็นคุณแม่คุณภาพ”ร่วมรับฟังการบรรยายในหัวข้อ " อาหาร คือสื่อรักจากแม่ สู่ลูก " โดยนักโภชนาการ โรงพยาบาลเกษมราษฎร์ ศรีบุรินทร์ ร่วม Workshop โยคะสำหรับคุญแม่ตั้งครรภ์ โดยคุณครูสอนโยคะ จากฮักโยคะเชียงราย
โรงพยาบาลนนทเวช อบรมคุณภาพแม่ตั้งครรภ์คุณภาพ ปี 2566
ตารางจัดกิจกรรมอบรม โรงพยาบาลนนทเวช ในรอบปี 2566
วันเสาร์ที่ 28 มกราคม 2566
วันอาทิตย์ที่ 26 กุมภาพันธ์ 2566
วันเสาร์ที่ 25 มีนาคม 2566
วันอาทิตย์ที่ 23 เมษายน 2566
วันเสาร์ที่ 27 พฤษภาคม 2566
วันอาทิตย์ที่ 25 มิถุนายน 2566
วันเสาร์ที่ 22 กรกฎาคม 2566
วันอาทิตย์ที่ 27 สิงหาคม 2566
วันเสาร์ที่ 23 กันยายน 2566
วันอาทิตย์ที่ 29 ตุลาคม 2566
วันเสาร์ที่ 25 พฤศจิกายน 2566
วันอาทิตย์ที่ 17 ธันวาคม 2566
เวลาอบรม 8.30-12 น.
งานวันไหลปากน้ำปราณ มหาสงกรานต์ 13-23 เมษายน 2566 LINK
เทศบาลตำบลปากน้ำปราณ จ.ประจวบฯ เตรียมจัดงาน “วันไหลปากน้ำปราณ มหาสงกรานต์ อาหารทะเลสด” วันที่ 13 เม.ย .-23 เม.ย.66 เวลา 17.00 น. เป็นต้นไป ณ บริเวณชายหาดปากน้ำปราณ อ.ปราณบุรี จ.ประจวบคีรีขันธ์ บนพื้นที่ 24 ไร่ ศิลปินดังเพียบ เสก โลโซ L.ก.ฮ. มินตรา อินทิรา เนส กาแฟ เก๋าซึม พัทลุง ทอมดันดี
บุญบั้งไฟกุดชุม 23-30 เมษายน 2566
บุญบั้งไฟกุดชุม 23-30 เมษายน 2566 บริเวณหน้าที่ว่าการอำเภอกุดชุม ยโสธร ชมพิธีเปิดสุดยิ่งใหญ่ ประกวดบั้งไฟสวยงาม ประกวดบั้งไฟโก้ ประกวดขบวนเซิ้งสวยงาม ประกวดแข่งขันจุดบั้งไฟขึ้นสูง ชมคอนเสิร์ต 28 เม.ย. ยูิก ไหทองคำ เต็มวง 29 เม.ย. ใบปอ รัตติยา เต็มวง
งาน Midtown Coffee&Spirit 2024 วันที่ 24-28 เมษายน 2567
งาน Midtown Coffee&Spirit 2024 มาเจอกันที่ Emsphere Bangkok 24-28 เมษายน 2567 ยกทัพร้านเด็ด เมนูปัง มาให้ชาวสุขุมวิทได้ลิ้มลอง จัดหนัก จัดเต็ม 3 บูธโซนสุดปังงงง ????COFFEE ????NON-COFFEE ????FOOD & BEVERAGE การจัดแสดงออกร้านของผู้ประกอบการกาแฟชั้นนำ ของประเทศไทย ที่นำเมล็ดกาแฟรสเลิศทั้งไทยและต่างประเทศมาไว้ที่เดียวกัน
เมษายน 65 โรงพยาบาลรามคำแหง ลงทุนในโรงพยาบาลเอกชัย
26 เมษายน 2565 โรงพยาบาลรามคำแหง จำกัด (มหาชน) มีมติซื้อหุ้นเพิ่มทุนของ บริษัท เอกชัยการแพทย์จำกัด (มหาชน) ซึ่งเป็นเจ้าของและบริหารกิจการโรงพยาบาลเอกชัย ในจ.สมุทรสาคร ในวงเงินลงทุน 252 ล้านบาท
PET FESTIVAL 26-28 เม.ย. 2567
มหกรรมสัตว์เลี้ยงสุดยิ่งใหญ่ "PET FESTIVAL" วันที่ 26-28 เม.ย. ISLAND HALL 3FL. ศูนย์การค้าแฟชั่นไอส์แลนด์ านประกวดสารพัดสัตว์นานาพันธุ์... กิจกรรมหนูและกระต่าย Bunny & CAVY THAILAND
กิจกรรม สนุกสนานในงาน... ❤โชว์สัตว์แสนรู้ โดยผู้ฝึกสอนสัตว์ระดับโลก Cartoon Birds Train ❤ตัดขนน้องหมาเพื่อการกุศล( ตัดขน/เล็บ สุนัขฟรี)โดย เกรียงไกร ธาตวากร ❤มุมถ่ายรูปสวยๆ กับโลกของผีเสื้อ และแมลง สุดมหัศจรรย์ ❤รวมทาสสกังก์ THAILAND / Bushbaby ทาสกระรอกและผองเพื่อน ❤โชว์กุ้งเครฟิช สีแปลกของโลก / กิจกรรมตกกุ้งหลากสียอดฮิต ❤โชว์ไก่สวยงามสายพันธุ์ ต่างประเทศ ❤Exotic pet เสริมเฮง เสริมปัง อุ้มเจ้านายมาดูดวงฟรี ❤ประกวดชุดแฟนซีคู่กับสัตว์เลี้ยง ในธีม SECRET GARDEN ❤แฟชั่นโชว์ และขบวนพาเหรด ❤แนะนำ เทคนิคการดูแลสัตว์เลี้ยง/ตรวจสุขภาพสัตว์เลี้ยงฟรี โดยสัตวแพทย์ ❤แนะนำ เทคนิคการกรูมมิ่งสัตว์เลี้ยง ❤❤ช้อปปิ้งกับร้านค้าจำหน่ายสัตว์เลี้ยงและอุปกรณ์ชั้นนำมากมาย ❤❤คาเฟ่ กระต่าย / แมว / หนู ❤❤ถ่ายภาพที่ระลึกแสนประทับใจ จากช่างภาพสตูดิโอมืออาชีพ
เมษายน 65 กรุงเทพดุสิตเวชการ จัดตั้ง 2 บริษัทย่อย ดำเนินธุรกิจร้านยา Stand Alone
27 เมษายน 2565 บ.กรุงเทพดุสิตเวชการ จำกัด (มหาชน) จัดตั้งบริษัทย่อย 2 บริษัท ได้แก่ บ.รอยัลบางกอก เฮ็ลธ์แคร์ (RBH) และบ.ย่อยของบ.คอมเซเว่น จำกัด (มหาชน) เพื่อร่วมทุนดำเนินธุรกิจร้านขายยาขนาดใหญ่ ในรูปแบบร้าน Stand alone และตั้งอยู่ในห้างสรรพสินค้า โดยคาดว่าจะเริ่มเปิดดำเนินการภายในไตรมาสที่ 4 ปี 2565
27 เมษายน 2566 เทศบาลตำบลเสาธงหิน ทำหมันสุนัขและแมว ฟรี
เทศบาลตำบลเสาธงหิน ร่วมกับปศุสัตว์จังหวัดนนทบุรี จัดกิจกรรมทำหมันสุนัขและแมว ฟรี จำนวนจำกัด วันที่ 27 เมษายน 2566 ตั้งแต่เวลา 8.30-12.00 น. โดยหน่วยเคลื่อนที่ บริเวณศูนย์การศึกษานอกระบบจังหวัดนนทบุรี (กศน.) หมู่ที่ 4 ต.เสาธงหิน ลงทะเบียนล่วงหน้าได้ที่ โทร. 02-5950888 และ 02-1473640 นำบัตรประชาชนมาด้วย สงวนสิทธิ์ 1 ใบต่อสัตว์เลี้ยง 1 ตัว หมายเหตุ งดน้ำงดอาหารอย่างน้อย 8-12 ชม. ก่อนเข้ารับการผ่าตัด
งานแข่งขันคั่วกาแฟ "เล่นกะแฟ" 27-28 เมษายน 2567
งานแข่งขันคั่วกาแฟ "
เล่นกะแฟ" วันที่ 27-28 เมษายน 2567 ที่ร้าน kate and kim เชียงใหม่ สำหรับนักแข่งผู้มีความสามารถ 3 อันดับแรก!!! ที่ผ่านการแข่งขันจากการคัดเลือกโดยกรรมการ ????ผู้ชนะอันดับที่ 1 จะได้รับเงินรางวัลเป็นเครื่องคั่ว SANTOKER X3 มูลค่า 80,000 บาท ????รองชนะเลิศอันดับ 1 จะได้รับเงินรางวัลCoffee roast analyzer มูลค่า 15,000 บาท ????รองชนะเลิศอันดับ 2 จะได้รับเงินรางวัลมูลค่า 5,000 บาท และของรางวัลจากสปอนเซอร์ใจดี
HealthyMax Expo (Excusive) 27 เมษายน - 31 พฤษภาคม 2567
มหกรรม HealthyMax Expo (Excusive) วันที่ 27 เมษายน - 31 พฤษภาคม 2567 เติมเต็มการมีสุขภาพดีทุกจังหวะชีวิต พบกับสินค้าเพื่อสุขภาพ มากกว่า 200 แบรนด์ ราคาพิเศษ ที่สุดแห่งปี พร้อมบริการให้คำปรึกษาจากเภสัชกรและทีมงานผู้เชี่ยวชาญ และพบกับผลิตภัณฑ์เพื่อสุขภาพอีกมากมาย ณ ร้านเฮลธิแมกซ์ สาขาไอคอนสยาม ชั้น 5 Call Connect : 02-288-0988
เมษายน 65 โรงพยาบาลรามคำแหง ลงทุนในบ.สินแพทย์ นครปฐม
28 เมษายน 2565 โรงพยาบาลรามคำแหง ลงทุนในบ.สินแพทย์ นครปฐม ผ่านบ.โรงพยาบาลวิภาราม ซึ่งเป็นบ.ย่อย มูลค่า 576 ล้านบาท บริษัทโรงพยาบาลสินแพทย์นครปฐม จำกัด ดำเนินธุรกิจโรงพยาบาลเอกชน ขนาด 240 เตียง ใน อ.เมือง จ.นครปฐม
Phuket Bike Week 2023 วันที่ 28-30 เม.ย.2023 LINK
ภูเก็ตไบค์วีค Phuket Bike Week 2023 ครั้งที่ 27 ปีนี้ วันที่ 28 - 30 April, 2023 ณ Loma park, Patong Beach Phuket Thailand จัดโดยสมาคมภูเก็ตไบค์วีค (Phuket Bike Week Association) PHUKET BIKE WEEK 2023 “Amazing Ride Together”, the legendary event in Asia, will celebrate the 27th anniversary on 28th – 30th April 2023. This event will be the large gathering of motorcyclists, esxpecting to draw over 10,000 motorcycles, 50,000 visitors from 30 countries to Phuket. The excitement will take place in Patong Beach
ศิริราชเดินวิ่ง ครั้งที่ 16/2024 วันที่ 28 เมษายน 2567 LINK
ศิริราชเดินวิ่ง ครั้งที่ 16/2024 วันที่ 28 เมษายน 2567 ณ โรงพยาบาลศิริราช รายได้สมทบทุนศิริราชมูลนิธิ กองทุนสถาบันการแพทย์สยามินทราธิราช ระยะวิ่ง 21.1/11/.5.5 km / Vip เลือกระยะได้ เปิดรับสมัคร วันที่ 15 มกราคม 2567 เวลา 12.00 น. เป็นต้นไป จนกว่าจะครบจำนวน
นั่งเล beach party and music festival 2 วันที่ 29 เมษายน 2023
นั่งเล beach party and music festival 2 เทศกาลดนตรีและปาร์ตี้ริมทะเลที่ใหญ่ที่สุด และเผ็ชที่สุดแห่งปี 29 เมษายน 2023 Triple Tree Beach (ใกล้ครัวเม็ดทราย) ชะอำ
30 เมษายน วันคุ้มครองผู้บริโภค
30 เมษายน พ.ศ.2522 เป็นวันที่ในหลวง ร.9 ทรงลงพระปรมาภิไธย ตราพระราชบัญญัติคุ้มครองผู้บริโภค และประกาศในราชกิจจานุเบกษา วันที่ 4 พฤษภาคม 2522 มีผลการใช้บังคับ ตั้งแต่วันที่ 5 พฤษภาคม 2522 ในสมัย พลเอกเกรียงศักดิ์ ชมะนันท์ เป็นนายกรัฐมนตรี นับเป็นจุดเริ่มต้นการคุ้มครองผู้บริโภคในประเทศไทย [ข้อมูลและภาพ
มูลนิธิผู้บริโภค]
บุญบั้งไฟ พังโคน สกลนคร 30 เมษา-6 พฤษภา 66
บุญบั้งไฟ พังโคน 30 เมษายน - 6 พฤษภา 66 ตลาดโต้รุ่ง อ.พังโคน สกลนคร
Saraburi International Jazz Day #2 30 เมษายน 2566 สระบุรี LINK
กิจกรรมครั้งนี้มีชื่อว่า “Swing & Wine” จัดขึ้นในวันอาทิตย์ที่ 30 เมษายน 2566 ฉลองวาระ “วันแจ๊สโลก” ร้าน ณ Hobby Log สระบุรี วงดนตรีที่แสดง อาทิ Sea’n Gun Brothers Siam Cubano (สยามคิวบาโน่) Jazz Big Band จากมหาวิทยาลัยราชภัฏวไลยอลงกรณ์ และพิเศษสุดคือ Project Saraburi All Stars รวบรวมวงดนตรีนักดนตรีที่ชื่นชอบดนตรีแจ๊ส ของสระบุรีเข้าไว้ด้วยกัน ไปสัมผัสความอบอุ่นกระชุ่มกระชวย ณ ชุมชนดนตรีแจ๊สแห่งสระบุรีด้วยกัน
Coffee Run Classic Festival 30 เมษายน – 5 พฤษภาคม 2567 เทศกาลงานกาแฟ ที่ยิ่งใหญ่ที่สุดจังหวัดยะลา
Coffee Run Classic Festival เทศกาลงานกาแฟ ที่ยิ่งใหญ่ที่สุดจังหวัดยะลา ระหว่างวันที่ 30 เมษายน – 5 พฤษภาคม 2567 ณ สวนพิพิธภัณฑ์ผังเมืองยะลา 94 ไร่ สวนศรีเมืองเทศบาลนครยะลา
งานใหญ่ของจ.ยะลา อีกงาน เพื่อคนรักกาแฟอย่างแท้จริง กิจกรรมภายในงานที่น่าสนใจ
1. โซนคนชอบกาแฟ
2. โซนรวมพลคนคลาสสิค
3. โซนกิจกรรมสร้างสรรค์
4. โซนบอลลูน
5. โซนอาหารและเครื่องดื่ม
6. โซนของเล่นเด็กและครอบครัว
7. โซนกิจกรรมแวรุง
8. โซนลานกางเต็นท์
ตัวอย่างหน้า Content ในเว็บไซต์
• เนื้อหาแสดงข้อความ ภาพประกอบ วิดีโอ (Youtube) แบบฝังในเพจได้ (
ตัวอย่าง)
• ใส่ลิงค์ไปยังเว็บไซต์ / Facebook / Youtube / IG / Tiktok ได้
• แสดงข้อมูลติดต่อได้ เช่น อีเมล์ เบอร์โทร ไลน์
• ระยะเวลาแสดงเนื้อหา 1 ปี และแสดงต่อเนื่องไปได้หลังจากนั้น
• พิจารณาเนื้อหาก่อนเผยแพร่ - เนื้อหาที่ไม่สามารถให้บริการได้ ได้แก่ สินค้าหรือบริการที่ผิดต่อหลักศีลธรรม จรรยาบรรณ หรือต่อหลักกฎหมาย การเมือง การพนัน ยาเสพติด ความรุนแรง หรืออื่นๆ ตามดุลพินิจของบริษัทฯ เป็นสำคัญ
สาดน้ำสงกรานต์ที่ไอคอนสยาม 11 เม.ย. – 17 เม.ย. 2566 LINK
สงกรานต์ปีนี้ เตรียมตัวมา สาดน้ำ ที่ไอคอนสยามได้เลย รับรองสนุกแน่กับเซอร์ไพรส์พิเศษ #อุโมงค์น้ำขนาดใหญ่ ให้ได้สาดสุขสนุกตลอดวันตั้งแต่วันที่ 11 เม.ย. – 17 เม.ย. 2566 ในมหาปรากฏการณ์เทศกาลสงกรานต์สุดยิ่งใหญ่ THE ICONIC SONGKRAN FESTIVAL 2023
ขั้นตอนการตรวจสอบและใช้สิทธิ กรณีหน่วยบริการถูกยกเลิกสัญญา LINK
- ตรวจสอบรายชื่อ หน่วยบริการที่ออกจากโครงการได้จาก www.nhso.go.th
- สำหรับผู้ที่ได้รับผลกระทบสามารถเข้ารับบริการที่ คลินิก ศูนย์บริการสาธารณสุข โรงพยาบาลรัฐและเอกชนใกล้บ้าน ที่เข้าร่วมโครงการหลักประกันสุขภาพได้ก่อน
- ผู้ที่อยู่ระหว่างนอนรักษาในโรงพยาบาล ที่ถูกยกเลิกสัญญา ท่านสามารถใช้สิทธิรักษาต่อเนื่องได้ จนกว่าแพทย์จะอนุญาตให้กลับไปพักฟื้นที่บ้าน
- ผู้ป่วยที่มีหนังสือส่งตัวที่ออกให้จากหน่วยบริการที่ถูกยกเลิกสัญญา ท่านสามารถเข้ารับการรักษากับโรงพยาบาลที่ได้รับการส่งต่อได้เลย
- ผู้ป่วยโรคเรื้อรัง เช่น เบาหวาน ความดัน หัวใจ HIV ฯ รวมถึงหญิงตั้งครรภ์ ให้นำซองยาเดิมไปให้หน่วยบริการแห่งใหม่ เพื่อการรักษาต่อเนื่อง
ปัจจุบันศูนย์บริการสาธารณสุข และ รพ.รัฐใน กทม. สามารถสืบค้นประวัติการรักษาได้โดยผู้ป่วยต้องยืนยันตนเองผ่านบัตรประจำตัวประชาชน
- สามารถขอประวัติการรักษาเดิมจากหน่วยที่ถูกยกเลิกสัญญาได้โดยไม่เสียค่าใช้จ่าย หากถูกเรียกเก็บให้แจ้งไปที่กรมสนับสนุนบริการสุขภาพ (สบส.) โทร 1426 วันและเวลาทำการ
- เอกสารประกอบการใช้สิทธิคือ บัตรประจำตัวประชาชน หากเป็นเด็กใช้สูติบัตร โดยแจ้งกับหน่วยบริการที่รับรักษาว่า เป็นกลุ่มผู้ป่วยที่ได้รับผลกระทบ จากกรณีหน่วยบริการถูกยกเลิกสัญญา
- สำหรับหน่วยบริการที่ให้บริการกับประชาชนกลุ่มดังกล่าว สามารถเรียกเก็บค่าบริการสาธารณสุขมาที่ สปสช.เป็นกรณีสิทธิว่าง
กทม ปรับ 20,000 ไม่สวมหน้ากากออกนอกเคหสถาน เริ่ม 25 เมย 64 LINK
ประกาศกรุงเทพมหานคร เรื่อง ให้ประชาชนในพื้นที่กรุงเทพมหานครสวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้งตลอดเวลาที่ออกนอกเคหสถาน หรือสถานที่พำนัก
1.พบเห็นคนไม่สวมหน้ากาก
2.แจ้งตำรวจ หรือเจ้าพนักงานควบคุมโรคติดต่อ (เขต)
กรณีแจ้งเขต เขตต้องดำเนินการแจ้งความต่อตำรวจต่อไป
3.ตำรวจสอบสวน
4.พนักงานสอบสวนนำส่งอัยการ
5.พนักงานอัยการนำส่งศาลพิจารณาเพื่อเปรียบเทียบปรับตามดุลพินิจศาลต่อไป
สถานการณ์ 30 เมย 64
กรมควบคุมโรค ก.สาธารณสุข รายงานสถานการณ์การติดเชื้อ #โควิด19 รายใหม่ วันนี้ (30 เม.ย.)
พบผู้ติดเชื้อรายใหม่ 1,583 คน
ยืนยันสะสม 65,153 คน มีผู้เสียชีวิตเพิ่ม 15 คน
เสียชีวิตสะสม 203 คน ทั้งนี้ เวลา 11.30 น.
ศบค. จะแถลงรายละเอียดอย่างเป็นทางการอีกครั้ง
อ้างอิงข้อมูล : กรมควบคุมโรค ก.สาธารณสุข | 30 เมษายน 2564
ใบรับรองการรับวัคซีนประเทศไทย
กระทรวงสาธารณสุข จะออกใบรับรองการรับวัคซีนแบบดิจิทัล (Smart Vaccine Certificate) รูปแบบคิวอาร์โค้ด ที่สร้างเฉพาะแต่ละบุคคล ไม่มีซ้ำกัน (Universally unique identifier : UUID) เมื่อประชาชนได้รับการฉีดวัคซีนโควิด-19 ครบทั้ง 2 เข็มแล้ว ในใบรับรองจะมีรายละเอียดต่าง ๆ ได้แก่ วันที่ได้รับวัคซีน ชื่อการค้าวัคซีน ชื่อบริษัทผู้ผลิตวัคซีน รุ่นการผลิต และหน่วยบริการที่ฉีดวัคซีน
โดยใบรับรองดังกล่าว จะถูกส่งไปที่ไลน์หมอพร้อม หรือพิมพ์เป็นเอกสารรับรองการได้รับวัคซีนป้องกันโรคโควิด-19 ของประเทศไทย (THAILAND NATIONAL CERTIFICATE OF COVID-19 VACCINATION) จากโรงพยาบาลที่ประชาชนรับการฉีดได้ทันที
งาน "Bumrungrad: Shifting the Future of Healthcare" เมื่อวันที่ 24 ก.พ.2565
5.บุคคลที่เกี่ยวข้องกับข้อมูลส่วนบุคคล
สภากาชาดไทย เชิญพสกนิกรไทย น้อมจิตบริจาคโลหิต ถวายสดุดี 90 พรรษา LINK
ขอเชิญพสกนิกรไทย น้อมจิตบริจาคโลหิต ถวายสดุดี ๙๐ พรรษา สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง สภานายิกาสภากาชาดไทย เนื่องในโอกาสทรงเจริญพระชนมพรรษา ๙๐ พรรษา ตลอดเดือนสิงหาคม ๒๕๖๕
ใกล้ที่ไหน... บริจาคโลหิตที่นั่น
- ศูนย์บริการโลหิตแห่งชาติ สภากาชาดไทย
- ภาคบริการโลหิตแห่งชาติ 12 แห่ง
- หน่วยรับบริจาคโลหิตประจำที่ 7 แห่ง (Fixed Station)
- โรงพยาบาลสาขาบริการโลหิต 6 แห่ง ในเขตกรุงเทพฯ
- โรงพยาบาลสาขาบริการโลหิตทั่วประเทศ
หรือ เช็คหน่วยรับบริจาคโลหิตเคลื่อนที่ใกล้คุณ ได้ทาง
www.blooddonationthai.com ใกล้ที่ไหน บริจาคที่นั่น
พาดหัวจากสำนักข่าว
ดีเดย์พิจารณากฏหมาย พ.ร.บ.กัญชา วันนี้อยู่ในความสนใจของประชาชนอย่างมาก ติดตามการรายงานจากสำนักข่าวต่างๆ ได้ดังนี้
จำนวนผู้บาดเจ็บและเสียชีวิต
- จำนวนผู้เสียชีวิต 154 ราย บาดเจ็บนับร้อยราย [Yonhop News, BBC]
- มีผู้เสียชีวิตชาวต่างชาติ 26 ราย ประกอบด้วย ชาวอิหร่าน 5 ราย จีน 4 ราย รัสเซีย 4 ราย สหรัฐ 2 ราย ญี่ปุ่น 2 ราย และประเทศละราย ได้แก่ ฝรั่งเศส ออสเตรเลีย นอร์เวย์ ออสเตรีย เวียดนาม ไทย คาซัคสถาน อูซเบกิสถาน และศรีลังกา [Yonhap]
5 พ.ย.65 ร่าง พ.ร.บ.กัญชา กัญชง และ กัญชาทางการแพทย์
5 พฤศจิกายน 2565
ร่าง พ.ร.บ.กัญชา กัญชง
- นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และ รมว.สธ. โพสต์ภาพคู่ "ซอฟเสริฟกัญชา ไอศกรีมรสนมฮอกไกโด ผสมกัญชา" พร้อมสุภาษิตผ่านเฟซบุ๊ก Anutin Charnvirakul ระบุว่า "สองคนยลตามช่อง คนหนึ่งมองเห็นโคลนตม อีกคนตาแหลมคม เห็นดวงดาวอยู่พราวแพรว"
-เพจเฟซบุ๊ก "อนุทิน ชาญวีรกูล" โพสต์ ยืนยัน กัญชาเป็นนโยบายรัฐบาล มี 3 เป้าหมาย คือ การแพทย์ เศรษฐกิจ สร้างรายได้ ย้ำต้องมีกฎหมายควบคุมการใช้ทางที่ผิด เป็นไปตามนโยบายรัฐบาลที่พรรคร่วมรัฐบาลต้องสนับสนุน
-นายจุรินทร์ ลักษณวิศิษฏ์ รองนายกรัฐมนตรีและรมว.พาณิชย์ ในฐานะหัวหน้าพรรคประชาธิปัตย์ กล่าวย้ำจุดยืนพรรคว่า สนับสนุนกัญชาทางการแพทย์ แต่ไม่สนับสนุนกัญชาเสรีเพราะเป็นห่วงอนาคตประเทศ ส่วนข้อกล่าวหาที่พรรคภูมิใจไทย กล่าวหาว่าประชาธิปัตย์ไปรับงานใครมาและการให้ความเห็นว่าไม่มีมารยาทนั้น ย้อนถาม ว่า ประชาธิปไตยต้องเคารพ
ความเห็นต่าง และไม่ระรานคนที่มีความเห็นต่าง โดยประชาธิปัตย์มีจุดของพรรค ไม่ได้เป็นลูกจ้างส่วนตัวของใครที่จะมาใช้อำนาจ หัวใจสำคัญของระบบประชาธิปไตยคือไม่ใช้อารมณ์และต้องใช้หลักเหตุผล ถ้ายึดถือหลักนี้ได้ การทำงานในฐานะรัฐบาล และในฐานะพรรคร่วมก็ไม่มีปัญหาแน่นอน จะให้เห็นเหมือนกันทั้งหมดไม่ได้ต้องเคารพเสียงประชาชน ถามว่าประชาธิปัตย์รับงานใคร ก็รับงานประชาชน
-นายอนุทิน ชาญวีรกูล รองนายกฯ รมว.สธ. และหัวหน้าพรรคภูมิใจไทย กล่าวถึงประเด็นความขัดแย้งกับนายจุรินทร์ลักษณวิศิษฏ์ หัวหน้าพรรคประชาธิปัตย์เรื่อง พ.ร.บ. กัญชา กัญชง ว่า ขอทำงานต่อ ไม่ควรมานั่งตอบโต้ถือว่านโยบายกัญชาประสบความสำเร็จแล้ว ต่อให้มีหรือไม่มี พ.ร.บ.ประชาชนสามารถใช้ประโยชน์จากกัญชาได้อย่างเต็มที่ พรรคที่ไม่สนับสนุนต้องไปตอบประชาชนให้ได้ว่าทำไมถึงค้าน เพราะกฎหมายฉบับนี้ผ่านชั้นรับหลักการไปแล้ว คิดเป็นอย่างอื่นไม่ได้ นอกจากเล่นการเมือง
กัญชาทางการแพทย์
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมว.สธ. เป็นประธานการประชุมคณะกรรมการขับเคลื่อนนโยบายกัญชาเสรีทางการแพทย์ครั้งที่ 5/2565 แจงผลงานกัญชาปี 65 เห็นผล 4 ด้าน เพิ่มการเข้าถึงของผู้ป่วย สร้างวิจัยและนวัตกรรม คุ้มครองผู้บริโภค และปกป้องกลุ่มเปราะบาง ทำให้ผู้ป่วยร้อยละ 154.38 เข้าถึงยากัญชาได้ เมื่อเทียบกับปีงบ 64 และสูงกว่าเป้าหมายที่ตั้งไว้ส่วนปี 66 จะเน้นส่งเสริมและกำกับการใช้ให้ประชาชนปลอดภัย โดยเฉพาะผลิตภัณฑ์และบริการในท้องตลาดจะนำข้อกฎหมายมาบังคับใช้ให้มีประสิทธิภาพมากขึ้น ควบคู่กับการสร้างความรอบรู้ให้ผู้บริโภคและผู้ป่วย ทั้งนี้ปัจจุบันมียากัญชาทั้งในรูปแบบสารสกัด และยาตำรับแพทย์แผนไทยและแพทย์พื้นบ้านรวม 10 รายการ อยู่ระหว่างการพิจารณาอีก 1 รายการประชาชนเข้าถึงได้โดยไม่เสียค่าใช้จ่าย โดยกรมการแพทย์แผนไทยฯ จะปรับสถานะยาน้ำมันเดชา จากบัญชี 3 ของบัญชียาหลักแห่งชาติ ให้มาเป็นบัญชี 1 เพื่อให้สามารถสั่งจ่ายได้กว้างขวางมากยิ่งขึ้น เพราะการวิจัยที่ผ่านมา พบว่าได้ผลดี
-นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ เปิดเผยว่า กรมการแพทย์ได้ทำการศึกษาวิจัยติดตามผู้ป่วยโรคลมชักรักษายากในเด็กที่ได้สารสกัดกัญชาซีบีดีสูง ร่วมกับยากันชักหลายชนิด เป็นระยะเวลา 12 เดือน จำนวน 14 ราย พบว่า จำนวนผู้ป่วยมีอาการชักรุนแรงลดลง 7 ราย คิดเป็นร้อยละ 50 พบผลข้างเคียงทุกราย ส่วนใหญ่ไม่รุนแรง และมักเกิดในช่วง 3 เดือนแรก โดยเฉพาะเมื่อได้รับสารสกัดกัญชาในขนาดสูง ซึ่งพบผู้ป่วย 4 รายต้องหยุดยาเนื่องจากชักมากขึ้น จึงสรุปได้ว่า สารสกัดกัญชาชนิดซีบีดีสูงมีประสิทธิผลในการรักษาโรคลมชักรักษายากในเด็กไทย พบผลข้างเคียงส่วนใหญ่ไม่รุนแรง โดยเริ่มยาขนาดต่ำและเฝ้าระวังผลข้างเคียงที่รุนแรงในช่วง 3 เดือนแรก
- นพ.ธนินทร์ เวชชาภินันท์ ผอ.สถาบันประสาทวิทยา กล่าวว่า ได้เสนอสารสกัดกัญชาชนิดซีบีดีสูงรักษาโรคลมชักรักษายากในเด็ก และได้รับอนุมัติบรรจุในบัญชียาหลักแห่งชาติด้านสมุนไพร บัญชี 3 เบิกจ่ายในสิทธิประกันสุขภาพถ้วนหน้า เพื่อเพิ่มการเข้าถึงการรักษาของผู้ป่วยกลุ่มนี้
- ภญ.นันทกาญจน์ สุวรรณปิฎกกุล รองผอ.องค์การเภสัชกรรม (อภ.) กล่าวว่า บัญชียาหลักแห่งชาติด้านสมุนไพร (ฉบับที่ 2) พ.ศ.2565 ได้บรรจุรายการยาจากกัญชาที่ผลิตโดย อภ.เพิ่มเป็นตำรับที่ 4 คือ GPO SIBANNAC THC Forte Cannabis Oil (จีพีโอ ซีบาแนค ทีเอชซี ฟอร์ท แคนนาบิส ออยล์) ซึ่งมี THC เข้มข้นในปริมาณ 81 มิลลิกรัม ต่อ 1 มิลลิลิตร หรือปริมาณความเข้มข้น THC สูงถึง 6 เท่าของผลิตภัณฑ์เดิม ใช้รักษาเสริมในภาวะคลื่นไส้ อาเจียนจากเคมีบำบัด ผู้ป่วยโรคมะเร็งระยะท้ายที่มีอาการนอนไม่หลับ เบื่ออาหาร หรือมีอาการปวดในระดับปานกลางจนถึงรุนแรง โดยผู้ป่วยสามารถใช้สิทธิรักษาตามหลักประกันสุขภาพ โดยไม่เสียค่าใช้จ่ายที่คลินิกกัญชาทางการแพทย์ในสถานพยาบาลของรัฐทั่วประเทศ
มาตรการเรื่องของเหลวและการตรวจค้น ท่าอากาศไทย
บ.ท่าอากาศไทย ไม่ได้กำหนดเฉพาะเจาะจงในการให้หรือห้ามนำยาขึ้นเครื่อง แต่จะกำหนดในมาตรการเรื่องของเหลวแทน ซึ่งโดยหลัก คือ ของเหลว เจล สเปรย์ วัตถุหรือสารอื่นๆ ที่มีลักษณะคล้ายคลึงกันที่มี
ขนาดบรรจุเกินกว่า 100 มิลลิลิตร (ที่ไม่ใช่วัตถุอันตราย) ใส่ในกระเป๋าสัมภาระที่จะบรรทุกไปใต้ท้องเครื่องบิน
ไม่อนุญาตให้นำติดตัวขึ้นเครื่องบิน [
source]
มาตรการเรื่องของเหลว เจล สเปรย์ หรือวัตถุและสารอื่น ๆ ซึ่งมีลักษณะคล้ายคลึงกัน (Liquids, Aerosols and Gels : LAGs)
เป็นขั้นตอนการตรวจค้นสำหรับผู้โดยสาร และเจ้าหน้าที่ประจำอากาศยานที่เดินทางไปกับอากาศยานในทุกเที่ยวบินที่ทำการบินออกจากทุกท่าอากาศยานของ ทอท. รวมทั้งเจ้าหน้าที่และบุคคลที่ได้รับสิทธิในการเข้า-ออกพื้นที่หวงห้ามหลังจุดตรวจค้น ณ ทุกท่าอากาศยานของ ทอท. โดยไม่ใช้ปฏิบัติสำหรับของเหลว เจล สเปรย์ (LAGs) หรือวัตถุและสารอื่น ๆ ซึ่งมีลักษณะคล้ายคลึงกัน ประเภทยาและนม หรืออาหารสำหรับเด็กทารก ซึ่งอนุญาตให้นำขึ้นในห้องโดยสารอากาศยานได้ในปริมาณที่เหมาะสม
ขั้นตอนการปฏิบัติ
1. กรณี LAGs ที่เป็นสัมภาระส่วนตัว
1.1 ต้องบรรจุในภาชนะที่มีกำหนดปริมาณความจุไม่เกิน 100 มิลลิลิตร (กรณีภาชนะที่มีกำหนดปริมาณความจุเกิน 100 มิลลิลิตร แต่มี LAGs บรรจุอยู่ถึงแม้ว่าจะไม่เกิน 100 มิลลิลิตร จะไม่อนุญาตให้นำขึ้นในห้องโดยสารอากาศยาน)
1.2 ภาชนะที่บรรจุ LAGs ตามข้อ 2.1.1 ต้องถูกใส่รวมในถุงพลาสติกใส (Transparent Re-Sealable Plastic Bag) รวมกันแล้วไม่เกิน 1,000 มิลลิลิตร (หรือปริมาณที่เทียบเท่าในหน่วยวัดปริมาณอื่น) และปิดผนึกปากถุงให้เรียบร้อย โดยอนุญาตให้ผู้โดยสาร 1 คน ต่อ 1 ถุง
1.3 ให้ผู้โดยสารแยกถุงพลาสติกใสตามข้อ 2.1.2 ออกจากกระเป๋า/สัมภาระอื่นๆ ที่จะนำขึ้นในห้องโดยสารอากาศยาน รวมทั้งเสื้อคลุม และอุปกรณ์คอมพิวเตอร์ เพื่อตรวจค้นเป็นการเฉพาะ
ผู้โดยสารต้องเตรียมพร้อมเพื่อผ่านจุดตรวจค้นเพื่อการรักษาความปลอดภัย ดังนี้
1. นำของเหลว เจล และสเปรย์ หรือวัตถุและสารอื่นๆ ซึ่งมีลักษณะคล้ายคลึงกัน ที่บรรจุมาในภาชนะบรรจุขนาดเกินกว่า 100 มิลลิลิตรใส่ในสัมภาระบรรทุก (Checked Baggage) เพื่อทำการ Check-in เนื่องจากไม่อนุญาตให้นำติดตัวขึ้นบนอากาศยาน
2. หากต้องการนำ ของเหลว เจล และสเปรย์ฯ ติดตัวขึ้นบนอากาศยาน (Carry-on) ของเหลวฯ นั้นต้องมีขนาดบรรจุภัณฑ์ไม่เกิน 100 มิลลิลิตร นำใส่ไว้ในถุงพลาสติกใสแบบ Zip-lock ขนาด 20 x 20 ซม. (มีจัดเตรียมไว้ให้ที่โต๊ะบริการ บริเวณด้านหน้าเคาน์เตอร์ Check-in) ผู้โดยสาร 1 คน ต่อถุง Zip-lock 1 ถุง โดย
ปริมาณของเหลวฯ เมื่อรวมกันแล้วต้องไม่เกิน 1 ลิตร และนำผ่านเครื่อง X-Ray ซึ่งแยกจากสัมภาระติดตัวอื่น ๆ
ตั้งแต่วันที่ 1 มิถุนายน พ.ศ. 2550 กรมการขนส่งทางอากาศได้ประกาศใช้ข้อกำหนดเกี่ยวกับการนำของเหลว เจล สเปรย์ หรือวัตถุ และสารอื่นๆ ซึ่งมีลักษณะคล้ายคลึงกันติดตัวขึ้นเครื่องบินของผู้โดยสารทุกสัญชาติ โดยสัมภาระติดตัวที่เป็นของเหลวต่างๆ เช่น ผลิตภัณฑ์ประเภทเครื่องดื่ม อาหารกระป๋อง ช็อกโกแลต น้ำยาบ้วนปาก ครีมโกนหนวด สเปรย์จัดแต่งทรงผม น้ำหอม โคโลญจน์ ครีม ยาหม่อง ยาทาเล็บ เทียนไข ผลิตภัณฑ์เครื่องสำอาง (เช่น ลิปกลอส มาสคารา ครีมรองพื้น ฯลฯ) และอื่นๆ ที่มีลักษณะเป็นของเหลว สามารถนำขึ้นเครื่องได้ โดยขนาดของแต่ละบรรจุภัณฑ์ต้องไม่เกิน 100 มิลลิลิตร (100 CC) ซึ่งของเหลวทั้งหมดต้องบรรจุภายในถุงพลาสติกใสขนาดไม่เกิน 20 x 20 เซนติเมตร ที่เปิดปิดผนึกได้ (หรือถุงซิปล็อค) โดยขนาดของถุงพลาสติกต้องมีความจุไม่เกิน 1 ลิตร และผู้โดยสาร 1 คน สามารถนำถุงพลาสติกใสขึ้นเครื่องได้คนละ 1 ใบ เท่านั้น สำหรับสินค้าที่เป็นของเหลวที่ซื้อภายในคิง เพาเวอร์ ดิวตี้ ฟรี สามารถซื้อได้ไม่จำกัดจำนวน ยกเว้นผู้โดยสารที่มีจุดหมายปลายทางไปยังประเทศที่มีข้อจำกัดเฉพาะ
[
source]
รอบ 16 ทีม
3 ธันวาคม 2565
เวลา 22.00 น. เนเธอร์แลนด์ 3 - 1 สหรัฐอเมริกา (True4U True Sports 2)
4 ธันวาคม 2565
เวลา 2.00 น. อาร์เจนตินา 2 - 1 ออสเตรเลีย (3HD True Sports 2)
เวลา 22.00 น. ฝรั่งเศส 3 - 1 โปแลนด์ (True4U True Sports 2)
5 ธันวาคม 2565
เวลา 2.00 น. อังกฤษ 3 - 0 เซเนกัล (MONO29 True Sports 2)
เวลา 22.00 น. ญี่ปุ่น 1 (1) - 1 (3) โครเอเชีย (True4U True Sports 2)
6 ธันวาคม 2565
เวลา 2.00 น. บราซิล 4 - 1 เกาหลีใต้ (True4U True Sports 2)
เวลา 22.00 น. โมร็อกโก 0 (3) - 0 (0) สเปน (ช่อง 8 True Sports 2)
7 ธันวาคม 2565
เวลา 2.00 น. โปรตุเกส 6 - 1 สวิตเซอร์แลนด์ (GMM25 True Sports 2)
ของขวัญปีใหม่ ปี 2566 จากกระทรวงต่างๆ
20 ธันวาคม 2565 คณะรัฐมนตรีรับทราบโครงการ/กิจกรรมที่จะดำเนินการเพื่อมอบเป็นของขวัญปีใหม่ ปี 2566 ให้แก่ประชาชนตามที่ 19 หน่วยงานเสนอ เช่น
พลิกวิกฤตการเงินของโรงพยาบาล
"เริ่มจากวิกฤตการเงินของโรงพยาบาล ที่แย่ขนาดว่า โรงพยาบาลสั่งของบริษัทแล้วบริษัทไม่ส่งของให้ เนื่องจากติดหนี้เยอะ และนานเกิน วิกฤตการเงินระดับ7 หนี้สินสุทธิ 280 ล้าน กลับกลายมาเป็นโรงพยาบาลที่มีเงินบำรุงเป็นบวกอยู่พอสมควร อาจจะโชคดีด้วยครับที่มีการรักษาโควิดเยอะ ทำให้มีรายได้มาก ที่สำคัญกว่าเงินที่มีอยู่ คือเจ้าหน้าที่ตระหนักรู้เรื่องการเงินโรงพยาบาล"พิธีเปิดเทศกาล 7 กุมภาพันธ์ 2566
วันอังคารที่ 7 กุมภาพันธ์ 2566 มีพิธีเปิดเทศกาลภาพยนตร์ญี่ปุ่น 2566 ที่โรงภาพยนตร์เฮ้าส์ สามย่าน ณ สามย่านมิตรทาวน์ ทางเทศกาลได้มีการฉายภาพยนตร์เรื่อง "BL Metamorphosis" เป็นภาพยนตร์เปิดเทศกาล พิเศษปีนี้้ ได้รับการสนับสนุนจากทางซูชิฮิโระในการจัดเตรียมซูชิสำหรับผู้ร่วมงานอีกด้วย
นพ.ภัทรพล คำมุลตรี ผอ.พานาซี พระราม 2 ขึ้นบรรยายเรื่อง มหัศจรรย์สเต็มเซลล์ CD34 ตารางบริการด้านปฐมภูมิองค์รวม
บุฟเฟต์ทุเรียนในกรุงเทพ
ห้องตรวจเวชศาสตร์ฟื้นฟู
ห้องตรวจเวชศาสตร์ฟื้นฟู อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 2 เบอร์โทรศัพท์ 044-615002 ต่อ 4215
10 อันดับ คะแนนบัญชีรายชื่อรวม @16 พฤษภาคม 16.00 น. LINK
อันดับ 1 ก้าวไกล 14,233,895
อันดับ 2 เพื่อไทย 10,865,836
อันดับ 3 รวมไทยสร้างชาติ 4,673,691
อันดับ 4 ภูมิใจไทย 1,121,595
อันดับ 5 ประชาธิปัตย์ 899,303
อันดับ 6 ประชาชาติ 576,613
อันดับ 7 พลังประชารัฐ 530,017
อันดับ 8 เสรีรวมไทย 347,607
อันดับ 9 ไทยสร้างไทย 338,042
อันดับ 10 ประชาธิปไตยใหม่ 266,799
อันดับ 11 ใหม่ 246,177
อันดับ 12 ชาติพัฒนากล้า 207,860
คลินิกพิเศษนอกเวลาระดับรพ.ศูนย์ ภาคตะวันออก
ตลาดความรู้ วันเสาร์ที่ 1 กรกฏาคม 2566 เวลา 10.00 – 20.00 น. ห้องฟินิกซ์ 2-6 ฮอลล์ 11-12 อิมแพค เมืองทองธานี
ตารางอบรมตลาดความรู้ด้านแพทย์แผนไทย แพทย์พื้นบ้าน และแพทย์ทางเลือกในงานมหกรรมสมุนไพรแห่งชาติครั้งที่ 20
วันเสาร์ที่ 1 กรกฎาคม 2566 ห้องฟินิกซ์ 2-6 อิมแพค เมืองทองธานี
10.00-12.00 น.
ห้องฟินิกซ์ 2 เปิดผัสสะทั้ง 5 ด้วยสมุนไพร มูลนิธิเพื่อเด็กพิการ
ห้องฟินิกซ์ 3 เม็ดสครับสมุนไพรขัดผิวหน้า สถาบันวิทยาศาสตร์และเทคโนโลยีแห่งประเทศไทย (วว.)
ห้องฟินิกซ์ 4 เพิ่มคุณค่าสมุนไพรไทย ด้วยการสกัดน้ำมันหอมระเหย
ห้องฟินิกซ์ 5 สุมยาสมุนไพร ต้านภัย PM2.5
ห้องฟินิกซ์ 6 เจลลี่สมุนไพร บำรุงโลหิต
13.00-15.00 น.
ห้องฟินิกซ์ 2 การนวดลดการอักเสบฤศดวงและการบริหารร่างกายเพื่อปรับโครงสร้างร่างกาย
ห้องฟินิกซ์ 3 ฝึกรู้ทันเหตุกดดัน คุ้มกันกายใจไม่ป่วย
ห้องฟินิกซ์ 4 กินเห็ดเพื่อชีวิต พลิกโรค (การทำน้ำพริกเห็ดแครง)
ห้องฟินิกซ์ 5 ปลูกพืชสนุก สุขภาพดี
ห้องฟินิกซ์ 6 คุณภาพกัญชา เริ่มที่การปลูก
15.45-17.45 น.
ห้องฟินิกซ์ 2 โปรแกรมจัดการอาการปวดเข่าด้วยแผนไทย
ห้องฟินิกซ์ 3 นวดดัดดึง เพื่อรักษาอาการปวดคอ บ่า ไหล่
ห้องฟินิกซ์ 4 น้ำกระสายยา เสริมฤทธิ์การรักษา
ห้องฟินิกซ์ 5 เซรั่มสมุนไพรนางพญาหน้าขาว ลดฝ้า จุดด่างดำ สูตรธรรมชาติ 100% ปราศจากสารสังเคราะห์
ห้องฟินิกซ์ 6 การนวดกดจุด สะท้อนเท้า ฟื้นฟูสุขภาพ
อบรมฟรี ทุกหลักสูตร
ลงทะเบียนล่วงหน้า 20 คน และหน้างาน 40 คน
ระยะเวลาอบรม 2 ชม. /หลักสูตร จำกัดจำนวน 60 คน/หลักสูตร
หลักสูตรที่เป็นการทำผลิตภัณฑ์จะมีของให้ปฏิบัติจริง
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง LINK
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ดูแลสัตว์จรจัดภายในเขตเทศบาลนครระยอง
เงื่อนไขการรับสุนัขเข้ามาดูแลที่ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง
1.สุนัขตามคำร้องเรียนในพื้นที่เขตเทศบาลนครระยอง
2.สุนัขจรจัดก่อเหตุเดือดร้อนรำคาญ เช่น ไล่กัดผู้สัญจรไปมา
3.กรณีเร่งด่วน เช่น สุนัขต้องสงสัยโรคพิษสุนัขบ้า หรือโรคร้ายแรงอื่นๆที่สามารถติดต่อสู่คน
*สำหรับกรณีนอกเหนือจากนี้ ทางศูนย์พักพิงฯ ไม่สามารถนำเข้ามาดูแลได้เนื่องจากอยู่นอกขอบเขตและภารกิจงานของศูนย์พักพิงฯ
**ทางศูนย์พักพิงฯ มีความยินดีหากมีผู้ประสงค์จะขอรับน้องๆ ในศูนย์พักพิงฯไปเลี้ยงเลี้ยงดูต่อ หากสนใจสามารถติดต่อได้ผ่านงานสัตวแพทย์ หรือสำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครระยอง ในวันและเวลาตามราชการ
***หากท่านใดประสงค์จะบริจาคอาหารหรือให้ความช่วยเหลือในการดูแลน้องๆในศูนย์พักพิงฯ สามารถติดต่อได้ผ่านงานสัตวแพทย์ หรือสำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครระยอง ในวันและเวลาตามราชการ
ภาพบรรยากาศพิธีเปิด
พิธีเปิดอย่างยิ่งใหญ่ วันนี้ 1 กรกฏาคม กล่าวเปิดงานโดย ม.โนริอากิ ยามชิตะ กรรมการผู้จัดการใหญ่ โตโยต้า มอเตอร์ ประเทศไทย บนเวที พร้อมผู้มีเกียรติและผู้มีส่วนสำคัญต่อการแข่งขันครั้งนี้ในทุกภาคส่วนในประเทศไทยและนานาชาติ ปิดท้ายด้วยผู้ว่าราชการจังหวัดชลบุรี ท่านธวัชชัย ศรีทอง กล่าวเปิดการแข่งขัน
กำหนดการท่องเที่ยวรถไฟคิฮะและรถไฟไทย รายเดือน
เดือนมีนาคม 2566 : ธีมเที่ยวศิลปะวัฒนธรรม วันที่ 4-5, 11-12, 18-19 และ วันที่ 25
เดือนเมษายน 2566 : ธีมย้อนรอยประวัติศาสตร์ วันที่ 1-2, 8-9, 22-23 และ 29-30 (ค้างคืน)
เดือนพฤษภาคม 2566 : ธีมผจญภัยเหนือสายน้ำ วันที่ 67 13-14 20-21 (ค้างคืน) และ 27-28
เดือนกรกฏาคม 2566 : 5 ทริป 5 จังหวัด คอนเซ็ปต์ สืบสาน รักษา ต่อยอด (โครงการพระราชดำริ)
เดือนสิงหาคม 2566 : 4 ทริป 3 จังหวัด : คอนเซ็ปต์พิรุณโปรยปราย เที่ยวสบาย ๆ กลางสายฝน
เดือนกันยายน 2566 : คอนเซ็ปต์นั่งรถไฟอิ่มบุญ ปันรอยยิ้ม เที่ยวกันทั้งทีต้องดีต่อใจ
............
กำหนดการแสดงกิจกรรมบนเวที 2-6 สิงหาคม #งานเทศกาลเที่ยวเมืองไทย
วันออกพรรษา ประจำปี 2566 - วันอาทิตย์ที่ 29 ตุลาคม 2566
วันออกพรรษา ถือเป็นวันสิ้นสุดการจำพรรษา ซึ่งตรงกับวันขึ้น 15 ค่ำ เดือน 11 เป็นวันที่พ้นจากข้อกำหนดทางพระวินัยในช่วงฤดูฝนนั่นเอง วันออกพรรษา 2566 ตรงกับวันอาทิตย์ที่ 29 ตุลาคม 2566 กิจกรรมสำคัญในเทศกาลออกพรรษา เช่น
- พิธีตักบาตรเทโวโรหณะ ที่มีชื่อเสียงคือ ที่พระปฐมเจดีย์ จ.นครปฐม และ วัดสะแกกรัง จ.อุทัยธานี
- ประเพณีชักพระ ทางภาคใต้ มีสองกรณี คือ ชักพระทางบก จ.จังหวัดนครศรีธรรมราช และชักพระทางน้ำ จ.สุราษฏร์ธานี
- พิธีรับพระภาคกลาง มักจะปรากฏในภาคกลางที่อยู่ติดกับแม่น้ำ ลำคลอง ที่เป็นคมนาคมทางน้ำ เช่น อำเภอบางบ่อ บางพลี จังหวัดสมุทรปราการ
- ประเพณีตักบาตรพระร้อย หรือ ใส่บาตรพระร้อยรูป ส่วนมากจัดพิธีขึ้นทางน้ำเนื่องด้วยแต่เดิมบ้านอยู่ติดริมน้ำลำคลอง จึงใช้เรือสัญจร พระส่วนมากจึงใช้เรือบิณฑบาต
การยื่นลงทะเบียนผ่านแอปพลิเคชัน “เงินเด็ก”
การยื่นลงทะเบียนผ่านแอปพลิเคชัน “เงินเด็ก”
1.ดาวน์โหลด App เงินเด็ก และ App D.DOPA
2.ผู้ปกครองต้องยืนยันตัวตนผ่านแอปพลิเคชัน D.DOPA ของกรมการปกครอง
- ส่วนภูมิภาค ยืนยันตัวตน ณ ที่ว่าการอำเภอ
- กรุงเทพมหานคร ยืนยันตัวตน ณ สำนักงานเขต
3.เมื่อยืนยันตัวตนเรียบร้อยแล้วสามารถยื่นลงทะเบียนผ่านแอปพลิเคชัน “เงินเด็ก”โดยกรอกข้อมูลของผู้ลงทะเบียนในเมนู “ลงทะเบียน” ให้ครบถ้วน
4. แนบเอกสารการรับรองของผู้รับรองคนที่ 1 และคนที่ 2 ให้ครบถ้วน
หมายเหตุ : เตรียมสำเนาเอกสารของผู้รับรองคนที่ 1 และคนที่ 2 ให้พร้อมก่อนลงทะเบียนผ่านแอปพลิเคชัน “เงินเด็ก”
ข้อมูลเกี่ยวกับแอป เงินเด็ก
แอพพลิเคชันสำหรับประชาชนในการลงทะเบียน เปลี่ยนแปลงสิทธิ รับการแจ้งเตือน ตรวจสอบสิทธิ และติดต่อสอบถามโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดของกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ซึ่งเป็นสวัสดิการให้แก่เด็กแรกเกิด (0 - 6 ปี) ที่อยู่ในครัวเรือนที่มีรายได้น้อย (รายได้เฉลี่ยไม่เกิน 100,000 บาท ต่อคน ต่อปี) เพื่อให้เด็กได้รับการดูแลให้มีคุณภาพชีวิตที่ดี มีพัฒนาการเหมาะสมตามวัย รวมทั้งเป็นหลักประกันให้เด็กได้รับสิทธิด้านการอยู่รอดและการพัฒนาตามอนุสัญญาว่าด้วยสิทธิเด็ก
สแกน QR code อย่างไรให้ปลอดภัย
การใช้ชีวิตแบบสแกน QR code ไม่ว่าจะจ่ายเงิน อ่านข้อมูลต่าง ๆ หรือลงทะเบียนรับสิทธิใด ๆ ก็มักจะพบเห็นได้ในปัจจุบัน ซึ่งเป็นขั้นตอนที่สะดวกมากขึ้น แต่ใครหลายคนก็มักจะละเลย ไม่ตรวจเช็กให้ถี่ถ้วนก่อนทำการสแกน เพราะมิจฉาชีพก็สามารถทำ QR code ปลอมขึ้นมาหลอกเอาเงิน หรือข้อมูลส่วนตัวได้ง่าย ๆ เช่นกัน
????ดังนั้น
✅ทุกการสแกนจะต้องตรวจสอบชื่อผู้รับโอนและยอดเงินทุกครั้ง
✅ถ้าจะจ่ายหรือโอนเงินให้หน่วยงาน เช่น มูลนิธิ ราชการ ชื่อผู้รับควรเป็นชื่อหน่วยงานนั้นโดยตรง หากสแกนแล้วเป็นชื่อบุคคล ควรตรวจสอบหรือโทรถามให้แน่ใจก่อนกดโอน
✅หากสแกนเพื่อจุดประสงค์อื่น เช่น เพื่ออ่านข้อมูลเพิ่มเติม หรือรับสิทธิพิเศษต่าง ๆ เมื่อสแกนแล้ว ต้องสังเกตลิงก์ URL ว่าถูกต้องและปลอดภัยหรือไม่ ขั้นตอนนี้มิจฉาชีพจะ “ยัง” ไม่สามารถดูดเงินในบัญชีเราออกไป
✅ถ้าไม่แน่ใจอย่าคลิกต่อ
‼️ทั้งนี้ ลิงก์ URL ของมิจฉาชีพมักเป็นเว็บไซต์ธนาคาร “ปลอม” หลอกให้กรอกชื่อผู้ใช้/รหัสผ่าน หรือเป็นเว็บไซต์หลอกให้ดาวน์โหลดมัลแวร์ต่าง ๆ ซึ่งหากเราเผลอกรอกข้อมูลสำคัญ หรือกดดาวน์โหลด จะโดนดูดเงินในบัญชีออกไปได้
ทันตแพทยศาสตร์ จุฬาฯ จัดโครงการรักษาฟันฟรี 1050 คน 20 ตุลาคม 2566
คณะทันตแพทยศาสตร์ จุฬาฯ จัดโครงการ "รักษาฟันฟรี" เพื่อถวายเป็นพระราชกุศล
แด่สมเด็จพระศรีนครินทราบรมราชชนี และเนื่องในวันทันตสาธารสุขแห่งชาติ ในวันศุกร์ที่ 20 ตุลาคม 2566 ณ อาคารบรมนาถศรีนครินทร์ คณะทันตแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ถนนอังรีดูนังต์ เขตปทุมวัน กรุงเทพมหานคร โดยให้บริการ อุดฟัน ถอนฟัน ขูดหินปูน (1 คน ต่อ 1 รายการ) รับจำนวนจำกัด ผู้ใหญ่ 900 คน เด็ก 150 คน (ผ่าฟันคุดไม่เกิน 84 ซี่) เริ่มแจกบัตรคิว 6.30 น. ลงทะเบียน ตั้งแต่ 7.00 น. เริ่มตรวจตั้งแต่ 7.45-11.45 น. หรือเมื่อครบตามจำนวนที่กำหนด
นำบัตรประชาชนมาแสดง ในการลงทะเบียน สำหรับเด็กอายุต่ำกว่า 12 ปี ต้องมีผู้ปกครองมาด้วย ผู้มีอายุต่ำกว่า 18 ปี ต้องมีใบยินยอม และมีสำเนาบัตรประชาชนผู้ปกครองมาแสดง (ดาวน์โหลดแบบฟอร์มใบยินยอมจาก QR Code)
** งดให้บริการกับผู้ที่มีไข้ไอเจ็บคอ หรือมีอาการคล้ายหวัด และต้องสวมหน้ากากอนามัยก่อนเข้าพื้นที่และตลอดเวลาในการรับบริการ ***
*** ผุ้มีโรคประจำตัว ให้นำยาที่รับประทานประจำมาด้วย
ตารางบริการศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ
สังเกต ธงน่านเฟส เอาไว้ เจอที่ไหน แวะได้เลย
น่านเฟส มีขึ้นเพื่อ
1. "ปลุกความเป็นน่าน" ให้คนน่านเริ่มกลับมาใช้วิถีชีวิตชุมชนนอกบ้าน (เพราะเมืองน่าน ตั้งแต่อดีต เป็นเมืองที่ เต็มไปด้วยการสร้างสรรค์ เทศกาลของชุมชนหลากหลายตามประเพณีนิยม) เพื่อให้น่าน เป็นเมืองแห่งการสร้างสรรค์อย่างต่อเนื่องโดยไม่ทิ้งความเป็นน่านในชีวิตวิถีใหม่ที่ร่วมสมัย เป็นการหลอมรวมวิถีสร้างสรรค์ร่วม สมัยกับชีวิตวัฒนธรรมดั้งเดิมที่ดำเนินมาในพื้นที่ชุมชน ให้เกิดความต่อเนื่อง สืบสาน เป็นน่านเมืองที่มีชีวิตใหม่อยู่เสมอ
2. เปิดประตูนานสู่เทศกาลน่าน ๔-๖ เดือน หรือทั้งปี เพื่อให้น่านเป็นเมืองแห่งเทศกาล เพราะตั้งแต่ อดีตกาลมาน่านไม่เคยว่างเว้นเทศกาลงานวัด ๑๒ ฮีต ตามประเพณี ในวัฎจักรของวิถีเกษตรกรรมส่ง เสริมการท่องเที่ยว และการค้าขายของร้านอาหาร โรงแรมที่พัก ร้านขายของที่ระลึก เสื้อผ้า ผลิตภัณฑ์ ชุมชน ให้เป็นที่รู้จักโดยใช้แพลตฟอร์มของเทศกาลน่าน ในรูปแบบของศิลปะที่รวมผู้คนให้มาใช้ชีวิตร่วมกัน ได้แก่ ดนตรี การแสดง ภาพยนตร์ ศิลปะและงานออกร้าน
นายยอน ธอร์กอร์ด (H.E. Mr. Jon Thorgaard) เอกอัครราชทูตเดนมาร์กประจำประเทศไทย ระบบสถิติทางการทะเบียน กรมการปกครอง LINK
สถิติการบริการด้านการทะเบียน
ทำเนียบท้องที่
สถิติการบริการ
ด้านการทะเบียนราษฎร
ประกาศสถิติ
จำนวนประชากรประจำปี
จำนวนประชากรรายอายุ
จำนวนประชากร
การแสดงสถิติรูปแบบกราฟ
ทะเบียนสมรส
ทะเบียนหย่า
ทะเบียนรับรองบุตร
ทะเบียน
รับบุตรบุญธรรม
ทะเบียนเลิก
รับบุตรบุญธรรม
ทะเบียนบันทึก
ฐานะแห่งครอบครัว
สถิติการปฏิบัติงานของ
ศูนย์ตอบปัญหางานทะเบียนและบัตร
Call Center 1548
สถิติการคัดรับรอง
รายการทะเบียนราษฎร (ทร.14/1)
ของหน่วยงานรัฐวิสาหกิจ
สถิติทะเบียนชื่อบุคคล
ออกแบบและพัฒนาโดย
ส่วนบริหารและพัฒนาเทคโนโลยีการทะเบียน
สำนักบริหารการทะเบียน กรมการปกครอง
59 หมู่ 11 ตำบลบึงทองหลาง อำเภอลำลูกกา
จังหวัดปทุมธานี 12150
คลินิกทันตกรรม รพ.สต.บางขะแยง
สอบถามข้อมูลเพิ่มเติม โทร 02-598-2723
เป้าหมายการพัฒนาระบบบัตรประชาชนใบเดียวรักษาได้ทุกที่
“บัตรประชาชนใบเดียวรักษาทุกที่” ระยะแรกจะเริ่มใน 4 จังหวัดนำร่อง ได้แก่ “แพร่ เพชรบุรี ร้อยเอ็ด นราธิวาส” เป้าหมายการพัฒนาระบบบัตรประชาชนใบเดียวรักษาได้ทุกที่ จะเชื่อมโยงข้อมูลสุขภาพหน่วยบริการทุกระดับ เพื่ออำนวยความสะดวกแก่ประชาชน ส่งผลให้เกิดการพัฒนาระบบข้อมูล เชื่อมต่อกัน ทั้ง รพ.รัฐ ร้านยา เอกชน ,พัฒนาการตรวจสอบสิทธิ์ระบบยืนยันตัวตน ,การพัฒนาระบบการทำงานใบรับรองแพทย์แบบอิเล็กทรอนิกส์ สมุดสุขภาพประชาชน ใบรับรองแพทย์ดิจิทัล และ พัฒนาระบบเชื่อมต่อประชาชน ทางไลน์แอปพลิเคชัน
หากประชาชนบางส่วนไม่ถนัดการใช้มือถือแบบสมาร์ทโฟน สามารถใช้บัตรประชาชนใบเดียวในการรับบริการสามารถเชื่อมโยงข้อมูลในการรักษาพยาบาลได้ทุกแห่งเช่นเดียวกัน
การพัฒนาระบบแบ่งเป็น 4 ส่วน ดังนี้
1. พัฒนาระบบบันทึกข้อมูล ทั้งจาก รพ.รัฐ สังกัดกระทรวงสาธารณสุข นอกสังกัด สธ. รพ.เอกชน รพ.สต. คลินิก ร้านยา
2. พัฒนาระบบยืนยันตัวตน ทั้งการยืนยันตัวตนผู้รับบริการ เช่นดิจิทัลไอดี ยืนยันตัวตนผู้ให้บริการ การตรวจสอบสิทธิ การยืนยันเข้ารับบริการ ลายมือชื่ออิเล็กทรอนิกส์ การยืนยันตัวตนคนต่างด้าว
3. พัฒนาระบบการทำงาน เช่น ประวัติสุขภาพอิเล็กทรอนิกส์ สมุดสุขภาพประชาชน ใบรับรองแพทย์ดิจิทัล การนัดหมายออนไลน์ การดูแลผู้ป่วยที่บ้าน เป็นต้น
4.การพัฒนาระบบเชื่อมต่อประชาชน ทั้งการผ่าน LINE OA และ Application เพื่อให้สามารถเชื่อมโยงประชาชนทั้งประเทศ สถานการณ์โควิดในไทยเดือนธันวาคม 2566 - ไทยรู้สู้โควิด
ข้อดีของบัตรประชาชนใบเดียวรักษาทุกที่
เย็นทั่วหล้า มหาสงกรานต์ 11 – 15 เมษายน 2567 ณ ท้องสนามหลวง
รัฐบาลไทยประกาศจัดงาน “เย็นทั่วหล้า มหาสงกรานต์ 2567” Maha Songkran World Water Festival 2024 ระหว่างวันที่ 11 – 15 เมษายน 2567 บริเวณ ถนนราชดำเนินกลางและท้องสนามหลวง โดยมีกิจกรรมที่น่าสนใจ ได้แก่
- “ขบวนรถพาเหรด” ยิ่งใหญ่ตระการตา กว่า 20 ขบวน เช่น เทพีสงกรานต์ “มโหธรเทวี” รถพาเหรด 16 จังหวัดที่จัดงานสงกรานต์ได้มีเอกลักษณ์ รถพาเหรดซอฟต์พาวเวอร์ พร้อมการแสดงศิลปวัฒนธรรมจากนักแสดงและผู้ร่วมขบวนแห่กว่าพันคน ซึ่งจะเคลื่อนจากสะพานผ่านฟ้าลีลาศ – ถนนราชดำเนินกลาง – ท้องสนามหลวง ในวันที่ 11 และจอดแสดงโชว์ที่ท้องสนามหลวง ถึงวันที่ 15
กิจกรรมน่าสนใจในพื้นที่ท้องสนามหลวง เช่น
- โซนสงกรานต์อัตลักษณ์ 5 ภาค ได้แก่ เวณีปี๋ใหม่เมืองเชียงใหม่ จ.เชียงใหม่ ประเพณีสงกรานต์กรุงเก่า จ.พระนครศรีอยุธยา ประเพณีแห่ต้นดอกไม้ จ.เลย ประเพณีก่อพระทรายวันไหล จ.ชลบุรี และประเพณีแห่นางดาน จ.นครศรีธรรมราช
- โซนซอฟต์พาวเวอร์ นำเสนอเอกลักษณ์ไทย เช่น การแสดงนาฏยุทธมวยไทย การสาธิตมวยโบราณ อาหารไทยโบราณ อาหารไทยชาววัง ขายแพคเกจส่งเสริมการท่องเที่ยวภายในประเทศ
- ลานเล่นน้ำ มีอุโมงค์น้ำ ถังน้ำล้นยักษ์ สถานีน้ำ ให้นักท่องเที่ยวร่วมเล่นน้ำ
- โซนจำหน่ายผลิตภัณฑ์และสุดยอดของดี OTOP จากทั่วประเทศ
วันที่ 13 มีกิจกรรมทำบุญตักบาตร สรงน้ำพระ รดน้ำผู้สูงอายุ เพื่ออนุรักษ์และสืบสานวัฒนธรรมประเพณีไทยอันดีงาม และเสริมสิริมงคลแก่ผู้ร่วมงาน
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน พฤษภาคม 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน พฤษภาคม 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆโทรสอบถาม อบต./เทศบาล ในพื้นที่
ธรรมะในสวน พฤษภาคม 2567 เดือนแห่งธรรมะวิสาขะ
ความสุขที่แท้จริงของเราคืออะไร? หาได้จากที่ไหน?
ความสุขของแต่ละคนนั้นนิยามแตกต่างกัน หลายคนจะมีความสุขกับสิ่งภายนอก ไม่ว่าจะเป็นการมีบ้านที่ใหญ่โต ทานอาหารในร้านหรู ชอปปิงของแบรนด์เนม ขับรถราคาแพง ท่องเที่ยวต่างประเทศ เราจึงพยายามไขว่คว้าหาสิ่งที่ต้องการ และสามารถตอบสนองความต้องการของตนเอง เพื่อให้เรารู้สึกมีความสุข แต่...เราเคยถามตัวเองหรือไม่ว่า...ความสุขที่แท้จริงเป็นแบบไหน? แล้วสิ่งเหล่านี้เป็นความสุขจริง ๆ หรือไม่ หรือ เรากำลังเสพติดความสุขอยู่?
เนื่องในเดือนแห่งธรรมะวิสาขะ ศูนย์การประชุมแห่งชาติสิริกิติ์ ขอชวนทุกท่านมาร่วมหาคำตอบในการใช้ชีวิตให้มีความสุขไปกับกิจกรรม “ธรรมะในสวน” ฟังธรรมะหัวข้อ “เข้าใจชีวิต พิชิตสุข” พร้อมวิสัชนาธรรม ภายใต้บรรยายากาศที่ร่มรื่นของสวนเบญจกิติเพื่อค้นหาความสุขที่แท้จริงของชีวิตที่ไม่ต้องแสวงหา ด้วยตัวคุณเอง
พบกันวันเสาร์ที่ 4 พฤษภาคม 2567
พระเทพวชิรวาที วัดประยุรวงศาวาส
หัวข้อ : เข้าใจชีวิต พิชิตสุข
เสาร์ที่ 4 พฤษภาคม 2567
เวลา 8.30-10.00 น.
ณ บริเวณองค์พระพุทธวิสุทธิมงคล ริมทะเลสาบ สวนเบญจกิติ
หมายเหตุ : เข้าร่วมกิจกรรมฟรี! ผู้จัดงานได้เตรียมเสื่อ และเก้าอี้ เพื่ออำนวยความสะดวกให้กับผู้เข้าร่วมงานทุกท่าน
สำหรับผู้มาร่วมฟังธรรม ยังสามารถเข้ามาสนทนาธรรม หรือหาที่พักผ่อนคลายได้ภายในโซนรีเทลของศูนย์ฯ สิริกิติ์ ที่ตอบโจทย์ทุกไลฟ์สไตล์ของทุกคน ไม่ว่าจะเป็น ร้านอาหาร คาเฟ่ ร้านหนังสือ ร้านสปาและห้องอาบน้ำ รวมไปถึง Co-Working Space
โลโก้ โรงพยาบาลตากสิน
โลโก้ โรงพยาบาลตากสิน
ออกแบบโดย:งานเวชนิทัศน์ ฝ่ายวิชาการและแผนงาน โรงพยาบาลตากสิน
ตารางบริการคลินิกนอกเวลา โรงพยาบาลอุตรดิตถ์
ดนตรีในสวน พฤษภาคม 2567
กิจกรรมดนตรีในสวนกรุงเทพมหานคร ณ สวนเบญจกิติ Singlebar & Unready @ Music in the Park
- เสาร์ที่ 18 พฤษภาคม 2567 สวนวชิรเบญจทัศ ไปมันส์กันกับ 5 หนุ่ม ที่ฝีมือทางดนตรีไม่ธรรมดา วง RAINYROOM เริ่ม 17.00 น. / สวนลุมพินี เพลิดเพลินกับการบรรเลงดนตรีแบบ Acoustic และนักร้องคุณภาพจาก กองการสังคัต กทม. วง Bangkok Trio เริ่ม 17.00 น.
- อาทิตย์ที่ 19 พฤษภาคม2567 สวนปทุวนานุรักษ์ วงนี้...สนุกสนาน ม่วนซื่น แน่นอน วง คอนเทมกรุงเทพมหานค เริ่ม 17.00 น. / สวนเบญจกิติ ไปชม ไปเชียร์ น้องๆ กลุ่มเยาวชนดนตรี Harmon วง KFC วง Root36 วง SYNK เริ่ม 17.00 น. / อุทยานเบญจสิริ แจกความน่ารักสดใสด้วยเสียงร้องและแนวดนตรีฟังสบาย วง Sourdough เริ่ม 17.00 น.
- เสาร์ที่ 25 พฤษภาคม 2567 สวนเบญจกิติ พบกับเยาวชนนักดนตรี จากโรงเรียนเซนต์คาเบรียล วง Singlebar และ วง Unready Band เริ่ม 17.00 น. / สวนวชิรเบญจทัศ ไปสนุกสนานกับกลุ่มศิลปินเยาวนชน Good time (ไทม์) วง Sigsag วง God Ar-Ma วง Saturn. /. สวนลุมพินี Lets Jazz Music & Swing Dance with Thailand Jazz Orchestra & Jelly Roll Jazz Club เริ่ม 16.30 น.
- อาทิตย์ที่ 26 พฤษภาคม2567 สวนวชิรเบญจทัศ พบกับ 4 หนุ่ม วง Hoya ที่จะมาบอกเล่าประสบการณ์ทางดนตรีของพวกเค้าให้ทุกท่านได้ฟัง เริ่ม 17.00 น. / อุทยานเบญจสิริ เชิญไปสุนทรีและมันส์กับ 2 วง ดนตรี 2 สไตล์ วง Bangkok String Ensemble วง AGAIN โรงเรียนสาธิต มศว. ประสานมิตร / สวนลุมพินี เชิญไปเพลิดเพลินกับการบรรเลงบทเพลงหลากหลายสไตล์ และไปชมไปเชียร์วงประสานเสียงน้องใหม่ของ กทม. วง Bangkok Big Band วง มิตรไมตรีคอรัส
ภาพประกอบบทความ
"ไอโอซี" ไฟเขียว 2 นักมวยไม่ผ่านการตรวจเพศแข่งโอลิมปิก 2024
ThaiPBS 31 ก.ค.2567 คณะกรรมการโอลิมปิกสากล (ไอโอซี) ออกมาปกป้องสิทธิของ หลิน ยู่ติง นักมวยสากลหญิงจากไต้หวัน และ อิมาน เคลิฟ นักชกจากแอลจีเรีย ว่า มีสิทธิขึ้นชกมวยสากลสมัครเล่นหญิงกีฬาโอลิมปิก แม้ว่าทั้ง 2 คน จะถูกตัดสิทธิจากการแข่งขันชิงแชมป์โลกเมื่อปีที่แล้ว เนื่องจากไม่ผ่านการทดสอบระดับฮอร์โมนเพศชาย
มาร์ค อดัมส์ โฆษกไอโอซี แถลงข่าวเมื่อวันที่ 31 ก.ค. ว่า นักกีฬาทุกคนในประเภทหญิงต้องปฏิบัติตามกฎเกณฑ์และคุณสมบัติในการแข่งขันโอลิมปิก ซึ่ง โฆษกไอโอซี ยืนยันว่า นักมวยสากลทั้ง 2 คน เป็นผู้หญิงในหนังสือเดินทาง กรณีนี้ พวกเขาเป็นผู้หญิง ซึ่ง ไอโอซี ใช้กฎเกณฑ์ในกีฬามวยสากลเช่นเดียวกับโอลิมปิก 2020 ที่กรุงโตเกียว โดยทั้ง หลิน ยู่ติง กับ อิมาน เคลิฟ ก็ลงแข่งขันโอลิมปิกที่กรุงโตเกียวมาแล้ว
สำหรับ หลิน ยู่ติง ถูกริบเหรียญทองแดงชิงแชมป์โลกเมื่อปีที่แล้ว เช่นเดียวกับ อิมาน เคลิฟ ที่ถูกดิสควอลิฟายด์ก่อนแข่งรอบชิงในศึกชิงแชมป์โลกจาก สหพันธ์มวยสากลนานาชาติ (ไอบ้า) เพราะไม่ผ่านการตรวจเพศ แต่ โอลิมปิกหนนี้รวมทั้งรอบคัดเลือกโอลิมปิก มวยสากลสมัครเล่น จัดโดย ไอโอซี ซึ่ง หลิน ยู่ติง คว้าโควตาโอลิมปิกหลังได้แชมป์เอเชี่ยนเกมส์ และ อิมาน เคลิฟ คว้าแชมป์รอบคัดเลือกของทวีปแอฟริกา
ส่วนมวยสากลสมัครเล่นหญิงในปารีสเกมส์ครั้งนี้ อิมาน เคลิฟ จะลงแข่งในรุ่นเวลเตอร์เวท 56 กก. ในวันพฤหัสบดีที่ 1 ส.ค.นี้ ส่วน หลิน ยู่ติง จะลงแข่งขันรุ่นเฟเธอร์เวท 57 กก. ในวันศุกร์ที่ 2 ส.ค.นี้
สภากาชาดไทย ร่วมปันน้ำใจช่วยเหลือผู้ประสบอุทกภัย LINK
สภากาชาดไทย บริจาคผ่านบัญชี ธนาคารไทยพาณิชย์ สาขาสภากาชาดไทย ชื่อบัญชี “สภากาชาดไทย เพื่อภัยพิบัติ” ประเภทบัญชี “กระแสรายวัน” เลขที่บัญชี 045-3-04637-0 กรณีการโอนเงิน-หากประสงค์รับใบเสร็จรับเงิน แจ้งชื่อ-นามสกุล เลขที่บัตรประชาชน ที่อยู่ เบอร์โทรศัพท์ และอีเมล ระบุ “เพื่อช่วยเหลือผู้ประสบอุทกภัย” พร้อมแนบสลิปการโอนเงินบริจาคอีเมล์ donation@redcross.or.th โทรสาร 02-250-0312 หรือ Line : @redcrossfund
ข้อมูลข่าวสารที่เกี่ยวข้อง
- รพ.สต ในจังหวัดอุบลราชธานี ที่ถ่ายโอนไปยังอบจ.อุบลราชธานี เมื่อ ตุลาคม 2565 รวม 54 แห่ง
- สรุปผลการดำเนินงานของโรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.) ประจำปี 2566 (13 พฤศจิกายน 2566) มอบพัดลมตั้งโต๊ะ จำนวน 54 เครื่อง ให้กับโรงพยาบาลส่งเสริมสุขภาพตำบล(ร.พ.สต.)ในสังกัดจำนวน 54 แห่ง
- ปี 2568 รับรพ.สต.เพิ่ม 25 แห่ง องค์การบริหารส่วนจังหวัดอุบลราชธานี รับการถ่ายโอนภารกิจสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี และโรงพยาบาลส่งเสริมสุขภาพตำบล ปีงบประมาณ พ.ศ. 2568 เพิ่มอีกจำนวน 25 แห่ง
• อ.ตระการพืชผล จำนวน 4 แห่ง ได้แก่ รพ.สต.บ้านโพนเมือง ต.ตระการ , รพ.สต.บ้านสะพือ ต.สะพือ, รพ.สต.บ้านนาพิน ต.นาพินและรพ.สต.บ้านกุง ต.คำเจริญ
• รพ.สต.บ้านบุ่งคำ ต.พรสวรรค์, รพ.สต.บ้านตบหู ต.โนนสวรรค์ อ.นาจะหลวย ,รพ.สต.บ้านบก ต.ห้วยข่า และรพ.สต.บ้านโนนบาก ต.บัวงาม อ.บุณฑริก
• รพ.สต.สำโรง อ.ตาลสุม รพ.สต.หนามแท่ง อ.ศรีเมืองใหม่
• 9 กรกฎาคม 2567 ตรวจเยี่ยมฯ 3 แห่งรพ.สต.บ้านไผ่ใหญ่ ต.ไผ่ใหญ่, รพ.สต.แสงไผ่ ต.ไผ่ใหญ่, รพ.สต.บ้านหนองเหล่า ต.หนองเหล่า และรพ.สต.บ้านโนนขวาว ต.เตย อ.ม่วงสามสิบ
• 6 กรกฎาคม 2567 ตรวจเยี่ยมฯ 3 แห่ง ได้แก่ รพ.สต.บ้านบัวยาง ต.ดุมใหญ่ , รพ.สต.บ้านหนองแสง ต.ดุมใหญ่และรพ.สต.บ้านหนองหลัก ต.เหล่าบก อ.ม่วงสามสิบ
ค่าบริการผ่าตัดเลสิกศูนย์เลสิกเมตตา
บุญบั้งไฟ บ้านหัวดง จ.อำนาจเจริญ 1-2 พฤษภาคม 2566
บุญบั้งไฟ 2566 บ้านหัวดง จ.อำนาจเจริญ 1-2 พฤษภาคม 2566 ร่วมเป็นเจ้าภาพทอดผ้าป่าสามัคคี สมทบทุนสร้างกุฏิวัดหัวดง ร่วมงานบุญประจำปี บ้านหัวดง ต.เต็งใหญ่ อ.หัวตะพาน จ.อำนาจเจริญ กิจกรรมในงาน วันที่ 1 พ.ค. ชมขบวนฟ้อน เซิ้ง บั้งไฟอันสวยงาม วันที่ 2 พ.ค. ชมการจุดบั้งไฟ และมหรสพทั้งวัน
ประเพณีบุญมหาชาติ บุญบั้งไฟพังโคน 1-7 พฤษภาคม 66
ประเพณีบุญมหาชาติ บุญบั้งไฟพังโคน 1-7 พฤษภาคม 66 บริเวณถนนหน้าวัดศรีจอมธาตุ อ.พังโคน จ.สกลนคร มหกรรมสินค้าราคาถูก อาหารดีอร่อย ชมการแสดง
3 พ.ค. เก่ง วงเฟลม GPS Music ยกค่าย 4 พ.ค. บุ๊ค ศุภกาญจน์ เต็มวง 5 พ.ค. ประกวดธิดาบั้งไฟ 6 พ.ค. พิธีเปิดขบวนแห่บั้งไฟ ชมมวย หมอลำคณะเสียงวิหก 7 พ.ค. แข่งขันจุดบั้งไฟทางไกล แข่งขันมอเตอร์ครอส
กินทุเรียนก่อนใคร ไประยอง : Rayong Fruitastic 2023 (1 พ.ค. - 31 ก.ค.66) LINK
ททท.สำนักงานระยอง จัดกิจกรรมโดนใจผู้ชื่นชอบชิมทุเรียนสดๆ ชาวทุเรียนเลิฟเวอร์ ต้องไม่พลาด ในกิจกรรม "กินทุเรียนก่อนใคร ไประยอง : Rayong Fruitastic 2023 ฤดูผลไม้กับ 25 สวนผลไม้จังหวัดระยอง" หมายถึงสามารถไปเยี่ยมชม ชิม ช็อปทุเรียนใน 25 สวนได้อย่างเต็มอิ่ม พร้อมแจกสิทธิ์โปรโมชั่น ลด 100 บาทเมื่อซื้อครบ 500 ขึ้นไป คุ้มสุดๆ ไปเลย ระยะเวลากิจกรรม ตั้งแต่ (1 พ.ค. - 31 ก.ค.66) เช็คชื่อ 25 สวน
ได้ที่นี่ World of Coffee Busan 2024 - May 1-4, 2024
World of Coffee Busan 2024 will take place at the Busan Exhibition & Convention Center (BEXCO) May 1-4, 2024. Event organize by Specialty Coffee Association (
SCA), a nonprofit, membership-based organization that represents thousands of coffee professionals, from producers to baristas all over the world, based in California, USA.
World of Coffee Busan 2024 marks the first World of Coffee trade show on the Asian continent and is a testament to the strong growth of the specialty coffee industry in this region. South Korea, in particular, has long been recognized as a destination for specialty coffee craft, technology, retail, research, and culture. The city of Busan, the second-largest city and coffee trade hub of South Korea, a natural destination for a specialty coffee trade show.
งาน Esan Coffee Fair 2024 วันที่ 1 - 5 พ.ค. 2567
งาน Esan Coffee Fair 2024 วันที่ 1 - 5 พ.ค. 2567 ณ เซ็นทรัลโคราช Korat Hall ชั้น 4 กิจกรรมต่างๆ ที่น่าสนใจ ตลอด 5 วันเต็ม . ⭐️กิจกรรม Brewer Cup & Cup Taster ชิงแชมป์ประเทศไทยครั้งแรก ⭐️กิจกรรม Workshop สอนทำกาแฟ พร้อมแลกเปลี่ยนประสบการณ์ใหม่จากกูรูด้านกาแฟ ⭐️ชิมกาแฟกิโลละแสนจากฝีมือแชมป์โลก ⭐️และอื่นๆอีกเพียบ
บุญบั้งไฟ กู่แก้ว อุดร 3-9 พ.ค.66
บุญบั้งไฟ กู่แก้ว อุดร 3-9 พ.ค.66 บริเวณลาดคลองถม อ.กู่แก้ว อุดรธานี ชมคอนเสริ์ตศิลปินดัง 4-9 พ.ค.
เทศกาลของคนรักทุเรียน เซ็นทรัล รามอินทรา 3-9 พค 66
เทศกาลของคนรักทุเรียน เซ็นทรัล รามอินทรา ร่วมกับกรมการค้าภายใน ส่งต่อความสุข อิ่มอร่อยเต็มพิกัดกับ Durian Fruit Festival พบกับทุเรียน 7 สายพันธุ์ดังหาทานยาก ส่งตรงจากสวนเกษตรกรไทย 4 จังหวัด จันทบุรี ระยอง อุตรดิตถ์ และเพชรบูรณ์ พร้อมลิ้มรสทุเรียนแปรรูป และผลไม้ดังประจำจังหวัดอื่น ๆ ในราคาเกษตรกรแบบจัดเต็ม เตรียมตัวพบราชาผลไม้ไทย หวานกลมกล่อม กรอบนอกนุ่มใน
3 - 9 พ.ค. 66 ณ ลานกิจกรรม ชั้น 4 เซ็นทรัล รามอินทรา
งาน Amazing Thai Taste Festival 2023 วันที่ 3-5 มิถุนายน 2566 ศูนย์การค้าเซ็นทรัลระยอง
งาน Amazing Thai Taste Festival 3-5 มิถุนายน 2566 ณ ลานด้านหน้าศูนย์การค้าเซ็นทรัลระยอง งานที่จะยกระดับ Soft Power : F-Food ปลุกกระแสการเดินทางท่องเที่ยวเชิงอาหารสู่นานาชาติ นำเสนอภายใต้แนวคิด “Food Lover Paradise สวรรค์ของนักกิน” มุ่งยกระดับ Soft Power คือ F-Food สร้างการรับรู้ประเทศไทยเป็นเมืองที่มีความอุดมสมบูรณ์และหลากหลายทางวัฒนธรรมอาหาร และต่อยอดสู่กระแสการเดินทางท่องเที่ยวเชิงอาหาร (Gastronomy) พบกับ การออกร้านอาหารจาก Michelin Guide ร้านอาหาร Street food ชื่อดัง ร้านเด่นร้านดัง ที่มีชื่อเสียง ร้าน Craft Food truck กว่า 50 ร้าน และการแสดงมินิคอนเสิร์ตจากศิลปินชื่อดัง อาทิ The mousses ป๊อป ปองกูล Sara Getsunova Zani และวง Cocktail
น่านเมืองกาแฟ 3-5 พฤษภาคม 2567
จังหวัดน่าน โดยสำนักงานอุตสาหกรรมจังหวัดน่าน ขอเชิญเที่ยวงาน "น่านเมืองกาแฟ" ภายในงาน กิจกรรมจัดเต็ม ✅บูธกาแฟและอุปกรณ์มากกว่า 20 บูธ ✅จิบกาแฟ พร้อมดนตรีคลาสสิคยามเย็น ✅ชิมกาแฟรางวัล มาตรฐานระดับประเทศ ✅ร่วมโหวต กาแฟในดวงใจ Coffee X Product ขวัญใจคอกาแฟน่าน ✅ร่วมสนุก Workshop "How to drip Coffee" DIY งานคราฟต์เก๋ๆ ระหว่างวันที่ 3-5 พฤษภาคม 2567 เวลา 10.00 - 21.00 น.????ณ ลานข่วงน้อย ถนนคนเดินเมืองน่าน
ประเพณีบุญเดือนหก บุญบั้งไฟกู่แก้ว อุดรธานี 4-5 พฤษภาคม 2566
อ.กู่แก้ว ร่วมกับ อบจ.อุดรธานี ร่วมสืบสานประเพณีบุญเดือนหก บุญบั้งไฟกู่แก้ว อุดรธานี 4-5 พฤษภาคม 2566 ณ สนามกีฬากลางโรงเรียนอนุบาลกู่แก้ว
งานบุญบั้งไฟยางชุมน้อย ศรีสะเกษ 4-11 พฤษภาคม 2566
งานบุญบั้งไฟยางชุมน้อย 4-11 พฤษภาคม 2566 บริเวณหน้าที่ว่าการอำเภอยางชุมน้อย อำเภอยางชุมน้อย จังหวัดศรีสะเกษ
Sukhothai Coffee Carnival x Thailand Coffee Brewer League 4 - 6 พ.ค.67
มหกรรมงานกาแฟสุโขทัยยิ่งใหญ่ระดับประเทศ Sukhothai Coffee Carnival x Thailand Coffee Brewer League รอบนี้จัดเต็ม 3 วันรวด 4 - 6 พ.ค.67 เวลา 10.00-20.00 น. ณ โรงแรมอนันดา เมืองสุโขทัย Ananda Museum Gallery Hotel
ระนองคอฟฟี่คอนเน็กซ์ 4-5 พ.ค.2567 ณ สุขปาร์ค
Ranong Coffee Connext : ระนองคอฟฟี่คอนเน็กซ์ วันที่ 4-5 พฤษภาคม 2567 ณ สุขปาร์ค ถ.เรืองราษฎร ต.เขานิเวศน์ อ.เมือง จ.ระนอง
ประเพณีบุญบั้งไฟ ต.สันทรายงาม อ.เทิง เชียงราย 5 - 6 พฤษภาคม 2566
ขอเชิญชวนเที่ยวงาน "ประเพณีบุญบั้งไฟ ประจำปี 2566" ในวันที่ 5 - 6 พฤษภาคม 2566 ณ บ้านหนองบัว หมู่ที่ 5 ตำบลสันทรายงาม อำเภอเทิง จังหวัดเชียงราย ** มีกิจกรรมมากมายภายในงาน** ขบวนเอ้บั้งไฟ การฟ้อนรำเพื่อบูชาพญาแถน ประกวดผาแดง นางไอ่ การแสดงหมอลำย้อนยุกต์และกิจกรรมอื่นๆ
บุญบั้งไฟล้าน ทุ่งโพธิ์ทะเล กำแพงเพชร 5-7 พ.ค.66
อัมพวาเฉิดไฉไล ตลาดน้ำอัมพวา ฮาล์ฟมาราธอน ครั้งที่ 8 วันอาทิตย์ ที่ 5 พฤษภาคม 2567
อัมพวาเฉิดไฉไล ตลาดน้ำอัมพวา ฮาล์ฟมาราธอน ครั้งที่ 8 INFINITY RUN สนุกอนันต์ ไม่รู้จบ วันอาทิตย์ ที่ 5 พฤษภาคม 2567 ณ วัดพระยาญาติ (ปากง่าม) อำเภออัมพวา จังหวัดสมุทรสงคราม
facebook.com7 พ.ค. 2022 รายงานพบเคสแรกในอังกฤษ
7 พ.ค. 2022 UKHSA รายงานพบเคสแรกในอังกฤษ เชื่อว่าติดเชื้อจากต่างประเทศ รายแรกพบว่าตนเองเป็นผื่นขึ้น (5 พ.ค.) จึงไปพบแพทย์ในลอนดอนและแอดมิทเข้ารักษาวันที่ 6 พ.ค. และประกาศยืนยันอย่างเป็นทางการว่าพบผู้ป่วยฝีดาษลิงในวันที่ 12 พ.ค.2022 อีกรายที่พบเริ่มมีอาการผื่นตั้งแต่ 30 เมษายน และมายืนยันโรค วันที่ 13 พ.ค. ทั้งสอบรายยืนยันด้วยการตรวจ RT PCR [
WHO]
ต่อมา 14 พ.ค. พบอีก 2 เคส เป็นคนในครอบครัวเดียวกัน แต่ไม่มีประวัติเดินทางไปต่างประเทศหรือสัมผัสกับผู้ป่วยรายแรก 16 พ.ค. พบเพิ่มอีก 4 ราย ทั้งหมดไม่มีประวัติเดินทางต่างประเทศและสัมผัสกับผู้ป่วย 2 ชุดแรกแต่อย่างใด ทั้ง 4 รายเป็นกลุ่มชายรักชาย
8 พฤษภาคม วันกาชาดโลก World Red Cross and Red Crescent Day
8 พฤษภาคมของทุกปี วันคล้ายวันเกิดนายอังรี ดูนังต์ (8 พฤษภาคม 2371 (ค.ศ.
1828)) ผู้ให้กำเนิดกาชาดสากล สหพันธ์สภากาชาดและสภาเสี้ยววงเดือนแดงระหว่างประเทศ (IFRC) และคณะกรรมการกาชาดระหว่างประเทศ (ICRC)
บุญบั้งไฟ ค้อวัง ยโสธร 8-14 พ.ค. 66
บุญบั้งไฟ ค้อวัง ยโสธร 8-14 พ.ค. 66 ที่หน้าที่ว่าการอ.ค้อวัง ยโสธร สินค้าราคาถูก อาหารอร่อย สินค้าโอท็อปเพียบ ชมคอนเสิร์ต 5 คืน - 8 พ.ค. GPS Music ยกค่าย 10 พ.ค. บุ๊ค ศุภกาญจน์ เต็มวง 12 พ.ค. ข้าวฟ่าง เบียร์ พร้อมพงษ์ เต็มวง 13 พ.ค. เม้ก อภิสิทธิ์ 14 พ.ค. บิ๊กวัน กันทรลักษณ์ เต็มวง
Pet Expo Thailand 2024 (9-12 พฤษภาคม 2567)
Pet Expo Thailand 2024 วันที่ 9-12 พฤษภาคม 2567 ฮอลล์ 6-8 ศูนย์การประชุมแห่งชาติสิริกิติ์ เตรียมตัวพาเพื่อนสี่ขาไปออกตามล่าหาขุมทรัพย์ สินค้าและบริการ แบรนด์ดัง แบรนด์ใหม่กว่า 400 ร้านค้า ผจญภัยไปในโลกของสัตว์เลี้ยงและโซนพิเศษต่าง ๆ พิชิตกิจกรรมสุดน่ารักพร้อมรับของรางวัลมากมายภายในงาน
รายชื่อศิลปินขึ้นเวที สัปดาห์ที่ 3 วันที่ 17-18 มีนาคม
วันศุกร์ที่ 17 มีนาคม 2566
เวทีชายหาดพัทยาเหนือ โค้งดุสิต (Main stage)
19.00 น. - 20.00 น. CLOCKWORK MOTIONLESS
20.15 น. - 21.15 น. ANATOMY RABBIT
21.30 น. - 22.30 น. WANYAi x Mon Monik
22.45 น. - 23.45 น. PMC ปู่จ๋าน ลองไมค์
วันเสาร์ที่ 18 มีนาคม 2566
เวทีชายหาดพัทยาเหนือ โค้งดุสิต (Main stage)
19.00 น. - 20.00 น. ONLY MONDAY
20.15 น. - 21.15 น. ZWEED N’ROLL
21.30 น. - 22.30 น. MEAN
ช่องทางติดต่อขอรับการช่วยเหลือเร่งด่วน
ซึมเศร้าแค่ไหน เป็นโรคซึมเศร้า
แผน 5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม
แผน 5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม มีจำนวน 127 โครงการ งบประมาณ 75,025,762 ล้านบาท ได้แก่12 พฤษภาคม วันพยาบาลสากล International Nurses Day
สภาพยาบาลระหว่างประเทศ (International Council of Nurses, ICN) ซึ่งเป็นองค์กรวิชาชีพพยาบาล ได้กำหนดให้วันที่ 12 พฤษภาคม ของทุกปี เป็นวันพยาบาลสากล (International Nurses Day) กำหนดขึ้นตามวันเกิดของมิสฟลอเรนซ์ ไนติงเกล "สุภาพสตรีแห่งดวงประทีป" สุภาพสตรีชาวกรุงลอนดอน ประเทศอังกฤษ ในฐานผู้ก่อกำเนิดวิชาชีพการพยาบาล ที่เกิดขึ้นด้วยความตั้งใจบำเพ็ญสาธารณประโยชน์เพื่อมวลมนุษย์ จนได้รับการยกย่องและเป็นที่รู้จักไปทั่วโลก โดยมีวัตถุประสงค์เพื่อสดุดีคุณงามความดีของมิสฟลอเรนซ์ ไนติงเกล ที่ทำประโยชน์อย่างมากมายให้แก่มวลมนุษย์ รวมทั้งเพื่อเป็นการยกย่อง ให้เกียรติ และเชิดชูเป็นต้นแบบ อีกทั้งยังมีจุดมุ่งหมายให้พยาบาลทั่วโลก ร่วมมือจัดกิจกรรมบำเพ็ญประโยชน์แก่สาธารณชน และกำหนดแนวทางเพื่อให้พยาบาลทั่วโลกรณรงค์แก้ไขปัญหาสุขภาพในแต่ละปี โดยในปีนี้ได้กำหนดแนวทางดังคำขวัญที่ว่า "Nurse : A Voice to Lead Nursing The World to Health." (พยาบาล : เสียงแห่งพลังนำการพยาบาลสู่สุขภาพดีทั่วโลก) ภาพและข้อมูลเพิ่มเติม อ่านได้จาก
BBC พฤษภาคม 65 โรงพยาบาลวัฒนแพทย์ ตรัง ลงทุนเพิ่ม ขยายโครงการโรงพยาบาลวัฒนแพทย์ สมุย
12 พฤษภาคม 2565 โรงพยาบาลวัฒนแพทย์ ตรัง จำกัด (มหาชน) รายงานการอนุมัติเพิ่มงบประมาณการก่อสร้างโรงพยาบาลวัฒนแพทย์ สมุย เพิ่มเป็น 838 ล้านบาท จากงบลงทุนเดิมราว 558 ล้านบาท เป็นการลงทุนเพื่อเพิ่มพื้นที่ใช้สอยรองรับการบริการได้มากขึ้น รวมถึงเครื่องมือและอุปกรณ์ทางการแพทย์ภายหลังการก่อสร้างแล้วเสร็จ โดยคาดว่าโครงการจะแล้วเสร็จในไตรมาส 1 ปี 2566 จากเดิมที่กำหนดไว้ในไตรมาส 4 ปี 2565
โครงการโรงพยาบาลวัฒนแพทย์ สมุย ตั้งอยู่ที่ ต.บ่อผุด อ.เกาะสมุย จ.สุราษฎร์ธานี ก่อสร้างเป็นอาคาร 3 ชั้น และมีพื้นที่ใช้สอยประมาณ 9.960 ตารางเมตร (จากเดิมมีพื้นที่ใช้สอยประมาณ 9,000 ตารางเมตร) บนที่ดินเนื้อที่รวม 6 ไร่ 3 งาน 5.4 ตารางวา มูลค่ารวมของโครงการ 838,000,000 บาท ประกอบด้วยที่ดิน จำนวนประมาณ 218,000,000 บาท ค่าก่อสร้างและงานระบบและค่าเครื่องมือและอุปกรณ์ทางการแพทย์อีก จำนวน ประมาณ 620,000,000 บาท
โครงการโรงพยาบาลวัฒนแพทย์ สมุย เป็นโครงการลงทุนแห่งใหม่ ตามมติคณะกรรมการเมื่อ 21 กุมภาพันธ์ 2561 ภายใต้งบประมาณเริ่มต้น 425 ล้านบาท เป็นโรงพยาบาลขนาด 29 เตียง บทที่ดิน 3 แปลง รวม 6 ไร่ 3 งาน 5.4 ตารางวา ให้บริการการแพทย์อย่างครบวงจรโดยผู้เชี่ยวชาญเฉพาะสาขา รองรับลูกค้าทั่วไปและลูกค้าคู่สัญญา มีคลินิกและศูนย์แพทย์เฉพาะทางให้บริการแก่ผู้ป่วยนอก คาดว่ารองรับผู้ป่วยได้ราว 60 คนต่อวัน
ปี 2562 คณะกรรมการมติ ในการขยายโครงการจาก 29 เตียงเป็นไม่เกิน 59 เตียง เพิ่มงบประมาณอีกราว 133 ล้านบาท ทำให้งบลงทุนโดยรวมเพิ่มเป็น 558 ล้านบาท คาดว่าโครงการจะเสร็จและเปิดให้บริการได้ในไตรมาส 3 ปี 2564
HUA HIN Marathon 2024 วันที่ 12 พฤษภาคม 2567 LINK
HUA HIN Marathon 2024 หัวหินมาราธอน 2024 (ครั้งที่ 4) งานวิ่งมาราธอนเพื่อส่งเสริมการท่องเที่ยวและอนุรักษ์สิ่งแวดล้อมเมืองหัวหิน 12 พฤษภาคม 2567 วัดเขาไกรลาศ ต.หนองแก อ.หัวหิน จ.ประจวบคีรีขันธ์ ระยะทาง 5Km. / 10.5Km. / 21.1Km. / 42.195Km.
HUA HIN Marathon 2024 (ครั้งที่ 4) 12 พฤษภาคม 2567
HUA HIN Marathon 2024 (ครั้งที่ 4) "...ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี..." รางวัล OVER ALL MARATHON ชาย 1 รางวัล หญิง 1 รางวัล วันรับอุปกรณ์ เสาร์ที่ 11 พฤษภาคม 2567 (09.00-18.00 น.) วันแข่งขัน อาทิตย์ที่ 12 พฤษภาคม 2567 (02.00-11.00 น.) วัดเขาไกรลาศ ต.หนองแก อ.หัวหิน จ.ประจวบคีรีขันธ์ ระยะการแข่งขัน MARATHON 42.195 km. / HALF MARATHON 21 km. / MINI MARATHON 10.5 km. / FUN RUN 5 km. (เดิน-วิ่งเพื่อสุขภาพ) จัดโดย ชมรมพิทักษ์หัวหิน 0845645305 / 0968020908
โรโบแมน ไตรกีฬา 2565 | 15 พ.ค.65 ชายหาด โรงแรมสิรินพลา บ้านฉาง ระยอง LINK
Roboman Triathlon 2022 จะจัดขึ้นในวันที่ 15 พฤษภาคม พ.ศ. 2565 ที่ ชายหาด โรงแรมสิรินพลา บ้านฉาง จังหวัดระยอง
การแข่งขันสุดยอดกีฬาคนพันธุ์อึดกำลังจะกลับมาอีกครั้ง “โรโบแมนไตรกีฬา ประจำปี 2565”จากการรอคอยอย่างยาวนาน ภายหลังรัฐบาลประกาศผ่อนคลายมาตรการควบคุมการแพร่ระบาดของโรคโควิด-19 และนโยบายเปิดประเทศของรัฐบาล ด้วยแนวคิด “ความสมบูรณ์แบบไร้ขีดจำกัด” (Limitless perfection) บนสนามที่คุ้นเคย ณ ชายหาด รร.สิริน พลา ตำบลพลา อำเภอบ้านฉาง จังหวัดระยอง สนามที่เส้นทางงดงามและท้าทาย การเดินทางที่สะดวกสบาย ใช้เวลาเพียง 2 ชั่วโมงจากกรุงเทพมหานคร สู่มหานครการบินและเมืองต้นแบบ 5G ในเมกะโปรเจคของรัฐบาล พบกับบรรยากาศของชุมชนชาวประมงที่รอต้อนรับนักกีฬาอย่างอบอุ่น พร้อมมาตรฐานการจัดงานที่เน้นความปลอดภัยในทุกรายละเอียดเส้นทางการแข่งขันของทีมงาน U-TAC ที่ได้รับความไว้วางใจมาอย่างต่อเนื่อง
ประเภทการแข่งขัน
ไตรกีฬาซูเปอร์ โอลิมปิค ประเภทเดี่ยวและทีม
ชาย 18-29, 30-39, 40-49, 50-59, 60-69, 70 ปีขึ้นไป
หญิง 18-29, 30-39, 40-49, 50-59, 60 ปีขึ้นไป
ประเภททีม ไม่จำกัด
ไตรกีฬาซูเปอร์ สปริ้นท์
ชาย 18-29, 30-39, 40-49, 50-59, 60-69, 70 ปีขึ้นไป
หญิง 18-29, 30-39, 40-49, 50-59, 60 ปีขึ้นไป
ทวิกีฬา
ชาย 18-29, 30-39, 40-49, 50-59, 60-69, 70 ปีขึ้นไป
หญิง 18-29, 30-39, 40-49, 50-59, 60 ปีขึ้นไป
บุญบั้งไฟ อ.ศรีธาตุ อุดรธานี 15-21 พฤษภาคม 66
15 พฤษภาคม 2567 โรงแรม Shama Yen-Akat Bangkok และโรงพยาบาลสัตว์หมอเจี๊ยบ เปิดให้บริการฉีดวัคซีนพิษสุนัขบ้าฟรี
โรงแรม Shama Yen-Akat Bangkok และโรงพยาบาลสัตว์หมอเจี๊ยบ เปิดให้บริการฉีดวัคซีนพิษสุนัขบ้าฟรีให้แก่สัตว์จรจัด และสัตว์เลี้ยง จำนวน 80 ตัว ในวันพุธ ที่ 15 พฤษภาคม 2567 ตั้งแต่เวลา 09.30-17.30 น. ณ โรงแรมชามา เย็นอากาศ กรุงเทพฯ ท่านใดที่สนใจต้องเปิดลงทะเบียนล่วงหน้า โทร 0966352086 (คุณออม) หรือสแกน QR Code (line Official)
งานมหกรรม สุขภาพนครแหลมฉบัง ครั้งที่ 7 วันที่ 15-17 พฤษภาคม 2567
งานมหกรรม สุขภาพนครแหลมฉบัง ครั้งที่ 7 ตอน"มารีเซ็ตสุขภาพกันเถอะ" ฟรี ตรวจสุขภาพโดย 14 โรงพยาบาลชั้นนำ ในวันที่ 15-17 พฤษภาคม 2567 ณ ศาลาประชาคมอ่าวอุดม สนใจติดต่อสอบถามเพิ่มเติม 082 -4719900
Cafe Mania อุดรธานี เทศกาลสำหรับคนรักกาแฟ 16-22 พฤษภาคม 2567
เทศกาลสำหรับคนรักกาแฟ ในงาน Cafe Mania เติมเต็มความสุขของคนรักกาแฟ จากบาริสต้าดีกรีระดับแชมป์ .พบร้านกาแฟ Specialty Coffee เจ้าดัง ขนมอร่อยๆ จากทั่วประเทศไทยและลาว ครั้งแรกของอุดรกับการแข่งขัน Thailand Coffee Brewer League Coffee Workshop ร่วมสัมผัสประสบการณ์สุด Exclusive จากเมล็ดกาแฟพรีเมี่ยมโดยบาริสต้าระดับประเทศ พบกัน 16-22 พฤษภาคม 2567 นี้ ณ ลานกิจกรรม ชั้น 1 เซ็นทรัล อุดร
17 พฤษภาคม วันความดันโลหิตสูงโลก World Hypertension Day
วันความดันโลหิตสูงโลก ริเริ่มโดย The World Hypertension League (
WHL) กำหนดขึ้นครั้งแรกเมื่อ 14 พฤษภาคม 2005 เพื่อสร้างการตระหนักรู้ถึงภัยของโรคจากความดันโลหิตสูง เพื่อกระตุ้นให้เกิดความใส่ใจและป้องกันตนเอง ด้วยการตรวจเช็คความดันของตนเป็นประจำ
CDC สหรัฐ ระบุว่าประชากรโลกกว่าพันล้านคน มีปัญหาสุขภาพด้านความดันโลหิตสูง ซึ่งเป็นความเสี่ยงอันดับหนึ่งของปัญหาโรคหัวใจ โรคหลอดเลือดสมอง โรคไตเรื้อรัง และอีกหลายโรค ที่จะตามมา
งานประเพณีบุญบั้งไฟ ยโสธร 17-21 พ.ค.66
งานเทศกาลประเพณีบุญบั้งไฟ ยโสธร ยิ่งใหญ่ที่สุดในภาคอีสาน กำหนดจัดงานช่ัวเดือนพฤษภาคม ณ บริเวณหน้าที่ว่าการอำเภอเมืองยโสธร ลานวิมานพญาแถน (พญาคันคาก-พญานาค) และสวนสาธารณะพญาแถน จัดวันที่ 17-21 พ.ค. 66
18 พ.ค. 2022 เริ่มรายงานพบเคสแรกในยุโรป
18 พ.ค. 2022 โปรตุเกส รายงานยืนยัน 5 เคส ต้องสงสัยกว่า 20 ราย ทั้งหมดเป็นชายวัยหนุ่ม ในกรุงลิสบอน สเปน รายงานพบ 8 ราย [
ECDC]
19 พ.ค. 2022
สวีเดนพบเคสแรกในสต๊อกโฮล์ม สาธารณสุขสวีเดนกำลังสอบสวนว่าติดจากที่ใด [
outbreaknews]
เบลเยี่ยม รายงานพบ 2 รายแรกในประเทศ รายแรกพบในอันท์เวิร์ป อีกรายอยู่ในจังหวัดเฟลมิชบราบันต์ [
StraitTimes]
20 พ.ค. 2022
ฝรั่งเศส - ชายวัย 29 ปีในพื้นที่แคว้น Ile-de-France (รวมปารีส) ไม่พบว่าเคยเดินทางไปประเทศที่เสี่ยงต่อการระบาด (แอฟริกา) แต่อย่างใด [
France24]
พบเคสแรกในมิวนิค เยอรมนี เป็นชายวัย 26 ชาวบราซิล เดือนทางจากโปรตุเกส ผ่านทางสเปน ตรวจสอบพบเชื้อสายพันธุ์แอฟริกาตะวันตก [
DW]
เนเธอร์แลนด์ พบเคสแรก [
Reuters]
21 พ.ค. 2022
พบเยอรมัน 2 รายแรกในเบอร์ลิน เพียงวันเดียวถัดจากรายงาน [
DW]
มีรายงาน พบ 1 เคสใน สวิสเซอร์แลนด์
อิสราเอล พบ 1 เคส ในชายวัย 30 ปี กลับจากยุโรป
นอร์เวย์ เฝ้าระวัง 1 ราย
22 พ.ค. 2022
รายงานเคสแรก ในออสเตรีย
23 พ.ค.2022
เดนมาร์คพบเคสแรก เป็นชายวัยกลางคนที่เดินทางกลับจากสเปน [
Reuters]
24 พ.ค.2022
พบเคสแรกในกรุงปราก สาธารณรัฐเชค เป็นหญิงที่เพิ่งเดินทางกลับจากงานเทศกาลในเบลเยี่ยม [
Reuters]
สโลเวเนีย พบเคสแรกในเมืองซาราเยโว เป็นชายที่เพิ่งเตินทางกลับจากเกาะคานารี่ สเปน [
Reuters]
18 พ.ค.2022 เคสแรกในสหรัฐ
CDC สหรัฐ รายงานพบผู้ป่วยมีผลตรวจเป็นบวกติดเชื้อฝีดาษลิงคนแรก เป็นชายเดินทางกลับมาจากแคนาดา CDC กำลังสอบสวนโรคและติดตามคลัสเตอร์การระบาดในยุโรปอย่างใกล้ชิด และได้ออกคำเตือนให้เฝ้าระวังในผู้ที่มีอาการผื่นขึ้นเป็นพิเศษ ไม่ว่าผู้นั้นจะเคยมีประวัติเดินทางต่างประเทศหรือมีความเกี่ยวพันธ์กับกลุ่มรักร่วมเพศหรือไม่ก็ตาม - ติดตามข้อมูลอย่างต่อเนื่องได้ที่ CDC
2022 United States Monkeypox Case และ ข้อมูลเกี่ยวกับ
Monkeypox โดย CDC19 พ.ค.2022 เคสแรกในแคนาดา
19 พ.ค.2022 Public Health Agency of Canada (PHAC) สาธารณสุขแคนาดา รายงานพบ 2 เคสแรกในเมืองควิเบค อีก 17 รายกำลังตรวจสอบ [Reuters]
25 พ.ค. 2022
PHAC รายงานแคนาดาพบผู้ป่วยเพิ่มขึ้นเป็น 16 เคสแล้ว ทั้งหมดพบในรัฐควิเบค
2nd Thailand Festival Leipzig 19-21/05/2023
Willkommen beim großen Thailand Festival in Leipzig vom 19.5.2023 bis 21.5.2023
Welcome to the big Thailand Festival in Leipzig from 19.5.2023 to 21.5.2023
พยาบาลวิชาชีพ รพ.เกษมราษฎร์บางแค ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนท้ายรถบรรทุก บริเวณถนนปู่เจ้าสมิงพราย
19 พฤษภาคม 2566 เวลาประมาณ 22.00 น. พว.วิยะดา วังวร พยาบาลวิชาชีพ สังกัดแผนกผู้ป่วยวิกฤต โรงพยาบาลเกษมราษฎร์บางแค ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนท้ายรถบรรทุก บริเวณถนนปู่เจ้าสมิงพราย อำเภอพระประแดง จังหวัดสมุทรปราการ จากการตรวจสอบพบผู้ขับขี่รถจักรยานยนต์เพศชาย 1 ราย จึงได้ทำการประเมินสัญญาณชีพ ประเมินบาดแผลพบว่าผู้บาดเจ็บมีเลือดออกบริเวณศีรษะจำนวนมาก ไม่รู้สึกตัว คลำชีพจรไม่ได้ จึงได้ร่วมกับเจ้าหน้าที่อาสาสมัครมูลนิธิร่วมกตัญญูทำการกดนวดหัวใจ (CPR) และประเมินอาการซ้ำ พบว่าผู้บาดเจ็บเสียชีวิตในที่เกิดเหตุ จึงประสานให้หน่วยงานที่เกี่ยวข้องดำเนินการต่อไป
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.วิยะดา วังวร ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดีจนเป็นที่ประจักษ์ต่อสังคม
งาน Thasala Coffee Spirit Coffee Camp#1 อาทิตย์ที่ 19 พ.ค. 2567 LINK
งาน Thasala Coffee Spirit การรวมตัวของคนกาแฟมากที่สุดในเมืองคอน อาทิตย์ที่ 19 พ.ค. 67 เวลา 5.30 - 10.00 น. ณ สวนสน หาดบ่อนนท์ จัดโดย ทีม NCC ร่วมกับ ชมรมท่องเที่ยวท่าศาลา กิจกรรมเด่นๆ ในงานมากมาย ได้แก่ ร่วมฟังเสวนาเกี่ยวกับกาแฟ Workshop สำหรับผู้ที่สนใจเรื่องกาแฟ ดื่มด่ำกาแฟเคล้าเสียงดนตรีไปกับบรรยากาศใต้ร่มสนชายทะเล คัดสรรร้านค้า อาหาร เครื่องดื่มมาให้แบบปัง ๆ สันทนาการ กิจกรรมชายหาด เล่นน้ำ กิจกรรมเสริมการเรียนรู้ มาเดี่ยว เป็นคู่ ครอบครัว เป็นทีม ได้หมดดด และ และ ที่สำคัญ!!! อย่าลืม!! ตื่นแต่เช้าตรู่ มาชมพระอาทิตย์ขึ้นแล้วร่วมจิบกาแฟดีไปด้วยกัน
Young Latte Art Competition 2024 ซ้อม 18 พ.ค. วันแข่ง 19 พ.ค. 2567
การแข่งขันลาเต้อาร์ท Young Latte Art Competition 2024 ที่ Espresso Academic Thailand x MunMun Srinakarin จัดขึ้นเพื่อเฟ้นหาผู้ที่มีความสามารถในการสร้างสรรค์ผลงานศิลปะบนถ้วยกาแฟ วันที่ 18-19 พ.ค.นี้ ชิงราลวัลมูลค่ารวมกว่า 30,000 บาท โดยจะมีกิจกรรม Workshop ให้น้องๆได้ซ้อมเทกันก่อนในวันที่ 18 พ.ค. และวันที่ 19 พ.ค. จะเป็นวันแข่งขันจริง น้องๆคนไหนมีความสนใจและชอบความท้าทายอย่ารอช้า โอกาสที่จะได้โชว์ฝีมือมาแล้ว! สมัครด่วน!
เปิดรับสมัครแล้วตั้งแต่วันนี้เป็นต้นไป
วันเสาร์ที่ 18 พ.ค. 67 Workshop Latte Art
วันอาทิตย์ที่ 19 พ.ค. 67 การแข่งขัน Latte Art
ค่าสมัคร 500 บาท/ท่าน (รวม Workshop+แข่งขัน)
อายุ 16-24 ปี หรือ ศึกษาอยู่ในระดับมัธยมปลาย-มหาวิทยาลัยระดับปริญญาตรี
สอบถามเพิ่มเติมหรือสมัคร คลิก https://lin.ee/wxqmXY1
20 พ.ค.2022 เคสแรกในออสเตรเลีย
20 พ.ค.2022 BBC อ้างถึง
Victorian Department of Health ว่าพบเคสแรกในออสเตรเลีย เป็นชายที่เพิ่งเดินทางกลับจากอังกฤษ ทางการนำเข้ากักตัวและสอบสวนโรค พร้อมกับติดตามผู้ที่สัมผัสใกล้ชิด
Thailand Festivals in UK 2023 (May-September) LINK
- 20–Sun 21 May 2023 Poole Harbourside (Baiter) Park Sat
- Bristol Date to be confirmed
- Sat 10–Sun 11 June 2023 Basingstoke The War Memorial Park
- Sat 24–Sun 25 June 2023 Nottingham Forest Recreation Ground (Goose Fair Site)
- Sat 8–Sun 9 July 2023 Warwick Warwick Racecourse
- Sat 15-Sun 16 July 2023 Norwich Earlham Park
- Sat 29–Sun 30 July 2023 Manchester Platt Fields Park
- Sat 5–Sun 6 August 2023 Cambridge Parker’s Piece
- Sat 19–Sun 20 August 2023 Brighton Preston Park
- Sat 2–Sun 3 September 2023 London Ealing Common
23rd Thai Festival 2023 in Tokyo LINK
Royal Thai Embassy, Tokyo announce that the 23rd Thai Festival 2023 will be held between 20 – 21 May 2023 at Yoyogi Park, with the collaboration between the Royal Thai Embassy in Tokyo and G-Yu Creative Co., Ltd.
In this connection, G-Yu creative Co., Ltd. will be the main event organizer and responsible for restaurants and exhibitors’ recruitment while Embassy will render necessary support. Further details will be updated in due course.
เวทีพิเศษ สัปดาห์ที่ 3 หาดแสม เกาะล้าน เฉพาะวันเสาร์ที่ 18 มีนาคม 2566
สัปดาห์ที่ 3 เฉพาะวันเสาร์ที่ 18 มีนาคม 2566 หาดแสม เกาะล้าน (
พิกัดเวที )
17.30 น. - 18.45 น. The Respect Band (House Band)
19.00 น. - 20.00 น. เขียนไข & วานิช
20.15 น. - 21.15 น. MAX JENMANA
21.30 น. - 22.30 น. OG-ANIC & 34PANATA
22.45 น. - 23.45 น. TWOPEE SOUTHSIDE
24.00 น. - 01.00 น. DJ.22Bullets
เตรียมตัว เตรียมพวกมามันกันให้สุดๆ ไปเรย
20-31 พฤษภาคม 67 ปศุสัตว์จังหวัดขอนแก่น บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️
ปศุสัตว์จังหวัดขอนแก่น บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ระหว่างวันที่ 20-31 พฤษภาคม 2567 ตั้งแต่เวลา 09.00-16.00 น. ณ สำนักงานปศุสัตว์จังหวัดขอนแก่น
แผน 5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข
แผน 5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข มีจำนวน 11 โครงการ งบประมาณ 2,409,120 ล้านบาท ได้แก่ประจำเดือนพฤษภาคม 2566
ประจำเดือนพฤษภาคม 2566
• จำนวนประชากรในประเทศ 67.212 ล้านคน
• จำนวนประชากรที่มีสิทธิหลักประกันสุขภาพ 66.891 ล้านคน
• สิทธิหลักประกันสุขภาพแห่งชาติ (สิทธิบัตรทอง 30 บาท) 47.004 ล้านคน
• สิทธิประกันสังคม 12.836 ล้านคน
• สิทธิข้าราชการ/รัฐวิสาหกิจ 5.290 ล้านคน
• สิทธิพนักงานท้องถิ่น 0.679 ล้านคน
• สิทธิครูเอกชน 0.085 ล้านคน
ข้อมูลวันที่ : 12 มิถุนายน 2566
21 พ.ค. 2022 - WHO รายงานพบโรคฝีดาษลิง LINK
องค์การอนามัยโลก ออกรายงานเกี่ยวกับการพบโรคฝีดาษลิง ตั้งแต่ 13 พ.ค.2022 ว่าพบการระบาดใน 12 ประเทศสมาชิก ใน 3 ทวีป ซึ่งโรคนี้ปกติแล้ว ไม่พบว่าเป็นโรคประจำถิ่นในประเทศเหล่านั้น อีกทั้งไม่พบว่ามีเชื่อมโยงกับการเดินทางข้ามประเทศแต่อย่างใดเช่นกัน จากข้อมูลที่เท่าพอมีเบื้องต้น ผู้ป่วยส่วนใหญ่ที่พบจะอยู่ในกลุ่มชายรักชาย (MSM) ที่เข้ามารับการรักษาเบื้องต้นตามคลินิก WHO ออกคำเตือนฉบับนี้เพื่อให้โลกรู้และตระหนักเพื่อเฝ้าระวังป้องกัน (
Multi-country monkeypox outbreak in non-endemic countries)
21 พ.ค.2022 ตัวเลขการระบาดในประเทศต่างๆ WHO LINK
WHO เปิดรายงานระบุว่าพบเคสยืนยันแล้ว 92 ราย และเคสต้องสงสัย 28 ราย จาก12 ประเทศทั้งในยุโรป 9 ประเทศ สหรัฐอเมริกา แคนาดา และออสเตรเลีย
ประเทศที่พบจำนวนมาก 3 ประเทศ คือ อังกฤษ สเปน และโปรตุเกส ที่พบระหว่าง 21-30 เคส โดยเฉพาะสเปน ยังมีเคสต้องสงสัยอีก 6-10 เคส
ส่วนแคนาดา มีเคสยืนยันไม่มาก แต่ต้องสงสัย 11-20 เคส นับว่าสูง
ประเทศเหล่านี้ไม่มีโรคฝีดาษลิง เป็นโรคประจำถิ่น (เฉพาะประเทศแถบแอฟริกาเท่านั้น)
รายการการระบาดในกลุ่มประเทศแถบแอฟริกา ที่โรคฝีดาษลิงเป็นโรคประจำถิ่น
รายงานจำนวนผู้ป่วยใน 4 ประเทศแถบแอฟริกา ที่โรคฝีดาษลิงเป็นโรคประจำถิ่น ได้แก่ แคเมอรูน พบ 25 เคส (เสียชีวิตน้อยกว่า 5 ราย) แอฟริกากลาง พบ 6 ราย สาธารณรัฐคองโก พบ 1,238 ราย เสียชีวิตถึง 57 ราย และไนจีเรียพบ 46 ราย ไม่มีเสียชีวิต
โรคฝีดาษลิง นับเป็นโรคประจำถิ่นของประเทศดังนี้ : Benin, Cameroon, the Central African Republic, the Democratic Republic of the Congo, Gabon, Ghana (identified in animals only), Ivory Coast, Liberia, Nigeria, the Republic of the Congo, Sierra Leone, and South Sudan
รายงานพบเคสแรกในละตินอเมริกาและเอเซีย
21 พ.ค. 2022
อิสราเอล พบ 1 เคส ในชายวัย 30 ปี กลับจากยุโรป
22 พ.ค. 2022
รายงานเคสแรก ในกรุงบัวโนสไอเรส อาร์เจนตินา มีประวัติเดินทางไปสเปน ไม่มีอาการรุนแรงและอยู่ในระหว่างกักตัวและทดสอบ
รายงานเคสแรก ในออสเตรีย รัฐวิคทอเรีย
24 พ.ค. 2022
สหรัฐอาหรับเอมิเรทส์ รายงานพบ 1 เคส เป็นหญิงวัย 29 ปี กลับจากแอฟริกาตะวันตก [
ArabNews]
22 พ.ค.2022 ปธน.โจ ไบเดน ห่วงใยสถานการณ์
22 พ.ค.2022 ปธน.โจ ไบเดน กล่าวถึงโรคฝีดาษลิง ว่าน่าเป็นห่วง แม้ว่าขณะนี้ในสหรัฐจะพบผู้ป่วยเพียง 2 รายเท่านั้น แต่โอกาสจะพบผู้ป่วยเพิ่มขึ้นก็มีไม่น้อย ซึ่งขณะนี้ CDC กำลังเฝ้าระวังผู้ต้องสงสัยว่าจะติดเชื้อจำนวน 6 ราย อย่างไรก็ตามที่ปรึกษาด้านโควิดของทำเนียบขาว ย้ำความเชื่อมั่นว่าโรคนี้จะไม่ระบาดแบบโควิด ขณะที่นักวิทยาศาสตร์ได้จับตาพร้อมกับพัฒนาวัคซีนมานับสิบปีแล้ว รัฐบาลกลางจะทำการติดตามผู้ติดเชื้อและป้องกันไม่ให้เกิดการแพร่เชื้อ [
Forbes]
บุญบั้งไฟ เลิงนกทา 22-29 พฤษภาคม 66
บุญบั้งไฟ เลิงนกทา 22-29 พฤษภาคม 66 บริเวณหน้าที่ว่าการอำเภอเลิงนกทา จ.ยโสธร วันที่ 26 พ.ค. ชมพิธีเปิดและขบวนแห่งบั้งไฟ วันที่ 27 พ.ค. คอนเสิร์ต เวียง นฤมล เต็มวง วันที่ 28 พ.ค. ชมการจุดบั้งไฟ
23 พ.ค.2022 WHO ระบุไม่มีหลักฐานว่าฝีดาษลิงมีการกลายพันธุ์
WHO ระบุไม่มีหลักฐานว่าฝีดาษลิงมีการกลายพันธุ์ และย้ำว่าโรคนี้เป็นโรคประจำถิ่นของประเทศในแถบแอฟริการกลางและแอฟริกาตะวันตก
โรซามุนด์ ลิวอิส ผู้เชี่ยวชาญด้านโรคฝีดาษ กล่าวว่าโอกาสของการกลายพันธุ์มีอยู่ต่ำมาก การตรวจลำดับจีโนมช่วยให้เราเข้าใจการระบาดได้อย่างดี จากจำนวนผู้ป่วยที่พบกว่า 100 รายในยุโปรและอเมริการเหนือตอนนี้ อาการไม่รุนแรง "สถานการณ์ที่ควบคุมได้" มาเรีย แวน เคอร์คฮอฟ กล่าว และเสริมว่า การระบาดนั้นเกิดขึ้นได้เป็นปกติ แม้ในประเทศที่การระบาดไม่ค่อยพบมากนักก็ตาม ขณะนี้นักวิทยาศาสตร์กำลังค้นหาต้นตอของการติดเชื้อและอื่นใดก็ตามที่เกี่ยวข้องกับไวรัสชนิดนี้ [
VOA - Reuters]
พยาบาลวิชาชีพชำนาญการ โรงพยาบาลพนมไพร ร้อยเอ็ด ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนรถบรรทุกพ่วง LINK
23 พฤษภาคม 2566 เวลาประมาณ 17.00 น. พว.พิมใจ โคตรสีหา พยาบาลวิชาชีพชำนาญการ และนางสาวสำอาง สมภักดี นักวิชาการสาธารณสุขชำนาญการ สังกัดโรงพยาบาลพนมไพร อำเภอพนมไพร จังหวัดร้อยเอ็ด ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนรถบรรทุกพ่วง ในเขตเทศบาลตำบลพนมไพร อำเภอพนมไพร จังหวัดร้อยเอ็ด พบผู้บาดเจ็บเป็นเพศชาย 1 ราย จึงทำการประเมินสัญญาณชีพและระดับความรู้สึกตัว ผู้บาดเจ็บมีอาการขาซ้ายผิดรูป จึงได้ทำการดามขาเบื้องต้นเพื่อป้องกันการบาดเจ็บซ้ำ ดูแลทำแผล พร้อมทั้งโทรศัพท์ประสานโรงพยาบาลพนมไพรเพื่อนำส่งผู้บาดเจ็บรักษาตัวต่อไป
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.พิมใจ โคตรสีหา และนางสาวสำอาง สมภักดี ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดีจนเป็นที่ประจักษ์ต่อสังคม
ผู้บริหารระดับสูง คณะพยาบาลศาสตร์ สถาบันพระบรมราชชนก ได้ให้การช่วยเหลือผู้บาดเจ็บที่ประสบอุบัติเหตุ ในเขตพื้นที่อำเภอเมือง จังหวัดพะเยา LINK
23 พฤษภาคม 2566 เวลาประมาณ 18.00 น. ดร.นันทิกา อนันต์ชัยพัทธนา รักษาราชการแทนรองผู้อำนวยการด้านกิจการนักศึกษาและทะนุบำรุงศิลปวัฒนธรรม สังกัดวิทยาลัยพยาบาลบรมราชชนนี พะเยา คณะพยาบาลศาสตร์ สถาบันพระบรมราชชนก ได้ให้การช่วยเหลือผู้บาดเจ็บที่ประสบอุบัติเหตุ ในเขตพื้นที่อำเภอเมือง จังหวัดพะเยา โดยการประเมินสัญญาณชีพ ทำแผลเบื้องต้น และจัดท่าเพื่อป้องกันการบาดเจ็บเพิ่ม พร้อมทั้งประสานงานหน่วยกู้ชีพนำผู้ป่วยส่งไปรักษาต่อที่โรงพยาบาลพะเยาต่อไป
ในการนี้สภาการพยาบาลขอแสดงความชื่นชมและเชิดชูเกียรติ ดร.นันทิกา อนันต์ชัยพัทธนา ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดี จนเป็นที่ประจักษ์ต่อสังคม
23 พฤษภาคม 2567 มอบป้ายรับรอง SAN ร้านอาหารภายในอาคารผู้โดยสารท่าอากาศยานสุวรรรภูมิ
23 พฤษภาคม 2567 นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย พร้อมด้วยนายรังสรรค์ วงษ์บุญหนัก รองนายแพทย์สาธารณสุขจังหวัดสมุทรปราการ นายอุดม กลิ่นพวง นายกองค์การบริหารส่วนตำบลหนองปรือ นางกรรณิการ์ เปรมประเสริฐ รองผู้อำนวยการท่าอากาศยานสุวรรณภูมิ (สายปฏิบัติการ 2) และนายชัยเลิศ กิ่งแก้วเจริญชัย รองผู้อำนวยการสำนักสุขาภิบาลอาหารและน้ำ ร่วมพิธีมอบป้ายรับรองมาตรฐาน “อาหารสะอาด ปลอดภัย ได้มาตรฐาน" : SAN" ให้แก่ร้านอาหารภายในอาคารผู้โดยสารท่าอากาศยานสุวรรรภูมิ จำนวน 84 ร้าน ตามโครงการคุ้มครองผู้บริโภค ประจำปีงบประมาณ 2567 องค์การบริหารส่วนตำบลหนองปรือ อำเภอบางพลี จังหวัดสมุทรปราการ ณ ห้องจัดเลี้ยง 1 ชั้น 5 อาคารสำนักงานท่าอากาศยาน (AOB)
อบต.ท่าคล้อ อ.แก่งคอย จ.สระบุรี ฝึกอบรมปฏิบัติการทำยาหม่อง ยาดม ครีมแก้คัน จากสมุนไพร
วันที่ 23 พฤษภาคม 2567 กองสวัสดิการสังคม ได้จัดโครงการพระราชดำริด้านสาธารณสุข ภายใต้กิจกรรม อบรมหมอหมู่บ้านในพระราชประสงค์ ณ อาคารอเนกประสงค์องค์การบริหารส่วนตำบลท่าคล้อ อ.แก่งคอย จ.สระบุรี โดยวิทยากรผู้เชี่ยวชาญจาก โรงพยาบาลเจ้าพระยาอภัยภูเบศร บรรยายให้ความรู้ด้านความสำคัญของหมอชาวบ้าน พร้อมฝึกปฏิบัติการทำยาหม่อง ยาดม ครีมแก้คัน จากสมุนไพร ทั้งนี้ มีประชาชนผู้สนใจ อสม. และแกนนำสุขภาพ เข้าร่วมโครงการทั้งสิ้นจำนวน 110 คน
24 พ.ค.2022 รายงานเคสแรกใน UAE Czech Republic Slovenia หลายประเทศพบเคสเพิ่ม
24.05.2022 Reuters รายงานพบเคสแรกใน UAE Czech Republic Slovenia
พบเคสแรกในกรุงปราก สาธารณรัฐเชค เป็นหญิงที่เพิ่งเดินทางกลับจากงานเทศกาลในเบลเยี่ยม
สโลเวเนีย พบเคสแรกในเมืองซาราเยโว เป็นชายที่เพิ่งเตินทางกลับจากเกาะคานารี่ สเปน
หลายประเทศพบเคสเพิ่ม สเปนเพิ่มเป็น 48 ราย ส่วนใหญ่พบในกรุงแมดริด อังกฤษ
24 พ.ค. 2022 โมเดอร์นาเริ่มทดลองทางคลินิก วัคซีนโรคฝีดาษลิง
Reuters, Channelnews Asia, Market watch และอีกหลายสำนัก ระบุว่าโมเดอร์นาเริ่มการทดลองทางคลินิกวัคซีนโรคฝีดาษลิงที่กำลังระบาดในยุโรปและแคนาดา แต่ยังไม่มีข้อมูลเพิ่มเติมจากโมเดอร์นาต่อข่าวนี้24 พ.ค. 2022 ยังไม่เป็นโรคระบาดใหญ่ครั้งใหม่แต่อย่างใด - รมต.สธ.เยอรมัน
รมต.สธ. เยอรมัน นายคาร์ล เลาเทอร์บัค แถลงถึงสถานการณ์โรคฝีดาษลิงที่เริ่มพบมากขึ้นในยุโรปและเยอรมัน ว่า ไม่พบว่าจะเป็นเหตุให้เกิดการระบาดใหญ่ครั้งใหม่แต่อย่างใด แต่ได้ออกแนวปฏิบัติว่า ผู้ป่วยจะต้องถูกกักตัว 21 วัน การควบคุมโรคทำได้ด้วยการลดการสัมผัส และชี้ว่า การติดเชื้อเกิดขึ้นได้ง่ายกว่าในกรณีการมีเพศสัมพันธ์ที่ไม่มีการป้องกันที่ดีพอ กลุ่มคนที่มีอาชีพเกี่ยวพันธ์ด้านการบริการทางเพศอาจมีความเสี่ยงมากขึ้น และโรคนี้สามารถแพร่กระจายได้กับทุกวัย ทุกเพศ ทั้งเด็กและผู้ใหญ่ และทางการเยอรมันได้ส่ังวัคซีน 40,000 โดสจากสหรัฐแล้ว [
DW]
ล่าสุด (24 พ.ค.) เยอรมันรายงานพบผู้ป่วย 5 ราย
THE MALL LIFESTORE PET FIESTA 24 - 29 พ.ค. 67
งาน THE MALL LIFESTORE PET FIESTA วันที่ 24 พ.ค. 67 - 29 พ.ค. 67 บริเวณ M GRAND HALL, M SPACE และ M LIFESTYLE HALL ชั้น G เดอะมอลล์ไลฟ์สโตร์ บางกะปิ มหกรรมปาร์ตี้ครั้งยิ่งใหญ่ ของแก๊ง 4 ขา และผองเพื่อน ???? สุดเซอร์ไพรส์กับกิจกรรมอัดแน่น พบปะเหล่าเพื่อนซี้แสนรัก
25 พ.ค.2022 พบผู้ป่วยเพิ่มในยุโรป แคนาดา
25 พ.ค.2022
ฝรั่งเศส รายงานพบเพิ่มเป็น 5 ราย (จาก 3 รายเมื่อสัปดาห์ก่อน)
แคนาดา รัฐควิเบค พบแล้ว 15 ราย คาดว่าจะพบเพิ่มอีก
25 พ.ค.2022 บ.โรช พัฒนาชุดตรวจโรคฝีดาษลิง
บ.โรช ยักษ์ใหญ่ด้านเวชภัณฑ์ ของสวิสเซอร์แลนด์ ประกาศพร้อมจะพัฒนาชุดตรวจ 3 แบบ เพื่อใช้หาโรคฝีดาษลิง โดยแบบแรก LightMix Modular Virus เพื่อใช้ตรวจหาเชื้อ orthopoxviruses ที่เป็นสาเหตุของโรคฝีดาษลิง ซึ่งไวรัสนี้เกี่ยวพันธุ์กับฝีดาษคน และฝีดาษวัว แบบที่สอง ใช้ตรวจหาโรคฝีดาษลิง สายพันธุ์แอฟริการตะวันตก และแบบที่สาม สำหรับตรวจหาไวรัส orthopoxviruses และไวรัสโรคฝีดาษลิง [
CNBC]
25 พ.ค. 2022 อัปเดทสถานการณ์ กรมควบคุมโรค
ข้อมูล ณ วันที่ 25 พฤษภาคม 2565
25 พ.ค.2022 สำนักการแพทย์ กรุงเทพมหานคร เฝ้าระวังติดตามใกล้ชิด
กรุงเทพมหานครโดยสำนักการแพทย์ ได้เฝ้าระวังติดตามสถานการณ์การแพร่ระบาดของโรคฝีดาษลิงตามแนวทางกระทรวงสาธารณสุข แม้ในพื้นที่กรุงเทพมหานครจะยังไม่ตรวจพบผู้ติดเชื้อไวรัสดังกล่าว เพื่อป้องกันการระบาดที่อาจจะเกิดขึ้น เนื่องจากในระยะนี้เป็นช่วงที่เริ่มเปิดให้มีการเดินทางเข้าประเทศได้มากขึ้น อาจมีความเสี่ยงจากผู้เดินทางมาจากพื้นที่ที่มีการระบาด การเดินทางไปท่องเที่ยวหรือทำธุรกิจ ในประเทศกลุ่มเสี่ยง อาจมีโอกาสติดเชื้อและนำกลับมายังประเทศได้ โดยมีกลุ่มเสี่ยงคือ แรงงานต่างชาติ หรือคนไทยที่ไปทำงานในประเทศที่มีการติดเชื้อ นักท่องเที่ยว ผู้ประกอบการท่องเที่ยว
กรุงเทพมหานครขอให้ประชาชนติดตามข่าวสารอย่างใกล้ชิด และหากต้องเดินทางไปยังประเทศที่พบผู้ป่วยฝีดาษลิง ควรระมัดระวัง หลีกเลี่ยงการสัมผัสสัตว์พาหะ และหลังจากเดินทางกลับจากประเทศที่มีการระบาด ให้สังเกตอาการ หากพบมีความผิดปกติ เช่น มีไข้ มีตุ่มผื่นที่ใบหน้า แขน และขา ให้รีบพบแพทย์ทันที รวมทั้งปฏิบัติตามมาตรการ Universal Prevention โดยการหมั่นล้างมือด้วยสบู่หรือเจลแอลกอฮอล์บ่อย ๆ หากมีข้อสงสัยสอบถามเพิ่มเติมได้ที่ สายด่วนสุขภาพสำนักการแพทย์ กรุงเทพมหานคร โทร. 1646 ตลอด 24 ชั่วโมง
พฤษภาคม 65 BDMS ประกาศจัดตั้ง บ.ย่อย ลงทุนโครงการ BDMS Silver Wellness & Residence
25 พฤษภาคม 2565 BDMS ประกาศจัดตั้งบ.ย่อย ในนามบ.บีดีเอ็มเอส ซิลเวอร์ จำกัด (BDMS Silver Company Limited) ทุนจดทะเบียน 5,000 ล้านบาท เพื่อลงทุนโครงการ BDMS Silver Wellness & Residence และ เข้าทำสัญญาเช่าที่ดินระยะยาว เนื้อที่ 13 ไร่ 60.18 ตารางวา บริเวณหัวมุมถนนสารสินและถนนหลังสวน (ตรงข้ามสวนลุมพินี) จากสำนักงานทรัพย์สินส่วนพระมหากษัตริย์ เพื่อพัฒนาโครงการดังกล่าว
Cafe Asia 25 - 27 May 2023 (Singapore)
Cafe Asia 25 - 27 May 2023 Sands Expo and Convention Centre, Singapore
"Southeast Asia’s Biggest Cafe, Coffee and Tea Industry Expo" Cafe Asia will showcase an array of equipment, machinery, accessories, and other supplies and products for the effective running of coffee establishments and tea businesses. This makes the exhibition the perfect one-stop sourcing platform for industry professionals to cater to the needs of the growing industry. Gain valuable insights on the latest cafe trends, innovative products, and services that are brewing in the region and beyond.
Cat Pirate 2024 วันที่ 25 พ.ค. - 3 มิ.ย. 67
Cat Pirate 2024 ลานศูนย์การค้าเซ็นทรัล ปิ่นเกล้า ชั้น 1 โซนลิฟต์แก้ว วันที่ 25 พ.ค. - 3 มิ.ย. 67
26 พ.ค.2022 สเปนเตรียมสั่งวัคซีน หลังผู้ป่วยพุ่ง 55 ราย โปรตุเกสเพิ่มเป็น 49 ราย
26 พ.ค.2022 สเปนเตรียมสั่งวัคซีนโรคฝีดาษลิง หลังผู้ป่วยพุ่ง 55 ราย
คาโรริน่า ดาเรียส รมต.สธ. สเปนเผยว่าจะสั่งวัคซีนจาก Imvanex ของบ. บาวาเรียน นอร์ดิก ในเดนมาร์ค แต่ไม่เปิดเผยจำนวนที่จะสั่ง
รายงานผู้ป่วยที่พบในสเปนทั้งหมดพบจาก 2 จุด กล่าวคือ 51 รายพบในเมืองแมดริด เชื่อมโยงกับเซาว์น่าสำหรับผู้ใหญ่ที่ถูกสั่งปิดไปแล้วตั้งแต่สัปดาห์ที่แล้ว ขณะที่อีก 4 ราย พบบนเกาะคานารี่ ผู้ป่วยหลายรายจากทั้งสองกรณี เชื่อมโยงการเทศกาลเกย์ไพรด์ ที่จัดที่เกาะคานารี่ ซึ่งเป็นงานใหญ่มีคนร่วมกว่าแปดหมื่นคนและจัดนานถึง 10 วัน
จุดที่เป็นจับตาว่าเป็นแหล่งแพร่กระจายโรค เป็นย่านพักอาศัยหรูในแมดริดหลายแห่ง บางแห่งพบว่ามีผู้เดินทางจากอังกฤษด้วย ทางการอังกฤษรายงานพบผู้ป่วยรายแรกตั้งแต่ 7 พ.ค.2022
ขณะที่โปรตุเกสรายงานพบเพิ่มใหม่ 10 ราย รวมเป็น 49 ราย ผู้ป่วยทั้งหมดเป็นชายอายุต่ำกว่า 40 ปี และไม่มีรายใดต้องเข้ารักษาในโรงพยาบาล
26 พ.ค. 2022 ไทยพบผอ. WHO ขอรับสนับสนุนวัคซีนฝีดาษคน LINK
รมว.สธ. หารือ ผอ.ใหญ่องค์การอนามัยโลก ขอสนับสนุนวัคซีนฝีดาษคน เพื่อเตรียมการรองรับกรณีมีการแพร่ระบาดของโรคฝีดาษวานร เนื่องจากประเทศไทยมีนักท่องเที่ยวเดินทางเข้าประเทศเพิ่มมากขึ้น จึงมีการเตรียมพร้อมเฝ้าระวังคัดกรองโรคในผู้ที่เดินทางมาจากประเทศที่มีการแพร่ระบาด โดยในการเข้าพบนายเท็ดรอสได้มีการหารือเพื่อขอรับการสนับสนุนเรื่องวัคซีนฝีดาษคน (Smallpox) จากองค์การอนามัยโลกด้วย
หาดใหญ่มาราธอน ครั้งที่ 16 วันที่ 26 พฤษภาคม 2567
หาดใหญ่มาราธอน ครั้งที่ 16 วิ่งวันที่ 26 พฤษภาคม 2567 สถานที่วิ่ง : สนามกีฬาจิระนคร ประเภทการแข่งขัน Fun Run 4 KM / Mini Marathon 10.5 KM / Half Marathon 21.1 KM / Marathon 42.195 KM
Mothers Class ครั้งที่ 3 วันอาทิตย์ ที่ 26 พฤษภาคม 2567
"Mothers Class" ครั้งที่ 3 วันอาทิตย์ ที่ 26 พฤษภาคม 2567 เวลา 9.30 - 12.00 น. ณ ห้องประชุมนายแพทย์สมชัย ตั้งพร้อมพันธ์ ชั้น 2 อาคารศูนย์การแพทย์เฉพาะทางเกษมราษฎร์ ศรีบุรินทร์ **(ไม่เสียค่าใช้จ่าย)** “เตรียมความพร้อมเข้าสู่การเป็นคุณแม่คุณภาพ”ร่วมรับฟังการบรรยายในหัวข้อ ภาวะเบาหวานขณะตั้งครรภ์ที่คุณแม่ต้องรู้ โดย แพทย์หญิงจิตรลดา อุทัยพิบูลย์ แพทย์ผู้เชี่ยวชาญด้านอายุรศาสตร์ ร่วม Workshop ของว่างน้ำตาลน้อยอร่อยมากโภชนาการสูง โดยนักโภชนาการอาหารโรงพยาบาลเกษมราษฎร์ศรีบุรินทร์
Amazing Race Festival & Triathlon บ่อพลอย กาญจนบุรี 27-29 พ.ค.65 LINK
Amazing Race Festival & Triathlon เป็นการแข่งขันไตรกีฬา ว่ายน้ำ จักรยาน วิ่ง และกิจกรรมกีฬาเพื่อส่งเสริมการท่องเที่ยว วันที่ 27-29 พฤษภาคม 2565 ณ สนามกอล์ฟกรังด์ปรีซ์ อ.บ่อพลอย จ.กาญจนบุรี จัดโดย ททท. ภายใต้โครงการ Thailand Festival Experience ขึ้น โดยใช้ชื่อว่า “Amazing Sports & Extreme Month” เพื่อเป็นการส่งเสริมการท่องเที่ยวเชิงกีฬา (Sport Tourism) ซึ่งกำลังเป็นกระแสความนิยมในกลุ่มคนรุ่นใหม่ เป็นการประชาสัมพันธ์การเปิดประเทศต้อนรับนักท่องเที่ยว และการยกระดับสู่การเป็น Sport Tourism Destination ของประเทศไทย
ไตรกีฬา (Triathlon)
ระยะแข่งขัน: ซุปเปอร์สปริ้นท์ (ว่ายน้ำ 300 ม./จักรยาน 1.2 กม.x4 รอบ/วิ่ง 1.6 กม.)
วัน-เวลาแข่งขัน: แข่งขันเป็นรอบๆ ละ 1 ชั่วโมง (โดยประมาณ) เสาร์ที่ 28 พ.ค. 65 เวลา 06.15-18.00 น. (8 รอบ)
สถานที่แข่งขัน: ณ สนามกอล์ฟกรังด์ปรีซ์ อ.บ่อพลอย จ.กาญจนบุรี
การจัดกลุ่มอายุ:
Beginner ไม่จำกัดอายุ (มือใหม่เท่านั้น)
หญิงเดี่ยว ( Over All Female )
ชายเดี่ยว รุ่นกลุ่มอายุระหว่าง 16 - 24 ปี
ชายเดี่ยว รุ่นกลุ่มอายุระหว่าง 25-34 ปี
ชายเดี่ยว รุ่นกลุ่มอายุระหว่าง 35-49 ปี
ชายเดี่ยว รุ่นกลุ่มอายุ 50 ปีขึ้นไป
*คุณสมบัติของผู้สมัครประเภทบุคคลจะต้องมีความสามารถดังนี้ ความเร็วเฉลี่ยในการว่ายน้ำต่อ 100 เมตร ต่ำกว่า 2.00
Mixed Team 3 คน ไม่จำกัดเพศ ไม่จำกัดอายุ คุณสมบัติของผู้สมัครประเภททีมจะต้องมีความสามารถดังนี้
ความเร็วเฉลี่ยในการว่ายน้ำต่อ 100 เมตร ต่ำกว่า 1.40 นาที
ความเร็วเฉลี่ยในการปั่นจักรยาน 37 กิโลเมตร ต่อ ชั่วโมง
ความเร็วเฉลี่ยในการวิ่ง 4.3 นาทีต่อ 1 กิโลเมตร
อบต.สบปราบ ลำปาง อบรมหมอหมู่บ้าน บทบาท หมอ1 อสม และหมอ4 กำนัน ผู้ใหญ่บ้าน เจ้าหน้าที่ที่เกี่ยวข้อง
วันที่ 27 - 28 พฤษภาคม 2567 งานสาธาธารณสุขและสิ่งแวดล้อม องค์การบริหารส่วนตำบลสบปราบ โดยนายมนัส ใจเรือน นายก อบต. พร้อมด้วย นางสาวธนัฏฐาธร ด่านอินถา ปลัด อบต. ได้จัดทำโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ประจำปีงบประมาณ พ.ศ.2567 เพื่อให้หมอหมู่บ้าน ได้เข้าใจในบทบาทหน้าที่และช่องทางการสื่อสารในการดูแลสุขภาพ และคุณภาพชีวิตของประชาชนในพื้นที่ โดยมีหมอคนที่ 1 ได้แก่ อาสาสมัครสาธารณสุขประจำหมู่บ้าน(อสม.) และหมอคนที่ 4 ได้แก่ กำนัน ผู้ใหญ่บ้าน เจ้าหน้าที่ที่เกี่ยวข้อง เข้าร่วมโครงการจำนวน 130 คน ณ ห้องประชุมองค์การบริหารส่วนตำบตำบลบปราบ อำเภอสบปราบ จังหวัดลำปาง.
#องค์กรมีมาตรฐาน บริการประทับใจ ใช้หลักเศรษฐกิจพอเพียง หล่อเลี้ยงความสุขของประชาชนอย่างยั่งยืน #www.sopprap.go.th
28 พ.ค. 2022 พบใน 2 ประเทศละตินอเมริการแล้ว
รายงานพบเคสแรกใน เม็กซิโก และ อาร์เจนตินา
อาร์เจนตินา ยืนยันพบผู้ป่วยโรคฝีดาษลิง รายแรกเมื่อวันศุกร์ (26 พ.ค.) นับเป็นผู้ป่วยโรคนี้รายแรกในทวีปนี้
เม็กซิโกรายงานพบเคสแรก เป็นชายวัย 50 ปี ชาวนิวยอร์ค คาดว่าน่าจะติดจากเนเธอร์แลนด์ รัฐมนตรีสาธารณสุขเม็กซิโกระบุ ตอนนี้ผู้ป่วยถูกแยกกักตัวและอาการคงที่ [euronews]
ไอร์แลนด์รายงานพบผู้ป่วยรายแรกเช่นกัน
ในอังกฤษรายงานพบผู้ป่วย เพิ่มอีก 16 ราย ทำให้มีผู้ป่วยสะสม ตั้งแต่ 7 พฤษภาคม รวมแล้ว 106 ราย
สก๊อตแลนด์ และไอร์แลนด์เหนือ ต่างรายงานพบประเทศละ 3 ราย
เวลส์ พบผู้ป่วยแล้ว 3 รายเช่นกัน รายแรกยืนยันเมื่อวันพฤหัส (25 พ.ค.)
28 พ.ค.66 Ngorn Nak Trail 2023 LINK
28 พฤษภาคม 2566 นี้ กระบี่กำลังมีงานวิ่งเทรลน๊า จะสายอึด จะสายชิว หรือจะสายชอบความท้าทายก็สามารถเซฟวันที่ได้เลย กับงานวิ่งเทรล Ngorn Nak Trail 2023 พบกับเส้นทางชายหาดที่ทอดยาวเชื่อมต่อกับเขาหงอนนาคกันอย่างมีเสน่ห์และงดงาม
Hatyai Marathon 2023 - May 28 LINK
Hatyai Marathon 2023, 28 May 2023, Organized by Hat Yai Running Club, running distances of 42 Km. / 21 Km / 10.5 Mini / 4 Km Fun Run. Jiranakorn Stadium is the race start.
Broken Hurt Mountain Concert 28 พฤษภาคม 2566
กลับมาเอาใจสายแคมป์อีกครั้งกับงาน Broken Hurt Mountain Concert คนโสด I อกหัก I พายSUP I ดูคอนเสิร์ต Silly Fools Band วันอาทิตย์ที่ 28 พฤษภาคม 2566 ศูนย์ฝึกกีฬาเรือพายราชนาวี คลองบางไผ่ อ.บ้านฉาง จ.ระยอง ภายในงานพบกับ ♂️แข่งขันพาย SUP Board (Highlight) ♀️โชว์พายเรือสลาลอมผสมแสง เสียง (Highlight) ลองพาย SUP Board ในงาน ชมคอนเสิร์ต Silly Fools @18.45 น.
กำหนดการลงพื้นที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมว ปี 2567
เทศบาลนครอุดรธานี ประกาศ
ตารางกำหนดการลงพื้นที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมว ภายในชุมชนเขตเทศบาลนครอุดรธานี เขต 1 - เขต 4 โดยเริ่มดำเนินการ ตั้งแต่วันที่ 28 พฤษภาคม เป็นต้นไป
ติดต่อสอบถามรายละเอียดเพิ่มเติม ได้ที่ กลุ่มงานบริการสาธารณสุข สำนักสาธารณสุขและสิ่งแวดล้อม โทร. 042-325176-85 ต่อ 2107 , 2130 วันและเวลาราชการ
กำหนดการ ปี 2567 ดังนี้
- 28 พ.ค. 2567 ชุมชนโพธิ์ทอง ชุมชนพิชัยรักษ์ ชุมชนหนองตาเหล็ก 1 ชุมชนพละบุดีศรีอุดร ชุมชนหนองตาเหล็ก 3
- 31 พ.ค. 2567 ชุมชนคลองเจริญ 1 ชุมชนโพธ์สว่าง 3 ชุมชนโพธ์สว่าง 1 ชุมชนโพธ์สว่าง 2
- 4 มิ.ย. 2567 ชุมชนคลองเจริญ 2 ชุมชนโพธิสมภรณ์ ชุมชนหนองนาเกลือ ชุมชนโนนอุทุม
- 7 มิ.ย. 2567 ชุมชนโนนวัฒนา ชุมชนบ้านโนน ชุมชนเบญจางค์ ชุมชนบ้านห้วย 3
- 11 มิ.ย. 2567 ชุมชนมิตรประชา ชุมชน ท.6 โนนนิเวศน์ ชุมชนเวียงพิงค์ ชุมชนมธุรส
- 13 มิ.ย. 2567 ชุมชนบ้านเหล่า 1 ชุมชนบ้านเหล่า 2 ชุมชนบ้านเหล่า 3 ชุมชนบ้านเดื่อ 3 ชุมชนเทศบาล 9
- 18 มิ.ย. 2567 ชุมชนบ้านเดื่อ 1 ชุมชนทุ่งสว่างตะวันตก ชุมชนรถไฟ ชุมชนทุ่งสว่างตะวันออก 2
- 20 มิ.ย. 2567 ชุมชนทองใหญ่ ชุมชนทุ่งมั่ง ชุมชนหนองเหล็ก 1 ชุมชนหนองเหล็ก 2
- 25 มิ.ย. 2567 ชุมชนหนองบัว 1 ชุมชนหนองบัว 2 ชุมชนชลประทาน ชุมชนแจ่มศิริ
- 28 มิ.ย. 2567 ชุมชนบ้านห้วย 1 ชุมชนเวียงพิงค์ 2 ชุมชนหนองบัว 3 ชุมชนหนองบัว 4
- 2 ก.ค. 2567 ชุมชนหนองบัว 6. ชุมชนหนองบัว 7. ชุมชนหนองตุ 1 ชุมชนหนองตุ 3
- 4 ก.ค. 2567 ชุมชนหนองตุ 2 ชุมชนเก่าจาน 1 ชุมชนเก่าจาน 2 ชุมชนเก่าจาน 3
- 9 ก.ค. 2567 ชุมชนเก่าจาน 4 ชุมชนเก่าจาน 5 ชุมชนเก่าจาน 6 ชุมชนเก่าจาน 7
- 12 ก.ค. 2567 ชุมชนเก่าจาน 8 ชุมชนเมืองทอง ชุมชนเมืองทอง 2 ชุมชนบ้านม่วง
- 16 ก.ค. 2567 ชุมชนสามัคคี ชุมชนสามัคคี 2 ชุมชนโพธิวราราม ชุมชนสร้างแก้ว 1
- 19 ก.ค. 2567 ชุมชนสร้างแก้ว 2 ชุมชนสร้างแก้ว 3 ชุมชนทองคำอุทิศ 1 ชุมชนทองคำอุทิศ 2
- 23 ก.ค. 2567 ชุมชนศรีพินิจ ชุมชนโนนยาง 1 ชุมชนศรีเจริญสุข ชุมชนหนองขอนกว้าง 2
- 26 ก.ค. 2567 ชุมชนหนองขอนกว้าง 1 ชุมชนหนองขอนกว้าง 2. ชุมชนศรีชมชื่น 1 ชุมชนศรีชมชื่น 2
อบต.ดงพญา อ.บ่อเกลือ น่าน อบรมการปฐมพยาบาลเบื้องต้น เพื่อเป็นที่พึ่งพิงด้านสาธารณสุขแก่หมู่บ้านได้
วันที่ 28-31 พฤษภาคม 2567 องค์การบริหารส่วนตำบลดงพญา ร่วมกับ คณะกรรมการหมู่บ้านและ อสม. จัดทำโครงการอบรมหมอหมู่บ้าน ในพระราชประสงค์ ประจำปีงบประมาณ 2567 เป็นโครงที่จัดขึ้นเพื่อให้ความรู้ประชาชนเกี่ยวกับการปฐมพยาบาลเบื้องต้น ให้ผู้ที่เข้าร่วมการอบรมสามารถเป็นที่พึ่งพิงด้านสาธารณสุขแก่หมู่บ้านได้ โดยได้รับความอนุเคราะห์วิทยากรจาก รพ.สต.ดงพญา ณ บ้านน้ำแคะหมู่ที่ 4 บ้านสว้าใต้หมู่ที่ 7 บ้านสะปันหมู่ที่ 1 วันที่/พื้นที่ทำกิจกรรม
วันทึ่ 28 พฤษภาคม 2567 หมู่ 4 บ้านน้ำแคะ
วันที่ 29 พฤษภาคม 2567 หมู่ 7 บ้านสว้า
วันที่ 31 พฤษภาคม 2567 หมู่ 1 บ้านสะปัน
วันที่ 18 มิถุนายน 2567 หมู่ที่ 5
บุญบั้งไฟ เมืองสรวง ร้อยเอ็ด 29 พ.ค. - 4 มิ.ย. 66
บุญบั้งไฟ เมืองสรวง ร้อยเอ็ด 29 พ.ค. - 4 มิ.ย. 66 บริเวณสนามโรงเรียนหน้าตลาด อ.เมืองสรวง จ.ร้อยเอ็ด ชมขบวนแห่ วันที่ 3 มิ.ย. และแข่งจุดบั้งไฟวันที่ 4 มิ.ย.
แผน 5.3 เพิ่มประสิทธิภาพ การเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ
ยังไม่มีรายละเอียด31 พฤษภาคม วันงดสูบบุหรี่โลก World No Tobacco Day
วันงดสูบบุหรี่โลกจัดขึ้นครั้งแรกในวันที่ 31 พฤษภาคม ค.ศ. 1988 โดยองค์การอนามัยโลก เนื่องจากเล็งเห็นอันตรายของบุหรี่ต่อสุขภาพ ของผู้สูบบุหรี่และผู้ไม่สูบบุหรี่แต่ได้รับควันบุหรี่ การจัดงานวันงดสูบบุหรี่โลกก็เพื่อกระตุ้นให้ผู้สูบบุหรี่เลิกสูบ ให้รัฐบาลชุมชนและประชากรโลก ตระหนักถึงความสำคัญและเข้าร่วมกิจกรรมและกระตุ้นให้รัฐบาลกำหนดนโยบาย/กฏหมายเพื่อควบคุมยาสูบ องค์การอนามัยโลกระบุชัดเจนว่า การสูบบุหรี่เป็นสาเหตุสำคัญของการป่วยและเสียชีวิตก่อนวัยอันควรที่สามารถป้องกันได้ และกำหนดให้ วันที่ 31 พฤษภาคม ของทุกปีเป็นวันงดสูบบุหรี่โลก (World No Tobacco Day) วันงดสูบบุหรี่โลกครั้งแรก ใช้คำขวัญ “บุหรี่หรือสุขภาพต้องเลือกสุขภาพ”
พยาบาลวิชาชีพระดับชำนาญ 2 ท่าน ให้การช่วยเหลือผู้บาดเจ็บที่ประสบอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ ใน จังหวัดมหาสารคาม LINK
31 พฤษภาคม 2566 เวลาประมาณ 07.55 น. พว.สิวาพร พานเมือง พยาบาลวิชาชีพระดับชำนาญการพิเศษ (ด้านการสอน) และ พว.วิไลลักษณ์ เผือกพันธ์ พยาบาลวิชาชีพระดับชำนาญการ (ด้านการสอน) สังกัดวิทยาลัยพยาบาลศรีมหาสารคาม คณะพยาบาลศาสตร์ สถาบันพระบรมราชชนก ได้ให้การช่วยเหลือผู้บาดเจ็บที่ประสบอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ ในเขตพื้นที่บ้านบ่อน้อย อำเภอเมือง จังหวัดมหาสารคาม โดยประเมินอาการผู้บาดเจ็บ ประเมินสัญญาณชีพ ช่วยห้ามเลือดที่แผล ดามแขนและขาด้วยไม้เพื่อป้องกันการบาดเจ็บเพิ่ม พร้อมทั้งประสาน 1669 เพื่อนำส่งผู้ป่วยไปรักษาต่อยังโรงพยาบาลมหาสารคามต่อไป
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.สิวาพร พานเมือง และ พว.วิไลลักษณ์ เผือกพันธ์ ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดีจนเป็นที่ประจักษ์ต่อสังคม
งาน Pet Play Park#2 31 พค - 2 มิย 67
งาน Pet Play Park#2 Lasalles Avenue 31 พค - 2 มิย ลาซาลอเวนิว 10.30-19.30 พบกับ Market สินค้า บริการ สัตว์เลี้ยงกว่า 20 ร้านค้าพร้อมทั้งกิจกรรมสนุกๆเอาใจ ลูกๆ 4 ขา และกระทบไหล่น้องอินฟูลแก๊ง เฟรนช์แสนน่ารัก
แผน 5.4 เพิ่มประสิทธิภาพการเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ
ยังไม่มีรายละเอียดรายชื่อศิลปินขึ้นเวที สัปดาห์ที่ 4 วันที่ 24-25 มีนาคม
วันศุกร์ที่ 24 มีนาคม 2566
เวทีชายหาดพัทยาเหนือ โค้งดุสิต (Main stage)
19.00 น. - 20.00 น. PAPER PLANES
20.15 น. - 21.15 น. GETSUNOVA
21.30 น. - 22.30 น. BIG ASS
22.45 น. - 23.45 น. SLOT MACHINE
วันเสาร์ที่ 25 มีนาคม 2566
เวทีชายหาดพัทยาเหนือ โค้งดุสิต (Main stage)
19.00 น. - 20.00 น. 1Mill x Fiixd & DJ T-Double E
20.15 น. - 21.15 น. OAT PRAMOTE
21.30 น. - 22.30 น. MAIYARAP
22.45 น. - 23.45 น. THAITANIUM
สอบถามข้อมูล โทร. สายด่วนเมืองพัทยา 1337
แผน 5.5 พัฒนานวัตกรรมการรักษาพยาบาล
แผน 5.4 พัฒนานวัตกรรมการรักษาพยาบาล มีจำนวน 3 โครงการ งบประมาณ 10 ล้านบาท ได้แก่
1. กิจกรรมการเปิดให้บริการ UMSC ในโรงพยาบาลสังกัดสำนักการแพทย์ เป้าหมายเพื่อเป็น ศูนย์สอบถามปัญหาสุขภาพ Call center จำนวนโรงพยาบาลที่เปิดให้บริการ UMSC 11 แห่ง ดำเนินการโดย สำนักการแพทย์ งบประมาณ 0 บาท
2. โครงการจัดตั้งคลินิกรักษ์หัวใจ โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ (**แทนศูนย์โรคไต โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ เนื่องจากรอตึกใหม่โดยเริ่มก่อสร้าง ปี 2567) เป้าหมาย คือ จัดตั้งเป็น Excellent center และ ศูนย์เวชศาสตร์เขตเมือง (คลินิกรักษ์หัวใจ และ IMC รพ.หลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ) จำนวน 2 ศูนย์ ดำเนินการโดย สำนักการแพทย์ งบประมาณ 10 ล้านบาท
3. โครงการจัดตั้งศูนย์บริบาลผู้ป่วยระยะฟื้นฟู (Intermediate Care : IMC) (โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ) (งบประมาณทั้งสิ้น 12,403,203.- บาท) (เงินนอกงบประมาณ) เป้าหมายเพื่อ จำนวน Excellent center และ ศูนย์เวชศาสตร์เขตเมือง (คลินิกรักษ์หัวใจ และ IMC รพ.หลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ) รวมจำนวน 2 ศูนย์ ดำเนินการโดย สำนักการแพทย์ งบประมาณ 0 บาท
46 จังหวัด ที่ต้องกักตัว ผู้เดินทางมาจากนอกพื้นที่ (21 เมย 64) LINK
ภาคเหนือ 14 จังหวัด • เชียงใหม่ ตาก นครสวรรค์ น่าน พะเยา พิจิตร พิษณุโลก เพชรบูรณ์ แพร่ ลำพูน ลำปาง สุโขทัย อุตรดิตถ์ อุทัยธานี
ภาคจะวันออกเฉียงเหนือ 15 จังหวัด • ขอนแก่น ชัยภูมิ นครพนม บึงกาฬ บุรีรัมย์ มหาสารคาม มุกดาหาร ยโสธร สกลนคร สุรินทร์ หนองคาย หนองบัวลำภู อำนาจเจริญ อุดรธานี อุบลราชธานี
ภาคกลาง/ตะวันออก/ตะวันตก 5 จังหวัด • ชัยนาท นครนายก ประจวบฯ ลพบุรี สิงห์บุรี
ภาคใต้ 12 จังหวัด • กระบี่ ชุมพร ตรัง นครศรีธรรมราช นราธิวาส ปัตตานี พังงา พัทลุง ระนอง สงขลา สตูล สุราษฎร์ธานี
คำแนะนำและประเด็นต่างๆ ดังนี้
สถานการณ์ 29 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 1,871 ราย
ผู้ป่วยยืนยันสะสม 63,570 ราย
หายป่วยแล้ว 35,394 ราย
เสียชีวิตสะสม 188 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 28 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 1,344,646 โดส
แจ้งเข้าระบบรักษาตัวที่บ้าน
รูปแบบการท่องเที่ยวที่จะเปลี่ยนไปใน 3 สไตล์
โรงพยาบาลศูนย์และโรงพยาบาลทั่วไปในชัยภูมิ
ติดต่อขอรับการตรวจได้ที่โรงพยาบาลศูนย์และโรงพยาบาลประจำอำเภอ ดังนี้
*ขอความร่วมมือแจ้งประวัติเสี่ยงและอาการก่อนเดินทางไปโรงพยาบาล
โรงพยาบาลชัยภูมิ
044-811016
โรงพยาบาลเกษตรสมบูรณ์
044-869137
โรงพยาบาลแก้งคร้อ
044-882741
โรงพยาบาลคอนสวรรค์
044-889022
โรงพยาบาลคอนสาร
044-876324
โรงพยาบาลจัตุรัส
044-851499
โรงพยาบาลซับใหญ่
044-056-196
โรงพยาบาลเทพสถิต
044-855097
โรงพยาบาลเนินสง่า
044-846252
โรงพยาบาลบ้านเขว้า
044-891124
โรงพยาบาลบ้านแท่น
044-887013
โรงพยาบาลบำเหน็จณรงค์
044-859099
โรงพยาบาลภักดีชุมพล
044-133100
โรงพยาบาลภูเขียวเฉลิมพระเกียรติ ชัยภูมิ
044-861700
โรงพยาบาลหนองบัวแดง
044-872382
โรงพยาบาลหนองบัวระเหว
044-097022
อบจ.ปทุมธานี เปิดรับลงทะเบียนวัคซีนโมเดอร์นาเข็มที่ 3 LINK
อบจ.ปทุมธานี เปิดรับลงทะเบียนวัคซีนโมเดอร์นาเข็มที่ 3 (รอบที่ 2) วันนี้ (29 พ.ย. 64) เวลา 10.00 น. เป็นต้นไป สามารถลงทะเบียนเพื่อขอรับวัคซีนได้ ผ่านทาง Line Official Account ของ อบจ.ปทุมธานี
เงื่อนไขการลงทะเบียน
1. บุคคลสัญชาติไทย ผู้มีอายุ 18 ปี ขึ้นไป
2. บุคคลผู้มีชื่ออยู่ในทะเบียนบ้านเขตจังหวัดปทุมธานี
3. ได้รับวัคซีนซิโนฟาร์ม (Sinopharm) หรือวัคซีนซิโนแวค (Sinovac) ชนิดเดียวกัน ทั้งเข็มที่ 1 และ 2 มาแล้วไม่น้อยกว่า 60 วัน
4. ผู้ได้รับวัคซีนสูตรไขว้ หรือวัคซีนอื่นตามข้อ 3 ไม่สามารถลงทะเบียนเพื่อรับวัคซีนได้ โดยเป็นไปตามเกณฑ์ที่สภากาชาดไทยกำหนด
* วัคซีนโดย อบจ.ปทุมธานี ฉีดให้กับทุกท่าน โดยไม่มีการเสียค่าใช้จ่ายใดๆ ทั้งสิ้น
อบจ.ปทุมธานี ได้รับจัดสรรวัคซีนโมเดอร์นาจากสภากาชาดไทย เดือนละ 1 ครั้ง ในปริมาณที่จำกัด จึงส่งผลต่อปริมาณที่เปิดรับเพื่อลงทะเบียน ส่งผลให้ไม่เพียงพอต่อความต้องการของประชาชน
จุดฉีดวัคซีน รพ.หนองคาย ธันวาคม 64 LINK
เฉพาะเสาร์-อาทิตย์ ตลอดธันวาคม 64
อำเภอเมืองย้ายมาฉีดวัคซีนโควิดที่ รพ.หนองคาย
หน้าห้องตรวจศัลยกรรมชั้น 1 อาคารเมตตาบารมี พระอนาลโย หลวงปู่ขาว
บริการฉีดให้ทุกกลุ่มอายุ
อบจ.งดฉีดวันหยุดราชการ
รพ.ในจังหวัดกาฬสินธุ์
รพ.กาฬสินธุ์ 043-811020
Website |
แผนที่
รพ.ชุมชน (อำเภอ) ในกาฬสินธุ์
รพ.เอกชนในกาฬสินธุ์
นพ.สสจ.สุรินทร์ แถลงกรณีโอมิครอนในสามีภรรยาจากเดนมาร์ค ไม่เกี่ยวกับงานช้าง LINK
นพ.สสจ.สุรินทร์ แถลงรายละเอียดผู้ติดเชื้อโอมิครอน กรณีชาวเดนมาร์ค ไม่เกี่ยวกับงานช้าง โดยทั้งสองราย มีไทม์ไลน์ดังนี้
16 ธ.ค. เดินทางถึงประเทศไทย ตรวจ PCR ทันที ณ สนามบินสุวรรณภูมิ เข้าพักที่ รร.แกรนด์ เซ็นเตอร์พอยต์ เทอมินัล 21 พร้อมลูกชาย 1 โดยรถของโรงแรม
17 ธ.ค. แจ้งผลตรวจครั้งที่ 1 ไม่พบเชื้อ ผลตรวจลูกชาย ไม่พบเชื้อ
18 ธ.ค. เดินทางจาก กทม. มาถึง อ.กาบเชิง ช่วงเย็นกินข้าวกับญาติ
23 ธ.ค. พาหลานชายไปรพ.เอกชน อ.เมือง สุรินทร์ เนื่องจากมีอาการไข้ ไอ เจ็บคอ ผลตรวจพบเชื้อโควิด
24 ธ.ค. เข้ารักษาที่รพ.กาบเชิง พร้อมส่งตรวจพันธุกรรมหาโอไมครอน เวลา 24 น. รพ.สมิติเวช กรุงเทพนำรถเข้ารับไปรักษา
25 ธ.ค. รพ.กาบเชิง ยืนยันผลตรวจพบโอมิครอน
นพ.ยืนยันว่า ทั้งสองสามี-ภรรยา ไม่เกี่ยวกับงานช้างแฟร์ ไม่ได้ไปชมงาน
6.การเก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลส่วนบุคคล
SPACE TIME ร้านขายกัญชาย่านบางนา LINK
เดินเข้ามาในร้านเจอการตกแต่งร้านธีมอวกาศสวยงามอลังการมาก ซึ่งภายในร้านจะมีกัญชาให้เลือก 15-20 ชนิด บ้องกัญชามากกว่า 100 แบบ และอุปกรณ์เสริมต่างๆ อีกมากมาย ที่สำคัญพนักงานที่นี่ตอบคำถามและให้คำแนะนำได้ดีมากๆ
6 พ.ย. 65 กัญชาทางการแพทย์
กัญชาทางการแพทย์
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมว.สธ.กล่าวว่า การดำเนินงานกัญชาทางการแพทย์ ปีงบประมาณ 2565 เน้น 4 ประเด็นหลัก ได้แก่ การเข้าถึงยากัญชาที่มีคุณภาพของผู้ป่วย, การพัฒนาวิจัยและนวัตกรรม, การคุ้มครองผู้บริโภค และการปกป้องกลุ่มเปราะบาง ซึ่งผลการดำเนินงานเป็นไปตามเป้าหมาย ส่วนในปีงบประมาณ 2566 จะเพิ่มเติมอีก 2 ประเด็น คือสร้างความรอบรู้ด้านกัญชา และการบังคับใช้กฎหมายให้มีประสิทธิภาพ โดยแผนพัฒนาระบบบริการสุขภาพ (Service Plan) สาขากัญชา เขตสุขภาพ สถาบันกัญชาทางการแพทย์ กองบริหารการสาธารณสุข และกรมวิชาการ คือ กรมการแพทย์ กรมการแพทย์แผนไทยและการแพทย์ทางเลือก และกรมสุขภาพจิต จะร่วมกันทำวิจัยเพื่อขยายกลุ่มโรค และเสนอเข้าสู่สิทธิประโยชน์หลักประกันสุขภาพ เพื่อให้ผู้ป่วยเข้าถึงยามากขึ้นและไม่เสียค่าใช้จ่าย เช่น กรมการแพทย์จัดตั้งศูนย์วิจัยกัญชาทางการแพทย์ระหว่างประเทศ มีการลงนามความร่วมมือกับเนเธอร์แลนด์แล้ว กำลังหารือร่วมกับมาเลเซีย ส่วนกรมการแพทย์แผนไทยฯ จะวิจัยกัญชาทางการแพทย์แผนไทย เพื่อสนับสนุนการใช้โดยเฉพาะในหน่วยปฐมภูมิ และจะปรับสถานะน้ำมันกัญชาสูตรอาจารย์เดชาในบัญชียาหลักแห่งชาติด้านสมุนไพร จากบัญชี 3 รายการยาสำหรับโครงการพิเศษของหน่วยงานรัฐมาเป็นบัญชี 1 รายการยาที่ใช้ในการป้องกันและแก้ไขปัญหาสุขภาพ เพื่อให้สามารถสั่งจ่ายได้กว้างขวางมากยิ่งขึ้น เนื่องจากที่ผ่านมาพบว่าใช้ได้ผลดี
ร่าง พ.ร.บ.กัญชา กัญชง
- นพ.บัญญัติ เจตนจันทร์ ส.ส.ระยอง พรรคประชาธิปัตย์ ยืนยันว่า พรรคประชาธิปัตย์ มีจุดยืนเรื่องการส่งเสริมกัญชาทางการแพทย์มาโดยตลอด เมื่อปี 63 สภามีการพิจารณารายงานของคณะกรรมาธิการวิสามัญพิจารณาศึกษาหาแนวทางการแก้ไขปัญหาเกี่ยวกับการใช้กัญชา กัญชง และกระท่อมอย่างเป็นระบบ ซึ่งคณะกมธ.ได้จัดทำรายงานและข้อสังเกตเสนอต่อสภาผู้แทนราษฎร กระทั่งสภาผู้แทนราษฎรเห็นชอบให้สามารถนำกัญชา กัญชง และกระท่อม มาในประโยชน์ทางการแพทย์และมีข้อสังเกตท้ายรายงาน ให้รัฐบาลเสนอ "ร่าง พ.ร.บ. พืชควบคุมเพื่อประโยชน์ทางการแพทย์ พ.ศ. .... " ด้วย แต่ปรากฎว่าทางผู้เสนอร่างกฎหมายกัญชาในครั้งนี้ ไม่เสนอร่างพ.ร.บ. ตามข้อสังเกตในรายงานฉบับดังกล่าว กลับเสนอ "ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. .... " แทน ซึ่งตนและพรรคประชาธิปัตย์มีความกังวลในหลายมาตรา
ก่อนปิดสมัยประชุม ในเดือนก.ย. 65 พรรคประชาธิปัตย์และสมาชิกสภาผู้แทนราษฎรก็มีมติเสียงข้างมากให้ กมธ.วิสามัญ ฯ ชุดนี้ถอนร่างไปทบทวนให้เป็นกฎหมายที่มีความถูกต้องสมบูรณ์ ไม่ไปทางกัญชาเสรีมากจนเกินไป และร่าง พ.ร.บ.มีการแก้ไขเพิ่มเติมจากร่างที่ผ่านความเห็นชอบในวาระ 1 อย่างมาก ซึ่งพรรคประชาธิปัตย์ได้เสนอให้คณะ กมธ. วิสามัญ ฯ ชุดนี้นำไปปรับปรุงถึง 13 ประเด็น แต่คณะกมธ. วิสามัญ ฯ ชุดนี้กลับยืนยันร่างเดิมทุกมาตรา โดยไม่มีการทบทวนแต่อย่างใด กัญชาแม้ไม่ใช่ยาเสพติดให้โทษตามนิยามของรมว.สธ.คนปัจจุบัน แต่ทางการแพทย์ทั่วโลกก็ยังจัดกัญชาเป็น "สารเสพติด" หากปล่อยให้มีการใช้กัญชาอย่างเสรี ระยะยาวจะส่งผลให้เกิดโทษและพิษภัยต่อสมองของประชาชน ดังนี้ ระยะที่ 1 สารเสพติดจะทำลายสมองส่วนควบคุมสติปัญญาและเหตุผล ระยะที่ 2 สารเสพติดจะทำลายสมองส่วนควบคุมอารมณ์ ระยะที่ 3 เมื่อสมองถูกทำลายในระยะที่ 1 และระยะที่ 2 สมองจะเหลือแต่ส่วนสัญชาตญาณที่ขาดการควบคุม ขาดการยับยั้งชั่งใจ ขาดเมตตา เป็นอันตรายต่อร่างกาย จิตใจ สังคม และจิตวิญญาณความเป็นมนุษย์
3 ตุลาคม 2565 เป็นวันนำเสนอผลงานและตัดสิน และผลการตัดสินมีดังนี้
รับมือวิกฤตโควิด ถล่มสมุทรปราการ
"ต่อด้วยโควิดกระหน่ำโลก โรงพยาบาลสมุทรปราการเราเปิด Cohort ward มากกว่า10 ward รับคนไข้ ใน ปกติเกือบ 600 เตียงเป็นเกือบ 800 เตียง เปิดโรงพยาบาลสนามและ Hospitel รวม 9 แห่งรับคนไข้ช่วงพีคๆเฉลี่ยเกือบ 3000 คนต่อวัน เหนื่อยแทนน้องๆ ทั้งหมอ พยาบาลและทุกๆคนเลยหล่ะครับ
อ้อ! ต้องขอบคุณผู้บริจาคของ ทุกคนที่มาร่วมบริจาคเงิน ข้าวของ กันอย่างมากมายด้วยครับ ขอบคุณสถาบันราชภัฏธนบุรี สมุทรปราการ และคุณจูน WHA เอื้อเฟื้อสถานที่ครับ"
/// รายชื่อศิลปินขึ้นเวที สัปดาห์ที่ 1 วันที่ 3-4 มีนาคม 3 เวที
รายชื่อศิลปินขึ้นเวที
สัปดาห์ที่ 1 วันที่ 3-4 มี.ค. 2566 จำนวน 3 เวที ณ ชายหาดพัทยา
เวที 1 (หลัก) ชายหาดโค้งดุสิต
เวที่ 2 ชายหาดซอย 6
เวที 3 หน้าร้านปลาทอง พัทยากลาง
3 มีนาคม
- Tattoo Color
- Joey Phuwasit
- SLAPKISS
- Musketeers
เวที พัทยาเหนือ (ซอย 6)
- ไทรถแห่เต็มวง
- หญิงแย้ เจติยา
- เต้ย อภิวัฒน์
- หญิงลี ศรีจุมพล
เวที พัทยากลาง
- Dept
- Your Mood feat. MARC
- Moving and Cut
- สิงโต นำโชค
4 มีนาคม
เวที หลัก พัทยาเหนือ โค้งดุสิต
- พั้นช์ & ปราโมทย์
- เสือ ธนพล & NENG Y Not7
- Dome & James
- NUVO
เวที พัทยาเหนือ (ซอย 6)
- PROM+
- SCRUBB
- Stamp
- YOUNGOHM
เวที พัทยากลาง
รายชื่อศิลปินขึ้นเวที สัปดาห์ที่ 2 วันที่ 10-11 มีนาคม
วันศุกร์ที่ 10 มีนาคม
เวที ชายหาดจอมเทียน
19.00 น. - 20.00 น. คณะขวัญใจ
20.15 น. - 21.15 น. PALMY
21.30 น. - 22.30 น. PARADOX
22.45 น. - 23.45 น. LOMOSONIC
วันเสาร์ที่ 11 มีนาคม
เวที ชายหาดจอมเทียน
19.00 น. TXRBO & BEAR KNUCKLE
20.15 น. BOOM BOOM CASH
21.30 น. TILLY BIRD
22.45 น. COCKTAIL
เขตคลองเตย LINK
สำนักงานเขตคลองเตย ร่วมกับศูนย์บริการสาธารณสุข 10 สุขุมวิท ศูนย์บริการสาธารณสุข 41 คลองเตย ให้ บริการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์
ครั้งที่ 1 ประจำปี 2566
วันที่ 13 มีนาคม - 25 เมษายน 2566
โดยให้บริการตั้งแต่เวลา 10.00-12.00 น.
ฟรี!!! ไม่มีค่าใช้จ่าย
ตรวจสุขภาพประจำปี ศูนย์การแพทย์กาญจนาภิเษก LINK
โปรแกรม A (อายุน้อยกว่า 35 ปี) 1,315 / 1,870 (นอกเวลา)
โปรแกรม B (อายุมากกว่า 35 ปี) 1,640 / 2,195 (นอกเวลา)
โปรแกรม C (อายุมากกว่า 50 ปี) ชาย 2,070 / 2,625 (นอกเวลา) หญิง 1,740 / 2,295 (นอกเวลา)
โปรแกรม D (คู่สมรส) ชาย 2,2020 / 2,575 (นอกเวลา) หญิง 2,240 / 2,795 (นอกเวลา)
เวลาทำการ
วันจันทร์ – วันศุกร์ เวลา 07.00–16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
คลินิกพิเศษวันเสาร์ (ทุกเสาร์) เวลา 07.30-12.00 น.
คลินิกพิเศษวันอาทิตย์(สัปดาห์ที่1,2,3) เวลา 07.30-12.00 น.
สอบถามเพิ่มเติมโทร 02-8496600 ต่อ 3004-3005(วันจันทร์ – วันศุกร์ 13.00-15.00น.)
ความเต็มใจที่จะจ่ายเพื่อสุขภาพและความเป็นอยู่ที่ดี
เนื่องจากผู้บริโภคในภูมิภาคเอเชียแปซิฟิกมีความใส่ใจในสุขภาพมากขึ้น จึงไม่น่าแปลกใจที่ผู้บริโภคจำนวนมาก (72%) ยินดีที่จะจ่ายเพิ่มในส่วนที่เกี่ยวข้องกับสุขภาพและความเป็นอยู่ที่ดี โดยเฉพาะอย่างยิ่งผู้บริโภคในเวียดนาม (95%), ฟิลิปปินส์ (90%), อินโดนีเซีย (86%) และไต้หวัน (85%) โดยข้อมูลเฉลี่ยระบุว่า
- 56% ยินดีจ่ายเพิ่ม 1% - 10%
- 31% ยินดีจ่ายเพิ่ม 11% - 20%
- 13% ยินดีจ่ายเพิ่มอย่างน้อย 20%
ข้อมูลดังกล่าวแสดงให้เห็นว่าผู้ตอบแบบสำรวจตระหนักถึงความสำคัญของการลงทุนด้านสุขภาพ พร้อมกับแบ่งปันข้อมูลว่ายินดีจ่ายเพิ่มเพื่อ
- เลือกรับประทานอาหารที่ดีต่อสุขภาพมากขึ้น (65%)
- ซื้อ/บริโภคผลิตภัณฑ์เสริมอาหาร (52%)
- ตรวจสุขภาพเป็นประจำ (48%)
- ปรึกษาผู้เชี่ยวชาญเพื่อขอคำแนะนำ (28%)
- ขอคำปรึกษาด้านสุขภาพจิต (25%)
ผลสำรวจนี้แสดงให้เห็นอย่างชัดเจนว่า ผู้คนทั่วทั้งภูมิภาคยกย่องว่าโภชนาการมีบทบาทสำคัญต่อการรักษาสุขภาพและกำลังวังชาในระยะยาว
คลินิกพิเศษนอกเวลาระดับรพ.ศูนย์ ภาคเหนือ
ศูนย์ฝึกอบรมปฐมพยาบาลฯ สภากาชาดไทย จัดอบรม ฟรี 22 มิถุนายน 2566 LINK
ศูนย์ฝึกอบรมปฐมพยาบาลฯ สภากาชาดไทย เปิดรับสมัครเข้ารับการอบรม หลักสูตร “การช่วยชีวิตขั้นพื้นฐาน” Basic Life Support ( แบบผสมผสาน ) สำหรับประชาชนทั่วไป รุ่นที่ 7 รับสมัครรุ่นละ 30 คน สมัครผ่านระบบ Learning Platform สภากาชาดไทย ( WISIMO )
• เปิดรับสมัคร วันที่ 6 – 15 มิถุนายน 2566
• เรียน Online วันที่ 6 – 21 มิถุนายน 2566 ( ผ่านระบบ WISIMO ด้วยตัวเอง )
• เรียน Onsite วันที่ 22 มิถุนายน 2566 ( ณ สภากาชาดไทย )
ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย
1871 อาคารเฉลิม บูรณะนนท์ ชั้น 2 เลขที่ 1871 ถนนอังรีดูนังต์ แขวงวังใหม่ เขตปทุมวัน กรุงเทพมหานคร 10330
โทร 02-2564041 02-2564042 กด 2 , 02 - 253 - 4803 , 083 - 029 - 9280
ปฏิทินท่องเที่ยวงาน Food Fair จันทบุรี เดือนมิถุนายน - กรกฎาคม 2566
ปฏิทินท่องเที่ยวงาน Food Fair จันทบุรี เดือนมิถุนายน - กรกฎาคม 2566
งาน " ฟู้ดติดดาว " ระหว่างวันที่ 29 มิ.ย. - 5 ก.ค. 2566 เทสโก้โลตัส จันทบุรี
โลตัส ร่วมกับ การท่องเที่ยวแห่งประเทศไทย (ททท.) จัดงาน “ฟู้ดติดดาว” ขนขบวนพันธมิตรร้านอาหารระดับมิชลิน และร้านสตรีทฟู้ดชื่อดัง มาจัดโรดโชว์ออกบูธจำหน่ายอาหาร ในโลตัสสาขาพิเศษ เปิดประสบการณ์แบบ Amazing Thailand สัมผัสรสชาติความอร่อยหลากสไตล์ของคนไทย
งาน " ถนนคนเดิน ครั้งที่ 8 " ระหว่างวันที่ 9-18 มิถุนายน 2566
บริเวณสุขุมวิท ถนนเทศบาลสาย7 อ.ขลุง จ.จันทบุรี
งาน " จันทเขลม Food Fair " ระหว่างวันที่ 10-18 มิถุนายน 2566
ลานอเนกประสงค์จันทเขลม อ.คิชฌกูฏ จ.จันทบุรี
" เทศกาลอาหาร ครั้งที่ 1 " ระหว่างวันที่ 23 มิ.ย. - 2 ก.ค. 2566
มหาวิทยาลัยราชภัฏรำไพพรรณี จันทบุรี
งาน " ของดีเมืองจันท์ " ระหว่างวันที่ 7-16 กรกฎาคม 2566
สนามทุ่งนาเชย จ.จันทบุรี
ปฏิทินท่องเที่ยวจันทบุรีเดือนมิถุนายน 2566
เชิญพบกับงาน " สบายใจสไตล์จันท์ "
พร้อมเวทีแห่งความสุข ศิลปินสุดจี๊ด
ระหว่างวันที่ 3-5 มิถุนายน 2566
วันที่ 1 GETSUNOVA และ ONEONE
วันที่ 2 PARADOX , SLAPKISS
วันที่ 3 URBOYTJ , PRETZELLE
ณ สนามสามเหลี่ยม (ทุ่งนาเชย) อ.เมือง จ.จันทบุรี
ขอเชิญเที่ยวงาน " ถนนคนเดิน ครั้งที่ 8 "
ระหว่างวันที่ 9-18 มิถุนายน 2566
ณ บริเวณสุขุมวิท ถนนเทศบาลสาย7 อ.ขลุง จ.จันทบุรี
ขอเชิญร่วมกิจกรรม Run Fun Fruit " วิ่งเข้าสวน ชวนกินผลไม้ "
ระหว่างวันที่ 3 มิถุนายน 2566
ณ องค์การบริหารส่วนจังหวัดจันทบุรี
ขอเชิญร่วมกิจกรรม Pongnamron
Run-To-Give โป่งน้ำร้อน
" วิ่ง ปัน สุข "
ในวันที่ 18 มิถุนายน 2566
ณ ชายแดนไทย-กัมพูชา (ตลาดบ้านแหลม)
ขอเชิญเที่ยวงาน " ของดีเมืองจันท์ "
ในวันที่ 30 มิถุนายน - 9 กรกฎาคม 2566
ณ สนามทุ่งนาเชย
วันที่ 28-30 มิถุนายน 2566 สัมมนาวิชาการนานาชาติ เรื่อง กัญชา กัญชง MEDICAL CANNABIS & GACP THAILAND
สัมมนาวิชาการนานาชาติ เรื่อง กัญชา กัญชง MEDICAL CANNABIS & GACP THAILAND "the International Medical Cannabis Conference" วันที่ 28-30 มิถุนายน 2566 เวลา 10.00 - 16.00 น. ณ ห้อง Phoenix 1-2 ฮอลล์ 11-12 อิมแพค เมืองทองธานี . ลงทะเบียนฟรี >>
https://bit.ly/45EPpR2 ***CME 10.5 หน่วยคะแนน สำหรับแพทย์เท่านั้น
ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day4] วันที่ 30 มิถุนายน
ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day4] วันที่สี่ 30 มิถุนายน วันแข่งขันวันแรก ทุกคันอัดกันแบบเต็มๆไม่มียั้งเพื่อพุ่งเข้าเส้นชัย สาว race queen ตื่นตามากกก ผู้ชมกองเชียร์ก็เต็มที่เหมือนกัน ชมภาพเต็มอิ่มที่ Thailand Super Series
สถานีกรุงเทพ หัวลำโพง มีประวัติศาสตร์นานมา แรกสถาปนาเมื่อ 2453
สถานีรถไฟกรุงเทพ (หัวลำโพง) หรือ สถานีรถไฟกรุงเทพ เป็นสถานีรถไฟหลักของประเทศไทย และเป็นสถานีที่เก่าแก่ที่สุด เริ่มก่อสร้างขึ้นในปลายรัชสมัยพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว ในปี พ.ศ. 2453 สร้างเสร็จและเปิดใช้งานเมื่อวันที่ 25 มิถุนายน พ.ศ. 2459 ในรัชสมัยพระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว ปัจจุบันสามารถเชื่อมต่อกับรถไฟฟ้ามหานคร สายเฉลิมรัชมงคล ได้บริเวณถนนพระรามที่ 4 โดยมีรูปแบบของทางเชื่อมต่อทางสถาปัตยกรรมที่กลมกลืนกับรถไฟฟ้ามหานคร
สถานีกรุงเทพก่อสร้างในลักษณะโดมสไตล์อิตาเลียนผสมกับศิลปะแบบเรอเนสซองซ์ คล้ายกับสถานีรถไฟแฟรงก์เฟิร์ตในประเทศเยอรมนี ประดับด้วยหินอ่อนและเพดานมีการสลักลายนูนต่าง ๆ เป็นหลัก โดยมีนาฬิกาขนาดใหญ่รัศมี 80 เซนติเมตร ตั้งอยู่กลางสถานีรถไฟเป็นสัญลักษณ์แห่งหนึ่ง
ก่อนปี พ.ศ. 2566 สถานีกรุงเทพเคยมีรถไฟกว่า 100 ขบวนต่อวัน โดยมีผู้โดยสารที่มาใช้บริการที่สถานีกรุงเทพหลายหมื่นคน (ข้อมูลในปี พ.ศ. 2561) และโดยเฉพาะช่วงวันสำคัญและวันหยุดเนื่องในเทศกาลต่าง ๆ ของไทย เช่น วันขึ้นปีใหม่ วันสงกรานต์ จะมีผู้โดยสารเป็นจำนวนมาก
ปัจจุบันมีเพียงรถไฟทางไกลขบวนรถธรรมดา รถชานเมือง และรถนำเที่ยวจำนวน 62 ขบวนเท่านั้น ที่ยังคงเริ่มต้นให้บริการที่สถานีกรุงเทพ ส่วนขบวนรถเร็ว รถด่วน และรถด่วนพิเศษ รวมจำนวน 52 ขบวน ได้ย้ายไปเริ่มต้นให้บริการที่สถานีกลางกรุงเทพอภิวัฒน์ (สถานีกลางบางซื่อ) ตั้งแต่ช่วงบ่ายของวันที่ 19 มกราคม พ.ศ. 2566
สถานีนี้เริ่มสร้างในรัชสมัยรัชกาลที่ 5 ในปี พ.ศ. 2453 สร้างเสร็จและเริ่มใช้งานเมื่อวันที่ 25 มิถุนายน พ.ศ. 2459 ในรัชสมัยรัชกาลที่ 6 สถานีรถไฟกรุงเทพ เดิมเป็นสถานีที่ให้บริการทั้งด้านการขนส่งสินค้า และขนส่งมวลชน ต่อมาการขยายตัวในด้านการโดยสารและขนส่งสินค้ามีมากขึ้น แต่ด้วยพื้นที่อันจำกัดเพียง 120 ไร่ จึงทำให้ต้องย้ายกิจการขนส่งสินค้าไปอยู่ที่ย่านสินค้าพหลโยธิน ตั้งแต่ปี พ.ศ. 2503 และทำการปรับปรุงสถานีรถไฟกรุงเทพให้เป็นสถานีรถไฟสำหรับบริการด้านขนส่งมวลชนเพียงอย่างเดียว เพื่อสามารถรองรับผู้โดยสารจากทั่วทุกสารทิศของประเทศ
มิถุนายน 2566 ปศุสัตว์จังหวัดนนทบุรี ผลการดำเนินงาน ทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
ครอบครัวปศุสัตว์นนทบุรี นำโดย นายสัตวแพทย์ไทยวิวัฒน์ วรรณสุข ปศุสัตว์จังหวัดนนทบุรี พร้อมด้วย กลุ่มพัฒนาสุขภาพสัตว์ กลุ่มงานทุกกลุ่มงาน สำนักงานปศุสัตว์อำเภอทุกอำเภอ ข้าราชการ พนักงานราชการ พนักงานจ้างเหมา และอาสาจ้างเหมาช่วยงานด้านสัตวแพทย์ ร่วมกับ องค์กรปกครองส่วนท้องถิ่น ลงพื้นที่ปฏิบัติงานออกหน่วยสัตวแพทย์เคลื่อนที่ ภายใต้แผนยุทธศาสตร์การดำเนินโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธานศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี ผลการดำเนินงานในเดือนมิถุนายน 2566 จำนวน 3 ครั้ง ดังนี้
- ผ่าตัดทำหมัน สุนัข 28 ตัว ผ่าตัดทำหมัน แมว 240 ตัว รวม จำนวน 268 ตัว
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัข จำนวน 45 ตัว แมว จำนวน 275 ตัว
รวมทั้งสิ้น 320 ตัว มีผู้เข้ารับบริการ จำนวน 153 ราย
ทั้งนี้ได้ทำการให้ความรู้แนะนำกับผู้เข้ารับบริการให้การดูแลสัตว์หลังการผ่าตัดทำหมัน ณ สถานที่ของทั้ง 3 อำเภอในจังหวัดนนทบุรี ติดต่อสอบถามที่เบอร์025950992 ต่อ13 นะคะ ในวันและเวลาราชการ
14 ต.ค.66 แบบสอบถามความประสงค์การขอขึ้นเครื่องบินอพยพเพื่อเดินทางกลับไทยของแรงงานไทยในอิสราเอล
สถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ ขอเรียนว่า การอพยพเดินทางกลับประเทศไทยอาจส่งผลกระทบต่อสิทธิประโยชน์ที่ท่านได้รับ และความเป็นไปได้ของการเดินทางกลับไปทำงานที่อิสราเอล
ผู้ที่ประสงค์ขอขึ้นเครื่องบินอพยพเพื่อเดินทางกลับไทย
กรุณากรอกแบบสอบถาม โดยตอบคำถามทุกข้อ
คลิปแนะนำโครงการ การลงทะเบียนและสิทธิประโยชน์ จัดทำโดยสสจ.แพร่ LINK
สำนักงานสาธารณสุขจังหวัดแพร่ คลิปแนะนำโครงการและเชิญชวนชาวแพร่ ร่วมลงทะเบียนพิสูจน์และยืนยัน Health ID ผ่านระบบหมอพร้อม DID ด้วยบัตรประจำตัวประชาชน และโทรศัพท์มือถือที่ติดตั้งแอพพลิเคชั่น "หมอพร้อม"ได้ที่ ศูนย์ราชการสะดวก สสจ.แพร่ รพ.ของรัฐทุกแห่ง รพ.สต. และ สสอ.ทุกแห่ง ในวันเวลาทำการ จันทร์-ศุกร์ 8.30-16.30 น. เว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์
รพ.บางละมุง อ.บางละมุง จ.ชลบุรี
รพ.บางละมุง เป็นรพ.ชุมชนระดับอำเภอ ขนาดใหญ่ ตั้งอยู่ที่ 669 หมู่ 5 ต.นาเกลือ อ.บางละมุง จ.ชลบุรี 20150 โทร 038 429 244 รพ.บางละมุง ยกระดับขึ้นมาให้บริการผู้ประกันตนในปี 2567 เป็นปีแรก รองรับการขยายตัวตามจำนวนผู้ประกันตนที่ทำงานในพื้นที่ อ.บางละมุง และอ.ใกล้เคียงที่เพิ่มมากขึ้น โดยเฉพาะพื้นที่ พัทยา ที่เติบโตขึ้นมาก
Infographic ปัญหาการฆ่าตัวตาย สัญญาณ และทางออก
ภาพ Infographic จากกรมสุขภาพจิต เกี่ยวกับสถานการณ์ปัญหาการฆ่าตัวตาย การสังเกตผู้ที่อาจเสี่ยงฆ่าตัวตาย วิธีเลี่ยง
นานาเสียงสะท้อนจากมุมมองแพทย์
เงื่อนไขและช่องทางการลงทะเบียน รับบริการ ทำหมัน หมาแมว
เงื่อนไขการลงทะเบียน รับบริการ ทำหมัน หมาแมว ตามระบุในภาพ ผ่าน 2 ช่องทาง
1) ทางโทร. 034-242199 และ 034-966440 , 034-966441 , 034-966442 , 034-966443 , 034-966444 (ต่อ 21) ในเวลาราชการ 9-15 น. เว้นวันหยุดราชการ
2) สแกน QR Code ตามภาพได้เลย
ชาวนครปฐม สามารถติดตามประกาศการบริการทำหมันหมาแมวในพื้นที่ ได้จากเพจ
งานประชาสัมพันธ์ เทศบาลนครนครปฐม เพื่อได้ทราบกำหนดการและเงื่อนไขการรับบริการได้ อย่างทันสถานการณ์ (สอบถามโทร 034-966440 : สำนักงานเทศบาลนครนครปฐม 888 ทหารบก ตำบลบ่อพลับ อำเภอเมืองนครปฐม นครปฐม 73000)
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน มิถุนายน 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน มิถุนายน 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น** พื้นที่อื่นๆ รอ Update หรือโทรสอบถาม อบต./เทศบาล ในพื้นที่
กิจกรรมในปี 2567
เทศบาลเมืองกะทู้ ร่วมกับ กรมปศุสัตว์ จัดโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ประจำปีงบประมาณ พ.ศ. 2567 ออกหน่วยบริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และ ทำหมันสุนัขและแมว
ดนตรีในสวน มิถุนายน 2567
การแสดงดนตรีในงาน "BKK EXPO 2024" 20 - 23 มิถุนายน 2567 เวลา 18.00 - 20.00 น. ณ เวทีกลาง อาคารพิพิธภัณฑ์สวนป่าเบญจกิติ
วันพฤหัสบดีที่ 20 มิถุนายน 2567 พบกับ วง Goons จากโรงเรียนเตรียมอุดมดนตรีวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล (Young Artist Music Program, College of Music, Mahidol University) วง Untitled จากกลุ่มศิลปินเยาวนชน Good time (ไทม์)
วันศุกร์ที่ 21 มิถุนายน 2567 พบกับ วง D-Day วง Charisma วง Sopha Band
วันเสาร์ที่ 22 มิถุนายน 2567 พบกับ เก่ง ธัญลักษณ์ & มะเดี่ยว Rainyroom
วันอาทิตย์ที่ 23 มิถุนายน 2567 พบกับ Painkiller จากโรงเรียนสาธิต มศว ประสานมิตร (ฝ่ายมัธยม) Sourdough
อว. แถลงความพร้อม อว.แฟร์2024


10 กรกฎาคม 2567 ห้องอินฟินิตี้บอลรูม โรงแรมพูลแมน คิง เพาเวอร์ กรุงเทพ: นางสาวศุภมาส อิศรภักดี รัฐมนตรีว่าการกระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม(อว.) เป็นประธานแถลงข่าว การจัดมหกรรมส่งเสริมการใช้ประโยชน์ อววน. เพื่อการพัฒนาเศรษฐกิจไทยอย่างยั่งยืน ด้วยพลังสหวิทยาการ (อว.แฟร์ : SCI POWER FOR FUTURE THAILAND) หรืองาน “อว.แฟร์ 2024 ซึ่งจะจัดขึ้น ระหว่างวันที่ 22 – 28 กรกฎาคม 2567 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ ในโอกาสนี้นายเพิ่มสุข สัจจาภิวัฒน์ ปลัดกระทรวงอว. ศาสตราจารย์ ดร.ชูกิจ ลิมปิจำนงค์ ผู้อำนวยการสำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) คณะผู้บริหารเจ้าหน้าที่หน่วยงานภายใต้กระทรวง อว. ร่วมแถลงข่าว โดยงาน อว.แฟร์ 2024 ถือเป็นการผนึกกำลังเครือข่ายพันธมิตร ทั้งภาครัฐและภาคเอกชนเพื่อยกระดับทักษะองค์ความรู้ด้านวิทยาศาสตร์และนวัตกรรมแก่ประชาชนไทยให้มีมาตรฐานทัดเทียมนานาชาติ พร้อมแสดงศักยภาพของไทยในการพัฒนาเศรษฐกิจด้วยการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม ตลอดจนเป็นเวทีให้ผู้เข้าร่วมงานได้แลกเปลี่ยนความรู้และประสบการณ์ พร้อมทั้งสร้างความร่วมมือในด้านต่าง ๆ บนพื้นที่กว่า 23,000 ตารางเมตร กับนิทรรศการ 6 โซนไฮไลต์ ซึ่งผู้สนใจสามารถเข้าร่วมได้ฟรีตลอดงาน
นางสาวศุภมาส อิศรภักดี รัฐมนตรีว่าการกระทรวง อว. กล่าวว่า “ตลอดระยะเวลา 5 ปีของการก่อตั้งกระทรวง อว. เพื่อใหเป็นกระทรวงแห่งปัญญา โอกาส และอนาคต กระทรวง อว. ได้สร้างผลงานไว้มากมาย ทั้งการพัฒนากำลังคนระดับอุดมศึกษา การพัฒนาด้านวิทยาศาสตร์ วิจัย เทคโนโลยีและนวัตกรรม เมื่อดิฉันได้เข้ามารับตำแหน่งรัฐมนตรีว่าการกระทรวง อว. จึงได้ดำริให้มีการจัดงาน อว.แฟร์ ขึ้น เพื่อให้ประชาชนทั้งประเทศได้รับรู้ถึงผลงานของหน่วยงานในกระทรวง อว. ที่จะรวมพลังในการนำสหวิทยากรเพื่อสร้างการเปลี่ยนแปลง สร้างโอกาส และสร้างอนาคตใหม่ให้กับประเทศ โดยการจัดงาน อว.แฟร์ ดิฉันได้กำหนดให้มีการจัดงาน 2 ส่วน คือ ส่วนภูมิภาค และส่วนกลาง โดยการจัดงานในส่วนภูมิภาคได้ดำเนินการจัดกิจกรรมเดินสาย Roadshow แสดงศักยภาพขับเคลื่อนเศรษฐกิจไทยอย่างยั่งยืนใน 4 ภูมิภาค โดยภาคตะวันออกเฉียงเหนือ จัดที่จังหวัดมหาวิทยาลัยเทคโนโลยีสุรนารี จังหวัดนครราชสีมา ภาคเหนือ จัดที่มหาวิทยาลัยเชียงใหม่ จังหวัดเชียงใหม่ ภาคใต้จัดที่มหาวิทยาลัยวลัยลักษณ์ จังหวัดนครศรีธรรมราช และภาคกลาง/ภาคตะวันออก จัดที่มหาวิทยาลัยบูรพา จังหวัดชลบุรี โดยผลตอบรับของการจัดงาน อว.แฟร์ ระดับภูมิภาค ที่ผ่านมา มีประชาชนให้ความสนใจเข้าร่วมชมงานทั้ง Onsite และ Online ไม่น้อยกว่า 200,000 คน กระตุ้นให้เกิดการจับจ่ายใช้สอย ส่งผลต่อเศรษฐกิจในระดับภูมิภาคเติบโตขึ้น และสร้างมูลค่าทางเศรษฐกิจไม่น้อยกว่า 50 ล้านบาท
สำหรับงาน “อว.แฟร์ ส่วนกลาง” งานมหกรรมที่รวมสหวิทยาการทั้งด้านวิทยาศาสตร์ วิจัย เทคโนโลยีและนวัตกรรม การศึกษาที่มีคุณภาพ ด้าน Soft power ที่มีอยู่ในมหาวิทยาลัย หน่วยงานวิจัยมากกว่า 170 หน่วยงาน ครอบคลุมทั่วประเทศ ผู้เข้าชมงานจะได้พบกับกิจกรรมดี ๆ และสาระความรู้ที่ไม่ควรพลาด อาทิ นิทรรศการ 6 โซน ได้แก่ INSPIRED BY SCIENCE, SCIENCE FOR LIFELONG LEARNING, STARTUP LAUNCHPAD, SCIENCE FOR EXPONENTIAL GROWTH, SCIENCE FOR ALL-WELL BEING และ SCIENCE FOR FUTURE THAILAND โดยมีไฮไลต์เป็น ‘หินดวงจันทร์จากยานอวกาศฉางเอ๋อ 5’ ที่นำมาจัดแสดงนอกประเทศเป็นครั้งแรกในประเทศไทย เป็นสื่อสัมพันธไมตรีระหว่างสาธารณรัฐประชาชนจีนและประเทศไทย เครื่องเล่น VR สุดล้ำจากบริษัทผู้พัฒนาเกมออนไลน์รายใหญ่ของจีน การเฉลยข้อสอบ TCAS และการแนะแนวอาชีพในอนาคต บูธแสดงผลงานจากผู้ประกอบการและสตาร์ตอัป มากกว่า 300 บูธ ร่วมชม ช้อป ผลิตภัณฑ์ฐานงานวิจัยการันตีรางวัลจากหลายเวที ไม่ว่าจะเป็น อาหารนวัตกรรม ผลิตภัณฑ์เพื่อสุขภาพ (Functional Food) อาหารแห่งอนาคต (Future Food) เครื่องสำอาง และสินค้าที่พัฒนาจากวิทยาศาสตร์ งานวิจัย เทคโนโลยี นวัตกรรม และสินค้าด้าน Soft power โดยมีสินค้ามากกว่า 200 รายการ 20,000 กว่าชิ้น
นอกจากนี้ท่านจะได้พบกับการประกวดแข่งขันจากระดับภูมิภาคที่จะมาชิงชนะเลิศในระดับประเทศ ในงาน อว.แฟร์ เช่น e-sport แข่ง ROV Tournament ระดับประเทศ แข่งขัน Innovation Award 2024 และ MHESI Music Variety Award 2024 พร้อมกิจกรรมสาระความบันเทิงที่น่าสนใจมากมาย อาทิเช่น การบินโดรนแปรอักษรเทิดพระเกียรติ ขบวนพาเหรดมาสคอต ขบวนพาเหรดหุ่นยนต์ Live Commerce ขายสินค้าไทยโดยเหล่าอินฟลูเอนเซอร์ทั้งในและต่างประเทศ มินิคอนเสิร์ตจากศิลปินชื่อดัง อาทิ ซาร่าห์ ซาโรลา (Sarah Salola) อีทีซี (ETC) เปเปอร์ เพลนส์ (Paper Planes) เดอะทอยส์ (THE TOYS) ซีซันไฟฟ์ (Season Five) ปาล์มมี่ (PALMY) ตู่ ภพธร (Two Popetorn) และพลาดไม่ได้สำหรับท่านที่มาร่วมงาน อว.แฟร์ มีสิทธิ์ลุ้นรับรางวัลประจำวัน ได้แก่ จักรยานยนต์ EV วันละ 2 คัน และรางวัลสูงสุดเป็นรถกระบะ EV จำนวน 1 คัน พร้อมของรางวัลอื่น ๆ อีกมากกว่า 17,000 ชิ้น
สำหรับท่านที่ต้องการมาหาความรู้ด้านวิทยาศาสตร์ วิจัย เทคโนโลยีและนวัตกรรมใหม่ ๆ ภายใน อว.แฟร์ จัดให้มีกิจกรรมการมอบรางวัล การประชุม บรรยาย เสวนา Workshop ในหัวข้อที่น่าสนใจมากมาย เช่น มอบรางวัล Prime Minister Award 2024, การสัมมนา Innovation for Growth and Sustainability, การเสวนา Unicorn Talk , StartupAsia Report OECD, Deep Tech Startup Ecosystem in Montgomery County, Maryland, USA (Judy Costello), Global Innovation Club , สัมมนา Science for Exponential Growth: Tech to BiZ Thailand Tech Show 2024 การเสวนา เรื่อง “Disruptive Trends : ESG, Network Technology Block Chain, Cyber Security”, การประชุม Quantum Thrive: Thailand’s Journey into the Quantum Era “การเดินทางของประเทศไทยสู่ยุคควอนตัม”, IDE VC for SMEs /Call proposal/ Success Story sharing, การเสวนา 5 ปี : อว. กับการปฏิรูป อววน. และทิศทางในอนาคต เนื่องในโอกาสครบรอบการสถาปนากระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม, Climate Tech Workshop – UNSCAP,การจัดการศึกษาตลอดชีวิตและระบบคลังหน่วยกิตของสถาบันอุดมศึกษา, การเสวนาเรื่อง “อาหารสู่การสร้าง Soft Power เพื่อส่งเสริมการท่องเที่ยวเชิงวัฒนธรรมอาหารของไทย”, การบรรยาย เรื่อง นโยบายสำคัญเร่งด่วน (Quick Win) ด้านการแก้ไขปัญหายาเสพติดของประเทศไทย, Agri-Aqua Business Incubation of Philippines and Thailand Networking Workshop, การบรรยาย เรื่อง การประเมินคาร์บอนฟุต พริ้นท์สำหรับผลิตภัณฑ์ Carbon Footprint for Product (CFP), อบรม Empowerment Thailand by Synchrotron Technology และอื่น ๆ อีกมากมายกว่า 150 หัวข้อ. [สวทช]
โครงการเติมเงิน 10,000 บาท ผ่าน Digital Wallet LINK
โครงการเติมเงิน 10,000 บาท ผ่าน Digital Wallet โครงการเพื่อประชาชน พร้อมขับเคลื่อนเศรษฐกิจ
ประชาชนทุกคนที่มีคุณสมบัติตามที่โครงการฯ กำหนดมีแนวทางการลงทะเบียนรับสิทธิ ดังนี้
- สมัครใช้งานแอปพลิเคชัน “ทางรัฐ” ผ่านสมาร์ตโฟนได้ตั้งแต่วันนี้เป็นต้นไป
- ลงทะเบียนรับสิทธิโครงการฯ สำหรับผู้ที่มีสมาร์ตโฟน โดยเปิดลงทะเบียน ระหว่างวันที่ 1 สิงหาคม – 15 กันยายน 2567
พิพิธภัณฑ์สิรินธร Dinosaur museum อ.สหัสขันธ์ จังหวัดกาฬสินธุ์ LINK
พิพิธภัณฑ์สิรินธร-Dinosaur museum แหล่งค้นพบไดโนเสาร์ไทยที่สมบูรณ์ที่สุดในเอเชียตะวันออกเฉียงใต้ ต.โนนบุรี อ.สหัสขันธ์ จังหวัดกาฬสินธุ์ โทร 043871613 เปิดบริการวันอังคาร - วันอาทิตย์ เวลา 09.30 - 16.30 น. กิจกรรมน่าสนใจ
- งาน "สัปดาห์วิทยาศาสตร์ ณ พิพิธภัณฑ์สิรินธร" ไขปริศนาบรรพกาลกับ 13 ไดโนเสาร์ไทย ในวันที่ 15 - 16 สิงหาคม 2567
- พิพิธภัณฑ์สิรินธร จังหวัดกาฬสินธุ์ เปิดให้เข้าชมฟรี 21 - 30 กรกฎาคม 2567 เวลา 09.30 - 16.30 น 10 วันรวด เนื่องในโอกาสวันเฉลิมพระชนมพรรษา ในหลวง รัชกาลที่ 10
- กรกฎาคม 2567 เปิดตัว โซนนิทรรศการปลา Living Fossil Exhibition โซนใหม่ของพิพิธภัณฑ์สิรินธร แสดงเรื่องราววิวัฒนาการสายพันธุ์ปลาจากอดีตสู่ปัจจุบัน และเพลิดเพลินไปกับปลาโบราณที่ยังมีชีวิตหลากสายพันธุ์
- ไดโนเสาร์ไทยได้บินลัดฟ้าเพื่อนำไปศึกษาวิจัยไกลถึงประเทศญี่ปุ่น พร้อมทั้งได้อวดโฉมในงานนิทรรศการไดโนเสาร์ยักษ์ 2024 ร่วมกับไดโนเสาร์จากพิพิธภัณฑ์ระดับโลกอีกมากมาย ระยะเวลาจัดนิทรรศการ 13 ก.ค. - 13 ก.ย. 67 Pacifico Yokohama Exhibition Hall A
- ร่วมกับพิพิธภัณฑ์พระบาทสมเด็จพระปกเกล้าเจ้าอยู่หัว จัดนิทรรศการเคลื่อน "มองสยาม ตามรอยพระปกเกล้า" วันที่ 4 กรกฎาคม 2567 – 15 กันยายน 2567
- ร่วมกับสถาบันวิจัยภาษาและวัฒนธรรมเอเชีย มหาวิทยาลัยมหิดล จัดนิทรรศการพิเศษเคลื่อนที่ “วิวิธชาติพันธุ์” (VIVID ETHNICITY) 27-28 มิถุนายน 2567
เขตพระนคร จัดหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีน ฟรี ประจำปี 2567 วันที่ 2 - 13 กันยายน
สำนักงานเขตพระนคร ร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ จัดหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 2 - 13 กันยายน 2567 (ในวันราชการ) เวลา 10.00 - 12.00 น. ไม่เสียค่าใช้จ่าย สัตว์เลี้ยงที่เข้ารับวัคซีนจะต้องมีสุขภาพแข็งแรง ไม่ป่วย และมีอายุ 3 เดือนขึ้นไป
ตารางออกหน่วยเคลื่อนที่
2 ก.ย. 67 ชุมชนเฟื่องทอง-ตรอกวิสูตร
3 ก.ย. 67 ชุมชนมัสยิดจักรพงษ์ และตลาดนรรัตน์
4 ก.ย. 67 ชุมชนวัดอินทรวิหาร
5 ก.ย. 67 วัดสุทัศนเทพวราราม
6 ก.ย. 67 ชุมชนวัดสามพระยา
9 ก.ย. 67 ชุมชนวัดเทพธิดาราม
10 ก.ย. 67 ชุมชนวัดสังเวชวิศยาราม
11 ก.ย. 67 ชุมชนวัดใหม่อมตรส
12 ก.ย. 67 วัดมหาธาตุยุวราชรังสฤษฎิ์
13 ก.ย. 67 ชุมชนวัดนรนาถ จึงขอประชาสัมพันธ์เชิญชวนประชาชนนำสัตว์เลี้ยง มาฉีดวัคซีนฯ ตามวัน เวลา และสถานที่ที่กำหนด
สอบถามเพิ่มเติม โทร. 0 2281 8921
โครงการโดยสำนักการแพทย์ และ สำนักอนามัย
บริการที่จอดรถฟรี ที่เทอร์มินอล21พัทยา
ได้เฮอีก เทอร์มินอล 21 พัทยา ใจดีมาก ให้บริการที่จอดรถฟรี สำหรับใครจะมางาน Pattaya Music Festival 2025 “Sound on the Sand” พิเศษ! วันที่ 8-9 มีนาคม 2568 มีบริการ ที่จอดรถฟรี ถึงเวลา 02:00 น. ที่จอดรถอยู่ใกล้เวทีโค้งดุสิต เพียง 5 นาที เท่านั้น สะดวกสุด ๆ
กำหนดการบริการ วัคซีนป้องกัน เดือนมีนาคม 2568
ขอเชิญชาวเขตเทศบาลนครระยอง นำสุนัขและแมวของท่านเข้ารับบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่2) ประจำปีงบประมาณ 2568 ในโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ โดยงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม
บริการตามแต่ละชุมชนเวลา 13.30 - 16.00 น.
เงื่อนไขการเข้ารับบริการ 1. เตรียมบัตรประชาชน และต้องอาศัยอยู่ในเขตเทศบาลนครระยอง 2. สุนัขและแมวต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี 3. สุนัขและแมวไม่อยู่ในช่วงตั้งท้อง และให้นมลูก #เทศบาลนครระยอง #งานสัตวแพทย์ #ศูนย์พักพิงสุนัขจรจัด #สำนักสาธารณสุขและสิ่งแวดล้อม #ฉีดวัคซีนฟรี สำหรับในเขตชุมชนอื่นๆในเทศบาล จะมีประกาศอีกครั้ง
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการ จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305
O’Cannabiz Conference Expo & Awards - Toronto 2022 June 1-3, 2022 LINK
O’Cannabiz Conference Expo & Awards - Toronto 2022 June 1-3, 2022 งานนี้มีแจกรางวัลกันด้วย งานใหญ่ประจำชาติแคนาดากันเลยทีเดียว ใครๆ ในแคนาดา ที่อยู่ใน คานาบิสสเปซ ต้องมางานนี้ โดดเด่นมากต้องเซคชั่น Industry Insights กับหัวข้อซีเรียสๆ ที่ต้องสนใจ
The Emergence of Actech in The Cannabis Space
Cannabis Extraction Standards and Compliance in Canada
Supply Chain Resiliency
Cannabis Retail : Are we headed for Tuplip Mania 2.0
Lost in Space
CBD as a Super Ingredient - Neptune Wellness
Medical Cannabis Ecosystem
California Dreaming : What’s next in the world’s largest cannabis market
1 มิถุนายน 65
วันพุธที่ 1 มิถุนายน 2565 เวลา 11.30 น.
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ข้อมูลตั้งแต่วันที่ 1 มกราคม 2565
ผู้ป่วยรายใหม่ 4,563 ราย
ผู้ป่วยยืนยันสะสม 2,231,585 ราย
หายป่วยแล้ว 2,217,208 ราย
เสียชีวิตสะสม 8,349 ราย
----------------------------
วันที่ 31 พฤษภาคม 2565 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 13,377 ราย
เข็มที่ 2 จำนวน 35,238 ราย
เข็มที่ 3 จำนวน 72,124 ราย
บุญบั้งไฟ เพ็ญ อุดรธานี 1-7 มิถุนายน 66
บุญบั้งไฟ เพ็ญ อุดรธานี 1-7 มิถุนายน 66 บริเวณหน้าที่ว่าการ อ.เพ็ญ อุดรธานี ชมการแสดง เต็มๆ วันที่ 2 มิ.ย. สาวน้อย เพชรบ้านแพง 3 มิ.ย. พิธิเปิดและขบวนแห่สุดยิ่งใหญ่ 4-5 มิ.ย. จุดบั้งไฟ 7 มิ.ย. เม้ก อภิสิทธิ์
เฮลิคอปเตอร์รับผู้ป่วยฉุกเฉิน ชาย 56 ปี จากแม่สะเรียง ส่งต่อรพ.มหาราชนครเชียงใหม่
1 มิถุนายน 66 เวลา 09.41 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอน ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน เพื่อขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศชาย อายุ 56 ปี ประวัติ 10 นาทีก่อนมาโรงพยาบาล ขับขี่รถจักรยานยนต์ชนท้ายรถจักรยานยนต์ ไม่รู้สึกตัว มีเลือดออกหูข้างขวาและจมูก 2 ข้าง หน้าผากบวมโน โดยมีหน่วยบริการการแพทย์ฉุกเฉินโรงพยาบาลแม่สะเรียง นำผู้ป่วยส่งเข้ารับการรักษาที่โรงพยาบาลแม่สะเรียง อ.แม่สะเรียง จ.แม่ฮ่องสอน ซึ่งเมื่อประเมินอาการแล้ว จึงได้ใส่ท่อช่วยหายใจ และประสานงานส่งต่อไปยังโรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่ ได้รับการวินิจฉัยโรค severe head injury (การบาดเจ็บที่ศีรษะอย่างรุนแรง) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน จึงได้ประสานงานส่งต่อผู้ป่วยไปยังโรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองกำลังผามือง จังหวัดเชียงใหม่ ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 ชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ยงยุทธ แสวงทอง, ร.ท.ปฏิภาณ แก้วสนิท, จ.ส.อ.สุริยา พรมชาติ และ จ.ส.อ.โกมล บุญสะอาดและชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลนครพิงค์ จ.เชียงใหม่ ประกอบด้วย พญ.วรัตม์สุดา สมุทรทัย, พญ.รักษิณา อ่อนตา, นายอานนท์ เขื่อนคำ และ นางสาวสุนิสา จันตากอง และเมื่อเวลา 11.54 น.ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
วิจิตร 5 ภาค @ระยอง แสงแห่งขุมทรัพย์ตะวันออก 1 - 4 มิ.ย. 66
วิจิตร 5 ภาค @ระยอง แสงแห่งขุมทรัพย์ตะวันออก THE TREASURE OF LIGHTING EASTPERIENCE ครั้งแรกกับเทศกาลแสง สี เสียงกลางป่าชายเลน ณ #พระเจดีย์กลางน้ำ จ.ระยอง รวม 15 โซนจัดแสดง Projection Mapping, Light Up, Light Installation และพลุ ดอกไม้ไฟสุดอลังการ เข้าชมฟรี ตั้งแต่ 1 - 4 มิ.ย. 66 เวลา : 18.00 - 24.00 น. พิกัด : เจดีย์กลางนํ้าป่าชายเลน จังหวัดระยอง
กิจกรรมการแข่งขัน Eastern LATTE ART Competition season#1 วันที่ 1 มิย 2567
กิจกรรมการแข่งขัน Latte Art วันที่ 1 มิย 2567 ณ ศูนย์การค้าเซ็นทรัลชลบุรี โชว์ความสามารถในการสร้างสรรค์ผลงานศิลปะบนถ้วยกาแฟ“ Eastern LATTE ART Competition season 1 ชิงเงินรางวัลมากกว่า 38,000 บาท พร้อมโล่ห์รางวัลประกาศเกียรติคุณ ติดต่อสอบถามเพิ่มเติม 084 654 5444 แล้วพบกัน 27 พ.ค. - 3 มิ.ย. 67 ณ ลานกิจกรรมชั้น 1 เซ็นทรัลชลบุรี
งานตลาดกาแฟสถานีผัก (Sathaneepak Coffee market) 1-2 มิถุนายน 2567 LINK
งานตลาดกาแฟสถานีผัก (Sathaneepak Coffee market) เสาร์-อาทิตย์ 1-2 มิ.ย 67 นี้ เวลา 9.00-20.00 น. ที่ สถานีผัก คนรักกาแฟ พุทธมนฑลสาย4-5 สามพราน นครปฐม ธีม Colors of Love. Celebrating Pride Month. สถานีผัก สีรุ้ง สีสัน สนุกสนาน ยกขบวนร้านกาแฟทั้ง Specialty, Slow bar และเมล็ดกาแฟคัดสรรคุณภาพ หลากหลายสายพันธุ์ แต่ละร้านก็มีเอกลักษณ์เฉพาะตัว ให้คอกาแฟได้เลือกสรร เลือกเสพอรรถรสตามความพึงพอใจ เอาใจสายชาเขียวกับร้านมัทฉะพรีเมี่ยมเข้มข้น มัทฉะเกรดพิธีจากเกียวโต มาสัมผัสความพิเศษของมัทฉะแบบญี่ปุ่นกันได้ เครื่องดื่มดับร้อนสดชื่นๆ ทั้งชาดอกไม้น้ำผึ้งชันโรง น้ำบ๊วยน้ำผึ้งโซดา หรือจะเป็นโกโก้ปลูกเองทำเองทุกขั้นตอน ส่วนสายชาไทยก็มามีท๊อปบนแก้วด้วยทุเรียนหรือวาฟเฟิลหอมๆ ทีเด็ดจากร้านดังนนทบุรีต้องมาลองน๊าา คราฟต์ซ่าหรือหอมซ่า????เย็นๆก็มีมาให้จิบให้จอยเบาๆพอหอมปากหอมคอ เบเกอรี่ อาหารคาว สตรีทฟู้ด ฟู๊ดทรัคไอติม ของหวาน หลากหลายเมนู ก็พร้อมเพียง สินค้างานคราฟท์จากสมุนไพร ไม่ว่าจะเป็นยาหม่อง/สเปรย์สูตรเย็น แชมพูจากสมุนไพรไทย ครีมแก้ปวดพลับพลึง อุปกรณ์ดริปเปอร์ ถ้วย แก้วชา แก้วกาแฟ จากหินแกรนิต เก็บความร้อนได้ดี มีมาให้เลือกช็อปกลับบ้าน งานแฮนด์เมด เครื่องประดับจากเรซิ่น และเครื่องประดับจากดินปั้น มีมาให้สาวๆได้ช็อปปิ้ง Coffee Workshop ณ ลานกิจกรรม ที่จะมาให้ความรู้เรื่องกาแฟ การใช้เครื่องทำกาแฟ การสกัดช็อตกาแฟ และอื่นๆอีกมากมายภายในงาน หย่อนใจเพลิดเพลินกับ Workshop จัดดอกไม้ในขวดน้ำมันHerbarium Oil (ใส่ตอนท้ายเพื่อคงสภาพ) สามารถทำได้ทั้งเด็กและผู้ใหญ่ ได้ใช้เวลาทำกิจกรรมร่วมกัน มีครบจบในงาน ฟังดนตรีสด เคล้าบรรยากาศสีเขียวร่มรื่นฮีลใจในวันหยุดของทุกท่าน
2 มิถุนายน ประเดิมงานแรกปลูกต้นไม้ล้านต้น เริ่มต้นแรก ณ สวนเบญจกิติ LINK
ผู้ว่าคนใหม่สุดฟิต ประเดิมงานแรก ปลูกต้นไม้ต้นแรกจาก 1 ล้านต้น ที่ สวนเบญจกิติ ท่ามกลางทัพนักข่าว โดยมีท่านรองผู้ว่า จักกพันธุ์ ผิวงาม พร้อมเตรียมพร้อมลงสนาม ระหว่างทางอวดภาพครอบครัวนกเค้าแมวที่พำนักในต้นไม้ใหญ่ในสวนแห่งนี้ นักข่าวท่านหนึ่งเติมข้อมูลว่า นกเค้าแมวครัวนี้ย้ายมาจากสวนลุมเพราะหนีแมว! ผู้ว่าบอก "พวกเราถ้าช่วยกันดูแลต้นไม้ นกจะได้อยู่กัน มีนกให้ดูเยอะแยะแบบนี้ หาไม่ง่ายนักในกรุงเทพนะ"
2 มิถุนายน CCTV & ทราฟฟี ฟองดูว์
ทราฟฟี ฟองดูว์ แอป สวทช. ทำไว้ให้
กรมขนส่งทางบก [โหลดได้ที่
google play] รับแจ้งปัญหาจาก ปชช. ส่งเรื่องต่อให้เขตต่างๆ ดำเนินการแก้ไข ปชช. มีส่วนร่วม ส่งเรื่องเข้าไปเลย กทม.จะมอนิเตอร์อยู่ ส่งแล้วคอยติดตาม แก้/ไม่แก้ จะได้กระทุ้งผู้ว่าอีกที
2 มิถุนายน 2565 LINK
วันพฤหัสบดีที่ 2 มิถุนายน 2565 เวลา 12.30 น.
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ข้อมูลตั้งแต่วันที่ 1 มกราคม 2565
ผู้ป่วยรายใหม่ 2,560 ราย
ผู้ป่วยยืนยันสะสม 2,234,145 ราย
หายป่วยแล้ว 2,222,813 ราย
เสียชีวิตสะสม 8,383 ราย
----------------------------
วันที่ 1 มิถุนายน 2565 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 14,194 ราย
เข็มที่ 2 จำนวน 36,741 ราย
เข็มที่ 3 จำนวน 66,593 ราย
ประเพณีบุญบั้งไฟล้าน อ.โพนทราย ร้อยเอ็ด 2-11 มิ.ย.66
ประเพณีบุญบั้งไฟล้าน อ.โพนทราย ร้อยเอ็ด 2-11 มิ.ย.66
Coffee Cation X Surf Edition 2-5 June 2023
Great event for coffee lovers, Coffee Cation X Surf Edition, 2-5 June 2023 at Laybay Khaolak AT La Vela Khaolak, another coffee event in the South. where coffee lovers wait Great activities at the event ✅️Public Cupping & Robusta Green Coffee Community ✅️Leva Contest Speed ✅️Speed Sufskate ✅️Coffee Community and many more that will be revealed soon. Follow the event information and application channels at the LA VELA KHAOLAK page, call 076-428555.
มูลนิธิป่อเต็กตึ๊ง จัดอบรมเดือนมิถุนายน2566 ทั้งหมด 5 หลักสูตร (อบรมฟรี มีใบประกาศให้) LINK
1. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 5/66
รับสมัครจำนวน 100 คน เปิดรับสมัครวันที่ 15 พ.ค.-2 มิ.ย.66
อบรมวันที่ 7 มิ.ย.66 เวลา 08.30-16.30 น. "(ผ่านระบบ Google Meet)"
2. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (On-site) รุ่นที่ 4/66
รับสมัครจำนวน 60 คน เปิดรับสมัครวันที่ 19 พ.ค.-9 มิ.ย.66
วันอบรม วันที่ 16 มิ.ย.66 เวลา 08.30 - 16.30 น.
"ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
3. หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 5/66
รับสมัครจำนวน 60 คน เปิดรับสมัครวันที่ 17 พ.ค.-4 มิ.ย.66
วันอบรม ภาคทฤษฎี (Online) วันที่ 9 มิ.ย. 66 เวลา 09.00 - 12.00 น.
อบรมผ่านระบบ Google Meet ภาคปฏิบัติ (On-site) วันที่ 17 มิ.ย.66
มี 2 รอบให้เลือกเช้าหรือบ่าย เวลา 09.00-12.00 หรือ 13.00-16.00
"ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
4.หลักสูตรนิติเวชเบื้องต้นและการจัดการศพเป็นจำนวนมาก รุ่นที่ 1
รับสมัครจำนวน 60 คน เปิดรับสมัครวันที่ 25 พ.ค.-18 มิ.ย.66
อบรมทฤษฎีวันที่ 23 มิ.ย.66 “ณ มหาวิทยาลัยหัวเฉียวเฉลิมพระเกียรติ วิทยาเขตยศเส”
5.หลักสูตรพนักงานขับรถพยาบาลและขับขี่ปลอดภัย รุ่นที่2
รับสมัครจำนวน 30 คน เปิดรับสมัครวันที่ 25 พ.ค.-4 มิ.ย.66
อบรมทฤษฎีวันที่ 9 มิ.ย. 66 07.00-19.00 น.
อบรมทฤษฎีวันที่ 10 มิ.ย. 66 07.00-18.00 น.
หลักสูตรที่ 4 และ 5 สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊งเท่านั้น !!!!!!!
สถาบันการแพทย์ฉุกเฉิน อบรม หลักสูตรการลำเลียงผู้ป่วยทางเฮลิคอปเตอร์ (Basic HEMS)
2 มิถุนายน 2566 เรืออากาศเอก นายแพทย์อัจฉริยะ แพงมา เลขาธิการสถาบันการแพทย์ฉุกเฉินแห่งชาติ เป็นประธานในพิธีปิดการอบรม หลักสูตรการลำเลียงผู้ป่วยทางเฮลิคอปเตอร์ (Basic HEMS) พร้อมทั้งมอบประกาศนียบัตร และเข็มวิทยฐานะแก่ผู้ผ่านการฝึกอบรม รวมถึงได้มอบอาร์ม Sky doctor ให้กับ นพ.สมพร สหจารุพัฒน์ รองผู้อำนวยการฝ่ายการแพทย์ ผู้รับผิดชอบโครงการ นักบินและช่าง ค่ายวชิราวุธ จังหวัดนครศรีธรรมราช โดยมี ดร.พิเชษฐ์ หนองช้าง รองเลขาธิการสถาบันการแพทย์ฉุกเฉินแห่งชาติ นายไพศาล ก้อนจำปา ผู้ช่วยเลขาธิการสถาบันการแพทย์ฉุกเฉินแห่งชาติ และผู้ประสานงาน สำนักบริหารจัดการระบบการแพทย์ฉุกเฉินพื้นที่ 4 ร่วมเป็นเกียรติในพิธีปิดการอบรมครั้งนี้ ณ โรงพยาบาลค่ายวชิราวุธ กองทัพภาคที่ 4 จังหวัดนครศรีธรรมราช
.
การฝึกอบรม หลักสูตรการลำเลียงผู้ป่วยทางเฮลิคอปเตอร์ (Basic HEMS) จัดขึ้นระหว่างวันที่ 29 พฤษภาคม 2566 - 2 มิถุนายน 2566 โดย สถาบันการแพทย์ฉุกเฉินแห่งชาติ ร่วมกับ สำนักงานสาธารณสุขจังหวัดนครศรีธรรมราช และคณะทำงานพัฒนาระบบบริการสุขภาพสาขาอุบัติเหตุและฉุกเฉิน เขตสุขภาพที่ 11 เพื่อเป็นการเพิ่มทักษะ ให้แก่ผู้ปฎิบัติการฉุกเฉินของหน่วยปฏิบัติการแพทย์ ในเขตสุขภาพที่ 11 ก่อให้เกิดความร่วมมือในการประสานงานของภาคส่วนต่างๆ ที่จะช่วยพัฒนาระบบส่งต่อผู้ป่วยฉุกเฉินด้วยเฮลิคอปเตอร์ หรือ HEMS ในพื้นที่ภาคใต้ที่มีความสำคัญ ในการส่งต่อผู้ป่วยฉุกเฉินที่ครอบคลุม รวดเร็ว และปลอดภัยต่อผู้ป่วยฉุกเฉินวิกฤต ให้สามารถเข้าถึงบริการการแพทย์ฉุกเฉินได้อย่างทั่วถึง เท่าเทียม เกิดความปลอดภัยต่อภาวะสุขภาพของประชาชน
3 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันศุกร์ที่ 3 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,976 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,673 ราย
ผู้ป่วยมาจากต่างประเทศ 3 ราย
ผู้ป่วยสะสม 2,237,121 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 4,238 ราย
หายป่วยสะสม 2,227,051 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 34,898 ราย
---------------------
เสียชีวิต 32 ราย
เสียชีวิตสะสม 8,415 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 818 ราย
----------------------------
วันที่ 2 มิถุนายน 2565 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 10,635 ราย
เข็มที่ 2 จำนวน 25,655 ราย
เข็มที่ 3 จำนวน 52,735 ราย
3 มิถุนายน 4 ทุ่ม ไปเยือนสำนักระบายน้ำ
ผู้ว่าถามท่านผอ.ว่า อยากปรับปรุงอะไรก่อน ท่านตอบว่า ปรับจุดเสี่ยง 2 จุด คือรัชดา และแจ้งวัฒนา จากทั้งหมด 9 จุด กับจุดเฝ้าระวัง 48 จุด การลอกท่อ งบปี 65 ได้งบลอกท่อ 2 คลอง จาก 1,980 คลอง กับได้เพิ่มเติมอีก 10 คลอง หัวใจการระบายน้ำให้ได้ผล คือคลอง+ท่อ อุโมงค์คือตัวเชื่อมเท่านั้นเอง ถามว่าน้ำท่วมชาวบ้านแจ้งมาได้ไหม ตอบว่าได้ แต่เบอร์จำยากหน่อย
ถามผอ.ว่า ศูนย์นี้รู้ไหมว่ามีจุดไหนน้ำท่วมบ้าง ผอ.บอกว่ารู้บางจุด ไม่ทั้งหมด หลักๆที่มีเซนเซอร์อยู่ ตามซอยต้องอาศัยพื้นที่ หรือจส.100
ผอ.เล่าถึงการทำ water bank (แก้มลิง) ใช้พื้นที่การเคหะใต้สนามกีฬา แก้ปัญหาน้ำท่วมแถวดินแดง ปัญหาน้ำท่วมส่วนหนึ่งเกิดจาก สิ่งปลูกสร้าง รถไฟฟ้า คอนโดที่มีมาก [
watch]
กราฟฟิคอาคารรับน้ำและอุโมงค์รับน้ำ กทม.
กราฟฟิคอาคารรับน้ำและอุโมงค์รับน้ำ และการเชื่อมต่อระหว่างจุด จากจุดรับน้ำมักกะสัน แสนเลิศ ไผ่พิทัก ขอบถนนเชื้อเพลิง วัดช่องลม มีปั้มดูดออกเจ้าพระยา
งาน สบายใจสไตล์จันท์ #เที่ยวจันท์กันเถาะ 3-5 มิ.ย.66
งาน “สบายใจสไตล์จันท์” #เที่ยวจันท์กันเถาะ 3-5 มิ.ย.66 เวลา 17.00-21.00 น. ณ สนามสามเหลี่ยม(ทุ่งนาเชย) อ.เมือง จ.จันทบุรี
4 มิถุนายน 2565 LINK
วันเสาร์ที่ 4 มิถุนายน 2565 เวลา 11.30 น.
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ข้อมูลตั้งแต่วันที่ 1 มกราคม 2565
ผู้ป่วยรายใหม่ 3,001 ราย
เสียชีวิต 30 ราย
เสียชีวิตสะสม 8,445 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 799 ราย
---------------------
ผู้ป่วยยืนยันสะสม 2,240,122 ราย
หายป่วยแล้ว 2,230,864 ราย
เสียชีวิตสะสม 8,445 ราย
----------------------------
วันที่ 3 มิถุนายน 2565 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 16,589 ราย
เข็มที่ 2 จำนวน 41,546 ราย
เข็มที่ 3 จำนวน 73,760 ราย
4 มิถุนายน ประกบผู้ว่าการไฟฟ้านครหลวง ลงถนนพระราม 3
ผู้ว่ากทม. ประกบผู้ว่าการไฟฟ้านครหลวง ลงพื้นที่ ดูปัญหาผิวจราจรบนถนนพระราม 3 ที่มีการร้องเรียนมามาก ฝาบ่อไม่เรียบ ผู้ว่าไฟฟ้าสั่งการให้ ทำใหม่+ออกแบบใหม่ไม่ให้ทรุดตัว จำนวนฝาน้อยลง รอยต่อน้อยลง ทำให้ผิวถนนเรียบขึ้นมาก และแนวทางแก้เรื่องสายสื่อสาร เริ่มจากจัดระเบียบ ตัดสายตายก่อน คุยกับกสทช. ไฟฟ้านครหลวง และกทม. และ operator ด้วย ผู้ว่าบอกกทม.จะเป็นเจ้าภาพเรื่องนี้ [
watch]
4 มิถุนายน พายเรือคายัคเก็บขยะ ปลูกต้นมะฮอกกานี
ผู้ว่าฯ ชัชชาติพายเรือคายัคเก็บขยะในแม่น้ำเจ้าพระยาและปลูกต้นมะฮอกกานีเนื่องในวันสิ่งแวดล้อมโลก 2565
วิ่งมหัศจรรย์ บ้านแลง แดนผลไม้ 4 มิ.ย.66
"BANLANG RUN WONDER FRUIT" " วิ่งมหัศจรรย์ บ้านแลง แดนผลไม้ " (มีบุฟเฟ่ต์ผลไม้ ทานฟรีวันแข่งขัน) ▶️: วันอาทิตย์ที่ 4 มิถุนายน 2566 ▶️: องค์การบริหารส่วนตำบลบ้านแลง อ.เมือง จ.ระยอง ▶️: 05:00 น.
เฮลิคอปเตอร์รับผู้ป่วยฉุกเฉิน เพศชาย 34 ปี จากอ.ปาย ส่งรพ.นครพิงค์
วันที่ 4 มิถุนายน เวลา 08.57 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอน ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศชาย อายุ 34 ปี เมื่อ 11 นาทีก่อนมาโรงพยาบาล ญาติให้ประวัติ ญาติไปเข้าห้องน้ำได้ยินเสียงครืดคราด เข้าไปดู เรียกไม่รู้สึกตัว ยังหายใจ มีน้ำลายฟูมปาก โดยมีโรงพยาบาลปายออกให้บริการการแพทย์ฉุกเฉิน และ ณ จุดเกิดเหตุ มีปากม่วงคล้ำ หายใจเฮือก 1 ครั้ง คลำชีพจรไม่ได้ จึงได้ทำการ CPR และนำผู้ป่วยส่งเข้ารับการรักษาที่โรงพยาบาลปาย อ.ปาย จ.แม่ฮ่องสอน ซึ่งเมื่อประเมินอาการแล้ว จึงได้ใส่ท่อช่วยหายใจ ได้รับการวินิจฉัยโรค มีภาวะเลือดออกบริเวณก้านสมองและโพรงสมองร่วมกับภาวะหัวใจหยุดเต้น จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน จึงได้ประสานงานส่งต่อผู้ป่วยไปยังโรงพยาบาลนครพิงค์ จ.เชียงใหม่ โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจสิงหนาท จังหวัดแม่ฮ่องสอน ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 ชุดปฏิบัติการบิน ประกอบด้วย พ.ต.ฉลาด สุวพันธ์, ร.ท.ประสิทธิ์พร ทันลา, จ.ส.อ.อนุพงศ์ โคตรพรม และ จ.ส.อ.พยัก แก้วม่วง และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ประกอบด้วย นพ.กรีฑา คำเนียม, นางสาวฉัตรพร วงศ์เผือก และ นายปภาวิน ประเสริฐกุล และเมื่อเวลา 10.33 น.ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
งานอัฐมีบูชา วันทาพระพุทธเจ้า 4,7,11 มิถุนายน พ.ศ.2566
ขอเชิญผู้มีจิตศรัทธาร่วมงานอัฐมีบูชา วันทาพระพุทธเจ้า เพื่อเป็นการรำลึกถึงวันถวายพระเพลิงพระพุทธสรีระของสมเด็จพระสัมมาสัมพุทธเจ้า และถวายสักการะแด่พระพุทธรูปปางเข้านิพพาน หรือพระพุทธเจ้าเข้านิพพานของวัดท่าฬ่อ ตั้งแต่วันที่ 4-11 มิถุนายน พ.ศ.2566 ณ วัดท่าฬ่อ
กำหนดการไฮไลต์
วันที่ 4 มิถุนายน พ.ศ.2566
เวลา 08.00 น. ชมขบวนแห่องค์พระพุทธเจ้าเข้านิพพาน และพิธีบรวงสรวง
เวลา 16.00 น. พิธีเปิดงาน ชมขบวนรำบูชาถวาย
วันที่ 7 มิถุนายน พ.ศ.2566
เวลา 20.00 น. ชมการแสดงโขน
วันที่ 11 มิถุนายน พ.ศ.2566
เวลา 19.00 น. ร่วมถวายพระเพลิงองค์สมเด็จพระสัมมาสัมพุทธเจ้า(จำลอง)
เวลา 20.00 น. ชมการแสดง แสง สี เสียง
***หมายเหตุ*** ร่วมฟังเทศน์และสวดพระอภิธรรมเพื่อถวายเป็นกุศลในทุกคืน ยกเว้นคืนแรก
5 มิถุนายน วันสิ่งแวดล้อมโลก World Environment Day
วันสิ่งแวดล้อมโลก เกิดขึ้นจากความห่วงใยในปัญหาวิกฤตการณ์ด้านสิ่งแวดล้อมที่มีแนวโน้มรุนแรงขึ้นในอนาคต องค์การสหประชาชาติ ได้จัดให้มีการจัดประชุมใหญ่ระดับโลก
“การประชุมสหประชาชาติเรื่องสิ่งแวดล้อมของมนุษย์ UN Conference on the Human Environment” ที่ กรุงสตอกโฮลม์ ประเทศสวีเดน ในช่วงวันที่ 5-16 มิถุนายน พ.ศ. 2515 มีผู้เข้าร่วมประชุมกว่า 1,200 คน จาก 113 ประเทศ รวมทั้งสื่อมวลชนจากทั่วโลก ผลจากการประชุมครั้งนั้นได้มีข้อตกลงร่วมกันมากมาย และได้จัดตั้งโครงการสิ่งแวดล้อมแห่งสหประชาชาติ (UNEP : United Nations Environment Programme) ต่อมา เพื่อดำเนินการให้รัฐบาลประเทศต่างๆ นำเอาข้อตกลงจากการประชุมคราวนั้นไปจัดตั้งหน่วยงานด้านสิ่งแวดล้อมขึ้นในประเทศของตนต่อไป และได้ประกาศให้วันที่ 5 มิถุนายนของทุกปี เป็นวันสิ่งแวดล้อมโลก [
กรมป่าไม้]
5 มิถุนายน 65 LINK
วันอาทิตย์ที่ 5 มิถุนายน 2565 เวลา 11.30 น.
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ข้อมูลตั้งแต่วันที่ 1 มกราคม 2565
ผู้ป่วยรายใหม่ 3,236 ราย
เสียชีวิต 28 ราย
เสียชีวิตสะสม 8,473 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 775 ราย
----------------------------
ผู้ป่วยยืนยันสะสม 2,243,358 ราย
หายป่วยแล้ว 2,235,875 ราย
เสียชีวิตสะสม 8,473 ราย
----------------------------
วันที่ 4 มิถุนายน 2565 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 3,499 ราย
เข็มที่ 2 จำนวน 10,966 ราย
เข็มที่ 3 จำนวน 25,979 ราย
5 มิถุนายน บางบัว แยก ณ ระนอง ร่วมขบวนสีลม ปิดท้ายด้วยคอนเสิร์ตสวนลุม
ช่วงเช้า ปลัด กทม. Kick off กิจกรรม
ปลูกต้นไม้ล้านต้น เขตจตุจักร
สาย ไปเยือน
เคหะชุมชนบางบัว เร่งรัดปัญหาท่อระบายน้ำก่อสร้างกีดขวางจราจร ผอ.สำนักงานเขตหลักสี่ รับลูกทันควัน สั่งย้ายคอนกรีตบนถนนขึ้นบนฟุตบาทแทน ได้ถนนแต่แลกด้วยทางเท้า รถขนมีจำกัด เลยขนย้ายช้า (ย้ายไปสายไหม + ลาดกระบัง) หวังว่าคงไม่นาน ชาวบ้านยิ้มออกได้บ้างแล้ว
บ่าย ไป
5 แยก ณ ระนอง อีกจุดที่ก่อสร้างยาวนาน ประชาชนร้องเรียนมาก เข้าใจว่าทำยากมีถนนหลายเส้นเกี่ยวข้อง ข้ามหลายแยก+ทางรถไฟ เริ่มมาตั้งแต่มีนา 61 กำหนดเสร็จมีนา 64 แต่อุปสรรคคือล่าช้าในการขอเข้าพื้นที่ ที่ต้องขอกับการรถไฟกับทางด่วน เอาผังงานมากางกัน ผอ.ยืนยันว่ากำหนดเสร็จ ธันวา 65 เสร็จแน่ไม่เลื่อน ถามถึงอุปสรรค ผอ.บอกว่า ผู้รับเหมามีปัญหาขาดแรงงาน อื่นๆ ไม่มี ผู้ว่าขอให้เสร็จตามแผน บางส่วนเสร็จก่อนเปิดได้ก่อน คือกรกฎา-สิงหานี้ ให้เขตแจ้งรถไฟแก้จุดทางข้ามที่พื้นไม่เรียบ แผ่นคอนกรีนกระดก ทำให้รถต้องชะลอ เน้นย้ำให้ผอ.เร่งรัดกับผู้รับเหมา "ต้องโหดๆ กับผู้รับเหมาหน่อย" ปรับ/หลบไม่ให้กีดขวางจราจร แนวโค้งให้รถเลี้ยวง่าย เก็บขยะ คุยกับตำรวจสน.ท่าเรือ ด้วย
เย็นไปสวนลุม #ดนตรีในสวน เป็นเพียงจุดเริ่มต้นเท่านั้น ก่อนจะขยายไปทุกเขต ทุกสวนสาธารณะในอนาคต เดินหน้าต่อไปด้วยกันครับ
*******
Comment of the day
ท่านค่ะ ประชาชนตาดำๆ ขอประท้วงนิดเดียวค่ะ วันอาทิตย์ขอร้องให้ท่านพักผ่อนบ้าง ประชาชนตาดำๆไม่มีเวลาดูซีรี่ย์เลยค่ะ ต้องตามดูท่านไลฟ์สดทุกวันเลยค่ะ เรามาถึงวันที่ไลฟ์ท่านชัชชาติน่าสนใจกว่าซีรี่ย์แล้วนะ -
Savittri W Rimestad ศูนย์รับแจ้งเหตุเชียงใหม่ ลำเลียงเด็กชาย 6 ปี จากแม่แจ่ม ส่งรพ.มหาราชนครเชียงใหม่
วันที่ 5 มิ.ย. 66 เวลา 10.20 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย 1 ราย อายุ 6 ปี ได้รับบาดเจ็บที่ศีรษะอย่างรุนแรง ทั้งนี้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน โดยต้นทางโรงพยาบาลเทพรัตนเวชชานุกูล เฉลิมพระเกียรติ ๖๐ พรรษา อำเภอแม่แจ่ม จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่ ได้รับการสนับสนุนอากาศยานจากหน่วยกองบินตำรวจ จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย พ.ต.ต.จักรพันธ์ อธิคมภาษิต, ร.ต.อ.ประเทือง ชูเลิศ, พ.ต.ต.ณรงค์ วังรังกา ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่ ประกอบด้วย พญ.พัณณ์ชิตา ชำนาญกิจวนิชย์, น.ส.เบญจวรรณ ยืนธรรม, นายคเนศ ชูสุวรรณ์ เมื่อเวลา 12.23 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลโรงพยาบาลมหาราชนครเชียงใหม่ เป็นที่เรียบร้อย
Thailand Coffee Hub 2024 @เซ็นทรัลขอนแก่น 5-9 มิ.ย. 67
Thailand Coffee Hub 2024 ภาคอีสาน @เซ็นทรัลขอนแก่น วันที่ 5-9 มิ.ย. 67
พบกับร้านกาแฟชั้นนำกว่า 40 ร้านที่จะมาเนรมิตประสบการณ์การดื่มกาแฟที่ไม่เหมือนใคร ให้คุณได้ลิ้มลองกาแฟหลากหลายสายพันธุ์ พร้อมสัมผัสเทคนิคการชงกาแฟที่พิถีพิถันจากบาริสต้ามืออาชีพ รวมถึงมีกิจกรรมพิเศษอีกมากมายที่จัดมาให้สำหรับชาวขอนแก่นโดยเฉพาะ
Thailand Coffee Hub 2024 @เซ็นทรัลขอนแก่น วันที่ 5 - 9 มิ.ย. 2567
Thailand Coffee Hub 2024 ภาคอีสาน @เซ็นทรัลขอนแก่น วันที่ 5-9 มิ.ย. 67 พบกับร้านกาแฟชั้นนำกว่า 40 ร้านที่จะมาเนรมิตประสบการณ์การดื่มกาแฟที่ไม่เหมือนใคร ให้คุณได้ลิ้มลองกาแฟหลากหลายสายพันธุ์ พร้อมสัมผัสเทคนิคการชงกาแฟที่พิถีพิถันจากบาริสต้ามืออาชีพ รวมถึงมีกิจกรรมพิเศษอีกมากมายที่จัดมาให้สำหรับชาวขอนแก่นโดยเฉพาะ
เซ็นทรัลขอนแก่น6 มิถุนายน 2565
รายงานผู้ป่วยติดเชื้อโควิด-19
วันจันทร์ที่ 6 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,162 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,160 ราย
ผู้ป่วยมาจากต่างประเทศ 2 ราย
ผู้ป่วยสะสม 2,245,520 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 4,879 ราย
หายป่วยสะสม 2,240,754 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 29,509 ราย
---------------------
เสียชีวิต 27 ราย
เสียชีวิตสะสม 8,500 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 761 ราย
6 มิถุนายน ประชุมสภาพกทม.ครั้งแรก ประชุม ACT เดินหน้าปราบคอรัปชั่น LINK
ครั้งแรกในชุดข้าราชการ กทม. เต็มยศ
เช้า เปิดประชุมสภากทม.ครั้งแรก มีพลเอก อนุพงษ์ เผ่าจินดา รมว.มหาดไทย เปิดประชุม ที่ประชุมเลือก 1) นายวิรัตน์ มีนชัยนันท์ สก.มีนบุรี เป็นประธานสภากรุงเทพมหานคร
2) นางชญาดา วิภัติภูมิประเทศ สก.คันนายาว เป็นรองประธานสภากรุงเทพมหานครคนที่หนึ่ง
3) นายอำนาจ ปานเผือก สก.บางแค เป็นรองประธานสภากรุงเทพมหานครคนที่สอง
บ่าย ประชุมกับ
องค์กรต่อต้านคอรัปชั่น ACT ณ ชั้น 16 อาคารศรีจุลทรัพย์ เขตปทุมวัน โดยมี นายประมนต์ สุธีวงศ์ ประธาน ACT และ นายวิเชียร พงศธร รองประธาน ACT ร่วมประชุม ผู้ว่ากทม.แถลงสรุป ระบุการประชุมวันนี้เหตุจากประชาชนหมดหวังกับภาพลักษณ์กทม.มาก ACT มีบทบาทด้านนี้มานาน [อ่าน
6 ข้อเสนอผู้ว่าปราบโกง ] มีเป้าหมายร่วมกันว่าจะต้านทุจริตคอรัปชั่นได้อย่างไร สิ่งที่จะเกิดคือความโปร่งใสในการกระบวนการ การเปิดเผยข้อมูลการจัดซื้อจัดจ้าง มีการตั้งคณะทำงานมาทำงานและประชุมร่วมกัน ติดตามทุกเดือน จะขอให้มีองค์กรภายนอกมาร่วม อย่าง TDRI ทำมาตรฐานต่างๆ เป็นจุดเริ่มต้น พร้อมๆ กับความกระตือรือร้นของประชาชน ก้าวไปพร้อมกัน โครงการ/ประเด็นที่จะเร่งรัดคือรถไฟสายสีเขียว โรงกำจัดขยะ การขอใบอนุญาตต่างๆ [
อ่านเพิ่มเติม]
เย็น ศูนย์ควบคุมระบบป้องกันน้ำท่วมกรุงเทพ อีกครั้ง ณ เวลาฝนตก มาดูว่าระบบบอกอะไรได้บ้าง จุดใดน่าเป็นห่วง การรับเรื่อง สั่งงาน แก้ไข/ทำงานอย่างไร ประชาชนในพื้นใดประสบปัญหาน้ำท่วม โทรแจ้งได้ที่ 1555 หรือ 02-2485115 จะเข้ามาศูนย์นี้ และจากนี้จะสั่งงานไปยังเขตต่างๆ เพื่อจัดการปัญหาต่อไป
Comment of the day
สวัสดีครับ ผมติดตามไลพ์อาจารย์ เพราะตอนนี้ผมรู้สึกดาวน์กับชีวิตมากๆครับ มีความสุขจริงๆที่ได้ดูไลพ์ - Raweewat Thongklom
เย็น 6 มิถุนายน - ศูนย์ควบคุมน้ำท่วม และ ประชุม Open Bangkok
เย็น ศูนย์ควบคุมระบบป้องกันน้ำท่วมกรุงเทพ อีกครั้ง ณ เวลาฝนตก มาดูว่าระบบบอกอะไรได้บ้าง จุดใดน่าเป็นห่วง การรับเรื่อง สั่งงาน แก้ไข/ทำงานอย่างไร ประชาชนในพื้นใดประสบปัญหาน้ำท่วม โทรแจ้งได้ที่ 1555 หรือ 02-2485115 จะเข้ามาศูนย์นี้ และจากนี้จะสั่งงานไปยังเขตต่างๆ เพื่อจัดการปัญหาต่อไป
Open Bangkok ประชุมที่ ตึกทำงาน กทม.ดินแดง มีหลายทีมมาร่วมเช่น change.org, กลุ่ม data journalist และตัวแทน UNDP - คอนเซปต์ Open Bangkok คือ digitize, decentralize & democratize กรุงเทพจะเป็นศูนย์กลางในการทำข้อมูลต่างๆ ให้กลุ่มองค์กรต่างๆ นำไปใช้ได้ Open ทำยังไงให้ข้อมูลภาครัฐเป็นข้อมูลเปิด (บันดาลใจจาก อดีตปธน.โอบามา) หรือตัวอย่างจากไต้หวัน
เข้าถึงข้อมูล ที่กทม.ได้ทำและเผยแพร่ไว้ ได้ที่
data.bangkok.go.th/dataset/ ต่อไปคาดว่าจะมีการพัฒนาปรับปรุงให้มีมากขึ้น เป็นปัจจุบันมากขึ้น ใช้ประโยชน์ได้ง่ายขึ้น มีการจัดลำดับความสำคัญ ฯลฯ ที่จะพัฒนาไป
ชัชชาติหารือการแก้ปัญหาคอรัปชั่น กทม.
ข้อมูลสำคัญที่ต้องจับตา คือ ข้อมูลการจัดซื้อจัดจ้าง กทม. ที่หลายฝ่ายเฝ้ารอ เหตุเพราะ กทม.มีปัญหาเชิงระบบในประเด็นนี้มานานและไม่เปิดเผย ไม่โปร่งใส ติดตามผู้เชี่ยวชาญคุยในประเด็นนี้และแนวทางที่กทม.จะต้องทำเพื่อเป้าหมายความโปร่งใส การใช้เงิน การใช้อำนาจ จะทำอย่างไร จะมีกลไกตรวจสอบได้อย่างไร [
ThaiPBS]
7 มิถุนายน หารือกรมราชทัณฑ์นำผู้ต้องขังลอกท่อระบายน้ำให้กับ กทม. เริ่ม 1 ก.ค.นี้
หารือกรมราชทัณฑ์นำผู้ต้องขังลอกท่อระบายน้ำให้กับ กทม. เริ่ม 1 ก.ค.นี้
"ที่ผ่านมาจากการลงพื้นที่ได้รับคำชมจากประชาชนส่วนใหญ่บอกว่าการลอกท่อที่ทำโดยผู้ต้องขังจากกรมราชทัณฑ์คุณภาพดี ประชาชนในชุมชนนำอาหารมาเลี้ยงขอบคุณในการทำงานหนักและมีคุณภาพ อีกทั้งผู้ต้องขังได้ทำประโยชน์ให้สังคม มีรายได้เพิ่มเข้ามา ได้ลดโทษ อย่างไรก็ตามการนำผู้ต้องขังมาทำงานนั้น ได้เน้นย้ำในเรื่องของสิทธิมนุษยชน ซึ่งสิ่งเหล่านี้เป็นนโยบายของกรมราชทัณฑ์อยู่แล้ว "
ปัจจุบันกทม. มีท่อระบายน้ำที่ต้องดำเนินการลอกทำความสะอาดทั้งสิ้น 6,564 กิโลเมตร แบ่งเป็นในส่วนของสำนักการระบายน้ำ ที่ดูแลรับผิดชอบ 2,050 กิโลเมตร และสำนักงานเขต 50 เขต ดูแลรับผิดชอบ 4,514 กิโลเมตร ในปีนี้ได้ดำเนินการไปแล้วประมาณ 2,000 กิโลเมตร
"การระบายน้ำในพื้นที่กรุงเทพมหานคร แบ่งเป็น 2 ส่วน ได้แก่ เส้นเลือดใหญ่ ดูแลโดยสำนักการระบายน้ำ คือคลองสายหลักและท่อระบายน้ำหลัก เส้นเลือดฝอย คือคลองย่อยและท่อระบายน้ำย่อย ดูแลโดยสำนักงานเขต จากฝนตกเมื่อช่วงเย็นวานนี้ก็ไม่มีปัญหาน้ำท่วมขัง นับว่าเป็นการตื่นตัวมีการปรับปรุงเครื่องสูบน้ำ มีการทำงานในเส้นเลือดฝอยเพิ่มมากขึ้น"
อธิบดีกรมราชทัณฑ์ กล่าวว่าขอบคุณที่กทม.ให้ความไว้วางใจกรมราชทัณฑ์อีกครั้ง กรมฯ ได้เตรียมผู้ต้องขังไว้ 1,000 คน จาก 10 เรือนจำ พร้อมดำเนินการได้ทันทีในวันที่ 1 ก.ค.นี้ [
pr bangkok] [
The Standard]
หารือการขับเคลื่อนงานด้านคนพิการ
บ่าย - หารือการขับเคลื่อนงานด้านคนพิการของกรุงเทพมหานคร ร่วมกับภาคีเครือข่ายที่เกี่ยวข้อง อาทิ องค์กรคนพิการ 7 ประเภท สมาคมคนตาบอดแห่งประเทศไทย สมาคมคนหูหนวกแห่งประเทศไทย สมาคมคนพิการแห่งประเทศไทย สมาคมเพื่อผู้ปกครองทางจิตแห่งประเทศไทย สมาคมผู้ปกครองคนพิการทางสติปัญญาแห่งประเทศไทย สมาคมผู้ปกครองบุคคลออทิซึม (ไทย) สมาคมสภาคนพิการทุกประเภทแห่งประเทศไทย กรมส่งเสริมและพัฒนาคุณภาพชีวิตคนพิการ(พก.) สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) รับฟังข้อเสนอด้านต่าง ๆ ประกอบด้วย ด้านอาชีพ สิ่งอำนวยสะดวก เทคโนโลยีนวัตกรรม สวัสดิการสังคม การแพทย์และการศึกษา ยังครอบคลุมถึง การส่งเสริมสิทธิสตรีพิการ การป้องกันภัยพิบัติคนพิการ จัดรถบริการรับ-ส่ง กทม. สำหรับคนพิการเป้าหมาย 200 คันเพื่อบริการคนพิการ การเตรียมปรับข้อบัญญัติให้เอื้อคนพิการในทุกมิติ การมีคณะทำงานคนพิการ ใน 50 เขต การมีกลไกในการติดตามผ่านคณะอนุกรรมการคนพิการจังหวัด การเชื่อมโยงคนพิการผ่านสถานีโทรทัศน์หรือวิทยุชุมชนเพื่อให้คนพิการเข้าถึงได้ และจะผลักดันด้านกฎหมาย เพื่อปรับปรุง ข้อบัญญัติ ระเบียบ ให้มีสภาพบังคับในการปฏิบัติให้เกิดแรงผลักดันที่ชัดเจน
“การสร้างมหานครสำหรับทุกคน ไม่ได้มีประโยชน์เฉพาะคนพิการเท่านั้น ผู้สูงอายุ เด็ก ก็จะได้รับประโยชน์ด้วย และยังเป็นการสื่อสารถึงความห่วงใยซึ่งกันและกัน ดูแลซึ่งกันและกัน ห่วงใยเพื่อนร่วมเมือง เป็นมิติที่เหนือกว่าแค่ด้านกายภาพ แต่ยังหมายถึงด้านจิตใจที่มีการเอื้อเฟื้อเผื่อแผ่ การมีน้ำใจ เข้าใจจิตใจผู้อื่น ห่วงใยเพื่อนที่อยู่ร่วมเมืองเดียวกัน ซึ่งเป็นหัวใจสำคัญของเมืองที่มีคุณภาพ ซึ่งกทม.จะทำแต่เพียงหน่วยงานเดียวไม่ได้ ต้องได้รับความร่วมมือจากภาคีเครือข่ายต่าง ๆ เพื่อขับเคลื่อนร่วมกันเพื่อทำให้กรุงเทพฯ ดีขึ้น ” ผู้ว่า ฯ กทม. กล่าว [
prbangkok] [
watch]
ผู้ว่าเผยเตรียมหารือมหาดไทย ปรับระบการจัดเก็บภาษีที่ดินตามโซนผังเมือง แทนประเภทโซน (โซนพาณิชย์ โซนเกษตร) และเสนอให้กทม.ทำประโยชน์เพื่อยกเว้นภาษีให้ [
Mcot]
7 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันอังคารที่ 7 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,224 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,224 ราย
ผู้ป่วยมาจากต่างประเทศ - ราย
ผู้ป่วยสะสม 2,247,744 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 4,824 ราย
หายป่วยสะสม 2,245,578 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 26,889 ราย
---------------------
เสียชีวิต 20 ราย
เสียชีวิตสะสม 8,520 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 725 ราย
มิถุนายน 65 โรงพยาบาลรามคำแหง ลงทุน ในโรงพยาบาลเชียงรายอินเตอร์
7 มิถุนายน 2565 โรงพยาบาลคำแหง จำกัด (มหาชน) ลงทุนวงเงิน 241.55 ล้านบาท ใน บ.วัชรศิริเวช จำกัด ซึ่งดำเนินธุรกิจ โรงพยาบาลเชียงรายอินเตอร์ ตั้งอยู่ที่ ต.รอบเวียง อ.เมือง จ.เชียงราย เป็นโรงพยาบาลเอกชนขนาด 50 เตียง เปิดดำเนินการมาตั้งแต่ 4 กุมภาพันธ์ 2557 จุดมุ่งหมายการลงทุน เนื่องจากเป็นโรงพยาบาลที่ตั้งอยู่ในทำเลที่ดี เป็นเมืองท่องเที่ยว และมีความเจริญทางเศรษฐกิจดี
7 มิถุนายน 2567 มอบป้ายรับรองมาตรฐาน SAN Plus ตลาดต้นสัก สนามบินน้ำ
7 มิถุนายน 2567 นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย มอบป้ายรับรองมาตรฐาน SAN Plus “สะอาด ปลอดภัย ได้มาตรฐาน ” แก่ตลาดต้นสัก สนามบินน้ำ โดยความร่วมมือจากเทศบาลนนทบุรี และผู้ประกอบการในตลาด เพื่อให้ประชาชนมีความมั่นใจในการเข้ามาใช้บริการมากยิ่งขึ้น
8 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันพุธที่ 8 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,688 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,688 ราย
ผู้ป่วยมาจากต่างประเทศ - ราย
ผู้ป่วยสะสม 2,250,432 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 4,130 ราย
หายป่วยสะสม 2,249,708 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 25,426 ราย
---------------------
เสียชีวิต 21 ราย
เสียชีวิตสะสม 8,541 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 708 ราย
8 มิถุนายน 2566 องค์การบริหารส่วนตำบลบางใหญ่ เปิดรับขึ้นทะเบียนทำหมันสุนัขและแมว LINK
องค์การบริหารส่วนตำบลบางใหญ่ เปิดรับขึ้นทะเบียนทำหมันสุนัขและแมว ในเขตพื้นที่ องค์การบริหารส่วนตำบลบางใหญ่ สามารถจองผ่านลิงค์ไลน์ เงื่อนไข
1.รับลงทะเบียนทำหมันสุขนันและแมวในเขตพื้นที่อำเภอบางใหญ่เท่านั้น
2.เจ้าหน้าที่เริ่มรับลงทะเบียนในวันที่ 8 มิถุนายน 2566 (ตั้งแต่เวลา 08.30 น. - 10.30 น.)
รับจำนวนจำกัด โทรศัพท์ : 02-9277477 โทรศัพท์(งานป้องกันฯ) : 085-6791116
กิจกรรมดนตรีในสวน เนื่องในวันต่อต้านยาเสพติดโลก ประจำปี 2567
สำนักงาน ป.ป.ส. ขอเชิญร่วมกิจกรรมดนตรีในสวน เนื่องในวันต่อต้านยาเสพติดโลก ประจำปี 2567 พบกับศิลปินชื่อดังขวัญใจวัยรุ่น ที่จะชวนให้ทุกคนมาขยับร่างกาย ปลุกพลังใจ ร่วมต้านภัยยาเสพติด เเละฟังเพลงเพราะๆ กับบรรยากาศดีๆ ในสวนสุดร่มรื่นไปพร้อมกัน
- เสาร์ที่ 8 มิถุนายน 2567 ศิลปิน : เบล วริศรา และ SEASON FIVE เวลา 17.00-20.00 น. ณ สวนวชิรเบญจทัศ (สวนรถไฟ)
- เสาร์ที่ 15 มิถุนายน 2567 ศิลปิน : PIXXIE และ Yes indeed เวลา 17.00-20.00 น. ณ สวนปทุมวนานุรักษ์ (สวนสีเขียวข้างเซ็นทรัลเวิร์ลด์)
นอกจากนี้ ภายในงานยังมีจุดถ่ายรูปสุดเก๋ กิจกรรม Workshop และกิจกรรมดีๆ ให้ร่วมสนุกพร้อมลุ้นรับของรางวัลมากมาย บอกได้เลยใครไม่มาที่นี่พลาดมากๆ งานนี้เข้าชมฟรี เตรียมตัวให้พร้อม ปล่อยใจเเล้วมาจอยกัน
9 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันพฤหัสบดีที่ 9 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 3,185 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 3,185 ราย
ผู้ป่วยมาจากต่างประเทศ - ราย
ผู้ป่วยสะสม 2,253,617 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 3,326 ราย
หายป่วยสะสม 2,253,034 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 25,262 ราย
---------------------
เสียชีวิต 23 ราย
เสียชีวิตสะสม 8,564 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 678 ราย
สถานพยาบาล ม.เกษตรศาสตร์ เชิญนิสิต มก.อบรม ฟรี ปฐมพยาบาลเบื้องต้น 9, 23, 30 มิถุนายน 2566 LINK
สถานพยาบาลมหาวิทยาลัยเกษตรศาสตร์ ขอเชิญนิสิต มก. ทุกท่านสมัครเข้าร่วมโครงการอบรมปฐมพยาบาลเบื้องต้นประจำปี 2566 วันที่ 9, 23, 30 มิถุนายน 2566 เวลา 16.30 น. – 20.00 น. จัดการอบรม 3 รอบ
รอบที่ 1 วันศุกร์ที่ 9 มิถุนายน 2566 เวลา 16.30 น. – 20.00 น.
รอบที่ 2 วันศุกร์ที่ 23 มิถุนายน 2566 เวลา 16.30 น. – 20.00 น.
รอบที่ 3 วันศุกร์ที่ 30 มิถุนายน 2566 เวลา 16.30 น. – 20.00 น.
ณ อาคารสถานพยาบาล สามารถรับบัตรผ่านชั่วโมงกิจกรรมนิสิตด้านพัฒนาสุขภาพได้
สนใจ ติดต่อลงทะเบียนล่วงหน้าได้ที่ งานการพยาบาล อาคาร 1 ชั้น 1 สถานพยาบาล มก.
โทร. 029406630-1 ต่อ 101/มือถือ. 0941531190
ลงทะเบียนผ่านเว็บได้ที่ https://www.inf.ku.ac.th/firstaid
เยี่ยมชมการทำงานของ Essex and Herts Air Ambulance (EHAAT)


วันที่ 9 มิ.ย. 2566 เวลา 09:00-11:30 น. เรืออากาศเอกนายแพทย์อัจฉริยะ แพงมา เลขาธิการสถาบันการแพทย์ฉุกเฉินแห่งชาติพร้อมด้วย พลอากาศตรีเฉลิมพร บุญสิริ กรรมการการแพทย์ฉุกเฉินนาวาเอก (พิเศษ) พิสิทธิ์ เจริญยิ่ง รองเลขาธิการสถาบันการแพทย์ฉุกเฉินแห่งชาติ นายแพทย์ชายวุฒิ สววิบูลย์ ผู้อำนวยการวิทยาลัยวิชาการเตรียมความพร้อมด้านการแพทย์ฉุกเฉิน นายวสันต์ เวียนเสี้ยว ผู้จัดการกลุ่มงานสนับสนุนปฏิบัติการฉุกเฉิน และนางสาวดังฝัน พรมขำ ศูนย์ประสานความร่วมมือระหว่างประเทศด้านการแพทย์ฉุกเฉิน เยี่ยมชมการทำงานของ Essex and Herts Air Ambulance (EHAAT) ที่มีลักษณะเป็นองค์กรไม่แสวงหากำไร/มูลนิธิ ที่ให้บริการการแพทย์ฉุกเฉินด้วยเฮลิคอปเตอร์และรถยนต์แบบเร่งด่วน ในการให้บริการการแพทย์ฉุกเฉินในสถานการณ์ต่างๆ EHAAT ให้บริการการแพทย์ฉุกเฉินในพื้นที่ Essex, Hertfordshire และพื้นที่โดยรอบด้วยเฮลิคอปเตอร์รุ่น AW169 และมีกิจกรรมการฝึกอบรมให้แก่บุคลากรที่ทันสมัย เช่น ห้องจำลองสถานการณ์เสมือนจริงที่จำลองตำแหน่งที่นั่งและปฏิบัติภารกิจของทีมบนเฮลิคอปเตอร์ และใช้การฉายภาพบนผนังเพื่อให้เห็นสถานการณ์ที่ใกล้เคียงความเป็นจริงในสถานที่ต่างๆ เช่น ในสถานบันเทิงหรือบ้านเรือน
จากนั้น เวลา 13:30 -16:00 น. คณะฯ ได้เยี่ยมชมการทำงานของ London Air Ambulance (LAA) ซึ่งมีลักษณะเป็นมูลนิธิ (Charity) ที่ให้บริการการแพทย์ฉุกเฉินด้วยเฮลิคอปเตอร์ร่วมกับ Royal London Hospital สหราชอาณาจักร LAA ให้บริการผู้ป่วยจำนวนมากกว่า 17,000 คนในบริเวณพื้นที่ลอนดอนในแต่ละปี โดยจะให้ความสำคัญกับการเจ็บป่วยฉุกเฉินแบบ Trauma เท่านั้น เช่น การโดนแทง การโดนยิง การตกจากที่สูง อุบัติเหตุทางจราจรที่รุนแรง การโดนรถไฟทับ และเหตุฉุกเฉินที่มีความรุนแรงและเร่งด่วนมากอื่นๆ และมีหลักการทำงานคือการนำทีมแพทย์และ Paramedic ไปถึงผู้ป่วยให้เร็วที่สุดเพื่อให้การรักษาด้วยวิธีการต่างๆ เช่น การให้ยาหรือการผ่าตัดเปิดช่องอก จึงทำให้ทีมแพทย์นะ่นประกอบไปด้วยแพทย์สาขาต่างๆหลากหลาย จากข้อมูลยังพบด้วยอีกว่า LAA ให้บริการแก่ผู้ป่วยที่ส่วนใหญ่อายุไม่มากนักและเป็นผู้ชายมากถึง 80 %
เทศกาล Korea Week ณ ลานถาวร อ.บ้านฉาง จ.ระยอง 9-11 มิถุนายน 2566
เทศกาล Korea Week ณ ลานถาวร อ.บ้านฉาง จ.ระยอง ตั้งแต่วันที่ 9-11 มิถุนายน 2566 #เรายกฮงแดมาไว้ที่บ้านฉาง #สายเกาห้ามพลาด ภายในงานจัดเต็มกับคาราวานอาหารเกาหลีและอาหารอื่นๆหลากหลายสัญชาติกว่า 100 ร้านค้า การแสดง Cover Dance โชว์พิเศษกว่า 10 วง Random Dance (วงการ K-Pop ต้องลุกเป็นไฟ) การแสดงดนตรีสดทุกคืน การแข่งขันกินอาหารเกาหลี 9 -11 มิถุนายน 2566 ลานถาวร ซอยเทศบาล46 อ.บ้านฉาง จ.ระยอง เดินถ่ายรูปเช็คอิน กับจุดเช็คอินปังมากกก เหมือนยกฮงแดมาไว้ที่บ้านฉาง *** ติดต่อร้านค้า : 062-7813195 / 065-5918959
เทศกาลทุเรียนระยอง ถนนยมจินดา 9 - 10 มิถุนายน 2566
เทศกาลทุเรียนระยอง การนำเสนอวัตถุดิบท้องถิ่นและผลไม้ของระยองขึ้นชื่อ การทำสวนออร์แกนิคแบบปลอดภัยที่เป็นมิตรต่อสิ่งแวดล้อมและตลาดเก่าริมคลองเมืองระยองหลังบ้านสัตย์อุดม
• วันที่ 9 - 10 มิถุนายน 2566 ตั้งแต่เวลา 17:00 - 22:00 น. ถนนยมจินดา จ.ระยอง
ฟรี! บริการรถรับส่ง เส้นทางเดินรถนิลมังกร : ตลาดเนินอุไร - แยกมะขามใหญ่ (ซุ้มประตูฝั่งตลาดโรงสี)
พยาบาลวิชาชีพ 2 ท่าน โรงพยาบาลกรุงเทพปากช่อง ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ LINK
9 มิถุนายน 2566 เวลา 12.30 น. พว.บัณฑิต ดีใต้ พยาบาลวิชาชีพ หัวหน้าแผนกอุบัติเหตุและฉุกเฉิน และ พว.ชยาภรณ์ แย้มจันทึก พยาบาลวิชาชีพ หัวหน้าแผนกผู้ป่วยนอก สังกัดโรงพยาบาลกรุงเทพปากช่อง ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ ที่บริเวณแยกไฟแดงบ้านโพธิ์ ตำบลบ้านโพธิ์ อำเภอเมือง จังหวัดนครราชสีมา พบเป็นผู้บาดเจ็บ 2 ราย โดยรายที่ 1 เป็นเพศหญิง ประเมินอาการรู้สึกตัวดี มีแผลถลอกตามร่างกาย ปวดขาด้านซ้าย จึงทำการปฐมพยาบาลและทำแผลเบื้องต้น และผู้บาดเจ็บอีกรายเป็นเพศชาย หมดสติ คลำไม่พบชีพจร จึงได้ให้การช่วยเหลือด้วยการกดนวดหัวใจ (CPR) ร่วมกับทีมกู้ชีพ ผู้บาดเจ็บเสียชีวิตในเวลาต่อมา จึงได้ประสานหน่วยงานที่เกี่ยวข้องให้การดูแลต่อไป
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.บัณฑิต ดีใต้ และ พว.ชยาภรณ์ แย้มจันทึก ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดีจนเป็นที่ประจักษ์ต่อสังคม
360 องศา ปลดล็อค "กัญชา" 10-12 มิถุนายน 2565 LINK
มหกรรม 360 องศา ปลดล็อคกัญชา ประชาชนได้อะไร วันที่ 10-12 มิถุนายน 2565 เวลา 09.00-16.30น. ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จ.บุรีรัมย์ ลงทะเบียนเข้าร่วมงานฟรี เข้าฟรี ชมฟรี มีของแจก ลงทะเบียนล่วงหน้า
NECANN 2022 LINK
NECANN 2022 อีกผู้จัดที่วางแผนมาแบบยาวเต็มปี 2022 จัด 7 งานทั่วสหรัฐ
New York Cannabis Convention May 14-15, 2022 72 Noble St, Brooklyn, NY
Illinois Cannabis Convention Chicago, IL | June 10-11, 2022 McCormick Place Lakeside Center
Vermont Cannabis Convention Burlington, VT | June 25-26, 2022 Champlain Valley Expo
New York Cannabis Convention Albany, NY | August 26-27, 2022 Albany Capitol Center, 55 Eagle St
New Jersey Cannabis Convention Atlantic City, NJ | Sept 9-10, 2022 Atlantic City Convention Center
Maine Cannabis Convention Portland, ME | Sept 24-25, 2022 Portland Sports Complex
Maine NECANN Cup NEW EVENT! High Lifestyle Show HLS square Boxborough, MA | October 7-9, 2022 Boxboro Regency Hotel
10 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันศุกร์ที่ 10 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,836 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,835 ราย
ผู้ป่วยมาจากต่างประเทศ 1 ราย
ผู้ป่วยสะสม 2,256,453 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 3,518 ราย
หายป่วยสะสม 2,256,552 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 24,556 ราย
---------------------
เสียชีวิต 24 ราย
เสียชีวิตสะสม 8,588 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 673 ราย
Amazing Kids Triathlon Race 2023 (Series 1) LINK
Amazing Kids is Pattana’s signature children race, including all 3-multi-sports disciplines in one weekend.
Triathlon / Duathlon / Aquathon - All 3 races will be based on a point system. The overall winner will be the person with the highest number of points. It will be fast and fun racing due to the short distances involved in all 3 race formats.
However, this year it will be done with a twist in which Amazing Kids Duathlon will be on Saturday and Triathlon, Aquathlon will be on Sunday. Which will allow the athletes to compete in one or in all 3 events over the weekend.
Series 1: 10 - 11 June 2023
Series 2: 9 - 10 September 2023
Series 3: 18 - 19 November 2023
Amazing kids Triathlon 2023 Series 1
Registration Open:
• Early bird price open on 29 March - 30 April 2023
• Normal price open on 1-31 May 2023
Technical issue: 065-524-9100
Facebook Page: C55 Events
เฮลิคอปเตอร์รับเด็กหญิง 8 ปี ไส้ติ่งอักเสบเฉียบพลัน จากแม่สะเรียง ส่งรพ.แม่สะเรียง
วันที่ 10 มิถุนายน 2566 เวลา 11.20 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอน ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศหญิง อายุ 8 ปี ภูมิลำเนาอยู่ที่บ้านปอหมื้อ ม.9 ต.แม่คง อ.แม่สะเรียง จ.แม่ฮ่องสอน ประวัติ มีอาการปวดท้องด้านขวา มีไข้ คลื่นไส้อาเจียน เข้ารับการรักษาที่สุขศาลาพระราชทานศูนย์การเรียนตำรวจตระเวนชายแดนบ้านปอหมื้อ ได้รับการรักษาเบื้องต้น แต่อาการไม่ดีขึ้น จึงได้ปรึกษาด้านการรักษาพยาบาลกับโรงพยาบาลแม่สะเรียง ได้รับการวินิจฉัยโรค acute appendicitis ( ไส้ติ่งอักเสบเฉียบพลัน ) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน และส่งต่อไปรักษาที่โรงพยาบาลแม่สะเรียง จ.แม่ฮ่องสอน ดังนั้นจึงได้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน จากหน่วยเฉพาะกิจสิงหนาท จ.แม่ฮ่องสอน ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ประสิทธิ์ ตอสกุล, ร.ท.ประสิทธิ์พร ทันลา, จ.ส.อ.อนุพงศ์ โคตรพรม, จ.ส.อ.สมชาย ยำยวน และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลแม่สะเรียง จ.แม่ฮ่องสอน ประกอบด้วย พญ.กันติชา วาณิชย์เจริญชัย, นายภาคภูมิ ขยันกิจ, นางสาวอรอนงค์ ไกรเกริกเกียรติ และเมื่อเวลา 13.24 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลแม่สะเรียง จ.แม่ฮ่องสอน เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
จันทเขลม Food Fair 10-18 มิถุนายน 2566
จันทเขลม Food Fair ระหว่างวันที่ 10-18 มิถุนายน 2566 ลานอเนกประสงค์จันทเขลม อ.คิชฌกูฏ จ.จันทบุรี
นักศึกษาพยาบาล ห้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถบรรทุก บริเวณอำเภอตาพระยา จังหวัดสระแก้ว LINK
10 มิถุนายน 2566 เวลาประมาณ 14.20 น. นางสาวพัชรีย์ สารตัน นักศึกษาพยาบาล ชั้นปีที่ 3 คณะพยาบาลศาสตร์ มหาวิทยาลัยเกษมบัณฑิต ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถบรรทุก บริเวณอำเภอตาพระยา จังหวัดสระแก้ว ในระหว่างที่เดินทางกลับภูมิลำเนา จากการตรวจสอบ ณ จุดเกิดเหตุ พบผู้บาดเจ็บเป็นชายชาวต่างชาติ 1 ราย ประเมินอาการผู้บาดเจ็บรู้สึกตัวดี มีบาดแผลบริเวณศีรษะและใบหน้า จึงได้ช่วยสื่อสารให้ข้อมูล ประเมินสัญญาณชีพ และปฐมพยาบาลเบื้องต้น พร้อมทั้งโทรแจ้ง 1669 เพื่อนำส่งผู้บาดเจ็บไปรักษาต่อที่โรงพยาบาลต่อไป
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ นางสาวพัชรีย์ สารตัน ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดี จนเป็นที่ประจักษ์ต่อสังคม
พยาบาลวิชาชีพชำนาญการ อำเภอป่าซาง จังหวัดลำพูน ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถจักรยานยนต์ LINK
10 มิถุนายน 2566 เวลา 09.00 น. พว.สุพาภรณ์ กันยะติ๊บ พยาบาลวิชาชีพชำนาญการ สังกัดโรงพยาบาลส่งเสริมสุขภาพตำบลน้ำดิบ อำเภอป่าซาง จังหวัดลำพูน ได้ให้การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุรถจักรยานยนต์ชนกับรถจักรยานยนต์ ในเขตพื้นที่อำเภอป่าซาง จังหวัดลำพูน พบผู้บาดเจ็บจำนวน 2 ราย ได้ใช้ทักษะทางวิชาชีพในการประเมินอาการเบื้องต้น ประเมินสัญญาณชีพและระดับความรู้สึกตัว ทำการปฐมพยาบาล ณ จุดเกิดเหตุ โดยทีมกู้ภัยจากมูลนิธิฯ นำส่งผู้ป่วยไปรักษาต่อยังโรงพยาบาล อาการปลอดภัยดี
ในการนี้สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.สุพาภรณ์ กันยะติ๊บ พยาบาลวิชาชีพชำนาญการ โรงพยาบาลส่งเสริมสุขภาพตำบลน้ำดิบ อำเภอป่าซาง จังหวัดลำพูนที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดี จนเป็นที่ประจักษ์ต่อสังคม
20 โครงการ โดย สำนักการแพทย์ กรุงเทพมหานนคร ปี 2568
สำนักการแพทย์ ดูแลรับผิดชอบดำเนินการ 20 โครงการ งบประมาณ 6,546 ล้านบาท ประกอบด้วย
5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม 5 โครงการ งบประมาณ 97.00
5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข 6 โครงการ งบประมาณ 6,426 ล้านบาท
5.3 เพิ่มประสิทธิภาพ การเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ 5 โครงการ งบประมาณ 13 ล้านบาท
5.4 พัฒนานวัตกรรมการรักษาพยาบาล 3 โครงการ งบประมาณ 10 ล้านบาท
8.2 สนับสนุนเงื่อนไขการดำรงชีพคนไร้บ้าน คนพิการ และกลุ่มเปราะบาง
1 โครงการ งบประมาณ 0 บาท
20 โครงการโดยสำนักการแพทย์
5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม
1โครงการพัฒนาระบบการแพทย์ฉุกเฉินทางไกล (EMS Telemedicine) kpi
2 โครงการเพิ่มประสิทธิภาพการเข้าถึงเพื่อช่วยเหลือผู้เจ็บป่วยฉุกเฉินในระบบบริการการแพทย์ฉุกเฉินกรุงเทพมหานคร
3 กิจกรรมการให้บริการการแพทย์ฉุกเฉินด้วยรถจักรยานยนต์ฉุกเฉินทางการแพทย์ (Motorlance)
4 กิจกรรมให้การสนับสนุนวิทยากรฝึกอบรมการช่วยฟื้นคืนชีพขั้นพื้นฐาน (CPR) และการใช้เครื่องกระตุกหัวใจไฟฟ้าอัตโนมัติ (AED)
5 กิจกรรมการให้บริการคลินิกสุขภาพเพศหลากหลายกรุงเทพมหานคร (BKK Pride Clinic)
5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข
6 โครงการก่อสร้างโรงพยาบาลพระมงคลเทพมุนี (สด จนฺทสโร) วัดปากน้ำ เขตภาษีเจริญ (ปี 2568 -2571)
7 โครงการก่อสร้างอาคารโรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ (ปี 2567 – 2571) (งบประมาณทั้งสิ้น 2,017,222,000.-บาท)
8 โครงการก่อสร้างโรงพยาบาลบางนา กรุงเทพมหานคร (ปี 2566 – 2570) (งบประมาณทั้งสิ้น 3,016,100,000.-บาท)
9 โครงการปรับปรุงอาคารอเนกประสงค์ 5 ชั้น โรงพยาบาลเวชการุณย์รัศมิ์ (ปี 2567 – 2568) (งบประมาณทั้งสิ้น 25,100,000.-บาท)
10 โครงการก่อสร้างอาคารอเนกประสงค์โรงพยาบาลตากสิน (ปี 2561 – 2568) (งบประมาณทั้งสิ้น 2,087,038,618.-บาท)
11 โครงการก่อสร้างศูนย์การแพทย์โรงพยาบาลกลางและอาคารสำนักการแพทย์ (ปี2566–2571) (งบประมาณทั้งสิ้น 4,000,000,000.-บาท)
5.3 เพิ่มประสิทธิภาพ การเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ 12 กิจกรรมการเชื่อมโยง HIS โรงพยาบาล 11 แห่ง กับระบบ e-Prescription สปสช.
13 กิจกรรมการรับ-ส่งต่อผู้ป่วยระหว่างโรงพยาบาลในสังกัดสำนักการแพทย์/ศูนย์บริการสาธารณสุข/คลินิกชุมชนอบอุ่นผ่านระบบ e-Referral
14 โครงการจัดหาอุปกรณ์จัดเก็บข้อมูลแบบ SAN / NAS
15 กิจกรรมการเปิดให้บริการศูนย์เทคโนสุขภาพดี
16 กิจกรรมการรักษาพยาบาลด้วยระบบโทรเวชกรรม(Telemedicine)
5.4 พัฒนานวัตกรรมการรักษาพยาบาล
17 กิจกรรมการเปิดให้บริการ UMSC ในโรงพยาบาลสังกัดสำนักการแพทย์
18 โครงการจัดตั้งคลินิกรักษ์หัวใจ (โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ) (**แทนศูนย์โรคไต โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ เนื่องจากรอตึกใหม่โดยเริ่มก่อสร้าง ปี 2567)
19 โครงการจัดตั้งศูนย์บริบาลผู้ป่วยระยะฟื้นฟู (Intermediate Care : IMC) (โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ) (งบประมาณทั้งสิ้น 12,403,203.- บาท) (เงินนอกงบประมาณ)
8. ด้านสังคมดี
8.2 สนับสนุนเงื่อนไขการดำรงชีพคนไร้บ้าน คนพิการ และกลุ่มเปราะบาง
20 กิจกรรมการให้บริการศูนย์บริการคนพิการแบบเบ็ดเสร็จในโรงพยาบาลสังกัดสำนักการแพทย์
เทศบาลนครตรัง จัดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ชุมชนวังตอ
10 มิถุนายน 2567 ดร.สัญญา ศรีวิเชียร นายกเทศมนตรีนครตรัง มอบหมายให้ นายแพทย์ไพศาล เกื้ออรุณ รองนายกเทศมนตรีนครตรัง เป็นประธานเปิดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ชุมชนวังตอ (โครงการตามแนวพระราชดำริด้านสาธารณสุข) ประจำปีงบประมาณ 2567 โดยมี น.ส.ณิชารีย์ วีระพรชัยกุล ประธานคณะกรรมการชุมชนวังตอ กล่าวรายงานวัตถุประสงค์ของการจัดโครงการฯ และมี นางสุดใจ ทองย้อย นายวีร์รัศมิ์ เจือกโว้น รองนายกเทศมนตรีนครตรัง และ นางจันทิพย์ รังสิปราการ รองปลัดเทศบาล ร่วมพบปะเป็นขวัญและกำลังใจแก่ผู้เข้าร่วมโครงการ และสมาชิกสภาเทศบาลนครตรัง เขต 4 ร่วมเป็นเกียรติในพิธีเปิด ณ ที่ทำการชุมชนวังตอ ต.ทับเที่ยง อ.เมือง จ.ตรัง
ด้วยชุมชนวังตอ เทศบาลนครตรัง ได้รับการอนุมัติโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ชุมชนวังตอ (โครงการตามแนวพระราชดำริด้านสาธารณสุข) ประจำปีงบประมาณ 2567 และได้รับการสนับสนุนงบประมาณจากเทศบาลนครตรัง จำนวนเงิน 20,000 บาท เพื่อจัดทำ "โครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ชุมชนวังตอ" โดยมีวัตถุประสงค์เพื่อเสริมสร้าง สนับสนุนให้ประชาชนมีความรู้ มีภาวะสุขภาพที่ดีได้รับการดูแลด้านสาธารณสุขเบื้องต้น โดยพึ่งพิงตนเองได้อย่างถูกต้อง เน้นกิจกรรมต่างๆ เช่น การอบรมให้ความรู้เรื่องการปฐมพยาบาลเบื้องต้นอย่างถูกวิธี เพื่อให้ประชาชนสามารถนำไปใช้ประโยชน์ช่วยเหลือผู้อื่นได้ก่อนนำส่งต่อสถานพยาบาลต่อไป
11 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันเสาร์ที่ 11 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,501 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,501 ราย
ผู้ป่วยมาจากต่างประเทศ - ราย
ผู้ป่วยสะสม 2,258,954 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 2,917 ราย
หายป่วยสะสม 2,259,469 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 24,112 ราย
---------------------
เสียชีวิต 28 ราย
เสียชีวิตสะสม 8,616 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 639 ราย
HUA HIN Marathon 2023 - June 11
Hua Hin Marathon is a running event that raises funds to support environmental preservation activities in the municipality of Hua Hin and to continue raising funds for the Hua Hin Mangrove Ecosystem Development Project, which covers 18 rai in the vicinity of Khao Krailas Temple.
Race distance:
- MARATHON 42.195 km. START 03.00 AM. CUT OFF 10.00 AM. (7 hours.)
- HALF MARATHON 21 km. START 05.00 AM. CUT OFF 08.30 AM. (3.30 hours.)
- FUN RUN 5 km. (Walking-Running for health) START 05.45 hrs. CUT OFF 08.00 hrs. (2.15 hrs.)
Laguna Phuket Marathon 2023 LINK
Phuket Marathon is the largest sporting event and a top marathon major in Thailand, Supersports Laguna Phuket Marathon meets stringent international standards. Certified by IAAF AIMS (Association of International Marathons and Distance Races) since the event’s first year, it is a qualifying event for the Boston Marathon.
RACE PACK COLLECTION & EXPO
Race Venue: Big maquee, Laguna grove [
map]
Friday, 9 June 2023 11:00 - 19:00 Race pack collection & expo
Saturday, 10 June 2023 Race Day 10.5 KM / 5 KM / 2 KM Kids Run
Sunday, 11 June 2023 Race Day Marathon & Marathon Relay start
เชียงใหม่ลำเลียงผู้ป่วยฉุกเฉินหญิง 2 ราย
วันที่ 11 มิ.ย. 66 เวลา 06.49 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วย 2 ราย รายแรกเพศหญิงอายุ 40 ปี คลอดบุตรแล้วมีภาวะรกค้าง รายที่สองเด็กหญิงทารกแรกคลอด มีภาวะคลอดก่อนกำหนด โดยได้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน โดยต้นทางโรงพยาบาลเวียงแหง อำเภอเวียงแหง จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลสันทราย จังหวัดเชียงใหม่
รายที่ 1 ได้รับการสนับสนุนอากาศยานจากหน่วยบินกองกำลังผาเมือง จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย ร.อ.กฤติเดช ขะวะเขื่อน, ร.ท.ปฎิภาณ แก้วสนิท, จ.ส.อ.สุริยา พรมชาติ, จ.ส.ต.ปัญจนาสย์ ป้อมทอง ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่ ประกอบด้วย ผศ.ดร.นพ.บวร วิทยชำนาญกุล, น.ส.วันชนก วิริยะกิจ, นายสรรค์สกุล วุฒิสรรพ์
รายที่ 2 ได้รับการสนับสนุนอากาศยานจากหน่วยกองบินตำรวจ จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วยพ.ต.ต.จักรพันธ์ อธิคมภาษิต, ร.ต.อ.สัณหวัช พรหมจรรย์, ส.ต.อ.เจษฎา เหล่ามงคล ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่ ประกอบด้วย นพ.อิทธาวุธ งามพสุธาดล, พญ.กัญญรัตน์ อินพรหม, น.ส.วิรากานต์ สมณะ, น.ส.วันพร ไพศาล
ผู้ป่วยทั้งสองรายได้รับเข้าการรักษาต่อที่โรงพยาบาลโรงพยาบาลสันทราย เป็นที่เรียบร้อย เมื่อเวลา 10.44 น. 10.46 น. ตามลำดับ
12 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันอาทิตย์ที่ 12 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 2,474 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 2,474 ราย
ผู้ป่วยมาจากต่างประเทศ - ราย
ผู้ป่วยสะสม 2,261,428 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 4,236 ราย
หายป่วยสะสม 2,263,705 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 22,330 ราย
---------------------
เสียชีวิต 20 ราย
เสียชีวิตสะสม 8,636 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 659 ราย
พว. โรงพยาบาลสุโขทัย ให้การช่วยเหลือผู้บาดเจ็บจำนวน 2 ราย จากอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ LINK
เมื่อวันที่ 12 มิถุนายน 2566 ที่ผ่านมา เวลาประมาณ 17.00 น. พว.เปรมอนันต์ นนทประสาท พยาบาลวิชาชีพปฏิบัติการ หอผู้ศัลยกรรมกระดูกและข้อ โรงพยาบาลสุโขทัย จังหวัดสุโขทัย ได้ให้การช่วยเหลือผู้บาดเจ็บจำนวน 2 ราย จากอุบัติเหตุรถจักรยานยนต์ชนกับรถยนต์ บริเวณถนนสายวังไม้ขอน-ทับผึ้ง อำเภอศรีสำโรง จังหวัดสุโขทัย โดยการใช้ทักษะทางวิชาชีพในการประเมินอาการและสัญญาณชีพ ให้การช่วยเหลือและปฐมพยาบาล ณ จุดเกิดเหตุ จนทีมกู้ภัยจากมูลนิธินำส่งผู้ป่วยไปรักษาต่อ หลังการช่วยเหลือผู้ป่วยได้รับการส่งตัวไปยังโรงพยาบาล อาการปลอดภัยดี
ในการนี้ สภาการพยาบาลขอแสดงความชื่นชมและขอเชิดชูเกียรติ พว.เปรมอนันต์ นนทประสาท พยาบาลวิชาชีพปฏิบัติการ หอผู้ศัลยกรรมกระดูกและข้อ โรงพยาบาลสุโขทัย จังหวัดสุโขทัย ที่ได้เสียสละและใช้ความรู้ทางวิชาชีพทำความดี จนเป็นที่ประจักษ์ต่อสังคม
13 มิถุนายน 2565 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันจันทร์ที่ 13 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 1,801 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 1,795 ราย
ผู้ป่วยมาจากต่างประเทศ 6 ราย
ผู้ป่วยสะสม 2,263,229 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 2,330 ราย
หายป่วยสะสม 2,266,035 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 21,786 ราย
---------------------
เสียชีวิต 15 ราย
เสียชีวิตสะสม 8,651 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 661 ราย
รพ.วิภาวดี เปิดอบรมปฐมพยาบาลและกู้ชีพขั้นพื้นฐาน รอบปี 2566 ฟรี 7 รอบ เดือนมิถุนายน-กรกฏาคม LINK
รพ.วิภาวดี เปิดอบรมการปฐมพยาบาลเบื้องต้นและกู้ชีพขั้นพื้นฐานสำหรับประชาชนทั่วไปปี 2566 (First Aid and BLS with AED for Bystander) ปีที่ 24 จำนวน 7 รุ่น เดือนมิถุนายน-กรกฎาคม 2566 อบรมฟรี ไม่มีค่าใช้จ่าย ลงทะเบียนล่วงหน้าด่วน
รุ่นที่ 1 วันอังคารที่ 13 มิ.ย. 2566
รุ่นที่ 2 วันอังคารที่ 20 มิ.ย. 2566
รุ่นที่ 3 วันอังคารที่ 27 มิ.ย. 2566
รุ่นที่ 4 วันอังคารที่ 4 ก.ค. 2566
รุ่นที่ 5 วันอังคารที่ 11 ก.ค. 2566
รุ่นที่ 6 วันอังคารที่ 18 ก.ค. 2566
รุ่นที่ 7 วันอังคารที่ 25 ก.ค. 2566
เวลาอบรม ตั้งแต่ เวลา 13.00 – 16.00 น. ภาคทฤษฎีและภาคปฏิบัติ
สอบถามโทร. 02-561-1111, 02-058-1111
Cosmoprof CBE Asean 2024 วันที่ 13-15 มิถุนายน 2567
Cosmoprof CBE Asean 2024 วันที่ 13 - 15 มิ.ย. 2567 ศูนย์การประชุมแห่งชาติสิริกิติ์ - QSNCC งานที่รวมออกงานแสดงสินค้าและแบรนด์ด้านความงามคุณภาพกว่า 500 บริษัท บนพื้นที่จัดแสดงงานกว่า 10,000 ตารางเมตร ทำให้งานครั้งแรกของ คอสโมพรอฟ ซีบีอี อาเซียน กลายเป็นศูนย์รวมของอุตสาหกรรมความงามในอาเซียนอย่างแท้จริง
14 มิถุนายน 65 LINK
รายงานผู้ป่วยติดเชื้อโควิด-19
วันอังคารที่ 14 มิถุนายน 2565
ผู้ป่วยใหม่ จำนวน 1,833 ราย จำแนกเป็น
ผู้ป่วยในประเทศ 1,832 ราย
ผู้ป่วยมาจากต่างประเทศ 1 ราย
ผู้ป่วยสะสม 2,265,062 ราย (ตั้งแต่ 1 มกราคม 2565)
---------------------
หายป่วยกลับบ้าน 2,155 ราย
หายป่วยสะสม 2,268,190 ราย (ตั้งแต่ 1 มกราคม 2565)
ผู้ป่วยกำลังรักษา 21,445 ราย
---------------------
เสียชีวิต 19 ราย
เสียชีวิตสะสม 8,670 ราย (ตั้งแต่ 1 มกราคม 2565)
จำนวนผู้ป่วยปอดอักเสบ
รักษาตัวอยู่ในโรงพยาบาล 656 ราย
* เนื่องจากตั้งแต่ 1 มิ.ย. 65 เป็นต้นมา มีการปรับระบบรายงาน
โดยรายงานเฉพาะผู้ป่วยที่ต้องรับการรักษาในโรงพยาบาล
จึงทำให้รายงานยอดผู้ป่วยสะสม มีจำนวนที่น้อยกว่ายอดผู้หายป่วยสะสม
14 มิถุนายน วันผู้บริจาคโลหิตโลก World Blood Donor Day 2022
14 มิถุนายน วันผู้บริจาคโลหิตโลก World Blood Donor Day 2022
ร่วมระลึกถึง ดร.คาร์ล แลนด์สไตเนอร์ ชาวออสเตรีย ผู้ค้นพบหมู่โลหิตระบบ ABO เป็นครั้งแรก ซึ่งมีความสำคัญอย่างยิ่งต่องานบริการโลหิตทั่วโลก และเป็นวันแห่งการขอบคุณผู้บริจาคโลหิต [
Thai Red Cross Society]
Paws in the Park 14-16 มิถุนายน 67
Paws in the Park 14-16 มิถุนายน 67 ตั้งแต่เวลา 10.00-20.00 น. เดอะ พาซิโอ พาร์ค กาญจนาภิเษก (บริเวณพลาซ่า หลังธนาคารไทยพาณิชย์ ) Paws Behavior training class กิจกรรมปรับพฤติกรรมสุนัข จากนักปรับพฤติกรรมฟรี!! ตั้งแต่เวลา 16:00 น. เป็นต้นไป วันที่ 15 มิ.ย. หัวข้อ รู้ใจหมา By @ohana and friends วันที่ 16 มิ.ย. หัวข้อ น้องหมาหมาหวงของ Khon Jai Ma - Natt Hamon Workshop & DIY ทำป้ายชื่อห้อยคอสุดคิ้วท์ฟรี Paws mini grooming บริการตัดเล็บน้องหมาฟรี‼ โดยช่างมืออาชีพจากร้าน P&P Pet shop Check me up บริการตรวจสุขภาพน้องๆ ฟรี‼ จาก โรงพยาบาลสัตว์แสนดี 24 ชั่วโมง
ฮ.รับผู้ป่วยหญิง 50 ปี อาการโรคลมชัก ชักเกร็ง 10 ครั้ง จาก ต.ไล่โว่ อ.สังขละบุรี ส่งรพ.ทองผาภูมิ
วันที่ 15 มิถุนายน 2565 เวลา 12.48 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการศูนย์จังหวัดกาญจนบุรี ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิง อายุ 50 ปี มีอาการชักเกร็ง 10 ครั้ง หลังชักหมดสติไม่รู้สึกตัว วินิจฉัย โรคลมชัก (R/O seizure) เพื่อส่งผู้ป่วยจากสาธารณสุขชุมชนบ้านจะแก ตำบลไล่โว่ อำเภอสังขละบุรี จังหวัดกาญจนบุรี ไป โรงพยาบาลทองผาภูมิ ตำบลท่าขนุน อำเภอทองผาภูมิ จังหวัดกาญจนบุรี สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองบินตำรวจ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลทองผาภูมิ
ผจญภัยสัตว์ทะเลทราย THE MALL LIFESTORE THAPRA DESERT ANIMALS 15 – 21 มิ.ย. 66
งาน “THE MALL LIFESTORE THAPRA DESERT ANIMALS” ผจญภัยสัตว์ทะเลทราย ใจกลางท่าพระ ชมสัตว์ทะเลทรายและสัตว์แปลกหาชมยากกว่า 20 สายพันธุ์ อาทิ กิ้งก่าอีกัวน่า, แมวเซอร์วัล, เมียร์แคต, นกเค้าอินทรียูโรเปี้ยน, แพรี่ด็อก พร้อมกิจกรรมให้ร่วมสนุก
วันงาน 15 มิ.ย. 66 – 21 มิ.ย. 66 เดอะมอลล์ไลฟ์สโตร์ ท่าพระ ชั้น G บริเวณ M LIFESTYLE HALL และ M ATRIUM พบวิทยากรจากสมาคมการค้าเกษตรทางเลือก ผู้เพาะพันธุ์ และพัฒนาสัตว์เลี้ยงชนิดพิเศษ ที่จะมาให้ความรู้ พูดคุย เกี่ยวกับการเลี้ยงดู งู และ กิ้งก่า ในวันที่ 17 มิ.ย. 66 เวลา 13.00 น. และ 15.00 น.
Phitsanulok Coffee & Bakery Fest 16-20 June 2023
Phitsanulok Coffee & Bakery Fest 2023, the 2nd coffee and bakery fair in the lower northern region, from 16 - 20 June 2023 at Central Phitsanulok. Highlights of the event: Meet King Of Latte Art, a world-class champion. with various activities Whether it’s a barista competition, work shop activities, knowledge from experts and celebrities in the coffee industry. Ready to open for tasting rare coffee varieties and mini-concerts from artists and booths at famous coffee shops such as Caffa Maker.
ดนตรีในสวนกรุงเทพมหานคร 16 มิถุนายน 2567 สวนวชิรเบญจทัศ
ดนตรีในสวนกรุงเทพมหานคร มาชวนทุกท่านไปร่วม ร้อง & บรรเลงดนตรี ในสวน เพียงแค่เตรียมตัว เตรียมใจ และพกเครื่องดนตรี มา Jam กับ กลุ่มศิลปิน Oneday Memory วันอาทิตย์ที่ 16 มิถุนายน 2567 ณ สวนวชิรเบญจทัศ เริ่ม 15.30 น.
AMAZING RACE FESTIVAL & TRIATHLON 2022 18-19 JUNE 2022 | PHATTHALUNG LINK
การท่องเที่ยวแห่งประเทศไทย ร่วมกับจังหวัดพัทลุง ขอเชิญทุกท่านร่วมประลองความแกร่ง ทดสอบขีดความสามารถของร่างกาย ตลอดสุดสัปดาห์ในมหกรรมไตรกีฬา ว่าย-ปั่น-วิ่ง ส่งเสริมการท่องเที่ยวรูปแบบใหม่ ซึ่งประกอบไปด้วย กิจกรรมปั่นจักรยานทางไกล ระยะ 100 กม. 50 กม.การแข่งขันวิ่งแบบ Road Running ระยะ 21 กม. 10 กม. 5 กม. ว่ายน้ำ Open Water Swim ระยะ 4.5 กม. 3 กม. 1.5 กม. และไตรกีฬารูปแบบใหม่ Standard S2 - ว่าย 750 ม. ปั่น 20 กม. วิ่ง 5 กม. (2 รอบ) , Sprint - ว่าย 750 ม. ปั่น 20 กม. วิ่ง 5 กม. ในรายการ AMAZING RACE FESTIVAL & TRIATHLON PHATTHALUNG 2022 วันที่ 18-19 มิถุนายน 2565 นี้ ณ หาดแสนสุขลำปำ อำเภอ เมือง จังหวัดพัทลุง รับประกันความมันส์โดย...ไทยแลนด์ไตรลีก และ Tab Sports
ประเภทการแข่งขัน
1) ไตรกีฬา Triathlon
ระยะ: Standard S2 - ว่าย 750 ม. ปั่น 20 กม. วิ่ง 5 กม. (2 รอบ)
และ Sprint - ว่าย 750 ม. ปั่น 20 กม. วิ่ง 5 กม.
วันรับอุปกรณ์แข่งขัน: วันศุกร์ที่ 17 มิ.ย. 65 เวลา 15.00-19.30 น.
และวันเสาร์ที่ 18 มิ.ย. 65 เวลา 15.00-19.30 น.
วันแข่งขัน: วันอาทิตย์ที่ 19 มิ.ย. 65 เวลา 06.45-10.30 น.
รุ่นแข่งขัน: ประเภทชายเดี่ยว รุ่นกลุ่มอายุ 16-29 ปี 30-39 ปี 40-49 ปี 50 ปีขึ้นไป ,
ประเภทหญิงเดี่ยว รุ่นกลุ่มอายุ 16-29 ปี 30-39 ปี 40 ปีขึ้นไป , อีลิท (ชาย)
จำนวนผู้แข่งขัน: 300 คน (คละระยะ)
2) ว่ายน้ำทางไกล OpenWaterSwim
ระยะ: 1.5 กม / 3 กม / 4.5 กม
วันรับอุปกรณ์แข่งขัน: วันศุกร์ที่ 17 มิ.ย. 65 เวลา 15.00-19.30 น.
วันแข่งขัน: วันเสาร์ที่ 18 มิ.ย. 65 เวลา 07.00-11.00 น.
รุ่นแข่งขัน: อายุ 11-15 ปี 16-20 ปี 21 ปี ขึ้นไป
จำนวนผู้แข่งขัน: 200 คน (คละระยะ)
รูปแบบ: นักว่ายน้ำจะต้องว่ายให้ครบตามจำนวนระยะทางที่สมัคร โดยในแต่ละจะมีความยาวของสนามที่ 750 เมตร ในกรณีที่นักกีฬาสมัครในระยะ 1.5 กม. ระยะ 3 กม. และ 4.5 กม. จะต้องว่าย 2 , 4 รอบ และ 6ตามลำดับ
3) จักรยานทางไกล RoadCycling Touring
ระยะ: 100 กม. 50 กม.
วันรับอุปกรณ์แข่งขัน: วันศุกร์ที่ 17 มิ.ย. 65 เวลา 15.00-19.30 น. และ วันเสาร์ที่ 18 มิ.ย. 65 เวลา 05.00-06.30 น.
วันแข่งขัน: วันเสาร์ที่ 18 มิ.ย. 65 เวลา 07.10-12.00 น.
รุ่นแข่งขัน: ทั่วไป
จำนวนผู้แข่งขัน: 800 คน (คละระยะ)
รูปแบบ: เป็นการจัดการปั่นแบบ Touring เน้นนักปั่นจักรยานสายท่องเที่ยว ที่ชื่นชอบการปั่นจักรยานในระยะ 50 กม ถึง 100 กม
4) วิ่ง Roadrunning
ระยะ: 21.1 กม 10.5 กม 5 กม
วันรับอุปกรณ์แข่งขัน: วันศุกร์ที่ 17 มิ.ย. 65 เวลา 15.00-19.30 น.
และวันเสาร์ที่ 18 มิ.ย. 65 เวลา 15.00-19.30 น.
วันแข่งขัน: วันอาทิตย์ที่ 19 มิ.ย. 65 เวลา 05.00-09.00 น.
รุ่นแข่งขัน: ทั่วไป
จำนวนผู้แข่งขัน: 2,000 คน (คละระยะ)
วันแข่งขัน
วันเสาร์-อาทิตย์ที่ 18 - 19 มิ.ย. 65 เวลา 06.30-18.00 น.
ลงทะเบียนรับสมัคร
เปิดรับสมัคร 7 มิถุนายนนี้ พร้อมกันทั่วประเทศ (จำนวนจำกัด)
เทศบาลเมืองบางรักพัฒนา อบรมหมอหมู่บ้าน การปฐมพยาบาลเบื้องต้นและการช่วยชีวิตฉุกเฉิน (CPR) การใช้เครื่องกระตุ้นไฟฟ้าหัวใจ (AED)
วันที่ 18 มิถุนายน 2567 นางสาวปีย์วรา จริยเมโธ รองนายกเทศมนตรีเมืองบางรักพัฒนา เป็นประธานในพิธีเปิดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ หมู่ที่ 2-15 ประจำปี พ.ศ. 2567 พร้อมด้วย หัวหน้าส่วนราชการ เจ้าหน้าที่เทศบาลเมืองบางรักพัฒนา และอาสาสมัครสาธารณสุขหมู่บ้าน (อสม.) เข้าร่วมพิธี ณ ห้องประชุมชั้น 2 อาคารเอนกประสงค์ เทศบาลเมืองบางรักพัฒนา
โดยโครงการนี้จัดขึ้นระหว่างวันที่ 18-19 มิถุนายน 2567 เพื่อให้เจ้าหน้าที่ อาสาสมัครสาธารณสุขหมู่บ้าน และประชาชน มีความรู้ในเรื่องการปฐมพยาบาลเบื้องต้นและการช่วยชีวิตขั้นพื้นฐาน โดยได้รับเกียรติจากนายทินกร นิลผาย พยาบาลวิชาชีพปฏิบัติการ พร้อมด้วยเจ้าหน้าที่กู้ชีพ จากเทศบาลนครรังสิต มาให้ความรู้ในด้านต่าง ๆ เช่น การปฐมพยาบาลเบื้องต้นและการช่วยชีวิตฉุกเฉิน (CPR) การใช้เครื่องกระตุ้นไฟฟ้าหัวใจ (AED) การทำแผล การปฐมพยาบาลเบื้องต้น การปฐมพยาบาลช่วยชีวิตฉุกเฉินกรณีมีสิ่งแปลกปลอมติดคอ และมีการฝึกปฏิบัติเพื่อให้เจ้าหน้าที่ ประชาชน และเจ้าหน้าที่ อสม. ได้มีการปฏิบัติจริง เพื่อเพิ่มพูนความรู้ความสามารถ
กิจกรรมอบรมฟรี‼️ "ศิลปะการจัดตกแต่งอาหารเพื่อเพิ่มมูลค่า ด้วยอายตนะทั้ง 6 Food Stylish ; The Six Sences of Food"
กิจกรรมอบรมฟรี‼️ "ศิลปะการจัดตกแต่งอาหารเพื่อเพิ่มมูลค่า ด้วยอายตนะทั้ง 6 Food Stylish ; The Six Sences of Food" ภายใต้โครงการมหัศจันท์แห่งรสชาติ ????????????✨
พบกับ Food stylish ชื่อดังกับคุณดวงฤทธิ์ แคล้วปลอดทุกข์ ????✨
????จัดขึ้นในวันจันทร์ที่ 19 มิถุนายน 2566
????ณ ห้องประชุม โรงแรมบลูแรบบิท
????เวลา 08.30-17.30 น.
สร้างสรรค์ศิลปะอาหารจันท์ให้เลอค่า สวยจนน่ากิน ด้วยศาสตร์ศิลป์อันล้ำค่า
สสจ.แม่ฮ่องสอน แจ้งขอฮ.รับผู้ป่วยฉุกเฉินหญิง ไข้เลือดออกมีภาวะช็อคร่วมปอดอักเสบและติดเชื่อในกระแสเลือด ส่งจ.เชียงใหม่ด่วน
วันที่ 19 มิถุนายน 2566 เวลา 09.18 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอน ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศหญิง อายุ 15 ปี ประวัติ เป็นผู้ป่วยจากโรงพยาบาลขุนยวมที่ส่งต่อมารับการรักษาที่โรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ตั้งแต่วันที่ 13-19 มิถุนายน 2566 มาด้วยอาการ มีไข้สูง อาเจียน กินไม่ได้ ได้รับการวินิจฉัยโรค Dengue shock with pneumonia with septic shock (ไข้เลือดออกที่มีภาวะช็อกร่วมกับปอดอักเสบจากการติดเชื้อและภาวะช็อคจากการติดเชื้อในกระแสโลหิต) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน และส่งต่อไปรักษาที่โรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่
โดยจึงได้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจสิงหนาท กองกำลังนเรศวร ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ประสิทธิ์ ตอสกุล, ร.อ.ชัยวัฒน์ จิตรเกตุ, จ.ส.อ.สุวคุณ สุวัสส์ และจ.ส.ท.ศิริวัฒน์ จันทร์แก้ว และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ประกอบด้วย นพ.กรีฑา คำเนียม, นางธีรดา วงค์ใจ และ นายอุเทน เขิ่งภักดี
และเมื่อเวลา 11.02 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
Grow Up Cannabis Conference, Expo and Awards June 20-22, 2022 Victoria Exhibitors LINK
Grow Up Cannabis Conference, Expo and Awards June 20-22, 2022 Victoria Exhibitors อีกงานของสายปลูกระดับพระกาฬจากทั่วโลก ปีนี้ จิม เบลูชี ดาราฮอลลีวู๊ด ขึ้นเวที เป็นคีย์โน๊ต คนหนึ่งของงาน ท่ามกลางเทพสายปลูกอีกนับร้อย ดูหัวข้อคุยอื่นๆ แบบว่าต้องหูผึ่ง
20 มิย GrowUp Psychedelic Summit
21-22 มิย Elevate your Growing Masterclass - A Deep Dive into Cultivation Practices
21-22 มิย GrowUP Extraction Zone
22 มิย Learn from the Best in the Industry - Bring Your Homegrown to a Higher Level
นี่มันระดับโปรทั้งนั้น
งาน Border coffee carnival 21-23 มิถุนายน 2567
งานกาแฟไทย-มาเลเซียหน้าโรงบาลสุไหงโกลก 21-23 มิ.ย. สายกาแฟไม่ควรพลาด " Border coffee carnival "
กิจกรรมลานดนตรีในสวน Music in the Garden Suphanburi มิถุนายน-กรกฎาคม 2567
สำนักงานวัฒนธรรมจังหวัดสุพรรณบุรี ขอเชิญร่วมกิจกรรมลานดนตรีในสวน Music in the Garden Suphanburi ภายในงานชมกิจกรรมการแสดงดนตรี และร่วมเล่นบูธงาน Crafts โดยจัดกิจกรรม จำนวน 6 ครั้ง ดังนี้ [
Suphanburi Creative City of Music]
วันที่ 21 มิถุนายน 2567 เวลา 16.30 - 19.00 น. ครั้งที่ 1 Robinson Lifestyle Suphanburi
วันที่ 22 มิถุนายน 2567 เวลา 16.00 - 21.00 น. ครั้งที่ 2 บริเวณหน้าอำเภออู่ทอง
วันที่ 23 มิถุนายน 2567 เวลา 16.00 - 21.00 น. ครั้งที่ 3 สวนเฉลิมภัทรราราชินี อำเภอเมืองสุพรรณบุรี
วันที่ 25 มิถุนายน 2567 เวลา 16.00 - 21.00 น. ครั้งที่ 4 สวนสาธารณะอำเภอด่านช้าง
วันที่ 29 มิถุนายน 2567 เวลา 16.00 - 21.00 น. ครั้งที่ 5 ดอนเจดีย์ สตรีทฟู๊ด
วันที่ 6 กรกฎาคม 2567 เวลา 16.00 - 21.00 น. ครั้งที่ 6 ตลาดท่าช้าง อำเภอเดิมบางนางบวช
ศูนย์ฯ ภูเก็ต แจ้งขอลำเลียงอากาศรับผู้ป่วยชาย 53 ปี โรคหลอดเลือดสมอง มีอาการอ่อนแรงซีกขวา จากวชิระภูเก็ต ไปรพ.ตรัง
วันที่ 22 มิถุนายน 2566 14.30 น. ศูนย์นเรนทรสถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดภูเก็ต ขออนุมัติลำเลียงทางอากาศยานในการนำส่งผู้ป่วยชายไทยอายุ 53 ปี จาก รพ.วชิระภูเก็ตไปโรงพยาบาลตรัง โดยผู้ป่วยมีอาการอ่อนแรงซีกขวา ได้รับการตรวจวินิจฉัยด้วยเอกซเรย์คอมพิวเตอร์ ความเร็วสูง (CT brain NC) วินิจฉัยว่าเป็นเป็นโรคหลอดเลือดสมอง (Left MCA infarction) ทำใหเกิดการอ่อนแรงซีกขวา (Right hemiplegia with severe aphesia) จำเป็นต้องได้รับการรักษาด้วยการสอดสายสวน (thrombectomy) อย่างเร่งด่วน
ทั้งนี้ได้รับการสนับสนุนจากกองทัพเรือให้ใช้อากาศยานของกองทัพเรือภาค 3 ด้วยเครื่องบิน Dornier 228 และชุดทีมปฏิบัติการ โรงพยาบาลวชิระภูเก็ตลำเลียงจากหน่วยบินเฉพาะกิจไม้ขาว จังหวัดภูเก็ต ไปยังสนามบินตรัง และส่งต่อไปยังโรงพยาบาลตรัง ช่วยลดระยะเวลาในการนำส่ง สามารถช่วยให้ผู้ป่วยได้รับการรักษาอย่างทันท่วงที
สถาบันการแพทย์ฉุกเฉินแห่งชาติขอขอบคุณกองทัพเรือ กองทุนการแพทย์ฉุกเฉิน ศูนย์รับแจ้งเหตุและสั่งจังหวัด ภูเก็ต หน่วยปฏิบัติการเฉพาะทางสาขาฉุกเฉินการแพทย์ทางอากาศ และโรงพยาบาลวชิระภูเก็ต ที่ได้ร่วมกันปฏิบัติการการแพทย์ฉุกเฉินทางทะเล เพื่อให้ประชาชนได้รับการช่วยเหลือได้ทางการแพทย์ฉุกเฉินได้อย่างทั่วถึง และเท่าเทียมต่อไป
สสจ.แม่ฮ่องสอน ขอฮ.รับผู่ป่วยฉุกเฉินชาย ภาวะเลือดออกในสมอง จากแม่สะเรียง ส่งต่อรพ.ประสาทเชียงใหม่
วันที่ 22 มิถุนายน 2566 เวลา 12.57 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอนได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศชาย อายุ 46 ปี ภูมิลำเนาอยู่ที่ หมู่1 ต.บ้านกาศ อ.แม่สะเรียง จ.แม่ฮ่องสอน ประวัติ มีอาการชักเกร็งกระตุกทั้งตัว นาน 2 นาที ก่อนเข้ารับการรักษา ณ ห้องอุบัติเหตุและฉุกเฉิน โรงพยาบาลแม่สะเรียง อ.แม่สะเรียง จ.แม่ฮ่องสอน หลังอาการชักเกร็ง ไม่พูด ซีกขวาอ่อนแรง ได้รับการวินิจฉัยโรค Subarachnoid haemorrhage (ภาวะเลือดออกในเยื่อหุ้มสมองชั้นกลาง) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วนและส่งต่อไปรักษาที่โรงพยาบาลประสาทเชียงใหม่ จ.เชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจสิงหนาท กองกำลังนเรศวร ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ประสิทธิ์ ตอสกุล, ร.ต.สุรราช เดชก้อง, จ.ส.อ.สุวคุณ สุวัสส์ และ จ.ส.อ.เมธี ขจรจิตร และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ประกอบด้วย นพ.กรีฑา คำเนียม, นางสาวธัญสุดา นานาวรรณาคาร และนางสาวปิยะกาญจน์ ธาราวนาพิทักษ์
และเมื่อเวลา 15.09 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลประสาทเชียงใหม่ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
ISTH 2024 Congress วันที่ 22-26 มิถุนายน 2567
ISTH 2024 Congress การประชุมองค์การสากลเกี่ยวกับลิ่มเลือดอุดตันและกลไกการห้ามเลือด ครั้งที่ 32 การประชุมที่อัดแน่นไปด้วยงานวิจัยเชิงนวัตกรรมที่จะสร้างการเปลี่ยนแปลง พร้อมพบปะกับผู้เชี่ยวชาญระดับโลก เพิ่มโอกาสในการสร้างเครือข่ายเพื่อพัฒนาความเชี่ยวชาญ ลงทะเบียนเข้าร่วมงานได้ที่
Delta 8 Expo + conversions in partnership with the CBD Expo Tour In conjunction with the Physicians CBD Council LINK
Delta 8 Expo + conversions in partnership with the CBD Expo Tour In conjunction with the Physicians CBD Council จัดโดยทีมนิตยสาร Delta 8 Magazine และ CBD Health & Wellness Magazine เป็นครั้งที่ 28 น่าทึ่งมาก ผู้จัดเล่าว่าเป็นการขยับเติบโตมาจากการกลุ่มไพรเวทเล็กๆ จนขยายใหญ่ขึ้นเรื่อยมาถึงปัจจุบัน โดยมุ่งเชื่อมโยงแลกเปลี่ยนความรู้ในเชิงการใช้เพื่อการแพทย์ บรรเทาปัญหาสุขภาพ ตลอดมา ลักษณะงานเรียกว่าเป็นแบบทัวร์สต๊อป วนไปจัดตามเมืองต่างๆ ปีนี้ มี 4 ครั้ง ดังนี้
Charlotte, North Carolina
JUNE 23 -24, 2022
Embassy Suites by Hilton Charlotte Concord Golf Resort & Spa at 5400 John Q. Hammons NW, Concord, NC 28027
St. Paul, Minnesota
AUGUST 18-19, 2022
InterContinental Saint Paul Riverfront, an IHG Hotel at 11 E Kellogg Blvd, St Paul, MN 55101
Orlando, Florida
OCTOBER 6-7, 2022
Hilton Orlando at
6001 Destination Pkwy, Orlando, FL 32819
Las Vegas, NV
DECEMBER 1-2, 2022
Westgate Las Vegas Resort & Casino at 3000 Paradise Rd, Las Vegas, NV 89109
ลำเลียงทารกคลอดก่อนกำหนดป่วย จากอมก๋อย ส่งรพ.มหาราชนครเชียงใหม่
วันที่ 23 มิ.ย. 66 เวลา 09.50 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย 1 ราย ทารกคลอดก่อนกำหนด ต้นทางจากโรงพยาบาลแม่ตื่น อำเภออมก๋อย จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่
ทั้งนี้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานได้รับการสนับสนุน อากาศยานจากหน่วยกองบินตำรวจ จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย ร.ต.อ. สันหวัช พรหมจรรย, ร.ต.ท.ประเทือง ชูเลิศ, ส.ต.อ.ธนาวิช สาระแปง ชุดปฏิบัติการบิน Sky Doctor ของโรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่ ประกอบด้วย พญ.ภาวิตา เลาหกุล, นส.กุลวัลย์ ยอดยา, นส.ณัฐนิชา หล้าหนัก
เมื่อเวลา 13.11 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลโรงพยาบาลมหาราชนครเชียงใหม่ เป็นที่เรียบร้อย
Mothers Class ครั้งที่ 4 วันอาทิตย์ ที่ 23 มิถุนายน 2567
"Mothers Class" ครั้งที่ 4 มาแล้วจ้า ขอเชิญคุณแม่ตั้งครรภ์และคุณพ่อที่สนใจ **(ไม่เสียค่าใช้จ่าย)** “เตรียมความพร้อมเข้าสู่การเป็นคุณแม่คุณภาพ”ร่วมรับฟังการบรรยายในหัวข้อ 9 เดือนมหัศจรรย์กับครรภ์คุณภาพ โดย พว.นวรัตน์ วงศ์ขัติย์ ร่วม Workshop สอนการอุ้มและอาบน้ำเด็กแรกเกิด โดยเจ้าหน้าที่แผนกเด็กแรกเกิด โรงพยาบาลเกษมราษฎร์ศรีบุรินทร์ ในวันอาทิตย์ ที่ 23 มิถุนายน 2567 เวลา 9.30 - 12.00 น. ณ ห้องประชุมนายแพทย์สมชัย ตั้งพร้อมพันธ์ ชั้น 2 อาคารศูนย์การแพทย์เฉพาะทางเกษมราษฎร์ ศรีบุรินทร์ **รับของที่ระลึกและเป้อุ้มเด็ก ฟรี!! เมื่อซื้อแพ็กเกจคลอดภายในงาน สนใจเข้าร่วมงานติดต่อได้ที่ฝ่ายการตลาด โทร.053-910999 ต่อ 275
24 มิถุนายน : A Night with Beethoven: Lucerne Symphony Orchestra
A Night with Beethoven: Lucerne Symphony Orchestra
Main Hall, Thailand Cultural Centre
Date and Time Saturday 24 June 2023 at 7:00 PM
Ticket Price 7,500/ 6,000/ 4,500/ 3,000/ 1,800 THB
Lucerne Symphony Orchestra
A Night with Beethoven
วันเสาร์ที่ 24 มิถุนายน 2566 เวลา 19.00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
สนับสนุนโดย สถานเอกอัครราชทูตสวิตเซอร์แลนด์และ Institut auf dem Rosenberg
หัวหน้าวาทยกร: Michael Sanderling
นักไวโอลิน: Augustin Hadelich
รายการแสดง
ลุดวิค ฟาน เบโธเฟน :
Violin Concerto in D major, Op. 61
Symphony No. 5 in C minor, Op. 67
ครั้งแรกในประเทศไทยกับวงออร์เคสตราที่เก่าแก่ที่สุดจากสวิตเซอร์แลนด์ ลูเซิร์น ซิมโฟนี ออร์เคสตรา ที่ตั้งใจนำบทเพลงเด่นของ เบโธเฟน อย่าง ไวโอลินคอนแชร์โต ที่แต่งขึ้นในช่วง ค.ศ. 1805 ปีก่อตั้งวงลูเซิร์นฯ มาจัดแสดงพร้อมกับอีกหนึ่งบทเพลงของ เบโธเฟน ที่เป็นที่รู้จักมากที่สุดเพลงหนึ่งของโลก คือ ซิมโฟนี หมายเลข 5
ลูเซิร์น ซิมโฟนี ออร์เคสตรา ที่มีชื่อเสียงในระดับนานาชาติ ก่อตั้งในเมืองลูเซิร์น เมืองแห่งวัฒนธรรมทางดนตรีที่เก่าแก่กว่า 200 ปี ปัจจุบันจัดแสดงประจำอยู่ที่หอแสดงชื่อดังของเมือง KKL Luzern และเป็นวงออร์เคสตราที่มีผลงานร่วมกับ Warner Classics อย่างสม่ำเสมอ
อำนวยเพลงโดย วาทยกรชื่อดังระดับโลก ไมเคิล แซนเดอร์ลิง ที่มีผลงานอำนวยเพลงกับวงออร์เคสตราชั้นนำของยุโรปมากมาย อาทิ เบอร์ลินฟิลฮาร์โมนิก และมิวนิกฟิลฮาร์โมนิก
ร่วมด้วย นักไวโอลินเจ้าของรางวัลแกรมมี่ ออกัสติน ฮาเดอลิค ที่ได้รับการโหวตให้เป็น ‘Instrumentalist of the Year’ ในค.ศ. 2018 และเป็นหนึ่งในนักไวโอลินอันดับต้นของโลก โดยไวโอลินที่ใช้แสดง ‘Leduc, ex Szeryng’ อายุกว่า 300 ปี ผลิตโดยนักสร้างไวโอลินระดับตำนาน Guarneri del Gesù
ลำเลียงผู้ป่วยหญิง ภาวะตกเลือดหลังคลอด จากรพ.แม่ตื่น อมก๋อย ส่งรพ.นครพิงค์
วันที่ 24 มิ.ย. 66 เวลา 07.55 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยหญิง 1 รายมีภาวะตกเลือดหลังคลอด ต้นทางจากโรงพยาบาลแม่ตื่น อำเภออมก๋อย จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลจอมทอง จังหวัดเชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน ได้รับการสนับสนุนอากาศยานจาก หน่วยเฉพาะกิจสิงหนาท จังหวัดแม่ฮ่องสอน ชุดปฏิบัติการบินประกอบด้วย พ.ท.ประสิทธิ์ ตอสกุล, ร.อ.ชัยวัฒน์ จิตรเกตุ จ.ส.อ. สุวคุณ สุวัสส์, จ.ส.อ.เมธี ขจรจิตร ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลศรีสังวาลย์ จังหวัดแม่ฮ่องสอน ประกอบด้วย นพ.ภวพล กีรติชีวนันท์, นางศิริรัตน์ พันตารักษ์, น.ส.ปิยะกาญจณ์ ธาราวนาพิทักษ์
เมื่อเวลา 11.09 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลจอมทอง เป็นที่เรียบร้อย
25 มิถุนายน วันไอโอดีนแห่งชาติ
วันที่ 25 มิถุนายน เป็นวันที่สภาการควบคุมโรคขาดสารไอโอดีนนานาชาติ (International Council for Control of Iodine Deficiency Disorders, ICCIDD) ได้ทูลเกล้าถวายเหรียญทอง ICCIDD แด่พระบาทสมเด็จพระเจ้าอยู่หัว เมื่อวันที่ 25 มิถุนายน 2540 เพราะพระองค์ทรงมีพระมหากรุณาธิคุณในการวินิจฉัยปัญหา และพระราชทานแนวทางการควบคุมป้องกันโรคขาดสารไอโอดีน อันเป็นหลักชัยให้พสกนิกรไทยรวมพลังร่วมใจขจัดภัยโรคขาดสารไอโอดีน ให้ลดน้อยลงจนอยู่ในระดับที่ควบคุมได้เป็นที่ประจักษ์แก่ประชาคมโลก นับเป็นพระมหากษัตริย์องค์แรกพระองค์เดียวของโลกที่ได้รับรางวัลดังกล่าว คณะรัฐมนตรีจึงได้ลงมติเห็นชอบให้วันที่ 25 มิถุนายน ของทุกปี เป็นวันไอโอดีนแห่งชาติ [
โรงพยาบาลบุรีรัมย์]
25 มิ.ย.66 อัลตร้าเทรลเขาค้อ LINK
อัลตร้าเทรลเขาค้อ วันที่ 25 มิถุนายน 2566 เบิร์ดแลนด์รีสอร์ท เขาค้อ เพชรบรูณ์ ระยะ 48 KM/30KM/20KM/10KM/5KM สมัครและโอนเงินภายในวันนี้ ถึง 30 พย 65 รับส่วนลด EarlyBird (16-30 NOV 2022)
Phitsanulok Coffee & Bakery Fest 2024 วันที่ 26-30 มิถุนายน 2567
Phitsanulok Coffee & Bakery Fest 2024 วันที่: 26-30 มิถุนายน 2567 ณ ศูนย์การค้าเซ็นทรัลพิษณุโลก เวลา: 10.00 น. - 21.00 น. เตรียมตัวให้พร้อม! พบกับงาน "Phitsanulok Coffee & Bakery Fest 2024" งานรวมตัว ของคนรักกาแฟและเบเกอรี่ พบกับ:
• บูธกาแฟจากร้านดังทั่วพิษณุโลกและภาคเหนือ
• เบเกอรี่หลากหลายชนิด
• กิจกรรมสนุก ๆ ประกวด บาริสต้า
• ดนตรีและ โชว์พิเศษ
Thailand Healthcare 2024 เกษียณสโมสร 27-30 มิถุนายน 2567


Thailand Healthcare 2024 เกษียณสโมสร งานกิจกรรมสุขภาพโดยเครือมติชน ร่วมกับพันธมิตรโรงพยาบาลชั้นนำ จัดเต็ม 4 ไฮไลต์เพื่อสุขภาพ วันพฤหัสบดีที่ 27 ถึง วันอาทิตย์ที่ 30 มิถุนายน 2567 นี้ ที่สามย่านมิตรทาวน์ฮอลล์ ชั้น 5 กิจกรรมเด่นในงานนี้ - 30 โรงพยาบาลชั้นนำ ตรวจสุขภาพ ฟรี! 30 เวทีเสวนาที่ดีที่สุด จากแพทย์ผู้เชี่ยวชาญ ฟรี! ฟังเสวนาจากแพทย์และประสบการณ์จริงเรื่องสุขภาพจากอินฟลูเอนเซอร์ดัง พบเวที Health Talk โดยแพทย์เบอร์ต้นของประเทศ เวที Special Talk โดยเหล่าคนดังและกูรูด้านสุขภาพ 4 กิจกรรมไฮไลต์ตลอดงาน ฟรี! ???? ครั้งแรก! รพ.นวเวช จับมือกับสถาบันดนตรี KPN MUSIC ออกแบบและให้ความรู้ด้าน Music Therapy ดนตรีบำบัดกับผู้สูงอายุ ภายในงานทุกวัน! ???? เวิร์กชอป ‘สูงวัยสายวิทย์’ กับ ดร.บัญชา ธนบุญสมบัติ พบกิจกรรม ‘โอริกามิ ฝึกสมาธิจากการพับกระดาษ’ ช่วยเรื่องความจำ การเคลื่อนไหวของร่างกาย สร้างความภูมิใจเมื่อได้ผลงาน, ‘มหัศจรรย์บนท้องฟ้า ไขปริศนา เมฆบอกอะไร?’ ช่วยให้ผ่อนคลาย เสริมสร้างการจินตนาการ ฝึกดูฟ้า-ฝน และในหลายรายช่วยเรื่องอาการซึมเศร้า ???? ย้อนเวลาพร้อมขยับร่างกายผ่านเพลงวงดนตรีกรมประชาสัมพันธ์ นำโดย ‘โฉมฉาย อรุณฉาน’ ที่มาขับกล่อม และชวนร่วม ‘เต้นลีลาศ’ เพื่อเสริมสร้างทักษะความจำ กับ ‘บุญเลิศลีลาศ’ ???? ขยับแข้งขยับขากันต่อ กับ ‘ครูดิน-สถาวร จันทร์ผ่องศรี’ ที่ชวนมาพิสูจน์ด้วยตัวเอง ให้รู้กันว่า ‘สูงวัย วิ่งได้มั้ย?’... อ่านข่าวต้นฉบับได้ที่ : https://www.matichon.co.th/local/quality-life/news_4641550
อบต.กำแพงดิน อ.สามง่าม พิจิตร อบรมหมอหมู่บ้าน การช่วยฟื้นฟูคืนชีพ (CPR) และวิธีการใช้เครื่องกระตุกหัวใจไฟฟ้า (AED)
27 มิ.ย. 2567 นางสาววนิดา อังกุลดี นายกองค์การบริหารส่วนตำบลกำแพงดิน เป็นประธานเปิดโครงการพระราชดำริ ด้านสาธารณสุขฯ กิจกรรมโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ประจำปีงบประมาณ2567 โดยมีวัตถุประสงค์ เพื่อให้ผู้เข้าร่วมอบรมมีความรู้ ด้านการปฐมพยาบาลเบื้องต้น การรักษาโรคเบื้องต้น การใช้ยาสามัญประจำบ้าน ยาสมุนไพร การช่วยฟื้นฟูคืนชีพ (CPR) และวิธีการใช้เครื่องกระตุกหัวใจไฟฟ้า (AED) เพิ่มขึ้น จัดโดยองค์การบริหารส่วนตำบลกำแพงดิน ณ ห้องประชุมองค์การบริหารส่วนตำบลกำแพงดิน ขอขอบคุณวิทยากร จากโรงพยาบาลส่งเสริมตำบลกำแพงดิน
บินรับเด็กชาย มีภาวะผนังกั้นหัวใจห้องบนรั่วและหายใจล้มเหลว จาก อมก๋อย ส่งรพ.นครพิงค์
วันที่ 28 มิ.ย. 66 เวลา 11.44 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย 1 ราย มีภาวะผนังกั้นหัวใจห้องบนรั่วและมีภาวะหายใจล้มเหลว ต้นทางจากโรงพยาบาลอมก๋อย อำเภออมก๋อย จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน ได้รับการสนับสนุนอากาศยานจากหน่วยบินกองกำลังผาเมือง จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย ร.อ.ปณตพงษ์ เตชะประเสริฐพร, ร.ท.กิตติ จิตติวุฒินนท์, จ.ส.อ.วีรพนธ์ วรสาร ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่ ประกอบด้วย นพ.บุญฤทธิ์ คำทิพย์,น.ส.วันชนก วิริยกิจ, น.ส.สุนิสา ต๋าจ๊ะ
เมื่อเวลา 14.36 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลนครพิงค์เป็นที่เรียบร้อย
เฮลิคอปเตอร์บินรับผู้ป่วยชาย 49 ปี จากปางหมู แม่ฮ่องสอน ส่งรพ.นครพิงค์ จ.เชียงใหม่
วันที่ 28 มิถุนายน 2566 เวลา 13.01 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอนได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศชาย อายุ 49 ปี ภูมิลำเนาอยู่ที่ ม.4 ต.ปางหมู อ.เมือง จ.แม่ฮ่องสอน ประวัติ 2 ชั่วโมงก่อนมา ไม่รู้สึกตัว หายใจได้เอง มีหน่วยบริการการแพทย์ฉุกเฉินโรงพยาบาลศรีสังวาลย์ออกรับผู้ป่วย ณ จุดเกิดเหตุ และนำส่งเข้ารักษาที่โรงพยาบาลศรีสังวาลย์ อ.เมือง จ.แม่ฮ่องสอน เมื่อประเมินอาการแล้วจึงได้ใส่ท่อช่วยหายใจ ได้รับการวินิจฉัยโรค hemorrhagic stroke (โรคเส้นเลือดในสมองแตก) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วนและส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจสิงหนาท กองกำลังนเรศวร ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 มีชุดปฏิบัติการบิน ประกอบด้วย ร.อ.ชัยวัฒน์ จิตรเกตุ, ร.ต.สุรราช เดชก้อง, จ.ส.อ.อนุพงศ์ โคตรพรหม และ จ.ส.อ.สมชาย ยำยวน และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ประกอบด้วย นพ.กรีฑา คำเนียม, น.ส.ฉัตรพร วงศ์เผือก และ น.ส.อาภากร ประยูร
และเมื่อเวลา 14.45 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
ROBUSTA CAMP THAILAND # 1 Coffee Arts Crafts Camping 28- 30 มิ.ย. 67
28- 30 มิถุนายน 2024 กิจกรรม ROBUSTA CAMP THAILAND # 1 Coffee Arts Crafts Camping กิจกรรมพบปะแลกเปลี่ยนและเชื่อมโยงซึ่งวิสาหกิจชุมชนกาแฟคั่วมือคือจุดกำเนิด กิจกรรมรวมกลุ่มชุมชนเกษตรกรกาแฟโรบัสตาทั่วประเทศ ผสานท่องเที่ยวเชิงธรรมชาติ เรียนรู้เรื่องกาแฟศิลปะ ดนตรี แคมป์ ท่ามกลางหุบเขา ก้องวัลเลย์ ที่โอบล้อมด้วยต้นไม้ สายธาร กลิ่นกาแฟและดนตรี พูดคุยทิศทาง โรบัสต้า คุณภาพพิเศษ ตั้งแต่ 10.00-22.00น
ศิลปิน ทั้ง งานศิลปะ งานดนตรี ตั้งแต่ เวลา 18.00-23.00 รายชื่อศิลปิน ได้แก่ 1.พี่นุ เร้กเก้แมน 2.THE Left (นุ กีต้าร์ซ้าย) 3.โจ๊ก ฮาวายาตรา 3.Monkey follow 4.สายน้ำและคนเดินทาง และศิลปินอื่นๆ ร่วมแจมอีกมากมาย
พื้นที่จัดแสงงานศิลปะ มี เวิร์คช็อปงานศิลปะ เวิร์คช็อปศิลปะ สำหรับเด็กกับศิลปิน โซน แคมป์ปิ้งพร้อมจุดกางเต็นท์ ความรู้เป็นสาธารณะ ฟรี ทุกกิจกรรม
ฟู้ดติดดาว 29 มิ.ย. - 5 ก.ค. 2566 เทสโก้โลตัส จันทบุรี
งาน " ฟู้ดติดดาว " ระหว่างวันที่ 29 มิ.ย. - 5 ก.ค. 2566 เทสโก้โลตัส จันทบุรี
โลตัส ร่วมกับ การท่องเที่ยวแห่งประเทศไทย (ททท.) จัดงาน “ฟู้ดติดดาว” ขนขบวนพันธมิตรร้านอาหารระดับมิชลิน และร้านสตรีทฟู้ดชื่อดัง มาจัดโรดโชว์ออกบูธจำหน่ายอาหาร ในโลตัสสาขาพิเศษ เปิดประสบการณ์แบบ Amazing Thailand สัมผัสรสชาติความอร่อยหลากสไตล์ของคนไทย
สมาร์ทฮาร์ท พรีเซนส์ ไทยแลนด์อินเตอร์เนชั่นแนล ด็อกโชว์ 2022 วันที่ 30 มิ.ย.- 3 ก.ค.65
สมาร์ทฮาร์ท พรีเซนส์ ไทยแลนด์อินเตอร์เนชั่นแนล ด็อกโชว์ 2022
มหกรรมคนรักสุนัขอันดับหนึ่งของประเทศไทย เอาใจคนรักสุนัขอย่างแท้จริง รวมสินค้าชั้นนำสำหรับสุนัขครบวงจร ทั้งอาหาร เสื้อผ้าเครื่องประดับ อุปกรณ์สำหรับสุนัข ประกันสุนัข ตลอดจนโรงแรมและที่พักที่สุนัขพักได้ในราคาพิเศษที่งานนี้โดยเฉพาะ
SmartHeart presents Thailand International Dog Show ครั้งที่ 20 จัดเต็มทุกตารางเมตร วันที่ 30 มิถุนายน - 3 กรกฎาคม 2565 พฤศจิกายน 2565 เวลา 10.00 - 20.00 น. ณ Hall 5-6 อิมแพ็ค เมืองทองธานี
งานกินดีอยู่ดี 2022 ครั้งที่ 2 30 มิถุนายน - 03 กรกฏาคม 2565
งานแฟร์ที่รวม ร้านเด็ด แบรนด์ดัง สินค้าสุขภาพ, ความงาม, สินค้าจากธรรมชาติ, ผัก, ผลไม้, สมุนไพร, ออร์แกนิค, อาหาร, เครื่องดื่ม, ขนม, เบเกอรี่ กินอร่อย สุขภาพดี ช้อปสนุก สุขภาพจัดเต็ม วันงาน 30 มิถุนายน - 03 กรกฏาคม 2022 ไบเทคบางนา
AMARIN BABY KIDS FAIR 2022 ครั้งที่ 21 30 มิถุนายน - 3 กรกฎาคม 2565
ช้อปแหลกเพื่อลูก กับงานแฟร์แม่-ลูกที่ดีที่สุด เพื่อทุกคนในครอบครัว ด้วยสินค้าคุณภาพมากว่า 300 แบรนด์ 30 มิ.ย. 65 – 3 ก.ค. 65 ไบเทคถูกและดี ต้องที่นี่! Amarin Baby & Kids Fair ครั้งที่ 21 ครั้งนี้เรามาพร้อมมาตรการเข้มข้นด้านความสะอาดและความปลอดภัย เพื่อให้คุณพ่อคุณแม่ช้อปอย่างสบายใจไร้กังวล
ระยองสร้างสรรค์ ครั้งที่ 2 : RAYONG PRIDE 30 มิถุนายน - 1 กรกฎาคม 2566
Pride Everyday ร่วมเฉลิมฉลองเดือนแห่งความหลากหลายทางเพศและความภูมิใจในเอกลักษณ์ของตัวเองในงาน ระยองสร้างสรรค์ ครั้งที่ 2 : RAYONG PRIDE ระยอง เมืองแห่งความหลากหลาย 30 มิถุนายน - 1 กรกฎาคม 2566 ถนนยมจินดา อ.เมือง จ.ระยอง
พบกับกิจกรรม
❤️ ขบวน Pride Parade สนับสนุนอัตลักษณ์ความหลากหลายของระยอง
???? ประกวดขบวน Popular Vote Pride Parade
???? ประกวดฑูตวัฒนธรรมความหลากหลายทางเพศ LGBTQIA+ Ambassdor
???? ประกวดลิปซิงค์ ตัวแม่ ตัวมัประจำระยอง
???? เสวนาชวนคุย "ความหลากหลายทางเพศ" ในจังหวัดระยอง
???? นิทรรศการความหลากหลายทางเพศ และ #สมรสเท่าเทียม ????
ตลาดริมคลองย้อนยุค พิพิธภัณฑ์เมืองระยอง
30 มิถุนายน 2567 Kick off มหกรรม Street Food จ.ภูเก็ต
30 มิถุนายน 2567 ณ Chartered Walking Street จังหวัดภูเก็ต นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย เป็นประธานเปิดงาน Kick off มหกรรม Street Food Good Health from Local to Global พร้อมด้วย นายแพทย์กู้ศักดิ์ กู้เกียรติกูล นายแพทย์สาธารณสุขจังหวัดภูเก็ต นางสุธิดา อุทะพันธุ์ ผู้ช่วยอธิบดีกรมอนามัย และผู้อำนวยการสำนักสุขาภิบาลอาหารและน้ำ นายกเทศมนตรีนครภูเก็ต ผู้แทนองค์กรปกครองส่วนท้องถิ่นจังหวัดภูเก็ต ผู้แทนกระทรวงการต่างประเทศ การท่องเที่ยวแห่งประเทศไทย กรมการท่องเที่ยวและภาคีเครือข่ายถนนคนเดินวิสาหกิจชุมชนท่องเที่ยวชาร์เตอร์ เข้าร่วมงาน
ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day2] วันที่ 28 มิถุนายน
ภาพบรรยากาศ
Bangsaen Grand Prix 2023 [Day2] วันที่สอง 28 มิถุนายน บรรยากาศการแข่งระดับอินเตอร์ฉายแสงอย่างแท้จริง สตาฟ/นักแข่ง/ทีมงานฝ่ายจัดการแข่งขัน เข้มข้นกันสุดๆ ชมภาพเต็มอิ่มที่ Thailand Super Series
ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day1] วันที่ 27 มิถุนายน
ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day1] วันแรก 27 มิถุนายน คึกคักไปทั้งบางแสน ทุกภาคส่วนที่มีส่วนร่วม บรรยากาศสมกับเป็นงานระดับอินเตอร์อย่างแท้จริง ชมภาพเต็มอิ่มที่ Thailand Super Series
สถานการณ์ 28 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 2,012 ราย
ผู้ป่วยยืนยันสะสม 61,699 ราย
หายป่วยแล้ว 34,402 ราย
เสียชีวิตสะสม 178 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 27 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 1,227,032 โดส
อบจ.ภูเก็ต ได้รับจัดสรร 5,060 โดส พร้อมฉีด 23-24 พ.ย. LINK
อบจ.ภูเก็ต พร้อมฉีดโมเดอร์นา 23-24 พย ศูนย์ฉีดวัคซีนภูเก็ตเมอร์ลิน
....
อบจ.ภูเก็ต "ชาวภูเก็ตที่รอคอยวัคซีนโมเดอร์นา ที่ อบจ.ภูเก็ต ได้รับจัดสรรจากสภากาชาดไทย จำนวน 5,060 โดส เพื่อฉีดให้คนภูเก็ตจำนวน 2,030 คน ใน 5 กลุ่มที่กำหนด ที่ไม่เคยได้รับวัคซีนมาก่อน แต่จะยินยอมให้บุคลากรทางการแพทย์เท่านั้น โดยทาง อบจ.ภูเก็ต จะเปิดให้ 5 กลุ่มเป้าหมายได้ลงทะเบียนผ่านทางเว็ปไซต์ในระหว่างวันที่ 1-15 กันยายนนี้เท่านั้น หลังจากนั้นจะนำรายชื่อเสนอคณะกรรมการโรคติดต่อจังหวัดภูเก็ตและสภากาชาดไทยรับทราบเพื่อขออนุมัติฉีดให้กับคนที่ได้ลงทะเบียนไว้"
อัพเดท เชื้อโควิดกลายพันธุ์ (Omicron) กระทรวงสาธารณสุข
- แพร่ระบาดได้เร็วกว่าสายพันธุ์ที่ผ่านมา 2-5 เท่า
- ผู้ติดเชื้อ Omicron ส่วนใหญ่ไม่มีอาการ หรืออาการน้อยคล้ายโรคไข้หวัด
(ผู้ติดเชื้อในต่างประเทศส่วนใหญ่ไม่ต้องเข้ารับการรักษาที่โรงพยาบาล)
- ยังไม่มีรายงานผู้ติดเชื้อ Omicron เสียชีวิต
มาตรการป้องกัน
- ฉีดวัคซีนโควิดให้ครอบคลุมมากที่สุด
ใช้มาตรการป้องกันส่วนบุคคลที่เข้มงวด
เช่น สวมหน้ากาก ล้างมือ เว้นระยะห่าง และ VUCA
- ยกระดับการเฝ้าระวัง ณ ช่องทางเข้าออกประเทศ และสถานที่ท่องเที่ยว
- ทำการสุ่มตรวจคัดกรองกลุ่มเสี่ยง และผู้ป่วยไข้หวัดที่เป็นกลุ่มก้อน (Cluster)
- ส่งตัวอย่างเชื้อที่พบจากผู้เดินทางหรือรายที่น่าสงสัย
ไปตรวจหาสายพันธุ์ Omicron ที่กรมวิทยาศาสตร์การแพทย์
ที่มา : กระทรวงสาธารณสุข
สระแก้ว บริการคัดกรอง ATK ประชาชนที่เดินทางกลับภูมิลำเนา
สระแก้ว บริการคัดกรอง ATK ประชาชนที่เดินทางกลับภูมิลำเนา ช่วงเทศกาลปีใหม่ 2565 จำนวน 16 จุด ทั่วทุกอำเภอ โทร.ติดต่อผู้ประสานงานแต่ละจุดได้ตามภาพ
หากมีความเสี่ยง หรือมีผลตรวจ ATK เป็นบวก ติดต่อ ผ่าน QR Code เซฟชลบุรี
สสจ.ชลบุรี ประชาชนในจังหวัดชลบุรี หากมีความเสี่ยง หรือมีผลตรวจ ATK เป็นบวก ต้องทำอย่างไร? ให้ท่านติดต่อผ่านช่องทางต่างๆ ดังนี้
สายด่วนโควิด ชลบุรี 038-119777
ปฏิทินท่องเที่ยวเดือนแห่งความรัก LINK
กุมภาฯ อยากพาคนพิเศษไปไหน ลองดูปฏิทินท่องเที่ยวเดือนนี้ที่อบอวลไปด้วยความรัก และวันสำคัญต่างๆ ที่จะชวนทุกคนออกไปสร้างประสบการณ์และความทรงจำดีๆ ด้วยกัน
สถิติผู้ใช้บริการของศูนย์พัฒนาการฯ ทั้ง 12 ศูนย์ (ปี 2563)
7 พ.ย. 65 งานวิจัยกัญชา ปัญหาเสพกัญชา ข้อห่วงใย
งานวิจัยกัญชากับการรักษาบรรเทาโรคจิตเวช
- รศ.ดร.นพ.ปัตพงษ์ เกษสมบูรณ์ คณะแพทยศาสตร์ ม.ขอนแก่น เผยมีหลักฐานตั้งแต่อดีตถึงปัจจุบันว่า กัญชามีสรรพคุณช่วยรักษาบรรเทาโรคทางจิตเวชได้ โดยเฉพาะสรรพคุณของซีบีดี รัฐบาลและหน่วยงานที่เกี่ยวข้องควรทุ่มเทลงทุนศึกษาวิจัยเรื่องนี้จริงจังจะช่วยผู้ป่วย ครอบครัว และประเทศชาติได้อย่างมากผลข้างเคียงหลังเสพกัญชา และทำร้ายร่างกาย
- น.ส.อาภรณ์ วัย 43 ปี แจ้งความกรณีนายธีระพงษ์ ชายวัย 25 ปี และเด็กวัย 14 ปี บุกเข้าไปในห้องนอนลูกสาว อ้างว่า รู้จักกันทางเฟซบุ๊ก และเข้ามานั่งเสพกัญชา ค้นตัวพบกัญชา 20 กรัม 1 ถุง เผยปกติยังเสพยาบ้าวันละ 10 เม็ด จึงถูกแจ้งความดำเนินคดีข้อหาบุกรุรก
- นายบุญส่ง วัย 31 ปี ถูกนายนันทิน วัย 45 ปี เจ้าของไร่กัญชา 2 พันต้น และเป็นนายจ้างจับตัวไปเค้นถามสาเหตุการนำน้ำกรดไปหยดใส่กัญชา เสียหายนับ 10 ล้านบาท และทำร้ายร่างกายโดยใช้สายไฟฟาด จึงได้อ้างว่านายเจือน ผู้ใหญ่บ้าน ต.โคกว่าน จ.บุรีรัมย์ เป็นคนจ้างวาน เพื่อให้รอดจากอันตรายและมาร้องสื่อเนื่องจากนายจ้างเป็นคนมีอิทธิพลในพื้นที่ เมื่อผู้ใหญ่บ้านที่ถูกอ้างชื่อจึงปรึกษานักกฎหมายเพื่อแจ้งความเอาผิดนายบุญส่งเพราะทำให้เสื่อมเสียชื่อเสียง ด้านนายนันทินยอมรับทำร้ายผู้บาดเจ็บจริง แต่ยังไม่ทราบสาเหตุที่แน่ชัด
- นพ.ธีระ วรธนารัตน์ โพสต์ว่า เช้านี้มีแต่ข่าวกัญชาที่เอี่ยวอยู่ในอาชญากรรม บุกรุกบ้าน ทำร้ายร่างกาย เต็มไปหมดรวมทั้งโพสต์ว่า กัญชาส่งผลต่อสมอง ทั้งในเรื่องความจำ การเรียนรู้ สมาธิ การตัดสินใจ อารมณ์ และเวลาในการตอบสนองนอกจากนี้ยังได้โพสต์เรื่องราวพิษจากกัญชาในขนมสำหรับเด็กที่แคนาดาหลังประกาศกัญชาเสรี พบเด็กต่ำกว่า 10 ปี ต้องเข้ารับการรักษาตัวใน รพ. เนื่องจากภาวะเป็นพิษจากการเสพกัญชาโดยไม่ตั้งใจ สูงขึ้นถึง 6.3 เท่า ส่วนประเด็นกัญชากับการคลอดก่อนกำหนด นพ.ธีระ โพสต์ว่าสตรีที่ตั้งครรภ์และใช้กัญชา จะเสี่ยงคลอดก่อนกำหนดมากกว่าคนที่ไม่ใช้กัญชา 1.35 เท่า
พ.ร.บ.กัญชา
- นายจุรินทร์ ลักษณวิศิษฎ์ รองนายกฯ และรมว.พณ. เผย ร่าง พ.ร.บ.กัญชาฯ ไม่ใช่กฎหมายของรัฐบาล ทุกพรรคมีสิทธิรับ-ค้าน ฟังประชาชนว่ารู้สึกอย่างไรกับกัญชาเสรี
- นายสุทิน คลังแสง ประธานวิปฝ่ายค้าน เผยโอกาสที่จะพิจารณาร่าง พ.ร.บ.กัญชาฯ สัปดาห์นี้มีโอกาส 50:50 ต้องรอการพิจารณาร่าง พ.ร.บ.การเข้าชื่อถอดถอนผู้บริหารท้องถิ่นที่ค้างการพิจารณาอยู่ และร่าง พ.ร.บ.ขนส่งทางรางก่อน ในส่วนของฝ่ายค้านโดยเฉพาะพรรคเพื่อไทย มีจุดยืนชัดเจนว่าหากกัญชาไม่ได้ถูกใช้ในกรอบทางการแพทย์ ไม่ให้ผ่านแน่นอน
- น.ส.พิมพ์รพี พันธ์วิชาติกุล ส.ส.พรรคประชาธิปัตย์ กล่าวถึงร่าง พ.ร.บ.กัญชาฯ ว่า ตนและเพื่อนร่วมพรรคที่ลงรับฟังปัญหาประชาชนมีความเห็นตรงกันว่าร่างกฎหมายฉบับนี้ยังมีช่องโหว่ ขาดความรัดกุม ไม่ได้เน้นประโยชน์ทางการแพทย์ตามที่มีการกล่าวอ้าง เปิดช่องว่างมอมเมา และมุ่งเชิงเศรษฐกิจ ดังจะเห็นได้จาก รมว.สธ. ใช้ตัวเองเป็นพรีเซนเตอร์ถ่ายภาพคู่กับไอศกรีมรสนมฮอกไกโดผสมกัญชา ไม่สามารถตีความเป็นอย่างอื่นไปได้ ฝากถึงนายอนุทินว่าประชาชนฝากผู้แทนฯ คือเรื่องปัญหาสังคม กังวลว่าลูกหลานจะเข้าสู่วังวนยาเสพติดได้ง่ายขึ้น
โรงพยาบาลในสังกัดสำนักงานปลัดกระทรวง กระทรวงสาธารณสุข 86 แห่ง
1. โรงพยาบาลเชียงคำ
2. โรงพยาบาลเชียงรายประชานุเคราะห์
3. โรงพยาบาลน่าน
4. โรงพยาบาลฝาง
5. โรงพยาบาลพะเยา
6. โรงพยาบาลแพร่
7. โรงพยาบาลลำปาง
8. โรงพยาบาลลำพูน
9. โรงพยาบาลศรีสังวาลย์
10. โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช
11. โรงพยาบาลพุทธชินราช
12. โรงพยาบาลเพชรบูรณ์
13. โรงพยาบาลแม่สอด
14. โรงพยาบาลศรีสังวรสุโขทัย
15. โรงพยาบาลสุโขทัย
16. โรงพยาบาลอุตรดิตถ์
17. โรงพยาบาลกำแพงเพชร
18. โรงพยาบาลชัยนาทนเรนทร
19. โรงพยาบาลพิจิตร
20. โรงพยาบาลสวรรค์ประชารักษ์
21. โรงพยาบาลอุทัยธานี
22. โรงพยาบาลพระนั่งเกล้า
23. โรงพยาบาลปทุมธานี
24. โรงพยาบาลพระนครศรีอยุธยา
25. โรงพยาบาลพระนารายณ์มหาราช
26. โรงพยาบาลสระบุรี
27. โรงพยาบาลเสนา
28. โรงพยาบาลอ่างทอง
29. โรงพยาบาลกระทุ่มแบน
30. โรงพยาบาลดำเนินสะดวก
31. โรงพยาบาลบ้านโป่ง
32. โรงพยาบาลประจวบคีรีขันธ์
33. โรงพยาบาลพระจอมเกล้า จังหวัดเพชรบุรี
34. โรงพยาบาลพหลพลพยุหเสนา
35. โรงพยาบาลโพธาราม
36. โรงพยาบาลราชบุรี
37. โรงพยาบาลสมเด็จพระพุทธเลิศหล้า
38. โรงพยาบาลสมเด็จพระสังฆราชองค์ที่ ๑๗
39. โรงพยาบาลสมุทรสาคร
40. โรงพยาบาลเจ้าพระยาอภัยภูเบศร
41. โรงพยาบาลตราด
42. โรงพยาบาลบางพลี
43. โรงพยาบาลพระปกเกล้า
44. โรงพยาบาลพุทธโสธร
45. โรงพยาบาลสมเด็จพระยุพราชสระแก้ว
46. โรงพยาบาลสมุทรปราการ
47. โรงพยาบาลกาฬสินธุ์
48. โรงพยาบาลขอนแก่น
49. โรงพยาบาลมหาสารคาม
50. โรงพยาบาลร้อยเอ็ด
51. โรงพยาบาลสิรินธร ภาคตะวันออกเฉียงเหนือ
52. โรงพยาบาลนครพนม
53. โรงพยาบาลสกลนคร
54. โรงพยาบาลสมเด็จพระยุพราชสว่างแดนดิน
55. โรงพยาบาลหนองคาย
56. โรงพยาบาลหนองบัวลำภู
57. โรงพยาบาลอุดรธานี
58. โรงพยาบาลชัยภูมิ
59. โรงพยาบาลเทพรัตน์นครราชสีมา
60. โรงพยาบาลบุรีรัมย์
61. โรงพยาบาลปราสาท
62. โรงพยาบาลปากช่องนานา
63. โรงพยาบาลมหาราชนครราชสีมา
64. โรงพยาบาลสุรินทร์
65. โรงพยาบาลมุกดาหาร
66. โรงพยาบาลยโสธร
67. โรงพยาบาลศรีสะเกษ
68. โรงพยาบาลอำนาจเจริญ
69. โรงพยาบาลกระบี่
70. โรงพยาบาลเกาะสมุย
71. โรงพยาบาลชุมพรเขตรอุดมศักดิ์
72. โรงพยาบาลตะกั่วป่า
73. โรงพยาบาลพังงา
74. โรงพยาบาลมหาราชนครศรีธรรมราช
75. โรงพยาบาลระนอง
76. โรงพยาบาลวชิระภูเก็ต
77. โรงพยาบาลสิชล
78. โรงพยาบาลตรัง
79. โรงพยาบาลนราธิวาสราชนครินทร์
80. โรงพยาบาลเบตง
81. โรงพยาบาลปัตตานี
82. โรงพยาบาลพัทลุง
83. โรงพยาบาลยะลา
84. โรงพยาบาลสงขลา
85. โรงพยาบาลสตูล
86. โรงพยาบาลสุไหงโก-ลก
ศิลปะการทำกาแฟ ระดับมืออาชีพ LE CORDON BLEU THAILAND 25,000/3 วัน LINK
คอร์สศิลปะการทำกาแฟ (Barista) ได้รับการพัฒนาขึ้นเพื่อให้ครอบคลุมความรู้และทักษะที่จำเป็นสำหรับการเป็นมืออาชีพมากขึ้น ซึ่งเหมาะสำหรับผู้ที่ต้องการประกอบธุรกิจร้านกาแฟ หรือผู้ที่ใฝ่ฝันอยากจะเป็นบาริสต้ามืออาชีพ ตลอดระยะเวลา 3 วัน ผู้สอนมุ่งเน้นถ่ายทอดเนื้อหา เทคนิควิธีการชงกาแฟ พร้อมหัวใจสำคัญที่จะทำให้ได้กาแฟเอสเพรสโซ่คุณภาพดี เพื่อการทำเครื่องดื่มกาแฟประเภทต่าง ๆ อาทิ กาแฟสไตล์อิตาเลี่ยนทั้งแบบร้อนและเย็น การตกแต่งหน้ากาแฟ การสาธิตศิลปะการทำฟองนมลาเต้อาร์ต (Latte Art) ขั้นพื้นฐาน การใช้งานเครื่องบดเมล็ดกาแฟ และการดูแลรักษาเครื่องทำกาแฟ
หัวข้อหลักสูตร "ศิลปะการทำกาแฟ ระดับมืออาชีพ" จำนวนชั่วโมงรวม: 18 ชั่วโมง
ระยะเวลาเรียน: 3 วัน
ชั่วโมงเรียนต่อวัน: 6 ชั่วโมง
เวลาเรียน: 09.00 - 16.00 น.
ภาษาที่ใช้ในการเรียน: ภาษาไทย
จำนวนผู้เรียน: 12 ท่าน
สถานที่เรียน: อาคารเซ็นทรัลทาวเวอร์ ชั้น 17 ศูนย์การค้าเซ็นทรัลเวิล์ด
วันที่ 3-4 มี.ค. เวทีการแสดงสำหรับเด็กๆ เยาวชน
พัทยาเหนือ
17-20 น. วงโรงเรียนเมืองพัทยา 2
20-22 น. วง Brew
พัทยาเหนือ ซอย 6
17-18 น. วงโรงเรียนเมืองพัทยา 8
18-19 น. วงโรงเรียนเมืองพัทยา 7
19-20 น. วง Sugar cream
20.30 -22 น. วง Crab muscle
พัทยากลาง ซอย 9
17-18 น. วงโรงเรียนเมืองพัทยา 3
18.30-21 น. วงครูไทย
เขตทุ่งครุ LINK
สำนักงานเขตทุ่งครุร่วมกับศูนย์บริการสาธารณสุข 54 ทัศน์เอี่ยม และศูนย์บริการสาธารณสุข 59 ทุ่งครุ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
กิจกรรมออกหน่วยที่ผ่านมา
กิจกรรมที่ผ่านมาปี 2566
วันเสาร์ ที่ 18 กุมภาพันธ์ พ.ศ.2566 เวลา 09.30 -11.30 น. ณ ชุมชนหน้าทักษิณ เทศบาลนนครศรีธรรมราช
วันเสาร์ที่ 11 กุมภาพันธ์ พ.ศ.2566 เวลา 09.30 -11.30 น. ณ ชุมชนบ้านตก ชุมชนสถานีรถไฟ เขตนอกโคก
วันเสาร์ ที่ 28 มกราคม พ.ศ.2566 เวลา 09.30 น. – 11.30 น. ณ ชุมชนบ่ออ่าง และชุมชนตลาดยาว เทศบาลนครนครศรีธรรมราช
วันเสาร์ที่ 21 มกราคม พ.ศ.2566 เวลา 09.30 -11.30 น. ณ ชุมชนพะเนียด และชุมชนเศรษฐีศรีนคร
กิจกรรมที่ผ่านมาปี 2565
วันที่ 18 มิถุนายน 2565 เวลา 09.30 น. – 11.30 น. ออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนตลาดหัวอิฐ (ที่ทำการชุมชนตลาดหัวอิฐ) สำหรับในวันนี้มีประชาชนมาใช้บริการขึ้นทะเบียนเจ้าของสัตว์ เลี้ยง21 ราย สุนัข 20 ตัว แมว 22 ตัว
วันเสาร์ที่ 25 มิถุนายน 65 เวลา 09.30 -11.30 น. ณ ชุมชนบ้านโพธิ์ และชุมชนคลองห้วย เทศบาลนครนครศรีธรรมราช
วันที่ 2 กรกฎาคม 2565 เวลา 09.30 น. – 11.30 น. ณ ชุมชนวัดหัวอิฐ และชุมชน บขส. สถานพยาบาลสัตว์ เทศบาลนครนครศรีธรรมราช ออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
วันเสาร์ที่ 1 ตุลาคม 2565 เวลา 09.30 -11.30 น. ลงพื้นที่ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนหัวถนนก้าวหน้า และชุมชนศาลามีชัย เทศบาลนครนครศรีธรรมราช
วันเสาร์ ที่ 8 ตุลาคม 2565 เวลา 09.30 น. – 11.30 น. ให้บริการออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนเพชรจริก และชุมชนพระเวียง
วันเสาร์ที่ 15 ตุลาคม พ.ศ. 2565 เวลา 09.30 น. – 11.30 น. ออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนหอไตร และชุมชนท้าวโคตร
เทศบาลนครนครศรีธรรมราช
วันเสาร์ที่ 22 ตุลาคม 2565 เวลา 09.30 -11.30 น. ลงพื้นที่ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนหัวท่า และชุมชนประตูชัย เทศบาลนครนครศรีธรรมราช
วันเสาร์ ที่ 29 ตุลาคม 2565 เวลา 09.30 -11.30 น. ณ ชุมชนหน้าวัดพระธาตุ และชุมชนหลังวัดพระธาตุ
วันเสาร์ ที่ 5 พฤศจิกายน 2565 เวลา 09.30 น. – 11.30 น. ออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนบุญนารอบ และชุมชนศรีธรรมโศก เทศบาลนครนครศรีธรรมราช
วันเสาร์ ที่ 19 พฤศจิกายน 2565 เวลา 09.30 น. – 11.30 น. บริการออกหน่วยจัดทำทะเบียนประวัติสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้แก่ชุมชนมุมป้อม และชุมชนป้อมเพชร ณ วัดมุมป้อม
วันเสาร์ที่ 24 ธันวาคม 2565 เวลา 09.30 -11.30 น. ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ณ ชุมชนท่าช้าง และชุมชนลูกแม่อ่างทอง เทศบาลนครนครศรีธรรมราช
สามารถติดต่อสอบถามได้ที่สถานพยาบาลสัตว์ทุ่งท่าลาด โทร.075-358292 (วัน-เวลาราชการ)
Thailand Earth Trail 4 สนาม by WARRIX LINK
WARRIX PRESENTED THAILAND EARTH TRAIL SERIES 2023 (TETS2023) (ไทยแลนด์ เอิร์ธ เทรล)
Thailand Earth Trail - วิ่งเทรลวิถีใหม่ ใส่ใจสิ่งแวดล้อม พร้อมให้คุณมาสัมผัสแล้วในปี 2023 นี้ 4 สนาม
Thailand Earth Trail@Saraburi ลานรักแคมป์ ต.ชะอม อ.แก่งคอย จ. สระบุรี 22-23 กรกฎาคม 2566 ระยะการแข่งขัน 40k/ 15k/ 8k
Thailand Earth Trail @Rayong
Thailand Earth Trail@Chaiyaphum
Thailand Earth Trail@Suphanburi
คลินิกพิเศษนอกเวลาระดับรพ.ศูนย์ ภาคตะวันออกเฉียงเหนือ
งานแถลงข่าว Eye Excellence Center (31 พฤษภาคม 2566) LINK
งานแถลงข่าว Eye Excellence Center ขึ้นเพื่อสร้างความตระหนักรู้เกี่ยวกับการดูแลสุขภาพดวงตาและการป้องกันก่อนเกิดโรค เมื่อวันที่ 31 พฤษภาคม 2566 นำโดยผู้บริหารและทีมแพทย์ผู้เชี่ยวชาญด้านโรคจักษุในทุกสาขา ร่วมให้ข้อมูลศักยภาพความพร้อมในการบริการได้อย่างครบวงจร สามารถทำงานร่วมกันได้อย่างไร้รอยต่อ พร้อมมีเทคโนโลยีที่ทันสมัย จะเพิ่มโอกาสให้ผู้ป่วยได้รับการรักษาที่มีประสิทธิภาพและความปลอดภัยมากยิ่งขึ้น
มูลนิธิป่อเต็กตึ๊ง จัดอบรมเดือนกรกฎาคม 2566 ทั้งหมด 3 หลักสูตร (อบรมฟรี มีใบประกาศให้) LINK
แผนกฝึกอบรมมูลนิธิป่อเต็กตึ๊ง จัดการอบรมให้ความรู้การช่วยชีวิต เดือนกรกฎาคม 2566 จะเปิดทั้งหมด 3 หลักสูตร ดังนี้ (* อบรมฟรี ทุกหลักสูตร + ออกใบประกาศให้ทุกหลักสูตร รายละเอียดเพิ่มเติม โทร 02-2250020 ต่อ 365/372/431/432)
1. หลักสูตร การกู้ภัยเบื้องต้น Basic Rescue Course (ฺBRC) รุ่นที่ 1/66
- รับสมัครจำนวน 60 คน
- เปิดรับสมัครวันที่ 12 มิ.ย.-22 มิ.ย.66
- อบรมวันที่ 1-3 ก.ค.66 ณ ศูนย์ผึกอบรมอาสาสมัครป้องกันภัยฝ่ายพลเรือน จ. ชัยนาท
*สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊งเท่านั้น !!!!!!!
2. หลักสูตร ดับเพลิง (ฺBasic Fire Fighting) รุ่นที่ 1/66
- รับสมัครจำนวน 30 คน
- เปิดรับสมัครวันที่ 26 มิ.ย.-6 ก.ค.66
- วันอบรม วันที่ 15-17 ก.ค.66 ณ ศูนย์ฝึกแอนตี้ไฟร์เทรนนิ่งเซ็นเตอร์ จ.ฉะเชิงเทรา
*สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊งเท่านั้น !!!!!!!
3. หลักสูตร ปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 6/66
- รับสมัครจำนวน 100 คน
- เปิดรับสมัครวันที่ 16-26 มิ.ย.66
- วันอบรม วันที่ 5 ก.ค.66 เวลา 08.30-16.00 น. "(ผ่าน Google meet)"
รายละเอียดเพิ่มเติม โทร 02-2250020 ต่อ 365/372/431/432
Coffee Course เรียนชงกาแฟกับบลูคอฟ LINK
Coffee Course เรียนชงกาแฟกับบลูคอฟ หลักสูตรที่เปิดสอน
1. Basic Barista Course เรียน 1 วันเต็ม ราคา 3,900 บาท ต่อ 1 ท่าน หลักสูตรเริ่มต้นสำหรับผู้ที่ต้องการเรียนชงกาแฟ โดย Bluekoff เน้นให้ผู้ที่มาเรียนได้ปฏิบัติจริง เริ่มต้นตั้งแต่ปูพื้นฐานในการชงกาแฟแรกเริ่มทุกขั้นตอน
2. Basic Barista Course Plus เรียน 2 วันเต็ม ราคา 6,900 บาท ต่อ 1 ท่าน หลักสูตรเริ่มต้นสำหรับผู้ประกอบการร้านกาแฟ หรือผู้ที่ต้องการเรียนชงกาแฟ
3. Basic Latte Art เรียน 1 วัน ราคา 4,900 บาท ต่อ 1 ท่าน หลักสูตรพื้นฐานสำหรับผู้ที่สนใจเทลาเต้อาร์ต เรียนรู้ตั้งแต่ปัจจัยที่มีผลต่อการทำฟองนม เทคนิคการทำฟองนม
4. Advanced Latte Art เรียน 1 วัน ราคา 8,900 บาท ต่อ 1 ท่าน หลักสูตรติวเข้มสำหรับการเทลาเต้อาร์ต ได้เรียนทั้งทฤษฎีและลงมือปฏิบัติจริง
5. Home Brewing Class: Pour-Over เรียน 1 วัน ราคา 3,900 บาท ต่อ 1 ท่าน หลักสูตรเรียนรู้การชงกาแฟในรูปแบบ Home Brewing แบบต่างๆ
สถานที่ - Boffkool Cafe ตั้งอยู่ที่อาคารพร้อมพันธุ์ 2 ชั้น 1 ซ.ลาดพร้าว 3 โทร 081-9799565 กด 3
รายงานผลสำรวจความเห็น เรื่องการบริการสุขภาพ
บันทึกผลการสำรวจ และรายละเอียด เพื่อประโยชน์ต่อการศึกษาสำหรับผู้ที่สนใจ - เริ่มแจงโดยละเอียด หลังจากจำนวนผู้เข้าร่วมทำแบบสอบถามเกิน 1,000 รายขึ้นไปแล้วเมื่อเดือนกรกฏาคม 2567 ที่ผ่านมา (แบบสอบถามนี้เริ่มต้นเมื่อ 02/2022 และจะอัพเดตผลสำรวจทุก 1-2 สัปดาห์ ภาพกราฟฟิคที่แสดงจะเป็นข้อมูลล่าสุดที่อัพเดต)
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน
- 29 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 613 ท่าน
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน
Healthserv รู้สึกเป็นเกียรติและขอขอบคุณประชาชนคนไทยทุกท่านที่สละเวลา ทำแบบสอบถามและแสดงความคิดผ่านแบบสอบถามนี้ ผลที่ได้มาจากแบบสำรวจนี้ (ซึ่งแสดงด้านล่าง) คือการสะท้อนความต้องการของประชาชนทุกท่านอย่างตรงไปตรงมา ในฐานประชาชนคนไทย ที่สามารถจะคาดหวัง และสมควรได้รับการดูแลด้านสุขภาพอย่างเหมาะสม ครบถ้วน และตรงตามความต้องการที่สุด จากรัฐหรือหน่วยงานที่มีหน้าที่ทั้งโดยตรงและที่เกี่ยวข้อง
สถิติผู้สูงอายุ กรมกิจการผู้สูงอายุ พม. LINK
ข้อมูลผู้สูงอายุทั่วไป สถิติผู้สูงอายุ
อัตราส่วนการเป็นภาระวัยสูงอายุ และ อ้ตราส่วนการเป็นภาระ ของ ประชากรไทย ปี พ.ศ.2565 ระดับ จังหวัด เขต/อำเภอ ตำบลรวบรวมจากข้อมูลของกรมการปกครอง
รพ.กุมภวาปี อ.กุมภวาปี จ.อุดรธานี
ข่าวดีสำหรับชาวอ.กุมภวาปี และอ.ใกล้เคียง ในจ.อุดรธานี ที่ รพ.กุมภวาปี พร้อมดูแลผู้ประกันตนแล้ว ในปี 2567 นี้ และเริ่มเปิดรับผู้ประกันตน ที่สนใจและประสงค์ย้ายสิทธิได้ สอบถามรายละเอียด ที่งานประกันสุขภาพ อาคาร 3 ชั้น 1 โทร. 042-334412 042-334413 สำหรับความพร้อมด้านศักยภาพของรพ.กุมภวาปี เป็นรพ.มาตรฐาน HA และโรงพยาบาลแม่ข่ายของโซนลุ่มน้ำปาว จ.อุดรธานี และจ.ใกล้เคียง มีการจัดพื้นที่ให้บริการผู้ป่วยนอกแบบ One stop service มีทีมแพทย์เฉพาะทาง พร้อมดูแลหลายสาขา รพ.ผ่านการรับรองเป็นศูนย์ไตเทียม ของสปสช. (บัตรทอง) มีบริการตรวจสุขภาพประจำปี ฟรี บริการทันตกรรม ไม่ต้องสำรองจ่าย ผู้ประกันตนที่สนใจสามารถเลือกย้ายสิทธิการรักษาได้แล้ว ตั้งแต่วันนี้ถึง 19 ธันวาคม 2567 สอบถามเพิ่มเติม งานประกันสุขภาพ โทร. 042-334400 ต่อ 3126
facebook.com/kumhosp/ นายประสิทธิ์ ทองแท่งไทย รองนายกองค์การบริหารส่วนจังหวัดขอนแก่น ค่าบริการคลินิกนอกเวลา (SMC) รงพยาบาลแกลง LINK
- ค่าบริการ 450 บาท (ไม่สามารถเบิกคืนได้)
- ค่าบริการ 400 บาท หากเป็นสิทธิ์เบิกจ่ายตรง
- ค่ายาเบิกได้ตามสิทธิ์
- ขอใบรับรองแพทย์ เริ่มต้น 150 บาท
ติดต่อสอบถามในวันอังคาร หรือ พฤหัสบดี เวลา 16.30-20.00 น.
062-648-9010 // 038-677-533 ต่อ 319
Line ID :@838nzinb
ปี 2567 โรงพยาบาลเปาโล พระประแดง รับผู้ประกันตนรวมกว่า 106,950 คน
เปลี่ยนสถานพยาบาล "ประกันสังคม" ประจำปี 2567 เลือกโรงพยาบาลเปาโล พระประแดง สถานพยาบาลในเครือข่ายประกันสังคม ปี 2567 สามารถรับผู้ประกันตนรวมกว่า 106,950 คน
✅ ให้บริการโดยทีมแพทย์สหสาขาร่วมดูแลด้วยระบบส่งต่อรักษา
✅ มอบสิทธิประโยชน์เพื่อดูแลผู้ประกันตนและครอบครัว
✅ ตรวจสุขภาพประจำปีและบริการทันตกรรมไม่ต้องสำรองจ่าย
สิทธิประโยชน์สำหรับผู้ประกันตน
✅ เข้ารับบริการตรวจสุขภาพประจำปีตามเงื่อนไขช่วงอายุ โดยไม่เสียค่าใช้จ่าย
✅ รับบริการทันตกรรมตามสิทธิ์ โดยไม่ต้องสำรองจ่าย
✅ ส่วนลดรักษาพยาบาลสำหรับครอบครัวผู้ประกันตน
ผู้ประกันตนสามารถเปลี่ยนสถานพยาบาลประกันสังคมได้ตั้งแต่ วันที่ 16 ธันวาคม 2566 จนถึง 31 มีนาคม 2567
อั่งเปา ตั่วๆ ไก๊ ลื้อจุดธูปเทียนไว้ อย่าลืมดับล่วยยยยย ปรารถนาดีจาก กรุงเทพมหานคร
อั่งเปา ตั่ว ๆ ไก๊ ลื้อจุดธูปเทียนไว้ อย่าลืมดับล่วยยยยย
新年快乐 身体健康 ซินเหนียนไคว่เล่อ เซินถีเจี้ยนคัง
ขอให้มีความสุขในวันปีใหม่ สุขภาพแข็งแรงตลอดปี
หากเกิดเหตุอัคคีภัย แจ้ง 199
ด้วยความปรารถนาดีจาก กรุงเทพมหานคร
ความยิ่งใหญ่ของเทศกาลสงกรานต์ไทย ยกระดับเป็นมรดกวัฒนธรรมของโลกไปแล้ว
เมื่อวันที่ 6 ธ.ค. 2566 ยูเนสโก ได้ประกาศขึ้นทะเบียนให้ “สงกรานต์ในประเทศไทย” เป็นรายการในบัญชีตัวแทนมรดกภูมิปัญญาทางวัฒนธรรมที่จับต้องไม่ได้ของมนุษยชาติ (Representative List of the Intangible Cultural Heritage of Humanity) ในการประชุมคณะกรรมการระหว่างรัฐบาลว่าด้วยการสงวนรักษามรดกวัฒนธรรมที่จับต้องไม่ได้ ครั้งที่ 18 ณ เมืองคาเซเน สาธารณรัฐบอตสวานา
ทำให้ “สงกรานต์ในประเทศไทย” (Songkran in Thailand, traditional Thai New Year festival) ถือเป็นรายการในบัญชีตัวแทนมรดกภูมิปัญญาทางวัฒนธรรมที่จับต้องไม่ได้ของมนุษยชาติ ลำดับที่ 4 ของประเทศไทย โดยก่อนหน้านี้ UNESCO ได้ประกาศขึ้นทะเบียนให้แก่ “โขน” (Khon, masked dance drama in Thailand) ในปี 2561, “นวดไทย” (Nuad Thai, Traditional Thai Massage) ในปี 2562 และ “โนรา” ของภาคใต้ (Nora, Dance Drama in Southern Thailand) ในปี 2564
เพื่อเป็นการเฉลิมฉลอง ครม. ได้มีมติจัดกิจกรรมสงกรานต์ 2567 เป็นเวลา 21 วัน โดยใช้ชื่อว่า งาน “Maha Songkran World Water Festival เย็นทั่วหล้า มหาสงกรานต์ 2567” จัดขึ้นตั้งแต่วันที่ 1-21 เมษายนทั่วประเทศ เช่น เชียงราย เชียงใหม่ สุโขทัย พระนครศรีอยุธยา
พร้อมกันนั้น ได้กำหนดวันหยุดประจำปี ช่วงเทศกาลสงกรานต์ เพิ่มเติม อีก 2 วัน คือ ตั้งแต่ วันศุกร์ที่ 12 ถึง วันอังคารที่ 16 เมษายน 2567 โดยวันให้วันที่ 12 เป็น วันหยุดพิเศษ และ วันที่ 16 วันหยุดชดเชย
เมื่อปี 2566 กระทรวงวัฒนธรรมประกาศ เทศกาลสงกรานต์ นี้ ทุกจังหวัดจัดกิจกรรมได้แบบเต็มรูปแบบได้เป็นครั้งแรก หลังสถานการณ์โควิด-19 คลี่คลาย นอกจากนี้ยังมอบหมายให้วัฒนธรรมจังหวัดประสานงานกับผู้ว่าราชการจังหวัดวางแผนการประชาสัมพันธ์แหล่งท่องเที่ยวเชิงวัฒนธรรม และชุมชนยลวิถีต้นแบบ 20 แห่ง รวมทั้ง แหล่งท่องเที่ยวทางประวัติศาสตร์ ให้มีการจัดทำเส้นทางการท่องเที่ยวที่น่าสนใจ ซึ่งคาดว่าจะช่วยกระตุ้นเศรษฐกิจในท้องถิ่นได้เป็นอย่างดี [
กิจกรรมสงกรานต์ปี 2566]
ฤดูร้อนประเทศไทย เริ่มตั้งแต่วันที่ 21 กุมภาพันธ์ 2567
กรมอุตุนิยมวิทยาได้ประกาศเข้าสู่ฤดูร้อนตั้งแต่วันที่ 21 กุมภาพันธ์ 2567 คาดการณ์ฤดูร้อนปีนี้ ประเทศไทยจะมีอากาศร้อนอบอ้าวโดยทั่วไป และมีอากาศร้อนจัดในหลายพื้นที่ อุณหภูมิสูงสุดเฉลี่ยบริเวณประเทศไทยตอนบน 35.0 – 38.0 องศาเซลเซียส โดยคาดการณ์อุณหภูมิสูงที่สุด 43.0 - 44.5 องศาเซลเซียส ซึ่งใกล้เคียงหรือเทียบเท่ากับสถิติของประเทศไทย (44.6 องศาเซลเซียส ที่อำเภอเมือง จังหวัดแม่ฮ่องสอน เมื่อวันที่ 28 เมษายน 2559 และ อ.เมือง จ.ตาก เมื่อวันที่ 15 เมษายน 2566) โดยช่วงกลางเดือนมีนาคมถึงต้นเดือนพฤษภาคม จะมีอากาศร้อนจัดต่อเนื่องเป็นเวลานาน อาจทำให้เกิดภัยและโรคที่มีสาเหตุมาจากอากาศร้อน โดยเฉพาะกลุ่มเสี่ยงและเปราะบาง เช่น ผู้ป่วย ผู้สูงอายุ และเด็ก จึงขอให้ประชาชนหลีกเลี่ยงสถานที่ที่มีอากาศร้อนจัดเป็นเวลานาน ๆ และหมั่นตรวจสอบดูแลคนในครอบครัวให้เตรียมสภาพร่างกายให้พร้อมที่จะเผชิญกับสภาพอากาศฤดูร้อน ปีนี้อุณหภูมิสูงสุด 43.0 – 44.5 องศาเซลเซียส แต่ความรู้สึกของมนุษย์ หรือค่าดัชนีความร้อน หรือ Heat Index อาจสูงมากกว่า ซึ่งอยู่ในระดับอันตรายมากในบางวัน โดยเฉพาะในช่วงเดือนเมษายนถึงต้นเดือนพฤษภาคม ส่วนมากบริเวณประเทศไทยตอนบน ซึ่งประกอบด้วยภาคเหนือ ภาคตะวันออกเฉียงเหนือ ภาคตะวันออก ภาคกลาง รวมทั้งกรุงเทพมหานคร ทั้งนี้ ประเทศไทยจะสิ้นสุดฤดูร้อนประมาณกลางเดือนพฤษภาคม 2567 และเพื่อให้รู้ถึงสภาพอากาศและสามารถวางแผนการใช้ชีวิตประจำวันให้เกิดผลกระทบต่อสุขภาพน้อยที่สุด ประชาชนควรติดตามข่าวการพยากรณ์อากาศและการพยากรณ์ค่าดัชนีความร้อนจากกรมอุตุนิยมวิทยาทางเว็บไซต์ www.tmd.go.th และเฟซบุ๊กกรมอุตุนิยมวิทยาอย่างต่อเนื่อง
ตรวจสุขภาพฟรี เดือนกรกฎาคม 2567
ตรวจสุขภาพฟรี เดือนกรกฎาคม 2567 ที่ศูนย์การค้าในเครือเซ็นทรัลทั้ง 7 แห่ง
- 5 - 7 ก.ค. ที่ โซน Thai Classic ชั้น 4 เซ็นทรัลปิ่นเกล้า
- 6 - 7 , 13 - 14 , 20 - 22 , 27 - 29 ก.ค. ที่ โซนธนาคาร ชั้น G เซ็นทรัลพระราม 2
ครั้งที่ 1 : วันที่ 12 - 14 ก.ค. ที่ บางนาฮอลล์
ครั้งที่ 2 : วันที่ 19 - 21 ก.ค. ที่ ลานกิจกรรม ชั้น 5 เซ็นทรัลบางนา
- 19 - 21 ก.ค. ที่ โซน Eden ชั้น 3 เซ็นทรัลเวิลด์
- 19 - 21 ก.ค. ที่ ลานกิจกรรม ชั้น 4 เซ็นทรัล รามอินทรา
- 19 - 21 ก.ค. ที่ โซนหน้าธนาคาร ชั้น 2 เอสพลานาด รัชดาภิเษก
- 26 - 28 ก.ค. ที่ พื้นที่หน้าสตาร์บัค ชั้น 1 เซ็นทรัลพระราม 3
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน กรกฎาคม 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กรกฎาคม 2567 ดังนี้ 12 ก.ค. 67 เทศบาลตำบลเกาะสีชัง 17 ก.ค. 67 วัดบ่อวิน เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา 25 ก.ค. 67 โดมเทศบาลบ้านสวน เทศบาลเมืองบ้านสวน อ.เมืองชลบุรี ทุกจุดกำหนดเวลาออกหน่วยบริการ 8.30 - 11.00 น. (รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น** )
ดนตรีในสวนกรุงเทพมหานคร เดือนกรกฎาคม 2567
กิจกรรมดนตรีในสวนกรุงเทพมหานคร เดือนกรกฎาคม 2567
- วันเสาร์ที่ 6 กรกฎาคม 2567
หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร (ห้องโถงชั้น 1) พบกับการแสดงดนตรีในรายการ “String @ BACC” โดย วง Bangkok String Ensemble เริ่ม 11.00 น.
สวนธนบุรีรมย์ พบกับกลุ่มจิตอาสาคณะนักร้องประสานเสียงผู้สูงวัย "สานใจคอรัส" เริ่ม 17.00 น.
- เสาร์ที่ 13 กรกฎาคม 2567 นี้ พบกับการแสดงขับร้องประสานเสียง โดย กลุ่มจิตอาสาคณะนักร้องประสานเสียงผู้สูงวัย "สานใจคอรัส" ณ สวนเบญจกิติ เริ่ม 17.00 น.
รวมเป็นบัตรเดียว ตั้งแต่สิงหาคม 2567
7 สิงหาคม 2567 ศูนย์รับบริจาคอวัยวะสภากาชาดไทย ประกาศว่า การรวมบัตรประจำตัวผู้แสดงความจำนงบริจาคดวงตา-อวัยวะ อยู่ในบัตรเดียวกัน และจะไม่แสดงหมายเลขผู้บริจาคดวงตา-อวัยวะ ในการเช็คข้อมูลผู้บริจาคดวงตา-อวัยวะ จะใช้หมายเลขบัตรประชาชน เป็นหลัก
เมื่อท่านได้แสดงความจำนงบริจาคดวงตา-อวัยวะ ทั้งผ่านเว็บไซต์ https://eyeorgandonate.redcross.or.th หรือบริจาคผ่านการดาวน์โหลดแอปพลิเคชั่นบริจาคดวงตา-อวัยวะ หรือบริจาคด้วยตนเอง ทางศูนย์รับบริจาคอวัยวะ และศูนย์ดวงตาจะทำการจัดส่งบัตรผู้มีความจำนงบริจาคดวงตา-อวัยวะ ทางไปรษณีย์ในที่อยู่ที่ท่านได้ระบุไว้
หลังจากแสดงความจำนงบริจาคดวงตา-อวัยวะ แล้วเมื่อได้รับบัตรประจำตัวผู้บริจาคดวงตา-อวัยวะ ควรทำอย่างไร
- เมื่อได้รับบัตรบริจาคดวงตา-อวัยวะ แล้วให้กรอกรายละเอียดด้านหลังบัตร โดยเฉพาะชื่อพร้อมหมายเลขโทรศัพท์ของผู้ที่สามารถติดต่อได้ในกรณีฉุกเฉิน
- แจ้งบุคคลในครอบครัวหรือญาติให้รับทราบถึงเจตนารมณ์ในการบริจาคดวงตา-อวัยวะ ทั้งนี้เมื่อเสียชีวิตและสามารถบริจาคดวงตา-อวัยวได้ ทางศูนย์ฯ จะต้องขอความยินยอมจากญาติเป็น ลายลักษณ์อักษร หากญาติไม่อนุญาตจะไม่สามารถทำตามเจตนารมณ์ผู้บริจาค และไม่สามารถนำอวัยวะของผู้บริจาคไปปลูกถ่ายช่วยชีวิตผู้อื่นได้
- พกบัตรหรือเก็บไว้ในที่หาได้ง่าย
- เมื่อผู้บริจาคอวัยวะ-ดวงตา เสียชีวิตลง บุคคลในครอบครัวหรือญาติ โทรแจ้งสายด่วนบริจาคอวัยวะ โทร .1666 กด 5 แจ้งเสียชีวิต บริจาคดวงตา โทร. 08-1902-5938 หรือ 08-1836-4927
ผู้แสดงความจำนง ที่มีบัตรเดิม ยังคงใช้ได้ต่อไป หากต้องการบัตรใหม่แบบรวม สามารถ โทร .1666 กด 1 ฝ่ายรับแสดงความจำนงบริจาคอวัยวะ (วัน เวลา ราชการ)
กรณีต้องการแก้ไขข้อมูลส่วนตัว ยังไม่ได้รับบัตร บัตรหาย บริจาคอวัยวะ ติดต่อสายด่วนบริจาคอวัยวะ โทร.1666 กด 1 บริจาคดวงตา โทร. 0 2256 4039-40 (เวลาราชการ) |
Facebook ศูนย์รับบริจาคอวัยวะสภากาชาดไทยศูนย์บริการสาธารณสุข 7 และ 55 เขตยานนาวา ฉีดวัคซีน ฟรี 2 - 13 กันยายน 2567
สำนักงานเขตยานนาวา ร่วมกับศูนย์บริการสาธารณสุข 7 และ ศูนย์บริการสาธารณสุข 55 จัดกิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในพื้นที่เขตยานนาวา โดยออกหน่วยเคลื่อนที่ ระหว่างวันที่ 2 - 13 กันยายน 2567 ตั้งแต่เวลา 09.00 - 12.00 น. เจ้าของสัตว์เลี้ยงที่สนใจ สามารถพาสัตว์เลี้ยงมารับบริการได้ โดยไม่ต้องเสียค่าใช้จ่าย สัตว์เลี้ยงที่สามารถพามาฉีดวัคซีนได้ เช่น สุนัข แมว กระต่าย โดยสัตว์ต้องมีอายุเฉลี่ย 3 เดือนขึ้นไป มีสุขภาพแข็งแรงไม่ป่วย
สามารถสอบถามข้อมูลเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตยานนาวา โทร 02-2942397
จุฬาลงกรณ์มหาวิทยาลัย ขอเชิญร่วมบริจาคสิ่งของและปัจจัยเพื่อช่วยเหลือผู้ประสบอุทกภัย LINK
ศูนย์เครือข่ายการเรียนรู้เพื่อภูมิภาค
จุฬาลงกรณ์มหาวิทยาลัย ขอเชิญร่วมบริจาคสิ่งของและปัจจัยเพื่อช่วยเหลือผู้ประสบอุทกภัย จังหวัดน่านที่กำลังประสบความเดือดร้อนจากอุทกภัยในขณะนี้
สิ่งของที่รับบริจาคประกอบด้วย น้ำดื่ม อาหารแห้ง ยารักษาโรค อุปกรณ์ทำความสะอาดบ้าน ผ้าอ้อมสำเร็จรูปสำหรับเด็กและผู้ใหญ่
ผู้สนใจสามารถบริจาคได้ที่ศูนย์เครือข่ายการเรียนรู้เพื่อภูมิภาค ชั้น 2 อาคารจามจุรี 1 ตั้งแต่บัดนี้ – 31 สิงหาคม 2567
การบริจาคเงินเพื่อช่วยเหลือผู้ประสบภัย สามารถบริจาคได้ที่เลขที่บัญชี 430-190804-4 ชื่อบัญชี “จุฬาลงกรณ์มหาวิทยาลัยช่วยผู้ประสบอุทกภัย จังหวัดน่าน” ธนาคารไทยพาณิชย์ สาขาสภากาชาดไทย
สอบถามรายละเอียดเพิ่มเติมได้ที่โทร. 0-2218-0087
10 ประเภทโครงการที่สามารถขอรับการสนับสนุนจากกองทุนผู้สูงอายุได้
1.ส่งเสริมการศึกษา 2.เฝ้าระวังเกื้อกูล 3.อนุรักษ์วัฒนธรรม 4.สุขภาพ/กีฬา นันทนาการ 5.ศูนย์อเนกประสงค์ 6.ภูมิปัญญา 7.ฝึกอาชีพ 8.จัดตั้ง/พัฒนาเครือข่าย 9.ศึกษาวิจัย 10.สิ่งอำนวยความสะดวก
งานวัดประจำปี งานปิดทองไหว้พระ ในสุพรรณบุรี
- 11-15 กุมภาพันธ์ 2567 งานวันบูรพาจารย์ หลวงพ่อหร่ำ กิตฺติสาโร หลวงพ่อทองหยด ปวโร (พระครูบวรธรรมรัต) วัดวังจิก ตำบลวังลึก อำเภอสามชุก จังหวัดสุพรรณบุรี
- 17-19 กุมภาพันธ์ 2567งานประจำปี ปิดทองหลวงพ่อโต และ ทำบุญครบรอบวันมรณภาพหลวงพ่อเตี้ย เพื่อสมทบในการบูรณะบ้านหลังสุดท้ายของชีวิต (เมรุ) ณ วัดสามเอก ตำบลโคกช้าง อำเภอเดิมบางนางบวช จังหวัดสุพรรณบุรี
- 8-16 กุมภาพันธ์ 2567 งานมหากุศล ปิดทองฝังลูกนิมิต วัดรางเข็มทอง ตำบลบ่อสุพรรณ อำเภอสองพี่น้อง จังหวัดสุพรรณบุรี
- 23-24 กุมภาพันธ์ 2567 งานวันบูรพาจารย์ (รำลึก) พระครูทุย กนฺตสีโล อดีตเจ้าอาวาสวัดสวนแตง วัดสวนแตง ตำบลสวนแตง อำเภอเมืองสุพรรณบุรี จังหวัดสุพรรณบุรี
- 15-17 มีนาคม 2567 งานประจำปีปิดทองไหว้พระ ขอพรหลวงพ่อหยกขาว และ งานยกช่อฟ้าอุโบสถ วัดหนองยาว วัดหนองยาว ตำบลห้วยขมิ้น อำเภอด่านช้าง จังหวัดสุพรรณบุรี
- 23-28 มีนาคม 2567 งานประจำปีนมัสการปิดทองหลวงพ่อแสงสว่างฟ้า วัดดาว ตำบลวัดดาว อำเภอบางปลาม้า จังหวัดสุพรรณบุรี
- 14-15 เมษายน 2567 งานพิธียกช่อฟ้าอุโบสถและทอดผ้าป่าสามัคคี ปิดทองหลวงพ่อโต วัดทับกระดาษ ราษฎร์บำรุง ตำบลนิคมกระเสียว อำเภอด่านช้าง จังหวัดสุพรรณบุรี
- 29-30 เมษายน 2567 งานประจำปีปิดทองไหว้พระและฟังเทศน์มหาชาติ วัดม่วงเจริญผล วัดม่วงเจริญผล ตำบลศรีประจันต์ อำเภอศรีประจันต์ จังหวัดสุพรรณบุรี 29 เม.ย. 67 ฟังเทศน์มหาชาติ พระเวสสันดรชาดก 13 กัณฑ์ & ลิเกคณะ พรเทพ พรทวี 30 เม.ย. 67 รำวงย้อนยุค อ๊อด โฟร์เอส
ตารางแพทย์ออกตรวจ งานตรวจสุขภาพและคลินิกโรคจากการทำงานและสิ่งแวดล้อม ปี 2567
ตารางแพทย์ออกตรวจประจำวันปี 2567 งานตรวจสุขภาพและคลินิกโรคจากการทำงานและสิ่งแวดล้อม
E-Book Thailand Tourism Award 2021 Travel Guide LINK
ททท.สำนักงานระยอง ขอประชาสัมพันธ์ "E-Book Thailand Tourism Award 2021 Travel Guide" ตามรอยเส้นทางท่องเที่ยวที่ได้รับรางวัล Thailand Tourism Awards ครั้งที่ 13 หรือรางวัลอุตสาหกรรมท่องเที่ยว โดยใช้ "กินรี" เป็นเครื่องหมายรับรองคุณภาพของสินค้าและบริการที่ได้มีการจัดการและคัดสรรมาแล้วอย่างเข้มข้น โดยผู้ทรงคุณวุฒิจากหน่วยงานภาครัฐ เอกชน และ NGO ภายใต้กรอบหลักเกณฑ์ที่เป็นมาตรฐานเทียบได้กับรางวัลนานาชาติ มาเที่ยวตามรอยอุตสาหกรรมท่องเที่ยวทั้ง 5 เส้นทาง
ดาวน์โหลดได้ ททท.1-5 กรกฎาคม 2567 ดนตรีในงาน “Lanna Creative Craft” ลานอเนกประสงค์ ศูนย์ราชการ
งาน “Lanna Creative Craft” วันที่ 1 - 5 กรกฎาคม 2567 ณ ลานอเนกประสงค์ ศูนย์ราชการเฉลิมพระเกียรติ 80 พรรษา 5 ธันวาคม 2550 อาคารรัฐประศาสนภักดี (อาคาร B ชั้น 2 ประตู 4) ถ.แจ้งวัฒนะ หลักสี่ กรุงเทพฯแสดงจากศิลปิน 1 ก.ค.67 พบศิลปินล้านนาเสียงหวาน “ตู่ ดารณี” 2 ก.ค.67 พบวงดนตรี “W Band” 3 ก.ค.67 พบศิลปินหนุ่มหล่อเสียงหวาน “เตวิชญ์ ชัยธัช” 4 ก.ค.67 พบวงดนตรี “HugBand” 5 ก.ค.67 พบวงดนตรี “TeddyBand”
โปรแกรมดนตรีในสวน จัดโดย อบจ.สงขลา 2567
กองการศึกษาศาสนาและวัฒนธรรม
องค์การบริหารส่วนจังหวัดสงขลา ขอเชิญรับชม ดนตรีในสวน ณ สวนสาธารณะเมืองสงขลา อำเภอเมืองจังหวัดสงขลา ตั้งแต่เวลา 17.30 -19.30 น.
ครั้งที่ 1 วันเสาร์ที่ 27 มกราคม 2567
ครั้งที่ 2 วันเสาร์ที่ 17 กุมภาพันธ์ 2567
ครั้งที่ 3 วันเสาร์ที่ 9 มีนาคม 2567
ครั้งที่ 4 วันเสาร์ที่ 20 เมษายน 2567
ครั้งที่ 5 วันเสาร์ที่ 11 พฤษภาคม 2567
ครั้งที่ 6 วันเสาร์ที่ 8 มิถุนายน 2567
ครั้งที่ 7 วันเสาร์ที่ 13 กรกฎาคม 2567
ครั้งที่ 8 วันเสาร์ที่ 10 สิงหาคม 2567
ครั้งที่ 9 วันเสาร์ที่ 14 กันยายน 2567
มหกรรมสมุนไพรแห่งชาติครั้งที่ 21 วันที่ 3–7 กรกฎาคม 2567
กรมการแพทย์แผนไทยและการแพทย์ทางเลือก เตรียมพร้อมจัดงาน "มหกรรมสมุนไพรแห่งชาติ ฯ ครั้งที่ 21" จัดขึ้นระหว่างวันที่ 3 – 7 กรกฎาคม 2567 ณ อาคาร 11 – 12 ศูนย์แสดงสินค้าและการประชุม อิมแพ็ค เมืองทองธานี
งานมหกรรมสมุนไพรแห่งชาติ ครั้งที่ 21 จัดขึ้นเพื่อเป็นเวทีขับเคลื่อนนโยบายยุทธศาสตร์ระดับชาติ และพื้นที่ขับเคลื่อนด้านการแพทย์แผนไทย การแพทย์พื้นบ้าน และการแพทย์ทางเลือก ส่งเสริมและพัฒนาด้านวิชาการ นวัตกรรม และถ่ายทอดองค์ความรู้ในการดูแลสุขภาพที่ถูกต้องให้แก่ประชาชน (Health literacy) และเป็นช่องทางในการขับเคลื่อนการสร้างมูลค่าเพิ่มด้านการบริการและสมุนไพรเพื่อสุขภาพ สร้างเศรษฐกิจ เกิดการมีส่วนร่วมของภาคีเครือข่าย ทั้งภาครัฐ และเอกชน
3 กรกฎาคม 2567 เปิดรับลงทะเบียนทำหมันฉีดวัคซีนสุนัขและแมว (ฟรี)
เปิดรับลงทะเบียนทำหมันฉีดวัคซีนสุนัขและแมว (ฟรีไม่เสียค่าใช้จ่าย) ณ ลานกีฬาพัฒน์2 (ฝั่งบ้านหนังสือ) เขตราชเทวี วันที่ 3 กรกฎาคม 2567 เวลา 09.00-11.30น. หมายเหตุ : ลงทะเบียนจองคิวได้ที่ https://forms.gle/Ki1qH7tpyj2upqHY9
3 กรกฎาคม 2567 ดนตรีในสวน ครั้งที่ 3 ศิลปินจากวงดนตรีกรมประชาสัมพันธ์
“ดนตรีในสวน ครั้งที่ 3” เพลิดเพลินเสียงเพลงจากวงดนตรีกรมประชาสัมพันธ์ เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 . ▪️ ครั้งนี้ 3 ณ หอประชุมใหญ่ กรมประชาสัมพันธ์ (ซอยอารีย์สัมพันธ์) กรุงเทพมหานคร วันพุธ ที่ 3 กรกฎาคม 2567 เวลา 17.00 น. เป็นต้นไป พบกับศิลปิน * ศิลปินรุ่นใหม่จากวงดนตรีกรมประชาสัมพันธ์ * โฉมฉาย อรุณฉาน ศิลปินเพลงลูกกรุงบทเพลงอมตะ * อลิศ ธนัศลักษณ์ (The Golden song 2) * โก๊ะตุลย์ พันธนนท์ The golden Song 6) ชมการแสดงละเล่นไทยจากสมาคมเยาวชนอาสาสมัคร และร่วมสนุกไปกับ วงโปงลาง จากกองการสังคีต กรุงเทพมหานคร . เข้าชมฟรี!!
Tea and coffee International Symposium 2023 - 4-5 July 2024
Tea and coffee International Symposium 2023 "Tea and Coffee for Sustainability and Well-being" 4-5 July 2024 at Mae Fah Luang University, Chiang Rai Thailand. Keep update at
fb/teaandcoffeeinstitute.mfu4 กรกฎาคม 2567 ผ่ฉีดวัคซีน ณ วัดไผ่ตัน ซอยพหลโยธิน 15
เขตพญาไท ร่วมกับกลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข เขตดินแดง จัดกิจกรรมบูรณาการออกหน่วยสัตวแพทย์เคลื่อนที่กับภาคีเครือข่าย ผ่าตัดทำหมันสุนัขและแมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในพื้นที่กรุงเทพมหานคร ฟรี‼️ ณ วัดไผ่ตัน ซอยพหลโยธิน 15 เขตพญาไท ✅ วันพฤหัสบดีที่ 4 กรกฎาคม 2567 ✅ เวลา 09.00 ถึง 11.00 น. รับจองทำหมันจำนวนจำกัด 35 ตัว ฉีดวัคซีนโรคพิษสุนัขบ้า จำนวน 200 ตัว ลงทะเบียนหน้างาน
4 กรกฎาคม 2567 ดนตรีในสวน “รื่นรมย์ สมฤดี 132 ปี กระทรวงศึกษาธิการ”
4 กรกฎาคม 2567 - กระทรวงศึกษาธิการ จัดกิจกรรมดนตรีในสวน “รื่นรมย์ สมฤดี 132 ปี กระทรวงศึกษาธิการ” เวลา 16.30 น. ณ บริเวณศาลาร้อยปี กระทรวงศึกษาธิการ อาทิเช่น การแสดงดนตรี วง Potisarn Music Unique Band โดย โรงเรียนโพธิสารพิทยากร การแสดงกระบี่กระบอง โดย โรงเรียนธนบุรีวรเทพีพลารักษ์ การแสดงดนตรี โดย โรงเรียนโยธินบูรณะ
4,11,18,25 กรกฎาคม 2567 ฉีดวัคซีน ฟรี ศบส.40 บางแค
ศูนย์บริการสาธารณสุข 40 บางแค ชวนฉีดวัคซีนป้องกันพิษสุนัขบ้า ฟรี‼️ฟรี‼️ ฟรี‼️ ตามวัน เวลา ด้านล่างนี้
4 ก.ค.67 08.30 - 10.00 น. ~ ชุมชนข้างโรงพยาบาลราชพิพัฒน์ / 10.00 - 12.00 น. ~ ชุมชนสามัคคีศิริเกษม 2
11 ก.ค.67 08.30 - 10.00 น. ~ ชุมชนศิริเกษมรวมใจ 50 / 10.00 - 12.00 น. ~ ชุมชนศิริเกษมพัฒนา
18 ก.ค.67 09.00 - 11.00 น. ~ ชุมชนจั่นแก้ว
25 ก.ค.67 09.00 - 11.00 น. ~ ชุมชนเทพพิทักษ์
หมายเหตุ : อายุตั้งแต่ 3 เดือนขึ้นไป สุขภาพร่างกายแข็งแรงสมบูรณ์ ไม่อยู่ในช่วงตั้งครรภ์ หรือให้นมลูก
***เตรียมบัตรประชาชน และกระติกใส่น้ำแข็งมาด้วย
อากาศยานลำเลียงเด็กชายอายุ 1 ปี ภาวะหายใจเหนื่อยหอบเฉียบพลัน หายใจล้มเหลว จากเวียงแหง ส่งรพ.นครพิงค์
วันที่ 5 กรกฎาคม 66 เวลา 09.50 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย 1 ราย อายุ 1 ปี มีภาวะหายใจเหนื่อยหอบเฉียบพลันและมีภาวะหายใจล้มเหลว ต้นทางจากโรงพยาบาลเวียงแหง อำเภอเวียงแหง จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน ได้รับการสนับสนุนอากาศยานจากหน่วยบินกองกำลังผาเมืองจังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย ร.อ.ปณตพงษ์ เตชะประเสริฐพร, ร.ท.กิตติ จิตติวุฒินนท์, จ.ส.อ.วีรพนธ์ วรสาร, จ.ส.อ.ไพรัช ฤดีสายเจริญสุข ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่ ประกอบด้วย พญ.หทัยรัตน์ จันทรพรหมกุล, พญ.พิจิตรา จันทร์เจนจบ, น.ส.วิรากานต์ สมณะ
เมื่อเวลา 11.55 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลโรงพยาบาลนครพิงค์ เป็นที่เรียบร้อย
5-31 กรกฎาคม 2567 รพ.สัตว์ ม.เกษตร 5 แห่ง ฉีดวัคซีน ฟรี
เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ พระบาทสมเด็จพระเจ้าอยู่หัว และวันคล้ายวันประสูติ สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารีฯ
คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ขอเชิญเจ้าของสัตว์เลี้ยง นำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วัคซีนรวม 5 โรค และวัคซีนโรคไข้หัดแมว ฟรี ณ โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ทั้ง 5 แห่ง (บางเขน กำแพงแสน หนองโพ หัวหิน ทิพย์พิมาน) เฉพาะในเวลาทำการ
6 กรกฎาคม 65 รับผู้ป่วยสโตรคหญิงวัย 79 ปี จากเคียนซา ส่งต่อรพ.สงขลานครินทร์ LINK
6 กรกฎาคม 2565 เวลา 10.07 น. ศูนย์กู้ชีพตาปีได้รับการสนับสนุนเอลิคอปเตอร์เพื่อส่งต่อ ผู้ป่วยฉุกเฉิน เพศหญิง อายุ 79 ปี มีประวัติแขนขาด้านซ้ายอ่อนแรงเฉียบพลัน และมีอาการสับสน เข้ารับการรักษา รพ.เคียนซา และส่งต่อมายัง รพ.สุราษฎร์ธานี
แพทย์วินิจฉัยเป็น Stroke Fast track : Right middle cerebral infarction (ภาวะหลอดเลือดในสมองอุดต้นเฉียบพลัน) จำเป็นต้องได้รับการสวนเปิดหลอดเลือดสมอง ซึ่งเกินศักยภาพในการรักษาของโรงพยาบาลสุราษฎร์ธานี
นพ.คมกฤษ ปัญญวัฒน แพทย์เจ้าของไข้ ได้ ประสานงานส่งต่อ รพ.สงขลานครินทร์ แพทย์ผู้ให้การรักษาหลอดเลือดคือ ผศ.พญ.รุจิมาส คุ้มทอง และ ผศ.พญ.ธัญลักษณ์ อมรพจน์นิมมาน แพทย์อำนวยการปฏิบัติการฉุกเฉินท้องที่ คือ นพ.จารุวัฒน์ สำลีพันธ์
ประสานงานผ่านศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติเพื่อแจ้งขอสนับสนุนอากาศยานจากหน่วย กองบินตำรวจภูธร8 จังหวัดสุราษฎร์ธานี ประเภทอากาศยานเฮลิคอปเตอร์ Bell 212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ต.ท.กิตติ จันทร์คง ร.ต..วสุพล ราชวงศ์ ชุดลำเลียงทางอากาศ
โดยทีม รพ.สุราษฎร์ธานี ประกอบด้วย พญ.อมรรัตน์ มณีรัตนประเสริฐ พว.รัชนาภรณ์ ฟูแก้ว เมื่อเวลา 15.25 น. ผู้ป่วยได้ส่งตัวเข้ารับการรักษาต่อโรงพยาบาลสงขลานครินทร์ จ.สงขลา เป็นที่เรียบร้อย การส่งต่อครั้งนี้ได้รับการสนับสนุนงบประมาณจากสถาบันการแพทย์ฉุกเฉินแห่งชาติ
ตลาดนัดกาแฟสถานีผัก Coffee market 6-7 กรกฎาคม 67 LINK
ตลาดนัดกาแฟสถานีผัก Coffee market รอบ 6-7 กรกฎาคม สถานที่ : สถานีผัก&คนรักกาแฟ พุทธมณฑลสาย4-5 สามพราน นครปฐม นำสัตว์เลี้ยงเข้าได้ #Petfriendly เวลาเปิด-ปิดงานตลาด : 9.00-18.00น. มีที่จอดรถกว่าร้อยคัน 2 บริเวณ ณ ลานกว้าง และในรร.บางกระทึก (เลยตลาดไปเพียง20เมตร) เปิดรับสมัครร้านค้า จำนวนจำกัดเพียง 60 บูธ
6,12,13 กรกฎาคม 2567 รพ.สัตว์ตลิ่งชัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสำหรับสัตว์เลี้ยงฟรี
โรงพยาบาลสัตว์ตลิ่งชัน เล็งเห็นถึงความสำคัญในการสร้างชุมชนให้ปลอดภัยจากพิษสุนัขบ้า และเพื่อสร้างความมั่นใจให้กับนักท่องเที่ยวที่มาใช้บริการตลาดน้ำสำคัญทั้ง 4 แห่งของเขตตลิ่งชัน จึงจัดทำโครงการ "ตลิ่งชัน x ตลิ่งชัน" ให้บริการฉีดวัคซีนพิษสุนัขบ้าฟรีสำหรับสุนัขและแมวจร รวมถึงสุนัขและแมวมีเจ้าของที่อาศัยอยู่ย่านตลาดน้ำ เพราะตลิ่งชันดูแลตลิ่งชัน สถานที่ และ วันที่เข้ารับบริการ
•. ตลาดน้ำตลิ่งชัน จุคเช็คอินข้างเวที (ตลาดน้ำสองคลองและตลิ่งชันรวมฉีดที่เดียวที่ตลาดน้ำตลิ่งชัน) / วันเสาร์ที่ 6 กรกฎาคม 2567 / เวลา 08:00-13:00 น.
•. ตลาดน้ำคลองลัดมะยม โซน 2 / วันศุกร์ที่ 12 กรกฎาคม 2567 / เวลา 08:00-13:00 น.
•. ตลาดน้ำวัดสะพาน / วันเสาร์ที่ 13 กรกฎาคม 2567 / เวลา 08:00-13:00 น.
6 กรกฎาคม 2567 เขตมีนบุรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว และฉีดไมโครชิปจดทะเบียนสุนัข ฟรี
วันเสาร์ที่ 6 กรกฎาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข จัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว และฉีดไมโครชิปจดทะเบียนสุนัข ฟรี ที่ตลาดนัดมีนบุรี (จตุจักร 2) แขวงมีนบุรี เขตมีนบุรี เวลา 8.00 - 15.00 น.
กิจกรรม จะมีการตรวจคัดกรองสุขภาพ เจาะเลือด เอกซเรย์ปอด ตรวจคลื่นไฟฟ้าหัวใจ ตรวจจอประสาทตา สามารถเริ่มลงทะเบียนได้ตั้งแต่เวลา 08.00 น. เป็นต้นไป เพื่อ ป้องกันหรือค้นหาโรคและภาวะผิดปกติในร่างกายของประชาชนผู้รับบริการ การให้บริการขออนุญาตประกอบกิจการที่เป็นอันตรายต่อสุขภาพ “ที่เกี่ยวกับสัตว์เลี้ยง“ และยังมีหน่วยสัตวแพทย์เคลื่อนที่ เพื่อฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยงของท่าน ผู้สนใจสามารถนำสัตว์เลี้ยงของท่านมาฉีดวัคซีน โดยไม่เสียค่าบริการแต่อย่างใด
สามารถสอบถามข้อมูลเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตมีนบุรี เบอร์โทรติดต่อ 02 914 5834
6 กรกฎาคม 2567 ดนตรีในสวน บริเวณลานกิจกรรมเกาะลอยด้านใน(ทางไปขึ้นท่าเรือเกาะศรีชัง)
วันเสาร์ที่ 6 กรกฎาคม 2567 ขอเชิญทุกท่านมาเที่ยวเกาะลอย ชมวิวทะเลพระอาทิตย์ตกดิน และมาร่วมเป็นกำลังใจให้กับน้องๆ ในกิจกรรม ดนตรีในสวน บริเวณลานกิจกรรมเกาะลอยด้านใน (ทางไปขึ้นท่าเรือเกาะศรีชัง) เป็นการรวมตัวกันของน้องๆที่รักในเสียงดนตรี น้องนูรีน จากโรงเรียนดาราสมุทร น้องมารีน/น้องนาริน จากโรงเรียนศรีราชา และวงดนตรีระดับปฐมศึกษา Power Dream จากเด็กๆโรงเรียนศรีสุวิช บรรยากาศสบายๆ พร้อมรับประทานอาหารจากร้านค้ามากมาย ภายในลานกิจกรรม การแสดงเริ่ม เวลา 17.00 น. เป็นต้นไป
6 กรกฎาคม 2567 งาน Music Mountain Mist ดนตรีพลิ้วไหว จ.พังงา
งาน “Music Mountain Mist" ดนตรีพริ้วไหว ละเอียดสายหมอกท่ามกลางหุบเขา ในวันเสาร์ที่6 กรกฎาคม 2567 ตั้งแต่เวลา09:00-18:00น. ณสวนสาธารณะเฉลิมพระเกียรติสมเด็จพระศรีนครินทร์บรมราชชนนี (ถำ้ฤษี) ในงานมีกิจกรรม ช๊อป อาหาร เครื่องดื่ม ฟังบทเพลงอันไพเราะจากหลากหลายศิลปิน
MISSISSIPPI CANNABIS EXPO JULY 7–9, 2022 LINK
CANNAONE เป็นผู้จัดอีเวนต์งานกัญชา 3 งานปีนี้ ที่ มิสซิสซิปปี้ นิวเจอร์ซี่ และ ลาสเวกัส
MISSISSIPPI CANNABIS EXPO
CANNABIS MEETS HEALTHCARE EXPO
JULY 7–9, 2022
Gulf Coast Convention Center BILOXI
NEW JERSEY CANNABIS EXPO
Cannabis Investment Expo
October 10-12, 2022
New Jersey Convention Center EDISON
CannaCosmo Health + Beauty EXPO
Women Grow Strong Expo
December 14-16, 2022
Mirage Las Vegas Convention Center LAS VEGAS
7 กรกฎาคม 65 บินรับผู้ป่วยสโตรค ชายสูงอายุ จากท่าโรงช้าง ส่งต่อรพ.ตรัง LINK
7 กรกฎาคม 2565 เวลา 10.06 น ศูนย์กู้ชีพตาปี จังหวัดสุราษฎร์ธานี ได้รับการสนับสนุน เฮลิคอปเตอร์เพื่อส่งต่อผู้ป่วยฉุกเฉิน เพศชาย อายุ 82 ปี ประวัติมีอาการอ่อนแรงแขนขาด้านขวา และมีอาการ สับสน เข้ารับการรักษาที่โรงพยาบาลท่าโรงช้าง โดย แพทย์หญิงสิรินาถ จันทร์ลา และ นายแพทย์คมกฤษ ปัญญวัฒน วินิจฉัยโรคเป็น Stroke fast track : Left middle cerebral artery occlusion (ภาวะหลอด เลือดอุดตันในสมองเฉียบพลัน) จำเป็นต้องได้รับการสวนเปิดหลอดเลือดมอง ซึ่งเกินศักยภาพในการรักษา ของโรงพยาบาลสุราษฎร์ธานี จึงได้ประสานงานส่งต่อโรงพยาบาลตรัง จังหวัดตรัง แพทย์ผู้ให้การรักษาเปิด หลอดเลือด คือแพทย์หญิงทิพย์ลัดดา บุญชัย และประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจกองบิน7 จังหวัดสุราษฎร์ธานี ประเภทอากาศยาน เฮลิคอปเตอร์ EC725มีชุดปฏิบัติการบินประกอบด้วย รต.จิรันรนิร ธโนปจัยสิทธกุล ,พ.อ.อ.พิศาล แสงโทโพธิ์ และชุดปฏิบัติการลำเลียงทางอากาศโดยทีมโรงพยาบาลสุราษฎร์ธานี ประกอบด้วย แพทย์หญิงมัลลิกา บุญเนียม พว.จิราภรณ์ สุขวิสุทธิ์ เมื่อเวลา 12.58 น ผู้ป่วยได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลตรัง จังหวัดตรัง เป็นที่เรียบร้อย การส่งต่อครั้งนี้ได้รับการสนับสนุนงบประมาณจากสถาบันการแพทย์ฉุกเฉินแห่งชาติ
TAK MARATHON 2024 วันแข่ง 7 กรกฏาคม 2567 LINK
TAK MARATHON 2024 วันแข่ง 7 กรกฏาคม 2567 ระยะวิ่ง 42.195km 21km 10km 5km การแข่งขันวิ่งในจังหวัดตาก ที่มีระยะมาราธอนรายการแรก จัดขึ้นเป็นครั้งที่ 2 ของจังหวัดตาก เส้นทางการแข่งขัน TAK MARATHON SEREIS ได้รับรองจากสมาคมกีฑาแห่งประเทศไทย
Run for the Wild 2024 by Run Happy Series 7 กรกฎาคม 2567 LINK
Run for the Wild 2024 by Run Happy Series จะพานักวิ่งไปสัมผัสกับวิถีชีวิตที่สวยงามใกล้ชิดธรรมชาติ อากาศบริสุทธิ์ ของชาวนครนายก เส้นทางธรรมชาติสวยๆ ทั้งหมด 4 ระยะ - RFTW 50 km 1,930 m - RFTW 30 km 780 m - RFTW 15 km 510 m - RFTW 7 km 150 m วันแข่งขัน : 7 กรกฎาคม 2567 วันรับอุปกรณ์ : 6 กรกฎาคม 2567 สถานที่: วังรี รีสอร์ท แอนด์สปา จ.นครนายก
มหกรรม 80 ปี กรมการแพทย์ วันที่ 8-10 กรกฎาคม 2565 LINK
เชิญร่วมงานมหกรรม 80 ปี กรมการแพทย์ ในวันที่ 8-10 กรกฎาคม 2565 ณ บางกอก คอนเวนชั่น เซ็นทรัลเวิลด์ ฟรี ตลอดงาน กิจกรรมในงาน
- เข้ารับบริการสุขภาพจาก 15 หน่วยบริการ ฟรีตลอดงาน
- เสวนาสุขภาพโดยแพทย์ผู้เชี่ยวชาญและศิลปินดารา
- สัมมนาเชิงลึกด้านการแพทย์แขนงต่างๆ
- เลือกซื้อสินค้าสุขภาพกว่า 100 ร้านค้า
- ร่วมซื้อสินค้าในงานสมทบทุน "มูลนิธิกรมการแพทย์" กองทุนเพื่อการพัฒนาการแพทย์ และจัดซื้ออุปกรณ์ทางการแพทย์เพื่อบริการประชาชนทั้งประเทศ
สสจ.แม่ฮ่องสอน ประสานฮ.รับผู้ป่วยชาย 65 ปี ชักเกร็งตาเหลือก จากอ.ปาย ส่งรพ.นครพิงค์
วันที่ 8 กรกฎาคม 2566 เวลา 14.10 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอน ได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศชาย อายุ 65 ปี ภูมิลำเนาอยู่ที่ ม.3 ต.เมืองแปง อ.ปาย จ.แม่ฮ่องสอน ประวัติ 10 นาทีก่อนมา ญาติให้ข้อมูลว่า ผู้ป่วยล้ม ศีรษะกระแทกพื้น มีอาการชักเกร็งตาเหลือก ประมาณ 1 นาที จึงได้นำส่งเข้ารับการรักษาที่โรงพยาบาลส่งเสริมสุขภาพตำบลห้วยหมี(บ้านแกงหอม) อ.ปาย จ.แม่ฮ่องสอน แต่อาการไม่ดีขึ้น ยังมีชักเกร็งซ้ำอีกหลายครั้งร่วมกับความรู้สึกตัวลดลง ซึ่งเกินศักยภาพในการรักษาจึงได้ประสานขอรับคำปรึกษาด้านการรักษาพยาบาลกับโรงพยาบาลปาย จ.แม่ฮ่องสอน เพื่อส่งต่อไปยังโรงพยาบาลนครพิงค์ จ.เชียงใหม่ ได้รับการวินิจฉัยโรค post traumatic seizure (มีอาการชักหลังได้รับบาดเจ็บ) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วนและส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองกำลังผาเมือง จ.เชียงใหม่ ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท.212 มีชุดปฏิบัติการบิน ได้แก่ ร.อ.กฤติเดช ขะระเขื่อน, ร.ท.ปฏิภาณ แก้วสนิท และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโรงพยาบาลนครพิงค์ จ.เชียงใหม่ ได้แก่ นพ.ประสาน เปี่ยมอนันต์, นางสาวอรุณี คำมาเร็ว และนายจีราวัฒน์ ชัยสมส่วน
และเมื่อเวลา 16.54 น. ได้ส่งตัวผู้ป่วยเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่ เป็นที่เรียบร้อยการส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
เทศกาลไทย ณ กรุงเบิร์น ครั้งที่ 23 วันที่ 9-10 ก.ค.65 LINK
สถานเอกอัครราชทูต ณ กรุงเบิร์น และหน่วยงานทีมประเทศไทยประจำสวิตเซอร์แลนด์ ขอเชิญทุกท่านมาร่วมส่งเสริมความเป็นไทยในสวิตเซอร์แลนด์ ในงานเทศกาลไทย ณ กรุงเบิร์น ครั้งที่ 23 ในวันเสาร์-อาทิตย์ ที่ 9-10 ก.ค. 2565 เวลา 10.00 - 18.00 น. ณ สถานเอกอัครราชทูต ณ กรุงเบิร์น (Kirchstrasse 56, 3097 Liebefeld, Steinholzli)
ปีนี้ เรามาใน theme #EcoFriendly #Food #Fit #Fun #ThaiFestBern นอกจากอาหารไทยจากทั่วทุกภาคแล้ว ยังมีสินค้า ผลิตภัณฑ์ การแสดงทางวัฒนธรรม มวยไทย นวดไทย และการสาธิตการทำอาหาร แกะสลักและงานฝีมือไทย ครบถ้วนรสชาติความเป็นไทย #Thainess ติดตามรายละเอียดเพิ่มเติมได้ที่
thaiswiss90years/23rd-thai หรือ สแกน QR Code
อย่าลืมชวนครอบครัว เพื่อนฝูงชาวสวิสและชาวต่างชาติ ให้มารู้จักความเป็นไทยและความสนุกสนานครื้นเครงของคนไทยกันในงาน #ThaiFestBern เทศกาลไทย ครั้งที่ 23 กัน
Amazingkids Tri-Series 2022 ครั้งที่ 2 แข่งขัน Race 2 วันที่ 9-10 ก.ค 65 LINK
เปิดรับสมัครแล้วกับการแข่งขัน Amazingkids Tri-Series 2022 ครั้งที่ 2
น้องๆ ที่ชื่นชอบไตรกีฬา อย่าลืมเตรียมร่างกายให้พร้อม ในครั้งนี้สะสมคะแนนเพื่อที่จะเข้าลุ้นเป็นผู้ชนะ Amazing Kids Series Champion สมัครกดที่ลิงค์
https://bit.ly/3yJIdDh
แข่งขัน Race 2 วันที่ 9-10 ก.ค 65 Amazing Kids Tri-Series 2022
ปีนี้พิเศษกว่าปีก่อนๆ เพราะเรามีถึง 3 ประเภทกีฬา รวมอยู่ในสัปดาห์เดียวกัน ทำให้วันหยุดสุดสัปดาห์เป็นวันหยุดสุดแอคทีฟ
Duathlon
Triathlon
Aquathon
โดยการแข่งขัน เริ่มจาก Duathlon (วิ่ง-ปั่น-วิ่ง)
ในวันเสาร์ และตามด้วย Triathlon (ว่าย-ปั่น-วิ่ง)
กับ Aquathlon (ว่าย-วิ่ง) ในวันอาทิตย์
กติกา: น้องๆจะต้องสะสมแต้มจากการแข่งขัน ผู้ที่ทำคะแนนสะสม 3 ซีรีย์
ได้สูงที่สุดในรุ่นอายุ จะได้เป็นผู้ชนะ Amazing Kids Series Champion ไปเลย!
หรือโทรสอบถาม
Th: +66 65 524 9100 (Nui)
Eng: +66 89 668 1096 (Joe)
สสจ.แม่ฮ่องสอน ประสานขอฮ.รับผู้ป่วยชาย 54 ปี เลือดออกในสมอง จากแม่ฮ่องสอน ส่งนครพิงค์
วันที่ 9 กรกฎาคม 2566 เวลา 09.03 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอนได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนว่า ได้ขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉินเพศชาย อายุ 54 ปี ประวัติ 2 ชั่วโมงก่อน มีไข้หนาวสั่น ปวดศีรษะ มีอาการพูดไม่ชัดลิ้นแข็ง ระหว่างนำส่งโรงพยาบาล ผู้ป่วยหมดสติไม่รู้สึกตัว และเข้ารับการรักษาที่โรงพยาบาลศรีสังวาลย์ อ.เมือง จ.แม่ฮ่องสอน ได้รับการวินิจฉัยโรค Rt Basal ganglia hemorrhage (เลือดออกในสมองบริเวณสมองซีกขวา) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน และส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่
โดยได้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจสิงหนาท กองกำลังนเรศวร ประเภทอากาศยานเฮลิคอปเตอร์ ฮ.ท. 212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ประสิทธิ์ ตอสกุล, ร.อ.อัศม์เดช สุขพลอ, จ.ส.อ.อนุพงศ์ โคตรพรม และจ.ส.อ.สมชาย ยำยวน และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ จ.แม่ฮ่องสอน ประกอบด้วย นพ.กรีฑา คำเนียม, นพ.ประภัทร อัสสันตชัย, นายปภาวิน ประเสริฐกุล และนายสรพงษ์ รัตนจำเริญ และ
เมื่อเวลา 10.37 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ จ.เชียงใหม่ เป็นที่เรียบร้อยการส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
ลำเลียงเด็กชาย 1 ปี ป่วยภาวะหายใจล้มเหลว จากอมก๋อย ส่งนครพิงค์ เชียงใหม่
วันที่ 9 กรกฎาคม 66 เวลา 12.30 น. ศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุน การลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย 1 ราย อายุ 1 ปี มีภาวะหายใจล้มเหลว ต้นทางจากโรงพยาบาลส่งเสริมสุขภาพตำบลบ้านนาเกียน อำเภออมก๋อย จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่
ทั้งนี้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยาน ได้รับการสนับสนุนอากาศยานจากหน่วยบินกองกำลังผาเมือง จังหวัดเชียงใหม่ ชุดปฏิบัติการบินประกอบด้วย ร.อ.ปณตพงษ์ เตชะประเสริฐพร, ร.อ.ศรัณยู ศรีตานัน, จ.ส.อ.ศุภชัย สมบุตร ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่ ประกอบด้วย พญ.มาริสา ทองนอก, น.ส.วิรากานต์ สมณะ, น.ส.อรุณี คำมาเร็ว
เมื่อเวลา 16.38 น. ได้รับเข้าการรักษาต่อที่โรงพยาบาลโรงพยาบาลนครพิงค์ เป็นที่เรียบร้อย
CPHI South East Asia 2024 วันที่ 10-12 กรกฏาคม 2024
CPHI South East Asia 2024 เป็นแพลตฟอร์มการค้าและการประชุมแบบครบวงจรสำหรับผู้คนในอุตสาหกรรมยาในเอเชียตะวันออกเฉียงใต้ งานประจำปีนี้คาดว่าผู้ผลิต ผู้จัดจำหน่าย และผู้สร้างสรรค์นวัตกรรมในธุรกิจยาและธุรกิจที่เกี่ยวข้องมากกว่า 600 รายจะมาจัดแสดงนวัตกรรม เทคโนโลยี ผลิตภัณฑ์ และอุปกรณ์ งานนี้ยังจะทำให้อุตสาหกรรมยาของไทยปรากฏบนแผนที่โลก และทำให้คนไทยสามารถเข้าถึงผลิตภัณฑ์ยาคุณภาพสูงได้ง่ายขึ้น. วันที่ 10-12 กรกฏาคม 2024 Exhibition Hall 1-3, ชั้น G เวลา 10.00- 18.00 น.
ภาพรวมสถานการณ์ (กรกฎาคม 2567)
- พื้นที่ระบาด 426 อำเภอ 76 จังหวัด จำนวนผู้ป่วยมากกว่าค่ามัธยฐาน
- เสี่ยง 56 อำเภอ 38 จังหวัด จำนวนผู้ป่วยเท่ากับค่ามัธยฐาน
- ปกติ 310 อำเภอ 68 จังหวัด จำนวนผู้ป่วยน้อยกว่าค่ามัธยฐาน
- ไม่มีรายงานผู้ป่วย 136 อำเภอ 48 จังหวัด
สรุปภาพรวม (กรกฎาคม 2567)
- จำนวนผู้ป่วย 47,527 ราย มากที่สุดตามลำดับ คือ ภาคเหนือ ภาคกลางไม่รวมกทม. ภาคใต้ กทม และภาคอีสาน
- ตาย สะสม 44 ราย (อัตราป่วย 0.08) มากที่สุดตามลำดับ คือ ภาคกลาง (ไม่รวมกทม.) ภาคอีสาน ภาคเหนือ ภาคใต้ และ กทม. เป็น ชาย 25 ราย หญิง 19 ราย และพบทุกช่วงอายุ (ตั้งแต่ 0-4 ปี จนถึง 65 ปีขึ้นไป)
Medlab Asia and Asia Health 10-12 กรกฏาคม 2024
สัมผัส เครื่องมือแพทย์จากแบรนด์ชั้นนำ นวัตกรรม เทคโนโลยีล่าสุด สร้างเครือข่ายกับผู้คนในอุตสาหกรรม พร้อมทั้งเรียนรู้จากประชุมวิชาการในหลากหลายสาขาทางการแพทย์และสัมมนาเพื่อภาคธุรกิจเครื่องมือแพทย์ ที่งาน Medlab Asia และ Asia Health 2024 ครอบคลุมทั้งอุตสาหกรรมเครื่องมือแพทย์และห้องปฏิบัติการทางการแพทย์ไว้ในที่เดียว ในปีนี้ Medlab Asia และ Asia Health 2024 จัดงานควบคู่กับ "CPHI South East Asia 2024 ภายใต้คอนเซ็ป International Healthcare Week ที่มุ่งเน้นการสร้างศักยภาพการพัฒนาระบบและการดูแลสุขภาพครบวงจร
Amazing SURAT COFF CRAFT วันที่ 10-14 กรกฎาคม 2567
ททท.สำนักงานสุราษฎร์ธานี : TAT SuratThani Office x Central Surat Thani ขอเชิญผู้ที่รัก คลั่งไคล้ หลงใหลในการดื่มกาแฟ ตลอดจนการทำกาแฟ มาร่วมงาน Amazing SURAT COFF CRAFT วันที่ 10-14 กรกฎาคม 2567 ณ ชั้น 1 ศูนย์การค้าเซ็นทรัล สุราษฎร์ธานี สุดพิเศษกับร้านกาแฟชื่อดัง พร้อมเมนูกาแฟหลากหลายที่รังสรรค์จากวัตถุดิบท้องถิ่นของสุราษฎร์ธานี อาทิ กาแฟไข่เค็ม กาแฟเงาะ กาแฟมังคุดสกัดเย็น และการโชว์ฝีมือจากบาริสต้าชื่อดัง
33 โครงการ สำนักอนามัย กรุงเทพมหานนคร ปี 2568 LINK
สำนักอนามัย ดูแลรับผิดชอบดำเนินการ 33 โครงการ งบประมาณ 89,895,681 ล้านบาท ประกอบด้วย
5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม 25 โครงการ งบประมาณ 72,788,135 ล้านบาท
5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข 3 โครงการ งบประมาณ 2,402,694 ล้านบาท
5.3 เพิ่มประสิทธิภาพ การเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ 2 โครงการ งบประมาณ 10,256,000 ล้านบาท
5.3 เพิ่มประสิทธิภาพการเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ 1 โครงการ งบประมาณ 1,636,950 ล้านบาท
8.2 สนับสนุนเงื่อนไขการดำรงชีพคนไร้บ้าน คนพิการ และกลุ่มเปราะบาง 1 โครงการ งบประมาณ 2,811,900 ล้านบาท
โครงการไม่มีชื่อ 1 โครงการ งบประมาณ 2 ล้านบาท
THAILAND COFFEE FEST 2024 11 - 14 ก.ค. 2567
THAILAND COFFEE FEST 2024 ระหว่างวันที่ 11 - 14 ก.ค. 2567 ณ ศูนย์แสดงสินค้าและการประชุมอิมแพ็ค
ขอนแก่นแคทโชว์ Khonkaen Cat Show 2024 วันที่ 11-14 ก.ค.67
ขอนแก่นแคทโชว์ Khonkaen Cat Show 2024 วันที่ 11-14 ก.ค.67 ประกวดแมว : Thailand Grand Cat Show 2024 @KhonKaen (วันที่ 13-14 กรกฎาคม 2024)
12 กรกฎาคม 2567 ตรวจเยี่ยม โครงการสนั่นนภา ซอยอารีย์ 1 ถนนอารีย์ กทม.
12 กรกฎาคม 2567 ณ โครงการสนั่นนภา ซอยอารีย์ 1 ถนนอารีย์ เขตพญาไท กรุงเทพมหานคร นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย เป็นประธานในพิธีเปิดมหกรรมขับเคลื่อนนโยบาย ยกระดับมาตรฐานอาหารริมบาทวิถี (Thai Street Food Good Health From Local to Global) พร้อมด้วย ดร.นายแพทย์นิธิรัตน์ บุญตานนท์ ผู้อำนวยการสถาบันพัฒนาสุขภาวะเขตเมือง ผู้บริหารกรมอนามัย ผู้บริหารกรุงเทพมหานคร และแขกผู้มีเกียรติ เข้าร่วมงาน
นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย กล่าวว่า กรมอนามัย มีนโยบายขับเคลื่อนประเด็นนักท่องเที่ยวปลอดภัย เพื่อยกระดับงานสุขาภิบาลอาหารให้เขตสุขภาพมีจังหวัดที่มีที่พัก/ที่กิน/ที่เที่ยว และผู้ให้บริการได้มาตรฐาน ซึ่งสอดคล้องกับนโยบายขับเคลื่อนกรุงเทพมหานคร ของผู้ว่าราชการกรุงเทพมหานคร นายชัชชาติ สิทธิพันธุ์ ในมิติด้าน “เศรษฐกิจดี” คือ การยกระดับผู้ค้าแผงลอยให้มีความยั่งยืน เพิ่มโอกาสการเข้าถึงแหล่งเงิน การให้ความช่วยเหลือด้านเทคโนโลยีและจัดหาสถานที่ค้าขายที่ได้มาตรฐาน ซึ่งกรมอนามัยส่งเสริมการยกระดับมาตรฐานอาหารริมบาทวิถี ผ่านมาตรฐาน SAN & SAN Plus “สะอาด ปลอดภัย ได้มาตรฐาน” โดยพัฒนาจากมาตรฐาน Clean Food Good Taste เดิม เพื่อให้เป็นมาตรฐานเดียวกันทั่วประเทศ ผู้ประกอบการ ผู้สัมผัสอาหาร จึงต้องผ่านการอบรมตามหลักสูตรที่กฎกระทรวงกำหนด สถานประกอบการมีส่วนร่วมด้วยการประเมินตนเอง และผ่านการประเมินรับรองโดยเจ้าหน้าที่ในพื้นที่ หรือ กรุงเทพมหานครหากมีการปฏิบัติครบทุกขั้นตอน จึงได้ป้ายรับรองมาตรฐาน SAN & SAN Plus ซึ่งสามารถประเมินผ่านระบบ foodhandler ด้วยตนเอง
Thailand Coffee Fest 2023 : Good Coffee for Everyone 13 - 16 July 2023 LINK
Thailand Coffee Fest 2023 : Good Coffee for Everyone is bigger than ever, spanning across 4 halls with a total of 20,000 sq.m. It offers a plethora of highlights, gathering over 300 related and similar businesses, making it a hub that brings every industry stakeholder together and intensifies the coffee culture.
Thailand Coffee Fest 2023 IMPACT Exhibition Center, Hall 5 - 8, Muang Thong Thani July 13 - 16, 2023, from 10.00 am to 8.00 pm.
14 กรกฎาคม 2567 ฟรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว ณ วัดพระยาสุเรนทร์ เขตคลองสามวา
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตคลองสามวา ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตคลองสามวา (เท่านั้น) เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันอาทิตย์ที่ 14 กรกฎาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดพระยาสุเรนทร์ เขตคลองสามวา (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
ทำหมัน รับจำนวนจำกัด 100 ตัว. จำกัดคนละไม่เกิน 2 ตัว _ จองคิว โดยสแกน QR code
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว _ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
วิ่งรักษ์คลอง @กระทุ่มแบน 14 กรกฏาคม 2567
วิ่งรักษ์คลอง @กระทุ่มแบน วันอาทิตย์ที่ 14 กรกฏาคม 2567 ณ มารีน่า ต.ท่าเสา อ.กระทุ่มแบน จ.สมุทรสาคร ดูรายละเอียดและสมัครออนไลน์ได้ที่ www.ktbrun.com
14 กรกฎาคม 2567 บุกเชียงใหม่ ตรวจเยี่ยมเสริมพลังมหกรรม Chiang Mai Street Food
14 กรกฎาคม 2567 นางจิตรา หมีทอง ผู้ช่วยเลขานุการรัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวภายหลังการตรวจเยี่ยมเสริมพลังมหกรรม Chiang Mai Street Food Good Health from Local to Global พร้อมด้วย นายวีรพงศ์ ฤทธิ์รอด รองผู้ว่าราชการจังหวัดเชียงใหม่ นายแพทย์อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย แพทย์หญิงสิดาพัณณ์ ยุตบุตร รองผู้อำนวยการศูนย์อนามัยที่ 1 เชียงใหม่ แพทย์หญิงเสาวนีย์ วิบุลสันติ ผู้อำนวยการสำนักงานป้องกันควบคุมโรคที่ 1 เชียงใหม่ นายแพทย์นิมิต อินปั๋นแก้ว รองนายแพทย์สาธารณสุขจังหวัดเชียงใหม่ นายกเทศมนตรีนครเชียงใหม่ และภาคีเครือข่ายถนนคนเดินเชียงใหม่ ณ ลานจัดกิจกรรมประตูท่าแพ ถนนคนเดินเชียงใหม่ อำเภอเมือง จังหวัดเชียงใหม่ ว่า
อาหารริมบาทวิถี หรือ “Street Food” ของไทย ซึ่งได้รับความนิยมอย่างมากทั้งจากชาวไทยและนักท่องเที่ยวต่างชาติ กระทรวงสาธารณสุข จึงมีนโยบายให้พัฒนาและยกระดับอาหารริมบาทวิถีให้ได้มาตรฐาน SAN & SAN Plus ทั้งสถานที่ อาหาร ภาชนะบรรจุอาหาร บุคคล สัตว์และแมลงนำโรค ที่จะต้อง “สะอาด ปลอดภัย ได้มาตรฐาน” สู่ระดับสากล เทียบเท่าเครื่องหมายมิชลิน ที่ได้รับการยอบรับและเชื่อมั่นด้านความอร่อยจากทั่วโลก โดยความร่วมมือจากภาคีเครือข่ายทุกภาคส่วน ที่จะช่วยกันสนับสนุนการพัฒนาและยกระดับมาตรฐานอาหารริมบาทวิถีให้ดำเนินการได้อย่างต่อเนื่อง ได้แก่
1) มีการสร้างระบบและกลไกภาคีเครือข่ายในการพัฒนาอาหารริมบาทวิถีในระดับพื้นที่ร่วมกันอย่างเข้มแข็ง ระหว่างองค์กรปกครองส่วนท้องถิ่น เจ้าหน้าที่สาธารณสุข คณะกรรมการชมรม สมาคมผู้ประกอบการอาหารริมบาทวิถีและหน่วยงานภาครัฐ – เอกชนที่เกี่ยวข้อง
2) มีมาตรฐาน SAN & SAN Plus ที่แสดงถึงสุขลักษณะ และความปลอดภัยของอาหาร พร้อมเพิ่มมาตรการในการตรวจติดตามและเฝ้าระวังความปลอดภัยอาหารอย่างต่อเนื่อง รวมถึงส่งเสริมการบริโภคอาหารที่มีคุณค่าทางด้านโภชนาการ
3) มีการส่งเสริมการท่องเที่ยว กระตุ้นเศรษฐกิจ และวัฒนธรรมในพื้นที่ เช่น การจัดงานเทศกาลต่าง ๆ ส่งเสริมการจำหน่ายอาหารประจำถิ่น การแต่งกายพื้นเมือง เป็นต้นพร้อมฝากผู้บริโภคและผู้ประกอบการให้ความสำคัญกับ SAN และ SAN Plus เพราะ “มี SAN ไม่มีเซ็ง” แน่นอน
16 ก.ค.66 Columbia Trail Masters Thailand 2023 LINK
COLUMBIA TRAIL MASTERS 2023 16 กรกฎาคม 2566 A tougher challenge than before. We kept searching for an excellent new track only few hours from Bangkok. Beside the beautiful scenery, there are exciting obstacles such as floating rocks, streams, sands, tree shade, sunlight, steep slopes, and ramp. This composition will definitely make runners enjoy finding ways to overcome these obstacles and keep running. This year will absolutely be fun, we guarantee.
COFFEE TRAVELER : EP.3 "Coffee traveler with Cuppa Campers" 19 - 22 กรกฎาคม 2567
COFFEE TRAVELER : EP.3 "Coffee traveler with Cuppa Campers" ชั้น 1 มันมันศรีนครินทร์ กิจกรรมกาแฟในบรรยากาศ City Camp จัดเป็นครั้งที่ 3 แล้ว จำลองที่ท่องเที่ยวพักใจในคอนเซ็ปต์ "Slowbar in the City Campsite" เอาใจคอกาแฟที่รักการตั้งแคมป์ 4 วันเต็ม ที่จะได้ลิ้มรสกาแฟจากแหล่งปลูกต่าง ๆ ทั้งแบบ Slow Bar, Speed Bar หรือแม้แต่ Non – Coffee พร้อมช้อปอุปกรณ์ตั้งเเคมป์ ไปจนถึงอุปกรณ์กาเเฟ ครบจบในงานเดียว Workshop ครั้งที่ 3 “เทคนิคการคั่วที่มีผลต่อรสชาติกาแฟ” เรียนรู้ศิลปะการคั่วกาแฟจาก คุณติ๊ก (อภิชา แย้มเกษร) ผู้ก่อตั้งบริษัท ซาลอตโต้ จำกัด ที่จะมาฝึกอบรมแบบลงมือปฏิบัติจริง ผ่าน PROBAT - P Series : P01 พร้อมแบ่งปันเคล็ดลับการใช้เครื่องคั่วให้มีประสิทธิภาพ ซึ่งจะช่วยปรับทักษะการคั่วกาแฟ และเพิ่มพูนความรู้เกี่ยวกับกาแฟของคุณให้ลึกซึ้งยิ่งขึ้น
เทศกาลคนปลูกกาแฟน่าน Nan Coffee Farmer’s Fest 2024 และตลาดนัดกาแฟน่าน ครั้งที่ 1 วันที่ 19-21 กรกฎาคม 2567
งาน “เทศกาลคนปลูกกาแฟน่าน Nan Coffee Farmer’s Fest 2024 และตลาดนัดกาแฟน่าน ครั้งที่ 1 วันที่ 19-21 กรกฎาคม 2567 ณ ข่วงน้องเมืองน่าน เอาใจคนรักกาแฟ เพื่อยกระดับกาแฟน่านให้เติบโต ไปอย่างยั่งยืน
จัดแสดงนิทรรศการและประชาสัมพันธ์กาแฟของจังหวัดน่าน เพื่อเผยแพร่ประชาสัมพันธ์สร้างการรับรู้ให้กับผู้บริโภค กิจกรรมเผยแพร่ประชาสัมพันธ์สร้างการรับรู้กาแฟน่าน ประจำปีงบประมาณ พ.ศ. 2567 ของจังหวัดน่าน โดยมีวัตถุประสงค์เพื่อพัฒนาและยกระดับผลิตภัณฑ์กาแฟน่านให้สอดคล้องกับความต้องการตลาดเป้าหมาย / เพื่อเพิ่มช่องทางการจำหน่ายกาแฟและผลผลิตทางการเกษตร ให้แก่เกษตรกร กลุ่มเกษตรกร และสถาบันเกษตรกร / และเพื่อเผยแพร่ประชาสัมพันธ์สร้างการรับรู้กาแฟน่านให้แพร่หลายสู่สาธารณชน
กิจกรรมในงานจะประกอบไปด้วย การจัดแสดงนิทรรศการ แสดงประวัติความเป็นมาผลิตภัณฑ์กาแฟ ของจังหวัดน่าน การสาธิตผลิตภัณฑ์กาแฟของแต่ละกลุ่มเกษตรกร และหน่วยงานภาคีเครือข่าย และการสาธิตการชงกาแฟในรูปแบบต่าง ๆ การจัดการประกวดสุดยอดเมล็ดกาแฟ และกิจกรรมบันเทิง ได้แก่ การประกวดธิดากาแฟ การแสดงดนตรี และศิลปวัฒนธรรมเป็นประจำทุกวัน นอกจากนี้ยังมีการจัดแสดงและจำหน่ายสินค้า “ตลาดนัดกาแฟ ครั้งที่ 1” จำนวน 50 คูหา พร้อมกิจกรรมส่งเสริมการขาย
พัทยามาราธอน 2024 วันที่ 20-21 กรกฎาคม 2567 LINK
พัทยามาราธอน 2024 พร้อมแล้ว! มหกรรมวิ่งมาราธอนสุดยิ่งใหญ่แห่งภาคตะวันออก แล้วพบกัน 20-21 กรกฎาคม 2567 นี้ ที่เมืองพัทยา จังหวัดชลบุรี เปิดรับสมัครพร้อมกันทั่วประเทศ ตั้งแต่วันที่ 6 มิย 67 เป็นต้นไป
การจัดการแข่งขันพัทยามาราธอนในครั้งนี้ เมืองพัทยาได้เชิญจังหวัดชลบุรี การท่องเที่ยวแห่งประเทศไทย กองบัญชาการตำรวจภูธรภาค 2 ร่วมเป็นเจ้าภาพในการจัดงาน เพื่อยกระดับการจัดงานให้เทียบเท่าในระดับนานาชาติ และจากผลการดำเนินงานของปีที่แล้ว ทำให้สมาคมกรีฑาโลก หรือ World Athletics ได้ประกาศรับรองมาตรฐานของการจัดงานในระดับสากล ให้ label แก่พัทยามาราธอน ทั้ง 3 ระยะแข่งขัน คือ 42k, 21k และ 10k ถือเป็นรายการมาราธอนเพียง 1 ใน 2 ของประเทศเท่านั้น ที่ได้รับการรับรองทั้ง 3 ระยะแข่งขันจากสมาคมกรีฑาโลก ซึ่งจะเป็นอีกหนึ่งมหกรรมงานวิ่งสุดยิ่งใหญ่ของประเทศ ที่จะดึงดูดนักวิ่งและครอบครัวจากทั่วโลก ให้เดินทางมาร่วมในการแข่งขันครั้งนี้
HOKA FLY RUN BANGKOK 2024 วันที่ 20 กรกฏาคม 2567
HOKA FLY RUN BANGKOK 2024 จัดวันที่ : 20 กรกฏาคม 2567 สถานที่ : สวนวชิรเบญจทัศ (สวนรถไฟ) ระยะทาง : 5, 10k
งาน doggi day#17 - 20-21 ก.ค. 2567
งาน doggi day#17 20-21 ก.ค. 2567 kvillage สุขุมวิท 26 10.00-20.00 งานที่รวบตึง สินค้า อุปกรณ์ ของใช้สัตว์เลี้ยงไว้ครบ จบที่เดียวในงาน กว่า 70 บูธ บริการพิเศษจาก Arak Animal Hospital โรงพยาบาลสัตว์อารักษ์ บูธน้องหมา น้องแมวหาบ้าน สี่ขาหาบ้าน หมากระสอบ ปล. ศูนย์การค้าเควิลเลจเป็น petfriendly พาน้องๆมาเที่ยวได้โดยไม่ต้องใส่รถเข็น
33 โครงการ สำนักอนามัย
5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม
1 โครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ
2 กิจกรรมออกหน่วยสัตวแพทย์เคลื่อนที่เชิงรุกฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิป และจดทะเบียนสุนัข พื้นที่กรุงเทพมหานคร
3 กิจกรรมการตรวจประเมินสุขลักษณะและ/หรือขออนุญาตประกอบกิจการที่เป็นอันตรายต่อสุขภาพในสถานประกอบการเกี่ยวกับสัตว์เลี้ยง
4 กิจกรรมการจัดทำฐานข้อมูลสุนัขและแมวในชุมชนพื้นที่กรุงเทพมหานคร
5 กิจกรรมการฟื้นฟูสมรรถภาพผู้ติดยาเสพติดบ้านพิชิตใจ
6 โครงการอาสาสมัครกรุงเทพมหานครด้านการป้องกันและแก้ไขปัญหายาและสารเสพติด
7 โครงการเสริมสร้างภูมิคุ้มกันยาและสารเสพติดแบบครบวงจร* (ยังไม่มีตัวชี้วัดในแผนสนอ. แต่มีในตัวชี้วัดแผนกทม.)
8 กิจกรรมการดูแลช่วยเหลือผู้มีปัญหายาเสพติดเพื่อเข้ารับการฟื้นฟูสภาพทางสังคม
9 โครงการพัฒนาประสิทธิภาพการบำบัดฟื้นฟูผู้เสพผู้ติดยาเสพติด
10 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงธนเหนือ
11 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงเทพเหนือ
12 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงเทพกลาง
13 โครงการผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวพื้นที่กรุงเทพมหานคร
14 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงเทพตะวันออก
15 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงเทพใต้
16 โครงการจ้างเหมาผ่าตัดทําหมันควบคุมจํานวนและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวจรจัดในพื้นที่กลุ่มเขตกรุงธนใต้
17 กิจกรรมการรับอุปการะสุนัขจากศูนย์ควบคุมสุนัขกรุงเทพมหานคร
18 โครงการชมรมผู้สูงอายุ Active Aging-
19 โครงการ BKK Happy Aging fair
20 โครงการแลกเปลี่ยนเรียนรู้การดำเนินงานกองทุนหลักประกันสุขภาพกรุงเทพมหานคร-
5.2 ยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข
21 โครงการพัฒนาระบบบริการปฐมภูมิศูนย์บริการสาธารณสุข
22 กิจกรรมคลินิกครอบครัวอบอุ่น
23 โครงการจัดบริการมิติสุขภาพเพื่อการเข้าถึงสิทธิสวัสดิการสำหรับคนพิการ
5.3 เพิ่มประสิทธิภาพ การเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ
24 โครงการพัฒนาระบบบริการส่งเสริมทันตสุขภาพเชิงรุกในกลุ่มผู้สูงอายุติดบ้าน ติดเตียง โดยใช้กล้องส่องภายในช่องปาก* (มี แต่ยังไม่มีเชื่อมแผนสนอ.)
25 โครงการจัดบริการศูนย์เด็กอ่อนกรุงเทพมหานคร
5.3 เพิ่มประสิทธิภาพการเข้าถึงการรักษา พยาบาลที่เชื่อมโยง ไร้รอยต่อ
26 โครงการพัฒนาศักยภาพผู้ดูแลเพื่อช่วยเหลืองานพยาบาลผู้ป่วยและผู้สูงอายุ ที่ต้องได้รับการดูแลต่อเนื่องที่บ้าน
8. ด้านสังคมดี
8.2 สนับสนุนเงื่อนไขการดำรงชีพคนไร้บ้าน คนพิการ และกลุ่มเปราะบาง
27 โครงการกรุงเทพฯ เมืองแห่งสุขาภิบาลสิ่งแวดล้อมและอาชีวอนามัยที่ดี สะอาด ปลอดภัย กิจกรรมที่ 4 การพัฒนาห้องน้ำสาธารณะในพื้นที่สาธารณะของกรุงเทพมหานคร* (มี แต่ยังไม่มีเชื่อมแผนสนอ.)
5.1 สนับสนุนและพัฒนากิจกรรมส่งเสริมสุขภาพชุมชนทุกกลุ่ม
28 โครงการรักอย่างปลอดภัย ใส่ใจสุขภาพ* (มี แต่ยังไม่มีเชื่อมแผนสนอ.)
29 โครงการบริการเชิงรุกสุขภาพดีในพื้นที่เป้าหมาย* (มี แต่ยังไม่มีเชื่อมแผนสนอ.)
30 โครงการคลินิกให้คำปรึกษา
31 โครงการการบริการป้องกันและดูแลรักษาโรคเอดส์ วัณโรคและโรคติดต่อทางเพศสัมพันธ์ (เงินอุดหนุน)* (มี แต่ยังไม่มีเชื่อมแผนสนอ.)
32 กิจกรรมพัฒนาคลินิกสุขภาพเพศหลากหลาย
33 โครงการกรุงเทพฯ เมืองแห่งสุขาภิบาลสิ่งแวดล้อมและอาชีวอนามัยที่ดี สะอาด ปลอดภัย กิจกรรมที่ 2 การส่งเสริมสุขลักษณะที่ดีในสถานประกอบการที่ก่อให้เกิดมลพิษอากาศในเขตกรุงเทพมหานคร
ประจำเดือนกรกฎาคม 2566
ประจำเดือนกรกฎาคม 2566
• จำนวนประชากรในประเทศ 67.215 ล้านคน
• จำนวนประชากรที่มีสิทธิหลักประกันสุขภาพ 66.890 ล้านคน
• สิทธิหลักประกันสุขภาพแห่งชาติ (สิทธิบัตรทอง 30 บาท) 47.006 ล้านคน
• สิทธิประกันสังคม 12.827 ล้านคน
• สิทธิข้าราชการ/รัฐวิสาหกิจ 5.296 ล้านคน
• สิทธิพนักงานท้องถิ่น 0.680 ล้านคน
• สิทธิครูเอกชน 0.082 ล้านคน
ข้อมูลวันที่ : 18 สิงหาคม 2566
Mae Kampong Cross-Country Run 2024 - 21 กรกฎาคม 2567 LINK
Mae Kampong Cross-Country Run 2024 วันแข่งขัน : 21 กรกฎาคม 2567 สถานที่จัดการแข่งขัน : Nonbiri Cafe บ้านแม่กำปอง อำเภอแม่ออน จังหวัดเชียงใหม่ พร้อมต้อนรับนักวิ่งที่ชื่นชอบความท้าทายด้วยการแข่งขันวิ่ง Cross-Country ระยะทาง 5km / 10km / 21km และการแข่งขันวิ่ง Trail ระยะ 30K จุดปล่อยตัวของการแข่งขัน Mae Kampong Cross-Country Run 2024 จะอยู่ที่ Nonbiri Cafe บ้านแม่กำปอง อำเภอแม่ออน จังหวัดเชียงใหม่ เป็นหมู่บ้านเล็กๆ น่ารักกลางหุบเขา ที่อากาศดีตลอดทั้งปีเลยทีเดียว แม่กำปองยังเป็นบ้านของ น้ำตกแม่กำปองที่มีน้ำไหลตลอดปี และเป็นต้นน้ำของลำธารที่ไหลผ่านหมู่บ้านแม่กำปองด้วย และไม่ไกลจากน้ำตกจะเป็นที่ตั้งของร้านกาแฟ ระเบียงแม่กำปอง ร้านนี้มีความพิเศษ คือ มีวิวที่มองเห็นหมู่บ้านแม่กำปองจากมุมสูง เรียกได้ว่าเป็นมุม signature ของหมู่บ้านแม่กำปองอีกมุมนึงที่ใครหลายคนอยากมาเห็นเลยทีเดียว!
อบต.นาขอม อ.ไพศาลี นครสวรรค์ อบรมหมอหมู่บ้าน ให้กับกลุ่มเยาวชนวัยเรียน ผู้นำชุมชน อสม.และประชาชนทั่วไป
วันที่ 23-24 กรกฎาคม 2567 องค์การบริหารส่วนตำบลนาขอม อ.ไพศาลี จ.นครสวรรค์ ได้จัดกิจกรรมโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ประจำปีงบประมาณ พ.ศ.2567 โดยมีวัตถุประสงค์ เพื่อให้ความรู้เชิงปฏิบัติการด้านการดูแลรักษาสุขภาพเบื้องต้น และการปฐมพยาบาลเบื้องต้น ให้กับกลุ่มเป้าหมายจำนวน 200 คน ดังนี้
1. กลุ่มเยาวชนวัยเรียน จำนวน 100 คน
2. กลุ่มผู้นำชุมชน อสม. และประชาชนทั่วไป จำนวน 100 คน
เพื่อให้ผู้เข้ารับการอบรมสามารถนำความรู้ที่ได้รับไปดูแลรักษาสุขภาพของตนเอง ครอบครัว และแนะนำให้ความช่วยเหลือคนในชุมชนได้
ปั่นจักรยาน Rachalothorn - Tour to the New World 2022 | 24 ก.ค.65 LINK
กิจกรรมปั่นจักรยาน “Rachalothorn - Tour to the New World 2022” หนึ่งในใต้ร่มกิจกรรม Color of EEC เพื่อกระตุ้นการท่องเที่ยว ต้อนรับการเปิดประเทศ อาทิตย์ที่ 24 กรกฎาคม 2565 ปั่นสนุก ได้ชื่นชมธรรมชาติรอบอ่างเก็บน้ำ หลายจุด ทั่วภาคตะวันออก สนุกสนานโค้งถนน และท้าทายความชัน ในบรรยากาศยามเช้าของชุมชน กับเส้นทาง 2 ระยะ คือ ระยะเพลินมินิ 10 กม. และ ระยะท้าทาย 21 กม. นอกจากปั่นจักรยาน ยังมีวิ่งมาราธอนหลายรายการ
BCG Model in the Health and Wellbeing Sector LINK
We are pleased to invite you to the second seminar on Thailand’s Bio-Circular-Green Economy Model: Awareness Raising, Capacity Building and International Perspective. This seminar will focus on the ‘Health and Wellbeing Sector’ and will be held on Monday, 25 July 2022, 13:30 to 16:05 hrs Bangkok Time GMT+7 (Virtual). The speakers will introduce the BCG model and broadly describe how it is being applied.
The Bio-Circular-Green Economy (BCG) model has been conceptualized to underpin Thailand 4.0. It is an integration of bioeconomy, circular economy and green economy. Bioeconomy involves the production of renewable biological resources and the conversion of these resources into value-added products. Circular economy aims at reusing and recycling resources. Green economy aims to keep the economy, society and environment in balance, leading to sustainable development.
The BCG model represents a strategy to drive the country’s economic and social development. As such, the BCG model is expected to provide further impetus for implementation of the Sustainable Development Goals. In addition, the BCG model is expected to be a focus of discussion at the 2022 Asia-Pacific Economic Cooperation (APEC) Ministerial Meeting, chaired by Thailand.
25 กรกฎาคม 2567 ทำหมันสุนัขและแมว ฉีดวัคซีน วัดสวัสดิ์วารีสีมาราม เขตดุสิต
สำนักอนามัย โดยสำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ มหาวิทยาลัยนวมินทราธิราช จัดกิจกรรมทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ในวันพฤหัสบดีที่ 25 กรกฎาคม 2567 เวลา 8.30 - 11.30 น. ณ วัดสวัสดิ์วารีสีมาราม เขตดุสิต ผู้ที่สนใจสามารถลงทะเบียนจองคิวทำหมันล่วงหน้าในแบบจองได้ [ลิงค์จอง] (จำกัดสิทธิ์ในการทำหมันเพียง 40 ตัวเท่านั้น)
หมายเหตุ 1. ท่านที่จองสิทธิ์ทำหมันให้สุนัข แมว ในระบบไว้แล้ว ต้องมาลงทะะเบียนรายงานตัวหน้างานเพื่อรับบัตรคิวในเวลา 08.30 - 10.00 น. 2. บริการฉีดวัคซีนป้องกันพิษสุนัขบ้าให้สุนัขและแมวไม่จำกัดจำนวน 3. จองก่อนได้สิทธิ์ก่อน 4. จะโทรแจ้งเพื่อยืนยันการจองสิทธิ์ภายในวันที่ 23 กรกฎาคม 2567
26 กรกฎาคม 2567 Swing Dancing at Creative Pop Park
Swing Dancing at Creative Pop Park ไปรสนียาคาร เชิงสะพานพระปกเกล้า วันที่ 26 กรกฎาคม 2567 กิจกรรม
8:30-19:00 Free Swing dance class from Jelly Roll Jazz Club
19:00-20:00 Free live music from The Stumbling Swingout
Swing Dancing at Creative Pop Park เป็นส่วนหนึ่งของ กิจกรรม
Creative Pop Park โดยจะจัดขึ้นที่ บริเวณพื้นที่โดยรอบอาคารไปรสนียาคาร ตั้งแต่วันที่ 26 กรกฎาคม - 28 กรกฎาคม 2567 ซึ่งงานนี้จะมีการจัดกิจกรรมเพื่อเปิดพื้นที่ทดลองใช้ให้เป็นสวนสาธารณะ เช่น ตลาดชุมชนจากผู้ประกอบการรายย่อยในเขตพระนคร นิทรรศการให้ความรู้และกระบวนการมีส่วนร่วมในการพัฒนาพื้นที่ใต้สะพานพระปกเกล้า ดนตรีในสวน และกิจกรรม Workshop งานศิลปะจากวิทยาลัยและโรงเรียนในเขตพระนคร
งาน Happy Farm ตะลุยฟาร์มสัตว์แสนสุข 23-28 ก.ค. 67 ธัญญาพาร์ค
งาน Happy Farm ตะลุยฟาร์มสัตว์แสนสุข 23-28 ก.ค. 67 Ozone Square ชั้น G ศูนย์การค้า ธัญญาพาร์ค ศรีนครินทร์ ติดรถไฟฟ้าสายสีเหลือง สถานีกลันตัน ชมความน่ารักแสนรู้ของเหล่าสัตว์น้อยใหญ่ และสัตว์แปลกที่หาดูยาก โซนป้อนอาหารสัตว์น่ารัก ชมสัตว์ Exotic หายาก ถ่ายรูปกับนกเค้า และงูหลามยักษ์ ขี่ม้าแคระ โชว์กุ้งเครฟิช และกิจกรรมตกกุ้งเครฟิชหรรษา
27 ก.ค. 67 - Hello Golden Meeting รวมน้องหมาโกลเด้นมาเล่นเกม แฟชั่นโชว์สัตวเลี้ยงกับเจ้านายตัวจิ๋ว
28 ก.ค. 67 - ถ่ายรูปกับน้องสิงโต โชว์นกแก้วมาคอว์บินอิสระ ประกวดไก่แจ้สวยงาม
28 กรกฎาคม 2567 อบต.หนองกระโดน ดนตรีในสวนเฉลิมพระเกียรติ
อบต.หนองกระโดน ขอเชิญทุกท่าน ร่วมกิจกรรมในวันที่ 28 กรกฎาคม 2567 ดนตรีในสวนเฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาส พระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 พบกับ บอลลูน(ยักษ์) (ชมบรรยากาศ ด้วยเเสง สี เสียง ฟังเพลงไพเราะจากวงดนตรี ) เวลา 16:00 - 21:00 น.ณ องค์การบริหารส่วนตำบลหนองกระโดน
ดนตรีในสวน เฉลิมพระเกียรติ หนองกระโดน อ.เมือง จ.นครสวรรค์ 28 กรกฎาคม 2567
ขอเชิญร่วมกิจกรรม ดนตรีในสวน เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาส พระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ณ บริเวณสวนเฉลิมพระเกียรติฯ 6 รอบ 28 กรกฎาคม 2567 องค์การบริหารส่วนตำบลหนองกระโดน อ.เมือง จ.นครสวรรค์ ภายในงานมีกิจกรรมมากมาย
✅ เวลา 16.00 น. ถึงเวลา 21.00 น. ชมฟรี บอลลูน(ยักษ์)
✅ เวลา 17.00 น. กิจกรรมร้องเพลงพระราชนิพนธ์จากเด็กและเยาวชนโรงเรียนในเขตตำบลหนองกระโดน
✅ เวลา 18.00 น. การแสดงร้องเพลงเฉลิมพระเกียรติฯ 6 รอบ 28 กรกฎาคม 2567 จากโรงเรียนพระบางวิทยา
✅ เวลา 19.00 น.พิธีเปิดงานและร่วมจุดเทืียนชัยถวายพระพรแด่องค์พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567
✅ เวลา 19.30 น. ชมการแสดงดนตรี เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 จัดงานโดย องค์การบริหารส่วนตำบลหนองกระโดน
Lucky Leaf Expo 2022 LINK
Lucky Leaf Expo กลุ่มผู้จัดงานอีเว้นต์กัญชาที่สุดแอคทีฟเจ้าหนึ่ง ปีนึงหมุนเวียนจัดถึง 4-5 งาน วนไปในหลายเมือง ได้แก่ Albuquerque, ดีทรอยต์, ริชมอนด์, โอคลาโฮมา ที่ไหนเมื่อไหร่แน่ๆ ตามนี้
Albuquerque, NM February 25-26, 2022,
Detroit, MI, March 25-26, 2022,
Richmond, VA, July 29-30, 2022,
Oklahoma City, OK, September 22-23, 2022
JACKSON October 7-8, 2022
Albuquerque October 21-22, 2022
เปรียบเที่ยบตัวเลขและคาดการณ์สัดส่วนรายได้จากนักท่องเที่ยว 2019-2021 ลงทะเบียนบัตรใหม่ออนไลน์ LINK
ลงทะเบียนออนไลน์สำหรับประชาชนทั่วไป
1. ผู้ใช้สามารถลงทะเบียนได้ที่ลิงค์
จะปรากฏหน้าจอ เพื่อกรอกเลขบัตรประชาชน หมายเลขโทรศัพท์
ตรวจสอบ 2 กรณี
- กรณีที่ 1
- เลขบัตรประชาชน มีประวัติการรักษาที่โรงพยาบาลแล้ว จะปรากฏหน้าจอ
ระดับผู้ใช้งานทั่วไป
- กรณีที่ 2
- เลขบัตรประชาชน ยังไม่มีประวัติการรักษาที่โรงพยาบาล จะปรากฏหน้าจอ กรอกข้อมูลการ
- ลงทะเบียนทำบัตรใหม่ ผู้ลงทะเบียนจะต้องกรอกข้อมูลให้ครบถ้วนการลงทะเบียนจึงจะสมบูรณ์
- เมื่อกรอกข้อมูลครบถ้วน คลิก บันทึกข้อมูล จะปรากฏหน้าจอ
- หลังจากนั้นผู้ลงทะเบียนจะได้รับ SMS แจ้ง HN ภายใน 2 วันทำการ
RSV - ศ.นพ.ยง ภู่วรวรรณ LINK
ได้กล่าวไว้แล้วว่า RSV ไม่ใช่โรคใหม่ เป็นโรคที่พบกันมานานกว่า 50 ปีและมีการระบาดทุกปีโดยเฉพาะในเด็กเล็ก
จากข้อมูลการศึกษาวิจัยของศูนย์ไวรัสที่จุฬาฯที่ผมทำการศึกษาอยู่ดังแสดงในรูปจะเห็นว่าพบได้ทุกปีในฤดูฝนของทุกปี ยกเว้นปีนี้ที่มีการปิดเรียนยาวนานหน่อย โรคเลยเกิดขึ้นช้ากว่าทุกปี มาสูงสุดเดือนตุลาคมและเชื่อว่ากำลังจะลดลง
โรคนี้เป็นแล้วเป็นได้อีก การศึกษาของเรามีเด็กบางคนเป็นทุกปี ส่วนใหญ่จะมีอาการน้อย ถ้ามีการศึกษาภูมิต้านทานจะรู้ว่าภูมิต้านทานจะอยู่สั้นมากจึงทำให้เป็นแล้วเป็นได้อีก ส่วนใหญ่จะมีอาการมากในเด็กเล็กและจะน้อยลงเมื่อโตขึ้น โดยเฉพาะเมื่ออายุเกิน 5 ปีไปแล้วก็ยังเป็นโรคได้แต่อาการจะน้อยมาก ในผู้ใหญ่ก็เป็นได้ส่วนใหญ่ไม่ค่อยมีอาการและจะมีอาการมากอีกครั้งหนึ่งเมื่อเข้าสู่สูงวัยหรือผู้เฒ่าผู้แก่เช่นเดียวกับโรคทางเดินหายใจอื่นๆ
โรคนี้อาการลงปอดจะลงที่หลอดลมฝอยไม่ได้ลงที่เนื้อปอด เมื่อลงที่หลอดลมขนาดเล็กหรือหลอดลมฝอยมีการอักเสบของหลอดลม ก็จะเกิดการบวมของหลอดลม ทำให้รูหายใจเข้าเล็กลง ลมเข้าออกจะลำบากจึงหายใจหอบ มีเสียงวี๊ดหรือครืดคราด เมื่อการอักเสบดีขึ้นจะหายเป็นปกติ เด็กเล็กหลอดลมก็เล็กก็จะมีอาการมาก เมื่อเอกซเรย์ลักษณะปอดจะดำกว่าปกติเพราะมีลมค้างอยู่ในปอด และมีร่องรอยของหลอดลมเป็นร่างแหเห็นได้
โอกาสที่โรคนี้จะเสียชีวิตน้อยมาก การรักษาเป็นการรักษาตามอาการประคับประคองเรื่องการหายใจของเด็ก รอเวลาให้การอักเสบต่างๆดีขึ้นด้วยระบบภูมิต้านทานของเด็กเอง โรคนี้ไม่ใช่โรคอุบัติใหม่ รู้จักกันมานานและมีการพยายามที่จะพัฒนาวัคซีนมากกว่า 30 ปี ก็ไม่ประสบความสำเร็จด้วยปัจจัยหลายอย่างที่ภูมิคุ้มกันไม่ได้อยู่ยาวนาน การศึกษาภูมิต้านทานจนถึงเด็กอายุ 4 ขวบที่ทำอยู่ขณะนี้ พบว่าเด็กเกือบทั้งหมดเคยติดเชื้อไวรัส RSV มาแล้วและจำนวนมากมีอาการน้อยหรือไม่ทราบด้วยซ้ำ แค่ป่วยเป็นโรคทางเดินหายใจธรรมดา
ในปัจจุบันมีวิธีการตรวจที่ดีขึ้น ทำให้ตรวจได้ง่ายและมีการแพร่กระจายข่าวในสื่อสังคม ทำให้เป็นที่ตื่นตระหนกกับมารดาจำนวนมาก การป้องกันดังได้กล่าวมาแล้วว่าโรคนี้จะเป็นไปตามฤดูกาลโดยพบมากในฤดูฝนหรือหลังเปิดเทอมแรกของนักเรียน การแพร่กระจายที่สำคัญจึงอยู่ที่โรงเรียนอนุบาล การใช้ของร่วมกัน การอยู่ร่วมกัน การนอนร่วมกันโดยเฉพาะในห้องแอร์ จึงเป็นแหล่งแพร่กระจายโรคได้ดี
การป้องกันที่ดีที่สุดคือห้องเรียนจะต้องมีอากาศถ่ายเทได้ดี ทำความสะอาดข้าวของเครื่องใช้ ไม่ใช้ของใช้ร่วมกัน ล้างมือทำความสะอาดเสมอ เด็กที่ป่วยควรอยู่บ้าน ไม่ควรไปโรงเรียน การใส่หน้ากากอนามัยในเด็กโตช่วยได้ แต่ไม่แนะนำให้ในเด็กเล็กที่ต่ำกว่า 2 ขวบ โดยเฉพาะเวลานอน
ในเด็กอนุบาล เมื่อไม่สบายเป็นโรคทางเดินหายใจ หายใจแรง มีเสียงดัง หรือหอบ ควรไปพบแพทย์ ในรายที่ไม่เป็นมาก ถึงแม้ว่าจะตรวจพบว่าเป็น RSV ก็ไม่มีเหตุผลให้นอนโรงพยาบาล อาการที่ควรจะนอนโรงพยาบาลคือ มีไข้สูง หายใจหอบ หายใจแรง และต้องพ่นยาบ่อยครั้ง
21 ธค 63
เปิดให้คำปรึกษาทางโทรศัพท์ 037-243018-20
สโลแกนประจำสาขา
สโลแกนประจำสาขา "สงบ อิ่มเอมใจ จิตใจแจ่มใส มีสมาธิ"
Update ล่าสุด 1 เมษายน 65
จำแนกตามจังหวัดได้ดังนี้
- กรุงเทพและปริมณฑล : กรุงเทพ 4 นนทบุรี 4 ปทุมธานี 4 สมุทปราการ 3 สมุทรสงคราม 1
- ภาคตะวันออก : จันทบุรี 4 ฉะเชิงเทรา 1 ชลบุรี 5 ตราด 1 ปราจีนบุรี 4 ระยอง 4 สระแก้ว 5
- ภาคกลาง : กาญจนบุรี 11 กำแพงเพชร 4 ชัยนาท 1 ตาก 1 นครนายก 1 นครปฐม 1 นครสวรรค์ 12 พิษณุโลก 4 เพชรบุรี 1 พิจิตร 2 พระนครศรีอยุธยา 3 ราชบุรี 1 ลพบุรี 5 สุโขทัย 2 สุพรรณบุรี 1 สระบุรี 2 อ่างทอง 3 อุทัยธานี 15
- ภาคอีสาน : กาฬสินธุ์ 9 ขอนแก่น 3 ชัยภูมิ 3 นครพนม 8 นครราชสีมา 17 บึงกาฬ 3 บุรีรัมย์ 25 เพชรบูรณ์ 3 มหาสารคาม 11 มุกดาหาร 5 ยโสธร 3 ร้อยเอ็ด 32 เลย 5 ศรีสะเกษ 5 สกลนคร 19 สุรินทร์ 3 หนองคาย 6 หนองบัวลำภู 1 อำนาจเจริญ 2 อุดรธานี 23 อุบลราชธานี 5
- ภาคเหนือ : เชียงใหม่ 8 เชียงราย 5 น่าน 3 แพร่ 3 แม่ฮ่องสอน 1 ลำปาง 3 ลำพูน 4 อุตรดิตถ์ 2
- ภาคใต้ : กระบี่ 1 ชุมพร 2 ตรัง 4 นครศรีธรรมราช 2 ปัตตานี 5 ประจวบคีรีขันธ์ 1 พังงา 2 พัทลุง 5 ภูเก็ต 6 สงขลา 1 สตูล 2 สุราษฎร์ธานี 3
ศาลแขวงสุราษฎร์ธานี พิพากษาปรับ 4,000 บาท ไม่สวมหน้ากากอนามัย LINK
จับจริง ปรับจริงแล้ว ไม่สวมหน้ากากอนามัย
ศาลแขวงสุราษฎร์ธานี พิพากษาปรับ 4,000 บาท วันที่ 21 เมษายน 2564 ศาลแขวงสุราษฎร์ธานี ได้ออกประกาศข่าวศาล จับจริง ปรับจริง โดยวันนี้ พนักงานอัยการคดีศาลแขวงสุราษฎร์ธานี ได้ยื่นฟ้องผู้ฝ่าฝืนไม่สวมหน้ากากอนามัย (1 รายในพื้นที่ อ.เมืองสุราษฎร์ธานี) ตามคำสั่งจังหวัดสุราษฎร์ธานี ที่ 2323/2564 เรื่อง ให้ประชาชนในพื้นที่จังหวัดสุราษฎร์ธานี สวมหน้ากากอนามัย หรือหน้ากากผ้าทุกครั้งตลอดเวลาที่ออกนอกเคหสถานหรือสถานที่พำนักของตนในฐานความผิดตามมาตรา 51 แห่งพระราช บัญญัติโรคติดต่อ พ.ศ. 2558โดยศาลมีคำพิพากษาปรับ 4,000 บาท จำเลยให้การรับสารภาพลดโทษให้กึ่งหนึ่งคงปรับ 2,000 บาท
สถานการณ์ 27 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 2,179 ราย
ผู้ป่วยยืนยันสะสม 59,687 ราย
หายป่วยแล้ว 33,551 ราย
เสียชีวิตสะสม 163 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 26 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 1,227,032 ราย
อบจ.นนทบุรี ฉีด 23 พ.ย. 64 ล็อต1 LINK
23 พ.ย.
ฉีดโมเดอร์นาล็อตแรก ณ เวสต์เกต ฮอลล์ ชั้น 4 ศูนย์การค้าเซ็นทรัลเวสต์เกต
ตรวจสอบสิทธิ์ ผู้ลงทะเบียนขอรับวัคซีนโมเดอร์นา ขององค์การบริหารส่วนจังหวัดนนทบุรี รอบแรก และ รอบที่สอง (ตรวจสอบโดยหมายเลขบัตรประชาชน) สแกน QR Code ด้านล่าง หรือตามลิงค์
nonthaburi/check_moderna
18 พ.ย.
อบจ.แจงเหตุรายชื่อผู้ลงทะเบียนไม่เป็นตามลำดับ
9 พ.ย. อบจ.นนทบุรี ประกาศเปิดรับลงทะเบียนรับวัคซีนโมเดอร์นาเข็ม 3 (บูสเตอร์) ผ่าน
ไลน์วัคซีน อบจ.นนทบุรี ตั้งแต่วันพุธที่ 10 พ.ย. เป็นต้นไปจนกว่าจะครบจำนวน โดยจะได้รับวัคซีนในวันอังคารที่ 23 พฤศจิกายน 2564 ณ สนามฉีดวัคซีนเซ็นทรัลพลาซาเวสต์เกต อำเภอบางใหญ่ จังหวัดนนทบุรี
อ่านเพิ่มเติมอบจ.กาฬสินธุ์ กำหนดวันฉีดล็อตแรก 29 พ.ย.64 LINK
อบจ.กาฬสินธุ์ ได้รับจัดสรรวัคซีนล็อตแรกจำนวน 840 โดส จากจำนวนโควต้าทั้งหมด 7,500 โดส (3,750 ราย) กำหนดวันฉีดล็อตแรก 29 พ.ย.64 เวลา 8.30-15 น. ณ ห้องประชุมเฉลิมพระเกียรติ 80 พรรษา หน้าศาลากลางจ.กาฬสินธุ์ หลังเก่า
บริการตรวจโควิด RT-PCR และ ATK ของโรงพยาบาลหนองคาย LINK
อัตราค่าบริการ
- RT-PCR 1,700 บาท + ค่าบริการ รพ.50 บาท รวม 1,750 บาท
- ATK 400 บาท + ค่าบริการ รพ.50 บาท รวม 450 บาท
ตั้งแต่ 1 พ.ย.64 เป็นต้นไป
ให้บริการทุกวัน เช้า 8-11.30 น.
บ่าย 13-15.30 ย.
สถานที่ตรวจ คลินิกระบบทางเดินหายใจ (ARI) หน้าอาคาร 10 ชั้น
โรงพยาบาลสินแพทย์ ลำลูกกา เปิดรับสมัครงาน เจ้าหน้าที่การตลาดฝ่ายขาย -.เวรเปล LINK
ร่วมงานกับ รพ.สินแพทย์ ลำลูกกา เปิดรับสมัครงาน
1.นักรังสีเทคนิค 2.เภสัชกร 3.เจ้าหน้าที่การตลาดฝ่ายขาย 4.เวรเปล
สอบถามเพิ่มเติมแผนกบุคคล โทร. 02-006-9999 ต่อ 10231,10237
- ส่งประวัติพร้อมเอกสารสมัครงานมาที่อีเมล์: synphaetlk_hr@hotmail.com
- ส่งประวัติผ่านทางเว็บไซต์ >> https://www.synphaet.co.th/jobs/
หรือสมัครด้วยตนเองที่รพ.สินแพทย์ ลำลูกกา วันจันทร์-ศุกร์ 08.00-17.00 น.
กทม. เปิดสอบแข่งขันเป็นครูผู้ช่วย สังกัดสำนักพัฒนาสังคม 6 กลุ่มวิชา รวม 35 ตำแหน่ง LINK
สำนักงานคณะกรรมการข้าราชการกรุงเทพมหานคร (สำนักงาน ก.ก.) จะดำเนินการสอบแข่งขันเพื่อบรรจุและแต่งตั้งบุคคลเข้ารับราชการเป็นข้าราชการครูและบุคลากรทางการศึกษากรุงเทพมหานคร ตำแหน่งครูผู้ช่วย สังกัดสำนักพัฒนาสังคม ครั้งที่ 1/2565 จำนวน 6 กลุ่มวิชา รวมตำแหน่งว่าง 35 ตำแหน่ง ได้แก่
• กลุ่มวิชาคอมพิวเตอร์ธุรกิจและเทคโนโลยีสารสนเทศ
• กลุ่มวิชาช่างไฟฟ้ากำลัง
• กลุ่มวิชาช่างยนต์
• กลุ่มวิชาช่างอิเล็กทรอนิกส์และเทคโนโลยีโทรคมนาคม
• กลุ่มวิชาผ้าและเครื่องแต่งกาย
• กลุ่มวิชาอาหารและโภชนาการ
สอบถามเพิ่มเติม โทร. 0 2221 2141-69 ต่อ 1148 หรือ 1168
5 ข้อควรรู้เกี่ยวกับ MIS-C by Dr.Mai LINK
(Multisystem inflammatory syndrome in children) หรือ กลุ่มอาการอักเสบหลายระบบในเด็ก เป็นสาเหตุหนึ่งที่เราควรป้องกันการติดเชื้อโควิดในเด็กๆให้ดีค่ะ เพราะค่อนข้างจะมีอันตรายร้ายแรงได้
1. เป็นภาวะหลังจากที่เด็กติดโควิดแล้วมีเกิดอาการอักเสบในอวัยวะต่าง ๆ ทั่วร่างกาย เกิดจากระบบภูมิคุ้มกันที่สูงผิดปกติ
2. มักเกิดขึ้น 2-6 สัปดาห์หลังจากเด็กและวัยรุ่นหายป่วยจากโควิด-19
3. MIS-C ก่อให้เกิดอาการอักเสบในอวัยวะต่าง ๆ ทั่วร่างกาย อาการของโรค MIS-C ได้แก่ มีไข้สูง เกิน 38 องศาเซลเซียส นานเกิน 24 ชั่วโมง, ระบบหัวใจและหลอดเลือด : ทำให้มีอาการช็อค ความดันต่ำ หัวใจอักเสบ ลิ้นหัวใจอักเสบ เส้นเลือดหัวใจผิดปกติ, ระบบทางเดินหายใจ : ปอดอักเสบ กลุ่มอาการหายใจลำบากเฉียบพลัน ลิ่มเลือดอุดตันในปอด, ระบบทางเดินอาหาร : ท้องเสีย ท้องอืด อาเจียน ปวดท้อง เลือดออกทางเดินอาหาร หรือตับอักเสบ, ผิวหนัง : ผิวหนังแดง เยื่อบุอักเสบ เป็นผื่น, ระบบประสาท : มีอาการชัก เยื่อหุ้มสมองอักเสบ, ระบบเลือด : เกิดการแข็งตัวของเลือดผิดปกติ, ทางเดินปัสสาวะ : ไตวายฉับพลัน
4. การดูแลรักษาผู้ป่วย MIS-C ประกอบด้วยการรักษาแบบประคับประคองหรือตามระบบที่มีการอักเสบ เช่น การให้น้ำเกลือ ยากระตุ้นความดันโลหิต การช่วยหายใจ ส่วนยาต้านการอักเสบที่ใช้คือการให้อิมมูโนโกลบูลินทางหลอดเลือดดำ (IVIG) ยาสเตียรอยด์ รวมถึงยาแอสไพริน เพื่อลดภาวะแทรกซ้อนของหลอดเลือดหัวใจ
5. เนื่องจากภาวะนี้เกิดหลังจากการติดเชื้อโควิด การป้องกันโรค COVID-19 จึงเป็นแนวทางป้องกัน MIS-C ได้ด้วยเช่นกัน ไม่ว่าจะเป็นการ สวมหน้ากากอนามัย ล้างมือ เว้นระยะห่าง และฉีดวัคซีน
***ผู้ป่วยเด็กที่มีการติดเชื้อโควิดแล้ว มีอาการที่เข้าได้กับโรคนี้ ควรไปพบแพทย์ เพื่อการวินิจฉัย และการรักษาที่เหมาะสมต่อไปค่ะ
ข้อมูลจากเพจ
คุยกับหมอภูมิแพ้เด็ก by Dr.Mai 3 กุมภาพันธ์ 65
4 ขั้นตอนแยกกักตัวที่บ้าน HOME ISOLATION (ระบบพื้นฐานสปสช.สำหรับทุกคน)
การแยกกักตัวที่บ้านและชุมชน HOME ISOLATION
ผู้ที่ตรวจ ATK แล้วพบว่าผลเป็นบวกติดเชื้อโควิด-19 ตามหลักเกณฑ์การให้บริการโรคติดเชื้อโควิด-19 ท่านต้องเข้าสู่ระบบการดูแลผู้ติดเชื้อโควิด-19 ที่บ้าน (Home Isolation) เพื่อติดตามอาการและเฝ้าระวัง นอกจากป้องกันภาวะโรคที่อาจรุนแรงแล้ว ยังเป็นการควบคุมการแพร่ระบาดด้วย ทั้งนี้ ระบบ Home Isolation เป็นบริการที่ครอบคลุมดูแลผู้ติดเชื้อโควิด-19 ทุกสิทธิการรักษา
4 ขั้นตอนการเข้าสู่ระบบการแยกกักตัวที่บ้าน
1. ใช้ชุดตรวจโควิด (Antigen Test Kit)
** ที่ผ่านการรับรองจาก อย. ด้วยตัวเองหรือตรวจจากหน่วยตรวจโควิดเชิงรุก
2. หากผลตรวจเป็นบวก (ติดเชื้อ) และผู้ป่วยต้องการแยกกักตัวที่บ้าน สามารถเข้าสู่ระบบด้วย 3 ช่องทาง
2.1 โทรสายด่วน สปสช. 1330 กด 14
2.2 กรอกข้อมูลด้วยตนเอง ที่ลิงค์ https://crmsup.nhso.go.th/#TicketHI
2.3 Line สปสช. @nhso หรือคลิก https://lin.ee/zzn3pU6 ทำได้ง่ายๆ ดังนี้
- หลังจากเพิ่มเพื่อนไลน์ @nhso ให้กดเมนู บริการเกี่ยวกับโควิด-19 หลังจากนั้นเลือกหัวข้อลงทะเบียนเข้าสู่ระบบการดูแลที่บ้าน (Home Isolation) และกรอกข้อมูลในแบบฟอร์ม Support Covid-19 ทั้งในส่วนข้อมูลบุคคลและข้อมูลผู้ป่วย Covid-19
3. เจ้าหน้าที่จะติดต่อกลับ หลังจากจับคู่ผู้ป่วยกับคลินิก ศูนย์บริการสาธารณสุข หรือโรงพยาบาล ที่จะรับหน้าที่ดูแลผู้ป่วยระหว่างแยกกักตัวที่บ้าน
4. แพทย์ทำการพิจารณาผู้ป่วยอีกครั้ง หากไม่มีอาการ หรืออาการเล็กน้อย (ผู้ป่วยสีเขียว) จะสามารถเริ่มต้นเข้าสู่ระบบการแยกกักตัวที่บ้านได้
**ชุดตรวจโควิดต้องใช้ชนิดตรวจได้ด้วยตนเอง (Home Use) เท่านั้น โดยจะเป็นการตรวจผ่านโพรงจมูก (Nasal swab) หรือน้ำลาย
ข้อมูลล่าสุด ณ วันที่ 30 กรกฎาคม 2564 หมอพร้อม,สปสช.,สสส, กรมควบคุมโรค
และ วันที่ 06 มกราคม 2565
www.nhso.go.th/news/3431ตรวจ ATK ขึ้น 2 ขีด แล้วทำอย่างไรต่อ? - พญ.วรรษมน จันทรเบญจกุล รพ.จุฬาลงกรณ์
ตรวจ ATK ขึ้น 2 ขีด แล้วทำอย่างไรต่อ? เป็นคำถามที่หลายคนสงสัย และไม่รู้ต้องทำอย่างไรเมื่อผลออกมาเป็นบวก เรามีคำแนะนจาก อ. ดร. พญ.วรรษมน จันทรเบญจกุล ศูนย์โรคอุบัติใหม่ด้านคลินิก โรงพยาบาลจุฬาลงกรณ์ มาฝาก - Spring News
รองอธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก ตรวจเยี่ยมการดำเนินงานการแพทย์แผนไทย โรงพยาบาลบางกระทุ่ม
10 มีนาคม 2565 นายแพทย์ขวัญชัย วิศิษฐานนท์ รองอธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก พร้อมด้วย คณะผู้บริหารและเจ้าหน้าที่กรมฯ ตรวจเยี่ยมการดำเนินงานการแพทย์แผนไทย โรงพยาบาลบางกระทุ่ม โดยมีแพทย์หญิงดวงรัตน์ เชี่ยวชาญ ผู้อำนวยการโรงพยาบาลบางกระทุ่ม พร้อมด้วยคณะผู้บริหารและเจ้าหน้าที่ รพ.บางกระทุ่ม ให้การต้อนรับและนำเสนอผลการดำเนินงาน ในการนี้ได้เข้าเยี่ยมชมอาคารผลิตยาสมุนไพร ณ โรงพยาบาลบางกระทุ่ม จังหวัดพิษณุโลก
8.ความยินยอมของผู้เยาว์ คนไร้ความสามารถ และคนเสมือนไร้ความสามารถ
ร้องเรียน/ปรึกษา/แจ้งเบาะแส/ตรวจสอบคลินิก ติดต่อที่ไหน
ร้องคลินิก ต้องไปที่ไหน?
มีปัญหา สงสัยคลินิกเถื่อน ค่ารักษาพยาบาลที่คลินิกไม่ถูกต้อง ค่ารักษา รวมถึงคลินิกไม่รับผิดชอบผลของการผ่าตัดต่างๆ จะรักษา ด้วยการเจาะเลือดแปลกๆ สเต็มเซลล์ที่ยังไม่อนุญาต และไม่เป็นมาตรฐาน ต้องดำเนินการตามพระราชบัญญัติสถานพยาบาล อยู่ในความรับผิดชอบของกรม สบส. สามารถแจ้งได้ตาม โปสเตอร์ หรือ โทร 02-1937057 หรือ เฟสบุ๊ค
มือปราบสถานพยาบาลเถื่อน
ขอบคุณหลายท่านที่ส่งมาที่แพทยสภา ผมได้ส่งต่อให้แล้วนะครับ แต่ถ้าเป็นไปได้ส่งตรงเลย แพทยสภา จะดูแลได้ตามอำนาจ ใน พรบ วิชาชีพเวชกรรม ซึ่งจะดูเฉพาะตัวแพทย์ไม่เกี่ยวกับตัวคลินิก และลงโทษได้เฉพาะผู้ถือใบประกอบวิชาชีพเวชกรรม ไม่มีอำนาจในการไกล่เกลี่ย ขอเงินคืนต่างๆ รวมถึงให้จ่ายชดเชย อันนั้นของ สบส.และ สคบ.ครับ
"สบส.ฮอทไลน์"
เบอร์โทรศัพท์สายด่วนกรณีปัญหาจากคลินิกและ รพ.เอกชน ตามพระราชบัญญัติ สถานพยาบาลครับ
- ร้องเรียน/ปรึกษา จากการไปรับบริการกับคลินิก และ รพ.เอกชน และได้รับความเสียหายหรือเกิดผลกระทบจากการไปใช้บริการ เบอร์โทร 02-193-7000 ต่อ 18833
- แจ้งเบาะแส คลินิกเถื่อน หมอเถื่อน เบอร์โทร 02-193-7000 ต่อ 18822
- ตรวจสอบคลินิกที่ไปใช้บริการได้รับอนุญาตถูกต้องหรือไม่ เบอร์โทร 02-193-7000 ต่อ 18407
- ปรึกษาเรื่องอื่นๆ เบอร์โทร 02-193-7000 หรือ 02-590-2999
เครดิต Ittaporn Kanacharoen
25 พฤศจิกายน 2017
มือปราบสถานพยาบาลเถื่อน คลินิกเถื่อน หมอเถื่อน
ไทม์ไลน์เหตุการสะเทือนขวัญ ตำรวจคลั่งกราดยิงในศูนย์เด็กเล็ก จ.หนองบัวลำภู เจ็บ-ตายจำนวนมาก
ข้อมูลจากสถาบันโกลบอลเวลเนส (Global Wellness Institute; GWI) รายงานว่า ในปี พ.ศ. 2563 ภาคสาธารณสุข เวชศาสตร์ป้องกัน และการแพทย์เฉพาะบุคคล (Public Health, Prevention, & Personalized Medicine) สร้างรายได้ 375,400 ล้านเหรียญสหรัฐฯ โดยมีภาคสาธารณสุขและเวชศาสตร์ป้องกัน (Public Health and Preventive Medicine) ถือครองตลาดสูงถึง 92% คิดเป็นมูลค่า 344,100 ล้านเหรียญสหรัฐฯ และการแพทย์เฉพาะบุคคล (Personalized Medicine) 31,200 ล้านเหรียญสหรัฐฯ ถึงแม้การแพทย์เฉพาะบุคคลจะมีมูลค่าตลาดน้อยกว่า แต่ระหว่างปี พ.ศ. 2562 – 2563 กลับมีอัตราการเติบโตเฉลี่ยต่อปีสูงถึง 11% จากตัวเลขดังกล่าวแสดงให้เห็นว่าผู้คนทั่วโลกต่างหันมาให้ความสนใจการดูแลสุขภาพเชิงป้องกันมากยิ่งขึ้น
คุณหมอแอมป์เปรียบเทียบสุขภาพเหมือนกับรถยนต์ บางคนขับรถคันโปรดไปโดยไม่เคยตรวจเช็คระยะ เมื่อวันหนึ่งรถเกิดความเสียหาย ก็ต้องเสียเวลา เสียเงินทองไปกับการซ่อมแซม ยังดีที่รถยนต์ยังมีอะไหล่สำรองทดแทน แต่สุขภาพของคนเรานั้น เมื่อเกิดความเสียหาย เราไม่มีอะไหล่ทดแทน แม้รักษาได้ แต่ไม่อาจกลับมามีสภาพดีสมบูรณ์แข็งแรงได้เหมือนเดิม
การตรวจสุขภาพเชิงป้องกัน ก้าวหน้าไกลกว่าการตรวจเช็คระยะรถยนต์ตามปกติ แต่เหมือนกับการตรวจสภาพรถแข่งโดยทีมผู้เชี่ยวชาญที่รู้ข้อมูลของรถคันนี้อย่างละเอียด เพื่อเพิ่มประสิทธิภาพของรถยนต์ให้ทำงานได้อย่างเต็มที่ และทำให้รู้ว่ารถคันนี้จะวิ่งไปได้ไกลมากแค่ไหน
เพราะ “สุขภาพคือสมบัติที่สำคัญที่สุด” คุณหมอแอมป์กล่าว เรามีครอบครัวที่เรารัก มีพ่อแม่ มีลูก มีคนที่เราห่วงใย เพราะฉะนั้นรถยนต์คันนี้จะพังไม่ได้ การตรวจสุขภาพเชิงป้องกันจึงเหมือนกับการนำร่างกายที่รักของเราไปตรวจเช็คกับทีมแพทย์ผู้เชี่ยวชาญ เพื่อให้ได้ข้อมูลอย่างละเอียดครบถ้วน นำไปใช้วางแผนรักษาสุขภาพ ให้อยู่อย่างแข็งแรง ยืนยาว อย่างมีคุณภาพ
การตรวจสุขภาพเชิงป้องกัน มุ่งเน้นที่การดูแลคนสุขภาพดีไม่ให้เจ็บป่วย ต่างกับการรักษาโรคที่เป็นการดูแลคนป่วยให้หายดี ฉะนั้นการตรวจสุขภาพเชิงป้องกัน จะมีความแตกต่างกันไปตามแต่ละบุคคล ขึ้นอยู่กับ อายุ เพศและสภาวะของร่างกาย ทีมแพทย์ผู้เชี่ยวชาญจะประเมินประวัติสุขภาพโดยละเอียด เพื่อวางแผนการตรวจสุขภาพ ตลอดจนการดูแลสุขภาพที่เหมาะสมกับแต่ละบุคคลมากที่สุด
ปฏิทินเที่ยวลอยกระทง ททท.
8 พ.ย. 65 กัญชากับการรักษาผู้ป่วยโรคลมชักในเด็ก
กัญชากับการรักษาผู้ป่วยโรคลมชักในเด็ก
- นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ เผย สถาบันประสาทวิทยาและสถาบันเด็กฯ ได้ศึกษาวิจัยติดตามผู้ป่วย โรคลมชักรักษายากในเด็กที่ได้สารสกัดกัญชาซีบีดีสูง ร่วมกันยากันชักหลายชนิด จำนวน 14 ราย ระยะเวลา 1 ปี พบว่าผู้ป่วย มีอาการชักรุนแรงลดลง 7 ราย ทั้งนี้พบผลข้างเคียงทุกราย ส่วนใหญ่ไม่รุนแรง กรมฯ จึงได้เสนอสารสกัดกัญชาชนิดซีบีดีสูงใน การรักษาโรคลมชักรักษายากในเด็ก เข้าบัญชียาหลักแห่งชาติ สมุนไพร และได้รับอนุมัติบรรจุในบัญชียาหลักแห่งชาติด้าน สมุนไพร บัญชี 3 สามารถเบิกจ่ายในสิทธิบัตรทอง และจะมีการจัดทำโครงการติดตามผลการรักษาทั่วประเทศ จากนั้นจะ นำไปสู่การเสนอเข้าสู่บัญชียาหลักแห่งชาติด้านสมุนไพร บัญชี 1 ในปี 2567 ต่อไป
ผลข้างเคียงหลังเสพกัญชา
- จ.นนทบุรี : หญิงสาวแจ้งความอดีตแฟนหนุ่มบุกอาละวาดทำลายข้าวของในห้องพัก มีพฤติกรรมเสพยาบ้าและกัญชา - จ.ปทุมธานี : หญิงพิการวัย 43 ปี ร้องขอความช่วยเหลือจากเพจสายไหมต้องรอด หลังถูกลูกชายวัย 20 ปี ทำร้ายจน บาดเจ็บ มีพฤติกรรมเสพยาบ้าและสูบกัญชาเป็นประจำ
ร่าง พ.ร.บ.กัญชาฯ
- นายชินวรณ์ รองประธานวิปรัฐบาล กล่าวว่า การประชุมสภาฯ เดือน พ.ย. จะเว้นสัปดาห์ที่ไทยเป็นเจ้าภาพเอเปก แล้ว ไปจัดประชุมนัดพิเศษวันที่ 25 พ.ย. ร่าง พ.ร.บ.กัญชาฯ คาดว่าจะเข้าสู่การพิจารณาหลังการประชุมเอเปก ที่ผ่านมาวิปรัฐบาล มีมติเห็นด้วยกับกรรมาธิการเสียงข้างมาก เพียงแต่ย้ำว่ามีการแก้ไขเพิ่มเติมจำนวนมาก อยากให้พิจารณาโดยรอบคอบ โดยไม่ เอาผลประโยชน์ทางการเมืองเป็นตัวตั้ง
น้ำยาล้างคอนแทคเลนส์จัดเป็นของเหลวประเภทยาถ้ามีขนาดไม่เกิน 100 ml สามารถนำขึ้นเครื่องบินได้ [Johnson & Johnson Vision]
จุดจอดรถและบริการ รถรับ-ส่งฟรี สัปดาห์ที่ 1 ระหว่างวันที่ 3-4 มีนาคม 2566
จุดจอดรถและบริการ รถรับ-ส่งฟรี สัปดาห์ที่ 1 ระหว่างวันที่ 3-4 มีนาคม 2566 เวลา 15.00 น. - 01.00 น.
วัดหนองใหญ่ >> โลตัสพัทยาเหนือ >> ชายหาดพัทยาเหนือ
ห้างฮาร์เบอร์พัทยา >> บิ๊กซีเอ็กซ์ตร้า >> ชายหาดพัทยาเหนือ
โลตัส พัทยาใต้ >> โรงเรียนเมืองพัทยา 8 >> เซ็นทรัลพัทยา
จอดรถฟรี !! ที่เซ็นทรัล พัทยา เราพร้อมให้บริการลูกค้าทุกท่าน
เขตบางกะปิ LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางกะปิ ร่วมกับ ศูนย์บริการสาธารณสุข 35 หัวหมาก ขอประชาสัมพันธ์ เชิญชวน ประชาชนที่สนใจ สามารถนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ตามสถานที่และวันเวลาดังกล่าว #ฟร
เขตวังทองหลาง วันที่ 15 - 27 มีนาคม 2566 LINK
สำนักงานเขตวังทองหลางร่วมกับศูนย์บริการสาธารณสุข 15 ลาดพร้าว ให้บริการออกหน่วยรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 15 - 27 มีนาคม 2566 เวลา 09.00 - 11.30 น. (ให้บริการฟรี) สอบถามเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมฯ 02-514-0512
รายชื่อศิลปินและวันที่เล่น (13-14 เมษายน)
เบอร์ใหญ่ทั้งนั้น ดีเจ ก็เด็ดมาก
13 เมษายน
ปาล์มมี่
Foolstep
DJ Mafia
DJ Katoy
DJ Raya
Mint AF
14 เมษายน
Tilly Birds ทิลลี่ เบิร์ด
Three Man Down
DJ Foamie
DJ Kikie
DJ Bubblepaint
วัดมัชฌันติการาม แขวงวงศ์สว่าง เขตบางซื่อ
วัดมัชฌันติการาม แขวงวงศ์สว่าง เขตบางซื่อ กรุงเทพมหานคร บริการฌาปนกิจสัตว์เลี้ยง ทุกชนิด เตาเผาสัตว์ ขจัดมลพิษวัดมัชฌันติการาม แขวงวงศ์สว่าง เขตบางซื่อ กรเทพมหานคร สร้างเสร็จเรียบร้อย พร้อมให้ผู้รักสัตว์ เช่น น้อง หมาน้องแมว และสัตว์อื่นๆที่เราเลี้ยงจากเราไป ได้มีโอกาสส่งสัตว์เลี้ยงแสนรักไปภพภูมิที่ดีและได้ทำบุญให้เขาเป็นครั้งสุดท้าย
การให้บริการ ตั้งแต่เวลา 09.00 น. – 16.30 น. ทุกวัน สอบถามโทร. 089-1498310, 083-4266533 สถานที่ 102 ซอย วงศ์สว่าง 11 แขวงวงศ์สว่าง เขตบางซื่อ กรุงเทพมหานคร 10800
แผนที่ google map -
Facebook
คลินิกพิเศษนอกเวลาระดับรพ.ศูนย์ ภาคใต้
ข้อมูลแผนกฝึกอบรมมูลนิธิป่อเต็กตึ๊ง
แผนกฝึกอบรมมูลนิธิป่อเต็กตึ๊ง มีภาระกิจจัดการอบรมเพื่อช่วยชีวิตให้กับเจ้าหน้าที่และประชาชน "ลดวิกฤตเมื่อรอรักษา ส่งเสริมทัศนสู่ความศรัทธา มุ่งสร้างทุกชีวาให้ปลอดภัย" ตั้งอยู่ที่ 326 ถนน เจ้าคำรพบรรจบกับถนนพลับพลาไชย แขวง ป้อมปราบ เขต ป้อมปราบศัตรูพ่าย กรุงเทพ โทร. 02-2250020 ไลน์ ID: training1418 อีเมล์ Training@pohtecktung.org
เว็บไซต์ ติดตามข่าวสารผ่านเพจแผนกฯ ได้ที่
https://www.facebook.com/PTTFtraining ติดตามผ่าน
ช่อง Youtube ศูนย์ฝึกอบรม มูลนิธิป่อเต็กตึ๊ง ได้รวบรวมสื่อวีดีโอสำหรับการฝึกอบรมในหลักสูตรต่างๆของแผนกฝึกอบรมมูลนิธิฯ เอาไว้เพื่อการศึกษาเป็นอย่างดี
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) ได้แบ่งปันมุมมองใหม่ให้กับแบรนด์ เพื่อให้ปรับตัวให้เข้ากับสถานการณ์นี้ไว้ว่า
วันแรกของงาน 26 มิย มิตรรักหลากวัย คับคั่ง สามย่านมิตรทาวน์
งานจัดระหว่าง 29 มิ.ย.-2 ก.ค. ณ สามย่านมิตรทาวน์ฮอลล์ ชั้น 5 สามย่านมิตรทาวน์ เขตปทุมวัน กรุงเทพฯ กิจกรรมฟรีฟรี ดีๆ มากมายในงาน ได้แก่ ตรวจสุขภาพช่องปากฟรี ตรวจสุขภาพตา ผ่าตัดต้อกระจก 50 ราย ฟรี ตรวจคัดกรองมะเร็งปอด รู้ผลใน 3 นาที ฟรี ฉีดวัคซีน ไข้หวัดใหญ่ โควิด ฟรี ตรวจการได้ยิน บ่งชี้โรคสมองเสื่อม ฟรี พาคุณพ่อคุณแม่ไป ก็ดีนะ
*ภาพจากมติชน2. การลงแบนเนอร์โฆษณา ในเว็บไซต์
ลักษณะ "แบนเนอร์โฆษณา" จะเป็นในรูปแบบรูปภาพ หรือรูปภาพ+ข้อความ หรือ เฉพาะข้อความ ก็ได้ พร้อมการใส่ hyperlink ตำแหน่งแบนเนอร์โฆษณา ดังนี้
- ขอรับ Rate card การลงแบนเนอร์ - ขอรับใบเสนอราคาอีเมล์มาที่ healthserv.net@gmail.com หรือ โทร. 081-6969454 (คุณธนพรรณ Sale MKT)
เปิดตัวระบบเมื่อมิถุนายน 66 ที่ผ่านมา 5 จุดนำร่อง
กรุงเทพมหานคร เปิดตัวโครงการ AI กล้อง CCTV จับผิดมอเตอร์ไซค์ขี่มอเตอร์ไซค์บนทางเท้า โดย นายสิทธิชัย อรัณยกานนท์ ผู้ช่วยเลขานุการผู้ว่าราชการกรุงเทพมหานคร เมื่อวันที่ 21 มิถุนายน 2566 โดยนำสื่อมวลชนเยี่ยมชมการใช้เทคโนโลยี AI ร่วมกับระบบกล้อง CCTV บริเวณปากซอยรัชดาภิเษก 36 (ซอยเสือใหญ่อุทิศ) ระบุว่า เบื้องต้นทดลองติดตั้ง 5 จุด ประกอบด้วย
1. ปากซอยรัชดาภิเษก 36 (ซอยเสือใหญ่อุทิศ) เขตจตุจักร
2. โรงเรียนนิเวศน์วารินทร์ เขตบางเขน
3. ปากซอยเพชรเกษม 28 เขตภาษีเจริญ
4. ถนนเทพารักษ์ เขตบางเขน
5. ปากซอยเพชรบุรี 9 เขตราชเทวี
โดยมีเป้าหมายติดตั้งให้ครบ 100 จุดทั่วกรุงเทพฯ
ภาพบรรยากาศ กิจกรรม Mother Class ครั้งที่ 8 เดือนสิงหาคม
ภาพบรรยากาศ กิจกรรม Mother Class ครั้งที่ 8 วันเสาร์ที่ 19 สิงหาคม 2566 ที่ผ่านไป บรรยากาศอบอุ่นสนุกสนานดีมากค่ะ (ภาพจากเพจรพ.เกษมราษฎร์ ประชาชื่น)
งานกัญชง-กัญชานานาชาติ 2022
Asia International HEMP and Cannabis Expo 2022 งานกัญชง-กัญชา วันที่ 30 พฤศจิกายน – 2 ธันวาคม 2565 เป็นงานครั้งแรก และเป็นงานที่ยิ่งใหญ่ที่สุดอีกงานในประเทศไทยและระดับชาติ โดยความร่วมมือระหว่าง สมาคมการค้าอุตสาหกรรมกัญชงไทย (TIHTA) ร่วมกับ NEO (N.C.C. Exhibition Organizer)
งาน Asia International HEMP and Cannabis Expo 2022 งานแสดงเทคโนโลยี นวัตกรรม และผลิตภัณฑ์กัญชง-กัญชานานาชาติ ที่ยิ่งใหญ่ที่สุดในประเทศไทยและระดับเอเซีย จัดขึ้นระหว่างวันที่ 30 พฤศจิกายน – 2 ธันวาคม 2565 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์ โฉมใหม่ จะเป็นงานที่จะรวมทุกพันธมิตรในธุรกิจกัญชง-กัญชา ทั้งภาครัฐ เอกชน ทุกระดับและทุกสาขาในอุตสหกรรมที่จะเกี่ยวข้องกับการผลิต แปรรูป จำหน่าย การตลาด เทคโนโลยี นวัตกรรม การแพทย์ เวชภัณฑ์ ฯลฯ ปลดล็อคทุกข้อจำกัดและเปิดโอกาสสู่การพัฒนาอุตสาหกรรมกัญชง-กัญชาให้เติบโตระดับโลก
พื้นที่โซนจัดแสดง
ในงานจัดโซนน่าสนใจ ออกเป็น 2 โซนหลัก คือ Plantation Zone และ Production Zone
Plantation Zone
จะครอบคลุมทุกองค์ประกอบในการผลิต ต้นน้ำ กลางน้ำ และปลายน้ำ
จำแนกเป็น
1) ด้านการเกษตรอุตสาหกรรม เทคโนโลยีการเกษตร ได้แก่ การเพาะปลูกในโรงเรือน หรือกลางแจ้ง , เมล็ดพันธุ์และพันธุกรรมพืช, ระบบน้ำ พลังงาน, ระบบดินสำหรับเพาะปลูก, ต้นพันธุ์และระบบจัดการวัชพืช, การเก็บเกี่ยว ระบบเพาะปลูก เพาะพันธุ์ รวมไปถึงเทคโนโลยีและซอฟต์แวร์ที่น่าสนใจ
2) กระบวนการและเทคโนโลยีการแปรรูปผลิตภัณฑ์ ตั้งแต่ การวิเคราะห์วิจัยทางวิทยาศาสตร์ การกำหนดสูตร กระบวนการผลิต ระบบมาตรฐาน GMP การตรวจสอบมาตรฐาน การอบแห้ง การจัดเก็บ และการขนส่ง
3) ธุรกิจเกี่ยวเนื่อง ที่สนับสนุนอุตสาหกรรมในมิติอื่น ได้แก่ ด้านการสื่อสารการตลาดประชาสัมพันธ์ อุตสาหกรรมหีบห่อ ธุรกิจการเงิน สินเชื่อ การประกัน รวมถึงที่ปรึกษาด้านกฏหมายและนิติกรรม
Production Zone
ความหลากหลายของอุตสาหกรรมปลายน้ำที่กัญชง-กัญชาสามารถพัฒนาหรือประยุกต์เข้าไปถึงได้ ไม่ว่าจะเป็นผลิตภัณฑ์ที่รับรู้เป็นอย่างดี เช่น ยา เวชภัณฑ์ด้านการแพทย์ อาหาร เครื่องดื่ม เครื่องสำอางค์ แฟชั่น อาหารเสริม อาหารสัตว์ ไปจนถึงอุตสาหกรรมอื่นๆ ที่อาจคาดไม่ถึง เช่น ชิ้นส่วนยานยนต์ วัสดุก่อสร้าง พลังงานไบโอ เฟอร์นิเจอร์ สปาและการผ่อนคลายในอุตสาหกรรมการท่องเที่ยว
คาดว่าจะมีร่วมงานกว่า 300 ราย ต้อนรับผู้ค้านักธุรกิจนักลงทุนกว่า 10,000 รายจากทั่วโลก มาร่วมเจรจาโอกาสทางธุรกิจที่จะเกิดขึ้นในงานกว่า 1,500 ฟอรั่มภายในงาน
และในครั้งนี้ ยังมีการจัดเวทีเสวนาจากตัวจริงวงการกัญชง-กัญชาจากทั่วโลก "The 2nd International Hemp Environmental Forum" ซึ่งทางสมาคมได้รับการส่งไม้ต่อเป็นเจ้าภาพจากทางประเทศญี่ปุ่น
งาน Asia International HEMP and Cannabis Expo 2022 จะเป็นอีกก้าวสำคัญที่จะผลักดันให้ไทยขึ้นสู่การเป็นฮับกัญชงและกัญชาในภูมิภาค สร้างโอกาสการเจรจาทางธุรกิจและการลงทุนใหม่ๆ ให้กับประเทศและภูมิภาค สอดคล้องไปกับนโยบาย BCG Model สู่เศรษฐกิจใหม่แห่งอนาคต
ติดตามข้อมูลได้ที่ Asia Hemp Expo www.facebook.com/asiahempexpo/
ไข้เลือดออก เกิดจากเชื้อไวรัสเดงกี มียุงลายเป็นพาหะ
ไข้เลือดออก เกิดจากเชื้อไวรัสเดงกี มียุงลายเป็นพาหะ
อาการ ไข้สูงเฉียบพลัน หน้าแดงมีผื่น
คลื่นไส้อาเจียน เบื่ออาหาร อ่อนเพลีย
ปวดกล้ามเนื้อ เลือดกำเดาไหล เลือดออกตามไรฟัน อาเจียนเป็นเลือด ถ่ายเป็นเลือด
ควรรีบพบแพทย์เพื่อจะได้รักษาทันท่วงที
ห้ามกินยากลุ่ม NSAIDS เช่น ไอบูโพรเฟน แอสไพริน ยาชุด เด็ดขาด
กลุ่มเสี่ยง
เด็กที่มีอายุต่ำกว่า 5 ปี ผู้สูงอายุ ผู้ที่มีโรคประจำตัว ผู้ที่มีภาวะอ้วน
ศูนย์ส่งเสริมสุขภาพแผนไทย อาคารเรือนไทย บริการปรึกษาทางไกล
ระบบปรึกษาการแพทย์แผนไทยทางไกล ศูนย์ส่งเสริมสุขภาพแผนไทย นนทบุรี (เรือนไทย)
เปิดให้บริการ
- ปรึกษากับแพทย์แผนไทยผ่านทางระบบวิดีโอคอล
- ปรึกษารับยาสมุนไพรผ่านทางไปรษณีย์ ยาสมุนไพรทั่วไป อาทิ ฟ้าทะลายโจร ขมิ้นชัน ยาหอม น้ำมันกัญชา กลุ่มยาสมุนไพรบรรเทาอาการ long-covid
- นัดติดตามอาการและรับยาต่อเนื่อง
แอดไลน์ ติดต่อศูนย์เพื่อรับบริการได้ตามภาพ
คลินิกพิเศษเฉพาะทางนอกเวลา โรงพยาบาลกระทุ่มแบน สอบถามโทร 086-3254509 ศูนย์ประสานงานผู้ป่วยนอกเวลา
คลินิกพิเศษเฉพาะทางนอกเวลา โรงพยาบาลกระทุ่มแบน ลดเวลารอคอย ไม่ต้องลางาน พบแพทย์เชี่ยวชาญ และเบิกค่ายาและค่าเจาะเลือดได้ตามสิทธิ์ สอบถามโทร 086-3254509 ศูนย์ประสานงานผู้ป่วยนอกเวลา
รพ.ทันตกรรม คณะทันตแพทยศาสตร์ มหิดล ทำฟันฟรี 1,330 คน 20 ตุลาคม 2566
เนื่องในวันคล้ายวันพระราชสมภพ สมเด็จพระศรีนครินทราบรมราชชนนี และวันทันตสาธารณสุข ในวันศุกร์ 20 ตุลาคม 2566 โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มหาวิทยาลัยมหิดล ขอเชิญผู้มีสัญชาติไทย เข้ารับบริการทันตกรรม (โดยไม่มีค่าใช้จ่าย) จำนวน 1,330 บาท ให้บริการอุดฟัน ถอนฟัน ผ่าฟันคุด ขูดหินน้ำลาย รักษารากฟันฉุกเฉิน ทันตกรรมเด็ก ถ่ายภาพรังสีทางทันตกรรม (1 คน / 1 การรักษา) สถานที่บริการ อาคารเฉลิมพระเกียรติ 50 พรรษา โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มหาวิทยาลัยมหิดล ถนนโยธี เขตราชเทวี ติดต่อโทร 02-2007727 02-2007601 ในจำนวน 1,330 ท่าน แบ่งเป็น
- ผู้ใหญ่ 1,230 ราย เริ่มแจกบัตรคิว 6.00-10.00 น. (หรือจนบัตรคิวหมด) ณ ลานอเนกประสงค์ ชั้น 1
- เด็ก 100 ราย เริ่มแจกบัตรคิว 7.00-10.00 น. (หรือจนบัตรคิวหมด) ณ คลินิกทันตกรรมเด็ก ลานอเนกประสงค์ ชั้น 4
กำหนดการบริการ ตรวจคัดกรองโดยทีมพยาบาล เริ่ม 06.45 น. เข้ารับบริการ 8.00-15.00 น.
นำบัตรประชาชนมาแสดง ในการลงทะเบียน สำหรับเด็กอายุต่ำกว่า 12 ปี ต้องมีผู้ปกครองมาด้วย ผู้มีอายุต่ำกว่า 18 ปี ต้องมีใบยินยอม และมีสำเนาบัตรประชาชนผู้ปกครองมาแสดง ผู้รับบริการ ต้องยื่นใบยินยอมเข้ารับการรักษาล่วงหน้าได้ที่
dt.mahidol.ac.th หรือสแกน QR Code
สถานการณ์โรคพิษสุนัขบ้าในปี 2564 ผู้เสียชีวิต 3 ราย
สถานการณ์โรคพิษสุนัขบ้าในปี 2564 ที่ผ่านมา พบผู้เสียชีวิต 3 รายใน 3 จังหวัด (จังหวัดสุรินทร์ 2 ราย และจังหวัดบุรีรัมย์ 1 ราย)
กสทช. ยืนยัน เบอร์ที่ขึ้นต้นด้วย +697 เป็นเบอร์ที่โทรจากต่างประเทศและเป็นมิจฉาชีพ จริง
ตามที่มีการเผยพร่ข้อมูลประเด็นเรื่องกสทช. กำหนดเบอร์ที่ขึ้นต้นด้วย +697 เป็นเบอร์ที่โทรจากต่างประเทศและเป็นมิจฉาชีพ ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสำนักงานคณะกรรมการกิจการกระจายเสียง กิจการโทรทัศน์ และกิจการโทรคมนาคมแห่งชาติ (กสทช.) กระทรวงดิจิทัลเพื่อเศรษฐกิจและสังคม พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลจริง
สำนักงาน กสทช. ขอแจ้งผลการตรวจสอบข้อเท็จจริง เรื่อง กสทช. กำหนดเบอร์ที่ขึ้นต้นด้วย +697 เป็นเบอร์ที่โทรจากต่างประเทศและเป็นมิจฉาชีพ ดังนี้ สำนักงาน กสทช. ได้ตรวจสอบแล้วพบว่า ข้อเท็จจริงดังกล่าวเป็น ความจริง โดยสำนักงานฯ ได้ออกมาตรการให้ผู้ให้บริการโทรศัพท์เคลื่อนที่ทุกราย ใส่เครื่องหมาย + นำหน้าเบอร์ที่โทรมาจากต่างประเทศ เพื่อให้เป็นที่สังเกตของประชาชน เพื่อให้ประชาชนระมัดระวัง อย่ารับสาย เพื่อป้องกันการถูกมิจฉาชีพหลอกลวง
ศูนย์ต่อต้านข่าวปลอม
โฆษกรัฐบาลเผย นายกฯ ห่วงใยต้องการให้ปล่อยตัวประกันชาวไทยโดยเร็ว
24 พฤศจิกายน 2566 นายสัตวแพทย์ชัย วัชรงค์ โฆษกประจำสำนักนายกรัฐมนตรี กล่าวว่า นายเศรษฐา ทวีสิน นายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการคลัง ห่วงใยและได้สั่งการให้ติดตามสถานการณ์และความคืบหน้าการช่วยเหลือตัวประกันไทยที่อยู่ในพื้นที่สู้รบระหว่างอิสราเอลและฮามาสอย่างสม่ำเสมอและต่อเนื่อง
ซึ่งมีรายงานว่าได้มีการเจรจาและบรรลุข้อตกลงให้หยุดการสู้รบเป็นเวลา 4 วัน เพื่อเหตุผลทางด้านมนุษยธรรม โดยเริ่มวันนี้ (วันศุกร์ที่ 24 พ.ย. 2566) เวลา 07.00 น. ตามเวลาท้องถิ่น (0500 GMT) และในช่วงบ่ายของวันเดียวกันคาดว่าจะมีการปล่อยตัวประกันที่ถูกจับกุมไปด้วย เบื้องต้นคาดว่าจะได้รับการปล่อยตัวประมาณ 13 ราย และจะได้รับการปล่อยตัวเพิ่มอีก 50 คนในช่วง 4 วันของข้อตกลง
โดยกระทรวงการต่างประเทศได้ออกแถลงการณ์ว่า “ยินดีกับความตกลงล่าสุดที่จะเริ่มปล่อยตัวประกันที่ถูกจับไปจากเหตุการณ์ความไม่สงบในอิสราเอลและฉนวนกาซาเพิ่มเติมในวันนี้ ซึ่งถือเป็นความคืบหน้าอันสำคัญหลังความพยายามในการเจรจาอย่างเต็มที่ของทุกฝ่ายในหลายสัปดาห์ที่ผ่านมา และมีความยินดีที่มีการหยุดยิงชั่วคราวเพื่อเหตุผลด้านมนุษยธรรม ตามที่คณะมนตรีความมั่นคงแห่งสหประชาชาติเรียกร้อง เพื่อให้ความช่วยเหลือด้านมนุษยธรรมสามารถเข้าถึงผู้ที่ต้องการได้ ประเทศไทยหวังเป็นอย่างยิ่งว่า แนวโน้มเชิงบวกนี้จะสามารถดำรงไว้จนนำไปสู่การปล่อยตัวประกันทั้งหมด ซึ่งมีคนไทยผู้บริสุทธิ์รวมอยู่ด้วย โดยเร็วที่สุด ตามที่ไทยได้เรียกร้องมาอย่างต่อเนื่อง
กระทรวงการต่างประเทศขอขอบคุณและชื่นชมรัฐบาลกาตาร์ อิสราเอล สหรัฐอเมริกา อียิปต์ คณะกรรมการกาชาดระหว่างประเทศ และทุกฝ่ายที่มีส่วนเกี่ยวข้องในความพยายามและการเจรจาเพื่อนำมาสู่การปล่อยตัวประกันครั้งล่าสุดนี้ และขอแสดงความปรารถนาดีไปยังผู้ที่ได้รับการปล่อยตัวและครอบครัวด้วย”
“นายกรัฐมนตรีติดตามสถานการณ์ด้วยความหวัง สั่งการให้หน่วยงานที่เกี่ยวข้อง ดำเนินการด้วยทุกวิถีทางในทุกช่องทาง เพื่อให้คนไทยที่ถูกจับเป็นตัวประกันได้รับการปล่อยตัวอย่างปลอดภัยโดยเร็วที่สุด” นายชัย กล่าว
Coffee & Bakery Thailand 2024 (21-24 Aug 2024)
Coffee & Bakery Thailand 2024 on 21 - 24 Aug 2024 Trade Show Queen Sirikit National Convention Center, Bangkok, Thailand
ตรุษจีนปลอดโรคไข้หวัดนก (กรมควบคุมโรค)
กรมควบคุมโรค กระทรวงสาธารณสุข ตรุษจีนนี้ เฮง ๆ ปัง ๆ
ปลอดโรคไข้หวัดนก แนะ เลือกหลีก ล้าง
ปรับการไหว้วันตรุษจีน เลี่ยงลดจุด ลดเผา
ปลอดโรคปลอดภัยจากอาหารเป็นพิษ ยึดหลัก สุก ร้อน สะอาด
ทำหมันสุนัขเพศเมียฟรีเชียงใหม่-กับแฮนด์ทูพอว์ Hand to Paw LINK
มูลนิธิแฮนด์ทูพอว์ (Hand to Paw) บริการ ทำหมันสุนัขเพศเมีย ฟรี เชียงใหม่ โทร 080-6731770 (สามารถโทรลงทะเบียนตามวันเวลาราชการเท่านั้น เนื่องจากทางเราออกหน่วยวันเสาร์-อาทิตย์ ไม่สะดวกในการลงทะเบียน หากไม่รับสายจะโทรกลับทุกเบอร์นะคะ)
ต้องแน่ใจว่ามาได้เท่านั้น รับบัตรคิวหน้างาน :เวลา 08.30-11.00 น
การเตรียมความพร้อมน้องหมา ก่อนผ่าตัด
• งดอาหาร/ข้าว อย่างน้อย 6 ชม.
• งดน้ำอย่างน้อย 4 ชม.
• สัตว์ต้องไม่ป่วย ไม่ซึม ไม่บาดเจ็บ
น้องหมาที่พร้อมจะทำหมัน ต้องเป็น
• ลูกสุนัข อายุ 4 เดือนขึ้นไป น้ำหนัก 4 กก.ขึ้น
• แม่สุนัข ต้องหลังคลอดลูกแล้ว 2 เดือนแต่ไม่เกิน 4 เดือน (เพราะอาจเสี่ยงตั้งท้อง)
การดูแลผู้ป่วยติดเตียงในช่วงฤดูร้อน
การดูแล ผู้สูงอายุติดเตียงในช่วงฤดูร้อน
- จัดห้องให้สะอาด อากาศถ่ายเทสะดวก สามารถเคลื่อนย้ายผู้ป่วยได้สะดวก กรณีเกิดเหตุฉุกเฉิน
- เปิดเครื่องปรับอากาศในช่วงที่สภาพอากาศร้อนจัดในตอนกลางวัน หากไม่มี ให้เปิดหน้าต่าง เปิดพัดลมเพื่อช่วยระบายอากาศ ไม่ควรเปิดพัดลมจ่อใส่ผู้สูงอายุเพราะจะทำให้เป็นไข้หวัดได้ง่าย
- ระวังเรื่องแผลกดทับ พลิกตัวทุกๆ 2 ชั่วโมงและเปลี่ยนท่านอนสลับกันไป เพื่อป้องกันการเกิดแผลกดทับและความอับชื้น
- ใช้ผ้าชุบน้ำบิดหมาดๆ เช็ดตัวผู้สูงอายุเพื่อระบายความร้อน
- ดูแลให้ผู้สูงอายุดื่มน้ำสะอาดอย่างเพียงพอ โดยไม่ต้องรอให้กระหายน้ำ
- เตรียมยารักษาโรคประจำตัว ให้พร้อม หากมีเหตุฉุกเฉิน ให้รับติดต่อสถานพยาบาลใกล้ที่สุด หรือ โทร. 1669
โครงการปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า 2567
โครงการปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า โดย สำนักงานปศุสัตว์จังหวัดภูเก็ต ร่วมกับเทศบาลเมืองกะทู้ เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร. สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร. สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี ประจำปีงบประมาณ 2567
กำหนดการออกหน่วยให้บริการ ทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัข - แมว ฟรี
วันอังคาร ที่ 9 กรกฎาคม 2567 เวลา 08.30 น. เป็นต้นไป ณ สวนสาธารณะ ลานกีฬาอำเภอกะทู้ (โรงเหล้าเก่า) จังหวัดภูเก็ต
- ลงทะเบียนหน้างาน เวลา 8.30 น.
- งดน้ำและอาหารอย่างน้อย 6-8 ชั่วโมง
- งดรับสุนัขหน้าสั้นพันธุ์เล็ก
กฎหมายรอการรับรอง 3 ฉบับ เพื่อเข้าสู่สภา
ปัจจุบันมีกฎหมายที่ “รอการรับรอง” จากนายกรัฐมนตรี อยู่ที่สำนักงานของนายกรัฐมนตรี 3 ฉบับ
ฉบับแรก คือการเข้าชื่อของสมาชิกสภาผู้แทนราษฎรพรรคภูมิใจไทย เพื่อเสนอเป็นร่างพระราชบัญญัติ กัญชา กัญชง ที่คัดลอกมากจาการพิจารณาของคณะกรรมาธิการฯในสมัยสภาผู้แทนราษฎรชุดก่อนหน้า
ฉบับที่สอง คือการเข้าชื่อของประชาชนในนามเครือข่ายเขียนอนาคตกัญชาไทย ซึ่งได้เข้าชื่อประชาชนครบจำนวนเสนอกฎหมายกัญชา กัญชงต่อสภาผู้แทนราษฎรแล้ว
ฉบับที่สาม คือการเข้าชื่อของประชาชนในนามเครือข่ายกัญชา กัญชง ม่าง (ภาคประชาชน) ซึ่งได้เข้าชื่อประชาชนครบจำนวนเสนอกฎหมายกัญชา กัญชง ม่างต่อสภาผู้แทนราษฎรแล้ว
เนื่องด้วยกฎหมายทั้ง 3 ฉบับ เป็นกฎหมายทางการเงิน จึงต้องได้รับการรับรองจากนายกรัฐมนตรีเสียก่อน หลังจากนั้นจึงสามารถนำเข้าสู่การพิจารณาของสภาผู้แทนราษฎรต่อไป [
ปานเทพ]
17 SDGs การพัฒนาอย่างยั่งยืน UNDP LINK
เป้าหมายความยั่งยืน 17 ประการ สหประชาชาติ
1.NO POVERTY ขจัดความยากจน
2.ZERO HUNGER ภาวะอดอยากเป็นศูนย์
3.GOOD HEALTH AND WELL-BEING สุขภาพและความเป็นอยู่ที่ดี
4.QUALITY EDUCATION การศึกษาที่มีคุณภาพ
5.GENDER EQUALITY ความเท่าเทียมทางเพศ
6.CLEAN WATER AND SANITATION น้ำสะอาดและสุขอนามัย
7.AFFORDABLE AND CLEAN ENERGY พลังงานสะอาดที่ซื้อหาได้
8.DECENT WORK AND ECONOMIC GROWTH งานที่เหมาะสมและการเติบโตทางเศรษฐกิจ
9.INDUSTRY, INNOVATION AND INFRASTRUCTURE อุตสาหกรรม นวัตกรรม และโครงสร้างพื้นฐาน
10.REDUCED INEQUALITIES ความไม่เท่าเทียมกันจะลดลง
11.SUSTAINABLE CITIES AND COMMUNITIES เมืองและชุมชนที่ยั่งยืน
12.RESPONSIBLE CONSUMPTION AND PRODUCTION การบริโภคและการผลิตที่รับผิดชอบ
13.CLIMATE ACTION การดำเนินการด้านสภาพภูมิอากาศ
14.LIFE BELOW WATER ชีวิตใต้ผืนน้ำ
15.LIFE ON LAND ชีวิตบนผืนดิน
16.PEACE, JUSTICE AND STRONG INSTITUTIONS สันติภาพ ความยุติธรรม และสถาบันที่เข้มแข็ง
17.PARTNERSHIPS FOR THE GOALS ความร่วมมือเพื่อเป้าหมาย
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน สิงหาคม 2567
เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
เขตดุสิต ออกหน่วยวันที่ 2-13 กันยายน 2567
วันสร้างสุข สู้ภัยน้ำท่วม 2567 LINK
โครงการวันสร้างสุข โดย กลุ่ม เดอะวัน เอ็นเตอร์ไพรส์ ร่วมกับ มูลนิธิเรวัต พุทธินันทน์
"วันสร้างสุข สู้ภัยน้ำท่วม 2567"
เชิญชวนร่วมบริจาคเพื่อจัดทำถุงยังชีพ
จัดซื้ออุปกรณ์ที่จำเป็นต่อการดำรงชีพ และการฟื้นฟูเพื่อผู้ประสบภัย
ชื่อบัญชี มูลนิธิเรวัต พุทธินันทน์ สำหรับโครงการวันสร้างสุข เพื่อผู้ประสบภัย
บัญชีกระแสรายวัน เลขที่บัญชี 925-3-013131 ธนาคารกรุงเทพ จำกัด (มหาชน) สาขาถนนอโศกมนตรี
หรือสแกน QR Code ผ่านทางหน้าจอ
เอทิลแอลกอฮอล์ กับ เมทิลแอลกอฮอล์ อันไหนกินได้กันแน่
กรมควบคุมโรค จำแนก แอลกอฮอล์ 2 ประเภท ดังนี้
1. เอทิลแอลกอฮอล์(เอทานอล)
ของเหลวไวไฟ ละลายน้ำไม่มีสี มีกลิ่นและ รสขม ได้จากการหมักพืชผลทางการเกษตร เช่น อ้อย กากน้ำตาล กากอ้อย แป้ง มันสำปะหลัง มันเทศ ธัญพืชต่าง ๆ
ความเป็นพิษต่อร่างกาย : ดื่มเป็นระยะเวลานานจะเกิดโรคพิษสุราเรื้อรัง ตับอักเสบ มะเร็งตับ
การใช้ประโยชน์ และตัวอย่าง ใช้ทำเครื่องดื่มแอลกอฮอล์ เปอร์เซ็นต์แอลกอฮอล์ที่มีแตกต่างกัน
2. เมทิลแอลกอฮอล์ (เมทานอล)
ของเหลวไวไฟ ละลายน้ำไม่มีสี มีกลิ่นและรส ไม่ต่างจากเอทิลแอลกอฮอล์ได้จากกระบวนการ กลั่นทางปิโตรเคมี
ความเป็นพิษต่อร่างกาย
ทางเดินหายใจ : ระคายเคืองต่อทางเดินหายใจ หลอดลมอักเสบ หายใจลำบาก
ทางปาก : ปวดท้อง เวียนหัว คลื่นไส้ อาเจียน กล้ามเนื้อกระตุก และเสียชีวิตได้
ทางตา : ระคายเคืองเยื่อบุตา การมองเห็น ผิดปกติ อาจทำให้ตาบอด
การใช้ประโยชน์ และตัวอย่าง ใช้ในอุตสาหกรรม เช่น สีทาไม้ น้ำยาลอกสี น้ำมันเคลือบเงา
คำแนะนำสำหรับประชาชน เมื่อต้องเลือกซื้อเครื่องดื่มแอลกอฮอล์
- ควรซื้อเหล้าจากร้านที่เชื่อถือได้ มีแสตมป์สรรพสามิตที่ขวด
- ขวดต้องไม่มีการนำมาแยกบรรจุใหม่
- ไม่มีการใช้ขวดเครื่องดื่มอื่นๆ มาบรรจุแทน ฉลากต้องชัดเจน
- หากพบว่า เหล้ามีสี กลิ่น รสชาติเปลี่ยนไปจากเดิม ขุ่นหรือมีตะกอนไม่ควรดื่ม
สำนักงานเขตบางนา ร่วมกับศูนย์ฯ8 และ ศูนย์32 ฉีดวัคซีน 2-12 กันยายน
สำนักงานเขตบางนา ร่วมกับศูนย์ฯ 8 และ ศูนย์32 ฉีดวัคซีน 2-12 กันยายน เวลา 9.00-11.00 น. ณ จุดให้บริการ ตามภาพ
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ และแพทย์
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ อายุรกรรมระบบประสาทและสมอง โรงพยาบาลหนองคาย
โดย แพทย์หญิงชนิตา ราชบัณฑิต
อายุรแพทย์โรคระบบประสาทและสมอง
เปิดให้บริการ ทุกวันพุธ เวลา 16.30-20.30 น.
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ศัลยกรรมกระดูกและข้อ (กระดูกสันหลัง) โรงพยาบาลหนองคาย
โดย นายแพทย์ณัฏฐพล รุจิระโชติวัฒน์
(ศัลยแพทย์กระดูกและข้อ อนุสาขา กระดูกสันหลัง)
เปิดให้บริการ ทุกวันพฤหัสบดี เวลา 16.30 - 20.30 น.
เริ่มให้บริการ วันที่ 1 สิงหาคม 2567 เป็นต้นไป
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ศัลยกรรมกระดูกและข้อ (กระดูกสันหลัง) โรงพยาบาลหนองคาย
โดย นายแพทย์วรัญญู ลิ้มมณีวิจิตร
(ศัลยแพทย์กระดูกและข้อ อนุสาขา กระดูกสันหลัง)
เปิดให้บริการ ทุกวันพุธ เวลา 16.30 - 20.30 น.
เริ่มให้บริการ เดือนสิงหาคม 2567 เป็นต้นไป
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ อายุรกรรมต่อมไร้ท่อ โรงพยาบาลหนองคาย
โดย แพทย์หญิงนีรนาท สีมะสิงห์
อายุรแพทย์ต่อมไร้ท่อและเมตาบอลิซึม
เปิดให้บริการ ทุกวันอังคาร เวลา 16.30-20.30 น.
คลินิกรักษ์ใจ
โดย น.พ.จิรัสย์ สมัครราษฎร์
เปิดให้บริการ ทุกวันเสาร์ เวลา 08.30 - 12.30 น.
เริ่ม เสาร์ ที่ 7 กันยายน 2567
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ทันตกรรม โรงพยาบาลหนองคาย
เปฺิดให้บริการ วันจันทร์ - วันพฤหัสบดี 16.30 น. - 20.30 น.
วันเสาร์ 08.30 น. - 12.30 น.
งดวันหยุดนักขัตฤกษ์ สามารถสอบถามข้อมูลเพิ่มเติม หรือ จองคิวตรวจ สายตรงทันตกรรม รพ.หนองคาย
โทร 061-0290404 หรือ 042413456 ต่อ 119
อุทยานการเรียนรู้สุราษฎร์ธานี FB
TK Park Suratthani โดย องค์การบริหารส่วนจังหวัดสุราษฎร์ธานี เปิดบริการ วันอังคาร - วันศุกร์ 09.00-18.30 น. วันเสาร์ - อาทิตย์ 08.30-16.30 น. **หยุดทุกวันจันทร์และวันหยุดนักขัตฤกษ์** ยินดีต้อนรับนักท่องเที่ยวมาเยี่ยมเยือนสุราษฎร์
ห้าม นำสัตว์เลี้ยงทุกประเภทเข้า ฝ่าฝืนปรับไม่เกิน 20,000 บาท
ข้อสำคัญ นักท่องเที่ยวห้ามนำสัตว์เลี้ยงทุกประเภทเข้าในเขตอุทยานเเห่งชาติเเละในงานประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ หากฝ่าฝืนมีโทษปรับไม่เกิน 20,000 บาท
1-7 สิงหาคม สัปดาห์รณรงค์นมแม่
1-7 สิงหาคมของทุกปี สัปดาห์นมแม่โลก จะมีการรณรงค์ร่วมกันในเรื่องการส่งเสริมการเลี้ยงลูกด้วยนมแม่ โดยมี องค์การพันธมิตรโลกเพื่อการส่งเสริมการเลี้ยงลูกด้วยนมแม่ (World Alliance for Breastfeeding Actions
WABA ) เป็นแกนนำ โดยการสนับสนุนจากองค์กรหลายองค์กรร่วมทั้ง UNICEF และ WHO
InterCare Asia 2024 วันที่ 1-3 สิงหาคม 2567
InterCare Asia 2024 x Medical &Wellness Travel Fair 2024 วันที่ 1 - 3 สิงหาคม 2567 Exhibition Hall 5, ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์ เวลา 10.00 - 18.00 น. งานแสดงสินค้าและนวัตกรรมแห่งปี เพื่อสุขภาพและคุณภาพความเป็นอยู่ที่ดีสำหรับทุกวัย งานประจำปีที่ยิ่งใหญ่และครบวงจรที่สุด อัดแน่นด้วยสินค้าและนวัตกรรมเพื่อสุขภาพ ความงามและคุณภาพชีวิต อาทิ ศูนย์ดูแลสุขภาพและความงาม สปา, ผลิตภัณฑ์เสริมอาหาร, อาหารและเครื่องดื่มเพื่อสุขภาพ, อุปกรณ์และสินค้าเพื่อความงาม, อุปกรณ์ทางการแพทย์และการฟื้นฟูสมรรถภาพ ฯลฯ พร้อมบริการและกิจกรรมห้ามพลาดอีกเพียบ!
Coffee & Bakery Fest Hat Yai 2024 วันที่ 1-4 สิงหาคม 2567
Coffee & Bakery Fest Hat Yai 2024 วันที่ 1-4 สิงหาคม 2567 เวลา 10.30 - 20.30 น. ณ ศูนย์ประชุมนานาชาติฉลองสิริราชสมบัติครบ ๖๐ ปี งานดีปีละครั้งเท่านั้น Highlight Activities ในงาน
การแข่งขันลาเต้อาร์ตสแมคดาวน์ ปักษ์ใต้ ครั้งที่ 6
การแข่งขัน The Best Robusta Cup 2024
Exclusive Sharing & Tasting: เคล็ดลับเอสเย็น จาก แชมป์ Thailand Es Yen Championship 2024 คุณลี่ Pym Coffee & Roastery และ พี่อ๊อด a cup of joe
ผู้บุกเบิกสูตรเอสเย็นแชมป์ปี 2017 พร้อมพบกับ Pop-up Cafe เอสเย็นสูตรแชมป์
จำนวนจำกัด 50 แก้ว เท่านั้น
Exclusive Sharing & Tasting: กาแฟไทย เพาะ (เพราะ) “พิเศษ” ให้เติบโต
• พี่ลี (Akha Ama) ผู้สร้างแรงบันดาลใจ พัฒนากาแฟไทยสู่ระดับโลก
• พี่เม่น (Foresto) บทบาทสมาคมกาแฟพิเศษไทยต่อการพัฒนากาแฟไทย
• พี่ต่าย (Nutt-Phob Coffee) เจ้าของร้านต้องรับมือกับกระแสกาแฟพิเศษอย่างไร
• ดำเนินการเสวนา โดย พี่ลัค (Luck Coffee)
พร้อมร่วมกิจกรรม ล้อมวงจิบกาแฟพิเศษ Thailand Specialty Coffee Awards 2024 โดย สมาคมกาแฟพิเศษไทย รวมทั้ง หลากหลายเมล็ดกาแฟคุณภาพจากเกษตรกรบ้านแม่จันใต้ และกาแฟโรบัสต้าหาดใหญ่
Exclusive Sharing & Tasting: แชมป์บาริต้าประเทศไทย
พบกับเมนูที่ใช้ในการแข่งขัน พร้อมพูดคุยกับคุณ กิตติภพ เอ่งฉ้วน (ฟิวเจอร์) จาก Asterisk espresso (ภูเก็ต) แชมป์บาริต้าคนล่าสุดของประเทศไทย (Thailand Barista Champion 2025)
2-3 ก.ย.66 Ultra-Trail Khao Eto.2023
Ultra-Trail Khao Eto.2023 วันเสาร์ที 2 และอาทิตย์ที่ 3 กันยายน 2566 ณ ป่ามันธนาคารน้ำตกเขาอีโต้-ป่าในเมืองเดิม อ.เมือง จ.ปราจีนบุรี
งานประกวดแมว Sweet Fun Fin with Cat Show by CLC 3-4 สิงหาคม 67
งานประกวดแมว Sweet Fun Fin with Cat Show by CLC 3-4 สิงหาคม 67 ณ SC Plaza สายใต้ ตลิ่งชัน ชั้น 1 (มีค่าสมัครเข้าประกวด) ประเภทประกวด UCA International Cat Show - All breed แยกตามอายุแมว ประกวดแมวแสนรั ตรวจสอบสายพันธุ์แมว ประกวดแมวไทยแท้ คณะกรรมนานาชาติจากหลายประเทศ (ไทย จีน มาเลเซีย อินโดนีเซีย)
งานประเพณีทิ้งกระจาด (ซิโกว) ประจำปี 2567 ศาลเจ้าอ่างทอง 3-7 สิงหาคม
งานประเพณีทิ้งกระจาด (ซิโกว) ประจำปี 2567 ศาลเจ้าอ่างทอง 3-7 สิงหาคม 2567 ทิ้งกระจาดวันที่ 5 สิงหาคม บริเวณหน้าศาลเจ้า
กำหนดการ มีดังนี้
วันเสาร์ที่ 3 สิงหาคม 2567 (ลักว่วย ยี่เก้า)
07.00 น.อัญเชิญเทพเจ้าทุกศาลเจ้าพร้อมคณะสิงโต
09.00 น. อุปรากรณ์จีนแสดงป่วงเซียง
(งิ้ว คืนแรก)
วันอาทิตย์ที่ 4 สิงหาคม 2567 (ชิกว่วย ชิวอิก)
08.30 น. สักการะเทพเจ้าทุกพระองค์เนื่องในวันพระจีน
09.00 น. คณะงิ้วป่วงเซียง
(งิ้ว คืนที่สอง)
วันจันทร์ที่ 5 สิงหาคม 2567 (ชิกว่วย ชิวหยี)
09.30 น. คณะสงฆ์จีนอนัมนิกาย ทำพิธีสวดมนต์
13.30 น. ทำพิธีไหว้ฮอเฮียตี๋ บริเวณด้านหน้าโรงงิ้ว และโกวแป๊
14.30 น. เริ่มทำการแจก คูปอง ข้าวสาร-น้ำดื่ม
16.00 น. เชิญประธานตรวจเช็คยอดติ้ว และขึ้นบนโกวแป๊ เหวี่ยงติ้ว ( งิ้ว คืนที่สาม)
วันอังคารที่ 6 สิงหาคม 2567 (ชิกว่วย ชิวซา) (งิ้วคืนที่ 4)
วันพุธที่ 7 สิงหาคม 2567 (ชิกว่วย ชิวสี่)
19.30 น. ทำพิธีเหี่ยงเพ้า
20.30 น. ส่งเทพเจ้ากลับสู่ศาลเดิม (อุปรากรณ์จีน งิ้ว คืนที่ห้า คืนสุดท้าย)
วันพฤหัสบดีที่ 8 สิงหาคม 2567
09.30 จัดส่งทีกงเต็งเทศกาลทิ้งกระจาด
4 สิงหาคม วันสัตวแพทย์ไทย
สัตวแพทย์ เป็นสาขาวิชาทางการแพทย์อีกหนึ่งสาขาที่นับว่ามีความสำคัญ โดยนอกจากสัตวแพทย์จะเป็นผู้ดูแลรักษาสัตว์ทั้งสัตว์เลี้ยงและสัตว์เศรษฐกิจ เพื่อให้มีสุขภาพแข็งแรงแล้วยังเป็นการป้องกันไม่ให้เกิดการติดต่อของโรคจากสัตว์สู่คน ได้อีกด้วย ซึ่งปัจจุบันวิชาชีพด้านสัตวแพทย์ยังขาดแคลนบุคลากรอีกมาก
ราชวิทยาลัยจุฬาภรณ์ มุ่งตอบสนองพระปณิธานองค์ประธานราชวิทยาลัยจุฬาภรณ์ ในการดูแลสุขภาพและยกระดับคุณภาพชีวิตของประชาชน โดยคณะสัตวแพทยศาสตร์และสัตววิทยาประยุกต์ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ ได้ถือกำเนิดขึ้น ตามแนวคิดสุขภาพหนึ่งเดียว หรือ One Health เพื่อการดูแลสุขภาพอย่างครบวงจร อันได้แก่ สุขภาพคน สุขภาพสัตว์ และสุขภาพสิ่งแวดล้อม ที่ล้วนมีความสัมพันธ์กันเพื่อให้บัณฑิตสัตวแพทย์ มีความสามารถในการปฏิบัติงานร่วมกับสหสาขาวิชาชีพ เป็นสัตวแพทย์ที่มีความสามารถและพร้อมออกปฏิบัติงานได้จริง
Bangkok Double Bridge Run 2024 วันอาทิตย์ที่ 4 สิงหาคม 2567 LINK
Bangkok Double Bridge Run 2024 ความท้าทายที่ไม่เคยหยุดนิ่ง ปีนี้พบกัน 4 สะพานข้ามแม่น้ำเจ้าพระยา สะพานพระพุทธยอดฟ้า สะพานพระปกเกล้า สะพานสมเด็จพระปิ่นเกล้า และสะพานพระราม 8 กับ 3 ระยะทางที่จะพาคุณไปสัมผัสและรู้จักกรุงเทพมหานคร ผ่านชุมชนและสถานที่สำคัญทางประวัติศาสตร์สองฝั่งแม่น้ำเจ้าพระยา ทั้งฝั่งพระนครและธนบุรี ในระยะ Half Marathon 21 กม. Mini Marathon 11 กม. และ Micro Marathon 7 กม.
วันอาทิตย์ที่ 4 สิงหาคม 2567 ณ ลานทัศนาภิรมย์ หอประชุมกองทัพเรือ ริมฝั่งเจ้าพระยา
SATHORN RMUTK RUN FOR MOM อาทิตย์ที่ 4 สิงหาคม 2567 LINK
ขอเชิญร่วมกิจกรรม SATHORNRMUTKRUNFORMOM ชิงถ้วยพระราชทาน จากสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ในวันอาทิตย์ที่ 4 สิงหาคม 2567 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลกรุงเทพ
สมัครเข้าร่วมกิจกรรม SATHORN RMUTK RUN FOR MOM ได้ตั้งแต่บัดนี้ ถึง 24 กรกฎาคม 2567
ประเภทการแข่งขัน วิ่งระยะทาง 5 Km. ชาย-หญิง สำหรับนักศึกษา ชาย-หญิง วิ่งระยะทาง 10 Km. รางวัล Overall ชาย-หญิง
KhaoKheow10 งานวิ่งในสวนสัตว์ที่ใหญ่ที่สุด 4 สิงหาคม 2567 LINK
KhaoKheow10 Season7 Presented by YumYum Changnoi งานวิ่งฟันรัน นักวิ่งจะได้เพลิดเพลินกับเส้นทางวิ่งที่สวยงามรายล้อมไปด้วยธรรมชาติ และ สัตว์นานาชนิด ในสวนสัตว์เปิดเขาเขียว สวนสัตว์เปิดอันดับหนึ่งของเอเชีย พร้อมอร่อยสนุกไปกับยำยำช้างน้อย หลากหลายรสชาติ .
งานวิ่งจัดวันอาทิตย์ที่ 4 สิงหาคม 2567 ณ สวนสัตว์ เปิดเขาเขียว รับเสื้อและบิบ วันเสาร์ที่ 3 สิงหาคม 2567 ณ สวนสัตว์ เปิดเขาเขียว
สิทธิประโยชน์สำหรับผู้สมัคร และผู้ติดตาม สามารถเข้าเที่ยวชมสวนสัตว์เปิดเขาเขียวได้ฟรี ทั้งวันเสาร์ที่ 3 และ อาทิตย์ที่ 4 สิงหาคม 2567 พร้อมฟรีค่านำรถยนต์เข้าพื้นที่
เทศกาลดนตรีเมืองพัทยา 2565 (Pattaya Music Festival 2022) สิงหาคม 65 LINK
เทศกาลดนตรีเมืองพัทยา ประจำปี 2565 (Pattaya Music Festival 2022) จัดงานตลอดเดือนสิงหาคม ทุกวันศุกร์และเสาร์ รวม 3 สัปดาห์ 17:00 น. ถึง 01:00 น.
5-6 สิงหาคม 2565 ชายหาดพัทยาเหนือ/กลาง/ใต้
12-13 สิงหาคม 2565 ชายหาดจอมเทียน
19-20 สิงหาคม 2565 สวนสาธารณะลานโพธิ์นาเกลือ
26-27 สิงหาคม 2565 ชายหาดพัทยากลาง
เทศกาลดูผีเสื้อปางสีดา ครั้งที่ 17 ประจำปี 65 LINK
เลือกซื้อสินค้าชุมชนของดีเมืองสระแก้ว ที่ตลาดผีเสื้อ “Butterfly Night Market”
ณ สวนสาธารณะสระแก้วสระขวัญ อ.เมืองสระแก้ว จ.สระแก้ว
วันที่ 5-7 สิงหาคม 2565
กิจกรรมปั่นจักรยานพิชิตจุดชมวิว ณ อุทยานแห่งชาติปางสีดา
วันเสาร์ที่ 13 สิงหาคม 2565 (เปิดรับสมัครเร็วๆนี้)
กิจกรรมวิ่งฮาล์ฟมาราธอน
วันอาทิตย์ที่ 21 สิงหาคม 2565 (เปิดรับสมัครเร็วๆนี้)
ประชุมวิชาการ เวชศาสตร์และวิทยาการด้านผู้สูงอายุ 7 – 9 สิงหาคม 2566


กรมการแพทย์ โดยสถาบันเวชศาสตร์สมเด็จพระสังฆราชญาณสังวรเพื่อผู้สูงอายุ จะจัดงานมหกรรมสุขภาพผู้สูงอายุ ครั้งที่ 4 ภายใต้ชื่อ “การประชุมวิชาการเวชศาสตร์และวิทยาการด้านผู้สูงอายุ The 4th Thailand Elderly Health Service Forum 2023” ซึ่งจะจัดขึ้นในระหว่างวันที่ 7 – 9 สิงหาคม 2566 ณ อาคารอิมแพคฟอรั่ม เมืองทองธานี อำเภอปากเกร็ด จังหวัดนนทบุรี โดยธีมงานในปีนี้คือ “Aging in Place: The Meanings of Aging in Place “ความหมาย ในความต้องการของผู้สูงอายุ” โดยมีวัตถุประสงค์เพื่อร่วมกระตุ้นให้ทุกภาคส่วน ทั้งภาครัฐ เอกชน ชุมชน ท้องถิ่น ตลอดจนภาคประชาสังคม ตระหนักถึงความสำคัญในการเตรียมพร้อมทุกด้านเพื่อรองรับสังคมสูงวัย ในบริบทของสังคมไทย ภายในงานมีกิจกรรมออกบูธนิทรรศการวิชาการและการให้บริการสุขภาพสำหรับผู้สูงอายุจากโรงพยาบาลสังกัดกรมการแพทย์ เช่น การคัดกรองความเสี่ยงภาวะสมองเสื่อม ตรวจสุขภาพตาในผู้สูงอายุ บริการทำสปาเปลือกตา การอัลตร้าซาวด์หลอดใหญ่ที่คอ บริการคัดกรองโรคผิวหนัง การตรวจสุขภาพสำหรับวัยทำงานก่อนเกษียณ บริการตรวจสุขภาพเท้า ตลอดจน บูธนิทรรศการจากองค์การเภสัชกรรม บูธกิจกรรมจาก สสส. บูธให้คำปรึกษาทางด้านการเงินและการออม ตลอดจนบูธนิทรรศการด้านสุขภาพผู้สูงอายุกระทรวงสาธารณสุข อาทิ กรมสุขภาพจิต กรมควบคุมโรค กรมการแพทย์แผนไทยและการแพทย์ทางเลือก
นอกจากนี้ ภายในงานยังมีกิจกรรมที่สำคัญ คือการเสวนาเพื่อร่วมแลกเปลี่ยนเรียนรู้จากผู้เชี่ยวชาญด้านผู้สูงอายุระดับประเทศ ทั้งด้านสุขภาพ นโยบาย สังคม ท้องถิ่น สิ่งแวดล้อม กฎหมาย การเงิน และการใช้ชีวิตในวัยสูงอายุได้อย่างปลอดภัยและมีความสุข ผู้สนใจ สามารถลงทะเบียนเข้าร่วมงานได้โดยไม่เสียใช้จ่าย
Organizers: กรมการแพทย์ กระทรวงสาธารณสุข โดยสถาบันเวชศาสตร์สมเด็จพระสังฆราชญาณสังวรเพื่อผู้สูงอายุ
ร่วมกับ: 1) SingHealth 2 ) Malaysia 3) กรมการแพทย์ โดยกลุ่ม CR5GDNA 4) กรมใน สธ. 5) กระทรวงที่เกี่ยวข้อง 6) เอกชน 7) สสส. 8) มูลนิธิ/สมาคม 9) เครือข่ายด้านผู้สูงอายุ
การประชุมวิชาการ International Drug Forum 7-9 สิงหาคม 2566
สำนักงานเลขานุการคณะกรรมการบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติด กระทรวงสาธารณสุข จัดการประชุมวิชาการ International Drug Forum ระหว่างวันที่ 7-9 สิงหาคม 2566 ณ อาคารอิมแพค ฟอรั่ม เมืองทองธานี จังหวัดนนทบุรี เพื่อส่งเสริมให้เกิดการแลกเปลี่ยนและเผยแพร่ผลงานด้านการบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติด จึงขอเรียนเชิญบุคลากรผู้สนใจ ศูนย์คัดกรองยาเสพติด สถานพยาบาลยาเสพติด สถานฟื้นฟูสมรรถภาพผู้ติดยาเสพติด ศูนย์ฟื้นฟูสภาพทางสังคม องค์กรการกุศล ภาคีเครือข่าย อาจารย์ นักศึกษา และผู้ที่สนใจ ร่วมประชุม สามารถลงทะบียนร่วมประชุม โดยไม่มีค่าลงทะเบียนได้ตั้งแต่วันนี้ เป็นต้นไปจนกว่าผู้ร่วมประชุมจะครบจำนวน
งานทิ้งกระจาด มูลนิธิร่วมกุศลสมุทรปราการ ประจำปี 2567 วันที่ 7-9 สิงหาคม LINK
งานทิ้งกระจาดมูลนิธิร่วมกุศลสมุทรปราการ ประจำปี 2567 วันที่ 7-9 สิงหาคม 2567 ณ มูลนิธิร่วมกุศลสมุทรปราการ
ช่องทางการทำบุญบริจาคออนไลน์ โอน บัญชี
มูลนิธิร่วมกุศลสมุทรปราการ ธ.กสิกรไทย เลขที่ 224-2-22221-5
หรือผ่านคิวร์อาร์โค้ตใต้ภาพ หรือเดินทางมาที่มูลนิธิร่วมกุศลสมุทรปราการ ถนนท้ายบ้านซ.17 ต.ปากน้ำ อ.เมือง จ.สมุทรปราการ
ติดต่อสอบถาม โทร.021758789 021758668 0841509101
ขอเชิญทำบุญงานทิ้งกระจาดมูลนิธิร่วมกุศลสมุทรปราการ
ถนนท้ายบ้านซ.17 ตั้งแต่บัดนี้เป็นต้นไปจนถึง 7-8-9 สิงหาคม 2567
1.บริจาคข้าวสารถุงละ5 กก. ร่วมทำบุญ ถุงละ 100 บาท
2.บริจาคข้าวสารกระสอบ ร่วมทำบุญ กระสอบละ1,500 บาท
3.บริจาคอาหารแห้งทุกชนิด อาทิเช่น ข้าวสาร มาม่า ปลากระป๋อง น้ำปลา น้ำตาลเครื่อง น้ำดื่ม อุปโภคในการดำเนินชีวิต ตามกำลังศรัทธา
4.บริจาคโรงทานเพื่อแจกผู้ยาากไร้ซุ้มละ 5,000 บาท
5.บริจาคโรงทานผู้ใจบุญจัดเตรียมอาหารและสิ่งของมาเองทางเรามีจัดซุ้มอำนวยความสะดวกให้
6.มีอุยเซีย(หีบสมบัติ) ชุดโกวอีเดี่ยว เพื่อไหว้ให้บรรพบุรุษ
กล่องละ 300 บาท
7.มีอุยเซีย(หีบสมบัติ) ชุดโกวอีคู่ เพื่อไหว้ให้บรรพบุรุษ
กล่องละ 320 บาท
สิงหาคม 65 โรงพยาบาลราชธานี เริ่มโครงการให้บริการรังสีรักษา (Radiotherapy)
8 สิงหาคม 2565 โรงพยาบาลราชธานี จำกัด (มหาชน) มีมติอนุมัติให้จัดตั้งบริษัทย่อย เพื่อดำเนินโครงการโรงพยาบาลให้บริการรังสีรักษา (Radiotherapy) สำหรับบำบัดรักษาโรคมะเร็ง มูลค่าการลงทุนของโครงการรวม 210 ล้านบาท ประกอบด้วยค่าอาคารและอุปกรณ์รวม 147.5 ล้านบาท และค่าที่ดิน 62.5 ล้านบาท โดยบริษัทย่อยดังกล่าว จะมีทุนจดทะเบียนประมาณ 140 ล้านบาท ซึ่งบริษัทฯจะถือหุ้นร้อยละ 60 โครงการตั้งอยู่ที่ ถนนโรจนะ ต.สามเรือน อ.อุทัย จ.พระนครศรีอยุธยา เนื้อที่ดิน 2.5 ไร
8 สิงหาคม 65 บินรับผู้ป่วยจากพะงัน ส่งต่อ รพ.สุราษฎร์ LINK
8 สิงหาคม 2565 เวลา 12.28 น. รพ.เกาะพะงัน และศูนย์กู้ชีพนเรนทรอ่าวไทย ได้ร้องขอการสนับสนุนเฮลิคอปเตอร์เพื่อส่งต่อผู้ป่วยฉุกเฉิน เพศชาย อายุ 91 ปี มีประวัติหายใจหอบเหนื่อย วูบหมดสติ ชีพจรต่ำ ความดันโลหิตตก แพทย์วินิจฉัยเป็น NSTEMI with complete heart block (ภาวะหัวใจขาดเลือดเฉียบพลัน) จำเป็นต้องได้รับการสวนเปิดหลอดเลือดหัวใจ ซึ่งเกินศักยภาพในการรักษาของโรงพยาบาลเกาะพะงัน นพ.พหล พิระภิญโญ แพทย์เจ้าของไข้ ได้ประสานงานส่งต่อ รพ.สุราษฎร์ธานี แพทย์ผู้ให้การรักษาคือ นพ.สุชาติ อรุณศิริวัฒนา แพทย์ อายุรศาสตร์โรคหัวใจ แพทย์อำนวยการปฏิบัติการฉุกเฉินท้องที่และหัวหน้าทีมปฏิบัติการทางการแพทย์ คือ นพ.จารุวัฒน์ สำลีพันธ์ ประสานงานผ่านศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติเพื่อแจ้งขอสนับสนุน อากาศยานจากหน่วยกองบิน 7 จังหวัดสุราษฎร์ธานี ประเภทอากาศยานเฮลิคอปเตอร์ EC725 มีชุดปฏิบัติการ บินประกอบด้วย น.ต.อิศรายุทธ แสงจันทร์ และ ร.อ.ศฎิล ฟักเฟื่องบุญ ชุดลำเลียงทางอากาศประกอบด้วย นฉพ.ชูรียานา อีซอ รพ.สุราษฎร์ธานี และ พ.ว.ณัฐณิชา บุญคุ้มครอง รพ.เกาะพะงัน เมื่อเวลา 15.48 น. ผู้ป่วยได้ส่งต่อเข้ารับการรักษาปฏิบัติการสวนหัวใจเป็นที่เรียบร้อย การส่งต่อครั้งนี้ได้รับการสนับสนุนงบประมาณ จากสถาบันการแพทย์ฉุกเฉินแห่งชาติ
Good Life Celebration @PARADISE PARK 8-12 สิงหาคม 2567
กิจกรรมฉลองโฉมใหม่ Living in Harmony ใส่ใจการใช้ชีวิต กินดี อยู่ดี สุขภาพดี ศูนย์การค้าฯ ที่ปังที่สุดในย่านศรีนครินทร์ มาร่วมฉลองไปด้วยกันกับโชว์สุดยิ่งใหญ่ตลอด 5 วัน 8 - 12 ส.ค. 67 ลานกิจกรรม (ข้างร้าน Pharmax) ชั้น 3 ศูนย์การค้าพาราไดซ์ พาร์ค
8 ส.ค. 67 พิธีเปิดพบกับ คุณเจี๊ยบ พิจิตตรา ควงคู่มากับ คุณบอย พีชเมคเกอร์ และคุณหมอเจี๊ยบ ลลนา ร่วมพูดคุยถึง "Good Lifestyle" ส่งมอบความสุขปิดท้ายด้วย มินิคอนเสิร์ต จากคุณบอย พีชเมคเกอร์
9 ส.ค. 67 พบกับศิลปินเพลงเอก บาร็อก ชลธาร (รองแชมป์ซีซั่น3), วิรัช ศรีพงษ์ (อันดับ3ซีซั่น3) และศิลปินไฮไลท์ คุณอรวี สัจจานนท์ พร้อมวงสุนทราภรณ์เต็มวง
10 ส.ค. 67 พบกับ ไรอัล กาจบัณฑิต แชมป์ไมค์ปลดหนี้ 200 สมัย และ การแสดงฉ่อย 3 น้า น้าโย่ง / น้าพวง / น้านงค์
11 ส.ค. 67 พบกับ มินิคอนเสิร์ต นักแสดงจากซีรี่ย์ “ขอเป็นพระเอกในหัวใจพระเอก” และ ลิเกเงินล้านจากคณะ “ศรราม น้ำเพชร”
12 ส.ค. 67 การแสดงโขน เดอะ เธียเตอร์ ตอน “อินทรชิตถูกศรกินนม”
Coffee Society AYUTTHAYA วันที่ 8-14 สิงหาคม 67 เซ็นทรัล อยุธยา
COFFEE SOCIETY AYUTTHAYA วันที่ 8-14 ส.ค. 67 ณ ลานกิจกรรม ชั้น G เซ็นทรัล อยุธยา ปฐมบทแห่งความสุข ปีที่ 3 ยกทัพร้านกาแฟ และเบเกอรี่ชื่อดังมาถึงอยุธยา ภายในงาน ยังพบกับร้านเด็ด ร้านดัง Best of Society Drink ที่คัดสรรมาเพื่อชาวอยุธยา โดยเฉพาะ เครื่องดื่มระดับแชมป์ชง โกโก้รางวัลระดับโลก ชาเขียวเกรดพรี่เมี่ยมสุดๆ และสุดยอดน้ำผึ้งไทย รวมถึงเครื่องดื่มพิเศษมากมาย พบกับกิจกรรมไฮไลท์
10 สค. การแข่งขันกาแฟ รายการ TEAM BATTLE THAILAND COFFEE BREWER LEAGUE 2024
11-12 สค. การแข่งขันกาแฟ รายการ THAILAND COFFEE BREWER LEAGUE 2024
13 ส.ค การแข่งขัน รายการ AYUTTHAYA : SPEED CUP TASTER CHALLENGE 2024
14 ส.ค ฟรี CONCERT จากศิลปิน THE WHITE HAIR CUT
คณะเภสัชศาสตร์ ม.นเรศวร จัดการอบรมเชิงปฏิบัติการร่วมกับ เทศบาลตำบลบางกระทุ่ม
วันศุกร์ที่ 9 สิงหาคม 2567 คณะเภสัชศาสตร์ มหาวิทยาลัยนเรศวร นำโดย ผศ.ดร.ภก.ดำรงศักดิ์ เป๊กทอง, ผศ.ดร.ภญ.สุภาวดี พาหิระ พร้อมด้วยทีมงานจัดโครงการบริการวิชาการสู่ชุมชนในท้องถิ่น ประจำปีงบประมาณ 2567 ร่วมกับ เทศบาลตำบลบางกระทุ่ม นำโดย นายบุญสวน มณีท่าโพธิ์ นายกเทศมนตรีเทศบาลอำเภอบางกระทุ่ม ภายใต้โครงการอบรมหมอหมู่บ้าน ในพระราชประสงค์ ประจำปีงบประมาณ 2567 จัดการอบรมเชิงปฏิบัติการ เรื่อง “การดูแลป้องกันตัวเองจากเชื้อไวรัส และปฏิบัติการทำน้ำยาอเนกประสงค์” จากอาสาสมัครสาธารณสุขประจำหมู่บ้านเทศบาลตำบลบางกระทุ่ม แกนนำ ชุมชนภายในเขตเทศบาลตำบลบางกระทุ่ม และครู นักเรียนโรงเรียนบางกระทุ่มพิทยาคม จำนวนกว่า 40 คน และในวันเดียวกันนี้อาสาสมัครสาธารณสุขประจำหมู่บ้านเทศบาลตำบลบางกระทุ่มได้นำ ยาเหลือใช้ ที่จัดเก็บได้ภายในชุมชน ส่งมอบให้กับคณะเภสัชศาสตร์เพื่อส่งต่อให้กับผู้ป่วยได้ใช้ประโยชน์ต่อไป
Warrix Thailand Earth Trail Test-Special ไทรโยค กาญจนบุรี 10 -11 สิงหาคม 2567 LINK
Warrix Thailand Earth Trail วันจัดงาน: 10 -11 สิงหาคม 2567 สถานที่จัดงาน: บ้านหาดงิ้ว อำเภอไทรโยค จังหวัดกาญจนบุรี สนามครอสคันทรีที่ขึ้นชื่อว่าสวยที่สุดในประเทศไทย เปิดประสบการณ์วิ่งครั้งใหม่เพื่อมาประชันความเร็ว ลัดเลาะริมแม่น้ำแคว ท่ามกลางบรรยากาศขุนเขา สัมผัสกลิ่นอายธรรมชาติแบบใกล้ชิด เพื่อฝึกซ้อมเติมเต็มประสิทธิภาพได้อย่างสมบูรณ์แบบ เตรียมความพร้อมก่อนลุยสนามเทรลจริง มาร่วมบันทึกความทรงจำสุดงดงาม ผ่าน ทริปนี้ไปด้วยกัน
room The Design Clinic for SMEs EP.07 "ถอดรหัสความสำเร็จฉบับ NaNa Coffee Roasters" 10 สิงหาคม 2567
room The Design Clinic for SMEs EP.07 "ถอดรหัสความสำเร็จฉบับ NaNa Coffee Roasters" วันที่ 10 สิงหาคม 2567 เวลา 13.00-14.45 น. ณ เวที room x LIVING ASEAN PAVILION ฮอลล์ 103
"ถอดรหัสความสำเร็จฉบับ NaNa Coffee Roasters" บอกเล่าประสบการณ์เส้นทางการเดินทางของแบรนด์ NaNa ก่อนจะกลายเป็นแบรนด์ระดับท๊อปของประเทศไทยในวันนี้ โดยคุณกุ้ง - วรงค์ ชลานุชพงศ์ ผู้ก่อตั้ง NaNa Coffee Roaster แบรนด์กาแฟที่เรียกได้ว่า ผู้ชื่นชอบในกาแฟคุณภาพไม่มีทางที่จะไม่รู้จัก พร้อมเรียนรู้เคล็ดลลับการสร้างแบรนด์ในแบบ NaNa รวมทั้งตอบคำถามอย่างใกล้ชิด เหมาะสำหรับ - กลุ่มผู้ประกอบการร้านอาหาร คาเฟ่ ที่สนใจการประยุกต์ใช้ประสบการณ์จากผู้รู้จริงเพื่อพัฒนาธุรกิจของตัวเอง - นักออกแบบรุ่นใหม่ที่สนใจแลกเปลี่ยนแนวคิดการออกแบบในธุรกิจอาหารและเครื่องดื่ม - นักศึกษาด้านการออกแบบที่สนใจเรียนรู้ด้านการออกแบบในธุรกิจอาหารและเครื่องดื่ม
กำหนดการ ลงทะเบียน 13.00 – 13.30 น. เสวนา 13.30-13.45 น. ช่วงตอบคำถาม . "เคล็ดลับการเพิ่มมูลค่าด้วยงานออกแบบในพื้นที่ธุรกิจ ฉบับ IDIN" 13.45-14.00 น. ลงทะเบียน 14.00 – 14.30 น. เสวนา 14.30-14.45 น. ช่วงตอบคำถาม . ณ เวที room x LIVING ASEAN PAVILION ฮอลล์ 103 . The Design Clinic for SMEs ไม่ว่าจะเป็นคาเฟ่ ร้านอาหาร บาร์ โฮสเทล หรือโรงแรม room คือ “ตัวกลาง” เชื่อมต่อระหว่างนักออกแบบกับผู้ประกอบการ SMEs พร้อมสนับสนุนทุกพื้นที่ธุรกิจให้ขับเคลื่อนด้วยดีไซน์ที่ดี
Healthy Hero เดิน-วิ่งเพื่อสุขภาพ รู้เท่าทันบุหรี่ไฟฟ้าและป้องกันโรค NCDs 11 สิงหาคม 2567 LINK
HEALTHY HERO เดิน-วิ่งเพื่อสุขภาพ รู้เท่าทันบุหรี่ไฟฟ้าและป้องกันโรค NCDS 11 สิงหาคม 2567 ณ ศาลาอ่างแก้ว มหาวิทยาลัยเชียงใหม่ ค่าสมัคร 250 บาท เท่านั้น
จัดโดย สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) ร่วมกับ มูลนิธิสมาพันธ์ชมรมเดิน-วิ่งเพื่อสุขภาพไทย มูลนิธิรณรงค์เพื่อการไม่สูบบุหรี่ ราชวิทยาลัยแพทย์เวชศาสตร์ฟื้นฟู แห่งประเทศไทย สมาคมนิสิตนักศึกษาแพทย์นานาชาติ (ประเทศไทย) ศูนย์พัฒนาองค์ความรู้ด้านกิจกรรมทางกายประเทศไทย (TPAK) สถาบันวิจัยประชากรและสังคม มหาวิทยาลัยมหิดล และภาคีกิจกรรมทางกาย
ประเพณีทิ้งกระจาด มูลนิธิชุมพรการกุศลสงเคราะห์ ประจำปี 2567 วันที่ 13-15 สิงหาคม LINK
มูลนิธิชุมพรการกุศลสงเคราะห์ จัดงานประเพณีทิ้งกระจาด (ซิโกว) ประจำปี 2567 วันที่ 13-15 สิงหาคม 2567 ณ มูลนิธิชุมพรการกุศลสงเคราะห์ 59/1-5 ถนนประชาอุทิศ ตำบลท่าตะเภา อำเภอเมืองชุมพร จังหวัดชุมพร
เรียนเชิญร่วมบริจาค ข้าวสาร อาหารแห้ง เครื่องนุ่งห่ม หรือปัจจัยแก่ผู้ยากไร้ ได้ทุกวัน ที่สำนักงานมูลนิธิชุมพรการกุศลสงเคราะห์
หรือ โอนบริจาคผ่านบัญชีธนาคารหมายเลข 654-26500-8 ชื่อบัญชี มูลนิธิชุมพรการกุศลสงเคราะห์ ประเภท ออมทรัพย์ ธนาคารไทยพาณิชย์ สาขาชุมพร
สอบถาม สำนักงาน โทร 077-502861 , 093-581-6887 บรรเทาสาธารณภัย โทร 077-502861
งานมหกรรมสุขภาพ ครั้งที่ 1 ประจำปี 2567 “Wellness City ศรีราชา เมืองแห่งสุขภาวะที่ดี” 14 สิงหาคม 2567
เทศบาลเมืองศรีราชา จัดงานมหกรรมสุขภาพ ครั้งที่ 1 ประจำปี 2567 “Wellness City ศรีราชา เมืองแห่งสุขภาวะที่ดี” บริการด้านสุขภาพแก่ประชาชนฟรี วันที่ 14 สิงหาคม 2567 เวลา 09.00 น.ณ ศรีราชา ฮอลล์ ชั้น 4 ศูนย์การค้าเซ็นทรัล ศรีราชา ประชาชน เข้ารับบริการ ไม่จำกัดสิทธิงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568 (เถ่านั้ง 109) 14-19 สิงหาคม LINK
งานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568 (เถ่านั้ง 109) ขอเชิญท่านผู้มีจิตศรัทธา ร่วมทำบุญเครื่องอุปโภคและบริโภคเพื่อบริจาค ให้แก่ผู้ที่มีรายได้น้อย เนื่องในโอกาส งานประเพณีทิ้งกระจาดและเทศกาลสารทจีน ประจำปี 2567 ระหว่างวันที่ 14-19 สิงหาคม 2567 ณ ศาลเจ้าแม่ (หน้าผา)
กำหนดการจัดงานมีดังนี้
14 สค. ลงทะเบียนรับบัตรคิว
15 สค. ประเพณีทิ้งกระจาด ศาลเจ้าแม่ (หน้าผา)
18 สค. เทศกาลสารทจีน (วันไหว้บรรพบุรุษ)
คณะกรรมการจัดงานฯ ขอขอบคุณทุกท่านที่ได้ร่วมบริจาคให้แก่ผู้ที่มีรายได้น้อย ขอบารมีองค์เจ้าพ่อ-เจ้าแม่ปากน้ำโพจงดลบันดาลให้ครอบครัวของท่านประสบแต่ความสุข ความเจริญและขอให้กิจการงานของท่านเจริญรุ่งเรืองยิ่งๆขึ้นไป
เทศบาลตำบลวานรนิวาส จัดอบรมหมอหมู่บ้าน การรักษาเบื้องต้น และสามารถเป็นที่พึ่งพิงด้านสาธารณสุขของเพื่อนร่วมหมู่บ้าน
วันพุธที่ 14 สิงหาคม พ.ศ.2567 เวลา 09.00 น. เทศบาลตำบลวานรนิวาส จัดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ ภายใต้โครงการพระราชดำริด้านสาธารณสุข ประจำปีงบประมาณ พ.ศ. 2567 ให้กับผู้นำชุมชน ของชุมชนแหลมทองพัฒนา ณ ศาลาประชาคม หมู่ที่ 16 เพื่อให้ผู้เข้าร่วมอบรมมีความรู้ เกี่ยวกับการรักษาเบื้องต้น และสามารถเป็นที่พึ่งพิงด้านสาธารณสุขของเพื่อนร่วมหมู่บ้านได้
Pet Expo Championship 2024 วันที่ 15-18 สิงหาคม 2567
Pet Expo Championship 2024 วันที่ 15-18 สิงหาคม 2567 Hall 7-8 ศูนย์ประชุมศิริกิติ์ งานแสดงสินค้า บริการสำหรับสัตว์เลี้ยง และการแข่งขันสัตว์เลี้ยงประจำปี อาทิ Dog Agility, Skateboarding Dog, My Dog Anywhere, High Jump และ Fun Games ต่าง ๆ ให้ผู้ร่วมงานได้ร่วมสนุก พร้อมรับของรางวัล การประกวดสัตว์เลี้ยงประเภทต่าง ๆ ไม่ว่าจะเป็น น้องแมว น้องงู น้องเบียร์ดดราก้อน และอื่นๆ พร้อมช้อปสนุกไปกับสินค้าและบริการกว่า 300 บูธจากแบรนด์ชั้นนำ สาย Exotic Pet ก็ห้ามพลาดขนขบวนเหล่าสัตว์เลี้ยงพิเศษมาให้ได้สัมผัสกันแบบใกล้ชิด
Amazing Green Fest 2024 วันที่ 15-18 สิงหาคม 2567
Amazing Green Fest 2024 ในวันที่ 15 - 18 สิงหาคม 2567 เวลา 10.00 - 20.00 น. ณ พารากอน ฮอลล์ ชั้น 5 ศูนย์การค้าสยามพารากอน งาน Amazing Green Fest 2024 ไม่ใช่งานท่องเที่ยวธรรมดา แต่เป็นงานท่องเที่ยวยั่งยืนที่เราตั้งใจจัด เพื่อให้ทุกคนได้ตั้งใจเที่ยวแบบสบายกาย สบายใจ และสบายโลกอีกด้วย ตั้งใจให้อีเวนต์ในครั้งนี้ เป็น Carbon Neutral Event หรือ การจัดงานที่คาร์บอนเป็นศูนย์ ด้วยการควบคุมปริมาณการปล่อยก๊าซคาร์บอนไดออกไซด์ให้เหลือน้อยที่สุด
Medlab Asia and Asia Health 2023 - 16-18 สิงหาคม 2566
Medlab Asia & Asia Health 2023 – 16-18 สิงหาคม 2566 10.00-18.00 น. ณ ฮอลล์ 6-7 อิมแพ็ค เมืองทองธานี งานแสดงเครื่องมือแพทย์และประชุมวิชาการทางการแพทย์นานาชาติ รวบรวมผู้ประกอบการด้านเครื่องมือแพทย์และห้องปฏิบัติการทางการแพทย์จากกลุ่มประเทศอาเซียนเข้าด้วยกัน ผลักดันให้เกิดการทำธุรกิจและเรียนรู้ผ่านประชุมวิชาการที่มีคะแนนศึกษาต่อเนื่องของแพทย์ภายในงานเดียว
Thailand Wellness & Healthcare Expo 2024 วันที่ 16-18 สิงหาคม 2567
Thailand Wellness & Healthcare Expo 2024 วันที่ 16-18 สิงหาคม 2024 @ HALL 99 BITEC มหกรรมสินค้าและบริการด้านสุขภาพ ความงาม & นวัตกรรมการแพทย์ ครบวงจร สิ่งที่น่าสนใจในงาน ☑️ การลงทุนธุรกิจสุขภาพ ☑️ อัพเดทเทรนด์สุขภาพโลกยุคใหม่ ☑️ สินค้าและบริการเพื่อสุขภาพ เวชภัณฑ์ทางการแพทย์ อาหารเสริม ฯลฯ ☑️ โรงพยาบาล ศูนย์ดูแลผู้สูงวัย คลินิกความงาม เวชศาสตร์ชะลอวัย สปา ☑️ นวัตกรรมด้านการแพทย์ครบวงจร ☑️ เสวนาให้ความรู้โดยผู้เชี่ยวชาญด้านสุขภาพ ☑️สินเชื่อสำหรับผู้สนใจลงทุนด้านสุขภาพ
วิ่งกับผู้ว่าฯ บูชาพญาศรีสุทโธนาคราช 17 สิงหาคม 2567
วิ่งกับผู้ว่าฯ บูชาพญาศรีสุทโธนาคราช 17 สิงหาคม 2567 ณ อ่างเก็บน้ำธวัชชัย อ.ธวัชบุรี จังหวัดร้อยเอ็ด ประเภทการแข่งขัน Fun Run 5k Mini Marathon 10k สมัครออนไลน์ https://forms.gle/PNBTgYbUudHtoPnP8 หรือ สมัครด้วยตนเอง ณ ที่ทำการปกครองจังหวัดร้อยเอ็ด ชั้น 3 ศาลากลางจังหวัดร้อยเอ็ด
การแสดงดนตรีจิตอาสาเฉลิมพระเกียรติ 17 สิงหาคม 2567 วัดป่าเลไลยก์วรวิหาร จังหวัดสุพรรณบุรี
การแสดงดนตรีจิตอาสาเฉลิมพระเกียรติ โดยวงโยธวาทิตโรงเรียนกรรณสูตศึกษาลัย วันที่ 17 สิงหาคม 2567 ตั้งแต่เวลา 06:00 น. ณ ศูนย์อนุรักษ์พันธุ์กล้วย วัดป่าเลไลยก์วรวิหาร จังหวัดสุพรรณบุรี
เทศกาลกาแฟล้านนาตะวันออก สวรรค์ของเมืองกาแฟ Eastern Lanna Coffee Fest 2024 วันที่ 17-18 สิงหาคม 2567
เทศกาลกาแฟล้านนาตะวันออก สวรรค์ของเมืองกาแฟ Eastern Lanna Coffee Fest 2024 วันที่ 17-18 สิงหาคม 2567 ณ ลานกิจกรรมชั้น G ศูนย์การค้าเซ็นทรัลเชียงราย กิจกรรมภายในงาน ประกอบด้วย การออกบูธประชาสัมพันธ์ จัดแสดง และจำหน่ายผลิตภัณฑ์กาแฟคุณภาพของจังหวัดเชียงราย พะเยา แพร่ และน่าน และบูธของหน่วยงานที่เกี่ยวข้องกับการพัฒนากาแฟ รวม 30 บูธ การเจรจาธุรกิจ และมีกิจกรรม workshop สาธิตให้ความรู้ด้านกาแฟ การทำสครับกาแฟ เทคนิคการชงกาแฟให้ได้รสชาติที่ดี และชิมกาแฟคุณภาพจากเกษตรกรผู้ปลูกที่คัดสรรมาจาก 4 จังหวัด ที่จะสลับสับเปลี่ยนมาให้ผู้ร่วมงานได้ชิมรสชาติกันทุกวัน พร้อมกิจกรรมการแสดงดนตรี ศิลปวัฒนธรรม และการร่วมสนุกเล่นเกมส์รับของรางวัล
การจัดงานในครั้งนี้ จัดขึ้นตามนโยบายและทิศทางการพัฒนาของกลุ่มจังหวัดภาคเหนือตอนบน 2 (เชียงราย พะเยา แพร่ น่าน) ตามประเด็นการพัฒนา ส่งเสริมการผลิตและพัฒนานวัตกรรม เพื่อยกระดับสินค้าเกษตรเชิงสร้างสรรค์ ภายใต้แนวทางการพัฒนาที่ยั่งยืน โดยมีวัตถุประสงค์ เพื่อพัฒนาบรรจุภัณฑ์ สร้างตราสินค้ากาแฟ ตลอดจนประชาสัมพันธ์ และนำเสนอกาแฟคุณภาพของเกษตรกรที่ได้รับการพัฒนาต่อผู้บริโภค และเชื่อมโยงตลาดเมล็ดกาแฟคุณภาพ ซึ่งสำนักงานเกษตรและสหกรณ์จังหวัดเชียงราย ร่วมกับมหาวิทยาลัยแม่ฟ้าหลวง ร่วมกันดำเนินการยกระดับเกษตรกรผู้ปลูกกาแฟ จำนวน 27 ราย จาก 4 จังหวัด โดยการอบรมให้ความรู้ด้านการทดสอบรสชาติของกาแฟ หรือ cupping และประเมินคุณภาพเมล็ดกาแฟโดย Q grader ตามมาตรฐานการรับรองของสมาคมกาแฟพิเศษแห่งสหรัฐอเมริกา หรือ SCAA พร้อมทั้งให้เกษตรกรแบ่งผลผลิตมาผลิตเป็นกาแฟพิเศษ (Specialty Coffee) เพื่อสร้างมูลค่าเพิ่ม
18 สิงหาคม 65 นำชายวัย 50 ปี กล้ามเนื้อหัวใจขาดเลือดจาก รพ.ศรีสังวาลย์ มารักษาต่อที่ รพ.นครพิงค์
18 สิงหาคม 2565 เวลา 11.47 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชาย อายุ 50 ปี ผู้ป่วยมีอาการเจ็บอก เหงื่อออก ตัวเย็น วินิจฉัย กล้ามเนื้อหัวใจขาดเลือด (STEMI) เพื่อส่งผู้ป่วยจากโรงพยาบาลศรีสังวาลย์ จังหวัดแม่ฮ่องสอน ไป รักษาต่อที่ศูนย์โรคหัวใจ โรงพยาบาลนครพิงค์เชียงใหม่ จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองบินตำรวจ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ bell 112 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่
การลำเลียงผู้ป่วยลุล่วงไปด้วยดี
ขอขอบคุณ สำนักงบประมาณ กระทรวงสาธารณสุข รู้จริงสิทธิบัตรทอง สปสช. กทม. สถาบันการแพทย์ฉุกเฉินแห่งชาติ -สพฉ.1669 โรงพยาบาลศรีสังวาลย์ | Sri sang wan Hospital โรงพยาบาลนครพิงค์ โรงพยาบาลมหาราชนครเชียงใหม่ กองบินตำรวจ
Indochina Trail Running Series 2024 วันที่ 18 สิงหาคม 2567
ซีรีส์งานวิ่งที่ยิ่งใหญ่ที่สุดในกลุ่มภาคเหนือตอนล่างบนบรรยากาศเส้นทางระเบียงเศรษฐกิจ วันที่ 18 สิงหาคม 2567 ณ โรงเรียนบ้านตึก อ.ศรีสัชนาลัย จ.สุโขทัย ระยะที่รับสมัคร 21 KM /10 KM /5 KM
เกาะหมาก Sexy Run งานวิ่งบนเกาะเล็กๆ 19 - 20 สค.65
Sexy Run เกาะหมาก งานวิ่งบนเกาะเล็ก ๆ บรรยากาศแจ่ม ๆ ของจังหวัดตราด ระยะทาง 5 และ 10 กิโลเมตร ระหว่างวันที่ 19 - 20 สิงหาคม 2565 ณ เกาะหมาก จังหวัดตราด .สอบถามเพิ่มเติม 09-2979-8287
race.thai.run/sexyrunFamily 3S Plus “Smart Save and Share” ครอบครัวสร้างสรรค์ แบ่งปันสังคม 19-20 สิงหาคม 2566
Family 3S Plus “Smart Save and Share” ครอบครัวสร้างสรรค์ แบ่งปันสังคม ร่วมเป็นส่วนหนึ่งในการสร้างสรรค์สิ่งแวดลัอม ในวันที่ 19-20 สิงหาคม 2566
คุณสมบัติครอบครัวที่สนใจเข้าร่วมโครงการ
1.ผู้ปกครองอายุ ไม่เกิน 65 ปี
2.บุตร หลาน มีอายุตั้งแต่ 6 – 18 ปี
3.ไม่มีโรคติดต่อร้ายแรง
4.มีความพร้อม สามารถเข้าร่วมโครงการตั้งแต่ต้นจนจบโครงการ พร้อมทั้งปฏิบัติตามระเบียบโครงการและ ไม่เรียกร้องใดๆ ทั้งสิ้น
5.เป็นผู้รับวัคซีนป้องกันโรคโควิด – 19 จำนวน 2 เข็มขึ้นไป
6.จำกัดสมาชิกครอบครัว ไม่เกินครอบครัวละ 4 คน
ดาวน์โหลดใบสมัคร
เปิดรับสมัครตั้งแต่บัดนี้ ถึง วันที่ 30 เมษายน 2566
ประกาศผลครอบครัวที่ผ่านการคัดเลือก ภายในวันที่ 31 พฤษภาคม 2566
ติดตามรายละเอียดได้ที่ Facebook Page : อุทยานสิ่งแวดล้อมนานาชาติสิรินธร
Website : อุทยานสิ่งแวดล้อมนานาชาติสิรินธร
สอบถามรายละเอียดเพิ่มเติม โทรศัพท์ 032 508 352 ต่อ 501 , 503 กลุ่มนโยบายและแผนงาน
ททท.ตราด แจกแผนที่เที่ยวตราด 7 อำเภอ โหลดด่วน LINK
เส้นทางท่องเที่ยวจังหวัดตราด ที่สามารถเชื่อมโยงกันได้ทั้งจังหวัด ใน 7 อำเภอ 7 นิยามเมืองตราด
1. ชื่นใจในเมืองตราด
2.ตำนานแห่งเมืองอัญมณี
3.Unseen R10 Road of Paradise สุดทางอาคเนย์
4.สุดทางบูรพา
5.วิถี Slow Life @เกาะช้าง
6.นอนโฮมสเตย์กินปู ดูดาว สาวหมึก@เกาะหมาก
7.ตามรอยประวัติศาสตร์
งานประเพณีทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี 20 สิงหาคม - 2 กันยายน 2567 LINK
งานประเพณี ทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี ระหว่าง วันที่ 20 สิงหาคม ถึง 2 กันยายน 2567 ณ บริเวณศาลเจ้าพ่อหลักเมืองสุพรรณบุรี กำหนดพิธีการ
21 สิงหาคม 2567 เวลา 08.00 น ขบวนอัญเชิญเจ้าพ่อหลักเมืองสุพรรณบุรีให้ชาวสุพรรณสักการะ รอบตลาดในเมืองสุพรรณบุรี เวลา 19:00 น. ชมการแสดงมังกร ชมการแสดงสิงโต ถวายเจ้าพ่อหลักเมือง หน้าบริเวณงาน
22 สิงหาคม 2567 เวลา 18.00 น. พิธีลอยกระทงบริเวณแม่น้ำท่าจีน สี่แยกนางพิม
23 สิงหาคม 2567 เวลา 15.00 น. พิธีแจกทานข้าวสารกระจาดฟ้า
2 กันยายน 2567 เวลา 15.00 น. พิธีแจกทานข้าวสาร กระจาดดิน
ประจำเดือนสิงหาคม 2566
ประจำเดือนสิงหาคม 2566
• จำนวนประชากรในประเทศ 67.217 ล้านคน
• จำนวนประชากรที่มีสิทธิหลักประกันสุขภาพ 66.891 ล้านคน
• สิทธิหลักประกันสุขภาพแห่งชาติ (สิทธิบัตรทอง 30 บาท) 46.975 ล้านคน
• สิทธิประกันสังคม 12.848 ล้านคน
• สิทธิข้าราชการ/รัฐวิสาหกิจ 5.304 ล้านคน
• สิทธิพนักงานท้องถิ่น 0.681 ล้านคน
• สิทธิครูเอกชน 0.082 ล้านคน
ข้อมูลวันที่ : 20 กันยายน 2566
Recovery Festival@ปราจีนบุรี 23-24 ก.ค.65 ESC Base Camp Prachinburi LINK
สายเฮ้ลตี้ต้องห้ามพลาดกับงาน Recovery Festival
มาปลดปล่อยพลังงาน ออกกำลังกายและฝึกโยคะกับครูระดับโปรเฟสชันแนล ยังไม่พอยังมีโซนบำบัดจิตใจ ทำสมาธิละลายพฤติกรรมเพื่อช่วยรีเฟรชชีวิต กับเวิร์คช็อปที่จะนำทุกคนเข้าถึงสมาธิและความผ่อนคลายขั้นสุดหรือจะมา ช็อปปิ้ง นั่งชิวๆกินอาหารจากร้านชื่อดังและสินค้าสุขภาพในจังหวัดปราจีนบุรี มางานนี้รับรองได้พลังชีวิตและพลังสมาธิกลับบ้านแบบเต็มๆ
ESC Base Camp Prachinburi
เสาร์ที่ 23-24 ก.ค. 2565
21 ส.ค. - 1 ก.ย. 66 @เขตมีนบุรี ฉีดวัคซีนสุนัขบ้าหน่วยเคลื่อนที่ ใน กทม. LINK
ประชาสัมพันธ์ หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 21 สิงหาคม - 1 กันยายน 2566
ผู้ที่จะมารับบริการ โปรดนำบัตรประชาชนมาด้วย และสัตว์เลี้ยงที่มาฉีดวัคซีนป้องกันพิษสุนัขบ้าต้องมีอายุ 3 เดือนขึ้นไป ไม่มีอาการป่วย และไม่ท้อง
หมายเหตุ: สามารถรับบริการได้ทุกคน โดยไม่จำเป็นว่าต้องอยู่ในชุมชนที่เเจ้งนะคะ สามารถเข้ารับบริการตามสถานที่ที่สะดวกได้เลย
FHT : Food & Hospitality Thailand 21-24 August 2024
21-24 August 2024. at Bangkok - Queen Sirikit National Convention Center, Bangkok, Thailand
FHT is an integrated trade platform that caters to all companies in the Food & Hospitality industry. These features will provide businesses with innovative solutions and strong network to help them overcome the challenges of changing demands.
Hotel & Shop Plus is a company that has been dedicated to the hospitality and commercial spaces for over 30 years. The platform is a unique trade platform that caters to investors, developers, hoteliers and operators in the hospitality and commercial space markets in China and Asia. The annual mega-event brings together leading suppliers from a variety of industries, including Bathroom & Swimming Pool & Saunas, Wall & Floor Coverings and Outdoor Design. Also included are Interior Design, Smart Hotel, Decorative Lighting Systems, Intelligent Control Systems as well as Room Amenities.
Coffee & Bakery Thailand is a part Food & Hospitality Thailand and offers a platform for businesses in the coffee and bakery industries to find solutions that will help them stand out on this exciting market. Meet the largest line-ups of coffee and tea, breads, cakes, pastries, and confectionery suppliers. This premium platform, with its connection to professionals and showcase of new products, will help expand the industry and make it more flavorful.
Food & Hospitality Thailand 21-24 สิงหาคม 2567
Food & Hospitality Thailand (FHT) 2024 วันที่ 21 - 24 สิงหาคม 2567 ฮอลล์ 1-4 ชั้น G ศูนย์ฯสิริกิติ์ กรุงเทพฯ 10.00-18.00 น. โอกาสใหม่ๆให้กับธุรกิจงานแสดงสินค้าที่มีตั้งแต่วัตถุดิบ อุปกรณ์ นวัตกรรม เทคโนโลยี และโซลูชั่นที่ครอบคลุมทุกภาคส่วนของอุตสาหกรรมโรงแรม ร้านอาหาร บาร์ ร้านกาแฟ และธุรกิจบริการ งานที่จะช่วยเพิ่มโอกาสให้คุณได้พบพาร์ทเนอร์คนสำคัญ และเจรจาธุรกิจเพื่อต่อยอดการเติบโตให้ธุรกิจของคุณ
22 สิงหาคม ฮ.EC 725 บินรับผู้ป่วยหญิงไทย 91 ปี Stroke Fast track จากระนองส่งรพ.ตรัง
22 สิงหาคม 2566 เวลา 14.10 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดระนอง ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงไทย อายุ 91 ปี มีอาการ ปากด้านซ้ายเบี้ยว แขนซ้าย ไม่มีแรง พูดไม่รู้เรื่อง ตามองไปด้านขวา วินิจฉัย ภาวะโรคหลอดเลือดสมองเฉียบพลัน (Stroke Fast track) เพื่อส่งผู้ป่วยจากโรงพยาบาลระนอง ตำบลเขานิเวศน์ อำเภอเมือง จังหวัดระนอง ไปโรงพยาบาลตรัง ตำบลทับเที่ยง อำเภอเมือง จังหวัดตรัง ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพอากาศ ขอสนับสนุนอากาศยาน และนักบิน ประเภทอากาศยานเฮลิคอปเตอร์ EC 725 ชุดปฏิบัติการลำเลียงทางอากาศจาก โรงพยาบาลกองบิน7
CANNABIS Conference August 23-25, 2022 LINK
CANNABIS Conference August 23-25, 2022 PARIS LAS VEGAS HOTEL & CASINO งานนี้เน้นไปทางกลุ่มเพาะปลูก ผู้ประกอบการ ผู้จำหน่ายรายย่อยที่มีหน้าร้านของตนเอง แบบ Dispensary ขาย-จ่ายยาตามใบสั่งแพทย์ได้ เป็นอีกงานที่เน้นวิชาการเข้มข้น
23-24 ก.ย.66 Muser 100 อัลตร้าเทรลดอยมูเซอ LINK
MUSER100 @Tak Thailand 20k, 40k, 65k, 100k เปิดรับสมัคร นักวิ่งใหม่กับราคา EARLY BIRD จะเปิดรรับสมัครพร้อมกับนักวิ่งเก่าในจำนวนจำกัด ซึ่งแต่ละระยะจะอ้างอิงกับจำนวนนักวิ่งแต่ละระยะที่จะเปิดรับ ดูข้อมูลเพิ่มเติมที่เพจ
Coffee & Bakery Thailand 23-26 August 2023
Held concurrently with FHT, Coffee & Bakery Thailand (CBT) is a stage for coffee and bakery businesses to discover solutions to make distinctive points in this exciting market. It is where decision makers can meet the most extensive line-up of leading coffee & tea, bread, cakes, pastries and confectionery suppliers. With its showcase of fresh new products and connection with professionals, this premium platform will help expand the coffee and bakery industry and make this fascinating business more flavorful than ever.
Coffee & Bakery Thailand 23-26 August 2023 at Queen Sirikit National Convention Center (QSNCC)
สงขลามาราธอน 2024 วันที่ 24-25 สิงหาคม 2024 LINK
สงขลามาราธอน 2024 (SONGKHLA INTERNATIONAL MARATHON 2024) วันที่ 24 -25 สิงหาคม 2567 สถานที่: สวนสาธารณะสงขลา จังหวัดสงขลา ระยะวิ่ง 42 km / 21 km / 10 km / 5km
*สำหรับปีนี้ ทุกระยะการแข่งขัน ใช้ระบบ CHIP TIME ในการตัดสิน นะคะ เพื่อความถูกต้องและเป็นมาตรฐาน
เทศบาลตำบลเวียงฝาง อ.ฝาง จ.เชียงใหม่ อบรมหมอหมู่บ้าน การใช้ผ้าขาวม้าเพื่อการดูแลสุขภาพ
วันที่ 24 สิงหาคม 2567 เวลา 08.30 น. นายฐานิศร์ กมลรัตนา นายกเทศมนตรีตำบลเวียงฝาง เป็นประธานในพิธีเปิด "โครงการอบรมหมอหมู่บ้าน (ภายใต้โครงการพระราชดำริด้านสาธารณสุข)" ประจำปีงบประมาณ พ.ศ. 2567 จัดโดยกองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลเวียงฝาง อ.ฝาง จ.เชียงใหม่ ภายใต้สโลแกน "หมอที่ดีที่สุดคือตัวเราเอง" โดยเชิญวิทยากรจากกลุ่มภูมิปัญญาแพทย์แผนไทยตำบลต้นเปา อำเภอสันกำแพง จังหวัดเชียงใหม่ มาบรรยายให้ความรู้เกี่ยวกับการออกกำลังกาย ได้แก่ การยืดเหยียด คลายกล้ามเนื้อด้วยผ้าขาวม้า และการทำลูกประคบ กดจุดรักษาโรคด้วยผ้าขาวม้า ซึ่งได้รับความสนใจจากคณะผู้บริหารเทศบาล สมาชิกสภาเทศบาล หัวหน้าส่วนราชการ พนักงานเจ้าหน้าที่เทศบาล และพี่น้องประชาชนในเขตเทศบาลฯ เข้าร่วมโครงการดังกล่าวเป็นจำนวนมาก ณ ห้องประชุมสภาเทศบาลตำบลเวียงฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่
THE FOODISM SHOW 25 - 28 สิงหาคม 2022
THE FOODISM SHOW - ALL ABOUT DIET & HEALTHY EATING 25 - 28 สิงหาคม 2022 Hall 7
สายเฮ้ลท์ตี้เตรียมตัวพบกับงานรวมพลสุดยิ่งใหญ่ของคนใส่ใจรูปร่างและรักสุขภาพ รวบรวมอาหารและวัตถุดิบเพื่อคนรักสุขภาพและควบคุมน้ำหนักโดยเฉพาะ! ตื่นตากับร้านอาหารสุขภาพเด็ดๆ ร้านอาหารทางเลือกร้านดัง ผู้ผลิตวัตถุดิบอาหารคุณภาพ ไม่ว่าจะอาหารคลีน คีโต วีแกน โลว์คาร์บ หรือสายไหนๆ เราเอาทุกอย่างมาไว้ให้ในที่เดียวกว่า 150 บริษัทและร้านค้า! และรวบรวมผู้เข้าชมงานกว่า 15,000 คน ตลอดทั้ง 4 วัน!!!
25 สิงหาคม 2567 กิจกรรม "เด็กใต้ หัวใจป๋า" ณ สวนประวัติศาสตร์ พลเอกเปรม ติณสูลานนท์ จังหวัดสงขลา
กำหนดการ
๐๗.๐๐ – ๐๙.๐๐ น. พิธีบวงสรวง สมโภชองค์หลวงปู่ทวดครบรอบ ๙ ปี และพิธีตักบาตร
๐๙.๐๐ – ๑๒.๐๐ น. ประกวดเต้น cover เพลง “เด็กใต้ หัวใจป๋า”
๑๒.๐๐ – ๑๕.๐๐ น. ประกวดร้องเพลงลูกกรุง รอบคัดเลือก
๑๔.๐๐ – (๒๐.๐๐ น.) การแข่งขันกีฬาเอ็กซ์ตรีม “เอ็กซ์ตรีม หัวใจป๋า”
• จักรยานบาร์ลานไบค์ (ขาไถ)
• โรลเลอร์สเก็ต
• เซิร์ฟสเก็ต
๑๕.๐๐ – ๑๗.๐๐ น. ประกวดร้องเพลงลูกกรุง รอบชิงชนะเลิศ
๑๗.๐๐ – ๑๘.๐๐ น. วิ่ง-เดิน ฟันรัน เส้นทางรอบสวนประวัติศาสตร์
พลเอกเปรม ติณสูลานนท์
• ถ่ายภาพ เช็คอิน ภายในเส้นทาง
๑๘.๐๐ – ๑๘.๓๐ น. ประกวดนักวิ่ง-เดิน แฟนซี “เด็กใต้ หัวใจป๋า”
นำเสนอรูปแบบแฟนซี และมอบรางวัลจับรางวัลผู้ร่วมวิ่ง-เดิน ฟันรัน
๑๘.๓๐ – ๒๐.๐๐ น. มินิคอนเสิร์ต ร่วมกับ THE HUMBLE Band จากโรงเรียนมหาวชิราวุธ จังหวัดสงขลา
๒๐.๐๐ – ๒๐.๓๐ น. ประกาศรางวัล และมอบรางวัล
• ประกวดร้องเพลงลูกกรุง ถ้วยประทานรางวัลจากพระเจ้าวรวงศ์เธอ พระองค์เจ้าอทิตยาทรกิติคุณ
• ประกวดเต้น cover เพลง “เด็กใต้ หัวใจป๋า”
• การแข่งขันกีฬาเอ็กซ์ตรีม “เอ็กซ์ตรีม หัวใจป๋า”
๒๐.๓๐ – ๒๑.๓๐ น. การแสดงพลุดอกไม้ไฟเชิดชูเกียรติ
พลเอกเปรม ติณสูลานนท์ โดย “ทีมงานศุภักษร”
เชิญร่วมกิจกรรมบริเวณงาน บูธอาหารอร่อย
และจำหน่ายเสื้อวิ่ง-เดิ่น ของที่ระลึก
รายได้ช่วยเหลือผู้ป่วยเด็กโรคหัวใจ
โรงพยาบาลสงขลานครินทร์
พระนครรัน ๒ งานวิ่งแห่งเมืองพระนคร 25 สิงหาคม 2567 LINK
พระนครรัน ๒ งานวิ่งแห่งเมืองพระนคร บนเส้นทางผ่านจุดเช็คอินที่ทุกท่านไม่ควรพลาด เปิดลงทะเบียนแล้วตั้งแต่วันนี้เป็นต้นไป วันที่จัดงาน 25 สิงหาคม 2567 ณ สนามหลวง ประเภทการแข่งขัน 3 / 5.6 / 11.6 กม. ดูรายละเอียดเพิ่มเติมและสมัครเข้าร่วมกิจกรรมได้ที่ fanaticrun.com/activity/phranakhon-run-2024
D RUN FOR LIFE 2024 แก่งกระจาน 25 สิงหาคม 2567 LINK
D RUN FOR LIFE 2024 แก่งกระจาน อาทิตย์ ที่ 25 สิงหาคม 2567 ณ อุทยานแห่งชาติแก่งกระจาน จ.เพชรบุรี [ ลานกางเต็นท์โซนริมน้ำ ] ระยะทาง Mini Marathon 10 Km / Fun Run 5 Km / เดินเพื่อการกุศล 2 Km
D RUN FOR LIFE 2024 แก่งกระจาน เป็น 1 ใน 4 รายการ มรดกโลกซีรีส์รัน "World Heritage Series Run 2024" 4 สนาม ได้แก่ อุทยานแห่งชาติเขาใหญ่-ดงพญาเย็น จ.นครราชสีมา อุทยานแห่งชาติแก่งกระจาน จ.เพชรบุรี อุทยานประวัติศาสตร์พระนครศรีอยุธยา จ.พระนครศรีอยุธยา อุทยานประวัติศาสตร์ศรีเทพ จ.เพชรบูรณ์
LANNA HALF MARATHON 2024 เชียงใหม่ 25 สิงหาคม 2567 LINK
เชียงใหม่พร้อมแล้วจ้าว LANNA HALF MARATHON 2024 วันที่ 25 สิงหาคม 2567 เตรียมสัมผัสเส้นทางวิ่งใหม่! วิ่งไปพร้อมชื่นชมทิวทัศน์พันธุ์ไม้และสถาปัตยกรรม ณ อุทยานหลวงราชพฤกษ์ ในปีนี้ ! ใครที่สมัครสนามสมุยไม่ทันห้ามพลาด พบความพิเศษมากมายอัดแน่นเต็มพิกัด! ร่วมวิ่งไปกับคุณบอย ปกรณ์และน้องวันใหม่ เสื้อวิ่งผลงานออกแบบโดย Asava แบรนด์แฟชั่นชั้นนำ กองทัพช่างภาพ พร้อมดาวน์โหลดรูปฟรี! Kids series เส้นทางวิ่งเฉพาะของน้องๆ ปล่อยพลังกันเต็มที่ FLY to RUNโปรโมชั่นสุดพิเศษ วิ่งฟรี! เมื่อบินกับบางกอกแอร์เวย์ส ของรางวัลมากมายจากสปอนเซอร์! รับจำนวนจำกัด!
Lets Swing Dance! 25 สิงหาคม 2567
Lets Swing Dance! ขอเชิญทุกท่านไปออกสเต็ปกันในสถานีรถไฟสุดวินเทจที่งาน Step into Swing : Take A Train at Hua Lamphong ในวันอาทิตย์ที่ 25 สิงหาคม 2567 เวลา 16:00 - 19:00 น. งานนี้ Jelly Roll Jazz Club เค้าเสกให้หัวลำโพงกลายเป็นฟลอร์เต้นสวิงกันแบบยิ่งใหญ่ เต้นไม่เป็นก็มาได้นะ!
พิเศษกว่าครั้งไหนๆ เพราะเรามีวงดนตรีแจ๊สชั้นนำถึง 3 วง จาก 3 ประเทศมาร่วมสนุกด้วย
สนุกไปกับการแข่งขัน Battle รอบชิงชนะเลิศระหว่างนักเต้นนานาชาติ และยังมีกิจกรรมอีกเพียบ
งานนี้เข้าร่วมฟรี ใครเต้นไม่เป็นก็เข้าร่วมได้ มีสอนเต้นพื้นฐานฟรี เวลา 17:00 น. จากคุณครู Jelly Roll Jazz Club อยากลองประสบการณ์พิเศษไม่เหมือนใคร แค่ได้แต่งตัวแนววินเทจก็สนุกแล้ว ชวนเพื่อนไปงานนี้กัน!
26 สิงหาคม 2567 เปิดงานกิจกรรมพิเศษเรื่องเล่าจากแพทย์ LINK
26 สิงหาคม 2567 นายแพทย์นล จันทนภาพ รองผู้อำนวยการฝ่ายบริหารทรัพย์สินและกิจการพิเศษ ได้เป็นประธานเปิดงานกิจกรรมพิเศษเรื่องเล่าจากแพทย์ ตอน "โรคอัลไซเมอร์ และโรคทางตาในผู้สูงอายุ" ซึ่งภายในงานจะมีการบรรยายโดยนักวิชาการ แพทย์ นักจิตเวช และผู้เชี่ยวชาญ ที่มาให้ความรู้เกี่ยวกับโรคอัลไซเมอร์ และโรคทางตา นอกจากนั้นยังมีการออกร้านจำหน่ายสินค้าให้ได้เดินเล่นผ่อนคลายและจับจ่ายซื้อสินค้าด้วย
27 สิงหาคม 2567 ดูแลผู้ป่วยอัลไซเมอร์ … ถ้าเครียดต้องทำอย่างไร LINK
27 สิงหาคม 2567 อาจารย์มโนรถ กุศลศักดิ์ นักจิตวิทยาให้การปรึกษา ได้มาขึ้นเวทีงานเรื่องเล่าจากแพทย์ ของศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน หัวข้อ “ดูแลผู้ป่วยอัลไซเมอร์ … ถ้าเครียดต้องทำอย่างไร” บอกเล่าการผ่อนคลายความเครียด ปรับอารมณ์ให้เย็น และมีความสุข เพราะจิตใจและความคิดมีผลต่อสุขภาพร่างกาย ดังนั้นคิดเครียดกายเครียดไปด้วย จึงควรฝึกคิดปัจจุบันให้สบายๆ ผ่อนคลาย ลดกังวล เพื่อร่างกายจะได้มีความสุขตามไปด้วย
Thailand Coffee Hub 2024 @เซ็นทรัลหาดใหญ่ 28 ส.ค. - 1 ก.ย. 2567
THAILAND COFFEE HUB 2024 หาดใหญ่ กลับมาแล้ว!! เทศกาลกาแฟที่ใหญ่ที่สุดในภาคใต้ 28 สิงหาคม – 1 กันยายน 2567 ชั้น 1 เซ็นทรัล หาดใหญ่ Hubคนรักกาแฟภาคใต้ กับกิจกรรมเพียบดังนี้
• รวมแบรนด์กาแฟพิเศษชื่อดังจากทั่วไทย มากที่สุดในภาคใต้
• SIP Thai & SIP Talk by SCATH ร่วมเปิดประสบการณ์กาแฟพิเศษระดับเวทีประกวดไปกับสมาคมกาแฟพิเศษไทย
• SIP Inter ชวนเปิดประสบการณ์กาแฟใหม่ๆ จากบาริสต้าต่างประเทศ
• Fine Robusta Omakase สัมผัสรสชาติกาแฟ Fine Robusta รูปแบบใหม่ เสิร์ฟเป็นคอร์สแบบโอมากาเสะจากบาริสต้าชื่อดัง
• Coffee Idols กระทบไหล่คนดังวงการกาแฟพิเศษ ตลอดงาน
• รวมคราฟต์โกโก้จากแหล่งปลูกทั่วไทย การันตีด้วยรางวัลช็อกโกแลตระดับโลก
• ชวนเปิดโลก Specialty Matcha ชาเขียวสุดพรีเมียม หลากหลายเมนู
• ร่วมเชียร์การแข่งขันชงกาแฟระดับประเทศ 3 รายการสุดมันส์
28 สิงหาคม 2567 วิธีป้องกันไม่ให้ตกเป็นเหยื่อแก๊งค์มิจฉาชีพ LINK
28 สิงหาคม 2567 พ.ต.ต.อัศวิน สุภิษะ สวป.(ชส.)สภ.ปากเกร็ด มาขึ้นเวทีงานเรื่องเล่าจากแพทย์ ที่ศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน บรรยายเรื่อง วิธีป้องกันไม่ให้ตกเป็นเหยื่อแก๊งค์มิจฉาชีพ โดยท่านสารวัตรให้ข้อมูลว่ามิจฉาชีพเหล่านี้มีนายทุนหนุนหลังพร้อมด้วยงบประมาณและเทคโนโลยีในการล้วงข้อมูลส่วนบุคคล ทั้งผ่านระบบการสื่อสารดาวเทียม แฮกเกอร์ และคอลเซ็นเตอร์ ดังนั้นให้ประชาชนคอยดูข่าวสารและรู้เท่าทัน หากพบเจอการสื่อสารในลักษณะแปลกๆ เช่น โทรมาให้โหลดแอพพลิเคชั่น หรือโทรมาขอความช่วยเหลือ , ข่มขู่ , แจ้งเรื่องให้กังวล , อ้างตัวเป็นเจ้าหน้าที่หน่วยงานราชการหรือธนาคาร ให้รีบวางสายหยุดการสนทนาทันที
29 สิงหาคม 2567 เรื่องโรคทางตาในผู้สูงอายุ LINK
29 สิงหาคม 2567 นายแพทย์ธนภัทร รักพานิชมณี และ แพทย์หญิงวรรณิศา ศุภเจียรพันธ์ อาจารย์แพทย์สาขาวิชาจักษุวิทยา ศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน ขึ้นเวทีงานเรื่องเล่าจากแพทย์ให้ความรู้เกี่ยวกับโรคทางตาในผู้สูงอายุ ทั้งโรคต้อประเภทต่าง ๆ , อาการตาแห้ง , ภาวะเบาหวานขึ้นตา โดยจักษุแพทย์แนะนำว่าเมื่ออายุมากขึ้นจะมีโรคทางตาเกิดขึ้นได้ตามวัย ดังนั้นผู้ที่อายุ 45 ปีขึ้นไป ควรมาพบแพทย์เพื่อตรวจสุขภาพดวงตา และหมั่นสังเกตุการมองเห็นด้วยการทดสอบปิดตาข้างใดข้างหนึ่งเพื่อทดสอบการมองเห็น หากมีอาการตาพร่ามัว หรือเห็นแสงคล้ายๆ แสงฟ้าผ่า หรือจุดดำๆ ลอยไปลอยมา ให้มาพบแพทย์เพื่อตรวจเช็คสุขภาพดวงตา
มินิอีเว้นท์ "Open House กิจกรรมเปิดบ้าน ดื่มกาแฟในสวน" ขุขันธ์ ศรีสะเกษ 30-31 สิงหาคม 2567
มินิอีเว้นท์ "Open House กิจกรรมเปิดบ้าน ดื่มกาแฟในสวน" เปลี่ยนบ้านให้เป็นร้านกาแฟแบบเฉพาะกิจ 2 วัน เพื่อชาวขุขันธ์ ศรีสะเกษที่น่ารัก วันที่ 30-31 สิงหาคม 2567 เวลา 10:00 - 17:00 น.
InterCare Asia 2023 @QSNCC, Thailand
วันที่ 31 สิงหาคม - 2 กันยายน 2566 ณ ฮอลล์ 5 ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์ งานแสดงสินค้าและบริการ เพื่อสุขภาพและคุณภาพชีวิตอิสระที่ดีกว่า งานแสดงสินค้าและนวัตกรรมเพื่อสุขภาพและความเป็นอยู่ สำหรับทุกวัยครบวงจร พบกับการรวมตัวของผู้ประกอบการชั้นนำกว่า 150 บริษัท จากธุรกิจอาหาร เครื่องดื่ม เครื่องสำอาง อุปกรณ์สำหรับผู้สูงอายุ สถานบริการ คลินิกสุขภาพ บริการท่องเที่ยว สินค้าแฟชั่น ฯลฯ ที่พร้อมนำเสนอผลิตภัณฑ์และบริการในการเตรียมความพร้อม เพื่อคุณภาพชีวิตที่ดีกว่าสำหรับทุกวัย พร้อมกิจกรรมพิเศษ ตลอดทั้ง 3 วันของการจัดงาน เปิดประสบการณ์ประทับใจที่สุดสำหรับผู้สูงอายุโดยเฉพาะ
งานประเพณีทิ้งกระจาด วัดพนัญเชิงวรวิหาร ประจำปี 2567 วันที่ 31 สิงหาคม - 2 กันยายน LINK
วัดพนัญเชิงวรวิหาร แจ้งกำหนดงานประเพณีทิ้งกระจาด ประจำปี 2567 ระหว่าง วันที่ 31 สิงหาคม - 2 กันยายน 2567 ผู้ที่ประสงค์จะบริจาคข้าวสารอาหารแห้งเพื่อแจกทานและมอบเข้าโครงการอาหารกลางวันสำหรับนักเรียน สามารถสนับสนุนร่วมทำบุญหรือร่วมแจกของและแจกทานได้ที่ กองอำนวยการ วัดพนัญเชิงฯ ( วัดพนัญเชิงวรวิหาร ไม่มีการเรี่ยไรนอกสถานที่ ) ร่วมบุญออนไลน์ กับทางวัดได้ที่ : ธนาคารกรุงไทย (ใบอนุโมทนาวัดพนัญเชิงฯ) :เลขบัญชี 1010716603
ลุ้นผลตรวจโควิด! อธิบดี-ผู้บริหาร สธ. ลงพื้นที่สมุทรสาคร หลังผู้ว่าฯติดเชื้อ LINK
ปลัด สธ.เผยขณะนี้สบายดี จัดอยู่ในกลุ่มเสี่ยงต่ำ ล่าสุดตรวจหาเชื้อกลุ่มใกล้ชิดผุ้ว่าฯ ทั้งภรรยาและเลขานุการหน้าห้องไม่พบเชื้อ ย้ำไม่อยากให้เกิดดราม่า เพราะคนลงพื้นที่ตั้งใจไปทำงานเพื่อบ้านเมืองทุกคน
หลังจากนายอนุทิน ชาญวีรกูล รองนายกฯและรัฐมนตรีว่าการกระทรวงสาธารณสุข(สธ.) ประกาศกักตัวเอง 14 วันและผลตรวจเชื้อครั้งแรกไม่พบโควิด-19 ภายหลังที่นายวีระศักดิ์ วิจิตร์แสงศรี ผู้ว่าราชการจังหวัดสมุทรสาคร ติดเชื้อ ขณะที่ผู้บริหารท่านอื่นๆ รวมทั้งนพ.เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข ได้ตรวจเชื้อเช่นกันและขณะนี้เฝ้าระวังสังเกตอาการ โดยผลตรวจเชื้อของทีมผู้บริหารสธ.จะออกภายในวันนี้
ล่าสุดเมื่อวันที่ 28 ธ.ค. นพ.เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข กล่าวถึงกรณีนี้ ว่า ขณะนี้ตนสบายดี จากการตรวจของกรมควบคุมโรค ตนอยู่ในกลุ่มเสี่ยงต่ำ ขณะนี้ไม่อยากให้เกิดประเด็นดราม่า ทุกคนที่ไปร่วมงานตั้งใจทำงานเพื่อบ้านเมือง ไม่มีใครอยากให้เหตุการณ์แบบนี้เกิดขึ้น ทั้งนี้ จากการตรวจหาเชื้อในบุคคลใกล้ชิดผู้ว่าฯ จ.สมุทรสาคร ทั้งภรรยาและเลขานุการหน้าห้องที่มีความใกล้ชิดมาก ก็ยังไม่มีใครติดเชื้อจากผู้ว่าฯ
นพ.เกียรติภูมิ กล่าวว่า สำหรับการทำงานของตนจากนี้ปฎิบัติตามคำแนะนำของกรมควบคุมโรค กลุ่มเสี่ยงต่ำไม่ต้องกักตัว แต่ต้องเฝ้าระวังตนเองสังเกตอาการมีการวัดไข้ทุกวัน ลดการพบปะกับผู้อื่น ซึ่งสำหรับการทำงานของกระทรวงสาธารณสุข จากนี้ตนยังคงทำงานตามปกติแต่จะใช้ระบบการประชุมแบบวีดีโอคอนเฟอเรนซ์แทนเพื่อลดการพบปะกับผู้อื่น
ผู้สื่อข่าวรายงานว่า สำหรับผลตรวจเชื้อโควิดของทีมผู้บริหาร อธิบดีที่ลงพื้นที่จ.สมุทรสาครร่วมงานการรับประทานอาหารทะเล ปลอดภัยแต่ต้องปรุงสุก ที่จ.สมุทรสาครเมื่อวันที่ 27 ธ.ค.ที่ผ่านมา อยุ่ระหว่างรอผลตรวจเชื้อ คาดว่าจะทราบผลภายในวันนี้(28 ธ.ค.)
ธนาคารเลือด รพ.แม่สอด LINK
ธนาคารเลือด โรงพยาบาลแม่สอด
รับบริจาคเลือดทุกวัน ไม่เว้นวันหยุดราชการและวันนักขัตฤกษ์
เปิดเวลา 08.30-15.30 น. พักเวลา 12.00-13.00น.
โทร 055-542337 ต่อ 1532
ภาคบริการโลหิตแห่งชาติที่ 10 จ.เชียงใหม่ (ข้างโรงเรียนยุพราช) LINK
ภาคบริการโลหิตแห่งชาติที่ 10 จ.เชียงใหม่ (ข้างโรงเรียนยุพราช)
เวลาให้บริการ
- วันจันทร์ / ศุกร์ เวลา 08.30-16.30 น.
- วันอังคาร / พฤหัสบดี เวลา 08.30-19.30 น.
- วันเสาร์ / อาทิตย์ และวันหยุดนักขัตฤกษ์ เวลา 08.30 - 15.30น.
หน่วยรับบริจาคโลหิตอาจมีการเปลี่ยนแปลงสามารถสอบถามเพิ่มเติมได้ที่
เบอร์โทรศัพท์ 053-418389 ต่อ 17 (นอกเวลาราชการต่อ 11)
ตารางหน่วยรับบริจาคเคลื่อนที่ มกราคม 2564
กัญซ่าส์ คราฟต์โซดาจากใบกัญชา พระเอกของงานนี้
กัญซ่าส์ คราฟต์โซดา กับขวดและกราฟฟิคสไตล์คลาสสิกวินเทจบ้านทุ่ง มีเอกลักษณ์มากๆ แถมนิด ถ้าไปญี่ปุ่นเราจะพบเครื่องดื่มสไตล์นี้ในแทบทุกๆเมือง เพราะบ้านเค้านิยมทำกันมาก หวังว่าบ้านเรา จะมีมากมายให้ลองชิมเช่นกัน
รวมข่าวสถานการณ์โควิด 18 เมษายน 64
[12 ธันวาคม 64] รพ.ชลบุรี ให้บริการตรวจหาเชื้อ Covid-19 แบบ RT-PCR และ ATK LINK
1. ตรวจแบบ RT-PCR ค่าบริการ 2,450 บาท
เอกสารที่จะได้รับ ดังนี้ ใบรับรองแพทย์ และใบผลการตรวจ
**รับผลวันทำการถัดไป เวลา 10.00 น.
2. ตรวจแบบ ATK ค่าบริการ 600 บาท
เอกสารที่จะได้รับ ดังนี้ ใบรับรองแพทย์ ใบผลการตรวจ
**รอผลตรวจภายใน 1 ชม.-1 ชม. 30 นาที
เปิดให้บริการ วันจันทร์-ศุกร์ (ยกเว้นวันหยุดราชการ)
เวลา 8.00 น. -11.00 น.
ณ ศูนย์อาชีวเวชศาสตร์ อาคารอำนวยการ ชั้น1 (ข้างเซเว่น)
สอบถามเพิ่มเติม โทร 038-931564 038-931589
สปสช ให้ผู้ติดเชื้อโควิด ลงชื่อเพื่อเข้าระบบกักตัวที่บ้าน และรับการดูแลติดตามพร้อมอาหาร LINK
สปสช (บัตรทอง) ประกาศว่า ผู้ติดเชื้อโควิด-19 ท่านใดที่เข้าระบบดูแลที่บ้าน (Home Isolation) แล้ว แต่ยังไม่ได้รับการติดต่อ หรือผู้ติดเชื้อโควิด-19 รายใหม่ที่ต้องการเข้าระบบการดูแลที่บ้าน
เพื่อให้ได้รับการดูแลและจัดสรรสิ่งจำเป็นในการดูแลตนเองระหว่างกักตัวที่บ้าน โดย ท่านจะได้รับ
1. ประเมินอาการด้วยวิดิโอคอลวันละ 2 ครั้ง
2. อาหาร 3 มื้อ
3. ส่งปรอทวัดไข้แบบดิจิตอลและเครื่องวัดออกซิเจนปลายนิ้วให้
4. ยาฟ้าทะลายโจรและยาพื้นฐานอื่นๆ
5. ประสานส่งต่อรักษาหากอาการแย่ลง พร้อมยาฟาวิพิราเวียร์ประคองอาการก่อน
โรงพยาบาลตำรวจ เปิดลงทะเบียน ตั้งแต่วันอังคารที่ 24 สิงหาคม พ.ศ. 2564 LINK
โรงพยาบาลตำรวจ เปิดลงทะเบียนฉีดวัคซีนโควิด-19 (เข็มที่ 1 เท่านั้น) สำหรับประชาชน และบุคคลทั่วไป
เริ่มลงทะเบียน ได้ตั้งแต่วันอังคารที่ 24 สิงหาคม พ.ศ. 2564 เริ่มตั้งแต่เวลา 08.00 น. เป็นต้นไป
ผู้รับบริการสามารถลงทะเบียนสเเกน QR Code หรือ ลิงก์
docs.google.com/form
ข้อกำหนดและเงื่อนไข
1.เป็นประชาชนถือสัญชาติไทย อายุตั้งแต่ 18 ปีบริบูรณ์ขึ้นไป
2.เป็นผู้ที่ลงทะเบียนและได้รับการยืนยันการนัดหมายเข้ารับบริการวัคซีนผ่านเว็ปไซด์โรงพยาบาลตำรวจ
3.ไม่รับบริการฉีดวัคซีนผู้ที่ไม่ได้ลงทะเบียนล่วงหน้าหรือแบบ Walk-in
4.วัคซีนที่ให้บริการฉีด ณ หน่วยความร่วมมือบริการฉีดวัคซีนเป็นไปตามการบริหารจัดการวัคซีนของคณะทำงานบริหารจัดการวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 (Covid-19) ของโรงพยาบาลตำรวจ
การฉีดวัคซีน
ขอเชิญเข้ารับบริการฉีดวัคซีนป้องกันโควิด-19 ตั้งเเต่วันพุธที่ 1 กันยายน พ.ศ. 2564 เป็นต้นไป เปิดให้บริการจันทร์-ศุกร์ เวลา 10.00-15.00 น. เว้นวันหยุดราชการ
จุดฉีด ณ หน่วยความร่วมมือบริการฉีดวัคซีนโควิด-19 The Event Space ชั้น 3 ศูนย์การค้าอัมรินทร์พลาซ่า กรุงเทพมหานคร
สอบถามโทร 02-2076000 ในวันและเวลาราชการ
คอร์สสุขภาพและการแพทย์ โครงการมหาวิทยาลัยไซเบอร์ไทย LINK
โครงการมหาวิทยาลัยไซเบอร์ไทย (Thailand Cyber University) เป็นความร่วมมือระหว่างกระทรวงอุดมศึกษาและสถาบันต่างๆ จัดสรรคอร์สวิชาต่างๆ หลายแขนง ตามความสนใจและเลือกเรียน
สุขภาพและการแพทย์ เป็นอีกแขนงหนึ่งที่มีให้เลือก และน่าสนใจมาก อาทิ คอร์สดูแลใส่ใจวัยสูงอายุ, การสาธารณสุขพื้นฐาน, การจัดสภาพแวดล้อมที่ดี ถูกสุขอนามัย ปลอดภัย และน่าอยู่ สำหรับผู้ดูแลผู้สูงอายุ, การดูแลโภชนาการอย่างปลอดภัย และ ฯลฯ
คลิกเลยโรงพยาบาลมหาราชนครราชสีมา
อบจ.นครนายก ได้รับจัดสรร 840โดส เริ่มฉีด 16 พ.ย.64 LINK
16 พ.ย.64 อบจ.นครนายก เริ่มฉีดวัคซีน "โมเดอร์นาประชาชนฟรี" ล็อตแรกแล้ว 4 อำเภอ
.
5 พ.ย.64 อบจ.นครนายก ประกาศได้รับการจัดสรรวัคซีน รอบแรก จากสภากาชาดไทย จำนวน 420 คน (840โดส) ตามลำดับให้กับ กลุ่มที่ 1 ผู้พิการ ผู้ป่วยติดเตียง และสตรีตั้งครรภ์ (เกิน 12 สัปดาห์ขึ้นไป) ที่ยังไม่ได้รับการฉีดวัคซีนมาก่อน และ กลุ่มผู้สูงอายุ (บางส่วน) ประกอบด้วย
กลุ่มผู้พิการ ผู้ป่วยติดเตียง และสตรีตั้งครรภ์ จำนวน 371 คน ( 742 โดส)
- อำเภอองครักษ์ 101 คน
- อำเภอเมืองนครนายก 170 คน
- อำเภอปากพลี 56 คน
- อำเภอบ้านนา 44 คน
กลุ่มผู้สูงอายุ จำนวน 49 คน ( 98 โดส)
Street Music งานลอยกระทง ถนนคนเดินคลองโอ่งอ่าง
กทม.เปิดพื้นที่แสดงดนตรี Street Music บริเวณ ถนนคนเดินคลองโอ่งอ่าง (สะพานดำรงสถิต จนถึงสวนลอยฟ้าเจ้าพระยา) วันที่ 19-21 พ.ย. ให้ศิลปิน นักดนตรี นักร้อง ทุกประเภท ทั้งมืออาชีพและสมัครเล่นร่วมเล่นดนตรีเปิดหมวก สร้างบรรยากาศ สร้างความเพลิดเพลินในช่วงเทศกาลลอยกระทง วงดนตรีที่สนใจร่วม ติดต่อ 09-6239-2559
อบจ.ลพบุรี ฉีดล็อตแรก 15 -19 พ.ย.64 LINK
อบจ.ลพบุรี ดำเนินการฉีดวัคซีน ระหว่างวันที่ 15-19 พฤศจิกายน 2564 ซึ่งในวันที่ 16 พฤศจิกายน 2564 ได้ดำเนินการให้บริการฉีดวัคซีน ณ หน่วยฉีดวัคซีน หอประชุมที่ว่าการอำเภอชัยบาดาล จังหวัดลพบุรี - ภาพการฉีดวันที่ 17 พ.ย.64
อบจ.ลพบุรี รศ. นพ. เพชร รอดอารีย์ เลขาธิการสมาคมโรคเบาหวานแห่งประเทศไทยในพระราชูปถัมภ์ สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี กล่าวถึงสถานการณ์จริงในปัจจุบัน ปี 2563 มีผู้ป่วยเบาหวานเพิ่มขึ้นเป็น 9.5% ของประชากรทั้งหมด ซึ่งอัตราผู้ป่วยเบาหวานสูงกว่าจากที่ได้คาดการณ์ไว้ อีกทั้งยังมีผู้ที่มีภาวะโรคอ้วนเพิ่มขึ้นถึง 40% ด้วย โดยในกลุ่มดังกล่าวนี้ มีผู้ที่ไม่ทราบว่าตนป่วยเป็นเบาหวานถึง 31% ทราบว่าเป็นเบาหวานแต่ไม่ได้รักษา 14% และ 29% รักษาแต่ควบคุมไม่ได้ ในขณะที่มีเพียง 26% ที่รักษาและสามารถควบคุมได้ ซึ่งยังต่ำกว่าเป้าหมายอยู่มาก
จากอัตราการเพิ่มขึ้นของผู้ป่วยเบาหวาน เกือบ 2 เท่าในช่วง 10 ปีที่ผ่านมา ตัวแปรสำคัญคือการทำงานของตับอ่อน มักพบว่าในวันที่วินิจฉัยได้ว่าป่วยเป็นเบาหวาน การทำงานของตับอ่อนลดลงถึง 50% แล้ว ประกอบกับภาวะดื้อต่ออินซูลินจากความอ้วน ดังนั้นผู้มีส่วนเกี่ยวข้องด้านสาธารณสุข จึงจำเป็นต้องดำเนินการเชิงรุกเพื่อตรวจคัดกรองกลุ่มเสี่ยงก่อนที่จะเป็นเบาหวาน ประมาณ 5-10 ปี ก่อนที่การทำงานของตับอ่อนจะลดประสิทธิภาพลงจนไม่สามารถฟื้นสภาพได้
การคัดกรองถือว่าเป็นตัวแปรสำคัญในการลดอัตราผู้ป่วยเบาหวาน เพราะนอกจากจะคัดกรองกลุ่มเสี่ยงที่มีโอกาสเป็นเบาหวานแล้ว ยังสามารถป้องกันผู้ที่มีสุขภาพแข็งแรงเพื่อไม่ให้เกิดโรคอีกด้วย สำหรับผู้เป็นเบาหวานแล้วก็พยายามไม่ให้เกิดโรคแทรกซ้อนตามมา นอกจากนี้ การปรับแนวคิดหรือวิธีปฎิบัติในชุมชน อาทิ ปรับค่าเฉลี่ยของน้ำตาลในเลือดของคนในชุมชนหรือคนในกรุงเทพฯ ให้ลดลง, จัดกิจกรรมออกกำลังกายในชุมชน, สนับสนุนอาหารเช้าที่ถูกหลักโภชนาการภายในโรงเรียน หรือการนำเทคโนโลยีเข้ามาใช้อย่างเหมาะสม ฯลฯ ก็มีส่วนสำคัญในการผลักดันให้บรรลุเป้าหมายขององค์การอนามัยโลก (WHO) ที่จะหยุดการเพิ่มขึ้นของโรคเบาหวานและโรคอ้วน และหากสามารถดำเนินการส่งต่อกลุ่มเสี่ยงหรือผู้ป่วยเบาหวานจากชุมชนเพื่อเข้าสู่โมเดลการดูแลรักษาแบบครบวงจร โดยมีการเชื่อมโยงกับทั้งระบบสาธารณสุขไทย ก็จะทำให้คนไทยมีคุณภาพชีวิตที่ดีขึ้นได้อย่างยั่งยืน
ข้อมูลและเอกสารจำเป็นเพื่อการบริจาค
หมายเหตุ ผู้บริจาคโลหิตที่ปรินท์แบบฟอร์มใบสมัครผู้บริจาคโลหิตมาจากบ้าน จะต้องปรินท์แบบคัดกรองตนเองเพื่อประเมินความเสี่ยงในการแพร่เชื้อไวรัส COVID-19 แนบมาด้วย
WHO เรียกประชุมด่วน
WHO ได้เรียกประชุมด่วนในวันนี้ (26 พ.ย.64) เพื่อหารือเกี่ยวกับไวรัสกลายพันธุ์ B.1.1.529 ตัวนี้ ขณะที่ทั่วโลกเฝ้ารอผลสรุป รวมถึงชื่อเรียกไวรัสตัวนี้
อบจ.นนทบุรี เปิดลงชื่อ Booster เข็ม 3 Moderna จำนวน 15,000 คน LINK
องค์การบริหารส่วนจังหวัดนนทบุรี เปิดรับลงทะเบียนวัคซีน อบจ.Booster รับวัคซีนเข็ม 3 Moderna จำนวน 15,000 คน รอบฉีด วันที่ 8 ธันวาคม 2564 ณ ศูนย์การค้าเซ็นทรัลพลาซาเวสต์เกต
เงื่อนไขการรับวัคซีน
- รับวัคซีนซิโนแวคมาแล้ว 2 เข็ม หรือ ซิโนฟาร์ม มาแล้ว 2 เข็ม
- ประชาชนสัญชาติไทย อายุ 18 ปีขึ้นไป
- มีทะเบียนบ้านในจังหวัดนนทบุรี หรือ อาศัยอยู่ในจังหวัดนนทบุรี (เจ้าบ้านเซ็นรับรองการอยู่อาศัย)
หลักฐานการลงทะเบียน
- สำเนาบัตรประชาชน
- สำเนาทะเบียนบ้านจังหวัดนนทบุรี หรือ หนังสือรับรอง
การอยู่อาศัย (แนบสำเนาบัตรประชาชน+สำเนาทะเบียนบ้านของเจ้าบ้าน)
****กรุณาเข้ามาตรวจสอบสิทธิ์ของท่านในวันที่ 7 ธันวาคม 2564******
โรงพยาบาลในจังหวัดน่าน
โรงพยาบาลชุมชน (อำเภอ) ในจังหวัดน่าน
น้ำมันกัญชา 3 สูตร ของกรมการแพทย์แผนไทย
น้ำมันกัญชา 3 สูตร ของกรมการแพทย์แผนไทย ได้แก่ สูตรอ.เดชา สูตรเมตตาโอสถ (THC เด่น) และสูตรการุณย์โอสถ (CBD เด่น) จ่ายให้โดย รพ./คลินิกกัญชาทางการแพทย์ทั่วประเทศ
รพ.ในขอนแก่น
รพ.ศูนย์/ทั่วไปในขอนแก่น
รพ.ชุมชน (อำเภอ) ในขอนแก่น
รพ.เอกชนในจังหวัดขอนแก่น
กรุงเทพ
หาผลตรวจ ATK เป็นบวก ติดต่อศูนย์โควิดแต่ละอำเภอ
เพื่อเจ้าหน้าที่จะทำการซักประวัติเบื้องต้น และประสานงานต่อในการตรวจซ้ำ
สสจ.เชียงราย โทร 065-0846054, 065-1208911
- สายด่วนระยองสู้โควิด Call Center 033-010885 (8-22 น.)
- ศูนย์โควิด19จังหวัดระยอง facebook.com/ryinfo19/
- ไลน์ @RayongFightCovid เพื่อติดตามประกาศ/คำสั่ง ของ จังหวัดระยอง
ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ.2564
โรงพยาบาลคามิลเลียน รับสมัครงานนอกวิชาชีพ 5 ตำแหน่ง LINK
ร่วมงานกับโรงพยาบาลคามิลเลียน อัพเดทตำแหน่งงานว่างประจำเดือนกุมภาพันธ์ 2565
นอกวิชาชีพ
1. เจ้าหน้าที่การเงินผู้ป่วยใน 1 อัตรา
2. เจ้าหน้าที่การเงินผู้ป่วยนอก 1 อัตรา
3. เจ้าหน้าที่ทั่วไป 1 อัตรา
4. ช่างซ่อมบำรุง 1 อัตรา
5. Sale Insurance 1 อัตรา
สนใจสมัคร ส่งเอกสารที่ : ฝ่ายทรัพยากรบุคคล โรงพยาบาลคามิลเลียน
สอบถามข้อมูลเพิ่มเติมได้ที่ หมายเลขโทรศัพท์ : 0-2185-1444 ต่อ 565
062-747-8243 สามารถส่งเรซูเม่มาที่ E-Mail : hrm@camillianhospital.org หรือ JobTH
รพ.เอกชนในกรุงเทพ และปริมณฑล LINK
| โรงพยาบาล |
คลินิกเครือข่าย |
กรุงเทพ
|
| รพ.กล้วยน้ำไท |
(02)7692000 |
| รพ.วิภาวดี |
(02)5611111, (02)941-2900, (02)9412800 |
| รพ.บางขุนเทียน1 |
(02)47722903 |
| รพ.บางปะกอก 9 อินเตอร์เนชั่นแนล |
(02)8771111 |
| รพ.ธนบุรี 2 |
|
| รพ.วิชัยเวช แยกไฟฉาย |
(02)412005560 |
| รพ. พีเอ็มจี |
(02)4514920 |
| รพ.เกษมราษฎร์ประชาชื่น |
(02)910160049 |
| รพ.บางโพ |
(02)5870144 |
| รพ.ศิครินทร์ |
(02)3669900-99 |
| รพ.บางปะกอก 8 |
|
| รพ.เกษมราษฎร์ บางแค |
(02)4550110 |
| รพ.นวเวช |
(02)4839999 |
| รพ. สินแพทย์ ศรีนครินทร์ |
(02)0068888 |
| รพ.มิตรประชา |
(02)4555599 |
| รพ.นวมินทร์ 9 |
(02)51181818 |
| รพ.บางปะกอก 1 |
(02)1091111 |
| รพ.สุขสวัสดิ์ |
(08)28746767 |
| รพ.เกษมราษฎร์ รามคำแหง |
(02)-339-0000 |
| รพ.บี.แคร์ เมดิคอลเซ็นเตอร์ |
(02)523335971 |
| รพ.วิชัยเวชอินเตอร์เนชั่นแนล หนองแขม |
(02)8074044, (02)4211888-9 |
| รพ.ปิยะเวท |
(02)1295555 |
| รพ.วิมุต |
(02)0790000 |
นนทบุรี
|
| รพ.เกษมราษฎร์รัตนาธิเบศร์ |
|
| รพ.เกษมราษฎร์อินเตอร์เนชั่นแนล รัตนาธิเบศร์ |
(02)594002065 |
| รพ.กรุงไทย |
(02)5822299 |
| รพ.เวิลด์เมดิคอล |
|
ปทุมธานี
|
| รพ.การุญเวช ปทุมธานี |
|
| รพ.ภัทร-ธนบุรี |
|
| รพ.ธนบุรีบูรณา |
(02)0785777 |
| รพ.ซีเมดลีฟวิ่งแคร์ |
(02)1992111 |
| รพ.บางปะกอกรังสิต 2 |
|
| รพ.กรุงไทย ปทุม |
(021)472565 |
| รพ.กรุงสยามเซนต์คาร์ลอส |
(02)9756701 |
สมุทรปราการ
|
| รพ.บางนา 5 |
(02) 1381155-65, 085-5150525 |
| รพ.พริ้นซ์สุวรรณภูมิ |
(02)0805999 |
| รพ.บางปะกอก 3 |
(02) 1093111 |
| รพ.บางปะกอกสมุทรปราการ |
(02) 1093222 |
| รพ.สินแพทย์ เทพารักษ์ |
(02) 7615999 |
| รพ.ศิครินทร์ สมุทรปราการ |
(02)32329917 |
โรงงานผลิตยาสมุนไพร โรงพยาบาลบางกระทุ่ม
โรงพยาบาลบางกระทุ่ม มีโรงงานผลิตยาสมุนไพร ผลิต ผลิตภัณฑ์สมุนไพรหลายชนิด ได้แก่ ยาสมุนไพรประเภทแคปซูล ยาน้ำ ชาชง ยาลูกกลอน และ ยาสมุนไพรประเภทเสริมความงาม นอกจากนี้ โรงงานยังพร้อมรองรับการผลิตผลิตภัณฑ์กัญชา เพื่อป้อน คลินิกกัญชา ของโรงพยาบาลอีกด้วย
ขับรถรักษ์โลก สไตล์กระทรวงคมนาคม
บางจาก แนะ 10 เทคนิคขับรถประหยัดน้ำมัน เซฟตังในกระเป๋า
บางจาก แนะ 10 เทคนิคขับรถประหยัดน้ำมัน เซฟตังในกระเป๋า
1. ตรวจสอบลมยางเป็นประจำ
2. ดับเครื่องยนต์ทุกครั้ง เมื่อต้องจอดรถนานๆ
3. ใช้เกียร์ให้เหมาะสมกับสภาพเส้นทาง
4. ไม่เปิดเครื่องปรับอากาศ
5. ไม่ออกรถกระชาก
6. ไม่เร่งเครื่องยนต์ทันทีที่สตาร์ทรถตอนเกียร์ว่าง
7. ตรวจเช็กเครื่องยนต์อย่างสม่ำเสมอ
8. ไม่บรรทุกน้ำหนักเกิน
9. เช็กแผนที่ในการเดินทางให้ดี
10. หมั่นตรวจเช็กเปลี่ยนน้ำมันเครื่องและไส้กรอง
9.ข้อมูลส่วนบุคคลที่มีความละเอียดอ่อน
ผู้ประกอบการค้าเบตง แฮปปี้สุดๆ
ผู้ประกอบการย่านการค้าเมืองเบตงแฮปปิ้สุดๆ กับกิจกรรมระดับโลกอย่างวิ่งเทรล ที่จะทำให้เศรษฐกิจในพื้นที่ฟื้นตัว สร้างความคึกคัก พร้อมต้อนรับนักท่องเที่ยว
จากการลงพื้นที่เยี่ยมให้กำลังใจผู้ประกอบการ พ่อค้าแม่ค้า ย่านเศรษฐกิจ ณ บริเวณหอนาฬิกา เทศบาลเมืองเบตง จังหวัดยะลา พบว่าร้านค้า ร้านอาหาร เปิดร้านพร้อมให้บริการช่วงเช้าอย่างคึกคัก
ผู้ประกอบการในพื้นที่ส่วนใหญ่ รู้สึกดีใจที่ได้มีกิจกรรมดีๆ และเป็นกิจกรรมระดับโลก มาจัดขึ้นในพื้นที่ การมีชาวต่างชาติ มาเข้าร่วมการแข่งขันจำนวนมาก ช่วยทำให้บรรยากาศด้านการค้าขายดีขึ้น เกิดการกระตุ้นเศรษฐกิจแน่นอน ทั้ง โรงแรม ที่พักต่าง ๆ เต็มหมดทุกแห่ง ถือเป็นปรากฏการณ์ ครั้งประวัติศาสตร์หลังจากที่เกิดสถานการณ์แพร่ระบาดของเชื้อไวรัสโควิด 19 ขึ้น อย่างหนักกว่า 2 ปี ที่ผ่านมา
พร้อมกันนี้ยังขอขอบคุณทุกภาคส่วนที่ช่วยกันขับเคลื่อนกิจกรรมดีๆแบบนี้ และอนาคตหากเป็นไปได้ อยากให้ภาครัฐมีการจัดกิจกรรมอย่างต่อเนื่อง เพื่อเป็นการส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจในพื้นที่ให้ดีขึ้น ซึ่งชาวอำเภอเบตงทุกคนพร้อมให้ความร่วมมือและต้อนรับนักท่องเที่ยวที่มาเยือนอย่างแน่นอน
ข้อมูลและภาพ
สวท.เบตง News อัตราค่าบริการ ตามสิทธิ
- สิทธิ์ประกันสุขภาพทั่วหน้า UC
- สิทธิ์บุคคลผู้มีปัญหาและสิทธิ์
- สิทธิ์ประกันสังคม
- สิทธิ์กรมบัญชีกลาง
- สิทธิ์ต่างด้าว
ตัวอย่างหน้าจอแอปปลูกกัญ iOS และ Google Play
นายกฯ เล็งตั้งกก.ดูแลความเรียบร้อยหลังปลดล็อกกัญชาพ้นยาเสพติด LINK
ถ้อยแถลงจากนายกรัฐมนตรี ประยุทธ์ จันทรโอชา เมื่อกัญชาพ้นยาเสพติดมีผลบังคับใช้ 9 มิถุนายน นี้
"กัญชา กัญชง จะถูกถอดจากการเป็นยาเสพติด ประเภทที่ 5 ตั้งแต่ 9 มิถุนายน เป็นต้นไป โดยเฉพาะการปลูก เสพ สูบ กัญชากัญชง สามารถทำได้โดยถูกกฏหมาย แต่ไม่ใช่จะเสรี 100% นะ
เพราะพิษภัยของกัญชายังมีอยู่ เพราะพฤติกรรมการใช้บางเรื่อง รัฐจำเป็นต้องควบคุม อาทิ การสูบต้องไม่ก่อความรำคาญกับผู้อื่น การสูบแล้วขับรถอาจจะผิดกฏหมาย (เหมือนดื่มแล้วไม่ขับ) การใช้ช่อดอกซึ่งมีสารเสพติด ต้องระมัดระวัง ให้เป็นไปตามกฏหมาย ห้ามจำหน่ายแก่เด็ก ต้องมีการควบคุม การผลิตจำหน่ายต้องเสียภาษี เป็นต้น อย่างไรก็ตาม จะมีกฏหมายใหม่ เพื่อจะกำหนดในรายละเอียดต่อไป
ปัจจุบันเราอยู่ระหว่างการเสนอร่าง พ.ร.บ.กัญชาต่อสภา คงใช้เวลาพอสมควร ในระหว่างนี้ นับแต่ วันที่ 9 มิถุนายน เป็นต้นไป จนถึงวันที่ กม. มีผลบังคับใช้ รัฐบาลได้ตั้งคณะกรรมการบูรณาการ นโยบายพืชกัญชา กัญชง ประกอบด้วย สธ. ยธ. ปปส. กต. กศ. พม. กค. ตำรวจ นักวิชาการ และภาคประชาชน เพื่อกำกับดูแลช่วงรอยต่อนี้ ให้เป็นไปตามความเรียบร้อยตามข้อห่วงใย จะต้องสร้างการรับรู้ และรับเรื่องร้องเรียนต่างๆ ที่อาจเป็นปัญหา จากความไม่เข้าใจซึ่งกันและกันอีกด้วย"
ภาพจาก TOP NEWS
แจกกัญชา 1000 ต้น วันแรกแจกราว 100 ต้น
ถาม-ตอบ เรื่องการจดแจ้ง ตอบปัญหาโดย Thai FDA Cannabis
Q: จดแจ้ง เพื่ออะไรครับ
เพื่อให้ทราบจำนวนและแหล่งที่ปลูกกัญชา และกัญชงทั่วประเทศ อีกทั้ง ยังเป็นแหล่งข้อมูลให้ผู้ประกอบการแสวงหาวัตถุดิบเพื่อนำไปผลิตเป็นผลิตภัณฑ์ที่มีคุณภาพมาตรฐานออกสู่ตลาด เป็นการเพิ่มทางเลือกให้กับผู้บริโภค และเป็นการกระตุ้นเศรษฐกิจค่ะ
Q: ต้นให้คนจดแจ้ง รับฟรีมั้ยคับ
ติดต่อขอรับที่กรมวิชาการเกษตร โทรสายด่วน 1174 ค่ะ
Q: ลงทะเบียนจดแจ้งแล้ว แต่ข้อมูลผิด แก้ไขอย่างไรครับ
ถ้าเป็นเรื่องของปัญหาการใช้งานระบบ รบกวนติดต่อศูนย์ข้อมูลสารสนเทศ
โทร 02 590 7064 ได้เลยนะคะ
Q: ลงจำนวนต้นผิดแก้ไขอย่างไรครับ
สามารถเข้าไปแก้ไขจำนวนต้นที่ต้องการปลูกในแอปพลิเคชัน "ปลูกกัญ" ได้เลยค่ะ
+++++
แก้เมาด้วยการดื่มน้ำหรืออาบน้ำ
บางตำราบอกว่า หากเมากัญชา ให้แก้ด้วยน้ำ
1) ดื่มน้ำเปล่าในปริมาณมาก ๆ เพื่อบรรเทาอาการคอแห้งปากแห้ง
2) การอาบน้ำเป็นตัวเลือกที่ดี ที่ช่วยให้รู้สึกผ่อนคลายมากขึ้นระหว่างที่รอให้สร่างเมา
ไม่ควรดื่มเครื่องดื่ม แอลกอฮอร์หรือเครื่องดื่มที่มีคาเฟอีน
แก้เมาด้วยการผ่อนคลายร่างกาย
บางสำนักบอกว่า หากเมากัญชา ให้แก้ด้วยการผ่อนคลาย
ผ่อนคลายร่างกาย
หาที่เงียบๆนุ่มๆสบายๆ ทิ้งตัวลงนอน สูดหายใจเข้าออกลึกๆ ถ้าสามารถงีบได้ช่วงสั้นๆก็จะดีมากๆ
ออกไปสูดอากาศข้างนอกบ้าง
ถ้าเดินไหว ลองลุกออกไปเดินเล่นข้างนอก สูดอากาศสดชื่นๆบ้าง จะช่วยเติมพลังให้ร่างกายได้อย่างดี แต่ถ้ารู้สึกว่า เดินไม่ไหวอย่าฝืน ให้ผ่อนคลายร่างกาย
ดีสุดคือ นอนไปเลย นอนไปสักพัก ตื่นมาหายเองได้ สดชื่น
ถ้าเป็นกลางคืน ก็หลับยาวไปเลย กัญชาจะช่วยให้นอนได้เต็มที่ หลับลึก สุขภาพดี
กรรมาธิการฯพิจารณา ร่าง พรบ.กัญชา กัญชง พ.ศ….
ขณะนี้ ร่าง พรบ.กัญชา กัญชง พ.ศ… อยู่ในระหว่าง กรรมาธิการฯ พิจารณา โดยมีนายศุภชัย ใจสมุทร ส.ส.บัญชีรายชื่อ พรรคภูมิใจไทย เป็นประธานกรรมาธิการฯ กำหนดการประชุมสัปดาห์ละ 2 ครั้ง คือ วันจันทร์กับวันศุกร์ และมีการแถลงทุกครั้งที่มีการประชุม
ตารางเวลาให้บริการอินทัชเมดิแคร์ ทั้ง 5 สาขา
โปรแกรมลดน้ำหนัก ด้วยศาสตร์แพทย์ทางเลือก LINK
โปรแกรมที่เหมาะกับผู้มีน้ำหนักเกินจากการทานมาก ไม่ได้ออกกำลังกาย โปรแกรมรักษา ได้แก่ การฝังเข็ม อบสมุนไพร ยาสมุนไพรชาชงจีน ยาสมุนไพรแช่เท้าจีน ยาอบสมุนไพร ตรวจเลือด รวม 6,480 บาท/คอร์ส คอร์สละ 10 ครั้ง
สอบถามโทร. 053-917589
ระบบกล้องโทรทัศน์วงจรปิด CCTV ตรวจวัดและรายงานสภาพการจราจร LINK
เว็บไซต์ สำนักการจราจรและขนส่ง 44 ถนนวิภาวดีรังสิต ดินแดง กรุงเทพมหานคร 10400 โทร. 0-23541210 ถึง 5
วิธีดู : คลิกที่ ไอค่อน กลมๆ มีรูปกล้อง (ดูในภาพตัวอย่าง)
สามารถลากบนแผนที่ไปยังที่ต่างๆ ทั่วกรุงเทพได้
หรือใช้ช่องค้นหาด้านล่าง เป็นเครื่องมือช่วยค้นหาได้รวดเร็วขึ้น
หรือใช้เครื่องมือ ช่วยค้นหาเส้นทาง เพื่อกำหนดจุดเริ่ม ไปยังเป้าหมายที่ต้องการ (แบบเดียวกับบน google map)
โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต รับสมัครแพทย์เฉพาะทาง LINK
โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต รับสมัครแพทย์เฉพาะทาง
1. ศัลยแพทย์ทั่วไป (fulltime)
2. แพทย์ตจวิทยา (โรคผิวหนัง) (ออกตรวจวันศุกร์ - เสาร์)
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่
คุณกิ่งแก้ว เลขาแพทย์ โทร. 089 - 9815396
หรือส่ง Resume ได้ที่ Chularat9@chularat.com
ห้วยขวาง ตรวจติดตามสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ LINK
5 สิงหาคม 2565 เวลา 18.00 น. นายชัชชญา ขำจันทร์ ผู้อำนวยการเขตห้วยขวาง พร้อมด้วยนางสาวนภาภรณ์ แสงสุวอ หัวหน้าฝ่ายสิ่งแวดล้อมฯ เจ้าหน้าที่ฝ่ายเทศกิจ เจ้าหน้าที่ฝ่ายสิ่งแวดล้อมฯ ร่วมกับสถานีตำรวจนครบาลมักกะสัน สถานีดับเพลิงบางกะปิ
ลงพื้นที่ตรวจติดตามสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ ให้ปฏิบัติตามมาตรการป้องกันโรคตามที่ทางราชการกำหนด ตามประกาศกรุงเทพมหานคร เรื่อง มาตรการเฝ้าระวัง ป้องกัน และควบคุมการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) ลงวันที่ 24 มิถุนายน 2565 เพื่อป้องกันและลดการแพร่ระบาดของโรคโควิด-19 รวมทั้งตรวจแนะนำด้านความปลอดภัยของอาคาร ตรวจระบบป้องกันอัคคีภัย โดยตรวจสอบทางหนีไฟ ไฟฉุกเฉิน และความพร้อมของอุปกรณ์ดับเพลิง ณ สถานประกอบการย่าน RCA เขตห้วยขวาง
เขตวัฒนา ตรวจความพร้อมด้านการป้องกันอัคคีภัยของสถานบริการและสถานประกอบการที่คล้ายสถานบริการ LINK
10 สิงหาคม 2565 สำนักงานเขตวัฒนา (ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ฝ่ายโยธา) ลงพื้นที่ตรวจความพร้อมด้านการป้องกันอัคคีภัยของสถานบริการและสถานประกอบการที่คล้ายสถานบริการฯ บริเวณถนนสุขุมวิท 3 และเป็นการตรวจตามคำสั่ง คสช. ที่22/2558 ตรวจตามมาตรการป้องกันและควบคุมโรคของกรุงเทพมหานคร จำนวน 4 แห่ง ดังนี้
1.ร้าน W Club
2.ร้านแบมบูบาร์
3.ร้านดีโน่บาร์
4.ร้านโกลเด้นแซนด์ (ปิดบริการ)
บริเวณซอยสุขุมวิท 3 แขวงคลองเตยเหนือ เขตวัฒนา
โรงพยาบาลเฉพาะทางมะเร็งแคนเซอร์อลิอันซ์ ศรีราชา LINK
โรงพยาบาลเฉพาะทางมะเร็งแคนเซอร์อลิอันซ์ ศรีราชา เป็นโรงพยาบาลเฉพาะทางเชี่ยวชาญด้านโรคมะเร็งและการรักษามะเร็ง ซึ่งมีการนำเอากัญชาทางการแพทย์มาใช้ร่วมในการดูแลรักษาผู้ป่วยด้วย โดยผสานศาสตร์แผนไทยและแผนปัจจุบันเข้าด้วยกันภายใต้การดูแลของแพทย์ผู้เชี่ยวชาญเฉพาะด้านโดยตรง ศึกษาสอบถามหรือปรึกษาเกี่ยวกับการใช้ยากัญชาทางการแพทย์ ได้ที่โทร.033-046-333
แพคเกจตรวจสุขภาพ ชาย 5 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
ชนิดการตรวจสุขภาพเชิงป้องกัน
ในยุคปัจจุบันที่วิทยาศาสตร์การแพทย์พัฒนาไปอย่างมาก การตรวจสุขภาพเชิงป้องกัน จึงมีหัวข้อต่างๆ มากมาย ยกตัวอย่างดังนี้
เทศกาลสีสันแห่งสายน้ำ มหกรรมลอยกระทง สวนสันติชัยปราการ
เทศกาลสีสันแห่งสายน้ำ มหกรรมลอยกระทง
6 - 8 พฤศจิกายน 2565 สวนสันติชัยปราการ กรุงเทพมหานคร
ประเพณีลอยกระทงอันทรงคุณค่า สะท้อนความรุ่งเรือง งดงามของวัฒนธรรมไทยกับสายน้ำสู่สากล ผสานความทันสมัยของสื่อผสมและเทคโนโลยีเพื่อให้เข้าถึงคนรุ่นใหม่ได้ สร้างการรับรู้ถึงคุณค่าของกิจกรรม และร่วมรับประสบการณ์ Amazing Experience เน้นย้ำความสุขและคุณค่าอย่างวิถีไทย นำส่งคุณค่าและประสบการณ์ใหม่ของประเพณีลอยกระทงที่ใส่ใจสิ่งแวดล้อมให้กับนักท่องเที่ยวได้รับความประทับใจ
1. โซนกระทง 5 พื้นที่เอกลักษณ์
การผสมผสานวัฒนธรรมวิถีชีวิตและความรุ่งเรืองของวัฒนธรรมที่สื่อผ่านสัญลักษณ์แลนด์มาร์คที่เป็นเอกลักษณ์ 5 พื้นที่ ได้แก่
- ประเพณียี่เป็ง จังหวัดเชียงใหม่
- ประเพณีลอยกระทงสายไหลประทีป ๑๐๐๐ ดวง จังหวัดตาก
- ประเพณีลอยกระทงเผาเทียนเล่นไฟ จังหวัดสุโขทัย
- ประเพณีลอยกระทงกาบกล้วยเมืองแม่กลอง จังหวัดสมุทรสงคราม
- ประเพณี สมมาน้ำคืนเพ็ง เส็งประทีป จังหวัดร้อยเอ็ด
2. กิจกรรมสาธิตวิถีไทย ได้แก่ การประดิษฐ์โคมล้านนา การทำกระทงกะลามะพร้าว การทำกระทงใบลาน การทำกระทงกาบกล้วย และการประดิษฐ์กระทงรวงข้าว
3. โซนพิธีลอยกระทงและกิจกรรมการแสดง
- กิจกรรมลอยกระทงในกระบะทดน้ำจากแม่น้ำเจ้าพระยา ในบรรยากาศลอยกระทงในอดีตที่ได้ขอขมาพระแม่คงคาและสัมผัสสายน้ำด้วยตนเอง
- ขบวนแห่ประเพณีลอยกระทงที่ยิ่งใหญ่ตระการตาและนางนพมาศ วันที่ 8 พฤศจิกายน 2565 เวลา 18.30 น. และพิธีวันลอยกระทง เวลา 19.00 น.
- การแสดงทางวัฒนธรรม วันที่ 6-7 พฤศจิกายน 2565 เวลา 16.00-21.00 น. / วันที่ 8 พฤศจิกายน 2565 เวลา 16.00 -24.00 น. และการแสดงดนตรีไทย
4. โซนสาธิตอาหารชาววัง ได้แก่ การทำขนมบุหรันดั้นเมฆ การทำขนมกรทงทอง การทำหมี่กรอบชาววัง การทำขนมมะละกอรังแตนการแกะสลักผักผลไม้
5. โซนกิจกรรมประดิษฐ์กระทงด้วยตนเองจากวัสดุธรรมชาติ ได้แก่ การทำกระทงจากใบตองสด การทำกระทงจากกะลามะพร้าว การทำกระทงจากกาบกล้วย
6. การประดับไฟสวยงามรอบบริเวณงาน
9 พ.ย. 65 งานวิจัยกัญชา one stop service กัญชา
one stop service กัญชา
-นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมว.สธ. เผยได้หารือกรมการแพทย์แผนไทยฯ สำนักงานคณะกรรมการอาหารและ ยา และสถาบันกัญชาทางการแพทย์สป.สธ. เพื่อบูรณาการทำงานให้ประชาชนได้รับการอนุญาตอย่างรวดเร็ว ลดขั้นตอนการ ทำงานที่ไม่จำเป็น และมีฐานข้อมูลผู้ได้รับอนุญาตกัญชาอย่างเป็นระบบ โดยให้บริการในระบบ One stop Service ทั้งระบบ ออนไลน์ ผ่าน application และออนไซต์รวมถึงเตรียมบูรณาการกับกรมวิชาการเกษตร เนื่องจากมีกฎหมายที่เกี่ยวข้อง เช่น ด้านการนำเข้าเมล็ดพันธุ์ จำหน่ายเมล็ดหรือต้นกล้า เพื่อจะได้สอดคล้องกับกระทรวงสาธารณสุข ทั้งนี้ จะดำเนินการอย่างเร็ว ที่สุด และประชาสัมพันธ์ให้กับประชาชน ผู้ประกอบการ ทราบแนวทางการดำเนินการอย่างถูกต้องภายใน 2 สัปดาห
งานวิจัยกัญชา
-รศ.ดร.นพ.ปัตพงษ์ เกษสมบูรณ์ ม.ขอนแก่น กล่าวว่า งานวิจัยที่ระบุว่ากัญชาเป็นสาเหตุของโรคจิต ถูกโต้แย้งว่ามีปัญหา เรื่องความน่าเชื่อถือ บทเรียนจากนานาชาติ พบหลังแก้กฎหมายกัญชา สถิติคนเป็นโรคจิตมีจำนวนคงที่หรือมีแนวโน้มลดลง และปัญหาจากกัญชาสังเคราะห์ลดลง ข้อมูลประเทศไทยพบเช่นเดียวกัน ว่าความชุกของคนเป็นโรคจิตมีแนวโน้มลดลง และ มาใช้บริการลดลง ทั้งนี้ รัฐบาลและหน่วยงานที่เกี่ยวข้องควรเร่งให้ความรู้แก่ประชาชนไม่ให้ใช้กัญชาเกินขนาด และหลีกเลี่ยง การใช้กัญชาสังเคราะห์
พ.ร.บ.กัญชา
-นายอนุทิน ชาญวีรกุล รองนายกฯ และรมว.สธ. กล่าวถึง ร่าง พ.ร.บ.กัญชา กัญชงหวังว่าจะได้รับการสนับสนุน เพราะมี ประโยชน์กับประชาชน ซึ่งการประชุมสภาฯ ในครั้งนี้จะได้พิจารณาทั้ง 95 มาตรา โดยเชื่อว่าทางคณะ กมธ.ยินดีที่จะรับฟัง รวมทั้งปรับปรุงแก้ไขในประเด็นที่เป็นความห่วงใยของสมาชิกสภาผู้แทนราษฎร การที่มีร่าง พ.ร.บกัญชา กัญชง ก็เพื่อทำให้ เกิดความมั่นใจในการควบคุมการใช้กัญชาอย่างถูกวิธีและให้เกิดประสิทธิภาพ หากร่างกฎหมายไม่ผ่าน สามารถใช้ประกาศ ของสธ. ซึ่งเป็นกฎหมายอยู่ภายใต้ พ.ร.บ.สาธารณสุขกำกับอยู่แล้ว เหมือนที่ทำอยู่ในปัจจุบัน
-นายอนุทิน ชาญวีรกุล รองนายกฯ และรมว.สธ. กล่าวถึง กระแสข่าวนายกฯ สั่งการให้พรรคภูมิใจไทยกับพรรค ประชาธิปัตย์ พักรบกันจากประเด็นร่าง พ.ร.บ.กัญชา กัญชง ว่า ไม่มีรบกับใครที่ไหน ขณะนี้เป็นเรื่องของสภาฯ โดยเฉพาะ ร่าง พ.ร.บ.กัญชา กัญชง หากพิจารณาแล้วทุกคนมีเหตุผล สามารถใช้เอกสิทธิ์ในการลงคะแนน ซึ่ง กมธ. ยืนยันว่า เสนอกฎหมายให้ดีที่สุด ทั้งนี้ การประชุม ครม. ได้พบและพูดคุยกับนายจุรินทร์ ลักษณวิศิษฏ์ รองนายกฯ รมว.พาณิชย์ ก็ทักทายตามปกติไม่มีอะไรกัน เพราะเป็นเรื่องความเห็นที่ต่างกัน
-นายศุภชัย ใจสมุทร ประธานคณะกมธ. วิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง กล่าวถึง ร่าง พ.ร.บ.กัญชา ซึ่งกำลัง เป็นประเด็นพิพาทระหว่างพรรคภูมิใจไทย กับพรรคประชาธิปัตย์ ไม่เกี่ยวกับพรรคการเมือง เพราะเป็นร่างของสภา ที่ตั้ง กมธ.มาจากทุกพรรค หากสภาฯพิจารณาไม่ผ่านอาจต้องยุบสภาหรือลาออก ส่วนเรื่องการเอากลับไปเป็นยาเสพติด ขอให้ดู ท่าทีของทั่วโลก UN เตรียมปลดกัญชาออกจากยาเสพติด ในสหรัฐฯ ประมาณ 45 รัฐ และแคนาดาปลดล็อกแล้ว เพราะเห็น คุณค่ากับกัญชาในประเทศไทย
ยาต้องห้าม ห้ามนำเข้าประเทศญี่ปุ่น
อย.ไทย ประกาศ "ระวังยาต้องห้าม ห้ามนำเข้าประเทศญี่ปุ่น" ดังนี้
1. TYLENOL COLD
2. NYQUIL
3. NYQUIL LIQUICAPS
4. ACTIFED
5. SUDAFED
6. ADVIL COLD & SINUS
7. DRISTAN COLD/ “NO DROWSINESS”
8. DRISTAN SINUS
9. DRIXORAL SINUS
10. VICKS INHALER (ยาพ่น)
11. LOMOTIL
โดยยาที่มีชื่อการค้าลำดับ ที่ 1-10 เป็นยาที่มีสาร ซูโดอีเฟดรีน (Pseudoephedrine) เป็นสารสำคัญ ใช้ในการใช้แก้ปวด ลดไข้ บรรเทาอาการไอ คัดจมูก แพ้อากาศ ลดน้ำมูก เป็นต้น
ส่วนยาในลำดับที่ 11 มีสารสำคัญที่จัดเป็นยาเสพติดให้โทษในประเภท 3 (Atropine และ Diphenoxylate)ใช้ในการบรรเทาอาการท้องเสีย
*อ้างอิงรายชื่อยาจากเว็บไซต์สถานกงสุลใหญ่ญี่ปุ่นประจำนครซีแอทเทิล
เพื่อความสบายใจ การพกยาใดๆ เข้าประเทศญี่ปุ่นก็ควรมี
1. ใบสั่งแพทย์ต้องนำใบสั่งแพทย์นั้นติดตัวไปด้วยทุกครั้ง
2. ยาต้องอยู่ในแผงยา หรือบรรจุภัณฑ์ เพื่อแสดงรายละเอียดของยาแก่เจ้าหน้าที่
3. จำนวนของยาจำเป็นที่ติดตัวได้ต้องใช้ได้ไม่เกิน 30 วัน
4. ยาที่มีส่วนผสมของยาเสพติด ให้โทษที่ใช้ทางการแพทย์ต้องมีมาตรการควบคุมเป็นพิเศษ
5. ยากลุ่มยานอนหลับควรระวังในการพกพา
[
source]
รอบแบ่งกลุ่ม
20 พฤศจิกายน 2565
กลุ่ม A เวลา 23.00 น. กาตาร์ 0 - 2 เอกวาดอร์ (True4u , T Sports 7)
21 พฤศจิกายน 2565
กลุ่ม B เวลา 20.00 น. อังกฤษ 6 - 2 อิหร่าน (True4u)
กลุ่ม A เวลา 23.00 น. เซเนกัล 0 - 2 เนเธอร์แลนด์ (JKN18)
กลุ่ม B เวลา 02.00 น. สหรัฐอเมริกา 1 - 1 เวลส์ (T Sports 7)
22 พฤศจิกายน 2565
กลุ่ม C เวลา 17.00 น. อาร์เจนตินา 1 - 2 ซาอุดีอาระเบีย (True4u)
กลุ่ม D เวลา 20.00 น. เดนมาร์ก 0 - 0 ตูนิเซีย (True4u)
กลุ่ม C เวลา 23.00 น. เม็กซิโก 0 - 0 โปแลนด์ (ช่อง 3 HD)
กลุ่ม D เวลา 02.00 น. ฝรั่งเศส 4 - 1 ออสเตรเลีย (MONO 29)
23 พฤศจิกายน 2565
กลุ่ม F เวลา 17.00 น. โมร็อกโก 0 - 0 โครเอเชีย (True4u)
กลุ่ม E เวลา 20.00 น. เยอรมัน 1 - 2 ญี่ปุ่น (ช่อง 7 HD)
กลุ่ม E เวลา 23.00 น. สเปน 7 - 0 คอสตาริก้า (True4u)
กลุ่ม F เวลา 02.00 น. เบลเยียม 1 - 0 แคนาดา (ไทยรัฐทีวี ช่อง 32)
24 พฤศจิกายน 2565
กลุ่ม G เวลา 17.00 น. สวิตเซอร์แลนด์ 1 - 0 แคเมอรูน (ช่อง ThaiPBS True Sports 2)
กลุ่ม H เวลา 20.00 น. อุรุกวัย 0 - 0 เกาหลีใต้ (True4u T Sports 7 True Sports 2)
กลุ่ม H เวลา 23.00 น. โปรตุเกส 3 - 2 กานา (True4u Thai PBS True Sports 2)
กลุ่ม G เวลา 02.00 น. บราซิล 2 - 0 เซอร์เบีย (ช่อง CH8 True Sports 2)
25 พฤศจิกายน 2565
กลุ่ม B เวลา 17.00 น. เวลส์ 0 - 2 อิหร่าน (True4u JKN18 True Sports 2)
กลุ่ม A เวลา 20.00 น. กาตาร์ 1 - 3 เซเนกัล (True4u PPTV True Sports 2)
กลุ่ม A เวลา 23.00 น. เนเธอร์แลนด์ 1 - 1 เอกวาดอร์ (PPTV HD 36 True Sports 2)
กลุ่ม B เวลา 02.00 น. อังกฤษ 0 - 0 สหรัฐอเมริกา (True4u True Sports 2)
26 พฤศจิกายน 2565
กลุ่ม D เวลา 17.00 น. ตูนิเซีย 0 - 1 ออสเตรเลีย (True4u Amarin TV True Sports 2)
กลุ่ม C เวลา 20.00 น. โปแลนด์ 2 - 0 ซาอุดีอาระเบีย (True4u 9 MCOT HD True Sports 2)
กลุ่ม D เวลา 23.00 น. ฝรั่งเศส 2 - 1 เดนมาร์ก (T Sports 7 PPTV True Sports 2)
กลุ่ม C เวลา 02.00 น. อาร์เจนตินา 2 - 0 เม็กซิโก (ช่อง NBT True Sports 2)
27 พฤศจิกายน 2565
กลุ่ม E เวลา 17.00 น. ญี่ปุ่น 0 - 1 คอสตาริก้า (GMM25 True Sports 2)
กลุ่ม F เวลา 20.00 น. เบลเยียม 0 - 2 โมร็อกโก (ช่อง 9MCOT 30 True Sports 2)
กลุ่ม F เวลา 23.00 น. โครเอเชีย 4 - 1 แคนาดา (True4u 3HD True Sports 2)
กลุ่ม E เวลา 02.00 น. สเปน 1 - 1 เยอรมัน (ช่อง เนชั่นทีวี 22 True Sports 2)
28 พฤศจิกายน 2565
กลุ่ม G เวลา 17.00 น. แคเมอรูน 3 - 3 เซอร์เบีย (อมรินทร์ทีวี 34 True Sports 2)
กลุ่ม H เวลา 20.00 น. เกาหลีใต้ 2 - 3 กานา (True4u NBT True Sports 2)
กลุ่ม G เวลา 23.00 น. บราซิล 1 - 0 สวิตเซอร์แลนด์ (ช่อง ONE 31 True Sports 2)
กลุ่ม H เวลา 02.00 น. โปรตุเกส 2 - 0 อุรุกวัย (ช่อง ททบ.5 True Sports 2)
29 พฤศจิกายน 2565
กลุ่ม A เวลา 22.00 น.
เนเธอร์แลนด์ 2 - 0 กาตาร์ (True4U Amarin TV True Sports 2)
เอกวาดอร์ 1 - 2 เซเนกัล (ช่อง 8 True Sports 5)
30 พฤศจิกายน 2565
กลุ่ม B เวลา 2.00 น.
อิหร่าน 0 - 1 สหรัฐอเมริกา (GMM25 True Sports 5)
เวลส์ 0 - 3 อังกฤษ (True4U True Sports 2)
กลุ่ม D เวลา 22.00 น.
ตูนิเซีย 1 - 0 ฝรั่งเศส (True4U ททบ.5 HD True Sports 2)
ออสเตรเลีย 1 - 0 เดนมาร์ก (NBT True Sports 5)
1 ธันวาคม 2565
กลุ่ม C เวลา 2.00 น.
โปแลนด์ 0 - 2 อาร์เจนตินา (True4U ททบ.5 HD True Sports 2)
ซาอุดิอาระเบีย 1 - 2 เม็กซิโก (MONO29 True Sports 5)
กลุ่ม F เวลา 22.00 น.
โครเอเชีย 0 - 0 เบลเยียม (True4U 9 MCOT HD True Sports 2)
แคนาดา 1 - 2 โมร็อกโก (Thai PBS True Sports 5)
2 ธันวาคม 2565
กลุ่ม E เวลา 2.00 น.
ญี่ปุ่น 2 - 1 สเปน (True4U 7HD True Sports 2)
คอสตาริกา 2 - 4 เยอรมนี (Thairath TV True Sports 5)
กลุ่ม H เวลา 22.00 น.
เกาหลีใต้ 2 - 1 โปรตุเกส (True4U True Sports 2)
กานา 0 - 2 อุรุกวัย (Nation TV True Sports 5)
3 ธันวาคม 2565
กลุ่ม G เวลา 2.00 น.
เซอร์เบีย 2 - 3 สวิสเซอร์แลนด์ (ONE31 True Sports 5)
แคเมอรูน 1 - 0 บราซิล (True4U Nation TV True Sports 2)
กระทรวงการคลัง LINK
กระทรวงการคลัง และหน่วยงานที่เกี่ยวข้อง มอบเป็นของขวัญปีใหม่ พ.ศ. 2566 ให้แก่ประชาชน หลายโครงการ ได้แก่
1. มาตรการภาษีและค่าธรรมเนียม จำนวน 5 มาตรการ ได้แก่
1.1 มาตรการ “ช้อปดีมีคืน ปี 2566”
1.2 มาตรการลดภาษีที่ดินและสิ่งปลูกสร้างปี 2566 (มาตรการลดภาษีที่ดินฯ)
1.3 มาตรการลดค่าธรรมเนียมจดทะเบียนสิทธิและนิติกรรมสำหรับที่อยู่อาศัยปี 2566 (มาตรการลดค่าธรรมเนียมฯ)
1.4 มาตรการปรับลดอัตราภาษีสรรพสามิตสำหรับน้ำมันเชื้อเพลิงเครื่องบินไอพ่นที่นำไปใช้เป็นเชื้อเพลิงสำหรับอากาศยานภายในประเทศ
1.5 มาตรการยกเว้นค่าธรรมเนียมการอนุญาตขายสุรา ยาสูบ และไพ่ ตามพระราชบัญญัติภาษีสรรพสามิต พ.ศ. 2560
2. มาตรการ/โครงการของสถาบันการเงินเฉพาะกิจ โดยสถาบันการเงินเฉพาะกิจได้จัดทำโครงการของขวัญปีใหม่ปี 2566 รวมทั้งสิ้น 15 โครงการ ได้แก่
ธนาคารออมสิน จำนวน 2 โครงการ
ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร (ธ.ก.ส.) 4 โครงการ
ธนาคารอาคารสงเคราะห์ (ธอส.) 1 โครงการ
ธนาคารพัฒนาวิสาหกิจขนาดกลางและขนาดย่อมแห่งประเทศไทย (ธพว.) 3 มาตรการ/โครงการ
ธนาคารเพื่อการส่งออกและนำเข้าแห่งประเทศไทย 2 มาตรการ
ธนาคารอิสลามแห่งประเทศไทย (ธอท.) 1 โครงการ
บรรษัทประกันสินเชื่ออุตสาหกรรมขนาดย่อม (บสย.) 2 มาตรการ
3. มาตรการ/โครงการอื่น จำนวน 7 มาตรการ/โครงการ ได้แก่
3.1 โครงการเที่ยวปีใหม่สุขใจไปกับพิพิธภัณฑ์ธนารักษ์ เพื่อมอบเป็นของขวัญปีใหม่ พ.ศ. 2566
3.2 โครงการสนับสนุนตลาดทุนและเศรษฐกิจของประเทศให้เติบโตอย่างยั่งยืนลดภาระแก่ผู้ประกอบธุรกิจเพื่อความสุขที่มั่นคงของทุกภาคส่วน (สำนักงาน ก.ล.ต.)
3.3 โครงการส่งเสริมให้ประชาชนและผู้ลงทุนมีศักยภาพในการสร้างสุขภาพทางการเงินที่ดีและมีภูมิคุ้มกัน ไม่ถูกหลอกลวง (สำนักงาน ก.ล.ต.)
3.4 โครงการกรมธรรม์ประกันภัยรายย่อย (ไมโครอินชัวรันส์) สำหรับเทศกาลปีใหม่ 2566 จาก สำนักงานคณะกรรมการกำกับและส่งเสริมการประกอบธุรกิจประกันภัย (สำนักงาน คปภ.)
3.5 มาตรการช่วยเหลือผู้กู้ยืมเงินเพื่อเป็นของขวัญปีใหม่ พ.ศ. 2566
กองทุนเงินให้กู้ยืมเพื่อการศึกษา (กยศ.)
3.6 มาตรการของขวัญปีใหม่ปี 2566 ให้กับลูกค้ารายย่อยที่ไม่มีหลักประกัน/ผู้ค้ำประกัน บริษัท บริหารสินทรัพย์ ธนาคารอิสลามแห่งประเทศไทย จำกัด (บสอ.)
โรงพยาบาลในสังกัดกรมการแพทย์ กระทรวงสาธารณสุข 1 แห่ง
1. โรงพยาบาลราชวิถี
โรงพยาบาลในสังกัดกระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม 7 แห่ง
1. โรงพยาบาลมหาราชนครเชียงใหม่
2. โรงพยาบาลศูนย์การแพทย์มหาวิทยาลัยแม่ฟ้าหลวง
3. ศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ
4. โรงพยาบาลศรีนครินทร์
5. โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี
6. โรงพยาบาลสงขลานครินทร์
7. โรงพยาบาลรามาธิบดี
หน่วยงานในกำกับกรุงเทพมหานคร 1 แห่ง
1. คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช
โรงพยาบาลในสังกัดกรมแพทย์ทหารบก กระทรวงกลาโหม
1. โรงพยาบาลอานันทมหิดล
โรงพยาบาลในสังกัดองค์การมหาชน 1 แห่ง
1. โรงพยาบาลบ้านแพ้ว องค์การมหาชน
โรงพยาบาลในสังกัดสำนักงานศาลยุติธรรม 1 แห่ง
1.โรงพยาบาลตุลาการเฉลิมพระเกียรติ
การประชุมวิชาการ 28-30 มิถุนายน 2566 ห้องฟินิกซ์ 2-6 อิมแพค เมืองทองธานี


นางศิริญา เทพเจริญ กรรมการบริหาร PANACEE MEDICAL CENTER ได้กล่าวถึงการเปิด รพ.พานาซี พระราม 2 เป็นศูนย์การแพทย์มะเร็งบูรณาการว่า “ รพ.พานาซี เราตระหนักถึงจิตใจของผู้ป่วยว่า ทันทีที่ได้รับการวินิจฉัยจากแพทย์ว่าป่วยเป็นมะเร็ง มันคือที่สุดของความทุกข์ ทั้งขวัญและกำลังใจมันหายไปหมด และไม่ใช่แค่ตัวผู้ป่วยเท่านั้น หากแต่มันลามไปถึงทุกคนในครอบครัว และเมื่อเข้าสู่กระบวนการรักษามะเร็งทั้ง 3 ขั้นตอน ไม่ว่าผ่าตัด ให้เคมีบำบัด หรือการฉายแสง การรักษาในทุกขั้นตอนมันทำให้ผู้ป่วยบางท่านทุกข์ทรมาน หลายท่านถอดใจไม่อยากรักษาแล้ว เพราะทน และไปต่อไม่ไหวกับการรักษา รพ.พานาซี เราจึงตั้ง ศูนย์การแพทย์มะเร็งบูรณาการพานาซี พระราม 2 ขึ้นมา ที่พานาซีจะเน้นเชิงบูรณาการ มีเรื่องภูมิคุ้มกันบำบัด มีเรื่องของเซลล์บำบัดฆ่ามะเร็ง และการใช้สมุนไพร+กัญชา และการใช้เครื่องมือที่มีนวัตกรรมสูง โดยเราจะอยู่เคียงข้างผู้ป่วยและญาติ เพื่อดูแลช่วยเหลือในทุกขั้นตอนทั้งกายและใจ พร้อมการฟื้นฟูผู้ป่วยโรคมะเร็งแบบบูรณาการหลากหลายวิธีเช่น โอโซนบำบัด Ozone therapy / ออกซิเจนบำบัด Hyperbaric Oxygen Therapy / สารสกัดจากขมิ้นชัน Curcumin IV /เรสเวอราทรอล Resveratrol IV / วิตามินซีบำบัดและไมเยอร์ ค็อกเทล Megadose Vit C and Myer’s Cock tail IV


นพ.สุขุม กาญจนพิมาย นายกแพทยสมาคมแห่งประเทศไทยฯ กล่าวว่า “การระบาดของโรคติดเชื้อโควิด-19 ถือได้ว่าเป็นโรคระบาดใหญ่ทั่วโลก นับตั้งแต่ปี 2563 จนถึงปัจจุบันที่ประชาชนต้องเผชิญกับสถานการณ์นี้ ซึ่งส่งผลกระทบในวงกว้าง ทั้งด้านสังคม เศรษฐกิจ รวมไปถึงระบบบริการสุขภาพที่ต้องปรับเปลี่ยนการให้บริการในการรักษาใหม่เพื่อให้สอดคล้องกับสถานการณ์ และถึงแม้การแพร่ระบาดของโควิด-19 จะผ่อนคลายลง และเป็นโรคประจำถิ่นแล้ว แต่การเฝ้าระวังตนเอง และการป้องกันยังคงเป็นสิ่งสำคัญสูงสุด จากรายงานของกรมควบคุมโรค กระทรวงสาธารณสุข ยังคงพบผู้ป่วยที่ติดเชื้อโควิด-19 อันเกิดจากการกลายพันธุ์ของเชื้อไวรัส นอกจากนี้ยังพบอุบัติการณ์ของโรคจากระบบทางเดินหายใจที่สามารถติดต่อได้อื่น ๆ ได้แก่ ไข้หวัดใหญ่ และปอดอักเสบ ซึ่งเชื้อก่อโรคที่ทำให้เกิดโรคระบบทางเดินหายใจ เหล่านั้นมีความรุนแรงแตกต่างกันขึ้นอยู่กับระบบภูมิคุ้มกันของแต่ละคน โดยเฉพาะประชาชนกลุ่มเปราะบางที่มีโอกาสสูงที่เกิดอาการรุนแรงจากการติดเชื้อก่อโรคอันนำไปสู่โรคระบบทางเดินหายใจ ด้วยบทบาทของแพทยสมาคมแห่งประเทศไทย ในพระบรมราชูปถัมภ์ ที่เป็นสื่อกลางทำงานร่วมกับองค์กรทางการแพทย์ต่าง ๆ ทั้งหน่วยงานของรัฐและเอกชนในการพัฒนามาตรฐานการให้การรักษาพยาบาลรวมถึงการสาธารณสุขของประชาชนทั้งประเทศ ทั้งมุ่งเน้นเผยแพร่ความรู้เกี่ยวกับการแพทย์ และสาธารณสุขแก่ประชาชน เพื่อให้ประชาชนสามารถปฏิบัติตนให้ถูกต้อง ทั้งด้านการป้องกันและการรักษาโรค จึงยังคงเดินหน้าเตรียมความพร้อมอยู่เสมอในการรับมือกับสถานการณ์ที่อาจเกิดขึ้นได้อย่างทันท่วงที โดยโครงการ “รู้ว่าเสี่ยง เลี่ยงเสียศูนย์” เป็นอีกหนึ่งความร่วมมือเพื่อประชาชน ซึ่งถือว่าเป็นโครงการนำร่องที่ดี ทุก ๆ ภาคส่วนต้องเดินไปพร้อมกันทั้งความพร้อมของเครื่องมือ ความพร้อมของบุคลากรผู้ปฏิบัติงาน และการได้รับการสนับสนุนจากทุกภาคส่วนที่เกี่ยวข้อง เพื่อเป็นการสร้างความเชื่อมั่นให้คนไทยได้เข้าถึงการดูแลรักษาที่มีประสิทธิภาพสูงสุด”
เชิญชวนร่วมบริจาค สมาคมแพทย์สตรีแห่งประเทศไทย
เชิญชวนร่วมบริจาคให้กับ สมาคมแพทย์สตรีแห่งประเทศไทย ในพระบรมราชินูปถัมภ์ เพื่อใช้การเป็นทุนการศึกษานักเรียนแพทย์สตรี และโครงการคลินิกมะเร็งในสตรี ของสมาคมฯ การบริจาคทำได้ ด้วยวิธีต่างๆ ดังนี้
- บริจาคด้วยเงินสด ณ สมาคมแพทย์สตรีแห่งประเทศไทย ในพระบรมราชินูปถัมภ์ ฝาก / โอนเงินเข้า บัญชี สมาคมแพทย์สตรีแห่งประเทศไทย ในพระบรมราชินูปถัมภ์ ธนาคารทหารไทย จำกัด ( มหาชน ) บัญชีเลขที่ 017-2-30238-2 ( ออมทรัพย์)
- สแกน QR Code ตามภาพ
- แจ้งหลักฐาน การ ฝาก/โอนเงิน ชื่อสกุล และที่อยู่ ส่งมาที่ tmwa2495@hotmail.com หรือ Fax.โทรสาร : (02) 391-4081)
- หรือแจ้งทาง www.tmwa.or.th/new/bill.php
- ข้อมูลเกี่ยวกับการบริจาค จากเว็บไซต์ของสมาคมฯ
ฤกษ์แต่งงานปี 2567
ฤกษ์แต่งงาน เดือนมกราคม ปี 2567
วันจันทร์ ที่ 1 มกราคม
วันพุธ ที่ 3 มกราคม
วันอังคาร ที่ 9 มกราคม
วันจันทร์ ที่ 15 มกราคม
วันพฤหัสบดีที่ 25 มกราคม
วันเสาร์ที่ 27 มกราคม
ฤกษ์แต่งงาน เดือนกุมภาพันธ์ ปี 2567
วันอังคาร ที่ 13 กุมภาพันธ์
วันพุธ ที่ 14 กุมภาพันธ์
วันอาทิตย์ ที่ 18 กุมภาพันธ์
วันอังคาร ที่ 20 กุมภาพันธ์
วันอาทิตย์ ที่ 25 กุมภาพันธ์
ฤกษ์แต่งงาน เดือนมีนาคม ปี 2567
วันอังคาร ที่ 5 มีนาคม
วันเสาร์ ที่ 9 มีนาคม
วันจันทร์ ที่ 18 มีนาคม
วันพฤหัสบดี ที่ 21 มีนาคม
วันพุธ ที่ 27 มีนาคม
วันเสาร์ ที่ 30 มีนาคม
ฤกษ์แต่งงาน เดือนเมษายน ปี 2567
วันพฤหัสบดี ที่ 4 เมษายน
วันเสาร์ ที่ 6 เมษายน
วันอาทิตย์ ที่ 14 เมษายน
วันศุกร์ ที่ 19 เมษายน
วันพุธ ที่ 24 เมษายน
วันศุกร์ ที่ 26 เมษายน
ฤกษ์แต่งงาน เดือนพฤษภาคม ปี 2567
วันพุธ ที่ 1 พฤษภาคม
วันอาทิตย์ ที่ 5 พฤษภาคม
วันพฤหัสบดี ที่ 9 พฤษภาคม
วันอังคาร ที่ 14 พฤษภาคม
วันศุกร์ ที่ 17 พฤษภาคม
วันพฤหัสบดี ที่ 23 พฤษภาคม
วันอาทิตย์ ที่ 26 พฤษภาคม
วันพฤหัสบดี ที่ 30 พฤษภาคม
ฤกษ์แต่งงาน เดือนมิถุนายน ปี 2567
วันพฤหัสบดี ที่ 13 มิถุนายน
วันอังคาร ที่ 18 มิถุนายน
วันศุกร์ ที่ 21 มิถุนายน
วันอังคาร ที่ 25 มิถุนายน
ฤกษ์แต่งงาน เดือนกรกฎาคม ปี 2567
วันศุกร์ ที่ 5 กรกฎาคม
วันศุกร์ ที่ 12 กรกฎาคม
วันจันทร์ ที่ 15 กรกฎาคม
วันพฤหัสบดี ที่ 18 กรกฎาคม
วันอาทิตย์ ที่ 28 กรกฎาคม
วันอังคาร ที่ 30 กรกฎาคม
ฤกษ์แต่งงาน เดือนสิงหาคม ปี 2567
วันเสาร์ ที่ 3 สิงหาคม
วันอาทิตย์ ที่ 11 สิงหาคม
วันเสาร์ ที่ 17 สิงหาคม
วันศุกร์ ที่ 23 สิงหาคม
วันอังคาร ที่ 27 สิงหาคม
วันพฤหัสบดี ที่ 29 สิงหาคม
ฤกษ์แต่งงาน เดือนกันยายน ปี 2567
วันจัทร์ ที่ 2 กันยายน
วันจันทร์ ที่ 9 กันยายน
วันพฤหัสบดี ที่ 12 กันยายน
วันอาทิตย์ ที่ 15 กันยายน
วันเสาร์ ที่ 21 กันยายน
วันศุกร์ ที่ 27 กันยายน
ฤกษ์แต่งงาน เดือนตุลาคม ปี 2567
วันอังคาร ที่ 1 ตุลาคม
วันเสาร์ ที่ 12 ตุลาคม
วันอังคาร ที่ 15 ตุลาคม
วันจันทร์ ที่ 21 ตุลาคม
วันศุกร์ ที่ 25 ตุลาคม
วันอาทิตย์ ที่ 27 ตุลาคม
วันพฤหัสบดี ที่ 31 ตุลาคม
ฤกษ์แต่งงาน เดือนพฤศจิกายน ปี 2567
วันพฤหัสบดี ที่ 7 พฤศจิกายน
วันอาทิตย์ ที่ 10 พฤศจิกายน
วันอังคาร ที่ 19 พฤศจิกายน
วันเสาร์ ที่ 23 พฤศจิกายน
วันจันทร์ ที่ 25 พฤศจิกายน
วันศุกร์ ที่ 29 พฤศจิกายน
ฤกษ์แต่งงาน เดือนธันวาคม ปี 2567
วันเสาร์ ที่ 7 ธันวาคม
วันอังคารที่ 10 ธันวาคม
วันศุกร์ ที่ 13 ธันวาคม
วันพฤหัสบดี ที่ 19 ธันวาคม
วันจันทร์ ที่ 23 ธันวาคม
วันอาทิตย์ ที่ 29 ธันวาคม
ข้อมูลจากเพจแสนสิริ
ฤกษ์แต่งงาน เดือนมกราคม ปี 2567
วันจันทร์ ที่ 1 มกราคม
วันพุธ ที่ 3 มกราคม
วันอังคาร ที่ 9 มกราคม
วันจันทร์ ที่ 15 มกราคม
วันพฤหัสบดีที่ 25 มกราคม
วันเสาร์ที่ 27 มกราคม
ฤกษ์แต่งงาน เดือนกุมภาพันธ์ ปี 2567
วันอังคาร ที่ 13 กุมภาพันธ์
วันพุธ ที่ 14 กุมภาพันธ์
วันอาทิตย์ ที่ 18 กุมภาพันธ์
วันอังคาร ที่ 20 กุมภาพันธ์
วันอาทิตย์ ที่ 25 กุมภาพันธ์
ฤกษ์แต่งงาน เดือนมีนาคม ปี 2567
วันอังคาร ที่ 5 มีนาคม
วันเสาร์ ที่ 9 มีนาคม
วันจันทร์ ที่ 18 มีนาคม
วันพฤหัสบดี ที่ 21 มีนาคม
วันพุธ ที่ 27 มีนาคม
วันเสาร์ ที่ 30 มีนาคม
ฤกษ์แต่งงาน เดือนเมษายน ปี 2567
วันพฤหัสบดี ที่ 4 เมษายน
วันเสาร์ ที่ 6 เมษายน
วันอาทิตย์ ที่ 14 เมษายน
วันศุกร์ ที่ 19 เมษายน
วันพุธ ที่ 24 เมษายน
วันศุกร์ ที่ 26 เมษายน
ฤกษ์แต่งงาน เดือนพฤษภาคม ปี 2567
วันพุธ ที่ 1 พฤษภาคม
วันอาทิตย์ ที่ 5 พฤษภาคม
วันพฤหัสบดี ที่ 9 พฤษภาคม
วันอังคาร ที่ 14 พฤษภาคม
วันศุกร์ ที่ 17 พฤษภาคม
วันพฤหัสบดี ที่ 23 พฤษภาคม
วันอาทิตย์ ที่ 26 พฤษภาคม
วันพฤหัสบดี ที่ 30 พฤษภาคม
ฤกษ์แต่งงาน เดือนมิถุนายน ปี 2567
วันพฤหัสบดี ที่ 13 มิถุนายน
วันอังคาร ที่ 18 มิถุนายน
วันศุกร์ ที่ 21 มิถุนายน
วันอังคาร ที่ 25 มิถุนายน
ฤกษ์แต่งงาน เดือนกรกฎาคม ปี 2567
วันศุกร์ ที่ 5 กรกฎาคม
วันศุกร์ ที่ 12 กรกฎาคม
วันจันทร์ ที่ 15 กรกฎาคม
วันพฤหัสบดี ที่ 18 กรกฎาคม
วันอาทิตย์ ที่ 28 กรกฎาคม
วันอังคาร ที่ 30 กรกฎาคม
ฤกษ์แต่งงาน เดือนสิงหาคม ปี 2567
วันเสาร์ ที่ 3 สิงหาคม
วันอาทิตย์ ที่ 11 สิงหาคม
วันเสาร์ ที่ 17 สิงหาคม
วันศุกร์ ที่ 23 สิงหาคม
วันอังคาร ที่ 27 สิงหาคม
วันพฤหัสบดี ที่ 29 สิงหาคม
ฤกษ์แต่งงาน เดือนกันยายน ปี 2567
วันจัทร์ ที่ 2 กันยายน
วันจันทร์ ที่ 9 กันยายน
วันพฤหัสบดี ที่ 12 กันยายน
วันอาทิตย์ ที่ 15 กันยายน
วันเสาร์ ที่ 21 กันยายน
วันศุกร์ ที่ 27 กันยายน
ฤกษ์แต่งงาน เดือนตุลาคม ปี 2567
วันอังคาร ที่ 1 ตุลาคม
วันเสาร์ ที่ 12 ตุลาคม
วันอังคาร ที่ 15 ตุลาคม
วันจันทร์ ที่ 21 ตุลาคม
วันศุกร์ ที่ 25 ตุลาคม
วันอาทิตย์ ที่ 27 ตุลาคม
วันพฤหัสบดี ที่ 31 ตุลาคม
ฤกษ์แต่งงาน เดือนพฤศจิกายน ปี 2567
วันพฤหัสบดี ที่ 7 พฤศจิกายน
วันอาทิตย์ ที่ 10 พฤศจิกายน
วันอังคาร ที่ 19 พฤศจิกายน
วันเสาร์ ที่ 23 พฤศจิกายน
วันจันทร์ ที่ 25 พฤศจิกายน
วันศุกร์ ที่ 29 พฤศจิกายน
ฤกษ์แต่งงาน เดือนธันวาคม ปี 2567
วันเสาร์ ที่ 7 ธันวาคม
วันอังคารที่ 10 ธันวาคม
วันศุกร์ ที่ 13 ธันวาคม
วันพฤหัสบดี ที่ 19 ธันวาคม
วันจันทร์ ที่ 23 ธันวาคม
วันอาทิตย์ ที่ 29 ธันวาคม
ข้อมูลจากเพจแสนสิริ
Health and Wealth Expo 2024 LINK
เนื่องด้วยเหตุสุดวิสัย งาน Thailand Health, Fitness & Wellness Expo ประจำปี 2024 จึงจำเป็นต้องถูกเลื่อนออกไป กำหนดการจัดงานสำหรับปี 2025 จะแจ้งให้ทราบในภายหลัง
เปลี่ยนสิทธิ์ #ประกันสังคม รพ.เปาโล พระประแดง ดีอย่างไร
เปลี่ยนสิทธิ์ #ประกันสังคม รพ.เปาโล พระประแดง ดีอย่างไร? สะดวก รวดเร็ว ไม่ต้องรอคิวนาน
✅ทีมแพทย์เฉพาะทางที่พร้อมดูแลรักษา
✅มีบริการด้านสุขภาพรูปแบบใหม่ ผ่าน Health Up Application
✅บริการปรึกษาแพทย์ออนไลน์
✅บริการนัดหมายแพทย์ล่วงหน้า
✅ส่งยาถึงบ้านโดย (ไม่เสียค่าใช้จ่าย)
✅ตรวจสุขภาพประจำปีและบริการทันตกรรมตามสิทธิ์โดยไม่ต้องสำรองจ่าย
✅รับส่วนลดรักษาพยาบาล ค่าห้อง 20% ค่ายา 10%
#สามารถดำเนินการได้ด้วยตนเอง ง่ายๆ ผ่าน 4 ช่องทาง คือ
ยื่นแบบการเลือกสถานพยาบาลในการรับบริการทางการแพทย์ (สปส. 9-02) ที่สำนักงานประกันสังคมทุกแห่งทั่วประเทศ
สถานการณ์โรคพิษสุนัขบ้า จังหวัดที่พบและจำนวนเคสที่พบ
Thai Rabies Net รายงานพื้นที่เกิดโรคพิษสุนัขบ้าสูงสุด (พบในสุนัข แมว โค กระบือ)
8 มีนาคม - 8 เมษายน 2567 • สงขลา 6 เคส • อุบลราชธานี 5 เคส • กาฬสินธุ์ 4 เคส • อำนาจเจริญ 3 เคส • ชลบุรี 3 เคส • ระยอง 3 เคส • จันทบุรี 2 เคส • สุรินทร์ 2 เคส • พัทลุง 1 เคส • ปราจีนบุรี 1 เคส
15 มิถุนายน - 15 กรกฎาคม 2567 • สุรินทร์ 6 เคส • บุรีรัมย์ 3 เคส • สงขลา 2 เคส • ชลบุรี 2 เคส • ศรีสะเกษ 2 เคส • อุบลฯ 2 เคส • สมุทรปราการ 1 เคส • นครราชสีมา 1 เคส
4 กลุ่มเสี่ยง กลุ่มเปราะบาง ที่ต้องเฝ้าระวังในช่วงอากาศร้อน
4 กลุ่มเสี่ยง กลุ่มเปราะบาง ที่ต้องเฝ้าระวังในช่วงอากาศร้อน ได้แก่ เด็กเล็ก ผู้สูงอายุ ผู้ที่มีภาวะอ้วน และผู้ที่มีโรคประจำตัว แนะนำให้งดการทำกิจกรรมกลางแจ้งในช่วงที่มีอากาศร้อนจัด และ หมั่น ติดตามพยากรณ์อากาศ หากมีเหตุฉุกเฉินให้รีบติดต่อสถานพยาบาลที่ใกล้ที่สุด หรือติดต่อสายด่วน 1669
ผลสำรวจความเห็น ยาเสพติดกับสังคมไทย สวนดุสิตโพล
ผลสำรวจความคิดเห็น เรื่อง “ยาเสพติดกับสังคมไทย” สวนดุสิตโพลชี้ให้เห็นข้อกังวลและความต้องการของประชาชนหลายด้าน เช่น สาเหตุที่คนหันไปพึ่งยาเสพติดเพราะซื้อขายได้ง่ายขึ้น การจัดการปัญหายาเสพติดปัจจุบันไม่มีประสิทธิภาพ อยากให้รัฐบาลเพิ่มบทลงโทษและบังคับใช้กฎหมายอย่างเข้มงวด เป็นต้น [
ผลสำรวจ และบทวเคราะห์]
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนธันวาคม 2566
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
ธันวาคม 2566 ตามที่กระทรวงอุตสาหกรรม (อก.) เสนอ
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมเดือนธันวาคม 2566 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) หดตัวร้อยละ 6.3 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากปัญหาหนี้ครัวเรือน และดอกเบี้ยอยู่ในระดับสูง ส่งผลให้การบริโภคภายในประเทศโดยเฉพาะสินค้ากึ่งคงทนและสินค้าคงทนปรับตัวลดลง เช่น รถยนต์ เป็นต้น ประกอบกับการชะลอตัวของเศรษฐกิจประเทศคู่ค้าหลัก เช่น สหรัฐอเมริกา ญี่ปุ่น สหภาพยุโรป และ CLMV ส่งผลให้การส่งออกชะลอตัวในกลุ่มชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ เครื่องปรับอากาศ เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนธันวาคม 2566 หดตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน คือ
1. รถยนต์ หดตัวร้อยละ 20.59 จากรถบรรทุกปิคอัพ รถยนต์นั่งขนาดเล็ก และเครื่องยนต์ดีเซล เป็นหลัก โดยหดตัวจากตลาดในประเทศ (-30.66%) ตามภาวะเศรษฐกิจชะลอตัวภายในประเทศ ปัญหาหนี้ครัวเรือนอยู่ในระดับสูงทำให้สถาบันการเงินมีความเข้มงวดในการปล่อยสินเชื่อเช่ามากขึ้น ประกอบราคารถยนต์มือสองปรับตัวลดลงต่อเนื่องกระทบต่อการตัดสินใจซื้อรถยนต์ใหม่
2. น้ำตาล หดตัวร้อยละ 22.93 จากการเปิดหีบช้ากว่าปีก่อน 10 วัน (ปีก่อนเปิดหีบ 1 ธ.ค. 65) เนื่องจากฝนตกชุกในหลายพื้นที่เพาะปลูกเป็นอุปสรรคต่อการเข้าตัดอ้อย ส่งผลต่อปริมาณอ้อยเข้าสู่โรงงานน้อยกว่าปีก่อน
3. ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 12.61 จาก Integrated circuits (IC) และ PCBA เป็นหลัก เป็นไปตามทิศทางความต้องการชิ้นส่วนอิเล็กทรอนิกส์ในตลาดโลกที่ลดลงตามภาวะเศรษฐกิจที่ชะลอตัว
อุตสาหกรรมสำคัญที่ยังขยายตัวในเดือนธันวาคม 2566 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม ขยายตัวร้อยละ 7.22 จากน้ำมันดีเซลหมุนเร็ว น้ำมันเครื่องบิน และก๊าซหุงต้ม เป็นหลัก ตอบสนองการใช้น้ำมันเชื้อเพลิงที่เพิ่มขึ้นจากตลาดในประเทศและตลาดส่งออก ตามการฟื้นตัวต่อเนื่องของภาคการท่องเที่ยว รวมถึงปีก่อนโรงกลั่นเริ่มกลับมาผลิตปกติหลังหยุดซ่อมบำรุงในช่วงก่อนหน้า
2. สายไฟและเคเบิลอื่น ๆ ขยายตัวร้อยละ 43.29 จากสายไฟฟ้าเป็นหลักตามการขยายตัวของตลาดในประเทศ (+55.55%) หลังได้รับคำสั่งซื้อต่อเนื่องจากหน่วยงานการไฟฟ้าของรัฐและความต้องการใช้ในภาคเอกชนขยายตัว
3. กระดาษ ขยายตัวร้อยละ 20.28 จากกระดาษคราฟท์และเยื่อกระดาษเป็นหลักตามความต้องการใช้ในบรรจุภัณฑ์และการขนส่งสินค้า
เขตบางซื่อ ศูนย์บริการสาธารณสุข 3 บางซื่อ และศูนย์บริการสาธารณสุข 19 วงศ์สว่าง
เขตบางซื่อ "บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า" ฟรี!! ระหว่างวันที่ 3 - 20 กันยายน 2567 เวลา 09.00 - 11.30 น. โดย สำนักงานเขตบางซื่อ ศูนย์บริการสาธารณสุข 3 บางซื่อ และศูนย์บริการสาธารณสุข 19 วงศ์สว่าง
วันที่ 3 กันยายน 2567 1. ชุมชนหัวรถจักรตึกแดง 1 2. ชุมชนหัวรถจักรตึกแดง 2,3
วันที่ 4 กันยายน 2567 1. ชุมชนซอยโจ๊ก 2. ชุมชนซอยประดู่
วันที่ 5 กันยายน 2567 1. ชุมชนหลังตลาดบางซื่อ 2. ชุมชนวัดประดู่ธรรมาธิปัตย์
วันที่ 6 กันยายน 2567 1. ชุมชนซอยสนิท 2. ชุมชนบุญเหลือ 1-2
วันที่ 10 กันยายน 2567 1. ชุมชนราชทรัพย์ 2. ชุมชนวัดบางโพโอมาวาส
วันที่ 11 กันยายน 2567 1. ชุมชนปทุมทิพย์ 2. ชุมชนสมบุญดี
วันที่ 12 กันยายน 2567 1. ชุมชนสุขสันต์ 2 2. ชุมชนสุดชอยสมถวิล
วันที่ 13 กันยายน 2567 1. ชุมชนประชานฤมิตร
วันที่ 17 กันยายน 2567 1. ชุมชนศรีบุญยืนพัฒนา 2. ชุมชนศรีบุญยืน 3. ชุมชนพัฒนาประชาราษฎร์ 30
วันที่ 18 กันยายน 2567 1. ชุมชนข้างธนาคารอาคารสงเคราะห์ 2. ชุมชนหลังเทคโนโลยีพระจอมเกล้าฯ
วันที่ 19 กันยายน 2567 1. ชุมชนสุดซอยสีน้ำเงิน 2. ชุมชนหลังตลาดศรีเขมา 3. ชุมชนชอยสีน้ำเงิน 1
วันที่ 20 กันยายน 2567 1. ชุมชนยิ้มประยูรพัฒนา 2. ชุมชนวัดเสาหิน
*หมายเหตุ กำหนดการอาจมีการเปลี่ยนแปลง
***ข้อควรระวัง 1. สัตว์เลี้ยงเพศเมีย ต้องไม่อยู่ในระหว่างตั้งท้องหรือให้นม 2. สุนัข แมว กระรอก หนู กระต่าย หรือสัตว์เลี้ยงลูกด้วยนมมีอายุตั้งแต่ 3 เดือนขึ้นไป
ข้อมูลเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางซื่อ โทร. 0 2586 9977 ต่อ 6017 หรือ 0 2586 9982
ภาวะพิษจากเมทานอล
เมทานอล เป็นแอลกอฮอล์ชนิดหนึ่ง ไม่มีสี ระเหยง่าย ใช้ในอุตสาหกรรมการผลิตสารเคมี และตัวทำละลาย ไม่เหมาะสมสำหรับการบริโภคเนื่องจากมีความเป็นพิษสูง
ช่องทางรับสัมผัส และผลกระทบด้านสุขภาพ
- ทางจมูก ระคายเคืองทางเดินหายใจ วิงเวียน ปวดศรีษะ อ่อนเพลีย และหายใจลำบาก
- ทางตา ตาแดง ปวดตา ตาพร่ามัว
- ทางผิวหนัง ผิวแห้งและแดง
- ทางปาก ระคายเคืองทางเดินอาหาร คลื่นไส้ อาเจียน ชัก หมดสติ และเสียชีวิตได้
การปฐมพยาบาลเบื้องต้น
- หากสูดดมเข้าไป ให้ย้ายผู้ป่วยไปยังบริเวณที่มีอากาศบริสุทธิ์
- หากสัมผัสผิวหนัง ล้างด้วยสบู่และน้ำปริมาณมาก ถอดเสื้อผ้าที่ปนเปื้อนออกทัน
- หากสัมผัสดวงตา ล้างตาด้วยน้ำสะอาด อย่างน้อย 20 นาที
- หากกิน บ้วนปากด้วยน้ำสะอาด อย่าทำให้อาเจียนเอง รีบนำส่งโรงพยาบาลทันที
การป้องกันสำหรับประชาชน
- หลีกเลี่ยงการบริโภคเหล้ายาดอง รวมทั้งสุราที่ไม่ได้รับอนุญาตจากกรมสรรพสามิต
- หากพบว่า มีสี กลิ่น รสเปลี่ยนไป จากเดิม ขุ่นหรือมีตะกอนไม่ควรดื่ม
- ใช้เมทานอลในบริเวณที่มีการระบายอากาศ
- สวมใส่อุปกรณ์ป้องกัน เช่น ถุงมือ แว่นตา และหน้ากาก ในการใช้เมทานอล
รพ.ชัยภูมิ เปิดคลินิกทันตกรรม พิเศษนอกเวลา
รพ.ชัยภูมิ เปิดคลินิกทันตกรรม พิเศษนอกเวลา เริ่ม วันที่ 5 สิงหาคม 2567 นี้ สอบถามรายละเอียดเพิ่มเติมได้ที่ 044-104610 ต่อ 82200
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน กันยายน 2567
เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
ทีมแพทย์การปลูกถ่ายอวัยวะรพ.บำรุงราษฎร์ มาบอกเล่าความสำเร็จและความก้าวหน้าในการปลูกถ่ายอวัยวะ ซึ่งต้องอาศัยความชำนาญการของทีมแพทย์และเทคโนโลยีที่ทันสมัย และทำในสถาบันที่มีมาตรฐานและมีประสบการณ์สูง
อัพเดตสถานการณ์
1-16 ก.ย.65 ศูนย์ฯ 4 ดินแดง ออกหน่วยฉีดวัคซีน ฟรี LINK
ศูนย์บริการสาธารณสุข 4 ดินแดง ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชน ฟรี โดยไม่เสียค่าใช้จ่าย ระหว่าง วันที่ 1-16 กันยายน 2565 เวลา 10.00-12.00 น.ณ.ชุมชนเขตดินแดง
1 กันยายน ชุมชนสวัสดี ซ.ประชาสงเคราะห์ 26
8 กันยายน ชุมชนสุขใจ ซ.ประชาสงเคราะห์ 22
14 กันยายน ชุมชนตลาดศรีดินแดง
16 กันยายน ชุมชนตลาดกลางดินแดง
ประเพณีตักบาตรเทโว วัดสังกัสรัตนคีรี จังหวัดอุทัยธานี ประจำปี 2566 (รอประกาศวันที่อย่างเป็นทางการ)
จังหวัดอุทัยธานีมีกิจกรรมประเพณีตักบาตรเทโวหลังออกพรรษาเป็นประจำทุกปี เป็นงานที่มีชื่อเสียงระดับประเทศที่สาธุชนจากทั่วสารทิศหลั่งไหลมาร่วมพิธี ณ วัดสังกัสรัตนคีรี หรือ วัดเขาสะแกกรัง เป็นวัดสำคัญของจังหวัดอุทัยธานี ที่ประดิษฐาน พระพุทธมงคลศักดิ์สิทธิ์ พระพุทธรูปคู่บ้านคู่เมืองอุทัยธานี โดยประเพณีตักบาตรเทโวในปีนี้ วัดสังกัสรัตนคีรีจะมีการจัดขึ้นในเดือน ตุลาคม ของทุกปี พิธีจะมีพระสงฆ์กว่า 500 รูป จะเดินลงมาตามบันได 449 ขั้น จากมณฑปบนยอดเขาสะแกกรังมาสู่ลานวัดสังกัสรัตนคีรีเบื้องล่าง เพื่อมารับบิณฑบาต สอดคล้องกับพุทธประวัติในวันที่พระพุทธเจ้าเสด็จลงมาจากสวรรค์ชั้นดาวดึงส์ภายหลังจากการเทศนาโปรดพระมารดา พุทธศาสนิกชนชาวไทยและชาวต่างชาติ ต่างอยากมาสัมผัสพิธีตักบาตรเทโว จ.อุทัยธานี สักครั้งในชีวิต
1-30 ก.ย.66 ฉีดวัคซีนได้ที่ สัตวแพทย์ฯ ม.เกษตร LINK
ขอเชิญชวนประชาชนนำสัตว์เลี้ยงเข้ามรับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ที่โรงพยาบาลสัตว์ ม.เกษตร ทั้ง 5 แห่ง ได้ฟรี ตั้งแต่วันที่ 1-30 กันยายน 2566
รพ.สัตว์ ม.เกษตรทั้ง 5 แห่งได้แก่
โรงพยาบาลสัตว์ ม.เกษตร กำแพงแสน
โรงพยาบาลสัตว์ ม.เกษตร หนองโพ
โรงพยาบาลสัตว์ ม.เกษตร หัวหิน
โรงพยาบาลสัตว์ ม.เกษตร ณ ทิพย์พิมาน
เดิน-วิ่ง เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว วันอาทิตย์ที่ 1 กันยายน 2567 LINK
เดิน-วิ่ง เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ๒๘ กรกฎาคม ๒๕๖๗ ชิงถ้วยพระราชทานสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามพระบรมราชกุมารี วันอาทิตย์ที่ 1 กันยายน 2567 สถานที่วิ่ง สวนสมเด็จพระนางเจ้าสิริกิติ์-สวนวชิรเบญจทัศ-สวนจตุจักร ระยะวิ่ง 3 ระยะ มินิมาราธอน ระยะทาง 10 กิโลเมตร ฟันรัน ระยะทาง 5 กิโลเมตร ฟันรัน ระยะทาง 2.5 กิโลเมตร
ประเพณีทำบุญเทกระจาด ศาลเจ้าแม่ลิ้มกอเหนี่ยว ประจำปี 2567 วันอาทิตย์ที่ 1 กันยายน (วัน 29 ค่ำเดือน 7 ตามปฏิทินจีน) LINK
ร่วมสร้างบุญแจกทานเป็นมหากุศล ร่วมกับเจ้าแม่ลิ้มกอเหนี่ยว ปีมังกรทอง ประเพณีทำบุญเทกระจาด ประจำปี 2567 วันอาทิตย์ที่ 1 กันยายน 2567 (วัน 29 ค่ำเดือน 7 ตามปฏิทินจีน)
เวลา 15.00 น. พิธีเซ่นไหว้ดวงวิญญาณบรรพบุรุษ และดวงวิญญาณไร้ญาติ (ตามธรรมเนียมจีน)
เวลา 16.00 น. แจกทาน ข้าวสาร อาหารแห้งเครื่องอุปโภคบริโภคให้แก่ผู้ยากไร้ในจังหวัดปัตตานี
ณ บริเวณศาลเจ้าเล่งจูเกียงปัตตานี และมูลนิธิเทพปูชนียสถาน (เจ้าแม่ลิ้มกอเหนี่ยว)
ร่วมทำบุญกับเจ้าแม่ฯ ร่วมบริจาคข้าวสาร น้ำตาลทราย และอาหารแห้ง ให้ผู้ยากไร้ในจังหวัดปัตตานี เนื่องในวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาดประจำปี 2567 ตั้งแต่วันนี้ถึง 2 กันยายน 2567
Lucky Run Series 2024 by ลอตเตอรี่พลัส 1 กันยายน 2567
ลอตเตอรี่พลัสจัดใหญ่ จัดเต็ม “วิ่งลุ้นรวย!” เอาใจสายวิ่งและสายลุ้น ชวนมาร่วมสนุก ร่วมลุ้นกับกิจกรรมวิ่งสุดบันเทิงแห่งยุค! Lucky Run Series 2024 by ลอตเตอรี่พลัส งวดที่ 1 สนามกรุงเทพฯ ณ สวนหลวง ร.9 -วันจัดกิจกรรม: อาทิตย์ที่ 1 กันยายน 2567 -ระยะทาง: 3 กม. และ 5 กม. -รับอุปกรณ์: 09.30-15.00 น. -เริ่มวิ่ง: 16.30 น. ถึง 18.00 น. -ราคาบัตร: 400 บาท และ 450 บาท -รูปแบบ: วิ่งฟันรัน ตะลุยด่านลุ้นโชค 4 ด่าน
2 กันยายน : Zubin Mehta & Symphony Orchestra of Maggio Musicale Fiorentino
Zubin Mehta & Symphony Orchestra of Maggio Musicale Fiorentino
Main Hall, Thailand Cultural Centre
Date and Time Saturday 2 September 2023 at 7:00 PM
Ticket Price 10,000/ 7,000/ 5,000/ 4,000/ 2,000
วาทยกรระดับตำนานที่ครองความยิ่งใหญ่มาหลายทศวรรษ สุบิน เมห์ทา จะมาพร้อมกับวงออร์เคสตราคู่ใจ Symphony Orchestra of Maggio Musicale Fiorentino เพื่อจัดแสดงสองบทเพลงอันยิ่งใหญ่ของไชคอฟสกี ซิมโฟนี หมายเลข 4 และ 6
สุบิน เมห์ทา เคยครองตำแหน่งผู้อำนวยการดนตรีของวงออร์เคสตราระดับท็อปของโลกมามากมาย ทั้ง มอนทรีออลซิมโฟนี ลอสแอนเจลิสฟิลฮาร์โมนิก อิสราเอลฟิลฮาร์โมนิก และ นิวยอร์กฟิลฮาร์โมนิก ส่วนกับวงออร์เคสตราระดับโลกจากนครฟลอเรนซ์นี้ เขาดำรงตำแหน่งหัวหน้าวาทยกรให้อยู่หลายทศวรรษ ก่อนจะเลื่อนขึ้นเป็นผู้อำนวยการกิตติมศักดิ์ตลอดชีพ พร้อมกับได้รับเกียรติจากคณะฯ ในการอุทิศชื่อหอแสดงดนตรีใหม่แก่เขา
จากความสำเร็จทางด้านดนตรีที่โดดเด่นในระดับนานาชาติ ชื่อของเขาได้รับการประทับลงบน Hollywood Walk of Fame เขาได้รับรางวัล “Praemium Imperiale” จากราชวงศ์ญี่ปุ่น, รางวัล Cross of Merit จากเยอรมนี และรางวัล Tagore Award ด้านวัฒนธรรมจากรัฐบาลอินเดีย อัจฉริยะภาพด้านดนตรีของเขาสืบทอดมาจากบิดา ซึ่งเป็นนักไวโอลินผู้ก่อตั้งวง Bombay Symphony Orchestra และนับเป็นเกียรติอย่างยิ่งที่สุบิน เมห์ทา ศิลปินระดับโลกให้เกียรติมาแสดงเปิดการฉลองครบ 25 ปี ของงานมหกรรมฯ ที่ยิ่งใหญ่ในครั้งนี้
วันเสาร์ที่ 2 กันยายน 2566 เวลา 19.00 น.
สนับสนุนโดย สถานเอกอัครราชทูตอิตาลี
วาทยกร: สุบิน เมห์ทา
รายการแสดง
ปีเตอร์ อีลิทช์ ไชคอฟสกี :
Symphony No. 4 in F minor, Op. 36 (Fatum)
Symphony No. 6 in B minor, Op. 74 (Pathétique)
งานประเพณีรับบัว วัดบางพลีใหญ่ใน อ.บางพลี จ.สมุทรปราการ (รอประกาศ)
งานประเพณีรับบัว เป็นโบราณที่ยังคงจัดในประเทศไทยเพียงแห่งเดียวในโลก ณ วัดบางพลีใหญ่ใน อ.บางพลี จ.สมุทรปราการนี่เอง จะทุกวันขึ้น 14 ค่ำ เดือน 11 ของทุกปี สำหรับปี 2566 นี้ ยังไม่ได้กำหนดวันที่แน่นอนอย่างเป็นทางการ (โปรดติดตาม)
สำหรับปีที่ผ่านมา (2565) งานประเพณีรับบัว จัดขึ้นเมื่อ วันที่ 20-23 ตุลาคม 2565 ที่ลานหน้าโบสถ์หลวงพ่อโต วัดบางพลีใหญ่ใน (พระอารามหลวง) อำเภอบางพลี จังหวัดสมุทรปราการ โดยมี ผู้ว่าราชการจังหวัดสมุทรปราการ นายชาติชาย อุทัยพันธ์ เป็นประธานเปิดงาน ร่วมกับข้าราชการระดับสูง หัวหน้าส่วนราชการประจำจังหวัดสมุทรปราการ และอำเภอบางพลี พี่น้องประชาชนร่วมพิธีเปิดงานเป็นจำนวนมาก 3 ก.ย. 66 @เขตดอนเมือง ศูนย์บริการสาธารณสุข 60 ฉีดวัคซีน ทำหมัน ฉีดไมโครชิป LINK
ศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร เขตดอนเมือง ร่วมกับ สำนักงานเขตดอนเมือง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!
• ทำหมัน รับจำนวนจำกัด 100 ตัว
• จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 3 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนประชาอุทิศ (จันทาบอนุสรณ์) เขตดอนเมือง
3 กันยายน ฮ.Bell 412 บินรับผู้ป่วยชาย 49 ปีจากฝางส่งนครพิงค์
3 กันยายน 2566 เวลา 12.28 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 49 ปี มีอาการเจ็บแน่นหน้าอก วินิจฉัย ภาวะกล้ามเนื้อหัวใจขาดเลือดเฉียบพลัน (STEMI) เพื่อส่งผู้ป่วยจากโรงพยาบาลฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองบินตำรวจ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 412 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลนครพิงค์
งาน French Bulldog Party 3-9 กันยายน 2567
งาน French Bulldog Party 3-9 กันยายน 2567 ชั้น LG - Caribbean Village เทอร์มินอล21 พระราม3 กิจกรรมห้ามพลาด Meet & Greet กับเหล่าแก๊งเซเลปน้องหมาตัวจี๊ด 3 ก.ย. - พบกับ "น้องเดอะฮัค ลาเต้ มิสชูว มีเฮ" แก๊งเฟรนชี่ตัวตึง 5 ก.ย. - พบกับ "นปโปะ" หม่ำๆ หม่ำๆ กู้ดบอย 7 ก.ย. - พบกับ "น้องหมูนุ่ม วิบวับ" ดูโอ้ สุดน่ารัก 8 ก.ย. - พบกับ "สตีฟ สตีม" เจ้าน้องโกลเด้นและฮัสกี้ คาเฟ่ Dog City ยกทัพน้องหมาตัวตึง ที่ขนทัพความน่ารัก มาเติมเต็มความใจฟูวว แถมโปรเข้าฟรี! เมื่อช้อปสินค้าครบ 800 บาท/ใบเสร็จ *จำกัด 14 สิทธิ์/วัน
4-15 ก.ย.66 @เขตวังทองหลาง ศูนย์ฯ สาธารณสุข 15 บริการฉีดวัคซีนป้องกันพิษสุนัขบ้า LINK
ศูนย์บริการสาธารณสุข15ลาดพร้าว ชวนพาสัตว์เลี้ยงไปฉีดวัคซีนป้องกันพิษสุนัขบ้า โดยทางศูนย์ฯ ได้จัดหน่วยบริการฉีดวัคซีนป้องกันพิษสุนัขบ้าครั้งที่ 2 ในเดือนกันยายน ระหว่างวันที่ 4-15 กันยายน เวลา 9.00-11.30 น. กำหนดการออกหน่วยตามสถานที่ต่าง ๆ ตามภาพ หากมีข้อสงสัยสามารถสอบถามได้ที่ โทร. 02-5418380 02-9399538 หรือ เพจ Facebook ศูนย์บริการสาธารณสุข 15 ลาดพร้าว
4-15 ก.ย.66@เขตยานนาวา LINK
สำนักงานเขตยานนาวา ร่วมกับ ศูนย์บริการสาธารณสุข เจ็ด บุญมี ปุรุราชรังสรรค์ และ ศบส ห้าสิบห้า เตชะสัมพันธ์ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ระหว่างวันที่ 4 - 15 กันยายน 2566 ตั้งแต่เวลา 09.00 - 12.00 น. ลูกสุนัขควรได้รับการฉีดวัคซีนพิษสุนัขบ้าในสุนัขเข็มแรกเมื่อมีอายุประมาณ 16 – 18 สัปดาห์ ฉีดวัคซีนตามนัดหมายทุกครั้ง โดยสุนัขโต ต้องได้รับวัคซีนกระตุ้นซ้ำทุกปี
4-15 ก.ย.66@เขตหนองแขม LINK
สำนักงานเขตหนองแขม ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 4 - 15 กันยายน 2566 เวลา 09.00 - 12.00 น. ฟรี
4-25 ก.ย.66@เขตคลองสาน LINK
สำนักงานเขตคลองสาน ร่วมกับศูนย์บริการสาธารณสุข 28 กรุงธนบุรี ชวนทุกท่านนำสัตว์เลี้ยงฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย
ในวันเวลา และสถานที่ตามภาพ เวลา 10.00 - 12.00 น. สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร 028631664 ในวันและเวลาราชการ
4-15 ก.ย.66@บางรัก LINK
สำนักงานเขตบางรัก ร่วมกับ ศูนย์บริการสาธารณสุข 23 สี่พระยา สำนักอนามัย ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่เขตบางรัก ประจำปี 2566 ระหว่างวันที่ 4-15 กันยายนนี้
ทั้งนี้ให้บริการฉีดวัคซีนฟรี! ไม่มีค่าใช้จ่ายแต่อย่างใด สามารถนำลูกหลานสุดรักหรือน้องๆ มาฉีดวัคซีนกันได้ตามตารางด้านบนนะเออ
ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02 236 1395 ต่อ 6215 หรือศูนย์บริการสาธารณสุข 23 สี่พระยา โทร. 02 236 4055 , 080 552 3539
4-15 ก.ย.66@เขตบางเขน LINK
สำนักงานเขตบางเขน ร่วมกับศูนย์บริการสาธารสุข 24 บางเขน ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ตั้งแต่เวลา 10.00 ถึง 12.00 น.
4-16 ก.ย. 66 @เขตดินแดง LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตดินแดง ร่วมกับศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยงในพื้นที่เขตดินแดง ครั้งที่ 2
ระหว่างวันที่ 4 - 16 กันยายน 2566 เวลา 10.00 - 12.00 น. ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ขอเชิญประชาชนผู้ที่สนใจทุกท่านนำสุนัขและสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาดังกล่าวได้เลยจ้า
4-15 ก.ย.66 @เขตราษฎร์บูรณะ ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ และศูนย์บริการสาธารณสุข 58 ล้อม-พิมเสน ฟักอุดม LINK
สำนักงานเขตราษฎร์บูรณ ร่วมกับศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ และศูนย์บริการสาธารณสุข 58 ล้อม-พิมเสน ฟักอุดม กำหนดวันออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรีให้กับสัตว์เลี้ยงของประชาชนในพื้นที่ เขตราษฎร์บูรณะ ตั้งแต่เวลา 09.00 – 12.00 น. ดังนี้
วันที่ 4 กันยายน 2566 ณ ชุมชนแจงร้อน
วันที่ 5 กันยายน 2566 ณ ชุมชนสุขสวัสดิ์ 29
วันที่ 6 กันยายน 2566 ณ ชุมชนเบอร์ลี่
วันที่ 7 กันยายน 2566 ณ ชุมชนหมู่ 5 ประชาอุทิศ 17
วันที่ 8 กันยายน 2566 ณ ชุมชนหมู่ 3 ราษฎร์บูรณะ
วันที่ 11 กันยายน 2566 ณ ชุมชนรวมน้ำใจ
วันที่ 12 กันยายน 2566 ณ ชุมชนรัตนจีนะ
วันที่ 13 กันยายน 2566 ณ ชุมชนรวมน้ำใจในสวน
วันที่ 14 กันยายน 2566 ณ วัดราษฎร์บูรณะ
วันที่ 15 กันยายน 2566 ณ ซอยสุขสวัสดิ์ 42
เพื่อเป็นการป้องกันไม่ให้เกิดอันตรายต่อประชาชน และระงับการแพร่ระบาดของโรคพิษสุนัขบ้าในสัตว์ในพื้นที่เขตราษฎร์บูรณะ
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมฯ โทร. 02-4284884 ต่อ 6820
4-15 ก.ย.66 @เขตจตุจักร LINK
สำนักงานเขตจตุจักร ร่วมศูนย์บริการสาธารณสุข 51 จตุจักร และ ศูนย์บริการสาธารณสุข 17 ประชานิเวศน์ จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในพื้นที่เขตจตุจักร จึงขอเชิญชวนประชาชนนำสัตว์เลี้ยง สุนัขและแมวที่มีสุขภาพแข็งแรง ไม่อยู่ระหว่างตั้งท้อง และมีอายุมากกว่า 3 เดือนขึ้นไป เข้าร่วมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯ เคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่าย ตั้งแต่วันที่ 4-15 กันยายน 2566 ตามสถานที่และเวลาดังกล่าว สามารถสอบถามรายละเอียดเพิ่มเติม ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตจตุจักร โทร.02-5139947
4-15 ก.ย.66@เขตประเวศ LINK
สำนักงานเขตประเวศ ขอเชิญชวนประชาชนในพื้นที่เขตประเวศ พาน้องหมาน้องแมวเข้ารับบริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าระหว่างวันที่ 4-15 กันยายน 2566 โดยมีรายละเอียด
ภายใต้ความร่วมมือของ สำนักงานเขตประเวศ โดย #ฝ่ายสิ่งแวดล้อมและสุขาภิบาล #ศูนย์บริการสาธารณสุข 22 (วัดปากบ่อ) #ศูนย์บริการสาธารณสุข 57 (บุญเรือง ล้ำเลิศ)
สอบถามรายละเอียดเพิ่มเติม ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร.02-3287153
4-13 ก.ย.66@เขตพระโขนง LINK
ศูนย์บริการสาธารณสุข 34 โพธิ์ศรี ร่วมกับ สำนักงานเขตพระโขนง ได้จัดบริการออกหน่วยให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่เขตพระโขนง ตั้งแต่วันที่ 4 - 13 กันยายน 2566 ตามสถานที่ข้างต้น โดยท่านสามารถนำสัตว์เลี้ยงมารับวัคซีนตามจุดบริการ ได้ ตั้งแต่เวลา09.00-11.00 ไม่เสียค่าใช้จ่ายใดๆ
4-15 ก.ย.66 @เขตจอมทอง LINK
สำนักงานเขตจอมทอง ร่วมกับ #ศูนย์บริการสาธารณสุข29 (ช่วง นุชเนตร) สำนักอนามัย จัดหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง เพื่อเสริมสร้างภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ประจำปี 2566 (รอบที่ 2 ) ระหว่างวันที่ 4-15 กันยายน 2566 จำนวน 10 วัน ตั้งแต่เวลา 09.00- 12.00 น. lอบถามเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ชั้น 4 สำนักงานเขตจอมทอง โทร 02-4276671
4–8 ก.ย.66@เขตบางคอแหลม LINK
ศูนย์บริการสาธารณสุข 18 มงคล-วอน วังตาล ร่วมกับสำนักงานเขตบางคอแหลม จัดหน่วยเคลื่อนออกรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงใน เขตบางคอแหลม ระหว่างวันที่ 4–8 กันยายน 2566 เวลา 9.00-12.00 น. สอบถามโทร. 02-2110860
4-15 ก.ย. 66 @เขตบึงกุ่ม LINK
เขตบึงกุ่ม ร่วมกับศูนย์สาธารณะสุข 50 บึงกุ่ม และศูนย์สาธารณะสุข 56 ทับเจริญ ประชาสัมพันธ์ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!!! สามารถรับบริการได้ตามวันและเวลาที่กำหนด ตั้งแต่วันที่ 4-15 กันยายน 2566 สอบถามข้อมูล โทร 02-3647385
4-27 ก.ย.66 @ เขตคลองเตย โดย ศูนย์41 คลองเตย และ ศูนย์ 10 สุขุมวิท LINK
สำนักงานเขตคลองเตย โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุขที่ 41 คลองเตย และศูนย์บริการสาธารณสุขที่ 10 สุขุมวิท จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประจำปี 2566 ครั้งที่ 2 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ฟรี‼️ไม่มีค่าใช้จ่ายใดๆ
หากท่านใดสนใจสามารถนำสัตว์เลี้ยง น้องหมาน้องแมวที่มีสุขภาพแข็งแรง อายุตั้งแต่ 3 เดือนขึ้นไป ไปรับวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯเคลื่อนที่ใกล้บ้านท่านได้ โดยเริ่มออกหน่วยเคลื่อนที่ฯ ตั้งแต่วันที่ 4 - 27 กันยายน 2566 เวลา 09.00-12.00 น.
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคลองเตย โทร.02-2495532
4-15 ก.ย.66 @เขตบางกะปิ LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางกะปิ ร่วมกับ ศูนย์บริการสาธารณสุข 35 หัวหมาก ขอประชาสัมพันธ์กำหนดการออกหน่วยให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 4-15 กันยายน 2566 ตั้งแต่ เวลา 9:00 - 11.00 น ตามวันเวลาและสถานที่ดังนี้ #ขอเชิญชวนผู้ที่สนใจสามารถนำสัตว์เลี้ยงเข้ารับบริการได้ฟรี
4-15 ก.ย.66 @เขตสายไหม LINK
สำนักงานเขตสายไหม เชิญชวนประชาชนพื้นที่เขตสายไหมนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 4-15 กันยายน 2566
4-15 ก.ย.66 @คลองสามวา LINK
ประชาสัมพันธ์ ศูนย์บริการสาธารณสุข64 คลองสามวา ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ระหว่างวันที่ 4-15 กันยายน 2566
4-15 ก.ย.66@บางบอน LINK
ตารางการออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์ ตั้งแต่วันที่ 4-15 กันยายน 2566 เวลา9.30-11.30 น. สอบถามข้อมูลเพิ่มเติม โทร. 02-4530526 ต่อ 407 งานควบคุมโรคติดต่อ ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน
4-14 ก.ย.66@เขตหนองจอก LINK
เขตหนองจอก ประชาสัมพันธ์การออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 4 - 14 กันยายน 2566
4-15 ก.ย.66@เขตดอนเมือง LINK
ศูนย์บริการสาธารณสุข หกสิบ รสสุคนธ์ มโนชญากร เขตดอนเมือง ขอเชิญ...นำสัตว์เลี้ยงของท่านมารับวัคซีนกัน วันที่ 4-15 กันยายน ตามกำหนดการ สอบถามโทร. 02-5655257
4-15 ก.ย.66@เขตพญาไท LINK
ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์ ให้บริการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกัน โรคพิษสุนัขบ้า (สำหรับสัตว์เลี้ยง) ฟรี ‼️ ไม่มีค่าใช้จ่าย วันที่ 4-15 กันยายน 2566
ตั้งแต่ เวลา 09.00 - 12.00 น. ตามวันและสถานที่ที่กำหนด
4-15 ก.ย.66 @เขตธนบุรี ศูนย์บริการสาธารณสุข 27 จันทร์ ฉิมไพบูลย์ LINK
ศูนย์บริการสาธารณสุข 27 จันทร์ ฉิมไพบูลย์ ประชาสัมพันธ์ แผนการออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง เวลา 9-11 น.
4 ก.ย.66 ชุมชนตรอกเทวดา
5 ก.ย.66 ชุมชนตากสินสัมพันธ์
6 ก.ย.66 ชุมชนสวนพลู
7 ก.ย.66 วัดกันตะทาราราม
8 ก.ย.66 ชุมชนข้างสถานีรถไฟวงเวียนใหญ่
11 ก.ย.66 ชุมชนปากคลองบางสะแก
12 ก.ย.66 วัดบางสะแกนอก
13 ก.ย.66 วัดบางสะแกใน
14 ก.ย.66 วัดใหม่ยายนุ้ย
สัตว์เลี้ยงที่สามารถฉีดวัคซีนได้
1.ต้องมีอายุ 3 เดือนขึ้นไป
2.ไม่ตั้งครรภ์หรือกำลังให้นมบุตร
3.ไม่ป่วย
4-15 ก.ย. 66 @เขตประเวศ ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ
เขตประเวศ โดยศูนย์บริการสาธารณสุข ห้าสิบเจ็ด บุญเรือง ล้ำเลิศ ประชาสัมพันธ์ "ตารางการออกหน่วยฉีดวัคซีนพิษสุนัขบ้าในสัตว์เลี้ยง ตั้งแต่วันที่ 4 - 15 กันยายน 2566
4-15 ก.ย.66 @เขตบางนา ศูนย์บริการสาธารณสุข 8 และศูนย์บริการสาธารณสุข 32
สำนักงานเขตบางนา ร่วมกับศูนย์บริการสาธารณสุข 8 และศูนย์บริการสาธารณสุข 32 กำหนดออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ฟรี !! ตั้งแต่เวลา 09.00 - 11.00 น. ทั้ง 11 วัน สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2173 5270
4-15 ก.ย.66@เขตทวีวัฒนา
ฝ่ายสิ่งแวดล้อมและสุขาภิบาลร่วมกับศูนย์บริการสาธารณสุข 67 (ทวีวัฒนา) เชิญชวนประชาชนนำสัตว์เลี้ยง สุนัข แมว นำไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ครั้งที่ 2 โดยจัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง เพื่ออำนวยความสะดวกให้กับประชาชน ผู้ที่สนใจสามารถนำสัตว์เลี้ยงลูกด้วยนมทุกชนิด มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในระหว่างวันที่ 4-15 กันยายน 2566 เวลา 10.00 - 12.00 น. สามารถนำมาฉีดได้ "ฟรี " ตามจุดรับบริการดังกล่าว
4-15 ก.ย.66 @เขตปทุมวัน ศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์
ศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์ กำหนดการออกหน่วยเคลื่อนที่ เพื่อฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 2 ประจำปี 2566 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์ และศูนย์บริการสาธารณสุข 16 ลุมพินี ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงลูกด้วยนม เช่น สุนัข แมว กระต่าย ฯลฯ เพื่อเป็นการป้องกันและควบคุมโรคพิษสุนัขบ้าในพื้นที่เขตปทุมวัน
4-15 ก.ย. 66 @เขตราชเทวี ศูนย์บริการสาธารณสุข 2 วัดมักกะสัน LINK
ศูนย์บริการสาธารณสุข 2 วัดมักกะสัน ร่วมกับฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตราชเทวี จัดหน่วยเคลื่อนที่ ออกรณรงค์ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ในพื้นที่เขตราชเทวี ระหว่างวันที่ 4-8 และ 11-15 กันยายน 2566 บริการฟรี สามารถมาใช้บริการได้ตามสถานที่ที่ระบุ
4 - 15 กันยายน 2567 เขตหนองแขม ออกหน่วยเคลื่อนที่ฉีดวัคซีนฟรี
สำนักงานเขตหนองแขม ร่วมกับศูนย์บริการสาธารณสุข 48 (นาควัชระอุทิศ) กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ฟรี ระหว่างวันที่ 4-15 กันยายน 2567 ตั้งแต่เวลา 09.00 – 12.00 น.
4-15 ก.ย.66 @เขตลาดกระบัง ศบส.46 กันตารัติอุทิศ LINK
ศบส.46 กันตารัติอุทิศ เขตลาดกระบัง เชิญชวน ประชาชนที่อยู่ในพื้นที่ดังกล่าว นำสัตว์เลี้ยงของท่านมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยเจ้าหน้าที่จะเข้าดำเนินการ ลงพื้นที่แบบ หน่วยเคลื่อนที่ไปยังชุมชนของท่าน ระหว่างวันที่ 4 - 15 กันยายน 2566 สถานที่ ตามรายละเอียด
4-15 ก.ย.66 @เขตลาดกระบัง ศบส.45 ร่มเกล้า
ศูนย์บริการสาธารณสุข 45 ร่มเกล้า จัดออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในชุมชนตามกำหนดการประจำปี วันที่ 4-8 และ 11-14 กันยายน 2566 ตามสถานที่ในภาพ สามารถนำสัตว์เลี้ยงของท่านมารับวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี ไม่มีค่าใช้จ่าย
สอบถามข้อมูลเพิ่มเติมได้ที่ อสส.หรือผู้นำชุมชนที่มีรายชื่อ หรือโทร 02543 0393 ต่อ 306 แผนกควบคุมโรค ศบส.45 ร่มเกล้า ในวันและเวลาราชการ
หมายเหตุ* หากเป็นชุมชนพื้นที่ไม่มีศูนย์สุขภาพชุมชน อาจใช้วิธี นำรถออกไปฉีดตามจุดที่มีบ้านเรือนตั้งอยู่เยอะๆ แทน
5 -16 ก.ย.65 ศูนย์ฯ 43 มีนบุรี ออกหน่วยเคลื่อนที่ LINK
ศูนย์บริการสาธารณสุข 43 มีนบุรี ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2565 ตั้งแต่วันที่ 5 -16 กันยายน 2565 ผู้สนใจพาสัตว์เลี้ยงมารับบริการได้ ฟรี ได้ที่จุดให้บริการดังนี้
5 กันยายน 2565 ศูนย์สุขภาพชุมชนวาสนา
6 กันยายน 2565 รร.สุเหร่าทรายกองดิน
7 กันยายน 2565 หมู่บ้านปรีชา 10 (ท้ายหมู่บ้าน)
8 กันยายน 2565 หมู่บ้านมีนบุรีการ์เด้นโฮม (ลานกีฬาชุมชน)
9 กันยายน 2565 หมู่บ้านพฤกษาวิลล์ 5 (ลานกีฬาชุมชน)
12 กันยายน 2565 หมู่บ้านบัวขาวฝั่งใน (ศูนย์สุขภาพชุมชน)
13 กันยายน 2565 ชุมชนสินธานี 2 ชมรมผู้สูงอายุ ท้ายซอย
14 กันยายน 2565 ชุมชนปรีชา 11 ลานกิจกรรม
15 กันยายน 2565 หมู่บ้านรุ่งนภา 2 (ท้ายหมู่บ้าน)
16 กันยายน 2565 ชุมชนเคหะรามคำแหง ศาลาอเนกประสงค์
5-16 ก.ย.65 ศูนย์ฯ 24 บางเขน ออกหน่วยฉีดวัคซีน ฟรี LINK
ศูนย์บริการสาธารณสุข 24 บางเขน ประกาศกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 5 - 16 กันยายน 2565 ฟรี !!
5 กันยายน 2565 ชุมชนโสรัส
6 กันยายน 2565 ชุมชนชมรมพหลโยธิน 48
7 กันยายน 2565 ชุมชนรุ่งสว่างวิลเลจ
8 กันยายน 2565 ชุมชนเพชรสยาม
9 กันยายน 2565 ชุมชนเคหะรามอินทรา
12 กันยายน 2565 ชุมชนหมู่บ้านเฉลิมสุขนิเวศน์
13 กันยายน 2565 ชุมชนหมู่บ้านพัชรัฐ
14 กันยายน 2565 ชุมชนอุทิศนุสรณ์
15 กันยายน 2565 ชุมชนหมู่บ้านสินทรัพย์นคร
16 กันยายน 2565 ชุมชนหมู่บ้านเฉลิมสุข 9
5-9 ก.ย.65 ศูนย์ฯ 16 ลุมพินี ออกหน่วยฉีดวัคซีน ฟรี LINK
ศูนย์บริการสาธารณสุข 16 ลุมพินี ขอเชิญชวนพาสัตว์เลี้ยงมารับวัคซีนป้องกันโรคพิษสุนัขบ้า เวลา 9-111 น. ตามวันและสถานที่ดังนี้
5 กันยายน ชุมชนพระเจน
6 กันยายน ชุมชนโปโล ชุมชนร่วมฤดี
7 กันยายน ชุมชนหลังวัดปทุมวนาราม
8 กันยายน ชุมชนพัฒนาบ่อนไก่
9 กันยายน ชุมชนเคหะบ่อนไก่ ชุมชนกุหลาบแดง
5-16 ก.ย.65 ศูนย์ 15 ลาดพร้าว ออกหน่วยฉีดวัคซีน ฟรี LINK
5 กันยายน 2565 สะพานสอง แจ่มศึกษา
6 กันยายน 2565 ชุมชนจันทราสุข
7 กันยายน 2565 หมู่บ้านประชากรไทย ซ.ลาดพร้าว 93
8 กันยายน 2565 หมู่บ้านปรางทิพย์ ซ.ลาดพร้าว 97 (ลานกีฬา)
9 กันยายน 2565 หมู่บ้านอยู่เจริญ
12 กันยายน 2565 ชุมชนสุเหร่าดอนสะแก
13 กันยายน 2565 ซ.ลาดพร้าว 110
14 กันยายน 2565 ชุมชนเทพลีลา
15 กันยายน 2565 ชุมชนทรัพย์สินใหม่
16 กันยายน 2565 หมู่บ้านพลับพลา 30 ไร่ ซ.รามคำแหง 21
สอบถามโทร.02-5418380 02-9399583
5-16 ก.ย.65 ศูนย์ฯ 13 ไมตรีวานิช ออกหน่วยฉีดวัคซีน ฟรี LINK
5 กันยายน 2565 วัดปทุมคงคา
6 กันยายน 2565 วัดจักรวรรดิราชวาส
7 กันยายน 2565 วัดสัมพันธวงศาราม
8 กันยายน 2565 ชุมชนพิพากษา
9 กันยายน 2565 วัดชัยชนะสงคราม
12 กันยายน 2565 ชุมชนภิรมย์
13 กันยายน 2565 ชุมชนโปลิสสภา/ชุมชนโชฎึก/วัตไตรมิตร
14 กันยายน 2565 ชุมชนตลาดน้อย/ศาลเจ้าโจวซือกง
15 กันยายน 2565 ชุมชนกรมภูธเรศร์
16 กันยายน 2565 สำนักงานเขตสัมพันธวงศ์
สอบถามโทร.02-2330846
5-16 ก.ย.65 ศูนย์ฯ 27 จันทร์ ฉิมไพบูลย์ ออกหน่วยฉีดวัคซีน ฟรี LINK
5 กันยายน 2565 ชุมชนสองร้อยห้อง
6 กันยายน 2565 ชุมชนวัดใหญ่ศรีสุพรรณ / สามัคคีศรีสุพรรณ
7 กันยายน 2565 ชุมชนสายสัมพันธ์ (ลานจอดรถ)
8 กันยายน 2565 ชุมชนตากสินสัมพันธ์
9 กันยายน 2565 ชุมชนตรอกเทวดา
12 กันยายน 2565 ชุมชนสนามแดง
13 กันยายน 2565 ชุมชนปากคลองบางสะแก
14 กันยายน 2565 ชุมชนรวมพลัง
15 กันยายน 2565 ชุมชนกุฎิขาว / ชุมชนวัดประยูรวงศ์
16 กันยายน 2565 ชุมชนวัดกัลยาณ์ / ชุมชนกุฎีจีน
สอบถามโทร.02-4650025
5-16 ก.ย.65 ศูนย์ฯ 26 เจ้าคุณพระประยุรวงศ์ ออกหน่วยฉีดวัคซีน ฟรี
5 กันยายน 2565 ชุมชนประสานมิตร บริเวณบ้านลุงวิชัย หัวโค้งเข้าตลาด
6 กันยายน 2565 ชุมชนวัดใหญ่ศรีสุพรรณ / สามัคคีศรีสุพรรณ
7 กันยายน 2565 ชุมชนศรีภูมิ (ลานจอดรถ)
9 กันยายน 2565 ชุมชนสี่แยกบ้านแขก (หน้าบ้านประธานชุมชน) / มัสยิดบ้านสมเด็จ (หน้าศูนย์สุขภาพชุมชน บ้านป้าสะเย๊าะ)
12 กันยายน 2565 ชุมชนบางไส้ไก่ หน้าศูนย์สุขภาพองค์พระ
13 กันยายน 2565 ชุมชนวัดประดิษฐาราม (ลานจอดรถ)
14 กันยายน 2565 ชุมชนโรงคราม / ชุมชมบุปผาราม
15 กันยายน 2565 ชุมชนกุฎิขาว / ชุมชนวัดประยูรวงศ์ (ท้ายตลาดนกกระจอก สะพานพลอย)
16 กันยายน 2565 ชุมชนวัดกัลยาณ์ (ศูนย์สุขภาพคอนโดข้างวัดฯ) / ชุมชนกุฎีจีน (ที่ทำการชุมชน)
สอบถามโทร.02-4650014 ต่อ 412
5-13 ก.ย.65 ศูนย์ฯ 12 จันทร์เที่ยง เนตรวิเศษ ออกหน่วยฉีดวัคซีน ฟรี LINK
สำนักงานเขตบางคอแหลมร่วมกับศูนย์บริการสาธารณสุข บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เสี้ยง ตามรายละเอียดรูปด้านล่างนะคะ หรือสามารถติดต่อสอบถามฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางคอแหลม โทร 02-291-0284 ต่อ 5918
5 กันยายน ชุมชนวัดจันทร์ใน / ชุมชนบางโคล่
6 กันยายน ชุมชนเมืองอยู่ดี
7 กันยายน ชุมชนวัดอินทร์บรรจง / ชุมชนวัดไผ่เงิน
8 กันยายน ชุมชนวัดลาดบัวขาว / ชุมชนโรงแก้ว
9 กันยายน ชุมชนห้องเย็น
12 กันยายน ชุมชนวัดพระยาไกรระยะ 3
13 กันยายน ชุมชนโรงเจ
5-26 ก.ย.65 ศูนย์ฯ 36 บุคคโล ออกหน่วยฉีดวัคซีน ฟรี LINK
5 กันยายน 2565 ตรอกพระปิ่น 6 หลังวินมอไซด ชุมชนสองร้อยห้อง
7 กันยายน 2565 ชุมชนสายสัมพันธ์ (ลานจอดรถ)
12 กันยายน 2565 ชุมชนสนามแดง ทางเข้าหมู่บ้านสาริน
14 กันยายน 2565 ศูนย์สุขภาพชุมชนรวมพลัง
19 กันยายน 2565 ชุมชนแซ่ซิ้ม ศาลพระภูมิกลางชุมชน
21 กันยายน 2565 ศูนย์สุขภาพชุมชนมะนาวหวาน
26 กันยายน 2565 ศูนย์สุขภาพชุมชนโกวบ๊อพัฒนา
ให้บริการเวลา 9-11.30 น.
สอบถามโทร.02-4685297
5-16 ก.ย.65 ศูนย์ฯ 49 วัดชัยพฤกษมาลา ออกหน่วยฉีดวัคซีน ฟรี LINK
เวลา 10-12 น.
5 กันยายน 2565 ชุมชนหลังวัดรัชฎาธิษฐาน
6 กันยายน 2565 ชุมชนริมทางรถไฟชัยพฤกษ์
7 กันยายน 2565 ชุมชนมบ.พัฒนา ม.7 ฉิมพลี
8 กันยายน 2565 วัดประสาท
9 กันยายน 2565 ชุมชนสะพานผัก-คลองศาลเจ้า
12 กันยายน 2565 ชุมชนวัดกระจัง
13 กันยายน 2565 ชุมชนวัดจำปา
14 กันยายน 2565 วัดศิริวัฒนาราม
15 กันยายน 2565 ชุมชนวัดชัยพฤกษมาลา
16 กันยายน 2565 วัดเพลงกลางสวน
5-16 ก.ย.65 ศูนย์ฯ 64 คลองสามวา ออกหน่วยฉีดวัคซีน ฟรี LINK
ศูนย์บริการสาธารณสุขที่64 คลองสามวา แจ้งกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี2565 ระหว่างวันที่ 5-16 กันยายน2565 เวลา 09.00-11.30 น.บริการฟรี ไม่มีค่าใช้จ่าย
5 กันยายน 2565 หมู่บ้านเมืองประชา
6 กันยายน 2565 ชุมชนบำรุงสุข-บุญมา หมู่บ้านเบล็สวิลล์ หมู่บ้านพฤกษา
7 กันยายน 2565 หมู่บ้านสุภาวัลย์ ชุมชนหทัยราษฎร์ 8 และ 31
8 กันยายน 2565 หมู่บ้านบ้านพูน / หมู่บ้านพนาสนธิ์ 4 / หมู่บ้านอาลักษณ์ / หมู่บ้านนันทิศา
9 กันยายน 2565 หมู่บ้านเลิศอุบล ริมคลองพระยาสุเรนทร์
12 กันยายน 2565 หมู่บ้านร่มทิพย์
13 กันยายน 2565 สุเหร่าแสนแสบ
14 กันยายน 2565 หมู่บ้านวรารักษ์
15 กันยายน 2565 หมู่บ้านบุศรินทร์ หมู่บ้านเคซี 5 หมู่บ้านเสนา
16 กันยายน 2565 ชุมชนเคหะคลอง 9
สอบถามโทร.02-5480495 ถึง 8
5-16 ก.ย.65 ศูนย์ฯ 65 รักษาศุข บางบอน ออกหน่วยฉีดวัคซีน ฟรี LINK
ตารางการออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์ ตั้งแต่วันที่ 5-16 กันยายน 2565 เวลา9.30-11.30 น. สอบถามข้อมูลเพิ่มเติม โทร . 02 453 0526 ต่อ 407 งานควบคุมโรค
5 กันยายน 2565 วัดนินสุขาราม
6 กันยายน 2565 ชุมชนคลองบางพราน
7 กันยายน 2565 หมู่บ้านพระปิ่น 5
8 กันยายน 2565 ชุมชนสวนผัก
9 กันยายน 2565 ชุมชนบางบอน 5 ซ.6
12 กันยายน 2565 ซอยเอกชัย 82 84 86
13 กันยายน 2565 หมู่บ้านกานดาการ์เด้น
14 กันยายน 2565 ชุมชนหนทางใหม่ปิ่นทอง
15 กันยายน 2565 ชุมชนรางโพธิ์
16 กันยายน 2565 บ้านมั่งคงวิมานทอง
สอบถามโทร.094-1915161 , 081-8216963
กันยายน 2565 BDMS เปิดตัว "N Health Novogene Genomics" ศูนย์การแพทย์จีโนมิกส์ชั้นนำแห่งเอเซียตะวันออกเฉียงใต้ LINK
BDMS เปิดตัว N Health Novogene Genomics โครงการ BDMS Genomic Center โครงการที่นำเอาเทคโนโลยีอิลลูมินา (Illumina) นวัตกรรมเทคโนโลยีขั้นสูงของการวิเคราะห์หาลำดับดีเอ็นเอและการหาลำดับเพื่อการรักษาโรคที่ใช้อย่างแพร่หลายในแล็บชั้นนำระดับโลกมาใช้ในไทย ยกระดับขีดความสามารถทางการแพทย์ของไทยให้เป็นอีกหนึ่งทางเลือกในการรักษาแบบเฉพาะบุคคล พร้อมเตรียมให้ความร่วมมือสถาบันการศึกษาทางการแพทย์เพื่อพัฒนาบุคลากรให้พร้อมรองรับ หวังสร้างให้ไทยก้าวสู่การเป็น Genomic Center แห่งเอเชียตะวันออกเฉียงใต้
5-19 ก.ย.66@เขตพระนคร LINK
สำนักงานเขตพระนคร ร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ จัดหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 5 - 19 กันยายน 2566 (ในวันราชการ)
เวลา 10.00 - 12.00 น. ไม่เสียค่าใช้จ่าย สัตว์เลี้ยงที่เข้ารับวัคซีนจะต้องมีสุขภาพแข็งแรง ไม่ป่วย และมีอายุ 3 เดือนขึ้นไป จึงขอประชาสัมพันธ์เชิญชวนประชาชนนำสัตว์เลี้ยง มาฉีดวัคซีนฯ ตามวัน เวลา และสถานที่ที่กำหนด สอบถามเพิ่มเติม โทร. 022818921
Healthy Living & Innovation Expo 2024 วันที่ 5-8 กันยายน 2567
Healthy Living & Innovation Expo 2024 ระหว่างวันที่ 5-8 กันยายน 2567 เวลา 10.00 - 20.00 น. ณ ศูนย์ประชุมนานาชาติฯ ม.อ. หาดใหญ่ งานแสดงสินค้า บริการ และนวัตกรรมเพื่อคนรักสุขภาพ งานที่รวบรวมสินค้าและบริการ ด้านการดูแลสุขภาพ การดูแลความงาม การดูแลผู้สูงอายุ และนวัตกรรมใหม่ที่พร้อมต่อยอด สร้างโอกาสทางธุรกิจ พร้อมทั้งกิจกรรมต่างๆ อีกมากมาย
KhonKaen10 วันที่ 7-8 กันยายน 2567 LINK
KhonKaen10 หนึ่งในซีรีย์ Khon Kaen Road Race 7-8 ก.ย. 2567 ที่มหาวิทยาลัยขอนแก่น การแข่งขันปีนี้ นอกจากประเภท 10 Km (Mini Marathon) แล้ว ยังมีการแข่งขันประเภทอื่น ๆ ที่เน้นความเป็นครอบครัว เช่น ประเภท Fun Run - 4 Km / ประเภท Kids Run - 3 Km / และที่น่าตื่นเต้นคือ Relay - ประเภททีมผลัด เปิดรับสมัครจันทร์ที่ 1 ก.ค. 2567 เวลา 12.10น.
พังงาบีชรัน 2024 วันที่ 7 กันยายน 2567
พังงาบีชรัน 2024 วิ่งวันที่ 7 กันยายน 2567 ณ ชายทะเลท้ายเหมือง
Buakaw Run สุดเอ็กซ์ตรีม 7 กันยายน 2567
งาน Buakaw Run 7 กันยายน 2567 งานวิ่งในบรรยากาศค่ายทหาร ศูนย์การกำลังสำรอง (ศสร.) อ.ปราณบุรี จ.ประจวบคีรีขันธ์ โดยร่วมวิ่งกับนักมวยไทยอย่าง บัวขาว บัญชาเมฆ ระยะวิ่ง: 5K, 10K วัตถุประสงค์หลัก : งานวิ่งบัวขาวรันจัดขึ้นเพื่อส่งเสริมการออกกำลังกายและสุขภาพที่ดีให้กับชุมชน โดยมีเป้าหมายในการเชิญชวนให้ผู้คนมาร่วมกิจกรรมที่สร้างสรรค์และมีประโยชน์ บัวขาว บัญชาเมฆ ในฐานะนักมวยชื่อดัง มุ่งหวังที่จะเป็นตัวอย่างที่ดีในการส่งเสริมวิถีชีวิตที่มีสุขภาพดี
วิ่งมหากาพย์ รามเกียรติ์ 3 ทัพ ทศกัณฐ์ยกทัพ พระนารายณ์อวตาร ศึกกุมภกรรณ์ 22 กันยายน 2567 LINK
วิ่งมหากาพย์ รามเกียรติ์ RAMAKIAN RUN 3 ทัพ
ทศกัณฐ์ยกทัพ วันอาทิตย์ที่ 8 กันยายน 2567 ณ อุทยานพระบรมราชานุสรณ์ พระบาทสมเด็จพระพุทธเลิศหล้านภาลัย จังหวัดสมุทรสงคราม ระยะยกทัพ : 3 K : 5K : 13 K : วิ่งเก็บระยะ VRRUN
พระนารายณ์อวตาร วันอาทิตย์ที่ 15 กันยายน 2567 ณ วัดขนอนหนังใหญ่ จังหวัดราชบุรี ระยะยกทัพ : 3 K : 5K : 10 K : วิ่งเก็บระยะ VRRUN
ศึกกุมภกรรณ์ วันอาทิตย์ที่ 22 กันยายน 2567 ณ วัดเขาสมอคอน จังหวัดลพบุรี ระยะยกทัพ : 3 K : 5K : 10 K : วิ่งเก็บระยะ VRRUN
เปิดรับสมัครพร้อมกัน 3 สนาม
สมุทรสงคราม : ณ อุทยาน ร.2 /วันอาทิตย์ที่ 8 กย. 67
ราชบุรี : ณ วัดขนอนหนังใหญ่ /วันอาทิตย์ที่ 15 กย. 67
ลพบุรี : ณ วัดเขาสมอคอน /วันอาทิตย์ที่ 22 กย. 67
First Aid Run วิ่งแบ่งปันวัน First Aid โลก 8 กันยายน 2567 LINK
กิจกรรม เดิน-วิ่งการกุศล First Aid Run วิ่งแบ่งปันวัน First Aid โลก เนื่องใน วันปฐมพยาบาลโลก
รายได้สมทบทุนจัดซื้อ First Aid Kitให้กับโรงเรียนตำรวจตระเวนชายแดนในถิ่นทุรกันดาร 200 โรงเรียน
เปิดรับสมัครแล้ววันนี้ ถึงวันที่ 31 สิงหาคม 2567
ค่าสมัครวิ่งพร้อมเสื้อ: ราคา 500 บาท / หากรับเฉพาะเสื้ออย่างเดียว: ราคา 300 บาท (ใบเสร็จรับเงินค่าสมัครวิ่งหรือซื้อเสื้ออย่างเดียวไม่สามารถนำไปลดหย่อนภาษีได้)
กำหนดการ:
วันอาทิตย์ที่ 8 กันยายน 2567 บริเวณจัดกิจกรรมอุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย
รวมตัวเข้าจุดการเริ่มแข่งขันตั้งแต่เวลา 05:00 น.
และจบกิจกรรมการวิ่งเวลา 08:00 น.
Scenic Half Marathon Krabi 2023, 9 - 10 September LINK
Scenic Half Marathon Krabi 2023 - RUN TO THE HORIZON RUN ROMANTIC Date 9 - 10 September 2023 The most satisfying running route to conquer the horizon. On the romantic road, release: at Hat Noppharat Thara-Phi Phi Islands National Park, Ao Nang Subdistrict, Mueang District, Krabi Province Beach Run 3 KM / 5 KM / Half Marathon 21.1 KM / Mini Marathon 10 KM
9 กันยายน : Aida by Helikon Opera
Aida by Helikon Opera
Main Hall, Thailand Cultural Centre
Date and Time Saturday 9 September 2023 at 7:00 PM
Ticket Price 6,000/ 5,000/ 4,000/ 3,000/ 1,800 THB
เรื่องราวของความรักที่ก่อตัวขึ้นท่ามกลางไฟสงครามและความขัดแย้ง การทรยศหักหลัง การต่อสู้กันระหว่างเสียงของหัวใจและหน้าที่ความรับผิดชอบต่อแผ่นดิน
Aida โอเปราชิ้นเอก ที่นักประพันธ์ Giuseppe Verdi แต่งขึ้นใน ค.ศ. 1870 เพื่อจัดแสดงที่โรงละครโอเปราที่เก่าแก่ที่สุดของไคโร จะนำทุกท่านย้อนไปสู่ยุคของฟาโรห์ เพื่อพบกับโศกนาฏกรรมความรักครั้งยิ่งใหญ่ของทหารหนุ่มชาวอียิปต์และเจ้าหญิงเอธิโอเปียที่ตกเป็นเชลยสงคราม
จัดแสดงพร้อมวงออร์เคสตราและคอรัสจาก Helikon Opera คณะละครโอเปราที่ใหญ่และมีชื่อเสียงระดับนานาชาติมากที่สุดแห่งหนึ่งในรัสเซีย เจ้าของรางวัลหน้ากากทองคำมากกว่า 10 รางวัล โดยผู้อำนวยการฝ่ายศิลป์ Dmitry Bertman ได้รับการยอมรับว่าเป็นผู้กำกับโอเปราชั้นนำของประเทศ
มีคำบรรยายภาษาไทยและภาษาอังกฤษ
วันที่ 9 กันยายน 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
10 ก.ย.66 @เขตสวนหลวง LINK
ศูนย์บริการสาธารณสุข 37 ประสงค์-สุดสาคร ตู้จินดา เขตสวนหลวง ร่วมกับ สำนักงานเขตสวนหลวง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
⏩️ ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 10 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดใต้ เขตสวนหลวง
11-15 ก.ย. 66 @ศบส.17 ประชานิเวศน์ เขตจตุจักร LINK
ศบส.17 ประชานิเวศน์ จัดฉีดวัคซีนโรคพิษสุนัขบ้า วันที่ 11-15 กันยายน 2566 เวลา 8.30-12.00 น. ออกให้บริการ ณ จุดต่างๆ ดังนี้
11 กันยายน ชุมชนซีเมนต์ไทย ชุมชนรัชดาประชาชื่น
12 กันยายน ชุมชนภักดี ชุมชนไทรคู่ ชุมชนสวนผัก ชุมชนเคหะสถานเจริญชัย
13 กันยายน ชุมชนหนองจุฬา
14 กันยายน ชุมชนการเคหะแห่งชาติ ชุมชนธรณีสงฆ์
15 กันยายน ชุมชนบ่อฝรั่ง
11-15 ก.ย. 66 @เขตดุสิต ศูนย์บริการสาธารณสุข 38 จี๊ดทองคำบำเพ็ญ
ศูนย์บริการสาธารณสุข สามสิบแปด จี๊ดทองคำบำเพ็ญ ออกหน่วยเคลื่อนที่ฉีดวัคซีน วันที่ 11-15 กันยายน สอบถามโทร. 02-2418378
Health & Innovation Asia 2024 วันที่ 11-13 กันยายน 2024
Health & Innovation Asia 11-13 September 2024 Hall 104, Bangkok International Trade and Exhibition Centre (BITEC), Bangkok, Thailand
Health and Innovation Asia, in conjunction with Thailand LAB INTERNATIONAL, highlights our commitment to advancing academic excellence and medical technology in the healthcare sector. This collaboration will offer healthcare professionals and academics extensive opportunities to engage in high-level conferences, exploring the latest medical and healthcare technology advancements, all under one roof.
Food for Health 11-13 กันยายน 2024
Hall 104, Bangkok International Trade and Exhibition Centre (BITEC), Bangkok, Thailand
Asia’s Gateway to Food for Health and Innovation
The Food for Health Pavilion is a dedicated event within Health & Innovation Asia, organized by VNU Asia Pacific. This pavilion focuses on healthy food, organic food, vegan food, plant-based food, functional food, and free-from food trade in the ASEAN and Asia Pacific regions. It is co-located with Thailand LAB INTERNATIONAL, Bio Asia Pacific, and FutureCHEM INTERNATIONAL 2024, creating a comprehensive event that spans food, health, technology, and science laboratories, all under one roof.
12-16 ก.ย.65 ศูนย์ฯ 59 ทุ่งครุ ออกหน่วยฉีดวัคซีน ฟรี LINK
ศูนย์บริการสาธารณสุข 59 ทุ่งครุ ตารางนัดบริการ ฉีดวัคซีนป้องกันพิษสุนัขบัา แก่สัตว์เลี้ยงในชุมชน 12-16 กันยายน 65 ตาม วัน เวลา และสถานที่ดังนี้
12 กันยายน ชุมชนใต้สะพาน
13 กันยายน ประชาอุทิศ 68
14 กันยายน ชุมชนคลองเก้าห้อง
15 กันยายน ชุมชนทุ่งครุพัฒนา
16 กันยายน ชุมชนคอลิดีน
12 กันยายน ฮ. EC 725 บินรับผู้ป่วยชายไทย 44 ปี จากฝาง ส่งรักษานครพิงค์
12 กันยายน 2566 เวลา 15.00 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 44 ปี มีอาการอ่อนแรงซีกขวา วินิจฉัย โรคหลอดเลือดสมอง มีเลือดคลั่งในสมอง (Rt Basal ganglia hemorrhage) เพื่อส่งผู้ป่วยจากโรงพยาบาลฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองทัพอากาศ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ EC 725 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่
ฮ.EC725 บินรับเด็กหญิง 7 ปี ติดเชื้อในกระแสเลือด ส่งรพ.แม่สะเรียง
12 กันยายน 2566 เวลา 08.55 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยเด็กหญิง สัญชาติไทย อายุ 7 ปี มีอาการปวดท้อง 2 วัน มีไข้ อาเจียน ถ่ายเหลว วินิจฉัย สงสัยภาวะติดเชื้อในกระแสเลือดภายในช่องท้อง (R/O intraabdominal sepsis) เพื่อส่งผู้ป่วยจากสุขศาลาพระราชทานบ้านปอหมื้อ ตำบลแม่คง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ไป โรงพยาบาลแม่สะเรียง ตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองทัพอากาศ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ EC725 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลนครพิงค์
Medical Fair2023 วันที่ 13-15 กันยายน 2566 ไบเทค บางนา
10th International Exhibition on Hospital, Diagnostic, Pharmaceutical, Medical & Rehabilitation Equipment & Supplies 13-15 SEP 2023 | 16-22 SEP 2023
งานแสดงสินค้าอันดับ 1 ของประเทศไทย สำหรับอุตสาหกรรมด้านการแพทย์และการดูแลสุขภาพ ด้วยประวัติการจัดงานตั้งแต่ปี พ.ศ. 2546 งานเมดิคอลแฟร์ ไทยแลนด์ เติบโตขึ้นอย่างแข็งแกร่ง ในฐานะที่เป็นงานแสดงสินค้าด้านการแพทย์และการดูแลสุขภาพ อันดับ 1 ของประเทศไทย ด้วยการมุ่งเน้นไปที่อุปกรณ์และเวชภัณฑ์สำหรับอุตสาหกรรมโรงพยาบาล การวินิจฉัยโรค เภสัชกรรม การแพทย์ และเวชศาสตร์ฟื้นฟู งานเมดิคอลแฟร์ ไทยแลนด์ นำเสนอโอกาสทางธุรกิจที่ดีที่สุด ให้กับบริษัทของท่านเพื่อโลดแล่นไปในตลาดที่มีอัตราการเติบโตสูงของประเทศไทยและในภูมิภาคเอเชียตะวันออกเฉียงใต้ ด้วยการสนับสนุนจากหน่วยงานของรัฐและสมาคมธุรกิจการค้าในอุตสาหกรรมอันเป็นที่ยอมรับและมีชื่อเสียงที่สุดของทั้งในประเทศไทยและในภูมิภาค อาทิ กระทรวงสาธารณสุข สมาพันธ์โรงพยาบาลอาเซียน (Asian Hospital Federation) และอื่นๆอีกมากมาย งานเมดิคอลแฟร์ ไทยแลนด์ ถือเป็นเวทีที่เหมาะอย่างยิ่งสำหรับธุรกิจของท่าน
The Foodism Show 2024 วันที่ 30 สิงหาคม - 1 กันยายน 2567
The Foodism Show 2024 - All About Diet & Healthy Eating ครั้งที่ 3 วันที่ 13-15 กันยายน 2567 เวลา 09.00 - 20.00 น. อาคาร 8 อิมแพ็ค เมืองทองธานี งานอาหารและสินค้าเพื่อคนรักสุขภาพ กินดี ชีวิตดี แบบมีสมดุล
BIO ASIA PACIFIC 14 - 16 กันยายน 2565
Cosmoprof CBE ASEAN 2023 วันที่ 14-16 กันยายน 2566 ศูนย์การประชุมแห่งชาติสิริกิติ์
งานแสดงสินค้าเพื่อธุรกิจความงามระดับโลก ที่พร้อมระเบิดสีสันของโลกธุรกิจความงามให้เจิดจ้ากว่าที่เคย Cosmoprof CBE ASEAN 2023 งานแสดงสินค้าที่พิสูจน์ความสำเร็จมาแล้วจาก 5 ประเทศ ภายใต้เครือข่ายธุรกิจความงาม Cosmoprof เริ่มตั้งแต่ Cosmoprof Worldwide Bologna อิตาลี, Cosmoprof ASIA Hong Kong จีน, Cosmoprof North America Las Vegas/ MIAMI สหรัฐอเมริกา, Cosmoprof India Mumbai อินเดีย และที่ประเทศไทย
Cosmoprof CBE ASEAN 2023 กลับมาอีกครั้ง พร้อมกับผู้แสดงสินค้าชั้นนำกว่า 1,000 แบรนด์ส่งตรงจากทั้งยุโรป อเมริกา และเอเชีย และสินค้าความงามมากกว่า 10,000 รายการ ให้คุณได้เลือกช็อป เลือกสั่งผลิตสินค้า พร้อมโอกาสคุยตรงกับเจ้าของแบรนด์ตามใจคุณ! พบกัน 14-16 กันยายน 2566 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ ลงทะเบียนชมงานฟรี ไม่เสียค่าใช้จ่าย!
14 กันยายน 66 อบต.คลองข่อย ทำหมันสุนัขและแมว ณ.วัดศรีเขตนันทาราม (วัดกล่ำ) LINK
โครงการออกหน่วยทำหมันสุนัข-แมว พร้อมกับฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า...ฟรี..
สำนักงานปศุสัตว์อำเภอปากเกร็ด ขอแจ้งแผนโครงการออกหน่วยทำหมันสุนัข-แมว พร้อมกับฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า.......ฟรี ในวันที่ 14 กันยายน 2566 ณ.วัดศรีเขตนันทาราม (วัดกล่ำ) หมู่ที่ 10 ต.คลองข่อย เปิดรับลงทะเบียน ตั้งแต่เวลา 08.00 น. ลงทะเบียนจองคิว ได้ที่กองสาธารณสุขและสิ่งแวดล้อม อบต.คลองข่อย โทร. 02-9260597-8 ต่อ 15 โทรจองลงทะเบียนล่วงหน้า 50 ตัว รับลงทะเบียนหน้างานวันจริง 30 ตัว
สุนัขและแมวที่จะทำหมัน
- งดน้ำงดอาหาร 8 ชั่วโมงขึ้นไป
- อายุ 5 เดือนขึ้นไป
- สุขภาพร่างกายแข็งแรงไม่มีโรคประจำตัว
****************
วันพฤหัสบดีที่ 14 กันยายน 2566 กองสาธารณสุขและสิ่งแวดล้อม อบต.คลองข่อย สำนักงานปศุสตัว์นนทบุรี ร่วมกับ กองสาธารณสุขและสิ่งแวดล้อม ได้ดำเนินการทำหมันให้กับสุนัขและแมวในพื้นที่ ตำบลคลองข่อย และพื้นที่ข้างเคียง โดยมีนายคำรณ บางจริง นายก อบต.คลองข่อย พร้อมคณะผู้บริหาร และนายสัตวแพทย์ชนินทร์ ทิพปภาสมิทธิ์ ซึ่งมีสุนัขและแมวที่ได้รับการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแล้ว (ครั้งที่ 2) จำนวน 76 ตัว ณ วัดศรีเขตนันทาราม (วัดกล่ำ) ตำบลคลองข่อย
*****************
26 มกราคม 2566 กองสาธารณสุขและสิ่งแวดล้อม องค์การบริหารส่วนตำบลคลองข่อย ร่วมกับ สำนักงานปศุสตัว์นนทบุรี และ สำนักงานทหารพัฒนาหน่วยบัญชาการทหารพัฒนา กองบัญชาการกองทัพไทย ช่วยเหลือประชาชนชุดสัตวแพทย์เคลื่อนที่ ดำเนินการทำหมันให้กับสุนัขและแมวในพื้นที่ตำบลคลองข่อย และพื้นที่ข้างเคียง โดยมีนายคำรณ บางจริง นายกอบต.คลองข่อย พร้อมคณะผู้บริหาร และนายสัตวแพทย์ชนินทร์ ทิพปภาสมิทธิ์ ซึ่งมีสุนัขและแมวที่ได้รับการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแล้ว (ครั้งที่ 1) จำนวน 145 ตัว
15 กันยายน : Carmen by Granada Flamenco Ballet
Carmen by Granada Flamenco Ballet
Main Hall Thailand Cultural Centre
Date and Time : Friday 15 September 2023 at 7:00 PM
Ticket Price : 3,000/ 2,500/ 2,200/ 2,000/ 1,500
คาร์เมน แต่งขึ้นเมื่อ 150 ปีก่อนโดย Georges Bizet ถึงเรื่องราวความรักสามเส้าของสาวยิปซีกับหนุ่มเลือดร้อน ได้ถูกจับมาตีความใหม่ในแบบฉบับระบำฟลาเมงโกที่แสนเร่าร้อน ประกอบเสียงเครื่องดนตรีอันเป็นเอกลักษณ์ของสเปน และบรรยากาศแสนเย้ายวนทั้งภาพและแสง
กรานาดา ฟลาเมงโก บัลเลต์ ทูตทางวัฒนธรรมด้านฟลาเมงโกของกรานาดาในปัจจุบัน มาเยือนเมืองไทยพร้อมเรื่องราวอันน่าตื่นเต้นในเวอร์ชันของพวกเขา ความรักและความหึงหวงระหว่าง Carmen, Don Jose และ Escamillo ที่ทั้งเคลิบเคลิ้มและคุกรุ่นจนคุณสัมผัสได้
วันที่ 15 กันยายน 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
สนับสนุนโดย สถานเอกอัครราชทูตสเปน
15 กันยายน ฮ.BELL 212 รับผู้ป่วยชาย 58 ปี หัวใจขาดเลือดเฉียบพลัน จากอ.ฝาง
15 กันยายน 2566 เวลา 09.50 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 58 ปี มาด้วยหายใจเหนื่อย นอนราบไม่ได้ วินิจฉัย มีภาวะกล้ามเนื้อหัวใจขาดเลือดเฉียบพลัน (STEMI) เพื่อส่งผู้ป่วยจากโรงพยาบาลฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองทัพบก (กองกำลังผาเมือง) เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ BELL 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่
โรงพยาบาลระยอง ประกาศรับสมัครงาน LINK
พนักงานกระทรวงสธ.และแบบลูกจ้างชั่วคราวรายวัน
ลูกจ้างชั่วคราวรายวัน ได้แก่
ผู้ช่วยทันตแพทย์ พนักงานธุรการ พนักงานช่วยเหลือคนไข้ นักเทคนิคการแพทย์ พนักงานประกอบอาหาร พนักงานเปล พนักงานประจำห้องยา พยาบาลวิชาชีพ ผู้ช่วยพยาบาล
สอบถาม กลุ่มงานทรัพยากรบุคคล ชั้น 12 อาคารบูรพาทิศ รพ.ระยอง วัน-เวลาราชการ
โทร. 038-611104 ต่อ 2310
16 กันยายน : Dance for Me by Granada Flamenco Ballet
Dance for Me by Granada Flamenco Ballet
Main Hall, Thailand Cultural Centre
Date and Time : Saturday 16 September 2023 at 7:00 PM
Ticket Price : 3,000/ 2,500/ 2,200/ 2,000/ 1,500
การแสดงฟลาเมงโกใหม่ล่าสุดจากคณะ กรานาดา ฟลาเมงโก บัลเลต์ Dance for Me ที่ทลายขอบเขตระหว่างดนตรีและการเต้นรำ และพาคุณไปเพลิดเพลินกับการแสดงในแบบฉบับของอันดาลูเชีย เมืองหลวงของฟลาเมงโก ซึ่งมีรากเหง้ามาจากการผสมผสานอย่างลงตัวระหว่างวัฒนธรรรมของยิปซี มัวร์ และสเปน
ร่วมออกแบบท่าเต้นโดย Patricia Guerrero ผู้ชนะรางวัลการประกวดเต้นระดับชาติของสเปน Dance for Me เริ่มต้นด้วยผลงานของนักประพันธ์ชื่อดังชาวกรานาดา Federico García Lorca และปิดด้วยการเต้นส่งท้าย fin de fiesta อันเปี่ยมพลัง ที่ปล่อยให้นักเต้นทุกคนงัดเอาสเต็ปของตัวเองออกมาแสดงได้อย่างเต็มที่ ความตื่นตาตื่นใจของฝีเท้านักเต้นจะทำเวทีลุกเป็นไฟและหัวใจพวกเราทุกคนเต้นแรงไปด้วยกัน
วันที่ 16 กันยายน 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
ระดมความคิดเห็น เพื่อจัดทำ พ.ร.บ กัญชา 16 กันยายน 2566 ณ สมาคมกัญชาจังหวัดขอนแก่น LINK
ขอเรียนเชิญ ผู้เกี่ยวข้องทุกท่าน
ร่วมระดมความคิดเห็น เพื่อจัดทำ พ.ร.บ กัญชา
พบ กับแขกรับเชิญพิเศษ
รศ.นพ ปัตตพงษ์ เกษสมบูรณ์
ผู้เชี่ยวชาญ และ
ผู้ศึกษาวิจัย กัญชาทางการแพทย์
คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่น
เครือข่ายเขียนอนาคตกัญชาไทย
ร่วมกับ สมาคมกัญชาขอนแก่น ขอเชิญ
ผู้ประกอบการ ร้านค้า วิสาหกิจชุม แพทย์ หมอพื้นบ้าน
ผู้ป่วย นักศึกษา วิจัย และ หน่วยงานต่างๆ ที่เกี่ยวข้อง กับ พืชยากัญชา
ร่วมแลกเปลี่ยนแสดงความคิดเห็น
ในวันเสาร์ ที่ 16 กันยายน 2566 ณ
สมาคมกัญชาจังหวัดขอนแก่น
กิจกรรมอบรมครรภ์คุณภาพ Happy & Healthy Mom โรงพยาบาลสินแพทย์ ลำลูกกา
โรงพยาบาลสินแพทย์ ลำลูกกา จัดกิจกรรมอบรมครรภ์คุณภาพ “Happy & Healthy Mom” โรงพยาบาลสินแพทย์ ลำลูกกา เพื่อการดูแลครรภ์ให้มีคุณภาพ และเพื่อพัฒนาการที่ดีของลูกรักในครรภ์ ศูนย์ฝากครรภ์คุณภาพ แผนกสูตินรีเวช โรงพยาบาลสินแพทย์ ลำลูกกา สำหรับหญิงเริ่มตั้งครรภ์ – 28 สัปดาห์ ประจำปี 2566 โดยแพทย์ชำนาญการ ณ ห้องประชุม 2 ชั้น 18 โรงพยาบาลสินแพทย์ ลำลูกกา
อบรมการดูแลครรภ์ โดย พญ.สราพรรณ ณ นคร สูตินรีแพทย์ชำนาญการ
• การสร้างความฉลาด (IQ และ EQ) ให้ลูกรักตั้งแต่ในครรภ์
• การเปลี่ยนแปลงของร่างกาย และการปฏิบัติตัวระหว่างตั้งครรภ์
• การตรวจสุขภาพทั่วไปและการประเมินความสมบูรณ์ของทารกในครรภ์
• คลอดปกติ VS ผ่าตัดคลอด
อบรมเพื่อพัฒนาการที่ดีของลูกรัก โดย นพ.เฉลิมลักษณ์ มหิพันธุ์ แพทย์ชำนาญการทารกแรกเกิด
• การเลี้ยงดูทารกแรกเกิด
ปฏิทินการอบรมครรภ์คุณภาพ
ครั้งที่ 2 วันเสาร์ที่ 10 มิ.ย.2566
ครั้งที่ 3 วันเสาร์ที่ 16 ก.ย.2566
ครั้งที่ 4 วันเสาร์ที่ 16 ธ.ค.2566
** เหมาะสำหรับสตรีที่เริ่มตั้งครรภ์ ถึงอายุครรภ์ 28 สัปดาห์ ไม่มีค่าใช้จ่ายในการอบรม
สำรองที่นั่งและสอบถามเพิ่มเติม แผนกสูตินรีเวช โทร 02-0069999 ต่อ 10881,10801
16 กันยายน กองผาเมือง รับผู้ป่วยจากรพ.ฝาง ส่งต่อทำ primary PCI อย่างเร่งด่วน รพ.นครพิงค์
16 กันยายน 2566 เวลา 09.37 น. หน่วยปฏิบัติการอำนวยการฉุกเฉินการแพทย์ระดับสูง (ศูนย์เวียงพิงค์) ร่วมกับหน่วยบินกองกำลังผาเมือง กองทัพบก ได้รับการประสานจาก รพ.ฝาง เคสชาย 58 ปี เจ็บแน่นหน้าอก หายใจเหนื่อย Dx.STEMI with HF, respiratory failure เพื่อส่งต่อทำ primary PCI อย่างเร่งด่วนนำส่ง รพ.นครพิงค์ อย่างปลอดภัย
พญาไท 3 อบรมคุณแม่คุณภาพ Mohter Class 2023 สำหรับคุณแม่ตั้งครรภ์ (มีค่าอบรม)
รพ.พญาไท 3 อบรมคุณแม่คุณภาพ Mohter Class 2023 สำหรับคุณแม่ตั้งครรภ์ สอบถามโทร 02-4671111 ต่อ 3264 3265 Call center 1772
18 กันยายน ฮ.Bell 212 บินรับหญิงต่างด้าวครรภ์เป็นพิษจากแม่สะเรียง
18 กันยายน 2566 เวลา 11.34 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงต่างด้าว อายุ 30 ปี อายุภรรค์ 5 เดือน BP 170/120 Bw 65 ชักเกร็งทั้งตัว 1 วัน วินิจฉัย ภาวะครรภ์เป็นพิษ (Eclampsia) เพื่อส่งผู้ป่วยจากบ้านอูนู ตำบลแม่คง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ไป โรงพยาบาลแม่สะเรียง ตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองบินตำรวจ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลแม่สะเรียง จังหวัดแม่ฮ่องสอน
Vitafoods Asia 2024 วันที่ 18-20 กันยายน 2567
Vitafoods Asia 2024 คืองานแสดงสินค้า นวัตกรรม และเทคโนโลยีในด้านอุตสาหกรรมเสริมอาหารและสารสกัดเพื่อสุขภาพ พร้อมเปิดโอกาสให้ผู้ประกอบการได้เข้ามาเชื่อมต่อโอกาสทางธุรกิจและอัปเดตเทรนด์ด้านสุขภาพกับบริษัทชั้นนำกว่า 600 รายจากทั่วทุกมุมโลก
ครั้งเดียวในรอบปีที่ผู้ชมงานจะได้สัมผัสที่สุดแห่งความครอบคลุมทุกโซลูชัน ไม่ว่าจะเป็น สารสกัด วัตถุดิบ ผลิตภัณฑ์เสริมอาหารพร้อมจำหน่าย อุปกรณ์การผลิต บรรจุภัณฑ์ และผู้รับจ้างผลิต ซึ่งล้วนแล้วแต่ได้รับคุณภาพและการรับรองตามมาตรฐานสากล อีกทั้งงานไวต้าฟู้ด เอเชีย ยังเป็นศูนย์กลางในการให้ความรู้เรื่องเทรนด์สารสกัดและผลิตภัณฑ์เสริมอาหารในเอเชีย พร้อมพื้นที่จัดแสดงนวัตกรรมและสินค้า ให้ผู้ที่สนใจได้เข้ามาสัมผัสและทดลองสินค้าได้ด้วยตนเองรวบรวมที่สุดแห่งผู้เชี่ยวชาญด้านสุขภาพและโภชนาการ เพื่อให้คุณก้าวเป็นผู้นำในวงการเสริมอาหารได้อย่างมีประสิทธิภาพ
19 กันยายน บินรับผู้บาดเจ็บหญิง จากรพ.แม่สะเรียง ส่ง รพ.มหาราชฯ
19 กันยายน 2566 เวลา 14.47 น. หน่วยปฏิบัติการอำนวยการฉุกเฉินการแพทย์ระดับสูง (ศูนย์เวียงพิงค์) ร่วมกับกองกำลังผาเมือง กองทัพบก จ.เชียงใหม่ ได้รับการประสานจาก ศูนย์สั่งการจ.แม่ฮ่องสอน ออกรับผู้บาดเจ็บ เคสหญิง 69 ปี เหตุยนต์ชนจักรยานยนต์ Dx.Severe TBI ต้นทาง รพ.แม่สะเรียง นำส่ง รพ.มหาราชนครเชียงใหม่ อย่างปลอดภัย -
ศูนย์เวียงพิงค์ จังหวัดเชียงใหม่19 กันยายน ฮ.EC725 บินรับผู้ป่วยหญิง 88 ปี หัวใจขาดเลือดเฉียบพลัน จากแม่อาย ส่งรพ.นครพิงค์
19 กันยายน 2566 เวลา 11.48 น.
ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงไทย อายุ 88 ปี มีอาการแน่นหน้าอก วินิจฉัย หัวใจขาดเลือดเฉียบพลัน (STEMI Fast Track) เพื่อส่งผู้ป่วยจากโรงพยาบาลแม่อาย ตำบลแม่อาย อำเภอแม่อาย จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสาน กองทัพอากาศ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ EC725 ชุดปฏิบัติการลำเลียงทางอากาศโดย โรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่
19 กันยายน ฮ.Bell212 บินรับผู้ปวยฉุกเฉินหญิง 69 ปี อุบัติเหตุไม่รู้สึกตัว จากแม่สะเรียง
19 กันยายน 2566 เวลา 15.19 น. สำนักงานสาธารณสุขจังหวัดแม่ฮ่องสอนได้รับแจ้งจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอนเพื่อขอรับการสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยฉุกเฉิน เพศหญิง อายุ 69 ปี ประวัติ 15 นาทีก่อนมา ขับขี่รถจักรยานยนต์ชนรถยนต์ส่วนบุคคล มีอาการ ไม่รู้สึกตัว ศีรษะด้านขวาบวมโน ขนาด 8 ซม. มีแผลถลอกที่มือขวาและเข่าขวา โดยมีหน่วยบริการการแพทย์ฉุกเฉินโรงพยาบาลแม่สะเรียงออกรับผู้บาดเจ็บ ณ จุดเกิดเหตุ และนำส่งเข้ารับการรักษาที่โรงพยาบาลแม่สะเรียง อ.แม่สะเรียง จ.แม่ฮ่องสอน ได้รับการวินิจฉัยโรค severe head injury (การบาดเจ็บที่ศีรษะอย่างรุนแรง) จำเป็นต้องได้รับการรักษาอย่างเร่งด่วน และส่งต่อไปรักษาที่โรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่
.
โดยประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอสนับสนุนอากาศยานจากกองกำลังผาเมือง จ.เชียงใหม่ ประเภทอากาศยานเฮลิคอปเตอร์ Bell212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ท.ยงยุทธ แสวงทอง, ร.ท.ดำรงศักดิ์ จินตวรณ์, จ.ส.อ.โกมล บุญสะอาด และ จ.ส.ท.ปัญจานาสย์ ป้อมทอง และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลนครพิงค์ จ.เชียงใหม่ ประกอบด้วย นพ.ประสาน เปี่ยมอนันต์, นายก้องกิดากร นันทเดช และนายคเนศ ชูสุวรรณ
.
และเมื่อเวลา 17.13 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลมหาราชนครเชียงใหม่ จ.เชียงใหม่ เป็นที่เรียบร้อย การส่งต่อผู้ป่วยในครั้งนี้ ได้รับการสนับสนุนงบประมาณจากกองทุนการแพทย์ฉุกเฉิน สถาบันการแพทย์ฉุกเฉินแห่งชาติ
21 กันยายน 2566 เทศบาลตำบลบ้านบางม่วง ทำหมันสุนัขและแมว 80 ตัว LINK
เทศบาลตำบลบ้านบางม่วงร่วมกับสำนักงานปศุสัตว์จังหวัดนนทบุรี จัดหน่วยแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า
.ในวันพฤหัสบดีที่ 21 กันยายน 2566 ณ วัดพระเงิน ตั้งแต่เวลา 09.00-12.00 น. (รับลงทะเบียนถึงเวลา 11.00น.) รับจำนวนจำกัด
-ในพื้นที่เทศบาลตำบลบ้าบางม่วง รับจำนวน 50 ตัว
-นอกพื้นที่เทศบาลตำบลบ้านบางม่วง รับจำนวน 30 ตัว
. หมายเหตุ : จำกัดจำนวนบ้านละไม่เกิน 4 ตัว
เจ้าของสุนัข/แมว โปรดนำบัตรประชาชนมาด้วย
ลงทะเบียนล่วงหน้าได้ที่กองสาธารณสุขฯ โทร 02-443-6383
ข้อควรปฏิบัติก่อนการทำหมันสัตว์
1.งดน้ำงดอาหารสัตว์ อย่างน้อย 12 ชั่วโมง ก่อนทำหมัน
2.สัตว์ที่นำมาทำหมันต้องมีอาการปกติ ไม่ป่วย
3.อายุสัตว์ที่สามารถทำหมันได้ ตั้งแต่ 4 เดือนขึ้นไป
4.สัตว์ที่นำมาทำหมัน(สุนัข) ไม่ควรมีประจำเดือน เพราะจะทำให้สัตว์เสียเลือดมาก
5.สุนัขหรือแมว แม่ลูกอ่อนเมื่อลูกอายุ 2 เดือนเหมาะที่จะทำหมัน
21 กันยายน ฮ.EC-725 บินรับผู้ป่วยไทย 64 ปี สมองขาดเลือด จากสุราษฎร์ ส่ง รพ.สงขลาฯ
21 กันยายน 2566 เวลา 11.07 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการศูนย์จังหวัดสุราษฎร์ธานี ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชาย สัญชาติไทย อายุ 64 ปี มีอาการแขนขาด้านขวาอ่อนแรง ซึมลง ลืมตาแต่ไม่พูด วินิจฉัย ภาวะสมองขาดเลือด (Left MCA infarction ) เพื่อส่งผู้ป่วยจากโรงพยาบาลสุราษฎร์ธานี ตำบลมะขามเตี้ย อำเภอเมือง จังหวัดสุราษฎร์ธานี ไป โรงพยาบาลสงขลานครินทร์ ตำบลคอหงส์ อำเภอหาดใหญ่ จังหวัดสงขลา สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพอากาศ เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ EC-725 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลสุราษฎร์ธานี
วิ่งในหลาดชมเมือง KHOKKLOY NIGHT RUN 2024 #SEASON3 วันเสาร์ที่ 21 กันยายน 2567
กิจกรรม KHOKKLOY NIGHT RUN 2024 #SEASON3 วิ่งในหลาดชมเมือง ระยะทาง 5 กิโลเมตร ใน รายได้หลังหักค่าใช้จ่าย ทางเทศบาลตำบลโคกกลอยจะนำไปสนับสนุนกิจกรรมกีฬาของเด็กๆโรงเรียนเทศบาลโคกกลอย
22 กันยายน บินฮ.Bell 212 รับผู้ป่วยชาย จากสบเมย ส่งนครพิงค์
22 กันยายน 2566 เวลา 12.42 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการศูนย์จังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชาย สัญชาติไทย อายุ 57 ปี มีอาการใจสั่น จุกแน่นหน้าอก (acute inferior wall STEMI) เพื่อส่งผู้ป่วยจาก โรงพยาบาลสบเมย ตำบล แม่คะตวน อำเภอสบเมย จังหวัดแม่ฮ่องสอน ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่
LOMA RUN ON THE BEACH 2024 - 22 กันยายน 2567 LINK
LOMA RUN ON THE BEACH 2024 (ปีที่10) งานวิ่งบรรยากาศดีๆ บนเส้นทางหาดจอมเทียนพัทยา ระยะ 5.5K และ 10.5K ในวันอาทิตย์ที่ 22 กันยายน 2567
งานเดิน-วิ่ง การกุศลที่ชายหาดนาจอมเทียน เมืองพัทยา จังหวัดชลบุรี โดยความร่วมมือกันของทีมงาน LOMA RUN Organizer, มูลนิธิ เอช เอช เอ็น เพื่อเด็กไทย และเมืองพัทยา มีระยะจำนวน 2 ระยะการแข่งขัน กล่าวคือ 1) ระยะมินิมาราธอน 10.5 กิโลเมตร (Mini Marathon) 2) ระยะฟันรัน 5.5 กิโลเมตร (Fun Run) เพื่อช่วยเหลือและสนับสนุนทุนการศึกษาสำหรับเด็กด้อยโอกาสในโครงการของมูลนิธิ เอช เอช เอ็น เพื่อเด็กไทย และเป็นการส่งเสริมการสร้างสุขภาพที่ดีให้กับผู้เข้าร่วมโครงการ ทั้งยังเป็นการส่งเสริมการท่องเที่ยวในรูปแบบของเมืองกีฬา (Sport City) ตามนโยบายของเมืองพัทยา
ASICS META: Time: Trials THAILAND 2024 - 22 กันยายน 2567
ASICS META: Time: Trials THAILAND 2024 . 22 กันยายน 2567 ณ. สนามศุภชลาศัย เขตปทุมวัน จ.กรุงเทพฯ
23 กันยายน : The Roots by Cie Accrorap
The Roots by Cie Accrorap
Main Hall, Thailand Cultural Centre
Date and Time : Saturday 23 September 2023 at 7:00 PM
Ticket Price : 3,000 / 2,500 / 2,200 / 2,000 / 1,500 THB
การแสดง The Roots โดยคณะฮิปฮอปชั้นนำของฝรั่งเศส Accrorap ที่มาเปิดการแสดงเป็นครั้งแรกในประเทศไทย พร้อมนักเต้นฮิปฮอปมากความสามารถ 11 คน ที่ต่างโดดเด่นในเอกลักษณ์การเต้นของตัวเอง แต่ก็สอดประสานออกมาเป็นการแสดงร่วมกันได้อย่างกลมกลืน
ลีลาการเต้นสไตล์ฮิปฮอป ทั้ง breakdance, locking, popping ออกแบบท่าเต้นโดย ศิลปินนักปฏิวัติ Kader Attou ที่ผสมผสานกับการเคลื่อนไหวร่างกายในหลากรูปแบบ ทั้งการเล่นสเก็ต เต้นแท็ป กายกรรม ชกมวย ละครตลก หรือแม้แต่ละครใบ้ จนออกมาเป็นการแสดงที่ไม่เหมือนใคร
วันที่ 23 กันยายน 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
สนับสนุนโดย สถานเอกอครราชทูตฝรั่งเศษ
23 กันยายน บินรับผู้ป่วยชาย 46 ปี จากแม่แจ่ม ส่ง รพ.มหาราชนครเชียงใหม่
วันที่ 23 กันยายน 2566 เวลา 15.28 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการศูนย์จังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชาย สัญชาติไทย อายุ 46 ปี มีอาการเจ็บหน้าอกซ้าย ร้าวไปไหล่ซ้ายลงแขนซ้าย ใจสั่น วินิจฉัย ภาวะหัวใจขาดเลือด (Infero-posterior wall STEMI) เพื่อส่งผู้ป่วยจาก โรงพยาบาลเทพรัตนเวชชานุกูล เฉลิมพระเกียรติ 60 พรรษา ตำบลช่างเคิ่ง อำเภอแม่แจ่ม จังหวัดเชียงใหม่ ไป โรงพยาบาลมหาราชนครเชียงใหม่ ตำบลสุเทพ อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่ สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่
ฮ.รับผู้ป่วยชาย 46 ปี ภาวะหัวใจขาดเลือด จากแม่แจ่มส่งมหาราชเชียงใหม่
23 กันยายน 2566 เวลา 15.28 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการศูนย์จังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชาย สัญชาติไทย อายุ 46 ปี มีอาการเจ็บหน้าอกซ้าย ร้าวไปไหล่ซ้ายลงแขนซ้าย ใจสั่น วินิจฉัย ภาวะหัวใจขาดเลือด (Infero-posterior wall STEMI) เพื่อส่งผู้ป่วยจาก โรงพยาบาลเทพรัตนเวชชานุกูล เฉลิมพระเกียรติ 60 พรรษา ตำบลช่างเคิ่ง อำเภอแม่แจ่ม จังหวัดเชียงใหม่ ไป โรงพยาบาลมหาราชนครเชียงใหม่ ตำบลสุเทพ อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่ สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่
24 กันยายน วันมหิดล LINK
"ขอให้ถือประโยชน์ตนเปนที่สอง ประโยชน์ของเพื่อนมนุษย์เปนกิจที่หนึ่ง ลาภทรัพย์และเกียรติยศจะตกมาแก่ท่านเอง ถ้าท่านทรงธรรมะแห่งวิชาชีพย์ไว้ให้บริสุทธิ์"
วันมหิดล ตรงกับวันที่ 24 กันยายนของทุกปี อันเป็นวันคล้ายวันสวรรคต ของสมเด็จพระมหิตลาธิเบศร อดุลยเดชวิกรม พระบรมราชชนก เป็นพระบิดาของพระบาทสมเด็จพระมหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร หรือ พระบรมวงศานุวงศ์ เสด็จพระราชดำเนินทรงวางพวงมาลา ณ พระบรมราชานุสาวรีย์สมเด็จพระมหิตลาธิเบศร อดุลยเดชวิกรม พระบรมราชชนก ภายในโรงพยาบาลศิริราช แขวงศิริราช เขตบางกอกน้อย กรุงเทพมหานคร ที่เสด็จพระราชดำเนินทรงเปิดเมื่อวันที่ 27 เมษายน พ.ศ. 2493
26 กันยายน วันคุมกำเนิดโลก (World Contraception Day)
26 กันยายน วันคุมกำเนิดโลก สิทธิประโยชน์หลักประกันสุขภาพครอบคลุมการคุมกำเนิดและวางแผนครอบครัว วันคุมกำเนิดโลก World Contraception Day (WCD) เกิดขึ้นเมื่อปี พ.ศ. 2550 ตรงกับวันที่ 26 กันยายนของทุกปี เพื่อให้ทุกคนตระหนักถึงความสำคัญของการป้องกันการตั้งครรภ์อย่างถูกวิธี และผลักดันให้ประชากรมีการศึกษาในเรื่องการวางแผนครอบครัว ด้านสุขภาพทางเพศและอนามัยการเจริญพันธุ์ โดยเน้นให้คู่รักและบุคคลทุกคู่ ตัดสินใจการวางแผนมีบุตร เพื่อลดการตั้งครรภ์ที่มีความเสี่ยงสูง การตั้งครรภ์ในวัยรุ่นและการตั้งครรภ์ที่ไม่ได้วางแผน
งานประเพณีชักพระ – ทอดผ้าป่า และแข่งเรือยาว ประจำปี 2566 จ.สุราษฎร์ธานี 26 ตุลาคม – 3 พฤศจิกายน 2566
งานประเพณีชักพระ – ทอดผ้าป่า และแข่งเรือยาว ประจำปี 2566 จัดขึ้นระหว่างวันที่ 26 ตุลาคม – 3 พฤศจิกายน 2566 และพิธีเปิดงานชักพระในวันที่ 30 ตุลาคม 2566 ซึ่งตรงกับวันแรม 1 ค่ำ เดือน 11 โดยความร่วมมือระหว่างเทศบาลนครสุราษฎร์ธานี ร่วมกับจังหวัดสุราษฎร์ธานี, อบจ.สุราษฎร์ธานี, ททท. สำนักงานสุราษฎร์ธานี และหน่วยงานภาคีเครื่อข่าย กิจกรรมในงานปีนี้ อาทิ การแสดงนิทรรศการงานประเพณีชักพระ, พิธีฉลองถ้วยพระราชทานฯ, ขบวนแห่เรือพนมพระทางบกของวัดในเขตเทศบาล, พิธีสมโภชเรือพนมพระ, การจัดพุ่มผ้าป่าหน้าบ้านและหน้าสำนักงาน การชักพุ่มผ้าป่า พุ่มเมือง ตลอดจนการแข่งขันเรือยาวและการประกวดเรือแต่ง รวมถึง กิจกรรมงานวิ่งพรมน้ำมนต์ ที่จัดมาแล้ว 3 ครั้ง และได้รับการตอบรับอย่างดีจากประชาชน คณะผู้จัดงานเชื่อมั่นว่า การจัดงานในปีนี้ จะยิ่งใหญ่ไม่แพ้ทุกปีที่ผ่านมา อย่างแน่นอน
วัดอุภัยภาติการาม หลวงพ่อโต ซำปอกง ทิ้งกระจาด ประจำปี 2567 วันที่ 21-22 สิงหาคม LINK
วัดอุภัยภาติการาม หลวงพ่อโต ซำปอกง ขอเชิญร่วมเป็นเจ้าภาพ ทิ้งกระจาด ประจำปี 2567 วันที่ 21-22 สิงหาคม 2567 เป็นเจ้าภาพ ร่วมบุญตามกำลังศรัทธา - เจ้าภาพข้าวสารอาหารแห้งและของใช้ต่างๆ ข้าวสาร อาหารแห้ง น้ำดื่มลัง - เจ้าภาพเครื่องกระดาษ ภูเขาเงินทอง ชุดเสื้อผ้าผู้ล่วงลับ ก้อนเงินก้อนทอง
ร่วมบุญผ่านบัญชีธนาคารได้ที่ ธ.กรุงไทย เลขที่บัญชี : 269-0-18971-2 ชื่อบัญชี : วัดอุภัยภาติการาม ติดต่อสอบถามโทร 061-0429955 / 094-663-8622 / 082-849-5999 ณ วัดอุภัยภาติการาม (ซำปอกง) แปดริ้ว ฉะเชิงเทรา
28 กันยายน วันป้องกันโรคพิษสุนัขบ้าโลก World Rabies Day
องค์การอนามัยโลก กำหนดให้วันที่ 28 กันยายนของทุกปี เป็นวันป้องกันโรคพิษสุนัขบ้าโลก เพื่อรำลึกถึงวันเสียชีวิตของหลุยส์ ปาสเตอร์ (ค.ศ.1895) ผู้คิดค้นวัคซีนป้องกันโรคพิษสุนัขบ้าได้สำเร็จ เป็นวัคซีนสำคัญที่ช่วยปกป้องชีวิตมนุษย์นับล้านทั่วโลกจนถึงปัจจุบัน
หนองคายเทรล 28-29 กันยายน 2567 LINK
จังหวัดหนองคาย ขอเชิญทุกท่านมาพบกับกิจกรรมสุดท้าทายที่จะได้สัมผัสความสวยงามของขุนเขาและโค้งน้ำ ในกิจกรรม NongKhaiTrail “วิ่งขึ้นภู ดูหมอก เอิ้นบอกตะเว็น” ในวันที่ 28-29 กันยายน 2567 กับระยะการแข่งขันที่เปิดให้นักวิ่งนักที่ยังไม่เคยสัมผัสกับขุนเขาได้เลือกความสนุกตามความสามารถ ไม่ว่าจะเป็น ระยะ 5 กิโลเมตร ชมความงามของหมู่บ้านในหุบเขาที่วิวสวยตรึงตา หมู่บ้านวังมน อ.สังคม ⛰ระยะ 10 กิโลเมตร ชมวิวของโค้งน้ำวิวสุดลูกหูลูกตาของแม่น้ำโขง บนภูห้วยอีสัน และ ระยะ 20 กิโลเมตร ที่ขอเชิญทุกท่านมาร่วมพิสูจใจตัวเอง
29 กันยายน วันหัวใจโลก World Heart Day
ความคิดริเริ่มที่จะจัดตั้งวันหัวใจโลก มีขึ้นตั้งแต่ปี 1999 โดย สมาพันธ์หัวใจโลก (World Heart Federation
WHF) ด้วยความร่วมมือขององค์การอนามัยโลก WHO กระทั่งปี 2000 จึงประกาศอย่างเป็นทางการกำหนดให้วันที่ 24 กันยายน เป็นวันหัวใจโลก จนถึงปี 2012 จึงได้ปรับเปลี่ยนมาเป็นวันที่ 29 กันยายน ของทุกปี จนถึงปัจจุบัน
WHF
ระบุว่า โรคหัวใจร่วมหลอดเลือด หรือ โรคหัวใจและหลอดเลือด (Cardiovascular disease ตัวย่อ CVD) รวมถึงโรคหัวใจและโรคหลอดเลือดสมอง (stroke) เป็นเหตุให้มีผู้เสียชีวิตราว 18.6 รายต่อปี
29 กันยายน 65 รับผู้ป่วยหัวใจขาดเลือด จาก อ.เวียงแหง มารักษาต่อ รพ.นครพิงค์
29 กันยายน 2565 เวลา 13.35 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนันสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิง อายุ 53 ปี มีอาการ เจ็บแน่นหน้าอกร้าวไปแขน 2ข้างวินิจฉัย ภาวะหัวใจขาดเลือดเฉียบพลัน (STEMI) เพื่อส่งผู้ป่วยจาก โรงพยาบาลเวียงแหง จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์เชียงใหม่ จังหวัดเชียงใหม่
ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก เพื่อขอสนับสนุนอากาศยาน โดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดย ทีมโรงพยาบาลมหาราชนครเชียงใหม่ จังหวัดเชียงใหม่
การลำเลียงผู้ป่วยลุล่วงไปด้วยดี ผู้ป่วยอยู่ระหว่างรับการรักษาที่ศูนย์โรคหัวใจโรงพยาบาลนครพิงค์
ขอขอบคุณ สำนักงบประมาณ กระทรวงสาธารณสุข สถาบันการแพทย์ฉุกเฉินแห่งชาติ -สพฉ.1669 โรงพยาบาลมหาราชนครเชียงใหม่ โรงพยาบาลเวียงแหง โรงพยาบาลนครพิงค์ กองบัญชาการกองทัพไทย กองทัพบก Royal Thai Army กองทัพบก หน่วยงานภาคีเครือข่ายที่เกี่ยวข้อง
PEA Mini Marathon 2024 : Run for Better life and sustainability 5 จังหวัด - 29 กันยายน 2567 LINK
Run for Better life and sustainability จัดโดยสมาคมสโมสรการไฟฟ้าส่วนภูมิภาค รายได้หลังหักค่าใช้จ่าย บริจาคเพื่อเป็นการกุศลและให้กับสถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพทางการแพทย์แห่งชาติเพื่อฟูคนพิการ โดยจัดวิ่ง 5 เส้นทาง 5 จังหวัด
กรุงเทพมหานคร วันอาทิตย์ที่ 29 กันยายน 2567สถานที่จัดงาน : การไฟฟ้าส่วนภูมิภาคสำนักงานใหญ่
เชียงใหม่ วันอาทิตย์ที่ 3 พฤศจิกายน 2567 สถานที่จัดงาน : ห้วยตึงเฒ่า อ.แม่ริม
อยุธยา วันอาทิตย์ที่ 24 พฤศจิกายน 2567 สถานที่จัดงาน : อุทยานประวัติศาสตร์พระนครศรีอยุธยา
ประจวบคีรีขันธ์ วันอาทิตย์ที่ 15 ธันวาคม 2567 สถานที่จัดงาน : บริเวณเส้นทางเลียบชายทะเล ปากน้ำปราณ อ.ปราณบุรี
นครราชสีมา วันอาทิตย์ที่ 22 ธันวาคม 2567 สถานที่จัดงาน : มหาวิทยาลัยเทคโนโลยีสุรนารี จ.นครราชสีมา
Koh Chang Trail 2024 - 29 กันยายน 2567 LINK
จังหวัดตราด อุทยานแห่งชาติหมู่เกาะช้าง และภาคีภาครัฐและเอกชน ร่วมจัดกิจกรรมวิ่งเทรลบนเกาะช้าง ส่งเสริมการท่องเที่ยว ชวนทุกคนมาร่วม "ปลุกช้างหลับ - Awaken Koh Chang" ระยะทาง : 55 KM / 30 KM / 15 KM รายละเอียดการแข่งขัน
วันแข่งขัน : อาทิตย์ที่ 29 กันยายน 2567 (Race Day)
วันรับอุปกรณ์ : เสาร์ที่ 28 กันยายน 2567 (Expo Day)
เวลา 10.00 - 18.00 น. ลงทะเบียน ตรวจอุปกรณ์บังคับ และ รับหมายเลขการแข่งขัน(BIB)
สถานที่ : โรงเรียนบ้านบางเบ้า
**ไม่มีการจัดส่งอุปกรณ์**
**ไม่มีการรับอุปกรณ์วันแข่งขัน**
เกาะช้างเทรล KOH CHANG TRAIL 2024 - Awaken Koh Chang วันที่ 29 กันยายน 2567
KCT 2024 เกาะช้างเทรล 2024 ปลุกช้างหลับด้วยกัน 29 กันยายน 2567 START : โรงเรียนบ้านบางเบ้า ต.เกาะช้างใต้ อ.เกาะช้าง จ.ตราด . เปิดลงทะเบียนแล้วภายใน 31 สิงหาคม 67 ระยะวิ่ง 55K, 30K, 15K, 8K
วิ่ง PTTLNG 20th ANNIVERSARY TULIP RUN 2024 LINK
กิจกรรมวิ่ง PTTLNG 20th ANNIVERSARY TULIP RUN 2024 วันแข่ง 29 กันยายน 2024 อาคารนิทรรศน์พรรณพฤกษา อ.มาบตาพุด จ.ระยอง ระยะวิ่ง MiniMarathon 10 KM. ปล่อยตัว 05:30 น.FunRun 5 KM. ปล่อยตัว 05:45 น.
30 กันยายน และ 1 ตุลาคม : Swan Lake by Les Ballets de Monte Carlo
Swan Lake by Les Ballets de Monte Carlo
Main Hall, Thailand Cultural Centre
Date and Time :
• Saturday 30 September 2023 at 7:00 PM
• Sunday 1 October 2023 at 7:00 PM
Ticket Price : 4,500/ 4,000/ 3,500/ 2,700/ 1,800 THB
การฉลอง 25 ปีของงานมหกรรมฯ จะไม่สมบูรณ์ได้เลย ถ้าขาดการแสดงบัลเลต์ยอดนิยมตลอดกาลอย่างสวอนเลค โดยในครั้งนี้ ตำนานความรักของเจ้าชายซิกฟรีด และโอเด็ต หงส์ขาวต้องคำสาป จะเล่าผ่านการตีความของ Jean-Christophe Maillot ประกอบโปรดักชั่นยิ่งใหญ่ และเครื่องแต่งกายสุดอลัง ที่เสริมความลึกลับน่าพิศวงให้เรื่องราวอมตะเรื่องนี้
ท่วงทำนองเพลงอันงดงามจากผลงานประพันธ์ของไชคอฟสกี จะทำให้คุณตกอยู่ในภวังค์ และเคลิบเคลิ้มไปกับเรื่องราวของความรักที่เต็มไปด้วยอุปสรรค เวทมนตร์ การหลอกลวง และการต่อสู้กันระหว่างความดีและความชั่ว ที่ไม่ว่าจะบอกเล่าใหม่อีกกี่ร้อยครั้งก็ยังคงจับใจผู้ชมอยู่เสมอ
???? วันเสาร์ 30 กันยายน 2566 เวลา 19:00 น. และ วันอาทิตย์ 1 ตุลาคม 2566 เวลา 14:30 น.
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตดอนเมือง
สธ.จัดระบบรองรับนักท่องเที่ยวระยะยาว สร้างความปลอดภัย ป้องกันโรคโควิด 19
กระทรวงสาธารณสุข จัดระบบรองรับนักท่องเที่ยวระยะยาว 270 วัน สร้างความปลอดภัย ป้องกันโรคโควิด 19 วางเงื่อนไขกักกัน 14 วัน ปฏิบัติตามมาตรการด้านสาธารณสุขเพื่อป้องกันโรคโควิด 19 ได้ พร้อมสร้างความเข้าใจผู้ประกอบการ ประชาชน และชุมชน
วันป้องกันโรคพิษสุนัขบ้าโลก World Rabies Day 2020 LINK
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day 2020) กำหนดจัดงานในวันที่ 28 กันยายน 2563 ภายใต้แนวคิด “End Rabies: Collaborate, Vaccinate (ร่วมกันกำจัดโรคพิษสุนัขบ้า ด้วยการพาสัตว์เลี้ยงมาทำวัคซีน)” จัดโดย กรมปศุสัตว์เจ้าภาพหลัก
Video ศูนย์โรคหัวใจ โรงพยาบาลเจริญกรุงประชารักษ์ LINK
"แม้งานด้านการรักษา จะพัฒนาไปมาก แต่ผู้ป่วยโรคหัวใจก็มากขึ้นเช่นกัน
แสดงให้เห็นว่า โรคหลอดเลือดหัวใจ มีความรุนแรงเพิ่มขึ้น และมีแนวโน้มเพิ่มขึ้นอย่างต่อเนื่อง ส่งผลกระทบต่อคุณภาพชีวิตของประชากร เกิดความสูญเสียทางเศรษฐกิจ จากการเสียชีวิตก่อนวัยอันควร ส่งผลกระทบต่อระดับบุคคล ครอบครัว สังคม และประเทศชาติ"
จะดีกว่าไหมหาก เราทุกคนตระหนักถึงความรุนแรงของโรคหัวใจ หันมาดูสุขภาพของตนเอง รวมทั้งคนใกล้ชิด ให้มากขึ้น เพื่อหัวใจแข็งแรงมากขึ้น รวมทั้งป้องกันการเกิดภาวะโรคหัวใจกับผู้ที่มีภาวะเสี่ยงแล้ว
ได้แก่
- การควบคุมภาวะความดันโลหิตสูง
- เบาหวาน
- ไขมัน
- งดการสูบบุหรี่
เพื่อเลี่ยงภาวะเสี่ยงดังกล่าว ต้องสัญญากับตนเองว่า จะทำสิ่งเหล่านี้
- กินอย่างชาญฉลาด
- จะกระฉับกระเฉงมากขึ้น
- เลิกบุหรี่
แล้วภาวะเสี่ยงโรคหัวใจ จะไม่เกิดกับตัวคุณและคนที่คุณห่วงใย
การดูแลผู้ป่วยระยะสุดท้าย แบบประคับประคอง (Palliative Care) PDF LINK
คู่มือสำหรับประชาชน การดูแลผู้ป่วยระยะสุดท้าย แบบประคับประคอง (Palliative Care) PDF
มีนาคม 2556 รวม 47 หน้า
จัดทำโดยสำนักงานคณะกรรมการสุขภาพแห่งชาติ (สช.)
สารบัญ
ตอนที่ 1 แนวคิดและหลักการของการดูแลผู้ป่วยระยะสุดท้าย แบบประคับประคอง (Palliative Care)
ตอนที่ 2 การดูแลสุขภาพร่างกายเบื้องต้น
ตอนที่ 3 การดูแลทางจิต อารมณ์ ความรู้สึกของผู่ป่วยและญาต
ส่งท้าย
บรรณานุกรม
อาชีพผู้ดูแลผู้สูงอายุ โดย สถาบันคุณวุฒิวิชาชีพ (องค์การมหาชน)
สถาบันคุณวุฒิวิชาชีพ (องค์การมหาชน) เป็นหน่วยงานที่ได้ดำเนินการพัฒนาระบบคุณวุฒิวิชาชีพและจัดทำมาตรฐานอาชีพต่างๆ เพื่อให้ประชาชนได้เข้าถึงโอกาสการเรียนรู้และพัฒนาทักษะวิชาชีพ และสาขาวิชาชีพบริการสุขภาพ ก็เป็นหนึ่งในสาขาที่สถาบันฯ ได้จัดทำ สามารถคลิกเรียนได้ ฟรี ดังนี้
อาชีพผู้ดูแลผู้สูงอายุ ชั้น 1
ภาพรวมของธุรกิจ LINK
ธุรกิจสถานดูแลผู้สูงอายุ หมายถึง สถานบริการที่ไม่ใช่โรงพยาบาล มีการให้บริการ ที่พำนัก บริการยาแก่ผู้สูงอายุที่ไม่ต้องอยู่ภายใต้การดูแลของแพทย์อย่างเป็นประจำ โดยทั่วไปจะครอบคลุม การให้บริการอาหาร การดูแลความสะอาดเสื้อผ้าและที่พัก ตลอดจนความสะอาดของร่างกาย พร้อมทั้งติดตามดูแลสุขภาพเบื้องต้นอย่างใกล้ชิด แต่ ไม่ได้ให้การรักษาพยาบาล หากมีความเจ็บป่วยจะบริการนำส่งต่อแผนกคนไข้ของ โรงพยาบาลใกล้เคียงเพื่อรับการรักษาพยาบาลต่อไป
ปัจจุบันธุรกิจสถานดูแลผู้สูงอายุมีการแบ่งประเภทการให้บริการอยู่ 2 มิติ ดังนี้
มิติที่ 1 แบ่งตามระยะเวลาที่ผู้สูงอายุเข้ารับบริการ แบ่งเป็น 2 ประเภทคือ
1) การบริการแบบไปเช้า-เย็นกลับ (Day Care) สำหรับผู้สูงอายุที่ช่วยเหลือตนเองได้และมีญาติรับ-ส่ง
2) การบริการแบบสถานบริการดูแลระยะยาว (Long Stay) ที่ผู้สูงอายุอาศัยในสถานบริการนั้นเลยหรืออาศัยในช่วงเวลาใดเวลาหนึ่ง โดยญาติที่ไม่มีเวลาดูแลจะนำผู้สูงอายุมาฝากดูแล และมาเยี่ยมเป็นครั้งคราว
มิติที่ 2 แบ่งตามความต้องการการดูแลของผู้สูงอายุที่เข้ารับบริการ แบ่งเป็น 2
ประเภทคือ
1) ผู้สูงอายุที่ช่วยเหลือตนเองได้
2) ผู้สูงอายุที่อยู่ในภาวะพึ่งพา ทุพพลภาพ ช่วยเหลือตัวเองไม่ได้ มีโรคเรื้อรังหรือ
ต้องการผู้บริบาลและการรักษาพยาบาลอย่างใกล้ชิด
การขออนุญาตประกอบธุรกิจ
ในกรณีที่มีการดำเนินงานเป็นรูปแบบ “สถานพยาบาล” ต้องมีการขออนุญาตใน รูปแบบสถานพยาบาลตาม พ.ร.บ. สถานพยาบาล พ.ศ. 2541 และ พ.ร.บ. สถานพยาบาล (ฉบับที่ 2) พ.ค. 2547 และเป็นไปตามกฎกระทรวงว่าด้วยการประกอบ กิจการสถานพยาบาล พ.ศ. 2545 โดยยื่นคำขอและแจ้งได้ที่ศูนย์บริการธุรกิจสุขภาพ (one stop service) ชั้น 1 อาคารกรมสนับสนุนบริการสุขภาพหรือสำนักงาน สาธารณสุขจังหวัด
กิจวัตรจำเป็น 5 อย่าง (ADL)
ส่วนกิจวัตรจำเป็น 5 อย่าง (ADL*) ได้แก่
- อาบน้ำแปรงฟันได้เอง
- แต่งตัวสวมเสื้อผ้าได้เอง
- กินเองได้
- อึฉี่เองได้
- เดินเหินเองได้
* Activities of Daily Living
นพ.สันต์ ใจยอดศิลป์
-----
บางส่วนจากบทความโดย นพ.สันต์ ใจยอดศิลป์
เรื่อง "แผนชีวิตยามชรา..ถ้าระบบบัตรทองไม่ล่มไปเสียก่อน"
06 กุมภาพันธ์ 2563
Live สปสช ย้อนหลังและรายการต่างๆ
Live ย้อนหลังและรายการต่างๆ
ระบบจองห้องพิเศษออนไลน์ โรงพยาบาลราชวิถี LINK
ระบบจองห้องพิเศษออนไลน์ โรงพยาบาลราชวิถี
- หน่วยติดต่อ - สอบถามและจองห้องพิเศษ โทร. 02-2062900
- วันจันทร์-วันศุกร์ เวลา 08.00 - 16.00 น. ต่อ 10110-11,30109
เวลา 16.00 - 20.00 น. ต่อ 30109
- วันเสาร์-อาทิตย์ และวันหยุดราชการ เวลา 08.00 - 20.00 น. ต่อ 30109
กรมสุขภาพจิต จับมือกองปราบและเพจดัง เปิดตัว ทีมปฏิบัติการพิเศษป้องกันการฆ่าตัวตาย HOPE Task Force LINK
กรมสุขภาพจิต จับมือกองปราบและเพจดัง เปิดตัว ทีมปฏิบัติการพิเศษป้องกันการฆ่าตัวตาย HOPE Task Force
วันนี้ (9 ตุลาคม 2563) ในงานวันสุขภาพจิตโลก 2563 กรมสุขภาพจิตเปิดตัวนวัตกรรมด้านสุขภาพจิตรูปแบบใหม่ภายใต้ความร่วมมือกับ กองบังคับการปราบปราบ และ Social Influencer ชื่อดัง 3 เพจ ได้แก่ หมอแล็บแพนด้า Drama-addict และ แหม่มโพธิ์ดำ จัดตั้งทีมปฏิบัติการพิเศษป้องกันการฆ่าตัวตาย หรือ HOPE Task Force โดยคำว่า HOPE ย่อมาจาก Helpers of Psychiatric Emergency ซึ่งหมายถึง ผู้ช่วยเหลือด้านสุขภาพจิตฉุกเฉิน โดยทีมปฏิบัติการดังกล่าวจัดตั้งขึ้นเพื่อนำมาใช้ดูแลช่วยเหลือผู้ที่กำลังได้รับผลกระทบหรือมีสัญญานเสี่ยงต่อการฆ่าตัวตายในโลกโซเชียลให้ได้รับการช่วยเหลืออย่างทันท่วงที
ดร.สาธิต ปิตุเตชะ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า ภารกิจของ HOPE Task Force จะเริ่มตั้งแต่ประชาชนสามารถส่งข้อมูลบุคคลที่มีสัญญานเสี่ยงการฆ่าตัวตายที่ปรากฏอยู่บนโลกโซเชียลให้กับเฟสบุ๊คเพจ หมอแล็บแพนด้า Drama-addict และ แหม่มโพธิ์ดำ เพื่อรวบรวมข้อมูลเพิ่มเติม หลังจากนั้นในส่วนกองปราบปรามและกรมสุขภาพจิตจะร่วมกันวางแผนเข้าช่วยเหลือเร่งด่วนในพื้นที่ โดยมีการประสานกับตำรวจในท้องที่และโรงพยาบาลในพื้นที่เพื่อรองรับบุคคลที่มีความเสี่ยงในการฆ่าตัวตายและให้การดูแลจนหมดภาวะฉุกเฉิน และมีการจัดทีมเยียวยาด้านสุขภาพจิตดูแลอย่างต่อเนื่องในระยะยาวเพื่อป้องกันความเสี่ยงในการฆ่าตัวตายซ้ำ นับว่าความร่วมมือในครั้งนี้เป็นนิมิตหมายอันดีในการทำงานด้านสุขภาพจิต ถือเป็นโมเดลต้นแบบในการทำงานด้านสุขภาพจิตแบบบูรณาการในอนาคต และยังจะก่อให้เกิดประโยชน์ต่อประชาชนและสังคมไทยอย่างมากมาย โดยทำให้เกิดระบบการช่วยชีวิตที่รวดเร็ว ได้รับความช่วยเหลือทางด้านสุขภาพจิตอย่างฉับไว และมีการติดตามดูแลรักษาและบำบัดเยียวยาในระยะยาวเพื่อลดอัตราการฆ่าตัวตายซ้ำในอนาคต
พญ.พรรณพิมล วิปุลากร อธิบดีกรมสุขภาพจิต กล่าวว่า การจัดตั้ง HOPE Task Force ในครั้งนี้ เป็นการรวมตัวกันของ 3 ภาคส่วนที่มีเป้าหมายเดียวกันในการรักษาชีวิตประชาชน และเป็นการนำจุดแข็งของทั้ง 3 ภาคส่วนมารวมไว้ในที่เดียวกัน กรมสุขภาพจิตมีศักยภาพในการเยียวยารักษาปัญหาด้านสุขภาพจิตของประชาชน และบำบัดฟื้นฟูในระยะยาวเพื่อให้กลับมาใช้ชีวิตได้อย่างปกติสุข ด้านกองบังคับการปราบปรามมีศักยภาพในการสืบสวนและประสานงานในการเข้าถึงพื้นที่ได้อย่างรวดเร็วทั่วประเทศ และในด้าน social influencer มีความสามารถในการเข้าถึงสัญญาณเตือนที่ถูกส่งมาจากพี่น้องประชาชนได้อย่างรวดเร็ว เมื่อนำความเข้มแข็งของทั้งสามส่วนมารวมเข้าไว้ด้วยกัน จึงเกิดนวัตกรรมใหม่ที่ไม่เคยเกิดขึ้นที่ใดมาก่อน ทีมปฏิบัติการพิเศษป้องกันการฆ่าตัวตายนั้น ในระยะต้นจะเน้นการช่วยเหลือบุคคลที่ส่งสัญญาณความเสี่ยงต่อการฆ่าตัวตายในโลกออนไลน์เป็นสำคัญ แต่ในอนาคตนั้นจะสามารถขยายความช่วยเหลือไปยังภาวะฉุกเฉินด้านสุขภาพจิตอื่น ๆ นอกจากนั้นในระยะยาว กรมสุขภาพจิตยังมีแผนที่จะถ่ายทอดองค์ความรู้ การจัดการกับภาวะฉุกเฉินด้านสุขภาพจิตและการฆ่าตัวตายให้กับเจ้าหน้าที่กองบังคับการปราบปราม เจ้าหน้าที่ตำรวจที่สนใจ และ social influencers อีกด้วย กรมสุขภาพจิตจึงขอเชิญชวนพี่น้องประชาชนให้เป็นส่วนนึงของทีมปฏิบัติการพิเศษนี้ เพราะทุกคนสามารถเป็นความหวังแห่งชีวิตของใครสักคนได้เสมอ
พล.ต.ต.สุวัฒน์ แสงนุ่ม ผู้บังคับการปราบปราม กล่าวว่า การดำเนินงานนำร่องของ HOPE Task Force ในช่วงหลายเดือนที่ผ่านมา เพื่อพัฒนาและทดสอบความเป็นไปได้ของระบบนี้ จากทีมเล็ก ๆ จากหลายภาคส่วนที่มีความตั้งใจจริงในการช่วยเหลือประชาชน และเราก็เรียนรู้ว่าถ้าเราประสานพลังกัน การดำเนินงานรูปแบบใหม่นี้จะมีความเป็นไปได้และเป็นประโยชน์อย่างมหาศาลต่อประชาชน โดยตั้งแต่ต้นปีชุดเฉพาะกิจก็สามารถช่วยเหลือชีวิตคนที่มีความเสี่ยงในการฆ่าตัวตายไปแล้วไม่น้อยกว่า 60 ราย พี่น้องประชาชนอาจคุ้นเคยกับกองปราบปรามที่ปฏิบัติภารกิจด้านคดีอาชญากรรม แต่กองปราบปรามถือว่าการช่วยเหลือบุคคลที่ส่งสัญญาณความเสี่ยงต่อการฆ่าตัวตายบนโลกโซเชียลนั้น ก็เป็นอีกหนึ่งในภารกิจที่สำคัญของหน่วยงาน เพราะเราเล็งเห็นว่าไม่ว่าการช่วยเหลือประชาชนนั้นจะมาจากรูปแบบใดหรือเรื่องใด หากประชาชนสามารถคลายความทุกข์ได้ ก็ถือเป็นหน้าที่ที่พึงกระทำของพวกเรา
นทพ.ภาคภูมิ เดชหัสดิน หรือ หมอแล็บแพนด้า กล่าวว่า ในฐานะที่ผมเป็นตัวแทนของภาคส่วนที่เป็น Social influencers ทั้ง 3 เพจ ได้แก่ หมอแล็บแพนด้า Drama-addict และ แหม่มโพธิ์ดำ ต้องขอเรียนว่าพวกเรารู้สึกภูมิใจที่ได้เป็นส่วนหนึ่งของทีมปฏิบัติการพิเศษนี้ ความร่วมมือในครั้งมีลักษณะที่แตกต่างจากความร่วมมือด้านการประชาสัมพันธ์หรือให้ความรู้ทั่วๆไป เพราะ Social influencers และ เพจต่างๆ นั้นจะเข้าไปเป็นส่วนหนึ่งของปฏิบัติการพิเศษด้วยตั้งแต่แรกเริ่ม ซึ่งพลังของโลกโซเชียลนั้นทำให้เราสามารถรวบรวมข้อมูลได้มหาศาลในระยะเวลาอันสั้น ซึ่งข้อมูลเหล่านั้นก็เกิดจากความรักและความห่วงใยที่พวกเรามีให้กันในสังคม ผมเชื่อว่าเราทุกคนคงอยากเห็นความร่วมมือดีดีแบบนี้ถูกพัฒนาต่อไปในอนาคต
9 ตุลาคม 2563
โรงพยาบาลมหาวชิราลงกรณธัญบุรี เปิดโครงการ สัปดาห์ World Hospice & Palliative Care Day ครั้งที่ 10 LINK
ด้าน นายแพทย์อาคม ชัยวีระวัฒนะ ผู้อำนวยการโรงพยาบาลมหาวชิราลงกรณธัญบุรี กล่าวว่า เนื่องจากทุกวันเสาร์ ที่ 2 ของเดือนตุลาคม ทั่วโลกจะจัด World Hospice & Palliative Care Day เพื่อเป็นการกระตุ้น เตือนให้สังคมรับรู้ ถึงการดูแลประคับประคองผู้ป่วย ซึ่งการดูแลรักษาผู้ป่วยมีทั้งส่วนที่หายและไม่หาย โดยเฉพาะผู้ป่วยโรคมะเร็งมีความจำเป็นต้องได้รับการดูแลในระยะท้าย เพื่อที่จะให้ผู้ป่วยมีคุณภาพชีวิตที่ดี และสามารถจากไปอย่างสงบ สมศักดิ์ศรี ของความเป็นมนุษย์ หรือเรียกว่าตายดี ซึ่งการจัดงานในครั้งนี้เป็นการกระตุ้นเตือน ซึ่งปีนี้จัดภายใต้ Theme Palliative care: “My care ,My comfort: ดูแลห่วงใยใส่ใจความสุขสบาย” เพื่อให้ทุกฝ่ายเข้าใจและตระหนักว่าผู้ป่วยมีสิทธิ์ได้รับการดูแลระยะประคับประคองที่ดี ซึ่งทั่วโลกพบว่ามีผู้ป่วยที่เข้าถึงการดูแลที่ดีเพียง 10 – 15 เปอร์เซ็นต์ โดยในประเทศไทยได้มีการส่งเสริมการดูแลผู้ป่วยระยะนี้เพิ่มมากขึ้น ได้รู้จักกับทางเลือกในการดูแลผู้ป่วยในระยะท้าย เป็นโอกาสให้ได้พบแพทย์ที่ให้การดูแลแบบประคับประคอง ทำให้ผู้ป่วยจากไปอย่างสงบ
6 ตุลาคม 2563
นายแพทย์อาคม ชัยวีระวัฒนะ ผู้อำนวยการโรงพยาบาลมหาวชิราลงกรณธัญบุรี เป็นประธานกล่าวเปิดโครงการ สัปดาห์ World Hospice & Palliative Care Day ครั้งที่ 10
นายแพทย์อาคม ชัยวีระวัฒนะ ผู้อำนวยการโรงพยาบาลมหาวชิราลงกรณธัญบุรี เป็นประธานกล่าวเปิดโครงการ สัปดาห์ World Hospice & Palliative Care Day ครั้งที่ 10 พร้อมด้วยนายแพทย์วิโรจน์ รัตนอมรสกุล ประธาน Service Plan ด้าน Palliative Care เขตสุขภาพที่ 4 ร่วมตัดริบบิ้นเปิดงานนิทรรศการ โดยมี ดร.ทัศนีย์ เกริกกุลธร ผู้อำนวยการวิทยาลัยพยาบาลบรมราชชนนี สระบุรี นายสุรินทร์ คำสิน ปลัดเทศบาล เทศบาลเมืองสนั่นรักษ์ เครือข่ายด้านการดูแลผู้ป่วยแบบประคับประคอง และคณะผู้บริหารร่วมในพิธี ณ ลานอเนกประสงค์ โรงพยาบาลมหาวชิราลงกรณธัญบุรี จังหวัดปทุมธานี เมื่อวันที่ 7 ตุลาคม 2562
Absolute View Suite
ห้องพักผู้ป่วยวีไอพี สามารถเห็นวิวพาโนรามา ได้ทั้งด้านทะเลสาบ-สวนป่าเบญจกิติ และโค้งน้ำเจ้าพระยา เป็นห้องที่มีพื้นที่กว้างขวาง ถึง 90 ตารางเมตร มีการแบ่งพื้นที่ห้องผู้ป่วยเป็นสัดส่วน เพื่อสนองความต้องการของผู้ป่วยที่ต้องการความเป็นส่วนตัว มีโซนพักผ่อนของญาติแยกเป็นสัดส่วน
พื้นที่ห้อง 90 Sq.M.
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- ตู้เย็น
- ไมโครเวฟ
- ทีวี
- อุปกรณ์ในห้องน้ำ
- ตู้เซฟ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 14,500 บาท
- ค่าอาหาร 1,500 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 1,000 บาท
รวม 20,200 บาท
ศูนย์เลสิก ม.อ. PSU Lasik Center LINK
คลินิกพิเศษ(Premium Clinic) ภายใต้มาตรฐานการรักษาของโรงพยาบาลสงขลานครินทร์
ใครยังลังเลอย่ารอช้า สายตาสั้น เอียง หรือยาวตั้งแต่กำเนิด
ได้เวลาบอกลาแว่นตาและคอนแทคเลนส์กันแล้วค่ะ ?
—
สอบถามเพิ่มเติมหรือจองคิว
☎ โทร : 074-451-746
ศุนย์โรคหัวใจ รพ.เจริญกรุงประชารักษ์
หน่วยงานและคลินิกที่เกี่ยวกับศูนย์โรคหัวใจ โรงพยาบาลเจริญกรุงประชารักษ์
- คลินิกอายุรศาสตร์โรคหัวใจ (Cardiology Clinic)
- คลินิกศัลยกรรมหัวใจและทรวงอก (Cardio Thoracic Surgery)
- ห้องปฏิบัติการสวนหัวใจและหลอดเลือด (Cardiac Catheterization Laboratory)
- คลินิกหัวใจเข้มแข็ง (Heart Failure Clinic)
- คลินิกวาร์ฟาริน (Warfarin Clinic)
- ห้องกระตุ้นไฟฟ้าหัวใจ (Electrocardiogram : EKG)
- ห้องตรวสมรรถภาพหัวใจ (Cardiac echo : Echocardiogram) ห้องฟื้นฟูสมรรถภาพหัวใจ (Cardiac Rehabilitation)
ติดต่อ คลินิกอายุรศาสตร์โรคหัวใจ
โทรศัพท์ :E-mail :ckphf19@gmail.com
ติดต่อ คลินิกศัลยกรรมหัวใจและทรวงอก
ที่ตั้ง :ห้องปฏิบัติการสวนหัวใจและหลอดเลือด
ชั้น 5 อาคาร 72 พรรษา มฐา
ราชินี
โทรศัพท์ : 02-289-7510
E-mail : ckphf19@gmail.com
ศูนย์ความเป็นเลิศ : ศูนย์หัวใจและห้องปฏิบัติการสวนหัวใจผ่านทางข้อมือ LINK
ศูนย์หัวใจและห้องปฏิบัติการสวนหัวใจผ่านทางข้อมือ(Transradial Catheterization Center)
เปิดให้บริการตั้งแต่เดือนกันยายน พ.ศ. 2553 สามารถทำการฉีดสี ทำบอลลูน ใส่ขดลวดขยายหลอดเลือดหัวใจ (Percutaneous Coronary Intervention;PCI) ทำการผ่าตัดศัลยกรรมหัวใจและทรวงอกเพื่อทำการรักษาแก่ผู้ป่วยที่ไม่สามารถรักษาได้ด้วยการทำบอลลูน ขยายหลอดเลือดหัวใจด้วยการผ่าตัดเบี่ยงหลอดเลือดหัวใจ (Coronary Artery Bypass Graft Surgery; CABG) การสวนหัวใจเร่งด่วนในผู้ป่วยหัวใจขาดเลือดแบบเฉียบพลัน ชนิด STEMI แบบผ่านทางข้อมือ ตลอด 24 ชั่วโมง
นอกจากนี้โรงพยาบาลสมเด็จพระปิ่นเกล้าวางแผนพัฒนาให้เป็นศูนย์หัวใจครบวงจรแบบ One Stop Service ที่บริเวณ ชั้น 4 ของอาคารพิเคราะห์และบำบัดโรคโดยจุดเด่นคือมีห้องพักสำหรับ ผู้ป่วยที่ได้รับ การสวนหัวใจผ่านทางข้อมือ (Radial Lounge) เป็นการบริการแบบ Same Day Discharge เพื่อให้ผู้ป่วย ได้รับความสุขสบายลดภาระค่าใช้จ่ายในการนอนโรงพยาบาล ระยะเวลารอคอยการทำหัตถการสวนหัวใจสั้นลง เหลือเพียง 14 วัน
อลอฟท์ กรุงเทพ สุขุมวิท 11 ร่วมกับโรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนล
พร้อมเป็นสถานที่กักตัวทางเลือก Alternative State Quarantine (ASQ) อย่างคุ้มค่าใจกลางกรุงเทพ ราคาเริ่มต้นที่ 49,500 บาท
Our Facility 5th Floor (OPD Floor)
Reception and Waiting area, interior design is inspired by interior design of our H/Q in Japan which emphasizes functionality and clean environment.
Counseling Room, welcoming and feeling safe, you will be discussing with the doctor without time restriction.
Examination Room/ Ultrasound scan, clean and feel comfortable, 2 display monitors during the examination you will be separated from doctor by curtain to keep your privacy and less embarrassment.
Nurse station, you will be teaching and practicing how to inject medicine by yourself at home.
Blood Collection & Injection Room, hygienic and tidy, your blood sample will be collected as per request from doctor and supporting injection in case you feel afraid to inject by yourself.
กรณีที่ 1 ด่านพรมแดนทางบก (ไม่แวะพัก)
หมายเหตุ
- รถพยาบาล (Ambulance) ต้องมีมาตรฐานตามที่สถาบันการแพทย์ฉุกเฉินแห่งชาติ หรือสถาบันบำราศนราดูร กรมควบคุมโรคกำหนด หรือ
- รถตู้ผลิตจากโรงงาน ไม่เกิน 11 ที่นั่ง ไม่มีห้องน้ำ เป็นไปตามมาตรฐานความปลอดภัยด้านสุขอนามัย (Amazing Thailand Safety and Health Administration: SHA) ของการท่องเที่ยวแห่งประเทศไทย
บริษัทยา ไฟเซอร์ (Pfizer) เปิดเผยผลการทดสอบวัคซีนโควิด-19 เฟส 3 ซึ่งประสบผลสำเร็จมากกว่า 90%
นายอัลเบิร์ต บัวร์ลา กรรมการผู้จัดการใหญ่และประธานฝ่ายบริหารของไฟเซอร์ ประกาศผลการทดสอบวัคซีนเฟส 3 ขั้นตอนท้าย ในวันจันทร์ร่วมกับบริษัทพันธมิตร BioNTech โดยระบุว่าประสบความสำเร็จมากกว่า 90% ในการป้องกันการติดเชื้อโคโรนาไวรัสของกลุ่มตัวอย่างอาสาสมัครที่เข้าร่วมในการทดสอบ
การวิเคราะห์ข้อมูลการทดสอบครั้งนี้จัดทำโดยคณะกรรมการอิสระ โดยมีอาสาสมัครเข้าร่วมเกือบ 40,000 คนใน 6 ประเทศ รวมทั้งสหรัฐฯ
นายอัลเบิร์ต บัวร์ลา กล่าวว่าผลการทดสอบแสดงให้เห็นว่าวัคซีนชนิดนี้สามารถช่วยป้องกันการติดโควิด-19 ในคนส่วนใหญ่ที่ได้รับวัคซีน และถือเป็นก้าวสำคัญสำหร้บการทดสอบขั้นต่อไป อย่างไรก็ตาม เขาเตือนว่าเฉพาะแค่ผลการทดสอบนี้อาจจะยังไม่เพียงพอที่จะได้รับการรับรองจากองค์การอาหารและยาของสหรัฐฯ หรือ เอฟดีเอ สำหรับใช้ในกรณีฉุกเฉิน และจำเป็นต้องมีการเก็บข้อมูลด้านความปลอดภัยของวัคซีนเพิ่มเติม
ซีอีโอของไฟเซอร์ผู้นี้ชี้ว่า ข้อมูลด้านความปลอดภัยของวัคซีนเข็มที่สองและเข็มสุดท้ายในช่วงเวลาเฉลี่ยสองเดือนตามแนวทางที่เอฟดีเอกำหนดไว้นั้น จะสามารถเปิดเผยออกมาได้ในช่วงสัปดาห์หน้า ก่อนที่จะเข้าสู่ขั้นตอนต่อไป
ก่อนหน้านี้ นายแพทย์แอนโธนี เฟาชี่ แห่งสถาบันโรคภูมิแพ้และโรคติดเชื้อแห่งชาติของสหรัฐฯ ระบุว่าวัคซีนที่มีอัตราผลสำเร็จในระดับ 70 - 75% ถือว่ายอมรับได้
และในวันจันทร์ ประธานาธิบดีโดนัลด์ ทรัมป์ ทวีตข้อความแสดงความยินดีต่อข่าวความคืบหน้าด้านวัคซีนของไฟเซอร์ โดยบอกว่าเป็น "ข่าวดีอย่างยิ่ง" และว่า ดัชนีหุ้นต่าง ๆ ต่างดีดตัวสูงขึ้นรับข่าวนี้
ทางด้านว่าที่ประธานาธิบดีสหรัฐฯ คนใหม่ โจ ไบเดน มีแถลงการณ์แสดงความยินดีต่อการประกาศของไฟเซอร์เช่นกัน แต่ก็เตือนว่าการต่อสู้กับโควิด-19 ยังต้องดำเนินต่อไปอีกหลายเดือน
VOA Thai
10/11/2563
บทนำ
เมื่อพูดถึงอาการนอนกรน คงไม่มีใครที่ไม่รู้จัก อาการนอนกรนเป็นสิ่งที่พบได้บ่อยมากจนอาจจะกล่าวได้ว่า ไม่มีใครเลยที่ไม่เคยได้ยินเสียงกรนจากคนใกล้ชิด ดังนั้นใครก็ตามเมื่อได้ยินเสียงดังกล่าวแม้จะไม่ได้เห็นต้นเสียง ก็สามารถบอกได้ทันทีว่าเป็น “เสียงกรน” และคิดต่อไปโดยทันทีว่าเจ้าของเสียงกำลังหลับสนิท คนส่วนใหญ่เห็นเป็นเรื่องปกติเพราะพบได้บ่อยมากและกลับเห็นเป็นเรื่องตลกขบขัน นำ มาล้อเลียนกันในตอนเช้า แต่น้อยคนนักที่จะทราบว่าเสียงกรนเหล่านี้ จริงๆเป็นสัญญาณขอความช่วยเหลือจากเจ้าของเสียง ที่เรียกร้องให้คนใกล้ชิดหรือผู้พบเห็นได้ช่วยบอกเจ้าของเสียงว่า การหลับของเขานั้นไม่เคยจะสนิทเลยเนื่องจากการหายใจขณะหลับของเขากำลังมีปัญหา
อัพเดตข้อมูลใหม่ก่อนเริ่มใช้ บัตรทอง 30 บาทรักษาได้ทุกที่
แผนปฎิบัติการแก้ไขปัญหาฝุ่น PM 2.5 ของกรุงเทพมหานคร
10 ข้อ เพื่อความเข้าใจที่ถูกต้อง
วิธีที่ 1 - ยื่นด้วยแบบฟอร์ม สปส. 9-02
สำหรับการลงทะเบียนขอเปลี่ยนสถานพยาบาลของประกันสังคม ผู้ประกันตนต้องเตรียมเอกสาร ดังนี้
- กรอกแบบขอบัตรรับรองสิทธิการรักษาพยาบาล สปส. 9-02
- บัตรรับรองสิทธิการรักษาพยาบาลฉบับเดิม
- สำเนาบัตรประจำตัวประชาชน
- กรณีย้ายที่อยู่ควรเตรียมหลักฐานการย้ายที่อยู่ด้วย
กรณียื่นเอกสารระหว่างวันที่ 1 ถึง 15 (ก่อน 16.30 น.ของวันที่ 15) ผู้ประกันตนจะสามารถใช้สิทธิของโรงพยาบาลแห่งใหม่ได้ในวันที่ 16 ของเดือนนั้น ส่วนกรณียื่นเอกสารระหว่างวันที่ระหว่างวันที่ 16 ถึงวันทำการสุดท้ายของเดือน (ก่อน 16.30 น.ของวันสุดท้ายของเดือน) ผู้ประกันตนจะสามารถใช้สิทธิของโรงพยาบาลแห่งใหม่ได้ในวันที่ 1 ของเดือนถัดไป
เที่ยวเมืองไทย สุขภาพดี วิถีถิ่น 2020 (Thailand Travel)
เที่ยวเมืองไทย สุขภาพดี วิถีถิ่น 2020 (Thailand Travel)
9 - 13 ธันวาคม 2563
ณ ลานเมือง ชั้น G เมืองสุขสยาม ไอคอนสยาม กรุงเทพมหานคร
- สัมผัสเส้นทางท่องเที่ยวเชิงสุขภาพ ศาสตร์เพื่อการรักษา สมุนไพรเพื่อความผ่อนคลาย จากเมืองสมุนไพร
- เวิร์คช้อปเพื่อการบำบัด อาทิ นวด ล้างพิษ จิบชาเพื่อบำบัด
- แพคเกจท่องเที่ยวเชิงสุขภาพราคาปันสุข
- Half Day Trip : The Hidden Gem in Bangkok เส้นทางศาสตร์เพื่อสุขภาพและการบำบัด ตามรอยหมอไทย ยาไทย
- กิจกรรมวิถีถิ่น 4 ภาค
- กิจกรรมแจก voucher และส่วนลดที่พัก
- เส้นทางกัญชาทางการแพทย์และท่องเที่ยวเชิงสุขภาพ จังหวัดสกลนคร และ จังหวัดพัทลุง
Update ‼️1 ธันวาคม 2563 LINK
การตรวจติดตามกลุ่มผู้สัมผัส ผู้ป่วยโควิด-19 รายที่ 42 ของจ.เชียงใหม่
ความคืบหน้าในการติดตามผู้สัมผัสผู้ป่วยในวันนี้ พบว่ามีผู้สัมผัส 312 ราย ตรวจไปแล้ว 295 ราย ผลการตรวจ "ไม่พบเชื้อ" ทั้งหมด โดยมีรายละเอียดดังนี้
- กลุ่มเสี่ยงสูง 90 ราย :
ตรวจแล้ว 88 ราย ผลเป็นลบทั้งหมด ยังขาดอีก 2 ราย คือผู้ที่โดยสารรถกรีนบัสร่วมกับผู้ป่วย ที่อยู่ระหว่างติดตามตัวเพื่อทำการตรวจต่อไป ผู้สัมผัสในกลุ่มนี้ จะถูกกักตัวและจะได้รับการตรวจซ้ำอีกครั้ง
- กลุ่มเสี่ยงต่ำ 150 ราย :
ตรวจแล้ว 135 ราย ผลเป็นลบทั้งหมด สำหรับกลุ่มนี้ตรวจได้เพิ่มจากเมื่อวาน 56 ราย เป็นกลุ่มสัมผัสในห้างเซนทรัลเฟสติวัล
- กลุ่มอื่นๆ 72 ราย :
ตรวจครบแล้ว 72 ราย ผลเป็นลบทั้งหมด กลุ่มนี้คือผู้ที่อาศัยคอนโดเดียวกับผู้ป่วยและผู้ที่สแกนไทยชนะห้างเซนทรัลเฟสติวัล
ทำให้ยังเหลือผู้สัมผัสอีก 17 รายที่ต้องติดตามมาตรวจต่อไป
นอกจากนี้แล้วคณะกรรมการโรคติดต่อจ.เชียงใหม่ ร่วมกับ สคร.1 คณะเทคนิคการแพทย์มหาวิทยาลัยเชียงใหม่ ได้ทำการตรวจกลุ่มผู้ที่อยู่นอกเหนือจากผู้สัมผัสใกล้ชิด ณ ห้างเซนทรัลเฟสติวัล จำนวน 316 ราย ผลเป็นลบทั้งหมด
ขณะที่โรงพยาบาลนครพิงค์ได้ทำการคัดกรองผู้ป่วยในคลินิกไข้หวัด (ARI clinic) และ จุดคัดกรองโควิด (Modular swab unit) ระหว่าง 27 พ.ย.- 1 ธ.ค. ตรวจไป 138 ราย ผลเป็นลบทั้งหมด
Cr ข้อมูลจาก สำนักงานสาธารณสุขจังหวัดเชียงใหม่
และงานควบคุมโรคและระบาดวิทยา รพ.นครพิงค์
ผู้ป่วยยืนยันโรคโควิด-19 บุคลากรทางการแพทย์ ปฏิบัติงานที่ ASQ
ผู้ป่วยยืนยันโรคโควิด-19 บุคลากรทางการแพทย์ ปฏิบัติงานที่ ASQ จำนวน 6 ราย ติดเชื้อจากการปฎิบัติหน้าที่และการใช้ชีวิตประจำวันนอกเวลางานกับเพื่อนร่วมงาน
สั่งปิดงานบิ๊กเม้าท์เท่น วันที่ 13-14 ธ.ค. 63
เหตุไม่เป็นไปตามมาตรการป้องกันโควิด-19 เสี่ยงแพร่โรค
ผู้ว่าจังหวัดนครราชสีมามีคำสั่งปิดคอนเสิร์ต Big Mountain Music Festival ครั้งที่ 11 ณ สนามกอล์ฟ ดิโอเชี่ยนเขาใหญ่ อ.ปากช่อง จ.นครราชสีมา ในวันที่ 13 ธ.ค. 63 เวลา 14.00 น. ถึงวันที่ 14 ธ.ค. 63 เวลา 14.00 น.
เนื่องจากการจัดงานไม่เป็นไปตามมาตรการป้องกันโควิด-19 ทำให้เสี่ยงต่อการแพร่โรค ดังนี้
- ไม่สามารถจำกัดจำนวนผู้เข้าร่วมงานตามมาตรการ ทำให้เกิดความแออัด
- ผู้เข้าร่วมงานส่วนใหญ่ไม่สวมหน้ากากอนามัยตลอดเวลา
- มีการตะโกนร้องเพลงเป็นระยะ ๆ
- ผู้จัดงานไม่ปฏิบัติตามมาตรการป้องกันโรคอย่างเคร่งครัด
- ไม่มีผู้ควบคุมงานที่สามารถตัดสินใจได้มาควบคุมงาน
ทั้งนี้ หลังผู้จัดงานขอยื่นอุทธรณ์ คณะกรรมการโรคติดต่อจังหวัดนครราชสีมาได้ประชุมและมีมติให้ยืนยันคำสั่งปิดตามเดิม รวมถึงออกคำสั่งให้บังคับใช้กฎหมายแล้ว
ที่มา:
สำนักงานจังหวัดนครราชสีมา (https://covid-19.nakhonratchasima.go.th/announce/detail/37)
เมียนมา ขยายมาตรการยับยั้งการระบาดของโรค COVID-19
สาธารณรัฐแห่งสหภาพเมียนมา ประกาศขยายมาตรการยับยั้งการระบาดของโรค COVID-19 ออกไปจนถึงวันที่ 31 ธันวาคม 2563 โดยจะมีผลกับคำสั่งทั้งหมดที่ออกโดยองค์กรรัฐและกระทรวงต่าง ๆ ที่จะหมดอายุในวันที่ 15 ธันวาคม 2563
เทศกาลปีใหม่ที่ย่านไทม์สแควร์จัดตามปกติ แต่ห้ามเข้า ชมผ่านทีวีแทน
สหรัฐอเมริกา คณะกรรมการจัดงานเคาท์ดาวน์นิวยอร์ก ระบุว่าการจัดกิจกรรมเฉลิมฉลองเทศกาลปีใหม่ที่ย่านไทม์สแควร์ จะยังคงมีขึ้นตามปกติแต่ไม่อนุญาตให้ประชาชนเข้าพื้นที่จัดงาน ทั้งนี้จะถ่ายทอดสดผ่านทางสถานีโทรทัศน์ให้ประชาชนได้ชม
Timeline ผู้ป่วย จ.สมุทรสาคร
Timeline ผู้ป่วย เพศหญิง สัญชาติไทย อายุ 67 ปี อาชีพค้าขาย (เจ้าของแพปลา ตลาดกุ้ง จ.สมุทรสาคร)
Timeline ผู้ป่วย เพศหญิง สัญชาติไทย อายุ 67 ปี อาชีพค้าขาย (เจ้าของแพปลา ตลาดกุ้ง จ.สมุทรสาคร)
กรณีสมุทรสาคร จะเป็นบทเรียนอันยิ่งใหญ่สำหรับประเทศไทย
โควิด 19
ทั่วโลกมีการระบาดอย่างหนักมีการเพิ่มขึ้นถึงจำนวน 6 - 7 แสนคนต่อวัน ภายในเดือนมกราคมประชากรโลกที่เสียชีวิตจากโควิด 19 น่าจะถึง 2 ล้านคน
เราจะต้องอยู่ในความไม่ประมาท เรามีบทเรียนจากสิงคโปร์และมาเลเซีย
ที่มีการระบาดอย่างมากในกลุ่มแรงงาน และโรงงานอุตสาหกรรม เช่น โรงงานถุงมือยางในมาเลเซีย ที่ต้องปิดโรงงานจำนวนมาก
การป้องกันการระบาดในรายงาน จึงเป็นเป้าหมายใหญ่ที่จะป้องกันการระบาดในประเทศไทย
กรณีสมุทรสาคร จะเป็นบทเรียนอันยิ่งใหญ่สำหรับประเทศไทย
เรามีแรงงานต่างด้าวเป็นจำนวนมาก โดยเฉพาะในอาชีพประมงที่คนไทยไม่ยอมทำ
การระบาดในกลุ่มแรงงานที่มีการอยู่กันอย่างหนาแน่น จะทำให้เกิดการระบาดเป็นจำนวนมากอย่างรวดเร็ว
สิ่งสำคัญอีกอย่างหนึ่งโรงงานอุตสาหกรรม การก่อสร้าง ที่มีแรงงานจำนวนมาก จำต้องมีมาตรการที่เข้มแข็งในการป้องกันการระบาดในกลุ่มประชากรดังกล่าว
บทเรียนจากญี่ปุ่นเกาหลีและของไทย ที่ผ่านมาเกิดการระบาดในสถานที่ปกปิด สนามมวย ผับบาร์ กิจกรรมทางศาสนา
บทเรียนจากสิงคโปร์และมาเลเซีย เกิดกับแรงงานที่อยู่รวมกันจำนวนมาก
ทุกบทเรียนในอดีต จะต้องเข้ามาอยู่ในกระบวนการป้องกัน ทุกคนสามารถช่วยกันป้องกันได้ จะต้องเห็นประโยชน์ต่อส่วนรวม
เราจะต้องเสียค่าใช้จ่ายเป็นจำนวนมาก ในการตรวจวินิจฉัย สอบสวนโรค และการรักษาถ้ามีการระบาดเกิดขึ้นในประเทศไทย
Yong Poovorawan
19 ธ.ค. 2563
ผู้ที่ไปตลาดกลางกุ้ง สมุทรสาคร ในช่วงวันที่ 1 ธันวาคม 2563 ให้ขอรับการตรวจโรคโควิด-19 ได้ที่โรงพยาบาลทุกแห่ง
ย้ำเตือน...
ผู้ที่ไปตลาดกลางกุ้ง จังหวัดสมุทรสาคร ในช่วงวันที่ 1 ธันวาคม 2563 หากมีอาการสงสัยว่าป่วย หรือสงสัยสัมผัสผู้ป่วย ให้ขอรับการตรวจโรคโควิด-19 ได้ที่โรงพยาบาลทุกแห่ง พร้อมแจ้งประวัติเสี่ยงค่ะ
@riskcom
@DDChotline
โทร 1422
ไทยรู้สู้โควิด
กรุงเทพฯ LINK
ทางกทม ได้แจ้งขอความร่วมมือ ผู้ที่อาศัยอยู่ในกทม ให้ร่วมประเมินความเสี่ยงติดเชื้อ ในกรณี ดังนี้
- มีประวัติเดินทางไปยังตลาดกลางกุ้ง จ. สมุทรสาคร ในช่วงวันที่ 1 ธ.ค. เป็นต้นมา
- มีลูกจ้างและพนักงานโดยเฉพาะชาวต่างชาติ
เห็นชอบหลักการกรณีใช้น้ำมันกัญชาในผู้ป่วยโรคมะเร็ง พาร์กินสัน และไมเกรน
บอร์ด สปสช. ได้เห็นชอบหลักการกรณีใช้น้ำมันกัญชาในผู้ป่วยโรคมะเร็ง พาร์กินสัน และไมเกรน และสารสกัดกัญชาในผู้ป่วยโรคลมชัก และมะเร็งระยะท้าย วงเงิน 58.3 ล้านบาท ซึ่งจะนำเข้าสู่คณะกรรมการพัฒนายาหลักแห่งชาติต่อไป
ล็อกดาวน์ จ.สมุทรสาคร 19ธ.ค.63-3ม.ค.64 (14วัน)
ล็อกดาวน์ สกัดCOVID-19 จ.สมุทรสาคร 19ธ.ค.63-3ม.ค.64 (14วัน) พร้อมออกมาตรการคุมเข้มในจังหวัด
21 ธค 63
เทคนิคล้างมือ 7 ขั้นตอน
เทคนิคล้างมือ 7 ขั้นตอน
- เริ่มล้างมือด้วยน้ำและสบู่ ใช้ฝ่ามือถูกัน
- ใช้ฝ่ามือถูหลังมือและนิ้วถูซอกนิ้ว
- ใช้ฝ่ามือถูฝ่ามือและนิ้วถูซอกนิ้ว
- ใช้หลังนิ้วมือถูฝ่ามือ
- ใช้ฝ่ามือถูนิ้วหัวแม่มือโดยรอบ
- ใช้ปลายน้ิวมือถูขวางฝ่ามือ
- ใช้ฝ่ามือถูรอบข้อมือ
เซฟเก็บไว้ในมือถือ ส่งต่อให้เพื่อน แจกจ่ายและแชร์ออกไปให้กว้างขวาง
ผลตรวจรอบแรกออกแล้ว! ปลัดสธ.-ผู้บริหารสธ.ทุกคนเป็นลบ ไม่พบโควิด19 LINK
ปลัดสธ. เผยผลตรวจหาเชื้อโควิดรอบแรกผู้บริหารทุกคน ไม่พบโควิด-19 พร้อมเฝ้าระวังสังเกตอาการตามมาตรการกรมควบคุมโรค กระทรวงสาธารณสุข
หลังจากนายอนุทิน ชาญวีรกูล รองนายกฯและรัฐมนตรีว่าการกระทรวงสาธารณสุข(สธ.) ประกาศกักตัวเอง 14 วันและผลตรวจเชื้อครั้งแรกไม่พบโควิด-19 ภายหลังที่นายวีระศักดิ์ วิจิตร์แสงศรี ผู้ว่าราชการจังหวัดสมุทรสาคร ติดเชื้อ ขณะที่ผู้บริหารท่านอื่นๆ รวมทั้งนพ.เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข ได้ตรวจเชื้อเช่นกันและขณะนี้เฝ้าระวังสังเกตอาการ โดยผลตรวจเชื้อของทีมผู้บริหารสธ.จะออกภายในวันนี้
ล่าสุดเมื่อวันที่ 28 ธ.ค. นพ.เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข กล่าวถึงกรณีนี้ ว่า ขณะนี้ไม่อยากให้เกิดประเด็นดราม่า ทุกคนที่ไปร่วมงานตั้งใจทำงานเพื่อบ้านเมือง ไม่มีใครอยากให้เหตุการณ์แบบนี้เกิดขึ้น ทั้งนี้ จากการตรวจหาเชื้อในบุคคลใกล้ชิดผู้ว่าฯ จ.สมุทรสาคร ทั้งภรรยาและเลขานุการหน้าห้องที่มีความใกล้ชิดมาก ก็ยังไม่มีใครติดเชื้อจากผู้ว่าฯ ส่วนทีมผู้บริหาร อธิบดีที่ลงพื้นที่จ.สมุทรสาครร่วมงานการรับประทานอาหารทะเล ปลอดภัยแต่ต้องปรุงสุก ที่จ.สมุทรสาครเมื่อวันที่ 27 ธ.ค.ที่ผ่านมา อยุ่ระหว่างรอผลตรวจเชื้อ คาดว่าจะทราบผลภายในวันนี้(28 ธ.ค.)
(ข่าวเกี่ยวข้อง: ลุ้นผลตรวจโควิด! อธิบดี-ผู้บริหาร สธ. ลงพื้นที่สมุทรสาคร หลังผู้ว่าฯติดเชื้อ)
ต่อมาเวลาประมาณ 14.40 น. เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข โพสต์เฟซบุ๊กว่า กรมวิทยาศาสตร์การแพทย์ แจ้งผลตรวจ RT-PCR ของผู้บริหารกระทรวงสาธารณสุขเป็นลบทุกคน
1. นัดหมายออนไลน์
สำหรับผู้ป่วยใหม่ที่ต้องการทำนัด สามารถทำผ่านระบบออไลน์ Telemedicine โดยสแกน QR ได้ทันที ซึ่งระบบนี้จะสร้างความมั่นใจในเรื่องการนัดหมาย ไม่ต้องรอคิว ลดแออัด มีกำหนดแน่นอน
1. บริษัท Pfizer
เป็นวัคซีนชนิด mRNA ต้องฉีด 2 ครั้ง ห่างกัน 21 วัน ต้องเก็บในอุณหภูมิ -70 องศา
ข้อดี ทำได้ง่ายและเป็นจำนวนมากอย่างรวดเร็ว เพราะทำในโรงงาน กระตุ้นภูมิต้านทานได้สูง
ข้อเสีย อยู่ที่ RNA สลายตัวได้ง่าย ต้องเก็บที่อุณหภูมิต่ำมากๆและวัคซีนชนิดนี้เป็นชนิดแรกที่ใช้ในมนุษย์
อาการข้างเคียง หลังฉีดพบได้บ่อยกว่าวัคซีนที่ทำโดยชนิดเก่า เช่น มีไข้ ปวดเมื่อย ส่วนผลข้างเคียงรุนแรง ที่พบคือ ไส้ติ่งอักเสบ บาดเจ็บจากการฉีดที่ไหล่
ด่วน! รพ.อุดรธานี ขาดเลือด กรุ๊ป A จำนวนมาก LINK
ด่วน! โรงพยาบาลอุดรธานี ขาดเลือด กรุ๊ป A จำนวนมาก เพื่อช่วยเหลือผู้ป่วยในโรงพยาบาล บริจาคได้ที่ ห้องรับบริจาคโลหิต โรงพยาบาลอุดรธานี
#ให้เลือดฝ่าวิกฤต covid-19 คนไทยต้องไม่ทิ้งกัน
หน่วยรับบริจาคเคลื่อนที่ รพ.อุดรธานี (เปิดรับบริจาคตั้งแต่ 9-12 น.)
ประจำเดือน มกราคม 2564
- 7 มค ที่ว่าการอำเภอบ้านผือ
- 11 มค ที่ว่าการอำเภอหนองหาน
- 13 มค วิทยาลัยเทคโนโลยีอีสานเหนือ
- 14 มค ที่ว่าการอำเภอเมืองอุดรธานี
- 18 มค ที่ว่าการอำเภอกู่แก้ว
- 19 มค วิทยาลัยเทคโนโลยีอีสานเหนือ
- 20 มค โรงเรียนอุดรพัฒนาการ
- 21 มค โรงเรียนสตรีราชินูทิศ
- 25 มค ที่ว่าการอำเถอ กุมภวาปี
- 27 มค โรงเรียนประจักษ์ศิลปาคาร
- 28 มค โรงเรียนอุดรพิชัยรักษ์พิทยา
มาเริ่มต้นสิ่งดีๆ ปี 2564 นี้ด้วยการบริจาคเลือดกันนะครับ
ห้องรับบริจาคโลหิต โรงพยาบาลอุดรธานี เปิดบริการทุกวัน ตั้งแต่เวลา 09:00-19:00 น
คลังเลือดรพ.เลย เข้าสู่ภาวะขาดเลือดขั้นวิกฤติ โดยเฉพาะหมู่เลือดโอและเอ LINK
เนื่องจากสัปดาห์ที่ผ่านมาทางโรงพยาบาลเลย มีผู้ป่วยอุบัติเหตุฉุกเฉินที่ได้รับการรักษาด้วยเลือดจำนวนมากทำให้สถานการณ์คลังเลือดโรงพยาบาลเลย เข้าสู่ภาวะขาดเลือดขั้นวิกฤติ โดยเฉพาะหมู่เลือดโอและเอ
จึงขอเชิญชวนผู้มีจิตศรัทธาทุกท่าน ร่วมบริจาคโลหิตช่วยเหลือผู้ป่วยได้ที่ ห้องบริจาคโลหิต ชั้น 3 อาคารผู้ป่วยนอก โรงพยาบาลเลย
- วันจันทร์-ศุกร์ เวลา 08.30 -11.30 น. และ 13.00 -19.00 น.
- วันเสาร์-อาทิตย์และวันหยุดราชการ เวลา 08.30-15.00 น.
ธนาคารเลือด โรงพยาบาลเลย
โทรศัพท์ 042-862123 ต่อ 2271
หลักเกณฑ์การตรวจคัดกรองการเดินทางออกนอกพื้นที่ควบคุมสูงสุดและเข้มงวด สำหรับพื้นที่ควบคุมสูงสุดและเข้มงวด 5 จังหวัด ประกอบด้วย จังหวัดสมุทรสาคร ชลบุรี ระยอง จันทบุรี และตราด LINK
หลักเกณฑ์การตรวจคัดกรองการเดินทางออกนอกพื้นที่ควบคุมสูงสุดและเข้มงวด สำหรับพื้นที่ควบคุมสูงสุดและเข้มงวด 5 จังหวัด ประกอบด้วย จังหวัดสมุทรสาคร ชลบุรี ระยอง จันทบุรี และตราด
-----------------------------------
ไม่ว่าจะกรณีใดก็ตามทุกคนต้องโหลดแอพพลิเคชัน "หมอชนะ" และมีบัตรประจำตัวประชาขน/หนังสือเดินทางเพื่อยืนยันกับเจ้าหน้าที่
1. กรณีผู้ประสงค์จะเดินทางทั่วไปและผู้มีความจำเป็นต้องติดต่อราชการนอกจังหวัดระยอง
แล้วยื่นแบบคำขอเอกสารรับรองความจำเป็นฯ ต่อ นายอำเภอ ปลัดอำเภอ หรือ ข้าราชการที่นายอำเภอมอบหมาย ปลัด อปท. หรือ ปลัด อปท.มอบหมาย กำนัน ผู้ใหญ่บ้าน ในพื้นที่
------------------------------------
2. ผู้ประสงค์จะเดินทางซึ่งปฏิบัติหน้าที่ต่อไปนี้
1) ผู้ขนส่งสินค้าเพื่อประโยชน์และการดำรงชีวิตของประชาชน เช่น อาหาร ยา เวชภัณฑ์ เครื่องมือแพทย์ สินค้าอุปโภคบริโภค น้ำมันเชื้อเพลิง วัสดุ/สินค้าอุตสาหกรรม ไปรษณียภัณฑ์ พัสดุภัณฑ์ หนังสือพิมพ์ เป็นต้น และสินค้าเพื่อการนำเข้าหรือส่งออก
2) ผู้ปฏิบัติงานในกิจการ/กิจกรรมเพื่อประโยชน์ด้านสาธารณูปโภค สาธารณูปการ การสื่อสารโทรคมนาคม การก่อสร้าง การซ่อมบำรุงต่าง ๆ และพนักงานที่ทำงานในสถานประกอบการ/โรงงาน
3) ผู้ปฏิบัติงานด้านการแพทย์ การธนาคาร การศึกษา การขนส่งประชาชน/บุคคลไปสู่ที่เอกเทศ เพื่อกักกันตามกฎหมายว่าด้วยโรคติดต่อ
4) เจ้าหน้าที่ผู้ปฏิบัติงานตามข้อกำหนด ประกาศ หรือคำสั่งต่าง ๆ ของทางราชการ
.
แล้วยื่นคำขอเอกสารรับรองการปฏิบัติหน้าที่ต่อผู้ประกอบการ นายจ้าง บริษัท หัวหน้า หน่วยงานของรัฐ (แล้วแต่กรณี)
ทั้งนี้ เมื่อได้รับเอกสารรับรองความจำเป็น/รับรองการปฏิบัติหน้าที่แล้ว ให้แสดงต่อพนักงานเจ้าหน้าที่ประจำจุดตรวจหรือจุดสกัดในวันเดินทาง
สำนักงานประชาสัมพันธ์จังหวัดระยอง กรมประชาสัมพันธ์
โลหิตขาดแคลน รพ.นครพิงค์ เชิญชวนร่วมบริจาคโลหิต LINK
โลหิตขาดแคลน เนื่องจากในช่วงที่มีการระบาดของโรคโควิด-19 เกิดภาวะขาดแคลนโลหิตที่จะใช้ในการดูแลรักษาผู้ป่วย
- โรงพยาบาลนครพิงค์จึงขอเชิญชวนผู้มีจิตศรัทธา ร่วมบริจาคโลหิต ที่งานธนาคารเลือด อาคาร 10 ชั้น 2 ได้ทุกวัน เวลา 8.00-20.00 น.ในวันราชการ และ 8.00-16.00น.ในวันเสาร์,อาทิตย์และวันหยุดนักขัตฤกษ์
หมายเหตุ* : อาคารที่ใช้ในการดูแลผู้ป่วยโควิด-19 จะแยกจากส่วนบริการอื่นๆ และเป็นห้องความดันลบทั้งหมด จึงไม่มีผลต่อผู้รับบริการส่วนอื่นๆของโรงพยาบาล
ติดต่อสอบถาม : 053-999200 ต่อ 1108 หรือ 9225
ภาคบริการโลหิตแห่งชาติที่ 9 จังหวัดพิษณุโลก สภากาชาดไทย เปิดทำการทุกวัน LINK
ภาคบริการโลหิตแห่งชาติที่ 9 จังหวัดพิษณุโลก สภากาชาดไทย
เปิดทำการทุกวัน (ปิด 1 มกราคม*)
ประชาสัมพันธ์ โทร. 092-225-8845
------------------------------------------------------------
9 ขั้นตอน เตรียมตัวก่อนบริจาคโลหิต *
1. พักผ่อนให้เพียงพอ
2. สุขภาพพร้อมสมบูรณ์ดีทุกประการ
3. ไม่อยู่ในระหว่างทานยารักษาโรคบางอย่าง
4. งดอาหารมันจัด หวานจัด เลี่ยงของมัน ทอด และหวาน
5. ดื่มน้ำ 3-4 แก้ว ก่อน 20-30 นาที
6. งดเครื่องดื่มแอลกอฮอล์ 24 ชั่วโมง
7. งดสูบบุหรี่ก่อนและหลังบริจาค 1 ชั่วโมง
8. งดบริจาคเมื่อเป็นหวัดท้องเสียหรือเจ็บป่วย
9. บริจาคโลหิตทุก 3 เดือนยิ่งให้ยิ่งได้สุขภาพดี
?ร่วมกันบริจาคโลหิต?️?️?️?️ผ่านวิกฤติโรคระบาด ส่งต่อโลหิตที่ปลอดภัยให้กับผู้ป่วย
เชิญชวนบริจาคเลือด ภาคบริการโลหิตแห่งชาติที่ 8 จังหวัดนครสวรรค์ LINK
ภาคบริการโลหิตแห่งชาติที่ 8 จ.นครสวรรค์
57/12 ถนนโกสีย์ใต้ ตำบลปากน้ำโพ อำเภอเมือง จังหวัดนครสวรรค์ 60000
โทร 056 371 447
เปิดตลอดเวลา
กรุณาแสดงบัตรประชาชนก่อนบริจาคโลหิตทุกครั้ง
ตารางหน่วยรับบริจาคโลหิตเคลื่อนที่
14 มค 64 ศาลาประชาคม ที่ว่าการอ.โพธิ์ประทับช้าง 9-12 น.
14 มค 64 ศาลาประชาคม ที่ว่าการอ.ไพศาลี 9-12 น.
15 มค 64 ศาลาประชาคม ที่ว่าการอ.หันคา 9-12 น.
ส่งต่อเลือด ส่งต่อชีวิตใหม่ ณ ธนาคารเลือด รพ.วชิระภูเก็ต LINK
ส่งต่อเลือด ส่งต่อชีวิตใหม่ ขอเชิญชวนทุกท่าน ร่วมบริจาคโลหิต เพื่อส่งต่อชีวิตใหม่ได้ ณ ธนาคารเลือด รพ.วชิระภูเก็ต
วันจันทร์-ศุกร์ 8.30-20.00 น.
วันเสาร์-อาทิตย์ และวันหยุดราชการ 8.30-15.00 น.
สอบถามเพิ่มเติม โทร076-361234 ต่อ1287
สถานที่ออกหน่วยรับบริจาคโลหิต ประจำเดือนมกราคม 2564 เชิญทุกท่านร่วมบริจาคโลหิต ณ หน่วยรับบริจาคโลหิตที่สะดวกค่ะ
พิเศษ!! ผู้บริจาคโลหิตรับของที่ระลึกพร้อมลุ้นรับของที่ระลึกน่ารักๆ จาก gomufamily
บริจาคโลหิตภายใน ร.พ.เจ้าพระยาอภัยภูเบศรปีนี้ รับสิทธิพิเศษดูแลสุขภาพเป็นอย่างดี LINK
ต้อนรับกับแคมเปญพิเศษ ปี 2021 รณรงค์เพิ่มจำนวนผู้บริจาคโลหิตในโรงพยาบาล สำหรับชาว #ฮีโร่ ของพวกเรา
มาบริจาคโลหิตภายใน ร.พ.เจ้าพระยาอภัยภูเบศรปีนี้ รับสิทธิพิเศษดูแลสุขภาพเป็นอย่างดี
- บริจาคโลหิตภายในโรงพยาบาลวันนี้-31 มกราคม 64 รับคูปองส่วนลดทานอาหารที่เดสปา 5% และทำสปา 30% อิ่มบุญ อิ่มทอง พร้อมสุขภาพดี มาบริจาคโลหิตกันนะคะ
ติดต่อสอบถามข้อมูลงานธนาคารเลือด ณ โรงพยาบาลเจ้าพระยาอภัยภูเบศร ตึก 58 ปี ชั้น 2
โทร 037-211088 ต่อ 3510
วันจันทร์ - ศุกร์ เปิดเวลา 8.30 - 19.00น.
วันเสาร์ - อาทิตย์ และวันหยุดนักขัตฤกษ์ เปิดทำการเวลา 9.00- 15.00น.
เพื่อลดการแออัด ผู้บริจาคโลหิตสามารถนัดวันเวลาเข้ารับบริการใน Inbox หรือโทร 037-211-088 ต่อ 3510
หน่วยบริจาคเคลื่อนที่ เดือนมกราคม 64
7 มค 64 อ.เมือง ปราจีน
21 มค 64 บ.โคจิมะ (ไทยแลนด์)
26 มค 64 พล.ร.2 รอ. (ก)
27 มค 64 บ.สยามไอซินฯ 2
28 มค 64 อ.ประจันตคาม
สถานะสำรองโลหิต ธนาคารเลือดนครปฐม เหลือน้อยมากๆ LINK
สถานะสำรองโลหิต ธนาคารเลือดนครปฐม
บริจาคโลหิต A B O AB ธนาคารเลือด ร.พ.นครปฐม อาคารรวมเมฆชั้น 3
เวลาทำการ
- จันทร์ – ศุกร์ เวลา 08.30 – 15.00 น. (พักเที่ยง)
- เสาร์ เวลา 08.30 – 12.00 น.
- อาทิตย์ และวันหยุดนักขัตฤกษ์ เวลา 08.30 – 15.00 น.(พักเที่ยง)
- สอบถามรายละเอียดโทร 034-254150 ต่อ 1030
ผู้มาบริจาคโลหิตที่ขับรถมา สามารถแจ้งเจ้าหน้าที่รักษาความปลอดภัยให้จัดหาที่จอดรถให้ครับ
บริจาคโลหิตปลอดภัย กับธนาคารเลือด รพ.ระยอง LINK
บริจาคโลหิตปลอดภัย กับธนาคารเลือด รพ.ระยอง
งานธนาคารเลือด รพ.ระยอง ขอเชิญชวนผู้มีจิตเมตตา และมีสุขภาพแข็งแรงร่วมบริจาคโลหิตสู้วิกฤต COVID-19 กันนะคะ
วันที่ 1-31 มกราคม 2564 ยกเว้นวันอาทิตย์ ณ งานธนาคารเลือด รพ.ระยอง
เช้า 08.30-11.30 น. บ่าย 13.00-16.00 น.
โทร 038-611104 ต่อ 2079, 2080
งานธนาคารเลือด รพ.ระยอง ชั้น 1 อาคารผู้ป่วยนอกและอุบัติเหตุ
- A ยังมีผู้ป่วยจำนวนมากรอรับการรักษาด้วยการให้โลหิต
- B ยังมีผู้ป่วยรออีกหลายร้อยหลายพันรายที่รอการผ่าตัด
- O ยังมีผู้ป่วยป่วยอุบัติเหตุที่จะพ้นขีดอันตรายหากพวกเขาได้รับโลหิตอย่างเพียงพอ และทันท่วงที
- AB ยังมีผู้ป่วยอีกหลายโรคที่จะสามารถกลับมามีคุณภาพชีวิตที่ดีและเป็นปกติ เพียงพวกเขาเหล่านั้นได้รับส่วนประกอบโลหิตตามความจำเป็นของแต่ละโรค
ผู้บริจาคโลหิตทุกท่านคะ
ท่านคือ HERO ของผู้ป่วย ทุกคนรอท่านอยู่ค่ะ
ชวนบริจาคเลือด ธนาคารเลือด รพ.มหาราชนครเชียงใหม่ LINK
ชวนบริจาคเลือด ธนาคารเลือด รพ.มหาราชนครเชียงใหม่
เวลาเปิด-ปิดทำการ
จันทร์-ศุกร์ 08.30 น.- 16.00 น. (ปิดพักเที่ยง เฉพาะวันที่ออกหน่วยรับบริจาคโลหิต)
วันเสาร์-อาทิตย์และวันหยุดนักขัตฤกษ์ 08.30 น.-16.00 น. ปิดพักเที่ยง
หน่วยจัดหาและตรวจความปลอดภัยของโลหิต 0-5393-5624
หน่วยเก็บรักษาและบริการโลหิต 0-5393-5622
ธนาคารออมสิน
ธนาคารออมสิน แจ้งเปลี่ยนเวลา ปิด ทำการสาขาในห้างสรรพสินค้า
เนื่องจากสถานการณ์ COVID-19
ธนาคารออมสินขอแจ้งเปลี่ยนเวลาปิดทำการสาขา
ในห้างสรรพสินค้าทั่วประเทศ
เป็นเวลา 18.00 น.
ตั้งแต่วันที่ 6 มกราคม 2564 เป็นต้นไป
โลหิตสำรองไม่เพียงพอ เปิดรับบริจาคทุกวัน รพ.มหาราชนครเชียงใหม่ -สวนดอก LINK
โลหิตสำรองไม่เพียงพอ
ธนาคารเลือด โรงพยาบาลมหาราชนครเชียงใหม่ ขอเชิญชวนประชาชนร่วมบริจาคโลหิตเพื่อช่วยเหลือผู้ป่วย ผ่านวิกฤติโรคระบาด COVID-19
ที่ห้องรับบริจาคโลหิต ชั้น 1 อาคารศรีพัฒน์ โรงพยาบาลมหาราชนครเชียงใหม่
เปิดรับบริจาคทุกวัน เวลา 8.30-16.00 น.
สอบถามเพิ่มเติม 053935624
ผู้บริจาคสามารถจอดรถได้ที่บริเวณที่จอดรถข้างตึกศรีพัฒน์ ฝั่งคณะเทคนิคการแพทย์
1 แบ่งกลุ่มคนเป็น 4 กลุ่ม A B C D
บริจาคโลหิตได้สิทธิสุดคุ้ม ที่ ร.พ.เจ้าพระยาอภัยภูเบศร LINK
ข่าวดี!!!! ต้อนรับกับแคมเปญพิเศษ ปี 2021
“รณรงค์เพิ่มจำนวนผู้บริจาคโลหิตในโรงพยาบาล”
สำหรับชาว #ฮีโร่ ของพวกเรา
มาบริจาคโลหิตภายใน ร.พ.เจ้าพระยาอภัยภูเบศรปีนี้ รับสิทธิพิเศษดูแลสุขภาพเป็นอย่างดี
- บริจาคโลหิต ครบ 2 ครั้ง ต่อปี
รับคูปองส่วนลดค่าอาหารเดย์สปา 5%
คูปองส่วนลดค่าทรีทเม้นท์สปา 30%
- บริจาคโลหิตครบ 3 ครั้งต่อปี
รับสิทธินวดแผนไทยฟรี 1 ชั่วโมง
- บริจาคโลหิตครบ 24 ครั้ง ขึ้นไป ต่อเนื่องทุก 3 เดือน หรือ ปีละ 4 ครั้ง
ได้สิทธิตรวจสุขภาพประจำปี 1 ครั้ง : ไขมัน ตับ ไวรัสตับ ไตอักเสบ ปัสสาวะ เก๊าท์ เบาหวาน ความสมบูรณ์เม็ดเลือด
*ฝากแชร์เชิญชวนบอกบุญกันเยอะๆน้า ไม่ต้องห่วงความปลอดภัยเรามีมาตรการเข้มงวด ปลอดเชื้อโควิด สามารถรับบัตรจอดรถด้านหน้าโรงพยาบาลได้เลย
อย่าลืมดูแลสุขภาพกันนะคะอากาศเปลี่ยนแปลงบ่อยสวมหน้ากากอนามัยทุกครั้งที่ออกจากบ้าน รักษาระยะห่าง หมั่นล้างมือกันด้วยจ้า
Wear mask, hand washing, keep physical distancing
ขั้นตอนการลงทะเบียนแอปพลิเคชั่น ThailandPlus
ศูนย์ไตเทียม LINK
ศูนย์ไตเทียม เทียนฟ้าบริบาลภิวัฒน์
ก่อตั้งโดย โรงพยาบาลเทียนฟ้า มูลนิธิ
เพื่อช่วยผู้ป่วยโรคไตที่ต้องฟอกเลือดด้วยไตเทียม ให้รับบริการที่เป็นเลิศ
ศูนย์ฯ ตั้งอยู่ที่ ถนนหทัยราษฏร์ 25 เขตมีนบุรี กท. 10510
จะเปิดให้บริการ ฟอกเลือดด้วยเครื่องไตเทียม ในต้นปีหน้า 2564
ผู้ป่วยสิทธิประกันสังคมและสิทธิประกันสุขภาพถ้วนหน้า จะไม่มีค่าใช้จ่ายเพิ่มเติม
ติดต่อขอทราบรายละเอียด โทร 063-614-9654
คลินิกศูนย์แพทย์พัฒนา ฉะเชิงเทรา เปิดให้บริการแล้ว LINK
คลินิกศูนย์แพทย์พัฒนา ฉะเชิงเทรา เปิดให้บริการแล้ว
ตั้งแต่วันที่ 6 มกราคม 2563 เป็นต้นไป
บริการรักษาพยาบาลโรคเฉพาะทาง สาขาจักษุ สาขาทันตกรรม
เปิดบริการทุกวัน (ยกเว้นช่วงเทศกาลปีใหม่และสงกรานต์)
โดยช่วงแรก เปิด 08.00 – 17.00 น.
สอบถามรายละเอียดเพิ่มเติม โทร. 038-500-600
Surveillance areas
Surveillance areas (54 provinces, including 19 newly-classified): (region by region) Central: Ang Thong, Chai Nat, Lop Buri, Nakhon Sawan, Phetchabun, Sing Buri, and Uthai Thani; East: Chanthaburi, Prachin Buri, Sa Kaeo, and Trat; North: Chiang Mai, Chiang Rai, Kamphaeng Phet, Lampang, Lamphun, Mae Hong Son, Nan, Phayao, Phichit, Phitsanulok, Phrae, Sukhothai, and Uttaradit; Northeast: Amnat Charoen, Bueng Kan, Buri Ram, Chaiyaphum, Kalasin, Khon Kaen, Loei, Maha Sarakham, Mukdahan, Nakhon Phanom, Nakhon Ratchasima, Nong Bua Lamphu, Nong Khai, Roi Et, Sakon Nakhon, Si Sa Ket, Surin, Ubon Ratchathani, Udon Thani, and Yasothon, and South: Krabi, Nakhon Si Thammarat, Pattani, Phang Nga, Phatthalung, Phuket, Prachuap Khiri Khan, Satun, Surat Thani, and Trang.
Reopening with strict disease control measures allowed for:
- Entertainment venues of all types, including pubs, bars, and karaoke shops can resume normal operation hours in accordance with the relevant laws, including dining-in and the sale and consumption of alcoholic drinks. Music performances and dancing are also allowed.
- Restaurants and eateries can resume normal operations.
- Screening in place for Thai travellers, especially those from the maximum and high controlled areas.
- Bath and massage parlours, but with a limited number of customers.
- Spas and Thai traditional massage shops, but with a limited number of customers.
- Indoor and outdoor gyms and fitness centres and boxing stadiums. Competitions can be organised with a number of audiences in accordance with the rules and regulations.
Closure orders remain in place for:
X Gambling venues of all types, including fighting cock and bull venues.
จุดเริ่มต้นโครงการ LINK
โครงการติดตั้งโซล่าร์เซลล์ให้กับโรงพยาบาลของพระครูวิมลปัญญาคุณเริ่มตั้งแต่การสอนนักเรียนให้รู้จักโซล่าร์เซลล์ และใช้เองในวัดในโรงเรียนศรีแสงธรรม 100% จนกลายเป็นศูนย์อบรมโซล่าร์เซลล์ให้กับผู้ที่สนใจทั่วไปเปิดอบรมมากกว่า 30 รุ่น ทั้งนี้ยังเป็นแหล่งศึกษาดูงานของหน่วยงาน และผู้ที่สนใจทั่วใจทั่วไปนำไปต่อยอดใช้งานให้เกิดประโยชน์มากขึ้น จากนั้นทางโรงเรียนยังได้ออกไปบริการสังคม ช่วยเหลือตามวัดต่างๆ หรือชุมชนที่เดือดร้อนไม่มีไฟฟ้าใช้ทั้งในเมืองและตามชนบท รวมไปถึงช่วยเหลือในงานภัยพิบัติต่างๆ เช่นน้ำท่วมก็จะมีชุดเคลื่อนที่ออกไปแจกจ่ายประชาชนที่ได้รับความเดือดร้อน จนกระทั่งปี 2560 นพ.เศวต ศรีศิริ ผู้อำนวยการโรงพยาบาล 50 พรรษา มหาวชิราลงกรณ ได้พานักศึกษาแพทย์มาศึกษาดูงานที่โรงเรียนศรีแสงธรรม เพราะมีแนวคิดอยากจะใช้พลังงานสะอาดเพื่อเป็นตัวอย่างของโรงพยาบาลในการประหยัดค่าไฟฟ้า จึงมีการระดมทุนบริจาคโดยพระครูวิมลปัญญาคุณได้รวบรวมติดตั้งขนาด 30.72 กิโลวัตต์ สามารถประหยัดค่าไฟฟ้าไปเดือนละ 18,000 บาท และขยายการติดตั้งจนประหยัดค่าไฟฟ้าได้ปีละประมาณ 5,000,000 บาท จึงเป็นที่มาของการขยายแนวคิดนีัไปสู่โรงพยาบาล 7 แห่งทั่วประเทศในนาม”กองทุนแสงอาทิตย์” ที่มีภาคีเครือข่ายเข้ามาร่วมดำเนินกิจกรรม และรับเงินบริจาคเมื่อครบแล้วก็ไปติดตั้งให้กับโรงพยาบาลต่างๆ
จุดเริ่มต้นและการค้นพบ Endocannabinoid System LINK
จุดเริ่มต้นมาจากปี ค.ศ. 1964 โดยนักเคมีชื่อ Rapheal Machoulam และทีมวิจัยจากสถาบันวิทยาศาสตร์ไวซ์แมนประเทศอิสราเอล ได้สกัดสารประกอบต่างๆในกัญชาเรียกว่าสาร Cannabiniods แยกเป็นหลายชุดและฉีดแต่ละชุดเข้าไปในลิงเพื่อค้นหาสารสำคัญที่ออกฤทธิ์ต่อจิตประสาท จนได้พบสารชุดหนึ่ง เมื่อฉีดเข้าไปในลิงที่ปรกติจะมีความก้าวร้าวกลับสงบลงอย่างมีนัยยะสำคัญ และนั่นเป็นจุดเริ่มต้นของการค้นพบสารสำคัญในกัญชาชื่อว่า Delta-9-tetrahydrocannabinol หรือ △9-THC ที่เรารู้จักกันทุกวันนี้นั่นเอง การค้นพบ THC ของ Machoulam นั้น ก่อให้เกิดการค้นพบสาร Cannabinoids ในกัญชาต่างๆเพิ่มมากขึ้น มีงานวิจัยออกมาอีกมากมาย แต่นักวิทยาศาสตร์ยังคงไม่สามารถเข้าใจระบบการทำงานที่ซับซ้อนของ Cannabinoid ได้เพราะยังขาดตัวแปลสำคัญ จนกินเวลาไปเกือบ 30 ปี จึงได้มีการค้นพบครั้งสำคัญขึ้นอีกครั้ง
ในปี ค.ศ.1991 Miles Herkenham และทีมวิจัย ได้ค้นพบตัวรับสารสื่อประสาท (Receptor) ของ THC ในร่างกายมนุษย์ชื่อว่า CB1 ทีมวิจัยได้พบต่อมรับสารสื่อประสาทนี้ในระบบสำคัญสำหรับการทำงานของสมองและร่างกายคือ Hippocampus (ความจำ), Cerebral Cortex (การรับรู้), Cerebellum (การทำงานรวมกันของระบบประสาทเพื่อให้เกิดการเคลื่อนไหวของร่างกาย), Hypothalamus (ความต้องการพื้นฐานเช่น ความหิว การสืบพันธุ์ และ การพักผ่อน), Amygdala (อารมณ์) และที่อื่นๆ ไม่นานหลังจากนั้นได้ค้นพบตัวรับสารสื่อประสาทตัวที่สอง ชื่อว่า CB2 ในระบบภูมิคุ้มกันและระบบประสาทส่วนปลายและยังพบใน กระเพาะ ม้าม ตับ หัวใจ ไต กระดูก เส้นเลือด เซลล์น้ำเหลือง ต่อมไร้ท่อต่างๆ และ อวัยวะสืบพันธุ์
การค้นพบ CB1 และ CB2 ทำให้นักวิทยาศาสตร์เชื่อว่า ร่างกายมนุษย์เองก็น่าจะสามารถผลิตสารสื่อประสาทที่ทำงานกับตัวรับ CB1 และ CB2 แบบเดียวกันกับกัญชาได้ และ Raphael Machoulam บิดาแห่ง THC ก็ได้ค้นพบ Cannabinoids ที่ร่างกายสามารถผลิตขึ้นมาได้เอง ชื่อว่า Anandamide (อนันดามายด์) ในปี ค.ศ.1992 และได้ค้นพบสารตัวที่สองชื่อว่า 2-AG (2-arachidonoylglycerol) ในปี ค.ศ.1995 และเรียกระบบการทำงานของสาร Cannabinoids กับสาร CB1 และ CB2 ที่กระจายอยู่ทั่วร่างกายว่า “Endocannabinoid System”
[Cannabit Addict]
กัญซ่าส์ คราฟต์โซดา พระเอกของงานนี้ เครื่องดื่มซ่าสุดเริ่ม ที่มีส่วนผสมจากใบกัญชา ไอเดีย จากรพ.อภัยภูเบศร ซึ่งทางรพ.ก็แจกสูตรให้ด้วย ไม่หวงแต่อย่างใด
คลิกได้ที่นี่ *HealthServ.net เป็นสื่อกลางในการเผยแพร่ข้อมูลนี้ไปสู่ผู้ชมเท่านั้น ไม่ได้เป็นไปเพื่อการค้า และไม่ได้เป็นเจ้าลิขสิทธิ์ของเนื้อหา ศ.เกียรติคุณ นพ.ปิยะสกล สกลสัตยาทร
อดีตรัฐมนตรีว่าการกระทรวงสาธารณสุข
จากที่มีการประกาศจากประเทศเดนมาร์ค ว่าพบผลข้างเคียงจากการฉีดวัคซีน ในลักษณะเลือดเกิดการแข็งตัวในหลอดเลือดดำ และทำให้มีผลไม่พึงประสงค์เกิดขึ้น รัฐบาลเดนมาร์คจึงประกาศชะลอการฉีดวัคซีนแอสตร้าเซนเนก้า ไปก่อน ด้วยเหตนี้ ทำให้คณะกรรมการแพทย์และทีมงานที่ดูแลด้านการฉีดวัคซีน ต้องนำมาพิจารณา ถึงความปลอดภัย โดยการชะลอการฉีด เพื่อรอฟังผลจากเดนมาร์คว่ามีความเกี่ยวข้องกับวัคซีนหรือไม่
กทม รายงานพบผู้ติดเชื้อ 93 ราย (14 มีค 64)
ศูนย์บริหารสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 ( โควิด-19 ) เปิดเผยข้อมูลประจำวัน (14 มี.ค.64 ) โดยวันนี้พบผู้ติดเชื้อรายใหม่ 170 คน ทำให้ยอดผู้ป่วยสะสมเพิ่มเป็น 26,927 คน มีผู้ป่วยรักษาหายกลับบ้านได้เพิ่ม 66 คน และยังอยู่ระหว่างการรักษา 687 คน ขณะที่มีผู้ป่วยรักษาหายสะสม 26,154 คน โดยวันนี้ไม่มีรายงานผู้เสียชีวิต จำนวนผู้เสียชีวิตสะสม 86 คน
สำหรับผู้ติดเชื้อรายใหม่ 170 คน
เป็นการติดเชื้อในประเทศจำนวน 156 คน
- พบในกรุงเทพฯ 93 คน
- สมุทรสาคร 43 คน
- ปทุมธานี 12 คน
- เพชรบุรี 3 คน
- นครปฐม 3 คน
- นราธิวาส 2 คน
ขณะที่มีผู้เดินทางกลับจากต่างประเทศ ตรวจพบเชื้อในสถานที่กักกันตัวที่รัฐจัดให้ 13 คน ลักลอบเดินทางเข้าประเทศ จากชายแดนประเทศมาเลเซีย ไม่เข้าสถานกักกันตัว ตรวจพบติดเชื้อ 1 คน
EPI program : วัคซีนพื้นฐาน
กระทรวงสาธารณสุขได้กำหนดบริการวัคซีนพื้นฐานที่เด็กไทยทุกคนควรได้รับ โดยเน้นวัคซีนป้องกันโรค ที่เป็นปัญหาสำคัญ ซึ่งในปัจจุบันประกอบด้วยวัคซีน 8 ชนิด ได้แก่ วัคซีนวัณโรค (BCG) วัคซีนตับอักเสบบี (HB) วัคซีนรวมคอตีบ-บาดทะยัก-ไอกรน-ตับอักเสบบี (DTP-HB) วัคซีนโปลิโอ (OPV) วัคซีนรวมหัด-คางทูม-หัดเยอรมัน (MMR) วัคซีนไข้สมองอักเสบเจอี (JE) วัคซีนคอตีบ-บาดทะยัก-ไอกรน (DTP) และวัคซีนคอตีบ-บาดทะยัก (dT) โดยกระทรวงสาธารณสุขจัดระบบบริการเพื่อให้เด็กทุกคนในประเทศได้รับวัคซีนตามกำหนด โดยให้สถานบริการ สาธารณสุขของรัฐเป็นหน่วยบริการหลัก ทั้งนี้ตั้งแต่ปี พ.ศ. 2553 สำนักงานหลักประกันสุขภาพแห่งชาติรับผิดชอบ ในการจัดหาวัคซีน และกระจายวัคซีนจากส่วนกลางไปยังคลังวัคซีนระดับอำเภอทุกแห่งโดยตรง วัคซีนที่กำหนดไว้ใน แผนการสร้างเสริมภูมิคุ้มกันโรคในประเทศต่างๆ อาจแตกต่างกันขึ้นกับการพิจารณาของแต่ละประเทศเกี่ยวกับ อุบัติการณ์ ความรุนแรงของโรค ประสิทธิภาพของวัคซีน ราคาของวัคซีน และสถานการณ์โดยรวมของวัคซีนในประเทศ ในอนาคตแผนการสร้างเสริมภูมิคุ้มกันโรค อาจปรับปรุงเปลี่ยนแปลงได้โดยขยายเพิ่มชนิดของวัคซีน ขยายกลุ่มเป้าหมาย รวมทั้งปรับเปลี่ยนกำหนดการให้วัคซีน ทั้งนี้โดยพิจารณาปัจจัยต่างๆ อย่างเหมาะสม
กัญชา กัญชง (พืชชนิดเดียวกัน แต่คนละ Subspecies)...ต่างกันอย่างไร
Raksa หาหมอ และซื้อยาออนไลน์ได้ง่ายๆ ผ่านมือถือ
Raksa ผสานเทคโนโลยีด้านโทรเวชกรรม (Telemedicine) เข้ากับนวัตกรรมโมเดลธุรกิจ เพื่อให้การเข้าถึงผู้ให้บริการทางการแพทย์เป็นเรื่องง่ายกว่าเดิม ช่วยลดค่าใช้จ่ายของบริการสุขภาพ รวมถึงทำให้การหาหมอเป็นประสบการณ์ที่สะดวกสบาย ในราคาสบายกระเป๋า
ปรึกษาแพทย์ได้ตลอด 24 ชั่วโมง
- ปรึกษาแพทย์ได้จากบ้าน ที่ทำงาน หรือระหว่างการเดินทาง
- รับคำแนะนำทางการแพทย์ ตรวจผลแลป หรือสั่งยาออนไลน์
- รับยาส่งตรงถึงบ้าน
ร้านยา พร้อมส่งตรงถึงบ้านคุณ
- ยาและเวชภัณฑ์มากกว่า 10,000 ชิ้น
- ยาทุกชิ้นส่งจากร้านยาคุณภาพที่ได้รับการรับรอง
- บริการให้คำปรึกษาในการใช้ยาฟรี
โรคที่เรารับปรึกษา
แอปที่รวมทุกอย่างเกี่ยวกับเรื่องสุขภาพ
Raksa เป็นแพลตฟอร์มสำหรับบริการปรึกษาแพทย์และซื้อยาออนไลน์ที่ใหญ่ และสมบูรณ์ที่สุดในประเทศไทย เราให้บริการปรึกษาแพทย์ ออกใบสรุปการปรึกษาอิเล็กทรอนิกส์ ใบสั่งยาอิเล็กทรอนิกส์ ร้านขายยาออนไลน์ บริการปรึกษาเภสัชกร การเคลมประกัน และอื่นๆ
การดูแลแบบผู้ป่วยเป็นศูนย์กลาง
Raksa เป็นผู้ให้บริการด้านสุขภาพอย่างครบวงจร เพื่อให้มั่นใจได้ว่าผู้ใช้งานจะได้รับประสบการณ์ที่เชื่อมต่อเป็นหนึ่งเดียว ทุกๆ ส่วนของแพลตฟอร์มถูกดำเนินการโดยทีมภายในองค์กรทั้งหมด เราเชื่อมั่นในโมเดลการกระจายการเข้าถึงบริการสุขภาพอย่างทั่วถึง ซึ่งผู้ป่วยสามารถรับการรักษาได้จากที่บ้าน
เชียงใหม่ งานประเพณีสงกรานต์ (ปี๋ใหม่เมือง) ประจำปี 2564 - สืบฮีตโตยฮอย เมืองเจียงใหม่ 725 ปี๋ LINK
เทศบาลนครเชียงใหม่ ร่วมกับ จังหวัดเชียงใหม่ องค์การบริหารส่วนจังหวัดเชียงใหม่ และหน่วยงานภาคีเครือข่ายทั้งภาครัฐ ภาคเอกชน และเครือข่ายภาคประชาสังคม ได้กำหนดจัดงานประเพณีสงกรานต์เชียงใหม่ (ป๋าเวณีปี๋ใหม่เมืองเจียงใหม่) ประจำปี 2564 ขึ้น ภายใต้แนวคิด “สืบฮีตโตยฮอย เมืองเจียงใหม่ 725 ปี๋” เพื่อเป็นการอนุรักษ์และสืบสานประเพณีท้องถิ่นที่ปฏิบัติสืบเนื่องกันมาตั้งแต่อดีต และเป็นการส่งเสริมการท่องเที่ยวในท้องถิ่น
- มีพิธีเปิดงานป๋าเวณีปี๋ใหม่เมืองเจียงใหม่ ประจำปี 2564 ขึ้น ในวันที่ 13 เมษายน เวลา 08.30 น. ณ ข่วงประตูท่าแพ
- งดการจัดขบวนแห่พระพุทธสิหิงค์และพระพุทธรูปสำคัญ โดยเปลี่ยนรูปแบบเป็นการสมโภชพระพุทธสิหิงค์ โดยอัญเชิญพระพุทธสิหิงค์มาประดิษฐานด้านหน้าวิหารลายคำ วัดพระสิงห์วรมหาวิหาร เพื่อให้ประชาชนได้สรงน้ำ ระหว่างวันที่ 11-15 เมษายน 2564 และ งดการเล่นสาดน้ำรอบคูเมืองโดยเด็ดขาด
งานป๋าเวณีปี๋ใหม่เมืองเจียงใหม่ในปีนี้ก็ยังคงมีกิจกรรมทางวัฒนธรรมที่น่าสนใจอีกมากมาย เช่น
- พิธีตานตุงไชย 725 ปี เมืองเชียงใหม่ และ ตกแต่งตุงไชยรอบคูเมือง ระหว่างวันที่ 1 – 19 เมษายน 2564
- กิจกรรมยอสวย ไหว้สา พระญามังราย ณ ลานอนุสาวรีย์สามกษัตริย์ ระหว่างวันที่ 11 – 12 เมษายน 2564 การอัญเชิญ “น้ำติ๊บปี๋ใหม่เมือง” จำนวน 9,725 ขวด ฉลองเมืองเชียงใหม่ครบ 725 ปี แจกจ่ายให้นักท่องเที่ยวและประชาชน ซึ่งเป็นน้ำทิพย์จากแหล่งน้ำศักดิ์สิทธิ์ในจังหวัดเชียงใหม่
- การแข่งกลองหลวง ด้านหน้าพิพิธภัณฑ์พื้นถิ่นล้านนา ในวันที่ 12 เมษายน 2564
- กิจกรรม สืบฮีต สานฮอย ป๋าเวณีปี๋ใหม่เมือง ซึ่งเป็นการสาธิตภูมิปัญญาท้องถิ่น เช่น การตัดตุง การก่อเจดีย์ทราย ข่วงกาดหมั้วอาหารและขนมพื้นเมือง
- การแสดงศิลปวัฒนธรรมพื้นเมือง ระหว่างวันที่ 13-15เมษายน 2564 ด้านหน้าพิพิธภัณฑ์พื้นถิ่นล้านนา
- พิธีขอขมาและบวงสรวงเศียรท้าวกบิลพรหมองค์มหาสงกรานต์ขึ้น ในวันที่ 12 เมษายน 2564 เวลา 10.09 น. ณ สำนักงานเทศบาลนครเชียงใหม่
- การประกวดแม่ญิงขี่รถถีบกางจ้อง เราก็ยังคงจัดให้มีเหมือนเดิม ณ ข่วงประตูท่าแพ ระหว่างวันที่ 13 เมษายน 2564
เน้นย้ำอีกครั้งหนึ่งว่า งดการเล่นสาดน้ำรอบคูเมืองโดยเด็ดขาด
พัทยา จัดงานประเพณี และวันไหล18-20 เมย 64 งดสาดน้ำ
งานเทศกาลสงกราต์และวันไหลเมืองพัทยาในปีนี้ จะจัดกิจกรรมตามประเพณีที่สืบทอดมาตั้งแต่วันที่ 18 เมษายน 2564 ในการจัดกิจกรรมวันไหลนาเกลือ วันที่ 19 เมษายน วันไหลเมืองพัทยาและวันที่ 20 เมษายน วันกองข้าว ซึ่งการจัดกิจกรรมในช่วงเทศกาลสงกรานต์นั้นจะคงจัดในส่วนของกิจกรรมตามประเพณีเท่านั้น เพื่อให้พี่น้องประชาชนได้ร่วมสืบสานวัฒนธรรมและร่วมกิจกรรมแบบ New Normal เว้นระยะห่าง ตรวจวัดอุณหภูมิ และสวมใส่หน้ากาออนายมัย ตามมาตรการของศบค.กำหนด
งดให้มีการเล่นสาดน้ำ ประแป้ง สงกรานต์
อสม.ไทยกว่าล้านคน หรือ ผู้ปิดทองหลังพระ LINK
อสม.ไทยกว่าล้านคน หรือ “ผู้ปิดทองหลังพระ” ช่วยสอดส่องดูแลให้ชุมชนห่างไกลโควิด 19
28 August 2020 WHO
กระทรวงสาธารณสุขบริหารจัดการอสม.จำนวน 1.04 ล้านคนทั่วประเทศ รวมถึงอาสาสมัคร 15,000 คนในกรุงเทพฯ อสม.แต่ละคนได้รับเงิน 1,000 บาทต่อเดือน และได้รับอีก 500 บาทเพิ่มในช่วงสถานการณ์การแพร่ระบาดของโรคโควิด 19
อสม.เหล่านี้เป็นส่วนสำคัญของระบบสุขภาพปฐมภูมิในช่วงสี่ทศวรรษที่ผ่านมา พวกเขาออกไปสำรวจข้อมูลด้านสาธารณสุข เก็บข้อมูล เก็บบันทึกด้านสุขภาพของครอบครัว และรณรงค์เรื่องการป้องกันโรคเพื่อสนับสนุนการทำงานของเจ้าหน้าที่สาธารณสุข ในช่วงที่มีการแพร่ระบาด การเก็บประวัติสุขภาพของสมาชิกในชุมชนโดยละเอียดได้ถูกนำมาใช้เพื่อติดตามผู้สัมผัสโรคและเพื่อติดตามด้านสุขภาพ
อสม.เหล่านี้ได้ปกป้องคนในชุมชนจากโรคที่คุ้นเคยตลอดฤดูกาลระบาดมานานแล้ว ในช่วงฤดูฝน พวกเขาไปเยี่ยมตามบ้านเพื่อช่วยกำจัดแหล่งน้ำขังซึ่งเป็นที่เพาะพันธุ์ยุงลายอันเป็นพาหะของโรคไข้เลือดออก ช่วยกำจัดลูกน้ำ และกำจัดแหล่งเพาะพันธุ์อื่นๆ ส่วนในช่วงฤดูร้อน พวกเขาช่วยทางปศุสัตว์ท้องถิ่นฉีดวัคซีนโรคพิษสุนัขบ้าให้โคกระบือและสัตว์เลี้ยง
อ่านทั้งหมดเมนูอาหารจากกัญชา
เมนูอาหารจากกัญชา
- ซู่ซ่าร่างเริง - น้ำเชื่อมจากชาไทยผสมใบหูเสือและกานพลู ผสมน้ำมะนาวคั้นสด โซดา ราดด้วยน้ำกัญชาคั้นสด 1 ใบ
- สดชื่นรื่นรมย์ - กัญชา 1 ใบแห้งต้มผสมขิง อบเชย ลูกผักชี และผิวส้ม ปรุงรสด้วยน้ำเลมอนและน้ำส้ม
- ข้าวกะเพราสุขใจ - 1/2 ใบสดตำกับเครื่องกะเพราะ พริกแห้งและกระเทียม
- ขนมจีน ข้าวไรซ์เบอรี่ เขียวหวานไก่กัญ - 1/2 ใบสดตำผสมเครื่องแกงเขียวหวาน ลูกผักชี ข่า ตะไคร้ซอย ผิวมะกรูด หัวหอมแดง
- ต้มยำไก่ใบกัญ - 1/2 ใบสดค้มพร้อมเครื่องค้มยก พริม หอมแดง ข่า ตะไคร้
- ข้างตังหน้าตั้งกัญ - 1/2 ใบสดซอยผสมหน้าตั้ง ทำจากเนื้อไก่ หอมแดง ถั่วและกะทิ
- ก๋วยเตี๋ยว/เกาเหลา หมูตุ๋นอารมณ์ดี - หมู่ตุ๋นในเครื่องเทศจากรากผักชี กระเทียม พริกไทย กระวาน และลูกผักชีผสมใบกัญชา
ผู้ทีควรหลีกเลี่ยง
อายุต่ำกว่า 25 ปี
สตรีมีครรภ์
ผู้ที่ใช้ยาวาร์ฟาริน
ผู้มีปัญหาโรคหัวใจ ตับ ปอด
มาตรการ
สถานที่รับบริจาคโลหิตทั่วประเทศ
ภูเก็ต - 20 เมย 64 มีเงื่อนไข 3 ข้อในการเดินทางเข้าจังหวัด LINK
2. อนุญาตให้ผู้ที่มีผลตรวจเชื้อcovid19 ภายใน 72 ชั่วโมง ก่อนการเดินทาง (Covid-Free Certificate) เข้ามาได้
3. ผู้ที่ไม่มีเอกสาร ข้อ 1 หรือ ข้อ 2 จะต้องเข้ารับการตรวจแบบรวดเร็ว ( Rapid Antigen Test เสียค่าใช้จ่าย คนละ 300 บาท)
หมายเหตุ
- การตรวจ ณ ท่าอากาศยาน ตรวจทุกคนที่เดินทางมาจากทุกจังหวัดเข้าภูเก็ต
- การตรวจ ณ ด่านท่าฉัตรไชย ตรวจเฉพาะผู้เดินทางพื้นที่ควบคุมสูงสุดสีแดง 17 จังหวัด
4. ทุกคนต้องดาวน์โหลด "หมอชนะ" และลงทะเบียน ผ่าน
WWW.GOPHUGET.COM แจ้งศูนย์ EOC ตำบล เพื่อประโยชน์ในการติดตามตัวในขณะอยู่ในพื้นที่
ยกเว้น ผู้ที่ขนส่งสินค้าและไม่ค้างคืนในพื้นที่โดยต้องมีจดหมายรับรองจากต้นสังกัดแสดงที่ด่านท่าฉัตรไชย
/////////////
สามารถสอบถามรายละเอียดได้ที่ กรมควบคุมโรค 1422 หรือ
สสจ. 094-593-5342 , 094-593-8876
รพ. วชิระภูเก็ต โทร 076-361-234
รพ. วชิระภูเก็ต สาขาหยี่เต้ง โทร 076-361-333
รพ. องค์การบริหารส่วนจังหวัดภูเก็ต โทร 076-361-234
รพ.ฉลอง โทร 076-348-342
รพ.ป่าตอง โทร 076-342-633
รพ.มิชชั่นภูเก็ต โทร 076-237-227 076-237-220 076-237-226
เพจ
ศูนย์ข้อมูลโควิดภูเก็ต SCB Protect แจกฟรี ประกันโควิดและอุบัติเหตุ LINK
โควิดมาอีกแล้ว รีบลงทะเบียนด่วน SCB Protect แจกฟรี ประกันโควิดและอุบัติเหตุ
กดลิงก์รับเลย
- ตรวจพบโควิด รับ 3,000 บาท ระยะเวลารอคอย 14 วัน
- นอนโรงพยาบาลชดเชยรายวัน 300 บาทต่อวัน สูงสุด 20 วัน กรณีผลกระทบจากวัคซีนโควิดหรืออุบัติเหตุ
- เสียชีวิตจากวัคซีนโควิดรับ 5,000 บาท ยกเว้นกรณีเสียชีวิตจากการเจ็บป่วยภายใน 14 วันแรก
- เกิดเหตุไม่คาดฝันคนข้างหลังรับสูงสุด 100,000 บาท
- คุ้มครอง 30 วันเลือกวันเริ่มได้
แค่กดไลค์เพจ
SCB Protect และกรอกข้อมูลจำเป็นเพื่อรับสิทธิ์พร้อมดูรายละเอียดความคุ้มครองเพิ่มเติม
ที่ลิงก์นี้ รับสิทธิ์ฟรีได้ตั้งแต่ 1 เม.ย.-31 พ.ค.64 หรือจนกว่าจะครบ 20,000 สิทธิ์
เงื่อนไขการรับประกัน
- เป็นผู้มีสัญชาติไทยอายุ 20-70 ปีบริบูรณ์ตามบัตรประชาชนในวันที่เริ่มความคุ้มครองวันแรก
- ข้อมูลที่กรอกต้องเป็นข้อมูลที่ถูกต้องตามบัตรประชาชน มิฉะนั้นกรมธรรม์จะไม่มีผลบังคับใช้
- เลือกเริ่มรับความคุ้มครองได้ตั้งแต่ 1 เม.ย.-31 พ.ค.64 (ไม่สามารถเริ่มก่อนวันที่ลงทะเบียนได้)
- บริษัท เอฟดับบลิวดี ประกันชีวิต จำกัด (มหาชน) จะจัดส่งกรมธรรม์ออนไลน์ให้ผู้เอาประกันที่กรอกข้อมูลถูกต้องตามเงื่อนไขทาง SMS ตามเบอร์มือถือที่ให้ไว้
- กรมธรรม์ออนไลน์จะมีผลบังคับใช้ตั้งแต่วันเริ่มความคุ้มครองที่เลือกไว้นับไป 30 วัน
- ผู้เอาประกันมีสิทธิ์รับความคุ้มครองเพียง 1 สิทธิ์ต่อ 1 เลขบัตรประชาชนต่อหมายเลยโทรศัพท์มือถือตลอดระยะเวลาแคมเปญ
- ทายาทโดยธรรม เป็นผู้รับประโยชน์ตามกรมธรรม์ประกันภัยฉบับนี้
- กรณีต้องการเรียกร้องสินไหมทดแทน ติดต่อศูนย์บริการลูกค้าเอฟดับบลิวดี โทร.02-632-6400 ได้ตลอด 24 ชั่วโมง
- ผู้ซื้อควรทำความเข้าใจรายละเอียดและเงื่อนไขก่อนตัดสินใจทำประกันภัยทุกครั้ง
- รับประกันโดยบริษัท เอฟดับบลิวดี ประกันชีวิต จำกัด (มหาชน) โทร.1351
- บริษัท ไทยพาณิชย์ โพรเทค จำกัด เป็นนายหน้าประกันชีวิตในการนำเสนอผลิตภัณฑ์ประกันภัย
- แคมเปญนี้เริ่มตั้งแต่ 1 เม.ย.-31 พ.ค.64 หรือจนกว่าจะครบ 20,000 สิทธิ์
SCB Protect 7/4/2021
รายงานสถานการณ์โควิด 11 เมษายน 64
ประชาชนทั่วไป เมื่อไหร่ต้องไปตรวจโควิด
ข่าวโควิด 13 เมษายน 64
14 เมษายน 64
15 เมษายน 64
เส้นทางกลับบ้าน ทรุมเซอ (Tromsø) ออสโล โคเปนเฮเกน กรุงเทพ
ทริปนี้ อยู่นานกว่าปกติ เตรียมตัวกลับบ้านมาสองรอบล่ะ แต่ก็มีเหตุให้ต้องเลื่อน เลื่อนจนเลื่อนไม่ได้อีกแล้ว ก็เลยต้อง detour เส้นทางกลับบ้าน เพราะสนามบินเมืองคุณฝรั่งยกเลิกไฟลท์เช้าและหยุดบินวันเสาร์ชั่วคราว เลยต้องมาขึ้นเครื่องที่ Tromsø เพื่อไปต่อเครื่องที่ออสโล เพื่อต่อไปโคเปนเฮเกน ดูวิวปลอบใจกันไป วิถีคนแฟนไกล
13 ธันวาคม 2020
ยันต์กันผีโควิด-19
1. รักษาวินัยส่วนตน วงจรมือ หน้า ปาก
2. รักษาระยะห่าง
3. ระยะเวลาที่ใกล้ชิด
4. พฤติการณ์ ณ ขณะนั้น
5. สถานที่อับ
ในสถานบันเทิงเช่น ผับ ขาดทุกข้อ
แต่ที่ที่สามารถเกิดขึ้นได้เช่นกัน เช่น การโดยสารรถคันเดียวกันโดยเฉพาะรถสาธารณะคนหนาแน่น
ทั้งนี้เนื่องจากมีคนที่ติดเชื้อและแพร่เชื้อได้กระจายอยู่ทั่วไปที่ไม่ได้ตรวจ
ผู้ป่วยที่มีอาการรุนแรงและวิกฤต กำลังเพิ่มมากขึ้น
1.ทำแบบประเมินความเสี่ยง
ใช้แบบประเมินของโรงพยาบาลราชวิถี
ตามลิงค์นี้ หรือ ตาม QR
กาญจนบุรี สั่ง ณ วันที่ 20 เมษายน 2564 LINK
ให้ประชาชนในพื้นที่จังหวัดกาญจนบุรีสวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้ง เมื่ออยู่ในบริเวณตลาด ตลาดนัด และตลาดน้ำทุกแห่ง หากผู้ใดฝ่าฝืนหรือไม่ปฏิบัติตามคำสั่งนี้โดยไม่มีเหตุอันสมควรจะมีความผิดตามมาตรา 51 แห่งพระราชบัญญัติโรคติดต่อ พ.ศ. 2558 ต้องระวางโทษปรับไม่เกินสองหมื่นบาท ทั้งนี้ ตั้งแต่วันที่ 20 เมษายน พ.ศ. 2564 เป็นต้นไปจนกว่าจะมีคำสั่งเปลี่ยนแปลง สั่ง ณ วันที่ 20 เมษายน พ.ศ. 2564
การบริจาคโลหิต หลังฉีดวัคซีนป้องกันโควิดแล้ว
- กรณีผู้ที่ฉีด Sinovac เว้น 1 สัปดาห์ บริจาคโลหิตได้
- กรณีฉีดแอสตร้าเซเนก้า หรือ จอห์นสันแอนด์จอห์นสัน ให้เว้น 4 สัปดาห์ จึงบริจาคได้
- กรณีมีอาการข้างเคียงหลังฉีดวัคซีน ขอให้หายดีก่อน โดยเว้น อีก 2 สัปดาห์ จึงบริจาคได้
25 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 2,438 ราย
ผู้ป่วยยืนยันสะสม 55,460 ราย
หายป่วยแล้ว 31,113 ราย
เสียชีวิตสะสม 140 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 24 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 1,124,153 ราย
------------------------------
วันที่ 24 เมษายน 2564 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 14,675 ราย
เข็มที่ 2 จำนวน 14,033 ราย
หมอพร้อม v.2 Google Play Store LINK
คำแนะนำการใช้แอป
ผู้ที่สามารถ Login เข้าใช้งานได้ จำเป็นต้องมีข้อมูล 13 หลัก และ เบอร์โทรศัพท์
อยู่ในฐานข้อมูลของกระทรวงสาธารณสุข Moph Immunization เท่านั้น
แอพพลิเคชั่นสำหรับตรวจสอบการฉีดวัคซีนของผู้รับบริการ มีฟังก์ชั่นการทำงาน ดังนี้
- จองวัคซีน
- นัดรับวัคซีน
- แสดงประวัติการรับวัคซีน
- แสดงใบรับรองการฉีดวัคซีน
- ตรวจสอบใบรับรองของการฉีดวัคซีน
ปรับระดับพื้นที่สถานการณ์
Q : ถ้าหากรายชื่อในการฉีดวัคซีนโควิด 19 ตกหล่นต้องทำอย่างไร?
Q : ถ้าหากรายชื่อในการฉีดวัคซีนโควิด 19 ตกหล่นต้องทำอย่างไร?
A : ถ้าพบว่ารายชื่อตกหล่น ให้แจ้งไปที่โรงพยาบาลที่มีประวัติการรักษา เพื่อนำรายชื่อเข้าระบบหมอพร้อม
ที่มา: กองยุทธศาสตร์และแผนงาน สำนักงานปลัดกระทรวงสาธารณสุข
1. เลือกลงทะเบียนเปลี่ยนหน่วย
กดเลือกไอค่อน ลงทะเบียนเปลี่ยนหน่วย
1.ติดตั้งไลน์ @nhso หรือสแกน QR Code
ติดตั้งไลน์ @nhso หรือสแกน QR Code
Episode 1: การฝึกกล้ามเนื้อหายใจกระบังลมเพื่อขยายปอด
Episode 1: Episode 1: การฝึกกล้ามเนื้อหายใจกระบังลมเพื่อขยายปอด
แบ่งเป็นขั้นตอน คือ
ขั้นที่ 1 : ฝึกกะบังลมหายใจเข้า
ขั้นที่ 2 : ฝึกการหายใจโดยการเป่าปาก
ขั้นที่ 3 : ผสานทั้งสองขั้นเข้าด้วยกัน
รายงานการได้รับวัคซีนอย่างน้อย 1 โดส และแบบเต็มโดส LINK
กลุ่มผู้ใหญ่ (อายุ 18 ปีขึ้นไป)
ที่ได้รับวัคซีนแล้ว
อย่างน้อย 1 โดส |
กลุ่มผู้ใหญ่ (อายุ 18 ปีขึ้นไป)
ที่ได้รับวัคซีน
ครบโดสแล้ว |
Data 2021-05-20
38.9%
234,065,392 |
Data 2021-05-20
16.1%
202,473,282 |
Data 2021-05-14
35.5%
215,717,952 |
Data 2021-05-14
14.1%
182,672,105 |
* ใต้ % คือจำนวนวัคซีนโดสทั้งหมดที่จัดสรรให้กับประเทศสมาชิก
Total doses distributed to EU/EEA Member States
เอกชน แบรนด์ๆ ต่างก็เอาด้วย ชวนฉีดวัคซีนแจกรางวัล
ชลบุรี รายงานผู้ติดเชื้อรายใหม่ 47 ราย LINK
สำนักงานสาธารณสุขจังหวัดชลบุรี รายงานผู้ติดเชื้อโควิด19 รายใหม่ จำนวน 47 ราย
1. สัมผัสผู้ป่วยยืนยัน
1.1 ในครอบครัว 7 ราย
1.2 จากที่ทำงาน 6 ราย
2. ติดเชื้อจากโรงงานแห่งหนึ่งในอำเภอปลวกแดง จังหวัดระยอง เข้ามารักษาในจังหวัดชลบุรี 5 ราย
3. ผู้สัมผัสผู้ป่วยยืนยัน ซึ่งอยู่ระหว่างสอบสวนโรค 16 ราย
4. อยู่ระหว่างการสอบสวนโรค 13 ราย
วันนี้ได้รับรายงานการค้นหาผู้สัมผัสทั้งหมดจำนวน 202 ราย, ค้นหาเชิงรุกเบื้องต้น อีกจำนวน 851 ราย และอยู่ระหว่างการรอรับรายงานการค้นหาเชิงรุกเพิ่มเติม
ตารางที่ 1 – อาการไม่พึงประสงค์ที่เกิดจากยา
NHS app ใบรับรองวัคซีนและวัคซีนพาสปอร์ตของอังกฤษ
NHS app ใช้สำหรับเข้าถึงข้อมูลสุขภาพของชาวอังกฤษ ตั้งแต่โควิดระบาด แอปใช้สำหรับแจ้งเตือนการติดเชื้อ แต่น้อยคนจะโหลดมาใช้ จนถึงวันนี้ ได้เพิ่มข้อมูลการรับวัคซีนเข้ามาเพื่อใช้เป็นวัคซีนพาสปอร์ต เพื่อชาวอังกฤษใช้แสดงเมื่อเดินทางไปท่องเที่ยวทั้งในยุโรปและอื่นๆ
Reference :
BBCอบจ.ปทุมธานี ซื้อวัคซีน 500,000 โดส เปิดให้ประชาชนลงทะเบียนเเล้ว LINK
23 มิย 64 องค์การบริหารส่วนจังหวัดปทุมธานี โดยพลตำรวจโท คำรณวิทย์ ธูปกระจ่าง นายกองค์การบริหารส่วนจังหวัดปทุมธานี ได้รับการจัดสรรวัคซีนทางเลือก #ซิโนฟาร์ม จากราชวิทยาลัยจุฬาภรณ์ เปิดให้ประชาชนลงทะเบียนเเล้ว
หลักเกณฑ์เงื่อนไข
- เป็นบุคคลผู้มีสัญชาติไทยอายุ 18 ปีขึ้น
- มีชื่อในทะเบียนบ้านจังหวัดปทุมธานี หรือประกอบกิจการ หรือทำงานในเขตพื้นที่จังหวัดปทุมธานี
- ทำการสแกน QR Code หรือลงทะเบียนได้ผ่านลิงก์ lin.ee/dq3DKGf
ทั้งนี้ นายกองค์การบริหารส่วนจังหวัดปทุมธานี พลตำรวจโท คำรณวิทย์ ธูปกระจ่าง แสดงความประสงค์สั่งซื้อวัคซีน 500,000 โดส ตั้งแต่วันแรกของการประกาศนำเข้า
เพจ
อบจ.ปทุมธานี รศ.นพ. ทวีสิน ตันประยูร ประธานปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “สืบเนื่องจากกระแสปัจจุบันที่มีกลุ่มคนรุ่นใหม่ ที่มีความมั่นใจ กล้าแสดงออกและมีมุมมองในการยอมรับนับถือผู้อื่นโดยไม่ใช้เรื่องของเพศสภาพ หรือรสนิยมส่วนตัวมาตัดสิน อีกทั้งจากประสบการณ์ของทีมแพทย์ผู้เชี่ยวชาญของเราที่ได้พบปะพูดคุยกับกลุ่มคนที่หลากหลาย ทำให้พบว่ามีความต้องการรับการบริบาลจากกลุ่มที่มีความหลากหลายทางเพศ รวมถึงจากผู้ปกครองและญาติมิตร เริ่มตั้งแต่การให้คำปรึกษาทางด้านจิตวิทยา การเตรียมความพร้อมเรื่องฮอร์โมน การทำหัตถการ และการใช้ศัลยกรรมช่วยปรับแต่งลักษณะทางกายภาพ รวมถึงการผ่าตัดเปลี่ยนเพศด้วยวิธีที่ถูกต้องตามหลักวิทยาศาสตร์อย่างแท้จริง และการดูแลอย่างต่อเนื่องภายหลังการผ่าตัด ภายใต้การดูแลของทีมศัลยแพทย์และแพทย์ผู้ชำนาญการที่เกี่ยวข้องในทุกด้าน การเปิด Pride Clinic ในวันนี้ นับเป็นการบริบาลทางการแพทย์ล่าสุดของบำรุงราษฎร์ ที่มุ่งยกระดับให้ครอบคลุมและมีความหลากหลายมากยิ่งขึ้น แต่เรายังคงไว้ซึ่งคุณภาพมาตรฐานและความปลอดภัยสูงสุดของผู้รับบริการทุกคน”
โรงพยาบาลเพชรบุรี
โรงพยาบาลเพชรบุรี ได้ก่อสร้างขึ้นในปี พ.ศ.2491 โดยการนำของพระสมัครสโมสร(เสงี่ยม สมัครสโมสร) ซึ่งดำรงตำแหน่งเป็นผู้ว่าราชการจังหวัด ร่วมกับคณะกรรมการจังหวัดได้ร่วมมือกันจัดตั้งองค์กรการกุศล ชักชวนข้าราชการ พ่อค้า คหบดี ตลอดจนประชาชน ได้ร่วมบริจาคเงิน เพื่อนำไปสมทบกับงบประมาณของกระทรวงสาธารณสุข พระบำราศโรคาพาฬห์ (สาธารณสุขจังหวัด ในขณะนั้น) ได้มีส่วนในการจัดหาสถานที่ จำนวน 42 ไร่ ซึ่งต้องเช่าที่ดินทรัพย์สินส่วนพระมหากษัตริย์และร่วมเป็นคณะกรรมการควบคุมการก่อสร้างจนแล้วเสร็จในปี พ.ศ.2492 โรงพยาบาลเพชรบุรี เป็นส่วนราชการภูมิภาคในสังกัดของกรมการแพทย์ จนถึงปี พ.ศ.2532 จังหวัดเพชรบุรี จึงได้ขอพระราชทานพระบรมราชานุญาต เชิญพระบรมนามาภิไธย-พระบาทสมเด็จพระจอมเกล้าเจ้าอยู่หัว มาเป็นชื่อโรงพยาบาลเพชรบุรี มีชื่อว่า โรงพยาบาลพระจอมเกล้า จังหวัดเพชรบุรีอบจ.ปทุมธานี เปิดลงทะเบียนผ่านไลน์ LINK
องค์การบริหารส่วนจังหวัดปทุมธานี โดยพลตำรวจโท คำรณวิทย์ ธูปกระจ่าง นายกองค์การบริหารส่วนจังหวัดปทุมธานี ได้รับการจัดสรรวัคซีนทางเลือก #ซิโนฟาร์ม จากราชวิทยาลัยจุฬาภรณ์
เปิดให้ประชาชนลงทะเบียนเเล้ว....
หลักเกณฑ์เงื่อนไข
- เป็นบุคคลผู้มีสัญชาติไทยอายุ 18 ปีขึ้น
- มีชื่อในทะเบียนบ้านจังหวัดปทุมธานี หรือประกอบกิจการ หรือทำงานในเขตพื้นที่จังหวัดปทุมธานี
- ทำการสแกน QR Code หรือลงทะเบียนได้ผ่านลิงก์ https://lin.ee/dq3DKGf
หากมีข้อขัดข้องหรือข้อสงสัยใดๆสามารถโทรสอบถามได้อย่างที่เบอร์02 430 6695
1 ยังไม่มีโอกาสตรวจเชื้อ หรือมีอาการไม่สบาย ใช้อย่างไร
1.ยังไม่มีโอกาสตรวจเชื้อ หรือมีอาการไม่สบาย (เจ็บคอ,มีไข้, ครั่นเนื้อตัวแม้ไม่มีไข้, ปวดศีรษะ, ปวดเมื่อยเนื้อตัว) ถ้าใช้ผงฟ้าทะลายโจรทั่วๆไป ให้สังเกตว่าขนาดแคปซูลเท่าไหร่ ให้ใช้ดังนี้
- ขนาด 400 มิลลิกรัม ให้ใช้ฟ้าทะลายโจร 4 เม็ดต่อครั้งและ 4 ครั้งต่อวันติดต่อกัน 5 วัน
- ขนาด 500 มิลลิกรัม ให้ใช้ฟ้าทะลายโจร 3 เม็ดต่อครั้งและ 4 ครั้งต่อวันติดต่อกัน 5 วัน
ปริมาณดังกล่าวนี้เป็นปริมาณต่ำสุดของไข้หวัดธรรมดา ที่ใช้ผงฟ้าทะลายโจร 6 กรัมต่อวัน ตามบัญชียาหลักแห่งชาติที่ใช้สำหรับคนไทยมา 20 กว่าปี จึงมีความปลอดภัย ไม่เกิดพิษเฉียบพลัน และพิษเรื้อรัง
สำหรับเด็กให้ลดทอนลงมาตามน้ำหนัก 6 กรัม/วัน (แคปซูล 400 มิลลิกรัม 16 แคปซูลต่อน้ำหนัก 50 กิโลกรัม) เช่น เด็กน้ำหนัก 25 กิโลกรัมจะเหลือ 3 กรัม/วัน ถ้าเด็กเล็กกลืนไม่ได้ ให้ผสมน้ำผึ้งแล้วกวาดคอให้ตัวยาถึงเนื้อคอด้านใน
ใบจำหน่ายพืช ออกโดย อย.
หลักฐานการรับซื้อส่วนของกัญชาที่ได้รับการยกเว้น ให้ไม่จัดเป็นยาเสพติดให้โทษประเภท 5 เอกสารฉบับนี้ ออกโดย อย. ซึ่งจะต้องมีเอกสารนี้ทุกครั้งที่มีการ ซื้อขาย หรือจำหน่าย ชิ้นส่วนต่าง ๆ ของกัญชา โดยจะเป็นการออกจาก อย. ให้กับผู้ซื้อ ซึ่งจะมี QR Code เพื่อตรวจสอบเอกสาร อยู่ใต้เอกสาร
*ภาพมีการตกแต่งเพิ่มเติม เพื่อให้เกิดความชัดเจนมากขึ้นเท่านั้น
แปลงปลูกวัถุดิบสมุนไพร LINK
โครงการเยี่ยมแปลงปลูกวัถุดิบสมุนไพรปีงบประมาณปี64 ส่งเสริมและพัฒนาการเตรียมวัตถุดิบแห้งเพื่อให้ได้คุณภาพ ตามมาตรฐาน...
- โซนที่ 1 โซนบ้านท่าลาด คุณเกรียงศักดิ์ เวฬุวนารักษ์ ประธานกลุ่ม
- โซนที่ 2 บ้านกำแมด คุณแม่ทองสาย ชิงชัย ประธานกลุ่ม
- โซนบ้านนางาม ต.โพนงาม บ้านโนนประทาย ต.หนองแหน และบ.ห้องแซงอ.เลิงนกทา จ.ยโสธร
Info+QR code รวมช่องทางหาเตียงสำหรับผู้ป่วยโควิด-19 ทั้งรัฐและเอกชน จัดทำโดย ชมรมอัสสัมชัญอาสาพัฒนา - อาสาจะทำ
เชิญร่วมเป็นส่วนหนึ่งใน การให้ โดยบริจาคเงินผ่านกองทุน
ขอเชิญร่วมเป็นส่วนหนึ่งใน "การให้" โดยบริจาคเงินผ่านกองทุน
บัญชี กองทุนบริหารจัดการศูนย์ดูแลในชุมชน (แผนไทย)
เพื่อสนับสนุนการเรียน การสอน การวิจัย โดยใช้ศาสตร์การแพทย์แผนไทย
ในการดูแลรักษาพยาบาลผู้ติดเชื้อโคโรน่าไวรัส (Covid-19)
เลขที่ 419-3-58793-2 ธนาคารกรุงไทย | สาขาพังโคน
*หมายเหตุ* เงินบริจาคสามารถนำไปลดหย่อนภาษีได้
โดยส่งหลักฐานการโอนเงิน แจ้งชื่อ ที่อยู่ และหมายเลขโทรศัพท์อย่างชัดเจนมาที่เพจโดยตรง หรือข้อมูลตามภาพด้านล่าง
สิ่งที่ต้องมี เมื่อต้องกักตัวที่บ้าน Home Isolation
ข้อมูล/ข่าวเกี่ยวข้องกับศูนย์วัคซีนกลางบางซื่อ
ฝั่งธนบุรี
คณะแพทยศาสตร์ ศิริราชพยาบาล [แผนที่]
วิธีตรวจ : Walk-In
เวลาทำการ :
วันทำการ :
วันที่ให้บริการ :
ปริมาณตรวจ : 20-30 คน/วัน
สถานะ : ว่าง
โทรศัพท์ : 024197000
หมายเหตุ
ราคาขึ้นอยู่กับการประเมินความเสี่ยง / แจกคิว 7.00 น. / ตึกนวมินทร์ ชั้น G
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 01:49 (6 ชั่วโมงที่แล้ว)
มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-17:00]
วันทำการ : [จ. อา. ส. ศ. พฤ. พ. อ. ]
วันที่ให้บริการ : [2021-07-26] ถึง [2021-08-01]
ปริมาณตรวจ : 600 คน/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 024650025, 024737000
หมายเหตุ
จองคิวล่วงหน้า 1 วัน ผ่าน Application QueQ หรือ
ผ่านลิงค์ QueQ
ตรวจหาเชื้อโควิด-19 ต้องเตรียม บัตรประจำตัวประชาชนตัวจริง พร้อมสำเนาบัตร 1 ฉบับ และรับรองสำเนาถูกต้องให้เรียบร้อย และนำปากกาส่วนตัวมาด้วย สอบถามเพิ่มเติม โทร 02-465-0025 ต่อ 5618-9 หรือ 5636-8
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 02:17 (5 ชั่วโมงที่แล้ว)
ศูนย์การแพทย์กาญจนาภิเษก คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล [แผนที่]
วิธีตรวจ : ขึ้นอยู่กับการตรวจคัดกรองและการพิจารณาจากทีมแพทย์
เวลาทำการ : [08:00-14:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ]
วันที่ให้บริการ :
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 028496600
หมายเหตุ
วันจันทร์-ศุกร์ เปิดบริการ 08.00-14.00 น. วันเสาร์-อาทิตย์ เปิดบริการ 08.00-10.00 น.
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 11:01 (20 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [12:00-17:00] [12:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ] [ส. อา. ]
วันที่ให้บริการ : [2021-07-12] ถึง [2021-07-18]
ปริมาณตรวจ : 900/วัน
สถานะ : ว่าง
โทรศัพท์ : 0909834880
หมายเหตุ
- เตรียมบัตรประจําตัวประชาชนตัวจริงพร้อมสำเนา - เตรียมปากกาส่วนตัวเพื่อลงทะเบียน - ตรวจเฉพาะ คนไทย - ตรวจเฉพาะผู้พักอาศัยใน กทม.
บันทึกข้อมูลล่าสุดเมื่อ: 27 ก.ค. 64 20:01 (2 วันที่แล้ว)
ศูนย์แพทย์อาชีวเวชศาสตร์กรุงเทพ [แผนที่]
วิธีตรวจ : Rapid Test, RT-PCR
เวลาทำการ : [08:00-11:30] [13:30-16:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ] [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-30] ถึง [2021-10-31]
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 065-2425718
15,17 ซอยพระรามที่ 2 ซอย 30 แขวง บางมด เขตจอมทอง กรุงเทพมหานคร 10150
http://www.bomc.co.th/หมายเหตุ
Drive Thru
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 02:59 (4 ชั่วโมงที่แล้ว)
คลินิกเวชกรรมเคอร์เนลแสตมป์ [แผนที่]
วิธีตรวจ : Rapid Test, RT-PCR
เวลาทำการ : [10:00-20:00] [12:00-20:00]
วันทำการ : [ศ. ส. อา. ] [จ. อ. พ. พฤ. ]
วันที่ให้บริการ : [2021-07-30] ถึง [2021-10-31]
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 0838485656
ที่อยู่ 54, 1 ถ. พรานนก - พุทธมณฑลสาย 4 แขวง บางพรม เขตตลิ่งชัน กรุงเทพมหานคร 10170
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 03:14 (4 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [-]
วันทำการ : []
วันที่ให้บริการ :
ปริมาณตรวจ : 50 ท่าน ต่อวัน และต้องจองผ่านเวบไซต์ https://www.nakornthon.com/package/detail/24-deals/วัน
สถานะ : ว่าง
โทรศัพท์ : 024509999
หมายเหตุ
ราคา 4,500 บาท รู้ผลภายใน 48 ชม. ผู้ที่สามารถตรวจได้ต้องมีคุณสมบัติตามด้านล่าง - มีสัญชาติไทย - อายุ 1 – 50 ปี - BMI ไม่เกิน 30 - ไม่ตั้งครรภ์ หรือ สงสัยตั้งครรภ์ หรือ ประจำเดือนขาดมากกว่า 1 เดือน - ผ่านเกณฑ์พิจารณาจากการทำแบบประเมินของทางโรงพยาบาล *** หากกรณีตรวจพบเชื้อ การรับไว้รักษาในโรงพยาบาลเป็นไปตามเกณฑ์การพิจารณาของโรงพยาบาล และจำนวนเตียงในขณะนั้น***
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 00:28 (1 วันที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [07:00-18:00]
วันทำการ : [จ. พ. พฤ. ส. ศ. อ. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 024872100
หมายเหตุ
อายุ 15-45 ปี I น้ำหนักไม่เกิน 85 กก. หรือ BMI ไม่เกิน 30 I งดรับผู้มีโรคประจำตัวและสตรีมีครรภ์
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 01:21 (6 ชั่วโมงที่แล้ว)
ผู้ติดเชื้อโควิด-19 ที่ยังไม่ได้เข้าสู่ระบบการรักษาต้องทำอย่างไร?
1.ลงทะเบียนเพื่อเข้าสู่การดูแลที่บ้าน (Home Isolation)
2.กรณีลงทะเบียนแล้วแต่ยังไม่ได้รับการติดต่อกลับเกิน 48 ชั่วโมง
4.ติดตามสถานการณ์ดูแลผู้ติดเชื้อโควิด-19 ในระบบการดูแลที่บ้าน (Home Isolation)
ที่ Line @nhso เลือกเมนูบริการเกี่ยวกับโควิด-19
หมายเหตุ ทั้ง 4 บริการ สามารถดูได้ที่ Line Official Account หรือไลน์ OA ของ สปสช. โดยเพิ่มเพื่อนผ่านไลน์ @nhso เลือกบริการเกี่ยวกับโควิด-19 เพื่อกรอกข้อมูลเข้าสู่ระบบได้เช่นกัน
เลขหมายประจำเขต กรุงเทพเหนือ
เลขหมายประจำเขต กรุงเทพเหนือ
ภารกิจ พาหลานย่า_กลับสู่อ้อมกอดครอบครัว อบจ.นครราชสีมา LINK
องค์การบริหารส่วนจังหวัดนครราชสีมา เปิดภารกิจ “ #พาหลานย่า_กลับสู่อ้อมกอดครอบครัว ”
จัดรถรับ-ส่ง ผู้ป่วยที่รักษาโควิด – 19 หายแล้ว ออกจาก รพ.สนาม – ไปพักฟื้นต่อที่บ้าน โดยไม่มีค่าใช้จ่าย เริ่มตั้งแต่วันที่ 12 กรกฎาคม จนถึงปัจจุบัน
ขอรับบริการรถ ที่นี่!! Line Official Account @koratpao
กดลิ้งค์>> https://lin.ee/CYYG8iW
โทร.แจ้งที่สายด่วน สปสช. 1330 กด 15 LINK
ผู้ป่วยที่มีความประสงค์จะกลับภูมิลำเนา สามารถลงทะเบียนได้ที่เว็บไซต์ของ สปสช.
https://crmdci.nhso.go.th/ หรือ โทร.แจ้งที่สายด่วน สปสช. 1330 กด 15 หรือโทรติดต่อตามหมายเลขที่ทางจังหวัดจัดเตรียมไว้
สปสช.จะประสาน กระทรวงสาธารณสุข สถาบันการแพทย์ฉุกเฉินแห่งชาติ กองทัพบก กระทรวงคมนาคม เพื่อจัดรถรับผู้ป่วยกลับไปรักษา พร้อมมีแพทย์วิดีโอคอลให้คำปรึกษาระหว่างการเดินทาง
ตารางทีม TTV วันที่ 13-21 ส.ค.64 LINK
กำหนดวันที่ให้บริการตั้งแต่ 13-21 ส.ค. 64 เวลา 8.30-15 น. ในพื้นที่และสถานที่ฉีด ดังนี้
13 ส.ค. 64 ตำบลบางหญ้าแพรก สถานที่ : วัดบางหญ้าแพรก
14 ส.ค. 64 ตำบลนาดี สถานที่ : รร.วัดบางปิ้ง
15 ส.ค. 64 ตำบลบ้านเกาะ สถานที่ : อบต.บ้านเกาะ
16 ส.ค. 64
ตำบลท่าฉลอม สถานที่ : รพ.นครทำฉลอม
ตำบลท่าจีน สถานที่ : วัดน้อยนางหงส์
17 ส.ค. 64
ตำบลบางโทรัด สถานที่ : รร.เมืองสมุทรสาคร
ตำบลบางน้ำจืด สถานที่ : วัดโพธิ์แจ้
18 ส.ค. 64
ตำบลโกรกกราก สถานที่ : รร.วัดโกรกกราก
ตำบลบางหญ้าแพรก สถานที่ : วัดสามัคคีศรัทธาราม
19 ส.ค. 64
ตำบลบางกระเจ้า สถานที่ : วัดบางกระเจ้า
ตำบลนาโคก สถานที่ : วัดนาโคก
20 ส.ค. 64
ตำบลคอกกระบือ สถานที่ : วัดราษฎร์รังสรรค์
ตำบลบ้านบ่อ สถานที่ : วัดใต้บ้านบ่อ
21 ส.ค. 64
ตำบลชัยมงคล สถานที่ : วัดพรหมคุณาราม (วัดบางตะคอย)
ตำบลกาหลง สถานที่ : วัดกาหลง
ผู้ติดเชื้อในอยุูยา ติดต่อที่นี่
พิษณุโลก ลงทะเบียน 2 ช่องทาง LINK
คนพิษณุโลกที่อยู่ในเขตอำเภอเมืองพิษณุโลก และได้รับการฉีด วัคซีนโควิด-19 เข็ม 1 จากสถานีกลางบางซื่อ หรือจากต่างจังหวัด หากมีความประสงค์จะรับ วัคซีนโควิด-19 เข็ม 2 ที่ศูนย์ฉีดวัคซีน หอประชุมศรีวชิรโชติ มหาวิทยาลัยราชภัฎพิบูลสงคราม ติดต่อได้ 2 ช่องทาง ดังนี้
1.ลงทะเบียนด้วยตัวเองที่ศูนย์ฉีดวัคซีนฯ วันจันทร์-ศุกร์ เวลา 9-15 น. เว้นวันหยุดราชาการ
2.ลงทะเบียนทาง Line โดยเพิ่มเพื่อน Line ด้วยหมายเลข 0644058780 และส่งข้อมูลทางไลน์ได้แก่ บัตรประชาชน เบอร์โทร บัตรนัดเข็ม 2 จากที่เดิม
เจ้าหน้าที่จะตอบกลับใน 3 วัน หากไม่มีการตอบกลับ โทรสอบถามที่ 064-4058780 อีกครั้ง
รพ.บางพลี เปิดให้กลุ่มผู้ที่มีอายุตั้งแต่ 18-59 ปี ลงทะเบียนผ่าน QRcode LINK
ศูนย์ฉีดวัคซีนวัดบางพลีใหญ่กลาง โดยโรงพยาบาลบางพลี จัดฉีดวัคซีนซิโนแวค เข็ม1 (โดยเข็ม2 เป็นแอสตร้าเซเนก้า) จำนวน 7,000 คน สำหรับผู้ที่ยังไม่เคยฉีดวัคซีนโควิดมาก่อน
• กลุ่มเสี่ยง ได้แก่ ผู้สูงอายุตั้งแต่ 60 ปีขึ้นไป, หญิงตั้งครรภ์ 12 สัปดาห์ขึ้นไป และผู้ป่วยในกลุ่มโรคเสี่ยง 7 โรค (โรคทางเดินหายใจเรื้อรังรุนแรงและโรคหอบหืด โรคหัวใจและหลอดเลือด โรคหลอดเลือดสมอง โรคไตเรื้อรัง โรคมะเร็ง โรคเบาหวาน และโรคอ้วนที่มีน้ำหนักเกิน 100 กก. หรือ BMI เกิน 35)
• ผู้ที่มีอายุตั้งแต่ 18-59 ปี
โดยลงทะเบียนผ่าน QRcode หรือลิงค์
ได้ตั้งแต่วันที่ 22 สค 64 เวลา 12.00 น
รับลงทะเบียนจนกว่าจะเต็มจำนวน
โปรดรอรับ SMS ตอบกลับเพื่อนัดวันเวลาฉีดวัคซีนในช่วงวันที่ 24 สค- 3 กย 64
บางขุนเทียน หน่วยเคลื่อนที่ 8-17 กันยายน 64
บางขุนเทียน ร่วมกับศูนย์บริการสาธารณสุข 42 ออกหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ฟรี !!! ตามวันที่และจุดให้บริการ ดังนี้
- วันที่ 8 กันยายน 2564 การเคหะธนบุรี 1 ส่วน 2 (
ชมภาพบรรยากาศวันฉีด)
- วันที่ 9 กันยายน 2564 ชุมชนศักดิ์มงคลชัย
- วันที่ 10 กันยายน 2564 ชุมชนวัดหัวกระบือ
- วันที่ 13 กันยายน 2564 หมู่บ้านเอื้ออาทร ซ.เทียนทะเล 28
- วันที่ 14 กันยายน 2564 หมู่บ้านคุณาลัย
- วันที่ 15 กันยายน 2564 วัดสุธรรมวดี ซ.บางกระดี่ 25
- วันที่ 16 กันยายน 2564 ชุมชนวัดบางกระดี่
- วันที่ 17 กันยายน 2564 ชุมชนวัดพรหมรังษี
Nok Air LINK
เดินทางสะดวกมากขึ้น ไม่ต้องวุ่นเตรียมเอกสาร กับ Digital Health Pass ใช้งานผ่าน "หมอพร้อม" Application เพียงเลือกเมนู Digital Health Pass แสดง QR Code ให้กับพนักงาน Check In เพื่อสแกนตรวจสอบเอกสาร
*หมายเหตุ โปรดตรวจสอบมาตรการจังหวัดปลายทางอีกครั้ง
WHO หากเคยป่วยด้วยโควิด 19 มาแล้ว ควรรับวัคซีนหรือไม่ LINK
WHO หากเคยป่วยด้วยโควิด 19 มาแล้ว ควรรับวัคซีนหรือไม่
แม้ว่าคุณจะเคยรับเชื้อโควิด 19 มาแล้ว คุณก็ควรรับวัคซีนอีกเมื่อมีโอกาส เพราะการปกป้องที่ได้รับจากการติดเชื้อไวรัสโควิด 19 จะแตกต่างกันไปในแต่ละบุคคล และเรายังไม่ทราบด้วยว่าภูมิคุ้มกันตามธรรมชาติจะคงอยู่ได้นานแค่ไหน
ขั้นตอนที่ 1 ตรวจสอบวันหมดอายุ
ออกจากบ้านเท่าที่จำเป็น
แต่เมื่อจำเป็นต้องออก ทุกครั้งต้องป้องกัน +
กลับถึงบ้านอาบน้ำ สระผม
หน่วยงานที่ให้บริการ
หน่วยงานที่ให้บริการ ออกหนังสือรับรองการสร้างเสริมภูมิคุ้มกันโรคโควิด 19 เพื่อใช้สำหรับการเดินทางไปต่างประเทศ
(ข้อมูล ณ วันที่7 กันยายน 2564 เวลา 10.50 น. -
กรมควบคุมโรค)
*** หมายเหตุ การให้บริการแต่ละแห่งอาจมีการเปลี่ยนแปลง เนื่องจาก สถานการณ์การระบาดของโรคโควิด 19 กรุณาตรวจสอบรายละเอียดการออกหนังสือรับรองฯ อีกครั้งกับหน่วยงานที่ท่านจะไปรับบริการ
Highland Café เมนูกัญชาพร้อมเสิร์ฟ
ร้านดังของสายเขียว สไตล์ urban rustic ดิบแบบเมืองๆ ในกรุงเทพ กับเมนูอาหารและเครื่องดื่มกัญชาพร้อมเสิร์ฟ ทั้งจานเดี่ยว จานด่วน หรือสำรับกับข้าว สายเขียวและไม่เขียว ต้องไม่พลาด
ข้อมูลร้าน
- ร้านอยู่ห้าแยกลาดพร้าว หลังMRT พหลโยธิน ประตู 2
- เปิดทุกวัน 11.00-21.00 ครัวเปิด 12.00-19.45
- นั่งทานที่ร้านได้ แต่ร้านไม่มีที่จอดรถ ถ้าจะจอดให้จอดที่ลาดพร้าวซอย 2 ได้
- สามารถสั่งผ่าน robinhood ได้
โรงแรม Novotel Bangkok on Siam Square เปิดให้บริการ Hospitel ร่วมกับ โรงพยาบาลนวเวช
โรงแรม Novotel Bangkok on Siam Square เปิดให้บริการ Hospitel โดยความดูแลของโรงพยาบาลนวเวช เปิดให้บริการตั้งแต่วันที่ 3 ก.ย. 64 เงื่อนไขเป็นไปตามที่รพ. กำหนด
- เป็นคนไข้หรือเข้ารับการรักษากับรพ.นวเวช
- กรณีที่ท่านมีผลตรวจ RT-PCR จากที่อื่น สามารถลงทะเบียนเข้ารับการรักษากับรพ.นวเวชได้เช่นกัน
- กรณีท่านยังไม่ได้รับการตรวจ Covid ทางโรงพยาบาลฯ มีบริการตรวจคัดกรองหาเชื้อ COVID-19 (Real Time PCR ) แบบ Drive thru ซึ่งสามารถจองซื้อแพ็กเกจตรวจ drive thru ผ่านช่องทางออนไลน์ได้ที่
ติดต่อสอบถามรายละเอียดเพิ่มเติม โทร 02-483-9999
ประกาศจากศูนย์วัคซีนกลางบางซื่อ LINK
สำหรับผู้ที่จะรับบริการ #เข็มที่ 3
ชนิดวัคซีน AstraZenece เป็นเข็มกระตุ้น (Bosster dose)
เฉพาะผู้ที่เคยได้รับ Sinovac 1,2 จากศูนย์ฉีดวัคซีนกลางบางซื่อเท่านั้น
โดยศูนย์ฯจะส่ง sms ยืนยันวันนัดหมาย
โปรดมาตรงตามวันเวลานัด
เช็คผลลงทะเบียนว้นเวลานัดฉีดผ่านแอพ "Vaccine บางซื่อ"
ติดตามสถานการณ์สภาพอากาศจากกรมอุตุนิยมวิทยา ตลอด 24 ชั่วโมง
ติดตามสถานการณ์สภาพอากาศจากกรมอุตุนิยมวิทยาและจากเรดาร์ตรวจฝนของกรุงเทพมหานคร ตลอด 24 ชั่วโมง
เขตต่างๆในกทม.พร้อมรับมือระดับน้ำขึ้นสูง - น้ำท่วม ในกทม.
ข้อพึงปฏิบัติสำหรับสถานพยาบาลสัตว์ ที่รับฝากหรือรักษาสัตว์เลี้ยงในกรณีที่เจ้าของสัตว์ป่วยด้วยโรคCOVID 19
1.น้ำมันกัญชาหยอดใต้ลิ้น 5 ml THC
น้ำมันกัญชาหยอดใต้ลิ้น 5 ml THC (THC 1.7% W/V (THC 0.5mg/drop))
รหัส SAS1
ส่วนประกอบ THC 1.7% W/V (THC 0.5mg/drop)
ขนาดบรรจุ 5 มิลลิลิตร/ขวด
รูปแบบของผลิตภัณฑ์ น้้ามันกัญชาหยดใต้ลิ้น
ข้อบ่งใช้
1.เพิ่มคุณภาพชีวิตผู้ป่วยมะเร็งระยะสุดท้าย เช่น ลดปวด ลดผลข้างเคียงต่อการใช้เคมีบำบัดหรือ
รังสีรักษา ท้าให้กินข้าวได้ นอนหลับ
2.บรรเทาอาการปวดในผู้ปวดปลายประสาทที่ไม่ตอบสนองในรักษา (intractable neuropatic pain) และโรคอื่นๆที่มีหลักฐานการใช้ว่าได้ประโยชน์และอยู่ในการพิจารณาของแพทย์ผู้ทำการรักษา
ผู้ผลิต โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ประเภทใบอนุญาต ผลิต (แปรรูปหรือสกัด) ซึ่งยาเสพติดให้โทษในประเภท 5
เลขที่ใบอนุญาต 10/2562
รายละเอียด
ผลิตภัณฑ์กัญชานี้ได้รับยกเว้นการรับรองตำรับจากสำนักงาน อย. เพื่อใช้สำหรับผู้ป่วยเฉพาะ
ราย ภายใต้รูปแบบพิเศษของการเข้าถึงยา (Special access scheme ) ต้องสั่งจ่ายโดยแพทย์ที่
ผ่านการอบรมหลักสูตรการใช้กัญชาและสารสกัดจากกัญชาในทางการแพทย์จากกระทรวงสาธารณสุขและต้องได้รับการยินยอมจากผู้ป่วยหรือผู้ดูแลผู้ป่วยโดยการลงนามเป็นลายลักษณ์อักษรในเอกสารแสดงความยินยอม
Wall of Chiang Mai ก๋ำแปงเวียง ระบบลงทะเบียนรับวัคซีน จังหวัดเชียงใหม่ LINK
1. แนวทางการฉีดวัคซีนโควิด-19 ให้ทุกกลุ่มเป้าหมาย ดังนี้ ฉีดวัคซีน Sinovac เป็นเข็มที่ 1 และวัคซีน AstraZeneca เป็นเข็มที่ 2 โดยฉีดห่างกัน 3 สัปดาห์
2. กลุ่มเสี่ยงที่ควรได้รับการฉีดวัคซีนทันที คือ 1.ผู้สูงอายุ 60 ปีขึ้นไป 2.หญิงตั้งครรภ์ 3.ผู้มีโรคประจำตัว 7 กลุ่มโรค ดังนี้
1).โรคทางเดินหายใจเรื้อรังรุนแรง ได้แก่ ปอดอุดกั้นเรื้อรัง และโรคหอบหืด 2).โรคหัวใจและหลอดเลือด 3).โรคไต 4).โรคหลอดเลือดสมอง 5).โรคมะเร็งทุกชนิด 6).โรคเบาหวาน 7).โรคอ้วน BMI >35 หรือ น้ำหนักมากกว่า 100 กิโลกรัม
3. ผู้ที่ได้สิทธิฉีดวัคซีนแล้ว แต่ไม่ได้ไปรับวัคซีนตามกำหนด สามารถนำ SMS เดิมหรือแสดงหน้าจอคิวก๋ำแปงเวียง ต่อเจ้าหน้าที่ ณ จุดฉีดที่ท่านได้รับสิทธิ เพื่อขอรับการฉีดวัคซีนได้เลย โดยไม่เสียสิทธิ
4. ผู้ที่มีสิทธิลงทะเบียนฉีดวัคซีนเข็มที่ 3 ในระยะนี้ จะต้องมีประวัติการรับวัคซีน เข็มที่ 1 และเข็มที่ 2 เป็นวัคซีน Sinovac ทั้งสองเข็ม โดยเป็นผู้ที่ได้รับวัคซีนครบ 2 เข็ม ระหว่างเดือน มี.ค. - พ.ค.
ก๋ำแปงเวียง เป็นระบบลงทะเบียนความประสงค์รับวัคซีนของจังหวัดเชียงใหม่ โดยเปิดให้ประชาชนทั่วไป ที่มีอายุตั้งแต่ 18 ปีขึ้นไปสามารถลงทะเบียนรับวัคซีนได้
เงื่อนไข
- การลงทะเบียนการฉีดวัควัคซีนจะไม่ลงวันที่นัดหมาย เมื่อหน่วยฉีดฯ ได้รับวัคซีนแล้วจะแจ้งผ่านทางเว็บไซต์ "ก๋ำแปงเวียง" หน้าตรวจสอบผลการลงทะเบียน และระบบจะส่ง SMS ไปตามเบอร์โทรที่ท่านได้ลงทะเบียนไว้ โดยจะแจ้งให้ทราบ วันเวลา และสถานที่ฉีด ล่วงหน้าอย่างน้อย 2-3 วัน
- ***หากไม่สามาถลงทะเบียนจองได้ เนื่องจากไม่พบชื่อในฐานข้อมูลของสาธารณสุขฯ ให้ท่านปฏิบัติ ดังนี้
1. ลงทะเบียนยืนยันตัวใน ไลน์หรือแอพพิลเคชั่น "หมอพร้อม" จึงจะมีชื่อท่านอยู่ในระบบฯ
2. จากนั้นกลับมาลงทะเบียนจองคิวที่เว็บ "ก๋ำแปงเวียง" จึงจะสามารถจองคิวได้
- การลงทะเบียนได้ 1 ครั้ง/คน ไม่สามารถจองหลายหน่วยบริการได้
- เป็นการลงทะเบียนเพื่อรับวัคซีนเข็มที่ 1 เท่านั้น สำหรับเข็มที่ 2 ต่อเนื่อง หน่วยฉีดจะออกใบนัดให้สำหรับท่าน
- สามารถแก้ไขข้อมูลการลงทะเบียน ได้ 2 ครั้ง ก่อนได้รับสิทธิ (แก้ไขข้อมูลส่วนตัว/ย้ายอำเภอ)
Call Center โควิดฯ โทร.
053-211048-50 ต่อ 433, 434 (จันทร์-ศุกร์ 08.00-16.30 น.)
084-8052121, 084-8053131, 098-1023422,
098-1025783, 098-1028632, 065-4723185 (เปิดให้บริการทุกวัน 08.30-24.00 น.)
ขอนแก่น Kick Off สร้างเกราะด้วยวัคซีน ต้อนรับเปิดเทอม LINK
4 ตุลาคม 2564 7.30 น.ดร.สมศักดิ์ จังตระกุล ผู้ว่าราชการจังหวัดชอนแก่น เดินทางร่วม Kick Off สร้างเกราะด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม ณ โรงเรียนศรีสังวาลย์ขอนแก่น อำเภอเมือง จังหวัดขอนแก่น ร่วมรับชมการถ่ายทอดสดจากเวทีกลาง โรงเรียนพิบูลย์อุปถัมภ์ กรุงเทพมหานคร โดยกล่าวถึง ความพร้อมของการฉีดวัคซีน Pfizer ให้กับนักเรียนที่มีอายุ 12-18 ปี เยี่ยมชมจุดฉีดวัคชีนสร้างความมั่นใจใน เยี่ยมชมจุดฉีดวัคนสร้างความมั่นใจในการเปิดเทอม มาตรการการฉีดวัคซีนให้กับเด็ก มาตรการการฉีดวัคซีห้กับเด็ก สร้างความเชื่อมั่นให้กับผู้ปกครอง ตามความสมัครใจให้ครอบคลุมอย่างน้อยร้อยละ 70 ของประชากร เพื่อลดความรุนแรงและการเสียชีวิตจากการป่วยด้วยโรคติดเชื้อไวรัสโคโรนา 2019 โรงเรียนศรีสังวาลย์มีจำนวนนักเรียนทั้งหมด 230 คนเปิดเรียน on site ตั้งแต่วันที่ 1 มิถุนายน 2564 โดยเปิดเป็นSand box safety zone เป็นความร่วมมือระหว่างโรงเรียนและกระทรวงสาธารณสุขปัจจุบันไม่มีรายงานการติดเชื้อในโรงเรียน กลุ่มเป้เป้าหมายในวันนี้มีจำนวนเด็กนักเรียนที่จะได้รับวัคซีน Pfizerจำนวน 78 คนเป็นกลุ่มแรกของโรงเรียน
โรงเรียนศรีสังวาลย์ขอนแก่น จัดการศึกษาสำหรับนักเรียนที่มีความบกพร่องทางร่างกายหรือการเคลื่อนไหว หรือสุขภาพ ตั้งแต่ชั้นประถมศึกษาปีที่ 1 ถึงชั้นมัธยมศึกษาปีที่ 6 ประเภทอยู่ประจำและไปกลับ นักเรียนส่วนใหญ่มาจากภาคตะวันออกเฉียงเหนือ และภูมิภาคต่างๆ ทั่วประเทศที่ไม่สามารถเข้าเรียนร่วมในโรงเรียนปกติได้
เรื่อง/ภาพ สสจ.ขอนแก่น
ประเพณีถือศีลกินผักจังหวัดภูเก็ต 6-14 ตุลาคม 2564 มาตรการเข้มพิธียกเสาโกเต๊ง
จังหวัดภูเก็ต จัดงานสืบสานประเพณีถือศีลกินผักจังหวัดภูเก็ต 6 - 14 ตุลาคม 2564 โดยปีนี้จัดงานภายใต้มาตรการ D-M-H-T-T-A การประกอบพิธีในปีนี้ทุกศาลเจ้าจะต้องปฏิบัติตามมาตรการป้องกันการแพร่ระบาดของโรค ซึ่งทางศาลเจ้าได้มีการตั้งจุดคัดกรอง ตรวจวัดอุณหภูมิ มีการเน้นย้ำเรื่องการเว้นระยะห่าง และการสวมใส่หน้ากากผ้า หรือหน้ากากอนามัย ทั้งนี้ ในส่วนของการประกอบพิธีนั้นมีเพียงองค์เล่าเอี๊ย ซึ่งเป็นองค์พระใหญ่ที่สุดประจำศาลเจ้า ประทับทรงเพียงองค์เดียว และไม่มีการแสดงปาฏิหาริย์ใดๆ [Phuketandamannews]
วันที่ 5 ตุลาคม 2564 ประกอบพิธี “ยกเสาโกเต้ง" มีการกำหนดข้อปฏิบัติไว้ดังนี้
1) ฉ้ายอิ้วที่จะเข้ามาร่วมประกอบพิธีกรรมยกเสาโกเต้ง จะต้องเป็นผู้ที่ได้รับการฉีดวัคซีนมาแล้วไม่น้อยกว่า 2 เข็ม หรือครบโดส และได้รับการตรวจด้วยชุดตรวจ ATK มาแล้วไม่เกิน 72 ชั่วโมงและผลเป็นลบ
2) ให้ผู้เข้าร่วมพิธีกรรมทุกคนสวมใส่หน้ากากอนามัยอย่างน้อย 2 ชั้น และสวมใส่ถุงมือในระหว่างประกอบพิธีกรรมตลอดเวลา
3) เมื่อยกเสาโกเต๊งเสร็จสิ้นแล้ว ให้ถอดถุงมือ แล้วทิ้งลงในถังแดงที่ได้เตรียมไว้ให้ แล้วล้างมือด้วยแอลกอฮอล์ก่อนแล้วจึงถอดหน้ากากอนามัยชั้นนอกทิ้งลงในถังแดงที่จัดเตรียมไว้ให้ แล้วล้างมือด้วยแอลกอฮอล์อีกคร้ังหนึ่ง
4) เมื่อเสร็จสิ้นพิธีกรรมแล้ว ให้ผู้ซึ่งไม่มีหน้าที่อื่นใดออกนอกบริเวณศาจเจ้าทันที
5) ปี 2564 นี้ เด็ก ผู้หญิงและผู้สูงอายุ งดร่วมพิธียกเสาโกเต๊ง
เอไอเอส AIS เปิดบริการลงทะเบียนรับวัคซีน อายุ 18 ปีขึ้นไป 2 กลุ่ม LINK
บริการลงทะเบียนรับวัคซีนโควิด-19 โดย เอไอเอส
จัดสรรโดย กรมการแพทย์ กระทรวงสาธารณสุข และกระทรวงคมนาคม
ข้อควรรู้ก่อนลงทะเบียนรับวัคซีน
เฉพาะผู้มีบัตรประชาชนไทย อายุ 18 ปีขึ้นไป 2 กลุ่ม
กลุ่ม 1 ยังไม่เคยรับวัคซีน:
ลงทะเบียนเพื่อรับสูตรไขว้ เข็ม 1 Sinovac + เข็ม 2 AstraZeneca
กลุ่ม 2 เคยรับ Sinovac ครบ 2 เข็มแล้ว ภายใน 31 ก.ค. 64 จากทุกศูนย์ฉีด:
ลงทะเบียนเพื่อรับ เข็ม 3 (เข็มกระตุ้น) AstraZeneca
รับวัคซีนที่ สถานีกลางบางซื่อ ตามวัน-เวลานัด
พัฒนาการของหมอชุมชน
"หมอชุมชน" เริ่มต้นเชิงวิชาการอย่างเป็นทางการ หลังจากที่ “หมอโรงพยาบาล” เข้มแข็ง
หลังจากที่ “วิทยาศาสตร์” เข้ามามีบทบาทสำคัญทางการแพทย์มีส่วนช่วยให้ “หมอตามบ้าน” สามารถค้นพบวิทยาการสมัยใหม่อย่างต่อเนื่อง พร้อมกับมีการ “ปฏิวัติการพยาบาล” ทำให้“โรงพยาบาล” ซึ่งเดิมมีไว้สำหรับคนจน คนไม่มีบ้าน และผู้อพยพ กลายเป็นสถานบริการสำหรับประชาชนทุกคน และเป็นศูนย์กลางของระบบบริการ มีผลให้แพทย์ถูกแบ่งออกเป็น 2 กลุ่มคือ แพทย์เวชปฏิบัติทั่วไป (จบแพทย์แต่ไม่เรียนต่อ เปิดคลินิกส่วนตัว ทำงานในชุมชน ลักษณะของการทำงานมีฐานที่มีพัฒนาการมาจากหมอตามบ้าน) และแพทย์เฉพาะทาง (จบแพทย์แล้วเรียนต่อเป็นแพทย์เฉพาะทาง และให้บริการอยู่ในโรงพยาบาล) ถึงแม้แพทย์เวชปฏิบัติทั่วไปที่ทำงานในชุมชน มีศักดิ์ศรีเชิงวิชาการน้อยกว่า แต่ด้วยฐานของความสัมพันธ์ที่พัฒนามาอย่างต่อเนื่องในลักษณะ “หมอกับคนไข้” ทำให้แพทย์เวชปฏิบัติทั่วไป (หมอชุมชน) ยังคงเป็นที่ศรัทธาและเป็นที่พึ่งหลักของประชาชน ทำให้ประเทศสหราชอาณาจักร (รวมทั้งประเทศในแถบตะวันตกโดยรวม) ไม่มีประสบการณ์ที่มีคนไข้แน่น OPD ของโรงพยาบาล
ปีค.ศ.1910–1960 การแพทย์เฉพาะทางในโรงพยาบาลเติบโตอย่างก้าวกระโดด
ในปี ค.ศ.1946 มีแพทย์เวชปฏิบัติทั่วไปชื่อ Micheal Balint8 ได้เริ่มทำการวิจัย โดยเรียกวิธีการวิจัยนี้ว่า “Research seminar” โดยรวมกลุ่มแพทย์เวชปฏิบัติทั่วไปที่ทำงานอยู่ในชุมชน นำ “กรณีที่น่าสนใจ” มานำเสนอในที่ประชุม เพื่ออภิปรายแลกเปลี่ยนประสบการณ์สัปดาห์ละครั้ง (ช่วงบ่ายของวันที่ว่าง) ต่อเนื่องกันเป็นเวลาประมาณ 3 ปี ผลของการวิจัยได้มีการนำเสนอเป็นกรณีศึกษา ที่ทำให้เห็นความจำเพาะเชิงวิชาการของการให้บริการในชุมชน ซึ่งมีความแตกต่างไปจากการให้บริการในโรงพยาบาล โดยเฉพาะอย่างยิ่งประเด็นทางด้าน จิตใจสังคม (Psycho-social) วิธีการนำเสนอผลการวิจัยทำได้อย่างน่าสนใจโดยแบ่งเป็น การวินิจฉัย เช่น ปัญหาทั่วไป
(General problems), คนไข้เสนอ หมอสนอง (The patient’s Offers and the Doctor’s Responses), ระดับของการวินิจฉัย (Level of diagnosis), การสมรู้ร่วมคิดที่จะปิดบัง (The collusion of Anonymity) และการรักษา เช่น ตัวหมอนั่นแหละแทนยา (Drug Doctor), การรักษาทางใจโดยที่ไม่ต้องใช้ยา (Psychotherapy), เริ่มต้นอย่างไร เมือไหร่ถึงจะหยุด (How to start, when to stop) เป็นต้น ผลงานชิ้นนี้ได้รับการตีพิมพ์ครั้งแรกในปีค.ศ.1954 เป็นจุดเปลี่ยนสำคัญที่ทำให้การทำงานในชุมชนมีความท้าทายเชิงวิชาการ และมีพัฒนาการมาอย่างต่อเนื่อง จนกระทั่งในที่สุดมีศักดิ์ศรีเชิงวิชาการที่ไม่ด้อยไปกว่าการให้บริการในโรงพยาบาล
2 บริการทุติยภูมิ (Secondary care)
2.1 NHS Trusts
NHS Trusts ที่เป็นโครงสร้างหลักที่สร้างขึ้นมารองรับการบริหารจัดการโรงพยาบาลให้มีความเป็นอิสระมากขึ้นมีอีกชื่อหนึ่งเรียกว่า Acute Trust เป็นโครงสร้างรองรับตั้งแต่มีนโยบาย Purchaser-provider split ในปี1990 ต่อมาในปีค.ศ. 1997 ได้มีการพัฒนากลไกทางการเงินใน NHS ขึ้นมาใหม่เรียกว่า Private Finance Initiative (PFI) โดยรัฐส่งเสริมให้สถาบันการเงินปล่อยกู้เพื่อการลงทุนให้กับสถานบริการที่อยู่ภายใน NHS โดยเฉพาะอย่างยิ่งโรงพยาบาล (NHS Trusts) โดยตรง โดยให้มีการใช้หนี้คืนให้กับสถาบันการเงินด้วยการผ่อนส่งในระยะยาว เพื่อส่งเสริมความอิสระทางด้านการลงทุนให้กับสถานบริการมากขึ้น
ปัจจุบันรายได้หลักของ NHS Trust มาจากการให้บริการด้วยการรับเงินผ่านการทำข้อตกลงกับ PCT และ Practice-basedcommissioners รัฐบาลมีเป้าหมายให้ NHS Trusts ทั้งหมดกลายเป็น Foundation Trusts (องค์กรอิสระ NHS) ในปี2008 ทั้งนี้รัฐบาลมีนโยบายที่จะพัฒนาบริการ ที่เดิมเคยอยู่ที่โรงพยาบาลไปสู่การจัดบริการใกล้บ้านหรือในชุมชนมากขึ้น
Foundation Trusts
Foundation Trusts เป็นโครงสร้างใหม่ที่พัฒนาขึ้นมารองรับ โครงสร้างเดิมภายใน NHS ให้มีอิสระเต็มที่ (Full autonomy) โดยที่ไม่ต้องอยู่ภายใต้การควบคุมในกรอบของ NHS โดยมี
วัตถุประสงค์ให้เป็นองค์กรที่ไม่หวังผลกำไร (Non-profit making organization) ที่จะเข้าไปมีส่วนร่วมบริหารระบบบริการในพื้นที่โดยที่ Secretary of State for Health ไม่มีอำนาจสั่งการ และไม่มีอำนาจในการแต่งตั้งคณะกรรมการ (Board members) ซึ่งคณะกรรมการมี2 ระดับคือ คณะกรรมการปกครอง (Board of Governor) ซึ่งมาจากการเลือกตั้งของสมาชิก (ประชาชนในพื้นที่) และกรรมการบริหาร (Board of Management) ซึ่งมีโครงสร้างในลักษณะเดียวกับคณะกรรมการบริหารของ Trust อื่นๆ โดยที่Board of Governor จะไม่เข้าดูในรายละเอียด แต่จะเป็นผู้ให้นโยบายและกำหนดยุทธศาสตร์ โดยมีIndependent regulator ซึ่งขึ้นตรงต่อรัฐสาภา (House of Parliament) ออกใบอนุญาตให้ Foundation Trust ทำหน้าที่ได้ตามกฎหมาย โครงสร้างที่ได้รับการคาดหมายให้เป็น Foundation trusts ทั้งหมดคือ NHS trusts
2.2 Ambulance Trusts
การให้บริการรถพยาบาลฉุกเฉินทั่วเกาะอังกฤษมีประมาณ 250,000 ครั้งต่อปีเดิมมี Ambulance Trusts ทั้งหมด 32 แห่ง ปัจจุบัน (ตั้งแต่ 2006) รวมตัวเชื่อมโยงกันเป็น 11 องค์กร การให้บริการรถพยาบาลฉุกเฉินมีมาตรฐานการให้บริการดังนี้
- กรณีฉุกเฉินที่มีผลต่อชีวิต (Life threatening: Category A) รถพยาบาลจะไปถึงภายใน 8 นาที
- กรณีฉุกเฉินที่ไม่อันตรายถึงชีวิต (Non-life threatening: Category B) รถพยาบาลจะไปถึงในเขตเมืองภายใน 14 นาทีส่วนเขตชนบทภายใน 19 นาที
- กรณีที่เรียกโดยแพทย์เวชปฏิบัติทั่วไป รถจะไปถึงโรงพยาบาลภายใน 15 นาทีหลังจากได้รับการดูแลจากแพทย์เวชปฏิบัติทั่วไป ทั้งนี้ขึ้นอยู่กับดุลยพินิจของแพทย์เวชปฏิบัติทั่วไป
- การบริการเพื่อละลายลิ่มเลือด (Thrombolysis: clot-busting drugs) บริการที่ไปกับรถพยาบาลจะไปถึงภายใน 60 นาที
ในปัจจุบันมีEmergency Care Practitioner ที่สามารถให้บริการกรณีฉุกฌฉินได้ถึงที่เกิดเหตุ ทำให้ลดอัตราการใช้บริการที่ห้องฉุกเฉิน (A&E department) และลดจำนวนการใช้รถพยาบาลอีกทั้งยังช่วยให้บริการร่วมกับแพทย์เวชปฏิบัติทั่วไป ในช่วงนอกเวลาได้อีกด้วย
2.3 Mental Health Trusts
สุขภาพจิตเป็นสิ่งที่รัฐบาลอังกฤษให้ความสำคัญ การให้บริการด้านสุขภาพจิตผสมผสานอยู่ในทั้งบริการปฐมภูมิ ทุติยภูมิและบริการเชิงสังคม ทั้งนี้ PCTs มีหน้าที่หลักในการเป็นนายหน้าจัดหาบริการด้านสุขภาพจิตเหล่านี้มาให้ประชาชน อย่างไรก็ตามรัฐบาลอังกฤษได้แยกศูนย์การให้บริการด้านสุขภาพจิตออกมาต่างหากเรียกว่า Mental Health Trusts ซึ่งมีทั้งหมด 39 แห่ง ซึ่งมีการให้บริการทั้งในโรงพยาบาล สนับสนุน และร่วมให้บริการกับทีมผู้ให้บริการปฐมภูมิในชุมชน
ไทยแลนด์พาส Thailand Pass
นักท่องเที่ยวสีเขียว Test and Go
รพ.เวิร์ลเมดิคอล ให้คำแนะนำการฉีดสูตรต่างๆ
รพ.เวิร์ลเมดิคอล ให้คำแนะนำการฉีดสูตรต่างๆ
* ข้อมูลอัพเดท ณ วันที่ 29 ตุลาคม 2564
เอกสารประกอบการลงทะเบียน
1. ชาวต่างชาติที่มีถิ่นพำนักในไทย (Expat) จำเป็นต้องมีเอกสารกรมธรรม์ประกันภัยที่มีวงเงินคุ้มครองไม่น้อยกว่า 50,000 ดอลลาร์สหรัฐ หรือไม่
- จำเป็น
- ชาวต่างชาติที่มีถิ่นพำนักหรือมีใบอนุญาตทำงานในไทยสามารถแสดงเอกสารกรมธรรม์ประกันภัยในไทยที่มีวงเงินคุ้มครองไม่น้อยกว่า 50,000 ดอลลาร์สหรัฐ หรือหลักฐานการประกันภัยอื่น ๆ อาทิ บัตรประกันสังคมหรือหนังสือรับรองการประกันภัยที่ออกโดยนายจ้าง
- ผู้มีสัญชาติไทยไม่จำเป็นต้องมีเอกสารกรมธรรม์ประกันภัยเพื่อลงทะเบียนใน Thailand Pass เนื่องจากได้รับรองการรักษาพยาบาลผ่านโครงการประกันสุขภาพถ้วนหน้าของไทยแล้ว
2. เอกสารกรมธรรม์ประกันภัยสำหรับยื่นประกอบการลงทะเบียนกับ Thailand Pass จำเป็นต้องเป็นประกันสุขภาพโควิด-19 หรือไม่
- ไม่จำเป็น โดยสามารถใช้กรมธรรม์ประกันภัยรูปแบบอื่น อาทิ ประกันทั่วไปหรือประกันสุขภาพที่มีวงเงินคุ้มครองไม่น้อยกว่า 50,000 ดอลลาร์สหรัฐ ได้
3. เอกสารที่ต้องใช้ประกอบการลงทะเบียนบน Thailand Pass?
- เอกสารที่จำเป็นจะแตกต่างกันตามรูปแบบการเดินทางเข้าประเทศไทย โดยมีรายละเอียด ดังนี้
** นอกจากนี้ ท่านจะต้องมีผลตรวจหาเชื้อโควิด-19 (RT-PCR) ที่ออกไม่เกิน 72 ชั่วโมงก่อนเวลาเดินทางเพื่อแสดงต่อเจ้าหน้าที่ด่านควบคุมโรคเมื่อเดินทางถึงประเทศไทย โดยข้อกำหนดนี้ยกเว้นสำหรับผู้มีสัญชาติไทยที่เดินทางเข้ารับการกักตัว ณ สถานกักกัน (Alternative Quarantine) ทั้งนี้ ผลตรวจหาเชื้อโควิด-19 (RT-PCR) จะต้องเป็นรูปแบบเอกสาร (hard copy) และเป็นภาษาไทยหรืออังกฤษเท่านั้น
4. หากไม่มีโทรศัพท์มือถือ จะสามารถแสดง Thailand Pass QR Code ต่อเจ้าหน้าที่ได้อย่างไร
- หากท่านไม่มีโทรศัพท์มือถือ ท่านสามารถพิมพ์ QR Code ออกมาเป็นเอกสารและนำมาแสดงต่อเจ้าหน้าที่ โดยท่านอาจลงทะเบียน Thailand Pass บนคอมพิวเตอร์เพื่อความสะดวกในการพิมพ์ QR Code ออกมาเป็นเอกสาร
5. สามารถใช้ผลตรวจหาเชื้อโควิด-19 รูปแบบอื่นนอกจาก RT-PCR เพื่อเดินทางเข้าประเทศไทยได้หรือไม่
- ไม่ได้ ผลตรวจหาเชื้อโควิด-19 จะต้องเป็นรูปแบบ RT-PCR เท่านั้น (ไม่ใช่ผลตรวจแบบ ATK) และผลตรวจดังกล่าวจะต้องออกภายใน 72 ชั่วโมงก่อนการเดินทาง
6. ชนิดวัคซีนที่ได้รับการยอมรับในประเทศไทยมีอะไรบ้าง
- วัคซีนที่ได้รับการยอมรับในประเทศไทยประกอบด้วย
- CoronaVac (Sinovac)
- AstraZeneca
- Pfizer-BioNTech
- Moderna
- COVILO (Sinopharm)
- Janssen (Johnson & Johnson)
- Sputnik V
7. ประเทศไทยยอมรับการฉีดวัคซีนสูตรไขว้หรือไม่
- ประเทศไทยยอมรับการฉีดวัคซีนสูตรไขว้ ทั้งนี้ ระยะเวลาที่ได้รับวัคซีนเข็มสองจะต้องเป็นไปตามระยะเวลาที่กำหนดของวัคซีนเข็มแรก ดังนี้
- เข็มแรก (Sinovac) = เว้นระยะ 2 สัปดาห์ ก่อนเข็มที่สอง
- เข็มแรก (AstraZeneca) = เว้นระยะ 4 สัปดาห์ ก่อนเข็มที่สอง
- เข็มแรก (Pfizer-BioNTech) = เว้นระยะ 3 สัปดาห์ ก่อนเข็มที่สอง
- เข็มแรก (Moderna) = เว้นระยะ 4 สัปดาห์ ก่อนเข็มที่สอง
- เข็มแรก (Sinopharm) = เว้นระยะ 3 สัปดาห์ ก่อนเข็มที่สอง
- เข็มแรก (Sputnik V) = เว้นระยะ 3 สัปดาห์ ก่อนเข็มที่สอง
* ผู้ได้รับวัคซีนครบถ้วนคือผู้ที่ได้รับวัคซีนเข็มที่สอง 14 วันก่อนเดินทาง
* ผู้ที่ได้รับการฉีดวัคซีน Janssen (Johnson&Johnson) จะถือว่าเป็นผู้ได้รับวัคซีนครบถ้วน หลังได้รับวัคซีนเข็มแรก 14 วัน
8. หากมีประวัติได้รับเชื้อโควิด-19 จะสามารถเดินทางไปประเทศไทยได้หรือไม่
- ได้ โดยหากมีประวัติได้รับเชื้อโควิด-19 จะต้องได้รับวัคซีน 1 เข็ม ภายในระยะเวลา 3 เดือนหลังจากหายป่วย โดยจะต้องแนบเอกสารรับรอง / ใบรับรองแพทย์ที่ยืนยันการหายป่วยจากโรคโควิด-19 มาพร้อมกับใบรับรองการฉีดวัคซีน 1 เข็มดังกล่าว ทั้งนี้ หากมีเอกสารรับรองการฉีดวัคซีนครบ 2 เข็ม ก่อนได้รับเชื้อโควิด-19 จะถือว่าเป็นผู้ได้รับวัคซีนครบตามเกณฑ์
อบจ.แพร่ ฉีดเข็มแรก 23 พ.ย. 64 LINK
อบจ.แพร่
ฉีดเข็มแรก 23 พ.ย. 64
อบจ.แพร่
ได้รับจัดสรร 20,000 โดส ฉีดเข็มแรก 23 พ.ย. 64 560 คน
19 พ.ย.64 ประกาศรายชื่อผู้ที่ได้รับการจัดสรรวัคซีนโมเดอร์นา 5 กลุ่มเป้าหมาย โดยรอบแรก 1,120 โดส/112 ขวด สำหรับ 560 คน กำหนดฉีดเข็มแรก วันที่ 23 พ.ย. 64 เวลา 9-12 น. เข็มที่สอง วันที่ 21 ธ.ค.64 ณ ศูนย์ฉีดวัคซีนกลางวิทยาลัยเทคนิคแพร่ ต.ในเวียง อ.เมือง แพร่
23 ก.ค. 64 อบจ.แพร่ ออกประกาศได้รับจัดสรร 20,000 โดส (10,000 คน)
ขั้นตอนการจอง โดยสังเขป
กดปุ่ม "International Certificate" แถวล่าง
บุคคลในภาพ: เภสัชกรหญิงศิริกุล เมธีวีรังสรรค์ (ที่สามจากซ้าย) รองผู้อำนวยการองค์การเภสัชกรรม พร้อมด้วย นายแพทย์ไพบูลย์ เอกแสงศรี (ขวาสุด) เลขาธิการสมาคมโรงพยาบาลเอกชน ร่วมเป็นสักขีพยานในการรับมอบวัคซีนโควิด-19 โมเดอร์น่า จำนวน 560,000 โด๊ส จากเภสัชกรหญิงสุนัยนา กิจเกษตรไพศาล (ที่สองจากซ้าย) ผู้จัดการทั่วไป แซดพี เทอราพิวติกส์ และนางสาวพักตร์นลิน บูลกุล (ซ้ายสุด) ประธานกรรมการบริหาร ซิลลิค ฟาร์มา ประเทศไทย ณ ท่าอากาศยานสุวรรณภูมิ โดยสายการบิน ลุฟท์ฮันซ่า เที่ยวบิน LH 772
เกี่ยวกับ แซดพี เทอราพิวติกส์
แซดพี เทอราพิวติกส์ เป็นพันธมิตรทางการค้าชั้นนำในอุตสาหกรรมบริการด้านการดูแลสุขภาพ มีสำนักงานอยู่ใน 13 ประเทศในเอเชีย และพนักงานกว่า 2,500 คน เรามุ่งหวังที่จะเร่งพัฒนาแนวทางการดูแลผู้ป่วย และผลลัพธ์ด้านสุขภาพ ผ่านความเป็นเลิศทางพาณิชย์ ศักยภาพในตลาดที่แข็งแกร่ง และจรรยาบรรณที่เข้มแข็ง ความมุ่งมั่นของเราคือการเพิ่มการเข้าถึงบริการสุขภาพให้มากขึ้น ขับเคลื่อนผ่านกระบวนการทำงานที่รวดเร็ว ยืดหยุ่น ถูกต้อง และความเป็นเลิศในทุกๆ สิ่งที่เราทำ
สมาคมผู้ดูแลผู้ป่วยสมองเสื่อม LINK
สมาคมผู้ดูแลผู้ป่วยสมองเสื่อม เป็นองค์กรที่ไม่แสวงหาผลกำไร และมีจุดประสงค์เพื่อให้ชุมชนได้ตระหนักถึงและมีความเข้าใจในโรคอัลไซเมอร์และสมองเสื่อมอื่นๆ เพื่อชวยเหลือและปรับปรุง ณภาพชีวิตของผู้ป่วยและครอบครัวให้ดีขึ้น
ในเว็บไซต์สมาคมมีข้อมูลเป็นประโยชน์ในหลายด้าน ได้แก่ ความรู้เรื่องโรค อาการ การวินิจฉัยและปัจจัยเสี่ยงต่างๆ เทคนิคการดูแลผู้ป่วย มีการแชร์ประสบการณ์มุมเรื่องเล่า
ติดต่อ สมาคมผู้ดูแลผู้ป่วยสมองเสื่อม ตู้ปณ. 224 ปณจ ราชดำเนิน เขตพระนคร กรุงเทพ 10200 โทร 086-990-4207 แฟกซ์ 02-201-2588
รพ.รวมแพทย์ชัยนาท จัดฉีด 9 พ.ย.64 LINK
รพ.รวมแพทย์ชัยนาท นำทีมโดยนายแพทย์สุเทพ วัตถุสินธุ์ได้ เริ่ม ให้บริการวัคซีน โมเดอร์นา เป็นวันแรก ให้กับผู้ที่จอง ผ่านทางโรงพยาบาลรวมแพทย์ชัยนาท วันที่ 9 พฤศจิกายน 2564
แอ่วยี่เป็งเชียงใหม่ ปีนี้ แอ่วผ่านออนไลน์ นะเจ้า LINK
แอ่วยี่เป็งเชียงใหม่ 64 ชมแสงศิลป์ประทีปเบิกฟ้า 13 จุด และ รถกระทงใหญ่ 7 จุดทั่วเมืองเชียงใหม่ จองผ่านทาง แอปพลิเคชัน "ยี่เป็งเชียงใหม่" เติมเต็มความสุข ทุกรอยยิ้ม เที่ยววิถีใหม่ แบบ New Normal โดย เทศบาลนครเชียงใหม่
เทศบาลนครเชียงใหม่ จัดงานลอยกระทง หรือประเพณียี่เป็งเชียงใหม่ ปี 64 ภายใต้แนวคิด “เชียงใหม่นครแห่งความสุข Chiangmai City of Happiness” ระหว่างวันที่ 19-20 พ.ย. 64 โดยปีนี้ได้ปรับเปลี่ยนรูปแบบการจัดงาน เน้นการถ่ายทอดสดทางออนไลน์ งาน “แสงศิลป์ประทีปเบิกฟ้า Yeepeng Lantern Festival” โคมล้านนานับหมื่นดวง ณ บริเวณ 5 ประตูเมือง 4 แจ่ง อาทิ ข่วงประตูท่าแพ, ลานอนุสาวรีย์สามกษัตริย์, สะพานเหล็ก, สะพานนวรัฐ, สะพานนครพิงค์ และไฮไลต์ของงานคือ โคมผัดล้านนาใหญ่ที่สุดในโลก ความสูง 7.25 เมตร เพื่อร่วมเฉลิมฉลองในโอกาสที่เมืองเชียงใหม่อายุครบ 725 ปี บริเวณข่วงประตูท่าแพ
ขณะเดียวกันการเรียนรู้และสร้างความเข้าใจที่ถูกต้องในการดูแลผู้ป่วยเบาหวาน ถือเป็นอีกหัวใจสำคัญที่จะช่วยลดภาวะโรคแทรกซ้อนได้
ศ. คลินิก นพ. วีระศักดิ์ ศรินนภากร นายแพทย์ทรงคุณวุฒิด้านอายุรศาสตร์ โรงพยาบาลราชวิถี และนายกสมาคมผู้ให้ความรู้โรคเบาหวาน กล่าวว่าด้วยจำนวนผู้ป่วยเบาหวานที่เพิ่มมากขึ้น ทำให้เกิดความไม่สมดุลระหว่างแพทย์ที่ดูแลรักษาและจำนวนผู้ป่วย อีกทั้งแพทย์ยังมีเวลาจำกัด ทำให้บางครั้งผู้ป่วยไม่เข้าใจโรคและไม่เข้าใจการใช้ยาฉีดอินซูลิน อาทิ ควรฉีดอย่างไร การปรับยาฉีด รวมถึงการแก้ไขปัญหาภาวะน้ำตาล เป็นต้น ซึ่งการจัดทำแพลตฟอร์มการเรียนรู้บนเว็บไซต์ www.t2dminsulin.com สำหรับผู้ป่วยเบาหวานชนิดที่ 2 ที่ต้องใช้อินซูลิน ที่ได้รับการสนับสนุนโดย บริษัท ซาโนฟี่-อเวนตีส (ประเทศไทย) จำกัด ได้เข้ามาเติมเต็มช่องว่างที่กล่าวข้างต้นและสร้างความรู้ความเข้าใจให้ผู้ป่วยได้รับข้อมูลความรู้ที่ถูกต้องเกี่ยวกับอินซูลิน และสามารถนำไปปรับใช้ดูแลตนเองได้
บรรยากาศลอยกระทง ม.เกษตร (PPTV) LINK
คนเยอะมาก! นศ.-ปชช. แห่ร่วมงานลอยกระทง2564 แน่น ม.เกษตรฯ เวลา 19.00 น. ประชาชนจำนวนมากเดินทางมาร่วมงานลอยกระทง 2564 ที่มหาวิทยาลัยเกษตรศาสตร์ บางเขน กันอย่างคึกคัก จนแน่นเต็มพื้นที่บริเวณรอบสระพระพิรุณ หลังจากรัฐบาลอนุญาตให้มีการจัดงานได้ แต่อยู่ภายใต้มาตรการการป้องกันของโรคโควิด-19 โดยทางมหาวิทยาลัยเกษตรศาสตร์ ได้จัดให้มีการตั้งจุดวัดอุณหภูมิ เจลแอลกอฮอล์ล้างมือที่บริเวณประตูทางเข้างาน และมีการแบ่งรอบจำนวนผู้เข้าร่วมงานเพื่อลดการแออัด (เมื่อวันที่ 19 พ.ย. 2564)
สถาบันประสาทวิทยา เปิดบริการฉีดวัคซีนสูตรใหม่ AZ+PZ ตั้งแต่ 15 พ.ย.
สถาบันประสาทวิทยา ประกาศ เปิดให้บริการฉีดวัคซีน COVID- 19 สำหรับประชาชนอายุมากกว่า 18 ปี ที่ไม่เคยได้รับการฉีดมาก่อน ด้วยวัคซีนสูตรใหม่ เข็ม 1 AZ+ เข็ม 2 PZ ไฟเซอร์ (ห่างกัน 1 เดือน) ตั้งแต่ 15 พ.ย. 64 ณ อาคารเฉลิมพระเกียรติ
ผู้สนใจสามารถลงทะเบียนผ่าน QR code
หมายเหตุ การกรอกข้อมูลเป็นเพียงการแจ้งความประสงค์เท่านั้น ท่านต้องได้รับการยืนยันจากระบบหมอพร้อม หรือเจ้าหน้าที่สถาบันประสาทวิทยาเท่านั้น
หลากหลายความเห็นและข้อเสนอ บ่งบอกทิศทางหลายอย่าง
โพสต์นี้ได้รับความสนใจและมีผู้ร่วมแสดงความคิดเห็น จำนวนกว่า 1000 ความเห็นแล้ว หากไล่เรียงดูความเห็นต่างๆ จะพบว่ามีความเห็นน่าสนใจมากมาย และหลายความเห็น สะท้อนปัญหา ออกมาอย่างตรงจุดนนท์พร้อม Pfizer Day Again!! LINK
นนท์พร้อม Pfizer Day Again!!
จัดฉีดวัคซีน Pfizer เข็ม 1 (เข็ม 2 เป็นวัคซีน Pfizer) สำหรับชาวไทยอายุตั้งแต่ 12 ปีขึ้นไป ที่ยังไม่เคยได้รับวัคซีนและไม่เคยมีประวัติติดเชื้อมาก่อน‼️
เปิดให้ลงทะเบียนตั้งแต่วันที่ 22 พ.ย. ถึงวันที่ 24 พ.ย. 64 ก่อนเวลา 17:00 น. (หรือจนกว่าวัคซีนจะหมด)
นนท์พร้อม.com
ฉีดวัคซีนวันที่ 25 (6,000 คน), วันที่ 26 (6,000 คน) และวันที่ 27 พ.ย. 2564 (7,000 คน) ที่ ศูนย์กีฬากำธน สินธวานนท์ การไฟฟ้าฝ่ายผลิตแห่งประเทศไทย (บางกรวย)
‼️ เป็นการยืนยันนัด แบบทราบวันนัด และสนามฉีดชัดเจนแล้ว ถือเป็นการยืนยันนัดทันที (ไม่มีการแจ้ง SMS) ในใบนัดจะแสดงสถานที่นัด วันและเวลานัดหมายชัดเจน ขอให้ไปตามเวลานัดหมาย เพื่อเป็นไปตามมาตรการ Social Distancing
ข้อมูลเพิ่มเติมน่าสนใจ LINK
- ศูนย์ฉีดอื่นๆ เช่น เอเชียทีค แฟชั่น จะได้ฉีดเป็นไฟเซอร์ ตั้งแต่พรุ่งนี้ (26 พ.ย.) เป็นต้นไป เช่นกัน
- คนที่จองไว้ก่อนหน้า น่าจะได้รับการเปลี่ยนให้ได้รับเข็ม 1 เป็นไฟเซอร์หรือโมเดอร์นาได้เลย
- ประชาชนทั่วประเทศจองได้ แต่เมื่อกำหนดฉีดต้องมาฉีดที่ศูนย์บางซื่อ
- สูตรนี้เหมาะพอดีกับคนที่ฉีดซิโนแวค ซิโนฟาร์ม ครบ 2 เข็มไปก่อนหน้าแล้ว และรอบู๊สเตอร์เข็ม 3 อยู่
- คนฉีดแอสตร้าไปครบ 2 เข็ม ยังไม่ต้องบู๊สเข็ม 3 ควรรอเวลา
- ผู้ที่ลงทะเบียนไว้ก่อนหน้าที่ระบุได้สูตร แอสตร้า+ไฟเซอร์ น่าจะได้รับการปรับสูตรเป็นไฟเซอร์หรือโมเดอร์นาในเข็มแรกได้ (โปรดตรวจสอบกับศูนย์ฉีดอีกครั้ง)
-
ความเห็นเบื้องต้นจาก WHO LINK
ดร.มาเรีย แวน เคิร์คโฮฟ แห่ง WHO กล่าวว่า "เราได้รับรายงานถึง ไวรัสกลายพันธุ์ B.1.1.529 จากเครือข่ายในแอฟริกา ขณะนี้ยังไม่มีข้อมูลเกี่ยวกับไวรัสตัวนี้มากนัก รู้เพียงคร่าวๆ ว่ามันมีการกลายพันธุ์ในหลายจุด ต้องใช้เวลาเพื่อดูว่าพฤติกรรมการกลายพันธุ์เป็นอย่างไร มีผลต่อการก่อโรค การบำบัดรักษาและผลต่อวัคซีนอย่างไร เป็นเรื่องดีที่มีมีการตรวจพบ เพื่อที่เราจะได้ศึกษา อาจต้องใช้เวลาร่วมสัปดาห์กว่าจะทราบถึงผลกระทบที่จะมี นักวิจัยกำลังศึกษาเพื่อให้มีผลสรุปสุดท้ายว่าจะเรานิยามว่าเป็นไวรัสที่ต้องเฝ้าระวัง หรือเป็นระดับที่ต้องกังวล รวมถึงระบุชื่อตามภาษากรีกให้มันด้วย จุดสำคัญที่นักวิจัยต้องการรู้คือไวรัสนี้มีความสามารถจะแพร่กระจายมากน้อยเพียงใด โอกาสแพร่ระบาดจะมีแค่ไหน การกลายพันธุ์จะมีต่อไปอีกหรือไม่ เหล่านี้คือสิ่งที่เรากำลังจับตา" พร้อมกับทิ้งท้ายว่าทุกคนมีส่วนที่จะช่วยให้ไวรัสหยุดการแพร่กระจายหรือกลายพันธุ์ได้ ด้วยการฉีดวัคซีน ป้องกันตนเอง เพื่อลดโอกาสรับและแพร่กระจายเชื้อให้ผู้อื่น
พบผู้ติดเชื้อ ในเบลเยี่ยม รายแรกยุโรป
พบผู้ติดเชื้อไวรัสออมิครอน ในเบลเยี่ยม รายแรกยุโรป
บรัสเซลส์ 26 พ.ย.64 ประเทศเบลเยี่ยมรายงานยืนยันผู้ติดเชื้อไวรัสตัวใหม่ "ออมิครอน" 1 ราย เมื่อวันศุกร์ 25 พ.ย. ที่ผ่านมา ตามประกาศของนาย แฟรงค์ แวนเดนบรุ๊คเค่ รัฐมนตรีสาธารณสุขเบลเยี่ยม "ผู้ป่วยไม่ได้ฉีดวัคซีน" เริ่มมีอาการและมีผลตรวจเป็นบวกตั้งแต่ 22 พ.ย. ผู้ป่วยเป็นหญิงวัยกลางคน เริ่มมีอาการในวันที่ 11 หลังจากเดินทางกลับจากอียิปต์ ผ่านทางตุรกี อาการคล้ายหวัดแต่ไม่มีอาการรุนแรงอื่นใด สมาชิกคนอื่นๆในครอบครัวก็ไม่มีอาการ แต่ขณะนี้กำลังรอผลตรวจเพิ่มเติม
รัฐบาลเบลเยี่ยม โดยนายกรัฐมนตรี อเล็กซานเดอร์ เดอ ครู ประกาศมาตรการปิดบาร์และร้านอาหารในทันที กำหนดให้ปิดเวลา 5 ทุ่มเป็นเวลา 3 สัปดาห์ มีผลตั้งแต่เสาร์ที่ 27 พ.ย.นี้เป็นต้นไป พร้อมกับกำหนดจำนวนผู้รับบริการในร้านไม่เกิน 6 คนต่อโต๊ะ
"ถ้าหากประเทศของเราไม่มีผู้ที่ฉีดวัคซีนในอัตราที่สูงแบบวันนี้ สถานการณ์เราจะแย่มากๆ แน่นอน"
มาตรการนี้ยังรวมการห้ามจัดงานไพรเวทปาร์ตี้ และกิจกรรมรวมกลุ่มต่างๆ ด้วยทั้งงานแต่งงาน งานพิธีศพ ส่วนการช็อปปิ้งทำเท่าที่จำเป็น
เบลเยี่ยม เป็นประเทศที่ยังคงมาตรการให้ประชาชนสวมหน้ากากอนามัยและทำงานที่บ้านอยู่
การฝังยาคุมกำเนิดในวัยรุ่น ดีจริงหรือ? LINK
ปัจจุบันการคุมกำเนิดทำได้หลายวิธี ไม่ว่าจะเป็นการใส่ถุงยางอนามัย การกินยาคุม การฉีดยาคุม การใช้ห่วงอนามัย และการฝังยาคุม ซึ่งวิธีเหล่านี้สามารถคุมกำเนิดได้ แต่ก็ไม่มีวิธีไหนที่สามารถคุมได้ถึง 100% นอกจากการไม่มีเพศสัมพันธ์เมื่อไม่พร้อม
แต่อย่างไรก็ตาม การคุมกำเนิดที่ดีที่สุดก็มีเช่นเดียวกัน นั้นก็คือ "การฝังยาคุมกำเนิด" สามารถคุมกำเนิดได้ถึง 99.95% หรือมีโอกาสท้องเพียง 0.05% เท่านั้น ซึ่งวิธีนี้สามารถคุมกำเนิดได้นานถึง 3-5 ปี แล้วแต่ชนิดตัวยา ที่สำคัญผลข้างเคียงน้อย และปลอดภัย
การฝังยาคุมช่วยคุมกำเนิดได้ แต่ไม่สามารถป้องกันโรคติดต่อจากเพศสัมพันธ์ได้
ประชาสัมพันธ์ สำหรับสาวๆ อายุ 10 – 20 ปี สามารถขอการรับฝังยาคุมกำเนิดได้ฟรี! ที่โรงพยาบาลรัฐทั่วประเทศ
"WHO" เองก็สนับสนุนให้ปรับวิกฤตให้เป็นโอกาส โดยให้สังเกตุผลลบที่ขาดหายไปบางตำแหน่ง เช่นบนยีน S ที่สร้างโปรตีนส่วนหนาม (S dropout หรือ S gene target failure) หากพบว่าขาดหายไปตรวจไม่พบ ให้สงสัยว่าอาจเป็นสายพันธุ์ "โอไมครอน" (ภาพ บน) จากนั้นให้ส่งตัวอย่างดังกล่าวไปถอดรหัสพันธุกรรมเพื่อยืนยันสายพันธุ์ต่อไป
อบจ.นนทบุรี ประกาศแจ้งนัดหมายวัน-เวลา
ประกาศแจ้งนัดหมายวัน-เวลา ฉีดวัคซีนโมเดอร์นา
สำหรับท่านที่ลงทะเบียนรับวัคซีนโมเดอร์นากับองค์การบริหารส่วนจังหวัดนนทบุรี รอบที่1,2,3
เข็มที่ 1 และเข็มที่ 3 (บูสเตอร์) และขึ้นสิทธิ์รอรับการนัดหมาย
ขอแจ้งให้ผู้ที่ได้รับสิทธิ์ มารับการฉีดวัคซีน
ในวันที่ 2 ธันวาคม 2564 เวลา 13.00-16.00 น.
ณ สนามฉีดเซ็นทรัลพลาซาเวสต์เกต
เจ้าฟ้าชายชาร์ลส์
24 มีนาคม สำนักพระราชวังอังกฤษ แถลงการว่า เจ้าชายชาลส์ เจ้าชายแห่งเวลส์ รัชทายาทแห่งราชบัลลังก์อังกฤษ วัย 73 พรรษา ทรงมีผลตรวจโควิดเป็นบวก และได้แยกกักตัวอยู่ในสก๊อตแลนด์ ส่วนนางคามิลลา ปาร์เกอร์ ดัชเชสแห่งคอร์นวอล มีผลตรวจเป็นลบ
ตัวเลขผู้ติดเชื้อโอมิครอนในแอฟริกาใต้เพิ่มรวดเร็วเป็นเท่าตัว
สำนักข่าว WION ของอินเดีย แสดงตัวเลขผู้ติดเชื้อโอมิครอนในแอฟริกาใต้ ในรอบสัปดาห์ เห็นได้ชัดถึงความชัดของกราฟที่หมายถึงจำนวนผู้ติดเชื้อที่เพิ่มขึ้นอย่างรวดเร็วมาก จาก 868 รายในวันที่ 23 พ.ย. เพิ่มขึ้น 3 เท่ามาเป็น 2,465 รายภายใน 2 วัน (25 พ.ย.) ทะลุไปเป็น 8,531 รายในวันที่ 1 ธ.ค. ประมาณ 4 เท่าใน 5 วัน และล่าสุดวันที่ 2 ธ.ค. จำนวนติดเชื้อ 11,535 ราย คิดเป็นราว 25% ของวันที่ 1 ธ.ค.
ศูนย์อนามัยที่ 10 อุบลราชธานี บริการตรวจโควิด PCR-ATK LINK
โรงพยาบาลศูนย์อนามัยที่ 10 อุบลราชธานี ให้บริการตรวจหาเชื้อ COVID-19 แบบ ATK Drive Thru และ RT-PCR
เวลาเปิดให้บริการ 2 รอบ 09.00-11.00น. และ 13.00-15.00น.
จันทร์ - ศุกร์/งดให้บริการวันหยุดนักขัตฤกษ์
รวดเร็ว ถูกต้อง ปลอดภัย
Rapid Antigen Test Kit
ตรวจแบบ(Swab) การตรวจด้วยเทคนิค Fluorescent Immunoassay (FIA)
ทราบผลตรวจภายใน 1 ชม.
ราคา 600 บาท
Real-time RT-PCR
ตรวจแบบ(Swab) การตรวจด้วยเทคนิคหลักการ Real time-PCR(RT-PCR)
ทราบผลตรวจภายใน 48-72 ชม.
ราคา 2,200 บาท
หมายเหตุ : ได้ใบรับรองผลการตรวจจากห้องปฏิบัติการ
กรุณานัดหมายล่วงหน้า ผ่านระบบมือถือและแอปพลิเคชั่นไลน์
กรุณาชำระเงินล่วงหน้า ผ่านช่องทางการโอนก่อนเข้ารับบริการ
กรณีต้องการเลื่อนนัด กรณาแจ้งล่วงหน้า 1 ชั่วโมง ก่อนเวลานัดหมาย
(ราคานี้ ตั้งแต่วันนี้-ธันวาคม 2564 โรงพยาบาลขอสงวนสิทธิ์การเปลี่ยนแปลงราคา โดยไม่แจ้งให้ทราบล่วงหน้า) สอบถามโทร 088-5818704 / 095-6363526
บริการตรวจโควิด-19 ณ โรงพยาบาลบุรีรัมย์ LINK
การรับบริการตรวจโควิด-19 ณ โรงพยาบาลบุรีรัมย์
1. สำหรับเดินทางข้ามจังหวัด
ทุกวันจันทร์ - อาทิตย์ เวลา 08.00 - 16.00 น.
ณ ด้านหน้าอาคารเฉลิมพระเกียรติฯ เข้าประตู 2 อยู่ซ้ายมือค่ะ
1) ตรวจด้วยวิธี Rapid Antigen Test
ค่าบริการ 600 บาทค่ะ รอผลประมาณ 2-3 ช.ม.
2) ตรวจด้วยวิธี RT - PCR
ค่าบริการ 2, 000 บาท รอผลประมาณ 24 ชม.
หรือติดต่อทางโทรศัพท์ 044615002 ต่อ 4346 (08.00-16.00 น.)
2. สำหรับเดินทางไปไปต่างประเทศ ( เอกสาร Fit to fly)
ตรวจด้วยวิธี RT - PCR รับผลตรวจในวันถัดไป
เปิดตรวจทุกวันจันทร์ - อาทิตย์
เวลา 08.00-16.00 น.
ณ ศูนย์ตรวจสุขภาพ อาคารจอดรถ ชั้น 1
ราคาค่าบริการ คนไทย 2,050 บ. ,ต่างชาติ 3,050 บ.
โทร 044611660 และ 044615002 ต่อ 3626
K Motor ศูนย์บริการโตโยต้าเค.มอเตอร์ส ทุกสาขา - รายการตรวจเช็กฟรี 24 รายการ พร้อมทำความสะอาดฆ่าเชื้อฟรี LINK
รายการตรวจเช็กฟรี 24 รายการ พร้อมทำความสะอาดฆ่าเชื้อฟรี
- แบตเตอรี่/ระดับน้ำกลั่น
- ระดับน้ำมันเกียร์
- สภาพยางรถยนต์
- ระบบฟรีแป้นเหยียบ/คลัตช์/เบรกมือ
- ที่ปัดน้ำฝน/น้ำยาล้างกระจก
- ยางกันฝุ่นเพลาขับ
- ระดับน้ำมันเครื่อง
- โช้คอัพหน้าหลัง
- ระดับน้ำในถังสำรอง/ระดับน้ำยาหล่อเย็น
- ลูกหมากปีกนก
- ระดับน้ำมันเบรก
- ลูกปืนล้อ
- ระดับน้ำมันพาวเวอร์
- ระบบเครื่องปรับอากาศ พัดลม และน้ำยา
- ไส้กรองอากาศเครื่องยนต์
- รอยรั่วและความผิดปกติของเครื่องยนต์
- ตรวจเสียงเครื่องยนต์ขณะสตาร์ท
- รอยรั่วและความผิดปกติของเกียร์
- สายพานต่างๆ
- รอยรั่วและความผิดปกติของหม้อน้ำ
- ระบบไฟส่องสว่าง/แตร
- รอยรั่วและความผิดปกติของท่อทางน้ำ
- เข็มขัดนิรภัย
- รอยรั่วและความผิตปกติของพวงมาลัยพาวเวอร์
- ระดับน้ำมันเฟืองท้าย (เพิ่มเติมเฉพาะรถที่มีอุปกรณ์ดังกล่าว)
- ระดับน้ำมันทรานเฟอร์ (เพิ่มเติมเฉพาะรถที่มีอุปกรณ์ดังกล่าว)
เช็กรถฟรี 24 รายการ มั่นใจ ปลอดภัยทุกการเดินทาง ที่ศูนย์บริการโตโยต้า เค.มอเตอร์ส ทุกสาขา… เช็กตรงจุด โตโยต้า เค.มอเตอร์ส อำนวยความสะดวก เพิ่มความปลอดภัยบนท้องถนน ในช่วงหยุดยาว ให้บริการเช็กรถฟรี 24 รายการ มั่นใจ ปลอดภัยทุกการเดินทาง ที่ศูนย์บริการโตโยต้า เค.มอเตอร์ส ทุกสาขา 1-31 ธ.ค. 64 นัดหมายล่วงหน้าโทร 02-662-6555 และ www.facebook.com/toyotakmotors
เพื่อสังเกตตัวเอง! อาการโควิด
#โอไมครอน หลัง สธ.แถลงพบผู้ติดเชื้อคนแรกในไทยแล้ว
▪ ปัจจุบันผู้ติดเชื้อในต่างประเทศส่วนใหญ่ไม่ต้องเข้ารักษาที่โรงพยาบาล และยังไม่มีรายงานผู้ติดเชื้อโอไมครอนเสียชีวิต
? พวกเราต้องช่วยกันยกระดับ! มาตรการป้องกัน #COVID19
✔ ฉีดวัคซีนโควิดให้ครอบคลุมมากที่สุด
✔ สวมหน้ากาก หมั่นล้างมือ เข้มงวดการเว้นระยะห่าง หลีกเลี่ยงการอยู่รวมกัน
โรคอัลไซเมอร์ คือ ภาวะสมองเสื่อมประเภทหนึ่งที่พบบ่อยที่สุด เกิดจากความบกพร่องของสมรรถภาพของสมอง ทําให้ความสามารถทางการรับรู้และเข้าใจลดลง เกิดความบกพร่องทางด้านความจํา ภาษา สมาธิ มักพบในผู้สูงอายุ ผู้มีโรคประจําตัวต่างๆ ??
น้องมังคุดมีวิธีป้องกันอัลไซเมอร์ที่สามารถลดความเสี่ยงได้ด้วยตนเองเพื่อช่วยให้อาการของผู้ป่วยทุเลาลงหรือประคับประคองไม่ให้อาการแย่ลง รวมถึงมีคุณภาพชีวิตที่ดีขึ้นและสามารถช่วยเหลือตัวเองได้ค่ะ
มาตรการความปลอดภัยช่วงปีใหม่ ที่ศบค.ขอความร่วมมือ
ระบบ e-service ประกันสังคม LINK
e-service บริการอิเล็กทรอนิกส์ บริการสำหรับสถานประกอบการ
สำนักงานประกันสังคมได้เปิดให้บริการอิเล็กทรอนิกส์ เพื่ออำนวยความสะดวกสำหรับสถานประกอบการและบุคคลทั่วไป ในการลดการเดินทางมาติดต่อยังสำนักงานประกันสังคม ผู้เข้าใช้บริการ กรุณาทำการล๊อกอินเข้าสู่ระบบ หากท่านยังไม่มีชื่อผู้ใช้งานและรหัสผ่าน กรุณาลงทะเบียนขอทำธุรกรรมผ่านอินเตอร์เน็ตเพื่อเข้าใช้งานระบบ คลิกที่นี่เพื่อดาวน์โหลดคู่มือการใช้งาน E-services
หากพบปัญหาการใช้งานระบบ หรือสอบถามวิธีการทำธุรกรรม ติดต่อได้ที่เบอร์โทร. 0 2956 2400 หรือที่ e-Mail: helpdesk@sso.go.th
e-service บริการสำหรับสถานประกอบการ
- ขอทำธุรกรรมผ่านอินเตอร์เน็ต
- ทะเบียนผู้ประกันตน
- ส่งข้อมูลเงินสมทบ
- สอบถามข้อมูล
- ตรวจสอบสถานะในการทำธุรกรรม
- ข้อมูลผู้ใช้
- เปลี่ยนแปลงสิทธิ์ในการทำธุรกรรม
- แจ้งลูกจ้างหยุดงานชั่วคราว
- แจ้งผู้ประกันตนหยุดงานชั่วคราว (ว่างงานสุดวิสัย)
- ขอหนังสือรับรอง (โครงการสินเชื่อฯ)
- แบบสำรวจลงทะเบียนฉีดวัคซีน
- ยื่นความประสงค์ขอรับเงินเยียวยา
ประกาศจังหวัดเชียงใหม่ สูตรวัคซีนล่าสุด
133 โรงพยาบาลที่มีหน่วยตรวจตา (Refraction unit) ปี 2565
กลุ่มหญิงตั้งครรภ์และหลังคลอด
กลุ่มหญิงตั้งครรภ์และหลังคลอด มีสิทธิประโยชน์บริการรับดังนี้ ทดสอบการตั้งครรภ์ ตรวจครรภ์และประเมินความเสี่ยง ตรวจครรภ์ด้วยอัลตร้าซาวด์ ตรวจเลือดคัดกรองภาวะโลหิตจาง ซิฟิลิส เอชไอวี ตับอักเสบบี ธาลัสซีเมียและดาวน์ ตรวจปัสสาวะ ฉีดวัคซีนคอตีบ บาดทะยักและวัคซีนไข้หวัดใหญ่ ให้ยาบำรุงเสริมธาตุเหล็ก โฟลิกและไอโอดีน การให้ยาต้านไวรัสเอชไอวีเพื่อป้องกันการติดเชื้อจากแม่สู่ลูก ตรวจช่องปากและฟัน ขัดและทำความสะอาดฟันรวมถึงการขูดหินน้ำลาย ประเมินสุขภาพจิต ตรวจหลังคลอดและคุมกำเนิด ส่งเสริมการเลี้ยงลูกด้วยนมแม่ และสมุดบันทึกสุขภาพ และในปีนี้ได้เพิ่มเติมสิทธิประโยชน์การตรวจคัดกรองซิฟิลิสและธาลัสซีเมียในสามีหรือคู่ของหญิงตั้งครรภ์
เครื่องช่วยหายใจ อัตราการไหลสูง Chula High Flow Nasal Cannula
Zone : 0 ลงทะเบียนสุขภาวัฒนะ
เริ่มต้นที่โซนลงทะเบียน จะทำการลงทะเบียนโดยกรอกข้อมูลของผู้เข้าชมงานด้วย iPad อย่างสะดวกสบาย และก่อนที่จะเข้าไปชมงานด้านใน จะมีการแจกสูจิบัตรของงานที่มีแผนที่นิทรรศการให้ทุกคนเดินตามได้อีกด้วย
1. วัคซีน Novavax ทำงานอย่างไร ใช้เทคโนโลยีใด?
มักจะมีการอ้างอิงกันถึงวัคซีนของ Novavax ที่ชื่อ Nuvaxovid กันบ่อยครั้งว่า เป็นวัคซีนเนื้อตายแบบที่รู้จักกัน ซึ่งจริงๆแล้ว จริงที่ Novavax อยู่ในกลุ่มวัคซีนเชื้อตาย แต่ในทางกลับกัน Novavax กลับไม่ได้ใช้เทคโนโลยีดั้งเดิมแบบที่เชื่อกัน ซึ่งแม้แต่บริษัท Novavax เองก็ยังพูดถึงวัคซีนของตนว่า "เป็นเทคโนโลยีอนุภาคนาโนรีคอมบิแนนท์ที่เป็นกรรมสิทธิ์นวัตกรรมของบริษัทเท่านั้น" โดยวัคซีนนี้จะถูกผลิตขึ้นในการเพาะเลี้ยงเซลล์แมลง และผลท้ายที่สุด ก็คือ สไปค์โปรตีนถึง 14 ชนิดจาก Sars-CoV-2 ที่เชื่อมต่อกันผ่านฐานเชื่อมต่อ
จากรูปภาพของบริษัท Novavax เองแสดงให้เห็นว่าเป็นอนุภาคนาโนทรงกลม ซึ่งสำหรับระบบภูมิคุ้มกันนั้น โครงสร้างนี้ก็จะมีหน้าตาคล้ายกับไวรัส จึงเรียกอนุภาพนี้ว่า "อนุภาคคล้ายไวรัส / virus-like particle" นอกจากนี้ผู้ผลิตยังจำเป็นต้องใส่สารเสริมประสิทธิภาพที่เรียกว่า adjuvants เพื่อกระตุ้นภูมิคุ้มกันให้แข็งแรงขึ้น และเมื่อฉีดเข้าไปแล้ว ร่างกายเราก็จะตรวจเจอโปรตีนนี้และ “คิดว่า” เป็นสิ่งแปลกปลอม ซึ่งก็จะส่งผลให้ระบบภูมิคุ้มกันของร่างกายถูกกระตุ้น แอนติบอดีจำเพาะและทีเซลล์จะถูกสร้างขึ้น ซึ่งหมายความว่า ร่างกายก็จะรู้จัก และพร้อมรับมือการติดเชื้อจริงได้ดีขึ้น ซึ่งก็จะต่างจากวัคซีน mRNA ที่ใช้พิมพ์เขียวสารพันธุกรรมเพื่อไปกระตุ้นร่างกายให้ผลิตสไปค์โปรตีนด้วยตัวเองเพื่อกระตุ้นการตอบสนองทางภูมิคุ้มกัน
เป็นการสะท้อนได้อย่างดีว่า สิ่งที่เกิดขึ้นนี้ไม่ได้เป็นเพียงกระแสชั่วคราวที่มาไวไปไว แต่กำลังจะกลายเป็นหนึ่งในไลฟ์สไตล์ของผู้บริโภคที่จะเปลี่ยนไปและกระจายวงกว้างมากขึ้น แต่ก่อน
จะชี้ให้เห็นว่า ผู้ประกอบการเอสเอ็มอีจะคว้าโอกาสจากอาหารแห่งอนาคตนี้ได้อย่างไรมาเริ่มต้นทำความรู้จักกับ Plant-based Food ให้มากขึ้นก่อน
Plant-based Food หรือ ผลิตภัณฑ์อาหารจากพืช เป็นอาหารกลุ่มโปรตีนทางเลือก (Alternative Protein) ที่ใช้วัตถุดิบจากพืชที่ให้โปรตีนสูง เช่น ถั่ว เห็ด สาหร่าย ข้าวโอ๊ต อัลมอนด์ โดยมีการพัฒนารสชาติ กลิ่น และสีสัน ให้เหมือนผลิตภัณฑ์จากสัตว์ เพื่อเป็นทางเลือกให้กับผู้บริโภคที่ไม่อยากรับประทานเนื้อ เรียกได้ว่า ด้วยนวัตกรรมด้านวิทยาศาสตร์การอาหารที่ก้าวหน้าไปอย่างมาก จึงทำให้รูปแบบของ Plant-based Food ในปัจจุบันมีความหลากหลายมากขึ้น
ทั้งนี้ หากจะให้แบ่งประเภทของ Plant-based Food จะพบว่า มีที่ได้รับความนิยมและมีโอกาสทางการตลาดอยู่ 4 กลุ่ม ได้แก่
Plant-based Meat
เนื้อสัตว์จากพืช ทำมาจากพืชประมาณ95 เปอร์เซ็นต์ และมีส่วนผสมอื่นที่ไม่ใช่พืชประมาณ 5 เปอร์เซ็นต์ โดยมีผลิตออกมาในรูปแบบต่างๆ เช่น เนื้อเบอร์เกอร์ ไส้กรอก หรือจะเป็น
เนื้อหมูจากพืช รวมถึงอาหารทะเลก็มีด้วย
Plant-based Milk & Dairy
นมและผลิตภัณฑ์จากนม ทำจากถั่วหรือธัญพืชต่างๆ เช่น นมมะพร้าว นมถั่วเหลืองนมอัลมอนด์ นมข้าวโพด รวมถึง โยเกิร์ตนมจากพืช ชีสจากพืช และไอศกรีมจากพืช เป็นต้น
Plant-based Meal
อาหารปรุงสำเร็จจากพืช ทั้งในรูปแบบอาหารแช่เย็น อาหารแช่แข็ง รวมถึงอาหารที่เก็บได้ที่อุณหภูมิห้องโดยไม่ต้องแช่เย็น
Plant-based Egg
ไข่จากพืช ทำจากถั่วเขียวเป็นส่วนประกอบหลักเพื่อสร้าง Texture ก่อนผ่านกระบวนการต่างๆ รวมถึงการแต่งสีและกลิ่นให้เหมือนไขตอบโจทย์กลุ่มคนดูแลสุขภาพและผู้บริโภคที่แพ้ผลิตภัณฑ์จากไข่
ต้อนรับด้วยนวัตกรรม Innovation
ต้อนรับทุกท่านด้วย นวัตกรรม Innovation ที่จะได้เห็นถึงพัฒนาการของผลิตภัณฑ์กัญชา กัญชง กระท่อม ที่น่าตื่นตะลึง
เครื่องสำอางค์ ผลิตภัณฑ์สมุนไพร กัญชา กัญชง
ผลิตภัณฑ์กัญชาจากรพ.ห้วยเกิ้ง อุดรธานี น้ำมันนวดกัญชา ยาดมกัญชา สบู่กัญชา บาล์มกัญชา
Amazing Thailand Countdown 2022 ริเวอร์ พาร์ค ไอคอนสยาม
31 ธ.ค. 64 ณ ริเวอร์ พาร์ค ไอคอนสยาม
งานใหญ่ประจำปีของไอค่อนสยาม ที่กลายเป็นสปอตไลท์ไปทั่วโลกเช่นกัน และงานส่งท้ายปีปีนี้ ไอค่อนจัดยิ่งใหญ่ "Amazing Thailand Countdown 2022" ร่วมกับ การท่องเที่ยวแห่งประเทศไทย, กรุงเทพมหานคร, กรมเจ้าท่า, สภาหอการค้าไทย, ไอคอนสยาม และพันธมิตรสมาคมการค้าธุรกิจในแม่น้ำเจ้าพระยาและชุมชน ผนึกกำลังส่งความสุข เติมรอยยิ้ม และส่งกำลังใจให้กับคนไทยในงาน "Amazing Thailand Countdown 2022" มหัศจรรย์แลนด์มาร์กงานเคาท์ดาวน์ระดับโลกหนึ่งเดียวในประเทศไทย ภายใต้แนวคิด “Win the World for Thailand” อัตลักษณ์ไทยชนะใจคนทั้งโลก ตระการตากับ Multimedia Fireworks การแสดงพลุข้าวเหนียวรักษ์โลก ผสมผสานแสง สี เสียง และเพลงบรรเลง ความยาวกว่า 1,400 เมตร ตลอดแนวโค้งน้ำเจ้าพระยาที่สวยที่สุด พร้อมมหกรรมความบันเทิงจากกองทัพศิลปินชื่อดังเต็มอิ่มทุกพื้นที่ ภายใต้มาตรการความปลอดภัยขั้นสูงสุดระดับ SHA Plus ตามที่ภาครัฐกำหนด
รายที่ 10118 เป็นหญิง อายุ 20 ปี อยู่อ.ดอนจาน 18 ธันวาคม ไปร้านคิกคาปู้
รายที่ 10118 เป็นหญิง อายุ 20 ปี อยู่อ.ดอนจาน ไม่มีโรคประจำตัว
18 ธันวาคม ไปร้านคิกคาปู้ เพื่อแวะหาเพื่อน
20 ธันวาคม เริ่มมีอาการป่วย ไข้ ไอ เจ็บคอ มีเสมหะ
สายด่วนโควิด-19 จ.สุรินทร์
ไทม์ไลน์ ผู้ป่วยยืนยันโอมิครอน รายที่ 1 (หมายเลขผู้ป่วย 19157)
ผู้ป่วยยืนยัน COVID-19 จังหวัดสุรินทร์ สายพันธุ์ Omicron รายที่ 1 (หมายเลขผู้ป่วย 19157)
- เพศชาย อายุ 16 ปี อาชีพนักศึกษา อำเภอกาบเชิง
- ประวัติเสี่ยง : สัมผัสเสี่ยงสูง/ผู้ป่วยยืนยันจังหวัดสุรินทร์รายที่ 19158,19159
- ผู้สัมผัสเสี่ยงสูง 30 ราย ผู้สัมผัสเสี่ยงต่ำ 21 ราย
ไทม์ไลน์
15 และ 17 ธ.ค. ไปชมการแสดงดนตรี งานช้างแฟร์ พร้อมน้องสาวและญาติ 5 คน โดยรถยนต์ส่วนตัว (นั่งกระบะท้าย) สวมหน้ากากอนามัย
18 ธ.ค. พบน้าสาว น้าเขย (ชาวเดนมาร์ค) มาจากเดนมาร์ค ช่วงเย็นร่วมรับประทานอาหาร
19 ธ.ค. ไปผาจำเนียง พร้อมลูกชายน้าเขย (ชาวเดนมาร์ค) หลายชายและหลานสาว โดยรถจยย. ระหว่างทางแวะกินข้าว ที่อ.กาบเชิง (สวมหน้ากากเป็นบางครั้ง) ช่วงเย็น 17-19 ไปโลตัส อ.ปราสาท พร้อมน้าสาว น้าเขย ลูกชายน้าสาวน้าเขย
20 ธ.ค. เริ่มมีอาการ ไข้ ไอ เจ็บคอ น้ำมูก
23 ธ.ค. ไปรพ.เอกชนในสุรินทร์ ขอตรวจโควิด เวลา 22 น.รพ.แจ้งผลพบโควิด
24 ธ.ค. เข้ารักษาที่รพ.กาบเชิง พร้อมส่งตรวจหาโอมิครอน
25 ธ.ค. รพ.กาบเชิง ยืนยันพบโอมิครอน
สร้างแบรนด์ด้วยความแตกต่าง: ไม่ได้แค่เจอกันตอนป่วย แต่เราช่วยดูแลทุก Lifestyle
นางสาว อังคณา ลิขิตจรรยากุล รองกรรมการผู้จัดการใหญ่ สายงานการตลาดองค์กรกลุ่ม บริษัท พฤกษา โฮลดิ้ง จำกัด (มหาชน) เปิดเผยถึงที่มาของแคมเปญ “ของหวานไกลเบาหวาน” ว่า “การสร้างแบรนด์ ให้คนรู้จักและไว้ใจเป็นเรื่องสำคัญ เราต้องการให้โรงพยาบาลวิมุต เป็น “Health Care Platform” เป็นตัวแทนในเรื่องการดูแลสุขภาพ ให้การรักษาสำหรับทุกคน ไม่ว่าจะเป็นคนไข้เพื่อให้หายจากการเจ็บป่วย หรือผู้บริโภคทั่วไปให้มีสุขภาพดี เราอยากให้โรงพยาบาลวิมุตเป็นที่จดจำได้ ไม่เฉพาะเวลาเจ็บป่วยเท่านั้น แต่เราอยากให้วิมุตอยู่ในทุกที่ ไม่ว่าจะเป็นคนไข้ หรือคนทั่วไป หรือผู้ที่มีไลฟ์สไตล์แบบใดก็ตามที่ต้องการดูแลสุขภาพ
ประชาชนขอรับ ATK ได้ ผ่านแอปเป๋าตัง LINK
ประชาชนขอรับ ATK ไปตรวจโควิด-19 ด้วยตนเองได้ ผ่านแอปเป๋าตัง
วิธีการ คือ ลงแอป เข้าแอป แจ้งขอ ATK ทำแบบสอบถาม แล้วไปขอรับชุดตรวจได้ที่จุดต่างๆ ในพื้นที่ เช่น รพ. รพ.สต. ร้านขายยา หรือคลินิก
ถ้าไม่มีมือถือ/สมาร์ทโฟน ไปขอรับได้ที่ รพ., รพ.สต. ทางเจ้าหน้าที่จะทำการคัดกรองและยืนยันตัวตนให้
Hospitel รพ.นวเวช LINK
รพ.นวเวช ร่วมกับ โรงแรม Novotel Bangkok on Siam Square เปิดให้บริการ Hospitel 02-483-9999
ร้านไม่บอก (ข้างอุทยานสวรรค์) ระหว่างวันที่ 30 ธันวาคม 2564 เวลา 17.00 - 20.00 น. ถึงวันที่ 1 มกราคม 2565 เวลา 17.00 - 20.00 น. LINK
#ประชาสัมพันธ์สำนักงานสาธารณสุขจังหวัดนครสวรรค์
?❗️ขอให้ประชาชนที่ไปรับประทานอาหารที่ “ร้านไม่บอก (ข้างอุทยานสวรรค์)” ระหว่างวันที่ 30 ธันวาคม 2564 เวลา 17.00 - 20.00 น. ถึงวันที่ 1 มกราคม 2565 เวลา 17.00 - 20.00 น.
#ติดต่อเข้ารับการตรวจหาเชื้อ COVID-19 ณ คลินิกไข้หวัด โรงพยาบาลของรัฐใกล้บ้าน หรือ ณ คลินิกไข้หวัด โรงพยาบาลสวรรค์ประชารักษ์ เปิดตรวจทุกวัน ระหว่างเวลา 08:30 – 22:00 น.
#โดยสวมหน้ากากอนามัยและใช้รถส่วนตัวในการเดินทาง
☎สอบถามเพิ่มเติมที่สายด่วน COVID-19 โทร. 081-3527696
⚠ และขอความร่วมมือผู้รับบริการทุกท่าน ไม่ปกปิดข้อมูลประวัติการเดินทาง หรือการสัมผัสกลุ่มเสี่ยง เพื่อความปลอดภัยของท่านและทุกคน ตลอดจนบุคคลากรทางการแพทย์
1) สรุปเงื่อนไขการเดินทางเข้าประเทศไทยล่าสุด (สถานะวันที่ 22 ธันวาคม 2564)
ผู้เดินทางเข้าไทยทุกคนต้องลงทะเบียนผ่านระบบ Thailand Pass
- ผู้ที่ลงทะเบียนสำเร็จจะได้รับ QR Code ทางอีเมล สำหรับใช้แสดงต่อสายการบิน และ ตม. ไทย หากไม่มี QR Code จะถูกปฏิเสธการเดินทางเข้าไทย
- คำถามที่พบบ่อยเกี่ยวกับ Thailand Pass คลิกที่นี่
สำหรับผู้ที่ลงทะเบียนขอรับ QR Code ผ่านระบบ Thailand Pass แล้วก่อนวันที่ 22 ธันวาคม 2564
(รวมถึงผู้ที่ลงทะเบียนก่อนวันที่ 22 ธันวาคม 2564 และยังรอผลการพิจารณา)
- สามารถใช้ QR Code ดังกล่าวเดินทางเข้าไทยตามโครงการที่เลือกไว้ได้ (ไม่มีข้อจำกัดว่าต้องเดินทางเข้าไทยก่อนกำหนดเวลาใด)
- ตัวอย่างเช่น หากได้รับอนุมัติให้เดินทางเข้าไทยภายใต้โครงการ Test & Go ไปแล้ว ก่อนวันที่ 22 ธันวาคม 2564 สำหรับการเดินทางเข้าประเทศไทยในวันที่ 1 กุมภาพันธ์ 2565 ท่านยังสามารถใช้ QR Code ดังกล่าวเดินทางเข้าไทยในวันที่ 1 กุมภาพันธ์ 2565 ตามเงื่อนไขโครงการ Test & Go ได้ กล่าวคือ ต้องพักที่โรงแรมจนกว่าจะได้รับผลตรวจ RT-PCR เป็นลบ และเมื่อได้รับผลตรวจเป็นลบสามารถเดินทางไปพื้นที่/จังหวัดอื่นได้
- ต้องใช้ผลตรวจโควิดแบบ RT-PCR อายุไม่เกิน 72 ชม. ก่อนขึ้นเครื่อง (ยกเว้นกรณี
(1) เด็กอายุไม่เกิน 6 ปี เดินทางพร้อมผู้ปกครอง และ
(2) ผู้ที่เคยติดเชื้อและหายป่วยแล้วไม่น้อยกว่า 14 วัน แต่ไม่เกิน 3 เดือน
สามารถใช้เอกสารยืนยันการหายป่วยได้กรณีที่ผลตรวจ RT-PCR เป็นบวก)
- เมื่อเดินทางเข้าประเทศไทยแล้ว จะต้องเข้ารับการตรวจเชื้อครั้งที่ 2 โดยวิธี RT-PCR ณ สถานที่ที่ทางราชการกำหนดโดยไม่เสียค่าใช้จ่าย โดยสามารถสอบถามข้อมูลสถานที่และขั้นตอนการตรวจหาเชื้อฯ ครั้งที่ 2 ได้จากโรงแรมที่พักแห่งแรก
สำหรับผู้ที่ลงทะเบียนผ่านระบบ Thailand Pass ตั้งแต่วันที่ 22 ธันวาคม 2564 เป็นต้นไป ไม่สามารถเลือกเข้าโครงการ Test & Go ได้
*แต่* ยังมี 2 ทางเลือก สำหรับการเดินทางเข้าไทย
ได้แก่
(1) Phuket Sandbox
(เฉพาะสำหรับผู้ที่ฉีดวัคซีนครบโดสแล้วเท่านั้น)
- ไม่ต้องกักตัวในโรงแรม แต่ต้องอยู่ในภูเก็ตอย่างน้อย 7 วัน เมื่อครบ 7 วันแล้ว จึงจะสามารถเดินทางไปพื้นที่/จังหวัดอื่น ๆ ได้
- จองและจ่ายค่าห้องพักที่โรงแรม SHA Extra+ ในภูเก็ต อย่างน้อย 7 วัน และมีหลักฐานการชำระค่าตรวจ RT-PCR 2 ครั้ง สามารถดูรายชื่อโรงแรม SHA Extra+ ได้ที่ thailandsha.com/shaextraplus (เลือกดูเฉพาะจังหวัดภูเก็ต)
- ต้องใช้ผลตรวจโควิดแบบ RT-PCR อายุไม่เกิน 72 ชม. ก่อนขึ้นเครื่อง (ยกเว้นกรณี (1) เด็กอายุไม่เกิน 6 ปี เดินทางพร้อมผู้ปกครอง และ (2) ผู้ที่เคยติดเชื้อและหายป่วยแล้วไม่น้อยกว่า 14 วัน แต่ไม่เกิน 3 เดือน สามารถใช้เอกสารยืนยันการหายป่วยได้กรณีที่ผลตรวจ RT-PCR เป็นบวก)
- คนไทยไม่ต้องใช้ประกันสุขภาพ (แต่ต่างชาติต้องใช้ประกันสุขภาพวงเงินไม่ต่ำกว่า 50,000 USD)
- ต้องตรวจ RT-PCR ในวันแรกที่เดินทางถึงไทย และครั้งที่ 2 ในวันที่ 5 หรือ 6
- เด็กอายุต่ำกว่า 18 ปี ที่ไม่ได้ฉีดวัคซีน และเดินทางพร้อมผู้ปกครอง สามารถเข้าไทยภายใต้โครงการ Sandbox ได้ตามเงื่อนไขเดียวกันกับผู้ปกครอง
เงื่อนไขสำคัญ
ต้องเดินทางเข้าภูเก็ตโดยตรงจากต่างประเทศเท่านั้น ห้ามเปลี่ยนเครื่องที่กรุงเทพฯ ผู้ที่เดินทางเข้าทางกรุงเทพฯ จะต้องกักตัวที่กรุงเทพตามโครงการ Alternative Qaurantine ไม่สามารถต่อเครื่องไปภูเก็ตได้จนกว่าจะกักตัวที่กรุงเทพฯ ครบตามกำหนด
(2) Alternative Quarantine (AQ)
- ผู้ที่ฉีดวัคซีนครบแล้ว กักตัวในโรงแรม AQ 7 วัน
(จองและจ่ายค่าที่พักเต็มจำนวน หรือจ่ายเงินมัดจำแล้วไม่น้อยกว่า 15,000 บาท โดยหลักฐานการจองโรงแรมจะต้องรวมค่าตรวจ RT-PCR 2 ครั้ง)
- ผู้ที่ไม่ได้ฉีดวัคซีนหรือฉีดวัคซีนไม่ครบโดส กักตัวในโรงแรม AQ 10 วัน
(จองและจ่ายค่าที่พักเต็มจำนวน หรือจ่ายเงินมัดจำแล้วไม่น้อยกว่า 15,000 บาท โดยหลักฐานการจองโรงแรมจะต้องรวมค่าตรวจ RT-PCR 2 ครั้ง)
- ผู้ที่เดินทางมายังท่าอากาศยานสุวรรณภูมิ/ดอนเมือง สามารถเลือกโรงแรม AQ ได้เฉพาะในกรุงเทพฯ และปริมณฑล ชลบุรี ปราจีนบุรี และนครนายก
- ผู้ที่เดินทางมายังท่าอากาศยานภูเก็ตฯ สามารถเลือกโรงแรม AQ ได้เฉพาะในภูเก็ตและพังงา
- ดูรายชื่อโรงแรม AQ ได้ คลิกที่นี่
- การจองโรงแรม AQ ให้ติดต่อโรงแรมโดยตรง หรือจองผ่านทาง www.agoda.com/quarantineth / https://asq.locanation.com / https://asq.ascendtravel.com / https://asqthailand.com / https://entrythailand.go.th (ไม่สามารถจองผ่านตัวแทนออนไลน์อื่น ๆ ได้)
- ต้องใช้ผลตรวจโควิดแบบ RT-PCR อายุไม่เกิน 72 ชม. ก่อนขึ้นเครื่อง (ยกเว้นกรณี (1) คนไทย (2) เด็กอายุไม่เกิน 6 ปี เดินทางพร้อมผู้ปกครอง และ (3) ผู้ที่เคยติดเชื้อและหายป่วยแล้วไม่น้อยกว่า 14 วัน แต่ไม่เกิน 3 เดือน สามารถใช้เอกสารยืนยันการหายป่วยได้กรณีที่ผลตรวจ RT-PCR เป็นบวก อย่างไรก็ดี สถานเอกอัครราชทูตฯ ขอแนะนำให้คนไทยทุกคนตรวจ RT-PCR ก่อนขึ้นเครื่อง)
- คนไทยไม่ต้องใช้ประกันสุขภาพ (แต่ต่างชาติต้องใช้ประกันสุขภาพวงเงินไม่ต่ำกว่า 50,000 USD)
ข้อมูล ข้อสังเกตอาการของโอมิครอน รวบรวมจากสื่อเผยแพร่ของรพ.ต่างๆ ที่เป็นข้อมูลที่เชื่อถือได้ เพราะมาจากรพ.โดยตรง รายละเอียดอาจแตกต่างกันได้ แนะนำศึกษาข้อมูลเพิ่มเติม
แนะนำวิธีใช้ แอปทางรัฐ กันหน่อย
ติดต่อ รพ.บางละมุง LINK
ประชาสัมพันธ์
ท่านที่ต้องการสอบถามข้อมูลเพิ่มเติม ติดต่อเบอร์โทรศัพท์
038-411-551
038-411-552
038-429-244
038-429-245
038-429-246
สายด่วน
099-2719305
066-0495383
066-0536710
099-5062590
066-0537923
หน่วยงานอื่นๆ ช่วยหาเตียง ที่กักตัว
เช็คความพร้อมเขตต่างๆ
คู่มือการจัดบริการ HOME ISOLATION กรมการแพทย์ LINK
กรมการแพทย์จึงร่วมกับภาคีเครือข่าย จัดทำแนวทางปฏิบัติสำหรับบุคลากรทางการแพทย์ ในการให้คำแนะนำผู้ป่วยและการจัดบริการผู้ป่วยโควิด-19 แบบ Home Isolation อีกทั้งหน่วยบริการในสังกัด ยังได้จัดบริการในรูปแบบ Home isolation โดยให้การดูแล รักษา ผู้ป่วยโควิด–19 ที่ไม่มีอาการหรือมีอาการ เพียงเล็กน้อย ภายใต้การกำกับ ติดตามของทีมบุคลากรทางการแพทย์และได้รวบรวมแนวทางและ การดำเนินงานดังกล่าวไว้ในเล่ม “การจัดบริการ Home Isolation กรมการแพทย์ กระทรวงสาธารณสุข”
หากตรวจ ATK ผลเป็นบวก โทรติดต่อรพ.ต่างๆ ในแต่ละอำเภอ
ศูนย์ปฏิบัติการ COVID & Home Isolation รพ.ลำปาง LINK
?ศูนย์ปฏิบัติการ COVID & Home Isolation เขตอำเภอเมืองลำปาง
?ตั้งแต่วันเสาร์ที่ 15 มกราคม 2565
ปรับเวลาให้บริการ
?ทุกวัน เวลา 8.30 - 20.00 น.
☎️054-019998
1. รับแจ้งกรณีตรวจ ATK ได้ผลบวก
2. รับแจ้งกรณีมีปัญหาระหว่างกักตัวที่บ้าน
3. สอบถามปัญหาทั่วไปเกี่ยวกับ COVID
“ข้อมูลของ ศศก.ที่พบว่ามีการใช้กัญชาเพื่อสันทนาการกว่า 1 ล้านคนถือว่าสูงมาก ขณะที่ต่างประเทศทำการมอนิเตอร์มา 10 ปี พบว่ามีการใช้ THC ในปริมาณที่สูงขึ้นเรื่อย ๆ เราไม่คัดค้านที่จะให้ใช้กัญชาทางการแพทย์ได้ แต่ไม่เห็นด้วยที่จะปลดกัญชาออกจากยาเสพติดทั้งหมด”
-------------------------
รศ.พญ.รัศมน กัลยาศิริ ผู้อำนวยการศูนย์ศึกษาปัญหาการเสพติค .(ศศก.)
ศาสตราจารย์แบรี่ เจมส์ มาแชล (Barry J. Marshall)
ศาสตราจารย์แบรี่ เจมส์ มาแชล (Barry J. Marshall) จากประเทศออสเตรเลีย ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการสาธารณสุข ประจำปี 2544 จากการค้นพบเชื้อแบคทีเรีย เฮลิโคแบคเตอร์ ไพลอรี่ เป็นสาเหตุของโรคกระเพาะอาหารเป็นแผล ต่อมาได้รับรางวัลโนเบล สาขาการแพทย์ ในปี 2548 ด้วยการค้นพบเดียวกัน
ที่กดน้ำดื่ม ที่แบ่งเป็นสามระดับความสูงคือความสูงระดับเอวสำหรับผู้ใหญ่ ความสูงระดับหัวเข่าสำหรับเด็ก และความสูงระดับข้อเท้าสำหรับสุนัข
นนท์พร้อม ขยายเวลาลงทะเบียนวัคซีนเข็ม 3 เป็น Pfizer (เข็มกระตุ้น) LINK
เฉพาะคนไทย ไม่จำกัดพื้นที่พักอาศัย เงื่อนไข
1. ฉีด AstraZeneca เข็ม 1 และ Pfizer เข็ม 2 โดยฉีดเข็ม 2 มาไม่น้อยกว่า 6 เดือน(ก่อน2 สค.64)
2. ฉีด Sinovac หรือ Sinopharm เข็ม 1 และ Pfizer เข็ม 2 โดยฉีดเข็ม 2 มาไม่น้อยกว่า 3 เดือน(ก่อน2 พย.64)
3. ฉีด AstraZeneca มาครบ 2 เข็ม และ ฉีดเข็ม 2 มาไม่น้อยกว่า 3 เดือน(ก่อน2 พย.64)
4. ฉีด Pfizer มาครบ 2 เข็ม และ ฉีดเข็ม 2 มาไม่น้อยกว่า 6 เดือน(ก่อน2 สค.64)
ลงทะเบียนตั้งแต่วันที่ 31 มกราคม 2565 ถึง วันที่ 1 กุมภาพันธ์ 2565 ก่อนเวลา 20.00 น. (หรือจนกว่าจะเต็มจำนวน)
ฉีดวัคซีนที่ ศูนย์กีฬากำธน สินธวานนท์ การไฟฟ้าฝ่ายผลิตแห่งประเทศไทย (บางกรวย) วันที่ 2 กุมภาพันธ์ 2565 วันละ 2,000 คน
เป็นการลงทะเบียน แบบทราบวันนัด และสนามฉีดชัดเจนแล้ว ถือเป็นการยืนยันนัดทันที (ไม่มีการแจ้ง SMS) ในใบนัดจะแสดงสถานที่นัด วันและเวลานัดหมายชัดเจน ขอให้ไปตามเวลานัดหมาย เพื่อเป็นไปตามมาตรการ Social Distancing
ทำแบบทดสอบประเมินตนเอง ว่าคุณเป็นคนหลั่งเร็วหรือไม่ LINK
แบบทดสอบ ว่าคุณหลั่งเร็ว หรือไม่ - Thai Premature Ejaculation Diagnostic Tool (PEDT) หรือ แบบทดสอบที่ใช้วินิจฉัยภาวะหลั่งเร็ว สำหรับให้ท่านชาย ได้ทดสอบประเมินตนเอง ต่อสภาวะการหลั่งเร็วหรือไม่ โดยชุดคำถาม 5 ข้อ แล้วดูคะแนนที่ได้เพื่อประเมินสภาวะของคุณ
ค่าธรรมเนียม ใบอนุญาตผลิตอาหาร นำเข้า ขึ้นทะเบียนตำรับอาหาร
อัตราการเก็บค่าธรรมเนียม อ้างอิงกฎกระทรวง ฉบับที่5 พระราชบัญญัติอาหาร พ.ศ.2522
ใบอนุญาตผลิตอาหาร
1) คนงานตั้งแต่ 50 คนขึ้นไป ไม่ใช้เครื่องจักร หรือ ใช้เครื่องจักรไม่ถึง 2 แรงม้า 5,000 บาท
2) คนงานตั้งแต่ 50 คนขึ้นไป เครื่องจักรตั้งแต 2 แรงมา แตไม่ถึง 10 แรงมา 6,000 บาท
3) คนงานตั้งแต่ 50 คนขึ้นไป เครื่องจักรตั้งแต 10 แรงมา แตไม่ถึง 25 แรงมา 7,000 บาท
4) คนงานตั้งแต่ 50 คนขึ้นไป เครื่องจักรตั้งแต 25 แรงมา แตไม่ถึง 50 แรงมา 8,000 บาท
5) คนงานน้อยกว่า 50 หรือ มากกว่า 50 คน เครื่องจักรตั้งแต 50 แรงมา ขึ้นไป 10,000 บาท
2. ใบอนุญาตนำหรือสั่งอาหารเข้ามาในราชอาณาจักร 15,000 บาท
3. ใบอนุญาตผลิตอาหารเป็นการเฉพาะคราว 2,000 บาท
4. ใบอนุญาตนำหรือสั่งอาหารเข้ามาในราชอาณาจักรเป็นการเฉพาะคราว 2,000 บาท
5. ใบสำคัญการขึ้นทะเบียนตำรับอาหาร 5,000 บาท
6. ใบแทนใบอนุญาต 500 บาท
7. ใบแทนใบสำคัญการขึ้นทะเบียนตำรับอาหาร 500 บาท
8. การต่ออายุใบอนุญาตครั้งละเท่ากับค่าธรรมเนียมใบอนุญาตประเภทนั้นๆ แต่ละฉบับ
หมายเหตุ อัตราค่าธรรมเนียมปรับข้อมูลคนงานและเครื่องจักร ตามการพิจารณาสถานที่ผลิตอาหารที่เข้าข่ายโรงงานปัจจุบัน
Package Basic Program (สำหรับอายุ 14 - 25 ปี)
1. February LOVE บอลลูนแห่งรัก @Singha Park Chiang Rai LINK
February LOVE @Singha Park Chiang Rai 10-15 กุมภาพันธ์นี้ เปิด flight บินบอลลูนนัดพิเศษ โรแมนติกและสุดแสนอลังการณ์ ด้วยการ take off แบบ mass ascension (การปล่อยบอลลูนแบบหมู่) กับ 3 รูปแบบขึ้นบิน
1) รับจองบินวันละ 2 รอบ sunrise และ sunset
2) บินคู่รัก จำนวนจำกัด รับเพียงรอบละ 4 คู่เท่านั้น
3) บินกับแก๊งเพื่อน และครอบครัว เปิดรับได้ 20 ท่านต่อรอบ
เปิดประสบการณ์การบินบอลลูนช่วงวาเลนไทน์แปลกใหม่แบบนี้ รับรองจะประทับใจไม่รู้ลืม
2. มนต์เสน่ห์เชียงใหม่เมืองดอกไม้งาม Charming Chiang Mai Flower Festival 2022 LINK
การจัดแสดงดอกไม้สุดยิ่งใหญ่!!! กับงานมนต์เสน่ห์เชียงใหม่เมืองดอกไม้งาม “Charming Chiang Mai Flower Festival 2022” ต้นเดือนกุมภาพันธ์นี้ ขอเชิญชวนนักท่องเที่ยวมาพบกับสวรรค์ของคนรักดอกไม้ ซึ่งถูกจัดแสดงขึ้นบนพื้นที่กว่า 27 ไร่ โดยองค์การบริหารส่วนจังหวัดเชียงใหม่ ภายใต้แนวคิด “งามสะพรั่งบุปผา พันธุ์พฤกษานครพิงค์ ณ สวนเฉลิมพระเกียรติ 82 พรรษา อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่(ด้านหลังศาลากลางจังหวัดเชียงใหม่)
เข้าชมฟรี ไม่มีค่าใช้จ่ายใดๆ
เข้าชมได้ตั้งแต่วันนี้ถึงวันที่ 15 กุมภาพันธ์ 2565 ตั้งแต่เวลา 08.00 – 20.00 น.
3. Trang Food FestiWOW : Season of Love 10-14 ก.พ.65
“Trang Food FestiWOW : Season of Love" 10-14 ก.พ. นี้ ณ สวนทับเที่ยง มาฉลองเทศกาลแห่งความรัก ในบรรยากาศสุดโรแมนติก มอบความรักผ่านเมนูอาหารและเครื่องดื่ม ในหลากหลายสไตล์ เลือกได้ตามใจชอบ อาทิ โซน Europe Style, โซน Forest & Sea, โซน Japanese Style, โซน Chinese Style, โซน Thai Style หรือจะเริ่มต้นชีวิตคู่ ก็ปรึกษาเราได้ในโซน Wedding Planner
คลินิกขาเทียม โรงพยาบาลบางกรวย LINK
คลินิกขาเทียม โรงพยาบาลบางกรวย
สิทธิ บัตรทองผู้พิการ ข้าราชการ(เบิกจ่ายตรงกรมบัญชีกลาง) และ ประกันสังคม
สามารถเข้ารับบริการทำขาเทียมได้โดยไม่มีค่าใช่จ่ายและ ไม่ต้องสำรองจ่าย
เปิดบริการ วันจันทร์- วันศุกร์ เวลา 08.00 – 16.00 น.
นอกเวลาทำการ เวลา 16.30-20.00 น.
สถานที่ให้บริการ โรงพยาบาลบางกรวย 2 ชั้น 5
เบอร์โทรติดต่อเพื่อนัดหมาย 02-447-5582-3 ต่อ 2408 2409
Thailand Digital Health Pass
เอกสารรับรองโควิดแบบดิจิตัล ของไทย เรียกว่า Thailand Digital Health Pass ทางการไทย ออกให้กับประชาชนไทย 2 รูปแบบ คือแบบเอกสาร และแบบดิจิตัล
1. แบบเอกสาร เป็นเอกสารที่จะออกให้ ณ จุดฉีดวัคซีน ประชาชนที่ต้องการ สามารถติดต่อรพ./ศูนย์ฉีดที่ไปฉีดวัคซีนได้
2. แบบดิจิตัล จะอยู่บนแอปหมอพร้อม ในรูปแบบ QR Code ที่มีลายเซ็นต์ดิจิตัล มาตรฐานของสหภาพยุโรป ป้องกันการปลอมแปลง
หน่วยบริการที่รับส่งต่อเฉพาะด้านรังสีรักษาทั่วประเทศ
หน่วยบริการที่รับส่งต่อเฉพาะด้านรังสีรักษาจำนวน 37 แห่ง
- สังกัดโรงเรียนแพทย์ 11 แห่ง
- สังกัดกรมการแพทย์ 9 แห่ง
- สังกัดกระทรวงกลาโหม 2 แห่ง
- สังกัดกระทรวงสาธารณสุข 10 แห่ง
- เอกชน 5 แห่ง
หน่วยบริการ
หน่วยบริการที่รับการส่งต่อ ทั่วประเทศ (จำแนกตามเขตสุขภาพ)
เขต 1 เชียงใหม่ - รพ.มหาราชนครเชียงใหม่, รพ.มะเร็งลำปาง
เขต 2 พิษณุโลก - รพ.พุทธชินราช, รพ.มหาวิทยาลัยนเรศวร, รพ.รังสีรักษาพิษณุโลก
เขต 3 นครสวรรค์ - รพศ.สวรรคประชารักษ์
เขต 4 สระบุรี - รพ.มะเร็งลพบุรี, รพ.มหาวิชราลงกรณ์, รพ.ธรรมศาสตร์
เขต 5 ราชบุรี - รพศ.ราชบุรี, รพ.ท่าฉลอม
เขต 6 ระยอง - รพ.มะเร็งชลบุรี, รพ.พระปกเกล้า จันทบุรี, รพ.แคนเซอร์อลิอันซ์ ศรีราชา, รพ.วิภารามอมตะนคร ชลบุรี
เขต 7 ขอนแก่น - รพ.ศรีนครินทร์, รพศ.ขอนแก่น, รพศ.ร้อยเอ็ด
เขต 8 อุดรธานี - รพ.มะเร็งอุดรธานี, รพศ.สกลนคร
เขต 9 นครราชสีมา - รพศ.มหาราชนครราชสีมา, รพศ.สุรินทร์
เขต 10 อุบลราชธานี - รพ.มะเร็งอุบลราชธานี
เขต 11 สุราษฎร์ธานี - รพ.มะเร็งสุราษฎร์ธานี, รพ.มหาราชนครศรีธรรมราช
เขต 12 สงขลา - รพ.สงขลานครินทร์
เขต 13 กรุงเทพ - รพ.ศิริราช, รพ.จุฬาฯ, รพ.รามาธิบดี, รพ.ราชวิถี, สถาบันมะเร็งแห่งชาติ, รพ.ภูมิพลอดุลยเดช, รพ.พระมงกุฏเกล้า, รพ.วิชรพยาบาล, รพ.จุฬาภรณ์, รพ.ศูนย์มะเร็งกรุงเทพ, รพ.วัฒโนสถ
การเปลี่ยนแปลงเนื่องจากความชรา (normal ageing change)
ผู้สูงอายุที่มีปัญหาด้านความจำ อาจเป็นการเปลี่ยนแปลงเนื่องจากความชราเอง หรืออาจเป็นระยะเริ่มแรกของโรค(preclinical stage) ในกลุ่มโรคที่เกิดจากความเสื่อมของระบบประสาท (neurodegenerative) ได้ การที่ไม่มีอาการทางเวชกรรมของโรคอย่างเด่นชัด จึงไม่ได้เป็นสิ่งที่บอกได้ว่าเป็นการเปลี่ยนแปลงเนื่องจากความชรา8 อย่างไรก็ตาม จะคิดถึงภาวะนี้ในผู้สูงอายุที่ยังทราบตนเองว่ามีความจำลดลง แต่ไม่เป็นปัญหาที่สำคัญมากนัก ไม่มีผลกระทบต่อการดำรงชีวิตประจำวันและอาการคงที่ตลอด ถือว่าน่าจะเป็นการเปลี่ยนแปลงเนื่องจากความชรา
ความผิดปกติเล็กน้อยของความสามารถของสมอง (mild cognitive impairment: MCI)
ภาวะนี้เป็นระยะที่อยู่ระหว่างการเปลี่ยนแปลงเนื่องจากความชราและภาวะสมองเสื่อม ในอดีตได้มีการใช้คำต่างๆที่แสดงถึงความผิดปกติในระยะนี้ เช่น benign senescent forgetfulness (ปีพ.ศ. 2505), age-associated memory impairment(ปีพ.ศ. 2529) ส่วนคำว่า mild cognitive impairment นั้นเริ่มใช้ในปี พ.ศ. 2533 โดยผู้ป่วยที่เป็น MCI จะมีความผิดปกติทางด้านความสามารถของสมองโดยเฉพาะความจำ ที่ผู้ป่วยเอง ญาติหรือแพทย์ผู้ดูแลสามารถบอกได้ว่ามีจริง อาจไม่มีความผิดปกติของสมองด้านอื่นๆหรือมีไม่มาก มีความผิดปกติของการทดสอบสุขภาวะทางจิต (mental status) โดยยังไม่เข้าเกณฑ์การวินิจฉัยภาวะสมองเสื่อม ความสามารถในการทำกิจวัตรชนิดพื้นฐานและความสามารถในการทำกิจวัตรชนิดอุปกรณ์ยังเป็นปกติ
แต่อาจสูญเสียความสามารถในด้านการบริหารจัดการ (executive function) บางด้าน เช่น การบริหารจัดการรายรับรายจ่ายการชำระเงินค่าใช้จ่ายต่างๆ เป็นต้น9 แม้ปัจจุบันมีความสนใจในภาวะนี้เป็นอย่างมาก แต่ข้อสรุปของคำนิยามของภาวะนี้ยังไม่แน่ชัด ทำให้อุบัติการณ์ของภาวะนี้มีตั้งแต่ร้อยละ 5 - 25 ขึ้นกับคำนิยามในแต่ละการศึกษา10-12 ปัจจัยที่ทำให้คำนิยามของภาวะนี้ไม่แน่ชัด เกิดจากสาเหตุหลายประการ เช่น MCI เป็นภาวะที่มีความหลากหลาย ส่วนหนึ่งของผู้ป่วยอาจมีอาการเลวลง จนกลายเป็นโรคอัลไซเมอร์ได้ในอนาคต หรือการให้คำนิยามจากแต่ละกลุ่มที่ศึกษาภาวะนี้แตกต่างกัน บางกลุ่มต้องการให้มีความผิดปกติของความจำร่วมด้วยเสมอ เรียกว่าเป็น amnestic MCI 13 ในขณะที่บางกลุ่มให้มีความผิดปกติของด้านอื่นที่ไม่ใช่ความจำก็ได้ (non-amnestic MCI)
นอกจากนั้นการที่เกณฑ์ต่างๆ ใช้ผลการตรวจทางจิตประสาท (neuropsychiatric test) เป็นตัวตัดสิน ทำให้อาจมีความผิดพลาดจากการทดสอบและการแปลผลการทดสอบได้ และการที่ใช้เกณฑ์เปรียบเทียบผลการทดสอบกับผู้ที่อายุใกล้เคียงกัน อาจไม่ได้แปลว่าผู้สูงอายุด้วยกันจะมีระดับความสามารถทางสมองเป็นปกติ
ผู้ป่วยที่มี MCI มีความผิดปกติของอารมณ์และจิตประสาท มีผลต่อความเครียดของผู้ดูแล14 มีคุณภาพชีวิตที่ลดลง15 และมีอัตราการเสียชีวิตสูงขึ้น 2 เท่าเมื่อเปรียบเทียบกับผู้สูงอายุทั่วไป และยังมีความเสี่ยงที่ต้องอยู่ในสถานสงเคราะห์คนชราสูงขึ้น 2 เท่า มีปัญหาในการทำกิจวัตรประจำวันมากกว่า มีโอกาสเสี่ยงต่อการเกิดโรคอัลไซเมอร์และภาวะสมองเสื่อมอื่นๆ สูงขึ้นกว่าผู้ที่ไม่มี MCI โดยเฉลี่ย 3 - 8 เท่า ปัจจัยเสี่ยงที่นำไปสู่การเกิดภาวะสมองเสื่อมในอนาคต ได้แก่ ความผิดปกติในการทำกิจวัตร (functional impairment) ปัญหาเรื่องการได้รับกลิ่น การตรวจพบปริมาตรของ entorrhinal cortex และ hippocampusน้อยผิดปกติจากการตรวจคลื่นแม่เหล็กไฟฟ้า การตรวจพบเมทาโบลิสซั่ม (metabolism) ของ glucose ลดลงที่ temporoparietal region จากการตรวจด้วย positron emission tomography (PET) หรือการวัดระดับของ τ หรือ β -amyloid ในน้ำไขสันหลัง
โรงพยาบาลเกษมราษฎร์ รามคําแหง เปิดรับสมัครพนักงาน Full Time ฝ่ายสนับสนุนบริการ LINK
เปิดรับสมัครพนักงาน Full Time ฝ่ายสนับสนุนบริการ ดังนี้
• เจ้าหน้าที่โอเปอเรเตอร์ จำนวน 1 อัตรา
• เจ้าหน้าที่ห้องผ้า จำนวน 2 อัตรา
• เจ้าหน้าที่เสริ์ฟอาหาร จำนวน 1 อัตรา
• เจ้าหน้าที่เวรเปล จำนวน 2 อัตรา
คุณสมบัติ จบม. 6 ขึ้นไป เพศชายต้องผ่านการเกณฑ์ทหารแล้ว
ท่านใดสนใจร่วมงานกับเรา ส่งเรซูเม่เข้ามาได้ที่ Skb3_hr@hotmail.co.th หรือ สอบถามได้ 02-339-0000ต่อ4064 หรือ กรอกใบสมัครที่แผนกบุคคล ชั้น 4 วันจันทร์-วันศุกร์ 08.00-15.00 น.
โรงพยาบาลกรุงเทพเชียงราย เปิดรับสมัครพนักงาน หลายตำแหน่ง LINK
โรงพยาบาลกรุงเทพเชียงราย เปิดรับสมัครพนักงาน ทุกตำแหน่งหากมีประสบการณ์ สามารถสื่อสารภาษาอังกฤษ และภาษาจีนได้ จะได้รับการพิจารณาเป็นพิเศษ” สอบถามรายละเอียดเพิ่มเติมได้ที่ 052-051826, 052-051827 รับสมัครเวลาทำการ วันจันทร์ – ศุกร์ เวลา 08.00 - 17.00 น. (ยกเว้น วันหยุดนักขัตฤกษ์)
โรงพยาบาลเกษมราษฎร์ อินเตอร์ เนชั่นแนล อรัญประเทศ รับสมัครพนักงานประจำ หลายตำแหน่ง LINK
รพ.เกษมราษฎร์ อินเตอร์ เนชั่นแนล อรัญประเทศ รับสมัครพนักงานประจำ ตำแหน่ง "สมุห์บัญชี" "เจ้าหน้าที่การเงิน" "พนักงานซักรีด" "พนักงานเวรเปล" "เจ้าหน้าที่เวชระเบียน" "เจ้าหน้าที่ลูกค้าสัมพันธ์"
หากสนใจสามารถส่ง CV. หรือ Resume เข้ามาได้ที่อีเมล์ hr.kihart@gmail.com พร้อมระบุตำแหน่งที่ต้องการสมัคร ติดต่อสมัครหรือสอบถามได้ที่ หมายเลขโทรศัพท์ 03-764-0000 ต่อ 3401 หรือ 0946678118 กรอกใบสมัคร ชั้น 1 วันจันทร์ - ศุกร์ เวลา 08.00 - 17.00 น. ยกเว้นเสาร์ อาทิตย์ และวันหยุดนักขัตฤกษ์
ข้อมูลเพิ่มเติม โควิดในประเทศไทย ตั้งแต่เริ่มระบาด ปี 2563 จนถึง 31 ธ.ค.2564 LINK
ข้อมูลโควิดในประเทศไทย จากศบค. นับตั้งแต่เริ่มระบาด ปี 2563 จนถึง วันที่ 31 ธันวาคม 2564
- จำนวนผู้ป่วย รวมทั้งสิ้น 2,226,446 ราย
- จำนวนผู้หายป่วย 2,171,809 ราย
- เสียชีวิตสะสม 21,708 ราย
- จำนวนผู้ป่วยในการรักษา (สิ้นปี 64) 32,929 ราย อยู่ในโรงพยาบาล 15,784 ราย อยู่ในโรงพยาบาลสนามและอื่นๆ 17,145 ราย
- ผู้ป่วยอาการหนัก 583 ราย ใส่เครื่องช่วยหายใจ 158 ราย
- จำนวนการฉีดวัคซีนรวม 104,444,169 โดส แบ่งเป็น
เข็ม 1 สะสม 51,295,617 ราย
เข็ม 2 สะสม 46,145,566 ราย
เข็ม 3 สะสม 7,002,986 ราย
* ข้อมูล 28 ก.พ.-31 ธ.ค.64
จุดแข็ง 3C1W
จุดแข็ง 3C1W ในด้านคุณภาพของการรักษา (Quality of Care) ของ บำรุงราษฎร์ คือ
1) Critical care
2) Complicated care
3) Collaboration of Expertise
4) Wellness and Prevention
MIS-C (รพ.วิภาราม) LINK
MIS-C หรือ กลุ่มอาการอักเสบหลายระบบในเด็กหลังจากเด็กติดเชื้อ COVID-19
- เป็นภาวะหลังจากที่เด็กติดโควิดแล้วมีเกิดอาการอักเสบในอวัยวะต่าง ๆ ทั่วร่างกาย เกิดจากระบบภูมิคุ้มกันที่สูงผิดปกติ
- จากรายงานมีโอกาสเกิดภาวะ MIS-C เพียง 0.03 -0.04% ของผู้ป่วยเด็กที่เป็นโควิด แต่เป็นภาวะที่มีความรุนแรง มักเกิดขึ้นตามหลังการติดเชื้อประมาณ 2-6 สัปดาห์ อายุเฉลี่ยของเด็กที่พบคือ 9.7 ปี
ข้อมูลจาก รพ.วิภาราม
กรมอนามัยเปิดสายด่วน สธ. 02-590-4111
กรมอนามัยเปิดสายด่วน 02-590-4111 จำนวน 10 คู่สาย ตั้งแต่เวลา 07.30-20.30 น. ช่วยให้คำปรึกษา คำแนะนำ ประสานงานเกี่ยวกับอาหาร ยา เครื่องตรวจวัดอุณหภูมิ สำหรับผู้ที่ติดเชื้อแล้วต้องการรักษาตัวที่บ้าน คล้ายกับการรักษาแบบผู้ป่วยนอก รวมถึงช่วยคัดกรองและแยกผู้ป่วยให้เข้ารับการักษาตามกลุ่มอาการ
ยังมีเพจเฟซบุ๊ค COVID Watch เพื่อให้คำปรึกษา อีกช่องทางหนึ่ง โดยเฉพาะเมื่อนอกเวลา จะมีการรับฝากข้อความเพื่อติดต่อกลับ
เจอ แจก จบ - กระทรวงสาธารณสุข LINK
เจอ แจก จบ เริ่มแล้ว 1 มี.ค.65 มาตรการดูแลผู้ติดเชื้อโควิดระบบใหม่ โดย กระทรวงสาธารณสุข และสปสช.
- เจอ ผลบวกจากตรวจ ATK
- แจก ยารักษาตามอาการ - ฟ้าทะลายโจร - ฟาวิพิราเวียร์
- จบ เข้าระบบการรักษา + ดูแลติดตามอาการใน 24 ชม
โรงพยาบาลปิยะเวชช์ บ่อวินรับสมัคร หลายอัตรา LINK
โรงพยาบาลปิยะเวชช์ บ่อวินรับสมัคร หลายอัตรา
1. พยาบาลวิชาชีพ 6 อัตรา (มีใบประกอบวิชาชีพ)
2. นักรังสีเอกซเรย์ จำนวน 1 อัตรา
3. เจ้าหน้าที่ เทคนิคการแพทย์ 2 อัตรา
4.เภสัชกร 3 อัตรา
5.เจ้าหน้าที่สาธารณสุข 6 อัตรา
6. ผู้ช่วยเภสัชกร 1. อัตรา
7. เจ้าหน้าที่เวชระเบียน 2 อัตรา
8.เจ้าหน้าที่การเงิน/กองทุนทดแทน 2 อัตรา
9. ผู้ช่วยเจ้าหน้าที่นักรังสี 2 อัตรา
10. เจ้าหน้าที่ออกแบบ 1 อัตรา
11. วิศวะโยธา 1 อัตรา
12. เจ้าหน้าที่ยานยนต์ 2 อัตรา
สมัครได้ด้วยตนเอง ที่ฝ่ายทรัพยากรบุคคล ชั้น1 บริเวณด้านหน้าฉุกเฉิน จันทร์-ศุกร์
เวลา 08:00-17:00 น.
โทรศัพท์ 038-345111,038-345333 ต่อ 120
1.โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน ศูนย์ราชการฯ แจ้งวัฒนะ
โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน ศูนย์ราชการฯ แจ้งวัฒนะ กรุงเทพ
โทร.02-1437759
เปิดทุกวัน จันทร์-ศุกร์ เวลา 9-11 น.
เว้นวันหยุดราชการ
แผนที่ |
เพจ Facebook
2.ศูนย์ส่งเสริมสุขภาพแผนไทย (เรือนไทย) กระทรวงสาธารณสุข จ.นนทบุรี
ศูนย์ส่งเสริมสุขภาพแผนไทย (เรือนไทย)
กระทรวงสาธารณสุข จ.นนทบุรี
โทร.02-5902606, 02-5911964
เปิดทุกวัน จันทร์-ศุกร์ เวลา 8.30-16.30 น.
3.โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน ยศเส กรุงเทพ
โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน ยศเส กรุงเทพ
โทร.02-2243201
เปิดทุกวัน จันทร์และพุธ 8.30-11.30 น.
บทที่ 1 - บทนำ
1. ความเป็นมา
คณะรัฐมนตรีในการประชุมเมื่อวันที่ 12 กุมภาพันธ์ 2562 พิจารณาเห็นว่าปัญหาฝุ่นละอองมีค่าสูงเกินค่ามาตรฐานที่เกิดขึ้นเป็นประจำและเป็นปัญหาในหลายจังหวัดของพื้นที่ภาคเหนือ ภาคกลาง และภาคตะวันออกเฉียงเหนือรวมทั้งพื้นที่กรุงเทพมหานครและปริมณฑล ซึ่งส่งผลกระทบโดยตรงต่อสิ่งแวดล้อม เศรษฐกิจและสุขภาพของประชาชนและมีแนวโน้มที่จะขยายตัวเป็นปัญหาสำคัญไปยังจังหวัดข้างเคียงในภูมิภาคอีกด้วย โดยแหล่งกำเนิดฝุ่นละอองที่สำคัญได้แก่ การเผาในที่โล่ง การจราจรขนส่ง และอุตสาหกรรม การแก้ไขปัญหาดังกล่าวจึงจำเป็นต้องดำเนินการอย่างเร่งด่วน เป็นระบบ โดยความร่วมมือของหน่วยงานภาครัฐ เอกชน และประชาชน คณะรัฐมนตรีจึงมีมติให้การแก้ไขปัญหามลภาวะด้านฝุ่นละอองเป็นวาระแห่งชาติเพื่อให้การดำเนินการแก้ไขปัญหาดังกล่าวเป็นไปอย่างมีประสิทธิภาพและประสิทธิผล ทั้งนี้ให้คณะกรรมการสิ่งแวดล้อมแห่งชาติเป็นกลไกหลักร่วมกับกระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมและหน่วยงานที่เกี่ยวข้องดำเนินการขับเคลื่อนวาระแห่งชาติดังกล่าวให้เกิดผลเป็นรูปธรรมโดยเร็ว
2. แผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ“การแก้ไขปัญหามลพิษด้านฝุ่นละออง”
การขับเคลื่อนวาระแห่งชาติฯ ตามมติคณะรัฐมนตรีเมื่อวันที่ 12 กุมภาพันธ์ 2562 จะดำเนินการโดยจัดทำ แผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ “การแก้ไขปัญหามลพิษด้านฝุ่นละออง” พ.ศ. 2562 - 2567 เพื่อให้ทุกภาคส่วนใช้เป็นแนวทางปฏิบัติในการดำเนินงานด้านการแก้ไขปัญหาฝุ่นละอองอย่างมีประสิทธิภาพและเกิดประสิทธิผลเป็นรูปธรรมโดยเร็ว นำ ไปสู่เป้าหมายประเทศ “สร้างอากาศดีเพื่อคนไทย และผู้มาเยือน”
3. สถานการณ์ฝุ่นละอองขนาดเล็ก
ฝุ่นละออง หมายถึงอนุภาคของแข็งหรือของเหลวที่มีอยู่ในอากาศ ฝุ่นละอองเกิดจากกิจกรรมต่างๆ ทั้งโดยธรรมชาติและจากกิจกรรมของมนุษย์สำหรับปัญหามลพิษด้านฝุ่นละอองมักเกิดจากฝุ่นละอองขนาดเล็ก ซึ่งส่วนใหญ่ เกิดจากการเผาไหม้ต่างๆ เช่น การเผาไหม้ของน้ำ มันดีเซล การเผาเศษวัชพืช ขยะ และปฏิกิริยาเคมีในอากาศโดยมีแหล่งกำเนิดมาจาก
- การคมนาคมและขนส่ง
จากสถิติกรมการขนส่งทางบก รายงานสถิติจำนวนรถจดทะเบียนใหม่ในแต่ละปี แนวโน้มเพิ่มขึ้นต่อเนื่อง โดยในปี2561 มีจำนวนรถจดทะเบียนใหม่ 3.09 ล้านคัน และ ณ เดือนกุมภาพันธ์ 2562 มีจำนวนรถจดทะเบียนใหม่ 0.54 ล้านคัน จากสถิติรถจดทะเบียน พบว่าจำนวนรถที่จดทะเบียนสะสมทั่วประเทศ ณ กุมภาพันธ์ 2562 มี 39.72 ล้านคัน เป็นรถดีเซล 10.93 ล้านคัน โดยในกรุงเทพมหานคร มี 10.33 ล้านคันและเป็นรถดีเซล 2.7 ล้านคัน ซึ่งปริมาณการจำหน่ายน้ำ มันดีเซลในปี2561 ทั่วประเทศ จำนวน 23.09 พันล้านลิตร แบ่งเป็นในกรุงเทพมหานครและปริมณฑล จำนวน 7.09 พันล้านลิตร ซึ่งเพิ่มขึ้นจากปี 2560 ซึ่งปริมาณการจำหน่ายน้ำมันดีเซลทั่วประเทศ จำนวน 22.68 พันล้านลิตร แบ่งเป็นในกรุงเทพมหานครและปริมณฑล จำนวน 6.86 พันล้านลิตร
- การเผาในที่โล่ง
จากข้อมูลสำนักงานพัฒนาเทคโนโลยีอวกาศและภูมิสารสนเทศ (องค์การมหาชน) ที่ได้มีการติดตามตรวจสอบสถานการณ์ไฟป่าในพื้นที่ประเทศไทยจากดาวเทียม TERRA และ AQUA ระบบ MODIS ระหว่างวันที่ 1 มกราคม - 31 พฤษภาคม 2561 พบว่า มีจุดความร้อนสะสม (Hotspot) จำนวน 14,565 จุด โดยส่วนใหญ่เกิดจุดความร้อนสะสมในพื้นที่ภาคตะวันออกเฉียงเหนือ จำนวน 5,085 จุด และพบสูงสุดในเดือนมีนาคม โดยเมื่อวิเคราะห์แยกตามการใช้ประโยชน์ที่ดิน พบจุดความร้อนสะสมสูงสุดในพื้นที่เกษตร ร้อยละ 50 รองลงมาเป็นพื้นที่ สปก.ร้อยละ 19 พื้นที่ชุมชน ร้อยละ 11 พื้นที่ป่าสงวนแห่งชาติร้อยละ 10 พื้นที่ป่าอนุรักษ์ร้อยละ 8 และพื้นที่ริมทางหลวง (50 เมตร) ร้อยละ 2 ตามลำดับ
- ภาคอุตสาหกรรม
จากข้อมูลกรมโรงงานอุตสาหกรรม ซึ่งรายงานสถิติสะสมของโรงงานอุตสาหกรรม ในปี 2560 มีจำนวน 139,446 แห่ง โดยเป็นโรงงานจำพวกที่ 3 เป็นโรงงานขนาดใหญ่ ซึ่งผู้ประกอบการจะต้องได้รับอนุญาตประกอบกิจการก่อนถึงจะประกอบกิจการได้จำนวน 78,798 โรง การก่อสร้าง มีทั้งกิจกรรมที่ก่อให้เกิดฝุ่นละอองโดยตรง เช่น ฝุ่นที่เกิดจากกิจกรรมการก่อสร้าง ฝุ่นจากการทำงานของเครื่องจักร ฝุ่นจากการขนส่งวัสดุก่อสร้าง ฝุ่นจากการเปิดหน้าดิน ฝุ่นที่เกิดจากการเข้า-ออกพื้นที่โครงการก่อสร้าง และในทางอ้อม โดยการก่อสร้างซึ่งทำให้พื้นผิวจราจรลดลง ทำให้การจราจรติดขัด ส่งผลให้การระบายมลพิษจากยานพาหนะสูงขึ้น
- หมอกควันข้ามแดน
เนื่องจากมลพิษทางอากาศสามารถแพร่กระจายไปได้ในระยะไกล ทำให้ในช่วงต้นปี ระหว่างเดือนมกราคม - เมษายน ที่ประเทศไทยเกิดปัญหาสถานการณ์หมอกควันในพื้นที่ภาคเหนือ 9 จังหวัด ส่วนหนึ่งได้รับผลกระทบจากหมอกควันข้ามแดนจากข้อมูลสำนักงานพัฒนาเทคโนโลยีอวกาศและภูมิสารสนเทศ (องค์การมหาชน) ที่ได้มีการติดตามตรวจสอบสถานการณ์จุดความร้อน (Hotspot) ในพื้นที่ประเทศไทยและประเทศในอนุภูมิภาคแม่โขง จากดาวเทียม TERRA และ AQUA ระบบ MODIS ระหว่างวันที่ 1 มกราคม - 31 พฤษภาคม 2561 พบว่า
• ประเทศเมียนมา มีจุดความร้อนสะสมสูงที่สุด จำนวน 41,204 จุด ลดลงจากช่วงเวลาเดียวกันในปี 2560 ที่พบจุดความร้อนสะสม 48,041 จุด
• รองลงมา คือ สปป.ลาว พบจุดความร้อนสะสม 27,417 จุด ลดลงจากปี 2560 ที่พบจุดความร้อน 28,496 จุด
• ประเทศกัมพูชา พบจุดความร้อนสะสม 23,106 จุด เพิ่มขึ้นจากปี2560 ที่พบจุดความร้อน 20,890 จุด
• ประเทศไทย พบจุดความร้อนสะสม 14,565 จุด ลดลงจากปี2560 ที่พบจุดความร้อน16,006 จุด
• ประเทศเวียดนาม พบจุดความร้อนสะสม 9,593 จุด เพิ่มขึ้นจากปี2560 ที่พบจุดความร้อน 8,867 จุด ตามลำดับ
สำหรับสถานการณ์หมอกควันภาคใต้ประเทศไทยอาจได้รับผลกระทบในช่วงกลางปีระหว่างเดือนมิถุนายน-กันยายน ซึ่งมีสาเหตุมาจากการเผาป่าพรุบนเกาะสุมาตรา เกาะบอร์เนียวในประเทศอินโดนีเซียในช่วงฤดูแล้งซึ่งเมื่อลมมรสุมตะวันตกเฉียงใต้ที่พัดผ่านประเทศไทยในช่วงเวลาดังกล่าวจะพัดเอาหมอกควันจากเกาะสุมาตราเข้าสูุ่ ภาคใต้ฝั่งตะวันตกของประเทศไทย ซึ่งส่งผลให้หลายจังหวัดภาคใต้ได้รับผลกระทบไปด้วยฝุ่นละอองขนาดเล็ก ที่กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม มีการติดตามตรวจสอบและเฝ้าระวังสถานการณ์ต่อเนื่อง แบ่งเป็น
- ฝุ่นละอองขนาดไม่เกิน 10 ไมครอน (PM10) เป็นฝุ่นละอองที่มีผลกระทบต่อสุขภาพ เนื่องจากเมื่อหายใจเข้าไปสามารถเข้าไปสะสมในระบบทางเดินหายใจ
- ฝุ่นละอองขนาดไม่เกิน 2.5 ไมครอน (PM2.5) เป็นฝุ่นละอองที่มีผลกระทบต่อสุขภาพมากกว่า เนื่องจากสามารถเข้าไปถึงถุงลมในปอดได้
จากการติดตามตรวจสอบคุณภาพอากาศโดยสถานีตรวจวัดคุณภาพอากาศอัตโนมัติจำนวน 63 สถานีใน 33 จังหวัด พบว่าสถานการณ์ฝุ่นละอองขนาดเล็ก เฉลี่ย 24 ชั่วโมง เกินเกณฑ์มาตรฐานเฉพาะในช่วงต้นปี และปลายปีโดยพื้นที่ที่มีปัญหามลพิษทางอากาศจะเป็นพื้นที่เมืองใหญ่ที่มีการจราจรหรือบรรทุกขนส่งหนาแน่น เช่น กรุงเทพมหานคร นครราชสีมา ขอนแก่น เป็นต้น และพื้นที่ที่มีการเผาในที่โล่ง เช่น พื้นที่ภาคเหนือ กาญจนบุรี ขอนแก่น เป็นต้น พื้นที่เขตอุตสาหกรรม เช่น สระบุรี เป็นต้น
สาเหตุหลักของปัญหาฝุ่นละออง
- แหล่งกำเนิด : ฝุ่นละอองมีแหล่งกำเนิดมาจากยานพาหนะที่ใช้เครื่องยนต์ดีเซล การเผาในที่โล่ง (การเผาวัสดุการเกษตร การเกิดไฟป่า การเผาขยะกิ่งไม้ใบไม้) โรงงานอุตสาหกรรม เป็นต้น
- สภาวะทางอุตุนิยมวิทยา : ในช่วงปลายฤดูหนาวของทุกปีบริเวณความกดอากาศสูงหรือมวลอากาศเย็นจากประเทศจีนจะแผ่ลงมาปกคลุมเป็นระลอกๆ ทำให้มรสุมตะวันออกเฉียงเหนือที่พัดปกคลุมประเทศไทยตอนบนมีกำลังแรงขึ้น ประเทศไทยตอนบนมีอุณหภูมิลดลงโดยทั่วไป โดยมีอากาศเย็นถึงหนาวและหนาวจัดบางพื้นที่ แต่มีบางช่วงความกดอากาศสูงที่แผ่ลงมาปกคลุมบริเวณดังกล่าวมีกำลังอ่อนลงจึงส่งผลให้มรสุมตะวันออกเฉียงเหนือมีกำลังอ่อนลงหรือมีลมสงบตามไปด้วย ประกอบกับมีการผกผันกลับของอุณหภูมิ(Inversion) ในระดับล่าง ส่งผลให้ระดับเพดานการลอยตัวและการกระจายตัวของฝุ่นละอองอยู่ในระดับต่ำ การไหลเวียนและถ่ายเทของอากาศไม่ดีจึงทำให้เกิดการสะสมของฝุ่นละอองในบรรยากาศและมีปริมาณเพิ่มสูงขึ้น
โดยพื้นที่ที่มีปัญหา/พื้นที่เสี่ยงต่อปัญหาฝุ่นละอองซึ่งเป็นพื้นที่ที่ประสบสถานการณ์ฝุ่นละอองเกินมาตรฐานในบางช่วงเวลา ได้แก่
- พื้นที่ภาคเหนือ 9 จังหวัด
ช่วงหน้าแล้งตั้งแต่เดือนมกราคม - เมษายนของทุกปีมักพบการเพิ่มสูงขึ้นของฝุ่นละอองในพื้นที่ภาคเหนือของประเทศไทยเนื่องจากความแห้งแล้ง ประกอบกับเกษตรกรจะทำการเผาเศษวัสดุเพื่อเตรียมพื้นที่เพาะปลูกสภาวะอากาศที่แห้งและนิ่ง ภูมิประเทศบางแห่งเป็นแอ่งกระทะทำให้ฝุ่นละอองไม่แพร่กระจายและแขวนลอยอยู่ในบรรยากาศได้นาน โดยสาเหตุหลักของปัญหาหมอกควันในแต่ละพื้นที่มีดังนี้
(1) พื้นที่ป่าอนุรักษ์และพื้นที่ป่าสงวนแห่งชาติ
เกิดจากการเผาเพื่อบุกรุกพื้นที่ป่าเพื่อขยายพื้นที่ทำกินการขยายตัวอย่างรวดเร็วของการปลูกข้าวโพดเลี้ยงสัตว์แต่ด้วยความสูงและความลาดชัน เกษตรกรจึงต้องใช้วิธีการเผาเพื่อกำจัดเศษวัสดุการเกษตร การเผาเพื่อหาของป่าและล่าสัตว์รวมถึงการเผาพื้นที่รอบป่าและลุกลามเข้าสู่ป่าเกิดเป็นไฟป่า
(2) พื้นที่เกษตร
จากข้อมูลการใช้ประโยชน์ที่ดินใน 9 จังหวัดภาคเหนือ และเนื้อที่ประเทศไทย ปี 2556 พบพื้นที่ปลูกข้าวและข้าวโพดคิดเป็นร้อยละ 34 และ 26 ของพื้นที่การเกษตรในภาคเหนือตามลำดับ ซึ่งเกษตรกรจะเผาเพื่อเตรียมพื้นที่เพาะปลูกและกำจัดเศษวัสดุเช่นเดียวกับการเกษตรในพื้นที่ป่า
- กรุงเทพมหานครและปริมณฑล
ในปี 2560 กรุงเทพมหานครและปริมณฑล ยังคงพบว่าปริมาณฝุ่นละออง มีค่าเกินเกณฑ์มาตรฐานในช่วงต้นปี ทั้งนี้แหล่งกำเนิดหลักมาจากยานพาหนะที่ใช้เครื่องยนต์ดีเซล การเผาในที่โล่ง โรงงานอุตสาหกรรม ซึ่งสถิติจำนวนรถที่จดทะเบียนสะสม ณ เดือนธันวาคม 2561 พบว่ามีมากกว่า 12 ล้านคัน นอกจากนี้ยังมาจากการก่อสร้างระบบรถไฟฟ้า อาคารสูง ระบบสาธารณูปโภค ยังส่งผลให้การจราจรติดขัดทำให้ปริมาณการระบายมลพิษเพิ่มขึ้น
- พื้นที่เสี่ยงปัญหาหมอกควันภาคใต้
พื้นที่ภาคใต้ซึ่งเป็นพื้นที่ที่อาจได้รับผลกระทบจากฝุ่นละอองที่มีสาเหตุหลักมาจากการเผาพื้นที่พรุในประเทศอินโดนีเซีย
- พื้นที่ตำบลหน้าพระลาน อำเภอเฉลิมพระเกียรติจังหวัดสระบุรี
พื้นที่ตำบลหน้าพระลาน อำเภอเฉลิมพระเกียรติจังหวัดสระบุรีเป็นพื้นที่ที่มีการประกอบกิจการโรงโม่บดหรือย่อยหิน เหมืองหิน โรงงานปูนซีเมนต์ โรงงานปูนขาว โรงแต่งแร่ และกิจกรรมที่เกี่ยวเนื่อง รวมทั้งการจราจรและบรรทุกขนส่งในพื้นที่เป็นจำนวนมาก ส่งผลให้เกิดปัญหาฝุ่นละออง PM10
- พื้นที่จังหวัดอื่นๆ ที่เสี่ยงปัญหาฝุ่นละออง
นอกจากพื้นที่ที่มีปัญหาฝุ่นละอองซึ่งนำ ไปสู่การระดมสรรพกำลังในการแก้ไขปัญหาอย่างต่อเนื่องยังพบว่ายังมีพื้นที่จังหวัดอื่นๆ อีกหลายพื้นที่ที่ประสบปัญหาฝุ่นละอองขนาดเล็กในบางช่วงเวลา เช่น พื้นที่ภาคตะวันออกเฉียงเหนือ จังหวัดกาญจนบุรีเป็นต้น ซึ่งในปี 2561 และปี 2562 ที่ผ่านมาพบว่า พื้นที่ภาคตะวันออกเฉียงเหนือ มีค่าฝุ่นละอองเฉลี่ย 24 ชั่วโมง เกินมาตรฐานในช่วงเดือนมกราคม - มีนาคม ซึ่งเป็นช่วงที่พบจำนวนจุดความร้อนสะสมในพื้นที่สูง เมื่อเปรียบเทียบสัดส่วนจุดความร้อนตามการใช้ประโยชน์ที่ดิน พบว่าในพื้นที่เกษตรมีจุดความร้อนสูงสุดถึงร้อยละ 50 ของจำนวนจุดความร้อนในพื้นที่ทั้งหมด
จังหวัดกาญจนบุรีเป็นอีกพื้นที่หนึ่งที่มักพบปริมาณฝุ่นละอองเกินมาตรฐานในช่วงระหว่างเดือนมกราคม - มีนาคม ซึ่งเมื่อพิจารณาจำนวนจุดความร้อน พบว่าจำนวนจุดความร้อนในพื้นที่จังหวัดกาญจนบุรีมีจำนวน 562 จุด โดยอยู่ในพื้นที่ป่าอนุรักษ์ร้อยละ 56 พื้นที่เกษตร ร้อยละ 14 พื้นที่ป่าสงวนแห่งชาติร้อยละ 11 พื้นที่ชุมชนและอื่นๆ ร้อยละ 13
มูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ จึงได้จัดเสวนา “ไขปัญหาไข้หวัดใหญ่ในยุคโควิด-19” โดยมีผู้ทรงคุณวุฒิและแพทย์ผู้เชี่ยวชาญจากหน่วยงานภาครัฐ ร่วมแลกเปลี่ยนความรู้ที่ถูกต้องเกี่ยวกับสถานการณ์ไข้หวัดใหญ่ ในปี 2565 รวมถึงเชื้อไวรัสต่างๆ ที่กำลังเข้าสู่ช่วงแพร่ระบาดในฤดูฝน ในเดือนพฤษภาคม ความสำคัญของการป้องกันไข้หวัดใหญ่ ความเสี่ยงของการติดเชื้อไข้หวัดใหญ่ความแตกต่างของวัคซีนไข้หวัดใหญ่ 3 สายพันธุ์ และ 4 สายพันธุ์ ความรุนแรงของโรคไข้หวัดใหญ่ในกลุ่มเสี่ยงต่างๆ โดยเฉพาะในเด็กเล็ก สตรีมีครรภ์ ผู้สูงอายุ และผู้ที่มีโรคประจำตัว รวมถึงการวิจัยใหม่ๆ เพื่อให้ประชาชนเกิดความตระหนักรู้และสามารถป้องกันความเสี่ยงที่อาจเกิดขึ้นได้ โดยมี รศ. นพ. ชิษณุ พันธุ์เจริญ อาจารย์พิเศษ ภาควิชากุมารเวชศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ให้เกียรติเป็นผู้ดำเนินรายการ
ยาสามัญประจำบ้าน
ยาสามัญประจำบ้าน
- ไทลินอล 500 มก.
- ยาเม็ดขับลม (AIR-X)
- ยาเม็ดแก้ท้องอึด ท้องเฟ้อ ไซเมทิโตน
- ยาผงถ่าน 10 เม็ด รักษาอาการท้องเสีย
- ยาแก้ไอผสมมะขามป้อม 120 ml
- ยาดมสูตรน้ำ
- เจลว่านหางจระเข้ 30 กรัม
- กาวิสตอน (รสเปปเปอร์มิ้น) ชนิดชอง 4 ซอง
- ยาอม strepsil รสน้ำผึ้ง-มะนาว 8 เม็ด
- ยาบรรเทาอาการแสบร้อนกลางอก เนื่องจากกรดไหลย้อน
ศูนย์การรักษา 4 ด้านที่เป็นจุดเด่นและมีชื่อเสียงของโรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนล
- สมองและระบบประสาท
- กระดูกและข้อ
- กระดูกสันหลัง
- การรักษาแบบบูรณาการองค์รวม
30 มีนาคมของทุกปี วันไบโพลาร์โลก
โดยทุกวันที่ 30 มีนาคมของทุกปี ตรงกับ "วันไบโพลาร์โลก" กรมสุขภาพจิต กระทรวงสาธารณสุข ได้จัดกิจกรรมกระตุ้นให้สังคมไทยตระหนักถึงโรคไบโพลาร์มาอย่างต่อเนื่อง ในปี 2565 นี้ กรมสุขภาพจิต ร่วมกับสมาคมจิตแพทย์แห่งประเทศไทย ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย และสำนักงานหลักประกันสุขภาพแห่งชาติ สนับสนุนโดย ซาโนฟี่ ประเทศไทย ได้จัดงาน World Bipolar Day 2022 เปิดใจให้ไบโพลาร์ ปี 2 ภายใต้คอนเซ็ปต์ ‘ใกล้ไกล ไบโพลาร์อุ่นใจ ด้วยจิตเวชทางไกล’ โดยมีแพทย์ผู้ทรงคุณวุฒิ จิตแพทย์ และตัวแทนผู้ป่วยไบโพลาร์ ‘ดีเจเคนโด้’ ร่วมแบ่งปันความรู้และประสบการณ์ตรง เพื่อสร้างการรับรู้ในวงกว้าง ให้สังคมเข้าใจถึงพฤติกรรมผู้ป่วยโรคไบโพลาร์ เกิดทัศนคติที่ดี ไม่แบ่งแยกผู้ป่วยออกจากสังคม และสนับสนุนให้ผู้ป่วยเข้าถึงการรักษาเพื่อการอยู่ร่วมกันอย่างปกติสุข ซึ่งถือเป็นกุญแจสำคัญในการมีคุณภาพชีวิตที่ดีขึ้น โดยได้รับเกียรติจาก ดร. สาธิต ปิตุเตชะ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข เป็นประธานในพิธีเปิดTest and Go
เป็นผู้ที่ได้รับวัคซีนครบตามหลักเกณฑ์ที่กระทรวงสาธารณสุขกำหนด เดินทางมาได้จากทุกประเทศ / พื้นที่
*เป็นวัคซีนที่ขึ้นทะเบียนกับ อย. หรือ รับรองโดยกระทรวงสาธารณสุข หรือ WHO และได้รับอย่างน้อย 14 วัน ก่อนเดินทาง
เอกสารประกอบการลงทะเบียน
1. หนังสือเดินทาง
2. หลักฐานการได้รับวัคซีน
อายุ 18 ปีขึ้นไป ต้องได้รับวัคซีนครบตามข้อกำหนด
อายุต่ำกว่า 18 ปี ดังนี้
ㆍหากเดินทางพร้อมผู้ปกครอง/ผู้ดูแลไม่จำเป็นต้องได้รับวัคซีน
ㆍหากเดินทางคนเดียว
- อายุต่ำกว่า 12 ปี ต้องได้รับวัคซีนครบตามข้อกำหนด
- อายุ 12-17 ปี ต้องได้รับวัคซีนอย่างน้อย 1 โดส
3. หลักฐานการชำระเงินค่าโรงแรม SHA Extra+/AQ จำนวน 1 วัน (วันที่เดินทางมาถึง) และค่าตรวจ RT-PCR 1 ครั้ง ชุดตรวจ ATK self-test 1 ชุดและพาหนะรับส่งจากสนามบิน
4. ประกันภัยที่ครอบคลุมค่ารักษาพยาบาลในวงเงินไม่น้อยกว่า USD 20,000 (ผู้มีสัญชาติไทยไม่ต้องมีประกันและชาวต่างชาติที่มีถิ่นพำนักสามารถใช้เอกสารประกันสังคมหรือเอกสารรับรองจากนายจ้าง /หน่วยงานในไทยแทมได้)
การลงทะเบียน
1.ลงทะเบียนบนระบบ Thailand Pass (ใช้เวลาพิจารณา 3 - 7 วัน)
2.เดินทางจากสนามบิน / ด่านตม. ไปยังโรงแรมด้วยพาหนะของโรงแรมในรูปแบu sealed route
3.ตรวจหาเชื้อแบบ RT-PCR ในวันแรกและรอผลตรวจที่โรงแรม
4.ตรวจ A TK self-test ด้วยตนเองในวันที่ 5-6 และรายงานผลตรวจผ่านช่องทางที่กระทรวงสาธารณสุขกำหนด
หมายเหตุ
ยกเลิกการตรวจ RT-PCR ก่อนเดินทางเข้าไทย แต่ผู้เดินทางต้องตรวจสอบข้อกำหนดของแต่ละสายการบิน / ประเทศที่แวะเปลี่ยนเครื่อง (transit)
Entry Scheme into Thailand through
(Revised measures effective from 1 April 2022)
กรมอุตุนิยมวิทยา ชี้แจงว่า LINK
กรมอุตุนิยมวิทยา ชี้แจงว่า สาเหตุที่อุณหภูมิทั่วไทยลดลง อากาศแปรปรวน หนาวเย็น เกิดจากมวลอากาศเย็นจากประเทศจีนแผ่ลงมาปกคลุม ในขณะที่ประเทศไทยอยู่ในช่วงฤดูร้อน จนเกิดฝนฟ้าคะนอง ซึ่งจะหนาวอีก 1-2 วัน
โดยปรากฏการณ์นี้เคยเกิดขึ้น เมื่อวันที่ 25 มี.ค.59 เป็นช่วงที่มีอากาศหนาวเย็นในฤดูร้อน แต่จะเป็นระยะเวลาสั้นๆ 2-3 วันเท่านั้น ไม่ได้มาจากอิทธิพลของกระแสลมวนขั้วโลก หรือ Polar Vortex - ข่าวช่องวัน
คำชี้แจงกรมอุตุนิยมวิทยา 3 เมษายน 2565
"ทันตกรรมเชิงป้องกัน" เพื่อฟันที่ดีมีคุณภาพระยะยาว
ทพญ.วลัยลักษณ์ เกียรติธนากร ผู้อำนวยการคลินิกทันตกรรม บีดีเอ็มเอส เวลเนส คลินิก กล่าวว่า คลินิกแห่งนี้เป็นคลินิกทันตกรรมเชิงป้องกัน (Preventive Dentistry) ดูแลทั้งคนไข้ที่มีปัญหาและไม่มีปัญหาสุขภาพฟันแบบองค์รวม โดยทันตแพทย์เฉพาะสาขาเพื่อช่วยให้การเคี้ยวอาหารเป็นไปอย่างมีคุณภาพ ทำให้สุขภาพกายดีควบคู่กัน อีกทั้งยังเน้นเรื่องความสวยงาม เพราะการมีฟันสวย มีรอยยิ้มที่สวยงามและเหมาะกับใบหน้าของแต่ละคน จะทำให้มั่นใจมากขึ้น โดยมีเป้าหมายกระตุ้นให้ทุกคนหันมาดูแลตนเองก่อนเพื่อจะมีสุขภาพที่ดี มีชีวิตที่ยืนยาวภายใต้แนวคิด Live Longer Healthier and Happier
“ที่คลินิกไม่ได้รักษาโรคฟันอย่างเดียว แต่ดูแลให้ฟันมีสุขภาพที่ดีด้วย อยากให้ทุกคนเข้ามาตรวจมาปรึกษาเพื่อให้มีสุขภาพฟันที่ดี ที่นี่จะเน้นการตรวจและวางแผนรักษาแบบ Personalized เฉพาะบุคคล เพราะแต่ละคนมีไลฟ์สไตล์ที่แตกต่างกัน บางคนชอบกินของหวาน บางคนชอบกินของเปรี้ยว เหล่านี้ล้วนมีผลต่อฟันทั้งสิ้น หรือคนไข้ที่มีโรค เช่น นอนกรน เราจะรักษาโรคให้มีความนิ่งแล้วจึงวางแผนการดูแลฟันให้มีความเหมาะสมกับไลฟ์สไตล์ของแต่ละคน”
วัคซีนป้องกันโรคพิษสุนัขบ้า (แบบก่อนสัมผัสโรค) 2 เข็ม รพ.กรุงเทพ
แพ็กเกจวัคซีนป้องกันโรคพิษสุนัขบ้า (แบบก่อนสัมผัสโรค) 2 เข็ม ราคา 3,000 บาท ราคาดังกล่าวรวมค่าแพทย์และค่าบริการแล้ว สอบถาม คลินิกวัคซีน โรงพยาบาลกรุงเทพ โทร. 02-3103003, 02-755-1003 Contact Center 1719
ตรวจสุขภาพ หลังติดเชื้อโควิด-19 รพ.บี.แคร์ เมดิคอลเซ็นเตอร์
โรงพยาบาล บี.แคร์ เมดิคอลเซ็นเตอร์ มีโปรแกรมตรวจสุขภาพ หลังติดเชื้อโควิด-19 (Long Covid-19 Program) 2 โปรแกรม ได้แก่ โปรแกรม A ราคา 1,990 บาท และ โปรแกรม B ราคา 2,599 บาท ทั้งสองโปรแกรมจะตรวจการทำงานพื้นฐานของอวัยวะหลายส่วนของร่างกาย พร้อมสมุดรายงานผลตรวจ - ติดต่อนัดหมายหรือสอบถามเพิ่มเติม ศูนย์ตรวจสุขภาพ อาคารบัณดารี โทร 02 532 4444 ต่อ 1130, 1227
รพ.เซนต์หลุยส์ จัดแพคเกจ เหมา • จ่าย • จบ รักษาโควิดแบบผู้ป่วยนอก 9,500 LINK
โรงพยาบาลเซนต์หลุยส์ เสนอทางเลือกสำหรับผู้ป่วย Covid-19 กลุ่มสีเขียวอาการไม่รุนแรง ที่ต้องการ Home Isolation ด้วยตนเอง เหมาะสำหรับ ???? ผู้ป่วยที่มีอาการน้อยหรือไม่มีอาการ ???? ไม่มีโรคประจำตัว ???? ไม่มีภาวะน้ำหนักเกินมาตรฐาน ???? อายุไม่เกิน 60 ปี ???? สามารถแยกห้องนอน, ห้องน้ำ และของใช้ส่วนตัวได้
แพคเกจประกอบด้วยบริการตรวจ RT-PCR ตรวจความสมบูรณ์ของเม็ดเลือด CBC ตรวจการทำงานของตับ (SGOT, AST, SGPT, ALT) เอกซเรย์ปอด ยาฟาวิพิราเวียร์
อัตราค่าบริการราคา 9,500 บาท รวมค่าแพทย์และค่าบริการ
หมายเหตุ: *ราคาดังกล่าวไม่รวมค่ายารักษาตามอาการ
**เงื่อนไขเป็นไปตามที่โรงพยาบาลกำหนด
สามารถสอบถามข้อมูลได้ที่: แผนกอายุรกรรม โทร. 02 838 5555 ต่อ 40120-1, 40100-1 ARI Clinic โทร. 02 838 5555 ต่อ 40175
ศูนย์โควิด รพ.กล้วยน้ำไท โทร.02-3812071-5, 092-2949583 LINK
ศูนย์โควิด รพ.กล้วยน้ำไท โทร.02-3812071-5, 092-2949583 Line ID : @covid027692000
สำหรับผู้ที่มีผล ATK เป็นบวก หรือ Rt-PCR พบเชื้อ ไม่ว่าจะตรวจที่ใดมา หรือมีสิทธิอยู่ที่ใด สามารถแจ้งข้อมูลขอเข้าพักรักษาได้ที่ ศูนย์โควิด รพ.กล้วยน้ำไท เจ้าหน้าที่จะดำเนินการจัดสรรเตียง และแจ้งกลับไปยังผู้ป่วยเพื่อรับเข้ารักษา
- หากเตียงเต็ม สามารถติดต่อเข้าระบบการรักษาได้ที่ บัตรทองโทร.1330 กด14, ประกันสังคม โทร.1506 กด6
เงื่อนไขการเข้าพักรักษา โดยไม่เสียค่าใช้จ่าย
- ทุกสิทธิการรักษา ตามเงื่อนไขของสิทธิ์
- เฉพาะผู้มีสิทธิ์บัตรทอง ที่เข้าตามเกณฑ์ของ สธ.กำหนดในการเข้าพักที่โรงพยาบาล (ในกลุ่ม สีเหลือง, แดง)
- ผู้ป่วยมีผลตรวจ ATK เป็นบวก หรือมีผลตรวจ Rt-PCR พบเชื้อ
- เริ่มตั้งแต่ 22 ก.พ.2565 หรือจนกว่าจะเปลี่ยนแปลง
รพ.กรุงเทพ MODERNA ราคาพิเศษเข็มละ 1,290 บาท LINK
โรงพยาบาลกรุงเทพ (สำนักงานใหญ่) ซ.ศูนย์วิจัย จัดโปรโมชั่นกระตุ้นภูมิรับมือโควิด-19
ซื้อและ Walk-in ฉีดได้ทันที* จำนวนจำกัด 100 ท่าน/วัน
▪️ วัคซีนทางเลือก MODERNA ราคาพิเศษเข็มละ 1,290 บาท
▪️ วัคซีนทางเลือก MODERNA ราคาเข็มละ 1,650 บาท + รับฟรี! วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ 1 เข็ม (มูลค่า 950 บาท)
โปรโมชั่นนี้ตั้งแต่ 12 - 30 เม.ย. 65 (หรือจนกว่าวัคซีนจะหมด)
เงื่อนไขเป็นไปตามที่รพ.กำหนด
สามารถซื้อได้ที่เคาน์เตอร์ชีววัฒนะ ชั้น 1 อาคาร D รพ.กรุงเทพ โทร. 0 2755 1729
รพ.พระปกเกล้า แนะนำชาวจันทบุรีที่ตรวจ ATK ขึ้น 2 ขีด LINK
ตรวจ ATK ขึ้น 2 ขีด ใน อ.เมือง ต้องทำอย่างไร
ไม่มีโรคประจำตัว ผู้ใหญ่, ไม่มีอาการหรืออาการน้อย สามารถตรวจและรับยาที่ รพสต. ใกล้บ้าน
- มีปัญหาเรื่องยา ปรึกษาได้ที่ 063-6273908, 064-7463831
- ศูนย์โทรศัพท์ Hotline 039-319690, 039-319695
- นอกเวลาราชการ 094-4488605, 061-5108190
อายุเกิน 60 ปี, มีน้ำหนักตัวเกิน 90 กก., มีโรคประจำตัว, เด็ก หรือมีอาการมาก ไปจุดคัดกรอง อบจ. (Hall A)
รพ.ชลบุรี เปิด Walk in วัคซีนโมเดอร์น่า 11-19 เมษายน 65 LINK
Walk in วัคซีนโมเดอร์น่า สำหรับประชาชนอายุ 12 ปีขึ้นไป และประชาชนกลุ่มเสี่ยง
วันที่ 12 เม.ย. 65 เวลา 8.00 น. - 14.00 น.
- ลงทะเบียนณอาคารผู้ป่วยนอกชั้น 1 รพ. ชลบุรี
วันที่ 11-19 เม.ย. 65 เวลา 18.00 น. - 20.00 น. จำกัด 50 คน ต่อวัน
- งานนมัสการพระพุทธสิหิงค์ บูธงาน รพ.ชลบุรี บริเวณสนามหน้าศาลากลาง จ.ชลบุรี
รพ.นครพิงค์ เปิด Walk in ฉีดวัคซีน Moderna เข็ม 4 LINK
โรงพยาบาลนครพิงค์ รับ Walk in ฉีดวัคซีน Moderna เข็ม 4 ‼️ ที่ศูนย์ฉีดวัคซีนรพ.นครพิงค์และเซ็นทรัลแอร์พอร์ต
องค์การบริหารส่วนจังหวัดเชียงใหม่ ร่วมกับ สภากาชาดไทยและรพ.นครพิงค์ เปิดรับ Walk in ฉีดวัคซีน Moderna เข็ม 1,2,3 และ 4 ฟรี (กรณีเข็มที่ 4 ต้องเว้นระยะจากเข็มที่ 3 อย่างน้อย 4 เดือน ปรับตามประกาศของกรมควบคุมโรค) รับบริการได้ที่
1.ศูนย์ฉีดวัคซีนโรงพยาบาลนครพิงค์ เปิดทุกวัน 8.00-14.00 น.
2.ศูนย์ฉีดวัคซีนเซ็นทรัลแอร์พอร์ต เปิดทุกวัน 8.00-14.00 น.(หลังจากเดือนเม.ย. เปิดให้บริการเฉพาะเสาร์-อาทิตย์)
Miracle CSR ธุรกิจแห่งการให้
Miracle CSR คือโอกาสที่ Nusa CSR เปิดให้มีส่วนร่วมโดยการเข้าร่วมเป็นสมาชิก "ให้โอกาสอันยิ่งใหญ่ ในการสร้างอาชีพ สร้างรายได้ ให้กับคุณและครอบครัว แนวทางที่สร้างความแข็งแกร่งให้กับทุกภาคส่วนที่เกี่ยวข้องได้ดีที่สุด และเป็ นช่องทางการจําหน่ายที่นับว่ามีประสิทธิภาพสูง เมื่อเทียบกับการตลาดแบบเดิม ๆ เพราะสามารถกระจายสินค้า ผลประโยชน์ แนวคิด การเป็ นผู้ ให้ ตลอดจนองค์ความรู้ต่างๆจากบริษัทฯ ไปยังผู้บริโภคได้ โดยตรง โดยระบบของ Nusa CSR"
วัตถุประสงค์
เพื่อสร้างโอกาสให้ต้นนํ้า แบ่งปันกําไรจนถึงปลายนํ้า ผลตอบแทนของสมาชิกสามารถเติบโตได้ ไม่มีขีดจํากัดเป็นสัดส่วนตาม Eco-System ที่เติบโตตามการจับจ่ายของสมาชิก จุดเด่นของแผนรายได้ คือ ไม่ต้องสะสมยอดรายได้ของสมาชิกจะมาจากการอุปโภค บริโภค ของตัวเองและจากการแนะนําสินค้าให้ผู้อื่น ด้วยระบบแห่งการแบ่งปัน สมาชิกทุกคนสามารถเติบโตไปพร้อมๆ กับเราได้อย่างรวดเร็วและมั่นคง เพียงแค่สมาชิกจับจ่ายใช้สอยใน Eco-System ของเรา สมาชิกก็จะได้รับโอกาสในการเป็ นเจ้าของธุรกิจแสนล้านและเติบโตไปพร้อมๆ กับเรา
ในพื้นที่อ.เมือง อุบลราชธานี ติดต่อหน่วย CMU
สถานการณ์โลก ไทยอยู่อันดับ 9
สถานการณ์โลก ไทยอยู่อันดับ 9 มีจำนวนเคสในรอบ 7 วัน ที่ 146,474 ราย เสียชีวิต 799 ราย
เบอร์โทร. QR Code รพ.จังหวัด และ รพ.อำเภอ
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว
QR Code รพ.หลักในชลบุรี ที่พร้อมดูแลผู้ติดเชื้อ
ท่านที่มีสิทธิ์รักษาตามรายชื่อโรงพยาบาลในภาพนี้ สามารถ สแกน QR Code ของโรงพยาบาลได้เลย
รวม 11 เบอร์ 11 อำเภอ จ.ชลบุรี
หน่วยงาน คลินิก ร้านยา ของเอกชน ในจ.นครสวรรค์
ถาม-ตอบ สิทธิรักษาโรคไต ประกันสังคม
ถาม - ม40 (ใช้สิทธิได้หรือไม่)
ประกันสังคมตอบ - สำหรับผู้ประกันตนตามมาตรา 40 จะได้รับสิทธิประโยชน์เงินทดแทนการขาดรายได้ กรณีประสบอันตรายหรือเจ็บป่วยตามหลักเกณฑ์เงื่อนไขและสามารถใช้สิทธิการรักษาพยาบาลของบัตรประกันสุขภาพถ้วนหน้า (บัตรทอง)
มาตรา 40 สำนักงานประกันสังคมไม่ได้คุ้มครองสิทธิรักษาพยาบาล
มาตรา 40 ตรวจสอบสิทธิรักษาพยาบาลติดต่อสายด่วนหลักประกันสุขภาพ บัตรทอง 0-2590-1565-79 สายด่วน 1330 ค่ะ
ถาม - เป็นโควิดหายคะ จะชดเชยใช้อีกสารตัวไหนคะ จะปริ้นค่ะของมี.40
ประกันสังคมตอบ - การยื่นเรื่องเบิกเงินทดแทนการขาดรายได้ กรณีประสบอันตรายหรือเจ็บป่วย
1. แบบคำขอรับประโยชน์ทดแทนผู้ประกันตนตามมาตรา 40 (สปส.2-01/ม.40) พร้อมลงนามในแบบฟอร์มด้วยตนเอง
2. บัตรประจำตัวประชาชนตัวจริง
3. ใบรับรองแพทย์ตัวจริง หรือ สำเนาเวชระเบียน (ให้เจ้าหน้าที่เวชระเบียนเซ็นรับรองสำเนาถูกต้อง)
4. สำเนาสมุดบัญชีเงินฝากธนาคารประเภทออมทรัพย์ สามารถใช้ได้ 4 ธนาคารดังนี้
-ธนาคารกรุงไทย จำกัด(มหาชน) KTB
-ธนาคารกรุงศรีอยุธยา จำกัด (มหาชน) BAY
-ธนาคารออมสิน
-ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร (ธ.ก.ส.)ครับ
แบบคำขอรับประโยชน์ทดแทนผู้ประกันตนตามมาตรา 40 (สปส.2-01/ม.40) ครับ
ถาม - สอบถามคะขึ้นทะเบียนว่างงานกรณีถูกเลิกจ้างแล้วเมื่อวันที่ 1/4/65 เงินประกันสังคมได้ 70% ใช่ไหมคะ แล้วจะได้เมื่อไหร่คะ ?
ประกันสังคมตอบ - สิทธิที่จะได้รับกรณีว่างงาน ปัจจุบัน
1.กรณีถูกเลิกจ้าง กรณีถูกเลิกจ้าง จะได้รับเงินว่างงานในอัตราร้อยละ 50 ของค่าจ้าง โดยคำนวณจากฐานค่าจ้างจริงแต่สูงสุดไม่เกิน 15,000 บาท เป็นระยะเวลาไม่เกิน 180 วันใน 1 ปีปฏิทิน (เริ่ม 1 มีนาคม 2565เป็นต้นไป)
2.กรณีลาออก หรือ สิ้นสุดสัญญาจ้าง กรณีลาออกหรือสิ้นสุดสัญญาจ้าง จะได้รับเงินว่างงาน ในอัตราร้อยละ 30 ของค่าจ้าง โดยคำนวณจากฐานค่าจ้างจริงแต่สูงสุด ไม่เกิน 15,000 บาท เป็นระยะเวลา ไม่เกิน 90 วัน ใน 1 ปีปฏิทิน ( เริ่ม 1 มีนาคม 2565เป็นต้นไป)
กรณีผู้ประกันตนต้องการตรวจสอบการอนุมัติสิทธิว่างงาน เนื่องจากเป็นข้อมูลส่วนบุคคล แนะนำติดต่อตรวจสอบผ่านช่องทางดังต่อไปนี้ครับ
- Inbox facebook (ตลอด 24 ชั่วโมง)
- live chat (ตลอด 24 ชั่วโมง)
- หรือ โทรสายด่วน 1506 กด 1 ได้ตลอด 24 ชั่วโมง
- สำนักงานประกันสังคมที่สะดวก ยกเว้น สำนักงานใหญ่ในบริเวณกระทรวงสาธารณสุข
เพื่อนถามต่อ - ทำไมในเน็ทบอก 70% อะคะ
เพื่อนตอบ - 70% อันนั้นก่อน 1 มีค ครับ ช่วงโควิด
ถาม - กรณีลาออกแล้ว..อยากได้เงินคืน..โดยไม่ต้องรออายุ55ปีคะ
ประกันสังคมตอบ - เบื้องต้นต้องขออภัยในความไม่สะดวกครับ ณ ปัจจุบันกรณีชราภาพเป็นไปตามหลักเกณฑ์ กรณีชราภาพโดยจะต้องสิ้นสุดความเป็นผู้ประกันตน และมีอายุไม่ต่ำกว่า 55 ปีบริบูรณ์ครับ จึงจะยื่นเรื่องขอรับเงินคืนได้ครับ หากมีการเปลี่ยนแปลงจะแจ้งให้ทราบต่อไปครับ
ถาม - ม.40 ส่งเดือน ธ.ค 64 แล้วก็มาส่งเดือน ก.พ มี.ค 65 เลย แต่ติดโควิดเดือน เม.ย 65 เบิกได้ไหมคะ ถ้าดูย้อนหลัง 4 เดือน
ประกันสังคมตอบ - เงื่อนไขการรับสิทธิเงินทดแทนการขาดรายได้มาตรา40
จะได้รับสิทธิเมื่อนำส่งเงินสมทบครบ3เดือนติดต่อกัน หรือภายใน4เดือนย้อนหลัง มีการนำส่งเงินสมทบรวมกันไม่น้อยกว่า3เดือน ก่อนเดือนที่ประสบอันตราย หรือ เจ็บป่วยค่ะ
ถาม - ม.40 ถ้าขาดส่งมา 3ปีแล้ว สามารถส่งต่อได้อีกไหมคะ
ประกันสังคมตอบ - ระยะเวลาในการนำส่งเงินสมทบ มาตรา 40
1. การนำส่งเงินสมทบจ่ายได้เป็นรายเดือน เดือนละ 1 ครั้ง ตั้งแต่วันที่ 1 ของเดือนนั้นจนถึงวันสุดท้ายของเดือน โดยไม่สามารถจ่ายเงินสมทบย้อนหลังได้
2. กรณีที่ขาดส่งเงินสมทบ หรือไม่ได้ส่งเงินสมทบต่อเนื่อง จะไม่สิ้นสภาพความเป็นผู้ประกันตน แต่การใช้สิทธิประโยชน์กรณีต่างๆจะเป็นไปตามหลักเกณฑ์และเงื่อนไขของแต่ละกรณี
3. เมื่อขาดส่งเงินสมทบ แล้วประสงค์จะส่งต่อ ให้นำส่งเงินสมทบตั้งแต่เดือนปัจจุบันเป็นต้นไป จะไม่สามารถชำระเงินสมทบย้อนหลังได้ครับ
มาตรา 40 จะไม่มีการตัดสิทธิผู้ประกันตนครับ หากขาดส่งเงินสมทบและไม่ได้มีการลาออกจากมาตรา 40 จะสามารถนำส่งเงินสมทบในงวดเดือนปัจจุบันได้เลยครับ
มาตรา 40 นำส่งเงินสมทบย้อนหลังไม่ได้ครับ ให้เริ่มนำส่งเงินสมทบงวดเดือนปัจจุบัน และสามารถนำส่งเงินสมทบล่วงหน้าได้ไม่เกิน 12 เดือนครับ
เพื่อนช่วยตอบ - ได้ครับ ผมขาดส่ง มค65 เดือนเดียว เบิกได้ครับ
ถาม - ค่าทดแทน ม.39 ได้แค่วันหละ80เองเหรอค่ะได้น่อยมาก
ประกันสังคมตอบ - สำหรับเงินทดแทนการขาดรายได้ ผู้ประกันตนมาตรา 39 จะมีสิทธิเมื่อนำส่งเงินสมทบภายใน 15 เดือนย้อนหลังมีการนำส่งเงินสมทบรวมกันไม่น้อยกว่า 3 เดือนจะติดต่อกันหรือไม่ก็ตาม ก่อนวันที่เข้ารับการรักษาพยาบาล โดยแพทย์มีคำสั่งให้หยุดพักรักษาตัว และต้องมีรายได้จากการประกอบอาชีพ
- จะได้รับเงินทดแทนการขาดรายได้ร้อยละ 50 โดยคิดจากฐานอัตราการนำส่งเงินสมทบของผู้ประกันตนมาตรา 39 (4,800 บาท) ครั้งละไม่เกิน 90 วัน ปีละไม่เกิน 180 วัน เว้นแต่โรคเรื้อรังไม่เกิน 365 วัน ค่ะ
ถาม - หากขาดส่ง 1 เดือนสามารถเบิกได้ไหมคะ..แล้วพอเช็คในระบบขึ้นจ่ายแค่เดือน ม.ค 65 แต่จริงๆแล้วจ่ายของเดือน มี.ค เม.ย.แล้วค่ะแต่จ่ายผ่านแอฟ
ประกันสังคมตอบ - เงินทดแทนการขาดรายได้มาตรา 40 กรณีประสบอันตรายหรือเจ็บป่วย
จะได้รับสิทธิเมื่อนำส่งเงินสมทบครบ 3 เดือนติดต่อกัน หรือ ภายใน 4 เดือนย้อนหลัง มีการนำส่งเงินสมทบรวมกันไม่น้อยกว่า 3 เดือน ก่อนเดือนที่จะประสบอันตราย หรือ เจ็บป่วย
ทางเลือกที่1,2 : เงินทดแทนการขาดรายได้กรณีประสบอันตราย หรือ เจ็บป่วยนอนพักรักษาตัวในโรงพยาบาลเป็นวันละ 300 บาท และกรณีไม่นอนพักรักษาตัวในโรงพยาบาล แต่มีใบรับรองแพทย์ให้หยุดพักรักษาตัวตั้งเเต่ 3 วัน ขึ้นไปจะได้รับเงินทดแทนการขาดรายได้วันละ 200 บาท ปีละไม่เกิน 30 วัน กรณีไปพบแพทย์(ผู้ป่วยนอก)และแพทย์มีความเห็นให้หยุดพักรักษาตัวไม่เกิน 2 วัน ได้รับเงินทดแทนการขาดรายได้ปีละไม่เกิน 3 ครั้ง ครั้งละ 50 บาท และมีใบรับรองแพทย์
ทางเลือกที่ 3 :
1.เมื่อนอนโรงพยาบาลตั้งเเต่ 1 วันขึ้นไป หรือ แพทย์ระบุให้หยุดงานตั้งเเต่ 3 วันขึ้นไปในอัตราวันละ 300 บาท
2.ไม่ได้นอนพักรักษาในโรงพยาบาล แต่แพทย์ให้หยุดพักรักษาตัวตั้งเเต่ 3 วันขึ้นไป ได้รับเงินทดแทนการขาดรายได้วันละ 200 บาท (เงื่อนไขการเกิดสิทธิยังคงเดิม)ทั้งนี้ ผู้ประกันตนที่ได้รับสิทธิเงินทดแทนการขาดรายได้ตามข้อ1 และข้อ 2เมื่อรวมกันเเล้วต้องไม่เกิน 90 วันต่อปี ครับ
ตารางบริการคลินิกแพทย์แผนไทย รพ.บางกระทุ่ม
ประชาชนในอ.เถิน ติดต่อ รพ.สต.
ปตท. OR แนะนำ 6 เทคนิคขับเกียร์ออโต้ ช่วยประหยัดน้ำมัน
ปตท. OR แนะนำ 6 เทคนิคขับเกียร์ออโต้ ช่วยประหยัดน้ำมัน
1. ปล่อยไหล เข้าเกียร์ D ประคองเบรค
2.ใส่เกียร์ N เมื่อจอดติดไฟแดง
3.อย่า "คิกดาวน์" เมื่อไม่จำเป็น
4.ถอนคันเร่ง ช่วยเปลี่ยนเกียร์เร็วขึ้น
5.เลี้ยงความเร็วให้คงที่ เมื่อขับทางโกล
6.ปรับเกียร์ L เมื่อขึ้นทางชัน
Grand Prix แนะนำ 6 วิธีขับรถที่ฉลาด ประหยัดค่าน้ำมัน 25%
Grand Prix แนะนำ 6 วิธีขับรถที่ฉลาด ประหยัดค่าน้ำมัน 25%
1.ขับอย่างนิ่มนวล
2.ลดความเร็วลง
3.อย่าบรรทุกของที่ไม่จำเป็น
4.ลดการต้านลม
5.อย่าติดเครื่องทิ้งไว้
6.ใช้โหมด Cruise Control
Money Buffalo แง้มสูตรขับรถแบบประหยัดน้ำมัน เซฟน้ำมัน
8 สูตรใช้รถให้ประหยัดน้ำมัน
1.รักษาความเร็วรถให้คงที่ - รักษาความเร็วในช่วง 80-96 กม./ชม.ประหยัดพลังงานเพิ่มขึ้น 33%
2.ค่อย ๆ เหยียบคันเร่ง - 5 วิแรก ให้เพิ่มความเร็วเพียง 25 กม./ชม.ประหยัดพลังงานเพิ่มขึ้น 30%
3.ไม่เหยียบเบรกกระทันหัน - ไม่ควรเร่งความเร็วบ่อยๆและเหยียบเบรคอย่างหนัก ลดการใช้เชื้อเพลิงลงได้ 40%
4.ปิดแอร์รถบ้างแอร์รถยนต์ใช้พลังงาน - จากการเผาผลาญน้ำมันลดการใช้เชื้อเพลิงลงได้
5.หลีกเลี่ยงเทินของบนหลังคารถ - เพราะเป็นการเพิ่มแรงต้านลม ประหยัดพลังงานเพิ่มขึ้น 8%
6.เช็กแรงดันลมยางและสภาพรถ - สภาพรถควรสมบูรณ์ และ มียางสมมากกว่า 10 psi ลดการใช้เชื้อเพลิงลงได้ 5-10%
7.ไม่เปิดกระจกหน้าต่างรถ - ตามหลักอากาศพลศาสตร์ทำให้เกิดแรงต้านมากขึ้น ลดการใช้เชื้อเพลิงลงได้
8.ขนของน้อยลง - น้ำหนักมากขึ้น เครื่องยนต์ต้องใช้พลังงานมากขึ้นประหยัดพลังงานเพิ่มขึ้น
14 วิธีขับรถประหยัดน้ำมัน โดย Kapook.com
14 วิธีขับประหยัดน้ำมัน
1.ไม่ขับรถเร็ว ถ้าไม่รีบ ควรขับ รถด้วยความเร็ว 80 กม./ชม.
2.อย่าออกรถเร็วแบบรถแข่งเพราะจะทำให้เปลืองน้ำมันมาก
3.ขับรถด้วยความเร็วสม่ำเสมอตลอดการเดินทาง
4.วางแผนการใช้รถก่อนออกจากบ้าน
5.มีจุดหมายในการเดินทางชัดเจน
6.ดับเครื่องทุกครั้งหากต้องจอดรถทิ้งไว้ 3-4 นาทีขึ้นไป
7.อุ่นเครื่องยนต์ในตอนเช้าประมาณ 1-2 นาทีก่อนใช้รถ
8.ใช้เครื่องปรับอากาศเท่าที่จำเป็น
9.ควรเติมลมยางให้ได้มาตรฐานอยู่เสมอ
10.หมั่นตรวจเช็กสภาพรถ
11.หมั่นตรวจเช็กไส้กรองอยู่เสมอ
12.อย่าบรรทุกของหนักเกินพิกัดหรือนำสิ่งของไว้บนหลังคารถ
13.ควรเปลี่ยนเกียร์ตามจังหวะและรอบความเร็วในการใช้งาน
14.เลือกใช้น้ำมันหล่อลื่นที่เหมาะสมกับการใช้งาน
บันทึกหลักการและเหตุผล ประกอบร่างพระราชบัญญัติกัญชา กัญชง พ.ศ....
บันทึกหลักการและเหตุผล ประกอบร่างพระราชบัญญัติกัญชา กัญชง พ.ศ....
หลักการ ให้มีกฏหมายว่าด้วยกัญชา และกัญชง
เหตุผล โดยที่ประมวลกฎหมายยาเสพติดไม่ใด้กำหนดให้กัญชาเป็นยาเสพติดให้โทษ ซึ่งเปิดโอกาสให้มีการนำกัญชา กัญชงมาใช้ประโยชน์ทางการแพทย์ การวิจัย และนำมาใช้ในอุตสาหกรรมอื่น แต่ก็ยังมีข้อจำกัดบางประการที่ส่งผลกระทบต่อโอกาสในการนำไปใช้ในการดูแลสุขภาพ การป้องกัน บำบัดโรค รักษาผู้ป่วย การศึกษาวิจัยหรือการพัฒนานวัตกรรม ฉะนั้น เพื่อให้ประชาชนมีสิทธิในการดูแลสุขภาพของตน และส่งเสริมให้มีการใช้ประโยชน์จากกัญชา กัญชง ให้เกิดประโยชน์สูงสุด ทั้งในด้านการพัฒนาภูมิปัญญา ด้านการแพทย์แผนไทย ตลอดจนองค์ความรู้ทางการแพทย์แผนปัจจุบัน และอุตสาหกรรมอื่นๆ จึงควรสนับสนุนการนำกัญชา กัญชง มาใช้ในการศึกษาวิจัย การใช้ประโยชน์ในทางการแพทย์ สุขภาพ การใช้ตามวิถีชีวิตชุมชน ตลอดจนเปิดโอกาสให้มีการผลิต ขาย นำเข้า ส่งออก หรือมีไว้ในครอบครองเพื่อส่งเสริมเกษตรกรรม อุตสาหกรรม และเศรษฐกิจของประเทศและเพื่อเป็นการคุ้มครองผู้บริโภคมิให้มีการบริโภคกัญชา กัญชงอย่างไม่เหมาะสม ซึ่งอาจเป็นอันตรายต่อผู้บริโภคสมควรกำหนดมาตรการกำกับดูแล ควบคุมการขาย การโฆษณาและการบริโภคกัญชา กัญชง เพื่อคุ้มครองสุขภาพของบุคคล จึงจำเป็นต้องตราพระราชบัญญัตินี้
ศูนย์ฉีดวัคซีนกลางบางซื่อ บริการ walk in ฉีดทุกเข็ม 1,2,3,4
ศูนย์ฉีดวัคซีนกลางบางซื่อ
เปิดบริการฉีดวัคซีนป้องกันโรคโควิด 19
ทุกเข็ม (เข็มที่ 1,2,3,4)
โดยไม่ต้องจองคิวล่วงหน้า (Walk in)
คนไทย / ต่างชาติ / ต่างด้าว
ผู้ที่มีอายุตั้งแต่ 12 ปี เข้ารับบริการที่ประตู 2
(เลือกวัคซีนไฟเซอร์ หรือ แอสตร้าเซเนก้า)
เด็กอายุ 5-11 ปี เข้ารับบริการที่ประตู 3
(วัคซีนไฟเซอร์ฝาสีส้ม)
ทุกวัน เวลา 9.00 - 16.00 น.
รอคิวตามลำดับที่เก้าอี้สีแดง
สำหรับคนเดิมบางซื่อ
(ผู้ที่เคยฉีดเข็มที่ 2 และ 3 กับศูนย์ฯในสูตรPP,AP,AM,MM,AAP,AAM
และครบกำหนดระยะรับเข็มกระตุ้นแล้ว)
ศูนย์ได้ทำการนัดฉีดเข็มกระตุ้น
เข็มที่ 3,4 แล้วอัตโนมัติ
ท่านสามารถตรวจสอบวันนัด
ผ่านช่องทางแอพพลิเคชั่น "Vaccine บางซื่อ"
บทที่ 1 สรุปสถานการณ์การระบาดของโรคโควิด 19ในประเทศไทย
จากการระบาดระลอกที่ 1 หรือระลอกแรก ซึ่งเป็นจุดเริ่มต้นการระบาดของเชื้อไวรัสสายพันธุ์ใหม่เกิดขึ้นที่เมืองอู่ฮั่น สาธารณรัฐประชาชนจีน เมื่อวันที่ 30 ธันวาคม 2562 ทําให้การระบาดแพร่กระจายอย่างรวดเร็วไปทั่วโลกส่งผลให้มีผู้ป่วยหนักและผู้เสียชีวิตจํานวนมาก สําหรับประเทศไทยพบผู้ติดเชื้อโควิด 19 ตั้งแต่เดือน มกราคม 2563 จนเมื่อวันที่ 11 มีนาคม 2563 องค์การอนามัยโลกได้ประกาศให้โรคโควิด 19เป็นโรคที่มีการระบาดใหญ่ไปทั่วโลก (Pandemic) ในขณะที่ประเทศไทยพบการติดเชื้อเป็นกลุ่มก้อน มีการแพร่ระบาดในสนามมวย และสถานบันเทิง จึงได้ประกาศปิดเมืองในพื้นที่กรุงเทพมหานคร ครั้งแรก เมื่อเดือนมีนาคม 2563 และประกาศสถานการณ์ฉุกเฉินในทุกเขตท้องที่ทั่วราชอาณาจักร ตาม พ.ร.ก.การบริหารราชการในสถานการณ์ฉุกเฉิน พ.ศ.2548 ตั้งแต่วันที่ 26 มีนาคม 2653 เป็นต้นมา ทุกคนที่เดินทางเข้าประเทศไทยต้องถูกกักกันในสถานกักกันของรัฐ คัดกรองและติดตามการสัมผัสและค้นหาผู้ป่วย เน้นการรักษาความสะอาดโดยเฉพาะ การล้างมือ เว้นระยะห่าง การเลี่ยงฝูงชน ใส่หน้ากากอนามัย สถานการณ์ค่อยๆ ดีขึ้นตามลําดับ จนสามารถควบคุมสถานการณ์ได้พบผู้ติดเชื้อในประเทศรายสุดท้ายเมื่อวันที่ 25 พฤษภาคม 2563 และไม่พบผู้ติดเชื้อในประเทศไทยยาวนานติดต่อกันกว่า 100 วัน
ต่อมาการระบาดระลอกที่ 2 หรือระลอกใหม่เกิดขึ้นอีกครั้งเมื่อกลางเดือนธันวาคม 2563 มีศูนย์กลางการระบาดอยู่ที่ตลาดกลางกุ้ง จังหวัดสมุทรสาครซึ่งเป็นศูนย์กลางการค้า อาหารทะเลขนาดใหญ่ของประเทศ ต่อมาการแพร่ระบาดเชื่อมโยงไปในสถานประกอบการ โรงงาน และชุมชนใกล้เคียง เป็นสะเก็ดไฟเล็กๆ ในหลายจังหวัดทั่วประเทศ โดยเฉพาะภาคกลาง และทางภาคตะวันออก การระบาดระลอกใหม่นี้หนักเป็น 1.8 เท่าของระลอกแรกที่จุดวิกฤตสุด แต่ด้วยมาตรการจาก ศบค. และยุทธศาสตร์การจัดการเชิงพื้นที่ระดับจังหวัดที่เข้มแข็ง จึงสามารถควบคุมสถานการณ์การแพร่ระบาดของโรคโควิด 19 ระลอกใหม่ให้อยู่ในภาวะสงบ ไม่เกินศักยภาพระบบสาธารณสุขรองรับได้
ซึ่งการระบาดในระลอกนี้ใช้ช่วงระยะเวลาสั้นๆ เพียง 3 เดือน (15 ธันวาคม 2563 –31 มีนาคม 2564) หลังจากนั้นการระบาดระลอกที่ 3 เมื่อต้นเดือนเมษายน 2564 พบคลัสเตอร์การระบาดใหม่จากสถานบันเทิงย่านทองหล่อ-เอกมัย กรุงเทพมหานคร คลัสเตอร์แคมป์คนงาน ในกรุงเทพมหานคร และคลัสเตอร์เรือนจํานราธิวาส โดยช่วงแรกของการระบาดระลอกนี้เกิดจากสายพันธุ์กลายพันธุ์ในประเทศอังกฤษ อันเป็นสายพันธุ์ที่มีความสามารถในการแพร่เชื้อสูง
เป็นเหตุให้จํานวนยอดผู้ป่วยโควิด 19 รายวันสูงขึ้น และพื้นที่การแพร่ระบาดที่ขยายเป็นวงกว้าง ซึ่งคาบเกี่ยวกับช่วงการเดินทางกลับภูมิลําเนา และการท่องเที่ยวในเทศกาลสงกรานต์
อย่างไรก็ตาม การระบาดระลอกนี้ พบว่าเกิดการระบาดจากหลายสายพันธุ์ โดยเฉพาะสายพันธุ์เดลต้าที่กลายมาเป็นสายพันธุ์หลักครอบคลุมกว่าร้อยละ 80 ของผู้ติดเชื้อ ซึ่งสายพันธุ์นี้มีความสามารถจับเซลล์ของมนุษย์ได้ง่ายขึ้น แพร่กระจายเชื้อได้รวดเร็ว และลงปอดได้เร็วขึ้น ทั้งนี้ การเพิ่มขึ้นของสายพันธุ์ที่น่ากังวลที่แพร่เชื้อได้ง่ายขึ้นและอันตรายมากขึ้นนี้ ได้ทําให้จํานวนยอดผู้ติดเชื้อกลับมาเพิ่มขึ้นอีกในหลายหลายประเทศ โดยเฉพาะอย่างยิ่ง ในผู้ที่ยังไม่ได้รับวัคซีน มีผู้ป่วยอาการรุนแรงทําให้สถานพยาบาลต้องรับภาระที่หนักมากขึ้นไปอีก
ในขณะที่การระบาดระลอกที่ 4 หรือระลอกมกราคม 2565 (1 มกราคม 2565 ถึงปัจจุบัน) จะต่อเนื่องมาจากในช่วงปลายเดือนพฤศจิกายน 2564 องค์การอนามัยโลก (WHO) ประกาศชื่อโควิดสายพันธุ์ใหม่ B.1.1.529 ว่า “โอไมครอน” พร้อมจัดให้อยู่ในกลุ่มเชื้อกลายพันธุ์ที่น่ากังวล (Variants of Concern : VOC) ตรวจพบครั้งแรกในแอฟริกาใต้ซึ่งเป็นสายพันธุ์ของเชื้อที่มีการกลายพันธุ์มากถึง 32 จุด หลายประเทศในยุโรปและเอเชีย รวมถึงประเทศไทยเริ่มใช้มาตรการต่าง ๆ รวมถึงการคุมเข้มการเดินทางจากประเทศ ในทวีปแอฟริกาใต้ ซึ่งมีการแพร่ระบาดของโควิดสายพันธุ์โอไมครอน สําหรับประเทศไทย พบผู้ติดเชื้อสายพันธุ์โอไมครอนรายแรก ในวันที่ 6 ธันวาคม 2564 เป็นชายไทย เดินทางมาจากสเปน และมีการติดเชื้อในประเทศรายแรก ซึ่งเป็นภรรยาของชายคนดังกล่าว ประกอบกับพบผู้เชื้อที่เดินทางเข้าประเทศในรูปแบบ Test and Go เพิ่มขึ้น 2 เท่า จึงมีการระงับการลงทะเบียนเข้าราชอาณาจักรในรูปแบบ Test and Go ตั้งแต่ วันที่ 22 ธันวาคม 2564
ด้านการสร้างแพทย์
รามาธิบดีมีการพัฒนานวัตกรรมการศึกษา โดยจัดทำ 2 หลักสูตรร่วมกับ 2 คณะของมหาวิทยาลัยมหิดล เพื่อรับมือกับยุค Disruption และเพื่อตอบสนองความสนใจที่หลากหลายของนักศึกษาแพทย์ โดยได้ร่วมมือกับ คณะวิศวกรรมศาสตร์ผลิต “แพทย์นวัตกร” ซึ่งเป็นแพทย์ที่มี 2 ปริญญา หลักสูตรแพทยศาสตรบัณฑิต และวิศวกรรมศาสตร์มหาบัณฑิต รวมถึงความร่วมมือกับวิทยาลัยการจัดการในการผลิต “แพทย์นักบริหาร” เพื่อส่งเสริมให้แพทย์มีทักษะและความพร้อมในการบริหารจัดการโรงพยาบาล และองค์กรด้านสาธารณสุขตั้งแต่ระดับชุมชนจนถึงระดับประเทศ นอกจากนี้ยังมีหลักสูตรผลิต “นักฉุกเฉินการแพทย์ทางด้านวิทยาศาสตร์การกีฬา – Sport Paramedic” เป็นหลักสูตรร่วมระหว่างภาควิชาฉุกเฉินการแพทย์ และสาขาวิชาวิทยาศาสตร์การกีฬาep. 1 “ใครเป็นใครใน PDPA”
10.การเก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลส่วนบุคคลที่มีความละเอียดอ่อน (Sensitive Personal Data)
มาตรการและหลักเกณฑ์ สำหรับผู้เดินทางเข้ามาในราชอาณาจักร
กินผงชูรส ทำให้ผมร่วงจริงหรือไม่ - รพ.จุฬาฯ LINK
กินผงชูรส ทำให้ผมร่วงจริงหรือไม่
ไม่จริง ไม่มีรายงานถึงความสัมพันธ์ของการบริโภคผงชรสแล้วผมร่วง โดยผู้ป่วยมักเชื่อมโยงเหตุการณ์ต่าง ๆ เกี่ยวกับอาการผมร่วง เช่น สวมหมวกนิรภัย หรือรับประทานบะหมี่กึ่งสำเร็จรูปบ่อยๆ แล้วทำให้ผมร่วง
สาเหตุของผมร่วงมีอะไรบ้าง
- โรคผมบางจากพันธุกรรมถ่ายทอดผ่านทางหลายยีนมากกว่าร้อยละ 60 ของผู้ชายมีภาวะผมบาง ศีรษะล้าน ถ่ายทอดจากบิดา
- ฮอร์โมนเพศชาย จะทำให้เส้นผมเล็กลงเรื่อย ๆ และหลุดร่วงไปในที่สุด เริ่มจากแนวผมที่เถิกร์นไปหรือบางตรงกลางกระหม่อม
- ผมร่วงหลังคลอด
- ผมร่วงฉับพลันจากการเจ็บป่วย มีไข้สูงต่อเนื่อง เช่น ไข้เลือดออก
- การเจ็บป่วยเรื้อรัง เช่น โรคมะเร็ง ผู้ป่วยเอชไอวี
- โรคของต่อมไร้ท่อบางชนิด เช่น โรคไทรอยด์
- ภาวะขาดวิตามินหรือแร่ธาตุบางชนิด เช่น สังกะสี ธาตุเหล็ก วิตามินบี 2 (riboflavin)
- ภาวะทุพโภชนาการ โดยเฉพาะการขาดโปรตีน ส่งผลให้ผมเส้นเล็ก หรือร่วงง่าย
- ความเครียดรุนแรง
- ภาวะหนังศีรษะอักเสบ หรือการแพ้สัมผัสอย่างรุนแรงบริเวณหนังศีรษะ เช่น แพ้ยาย้อมผมอย่างรุนแรง
- หลังจากได้รับยาบางชนิด เช่น ยาเคมีบำบัด ยารักษาสิวกลุ่ม Isotretinoin ยาลดความดันกลุ่มเบต้าบล็อกเกอร์ และยากลุ่ม Lithium
- การรับสารพิษ เช่น โลหหนักปริมาณต่อเนื่องกันเป็นเวลานาน หรือปริมาณมากแบบฉับพลัน
- การถอน ดึง แกะ หรือเกาผมตนเอง บริเวณเดิมเป็นประจำอย่างยาวนาน อาจทำให้ผมบริเวณนั้นไม่ขึ้นอีกเลย
ข้อมูล ณ วันที่ 27 เมษายน 2564
ที่มา : รศ. ดร. พญ.รัชต์ธร ปัญจประทีป
ย่านนวัตกรรมการแพทย์โยธี คืออะไร LINK
ย่านนวัตกรรมการแพทย์โยธี คือพื้นที่ตั้งบริเวณ ถนนโยธี อยู่ระหว่างถ.ราชวิถีและถ.ศรีอยุธยา เชื่อมต่อกับถ.พระราม 6 และถ.พญาไท เพราะถนนโยธีแห่งนี้เป็นที่ตั้งของศูนย์การแพทย์ สถาบันการแพทย์และโรงพยาบาลของรัฐและมหาวิทยาลัยชั้นนำของไทยหลายแห่ง ในพื้นที่บริเวณนั้น มาเป็นเวลายาวนาน เสมือนหนึ่งเป็นดั่ง Medical Academy District ของกรุงเทพที่สำคัญ จึงเป็นที่มาของการริเริ่มยกระดับย่านศูนย์การแพทย์แห่งนี้ ขึ้นเป็น "ย่านนวัตกรรมการแพทย์โยธี"
และล่าสุด เมื่อกุมภาพันธ์ 2565 สำนักงานนวัตกรรมแห่งชาติ องค์การมหาชน (NIA) เผยแพร่ ประกาศคณะกรรมการส่งเสริมการลงทุนเรื่อง “มาตรการส่งเสริมการลงทุนในเขตพื้นที่ย่านนวัตกรรมการแพทย์” ระบุให้ "ย่านนวัตกรรมการแพทย์โยธี เป็นเขตส่งเสริมการลงทุน" สามารถ "รับสิทธิ และประโยชน์การลดหย่อนภาษีเงินได้นิติบุคคลสำหรับกำไรสุทธิที่ได้จากการลงทุนในอัตราร้อยละ 50 ของอัตราปกติเป็นระยะเวลา 5 ปี" นับเป็นก้าวสำคัญ ในการสนับสนุนให้ประเทศไทยมีพื้นที่ศูนย์กลางการพัฒนานวัตกรรมและการวิจัยทางการแพทย์ รวมทั้งการพัฒนาเทคโนโลยีเชิงลึก (Deep Tech) ระหว่างผู้ประกอบการกับหน่วยงานภาครัฐ ซึ่งเป็นการยกระดับความสามารถในการแข่งขันด้านการแพทย์และสาธารณสุขของประเทศ
ทั้งนี้ ผู้ขอรับการส่งเสริมต้องมีความร่วมมือกับหน่วยงานในพื้นที่ 2 รูปแบบ ได้แก่
1. ความร่วมมือกับสถาบันการศึกษา เช่น โครงการสหกิจศึกษาและทวิภาคี
2. ความร่วมมือกับโรงพยาบาล สถาบันทางการแพทย์ สถาบันวิจัย หรือหน่วยงานภาครัฐในการพัฒนา Deeptech
กิจกรรมเป้าหมายในพื้นที่นี้
- กิจกรรมออกแบบทางอิเล็กทรอนิกส์
- กิจการพัฒนาซอฟต์แวร์แพลตฟอร์มเพื่อให้บริการดิจิทัล หรือดิจิทัลคอนเทนต์
- กิจการศูนย์บ่มเพาะด้านนวัตกรรม
- กิจการ Make Space หรือ Fabrication Lab
- กิจการวิจัยและพัฒนา
- กิจการเทคโนโลยีชีวภาพ (Biotechnology)
- กิจการบริการออกแบบทางวิศวกรรม
- กิจการบริการทดสอบทางวิทยาศาสตร์
- กิจการบริการสอบเทียบมาตรฐาน
- กิจการสถานฝึกฝนวิชาชีพ
- กิจการวิจัยทางคลินิก (Clinical Research)
ข้อมูลเพิ่มเติม
สารอาหารสำคัญสำหรับผู้สูงอายุ
แพทย์หญิงสุรีย์รัตน์ ศรีตั้งรัตนกุล แพทย์ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน (Preventive Medicine) ประจำคลินิกดูแล ป้องกัน และฟื้นฟูสุขภาพ บีดีเอ็มเอส เวลเนส คลินิก กล่าวว่า เมื่ออายุมากขึ้นร่างกายของเราเกิดการเปลี่ยนแปลง ทำให้สารอาหารบางชนิดมีความจำเป็นต่อร่างกายเพิ่มมากขึ้น เพื่อให้สุขภาพร่างกายของผู้สูงอายุยังสมบูรณ์แข็งแรง จึงมีคำแนะนำให้เพิ่มการรับประทานสารอาหารต่อไปนี้
เส้นทางท่องเที่ยวกัญชาเขต 8 เชื่อมโยง 7 จังหวัดอีสานเหนือริมโขง
ภาพรวม 7 จังหวัดในเขตอีสานเหนือริมโขงที่จะเชื่อมโยงเข้าหากันเป็นเส้นทางท่องเที่ยวกัญชาที่น่าตื่นตาตื่นใจ ทั้ง 7 จังหวัด
เลย - กับคำนิยาม "เที่ยวเลยกัญ พักผ่อนกาย สบายใจ สไตล์ Leisure Loei"
หนองคาย - 3 เส้นทางน่าค้นหา ได้แก่ ภูห้วยอีสัน ตายรอยพญานาค วังบัวแดงวิถีริมโขง
บึงกาฬ - ขอบบนของไทยริมโขง ชูคำขวัญ "พักกาย พักใจ หลงไหลบึงกาฬ" และต้องปักหมุด "ถ้ำนาคา" อันโด่งดัง ไว้เป็นเป้าหมายที่ต้องไม่พลาด
นครพนม - แนะนำเส้นทางสายชา ชิมกาแฟไร่ เส้นทางวัฒนธรรม โดดเด่นด้วยตลาดกัญชาชุมชน แวะชม 4 โรงงาน GMP
สกลนคร - แนะนำ 3 เส้นทาง สายศาสนา อ.เมืองสกลนคร สายกัญชา อ.พรรณานิคม สายสุขภาพชุมชน อ.พังโคน
อุดรธานี - แนะนำเส้นทางสมุนไพรอุดร 4 เส้นทาง
หนองบัวลำภู - แนะนำเส้นทางกัญชา 6 อำเภอโนนสัง อำเภอศรีบุญเรือง อำเภอนากลาง อำเภอนาวัง อำเภอสุวรรณคูหา อำเภอเมืองหนองบังลำภู
สิทธิข้าราชการ
ใช้สิทธิเบิกจ่ายตรงรักษาพยาบาลประเภทผู้ป่วยนอก แสดงบัตรประชาชน แบบสมาร์ทการ์ด ณ จุดชำระเงิน
หากลืมบัตร ต้องจ่ายค่ารักษาไปก่อน แล้วนำใบเสร็จไปเบิกกับหน่วยงานต้นสังกัด
(สอบถามกรมบัญชีกลาง โทร 02-2706400)
เอกสารที่ใช้แสดง กรณีผู้ใช้สิทธิต่างๆ
- ผู้มีสิทธิ หรือ คู่สมรส หรือ บิดามารดา หรือ บุตร อายุ 7-20 ปี ใช้บัตรประชาชน
- กรณีคู่สมรส หรือ บิดามารดา หรือชาวต่างชาติ ให้ใช้เลข 13 หลักตามที่ทางราชการออกให้ หากไม่มี ให้ใช้เลขที่กรมบัญชีกลางกำหนด
- กรณีบุตรอายุต่ำกว่า 7 ปี ใช้สูติบัตร หรือ ทะเบียนบ้าน หรือ สำเนา และบัตรประชาชนผู้ดูแล
- ผู้ป่วยติดเตียง / ผู้ที่มีปัญหาทางการเคลื่อนไหว ให้แสดงบัตรประชาชนของผู้มีสิทธิ ร่วมกับบัตรประชาชนผู้ดูแล
โปรแกรมตรวจสุขภาพ บุคคลทั่วไป
โปรแกรมตรวจสุขภาพ
โปรแกรมตรวจสุขภาพ 1 (บุคคลทั่วไป) ราคา 800 บาท รายการตรวจ 5 รายการ
โปรแกรมตรวจสุขภาพ 2 (บุคคลทั่วไป) ราคา 1,845 บาท รายการตรวจ 11 รายการ
โปรแกรมตรวจสุขภาพ 3 (บุคคลทั่วไป) ราคา 2,375 บาท รายการตรวจ 13 รายการ
โปรแกรมตรวจสุขภาพ 4 (บุคคลทั่วไป) ราคา 5,000 บาท รายการตรวจ 15 รายการ
ติดต่อสอบถามข้อมูลโรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี 044-376555
การรักษาแบบผู้ป่วยนอก และแยกกักตัวเอง
1.น้ำมันเมล็ดกัญชง มอก. 3171-2564 (Hemp seed oil)
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3171-2564
ชื่อ มอก. : น้ำมันเมล็ดกัญชง
TIS NAME : Hemp seed oil
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 8 กันยายน 2564
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 138ตอน พิเศษ 211 งวันที่ 8 กันยายน 2564
ประกาศกระทรวง : ฉบับที่ 6192วันที่ 30 มีนาคม 2564
เอกสารฉบับเต็ม
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานนี้ ครอบคลุมเฉพาะน้ำมันเมล็ดกัญชง ที่มีปริมาณสารเตตราไฮโดรแคนนาบินอลรวมเป็นไปตามที่กฎหมายกำหนด เพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม
Abstract : This standard covers only hemp seed oil with total tetrahydrocannabinol content as required by law for use as raw materials in the industry.
ถาม-ตอบ แนวทางการปลูกกัญชา นำเข้าและนำเข้าหรือติดตัวเพื่อใช้เฉพาะตัว ภายหลังจากปลดล็อกกัญชาพ้นยาเสพติดแล้ว 9 มิถุนายน 2565
คู่มือประกอบการใช้บัญชียาหลักแห่งชาติด้านสมุนไพร พ.ศ.2564 (pdf) LINK
จัดทําโดย สํานักงานคณะกรรมการอาหารและยา พิมพ์ครั้งที่ 1 พฤษภาคม 2565
คู่มือประกอบการใช้บัญชียาหลักแห่งชาติด้านสมุนพร พ.ศ. 2564 ประกอบด้วยปรัชญา หลักการเกณฑ์การพิจารณาคัดเลือกยาในบัญชียาหลักแห่งชาติด้านสมุนไพรในรอบปี 2564 - 2566 ขั้นตอน กลไกและกระบวนการทำงานในการคัดเลือกยาจากสมุนไพร รวมทั้งรายการบัญชียาหลักแห่งชาติด้านสมุนไพรจำนวน 94 รายการตามประกาศคณะกรรมการพัฒนาระบบยาแห่งชาติด้านสมุนไพร เรื่อง บัญชียาหลักแห่งชาติด้านสมุนไพร พ.ศ. 2564 ซึ่งถูกประกาศในราชกิจจานุเบกษา และมีผลใช้บังคับเมื่อวันที่ 19 กุมภาพันธ์ 2565 และคู่มือการใช้ยาในบัญชียาหลักแห่งชาติด้านสมุนไพร ตามประกาศคณะอนุกรรมการพัฒนาบัญชียาหลักแห่งชาติด้านสมุนไพรเรื่องคู่มือการใช้ยาในบัญชียาหลักแห่งชาติด้านสมุนไพร พ.ศ. 2564
การจัดทำคู่มือประกอบการใช้บัญชียาหลักแห่งชาติด้านสมุนไพร พ.ศ. 2564 มีวัตถุประสงค์เพื่อให้ผู้สั่งใช้ยาในระบบบริการสาธารณสุข ได้ทราบถึงรายการยาจากสมุนไพรที่ประชาชนจะได้รับตามสิทธิที่พึงมีและวิธีการใช้ยาจากสมุนไพรที่ถูกต้อง ส่งผลให้การใช้ยาจากสมุนไพรมีความปลอดภัย และเกิดประสิทธิภาพ เป็นส่วนหนึ่งในการสร้างความเชื่อมั่นต่อการใช้ยาจากสมุนไพร
คู่มือฉบับนี้ ได้รับความมือจากภาคีเครือข่ายต่าง ๆ ทั้งจากหน่วยงานภาครัฐ เอกชน และที่ขาดไม่ได้คือผู้ประกอบวิชาชีพ เวชกรรม เภสัชกรรม เวชกรรมไทย แพทย์แผนไทย แพทย์แผนไทยประยุกต์ และนักวิชาการ ที่มีความมุ่งมั่นในการพัฒนา และต่อยอดภูมิปัญญาแผนไทย หวังเป็นอย่างยิ่งว่า ผู้สั่งยาจะได้ประโยชน์จากคู่มือฉบับนี้ และใช้คู่มือฉบับนี้เป็นพื้นฐานสำหรับการใช้ยาจากสมุนไพรต่อไป
ตารางแพทย์ห้องตรวจอายุรกรรม
ตารางแพทย์ห้องตรวงสูติ-นรีเวชกรรม
ตารางแพทย์ห้องตรวจฝากครรภ์
ตารางแพทย์ห้องตรวจกุมารเวชกรรม คลินิกตรวจโรค คลินิกสุขภาพเด็กดี และคลินิกเฉพาะทาง
ฝีดาษวานร ยังไม่ควรตื่นตระหนกมาก - ธีระวัฒน์ เหมะจุฑา
1. เชื้อไวรัสนี้จะแพร่ต่อเมื่อคนติดเชื้อเริ่มมีอาการแล้ว ได้แก่ ไข้ปวดหัว ปวดเมื่อย มีต่อมน้ำเหลืองโต และที่สำคัญก็คือ จะมีผื่นที่ปรากฏเห็นได้ชัด ที่หน้าที่แขนและที่มือหลังจากเริ่มอาการป่วยไม่นาน
2. ความสามารถในการติดจากคนสู่คน ต่ำกว่า small pox หรือโรคฝีดาษซึ่งเป็นเชื้อสายพันธุ์ต้นตระกูลมากมาย
3. หากติดเชื้อ ความรุนแรงจนกระทั่งเสียชีวิต โดยทั่วไปจะถือว่าน้อยกว่า 10% แต่ในความเป็นจริงแล้ว อัตราการเสียชีวิตจากโรคนี้ต่ำมาก ประมาณ 1% หรือมากกว่า1% นั้นเล็กน้อย
4. ไวรัสตัวนี้เป็นชนิด DNA ดังนั้นความสามารถที่จะมีการแปรผันรหัสพันธุกรรมเกิดเป็นสายพันธุ์ใหม่แบบโควิดนั้น แทบเป็นไปไม่ได้เลย
5. การติดเชื้ออยู่ที่การสัมผัสใกล้ชิด ฝอยละออง จากการไอ จาม น้ำลาย จากคนติดเชื้อ ที่มีอาการแล้ว
และกรณีที่ติดจากสัตว์ จะเป็นจากการสัมผัสใกล้ชิด หรือ กับสัมผัสเนื้อ หรือสิ่งคัดหลั่งเลือด เวลาที่ทำอาหาร เช่นในแอฟริกา
อย่ากลัวสัตว์มาก เพราะในกรณีนี้ในประเทศต่างๆ คนติดจากคนด้วยกัน (ในการเกิดโรคเป็นกระจุก หลาย 10 ปีที่ผ่านมาในแอฟริกา เป็นจากสัตว์มาคน และคนสู่คน)
6. การติดเชื้อเป็นกระจุกเล็กๆมีมาในอดีตหลาย 10 ปีที่แล้วเช่นในสหรัฐเป็นต้น ไม่ใช่เรื่องใหม่
7. วัคซีนฝีดาษที่พวกเราสมัยก่อนเคยได้รับเมื่อ 50-60 ปีที่แล้ว จะได้ผลกับ monkey poxนี้ แต่ เป็นวัคซีนที่มีผลข้างเคียงพอสมควร โดยเฉพาะการเกิดสมองอักเสบจากภูมิคุ้มกันแปรปรวนและมีความรุนแรงของผลข้างเคียงถึงเสียชีวิตได้ถึง 50%
และขณะนี้วัคซีนรุ่นใหม่ถึงมีการพัฒนาแล้ว แต่ก็ไม่ได้ใช้แพร่หลาย เนื่องจากตัวโรคเองนั้นยังไม่เป็นโรคระบาด ไม่ได้มีความน่ากลัวรุนแรงแพร่กระจายในวงกว้างแบบฝีดาษ
8. การรักษายังคงเป็นการประคับประคองตามอาการแม้ว่าจะมียาที่ใช้ในยุโรป แต่เป็นการป้องกันไม่ให้มีการแพร่จากคนที่ติดเชื้อออกไปมากกว่า
สรุปสั้นๆก็คือ
การป้องกันตัวที่เราปฏิบัติขณะนี้สำหรับป้องกันโควิด ก็เหมาะกับเชื้อนี้เช่นเดียวกันคือการใส่หน้ากาก ล้างมือ รักษาสุขอนามัย เมื่อตนเองไม่สบายมีไข้ปวดเมื่อย อย่าอยู่ใกล้ชิดกับคนอื่นและถ้ามีอาการหนักขึ้นปรึกษาแพทย์
ศูนย์วิทยาศาสตร์สุขภาพโรคอุบัติใหม่ของเราเตรียมพร้อมในการวินิจฉัยฝีดาษวานรเรียบร้อยแล้ว
หมอดื้อ 20/05/2565
THAILAND CONSUMPTION FORECAST(APR 2022 issue)
รายงานฉบับนี้บอกเกี่ยวกับอะไร
- แนวโน้มการใช้จ่ายของคนไทย
- ประเภทหมวดสินค้าตามแนวโน้ม
- แนวโน้มตามช่วงอายุและภูมิภาค
- ทัศนคติต่อสถานการณ์ปัจจุบันและอนาคต
- ทัศนคติต่อการบริโภค
- ทัศนคติต่อปัจจัยสำคัญ
- ข้อเสนอแนะ
1.เปรียบเทียบแนวโน้มในช่วงที่ผ่านมา
เครื่องเอคโม่ ECMO
นพ.อรรถภูมิ สู่ศุภอรรถ ศัลยแพทย์หัวใจและทรวงอก ผู้ช่วยผู้อำนวยการ โรงพยาบาลหัวใจกรุงเทพ กล่าวว่า เครื่องเอคโม่ ECMO (Extracorporeal Membrane Oxygenation) เป็นเครื่องที่ใช้พยุงปอดและหัวใจ ด้วยการดึงเลือดออกจากตัวผู้ป่วยแล้วนำมาฟอกผ่านเครื่องโดยจะมีการควบคุมอุณหภูมิและออกซิเจน ซึ่งตัวเครื่องจะทำหน้าที่คล้ายกับปั๊มน้ำส่งคืนเลือดกลับเข้าไปในร่างกาย สามารถทำงานทดแทนปอดและหัวใจได้ ในกรณีที่ปอดและหัวใจไม่สามารถทำงานได้ตามปกติ
สมาคมการค้าอุตสาหกรรมกัญชงไทย - TIHTA LINK
สมาคมการค้าอุตสาหกรรมกัญชงไทย - TIHTA จัดตั้งเป็นสมาคมการค้า ตามพรบ.สมาคมการค้า ตั้งแต่ 21 เมษายน 2564 ก่อตั้งขึ้นจากผู้ที่มีประสบการณ์ในการประกอบกิจการกัญชาและกัญชง ทั้งในรูปแบบของเส้นใยไฟเบอร์ สารสกัดเพื่อการแพทย์และการพาณิชย์ Supplement, Food and Beverage, Skincare and Cosmetic ทั้งในประเทศและต่างประเทศ ทั้งนี้เพื่อให้สมาคมเป็นศูนย์กลางของความร่วมมือในการช่วยเหลือ ส่งเสริม และ สนับสนุนกลุ่มสมาชิก ให้สามารถขับเคลื่อนธุรกิจได้อย่างราบรื่น ช่วยให้ความรู้ความเข้าใจในกลุ่มสมาชิกตลอดไปจนถึงบุคคลภายนอกที่สนใจ เพื่อถ่ายทอดความรู้ ช่วยประสานความร่วมมือระหว่างองค์กร หน่วยงานภาครัฐ บริษัทเอกชนต่างๆ ทั้งในและต่างประเทศ เพื่อให้เกิดการขับเคลื่อนในเชิงเศรษฐกิจและอุตสาหกรรม จนนำไปสู่ความมั่นคงของผู้ประกอบการกัญชงในประเทศไทย
ราคาช่อดอกแห้ง ระบบ Indoor และ ระบบ Green House
เงื่อนไขการรับซื้อ ตามเกณฑ์กำหนด ดังนี้
เงื่อนไขการรับซื้อช่อดอกแห้ง (Conditions)
ปริมาณการซื้อขายเป็นไปตามมาตรฐานอุตสาหกรรม (มากกว่า 50 กิโลกรัมขึ้นไป) กำหนด 6 เกณฑ์ดังนี้
- มาตรฐานการปลูก GAP - อ้างอิงวัสดุปลูกและกรรมวิธีตามมาตรฐาน GAP
- มาตรฐานสิ่งแปลกปลอม - มาตรฐานสิ่งแปลกปลอมใหเป็ นไป ้ ตาม มอก.3099-2564 คือ ต้องไม่พบสิ่งแปลกปลอม ทดสอบโดยการตรวจพินิจ
- มาตรฐานตรวจวิเคราะห์ - ตรวจวิเคราะห์มาตรฐานด้วยห้องปฏิบัติการมาตรฐาน ISO 17025 เพื่อให้ใช้เป็นเกณฑ์ในการชี้วัดมาตรฐาน
- ปริมาณสารปนเปื้อน - สารกำจัดแมลงและศัตรูพืช ฯลฯ อ้างอิงตามเกณฑ์ของตำรับมาตรฐานยาสมุนไพรไทย หรือ Thai Herbal Pharmacopoeia (THP) โดยสำนักยาและวัตถุเสพติด กรมวิทยาศาสตร์การแพทย์
- ปริมาณความชื้น - ความชื้นในช่อดอกกัญชง ไม่เกิน 10%RH
- ปริมาณสารสำคัญ - ปริมาณสาร THC ในช่อดอกแห้ง ต้องไม่เกินตามกฎหมายของหน่วยงานที่เกี่ยวข้องกำหนด (1%)
หมายเหตุ: conditions อื่นๆ (การใช้ภายนอก) อาจมีการปรับเปลี่ยนเงื่อนไขการซื้อขายและราคาตามแต่ตกลง
ธนาคารเครื่องมือแพทย์ ป้าแดง อมราพร ศูนย์การแพทย์ชลประทาน LINK
ธนาคารเครื่องมือแพทย์ ศูนย์ส่งเสริมมิตรภาพบำบัดเพื่อนช่วยเพื่อน ตั้งอยู่ที่ ศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน ดูแลบริหารจัดการ โดย ป้าแดง อมราพร องอาจอิทธิชัย พยาบาลคนเก่งน้ำใจงาม
ญาติผู้ป่วยหรือผู้ดูแลผู้ป่วยท่านใดต้องการยืมอุปกรณ์
ติดต่อ 02-5022345 ต่อ 1750
แอดไลน์ @690kkyag
พร้อมเตรียมเอกสารให้ครบ 3 อย่างดังนี้
1. ใบรับรองแพทย์
2. สำเนาบัตรประชาชนผู้ป่วย
3. สำเนาบัตรประชาชนผู้ทำเรื่องยืม
เอกสาร ครบแล้วเข้ามายืมที่ศูนย์ส่งเสริมมิตรภาพบำบัดเพื่อนช่วยเพื่อนได้ในวันเวลาราชการ
ตั้งแต่ 08.00-15.00 น.
เว็บไซต์
https://ftc-chonprathan.com
เฟซบุ๊ค
www.facebook.comCannabis Relax and Restore Massage โรงแรมแมนดาริน โอเรียนเต็ล กรุงเทพฯ LINK
โรงแรมแมนดาริน โอเรียนเต็ล กรุงเทพฯ โรงแรมชั้นนำระดับโลก นำเสนอบริการ สปาทรีทเมนต์กัญชา โปรแกรมชื่อ "Cannabis Relax and Restore Massage" เป็นทรีทเม้นต์ 2 ชั่วโมง เพื่อความผ่อนคลายฟื้นฟู ที่เริ่มต้นอบร่ำด้วยกลิ่นสมุนไพร นวดตัวด้วยน้ำมันกัญชาสกัดเข้มข้นที่ผสมผสานกับใบกัญชาทั้งแบบใบสดและใบอบแห้ง ประคบด้วยตามด้วยลูกประคบสมุนไพรใบกัญชา ทรีทเมนต์ เหมาะสำหรับผู้ที่มีปัญหาเรื่องการนอน หรือเจ็ทแลค สร้างความผ่อนคลาย ช่วยหลับได้ดีขึ้น หลับสนิทยิ่งขึ้น
ติดต่อสอบถาม The Oriental Spa 02-6599000
หนังสือเวียนสำนักงานศาลยุติธรรม
รองศาสตราจารย์ ดร. ภญ.จุฑามณี สุทธิสีสังข์
รองศาสตราจารย์ ดร. ภญ.จุฑามณี สุทธิสีสังข์ รองอธิการบดีมหาวิทยาลัยมหิดล กล่าวถึง การออกฤทธิ์ของกัญชา: ประโยชน์และโทษ ว่า การออกฤทธิ์ของสาร THC (tetrahydrocannabinol) มีฤทธิ์ต่อจิตและประสาท ทำให้เกิดประสาทหลอน ความจำแย่ลง ส่วนการออกฤทธิ์ของสาร CBD (Cannabidiol) จะไม่มีฤทธิ์ต่อจิตและประสาท แต่ควรระวังเรื่องยาตีกลับ เพราะจะไปยับยั้งการทำงานของเอนไซม์ ที่ใช้ทำลายยาอื่น
ซึ่งผลจากการใช้กัญชาในระยะยาว จะมีผลต่อการพัฒนาการของสมอง โดยเฉพาะหากเริ่มใช้ตั้งแต่อายุน้อย จะทำให้เกิด สติปัญญาบกพร่อง ผลการเรียนตกต่ำ และหากติดกัญชาไปแล้ว จะยิ่งส่งผลให้เพิ่มความเสี่ยงของโรคจิตเรื้อรัง เกิดอาการหลอดเลือดสมองหดตัวแบบผันกลับ ผลต่อระบบไหลเวียนเลือด
เมื่อใช้เป็นครั้งคราวจะเพิ่มอัตราการเต้นของหัวใจ ใจสั่น หลอดเลือดขยาย ความดันต่ำ และเมื่อใช้เป็นเวลานาน หัวใจจะเต้นช้าลง หลอดเลือดขยาย ความดันต่ำ ซึ่งผู้ที่ห้ามใช้ผลิตภัณฑ์ที่มีสาร THC เป็นส่วนประกอบ คือ ผู้ที่เป็นโรคหัวใจ หรือมีปัจจัยเสี่ยงของโรคหลอดเลือดหัวใจ ผู้ที่มีอาการของโรคอารมณ์แปรปรวน หรือโรควิตกกังวล สตรีมีครรภ์ สตรีให้นมบุตร หรือสตรีที่มีการวางแผนการตั้งครรภ์ ซึ่งสาร THC จะส่งผลกระทบให้กับผู้ที่มีกลุ่มโรคเหล่านี้ให้มีอาการแย่ลง โดยในปัจจุบัน กัญชาสามารถนำมาใช้ได้อย่างเสรี ในฐานะที่เป็นสถาบันการศึกษาและสถาบันทางการแพทย์ จะต้องมีหน้าที่ให้ความรู้อย่างถูกต้อง โดยใช้หลักฐานทางวิชาการนำเสนอข้อมูล เพื่อนำไปสู่การใช้อย่างถูกวิธีให้กับประชาชนต่อไป
ไทม์ไลน์ผู่ป่วยสงสัย 3 ราย
30 พฤษภาคม 2565 ร่างผ่านคณะกรรมการแล้ว รอลงนาม
30 พฤษภาคม 2565 ที่โรงแรมพูลแมน คิง เพาเวอร์ กทม. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวระหว่างเปิดการประชุมการส่งเสริมการประกอบการด้านผลิตภัณฑ์สุขภาพจากกัญชา กัญชง เพื่อเปิดรับฟังความคิดเห็นและความคาดหวังของผู้ประกอบการ ต่อการปรับปรุงกฎระเบียบ กระบวนการให้บริการ รวมทั้งมาตรการส่งเสริมการประกอบการ รองรับการปลดล็อกกัญชา กัญชง ว่า นโยบายกัญชากัญชงจะประสบความสำเร็จได้นั้น การขับเคลื่อนของปลายน้ำมีความสำคัญ เนื่องจากเป็นการนำกัญชากัญชงไปใช้เป็นส่วนประกอบในผลิตภัณฑ์สุขภาพ ทั้งอาหาร สมุนไพรและเครื่องสำอาง เป็นโอกาสสร้างเศรษฐกิจของประเทศให้ฟื้นตัวจากโควิด 19 ซึ่งประเทศไทยได้รับการยอมรับในระดับโลก ว่าสามารถรับมือสถานการณ์โควิด 19 ได้อย่างดี มีการพัฒนาระบบสาธารณสุขอย่างเข้มแข็ง ทำให้การผลิตสินค้าเกี่ยวกับยาและสุขภาพจะได้รับการยอมรับโดยปริยาย
“กระทรวงสาธารณสุข ย้ำมาตลอดในการใช้กัญชาในทางที่ดี เป็นประโยชน์ทางการแพทย์ สุขภาพ และการเสริมสร้างรายได้ การนำไปใช้ในทางที่ไม่เกิดประโยชน์ต่อสุขภาพ เช่น การนำไปสูบ จึงไม่อยู่ในเจตนารมณ์ของกฎหมาย ทั้งนี้ กฎหมายกัญชากัญชงที่ขณะนี้ยังอยู่ในสภา ยืนยันว่าจะไม่เลื่อนการปลดล็อก เพราะจะกระทบกับคนจำนวนมากที่จะใช้ประโยชน์ทางการแพทย์ ขับเคลื่อนรายได้และเศรษฐกิจ ซึ่งผู้ประกอบการต่างๆ ได้เตรียมดำเนินการไปมากแล้ว” นายอนุทินกล่าว
นายอนุทินกล่าวต่อว่า วันนี้คณะกรรมการการสาธารณสุข ได้มีการประชุมพิจารณาประกาศกระทรวงสาธารณสุขเกี่ยวกับการกำหนดกลิ่นและควันจากกัญชากัญชงเป็นเหตุรำคาญเรียบร้อยแล้ว และจะส่งร่างประกาศมาให้พิจารณาในวันที่ 31 พฤษภาคม 2565 ซึ่งจะรีบพิจารณาและลงนามโดยเร็วที่สุด หลังลงนามแล้วจะส่งไปยัง
ราชกิจจานุเบกษาเพื่อประกาศและมีผลบังคับใช้ต่อไป [
สารนิเทศ สธ.]
อย. เปิดตัวทั้งแอปและเว็บไซต์ ปลูกกัญ
นพ.วิทิต สฤษฎีชัยกุล รองเลขาธิการคณะกรรมการอาหารและยา แนะนำแอปปลูกกัญ และเว็บไซต์เพื่อการจดแจ้งกัญชา
โรงพยาบาลพญาไท นวมินทร์ กรุงเทพ LINK
โรงพยาบาลพญาไท นวมินทร์ เป็นโรงพยาบาลเอกชนขนาดกลาง ขนาด 140 เตียง พร้อมรองรับผู้ประกันตนในพื้นที่กรุงเทพตอนเหนือ ย่านถนนนวมินทร์ รามอินทรา สายไหม รามคำแหง ลาดปลาเค้า ประเสริฐมนูกิจ และประดิษฐมนูธรรมได้ เป็นโรงพยาบาลในเครือเดียวกันกับกลุ่มโรงพยาบาลกรุงเทพและโรงพยาบาลเปาโล มีทีมแพทย์ผู้เชี่ยวชาญครบทุกสาขา พร้อมให้บริการ อาทิ สาขาอายุรแพทย์, ศัลย์แพทย์ เปิดให้บริการตลอด 24 ชม.
ข้อมูลล่าสุด พ.ค. 2565 รพ.พญาไท นวมินทร์ สามารถรับผู้ประกันตนเพิ่มได้อีก 47,157 ราย
โรงพยาบาลพญาไท นวมินทร์ มีคลินิกเครือข่ายประกันสังคม เป็นสถานพยาบาลในระดับสูง ได้แก่ คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช โรงพยาบาลศิริราช โรงพยาบาลศรีธัญญา กรมสุขภาพจิต
- สอบถามเกี่ยวกับบริการได้ที่ สายด่วน 1772 โทร. 02-9447111
- facebook.com
การนำ AI มาใช้ในด้านรังสีวิทยา
สำหรับการนำ AI มาใช้ในด้านรังสีวิทยาที่บำรุงราษฎร์นั้น ถือว่ามีความโดดเด่นมาก เนื่องจากมีการนำเทคโนโลยีมาใช้เป็นแผนกแรก ๆ ในโรงพยาบาล เรียกได้ว่า ‘รังสีแพทย์’ เป็นแถวหน้าด้านการแพทย์ในยุคดิจิทัล ซึ่งหากมองย้อนกลับไปตั้งแต่ปี 2543 หรือ 22 ปีก่อน บำรุงราษฎร์ได้เริ่มใช้งานระบบ Picture Archiving and Communication System (PACS) ซึ่งเป็นระบบที่ใช้ในการจัดเก็บรูปภาพทางการแพทย์ (Medical Images) หรือภาพถ่ายทางรังสี โดยมีการรับส่งข้อมูลภาพในรูปแบบดิจิทัลเป็นครั้งแรก ต่อมาในปี 2544 นับเป็นปีแรกที่เริ่มนำเทคโนโลยีการถ่ายภาพแบบ Computed Radiography คือการใช้แผ่นรับภาพหรือเรียกว่า image plate แทนการใช้ฟิล์ม โดยมีเครื่องอ่านภาพ (image reader) เพื่ออ่านข้อมูลบนแผ่นก่อนนำส่งผ่านระบบคอมพิวเตอร์ โดยแพทย์สามารถอ่านผลได้ทั้งการสั่งพิมพ์ฟิล์มหรือบนคอมพิวเตอร์และต่อมาในปี 2550 ได้พัฒนาเป็นดิจิตัลเต็มรูปแบบ โดยใช้ระบบเซ็นเซอร์หรือตัวรับภาพขนาดใหญ่ (detector) แทนการใช้แผ่นรับภาพแบบเดิม โดยประมวลผลและทราบผลภาพในเวลาเพียงเสี้ยววินาทีโดยไม่ต้องมีอุปกรณ์อ่านข้อมูล
2 มิ.ย. 65 มอบอำนาจ 4 รองผู้ว่าฯ กทม. สั่งและปฏิบัติราชการแทน
สำหรับสาระสำคัญในคำสั่งดังกล่าวประกอบด้วย
ข้อ 1. มอบหมายและมอบอำนาจให้รองผู้ว่าราชการกรุงเทพมหานครมีอำนาจหน้าที่ในการสั่งหรือการปฏิบัติราชการแทนผู้ว่าราชการกรุงเทพมหานคร ดังนี้
1.1 นายจักกพันธุ์ ผิวงาม มีอำนาจในการสั่งหรือการปฏิบัติราชการแทนเกี่ยวกับราชการของสำนักงบประมาณกรุงเทพมหานคร สำนักการคลัง สำนักเทศกิจ สำนักสิ่งแวดล้อม สำนักปลัดกรุงเทพมหานคร สำนักงานเลขานุการผู้ว่าราชการกรุงเทพมหานคร สำนักงานเลขานุการสภากรุงเทพมหานคร และสำนักงานเขตในส่วนที่เกี่ยวข้องกับฝ่ายการคลัง ฝ่ายรายได้ ฝ่ายเทศกิจ ฝ่ายปกครอง ฝ่ายทะเบียน และฝ่ายรักษาความสะอาดและสวนสาธารณะ
1.2 รศ.วิศณุ ทรัพย์สมพล มีอำนาจในการสั่งหรือการปฏิบัติราชการแทนเกี่ยวกับราชการของสำนักการโยธา สำนักการระบายน้ำ สำนักการจราจรและขนส่ง สำนักการวางผังและพัฒนาเมือง บริษัท กรุงเทพธนาคม จำกัด และสำนักงานเขตในส่วนที่เกี่ยวข้องกับฝ่ายโยธา
1.3 ผศ.ทวิดา กมลเวชช มีอำนาจในการสั่งหรือการปฏิบัติราชการแทนเกี่ยวกับราชการของสำนักการแพทย์ สำนักอนามัย สำนักยุทธศาสตร์และประเมินผล สำนักป้องกันและบรรเทาสาธารณภัย สำนักงานคณะกรรมการข้าราชการกรุงเทพมหานคร มหาวิทยาลัยนวมินทราธิราช และสำนักงานเขตในส่วนที่เกี่ยวข้องกับฝ่ายสิ่งแวดล้อมและสุขาภิบาล และ
1.4 นายศานนท์ หวังสร้างบุญ มีอำนาจในการสั่งหรือการปฏิบัติราชการแทนเกี่ยวกับราชการของสำนักการศึกษา สำนักพัฒนาสังคม สำนักวัฒนธรรม กีฬา และการท่องเที่ยว การพาณิชย์ของกรุงเทพมหานคร และสำนักงานเขตในส่วนที่เกี่ยวข้องกับฝ่ายการศึกษาและโรงเรียนในสังกัดกรุงเทพมหานคร และฝ่ายพัฒนาชุมชนและสวัสดิการสังคม
ข้อ 2. ในกรณีที่รองผู้ว่าฯ ในลำดับใดไม่อาจปฏิบัติราชการได้ ให้รองผู้ว่าฯ ในลำดับถัดไปตามที่กำหนดไว้ในข้อ 1. มีอำนาจในการสั่งหรือการปฏิบัติราชการแทน ส่วนกรณีรองผู้ว่าฯ ในลำดับที่ 1.4 ไม่อาจปฏิบัติราชการได้ ให้รองผู้ว่าฯ ในลำดับที่ 1.1 มีอำนาจในการสั่งหรือการปฏิบัติราชการแทน ยกเว้นผู้ว่าฯ จะมีคำสั่งเป็นอย่างอื่น
ข้อ 3. การสั่ง และการปฏิบัติราชการแทนผู้ว่าฯ เกี่ยวกับราชการของหน่วยงานหรือส่วนราชการที่ได้รับมอบหมายในข้อ 1. ให้รองผู้ว่าฯ เสนอผู้ว่าฯ เป็นผู้พิจารณาสั่งการในกรณีดังต่อไปนี้ เว้นแต่ผู้ว่าฯ จะมีคำสั่งเป็นอย่างอื่น
3.1 งานที่รองผู้ว่าฯ พิจารณาแล้วเห็นว่า เป็นเรื่องงานนโยบาย หรืองานที่เป็นเรื่องสำคัญและอาจมีผลกระทบต่อความเสียหายอย่างร้ายแรงแก่กรุงเทพมหานคร หรือแก่ราชการโดยส่วนรวม หรือแก่การรักษาความสงบเรียบร้อย หรือสวัสดิภาพของประชาชนโดยรวม
3.2 การบรรจุ การแต่งตั้ง การโอน การดำเนินการทางวินัย การออกจากราชการ การอุทธรณ์ และการร้องทุกข์ของข้าราชการกรุงเทพมหานครสามัญ
3.3 การเลื่อนขั้นเงินเดือนของข้าราชการ และ 3.4 เรื่องเสนอสภากรุงเทพมหานคร รัฐสภา รัฐมนตรี นายกรัฐมนตรี และคณะรัฐมนตรี
ข้อ 4. ในกรณีที่ผู้ว่าฯ ไม่อาจปฏิบัติราชการได้ ให้รองผู้ว่าฯ เป็นผู้รักษาราชการแทน ดังนี้ ลำดับที่ 1 นายจักกพันธุ์ ผิวงาม ลำดับที่ 2 รศ.วิศณุ ทรัพย์สมพล ลำดับที่ 3 ผศ.ทวิดา กมลเวชช และลำดับที่ 4 นายศานนท์ หวังสร้างบุญ
ทั้งนี้ อาศัยอำนาจตามความในมาตรา 55 และมาตรา 81 แห่งพระราชบัญญัติระเบียบบริหารราชการกรุงเทพมหานคร พ.ศ. 2528 เพื่อให้การปฏิบัติราชการแทนผู้ว่าฯ เปีนไปด้วยความเรียบร้อยและมีประสิทธิภาพ
โรงพยาบาลพิษณุโลกฮอลพิทอล จ.พิษณุโลก
โรงพยาบาลพิษณุโลก ฮอสพิทอลเป็นโรงพยาบาลเอกชนขนาด 60 เตียง ตั้งอยู่ที่ ตั้งอยู่เลขที่ 262/55 ถนนบรมไตรโลกนาถ ตำบลในเมือง อำเภอเมือง จังหวัดพิษณุโลก จดทะเบียนในนาม บริษัท พิษณุโลกอินเตอร์เวชการ จำกัด (ชื่อเดิมโรงพยาบาลอินเตอร์เวชการ) ได้เริ่มดำเนินการให้บริการตั้งแต่วันที่ 17 กุมภาพันธ์ พ.ศ. 2537 ปี พ.ศ. 2559 เปลี่ยนชื่อโรงพยาบาลอินเตอร์เวชการ เป็นโรงพยาบาลพิษณุโลก ฮอสพิทอล บริหารงานโดยกลุ่มบริษัท เอเวอร์แลนด์ จำกัด (มหาชน) ซึ่งมีโรงพยาบาลในเครือเดียวกันอีก 2 โรงพยาบาล คือ โรงพยาบาลเชียงใหม่ ฮอสพิทอล และ โรงพยาบาลราชสีมา ฮอสพิทอล
โรงพยาบาลพิษณุโลก ฮอสพิทอล เพิ่มศักยภาพการให้บริการ ใหม่ตั้งแต่ปลายปี 2559 มีวิสัยทัศน์เพื่อมุ่งเน้นการให้บริการดูแลชาวจังหวัดพิษณุโลกและจังหวัดใกล้เคียงให้ได้รับมาตรฐานและความปลอดภัยอย่างเต็มศักยภาพ ตลอด 24 ชั่วโมง จัดตั้งศูนย์ตรวจสุขภาพ เพื่อให้บริการตรวจสุขภาพแก่ผู้รับบริการ จัดตั้งศูนย์กายภาพบำบัด ให้การบริการตรวจ, ประเมิน, วินิจฉัยการบำบัดความบกพร่องของร่างกาย พัฒนาแผนกผู้ป่วยวิกฤต หรือ ห้อง I.C.U. ปรับปรุงการบริการในด้านอาคารสถานที่โรงพยาบาลได้ปรับปรุง หอผู้ป่วยในมีรูปโฉมใหม่ให้ดูทันสมัย บริการแผนกประกันสังคมแบบ One Stop Service อีกทั้งการปรังปรุงชั้น 1 แผนก Health Center, แผนกสูตินรีเวช, จุดบริการต้อนรับ ตกแต่งภายในให้ดูหรูหรา
ส่วนแบ่งการตลาดตามขนาดโรงพยาบาล จำนวนเตียง
โรงพยาบาลเอกชนทั้งหมด 378 แห่ง
รวมจำนวนเตียง 36,114 เตียง
สัดส่วนจำนวนโรงพยาบาลจำแนกตามขนาด
- โรงพยาบาลขนาดใหญ่ (Large) มากกว่า 200 เตียง จำนวน 22 แห่ง สัดส่วนตลาด 6% สัดส่วนเตียง 23%
- โรงพยาบาลขนาดกลาง (Medium) จำนวน 31-200 เตียง จำนวน 255 แห่ง สัดส่วนตลาด 70% สัดส่วนเตียง 73%
- โรงพยาบาลขนาดเล็ก (small) จำนวน 1-30 เตียง จำนวน 101 แห่ง สัดส่วนตลาด 24% สัดส่วนเตียง 4%
โรงพยาบาลเปาโล พระประแดง ปี 2562
โรงพยาบาลเปาโล พระประแดง เป็นโรงพยาบาลระดับทุติยภูมิ ขนาด 60 เตียง มีอาคาร 3 อาคารพร้อมให้บริการทางการแพทย์ โดยผู้เชี่ยวชาญทุกสาขาหลัก ซึ่งเป็นแพทย์ประจำโรงพยาบาล ได้แก่ สูตินรีแพทย์ ศัลยแพทย์ อายุรแพทย์ กุมารแพทย์ แพทย์ผิวหนัง แพทย์โสต-ศอ-นาสิก แพทย์ออโธปิดิกส์ และแพทย์วิสัญญี ตลอดเวลา 24 ชั่วโมง มีเครือข่ายส่งต่อทั้งระดับโรงพยาบาลระดับ ตติยภูมิ หรือโรงพยาบาลในเครือข่าย BDMS รวมทั้งโรงพยาบาลตามสิทธิผู้ป่วย
โทร.02-818-9000
นพ.มล.สมชาย จักรพันธุ์ ประธานที่ปรึกษารัฐมนตรีว่าการกระทรวงสาธารณสุข
นพ.มล.สมชาย จักรพันธุ์ ประธานที่ปรึกษารัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวว่า ตามที่ประกาศกระทรวงสาธารณสุข เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ. 2565 จะมีผลบังคับใช้ตั้งแต่วันที่ 9 มิ.ย. 2565 ทำให้ทุกส่วนของกัญชากัญชงไม่เป็นยาเสพติด ยกเว้นสารสกัดที่มีสาร THC เกิน 0.2% โดยน้ำหนักที่ยังคงเป็นยาเสพติด
ทั้งนี้ นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข เน้นย้ำถึงนโยบายที่รัฐบาล โดยกระทรวงสาธารณสุขผลักดันมาตลอด คือการนำกัญชา กัญชง มาใช้เพื่อประโยชน์ทางการแพทย์ การดูแลสุขภาพ การสร้างมูลค่าเพิ่มทางเศรษฐกิจ สร้างรายได้ให้ให้แก่ประชาชน โดยไม่มีการสนับสนุนให้ใช้กัญชากัญชงในทางที่ไม่เหมาะสม
สำหรับการกระตุ้นเศรษฐกิจนั้นทางกระทรวงสาธารณสุขได้มีการอนุญาตผลิตภัณฑ์สุขภาพที่มีส่วนประกอบของกัญชากัญชงและสารสกัด CBD เช่น เครื่องสำอาง ผลิตภัณฑ์อาหาร ผลิตภัณฑ์สมุนไพรและตำรับยาไทย มากถึง 1,181 รายการ
โดยผลการวิจัยของธนาคารกรุงศรีอยุธยาเมื่อปี 2564 คาดว่าในปี 2569 ตลาดกัญชงจะเจริญเติบโตและมีมูลค่ามากถึง 15,000 ล้านบาท และอาจจะสร้างมูลค่าทางเศรษฐกิจได้มากกว่านี้ เนื่องด้วยมีการประเมินมูลค่าตลาดกัญชาที่ถูกกฎหมายทั่วโลกมีมูลค่ากว่า 500,000 ล้านบาท และมีอัตราการเติบโตมากกว่าร้อยละ 17
โดยกัญชาในอุตสาหกรรมทางการแพทย์และสุขภาพสร้างรายได้ถึงร้อยละ 70 ของมูลค่าทั้งหมด ทั้งนี้ กระทรวงสาธารณสุขได้มีการแต่งตั้งคณะกรรมการสื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ เพื่อร่วมกันสื่อสารทำความเข้าใจการใช้กัญชากัญชงที่ถูกต้องกับประชาชน
รอง ผบ.ตร. เผยชัดเจน ตั้งแต่ 9 มิถุนา สูบกัญชาไม่มีความผิด แต่... LINK
8 มิ.ย. 2565 ที่สำนักงานตำรวจแห่งชาติ (ตร.) พล.ต.อ.รอย อิงคไพโรจน์ รองผู้บัญชาการตำรวจแห่งชาติ (รอง ผบ.ตร.) ในฐานะผู้อำนวยการศูนย์อำนวยการป้องกันและปราบปรามยาเสพติด สำนักตำรวจแห่งชาติ (ผอ.ศอ.ปส.ตร.) เปิดเผยถึงการบังคับใช้กฎหมายว่า นับแต่วันที่ 9 มิ.ย. 2565 พืชกัญชาไม่ถือเป็นยาเสพติด และยกเลิกความผิดฐานผลิต นำเข้า หรือส่งออก มีไว้ในครอบครอง จำหน่าย มีไว้ในครอบครองเพื่อเสพ หรือเสพพืชกัญชา รวมถึงการสูบ ก็ไม่ถือว่าเป็นความผิด
“การมีพืชกัญชาไว้ในครอบครอง หรือปลูกกัญชา ไม่ว่าจะมีจำนวนเท่าใด ก็ไม่มีความผิด แต่การ มี ใช้ จำหน่าย สารสกัดจากกัญชาที่มีปริมาณสาร THC เกินกว่า 0.2% ไม่มีใบอนุญาต ไม่มีใบสั่งแพทย์ ไม่ผ่านการรับรองโดยสำนักงานคณะกรรมการอาหารและยา หรือเป็นสารสกัดจากกัญชานั้นมีแหล่งที่มาจากนอกราชอาณาจักร ยังถือว่ามีความผิดตามกฎหมาย เมื่อตำรวจตรวจพบ จะยังไม่ดำเนินคดีในทันที เนื่องจากไม่เป็นความผิดซึ่งหน้า ตำรวจจะต้องยึดสารสกัดนั้นส่งผู้เชี่ยวชาญตรวจสอบหาค่าสาร THC สืบเสาะแหล่งที่มา ตรวจหลักฐานการขออนุญาต หากพบว่าผิดกฎหมาย จึงจะเรียกตัวมาแจ้งข้อกล่าวหา ดำเนินคดีภายหลัง”
การสูบกัญชาไม่มีความผิด แต่การสูบกัญชาในที่สาธารณะ รบกวนสิทธิผู้อื่น มีความผิดตาม พระราชบัญญัติการสาธารณสุข พ.ศ. 2535 โทษจำคุกไม่เกิน 3 เดือน ปรับไม่เกิน 25,000.-บาท อย่างไรก็ตามการสูบกัญชาในที่สาธารณะ ยังไม่มีกฎหมายควบคุมโดยตรง เช่น บุหรี่ ที่มีพระราชบัญญัติควบคุมผลิตภัณฑ์ยาสูบ ควบคุมอยู่
คณะกรรมการสื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ - ปลดล็อก กัญชา กัญชง ใช้กัญชาอย่างเข้าใจ LINK
8 มิถุนายน 2565 คณะกรรมการสื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ นำโดย นพ.มล.สมชาย จักรพันธุ์ ประธานที่ปรึกษารัฐมนตรีว่าการกระทรวงสาธารณสุข นพ. เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข นพ.ธงชัย กีรติหัตถยากร รองปลัดกระทรวงสาธารณสุข นพ.ไพศาล ดั่นคุ้ม เลขาธิการคณะกรรมการอาหารและยา และ นายปานเทพ พัวพงษ์พันธ์ คณบดีสถาบันแพทย์แผนบูรณาการและเวชศาสตร์ชะลอวัย มหาวิทยาลัยรังสิต ร่วมกันแถลงข่าวเกี่ยวกับกรณีการปลดล็อกกัญชากัญชง #ใช้กัญชาอย่างเข้าใจ ซึ่งมีผลบังคับใช้ตั้งแต่วันที่ 9 มิถุนายน 2565 นี้
คราฟต์ซ่ากัญชา กลับมาอีกครั้ง หลังจากเป็นพระเอกในปีที่แล้ว ปีนี้คงเด่นเหมือนเดิม
กัญชาช็อต LINK
1 แก้วมีกัญชาสด 10 ใบ
เครื่องดื่มกัญชาค้นสด ที่อุดมไปด้วยแร่ธาตุ และ THCA ไม่ทำให้เกิดอาการเมา
สวนประกอบ (ขนาด 6 ออนซ์)
น้ำคั้นใบกัญชาสด 100 มิลลิลิตร
น้ำเชื่อมกลิ่นบ๊วย 20 มิลลิลิตร
น้ำมะนาว 5 มิลลิลิตร
เกลือเล็กน้อย
วิธีทำ
- น้ำคั้นใบกัญชาสด ใช้กัญชา 100 กรัม ต่อน้ำ 1,000 มิลลิลิตร ปั่นละเอียดคั้นเอาแต่น้ำ
- ตวงส่วนผสมตามสูตร คนให้เข้ากันใส่ลงในแก้วขนาด 6 ออนซ์เติมน้ำแข็งดื่มแบบเย็น
โรงพยาบาลสิรินธร บริการฉีดวัคซีนโควิด-19 เข็ม 1-4 ให้บริการทุกวันศุกร์
โรงพยาบาลสิรินธร เปิดให้บริการฉีดวัคซีนไฟเซอร์ แอสตร้าเซเนก้า เข็ม 1-4 สำหรับผู้มีอายุ 5 ปีขึ้นไป วันที่มารับบริการ ติดต่อจุดลงทะเบียนฉีดวัคซีน ชั้น 1 อาคารบริการ โรงพยาบาลสิรินธร ตรงข้ามเวชระเบียน เวลา 13-15 น. รับจำกัดวันละ 500 คิวเท่านั้น จัดสรรตามวันและเวลาในระบบ QueQ
นพ.วัลลภ สำราญเวทย์ ผู้อำนวยการศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล
นพ.วัลลภ สำราญเวทย์ ผู้อำนวยการศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล กล่าวว่า โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนล ได้เปิดดำเนินการรักษาพยาบาล โดยจดทะเบียนเป็นโรงพยาบาลเฉพาะทางด้านกระดูกและข้อเป็นแห่งแรกในประเทศไทย เมื่อปี 2562 มุ่งเน้นให้การดูแลรักษาผู้ป่วยด้านกระดูกและข้อ อย่างครบครัน ชูคอนเซ็ปต์ Advanced Total Joint Care: เรื่องข้อครบ จบที่เดียว โดยนำเทคนิคและนวัตกรรมการผ่าตัดเปลี่ยนข้อเข่า-ข้อสะโพกเทียม ที่ช่วยให้เกิดผลลัพธ์และคุณภาพชีวิตที่ดีกับผู้ป่วย อาทิ การใช้ Digital Template Program วางแผนในการผ่าตัด Pre-operative planning program การใช้ระบบนำวิถีเนวิเกเตอร์นำร่องในขณะการผ่าตัด (Non-Invasive Navigation System) ร่วมกับเทคนิคระงับปวด (Pain Intervention Technique) และ ERAS Program (Enhanced Recovery After Surgery โปรแกรมช่วยให้ผู้ป่วยฟื้นตัวไว ในทุกขั้นตอน ก่อน-ระหว่าง-หลังผ่าตัด) ด้วยทีมแพทย์สหสาขา ผู้ชำนาญการเฉพาะทางโรคกระดูกและข้อ ผสานกับเทคโนโลยีที่ทันสมัยห้องผ่าตัด “Hybrid Operating Room” เป็นห้องผ่าตัดทันสมัยที่รวมเอาเทคโนโลยีขั้นสูงของการผ่าตัดไว้ด้วยกัน ช่วยให้ผู้ป่วยได้ผลลัพธ์ในการรักษาที่เป็นอย่างดี บาดเจ็บน้อย ฟื้นตัวไวซึ่งในปัจจุบัน ได้ให้การผ่าตัดรักษาผู้ป่วยมาแล้วมากกว่า 1,000 ราย
โรงพยาบาลตากสิน เปิดบริการ 3 คลินิก ดูแลเพื่อนๆ LGBTQ+ LINK
โรงพยาบาลตากสิน เปิดบริการ 3 คลินิก คลินิกตะวันใหม่ คลินิกLove care center และคลินิกรักษ์เพื่อน เพื่อดูแลเพื่อนๆ LGBTQ รับ PrideMonth
1. คลินิกตะวันใหม่
ให้บริการรักษา ให้คำปรึกษาผู้ป่วย HIV ครบวงจร
ไม่ติด ไม่ตาย ไม่ตีตรา : ร่วมยุติปัญหาเอดส์ และเพศสัมพันธ์ ไปด้วยกัน
บริการในเวลาราชการ จันทร์-ศุกร์ 8-16 น. เว้นวันหยุด
โทร.02-4370123 ต่อ 1136 1140
2. คลินิกเลิฟแคร์ Love care center
ให้บริการตรวจ รักษา
สำหรับชาย หญิง เพศทางเลือก
ตรวจรักษาโรคติดต่อทางเพศสัมพันธ์ เช่น HIV ซิฟิลิส หนองใน เริม ตกขาว
ให้บริการยา PrEP (ก่อนสัมผัสเชื้อ) และยา PEP (ยาป้องกันหลังสัมผัสเชื้อ)
ข้อมูลเรื่อง สมรรถภาพทางเพศ
บริการในเวลาราชการ จันทร์-ศุกร์ 8-16 น.
คลินิกนอกเวลา ทุกวันอังคาร 16-19 น.
โทร.098-5399746
Line Official: LOVECARE CENTER
3.คลินิกรักษ์เพื่อน
กล้ารัก กล้าเช็ค
ให้บริการตรวจเชื้อ HIV ซิฟิลิส ให้กับชายรักชาย สาวประเภทสอง และเพศทางเลือก
บริการคลินิกนอกเวลา ทุกวันจันทร์ พุธ พฤหัส 16-20 น.
โทร.02-4370123 ต่อ 1136 1140
โรงพยาบาลตากสิน บริการฉีดวัคซีนโควิด-19 เดือนมิถุนายน 2565 วันละ 400 คน
วัคซีนโควิด-19
รอบให้บริการฉีดวัคซีนโควิด-19 เดือนมิถุนายน 2565 มาแล้ว
เปิดฉีดวันจันทร์ที่ 6,13,20,27 มิถุนายน และ วันศุกร์ที่ 10,17,24 มิถุนายน
ตั้งแต่เวลา 08.00-14.00 น.
รับจอง QQ 200 คน
รับ walk in 200 คน
ข้อควรรู้และคำแนะนำเกี่ยวกับกัญชา ศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน
ข้อควรรู้และคำแนะนำเกี่ยวกับกัญชา ปลดล็อคกัญชา แต่พึงระวังในการใช้และการบริโภค เนื่องจากกัญชามีสารออกฤทธิ์ต่อจิตประสาท ... รู้ก่อนใช้ เพื่อความปลอดภัยของสุขภาพ
สอบถามเพิ่มเติมได้ที่
02 502-2345 ต่อ แผนกจิตเวช 1712
ศูนย์การแพทย์ปัญญานันทภิกขุ ชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ
@LINE : @egx1084y
เว็บไซต์ : pcmc.swu.ac.th
คุณหมอแอมป์ให้คำแนะนำง่ายๆ ว่า “ควรเริ่มจากการลดการบริโภคลง หรือบริโภคแต่น้อย”
ผลจากข้อมูลนี้ทำให้กระแสการดูแลสุขภาพด้วยการรับประทานอาหารจากพืชเป็นหลักหรือ Plant-based diet กำลังขยายตัวข้อมูลจาก STATISTA แสดงให้เห็นว่ามูลค่าตลาด Plant-based foods ทั่วโลกในปี พ.ศ. 2563 มีมูลค่า 1.3 หมื่นล้านดอลลาร์สหรัฐ หรือคิดเป็นเงินไทยประมาณ 3.9 แสนล้านบาท ซึ่งคาดการณ์ว่าตลาดจะเติบโตจนมีมูลค่า 3.5 หมื่นล้านดอลลาห์สหรัฐ หรือราว 1 ล้านล้านบาท ในปี พ.ศ. 2570
การรับประทานอาหารแบบ Plant-based diet มีความหมายกว้างกว่าการรับประทานอาหารแบบมังสวิรัติทั่วไป เคร่งครัดน้อยกว่าและไม่มีรูปแบบตายตัว แต่มุ่งเน้นในเรื่องสุขภาพจากการรับประทานผักหลากหลายชนิด ธัญพืชไม่ขัดสี เห็ดต่างๆหลายชนิด เลือกแหล่งโปรตีนจากเต้าหู้หรือถั่วหลากชนิด รวมทั้งหลีกเลี่ยงอาหารแปรรูปและอาหารที่ผ่านการปรุงแต่งต่างๆ
คลินิกดูแลป้องกันและฟื้นฟูสุขภาพ
คลินิกดูแลป้องกันและฟื้นฟูสุขภาพ โฟกัสที่ ศาสตร์แห่งการชะลอวัย ที่มุ่งเน้นชะลอความเสื่อมของร่างกาย ดูแลและรักษาแบบองค์รวม ตั้งแต่อาหาร การใช้ชีวิต การออกกำลังกาย ผสานการใช้เทคโนโลยีที่จำเป็น ในการตรวจสอบสภาวะของร่างกาย เพื่อการออกแบบโปรแกรมสุขภาพที่เหมาะสมกับแต่ละบุคคล เป็นการสร้างสุขภาวะและสุขภาพที่ดีจากภายใน
ภาพรวมของคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
20 มิถุนายน 2565: ศาสตราจารย์ แพทย์หญิงจิรพร เหล่าธรรมทัศน์ คณบดีคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ได้กล่าวถึงภาพรวมของคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ที่มีวิสัยทัศน์ดำเนินการเป็นบ้านแห่งการเรียนรู้ เพื่อสร้างบุคลากร องค์ความรู้ งานวิจัยและนวัตกรรมด้านวิทยาศาสตร์สุขภาพและการแพทย์เพื่อตอบสนองความต้องการของประเทศชาติและประชาชน พร้อมพันธกิจ ผลิตบัณฑิตที่มีคุณภาพภายใต้หลักสูตรที่ได้มาตรฐานวิชาการและมาตรฐานวิชาชีพ วิจัยเพื่อสร้างองค์ความรู้เทคโนโลยีและนวัตกรรมทางการแพทย์และการสาธารณสุขในลักษณะบูรณาการ สหวิทยาการเพื่อสร้างความเป็นเลิศวิชาการการแก้ไขปัญหาสาธารณสุขของประเทศ
Update : ความเห็นกรรมาธิการฯ กัญชา 10 ต้น - ปานเทพ พัวพงษ์พันธ์ 20 มิถุนายน 65
แจ้งความคืบหน้า ความเห็นกรรมาธิการฯ “กัญชา 10 ต้น” ใครจดแจ้งช่วงนี้กับ อ.ย. อาจให้เวลา “บทเฉพาะกาล” สำหรับการเปลี่ยนผ่าน 1 ปี
เมื่อวันที่ 20 มิถุนายน 2565 ได้ประชุมกรรมาธิการวิสามัญ พิจารณา ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ….ของสภาผู้แทนราษฎร ตั้งแต่เช้าผมได้แถลงข่าวในเวลาเที่ยง แต่ต่อมามีการประชุมเพิ่มเติมจนถึงตอนเย็น และยังทำให้มีการปรับปรุง “หลักการ”เพิ่มเติมในเรื่องกัญชาดังต่อไปนี้ (ยังมีการเปลี่ยนแปลงได้อีก)
ประการแรก ทางกรรมธิการฯ เสียงข้างมากได้เห็นชอบในหลักการกำหนดให้การปลูก “เพื่อใช้ในครัวเรือน” โดยที่ “ไม่มีการจำหน่าย” มีได้ครัวเรือนละไม่เกิน 10 ต้น ยกเว้นเป็นผู้ป่วยให้มีใบสั่งแพทย์สามารถปลูกได้มากกว่านั้นสำหรับดูแลตัวเอง โดยไม่ต้องขออนุญาตแต่ให้มีการจดแจ้ง
ประการที่สอง การปลูกกัญชาเพื่อ “จำหน่าย” สำหรับ “รายเล็ก” ทางกรรมาธิการฯ กำหนดให้รายเล็กคือไม่เกิน 5 ไร่ โดยจะให้เป็นการ “อนุญาต” โดยจะจัดกลุ่มดังกล่าวนี้ให้มีความสะดวกในการได้รับการอนุญาต และค่าธรรมเนียมและค่าใช้จ่ายต่ำที่สุด หรือไม่มีค่าใช้จ่ายเลย ซึ่งจะมีการพิจารณาในรายละเอียดต่อไป
ประการที่สาม การปลูกกัญชาเพื่อ “จำหน่าย” สำหรับ “รายกลาง” ทางกรรมาธิการฯ กำหนด “รายกลาง” คือปลูกเพื่อการพาณิชย์ 5 ไร่ขึ้นไปถึงไม่เกิน 20 ไร่, ส่วนรายใหญ่สำหรับผู้ปลูกเพื่อการพาณิชย์เกินกว่า 20 ไร่ขึ้นไป ทั้งรายกลางและรายใหญ่จะให้เป็นการ “อนุญาต” โดยค่าธรรมเนียมหรือค่าใช้จ่ายให้กับภาครัฐ (โดยหลักการคือผู้ปลูกขนาดใหญ่จะต้องจ่ายมากกว่าผู้ปลูกรายขนาดกลาง)
ประการที่สี่ ผู้ประกอบวิชาชีพ ได้แก่ แพทย์แผนไทย แพทย์แผนไทยประยุกต์ หมอพื้นบ้าน แพทย์แผนปัจจุบันสามารถปลูก หรือสกัดเพื่อการปรุงยาเฉพาะรายในสถานประกอบการของตัวเอง ด้วยการ “จดแจ้ง” ไม่ต้องขออนุญาต
ประการที่ห้า การสกัดเพื่อการแปรรูปอย่างง่ายในบ้านสามารถทำได้เพื่อใช้ในครัวเรือนเท่านั้น โดยห้ามจำหน่ายโดยเด็ดขาด
ประการที่หก การสกัดเพื่อการจำหน่ายไม่ว่าจะเป็นรูปแบบใดจะต้องขออนุญาตเท่านั้น ส่วน”ผลิตภัณฑ์” ให้เป็นไปตามมาตรฐานของกฎหมายในการควบคุมผลิตภัณฑ์นั้นๆ เช่น อาหาร, เครื่องสำอาง, เครื่องดื่ม, ผลิตภัณฑ์สมุนไพร ยา
ประการที่เจ็ด การสูบกัญชาในที่สาธารณะไม่สามารถกระทำได้, แต่จะไม่ก้าวล่วงการใช้ในครัวเรือนยกเว้น ห้ามจำหน่ายให้ใช้ในผู้ที่ต่ำกว่าอายุ 20 ปี สตรีมีครรภ์ สตรีให้นมบุตร และกลุ่มเสี่ยงอื่นๆ
ส่วนการสูบกัญชาเพื่อนันทนาการอยู่ระหว่างการพิจารณา เนื่องจากมีข้อคิดเห็นไม่เพียงด้านสุขภาพเท่านั้น แต่มีเสียงเรียกร้องจากประชาชนบางกลุ่มให้เปิดช่องสำหรับการใช้กัญชาเพื่อนันทนาการ “อย่างมีการควบคุม” เพื่อพัฒนาการท่องเที่ยวและเศรษฐกิจ
อย่างไรก็ตามเบื้องต้นทางกรรมาธิการฯเห็นว่าจะต้องมีการกระจายอำนาจสู่ท้องถิ่นและให้ประชาชนมีส่วนร่วมในการตัดสินใจของแต่ละพื้นที่ ซึ่งอาจมีการปฏิเสธหรือความต้องการแตกต่างกันในเรื่องการใช้เพื่อนันทนาการ และจะรับฟังเสียงของประชาชนในประเด็นนี้อย่างรอบด้านเพิ่มมากขึ้น
ประการที่แปด สำหรับการใช้ “กัญชาในร้านอาหาร” จะต้องมีการแสดงสัญลักษณ์เรื่องร้านอาหารและเมนูอาหารที่มีกัญชาเป็นส่วนผสม เพื่อการคุ้มครองผู้บริโภคตามที่กฎหรือประกาศกระทรวงกำหนด
ประการที่เก้า กรรมาธิการฯบางท่านเสนอให้เพิ่มขนาดสำหรับการพิจารณาอำนวยความสะดวกและค่าใช้จ่ายในการขออนุญาตปลูกกัญชง เช่น พื้นที่ขนาดเล็กไม่เกิน 10 ไร่ (ใช้การจดแจ้งไม่มีค่าใช้จ่าย), พื้นที่ขนาดกลางมากกว่า 10 ไร่ ถึง 40 ไร่ และพื้นที่ขนาดใหญ่มากกว่า 40 ไร่ขึ้นไปใช้การขออนุญาต
ประการที่สิบ ห้ามโฆษณาการสูบกัญชาเพื่อนันทนาการในทุกกรณี
ประการที่สิบเอ็ด กำหนดบทเฉพาะกาลสำหรับผู้ที่จดแจ้งกับ อ.ย.ในวันนี้ ทั้งในการขอจดแจ้งใหม่หรือขออนุญาตเปลี่ยนแปลงตามเกณฑ์ใหม่ตาม พ.ร.บ.กัญชา กัญชง พ.ศ….ให้แล้วเสร็จภายใน 1 ปี
ประการที่สิบสอง เห็นว่าควรมีการปรับปรุงคณะกรรมการกัญชา กัญชง ให้มีความคล่องตัวและเป็นตัวแทนจากทุกภาคส่วนรอบด้านมากขึ้น
ข้อคิดเห็นในเรื่อง “หลักการ”ข้างต้นจะนำไปสู่การแปรญัตติรายมาตราในวันศุกร์ที่ 24 มิถุนายน 2565 นี้ แต่ยังเปิดรับฟังความคิดเห็นรอบด้านจากประชาชนทุกภาคส่วน เพื่อช่วยกันปรับปรุงแก้ไขทำให้กฎหมายฉบับดังกล่าวเป็นประโยชน์ต่อประเทศชาติมากที่สุด
จึงเรียนมาเพื่อทราบ
ปานเทพ พัวพงษ์พันธ์
โฆษกกรรมาธิการวิสามัญพิจารณา ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ…. สภาผู้แทนราษฎร
20 มิถุนายน 2565 “ศูนย์ส่งเสริมพฤฒพลังผู้สูงอายุ” ประตูย้อนวัยของ สว.สุขภาพดี ตั้งอยู่บริเวณริมแม่น้ำปิง ต.ป่าแดด อ.เมือง จ.เชียงใหม่ เป็นศูนย์ที่สร้างขึ้นด้วยแนวคิดที่มุ่งเน้นการดูแลผู้สูงอายุ เป็นศูนย์ถ่ายทอดองค์ความรู้แก่ผู้สูงอายุ และผู้ดูแล โดยคำนึงถึงการสร้างรากฐานของร่างกายที่แข็งแรงเป็นหลักสำคัญ เพื่อพัฒนาคุณภาพชีวิต ส่งเสริมสุขภาพกาย ใจ และปัญญา พื้นที่แห่งนี้เปิดให้ผู้สูงอายุได้เข้ามาใช้บริการด้วยเป้าหมายคือ ลดอัตราการเจ็บป่วย ส่งเสริมให้คนป่วยน้อยที่สุด สอดคล้องกับประโยคที่ว่า “แก่ได้ แต่สุขภาพดี”
52% รายได้ที่ลดลง
จากผลการสำรวจยังพบอีกว่า ค่าครองชีพที่สูงขึ้นประกอบกับสถานการณ์โควิด-19 ในปัจจุบัน ได้ส่งผลกระทบในเชิงลบต่อการใช้ชีวิตของคนไทย โดย 52% คนประสบปัญหารายได้ที่ลดลง ทำให้สภาพคล่องทางการเงินลดลงเมื่อเปรียบเทียบกับปีที่แล้ว โดยเฉพาะในกลุ่มฐานรากที่ได้รับความเดือดร้อนต่อเนื่องจากเศรษฐกิจที่ย่ำแย่จากโควิด-19 หรือกลุ่มคนวัยทำงานที่มีความสุ่มเสี่ยงจากจำนวนรายได้ต่อเดือนที่ไม่คงที่ เช่น เจ้าของกิจการขนาดเล็ก, ผู้ที่ทำงานอิสระ หรือฟรีแลนซ์ เป็นต้น นอกจากนี้ค่าครองชีพที่สูงยังสร้างปัญหาให้กับครัวเรือนที่มีรายได้ต่ำ, ผู้บริโภคในภาคอีสาน หรือผู้ที่กำลังว่างงาน ซึ่งเป็นกลุ่มที่มีสถานะทางเศรษฐกิจที่ค่อนข้างเปราะบางอยู่แล้ว
พฤติกรรมการใช้ชีวิตของคนไทยกำลังจะกลับเข้าสู่สภาวะปกติอีกครั้ง - ชุติมา วิริยะมหากุล
คุณชุติมา วิริยะมหากุล ผู้อำนวยการฝ่ายธุรกิจ สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) กล่าวว่า “พฤติกรรมการใช้ชีวิตของคนไทยกำลังจะกลับเข้าสู่สภาวะปกติอีกครั้ง หลังจากต้องเผชิญกับการระบาดของโควิด-19 มาเป็นระยะเวลายาวนานกว่า 2 ปี ทุกคนล้วนมีความต้องการในการจับจ่ายใช้สอย เพื่อซื้อความสุขให้กับตนเอง”
แนวโน้มความต้องการในการใช้จ่ายจากผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนมิถุนายน พ.ศ. 2565 พบว่า ประเภทของสินค้าที่จะมีแนวโน้มในการจับจ่ายของคนไทยอันดับหนึ่งยังคงเป็น อาหาร แต่ที่น่าสนใจคือสินค้าประเภทของใช้ในชีวิตประจำวันอยู่ที่อันดับสองรองลงมา แต่กลับมีเปอร์เซ็นต์ที่สูงขึ้นถ้าหากเทียบกับผลสำรวจเมื่อเดือนเมษายนที่ผ่านมา และอันดับสามยังคงเป็นประเภทโทรศัพท์มือถือและสมาร์ตโฟนซึ่งอันดับนี้ก็มีความน่าสนใจเช่นกัน เนื่องจากมีเปอร์เซ็นต์ในความต้องการซื้อที่ต่ำลง สะท้อนให้เห็นถึงเรื่องของความต้องการของคนไทยในยุคปัจจุบันที่ว่า ซื้อของใช้จำเป็นเพื่อตนเองและครอบครัวก่อน
กสทช. แจงแนวปฏิบัติในการถ่ายทำรายการโทรทัศน์
ศาสตราจารย์ ดร.พิรงรอง รามสูต กรรมการกิจการกระจายเสียง กิจการโทรทัศน์ และกิจการโทรคมนาคมแห่งชาติ (กสทช.) กล่าวในการประชุมทำความเข้าใจเกี่ยวกับแนวปฏิบัติในการถ่ายทำรายการโทรทัศน์ ภาพยนตร์ และวีดิทัศน์ ฉบับปรับปรุง แก่ผู้ประกอบกิจการโทรทัศน์ และสื่อมวลชน เมื่อวันที่ 20 มิถุนายน 2565 ว่า แม้สถานการณ์การแพร่ระบาดโควิด -19 เริ่มคลี่คลายลง และข้อปฏิบัติหลาย ๆ อย่างจะเริ่มผ่อนคลาย แต่โควิดยังคงมีอยู่ หน้ากากอนามัยยังเป็นเครื่องมือที่มีความปลอดภัยสูงสุดในการป้องกันการแพร่ระบาดของโรค จึงขอความร่วมมือสื่อมวลชนให้ยังคงเป็นแบบอย่างที่ดีแก่ประชาชน ดำเนินการถ่ายทำรายการด้วยความระมัดระวังสูงสุด
ศาสตราจารย์ ดร.พิรงรอง กล่าวว่า ที่ผ่านมาการประชุมทำความเข้าใจแนวปฏิบัติในการถ่ายทำรายการโทรทัศน์ สำนักงาน กสทช. ได้นำข้อเสนอในที่ประชุมไปแก้ไขปรับปรุงแนวปฏิบัติและเสนอต่อ กสทช. ก่อนเสนอศูนย์ปฏิบัติการ ศูนย์บริหารสถานการณ์ โควิด-19 (ศปก.ศบค.) และ ศูนย์บริหารสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรน่า 2019 (โควิด-19) หรือ ศบค. โดยได้ข้อสรุป และกำหนดเป็นแนวปฏิบัติในการถ่ายทำรายการโทรทัศน์ ภาพยนตร์ และวีดิทัศน์ ฉบับปรับปรุง (ฉบับที่ 1)
นางสาวมณีรัตน์ กำจรกิจการ ผู้ช่วยเลขาธิการคณะกรรมการกิจการกระจายเสียง กิจการโทรทัศน์ และกิจการโทรคมนาคมแห่งชาติ กล่าวว่า ได้ชี้แจงรายละเอียดเกี่ยวกับการปรับปรุงแนวปฏิบัติในการถ่ายทำรายการโทรทัศน์ โดยมีประเด็นสำคัญ คือ ทุกคนในกองถ่ายต้องได้รับวัคซีนครบตามเกณฑ์ ต้องตรวจ ATK ก่อนเข้าพื้นที่ปฏิบัติงาน เว้นระยะห่างอย่างน้อย 1-2 เมตร และควรสวมหน้ากากอนามัยตลอดการปฏิบัติหน้าที่เพื่อลดความเสี่ยง เว้นแต่พิธีกร นักแสดง และผู้ร่วมรายการที่จำเป็นต้องออกหน้าจอ สามารถถอดหน้ากากอนามัยระหว่างการถ่ายทำรายการได้ แต่ยังคงต้องยึดหลักของการรักษาระยะห่าง และใช้มาตรการอื่นๆ ประกอบ เช่น การมีฉากกั้น จำกัดจำนวน และระบุบุคคลให้ชัดเจน และบันทึกประวัติการทำกิจกรรม นอกจากนี้ ยังต้องมีความเคร่งครัดเป็นพิเศษสำหรับกลุ่มผู้เปราะบาง กลุ่ม 608 หรือเด็กเล็กที่มีอายุน้อยกว่า 5 ขวบ
ทั้งนี้ในการประชุมผู้ประกอบกิจการโทรทัศน์ได้มีข้อซักถามเกี่ยวกับพิธีกร นักแสดงที่มีอายุมากกว่า 60 ปี ซึ่งถูกกำหนดให้สวมหน้ากากอนามัยระหว่างปฏิบัติงาน แต่มีความจำเป็นต้องแสดงสีหน้าท่าทางออกหน้าจอ โดยกรณีดังกล่าวมีคำแนะนำว่า สามารถถอดหน้ากากอนามัยระหว่างการถ่ายทำรายการได้หากเป็นผู้ที่มีสุขภาพแข็งแรง แต่จะต้องมีความระมัดระวังสูงสุด โดยใช้มาตรการอื่นๆ ประกอบ มีการลงนามรับทราบความเสี่ยง และจะต้องมีการขึ้นข้อความเพื่อทำความเข้าใจกับประชาชนว่าได้ปฏิบัติตามมาตรการอย่างเคร่งครัด และที่ประชุมได้มีความเห็นร่วมกันว่า พร้อมใจที่จะดำเนินการตามมาตรการในการถ่ายทำรายการโทรทัศน์ฉบับนี้
นางสาวมณีรัตน์ กล่าวทิ้งท้ายว่า สำนักงาน กสทช. พยายามผ่อนคลายมาตรการในการถ่ายทำรายการโทรทัศน์อย่างรอบคอบ และไม่ให้กระทบต่ออุตสาหกรรมในภาพรวม ซึ่งมาตรการในการถ่ายทำรายการโทรทัศน์อาจมีความเข้มงวดกว่าหลักปฏิบัติทั่วไปของประชาชน แต่เพื่อไม่ให้เกิดการแพร่ระบาดภายในกองถ่าย และเพื่อเป็นแบบอย่างที่ดีให้กับประชาชนในฐานะสื่อมวลชน จึงอยากขอความร่วมมือผู้ประกอบกิจการปฏิบัติตามอย่างมีวินัย อย่างไรก็ตาม หากมีการเปลี่ยนแปลงมาตรการสาธารณสุขเพิ่มเติม ก็จะเชิญสื่อมวลชนเข้ามาหารือเพื่อกำหนดมาตรการ เพื่อให้สามารถปฏิบัติไปในทิศทางเดียวกัน ทั้งนี้ ที่ประชุมได้มีความเห็นร่วมกันในการเริ่มปฏิบัติไปในแนวทางเดียวกัน [ข่าวกสทช.]
น่าสังเกตว่าในวันที่สังคมยังคงยกการ์ดสูงเฝ้าระวังโควิด-19 หลายคนยังอ่อนไหวต่อการติดเชื้อ เป็นหวัดบ่อยครั้ง เป็นไข้หวัดใหญ่ ท้องเสียง่าย อยู่ในภาวะลองโควิดที่ยาวนาน รวมทั้งเป็นเริม งูสวัด ฯลฯ เหล่านี้คือสัญญาณบ่งบอกถึงความอ่อนแอของระบบภูมิคุ้มกันในร่างกาย
แพ็กเกจคลอดเหมาจ่าย LINK
แพ็กเกจคลอดเหมาจ่าย
สิทธิพิเศษสำหรับคุณแม่และหนูน้อย ห้องพักพิเศษ 4วัน 3 คืน (กรณีมานอนก่อนไม่คิดค่าใช้จ่าย)
มีสูติ-นรีแพทย์ วิสัญญีแพทย์ ทีมพยาบาลดูแลตลอดขณะทำการคลอดและกุมารแพทย์รับเด็กดูแลตั้งแต่แรกเกิดจนถึงวันกลับบ้าน
ค่าห้องคลอด ห้องผ่าตัดคลอด และห้องพักฟื้น
ค่าห้องพักเดี่ยว สำหรับคุณแม่และค่าอาหารหลังคลอด
ค่าห้องพักสำหรับทารกแรกเกิด ค่าบริการทางการพยาบาลและทีมผู้ดูแลตั้งแต่คลอดจนกลับบ้าน
ค่าเครื่องมือแพทย์ อุปกรณ์ ค่าเวชภัณฑ์ และค่ายาที่จำเป็นสำหรับการคลอดขณะอยู่โรงพยาบาล
ค่าตรวจวิเคราะห์ความสมบูรณ์ของเกล็ดเลือด และการจองโลหิต แต่ไม่รวมการให้โลหิตและส่วนประกอบของเลือดที่ให้ก่อนการผ่าตัด ระหว่างผ่าตัด และหลังผ่าตัด (สำหรับคุณแม่)
เจาะเลือดตรวจเด็กแรกเกิด ABO, Rh, Screening PKU และ TSH, MB, HCT, Screening Jaundice
วัคซีนแรกเกิดพื้นฐานและค่ายา เช่น BCG, Hepatitis B เข็มที่ 1, Vitamin K และ ยาป้ายตาเพื่อป้องกันตาอักเสบ
ค่าตรวจการทำงานหัวใจทารกในครรภ์เบื้องต้น และค่าตรวจคัดกรองการได้ยินของทารกแรกเกิด (ABR) เบื้องต้น โดยการประเมินของแพทย์
ใบรับรองการแจ้งเกิด
Gife Set แรกเกิดและภาพถ่ายคู่แพทย์ผ่าตัด หรือ มารดาบิดา
สอนการให้นมบุตร นวดเต้านม อาบน้ำและทำความสะอาดบุตร
สิทธิข้าราชการใช้ได้ในกรณีนัดผ่าตัดล่วงหน้า
สัมภาษณ์พิเศษ ศาสตราจารย์ แพทย์หญิงจิรพร เหล่าธรรมทัศน์ คณบดีคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ


เราเป็นบ้านแห่งการเรียนรู้ เพื่อสร้างบุคลากร องค์ความรู้ งานวิจัยและนวัตกรรมด้านวิทยาศาสตร์สุขภาพและการแพทย์เพื่อตอบสนองความต้องการของประเทศชาติและประชาชน พร้อมพันธกิจ ผลิตบัณฑิตที่มีคุณภาพภายใต้หลักสูตรที่ได้มาตรฐานวิชาการและมาตรฐานวิชาชีพ วิจัยเพื่อสร้างองค์ความรู้เทคโนโลยีและนวัตกรรมทางการแพทย์และการสาธารณสุขในลักษณะบูรณาการ สหวิทยาการเพื่อสร้างความเป็นเลิศวิชาการการแก้ไขปัญหาสาธารณสุขของประเทศ
รวมถึงการนำไปต่อยอดและใช้ประโยชน์เชิงพาณิชย์รวมถึงสาธารณประโยชน์ ให้บริการทางวิชาการ วิชาชีพด้านวิทยาศาสตร์สุขภาพบนพื้นฐานของมาตรฐานวิชาชีพและการสร้างทุนทางปัญญาเพื่อพัฒนาคุณภาพชีวิตที่ดีของประชาชน อนุรักษ์ฟื้นฟูสืบสานและเผยแพร่ภูมิปัญญาการสร้างองค์ความรู้และทำความเข้าใจวัฒนธรรมวิถีชีวิตและสืบสานพระปณิธานใน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี องค์ประธานราชวิทยาลัยจุฬาภรณ์ ที่ทรงมุ่งหวังให้วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ซึ่งเป็นหน่วยงานภายใต้การกำกับของราชวิทยาลัยจุฬาภรณ์ เป็นศูนย์กลางการศึกษาและวิจัยสู่ความเป็นเลิศด้านวิชาการและวิชาชีพเพื่อบริการมวลมนุษยชาติอย่างยั่งยืน ภายใต้ปรัชญา “เป็นเลิศเพื่อทุกชีวิต”
สถานเอกอัครราชทูต ณ กรุงโตเกียว เตือนคนไทย ห้ามนำกัญชา กัญชง เข้าประเทศญี่ปุ่น LINK
สถานเอกอัครราชทูต ณ กรุงโตเกียว เตือนคนไทย ห้ามนำกัญชา กัญชง เข้าประเทศญี่ปุ่น หากฝ่าฝืน มีโทษตามกฎหมายญี่ปุ่น
สถานเอกอัครราชทูต ณ กรุงโตเกียว ขอแจ้งเตือนคนไทย ห้ามนำเข้ากัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของพืชชนิดดังกล่าว เข้ามาในประเทศญี่ปุ่น
หากฝ่าฝืน มีโทษตามกฎหมายญี่ปุ่น
มีไว้ในครอบครองเพื่อนำเข้าและส่งออก
-มีโทษจำคุกไม่เกิน 7 ปี
มีไว้ในครอบครองเพื่อจำหน่าย
-มีโทษจำคุกไม่เกิน 10 ปี และปรับไม่เกิน 3 ล้านเยน
**โปรดระวัง !! การรับฝากสิ่งของผิดกฎหมายเข้ามาในประเทศญี่ปุ่น
บุคลากรดีเด่นของโรงพยาบาลพระอาจารย์ฝั้น อาจาโร
โรงพยาบาลพระอาจารย์ฝั้น อาจาโร นับเป็นแหล่งผลิตบุคลากรดีเด่นอย่างแท้จริง โดยเฉพาะสายงานด้านการแพทย์แผนไทยและเภสัชกรรม เพราะมีบุคลากรของโรงพยาบาลหลายท่านที่เคยได้รับรางวัลดีเด่นด้านต่างๆ มาแล้ว ก่อนหน้านี้ ดังนี้แพทย์หญิงกัญญาภัค ศิลารักษ์ รับรางวัลข้าราชการพลเรือนดีเด่น ประจําปี 2564
แพทย์หญิงกัญญาภัค ศิลารักษ์ ผู้อำนวยการโรงพยาบาลพระอาจารย์ฝั้น อาจาโร รับรางวัลข้าราชการพลเรือนดีเด่น ประจําปี 2564 จังหวัดสกลนคร (ระดับประเทศ)
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาตลิ่งชัน
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาตลิ่งชัน
ที่อยู่ : 39/14-15 ถนนบรมราชชนนี แขวงตลิ่งชัน เขตตลิ่งชัน กรุงเทพฯ 10170
แพทย์ประจำ สาขาตลิ่งชัน
นายแพทย์จิตรทิวัส อำนวยผล
แพทยศาสตรบัณฑิต คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช พ.ศ.2561
ตารางออกตรวจ
วันจันทร์ - วันศุกร์ เวลา 08.00 - 19.00 น.
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 2 มักกะสัน LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 2 มักกะสัน ให้บริการวันพุธ เวลา 13.00 – 16.00 น. ยกเว้นวันหยุดนักขัตฤกษ์
โทรสอบถามเพิ่มเติม 02-2517735 – 37 กด 21
การให้บริการ
- ให้ความรู้ คำปรึกษา เกี่ยวกับ การวางแผนครอบครัว และหลังคลอด
- ซักประวัติ การคุมกำเนิด, การคลอด, ตรวจเต้านม และสอนการตรวจเต้านมด้วยตนเอง
- ประเมินสุขภาพทั่วไป ชั่งน้ำหนัก, วัดส่วนสูง, ประเมินดัชนีมวลกาย, วัดความดันโลหิตสูง และตรวจปัสสาวะ
- ให้บริการคุมกำเนิดโดยการใช้ยาเม็ดคุมกำเนิดหรือยาฉีดคุมกำเนิด
- ตรวจมะเร็งปากมดลูก และตรวจหลังคลอด
ขั้นตอนการให้บริการ
1. รับบัตรคิวที่จุดประชาสัมพันธ์ชั้น 1 เริ่มตั้งแต่เวลา 12.00 น.
2. ยื่นบัตรคิวพร้อมบัตรประจำตัวผู้รับบริการ, บัตรประชาชน, ที่ห้องเวชระเบียน
3. วัดสัญญาณชีพที่จุดเตรียมตรวจ
4. ซักประวัติ พบแพทย์
5.นั่งรอรับยา
งานป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์ LINK
งานป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์ ให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าใน สัตว์เลี้ยงลูกด้วยนมทุกชนิด
หมายเหตุ : หากสัตว์เลี้ยงเจ็บป่วยอยู่ ไม่ควรนำมารับวัคซีน
เข้ารับบริการ ได้ ทุกวันศุกร์ เวลา 13.00 - 16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
** ออกหน่วยรณรงค์ในชุมชนพื้นที่ในช่วงเดือนมีนาคม และ กันยายน ของทุกปี **
เบอร์ติดต่อ : 02 2842331 ต่อ 108
ที่ตั้งศูนย์ 663 ถ. สาธุประดิษฐ์ แขวง บางโพงพาง เขต ยานนาวา กรุงเทพมหานคร 10120
ทีมงาน
1. นายภูวดลย์ พิมพขันธ์ ตำแหน่ง พยาบาลเทคนิคชำนาญงาน
2. นายสุรพล รอดกันภัย ตำแหน่ง พนักงานทั่วไป
FAQ ใช้ Spring Up กับข้อมูลอาหาร
ฉันจะบันทึกรายการอาหารที่รับประทานในแต่ละวันได้อย่างไร?
คุณสามารถเริ่มต้นบันทึกรายการอาหารโดยการกดปุ่มรูปกล้อง จากนั้นคุณสามารถบันทึกรายการอาหารได้ 3 วิธี:
1. ถ่ายรูปอาหารที่คุณจะรับประทาน หรือเลือกรูปอาหารจากอัลบั้มรูปของคุณ จากนั้นจึงปรับปริมาณอาหารให้ตรงตามที่คุณรับประทาน
2. กด "ค้นหา" แล้วใส่ชื่อเมนูอาหาร หรือคำค้นหาหลัก จากนั้นจึงปรับปริมาณอาหารให้ตรงตามที่คุณรับประทาน
3. กด "เพิ่ม" แล้วเพิ่มรายการอาหารและสารอาหารด้วยตัวเอง
หากไม่พบรายการอาหารในระบบ ขอแนะนำให้คุณเลือกรายการอาหารที่ใกล้เคียงมากที่สุด และโปรดแจ้งให้เราทราบหากคุณต้องการเพิ่มรายการอาหารลงในระบบ โดยไปที่ "บริการช่วยเหลือ" > "ติดต่อเรา"
ฉันสามารถเช็กคุณค่าทางโภชนาการที่ต้องการในแต่ละวันได้อย่างไร?
คุณสามารถเช็กปริมาณแคลอรี่ที่ควรรับประทานต่อวันได้ที่ "หน้าหลัก" สำหรับสารอาหารประเภทอื่นๆ โปรดคลิกที่ "ดูเพิ่มเติม" จากนั้นกดปุ่ม "i"
แอป Spring Up สามารถเช็กคุณค่าทางโภชนาการอะไรได้บ้าง?
คุณสามารถเช็กคุณค่าทางโภชนาการและสารอาหารได้ ดังนี้:
แคลอรี่, โปรตีน, ไขมันทั้งหมด, คาร์บทั้งหมด, ใยอาหาร, น้ำตาล, โคเลสเตอรอล, แคลเซียม, โพแทสเซียม, เหล็ก, วิตามินซี, โซเดียม
แอป Spring Up คำนวณคุณค่าทางโภชนาการของแต่ละมื้ออย่างไร?
เราคำนวณคุณค่าทางโภชนาการโดยอ้างอิงจากฐานข้อมูล 2 แหล่ง ได้แก่ INMU-DailymenuPlan (iDP) โดยสถาบันโภชนาการ มหาวิทยาลัยมหิดล และฐานข้อมูลจากพาร์ทเนอร์ของเรา
ปริมาณสารอาหารที่แนะนำต่อวันอ้างอิงมาจากแหล่งใด?
เราอ้างอิงข้อมูลปริมาณสารอาหารที่ควรได้รับประจำวัน (Dietary Reference Intakes - DRIs) จากสถาบันโภชนาการ มหาวิทยาลัยมหิดล ซึ่งเป็นการแนะนำปริมาณสารอาหารสำหรับบุคคลทั่วไป
ข้อมูลรายการอาหารต่างๆ มาจากไหน?
เราได้รับการสนับสนุนด้านฐานข้อมูลรายการอาหารจากสถาบันโภชนาการ มหาวิทยาลัยมหิดล และพาร์ทเนอร์ของเรา อย่างไรก็ตาม เรายินดีรับฟังความคิดเห็นของคุณเสมอ โปรดแจ้งให้เราทราบหากคุณต้องการเพิ่มรายการอาหารลงในระบบ เพื่อให้ประสบการณ์การใช้งานแอป Spring Up ของคุณดียิ่งขึ้น
ฉันสามารถเช็กคุณค่าทางโภชนาการของเครื่องดื่มได้ด้วยหรือไม่?
คุณสามารถเช็กคุณค่าทางโภชนาการของเครื่องดื่มได้ เรามีฐานข้อมูลรายการเครื่องดื่มด้วยเช่นกัน
ฉันสามารถบันทึกรายการอาหารย้อนหลังของเมื่อวานได้หรือไม่?
คุณสามารถบันทึกรายการอาหารย้อนหลังได้ 2 วัน
9 มีนาคม 2565 ระเบิดบนเรือบรรทุกน้ำมัน บ.IRPC พระประแดง สมุทรปราการ LINK
จากเหตุการณ์ระเบิดบนเรือบรรทุกน้ำมันขณะกำลังขนถ่ายน้ำมัน บริเวณท่าเรือบริษัท ไออาร์พีซี จำกัด (มหาชน) สาขาพระประแดง จังหวัดสมุทรปราการ เมื่อวันที่ 9 มีนาคม 2565 เวลา 09.30 น. ทำให้มีผู้ได้รับบาดเจ็บ 3 ราย และเสียชีวิต 1 ราย
จากการตรวจสอบพบว่า เรือบรรทุกน้ำมันที่ประสบเหตุชื่อ สมูธ ซี 2 ขนาด 1989 ตัน เป็นเรือสัญชาติไทย ของบริษัท สมูธ ซี จำกัด เหตุการณ์ดังกล่าวมีลูกจ้างที่เป็นผู้ประกันตนได้รับบาดเจ็บ 3 ราย ชื่อ นายณัฐภูมิ ลักษณะจันทร์ อายุ 32 ปี อาการบาดเจ็บ ปวดหู หูอื้อ ข้างขวา นายสมพงษ์ คงวิเชียร อายุ 33 ปี อาการบาดเจ็บปวดแขนขวา และนายพีรกานต์ พงษา อายุ 25 ปี อาการบาดเจ็บแผลฉีกขาดแก้มขวา มีแผลไฟไหม้ตามร่างกาย ทั้ง 3 คน ถูกนำตัวส่งเข้ารักษาที่โรงพยาบาลบางปะกอก 3 เรียบร้อยแล้ว สำหรับผู้เสียชีวิต 1 ราย ทราบชื่อคือ นายศรรกฏิยพงษ์ สงวนพันธุ์
สำนักงานประกันสังคม เร่งประสานทายาทผู้มีสิทธิของลูกจ้างที่เสียชีวิต ให้มารับสิทธิประโยชน์จากกรณีบาดเจ็บและเสียชีวิตเนื่องจากการทำงาน ซึ่งจะได้รับค่ารักษาพยาบาลเท่าที่จ่ายจริงตามความจำเป็น แต่ไม่เกินตามอัตราที่กำหนดในกฎกระทรวง ค่าทดแทน 70% ของค่าจ้าง กรณีลูกจ้างหยุดพักรักษาตัวดามแพทย์สั่ง ตั้งแต่วันแรกที่หยุดงานแต่ไม่เกิน 1 ปี ค่าทตแทน 70% ของค่าจ้าง กรณีสูญเสียอวัยวะ ไม่เกิน 10 ปี ลูกจ้างจะได้รับการประเมินเมื่อสิ้นสุดการรักษา และค่าทดแทน 70% ของค่าจ้าง กรณีสูญหายหรือเสียชีวิต เป็นเวลา 10 ปี ในการนี้ สำนักงานประกันสังคม กระทรวงแรงงาน จะให้การดูแลสิทธิประโยชน์ของลูกจ้างผู้ประกันตนที่ได้รับบาดเจ็บ และทายาทของผู้เสียชีวิตให้ได้รับสิทธิประโยชน์อย่างครบถ้วน ดุจคนในครอบครัวเดียวกัน โดยไม่ทิ้งเขาไว้ข้างหลังอย่างแน่นอน
น้องด้อม ชวนตรวจ HIV เพื่อนกับเรา รับสติกเกอร์ไลน์สุดคิ้วท์ ฟรี ทันที
ร่วมรณรงค์ตรวจเอชไอวี เนื่องในวัน VCT 1 ก.ค. ด้วยไอเท็มสุดคิ้วท์!!!
"น้องด้อม ชวนตรวจ HIV" เป็นเพื่อนกับเรา รับทันที สติกเกอร์ไลน์ฟรี สุดคิ้วท์!!!
1. กดลิงก์ หรือ สแกน Qr Code เพื่อเพิ่มเพื่อน
2. ทักแชทแอดมินเพื่อแจ้ง ขอรับสติกเกอร์
3. รอรับสติกเกอร์
4. รับสติกเกอร์ กดที่ “รับของขวัญ” ให้น้องด้อมอยู่เป็นเพื่อนคุณ
คลินิกคุณภาพการนอนหลับ (Comprehensive Sleep Clinic)
การเปิด
คลินิกคุณภาพการนอนหลับ หรือที่เรียกว่า
Comprehensive Sleep Clinic โรงพยาบาลบำรุงราษฎร์ ในงานแถลงข่าว The Hidden Impact of Sleep ถือเป็นคลินิกการรักษาที่มีความสำคัญ ที่จะช่วยให้เรามีคุณภาพการนอนที่ดีและมีคุณภาพชีวิตที่ดีขึ้น ซึ่งปัญหาการนอนเกิดขึ้นได้จากหลายสาเหตุทั้งจากร่างกาย จิตใจ และสภาวะแวดล้อม โดยเฉพาะในกลุ่มผู้มีโรคประจำตัว หรือบางรายอาจมีโรคซับซ้อนแฝงอยู่ โดยที่ตัวผู้ป่วยเองอาจไม่เคยทราบมาก่อน ซึ่ง "คลินิกคุณภาพการนอนหลับ" โรงพยาบาลบำรุงราษฎร์ สามารถนำไปสู่การตรวจวินิจฉัยที่แม่นยำและทราบถึงสาเหตุของปัญหาการนอนเพื่อการรักษาได้ตรงจุด ที่สำคัญ กรณีตรวจพบว่าผู้ป่วยมีโรคอื่นร่วมด้วย บำรุงราษฎร์ยังสามารถส่งต่อการรักษาได้อย่างทันท่วงทีแบบไร้รอยต่อด้วยความชำนาญการและประสบการณ์ของทีมแพทย์เฉพาะทางที่ครอบคลุมทุกสาขา รวมถึงมีสหสาขาวิชาชีพที่ทำงานร่วมกันอย่างมืออาชีพเพื่อให้ผลลัพธ์ของการรักษาผู้ป่วยมีประสิทธิภาพสูงสุด
อภัยภูเบศร แนะนำสินค้ากัญชาใหม่
อภัยภูเบศร ผู้นำด้านสมุนไพรของประเทศไทย ปีนี้มีสินค้ากัญชามาแนะนำใน 2 กลุ่ม คือ
ประเภทรับประทาน ได้แก่ ชาจากใบกัญชา และยาสมุนไพรเข้ากัญชา 2 ตำรับ คือ ยาแก้ลมแก้เส้น และยาศุขไสยาศน์ และ
ประเภทสินค้าบำรุงผิวพรรณ ที่มีจำหน่ายแล้ว คือ ครีมบำรุงผิว แบบไนท์ครีม สูตรมีสารแอนตี้ออกซิแดนท์ จาก CBD ช่วยชะลอวัย บำรุงผิว ลดการเกิดริ้วรอย
นอกจากสินค้าที่ออกจำหน่ายแล้ว อภัยภูเบศรยังมีแผนพัฒนาผลิตภัณฑ์จากกัญชาอีกหลายรายการ ซึ่งขณะนี้อยู่ในการทำต้นแบบ ค้นคว้า และเตรียมจดเลขอย. แฟนคลับอภัยภูเบศร ขอให้ติดตามข่าวสาร
หนังสือความรู้ คู่มือกัญชา สมุนไพร อภัยภูเบศรจัดสรรมาให้ผู้สนใจ โอกาสดีที่หนังสือตำราต่างๆเกี่ยวกับกัญชามีมากขึ้น รู้ให้มาก อ่านให้มาก จะทำให้เราใช้กัญชาได้สมประโยชน์ ได้คุณค่า และอย่างมีคุณภาพ
โรงพยาบาลอุตรดิตถ์ แนะนำชาวอุตรดิตถ์ ที่ติดโควิด ปฏิบัติดังนี้
คลินิก เจอ แจก จบ โรงพยาบาลพระนารายณ์มหาราช จันทร์-ศุกร์
คลินิก เจอ แจก จบ โรงพยาบาลพระนารายณ์มหาราช เปิดให้บริการเฉพาะวันจันทร์ ถึงวันศุกร์ ในวันทำการ เวลา 8.00-16.00 น.
กองบิน 7 เข้าร่วมการฝึกการป้องกันและบรรเทาสาธารณภัย
กองบิน 7 เข้าร่วมการฝึกการป้องกันและบรรเทาสาธารณภัย การช่วยเหลือผู้ประสบภัยทางทะเล และการขจัดคราบน้ำมันในทะเล ประจำปี 2565
พลเรือโท สุนทร คำคล้าย ผู้บัญชาการทัพเรือภาคที่ 2 / ผู้อำนวยการ ศูนย์อำนวยการรักษาผลประโยชน์ของชาติทางทะเลภาค 2 เป็นประธานในการฝึกการป้องกันและบรรเทาสาธารณภัย การช่วยเหลือผู้ประสบภัยทางทะเล และการขจัดคราบน้ำมันในทะเล ประจำปี 2565 เพื่อเป็นการเตรียมความพร้อมของหน่วยงานทั้งภาครัฐ ภาคเอกชน มูลนิธิ และอาสาสมัคร ให้มีทักษะความชำนาญในการใช้เครื่องมือ อุปกรณ์ต่างๆ การประสานงานการปฏิบัติให้เป็นระบบมากยิ่งขึ้น สามารถสร้างความมั่นใจให้กับประชาชน นักท่องเที่ยวชาวไทยและชาวต่างชาติ และเพื่อเตรียมต้อนรับนักท่องเที่ยวจากการเปิดประเทศ โดยมี นายวิชวุทย์ จินโต ผู้ว่าราชการจังหวัดสุราษฎร์ธานี, พลเรือตรี สุรศักดิ์ ประทานวรปัญญา รองผู้อำนวยการ ศูนย์อำนวยการรักษาผลประโยชน์ของชาติทางทะเลภาค 2, นายอุดมศักดิ์ ขาวหนูนา ผู้อำนวยการศูนย์ป้องกันและบรรเทาสาธารณภัยเขต 11 สุราษฎร์ธานี, นายจำนง สวัสดิ์วงศ์ หัวหน้าสำนักงานป้องกันและบรรเทาสาธารณภัย จังหวัดสุราษฎร์ธานี และหัวหน้าส่วนราชการที่เกี่ยวข้อง ให้การต้อนรับและเข้าร่วมการฝึกฯ
โอกาสนี้ นาวาอากาศเอก พุทธพงศ์ ผลชีวิน ผู้บังคับการกองบิน 7 พร้อมด้วยข้าราชการ กองบิน 7 สถานีรายงานสมุย และหน่วยบิน 2037 สนับสนุนเฮลิคอปเตอร์ แบบที่ 11 (EC-725) และเจ้าหน้าที่ค้นหาและช่วยชีวิต ร่วมให้การต้อนรับและเข้าร่วมการฝึกฯ ณ สถานีเรือสมุย ฐานทัพเรือสงขลา ทัพเรือภาคที่ 2 อำเภอเกาะสมุย จังหวัดสุราษฎร์ธานี เมื่อวันที่ 14 มิถุนายน 2565
การอุดฟันด้วยอมัลกัม และวัสดุสีเหมือนฟัน ต่างกันอย่างไรนะ?
ข่าวปลอม อย่าแชร์! ดื่มน้ำมะนาวแก้อาการเมากัญชา LINK
ตามที่มีข้อความในประเด็นเรื่องดื่มน้ำมะนาวแก้อาการเมากัญชา ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสถาบันบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี (สบยช.) กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น
เป็นข้อมูลเท็จ
บทสรุปของเรื่องนี้คือ : การดื่มน้ำมะนาวไม่สามารถแก้อาการเมากัญชาได้ อีกทั้งกัญชาไม่มียาถอนพิษ หรือยาแก้เมา แต่สามารถลดพิษได้โดยการดื่มน้ำเปล่ามากๆ หากอาการไม่ดีขึ้นควรรีบปรึกษาแพทย์
บำรุงราษฎร์แอปพลิเคชัน LINK
บำรุงราษฎร์แอปพลิเคชัน พัฒนาโดยโรงพยาบาลบำรุงราษฎร์ เพื่ออำนวยความสะดวกให้ผู้รับบริการ สามารถเข้าถึงข้อมูลสุขภาพได้อย่างสะดวกรวดเร็ว ทุกที่ทุกเวลา ทั้งจุดเด่นในด้านค้นหาแพทย์ง่ายขึ้น และเข้าถึงข้อมูลสุขภาพได้ง่ายขึ้น พร้อมสามารถจัดการนัดหมายด้วยตนเองได้อย่างง่ายดาย อีกทั้งยังสอดรับกับไลฟ์สไตล์วิถีใหม่ ‘New Normal’ ด้วยการพกบัตรสมาชิก Digital Loyalty Card ภายในแอปพลิเคชัน แทนการพกบัตรแบบเดิม การซื้อแพ็กเกจสุขภาพล่วงหน้า ลดขั้นตอนการลงทะเบียนและชำระเงิน เมื่อรับบริการเสร็จสามารถกลับบ้านได้ทันที พร้อมมอบสิทธิประโยชน์อื่น ๆ เฉพาะผู้ใช้งานผ่านแอปพลิเคชันเท่านั้น
บำรุงราษฎร์แอปพลิเคชัน พร้อมให้ดาวน์โหลดทั้ง
iOS และ
Android แล้ววันนี้
ประเทศกานา พบผู้ติดเชื้อ ไวรัสมาร์บวร์ก 2 ราย เสียชีวิตทั้งคู่ [PPTV36] LINK
18 ก.ค. 65 กานายืนยันพบผู้ติดเชื้อ “ไวรัสมาร์บวร์ก (Marburg)” 2 รายแรกของประเทศ ซึ่งเป็นโรคติดต่อร้ายแรงในตระกูลเดียวกับไวรัสอีโบลา โดยระบุว่า ไม่นานมานี้ ผู้ป่วยทั้งสองเสียชีวิตในโรงพยาบาลในเขตอาชานติ ทางใต้ของประเทศ
ผลการตรวจหาไวรัสมาร์บวร์กของทั้งสองมาเป็นบวกเมื่อต้นเดือนนี้ และได้รับการยืนยันโดยห้องปฏิบัติการในเซเนกัลแล้วว่า เป็นไวรัสมาร์บวร์กจริง เจ้าหน้าที่สาธารณสุขในกานากล่าวว่า ขณะนี้มีผู้ต้องสงสัยว่าจะติดเชื้อไวรัสชนิดนี้ถึง 98 ราย ซึ่งอยู่ระหว่างการกักตัวเพื่อสังเกตอาการ
แพทย์ระบุว่า ปัจจุบันยังไม่มีวิธีรักษาไวรัสมาร์บวร์กโดยเฉพาะ แต่แพทย์บอกว่า การดื่มน้ำปริมาณมากและการรักษาตามอาการ จะช่วยเพิ่มโอกาสในการอยู่รอดของผู้ติดเชื้อได้
เจ้าหน้าที่เตือนประชาชนให้อยู่ห่างจากถ้ำและปรุงอาหารที่เป็นผลิตภัณฑ์จากเนื้อสัตว์ทั้งหมดให้สุกก่อนบริโภค
องค์การอนามัยโลก (WHO) กล่าวว่า ในแอฟริกา มีรายงานการระบาดของไวรัสมาร์บวร์กบ้างประปรายในแองโกลา สาธารณรัฐประชาธิปไตยคองโก เคนยา แอฟริกาใต้ และยูกันดา โดยการระบาดที่ร้ายแรงที่สุดในประวัติศาสตร์ของไวรัสมาร์บวร์กคือ คร่าชีวิตผู้คนไปมากกว่า 200 คนในแองโกลาในปี 2005
Highland Cafe ไฮแลนด์ คาเฟ่ ลาดพร้าว
แหล่งรวมของวัฒนธรรมกัญชา สำหรับแลกเปลี่ยนความรู้กัน ต้นถนนลาดพร้าว หลังประตูรถใต้ดินประตู 2
โปรแกรมรักษาออฟฟิศซินโดรม LINK
เปิดรับสมัครเข้าร่วมโครงการ 40 คน อายุ 18 ถึง 65 ปี ที่มีปัญหาอาการปวดตึงกล้ามเนื้อ คอ บ่า ไหล่
สอบถามโทร 053-917553 หรือ 083-4177516 อ.ดร.ดลยา พรหมแก้ว หรือ 087-3595169 ภก.กรกวิณท์ อินต๊ะเมา
วัคซีนไข้หวัดใหญ่ ประกันสังคมรวมชัยประชารักษ์ LINK
วัคซีนไข้หวัดใหญ่ ประกันสังคมรวมชัยประชารักษ์
ผู้ประกันตนที่มีสิทธิฯ(ผู้ประกันตน ม.33 และ ม.39) ที่มีอายุตั้งแต่ 50 ปีขึ้นไป(เกิดปี พศ.2515 เป็นต้นไป) สามารถเข้ารับการฉีดวัคซีนไข้หวัดใหญ่ ได้ที่ สถานพยาบาลที่สำนักงานประกันสังคมกำหนด ปีละ 1 ครั้ง
ซึ่งผู้ประกันตนของโรงพยาบาลรวมชัยประชารักษ์สามารถเข้ารับการฉีดวัคซีนไข้หวัดใหญ่ได้โดยแสดงบัตรประชาชน กรณีต่างชาติแสดงบัตรคนซึ่งไม่มีสัญชาติไทยหรือPassport ในช่วงระหว่าง
วันที่ 1 พฤษภาคม ถึง 31 สิงหาคม 2565 เวลา 08.00-18.00 น.
ข้อมูลเพิ่มเติม โทร.02-7087501-10 หรือ 085-9180942 ต่อ 812 (ประชาสัมพันธ์)
Day 1 - Day 12
12 วันแรก งดเล่นเฟซตั้ง 5 วันแน่ะ แต่ก็ไม่ได้ใจร้ายงดทั้งหมดสิ้นเชิงเลยนี่หน่า แบบว่าค่อยๆ งดไปทีละนิด เริ่มวันแรกเลย ให้งดถึงเที่ยงวันเอง เป็นการประเดิม แล้วดูซิจะทำได้มั๊ยในวันแรก วันต่อมาคือ "งดอัปเดต" ใดๆ ลงโซเชียลเลย เริ่มยากแล้วสิ ก็ต้องทนนะ วันต่อมาก็งดอีกถึง 11 โมง เร็วกว่าวันแรกนิดนึง วันที่ 4 อันนี้น่าจะดีคือโทร หาเพื่อนแทนการอัปลงโซเชียล คุยกันไปเลย คุยจบก็จบไป ไม่เหมือนเวลาโพสต์แล้ว มันจะดูดให้เรากลับมาตามตลอดเพราะคนโน้นคนนี้ เข้ามาเม้นต์ มาคุยตลอดเวลา จำไว้เลยว่า "ถ้าไม่โพสต์ ก็ไม่ต้องติดพัน" วันถัดๆ มาก็ทำเหมือนกัน คุยกับเพื่อนแทนการโพสต์ แต่บางวันก็ยอมให้เล่นได้บ้างนะ ไม่ใช่ห้าม งด อย่างเดียว จะได้ผ่อนคลายหน่อย ไม่เครียด แต่กลัวจะไปเครียดเพิ่มเมื่ออ่านโพสต์ในโซเชียลแทนนี่สิ โดยเฉพาะทวิตเตอร์นี่ แรงทั้งนั้น ถ้าไปสายติ๊กต็อก จะสนุกเฮฮากว่าเยอะ แล้วก็อย่าลืมว่าเล่นแล้ว ต้องกลับมา "อดโซเชียล" ต่อนะ แบบว่า อด-เล่น เล่น-อด สลับไป
BDMS Wellness Clinic ประเดิมภารกิจแรกจับมือกับ Celes Samui
อันดับที่ 1-10
1 รพ.บำรุงราษฏร์ อินเตอร์ฯ 94.79%
2 รพ.ศิริราช ปิยะมหาราชการุณย์ 90.24%
3 รพ.กรุงเทพ 88.42%
4 รพ.รามาธิบดี 82.83%
5 รพ.สมิติเวช สุขุมวิท 82.82%
6 รพ.ธนบุรี 82.64%
7 รพ.จุฬาลงกรณ์ 82.64%
8 รพ.พระราม9 76.23%
9 รพ.บางปะกอก9 อินเตอร์ฯ 75.74%
10 รพ.เมดพาร์ค
75.17%
Leaf Cannabis Cafe
Homemade Edible Cafe คาเฟ่สายเขียว ณ สาทร ร้านคลีนๆ สวยๆ น่านั่ง น่าโดนใจชาวละแวกสาทร
เพลินกัญ คาเฟ่กัญชา Happiness Canabis Cafe
เพลินกัญ คาเฟ่่กัญชา Happiness Canabis Cafe ร้านขาวๆ เบาๆ สบายๆ น่านั่งอีกร้าน เสริฟเครื่องดื่มกัญชา อยุ่แถวเทพารักษ์ ใกล้บ้านใครมั๊ย
Senior Marketing Executive
Senior Sales Executive
Quality Management Manager
พื้นที่ครอบคลุมทั้ง 12 ศูนย์ 6 กลุ่มเขต
ศูนย์บริการจัดการกล้องวงจรปิด CCTV 24 ชั่วโมง 12 ศูนย์ 6 กลุ่มเขต
1. กรุงเทพกลาง ครอบคลุมพื้นที่ 9 สำนักงานเขต เขตราชเทวี,เขตป้อมปราบศัตรูพ่าย,เขตสัมพันธวงศ์,เขตพระนคร,เขตดุสิต,เขตพญาไท,เขตห้วยขวาง,เขตดินแดง,เขตวังทองหลาง
ศูนย์ CCTV ห้วยขวาง เบอร์โทรศัพท์ 0 2275 2330-1
ศูนย์ CCTV ราชเทวี เบอร์โทรศัพท์ 0 2354 6179-80
2. กรุงเทพใต้ ครอบคลุมพื้นที่ 10 สำนักงานเขต เขตพระโขนง,เขตสวนหลวง,เขตคลองเตย,เขตวัฒนา,เขตบางนา,เขตบางคอแหลม,เขตปทุมวัน,เขตสาทร,เขตบางรัก,เขตยานนาวา
ศูนย์ CCTV พระโขนง เบอร์โทรศัพท์ 0 2331 0631-2
ศูนย์ CCTV บางคอแหลม เบอร์โทรศัพท์ 02292 1285-6
3. กรุงเทพเหนือ ครอบคลุมพื้นที่ 7 สำนักงานเขต เขตจตุจักร,เขตบางซื่อ,เขตลาดพร้าว,เขตบางเขน,เขตหลักสี่,เขตดอนเมือง,เขตสายไหม
ศูนย์ CCTV จตุจักร เบอร์โทรศัพท์ 0 2512 3524-5
ศูนย์ CCTV บางเขน เบอร์โทรศัพท์ 0 2521 1975-6
4. กรุงเทพตะวันออก ครอบคลุมพื้นที่ 9 สำนักงานเขต เขตมีนบุรี,เขตหนองจอก,เขตคลองสามวา,เขตลาดกระบัง,เขตสะพานสูง,เขตบึ่งกุ่ม,เขตประเวศ,เขตคันนายาว,เขตบางกะปิ
ศูนย์ CCTV มีนบุรี เบอร์โทรศัพท์ 0 2171 4235-6
ศูนย์ CCTV บึงกุ่ม เบอร์โทรศัพท์ 0 2364 7322-3
5. กรุงธนเหนือ ครอบคลุมพื้นที่ 8 สำนักงานเขต เขตบางพลัด,เขตบางกอกน้อย,เขตตลิ่งชัน,เขตทวีวัฒนา,เขตจอมทอง,เขตบางกอกใหญ่,เขตธนบุรี,เขตคลองสาน
ศูนย์ CCTV บางพลัด เบอร์โทรศัพท์ 0 2424 3200-1
ศูนย์ CCTV จอมทอง เบอร์โทรศัพท์ 0 2428 4393-4
6. กรุงธนใต้ ครอบคลุมพื้นที่ 7 สำนักงานเขต เขตบางบอน,เขตบางขุนเทียน,เขตหนองแขม,เขตบางแค,เขตราษฎร์บูรณะ,เขตทุ่งครุ,เขตภาษีเจริญ
ศูนย์ CCTV บางบอน เบอร์โทรศัพท์ 0 2405 2893-4
ศูนย์ CCTV ราษฎร์บูรณะ 0 2428 4354-5
ศูนย์ข้อมูลอุบัติเหตุ Thai Rsc LINK
Thai RSC เป็นศูนย์ข้อมูลอุบัติเหตุทางถนน จัดทำโดย บริษัท กลางคุ้มครองผู้ประสบภัยจากรถ จำกัด ประสงค์ให้เป็น ศูนย์วิชาการความปลอดภัยทางถนน เก็บข้อมูลอุบัติหตุต่างๆ จัดทำเป็นสถิติแยกตามประเภทรถ ช่วงอายุ แยกตาม Ranking ระดับจังหวัด สถิติชาวต่างชาติ ฯลฯ ให้มีการนำข้อมูลไปบริหารจัดการ และเพื่อสร้างความปลอดภัยทางถนนให้เกิดขึ้นกับคนไทย
ภาพจาก เวชนิทัศน์ รพ.สวรรค์ประชารักษ์
ร้านเช่าวีดีโอ LINK
สุวพันธุ์ เอี่ยมเกษมมาศ
ร้านเช่าวีดีโอ ปกติเช่าเรื่องอะไรมาดูบ้างและกี่วันคืน เคยเช่าเกิน10ปรับ100฿
คู่มือประชาชนในการเลือกคลินิก กรมสนับสนุนบริการสุขภาพ (ฉบับปี 2561) LINK
กรมสนับสนุนบริการสุขภาพ ได้จัดทำคู่มือประชาชนในการเลือกคลินิก ที่ได้รับอนุญาตจากกระทรวงสาธารณสุข ออกมาเพื่อให้เป็นแนวทางศึกษาเรียนรู้ การเลือกรับบริการจากคลินิก การตรวจสอบ ความรู้เกี่ยวกับคลินิกในหลายด้าน ได้แก่ ประเภทคลินิกและผู้ประกอบโรคศิลปะต้องมี มาตรฐานด้านต่างๆที่คลินิกต้องผ่านการตรวจสอบ ข้อสังเกตในการเลือกคลินิก การตรวจสอบคลินิก การร้องเรียนตรวจสอบ และสิทธิผู้ป่วย
ผลิตโดย : ศูนย์บริการธุรกิจสุขภาพ กลุ่มคลินิก สำนักสถานพยาบาลและการประกอบโรคศิลปะ กรมสนับสนุนบริการสุขภาพ ถนนติวานนท์ อำเภอเมือง จังหวัดนนทบุรี11000
โทรศัพท์ 0 2193 7999
พิมพ์ มกราคม 2561
คณะกรรมการปฏิรูปประเทศด้านสาธารณสุข
ศ.คลินิกเกียรติคุณ นพ.อุดม คชินทร ประธานคณะกรรมการปฏิรูปประเทศด้านสาธารณสุข กล่าวว่า “คณะกรรมการปฏิรูปประเทศด้านสาธารณสุขได้มีการดำเนินงานมาต่อเนื่อง ภายใต้แผนปฏิรูปประเทศด้านสาธารณสุข และในช่วงสำคัญที่คณะกรรมการปฏิรูปประเทศกำลังจะหมดวาระการดำเนินการ การจัดประชุมการปรึกษาหารือก้าวต่อไป ในประเด็นสำคัญของการปฏิรูปที่ต้องการขับเคลื่อนและต่อยอดนโยบายการดำเนินงานในระยะกลางเพื่อให้เกิดผลสำเร็จเป็นรูปธรรม ถือเป็นสิ่งสำคัญที่จะทำให้การปฏิรูปประเทศด้านสาธารณสุขสามารถดำเนินการได้อย่างมีระบบตรงตามนโยบายและแผนการปฏิรูปประเทศฯ เพราะมีหน่วยงานหลักสำคัญของประเทศ รวมถึงภาคีเครือข่ายต่างๆ ให้ความร่วมมือและสนับสนุนมาโดยตลอด
สำหรับการจัดประชุมปรึกษาหารือฯ ในครั้งนี้ ยังคงกำหนดประเด็นสำคัญ 3 ประเด็น ได้แก่ 1. การปฏิรูปและสร้างความเข้มแข็งของระบบสุขภาพปฐมภูมิในกรุงเทพมหานคร 2. การพัฒนา Digital Health/Health Information Systems 3. การสร้างความเข้มแข็งของ NRA (National Regulatory Authority) โดยเฉพาะการ จัดให้มีรูปแบบการบริหารจัดการองค์กรแบบใหม่”
มิติที่ 1 สาธารณสุข
กทม.ได้มีการปรับศูนย์บริหารสถานการณ์โควิดเดิม (ศบค.กทม.) ให้เป็น
ศูนย์เฝ้าระวังภาวะฉุกเฉินทางสุขภาพกรุงเทพมหานคร (Bangkok Health Emergency Operations Center : BHEOC) โดยดึงภาคประชาสังคมเข้ามามีส่วนร่วม ซึ่งมีบทบาทในการช่วยเหลือประชาชนที่ไม่ได้รับการดูแลรักษาอย่างทั่วถึง จึงนำมาเป็นบทเรียนและตั้งศูนย์ฯ นี้ขึ้นมา เพื่อเตรียมความพร้อมรองรับสถานการณ์ฉุกเฉินทางสุขภาพทุกรูปแบบ โดยมีเป้าหมายเพื่อแก้ไขสถานการณ์และช่วยเหลือประชาชนที่ได้รับผลกระทบกับวิกฤตสาธารณภัย ภัยพิบัติ ตลอดจนการแพร่ระบาด ให้เป็นไปด้วยความเรียบร้อยและมีประสิทธิภาพ
ด้านสถานการณ์โรคโควิด-19 ในช่วง 1 เดือนที่ผ่านมา ภาพรวมมีผู้ป่วยโควิดที่มารับบริการ ณ ศูนย์บริการสาธารณสุข รพ.ในสังกัดสำนักการแพทย์ และวชิรพยาบาล รายใหม่ 3,317 ราย สะสม (1 ก.ค. - 2 ส.ค. 65) 91,666 ราย ในขณะที่สถานการณ์เตียงตลอดเดือน ก.ค. ที่ผ่านมา รพ.สังกัดสำนักการแพทย์ กทม. เพียงพอรองรับผู้ป่วยสีเหลืองและสีแดงในกรุงเทพฯ ในส่วนของยาก็มีจำนวนเพียงพอรองรับกับจำนวนผู้ป่วย ไม่ว่าจะเป็น ฟาวิพิราเวียร์ โมลนูพิราเวียร์ หรือแพ็กซ์โลวิด รวมถึงยาชนิดอื่น ซึ่ง กทม. ยังคงรับมือได้
ในส่วนของการให้บริการฉีดวัคซีน กทม. ได้อำนวยความสะดวกให้กับประชาชน โดยขยายเวลาให้บริการเพิ่มในวันเสาร์ ที่ศูนย์บริการสาธารณสุข ทั้ง 69 แห่ง ตามเวลาราชการ และสามารถ walk-in ได้ที่อาคารกีฬาเวศน์ 1 ศูนย์เยาวชนกรุงเทพมหานคร (ไทย-ญี่ปุ่น) ดินแดง ทุกวัน ตั้งแต่เวลา 08.00 - 16.00 น. ในส่วนโรงพยาบาล กทม. ทั้ง 11 แห่ง เปิดให้บริการทั้งระบบจองคิวและ walk-in
กรณีโรคฝีดาษวานร ซึ่งพบผู้ป่วยรายแรกใน กทม. เมื่อวันที่ 28 ก.ค. 65 กทม.สามารถดำเนินการเข้าสอบสวนโรค และดำเนินการควบคุมเฝ้าระวังผู้สัมผัสเสี่ยงใกล้ชิดได้อย่างรวดเร็ว ซึ่งเกิดขึ้นได้จากมีการเตรียมความพร้อมรับมือประเมินสถานการณ์ไว้ก่อนหน้า ทั้งนี้ เมื่อวันที่ 3 ส.ค. 65 ได้ประชุมถอดบทเรียนการรับมือโรคฝีดาษวานรในสถานพยาบาล โดยมีสถานพยาบาลที่เข้าร่วมประชุมทั้งหมด 190 แห่ง นอกจากนี้ ยังให้ความรู้เกี่ยวกับแนวทางการรักษาพยาบาล การส่งต่อ และการป้องกันการติดเชื้อฝีดาษวานรในสถานพยาบาล รวมทั้งการป้องกันและควบคุมการแพร่กระจายของเชื้อด้วย
ตารางงานกิจกรรมวันแม่ จุดต่างๆในกทม.
ชมไฟประดับสะพานเฉลิมพระเกียรติ 13 จุด กรุงเทพและปริมณฑล (กรมทางหลวงชนบท)
กรมทางหลวงชนบท ร่วมสำนึกในพระมหากรุณาธิคุณและเฉลิมพระเกียรติ และเพื่อแสดงให้เห็นความงดงามของบรรยากาศของสะพานข้ามแม่น้ำเจ้าพระยา ขอเชิญประชาชนสามารถร่วมชมทัศนียภาพความสวยงามของไฟประดับสะพานข้ามแม่น้ำเจ้าพระยา ในพื้นที่กรุงเทพฯ และปริมณฑลที่อยู่ในความดูแล จำนวน 13 แห่ง ได้แก่
• สะพานพระราม 3
• สะพานพระราม 4
• สะพานพระราม 5
• สะพานพระราม 7
• สะพานมหาเจษฎาบดินทรานุสรณ์
• สะพานสมเด็จพระปิ่นเกล้า
• สะพานพระพุทธยอดฟ้า
• สะพานพระปกเกล้า
• สะพานสมเด็จพระเจ้าตากสินมหาราช สะพานกรุงธน
• สะพานกรุงเทพ
• สะพานภูมิพล 1
• และสะพานภูมิพล 2
โดยจะทำการเปิดไฟประดับตั้งแต่วันที่ 5 ถึงวันที่ 14 สิงหาคม 2565 เวลา 19.00 น. - 22.00 น.
และในคืนวันที่ 12 สิงหาคม 2565 จะทำการเปิดไฟเวลา 19.00 น. - 24.00 น.
ธนาคารเลือดวชิรพยาบาล เชิญร่วมบริจาคโลหิตถวายเป็นพระราชกุศล LINK
ขอเชิญร่วมบริจาคโลหิตถวายเป็นพระราชกุศล เนื่องในโอกาสวันเฉลิมพระชนมพรรษา สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง ๑๒ สิงหาคม ๒๕๖๕
ในวันพฤหัสบดีที่ ๑๑ สิงหาคม ๒๕๖๕ เวลา ๘.๐๐ - ๑๖.๐๐ น.
ณ ธนาคารเลือดวชิรพยาบาล อาคารพยาธิ ชั้น ๓
สอบถามเพิ่มเติมได้ที่ ธนาคารเลือดวชิรพยาบาล โทร. ๐๒๒๔๔๓๑๒๖ - ๘
เดินทางเข้า 75 ประเทศ ด้วย EU DCC
ประชาชนสามารถใช้งาน EU DCC ที่เมนู Digital Health Pass บน หมอพร้อม LINE OA และ Application สำหรับแสดงสถานะเกี่ยวกับโควิด 19 ก่อนการเดินทางเข้าประเทศหรือดินแดนที่เข้าร่วมกว่า 75 ประเทศ/ดินแดน
กิจกรรมจิตอาสาพระราชทาน วันแม่แห่งชาติ ณ สวนเบญจกิติ วันที่ 11-13 สิงหาคม LINK
กิจกรรมจิตอาสาพระราชทาน วันแม่แห่งชาติ ณ สวนเบญจกิติ วันที่ 11-13 สิงหาคม นี้
ตั้งแต่เวลา 11.00-17.00 น.
โดนจะจัดที่อาคารพิพิธภัณฑ์โนโรงงานยาสูบ
(รถยนต์เดินทางผ่าน ประตู รพ.ยาสูบ)
โดยมีหลายหน่วยงานร่วมด้วย
จึงขอประชาสัมพันธ์เพื่อทราบและเชิญชวนประชาชนเข้าร่วมกิจกรรม ดังนี้
1. กิจกรรมจัดขึ้นระหว่างวันที่ 11 -13 สิงหาคม 2565 ตั้งแต่เวลา 11.00 - 17.00 น. โดยวันที่ 12 สิงหาคม 2565 มีการจุดเทียนชัยถวายพระพรฯ เวลา 19.19 น.
2. ภายในงานจะมี
2.1 บริการทางการแพทย์ เช่น การตรวจโรคเบื้องต้น การฉีดวัคซีนกระตุ้น ป้องกันโรคโควิด -19 วัคซีนป้องกันโรคไข้หวัดใหญ่ การฝังเข็ม
2.2 บริการฝึกอาชีพ เช่น การวาดภาพ การตกแต่งหมวกและเสื้อด้วยผ้าลูกไม้ การตัดผม การทำเทียน การทำดอกไม้ประดิษฐ์ การร้อยพวงมาลัย การนวดแผนโบราณ
2.3 บริการช่างซ่อม เช่น ซ่อมเครื่องใช้ไฟฟ้าขนาดเล็ก (เตารีด หม้อหุงข้าว กาน้ำร้อน พัดลม ฯลฯ) ซ่อมรถจักรยาน เป็นต้น
2.4 บริการสำหรับสัตว์เลี้ยง เช่น การฉีดวัคซีนป้องกันโรค พิษสุนัขบ้า การทำหมัน สุนัขและแมว
2.5 บริการรถรับสมัครงานเคลื่อนที่ และสามารถนำงานกลับไปทำที่บ้านได้ด้วย
สำนักงานเขตบางนา เปิดรับสมัครงานหลายอัตรา LINK
สำนักงานเขตบางนา เปิดรับสมัครงานหลายอัตรา
มีตำแหน่งที่รับสมัคร ดังนี้
พนักงานทั่วไป (กวาด) จำนวน 14 อัตรา
พนักงานทั่วไป (เก็บขนมูลฝอย) จำนวน 14 อัตรา
พนักงานสวนสาธารณะ จำนวน 1 อัตรา
พนักงานขับเครื่องจักรกลขนาดเบา (รถตัดแต่งกิ่งไม้ไฮโดรลิก) จำนวน 1 อัตรา
พนักงานขับเครื่องจักรกลขนาดเบา (รถบรรทุกสิ่งปฏิกูล) จำนวน 1 อัตรา
พนักงานประจำรถ (รถกวาดและดูดฝุ่น) จำนวน 1 อัตรา
พนักงานขับรถยนต์ จำนวน 1 อัตรา
บางเขนลุยเข้ม ตรวจระบบป้องกันไฟไหม้ สถานบริการ-สถานบันเทิง LINK
6 ส.ค.65 เวลา 19.00 น. สำนักงานเขตบางเขน นำโดย นางสาวพิศมัย เรืองศิลป์ ผู้อำนวยการเขตบางเขน พร้อมด้วย คณะผู้บริหาร ฝ่ายที่เกี่ยวข้อง ร่วมกับสถานีดับเพลิงบางเขน สน.บางเขน, สน.คันนายาว และสน.โคกคราม ขานรับนโยบาย ผู้ว่าฯ ชัชชาติ ร่วมลงพื้นที่ตรวจเข้มระบบป้องกันอัคคีภัย ทางหนีไฟ ตามกฎหมายควบคุมอาคาร และตรวจติดตามมาตรการปลอดภัย COVID-Free Setting สถานบริการ สถานประกอบการที่มีลักษณะคล้ายสถานบริการสถานบันเทิง ผับ บาร์ คาราโอเกะ หรือสถานประกอบการอื่นๆ ที่คล้ายกัน ในพื้นที่ ประกอบด้วย
- ร้าน “ไปกันเรา” ถนนเทพรักษ์
- ร้าน “Hole 19” ถนนวัชรพล
- ร้าน “Scarlet 90” ถนนประดิษฐ์มนูธรรม
เพื่อขอความร่วมมือเจ้าของผู้ครอบครองอาคาร ผู้ใช้ประโยชน์ในอาคารให้ดูแลและระมัดระวังการใช้สอยอาคารให้เกิดความปลอดภัย และดำเนินการตามข้อแนะนำ
โดยเฉพาะเมื่อเกิดอัคคีภัยขึ้นกับอาคารประเภทสถานบริการ และสถานบันเทิง เพื่อให้มีการป้องกันการเกิดอัคคีภัย ลดการเสียชีวิต ความเสียหายของทรัพย์สินและตัวอาคารกรณีเกิดอัคคีภัยขึ้น ทั้งการติดตั้งถังดับเพลิงให้เพียงพอต่อขนาดพื้นที่ ติดตั้งสัญญาณเตือนภัย ติดตั้งแบบแปลนอาคาร แสดงตำแหน่งที่ติดตั้งอุปกรณ์ดับเพลิง ทางหนีไฟ ทางออก และประตูทางออก ไว้ในตำแหน่งที่เห็นได้ชัดเจน จัดให้มีทางออกและทางหนีไฟให้เพียงพอ
ทั้งนี้ได้ขอความร่วมมือผู้ประกอบการเร่งดำเนินการโดยทันที ในกรณีที่พบว่าสถานบริการและสถานประกอบการใดกระทําการที่ฝ่าฝืนกฎหมาย เจ้าหน้าที่จะดําเนินการตามอํานาจหน้าที่อย่างเง้มงวดต่อไป
FTAAP เขตการค้าเสรีเอเชีย-แปซิฟิก
เอเปคเริ่มหารือเรื่องการจัดตั้งเขตการค้าเสรีเอเชีย-แปซิฟิก หรือ FTAAP ตั้งแต่ปี ค.ศ. 2004 เพื่อกระชับความร่วมมือทางเศรษฐกิจในภูมิภาคเอเชีย-แปซิฟิก ซึ่งหากสำเร็จจะถือเป็นเขตการค้าเสรีที่ใหญ่ที่สุดในโลก
ไทยในฐานะเจ้าภาพเอเปค ปี 2565 ได้สานต่อการหารือ เรื่อง FTAAP โดยคำนึงถึงบริบทโลกยุคหลังโควิด-19 เพื่อให้ FTAAP ในอนาคตสามารถรับมือกับความท้าทายใหม่ สร้างโอกาสให้คนทุกกลุ่ม ภายใต้โมเดลเศรษฐกิจที่เป็นมิตรต่อสิ่งแวดล้อม
1. เน้นส่งเสริมการลดอุปสรรคการค้าการลงทุนรูปแบบเดิม เช่น ลดมาตรการการกีดกันทางการค้าที่มิใช่ภาษี ส่งเสริมการค้าภาคบริการ และสร้างกฎระเบียบการค้าที่โปร่งใส ซึ่งมีความสำคัญต่อการฟื้นฟูเศรษฐกิจจากสถานการณ์โรคระบาดในปัจจุบัน
2. หารือแนวทางส่งเสริมการดำเนินธุรกิจในโลกยุคใหม่ให้คล่องตัวยิ่งขึ้น เช่น การอำนวยความสะดวกการค้า e-commerce การค้าดิจิทัล การเพิ่มความเชื่อมโยงของห่วงโซ่อุปทาน รวมถึงการส่งเสริม MSMEs สตรีและกลุ่มคนที่เข้าไม่ถึงโอกาสทางเศรษฐกิจ ซึ่งล้วนเป็นประเด็นใหม่ที่ทวีความสำคัญขึ้นในยุคหลังโควิด-19
3. ส่งเสริมการค้าการลงทุนโดยคำนึงถึงผลกระทบทางสิ่งแวดล้อม และมุ่งส่งเสริมนโยบายการค้าการลงทุน ที่ลดปัญหาการเปลี่ยนแปลงสภาพภูมิอากาศด้วย ซึ่งในปีนี้ ไทยได้นำเสนอแนวคิดเศรษฐกิจ BCG ที่เน้นส่งเสริมการดำเนินธุรกิจด้วยนวัตกรรมเพื่อสร้างกำไรและรักษาสิ่งแวดล้อมไปพร้อมกัน
คลินิกทันตกรรม ศบส1 สะพานมอญ
ค่าบริการคลินิกทันตกรรม ศบส1 สะพานมอญ
คลินิกตรวจโรคทั่วไป
คลินิกตรวจโรคทั่วไป
วัน-เวลาทำการ จันทร์ – ศุกร์ 8.00 น. - 12.00 น. (หยุดวันหยุดนักขัตฤกษ์)
ขอบเขตการให้บริการ
1.คัดกรองความเสี่ยงด้านสุขภาพในผู้รับบริการทุกกลุ่มวัย ผู้ประกอบอาหาร ผู้สมัครงาน
2.ตรวจ วินิจฉัยปัญหาความรุนแรงของอาการป่วยในผู้ป่วยโรคทั่วไป โรคเรื้อรัง โรคระบาดตามฤดูกาล
3.ให้การรักษาผู้ป่วยตามมาตรฐานแบบองค์รวมอย่างเวชศาสตร์ครอบครัว
4.บริการให้คำปรึกษาด้านสุขภาพ นัดตรวจเจาะเลือดตามข้อบ่งชี้ของโรค
5.ประสานส่งต่อโรงพยาบาล ตรวจ รักษา วินิจฉัยเพิ่มเติม กรณีอาการซับซ้อน ฉุกเฉิน
6.ออกใบรับรองตรวจสุขภาพ สมัครงาน สมัครเรียน ออกใบพิการ
ลูกค้าประกันสังคม ฉีดวัคซีนไข้หวัดใหญ่ ลุ้นจับรางวัลเดือนสิงหาคม LINK
ลูกค้าประกันสังคม #ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ #ลุ้นจับรางวัล Lucky Draw เดือนสิงหาคม ของรางวัลสุดปัง!
- บัตรล่องเรือ Alanga cruise มูลค่า 2,000 บาท รางวัลละ 2 ใบ ➡ จำนวน 1 รางวัล
- เครื่องฟอกอากาศพกพา มูลค่า 200 บาท ➡ จำนวน 3 รางวัล
- บัตรสตาร์บัคส์ใช้แทนเงินสด มูลค่า 100 บาท ➡ จำนวน 3 รางวัล
- หน้ากากอนามัย มั่นใจพญาไท นวมินทร์ ➡ จำนวน 5 รางวัล
สำหรับลูกค้าประกันสังคม โรงพยาบาลพญาไท นวมินทร์ ที่เข้ารับบริการฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ เท่านั้น!
- ผู้ที่มีอายุมากกว่า 50 ปีขึ้นไป สามารถเข้ารับบริการฉีดวัคซีน ได้โดยไม่มีค่าใช้จ่าย
- ผู้ที่มีอายุน้อยกว่า 50 ปี ในราคาพิเศษ 590 บาท
รายละเอียด
1. ลูกค้าประกันสังคมที่ใช้บริการฉีดวัคซีน สามารถเขียน ➡ ชื่อ –นามสกุล ➡เบอร์โทรศัพท์➡ เลขที่ใบเสร็จ ใส่ในกล่อง Lucky Draw ที่แผนกผู้ป่วยนอกประกันสังคม ชั้น1
2. ร่วมสนุกได้ตั้งแต่วันนี้-31 ส.ค. 65 ประกาศรางวัลผู้โชคดี วันที่ 5 ก.ย. 65
3. โรงพยาบาลจะประกาศรางวัลผู้โชคดีทางช่องทาง Facebook Phyathai Nawamin Hospital
สอบถามรายละเอียดเพิมเติมได้ที่ : แผนกการตลาด โทร 02 944 7111 ต่อ 16301 จันทร์-ศุกร์ เวลา 09.00-16.00 น.
ทำฟันประกันสังคม กับรพ.เกษมราษฎร์ ปราจีนบุรี ไม่ต้องสำรองจ่าย 900 บาท‼️ LINK
ข่าวดี! ขอเชิญผู้ประกันตนสิทธิประกันสังคมเข้ารับบริการ ขูด...อุด...ถอน
ใช้สิทธิทำฟันได้ ไม่ต้องสำรองจ่าย 900 บาท‼️ (ตามเงื่อนไขประกันสังคม)
สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกทันตกรรม โทร 037-627000 ต่อ 2014
หมายเหตุ
-กรุณานัดหมายวันล่วงหน้าก่อนเข้าใช้บริการ 1 วัน
-ยื่นบัตรประชาชนเพื่อแสดงตนที่แผนกทันตกรรม
เปิดให้บริการทุกวัน 08.00 - 17.00 น.
สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกทันตกรรม
โทร 037-627000 ต่อ 2014
ผู้ใช้สิทธิ์ประกันสังคม (ทุกโรงพยาบาล) ตรวจสุขภาพช่องปากพร้อมขูดหินปูน+ รับของที่ระลึก LINK
รอคิวเรียกเข้าตรวจ ไปทำฟันกันดีกว่า #ตรวจสุขภาพช่องปากพร้อมขูดหินปูน สิทธิประกันสังคม #รับของที่ระลึก
คลินิกทันตกรรม โรงพยาบาลลานนา … ให้บริการผู้ประกันตน รับสิทธิ์ตรวจสุขภาพช่องปาก พร้อมรับบริการขูดหินปูน มูลค่ารวมกว่า 900 บาท โดยไม่จำเป็นต้องเป็นผู้ประกันตนของรพ.ลานนา !!!
ผู้ใช้สิทธิ์ประกันสังคม ทุกโรงพยาบาล สามารถขอรับสิทธิ์ตรวจสุขภาพ ตามเงื่อนไขอายุ ในโปรแกรมของสำนักงานประกันสังคม และสิทธิ์ในการทำฟัน ที่โรงพยาบาลลานนา ได้คนละ 900 บาท ต่อคนต่อปี
ขั้นตอนการรับสิทธิ์ รับบริการด้านทันตกรรรม ก็ง่ายๆค่ะ เพียงแสดงบัตรประชาชน หรือใบขับขี่ ตัวจริงทุกครั้ง เพื่อระบุตัวตนขิองท่าน หากมีการเปลี่ยนชื่อ-สกุล หรือคำนำหน้า ให้แนบหลักฐานมาด้วย ในกรณีชาวต่างชาติ ให้ใช้พาสปอร์ต พร้อมบัตรรับรองสิทธิ์ประกันสังคม เพื่อยืนยันการใช้สิทธิ์ในครั้งนี้
คลินิกทันตกรรม โรงพยาบาลลานนา เปิดให้บริการ ทุกวัน ตั้งแต่เวลา 08.00 – 20.00 น.
โทรสอบถามรายละเอียด เพิ่มเติมได้ที่ โทร. 052-134-742
อาการและวิธีป้องกัน โรค RSV (ราชวิทยาลัยจุฬาภรณ์)
แม้ว่าในวงการวิทยาศาสตร์การแพทย์ จะค้นพบเชื้อไวรัส RSV มานานกว่า 60 ปีแล้ว แต่ก็ยังไม่ประสบความสำเร็จในการคิดค้นหรือผลิตวัคซีนป้องกันการติดเชื้อนี้ได้ ดังนั้น การป้องกันก็ใช้วิธีเดียวกันกับการป้องกันการติดเชื้อในระบบทางเดินหายใจ คือ การใส่หน้ากากอนามัยเมื่ออยู่ในที่ชุมชนหรือมีคนอยู่แออัด หมั่นล้างมือบ่อยๆด้วยน้ำกับสบู่ หรือเจลแอลกอฮอล์ พยายามสอนหรือฝึกเด็กเล็กไม่ให้นำนิ้วมือใส่จมูก ปาก หรือ ขยี้ตา รักษาระยะห่างจากคนที่ป่วย หลีกเลี่ยงการนำเด็กไปเล่นคลุกคลีใกล้ชิดกับกลุ่มเด็กเล็ก หรือเด็กที่ป่วย ไอ ไม่สบาย ทำความสะอาดของเล่นเด็กและของใช้เป็นประจำ ไม่ใช้ของส่วนตัวร่วมกันกับเด็กคนอื่น หลีกเลี่ยงควันบุหรี่หรือมลพิษฝุ่นพิษในอากาศ ดื่มน้ำอุ่นน้ำสะอาดเป็นประจำ - รศ.นพ.ปรีดา วาณิชยเศรษฐกุล แพทย์เฉพาะทางสาขากุมารเวชศาสตร์ โรคมะเร็งและโลหิตวิทยา ราชวิทยาลัยจุฬาภรณ์
อ่านทั้งหมดเกษมราษฎร์ รามคำแหง รักษาผู้ป่วยโควิด กลุ่มสีเขียว ไม่มีอาการ ผู้ป่วยสิทธิประกันสังคมของทุกโรงพยาบาล
โรงพยาบาลเกษมราษฎร์ รามคำแหง
รักษาผู้ป่วยโควิด กลุ่มสีเขียว ไม่มีอาการ
ไม่มีค่าใช้จ่ายสำหรับ ผู้ป่วยสิทธิประกันสังคมของทุกโรงพยาบาล (ม.33-39)
“เจอ แจก จบ” OP with self Isolation
ประเภทการรักษา: OPD
กิจกรรมการรักษา
✅แยกกักตัวที่บ้าน
✅จ่ายยาตามอาการ
✅โทรติดตามอาการ (เมื่อครบ 48 ชั่วโมง)
เปิดบริการทุกวัน เวลา 08.00-16.00 น.
ผู้ประกันตน โรงพยาบาลบางปะกอก 8 ตรวจสุขภาพได้โดยไม่ต้องเสียค่าใช้จ่าย LINK
ผู้ประกันตนสิทธิ์ประกันสังคมกับโรงพยาบาลบางปะกอก 8 สามารถเข้ารับการตรวจสุขภาพได้โดยไม่ต้องเสียค่าใช้จ่าย
*โดยมีเงื่อนไขตามสิทธิ์ประกันสังคม
รายการตรวจตามช่วงอายุ
????ตรวจทั่วไป
✔️การคัดกรองการได้ยิน Finger Rub Test อายุ 15 ปีขึ้นไป ตรวจ 1 ครั้ง/ 1 ปี
✔️การตรวจเต้านมโดยแพทย์หรือบุคลากรสาธารณสุข อายุ 30-39 ปี ตรวจทุก 3 ปี , 40-54 ปี ตรวจทุกปี , 55 ปีขึ้นไป ตรวจตามความเหมาะสมหรือมีความเสี่ยง
✔️การตรวจตาโดยความดูแลของจักษุแพทย์ อายุ 40-54 ปีตรวจ 1 ครั้ง , อายุ 55 ปีขึ้นไป ตรวจทุก 1-2 ปี
✔️การตรวจสายตาด้วย Snellen eye Chart อายุ 55 ปีขึ้นไปตรวจ 1 ครั้ง/ปี
????ตรวจทางห้องปฏิบัติการ
✔️ความสมบูรณ์ของเม็ดเลือด CBC อายุ 18-54 ปีตรวจ 1 ครั้ง , อายุ 55-70 ปีตรวจ 1 ครั้ง/ปี
✔️ปัสสาวะ UA อายุ 55 ปีขึ้นไปตรวจ 1 ครั้ง/ปี
✔️น้ำตาลในเลือด FBS อายุ 35-54 ปีตรวจทุก 3 ปี , อายุ 55 ปีขึ้นไปตรวจ 1 ครั้ง/ปี
✔️การทำงานของไต Cr อายุ 55 ปีขึ้นไปตรวจ 1 ครั้ง/ปี
✔️ไขมันในเลือดชนิด Total cholesterol & HDL อายุ 20 ปีขึ้นไป ตรวจทุก 5 ครั้ง
????การตรวจอื่นๆ
✔️เชื้อไวรัสตับอักเสบ HBsAg สำหรับผู้ที่เกิดก่อน พ.ศ.2535 ตรวจ 1 ครั้ง
✔️มะเร็งปากมดลูก หรือ Pap Smear อายุ 30-54 ปีตรวจ 1 ครั้ง , อายุ 55 ปีขึ้นไปตรวจตามความเหมาะสมหรือมีความเสี่ยง
✔️มะเร็งปากมดลูกวิธี Via อายุ 30-54 ปีตรวจทุก 5 ปี , อายุ 55 ปีขึ้นไปแนะนำให้ตรวจ Pap Smear
✔️เลือดในอุจจาระ FOBT อายุ 50 ปีขึ้นไปตรวจ 1 ครั้ง/ปี
✔️Chest X-ray อายุ 15 ปีขึ้นไปตรวจ 1 ครั้ง
สอบถามรายละเอียดเพิ่มเติม โทร 02-109-8111
จากผลสำรวจในเดือนสิงหาคม พ.ศ. 2565 พบว่า แนวโน้มความต้องการในการใช้จ่ายโดยรวมเพิ่มสูงสุดที่ 67% โดยเฉพาะชาวกรุงเทพฯและปริมณฑลเพิ่มขึ้นถึงร้อยละ 15 อีกทั้งแนวโน้มความต้องการในการใช้จ่ายของคนไทยเริ่มมีการเปลี่ยนแปลง ไม่เพียงมองหาแต่ของใช้ที่จำเป็นหรืออาหารเพื่อดำรงชีพอีกต่อไป แต่ผู้บริโภคเริ่มมองหาการซื้อความสุขให้ตนเอง เพิ่มโอกาสในการออกไปท่องเที่ยว เข้าสังคม สังสรรค์ ทานอาหารนอกบ้าน ออกไปใช้ชีวิตเต็มที่ เติมความสุขให้ตนเองและครอบครัว โดยเฉพาะกลุ่มอายุ 20-29 ที่ซบเซามานาน
บันทึกผลงานการแสดงสมบัติ เมทะนี บน IMDB LINK
Sombat Metanee Filmography @IMDB
Sombat Matanee was a legendary Thai singer, movie idol and director of the 1960-70s with over 2,000 film credits and 200 song credits. Matanee was elected to the Thai senate for a 6 year term by popular vote in April 19, 2006 only to have his term cut short by the Military coupe in Thailand the same year.
Actor (68 credits)
2022Good Old Days (TV Series)
2016Luk Thung Signature
2008April Road Trip
2005Chok-Dee
2004Tawan young wan yoo
20042508 pit krom jap taai
2001The Legend of Suriyothai
2000Tears of the Black Tiger
1994Hob rak ma hom pa
1988Médecins des hommes (TV Series)
1985Kraithong 2
1985Thap phaya suea
19837 Phra Kan
1983Suer Pooparn
1982Gold Raiders
1980Jao Paa-yu
1980Kraithong
1980Magic Killer
1979Salak Jitr
1978Gui yu hu dou
1978Kru Kha Nu Ngao
1978Huajai Hong Tee Ha
1978The Great Stone
1977Ai kruie
1977Bionic Heroes (as Sung Pa)
1977Haek kai narok dien bien phu
1977Kuam rak see dam
1977Look Chao Phya
1977Louie
1977Poo Lom
1977Yeh nuat sua
1977Magnum Killers
1976Châat gleua (as Sombat Methanee)
1976Killer Elephants
1976Kom Chuen Kom
1976Krai Yai Krai Yoo
1976Narok Tarutao
1976The Tiger Devil
1976Xia liu she hui
1976Choom Pae
1975Gunman with a Baby
1975I Remember (as Sombat Methanee)
1975Satri ti lok leum
1975Tanon Nee Chua
1975The Golden Triangle
1975Nak leng pa sak
1975Tang Kong
1975Nu tao fan
1974Lang nu
1974Tipchang
1973Nong bua daeng
1973Tah Tien (as Sombat Methanee)
1973The Spoilers
1973Krasue Sao
1972Da di shuang ying
1972Rareing chl
1971Ai Tui
1971Chivith Phsang Preng
1971Poh-pla-lai
1970Rak thex semx
1970Thùng mharach
1969Kinnaree
1969Phu thaeng khwam rak
1969Kosawat hatsuanra
1967Kon Nuer Kon
1967Phueng luang
1966The Battle of Bang Rajan
1965Sugar Is Not Sweet
พันตรี นายแพทย์ ธนาพงษ์ สมกิจรุ่งโรจน์
พันตรี นายแพทย์ ธนาพงษ์ สมกิจรุ่งโรจน์
แพทย์เฉพาะทางและหัวหน้าหน่วยจักษุวิทยาภูมิคุ้มกันและการอักเสบ
แพทย์เฉพาะทางด้านจอตา, แพทย์เฉพาะทางด้านกระจกตา
โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย
ประธานชมรมต้อกระจกและผ่าตัดแก้ไขสายตาผิดปกติแห่งประเทศไทย
พันตรีนายแพทย์ ธนาพงษ์ สมกิจรุ่งโรจน์ จบการศึกษาจากวิทยาลัยแพทยศาสตร์พระมงกุฏเกล้าเมื่อปี พ.ศ. 2547 ได้รับวุฒิบัตรเชี่ยวชาญด้านจักษุวิทยา จากกรมการแพทย์ รพ.ราชวิถี
และได้รับตาแหน่งหัวหน้าหน่วยจักษุวิทยาภูมิคุ้มกันและการอักเสบที่ รพ.จุฬาลงกรณ์ฯ ในปี 2555 ซึ่งเป็นปีเดียวกับที่สาเร็จการศึกษาแพทย์เฉพาะทางต่อยอดด้านจอตาจาก รพ.จุฬาฯ หลังจากนั้น นพ.ธนาพงษ์ ได้ไปศึกษาต่อทางด้านจักษุวิทยาภูมิคุ้มกันและการอักเสบ และด้านกระจกตาที่ University of California, San Francisco, USA
นพ.ธนาพงษ์ ยังเป็นผู้ก่อตั้งการประชุม Chula-KKU-Proctor-UCSF (CKPU) ซึ่งเป็นการประชุมร่วมกันระหว่าง รพ.จุฬาฯ มหาวิทยาลัยขอนแก่น และ University of California, San Francisco ในเดือน ม.ค. ปี 2559 เป็นอาจารย์แพทย์ในการฝึกอบรมแพทย์เฉพาะทางด้านจักษุวิทยา แพทย์ประจาบ้านต่อยอดด้านจอตา และในปี 2560 ที่ผ่านมาได้เปิดการฝึกอบรมแพทย์ประจาบ้านต่อยอดด้านจักษุวิทยาภูมิคุ้มกันและการอักเสบที่ รพ.จุฬาฯ ซึ่งเป็นสาขาขาดแคลนทางจักษุวิทยาที่มีสถาบันเพียงไม่กี่แห่งในเอเซียตะวันออกเฉียงใต้ที่มีการเปิดฝึกอบรมในสาขานี้
นอกจากนี้ นพ.ธนาพงษ์ เป็นผู้เชี่ยวชาญด้านการผ่าตัดต้อกระจก และจอตาในผู้ป่วยที่มีความซับซ้อนสูง ในปี 2560 นพ.ธนาพงษ์ ได้รับรางวัล “The Distinguished Service Award” by ACOM community และได้รับตาแหน่งประธานชมรมต้อกระจกและผ่าตัดแก้ไขสายตาผิดปกติแห่งประเทศไทยในปี 2565 และมีส่วนร่วมในการบริหารและกิจกรรมของ ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย ชมรมจอตา ชมรมจักษุวิทยาภูมิคุ้มกันและการอักเสบ และยังเป็นวิทยากรในการบรรยายมากมายทั้งในการประชุมระดับประเทศ และระดับนานาชาติ
โครงการกัญนคร@ราชมงคลอีสาน - รศ.ดร.โฆษิต ศรีภูธร อธิการบดี มทร.อีสาน
รศ.ดร.โฆษิต ศรีภูธร อธิการบดี มทร.อีสาน เปิดเผยว่า “โครงการกัญนคร@ราชมงคลอีสาน” เกิดจากดำเนินงานตามนโยบายการขับเคลื่อนยุทธศาสตร์ด้านอาหารและสุขภาพ ที่ได้รับมอบหมายจากสภามหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน ซึ่งสอดรับกับการขับเคลื่อนนโยบายของกระทรวงสาธารณสุข ตั้งแต่ปี 2562
มทร.อีสาน ได้มีการศึกษาวิจัยพืชสมุนไพรจนเกิดความสำเร็จของการปลูกและการวิจัยกัญชา กัญชง เพื่อประโยชน์ทางการแพทย์ จนทำให้เกิดเป็นโครงการ “กัญนคร@ราชมงคลอีสาน” ซึ่งจะเป็นมิติของการขับเคลื่อนยุทธศาสตร์การพัฒนาพืชเศรษฐกิจใหม่ เพื่อเพิ่มมูลค่าในเชิงเศรษฐกิจและอุตสาหกรรม
โครงการนี้ มทร.อีสาน จะร่วมมือกับวิสาหกิจชุมชน จำนวน 10 กลุ่ม ต่อ 1 แปลง เพื่อร่วมกันปลูกกัญชา จำนวน 1,000 ต้น (ต่อ 1 รอบการปลูก) โดยจะมุ่งสร้างผู้ประกอบการแบบต้นน้ำ กลางน้ำ และปลายน้ำ อย่างครบวงจร เพื่อเป็นการยกระดับคุณภาพชีวิตและสร้างรายได้ให้กับวิสาหกิจชุมชน สหกรณ์ และ SMEs
ทั้งนี้ โครงการกัญนคร@ราชมงคลอีสาน มีเป้าหมายจะการขยายพื้นที่โครงการให้ครอบคลุมทุกวิทยาเขตของ มทร.อีสาน เพื่อให้เป็นแหล่งรวบรวมองค์ความรู้ในการปลูกและดูแลพืชกัญชาในแต่ละพื้นที่ ครอบคลุมวิสาหกิจชุมชนในแต่ละจังหวัด และหน่วยงานในพื้นที่ เพื่อขับเคลื่อนและกำกับดูแลการปลูกพืชกัญชาเพื่อประโยชน์ทางการแพทย์ การรักษาผู้ป่วย และการวิจัยพัฒนาเพื่อต่อยอดสู่เชิงพาณิชย์
นอกจากการศึกษาวิจัยและการผลักดัน เรื่องของพืชสมุนไพรกัญชง กัญชา แล้ว มทร.อีสาน ยังสนับสนุนให้มีการศึกษา วิจัยพืชสมุนไพรอื่นๆ ของไทยด้วย อาทิ กระท่อม ไพล เป็นต้น โดย มทร.อีสาน ได้มีการจัดทำความร่วมมือกับหน่วยงานทั้งภาครัฐและเอกชน ซึ่งจะองค์ความรู้ด้านวิทยาศาสตร์ การวิจัยและนวัตกรรม มาประยุกต์ใช้ให้เกิดประโยชน์สูงสุดต่อประเทศ ต่อไป รศ.ดร.โฆษิต ศรีภูธร อธิการบดี มทร.อีสาน กล่าวทิ้งท้าย
1 ก.ย. ศบค. ผ่อนคลายการจัดซื้อ-จ่ายยารักษาโควิด
ดี-เดย์ 1 ก.ย. นี้ ศบค. ผ่อนคลายการจัดซื้อ-จ่ายยารักษาโควิด รองรับการเปลี่ยนผ่านสู่ Post-Pandemic
- หน่วยบริการนอกสังกัดกระทรวงสาธารณสุข สามารถจัดซื้อยาได้
- ร้านยาสามารถจ่ายยาตามใบสั่งแพทย์ได้
ทั้งนี้ให้ สธ. จัดซื้อยาให้พอเพียง เพื่อสนับสนุนยาหน่วยบริการ โดยในส่วนของหน่วยบริการในสังกัดกระทรวงสาธารณสุขสามารถจัดซื้อยาได้ในวันที่ 1 ต.ค. 65
คลินิกตรวจโรค
ขอบเขตการให้บริการ
1.คัดกรองความเสี่ยงด้านสุขภาพในผู้รับบริการทุกกลุ่มวัย ผู้ประกอบอาหาร ผู้สมัครงาน
2.ตรวจ วินิจฉัยปัญหาความรุนแรงของอาการป่วยในผู้ป่วยโรคทั่วไป โรคเรื้อรัง โรคระบาดตามฤดูกาล
3.ให้การรักษาผู้ป่วยตามมาตรฐานแบบองค์รวมอย่างเวชศาสตร์ครอบครัว
4.บริการให้คำปรึกษาด้านสุขภาพ นัดตรวจเจาะเลือดตามข้อบ่งชี้ของโรค
5.ประสานส่งต่อโรงพยาบาล ตรวจ รักษา วินิจฉัยเพิ่มเติม กรณีอาการซับซ้อน ฉุกเฉิน
6.ออกใบรับรองตรวจสุขภาพ สมัครงาน สมัครเรียน ออกใบรับรองคนพิการ
บริการเจาะเลือดใหญ่ (ตามนัด) ทุกวันอังคารและพฤหัสเช้า
- เวลาปกติ 08.00 - 11.00 น.
วัน-เวลาทำการ
ในเวลาราชการ วันจันทร์ – วันศุกร์ 08.00 น. - 12.00 น.
นอกเวลาราชการ วันจันทร์ – วันศุกร์ 16.00 น. - 20.00 น.
วันเสาร์ 08.00 น. - 12.00 น.
**หยุดวันหยุดนักขัตฤกษ์**
ทีมงาน
1.นายแพทย์ธนัช พจน์พิศุทธิพงศ์ ผู้อำนวยการเฉพาะด้าน(แพทย์)ต้น
2.แพทย์หญิงพรรณทิพย์ วงศ์ธีระสุต นายแพทย์ชำนาญการพิเศษ
3.นายแพทย์ชูจิต กุลจรรยาวิวัฒน์ แพทย์ห้วงเวลา
4.แพทย์หญิงสิริเพ็ญ ลีฬหะกร แพทย์ห้วงเวลา
คลินิคโรคเรื้อรัง (เบาหวาน - ความดันโลหิตสูง)
ขอบเขตการให้บริการ
1.ผู้ป่วยเบาหวานจะได้รับการดูแลตามแผนผัง การให้บริการได้แก่ เจาะเลือดตรวจระดับน้ำตาลในเลือด ชั่งน้ำหนัก วัดความดันโลหิตทุกครั้งที่มารับบริการ
2.คัดกรองและประเมินปัญหาโดยพยาบาลคัดกรอง
- กรณีมีผู้ป่วยมีระดับน้ำตาลในเลือด< 70mg% ไม่มีอาการผิดปกติ ให้ผู้ป่วยรับประทานอาหารตามปกติ เจาะเลือดซ้ำหลังรับประทานอาหาร 1 ชั่วโมง ส่งเข้าพบแพทย์ พยาบาลให้คำแนะนำภาวะน้ำตาลในเลือดต่ำด้วยตนเองให้ผู้ป่วยรับประทานอาหารตามปกติจากน้ำตาลในเลือดต่ำ และสังเกตอาการ
- กรณีระดับน้ำตาลในเลือดมากกว่า 250mg% หรือมีอาการผิดปกติ ถือเป็นกรณีเร่งด่วนต้องได้รับการตรวจโดยแพทย์เพื่อสั่งการรักษา
3.พยาบาลวิชาชีพซักประวัติคัดแยกผู้ป่วยตามระดับน้ำตาลในเลือดโดยแบ่งผู้ป่วยออกเป็น 3 กลุ่มคือ
- ผู้ป่วยที่มีระดับน้ำตาลในเลือดตั้งแต่ 71-130 mg%
- ผู้ป่วยที่มีระดับน้ำตาลในเลือด 131-179 mg% จะได้รับการซักประวัติ ค้นหาปัญที่ทำให้ระดับน้ำตาลสูง ได้รับคำแนะนำจากพยาบาล และวางแผนร่วมกับผู้ป่วยในการปรับเปลี่ยนพฤติกรรมเพื่อควบคุมระดับน้ำตาลในเลือด ประเมินความรู้และการปฏิบัติตนของผู้ป่วยเบาหวานทั้งในด้านการควบคุมอาหาร การรับประทานยาเบาหวานที่ถูกต้อง การออกกำลังกายและพฤติกรรมสุขภาพ
- ผู้ป่วยที่มีระดับน้ำตาลในเลือด >180 mg% จะได้รับการให้คำปรึกษาแบบ Individual counselling และส่งต่อเยี่ยมบ้านหากว่าเข้าเกณฑ์ หรือส่งต่อเภสัชหากพบปัญหาเรื่องยา หรือส่งต่อคลินิกเสพติด,สังคมสงเคราะห์หากพบว่าเข้าเกณฑ์ที่ต้องส่งต่อ
เปิดให้บริการเวลา 08.00 – 12.00 น. ในวันอังคาร และ วันพฤหัสบดีของทุกสัปดาห์
ทีมงาน
1. นางอรพรรณ บุญฉั่ว พยาบาลวิชาชีพชำนาญการ
2. นางอุบล สังข์โพธิ์ พยาบาลวิชาชีพชำนาญการ
คลินิกกายภาพบำบัด
ขอบเขตการให้บริการ
งานกายภาพบำบัดเป็นงานที่ให้บริการสุขภาพที่ครอบคลุม 4 ด้านหลัก คือ งานส่งเสริมสุขภาพ ป้องกันโรค งานรักษาและการฟื้นฟูสมรรถภาพผู้พิการ ดูแลประชากรตั้งแต่แรกเกิดไปจนถึงวัยสูงอายุ โดยให้บริการทางกายภาพบำบัดครอบคลุมทุกระบบ ทั้งระบบโครงร่างและกล้ามเนื้อ ระบบประสาท ระบบทางเดินหายใจ หัวใจและหลอดเลือดและอื่นๆช่วยให้ประชาชนมีสุขภาพดีได้โดยไม่ต้องใช้เทคโนโลยีที่ซับซ้อนและค่าใช้จ่ายที่สูง ขอบเขตอย่างละเอียดมีดังนี้
การตรวจวินิจฉัยและการประเมินสภาพปัญหาของผู้ป่วยที่มีปัญหาทางกายภาพบำบัด
การบำบัดรักษาทางกายภาพบำบัด และการให้คำปรึกษาแนะนำตามมาตรฐาน
การส่งเสริมให้ผู้มารับบริการและบุคคลที่เกี่ยวข้องมีความรู้ความเข้าใจในการดูแลเกี่ยวกับโรคและปฏิบัติตนได้อย่างถูกต้อง
การให้ความรู้ในการป้องกันการเกิดปัญหาซ้ำในภาวะแทรกซ้อนต่างๆ
การฟื้นฟูสมรรถภาพให้ผู้ป่วยมีศักยภาพแห่งการใช้ชีวิตที่ดีขึ้นเป็นปกติหรือใกล้เคียงปกติตามพยาธิสภาพของผู้ป่วย
โปรแกรมการรักษาฟื้นฟูในคลินิกกายภาพบำบัด (คอร์ส)
ให้บริการรักษา ฟื้นฟูโรคทางกายภาพบำบัดเป็นจำนวน 10 ครั้ง ต่อ 1 คอร์ส เมื่อรักษาเสร็จสิ้นครบ 1 คอร์สจะให้กลับไปพบแพทย์เพื่อทำการประเมินซ้ำ
โปรแกรมการฟื้นฟูในชุมชน (เกณฑ์การเยี่ยมบ้านกายภาพบำบัด)
ผู้ป่วยรายใหม่ต้องได้รับการเยี่ยม ภายใน 30 วัน นับจากวันรับเรื่อง
ผู้ป่วยทางระบบประสาท (โรคหลอดเลือดสมองรายใหม่ นับจากวันที่เริ่มเป็นภายใน 6 เดือน) ต้องได้รับการเยี่ยมทุกเดือน อย่างน้อยเดือนละ 1 ครั้ง
ผู้ป่วยรายเก่า ได้รับบริการการเยี่ยมบ้าน ภายใน 90 วัน
วันและเวลาการให้บริการ
วันจันทร์ - วันศุกร์ เวลา 08.00 - 16.00 น.
ทีมงาน
1. นางสาวปัณฑิตา แจ้งสุทธิวรวัฒน์ นักกายภาพบำบัด
2. นางสาวณรากร พิมพ์ดา พนักงานช่วยงานด้านสาธารณสุข
คลินิกกามโรค
ให้บริการตรวจรักษาโรคติดต่อทางเพศสัมพันธ์ และตรวจคัดกรองการติดเชื้อ HIV และจัดบริการส่งเสริมเพื่อป้องกันและควบคุมการติดเชื้อ HIV ในประชากรที่มีภาวะเสี่ยงสูง
วันและเวลาให้บริการ
วันจันทร์ - วันศุกร์ เวลา 08.00 น. - 12.00 น.
คลินิกวัณโรค
ให้บริการตรวจรักษาผู้ติดเชื้อวัณโรค และผู้สัมผัสโรค จ่ายยาวัณโรคด้วยระบบ DOTs
วันและเวลาให้บริการ
วันจันทร์ - วันศุกร์ เวลา 08.00 - 12.00 น.
คลินิกบำบัดยาเสพติด
เป็นหน่วยบริการด้านการบำบัด รักษาและฟื้นฟูสมรรถภาพผู้ติดยาเสพติด ทั้งทางร่างกาย จิตใจ อารมณ์และสังคมอย่างครบถ้วน จนสามารถกลับไปใช้ชีวิตได้อย่างปกติโดยไม่ต้องพึ่งการใช้ยาเพสติด บริการบำบัดรักษา มี 4 รูปแบบ คือ เมธาโดนคลินิก ศูนย์จิตสังคมบำบัด คลินิกผู้ใช้แอลกอฮอล์ และคลินิกเลิกบุหรี่ ด้วยวิธีการตรวจร่างกาย การรักษาด้วยยา กระบวนการกลุ่ม กิจกรรมบำบัด การให้คำปรึกษา โดยทีมสหวิชาชีพ
วันและเวลาให้บริการ
วันจันทร์ - วันศุกร์ เวลา 08.00 - 12.00 น.
งานเภสัชกรรม
ให้บริการจ่ายยาและเวชภัณฑ์ที่มีคุณภาพ และให้คำแนะนำในการใช้ยาที่ถูกต้อง บริการให้คำปรึกษาปัญหาจากการใช้ยา และผลิตภัณฑ์สุขภาพทั้งในคลินิกและในชุมชน
เปิดบริการ 8.00 - 20.00 น
Consumption intentions
The August 2022 survey shows the highest surge of consumption intentions, reaching 67%, and is especially high for people in Greater Bangkok.
Consumers’ spending trends have changed, as necessary goods are no longer the sole priority. Thai people now spend for happiness, whether traveling, socializing, or eating out. They live to the fullest to boost happiness for themselves and their families. This is most pronounced in the 20-29 age group, which had stagnated for a long time.
4K Medical Solutions สำหรับการผ่าตัดส่องกล้อง Endoscope
สถิติสุขภาพคนไทย ThaiHealthStat LINK
สถิติสุขภาพคนไทย ThaiHealthStat รวบรวมและนำเสนอข้อมูลด้านสุขภาพประชาชนไทยในหลายมิติ ที่เป็นประโยชน์ด้านการศึกษาเชิงลึกต่อไป ได้แก่
- สถิติสุขภาพเชิงประเด็น
- สถิติสุขภาพตามกลุ่มวัย
- สถิติสุขภาพระดับพื้นที่
- สถิติสุขภาพตามระบบข้อมูล
- วิเคราะห์สถานการณ์สุขภาพ
- รายงานสุขภาพ
- เชื่อมโยงระบบสถิติสุขภาพ
- แนะนำระบบสถิติสุขภาพ
โรงพยาบาลเจริญกรุงประชารักษ์ ศูนย์บริการคนพิการแบบเบ็ดเสร็จ LINK
ศูนย์บริการคนพิการแบบเบ็ดเสร็จ โรงพยาบาลเจริญกรุงประชารักษ์
เริ่มเปิดให้บริการ วันพุธที่ 24 สิงหาคม 2565
ให้บริการทุกวันพุธ เวลา 9.00 - 15.00 น.
ณ ศูนย์บริการคนพิการแบบเบ็ดเสร็จ อาคารศูนย์เวชศาสตร์ฟื้นฟู ชั้น 1
* ยื่นคำร้องเพื่อขอบัตรประจำตัวคนพิการ
วันจันทร์-อังคาร และพฤหัสบดี-ศุกร์ เวลา 9.00 - 15.00 น.
บริเวณศูนย์ BFC อาคาร 72 พรรษา มหาราชินี ชั้น 1
ฝากเอกสารคำร้องเพื่อขอทำบัตรประจำตัวคนพิการ และรับบัตรประจำตัวทางไปรษณีย์
รพ.ให้บริการตรวจประเมินความพิการทั้ง 7 ประเภท
การออกเอกสารรับรอง เป็นไปตามเกณฑ์กประเมินและดุลยพินิจของแพทย์ผู้รักษา โดยผู้ขอรับการตรวจ ต้องได้รับการวินิจฉัย รักษา และฟื้นฟู ก่อนเข้ารับการประเมิน
กรณีรักษาและติดตามอาการประจำที่โรงพยาบาลเจริญกรุงประชารักษ์ ให้สอบถามและปรึกษาแพทย์ผู้รักษาที่นัด
รถคัดกรองมะเร็งสตรีเคลื่อนที่
ให้บริการตรวจหามะเร็งปากมดลูกและมะเร็งเต้านม การตรวจปากมดลูกจะเป็นการเก็บเซลล์ HPV DNA ผลการตรวจจะแจ้งไปยังศูนย์ฯสาธารณสุขในพื้นที่พำนักของผู้รับบริการ กรณีตรวจเต้านมจะแจ้งผลทันทีหากพบผิดปกติ และคำแนะนำเพื่อดำเนินการต่อไป
นอกจากนั้นยังเน้นความสำคัญด้านโรคติดต่อทางเพศสัมพันธ์ โดยมีการให้บริการตรวจคัดกรองโรคติดต่อทางเพศสัมพันธ์ ร่วมกับการแจกสื่อและถุงยางอนามัย ในทุกๆครั้งที่ออกให้บริการ ณ จุดต่างๆ ในกรุงเทพอีกด้วย
คลินิกกัญชา ม.รังสิต LINK
เป็นคลินิกกัญชา ของวิทยาลัยการแพทย์แผนตะวันออก มหาวิทยาลัยรังสิต ให้บริการโดยแพทย์แผนไทย ให้บริการยา 16 ตำรับ สูตรที่ผลิตโดยโรงพยาบาลพระอาจารย์ฝั้น อาจาโร จ.สกลนคร และอนาคตจะมีการเพิ่มสูตรน้ำมันกัญชาสูตรอาจารย์เดชา และสูตรอื่นๆ ได้ รวมถึงยากัญชาที่ผลิตโดยวิทยาลัยเภสัชศาสตร์ มหาวิทยาลัยรังสิต ซึ่งขณะนี้อยู่ในกระบวนการขออนุญาตให้ถูกต้องทางกฏหมาย
ยาตำรับกัญชาที่ใช้ จะช่วยดูแลสุขภาพ ดังนี้ ยาทัพยาธิคุณ ช่วยลดอาการมือชาเท้าชา ในผู้ป่วยโรคเบาหวาน และใช้รักษาอาการมือเท้าบวม ในผู้ป่วยมะเร็งตับ ยาศุขไสยาศน์ ช่วยให้นอนหลับ เจริญอาหาร ฟื้นฟูกำลังของผู้ป่วยโรคเรื้อรัง ยาน้ำมันสนั่นไตรภพ ช่วยลดอาการแทรกซ้อนในผู้ป่วยมะเร็งรังไข่ มะเร็งมดลูก มะเร็งตับในระยะเริ่มต้น เป็นต้น ซึ่งยาเหล่านี้ถูกห้ามใช้มาหลายปี ตอนนี้เรานำกลับมาใช้ใหม่และพบว่า นอกจากที่กล่าวไว้ในตำราแล้วยังช่วยรักษาโรคแผนปัจจุบันได้หลายชนิดด้วยกัน
คลินิกกัญชา ม.รังสิต จะเปิดให้บริการทุกวันอังคาร เวลา 09.00-15.00 น. ณ สหคลินิกการแพทย์แผนตะวันออกไทย-จีน บริเวณชั้น 1 อาคารรังสิตประยูรศักดิ์ (อาคาร 12) มหาวิทยาลัยรังสิต โทร. 02-791-6000 ต่อ 4406, 4407 หรือ 089-7705862
แพทย์หญิงปรมาภรณ์ ปราสาททองโอสถ ประธานกรรมการบริหาร และกรรมการผู้อำนวยการใหญ่ บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) หรือ BDMS เปิดเผยว่า ประเทศไทยมีนโยบายแห่งชาติว่าด้วยการพัฒนาการแพทย์จีโนมิกส์เพื่อให้ประชาชนชาวไทยมีโอกาสเข้าถึงการรักษาที่ทันสมัยได้อย่างมีประสิทธิภาพและทั่วถึง โดยแผนยุทธศาสตร์ชาติ พ.ศ. 2563 – 2583 นั้นประกอบด้วย ความร่วมมือระหว่างหน่วยงานต่างๆ ทั้งภาครัฐและภาคเอกชน ซึ่งครอบคลุมตั้งแต่การเก็บตัวอย่างพันธุกรรม การตรวจวิเคราะห์ดีเอ็นเอ (DNA sequencing) การจัดทำและกำกับดูแลคลังจีโนมของประเทศ ไปจนถึงการแปลผลเพื่อนำไปใช้ทางการรักษา นอกจากนี้ยังมีความร่วมมือด้านการวิจัยและการพัฒนาบุคลากร เพื่อเสริมสร้างขีดความสามารถทางการแพทย์จีโนมิกส์ของประเทศและลดการพึ่งพาห้องปฏิบัติการในต่างประเทศ BDMS ในฐานะเครือข่ายบริการทางการแพทย์ที่ครบวงจรของประเทศไทย และ N Health ในฐานะห้องปฏิบัติการที่ให้บริการทั้งภายในเครือข่ายและนอกเครือข่าย ที่มีความพร้อมในทุกๆ ด้าน จึงพร้อมที่จะสนับสนุนยุทธศาสตร์ของภาครัฐในด้านการแพทย์จีโนมิกส์ และผลักดันสู่การเป็นศูนย์กลางทางการแพทย์ระดับภูมิภาค (Medical Hub) ด้วยศักยภาพของโรงพยาบาลและคลีนิคในเครือกว่า 54 แห่ง ที่พร้อมให้บริการเก็บตัวอย่างพันธุกรรม แปลผล ให้คำแนะนำในการรักษา และร่วมมือในด้านงานวิจัยต่างๆ ขณะที่ N Health สามารถวิเคราะห์และจัดเก็บผลเพื่อสร้างเป็นคลังจีโนมร่วมกับภาครัฐ อันจะนำประโยชน์ด้านพัฒนาการทางการแพทย์มาสู่ประเทศไทยได้อีกขั้น
ศูนย์สุขภาพดี (Health & Wellness Center) โรงพยาบาลสงขลา LINK
ศูนย์สุขภาพดี (Health & Wellness Center) โรงพยาบาลสงขลา เปิดให้บริการแล้วดังนี้
ตรวจสุขภาพประจำปี
ตรวจสุขภาพประกันสังคม
ตรวจสุขภาพเข้าทำงาน
ตรวจสมรรถภาพ หู ตา ปอด
ขอใบรับรองแพทย์ ต่อใบขับขี่
ขอใบรับรองแพทย์ สมัครสอบ
ขอใบรับรองแพทย์ ศึกษาต่อ
ให้บริการ จันทร์-ศุกร์ เวลา 8-16 น. (เว้นวันหยุดราชการ/นักขัตฤกษ์)
สามารถเข้าจากทางหน้าโรงพยาบาล แล้วเลี้ยวซ้าย คลินิกจะอยู่บริเวณซ้ายมือ (อาคารสีส้ม)
***ก่อนเข้ารับบริการ ให้ผู้รับบริการติดต่อทำบัตร ณ ศูนย์บริการผู้ป่วยนอก ชั้น 1 อาคารผู้ป่วยนอก
สอบถามโทร. 074-338100 ต่อ 3505
ศูนย์ส่องกล้องนอกเวลาราชการ โรงพยาบาลสงขลา LINK
ศูนย์ส่องกล้องนอกเวลาราชการ โรงพยาบาลสงขลาสอบถามโทร. 074-338100 ต่อ 4011 บริการจันทร์-ศุกร์ 16.30-20 น. *ค่าบริการเพิ่มเติมไม่สามารถเบิกตามสิทธิได้ ค่ายาและค่าบริการอื่นๆ เบิกได้ตามสิทธิ์
ทราฟฟี่ ฟองดูว์ Traffy Fondue


Traffy Fondue (พัฒนาโดย NECTEC) เป็นแอปพลิเคชั่นสำหรับรับแจ้งปัญหา ข้อเสนอแนะจากผู้แจ้ง และ ระบบสนับสนุนการบริหารจัดการปัญหาให้มีประสิทธิภาพสูงขึ้น โดยผู้แจ้งไม่จำเป็นต้องรู้จักกับเจ้าหน้าที่ หรือทราบว่าใครเป็นผู้รับผิดชอบปัญหามาก่อน ก็สามารถแจ้งปัญหาได้ ระบบออกแบบมาให้ง่ายต่อการใช้งาน เพียงแค่ผู้แจ้งทำการถ่ายรูปและระบุประเภทของปัญหา ระบบจะทำการแจ้งปัญหาดังกล่าวไปยังเจ้าหน้าที่และทีมงานที่รับผิดชอบทันที ในด้านของเจ้าหน้าที่ ระบบจะช่วยคัดแยกประเภทของปัญหาและแจ้งปัญหาต่อเจ้าหน้าที่ผู้ที่มีหน้าที่ดูแลและรับผิดชอบโดยตรง ระบบสามารถให้ข้อมูลความก้าวหน้าในการดำเนินการและติดตามสถานะของปัญหาได้ผ่านโทรศัพท์มือถือ ระบบนี้ช่วยให้ผู้แจ้งมีส่วนร่วมในการดูแลสภาพแวดล้อมของชุมชน (คอนโดมิเนียม, นิคมอุตสาหกรรม, หมู่บ้าน) ของตนเอง และยังเปิดโอกาสให้ผู้แจ้งสามารถให้กำลังใจ ติชมการปฏิบัติงานของเจ้าหน้าที่ได้อีกด้วย ผู้แจ้งและเจ้าหน้าที่สามารถสื่อสารและช่วยกันแก้ไขปัญหาชุมชนร่วมกัน ซึ่งทำให้เกิดความหวงแหน ดูแล รักษา ให้ชุมชน (คอนโดมิเนียม, นิคมอุตสาหกรรม, หมู่บ้าน) มีความน่าอยู่ยิ่งขึ้น
ประเภทปัญหาที่แจ้งได้ เช่น 1. ความสะอาด ขยะ 2. ไฟฟ้า ประปา 3. ไฟถนนเสีย 4. ถนน ทางเท้า 5. อาคารสถานที่ชำรุด 6. อุปกรณ์ครุภัณฑ์ชำรุด 7. จุดเสี่ยง 8. สาธารณภัย : น้ำท่วม ไฟไหม้ เผาไหม้ 9. ต้นไม้ กลิ่น เสียง สัตว์ 10. ขึ้นทะเบียน ประชาสัมพันธ์ 11. ความช่วยเหลือ 12. สุขภาพ 13. เบาะแสทุจริต 14. อื่นๆ
คลินิกกัญชา โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต
คลินิกกัญชา – โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต
ให้บริการทุกวัน : เวลา 08:00 – 19:00 น.
เบอร์ติดต่อ สำหรับผู้ป่วยโรคมะเร็ง – โทร. 093-328-5561 หรือ 02-115-2111 ต่อ 1169,1170
สำหรับผู้ป่วยที่ไม่ใช่โรคมะเร็ง – โทร. 02-115-2111 ต่อ แผนกผู้ป่วยนอก
แพคเกจตรวจสุขภาพ หญิง 6 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
ผู้ประกันตนลงทะเบียนรายงานตัวกรณีว่างงาน LINK
ลงทะเบียนรายงานตัว ได้ที่เว็บไซต์ กรมแรงงาน
https://unemploy.doe.go.th/welcome
วิธีการ
- กรอกข้อมูลส่วนตัว
- วุฒิการศึกษา
- สถานการออกจากงาน ลาออก หรือ เลิกจ้าง
- ความต้องการหางานทำ จากการ ค้นหาตำแหน่งงานว่าง หรือ เลือกสมัครงาน
- การประกอบอาชีพอิสระ ให้ระบุประเภทอาชีพ
- กรอกข้อมูลในแบบ สปส.2-01/7
- แนบไฟล์สำเนาบัญชีธนาคาร ประเภทออมทรัพย์
การรายงานตัว
- กรณีมีงานทำแล้ว ระบุวันเดือนปีที่เริ่มงาน ตำแหน่งงาน อัตราค่าจ้าง ชื่อสถานประกอบการ
- กรณียังไม่มีงานทำ สามารถค้นหาตำแหน่งงานได้ เลือกสมัครงาน หรือเลือกอาชีพอิสระ
หมายเหตุ ระบบจะแจ้งเตือนเมื่อถึงกำหนดรายงานตัว
ตรวจสอบสถานะการรับผลประโยชน์ทดแทน
- ตรวจสอบการขึ้นทะเบียน
- ตรวจสอบการรายงานตัว
- ตรวจสอบการจ่ายเงินประโยชน์ทดแทน
พรรคประชาธิปัตย์แถลงความเห็น
14 กันยายน 2565 รัฐสภา ส.ส.พรรคประชาธิปัตย์ นำโดยนายสาทิตย์ วงศ์หนองเตย ส.ส.ตรัง น.ส. พิมพ์รพี พันธุ์วิชาติกุล ส.ส.บัญชีรายชื่อ นายอิสระ เสรีวัฒนวุฒิ ส.ส.บัญชีรายชื่อ และนายสาคร เกี่ยวข้อง ส.ส.กระบี่ แถลงผลการประชุมพรรคประชาธิปัตย์ต่อการพิจารณาร่างพระราชบัญญัติกัญชง กัญชา โดยนายสาทิตย์ กล่าวว่า มีส.ส.พรรคหยิบยกประเด็นนี้มาอภิปรายหลากหลายและวิตกกังวล หลังการประกาศกัญชาไม่เป็นยาเสพติด จะกระทบกับสังคม เด็กและเยาวชน เพราะที่ผ่านเมื่อประกาศกัญชาออกจากยาเสพติด มีผู้ที่เสพจนป่วยเป็นจิตเวชทำร้ายร่างกายคนในสังคม
“พรรคประชาธิปัตย์หวังว่าจะมีมาตรการควบคุมที่เข้มแข็ง ให้เป็นไปในลักษณะที่ใช้เพื่อประโยชน์ทางการแพทย์ แต่เมื่อพิจารณเนื้อหาในร่างแล้วเห็นว่า ยังกำหนดส่งเสริมสนับสนุนการปลูกกัญชา อนุญาตให้บุคคลทั่วไปจดแจ้งขอปลูกกัญชาได้ ซึ่งอาจนำไปสู่การเสพเพื่อนันทนาการ ส่งผลกระทบต่อสังคม จึงขอให้กระทรวงสาธารณสุขทบทวนประกาศเรื่องการปลดกัญชาออกจากการเป็นยาเสพติดกลับไปเป็นยาเสพติดเหมือนเดิม ขอให้กรรมาธิการฯ ถอนร่างกฎหมายดังกล่าวออกไป เพื่อนำกลับไปทบทวนใหม่ ให้สอดคล้อง หลังจากที่กระทรวงสาธารณสุขทบทวนประกาศ หากในที่ประชุมยังพิจารณากฎหมายนี้ต่อส.ส.ของพรรค จะอภิปรายและแจ้งให้ที่ประชุมรับทราบ” นายสาทิตย์ กล่าว
นายสาทิตย์ กล่าวว่า ได้แจ้งให้วิปรัฐบาลทราบถึงท่าทีของพรรคแล้ว ยืนยันว่าไม่ใช่เรื่องการเมือง แต่เป็นเรื่องหลักการของกฎหมาย และไม่คิดว่าจะเป็นผลกระทบกับพรรคร่วมรัฐบาลที่บางพรรคใช้เรื่องนี้เป็นนโยบาย เพราะเรื่องนี้เป็นเรื่องที่ต้องรับผิดชอบต่อสังคม เชื่อว่าพรรคร่วมรัฐบาลจะเข้าใจและรับทราบข้อวิตกกังวลของสังคม แต่หากที่ประชุมยังเดินหน้าพิจารณาต่อ พรรคจะโหวตไม่เห็นด้วย
น.ส.พิมพ์รพี กล่าวว่า จากการลงพื้นที่พบปัญหายาเสพติดในจังหวัดกระบี่หลายคดี แม้ไม่ใช่เรื่องกัญชาโดยตรง แต่การให้ทัศนคติว่าสิ่งเสพติดมีคุณโดยเฉพาะ การให้ความรู้เรื่องกัญชาก็เป็นเรื่องน่าห่วง เพราะมีผลต่อเด็กและเยาวชน.
สำนักข่าวไทย
นักการสาธารณสุขดีเด่น รางวัลชัยนาทนเรนทร
นักการสาธารณสุขดีเด่น รางวัลชัยนาทนเรนทร เป็นรางวัลที่มอบให้กับบุคคลที่ปฏิบัติงานหรือสนับสนุนงานด้านสาธารณสุข ทั้งในและนอกสังกัดกระทรวงสาธารณสุข เพื่อสร้างขวัญกำลังใจและเชิดชูเกียรติผู้ที่อุทิศตนในการพัฒนางานด้านสาธารณสุขที่มีผลงานโดดเด่นในระดับชาติ แบ่งเป็น 5 ประเภท ประกาศผลผู้ได้รับรางวัลในวันคล้ายวันสถาปนากระทรวงสาธารณสุข 27 พฤศจิกายนของทุกปี โดยปี 2564 มีผู้ได้รับรางวัล ดังนี้ออร์โธปิดิกส์ วชิรพยาบาล LINK
วชิรพยาบาล บริการพบแพทย์ด้านออร์โธปิดิกส์ หลายแขนง อาทิ
ออร์์โธปิดิกส์ทั่วไป ข้อสะโพกข้อเข่า การบาดเจ็บทางออร์์โธปิดิกส์ โรคกระดูกผู้ใหญ่ทั่วไป โรคกระดูกในเด็ก ปัญหาเกี่ยวกับกระดูกสันหลัง กระดูกมือ รวมทั้งด้านเวชศาสตร์การกีฬา บาดเจ็บ/ปัญหาจากการเล่นกีฬา สามารถพบแพทย์ได้
ติดต่อสอบถาม
ภาควิชาออร์โธปิดิกส์ อาคารมหาวชิราวุธ ชั้น 3
คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช
681 ถนนสามเสน แขวงวชิรพยาบาล
เขตดุสิต กรุงเทพมหานคร 10300
โทรศัพท์ 02-2443376
การให้บริการของโรงพยาบาลบ้านตาขุน
งานทันตกรรม
บริการจันทร์-ศุกร์
เช้า ให้บริการผู้ป่วยทั่วไป
บ่าย ให้บริการเฉพาะผู้ป่วยนัด
งานกายภาพบำบัด
บริการจันทร์-ศุกร์
เช้า
- ให้บริการวินิจฉัย ตรวจ รักษา ผู้ป่วยระบบกล้ามเนื้อและกระดูก
- ให้บริการตรวจประเมินอาการ คัดกรองและให้คำแนะนำเกี่ยวกับการออกกำลังกายที่ถูกต้อง
เหมาะสมกับโรค ทั้งในโรงพยาบาลและโรงพยาบาลส่งเสริมสุขภาพตำบล
- ให้บริการเยี่ยมบ้าน ดูแลผู้พิการและผู้สูงอายุที่จำเป็นต้องได้รับการฟื้นฟูสมรรถภาพ
บ่าย
- ให้บริการวินิจฉัย ตรวจ รักษา ฟื้นฟูสมรรถภาพ ผู้ป่วยระบบประสาทและไขสันหลัง
- ให้บริการรับปรึกษา ให้การรักษาทางกายภาพบำบัด ตึกผู้ป่วยใน
- ให้บริการออกเยี่ยมบ้าน ร่วมกับทีม Home health care
เสาร์-อาทิตย์ - ให้บริการรับปรึกษา ให้การรักษาทางกายภาพบำบัด ตึกผู้ป่วยใน
การให้บริการ การแพทย์แผนไทย
บริการจันทร์-ศุกร์
- นวดเพื่อการรักษา
- นวดเพื่อส่งเสริมสุขภาพ
- ประคบสมุนไพร
- อบไอน้ำสมุนไพร
- จ่ายยาสมุนไพรตามกลุ่มอาการ รวมทั้งยาต้มเฉพาะราย
- ดูแลมารดาหลังคลอด ซึ่งมีการนวด ทับหม้อเกลือ อบไอน้ำสมุนไพร
- ให้คำปรึกษาสุขภาพด้านแพทย์แผนไทย
ประกาศรับสมัครงาน ดังนี้
1. นักวิชาการคอมพิวเตอร์ จำนวน 1 อัตรา
2. เจ้าหน้าที่หน่วยพัฒนาคุณภาพ จำนวน 1 อัตรา
3. นักรังสีการแพทย์ จำนวน 1 อัตรา
ศึกษารายละเอียดการรับสมัครเพิ่มเติมได้ที่ https://cmu.to/L-cBb
หรือโทรสอบถามได้ที่ 053 - 935097 ต่อ 108 คุณดุชมณีกร
เพิ่มพื้นที่สีเขียว เติมความสุดชื่นให้มหานคร
คนกรุงเทพฯ ก็ไม่ต่างจากคนในมหานครใหญ่ทั่วโลก คือ ต้องทำงานหนัก เคร่งเครียด จากภาระหน้าที่การงานและการใช้ชีวิต ต้องผจญกับมลภาวะ โอกาสที่จะได้สัมผัสหรือใกล้ชิดกับธรรมชาติก็มีน้อย กรุงเทพมหานครจึงพยายามเพิ่มเติมความสดชื่น คืนธรรมชาติสู่วิถีชีวิตคนกรุงเทพฯ ด้วยการเพิ่ม "พื้นที่สีเขียว" ให้ครอบคลุมทั่วถึงทุกมุมเมือง ตั้งแต่การสร้างสวนหย่อมขนาดเล็ก สวนป่า สวนสุขภาพชุมชนไปจนถึงสวนสาธารณะขนาดใหญ่ การเพิ่มพื้นที่สีเขียวในพื้นที่สาธารณะต่าง ๆ เช่น ริมสองฝั่งถนน ฟุตบาท เกาะกลางถนน บริเวณป้ายรถประจำทาง พื้นที่ใต้แนวรถไฟฟ้า ฯลฯ ซึ่งไม่เพียงเพิ่มความร่มน มีชีวิตชีวา สร้างความน่าอยู่ให้แก่เมืองเท่านั้น แต่ยังสร้างทัศนียภาพที่สวยงาม และเพิ่ม "พื้นที่สำหรับทำกิจกรรม" ให้คนกรุงเทพฯ ได้มีมุมสงบสำหรับพักผ่อนหย่อนใจ มีช่วงเวลาที่รื่นรมย์และผ่อนคลายเสริมพลังกาย เติมพลังใจ เพิ่มพลังชีวิต และเชื่อมกระชับความสัมพันธ์ของคนเมืองให้ยิ่งใกล้ชิดแนบแน่นขึ้นอีกด้วย
และเพื่อให้การเพิ่มพื้นที่สีเขียวมีนโยบายและเป้าหมายที่ชัดเจน กรุงเทพมหานครจึงได้ริเริ่มโดรงการ Green Bangkok 2030 ขึ้นเมื่อเดือนธันวาคม 2562 ซึ่งมีเป้าหมายหลักๆ คือ
"เป้าหมาย GREEN BANGKOK 2030"
ก๋วยเตี๋ยวเรือกัญชา เชฟทศพล ประทุมวัน
ก๋วยเตี๋ยวเรือกัญชา
เชฟ/เจ้าของ: ทศพล ประทุมวัน
ร้าน: ครัวกัญชรักษ์ เวลเนส คลินิค
สรรพคุณทางยา:
“ก๋วยเตี๋ยวเรือกัญชา” ครัวกัญชรักษ์รังสรรค์เมนูอาหารก๋วยเตี๋ยวสายเขียว ให้ได้ลิ้มรสความอร่อยของเมนูกัญชาที่ทั้งอร่อยและมีประโยชน์ต่อสุขภาพ
ที่อยู่: 111 หมู่ 2 ตำบลบึงน้ำรักษ์ อำเภอธัญบุรี จังหวัดปทุมธานี 12110
Line: @Kancharak
Tel. 09-9169-2997
กะเพราคั่วใบกัญชา LINK
เครื่องปรุง
ใบกัญชา 1 ใบ / ใบกะเพรา 10 กรัม / พริกขี้หนู 10 กรัม / กระเทียม 15 กรัม / น้ำปลา 12 กรัม / ซอสถั่วเหลือ 12 กรัม / น้ำมันหอย 5 กรัม / ซีอิ้วดำ 2 กรัม / น้ำตาล 2 กรัม / น้ำมัน 20 กรัม / หมูสับ 180 กรัม
วิธีทำ
1. ตั้งกระทะใส่น้ำมัน รอจนน้ำมันร้อน แล้วจึงใส่พริกและกระเทียมลงไปผัดจนมีกลิ่นหอม
2. ใส่หมูสับลงไปผัดจนสุก
3. ใส่ใบกัญชาลงไป ปรุงรสด้วย น้ำมันหอย น้ำปลา ซอสถั่วเหลือง ซีอิ้วดำ น้ำตาล
4. คลุกเคล้าให้เข้ากันและเสริฟ์
ภาควิชา หน่วยงานภายใน คณะแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ LINK
ภาควิชา ประกอบด้วย 8 ภาควิชา ชั้นปรีคลินิก และ 17 ภาควิชา ชั้นคลินิก รวมทั้งหมด 25 ภาควิชา
ภาควิชาชั้นปรีคลินิก
1. ภาควิชากายวิภาคศาสตร์
2. ภาควิชาจุลชีวิทยา
3. ภาควิชาปรสิตวิทยา
4. ภาควิชาพยาธิวทยา
5. ภาควิชาพยาธิคลินิก
6. ภาควิชาสรีรวิทยา
7. ภาควิชาชีวเคมีและพันธุวิศวกรรม
8. ภาควิชาเภสัชวิทยา
ภาควิชาชั้นคลินิก
1. ภาควิชาเวชศาสตร์การเกษตรและชีวนวัตกรรม
2. ภาควิชาการแพทย์แผนไทย
3. ภาควิชากุมารเวชศาสตร์
4. ภาควิชาจิตเวชศาสตร์
5. ภาควิชาจักษุวิทยา
6. ภาควิชานิติเวชศาสตร์
ภาควิชารังสีวิทยา
ภาควิชาวิสัญญีวิทยา
ภาควิชาเวชศาสตร์ครอบครัว
ภาควิชาเวชศาสตร์ชุมชน
ภาควิชาเวชศาสตร์ฟื้นฟู
ภาควิชาเวชศาสตร์ฉุกเฉิน
ภาควิชาศัลยศาสตร์
ภาควิชาออร์โธปิดิคส์
ภาควิชาสูตินรีเวชศาสตร์
ภาควิชาโสต นาสิ ลาริงซ์
ภาควิชาอายุรศาสตร์
ศูนย์วิจัยทางการแพทย์ 4 หน่วยงาน
1. สำนักงานวิจัยทางการแพทย์
2. งานระบาดวิทยาและสถิติ
3. งานจริยธรรมการวิจัยในมนุษย์
4. ศูนย์วิจัยคลินิก
ศูนย์พัฒนาและประกันคุณภาพ 6 งาน
1. งานแพทย์ศาสตร์ศึกษา
2. งานประกันคุณภาพ
3. งานประเมินผล
4. งานวิทยบริการ
5. งานเวชนิทัศน์
6. งานห้องปฏิบัติการ
ศูนย์เทคโนโลยีและสารสนเทศ 3 งาน
1. งานโปรแกรมกาบริหารจัดการ
2. งานโปรแกรมการเรียนการสอน
3. งานระบบสารสนเทศ
โรงพยาบาลมหาวิทยาลัยเกษตรศาสตร์ 400 เตียง
ศูนย์การแพทย์ศาสตร์ศึกษา 2 ศูนย์
1. ศูนย์การแพทย์ศาสตร์ศึกษา โรงพยาบาลศูนย์สกลนคร
2. ศูนย์การแพทย์ศาสตร์ศึกษา โรงพยาบาลเจ้าพระยายมราช
สำนักงานเลขานุการ 4 งาน
1. งานบริหารและธุรการ
2. งานทรัพยากรบุคคล
3. งานคลังและพัสดุ
4. งานอาคาร สถานที่ และยานพาหนะ
การตรวจคัดกรองมะเร็งปากมดลูก
การตรวจคัดกรองมะเร็งปากมดลูก
วิธีตรวจคัดกรอง
Papanicolaou smear
- ควรทำทุก 1 ปี ในหญิงทุกคนที่อายุ 35-55 ปี และแนะนำในหญิงทุกคนที่เคยมีประวัติเคยมีเพศสัมพันธ์แล้ว ถ้าปกติติดต่อกัน 3 ปี ต่อไปทำทุก 3 ปี
การเตรียมตัวก่อนรับการตรวจ
- ต้องไม่มีการตรวจภายในมาก่อน 24 ชั่วโมง
- ไม่มีการเหน็บยาในช่องคลอดมาก่อน 48 ชั่วโมง
- ห้ามล้างหรือทำความสะอาดภายในช่องคลอดมาก่อน 24 ชั่วโมง
- งดการมีเพศสัมพันธ์คืนวันก่อนมารับการตรวจ
วิธีการตรวจ Pap smear technique
- ใส่ปลายแหลมของ Modified Ayre Spatula เข้าในรูปากมดลูก
- ดันส่วนโค้งของ Spatula ชิดปากมดลูก
- หมุน Spatula ด้วยแรงกด จนคิดว่าได้เซลล์จากทุกจุดในบริเวณปากมดลูกทั้งข้างนอกและใน
- ป้ายลงบนแผ่นกระจกโดยวางขนาน
- ค่อย ๆ ลาก Spatula ไปปลายใสของแผ่นกระจก ป้านไปทางเดียว
- ทำอย่างรวดเร็วและเกลี่ยให้บาง
- แช่ในขวดน้ำยา Alcohol
1.ศูนย์ ECH - ศูนย์เรียนรู้และพัฒนาสุขภาวะผู้สูงอายุแบบครบวงจรและบริบาลผู้ป่วยระยะท้าย (Ramathibodi Elderly Care and Hospice) LINK
ศูนย์ ECH และการบริการ
ศูนย์เรียนรู้และพัฒนาสุขภาวะผู้สูงอายุแบบครบวงจรและบริบาลผู้ป่วยระยะท้าย (Ramathibodi Elderly Care and Hospice หรือ ศูนย์ ECH ) คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี นั้น มุ่งเน้นพัฒนาสร้างต้นแบบและยกระดับมาตรฐานการให้บริการสุขภาพแบบองค์รวม (Holistic Patient-Centered Care) เพื่อเพิ่มคุณภาพชีวิตที่ดีที่สุดเท่าที่จะทำได้แก่ผู้ป่วยสูงวัยไทย โดยทีมแพทย์จะร่วมกันดูแล วางเป้าหมายและแผนของการรักษาให้เหมาะสมแก่ผู้ป่วยสูงวัยแต่ละรายไป
ศูนย์ ECH นั้นจะให้การบริการสุขภาพแบบครบวงจรทั้งในระบบผู้ป่วยนอก (OPD), ผู้ป่วยใน (IPD), และศูนย์กิจกรรมและดูแลผู้ป่วยสูงวัยเฉพาะช่วงกลางวันแบบเช้าไป-เย็นกลับ (Day Care Center) มุ่งเน้นการวางแผนการให้บริการสุขภาพแก่ผู้ป่วยสูงวัยไทยแบบเบ็ดเสร็จ (One Stop Service) โดยทีมแพทย์ผู้เชี่ยวชาญสหสาขา ได้แก่ อายุรศาสตร์ผู้สูงวัย เวชศาสตร์ฟื้นฟูและกายภาพบำบัด โรคสมองเสื่อม โภชนบำบัด และการดูแลรักษาผู้ป่วยแบบประคับประคองและระยะท้าย เป็นต้น ซึ่งการให้บริการของศูนย์ ECH นี้จะครอบคลุมการดูแลรักษาผู้ป่วยสูงวัยทั้งในด้านกายและใจ เริ่มตั้งแต่การสร้างเสริมฟื้นฟูสุขภาพ การป้องกันโรค การป้องกันภาวะแทรกซ้อนและภาวะพึ่งพา การวางแผนการดูแลรักษาล่วงหน้า จนถึงการบริบาลผู้ป่วยระยะท้ายและการจากลาอย่างสงบสุข
นอกจากการให้บริการด้านสุขภาพแล้ว ศูนย์ ECH นั้นยังมีพันธกิจหลักอีก 2 ด้าน ได้แก่
1) ศูนย์วิจัยและพัฒนานวัตกรรม (Research and Development) ที่เกี่ยวข้องกับผู้สูงวัยที่ทันสมัยและได้มาตรฐานสากล เพื่อนำผลงานศึกษาวิจัยและนวัตกรรมนั้นๆ ไปเผยแพร่และประยุกต์ใช้ให้สอดคล้องกับบริบททั้งในระดับประเทศและนานาชาติ
2) ศูนย์เรียนรู้และฝึกอบรม (Education and Training Center) เพื่อเผยแพร่องค์ความรู้ด้านอายุรศาสตร์ผู้สูงวัย การดูแลแบบประคับประคองและระยะท้ายแก่แพทย์ บุคลากรทางการแพทย์ ผู้ดูแลผู้สูงวัย และประชาชนทั่วไป มุ่งหวังเพื่อเพิ่มวิทยฐานะ สร้างงาน สร้างอาชีพ และช่วยยกระดับมาตรฐานการดูแลรักษาผู้ป่วยสูงวัยไทยแบบองค์รวมให้ทันสมัยและทัดเทียมนานาอารยะประเทศต่อไป
ความคืบหน้าโครงการ LINK
เริ่มงานถมดินโครงการ โครงการที่พักอาศัยผู้สูงอายุ รามาฯ-ธนารักษ์ จังหวัดสมุทรปราการ ได้เริ่มดำเนินการถมดินโครงการฯ เพื่อเตรียมความพร้อมงานก่อสร้างโครงการฯ ต่อไป
คลินิกพิเศษสาขาจักษุ (นอกเวลาราชการ)
คลินิกพิเศษสาขาจักษุ (นอกเวลาราชการ) เพื่อลดความแออัดและเป็นทางเลือกสำหรับท่านที่ไม่สะดวกในเวลาราชการ และพบแพทย์ตรงกับโรคที่ต้องการ เปิดให้บริการทุกวันอังคารที่ 2 และ 4 ของเดือน ตั้งแต่เวลา 16.00-20.00 น. เป็นต้นไป สอบถามข้อมูลเพิ่มเติมได้ทาง Line: @pakchongnana หรือโทร.044311856 ต่อ 341
แผนป้องกัน โดยกรมสนับสนุนสุขภาพ LINK
สไลด์ประกอบการแถลงข่าว วันที่ 26 กันยายน 2565 การป้องกันควบคุมโรคโควิด 19 ของ สธ. หลังยกเลิก พ.ร.ก.ฉุกเฉิน - ยุบ ศบค. โดย นพ.ธเรศ กรัษนัยรวิวงศ์ อธิบดีกรมสนับสนุนบริการสุขภาพ
เกี่ยวกับโรงพยาบาลวิมุต
โรงพยาบาลวิมุต ตั้งอยู่ใจกลางย่านธุรกิจใกล้สี่แยกสะพานควายของกรุงเทพฯ เป็นโรงพยาบาลขั้นตติยภูมิ (Tertiary Care) ขนาด 236 เตียงในรูปแบบอาคารสูง 18 ชั้น ซึ่งได้รับการออกแบบตามมาตรฐานสากลของ Joint Commission International (JCI) เน้นให้บริการรักษาโรคเกี่ยวกับหัวใจและหลอดเลือดหัวใจ สมอง เบาหวาน กระดูก ระบบทางเดินอาหาร และตับ รวมถึงกลุ่มโรคไม่ติดต่อเรื้อรัง (NCDs) นอกจากนี้ ยังมีบริการทางการแพทย์อื่น ๆ อาทิ ศูนย์สุขภาพผู้สูงอายุ (Geriatric center) เพื่อตอบโจทย์สังคมผู้สูงอายุ รวมถึงการดูแลพื้นฟูสภาวะหลังวิกฤต (Transitional Care) เพื่อฟื้นฟูร่างกายผู้ป่วยหลังจากรักษาเพื่อเตรียมตัวก่อนกลับบ้าน เรานำเสนอบริการในรูปแบบ One-stop Service ซึ่งครอบคลุมบริการดูแลสุขภาพถึงบ้าน (Health to Home) มอบความสะดวกสบายและทันสมัยผ่านการใช้ ViMUT Application สำหรับการตรวจสอบประวัติทางการแพทย์ส่วนบุคคล การจองนัดหมายแพทย์ด้วยตัวเอง การรับคำปรึกษาจากแพทย์แบบออนไลน์ (Telemedicine) และบริการจัดส่งยาและวัคซีนถึงบ้าน (ViMUT Drug delivery)
คณะเภสัชศาสตร์ มหาวิทยาลัยนเรศวร จัดกิจกรรมสัปดาห์เภสัชกรรม 25-30 กันยายน LINK
คณะเภสัชศาสตร์ มหาวิทยาลัยนเรศวร ร่วมเป็นส่วนหนึ่งในการ "รวมพลังเภสัชกรร่วมสร้างโลกแห่งสุขภาวะ" เตรียมพบกับกิจกรรมมากมายตลอดทั้งสัปดาห์ เปิดบูธกิจกรรมบริการด้านสุขภาพ ตอบคำถามด้านยาและสุขภาพ พร้อมกิจกรรมร่วมสนุกรับของที่ระลึก โดย ทีมอาจารย์เภสัชกร เภสัชกรร้านยาและนิสิตคณะเภสัชศาสตร์ พบกันได้ที่ ร้านยาคณะเภสัชศาสตร์ มหาวิทยาลัยนเรศวร ทั้ง 2 สาขา และตลาดไนท์พลาซ่า ม.นเรศวร
27 และ 29 กันยายน 65 เปิดบูทกิจกรรม ณ ตลาดไนท์พลาซ่า ม.นเรศวร บริเวณทางเข้าตลาด
25-30 กันยายน 65 ร้านยาคณะเภสัชศาสตร์ ม.นเรศวร จัดกิจกรรมภายในร้านยา ทั้ง 2 สาขา
สาขา 1 ติดโรงเรียนสาธิต ม.นเรศวร
สาขา 2 ทางเข้าประตู 4 ม.นเรศวร
สอบถามโทร.063-7151832
สาระน่ารู้
- ติดตาม บทบาทของเภสัชกร ในช่วงวิกฤตโควิด - 19
- ตรวจ ATK ต้องมั่นใจว่าถูกวิธี
- หากสงสัย/ติดโควิด มีแนวปฏิบัติและดูแลตนเองอย่างไร
บริการสุขภาพ
- ตอบคำถามด้านยาและสุขภาพ
- คัดกรองโรคเรื้อรัง
- คำปรึกษาเลิกบุหรี่
- วัดความดันโลหิต ประเมินสมรรถภาพปอด
- ติดตามอาการไม่พึงประสงค์จากการใช้ยา
ศาสตราจารย์ นายแพทย์นิธิ มหานนท์ เลขาธิการราชวิทยาลัยจุฬาภรณ์
ราชวิทยาลัยจุฬาภรณ์ มีความภาคภูมิใจและยินดีเป็นอย่างยิ่งในการสนับสนุน “โครงการพัฒนาระบบผลิตอาหารอัตโนมัติและครบวงจรสำหรับนักบินอวกาศ” ให้กับ ทีม KEETA (กีฏะ) ซึ่งมี อาจารย์จากวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ และนักวิจัยจากสหสถาบันร่วมกันพัฒนาโครงการนี้จนผ่านเข้าไปสู่เฟสที่ 2 ได้สำเร็จ โดยเป็น 1 ใน 9 ทีมที่ได้รับการคัดเลือก ทั้งนี้ ราชวิทยาลัยจุฬาภรณ์ได้เตรียมพื้นที่ห้องปฏิบัติการสำหรับทำงานวิจัยนี้ร่วมกัน ณ อาคารวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ โดยคาดหวังว่าที่นี่จะเป็นศูนย์กลางเพื่อพัฒนาองค์ความรู้ร่วมกันต่อไป
ในวันหัวใจโลกและในโอกาสครบรอบ 50 ปีของบริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ทางโรงพยาบาลกรุงเทพ สำนักงานใหญ่ ยกระดับการทำงานเป็นโรงพยาบาลอัจฉริยะรู้ใจทุกเรื่องสุขภาพเต็มรูปแบบ Your Healthcare Intelligence เราไปไกลกว่าการรักษา ด้วยการนำนวัตกรรมและเทคโนโลยีการรักษาที่มีประสิทธิภาพสูงสุด เข้ามาพัฒนาบริการทางการแพทย์ในทุกมิติ เพื่อตอบโจทย์การดูแลรักษาแบบไร้ขีดจำกัด เพื่อดูแลผู้ป่วยทุกคน ทุกเรื่องสุขภาพ ทุกการเชื่อมต่อถึงกันตลอด 24 ชั่วโมง ด้วยเทคโนโลยีดิจิทัลที่เข้าถึงทุกความต้องการด้านสุขภาพของคุณอย่างแท้จริง
กรุงเทพเหนือ
- เขตจตุจักร 090-8990418 , 090-8990419
- เขตตอนเมือง 084-8997374 , 081-7518422 , 095-5972892
- เขตบางเขน 093-0063840 , 02-5210666
- เขตบางชื่อ 090-8990480 , 02-5869977 ต่อ 6045
- เขตลาดพร้าว 02-5387119 , 082-4447988
- เขตสายไหม 02-0263500 ต่อ 6844
- เขตหลักสี่ 02-0266800
ข่าวปลอม! พบหินศิลาวิเศษมีสรรพคุณรักษามะเร็งราคาชิ้นละ 60,000 บาท LINK
จากกรณีที่มีการนําเสนอข่าวเกี่ยวกับการใช้หินพันทาบตามร่างกายเป็นเวลาหลายชั่วโมงเพื่อรักษาโรคมะเร็งและโรคเกี่ยวกับเส้นประสาทที่เรียกว่า “ศิลาบําบัด”ซึ่งอ้างว่าหินดังกล่าวมีคุณสมบัติในการดูดพิษออกจากร่างกายสามารถกําจัดเนื้อมะเร็งร้ายภายใน 10 วันและเรียกเก็บค่าบริการหลักแสนบาทซึ่งผู้ให้บริการนั้นอ้างว่าจบแพทย์แผนไทยสําหรับวิธีการใช้หินดูดพิษรักษาโรคหรือ “ศิลาบําบัด” ไม่ใช่องค์ความรู้ด้านการแพทย์แผนไทยการแพทย์พื้นบ้านและการแพทย์ทางเลือกการใช้วิธีการดังกล่าวรักษาผู้ป่วยโดยเฉพาะผู้ป่วยโรคมะเร็งอาจทําให้ผู้ป่วยขาดโอกาสในการได้รับการรักษาที่ถูกต้องตามมาตรฐานทางการแพทย์ซึ่งจะทําให้โรคที่เป็นอยู่รุกรามและทวีความรุนแรงเพิ่มมากยิ่งขึ้นได้ผู้ป่วยโรคมะเร็งหรือผู้ป่วยโรคอื่นๆที่มีความรุนแรงควรได้รับการรักษาตามมาตรฐานทางการแพทย์โดยแพทย์แผนปัจจุบันก่อนเพราะจะเป็นประโยชน์ต่อตัวผู้ป่วยมากที่สุดหากสนใจการแพทย์แผนไทยการแพทย์ทางเลือกหรือสมุนไพรเป็นการเสริมการรักษาต้องพิจารณาให้ถี่ถ้วนควรปรึกษา หมอแผนปัจจุบันและคลินิกแพทย์แผนไทยของรัฐทั่วประเทศเพื่อให้ผู้ป่วยมีทางเลือกในการรักษาควบคู่กันไปแต่ทั้งนี้การรักษาต้องคํานึงถึงสภาวะทางกายและจิตใจของผู้ป่วยร่วมด้วย
ข้อสรุป : ข่าว ปลอมศิลาบําบัดไม่ใช่องค์ความรู้ด้านการแพทย์แผนไทยการแพทย์พื้นบ้านและการแพทย์ทางเลือกและไม่มีข้อมูลวิชาการยืนยันว่ารักษามะเร็ง ได้ผู้ป่วยมะเร็งที่หลงเชื่ออาจทําให้ขาดโอกาสในการรักษาที่ถูกวิธีและทําให้โรคที่เป็นอยู่รุนแรงมากยิ่งขึ้นได้
ผลกระทบ/ข้อเสนอแนะ (ถ้ามี):ผลกระทบ ต่อสุขภาพผู้ป่วยโรคมะเร็งหรือผู้ป่วยโรคอื่นๆที่มีความรุนแรงควรได้รับการรักษาตามมาตรฐานทางการแพทย์โดยแพทย์แผนปัจจุบันก่อนหาก หลงเชื่ออาจทําให้ขาดโอกาสในการรักษาที่ถูกวิธีและทําให้โรคที่เป็นอยู่รุนแรงมากยิ่งขึ้นได้
ตำราพระโอสถพระนารายณ์ - กรมศิลปากร พิมพ์ครั้งที่ 7 LINK
ตำราพระโอสถพระนารายณ์ - กรมศิลปากร
พิมพ์ครั้งที่ 7 พิมพ์เป็นอนุสรณ์ ในงานฌาปณกิจศพ นายจอน ศุภลักษณ์ ณ เมรุวัดแก้วฟ้าล่าง วันที่ ๘ กุมภาพันธ์ ๒๕๐๘
พิมพ์ที่โรงพิมพ์ ชวนพิมพ์ 112 ถนนบริพัตร พระนคร โทร. 27246 นายชวน ศรสงคราม ผู้พิมพ์โฆษณา 2508
หนังสือเรื่องนี้ สมเด็จฯ กรมพระยาดำรงราชานุภาพได้ทรงพระนิพนธ์อธิบายไว้ เมื่อคราวพิมพ์ครั้งแรก พ.ศ. 2560 ว่า หนังสือที่เรียกว่า ตำราพระโอสถพระนารายณ์นี้ คือตำราพระโอสถตั้งแต่สมเด็จพระนารายณ์มหาราชกรุงเก่าหอพระสมุดฯ ได้ต้นฉบับของพระเจ้าบรมวงศ์เธอ กรมหลวงวงศาธิราชสนิท ซึ่งพระเจ้าน้องยาเธอ กรมหมื่นชัยนาทนเรนทรประทานมา เป็นหนังสือคัมภีร์ลานผูก 1 มีตำรา พระโอสถซึ่งหมอหลวงได้ประกอบถวายสมเด็จพระนารายณ์มหาราชหลายขนาน ปรากฏชื่อหมอ แลวันคืนที่ตั้งพระโอสถนั้นๆ จดไว้ชัดเจน อยู่ในระหว่างปีกุน จุลศักราช 1021 พ.ศ.2202 จนปีฉลู จุลศักราช 1023 พ.ศ. 2204 ระหว่างปีที่ 3 จนปีที่ 5 ในรัชกาลสมเด็จพระนารายณ์มหาราช ประหลาดที่มีตำราขี้ผึ้งรักษาบาดแผลของหมอฝรั่งประกอบถวายในครั้งนั้นด้วย ขี้ผึ้งตามตำรานี้ หมอฝรั่งพวกกุฎีจีนยังใช้รักษากันมาจนตราบเท่าทุกวันนี้ ตำราพระโอสถทั้งปวงนี้ พึ่งรวบรวมเข้าคัมภีร์ในชั้นหลัง จะเป็นในราวรัชกาลสมเด็จพระเจ้าอยู่หัวท้ายสระ หรือสมเด็จพระเจ้าอยู่หัวบรมโกศ...
"ยาในตำราพระโอสถนี้ คงจะเป็นยาดีโดยมาก ได้ยินว่า ตั้งแต่พิมพ์แล้ว มีผู้ได้ประกอบยาตำราพระโอสถใช้รักษาไข้ก็เห็นคุณ ถึงกระนั้นกรรมการหอพระสมุดฯ ต้องขอตักเตือนท่านทั้งหลายที่ได้ตำรานี้ไป ถ้าหากมิได้เป็นแพทย์ด้วยตนเอง และจะใคร่ประกอบยาตามตำราพระโอสถนี้ไซร์ ควรจะปรึกษาหารือแพทย์ผู้ชำนาญวิชาเสียก่อน จึงจะเป็นผู้ที่ไม่ตั้งอยู่ในความประมาท"
กรมศิลปากร
29 มกราคม 2508
ยกตัวอย่างคนไข้ Long COVID รายหนึ่งของโรงพยาบาลวิมุต เมื่อหายจากโควิดยังมีความรู้สึกว่าเหนื่อยง่าย จากเดิมที่เคยเดินขึ้นบันไดหรือสะพานลอยได้สบายๆ ภายหลังติดเชื้อและหายจากการติดเชื้อ ก็พบว่าตัวเองต้องหยุดพักและหอบเหนื่อยมากขึ้นหลังจากเดินขึ้นบันไดในระยะทางเท่าเดิม เมื่อทำการตรวจอย่างละเอียดจึงพบว่ามีภาวะ Oxygen Drop หลังจากออกแรงไปได้ 2-3 นาที ทีมแพทย์จึงวางแนวทางการฟื้นฟูโดยเริ่มที่การสอนวิธีการหายใจที่ถูกต้อง เพื่อให้ปอดขยายได้มากที่สุด ต่อด้วยโปรแกรมการเพิ่มความฟิตของร่างกาย เพื่อให้ระบบทางเดินหายใจ ระบบหัวใจและหลอดเลือด ตลอดจนสมรรถภาพทางกายโดยรวมฟื้นตัวและมีสุขภาพดีอย่างยั่งยืน
ศูนย์อุบัติเหตุและฉุกเฉิน
ศูนย์อุบัติเหตุและฉุกเฉิน ตั้งอยู่บริเวณชั้น 1 ของโรงพยาบาลกรุงเทพภูเก็ต ผ่านการรับรองระดับศูนย์บริบาลผู้บาดเจ็บประเทศไทยในระดับใกล้เคียงศูนย์แม่ข่ายที่ให้การบริบาลตติยภูมิครบวงจร (Comprehensive advance tertiary care) จากราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย ในระดับ 2 (Levels of Trauma Center)
มีมาตรฐานการเคลื่อนย้ายผู้ป่วยทางบกระดับโลก แห่งแรกในภาคใต้ โรงพยาบาลกรุงเทพภูเก็ต หนึ่งในโรงพยาบาลเครือบริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ที่ผ่านการรับรองมาตรฐานการเคลื่อนย้ายผู้ป่วยทางบกระดับสากลประเทศสหรัฐอเมริกาและสหภาพยุโรป (Commission on Accreditation of Medical Transport Systems :CAMTS and CAMTS EU “Dual Accreditation ภายใต้บริการ BDMS EMERGENCY SERVICES
เวลาทำการ
ศูนย์อุบัติเหตุและฉุกเฉิน
เปิดบริการทุกวัน ตลอด 24 ชั่วโมง
ติดต่อสอบถาม
โทร: 076 254 425 ต่อ 1060 – 62,
076 361 000 ต่อ 1060 – 62,
076 655 000 ต่อ 1060 – 62
คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการด้านวิจัยการตลาดและกลยุทธ์ สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด ฮาเซียน (ประเทศไทย) กล่าวเสริมว่าอย่างไรก็ตาม การท่องเที่ยวในบ้านเรายังคงคึกคัก มีนักท่องเที่ยวเพิ่มขึ้นอย่างต่อเนื่อง หลังเปิดประเทศ จังหวัดต่างๆ จากที่เคยซบเซาเพราะพิษโควิด ตอนนี้กลับมาเริ่มคึกครื้นมีนักท่องเที่ยวเข้ามาจับจ่ายใช้สอย คนในประเทศมีรายได้จากการท่องเที่ยวเพิ่มมากขึ้น และคนในประเทศเองได้กลับมาใช้ชีวิตกันอย่างปกติสุข จับจ่ายใช้สอยเพื่อตนเองและครอบครัว รวมถึงใส่ใจในเรื่องอนาคตของ ตนเองและครอบครัวมากยิ่งขึ้น โดยเฉพาะเรื่องความมั่นคงในครอบครัว คนในสังคมหันมามุ่งมั่นตั้งใจในการพัฒนาตนเองโดยถือคติที่ว่า “ความรู้คือจุดเริ่มต้นของความก้าวหน้า” หวังเพิ่มความรู้ความสามารถสร้างคุณภาพชีวิตที่ดี และความมั่งคั่งในอนาคตระยะยาว
กัญชาเพื่อประโยชน์ทางการแพทย์ โดยกระทรวงสาธารณสุข
กระทรวงสาธารณสุขเริ่มต้นกัญชาเพื่อประโยชน์ทางการแพทย์ จากการเปิดคลินิกให้คำปรึกษาด้านการแพทย์ เพื่อเก็บรวบรวมข้อมูลไปจนถึงต่อยอดการให้การรักษาด้วยสารสกัดกัญชาทางการแพทย์ สำหรับผู้ป่วยที่มีความจำเป็นต้องใช้ไปพร้อมกับการสร้างความเข้าใจ ของการใช้กัญชาทางการแพทย์ที่ถูกต้องแก่สังคม
สิ่งที่ได้รับจากงาน Health & Wellness Summit 2022 ซึ่งจัดขึ้นเมื่อวันที่ 10 ตุลาคม พ.ศ. 2565 ณ อนันตรา ริเวอร์ไซด์ กรุงเทพ รีสอร์ท ซึ่งได้รับเกียรติจาก พญ. ปรมาภรณ์ ปราสาททองโอสถ ประธานกรรมการบริหาร และกรรมการผู้อำนวยการใหญ่ บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) หรือ Bangkok Dusit Medical Services (BDMS) เป็นประธานกล่าวเปิดงาน นอกจากนี้ยังได้รับความรู้และได้อัพเดทเทรนด์สุขภาพจากแพทย์ระดับโลก อาทิ
ศาสตราจารย์ นายแพทย์ คีธ แบล็ค แพทย์ผู้เชี่ยวชาญด้านสมองและระบบประสาทตำแหน่งหัวหน้าแผนกศัลยกรรมประสาทและผู้อำนวยการสถาบันศัลยกรรมประสาท Maxine Dunitz ของศูนย์การแพทย์ Cedars-Sinaiประเทศสหรัฐอเมริกาในหัวข้อ The Keys to Long Lasting Brain Health
ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค ที่ปรึกษาฝ่ายบริหารคลินิกสร้างเสริมและฟื้นฟูระบบกล้ามเนื้อและกระดูกBDMS Wellness Clinic ประสบการณ์กว่า 40 ปีในการทำงานด้านเวชศาสตร์การกีฬา และดำรงตำแหน่งอดีตประธานฝ่ายแพทย์ของสหพันธ์ฟุตบอลนานาชาติ (ฟีฟ่า) กว่า 23 ปี บรรยายเรื่อง Exercise Pills and Balanced Nutrition ในกลุ่ม Silver Age (ช่วงอายุ 50 ปีขึ้นไป)
นายแพทย์ ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก มอบความรู้ในเรื่อง การเผยเคล็ดลับสุขภาพที่ดี และสร้างความตระหนักให้คนหันมาให้ความสนใจในการดูแลสุขภาพ จากการกินอยู่และนอนหลับที่ถูกต้อง
“ศิริราชปูพื้นฐานและพัฒนาการให้บริการเพื่ออำนวยความสะดวกแก่คนไข้ เริ่มจากแอปพลิเคชัน Siriraj Connect แพลตฟอร์มที่เชื่อมโยงข้อมูลการให้บริการสุขภาพในรูปแบบออนไลน์ สามารถแจ้งเตือนวันนัดหมายล่วงหน้า ลงทะเบียนเพื่อยืนยันเวลานัดก่อนเข้าพบแพทย์ แจ้งเตือนคิวตรวจแบบเรียลไทม์ เช็คคิวเจาะเลือดและรับยา และชำระเงินได้จากแอปพลิเคชันเดียว รวมถึงการให้คำปรึกษาทางไกล (Telemedicine) กับคนไข้ที่ไม่สะดวกมาที่โรงพยาบาลด้วย จากนั้นจึงร่วมกับพันธมิตรทั้งภาครัฐและเอกชน ในการนำเทคโนโลยี 5G Cloud และระบบปัญญาประดิษฐ์ (AI) มาประยุกต์ใช้ในการป้องกัน รักษา และฟื้นฟูสุขภาพ เพื่อเพิ่มคุณภาพการรักษาพยาบาล สร้างประสบการณ์ที่ดีในการมารับบริการ”
คณบดีคณะแพทยศาสตร์ศิริราชพยาบาล กล่าวเพิ่มเติมว่า สำหรับการเป็น Smart Hospital นอกจากเทคโนโลยีที่ทันสมัย สิ่งสำคัญคือบุคลากรต้องมีความเข้าใจในนวัตกรรม มีทักษะการใช้เครื่องไม้เครื่องมือ ซึ่งต้องเตรียมความพร้อมตั้งแต่เป็นนักศึกษาแพทย์ ซึ่งศิริราชมีความพร้อมทั้งระบบการศึกษา อาจารย์ที่เชี่ยวชาญ รวมถึงปัจจัยอื่น ๆ ที่จะสนับสนุนให้เกิดขึ้น โดยจัดพื้นที่ที่เรียกว่า “Smart Digital Hub” ให้นักเรียนนักศึกษา ประชาชน รวมถึงบุคลการของศิริราช ได้เข้ามาแลกเปลี่ยนองค์ความรู้เพื่อร่วมกันสร้างนวัตกรรม
“Siriraj Smart Hospital ในระยะแรกเรามีต้นแบบประมาณ 9 เรื่องพื้นฐาน และกำลังจะขยับไปในระยะที่ 2 เรามี Siriraj Data Plus เป็นศูนย์รวบรวมข้อมูลที่เกี่ยวข้องกับการบริหารระบบโรงพยาบาลทั้งหมด สามารถนำข้อมูลเหล่านี้ประกอบกับความสามารถของ AI เข้ามาดีไซน์จุดที่ต้องการพัฒนา ไม่ว่าจะเป็น ทรัพยากรบุคคล การเงิน การคลัง พัสดุทรัพย์สินโรงพยาบาล เป็นการบริหารจัดการที่นำข้อมูลดิบมาจัดการให้เกิดประสิทธิภาพ ลดค่าใช้จ่าย ลดเวลา ลดขั้นตอน เพิ่มความพึงพอใจให้กับผู้รับบริการ ซึ่งผมเชื่อมั่นจะเป็นต้นแบบให้กับโรงพยาบาลทั่วประเทศได้ในอนาคต”
ศ.นพ.อภิชาติ ทิ้งท้ายว่า “สิ่งที่ผมอยากทำคือการเสริมศักยภาพ สร้างนวัตกรรมในการดูแลรักษาพยาบาล และสมานความเป็นต้นแบบในระดับนานาชาติเพื่อให้คนไทยของเรามีความสุขและให้ชาวศิริราชทุกคนมีความสุขที่ได้ทำงานที่นี่เช่นเดียวกัน นี่คือสิ่งที่ผมตั้งใจจะทำให้ได้ในระยะเวลา 4 ปีข้างหน้า”
About the Speakers
Prof. Keith L Black, M.D.
BDMS Wellness Clinic Executive Advisor l Brain Wellness Clinic
Dr. Keith L. Black is a renowned neurosurgeon and scientist in Los Angeles. He received his medical degree from University of Michigan Medical School and has been in practice for more than 20 years.
Keith L. Black is the chairman of the Department of Neurosurgery and the director of the Maxine Dunitz Neurosurgical Institute at Cedars-Sinai Medical Center. Dr. Black also holds the Ruth and Lawrence Harvey Chair in Neurosciences and is a professor of neurosurgery at Cedars-Sinai Medical Center. At age seventeen, he published his first scientific paper, which earned the Westinghouse Science Award. He earned both his undergraduate and medical degrees in six years. He completed his internship in general surgery and residency in neurological surgery at the University of Michigan Medical Center in Ann Arbor.
Dr. Black has pioneered research on designing ways to open the blood-brain barrier, enabling chemotherapeutic drugs to be delivered directly into the tumor. His other ground-breaking research includes developing a vaccine to enhance the body’s immune response to brain tumors, using gene arrays to develop molecular profiles of tumors, employing optical technology for brain mapping. He has also made use of precisely targeted microwave radiation to kill cancer cells, a computer-driven technology that may someday be performed remotely, without requiring the physical presence of the surgeon in the operating room. His work had drawn national attention. He was profiled on the public television series The New Explorers, the magazine Esquire included him on its list of “The 21 Most Important People of the 21st Century,” and TIME magazine featured him on the cover of a 1997 special edition, “Heroes of Medicine.” His autobiography, Brain Surgeon, was published in 2009.
หลายฝ่ายสนับสนุนวิจัยร่วม “ปัญหาการได้ยิน” รองรับสังคมผู้สูงอายุ
Ms.Helga Stellmacher, Country Director ของ British Council บริติช เคานซิล ประเทศไทย กล่าวถึงความร่วมมือว่า “บริติช เคานซิล ได้สนับสนุนให้เกิดความร่วมมือระหว่างประเทศไทยและสหราชอาณาจักรในหลาย ๆ ด้าน แต่สิ่งที่เราให้ความสำคัญมากเป็นอันดับต้น ๆ คือความร่วมมือระหว่างสถาบันอุดมศึกษา ซึ่งที่ผ่านมา British Council และ British Embassy ได้มีส่วนร่วมในการให้การสนับสนุนในการพัฒนาการดูแลคนไข้ การมีส่วนร่วมของชุมชน การพัฒนาการวิจัย และความร่วมมือหลักสูตรในการพัฒนาแพทย์เฉพาะทางรุ่นใหม่ ผ่านทุน Research Environment Link และ โครงการ Thai-UK world class university consortium ซึ่งเรายินดีเป็นอย่างมากที่เห็นความร่วมมือนี้ ก่อให้เกิดงานวิจัยที่ยอดเยี่ยม พร้อมกับการสนับสนุนระบบสาธารณสุขของไทย โดยการต่อยอดงานวิจัยให้เป็นการบริการที่เป็นรูปธรรม พร้อมที่จะสนับสนุนการเติบโตทางเศรษฐกิจและสังคมของประเทศไทยต่อไป”
To mark this special occasion, Health and Wellness Summit was held on October 10, 2022 following the opening remarks delivered by Dr. Poramaporn Prasarttong-osoth, President of Bangkok Dusit Medical Services (BDMS), joining the summit as speakers were Dr. Tanupol Virunhagarun, M.D., William E. Heinecke, Prof. Keith L Black, M.D. and Prof. Jirí Dvorák, M.D. The event took place at Chao Phraya Ballroom, Anantara Riverside Bangkok Resort.
จาก HPV สู่มะเร็งปากมดลูก ความเสี่ยงรอบตัวที่ไม่ควรมองข้าม - นพ.วิทยา ถิฐาพันธ์
เริ่มที่ นพ. วิทยา ที่ได้กล่าวถึงข้อมูลเบื้องต้นของโรคชนิดนี้ว่า “HPV หรือ Human Papillomavirus คือเชื้อไวรัสชนิดหนึ่งที่มีลักษณะที่ชอบเกาะอยู่ตามพื้นผิวชื้นแฉะตามร่างกายคน พบได้มากตามช่องคลอดเพศหญิง ทำให้เกิดโรคติดต่อทางเพศสัมพันธ์ได้หลายชนิด ไม่ว่าจะเป็นมะเร็งปากมดลูก มะเร็งช่องคลอด มะเร็งปากช่องคลอด มะเร็งทวารหนัก หูดหงอนไก่ ฯลฯ ความน่ากลัวของ HPV คือถึงแม้ร่างกายคนส่วนใหญ่จะสามารถขจัดไวรัสไปได้ด้วยตนเอง แต่ก็อาจยังมีส่วนน้อยที่จะฟักตัวอยู่ในร่างกายต่อไปอีก 10-20 ปี โดยไม่แสดงอาการ นอกจากจะทำให้เซลล์ตรงส่วนที่ไวรัสฟักตัวอยู่กลายเป็นเซลล์มะเร็งแล้ว ระหว่างนั้นผู้ติดเชื้อก็อาจกลายเป็นพาหะที่ส่งต่อไวรัสสู่คู่นอนคนอื่นได้ด้วย ยิ่งไปกว่านั้นคือเชื้อ HPV สามารถเกาะอยู่ตามพื้นผิวสัมผัสต่าง ๆ ได้ในระยะเวลาหนึ่ง ฉะนั้นการใช้สิ่งของร่วมกับผู้อื่น ก็มีโอกาสรับเชื้อ HPV เข้าสู่ร่างกายได้เช่นกัน
1. ที่มา
1.1 การเปลี่ยนแปลงและพัฒนาการด้านเทคโนโลยีดิจิทัลในโลกปัจจุบันที่เกิดขึ้นอย่างรวดเร็วและต่อเนื่อง ส่งผลกระทบต่อสภาพเศรษฐกิจ สังคม ตลอดจนรูปแบบการดำรงชีวิตของประชาชน รวมถึงวิธีการทำงานและการให้บริการของหน่วยงานของรัฐอย่างชัดเจนและไม่อาจหลีกเลี่ยงได้ประกอบกับสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ซึ่งเริ่มต้นในประเทศไทยตั้งแต่ช่วงต้นปี พ.ศ. 2563 ที่ผ่านมา ยังเป็นปัจจัยกระตุ้นให้ภาครัฐเกิดการปรับตัวทั้งในระดับบุคคลและหน่วยงาน โดยได้มีการปรับเปลี่ยนรูปแบบและวิธีการทำงานและการให้บริการประชาชนของหน่วยงานเพื่อให้สอดคล้องกับสถานการณ์และบริบทที่เปลี่ยนแปลงไป ส่งผลให้เกิดการดำรงชีวิตและการทำงานภายใต้รูปแบบและวิถีใหม่ ซึ่งเรียกได้ว่าเป็นความปรกติใหม่ หรือฐานวิถีชีวิตใหม่ (New Normal) ทำให้เห็นได้อย่างชัดเจนว่าการเปลี่ยนแปลงในระยะเวลาที่ผ่านมานั้น เกิดขึ้นอย่างรวดเร็ว ไม่อาจควบคุมได้ และไม่มีความแน่นอนสูง ไม่อาจคาดการณ์ได้ว่าจะเกิดเหตุการณ์ในลักษณะเช่นเดียวกันนี้หรือเหตุการณ์ในรูปแบบใหม่ ๆ ที่คล้ายคลึงกันหรือรุนแรงกว่าหรือไม่ในอนาคต ซึ่งจะทำให้สภาพเศรษฐกิจ สังคม ตลอดจนรูปแบบการดำรงชีวิต พฤติกรรมการใช้ชีวิต และความต้องการของประชาชนเปลี่ยนแปลงไปเช่นเดียวกัน
1.2 แผนการปฏิรูปประเทศ (ฉบับปรับปรุง) ด้านการบริหารราชการแผ่นดิน ได้ตระหนักถึงความสำคัญของการเปลี่ยนแปลงดังกล่าว โดยในกิจกรรมปฏิรูปที่ 2 กำหนดให้ต้องมีการปรับปรุงโครงสร้างองค์กรและระบบงานภาครัฐให้มีความยืดหยุ่น คล่องตัว และเปลี่ยนแปลงได้ตามสถานการณ์ โดยพัฒนารูปแบบการปฏิบัติงานของหน่วยงานภาครัฐให้สอดคล้องกับบริบทที่เปลี่ยนแปลงไป รองรับฐานวิถีชีวิตใหม่ (New Normal) เพื่อให้ส่วนราชการและหน่วยงานของรัฐมีความยืดหยุ่น คล่องตัว สามารถปฏิบัติภารกิจเพื่อตอบสนองความต้องการของประชาชนได้อย่างทันท่วงที โดยมอบหมายให้สำนักงาน ก.พ. รับผิดชอบจัดทำรูปแบบการปฏิบัติราชการที่รองรับฐานวิถีชีวิตใหม่ (New Normal) เพื่อเป็นแนวทางการดำเนินการให้กับส่วนราชการและหน่วยงานของรัฐต่อไป
1.3 ในช่วงสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) หน่วยงานของรัฐได้มีการมอบหมายให้เจ้าหน้าที่ปฏิบัติงานที่บ้าน (Work from Home) มาอย่างต่อเนื่องดังนั้น เพื่อติดตามผลการดำเนินการดังกล่าว คณะกรรมการข้าราชการพลเรือน (ก.พ.) ในการประชุม เมื่อวันที่ 26 ตุลาคม 2564 จึงได้มอบหมายให้สำนักงาน ก.พ. จัดทำแบบสำรวจความคิดเห็นของประชาชนและข้าราชการพลเรือนสามัญต่อการปฏิบัติงานภาครัฐในสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ในรูปแบบออนไลน์ขึ้น ระหว่างวันที่ 24 มกราคม 2565 ถึงวันที่ 11 กุมภาพันธ์ 2565 เพื่อรวบรวมข้อมูลและความคิดเห็นของข้าราชการและประชาชนผู้รับบริการเกี่ยวกับประสิทธิภาพและคุณภาพการปฏิบัติงานภาครัฐ ในสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ตั้งแต่ช่วงต้นปี พ.ศ. 2563 จนถึงเดือนมกราคม พ.ศ. 2565 ซึ่งมีข้าราชการพลเรือนสามัญตอบแบบสำรวจฯ จำนวน 54,601 คน คิดเป็นร้อยละ 12.96 ของข้าราชการพลเรือนสามัญทั้งหมด จำนวน 421,304 คน (ข้อมูล ณ เดือนธันวาคม 2564) และมีประชาชนตอบแบบสำรวจฯ จำนวน 12,388 คน สรุปได้ว่าข้าราชการส่วนใหญ่มีความพึงพอใจต่อประสิทธิภาพและคุณภาพการปฏิบัติราชการ (ร้อยละ 81.62 และร้อยละ 80.73 ตามลำดับ) ซึ่งสอดคล้องกับความเห็นของประชาชนที่มีความพึงพอใจต่อประสิทธิภาพและคุณภาพการให้บริการของราชการเช่นกัน (ร้อยละ 88.91 และร้อยละ 88.67 ตามลำดับ) ซึ่งทำให้เห็นได้ว่าส่วนราชการได้มีการปรับตัว ทั้งในส่วนของรูปแบบการทำงานและการให้บริการประชาชนเพื่อไม่ให้กระทบต่อประสิทธิภาพและคุณภาพของบริการสาธารณะ
1.4 นอกจากนี้ สำนักงาน ก.พ. ได้จัดสัมภาษณ์ข้อมูลเชิงลึก เรื่อง “ถอดบทเรียนการบริหารงานบุคคลของส่วนราชการในช่วงสถานการณ์ COVID-19” โดยสัมภาษณ์ผู้แทนส่วนราชการ จำนวน 6 แห่ง ระหว่างวันที่ 30 มีนาคม 2565 ถึงวันที่ 1 เมษายน 2565 แบ่งตามลักษณะภารกิจของหน่วยงาน 3 ประเภท ได้แก่ ภารกิจการจัดทำนโยบายหรือสนับสนุนการดำเนินการภาครัฐ ได้แก่ สำนักงานคณะกรรมการกฤษฎีกา และสำนักงานคณะกรรมการพัฒนาระบบราชการ ภารกิจการให้บริการหรืออำนวยความสะดวกประชาชน ได้แก่ กรมสรรพากรกรมการขนส่งทางบก และภารกิจที่มีลักษณะเฉพาะ ได้แก่ กรมวิทยาศาสตร์บริการ และกรมราชทัณฑ์ สรุปได้ดังนี้
1.4.1 ส่วนราชการที่มีภารกิจการจัดทำนโยบายหรือสนับสนุนการดำเนินการภาครัฐ มีการลดขั้นตอนในการสั่งการภายในโดยเน้นการสื่อสารผ่านแอปพลิเคชันไลน์(LINE) และ Zoom Meeting และมีการจัดทำระบบปฏิบัติงานออนไลน์ในการจัดการงานการมอบหมายงาน และการติดตามงาน จึงสามารถมอบหมายให้เจ้าหน้าที่ส่วนใหญ่ปฏิบัติงานที่บ้านได้และให้ความสำคัญกับผลงานและการติดตามผลสำเร็จของงานมากกว่าการติดตามการปฏิบัติงานรายวัน นอกจากนี้ยังมีการจัดกิจกรรมผ่านระบบ Zoom Meeting เพื่อพัฒนาและเชื่อมความสัมพันธ์ของบุคลากรภายในอีกด้วย
1.4.2 ส่วนราชการที่มีภารกิจการให้บริการหรืออำนวยความสะดวกประชาชน มีการออกแนวทางการปฏิบัติราชการในสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) โดยแจ้งเวียนให้ทุกหน่วยงานพิจารณาการเหลื่อมเวลาการทำงานเวลาพักกลางวัน และการปฏิบัติงานที่บ้านตามความเหมาะสม มีการพัฒนาระบบงานบนเครือข่าย Intranet ให้สามารถเปิดใช้งานที่บ้านได้และกำหนดให้ผู้บังคับบัญชามอบหมายการปฏิบัติงานเป็นรายวันหรือรายสัปดาห์ โดยกำหนดเป้าหมาย ผลผลิต ตัวชี้วัดการทำงาน ระบบวิธีการสื่อสาร ติดตาม ความก้าวหน้า ตามความเหมาะสม
1.4.3 ส่วนราชการที่มีภารกิจที่มีลักษณะเฉพาะ มีการสนับสนุนให้บุคลากรปฏิบัติงานที่บ้าน (Work from Home) โดยปรับเวลาการปฏิบัติราชการเป็นแบบยืดหยุ่น(Flexible Time) กรณีบุคลากรมาปฏิบัติงานที่ส่วนราชการสามารถปฏิบัติราชการในระหว่างเวลา 07.30 – 17.30 น. ให้ครบ 8 ชั่วโมงในแต่ละวัน สำหรับงานลักษณะพิเศษ เช่น งานทดลองในห้องปฏิบัติการ (Laboratory) สามารถสลับเข้างานให้ครบ 8 ชั่วโมงหลังจากเวลาเลิกงานปรกติได้ อีกทั้งยังกำหนดให้มีการมอบหมายงานที่ชัดเจน ซึ่งสามารถนำมาประกอบการประเมินผลการปฏิบัติราชการ รวมทั้งกำหนดให้ผู้บังคับบัญชาต้องมีช่องทางที่สามารถติดตามงานได้ตลอดเวลาและมอบหมายให้ผู้บังคับบัญชาเป็นผู้กำกับติดตามงาน โดยเน้นการสื่อสารผ่านแอปพลิเคชันไลน์(LINE)
1.5 ข้อมูลของกรมบัญชีกลางโดยเปรียบเทียบค่าใช้จ่ายของส่วนราชการ ระหว่างปีงบประมาณ พ.ศ. 2562 ซึ่งอยู่ในช่วงสถานการณ์ปรกติ และปีงบประมาณ พ.ศ. 2564 ซึ่งอยู่ในช่วงสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) พบว่า ส่วนราชการสามารถประหยัดค่าใช้จ่ายรายการต่าง ๆ ที่เกิดจากการมอบหมายให้เจ้าหน้าที่ปฏิบัติงานที่บ้าน (Work from Home) ได้อย่างชัดเจน โดยเฉพาะอย่างยิ่งส่วนราชการที่มีการมอบหมายให้เจ้าหน้าที่ปฏิบัติงานที่บ้าน (Work from Home) ในสัดส่วนที่สูง ยกตัวอย่างเช่น สำนักงานคณะกรรรมการกฤษฎีกามีค่าใช้จ่ายรายการต่าง ๆ ลดลง ได้แก่ ค่าล่วงเวลา ลดลงร้อยละ 73.29 ค่าปิโตรเลียม ลดลงร้อยละ 40 ค่าไฟฟ้า ลดลงร้อยละ 40.06 ค่าประปา ลดลงร้อยละ 11.17 และค่าไปรษณีย์และขนส่ง ลดลงร้อยละ 66.96 สำนักงานคณะกรรมการพัฒนาระบบราชการ (ก.พ.ร.) มีค่าใช้จ่ายรายการต่าง ๆ ลดลง ได้แก่ ค่าล่วงเวลา ลดลงร้อยละ 93.16 ค่าปิโตรเลียม ลดลงร้อยละ 63.45 ค่าไฟฟ้า ลดลงร้อยละ 22.56 และค่าไปรษณีย์และขนส่ง ลดลงร้อยละ 83.67 และ สำนักงานคณะกรรมการข้าราชการพลเรือน (ก.พ.) มีค่าใช้จ่ายรายการต่าง ๆ ลดลง ได้แก่ ค่าล่วงเวลา ลดลงร้อยละ 67.19 ค่าปิโตรเลียม ลดลงร้อยละ 42.05 ค่าไฟฟ้า ลดลงร้อยละ 20.30 ค่าประปา ลดลงร้อยละ 18.10 และค่าไปรษณีย์และขนส่ง ลดลงร้อยละ 9.11
1.6 จากข้อมูลการดำเนินการของหน่วยงานของรัฐในช่วงสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ข้างต้น ทำให้เห็นได้ว่า ภาครัฐได้มีการปรับตัวทั้งในส่วนของหน่วยงานที่ได้เร่งนำเทคโนโลยีมาใช้ในการบริการประชาชน และการสร้างระบบงานอิเล็กทรอนิกส์ภายในหน่วยงาน ในขณะที่เจ้าหน้าที่ผู้ปฏิบัติงานก็ได้มีการปรับตัวให้สามารถทำงานได้ในทุกสภาวการณ์แม้ว่าบางลักษณะอาจจะไม่สามารถปฏิบัติงานที่บ้าน (Work from Home) ได้ก็ตาม ดังนั้น จึงเป็นโอกาสที่เหมาะสมในการสานต่อนโยบายการปรับปรุงรูปแบบและวิธีการปฏิบัติงานของภาครัฐให้เกิดผลอย่างแท้จริง เพื่อให้เกิดความต่อเนื่องในการให้บริการสาธารณะและสร้างประสิทธิภาพในการทำงานของเจ้าหน้าที่รัฐ อาทิ การให้บริการประชาชนผ่านระบบออนไลน์ การขยายเวลาการให้บริการเพื่อให้ประชาชนสะดวกมากยิ่งขึ้นและลดระยะเวลาในการเดินทางมาติดต่อราชการ การติดต่อสื่อสารภายในหน่วยงานผ่านระบบออนไลน์ การรับส่งเอกสารทางสารบรรณอิเล็กทรอนิกส์ การประชุมผ่านสื่ออิเล็กทรอนิกส์และการปฏิบัติงานที่มุ่งเน้นผลลัพธ์และความสำเร็จของงานมากกว่าเวลาเข้างาน - เลิกงาน โดยมีการปรับปรุงรูปแบบและวิธีการปฏิบัติราชการตลอดจนการบริหารทรัพยากรบุคคลที่สอดคล้องกันไปด้วย เพื่อให้ “คน” เป็นกำลังสำคัญในการขับเคลื่อน “งาน” ของภาครัฐได้อย่างมีประสิทธิภาพและช่วยขับเคลื่อนประเทศต่อไป
1.7 ด้วยเหตุผลข้างต้น สำนักงาน ก.พ. จึงได้จัดทำ “แนวทางการปฏิบัติราชการที่รองรับชีวิตและการทำงานวิถีใหม่” ขึ้น โดยแนวทางดังกล่าว เป็นแนวทางที่ทำให้ระบบราชการ มีแนวทางการปฏิบัติราชการที่ผสมผสาน (Hybrid) ทั้งการปฏิบัติงานที่ส่วนราชการและการปฏิบัติงานที่บ้านหรือนอกสถานที่ตั้ง เพื่อให้ส่วนราชการและหน่วยงานของรัฐมีแนวทางการปฏิบัติราชการรูปแบบใหม่ที่ยืดหยุ่น สามารถตอบสนองต่อการเปลี่ยนแปลงในมิติต่างๆ ทั้งในเชิงเศรษฐกิจ สังคม และเทคโนโลยีได้อย่างทันการณ์ และให้เหมาะสมกับสถานการณ์ในอนาคตที่ยากต่อการคาดการณ์โดยมีเป้าหมายสำคัญ คือ จะต้องไม่กระทบต่อการปฏิบัติงานของภาครัฐและการให้บริการประชาชน ตลอดจนส่งเสริมให้ผู้ปฏิบัติงานในภาครัฐมีความสามารถในการปรับตัวและปฏิบัติงานได้อย่างมีประสิทธิภาพภายใต้สถานการณ์ที่เปลี่ยนแปลงไป โดยแนวทางที่สำนักงาน ก.พ. ได้จัดทำขึ้นนี้ จะเป็นเครื่องมือช่วยให้ส่วนราชการและหน่วยงานของรัฐนำไปปรับใช้ได้กับทั้งสถานการณ์ในภาวะปรกติ และสถานการณ์ในภาวะไม่ปรกติ อาทิ การแพร่ระบาดของโรคภัยไข้เจ็บภัยพิบัติทางธรรมชาติ หรือเหตุการณ์ที่เจ้าหน้าที่ของรัฐไม่อาจปฏิบัติงานในหน่วยงานได้ตามปรกติ
ทั้งนี้ เจ้าหน้าที่ของรัฐพึงจะต้องปฏิบัติตนเป็นแบบอย่างที่ดีในการทำงานวิถีใหม่ โดยมีหน้าที่รักษาภาพลักษณ์ที่ดีของเจ้าหน้าที่ของรัฐที่มีความเสียสละและมีอุดมการณ์ ตลอดจนมุ่งสร้างความเชื่อมั่นที่ประชาชนมีต่อเจ้าหน้าที่ของรัฐไม่ว่าจะปฏิบัติงานในสถานที่ตั้งหรือนอกสถานที่ตั้งก็ตาม
ศูนย์จักษุพร้อมรองรับผู้ป่วยโรคตาที่มีความซับซ้อน - พญ. เมทินี ศิริมหาราช
พญ. เมทินี ศิริมหาราช หัวหน้าศูนย์จักษุ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “เนื่องจากตา เป็นอวัยวะที่สำคัญและประกอบด้วยเนื้อเยื่อต่างๆ หลายชนิด จึงจำเป็นต้องมีจักษุแพทย์ผู้ชำนาญการในแต่ละด้านเข้ามาดูแล โดยศูนย์จักษุประกอบด้วยคณะแพทย์ผู้เชี่ยวชาญในด้านต่างๆ ครอบคลุมทุกปัญหาที่เกี่ยวกับดวงตา ได้แก่ ต้อกระจก ต้อหิน ศัลยกรรมจักษุตกแต่งและเสริมสร้างจอประสาทตา ม่านตาอักเสบ โรคกระจกตา โรคตาในเด็กและตาเข จักษุประสาท การผ่าตัดรักษาภาวะสายตาผิดปกติด้วย ReLEx SMILE เป็นต้น
ทั้งนี้ ในกรณีที่ผู้ป่วยต้องได้รับการผ่าตัดและจำเป็นต้องได้รับการประเมินสภาพร่างกายและจิตใจ จักษุแพทย์จะทำงานร่วมกับแพทย์เฉพาะทางในสาขาอื่น ๆ ที่เกี่ยวข้อง เช่น อายุรแพทย์ วิสัญญีแพทย์ จิตแพทย์ พร้อมด้วยทีมสหสาขาวิชาชีพ เพื่อส่งมอบการรักษาที่มีคุณภาพและความปลอดภัยสูงสุด โดยศูนย์จักษุ ได้ปรับสถานที่เพื่อให้รองรับกับจำนวนผู้มารับบริการที่เพิ่มขึ้น มีห้องตรวจตาจำนวน 13 ห้อง พร้อมเครื่องมืออุปกรณ์ที่ทันสมัยสำหรับการตรวจวินิจฉัยและรักษาอย่างครบครัน เพื่อให้สามารถรองรับผู้ป่วยโรคตาที่มีความซับซ้อนมากขึ้นด้วย”
ในช่วง 2 ปีแรกตระกูลใหญ่ของโคโรนาไวรัสซึ่งมีรหัสพันธุกรรมแตกต่างกันอย่างมากได้เกิดขึ้นและถูกแทนที่ด้วยตระกูลใหญ่ถัดไปอย่างต่อเนื่อง ตั้งแต่ตระกูลไวรัสอู่ฮั่น ได้ถูกแทนที่ด้วยตระกูล อัลฟา, เบตา, แกมมา, เดลตา และ โอไมครอน ตามลำดับ
การระบาดย่างเข้าสู่ช่วงปีที่ 3 ในยุคของตระกูลโอไมครอนกลับมีวิวัฒนาการเกิดเป็นสายพันธุ์ย่อยมากกว่า 300 สายพันธุ์ (omicron subvariants) โดยแต่ละสายพันธุ์ย่อยของโอไมครอนมีการกลายพันธุ์ต่างไปจากไวรัสโคโรนา 2019 สายพันธุ์ดั้งเดิม “อู่ฮั่น” มากกว่า 100 ตำแหน่ง
ส่วนหนามของโอไมครอนแต่ละสายพันธุ์ย่อยมีทั้งที่ซ้ำกับสายพันธุ์โอไมครอนดั้งเดิมประหนึ่งเป็นการรีไซเคิล (recycle) นำตำแหน่งการกลายพันธุ์ดั้งเดิมที่ใช้ได้ผล (ในการหลบเลี่ยงภูมิ หรือจับกับเซลล์) กลับมาใช้ใหม่ผสมผสานกับการกลายพันธุ์ตำแหน่งใหม่ซึ่งจำเป็นใช้แข่งขันกันเองเพื่อการอยู่รอดในหมู่ของโอไมครอนสายพันธุ์ย่อย (variant soup)
WHO ได้เพิ่มหมวดใหม่ให้กับระบบติดตามโอไมครอนคือ “โอไมครอนสายพันธุ์ย่อยที่ควรเฝ้าติดตาม (Omicron subvariants under monitoring) เช่น BQ.1 และ XBB
ม.มหิดล มุ่งสร้างสรรค์องค์ความรู้ใหม่ๆ สู่การเป็น Smart Hospital - ศ.นพ.อภิชาติ อัศวมงคลกุล
ศ.นพ.อภิชาติ อัศวมงคลกุล คณบดีคณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล กล่าวว่า “ในฐานะที่คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล เป็นสถาบันทางการแพทย์ที่สร้างสรรค์สุขภาวะแก่มวลมนุษยชาติ สร้างสรรค์องค์ความรู้ใหม่ๆ ยกระดับคุณภาพชีวิตของผู้คนให้ดีขึ้นด้วยงานวิจัยและนวัตกรรม ไปสู่การเป็น Smart Hospital ในการดูแลรักษาพยาบาล ตลอดจนเป็นต้นแบบขององค์ความรู้ระดับประเทศและนานาชาติ เพื่อคุณภาพชีวิตของคนไทย
ซึ่งที่ผ่านมาเราได้รับรู้ถึงอุบัติการณ์ของการเกิดภาวะดื้อโบทูลินัมท็อกซินมาสักระยะหนึ่ง จึงมีเป้าหมายที่จะพัฒนาองค์ความรู้ในการรับมือกับภาวะดื้อยาที่เกิดจากการใช้ ‘โบทูลินัมท็อกซิน’ ในหัตถการความงามอย่างเป็นกิจจะลักษณะ เพื่อให้ประชาชนในวงกว้างได้เข้าถึงความรู้ และการตรวจวินิจฉัยภาวะที่อาจเกิดขึ้นจากการใช้ ได้อย่างปลอดภัยและมีประสิทธิภาพสูงสุด พร้อมกันนี้ แพทย์ที่ทำการรักษาก็จะมีความรู้ความเข้าใจถึงการทำหัตถการความงามอย่างถูกวิธีด้วยเช่นกัน เนื่องด้วยประเทศไทยในปัจจุบัน การทำหัตถการความงามอย่างการฉีดสาร ‘โบทูลินัมท็อกซิน’ ได้รับความนิยมอย่างแพร่หลาย ทำให้ประชาชนส่วนใหญ่ตัดสินใจเข้ารับบริการโดยที่อาจยังไม่มีความรู้ครอบคลุม และนำมาสู่ความเสี่ยงเกิดภาวะดื้อโบได้ ซึ่งถือเป็นความเสี่ยงทางด้านสาธารณสุขในกรณีที่ผู้ป่วยอาจมีความต้องการใช้โบทูลินัมท็อกซินเพื่อการรักษาโรคทางระบบประสาทหรือกล้ามเนื้อในอนาคต”ระดับง่าย 12 ขั้นตอน
เป็นท่าในการยืดกล้ามเนื้อ และฝึกความแข็งแรงของกล้ามเนื้อ
Bangkok Art Biennale เริ่มตั้งแต่ 22 ต.ค.65 - 23 ก.พ.66
Bangkok Art Biennale
เริ่มตั้งแต่ 22 ตุลาคม 65 - 23 กุมภาพันธ์ 66
จัดแสดง 12 แห่ง รอบกรุงเทพฯ
งานเทศกาลศิลปะร่วมสมัยนานาชาติกรุงเทพฯ หรือ Bangkok Art Biennale 2022 ครั้งนี้ จัดต่อเนื่องเป็นครั้งที่ 3 ภายใต้แนวคิด CHAOS : CALM ที่ภัณฑารักษ์ร่วมกันตั้งโจทย์ ดังนั้นงานศิลปะที่ศิลปินสร้างสรรค์ขึ้นเพื่อร่วมจัดแสดงในงานนี้จึงเป็นการเล่าเรื่องและสะท้อนความคิดเห็นในประเด็น “โกลาหล : สงบสุข”
โดยได้ผลงานศิลปะแบบจัดเต็มจาก 73 ศิลปินชั้นนำ จาก 35 สัญชาติทั่วโลกมาไว้ที่กรุงเทพ นับเป็นความภาคภูมิใจกับวงการศิลปะภูมิภาคเอเชียแปซิฟิก ด้วยผลงานศิลปะร่วมสมัยมากกว่า 200 ผลงาน บนสถานที่สำคัญของกรุงเทพมหานครทั้งหมด 12 แห่ง
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/bkkartbiennaleGhost 2565- อยู่ยังไงให้ไม่ตาย ที่ The Jim Thompson Art Center 12 ต.ค. - 13 พ.ย.65
Ghost 2565- อยู่ยังไงให้ไม่ตาย
เริ่มตั้งแต่ 12 ตุลาคม - 13 พฤศจิกายน 2565
จัดแสดงที่ The Jim Thompson Art Center
นิทรรศการว่าด้วยความผิดพลาดที่เกิดจากพื้นที่ เวลา และความเปลี่ยนแปลงของเมือง โดยได้แบ่งการจัดแสดงออกเป็น 2 ส่วน คือ ผลงานภาพเคลื่อนไหว และผลงานภาพยนตร์จัดวางใหม่ ผ่านหอศิลป์ต่างๆ ในกรุงเทพฯ กับอีกส่วนเป็นงานแสดงสดที่มีตั้งแต่การพาเยี่ยมชมย่านพร้อมงานศิลปิน ไปจนถึงมื้ออาหารค่ำ และการแสดงดนตรีสด ที่เป็นมากกว่ามื้ออาหารธรรมดา
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/ghostbangkok Bangkok River Festival 2022 เทศกาลสายน้ำแห่งวัฒนธรรมไทย ครั้งที่ 8 “รักษ์ ณ สายน้ำ”
วันที่ 5 - 8 พฤศจิกายน 2565 ณ 10 ท่าน้ำร่วมสมัย : วัดโพธิ์, วัดอรุณฯ, วัดระฆังฯ, วัดกัลยาฯ, วัดประยูรฯ, ศาลเจ้ากวนอู (คลองสาน), ท่ามหาราช, เดอะล้ง 1919, สุขสยาม ณ ไอคอนสยาม และเอเชียทีค เดอะ ริเวอร์ฟร้อนท์ - บริการเรือรับส่งฟรี!! (Free Shuttle Boat)
ชวนร่วมสืบสานประเพณีดีงามส่งท้ายปี ต่อยอดคุณค่าทางวัฒนธรรม กับประเพณีลอยกระทง และมงคลอันดีงามของไทย ไหว้พระ ทำบุญ ชมงานศิลป์ จากงาน BAB 2022 ลิ้มลองขนมไทย ที่ลานเสน่ห์ขนมไทย ที่ผสานสองวัฒนธรรมไทยและโปรตุเกส ช้อป ชิม สินค้าชุมชน พร้อมได้ความรู้เกร็ดชุมชนจากน้องๆ “เยาวชนเจ้าบ้าน สืบสานวัฒนธรรม” เพลิดเพลินกับวงดนตรีหลากหลายแนว จากศิลปินดังและวงดนตรีจากมหาวิทยาลัย
สังคมสูงวัยไทย
สังคมสูงวัย คือ สังคมที่มีสัดส่วนของผู้สูงอายุหรือประชากรที่มีอายุ 60 ปี ขึ้นไป ได้เพิ่มสูงขึ้นเรื่อยๆ ขณะที่สัดส่วนของอัตราการเกิด และจำนวนประชากรในวัยทำงานลดน้อยลง ในปี 2564 ประเทศไทยได้เข้าสู่สังคมผู้สูงอายุโดยสมบูรณ์ ตามหลักเกณฑ์ที่ว่า คือมี ผู้สูงอายุ หรือ “คนแก่” อายุ 60 ปีขึ้นไป มากกว่า 20% ของประชากรทั้งประเทศ และหากดูสถิติย้อนหลังจะพบว่าอัตราการเกิดของเด็กไทยลดลงอย่างต่อเนื่องและมีแนวโน้มลดลงเรื่อยๆ โดยในอีก 20 ปีข้างหน้าหรือเร็วกว่านั้น ประเทศไทยก็ต้องเผชิญปัญหาขาดประชาชนกลุ่มวัยทำงาน เพราะในสังคมจะมีแต่ผู้สูงอายุ ซึ่งน่าจะตามมาด้วยปัญหาสุขภาพและโรคเรื้อรังต่างๆ ด้วย
คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ได้เปิดหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ มุ่งสร้างบุคลากรด้านวิทยาศาสตร์การเคลื่อนไหวและสุขภาพที่เป็นทั้งนักวิชาการที่มีความรู้ ความสามารถ และนักปฏิบัติการที่มีทักษะปฏิบัติสามารถประยุกต์องค์ความรู้ด้านวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพที่มีคุณภาพ ใช้เวลาศึกษา 4 ปี ทั้งภาคทฤษฏีและปฏิบัติ ในภาคทฤษฏีประกอบด้วยวิชาหลักที่เกี่ยวข้องกับการเคลื่อนไหว เช่น กายวิภาคศาสตร์ ชีวกลศาสตร์ สรีรวิทยาการออกกำลังกาย จิตวิทยา โภชนาการ
มีนบุรี ตรวจเข้มท่าเรือโป๊ะ ลอยกระทง ย้ำความปลอดภัย จัดเจ้าหน้าที่ประจำทุกจุด
วันเสาร์ที่ 5 พฤศจิกายน 2565 เวลา 09.30 น.นายศักดิ์ชัย ใสสุข ผู้อำนวยการเขตมีนบุรี ลงพื้นที่ตรวจสอบโป๊ะ ท่าเรือทั่วพื้นที่เขตมีนบุรี พร้อมดูสถานที่จุดจัดงานลอยกระทง เพื่อเตรียมการวางแผนจัดกองอำนวยการร่วม รถพยาบาล จัดกำลังเจ้าหน้าที่ดูแลความปลอดภัย ควบคุมความหนาแน่น และจัดเส้นทางหนีภัย เพื่อป้องกันและแก้ไขอุบัติภัยกรณีฉุกเฉิน ให้กับประชาชนที่จะมาร่วมงานเทศกาลลอยกระทงในวันที่ 8 พฤศจิกายน 2565 นี้
ทั้งนี้ ผู้อำนวยการเขตมีนบุรี ได้สั่งการเจ้าหน้าที่ฝ่ายโยธาดำเนินการตรวจสอบทางขึ้น-ลงท่าเรือ และความมั่นคงแข็งแรงของท่าเรือต่างๆ พร้อมติดตั้งป้ายเตือนจำกัดจำนวนคน ได้แก่ ท่าน้ำวัดบำเพ็ญเหนือ-วัดบางเพ็งใต้, ท่าน้ำข้างสำนักงานอัยการเขตมีนบุรี, ท่าน้ำสวนเฉลิมพระเกียรติ ร.9, ท่าน้ำวัดใหม่ลำนกแขวก, ท่าน้ำวัดแสนสุข, ท่าเรือหลังตลาดมีนบุรี จุดลอยกระทงบริเวณสวนบึงกระเทียม และสวนพระยาภิรมย์ พบว่าท่าเรือและท่าน้ำมีความมั่นคงแข็งแรงดีโดยจะได้มอบหมายเจ้าหน้าที่เทศกิจแบ่งกำลังดูแลความปลอดภัยในช่วงวันลอยกระทงต่อไป
ติดตามมาตรการป้องกันฝุ่นละออง PM2.5 โครงการก่อสร้างขนาดใหญ่
ติดตามมาตรการป้องกันฝุ่นละออง PM2.5 โครงการก่อสร้างขนาดใหญ่
ศูนย์ดูแลผู้สูงอายุ SENERA SENIOR WELLNESS ตั้งอยู่ถนนคู้บอน เป็นโครงการก่อสร้างศูนย์ดูแลผู้สูงอายุแบบครบวงจรของภาคเอกชน ซึ่งเป็นโครงการก่อสร้างอาคารขนาดใหญ่อยู่ในแผนการตรวจตามมาตรการป้องกันฝุ่นละออง PM2.5 ของสำนักการโยธา เพื่อกำกับดูแลผู้ประกอบการให้ปฏิบัติตามวิธีและเงื่อนไขแนบท้ายใบอนุญาตในการก่อสร้างตามกฎกระทรวงฉบับที่ 4 (พ.ศ.2526) และแก้ไขเพิ่มเติมตามกฎกระทรวง ฉบับที่ 67 (พ.ศ.2563) และมาตรการป้องกันและแก้ไขปัญหาผลกระทบสิ่งแวดล้อม
โดยร่วมกับเขตฯ สุ่มตรวจควันดำรถบรรทุกเข้า – ออกที่ใช้ในโครงการก่อสร้าง นอกจากนี้เขตฯ ร่วมกับสำนักสิ่งแวดล้อมตรวจวัดควันดำรถบรรทุกใช้งานในแพลนท์ปูน การปฏิบัติงานประจำจุดตรวจวัดควันดำร่วมกับกองบังคับการตำรวจจราจรเป็นประจำทุกเดือนๆ ละ 8 ครั้ง การตรวจวัดควันดำรถยนต์ราชการโดยประสานกองโรงงานช่างกล ปีละ 2 ครั้ง
ส่วนการตรวจสอบคุณภาพอากาศเชิงรุกในโรงงาน ได้ตรวจสอบ แนะนำ ควบคุมสถานประกอบการที่ก่อให้เกิดฝุ่นละอองในพื้นที่ ไม่ให้ปล่อยมลพิษทางอากาศเกินค่ามาตรฐานที่กฎหมายกำหนด ระหว่างเดือนตุลาคม 2565 – เดือนมีนาคม 2566 อย่างน้อยแห่งละ 2 ครั้งต่อเดือน ในกิจการที่เป็นอันตรายต่อสุขภาพ ดังนี้ กิจการผสมซีเมนต์ (แพลนท์ปูน) จำนวน 2 แห่ง กิจการอู่พ่นสีรถยนต์ จำนวน 28 แห่ง กิจการประดิษฐ์หินเป็นของใช้ จำนวน 4 แห่ง
ระบบทางเดินอาหารเป็นระบบสำคัญที่ไม่ควรละเลย - ภญ. อาทิรัตน์ จารุกิจพิพัฒน์
ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ เปิดเผยว่า “ด้วยระบบทางเดินอาหาร ถือเป็นอีกหนึ่งระบบของร่างกายที่มีความสำคัญมาก ซึ่งมีผลต่อการสร้างคุณภาพชีวิตและไม่ควรละเลยที่จะดูแล จากตัวเลขการรักษาที่บำรุงราษฎร์พบว่ามีผู้ป่วยต่างชาติที่เป็นโรคกรดไหลย้อนถึง 50-60% ขณะที่ผู้ป่วยชาวไทยเป็นกรดไหลย้อน 10% และมีแนวโน้มเพิ่มขึ้นทุกปี ด้วยเหตุผลดังกล่าว “ศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร” (Gastrointestinal Motility Center) โรงพยาบาลบำรุงราษฎร์ จึงได้ก่อตั้งขึ้น ซึ่งถือเป็นเกียรติของบำรุงราษฎร์ที่ได้ผนึกความร่วมมือกับ ‘ศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร’ ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย นับเป็นการตอกย้ำเจตนารมณ์ของบำรุงราษฎร์ในด้านความเป็นเลิศทางการแพทย์ และเป็นการต่อยอดไปอีกขั้นของศูนย์ทางเดินอาหารและตับ โรงพยาบาลบำรุงราษฎร์ เพื่อส่งมอบผลลัพธ์ทางการรักษาที่ดีที่สุดให้แก่ผู้ป่วย”
นอกจากนี้ยังมีสิ่งที่ควรระวังในผู้สูงอายุที่เกิดจากการที่อวัยวะของร่างกายเสื่อมพร้อมกัน เช่น 1) หกล้ม 2) เวียนศีรษะ 3) นอนไม่หลับ 4) เบื่ออาหาร 5) น้ำหนักลด 6) ปัสสาวะเล็ด7) ซึมเศร้า 8) ผลข้างเคียงจากการทานยาหลายชนิด และอื่น ๆ “เห็นได้ชัดว่าผู้สูงอายุมีความเสี่ยงแทบทุกโรค ดังนั้น จึงควรต้องได้รับการตรวจสุขภาพประจำปี เพื่อให้ได้รับการรักษาอย่างทันท่วงทีและมีสุขภาพที่ดี” ผศ.พญ. แสงศุลี ธรรมไกรสร กล่าว
10 พ.ย. 65 กัญชาทางการแพทย์
กัญชาทางการแพทย์
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมว.สธ. เปิดเผยว่า ได้หารือร่วมกับหน่วยงานที่เกี่ยวข้องกับการขออนุญาตพืชและผลิตภัณฑ์กัญชา ได้แก่ กรมการแพทย์แผนไทยฯ อย. และสป. โดยสถาบันกัญชาทางการแพทย์ เพื่อบูรณาการทำงานให้ประชาชนได้รับการอนุญาตอย่างรวดเร็ว ลดขั้นตอนการทำงานที่ไม่จำเป็น และเป็นไปตามกฎหมายว่าด้วยข้อมูลส่วนบุคคลโดยการให้บริการในระบบ One stop Service ทั้งระบบออนไลน์ผ่าน application และออนไซต์ คือ หน่วยงานที่มีหน้าที่อนุญาต ตั้งแต่การปลูก ผลิต แปรรูป จำหน่าย และส่งออกรวมถึงให้คำปรึกษา โดยจะขยายการบูรณาการร่วมกับกรมวิชาการเกษตรให้สอดคล้องกัน โดยที่ประชุมได้ข้อสรุปเบื้องต้นว่า มีความเป็นไปได้ที่จะบูรณาการด้านข้อมูลและการอนุญาตร่วมกันได้มอบหมายให้กรมการแพทย์แผนไทยฯ อย. ร่วมกันหาแนวทางการปฏิบัติให้เกิดการดำเนินการอย่างเร็วที่สุด และประชาสัมพันธ์ให้ประชาชน ผู้ประกอบการ ทราบแนวทางการดำเนินการอย่างถูกต้องภายใน 2 สัปดาห์
- นพ.ณรงค์ อภิกุลวณิช รองปลัด สธ. กล่าวว่า สธ.ได้กำหนดมาตรการ 5 ด้าน เพื่อสนับสนุนการใช้กัญชาอย่างปลอดภัย คือ 1.การส่งเสริมให้เกิดการใช้ที่เหมาะสม ผ่านการให้ความรู้ประชาชนทั้งประโยชน์ โทษ และการจัดทำแนวทางการใช้กัญชาทางการแพทย์ทั้งแผนปัจจุบันและแผนไทยที่ชัดเจน 2. การบังคับใช้กฎหมายอย่างมีประสิทธิภาพ 3.การเฝ้าระวังป้องกันการใช้ในทางที่ผิด โดยวางระบบรายงานเฝ้าระวังผลการใช้กัญชา 4.การวางระบบการดูแลรักษาพยาบาลและบำบัดรักษา และ 5.การกำกับติดตามผลการขับเคลื่อนตามมาตรการที่กำหนด ในส่วนของข้อห่วงใยทางสังคม มีระบบ social listening หรือการรับฟังปัญหาของสังคมผ่านทางช่องทางสื่อสารต่างๆ แบบเรียลไทม์ ทำให้สามารถจัดการกับความเข้าใจ ข้อห่วงใยของสังคมได้อย่างทันท่วงที
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า กรมการแพทย์แผนไทยฯ ได้มีแนวทางการดูแลผู้ป่วยด้วยกัญชาทางการแพทย์แผนไทยแบบบูรณาการ 4 แนวทาง คือ (1) แนวทางการดูแลผู้ป่วยกลุ่มโรคมะเร็งและผู้ป่วยระยะประคับประคอง (Palliatives care) (2) แนวทางการดูแลกลุ่มผู้ป่วยระยะกลาง (Intermediate care) (3) การดูแลผู้ป่วยโรคพาร์กินสันด้วยกัญชาทางการแพทย์แผนไทย (4) การดูแลผู้ป่วยด้วยการแพทย์แผนไทยในหน่วยบริการปฐมภูมิ (Primary Care Cluster) มีการอบรมหลักสูตรการใช้กัญชาทางการแพทย์แผนไทย และหลักสูตรเพิ่มพูนทักษะการปรุงยาเฉพาะราย ให้กับแพทย์แผนไทย แพทย์แผนไทยประยุกต์ หมอพื้นบ้าน และสหวิชาชีพ รวม 1,233 คน เพื่อให้สามารถรักษาปรุงยาและจ่ายยาที่มีกัญชาปรุงผสม ฟื้นฟูสภาพผู้ป่วยที่มีความจำเป็นต้องใช้ยากัญชาในการรักษาโรคได้อย่างมีมาตรฐาน นอกจากนี้ได้ขยายการผลิตตำรับยาที่มีกัญชาปรุงผสมในโรงงานผลิตยา WHO GMP ในโรงพยาบาลสังกัด สป. สธ. 6 แห่ง คือ 1. รพ.พระอาจารย์ฝั้น อาจาโร จ.สกลนคร 2. รพร.เด่นชัย จ.แพร่ 3.รพ.คูเมือง จ.บุรีรัมย์ 4.รพ.ดอนตูม จ.นครปฐม 5.รพ.ท่าฉาง จ.สุราษฎร์ธานี 6.รพ.เจ้าพระยาอภัยภูเบศร จ.ปราจีนบุรี และมีการสื่อสารและสร้างความรอบรู้ การใช้ประโยชน์จากกัญชา กระท่อมทางการแพทย์แผนไทยในการดูแลสุขภาพ 10 เรื่อง สามารถติดตามข้อมูลกัญชาทางการแพทย์แผนไทย ได้ทางเว็บไซต์กรมการแพทย์แผนไทยฯ หรือสอบถามได้ที่คลินิกกัญชาทางการแพทย์แผนไทย ศูนย์ส่งเสริมสุขภาพแผนไทย กรมการแพทย์แผนไทยฯ เวลา 08.30-16.30 น. โทร.0 2590 2606 /0 2591 1964 Line @204snkkn
- นพ.รังสฤษฎ์ กาญจนะวณิชย์ หรือ หมอหม่อง อาจารย์แพทย์โรคหัวใจ ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ โพสต์ข้อความพร้อมตั้งคำถาม กรณีภาพ รมต.สธ. โปรโมต ไอติมกัญชา ที่สถานพยาบาล ว่านี่คือ กัญชาทางการแพทย์?
ร่างพ.ร.บ. กัญชา กัญชง
- นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและ รมว.สธ. กล่าวว่า ร่าง พ.ร.บ.กัญชา-กัญชง จะผ่านความเห็นชอบหรือไม่ ขึ้นอยู่กับการพิจารณาของสภาผู้แทนราษฎร ยอมรับว่ามีความเห็นที่ต่างกัน หาก กมธ.รับฟังความเห็นและนำไปแก้ไขปรับแก้ตามข้อห่วงใยของสมาชิกจะเป็นประโยชน์ หากมีพระราชบัญญัติมาควบคุมการใช้ผู้ที่ได้รับประโยชน์สูงสุดคือประชาชน ไม่ว่ามติจะออกมาเป็นอย่างไรก็รับได้หมด เพราะปัจจุบันกัญชาไม่ใช่ยาเสพติด และยังสามารถนำไปใช้ประโยชน์ส่งเสริมเศรษฐกิจตามนโยบายของรัฐบาล ยืนยันว่าเรื่องนี้ จะไม่เป็นเงื่อนไขนำไปสู่การเป็นอุบัติเหตุทางการเมือง ทั้งนี้นายกรัฐมนตรีได้วางตัวเป็นกลางและห่วงใยในเรื่องนี้ เพื่อไม่ให้กระทบกับการทำงานและเกิดปัญหาในพรรคร่วมรัฐบาล ซึ่งพรรคภูมิใจไทยขอให้มั่นใจว่าจะไม่นำปัญหาความขัดแย้งของสภามาเป็นปัญหาเรื่องการทำงานในรัฐบาลเช่นกัน
- นพ.ชลน่าน ศรีแก้ว ส.ส.น่าน และหัวหน้าพรรคเพื่อไทย กล่าวว่า ร่าง พ.ร.บ.กัญชง กัญชา มีหลักการกว้างมาก และสนับสนุนเพื่อใช้เพื่อการแพทย์ วิทยาศาสตร์ การทดลองวิจัย การพาณิชย์ และเศรษฐกิจ เป็นเหตุผลที่รับได้ แต่ยังมีข้อท้วงติง เรื่องการควบคุมกัญชาเสรี การไม่ให้เยาวชนเข้าไปเกี่ยวข้อง และตัวบทกฎหมายเขียนไว้ว่า กัญชาไม่ใช่ยาเสพติด จะเป็นยาเสพติดเมื่อเป็นไปตามประกาศของกระทรวงสาธารณสุข ภายใต้ความเห็นชอบของ ป.ป.ส. เท่านั้น คือมีสารสกัด THC มากกว่า 0.2 ขึ้นไป ส่วนที่เหลือได้เขียนเรื่องการอนุมัติและอนุญาตเท่านั้น อย่างไรก็ตาม พรรค พท.ได้ทักท้วงและถอนร่างออกไปเพื่อนำไปปรับแก้ สุดท้าย กมธ. ก็ไม่มีการปรับแก้ตามที่เสนอไป ฉะนั้น ในการพิจารณาวาระ 2 ก็จะสู้ต่อในมุมของเราว่าแก้ไขเปลี่ยนแปลงรายมาตราได้หรือไม่
- อาจมีการนำร่าง พ.ร.บ.กัญชา เข้าสู่การลงมติ ในวันนี้ (9 พ.ย.65) แต่คงต้องมีการอภิปรายกันอย่างดุเดือด
- นายทักษิณ ชินวัตร อดีตนายกรัฐมนตรี หรือ “โทนี่ วู้ดซัม” กล่าวผ่านรายการ CareTalk x Care ClubHouse ในหัวข้อ “ทำนโยบายสาธารณะไม่เป็น หรือเห็นแก่เงินของใคร” ว่า นโยบายกัญชาเสรี คนริเริ่มคิดมีความกล้าหาญดีแต่ไม่คิดให้รอบด้าน เรื่องสัดส่วนทางการแพทย์ทางสันทนาการ การควบคุมอันตราย แต่กลับปลดล็อกเลยโดยไม่ได้ควบคุม ทำให้เกิดปัญหากับเยาวชน ร่าง พ.ร.บ. กัญชา กัญชง ล่มจะส่งผลให้ยุบสภาหรือไม่นั้น ส่วนใหญ่จะล่มคือกฎหมายการเงินหากจะยุบสภาคงไม่สามัคคีในหมู่รัฐบาลมากกว่า
บริจาค ศิริราชมูลนิธิ ลดหย่อนภาษีได้ 2 เท่า
ร่วมบริจาคศิริราชมูลนิธิ เพื่อช่วยเหลือผู้ยากไร้โรงพยาบาลศิริราช ลดหย่อนภาษีได้ 2 เท่า สามารถบริจาคผ่าน e-Donation
หรือธนาคารไทยพาณิชย์ (กระแสรายวัน)
ชื่อบัญชี ศิริราชมูลนิธิ เลขที่บัญชี 016-3-04650-5
สัญญาณเตือน โรคเบาหวาน
วิธีสังเกตอาการที่เป็นสัญญาณเตือน โรคเบาหวาน มาเยือนคุณหรือไม่
กินเก่งขึ้น หิวน้ำบ่อย ปัสสาวะบ่อย แผลหายช้ากว่าปกติ อ่อนเพลียมาก น้ำหนักลด หายใจหอบเหนื่อย คลื่นไส้อาเจียน ซึมลงหรือหมดสติ หากคุณหรือคนในครอบครัวมีอาการเหล่านี้ แนะนำให้ปรึกษาแพทย์ผู้เชี่ยวชาญโดยเร็ว
ศ.นพ.ปิยะมิตร ศรีธรา คณบดี


ศ.นพ.ปิยะมิตร ศรีธรา คณบดีคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล และประธานคณะกรรมการบริหารมูลนิธิรามาธิบดีฯ กล่าวว่า “สถาบันการแพทย์จักรีนฤบดินทร์ ถือกำเนิดจากพระราชดำริของพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาทบพิตร (รัชกาลที่ 9) และสมเด็จพระกนิษฐาธิราชเจ้ากรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธรฯ สยามบรมราชกุมารี ที่มีพระราช-ประสงค์ให้มีสถานพยาบาลของรัฐขนาดใหญ่ จึงจัดตั้งสถาบันการแพทย์จักรีนฤบดินทร์ เพื่อบริการประชาชนในแถบจังหวัดสมุทรปราการและจังหวัดใกล้เคียง ให้เข้าถึงบริการสาธารณสุขมากขึ้น และขยายความสามารถในการรองรับผู้ป่วยให้ได้มากขึ้น สถาบันการแพทย์จักรีนฤบดินทร์ ถูกสร้างให้เป็น ‘โรงเรียนแพทย์ในฝัน’ เพื่อผลิตบุคลากรทางการแพทย์และพยาบาล บนพื้นที่ทั้งหมด 319 ไร่ ซึ่งใหญ่กว่าโรงพยาบาลรามาธิบดีศูนย์พญาไทถึง 10 เท่า โดยมีจุดประสงค์เพื่อให้เป็นโรงเรียนแพทย์ที่ผลิตบุคลากรด้านวิทยาศาสตร์การแพทย์ออกไปรับใช้ประชาชนทั่วประเทศ และเป็นพื้นที่ที่ทำให้นักศึกษาเรียนอย่างมีความสุข โดยหลักสูตรแพทยศาสตร์บัณฑิต มีการปรับหลักสูตรถึง 3 ครั้ง โดยให้นักศึกษาเขามามีส่วนร่วมในการปรับหลักสูตร เพื่อให้นักศึกษาได้เลือกเรียนตามความต้องการของตนเอง (Personalized Curriculum) ในบรรยากาศการเรียนการสอนที่สนุกสนาน พร้อมสภาพแวดล้อมที่ดี เพื่อยกระดับคุณภาพชีวิตและความเป็นอยู่ของนักศึกษาให้ดียิ่งขึ้น ซึ่งเชื่อว่าจะเป็นปัจจัยสำคัญในการผลิตบุคลากรทางการแพทย์ที่ดี”
ในส่วนของการศึกษาวิจัย สถาบันการแพทย์จักรีนฤบดินทร์ มีการบริหารจัดการให้เกิดชีวิตวิทยาเขต (Campus life) ที่สนับสนุนพันธกิจการศึกษาและวิจัยในลักษณะการศึกษาร่วมกันของ 4 หลักสูตร (Interprofessional education : IPE) ครอบคลุมถึงการเรียนการสอน การใช้ชีวิตและมีกิจกรรมร่วมกัน ทั้งในและนอกเวลา โดยได้นำนวัตกรรมและเทคโนโลยีทางการศึกษาที่เกี่ยวกับการแพทย์เข้ามาในหลักสูตรการเรียนการสอน มุ่งเพิ่มความเชี่ยวชาญและประสิทธิภาพในการให้ความรู้อย่างบูรณาการ ควบคู่ไปกับการปลูกฝังจิตวิญญาณในการช่วยเหลือเพื่อนมนุษย์โดยสร้างบรรยากาศและสิ่งแวดล้อมให้ใกล้ชิดกับผู้คนในชุมชน รวมถึงการสร้างสัมพันธ์อันดีกับเพื่อนร่วมสายงานที่มีหลากหลายบทบาทอาชีพ เพื่อสร้างบุคลากรทางการแพทย์ที่ดูแลผู้ป่วยด้วยหัวใจ
ครอบครัวอุปการะ
พ่อบุญเพ็ง นาคสูงเนิน อายุ 62 ปี หนึ่งในครอบครัวอุปการะ ชาวตำบลเมืองแฝก อ.ลำปลายมาศ จ.บุรีรัมย์ ผู้เข้าร่วมโครงการฯ มาตั้งแต่ปี 2546 กล่าวว่า ครอบครัวประกอบอาชีพเกษตรกรรม ทำนา ไร่มันสำปะหลัง เลี้ยงวัว เลี้ยงปลา และเกษตรผสมผสาน มีชาย 1 คน หญิง 1 คน ที่ผ่านมาครอบครัวเคยอุปการะเด็กมาแล้ว 3 คน เรียนจบปริญญาตรี 1 คน และกลับครอบครัวเดิม 2 คน โดยปัจจุบันยังดูแลเด็กอุปการะเด็กหญิงอยู่ 2 คน ส่วนจุดเริ่มเกิดจากตนเองร่วมโครงการเกษตรผสมผสานอาขีพ 7 อาชีพ 7 รายได้ ของมูลนิธิเจริญโภคภัณฑ์พัฒนาชีวิตชนบท และโครงการธนาคารโคกระบือ ของมูลนิธิเจริญโภคภัณฑ์ อยู่แล้ว เมื่อเจ้าหน้าที่มูลนิธิฯ แจ้งว่าต้องการครอบครัวเกษตรกรที่มีจิตอาสา สามารถเป็นครอบครัวอุปการะเลี้ยงดูเด็กกำพร้า เพื่อช่วยบ่มเพาะเด็กๆ ได้เรียนรู้และมีทักษะด้านการเกษตร ให้มีคุณภาพชีวิตที่ดี ซึ่งครอบครัวมีคุณสมบัติตรงตามความต้องการของโครงการ ประกอบกับอยากช่วยเหลือเด็กๆ ให้มีบ้านและครอบครัวดูแล จึงสมัครเข้าร่วมโครงการ
สำหรับการเลี้ยงเด็กอุปการะ พ่อบุญเพ็งบอกว่า ไม่แตกต่างกับการเลี้ยงดูบุตรของตนเอง คือครอบครัวต้องดูแล ให้ความรัก ความอบอุ่นกับเด็กอย่างเพียงพอ ซึ่งตนเองมีแนวคิดในการเลี้ยงดูเด็กๆ คือ การพาพวกเขาลงมือทำเกษตร เพราะนอกจากจะเป็นการเสริมสร้างทักษะให้กับเด็กๆ แล้ว ยังถือเป็นกิจกรรมที่ได้มีเวลาอยู่ร่วมกัน โดยจะใช้เวลาที่ทำกิจกรรมเกษตร เช่นเลี้ยงปลา เลี้ยงหมู เลี้ยงไก่ ปลูกผัก ในการสอนเด็กๆ ให้เรียนรู้เรื่องอื่นๆไปพร้อมกันด้วย ถือเป็นการสร้างความสัมพันธ์ในครอบครัว บ่มเพาะเด็กให้มีความรับผิดชอบและเป็นคนใจเย็น พ่อบุญเพ็งรู้สึกดีใจที่ครอบครัวนาคสูงเนินได้เป็นส่วนหนึ่งในการช่วยสร้างอนาคตให้กับเด็กๆ และภูมิใจที่ลูกอุปการะเรียนจบปริญญาตรี มีอาชีพการงานทำที่ดี และขอบคุณมูลนิธิฯ ที่เข้ามาช่วยดูแลเด็กๆ คอยให้คำแนะนำ เป็นที่ปรึกษา สนับสนุนและช่วยเหลือค่าใช้จ่ายต่างๆให้กับเด็กด้วย
ป้อมปราบศัตรูพ่าย รับสมัคร รปภ.
รับสมัครงาน รับสมัครพนักงานรักษาความปลอดภัย เพื่อปฏิบัติงานสำนักงานเขตป้อมปราบศัตรูพ่าย
คุณสมบัติ
*เพศชาย สัญชาติไทย สามารถฟัง พูด อ่าน เขียนภาษาไทยได้
*วุฒิการศึกษา ตามการศึกษาภาคบังคับในขณะที่กำลังศึกษาอยู่
*อายุไม่ต่ำกว่า 22 ปีบริบูรณ์ ไม่เกิน 50 ปีบริบูรณ์
*เป็นผู้ที่ผ่านเกณฑ์ทหาร หรือผ่านหลักสูตรวิชาทหาร ชั้นปีที่ 3
*ปฏิบัติหน้าที่ด้านการรักษาความปลอดภัยได้เป็นอย่างดี
*ความประพฤติเรียบร้อย สุภาพ ร่างกายแข็งแรง
*สามารถทำงานเป็นกะได้ ปฏิบัติงานที่สำนักงานเขตป้อมปราบศัตรูพ่าย
????รับสมัคร วันที่ 7 – 21 พ.ย. 65
????ประกาศรายชื่อผู้มีสิทธิสอบ วันที่ 23 พ.ย. 65
????สอบสัมภาษณ์ วันที่ 25 พ.ย. 65
????ประกาศผลสอบ วันที่ 28 พ.ย. 65
???? #อัตราค่าจ้าง เดือนละ 13,200.- บาท
สอบถามเพิ่มเติม ฝ่ายปกครอง ชั้น 2 โทร.02-281-6117
เขตพญาไท นัดเก็บขยะชิ้นใหญ่ทุกวันเสาร์ LINK
สำนักงานเขตพญาไท กำหนดบริการจัดเก็บขยะชิ้นใหญ่ สิ่งของเหลือใช้ และขยะอันตราย เดือนพฤศจิกายน 2565 กำหนดลงพื้นที่ ดังนี้
วันเสาร์ที่ 5 พฤศจิกายน 2565 ณ ซอยรณชัย 1, 2
วันเสาร์ที่ 12 พฤศจิกายน 2565 ณ ชุมชนมะกอกส่วนหน้า และชุมชนมะกอกกลางสวน
วันเสาร์ที่ 19 พฤศจิกายน 2565 ณ ชุมชนดุริยางค์ทหารบก
วันเสาร์ที่ 26 พฤศจิกายน 2565 ณ ซอยบุญอยู่
จึงขอความร่วมมือจากประชาชนที่อาศัยในบริเวณดังกล่าว นำขยะชิ้นใหญ่ สิ่งของเหลือใช้และขยะอันตราย ออกมาวางไว้บริเวณหน้าบ้านหรือริมถนนในซอย ก่อนเวลา 09.00 น. เพื่อให้เจ้าหน้าที่เขตฯ เข้าไปจัดเก็บแล้วนำมากำจัดอย่างถูกวิธีต่อไป
สอบถามโทร 02-2784344 ต่อ 6475
โรค IPD คือ โรคติดเชื้อแบคทีเรีย นิวโมคอคคัส - รองศาสตราจารย์ (พิเศษ) นายแพทย์ทวี โชติพิทยสุนนท์
รองศาสตราจารย์ (พิเศษ) นายแพทย์ทวี โชติพิทยสุนนท์ กรรมการและปฏิคมสมาคมโรคติดเชื้อในเด็กแห่งประเทศไทย กรรมการมูลนิธิวัคซีนเพื่อประชาชน เปิดเผยว่า “โรค IPD คือ โรคติดเชื้อชนิดลุกลามที่มีสาเหตุจากการติดเชื้อแบคทีเรียชื่อ “นิวโมคอคคัส หรือ Streptococcus pneumoniae” โดยทั่วไปแล้ว เชื้อชนิดนี้ มักอาศัยอยู่ในโพรงจมูกและลำคอ ทั้งในเด็กและผู้ใหญ่โดยยังไม่ก่อโรค แต่เมื่อใดที่ร่างกายอ่อนแอ หรือมีการติดเชื้อไวรัส เชื้อชนิดนี้ก็จะรุกรานไปอวัยวะข้างเคียง ทำให้เกิดการติดเชื้อในกระแสเลือด เยื่อหุ้มสมองอักเสบ หรือปอดอักเสบรุนแรง
โดยอาการของการติดเชื้อ IPD มีได้หลายอย่างขึ้นกับอวัยวะที่มีการติดเชื้อ หากเป็นโรคปอดอักเสบ มักจะมีอาการ ไข้ ไอ หายใจหอบเหนื่อย หากมีการติดเชื้อที่ระบบประสาท เช่น เยื่อหุ้มสมองอักเสบ ผู้ป่วยจะมีอาการไข้สูง ปวดศีรษะรุนแรง คลื่นไส้ อาเจียน คอแข็ง ในเด็กเล็กจะมีอาการงอแง ซึม ชัก และอาจเสียชีวิตอย่างรวดเร็ว หากเกิดการติดเชื้อในกระแสเลือด ผู้ป่วยก็จะมีอาการไข้สูง หายใจเร็ว หัวใจเต้นเร็ว อาจมีภาวะช็อก และอาจเสียชีวิตได้ โรค
IPD มักมีความรุนแรงสูงแตกต่างจากโรคหวัดทั่วไป เด็ก ๆ ที่ป่วยเป็นโรค IPD มักจำเป็นต้องนอนรักษาตัวอยู่ในโรงพยาบาลเป็นเวลานานโดยเฉลี่ยแล้วนานถึง 12 วัน และเสียค่าใช้จ่ายในการรักษาแต่ละครั้งโดยเฉลี่ย มากกว่า 50,000 บาท แม้จะรับการรักษาจากโรงพยาบาลรัฐก็ตาม นอกจากนี้เด็กที่หายป่วยจากโรค IPD บางคนอาจมีผลกระทบระยะยาว เช่น สูญเสียการได้ยิน พิการทางสมอง การเคลื่อนไหวผิดปกติ และมีอาการชัก จะเห็นได้ว่าโรค IPD ไม่เพียงแต่จะส่งผลกระทบต่อสุขภาพและพัฒนาการของเด็กเท่านั้น แต่ยังทำให้ครอบครัวต้องสูญเสียรายได้จาก ค่ารักษาพยาบาล และขาดรายได้เนื่องจากจำเป็นต้องหยุดงานเพื่อมาดูแลลูก ดังนั้นหากลูกหลานมีอาการใกล้เคียงกับโรค IPD ควรรีบได้รับการวินิจฉัย และรักษาจากแพทย์อย่างรวดเร็ว เพื่อลดอัตราการเสียชีวิตและโอกาสการเกิดผลกระทบระยะยาว
นอกจากนี้เชื้อนิวโมคอคคัสยังสามารถทำให้เกิดโรคต่าง ๆ ได้อีกหลายชนิดแม้ไม่รุนแรง แต่ก็พบได้บ่อย เช่น โรคไซนัสอักเสบ โรคหูชั้นกลางอักเสบ แพทย์สามารถวินิจฉัยโรค IPD จากการซักประวัติ จากอาการ และการตรวจร่างกายผู้ป่วย เช่น การเอกซเรย์ปอด และการตรวจเสมหะ หรือส่งตรวจทางห้องปฏิบัติการ เพื่อยืนยันว่าอาการของโรคเกิดจากเชื้อแบคทีเรียนิวโมคอคคัส และเมื่อตรวจพบเชื้อแบคทีเรียนิวโมคอคคัสแล้ว แพทย์จะทำการให้ยาต้านจุลชีพหรือยาปฏิชีวนะในขนาดที่เหมาะสมกับโรคและอาการ
แต่ถึงอย่างนั้นก็ตามก็พบว่าในประเทศไทยเชื้อนิวโมคอคคัส มีอัตราการดื้อยาปฏิชีวนะสูงขึ้น ซึ่งเกิดจากการใช้ที่ไม่ถูกวิธี ทำให้พบปัญหาเชื้อดื้อยามากขึ้นเรื่อย ๆ ส่งผลให้กระบวนการการรักษามีความซับซ้อน และเสียค่าใช้จ่ายในการรักษามากขึ้น นับได้ว่าสูญเสียทั้งเศรษฐกิจ และกำลังของประเทศเป็นอย่างมาก จึงเป็นหน้าที่ของทุก ๆ ฝ่ายในการรณรงค์ให้ความรู้แก่ประชาชนทั้งในด้านการส่งเสริมสุขภาพ และการป้องกันเพื่อให้จำนวนผู้ป่วยลดน้อยลง ดังนั้นการป้องกันโรค IPD ด้วยการฉีดวัคซีนจึงเข้ามามีบทบาทสำคัญ
ซึ่งปัจจุบันองค์กรต่าง ๆ ในภาครัฐก็พร้อมที่จะช่วยกันผลักดันวัคซีน IPD เข้าสู่แผนการสร้างเสริมภูมิคุ้มกันโรค นอกจากนี้ประชาชนเองก็สามารถดูแลตนเองได้ด้วยวิธีง่าย ๆ เพื่อให้ห่างไกลจากโรค IPD อาทิ หลีกเลี่ยงการไปสถานที่แออัด สวมหน้ากากอนามัย เว้นและรักษาระยะห่าง ดูแลสุขภาพให้แข็งแรงอยู่เสมอ ปรึกษาแพทย์เพื่อสร้างภูมิคุ้มกันที่เหมาะสม”
สายการบิน Jetstar Airways
การพกพายารักษาโรคระหว่างการเดินทาง
- สายการบิน แนะนำให้คุณรวบรวมอุปกรณ์การแพทย์ทั้งหมดที่จำเป็นไว้ในหีบห่อเดียวและใส่ไว้ในสัมภาระติดตัวของคุณ หรืออย่างน้อยที่สุดควรจัดเตรียมยาที่จำเป็นให้เพียงพอสำหรับหนึ่งสัปดาห์เป็นอย่างน้อย เพื่อให้คุณมียาที่จะสามารถใช้ได้หากเกิดเหตุการณ์ไม่คาดคิดที่ทำให้สัมภาระเช็คอินของคุณพลัดหลงจากคุณ ณ จุดใดจุดหนึ่งระหว่างการเดินทาง
- ยาดังกล่าวควรมีฉลากที่พิมพ์อย่างถูกต้องซึ่งระบุชื่อยาหรือชื่อผู้ผลิต หรือมีฉลากยาติดอยู่ เจ้าหน้าที่รักษาความปลอดภัยหรือเจ้าหน้าที่ศุลกากรอาจขอหลักฐานพิสูจน์ความจำเป็นที่ต้องใช้ยา
- หากคุณจำเป็นต้องพกพาเข็มฉีดยาชนิดฉีดเข้าใต้ผิวหนัง (Hypodermic Needle) ขึ้นเครื่องบิน คุณต้องสำแดงอุปกรณ์ดังกล่าวที่จุดตรวจคัดกรอง และเตรียมเอกสารหรือสิ่งที่ใช้ยืนยันอาการเจ็บป่วยของคุณถ้าเป็นไปได้ [source]
- หากคุณกำลังจะเดินทางพร้อมกับอุปกรณ์ให้ยา กรุณาเตรียมยาที่จำเป็นต่าง ๆ ให้เพียงพออย่างน้อยหนึ่งสัปดาห์ไว้ในสัมภาระติดตัวขึ้นเครื่องของคุณ เพื่อให้คุณยังสามารถใช้ยาได้ในกรณีสัมภาระเช็คอินเกิดพลัดหลงจากคุณ [source]
วิธีของมิจฉาชีพ
วิธีการของมิจฉาชีพ ด้วยวิธีหลอกลวงฟิชชิ่ง มีหลายแบบ ได้แก่
หลอกขอข้อมูลส่วนตัวเพื่อเปิดใช้งาน Internet Banking ลูกค้าได้รับอีเมลหลอกลวง อ้างว่าเป็นระบบรักษาความปลอดภัยของธนาคาร และขอข้อมูลส่วนบุคคลและให้กรอก OTP ที่ได้รับจากโทรศัพท์มือถือ มิจฉาชีพ นำข้อมูลไปสมัครบริการ Internet Banking และโอนเงินไปยังบัญชีมิจฉาชีพ
หลอกขอข้อมูลบัตรเครดิต
ผู้ใช้งานโปรแกรมดูหนังออนไลน์ ได้รับอีเมลหลอกลวง แจ้งว่าบัญชีโปรแกรมดูหนังออนไลน์ถูกระงับชั่วคราวให้ผู้ใช้คลิกลิงก์ปลอม เพื่อปรับปรุงข้อมูลส่วนบุคคลของบัญชีโปรแกรมดูหนังออนไลน์ แล้วมิจฉาชีพจึงนำข้อมูลดังกล่าวไปสวมตัวตน เพื่อทำธุรกรรมทางอินเทอร์เน็ตได้
หลอกติดตั้งโปรแกรมมัลแวร์เรียกค่าไถ่
เหยื่อได้รับอีเมลจากมิจฉาชีพ หลอกให้ติดตั้งโปรแกรมที่ส่งมากับอีเมลเพื่อความปลอดภัยของคอมพิวเตอร์เมื่อหลงเชื่อติดตั้งโปรแกรมมัลแวร์แล้ว ข้อมูลต่างๆ ในคอมพิวเตอร์จะถูกเข้ารหัส ทำให้ต้องจ่ายเงินค่าไถ่ให้กับมิจฉาชีพ หากต้องการเปิดไฟล์ที่ถูกเข้ารหัส
MY WEED (Turtle Village)
Turtle Village ตำบลไม้ขาว มีช่อดอกสารพัดพันธุ์ และบราวนี่น่ากัด
ใส่ใจตัวเองมากขึ้น (Me Mentality)
“ในช่วงที่ผ่านมานี้ ผู้บริโภคมีแนวคิดเพื่อส่วนรวม โดยได้ลดความต้องการส่วนตัวลงและให้ความสำคัญกับด้านสาธารณสุขและความปลอดภัยของส่วนรวม เมื่อสถานการณ์การแพร่ระบาดได้เริ่มคลี่คลายลง ผู้บริโภคจึงได้เริ่มกลับมาสนใจตัวเองอีกครั้ง
“เมื่อผู้บริโภคต้องการสร้างสิ่งใหม่ให้กับตัวตนของพวกเขา แบรนด์สามารถเติมเต็มความต้องการเหล่านั้นด้วยการส่งเสริมการเรียนรู้ทักษะและฝึกฝนความเชี่ยวชาญในด้านใหม่ ๆ สิ่งที่น่าสนใจคือ ความต้องการสินค้าที่เกี่ยวกับสุขภาพจิตและความเป็นอยู่ที่ดีจะเพิ่มมากขึ้น เพราะผู้บริโภคกำลังสำรวจและทำความเข้าใจกับสิ่งที่อาจจะถูกมองข้ามไป หากเรามองการณ์ไกลกว่านั้น ผู้บริโภคจะใช้เมตาเวิร์สในการสร้างตัวตนที่มีเอกลักษณ์และกลมกลืนไปกับสิ่งแวดล้อมดิจิทัลรอบ ๆ ตัว ซึ่งจะส่งผลให้เกิดการกระจายของตัวตนในโลกออนไลน์ และจะทำให้เกิดการเคลื่อนไหวเพื่อเรียกร้องในการคุ้มครองผู้บริโภคและข้อมูลส่วนตัว เนื่องจากข้อมูลการใช้งานดิจิทัลของผู้บริโภคมีความสำคัญและซับซ้อนมากกว่าเดิม”
เกษมราษฎร์ ประชาชื่น ค่าตรวจ RT-PCR Covid-19 (ทราบผล 24 ชั่วโมง) ราคา 1,500 บาท LINK
ค่าบริการตรวจหาเชื้อ Covid-19
RT-PCR Covid-19 (ทราบผล 24 ชั่วโมง)
ราคา 1,500 บาท
ใบรับรองแพทย์ 200 บาท
Rapid RT-PCR Covid-19 (ทราบผล 2 ชั่วโมง)
ราคา 2,000 บาท
ใบรับรองแพทย์ 200 บาท
ATK (Antigen Test Kit) (ทราบผลเป็นทางการ 1 ชั่วโมง)
ราคา 250 บาท
ใบรับรองแพทย์ 200 บาท
***กรณีใบรับรองแพทย์ Fit to fly 500 บาท
เปิดบริการทุกวัน 8.00-15.00น
(Walk in อย่างเดียว)
สอบถามโทร : ARI Clinic 02-910-1600 ต่อ 1106, 1695
ตรวจยีน หาความเสี่ยงมะเร็ง
ปรึกษาแพทย์เฉพาะทางมะเร็งวิทยา
นพ.คมกฤช มหาพรหม
หุ่นยนต์ช่วยผ่าตัดข้อเข่า โรงพยาบาลศิริราช ปิยมหาราชการุณย์
การรักษาข้อเข่าเสื่อมโดยการผ่าตัดเปลี่ยนข้อเข่าเทียม ศูนย์ออร์โธปิดิกส์ ชั้น 2 โซน A โรงพยาบาลศิริราช ปิยมหาราชการุณย์ ปัจจุบันใช้หุ่นยนต์ช่วยผ่าตัดข้อเข่าและข้อสะโพกเทียม ภายใต้การควบคุมของศัลยแพทย์ โดยหุ่นยนต์เป็นเพียงผู้ช่วยถืออุปกรณ์ เช่น เลื่อย หรือตัวปั่นกระดูก และควบคุมความแม่นยำให้ออกมาเป็นตัวเลขที่แสดงให้เห็นบนจอคอมพิวเตอร์แบบ real-time คอยเตือนและล็อกการเคลื่อนที่ของอุปกรณ์ผ่าตัดไม่ให้ออกนอกตำแหน่งที่วางแผนไว้ เรียกได้ว่าเป็นการผ่าตัดโดยแพทย์ผ่าตัดแต่มีผู้ช่วยที่เป็นหุ่นยนต์
ข้อดีของการผ่าตัดด้วยหุ่นยนต์ช่วยผ่าตัด
มีความแม่นยำของการวางแนวขาของผู้ป่วยในตำแหน่งของข้อเทียม คลาดเคลื่อนน้อยมาก ถือเป็นวิธีที่มีความแม่นยำที่สุดในปัจจุบัน
การปรับสมดุลของข้อ การจัดสมดุลภายในข้อ ทั้งเนื้อเยื่อ เส้นเอ็นรอบข้อ ให้เหมาะสมในการเคลื่อนไหว ยืดเหยียดงอ การปรับแต่งยังสามารถทำได้ทันที และเหมาะสมกับผู้ป่วยแต่ละรายได้
ความปลอดภัย ความแม่นยำสูง ย่อมลดความผิดพลาดได้ แพทย์เห็นภาพและทำงานได้อย่างชัดเจน หุ่นยนต์จะช่วยควบคุมอุปกรณ์การผ่าตัด ได้อย่างแม่นยำ ไม่คลาดเคลื่อน ลดความผิดพลาดได้มากที่สุด ส่งผลให้การผ่าตัดรวดเร็ว ทำได้เสร็จสิ้นในเวลาที่สั้นลง
ติดต่อ
ศูนย์ออร์โธปิดิกส์ โทร. 1474
ตาราง Group A
| |
Group A |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
เนเธอร์แลนด์ |
3 |
2 |
1 |
0 |
5 |
1 |
4 |
7 |
| 2 |
เซเนกัล |
3 |
2 |
0 |
1 |
5 |
4 |
1 |
6 |
| 3 |
เอกวาดอร์ |
3 |
1 |
1 |
1 |
4 |
3 |
1 |
4 |
| 4 |
กาตาร์ |
3 |
0 |
0 |
3 |
1 |
7 |
-6 |
0 |
เรื่องราวแรก น้องน้ำอิง เด็กหญิง 7 ขวบที่ไม่สามารถย่อยอาหารเองได้
เรื่องราวแรกคือ เคสของเด็กหญิงอภิชญา หรือน้องน้ำอิง วัย 7 ขวบ ผู้ป่วยภาวะลำไส้ไม่มีโพรงประสาทตั้งแต่เกิด ทำให้ไม่สามารถย่อยอาหารได้เอง จึงต้องอยู่ในโรงพยาบาลตั้งแต่แรกเกิดและเติบโตท่ามกลางการดูแลของทีมบุคลากรทางการแพทย์ในโรงพยาบาลรามาธิบดีจนถึงปัจจุบัน โรงพยาบาลรามาธิบดีจึงเปรียบเสมือนบ้านสำหรับน้องน้ำอิงที่รายล้อมไปด้วยความรักและความอบอุ่นจากทีมแพทย์และพยาบาล
สำหรับพิธีเปิดภายในงาน “WOW Festival 2022 อัศจรรย์เมืองน่าอยู่” ได้รับเกียรติจาก ชัชชาติ สิทธิพันธุ์ ผู้ว่าการกรุงเทพมหานคร และกรณ์ จาติกวณิช อดีตรัฐมนตรีว่าการกระทรวงการคลัง กล่าวเปิด และร่วมชมงานในครั้งนี้
2.1 Banner A on the top
ภาพแสดงตำแหน่งแบนเนอร์ Banner A บนอุปกรณ์ต่างๆ (ร่วมกับแบนเนอร์ H และ C)
• แบนเนอร์แนวนอน ขนาด 980x140 pixel
• Fix position ด้านบนสุดของทุกหน้า
• แสดงทุกหน้า ประกอบด้วย Homepage, content page และ content listing (หมวดหมู่)
• Content page จะแบ่งเป็น article content และ medical service content (หน้าข้อมูลสถานพยาบาล - โรงพยาบาล คลินิก)
โรงเรียนกายอุปกรณ์ สิรินธร ก่อตั้งเพื่อผลิตนักกายอุปกรณ์ที่มีคุณธรรมและคุณภาพ
ศ. นพ.อภิชาติ อัศวมงคลกุล คณบดีคณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล กล่าวว่า โรงเรียนกายอุปกรณ์ สิรินธร คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล ก่อตั้งเพื่อผลิตนักกายอุปกรณ์ที่มีคุณธรรมและคุณภาพ สร้างองค์ความรู้และนวัตกรรมเพื่อพัฒนาผู้พิการและให้บริการด้านกายอุปกรณ์ด้วยหัวใจความเป็นมนุษย์ตามมาตรฐานสากล เพื่อยกระดับคุณภาพชีวิตของผู้ที่มีความบกพร่องทางการเคลื่อนไหว ผู้สูงอายุ บุคคลทั่วไป รวมถึงนักกีฬา จัดการเรียนการสอนด้านกายอุปกรณ์ ในระดับปริญญาตรี ปริญญาโท และปริญญาเอกระดับนานาชาติ ซึ่งถือเป็นหลักสูตรแรกของภูมิภาคเอเชียตะวันออกเฉียงใต้ และเป็นหลักสูตรเดียวในประเทศไทย ดำเนินการเปิดหลักสูตรตั้งแต่ปี พ.ศ. 2545 ผลิตบัณฑิตในประเทศ และต่างประเทศไปแล้วเกือบ400คน
ศ. นพ. อภิชาติ กล่าวอีกว่า อีกหนึ่งพันธกิจของโรงเรียนกายอุปกรณ์สิรินธร คือการมุ่งเน้นงานวิจัยร่วมกับหลายภาคส่วนเพื่อพัฒนาวัสดุท้องถิ่นและเทคโนโลยีภายในประเทศ (local Thailand materials and technologies) แต่อุปกรณ์และเครื่องมือสนับสนุนงานวิจัยยังขาดแคลน ขณะเดียวกันในประเทศไทยมีจำนวนนักกายอุปกรณ์ผู้ให้บริการงานสาธารณสุขที่รองรับคนพิการทางการเคลื่อนไหวทั้งประเทศเพียง 200 กว่าคน เป็นปัจจัยหนึ่งที่ทำให้การเข้าถึงการรักษาของคนพิการยังน้อยมาก อีกทั้ง ค่าใช้จ่ายในการผลิตนักศึกษากายอุปกรณ์สูงมากกว่าค่าเทอมหลายเท่าตัว ทางโรงเรียนฯ ต้องรับภาระค่าใช้จ่ายส่วนเกินมาโดยตลอดทำให้ประสบภาวะขาดทุนจากการดำเนินงาน 50 ล้านบาทต่อปี โดย โรงพยาบาลศิริราชต้องแบกรับค่าใช้จ่ายส่วนนี้ ดังนั้นการระดมทุนเพื่อสนับสนุนพันธกิจและการดำเนินงานของโรงเรียนกายอุปกรณ์สิรินธรจึงมีความจำเป็นอย่างยิ่ง
Set A Executive Wellness Set
Set A Executive Wellness Set
ราคา 3,900 บาท (จากราคาปกติ 4,480 บาท) พร้อมกระเป๋าผ้าลายพิเศษ จาก NaRaYa
ประกอบไปด้วย BRN Gevity จำนวน 1 กล่อง ผลิตภัณฑ์เสริมอาหารที่คัดสรรส่วนประกอบอย่างพิถีพิถัน ประกอบด้วยวิตามิน แร่ธาตุ และสารอาหารที่จำเป็นจากหลายประเทศทั่วโลก อันได้แก่ น้ำมันปลา, ฟอสฟาติดิลซีรีน, แอล-ธีอะนีน, สารสกัดจากใบแปะก๊วย รวมถึงวิตามินชนิดต่าง ๆ เช่น วิตามินบี 1, 2, 3, 5, 6, 7, 9 และ 12 ที่มีส่วนช่วยในการทำงานตามปกติของระบบประสาทและสมอง พร้อมทั้งมีส่วนช่วยในการสังเคราะห์สารสื่อประสาทบางชนิด เหมาะสำหรับผู้ที่เหนื่อยล้า อ่อนเพลีย อันเนื่องมาจากการทำงานและสภาวะความเครียด
พร้อมทั้ง Vitalutein Plus จำนวน 1 กล่อง ซึ่งเป็นผลิตภัณฑ์เสริมอาหารสูตรสารสกัดจากธรรมชาติ ผสมวิตามินสำคัญหลากหลายชนิด ได้แก่ ลูทีน บิลเบอร์รี่ และวิตามินต่าง ๆ เช่น วิตามินเอ วิตามินบี 2 และวิตามินอี
โดยมีเบต้า-แคโรทีนที่เป็นสารตั้งต้นของวิตามินเอ เหมาะสำหรับผู้ที่ใช้สายตาทำงานกับอุปกรณ์อิเล็กทรอนิกส์เป็นเวลานาน
5 ประเทศคู่แข่ง Specialised Expo 2028 และการประชันวิสัยทัศน์ผ่านแนวคิดธีมงาน
คู่แข่ง 5 ประเทศที่ยื่นเสนอจัดงาน Specialised Expo 2028 วาระเดียวกันกับ จ.ภูเก็ต เสนอ ประกอบด้วย
ประเทศสหรัฐอเมริกา เมืองมินเนโซตา
ประเทศเซอร์เบีย เมืองเบลเกรด
ประเทศสเปน เมืองมาลาก้า
ประเทศอาร์เจนตินา เมืองซาน คาร์ลอส เดอ บาริโลเช
*ข้อมูลจาก
BIE-PARIS.ORG/expo2027-28 ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “เนื่องจากระบบประสาทเป็นระบบที่ซับซ้อน มีหน้าที่ควบคุมและประสานการทำงานของอวัยวะต่างๆ ในร่างกาย เช่น การเคลื่อนไหว ความคิด ความรู้สึก การพูด การหายใจ ซึ่งเชื่อมกับการทำงานของสมองและไขสันหลัง ดังนั้น ความผิดปกติของระบบประสาท รวมถึงข้อบกพร่องของโครงสร้าง ถือเป็นภัยเงียบที่คุกคามชีวิต ทั้งนี้ สามารถหลีกเลี่ยงหรือลดความรุนแรงลงได้ หากได้รับการประเมินและทำการรักษาอย่างรวดเร็วทันท่วงทีและตรงจุดโดยทีมแพทย์ที่มีประสบการณ์เฉพาะทาง”
3 - 5 ธ.ค.65 Rhythm of life ฟังเพลงพ่อคลอเสียงน้ำ เขื่อนขุนด่านฯ นครนายก
3 - 5 ธันวาคม 2565 เชิญเที่ยวนครนายก ร่วมเทศกาล "ฟังเพลงพ่อคลอเสียงน้ำ ครั้งที่ 3 Rhythm of life" ณ เขื่อนขุนด่านปราการชล นครนายก มาฟังเสียงเพลง คลอไปกับเสียงน้ำตกยักษ์ที่ยิ่งใหญ่ พร้อมชิลกับรรยากาศ สบายๆ คลอเสียงเพลง และละอองน้ำ โซนกิจกรรม workshop/DIY , โซนกาแฟ พร้อมอาหารเครื่องดื่ม ของอร่อยของดีนครนายกเพียบ อากาศดีๆ เพลงเพราะ กิจกรรม จุดถ่ายรูป และของกิน
กำหนดการ
3 ธค 65
15-16 น. การแสดงดนตรีวงเล็ก
16-20 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
17-17.30 น. พิธีเปิดงาน + การแสดงจากรร.อนุบาลนครนายก
17.30-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
4 ธ.ค. 65
15-16 น. การแสดงดนตรีวงเล็ก
16-17 น. การแสดงวงอยากเล่น
16-20 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
18-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
5 ธ.ค. 65
15-16 น. การแสดงดนตรีวงเล็ก
16-21 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
18-18.20 น. พิธีจุดเทียนเพื่อพ่อ
18-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
ฟอร์มาลิน (Formalin) LINK
ฟอร์มาลิน (Formalin) หรือสารละลายฟอร์มาลดีไฮด์ (Formaldehyde) มีสูตรเคมีว่า CH2O คนทั่วไปรู้จักกันว่าเป็นสารที่ใช้สำหรับดองศพเพื่อไม่ให้ศพเน่าเปื่อย ใช้ฆ่าเชื้อโรค ฆ่าเชื้อรา และทำความสะอาดห้องคนป่วย ลักษณะทั่วไปของฟอร์มาลินเป็นสารละลายใส ไม่มีสี มีกลิ่นฉุนเฉพาะตัว เป็นสารรีดิวซ์รุนแรง เมื่อสัมผัสกับอากาศจะถูกออกซิไดส์ช้า ๆ ไปเป็นกรดฟอร์มิกซึ่งมีฤทธิ์กัดกร่อน มีค่า pH ประมาณ 2.8-4.0 รวมตัวได้กับน้ำและแอลกอฮอล์ ชื่ออื่น ๆ ของฟอร์มาลิน คือ Methanal; Formic aldehyde; Methaldehyde
ฟอร์มาลินเป็นสารที่นิยมใช้กันในหลายด้าน ในด้านการแพทย์ ใช้ในการเก็บรักษาตัวอย่างทางกายวิภาค (anatomical specimens) เพื่อคงสภาพของเนื้อเยื่อไม่ให้เน่าเสีย ใช้ฆ่าเชื้อโรคในเครื่องมือต่าง ๆ เช่น เครื่องฟอกเลือด (เครื่องล้างไต) เครื่องมือเครื่องใช้ในการเตรียมและสังเคราะห์ผลิตภัณฑ์ยา วัคซีน ไอระเหยของฟอร์มาดีไฮด์สามารถนำมาอบห้องฆ่าเชื้อโรคตามโรงพยาบาล ในการทำเครื่องสำอางจะใช้สารฟอร์มาลินในยาสีฟัน ยาบ้วนปาก สบู่ ครีมโกนหนวดเพื่อฆ่าเชื้อโรค โดยใช้เป็นส่วนประกอบในความเข้มข้นที่ต่ำมาก ใช้ในน้ำยาดับกลิ่นตัว ใช้เป็นส่วนประกอบของแชมพูสำหรับสัตว์เลี้ยง เป็นต้น ในด้านอุตสาหกรรม ฟอร์มาลินมีสมบัติทำให้ผ้าและกระดาษแข็งเกาะกัน จึงนำมาใช้ในการทำบอร์ดหรือไม้อัด อุตสาหกรรมสิ่งทอใช้ผลิตสารที่ใช้เปลี่ยนแปลงลักษณะน้ำหนักและความแข็งแรงของไหมสังเคราะห์ รักษาผ้าไม่ให้ยับหรือย่น ในอุตสาหกรรมกระดาษ ใช้เพื่อให้กระดาษลื่นและกันน้ำได้ เป็นต้น ส่วนในด้านการเกษตรใช้สารฟอร์มาลินทำลายและป้องกันจุลินทรีย์ที่ทำให้ต้นไม้เป็นโรค ใช้เก็บรักษาและป้องกันผลิตผลเกษตรจากการเสียหายระหว่างการขนส่ง ใช้ฆ่าเชื้อราในดิน ใช้เป็นส่วนผสมของสารละลายที่ใช้เคลือบผัก ผลไม้จำพวกส้มระหว่างการเก็บเกี่ยวเพื่อชะลอการเน่าเสีย เป็นต้น พ่อค้า แม่ค้า นิยมนำฟอร์มาลินมาแช่ผัก เนื้อสัตว์ และอาหารทะเลสด เพื่อทำให้อาหารต่างๆ สดอยู่ได้นานไม่เน่าเสียเร็ว แต่ก่อให้เกิดอันตรายต่อผู้บริโภค
ในกรณีที่ร่างกายได้รับฟอร์มาลินในปริมาณต่ำ ร่างกายสามารถกำจัดได้ แต่หากได้รับในปริมาณที่สูงขึ้นถึง 30 – 60 มิลลิลิตรหรือมีความเข้มข้นมากขึ้น ฟอร์มาลินจะเปลี่ยนรูปเป็นกรดฟอร์มิค (Formic acid) ซึ่งมีฤทธิ์ทำลายการทำลายของเซลล์ในร่างกาย ทำให้เซลล์ตาย ฟอร์มาลินมีพิษต่อระบบต่างๆ เกือบทั่วทั้งร่างกาย เช่น ในระบบทางเดินหายใจ หากได้รับไอระเหยของฟอร์มัลดีไฮด์ แม้จะปริมาณต่ำจะทำให้หลอดลมบวม แสบจมูก เจ็บคอ ไอ หายใจไม่ออก ปอดอักเสบ น้ำท่วมปอด ถ้าสูดดมเข้าไปมาก ๆ จะทำให้น้ำท่วมปอด จนหายใจไม่ออก แน่นหน้าอกและตายในที่สุด อาการเหล่านี้อาจเกิดขึ้นหลายชั่วโมงหลังจากได้รับสารโดยไม่มีอาการเจ็บปวด เลยก็ได้ หากได้รับปริมาณน้อยเป็นเวลานาน จะมีอาการไอและหายใจติดขัดเพราะหลอดลมอักเสบ เป็นต้น ในระบบทางเดินอาหาร เมื่อรับประทานอาหารที่ปนเปื้อนฟอร์มาลินในปริมาณมากถึง 60 -90 มิลลิลิตร จะทำให้ปวดศีรษะอย่างรุนแรง หัวใจเต้นเร็ว แน่นหน้าอก ปากและคอแห้ง คลื่นไส้อาเจียน ถ่ายท้อง ปวดท้องอย่างรุนแรง กระเพาะอาหารอักเสบ เกิดแผลในกระเพาะอาหาร หากได้รับสารนี้โดยการบริโภค จะเกิดอาการพิษโดยเฉียบพลัน ซึ่งอาการมีตั้งแต่ปวดท้องอย่างรุนแรง อาเจียน อุจจาระร่วง ปัสสาวะไม่ออก หมดสติ ถ้าปล่อยทิ้งไว้อาจเสียชีวิตเพราะระบบหมุนเวียนเลือดล้มเหลว นอกจากนี้เมื่อสัมผัสจะเกิดการระคายเคืองต่อผิวหนัง ทำให้เกิดผื่นคัน เป็นผื่นแดงเหมือนลมพิษ จนถึงผิวหนังไหม้เปลี่ยนเป็นสีขาวได้
ดังนั้นฟอร์มาลินหรือสารละลายฟอร์มาลดีไฮด์ เป็นวัตถุห้ามใช้ในอาหารตามประกาศของกระทรวงสาธารณสุข แหล่งอาหารที่มักพบฟอร์มาลินปนเปื้อน ได้แก่ อาหารทะเล เนื้อสัตว์ ผักสดและผลไม้ ถ้าผู้บริโภคสงสัยว่าอาหารที่บริโภคนั้นมีฟอร์มาลินไม่ควรซื้อมารับประทาน เพราะฟอร์มาลินเป็นสารที่มีกลิ่นฉุนมากเมื่อนำไปใส่ในอาหารดังกล่าว ผู้บริโภคจะได้กลิ่นฉุนแน่นอน ดังนั้นก่อนการรับประทานหรือประกอบอาหารควร ล้างให้สะอาดเสียก่อนเพื่อความมั่นใจและรับประทานได้อย่างปลอดภัย
วิธีการตรวจสอบว่าอาหารมีฟอร์มาลินปนเปื้อนอยู่หรือไม่ อาจใช้วิธีสังเกตง่ายๆ ได้ดังนี้ ถ้าเป็นเนื้อสัตว์ให้สังเกตว่า หากถูกแสงแดด หรือลมเป็นเวลานาน แล้วยังสดอยู่ก็ไม่ควรซื้อ ถ้าเป็นผัก ผลไม้ที่มีลักษณะแข็ง เขียว กรอบหรือสดผิดปกติ และถ้าเป็นปลา หรือกุ้งเนื้อแข็งแต่บางส่วน เปื่อยยุ่ย ไม่ควรซื้อมาประกอบอาหารเนื่องจากอาจจะได้รับอันตรายจากฟอร์มาลินที่ปน เปื้อนมาได้ ส่วนผักหรือผลไม้ ให้ดมที่ใบ หรือหักก้านดม หรือดมที่ผล ว่ามีกลิ่นแสบจมูกหรือไม่ ถ้ามีแสดงว่ามีฟอร์มาลินปนเปื้อน
สำหรับการเลือกอาหารให้ปลอดภัยจากอันตรายของฟอร์มาลิน ควรเลือกซื้อดังนี้ ถ้าเป็นเนื้อที่ไม่แช่ฟอร์มาลิน หากถูกแสงแดด หรือลม เป็นเวลานานๆ เนื้อจะมีลักษณะแห้ง และไม่เต่งตึงอยู่เหมือนเดิม ควรเลือกซื้อผักอนามัย หรือผักกางมุ้ง เลือกผักที่ไม่มีลักษณะแข็ง หรือกรอบจนเกินไป การเลือกอาหารทะเลควรเลือกอาหารที่สด เนื้อไม่เปื่อยยุ่ย สีไม่ผิดปกติ และอาหารทะเลต้องวางจำหน่ายในน้ำแข็งตลอดเวลา ที่สำคัญต้องล้างอาหารให้สะอาดก่อนการปรุงเสมอ
หากสงสัยและต้องการตรวจสอบว่าในอาหารมีฟอร์มาลินปนเปื้อนอยู่หรือไม่ ก็ทำการตรวจสอบได้โดยใช้ชุดทดสอบฟอร์มาลินในอาหาร ของกรมวิทยาศาสตร์การแพทย์ ซึ่งภายในจะมีสารเคมีสำหรับตรวจสอบ 3 ชนิดและหลอดสำหรับใช้บรรจุของเหลวที่แช่อาหาร หรือผักผลไม้ที่จะตรวจสอบ
สารเคมีที่ใช้เป็นน้ำยาสำหรับตรวจสอบ อาจใช้ น้ำยาฟอร์มาลิน 1เป็นสารละลาย Phynylhydrazine hydrochloride (C6H9ClN2) น้ำยาฟอร์มาลิน 2 ใช้สารละลาย Potassium hexacyanoferrate (K4Fe(CN6)) และน้ำยาฟอร์มาลิน 3 เป็นสารละลายกรดไฮโดรคลอริกเข้มข้น (HCl conc.) โดยทำการตรวจสอบตามคำแนะนำในชุดทดสอบ
ปลายปีหลายคนมุ่งเน้นเรื่องการเฉลิมฉลอง เตรียมจับจ่ายซื้อของเพื่อตอบสนองตนเองและครอบครัว ไม่ว่าจะเป็น เสื้อผ้า โทรศัพท์มือถือ ของฟุ่มเฟือยเพื่อเป็นของขวัญ หรืออาหาร เพื่องานเลี้ยงสังสรรค์ในช่วงเทศกาล นอกจากนี้ยังรวมไปถึงค่าใช้จ่ายในการเดินทางกลับภูมิลำเนาเพื่อกลับไปหาครอบครัว สะท้อนถึงพฤติกรรมการบริโภคเชิงบวกอย่างมาก ซึ่งในประเด็นนี้เอง คุณธีรเมศร์ นิติจรรยาวงศ์ ผู้อำนวยการฝ่ายวางแผนกลยุทธ์ บริษัท ฮาคูโฮโด อินเตอร์เนชั่นแนล (จำกัด) ได้ให้คำแนะนำเพื่อเป็นแนวทางให้แบรนด์ต่างๆ เตรียมพร้อมให้สอดคล้องกับแนวโน้มความต้องการใช้จ่ายสูงสุดในรอบสองปีนี้ว่า
โรงพยาบาลลาดกระบังกรุงเทพมหานคร LINK
โรงพยาบาลลาดกระบังกรุงเทพมหานคร เป็นโรงพยาบาลในสังกัดสำนักการแพทย์ กรุงเทพมหานคร ปัจจุบัน ได้ขยายขีดความสามารถเป็นโรงพยาบาลประเภททั่วไประดับทุติยภูมิ ขนาด 60 เตียง ประกอบด้วย หอผู้ป่วยหญิง 30 เตียง, หอผู้ป่วยชาย 20 เตียง, ห้องพิเศษ 6 ห้อง และหออภิบาลผู้ป่วยหนัก 4 เตียง และอยู่ระหว่างขยายเป็นโรงพยาบาลขนาด 200 เตียงในอนาคต
- ตั้งอยู่ที่ 2 ซอย ลาดกระบัง 15 แขวง ลาดกระบัง เขตลาดกระบัง กรุงเทพมหานคร 10520
- โทร. 0-23269995 , 02-3267711
- แผนที่
- facebook
ไอคอนสยาม ICONSIAM GLOBAL COUNTDOWN DESTINATION 2023
ในค่ำคืนของวันที่ 31 ธันวาคม 2565 ไอคอนสยามจะเนรมิตทุกพื้นที่ให้เต็มไปด้วยความอลังการ พร้อมกับเปลี่ยนทัศนียภาพริมแม่น้ำเจ้าพระยาให้สว่างไสวตระการตา การันตีความสมบูรณ์แบบของทุกรายละเอียดที่ถูกสร้างสรรค์ขึ้นได้จากการที่ทันทีที่ภาพของงาน Amazing Thailand Countdown ที่ไอคอนสยามถูกถ่ายทอดสู่ทั่วโลกผ่านสำนักข่าวระดับโลก อาทิ CNN, BBC, AP, Reuter และ ABC ฯลฯ ทุกเสียงต่างเห็นตรงกันถึงความงดงามของค่ำคืนแห่งการก้าวสู่ปีใหม่บนโค้งน้ำเจ้าพระยา สายน้ำแห่งหัวใจของคนไทยทั้งประเทศ
Thailand & Bangkok Countdown 2023 บรรยากาศ Times Square of Asia ที่เซ็นทรัลเวิลด์
ศูนย์การค้าเซ็นทรัลเวิลด์ เนรมิตบรรยากาศ Times Square of Asia เพื่อเฉลิมฉลองเทศกาลแห่งความสุขปีใหม่ Thailand & Bangkok Countdown 2023 เพื่อให้เป็นปรากฏการณ์ฉลองเคานต์ดาวน์สนั่นโลก ฉลองข้ามปีอันลิมิเต็ดกันเลย
21 – 30 ธ.ค. 65 พรีเคานต์ดาวน์กับ centralwOrld Countdown Music Festival (10 ศิลปินดัง 10 วัน 10 คืน) อาทิ DOUBLEBAM, TANGMO WALAYUPATH (The Voice All Stars), TEWTER, LULA Energized By Rockstar , PRANG KANNARUN, GOB SAOVANIT & KHELA, HYBS, NO ONE ELSE, SARAH SALOLA, PURE THE VOICE, GETSUNOVA Energized By Rockstar
31 ธ.ค. 65 มันส์อันลิมิเต็ดกับ Top 10 ศิลปินติดท็อปชาร์ตทุกอะวอร์ด 4EVE, BILLKIN, BOWKYLION, JOEYBOY, THREE MAN DOWN, NONT TANONT, OAT PRAMOTE, PP KRIT, VIOLETTE WAUTIER และเซอร์ไพรส์ศิลปินระดับโลก
7 สุดยอดไฮไลต์เคานต์ดาวน์สนั่นโลก @เซ็นทรัลเวิลด์ศูนย์อายุรวัฒน์ 1 อาคาร 9 ชั้น 9
ศูนย์อายุรวัฒน์ 1 อาคารเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา อาคาร 9 ชั้น 9
(ห้องพักเดี่ยว 11 ห้อง และห้องพักคู่ 9 ห้อง มีสวนพักผ่อนเพื่อฟื้นฟูบริการแก่ผู้สูงอายุและญาติ)
โทร. 90920, 90923
เกณฑ์การประเมิน 3 ระดับ ได้แก่ ระดับ 1 2 และ 3 โดยแต่ละระดับมีหลักเกณฑ์ดังนี้
ระดับ 1
ระดับความรู้สึกตัวปกติ
ผู้สูงอายุที่ไม่มีปัญหาด้านสุขภาพแต่อายุมาก ช่วยเหลือตัวเองได้พอสมควร ญาติไม่พร้อมให้การดูแลที่บ้าน
รับประทานอาหารได้ด้วยตนเอง ไม่มีปัญหาในการกลืน
ราคาห้องคู่ /เดือน 24,000.- บาท
ราคาห้องเดี่ยว /เดือน 45,000.- บาท
**ไม่รวมวัสดุสิ้นเปลือง, ค่ายา, กายภาพบำบัด ฯลฯ (เบิกได้ตามสิทธิ์)**
ระดับ 2
ผู้สูงอายุที่ช่วยเหลือตัวเองไม่ได้ (status bed ridden)
ต้องให้อาหารทางสายยาง - ใส่สายสวนปัสสาวะ
ต้องทำกายภาพบำบัด - ปัสสาวะขับถ่ายบนเตียง
มีแผลกดทับ - มีภาวะอ่อนแรง - ต้องพลิกตะแคงตัว
ต้องได้รับอินซูลินชนิดฉีด
ราคาห้องคู่ /เดือน 32,000.- บาท
ราคาห้องเดี่ยว /เดือน 50,000.- บาท
**ไม่รวมวัสดุสิ้นเปลือง, ค่ายา, กายภาพบำบัด ฯลฯ (เบิกได้ตามสิทธิ์)**
ระดับ 3
ผู้สูงอายุที่ช่วยเหลือตัวเองไม่ได้ (status bed ridden)
ร่วมกับมีภาวะที่ต้องการให้พยาบาลเพิ่มเติม แต่ไม่รุนแรง
จนต้องเข้ารับการรักษาในโรงพยาบาล เช่น
- on tracheostomy (เจาะคอ) ต้องดูดเสมหะเป็นระยะ
- on oxygen therapy
ต้องได้รับการประเมินน้ำตาลในเลือดเป็นระยะ (Dextrostix) ได้รับอินซูลินชนิดฉีด
ต้องให้อาหารทางสายยาง - ต้องทำกายภาพบำบัด
ราคาห้องคู่ /เดือน 38,000.- บาท
ราคาห้องเดี่ยว /เดือน 55,000.- บาท
**ไม่รวมวัสดุสิ้นเปลือง, ค่ายา, กายภาพบำบัด ฯลฯ (เบิกได้ตามสิทธิ์)**
***หมายเหตุ : รายละเอียดอื่น ๆ กรุณาติดต่อ อาคาร 9 ชั้น 9 โทร. 90920, 90923 หรือ อาคาร 2 ชั้น 9 โทร. 20920, 20921***
นพ.พิชิต กังวลกิจ ประธานเจ้าหน้าที่บริหารโรงพยาบาลธนบุรี บำรุงเมือง กล่าวว่า โรงพยาบาลธนบุรีบำรุงเมืองได้ตระหนักถึงความสำคัญของการส่งเสริมสุขภาพ แบบการป้องกันและการดูแลเมื่อเจ็บป่วยอย่างรอบด้าน โดยมีแพทย์ผู้ชำนาญการหลากหลายสาขา และนำเทคโนโลยีที่ทันสมัยด้วยการใช้ Digital transformation ที่จะเข้ามาช่วยให้การวิเคราะห์และการตรวจวินิจฉัย และรักษาได้ตรงจุดมากขึ้น สำหรับการจัดงานมหกรรมสุขภาพในวันนี้ มีวัตถุประสงค์เพื่อให้ความรู้ส่งเสริมสุขภาพ ที่ถูกต้องเพื่อให้เข้าใจโรคและการเปลี่ยนแปลงตัวเอง ทำอย่างไรจะปลอดภัยจากโรคเพื่อสุขภาพที่ดีขึ้น ป้องกันการป่วยก่อนวัย โดยมีคอนเซปต์การจัดงานชื่อ “The Power of Health Transformation -การเปลี่ยนแปลงสุขภาพที่จะทำให้คุณเป็นคนใหม่” ซึ่งภายในงานทุกท่านจะมีโอกาสได้ตรวจสุขภาพเบื้องต้นเพื่อคัดกรองปัญหาสุขภาพ ที่อาจก่อเกิดโรคในอนาคต และได้พบผู้ชำนาญการ ฟังการบรรยายเรื่องสุขภาพในด้านต่าง ๆ เปิดโอกาสสอบถามข้อสงสัยแบบใกล้ชิด
กระทรวงสาธารณสุข เป็นเจ้าภาพประชุมคณะกรรมการบริหารของโครงการโรคเอดส์ แห่งสหประชาชาติ ครั้งที่ 51
ประเทศไทย โดยกระทรวงสาธารณสุข เป็นเจ้าภาพจัดการประชุมคณะกรรมการบริหารของโครงการโรคเอดส์ แห่งสหประชาชาติ ครั้งที่ 51 เพื่อหารือภาคีเครือข่ายขับเคลื่อนทิศทางและการบริหารจัดการแผนงานเอดส์ ของโครงการโรคเอดส์แห่งสหประชาชาติ เร่งขจัดการตีตราและการเลือกปฏิบัติทุกรูปแบบ พร้อมมุ่งยุติปัญหาเอดส์ทั่วโลกภายในปี 2573
13 ธันวาคม 2565 ที่โรงแรมแชงกรี-ลา อำเภอเมือง จังหวัดเชียงใหม่ นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธานการประชุมคณะกรรมการบริหารของโครงการโรคเอดส์แห่งสหประชาชาติ ครั้งที่ 51 (The 51st UNAIDS Programme Coordinating Board Meeting : PCB) โดยมี นายแพทย์โอกาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข นายแพทย์ธเรศ กรัษนัยรวิวงค์ อธิบดีกรมควบคุมโรค นายแพทย์ณรงค์ อภิกุลวณิช รองปลัดกระทรวงสาธารณสุข นายแพทย์ณรงค์ สายวงศ์ รองปลัดกระทรวงสาธารณสุข ผู้แทนจากประเทศสมาชิก 22 ประเทศ หน่วยงาน UN Cosponsors 11 องค์กร และ องค์กรเอกชนต่างประเทศ 5 องค์กร รวมประมาณ 220 คน เข้าร่วมการประชุม
อ้างอิง
- Intawong K, et al. Heterologous third and fourth dose vaccines reduce severity and mortality in COVID-19 patients during the periods of delta and omicron predominance in Thailand. International Journal of Infectious Diseases. DOI: https://doi.org/10.1016/j.ijid.2022.11.006 Available at: https://www.ijidonline.com/article/S1201-9712(22)00593-8/fulltext?dgcid=raven_jbs_aip_email Accessed: November 2022
- WHO Good Practice Statement on the use of second booster doses for COVID-19 vaccines. Available at https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE-good-practice-statement-second-booster. Accessed: October 2022
- WHO Good practice statement on the use of variant-containing COVID-19 vaccines. Available at https://www.who.int/publications/i/item/WHO-2019-nCoV-Vaccines-SAGE-Variants-2022.1 Accessed: October 2022
- Intawong, K et al. Effectiveness of heterologous third and fourth dose COVID-19 vaccine schedules for SARS-CoV-2 infection during delta and omicron predominance in Thailand: A test-negative, case-control study. The Lancet Regional Health - Southeast Asia, 2022, https://doi.org/10.1016/j.lansea.2022.100121
- Data estimates based on model outcomes from separate analyses conducted by Airfinity and Imperial College, United Kingdom. AstraZeneca Data on File. REF-156573, 11 July 2022
- Centers For Disease Control and Prevention. Understanding Viral Vector COVID-19 Vaccines. Available at: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/viralvector.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Fcovid-19%2Fhcp%2Fviral-vector-vaccine-basics.html. Accessed: October 2022
- Burn, E et al, Thrombosis and thrombocytopenia after vaccination against and infection with SARS-CoV-2: a population-based cohort analysis. Available at: https://www.medrxiv.org/content/10.1101/2021.07.29.21261348v1.full. Accessed: October 2022
- Burn, E et al, Thromboembolic Events and Thrombosis With Thrombocytopenia After COVID-19 Infection and Vaccination in Catalonia, Spain. Available at SSRN: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3886421. Accessed: October 2022
- P. Bhuyan et al. Very rare thrombosis with thrombocytopenia after second AZD1222 dose: a global safety database analysis. Lancet. Available at: https://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(21)01693-7.pdf. Accessed: October 2022
- Laporte JR et al. Vaccines against Covid-19, venous thromboembolism, and thrombocytopenia. A population-based retrospective cohort study. Available at https://www.medrxiv.org/content/10.1101/2021.07.23.21261036v1. Accessed: October 2022
- Voysey M, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. The Lancet 2021; 397: 881-91. Accessed: July 2022.
- Falsey A, et al. Phase 3 safety and efficacy of AZD1222 (ChAdOx1nCoV-19 Vaccine. NEJM. Available at: https://www.nejm.org/doi/full/10.1056/NEJMoa2105290?query=featured_coronavirus. . Accessed: October 2022
- Flaxman A, et al. Reactogenicity and immunogenicity after a late second dose or a third dose of ChAdOx1 nCoV-19 (AZ2021D1222) in the UK: a substudy of two randomized controlled trials (COV001 and COV002). The Lancet 2021; 398: 981-90. Accessed: July 2022.
- WHO Summary of Product Characteristics. COVID-19 Vaccine AstraZeneca. December, 2021; https://www.covax.azcovid-19.com/content/dam/azcovid/pdf/covax/who-clean-smpc-azd1222-en.pdf. Accessed: October 2022
งบประมาณ ฉบับประชาชน ประจำปีงบประมาณ พ.ศ. 2566 [PDF]
เอกสารงบประมาณฉบับประชาชน ประจำปีงบประมาณ พ.ศ. 2566 ฉบับนี้ได้นำเสนอ ข้อมูลงบประมาณตามร่างพระราชบัญญัติงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2566 โดยมีการนำเสนอข้อมูลภาวะเศรษฐกิจ ประมาณการรายรับ แหล่งที่มาของรายรับ นโยบาย วงเงินและโครงสร้างงบประมาณ การจำแนกงบประมาณตามมิติต่าง ๆ รวมทั้งมีการนำเสนอ ข้อมูลประโยชน์ที่ประชาชนจะได้รับจากงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2566 ในหัวข้อ “ประชาชนได้อะไรจากงบประมาณปี 2566” - สำนักงบประมาณ พฤษภาคม 2565
ดาวน์โหลด PDF
นโยบายการจัดทำงบประมาณ ปี 2566
“เพื่อพัฒนาและฟื้นฟูประเทศจากผลกระทบของการระบาดโควิด-19 มุ่งเน้น ให้ประชาชนมีคุณภาพชีวิตที่ดี มีหลักประกันและความคุ้มครองทางเศรษฐกิจ และสังคม กลุ่มเปราะบางและผู้ด้อยโอกาสได้รับการดูแลและช่วยเหลือ จากสวัสดิการภาครัฐอย่างทั่วถึง เป็นธรรม เศรษฐกิจเติบโตอย่างต่อเนื่อง กระจายประโยชน์สู่ประชาชนทุกกลุ่ม กลุ่มฐานรากมีความเข้มแข็ง หลุดพ้น จากปัญหาความยากจนและพึ่งพาตนเองได้” โดยกำหนดแนวทางการจัดสรรงบประมาณ ดังนี้
1. น้อมนำแนวทางพระราชดำริ และ “หลักปรัชญาของ เศรษฐกิจพอเพียง”
2. สอดคล้องกับยุทธศาสตร์ชาติ และแผนในระดับต่างๆ
3. ให้ความสำคัญกับการแก้ไขปัญหา ความยากจนแบบพุ่งเป้า
4. ส่งเสริม การกระจายอำนาจให้ อปท.
5. จัดทำงบประมาณ ครอบคลุมทุกแหล่งเงิน
6. ดำเนินการตามกฎหมาย ระเบียบ และมติ ครม. ที่เกี่ยวข้อง
ค่าใช้จ่ายในการบรรเทา แก้ไขปัญหา และเยียวยา ผู้ที่ได้รับผลกระทบจากการระบาดของโรคติดเชื้อไวรัสโคโรนำ 2019
พระราชบัญญัติงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2565 มีงบประมาณรายจ่ายงบกลาง รายการค่าใช้จ่ายในการบรรเทา แก้ไขปัญหา และเยียวยาผู้ที่ได้รับผลกระทบจากการระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 โดยเฉพาะ วงเงินจำนวน 16,362.0101 ล้านบาท และภายหลังโอนเปลี่ยนแปลงงบประมาณ มีวงเงินจำนวน 16,362.0101 ล้านบาท โดยคณะรัฐมนตรีได้อนุมัติกรอบวงเงินให้ใช้จ่ายสะสม ตั้งแต่ต้นปีงบประมาณ (ตุลาคม 2564) ถึงสิ้นปีงบประมาณ (เดือนกันยายน 2565) จำนวนทั้งสิ้น 16,041.2832 ล้านบาท คิดเป็นร้อยละ 98.04 ของวงเงินงบประมาณหลังโอนเปลี่ยนแปลง โดยในช่วงไตรมาสที่ 2 มีการอนุมัติให้ใช้จ่ายในกรอบวงเงินสูงที่สุด
กรอบวงเงินที่ได้รับอนุมัติเป็นการดำเนินการในด้านต่างๆ ที่สำคัญ ส่วนใหญ่เป็นค่าตอบแทน ค่าเสี่ยงภัยในการปฏิบัติงานของบุคลากรที่เกี่ยวข้องในการปฏิบัติหน้าที่ในช่วงการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 จำนวน 14,555.6436 ล้านบาท (ร้อยละ 90.74 ของวงเงินรวมที่อนุมัติ) ที่เหลือเป็นการดำเนินการแก้ไข ชดเชย เยียวยาผู้ได้รับผลกระทบ จากสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 จำนวน 1,485.6396 ล้านบาท (ร้อยละ 9.26 ของวงเงินรวมที่อนุมัติ)
ผลการเบิกจ่าย จากระบบ GFMIS ณ 17 ตุลาคม 2565 ค่าใช้จ่ายในการบรรเทา แก้ไขปัญหา และเยียวยา ผู้ที่ได้รับผลกระทบ จากการระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 มีการเบิกจ่าย จำนวนทั้งสิ้น 14,193.0103 ล้านบาท คิดเป็นร้อยละ 86.74 ของวงเงินงบประมาณหลังโอนเปลี่ยนแปลง หรือคิดเป็นร้อยละ 88.48 ของวงเงินที่อนุมัติ
ตรวจสุขภาพก่อนแต่งงาน เตรียมความพร้อมก่อนมีบุตร ฟรี LINK
รพ.อุ้มผาง ให้บริการตรวจสุขภาพก่อนแต่งงาน เตรียมความพร้อมก่อนมีบุตร ฟรี
บริการทุกวันพุธ เวลา 8.30-12 น. ที่คลินิกพิเศษ 2 ชั้้น 3
รายการตรวจ
1.ปรึกษาแนะนำโดยแพทย์
2.ตรวจความสมบูรณ์เม็ดเลือด
3.ตรวจหาหมู่เลือด
4.ตรวจหาการติดเชื้อซิฟิลิส
5.ตรวจหาเชื้อและภูมิคุ้มกันเอชไอวี
6.ตรวจหาความเสี่ยงโรคธาลัสซีเมีย
7.ตรวจหาเชื้อและภูมิคุ้มกันไวรัสตับอักเสบ บี
สอบถามโทร 055-561270 ต่อ 169 ฝ่ายส่งเสริมสุขภาพชุมชน
รางวัลชนะเลิศอันดับ 1 ทีม Healthy UFU Super App
รางวัลชนะเลิศอันดับ 1 ได้แก่ทีม Healthy UFU Super App กับผลงาน แพลตฟอร์มระบบบริการส่งเสริมสุขภาพผู้ป่วยที่บ้านและชุมชนเชิงคุณค่า และได้รับเงินรางวัลมูลค่า 50,000 บาท
ศ. นพ. กุลวี เนตรมณี ผู้อำนวยการสถาบันโรคหัวใจบำรุงราษฎร์
ศ. นพ. กุลวี เนตรมณี ผู้อำนวยการสถาบันโรคหัวใจบำรุงราษฎร์ และผู้อำนวยการสถาบันวิจัยหัวใจเต้นผิดจังหวะ แปซิฟิกริม ลอสแองเจลีส สหรัฐอเมริกา เปิดเผยว่า “ย้อนไปสัก 7-8 ปีที่แล้ว ผู้บริหารบำรุงราษฎร์ได้ทาบทามผม ซึ่งในขณะนั้นบำรุงราษฎร์มีความพร้อมในทุกด้านแล้ว แต่ยังมีอีกสิ่งที่ต้องการพัฒนาให้มากขึ้น คือ ‘การวิจัย’ เพื่อส่งเสริมให้ ‘สถาบันโรคหัวใจ’ เกิดการดูแลรักษาที่ดีที่สุดให้กับผู้ป่วยในภูมิภาคของเราหรือผู้ป่วยในระดับสากล และมุ่งมั่นเพื่อก้าวสู่ผู้นำโรงพยาบาลเอกชนของประเทศไทยที่ทัดเทียมกับมาตรฐานโลก จึงได้นำโมเดลของสถาบันวิจัยของผมที่สหรัฐอเมริกา มาสร้างที่โรงพยาบาลบำรุงราษฎร์ แต่ได้มีการพัฒนามากขึ้นไปอีกและต่อเนื่องมาจนถึงปัจจุบัน”
ศ. นพ. กุลวี เนตรมณี ผู้อำนวยการสถาบันโรคหัวใจบำรุงราษฎร์ LINK
ศ. นพ. กุลวี เนตรมณี ผู้อำนวยการสถาบันโรคหัวใจบำรุงราษฎร์ และผู้อำนวยการสถาบันวิจัยหัวใจเต้นผิดจังหวะ แปซิฟิกริม ลอสแองเจลีส สหรัฐอเมริกา ผู้นำโมเดลของสถาบันวิจัยจากสหรัฐอเมริกา มาสู่โรงพยาบาลบำรุงราษฎร์ เพื่อยกระดับ "การวิจัย" ให้มีการพัฒนาขึ้นสู่ระดับสากล และยกระดับทัดเทียมกับมาตรฐานโลก
พัทยาจัดอบรม Smart Senior โรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข..รุ่น 1 LINK
13 ธ.ค. 65 ณ ห้องประชุมทัพพระยา ศาลาว่าการเมืองพัทยา นายศิวัช บุญเกิด รองปลัดเมืองพัทยา เป็นประธานเปิดอบรมโรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข..รุ่น 1 “ดนตรี & ศิลปะ เพื่อสร้างเสริมสุขภาพแบบองค์รวม” ซึ่งมีผู้สูงอายุเข้าร่วมอบรมฯ จำนวน 100 คน
สำนักสาธารณสุขและสิ่งแวดล้อม ร่วมกับ ศูนย์สร้างเสริมสุขภาวะผู้สูงอายุเมืองพัทยาจัดโครงการส่งเสริมสุขภาพแบบองค์รวม สำหรับผู้สุงอายุเมืองพัทยา ตามนโยบาย Smart Senior ซึ่งเป็นโครงการที่ทำให้ผู้สูงอายุมีความสมาร์ทขึ้น วันนี้เมืองพัทยาได้จัดอบรมโรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข..รุ่น 1 เกี่ยวกับ“ดนตรี & ศิลปะ เพื่อสร้างเสริมสุขภาพแบบองค์รวม” เพื่อเป็นพื้นที่เรียนรู้สำหรับผู้สูงอายุ สามารถถ่ายทอดประสบการณ์ ภูมิปัญญา วัฒนธรรมท้องถิ่น เป็นเอกลักษณ์ของชุมชน และยังเป็น "เวที" เปิดโอกาสให้มีส่วนร่วมทำประโยชน์ และอาจเป็นแรงผลักดัน ร่วมเป็นอาสาสมัครในชุมชน มีทักษะด้านอาชีพ สร้างงาน สร้างรายได้ มีสังคม มีสุขภาพแข็งแรงกระจับกระเจง ลดการพึ่งพาผู้อื่น ช่วยคลายเหงา ภาคภูมิใจในตัวเอง มีสัมพันธภาพกับคนวัยเดียวกันและต่างวัย รู้เท่าทัน มีการปรับตัวและดำเนินชีวิตได้อย่างเหมาะสมต่อไป
ศูนย์เวลเนส ที่ผ่านการรับรอง (รอบแรกธันวาคม 2565)
1.ซี ซีคเกอร์ กระบี่ รีสอร์ท (Sea Seeker Krabi Resort)
ประเภทที่พักนักท่องเที่ยว
เลขที่ 963 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : +66 75 817777
2.ณสุข เวลเนส รีสอร์ท (Na Sook Wellness Resort )
ประเภทที่พักนักท่องเที่ยว
เลขที่ 199 หมู่ที่ 5 หมู่บ้าน/อาคาร - ซอย อ่าวน้ำเมาพัฒนา4 ถนน - แขวง/ตำบล ไสไทย เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 075680411
3.ณสุข เวลเนส รีสอร์ท(Na Sook Wellness Resort)
ประเภทภัตตาคาร ร้านอาหาร
เลขที่ 199 หมู่ที่ 5 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล ไสไทย เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 075680411
4.บริษัท เวสต์ แลนด์ เฮิร์บ (ไทยแลนด์) จำกัด(West land herb (Thailand) CO.,LTD)
ประเภทสถานพยาบาล
เลขที่ 127 หมู่ที่ 5 แขวง/ตำบล แคมป์สน เขต/อำเภอ เขาค้อ จังหวัด เพชรบูรณ์ รหัสไปรษณีย์ 67280
เบอร์โทรศัพท์ : 0840404440
5.บริษัท แอนติ เอจิ้ง กรุงเทพ จำกัด(Bangkok Anti-Aging Center)
ประเภทสถานพยาบาล
เลขที่ 3 ซอย ประมวลสุข ถนน สุทธิสารวินัจฉัย แขวง/ตำบล สามเสนนอก เขต/อำเภอ เขตห้วยขวาง จังหวัด กรุงเทพมหานคร รหัสไปรษณีย์ 10310
เบอร์โทรศัพท์ : 022772818
6.ปาหนัน กระบี่ รีสอร์ท(Panan Krabi Resort)
ประเภทที่พักนักท่องเที่ยว
เลขที่ 945 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : +66 (0) 75 817 788
7.รีฟ บีช คลับ กระบี่(REEVE Beach Club Krabi)
ประเภทภัตตาคาร ร้านอาหาร
เลขที่ 31/1 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 093 631 7599
8.ร้านอาหารสยามบราสเซอรี(Siam Brasserie Restaurant )
ประเภทภัตตาคาร ร้านอาหาร
เลขที่ 3477 ถนน พระราม9 แขวง/ตำบล สวนหลวง เขต/อำเภอ เขตสวนหลวง จังหวัด กรุงเทพมหานคร รหัสไปรษณีย์ 10250
เบอร์โทรศัพท์ : 02-308-8388
9.วังยาว ริเวอร์ไซด์ รีสอร์ท (Wang Yao Riverside Resort )
ประเภทที่พักนักท่องเที่ยว
เลขที่ 314 หมู่ที่ 3 ถนน สาริกา - นางรอง แขวง/ตำบล สาริกา เขต/อำเภอ เมืองนครนายก จังหวัด นครนายก รหัสไปรษณีย์ 26000
เบอร์โทรศัพท์ : 0661217525
10.ศูนย์การแพทย์บูรณาการแอ็บโซลูทเฮลธ์ (Absolute Health Regenerative Medicine)
ประเภทสถานพยาบาล
เลขที่ 53 หมู่ที่ - หมู่บ้าน/อาคาร อาคารUrbis ชั้น 3 ซอย ซ.ร่วมฤดี ถนน ถ.เพลินจิต แขวง/ตำบล ลุมพินี เขต/อำเภอ เขตปทุมวัน จังหวัด กรุงเทพมหานคร รหัสไปรษณีย์ 10330
เบอร์โทรศัพท์ : 02-651-5988
ความสามารถด้านการประหยัดพลังงานของอาคาร
การลดการใช้พลังงานและลดการทำลายชั้นบรรยากาศ
- ใช้น้ำเย็นจากกระบวนการเปลี่ยนสถานะก๊าซธรรมชาติเหลว(LNG) ของโครงการมาทำความเย็นให้กับกัระบบปรับอากาศของอาคารเพื่อพื่ทดแทนการใช้น้ำเย็นย็จากเครื่องทำน้ำเย็น (Chiller)
- อาคารสามารถลดการใช้พลังลังานไฟฟ้ารวมได้ถึง 43%เมื่อมื่เทียบกับกัอาคารทั่วไป
- ใช้พลังงานทดแทนจากSolarCellได้ถึง 6% (155,232kWh/year) จากประมาณการการใช้ไฟฟ้าตลอดทั้งปี
- มีการติดตั้งระบบควบคุมคุอาคารอัตโนมัติ (Building Automation System : BAS) สำหรับตรวจสอบ เก็บข้อมูลศัยภาพอาคารและควบคุมจากส่วนกลางได้เพื่อเอื้อต่อการบริหารจัดการอาคารและปรับแต่งระบบให้ประหยัดพลังงานในระหว่างใช้งานอาคาร
การป้องกันผลกระทบต่อสิ่งแวดล้อมโดยรอบโครงการ
- มีมาตรการป้องกันการสร้างมลภาวะต่อสิ่งแวดล้อมตลอดการก่อสร้าง ทั้งมลภาวะทางน้ำ เช่น ป้องกันการกัดกร่อนของพื้นดิและการตกตะกอนของดินและทางอากาศ เช่น การป้องกันกัฝุ่นละออง
- มีพื้นที่คัดแยกขยะตามแต่ละประเภท เช่น ขยะเปียก ขยะอันตราย กระดาษ โลหะ แก้วและพลาสติก เพื่อพื่ส่งเสริมการนำกลับมาใช้ใหม่หรือรีไซเคิล
- จัดวางเครื่องระบายความร้อนของระบบปรับอากาศห่างจากที่ดินดิข้างเคียงมากกว่า 4 เมตร เพื่อไม่ให้ก่อเกิดความเดือดร้อนต่อต่สภาพแวดล้อมใกล้เคียง
- เลือกใช้กระจกที่มีการสะท้อนแสงน้อยกว่า15% เพื่อลดการสะท้อนแสงซึ่งส่งผลต่อพื้นที่ข้างเคียง
- มีการติดตั้งมิเตอร์ไฟฟ้าที่ระบบบำบัดน้ำเสียเพื่อสามารถตรวจสอบได้ว่าระบบบำบัดน้ำเสียทำงานตลอดเวลา
คุณภาพสภาวะแวดล้อมภายในอาคาร
- มีระบบเติมอากาศบริสุทธ์เพื่อให้ภายในอาคารมีคุณภาพอากาศที่ดี
- ไม่อนุญาตให้สูบบุหรี่ภายในอาคารโดยกำหนดให้ มีจุดสูบอยู่ห่างจากอาคารมากกว่า 10 เมตร
- ติดตั้งพรมดักฝุ่นบริเวณทางเข้าอาคาร เพื่อลดมลภาวะที่จะเข้ามาในอาคาร
- ติดตั้งแผ่นกรองอากาศในระบบปรับอากาศ เพื่อลดมลภาวะภายนอกอาคารอาคารที่ระดับ MERV13
- ออกแบบระบบปรับอากาศให้เกิดสภาวะน่าสบายแก่ผู้ใช้งาน ตามมาตรฐานสากล (ASHRAE55-2004)
- ออกแบบแสงสว่างที่เพียงพอต่อประเภทการใช้งานตามมาตรฐานสมาคมไฟฟ้าแสงสว่างแห่งประเทศไทย
- ออกแบบให้มีโคมไฟส่วนตัว (TASKLIGHTING) ที่สามารถควบคุมแสงสว่างได้อย่างอิสระบริเวณพื้นที่ทำงานของผู้ใช้งานประจำ
- ใช้พรมสำหรับภายในอาคารที่มีสารพิษต่ำ
- ใช้วัสดุประเภทกาวยาแนวสีและสารเคลือบที่มีสารพิษต่ำ (LOW-VOC)
- ใช้ไม้ที่ไม่มีส่วนผสมของ UREA-FORMALDEHYDE หรือ เป็น E0MATERIAL
วัสดุและทรัพยากรในการก่อสร้าง
- มีการบริหารจัดการขยะที่เกิดจากการก่อสร้าง โดยสามารถนำขยะไปรีไซเคิลหรือใช้ซ้ำได้มากกว่า 90% ของปริมาณขยะทั้งหมด
- ใช้วัสดุรีไซเคิลมากกว่า 20% ของมูลค่าวัสดุก่อสร้าง
- ใช้วัสดุพื้นถิ่นหรือวัสดุภายในประเทศมากกว่า 30% ของมูลค่าวัสดุก่อสร้าง
การลดการทำลายชั้นบรรยากาศ
- ใช้สารดับเพลิงที่ไม่เป็นพิษต่อสิ่งแวดล้อม (ไม่มีส่วนผสมของสาร CFC, HCFC และ HALON)
- ใช้สารทำความเย็นในระบบปรับอากาศที่ไม่ทำลายชั้นบรรยากาศ (ไม่ใช่สาร CFC, HCFC-22)
การประหยัดน้ำ
- เลือกใช้สุขภัณฑ์ประหยัดน้ำ โดยสามารถลดการใช้น้ำได้ถึง 54.72% จากอาคารทั่วไป
- มีบ่อหน่วงน้ำขนาดใหญ่สำหรับกักเก็บน้ำฝน โดยน้ำฝนที่เก็บได้จะถูกใช้เพื่อรดน้ำต้นไม้ภายในโครงการ
พื้นที่สีเขียวและพื้นที่โล่งเชิงนิเวศของโครงการ
- มีพื้นที่สีเขียวถึง 66% ของพื้นที่เปิดโล่งเชิงนิเวศของโครงการ ซึ่งเป็นพื้นที่ซึมน้ำช่วยลดปัญหาน้ำท่วม
- ตัวอาคารปกคลุมด้วยหลังคาเขียวเพื่อป้องกันความร้อนเข้าสู่ตัวอาคาร และลดการเกิดปรากฎการณ์เกาะความร้อน (URBAN HEAT ISLAND)
- โครงการมีการปลูกไม้ยืนต้นมากกว่า 1 ต้น ต่อพื้นที่โล่ง 100 ตารางเมตร
สนับสนุนการใช้รถยนต์ประหยัดพลังงาน
- จัดให้มีช่องจอดเฉพาะและมีอุปกรณ์ชาร์จ สำหรับรถยนต์ไฟฟ้า (EV CHARGER)
ของขวัญปีใหม่ จากกระทรวงการคลัง กลุ่มที่ 1 มาตรการภาษีและค่าธรรมเนียม


- มาตรการ “ช้อปดีมีคืน ปี 2566” หักลดหย่อนค่าซื้อสินค้าหรือค่าบริการตามจำนวนที่จ่ายจริง แต่ไม่เกิน 40,000 บาท โดยแบ่งเป็น (1) ค่าซื้อสินค้าหรือค่าบริการ จำนวนไม่เกิน 30,000 บาท (ใบกำกับภาษีแบบกระดาษหรืออิเล็กทรอนิกส์) (2) ค่าซื้อสินค้าหรือค่าบริการ จำนวนไม่เกิน 10,000 บาท (เฉพาะใบก ากับภาษีอิเล็กทรอนิกส์)
- มาตรการลดค่าธรรมเนียมจดทะเบียนสิทธิ และนิติกรรมสำหรับที่อยู่อาศัยปี 2566 ลดค่าจดทะเบียนการโอนอสังหาริมทรัพย์จากร้อยละ 2 เหลือร้อยละ 1 และค่าจดทะเบียนการจำนอง อสังหาริมทรัพย์จากเดิม ร้อยละ 1 เหลือร้อยละ 0.01 สำหรับการซื้อขายที่อยู่อาศัย ได้แก่ บ้านเดี่ยว บ้านแฝด บ้านแถว อาคารพาณิชย์ และห้องชุด (ทั้งบ้านมือ 1 และมือ 2) เฉพาะที่มีราคาซื้อขายและราคาประเมินทุนทรัพย์ ไม่เกิน 3 ล้านบาท และวงเงินจ านองไม่เกิน 3 ล้านบาท ต่อสัญญา
- มาตรการลดภาษีที่ดินและสิ่งปลูกสร้าง ปี 2566 ลดภาษีให้ในอัตราร้อยละ 15 ของจำนวน ภาษีที่คำนวณได้สำหรับการจัดเก็บภาษี ที่ดินและสิ่งปลูกสร้างของปีภาษี พ.ศ. 2566
- มาตรการปรับลดอัตราภาษีสรรพสามิตสำหรับน้ำมัน เชื้อเพลิงเครื่องบินไอพ่นที่นำไปใช้เป็น เชื้อเพลิงสำหรับอากาศยานภายในประเทศ ลดอัตราภาษีตามปริมาณของน้ ามันเชื้อเพลิงสำหรับ เครื่องบินไอพ่นที่ใช้บินในประเทศ จากลิตรละ 4.726 บาท เหลือลิตรละ 0.20 บาท โดยมีผลบังคับใช้ตั้งแต่วันที่ 1 มกราคม ถึง 30 มิถุนายน 2566
- มาตรการยกเว้นค่าธรรมเนียมการอนุญาต ขายสุรา ยาสูบ และไพ่ ตามพระราชบัญญัติ ภาษีสรรพสามิต พ.ศ. 2560 ให้สิทธิยกเว้นค่าธรรมเนียมใบอนุญาตขายสุรา ยาสูบ และไพ่ ประเภทที่ 1 และประเภทที่ 2 สำหรับผู้ประกอบการที่ประสงค์จะประกอบกิจการ ต่อเนื่อง ณ สถานประกอบการเดิม ประเภทใบอนุญาตเดิมที่ยื่นคำขอ ระหว่างวันที่ 1 มกราคม ถึง 31 ธันวาคม 2566
กระทรวงการต่างประเทศ (กต.)
กต. มอบของขวัญปีใหม่ ปี 2566 ให้แก่ประชาชน ดังนี้
1. การให้บริการหนังสือเดินทางด่วนภายในวันเดียว (ทำเช้า รับบ่าย) โดยไม่เสียค่าธรรมเนียมเล่มด่วน ตั้งแต่วันที่ 3 - 13 มกราคม 2565 (ยกเว้นวันเสาร์ - อาทิตย์ และวันหยุดราชการ)
2. การให้บริการหนังสือเดินทางวันหยุดสุดสัปดาห์ (วันเสาร์ - อาทิตย์) ตลอดปี 2566 ณ สำนักงานหนังสือเดินทางชั่วคราวปทุมวัน (ศูนย์การค้า MBK Center) และบางใหญ่ (ศูนย์การค้า Central Plaza West Gate) ทั้งในรูปแบบบูธปกติและเครื่องทำหนังสือเดินทางด้วยตัวเอง (kiosk) จำนวน 20 เครื่อง
3. การให้บริการกงสุลสัญจร “ของขวัญตลอดปี” เพื่อให้บริการหนังสือเดินทางเคลื่อนที่ในพื้นที่ต่างจังหวัดทั่วประเทศ เดือนละ 1 ครั้ง รวม 12 ครั้ง ตลอดปี 2566 เพื่อบริการประชาชนในพื้นที่จังหวัดที่ไม่มีสาขาสำนักงานหนังสือเดินทางตั้งอยู่
4. การให้บริการแปลเอกสารภาษาอังกฤษ โดยไม่คิดค่าบริการ (จำกัดคนละ 1 เอกสาร โดยต้องเป็นเอกสารของตัวเองและเอกสารนั้นแปลเพื่อทำนิติกรณ์เอกสารเท่านั้น) ตั้งแต่วันที่ 3 - 31 มกราคม 2566 (วันจันทร์ - ศุกร์) ณ กรมการกงสุล ถนนแจ้งวัฒนะ สำนักงานหนังสือเดินทางชั่วคราวภูเก็ตและเชียงใหม่ เพื่อลดภาระค่าใช้จ่ายแก่ประชาชนในการจัดจ้างเอกชนแปลเอกสาร
5. การบริการรถทะเบียนเคลื่อนที่ของกรุงเทพมหานคร ณ กรมการกงสุล โดยเปิดให้บริการรถทะเบียนเคลื่อนที่กรุงเทพมหานคร (Bangkok Mobile Service) 3 - 31 มกราคม 2566 (วันจันทร์ - ศุกร์) ณ ลานจอดรถกรมการกงสุล ถนนแจ้งวัฒนะ เพื่อให้บริการทำบัตรประชาชนใหม่ และคัดสำเนาเอกสารทะเบียนราษฎรภาษาไทยและอังกฤษ 3 ประเภท ได้แก่ ทะเบียนบ้าน (ทร.14/1) สูติบัตร และมรณบัตร
อาจารย์ นายแพทย์สุขสันต์ กนกศิลป์ อาจารย์ประจำหลักสูตรฉุกเฉินการแพทย์ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ กล่าวว่า “เพราะการเจ็บป่วยไม่ได้เกิดเฉพาะโรงพยาบาล ความช่วยเหลือ ณ จุดเกิดเหตุ จึงสำคัญมากเพราะจะทำให้ผู้ป่วยมีอัตราการรอดชีวิตได้สูงกว่า”
การผลิตบัณฑิตฉุกเฉินการแพทย์ จะมีทักษะความรู้ความสามารถในระดับผู้ประกอบโรคศิลปะสาขาฉุกเฉินการแพทย์ ซึ่งจะครอบคลุมทั้งด้านคุณธรรม จริยธรรม และเจตคติที่ดี มีความรู้เกี่ยวกับข้อเท็จจริง หลักการ ทฤษฎี และแนวปฏิบัติต่าง ๆ ที่เกี่ยวข้องกับการแพทย์ฉุกเฉิน โดยเฉพาะอย่างยิ่งความรู้ทางกฎหมายที่เกี่ยวข้องกับการปฏิบัติงานฉุกเฉิน ระบบสุขภาพของประเทศไทย ระบบการแพทย์ฉุกเฉินของประเทศไทยและนานาชาติ หลักการพื้นฐานด้านระบบคุณภาพและความปลอดภัยของผู้ป่วย รวมทั้งมาตรฐานการปฏิบัติการฉุกเฉิน รวมถึงจะมีทักษะ ความสามารถปฏิบัติงาน ซึ่งนักปฏิบัติการฉุกเฉินการแพทย์ควรทำได้เมื่อได้รับมอบหมาย ประกอบด้วย ทักษะด้านกระบวนการคิด (Cognitive Skills) ทักษะการหยั่งรู้และความคิดสร้างสรรค์ (Logical, Intuitive and Creative Thinking) หรือทักษะการปฏิบัติ/วิธีปฏิบัติที่มีความคล่องแคล่วและความชำนาญในการปฏิบัติตามกรอบคุณวุฒิแห่งชาติได้อย่างดีเยี่ยม รวมทั้งได้พัฒนาคุณภาพและมาตรฐานของหน่วยปฏิบัติการและสถานพยาบาลที่เป็นแหล่งฝึกปฏิบัติการ เรียนรู้วิธีการจัดการศึกษารูปแบบใหม่ ซึ่งผลิตบัณฑิตได้ตรงต่อความต้องการของผู้ใช้ที่สุด ด้วยการสร้างและพัฒนาเครือข่ายความร่วมมือระหว่างผู้ผลิตและผู้ใช้บัณฑิต สามารถต่อยอดการผลิตนักฉุกเฉินการแพทย์เฉพาะทางได้ และพัฒนาต้นแบบของรูปแบบการศึกษาแนวใหม่ในการผลิตบัณฑิตสายวิชาชีพด้านสุขภาพ ที่เป็นสาขาขาดแคลนของประเทศ
อัพเดตผู้เสียชีวิตไฟไหม้บ่อนปอยเปต
AI ปัญญาประดิษฐ์ในการแพทย์สุขภาพ
ประเมินกันว่าขนาดของตลาดอุตสาหกรรมการแพทย์สุขภาพอันเกี่ยวโยงกับการใช้ AI ปัญญาประดิษฐ์ โดยเฉพาะ ด้าน Machine Learning (ML - กลไกการเรียนรู้ของโปรแกรมด้วยตัวเองมันเอง) จะขยายขึ้นมาแตะระดับ 20 ล้านเหรียญสหรัฐในปี 2023 ด้วยการนำเอา AI มาประยุกต์ใช้ในรูปแบบที่หลากหลายและกว้างขวางมากขึ้น โดยเฉพาะที่เด่นชัดมากใน 3 สาขา ดังนี้
Computer Vision - ศาสตร์ที่ใช้ในการทำให้คอมพิวเตอร์เข้าใจภาพนิ่งหรือภาพเคลื่อนไหว (วิดีโอ) ในลักษณะเดียวกับการมองเห็นของมนุษย์ เพื่อประมวลผล วิเคราะห์ สิ่งที่คอมพิวเตอร์เห็น ให้ออกมาเป็นข้อมูลและนำไปใช้ต่อได้ ในเชิงการคิดวิเคราะห์ ประเมิน พยากรณ์ หรือตัดสินใจก็ตาม ซึ่งแน่นอนว่าศาสตร์ computer vision นี้มีประโยชน์อย่างยิ่งยวดต่อด้านการแพทย์ การมองเห็นร่างกายมนุษย์ ชิ้นส่วนอวัยวะและการทำงาน วิเคราะห์โรค หาสาเหตุเพื่อไปสู่วิธีการรักษาได้ รวมถึงความสามารถในการสร้างแบบจำลองสำหรับการศึกษาเรียนรู้ของแพทย์ต่อการรักษาโรค ได้เป็นต้น
Natural Language Processing - การประมวลภาษาธรรมชาติ หรือ NLP เป็นศาสตร์ที่ศึกษาการปฏิสัมพันธ์ระหว่างภาษาคอมพิวเตอร์และภาษา (ธรรมชาติ) มนุษย์ ในเชิงที่โปรแกรมคอมพิวเตอร์สามารถดำเนินการวิเคราะห์และแปลงข้อมูลภาษาธรรมชาติได้
Pattern Recognition Algorithms - การรู้จำแบบ เป็นศาสตร์ที่มีจุดประสงค์ในเพื่อการจำแนก วัตถุ (objects) ออกเป็นประเภท (classes) ตาม รูปแบบ (pattern) ของวัตถุ โดยในการคำนวณจะมีการใช้เทคนิคจากสาขาอื่น ๆ มากมาย เช่น การประมวลผลสัญญาณ ปัญญาประดิษฐ์ และสถิติ คำว่า "รูปแบบ" (pattern) ในที่นี้หมายถึง รูปร่าง หรือ คุณลักษณะ ของวัตถุ ที่เราสนใจ โดยวัตถุนั้นอาจเป็น รูปธรรม หรือ นามธรรม ก็ได้ หรือจะเป็นรูปแบบ ที่กระจายบนพื้นที่ หรือ เปลี่ยนแปลงตามเวลา ก็ได้
จริงๆ แล้วระบบ AI ทั้ง 3 สาขาที่กล่าวถึง ได้ถูกนำมาใช้สักระยะหนึ่งแล้ว สำหรับปัจจุบันคือการจับตาดูต่อว่าการจะประยุกต์ใช้จะก้าวไปสู่อีกระดับได้อย่างไร หรือตอบโจทย์กับอุตสาหกรรมที่โฟกัสลงไปในประเด็นเฉพาะได้อย่างไร
ตัวอย่างที่น่าสนใจ อาทิเช่น การนำ AI มาใช้อุตสาหกรรมยา เพื่อการค้นคว้าทดลองหายาชนิดใหม่ๆ โดย AI จะช่วยในการประมวลผลและคาดการณ์ผลลัพธ์จากการทดลองทางคลินิก วิเคราะห์ผลข้างเคียงหรืออื่นๆ ได้ อย่างหลากหลายและครอบคลุม ในเวลาที่น้อยลงได้
หรือ การใช้ระบบคอมพิวเตอร์วิชั่นวิเคราะห์ภาพเอ็กซเรย์ หรือภาพสแกน เพื่อวินิจฉัยโรค หรือตรวจจับสัญญาณ เพื่อหาโรคร้ายอย่างพาร์คินสัน หรืออัลไซเมอร์ เป็นต้น
ไม่เพียงแต่การแพทย์ระดับสูงที่ซับซ้อน แต่ AI ยังนำมาประยุกต์ใช้ในระดับทั่วไป อย่างเช่น การประเมินความเสี่ยงในการทำประกัน ประวัติการรักษาพยาบาล การวิเคราะห์สุขภาพ หรือตัวอย่างที่เราคงคุ้นกัน คือ อุปกรณ์สวมข้อมือที่ข้างในจะมีระบบตรวจจับข้อมูลร่างกายในทุกด้านเอาไว้ เพื่อให้เรารู้ข้อมูลตัวเอง และสามารถจัดเก็บนำไปใช้ประโยชน์ในด้านอื่นๆ ต่อไปได้นั่นเอง
คู่มือ 10 Things Tourists need to know about cannabis in Thailand LINK
สำหรับคู่มือ 10 Things Tourists need to know about cannabis in Thailand มีดังนี้
1.Carrying Seeds Or Parts Of The CANNABIS Plant From And To Thailand For Personal Purposes Are Not Permitted.
2.CANNABIS Cultivation Is Legal But Registering In The Food And Drug Administration’s "Plook Ganja" Application Or Through Government Website Is Required.
3.Using CANNABIS Flower Buds For Research, Export, Sale, And Processing For Commercial Purposes Requires Official Permit.
4.Individuals Under 20 Years Old, Pregnant Women And Breastfeeding Women Are Not Eligible To Use CANNABIS Except Under The Supervision Of Health Professionals.
5.Possession Of Extract Containing More Than 0.2% THC And Synthetic THC Requires Permission.
6.CANNABIS Contained Dishes Are Available In Authorized Restaurants.
7.Approved CANNABIS Health Products Are Accessible Through Specific Channels.
8.Smoking CANNABIS In Public Spaces, Including Schools And Shopping Malls, Is Illegal.
9.Avoid Driving After Consuming Food Or Health Products Containing CANNABIS.
10.Those Who Have Serious Undesirable Health Outcomes From Consuming CANNABIS Should Promptly See Doctors For Treatment.
รพ.ราชธานี สั่งพักงาน17คน แก๊งพยาบาล ดื่มเหล้าคารพ. สาวในคลิปชิงลาออกแล้ว
3 ม.ค. ที่โรงพยาบาลราชธานี จ.พระนครศรีอยุธยา นายเอนก มุ่งอ้อมกลาง ผอ.สำนักงานป้องกันโรคที่ 4 จ.สระบุรี ผู้แทนสภาพยาบาลประจำจังหวัด พร้อมด้วย นพ.ชัชรินทร์ ปิ่นสุวรรณ ผอ.โรงพยาบาลราชธานี คณะผู้บริหาร ร่วมกันประชุมสอบสวนข้อเท็จจริงเหตุการณ์ที่เกิดขึ้น
นพ.ชัชรินทร์ กล่าวว่า ทางโรงพยาบาลรู้เสียใจกับเหตุการณ์ที่เกิดขึ้น ที่ปรากฏการแสดงที่ไม่เหมาะสมเกิดขึ้นในสถานพยาบาล เหตุการณ์ดังกล่าวเกิดขึ้นเมื่อวันที่ 30 ธ.ค.65 เวลาประมาณ 17.00 น. ทันที่เราทราบเรื่องและเห็นปรากฏตามสื่อโซเชียล เราได้ตรวจสอบข้อเท็จจริงทันทีในเบื้องต้น ซึ่งเป็นช่วงของวันหยุด มีบุคลากรการทางการแพทย์ เจ้าหน้าที่อยู่ในเหตุการณ์ทั้งหมด 17 คน สั่งพักงานทันที พร้อมกับหาข้อเท็จจริง วันนี้เป็นวันทำงานจึงได้สอบข้อเท็จจริงจากผู้เกี่ยวข้องอีกครั้งเกือบครบถ้วนสมบูรณ์แล้ว ทุกคนที่ปรากฏในคลิปเป็นการกระทำที่ผิดไม่เหมาะสม กระทบต่อสถานพยาบาลและกลุ่มเพื่อร่วมวิชาชีพเดียวกัน ตัวน้องพยาบาลที่อยู่ในความเครียดอย่างมากและขอแสดงความเสียใจ พร้อมขอโทษผู้เกี่ยวข้อง และแสดงรับผิดชอบด้วยการลาออกแล้ว [
Dailynews]
ผลตรวจวิเคราะห์แอลกอฮอล์ในเลือด
ผลตรวจจากทั้งหมด 538 ตัวอย่าง
- 49% เกินกฏหมายกำหนด
- 51% ไม่เกินกฏมายกำหนด
หลักเกณฑ์พิจารณาว่าเมาสุรา
อายุต่ำกว่า 20 ปีบริบูรณ์ หรือมีใบอนุญาตขับรถชั่วคราวหรือมีใบขับขี่สำหรับรถประเภทอื่นหรือไม่มีใบอนุญาตขับขี่ หรือถูกพักใบอนุญาต เกิน 20 mg% ให้ถือว่าเมาสุรา
อายุ 20 ปีบริบูรณ์ ขึ้นไป เกิน 50 mg% ให้ถือว่าเมาสุรา
แยกตามเพศ
- หญิง 16..54%
- ชาย 83.27%
- ไม่ระบุ 0.19%
สภาวะผู้ประสบอุบัติเหตุ
- เสียชีวิต 10.41%
- บาดเจ็บ 70.07%
- ไม่ระบุ 19.52%
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส เขตกรุงเทพมหานคร
รหัสสาขา 05251 ตลาดบัญญัติทรัพย์ จุด 2
รหัสสาขา 08319 ลาดพร้าว 25
รหัสสาขา 12193 พหลโยธิน 47
รหัสสาขา 02729 พหลโยธิน 26
รหัสสาขา 08279 ชัยกูลทาวเวอร์
รหัสสาขา 12093 ชุมชนศักดิ์มงคลชัย
รหัสสาขา 10403 ศรีนครินทร์ 27 (Modernform)
รหัสสาขา 13440 พัฒนาการ 38 (กลางซอย)
รหัสสาขา 11310 ปุณณวิถี 28
รหัสสาขา 04875 อาคารไทยศรี
รหัสสาขา 15374 เอกชัยศาลธนบุรี
รหัสสาขา 13365 สมาร์ท คอนโด พระราม 2
รหัสสาขา 13295 พัฒนาการตัดใหม่
รหัสสาขา 13064 ศรีนครินทร์ 57
รหัสสาขา 00396 ตลาดเพิ่มทรัพย์
รหัสสาขา 08090 หทัยราษฏร์ 37
รหัสสาขา 04345 รามอินทรา19 (ท้ายซอย)
รหัสสาขา 07014 ลาซาล 61
รหัสสาขา 07369 ตากสิน 39
รหัสสาขา 05601 ลาซาล (สุขุมวิท 105)
รหัสสาขา 15690 พุทธมณฑลสาย 2 ซอย 18
รหัสสาขา 09883 ประชาอุทิศ 17 (ยอดทอง)
รหัสสาขา 13115 เจริญราษฎร์ตัดใหม่
รหัสสาขา 09290 แบริ่งมอลล์
รหัสสาขา 13197 ไปรษณีย์บางนา
รหัสสาขา 02454 เทพลีลา (ราม39)
รหัสสาขา 15766 รัชดาภิเษก 32
รหัสสาขา 16145 รามคำแหง 50
รหัสสาขา 15113 ม.นิรันดร์วิลล์ 4 (ราม 2)
รหัสสาขา 16864 พัฒนาการ 44
รหัสสาขา 05369 พัฒนาการ 30 จุด 3
รหัสสาขา 06533 ทุ่งครุพลาซ่า
รหัสสาขา 11104 อ่อนนุช 24
รหัสสาขา 03382 วัฒนานันท์
รหัสสาขา 09413 เนียมอุทิศ จุด 2
รหัสสาขา 04415 ศรีดินแดง 2
รหัสสาขา 09141 ซอยสันติสุข (ถ.พิชัย)
รหัสสาขา 11170 ร่วมพัฒนา
รหัสสาขา 02948 เสริมสุข
กรุงเทพมหานคร
- รพ.กล้วยน้ำไท โทร. 027692000 ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- Better Being Hospital โทร. 026628464
- สถาบันจิตเวชศาสตร์สมเด็จเจ้าพระยา โทร. 024422500 จิตเวชผู้ใหญ่/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์
- โรงพยาบาลตากสิน โทร. 024370123 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- คลินิกกิจกรรมบำบัด KIDS PLUS สาขาเสนาเฟสท์ โทร. 0868944475 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.นพรัตน์ราชธานี โทร. 025481000
- รพ.สินแพทย์ โทร. 027935099
- รพ.เดอะซีเนียร์ โทร. 020014452
- บริษัท ออตโต บ๊อก เซาท์ อีสต์ เอเซีย จำกัด โทร. 025878799 ทำเครื่องดาม อุปกรณ์ช่วย
- รพ.บางปะกอก9อินเตอร์เนชั่นเนล โทร. 021099111 ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รร.รุ่งอรุณ โทร. 028707512 กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- สถาบันราชานุกูล โทร. 022488900 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ
- ศูนย์การศึกษาพิเศษส่วนกลาง โทร. 022474685-6
- รพ.วชิรพยาบาล โทร. 022443000
- สถาบันกัลยาณ์ราชนครินทร์ โทร. 024416100 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ ปรับพฤติกรรมเด็ก/ จิตเวชผู้ใหญ่/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์
- รร.อนุบาลจารุเวช โทร. 024480518 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ
- รร.นานาชาติ the village โทร. 028883337 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ
- Empowered kids โทร. 0811923046 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ
- รพ.สมเด็จพระปิ่นเกล้า หน่วยงานเวชศาสตร์ฟื้นฟู โทร. 024600000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Adaptive Environment
- สาขากิจกรรมบำบัด ภาควิชาเวชศาสตร์ฟื้นฟู คณะแพทยศาสตร์ศิริราชพยาบาล โทร. 024197508 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pressure Garment/ การยศาสตร์/ Adaptive Environments/ Community Rehab/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.ศิริราช (สาขาเวชศาสตร์ฟื้นฟูเด็ก) โทร. 024197516, 024199849
- รพ.ศิริราช (ภาควิชากุมารเวชศาสตร์) โทร. 024195960
- รพ.ศิริราช (สาขาจิตเวชเด็กและวัยรุ่น) โทร. 024197422
- รพ.ศิริราช ปิยมหาราชการุณย์ โทร. 024191000
- คลินิกกิจกรรมบำบัด KIDS PLUS สาขาปิ่นเกล้า โทร. 0911103545 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.เจ้าพระยา โทร. 024341111 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.เวชธานี โทร. 027340000
- สถาบันกระตุ้นพัฒนาการรพีพรรณ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ปิยะเวท โทร. 021295555 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ เตรียมความพร้อมการพูด/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.ผู้สูงอายุบางขุนเทียน โทร. 024527999 ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Pallitive Care/ Adaptive Environments/ Community Rehab/ เตรียมความพร้อมการพูด/ กระตุ้นพัฒนาการ/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.เจริญกรุงประชารักษ์ โทร. 022897000
- คลินิกการประกอบโรคศิลปะ สาขากิจกรรมบำบัด คิดส์ ไลฟ์ อินทิเกรชั่น โทร. 0909619473 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- Hugglory Play Co.,Ltd โทร. 0820253952 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ราชพิพัฒน์ โทร. 024212222 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Pallitive Care/ Community Rehab/ เตรียมความพร้อมการพูด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.เกษมราษฎร์ประชาชื่น โทร. 029101600
- รพ.กล้วยน้ำไท 2 โทร. 023994259
- สถานพยาบาลผู้ป่วยเรื้อรังกล้วยน้ำไท 2 โทร. 023994259-63
- รพ.ไทยนครินทร์ โทร. 023407777
- รพ.ทหารเรือกรุงเทพ กรมแพทย์ทหารเรือ โทร. 024752406 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Adaptive Environments/ Community Rehab/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.มนารมย์ โทร. 027259595 ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Community Rehab/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ จิตเวชผู้ใหญ่/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- ศูนย์กายภาพบำบัด มหิดล โทร. 0635205151 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- Kidsplus สาขาปิ่นเกล้า โทร. 0852533644 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.เลิดสิน โทร. 023539800 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.จุฬาลงกรณ์ สภากาชาดไทย โทร. 026494000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pressure garment/ Adaptive Environments/ Community Rehab/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.ตำรวจ โทร. 022076000 ฟื้นฟูแขนและมือ/ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง
- รพ.สิรินธร โทร. 023286900 ต่อ 11463 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/Cardiac Rehab/ การยศาสตร์/ Pallitive Care/ Community Rehab/ ฟื้นฟูผู้ป่วยบกพร่องการได้ยิน/ ฟื้นฟูผู้ป่วยบกพร่องการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ จิตเวชผู้ใหญ่/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- ศูนย์กระตุ้นพัฒนาการเด็กพิเศษสมาทร์คิดส์ โทร. 0891222203 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- คลินิกกิจกรรมบำบัด KIDS PLUS HeadQuarter โทร. 0868885375 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.สินแพทย์ ศรีนครินทร์ โทร. 020068888 ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.วิภาราม โทร. 020322550, 027222500 กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.กลาง โทร. 022208000
- รพ.ทหารผ่านศึก โทร. 026449400
- รพ.พญาไท โทร. 024671111
- รพ.พญาไท 2 โทร. 022716700
- รพ.วิชัยยุทธ โทร. 022657777 ผูู้ป่วยกาย ผู้สูงอายุ เด็ก จิต
- north light center for special needs children (ศูนย์เพื่อเด็กพิเศษแสงเหนือ) โทร. 022714455 Adaptive Environments/ ฟื้นฟูผู้ป่วยบกพร่องการได้ยิน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.เปาโล พหลโยธิน โทร. 022717000 ผู้ป่วยทางกาย พัฒนาการเด็ก จิตเวช วันรุ่นและผู้ใหญ่
- รร.อนุบาลพัสวี โทร. 023931567
- The senizens stroke rehab โทร. 024120999 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pallitive Care/ เตรียมความพร้อมการพูด/ จิตเวชผู้ใหญ่/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- บ้านสมถวิลดูแลผู้สูงอายุ โทร. 0830799438
- คิดส์ลัคคลินิก โทร. 020001508 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- สถาบันประสาทวิทยา โทร. 02-306-9899 ต่อ 3271 ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ เตรียมความพร้อมการพูด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุสมองเสื่อมตามวัย
- สถาบันสุขภาพเด็กแห่งชาติมหาราชินี 1415 ต่อ 61424 ,61418 ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pressure garment/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ราชวิถี โทร. 022062900 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Adaptive Environments/ เตรียมความพร้อมการพูด
- สถาบันสุขภาพจิตเด็กและวัยรุ่นราชนครินทร์ โทร. 02-2488999 ฟื้นฟูผู้ป่วยบกพร่องการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.พระมงกุฎเกล้า โทร. 027639300 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ กระตุ้นพัฒนาการ
- รพ.รามาธิบดี ม.มหิดล โทร. 022011000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย
- ศูนย์การแพทย์เทพรัตน์ รพ.รามาธิบดี โทร. 022003000
- รพ.พญาไท 1 โทร. 022014600
- Century care and rehabilitation center โทร. 0957132222 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยหลอดเลือดสมอง/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- บ้านพัฒนาการครูอ้อ โทร. 0818455414
- Little world special centre Co.Ltd
- รพ.บำรุงราษฎร์ โทร. 020668888 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสีื่อม อัลไซเมอร์
- รพ.สมิติเวช โทร. 020222222
- รพ.สุขุมวิท โทร. 023910011
- ATOC Learning Center โทร. 027117156
- รพ.สมิติเวช ศรีนครินทร์ โทร. 020222222 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Adaptive Environments/ ฟื้นฟูผู้ป่วยบกพร่องการได้ยิน/ ฟื้นฟูผู้ป่วยบกพร่องการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- คลินิกกิจกรรมบำบัดออมพลอย โทร. 0844669122 กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- คลินิกกิจกรรมบำบัด 7Senses โทร. 0959561740
- รพ.เซนหลุยส์ โทร. 02-8385555 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pallitive Care/ กระตุ้นพัฒนาการ
- Raintree International School โทร. 0632308000 กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ภูมิพลอดุลยเดช โทร. 025347000
- รพ.บีแคร์ เมดิคอลเซ็นเตอร์ โทร. 025324444
- รพ.เวชการุณย์รัศมิ์ โทร. 029884100 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pallitive Care/ เตรียมความพร้อมการพูด/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.จุฬาภรณ์ โทร. 026494000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pressure garment/ Adaptive Environments/ เตรียมความพร้อมการพูด
- รพ.กรุงเทพ โทร. 023103000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.กรุงเทพ (Bangkok mental health rehabilitation and recovery center) โทร. 023103000 or 1719
- รพ.ปิยเวท โทร. 021295555
- รพ.พระราม 9 โทร. 022029999
- Golden Year Nursing Home โทร. 026930733 ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
ภูมิภาคเอเชียแปซิฟิกคือผู้นำด้านข้อมูลสารสนเทศ เทคโนโลยี AI และการวิเคราะห์แนวโน้มล่วงหน้า
ผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิก จัดอยู่ในอันดับต้นของโลกที่ให้ความสำคัญด้านข้อมูลสารสนเทศต่อองค์กร โดยร้อยละ 82 เห็นด้วยว่าการลงทุนในด้านข้อมูลสารสนเทศมีความคุ้มค่า ทั้งในแง่ของเวลาและทรัพยากร เท่ากับสถิติของประเทศสหรัฐอเมริกา และสูงกว่าค่าเฉลี่ยทั่วโลก (ร้อยละ 65) และทวีปยุโรป (ร้อยละ 60) อย่างมีนัยสำคัญ
โดยเฉพาะอย่างยิ่งระบบสาธารณสุขของสิงคโปร์ที่นำหน้าประเทศอื่นๆ ให้ความสำคัญกับด้านข้อมูลสารสนเทศถึงร้อยละ 91 ซึ่งมากกว่าค่าเฉลี่ยทั่วโลกที่ร้อยละ 65 ในขณะที่ประเทศอินโดนีเซียและออสเตรเลียให้ความสำคัญกับด้านข้อมูลสารสนเทศถึงร้อยละ 82 และร้อยละ 75 ตามลำดับ ระดับความเชื่อมั่นในการใช้ข้อมูลสารสนเทศในภูมิภาคเอเชียแปซิฟิกนั้นสูงเช่นกัน โดยส่วนมากกล่าวว่าพวกเขาสามารถนำข้อมูลมาใช้งานได้จริงจากข้อมูลที่มีอยู่ถึงร้อยละ 85 และสามารถเข้าถึงเทคโนโลยีที่จำเป็นเพื่อใช้ประโยชน์จากข้อมูลได้ถึงร้อยละ 84 และเชื่อมั่นอย่างมากในความแม่นยำของข้อมูลในองค์กรถึงร้อยละ 82
ประเทศต่างๆ ในภูมิภาคเอเชียแปซิฟิกเห็นพ้องต้องกันถึงความสำคัญของการลงทุนด้านเทคโนโลยี AI และเทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้าภายใน 3 ปี โดยร้อยละ 55 ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ได้ลงทุนไปแล้วจำนวนมากในเทคโนโลยี AI ในขณะที่ร้อยละ 82 คาดการณ์ว่าการลงทุนด้าน AI จะเป็นการลงทุนมากที่สุดภายใน 3 ปีข้างหน้า และเมื่อสำรวจถึงจุดประสงค์ของการลงทุนด้านเทคโนโลยี AI พบว่าลงทุนเพื่อใช้สนับสนุนการวินิจฉัยด้านคลินิกมากที่สุดถึงร้อยละ 35 รวมถึงการใช้งานเพื่อวินิจฉัยหรือให้คำแนะนำในการรักษา การส่งสัญญานเตือนล่วงหน้า การตรวจหาโรคแบบอัตโนมัติ และแนวทางการตัดสินใจด้านคลินิก นอกจากนี้ ยังต้องการใช้เทคโนโลยี AI ในการคาดการณ์ผลลัพธ์ถึงร้อยละ 34 และใช้เพื่อรวบรวมข้อมูลการวินิจฉัยร้อยละ 33 ตามลำดับ
กิจกรรมวันเด็ก โรงพยาบาลนวเวช LINK
วันเด็กแห่งชาติ ขอเชิญเด็กๆ และผู้ปกครองเข้าร่วมสนุกกับกิจกรรม Children’s Day 2023 Share & Fun ในวันที่ 14 มกราคม 2566 พบกับกิจกรรมปลุกจินตนาการไปกับ Kids เพื่อโลก และสนุกกับมายากลรับลูกโป่งจากพี่ Bozo ณ บริเวณ Lobby ชั้น 1 เวลา 09.00-15.00 น. โรงพยาบาลนวเวช
สายด่วน 1441 ปรึกษาคดีออนไลน์เบื้องต้น หรือแชทบอท หมวดขวัญดาว LINK
ปรึกษาคดีออนไลน์เบื้องต้น ติดต่อดังนี้
- ปรึกษากับเจ้าหน้าที่โดยตรงรบกวนติดต่อ สายด่วน 1441 หรือ 081-8663000
- แอดไลน์@police1441 เพื่อปรึกษาผ่านแชทบอท "หมวดขวัญดาว"
หมวดขวัญดาว เป็นแชทบอท (Chatbot) หรือเรียกว่า ระบบตอบแชทอัตโนมัติ (Auto-reply) เป็นซอฟแวร์หุ่นยนต์ ที่ถูกพัฒนาขึ้นมาเพื่อช่วยตอบคำถาม เป็นประเภทแชทบอทเบื้องต้น แบบกดเมนู หรือกดปุ่ม (Menu/button-based chatbots) ใช้งานง่าย และไม่ซับซ้อน แชทบอทจะส่งปุ่มให้เลือกสอบถามตามความต้องการ เน้นเป็นคำถามพบบ่อยๆ
คลินิกอายุรกรรม
คลินิกอายุรกรรม ตรวจรักษาโรคอายุรกรรมทั่วไป ไม่ว่าจะเป็นโรคเบาหวาน, ความดันโลหิตสูง, โรคไขมันในเลือดสูง, โรคไต, โรคปอด รวมถึงโรคผู้สูงอายุ ทั้งยังมีแพทย์เฉพาะทางตรวจรักษาโรคหัวใจ โรคข้อ โรคทางเดินอาหาร โรคเลือดและโรคมะเร็ง
เปิดให้บริการทุกวันจันทร์ - ศุกร์
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์อุบัติเหตุและฉุกเฉิน - ไม่ว่าจะเป็นใคร เวลาใด สถานที่ไหน หรือสถานการณ์ใด เราพร้อมเสมอเพื่อผู้ป่วย
Tel: 052 089 823
Call Center: 1719
ศูนย์อุบัติเหตุและฉุกเฉิน " เปิดให้บริการตลอด 24 ชั่วโมง "
ศูนย์แห่งความเป็นเลิศทางด้านอุบัติเหตุและฉุกเฉิน โรงพยาบาลกรุงเทพเชียงใหม่ได้ออกแบบและพัฒนาความพร้อมในการดูแลผู้ป่วยอุบัติเหตุฉุกเฉินที่พร้อมให้บริการได้ทันที ตลอด 24 ชั่วโมงทุกวัน ด้วยหน่วยอภิบาลเคลื่อนที่ (Mobile ICU) ที่ประกอบด้วยทีมแพทย์เวชศาสตร์ฉุกเฉิน พยาบาล และเจ้าหน้าที่ที่มีความเชี่ยวชาญในการดูแลผู้ป่วยอุบัติเหตุและฉุกเฉิน สามารถให้การรักษาเบื้องต้นได้ทันที ณ จุดเกิดเหตุ เพื่อรักษาชีวิตและลดความเสี่ยงภาวะทุพพลภาพ การดูแลรักษาทุกขั้นตอนเป็นไปตามมาตรฐานสากล ตั้งแต่การปฐมพยาบาล การเคลื่อนย้ายและส่งต่อผู้ป่วยไปยังโรงพยาบาลอย่างรวดเร็ว เพื่อให้ผู้ป่วยได้รับการรักษาต่อเนื่อง ตลอดจนการฟื้นฟูสมรรถภาพร่างกายและจิตใจ จนผู้ป่วยสามารถกลับไปใช้ชีวิตได้อย่างปกติ
ในทุกวันเรายังมุ่งมั่นพัฒนาขีดความสามารถและความพร้อมในการให้บริการรักษาผู้ป่วยที่ต้องการความช่วยเหลือฉุกเฉิน ไม่ว่าจะเป็นทางบก หรือทางอากาศ ที่ศูนย์อุบัติเหตุและฉุกเฉินโรงพยาบาลกรุงเทพเชียงใหม่ เราสามารถให้บริการเฮลิคอปเตอร์ด้านการแพทย์ฉุกเฉิน ให้บริการด้านเวชศาสตร์การบินเพื่อช่วยชีวิต และเคลื่อนย้ายผู้ป่วยวิกฤติที่มีความจำเป็นต้องได้รับการเคลื่อนย้ายอย่างรวดเร็วและกระทบกระเทือนน้อย ด้วยเฮลิคอปเตอร์เครือข่ายบริษัทกรุงเทพดุสิตเวชการ ที่ภายในติดตั้งอุปกรณ์ช่วยเหลือผู้ป่วยครบชุด เทียบเท่าหรือเหนือกว่าห้องไอซียูทั่วไป นอกเหนือจากนี้ เรายังมีทีมแพทย์เฉพาะทางทุกสาขา ที่สามารถร่วมให้การดูแลรักษาแก่ผู้ป่วยได้ทันที ทุกระบบ อันประกอบด้วย
แพทย์เวชศาสตร์ฉุกเฉิน
แพทย์เวชบำบัดวิกฤต
ศัลยแพทย์อุบัติเหตุ
ศัลยแพทย์ทั่วไป
ศัลยแพทย์ประสาท
ศัลยแพทย์หลอดเลือด
ศัลยแพทย์หัวใจและทรวงอก
ศัลยแพทย์กระดูกและข้อ
ศัลยแพทย์ตกแต่งใบหน้าและกระดูกหน้า
สูตินรีแพทย์
วิสัญญีแพทย์
รังสีแพทย์
ปรับปรุง OPD ให้ดูทันสมัย
"ปรับปรุง OPD ให้ดูทันสมัยโล่งสบายตารวมทั้งจัดระบบเพื่อให้บริการให้ดีขึ้นมีพี่วีระ วรุณไพจิตร พี่สุมิตร เพชราภิรัตน์ และ Wang Fa Chang ช่วยบริจาคคนละ 1 ล้าน รวมสามล้านด้วยครับ โย่ว"
ในงานมีอะไรมาแสดงบ้าง
ดูรายการแสดงที่แนบมา บอกเลยว่าน่าสนใจไปหมด ต้องจัดตารางดีๆ เคลียร์คิวให้ว่างๆ เผื่อไว้ก่อนเลย ติดตาม/เช็คอัพเดตเรื่อยๆ ได้ที่
ผู้บริโภคที่เคยไปใช้บริการ หรือถูกหลอกลวง แจ้ง บก.ปคบ. ที่ Line : @cppd4
สำหรับผู้บริโภคที่เคยไปใช้บริการกับคลินิกเหล่านี้ หรือถูกหลอกลวง แอบอ้าง หรือเสียหายจากผลิตภัณฑ์ซิลิโคนเถื่อน สามารถติดต่อ กก.4 บก.ปคบ. ได้ ที่ Line : @cppd4 หรือสแกน QR Code เพื่อทาง บก.ปคบ. ได้เตรียมทีมสอบสวนเพื่อรองรับและจะได้นัดหมายเพื่อรับคิวเข้าไปให้ข้อมูลต่อ บก.ปคบ.ต่อไป
ซิลิโคนแท่งที่ใช้ในการเสริมจมูก/คาง
ซิลิโคนแท่งที่ใช้ในการเสริมจมูก/คาง จะมี 2 รูปแบบ (ภาพด้านบน) คือ
1. มาเป็นแผ่นใหญ่ แล้วให้ศัลยแพทย์นำไปตัดแบ่ง/เหลาเองในแต่ละเคส
2. แบบสำเร็จรูป ทำเป็นรูปทรงมาเรียบร้อยแล้ว
สำหรับกรณีที่ 1 หากซิลิโคนมาแบบเป็นแผ่นใหญ่ ควรจะมี ชื่อบริษัท และเลข LOT/serial number อยู่ที่ package ของแผ่นใหญ่ ที่มาจากโรงงาน ซึ่งหากศัลยแพทย์ตัดแบ่งเป็นชิ้นย่อยๆ แล้วจะต้องนำซิลิโคนไป sterile ก่อนใช้ในการผ่าตัดแต่ละเคสแล้ว โดยใน pack sterile ย่อยๆ เหล่านั้น ควรจะต้องมีเลข LOT แยกออกมาในแต่ละชิ้นแบบชัดเจนด้วย
แผนกอุบัติเหตุ – ฉุกเฉิน พร้อมให้บริการ 24 ชั่วโมง
นพ.วันชัย วงศ์อิศเรศ สาขาเชี่ยวชาญ ด้านศัลยศาสตร์ทั่วไป (General Surgeon) ตารางแพทย์ออกตรวจ จันทร์-ศุกร์ 8-17 น. พร้อมให้บริการดูแลประชาชน
สอบถาม Tel : 045-959683
โรงพยาบาลแพทย์รังสิต
โรงพยาบาลแพทย์รังสิต เปิดให้บริการอย่างเป็นทางการ ในวันที่ 9 มกราคม พ.ศ 2529 เป็นโรงพยาบาลเอกชนแห่งแรก ในจังหวัดปทุมธานี และเนื่องด้วยการเติบโตอย่างรวดเร็วของโรงพยาบาลแพทย์รังสิต เพื่อรองรับผู้มารับบริการตั้งแต่อดีตจนถึงปัจจุบัน โดยให้การบริการด้านสุขภาพอย่างครบวงจร การดูแลรักษากลุ่มผู้ป่วยอุบัติเหตุฉุกเฉิน โรคทั่วไป รวมถึงจัดตั้งศูนย์ไตเทียม ศูนย์หัวใจ และต่อมาได้สร้างกลุ่มรพ.เครือข่าย โดยมีทีมแพทย์ชำนาญการ เพื่อรับและส่งต่อผู้ป่วย จนเป็นสถานพยาบาลที่สำคัญในการดูแลรักษาโรคหัวใจของชาวจังหวัดปทุมธานีและจังหวัดใกล้เคียง
โรงพยาบาลมีความมุ่งมั่นพัฒนาอย่างต่อเนื่อง ทำให้เรามีจำนวนผู้บริการโดยเฉพาะสิทธิ์ประกันสังคม เพิ่มมากขึ้นในทุกๆปี และเล็งเห็นว่าจังหวัดปทุมธานี เป็นเมืองแห่งโอกาสในการพัฒนาคุณภาพชีวิต การจ้างงานที่มากขึ้น และเพื่อสนับสนุนคุณภาพชีวิตที่ดีและยืนยาวของชาวจังหวัดปทุมธานีและบริเวณใกล้เคียง เราจึงได้มีการขยายขีดความสามารถด้านการป้องกัน ดูแล รักษา และฟื้นฟู จนได้รับรางวัล สถานพยาบาลในดวงใจ จากสำนักงานประกันสังคม
กำหนดการเลือกตั้ง
กำหนดตรวจนับคะแนนเลือกตั้ง วันที่ 13 มกราคม 2566 เวลา 09.00 น. เป็นต้นไป ณ บริเวณหน้าห้องประชุมสิริวัฒนภักดี ชั้น 3 อาคารมหิตลาธิเบศร ซอยสาธารณสุข 8 กระทรวงสาธารณสุข ถนนติวานนท์ อำเภอเมือง จังหวัดนนทบุรี
การลงคะแนน
มี 2 วิธี
1. E-Vote (สำหรับผู้ที่แสดงความจำนงแล้ว)
เริ่ม 1 พฤศจิกายน 2565 เวลา 09.00 น.
ปิดรับลงคะแนน 12 มกราคม 2566 เวลา 16.30 น.
โทร. 02-590-1887 , 099-498-4509
2. ทางไปรษณีย์ (วิธีเดิม) เริ่ม 1 พฤศจิกายน 2565
ส่งบัตรลงคะแนนเลือกตั้งมายัง สำนักงานเลขาธิการแพทยสภา
ชั้น 12 อาคารมหิตลาธิเบศร ซอยสาธารณสุข 8 กระทรวงสาธารณสุข ถ.ติวานนท์ ต.ตลาดขวัญ อ.เมือง จ.นนทบุรี 11000
ให้ส่งทางไปรษณีย์เท่านั้น
ปิดรับบัตรลงคะแนน 12 มกราคม 2566 เวลา 16.30 น.
ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย Royal College of Surgeons of Thailand
ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย
Royal College of Surgeons of Thailand
อาคารเฉลิมพระบารมี 50 ปี เลขที่ 2 ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
โทรศัพท์ : 0-2716-6141-3 โทรสาร : 0-2716-6144
https://www.rcst.or.th/th/น้ำกัญชายันฮี น้ำดื่มอารมณ์ดี มีวิตามิน สดชื่น สบาย สบาย
น้ำดื่มอารมณ์ดี ยันฮีขวดเขียว น้ำกัญชาผสมวิตามิน กลิ่นลาเวนเดอร์ มิกซ์ เบอร์รี่ ไม่มีน้ำตาล รสชาติอร่อย หอมกลิ่นลาเวนเดอร์ มิกซ์ เบอร์รี่ น้ำดื่มอารมณ์ดี มีวิตามิน…สดชื่น สบาย สบาย
拉贾维蒂医院
拉贾维蒂医院
开放报名,预约在线排队(online)
第一剂辉瑞疫苗和加强剂
外国游客 12岁及以上
接受 COVID-19 疫苗的服务费
- 门诊费 300.- 泰铢
- 注射费 80.- 泰铢
- 辉瑞疫苗费 1,000.- 泰铢
- 总计 1,380.- 泰铢
仅每周五可注射
(无预约请带护照)
(公众假期除外)
- 时间 08.30 - 13.30
- 在疫苗接种大楼 (体育馆旁边的旧食堂)Rajavithi医院
笔记 :
- 1. 每周五上午8:30-下午2:00注射疫苗(下午1:30停止进场)
- 2. 联系疫苗接种大楼登记处的工作人员。 (体育馆旁边的旧食堂)
- 3. 出示护照(Passport)或网上预订的登记证明 (如果通过二维码预订)在接受服务之前
- 4. 在指定时间获得服务。 或提前15分钟来
- 5. 公众假期不提供服务。
CBS Valuation Innovators
ศ.(กิตติคุณ) ดร.กุณฑลี รื่นรมย์ และ ผศ.ดร.เอกก์ ภทรธนกุล แห่งภาควิชาการตลาด คณะพาณิชยศาสตร์และการบัญชี จุฬาฯ ทั้ง 2 ท่านเป็นผู้คิดค้นระบบ CBS Valuation ซึ่งเป็นเครื่องมือที่วัดมูลค่าแบรนด์องค์กร
กิจกรรมทำชาคอมบูฉะ และไวน์โฮมเมด
สายการบิน flydubai
ฟลายดูไบ flydubai เป็นสายการบินต้นทุนต่ำของสหรัฐอาหรับเอมิเรตส์ รัฐบาลดูไบได้ก่อตั้งฟลายดูไบในปีค.ศ. 2008 ได้รับการสนับสนุนการปฏิบัติการจากเอมิเรตส์ สายการบิน flydubai มีท่าหลักที่ท่าอากาศยานนานาชาติดูไบ โดยให้บริการจากอาคารผู้โดยสารที่ 2 ฟลายดูไบให้บริการเที่ยวบิน 94 เส้นทางใน 46 ประเทศภายในภูมิภาคตะวันออกกลาง, เอเชีย, และยุโรปจากดูไบ
สายการบิน flydubai มี่เครื่องบินประจำการในฝูงบิน โบอิง 737-800 จำนวน 33 ลำ โบอิง 737 MAX 8 จำนวน 27 ลำ และ โบอิง 737 MAX 9 จำนวน 3 ลำ รวม 63 ลำ
*ภาพจาก
flydubai.com/ ผู้มีใบขับขี่มีคนละไม่เกิน 12 คะแนน
ไม่ว่าจะเป็นใบขับขี่รถประเภทใด (รถยนต์ จักรยานยนต์ รถขนส่ง) เริ่มต้นและมีคนละไม่เกิน 12 คะแนน
* ไม่ตัดคะแนนนิติบุคคล
ปฏิกิริยาจากทุกสารทิศ
ต่อกรณีคำสั่งย้ายสายฟ้าแลบ หน่วยงานองค์กรหลายแห่ง แสดงปฏิกิริยาอย่างมาก
"อนุทิน" ปฏิเสธ ไม่เกี่ยวการโยกย้าย "นพ.สุภัทร" ThaiPBSศูนย์ข่าวภาคใต้ LINK
แรงกระเพื่อมในวงการเสื้อกาวน์ จากคำสั่งย้ายนายแพทย์สุภัทร ฮาสุวรรณกิจ ผู้อำนวยการโรงพยาบาลจะนะ จังหวัดสงขลา เพราะต้องยอมรับว่า ที่ผ่านมา บทบาทของหมอสุภัทรมีทั้งการเคลื่อนไหวทางสังคม การเคลื่อนไหวทางการเมือง ตลอดเส้นทาง 24 ปีที่อยู่ที่โรงพยาบาลจะนะสงขลา
หมอสุภัทร มองว่า กระทรวงสาธารณสุขออกแบบระบบไว้เป็นอย่างดี ก็คือตำแหน่งผู้อำนวยการโรงพยาบาลชุมชน เป็นตำแหน่งผู้เชี่ยวชาญวิชาการระดับ C9 ไม่ใช่ตำแหน่งผู้บริหาร ถือว่าเป็นตำแหน่งสูงสุด จึงไม่มีวาระการย้าย เพราะต้องการให้ทำงานในชุมชนนั้นนานๆ มีความใกล้ชิดกับชาวบ้านในพื้นที่ ผู้อำนวยการโรงพยาบาลชุมชนจำนวนมากจึงอยู่ในตำแหน่งนี้จนเกษียณอายุราชการ และตัวคุณหมอสุภัทรเองก็คิดแบบนั้น ยืนยันว่าจะยังรับราชการต่อไปโดยจะยื่นอุทธรณ์คำสั่งโยกย้ายต่อศาลปกครองตามมาตรา 157 เพราะมองว่าเป็นคำสั่งที่คุณหมอไม่ได้รับความเป็นธรรม การไปทำงานที่โรงพยาบาลสะบ้าย้อยก็ไม่มีปัญหาอะไร เพียงค่าเดินทางไกลขึ้น จะแสดงความคิดเห็นที่เกี่ยวข้องกับกระทรวงสาธารณะสุข และนโยบายกัญชา เหมือนเดิม
"ยังจะเป็นข้าราชการต่อไป การเป็นข้าราชการยังมีความหมายมากมายสำหรับผม แต่ต้องเป็นข้าราชการแบบที่ยังเป็นตัวตนแบบเรา ยังให้ความเห็นต่อสาธารณะแบบเดิมต่อไป ผมก็ยังจะพูดเรื่องจะนะ ผมยังพูดเรื่องชุมชน ผมยังจะพูดเรื่องกัญชาเสรี ไม่ใช่สิ่งที่ถูกต้อง เห็นความไม่เป็นธรรมในกระทรวงสาธารณสุข หรือในระบบ ผมก็ยังจะให้ความเห็น ไม่ว่าจะเป็นผู้อำนวยการที่นี่หรือที่ไหน ผมก็อยากจะทำสิ่งที่ผมทำอยู่เหมือนเดิม และผมก็ทำได้"
"ขอยืนยันว่า การโยกย้าย คุณหมอสุพัฒน์ ฮาสุวรรณกิจ ที่กำลังเป็นที่วิพากษ์วิจารณ์ กันอยู่ตอนนี้ โดยตัวคุณหมอเอง ผมก็ทราบจากข่าวที่กระจายออกไปเท่านั้นเอง ผมไม่ได้มีส่วนเกี่ยวข้อง ไม่ได้มีการให้แนวทางหรือใดใดทั้งสิ้น เพราะว่าเรื่องการโยกย้ายระดับผู้อำนวยการโรงพยาบาลชุมชนเนี่ย มันไม่ใช่อำนาจของรัฐมนตรี แล้วรัฐมนตรีคงไม่ได้มีความสามารถอะไรที่จะไปประเมิน ว่าเค้าสมควรถูกย้ายหรือไม่ถูกย้าย เพราะว่ามันเป็นเรื่องของราชการประจำเค้า ไม่เกี่ยวกับผมเลย" อนุทิน ชาญวีรกูล รัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวในข่าว
ThaiPBS
ขั้นตอนปกติการโยกย้ายผู้อำนวยการโรงพยาบาล สำนักงานสาธารณสุขจังหวัดโดยคณะกรรมการพัฒนาสาธารณสุขจังหวัด จะร่วมกันพิจารณาเมื่อมีตำแหน่งว่าง ว่าจะให้ใครไปเป็นผู้อำนวยการโรงพยาบาลไหน จากนั้นก็จะนำเข้าคณะกรรมการที่มีผู้ตรวจราชการของกระทรวงเป็นประธาน ซึ่งผู้ตรวจราชการมีอำนาจในการโยกย้ายได้โดยตรง
บำรุงราษฎร์ ตั้งเป้าสู่ปีแห่งความเป็นเลิศ (Year of Excellence)


ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ เปิดเผยว่า “บำรุงราษฎร์ ในฐานะโรงพยาบาลเอกชนชั้นนำของประเทศไทย ประกาศตั้งเป้าสู่ปีแห่งความเป็นเลิศ (Year of Excellence) ในงานแถลงข่าวปี 2566 และพร้อมมุ่งมั่นเพื่อก้าวสู่จุดหมายแห่งการดูแลสุขภาพและสุขภาวะที่น่าเชื่อถือที่สุด ซึ่งเป็นวิสัยทัศน์ใหม่ของปีนี้ ด้วยการผนึกความเชี่ยวชาญและต่อยอดของการรักษาโรคซับซ้อนเข้ากับการดูแลเชิงป้องกัน โดยบำรุงราษฎร์ริเริ่มและวางรากฐานเวชศาสตร์เชิงป้องกันเป็นแห่งแรกในเอเชีย ภายใต้ชื่อศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ซึ่งเป็นสถาบันเวชศาสตร์ชะลอวัยแบบบูรณาการ โดยยังคงยึดหลัก 4C1W เป็นปัจจัยหลักเพื่อก้าวสู่ปีแห่งความเป็นเลิศ ประกอบด้วย 1. Critical Care การรักษาผู้ป่วยภาวะวิกฤต 2. Complicated Care การรักษาผู้ป่วยที่มีอาการซับซ้อนหลายโรคหรือโรคหายาก 3. Cutting-edge technology การให้ความสำคัญและประยุกต์ใช้นวัตกรรมและเทคโนโลยี 4. Collaboration of expertise and partners การทำงานที่สอดประสานกันและการแสวงพันธมิตรที่เข้มแข็ง และ 1. W = Wellness การแพทย์เชิงป้องกัน”
วัดทิพย์สุคนธาราม อ.ห้วยกระเจา LINK
วัดทิพย์สุคนธาราม เป็นวัดราษฎร์สังกัดคณะสงฆ์ฝ่ายมหานิกาย ตั้งอยู่ในตำบลดอนแสลบ อำเภอห้วยกระเจา จังหวัดกาญจนบุรี ปัจจุบันมีพระศรีวชิรสุธี เป็นเจ้าอาวาส วัดทิพย์สุคนธารามตั้งวัดเมื่อวันที่ 4 มิถุนายน พ.ศ. 2550
วัดทิพย์สุคนธารามเป็นที่ประดิษฐานพระพุทธมหาเมตตาประชาไทยไตรโลกนาถคันธารราฐอนุสรณ์ พระพุทธรูปปางขอฝน (บางคันธารราฐ) องค์โลหะสำริด สูง 32 เมตร ยืนอยู่บนฐานสูง 8 เมตร ซึ่งสำนักงานทรัพย์สินส่วนพระมหากษัตริย์ร่วมกับหน่วยงานภาครัฐและภาคเอกชนจัดสร้างขึ้นโดยมีวัตถุประสงค์เพื่อเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษาครบ 7 รอบ 84 พรรษาเพื่อเฉลิมพระเกียรติสมเด็จพระนางเจ้าฯพระบรมราชินีนาถ เนื่องในโอกาสมหามงคลทรงเจริญพระชนมพรรษา 80 พรรษาและเพื่อเป็นการรำลึกถึงพระคุณสมเด็จพระมหาธีราจารย์ ซึ่งเป็นผู้ริเริ่ม พระพุทธมหาเมตตาประชาไทยไตรโลกนาถ คันธารราฐอนุสรณ์ ตั้งอยู่ที่ลานพระทักษิณซึ่งเสมือนเขตพุทธวาส บริเวณโดยรอบ มีหอเกียรติประวัติสมเด็จพระมหาธีราจารย์ อาคารประกอบต่างๆ และอ่างเก็บน้ำในพระบรมราชินูปถัมภ์ ซึ่งมีการปรับปรุงภูมิทัศน์สถานที่ให้เปรียบเสมือน“พุทธอุทยาน”ที่มีลานปฏิบัติธรรม สมเด็จพระนางเจ้าพระบรมราชินีนาถ ทรงมีพระมหากรุณารับโครงการไว้ในพระบรมราชินูปถัมภ์ เมื่อวันที่ 12 พฤษภาคม พ.ศ.2554 เปิดให้นักท่องเที่ยวและประชาชนเยี่ยมชมทุกวันระหว่างเวลา 08.00 - 17.00 น.
29 มกราคม 2566
1. ยืนยันคำสั่งย้ายไม่เกี่ยวกับการเมือง
- ที่ รพ.มหาราชนครราชสีมา อาคารอายุรกรรม มีเจ้าหน้าที่สาธารณสุข อสม. ถือป้ายข้อความให้กำลังใจ ปลัด สธ. จากกรณีคำสั่งโยกย้าย นพ.สุภัทร ซึ่งกลายเป็นกระแสที่หลายฝ่ายตั้งข้อสงสัยและมีชาวบ้านออกมาคัดค้านกับคำสั่งดังกล่าว
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า การโยกย้ายข้าราชการที่ต่ำว่า C10 เป็นอำนาจเต็มของปลัดสธ. รัฐมนตรีจะมีการปรึกษาหารือกับปลัด สธ. ต่อเมื่อจะมีการแต่งตั้งโยกย้ายข้าราชการตั้งแต่ระดับ C10 ขึ้นไปเท่านั้นเนื่องจากต้องนำเรื่องเข้าสู่ที่ประชุมครม. ส่วนการแต่งตั้งโยกย้ายข้าราชการระดับต่ำกว่า C10 ลงไป จะเป็นเรื่องของปลัด สธ.พิจารณา เพราะถือว่าเป็นหัวหน้าส่วนราชการ รัฐมนตรีไม่มีส่วนเกี่ยวข้องและฝ่ายการเมืองไม่เข้าไปยุ่งเกี่ยวแน่นอน
- กรณีคำสั่งโยกย้าย นพ.สุภัทร มีกระแสข่าวหลายด้าน เนื่องจาก นพ.สุภัทรได้วิพากษ์วิจารณ์เกี่ยวกับนโยบายกัญชา และอาจจะถูกย้ายโดยฝั่งการเมือง ทำให้มีประชาชนในพื้นที่ออกมาให้กำลังใจก่อนหน้านี้ค่อนข้างมาก ขณะที่มีบางฝ่ายมองว่าการย้ายครั้งนี้เป็นการหมุนเวียนการทำงานตามปกติของข้าราชการ โดย นพ.สุภัทร มีความชำนาญในการบริหารจัดการ รพ.จะนะ จึงให้มีการหมุนเวียนไปบริหาร รพ.สะบ้าย้อย เพื่อให้มีการพัฒนามากยิ่งขึ้น
- นพ.รุ่งเรือง กิจผาติโฆษกกระทรวงสาธารณสุข กล่าวถึงกรณีนี้ว่า การโยกย้ายเป็นเรื่องปกติ เป็นข้าราชการต้องรับใช้ประชาชนทุกคน ทุกพื้นที่ ต้องมีวินัยและสุจริต จะมาคิดยึดติดไม่ได้ ส่วนการโยกย้ายครั้งนี้เห็นว่าทำไปด้วยกระบวนการที่ถูกต้อง เป็นไปตามระเบียบข้าราชการระดับสูงที่ต้องมีการขยับทุก 4 ปีทั้งนี้ นพ.สุภัทรอยู่จะนะมา 20 กว่าปี เมื่อก่อนทำได้เพราะเป็นถิ่นกันดาร ถือว่าอยู่โดยสมัครใจ เป็นข้อยกเว้นของระเบียบ แต่ตอนนี้ทั้งพื้นที่และรพ.พัฒนาขึ้นมาก ไม่มีเงื่อนไขเรื่องความลำบากกันดารแล้ว ก็ต้องเข้าสู่ระบบปกติ
- นพ.จตุชัย มณีรัตน์ นพ.สสจ.เชียงใหม่ และประธานชมรม นพ.สสจ. กล่าวถึงกรณีนี้ว่า เป็นเรื่องปกติของข้าราชการมีทั้งย้ายในจังหวัด-ข้ามจังหวัด ทั้งสมัครใจและผู้บริหารพิจารณาตามเหมาะสมและเกิดประโยชน์กับทางราชการ การย้ายผอ.รพ.ชุมชน ไม่ต้องเสนอรัฐมนตรีหรือปลัดกระทรวง โดยผู้ตรวจราชการสามารถปฏิบัติหน้าที่แทนปลัด สธ. ได้ ตามที่ได้รับมอบอำนาจมา ซึ่งขั้นตอนคือ นพ.สสจ. พิจารณา และเสนอให้ผู้ตรวจราชการลงนามคำสั่ง
2. มวลชนรวมตัวคัดค้านย้าย ผอ.รพ.จะนะ
- ที่ห้อง Convention ศูนย์การค้าเซนทรัลเฟสติวัล อ.หาดใหญ่ จ.สงขลา ซึ่งมีการจัดงาน กิจกรรม Kick off ของขวัญปีใหม่ 2566 ปีแห่งสุขภาพสูงวัยไทย ระหว่างที่ นพ.สวัสดิ์ อภิวัจนีวงศ์ ผู้ตรวจราชการ สธ. เขตฯ 12 เป็นประธานพิธีเปิด กลุ่มมวลชนชาวบ้านอำเภอจะนะ และเครือข่ายจะนะรักษ์ถิ่น ได้ถือป้ายผ้าที่มีข้อความเกี่ยวกับการ save หมอสุภัทร เข้ามาภายในงาน โดยตัวแทนกลุ่มระบุว่าจะมายื่นหนังสือต่อ นพ.สวัสดิ์ ซึ่งเป็นคนลงนามคำสั่งย้าย นพ.สุภัทร โดยกลุ่มตัวแทนชาวบ้านได้พยายามสอบถามที่มาของการสั่งย้าย ทำให้เกิดภาพการยื้อยุดฉุดกระชากป้ายข้อความ โดยมี นพ.ปพน ดีไชยเศรษฐ รองนพ.สสจ.สงขลา พยายามเข้าเจรจาและทำความเข้าใจกับกลุ่มชาวบ้าน
- เพจสื่อเถื่อนข่าว โพสต์ว่า ในการจัดงาน ปรากฎคลิป นพ.ปพน ดีไชยเศรษฐ รอง นพ สสจ สงขลา เข้ามาแย่งป้ายผ้าคำถามเรื่องหมอสุภัทรจากชาวบ้าน และมีการแชร์คลิปนี้จนสังคมตั้งคำถามว่าสมควรแล้วหรือไม่ และเพื่ออะไร
3. ไม่เห็นด้วยกับคำสั่งโยกย้าย
- นายนิมิตร์ เทียนอุดม ที่ปรึกษา ผอ.มูลนิธิเข้าถึงเอดส์ กล่าวถึงกรณีคำสั่งย้ายหมอสุภัทรว่า ถ้าบอกว่าย้ายตามระบบคงไม่ใช่ เพราะ รพ.ชุมชน แตกต่างจาก รพ.จังหวัด รพ.ชุมชน ต้องคลุกคลีกับชุมชน ทางที่ดีที่สุด ผู้บริหาร สธ. ควรอธิบายเหตุผล เพราะหากไม่ชัดเจนเกิดความสงสัย ย่อมไม่ส่งผลดีต่อระบบธรรมาภิบาลสาธารณสุขภาพรวม
- นายบรรจง นะแส ที่ปรึกษาสมาคมรักษ์ทะเลไทย และภาคประชาชนภาคใต้ เดินทางไปเรียกร้องที่ สสจ.สงขลา ขอให้นพ.สวัสดิ์ อภิวัจนีวงศ์ผู้ตรวจราชการ สธ. ยกเลิกคำสั่งย้ายภายใน 3 วัน หากไม่คืบหน้าจะมีการเคลื่อนไหวอย่างแน่นอน โดยระบุว่า เป็นครั้งแรกที่เพิ่งมีระเบียบการย้ายออกมา เมื่อ 23 ม.ค. ที่ผ่านมาไม่เคยมีผู้ตรวจราชการ สธ. ย้าย ผอ.รพ.ชุมชนได้
- เพจชมรมแพทย์ชนบท โพสต์ นพ.ชูชัย ศุภวงศ์ อดีตเลขาธิการคณะกรรมการสิทธิมนุษยชนแห่งชาติ อดีตประธานชมรมแพทย์ชนบท โพสต์คำกลอนของ รูญ ระโนด สดุดี “หมอสุภัทร” ต่อกรณีถูกโยกย้ายอย่างไม่เป็นธรรม "เป็นหมอของมวล เป็นคนของชาวบ้าน มีปัญญาและกล้าหาญ มิอ่อนข้อทระนง ไม่เคยคิดรับใช้เป็นเป้าหมายเพราะซื่อตรง เกียรติยศจึงยืนยง และยืนหยัดขจัดพาล รวมพลเถอะพี่น้อง เพื่อปกป้องหมอจากมาร ร้องทุกข์ทั่วสาธารณ์ให้คนดีมีที่ยืน"
- เพจชมรมแพทย์ชนบท โพสต์ว่า กระทรวงสาธารณสุข หนุมานสารภาพ ตอนที่ 2 ระบุว่า ได้เปิดเผยถึงผู้ใหญ่ที่ฝากให้ นพ.สวัสดิ์ ไลน์ขอสสจ. 4 จังหวัดช่วยซื้อ fundus camera จากบริษัทแห่งหนึ่ง ชื่อย่อมีตัว ‘ท’ ‘ม’ ‘อ’ ทำให้มีผู้ใหญ่บางคนร้อนตัวและเร่งให้ นพ.สวัสดิ์ ชี้แจง จนกลายเป็นคำสารภาพสรุปได้ดังนี้ 1.ไลน์ที่หลุดนั้นตนเขียนเองสั่งเอง 2.ได้รับใบสั่งจากผู้ใหญ่ให้สนับสนุนบริษัทนี้จริง 3.สั่งใช้งบค่าเสื่อม 10% ของเขต 7 น่าจะเกือบ 50 ล้านบาท ให้ทั้ง 4 จังหวัดเสนอของบซื้อเครื่องมือแพทย์รายการนี้รายการเดียว 4.คำสารภาพแสดงให้เห็นว่านพ.สวัสดิ์รู้ว่าเป็นการกระทำที่ไม่ถูกต้อง จึงต้องสั่งในกลุ่มปิด 5.เรื่องนี้มีผลประโยชน์เพราะระบุว่า “ไม่ได้แตะผลประโยชน์จังหวัด” แสดงว่าผลประโยชน์ส่วนตนก็มากพอแล้ว และ 6.ขออภัยผู้ใหญ่ที่ทำไม่รอบคอบ ซึ่งมองว่า นพ.สวัสดิ์สารภาพเช่นนี้เพราะเดิมถูกนำแชทไลน์ที่ขอให้ช่วยบริษัทมาบีบให้สั่งย้ายหมอสุภัทร แต่เมื่อมีการต่อต้านจากสังคมอย่างรุนแรงต่อเนื่อง ผู้ใหญ่กลับไม่ช่วยเหลือและผลักให้รับผิดชอบทั้งหมดเรื่องที่น่าติดตาม คือคำสารภาพดังกล่าวเท่ากับว่าในทางพฤตินัย นพ.สวัสดิ์ เป็นโมฆะทั้งผู้ตรวจและปลัดเขต 12 แล้วผู้ใหญ่จะจัดการ 2 ตำแหน่งนี้อย่างไรต่อไป
4. ตั้งข้อสงสัย นพ.สุภัทร ปมชุดตรวจ ATK
- นพ.เอกภพ เพียรพิเศษ ที่ปรึกษา กมธ.สธ. โพสต์ถึงการสอบสวนเรื่องการนำ ATK ที่พยายามให้มีการจัดซื้อแบบล็อกสเปคเอื้อประโยชน์บางบริษัท ว่า ตอนที่อภ.จัดซื้อ ATK เพื่อแจกจ่ายให้ประชาชน กระจายการเข้าถึง ATK ทำให้ตลาดลดราคาจาก 200-300 บาทต่อชุด เหลือเพียง 30-40 บาทในปัจจุบัน มีผู้สังเกตการณ์จาก สปสช. (แพทย์ชนบท 2 คน) ให้ข้อมูลที่ตั้งใจจะเอื้อประโยชน์ต่อบางบริษัทที่ขายในราคา 120 บาทต่อชุด พยายามปรับรายละเอียด TOR เพื่อล็อกสเปกให้กับบริษัทนี้ แต่สุดท้ายไม่สำเร็จ เพราะอภ.และ สธ. ไม่ทำตาม จุดที่น่าสงสัยคือ กมธ.สธ. ขอให้นพ.สุภัทร ผอ.รพ.จะนะ ส่งรายละเอียดการจัดซื้อจัดจ้างชุดตรวจ ATK ของรพ. มาให้ตรวจสอบ แต่ถูกปฏิเสธ เท่ากับยอมรับข้อกล่าวหาว่ามีการจัดซื้อชุดตรวจ ATK ด้วยอำนาจของ ผอ. ในราคาและยี่ห้อที่น่าจะเป็นยี่ห้อเดียวกับที่ทางกลุ่มเครือข่ายพยายามผลักดัน และนำมาใช้ในการคัดกรองในกทม. เพื่อให้มีการจัดซื้อจำนวนมาก ชาวจะนะจึงควรตั้งคำถามถึงการใช้งบประมาณในตอนนั้นว่า การจัดซื้อชุดตรวจ ATK มาตรวจในกทม. แทนที่จะใช้กับคนในพื้นที่ และเอาเวลาราชการมาดูแลคนในกทม. ทิ้งคนในพื้นที่ซึ่งกำลังประสบปัญหาโควิด เป็นเรื่องสมควรแล้วหรือไม่
เขตคลองสามวา ห้องสมุดเพื่อการเรียนรู้คลองสามวา
ห้องสมุดอัตลักษณ์การท่องเที่ยว และส่งเสริมอาชีพ มีวัดวาอาราม มัสยิดงาม คู่วัฒนธรรม ไร่ข้าวไร่หญ้าเขียวขจี อีกโรงสีชุมชน สวนสัตว์ซาฟารีน่ายล ทุกชุมชนส่วนร่วมดี
มีบริการ หลายอย่าง ได้แก่ ห้องมินิเธียร์เตอร์ จอง/ขอใช้บริการ ตู้ล็อกเกอร์ ฟรีอินเตอร์เน็ต
ค่าสมัครสมาชิก ผู้ใหญ่ ๕๐ บาท เด็ก ๒๕ บาท วันเวลาทำการ อังคาร - เสาร์ ๐๘.๐๐ - ๒๐.๐๐ น. อาทิตย์ ๐๙.๐๐ - ๑๗.๐๐ น. #หยุดวันจันทร์และวันหยุดนักขัตฤกษ์ บริการยืม - คืนหนังสือ วิชาการ นวนิยาย ท่องเที่ยว เยาวชน นิทานสำหรับเยาวชนสองภาษา บริการอินเตอร์เน็ต วันละ ๑ ชม. (สำหรับสมาชิก) บริการ WIFI (สำหรับสมาชิก) จัดกิจกรรมนันทนาการสำหรับเด็กวัย ๕ - ๑๒ ปี ทุกวันเสาร์ เวลา ๑๓.๐๐ - ๑๕.๐๐ น.
15 ซอย เลียบคลองสอง 19 แขวงสามวาตะวันตก เขตคลองสามวา กรุงเทพมหานคร 10510
โทร.02-9170732
Website :
bangkoklibrary.go.th
แผนที่
google map
facebook
Khlongsamwalibrary/จุดเริ่ม สำหรับผู้บริหารสถาบันการศึกษา เพื่อจัดการปัญหาภายใน
นายพงษ์ศักดิ์ ธงรัตนะ ผู้อำนวยการสำนักสนับสนุนสุขภาวะองค์กร (สำนัก 8) สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) เปิดเผยว่า การเผยผลสำรวจพฤติกรรมสุขภาพของนิสิตนักศึกษาฯ ในวงกว้างครั้งนี้ ถือเป็นจุดเริ่มต้นที่ดีที่ทำให้ระดับผู้บริหารสถาบันการศึกษาได้รับรู้และเริ่มดำเนินการวางแผนจัดการภายในมหาวิทยาลัย รวมถึงขอความร่วมมือจากครูอาจารย์และบุคลากรที่เกี่ยวข้องในคณะต่างๆ ของมหาวิทยาลัย เพื่อยกระดับให้นิสิตนักศึกษามีสุขภาพทั้งทางกายและจิตใจ และเติบโตอย่างมีคุณภาพและมีศักยภาพพร้อมที่จะเป็นกำลังสำคัญในการขับเคลื่อนประเทศ
โดยทุกปัญหาที่สะท้อนออกมาจากผลสำรวจล้วนสำคัญ แต่ปัญหาที่เร่งด่วนอันดับต้นๆ ก็คือ เรื่องความเครียดและภาวะซึมเศร้าของนักศึกษา ซึ่งเป็นปัญหาที่ควรสำรวจต่อในเชิงรุก เพื่อจะรับรู้ถึงสาเหตุและระดับของปัญหาเพื่อหาแนวทางแก้ไขได้อย่างถูกต้องและตรงจุด เพราะการป่วยทางสภาพจิตใจย่อมส่งผลกระทบต่อเนื่องไปยังปัญหาอื่นๆ ซึ่งหากนักศึกษาเกิดความเครียดจากการเรียน ทางมหาวิทยาลัยเองก็บริหารจัดการ อาทิ หากิจกรรมที่ผ่อนคลาย หรือจัด Health Promotion เพื่อให้คำปรึกษาแนะนำเพื่อให้นักศึกษาจัดการกับความเครียดของตัวเอง แต่หากอยู่ในขั้นที่ไม่สามารถช่วยเหลือตัวเองได้ ก็จำเป็นต้องมีระบบการส่งต่อที่ดีไปยังหน่วยงานด้านสาธารณสุขหรือโรงพยาบาลในมหาวิทยาลัย เพื่อการดูแลในขั้นตอนต่อไป เป็นต้น
ปัญหารองลงมา คือด้านการเงิน เนื่องจากการที่รับรู้ว่าครอบครัวมีภาระหนี้สิน หรือแม้แต่ตัวนักศึกษาเองหากติดพนันออนไลน์ หรือมีหนี้นอกระบบ ก็ย่อมส่งผลให้เกิดความเครียดตามมา ซึ่งก็ควรมีแนวทางบริหารจัดการทางการเงิน และอีกปัญหาสำคัญอีกประการ คือ เหล้า บุหรี่ และยาเสพติดอื่นๆ ก็เป็นอีกสิ่งที่เวลามีความเครียดสะสมมากๆ ก็อาจหลงผิดไปพึ่งพาสิ่งเสพติดเหล่านี้ ซึ่งต้องคำนึงถึงสถานที่ตั้งของสถานบันเทิง ผับ บาร์ คาราโอเกะ ควรให้ห่างจากสถาบันการศึกษา ซึ่งในเชิงนโยบายควรมีตัวบทกฎหมายควบคุมอย่างชัดเจนและปฏิบัติตามอย่างเคร่งครัด
ทุกปัญหาควรได้รับการแก้ไขอย่างเป็นระบบ ซึ่งจำเป็นต้องมีหน่วยงานที่รับผิดชอบร่วมกัน โดยกลุ่มแรกที่ควรให้ความร่วมมือ ได้แก่ 1. ผู้บริหารสูงสุดและผู้บริหารระดับรองๆ ลงมาของสถาบันการศึกษา เพราะจะเป็นผู้ที่สามารถบริหารได้ทั้งสถาบัน สามารถคิดและวางกลไกในการดูแลนิสิตนักศึกษาได้ และจะต้องทำงานกันเป็นทีม 2. พ่อแม่และผู้ปกครอง เพราะครอบครัวเป็นหัวใจสำคัญที่จะช่วยดูแลนิสิตนักศึกษาได้อย่างใกล้ชิด 3. กลุ่มเพื่อน เพราะด้วยช่วงวัยนี้จะติดเพื่อน เชื่อเพื่อน ซึ่งเพื่อนเองก็ต้องคอยสังเกตเพื่อนด้วยกัน คอยดูแลใส่ใจกัน ซึ่งจากหลายผลวิจัยจะเห็นว่าโครงการเพื่อนช่วยเพื่อน ประสบความสำเร็จเป็นอย่างมาก แต่ขณะเดียวกัน ทางมหาวิทยาลัยเองก็ต้องให้ความรู้ไปพร้อมๆ กัน หรือควรมีการนำเทคโนโลยีเข้ามาช่วยในส่วนต่างๆ เช่น การวิเคราะห์พฤติกรรมของนิสิตนักศึกษา เป็นต้น อีกทั้ง กระทรวงอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม (อว.) ถือเป็นหน่วยงานที่มีส่วนเกี่ยวข้องโดยตรง สามารถดำเนินการเพื่อลดปัญหาสุขภาวะดังกล่าวได้ เนื่องจาก อว. มีอำนาจในการสั่งการและวางนโยบายต่างๆ อาทิ ให้ทุกมหาวิทยาลัยมีการดูแลสุขภาพทั้งในส่วนของนักศึกษาและบุคลากร นอกจากนี้ โรงพยาบาลและสถานพยาบาลในมหาวิทยาลัย หรือศูนย์พยาบาลสำหรับนิสิตนักศึกษาก็สามารถช่วยเหลือได้ โดยสามารถยกระดับในการสร้างเสริมสุขภาพ ด้วยการออกแบบแคมเปญการดูแลสุขภาพในเชิงรุก หรือเป็น Health Leader ยกตัวอย่างอาจปรับสถานพยาบาลให้เป็น Wellness Center คือไม่รอให้คนป่วยเดินเข้าไปหา แต่ต้องทำในเชิงป้องกันมากขึ้น เช่น จัดเวิร์กช้อปให้ความรู้ด้านสุขภาพ, เชิญชวนนักศึกษาและบุคลากรออกกำลังกาย, ให้ความรู้ผ่านสื่อเทคโนโลยี เป็นต้น
สำหรับด้านของมหาวิทยาลัยต่างก็มีความตื่นตัวถึงปัญหาต่างๆ มากขึ้น และได้มีการประชุมวางแผนเพื่อดำเนินการในระดับมหาวิทยาลัย ซึ่งเป็นผลพวงที่ต่อยอดจากผลสำรวจครั้งนี้ ทั้งในส่วนของสถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง (สจล.) และมหาวิทยาลัยราชภัฏนครปฐม (มรภ. นครปฐม) โดยทั้งสองสถาบันอยู่ใน 15 มหาวิทยาลัยที่ได้ทำการสำรวจ ทั้งนี้ มหาวิทยาลัยยังต้องมีการประเมินและวัดผลอย่างต่อเนื่อง เพื่อจะได้ทราบว่ามาตรการที่กำหนดนั้น มาถูกทางแล้ว หรือจะต้องปรับเปลี่ยนเพื่อให้เกิดประสิทธิภาพสูงสุด
ปี 2566 มี 2 โครงการหลักที่ต้องเร่งระดมทุน
โดยในปี พ.ศ. 2566 นี้ มูลนิธิรามาธิบดีฯมีโครงการหลักที่จะต้องเร่งระดมทุนใน 2 โครงการดังนี้
คุณทิพย์วิภา ทักษิมา ผู้กำกับเสียงพากย์สาวแห่งค่ายกันตนา เผยที่มาของการอยากมาทำศัลยกรรมเสริมหน้าอก ว่าเธอนั้นอยากเพิ่มความมั่นใจและเพิ่มโอกาสในการทำงาน เพราะที่ผ่านมาเคยไปแคสติ้งงานถ่ายแบบชุดว่ายน้ำแต่ไม่ผ่าน แม้ว่าคนว่าจ้างจะบอกว่าเธอหน้าตาสวยแต่ไม่ผ่านเพราะหน้าอกเธอไม่สวย ทำให้เรือนร่างดูไม่สมส่วน จึงไม่ถูกคัดเลือก หลังจากนั้นเธอจึงตัดสินใจเสริมหน้าอก และหลังศัลยกรรมหน้าอกเธอยอมรับว่าเป็นการสร้างโอกาสในหน้าที่การงานของเธอหลายเรื่อง
งานบวงสรวงเจ้าปู่อือลือ 2566
งานบวงสรวงเจ้าปู่อือลือ ณ ตำหนักศาลเจ้าปู่อือลือนาคราช อ.บึงโขงหลง จ.บึงกาฬ เป็นงานประเพณีบุญเดือนสาม (3ค่ำ เดือน 3) ที่ถือเป็นประเพณีสืบต่อกันมาจากรุ่นสู่รุ่น โดยในปีนี้จัดขึ้นระหว่าง 22 – 24 มกราคม 2566 โดยในปีนี้ นายนฤชา โฆษาศิวิไลซ์ ผู้ว่าราชการจังหวัดบึงกาฬ มีแนวคิดจะเร่งผลักดันและยกระดับให้เป็นงานระดับจังหวัดและระดับประเทศ หวังให้เป็นเผยแพร่และความงดงามของวัฒนธรรมของดินแดนลุ่มน้ำโขง บึงกาฬ อันมีอัตลักษณ์โดดเด่นมายาวนานออกสู่การรับรู้สู่สายตาชาวโลก
คลินิกพิเศษเฉพาะทางจักษุนอกเวลาราชการ
คลินิกพิเศษเฉพาะทางจักษุนอกเวลาราชการ
นายแพทย์กร กาญจนรจิต จักษุแพทย์เฉพาะทาง
ออกตรวจ ทุกวันจันทร์และวันพุธ
เวลา 16.30-20.30 น.
ค่าบริการ ชาวไทย 350 บาท ชาวต่างชาติ 450 บาท
ค่ายา เบิกได้ตามสิทธิ์การรักษาที่มี
**ผู้ป่วยต่างอำเภอ สามารถขอใบส่งตัวจาก รพ.ต้นสังกัดเพื่อมารับการรักษานอกเวลาได้ โดยไม่เสียค่ายา (ชำระค่าบริการ 350 บาท)
อุทยานแห่งชาติเขาคิชฌกูฏ


อุทยานแห่งชาติเขาคิชฌกูฏ เป็นต้นกำเนิดของแม่น้ำจันทบุรี ครอบคลุมพื้นที่อำเภอมะขาม และอำเภอเขาคิชฌกูฏ ด้วยสภาพป่าที่ยังคงความอุดมสมบูรณ์ ทั้งป่าดิบชื้น ป่าดิบเขา และป่าไม้ผลัดใบ มีสมุนไพรและกล้วยไม้ป่านานาชนิด รวมทั้งพันธุ์ไม้หายาก เช่น ไม้กฤษณา และมีสัตว์ป่าชุกชุม เช่น กระทิง เสือ หมี กวาง เก้ง เลียงผา รวมทั้งนกชนิดต่าง ๆ ตามลำห้วยมีปลาพลวง ปลาก้าง ปลาหนวด ปลาดุกรำพัน อาศัยอยู่ ไฮไลต์แห่งอุทยานฯ น้ำตกกระทิง มีต้นกำเนิดจากเทือกเขาคิชฌกูฏ เป็นน้ำตกขนาดใหญ่ 13 ชั้น ใช้เวลาเดินไปกลับ 3 ชั่วโมง ข้อดีของที่นี่คือเป็นน้ำตกที่สามารถเล่นน้ำได้อย่างปลอดภัย และชั้นที่สวยงามที่สุดคือชั้นที่ 8-9 ระหว่างทางจะผ่านป่าไผ่และพันธุ์ไม้หลากชนิด นอกจากนี้ยังมีชายหาดขนาดใหญ่ริมธารน้ำตกที่เกิดจากทรายที่ถูกน้ำป่าพัดลงมาเมื่อ ปี พ.ศ. 2542 ลำธารชั้นล่างของน้ำตกอยู่ห่างจากที่ทำการอุทยานฯ 100 เมตร
ยอดเขาพระบาท ประดิษฐานอยู่บนยอดเขาคิชฌกูฏ การเดินทางไปที่นี่ต้องเริ่มต้นที่วัดพลวงไปตาม ถนนลูกรังที่ลาดชันและคดเคี้ยวมาก ระยะทาง 8 กิโลเมตร จากนั้นต้องเดินขึ้นเขาไปอีก 1.2 กิโลเมตร ระหว่างทางมีจุดแวะพักให้สักการะสิ่งศักดิ์สิทธิ์ ทิวทัศน์บนยอดเขาคิชฌกูฏหรือเขาพระบาทนี้ ถือเป็นปรากฏการณ์ทางธรณีวิทยาที่นำมาผูกกับตำนานทางพระพุทธศาสนา ได้แก่ ศิลาเจดีย์ รอยพระพุทธบาทหลวง หินรูปบาตรคว่ำ ถ้ำฤๅษี หินที่มีรูปร่างคล้ายเต่าและช้างขนาดยักษ์ และหากต้องการเดินต่อไปจนถึงเขตผ้าแดง จะต้องเดินขึ้นเขาต่อจากลานพระบาทไปอีก 800 เมตร จากบนยอดเขาพระบาท สามารถมองเห็นทิวทัศน์ของเทือกเขาสระบาป เขาสุกิม เกาะนมสาว และตัวเมืองจันทบุรีได้อย่างชัดเจน
เฉพาะในช่วงเทศกาลตรุษจีนถึงช่วงวันมาฆบูชาของทุกปี จะมีประชาชนขึ้นไปนมัสการรอยพระพุทธบาททั้งกลางวันและกลางคืนเป็นจำนวนมาก (สำหรับผู้สูงอายุมีไม้เท้าให้เช่า ราคาอันละ 5 บาท และบริการแคร่แบกหามในราคาเที่ยวละ 400 บาท) การเดินทางไปยังยอดเขานั้น สามารถเดินทางได้โดยเริ่มจากตัวอำเภอเมืองจันทบุรีผ่านแยกเขาไร่ยา ใช้เส้นทางหลวงหมายเลข 3249 ระยะทางประมาณ 18 กิโลเมตร โดยใช้ทางขึ้นเขาพระบาทพลวง (ทางขึ้นคนละจุดกับอุทยานฯ ) เมื่อถึงวัดพระบาทพลวงต้องจอดรถส่วนตัวทิ้งไว้ (มีลานจอดรถไว้บริการ) จากนั้นมีรถสองแถวบริการขึ้นเขาพระบาท ออกจากวัดพลวงไปสิ้นสุดที่บริเวณทางขึ้นยอดเขาพระบาท โดยรถที่ขึ้นยอดเขาแบ่งเป็น 2 ช่วง ค่าโดยสารช่วงละ 50 บาท/คน (รวมไป-กลับ 200 บาท) มีรถบริการตลอดเวลา ใช้เวลาประมาณ 30 นาที จะถึงจุดเริ่มต้นการเดินเท้าขึ้นไปรอยพระบาท สอบถามรายละเอียดได้ที่อุทยานแห่งชาติเขาคิชฌกูฎ โทรศัพท์ 0 3945 2074
สุกี้ตี๋น้อย ฉลองเปิดสาขาใหม่ ต้อนรับปี 2566 สาขาที่ 44 เดอะ สตรีทรัชดา ชั้น 4 LINK
สุกี้ตี๋น้อย ขอเชิญร่วมฉลองเปิดสาขาใหม่ สาขาที่ 44 “ เดอะ สตรีทรัชดา ชั้น 4 ” [
แผนที่ เดอะสตรีทรัชดา] วันที่ 25 ม.ค. 66 โปรโมชั่นฉลองเปิดร้านใหม่ ดังนี้ วันที่ 25 - 26 ม.ค. 66 (เฉพาะ 2 วันนี้เท่านั้น) รับส่วนลด 50% บุฟเฟต์ สุกี้ จาก 219* บาท เหลือ 109* บาท เท่านั้น ! เฉพาะ 200 ท่านแรก (วันละ 200 ท่าน) * ราคานี้ยังไม่รวมน้ำรีฟิลล์ และภาษีมูลค่าเพิ่ม เปิดรับบัตรคิวลด 50% เวลา 09.30 น. (บัตรคิว 1 ใบ ต่อ ลูกค้า 1 ท่าน) * หมายเหตุ : หากครบ 200 ท่านแรกก่อนเวลาที่กำหนด ทางร้านขอสงวนสิทธิ์ทำการแจกบัตรคิวก่อนเวลาที่แจ้ง เปิดให้บริการ 12.00-05.00 น.
“ สุกี้ตี๋น้อย อร่อยไม่อั้นเที่ยงวันยันเช้า ” บุฟเฟต์ 219 บาท ราคาเดียว ทานได้ทุกอย่าง (ยังไม่รวมค่าเครื่องดื่มรีฟิลล์และภาษีมูลค่าเพิ่ม)
ชมภาพบรรยากาศความยิ่งใหญ่ งานอนุสรณ์ดอนเจดีย์จังหวัดสุพรรณบุรี ปีนี้ LINK
Thailand Festival เผยภาพความยิ่งใหญ่อลังการงานอนุสรณ์ดอนเจดีย์จังหวัดสุพรรณบุรี ประจำปี 2566 ณ พระบรมราชานุสรณ์ดอนเจดีย์ การแสดง แสง – เสียง “มหาวีรกรรมยุทธหัตถี”เทิดพระเกียรติ สมเด็จพระนเรศวรมหาราช อันยิ่งใหญ่ตระการตา การแสดงศิลปวัฒนธรรม ดนตรี มหรสพ การออกร้านธารากาชาด การจัดจำหน่ายสินค้าอุปโภคบริโภค ฯลฯ ถ้าปีนี้พลาดไป ปี้หน้าต้องได้ไป เชื่อสิ
งานบุญข้าวจี่ของดีเมืองโพธิ์ชัย จ.ร้อยเอ็ด 1-9 ก.พ 66
เที่ยวงานบุญข้าวจี่ของดีเมืองโพธิ์ชัย วันที่ 1-9 ก.พ 66 ณ ถนนหน้าตลาดสดและหน้าอำเภอโพธิ์ชัย จังหวัดร้อยเอ็ด ในงานจะได้สนุกกับ สินค้าดี อาหารอร่อย โชว์คอนเสิร์ต 5 คืน
4 ก.พ. บิ๊กวัน กันทรลักษ์
5 ก.พ. ทิว ทองปอน & ไก่ พรรณนิภา
7 ก.พ. ขบวนแห่ & ประกวดร้องเพลงเยาวชน & ซ้อมนางงาม
8 ก.พ. ชมหมอลำกลางวัน & งานพาแลง & ประกวดนางงามบุญข้าวจี่
9 ก.พ. งานพาแลง & ประกวดร้องเพลงผู้นำชุมชน
พญาครุฑ วัดโพธิทอง บางมด กรุงเทพฯ LINK
วัดอันดับหนึ่ง ที่เมื่อนึกถึงการสักการะ "พญาครุฑ" จะเป็นวัดอื่นไปไม่ได้ นอกจาก
วัดโพธิทอง ที่มี พระอาจารย์วราห์ ปุญญวโร เจ้าอาวาส ผู้เป็นเจ้าตำรับ พญาครุฑ อันลือเลื่องมานานนับสิบปี และทำให้วัดโพธิทอง เสมือนเป็นตักศิลาที่บรรดาผู้ศรัทธาในพญาครุฑจะมาชุมนุมกัน แลกเปลี่ยนศรัทธาประสาทะ แบ่งปันความนิยมต่อองค์พญาครุฑ สืบเนื่องกันมาจนปัจจุบันนั่นเอง
วัดโพธิทองเป็นวัดราษฎร์สังกัดคณะสงฆ์มหานิกาย ตั้งอยู่บริเวณที่คลองลัดขี้เหล็กตัดกับคลองเจ้าคุณ ในแขวงบางมด เขตจอมทอง กรุงเทพมหานคร ตั้งขึ้นเมื่อปี พ.ศ. 2450 เดิมชื่อ วัดทุ่ง ไม่ทราบผู้สร้างว่าเป็นใคร แต่สันนิษฐานว่าตระกูลบุนนาคเป็นผู้สร้าง ต่อมาในปี พ.ศ. 2507 ได้เปลี่ยนชื่อมาเป็น “วัดโพธิทอง” ด้วยเหตุผลที่ว่าบริเวณคลองบางปะแก้วมีวัดโพธิ์แก้วอยู่ทางต้นคลอง จึงตั้งชื่อ "วัดโพธิทอง" ควบคู่กันไป วัดได้รับพระราชทานวิสุงคามสีมาเมื่อวันที่ 15 มกราคม พ.ศ. 2513
Bacc หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร Bangkok Art & Culture Centre
หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร (BANGKOK ART AND CULTURE CENTRE - BACC) หอศิลป์ใหญ่ตัวแทนหมายเลขหนึ่งของหอศิลปในกรุงเทพ ตั้งอยู่กลางเมืองและมีพื้นที่จัดแสดงงานมากที่สุดกว่า 3,500 ตารางเมตร บนที่ชั้น 7, 8, 9 สำหรับงานธีมเรื่องราวศิลปินต่างๆ ผนังโค้ง บริเวณพื้นที่ผนังตลอดแนวโค้งชั้น 3 - 4 - 5 จัดแสดงงานจิตรกรรม ภาพถ่าย เป็นประจำ กิจกรรมการแสดง ละคร ก็มีเป็นระยะ ปี 2023 นี้ หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร เตรียมงานศิลป์นานาแขนงไว้รอมาเสพ เช็คได้จากตารางกิจกรรม
1. ส่งความรักให้คนในท้องถิ่น: Express Brand’s Love
หลังจบ High season ช่วงปีใหม่ ทำให้คนต่างจังหวัดเกิดความกังวลกับเรื่องเศรษฐกิจ แนะให้แบรนด์ใช้โอกาสนี้ ‘ส่งความรัก จากแบรนด์ สู่ลูกค้าท้องถิ่น’ ในช่วงวาเลนไทน์ โดยใช้การจัดโปรโมชันเพื่อตอบโจทย์คนในแต่ละภูมิภาคด้วยภาษาถิ่น เพื่อให้เกิดความประทับใจใหม่ผ่านแพลตฟอร์มที่โดนใจคนต่างจังหวัด เช่น ส่งเสริมการขายใน Tiktok Live ให้ผู้ชมเข้าถึงได้ง่าย ได้ทั้งความสนุกและสินค้าไปพร้อมกัน
2. Open House Open Experience: เปิดบ้านต้อนรับแขกบ้านแขกเมือง
การท่องเที่ยวในประเทศได้ฟื้นฟูขึ้นจากการเปิดประเทศครั้งใหญ่ กลับมาหนุนเศรษฐกิจไทยให้ดีขึ้น ถือเป็นโอกาสที่ดีของแบรนด์ที่จะสร้างโอกาสสำคัญในการขยายตลาดให้ชาวต่างชาติเข้าถึงสินค้าได้มากยิ่งขึ้น โดยไม่ใช่แค่ขายสินค้า แต่ต้องเสริมกิมมิกเล็กๆ ที่ผสมผสาน ‘ความเป็นไทย’ เข้าไป ให้เกิดความน่าสนใจ เช่น อาหารไทยฟิวชันเมนูพิเศษ หรือการผสมผสานเรื่องความเชื่อของสายมูเข้าไปในสิ่งของต่างๆ เพื่อกระตุ้นให้คนสนใจในตัวสินค้ามากยิ่งขึ้น
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร คือกลุ่มอาสาสมัครกลุ่มเล็ก ๆ ที่รวมตัวกันทำกิจกรรมเพื่อหารายได้ช่วยเหลือแมวจร เป็นคำารักษาพยาบาล ค่าอาหาร ค่าวัคซีน และการทำหมัน เพื่อหวังให้น้องแมวจรทั้งหลายมีสุขภาพ และชีวิตความเป็นอยู่ที่ดีขึ้น
วัตถุประสงค์ของมูลนิธิฯ
1. ช่วยเหลือรักษาแมวไม่มีเจ้าของ ที่เจ็บป่วย ได้รับอุบัติเหตุ หลักเกณฑ์การให้ความช่วยหลือ ระเบียบการให้ความช่วยเหลือสามารถดูได้ที่
www.rakmaw.com2. ลงพื้นที่ทำหมันแมวจร ตามวัด ตรอก ซอกซอยและสถานที่ต่าง ๆ เดือนละ 1 ครั้ง เพื่อลดจำนวนแมวจรไร้บ้านและไม่พึงประสงค์
3. ซื้ออาหารแมวแจกจ่ายให้กับผู้ดูแลแมวตามชุมชน และวัดต่างๆ เพื่อช่วยแบ่งเบาภาระของบุคคลเหล่านั้น
ขอความช่วยเหลือ ติดต่อมูลนิธิ
1. กิจกรรมทำหมันให้ส่งไปที่เมลล์ catpantip@gmail.com
2. เรื่องขอเคสให้ส่งไปที่เมลล์ request.rakmaw@gmail.com
3. เรื่องการบริจาคให้ส่งไปที่เมลล์ donated.rakmaw@gmail.com
4. เรื่องอื่น ๆ ส่งมาได้ที่เมลล์ rakmaw@gmail.com
facebook.com/catroompantip
กรมอนามัย ร่วม SAVE แกงส้ม
กรมอนามัย กระทรวงสาธารณสุข ร่วม SAVE แกงส้ม เมื่อแกงส้มของไทย ถูกจัดอับดับให้เป็นอาหารยอดแย่ที่สุดในโลก เผยแกงส้ม เป็นเมนูชูสุขภาพที่อยู่คู่ครัวไทย เพียบพร้อมทั้งคุณค่าทางโภชนาการ และคุณประโยชน์
ดร.นายแพทย์สราวุฒิ บุญสุข รองอธิบดีกรมอนามัย กล่าวว่า จากประเด็นในโลกโซเชียลเมื่อเมนูแกงส้มของไทย ได้รับการจัดอันดับให้เป็นอาหารยอดแย่ที่สุดในโลกโดยเว็บไซต์ท่องเที่ยวชื่อดัง ประจำเดือนกุมภาพันธ์ 2566 ซึ่งอยู่ในลำดับที่ 12 จากการโหวตให้เมนูแกงส้มมีคะแนน 2.3 คะแนน จากคะแนนเต็ม 5 คะแนน ส่งผลให้เกิดดราม่าเกิดแฮชแท็ก #SAVEแกงส้มในประเทศไทย กรมอนามัย กระทรวงสาธารณสุข จึงขอร่วม #SAVEแกงส้ม และอยากขอเชิญชวนให้ผู้บริโภคทั่วโลกเปิดใจรักแกงส้ม รวมทั้งเปิดประโยชน์และคุณค่าโภชนาการของแกงส้มในฐานะแกงไทยที่ถือเป็นอาหารหลักอยู่คู่กับสังคมไทยมาอย่างยาวนาน
ดร.นายแพทย์สราวุฒิ กล่าวต่อว่า แกงส้มจัดเป็นแกงไทยชนิดไม่ใส่กะทิ มีรสชาติความเป็นไทย ทั้งรสเผ็ด เค็ม เปรี้ยว และหวานปะแล่มครบรส ความโดดเด่น คือ รสเปรี้ยวนำจากมะขามเปียกซึ่งเป็นแหล่งวิตามินซีชั้นดี ตามด้วยสรรพคุณจากพริกแกงไทยซึ่งเป็นการใช้สมุนไพร อาทิ พริก กระเทียม หอมแดง กระชาย กะปิ มาโขลกรวมกัน จึงทำให้มีสรรพคุณหลากหลายมากมาย กระชายมีฤทธิ์ขับลมและยังช่วยดับกลิ่นคาวของเนื้อสัตว์ หอมแดงช่วยบรรเทาอาการหวัดคัดจมูก พริกชูรสชาติและเพิ่มอัตราการเผาผลาญพลังงาน กระเทียมช่วยลดระดับโคเลสเตอรอลในเลือด มะขามเปียกมีวิตามินซีสูง ช่วยต้านอนุมูลอิสระและเสริมสร้างระบบภูมิคุ้มกันในร่างกาย จนแกงส้มได้ชื่อว่าเป็น ‘แกงเพื่อสุขภาพ’ ไม่ใช่เพียงแค่ส่วนผสมของพริกแกงเท่านั้น แกงส้มยังใส่ผักและสมุนไพรหลายชนิดลงไป เช่น ผักกาดขาว ดอกแค แตงโมอ่อน มะละกอดิบ ผักบุ้ง ผักกระเฉด เป็นต้น นอกจากนี้แกงส้มยังมีโปรตีนจากเนื้อสัตว์ เช่น เนื้อปลาหรือกุ้ง ที่นิยมนำมาโขลกรวมกับพริกแกงหรือใส่แยกต่างหาก ซึ่งแกงส้มของแต่ละภาคจะมีขั้นตอนการปรุงอาหารแตกต่างกันเล็กน้อย ขึ้นอยู่กับวัตถุดิบในท้องถิ่นผักหลากหลายชนิด ทำให้แกงส้มมีไขมันต่ำ อุดมด้วยใยอาหารช่วยการทำงานของระบบขับถ่าย ผักมีวิตามินเอที่ช่วยการเจริญเติบโตของเนื้อเยื่อและระบบภูมิคุ้มกันของร่างกาย วิตามินซีช่วยเพิ่มการดูดซึมธาตุเหล็ก ต่อต้านอนุมูลอิสระป้องกันเลือดออกตามไรฟัน วิตามินบี 12 จากเนื้อสัตว์จะช่วยสร้างเม็ดเลือดแดง และการทำงานของระบบประสาทและสมอง
“สำหรับคุณค่าโภชนาการของแกงส้ม สำหรับบุคคลทั่วไปที่มีน้ำหนักตัวปกติ สามารถกินข้าวสวยแกงส้มผักรวมร่วมกับอาหารอย่างอื่นได้อีก เพราะแกงส้มจัดเป็นอาหารให้พลังงานต่ำ และอาหารที่นิยมกินกับแกงส้มมักจะเป็นไข่เจียว แต่เนื่องจากแกงส้มถ้าใส่กุ้งสดจะให้โคเลสเตอรอลสูง เมื่อทานรวมกับไข่เจียวอีก 1 ฟอง อาจจะให้โคเลสเตอรอลเกินปริมาณโคเลสเตอรอลที่แนะนำในแต่ละวันได้ ซึ่งปริมาณที่แนะนำ คือ ไม่ควรเกิน 300 มิลลิกรัมต่อวัน จึงอาจจะไม่เหมาะกับผู้ที่มีปัญหาโคเลสเตอรอลในเลือดสูง ดังนั้น ถ้ากินแกงส้มผักรวมกุ้งสด ควรเลือกกินกับอาหารอื่นที่ให้โคเลสเตอรอลต่ำ หรือถ้าต้องการกินแกงส้มกับไข่เจียว แนะนำให้เปลี่ยนจากเนื้อกุ้งเป็นเนื้อปลาแทน อีกข้อควรระวัง คือ ปริมาณโซเดียม ซึ่งอยู่ในเครื่องแกงและเครื่องปรุงรสของแกงส้มจะค่อนข้างสูง สำหรับกลุ่มที่มีปัญหาโรคความดันโลหิตสูง หรือผู้ที่ต้องจำกัดปริมาณโซเดียมในอาหาร ต้องระวังหากกินมาเกินไป จะทำให้ได้รับโซเดียมเกินได้ ที่สำคัญ ต้องกินเมื่อปรุงสุกใหม่ เพื่อความอร่อยถูกใจ อนามัยไม่ถูกลืม” รองอธิบดีกรมอนามัย กล่าว
สายลมแห่งรัก (Silom of Love @Bangrak) LINK
สำนักงานเขตบางรัก เปิดรับจองคิวออนไลน์จดทะเบียนสมรสใน "วันแห่งความรัก" 14 ก.พ. 66 แล้ว! โดยปีนี้มาในชื่องาน "สายลมแห่งรัก (Silom of Love @Bangrak)" งานที่ สายลม จะพัดเอา ความรัก อบอวลไปทั่วสีลม สำหรับครั้งนี้จะจัดขึ้น ณ อาคารยูไนเต็ด เซ็นเตอร์ ถนนสีลม
งานนี้ลุ้นรับทะเบียนสมรสทองคำทุกชั่วโมง จำนวน 10 รางวัล รวมทั้งของที่ระลึกและของรางวัลอีกมากมายภายในงาน
สำหรับคู่รักที่สนใจสามารถจองคิวออนไลน์ด้วยการสแกน QR Code ในภาพได้ตั้งแต่วันนี้เป็นต้นไป แล้วทักหาแอดมินโลด! (ในวันและเวลาราชการ: จันทร์-ศุกร์ เวลา 08.00-16.00 น.)
*ทั้งนี้คู่ที่จดทะเบียนสมรสกับต่างชาติ ต้องเดินทางมายื่นเอกสารด้วยตนเองที่สำนักงานเขต ในวันและเวลาราชการเท่านั้น (วันจันทร์ - วันศุกร์ 08.00-16.00 น.) หากเป็นประเทศกลุ่มเสี่ยง ทางเราไม่รับจดทะเบียนสมรสในวันวาเลนไทน์เน้อ
สอบถามเพิ่มเติม โทร. 02 236 1513 หรือ 02 236 1395 ต่อ 6230-34
ลงทะเบียนจองคิวออนไลน์ LINK
สถานพยาบาลสัตว์ กองสวัสดิภาพสัตว์และสัตวแพทย์บริการ เปิดระบบลงทะเบียนจองคิวออนไลน์
เปิดรับข้อมูลตั้งแต่เวลา 08.30-16.30 น. เริ่มตั้งแต่วันที่ 9 กุมภาพันธ์ 2566 เป็นต้นไป
พร้อมทำตามขั้นตอนการแจ้งเตือนของระบบ Line
อินุโอ #JFF2023 1 ชั่วโมง 37 นาที R:ท
อินุโอ #JFF2023
1 ชั่วโมง 37 นาที R:ท
©2021 “INU-OH” Film Partners แอนิเมชันมิวสิคัลแนวดราม่าย้อนยุคที่ดำเนินเรื่องด้วยดนตรีร็อก ในช่วงศตวรรษที่ 14 ของประเทศญี่ปุ่น นักดนตรีพื้นเมืองถ่ายทอดเรื่องราวตำนานสงครามโบราณที่แบ่งประเทศญี่ปุ่นออกเป็นสองฝ่าย ต่อมาทางการกลับเริ่ม “จัดระเบียบ” บทเพลงเฮเกะและประวัติศาสตร์ และสั่งให้นักดนตรีขับร้องได้เพียงแค่เนื้อเรื่องที่ถูกบัญญัติเอาไว้ในตำราของฝ่ายผู้ชนะเท่านั้น ในตอนนั้นเองที่โทโมนะ หรือในอีกชื่อหนึ่งคือโทโมอิจิ นักดนตรีบิวะตาบอด ได้พบกับอินุโอที่มีรูปร่างผิดแผกจากคนอื่น ไม่นานทั้งสองคนก็ทำให้ดนตรีและรูปแบบการเต้นรำที่ไม่เหมือนใครโด่งดังในชั่วพริบตา ด้วยภาพและการเล่าเรื่องที่มีเสน่ห์ผ่านกลิ่นอายดนตรีร็อกผสมผสานกับเครื่องดนตรีโบราณที่ผสมกลมกลืนอย่างลงตัว ผู้กำกับ “มาซาอากิ ยูอาสะ” นำเสนอภาพของนักแสดงโบราณในรูปแบบนักดนตรีร็อก และตัวเขาเองยังเป็นหนึ่งในผู้สร้างแอนิเมชันแถวหน้าของประเทศญี่ปุ่นอีกด้วย
10 ก.พ. 2566 เริ่มออกปฏิบัติภารกิจกู้ภัยครั้งแรกแล้ว
10 ก.พ. 2566 ทีม USAR ประเทศไทย เข้าพื้นที่และจัดตั้งฐานปฏิบัติการ และเริ่มออกปฏิบัติภารกิจกู้ภัยครั้งแรกแล้ว ร่วมกับหน่วยปฏิบัติการนานาชาติ (UCC) สุนัข 2 ตัว เซียร่า และ ซาฮาร่า ปรับตัวได้ดี วิ่งเล่นได้ ทั้งสองตัวถูกฝึกให้ค้นหาและแจ้งเตือนหากพบผู้รอดชีวิต มีชาวตุรกี 2 คน มาขอความช่วยเหลือ ทีมแพทย์ของไทยให้ดูแลเรียบร้อยดี [
Thai PBS]
มูลนิธิปิดทองหลังพระ LINK
มูลนิธิปิดทองหลังพระ สืบสานแนวพระราชดำริ ก่อตั้งขึ้นโดยปณิธานในการน้อมนำแนวพระราชดำริในพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราชบรมนาถบพิตร และพระบรมวงศานุวงศ์ทุกพระองค์มาเป็นหลักการในการพัฒนาประเทศและศักยภาพของคนไทย ให้ก้าวไปสู่ความมั่นคงและยั่งยืน ด้วยความศรัทธาและเชื่อมั่นในแนวพระราชดำริที่ได้รับการพิสูจน์มาตลอดระยะเวลามากกว่า ๖๐ ปีแล้วว่า เป็นแนวทางที่นำไปสู่ความสุขของประชาชนได้อย่างแท้จริง ด้วยความเห็นชอบจากคณะรัฐมนตรี จึงมีมติเมื่อวันที่ ๒๔ พฤศจิกายน พุทธศักราช ๒๕๕๒ ให้จัดตั้งมูลนิธิปิดทองหลังพระ สืบสานแนวพระราชดำริและสถาบันส่งเสริมและพัฒนากิจกรรมปิดทองหลังพระขึ้น
พันธกิจ
การจัดการความรู้และการส่งเสริมการพัฒนาตามแนวพระราชดำริอย่างเป็นระบบกว้างขวาง
จนกระทั่งเป็นแนวทางการพัฒนาหลักของประเทศ
วัตถุประสงค์
1.จัดตั้งและสนับสนุนการดำเนินงานของสถาบันส่งเสริมและพัฒนากิจกรรมปิดทองหลังพระ สืบสานแนวพระราชดำริ ซึ่งเป็นหน่วยปฏิบัติของมูลนิธิ ให้ดำเนิน การได้อย่างมีประสิทธิผล ประสิทธิภาพ สอดคล้องกับเจตนารมณ์แห่งการจัดตั้ง
2.ให้สถาบัน โดยมีมูลนิธิ สนับสนุนให้ทุนดำเนินงาน มีวัตถุประสงค์ ดังนี้
2.1 สนับสนุนส่งเสริมและให้ความช่วยเหลือในการแก้ไขปัญหาและพัฒนา แก่องค์กร ชุมชน ประชาสังคม องค์กรปกครองส่วนท้องถิ่น องค์กรภาครัฐ องค์กรทางสังคม สถาบันวิชาการ ภาคธุรกิจ ในการดำเนินงานที่สอดคล้องกับมิติการพัฒนาตามแนวพระราชดำริ เพื่อให้ประชาชนมีชีวิตความเป็นอยู่ที่ดีขึ้น รวมถึงส่งผลต่อการอนุรักษ์ทรัพยากรธรรมชาติและสิ่งแวดล้อม
2.2 สนับสนุนการจัดการความรู้ตามแนวพระราชดำริโดยประสานความร่วมมือกับศูนย์ศึกษาการพัฒนา โครงการส่วน พระองค์ โครงการตามพระราช ประสงค์ โครงการหลวง โครงการอันเนื่องมาจากพระราชดำริ องค์กรชุมชน ประชา สังคม องค์กรปกครองส่วนท้องถิ่น องค์กรภาครัฐ องค์กรทางสังคม สถาบันวิชาการ ภาคธุรกิจ เพื่อให้เกิดคลั ความรู้ การยกระดับความรู้ การต่อยอดชุดความรู้ใหม่ การพัฒนาหลักสูตรการศึกษาในและนอกระบบ ตลอดจนการ ขยายผลเชื่อมโยงสู่การนำไปปฏิบัติอย่างกว้างขวาง
2.3 ส่งเสริมให้เกิดการบูรณาการ ภารกิจและกิจกรรมของสถาบัน กับแผนชุมชน แผนองค์กรปกครองส่วนท้องถิ่น แผน พัฒนาจังหวัด แผนหน่วยงานภาค รัฐที่เกี่ยวข้อง และนโยบายรัฐบาล
2.4 สนับสนุน ส่งเสริม แนะนำ และช่วยเหลือ องค์กรชุมชน ประชาสังคม องค์กรปกครองส่วนท้องถิ่น องค์กรภาครัฐ องค์กรทางสังคม สถาบันวิชาการ ภาคธุรกิจ เพื่อให้น้อมนำแนวพระราชดำริไปปรับใช้ให้เกิดประโยชน์และเป็น แนวทางหลักในการพัฒนาทุกระดับของประเทศ
2.5 สร้างการรับรู้ ความเข้าใจ และความร่วมมือดำเนินการตามแนวพระราชดำริอย่างต่อเนื่อง
3.เพื่อสนับสนุนและส่งเสริมการศึกษา และทัศนศึกษาที่เกี่ยวกับการนำแนวพระราชดำริไปประยุกต์ใช้และ ขยายผลสู่ชุมชน
4.เพื่อส่งเสริมการประสานการดำเนินงานร่วมกับองค์กรชุมชน ประชาสังคม องค์กรปกครองส่วนท้องถิ่น องค์กรภาครัฐ องค์กรทางสังคม สถาบันวิชาการ ภาค ธุรกิจ เพื่อกิจกรรมพัฒนาและกิจกรรมสาธารณประโยชน์
5.ไม่ดำเนินการเกี่ยวข้องกับการเมืองแต่ประการใด
ผลผลิต
- เกิดแนวทางที่หลากหลายในการแก้ไขปัญหาและพัฒนาประเทศตามภูมิสังคมอย่างยั่งยืนตามแนวพระราชดำริ
- เกิดการมีส่วนร่วมจากภาคีทุกภาคนส่วนในการพัฒนายุทธศาสตร์ชาติ และยุทธศาสตร์สาขาตามแนวพระราชดำริ
- เกิดการรับรู้ เข้าใจ และ ความร่วมมือสนับสนุนจากภาครัฐ วิชาการ เอกชนท้องถิ่น ชุมชน ประชาสังคม และ นานาชาติ ในการร่วมสร้างภูมิคุ้มกันและร่วมแก้ไขปัญหาพื้นฐานที่สำคัญของประเทศตามแนวพระราชดำริ
ตักบาตร ท่ามกลางทุ่งเบญจมาศ
12 กุมภาพันธ์ 2566 อำเภอวังน้ำเขียว จัดให้มีกิจกรรม ตักบาตร ท่ามกลางทุ่งเบญจมาศ ได้รับความสนใจเข้าร่วมจำนวนมาก
วันที่ 12 กุมภาพันธ์ 2566 เวลา 07.30 น. นักท่องเที่ยวแห่ร่วมตักบาตร ท่ามกลางทุ่งเบญจมาศ บานในสายหมอก รับบุญเบิกบานในเดือนแห่งความรัก ที่วังน้ำเขียว แบ่งปันของตักบาตรช่วยเหลือผู้ยากไร้ บริเวณแปลงเบญจมาศ องค์การบริหารส่วนตำบลไทยสามัคคี ต.ไทยสามัคคี อ.วังน้ำเขียว จ.นครราชสีมา
นายสมภพ มุกดาสนิท นายอำเภอวังน้ำเขียว พร้อมด้วย นายประกอบ สิริวงศ์เทาสะอาด นายก อบต.ไทยสามัคคี นายพงษ์เทพ มาลาชาสิงห์ ประธานชมรมส่งเสริมการท่องเที่ยวอำเภอวังน้ำเขียว สิบเอกธงไชย ไชยฉิมพลี ประธานชมรมจักรยานเพื่อการท่องเที่ยว ร่วมกับประชาชน และนักท่องเที่ยว จำนวนมาก ร่วมกันตักบาตรอาหารแห้งพระสงฆ์ ท่ามกลางทุ่งดอกเบญจมาศบานในสายหมอก บรรยากาศเป็นใจในยามเช้า โดยแบ่งปันของตักบาตรช่วยเหลือผู้ยากไร้ในชุมชน กระตุ้นเศรษฐกิจการท่องเที่ยวชุมชน [ชมรมส่งเสริมการท่องเที่ยวอำเภอวังน้ำเขียว]
คำแนะนำเพิ่มเติม
อุทยานดาราศาสตร์สิรินธร เชียงใหม่
อุทยานดาราศาสตร์สิรินธร (Princess Sirindhorn AstroPark) ตั้งอยู่ที่ ตั้งอยู่ที่ ต.ดอนแก้ว อ.แม่ริม จ.เชียงใหม่ เปิดให้บริการอย่างเต็มรูปแบบในปี 2563 เป็นที่ตั้งสำนักงานของสถาบันวิจัยดาราศาสตร์แห่งชาติ ตั้งอยู่ที่ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ เปิดทุกวันยกเว้นวันจันทร์
เวลาทำการ:
วันจันทร์ ปิดทำการ
วันอังคาร 9:00–16:00
วันพุธ 9:00–16:00
วันพฤหัสบดี 9:00–16:00
วันศุกร์ 9:00–16:00
วันเสาร์ 10:00–17:00
วันอาทิตย์ 10:00–17:00
แกนความคิดเชิงออกแบบทำเพื่อสร้างนวัตกรรม ได้ถูกแบ่งไว้ 3 ส่วน ส่วนแรกทำให้คนรู้จักและสัมผัสของดีย่านตลาดพลู-วงเวียนใหญ่ ด้วยการเปิดพื้นที่ให้คนได้สัมผัสจากการลงมือทำผ่านกิจกรรมลักษณะทำเวิร์คช็อป เช่น การจัดกิจกรรมระบายสีหัวสิงโต เนื่องจากในย่านนี้มีคณะเชิดสิงโตที่มีชื่อเสียง กิจกรรมเรียนรู้เรื่องการทำว่าว เนื่องจากย่านนี้มีแชมป์การเล่นว่าว และการเปิดพื้นที่โรงสีเพื่อให้เรียนรู้เรื่องเส้นทางการค้าข้าวในอดีต
เทศกาลประดับไฟ Aqua Lumina 2022 กระบี่ ภูเก็ต พังงา
การท่องเที่ยวแห่งประเทศไทย จัดงาน “เทศกาลประดับไฟ Aqua Lumina” ที่จังหวัดกระบี่เป็นแห่งแรก สำหรับเทศกาลประดับไฟ “The Aqua Illumination in Southern Thailand” มหัศจรรย์แสงเรืองรองจากท้องทะเลอันดามัน ณ พิพิธภัณฑ์เรือหลวงลันตา และลานพระอาทิตย์ องค์การบริหารจังหวัดกระบี่ พื้นที่จัดงานกว่า 30,000 ตารางเมตร ภายใต้แนวคิด “ดินแดนสิ่งมีชีวิตมหัศจรรย์” จัดแสดงระบบแสงสีผ่านบรรดาสัตว์ใต้ท้องทะเลสุดน่ารักที่ถูกประดับประดาไปด้วยไฟหลากสีสัน และการแสดง Projection Mapping บนเรือหลวงลันตา พร้อมการออกร้านจำหน่ายอาหารขึ้นของจังหวัดกระบี่ กำหนดจัดตั้งแต่ 14 - 25 พฤษภาคม 2565
งาน The Aqua Illumination in Southern Thailand เป็นกิจกรรมประดับไฟสวยงาม 1 ใน 3 จังหวัด ตามแผนของการท่องเที่ยว ได้แก่ กระบี่ ภูเก็ต และพังงา
สำหรับงานจังหวัดภูเก็ต จะจัดขึ้นระหว่างวันที่ 20 - 31 พฤษภาคม 2565 ณ หาดในหาน ในพื้นที่จัดงานกว่า 12,000 ตารางเมตร ด้วยแนวคิดสุดยิ่งใหญ่ ตระการตา “ดินแดนผู้พิทักษ์แห่งอันดามัน” ซึ่งภายในงานประกอบไปด้วยแสงสีเสียง และมุมถ่ายรูปที่ประดับตกแต่งไฟ พร้อมทั้งรับชมการแสดง Projection Mapping
ปิดท้ายด้วยจังหวัดพังงา จะจัดขึ้นระหว่างวันที่ 27 พฤษภาคม - 2 มิถุนายน 2565 ณ หาดเมมโมรี่ พื้นที่จัดงานกว่า 14,000 ตารางเมตร ภายใต้แนวคิด "ดินแดนคลื่นเต้นระบำ" ด้วยเทคนิค MUSIC & ILLUMINATION ที่ผู้เข้าชมจะได้ชมการไฟประดับรูปทรงปะการังใต้ท้องทะเล พร้อมร้านอาหารมากกว่า 20 ร้าน และการแสดงคอนเสิร์ตของศิลปินทั้งจากในท้องถิ่น และขบวนศิลปินฮิปฮอปชื่อดัง ที่จะมาร่วมสร้างบรรยากาศให้สนุกสนานริมชายหาด
โปสเตอร์แบบที่ 1 เป็นผลงานของคุณอเล็ก เฟส (Alex Face) หรือ พัชรพล แตงรื่น ศิลปินผู้หลอมรวมโลกของสตรีทอาร์ต กับงานจิตรกรรมอิมเพรสชั่นนิสม์และนักสร้างงานกราฟฟิตี้ที่มีชื่อเสียงระดับโลก
1.The Save&Safe #ชัวร์ไว้ก่อน
The Save&Safe #ชัวร์ไว้ก่อน ไม่ว่าจะมีสถานการณ์โรคระบาด สงคราม เศรษฐกิจ หรือไม่ คนกลุ่มนี้ จะมีการ “เตรียมพร้อม” รับความไม่แน่นอนอยู่เสมอ และถือว่าเป็นกลุ่มที่เยอะที่สุดถึง 56% ของนักช้อปไทยในผลสำรวจ ดังนั้น ถ้าแบรนด์อยากจับคนกลุ่มนี้ แบรนด์ต้องให้ความรู้สึกพึ่งพาได้ ต้องสร้างความสัมพันธ์ที่คุ้นเคย ให้คนกลุ่มนี้เกิดความรู้สึกมั่นคงในการซื้อ
แถลงข่าว Esan Coffee Fair 2023 อย่างเป็นทางการ
3 ก.พ. 66 งาน Esan Coffee Fair 2023 เปิดตัวในการแถลงข่าวอย่างเป็นทางการ นำโดยคุณสยาม ศิริมงคล ผู้ว่าราชการจังหวัดนครราชสีมา ให้เกียรติเป็นประธานในการเปิดงาน พร้อมด้วยนายแพทย์เจษฎ์ บุณยวงศ์วิโรจน์ หัวหน้ากลุ่มพลังใจโคราช , คุณสุริยา ตันเจริญ ผู้อำนวยการสายงานปฏิบัติการ สาขาภาคตะวันออก เซ็นทรัลพัฒนา , คุณนิสา ชาภู่พวง ผู้จัดการทั่วไปศูนย์การค้า เซ็นทรัล โคราช , คุณสินชาย คุ้มศรีวงษ์ ผู้อำนวยการบังคับคดีจังหวัดนครราชสีมา , คุณปภิญญา ทองสมจิตร แรงจังหวัดนครราชสีมา , คุณพุทธิพร พลอยผักแว่น ท้องถิ่นจังหวัดนครราชสีมา , คุณนิมิต พุฒิวณิชย์พิมล ประธานชมรม Korat Friend Coffee และคุณชุน ผู้บริหารบริษัท 80 plus ผู้สนับสนุนการจัดงานในครั้งนี้
ไทม์ไลน์ เราเที่ยวด้วยกันเฟสที่ 5
Miracle of Life โดยคลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์
คลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์ (Fertility Center and IVF Clinic) มีความพร้อมด้วยทีมแพทย์ผู้เชี่ยวชาญ มากประสบการณ์ พร้อมดูแลให้คำปรึกษา วางแผน การมีบุตรอย่างครบวงจร เพื่อให้ผู้รับบริการประสบความสำเร็จตามเป้าหมาย
1. การแก้ปัญหาการขาดแคลนบุคลากรด้วยระบบการทำงานอัตโนมัติ (Workflow Automation) และปัญญาประดิษฐ์ (AI)
จากรายงาน Philips Future Health Index 2022 report เผยว่าปัญหาด้านบุคลากรเป็นเรื่องสำคัญอันดับแรกๆ ของผู้บริหารในวงการเฮลท์แคร์ และหากไม่จัดการกับปัญหานี้อย่างเร่งด่วน ภาวะหมดไฟและการขาดแคลนบุคลากรจะส่งผลให้ระบบสาธารณสุขอ่อนแอลงอย่างต่อเนื่อง ยกตัวอย่างเช่น ในด้านรังสีวิทยา มีงานวิจัยที่แสดงให้เห็นว่า นักรังสีวิทยาอย่างน้อยครึ่งหนึ่งในสหรัฐอเมริกาประสบกับภาวะเหนื่อยล้าจากการทำงาน และทำให้ประสิทธิภาพในการทำงานลดลง [1] ในขณะที่มีการคาดการณ์ว่า ทั่วโลกจะขาดแคลนเจ้าหน้าที่พยาบาลถึง 13 ล้านคนภายในปีค.ศ. 2030 [2] นอกจากนี้ บุคลากรทางการแพทย์ยังต้องเผชิญกับงานค้างจากการรักษาปกติที่ถูกพักไว้ในช่วงที่มีการแพร่ระบาดยิ่งทำให้เกิดภาวะตึงเครียดมากกว่าปกติ ซึ่งจากปัญหานี้ จะเห็นว่าผู้ให้บริการด้านสาธารณสุขได้นำระบบการทำงานอัตโนมัติที่มีเทคโนโลยี AI เข้ามาใช้ เพื่อเพิ่มประสิทธิภาพและขีดความสามารถของบุคลากรทางการแพทย์
ระบบการทำงานอัตโนมัติ (Automation) เป็นเทรนด์เทคโนโลยีด้านเฮลท์แคร์ที่สามารถช่วยลดภาระงานด้านเอกสารให้กับแพทย์ พยาบาล และนักเทคนิคการแพทย์ เพื่อให้บุคลากรทางการแพทย์ใช้เวลาอยู่หน้าจอคอมพิวเตอร์น้อยลงและมีเวลาอยู่กับผู้ป่วยมากขึ้น นั่นหมายถึงการปรับปรุงกระบวนการทำงานขั้นพื้นฐานที่ให้ผลลัพธ์สูง เช่น การเปิดใช้งานระบบส่งต่อข้อมูลตรวจติดตามผู้ป่วยเข้าสู่ระบบเวชระเบียนอิเล็กทรอนิกส์โดยตรง ซึ่งช่วยเพิ่มประสบการณ์ที่ดีและประสิทธิภาพการทำงานของบุคลากรทางการแพทย์ได้
ชมคลิปรายละเอียดโครงการ LINK
ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) และ ทพญ.วรางคนา เวชวิธี ผู้อำนวยการสำนักทันตสาธารณสุข กรมอนามัย
เชียงใหม่ Songkran Fun Fest 2023 ศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส)
Songkran Fun Fest 2023 เชียงใหม่ ต้อนรับทุกท่านมาเปียกที่เชียงใหม่ เเลนด์มาร์คใหญ่สุด อลังสุด พร้อมสาด พร้อมเปียก พร้อมปะทะน้ำ จัดเต็ม 3 วัน เเดนซ์ให้สุดกับ 5 ศิลปิน ที่จะพาทุกคนไปม่วนกันเเบบไม่มียั้ง ที่ศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส) เเล้วปะกั๋นเน้อ 13-15 เมษายน 2023 16:00-24:00 น.
13 Apr. NUM KALA / JOEY PHUWASIT
14 Apr. POTATO / F.HERO
15 Apr. BODYSLAM
อ้างอิง
[1] Catalina Lopez-Quintero, et al, Probability and predictors of transition from first use to dependence on nicotine, alcohol, cannabis, and cocaine: Results of the National Epidemiologic Survey on Alcohol and Related Conditions (NESARC),Drug and Alcohol dependence, Volume 115, Issues 1-2, May 2011, Pages 120-130
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3069146/
[2] คณะอนุกรรมการพิจารณาข้อมูลเกี่ยวกับการใช้กัญชาทางการแพทย์ แพทยสภา, คำแนะนำสำหรับแพทย์ การใช้กัญชาทางการแพทย์, ฉบับที่ 1, ตุลาคม 2562
https://tmc.or.th/pdf/fact/guideline_cannabis_101062.pdf
[3] Tom P Freeman, Medicinal use of cannabis based products and cannabinoids, BMJ 2019; Published 04 April 2019), doi: https://doi.org/10.1136/bmj.l1141
https://www.bmj.com/content/365/bmj.l1141
[4] กรมการแพทย์แผนไทยและการแพทย์ทางเลือก กระทรวงสาธารณสุข, ชุดตำราภูมิปัญญาการแพทย์แผนไทย ฉบับอนุรักษ์ ตำรับยาแผนไทยของชาติที่เข้าต้วยากัญชา, 2564, 454 หน้า, ISBN 978-616-11-4755-6
https://www.dtam.moph.go.th/.../ptmk/ptmk-ganja/index.html
[5] จักราวุธ เผือกคง, กัญชาทางการแพทย์แผนไทย,
http://164.115.41.179/tm/sites/default/files/6.%20หลักการใช้กัญชาทางการแพทย์แผนไทย.pdf
[6] พระยาทิพจักษุสาตร์ (สุ่น สุนทรเวช), แพทย์ประจำบ้าน, พิมพ์ครั้งที่ 2 พ.ศ. 2458 หน้า 172
[7] ราชกิจจานุเบกษา, ประกาศสภาการแพทย์แผนไทย เรื่อง เกณฑ์มาตรฐานและกรรมวิธกีารแพทย์แผนไทยผู้ประกอบวิชาชีพการแพทย์แผนไทย ตามพระราชบัญญัตวิชาชีพการแพทย์แผนไทย พ.ศ. 2556, วันที่ 15 กรกฎาคม 2563, เล่ม 137 ตอนพิเศษ 162 ง, หน้า 27, ท้ายประกาศหน้า 12 และ 19 จาก 42 หน้า
http://www.ratchakitcha.soc.go.th/.../2563/E/162/T_0027.PDF
[8] ธเนศพล พันธ์เพ็ง, สุกก์สลิล บูรณะทรัพย์ขจร, สุวีรวรรณ ลิ้มสุวรรณ, การปรุงยาสมุนไพร ตามกรรมวิธีทางการแพทย์แผนไทย 28 วิธี, สถานการแพทย์แผนไทยประยุกต์ คณะแพทย์ศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล พ.ศ. 2564-กรุงเทพฯ สำนักพิมพ์ศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล, 2564, 268 หน้า ISBN: 978-616-8201-17-6, (กรรมวิธีที่ 23 ยาประสมแล้วมวนบุหรี่สูบเอาควัน เช่น บุหรี่ โดย อรอุษา ธรรมเสริมสร้าง, หน้า 163-169
[9] สาวิตรี อัษณางค์กรชัย และคณะ. การศึกษาติดตามสถานการณ์การใช้และการให้บริการกัญชาทางการแพทย์ระยะที่สอง. ศูนย์ศึกษาปัญหาการเสพติด (ศศก). 2565
[10] Ziemowit BednarekI, et al., U.S. cannabis laws projected to cost generic and brand pharmaceutical firms billions, plos one, Published: August 31, 2022
https://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0272492&type=printable
[11] Shyam Raman, Ashley C. Bradford, Health Economics, Recreational cannabis legalizations associated with reductions in prescription drug utilization among Medicaid enrollees First published: 15 April 2022 https://doi.org/10.1002/hec.4519
https://onlinelibrary.wiley.com/doi/10.1002/hec.4519
[12] Rajavashisth TB, Shaheen M, Norris KC, Pan D, Sinha SK, Ortega J, Friedman TC. Decreased prevalence of diabetes in marijuana users: cross-sectional data from the National Health and Nutrition Examination Survey (NHANES) III. BMJ Open. 2012 Feb 24;2:e000494. doi: 10.1136/bmjopen-2011-000494.
[13] Huang J, Huang D, Ruan X, Huang J, Xu D, Heavey S, Olivier J, Na R. Association between cannabis use with urological cancers: A population-based cohort study and a Mendelian randomization study in the UK biobank. Cancer Med. 2022 Aug 17. doi: 10.1002/cam4.5132. PMID: 35975633.
[14] ผู้จัดการออนไลน์, เปิดอก “ไก่ ขอนแก่น” หนุ่มวัย ๓๓ ปีเลิกยาบ้าได้เด็ดขาดเพราะกัญชา, Todayline, 29 พฤศจิกายน พ.ศ. 2565, เวลา 14.06 น.
https://today.line.me/th/v2/article/mW30nJW
[15] ฐานข้อมูลการบำบัดรักษายาเสพติดทั่วประเทศของกระทรวงสาธารณสุข, 27 ธันวาคม 2565
[16] เดลินิวส์ออนไลน์, ป.ป.ส. เฉลยสาเหตุทำไม ‘ยาบ้า’ ราคาถูก พบลักลอบผ่านบริษัทขนส่งปรับ ๕ หมื่น, ๑๕ พฤศจิกายน พ.ศ. ๒๕๖๕
https://www.dailynews.co.th/news/1684530/
[17] Janice Mok, et al, Use of Cannabis for Harm Reduction Among People at High Risk for Overdose in Vancouver, Canada (2016–2018), American Journal of Public Health (AJPH) May 2021,
https://ajph.aphapublications.org/.../AJPH.2021.306168...
[18] Janice Mok, et al., Use of Cannabis as a Harm Reduction Strategy Among People Who Use Drugs: A Cohort Study, Cannabis and Cannabinoid Research, Published Online 31 May 2022
https://doi.org/10.1089/can.2021.0229
https://www.liebertpub.com/doi/10.1089/can.2021.0229
[19] Jack K. Reed, Impacts of Marijuana Legalization in Colorado, A Report Pursuant to C.R.S. 24-33.4-516, July 2021
https://cdpsdocs.state.co.us/.../2021-SB13-283_Rpt.pdf
[20] ดร.นพ.มูฮัมมัดฟาห์มี ตาเละ, เปรียบเทียบสถานะสารเสพติด (กัญชา) ที่ต่างกันสุดขั้วในเนเธอร์แลนด์และสิงคโปร์…….แล้วไทยควรเลือกทางไหน?, เว็บไซต์ศูนย์ศึกษาปัญหายาเสพติด, 30 กรกฎาคม 2564 : 9:32:15 น.
https://cads.in.th/cads/content?id=295
[21] ปานเทพ พัวพงษ์พันธ์, กัญชา” กับ “เนเธอร์แลนด์โมเดล” ลดปัญหาอาชญากรรม “เรือนจำร้าง”จนต้องนำเข้านักโทษจากต่างประเทศ!?, ผู้จัดการออนไลน์, เผยแพร่: 1 ก.ค. 2565 17:15 ปรับปรุง: 1 ก.ค. 2565 17:15 น.
https://mgronline.com/daily/detail/9650000062568
[22] Ellen Meier, et al., Cigarette Smokers Versus Cannabis Smokers Versus Co-users of Cigarettes and Cannabis: A Pilot Study Examining Exposure to Toxicants Get access
https://academic.oup.com/.../article.../24/1/125/6297574...
[23] The International Agency for Research on Cancer (IARC), monographs 2019.
https://monographs.iarc.who.int/.../OrganSitePoster...
https://monographs.iarc.who.int/monographs-available/
[24] ผู้จัดการออนไลน์, “ปานเทพ” เปิดกฎหมาย 12 ฉบับ ยัน “กัญชาไม่ได้เสรี”, เผยแพร่: 24 ก.พ. 2566 13:49 ปรับปรุง: 24 ก.พ. 2566 13:49
https://mgronline.com/politics/detail/9660000018017
ซ้อมแผนรับมือความรุนแรงในโรงพยาบาล: คู่อริ แผนกฉุกเฉิน บางโพ ทำร้ายผู้บาดเจ็บ พร้อมอาวุธ ครบมือ
วิสัยทัศน์อันกว้างไกลของทีมผู้บริหารและศ. นพ. กุลวี เนตรมณี
สถาบันโรคหัวใจบำรุงราษฎร์ ก่อตั้งขึ้นจากวิสัยทัศน์อันกว้างไกลของทีมผู้บริหารและศ. นพ. กุลวี เนตรมณี แพทย์ชำนาญการด้านอายุรศาสตร์โรคหัวใจ โรงพยาบาลบำรุงราษฎร์ และผู้อำนวยการสถาบันโรคหัวใจบำรุงราษฎร์ ตามที่ ศ. นพ. กุลวี กล่าวว่า “สถาบันโรคหัวใจบำรุงราษฎร์ มุ่งหวังที่จะให้การรักษาที่ดีและมีประสิทธิภาพที่สุดให้แก่ผู้ป่วยโรคหัวใจได้อย่างครอบคลุม”
“สถาบันโรคหัวใจบำรุงราษฎร์ มุ่งหวังที่จะเป็นศูนย์การแพทย์ที่ทันสมัยและให้การรักษาที่ครอบคลุมโรคหัวใจและหลอดเลือด เช่น โรคหัวใจเต้นผิดจังหวะ ภาวะหัวใจล้มเหลว การผ่าตัดปลูกถ่ายหัวใจ โครงสร้างของหัวใจผิดปกติ โรคหัวใจที่ถ่ายทอดทางพันธุกรรม โรคหัวใจพิการแต่กำเนิด รวมถึงการคัดกรองและการส่งเสริมสุขภาวะของหัวใจ นอกจากนี้ โรงพยาบาลบำรุงราษฎร์ยังมีแผนก Cardiac Care Unit (CCU) ที่ดูแลผู้ป่วยโรคหัวใจขั้นวิกฤต และผู้ป่วยหลังการผ่าตัดตลอด 24 ชั่วโมง เพื่อให้กลับมาฟื้นตัวได้เร็ว สามารถกลับมามีชีวิตปกติได้อย่างดีที่สุดและเร็วที่สุด” ศ. นพ. กุลวี อธิบาย
ภาพมุมสูงของแดนเนรมิต ราวปี พ.ศ.2529
ภาพมุมสูงของแดนเนรมิต ถนนพหลโยธินก่อนถึงแยกตัดกับถนนรัชดาภิเษก ในอดีต ราวปี พ.ศ.2529 [
เมืองไทยในอดีต]
วันศุกร์ ที่ 26 สิงหาคม 2565 เวลา 08.30 น. ณ สวนสาธารณะศรีธรรมาโศกราช ดร.กณพ เกตุชาติ นายกเทศมนตรีนครนครศรีธรรมราช เป็นประธานเปิดงานรณรงค์ป้องกันโรคพิษสุนัขบ้าและทำหมันสุนัขและแมว โดยกองสาธารณสุขและสิ่งแวดล้อม ได้ตระหนักถึงความสำคัญถึงโรคพิษสุนัขบ้าจึงได้จัดงานรณรงค์ป้องกันโรคพิษสุนัขบ้าและทำหมันสุนัขและแมวขึ้น ทั้งนี้เพื่อเป็นการสนองพระปณิธาน ศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอเจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี และกระตุ้นให้ประชาชนตระหนักถึงความสำคัญและอันตรายของโรคพิษสุนัขบ้า และควบคุมประชากรสุนัขและแมวเพื่อลดปัญหาสุนัขและแมวจรจัด ซึ่งภายในงานมีกิจกรรมที่สำคัญคือ จัดอบรมให้ความรู้เรื่องโรคพิษสุนัขบ้า,แบ่งกลุ่ม สาธิตการฉีดวัคซีนและให้ความรู้เรื่องวัคซีน,จัดนิทรรศการให้ความรู้เรื่องโรคพิษสุนัขบ้า,ขึ้นทะเบียนสุนัขและแมว,ตรวจสุขภาพสัตว์เลี้ยง,ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยงและทำหมันสุนัขและแมวร่วมกับสำนักงานปศุสัตว์จังหวัดนครศรีธรรมราช
กำหนดการชี้แจงรายละเอียดโครงการประกวด ผ่าน Online ทางระบบ Webex Meeting LINK
การท่องเที่ยวแห่งประเทศไทย (ททท.) ขอเชิญผู้ประกอบการท่องเที่ยวเข้าร่วมรับฟังการชี้แจงรายละเอียดโครงการประกวดรางวัลอุตสาหกรรมท่องเที่ยวไทย (Thailand Tourism Awards) ครั้งที่ 14 ประจำปี 2566 ผ่าน Online ทางระบบ Webex Meeting
รายละเอียดกำหนดการ
วันจันทร์ที่ 13 มีนาคม 66
เวลา 13.30 - 15.00 น. ประเภทการท่องเที่ยวเชิงสุขภาพ และประเภทการท่องเที่ยวคาร์บอนต่ำเพื่อความยั่งยืน
วันอังคารที่ 14 มีนาคม 66
เวลา 09.00 - 10.30 น. ประเภทที่พักนักท่องเที่ยว และประเภทการท่องเที่ยวคาร์บอนต่ำเพื่อความยั่งยืน
เวลา 13.30 - 15.00 น. ประเภทรายการนำเที่ยวและประเภทการท่องเที่ยวคาร์บอนต่ำเพื่อความยั่งยืน
วันจันทร์ที่ 20 มีนาคม 66
เวลา 13.30 - 15.00 น. ประเภทแหล่งท่องเที่ยว และประเภทการท่องเที่ยวคาร์บอนต่ำเพื่อความยั่งยืน
ตัวอย่างเพจทำใบขับขี่ปลอม
สถานการณ์ การปนเปื้อน PFASs ในสิ่งแวดล้อมประเทศไทย
จากการทบทวนผลการศึกษาในประเทศไทยที่ผ่านมาตรวจพบสาร PFASs ในตัวอย่างสิ่งแวดล้อม จำนวน 5 กลุ่ม รวม 20 ชนิด [
ดูรายชื่อ 20 ชนิด]
มีการศึกษาการปนเปื้อนสาร PFASs ในน้ำ จากตัวอย่างน้ำดิบในระบบน้ำประปา (ได้แก่ น้ำเข้าระบบ, ในถังทำน้ำใส, ระบบกรองทรายและน้ำผ่านการปรับปรุง) น้ำประปา และน้ำดื่มบรรจุขวด ในพื้นที่กรุงเทพฯ ผลการศึกษาตรวจพบสารกลุ่ม PFCAs และ PFSAs 5 ชนิด มีความเข้มข้นรวมอยู่ระหว่าง 3.31-25.79 ng/L โดยชนิดที่ตรวจพบมากที่สุดคือ PFOA
นอกจากนี้ กระบวนการปรับปรุงคุณภาพน้ำประปาไม่สามารถกำจัดสาร PFASs ออกจากน้ำได้ และในน้ำดื่มบรรจุขวดมีความเข้มข้นสูงกว่าน้ำประปา
ในปีเดียวกันมีการศึกษาการปนเปื้อนสาร PFASs ในตัวอย่างน้ำจากระบบบำบัดน้ำเสียส่วนกลางของ นิคมอุตสาหกรรมในพื้นที่ภาคกลางและภาคตะวัน ออกจำนวน 2 แห่ง โดยเก็บตัวอย่างน้ำที่เข้าระบบ น้ำในถังเติมอากาศ น้ำในถังตกตะกอนขั้นที่ 2 และ น้ำออกจากระบบบำบัด (อย่างละ 10 ตัวอย่าง รวม 40 ตัวอย่าง) และตัวอย่างกากตะกอน (4 ตัวอย่าง) ผลการศึกษาพบสารกลุ่ม PFCAs และ PFSAs 10 ชนิด โดยมีค่าความเข้มข้นรวมอยู่ระหว่าง 661.8- 1,382.8 ng/L และพบว่าระบบบำบัดน้ำเสียทั้ง 2 แห่ง ไม่สามารถกำจัดสาร PFASs ออกจากน้ำ เสียได้
น้องแมวน้องหมากำลังมีความสุข
ยกใบหูตั้งขึ้น ป้องมาด้านหน้า หรือขยับหูไปมาช้าๆ – ท่าทางแบบนี้บ่งบอกว่า เจ้าเหมียวของเรากำลังมีความสุข ผ่อนคลายสุดๆ หากนอนในท่าเอาอุ้งเท้ามาซุกใว้ใต้ตัว นอนตะแคงเหยียดยาว หงายท้องโชว์ขนปุกปุย แสดงว่าน้องแมวเชื่อใจเรามากด้วยเช่นกัน
โก่งก้น กระดิกหางไปมา – สำหรับเจ้าตูบ ท่านี้แปลว่าพวกเขากำลังแอคทีฟสุดๆ จนเก็บพลังไว้ไม่อยู่ อยากชวนคุณมาสนุกไปด้วยกัน หรือหากพวกเขาเดินวนหมุนตัวไปมา ไม่ต้องสงสัยเลยว่าน้องหมากำลังตื่นเต้น หรือหากส่งเสียงเห่า พร้อมกับกระโดดไปมา ซ้ายทีขวาที นั่นแปลว่า พวกเขากำลังมีความสุขอย่างมาก
คำแนะนำเรื่องเพศในวัยรุ่น โดย มูลนิธิสร้างความเข้าใจเรื่องสุขภาพผู้หญิง LINK
มูลนิธิสร้างความเข้าใจเรื่องสุขภาพผู้หญิง สนับสนุนโดย สสส. จัดทำข้อมูลเพื่อการสร้างความเข้าใจเรื่องเพศในวัยรุ่น ไว้อย่างครอบคลุมในหลายมิติที่สอดคล้องกับชีวิตและสถานการณ์จริงๆ มีประเด็นที่น่าใจ ดังนี้
ทำไมต้องคุยกับลูกเรื่องเพศ?
เพราะสังคมรอบข้างพูดเรื่องเพศอยู่ตลอดเวลา ทั้งในหนัง-ละคร โฆษณา เอ็มวี ข่าว ฯลฯ แล้วเด็กๆ ก็ใช้อินเทอร์เน็ตได้เอง แต่เด็กมักจะแยกแยะไม่ได้ ว่าเรื่องไหนจริง ไม่จริง ควรทำตาม หรือไม่ควรลอกเลียนแบบ
เด็กวัยไหน ต้องคุยอย่างไร
เด็กวัยก่อนเข้าเรียน (3-5 ปี) – เด็กวัยนี้สนใจเรื่องความแตกต่างของสรีระร่างกาย ผู้ชายกับผู้หญิง แต่เด็กยังแยกแยะบทบาทระหว่างเพศไม่ได้ เพราะฉะนั้น เด็กไม่ได้ต้องการคำตอบที่ซับซ้อน
จะคุยกับลูก เริ่มต้นอย่างไร
เริ่มต้นที่การเตรียมพร้อมของตัวคุณเอง ...เตรียมอะไรบ้าง?
เริ่มคุยเรื่องเพศกับลูกเมื่อไรดี
ยิ่งเร็วยิ่งดี อย่าให้สื่อเรื่องเพศที่ไม่เหมาะสมเป็นช่องทางเดียวในการรับรู้ของลูกหลาน เด็กยุคนี้ เผชิญความเสี่ยงจากสื่อและสังคมรอบข้างที่กระตุ้นความสนใจใคร่รู้เรื่องเพศในช่วงวัยที่ลดลงเรื่อยๆ เป็นไปไม่ได้ที่ผู้ปกครองจะติดตามปกป้องลูกหลานทุกฝีก้าว
ศูนย์ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง KIN Stroke Center
โรคหลอดเลือดสมอง หรือ Stroke เกิดจาก เส้นเลือดในสมองตีบ เส้นเลือดสมองแตก อัมพฤกษ์ อัมพาต หลังพบอาการควรทำการรักษาและฟื้นฟูในระยะ 3-6 เดือนแรก (Golden Period) จะเน้นการฟื้นฟูร่างกาย และการฟื้นฟูผู้ป่วยเส้นเลือดในสมองแตก โดยแพทย์ผู้เชี่ยวชาญเฉพาะทางด้าน แพทย์ผู้เชี่ยวชาญสมองและระบบประสาท แพทย์ผู้เชี่ยวชาญเวชศาสตร์ฟื้นฟู แพทย์แผนจีน นักกายภาพบำบัด นักกิจกรรมบำบัด นักจิตวิทยา นักวิทยาศาสตร์การกีฬา พยาบาลวิชาชีพ นักโภชนาการ และผู้ช่วยพยาบาล เพื่อให้การดูแลผู้ป่วย โรคหลอดเลือดสมอง อัมพาต อัมพฤกษ์ สามารถกลับมาใช้ชีวิตได้เป็นปกติโดยเร็วที่สุดสถานการณ์ของโรคไข้เลือดออกในกรุงเทพมหานคร
นายสุขสันต์ กิตติศุภกร รองปลัดกรุงเทพมหานคร กล่าวถึง สถานการณ์ของโรคไข้เลือดออกในกรุงเทพมหานคร “ตั้งแต่เดือนมกราคม-มีนาคมปีนี้พบผู้ป่วยโรคไข้เลือดออก จำนวนกว่า 1,600 รายแล้วโดยผู้ป่วยจะอยู่ในช่วงอายุ 5-14 ปีมากที่สุด ซึ่งการแพร่ระบาดของโรคไข้เลือดออกเป็นสิ่งที่ทางกรุงเทพมหานคร ให้ความสำคัญ โดยมีการดำเนินการให้ทั้งโรงเรียน สถานพยาบาล ชุมชนต่างๆ เฝ้าระวังพร้อมมาตรการจัดการลูกน้ำยุงลายที่เป็นแหล่งเพาะพันธุ์ของโรค ทั้งนี้ โครงการ “Dengue-zero School Project โรงเรียนติด Guard ห่างไกลไข้เลือดออก”ที่ทางทาเคดาและคาโอได้ร่วมกันขับเคลื่อนไปพร้อมกับกรุงเทพมหานคร สำนักอนามัย และสำนักการศึกษา ที่จะส่งเสริมความรู้ให้แก่กลุ่มเป้าหมายทั้งนักเรียนและคุณครู ช่วยกันสร้างชุมชนปลอดไข้เลือดออก ซึ่งทาง กทม. มีความยินดีเป็นอย่างยิ่งและพร้อมจะสนับสนุนให้โครงการดังกล่าวให้บรรลุผลและเกิดประสิทธิผลอย่างสูงสุด”


นางศิริญา เทพเจริญ กรรมการบริหาร PANACEE MEDICAL CENTER ได้กล่าวว่า “ตัวเลขของคนเสียชีวิตด้วยโรคหลอดเลือดน่ากลัวมาก คือ ตายเป็นอันดับ 2 รองจากมะเร็ง และมีแนวโน้มว่าจะเพิ่มมากขึ้น อย่าง โรคหลอดเลือดสมองหรือSTROKE (อัมพฤกษ์ อัมพาต) เป็นโรคที่มีความรุนแรง สูงถึงขั้นเสียชีวิต หรือทำให้เกิดความพิการระยะยาว และเป็นสาเหตุสำคัญอันดับ 2 ของการเสียชีวิต เป็นอันดับ 3 ของความพิการ จากการสำรวจในปี 2562 ทั่วโลกพบผู้ป่วยโรคหลอดเลือดสมองมากกว่า 101 ล้านคน เป็นผู้ป่วยรายใหม่ 12.2 ล้านคน หรือชัดๆเลยคือมีผู้ป่วยรายใหม่ 1 คนในทุก 3 วินาที และเสียชีวิตถึง 6.5 ล้านคน ส่วนโรคหลอดเลือดหัวใจที่ร้ายแรงไม่แพ้กัน จากข้อมูลจากองค์การอนามัยโลก มีคนเสียชีวิตจากโรคหลอดเลือดหัวใจ เป็นจำนวนถึง 7.2 ล้านคน หรือ 12.2% ของสาเหตุการเสียชีวิตทั้งหมด อัตราการเสียชีวิตจากโรคหัวใจและหลอดเลือด ในประเทศไทยมีประมาณปีละ 37,000 ราย เสียชีวิตชั่วโมงละ 2 คน และมีผู้ป่วยโรคหัวใจขาดเลือดเฉียบพลันในประเทศไทย จะมีอัตราการเสียชีวิตสูงกว่าที่อื่น ประมาณ 4-6 เท่า จากวิกฤติโรคจากหลอดเลือดนี้ ถือเป็นสิ่งที่ทำให้เราเลยต้องคิดค้นการป้องกันเรื่องหลอดเลือดอย่างเร่งด่วน รพ.พานาซีของเราจึงนำนวัตกรรมทางสเต็มเซลล์จากผนังหลอดเลือดมารักษาผู้ป่วยที่มีปัญหาอันเกี่ยวโยงกับเรื่องโรคหลอดเลือด ทั้งหลอดเลือดสมอง(STROKE) หลอดเลือดหัวใจ และเบาหวาน นวัตกรรมจากสเต็มเซลล์ตัวนี้นี้ไม่ใช่ทำได้แค่ซ่อมแซมหลอดเลือด ยังสามารถไปสร้างหลอดเลือดขึ้นมาใหม่ได้ด้วย ที่สำคัญเป็น สเต็มเซลล์จากเลือดของตัวเราเองจึงมีความปลอดภัยที่สุด
เดือนมีนาคม-เมษายน-พฤษภาคม 2566
เดือนมีนาคม 2566 : ธีมเที่ยวศิลปะวัฒนธรรม วันที่ 4-5, 11-12, 18-19 และ วันที่ 25
เดือนเมษายน 2566 : ธีมย้อนรอยประวัติศาสตร์ วันที่ 1-2, 8-9, 22-23 และ 29-30 (ค้างคืน)
เดือนพฤษภาคม 2566 : ธีมผจญภัยเหนือสายน้ำ วันที่ 67 13-14 20-21 (ค้างคืน) และ 27-28
ตารางให้บริการตรวจเชิงรุก เดือนมกราคม - กุมภาพันธ์ 2566
ขนส่งลำพูน ร่วมกับเอกชนเปิดให้ประชาชน “ตรวจรถฟรี ขับขี่ปลอดภัย รับเทศกาลปี๋ใหม่เมือง 2566
นางสุภมาส ลีลารักษ์สกุล ขนส่งจังหวัดลําพูน เปิดเผยว่า เทศกาลสงกรานต์ หรือปี๋ใหม่เมือง 13-17 เมษายน 2566 จะเป็นช่วงวันหยุดยาวที่ประชาชนนิยมเดินทางกลับภูมิลําเนา รวมทั้งเดินทางไปพักผ่อนท่องเที่ยวตามสถานที่ต่างๆ ทางสํานักงานขนส่งจังหวัดลําพูนได้ร่วมกับภาคีเครือข่าย ทั้งภาครัฐและเอกชน จัดกิจกรรม “ตรวจรถฟรี ขับขี่ปลอดภัย” เพื่อให้บริการตรวจสภาพความพร้อมของรถยนต์ และรถจักรยานยนต์เบื้องต้นก่อนเดินทางกว่า 20 รายการ โดยไม่คิดค่าบริการ อาทิ การตรวจระบบเบรก สภาพยาง การทํางานของเครื่องยนต์ ระดับน้ำมันเครื่องและความสกปรกของน้ำมันเครื่อง หม้อน้ำและรอยรั่ว ไส้กรองอากาศ การทํางานของไฟส่องสว่างและไฟสัญญาณต่าง ๆ เป็นต้น
ซึ่งจะได้รับการดูแลจากช่างผู้ชํานาญงาน เริ่มตั้งแต่บัดนี้ ถึง 15 เมษายน 2566 โดยสามารถนํารถเข้ามารับการตรวจเช็คความพร้อม ได้ที่สํานักงานขนส่งจังหวัดลําพูน สํานักงานขนส่งสาขาอําเภอบ้านโฮ่ง สํานักงานขนส่งสาขาอําเภอลี้ และภาคเอกชน ที่เข้าร่วม จํานวน 48 แห่ง
สำหรับภาคเอกชนสามารถเข้าใช้บริการได้ที่ บริษัท โตโยต้าลานนา ลําพูน บริษัท ลําพูนฮอนด้าคาร์ส จํากัด บริษัท ธาราลําพูนอีซูซุเซลส์ จํากัด บริษัท สยามนิสสัน ลําพูน จํากัด และสถานตรวจสภาพเอกชนในจังหวัดลําพูน เพื่อส่งเสริม และสร้างความตระหนักให้ผู้ใช้รถใช้ถนน เห็นความสําคัญในการตรวจเช็คสภาพความพร้อมของรถ ให้มีสภาพพร้อมใช้งานก่อนการเดินทาง ซึ่งจะเป็นส่วนช่วยให้ประชาชนเดินทางถึงที่หมายอย่างปลอดภัยไร้อุบัติเหตุ
.
หากมีข้อสงสัยเพิ่มเติม สามารถโทรสายด่วน โทร 1584 ตลอด 24 ชั่วโมง หรือติดต่อสํานักงานขนส่งจังหวัดลําพูน หมายเลขโทรศัพท์ 053 525 548 หรือทางเพจ Facebook ของสํานักงานขนส่งจังหวัดลำพูน
สัปดาห์วันนอนหลับโลกปีนี้มีความพิเศษ - รศ.นพ.ฉันชาย สิทธิพันธุ์
รศ.นพ.ฉันชาย สิทธิพันธุ์ ผู้อำนวยการโรงพยาบาลจุฬาลงกรณ์ และ คณบดีคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กล่าวเสริมว่า “โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทยตระหนักถึงปัญหาการนอนไม่หลับซึ่งมีจำนวนเพิ่มมากขึ้นเรื่อย ๆ ซึ่งเป็นปัญหาที่จะส่งผลกับสุขภาพทั้งทางตรงและทางอ้อม ทั้งทางกายและทางอารมณ์จิตใจ ทางโรงพยาบาลจึงให้ความสำคัญกับการรักษาผู้มีปัญหาด้านการนอนเป็นอย่างมากผ่านศูนย์นิทราเวชที่ได้พัฒนาการให้บริการและส่งเสริมการให้ความรู้ที่ถูกต้องผ่านการจัดกิจกรรม จุฬาฯ สัปดาห์วันนอนหลับโลกติดต่อกันมาอย่างต่อเนื่องเป็นปีที่ 6 ในปีนี้ ซึ่งที่ผ่านมาทุกปี มีผู้ให้ความสนใจและมีประชาชนจำนวนมากเข้าร่วมงาน โดยในปีนี้มีความพิเศษคือ มีการให้บริการให้คำปรึกษาด้านการนอนหลับจากแพทย์ผู้เชี่ยวชาญโดยไม่มีค่าใช้จ่ายอีกด้วย”
รศ. (พิเศษ) นพ.ทวี โชติพิทยสุนนท์ ประธานมูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่
รศ. (พิเศษ) นพ.ทวี โชติพิทยสุนนท์ ประธานมูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ กล่าวว่า “3 ปีที่ผ่านมาไข้หวัดใหญ่ไม่ได้หายไปไหน เพียงแต่ประชาชนทั่วไปให้ความสนใจเรื่องโควิดและมีการป้องกันตัวที่ดี เช่นการงดพบปะสังสรรค์ การสวมหน้ากากอนามัย การระวังเรื่องการมีปฏิสัมพันธ์ร่วมกับผู้อื่น ซึ่งพฤติกรรมดังกล่าวเป็นผลพลอยได้ ทำให้ป้องกันเชื้อโรคจากทางเดินหายใจต่างๆ ได้เกือบหมด แต่ในปัจจุบันที่สถานการณ์ต่างไป มีการกลับมาใช้ชีวิตประจำวันและทำกิจกรรมตามปกติ ทำให้คาดว่าในประเทศไทยโรคไข้หวัดใหญ่น่าจะกลับมาแพร่ระบาดอย่างแน่นอน อีกทั้งที่ผ่านมา 3-4 ปี คนไม่ค่อยติดเชื้อไข้หวัดใหญ่ ทำให้คนเหล่านั้นไม่มีภูมิคุ้มกัน เชื้อไข้หวัดใหญ่มีการกลายพันธุ์ไปอย่างมาก ซึ่งถ้าติดขึ้นมาจะอาการแย่ลงกว่าเก่า การป้องกันตัวเองที่ดีที่สุดคือฉีดวัคซีนเพื่อป้องกัน
โรคลมแดด โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ
การกำหนดค่าจ้างในประเทศไทย
1. การกำหนดค่าจ้างขั้นต่ำ
มีแนวคิดว่าคือ ค่าจ้างที่เพียงพอสำหรับแรงงานทั่วไปแรกเข้าทำงาน 1 คน ให้สามารถดำรงชีพอยู่ได้ตามสมควรแก่มาตรฐานการครองชีพ สภาพเศรษฐกิจและสังคม รวมทั้งเหมาะสมตามความสามารถของธุรกิจ
ค่าจ้างขั้นต่ำเพียงพอต่อค่าครองชีพของแรงงาน 1 คน
แรงงานที่มีประสบการณ์ยังคงได้รับเพียงค่าจ้างขั้นต่ำ
ตรวจสุขภาพก่อนแต่งงาน รพ.นนทเวช เบื้องต้น 8 รายการ ชาย 3,000 หญิง 3,500
เบื้องต้น 8 รายการ ชาย 3,000 หญิง 3,500
มีโปรแกรมเสริมตรวจเพิ่มเติม เช่น หากรรมพันธุ์ธาลัสซีเมียเบื้องต้น หรือแบบละเอียด หาภูมิคุ้มกันสุกใส ภูมิคุ้มกันไวรัสตับอักเสบซี
โทรศัพท์ 0-2596-7888
เจ้าหน้าที่เคลียร์สิทธิ LINK
เจ้าหน้าที่เคลียร์สิทธิ สมัครได้ทุกวันจันทร์ - เสาร์ เวลา 13.30 น. - 15.00 น. แผนกบุคคล ชั้น 2 สำเนาเอกสารสำคัญใช้ในการสมัครงาน และรูปถ่ายขนาด 1 นิ้ว 1 ใบ การแต่งกายของผู้สมัคร ผู้หญิง : สวมกระโปรง เสื้อเชิ้ต รองเท้าคัทชู ผู้ชาย : สวมกางเกงสแลค เสื้อเชิ้ต รองเท้าคัทชู
ฝุ่น PM คืออะไร?
ฝุ่นละอองขนาดเล็ก (Particulate Matter, PM) เป็นอนุภาคขนาดเล็กที่ประกอบไปด้วยส่วนผสมของแข็งและของเหลวแขวนลอยอยู่ในอากาศ มีรูปร่าง ขนาดและองค์ประกอบทางเคมีต่างกัน เช่น สารประกอบอนินทรีย์ (ซัลเฟต ไนเตรท แอมโมเนีย) สารประกอบอินทรีย์ โลหะหนัก (แคดเมียม ทองแดง สังกะสี) และสารโพลีไซคลิกอะโรมาติกไฮโดรคาร์บอน (Polycyclic aromatic hydrocarbons, PAHs) นอกจากนี้ “ยังสามารถพบสารก่อภูมิแพ้และเชื้อโรคต่าง ๆ ในอนุภาคขนาดจิ๋วนี้ได้ด้วย” คุณหมอแอมป์เสริม
โดยทั่วไป เรามักจะจำแนกอนุภาคนี้จากขนาดในหน่วยไมครอน (micron) กล่าวคือ หากฝุ่นตัวเล็กนี้มีขนาดไม่เกิน 10 ไมครอน จะเรียกว่า PM10 (Coarse particle) หากมีขนาดไม่เกิน 2.5 ไมครอน จะเรียกว่า PM2.5 (Fine particle) และหากมีขนาดเล็กกว่า 1.0 ไมครอนจะเรียกว่า PM1.0 (Ultrafine particle) ซึ่งในปัจจุบันเรามักจะให้ความสนใจกับ PM2.5 เป็นอย่างมากและแนวโน้มจะเป็นปัญหามากขึ้นในตอนนี้
จากที่กล่าวมาข้างต้น PM2.5 ซึ่งมีขนาดเล็กมาก ๆ เพื่อเข้าใจง่ายมากขึ้น คุณหมอแอมป์อธิบายเพิ่มเติมว่า “หากเปรียบเทียบกับเส้นผมเรานั้น ฝุ่นจิ๋วนี้มีขนาดเล็กกว่าเส้นผ่านศูนย์กลางของเส้นผมมนุษย์ถึง 20 - 28 เท่า และนั่นหมายถึงโอกาสที่จะเข้าสู่ร่างกายก็จะง่ายและรวดเร็วมากขึ้น”
ตรวจสุขภาพประจำปี โรงพยาบาลกรุงเทพคริสเตียน นครปฐม LINK
โปรแกรมสำหรับสมาชิก ได้แก่ standard Silver Gold Platinum Diamond เริ่มต้น 1,350 - 5,400 (Diamond) ในราคามีส่วนลด
โปรแกรม Sure สำหรับเตรียมแต่งงาน ชาย 2,600 หญิง 3,100 ตรวจ 11 รายการ
โปรแกรม DM ผู้ป่วยเบาหวาน ตรวจ 14 รายการ ราคา 2,800
รายการตรวจเพิ่มพิเศษอีกหลายรายการ
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ โทร 034-270080 ถึง 5
ก่อนทำขาเทียม ต้องเตรียมตัวอย่างไร?
ก่อนทำขาเทียม ต้องเตรียมตัวอย่างไร?
• เตรียมตอขาให้พร้อม • ออกกำลังกายตอขา ให้แข็งแรง • ระดับใต้เข่า —ไม่ใช้หมอนหนุนรองใต้ตอขาขณะนอน • ระดับเหนือเข่า —นอนคว่ำเพื่อยืดกล้ามเนื้อสะโพก
เบอร์โทรฉุกเฉิน จาก ตำรวจภูธรภาค 2
เบอร์โทรฉุกเฉิน เซฟไว้ใช้ช่วงสงกรานต์ ด้วยความปรารถนาดีจาก "ตำรวจภูธรภาค 2"
ลงทะเบียนจับคู่เจรจาธุรกิจฟรี Business Matching 28 มิถุนายน - 2 กรกฎาคม 2566
ขอเชิญลงทะเบียนจับคู่เจรจาธุรกิจฟรี งานมหกรรมสมุนไพรแห่งชาติ ครั้งที่ 20 วันที่ 28 มิถุนายน - 2 กรกฎาคม 2566 ณ ฮอลล์ 11-12 อิมแพ็ค เมืองทองธานี หมดเขตลงทะเบียน 15 เมษายน 2566 นี้
ขั้นตอนการสมัคร
1. ลงทะเบียนในระบบขอรับสิทธิ์ส่งเสริมผู้ประกอบการสมุนไพร รอการอนุมัติและดาวน์โหลดเอกสารใบรับรอง (สำหรับผู้ที่ยังไม่มีใบรับรอง)
2. ลงทะเบียนเพื่อร่วมกิจกรรมการเจรจาจับคู่ธุรกิจ
*** การลงทะเบียนจะขอสงวนสิทธิ์ไว้สำหรับผู้ที่ได้ลงทะเบียนขอรับสิทธิ์ส่งเสริมผู้ประกอบการแล้วเท่านั้น
ฉีดเกล็ดเลือดเข้มข้น โรงพยาบาลพริ้นซ์ สุวรรณภูมิ LINK
“PRP (Platelet Rich Plasma) หรือการรักษาด้วยพลาสมาเกล็ดเลือดเข้มข้น เป็นทางเลือกในการรักษา เพื่อบรรเทาอาการบาดเจ็บของอาการข้อเข่าเสื่อมการบาดเจ็บของเส้นเอ็น เอ็นกระดูกและเนื้อเยื่ออ่อนต่าง ๆ เพื่อเข้าไปเร่งกระบวนการซ่อมแซมของเนื้อเยื่อโดยไม่ต้องทำการผ่าตัด”
????????ปวดจากเส้นเอ็นอักเสบ
????????รักษาอาการปวดตามข้อ
????????โรคข้อเข่าเสื่อม
????????ไม่ต้องผ่าตัด
????????ไม่ต้องฉีดยา
“ฉีดเกล็ดเลือดแบบเข้มข้น รักษาข้อเสื่อม กล้ามเนื้อและเส้นเอ็น” สามารถนัดหมายก่อนเข้ารับบริการได้ที่ : 020805999 ต่อแผนกโรคกระดูกเเละข้อ โรงพยาบาลพริ้นซ์ สุวรรณภูมิ
ตรวจสุขภาพประจำปี LINK
โรงพยาบาลกรุงเทพคริสเตียน นครปฐม ขอเชิญชวนทุกท่านให้มาตรวจสุขภาพประจำปีกันนะคะ การตรวจสุขภาพอย่างสม่ำเสมอจะช่วยให้อุ่นใจ และคลายความกังวล เพราะการตรวจสุขภาพเป็นการตรวจสำหรับผู้ที่ยังไม่มีอาการผิดปกติใด ๆ เพื่อค้นหาความเสี่ยงของโรคที่ยังไม่แสดงอาการ ซึ่งการพบปัญหาแต่เนิ่น ๆ ลดภาวะแทรกซ้อนของโรคเท่านั้น แต่ยังเป็นการลดค่าใช้จ่ายด้านสุขภาพในระยะยาวอีกด้วย #สนใจตรวจสุขภาพตามโปรแกรมนี้ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ โทร 034-270080-5
ตารางออกตรวจแผนกอายุรกรรม
Plas-Tao Workshop
เพราะเกิดจากความคิด ความพยายามของ คุณเมย์-วิชชุดา ดำเนินยุทธ หรือตอนนี้ที่ใครหลายคนบนชุมชนเกาะเต่า เรียกว่า Plas-Tao จากชุมชนเกาะเต่าและผู้ประกอบการ ที่มีแนวความคิดและรณรงค์การลดใช้ ปริมาณ “พลาสติก” บนเกาะแล้วนั้น การจัดกิจกรรมในครั้งนี้ เราอยากให้ทุกท่าน ที่มีหัวใจรักษ์ทะเล รักษ์ที่จะปกป้อง ธรรมชาติบนโลกใบนี้ มาเป็นสมาชิกครอบครัว Plas–Tao ร่วมกิจกรรมที่เราพร้อมจะมอบความรู้ ความรัก และความอบอุ่น จากเกาะเต่า จากฝาขวดพลาสติก เป็นขยะที่ทุกคนทิ้ง วันนี้เรามีร้าน May and Co หรือ Plas–Tao ที่เปิดรับฝาขวด เพื่อให้ทุกคน ทุกร้านสะสมแล้วนำมาให้ที่ร้าน จากนั้นทางร้านจะนำไปแปรสภาพ เพื่อนำไปผลิตเป็นของที่ระลึก และอื่นๆ เช่นฝารองแก้วน้ำ ฝารองสบู่ และอีกมากมาย ที่ทุกคุณสามารถออกไอเดีย ด้วยกัน ได้ทั้งลดปริมาณขยะ ได้ทั้งสิ่งของที่เราทำขึ้นและสามารถนำไปใช้ได้จริง และสิ่งที่ทุกคนได้ร่วมกัน คือความคิด ความตั้งใจที่เราได้ อนุรักษ์ธรรมชาติ บนโลกของเรา
จุดรับส่งเส้นทางที่ 1 ศาลหลักเมือง - แพหน้าเมือง
เทศกาลบุฟเฟ่ต์ทุเรียน ไอคอนสยาม 14 เม.ย -28 พ.ค.66 (จำกัดรอบ) LINK
เทศกาลบุฟเฟ่ต์ทุเรียน ไอคอนสยาม 14 เม.ย -28 พ.ค.66 (จำกัดรอบ) Durian Lover Comeback!! กับเทศกาลบุฟเฟ่ต์ทุเรียนสุดพิเศษ ไอคอนสยาม สวรรค์ของคนรักทุเรียนอย่างแท้จริง ทุเรียนคุณภาพหลากหลายสายพันธุ์ ที่ คัดสรรโดยตรงจากสวนผลไม้ในประเทศไทย • งานจัดเฉพาะวันศุกร์ เสาร์ อาทิตย์ • จำกัดรอบละ 50 คนๆละ 60 นาที • โทร 064-6460302
ทำบุญเสริมดวง กับโรงพยาบาลสงฆ์ รับดาวพฤหัสย้ายราศี วันที่19เมษายน2566
หมอช้าง ทศพร ศรีตุลา แนะ ทำบุญรับดาวพฤหัสย้ายราศี วันที่ 19 เมษายน 2566 สถานที่ทำบุญ เช่นโรงพยาบาลสงฆ์,ศาลหลักเมือง จัดโต๊ะไหว้ด้วยผลไม้สีเหลือง 5 อย่าง หรือ 1 อย่างจำนวน 5 ผล พร้อมพวงมาลัย ดอกดาวเรือง โดยใช้ฤกษ์ 21.02 น. ผู้ไหว้หันหน้าไปทางทิศตะวันตก
ทำบุญแล้ว
ร่วมอธิฐานที่เพจ รพ.สงฆ์โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ดินแดง 1) LINK
โรงเรียนฝึกอาชีพสังกัด เลขที่ 4095/25-26 ซอยมิตรไมตรี 3 ถนนมิตรไมตรี แขวงดินแดง เขตดินแดง 10400
สำนักงานการส่งเสริมอาชีพ สำนักพัฒนาสังคม กรุงเทพมหานคร มีหน้าที่รับผิดชอบเกี่ยวกับการฝึกอาชีพระยะสั้นให้แก่ประชาชนผู้ขาดโอกาสศึกษาต่อระดับสูงสายสามัญ ในภาคปกติและภาคค่ำเพื่อยกระดับเศรษฐกิจและสังคมส่วนร่วมให้ดีขึ้น และขจัดปัญหาคนว่างงาน ตลอดจนพัฒนาอาชีพให้แก่ประชาชนทั่วไป โดยดำเนินการตามระเบียบกรุงเทพมหานครว่าด้วยการดำเนินสถานศึกษาฝึกอาชีพกรุงเทพ พ.ศ. 2542 การพัฒนาการศึกษาในปัจจุบันมีความจำเป็นจะต้องให้สอดคล้องและสนองต่อปัจจัยหลายๆ ด้าน ทั้งนโยบายแผนการศึกษาระดับชาติ ความต้องการของชุมชน เพื่อมุ่งเน้นที่จะพัฒนาคุณภาพการเรียนรู้ของทุกด้าน ทั้งในด้านความรู้ ทักษะและมีจิตสำนึกที่ดี มีคุณธรรม จริยธรรม พร้อมที่จะออกไปช่วยพัฒนาประเทศชาติ
- คุณสมบัติผู้สมัคร : อายุ 14 ปีขึ้นไป มีความรู้อ่านออกเขียนได้ มีความประพฤติเรียบร้อย สุขภาพสมบูรณ์ แข็งแรง เหมาะสมกับการเรียนวิชาชีพ ไม่เป็นโรคที่สังคมรังเกียจ หรือติดยาเสพติด
- ค่าสมัครเรียน : ค่าสมัครเรียน 105 บาท ค่าสมัครเรียน 305 บาทสำหรับหลักสูตรในกลุ่ม คอมพิวเตอร์ ,ซ่อมคอมพิวเตอร์ , สปา
- วันและเวลาเรียน : เรียนวันจันทร์-วันศุกร์ รอบเช้า เวลาเรียน 09:00-12:00 น. , รอบบ่าย เวลาเรียน 13:00-16:00 น. ,รอบค่ำ เวลาเรียน 17:30-20:30 น. และหลักสูตรวันอาทิตย์เต็มวัน
เตือนภัยคอทุเรียน เพจหลอกขายทุเรียน LINK
มิจฉาชีพปลอมเพจดังหลายเพจหลอกขายทุกเรียน สร้างภาพสร้างโปรไฟล์ให้เหมือนจริง เพื่อความน่าเชื่อถือ เมื่อผู้เสียหายโอนเงินให้แล้วเงียบหายไป ไม่มีการส่งของให้ลูกค้าแต่อย่างใด พอผู้เสียหายติดต่อหรือตามสินค้า จะถูกบล็อกเฟซบุ๊กขาดการติดต่อโดยทันที
ขณะนี้ก็ยังมีเปิดเพจปลอมขึ้นมาอยู่เรื่อย ๆ ต้องเช็คกันให้ชัวร์ก่อนสั่งกันนะคะ
ปรึกษา หรือ แจ้งเบาะแส โทร 1441 หรือ 081-866-3000
แจ้งความออนไลน์
www.thaipoliceonline.com ภาคกลาง กรุงเทพมหานคร "มู Light Experiences วิจิตรการมู (เตลู)"


ภาคกลาง : พบกับการแสดง แสง สี เสียง ภายใต้แนวคิด “มู Light Experiences วิจิตรการมู (เตลู)” การแสดง แสง สี เสียง สุดวิจิตร ที่สะท้อน 3 ความเชื่อของคนไทยผ่านแสงจันทร์และการอาบแสงจันทร์ เพื่อส่งมอบพลังบวกและความเป็นสิริมงคล โดยจะจัดขึ้นใน 3 พื้นที่ ได้แก่ ICONSIAM จัดการแสดง Contemporary Dance หน้าม่านน้ำ ด้วยเทคนิค Multimedia Water Features + Lighting ซึ่งจัดแสดง 5 วันตลอดการจัดงาน (29-30 เมษายนและ 4,6,7 พฤษภาคม 2566) พร้อมกิจกรรมแชะ & แชร์ เพื่อลุ้นรับ E-voucher มูลค่ารวมกว่า 500,000 บาท และยังได้รับสิทธิ์ลุ้นรับสติกเกอร์ยันต์มหามงคล ต่อมาพื้นที่ที่ 2 อาคารไปรษณีย์กลาง จัดแสดงการแสดง Mapping ไพ่ยิปซี 12 ราศีสุดยิ่งใหญ่บนอาคารไปรษณีย์กลาง ด้วยเทคนิค Mapping & Lighting พร้อมกิจกรรมสแกนเล่นเกม และกิจกรรมดูดวงจากนักพยากรณ์หลากหลายศาสตร์ สุดพิเศษใน วันที่ 30 เมษายน 2566 เชิญอาจารย์แห้วทำพิธีลงนะหน้าทอง ซึ่งนักท่องเที่ยวสามารถร่วมพิธีได้ตั้งแต่เวลา 17.00 น. เป็นต้นไป พร้อมลุ้นรับสติกเกอร์ยันต์มหามงคลและพื้นที่ที่ 3 สวน วชิรเบญจทัศ (สวนรถไฟ) พบกับการถ่ายทอดเรื่องราวของดวงดาว 12 นักษัตรผ่าน โคมไฟบอลลูนรอบสวนสาธารณะ และการตกแต่งแสงสีบนต้นไม้และพื้นหญ้า ด้วยเทคนิค Lighting Installation 3D ภายในงานยังมีกิจกรรม Walk Rally 12 นักษัตร ให้นักท่องเที่ยวได้ลุ้นรับรางวัลเหรียญมงคล 12 นักษัตร สุดพิเศษกับกิจกรรม Fan Meeting กับสองหนุ่ม ‘ฟอส-บุ๊ค’ ในวันที่ 6 พฤษภาคม 2566 เวลา 18:00 – 19:00 น. สามารถเที่ยวชมและร่วมกิจกรรมทั้ง 3 พื้นที่ได้ตั้งแต่วันที่ 29 เมษายน – 7 พฤษภาคม พ.ศ.2566
กิจกรรมที่จัดขึ้น ณ วันเปิดโครงการ
กิจกรรมที่จัดขึ้น ณ วันเปิดโครงการ “Dengue-zero School Project โรงเรียนติด Guard ห่างไกลไข้เลือดออก” อัดแน่นเวิร์คช็อปตั้งแต่สาเหตุของโรค พาหะนำโรค รวมไปถึงการป้องกันตนเองจากโรคไข้เลือดออก และการควบคุมปริมาณและกำจัดพาหะนำโรคในพื้นที่ที่ตนอาศัยอยู่ ซึ่งมีการเรียนรู้ทั้งภาคทฤษฎีและการปฏิบัติ โดยกิจกรรมต่าง ๆ แบ่งเป็นฐานความรู้ทั้งหมด 5 ฐาน ได้แก่ 1. วงจรชีวิตของยุง ไข่ ลูกน้ำ และตัวโม่งของยุงชนิดต่าง ๆ 2. การจำแนกยุงตัวโตเต็มวัยแต่ละชนิด 3. การควบคุมโรคที่เกิดจากยุงที่เป็นพาหะด้วยวิธีการต่าง ๆ 4. การจำลองสภาวะที่ดึงดูดยุง และ 5. การป้องกันยุงกัด (การทาสารกันยุง, การทาสารปรับปรุงพื้นผิวสัมผัส)
เทคนิค ‘ใจฟูมาร์เก็ตติ้ง’ เพิ่ม positivity เข้า feed ในโซเชียล
ฤดูร้อนปีนี้อุณหภูมิจะร้อนขึ้นแตะถึง 40 องศาเซลเซียสทำให้คนไทยร้อนทั้งกาย ร้อนทั้งใจ จากทั้งสภาพอากาศและข่าวชวนหัวร้อนที่เกิดขึ้นแบบรายวัน ทำให้อะไรๆ รอบตัวก็ดูน่าหงุดหงิดและไม่สดชื่นไปเสียหมด แบรนด์สามารถเข้ามาช่วยฮีลใจ เติมเต็มสีสันให้คนไทยในนาทีนี้ได้ ไม่ว่าจะเป็นการโพสต์กิจกรรม CSR ทำดีช่วยเหลือสังคม หรือใช้ sense of humor ผูกคอนเทนต์เกาะกระแสที่น่ารัก ชวนอมยิ้ม ให้แก่ผู้บริโภค เช่น ไอเดียใช้ตัวคาปิบารา (กะปิปลาร้า หมามะพร้าว) สัตว์แสนน่ารักที่กำลังเป็นไวรัลในโลกออนไลน์ หรือ #ขายด่วน (ด่วนจนรูปเบลอ) การใช้รูปเบลอมาทำแคมเปญให้เป็นไวรัล เพื่อเพิ่มรอยยิ้มให้แก่ผู้อ่าน
ร่วมสนับสนุนคนไทยให้กล้าที่จะก้าว first step “เริ่มสิ่งใหม่ ในแบบของตัวเอง”
ฝ่าฟันกันมานานกว่า 3 ปี ในที่สุดเทศกาลการเล่นสงกรานต์ครั้งแรกของคนไทยได้กลับมาอีกครั้ง คนไทยจะได้ฉลองแบบจัดเต็ม หนุนความอยากเริ่มต้นใหม่ สู่อนาคตที่ดีกว่าเดิม สิ่งใหม่ในที่นี้ไม่ใช่แค่สิ่งของ แต่เป็นได้ทุกด้านทั้ง ความรู้ ความสามารถ พฤติกรรม ความรู้สึก หรือแม้กระทั่งการเริ่มสิ่งใหม่ๆ อาทิ งานใหม่ พบเจอสังคมใหม่ๆ แบรนด์สามารถส่งเสริมและสนับสนุนให้คนกล้าเริ่ม first step โดยไม่ลังเล ไม่ว่าจะในระยะสั้นหรือระยะยาว
โรงพยาบาลกลาง เปิดให้บริการฉีดวัคซีน Pfizer Bivalent (ฝาสีเทา) LINK
โรงพยาบาลกลาง เปิดให้บริการฉีดวัคซีน Pfizer Bivalent (ฝาสีเทา)
สำหรับผู้ที่มีอายุ 12 ปีขึ้นไป ลงทะเบียนจองคิวผ่านคิวอาร์โค้ด หรือ
https://bit.ly/3mKUK7B ได้ตั้งแต่วันนี้ จนกว่าคิวจะเต็ม
วันที่ฉีด 19-21 เมษายน 2566 เวลา 13.00 น. - 15.00 น.
เอกสารที่ต้องนำมาในวันฉีดวัคซีน
- บัตรประชาชน
สอบถาม โทร. 02 220 8000
แนวทางปฏิบัติการจ่ายยาต้านพิษสำหรับผู้ป่วยที่ได้รับสารไซยาไนด์ (โรงพยาบาลระยอง)
พิธีพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดลประจำปี 2565
วันพฤหัสบดีที่ 26 มกราคม พ.ศ. 2566 เวลา 16.30 น. พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯ ให้สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธร มหาวชิราลงกรณวรราชภักดีสิริกิจการิณีพีรยพัฒน รัฐสีมาคุณากรปิยชาติ สยามบรมราชกุมารีเสด็จพระราชดำเนินแทนพระองค์ ไปพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปีพุทธศักราช 2565 ณ พระที่นั่งจักรีมหาปราสาท พระบรมมหาราชวัง
ในปีพุทธศักราช 2565 มีผู้ได้รับการเสนอชื่อเข้ารับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดลทั้งสิ้น 88 ราย จาก 34 ประเทศ ผลปรากฏว่ามีผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจ าปีพุทธศักราช 2565 สาขาการแพทย์ ได้แก่ ศาสตราจารย์นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ (Ralph A. DeFronzo, M.D.) จาก สหรัฐอเมริกา และสาขาการสาธารณสุขได้แก่ นายแพทย์ดักลาส อาร์. โลวี (Douglas R. Lowy, M.D.) จาก สหรัฐอเมริกา ดร.จอห์น ที. ชิลเลอร์ (John T. Schiller, Ph.D.) จากสหรัฐอเมริกา ศาสตราจารย์นายแพทย์เอียน เอช. เฟรเซอร์ (Ian H. Frazer, MB.ChB, M.D.) จาก สหราชอาณาจักร/ออสเตรเลีย
พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯ ให้ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธร มหาวชิราลงกรณวรราชภักดี สิริกิจการิณีพีรยพัฒน รัฐสีมาคุณากรปิยชาติ สยามบรมราชกุมารี เสด็จฯ แทนพระองค์ไปพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ. 2565 สาขาการแพทย์ แก่ ศาสตราจารย์ นายแพทย์ราล์ฟ เอ. ดีฟรอนโซ จากสหรัฐอเมริกา ณ พระที่นั่งจักรีมหาปราสาท พระบรมมหาราชวัง วันพฤหัสบดีที่ 26 มกราคม พ.ศ. 2566
พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯ ให้ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธร มหาวชิราลงกรณวรราชภักดี สิริกิจการิณีพีรยพัฒน รัฐสีมาคุณากรปิยชาติ สยามบรมราชกุมารี เสด็จฯ แทนพระองค์ไปพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ. 2565 สาขาการสาธารณสุข แก่ นายแพทย์ดักลาส อาร์. โลวี จากสหรัฐอเมริกา ณ พระที่นั่งจักรีมหาปราสาท พระบรมมหาราชวัง วันพฤหัสบดีที่ 26 มกราคม พ.ศ. 2566
พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯ ให้ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธร มหาวชิราลงกรณวรราชภักดี สิริกิจการิณีพีรยพัฒน รัฐสีมาคุณากรปิยชาติ สยามบรมราชกุมารี เสด็จฯ แทนพระองค์ไปพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ. 2565 สาขาการสาธารณสุข แก่ ดร.จอห์น ที. ชีลเลอร์ จากสหรัฐอเมริกา ณ พระที่นั่งจักรีมหาปราสาท พระบรมมหาราชวัง วันพฤหัสบดีที่ 26 มกราคม พ.ศ. 2566
พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯ ให้ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา เจ้าฟ้ามหาจักรีสิรินธร มหาวชิราลงกรณวรราชภักดี สิริกิจการิณีพีรยพัฒน รัฐสีมาคุณากรปิยชาติ สยามบรมราชกุมารี เสด็จฯ แทนพระองค์ไปพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ. 2565 สาขาการสาธารณสุข แก่ ศาสตราจารย์นายแพทย์เอียน เอช.เฟรเซอร์ จากสหราชอาณาจักร ออสเตรเลีย (นางสาวแอนเจลา เจน แม็กดอนัลด์ เอกอัครราชทูต ออสเตรเลียประจำประเทศไทย เป็นผู้แทนรับพระราชทานรางวัล) ณ พระที่นั่งจักรีมหาปราสาท พระบรมมหาราชวัง วันพฤหัสบดีที่ 26 มกราคม พ.ศ. 2566
สิ่งน่าสนใจในงาน Health & Wellness Expo ครั้งที่ 2
7 โซนน่าสนใจ MONEY EXPO 2023
- โซนตลาดเงิน : พบโปรโมชั่นพิเศษ สินเชื่อดอกเบี้ยต่ำเงินฝากดอกเบี้ยสูง จากธนาคารสถาบันการเงินชั้นนำ
- โซนตลาดทุน : ให้บริการการลงทุนเเบบครบถ้วนทั้ง หุ้น กองทุน ทองคำ
- โซนประกัน : วางแผนการเงินระยะยาว เพื่อความมั่นคงของชีวิต ด้วยประกันหลากหลายรูปแบบ
- โซนอสังหาริมทรัพย์ / รถยนต์ : โปรโมชั่นบ้าน ทาวน์เฮาส์ คอนโดมิเนียม เเละโซนรถยนต์ รถยนต์ใหม่ยี่ห้อชั้นนำ พร้อมสินเชื่อ-ประกันภัยรถยนต์
- โซน SME & Lifestyle : ช้อปปิ้งสินค้าจากแบรนด์ดัง เสื้อผ้า เครื่องแต่งกาย ของใช้ในบ้าน และสินค้าแฟชั่น
- โซน Food Zone By Gourmet & Cuisine : รวบร้านอร่อยเเบบครบครันทั้ง เมนูคาว-หวาน เครื่องดื่มจากร้านดัง
- โซน Health & Wellness Expo : พบกับสินค้าเพื่อสุขภาพ อาหารเสริม สปา นวดผ่อนคลาย และวางแผนการเงินระยะยาวเพื่อความยั่งยืน
.
ตรวจเครดิตบูโร ฟรี ภายในงาน Money Expo 2023
ตรวจเครดิตบูโร ฟรี ผ่านตู้ตรวจเครดิตบูโรด้วยตนเอง พร้อมรับรายงานรูปแบบอิเล็กทรอนิกส์ (NCB e-Credit Reports) ทางอีเมลได้ทันที
Rate Your Reliance LINK
Rate Your Reliance ผ่านแบบทดสอบเพื่อประเมินภาวะการพึ่งพายาสูดพ่นขยายหลอดลมชนิดออกฤทธิ์สั้นเพื่อบรรเทาอาการหอบหืด (SABA) และเป็นแหล่งข้อมูลความรู้เกี่ยวกับโรคหืด โดย AstraZeneca
การถอดรหัสพันธุกรรมโควิด-19 จีโนมในประเทศสหรัฐอเมริกา
จากการถอดรหัสพันธุกรรมโควิด-19 ทั้งจีโนมในประเทศสหรัฐอเมริกาพบการระบาดของโอไมครอนสายพันธุ์ลูกผสม XBB 3 สายพันธุ์ย่อย คือ XBB.1.5, XBB.1.16 และ XBB.1.9.1 คิดเป็นร้อยละ 68.8,11.7 และ 9.0 โดยพบการระบาดของ XBB.1.X คิดเป็นร้อยละ 97.8 ของโควิดทุกสายพันธุ์ที่ระบาดภายในประเทศ
ปัญญาประดิษฐ์ในการดูแลสุขภาพ (AI)


ตลาดสำหรับปัญญาประดิษฐ์ (AI) โดยเฉพาะเครื่องมือแมชชีนเลิร์นนิง (ML) ในการดูแลสุขภาพคาดว่าจะสูงถึง 20 ล้านดอลลาร์ในปี 2566 เทคโนโลยีต่างๆ ที่สอดคล้องกับ AI เช่น คอมพิวเตอร์วิทัศน์ การประมวลผลภาษาธรรมชาติ และอัลกอริธึมการจดจำรูปแบบมีอยู่แล้ว ฝังลึกอยู่ในระบบนิเวศด้านการดูแลสุขภาพและจะถูกนำมาใช้ต่อไปเพื่อเป็นหลักฐานว่าประโยชน์ของพวกมันเติบโตขึ้นตลอดปี 2023 ตัวอย่างของพื้นที่ที่ AI ถูกนำมาใช้ ได้แก่ การค้นคว้ายา ซึ่งสามารถช่วยคาดการณ์ผลลัพธ์ของการทดลองทางคลินิกและผลข้างเคียงที่อาจเกิดขึ้นจากยาใหม่ เช่นเดียวกับการวิเคราะห์ภาพทางการแพทย์ ซึ่งเกี่ยวข้องกับการใช้อัลกอริธึมการมองเห็นด้วยคอมพิวเตอร์เพื่อระบุสัญญาณเตือนภัยล่วงหน้าของโรคในการสแกนด้วยรังสีเอกซ์หรือ MRI นอกจากนี้ยังประสบความสำเร็จในการตรวจจับและรักษาความผิดปกติของระบบประสาท รวมถึงโรคพาร์กินสันและโรคอัลไซเมอร์
นอกเหนือจากงานทางคลินิกในแนวหน้าแล้ว AI ยังมีการประยุกต์ใช้ในงานธุรการ เช่น การดำเนินการเรียกร้องค่าสินไหมทดแทนและการจัดการ หรือการวิเคราะห์การเก็บเวชระเบียน นอกจากนี้ยังสามารถใช้ในการวิเคราะห์ข้อมูลที่รวบรวมจากอุปกรณ์ที่สวมใส่ได้ของผู้ป่วยหรือเซ็นเซอร์ในบ้านที่ใช้ในโรงพยาบาลเสมือนจริง (เพิ่มเติมในแนวโน้มถัดไปของฉัน) เพื่อให้การเตือนล่วงหน้าหรือการวินิจฉัยล่วงหน้าของเงื่อนไขต่างๆ กรณีการใช้งานทั้งหมดเหล่านี้บ่งชี้ว่า AI และ ML จะยังคงเป็นเทรนด์ที่โดดเด่นในด้านการดูแลสุขภาพตลอดทั้งปีที่จะถึงนี้
วัคซีนป้องกันไข้หวัดใหญ่ สิทธิประกันสังคม โรงพยาบาลลานนา มาแล้ว!! LINK
โรงพยาบาลลานนา โทร.052-134777 โรงพยาบาลลานนา3 โทร.052-015999 การป้องกัน #โรคไข้หวัดใหญ่ ที่ดีที่สุด คือ การฉีดวัคซีนเพิ่มภูมิคุ้มกันเชื้อไวรัสไข้หวัดใหญ่ ให้แก่ร่างกาย ฉีดวัคซีนไข้หวัดใหญ่ 1 เข็มต่อปี ช่วยกระตุ้นภูมิคุ้มกัน ลดความเสี่ยงภาวะแทรกซ้อน ลดอัตราการเสียชีวิต และความรุนแรงของโรคได้
>>> ผู้ประกันตน ของ #โรงพยาบาลลานนา และ #โรงพยาบาลลานนา3 ที่มีอายุ 50 ปี ขึ้นไป
รับสิทธิ์ฉีควัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ได้ทุกจุดบริการ โดยไม่มีค่าใช้จ่าย ตั้งแต่วันที่ 1 พฤษภาคม - 31 สิงหาคม 2566 นี้เท่านั้น
*** ผู้ใช้สิทธิ์ประกันสังคม โรงพยาบาลอื่น แสดงบัตรพนักงาน รับสิทธิได้ในราคา 450 บาท
ตำเเหน่งงานว่าง ประจำเดือน เมษายน 2566
สอบถามได้ที่ 033-009-800ต่อ 1228,1229,1232,1234 หรือส่งประวัติได้ที่ hr@vibharamlcb.com สามารถเข้ามากรอกใบสมัครได้ เเผนกบุคคลเเละพัฒนาบุคลากร ชั้น 2 โรงพยาบาลวิภาราม เเหลมฉบัง จังหวัดชลบุรี เวลา 08.00-16.00น. ***กรุณาเเต่งกายให้เรียบร้อย และติดต่อแลกบัตรผู้เข้ามาติดต่องานที่แผนกรักษาความปลอดภัยก่อนนะคะ
AI สามารถฆ่ามนุษย์ได้และอาจไม่มีทางหยุดมันได้
ดร.ฮินตัน เคยอธิบายไว้ในการสัมภาษณ์กับ
CNN ว่า AI จะฆ่าคนได้อย่างไร ว่า
เมื่อ AI ไปถึงขั้นที่เรียกว่า ฉลาดกว่ามนุษย์เรา มันจะบงการเราได้ทุกอย่าง เพราะมันเรียนรู้ไปจากเราว่า สิ่งที่ฉลาดกว่าถูกควบคุมโดยสิ่งที่ฉลาดน้อยกว่า และรู้วิธีการตั้งโปรแกรมเพื่อให้สามารถหาวิธีหลีกเลี่ยงข้อจำกัดที่เราวางไว้ มันสามารถหาวิธีชักใยผู้คนให้ทำในสิ่งที่มันต้องการได้
และเมื่อมีคำถามว่าจะแก้หรือทำอย่างไร เขาตอบว่า
"สำหรับผม ไม่ชัดเจนว่าเราสามารถแก้ปัญหานี้ได้ ผมเชื่อว่าเราต้องทุ่มความพยายามอย่างมากในการคิดหาวิธีแก้ปัญหา ผมเองก็ไม่มีคำตอบ ผมแค่ต้องการให้ผู้คนตระหนักว่านี่เป็นปัญหาที่ร้ายแรงจริงๆ และเราต้องคิดเกี่ยวกับเรื่องนี้อย่างจริงจัง ผมไม่คิดว่าเราจะหยุดการพัฒนาได้ ผมเองไม่เคยลงนามข้อเรียกร้องใดๆ ว่าจะหยุดทำงานด้าน AI เพราะถึงคนในอเมริกาหยุด แต่คนในจีนจะไม่หยุด เป็นการยากที่จะตรวจสอบว่าใครทำอะไรไปบ้าง
วัดไก่เตี้ย บริการฌาปนกิจเผาสุนัข จัดเตรียมงานศพ ดอกไม้พวงหรีด
วัดไก่เตี้ย ให้บริการฌาปนกิจเผาสุนัข จัดให้ตามต้องการ การจัดเตรียมงานศพ จัดดอกไม้หน้าโลงศพ บริการพวงหรีด และบริการทางพิธีกรรมอื่นๆ ค่าใช้จ่าย [
pettozone]
1. เผาศพเพียงสุนัขอย่างเดียวราคาประมาณ 2,000 บาท
2. ทำพิธีสวด พระ 1 รูป ทำการเผา พร้อมครบทุกอย่าง 3,500 – 5,500 บาท
สถานที่ 11/1 หมู่ 2, ซอยวัดไก่เตี้ย ซอยบรมราชชนนี 33 ถนนบรมราชชนนี เขต ตลิ่งชัน แขวงตลิ่งชัน กรุงเทพฯ โทร. 089-950-0155
แผนที่ google map -
facebookการฉีดวัคซีนป้องกันล่วงหน้า ป้องกันได้จริงหรือ
สำหรับวัคซีนที่ใช้ฉีดป้องกันล่วงหน้าก็ไม่ใช่วัคซีนใหม่ แต่เป็นวัคซีนชนิดเดียวกันกับที่ใช้ฉีดหลังโดนกัดแล้ว เพียงแต่จำนวนครั้งในการฉีดแค่ 3 ครั้ง (วันที่ 0 (วันเริ่มฉีดวัคซีน), วันที่ 7, วันที่ 21 หรือ 28) ซึ่งหากได้ฉีดวัคซีนล่วงหน้าไว้แล้วกรณีถูกสัตว์บ้ากัดจะฉีดวัคซีนกระตุ้นเพียง 1 - 2 ครั้ง โดยไม่จําเป็นต้องฉีดเซรุ่มรอบแผลอีก การฉีดเซรุ่มรอบแผลบอกเลยว่าเจ็บ ถ้ามีหลายแผลก็ต้องฉีดให้ครบทุกแผล ดังนั้นจึงไม่ต้องเจ็บปวดจากการฉีดเซรุ่ม ที่สำคัญลดโอกาสเสี่ยงที่จะแพ้เซรุ่ม และลดค่าใช้จ่ายไปได้มาก - รพ.ยันฮี
พิธีเปิดศูนย์แพทย์ชุมชน สาขา 1 (ละลม) พร้อมเปิดให้บริการ 9 กรกฎาคม 2561 เป็นต้นไป LINK
เมื่อวันที่ 3 กรกฎาคม 2561 นพ.จรัญ ทองทับ ผู้อำนวยการโรงพยาบาลบุรีรัมย์ พร้อมด้วย คณะผู้บริหารและเจ้าหน้าที่ ได้เข้าร่วมพิธีทำบุญอาคารศูนย์แพทย์ชุมชนสาขา 1 (ละลม) ซึ่งตั้งอยู่ตรงข้ามร้านเดิมบาร์แอนด์บิสโทร สี่แยกซอยคูเมือง ศูนย์แพทย์ชุมชนหลังใหม่ได้รับงบประมาณการก่อสร้างจากกระทรวงสาธารณสุข โดยได้ย้าย ศูนย์แพทย์ชุมชนสาขาสหชัชวาลมาปฏิบัติยังศูนย์แพทย์ชุมชนหลังใหม่ และพร้อมที่จะเปิดให้บริการ ตรวจสุขภาพแก่ประชาชนในเขตทศบาลเมืองบุรีรัมย์ ในวันที่ 9 กรกฎาคม 2561 เป็นต้นไป
คลินิกพิเศษอายุรกรรมนอกเวลา SMC
รพ.เมืองสมุทรปากน้ำ เปิดรับสมัครงานหลายตำแหน่ง รับสมัครพยาบาลวิชาชีพ ทั้ง Full time และ Part time หลายอัตรา
รพ.เมืองสมุทรปากน้ำ เปิดรับสมัครงานหลายตำแหน่ง ทั้งวิชาชีพ / งาน back office ติดต่อ 02-173-7766-75 : 203 (HR.)
เปิดรับสมัครพยาบาลวิชาชีพ ทั้ง Full time และ Part time ????⚕️????⚕️ หลายอัตรา ( ไม่มีใบประกอบวิชาชีพ สามารถสมัครได้ ) Tel. 02-173-7766 - 75 ต่อ 203 แผนกทรัพยากรบุคคล
โรงพยาบาลรัฐบาล
ยอดบริจาคกว่า 9 ล้านบาทแล้ว @9 พฤษภาคม 2566 LINK
ยอดบริจาคจัดหาทุนเพื่อเปิดศูนย์โรคหัวใจ โรงพยาบาลชุมพรเขตรอุดมศักดิ์ ณ วันที่ 9 พฤษภาคม 2566 จำนวนทั้งสิ้น 9,356,749.39 บาท ทั้งนี้เป้าหมายการจัดหาทุนอยู่ที่ 60,000,000 บาท คงเหลือขอรับบริจาค 50,643,250.61 บาท จึงขอขอบคุณผู้ร่วมบริจาคมา ณ โอกาสนี้
*เริ่มรับบริจาคตั้งแต่ ธันวาคม 2565คำว่าให้...ไม่สิ้นสุด ร่วมบริจาคมูลนิธิรามาธิบดี โครงการเพื่อผู้ป่วยยากไร้ LINK
คำว่าให้...ไม่สิ้นสุด
ชื่อบัญชี มูลนิธิรามาธิบดี โครงการเพื่อผู้ป่วยยากไร้
ธนาคารกสิกรไทย เลขที่ 879-2-00448-3
ธนาคารไทยพาณิชย์ เลขที่ 026-3-05216-3
ธนาคารกรุงเทพ เลขที่ 090-3-50015-5
สอบถามข้อมูลเพิ่มเติม กรุณาติดต่อ ที่ปรึกษาประชาสัมพันธ์ เฟลชแมน ฮิลลาร์ด ประเทศไทย
คุณญาณินี กสิธรานนท์ (ฝน) โทร 085-953-3330 อีเมล yaninee.kasitaranon@fleishman.com
สอบถามข้อมูลเพิ่มเติม กรุณาติดต่อ ฝ่ายประชาสัมพันธ์มูลนิธิรามาธิบดีฯ
คุณอรอุมา รัตนรุ่งเรืองชัย (โอ๋) โทร. 086-369-7980 อีเมล onuma.r@ramafoundation.or.th
FB มูลนิธิรามาธิบดีฯ LINE @RamaFoundation IG @RamaFoundation
เราจะเร่งขยายระบบนิเวศการดำเนินงานทางด้านการแพทย์ เพื่อเสริมสร้างสุขภาวะที่ดีของคนไทย - นพ.สุชัย หยองอนุกูล


นพ.สุชัย หยองอนุกูล ประธานกรรมการบริหาร โรงพยาบาลกรุงสยามเซนต์คาร์ลอส เผยว่า “ตลอดระยะเวลากว่า 22 ปี ของโรงพยาบาลกรุงสยามเซนต์คาร์ลอส เราเล็งเห็นถึงช่องว่างในการดูแลกลุ่มผู้ป่วยฟื้นฟูหรือผู้มีภาวะพึ่งพิงทุกกลุ่ม ตั้งแต่กลุ่มติดเตียง กลุ่มกึ่งติดเตียง ติดสังคม รวมถึงผู้มีภาวะพึ่งพิงไม่สามารถช่วยเหลือตัวเองได้ ที่เกิดจากโรคต่างๆ เช่น โรคหลอดเลือดในสมองตีบ แตก ตัน โรคสมองเสื่อม กลุ่มผู้ป่วยเรื้อรัง เช่น โรคมะเร็ง โรคเบาหวาน รวมถึง กลุ่มผู้ป่วยเปราะบางระยะสุดท้าย และผู้ป่วยหลังการผ่าตัดที่ต้องการการฟื้นฟูและดูแล รวมถึงกลุ่มผู้สูงอายุที่ป่วยหรือมีโรคเรื้อรัง ที่ต้องการการดูแลเอาใจใส่เป็นพิเศษในทุกมิติ ทั้งสภาพแวดล้อม สังคม กาย และใจ ซึ่งขณะนี้โรงพยาบาลกรุงสยามเซนต์คาร์ลอส มีความพร้อมเพื่อให้บริการกลุ่มผู้ป่วยเหล่านี้ เราจะเร่งขยายระบบนิเวศการดำเนินงานทางด้านการแพทย์ เพื่อเสริมสร้างสุขภาวะที่ดีของคนไทย รวมถึงช่วยแบ่งเบากลุ่มคนวัยทำงานที่ไม่สามารถหรือไม่มีเวลาดูแลกลุ่มผู้ป่วยในครอบครัวได้ด้วยตนเอง เราจึงมุ่งยกระดับสู่การเป็นโรงพยาบาลแบบองค์รวมที่มีแผนกพิเศษด้วยการเปิด “St.Carlos Rehabilitation and Extended Care Centre - St.Carlos RECC” ศูนย์ฟื้นฟูสมรรถภาพและการดูแลระยะยาว เพื่อดูแลรักษากลุ่มผู้ป่วยที่ต้องการการพักฟื้น จากทีมสหวิชาชีพอย่างใกล้ชิด ด้วยบริการทางการแพทย์และการดูแลสุขภาพแบบครอบคลุมทุกมิติ ทั้งด้านเทคโนโลยี นวัตกรรม ตลอด 24 ชั่วโมง เพื่อสุขภาวะที่ดีของผู้ป่วยและช่วยลดความกังวลของญาติ โดยตั้งเป้าสู่การเป็นศูนย์ฟื้นฟูสมรรถภาพ และการดูแลผู้ป่วยระยะยาว ชั้นนำของกรุงเทพฯและปริมณฑลตอนเหนือ”
งานด้านการแพทย์ พยาบาล ผู้ช่วยแพทย์พยาบาล LINK
นักรังสีเทคนิค แผนก X-RAY (ด่วน)
เภสัชกร แผนกเภสัชกรรม
พยาบาล
พนักงานผู้ช่วยแพทย์, พนักงานช่วยเหลือผู้ป่วย แผนก OPD, WARD, Special Unit, ทันตกรรม, Cath Lab
นักเทคนิคการแพทย์ แผนก LAB
ผู้ช่วยนักรังสีเทคนิค แผนก X-RAY
ผู้ช่วยนักกายภาพ แผนกกายภาพ
ผู้ช่วยเภสัชกร แผนกเภสัชกรรม
ตรวจสุขภาพประจำปี ฟรีทั้งค่าตรวจ-ค่าเดินทาง
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
ตรวจสุขภาพประจำปีทั้งสุขภาพกายและสุขภาพจิต พร้อมกับให้ค่าเดินทางสำหรับเดินทางมาตรวจสุขภาพ
คุณหมอแอมป์ให้คำแนะนำง่ายๆว่า การมีพฤติกรรมสุขภาพดีอย่างยั่งยืน สามารถปฏิบัติง่ายๆ ตามหลักการ 5 ข้อนี้ ได้แก่ 1.อาหารจากพืช 2.ออกกำลังกายอย่างสม่ำเสมอ 3.อากาศดี 4.การนอนหลับที่ดี และ 5.กิจกรรมจิตอาสา “ซึ่งทั้งหมดนี้ไม่เพียงแต่ช่วยให้สุขภาพของเราแข็งแรงขึ้นเท่านั้น แต่ยังส่งผลดีต่อโลกของเราอีกด้วย” คุณหมอแอมป์กล่าว
กุมภาพันธ์ 2566
วันที่ 1 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 31 แห่ง ดังนี้
1.ธราธรเมดิคอลคลินิกเวชกรรม
2.คลินิกเวชกรรมบ้านหมอราม 2
3.เจเอ็มทีคลินิกเวชกรรม
4.โมซอกฮีคลินิกเวชกรรม
5.แพนคลินิกเวชกรรม สาขาปิ่นเกล้า
6.แพนคลินิกเวชกรรม (เขตบางกะปิ)
7.แพนคลินิกเวชกรรม (เขตบางขุนเทียน)
8.ลาโบลเล่คลินิกเวชกรรม (นำส่ง OSS 1/2/66)
9.พริมยาคลินิกเวชกรรม สาขาทองหล่อ (สมุดหาย)
10.สยามเลเซอร์คลินิกเวชกรรม สาขาเซ็นทรัลปิ่นเกล้า (สมุดหาย)
11.หมออะตอมคลินิกเวชกรรม
12.พีพีคลินิกแบงคอก คลินิกเวชกรรม
13.อคีซีสไลฟ์คลินิกเวชกรรม
14.คลินิกเวชกรรมกล้วยน้ำไท สาขาคู้บอน
15.คลินิกเวชกรรมกล้วยน้ำไท สาขาศรีนครินทร์
16.มายด์คลินิกเวชกรรม
17.สดายุคลินิกเฉพาะทางด้านเวชกรรมผิวหนัง
18.คลินิกทันตกรรมฮ๊อปเตาปูน
19.ดีเอสคลินิกทันตกรรม (เพิ่มยูนิตทำฟันเป็น 2 ยูนิต)
20.คลินิกทันตกรรมศิวาพรทันตคลินิก (นำส่ง OSS 27 /1/66)
21.คลินิกทันตกรรมหมออุ๊ (นำส่ง OSS 31/1/66)
22.บ้านฟอฟันคลินิกทันตกรรม
23.ออลอะเบาท์ทีธคลินิกทันตกรรม
24.ซินเทียนคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
25.บัณฑิตคลินิกกายภาพบำบัด
26.บ้านรักษ์คุณคลินิกกายภาพบำบัด
27.ศิรคลินิกการแพทย์แผนไทย
28.อินเตอร์เวลเนสสหคลินิก
29.ลาวีสหคลินิก
30.ยูนิชายลด์สหคลินิก (เพิ่มผู้ปฎิบัติงานร่วม)
31.อีอียูสหคลินิก
วันที่ 7 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 10 แห่ง ดังนี้
1.ดอกเตอร์สมูทไลฟ์คลินิกเวชกรรม
2.เมญ่าคลินิกเวชกรรม
3.อมราคลินิกเวชกรรม
4.คลินิกเวชกรรมรัชดา-จรัญสนิทวงศ์
5.บีเอชซีคลินิกเวชกรรม
6.มอเก้นคลินิกเวชกรรม
7.เดอะยังคลินิกเวชกรรม
8.รุ่งพิสุทธิ์คลินิกเวชกรรม (สมุดหาย)
9.คลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวชทะคาระ ไอวีเอฟ บางกอก
10.บ้านคุณสุขคลินิการแพทย์แผนไทย (นำส่ง OSS 7/2/66)
วันที่ 10 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 59 แห่ง ดังนี้
1.คลินิกเวชกรรมศิริการแพทย์
2.เท็ดดี้บีคลินิกเวชกรรม
3.มิรา 1 คลินิกเวชกรรม
4.แททออฟคลินิกเวชกรรม สาขาเดอะพรอมานาด
5.พัทธมนคลินิกเวชกรรม
6.ราชเทวีโพลีคลินิกเวชกรรม
7.ดีเลิฟเวอรี่คลินิกเวชกรรม
8.บางจากคลินิกเวชกรรม
9.ฟรอเรนซ์คลินิกเวชกรรม สาขาเอสพลานาดรัชดา
10.ดอกเตอร์ไลฟ์คลินิกเวชกรรม สาขาซีคอนสแควร์ ศรีนครินทร์
11.มินันตาคลินิกเวชกรรม
12.สวนผักคลินิกเวชกรรม
13.แอนเพนคลินิกเวชกรรม
14.คินิก้าคลินิกเวชกรรม สาขาเซ็นทรัลปิ่นเกล้า
15.ฟารีดาคลินิกเวชกรรม สาขาบิ๊กซีลาดพร้าว
16.ทีเอ็มอาร์ซี เวลล์เนส เรฟโวลูชัน คลินิกเวชกรรม
17.เอบีซีสยามคลินิกเวชกรรม
18.เอจีคลินิกเวชกรรม
19.ธนิยะคลินิกเวชกรรม
20.เดอะคอกเทลคลินิกเวชกรรม
21.กองจูคลินิกเวชกรรม
22.ดี.เค.คลินิกเวชกรรม
23.ลุมพินีคลินิกเวชกรรม (นำส่ง OSS 9/2/66)
24.เอช เอ็ม ซี คลินิกเวชกรรม (นำส่ง OSS 9/2/66)
25.คลินิกเฉพาะทางด้านเวชกรรม สตอร์ค เอ.อาร์.ที.
26.ไอ เค คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง
27.มามองคลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวช
28.คุณหมอเมย์คลินิกเฉพาะทางด้านเวชกรรมจักษุ
29.ไทมะคลินิกเฉพาะทางด้านเวชกรรม หู คอ จมูก
30.คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์โรคไตธัญญเวชไตเทียม สาขาเจริญนคร (นำส่ง OSS 9/2/66)
31.คลินิกทันตกรรม ทูธ แอนด์ ทีธ
32.คลินิกทันตกรรม ดี.ทันตกิจ
33.คลินิกทันตกรรมซิตี้
34.คลินิกทันตกรรมโอเค สาขา 1
35.คลินิกทันตกรรมโอเค สาขา 3
36.คลินิกทันตกรรมบ้านสาธุประดิษฐ์
37.คลินิกทันตกรรมทันตแพทย์หมอสมชาย
38.คลินิกทันตกรรมรักสุข
39.คลินิกทันตกรรมพลัส สาขาลาดกระบัง
40.คลินิกทันตกรรมพลัส สาขาพระราม 2
41.คลินิกทันตกรรมพลัส สาขาสยาม
42.คลินิกทันตกรรมพลัส สาขาซีคอนบางแค
43.คลินิกทันตกรรมพลัส
44.คลินิกทันตกรรมพลัส สาขาอ่อนนุช
45.คลินิกทันตกรรมสไมล์วิธมี
46.คลินิกทันตกรรมเดนทอล-ดี
47.คลินิกทันตกรรมหมอจุก
48.คลินิกทันตกรรมเด้นท์กาญจนาภิเษก
49.คลินิกเฉพาะทางด้านทันตกรรมสไมล์เฮาส์
50.ดี.เค.16 คลินิกการพยาบาลและการผดุงครรภ์
51.เอสดีคลินิกกายภาพบำบัด
52.คลินิกกายภาพบำบัดบ้านแบนชะโด
53.คลินิกเทคนิคการแพทย์แบงคอกจีโนมิกส์ สาขา 2
54.คลินิกเทคนิคการแพทย์แบงคอกจีโนมิกส์
55.คลินิกการแพทย์แผนไทยสุวัตร์ 2
56.ตั้งเหลียงคลินิกการแพทย์แผนไทย
57.กรเอกคลินิกการแพทย์แผนไทย (นำเอกสารออกไปทำแล้ว)
58.สหคลินิกบำรุงราษฎร์อินเตอร์เนชั่นแนลกระดูกและข้อ และกายภาพบำบัด
59.โลตัส แอซเซอร์ เมดิคอล เซอร์วิส สหคลินิก
วันที่ 17 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 59 แห่ง ดังนี้
1.คลินิกเวชกรรมหมอพร
2.คลินิกเวชกรรมเบล่าโกลว์
3.มาคลินิกเวชกรรม
4.วีคลินิกเวชกรรม
5.ลิตเติ้ลคลินิกเวชกรรม
6.57 เฮลท์แคร์ คลินิกเวชกรรม
7.คลินิกเวชกรรมเดอะซีพลัส สาขาลาซาล
8.คลินิกเวชกรรมเจษ
9.เซลเมดคลินิกเวชกรรม
10.ด็อกเตอร์คุนน์คลินิกเวชกรรม
11.มาเด้คลินิกเวชกรรม
12.เบลิสมาคลินิกเวชกรรม
13.รมย์รวินท์คลินิกเวชกรรม สาขาเดอะพรอมานาด
14.คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดพร้าว 80
15.เฌอเม่คลินิกเวชกรรม
16.คลินิกเวชกรรมเอเพ็กซ์ สาขาพารากอน
17.โมริณคลินิกเวชกรรม
18.คลินิกเวชกรรมรัชดา-ศรีนครินทร์
19.ซองเนคลินิกเวชกรรม สาขาลาดพร้าว
20.คลินิกเวชกรรมรัชดา-บางขุนเทียน
21.คิวริทิสคลินิกเวชกรรม
22.เอ็มดีคลินิกเวชกรรม
23.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 12
24.วีรันคลินิกเวชกรรม
25.คลินิกเวชกรรมดับเบิลยูพลัส
26.โซลคลินิกเวชกรรม สาขาเซ็นทรัลบางนา
27.ปรเมศว์คลินิกเวชกรรม
28.วรตคลินิกเวชกรรม
29.คลินิกเวชกรรมดำรงค์การแพทย์
30.เอโมเดลคลินิกเวชกรรม (นำส่ง OSS 15/2/66)
31.ไมโก้คลินิกเวชกรรม (นำส่ง OSS 16/2/66)
32.คลินิกเวชกรรมแพทย์ กม.7 (นำส่ง OSS 14/2/66)
33.อีสคลินิกเวชกรรม (นำส่ง OSS 16/2/66)
34.บีอาร์คลินิกเวชกรรม (สมุดหาย)
35.สุทธา 10 คลินิกเฉพาะทางด้านเวชกรรมจักษุวิทยา
36.คลินิกเฉพาะทางด้านเวชกรรมศัลยศาสตร์ตกแต่งหลุยส์
37.ไร่ขิงคลินิกเฉพาะทางด้านเวชกรรมจักษุ
38.คลินิกทันตกรรมเดนทัลอาร์ทิสทรี
39.คลินิกทันตกรรมไบร์ทสไมล์เด็นทัล สาขาอนุสาวรีย์ชัยสมรภูมิ
40.คลินิกทันตกรรมเดนเต้พลัส
41.คลินิกทันตกรรมดิออเร้นจ์
42.คลินิกทันตกรรมสวีทสไมล์
43.คลินิกทันตกรรมบางกอกธนบุรี
44.คลินิกทันตกรรมพลัส สาขาอุดมสุข (นำส่ง OSS 15/2/66)
45.สุรชัยคลินิกทันตกรรม (นำส่ง OSS 13/2/66)
46.โบว์ธิยาคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
47.เวชพิพิธคลินิกการแพทย์แผนไทย
48.สิริโภคาเวลเนสคลินิกการแพทย์แผนไทย
49.ลีนาคลินิกกายภาพบำบัด
50.ปาวิตาคลินิกกายภาพบำบัด
51.แคร์คลินิกกายภาพบำบัด
52.เลอวีญ่าสหคลินิก
53.สกุลดีสหคลินิก
54.รีบาลานซ์เมดิกสหคลินิก
55.สหคลินิกเคหะร่มเกล้า 24
56.กรุงเทพแพทย์แผนบูรณาการสหคลินิก (เวชกรรมและการแพทย์แผนไทยประยุกต์)
57.ธนิศิริการแพทย์แผนไทยประยุกต์และการแพทย์แผนจีน สหคลินิก (เพิ่มผู้ปฎิบัติงานร่วม)
58.รีคัฟเวอร์สหคลินิก (เพิ่มผู้ปฏิบัติงานร่วมหลัก)
59.ชุมชนอบอุ่นสหคลินิก (นำส่ง OSS 15/2/66)
วันที่ 20 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 103 แห่ง ดังนี้
1.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 14
2.คลินิกเวชกรรมแอสทริดสตูดิโอ
3.รสรินคลินิกเวชกรรม
4.เอช เอช ซี คลินิกเวชกรรม
5.คลินิกเวชกรรมแพทย์ราม 22
6.ริณมณีย์คลินิกเวชกรรม
7.เอบีคลินิกเวชกรรม
8.เอสเคดีคลินิกเวชกรรม
9.คลินิกเวชกรรมเอกชัยการแพทย์
10.บีเอสท์คลินิกเวชกรรม
11.คลินิกเวชกรรมชุมชนราษฎร์อุทิศ 58
12.นนทรีคลินิกเวชกรรม
13.คลินิกเวชกรรมรามคำแหง 39
14.เดอะฟอเรสท์คลินิกเวชกรรม
15.เดอะภูแบงค็อกคลินิกเวชกรรม
16.เดลี่คลินิกเวชกรรม
17.เวอร์เทียร์คลินิกเวชกรรม
18.ยงเจริญคลินิกเวชกรรม
19.อธิฐาคลินิกเวชกรรม
20.ชณันคลินิกเวชกรรม
21.เดอะเวนิสคลินิกเวชกรรม สาขาเกตเวย์แอทบางซื่อ
22.เอสเตลล่าคลินิกเวชกรรม สาขาสยาม
23.วีว่าคลินิกเวชกรรม สาขาบีทีเอสวงเวียนใหญ่
24.ดอกเตอร์ไลฟ์คลินิกเวชกรรม สาขาเซ็นทรัลปิ่นเกล้า
25.วีบูสท์คลินิกเวชกรรม
26.เนสคลินิกเวชกรรม
27.เกรนคลินิกเวชกรรม
28.เพลินภิรมย์คลินิกเวชกรรม
29.ดิโอโซนคลินิกเวชกรรม สาขาเซ็นทรัลลาดพร้าว
30.มาเจสติกคลินิกเวชกรรม
31.คลินิกเวชกรรมพีพีการแพทย์
32.ลาโรเซ่คลินิกเวชกรรม
33.เอ็มเฮชคลินิกเวชกรรม
34.คลินิกเวชกรรมสุชาติการแพทย์
35.เดอะเวนีเซียคลินิกเวชกรรม สาขาซีคอนสแควร์ศรีนครินทร์
36.สมาร์ทกายคลินิกเวชกรรม
37.สหแพทย์ช่องนนทรีคลินิกเวชกรรม
38.คลินิกเวชกรรมเอเพ็กซ์ สาขาเทอร์มินอล 21 พระราม 3
39.เซอเคร่เดอลาโปคลินิกเวชกรรม
40.อัศวกรณ์คลินิกเวชกรรม
41.ศรัณย์แคร์คลินิกเวชกรรม สาขาปิ่นเกล้า
42.โน้ตคลินิกเวชกรรม
43.โบราคลินิกเวชกรรม
44.พิณคลินิกเวชกรรม
45.การแพทย์สายไหมคลินิกเวชกรรม
46.พลัสคลินิกเวชกรรม สาขาสุขุมวิท-อุดมสุข
47.ดีเอคลินิกเวชกรรม
48.วินวินคลินิกเวชกรรม
49.เรียลไทม์คลินิกเวชกรรม (นำส่ง OSS 20/2/66)
50.ลาโบลเล่คลินิกเวชกรรม (นำส่ง OSS 20/2/66)
51.อาศยาคลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง
52.เอสพลาสติกเซอร์เจอรี่คลินิกเฉพาะทางด้านเวชกรรมศัลยศาสตร์ตกแต่ง
53.คลินิกซอย 1 คลินิกเฉพาะทางด้านเวชกรรมสาขาศัลยกรรมตกแต่ง
54.วงเวียนใหญ่ไตเทียมคลินิกเฉพาะทางด้านเวชกรรมไตเทียม
55.ธนพันธ์คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งใบหน้า
56.ดีพแอนด์ฮาร์โมนิแคร์ไอวีเอฟคลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวช
57.เด็นท์แคร์คลินิกทันตกรรม
58.คลินิกทันตกรรมสถานี ฟ.ฟัน
59.คลินิกทันตกรรมสรัญญา
60.คลินิกทันตกรรมมิสเตอร์เดนทิสท์
61.รักษ์ฟันคลินิกทันตกรรม
62.รักฟันคลินิกทันตกรรม
63.คลินิกทันตกรรมเดนต้าแลนด์
64.คลินิกทันตกรรมกรีนไนน์
65.ทันตแพทย์แสงจตุรานนท์คลินิกทันตกรรม
66.คลินิกทันตกรรมสไมล์วายลี่
67.เด็นทัลแคร์คลินิกทันตกรรม
68.คลินิกทันตกรรมเดนทัลแพลน
69.คลินิกทันตกรรมทูธบัดดี้
70.คลินิกทันตกรรมบ้านฟันดี
71.คลินิกทันตกรรมบ้านฟันดี สาขาสายไหม
72.คลินิกทันตกรรมเด็นทัลฟอร์ยู
73.คลินิกบางกอกทันตกรรม
74.ไท้เอี้ยงทันตแพทย์คลินิกทันตกรรม
75.เด็นทัลแคร์คลินิกทันตกรรม
76.จิน สไมล์ คลินิกทันตกรรม
77.คลินิกทันตกรรมยัวร์เด็นทิส
78.คลินิกทันตกรรมเอ็มดี
79.คลินิกทันตกรรมบ้านสีขาว
80.คลินิกทันตกรรมไทม์ฟัน
81.คลินิกทันตกรรมจุฬา ซอย 9
82.คลินิกทันตกรรมลาซาล
83.คลินิกทันตกรรมเลอแกรนด์
84.คลินิกทันตกรรมสไมล์แคร์
85.คลินิกทันตกรรมดิออรัลเฮลท์
86.คลินิกทันตกรรมบางกอก นิว สไมล์
87.คังมิ้งคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
88.อาร์ วี ซี คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
89.808 คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
90.คังหนิง คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
91.ราศีคลินิกการแพทย์แผนไทย
92.เรณูคลินิกการแพทย์แผนไทย
93.ทิมเรืองเวชโอสถคลินิกการแพทย์แผนไทย
94.คลินิกเทคนิคการแพทย์ซาโนมิคส์
95.คลินิกเทคนิคการแพทย์เอ็มไอซีแลบ
96.เอ็นเฮลท์คลินิกเทคนิคการแพทย์
97.ฟิสิคอล คลินิกกายภาพบำบัด
98.คลินิกกายภาพบำบัดรัชตกายา
99.แอทเขตลาดพร้าว คลินิกกายภาพบำบัด (นำส่ง OSS 20/2/66)
100.สหคลินิกการแพทย์แผนไทยบิ๊กเฮิร์บแอนด์แลบ
101.เดอะซีพลัสสหคลินิก
102.บราธอร์เปา สหคลินิก (เพิ่ม สพ.6 ร่วม)
103.สถานพยาบาลและการผดุงครรภ์ สำนักงานกรุงเทพฯ (Toyota Alive) (นอก พ.ร.บ.)
วันที่ 27 กุมภาพันธ์ 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการใบอนุญาตให้ประกอบกิจการและดำเนินการสถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน จำนวน 75 แห่ง ดังนี้
1.ดุสิตเวชการคลินิกเวชกรรม
2.ณัฐธิดาคลินิกเวชกรรม สาขา 2
3.อีวีดีลักซูรี่ย์คลินิกเวชกรรม
4.คลองเตยมีสุขคลินิกเวชกรรม
5.คลินิกเวชกรรมสรศักดิ์การแพทย์
6.ดอกเตอร์การคลินิกเวชกรรม
7.คิวเอ็นคลินิกเวชกรรม
8.สุทธิพรการแพทย์คลินิกเวชกรรม
9.คลินิกเวชกรรมวิโรจน์การแพทย์
10.วิโรจน์คลินิกเวชกรรม
11.บลอสซั้มคลินิกเวชกรรม
12.คลินิกเวชกรรมรุ่งเจริญการแพทย์
13.มิชิโกะคลินิกเวชกรรม
14.อดุลคลินิกเวชกรรม
15.วีลาล่าคลินิกเวชกรรม
16.อามาด้าคลินิกเวชกรรม
17.ชีวาน่าคลินิกเวชกรรม
18.วีว่าคลินิกเวชกรรม
19.ไอเอชอาร์ซีคลินิกเวชกรรม
20.เฮโยคลินิกเวชกรรม
21.บางซ่อนคลินิกเวชกรรม
22.เดอะเวนิเซียคลินิกเวชกรรม
23.วิดาคลินิกเวชกรรม
24.คลินิกเวชกรรมนายแพทย์ศิริพรชัย
25.สนามหลวง 2 คลินิกเวชกรรม
26.คลินิกเวชกรรมซีเอ็ม สาขาเอกมัย
27.ซิกม่าคลินิกเวชกรรม
28.กรรน์ภิรมย์คลินิกเวชกรรม
29.สมิทธิ์คลินิกเวชกรรม สาขา 1
30.เฮอร์เมซคลินิกเวชกรรม สาขาเซ็นทรัลปิ่นเกล้า
31.ดร.สมชายคลินกเวชกรรม (เพลินจิต)
32.ดร.สมชายคลินิกเวชกรรม (อนุสาวรีย์ประชาธิปไตย)
33.โกลว์คลินิกเวชกรรม
34.ดิ ออริจิ้น คลินิกเวชกรรม
35.ลานปูนคลินิกเวชกรรม
36.เอสเมอรัลดาคลินิกเวชกรรม (นำส่ง OSS 24/2/66)
37.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 18 (นำส่ง OSS 22/2/66)
38.เมล่อนเมดิคอลคลินิกเวชกรรม (นำส่ง OSS 24/2/66)
39.คลินิกเวชกรรมเฉพาะทางผิวหนังศัลยศาสตร์ตกแต่งกรุงเทพ
40.รักษ์เด็กภูมิแพ้ คลินิกเฉพาะทางด้านเวชกรรมสาขากุมารเวชศาสตร์โรคภูมิแพ้
41.เลิฟลี่อายบายหมอรวงข้าวคลินิกเฉพาะทางด้านเวชกรรมจักษุ สาขาเอกมัย
42.คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งอัมรินทร์
43.คลินิกเฉพาะทางด้านเวชกรรมตจวิทยาวีดีไซน์ (นำส่ง OSS 23/2/66)
44.คลินิกทันตกรรมซีนเตซี่
45.คลินิกทันตกรรมเด็นทัลแอทโฮม
46.คลินิกทันตแพทย์อังกูร คลินิกทันตกรรม
47.คลินิกทันตกรรมต้นแค
48.สรัญญาทันตกรรมคลินิก
49.ซิกท์ทีนเด็นทัลไฮท์คลินิกทันตกรรม
50.คลินิกทันตกรรมสยาม
51.เกรซเดนทัลคลินิกทันตกรรม สาขาร่มเกล้า
52.คลินิกทันตกรรมนราธิวาส
53.คลินิกทันตกรรมเดนท์สไมล์
54.คลินิกทันตกรรมโนเอะสไมล์
55.คลินิกทันตกรรมเด้นท์คลีนิค
56.คลินิกทันตกรรมพีพีเค
57.คลินิกทันตกรรมดอกเตอร์โอ๊ต
58.คลินิกทันตกรรมสายไหมรักฟัน
59.บ้านฟันคลินิกทันตกรรม
60.คลินิกทันตกรรมเดนทอลสไมล์พลัส
61.คลินิกทันตกรรมภัทราเดนทัลโฮม
62.เย็นใจคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
63.เวชพงศ์โอสถคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน (เพิ่มห้องฝังเข็ม)
64.กรเอกคลินิกการแพทย์แผนไทย
65.สง่าคลินิกการแพทย์แผนไทย
66.เลอพิอุสปัญญาอินทราคลินิกกายภาพบำบัด
67.พีบีคลินิกกายภาพบำบัด
68.รีบาลานซ์เมดิกสหคลินิก สาขาทรูดิจิทัลพาร์ค
69.เวอร์เทคสหคลินิก
70.กองจูเวลเนส 3 สหคลินิก
71.เดอะทัชสหคลินิก
72.ไวทัลสลีปสหคลินิก
73.เจสหคลินิก สาขาเอกมัย (เพิ่มผู้ปฎิบัติร่วมหลัก)
74.สหคลินิกดีไลท์เฮอร์เบิลเฮาส์ (เพิ่มผู้ปฎิบัติร่วมหลัก)
75.วินรีแฮบสหคลินิก (นำส่ง OSS 24/2/66)
ธันวาคม 2565
วันที่ 22 ธันวาคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 18 แห่งดังนี้
1.ชัยโรจน์การแพทย์คลินิกเวชกรรม (ใบอนุญาต 10101140846)
2.แอลดีซีไลฟ์พลัสสหคลินิก สาขาสะพานใหม่ (ใบอนุญาต 10110003562)
3.เคคลินิกเวชกรรม สาขาสุภาพงษ์ 3 (ใบอนุญาต 10101006656)
4.ไพรัชเวชกรรมคลินิก (ใบอนุญาต 10101000246)
5.คลินิกเวชกรรมพหล 48 การแพทย์ (ใบอนุญาต 10101001256)
6.เคคลินิกเวชกรรม สาขาราม 2 (ใบอนุญาต 10101006756)
7.ชลัมพ์คลินิกเวชกรรม (ใบอนุญาต 10101082346)
8.แอนน่าคลินิกเวชกรรม (ใบอนุญาต 10101015556)
9.ลีลาคลินิกเวชกรรม (ใบอนุญาต 10101006356)
10.คลินิกเวชกรรมแพทย์สมชาย สาขาห้วยขวาง (ใบอนุญาต 10101020356)
11.คลินิกเฉพาะทางด้านเวชกรรมผิวหนัง แอล.เอส.ที. (ใบอนุญาต 10102003856)
12.ทูธเมโลดี้คลินิกทันตกรรม (ใบอนุญาต 10103009256)
13.คลินิกทันตกรรมเดนทัลโฮม (ใบอนุญาต 10103004356)
14.คลินิกทันตกรรมเดนทัลแคร์ (ใบอนุญาต 10103063946)
15.คลินิกทันตกรรมบ้านรักยิ้ม (ใบอนุญาต 10103040946)
16.เอวาตาร์คลินิกการแพทย์แผนไทย (ใบอนุญาต 10108003956)
17.พระคุณแม่คลินิกการแพทย์แผนไทย (ใบอนุญาต 10108003056)
18.เคสหคลินิก สาขาสุขุมวิท 93 (ใบอนุญาต 10110000256)
วันที่ 13 ธันวาคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 22 แห่งดังนี้
1.คลินิกสุกิจการแพทย์ (ใบอนุญาต 10101003346)
2.รัตนโกสินทร์คลินิกเวชกรรม (ใบอนุญาต 10101000456)
3.รมย์รวินท์คลินิกเวชกรรม สาขาสยามพารากอน สาขา 2 (ใบอนุญาต 10101020256)
4.ไชยแพทย์เวชกรรมคลินิก (ใบอนุญาต 1010102148)
5.พรคลินิกเวชกรรม (ใบอนุญาต 10101040756)
6.บี อี คลินิกเวชกรรม (ใบอนุญาต 10101014256)
7.คลินิกเวชกรรม ทีเอสดี แอ็ดวานซ์เมดิซีน เซ็นทรัลบางนา (ใบอนุญาต 10101007556)
8.คลินิกเวชกรรม ทีเอสดี แอ็ดวานซ์เมดิซีน เดอะมอลล์บางกะปิ(ใบอนุญาต 10101007856)
9.จรินทรคลินิกเวชกรรม (ใบอนุญาต 10101000356)
10.คลินิกทันตกรรมวีเลิฟเดนทิส (ใบอนุญาต 10103004656)
11.คลินิกทันตกรรมบ้านรักฟัน (ใบอนุญาต 10103003356)
12.คลินิกทันตกรรมเด็นทัลฮาร์ท (ใบอนุญาต 10103012156)
13.ไพบูลย์คลินิกทันตกรรม (ใบอนุญาต 10103038146)
14.คลินิกทันตกรรมสุขุมวิทสกายเทรน (ใบอนุญาต 10103009954)
15.คลินิกทันตกรรมกนิษฐาทันตแพทย์ (ใบอนุญาต 10103000456)
16.คลินิกทันตกรรมสไมล์แคร์ (ใบอนุญาต 10103002456)
17.คลินิกทันตกรรมนลินเด็นทัลแคร์ (ใบอนุญาต 10103009656)
18.คลินิกทันตกรรมเด็นทัลสตาร์ (ใบอนุญาต 10103000956)
19.สุรางค์คลินิกแพทย์แผนไทย (ใบอนุญาต 10108007246)
20.กรุงเทพไทยจีนคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108002956)
21.อินเตอร์เนชั่นแนล สเปเชียลลิส สหคลินิก (ใบอนุญาต 10110001756)
22.บีเอเอซีสหคลินิก (ใบอนุญาต 10110004963)
วันที่ 6 ธันวาคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 16 แห่งดังนี้
1.รมย์รวินท์คลินิกเวชกรรม สาขาสีลมคอมเพล็กซ์ (ใบอนุญาต 10101011656)
2.วีเมดิคัลคลินิกเวชกรรม (ใบอนุญาต 10101025756)
3.แพนลินิกเวชกรรม (ใบอนุญาต 10101006156)
4.คลินิกเวชกรรมยศสินี ซีคอนบางแค (ใบอนุญาต 10101022756)
5.ธรรมพิชญาคลินิกเวชกรรม (ใบอนุญาต 10101004756)
6.คลินิกเฉพาะทางด้านเวชกรรมผิวหนังแพทย์วชิระ (ใบอนุญาต 10102000256)
7.ด๊อกเตอร์สมศักดิ์คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรม (ใบอนุญาต 10102001556)
8.รัชนีคลินิกทันตกรรม (ใบอนุญาต 10103004756)
9.คลินิกทันตกรรมวงศกรทันตกรรม (ใบอนุญาต 10103002956)
10.ศูนย์ทันตกรรมแอลดีซี สาขานวมินทร์ (ใบอนุญาต 10103006156)
11.คลินิกทันตกรรมบางกอกนิวสไมล์ (ใบอนุญาต 10103008256)
12.คลินิกทันตกรรมสไมล์โซไซตี้ สาขาอารีย์ (ใบอนุญาต 10103007156)
13.ทูธ แฟรี่คลินิกทันตกรรม (ใบอนุญาต 10103001056)
14.เดนต้าวิลเลจคลินิกทันตกรรม (ใบอนุญาต 10103007256)
15.ศูนย์ทันตกรรกมแอลดีซี สาขารามอินทรา 37 คลินิกทันตกรรม (ใบอนุญาต 10103000356)
16.ศิริวานนท์คลินิกการแพทย์แผนไทย (ใบอนุญาต 10108003156)
รายชื่อผู้ได้รับรางวัลอย. ควอลิตี้ อวอร์ด ปี 2565
สถานประกอบการดีเด่นที่ได้รับรางวัล อย. ควอลิตี้ อวอร์ด ปี 2565
ประเภท Best of The Best จำนวน 5 รางวัล
1 บริษัท วันไทยอุตสาหกรรมการอาหาร จำกัด
2 องค์การเภสัชกรรม ธัญบุรี
3 บริษัท ศรีตรังโกลฟส์ (ประเทศไทย) จำกัด (มหาชน)
4 บริษัท เอส แอนด์ เจ อินเตอร์เนชั่นแนล เอนเตอร์ไพรส์ จำกัด (มหาซน)
5 บริษัท นวศรี แมนูแฟคเจอรี่ง จำกัด
ประเภท 3 ปีติดต่อกัน ปี 2563 - 2565 จำนวน 9 รางวัล
1 บริษัท จอมธนา จำกัด
2 บริษัท เบ๊ทเทอร์ฟาร์ม่า จำกัด
3 บริษัท โพสเฮลท์แคร์ จำกัด
4 บริษัท นวศรี แมนูแฟคเจอรี่ง จำกัด
5 บริษัท ปฐวิน จำกัด
6 มูลนิธิโรงพยาบาลเจ้าพระยาอภัยภูเบศรฯ
7บริษัท ไวท์เฮ้าส์คลีนนิ่ง โปรดักส์ จำกัด
8 บริษัก คิงส์สเตลล่า แลบบอราทอรี่ จำกัด
9 บริษัท ไอ ซี พี ลัดดา จำกัด
ประเภทรางวัลประจำปี ด้านอาหาร จำนวน 7 รางวัล
1 บริษัท ไทยโอซูก้า จำกัด
2 บริษัท สกายไลน์ เฮลท์แคร์ จำกัด
3 บริษัท น้ำมันพืชปทุม จำกัด
4 บริษัท บูโอโน่ (ประเทศไทย) จำกัด (มหาชน)
5 บริษัท ยูอาร์ชี (ประเทศไทย) จำกัด
6 บริษัท เพชรดำฟู้ดส์ จำกัด
7 โครงการส่วนพระองค์ สวนจิตรลดา
ประเภทรางวัลประจำปี ด้านยา จำนวน 6 รางวัล
1 บริษัท อินแพคฟาร์มา จำกัด
2 บริษัท อาร์เอ็กซ์ แมนูแฟคเจอรี่ง จำกัด
3 บริษัท ยูโทเปี้ยน จำกัด สาขา ปราจีนบุรี
4 บริษัท โอลิค (ประเทศไทย) จำกัด
5 บริษัท ไทยนครพัฒนา จำกัด
6 บริษัท ชุมชนเภสัชกรรม จำกัด (มหาชน)
ประเภทรางวัลประจำปี ด้านผลิตภัณฑ์สมุนไพร จำนวน 2 รางวัล
1 บริษัท มิลลิเมด จำกัด
2 บริษัท อ้วยอันโอสถ จำกัด
ประเภทรางวัลประจำปี ด้านเครื่องมือแพทย์ จำนวน 4 รางวัล
1 บริษัท โอกาโมโต รับเบอร์ โปรดักส์ จำกัด
2 บริษัท ไทยฮอสพิทอล โปรดักส์ จำกัด
3 บริษัท เอ็ม.อาร์.ไอ. จำกัด
4 บริษัท โนวาเมดิค จำกัด
ตารางออกตรวจ คลินิกพิเศษนอกเวลา เดือนพฤษภาคม 2566
ตารางออกตรวจ คลินิกพิเศษนอกเวลา เดือนพฤษภาคม 2566 เวลาออกตรวจ 16.30-19.00น. ค่าบริการเบื้องต้น 250บาท
คลินิกพิเศษอายุรกรรมโรคทั่วไป และโรคไต พญ.ปวิตรา ทุกวันอังคาร
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกอายุรกรรมโรคทั่วไปและอายุรกรรมโรคไต ให้บริการตรวจอายุรกรรมโรคไต อายุรกรรมทั่วไป เบาหวาน ความดัน ไขมัน โดย พญ.ปวิตรา วาสุเทพรังสรรค์ อายุรแพทย์โรคไต เปิดบริการทุกวันอังคารของเดือน เว้นวันหยุดนักขัตฤกษ์ เวลา 16.30-20.30 น. ณ ห้องตรวจเบอร์ 6 โรงพยาบาลสิงห์บุรี (เริ่ม เดือนมกราคม ๒๕๖๖ เป็นต้นไป)
สำหรับผลประกอบการในปี 2565 และงบลงทุนปี 2566-2568
สำหรับผลประกอบการในปี 2565 ของบริษัทอมรินทร์พริ้นติ้ง แอนด์ พับลิชชิ่ง จำกัด (มหาชน) และบริษัทย่อย มีรายได้รวม 4,274.45 ล้านบาท เติบโตขึ้นจากปีก่อนเป็นจำนวนเงิน 1,313.84 ล้านบาท หรือเติบโตขึ้นถึง 44.4 % ซึ่งมีเหตุผลหลักมาจาก
1. รายได้จากธุรกิจผลิตงานพิมพ์และจำหน่ายหนังสือ มีการเติบโตถึงร้อยละ 91.5 เมื่อเปรียบเทียบกับปี 2564 โดยมาจากการขยายตัวของธุรกิจบรรจุภัณฑ์ และการเติบโตของธุรกิจการจัดจำหน่ายหนังสือเล่มผ่านหน้าร้านหนังสือต่างๆ และโดยเฉพาะผ่านช่องทางออนไลน์ ซึ่งมีการอัตราการเติบโตถึงร้อยละ 83.4
2. รายได้จากธุรกิจมีเดียและอีเวนต์ รวมการให้บริการโฆษณาผ่านสื่อสิ่งพิมพ์และสื่อออนไลน์ และการจัดงานแสดงสินค้าและอีเวนต์ต่าง ๆ ซึ่งในปี 2565 มีอัตราการเพิ่มขึ้นถึงร้อยละ 72.9 เมื่อเปรียบเทียบกับปี 2564 โดยเฉพาะรายได้จากการจัดงานแสดงสินค้าที่เติบโตถึงร้อยละ 147.6 โดยบริษัทสามารถดำเนินการจัดงานแสดงสินค้าได้ใกล้เคียงกับแผนงานที่วางไว้ทั้งงานบ้านและสวนแฟร์ที่มีการจัดงานถึง 3 ครั้ง งานอมรินทร์ เบบี้แอนด์ คิดส์ แฟร์ ที่มีการจัดงานในระหว่างปีถึง 4 ครั้ง รวมทั้งงานอื่นๆ
3. รายได้จากธุรกิจสื่อทีวีดิจิทัล ที่ยังคงรักษาระดับรายได้ไว้ได้ แม้ว่ายอดในการซื้อสื่อทีวีดิจิทัลในอุตสาหกรรมจะมีมูลค่ารวมที่ลดลง แต่บริษัทยังมีรายได้ 1,287.33 ล้านบาท ใกล้เคียงกับรายได้ในปี 2564 ที่มีรายได้ 1,282.36 ล้านบาท
งบลงทุนปี 2566-2568
ปี 2566-2568 ตั้งงบลงทุนกว่า 2,100 ล้านบาท โดยแบ่งเป็น
- 800 ล้านบาท โอกาสการลงทุนในธุรกิจใหม่ และจากการร่วมมือกับคู่ค้า
- 600 ล้านบาท คอนเทนต์หนังสือ, ดิจิทัล, โทรทัศน์ ทั้งรูปแบบการซื้อลิขสิทธิ์ต่างประเทศ และสร้าง Local Content เพื่อพัฒนา Soft Power ให้กับประเทศไทย
- 250 ล้านบาท Infrastructure เช่น การสร้างสตูดิโอใหม่, การพัฒนาพื้นที่ที่มีอยู่ให้เกิดประโยชน์
- 250 ล้านบาท Technology เช่น AI, ML เพื่อต่อยอดธุรกิจให้มีประสิทธิภาพ
- 250 ล้านบาท Packaging เครื่องจักรและเทคโนโลยีการพิมพ์รองรับธุรกิจบรรจุภัณฑ์
ประโยชน์ของกลุ่มผู้สนับสนุน
ในการบรรลุเป้าหมายด้านสุขภาพหรือการเปลี่ยนแปลงวิถีชีวิตเชิงบวกนั้น การมีความมุ่งมั่นตั้งใจและมีแรงบันดาลใจตลอดเส้นทางอาจเป็นเรื่องที่ทำได้ยาก ด้วยเหตุนี้ กลุ่มผู้สนับสนุนจึงมีบทบาทสำคัญในการเอาชนะความท้าทายเพื่อเพิ่มโอกาสในการบรรลุเป้าหมาย ซึ่งผู้ตอบแบบสำรวจส่วนใหญ่ก็คิดเหมือนกัน (84%) โดยประโยชน์ที่ได้รับจากกลุ่มผู้สนับสนุนประกอบด้วย
- การแบ่งปันประสบการณ์และความรู้อันมีค่า (57%)
- การให้คำแนะนำและให้กำลังใจ (54%)
- การให้คำปรึกษาด้านสุขภาพ (49%)
- การมีความมุ่งมั่นตั้งใจบนเส้นทางสุขภาพของตนเอง (43%)
นอกจากการออกกำลังกายและการผ่อนคลายแล้ว การรับประทานอาหารที่มีประโยชน์ควบคู่ไปกับอาหารเสริมเพื่อแก้ปัญหาการขาดวิตามินสามารถช่วยป้องกันโรคไม่ติดต่อต่างๆ (Non Communicable Diseases: NCD) เช่น โรคเบาหวาน โรคหัวใจ และความดันโลหิตสูง สิ่งสำคัญคือเราต้องรู้ว่าการพักร้อนไม่ใช่เหตุการณ์ที่เกิดขึ้นเพียงครั้งเดียวแต่ส่งผลกระทบต่อไลฟ์สไตล์ของเราอย่างต่อเนื่อง การฝึกนิสัยที่ดีต่อสุขภาพจะต้องสนุกและเพลิดเพลินเพื่อให้แน่ใจว่าสิ่งเหล่านี้กลายเป็นส่วนหนึ่งของกิจวัตรประจำวันของเรา การศึกษาแสดงให้เห็นว่าการออกกำลังกายมีประโยชน์ต่อสุขภาพอย่างมาก ช่วยลดความเสี่ยงต่อโรคต่างๆ เช่น ภาวะสมองเสื่อม ภาวะซึมเศร้า ความวิตกกังวล และมะเร็งได้
สำหรับการออกกำลังกายแนะนำให้ผสมผสานการฝึกความอดทนและความแข็งแรงอย่างสมดุล ซึ่งสามารถช่วยเพิ่มมวลกระดูกและความหนาแน่น และเสริมสร้างเส้นเอ็นและกล้ามเนื้อ โดยระดับการออกกำลังกายขั้นต่ำที่แนะนำคือ 6 MET (Metabolic Equivalent of Task โดย 1 MET เท่ากับ 1 กิโลแคลอรี่ต่อน้ำหนักตัว 1 กิโลกรัม) ต่อวัน ซึ่งทำได้ผ่านกิจกรรมต่างๆ เช่น เทนนิส เดินเร็ว ขี่จักรยาน กอล์ฟ และการเต้นรำ การฝึกความทนทานและความแข็งแรงควรทำทุกวันๆ ละ 30 นาที เพื่อให้แน่ใจว่าได้ออกกำลังกายทั้งร่างกายอย่างสมดุล
เมื่อกัญชาเป็นยาเสพติดให้โทษ จะจ่ายยาโดยเภสัชเท่านั้น
นพ.เทวัญ ธานีรัตน์ รองอธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก
โพสต์ผ่านเพจส่วนตัว สั้นๆ ไว้ชวนตีความต่อ ว่า
"เมื่อกัญชาเป็นยาเสพติดให้โทษ แพทย์และแพทย์แผนไทยจะจ่ายยาเสพติดให้โทษได้จะต้องมีเภสัชกรแผนปัจจุบันในสถานพยาบาลเท่านั้น" พร้อมกับแนบภาพประกอบประมวลกฏหมายยาเสพติด แสดงเนื้อหาส่วนของมาตรา 39-41 โดยท่านเน้นว่า "ลองดูมาตรา 40 ของประมวลกฎหมายยาเสพติดครับ" ซึ่งมาตรา 40 ระบุว่า "ให้ผู้รับอนุญาตผลิต นำเข้า ส่งออก จำหน่าย หรือมีไว้ในครอบครองซึ่งยาเสพติด ให้โทษในประเภท ๒ ประเภท ๓ หรือประเภท ๕ หรือผู้รับอนุญาตผลิต นำเข้า ส่งออก หรือ จำหน่ายซึ่งวัตถุออกฤทธิ์ในประเภท ๒ ประเภท ๓ หรือประเภท ๔
ต้องจัดให้มีเภสัชกรอยู่ประจำ ควบคุมกิจการตลอดเวลาทำการซึ่งระบุไว้ในใบอนุญาต พร้อมทั้งต้องดูแลให้เภสัชกรได้ปฏิบัติหน้าที่ ทั้งนี้ ตามที่รัฐมนตรีว่าการกระทรวงสาธารณสุขกำหนดในกฎกระทรวง"
คลินิกทันตกรรมพิเศษเฉพาะทางนอกเวลา
คลินิกค้นหาความเสี่ยงโรคมะเร็ง (ตรวจสุขภาพ)
คลินิกทันตกรรมนอกเวลาราชการ
บริการอุดฟัน ถอนฟัน ขูดหินปูน ผ่าฟันคุด
วันจันทร์-พฤหัสบดี 16.30 - 20.00 น.
วันเสาร์ 9-16 น.
โทรสอบถาม/ติดต่อนัดหมายล่วงหน้าก่อนเข้ารับบริการ 034-622999 ต่อ 6200
รพ.หัวหิน สาขา2 (บ่อฝ้าย) LINK
เปิดให้บริการ
ตรวจรักษาโรคทั่วไป เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 8.30-12.00 น.
ทันตกรรม เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 8.30-12.00 น. (รับจำนวนจำกัด)
ฉีดยาทำแผล เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 13.00-15.30 น.
ฉีดวัคซีนป้องกันโรคในเด็ก ตามช่วงอายุ วันพฤหัส สัปดาห์ที่ 2 และ สัปดาห์ที่ 3 ของเดือน (โดยสามารถนัดหมายล่วงหน้าได้ที่โรงพยาบาลหัวหิน สาขา 2)
แพทย์แผนไทย เปิดให้บริการ วันจันทร์ – วันอาทิตย์ เวลา 8.30-20.00 น.
สำหรับผู้รับบริการที่ใช้สิทธิการรักษาที่โรงพยาบาลหัวหินสามารถเข้ารับบริการได้ โดยไม่เสียค่าบริการเพิ่ม สอบถามรายละเอียดเพิ่มเติมได้ที่ รพ.หัวหิน สาขา 2 บ่อฝ้าย โทร. 032- 520700
ดวงตาเป็นอวัยวะที่สำคัญและซับซ้อน จึงต้องมีผู้เชี่ยวชาญช่วยดูแล - ภญ. อาทิรัตน์ จารุกิจพิพัฒน์
ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ เปิดเผยว่า ปัญหาเกี่ยวกับ "ดวงตา" เป็นเรื่องใกล้ตัวซึ่งมีผลต่อการใช้ชีวิตประจำวัน สามารถเกิดขึ้นได้กับทุกเพศทุกวัย โรงพยาบาลบำรุงราษฎร์ได้ตระหนักถึงปัญหาเกี่ยวกับสุขภาพตาดังกล่าว จึงได้จัดงานแถลงข่าว Eye Excellence Center ขึ้นเพื่อสร้างความตระหนักรู้เกี่ยวกับการดูแลสุขภาพดวงตาและการป้องกันก่อนเกิดโรค เพราะดวงตาเป็นอวัยวะที่สำคัญและซับซ้อน จึงจำเป็นต้องมีผู้เชี่ยวชาญเฉพาะทางให้การดูแลเพื่อรักษาไว้ซึ่งการมองเห็นที่ดีตามช่วงวัยที่เหมาะสม
โดยศูนย์จักษุ โรงพยาบาลบำรุงราษฎร์ มีความพร้อมในการดูแลรักษาทุกโรคเกี่ยวกับดวงตาในทุกช่วงวัย ครอบคลุมตั้งแต่กลุ่มอาการทั่วไปจนถึงกลุ่มอาการที่มีความซับซ้อน รวมถึงผู้ที่ประสบอุบัติเหตุฉุกเฉินและกระทบต่อใบหน้าหรือดวงตาอย่างรุนแรง โดยมีจักษุแพทย์ผู้ชำนาญการในแต่ละด้าน (Sub-specialties) เช่น จักษุแพทย์เฉพาะทางโรคกระจกตา โรคของจอตา โรคของกล้ามเนื้อตา เนื้อเยื่อรอบดวงตาและเบ้าตา และในกรณีที่มีความซับซ้อนของโรคอื่นร่วมด้วย จักษุแพทย์จะให้การรักษาร่วมกันกับทีมแพทย์ผู้ชำนาญการเฉพาะทางศูนย์อื่นๆ เช่น แพทย์ผู้ชำนาญการด้านอายุรศาสตร์โรคต่อมไร้ท่อและเมตะบอลิสม, แพทย์ผู้ชำนาญการด้านประสาทวิทยา ทีมเภสัชกรและทีมสหสาขาวิชาชีพ ด้วยเครื่องมือที่ทันสมัยสำหรับการตรวจวินิจฉัยและรักษาได้อย่างรวดเร็วและแม่นยำ ซึ่งทั้งหมดเป็นปัจจัยสำคัญที่ทำให้ผลลัพธ์การรักษามีความปลอดภัยและมีประสิทธิภาพดียิ่งขึ้น
ปลดล็อกข้อมูลรัฐ จุดเปลี่ยนปราบโกง


จากนั้นเป็นการเปิดวงเสวนา ในหัวข้อ “ปลดล็อกข้อมูลรัฐ จุดเปลี่ยนปราบโกง” โดยได้รับเกียรติจาก ดร.ชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร ที่ให้ความสำคัญในเรื่องของ Open Bangkok คือ Open data การเปิดเผยข้อมูล ข้อมูลเป็นสิ่งสำคัญต้องมีการเปิดเผย มิใช่การเผยแพร่ ข้อมูลเปรียบเสมือนไฟฉายที่ทำให้เราเห็นช้างที่อยู่ในมุมมืด และต้องวัดได้ เทคโนโลยีในส่วนของการเก็บข้อมูลด้วย Format เดียวกัน การอ่านข้อมูล การประมวลข้อมูล การทำ Dashboard จะช่วยให้ทุกอย่างง่ายยิ่งขึ้น อีกทั้งยังเป็นการเพิ่มประสิทธิภาพของการดำเนินธุรกิจอีกด้วย เช่น ข้อมูลความเสี่ยงในพื้นที่ต่าง ๆ สัญญาจัดซื้อจัดจ้าง อำนาจต่อรองต่าง ๆ AI สามารถวิเคราะห์ได้เลย จากการเปิดเผยข้อมูลทำให้เรามีแนวร่วมจากพลังมหาชนที่มีมหาศาลเข้ามาช่วยวิเคราะห์หาความผิดสังเกตุจากฝ่ายบริหารที่มันตัวแปรซ่อนอยู่ในเชิงนโยบาย ถ้าเราสามารถสร้างความไว้วางใจกับประชาชนได้สุดท้ายเราจะได้แนวร่วมมหาศาล การที่เรา Open data มันคือการสร้างความเชื่อใจ สร้างศรัทธา ซึ่งเป็นสิ่งที่มีค่าที่สุดที่จะทำให้เกิดรัฐที่โปร่งใส รัฐที่ประชาชนมีส่วนร่วม ทำให้หน่วยงานไม่กล้าทุจริต ไม่กล้ากระทำผิด และการแจ้งเรื่องทุจริตผ่านทาง Traffy Fondue เป็นโปรแกรมง่าย ๆ เรื่องที่ประชาชนร้องเรียนมาในเรื่องต่างๆ จะไม่ถูกหมกอยู่ใต้พรมอีกต่อไป ลดความล่าช้าในการปฏิบัติงานอีกด้วย อีกทั้งยังเป็นการแสดงความโปร่งใสในการให้บริการอีกทาง”
“เราต้องมีการร่วมมือร่วมใจจากทุกส่วน 4 เกลียวที่ร่วมใจกัน ภาครัฐ ประชาชน เอกชน และภาควิชาการ ทำให้เกิดความแข็งแรงขึ้นในสังคมต่อการต่อต้านคอร์รัปชั่นและความโปร่งใส”
การใช้หนังสือภาพเป็นสื่อกลางการเรียนการสอนคณิตศาสตร์
ดร.กฤษฎ์ชัย สมสมาน ผู้อำนวยการศูนย์ SEAMEO STEM-ED ได้กล่าวถึงแนวคิดพัฒนาการอ่านอย่างมีความหมายผ่านหนังสือภาพว่า “เราเห็นแนวทางจากต่างประเทศ เช่น ญี่ปุ่น หรือชิลี ที่ใช้หนังสือภาพเป็นสื่อกลางการเรียนการสอนคณิตศาสตร์ จึงนำแนวคิดนี้มาต่อยอดร่วมกับเชฟรอนในโครงการ Picture Book ซึ่งอยู่ภายใต้โครงการ Chevron Enjoy Science โดยพัฒนาร่วมกับผู้เชี่ยวชาญด้านการอ่านและการเขียนจากมหาวิทยาลัยโคลัมเบีย ประเทศสหรัฐอเมริกาและคณะนักวิจัยการศึกษา จากมหาวิทยาลัยเครือข่ายทางวิชาการ จำนวน 7 แห่งของประเทศไทย เพื่อปูพื้นฐานให้เด็กๆ ระดับประถมศึกษาตอนต้นสามารถอ่านโดยใช้กระบวนการคิด การฟัง จินตนาการ และตั้งคำถาม พร้อมทั้งจัดอบรมครูให้มีทักษะการจัดการเรียนรู้โดยใช้หนังสือภาพ ซึ่งคัดเลือกจากเกณฑ์ที่เหมาะสมกับโครงการฯและนักเรียนระดับประถมศึกษาตอนต้น โดยจะต้องสามารถอ่านจบในเวลา 30 นาที รวมทั้งมีเนื้อเรื่องน่าติดตามและดำเนินเรื่องอย่างมีความหมายลึกซึ้ง ทำให้นักเรียนต้องค้นหาหรือได้คิด ซึ่งเราหวังว่าโครงการดังกล่าวจะเป็นโมเดลสำคัญเพื่อขยายผลในระดับประเทศและเป็นต้นแบบให้อาเซียนต่อไป”
สังเวียน สุราแผ่นดินสุพรรณบุรี กลั่นจากอ้อยสด LINK
"สังเวียน" เป็นสุรากลั่นจากจังหวัดสุพรรณบุรี ผลิตโดยใช้น้ำหวานจากอ้อยสดมาหมักให้เกิดแอลกอฮอล์แล้วนำไปกลั่น
คำว่า "สังเวียน" เป็นชื่อของคุณปู่ที่เสียชีวิตไปแล้ว คู่ชีวิตของคุณย่าที่เคยผลิตสาโทขายในอดีต ตั้งแต่ตัวเจ้าของแบรนด์ที่เป็นหลานยังไม่เกิด การใช้ชื่อนี้แทนชื่อคุณปู่ก็เพื่อให้คุณย่าระลึกถึงคนที่คุณย่ารักและสิ่งที่คุณย่ารักที่จะทำ แต่กฎหมายไม่สนับสนุนให้ทำ
ตัวเจ้าของแบรนด์ศึกษาด้านการผลิตเบียร์จากอังกฤษ เคยทำงานในบริวผับขนาดใหญ่ของไทยอยู่หลายปี ปัจจุบันยังทำเบียร์ดื่มเองและทำแบรนด์เหล้าสังเวียนอย่างจริงจัง
ข้อมูลและภาพจากเพจประชาชนเบียร์
ตัวอย่างหลักสูตรแต่ละแผนก/อุตสาหกรรม
พฤติกรรมด้านการดูแลสุขภาพของคนไทย
หลังเกิดการแพร่ระบาดของโควิด-19 ส่งผลให้การดูแลสุขภาพเป็นสิ่งที่สำคัญมากขึ้น เห็นได้ชัดจากกว่าร้อยละ 40 ของกลุ่ม Young Millennials ที่มีช่วงอายุ 26 ถึง 30 ปี มีการใช้อุปกรณ์และเทคโนโลยีเพื่อการดูแลสุขภาพส่วนบุคคลมากกว่าก่อนเกิดการแพร่ระบาดของโควิด-19 ในขณะที่ร้อยละ 70 ของกลุ่ม Gen X และ Baby Boomers ตระหนักถึงความสำคัญของการดูแลสุขภาพตนเองเป็นอย่างมาก โดยเฉพาะในกลุ่ม Baby Boomers ที่อยู่ในช่วงอายุ 56 – 65 ปี มีความตื่นตัวในการดูแลสุขภาพ ด้วยการหาข้อมูลด้านสุขภาพทางออนไลน์ มีการปรับเปลี่ยนพฤติกรรมด้านการดูแลสุขภาพ และมีการปรึกษาผู้เชี่ยวชาญด้านสุขภาพอย่างสม่ำเสมอ
Motorlance
สำหรับโครงการ Motorlance หรือ รถจักรยานยนต์ฉุกเฉินทางการแพทย์ ที่สามารถเข้าถึงประชาชนได้เร็วขึ้น ผู้ว่าฯ ชัชชาติ กล่าวว่า เป็นโครงการที่ดี เนื่องจาก 8 นาทีทองนั้นสำคัญมาก นั่นคือเมื่อเกิดเหตุฉุกเฉินเราสามารถไปถึงผู้ป่วยได้ภายใน 8 นาที ก็จะสามารถช่วยชีวิตผู้ป่วยได้ ซึ่งอุปกรณ์ภายในรถจักรยานยนต์ฉุกเฉินจะมีอุปกรณ์ที่จำเป็นในการปฐมพยาบาลและช่วยชีวิตฉุกเฉิน
"ขณะนี้เรามี 50 คันกระจายไป 50 เขต โดยทั้ง 50 คันนี้ไม่ได้ใช้งบประมาณหลวงแต่มีผู้บริจาคให้ ต่อไปในอนาคตอาจขยายผลเป็น 200 – 300 คัน"
รถ Motorlance นอกจากจะช่วยให้เข้าถึงประชาชนได้เร็วขึ้นแล้ว ยังเป็นการขยายเตียงโดยการนำเตียงผู้ป่วยที่อยู่ที่บ้านนำเข้ามาเป็นส่วนหนึ่งของระบบสาธารณสุข ทั้งหมดนี้เชื่อว่าเรามาถูกทางแล้ว และในปีที่ 2 นี้มีนโยบายอีก 24 นโยบายที่จะทำให้ระบบสาธารณสุขนั้นเข้มแข็งขึ้น
จุดเริ่มต้นของโครงการ
“จุดเริ่มต้นของโครงการเกิดจากคำถามที่ว่า ทำอย่างไรให้เราสามารถใช้ประโยชน์จากขาแท่นผลิตปิโตรเลียมที่ไม่ใช้งานแล้วให้เกิดประโยชน์สูงสุดแทนการนำไปจัดการบนฝั่ง”
นายชาทิตย์ ห้วยหงษ์ทอง ประธานกรรมการบริหาร บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด เล่าถึงที่มาของโครงการนำร่องฯ ว่า
“อ่าวไทยเปรียบเสมือนบ้านของเรา โดยตลอดกว่า 60 ปีของการดำเนินธุรกิจของเชฟรอนในประเทศไทย เราให้ความสำคัญกับสิ่งแวดล้อม และได้วัดผลกระทบต่อสิ่งแวดล้อมทางทะเลมาตลอด เราสังเกตถึงความอุดมสมบูรณ์และการเติบโตของประชากรปลาในบริเวณแท่นผลิตปิโตรเลียม โดยมีปลาหลากหลายชนิด รวมถึงฉลามวาฬเข้ามาแวะเวียนเสมอ โดยนอกจากบทบาทขณะที่อยู่กลางอ่าวไทยในการสร้างความมั่นคงทางพลังงานให้กับประเทศแล้ว ขาแท่นหลุมปิโตรเลียมยังมีอีกหนึ่งบทบาทแฝงซึ่งทำหน้าที่เสมือนปะการังเทียมอยู่ตลอด จึงเกิดแนวคิดต่อยอดการใช้ประโยชน์อย่างต่อเนื่องเพื่อเพิ่มพูนทรัพยากรทางทะเลรวมถึงประชากรปลาผ่านการพลิกบทบาทจากปลายทางของขาแท่นหลุมผลิตปิโตรเลียมที่ไม่ใช้งานแล้วสู่บ้านปลาแห่งใหม่ โดยแม้จะเป็นเรื่องใหม่ในประเทศไทย แต่ในฐานะบริษัทพลังงานที่มีกิจการทั่วโลก เราจึงสามารถนำโครงการ Rigs-to-Reefs ที่เชฟรอนเคยทำจากต่างประเทศมาปรับใช้สำหรับโครงการนี้เพื่อศึกษาความเป็นไปได้การต่อยอดโครงการในประเทศไทย”
หมอทวีศิลป์ แจงข้อมูลหมอลาออกคลาดเคลื่อน
7 มิถุนายน 2566 นพ.ทวีศิลป์ วิษณุโยธิน รองปลัดกระทรวงสาธารณสุข กล่าวว่า กระทรวงสาธารณสุข จะนำเสนอชุดข้อมูลของกระทรวงฯ เรื่องความขาดแคลน ภาระงาน การลาออก ความต้องการแพทย์เพื่อขับเคลื่อนระบบสุขภาพ ให้ที่ประชุมได้ช่วยกันพิจารณาหาทางออกที่เหมาะสมร่วมกัน
“เรื่องจำนวนแพทย์ที่ลาออกจากระบบราชการ ยังมีหลายกระแสข่าวว่าแพทย์จบใหม่ 2,700 คน มีการลาออกถึง 900 คน หรือ 1 ใน 3 ซึ่งเป็นการแปลความที่คลาดเคลื่อน จำนวน 900 คน นั้น เป็นการถูกจัดสรรไปยังหน่วยงานอื่นก่อนจัดสรรให้กระทรวงสาธารณสุขและกลาโหม ข้อมูลที่แท้จริง กระทรวงสาธารณสุขได้รับจัดสรรแพทย์ปีละประมาณ 1,800 คน มีการลาออกของแพทย์ใช้ทุนปี 1, ปี 2, ปี 3 และหลังใช้ทุนครบ 3 ปี รวมเฉลี่ยปีละ 455 คน สาเหตุที่ลาออกมีทั้งไปศึกษาต่อ ไปทำงานในภาคเอกชน หมดสัญญาชดใช้ทุน รวมถึงภาระงานด้วยส่วนหนึ่งซึ่งเมื่อรวมกับแพทย์ที่เกษียณปีละ 150-200 คน จะมีแพทย์ออกจากระบบปีละ 655 คน” นพ.ทวีศิลป์กล่าว
นพ.ทวีศิลป์กล่าวต่อว่า สำหรับเรื่องภาระงานที่เพิ่มขึ้นมากจากการให้บริการ ซึ่งส่วนหนึ่งเชื่อมโยงกับด้านสิทธิหลักประกันสุขภาพแห่งชาติ ท่านปลัดกระทรวงสาธารณสุขได้มอบหมายให้ นพ.พงศ์เกษม ไข่มุกด์ รองปลัดกระทรวงสาธารณสุข ซึ่งดูแลงานเกี่ยวกับหลักประกันสุขภาพ นัดหารือกับ สปสช.เร็วๆ นี้ ถึงทิศทางการลดภาระงานซึ่งไม่ใช่แพทย์ฝ่ายเดียว แต่รวมถึงทุกวิชาชีพที่ร่วมให้บริการ ส่วนเรื่องกรอบอัตรากำลังแพทย์ที่เกี่ยวข้องกับสำนักงานคณะกรรมการข้าราชการพลเรือน (ก.พ.) ได้มีการนัดหมายเลขาธิการ ก.พ. เพื่อหารือแนวทางการบริหารจัดการใหม่ๆ ทั้งเรื่องของแซนด์บ็อกซ์ รูปแบบการจ้างงานต่างๆ ในวันที่ 20 มิถุนายน นี้
การขออนุญาตทำและขายส่งสุรากลั่น และสุราแช่ชนิดเบียร์ และสุราผลไม้ LINK
การขออนุญาตทำและขายส่งสุรากลั่น และสุราแช่ชนิดเบียร์ และสุราผลไม้
1. หลักเกณฑ์การขออนุญาต
ตามประเภทสุรา
1.1 ประเภทสุรากลั่น
- ชนิดสุรา: วิสกี้้บรั่นดี้ยีน
คุณสมบัติผู้ขออนุญาต: บริษัทไทยผู้ถือหุ้นสัญชาติไทยไม่น้อยกว่า 51%
ทุนจดทะเบียนขั้นต่ำ : ไม่กำหนด
กำลังการผลิตขั้นต่ำ : 30,000 (28 ดีกรี)/วัน
พื้นที่ขั้นต่ำ : 200 ไร่
สถานที่ตั้งห่างจากแม่น้ำลำคลอง : 2 ก.ม.
- ชนิดสุรา: วิสกี้้ บรั่นดี้ ยีน และสุรากลั่นอื่น (ขาวผสมผสมพิเศษปรุงพิเศษ)
คุณสมบัติผู้ขออนุญาต: บริษัทไทยผู้ถือหุ้นสัญชาติไทยไม่น้อยกว่า 51%
ทุนจดทะเบียนขั้นต่ำ : ไม่กำหนด
กำลังการผลิตขั้นต่ำ : 90,000 (28 ดีกรี)/วัน
พื้นที่ขั้นต่ำ : 350 ไร่
สถานที่ตั้งห่างจากแม่น้ำลำคลอง : 2 ก.ม.
1.2 ประเภทสุราแช่
- ชนิดสุรา: เบียร์ขนาดใหญ่
คุณสมบัติผู้ขออนุญาต: บริษัทไทยผู้ถือหุ้นสัญชาติไทยไม่น้อยกว่า 51%
ทุนจดทะเบียนขั้นต่ำ : 10 ล้านบาท
กำลังการผลิตขั้นต่ำ : 10 ล้านลิตร/ปี
พื้นที่ขั้นต่ำ : ไม่กำหนด
สถานที่ตั้งห่างจากแม่น้ำลำคลอง : ไม่กำหนด
- ชนิดสุรา: เบียร์ขนาดเล็ก
คุณสมบัติผู้ขออนุญาต: บริษัทไทยผู้ถือหุ้นสัญชาติไทยไม่น้อยกว่า 51%
ทุนจดทะเบียนขั้นต่ำ : 10 ล้านบาท
กำลังการผลิตขั้นต่ำ : 100,000 ลิตร/ปี แต่ไม่เกิน 1 ล้านลิตร/ปี
พื้นที่ขั้นต่ำ : ไม่กำหนด
สถานที่ตั้งห่างจากแม่น้ำลำคลอง : ไม่กำหนด
หมายเหตุ: สุรากลั่นชนิดสุราสามทับ (แอลกอฮอล์) อนุญาตให้เฉพาะโรงงานสุราองค์การสุรากรมสรรพสามิต เป็นผู้ทำขายและกำหนดราคาขายและอนุญาตให้องค์การสุราฯทำและขายสุรากลั่น และสุราแช่ได้ทุกชนิด
2. เงื่อนไขและข้อปฏิบัติของผู้ได้รับอนุญาต
2.1 ต้องขออนุญาตประกอบกิจการโรงงานสุราตามกฎหมายของกรมโรงงานอุตสาหกรรม
2.2 สร้างโรงงานเสร็จต้องแจ้งล่วงหน้าก่อนทำสุราไม่น้อยกว่า 15 วันและต้องขอใบอนุญาตตามกฎหมายว่าด้วยสุรา
2.3 ไม่อนุญาตให้ทำสุราสามทับออกขายภายในประเทศ
2.4 ก่อนที่จะเปิดด่าเนินการทำและขายส่งสุราต้องทำสัญญาว่าด้วยการอนุญาตให้ทำและขายส่งสุรากับกรมสรรพสามิต ตามแบบที่กรมสรรพสามิตกำหนด
2.5 จะทำสุราชนิดใด้ชื่อใด้ต้องยื่นเรื่องของอนุญาตพร้อมกรรมวิธีการทำสุราและวัตถุดิบที่ใช้ ในการทำสุราให้
กรมสรรพสามิตพิจารณาอนุญาตก่อน ถ้าจะเปลี่ยนแปลงวิธีการทำสุรา หรือชนิดวัตถุดิบจากที่ได้อนุญาต ต้องได้รับความยินยอมจากกรมสรรพสามิตก่อน
2.6 จะต้องส่งตัวอย่างน้ำสุราที่ทำได้ ตาม 2.5 ให้กรมสรรพสามิตทำการวิเคราะห์ก่อน เมื่อได้รับอนุญาตแล้วจึงจะนำออกจากโรงงานสุราได้และถ้ามีการเปลี่ยนแปลงกรรมวิธีการทำสุรา หรือเปลี่ยนแปลงชนิดวัตถุดิบให้ผิดไปจากเดิม ต้องส่งตัวอย่างให้ทำการวิเคราะห์อีก
2.7 สุราที่ทำขึ้นต้องมีคุณสมบัติตามมาตรฐานผลิตภัณฑ์อุตสาหกรรมสุรา และตรงตามตัวอย่างที่กรมสรรพสามิตเก็บรักษาไว้
2.8 ต้องส่งตัวอย่างฉลากเครื่องหมายภาชนะและขนาดความจุของภาชนะที่จะใช้ให้กรมสรรพสามิตพิจารณาและให้ความเห็นชอบเสียก่อนโดยฉลากต้องมีข้อความที่ชัดเจนระบุชนิดสุรา ชื่อสุรา ชื่อโรงงานสุรา สถานที่้ตั้งของโรงงานสุรา ขนาดบรรจุ แรงแอลกอฮอล์ของสุรา วันเดือนปีที่บรรจุและคำเตือนตามประกาศ กระทรวงสาธารณสุขด้วยตัวอักษรภาษาไทย หรือภาษาอังกฤษหรือภาษาอื่นที่กรมสรรพสามิตเห็นชอบ และไม่
เลียนแบบฉลากหรือเครื่องหมายของโรงงานสุราแห่งอื่น ถ้าการใช้ฉลากหรือ เครื่องหมายต่างๆเกิดความเสียหายแก่บุคคลอื่น ผู้รับอนุญาตยินยอมชดใช้คำเสียหายรวมทั้งคำใช้จ่ายในการนี้
2.9 จะมีสุราอย่างอื่นนอกจากสุราที่ได้รับอนุญาตให้ทำไว้ในโรงงานสุราได้ต่อเมื่อได้รับอนุญาตจากกรมสรรพสามิตแล้วเทำนั้น
2.10 สุราที่ทำขึ้นจัดอยู่ในชนิดหรือประเภทใด้ให้เป็นไปตามคำสั่งของกรมสรรพสามิต และให้ถือว่าคำสั่งของกรมสรรพสามิตดังกล่าวนั้นเป็นอันเด็ดขาด
2.11 ยินยอมให้กรมสรรพสามิตทำการตรวจสอบคุณภาพสุราที่ทำขึ้นก่อนนำออกจากโรงงานสุรา ถ้าปรากฏว่า
สุรานั้นไม่มีคุณภาพตามที่กรมสรรพสามิตได้อนุญาตไว้ กรมสรรพสามิตมีสิทธิสั่งห้ามไม่ให้นำออกจากโรงงานสุราได้ โดยจะเรียกร้องค่าเสียหายหรือคำทดแทนจากกรมสรรพสามิตไม่ได้ทั้งสิ้น นอกจากนี้แล้วต้องยินยอมให้กรมสรรพสามิตเก็บตัวอย่างสุราที่ได้ตรวจสอบนั้น ตามจ่านวนที่เห็นสมควรโดยไม่คิดมูลค่าแต่อย่างใด
2.12 ต้องแจ้งราคาขาย ณ โรงงานสุรา ราคาขายส่งและขายปลีก ให้กรมสรรพสามิตทราบด้วย
2.13 ต้องทำบัญชีแสดงผลการทำสุราและการซื้อวัตถุดิบมาเพื่อใช้ทำสุราตามแบบที่กรมสรรพสามิตกำหนด
ยื่นบัญชีแสดงการทำสุราและการรับซื้อวัตถุดิบทุกเดือนต่อกรมสรรพสามิต หรือที่ส่านักงานสรรพสามิตจังหวัด
ที่ตั้งโรงงานสุรา ภายในวันที่้ 10 ของเดือนถัดไป ต้องปฏิบัติตามระเบียบและข้อบังคับที่ใช้ในปัจจุบันและใน
อนาคต ทั้งนี้ต้องยินยอมให้เจ้าพนักงานสรรพสามิตไปประจำควบคุมโดยเสียคำใช้จ่ายในการควบคุมตามระเบียบข้อบังคับดังกล่าว และจะต้องจัดสถานที่ไว้สำหรับเจ้าพนักงานสรรพสามิต ใช้ปฏิบัติราชการในการควบคุมโรงงานให้เป็นสัดส่วน โดยเฉพาะภายในบริเวณโรงงานสุรา อีกทั้งจะต้องจัดบ้านพักให้แก่เจ้าพนักงานสรรพสามิตผู้ควบคุมโรงงานสุราให้อยู่อาศัยได้ทั้งครอบครัวภายในบริเวณโรงงาน
สุรา และต้องอำนวยความสะดวกให้แก่เจ้าพนักงานสรรพสามิตตามสมควร กรณีรัฐมนตรีว่าการกระทรวงการคลังเห็นสมควรจะเรียกเก็บเงินคำใช้จ่ายในการ ควบคุมโรงงานสุราเพิ่มขึ้น ผู้รับอนุญาตต้องยินยอมชำระเงินดังกล่าว
2.14 ก่อนนำสุราออกจากโรงงานต้องช่าระเงินคำภาษีตามอัตราที่กำหนดไว้ในกฎหมายและรับแสตมป์สุราไปปิดภาชนะบรรจุสุรา ตามระเบียบว่าด้วยการควบคุมโรงงานสุราของกรมสรรพสามิต ถ้าประสงค์จะเสียภาษีสุราโดยวิธีอื่นนอกจากการปิดแสตมป์ตามวิธีที่กำหนดในกฎกระทรวง ต้องได้รับอนุญาตจากอธิบดีก่อน เมื่อได้รับอนุญาตแล้วจึงจะด่าเนินการต่อไปได้และมีหน้าที่ต้องปฏิบัติตามกฎกระทรวง ระเบียบข้อบังคับของทางราชการที่เกี่ยวข้อง ถ้ามีกฎหมายหรือระเบียบอื่นใดกำหนดให้ผู้รับอนุญาตต้องช่าระเงินคำภาษีหรือเงินอื่นใด
ต่อกรมสรรพสามิตหรือเจ้าพนักงานสรรพสามิต ผู้รับอนุญาตต้องยินยอมช่าระเงินคำภาษีหรือเงินอื่นใด้ตาม อัตราที่กำหนดไว้ทุกครั้งที่มีการช่าระเงินคำภาษีสุราหรือก่อนนำสุราออกจากโรงงานสุรา
2.15 ปฏิบัติตามกฎหมายว่าด้วยระเบียบ ข้อบังคับ ข้อกำหนดหรือคำสั่งกรมสรรพสามิตและตามกฎหมายว่าด้วยโรงงาน และตามประกาศกระทรวงอุตสาหกรรมเรื่องหลักเกณฑ์และเงื่อนไขการพิจารณาอนุญาตโรงงานสุรา ลงวันที่้ 3 เมษายน 2543 ใช้อยู่ใน ปัจจุบันหรือที่จะพึงนำออกใช้ในอนาคต กับทั้งยอมรับปฏิบัติตามคำสั่งของเจ้าพนักงานสรรพสามิตให้เป็นการเรียบร้อยด้วย ถ้าผู้รับอนุญาตไม่ปฏิบัติตามเงื่อนไขข้อนี้ ข้อหนึ่งข้อใด หรือมิได้ปฏิบัติให้เป็นไปตามกฎหมายระเบียบข้อบังคับ ข้อกำหนด หรือคำสั่งต่างๆ ของทางราชการ นอกจากจะต้องรับผิดตามกฎหมายแล้ว ต้องยินยอมให้ปรับตามที่กรมฯ เห็นสมควร้แต่ไม่เกินครั้งละ 100,000 บาท ถ้าไม่ปฏิบัติ กรมสรรพสามิตมีอำนาจพักใช้หรือเพิกถอนใบอนุญาตทำและขายสุรา เสียก็ได้ ในกรณีที่มีการกระทำผิดเงื่อนไข กฎหมายระเบียบข้อบังคับ ข้อกำหนดหรือคำสั่งของทางราชการ อันเกี่ยวกับการทำหรือการขายสุรา ยินยอมให้กรมสรรพสามิตปรับตามอัตราที่กำหนดตามกฎหมายว่าด้วยสุรา หรือสั่งพักใช้หรือเพิกถอนใบอนุญาตทำสุราหรือใบอนุญาตขายสุราของผู รับอนุญาตก็ได้ ทั้งนี้ผู้รับอนุญาตจะเรียกร่องค่าทดแทนความเสียหายจากผู้อนุญาตแต่อย่างใดไม่ได้
พื้นที่ปศุสัตว์เขต 1
สำนักงานปศุสัตว์เขต 1
สำนักงานปศุสัตว์จังหวัดนนทบุรี
พื้นที่ปศุสัตว์เขต 2
สำนักงานปศุสัตว์เขต 2
สำนักงานปศุสัตว์จังหวัดจันทบุรี
สำนักงานปศุสัตว์จังหวัดฉะเชิงเทรา
สำนักงานปศุสัตว์จังหวัดชลบุรี
พื้นที่ปศุสัตว์เขต 3
สำนักงานปศุสัตว์เขต 3
สำนักงานปศุสัตว์จังหวัดชัยภูมิ
สำนักงานปศุสัตว์จังหวัดบุรีรัมย์
พื้นที่ปศุสัตว์เขต 4
สำนักงานปศุสัตว์เขต 4
สำนักงานปศุสัตว์จังหวัดกาฬสินธุ์
สำนักงานปศุสัตว์จังหวัดขอนแก่น
สำนักงานปศุสัตว์จังหวัดนครพนม
พื้นที่ปศุสัตว์เขต 5
สำนักงานปศุสัตว์เขต 5
สำนักงานปศุสัตว์จังหวัดเชียงราย
สำนักงานปศุสัตว์จังหวัดเชียงใหม่
สำนักงานปศุสัตว์จังหวัดน่าน
พื้นที่ปศุสัตว์เขต 6
สำนักงานปศุสัตว์เขต 6
สำนักงานปศุสัตว์จังหวัดกำแพงเพชร
สำนักงานปศุสัตว์จังหวัดตาก
สำนักงานปศุสัตว์จังหวัดนครสวรรค์
พื้นที่ปศุสัตว์เขต 7
สำนักงานปศุสัตว์เขต 7
สำนักงานปศุสัตว์จังหวัดกาญจนบุรี
สำนักงานปศุสัตว์จังหวัดนครปฐม
สำนักงานปศุสัตว์จังหวัดประจวบคีรีขันธ์
พื้นที่ปศุสัตว์เขต 8
สำนักงานปศุสัตว์เขต 8
สำนักงานปศุสัตว์จังหวัดกระบี่
สำนักงานปศุสัตว์จังหวัดชุมพร
สำนักงานปศุสัตว์จังหวัดตรัง
พื้นที่ปศุสัตว์เขต 9
สำนักงานปศุสัตว์เขต 9
สำนักงานปศุสัตว์จังหวัดนราธิวาส
สำนักงานปศุสัตว์จังหวัดปัตตานี
สำนักงานปศุสัตว์จังหวัดยะลา
สำนักงานปศุสัตว์จังหวัดสงขลา
สำนักงานปศุสัตว์จังหวัดสตูล
พิธีเปิดศูนย์ 1 มิถุนายน 2566
วันที่ 1 มิถุนายน 2566 นพ.สวัสดิ์ อภิวันีวงศ์ ผู้ตรวจราชการ กระทรวงสาธารณสุข เขตสุขภาพที่ 12 เป็นประธานในพิธีเปิด "สถานีสุขภาพ โรงพยาบาลหาดใหญ่" นพ.ชยสิทธิ์ เทพชาตรี ผู้อำนวยการโรงพยาบาลหาดใหญ่ กล่าว รายงาน นพ.สงกรานต์ ไหมชุม นายแพทย์สาธารณสุขจังหวัดสงขลา นพ.ระพันธ์ ลีธนะกุล ผู้อำนวยการ สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 12 สงขลา สิบตำรวจโท ไพโรจน์ ตาแก้ว ปลัดอำเภอหาดใหญ่ คุณธรรมรัตน์ ศรีนุ่น หัวหน้าสำนักงานประกันสังคมจังหวัดสงขลา สาขาหาดใหญ่ นายสัมฤทธิ์ บุญรัตน์ รองนายกเทศมนตรีเทศบาลนครหาดใหญ่ กรรมการผู้จัดการบริษัทโชติวัฒน์อุตสาหกรรมจำกัด ผู้บริหาร บริษัทเซ็นทรัลพัฒนาและแขกผู้มีเกียรติ ร่วมการเปิดสถานีสุขภาพ โรงพยาบาลหาดใหญ่
หมอคนที่ 1 หรือ อสม.
หมอคนที่ 1 หรือ อสม. ทำงานร่วมกับกำนัน ผู้ใหญ่บ้าน ค้นหากลุ่มที่มีปัญหาทางจิตและยาเสพติด รายงานต่อหมอคนที่ 2 คือหมอสาธารณสุข
โรงพยาบาลทันตกรรม ณ รพ.สต.นาข่า
หน่วยฉีดวัคซีนโรคพิษสุนัขบ้า เดือนมีนาคม 2566
จุดบริการวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมว ฟรี ไม่มีค่าใช้จ่าย โดยสามารถมาเข้ารับบริการได้ตั้งแต่เวลา 16.00 - 19.00 น. กรุณาเตรียมบัตรประชาชน และเตรียมสุนัขและแมวของท่านให้พร้อม ผู้ที่สนใจสามารถพาสุนัขและแมวเข้ารับบริการตามจุดที่ท่านสะดวกได้เลย ตามตารางออกหน่วยนี้
พยาบาลศาสตรบัณทิต 4 ท่านที่ได้รับเกียรติบัตรรางวัล WISH AWARD
โอกาสนี้ นักศึกษาหลักสูตรพยาบาลศาสตรบัณทิต 4 ท่านที่ได้รับเกียรติบัตรรางวัล WISH AWARD ได้แก่ นายธนทัต สิงห์คำ นางสาวอรอร เดือนเพ็ญ นายทนงศักดิ์ พันจำปา และนางสาวศุภานน แซ่จ่าว ได้กล่าวถึงความรู้สึกตลอด 4 ปี
ธนทัต: อันดับแรกก็คือ ได้เพื่อนที่น่ารักและได้มิตรภาพจากทั้งทางอาจารย์และเพื่อนๆ รุ่นเดียวกัน เพราะที่นี่ไม่ได้โฟกัสแค่เรื่องความรู้ อาจารย์ก็เป็นที่ปรึกษาให้เราตลอด รวมถึงโอกาสความก้าวหน้าในหน้าที่การงานสามารถนำไปต่อยอดในด้านต่างๆ ได้ในอนาคต
อรอร: ได้รับทั้งความรู้ ความผูกพันและความรักจากการเรียนที่วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี โดยที่นี่สั่งสมให้นักศึกษาเป็นคนดีแล้วก็รักที่จะให้บริการกับผู้ป่วยหลังจากที่เราสำเร็จการศึกษาไป
ทนงศักดิ์: ฝึกฝนให้เราได้กล้าแสดงออกมากขึ้น มีการพัฒนาตัวเองอยู่สม่ำเสมอ นอกจากนี้ยังเน้นในเรื่องของการวิจัยและพัฒนานวัตกรรม โดยนักศึกษาได้ฝึกคิดวิเคราะห์ เพื่อที่จะนำนวัตกรรมใหม่ๆ มาต่อยอดพัฒนาวิชาชีพการพยาบาลต่อไป
ศุภานน: ได้ความรู้และการใช้ชีวิต รวมถึงการสร้างตัวตนของเราให้มีความมั่นใจให้ในตนเองและการพัฒนาตนเองในการสร้างอาชีพ
กิจกรรมทำหมันของเขตบางแค ก่อนหน้านี้ LINK
สำนักงานเขตบางแค เชิญชวนประชาชนคนรักน้องหมาน้องแมว ลงทะเบียนฉีดวัคซีนป้องกันพิษสุนัขบ้าและทำหมันสุนัขและแมว ฟรี ในวันที่ 9 มิ.ย. 2566 ณ บริเวณศาลาวัดม่วง ซ.เพชรเกษม 63 ตั้งแต่เวลา 09.00 น. เป็นต้นไป รับจำนวนจำกัด ดังนี้ รับทำหมัน จำนวน 30 ตัว ฉีดวัคซีน จำนวน 200 ตัว
ททท. เปิดตัวโครงการ “Amazing Happy Paws Thailand” ณ งานแถลงข่าว Pet Expo Thailand 2023 LINK
ส่งเสริมการท่องเที่ยวเพื่อคนรักสัตว์เลี้ยง จับมือพาร์ทเนอร์เว็บไซต์ เพ็ทเฟรนด์ลี่ ไทยแลนด์ ปั้นศูนย์กลางข้อมูลโปรโมทการท่องเที่ยวไทยเอาใจสายเที่ยวที่เดินทางพร้อมสัตว์เลี้ยงแบบสี่ขาพาตะลุย
วันพุธที่ 19 เม.ย. 2566 ณ งานแถลงข่าว Pet Expo Thailand 2023 ชั้น LG บริเวณ Atrium Stairs
ศูนย์การประชุมแห่งชาติสิริกิติ์ “นายขจรฤทธิ์ ขวัญมงคล” ผู้อำนวยการกลุ่มงานด้านสินค้าและธุรกิจท่องเที่ยว การท่องเที่ยวแห่งประเทศไทย (ททท.) ในฐานะตัวแทนผู้สนับสนุนการจัดงานนี้ ได้เปิดตัวโครงการ Amazing Happy Paws Thailand : สี่ขาพาตะลุย ตอบรับเมกะเทรนด์ Pet-Humanization ที่คนในปัจจุบันให้ความรักความเอ็นดูสัตว์เลี้ยงประหนึ่งเป็นลูกเป็นหลานหรือคนในครอบครัว และเต็มใจที่จะใช้จ่ายกับสัตว์เลี้ยง
อย่างการพาออกเดินทางท่องเที่ยวร่วมกัน โดย ททท. พบว่านักท่องเที่ยวที่เดินทางพร้อมสัตว์เลี้ยงมีอัตรา
การใช้จ่ายเพิ่มขึ้นต่อทริปประมาณ 20% และส่วนใหญ่เป็นกลุ่มที่มีกำลังใช้จ่ายสูง มีความพร้อมที่จะจ่ายเงินเพิ่มเพื่อให้สัตว์เลี้ยงได้เดินทางไปท่องเที่ยวด้วย นับเป็นกลุ่มตลาดใหม่ที่มีศักยภาพ และมีแนวโน้มการเติบโตที่ดี
ททท. เล็งเห็นโอกาสจึงจัดทำโครงการนี้ขึ้นเพื่อส่งเสริมการท่องเที่ยวให้กับกลุ่มคนรักสัตว์ ให้เป็นอีกหนึ่งทางเลือกสำหรับการท่องเที่ยวที่หลากหลายในประเทศไทย ได้มีโอกาสสร้างประสบการณ์ท่องเที่ยวที่ประทับใจกับสัตว์เลี้ยงแสนรักได้อย่างสะดวกสบาย โดยมีการจัดทำการสื่อสารบนแพลตฟอร์มดิจิทัลผ่านทางเว็บไซต์
https://petfriendly.tourismthailand.org/ และเปิดตัวตราสัญลักษณ์ Amazing Happy Paws Thailand
สร้าง Branding ให้ผู้ประกอบการใช้สื่อสารให้นักท่องเที่ยวได้ทราบถึงการมีความพร้อม และยินดีต้อนรับนักท่องเที่ยวที่เดินทางพร้อมสัตว์เลี้ยง ซึ่งทางโครงการก็ขอประชาสัมพันธ์เชิญชวนให้ผู้ประกอบการโรงแรม ร้านอาหาร สถานที่ท่องเที่ยว สามารถมาสมัครลงทะเบียนเข้าร่วมโครงการกับเราได้ที่ช่องทาง https://petfriendly.tourismthailand.org/ เพื่อขอรับตราสัญลักษณ์ภายใต้แนวทางปฏิบัติ และข้อกำหนดเบื้องต้นที่ ททท. ร่วมกับพันธมิตรสร้างสรรค์ขึ้นเพื่อเป็นข้อแนะนำสำหรับผู้ประกอบการ รวมถึงยังได้จัดทำเส้นทางท่องเที่ยวที่มีความเป็นมิตรต่อสัตว์เลี้ยง พร้อมให้คำแนะนำสำหรับเจ้าของที่เดินทางพร้อมสัตว์เลี้ยงด้วย
นอกจากนี้ ททท. ยังร่วมมือกับพาร์ทเนอร์หลักเว็บไซต์ www.petfriendlythailand.com/ เพื่อปั้นศูนย์กลางข้อมูลโปรโมทการท่องเที่ยวทั่วไทยสำหรับนักท่องเที่ยวที่ต้องการเดินทางพร้อมสัตว์เลี้ยงโดยเฉพาะ
โดย นางสาวอังศุมาลิน เทพหัสดิน ผู้บริหารเว็บไซต์ Pet Friendly Thailand (PFT) กล่าวว่า “เพ็ทเฟรนด์ลี่ ไทยแลนด์” เป็นเว็บไซต์ที่รวบรวมข้อมูลเกี่ยวกับโรงแรม และคาเฟ่ที่สามารถนำสัตว์เลี้ยงเข้าได้ที่ใหญ่ที่สุดในประเทศไทย ด้วยความตั้งใจจะเป็นสื่อกลางระหว่างเจ้าของสัตว์เลี้ยงและผู้ประกอบการท่องเที่ยวและไลฟ์สไตล์ อำนวยความสะดวกให้การวางแผนท่องเที่ยวกับสัตว์เลี้ยงแสนรักเป็นเรื่องง่ายเพียงแค่ คลิก-ค้น-จอง การได้ร่วมมือกับ ททท. ในโครงการ Amazing Happy Paws Thailand จึงเป็นการตอกย้ำความตั้งใจของการพัฒนาเว็บไซต์ ที่มุ่งเน้นการสร้างโอกาสทางการท่องเที่ยวสำหรับกลุ่มนักเดินทางพร้อมสัตว์เลี้ยงอย่างแท้จริง
สำหรับบรรยากาศในงานนี้ก็เต็มไปด้วยความคิวท์ ทุกสิ่งน่ารักมากขึ้นเมื่อเป็นสีพาสเทล โดยภายในงานมี การสาดความน่ารักของทั้งต้าวน้องหมา น้องแมว รวมถึงน้อง ๆ สัตว์เลี้ยงพิเศษ Exotic Pet ที่เหล่า Pet’s Influencer ตัวแทนนักท่องเที่ยวที่ออกเดินทางพร้อมน้อง ๆ สัตว์เลี้ยงได้พร้อมใจกันมาร่วมงานนี้ด้วย อาทิ เจ้าของ FB แฟนเพจ “สตีฟจิ๊บ Steve Jibs – เด้นติสต์ชีวิตติดเที่ยว”, “คุณมณี นินิว” และ “มะลิ รีวิวววววว ปู๊นปู๊นนนนนน” ที่นอกจากมาร่วมงานเปิดตัวโครงการแล้ว ทุกท่านยังได้ร่วมแชร์ประสบการณ์การวางแผนออกเดินทางท่องเที่ยวพร้อมสัตว์เลี้ยง รวมถึงแสดงความคิดเห็นที่เป็นประโยชน์ในการร่วมพัฒนา และความรู้สึกที่มีต่อโครงการดี ๆ ที่ ททท. ตั้งใจจัดขึ้น เพื่อส่งเสริม Pet-Friendly Community ดี ๆ ให้เกิดขึ้นในอุตสาหกรรมการท่องเที่ยวไทย
ททท.จันทบุรี แจกคูปองส่วนลด มูลค่า 100 บาท LINK
ททท. สำนักงานจันทบุรี แจกคูปองส่วนลด มูลค่า 100 บาท รับได้ที่หน้าสวน 12 แห่งที่ร่วมกิจกรรม สำหรับใช้เป็นส่วนลดค่าผลไม้ / ของฝาก (มีจำนวนจำกัด 1,000 สิทธิ์ คนแรก เท่านั้น )
เงื่อนไขรายละเอียด ดังนี้
1.คูปองมีมูลค่า 100 บาท สามารถใช้เป็นส่วนลดในการเข้าสวนรับประทานผลไม้ / ซื้อผลไม้ / ของฝาก สำหรับสวนที่เข้าร่วมโครงการกับ ททท.สำนักงานจันทบุรี
2.คูปองนี้ สามารถใช้เป็นส่วนลดได้ 1 ครั้ง ต่อ 1 ใบเสร็จ และไม่สามารถแลกเปลี่ยนเป็นเงินสดได้
3.คูปองนี้สามารถใช้ได้ตั้งแต่ 1 พ.ค.-31 ก.ค.66 หรือจนกว่าสิ้นสุดฤดูกาลผลไม้
4.เนื่องจากผลไม้เป็นผลผลิตตามฤดูกาล นักท่องเที่ยวจะต้องโทรสอบถาม หรือนัดหมายล่วงหน้ากับสวนผลไม้ อย่างน้อย 3-7 วัน ก่อนเข้าชมสวน
*เงื่อนไขอื่นๆ เป็นไปตามแต่ละสวนผลไม้กำหนด
12 สวนผลไม้ที่เข้าร่วมรับคูปอง ดังนี้
อำเภอมะขาม
1. สวนเคพี การ์เด้น จันทบุรี
โทร. 086-5662419 / 092-8914624 ติดต่อคุณอภิรดี ศิริวิจิตรกุล
เปิด 29 เมษายน-กลางเดือนกรกฎาคม 2566 (เปิดเสาร์อาทิตย์และวันหยุดนักขัตฤกษ์ กรณีเป็นกรุ๊ป 20 คนขึ้นไปสามารถเข้าใช้บริการวันธรรมดาได้ กรุณาจองล่วงหน้า 1 อาทิตย์)
อำเภอเมือง
2.ชบา รีสอร์ท จันทบุรี
โทร. 039471878 , 0877495667 ติดต่อ คุณศิณีพร สวัสดิชัย
อำเภอท่าใหม่
3. บ้านสวนอิสรีย์ เกษตรอินทรีย์ และ ฟาร์มม้าเมืองจันท์
โทร.089-9909141 ติดต่อคุณแววศิริ ฤทธิโยธี
เปิด 1 พ.ค. - 30 มิ.ย.2566 (จองล่วงหน้า 5 วัน)
4. สวนอรุณบูรพา
โทร.086-8249589 ติดต่อคุณณัฏยา ใจงาม (คาเฟ่ในสวนเปิดทุกวัน , ผลไม้สอบถามทางโทรศัพท์)
5. สวนรินรดี
โทร.062-3699545 ติดต่อคุณอนัญญา มณีกร
เปิด 1 พ.ค. - 10 ก.ค.2566
6.สวนป้าแกลบ & โอทอป
081-9364585, 086-3663097 , 061-9365446 ติดต่อ คุณนางวรรณี บุญสวัสดิ์
ผลไม้แปรรูปเปิดตลอดปี ผลไม้สดมีจำหน่ายหน้าสวนเดือน พค.2566 ถึงหมดฤดูกาล
7. สวนชุมชนรักษ์เขาบายศรี
โทร.086-8349604, 098-2833102 ติดต่อคุณนงลักษณ์ มณีรัตน์
8.บ้านสวนรัชนาฏ
โทร.065-1989354 (คาเฟ่ เปิดตลอดทั้งปี , สวนผลไม้เปิดสงกรานต์ถึงผลไม้หมด)
9.สวนตาบุญช่วย
รับเฉพาะจองเท่านั้น
โทร.065-9969655
อำเภอขลุง
10.สวนภูทิพย์ธารา
โทร.0942399445 , 065-3289229 ติดต่อคุณ พรทิพย์ ศิริเจริญธรรม
เปิด 1 พ.ค.2566 ถึงหมดฤดูกาล (จองล่วงหน้า3 วันเปิดรับชุดละ30 ท่าน)
อำเภอแหลมสิงห์
11.สวนสาวสุดใจ
โทร.081-377-3190 ติดต่อคุณ อรอุษา สุดประเสริฐ
เปิด 13 เม.ย.2566
12. สวนเจริญชัย
โทร.081-3773558
เปิด 13 เม.ย66
รายชื่อคลองในกรุงเทพ 1,161 คลอง
รายชื่อคลองในกรุงเทพ 1,161 คลอง
1 คลองกรวย
2 คลองกระเฉด
3 คลองกระดาษ
4 คลองกระท้อนแถว
5 คลองกระทุ้มแจ้
6 คลองกระทุ่มโพธิ์
7 คลองกระทุ่มล้ม
8 คลองกล้วย
9 คลองกลันตัน
10 คลองกอเลา
11 คลองกะจะ
12 คลองกาหลง
13 คลองกำนันเทียน
14 คลองกำนันประทีป
15 คลองกำนันเสงี่ยม
16 คลองกำพร้า
17 คลองกีบหมู (คลองสามวา)
18 คลองกีบหมู (มีนบุรี)
19 คลองกุฐิจีน
20 คลองกุ่ม
21 คลองกุ่มแดง
22 คลองเกรียง (บางกะปิ)
23 คลองเกรียง (ลาดพร้าว)
24 คลองเก้าห้อง
25 คลองเกาะตาเทิ่ง (เกาะเลา)
26 คลองแกลบ
27 คลองโกบ๊อ 1
28 คลองโกบ๊อ 2
29 คลองโกบ๊อ 3
30 คลองโกบ๊อ 4
31 คลองโกร่งประทุน
32 คลองขนมจีน
33 คลองขรัวตาแก่น
34 คลองขวาง
35 คลองขวาง (ลัดตากลั่น)
36 คลองขวาง 3
37 คลองขวาง (จอมทอง)
38 คลองขวาง (ทุ่งครุ)
39 คลองขวาง (บางกอกน้อย)
40 คลองขวาง (ประเวศ)
41 คลองขวางตะวันตก
42 คลองขวางตะวันออก
43 คลองขวางทุ่งมหาเมฆ (ยานนาวา)
44 คลองขวางทุ่งมหาเมฆ(สาทร)
45 คลองขวางบน
46 คลองขวางบน(พระโขนง)
47 คลองขวางบางประแก้ว
48 คลองขวางบางประทุน
49 คลองขวางบ้านใหม่
50 คลองขวางล่าง
51 คลองขวางวัดรางบัว
52 คลองขวางสะพานเตี้ย
53 คลองขวางหมู่ 2
54 คลองขันแตก
55 คลองข้าง สน.หัวหมาก
56 คลองข้างซอยวิเชียร
57 คลองข้างธนาคารนครหลวงไทย
58 คลองข้างไปรษณีย์
59 คลองข้างมัสยิดดารุ้ลวิลอิหซาน
60 คลองข้างโรงน้ำแข็ง
61 คลองข้างโรงเรียนบางจาก
62 คลองข้างโรงเรียนบางไผ่
63 คลองข้างโรงเรียนปทุมวิทยา
64 คลองข้างโรงเรียนเปี่ยมสุวรรณ
65 คลองข้างวัดกก
66 คลองข้างวัดบางปะกอก
67 คลองข้างวัดบุคคโล
68 คลองข้างวัดอนงค์
69 คลองข้างวัดอนงคาราม (คลองตลาดสมเด็จ)
70 คลองข้างหมู่บ้านภักดี
71 คลองข้างอู่รถเมล์บางจาก
72 คลองขี้เสือใหญ่ (บึงกุ่ม)
73 คลองขี้เสือใหญ่(ลาดพร้าว)
74 คลองขี้หมูไหล
75 คลองขุด
76 คลองขุดวัดภาษี
77 คลองขุดใหม่
78 คลองขุดใหม่ (ลัดครูถวิล)
79 คลองขุนคลัง
80 คลองขุนจ่าเมือง
81 คลองขุนทรัพย์ 1
82 คลองขุนราชพินิจใจ
83 คลองขุนศรีบุรีรักษ์
84 คลองขุนสกล
85 คลองขุนสากล (ช่วงปลาย)
86 คลองขุมทรัพย์ 2
87 คลองเขมร
88 คลองแขก
89 คลองแขก
90 คลองคราม
91 คลองครุ
92 คลองครูปรีชา
93 คลองครูสม
94 คลองครูเสงี่ยม
95 คลองควาย
96 คลองควาย
97 คลองควาย(บางแค)
98 คลองควาย(สวนหลวง)
99 คลองคาง
100 คลองค้างคาว
101 คลองคำหริ่ม
102 คลองคู้ (คลองตาสาด)
103 คลองคูเมืองเดิม (คลองหลอด)
104 คลองคู้หมัน
105 คลองเคล็ด
106 คลองโคกกุลี
107 คลองโคกคราม
108 คลองโคกบ่าวสาว
109 คลองเงิน (เม่งเส็ง)
110 คลองจรเข้ขบ
111 คลองจรเข้โพรง
112 คลองจระเข้บัว
113 คลองจวน
114 คลองจักร
115 คลองจักรทอง (วัดทอง)
116 คลองจั่น
117 คลองจ้าหล่า 1
118 คลองจ้าหล่า 2
119 คลองจ้าหล่าใหญ่
120 คลองจิก
121 คลองจิกกานดา
122 คลองจิต ( ระหว่างซอยราม ฯ 44-46 )
123 คลองจิตรมิตรมหาดไทย
124 คลองจีน
125 คลองจุลนาค
126 คลองเจ็ก
127 คลองเจ็ก
128 คลองเจ็ก (คลองสามวา)
129 คลองเจ็ก(บางขุนเทียน)
130 คลองเจ็ก(มีนบุรี)
131 คลองเจ็ก(ลาดกระบัง)
132 คลองเจ็ก(สะพานสูง)
133 คลองเจ๊กตาย
134 คลองเจ็ดขนัด
135 คลองเจ้าครุฑ
136 คลองเจ้าคุณ(จอมทอง)
137 คลองเจ้าคุณ(บางกอกน้อย)
138 คลองเจ้าคุณสิงห์
139 คลองเจียรดับ
140 คลองเจือศักดิ์
141 คลองแจงร้อน
142 คลองฉัตรโฉม
143 คลองเฉลิมชัยพัฒนา
144 คลองชวดด้วน
145 คลองชวดใหญ่ (ลำรางยมราช)
146 คลองช่องนนทรี
147 คลองชักพระ
148 คลองชัยรวมราษฎร์
149 คลองเชิงตาแพ
150 คลองเชื่อมคลองหลังวัดม่วงกับคลองผู้ใหญ่เส็ง
151 คลองแชเผือก
152 คลองซอย
153 คลองซอย 5 เจดีย์
154 คลองซอยกิตติกมล
155 คลองซอยจรัญสนิทวงศ์ 1
156 คลองซอยเจริญนคร 78
157 คลองซอยเชื่อมคลองลำแบนกับคลองหนองระแหง
158 คลองซอยตากสิน 18
159 คลองซอยตากสิน 5
160 คลองซอยทหารเรือ 1
161 คลองซอยทหารเรือ 2
162 คลองซอยที่ 10
163 คลองซอยที่ 11
164 คลองซอยที่ 8
165 คลองซอยที่ 9
166 คลองซอยเทพนิมิตร
167 คลองซอยประชากรไทย
168 คลองซอยพยุง
169 คลองซอยเภสัชไทย
170 คลองซอยร่วมใจ
171 คลองซอยโรงคราม
172 คลองซอยโรงเจ 1
173 คลองซอยโรงเจ 2
174 คลองซอยโรงเจ 3
175 คลองซอยโรงเจ 4
176 คลองซอยวรวิทย์
177 คลองซอยสะพานยาว
178 คลองซอยหลวงเชิดวุฒากาศ
179 คลองซุง(ปทุมวัน)
180 คลองแซ่ซิ้ม (หมอชุบ)
181 คลองญี่ปุ่น
182 คลองด้วน
183 คลองดอนอีกา
184 คลองด่าน
185 คลองดาวคะนอง
186 คลองต้นกร่าง
187 คลองต้นตะโก
188 คลองต้นตาล
189 คลองต้นตาล (เกษจำเริญ)
190 คลองต้นตาล (น้ำเค็ม)
191 คลองต้นตาล (น้ำจืด)
192 คลองต้นตาล (อาชีวธนบุรี)
193 คลองต้นไทร
194 คลองต้นไทร
195 คลองต้นไทร(บางกอกน้อย)
196 คลองต้นไทร(บางกอกใหญ่)
197 คลองต้นไทร(ราษฎร์บูรณะ)
198 คลองต้นนุ่น
199 คลองต้นมะฆะ
200 คลองต้นโศก
รากฟันเทียม คืออะไร??
รากฟันเทียม คืออะไร??
รากฟันเทียม คือ รากฟันที่สร้างขึ้นใช้ทดแทนรากฟันธรรมชาติ
เพื่อยึดฟันเทียมให้แน่นขึ้น
ใส่รากฟันเทียมแล้วดียังไง
1. ฟันเทียมแน่นกระชับ ไม่หลวมหลุด เคี้ยวอาหารดีขึ้น
2. ไม่มีปัญหาฟันเทียมหลวมหลุดขณะพูด
3. รู้สึกมั่นใจในการเข้าสังคม
4. มีคุณภาพชีวิตดีขึ้น
โครงการฟันเทียม รากฟันเทียม
เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 72 พรรษา28 กรกฎาคม 2567 "เพื่อให้คนไทยมีฟันเทียมและรากพันเทียมที่ใช้งานได้ดีกินข้าวได้อร่อย สุขภาพกายและใจที่แข็งแรงมีคุณภาพชีวิตที่ดี"
- ใส่ฟันเทียม สำหรับคนที่ไม่มีฟัน ทุกสิทธิการรักษา
- ฝังรากฟันเทียม สำหรับผู้ที่ใส่ฟันเทียมทั้งปากแล้วหลวม และทันตแพทย์ประเมินว่าจำเป็นต้องฝังรากเทียม
*** เฉพาะสิทธิหลักประกันสุขภาพแห่งชาติ(สิทธิบัตรทอง 30 บาท) เท่านั้น***
ขั้นตอนการเข้ารับบริการ
1 คนไทยทุกคนที่สูญเสียฟันทั้งแบบบางขี่หรือทั้งปาก ติดต่อใส่ฟันเทียมที่
สถานพยาบาลตามสิทธิการรักษาของท่าน
2. กรณีใส่ฟันเทียมทั้งปากและทันตแพทย์พบว่ามีการละลายตัวของกระดูกขากรรไกรมากจนไม่สามารถใส่ฟันเทียมตามวิธีปกติได้ หรือเมื่อใส่ฟันเทียมไปแล้ว ภายหลังต่อมา หลวม หลุดง่าย ไม่สามารถใช้งานได้อย่างมีประสิทธิภาพ
ทันตแพทย์จะทำการปรับแก้ จนกระทั่งไม่สามารถปรับแก้ได้แล้ว จึงจะพิจารณาให้ใส่รากฟันเทียมหรือส่งต่อท่านไปรับการฝังรากนเทียมที่โรงพยาบาลของรัฐที่เข้าร่วมโครงการ(ใช้สิทธิฝังรากฟันเทียมได้เฉพาะผู้ที่มีสิทธิหลักประกันสุขภาพแห่งชาติหรือสิทธิบัตรทองบัตร 30 บาท เท่านั้น)
หมายเหตุ : การฝังรากฟันเทียมท่านไม่สามารถติดต่อไปที่โรงพยาบาลที่เข้าร่วมโครงการได้โดยตรงเนื่องจากต้องให้ทันตแพทย์ที่สถานพยาบาลตามสิทธิการรักษาของท่านประเมินว่าท่านจำเป็นต้องรับการฝังรากฟันเทียมหรือไม่
คอกเขียวกลางเมืองกรุงเทพ 40 จุด
พื้นที่กลางเมือง ติดตั้งทั้งหมด 40 จุด มาตั้งทุกวันในเวลา 18.00 น. และเก็บก่อน เวลา 05.30 น. บริเวณถนนสุขุมวิท และถนนพระราม 1 ตั้งแต่เขตปทุมวัน วัฒนา คลองเตย พระโขนง และบางนา ประกอบด้วย
- สุขุมวิท 12, 18, 20, 30, 34, 36, 42, 42/1, 46, 50 ระหว่าง 54-56, 60/1, 62/1 ปากซอยเปี่ยมทรัพย์
- ป้ายรถเมล์สี่แยกบางนา (ทั้งฝั่งขาเข้า-ขาออก) ใต้สถานีรถไฟฟ้าบางนา
- สุขุมวิท 11, 33, 35, 55, 53/1, 57 หน้าเซเว่น (วัดธาตุทอง) หน้าตลาดพระโขนง
- สุขุมวิท 79 BTS อ่อนนุช
- สุขุมวิท 89
- สุขุมวิท 95 ขนส่งพื้นที่ 3
- สุขุมวิท 101/1 ใต้สะพานลอยสุขุมวิท 101/1 หน้าอาคารฟูจิ (ติดปั๊มบางจาก)
- ป้ายรถเมล์สถานีรถไฟฟ้าอุดมสุข ปากซอยอุดมสุข 2
- สุขุมวิท 103/1
- สุขุมวิท 107
- หน้าทีโอทีถนนเพลินจิต
- หน้าโรงแรมสยามแอทสยาม
- หน้าวัดชัยมงคล ถนนพระราม 1
เสวนาพิเศษ เรื่อง กระแสธุรกิจบริการสุขภาพเวลเนส (Wellness) กับทิศทางการสร้างมูลค่าเพิ่มเศรษฐกิจประเทศไทย 28 มิถุนายน 2566
เสวนาพิเศษ เรื่อง กระแสธุรกิจบริการสุขภาพเวลเนส (Wellness) กับทิศทางการสร้างมูลค่าเพิ่มเศรษฐกิจประเทศไทย วันที่ 28 มิถุนายน 2566 เวลา 13.00 - 15.00 น.
สถานที่ Symposium 4 ห้องประชุมฟีนิกซ์ 6 ฮอลล์ 11-12 อิมแพ็คเมืองทองธานี
-
ลงทะเบียนประชุมวิชาการประจำปี การแพทย์แผนไทย การแพทย์พื้นบ้าน และการแพทย์ทางเลือกแห่งชาติ ครั้งที่ 20: -
กำหนดการประชุมวิชาการ
วิทยากร
คุณพิมพ์พันธุ์ นรากุลมงคล นายกสมาคมผู้ประกอบการสปาไทย และผู้บริหารกันตวรรณสปา ประธานองค์กรหมอพื้นบ้านและภูมิปัญญาท้องถิ่นเครือข่ายวัฒนธรรม จ.กระบี่
ผศ.ดร.วันวิสาข์ ศรีสุเมธชัย ประจำภาควิชาอนามัยครอบครัว คณะสาธารณสุขศาสตร์ ม.มหิดล
คุณกุสุมา กิ่งเล็ก ประธานชมรมกระบี่ฮาลาล & มุสลิมเฟรนด์ลี่ ที่ปรึกษาสมาคมโรงแรม จ.กระบี่ กรรมการบริหาร อ่าวนางปริ้นซ์วิลล์ วิลล่า รีสอร์ท แอนด์ สปา
คุณสุนิศา โสบกระโทก ผู้บริหาร บ.เรเมดี้ ซีบีดี (ไทยแลนด์) สหคลินิก เรเมดี้ แคนน์ โคราช
ผู้ดำเนินรายการ
ภญ.ศิรินภา เซี่ยงหลิว กลุ่มงานคัดกรองศาสตร์และคุ้มครองผู้บริโภค กองการแพทย์ทางเลือก กรมแพทย์แผนไทยฯ
พท.ป.เบญจวรรณ หมายมั่น หัวหน้าฝ่ายสื่อสารข้อมูล ศูนย์หลักฐานเชิงประจักษ์ ด้านการแพทย์แผนไทยและสมุนไพร โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ชาย อายุ 53 ปี บริจาคอวัยวะ ไต 2 ข้าง ให้สภากาชาดไทย
14 มิถุนายน 2566 เวลา 09.30 น.
พว.พงศ์ลดา รักษาขันธ์ รองผู้อำนวยการฝ่ายการพยาบาล โรงพยาบาลสกลนคร และทีมรับบริจาคอวัยวะ ร่วมเป็นเกียรติในการมอบพวงหรีดและโล่ห์เชิดชูเกียรติ ให้ญาติ
นายสัมคัน คำชมภู อายุ 53 ปี ได้สร้างทานบารมีอันยิ่งใหญ่ โดยการบริจาคอวัยวะ ไต 2 ข้าง ให้สภากาชาดไทย
สถานที่ หน้าห้องผ่าตัดชั้น 4 ตึกหัวใจเพื่อแผ่นดิน
ในโอกาสนี้โรงพยาบาลสกลนคร ขออนุโมทนาบุญในครั้งนี้ ขอกุศลผลบุญนี้จงเป็นอานิสงส์ดลบันดาลให้ผู้บริจาคอวัยวะ ประสบความเกษมสุขในสัมปรายภพชั่วนิรันดร์
บรรยากาศในงานคึกคักและคับคั่งไปด้วยเหล่านักวิ่งและมือสมัครเล่นทุกเพศทุกวัยที่มาร่วมวิ่งออกกำลังกายเพื่อสุขภาพ พร้อมส่งต่อความสุขและสุขภาวะที่ดีด้วยการสนับสนุนการทำงานของบุคลากรในมูลนิธิแพทย์อาสาสมเด็จพระศรีนครินทราบรมราชชนนี (พอ.สว.) ฟูจิฟิล์ม มุ่งช่วยลดช่องว่างในการเข้าถึงการรักษาของผู้คนในพื้นที่ห่างไกล พร้อมเดินหน้าส่งเสริมสุขภาพและยกระดับความเป็นอยู่ของคนในสังคมไทย
นายประสิทธิ์ บุญดวงประเสริฐ ประธานคณะผู้บริหารซีพีเอฟ เปิดเผยว่าการยกระดับมาตรฐานความปลอดภัย สู่มาตรฐานอวกาศครั้งนี้ เกิดจากความเชื่อมั่นว่าเนื้อไก่ของซีพีเป็นหนึ่งในแบรนด์เนื้อสัตว์ที่มีมาตรฐานความปลอดภัยสูงสุดแล้วในโลก จึงตั้งเป้าใหญ่ที่จะพิชิตมาตรฐาน Space Food Safety Standard ให้เป็นอีกหนึ่งความภูมิใจของคนไทยในโครงการ Thai food - Mission to Space
“ซีพีเอฟ ตระหนักและให้ความสำคัญของความปลอดภัยและคุณภาพของอาหารอย่างที่สุด เมื่อได้พันธมิตรที่เชี่ยวชาญ อย่าง NANORACKS LLC และ MU Space มาร่วมดำเนินโครงการ Thai food - Mission to Space ที่จะปฏิบัติภารกิจร่วมกับ “ศูนย์วิจัยด้านอาหารอวกาศของสหรัฐ” จึงยิ่งมั่นใจว่าถึงเวลาแล้วที่เราจะพิสูจน์ว่าไก่ของประเทศไทยมีมาตรฐานความปลอดภัยสูงถึงระดับอวกาศ ซึ่งจะต้องผ่านมาตรฐานความปลอดภัยและคุณภาพด้านอาหาร รวมถึงการตรวจสารตกค้างและเชี้อโรคปนเปื้อนต่างๆตามข้อกำหนดของ NASA มากมายหลายสิบการตรวจสอบ จึงจะได้รับการอนุมัติให้นำไก่ของเราขึ้นไปบนสถานีอวกาศได้ สิ่งนี้จะเป็นความภาคภูมิใจของคนไทยเพราะเป็นครั้งแรกที่อาหารจากประเทศไทยจะได้รับรองมาตรฐานความปลอดภัยระดับนี้ นับเป็นการแสดงศักยภาพขั้นสูงของนวัตกรรมเทคโนโลยีและความปลอดภัยการผลิตเนื้อไก่ของไทย และที่สำคัญคือการยืนยันว่าคนไทยทุกคนได้กินไก่ปลอดภัยในระดับเดียวกับที่องค์กรระดับโลกยอมรับ” นายประสิทธิ์กล่าว
นอกจากนั้นสิ่งที่เป็นหัวใจหลักของโรงพยาบาลคือ เวลารับแพทย์เพื่อเข้ามาเป็นแพทย์ประจำเรามีหลักเกณฑ์ในการคัดเลือกคือ ต้องมีทัศนคติที่ตรงกับของโรงพยาบาล เพราะว่าโรงพยาบาลยึดหลักต้องทำสิ่งที่ดีที่สุดสำหรับผู้ป่วย รายได้และเรื่องอื่นๆ เป็นเรื่องรอง ต้องมองเห็นประโยชน์ของผู้ป่วยเป็นหลัก แพทย์ที่เข้ามาอยู่กับเราก็ต้องมีทัศนคติที่ตรงกับเรา เพราะฉะนั้นเมื่อมีทัศนคติที่ตรงกันแล้วจะมองข้ามไปอีกขั้นหนึ่ง เพราะแพทย์แต่ละท่านต่างก็จบมาจากหลากหลายที่ การรักษาที่หลากหลายวิธี แต่ละที่ก็เรียนมาอาจจะมีความแตกต่างกันบ้าง
“เหมือนคนทำผัดไทย บางคนเอาเส้นผัดก่อน บางคนเอากุ้งทอดก่อน บางคนเอาเต้าหู้ทอดก่อน แต่สุดท้ายมันก็ออกมาเป็นผัดไทยเหมือนกัน แต่รสชาติไม่เหมือนกัน ดังนั้นที่นี่เราจึงใช้วิธีโดยการฝึกอบรมให้เหมือนกัน ไม่ว่าจะจบจากที่ไหนก็ตาม เหมือนกับเราพูดภาษาเดียวกัน มีเทคนิคการรักษาที่เหมือนกัน แพทย์แต่ละท่านเวลาดูเคสของท่านอื่น เขาจะได้รู้ว่าแพทย์ท่านนี้คิดอย่างไร อันนี้ก็เป็นส่วนหนึ่งของมาตรฐานในการรักษาผู้ป่วยที่โรงพยาบาลเอสฯ ทำให้แพทย์ทุกคนเข้าใจทุกเคสของแต่ละท่านได้”
กิจกรรมที่ผ่านมาปี 2566
วันจันทร์ ทำท่า ฝึกถ่ายน้ำหนัก
ยืนให้ระยะห่างของเท้าทั้ง 2 ข้างกว้างเท่าความกว้างของไหล่ เอนตัวถ่ายน้ำหนักไปขาซ้ายและขวาสลับกันช้า ๆ ทำซ้ำอย่างน้อย 30 ครั้ง วันละ 3 ชุด
ผังเส้นทางและสถานีรถไฟฟ้าสายสีเหลือง
กำหนดการพิธีพระราชทานน้ำหลวงอาบศพ พระพิธีธรรม สวดพระอภิธรรม
กำหนดการ พิธีพระราชทานน้ำหลวงอาบศพ พระพิธีธรรม สวดพระอภิธรรม บำเพ็ญทักษิณานุปทาน และ พระราชพิธีพระราชทานเพลิงศพ นายณรงค์ศักดิ์ โอสถธนากร อดีตผู้ว่าราชการจังหวัดปทุมธานี ณ ศาลาพ่วงจินดา วัดพระศรีมหาธาตุวรมหาวิหาร บางเขน แขวงอนุสาวรีย์ เขตบางเขน กรุงเทพมหานคร
สหภาพแพทย์ผู้ปฏิบัติงาน แถลงการณ์แสดงความเสียใจต่อการจากไป
26 มิถุนายน 2566 เพจสหภาพแพทย์ผู้ปฏิบัติงาน เผยแพร่ [แถลงการณ์จากสหภาพแพทย์ผู้ปฏิบัติงาน] มีเนื้อหาว่า เนื่องด้วยในวันที่ 23 มิถุนายน 2566 พญ.ญาณิศา สืบเชียง (หมอมีน) ซึ่งเป็นแพทย์จบใหม่ ปีการศึกษา 2566 ปัจจุบันเพิ่งเริ่มปฏิบัติงานในตำแหน่งแพทย์เพิ่มพูนทักษะ ณ โรงพยาบาลพหลพลพยุหเสนา จังหวัดกาญจนบุรี หลังจากที่ทำงานขึ้นเวรติดต่อกันเป็นระยะเวลาทั้งหมด 32 ชั่วโมง หมอมีนได้ประสบอุบัติเหตุทางรถยนต์ขณะเดินทางลงเวร ทำให้ได้รับบาดเจ็บสาหัสและเสียชีวิตในเวลาต่อมา
หมอมีน เป็นแพทย์ในโครงการผลิตแพทย์เพิ่มเพื่อชาวชนบท จังหวัดราชบุรี ซึ่งการผลิตแพทย์คนหนึ่งล้วนใช้ความพยายามและเวลาในการศึกษาเล่าเรียนเป็นระยะเวลาถึง 6 ปี ทั้งนี้ หมอมีนได้มุ่งมั่นตั้งใจจนประสบความสำเร็จได้เป็นแพทย์ดั่งที่หวัง ถึงแม้ว่าจะสามารถขึ้นปฏิบัติงานในฐานะแพทย์ได้ไม่ถึงระยะเวลา 1 เดือนและจากไปอย่างน่าเศร้า แต่รอยยิ้มและความดีของหมอมีนจะยังคงอยู่ในความทรงจำของทุกคนเสมอ
เราไม่อาจพิสูจน์ได้ว่าอุบัติเหตุนี้เกี่ยวข้องกับการทำงานเป็นระยะเวลานานหรือไม่ แต่การเสียชีวิตของหมอมีน ถือเป็นความสูญเสียของครอบครัว เพื่อน ผู้ร่วมงาน และประชาชนไทย ที่เสียบุคลากรอันทรงคุณค่าต่อวงการสาธารณสุข ทางสหภาพแพทย์ผู้ปฏิบัติงานขอแสดงความเสียใจและร่วมไว้อาลัยต่อการเสียชีวิตในครั้งนี้ ขอให้ดวงวิญญาณของหมอมีนไปสู่สุคติและภพภูมิที่ดี
ด้วยความอาลัยรัก
สหภาพแพทย์ผู้ปฏิบัติงาน
26 มิถุนายน 2556
มหิดล ชี้ “คลินิกพยาบาลชุมชนอบอุ่น” ช่วยเติมเต็มระบบหลักประกันสุขภาพ
คณบดีคณะพยาบาลศาสตร์ มหาวิทยาลัยมหิดล ชี้ “คลินิกพยาบาลชุมชนอบอุ่น” ช่วยเติมเต็มระบบหลักประกันสุขภาพ ช่วยประชาชนรับการดูแลรักษาเบื้องต้น รวมถึงการดูแลต่อเนื่องที่บ้านโดยไม่ต้องไปแออัดที่โรงพยาบาล แนะ สปสช. เพิ่มการประชาสัมพันธ์สร้างการรับรู้แก่ประชาชนให้มากขึ้น
วันที่ 15 มิถุนายน 2566 รศ.ดร.ยาใจ สิทธิมงคล คณบดีคณะพยาบาลศาสตร์ มหาวิทยาลัยมหิดล กล่าวถึงการดำเนินงานของคลินิกการพยาบาลและการผดุงครรภ์ ซึ่งได้ขึ้นทะเบียนเป็น “คลินิกพยาบาลชุมชนอบอุ่น” ในระบบหลักประกันสุขภาพแห่งชาติ โดยระบุว่า จุดเริ่มต้นในการจัดตั้งคลินิกการพยาบาลและการผดุงครรภ์ของคณะพยาบาลศาสตร์ มหาวิทยาลัยมหิดลนั้น เกิดจากวิสัยทัศน์ของคณะฯ ที่ต้องการเป็นสถาบันชั้นนำระดับประเทศและนานาชาติ ตลอดจนเป็นแกนนำในการสร้างสุขภาวะแก่สังคม ขณะที่ในช่วงการระบาดของโควิด-19 ที่ผ่านมาพบว่ามีประชาชนจำนวนมากไม่สามารถมารับบริการที่โรงพยาบาลได้ ไม่ว่าจะเป็นในพื้นที่ กทม. หรือเขตบางกอกน้อยที่คณะฯ ตั้งอยู่ หรือถึงมาได้ก็ต้องเจอความแออัดผู้ป่วยแน่นโรงพยาบาลไปหมด
ด้วยเหตุนี้ คณะพยาบาลศาสตร์ มหาวิทยาลัยมหิดล จึงมองว่าการมีคลินิกการพยาบาลและการผดุงครรภ์จึงเป็นเรื่องจำเป็นและได้เริ่มให้บริการตั้งแต่วันที่ 21 ก.ย. 2565 จนถึงปัจจุบันโดยมีเป้าหมายคือ 1.ทำอย่างไรให้คนในพื้นที่บางกอกน้อยสามารถเข้ารับบริการที่มีคุณภาพในขอบเขตที่วิชาชีพพยาบาลสามารถให้ได้ 2. ทำให้คนที่ไม่สามารถไปโรงพยาบาลได้และไม่จำเป็นต้องพบแพทย์ เช่น ทำแผล เปลี่ยนสายสวนปัสสาวะ การฟื้นฟูต่างๆ ในส่วนที่วิชาชีพพยาบาลทำได้ ได้รับบริการสุขภาพที่มีคุณภาพมาตรฐาน โดยที่ไม่ต้องไปแออัดถึงในโรงพยาบาล
ขณะเดียวกัน การที่คณะฯ มีคลินิกการพยาบาลและการผดุงครรภ์ ก็จะเป็นแหล่งฝึกให้กับนักศึกษาพยาบาลได้ เพราะในช่วงโควิด-19 ไม่สามารถพานักศึกษาไปฝึกปฏิบัติที่โรงพยาบาลได้เลย แต่เมื่อมีคลินิกฯแล้ว หากในอนาคตเกิดการระบาดของโควิด-19 อีกครั้ง หรือเกิดโรคอุบัติใหม่ขึ้นมา ก็ยังสามารถที่จะบริหารจัดการการเรียนการสอนได้
การจัดบริการสำหรับคลินิกการพยาบาลและการผดุงครรภ์
สำหรับการจัดบริการนั้น รศ.ดร.ยาใจ กล่าวว่า คลินิกการพยาบาลและการผดุงครรภ์ของคณะฯ จะให้บริการตรวจรักษาโรคเบื้องต้นตามขอบเขตที่วิชาชีพพยาบาลทำได้ การให้บริการพยาบาลเชิงรุกออกไปดูแลต่อเนื่องที่บ้านของประชาชนในพื้นที่ โดยได้ประสานกับศูนย์บริการสาธารณสุขของ กทม. โรงพยาบาลศิริราชและโรงพยาบาลใกล้เคียงในการรับดูต่อ เมื่อผู้ป่วยออกจากโรงพยาบาลก็สามารถรับบริการจากคลินิกพยาบาลชุมชนอบอุ่นได้เลย ถือเป็นการแบ่งเบาภาระของศูนย์บริการสาธารณสุขที่มีข้อจำกัดเรื่องกำลังคน ช่วยให้ผู้ป่วยได้รับบริการอย่างมีคุณภาพ
“ส่วนประชาชนที่มารับบริการที่คลินิกมากที่สุดคือการดูแลแผล ซึ่งเป็นเรื่องที่น่าสนใจมากในแง่ที่ประชาชนสามารถได้รับบริการโดยที่ไม่ต้องมาอัดในโรงพยาบาล ตั้งแต่เริ่มดำเนินการจนถึงปัจจุบันรวม 6-7 เดือน เรามีการติดตามข้อมูลและพบว่าประชาชนในย่านบางกอกน้อยพึงพอใจกับการให้บริการโดยเฉพาะการดูแลต่อเนื่องที่บ้าน” รศ.ดร.ยาใจ กล่าว
คลินิกการพยาบาลและการผดุงครรภ์เข้ามาเป็นส่วนหนึ่งของเครือข่ายบริการของสำนักงานหลักประกันสุขภาพแห่งชาติ
รศ.ดร.ยาใจ กล่าวต่อไปว่า การมีคลินิกการพยาบาลและการผดุงครรภ์เข้ามาเป็นส่วนหนึ่งของเครือข่ายบริการของสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) จะเข้ามาเติมเต็มระบบบริการ อย่างเช่นในพื้นที่ กทม. จะพบว่าผู้สูงวัยหรือผู้มีปัญหาโรคเรื้อรังหลายๆ คนยังขาดคนดูแล และแม้จะมีสิทธิ์การรักษาที่รัฐบาลกำหนดให้ แต่คนเหล่านี้ก็มารับบริการที่โรงพยาบาลได้ยากลำบาก รวมทั้งเจ้าหน้าที่เอง เช่น ศูนย์บริการสาธารณสุขของ กทม. ก็มีกำลังคนไม่มาก คลินิกการพยาบาลฯ จะช่วยในเรื่องการให้บริการที่มีคุณภาพมาตรฐาน เพราะคณะพยาบาลศาสตร์มีอาจารย์กว่า 130 คน แต่ละคนมีความเชี่ยวชาญที่หลากหลายไม่ว่าจะเป็นการพยาบาลกุมารเวช ศัลยศาสตร์ อายุรศาสตร์ ผู้สูงอายุ สุขภาพจิต ผดุงครรภ์ หรือสุขภาพสตรี นอกจากให้บริการที่คลินิกแล้ว อาจารย์ของคณะฯ ยังออกไปให้บริการดูแลต่อเนื่องที่บ้านด้วย ทำให้เพิ่มการเข้าถึงบริการสุขภาพที่มีมาตรฐานมากยิ่งขึ้น
อย่างไรก็ดี จากประสบการณ์การทำงานที่ผ่านมา ก็ยังพบปัญหาในการดำเนินงาน เช่น ในแง่ของประชาชนยังไม่รู้จักคลินิกพยาบาลและการผดุงครรภ์ ซึ่งก็ต้องทำการประชาสัมพันธ์ให้มากขึ้น และคิดว่าทาง สปสช. ควรช่วยประชาสัมพันธ์ให้ประชาชนหรือเครือข่ายของ สปสช. รับรู้ว่ามีคลินิกการพยาบาลฯตั้งอยู่ในพื้นที่ไหน จะสามารถเข้าไปรับบริการได้ที่ไหนได้บ้าง และนอกจากเรื่องการประชาสัมพันธ์แล้ว อยากให้ สปสช. พิจารณากรอบศักยภาพของคลินิกการพยาบาลตามขอบเขตวิชาชีพพยาบาล หรือตามความสามารถเฉพาะทางที่พยาบาลสามารถให้การบริการแก่ประชาชนได้ เพื่อขยายขีดความสามารถในการให้บริการประชาชนของคลินิกการพยาบาลเพิ่มขึ้น
Hfocusแอป Clicknic แจกอะไรอีกบ้าง
นอกจากน้ำเกลือล้างจมูก แล้ว แอป Clicknic มีบริการแจกผลิตภัณฑ์ดูแลสุขภาพหลายรายการ ดังนี้1. โควิดลดลง แต่การดูแลตัวเองต้องไปต่อ: Self-care is health care!
ในขณะนี้สถานการณ์การแพร่ระบาดของโควิด-19 มีแนวโน้มลดลง แต่การดูแลสุขภาพของเราก็ยังคงต้องดำเนินต่อ ถึงแม้ว่าโควิดจะเบาลง แต่ยังมีสิ่งอื่นรอบตัวที่อาจส่งผลกระทบกับร่างกายโดยตรง อาทิ อากาศร้อน และ ฝุ่น PM 2.5 ซึ่งในจุดนี้เอง แบรนด์สามารถส่งเสริมให้ผู้บริโภคไม่ละเลยที่จะดูแลตัวเองอย่างสม่ำเสมอผ่านกิจกรรมที่ทำได้ง่ายและเร็วทั้งในเรื่องสุขภาพและความสวยงาม เช่น การเสนอให้มีการออกกำลังกายในร่มเพื่อหลีกเลี่ยงการพบเจอแสงแดด อากาศร้อน และฝุ่น จากภายนอกโดยตรง หรือนำเสนอไอเดียเรื่องการดูแลและปกป้องผิวพรรณจากความร้อน รังสี UV ที่อาจเข้ามากระทบผิวเราโดยตรงอีกทั้งยังต้องส่งเสริมเรื่องผิวต้องการความชุ่มชื่นจากน้ำอีกด้วย
สิ่งที่จะได้พบในงาน
30 โรงพยาบาลชั้นนำ บริการตรวจสุขภาพฟรี
30 เวทีเสวนาโดยกูรูและแพทย์ผู้เชี่ยวชาญ
8 เวิร์คชอปสร้างสมดุลชีวิต
100 ร้านค้า สินค้าสุขภาพชุมชน นวัตกรรมและผลิตภัณฑ์เพื่อสุขภาพ
29 มิถุนายน 2566 รายงานสั่นสะเทือน อ.แม่สรวย จ.เชียงราย
ล่าสุด 29 มิถุนายน 2566 เวลา 21:05:17 ตามเวลาประเทศไทย พ.ศ. 2566 มีรายงานสั่นสะเทือน บริเวณศูนย์กลาง ต.แม่สรวย อ.แม่สรวย จ.เชียงราย ขนาด 1.1 ความลึก 6 Km. (กิโลเมตร) ไม่มีรายงานความเสียหาย
รองผู้ว่าฯ พิษณุโลก สำรวจพื้นที่ความเสียหายและผลกระทบจากเหตุแผ่นดินไหว ณ โรงพยาบาลบางกระทุ่ม LINK
วันที่
29 มิถุนายน 2566 เวลา 13.00 น. นายวาทิต ปัญญาคม รองผู้ว่าราชการจังหวัดพิษณุโลก พร้อมด้วยนายธราดล อภิจา นายอำเภอบางกระทุ่ม สำนักงานป้องกันและบรรเทาสารารณภัยจังหวัดพิษณุโลก และวิศวกรจากโยราธิการและผังเมืองพิษณุโลก ลงสำรวจพื้นที่ความเสียหายและผลกระทบจากเหตุแผ่นดินไหว ณ โรงพยาบาลบางกระทุ่ม เบื้องต้นพบว่าอาคารผู้ป่วยนอก อาคารผู้ป่วยใน อาคารกายภาพบำบัด อาคารส่งเสริมสุขภาพ บ้านพักข้าราชการ และอาคารอื่นๆ มีรอยร้าวบริเวณผนังอาคารไม่มีผลกระทบต่อโครงสร้างอาคาร และแนะนำให้ประสานหน่วยงานที่เกี่ยวข้องเพื่อตรวจสอบโดยละเอียดอีกครั้ง
หมายเหตุ
ไวรัสแลงยา
ตระกูล: Paramyxoviridae
สกุล: Henipavirus
การแพร่เชื้อ: สัมผัสกับสัตว์คล้ายหนูขนาดเล็ก (shew)
อาการ: อาการทางระบบทางเดินหายใจ เช่น มีไข้ ไอ และอ่อนเพลีย
อัตราการเสียชีวิต: ยังไม่มีรายงานผู้เสียชีวิต
********************************
ไวรัสโม่เจียง
ตระกูล: Paramyxoviridae
สกุล: Henipavirus
การแพร่เชื้อ: สัมผัสกับค้างคาวในถ้ำ
อาการ: อาการทางระบบทางเดินหายใจ เช่น มีไข้ ไอ และอ่อนเพลีย
อัตราการเสียชีวิต: 50%
********************************
ไวรัสเฮนดรา
ตระกูล: Paramyxoviridae
สกุล: Henipavirus
การแพร่เชื้อ: สัมผัสกับของเหลวจากม้าติดเชื้อ มีรังโรคอยู่ในค้างคาว
อาการ: มีไข้ ไอ เจ็บคอ ปวดศีรษะ ปวดกล้ามเนื้อ เวียนศีรษะ
อัตราการเสียชีวิต: 60-75%
การระบาดครั้งแรกของไวรัสเฮนดราเกิดขึ้นในปี พ.ศ. 2537 ในเมืองเฮนดรา ชานเมืองบริสเบน ประเทศออสเตรเลีย ซึ่งมีม้า 13 ตัวและครูฝึกเสียชีวิต 1 คน
********************************
ไวรัสนิปาห์
ตระกูล: Paramyxoviridae
สกุล: Henipavirus
การแพร่เชื้อ: สัมผัสกับของเหลวจากค้างคาวหรือหมูที่ติดเชื้อ
อาการ: มีไข้ ปวดศีรษะ ปวดกล้ามเนื้อ อาเจียน กลุ่มอาการทางเดินหายใจเฉียบพลัน
อัตราการเสียชีวิต: 40-75%
การระบาดครั้งแรกของไวรัสนิปาห์เกิดขึ้นในมาเลเซียและสิงคโปร์ในปี 2542 ส่งผลให้มีผู้ติดเชื้อเกือบ 300 รายและเสียชีวิตมากกว่า 100 ราย มีการบันทึกการระบาดเกือบทุกปีในบางส่วนของเอเชียตั้งแต่นั้นมา ส่วนใหญ่ในบังกลาเทศและอินเดีย
********************************
SARS-CoV-2 (โควิด-19)
วงตระกูล: Coronaviridae
สกุล: Betacoronavirus
การแพร่เชื้อ: ละอองทางการหายใจ, การสัมผัสใกล้ชิด
อาการ: มีไข้ ไอ หายใจถี่ สูญเสียการรับรสหรือได้กลิ่น
อัตราการเสียชีวิต: แตกต่างกันไปตามอายุและสภาวะสุขภาพพื้นฐาน แต่คาดว่าจะอยู่ที่ประมาณ 1-2% จากรายงานจากองค์การอนามัยโลก และกรมควบคุมโรค สหรัฐอเมริกา
มีรายงานผู้ป่วยโควิด-19 รายแรกในเมืองอู่ฮั่น ประเทศจีน ในเดือนธันวาคม 2562
ไวรัสแพร่กระจายอย่างรวดเร็วไปยังส่วนอื่น ๆ ของจีน ซึ่งนำไปสู่การแพร่ระบาดไปทั่วโลก (Pandemic) ตั้งแต่นั้นมา ผู้คนนับล้านทั่วโลกเสียชีวิตจากโควิด-19 โดยมีรายงานจำนวนผู้เสียชีวิตสูงสุดในสหรัฐอเมริกา บราซิล อินเดีย และเม็กซิโก
นโยบายภาครัฐที่มีต่อภารกิจกำจัดมะเร็งปากมดลูก
นโยบายภาครัฐที่มีต่อภารกิจกำจัดมะเร็งปากมดลูกให้เป็นศูนย์ ผ่านสิทธิ์ประกันสุขภาพแห่งชาติโดยสำนักงานหลักประกันสุขภาพแห่งชาติ ผ่านกระเป๋าสุขภาพในแอปพลิเคชั่นเป๋าตัง
ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวว่า ปัจจุบันคนไทย 48 ล้านคน มีสิทธิ์บัตรทองที่เมื่อเจ็บป่วยเข้าโรงพยาบาล รักษาฟรี โดยมี สปสช. เป็นตัวแทนรัฐบาลในการจ่ายเงินให้ ตามราคาที่เราตกลงไว้กับโรงพยาบาล”
สปสช. มีนโยบายเรื่องการส่งเสริมสุขภาพป้องกันโรค ไม่ใช่การรักษา แต่เป็นการทําให้ร่างกายแข็งแรง เพื่อไม่ให้เป็นโรค เช่นการฉีดวัคซีน การตรวจคัดกรองมะเร็งปากมดลูก ซึ่งคือหนึ่งในกระบวนการป้องกันได้อย่างหนึ่ง เพราะพิสูจน์มาแล้วว่า มะเร็งปากมดลูกตรวจได้ง่าย เมื่อตรวจแล้วพบความผิดปกติ จะมีหลายระดับ ระยะศูนย์ หนึ่ง สอง สาม สี่ ดังนั้น หากเข้าสู่การรักษาได้ในระยะเริ่มต้น สามารถหายขาดได้
ผลสำรวจคำถาม 1. หากท่านมี งบประมาณ "ไม่จำกัด" ท่านอยากตรวจสุขภาพ/รักษาโรคใด?
บันทึกผลการสำรวจคำถาม 1
"มีเงินเยอะ เลือกให้ตัวเอง" พร้อมรายละเอียดบางส่วน
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน ตรวจมะเร็ง 30.7% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 11.6% ตรวจสุขภาพจิต 11.8% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 10.4% ตรวจด้านหัวใจ ระบบเลือด 9.4%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน ตรวจมะเร็ง 30.8% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 11.6% ตรวจสุขภาพจิต 11.4% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 9.9% ตรวจด้านหัวใจ ระบบเลือด 9.8%. ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 3.6% ตรวจเกี่ยวกับไต 2.4% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 3.6% ตรวจเกี่ยวกับตับ 1.5% ตรวจระบบทางเดินอาหาร 4.1%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน ตรวจมะเร็ง 29.9% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 13.2% ตรวจสุขภาพจิต 11.4% ตรวจด้านหัวใจ ระบบเลือด 9.7%. ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 9% ตรวจระบบทางเดินอาหาร 3.8% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 3.8% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 3.4% ตรวจเกี่ยวกับไต 2.4% ตรวจเกี่ยวกับตับ 1.6%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน
สถาบันเพื่อเศรษฐศาสตร์และสันติภาพ (The Institute for Economics & Peace - IEP)
สถาบันเพื่อเศรษฐศาสตร์และสันติภาพ (The Institute for Economics & Peace - IEP) เป็นหน่วยงานอิสระ ไม่ฝักใฝ่ฝ่ายใด และไม่แสวงหาผลกำไร อุทิศตนเพื่อเปลี่ยนจุดสนใจของโลกไปสู่สันติภาพ โดยเป็นมาตรวัดความเป็นอยู่และความก้าวหน้าในเชิงบวก บรรลุผล และจับต้องได้ของมนุษย์ IEP บรรลุเป้าหมายด้วยการพัฒนากรอบแนวคิดใหม่เพื่อกำหนดความสงบสุข จัดทำตัวชี้วัดเพื่อวัดความสงบสุข และเปิดเผยความสัมพันธ์ระหว่างธุรกิจ สันติภาพ และความเจริญรุ่งเรือง ตลอดจนส่งเสริมความเข้าใจที่ดีขึ้นเกี่ยวกับปัจจัยทางวัฒนธรรม เศรษฐกิจ และการเมืองที่ก่อให้เกิดสันติภาพ IEP มีสำนักงานใหญ่ในซิดนีย์ โดยมีสำนักงานในนิวยอร์ก บรัสเซลส์ กรุงเฮก เม็กซิโกซิตี้ และฮาราเร ทำงานร่วมกับพันธมิตรที่หลากหลายในระดับสากลและร่วมมือกับองค์กรระหว่างรัฐบาลในการวัดและสื่อสารคุณค่าทางเศรษฐกิจของสันติภาพ
1. บ้านอาจารย์อำนวย สุวรรณคีรี บางกะปิ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: วันจันทร์ถึงวันศุกร์ เวลา 09.00 - 20.30 น.
เบอร์ติดต่อ: 0819844081
ผู้ติดต่อ: ดร.อำนวย สุวรรณคีรี
2. วัดพุทธบูชา ทุ่งครุ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00-16.00น.
เบอร์ติดต่อ: 098-7898485
ผู้ติดต่อ: อ.สมศักดิ์ ชื่นชัยธรรม
3. วัดเทพเจติยาจารย์ อ.จอมทอง เชียงใหม่
เชียงใหม่
วันเวลาทำการ: 8.00น.-16..00น.
เบอร์ติดต่อ: 082-269-5329
ผู้ติดต่อ: อ.เรืออากาศโทจักรพันธ์ อภิรัชตานนท์
4. วัดสิริกมลาวาส ลาดพร้าว กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์ และ อาทิตย์ 9.00 น. - 16.00 น.
เบอร์ติดต่อ: 096 762 7990
ผู้ติดต่อ: อาจารย์นิธิรุจน์ โกมลศิระโรจน์
5. วัดดอนรัก อ.เมือง จ.สงขลา
สงขลา
วันเวลาทำการ: 8.30- 17.00 น. (เสาร์ - อาทิตย์)
เบอร์ติดต่อ: 086 598 0096
ผู้ติดต่อ: ดร.ไพจิตร กชกรจารุพงศ์
6. วัดบางโฉลงใน อ.บางพลี จ.สมุทรปราการ
สมุทรปราการ
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 08.00 - 17.00 น.
เบอร์ติดต่อ: 092-6351659 อ.อภิวิชญ์ ขำสุทธิ์
ผู้ติดต่อ: 083-5399824 อ.ลลิมาดา ศรีจำรูญ
7. มหาวิทยาลัยเนชั่น อ.เมือง จ.ลำปาง
ลำปาง
วันเวลาทำการ: -
เบอร์ติดต่อ: 0819616072
ผู้ติดต่อ: นางสาววรญา วิไลรัตน์
8. อาคารไอทาวเวอร์ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 098 354 5424
ผู้ติดต่อ: ผดล. ปริชาติ บุณยรัตพันธุ์
9. บ้านบรรณรุจิ อ.โพธาราม ราชบรี
ราชบุรี
วันเวลาทำการ: -
เบอร์ติดต่อ: 089-665-2323
ผู้ติดต่อ: ผดล. นันทนา บรรณรุจิ
10. วัดผ่องพลอยวิริยาราม บางนา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: 09:00 - 16:00 น. เสาร์ -อาทิตย์
เบอร์ติดต่อ: 089-115-9166
ผู้ติดต่อ: ผดล. พล.ต.ต.นพ. สมชัย วุฒิณรงค์ตระกูล
11. วัดเทพชุมนุม อ.หาดใหญ่ จ.สงขลา
สงขลา
วันเวลาทำการ: วันเสาร์ และวันอาทิตย์ เวลา 9:00 น. ถึง 16:30 น.
เบอร์ติดต่อ: 095-956 1536
ผู้ติดต่อ: นายบรรจง ลีลาศรีสุนทร
12. บ้านเหมืองหม้อ อ.เมือง แพร่
แพร่
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00 - 16.30 น.
เบอร์ติดต่อ: 0980015922
ผู้ติดต่อ: นายไชยยะ เศวตศิลา
14. บ้านปิยะธรรม สวนหลวง กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ 18.00-20.30 น.
เบอร์ติดต่อ: 0652391655
ผู้ติดต่อ: ธีรเดช จันทร์วิเมลือง
15. ศูนย์นำชัย อ.เมือง จ.ภูเก็ต
ภูเก็ต
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 17.30-20.30
เบอร์ติดต่อ: 093 661 9515, 089 472 3641, 089 590 1021
ผู้ติดต่อ: อ.สุพจน์ ทนุบำรุง
16. วัดสีตลาราม อ.เมือง จ.ตาก
ตาก
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 09.00 - 15.00 น.
เบอร์ติดต่อ: 0936589553
ผู้ติดต่อ: อ.กมลภพ ยศนันท์
17. วัดป่าหลวง อ.เมือง จ.อุดรธานี
อุดรธานี
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 085-000-5449
ผู้ติดต่อ: นายไกรรัชต์ ตรีสัตยพันธุ์
18. วัดเขาเต่า อ.หัวหิน จ.ประจวบคีรีขันธ์
ประจวบคีรีขันธ์
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 08.00 - 16.00 น.
เบอร์ติดต่อ: 081-4453305
ผู้ติดต่อ: 065-0524247
19. มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตศรีราชา จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00-16.30 น.
เบอร์ติดต่อ: 081-861 9707
ผู้ติดต่อ: อาจารย์สุรภา สุขสวัสดิ์
20. ศูนย์สมาธิพระยาวิสูตรโกษา อ.เมือง จ.จันทบุรี
จันทบุรี
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18.00 - 20.30 น. เสาร์-อาทิตย์ 08.00 - 16.00 น.
เบอร์ติดต่อ: 081 806 5030
ผู้ติดต่อ: อ.ประชิด ศรีวิโรจน์ ผู้ดูแลสาขา
21. อุทธยานธรรมกิตติลักษณ์ จ.เชียงราย
เชียงราย
วันเวลาทำการ: -
เบอร์ติดต่อ: 084-7679988
ผู้ติดต่อ: อ.กิตติ จงพิพัฒนมงคล
22. วัดเชตวัน อ.เมือง จ.ลำปาง
ลำปาง
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ 8.00-17.00น.
เบอร์ติดต่อ: 000-000-0000
ผู้ติดต่อ: อ.สมชาย ด้วงทอง
23. วัดเม็งรายมหาราช (ฮ่องลี่) อ.เมือง จ.เชียงราย
เชียงราย
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.30-16.00 น.
เบอร์ติดต่อ: 095-559-1740
ผู้ติดต่อ: อ.ณัฐพัชร นพชญานนท์
25. อโศก - สุขุมวิท (อาคารลาส โคลินาส) กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์-ศุกร์ (17.00-20.30 น.)
เบอร์ติดต่อ: 093-641-9995
ผู้ติดต่อ: อ.สุรัสวดี ร้อยพุทธ
26. พุทธสมาคมแห่งประเทศไทย ในพระบรมราชูปถัมภ์ เขตพระนคร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 08:00 - 16:00 น.
เบอร์ติดต่อ: 084-459-1100
ผู้ติดต่อ: อ.อภิภัต กิจธนะเสรี
27. วัดรัตนวนาราม อ.เมือง พะเยา
พะเยา
วันเวลาทำการ: 07.00-18.00
เบอร์ติดต่อ: 089-8516416 / 094-6194651
ผู้ติดต่อ: นางวิรัลพัชร ศิริสุภเศรษฐ์ (ผู้ดูแลสาขา) / นางกษมน เกษรเพชรนพคุณ (ผู้ช่วยผู้ดูแลสาขา)
28. กลอรี่เฮ้าส์ พระราม 9 กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์-ศุกร์ 18.00-20.30 น. (เมื่อเปิดเรียน)
เบอร์ติดต่อ: 093-256-2554
ผู้ติดต่อ: อุสา ธีรนิพัทธ์
29. วัดสุทธจินดาวรวิหาร อ.เมือง จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 9:00-16:30 น.
เบอร์ติดต่อ: 094-297 9242
ผู้ติดต่อ: อ.สุรีวรรณ์ ควรพันธุ์
30. โรงเรียนวชิรมกุฏ เขตพระนคร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์-ศุกร์ เวลา18.00-20.30 น.
เบอร์ติดต่อ: 099-332-9955
ผู้ติดต่อ: อ.พัชรศรัณย์ หมีกุละ WP30 wachiramakut https://lin.ee/D64haMo
31. วัดศรีจันทร์ อ.เมือง จ.ขอนแก่น
ขอนแก่น
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 08:00 - 16:00 น.
เบอร์ติดต่อ: 084-428-1395
ผู้ติดต่อ: ผดล. อ.มงคล หล้าหา
32. วัดโพธิสมภรณ์ พระอารามหลวง อ.เมือง จ.อุดรธานี
อุดรธานี
วันเวลาทำการ: จันทร์-ศุกร์ 18.00-20.30
เบอร์ติดต่อ: 081-7299308
ผู้ติดต่อ: อ.นุจรินทร์ พันโกฏิ (ผู้ดูแลสาขา)
33. มหาวิทยาลัยเอเชียอาคเนย์ หนองแขม กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: 08.00-16.30 น. (เสาร์-อาทิตย์)
เบอร์ติดต่อ: 089 992 6816
ผู้ติดต่อ: อ.จุติพงษ์ วงศ์วิวัฒน์ (ผู้ดูแลสาขา)
34. สถาบันพระปกเกล้า ศูนย์ราชการเฉลิมพระเกียรติ 80 พรรษา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 9.00-16.00 น.
เบอร์ติดต่อ: 0818083069
ผู้ติดต่อ: นางนฤมล ซู (ผู้ดูแลสาขา)
35. มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าพระนครเหนือ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: สัปดาห์ละ 3 วัน (พุธ-พฤหัสบดี-ศุกร์) เวลา 16.30 – 18.00 น.
เบอร์ติดต่อ: 089-212-4335
ผู้ติดต่อ: คุณเบญจมาศ จงรักษ์
36. วัดป่าท่าทราย ต.ท่าทราย อ.เมือง จ.สมุทรสาคร
สมุทรสาคร
วันเวลาทำการ: เสาร์-อาทิตย์ 09.00 น.-16.00 น.
เบอร์ติดต่อ: 062-7985-551
ผู้ติดต่อ: อ.วีณา รัตนสุภา
37. โรงเรียนอนุบาลพุทธชาด เขตบึงกุ่ม กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00 น. - 15.00 น.
เบอร์ติดต่อ: 085-491-4164
ผู้ติดต่อ: อ.มณฑิกา เทพกาญจนา
38. มหาวิทยาลัยสงขลานครินทร์ จ.สงขลา
สงขลา
วันเวลาทำการ: จันทร์ - พุธ เวลา 17:00 - 20:00 น.
เบอร์ติดต่อ: 081-540-5530
ผู้ติดต่อ: อ.มาริษา เขมะพันธ์มนัส
39. คณะนิติศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กรุงเทพมหานคร
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
40. วัดตรีรัตนาราม จ.ระยอง
ระยอง
วันเวลาทำการ: เสาร์ - อาทิตย์ 09.00 - 16.00 น.
เบอร์ติดต่อ: 0817829910
ผู้ติดต่อ: อ.พรทิพย์ เวชกามา
42. วัดคุ้มจัดสรรค์ อ.บ้านไผ่ จ.ขอนแก่น
ขอนแก่น
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00-16.30 น.
เบอร์ติดต่อ: 081-6627880
ผู้ติดต่อ: ผดล.สุรัตน์ นาคม
43. วัดจันทรสามัคคี อ.เมือง จ.หนองคาย
หนองคาย
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08:30 ถึง 16:30 น
เบอร์ติดต่อ: 0616916697
ผู้ติดต่อ: ผดล.อ.มุจจรินทร์ ทัศดรกุลพัฒน์
44. วัดสุปัฏนาราม วรวิหาร จ.อุบลราชธานี
อุบลราชธานี
วันเวลาทำการ: วันเสาร์และอาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 089-945-6042
ผู้ติดต่อ: ผศ.ศรีประไพ ธรรมแสง
45. วัดเดิม อ.พิมาย จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 0803356164
ผู้ติดต่อ: อ.สุวิมล พันธุ์เพียร
46. อาคาร วี. เอส. เคมเฮ้าส์ รองเมือง กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เวลาเปิดสอน เสาร์ - อาทิตย์ เวลา 9:00 -16:00 น.
เบอร์ติดต่อ: 0814222236
ผู้ติดต่อ: อ.ดร. ศิริพงษ์ โรจน์ลือชัย
47. บมจ. ซีฟโก้ คลองสามวา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ ถึง ศุกร์ 18:00-20:30 น.
เบอร์ติดต่อ: 081-985-1669
ผู้ติดต่อ: อาจารย์ ดร.ณรงค์ ทัศนนิพันธ์
48. วัดป่าสว่างอารมณ์ บ้านใหม่สำโรง อ.สีคิ้ว จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: วันเสาร์ อาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 092 2597894
ผู้ติดต่อ: นายสมชาย บุญฑีย์กุล
49. สำนักงานเลขาธิการวุฒิสภา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: วันจันทร์-วันศุกร์ เวลา 08.30 - 18.00 น
เบอร์ติดต่อ: 0853668989
ผู้ติดต่อ: นายสาโรจน์ ภคุโล
50. วัดนิโรธสังฆาราม อ.เมือง จ.ยะลา
ยะลา
วันเวลาทำการ: 08.00 - 16.00 น. เสาร์ - อาทิตย์
เบอร์ติดต่อ: 081-738-0567
ผู้ติดต่อ: นางสาววิจิตรา บุรี
9 โซน ตามนโยบาย 9 ด้าน 9 ดี
ในงานนี้ แบ่งออกเป็น 9 โซน โดยแบ่งพื้นที่การจัดแสดงตามนโยบาย 9 ด้าน 9 ดี ประกอบไปด้วย
สถานีดับเพลิงและกู้ภัยพระโขนง กปก.2
จับงูเหลือม 3 เมตร ซอยอ่อนนุช 6 สุขุมวิท 77 แขวง/เขตสวนหลวง
จับงูเขียวหางไหม้ ซอยสุขุมวิท62 แขวงพระโขนงใต้ เขตพระโขนง
ช่วยประชาชนจับงู ซ.อ่อนนุช2/1 สุขุมวิท77 แขวงพระโขนงเหนือ วัฒนา
นักดับเพลิงและกู้ภัยบางนา กปก.2
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 1.70 เมตร ภายในซอยลาซาล 12 สุขุมวิท 105 แขวงบางนาใต้ เขตบางนา
ช่วยเหลือประชาชนจับงูทางมะพร้าว ความยาวประมาณ 1 เมตร ภายในซอยลาซาล 50 สุขุมวิท 105 แขวงบางนาใต้ เขตบางนา
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 50 เซนติเมตร ภายในซอยลาซาล 42 สุขุมวิท 105 แขวงบางนาใต้ เขตบางนา
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 1.80 เมตร ภายในซอยบางนาตราด 4 ถนนเทพรัตน แขวงบางนาเหนือ เขตบางนา
ช่วยเหลือประชาชน กำจัดรังผึ้งมิ้ม ขนาดประมาณ 20 เซนติเมตร ภายในคอนโดฯ The Sky ถนนสุขุมวิท แขวงบางนาเหนือ เขตบางนา
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ความยาวประมาณ 40 เซนติเมตร ภายในห้างสะดวกซื้อ ปากซอยสุขุมวิท 70/5 แขวงบางนาเหนือ เขตบางนา
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ความยาวประมาณ 30 เซนติเมตร ภายในซอยลาซาล 41 สุขุมวิท 105 แขวงบางนาใต้ เขตบางนา
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ความยาวประมาณ 1.20 เมตร ภายในซอยลาซาล 32 สุขุมวิท 105 แขวงบางนาใต้ เขตบางนา
ดับเพลิงและกู้ภัยคลองเตย กปก.2
รับแจ้งเหตุ งูเหลือม ความยาว 1 เมตร 50 เซนติเมตร บ้านเลขที่ 49 ซอย แสนสบาย แยก3 แขวง พระโขนง เขต คลองเตย กรุงเทพ
รับแจ้งเหตุงูเหลือม ความยาว 50 เซนติเมตร บ้านเลขที่ 9/31 ซอย ธนาอาเขต สุขุมวิท63 แขวง พระโขนง เขต คลองเตย กรุงเทพ
รับแจ้งเหตุ ตัวเงินตัวทอง ความยาว 1 เมตร 60 เซนติเมตร บ้ายเลขที่44/5 ซอย สุขุมวิท31 แยก2 แขวง คลองตันเหนือ เขต วัฒนา กรุงเทพ
บริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี สำหรับชาวนครระยอง LINK
"ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง มีบริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี สำหรับชาวนครระยอง"
เงื่อนไขเข้ารับบริการ
- ต้องพาสัตว์เลี้ยงเข้ามารับบริการเท่านั้น ไม่อนุญาตให้ขอวัคซีนไปรับบริการที่บ้านเอง
- เตรียมบัตรประชาชน หรือบัตรทางราชการ เพื่อลงทะเบียนสัตว์เลี้ยง
- ไม่จำกัดสัตว์เลี้ยงเข้ารับบริการ
- สงวนสิทธิ์เฉพาะที่อยู่ปัจจุบันอยู่ในเขตนครระยอง เท่านั้น
- สัตว์เลี้ยงที่รับวัคซีนได้ ต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข
สามารถติดต่อได้ในวันและเวลาราชการ
จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น.
เบอร์ติดต่อ 038-612305
บริการแท็กซี่วีลแชร์ ของกรุงเทพมหานคร
รถตู้วีลแชร์บริการทั้งหมด 10 คัน ในพื้นที่รอบกรุงเทพมหานคร ดังนี้ 1. ศูนย์พระราม 3 2. ศูนย์รามคำแหง 3. ศูนย์หนองแขม ใครที่อยากใช้บริการแท็กซี่วีลแชร์สามารถติดต่อศูนย์บริการได้ทุกวัน ที่เบอร์ 02 -2946524 ตั้งแต่เวลา 09.00 - 16.00 น.
รถตู้วีลแชร์ มีระบบไฮดรอลิค รองรับรถวีลแชร์ พร้อมราวจับมั่นคง เพื่อนำขึ้นจากระดับดิน สู่ภายในตัวรถ
ผู้ใช้บริการขยับวีลแชร์ เข้ายังจุดเพื่อยกขึ้นสู่ตัวรถ สำหรับผู้สูงอายุ มือจับให้มั่นระหว่างที่อยู่ในตัวยก จะช่วยให้ปลอดภัยมั่นคงยิ่งขึ้น
ภายในรถตู้วีลแชร์ กว้างขวาง สำหรับรถวีลแชร์ 1 คัน พร้อมที่นั่งสำหรับผู้ดูแล 1 ท่าน
ขณะนำผู้ใช้บริการพร้อมรถวีลแชร์เข้าสู่ภายในตัวรถ
เจ้าหน้าที่จะยึดโยงรถให้แน่นหนาก่อนออกเดินทางป้องกันการลื่นไหลหรือไม่สมดุล ที่อาจเป็นความเสี่ยงต่างๆ ได้
เดินทางดี หนึ่งในวิสัยทัศน์ที่ต้องเป็นไปได้
รถตู้วีลแชร์บริการทั้งหมด 10 คัน ในพื้นที่รอบกรุงเทพมหานคร ดังนี้ 1. ศูนย์พระราม 3 2. ศูนย์รามคำแหง 3. ศูนย์หนองแขม ใครที่อยากใช้บริการแท็กซี่วีลแชร์สามารถติดต่อศูนย์บริการได้ทุกวัน ที่เบอร์ 02 -2946524 ตั้งแต่เวลา 09.00 - 16.00 น.
สัปดาห์นี้ 15-16 กรกฎาคม 66
ศูนย์ 2 วัดมักกะสัน LINK
ศูนย์บริการสาธารณสุขสอง วัดมักกะสัน ประกาศ รับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ
ตำแหน่ง : พนักงานช่วยงานด้านการเงินและบัญชี 1 อัตรา
วุฒิการศึกษา : ประกาศนียบัตรวิชาชีพชั้นสูง (ปวส.) สาขาวิชาการบัญชี
ค่าตอบแทน : วันละ 620 บาท
มีประกันสังคม เวลาปฏิบัติงาน 08.00-16.00 น.
สามารถมายื่นใบสมัครด้วยตนเองเท่านั้น พร้อมหลักฐาน ที่ธุรการ ศูนย์บริการสาธารณสุข 2 วัดมักกะสัน ในวันและเวลาราชการ
สอบถามข้อมูลเพิ่มเติมที่ ธุรการ เบอร์โทร : 0 2251 7735-37 ต่อ 11,12
การให้บริการคลินิกทันตกรรม ศูนย์บริการสาธารณสุข 15 ลาดพร้าว LINK
การให้บริการคลินิกทันตกรรม ศูนย์บริการสาธารณสุข 15 ลาดพร้าว
เพิ่มช่องทางการให้บริการใหม่ เพื่ออำนวยความสะดวกแก่ผู้มารับบริการ
ช่องทางการเข้ารับบริการทันตกรรม มี 2 ช่องทาง คือ
1. การรับบัตรคิวปกติ (คนไข้ walk in)
เริ่มแจกบัตรคิวทันตกรรมช่วงเช้า เวลา 07:30 น.
ด้านหน้าอาคาร ชั้น1 (ในเวลาราชการ จำกัด 7 - 10 คิว)
เริ่มแจกบัตรคิวทันตกรรมช่วงเย็น เวลา 15:30 น.
ด้านหน้าอาคาร ชั้น1 (นอกเวลาราชการ จำกัด 7 คิว)
2. จองนัดหมายออนไลน์ โดยสแกนคิวอาร์โค้ด (QR CODE) ข้างล่างนี้
เริ่มจองได้ ตั้งแต่วันที่ 15 มิถุนายน 2566 นี้เป็นต้นไป แบ่งเป็น 2 ช่วงเวลา คือ
นัดออนไลน์ (ในเวลาราชการ จำกัด 2 คิว) งานขูดหินปูน,อุดฟัน,ถอนฟัน
นัดออนไลน์ (นอกเวลาราชการ จำกัด 2 คิว) งานขูดหินปูน,อุดฟัน
(เงื่อนไขการนัดหมายเป็นไปตามระบบกำหนด)
สอบถามข้อมูลเพิ่มเติม คลินิกทันตกรรม ศูนย์บริการสาธารณสุข 15 ลาดพร้าว
โทรศัพท์ : 02-541-8531 , 02-541-8380 ต่อ 303
คลินิกก้าวใหม่ (ยาเสพติด) New Step Clinic ศูนย์บริการสาธารณสุข 51 จตุจักร
คลินิกก้าวใหม่ (ยาเสพติด) New Step Clinic
วัน - เวลาทำการ จันทร์ - ศุกร์ 08.00 - 16.00 น. เสาร์ - อาทิตย์และวันหยุดราชการ 08.00 - 12.00 น. (เฉพาะรับยาเมทาโดนและคัดกรองผู้เข้ารับบำบัด)
ขอบเขตการให้บริการ
ให้บริการบำบัดรักษาและฟื้นฟูสมรรถภาพผู้ติดสารเสพติดทุกประเภททั้งระบบสมัครใจและระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพผู้ติดยาเสพติด พ.ศ. ๒๕๔๕ แบบผู้ป่วยนอก รวมทั้งแนะนำให้ความรู้แก่ผู้เสพ/ผู้ติดยาเสพติด ครอบครัวและผู้เกี่ยวข้องที่เข้ารับการบำบัดฟื้นฟูสมรรถภาพฯ ตามแนวทางการให้บริการ ดังนี้
การบริการภายในศูนย์ฯ
1). บำบัดผู้ติดสารเสพติดด้วยระบบการใช้ยาทดแทน
ให้บริการบำบัดรักษาแบบผู้ป่วยนอกเฉพาะผู้ติดสารเสพติดประเภทฝิ่น อนุพันธ์ฝิ่น ได้แก่ เฮโรอีน มอร์ฟีน โดยการจ่ายยาเมทาโดน ทดแทนอาการอยากยา ให้รับประทานยาต่อหน้าแบบ (Dot) ให้บริการทั้งระบบสมัครใจและระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพผู้ติดยาเสพติด พ.ศ. ๒๕๔๕
2).โปรแกรมจิต สังคม บำบัด
ให้บริการบำบัดรักษาแบบผู้ป่วยนอกเฉพาะผู้ติดสารเสพติดประเภทกระตุ้นประสาท ได้แก่ ยาบ้า กัญชา ไอซ์ และได้รับการประเมินทางจิตแล้วไม่มีอาการทางจิตเวช ให้บริการบำบัดรักษาทั้งระบบสมัครใจ (ระยะเวลา 2 – 4 เดือน) และระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพ พ.ศ. ๒๕๔๕ (ระยะเวลา ๔ เดือน)
3).บำบัดผู้ติดบุหรี่ แบบบริการเบ็ดเสร็จจุดเดียวมีวิธีการบำบัดดังนี้
- การบำบัดโดยใช้ยา เช่น Bupropion, น้ำยาบ้วนปาก
- การบำบัดโดยไม่ใช้ยา ได้แก่ การเลิกบุหรี่ด้วยตนเองการให้การปรึกษารายบุคคลเพื่อการเลิกบุหรี่
4) การดูแลผู้ใช้แอลกอฮอล์ รูปแบบการบำบัดมี ๓ แบบ
- การให้คำแนะนำแบบสั้นเป็นการให้ข้อมูลแก่ผู้ดื่มเกี่ยวกับผลเสียของการดื่มเครื่องดื่มแอลกอฮอล์ โดยมีจุดมุ่งหมายในการสร้างความตระหนักถึงปัญหาเพื่อให้เกิดแรงจูงใจในการหยุดหรือเลิกดื่มเครื่องดื่มแอลกอฮอล์
- การให้ความช่วยเหลือแบบสั้นเป็นการให้ข้อมูลแก่ผู้ดื่ม พร้อมทั้งหาแนวทางและวางแผนการปฏิบัติที่เหมาะสมในการหยุดหรือลดการดื่มเครื่องดื่มแอลกอฮอล์
- การให้การปรึกษาเป็นการช่วยเหลือผู้ที่มีปัญหาจากการดื่มเครื่องดื่มแอลกอฮอล์โดยการเสริมสร้างแรงจูงใจเพื่อปรับพฤติกรรมและฝึกทักษะที่จำเป็นในการลด/เลิกดื่มเครื่องดื่มแอลกอฮอล์
การบริการภายนอกศูนย์ฯ
คลินิกบำบัดยาเสพติด ศูนย์บริการสาธารณสุข 51 วัดไผ่ตัน ได้มีการจัดทำกิจกรรมโครงการเพื่อการรณรงค์ป้องกันแก้ไขปัญหายาเสพติดของพื้นที่เขตจตุจักรอย่างต่อเนื่อง โดยมีการดำเนินการป้องกันเชิงรุกโดยการเป็นวิทยากรเผยแพร่ความรู้ด้านยาและสารเสพติดให้กับโรงเรียน ชุมชน และสถานประกอบการ
แถลงข่าวเปิดตัวความพร้อมการแข่งขัน LINK
12 กรกฎาคม 2566 ภาพบรรยากาศงานแถลงข่าวความพร้อมการจัดการแข่งขันวิ่งมาราธอนสุดยิ่งใหญ่แห่งภาคตะวันออก รายการ AMAZING THAILAND PATTAYA MARATHON 2023 presented by MAMA ณ ห้องนภาลัย เอ โรงแรมดุสิตธานี พัทยา
1.ประตูแห่งแสง 2. รูแสง
1.ประตูแห่งแสง
แนวคิด :จุดเริ่มต้นที่เรียบง่ายของธรรมชาติระหว่างแสงและเงา
เทคนิค :ใช้ไม้ไผ่คุณภาพดีจากภาคเหนือทำโครงซุ้มโดยเว้นช่องให้แสงจากภายในส่องผ่าน
2. รูแสง
แนวคิด :ความประทับใจของก้าวแรกบนเส้นทางที่นำไปสู่ความอัศจรรย์ของแสงสี
เทคนิค :การใช้เทคนิคเลเซอร์เพื่อสร้างอุโมงค์แสงสี่เหลี่ยมต่อเนื่องจาก(Gate of Light)
ชี้เป้าร้านเด็ดจากภูเก็ต
ชี้เป้าร้านเด็ดจากภูเก็ต ใครคิดถึงภูเก็ต อาหารภูเก็ต เสื้อผ้าภูเก็ต ชุมชนที่ภูเก็ตอย่าลืมแวะมาหากันที่งานนี้
เจอกันในวันที่ 2-6 สิงหาคม 2566 ณ หมู่บ้านโซนภาคใต้ ศูนย์ประชุมแห่งชาติสิริกิติ์
โซนร้านอาหาร
- Cafe’ in (โอ้เอ๋ว) Cafe’ In
- ลูกชิ้นปลา เก็จมุกดา
โซน OTOP
- ร้านเมธี ภูเก็ต เมธีภูเก็ต Methee Cashew Nut
โซน ห้องเสื้อ "เสน่ห์...ปักษ์ใต้
- YAYEE ยาหยี ชุดผ้าปาเต๊ะ Yayee
โซนกิจกรรม D.I.Y
- ท่องเที่ยวชุมชนบางโรง จ.ภูเก็ต ท่องเที่ยวชุมชนบางโรง Bangrong CBT
เขตมีนบุรี เตรียมพร้อมรับมือหน้าฝน แบ่งทีม เร่งกำจัดผักตบชวา เพิ่มประสิทธิภาพการระบายน้ำในพื้นที่


25 ก.ค.66 เขตมีนบุรี จัดเจ้าหน้าที่ดำเนินการเก็บผักตบชวา และกำจัดวัชพืช แหล่งน้ำในพื้นที่เขตมีนบุรี บริเวณคลองลำควายตาย และคลองเจ็ก เขตมีนบุรี เพื่อสภาพคล่องในการระบายน้ำ และเปิดทางน้ำไหล เพิ่มประสิทธิภาพการระบายน้ำในพื้นที่ ผู้อำนวยการเขตมีนบุรี ได้เน้นย้ำเจ้าหน้าที่ ดูแล และดำเนินการกำจัดผักตบชวา วัชพืชอย่างต่อเนื่อง เพื่อเปิดทางน้ำไหล และพัฒนาแหล่งน้ำในพื้นที่ โดยจะสับเปลี่ยนหมุนเวียนดำเนินการในทุกคลอง ทุกลำรางทั่วพื้นที่อย่างสม่ำเสมอ
26 ก.ค.66 จัดเจ้าหน้าที่ดำเนินการลอกท่อระบายน้ำ บริเวณซอยรามคำแหง 174 ถนนรามคำแหง เขตมีนบุรี เพื่อช่วยทำให้สภาพแวดล้อมดีขึ้น และช่วยเพิ่มสภาพคล่องในการระบายน้ำอย่างมีประสิทธิภาพ
ศักยภาพการรับมือน้ำท่วมเขตมีนบุรี ตรวจสอบดูแลเครื่องมือต่างๆ เครื่องสูบน้ำ ให้พร้อมใช้งานอยู่เสมอ โดยเตรียมพร้อมเครื่องสูบน้ำ จำนวน 14 เครื่อง และกระสอบทราย จำนวน 180,000 ใบ จัดเจ้าหน้าที่ออกตรวจความเรียบร้อย ปลอดภัย เมื่อเกิดฝนตกหนัก ได้แก่ ฝ่ายโยธา ประจำจุดอ่อนน้ำท่วม, ฝ่ายรักษาฯ ดูแลขยะหน้าตะแกรง และฝ่ายเทศกิจ อำนวยความสะดวกด้านการจราจร จัดเจ้าหน้าที่หน่วย Best พร้อมออกปฏิบัติหน้าที่ตลอด 24 ชั่วโมง เพื่อช่วยเหลือประชาชนได้อย่างทันท่วงที ในกรณีเกิดปัญหาน้ำท่วมขังระบายน้ำไม่ทัน หรือมีต้นไม้หักโค่นกีดขวางการจราจรล้มทับบ้านเรือนและทรัพย์สินของประชาชน กรณีน้ำท่วมสูง จัดเตรียมรถรับ-ส่ง บริการประชาชน กรณี เกิดน้ำท่วมระดับสูงในถนนสายหลัก 3 คัน จำนวน 2 จุด ได้แก่บริเวณหน้าตลาดใหม่มีนบุรี และบริเวณปากทางเข้าถนนสามวา (รถสายตรวจเทศกิจ 2 คัน รถหกล้อ 1 คัน) สอบถามข้อมูลได้ที่ฝ่ายเทศกิจ โทร 025407490
แจ้งเหตุน้ำท่วมขังหรือขอความช่วยเหลือ สามารถติดต่อได้ที่ ฝ่ายปกครอง สำนักงานเขตมีนบุรี โทร. 02-540-7214 (เวลาทำการ) หรือศูนย์วิทยุ โทร. 02-914-5838, 02 540 7490 หรือ Line@TraffyFondue ตลอด 24 ชั่วโมง
รถจักรไอน้ำแปซิฟิค 165 คลาสสิคยุคแรก ที่บูรณะไว้ในสภาพดีเยี่ยม
ปี 2566 รถจักรไอน้ำออกวิ่งแล้ว 3 ครั้ง
ในปี 2566 ขบวนรถจักรไอน้ำประวัติศาสตร์ ได้ออกวิ่งแล้ว 3 ครั้ง ดังนี้
1.
เนื่องในโอกาสวันคล้ายวันสถาปนากิจการรถไฟครบรอบ 126 ปี วันที่ 26 มีนาคม 2566 การรถไฟฯ ได้จัดเดินขบวนพิเศษรถจักรไอน้ำนำเที่ยว เส้นทางกรุงเทพ–อยุธยา พร้อมกับเปิดโอกาสให้ประชาชน และนักท่องเที่ยว ได้ร่วมเดินทางย้อนอดีตบนเส้นทางรถไฟสายประวัติศาสตร์ และร่วมน้อมรำลึกในพระมหากรุณาธิคุณของพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว รัชกาลที่ 5 เสด็จพระราชดำเนินทรงประกอบพิธีเปิดการเดินรถไฟระหว่างสถานีกรุงเทพ - สถานีกรุงเก่า เมื่อวันที่ 26 มีนาคม 2439 การจัดเดินขบวนพิเศษรถจักรไอน้ำนำเที่ยวประวัติศาสตร์ เส้นทางกรุงเทพ – อยุธยา – กรุงเทพ การรถไฟฯ ได้นำหัวรถจักรไอน้ำ รุ่นแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลกครั้งที่ 2 ผลิตโดยบริษัท นิปปอน ชาร์เรียว จำกัด ซึ่งปัจจุบันได้เก็บรักษาและซ่อมบำรุงอยู่ที่โรงรถจักรธนบุรีมาให้บริการลากจูง ในขบวนที่ 901/902 ออกจากสถานีกรุงเทพ (หัวลำโพง) เวลา 08.10 น. ถึงสถานีอยุธยา เวลา 10.20 น. จากนั้นนักท่องเที่ยวมีเวลาเดินทางไหว้พระขอพรสิ่งศักดิ์สิทธิ์ในจังหวัดพระนครศรีอยุธยา และท่องเที่ยวโบราณสถานที่ทรงคุณค่าทางประวัติศาสตร์ หรือร้านอาหารแบบผสมผสานกับบรรยากาศของความเป็นเมืองเก่าประมาณ 6 ชั่วโมง และเดินทางกลับออกจากสถานีอยุธยา เวลา 16.40 น. ถึงกรุงเทพ เวลา 18.55 น.
2.
เนื่องในโอกาสวันเฉลิมพระชนมพรรษา สมเด็จพระนางเจ้าสุทิดา พัชรสุธาพิมลลักษณ พระบรมราชินี วันที่ 3 มิถุนายน 2566 การรถไฟฯ จัดเดินขบวนรถจักรไอน้ำพิเศษนำเที่ยว เส้นทางกรุงเทพ–นครปฐม เฉลิมพระเกียรติสมเด็จพระนางเจ้าฯ พระบรมราชินี เนื่องในโอกาสวันเฉลิมพระชนมพรรษาพระราชินี 3 มิถุนายน 2566 การรถไฟฯ นำหัวรถจักรไอน้ำ รุ่นแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลกครั้งที่ 2 ผลิตโดยบริษัท นิปปอนชาร์เรียว จำกัด ซึ่งปัจจุบันได้เก็บรักษาและซ่อมบำรุงอยู่ที่โรงรถจักรธนบุรีมาเปิดให้บริการแก่ประชาชน
3.
เนื่องในโอกาสมหามงคลวันเฉลิมพระชนมพรรษา พระบาทสมเด็จพระเจ้าอยู่หัว 28 กรกฎาคม 2566 การรถไฟฯ ได้จัดขบวนรถพิเศษนำเที่ยวรถจักรไอน้ำเส้นทางประวัติศาสตร์ กรุงเทพ – อยุธยา – กรุงเทพ ได้นำหัวรถจักรไอน้ำ รุ่นแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลกครั้งที่ 2 ผลิตโดยบริษัท นิปปอน ชาร์เรียว จำกัด ซึ่งปัจจุบันได้เก็บรักษาและซ่อมบำรุงอยู่ที่โรงรถจักรธนบุรีมาให้บริการลากจูง ขบวนที่ 901/902 ออกจากสถานีกรุงเทพ (หัวลำโพง) เวลา 08.10 น. ถึงสถานีอยุธยา เวลา 10.20 น. จากนั้นนักท่องเที่ยวมีเวลาเดินทางไหว้พระขอพรสิ่งศักดิ์สิทธิ์ และท่องเที่ยวโบราณสถานที่ทรงคุณค่าทางประวัติศาสตร์ หรือร้านอาหารแบบผสมผสานกับบรรยากาศความเป็นเมืองเก่าของจังหวัดพระนครศรีอยุธยา โดยใช้เวลาประมาณ 6 ชั่วโมง และเดินทางกลับออกจากสถานีอยุธยา เวลา 16.40 น. ถึงกรุงเทพ เวลา 18.55 น.
แจ้งหยุดการแสดงชั่วคราว ตั้งแต่ วันเสาร์ที่ 5 ส.ค. 66
เอเชียทีค เดอะริเวอร์ฟร้อนท์ เดสติเนชั่น ของดการแสดงพลุชั่วคราว ในวันเสาร์ที่ 5 ส.ค. 66 เป็นต้นไปหรือจนกว่าจะมีการเปลี่ยนแปลง สามารถติดตามข่าวประชาสัมพันธ์ต่างๆได้จากทางหน้าเพจ
facebook/Asiatique.Thailandฤกษ์ออกรถปี 2566
ฤกษ์ออกรถปี 2566 เดือนมกราคม
วันจันทร์ที่ 9 มกราคม
วันอังคารที่ 17 มกราคม
วันเสาร์ที่ 21 มกราคม
วันพุธที่ 25 มกราคม
วันอาทิตย์ที่ 29 มกราคม
ฤกษ์ออกรถปี 2566 เดือนกุมภาพันธ์
วันพฤหัสบดีที่ 9 กุมภาพันธ์
วันอังคารที่ 14 กุมภาพันธ์
วันพุธที่ 15 กุมภาพันธ์
วันอาทิตย์ที่ 19 กุมภาพันธ์
วันพฤหัสบดีที่ 23 กุมภาพันธ์
วันอังคารที่ 28 กุมภาพันธ์
ฤกษ์ออกรถปี 2566 เดือนมีนาคม
วันพุธที่ 1 มีนาคม
วันอาทิตย์ที่ 5 มีนาคม
วันพุธที่ 8 มีนาคม
วันพฤหัสบดีที่ 9 มีนาคม
วันเสาร์ที่ 11 มีนาคม
วันอาทิตย์ที่ 12 มีนาคม
วันพฤหัสบดีที่ 16 มีนาคม
วันศุกร์ที่ 17 มีนาคม
วันเสาร์ที่ 25 มีนาคม
วันพฤหัสบดีที่ 30 มีนาคม
วันศุกร์ที่ 31 มีนาคม
ฤกษ์ออกรถปี 2566 เดือนเมษายน
วันเสาร์ที่ 1 เมษายน
วันอังคารที่ 4 เมษายน
วันจันทร์ที่ 10 เมษายน
วันอาทิตย์ที่ 16 เมษายน
วันจันทร์ที่ 17 เมษายน
วันอังคารที่ 18 เมษายน
วันจันทร์ที่ 24 เมษายน
วันอาทิตย์ที่ 30 เมษายน
ฤกษ์ออกรถปี 2566 เดือนพฤษภาคม
วันจันทร์ที่ 1 พฤษภาคม
วันอังคารที่ 2 พฤษภาคม
วันศุกร์ที่ 5 พฤษภาคม
วันพุธที่ 10 พฤษภาคม
วันพฤหัสบดีที่ 11 พฤษภาคม
วันจันทร์ที่ 22 พฤษภาคม
วันอังคารที่ 30 พฤษภาคม
ฤกษ์ออกรถปี 2566 เดือนมิถุนายน
วันพฤหัสบดีที่ 6 มิถุนายน
วันพุธที่ 7 มิถุนายน
วันอาทิตย์ที่ 11 มิถุนายน
วันพุธที่ 21 มิถุนายน
วันอาทิตย์ที่ 25 มิถุนายน
ฤกษ์ออกรถปี 2566 เดือนกรกฏาคม
วันพฤหัสบดีที่ 6 กรกฏาคม
วันอังคารที่ 11 กรกฏาคม
วันพุธที่ 12 กรกฏาคม
วันอาทิตย์ที่ 16 กรกฏาคม
วันพุธที่ 19 กรกฏาคม
วันพฤหัสบดีที่ 20 กรกฏาคม
วันเสาร์ที่ 22 กรกฏาคม
วันพฤหัสบดีที่ 27 กรกฏาคม
ฤกษ์ออกรถปี 2566 เดือนสิงหาคม
วันเสาร์ที่ 5 สิงหาคม
วันพฤหัสบดีที่ 10 สิงหาคม
วันศุกร์ที่ 11 สิงหาคม
วันเสาร์ที่ 12 สิงหาคม
วันอังคารที่ 15 สิงหาคม
วันจันทร์ที่ 21 สิงหาคม
วันอาทิตย์ที่ 27 สิงหาคม
วันจันทร์ที่ 28 สิงหาคม
วันอังคารที่ 29 สิงหาคม
ฤกษ์ออกรถปี 2566 เดือนกันยายน
วันศุกร์ที่ 1 กันยายน
วันพุธที่ 6 กันยายน
วันพฤหัสบดีที่ 7 กันยายน
วันศุกร์ที่ 15 กันยายน
วันพุธที่ 20 กันยายน
วันพฤหัสบดีที่ 21 กันยายน
ฤกษ์ออกรถปี 2566 เดือนตุลาคม
วันจันทร์ที่ 2 ตุลาคม
วันอังคารที่ 10 ตุลาคม
วันเสาร์ที่ 14 ตุลาคม
วันพุธที่ 18 ตุลาคม
วันอาทิตย์ที่ 22 ตุลาคม
ฤกษ์ออกรถปี 2566 เดือนพฤศจิกายน
วันพฤหัสบดีที่ 2 พฤศจิกายน
วันอังคารที่ 7 พฤศจิกายน
วันพุธที่ 8 พฤศจิกายน
วันอาทิตย์ที่ 12 พฤศจิกายน
วันพฤหัสบดีที่ 16 พฤศจิกายน
วันอังคารที่ 21 พฤศจิกายน
วันพุธที่ 22 พฤศจิกายน
วันพุธที่ 29 พฤศจิกายน
วันพฤหัสบดีที่ 30 พฤศจิกายน
ฤกษ์ออกรถปี 2566 เดือนธันวาคม
วันเสาร์ที่ 2 ธันวาคม
วันอาทิตย์ที่ 3 ธันวาคม
วันพฤหัสบดีที่ 7 ธันวาคม
วันศุกร์ที่ 8 ธันวาคม
วันเสาร์ที่ 16 ธันวาคม
วันศุกร์ที่ 22 ธันวาคม
วันเสาร์ที่ 23 ธันวาคม
รักแม่ มอบสุขภาพดี เป็นของขวัญ @รพ.กรุงเทพหาดใหญ่
รักแม่ มอบสุขภาพดี เป็นของขวัญ
โปรแกรมตรวจสุขภาพ Happy Healthy Mom ราคา 2,600 บาท (17 รายการ)
ฟรี! พวงมาลัยผ้าพันคอ มูลค่า 399 บาท (จำนวนจำกัด) เมื่อซื้อโปรแกรม Happy Healthy และโปรแกรมตรวจอื่นๆ ในโปรโมชั่นครบรอบ 26 ปี ครบ 3,000 บาท
เปิดจำหน่าย 7-14 ส.ค.66
รับบริการได้ตั้งแต่ 7 ส.ค. - 30 พ.ย.66
หรือซื้อได้ที่บูธมหกรรมสุขภาพ ชั้น 2 รพ.กรุงเทพหาดใหญ่ เวลา 09.00 - 16.00น
โรงพยาบาลมุกดาหารอินเตอร์เนชั่นแนล ....เปิดรับ LINK
1. ผู้จัดการฝ่ายการพยาบาล 1 อัตรา
-จบหลักสูตรปริญญาตรี สาขาพยาบาลศาสตร์
-มีใบประกอบวิชาชีพพยาบาล
-มีประสบการณ์การทำงานในโรงพยาบาล 5 ปีขึ้นไป
-มีประสบการณ์ด้านการบริหารจัดการ
-มีภาวะความเป็นผู้นำสูง มีทักษะในการสื่อสาร
-มีความสามารถในการวางแผนและการจัดการที่ดี
2.พยาบาลวิชาชีพ 5 อัตรา
-เพศหญิง อายุไม่เกิน 35 ปี
-จบหลักสูตรปริญญาตรี สาขาพยาบาลศาสตร์
-มีใบประกอบวิชาชีพพยาบาล
-หากมีประสบการณ์การทำงานจะพิจารณาเป็นพิเศษ
สถานที่ปฏิบัติงาน : โรงพยาบาลนายแพทย์หาญ จ.ยโสธร
ช่องทางการรับสมัคร
1. ส่ง Resume เอกสารการสมัคร มาที่ E-Mail : hr@mukinter.com
2. สอบถามรายละเอียดเพิ่มเติมได้ที่เบอร์ 042-611222 ต่อ 161 โทรศัพท์มือถือ 091-865-4012
1949
สำหรับในช่วงหลังสงครามโลกครั้งที่สอง คณะอเมริกันเพรสไบที่เรียนมิชชั่นได้ร่วมกับสภาคริสุตจักร ในประเทศไทย ซื้อที่ดินบนถนนสีลม มีเนื้อที่ประมาณ 1 1 ไร่ พร้อมอาคารไม้หลังเก่าที่ปลูกสร้างอยู่เดิม และดัดแปลงอาคารให้เหมาะสมที่จะใช้เป็นโรงพยาบาลและได้มีพิธีเปิดอย่างเป็นทางการ ในวันเสาร์ที่ 3 ธันวาคม ค.ศ. 1949 (พ.ศ. 2492) ใช้ชื่อว่า "โรงพยาบาลกรุงเทพฯคริสเตียนพยาบาล " โดยมี *พณฯ จอมพลแปลกพิบูลสงคราม นายกรัฐมนตรีเป็นประธาน
รางวัลชนะเลิศ Matias Bercovich
เพื่อก้าวขึ้นเป็นเซียนด้านขนมปัง กับ International Bakery Certificated Course@Food school LINK
คว้าโอกาสการเป็นเซียนด้านขนมปัง กับ “International Bakery Certificated Course” หลักสูตรใหม่ล่าสุดจาก The Food School Bangkok ที่พร้อมพาคุณท่องโลกของขนมปัง ขนมอบ และเบเกอรีต่างๆ จาก 31 สัญชาติ ให้คุณได้อัพสกิลแบบรอบโลกทั้งฝั่งตะวันตกและฝั่งตะวันออก ผ่านการลงมือปฏิบัติจริงตลอดทั้ง 256 ชั่วโมงเรียน สอนโดย Bakery Chef ระดับมืออาชีพอย่าง Chef Cyril Dubrous สอบถามข้อมูลเพิ่มเติม พร้อมสมัครเรียนได้แล้ววันนี้!
- เจาะลึกทุกองค์ความรู้ตั้งแต่ทฤษฎีของการรังสรรค์ขนมปังและขนมอบประเภทต่างๆ
- สนุกกับการเรียนรู้แบบ Recipe-based ลงมือทำมากกว่า 100+ เมนู พร้อมให้คุณสามารถเปิดร้านได้หลังเรียนจบ
- อัปเกรดความรู้ด้านขนมอบและเบเกอรีสไตล์อิตาเลียน สอนโดยเชฟจากสถาบัน ALMA – The School of Italian Culinary Arts
- เรียนจบ รับ Certificate of Completion จาก The Food School Bangkok และจากสถาบันระดับโลก อย่าง ALMA – The School of Italian Culinary Arts
ค่าเรียน 245,000+ บาท/ระดับ Tel.: 02-150-8786
ข้าวหมูแดงสีมรกต ซอยสุกร 1
ข้าวหมูแดงสีมรกต ซอยสุกร 1 ชื่อนี้ไม่เอ่ยถึงคงไม่ได้ บอกว่าไม่เคยไปกินคงโดนหยิก ค่ะ เคยไปกินค่ะ ข้าวหมูแดงสูตรแต้จิ๋วตรอกโรงหมูแห่งนี้ เปิดร้านมาผ่าน 70 ปีไปแล้ว ไม่เด็ดจริงลูกค้าคงไม่แน่นทุกวันแน่ๆ ถามว่าชอบไหม ตอบเลยว่าก็ชอบเหมือนท่านอื่นๆ น้ำราดสไตล์แต้จิ๋ว สีส้มผสมถั่วและงา ที่เคี่ยวน้ำต้มกระดูกหมูกับเครื่องเทศยาจีน หนืดพองาม เคี้ยวแล้วกลมกลืนกับหมูแดงเตาถ่านและหมูกรอบกรุบ กุนเชียงก็รสดีเข้ากัน กินให้ครบเลย อีกอย่างที่ลืมบอกไปเลยคือไข่ต้มยางมะตูมสีส้มแจ๊ดนุ่มปากอย่างคุ้นเคยมาก พอแค่นี้ก่อนนะคะ เปรี้ยวปากค่ะ
ร้านอยู่ในซอยสุกร 1 เยื้องวัดไตรมิตรเล็กน้อย พ้นหัวลำโพงข้ามสะพานข้ามคลองผดุงฯ มานิดเดียว แนบซ้ายไว้เลย ซอยเล็กหน่อยต้องค่อยๆ ไปนะคะ แต่หาที่จอดรถยากค่ะ นั่งรถไฟใต้ดินไป หรือนั่งรถรับจ้างไปง่ายกว่า ร้านบอกว่าเปิด 9 โมงเช้า ถึง 4 โมงเย็น แต่หลายทีก็หมดก่อนเวลาปิด ไปแต่เนิ่นๆ ได้กินชัวร์ค่ะ
ร่วมสมทบทุนเพื่อสร้างบ้านหลังที่สองของเด็กป่วย รพ.สรรพสิทธิประสงค์ อุบลราชธานี


รองศาสตราจารย์ แพทย์หญิงดุจใจ ชัยวานิชศิริ ผู้อำนวยการศูนย์บริการโลหิตแห่งชาติ สภากาชาดไทย กล่าวว่า “ศูนย์บริการโลหิตแห่งชาติ สภากาชาดไทย เป็นองค์กรการกุศลระดับชาติ ดำเนินการเพื่อมนุษยธรรมตามหลักกาชาดสากล การบริการโลหิต ถือเป็นหนึ่งในภารกิจหลักของสภากาชาดไทย และได้รับมอบหมายจากรัฐบาลให้มีหน้าที่ในการจัดหาโลหิตให้มีปริมาณเพียงพอ ปลอดภัย และมีคุณภาพสูงสุด จากผู้บริจาคโลหิตด้วยความสมัครใจไม่หวังสิ่งตอบแทน เพื่อนำไปใช้รักษาผู้ป่วยทั่วประเทศ” จากสถานการณ์การบริจาคโลหิตปัจจุบัน พบว่าปริมาณการจัดหาโลหิตยังไม่สม่ำเสมอ มีการขาดแคลนโลหิตบางช่วงเวลา และบางเดือน ส่งผลกระทบทำให้ปริมาณโลหิตสำรองคงคลังไม่เพียงพอ ทั้งในภาวะปกติ และในภาวะวิกฤติที่ต้องใช้โลหิตในการรักษาอย่างเร่งด่วนจำนวนมาก หน่วยงานภาครัฐและเอกชนต่างให้ความสำคัญและช่วยเหลือจัดกิจกรรมบริจาคโลหิต รวมถึง 2 หน่วยงาน 2 องค์กรหลัก ได้แก่ รถไฟฟ้า ร.ฟ.ท. และ เอเชีย เอรา วัน ที่ได้ร่วมกันจัดงานบริจาคโลหิตที่มีจิตอันเป็นกุศล โดยจัดเตรียมอำนวยความสะดวกในทุก ๆ ด้าน ทั้งสถานที่ บุคลากร และอุปกรณ์ต่าง ๆ รองรับ การจัดกิจกรรมบริจาคโลหิตในครั้งนี้ และคาดว่าในอนาคตจะสามารถใช้สถานที่นี้ในการเปิดเป็นจุดรับบริจาคโลหิตประจำได้อีกในอนาคต”
รู้หรือไม่ เรื่องโซเดียม
โซเดียมนั้นมีประโยชน์ แต่ถ้าร่างกายได้รับโซเดียมเกินความต้องการมากๆ เข้า ก็อาจส่งผลเสียได้ทั้งไตและหัวใจ ยังมีความรู้เกี่ยวกับโซเดียมที่ยังไม่รู้หรือยังเข้าใจไม่ถูกต้องอีกมากที่ต้องค่อยเรียนรู้กัน เพื่อจะได้ระวังป้องกัน
- โซเดียมไม่ได้มากับความเค็มเสมอไป ยังมีอาหารอีกหลายชนิดที่ไม่เค็ม แต่มีโซเดียมแฝงอยู่
- อาหารหวานหลายประเภท แต่ก็มีโซเดียมอุดมนะจ๊ะ ทำให้เราได้รับความเค็มโดยไม่รู้ตัว ก็คืออาหารมีโซเดียมแฝงต่างๆ อาทิ เค้ก ขนมปัง พิซซ่า น้ำผลไม้ น้ำอัดลม ฯลฯ อ่านเรื่อง 5 ประเภทโซเดียมแฝง โดยกรมอนามัย (ด้านล่าง)
- โรคที่เกิดจากการบริโภคโซเดียมมากเกินไป เช่น ไตวาย โรคกระดูกพรุน โรคความดันโลหิตสูง โรคหัวใจ โรคหลอดเลือดในสมอง โรคมะเร็งกระเพาะอาหาร โรคหอบหืด
- สังเกตปริมาณโซเดียมจากฉลากโภชนาการ ช่วยให้เรารู้ปริมาณการรับโซเดียมได้ หลักจำง่ายคือ อาหารมื้อหลักไม่ควรให้โซเดียมเกิน 600 มก./วัน ส่วน อาหารว่างไม่ควรมีโซเดียมเกิน 200 มก./วัน
- กินน้ำมากๆ และการออกกำลังกายอาจไม่ได้ช่วยขับโซเดียมได้มากอย่างที่คิด
- ไตมีความสามารถขับโซเดียมผ่านน้ำปัสสาวะ ได้ 450-500 mEq ต่อวัน หรือประมาณ 10,350 - 11,500 มก. เท่ากับการกินเกลือ 5.2 - 5.75 ช้อนชา
- การออกกำลังกายไม่ใช่กลไกหลักในการขับโซเดียม ร่างกายขับเหงื่อเพื่อขับความร้อนและรักษาอุณหภูมิร่างกายให้ปกติ โซเดียมออกมาทางเหงื่อได้ แต่น้อยมาก อ่าน กลไกการขับโซเดียมออกจากร่างกาย
- คนป่วยเบาหวาน ต้องระมัดระวังการบริโภคโซเดียมมากเกิน เพราะมีผลต่อไต อ่านเพิ่มเติม
เส้นทางมาโรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน
เส้นทางมาโรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน
ติดต่อสอบถามและทำนัด โทร.044-300974 หรือ 064-2055962
โมเดลการดูแลผู้ป่วยแบบใหม่เพื่อประสิทธิภาพ ทั้งด้านผลลัพธ์ทางสุขภาพและแนวทางการทำงาน
นอกจากขยายการเข้าถึงบริการสาธารณสุขและปรับปรุงผลลัพธ์ของการดูแลผู้ป่วยแล้ว รายงาน FHI ยังเผยให้เห็นว่าการนำโมเดลการดูแลผู้ป่วยแบบใหม่มาใช้ จะช่วยให้ผู้บริหารแถวหน้าของวงการเฮลท์แคร์ในภูมิภาคนี้ สามารถขับเคลื่อนให้เกิดการทำงานที่มีประสิทธิภาพและยั่งยืนมากขึ้น โดยสองในสาม (66%) ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์และบุคลากรทางการแพทย์รุ่นใหม่บอกว่า พวกเขามีความพร้อมในการทำงานอย่างมีประสิทธิภาพด้วยโมเดลการดูแลผู้ป่วยแบบใหม่ ในขณะที่ 63% เชื่อว่าการดูแลรักษาผู้ป่วยสามารถดำเนินการไปได้พร้อมๆ กับความเป็นมิตรต่อสิ่งแวดล้อมและความยั่งยืน
ผลสำรวจยังเผยให้เห็นถึงผลกระทบเชิงบวกต่อกำลังใจและการรักษาบุคลากรไว้ในองค์กร โดยบุคลากรทางการแพทย์ส่วนใหญ่หวังว่าโมเดลการดูแลผู้ป่วยแบบใหม่จะช่วยให้พวกเขามีสมดุลในการทำงาน (work-life balance) ที่ดีขึ้น (58%) และสร้างความพึงพอใจในการทำงานมากขึ้น (56%) มากกว่าโมเดลการดูแลผู้ป่วยแบบเดิมๆ
นอกจากนี้ 44% ของกลุ่มตัวอย่างในภูมิภาคนี้ยังเห็นว่าโมเดลการดูแลผู้ป่วยแบบใหม่มีประโยชน์ในด้านการยอมรับและปฏิบัติตามของผู้ป่วยในการรักษา ในขณะที่ 36% เห็นว่าช่วยให้ความรู้ความเข้าใจกับผู้ป่วยได้ดีขึ้น และ 35% เห็นว่าช่วยเพิ่มประสิทธิภาพ (เช่น ระยะเวลารอคอยในการรักษาที่สั้นลง, แพทย์ได้ตรวจและพบปะผู้ป่วยมากขึ้น) ความร่วมมือกับชุมชนเพื่อพัฒนาด้านสุขภาวะของประชากร และยกระดับความก้าวหน้าทางเทคโนโลยีเฮลท์แคร์มากขึ้น
ระบบ AI อัจฉริยะทำงานอย่างไร
ใช้กล้อง AI ตรวจจับรถจักรยานยนต์ขับขี่ จอดบนทางเท้า มีระบบการทำงาน โดยเมื่อกล้องตรวจจับความผิดได้ว่ามีการขับขี่บนทางเท้า ระบบจะประมวลภาพหาข้อมูลเจ้าของรถ แล้วส่งใบแจ้งค่าปรับถึงผู้กระทำผิด ให้ไปจ่ายค่าปรับต่อไป
ภาพล่าสุด
ปลอดภัยนะครับ เปลี่ยนที่นอน ขอพักผ่อนก่อนครับ ขอบคุณทุกคนที่เป็นห่วงครับ
โรงพยาบาลบางมด เป็นโรงพยาบาลเอกชนที่มีชื่อเสียงและมีคุณภาพมาอย่างยาวนานและยังเป็นโรงพยาบาลแห่งแรกบนถนนพระราม 2 ซึ่งปัจจุบันเร่งเดินหน้าขยายธุรกิจโรงพยาบาลเสริมความงามแบบครบวงจรอย่างแข็งแกร่ง พร้อมรุกจุดยืนศัลยกรรมหลักล้านที่แรกในไทย ภายใต้ชื่อ Bangmod Aesthetic & Wellness Hospital โดยเจาะกลุ่มลูกค้าและมุ่งบริการศัลยกรรมแบบ Ultra Luxury แบบครบวงจรแห่งแรก
สมาพันธ์ประมงญี่ปุ่นเรียกร้องรัฐบาลรับมือผลกระทบจากการปล่อยน้ำจากโรงไฟฟ้านิวเคลียร์ฟูกูชิมะ ไดอิจิ
ประธานสมาพันธ์ประมงแห่งญี่ปุ่นย้ำว่า ทางกลุ่มต้องการให้รัฐบาลดำเนินการเพื่อให้แน่ใจในเรื่องความปลอดภัยและลดผลกระทบต่อชื่อเสียง ในการปล่อยน้ำที่ได้รับการบำบัดและเจือจางแล้วจากโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะ ไดอิจิลงทะเล
นายซากาโมโตะ มาซาโนบุ ประธานสมาพันธ์สมาคมสหกรณ์ประมงแห่งชาติระบุในแถลงการณ์ในวันพฤหัสบดีที่ 24 สิงหาคมว่า ตอนนี้ผู้ที่เกี่ยวข้องกับอุตสาหกรรมประมงทั่วประเทศกังวลมากขึ้นไปอีกจากที่เริ่มกระบวนการปล่อยน้ำ
นายซากาโมโตะกล่าวว่า "เรายังคงคัดค้านการปล่อยน้ำที่ได้รับการบำบัดแล้วลงทะเล"
นายซากาโมโตะยังได้เรียกร้องอย่างจริงจังไปยังรัฐบาล ให้ดำเนินการในทันทีในการรับมือกับการเสียชื่อเสียงที่เกิดจากข่าวลือซึ่งได้แพร่ออกไปแล้ว
เขาได้เรียกร้องให้รัฐบาลทำตามสัญญาที่นายกรัฐมนตรีคิชิดะ ฟูมิโอะได้ให้ไว้ต่ออุตสาหกรรมประมง
ผู้นำญี่ปุ่นได้กล่าวว่า รัฐบาลจะสนับสนุนการประมงของญี่ปุ่นและดำเนินมาตรการที่จำเป็นอย่างต่อเนื่อง นอกจากนั้นจะรับผิดชอบอย่างเต็มที่ต่อผลกระทบที่เกิดจากการปล่อยน้ำ ถึงแม้ว่าจะใช้เวลาหลายสิบปีกว่าจะเสร็จสมบูรณ์ก็ตาม
NHK
โรคไข้เลือดออก..อันตราย (อาจทำให้เสียชีวิตได้)
หลังจากมีอาการแสดงวันที่ 3 เป็นต้นไป ผู้ป่วยมีโอกาสที่จะมีภาวะเลือดออกได้ อาการดังกล่าวเป็นกลไกของโรคไข้เลือดออก ส่งผลให้ระดับเกล็ดเลือดลดต่ำลงเรื่อยๆซึ่งเราจะสามารถสังเกตอาการที่บ่งชี้ถึงความรุนแรงของโรคได้ในช่วงที่มีไข้ตั้งแต่วันที่ 3 เป็นต้นไป ผู้ป่วยอาจเกิดอาการรุนแรงและเสี่ยงเกิดอาการช็อกได้ เมื่อไข้ลดลงใน 24 ชั่วโมงแรก ซึ่งถือเป็นช่วงเวลาโรคไข้เลือดออก...อันตราย (อาจเสียชีวิตได้) สิ่งสำคัญที่จะต้องเฝ้าสังเกตอาการอย่างใกล้ชิดในโรงพยาบาล
มีไข้....ให้ระวังไข้เลือดออก
#ป้องกันอย่าให้โดนยุงกัด
โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
39 ถนนอังรีดูนังต์ เขตปทุมวัน กรุงเทพมหานคร 10330
บริการ
หอสัตว์ป่วยใน แผนกชันสูตรโรคสัตว์ คลินิกอายุรกรรม คลินิกศัลยกรรม คลินิกสูติกรรม คลินิกฉุกเฉิน ธนาคารเลือด คลินิกผิวหนัง คลินิกระบบประสาท คลินิกหัวใจ คลินิกระบบขับถ่ายปัสสาวะ คลินิกเบาหวาน คลินิกมะเร็ง คลินิกสัตว์เลี้ยงพิเศษ คลินิกฝังเข็ม คลินิกเวชศาสตร์ฟื้นฟู ศูนย์โรคแมวเพื่อความเป็นเลิศ ศูนย์รังสีวินิจฉัย เอกซเรย์ อัลตราซาวนด์ ซ๊ทีสแกน คลินิกจักษุ
เวลาทำการ
จันทร์-ศุกร์ ในเวลา 08.00 -15.00 น. นอกเวลา 17.00 - 20.00 น.
เสาร์-อาทิตย์ และวันหยุด ในเวลา 08.30 -11.00 น. นอกเวลา 13.00 - 20.00 น.
ฉุกเฉิน เปิดตลอด 24 ชั่วโมง เฉพาะทางในเวลาเท่านั้น
โทร : 02-218-9751, 02-218-9715
Facebook |
Website |
แผนที่เชฟรอนส่งครูอาสาเปิดโลกความรู้สู่วิชานอกห้องเรียนกับ After School Program
เชฟรอนส่งครูอาสาเปิดโลกความรู้สู่วิชานอกห้องเรียนกับ After School Program 2 ท่าน ได้แก่ นายปริญญา ผลบุตร หรือ คุณหนุ่ม ผู้มีอาชีพหลักเป็นนักธรณีวิทยา (Petrophysicist) นายภาณุ บุญวัฒโนภาส หรือคุณบอย รองประธานกรรมการบริหาร ฝ่ายดิจิทัล และเทคโนโลยีสารสนเทศ บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด จากการดำเนินงานโครงการอาสาจุฬาภรณ์ที่ผ่านมาพบว่าอาสาจุฬาภรณ์รุ่นที่ 1 และ 2 มีความรู้ความเข้าใจที่ถูกต้องในการดูแลสุขภาพอนามัยของตนเองได้ดี สามารถถ่ายทอดความรู้ระหว่างกัน และสามารถดูแลสุขภาพคนในชุมชนได้อย่างมีประสิทธิภาพ เห็นได้จากการที่ชุมชนดังกล่าว ได้ผ่านวิกฤตการณ์แพร่ระบาดของ โรค COVID-19 ที่ผ่านมาได้อย่างเข้มแข็งและปลอดภัย
Download လမ်းညွှန်အပြည့်အစုံ
สุขสำราญนิทราคลินิก คลินิกปวดเรื้อรังและนอนไม่หลับ
สุขสำราญนิทราคลินิก คลินิกอาการปวดเรื้อรัง และ นอนไม่หลับ Chronic Pain and Insomnia ศูนย์ส่งเสริมสุขภาพแผนไทย กระทรวงสาธารณสุข เปิดให้บริการดูแลรักษาผู้ป่วยและจัดการอาการปวดเรื้อรัง และ นอนไม่หลับ ด้วยศาสตร์การแพทย์แผนไทยและการแพทย์ผสมผสาน
อาการที่พบบ่อย
นอนไม่หลับ
ปวดจากมะเร็ง
ปวดศีรษะไมเกรน
ปวดเข่า
ปวดกล้ามเนื้อ
*มีอาการมากกว่า 3 เดือนขึ้นไป
กิจกรรมในการรักษา
นวดกดจุดเพื่อการรักษา
ประคบสมุนไพรเพื่อการรักษา
อบสมุนไพรเพื่อการรักษา
แช่ยาสมุนไพร
พอกยาสมุนไพร
กักน้ำมัน (เฉพาะวันพฤหัสบดี)
รมยาสมุนไพร
ห้ตถการแผนจีน (ฝังเข็ม)
ยาสมุนไพร
ติดตามข้อมูลข่าวสารเพิ่มเติมได้ที่ 02-5902606
ศูนย์ส่งเสริบสุขภาพแผนไทย อาคารเรือนไทย
นัดหมายล่วงหน้าโทร. 02-5902606
เปิดให้บริการทุกวัน อังคาร และ พฤหัสบดี 9.00-15.00 น.
หลักเกณฑ์การเข้าร่วมโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด
คุณสมบัติ เด็กแรกเกิดที่มีสิทธิ
- มีสัญชาติไทย (พ่อแม่มีสัญชาติไทย หรือพ่อหรือแม่มีสัญชาติไทย)
- เกิดตั้งแต่วันที่ 1 ตุลาคม 2558 เป็นต้นไป จนมีอายุครบ 6 ปี
- อาศัยอยู่กับผู้ปกครองที่อยู่ในครัวเรือนที่มีรายได้น้อย
- ไม่อยู่ในสถานสงเคราะห์ของหน่วยงานของรัฐ หรือเอกชน
ผู้ปกครองที่มีสิทธิลงทะเบียน
- มีสัญชาติไทย
- เป็นบุคคลที่รับเด็กแรกเกิดไว้ในความอุปการะ
- เด็กแรกเกิดต้องอาศัยรวมอยู่ด้วย
- อยู่ในครัวเรือนที่มีรายได้น้อย คือ สมาชิกครัวเรือนมีรายได้เฉลี่ยไม่เกิน 100,000 บาท ต่อคน ต่อปี
* หมายเหตุ มารดาที่อยู่ระหว่างการตั้งครรภ์ยังไม่ต้องมายื่นคําร้องขอลงทะเบียนขอรับสิทธิเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด
สถานที่รับลงทะเบียน
สามารถลงทะเบียนได้ในพื้นที่ที่เด็กแรกเกิด และผู้ปกครองอาศัยอยู่จริง ดังนี้
- กรุงเทพมหานคร : ลงทะเบียนที่สํานักงานเขต
- เมืองพัทยา : ลงทะเบียนที่ศาลาว่าการเมืองพัทยา
- ส่วนภูมิภาค : ลงทะเบียนที่องค์การบริหารส่วนตําบล หรือเทศบาล
เอกสารประกอบการลงทะเบียน
ประกอบด้วย
- แบบคําร้องขอลงทะเบียน (ดร.01)
- แบบรับรองสถานะของครัวเรือน (ดร.02)
- บัตรประจําตัวประชาชนของผู้ปกครอง
- สูติบัตรเด็กแรกเกิด
- สมุดบัญชีเงินฝากของผู้ปกครอง (บัญชีออมทรัพย์ธนาคารกรุงไทย บัญชีเงินฝากเผื่อเรียกธนาคารออมสิน หรือบัญชีเงินฝากออมทรัพย์ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร (ธกส.) อย่างใดอย่างหนึ่งเท่านั้น)
- สมุดบันทึกสุขภาพแม่และเด็ก เฉพาะหน้าที่ 1 ที่มีชื่อของหญิงตั้งครรภ์ (ในกรณีที่สมุดสูญหายให้ใช้เฉพาะสําเนาหน้าที่ 1 พร้อมให้เจ้าหน้าที่สาธารณสุขบันทึกข้อมูลและรับรองสําเนา)
- กรณีที่ผู้ยื่นคําร้องขอลงทะเบียนและสมาชิกในครัวเรือนของผู้ยื่นคําร้องขอลงทะเบียน เป็นเจ้าหน้าที่ของรัฐ พนักงานรัฐวิสาหกิจ หรือพนักงานบริษัท ต้องมีเอกสาร ใบรับรองเงินเดือน หรือหนังสือรับรองรายได้ของทุกคนที่มีรายได้ประจํา(สลิปเงินเดือน หรือเอกสารหลักฐานที่นายจ้างลงนาม)
- สําเนาเอกสาร หรือบัตรข้าราชการ เจ้าหน้าที่ของรัฐ บัตรแสดงสถานะหรือตําแหน่ง หรือเอกสารอื่นใดที่แสดงตนของผู้รับรองคนที่ 1 และผู้รับรองคนที่ 2
การทำศัลยกรรม ในแต่ละประเทศ
สหรัฐอเมริกา รวม 7,448,196 ครั้ง (ผ่าตัด 1,645,435 ไม่ผ่าตัด 5,802,761 )
บราซิล รวม 3,020,552 (ผ่าตัด 2,049,257 ไม่ผ่าตัด 971,294)
ญี่ปุ่น รวม 2,459,326 (ผ่าตัด 359,157 ไม่ผ่าตัด 2,100,169)
เม็กซิโก รวม 1,693,325 (ผ่าตัด 938,096 ไม่ผ่าตัด 755,229)
ตุรกี รวม 1,097,054 (ผ่าตัด 470,875 ไม่ผ่าตัด 626,179)
เยอรมัน รวม 1,032,791 (ผ่าตัด 461,130 ไม่ผ่าตัด 571,661)
อาร์เจนตินา รวม 1,016,517 (ผ่าตัด 461,589 ไม่ผ่าตัด 554,929)
อิตาลี รวม 747,391 (ผ่าตัด 262,556 ไม่ผ่าตัด 747,391)
โคลัมเบีย รวม 732,783 (ผ่าตัด 466,453 ไม่ผ่าตัด 266,330)
อินเดีย รวม 711,922 (ผ่าตัด 387,767 ไม่ผ่าตัด 324,155)
สเปน รวม 431,315 (ผ่าตัด 220,960 ไม่ผ่าตัด 210,355)
กรีซ รวม 426,323 (ผ่าตัด 102,437 ไม่ผ่าตัด 323,886)
อิหร่าน รวม 321,094 (ผ่าตัด 182,814 ไม่ผ่าตัด 138,280)
โรเมเนีย รวม 235,604 (ผ่าตัด 93,558 ไม่ผ่าตัด 142,046)
สหราชอาณาจักร รวม 208,296 (ผ่าตัด 130,372 ไม่ผ่าตัด 77,924)
ไทย รวม 170,664 (ผ่าตัด 127,235 ไม่ผ่าตัด 43,429)
คำแนะนำวิธีพบโพสต์ปลอม ทำอย่างไร
คำแนะนำวิธีพบโพสต์ปลอม ทำอย่างไร
1. กดไปที่จุด 3 จุดมุมบนขวา
2. กดไปที่ Report Post รายงานโพสต์ปลอม
3. กด emoticon รูปโกรธใต้โพสต์เพื่อช่วยกันเตือนว่า โพสต์นี้เป็นโพสต์ปลอม
เกี่ยวกับโครงการเงินอุดหนุนเด็ก
โครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด ดำเนินการโดย กรมกิจการเด็กและเยาวชน กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ มีวัตถุประสงค์เพื่อสนับสนุนครอบครัวให้สามารถสนองตอบต่อความต้องการขั้นพื้นฐานของเด็กกลุ่มเปราะบางที่สุดของประเทศไทย และส่งเสริมการเข้าถึงบริการหลักในด้านต่างๆ เพื่อให้เด็กมีพัฒนาการที่สมวัยและพัฒนาศักยภาพได้อย่างเต็มที่ หยุดความยากจนที่ส่งต่อจากรุ่นสู่รุ่น
เงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดเป็นการจัดสวัสดิการในรูปแบบเงินสดที่ให้โดยไม่มีเงื่อนไข และผู้ได้รับประโยชน์ไม่ต้องจ่ายสมทบ โดยเริ่มโครงการดังกล่าวในปี พ.ศ. 2558 ในระยะแรกเริ่มโครงการนั้น ได้กำหนดเกณฑ์รายได้ของพ่อแม่หรือผู้ปกครองเด็กผู้มีสิทธิได้เงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดเฉลี่ย 36,000 บาทต่อปี โดยกำหนดเกณฑ์อายุเด็ก 0-1 ปี ได้รับเงินเดือนละ 400 บาทต่อคน ต่อมาในปี พ.ศ. 2559 ได้ขยายสิทธิอายุเด็กเป็น 0-3 ปี และเพิ่มเงินเป็นเดือนละ 600 บาทต่อคน และในปี พ.ศ. 2562 ได้เพิ่มและขยายเกณฑ์อีกครั้ง โดยได้ขยายเกณฑ์อายุเด็กเป็น 0-6 ปี และขยายเกณฑ์รายได้ของพ่อแม่หรือผู้ปกครองเด็กผู้มีสิทธิเฉลี่ย 100,000 บาทต่อปี
ปฏิทินการจ่ายเงินอุดหนุน ประจำปีงบประมาณ พ.ศ.2566 เห็ดไทย ไม่แพ้ชาติใดในโลก เมื่อสหรัฐฯ จดสิทธิบัตร ยาซึมเศร้า จาก เห็ดขี้ควาย - salika
เว็บไซต์ Salika เผยแพร่บทความ
เรื่อง เห็ดไทย ไม่แพ้ชาติใดในโลก เมื่อสหรัฐฯ จดสิทธิบัตร ยาซึมเศร้า จาก เห็ดขี้ควาย เล่าถึงก้าวสำคัญในวงการยาของสหรัฐและของโลก เมื่อนิตยสารนิวส์วีคตีพิมพ์บทความและขึ้นปก เรื่อง A New Treatment for Depression เป็นเรื่องการที่ประเทศสหรัฐอเมริการ ทำการจดสิทธิบัตรขั้นตอนการสกัดสาร Psilocybin และ Psilocine ที่เป็นสารสกัดจาก เห็ดขี้ควาย วงการยาสหรัฐฯ ได้มีการจดสิทธิบัตรสารสกัดจาก “เห็ดขี้ควาย” มาตั้งแต่ปี ค.ศ.1958 เลขสิทธิบัตร US3183172A นอกจากนี้ ยังมีการพัฒนายาจากสารสกัดจาก “เห็ดขี้ควาย” ร่วมกับเห็ดอื่น โดยจดสิทธิบัตรไว้เมื่อวันที่ 25 มกราคม ปี ค.ศ. 2018 เลขสิทธิบัตร 20180021326 เพื่อใช้กับ “ผู้ป่วยซึมเศร้า”
ส่วน “พี่ไทย” ได้จัดให้ ดอกเห็ด ก้านเห็ด และสปอร์ รวมถึงส่วนต่างๆ ของ “เห็ดขี้ควาย” ที่มีสาร Psilocybine หรือ Psilocine อยู่ในบัญชียาเสพติดให้โทษประเภท 5 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
อ่าน
เนื้อหาทั้งหมดได้ที่ Salikaรพ.วิภาวดี วัคซีนไข้เลือดออก 4 สายพันธุ์ ชนิดใหม่ (2 เข็ม)
ไข้เลือดออก ระบาดสูงสุดในรอบ 5 ปี !! ปกป้องคนที่คุณห่วงใยด้วย วัคซีนไข้เลือดออก 4 สายพันธุ์ ชนิดใหม่ (2 เข็ม) - สามารถฉีดได้ตั้งแต่อายุ 4 – 60 ปี - ราคา 2 เข็ม 4,300 บาท รวมค่าบริการรพ. **(ไม่รวมค่าแพทย์)** เริ่ม ตั้งแต่ วันนี้ - 31 ธ.ค. 66 สอบถามเพิ่มเติมได้ที่ เด็ก : แผนกกุมารเวช : 02-561-1111 ต่อ 4221 ผู้ใหญ่ :แผนกอายุรกรรม : 02-561-1111 ต่อ1222
วัคซีนไข้หวัดใหญ่ชนิด 4 สายพันธุ์ คืออะไร
นับตั้งแต่มีการแยกเชื้อไวรัสไข้หวัดใหญ่ได้ครั้งแรกในปีค.ศ. 1933 วัคซีนป้องกันไข้หวัดใหญ่ได้ถูกผลิตขึ้น และมีการพัฒนาอย่างต่อเนื่อง เพื่อให้เหมาะสมและตรงกับการระบาดของสายพันธุ์ไวรัสไข้หวัดใหญ่ ดังนี้
1. วัคซีนไข้หวัดใหญ่ ชนิด 1 สายพันธุ์ ประกอบไปด้วยไวรัสไข้หวัดใหญ่ชนิด A สายพันธุ์ H1N1
2. วัคซีนไข้หวัดใหญ่ ชนิด 2 สายพันธุ์ ประกอบไปด้วยไวรัสไข้หวัดใหญ่ชนิด A 1 สายพันธุ์และ ชนิด B 1 ตระกูล
3. วัคซีนไข้หวัดใหญ่ ชนิด 3 สายพันธุ์ ประกอบด้วยไวรัสไข้หวัดใหญ่ชนิด A 2 สายพันธุ์ คือ H1N1 , H3N2 และสายพันธุ์ B 1ตระกูล
จนกระทั่งปี ค.ศ. 2012 องค์การอนามัยโลก (WHO) ได้แนะนำให้เพิ่มไวรัสสายพันธุ์ B เข้าไปอีก 1 ตระกูล ทำให้วัคซีนป้องกันไข้หวัดใหญ่สามารถป้องกันเชื้อไวรัสไข้หวัดใหญ่ได้ครอบคลุม 4 สายพันธุ์ ซึ่งประกอบด้วยไวรัสไข้หวัดใหญ่ชนิด A 2 สายพันธุ์ คือ H1N1 , H3N2 และชนิด B 2 ตระกูลคือ Victoria, Yamagata
ข้อมูลระบาดวิทยาของไวรัสไข้หวัดใหญ่ในอดีต พบว่าเกิดจากเชื้อไวรัสสายพันธุ์ A (H1N1,H3N2) เป็นหลัก แต่ในปัจจุบันพบว่า สายพันธุ์ B เป็นสาเหตุที่พบได้บ่อยเพิ่มขึ้น และพบมีการระบาดร่วมกัน 2 ตระกูล (lineage) คือ Victoria และ Yamagata ซึ่งเดิมองค์การอนามัยโลกจะเลือกไวรัสสายพันธุ์ A 2 สายพันธุ์ และ สายพันธุ์ B เพียง 1 ตระกูลมาใช้ในการผลิตวัคซีน หากสายพันธุ์B ที่มีในวัคซีนไม่ตรงกับสายพันธุ์ที่ระบาด จะมีโอกาสเสี่ยงต่อการระบาดของโรคไข้หวัดใหญ่สายพันธุ์ B ที่ไม่มีอยู่ในวัคซีน และอีกประเด็นที่สำคัญคือ ไข้หวัดใหญ่ที่เกิดจากไวรัสไข้หวัดใหญ่สายพันธุ์ B ทำให้ผู้ติดเชื้อมีความเสี่ยงที่จะต้องเข้ารับการรักษาตัวในโรงพยาบาล และเสียชีวิตได้พอๆกับไข้หวัดใหญ่ที่เกิดจากไวรัสไข้หวัดใหญ่สายพันธุ์ A โดยเฉพาะในเด็กและในผู้สูงอายุ ดังนั้นการใช้วัคซีนป้องกันไข้หวัดใหญ่ที่มีไวรัสครบทั้ง 4 สายพันธุ์จะกระตุ้นภูมิคุ้มกัน ที่ครอบคลุมเชื้อไข้หวัดใหญ่ที่อาจระบาดในปีนั้นได้มากกว่า ทำให้ผู้ที่ได้รับวัคซีนป้องกันไข้หวัดใหญ่ชนิด 4 สายพันธุ์ มีความเสี่ยงที่จะเป็นโรคไข้หวัดใหญ่ลดลงมากกว่า 1
วิภาวดี JAB&GO ฉีดวัคซีน HPV 9 สายพันธุ์ 3 เข็ม ราคาพิเศษ
โปรโมชันวันที่ 9 เดือน 9 ฉีดวัคซีน HPV 9 สายพันธุ์ 3 เข็ม ราคาพิเศษ 17,000 บาท ณ คลินิก Jab&Go! (เฉพาะที่ JAB&GO ฉีดวัคซีนที่ BTS พญาไท นอกสถานี ตรงทางออก 3
2. เข็มที่ 1 รับบริการฉีดภายในวันที่ 31 ตุลาคม 2566) ข้อมูลเพิ่มเติม: โทร: 082 903 6450
โครงการทำหมันของซอยด๊อกด้วยกระบวนการ CNVR (Catch = จับ, Neuter = ทำหมัน, Vaccinate ฉีดวัคซีน, Return ปล่อยกลับสู่ถิ่นเดิม) มีผลสัมฤทธิ์และประสิทธิภาพเป็นที่ยอมรับในระดับประเทศ หน่วยงานต่าง ๆ อาทิ โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้าตามพระปณิธานศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี, กรุงเทพมหานคร และมหาวิทยาลัยชั้นนำของประเทศ โดยซอยด๊อกได้นำเสนองานควบคุมประชากรสัตว์และกำจัดโรคพิษสุนัขบ้าด้วยกระบวนการ CNVR จนได้รับความร่วมมือจากหน่วยงานดังกล่าว เช่น การลงนามบันทึกความเข้าใจ (MOU) ระหว่างกรุงเทพมหานครและซอยด๊อกเพื่อจัดการประชากรสุนัขและแมว ในเขตกรุงเทพฯ
นายศิษฏพล เอี่ยมวิสูตร์ ผู้อำนวยการสำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานคร ได้กล่าวแสดงความยินดีในโอกาสที่มูลนิธิฯ ทำหมันสัตว์ถึงหนึ่งล้านตัว เชื่อมั่นในศักยภาพของโครงการทำหมันซอยด๊อกและเล็งเห็นว่าการลงนามความร่วมมือครั้งนี้จะนำไปสู่การต่อยอดเพื่อแก้ไขปัญหาสัตว์จรจัดในพื้นที่กรุงเทพฯ ร่วมกันในอนาคต นอกจากนี้มูลนิธิฯ ยังเป็นหน่วยงานไม่แสวงหาผลกำไรเพียงแห่งเดียวที่ได้ร่วมเป็นคณะกรรมการขับเคลื่อนการดำเนินโครงการสัตว์ปลอดโรคฯ ตามพระปณิธานศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี
ข้อมูลหลักทรัพย์ GFC
ข้อมูลหลักทรัพย์ GFC
จำนวนหุ้น IPO 60,000,000 หุ้น
สัดส่วนการขาย
1) เสนอขายต่อบุคคลตามดุลยพินิจของผู้จัดจำหน่าย หลักทรัพย์ 53,000,000 หุ้น
2) เสนอขายต่อผู้มีอุปการคุณของบริษัทและบริษัทย่อย 1,400,000 หุ้น
3) เสนอขายต่อกรรมการ ผู้บริหาร และพนักงานของบริษัทและบริษัทย่อย 5,600,000 หุ้น
ราคาเสนอขาย 7.00 บาท
มูลค่าเสนอขาย 420,000,000 บาท
ราคาพาร์ 0.50 บาท/หุ้น
Book Value 1.05 บาท/หุ้น (ณ วันที่ 30 มิ.ย.2566)
P/E Ratio 21.17 เท่า (กำไรสุทธิต่อหุ้น 0.33 บาทต่อหุ้น) (Fully Diluted)
หุ้นไม่ติด Silent Period 42,779,000 หุ้น
ทุนจดทะเบียนและชำระแล้ว 110,000,000 บาท
เป็นหุ้นสามัญ 220,000,000 หุ้น
นโยบายเงินปันผล ไม่น้อยกว่า 40% ของกำไรสุทธิ
วันเริ่มซื้อขาย วันที่ 13 ก.ย. 2566
ตลาดรอง ตลาดหลักทรัพย์ เอ็ม เอ ไอ (mai)
กลุ่มอุตสาหกรรม บริการ
ประกอบธุรกิจ คลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์-นรีเวชวิทยา ภายใต้ชื่อ “Genesis Fertility Center”
วัตถุประสงค์การใช้เงิน
1) เพื่อใช้ในการชำระคืนเงินกู้ยืมจากสถาบันการเงิน
2) เพื่อใช้เป็นเงินลงทุนในโครงการขยายสาขา
3) เพื่อใช้เป็นเงินลงทุนในธุรกิจที่เกี่ยวเนื่องและโอกาสในธุรกิจใหม่ๆ ในอนาคต และเพื่อใช้เป็ นเงินทุนหมุนเวียนในการดำเนินธุรกิจ
ที่ปรึกษาทางการเงิน บริษัท แคปปิตอล วัน พาร์ทเนอร์ จำกัด
โรงพยาบาลบางปะกอก 8 วัคซีน HPV ผู้ชายผู้หญิง
วัคซีน HPV...ไม่ว่า "ผู้ชาย" หรือ "ผู้หญิง" ก็ไม่ควรมองข้าม เพื่อป้องกันความเสี่ยงที่ก่อให้เกิดโรคจากเชื้อไวรัส HPV อย่างเช่น มะเร็งปากมดลูก, โรคหูดหงอนไก่, มะเร็งทวารหนัก, มะเร็งช่องปากและลำคอ การฉีดวัคซีนป้องกันเชื้อ HPV เป็นการป้องกันและลดความเสี่ยงในการเกิดโรคดังกล่าว
◾️ วัคซีน HPV ชนิด 4 สายพันธุ์ (3 เข็ม)
สำหรับอายุ 15 ปี ขึ้นไป 7,500.-
◾️ วัคซีน HPV ชนิด 9 สายพันธุ์ (2 เข็ม)
สำหรับเด็ก 9-14 ปี ขึ้นไป 12,500.-
◾️ วัคซีน HPV ชนิด 9 สายพันธุ์ (3 เข็ม)
สำหรับอายุ 15 ปี ขึ้นไป 18,900.-
โรงพยาบาลบางปะกอก 8 สอบถามรายละเอียดเพิ่มเติม โทร : 02-109-8111
โรงพยาบาลกล้วยน้ำไท ให้บริการฉีดวัคซีน HPV 9 สายพันธุ์
โรงพยาบาลกล้วยน้ำไท ให้บริการฉีดวัคซีน HPV 9 สายพันธุ์ แบบฉีด 2เข็ม (อายุ 9-14 ปี) ราคา 12,500 บาท แบบฉีด 3 เข็ม (อายุ 15-45 ปี) ราคา 18,000 บาท *** ตั้งแต่วันนี้ จนถึง วันที่ 31 ธ.ค. .66 *** เงื่อนไข - ราคานี้รวมค่าวัคซีน ค่าแพทย์ ค่าพยาบาล และค่าบริการโรงพยาบาลแล้ว . สนใจติดต่อโทรจองนัดหมายได้ที่ โทร.02-381-2071-75 วันจันทร์-อาทิตย์ เวลา 8.00-18.00 น.
โรงพยาบาลวิภาราม
เพิ่มภูมิคุ้มกัน ป้องกันลูกน้อย จากเชื้อไวรัส EV 71 ด้วยการฉีดวัคซีนป้องกันโรคมือ เท้า ปาก
Package 2 เข็ม สำหรับเด็กอายุ 6 เดือน – 5 ปี (ควรได้รับวัคซีน 2 เข็ม โดยเว้นระยะห่างจากเข็มแรก 4 สัปดาห์) สอบถามข้อมูลเ พิ่มเติมได้ที่..แผนกกุมารเวช โรงพยาบาลวิภารามโทร.0-2032-2550 ต่อ 2415,2416
สงสัยจะเป็น RSV ปรึกษาแผนกเด็ก รพ.สมิติเวช ธนบุรี โทร : 02-408-0104 LINK
RSV เป็นเชื้อไวรัสชนิดหนึ่งที่ก่อให้เกิดโรคในระบบทางเดินหายใจ เด็กที่มีร่างกายแข็งแรง เมื่อติดเชื้อไวรัส RSV มักจะมีอาการเล็กน้อยคล้ายไข้หวัดธรรมดา แต่หากมีอาการรุนแรง จะมีไข้สูง ไอ ซึม หายใจลำบาก ฯลฯ คุณพ่อคุณแม่จึงควรสังเกตอาการของลูกอย่างใกล้ชิด
หากพบว่ามีอาการรุนแรงคล้ายเป็น RSV ควรรีบพาเด็กๆ พบแพทย์ เพื่อเข้ารับการรักษาที่เหมาะสมนะคะ ปรึกษาเพิ่มเติมที่ : แผนกเด็ก รพ.สมิติเวช ธนบุรี โทร : 02-408-0104
บริการตรวจสุขภาพ 2 แบบ สำหรับผู้มีอายุมากกว่า 35 ปี และ ต่ำกว่า 35 ปี
ตรวจสุขภาพ สำหรับผู้มีอายุมากกว่า 35 ปี ราคา 850 บาท
ประวัติโรงพยาบาลสูงเนิน ภาคบู้ลิ้ม ซู้งึ้งอุยหงี่
"ซู้งึ้งอุยหงี่" (อุยหงี่=โรงพยาบาล, ซู้งึ้ง=สูงเนิน) ตั้งอยู่บนถนนสาย โคลักซู้งึ้ง (โคราช-สูงเนิน) ในช่วงแรกได้ชื่อว่าเป็น ยุคสมัยแห่งการล้มลุกคลุกคลาน (ก่อนปี พ.ศ.2522) สมัยนั้นผู้คนในแคว้นซู้งึ้งประสบความยากลำบากนานัปการ มีความเจ็บไข้ได่วยล้มตายอยู่เนืองนิตย์ โรงยาที่ทานการจัดตั้งขึ้นแก้ปัญหาได้เพียงเล็กน้อย ประชาราษฎร์ถึงกับทำฎีกาขึ้นถวายส่วนกลางว่า เสนาบดีเอาแต่สนุกสนานเต้นระบำรำฟ้อน มิได้สนใจทุกข์ สุขราษฎร ต่อมาคหบดีผู้ใจบุญแห่งสำนักกิมก๊ก (บริษัทแหลมทอง) ได้บริจาคทรัพย์ถึง 2 ล้านชั่งเพื่อก่อสร้างซู้งึ้งอุยหงี่ ภายใต้การควบคุมการก่อสร้างจาก แปะเหนา ในบริเวณวัดซู้งึ้ง
พร้อมกับทางการได้ส่งผู้กล้าชุดแรก อันได้แก่ ผู้กล้าจากสำนักสีสิบลัก นามโต๋วเท้งเต้ง (นพ.ศิริชัย) ฉายาขุนพลหน้ายิ้ม และผู้กล้าจากสำนักลามา นามหยางซำหลง (นพ.สำเริง แหยงกระโทก) ฉายาหมัดพิฆาตเบียร์สิงห์ สองท่านนี้ได้เข้ามาฟื้นฟู ปรับระบบแก้ไขจุดบกพร่องต่างๆ ในการบริหารงานที่ผ่านมาให้เป็นระบบมากขึ้น มีการให้บริการพิเศษในวันหยุดราชการครึ่งวันเหมือนวันธรรมดา ยามค่ำคืนดึกดื่นก็มิได้พักผ่อนหลับนอน หากไม่เยียวยารักษาผ่าตัดผู้ป่วย ก็จะชักชวนไพล่พล ลิ่วล้อขึ้นหลังม้า บุกป่าฝ่าดงเข้าไปในป่าเขา หมู่บ้านกันดารห่างไกล ไต่ถามสารทุกข์บำบัด ช่วยเหลือปัดเป่าปัญหาต่างๆให้กับผู้คน สร้างความรักใคร่เป็นกันเองกับชาวบ้านร้านถิ่น ภาพพจน์ของอุยหงี่จึงได้แปรเปลี่ยนจากเดิมที่เหมือนโรงฆ่าสัตว์ เจ้าหน้าที่ละเลยไม่เอาใจใส่ต่อกิจการงาน เปลี่ยนไปในทางที่ดีขึ้น ผู้คนได้เริ่มพากนหลั่งไหลมารักษามากขึ้น มิเพียงเฉพาะแคว้นซู้งึ้งเท่านั้น แม้แต่จากแคว้นใกล้เคียงได้ทราบกิตติศัพท์ก็พากันทยอยมา เพียงไม่กี่ปีโรงยาซู้งึ้งก็เป็นที่ทราบกิตติศัพท์กันดีในหมู่ประชาว่า บริการดี มีน้ำใจ
ยุคสร้างเมืองใหม่ (พ.ศ.2522-2524) ภายใต้ความสามารถปราดเปรื่องเยี่ยมวิทยายุทธของ หยางซำหลง และโต๋วเท้งเต้ง ได้เป็นเครื่องดึงดูดให้ผู้เหี้ยมหาญอีกหลายท่านในยุทธจักรได้เดินทางมายังแคว้นซู้งึ้ง อันได้แก่ แม่ชีเจเพ็กเก็ง (ทันตแพทย์เจเจ’วิจิตร) ฉายาเขี้ยวทองอาญาสิทธิ์ ท่านผู้นี้มีหลักธรรมะ ความสมถะ และสันติธรรมต่อสู้กับปัญหาบ้านเมือง การเอารัดเอาเปรียบต่างๆ จิวเบ็งเฮ็ก (เภสัชกรจิ๋ว’วิทยา) ฉายาโอสถหัตถะมังกร ท่านผู้นี้ต่อมาได้มาเป็นหัวหน้าพรรคโอสถชุมชน และเป็นกำลังสำคัญในการก่อตั้ง สำนักโอสถชุมชนขึ้นทุกหนทุกแห่งในแคว้นซู้งึ้ง เหลี่ยงโกเหล็ง ฉายาดรรชนีโลหิต ต่อมาได้ย้ายไปอยู่ แอล เอ ก๊ก อ๋าบั๊กโก๋ (คุณเดือนชาติ’พ่อบ้านขณะนั้น) ฉายาบัณฑิตกระดาษแดง ผู้ระเหเร่ร่อนไปมา ได้ตั้งรกรากในซู้งึ้ง ต่อมาย้ายเป็นที่ปรึกษาทางด้านกฎหมายในเมืองโคลัก โย๋วทิกัง (นพ.โยธี) ฉายาบัณฑิตสลาตัน ต่อมาย้ายไปเป็นผู้พิชิตรักษาโรคทารกในเมืองโคลัก ด๋าตวง ฉายามือพิชิตมาร นอหจากนี้ยังมีอีกหลายท่าน อาทิเช่น กังจ๊กหนาน (พี่น้อย’กาญจนา) หัวหน้าตึกโฉมสะคราญการุญ หวังหนี่หนี้ (พี่แอ๋ว’วารุณี) หัวหน้าตึกเปี่ยมคุณธรรม ท่านเหล่านี้ได้ช่วยกันบุกเบิกต่อสู้ฟันฝ่าอุปสรรคต่างๆ ทำความเจริญก้าวหน้าให้กับซู้งึ้งอุยหงี่ จนเรียกได้ว่ายุคนี้เป็นยุคบุกเบิก สร้างเมืองใหม่ได้อย่างเต็มภาคภูมิ
ยุคก้าวกระโดด (พ.ศ. 2525-2528) โต๋วเท้งเต้งได้รับบัญชาจากเสนาบดีมณฑลโคลัก ให้ไปกินเมืองโชวพ๋วย (อ.ชุมพวง) เพื่อบำบัดความทุกข์ยากให้กับชาวเมืองซึ่งส่วนใหญ่มีฐานะยากจน การจากไปของหมอโต๋วเท้งเต้งได้สร้างความอาลัยอาวรณ์กับผู้คนยิ่งนัก แต่หยางซำหลงกลับได้ผู้กล้ามือฉมังมาร่วมงานอีก 3 ท่าน อันได้แก่ บุ๋นซำฮง (นพ.ไพบูลย์) ฉายาลายเปื้อนฟ้า ผู้แซ่บุ๋น เจนจัดด้านข้อมูลข่าวสารวิชาการ ด้านเครื่องสมองกล ได้พัฒนาระบบการเก็บวิเคราะห์ข้อมูลด้านต่างๆ ต่อมาๆได้ย้ายเป็นอาจารย์วิทยายุทธแห่งสำนักลามา เผ่าเง็กไหล (นพ.เผ่า) ฉายากระบี่ในรอยยิ้ม ผู้แซ่เผ่า นั้นถนัดในด้านการฝึกอบรม ได้ฝึกสอนทหารเล็กใหญ่ ทั้งภายในและนอกแคว้น จนซู้งึ้งอุยหงี่ มีชื่อเสียงในด้านเป็นสำนักฝึกหัดนักสู้ที่มีคุณภาพ ตู้ป้าเทียน (พี่อี๊ด’นิรันดร์) ฉายาดาบกล้วยไม้ ผู้แซ่ตู้นั้นรับผิดชอบด้านคดีความ ได้ช่วยรักษาการว่าความแทนหยางซำหลง ในครั้งที่ท่านได้ออกไปราชการต่างเมือง ในยุคนี้ได้เกิดสิ่งเปลี่ยนแปลงใหม่ๆ เช่นการตั้งหอผลิตยาเสริมโลหิต, การก่อตั้งศูนย์ฝึกเยาวชน, การรับอาสาสมัครบู๊มาทำงานพัฒนาบ้านเมือง, การพัฒนาระบบด้านสุขาภิบาลและน้ำสะอาด ปริมาณผู้คนที่พากันหลั่งไหลมาด้วยความศรัทธามีปริมาณเพิ่มขึ้น นับได้ว่าเป็ยยุคแห่งการปลี่ยนแปลงแบบก้าวกระโดด
ยุค 3 “จ” 1 “ส” (กค.2528 – มี.ค.2529) หยางซำหลง ได้รับพระราชโองการจากเมืองหลวงให้ไปช่วยราชการในเมืองโคลัก ช่วงเวลานั้นขุนนางมือดี เช่นบุ๋นซำฮง, เผ่าเง็กไหล, ตู้ป้าเทียน ล้วนมีราชการต้องออกไปช่วยแคว้นใกล้เคียงทั้งสิ้น ทำให้ขาดผู้ดูแลแคว้นซู้งึ้ง หยางซำหลง ได้แต่งตั้งขุนนาง 3 ท่านให้รักษาว่าราชการเมือง ได้แก่ แม่ชีเจเพ็กเก็ง, จิวเบ็งเฮ็ก และจังกู๋พัง เนื่องจากแซ่ของบุคคลทั้งสาม ล้วนออกเสียงเป็นตัว “จ” ทั้งสิ้น ผู้คนในสมัยต่อมาจึงพากันขนานนามยุคนั้นว่ายุค 3 จ ท่านรักษาบ้านเมืองอยู่ไม่กี่เดือน ผู้สำเร็จราชการมณฑลได้ส่งเสนาบดีหญิงที่มีความสามารถท่านหนึ่งนาม ซูเพ้งตา (พญ.สุพัตรา) มาว่าราชการ ท่านผู้นี้ต่อมาได้เป็นเจ้าเมืองบ๊วยหยาย (อ.บัวใหญ่) และท้ายที่สุดเป็นผู้นำชมรมผู้กล้าเจ็ดสอบสองแคว้น ช่วงนี้เป็นระยะเวลาสั้นไม่ถึงปี จึงมิได้มีความเปลี่ยนแปลงมากนัก ผู้คนพากันรียกยุคสมัยนี้ว่ายุค 3 จ. 1 ส.
ยุค “ล่องเรือฝ่าคลื่นลม” (พ.ศ.2529-2532) ผู้แซ่ตู้ ฉายาดาบกล้วยไม้ ได้กลับจากศึกษาวิทยายุทธขั้นสูง จากสำนักเสี้ยวลิ้มยี่ ส่วนกลางจึงแต่งตั้งให้ว่าราชการแทนหยางซำหลง ตู้ป้าเทียนนั้นถือได้ว่าเป็นทหารคนสนิทของหยางซำหลง เคยต่อสู้ร่วมรบกันหลายครั้งหลายครากิจการต่างๆจึงมีความคุ้นเคยกันอย่างดี การบริหารบ้านเมืองจึงสืบต่อในแนวลักษณะคล้านคลึงกับของเดิม ยุคนี้มีการเปลี่ยนแปลงโยกย้ายของขุนพลผู้กล้าต่างๆ เกิดขึ้นตลอดเวลา บางช่วงเป็นตอนหัวเลี้ยวหัวต่อ จึงเปรียบประดุจเรือโคลงเคลงไปตามกระแสคลื่นลมแรงบ้าง ยุคนี้ได้เกิดนวัตกรรมใหม่ๆขึ้นมากมายหลายเรื่องเช่น การพัฒนาระบบการแพทย์แผนโบราณ การนวด การใช้สมุนไพร การพัฒนาความสามารถด้านรักษาพยาบาลให้สูงขึ้น การพัฒนาระบบข้อมูลข่าวสารโดยใช้เครื่องมือกล เป้นต้น
คลินิคเฉพาะทางศัลยกรรมกระดูกนอกเวลาราชการ
คลินิคเฉพาะทางศัลยกรรมกระดูกนอกเวลาราชการ รพ.กระทุ่มแบน จะเริ่มเปิดบริการ ตั้งแต่ 20 มี.ค. 66 เป็นต้นไป ทุกวันจันทร์-พุธ 16.30-20.00น. (เว้นวันหยุดราชการ) รพ.กระทุ่มแบนเป็นศูนย์เชี่ยวชาญผ่าตัดเปลี่ยนข้อเข่า/ข้อสะโพก ศูนย์เชี่ยวชาญผ่าตัดกระดูกและข้อแบบส่องกล้อง แผลเล็ก ฟื้นตัวเร็ว สะดวกรวดเร็ว ไม่แออัด ใช้สิทธิค่ายา-หัตถการได้ เสียค่าบริการแพทย์แค่ 400 บาท Scan QR code หรือโทรสอบถาม/จองคิว
สปสช.พร้อมรับนโยบาย Quick Win บัตรปชช.ใบเดียวรักษาทุกที่ ทำได้รวดเร็ว LINK
เลขาธิการ สปสช. เผยความพร้อมการเดินหน้าตามนโยบายรัฐบาลและ รมว.สธ. “บัตรประชาชนใบเดียวรักษาได้ทุกที่” เชื่อเป็น Quick Win ที่สามารถทำได้รวดเร็ว หลังเทคโนโลยีมีความพร้อม-นำร่องบางส่วนมาแล้ว ยันไม่กังวลประชาชนมุ่งเข้ารับบริการ รพ.ใหญ่ มองต่อไปจะเกิดความสมดุลจากหน่วยบริการใกล้บ้านที่ถูกยกระดับมากขึ้น
นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) เปิดเผยถึงความพร้อมในการดำเนินตามนโยบายยกระดับ “30 บาทรักษาทุกโรค” ของรัฐบาล และรัฐมนตรีว่าการกระทรวงสาธารณสุข (รมว.สธ.) นพ.ชลน่าน ศรีแก้ว ว่า รมว.สธ.ได้มอบนโยบายการใช้ “บัตรประชาชนใบเดียวรักษาได้ทุกที่” ซึ่งเป็น 1 ในนโยบาย Quick Win ที่สามารถดำเนินการได้ในไม่ช้า หรืออาจเร็วกว่า 100 วันแรก โดยอาจมีการนำร่องในบางพื้นที่ก่อน หากยังไม่สามารถดำเนินการได้พร้อมกันในทั่วประเทศ ...
อ่านต่อสถิติจำนวนประชากร ปี 2566
- ชาย 32,232,522
- หญิง 33,827,514
- รวม 66,060,036
รายเดือน
- มกราคม 2566 ชาย 32,263,197 หญิง 33,818,007 รวม 66,081,204
- กุมภาพันธ์ 2566 ชาย 32,258,894 หญิง 33,817,660 รวม 66,076,554
- มีนาคม 2566 ชาย 32,255,409 หญิง 33,818,495 รวม 66,073,904
- เมษายน 2566 ชาย 32,249,261 หญิง 33,816,713 รวม 66,065,974
- พฤษภาคม 2566 ชาย 32,242,001 หญิง 33,814,864 รวม 66,056,865
- มิถุนายน 2566 ชาย 32,238,674 หญิง 33,816,156 รวม 66,054,830
- กรกฎาคม 2566 ชาย 32,237,380 หญิง 33,819,289 รวม 66,056,669
- สิงหาคม 2566 ชาย 32,235,163 หญิง 33,821,704 รวม 66,056,867
- กันยายน 2566 32,235,514 33,826,003 66,061,517
- ตุลาคม 2566 32,232,522 33,827,514 66,060,036
ผลงานวิจัย (Oral)
RES-001 การพัฒนารูปแบบการดูแลผู้ป่วยจิตเวชฉุกเฉินแบบผู้ป่วยใน
ในโรงพยาบาลชุมชน
นางสาวฟูรียา เบ็ญฮาวัน
(โรงพยาบาลรามัน)
RES-002 พัฒนารูปแบบการดูแลผู้ป่วยเด็กในโรงพยาบาลรามัน พว.อาฟีฟะ เจะโด
(โรงพยาบาลรามัน)
RES-003 การศึกษาเปรียบเทียบเทคนิคการกดเต้านมด้วยตนเอง
และเทคนิคมาตรฐานในการตรวจแมมโมแกรม
โรงพยาบาลกรุงเทพภูเก็ต
นางประพีพรรณ ถิรสุนทร
นางสุพรรณิการ์ พูนธนานิวัฒน์กูล
(โรงพยาบาลกรุงเทพภูเก็ต)
สธ.เริ่ม Quick Win เรื่องจิตเวช/ยาเสพติด รุกขยาย มินิธัญญารักษ์ ทั่วประเทศ LINK
ปลัดกระทรวงสาธารณสุข ขานรับนโยบายนายกฯ แก้ไขปัญหายาเสพติด เปลี่ยนผู้เสพเป็นผู้ป่วย เผยปัจจุบันมีผู้ป่วย 1.9 ล้านคน แบ่งดูแล 3 กลุ่ม “สีแดง-สีเหลือง-สีเขียว” ตามระดับความรุนแรง เพื่อคืนคนดีสู่สังคมพร้อมเดินหน้า Quick Win 100 วัน ตามนโยบายรัฐมนตรีว่าการกระทรวงสาธารณสุข จัดทำทะเบียนผู้ป่วยจิตเวชยาเสพติดเสี่ยงสูงก่อเหตุรุนแรง จัดตั้งมินิธัญญารักษ์ทั่วประเทศ พร้อมขยายระบบบำบัดผ่านเทเลเมดิซีนใน 6 เดือน ...
อ่านต่อรู้จักโครงการ มินิธัญญารักษ์ LINK
“มินิธัญญารักษ์” เกิดขึ้นจากแนวทางใหม่ของกฏหมายที่กำหนดให้การบำบัดรักษาผู้ป่วยยาเสพติด ต้องเป็นไปในระบบสมัครใจ (ไม่บังคับ) สธ.โดยกรมสุขภาพจิตและโรงพยาบาลธัญญารักษ์ จึงได้ริเริ่มรูปแบบ "มินิธัญญารักษ์" บนแนวคิดในการมุ่งขยายพื้นที่การให้บริการ เพิ่มโอกาสการเข้าถึงบริการของผู้ป่วยยาเสพติดในแต่ละเขตสุขภาพทั้ง 12 เขต และจะช่วยลดความแออัดสำหรับผู้ป่วยที่เข้ารับการบำบัดรักษาและฟื้นฟูสมรรถภาพระยะยาวในโรงพยาบาลเฉพาะทางซึ่งมีจำนวนเตียงไม่เพียงพอสำหรับจำนวนผู้ป่วยที่มีแนวโน้มสูงขึ้นได้เป็นอย่างดี ...
อ่านต่อสธ.เล็งนำบางส่วนกลับเป็นยาเสพติด
รายการเจาะลึกทั่วไทย ประจำวันที่ 22 ก.ย. 66 รายงานประเด็นต่อเนื่องจากกรณีคำสัมภาษณ์ของนายกฯ เศรษฐา ว่า "ขอ 6 เดือน ยกเลิกกัญชาเสรี" พร้อมรายละเอียดอ้างการแถลงของรัฐมนตรีว่าการกระทรวงสาธารณสุข นพ.ชลน่าน ศรีแก้ว ต่อการดำเนินการเพื่อไปสู่การกำกับนโยบายกัญชาเสรี พุ่งเป้าไปที่การเตรียมรื้อร่างพ.ร.บ.กัญชา ในหลายๆ ประเด็น อาทิ การอนุญาตให้ประชาชนทั่วไปปลูกกัญชาที่บ้านได้ 15 ต้น โดยอาจยกเลิกข้อนี้ และอาจะมีโทษหากพบมีการปลูก และ อาจจะมีการนำส่วนกัญชาที่มีสารเสพติด ช่อดอก สาร THC ในช่อดอก กลับไปเป็นยาเสพติด
Ganja TV ชี้ กัญชา ไม่มีทางกลับเป็นยาเสพติด
เพจ Ganja TV โพสต์ กัญชา ไม่มีทางกลับเป็นยาเสพติด
ก่อนการเลือกตั้งปี 2566 เรื่องของกัญชา กลายมาเป็นดราม่าของสังคมไทย เมื่อฝ่ายหนึ่ง เลือกมุมโจมตีกัญชา แบบรายวัน ถึงขั้นกระเทือนความนิยมพรรคภูมิใจไทย จนถึงจุดที่มีความกังวลว่าจะมีการนำกัญชากลับไปเป็นยาเสพติด
แต่เมื่อเลือกตั้งเสร็จสิ้น กระแสโจมตีพืชชนิดนี้ ก็เงียบหายไปด้วยอย่างน่าฉงนสงสัย
หรือว่า แท้ที่จริงแล้ว การด้อยค่าที่เกิดขึ้นเป็นเพียงส่วนหนึ่งของเกมอำนาจ เพื่อทำลายความนิยมของบางพรรคการเมืองเท่านั้น
เมื่อไม่นานมานี้ ศาลปกครองสูงสุด ได้พิจารณาของร้องของนายแพทย์สมิทธิ์ ศรีสนธิ์ หัวหน้าห้องปฏิบัติการนิติเวชศาสตร์ คณะแพทยศาสตร์ รพ.รามาธิบดี และนายกสมาคมแพทย์นิติเวชแห่งประเทศไทย กับพวกรวม 6 คน ที่ยื่นฟ้อง รมว.สธ. สมัยนั้น ที่ปลดล็อกกัญชา ออกมาเพื่อการใช้ประโยชน์
ศาลยกคำร้อง เพราะเห็นว่า ผู้ร้องไม่ได้รับความเสียหายจากนโยบาย แต่เมื่ออ่านรายละเอียดจะพบว่าศาล ให้ความเห็นอีกว่า สิ่งที่ผู้ร้องกล่าวหากัญชา ว่าใช้กันอย่างแพร่หลาย เกิดผลกระทบเชิงลบทางสังคม ล้วนแล้วแต่เป็นการคาดเดา ถึงสิ่งที่ยังไม่เกิด
เท่ากับข้อเท็จจริง คือ นโยบายกัญชา หาได้ สร้างความฉิบหายวายป่วง ดังที่หลายฝ่ายพยายามโจมตีกันไปก่อนหน้านี้
แต่เหนืออื่นใด คือ คำแถลงนโยบายของรัฐบาลเศรษฐา ยังระบุชัดเจนว่า ให้มี
“การใช้ประโยชน์จากกัญชาทางการแพทย์ และสุขภาพ เพื่อสร้างมูลค่าในเชิงเศรษฐกิจ”
ณ จุดนี้ หมายถึงการเปิดรับให้เรื่องของการใช้ประโยชน์จากกัญชา ได้กลับมาอยู่ในนโยบายรัฐบาลอีกหน
ย้อนกลับไป ปัญหาของนโยบายกัญชา เป็นส่วนหนึ่งของเกมการเมือง เสียมากกว่าที่ตัวนโยบาย เพราะภายหลังจากมีการปลดล็อกกัญชา ปรากฏว่าทางพรรคภูมิใจไทย ได้พยายามออกกฎหมายควบคุมในรูปแบบของพระราชบัญญัติ
เมื่อนำเสนอเข้าสภาในวาระแรก ยังได้รับความเห็นชอบอย่างท่วมท้น
แต่เมื่อยิ่งใกล้เข้าสู่การเลือกตั้ง ดังกล่าวกลับถูกสกัดขัดขวางจากฝ่ายการเมืองขั้วต่างๆ
ชั่วโมงนั้น กูรู ทุกสายฟันตรงกัน เป็นเรื่องการเมืองเพื่อบอนไซพรรคภูมิใจไทย โดยสร้างเงื่อนไข ให้เกิดปัญหา เป็นช่องไว้โจมตี
และก็ได้ผล เมื่อได้นายชูวิทย์ กมลวิศิษฐ์ ออกมาดิสเครดิตนโยบายแบบรายวัน
มาวันนี้ สถานการณ์ต่างๆ เปลี่ยนไป ได้เวลาที่สังคมไทย ได้กลับมายืนบนข้อเท็จจริง และตระหนักว่า ที่ผ่านมานั้น นโยบายกัญชา เป็นเพียงเหยื่อทางการเมือง
ผศ.ดร.นพ.ปัตพงษ์ เกษสมบูรณ์ คณะแพทยศาสตร์ ม.ขอนแก่น หนึ่งในแพทย์ที่ศึกษาเกี่ยวกับการใช้กัญชาเพื่อรักษาโรคมานานนับสิบปี ประเมินว่า ยากัญชามีศักยภาพในการเยียวยาคนไทยมากถึง 6,000,000 คน
โดยการใช้เกณฑ์ของคณะกรรมการ กระทรวงสาธารณสุขเอง ซึ่งประเมินว่าการใช้กัญชาซึ่งได้รับการพิสูจน์แล้วว่าได้ผลดี 4 อาการ คือ 1) คลื่นไส้อาเจียนจากเคมีบำบัด 2) ลมชักรักษายาก 3) เกร็งในปลอกหุ้มประสาทอักเสบ 4) ปวดระบบประสาท และประเมินว่าน่าจะได้ประโยชน์ 6 อาการคือ 1) พาร์กินสัน 2) อัลไซเมอร์ 3) ปลอกประสาทอักเสบ 4) วิตกกังวล 5) มะเร็งระยะท้าย 6) โรคอื่นๆของผู้ป่วยระยะสุดท้าย และต้องวิจัยเพิ่มเติม 1 กรณีคือโรคมะเร็ง
เมื่อเราได้มองดูนานาชาติ จะพบว่า มีการนำกัญชามาใช้ประโยชน์อย่างวงกว้าง อาทิ เยอรมัน ที่ผ่านกฎหมาย ให้ประชาชนสามารถปลูกใช้กัญชาได้ตามบ้าน เป็นต้น
หากดูในเรื่องของเศรษฐกิจ อ้างอิง ข้อมูล จากศูนย์วิจัยกสิกรไทย ประเมินว่า หลังปลดล็อก “กัญชา” ออกจากบัญชียาเสพติด มูลค่าตลาดกัญชา ในประเทศไทย จะเพิ่มขึ้นเป็น 2.1 หมื่นล้านบาท ภายในปี 2567 แบ่งสัดส่วน เป็นมูลค่าในแง่ กัญชาทางการแพทย์ ราว 7 พันล้านบาท และ กัญชา เพื่อสันทนาการ 1.4 หมื่นล้านบาท
ที่สำคัญคือท่าทีจากฝ่ายการเมืองพรรคต่างๆ ที่ตอนนี้ ไม่มีการด้อยค่ากัญชากันแล้ว ทั้งยังมีเรื่องของการใช้ประโยชน์กัญชาในนโยบายรัฐบาล
มันก็ชัดเจนว่า หากมองกันตามข้อมูลความเป็นจริง กัญชา มีคุณทั้งในเรื่องของการรักษาโรค และเศรษฐกิจ เกินกว่า จะนำกลับไปเป็นยาเสพติด
รองผู้ว่าฯ ทวิดา ตรวจติดตามความคืบหน้าการก่อสร้างศูนย์ฯ
21 ก.ย. 66 รศ.ดร.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร เป็นประธานการประชุมและลงพื้นที่ตรวจติดตามความคืบหน้าการก่อสร้างอาคารศูนย์ควบคุมสุนัข กรุงเทพมหานคร(ประเวศ) ร่วมกับนายจิรัฏฐ์ ม้าไว ผู้ช่วยเลขานุการผู้ว่าราชการกรุงเทพมหานคร พญ.ภาวิณี รุ่งทนต์กิจ รองผู้อำนวยการสำนักอนามัย น.สพ ศิษฏพล เอี่ยมวิสูตร์ ผู้อำนวยการสำนักงานสัตวแพทย์สาธารณสุข สำนักการโยธา เพื่อให้การก่อสร้างแล้วเสร็จตามกำหนด และได้มาตรฐานพร้อมสำหรับการเปิดให้บริการรองรับสุนัขจรจัดที่ได้รับข้อร้องเรียนจากประชาชน
กิจกรรมต่างๆ ในโอกาสวัน World Rabies Day 2023
งานพิธีเปิดตัวแบรนด์ “ศูนย์เวลเนสอัตลักษณ์ไทย” 27 กันยายน 2566
ทั้งนี้ มีกำหนดการงานพิธีเปิดตัวแบรนด์ “ศูนย์เวลเนสอัตลักษณ์ไทย” ในวันพุธที่ 27 กันยายน 2566 เวลา 10.00 – 14.00 น. ณ ห้องประชุมบัวหลวง อาคาร 2 ชั้น 1 กรมการแพทย์แผนไทยและการแพทย์ทางเลือก กรมการแพทย์แผนไทยและการแพทย์ทางเลือก กระทรวงสาธารณสุข ดำเนินการตามนโยบาย “คนไทยสุขภาพดี เศรษฐกิจมั่งคั่ง” (Health for Wealth) โดยกองการแพทย์ทางเลือก ดำเนินงานโครงการส่งเสริมการท่องเที่ยงเชิงสุขภาพ
ในงานนี้สถานประกอบการที่ผ่านการรับรอง “ศูนย์เวลเนสอัตลักษณ์ไทย” จะได้รับใบประกาศนียบัตร จาก นายแพทย์ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข
นายแพทย์พิษณุ มณีโชติ รองเลขาธิการมูลนิธิ พอ.สว. และ มร. โซ มารูโอะ กรรมการผู้จัดการ บริษัท ฟูจิฟิล์ม (ประเทศไทย) จำกัด
ฟูจิฟิล์ม เดินหน้าภารกิจสนับสนุน “หมอกระเป๋าเขียว” มูลนิธิ พอ.สว.ด้วยอุปกรณ์ดีๆ
ฟูจิฟิล์มได้สนับสนุนเครื่องอัลตราซาวด์และเอกซเรย์แบบพกพา ไปออกภารกิจหน่วยแพทย์เคลื่อนที่เดินเท้าในพื้นที่อำเภออมก๋อย จังหวัดเชียงใหม่ เมื่อวันที่ 20-25 สิงหาคม 2566
ผลการประเมินการเข้าถึงบริการวัคซีนป้องกันโรคไข้หวัดใหญ่
การศึกษาครั้งนี้ แบ่งการนำเสนอ ผลการศึกษา ออกเป็น ข้อมูลทั่วไป ประวัติการได้รับวัคซีน และความประสงค์เข้ารับการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ มีรายละเอียดดังนี้
1. ข้อมูลทั่วไป ผู้สูงอายุ 65 ปีขึ้นไป ในพื้นที่จังหวัดนนทบุรีระหว่างวันที่ 3 - 31 พฤษภาคม 2566
กลุ่มตัวอย่างในการศึกษาทั้งสิ้น 215 ราย เป็น เพศหญิง ร้อยละ 63.26 และเพศชาย ร้อยละ 36.74 ช่วงอายุส่วนใหญ่มีอายุ 65-70 ปี ร้อยละ 53.95 รองลงมาอายุ 71-80 ปีอายุ 81-90 ปีและอายุ 90 ปีขึ้นไป ร้อยละ 37.21, 8.37,0.47 ตามลำดับ โดยมีอายุเฉลี่ยกับ 71.60 ปี ดังกราฟที่ 1-2
การจัดบริการสุขภาพปฐมภูมิ
บุคคลทุกคนมีสิทธิได้รับบริการสุขภาพปฐมภูมิโดยแพทย์เวชศาสตร์ครอบครัว และคณะผู้ ให้บริการสุขภาพปฐมภูมิเป็นผู้ให้บริการสุขภาพปฐมภูมิตามพระราชบัญญัตินี้ ทั้งนี้ บริการ สุขภาพ ปฐมภูมิที่บุคคลมีสิทธิได้รับ ให้เป็นไปตามหลักเกณฑ์ วิธีการ และเงื่อนไขที่คณะกรรมการ ประกาศ กำหนด บริการสุขภาพปฐมภูมิตามวรรคหนึ่ง ต้องจัดให้มีการบันทึกข้อมูลด้านสุขภาพตามหลักเกณฑ์ วิธีการ และเงื่อนไขที่คณะกรรมการประกาศกำหนดตามมาตรา 21 (มาตรา 15) บุคคลซึ่งมีสิทธิได้รับการรักษาพยาบาลหรือรับบริการสาธารณสุขตามสวัสดิการ หรือตาม สิทธิที่ได้รับตามกฎหมาย บุคคลนั้นย่อมมีสิทธิได้รับบริการสุขภาพปฐมภูมิตามมาตรา 15 วรรคหนึ่ง ด้วย และให้การใช้สิทธิเป็นไปตามหลักเกณฑ์การได้รับสวัสดิการหรือสิทธิของบุคคลนั้น ค่าใช้จ่ายใน การรักษาพยาบาลหรือค่าใช้จ่ายเพื่อบริการสาธารณสุขในการรับบริการสุขภาพปฐมภูมิตามมาตรา 15 วรรคหนึ่ง อาจขยายให้ได้รับนอกเหนือหรือเพิ่มขึ้นจากที่กำหนดไว้สำหรับสวัสดิการ หรือสิทธิใน การรักษาพยาบาลหรือบริการสาธารณสุขก็ได้ ทั้งนี้ ตามที่กระทรวงการคลังกำหนด โดยความ เห็นชอบของคณะรัฐมนตรี หรือตามที่คณะกรรมการตกลงกับคณะกรรมการประกันสังคม คณะกรรมการ หลักประกันสุขภาพแห่งชาติ องค์กรปกครองส่วนท้องถิ่นแต่ละประเภทที่มีกฎหมาย จัดตั้ง หรือหน่วยงานของรัฐอื่นใดที่รับผิดชอบเกี่ยวกับสวัสดิการหรือสิทธิดังกล่าว แล้วแต่กรณี และ ให้หน่วยงาน ที่เกี่ยวข้องดำเนินการเพื่อให้ได้รับค่าใช้จ่ายดังกล่าว (มาตรา 16) หน่วยบริการปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิมีหน้าที่ ดังต่อไปนี้
(1) ให้บริการสุขภาพปฐมภูมิ โดยให้ความเสมอภาคและอำนวยความสะดวกในการให้บริการ
ตลอดจนเคารพสิทธิส่วนบุคคล ศักดิ์ศรีความเป็นมนุษย์ และความเชื่อทางศาสนา
(2) ให้ข้อมูลการบริการสุขภาพปฐมภูมิและให้ข้อมูลเกี่ยวกับสิทธิของผู้รับบริการแก่
ผู้รับบริการ อย่างเพียงพอ เพื่อให้ผู้รับบริการตัดสินใจในการเลือกรับบริการหรือเข้าสู่ระบบการส่งต่อ
(3) ให้ข้อมูลแก่ผู้รับบริการ ญาติ หรือผู้ซึ่งใกล้ชิดกับผู้รับบริการเกี่ยวกับแพทย์ บุคลากร
ด้านสาธารณสุข หรือผู้รับผิดชอบในการดูแลต่อเนื่องทางด้านสุขภาพกาย ด้านสุขภาพจิต และด้าน
สังคม ที่จะรับดูแลผู้รับบริการก่อนจำหน่ายผู้รับบริการออกจากหน่วยบริการปฐมภูมิหรือเครือข่าย
หน่วยบริการปฐมภูมิ
(4) รักษาความลับของผู้รับบริการจากการปฏิบัติหน้าที่ตาม (1) และ (2) อย่างเคร่งครัด เว้น
แต่เป็นการเปิดเผยต่อเจ้าหน้าที่ของรัฐซึ่งปฏิบัติหน้าที่ตามกฎหมาย
(5) จัดทำระบบข้อมูลการให้บริการสุขภาพปฐมภูมิเพื่อสะดวกต่อการตรวจสอบคุณภาพ
มาตรฐาน และบริการ รวมทั้งการขอรับค่ารักษาพยาบาลหรือค่าใช้จ่ายเพื่อบริการสาธารณสุข
(6) ปฏิบัติตามมาตรการควบคุมคุณภาพและมาตรฐานในการให้บริการสุขภาพปฐมภูมิตาม
มาตรา 24 การให้บริการสุขภาพปฐมภูมิตาม (1) การให้ข้อมูลตาม (2) และ (3) การจัดทำระบบ
ข้อมูล การให้บริการสุขภาพปฐมภูมิตาม (5) และการปฏิบัติตามมาตรการควบคุมคุณภาพและ
มาตรฐานตาม (6) ให้เป็นไปตามหลักเกณฑ์ วิธีการ และเงื่อนไขที่คณะกรรมการประกาศกำหนด
ในกรณีที่มีความจำเป็นต้องส่งต่อผู้รับบริการเพื่อให้ไปรับการรักษาพยาบาล ที่หน่วยบริการ
ปฐมภูมิอื่น เครือข่ายหน่วยบริการปฐมภูมิ หรือหน่วยบริการอื่นให้แพทย์เวชศาสตร์ครอบครัว หรือ
คณะผู้ให้บริการสุขภาพปฐมภูมิซึ่งดูแลผู้รับบริการดำเนินการให้มีการส่งต่อผู้รับบริการดังกล่าว ให้
หน่วยบริการปฐมภูมิ เครือข่ายหน่วยบริการปฐมภูมิ หรือหน่วยบริการที่รับการส่งต่อ ตามวรรคหนึ่ง
ดำเนินการตามความเหมาะสมและจำเป็น เพื่อประโยชน์ในการส่งต่อผู้รับบริการ ให้สำนักงานร่วมกับ
หน่วยบริการปฐมภูมิและเครือข่าย หน่วยบริการปฐมภูมิจัดให้มีระบบข้อมูลด้านสุขภาพของ
ผู้รับบริการและการเชื่อมโยงเพื่อใช้ข้อมูล ดังกล่าว โดยต้องปฏิบัติตามมาตรา 20 วรรคหนึ่ง (4) การ
ส่งต่อผู้รับบริการตามวรรคหนึ่ง การดำเนินการตามวรรคสอง และการจัดระบบและ การเชื่อมโยงเพื่อ
ใช้ข้อมูลด้านสุขภาพตามวรรคสาม ให้เป็นไปตามหลักเกณฑ์ วิธีการ และเงื่อนไข ที่คณะกรรมการ
ประกาศกำหนด
สาระสำคัญของพระราชบัญญัติระบบสุขภาพปฐมภูมิพ.ศ. 2562 มีกลไกหลัก 6 ด้าน ที่เปลี่ยนแปลงไปเพื่อให้เกิดบริการสุขภาพปฐมภูมิที่มีคุณภาพเท่าเทียม ประชาชนเข้าถึงบริการได้อย่างทั่วถึง คือ (
thairath.co.th/lifestyle)
1. การลงทะเบียน จะเป็นการลงทะเบียนที่มีชื่อแพทย์คู่กับประชาชน ต่อไปประชาชนคน ไทยทั่วประเทศจะมีหมอประจำตัวหรือหมอประจำครอบครัวที่ดูแลให้คำปรึกษาตั้งแต่ก่อนป่วย ป่วย มาก จนถึงการดูแลต่อเนื่องที่บ้าน มีหมอประจำตัวดูแลตั้งแต่ก่อนแรกเกิดจนถึงวาระสุดท้ายของชีวิต เป็นการจับคู่กัน ต่อไปประชาชนจะมีผู้รับผิดชอบสุขภาพ
2. ข้อมูลสารสนเทศ ต่อไปประชาชนที่ไปหาหมอที่โรงพยาบาลกลับมาแล้วดูแลต่อเนื่องใน ชุมชนจะมีข้อมูลการวินิจฉัย การรักษา มีแนวทางการวางแผนอย่างไร จะมีข้อมูลจากโรงพยาบาลใหญ่ ส่งกลับมาที่หน่วยบริการปฐมภูมิ เช่น รพ.สต.
3. การผลิตและพัฒนาบุคลากรสหวิชาชีพ เช่น หมอเวชศาสตร์ครอบครัว ทีมผู้ให้บริการ เช่น พยาบาล นักวิชาการสาธารณสุข นักกายภาพ จะมีการวางแผนและผลิตบุคลากรเหล่านี้ใน สัดส่วนที่เหมาะสม
4. มีกลไกด้านการเงินที่สนับสนุนการบริการตาม พ.ร.บ. ฉบับนี้
5. มีกลไกส่งเสริมให้ประชาชนมีส่วนร่วมในการดูแลจัดการสุขภาพของตนเองมากขึ้นทั้งใน ระดับพื้นที่ในระดับอำเภอ เป็นกลไกที่ทำให้ประชาชนได้รับการดูแลตรงกับความต้องการมากขึ้น
6. มีกลไกการดูแล กำกับ ติดตาม เพื่อให้มั่นใจว่าประชาชนจะได้รับการดูแลที่เหมาะสมและ เป็นธรรม
กู้ภัยลำปางลำเลียงผู้ป่วยท้องแก่ 8 เดือน LINK
สมาคมกู้ภัยลำปาง รายงานภารกิจ ช่วยเหลือเจ้าหน้าที่ ประปาสบปราบออกจากพื้นที ลำเลียงผู้ป่วยท้องแก่ 8 เดือน บ้านทุ่งหมู่ 5 ตำบลสบปราบ ช่วยเหลือผู้บาดเจ็บผู้ติดค้าง และนำอาหารน้ำดื่มเข้าไปแจกจ่าย
ฉลาดโอน.com ChaladOhn.com ศูนย์ช่วยเหลือประชาชน LINK
ChaladOhn.com โดยมหาวิทยาลัยเทคโนโลยีราชมงคลพระนคร ร่วมกับ กองกำกับการสืบสวน กองบังคับการตำรวจนครบาล 8 สนับสนุนโดยกองทุนวิจัยและพัฒนากิจการกระจายเสียง กิจการโทรทัศน์และกิจการโทรคมนาคม เพื่อประโยชน์สาธารณะ
ศูนย์ช่วยเหลือประชาชน ติดต่อผ่านไลน์ @chaladohn เพื่อขอความช่วยเหลือ ขอคำปรึกษาได้ตลอดเวลา
Mr. Tomasz Sypytkowski (นายโทมัส ไซไพคาวสกี้) พร้อมทีมผู้บริหาร Electrolux

รพ.พานาซี เราทำงานอย่างเป็นระบบ โดยแพทย์ เภสัชกร พยาบาล นักโภชนาการ นักกายภาพบำบัด และสหสาขาวิชาชีพเฉพาะทางด้าน เพื่อสร้างให้ผู้ป่วยโรคมะเร็งมีภูมิคุ้มกันที่แข็งแรง ซึ่งเป็นสิ่งสำคัญในการเอาชนะโรคมะเร็ง และความโดดเด่นในการคัดกรองมะเร็งของพานาซี คือ เราสามารถตรวจคัดกรองหามะเร็งได้ตั้งแต่ระยะที่ 0 ใครที่คิดว่ามีความเสี่ยงในการเป็นมะเร็งหรือเปล่า ทางพานาซีจะมีวิธีการตรวจดูจากพันธุกรรมของท่านว่ามีโอกาสเป็นมะเร็งได้มากน้อยแค่ไหน ซึ่งถ้าเป็นแล้ว นอกจากการดูแลแบบบูรณาการตามที่กล่าวมาแล้ว เรายังได้นำนวัตกรรมที่มีประสิทธิภาพสูงมาใช้เพื่อการรักษา นั่นก็คือเครื่อง Oncothermia หรือการรักษามะเร็งด้วยคลื่นความร้อน เป็นการรักษามะเร็งชนิดหนึ่ง ซึ่ง รพ.พานาซีเรามีความโดดเด่นเชี่ยวชาญในเรื่องนี้อยู่แล้ว โดยเรามีทีมแพทย์เฉพาะทาง อาทิ นพ.ภัทรพล คำมุลตรี, นพ.อัศวเดช แสนบัว ,นพ.โอม สุดชุมแพ ,นพ.สมนึก ศิริพานทอง ,พญ.จินตนา มโนรมย์ภัทรสาร มาเสริมให้เป็นดรีมทีมเพื่อดูแลผู้ป่วยมะเร็ง เพื่อให้ศูนย์การแพทย์มะเร็งบูรณาการ เป็นความหวัง เป็นทางเลือกของผู้ป่วยมะเร็งให้กลับมามีอายุยืนยาวอีกครั้ง เราจึงไม่อยากให้ผู้ป่วยถอดใจและหยุดการรักษา ขอให้คิดถึงเราเป็นอีกทางเลือกหนึ่งนะคะ” นางศิริญา เทพเจริญ กล่าว
รมต.มหาดไทย สั่งคุมเข้มครอบครองปืน
“อนุทิน” สั่งคุมเข้ม งดออกใบอนุญาตครอบครองอาวุธปืน จำกัดการนำเข้าซื้อขายอย่างเด็ดขาด ชี้!ประชาชนทั่วไปไม่จำเป็นต้องพก
นายอนุทิน ชาญวีรกูล รัฐมนตรีว่าการกระทรวงมหาดไทย เปิดเผยว่า ได้มอบหมาย นายอรรษิษฐ์ สัมพันธรัตน์ อธิบดีกรมการปกครอง งดการออกใบอนุญาตพกพาอาวุธปืนให้กับบุคคลทั่วไป เนื่องจากเห็นว่าประเทศมีกฎหมายในการปกป้องคุ้มครอง ดูแลความปลอดภัยอยู่แล้ว ไม่มีเหตุจำเป็นต้องพกพาอาวุธในที่สาธารณะ
พร้อมเตือน ผู้มีอาวุธปืนในครอบครองต้องเก็บให้มิดชิด เพราะเป็นทรัพย์สินส่วนตัว ไม่ควรให้ผู้อื่นเข้าถึงได้โดยง่าย และต้องปฏิบัติตนอย่างถูกต้องในการครอบครอง หรือพกพาตามกฎหมายอย่างเคร่งครัด
นายอนุทิน กล่าวเสริมว่า หากพบเจออันตรายหรือมีภัยคุกคาม ต้องแจ้งความต่อเจ้าหน้าที่ตำรวจ หรือเจ้าหน้าที่กรมการปกครอง เพื่อความปลอดภัยของตนเอง แทนการพกพาอาวุธอย่างไม่ถูกต้อง หรือสำหรับผู้ที่มีความจำเป็นต้องซื้อ ต้องขอใบอนุญาตในการครอบครองและพกพาอาวุธปืนให้ถูกต้องตามกฎหมาย และจะมีการตรวจสอบจากกรมการปกครองอย่างเข้มงวด ทั้งนี้ จะคุมเข้มจำกัดการนำเข้า ซื้อขายอาวุธปืนและอาวุธที่มีอาณุภาพคล้าย เช่น ปืน BB-GUN ปืนประดิษฐ์ กระสุนปืน ให้เข้มงวดและเด็ดขาดที่สุด
นายอนุทิน ชาญวีรกูล รัฐมนตรีว่าการกระทรวงมหาดไทย(มท.) เปิดเผยว่า เตรียมประชุมร่วมกับอธิบดีกรมการปกครองมาหารือ เกี่ยวกับการควบคุมการใช้อาวุธปืน และต้องการได้รับทราบถึงข้อกฎหมายต่างๆ ที่เกี่ยวกับการครอบครองอาวุธปืน รวมถึง แบงค์กัน หรือบีบีกัน และของเล่นต่างๆ ที่สามารถทำอันตรายได้ ต้องมาดูว่าตรงไหนที่ต้องควบคุม ซึ่งได้ให้นโยบาย ไปว่าจะไม่อนุญาตให้ออกใบอนุญาตให้กับบุคคลทั่วไป
นำบัตรประชาชนมาด้วยทุกครั้งที่รับบริการนะคะ
เปิดรับสมัครพยาบาลวิชาชีพ จำนวน 10 อัตรา อัตราค่าจ้าง วันละ 745 บาท
เปิดรับสมัครพยาบาลวิชาชีพ จำนวน 10 อัตรา
อัตราค่าจ้าง วันละ 745 บาท
ปฏิบัติงานกลุ่มภารกิจด้านการพยาบาลหรือหน่วยงาน
ที่ผู้อำนวยการโรงพยาบาลราชบุรีมอบหมาย
คุณสมบัติเฉพาะสำหรับตำแหน่ง
- ปริญญาตรีหรือคุณวุฒิอย่างอื่นที่เทียบได้ในระดับเดียวกัน ในสาขาวิชาพยาบาลศาสตร์
- ได้รับใบอนุญาตประกอบวิชาชีพการพยาบาลชั้นหนึ่ง หรือการพยาบาลและการผดุงครรภ์ชั้นหนึ่ง
การรับสมัคร
ยื่นใบสมัครด้วยตนเอง ตั้งแต่วันที่ 22 กันยายน 2566 ถึงวันที่ 12 ตุลาคม 2566 ในวันและเวลาราชการ
ณ กลุ่มงานทรัพยากรบุคคล ชั้น 2 ตึกอำนวยการ โรงพยาบาลราชบุรี
- ภาคเช้า เวลา 08.30 - 12.00 น.
- ภาคบ่าย เวลา 13.00 - 16.30 น.
หรือดาวน์โหลดแบบฟอร์มใบสมัคร
ได้ที่ www.rajburi.org
ติดต่อสอบถามรายละเอียดเพิ่มเติม โทร 032-719600 ต่อ 1314 หรือ 1556
โรงพยาบาลพุทธชินราช พิษณุโลก ณ ห้องชมนาด ชั้น 1 อาคารมหิดล LINK
โรงพยาบาลพุทธชินราช พิษณุโลก กลุ่มภารกิจด้านการพยาบาล และชมรมพยาบาลจังหวัดพิษณุโลก ขอเชิญบริจาคโลหิต เพื่อถวายเป็นพระราชกุศล
เนื่องในวัน “นวมินทรมหาราช” 13 ตุลาคม 2566
และ “วันพยาบาลแห่งชาติ” 21 ตุลาคม 2566
วันที่ 9 ตุลาคม 2566 เวลา 09.00-12.00 น.
ณ ห้องชมนาด ชั้น 1 อาคารมหิดล โรงพยาบาลพุทธชินราช พิษณุโลก
รพ.ธรรมศาสตร์เฉลิมพระเกียรติ ทำฟันฟรี 500 คน 20 ตุลาคม 2566
โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ สัปดาห์เทิดพระเกียรติสมเด็จย่า ประจำปี 2566 จัดบริการทำฟันฟรี 500 คน วันที่ 20 ตุลาคม 2566 ณ ชั้น 1 อาคารราชสุดา ลงทะเบียนตั้งแต่เวลา 7.00 น. (จนกว่าจะครบตามจำนวน) แบ่งเป็น
ผู้ใหญ่ 380 คน (อุดฟัน/ถอนฟัน/ขูดหินปูน)
เด็ก ตำกว่า 12 ปี 120 คน (อุดฟัน/ถอนฟัน/เคลือบฟลูออไรด์/เคลือบหลุมร่องฟัน)
สอบถามโทร. 02-9269012 02-9269896 วัน/เวลาราชการ
“ผมตื่นเต้นมากๆ เพราะเป็นครั้งแรกที่ได้มีโอกาสดูดาวในโดมท้องฟ้าจำลองแบบนี้ ซึ่งตอนแรกที่จินตนาการคิดว่าคงจะสวยมากแน่ๆ แต่พอได้เห็นของจริงแล้วภาพต่างๆ เหมือนจริงกว่าที่คิดไว้อีกครับ แถมได้เห็นถึงพื้นผิวของดวงจันทร์ ได้ฟังถึงต้นกำเนิดสิ่งมีชีวิต พอผมมองไปรอบๆ คือเพื่อนๆ ตื่นเต้นกันทุกคนเหมือนผมเลยเพราะเป็นภาพที่ไม่ได้เห็นบ่อยๆ นอกจากนี้ยังได้ลองใช้เครื่องส่องดูดาว เรียนรู้ดูกลุ่มดาว ทำให้ผมรู้สึกสนุกกับการดูดาวมากขึ้นไปอีกครับ” นายนนทวัฒน์ สุขมา หรือ น้องนนท์ อายุ 17 ปี ชั้นมัธยมศึกษาปีที่ 5 โรงเรียนเกาะพะงันศึกษาอำเภอเกาะพะงัน จังหวัดสุราษฎร์ธานี หนึ่งในตัวแทนของเด็กๆ หลายพันคนที่ได้มีโอกาสทำความรู้จักกับหมู่ดาวผ่านกิจกรรมนี้กล่าวขึ้นด้วยน้ำเสียงตื่นเต้นระคนดีใจ
โรงพยาบาลพัฒนานิคม จ.ลพบุรี เรื่องนวัตกรรมเชิงพาณิชย์ Mobile Application BP&glucose Monitor for hospital
ผลงานประกวด NCD Clinic Plus Awards เรื่องนวัตกรรมเชิงพาณิชย์ Mobile Application BP&glucose Monitor for hospital ของโรงพยาบาลพัฒนานิคม จ.ลพบุรี ได้รางวัล "รองชนะเลิศอันดับสอง ประเภทโรงพยาบาลขนาดกลาง"
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ทันตกรรม
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ทันตกรรมโรงพยาบาลพุทธชินราช พิษณุโลก
เปิดให้บริการ ทุกวันจันทร์ - วันพุธ เวลา 16.30 - 20.30 น. ณ คลินิกทันตกรรม ชั้น 4 อาคารผู้ป่วยนอก ถอนฟัน ผ่าฟันคุด อุดฟัน ขูดหินปูน รักษาคลองรากฟัน ฟันปลอม ครอบฟัน สะพานฟัน รากฟันเทียม ทันตกรรมสำหรับเด็ก
หมายเหตุ : มีค่าธรรมเนียมเพิ่มเติม
สอบถามได้ที่ 055-270-300 ต่อ 15406
ตรวจโรคทั่วไป
ตรวจโรคทั่วไป เวลาไห้บริการของ ศบส. 39 เปิดให้บริการวันจันทร์ – ศุกร์ เวลา 8.00 น. – 12.00 น. เวลา 16.00 น. – 20.00 น. (คลีนิคนอกเวลา) ตรวจรักษาโรคทั่วไปในระดับปฐมภูมิ และให้การพยาบาลเช่น ทำแผล ฉีดยา ตัดไหม พ่นยา เป็นต้น การให้บริการมีคังนี้
- คัดกรองความเสี่ยงด้านสุขภาพในผู้รับบริการทุกกลุ่มวัย ผู้ประกอบอาหาร ผู้สมัครงาน
- ตรวจ วินิจฉัยปัญหาความรุนแรงของอาการป่วยในผู้ป่วยโรคทั่วไป โรคเรื้อรัง โรคระบาดตามฤดูกาล
- ให้การรักษาผู้ป่วยตามมาตรฐานแบบองค์รวมอย่างเวชศาสตร์ครอบครัว
- บริการให้คำปรึกษาด้านสุขภาพ นัดตรวจเจาะเลือดตามข้อบ่งชี้ของโรค
- ประสานส่งต่อโรงพยาบาล ตรวจ รักษา วินิจฉัยเพิ่มเติม กรณีอาการซับซ้อน ฉุกเฉิน
- ออกใบรับรองตรวจสุขภาพ สมัครงาน สมัครเรียน ออกใบพิการ
คลินิกอายุรกรรม
คลินิกอายุรกรรม
- คลินิกไต ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกรูมาตอยส์ (โรคข้อและรูมิติสซั่ม) ในเวลาราชการ 08.00 - 12.00 น.
- คลินิกโลหิตวิทยา ในเวลาราชการ 08.00 - 12.00 น.
- คลินิกโลหิตวิทยา ในเวลาราชการ 08.00 - 12.00 น.
- คลินิกโรคหัวใจ ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกต่อมไร้ท่อ ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกมะเร็งโลหิตวิทยา นอกเวลาราชการ 16.00 - 20.00 น.
- คลินิกมะเร็งโลหิตวิทยา นอกเวลาราชการ 16.00 - 20.00 น.
- คลินิกตรวจโรคทั่วไป ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) เวลา 13.00 - 16.00 น. (บ่าย) นอกเวลาราชการ 16.00 - 20.00 น.
โทรนัดพบแพทย์คลินิกพิเศษเฉพาะทางนอกเวลาโรงพยาบาลกระบี่
เริ่มวันที่ 1 พฤศจิกายน 2566 เป็นต้นไปคลินิกพิเศษเฉพาะทางนอกเวลา
โทรได้ตั้งแต่วันจันทร์ถึงอาทิตย์
ได้ทุกวันจันทร์ - วันศุกร์
เวลา 08:00 น. - 20.30 น.
เสาร์ - อาทิตย์
เวลา 08.00 น. - 16.00 น.
โทรที่หมายเลข : 090-899-7080
อธิบดีกรมควบคุมโรค ลงเยี่ยมแรงงานไทย
16 ตุลาคม 2566 ณ อาคาร Quarantine Center กองด่านควบคุมโรคติดต่อระหว่างประเทศและกักกันโรค กรมควบคุมโรค นายแพทย์ธงชัย กีรติหัตถยากร รักษาราชการแทนอธิบดีกรมควบคุมโรค ตรวจเยี่ยมและให้กำลังใจแรงงานไทยที่เดินทางด้วยเครื่องบิน A-340-500 ของกองทัพอากาศ เที่ยวบิน RTAF218 ETA ออกเดินทางจากสนามบินนานาชาติ Ben Gurion อิสราเอล เมื่อเวลา 19.27 น. เมื่อวานที่ผ่านมา ได้นำคนไทยจำนวน 130 คน เดินทางถึงท่าอากาศยานกองบิน 6 ดอนเมืองแล้วเมื่อช่วงเช้าวันนี้ เวลา 06.50 น. และต่อมาได้พาแรงมาไทยมาถึง อาคาร Quarantine Center กองด่านควบคุมโรคติดต่อระหว่างประเทศและกักกันโรค สถาบันบำราศนราดูร เมื่อเวลาประมาณ 09.30 น. เพื่อตรวจสุขภาพจิตใจเพิ่มเติมในบางราย นัดพบญาติเพื่อเดินทางกลับภูมิลำเนา และตรวจรักษาเพิ่มเติม ณ สถาบันบำราศนราดูร
นายแพทย์ธงชัย กล่าวว่า แรงงานไทยที่กลับมาในรอบนี้ส่วนใหญ่มีสุขภาพแข็งแรงและคัดกรองรวม 130 ราย เป็นสัญชาติไทย 129 ราย และ สัญชาติอิตาลี 1 ราย พบผู้ที่มีอาการทางเดินหายใจ 6 ราย (ชาย 5 ราย หญิง 1 ราย) ตรวจสารพันธุกรรมของเชื้อก่อโรคทางเดินหายใจ พบไวรัสไข้หวัดใหญ่ชนิด A H1N1pdm2009 1 ราย ไวรัสไข้หวัด (common cold) 3 ราย ไม่พบเชื้อ 2 ราย ส่วนการบาดเจ็บมีล้มกระดูกแขนหัก 1 ราย (3 สัปดาห์ก่อน)ได้รับการรักษาผ่าตัดเรียบร้อยจากประเทศอิสราเอล ซึ่งได้ทำการตรวจเช็กสภาพร่างกายและล้างแผลเพิ่มเติม และมีเพียง 37 คน ที่ต้องได้รับการประเมินด้านสุขภาพจิตเพิ่มเติม ซึ่งผลการประเมินพบความเครียดระดับปานกลาง อยู่ในเกณฑ์ที่รับได้ ทุกคนสามารถเดินทางกลับภูมิลำเนาได้
นายแพทย์ธงชัย กล่าวเพิ่มเติมว่า ได้สั่งการให้หน่วยงานในสังกัดที่เกี่ยวข้อง เตรียมความพร้อม ดังนี้ 1) กองด่านควบคุมโรคต่อระหว่างประเทศและกักกันโรค เตรียมการคัดกรองสุขภาพ และประสานงานส่งผู้ป่วยบาดเจ็บ หรือโรคทั่วไป ไปที่โรงพยาบาลที่รับผู้ป่วย ทั้งอาคารอากาศยาน บน. 6 และ ท่าอากาศยานสุวรรณภูมิ 2) เตรียมที่พักชั่วคราว สำหรับผู้เดินทางที่ยังไม่สามารถกลับภูมิลำเนา ที่กองด่านฯ จำนวน 60 ห้อง ความจุ 90 คน 3) เตรียมการตรวจวินิจฉัยทางห้องปฏิบัติการชนิดรวดเร็ว (<2 ชม.) ที่ ท่าอากาศยานสุวรรณภูมิและสถาบันบำราศนราดูร สำหรับกรณีผู้ป่วยมีอาการ 4) เตรียมวัคซีน สำหรับทีมที่จะไปปฏิบัติงานยังต่างประเทศ เช่น วัคซีนไข้หวัดใหญ่ โควิด 19 ไข้กาฬ หลังแอ่น และ 5) สถาบันบำราศนราดูรเตรียมสถานที่ห้องพักต่าง ๆ รองรับผู้ป่วยโรคติดต่อ
นอกจากนี้ นายแพทย์ธงชัย ได้กำชับให้เจ้าหน้าที่ทุกคนปฏิบัติงานอย่างเต็มที่ และเพิ่มการสื่อสารกันให้มากขึ้น ทั้งนี้มีคนไทยกรอกแบบฟอร์มแจ้งความประสงค์การเดินทางกับทางสถานทูต ณ กรุงเทลอาวีฟ จำนวน 7,540 ราย จำแนกเป็น ผู้ที่ขอเดินทางกลับประเทศไทย จำนวน 7,446 ราย และ แจ้งความประสงค์ไม่ขอกลับ จำนวน 94 ราย ซึ่งจะทยอยกลับมาเรื่อย ความพร้อมระบบคัดกรองสุขภาพและตรวจรักษาโรคในเบื้องต้นก็จะสะดวกรวดเร็วขึ้น
พรเดือนตุลาคม พระอาจารย์โชคดี วัดไก่เตี้ย ตลิ่งชัน
สวัสดีตุลาคม ขอให้พบเจอความสำเร็จ ขอให้มีสุขภาพแข็งแรง มีความสุขกับครอบครัว ขอให้เดือนตุลาคมนี้ เต็มไปด้วยความสุขและความโชคดี
พระอาจารย์โชคดี วัดไก่เตี้ย ตลิ่งชัน
น่านสเคป วาดเขียนเมืองน่าน จิตรกรรมและกวี 16-23 ตุลาคม 2566
โครงการ่วมทุน BTO ผลตอบแทนรัฐ 3.6 พันล้านบาท LINK
โครงการ่วมทุน BTO
โครงการนี้จะเป็นการร่วมทุนประเภท Build-Transfer-Operate (BTO) คือ เอกชนเป็นผู้ออกแบบ ลงทุนก่อสร้างทรัพย์สินสำคัญ และโอนกรรมสิทธิ์ให้รัฐทันทีหลังก่อสร้างแล้วเสร็จ โดยได้รับการสนับสนุนด้วยการให้สิทธิประโยชน์ของเขตส่งเสริมเศรษฐกิจพิเศษเทียบเคียงกับสิทธิประโยชน์ของ BOI เช่น ยกเว้นภาษีเงินได้นิติบุคคล 8 ปี ยกเว้นอากรนำเข้าเครื่องจักร เป็นต้น
กระทรวงสาธารณสุข จะส่งมอบที่ดินพร้อมอาคารผ่าตัด-อุบัติเหตุ 5 ชั้น วงเงิน 232 ล้านบาทให้ภาคเอกชนก่อสร้างอาคารบริการเพิ่มเติม พร้อมทั้งประสานหน่วยงานประกันสุขภาพให้รับเป็นโรงพยาบาลในสังกัดสำนักงานปลัดกระทรวงสาธารณสุข ส่วนภาคเอกชน จะตกแต่ง ก่อสร้างอาคารเพิ่มเติม สาธารณูปโภคต่างๆ ให้แล้วเสร็จภายใน 3 ปี และโอนคืนให้สำนักงานปลัดกระทรวงสาธารณสุข พร้อมจัดหาครุภัณฑ์ บุคลากร เพื่อให้บริการทางการแพทย์ รวมถึงรับผิดชอบกรณีเกิดความเสียหายทางการแพทย์
ผลตอบแทนรัฐ 3.6 พันล้านบาท
“โครงการนี้ ถือเป็นต้นแบบการขยายโรงพยาบาลในสังกัดกระทรวงสาธารณสุขด้วยวิธี PPP มีมูลค่าการลงทุนรวม 2,647 ล้านบาท ทำให้ประชาชนมีสถานพยาบาลขนาดใหญ่ที่มีศักยภาพในการให้บริการในสาขาต่างๆ อยู่ในพื้นที่ สามารถเข้าถึงบริการสุขภาพที่มีมาตรฐาน ได้ในราคาที่เหมาะสม สะดวก รวดเร็ว รวมถึงรองรับบริการกรณีมีภัยพิบัติ หรือโรคระบาดเกิดขึ้นในพื้นที่ได้อย่างมีประสิทธิภาพ นอกจากนี้ยังสร้างผลประโยชน์ทางการเงินแก่ภาครัฐ ตลอดระยะเวลาโครงการ 50 ปี จำนวน 3,684.51 ล้านบาท โดยเป็นรายได้จากค่าตอบแทนการใช้ประโยชน์ที่ดิน 1,033.68 ล้านบาท และส่วนแบ่งรายได้จากภาคเอกชน 2,650.83 ล้านบาท” ดร.สาธิตกล่าว
ทันตกรรมนอกเวลา จ-ศ 16.30-20.00 น. เสาร์ 8.30-16.00น.
นายแพทย์โสภณ เอี่ยมศิริถาวร รองอธิบดีกรมควบคุมโรค กระทรวงสาธารณสุข กล่าวว่า “ด้วยสภาพภูมิอากาศของประเทศไทยมีลักษณะร้อนชื้น จึงเอื้อต่อการเจริญเติบโตของเชื้อไวรัสเดงกี โดยในปีนี้มีแนวโน้มผู้ป่วยโรคไข้เลือดออกสูงกว่า 3 ปีที่ผ่านมา ด้วยจำนวนผู้ป่วยสูงและต่อเนื่อง จึงต้องเพิ่มมาตรการในการควบคุมโรคให้เข้มข้นขึ้น กรมควบคุมโรคจึงแนะนำให้ประชาชนรีบกำจัดภาชนะที่เป็นแหล่งเพาะพันธุ์ลูกน้ำและป้องกันยุงลายกัดเป็นประจำ ซึ่งสามารถทำได้ด้วยการปฏิบัติตามหลัก ‘3 เก็บป้องกัน 3 โรค’ ได้แก่ 1.เก็บบ้านให้ปลอดโปร่งไม่ให้ยุงลายเกาะพัก 2.เก็บขยะ และ 3.เก็บแหล่งน้ำ ปิดภาชนะให้มิดชิดเพื่อไม่ให้ยุงลายลงไปวางไข่ ซึ่งจะช่วยป้องกันโรคไข้เลือดออกได้ อีกทั้งยังสามารถปฏิบัติตามแนวทางการป้องกันอื่นๆ ตามคำแนะนำของกระทรวงฯ เพื่อร่วมกันลดการระบาดของโรคไข้เลือดออกในสังคมไทยและขับเคลื่อนประเทศไทยไปสู่สังคมปลอดไข้เลือดออกได้ในอนาคต”
มิติสุขภาพเป็นหนึ่งในนโยบายที่กรุงเทพมหานครให้ความสำคัญ - ชัชชาติ สิทธิพันธุ์


รศ.ดร.ชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร กล่าวว่า “มิติสุขภาพเป็นหนึ่งในนโยบายหลักที่กรุงเทพมหานครให้ความสำคัญเป็นอันดับต้นๆ โดยการมี ‘สุขภาพที่ดี’ เป็นสิ่งที่คุ้มค่าในการลงทุน กรุงเทพมหานครตระหนักดีว่าการป้องกันโรคดีกว่าเกิดโรคแล้วค่อยไปรักษา และต้องการเห็นประชาชนปรับเปลี่ยนพฤติกรรมการบริโภคที่ถูกหลักโภชนาการ ใช้ชีวิตอย่างสมดุลเพื่อป้องกัน บรรเทา และหลีกเลี่ยงโรคเรื้อรังต่างๆ โดย ‘เมือง’ มีบทบาทสำคัญในการช่วยลดการเกิดภาวะลิ่มเลือดอุดตัน โดยเราได้มุ่งเน้น 3 ด้าน คือ 1. เมืองต้องเอื้อให้คนเดินออกกำลังกายได้สะดวก มีสวนสาธารณะที่มีคุณภาพและอยู่ใกล้บ้านในระยะเวลา 15 นาที สามารถเดินมาจากบ้านได้ ซึ่งเราได้ดำเนินการไปแล้วกว่า 100 แห่ง 2. การแพทย์ เรามีศูนย์ด้านสาธารณสุขที่กระจายเป็นเส้นเลือดฝอยกว่า 20 แห่ง มีการดูแลผู้ป่วยติดเตียงนับหมื่นรายที่อยู่ในชุมชน เป็นกลุ่มที่ไม่สามารถเข้าถึงเตียงโรงพยาบาลได้ เรามีการจัดเจ้าหน้าที่สาธารณสุขเข้าไปดูแลผู้ป่วยติดเตียงโดยร่วมมือกับโรงเรียนแพทย์ และ 3 คือการรณรงค์ให้ความรู้ในโรงเรียน ชุมชน และในระดับสาธารณสุข มีการจัดอบรมการดูแลผู้ป่วยสูงอายุ ซึ่งมีแนวโน้มเพิ่มสูงขึ้น โดยทั้ง 3 ส่วนนี้ก็จะช่วยลดภาระของโรงพยาบาล ซึ่ง กทม. ต้องขอขอบคุณหน่วยงานที่เกี่ยวข้องและภาคีเครือข่ายต่างๆ ที่ร่วมรณรงค์ให้ความรู้แก่ประชาชนในวันนี้ เพื่อช่วยลดความเสี่ยงและป้องกันการเกิดลิ่มเลือดอุดตัน”
สถานการณ์คุณภาพอากาศ พื้นที่ทั่วประเทศ 19 ตุลาคม พ.ศ.2566
สถานการณ์คุณภาพอากาศ พื้นที่ทั่วประเทศ 19 ตุลาคม พ.ศ.2566 [
Air4Thai]
คุณภาพอากาศอยู่ในระดับ คุณภาพดีมากถึงเริ่มมีผลกระทบต่อสุขภาพ
สารมลพิษทางอากาศที่ตรวจพบเกินมาตรฐานได้แก่ ฝุ่นละออง ขนาดไม่เกิน 2.5 ไมครอน (PM2.5) ตรวจพบค่าระหว่าง 6 - 48 ไมโครกรัมต่อลูกบาศก์เมตร (µg/m3) เกินมาตรฐานที่บริเวณต.มุกดาหาร อ.เมือง จ.มุกดาหาร, ต.ในเมือง,อ.เมือง จ.ยโสธร, ต.หน้าพระลาน อ.เฉลิมพระเกียรติ จ.สระบุรี, ริมถนนดินแดง เขตดินแดง จ.กรุงเทพฯ, ต.มีชัย อ.เมือง จ.หนองคาย, ต.ในเมือง อ.เมือง จ.อุบลราชธานี, ต.ในเมือง อ.เมือง จ.นครพนม, แขวงคลองกุ่ม เขตบึงกุ่ม, สวนเสรีไทย เขตบึงกุ่ม, ริมถนนลาดพร้าว ซอยลาดพร้าว 95 เขตวังทองหลาง จ.กรุงเทพฯ, ริมถนนพระรามที่ 4 หน้าสามย่านมิตรทาวน์ เขตปทุมวัน จ.กรุงเทพฯ, ริมถนนนราธิวาส เขตบางรัก จ.กรุงเทพฯ, แขวงทุ่งวัดดอน เขตสาทร จ.กรุงเทพฯ, ริมถนนพระราม 3 เขตยานนาวา จ.กรุงเทพฯ, ริมถนนบางนา-ตราด เขตบางนา จ.กรุงเทพฯ, ริมถนนศรีนครินทร์ เขตประเวศ จ.กรุงเทพฯ, ริมถนนเจริญนคร เขตคลองสาน จ.กรุงเทพฯ, ริมถนนแยกท่าพระ เขตบางกอกใหญ่ จ.กรุงเทพฯ, ริมถนนซอยนิคมบ้านพักรถไฟธนบุรี 5 เขตบางกอกน้อย จ.กรุงเทพฯ, แขวงคลองเตย เขตคลองเตย จ.กรุงเทพฯ
ผู้ป่วยสะโพกหัก ส่งต่อรักษารพ.เลิดสิน
20 ตุลาคม 2566 นพ.สุรโชค ต่างวิวัฒน์ รักษาราชการแทนรองปลัดกระทรวงสาธารณสุข ในฐานะผู้บัญชาการศูนย์ปฏิบัติการฉุกเฉินด้านการแพทย์และสาธารณสุข (PHEOC) เปิดเผยว่า นพ.ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข มีความเป็นห่วงและได้กำชับให้ติดตามการดูแลสุขภาพแรงงานไทยที่เดินทางมาจากอิสราเอลทุกราย รวมถึงคนในครอบครัวหรือญาติที่ได้รับผลกระทบทางจิตใจ ซึ่งจากการติดตามข้อมูล พบว่า ผู้บาดเจ็บที่เข้ารับการรักษาในโรงพยาบาลภูมิลำเนานั้น สามารถกลับบ้านได้แล้ว คงเหลือรายล่าสุดที่เดินทางกลับมาถึงเมื่อวานนี้ (19 ตุลาคม) มีอาการปวดสะโพกจากการตกจากที่สูง โรงพยาบาลพระสมุทรเจดีย์ จ.สมุทรปราการ ตรวจวินิจฉัยเบื้องต้นพบว่ากระดูกสะโพกหัก จึงประสานส่งต่อโรงพยาบาลเลิดสินที่มีความเชี่ยวชาญให้การรักษาต่อ อุทยานแห่งชาติดอยอินทนนท์
อุทยานแห่งชาติดอยอินทนนท์ อุทยานแห่งชาติลำดับที่ 6 ของประเทศไทย เป็นอุทยานที่มีนักท่องเที่ยวมาเยือนระดับท็อป 5 มายาวนาน ด้วยความเป็นอุทยานที่มีความอุดมสมบูรณ์ เพียบพร้อมด้วยความน่าสนใจทางธรรมชาติอันหลากหลาย ทั้งป่าดิบที่สมบูรณ์ที่สุด ยอดดอยอินทนนท์ที่ท้าทายนักเดินทางทุกยุคสมัย นักท่องเที่ยวที่นิยมการตั้งแคมป์ ชมทะเลหมอกหมอกไม่เคยผิดหวัง น้ำตกขนาดใหญ่สวยงาม เส้นทางเดินป่าธรรมชาติ เส้นทางขับขี่จักรยานท้าทายนักปั่น และที่สำคัญคือความพร้อมในการบริหารจัดการที่พัฒนามาตลอดหลายสิบปีที่ผ่านมา
ปัจจุบัน อุทยานแห่งชาติดอยอินทนนท์ มีบ้านพักพร้อมบริการทั้งหมด 9 หลัง เปิดให้บริการสำหรับนักท่องเที่ยวทุกท่านที่อยากเข้ามาพัก วันจันทร์ - วันพฤหัสบดี (ยกเว้นวันหยุดนักขัตฤกษ์) จองบ้านพักและดูรายละเอียดบ้านพักได้ที่
https://nps.dnp.go.th/reservation.php
ขณะที่ นักท่องเที่ยวสามารถ ซื้อบัตรเข้าอุทยานล่วงหน้าผ่านทางออนไลน์ ได้ผ่านในระบบ E- ticket ผ่านแอพ Que-Q สะดวก สบายมาก
อุทยานแห่งชาติดอยอินทนนท์ เลขที่ 119 ม.7 ต.บ้านหลวง อ.จอมทอง
โทร. 053-286729
อุทยานแห่งชาติภูชี้ฟ้า
อุทยานแห่งชาติภูชี้ฟ้า คือจุดหมายการชมทะเลหมอกอันดับท็อป 5 ของไทย ทุกปีนักท่องเที่ยวจะหลั่งไหลมาชมความงามพระอาทิตย์ขึ้นยามเช้า และทะเลหมอกที่นี่ ท่ามกลางอากาศอันหนาวเย็นสุดสบายที่ระดับ 15-17 องศาเซลเซียส (ตั้งแต่เดือนตุลาคมและจะลดลงเรื่่อยจนถึงสิ้นปี) คนเคยไปก็อยากไปอีกด้วยความประทับใจ ใครไม่เคยไปควรต้องมีสักครั้งในชีวิต
ภูชี้ฟ้า ลักษณะเป็นยอดเขาสูงสามารถมองเห็นทิวทัศน์ทาง 360 องศา ความสูงเฉลี่ยจากระดับน้ำทะเล 1,628 เมตร ด้านทิศตะวันออกติดสาธารณรัฐประชาธิไตยประชาชนลาว มีหน้าผาสูงชัน เป็นจุกชมวิวที่สวยที่สุด ในช่วงเดือน ตุลาคม-กุมภาพันธ์ จะมีทิวทัศน์ที่สวยงามเป็นพิเศษ สามารถชมพระอาทิตย์ขึ้น พระอาทิตย์ตก และทะเลหมอกที่สวยงาม และในช่วงเดือนกุมภาพันธ์ ต้นเสี้ยวดอกขาวรอบภูชี้ฟ้า จะออกดอกบานเต็มเชิงเชา และมีเทศกาลวันดอกเสี้ยวบานระหว่าง วันที่ 13-15 กุมภาพันธ์ ของทุกปี นอกจากนี้ยังมีแหล่งท่องเที่ยวใกล้เคียง ได้แก่ อุทยานแห่งชาติภูซาง สถานีเกษตรที่สูง ดอยผา ดอยผาตั้ง วัฒนธรรมเผ่าม้ง อาข่า เป็นต้น
ที่อุทยานไม่มีร้านค้าร้านอาหาร นักท่องเที่ยวควรจัดเตรียมไป สัญญาณโทรศัพท์ มีเพียง AIS เท่านั้น นักท่องเที่ยวต้องปฏิบัติตามกฏของอุทยานอย่างเคร่งครัด
โทรศัพท์ : 084-8079848 , 081-7186761
อุทยานแห่งชาติเขาแหลมหญ้า-หมู่เกาะเสม็ด
อุทยานแห่งชาติเขาเเหลมหญ้า-หมู่เกาะเสม็ด เป็นอุทยานแห่งชาติขวัญใจชาวไทยมายาวนาน ด้วยการเป็นเกาะที่อยู่บริเวณชายฝั่งทะเลด้านอ่าวไทยในจังหวัดระยอง (ครอบคลุมอำเภอแกลง และอำเภอเมือง) สามารถเดินทางไปได้ง่าย ไม่ไกลเกินไป นักท่องเที่ยววัยรุ่นวัยเริ่มเที่ยว มักจะเล็งหมู่เกาะเสม็ดเป็นจุดหมายปลายทางเสมอมา
ความสวยงามของชายหาดหลายๆ หาดบนเกาะ คือความประทับใจแก่ผู้มาท่องเที่ยวอย่างแท้จริง รวมถึงเกาะอีกหลายแห่งที่สามารถไปท่องเที่ยวชม ดำน้ำได้ อาทิ เกาะเสม็ด เกาะจันทร์ เกาะทะลุ เกาะกุฎี เกาะมะขาม และเกาะปลายตีน เขาแหลมหญ้าและชายทะเลด้านทิศตะวันตกของเขาแหลมหญ้า สถานที่ที่เด่นที่สุดเป็นที่รู้จักกันดี คือ เกาะเสม็ดหรือเกาะแก้วพิศดาร ชาดหาดที่มีชื่อเสียง ได้แก่ หาดแม่รำพึง, อ่าวลูกโยน, หาดทรายแก้ว, อ่าววงเดือน, อ่าวพร้าว, อ่าวปะการัง
ปัจจุบันเกาะเสม็ดมีชื่อเสียงในระดับนานาชาติแล้ว เป็นอีกเป้าหมายของนักท่องเที่ยวชาวต่างประเทศที่ต้องมาสัมผัส เหมาะสำหรับการพักผ่อนระยะเวลานาน รวมถึงการพัฒนาที่สูงมากขึ้น มีโรงแรมที่พักผุดขึ้นจำนวนมาก ความสะดวกสบายมีพร้อม ปัจจัยเหล่านี้ ทำให้อุทยานแห่งชาติเขาเเหลมหญ้า-หมู่เกาะเสม็ด ยังเป็นที่จุดหมายปลายทางอันดับต้นๆในใจนักเดินทางจนบัดนี้
โทรศัพท์/โทรสาร : 038-653034
แพทย์หญิง อัจจิมา สุวรรณจินดา แพทย์ผู้เชี่ยวชาญด้านผิวหนังและความงาม
แพทย์หญิง อัจจิมา สุวรรณจินดา แพทย์ผู้เชี่ยวชาญด้านผิวหนังและความงาม และประธานการจัดงาน The Dermatologic and Aesthetic Surgery International League (DASIL) World Congress ครั้งที่ 11 ได้กล่าวย้ำถึงความสำคัญของการร่วมมือระหว่างสมาคมด้านแพทย์ผิวหนังและความงามกับบริษัทนวัตกรรมความงาม โดยเห็นว่า “ภาคเอกชน อย่างบริษัทนวัตกรรมความงาม สามารถมีส่วนร่วมยกระดับวงการแพทย์ได้ เช่น การสนับสนุนให้มีการประชุมระดับชาติที่แพทย์จะสามารถเข้าร่วมได้ เพื่ออัปเดตองค์ความรู้ด้านนวัตกรรมและงานวิจัยต่างๆ ให้ทันสมัยอยู่เสมอ ซึ่งจะส่งผลดีต่อผู้ที่เข้ารับบริการเสริมความงามด้วย”
ตำรวจสอบสวนกลาง โดย ปคบ. ร่วม สบส., อย. รวบ 6 อภินิหาร อวดอ้างสรรพคุณยา รีดเลือดรักษามะเร็ง
เนื่องจากพบวัดมีพฤติกรรมเปิดเป็นสถานที่รักษาโรคให้กับประชาชนทั่วไป และมีการเรียกเก็บค่ายาในราคาสูง โดยยาที่ขายให้กับผู้เข้ารับการรักษาเป็นยาชนิดแคปซูล ไม่มีฉลาก เข้าข่ายเป็นการหลอกลวงให้ประชาชนหลงเชื่อ และมีการเผยแพร่การรักษา และการเชิญชวน ให้ประชาชนทั่วไปเข้ารับการรักษาผ่านทางเพจ เฟซบุ๊กชื่อ “สำนักพระกรรมฐานศากยาราม” มีการโพสต์รูปภาพ วีดีโอการรักษาโรค และข้อความสื่อให้ประชาชนโดยทั่วไปเข้าใจว่า พระนรสีห์ฯ กับพวกสามารถตรวจรักษา โรคมะเร็งโรคเบาหวาน โรคร้ายแรงอื่นๆ หายขาดใน 1-3 เดือน
โดยมีวิธีการตรวจรักษาที่ไม่ใช่วิธีการตามหลักวิชาการทางการแพทย์ เช่น การให้ผู้ป่วยนอนราบไปกับพื้น แล้วใช้มือสัมผัสตัวและนำหินมาวนบริเวณหน้าท้อง อก และใบหน้า และสอบถามอาการ พร้อมทั้งวินิจฉัยว่าป่วยเป็นโรคมะเร็งตับ มะเร็งลำไส้ และมะเร็งปอด หรือโรคร้ายแรงอื่นๆ จากนั้นมีการใช้เข็มลักษณะคล้ายเข็มเย็บผ้าแทงไปตามจุดต่างๆ ของร่างกาย เช่น บริเวณหน้าท้อง, ปลายนิ้วมือทั้งสองข้าง และต้นขาทั้งสองข้าง ตั้งแต่โคนขาจนถึงบริเวณเหนือหัวเข่าจำนวนหลายครั้ง บางราย แทงประมาณ 20 ครั้ง เพื่อให้เลือดออกมาจากรอยเจาะ จากนั้นใช้แท่งเหล็กลักษณะคล้ายปากกาถูวนบริเวณแผลที่มีเลือดออก เป็นต้น
จากพฤติการณ์ของพระนรสีห์ฯ กับพวก ตำรวจสอบสวนกลาง ได้จับกุมผู้ต้องหาทั้ง 6 ราย พร้อมตรวจยึดของกลาง ส่งพนักงานสอบสวนดำเนินคดีต่อไป
บก.ปคบ. 25 ตุลาคม 2566
รางวัล 10 บ้านน่าอยู่ประจำปี 2566
สำหรับผลรางวัล 10 บ้านน่าอยู่ประจำปี 2566 มีดังนี้
1. โฮมสตูดิโอเชียงใหม่ อบอุ่นใจด้วยแสงแดดและสองแมว
2. บ้านสวนชั้นเดียว พื้นที่สร้างความสุขเรียบง่ายจากการปลูกต้นไม้
3. บ้านพื้นถิ่นไทย ที่อบอุ่นด้วยงานไม้เก่า
4. บ้านชั้นเดียว รีโนเวต ทึบนอกโปร่งใน อยู่สบาย
5. บ้านโมเดิร์น ที่มีต้นไทรคู่ยักษ์เป็นหัวใจ
6. บ้านโมเดิร์นชั้นเดียว ที่ยกสูงให้ดูโปร่งตาเหมือนอยู่ชั้น 2
7. บ้านไม้ไผ่ในสวนแมว
8. บ้านไอซ์ซึ ณัฐรัตน์ นพรัตยาภรณ์ โลกคู่ขนานที่บรรจบกันของคนกับแมว
9. บ้านไม้ชั้นเดียว ภายใต้โรงเลี้ยงหมูเก่า กลางสวน
10. บ้านทิตา บ้านไม้พื้นถิ่นใต้ถุนสูงของสถาปนิกในบทบาทผู้อยู่อาศัย
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชานวัตกรรมวิทยาศาสตร์การแพทย์ (หลักสูตรใหม่ พ.ศ.2567)
สำหรับไฮไลท์แต่ละหลักสูตรภายในงาน CRA Open House 2024 เปิดโลกหลักสูตรวิทยาศาสตร์สุขภาพกับราชวิทยาลัยจุฬาภรณ์ คัดมาให้แล้วดังนี้ เริ่มต้นจากหลักสูตรใหม่ล่าสุดแห่งปี รองศาสตราจารย์ ดร.จตุพร กระจายศรี อาจารย์ประจำหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชานวัตกรรมวิทยาศาสตร์การแพทย์ (หลักสูตรใหม่ พ.ศ.2567) จากโครงการจัดตั้งคณะวิทยาศาสตร์ ราชวิทยาลัยจุฬาภรณ์
“หลักสูตรวิทยาศาสตรบัณฑิต (นวัตกรรมวิทยาศาสตร์การแพทย์) ชื่อย่อ วท.บ. (นวัตกรรมวิทยาศาสตร์การแพทย์) เป็นหลักสูตรระดับปริญญาตรี 4 ปี จุดเด่นของหลักสูตรมุ่งเน้นผลิตบัณฑิตที่มีความรู้และสมรรถนะในการทำวิจัยด้านนวัตกรรมทางการแพทย์ เพื่อสนับสนุนในภารกิจหน่วยงานภาครัฐและภาคเอกชน มีการจัดการเรียนการสอนคล้าย Pre-Medical School สามารถต่อยอดในการเข้าศึกษาหลักสูตรแพทยศาสตรบัณฑิตหรือวิชาชีพอื่นสายการแพทย์ได้ บูรณาการองค์ความรู้ด้วยศาสตร์ด้านการวิจัย นวัตกรรม วิทยาศาสตร์การแพทย์ การจัดการและการเป็นผู้ประกอบการ เปิดโอกาสให้บัณฑิตทำงานได้หลากหลาย เป็นสาขาที่ขาดแคลนและต้องการของประเทศเป็นอย่างยิ่ง อาชีพที่รองรับได้หลังสำเร็จการศึกษา เช่น บุคลากรวิจัยด้านวิทยาศาสตร์การแพทย์ นักวิชาการด้านวิทยาศาสตร์การแพทย์ในหน่วยงานภาครัฐหรือภาคเอกชน นวัตกรด้านวิทยาศาสตร์การแพทย์ บุคลากรทางด้านการศึกษาด้านวิทยาศาสตร์ในสถาบันการศึกษา เจ้าของธุรกิจหรือผู้ประกอบการด้านการแพทย์ เช่น บริษัทยา เวชภัณฑ์ และเครื่องมือทางการแพทย์ ห้องปฏิบัติการวินิจฉัยทางการแพทย์”
สถานที่จอดรถใกล้เคียงบริเวณจัดงาน เทศกาลพลุนานาชาติเมืองพัทยา 24-25 พ.ย. นี้
รายชื่อสถานที่จอดรถใกล้เคียงพื้นที่จัดงาน
- ห้างโลตัส พัทยาเหนือ
- ห้างโลตัส เทพประสิทธิ์
- เมืองพัทยา
- ห้างไมค์ ช้อปปิ้งมอลล์
- ห้างเทอร์มินัล 21
- ห้างรอยัลการ์เด้นท์
- วัดชัยมงคล
- ห้างเซ็นทรัล มารีนา
- โรงเรียนเมืองพัทยา 8
- ห้างบิ๊กซี่เอ็กสตร้า พัทยากลาง
- ห้างเซ็นทรัล เฟสติวัล พัทยา บีช
- อาคารจอดรถท่าเรือบาลีฮาย
- ห้างบิ๊กชี พัทยาใต้
- ลานสีฟ้าท่าเรือบาลีฮาย
เทศกาลประจำปีหลวงพ่อโสธรจัดขึ้นปีละ 2 ครั้ง
เทศกาลประจำปีหลวงพ่อโสธรจัดขึ้นปีละ 2 ครั้ง คือ
ครั้งแรกจัดช่วงเดือน 5 เรียกว่า งานกลางเดือน 5 เริ่มจัดงานตั้งแต่วันขึ้น 14-15 ค่ำ ถึงวันแรม 1 ค่ำ เดือน 5 รวม 3 วัน
ครั้งที่สองจัดช่วงเดือน 12 เรียกว่า งานกลางเดือน 12 เริ่มจัดงานตั้งแต่วันขึ้น 12 ค่ำ เดือน 12 ถึงวันแรม 1 ค่ำ เดือน 12 รวม 5 วัน โดยจัดร่วมกับงานกาชาดจังหวัดฉะเชิงเทรา
ภาพ
Siwadonn Wikipedia
ปฏิทินกิจกรรมเดือนตุลาคม 2566 ในพื้นที่จังหวัดพิษณุโลก - เพชรบูรณ์
สถานการณ์โรคพิษสุนัขบ้าในปี 2565 พบเสียชีวิตทั้ง 3 ราย
กรมควบคุมโรค
รายงานสถานการณ์โรคพิษสุนัขบ้าในปี 2565 ที่ผ่านมา พบผู้ป่วย 3 รายใน 3 จังหวัด และเสียชีวิตทั้ง 3 ราย (จังหวัดชลบุรี 1 ราย สงขลา 1 ราย และจังหวัดสมุทรปราการ 1 ราย)
นพ.ชลน่าน แจงกรณี 10 เม็ด
นพ.ชลน่าน ศรีแก้ว ได้โพสต์ผ่านเพจ หมอชลน่านFcไม่มีดราม่า ตอบคำถามในประเด็นที่มีผู้สอบและสงสัยต่อกรณีข่าวการปลดล็อกยาบ้าให้ครอบครองได้คนละ 10 เม็ด โดยให้คำอธิบายไว้ดังนี้
#ผู้เสพคือผู้ป่วย
มีคำถามเข้ามาในเพจ
หมอชลน่านFcไม่มีดราม่า จากผู้ใช้ fb Sao England "จริงมั้ยคะที่ว่า รมต.สธ. จะปลอดล๊อกยาเสพติดให้ครอบครองได้คนละ 10 เม็ด ไม่มีความผิดตามกฎหมาย ? "
ตอบ
รมว.สธ. ต้องทำหน้าที่ตามประมวลกฎหมายยาเสพติด 2564 กำหนด ให้ออกกฎกระทรวงกำหนดปริมาณยาเสพติดเพื่อสันนิษฐานว่ามีไว้ครอบครองเพื่อเสพ เพื่อแยกผู้เสพและผู้ค้ายาเสพติด เช่น ยาบ้า ไม่เกิน 10 เม็ด สันนิษฐานว่า มีไว้เพื่อเสพ ถ้าเกิน สันนิษฐานว่ามีไว้เพื่อค้า กรณีครอบครองไม่เกิน 10 เม็ด ถ้ามีพฤติกรรมว่ามีการค้า ให้ถือว่ามีครอบครองไว้เพื่อค้า
หลักการของประมวลกฎหมายยาเสพติด ให้ถือว่า #ผู้เสพคือผู้ป่วย ถ้าสมัครใจเข้าบำบัดรักษาฟื้นฟู ไม่เสียประวัติ ไม่มีความผิดทางอาญา เพื่อให้โอกาสคืนคนดีสู่สังคม ซึ่ง กสธ.ได้ประกาศเป็นนโยบายสำคัญเรื่องยาเสพติด ทำให้แล้วเสร็จ (Quickwin) ภายใน 100 วัน โดยจัดตั้งศูนย์บำบัดรักษา #มินิธัญญารักษ์ ครบทุกจังหวัด มีหอผู้ป่วยบำบัดรักษายาเสพติดทุกอำเภอ มีกลุ่มงานจิตเวชและยาเสพติด ทุก โรงพยาบาลชุมชน เพื่อรองรับผู้สมัครใจเข้ารับการบำบัดรักษา
ถ้าไม่สมัครใจ ไม่เข้ารับการบำบัดรักษาฟื้นฟู มีโทษตามกฎหมายกำหนด
ผู้เสพ ยาเสพติดประเภท 1 (ยาบ้า) โทษจำคุกไม่เกิน 1 ปี ปรับไม่เกิน 20,000 บาท
มีไว้ครอบครองเพื่อเสพ ยาบ้า โทษจำคุกไม่เกิน 2 ปี ปรับไม่เกิน 40,000 บาท
ผู้ครอบครองยาเสพติดประเภท 1 (ยาบ้า) มีไว้เพื่อค้า โทษหนัก จำคุก 1 - 15 ปี ปรับ ไม่เกิน 150,000 บาท
กฎกระทรวงกำหนดจำนวนปริมาณเม็ดยาบ้า เพื่อสันนิษฐานมีไว้เพื่อเสพ อยู่ในขั้นตอนการพิจารณาของคณะกรรมการจาก ป.ป.ส และ กสธ. จะประชุมพิจารณา ในวันที่ 3 พ.ย 2566 นี้ ว่าจะกำหนดกี่เม็ด เพื่อเสนอให้ รมว.สธ. ออกกฎกระทรวงต่อไป ( จำนวน 10 เม็ด เป็นข้อเสนอเบื้องต้น ยังไม่มีมติ)
สรุป
ผู้เสพยาบ้า ผู้ครอบครองยาบ้าไม่เกินกฎกระทรวงกำหนด ถือว่า #ผู้เสพเป็นผู้ป่วย ถ้าสมัครใจ เข้ารับการบำบัดรักษา ฟื้นฟู ไม่เสียประวัติ ไม่มีความผิดทางอาญา เป็นคนดีคืนกลับสู่สังคมได้
แต่ถ้าไม่สมัครใจ กฎหมายใหม่ไม่มีบังคับบำบัดรักษา มีโทษทั้งจำทั้งปรับ ติดคุกสถานเดียวครับ
นายกฯ เศรษฐา นั่งหัวโต๊ะ บัญชางานยาเสพติด
นายกฯ เศรษฐา นั่งหัวโต๊ะ บัญชางานยาเสพติด
วางเป้าลดความรุนแรงปัญหายาเสพติดเพื่อประชาชน
พร้อมถกแผนเร่งด่วน 1 ปี ลดผู้ป่วยจิตเวช
วันที่ 31 ตุลาคม 2566 นายเศรษฐา ทวีสิน นายกรัฐมนตรี เป็นประธานการประชุมคณะกรรมการป้องกันและปราบปรามยาเสพติด (บอร์ด ป.ป.ส.) ครั้งที่ 3/2566 ณ ห้องประชุมตึกภักดีบดินทร์ ทำเนียบรัฐบาล โดยมี นายสมศักดิ์ เทพสุทิน รองนายกรัฐมนตรี พ.ต.อ.ทวี สอดส่อง รัฐมนตรีว่าการกระทรวงยุติธรรม นายพิพัฒน์ รัชกิจประการ รัฐมนตรีว่าการกระทรวงแรงงานพล.ต.อ.เพิ่มพูน ชิดชอบ รัฐมนตรีว่าการกระทรวงศึกษาธิการ นายพรหมมินทร์ เลิศสุริย์เดช เลขาธิการนายกรัฐมนตรี นายเชิดชัย ตันติศิรินทร์ ผู้ช่วยรัฐมนตรีว่าการกระทรวงสาธารณสุข นางพงษ์สวาท นีละโยธิน ปลัดกระทรวงยุติธรรม พล.ต.ท.ภาณุรัตน์ หลักบุญ รักษาราชการแทน เลขาธิการ ป.ป.ส. นายธนากร คัยนันท์ รองเลขาธิการ ป.ป.ส. นายมานะ ศิริพิทยาวัฒน์ รองเลขาธิการ ป.ป.ส. นายปิยะศิริ วัฒนวรางกูร รองเลขาธิการ ป.ป.ส. พร้อมด้วยผู้แทนจากหน่วยงานที่เกี่ยวข้อง เข้าร่วมประชุม
การประชุมในครั้งนี้ นับเป็นการประชุมคณะกรรมการ ป.ป.ส. เป็นครั้งแรกของรัฐบาลชุดนี้ และมีนายกรัฐมนตรีเป็นประธานด้วยตนเอง ต่างจากในอดีตที่เป็นรองนายกรัฐมนตรีที่ได้รับการมอบหมายเป็นประธาน โดยมีวาระประชุมที่รัฐบาลให้ความสำคัญและต้องดำเนินการอย่างเร่งด่วนคือ การลดผู้เสพ/ผู้ติดยาเสพติด และผู้ป่วยจิตเวชจากยาเสพติด ปฏิบัติการลดความรุนแรงของปัญหายาเสพติด ในระยะเวลา 1 ปี
นายเศรษฐา ทวีสิน นายกรัฐมนตรี กล่าวในที่ประชุมว่า คณะกรรมการ ป.ป.ส. ถือเป็นกลไกสำคัญทางนโยบายด้านยาเสพติดของประเทศ ตนจึงต้องการเห็นทุกหน่วยงานที่เกี่ยวข้อง ทั้งในด้านการปราบปราม การป้องกัน การบำบัดรักษา ร่วมมือกันอย่างเต็มที่ในการลดความรุนแรงของปัญหายาเสพติด โดยตนจะนั่งหัวโต๊ะในการประชุมคณะกรรมการ ป.ป.ส. ผู้บัญชาการงานด้านยาเสพติดด้วยตนเอง เพื่อลดความรุนแรงของปัญหายาเสพติด
นายกรัฐมนตรี ยังได้กล่าว มอบแนวทางให้การทำงานบรรลุผลสำเร็จ อาทิ การยึดเป้าหมายร่วมกัน ไม่แยกกันทำ โดยมีเป้าหมายสูงสุดคือลดความเดือดร้อนของประชาชนให้ได้, การแก้ไขปัญหาความรุนแรงด้านจิตเวช-ยาเสพติด ซึ่งสร้างความเดือดร้อนให้กับประชาชน, การสร้างความเข้าใจ เนื่องจากแนวทางการทำงานที่ใหม่ จึงต้องทำความเข้าใจทั้งส่วนกลางและพื้นที่ เพื่อความสำเร็จในการปฏิบัติ, การขยายการมีส่วนร่วมของชุมชน, การใช้ประมวลกฎหมายยาเสพติดให้มากขึ้น รวมถึงให้มีการติดตาม และสรุปองค์ความรู้ใหม่ให้เป็น best practice เพื่อสร้างนวัตกรรมจากปฏิบัติการลดความรุนแรงของปัญหายาเสพติดนี้
ด้าน พ.ต.อ.ทวี สอดส่อง รัฐมนตรีว่าการกระทรวงยุติธรรม กล่าวถึง การยกระดับการใช้ประมวลกฎหมายยาเสพติด เพื่อลดความรุนแรงของปัญหา ซึ่งที่ผ่านมาแม้จะมีการบังคับใช้แล้ว แต่เนื่องจากเป็นกฎหมายที่ปรับแนวคิดการแก้ไขปัญหายาเสพติด ยึดผู้เสพเป็นเป็นผู้ป่วยต้องช่วยเหลือ สร้างอาชีพ ผู้ค้าต้องถูกลงโทษและยึดทรัพย์ ซึ่งหน่วยงานและผู้บังคับใช้กฎหมายต้องเร่งปรับตัว ทำความเข้าใจ เพื่อให้การใช้กฎหมายสอดคล้องกัน และนำไปสู่ประโยชน์ได้เต็มที่
พล.ต.ท.ภาณุรัตน์ หลักบุญ รักษาราชการแทนเลขาธิการ ป.ป.ส. ได้เสนอที่ประชุมให้กำหนดพื้นที่ที่มีความจำเป็นเร่งด่วนโดยใช้มาตรา 5 (10) ของประมวลกฎหมายยาเสพติด ในการกำหนดพื้นที่ที่มีความจำเป็นเร่งด่วนในการปราบปรามยาเสพติดตามแนวชายแดน เพื่อดำเนินการควบคุมเป็นพิเศษ เช่น ในพื้นที่ที่มีกลุ่มผู้ลักลอบมักใช้ลำเลียงยาเสพติดผ่านอย่างในจังหวัดพื้นที่ชายแดนภาคเหนือและพื้นที่ชายแดนภาคตะวันออกเฉียงเหนือ ซึ่งที่ประชุมมีมติเห็นชอบในหลักการดังกล่าว
นายเศรษฐา ทวีสิน นายกรัฐมนตรี กล่าวอีกว่า การแก้ไขปัญหายาเสพติด เป็นนโยบายที่สำคัญยิ่งของรัฐบาล ซึ่งผมได้ประกาศเป็นนโยบายที่จะลดปัญหายาเสพติดให้ได้อย่างเป็นรูปธรรม ภายในระยะเวลา 1 ปี ซึ่งเป็นเป้าหมายใหญ่ และท้าทายอย่างมาก หากทำได้สำเร็จผลมากเท่าใดจะลดความเดือดร้อนของประชาชนได้เท่านั้น
แม้ว่าอาการของทั้งสองโรคนี้จะดูคล้ายกันจนแทบแยกไม่ออก แต่ที่โรงพยาบาลเอส สไปน์ แอนด์เนิร์ฟ มีวิธีการวินิจฉัยโรคหมอนรองกระดูกยื่น หรือโรคกระดูกสันหลังเคลื่อน ได้อย่างแม่นยำ โดยแพทย์เฉพาะทางด้านกระดูกสันหลังจะทำการตรวจประเมินร่างกายเบื้องต้น ซักประวัติผู้ป่วยร่วมกับการทำ X-ray และการตรวจด้วยคลื่นแม่เหล็กไฟฟ้า หรือ MRI เพื่อให้แพทย์นำมาใช้ในการวินิจฉัยอาการและยืนยันความผิดปกติที่เกิดขึ้น ตลอดจนสามารถวางแผนการรักษาได้อย่างแม่นยำ และตรงจุด
การรักษาหมอนรองกระดูกยื่น เมื่อผู้ป่วยมีอาการปวดหลังและรับประทานยาแก้ปวดนานเกิน 1 เดือนแล้วและอาการไม่ดีขึ้น แพทย์จะพิจารณาทำการรักษาด้วยวิธีการผ่าตัดกระดูกสันหลังด้วยกล้องเอ็นโดสโคป หรือการเจาะรูส่องกล้อง ด้วยเทคนิค PSLD (Percutaneous Stenoscopic Lumbar Decompression) ที่บริเวณหลัง หรือ เทคนิค PSCD (Percutaneous Stenoscopic Cervical Decompression) ที่บริเวณคอ ซึ่งทั้งสองเทคนิคนี้จะใช้อุปกรณ์ที่มีเลนส์กำลังขยายสูง ที่ติดอยู่ที่บริเวณปลายกล้องเอ็นโดสโคป เปรียบเสมือนดวงตาของแพทย์ ทำให้แพทย์สามารถมองเห็นความผิดปกติได้อย่างชัดเจน แม่นยำ และปลอดภัย สามารถรักษาเฉพาะส่วนที่มีปัญหาโดยที่ไม่ต้องตัดเลาะกล้ามเนื้อส่วนที่ดีออก ทำให้แผลเล็ก เจ็บน้อย ปลอดภัย ฟื้นตัวเร็ว การรักษาด้วยวิธี MIS-Spine นี้จึงเป็นเรื่องง่ายและเป็นทางเลือกที่ดีสำหรับผู้ป่วย เพราะพักฟื้นเพียงแค่ 1 คืนก็สามารถกลับไปใช้ชีวิตได้ตามปกติ
ด้าน อ.นพ.สมเกียรติ ลีละศิธร ผู้อำนวยการ สถาบันราชสุดา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี เผยว่า “กลุ่มนักศึกษาหลักของสถาบันราชสุดาคือกลุ่มคนพิการทางการได้ยิน รวมถึงคนทั่วไปที่สนใจเข้ามาเรียนร่วมในหลักสูตรศิลปศาสตร์และศึกษาศาสตร์ ที่เมื่อจบไปแล้วสามารถเป็นครูสอนคนพิการ หรือประกอบอาชีพอื่น ๆ ได้ตามศักยภาพ
นับตั้งแต่เปิดสถาบันราชสุดาแห่งนี้ได้ผลิตบัณฑิตไปแล้วกว่า 692 ราย ปัจจุบันมีจำนวนนักศึกษาระดับปริญญาตรี ชั้นปีที่ 1 และ 3 ทั้งสิ้น 153 ราย แบ่งเป็น นักศึกษาที่มีความบกพร่องทางการได้ยิน จำนวน 84 ราย นักศึกษาที่มีการได้ยิน 69 ราย และคาดว่าจะมีผู้สำเร็จการศึกษาระดับปริญญาตรีในปี 2567 จำนวน 54 ราย
ในส่วนของระดับบัณฑิตศึกษา แบ่งเป็นระดับปริญญาโท 49 คน คาดว่าจะเสร็จการศึกษาปี 2566 จำนวน 7 ราย และระดับปริญญาเอก 24 ราย จะสำเร็จการศึกษาปี 2566 จำนวน 8 ราย โดยระดับนี้มีนักศึกษาที่มีความบกพร่องทางการเห็น นักศึกษาที่มีความบกพร่องทางการเคลื่อนไหว รวมถึงนักศึกษาทั่วไป
ปัจจุบันมีคนพิการจำนวนมากที่หลุดออกจากระบบการศึกษา ซึ่งสาเหตุเหล่านั้นมีทั้งความไม่พร้อมของสถานศึกษาในการรองรับคนพิการ, สภาพแวดล้อมในครอบครัว, ปัจจัยด้านการเดินทาง รวมถึงสถานะทางการเงิน ปัญหาเหล่านี้จึงยิ่งก่อให้เกิดความเหลื่อมล้ำสูงขึ้นในสังคมไทย การมีอยู่ของสถาบันราชสุดาจึงถือเป็นเรื่องสำคัญในฐานะสถาบันการศึกษาที่จะช่วยสร้างโอกาสให้คนพิการได้ เข้าถึงการศึกษา ผ่านการผลิตบัณฑิต และบัณฑิตเหล่านั้นไปส่งต่อความรู้ให้แก่คนพิการทางการได้ยินต่อไป”
รายชื่อสถานบำบัดประเภทต่างๆ (สบยช)
รายชื่อสถานบำบัดประเภทต่างๆ (สบยช)
รายชื่อสถานบำบัดประเภทต่างๆ (สบยช)
รายชื่อสถานบำบัดประเภทต่างๆ (สบยช)
สวนสุนัข Dog Park สวนเบญจกิติ
สวนสุนัข Dog Park สวนเบญจกิติ เปิดให้บริการมาตั้งแต่ 15 กันยายน 2566 ทางเข้าอยู่ใกล้กับทางเข้าหลักเลย เดินไม่ไกล พื้นที่สวนจะยาวขนานไประหว่างถนนและคลอง ในสวนมีการออกแบบพื้นที่ ทางเดิน สวนปลูกพันธุ์ไม้หลากหลายชนิด ไม้ดอก ไม้ใบ ไม้น้ำ มีป้ายแนะนำการดูแล ควบคุมและคำอธิบายต่างๆ ที่พี่ๆเจ้าของ ควรทราบและพึงปฏิบัติ
การใช้ สวนสุนัข Dog Park มีข้อปฏิบัติจำนวน 3 ข้อ
1. น้องหมาต้องใส่สายจูง และเจ้าของต้องจูงน้องเสมอ (ไม่อนุญาตให้ถอดสายจูงน้องหมา)
2. ต้องลงทะเบียนให้น้องหมา และแสดงหลักฐานการยืนยันการลงทะเบียนให้เจ้าหน้าที่รักษาความปลอดภัยก่อนเข้าใช้บริการ
3. เจ้าของน้องหมาต้องพกถุงใส่อุจจาระน้องหมา และจัดเก็บอุจจาระน้องหมาแล้วทิ้งขยะให้เรียบร้อย โดยที่ทางสวนฯ ได้จัดเตรียมห้องน้ำสำหรับสุนัขไว้ให้
ชมภาพ
สวนสุนัข Dog park สวนเบญจกิติล่าสุด
ป้ายกราฟฟิคสวยงาม ข้อห้าม ข้อปฏิบัติการใช้สนาม Dog Park ที่เจ้าของสุนัขต้องเคร่งครัด
ป้ายกราฟฟิคสวยงาม ธีมสีเหลืองเด่นเตะตา นอกจากรูปน้องหมาตัวใหญ่ๆ เป็นสัญลักษณ์ของสวน Dog Park นี้แล้ว ป้ายบอกข้อห้าม ข้อปฏิบัติ ก็มีความสำคัญที่ผู้ใช้สนาม เจ้าของสุนัขต้องเคร่งครัด
ข้อห้ามสำหรับสุนัขบางประเภท ได้แก่ ห้ามสุนัขป่วย ห้ามสุนัขช่วงผสมพันธุ์ ห้ามลูกสุนัข ห้ามสุนัขก้าวร้าว
ข้อห้ามการใช้สนาม ได้แก่ ห้ามภาชนะแก้วทุกชนิด ห้ามอาหาร/ขนมของคนและสุนัข
ข้อปฏิบัติการใช้สนาม Dog Park
- ต้องใส่สายจูงตลอดเวลา
- นำถุงขยะมาด้วยทุกครั้งและเก็บมูลสุนัขทันที
- สุนัขต้องได้รับใบอนุญาตและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าตามระยะเวลาที่กำหนด
- เจ้าของสุนัขต้องดูแลสุนัขของตนเองมิให้เป็นภัยแก่ผู้อื่นและใส่สายจูงเสมอ
- นำสุนัขไปขับถ่าย และเก็บรวมทั้งพับถุงก่อนทิ้งในถังขยะสัตว์เลี้ยงบริเวณที่ทางสวนได้จัดเตรียมไว้
- ห้ามสุนัขลงเล่นน้ำในบริเวณสวนนี้โดยเด็ดขาด
- ผู้จูงสุนัขต้องมีอายุอย่างน้อย 16 ปี เด็กอายุต่ำกว่า 13 ปี ต้องมีผู้ปกครองดูแลอย่างใกล้ชิด
- เจ้าของสุนัขต้องรับผิดชอบผลการกระทำหรือพฤติกรรมของสุนัขตนเองในทุกกรณี
สวัสดีครับ ผมเป็นมะเร็งปอดครับ
สวัสดีครับ
ผมเป็นมะเร็งปอดครับ
…
Squamous cell carcinoma of the lung with multiple brain, pleural, and lung to lung metastasis
.
มันจะเรียกว่า ระยะสุดท้ายก็ได้ครับ ระยะลุกลาม ระยะที่ไม่สามารถผ่าตัดเอาก้อนออกแล้วก็หายขาดได้อย่างแน่นอนครับ
.
กำลังบรรจุเป็นอาจารย์แพทย์ได้ 2 เดือน
ก็ได้ตั๋วเลื่อนขั้นเป็นอาจารย์ใหญ่เฉยเลย
สงสัยใช่ไหมครับ เพราะผมก็สงสัยเหมือนกัน
…
..
.
ผมมั่นใจในสุขภาพร่างกายตัวเองมากๆนะ ทั้งเข้ายิมสม่ำเสมอ เล่นกีฬา กินอาหารคลีน ไม่สูบบุหรี่ เครื่องดื่มแอลกอฮอล์ก็น้อยมากๆ ทำงานในสภาพแวดล้อมที่ไม่เครียด นอน 4 ทุ่ม ตื่น 6 โมงเช้ามาอ่านหนังสือ ทำวิจัย สอนนักศึกษา ไม่ได้เข้าเวรอดนอนอะไรเลย การงานอาชีพที่เรียกได้ว่ากำลังไปได้สวย เพิ่งจะอดทนเรียนแพทย์เฉพาะทางจบ พร้อมกับปริญญาโทวิทยาการข้อมูลอีกใบ เพื่อมาทำงานเป็นอาจารย์แพทย์ตามที่ฝันไว้
..
.
แล้วผมก็เริ่มไอครับ
ไอมีเสมหะบ้าง ไอแห้งบ้าง ตรวจโควิดแล้วก็ไม่เจอ ตอนนั้นรักษาไปทางกรดไหลย้อนก่อน
ผ่านไป 2 เดือน ระหว่างนี้ผมสามารถเล่นกีฬาได้ตามปกติ ทำงาน ใช้ชีวิตได้ตามปกติเลยจริงๆ มีแค่เรื่องไอที่ไม่หายสักที ไอจนรบกวนการสอน
จึงตัดสินใจไปตรวจจริงๆจัง เอาจริงๆคือเพิ่งจะมีเวลาว่างจากงานด้วยแหละครับ
3 ตุลาคม 2565 เป็นวันที่ไม่มีตารางงานเลย
จึงถือโอกาสไปตรวจสุขภาพหน่อย
…
..
.
Chest X-ray แผ่นแรกบอกผมว่า ชีวิตผมจะไม่เหมือนเดิมอีกต่อไปแล้ว เป็นฟิล์มที่ปอดข้างขวาผมเหลืออยู่ครึ่งเดียว ลักษณะเหมือนมีก้อนกับน้ำอยู่ในปอดด้านขวา และปอดด้านซ้ายก็มีก้อนเล็กๆเต็มไปหมด
.
จังหวะนี้ผมบอกเลยนะ
คุณจะไม่คิดถึงงานของคุณเลย ผมว่าผมเป็นคนบ้างานคนหนึ่งเลยแหละ แต่ ณ ตอนนั้นผม ไม่มีเรื่องงานเหลือในหัวเลย คุณจะไม่มีความคิดเลยว่าอยากทำงานให้มากกว่านี้ หรืออยากใช้เวลาในออฟฟิศให้นานกว่านี้สักนิดเลยครับ
…
..
ถึงจะคิดว่า อายุเราน้อย ไม่มีปัจจัยเสี่ยงอะไรเลย สุขภาพโคตรแข็งแรง แล้วเอาจริงก็คิดว่าผมไม่ใช่คนทำบาปเยอะอะไรนะ ถึงจะพยายามคิดเข้าข้างตัวเองว่าคงไม่ใช่หรอกน่า..
.
แต่
.
หลังจากผ่านการตรวจทุกอย่างมาแล้ว ทั้งเอกซเรย์คอมพิวเตอร์ ผ่าตัดเข้าไปเพื่อไปเอาชิ้นเนื้อมาตรวจ ตรวจคลื่นแม่เหล็กไฟฟ้าที่สมอง
ผลมันก็คือผมเป็น”มะเร็งปอด” จริงๆ
แถมเป็นระยะสุดท้ายด้วย ตัวก้อนหลักขนาดเกือบ 8 cm ที่ปอดด้านขวา นอกจากนี้ตัวมะเร็งยังมีการกระจายไปที่เยื่อหุ้มปอด และปอดข้างซ้ายอีกหลายจุด ที่สำคัญคือ มันกระจายไปที่สมองถึง 6 ก้อนด้วยกัน แต่ละก้อนก็ใหญ่ซะด้วย โชคดีที่ผมไม่มีอาการทางสมองอะไร ทั้งที่ตำแหน่งที่มันกระจายไป สามารถทำให้ผม แขนขาอ่อนแรง ชา เดินไม่ตรง ทรงตัวไม่ได้ หรือแม้แต่เสียการมองเห็นไปเลย
.
อย่างไรก็ตามผมได้รับการรักษาที่ดีที่สุด ณ ตอนนี้แล้วครับ ขอบพระคุณอาจารย์ทุกท่านจากใจจริงครับที่ให้ความช่วยเหลือผมมากขนาดนี้ ทั้งทีมผ่าตัด ทีมดมยา ทีมอาจารย์โรคมะเร็ง รวมถึงพี่พยาบาลเจ้าหน้าที่ทุกท่านที่ดูแลอย่างดี
ผมได้รับ chemotherapy Immunotherapy และได้รับการฉายแสงที่ศรีษะทันทีที่เจอก้อน
ถ้าไม่ได้รับการรักษาที่ยอดเยี่ยมและรวดเร็วแบบนี้ผมอาจจะไม่สามารถมานั่งเขียนสเตตัสนี้แล้วก็ได้ครับ ขอบคุณครับ ขอบคุณจริงๆ
…
..
รวมถึงประกันด้วยครับ ผมโชคดีที่ได้ทำประกันสุขภาพโรคร้ายแรงไว้ ตอนทำคิดแค่ว่าจะเอาไว้ไปผ่าไส้ติ่งที่เอกชน ถึงตอนนี้ประกันจะยังไม่อนุมัติ ยังอยู่ในกระบวนการสืบค้นข้อมูล ซึ่งมันก็เข้าใจได้ครับ ผมเป็นหมอ อายุน้อย ทำไมถึงเลือกประกันนี้ แล้วเป็นเร็วขนาดนี้ แต่ผมอยากจะบอกประกันเลยว่า ผมเนี่ยวางแผนชีวิตไว้เยอะมาก และก่อนหน้านี้ผมก็แข็งแรงมากๆ อนุมัติให้ผมเถอะ ผมไม่ได้ตุกติกครับ สำหรับคนที่ยังไม่มีประกันสุขภาพ ผมแนะนำครับ
.
ถ้าคนแบบผมเป็นมะเร็งได้ ทุกคนมีโอกาสเป็นได้จริงๆครับ โลกเราตอนนี้มันไม่ปกติครับ ทั้งมลภาวะ อากาศ น้ำ รังสีต่างๆ ยีนส์เรามันพร้อมกลายพันธ์ครับ
…
..
.
ตลอดชีวิตที่ผ่านมา ผมเป็นคนที่เชื่อสุดหัวใจว่า ถ้าเรามีเป้าหมายและวางแผน พยายามทุ่มเท อดทน มันจะได้มาซึ่งสิ่งที่เราต้องการได้ ผมเชื่อว่าเราสามารถควบคุมชีวิตเราได้ พัฒนาตัวเอง ดูแลสุขภาพ อ่านหนังสือ ลงทุน ใช้ชีวิตให้ยอดเยี่ยมมาเสมอ
.
มันเลยทำให้ในมือผมมีการ์ดดีๆมากมายเลยครับ
.
ผมมีสุขภาพที่โคตรแข็งแรง มีการงานที่โคตรมั่นคงและมีอนาคตสดใส ผมมีสังคมและความสัมพันธ์ที่อบอุ่นมากๆ รายล้อมไปด้วยผู้คนที่สุดยอดและน่ารัก ผมกล้าพูดว่าผมมีแต่คนรักมากกว่าคนเกลียด อาจเพราะผมใช้ชีวิตด้วยคติคือว่า “ทุกคนที่ได้มาเจอและรู้จักผม เขาจะต้องรู้สึกว่าโชคดีจังที่ได้รู้จักกับผม”
ผมทำแบบนั้นมาตลอด และตอนนี้ผมมีการ์ดเหล่านั้น ผมลงทุนมาตลอดเดินไปตามแผนเกษียณได้อย่างสบายๆ ผมกำลังจะแต่งงานกับผู้หญิงที่ผมรักมากที่สุด ผมกำลังจะสร้างบ้านในฝันของเรา
.
แล้ว
.
ผมก็จั่วได้การ์ด ที่ชื่อว่า “มะเร็งระยะสุดท้าย”
.
การ์ดที่ถึงผมจะไม่อยากได้ แต่ผมก็มีมันอยู่ในมือ
เป็นวันที่ตระหนักว่าจริงๆแล้ว มนุษย์เรามันโคตรเปราะบางเลยครับ
.
มันเหมือนโลกทั้งใบของเราแตกสลายลงไปต่อหน้าเลยนะครับ แผนชีวิตที่วางมาทั้งหมด พังลง ต่อหน้าต่อตาเลย ไม่รู้ด้วยซ้ำว่า ตอนที่ได้ chemo หรือได้ยาอะไรเข้าไปแล้วร่างกายจะเป็นยังไง ฉายแสงที่หัวด้วยรังสีเข้มข้น จะเกิดผลข้างเคียงอะไรไหม จะเดินได้อยู่ไหม จะมองเห็นอยู่ไหม จะกินข้าวได้อยู่ไหม จะยังจำทุกคนได้ไหม จะยังเป็นตัวของตัวเองแบบนี้ได้อีกนานแค่ไหน
.
ผมได้ตระหนักว่าชีวิตเรามันมีเวลาชีวิตจำกัด
ไม่ว่าผมจะตอบสนองกับยาดีแค่ไหน หรือผมจะแข็งแรงแค่ไหน ผมคงไม่ได้แก่ตายแน่ๆ
.
เวลาผมจำกัดแค่ไหนเหรอครับ
.
ตัวเลขจากวิจัยก็อาจจะหลักเดือน หกเดือน หนึ่งปี สองปี ถ้าโชคดีมากๆหน่อยก็อาจจะห้าปี
.
.
ผมไม่รู้จริงๆว่าโลกจะให้เวลากับผมเท่าไร และผมไม่สามารถพยายามอะไรได้เลย ทำได้แค่ภาวนาให้ยาตอบสนอง ให้โรคสงบ ให้ไม่มีผลข้างเคียงอะไรเกิดขึ้น ภาวนา ให้มีชีวิตอยู่อย่างปกติไปได้อีกสักวัน หรืออีกสักเดือน
.
..
…
แต่คุณเชื่อไหม
ผมไม่เสียดายชีวิตที่ผ่านมาเลยนะ
.
ผมมีช่วงชีวิตที่ผ่านมาที่โคตรดี ดีแบบไม่มีอะไรเสียใจ ไม่มีอะไรที่อยากย้อนกลับไปทำเลย ไม่มีอะไรที่อยากกลับไปแก้ไขในอดีตเลย
แปลว่าที่ผ่านมาใช้ชีวิตมาได้น่าพอใจมากๆเลยแหละ คือ ไม่ได้รู้สึกว่า รู้งี้ทำแบบนั้นตอนนั้นดีกว่า หรือย้อนกลับไปเปลี่ยนทางเดินชีวิตอะไรเลย ไม่ได้อยากไปเที่ยวรอบโลก ไม่ได้อยากขับ supercar ไม่ได้อยากมีสังคมกลุ่มใหม่ ไม่ได้อยากทำงานอื่น
.
ไม่ได้อยากมีอะไรที่มากไปกว่าที่ชีวิตตอนนี้มีอยู่เลย ผมว่าผมมีชีวิตที่ดีมากแล้วจริงๆ
.
28 ปีที่ผ่านมาของผม มันยอดเยี่ยมและมีคุณค่ามากพอที่จะเรียกว่าชีวิตที่มีความหมายแล้ว
.
.
ผมและพีมใช้เวลาหนึ่งเดือน ไปกับการรักษาทั้งสารรังสี ยาสลบ การผ่าตัด ยากระตุ้นภูมิ เคมีบำบัด รังสีรักษา รวมถึงยา molnupiravir (ใช่ครับ หลังได้คีโม ผมติดโควิด ลูกรักพระเจ้าไหมละ) และตั้งหลักชีวิตใหม่ เพื่อกลับมามองว่าผมจะเล่นการ์ดในมือนี้ต่อไปยังไง
.
การ์ดมะเร็งในมือนี้ เมื่อมันมาอยู่ในมือผม เพลย์ต่อไปที่ผมจะเล่น คือ
“การฝากบางอย่างไว้ให้กับโลกที่อาจจะไม่ได้น่ารักกับผมเท่าไร”
.
ผมได้รับโอกาสที่จะถ่ายทอดสิ่งที่ผมได้ตกตะกอนมาตลอดชีวิตผม สิ่งที่ได้เรียนรู้ มุมมองการใช้ชีวิต ความเชื่อ ความฝัน ความประทับใจ
รวมถึงเรื่องราวที่ผมอยากจะฝากไว้กับโลกนี้ ทั้งช่วงอารมณ์อ่อนไหว และเข้มแข็ง เผื่อถ้าวันหนึ่งที่ผมไม่อยู่แล้ว ตัวตนของผม จะยังอยู่ตลอดไป
.
ผมคงจะยังได้รับบทบาทเป็นอาจารย์
จะยังได้มีลูกศิษย์ ที่เติบโต ที่ได้เรียนรู้จากผมอยู่
.
..
มันคงจะดีมากๆถ้าการที่ชีวิตที่สั้นลงของผมสามารถเป็นกำลังใจ เป็นพลังให้กับคนที่ยังมีชีวิตอยู่ต่อ
…
ผมและเพื่อนรักของผม
จึงมีความตั้งใจที่จะสร้างเพจนี้ขึ้นมา
เพื่อส่งต่อสิ่งเหล่านี้ครับ
สู้ดิวะ
10 พฤศจิกายน 2565 ไฮไลต์สุดเอ็กซ์คูลซีฟ!!!! ร่วมพูดคุยกับนักแสดงหนุ่มสุดฮอต บอย-ปกรณ์ ฉัตรบริรักษ์ ที่จะมาร่วมพูดคุยถึงความประทับใจในเสน่ห์ของอาหารญี่ปุ่น โดยเฉพาะความชื่นชอบในขนมหวานสไตล์ญี่ปุ่นดั้งเดิม “วากาชิ” ในวันพฤหัสบดีที่ 16 พฤศจิกายน 2566 พิเศษสุด!! ชวนร่วมลิ้มลองเปิดประสบการณ์ความอร่อย กับขนมหวานสไตล์ดั้งเดิม “วากาชิ” ต้นตำรับขนานแท้จากประเทศญี่ปุ่น รังสรรค์โดย 7 เชฟดัง จาก 7 ร้านสุดฮอต ที่บินตรงจากประเทศญี่ปุ่นมาครีเอทเมนูสุดพรีเมี่ยมเพื่อวาระฉลองครบรอบ 5 ปี นำโดย
เกี่ยวกับ โครงการ Young Health Programme
โครงการสร้างเสริมสุขภาพที่ดีในเด็กและเยาวชน (Young Health Programme - YHP) ของบริษัทแอสตร้าเซนเนก้า มุ่งเน้นการปลูกฝังองค์ความรู้ การดูแลสุขภาพ ให้กับเยาวชนอายุระหว่าง 10-24 ปี ในพื้นที่ที่มีความเสี่ยงและความเปราะบางให้ห่างไกลจากปัญหาสุขภาพ โดยเฉพาะเพื่อป้องกันพฤติกรรมเสี่ยงต่อโรคไม่ติดต่อเรื้อรังที่พบบ่อย ได้แก่ มะเร็ง เบาหวาน โรคหัวใจ โรคระบบทางเดินหายใจ และสุขภาพจิต
โครงการ Young Health Programme ดำเนินงานร่วมกับ องค์การแพลน อินเตอร์เนชั่นแนล ประเทศไทย และ UNICEF และใช้ฐานองค์ความรู้จากข้อมูลการวิจัยจากสำนักวิชาสาธารณสุขศาสตร์ Johns Hopkins Bloomberg มีการดำเนินการไปแล้วกว่า 30 ประเทศ และส่งเสริมให้เด็กและเยาวชนมีข้อมูลในการป้องกันความเสี่ยงต่อโรคไม่ติดต่อเรื้อรังไปแล้วกว่า 12 ล้านคน โครงการ Young Health Programme มุ่งเน้นสนับสนุนการพัฒนาสภาพแวดล้อมในการป้องกัน และส่งเสริมให้เด็กและเยาวชนมีข้อมูลในการตัดสินใจเกี่ยวกับสุขภาพของตนเอง ผ่านการทำงานร่วมกับชุมชน การนำข้อมูลความรู้จากงานวิจัย และการผลักดันนโยบายด้านสุขภาพ รวมทั้งสนับสนุนการสร้างแกนนำนักเรียนและนักศึกษาสร้างเสริมสุขภาพ โครงการ Young Health Programme เป็นส่วนหนึ่งของสัญญาด้านความยั่งยืนของ บริษัทแอสตร้าเซนเนก้า ที่จะใช้ทรัพยากรและความสามารถขององค์กรเพื่อสร้างการเปลี่ยนแปลงมีความหมายต่อความต้องการด้านสุขภาพของสังคม
แพคเกจคลอดบุตร คลอดปกติ-ผ่าตัดคลอด
ค่าบริการ
คลอดปกติ 8,000 - 10,000 บาท
ผ่าตัดคลอด 20,000 - 22,000 บาท


ภายในงาน รศ.นพ.เชิดชัย ตันติศิรินทร์ ผู้ช่วยรัฐมนตรีประจำกระทรวงสาธารณสุข เป็นตัวแทนกระทรวงสาธารณสุขร่วมเป็นประธานในพิธี นับเป็นสัญญาณที่ดีในการสานต่อความสัมพันธ์ของความร่วมมือในการพัฒนาระบบสาธารณสุขในประเทศไทย ซึ่งเดนมาร์กมีความมุ่งมั่นในการทำงานเพื่อรักษาสุขภาพในระดับโลกมายาวนานหลายศตวรรษ สอดคล้องกับนโยบายของกระทรวงสาธารณสุข รวมถึงการจัดการกับความท้าทายด้านสุขภาพที่ยังเป็นวาระเร่งด่วนระดับโลก สำหรับประเทศไทย รัฐบาลตั้งเป้าหมายยกระดับโครงการ 30 บาทพลัส เพื่อตอบโจทย์การเป็นรัฐสวัสดิการที่ดูแลประชาชนในระดับพื้นฐาน ประเทศไทย มีประชากรป่วยเป็นโรคเบาหวานเพิ่มขึ้นปีละประมาณ 100,000 ราย ขณะที่ผู้ป่วยกลุ่ม NCDs เพิ่มสูงขึ้นประมาณ 300,000 รายต่อปี ส่งผลให้เกิดภาระค่าใช้จ่ายเพิ่มขึ้นตาม จึงจำเป็นต้องหาแนวทางในการทำงานบูรณาการร่วมกัน และเน้นป้องกันโรคมากกว่าการรักษา โดยสร้างเสริมสุขภาพและคุณภาพชีวิตของประชาชนไทยตลอดช่วงชีวิตทุกกลุ่มวัยก็จะส่งเสริมให้ประเทศไทยก้าวสู่สังคมสุขภาพที่ยั่งยืน โดยกระทรวงสาธารณสุขพร้อมเปิดกว้างและร่วมมือกับภาคเอกชนในการร่วมกันแก้ปัญหา เพื่อลดภาระประเทศในระยะยาว และเชื่อว่าความมั่งคั่งของประชาชนย่อมต้องมาพร้อมสุขภาพที่ดีควบคู่กัน
ช่วงกล่าวเปิดงาน นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข ย้ำถึงความสำคัญของการสร้างความร่วมมือระหว่างภาครัฐและภาคเอกชน (Public-Private Partnership: PPP) โดยเพิ่ม “คน” หรือ People ถือเป็นหัวใจสำคัญ และเน้นการแบ่งปันองค์ความรู้ระหว่างกัน เพราะเป็นปัจจัยหลักให้เกิดความยั่งยืนเชิงสุขภาพได้ในระยะยาว เนื่องจากโรคเบาหวานและโรคอ้วนถือเป็นโรคที่เกิดจากพฤติกรรม ดังนั้น จำเป็นต้องอาศัยการปรับเปลี่ยนพฤติกรรมจากตัวเอง สร้างสภาพแวดล้อมที่เอื้อให้มีการขยับร่างกายในชีวิตประจำวันเพิ่มขึ้น และให้สังคมหรือชุมชนช่วยกระตุ้นพฤติกรรมเชิงบวกร่วมกัน ทั้งนี้ กระทรวงสาธารณสุขได้ริเริ่มโครงการ ‘โรงเรียนเบาหวานวิทยา’ เพื่อให้ความรู้แก่ผู้ป่วยเบาหวานในชุมชนในการดูแลตัวเอง ตลอดจนส่งเสริมให้มีการนำเทคโนโลยีดิจิทัลมาใช้ในด้านสาธารณสุขเพื่อเพิ่มประสิทธิภาพในการดูแลรักษา
ทรงตัวผิดปกติ เดิน-ยืนเซ อันตรายที่มองไม่เห็น
การเดินเซ หรือปัญหาการทรงตัวเป็นปัญหาที่แฝงอยู่ในการเคลื่อนไหวของร่างกายในทุกอิริยาบถ จังหวะการก้าวเดินที่ไม่สมดุลจะทำให้เราไม่สามารถก้าวต่อไปได้อย่างมั่นคง ทำให้ล้ม เป็นอันตรายถึงชีวิตได้
การทรงตัวที่ไม่ปกติเกิดได้จากหลายสาเหตุ ไม่ว่าจะเป็นพันธุกรรม โรค การบาดเจ็บ การใช้ชีวิตประจำวันของแต่ละบุคคล รวมถึงสภาพร่างกายของแต่ละคน โดยเฉพาะกล้ามเนื้อ ข้อต่อ ระบบประสาทรับรู้ความรู้สึก การส่งสัญญาณ ไปจนถึงระบบสมอง
“หูมีผลต่อการทรงตัว หากมีอาการผิดปกติของหูข้างใดข้างหนึ่ง มีผลต่อให้ไม่สามารถทรงตัวได้ โดยเมื่อมีการเคลื่อนไหวจะแสดงอาการ พฤติกรรมในการใช้ชีวิตประจำวัน อาชีพที่ต้องใช้กำลังกล้ามเนื้อ ก็ส่งผลต่อการทรงตัวของเราเหมือนกัน” อาจารย์ชัชนีกล่าวยกตัวอย่างเหตุที่อาจก่อให้เกิดการทรงตัวผิดปกติ
“การมองด้วยตาเปล่า จะเห็นการทรงตัวผิดปกติได้แค่คร่าว ๆ เท่านั้น โดยมาก เราจะรู้ว่าการทรงตัวของเราผิดปกติ ก็ต่อเมื่อรู้สึกเซ หรือมีอาการเซ ไปจนถึงขั้นล้มแล้ว ดังนั้น การมีอุปกรณ์ที่สามารถวิเคราะห์การทรงตัวก็จะช่วยให้เรารับรู้ความผิดปกติของเรา เพื่อปรับเปลี่ยนพฤติกรรม และป้องกันไม่ให้เกิดการล้มในอนาคต”
อ้างอิง
- World Health Organization. Preterm birth. Available at: https://www.who.int/news-room/fact-sheets/detail/preterm-birth. [Accessed 19 June 2023]
- Nursing, Health, and Education Journal. Effects of Empowerment Program for pregnant wemen at risk of preterm labor on the prevalence of preterm labor and preterm delivery. Available at: https://he02.tci-thaijo.org/index.php/NHEJ/article/view/259766/178105 [Accessed 31 December 2022]
- MedlinePlus. Premature infant. Available at: https://medlineplus.gov/ency/article/001562.htm. [Accessed 6 March 2023]
- Goldenberg R et al. Epidemiology and causes of preterm birth. Lancet. 2008;371:75–84.
- Healthy Children. Developmental milestones of the premature baby. Available at: https://www.healthychildren.org/english/ages-stages/baby/preemie/pages/preemie-milestones.aspx. [Accessed 19 June 2023]
- Healthy Children. Caring for a premature baby: what parents need to know. Available at: https://www.healthychildren.org/english/ages-stages/baby/preemie/pages/caring-for-a-premature-baby.aspx. [Accessed 19 June 2023]
- Kaler J et al. Respiratory Syncytial Virus: A Comprehensive Review of Transmission, Pathophysiology, and Manifestation. Cureus. 2023;15(3):e36342
- Healthy Children. Health issues of premature babies. Available at: https://www.healthychildren.org/english/ages-stages/baby/preemie/pages/health-issues-of-premature-babies.aspx. [Accessed 19 June 2023]
- MedlinePlus. Intraventricular hemorrhage of the new born. Available at: https://medlineplus.gov/ency/article/007301.htm. [Accessed 19 June 2023]
- Piedimonte G, Perez MK. Respiratory syncytial virus infection and bronchiolitis. Pediatric Rev. 2014;35(12):519–530.
- Collins PL, Graham BS. Viral and host factors in human respiratory syncytial virus pathogenesis. J Virol. 2008;82(5):2040–2055.
- Rossi GA, Colin AA. Infantile respiratory syncytial virus and human rhinovirus infections: respective role in inception and persistence of wheezing. Eur Respir J. 2015;45(3):774–789.
- AstraZeneca. Data on file
- World Health Organization. Breastfeeding. Available at: https://www.who.int/en/health-topics/breastfeeding#tab=tab_1. [Accessed 19 June 2023]
- Goldstein M, et al. National Perinatal Association 2018 Respiratory Syncytial Virus (RSV) Prevention Clinical Practice Guideline: an evidence-based interdisciplinary collaboration. Neonatol Today. 2017;12(10):1–14.
- March of Dimes. Preterm babies are at higher risk for RSV. Available at: https://www.marchofdimes.org/find-support/blog/preterm-babies-are-higher-risk-rsv#:~:text=RSV. [Accessed 19 June 2023]
คลินิกฝังเข็ม โรงพยาบาลกลาง
คลินิกฝังเข็ม กลุ่มงานเวชกรรมฟื้นฟู โรงพยาบาลกลาง
โดยเปิดให้บริการทุกวันจันทร์ อังคาร พุธ ศุกร์
เวลา 08.00 – 12.00 น. (ในเวลาราชการ)
วันพุธ เวลา 16.00 – 20.00 น. (นอกเวลาราชการ)
(หยุดวันนักขัตฤกษ์)
ค่าใช้จ่ายในการรักษา :
ค่าฝังเข็ม (รวมเข็มและไม่จำกัดจำนวนเข็ม) 300 บาท/ครั้ง
ค่าบริการทางการแพทย์ 50 บาท/ครั้ง
หมายเหตุ
1.ผู้ป่วยใช้สิทธิเบิกจ่ายทางราชการ สามารถเบิกค่าฝังเข็มได้ 150 บาท/ครั้ง ตามที่ระบุในกรมบัญชีกลาง
2.ผู้ป่วยสิทธิประกันสังคมหรือประกันสุขภาพถ้วนหน้า ต้องชำระค่าฝังเข็มเองเต็มจำนวน
3.ผู้ป่วยสิทธิเบิกจ่ายทางรัฐวิสาหกิจหรือภาคเอกชน สามารถเบิกค่าฝังเข็มได้ตามสิทธิที่หน่วยงานนั้นๆ เป็นผู้กำหนด
ติดต่อสอบถามและนัดพบแพทย์
ได้ที่คลินิกฝังเข็ม กลุ่มงานเวชกรรมฟื้นฟู โรงพยาบาลกลาง
โทร. 0-220-8000 ต่อ 10800, 10801
โปรแกรมตรวจสุขภาพประจำปี อายุน้อยกว่า 35 ปี
โปรแกรมตรวจสุขภาพประจำปี อายุน้อยกว่า 35 ปี สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
วันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day)
องค์การอนามัยโลก หรือ WHO กำหนดให้วันที่ 28 กันยายนของทุกปีเป็นวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day) ประชาชนสามารถร่วมกันป้องกันโรคพิษสุนัขบ้าได้ ดังนี้
1) เจ้าของสัตว์เลี้ยง เช่น สุนัข แมว ต้องนำสัตว์เลี้ยงไปฉีดวัคซีนครั้งแรกเมื่ออายุ 2-4 เดือน แล้วฉีดซ้ำตามกำหนดนัดทุกปี
2) ไม่ควรปล่อยสัตว์เลี้ยงออกนอกบ้านตามลำพังโดยไม่ใส่สายจูง เพราะอาจถูกสุนัขจรจัดที่เป็นโรคพิษสุนัขบ้ากัดได้
3) ช่วยกันลดจำนวนสุนัขที่ไม่มีเจ้าของหรือสุนัขที่ไม่มีผู้รับผิดชอบโดยการทำหมันถาวร
4) ลดความเสี่ยงจากการถูกสุนัขกัดหรือป้องกันด้วย “คาถา 5 ย.” คือ อย่าแหย่ ให้สุนัขโมโห โกรธ อย่าเหยียบ หาง หัว ตัว ขา หรือทำให้สุนัขหรือสัตว์ต่าง ๆ ตกใจ อย่าแยก สุนัขที่กำลังกัดกันด้วยมือเปล่า อย่าหยิบ ชามข้าวหรือเคลื่อนย้ายอาหารขณะที่สุนัขกำลังกินอาหาร และอย่ายุ่ง หรือเข้าใกล้กับสุนัขหรือสัตว์ต่าง ๆ ที่ไม่มีเจ้าของหรือไม่ทราบประวัติ
นอกจากนี้ เมื่อถูกสุนัขหรือแมว กัด ข่วน ต้องล้างแผลด้วยน้ำและสบู่ให้สะอาด ใส่ยารักษาแผลสด กักสุนัขหรือแมวไว้ดูอาการ 10 วัน ไปพบแพทย์เพื่อรับการศึกษาที่ถูกต้อง และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้ครบตามนัด สอบถามเพิ่มเติมได้ที่ สถานเสาวภา สภากาชาดไทย โทรศัพท์ 0 2252 0161-4 หรือ 1664
จากกรณี ที่มีการโพสต์คลิป อาจารย์เอก ฝ่ามือพลังจิต รักษาผู้ป่วยที่มีปัญหาเรื่องหมอนรองกระดูก ด้วยการให้นอนคว่ำ และเดินถีบผู้ป่วยแต่ละคน โดยผู้ถ่ายคลิปบรรยายว่า ที่นอนอยู่นี่ มีอาการกระดูกทับเส้นทั้งหมด ไม่ต้องใช้เวลานาน แค่ให้อาจารย์ถีบแล้วลุกขึ้นเลย แล้วทดสอบเลยว่า เบาขึ้นไหม ดีขึ้นไหม ซึ่งมีคนยกมือตอบว่า โดนถีบแล้ว อาการดีขึ้น เบาขึ้น
อีกคลิปมาจากเพจ ฝ่ามือพลังจิต อาจารย์เอก โพสต์คลิปรักษาชาวบ้านด้วยการตบ พร้อมเขียนข้อความระบุว่า คนป่วย 2,000 กว่าคน ตบ ๆ หาย ถีบ ๆ หาย ในคลิป อาจารย์เอก เดินรักษาผู้มีอาการป่วย ด้วยการตบที่บริเวณ อกและไหล่อย่างแรง พร้อมบอกว่า เป็นการรักษาคอ บ่า ไหล่ ทำให้มีชาวเน็ตเข้ามาตั้งคำถามว่า การรักษาในลักษณะนี้ สามารถทำให้หายได้จริงหรือไม่
อาจารย์เอก ฝ่ามือพลังจิต
ผู้สื่อข่าวได้ไปคุยกับอาจารย์เอก ถึงเรื่องที่เกิดขึ้นว่า การรักษาโรคต่าง ๆ มันแล้วแต่ศาสตร์ ซึ่งการรักษาหมอนรองกระดูกทับเส้นประสาทในวิธีของตน กินกล้วยยังไม่ทันหมดลูกก็หาย การันตีได้ รักษามาแล้วเป็นหมื่นคน ถ้ามั่ว คนเป็นพันคนจะแห่มาหาทำไม ศาสตร์นี้คนละขั้วกับแพทย์แผนปัจจุบัน แต่สามารถรักษาควบคู่กันได้ ยืนยันไม่อุปโลก ไม่ได้มโน พร้อมขอท้าแพทย์แผนปัจจุบัน ทั้งรัฐมนตรีว่าการกระทรวงสาธารณสุข ให้มารักษากับตน พร้อมบอกกล้ามาวัดดวงกันไหม
นายกีรติ สมคิด หรือ อาจารย์เอก ฝ่ามือพลังจิต ชี้แจงกรณีท้าทาย นายแพทย์ ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข ว่า ตนไม่ได้ท้าทาย แบบนักเลงท้าตี ท้าต่อย แต่เป็นการเชิญให้มาพิสูจน์ให้รู้ว่าศาสตร์ที่ตนคิดค้นขึ้นมานี้มันมีจริงและดีจริง ควรจะให้การสนับสนุนให้เป็นรูปแบบ เพราะตอนนี้ตนยังไม่มีใบรับรองอะไร เพราะเป็นศาสตร์ที่ตนเพิ่งคิดค้นขึ้นมาเป็นครั้งแรก และอยู่ระหว่างรวบรวมเอกสารในการขอจดทะเบียนแพทย์ทางเลือก
จึงอยากให้หน่วยงานที่เกี่ยวข้อง มาพูดคุยและร่วมกันพิสูจน์หากมีตรงไหนที่ยังไม่ถูกต้องตนเองพร้อมปฏิบัติตาม ซึ่งเป้าหมายอยากให้ศาสตร์วิชาการรักษาของตนเป็นที่ดึงดูดของคนจากทั่วทั้งโลกให้มารักษาที่ประเทศไทย และต้องการทำให้นานาประเทศเห็นว่าในประเทศไทยมีการรักษาแบบนี้และผลของการรักษาก็เห็นแล้วว่า หายจริง
ชมคลิป
3PlusNews เที่ยงวันทันเหตุการณ์ วันที่ 15 พฤศจิกายน 2566
กรมอนามัย ส่งทีม SEhRT ศูนย์อนามัยลงพื้นที่เหนือ-อีสาน ประเมินผลกระทบสุขภาพจากเหตุแผ่นดินไหว
กรมอนามัย กระทรวงสาธารณสุข มอบหมายทีมปฏิบัติการด้านส่งเสริมสุขภาพและอนามัยสิ่งแวดล้อม (ทีมSEhRT) ศูนย์อนามัยลงพื้นที่เฝ้าระวัง ติดตามสถานการณ์ และประเมินผลกระทบด้านอนามัยสิ่งแวดล้อมจากแผ่นดินไหวในพื้นที่เสี่ยงภัย พร้อมทั้งแนะนำประชาชนในพื้นที่เสี่ยง เตรียมพร้อมรับมือแผ่นดินไหวอย่างปลอดภัย
แพทย์หญิงอัจฉรา นิธิอภิญญาสกุล อธิบดีกรมอนามัย กล่าวว่า จากข้อมูลรายงานการเกิดสถานการณ์ภัยพิบัติจากแผ่นดินไหวของกองเฝ้าระวังแผ่นดินไหว กรมอุตุนิยมวิทยา เมื่อวันที่ 17 พฤศจิกายน 2566 เวลา 08.37 น. เกิดแผ่นดินไหวจุดศูนย์กลางอยู่บริเวณประเทศเมียนมา ขนาด 6.4 ความลึก 9 กิโลเมตร ทางทิศตะวันตกเฉียงเหนือของ อ.แม่สาย จ.เชียงราย ประมาณ 100 กิโลเมตร ส่งผลให้เกิดความสั่นสะเทือนในหลายจังหวัด ได้แก่ เชียงราย เชียงใหม่ ลำปาง ลำพูน น่าน พะเยา แม่ฮ่องสอน อุดรธานี ขอนแก่น สกลนคร และกรุงเทพมหานคร จากสถานการณ์ดังกล่าวส่งผลให้ประชาชนในพื้นที่เสี่ยงภัยได้รับผลกระทบ เช่น ประชาชน มีอาการวิงเวียนศีรษะ อาคารสูง สถานที่ต่างๆ บ้านเรือนของประชาชน รวมถึงสถานบริการสาธารณสุขหลายแห่งได้รับผลกระทบและเกิดความเสียหายจากแรงสั่นสะเทือน เช่น โรงพยาบาลเชียงรายประชานุเคราะห์ จ.เชียงราย โรงพยาบาลศูนย์สกลนคร จ.สกลนคร ได้รับผลกระทบจากแรงสั่นสะเทือน ทำให้ตัวอาคารมีรอยแตกร้าวขนาดใหญ่ ต้องอพยพผู้ป่วยและประชาชนออกจากพื้นที่
แพทย์หญิงอัจฉรา นิธิอภิญญาสกุล กล่าวต่อไปว่า กรมอนามัยได้มอบหมายให้ทีมปฏิบัติการทีม SEhRT ของศูนย์อนามัย ร่วมกับหน่วยงานในพื้นที่ประเมินผลกระทบทางสุขภาพและความเสียหายด้านอนามัยสิ่งแวดล้อม ในสถานบริการสาธารณสุขที่เสียหายและชุมชน ได้แก่ ความปลอดภัยอาคาร ระบบออกซิเจน ระบบไฟฟ้าและไฟฟ้าสำรอง ระบบสาธารณูปโภค ระบบบำบัดน้ำเสีย และเร่งเฝ้าระวังด้านสุขาภิบาล เช่น การปนเปื้อนสารเคมีในน้ำจากระบบบำบัดน้ำเสียโรงพยาบาลที่เสียหาย การปนเปื้อนของฝุ่นละอองที่เกิดจากอาคารพังทลายเสียหาย เป็นต้น สำหรับประชาชนให้เร่งสื่อสารสร้างความรอบรู้เพื่อลดผลกระทบต่อสุขภาพประชาชน คือ 1) ติดตาม รับฟังข่าวสารจากหน่วยงานภาครัฐ เมื่อเกิดเหตุให้ตั้งสติ และเตรียมพร้อมอพยพ 2) กรณีอาศัยอยู่ภายในบ้านให้หมอบลงที่พื้นใต้โครงสร้างอาคารแข็งแรง ป้องกันสิ่งของจากเพดานหรือที่สูงหล่นใส่ 3) กรณีเปิดแก๊สประกอบปรุงอาหาร ให้หยุดการทำกิจกรรมดังกล่าว และปิดแก๊สโดยทันที 4) กรณีอยู่ในอาคารสูง คอนโด อพาร์ทเม้นท์ให้เตรียมอพยพ หากมีความรุนแรงต่อเนื่อง ให้รีบออกจากอาคารทันที โดยใช้ทางหนีไฟ ห้ามใช้ลิฟท์โดยสารเด็ดขาด เมื่อพ้นจากอาคารให้ออกไปให้ห่างจากตัวอาคารให้มากที่สุด และต้องคำนึงถึงบุคคลในบ้านที่เป็นกลุ่มเปราะบาง กลุ่มเสี่ยงทางสุขภาพควรเตรียมหาทางพาออกจากพื้นที่โดยเร่งด่วน 5) ออกห่างจากหน้าต่าง และประตู โดยเฉพาะกระจก ป้องกันอันตราย และลดความเสี่ยงการบาดเจ็บ หรือเสียชีวิตจากกรณีตัวโครงสร้างที่ถูกทำลาย จากแผ่นดินไหวรุนแรง 6) กรณีที่อยู่นอกตัวอาคารอยู่แล้ว ห้ามเข้าไปในอาคาร และสังเกตจุดที่ยืนหลบภัย ต้องไม่มีสิ่งปลูกสร้างสูง ป้ายโฆษณา ต้นไม้ เสาไฟฟ้า โดยรอบ เพื่อป้องกันการถล่มหรืออุบัติเหตุ และ 7) เตรียมเก็บสิ่งของที่จำเป็นให้พร้อม สามารถหยิบออกมาได้ทันที
“ทั้งนี้ ขอให้ประชาชนเฝ้าระวังติดตามสถานการณ์การเกิดแผ่นดินไหวอย่างใกล้ชิด โดยเฉพาะกลุ่มเสี่ยง กลุ่มเปราะบาง ได้แก่ ผู้สูงอายุ เด็กเล็ก หญิงตั้งครรภ์ ให้ดูแลและเฝ้าระวังเป็นพิเศษ ให้สังเกต ทำความคุ้นเคยทางออกฉุกเฉิน หรือทางหนีไฟที่ใกล้ตัวที่สุด หากเกิดเหตุการณ์แผ่นดินไหวจะได้สามารถหนีออกมาได้อย่างรวดเร็วและปลอดภัย ลดความเสี่ยงการสูญเสีย บาดเจ็บ และเสียชีวิต” อธิบดีกรมอนามัย กล่าวในที่สุด
พฤติการณ์กล่าวคือ สืบเนื่องจาก ปรากฏข่าวตามสื่อเกี่ยวกับภัยของยากลุ่มกระตุ้นอารมณ์ทางเพศ ออกมาอย่างต่อเนื่อง เช่น ไฮโซคนดังหยอดยาเสียสาวผสมเหล้าให้รับประทาน จนร่างกายเกิดภาวะช็อกเสียชีวิต, พริตตี้สาวถูกคนร้ายหวังข่มขืน โดนหยอดยาปลุกเซ็กส์ให้รับประทานจนเกิดความต้องการทางเพศ อาเจียน และเกิดภาวะช็อก และ ชายสูงวัยรับประทานยาไวอากร้าจนเกิดภาวะหัวใจวายเฉียบพลัน เป็นต้น โดย “ยาเสียสาว-ยาเสียหนุ่ม” อาจประกอบด้วยสารอันตรายชนิดต่างๆ ที่มีผลกระทบต่อระบบประสาท เช่น รู้สึกตื่นตัว สนุก รวมถึงกระตุ้นความรู้สึกอยากมีเพศสัมพันธ์ หรือบางชนิดอาจทำให้เบลอหรือง่วง ซึ่งปรากฏว่ามีการโฆษณาขายในโซเชียล ส่วนใหญ่จะเป็นของเหลวใส ง่ายต่อการผสมในเครื่องดื่ม
เจ้าหน้าที่ตำรวจกองกำกับการ 4 กองบังคับการปราบปรามการกระทำความผิดเกี่ยวกับการคุ้มครองผู้บริโภคจึงมีการเฝ้าระวังกลุ่มยาชนิดดังกล่าวเรื่อยมา ประกอบกับในช่วงเดือนพฤศจิกายน มีเทศกาลสำคัญซึ่งมีหนุ่มสาวออกมารวมตัวกันเพื่อ “ลอยกระทง” บางส่วนมีการจัดงานปาร์ตี้ส่วนตัว และสังสรรค์ตามสถานบันเทิง ซึ่งอาจเป็นช่องว่างให้มีการนำยาเสียสาวมาใช้กับเหยื่อเพื่อประสงค์ต่อทรัพย์สิน ล่วงละเมิดทางเพศ หรือก่ออาชญากรรมรูปแบบอื่น ๆ จึงเป็นที่มาของการระดมกวาดล้างยาเสียสาวต้อนรับเทศกาลลอยกระทงในครั้งนี้
24 พ.ย. 2566 คนไทยชุดแรก 10 คน ได้รับการปล่อยตัว
กระทรวงการต่างประเทศได้รับแจ้งจากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟว่าสถานเอกอัครราชทูตฯ ได้รับรายงานว่ามีคนไทยจำนวน ๑๐ คนได้รับการปล่อยตัวแล้ว ขณะนี้ได้ข้ามเข้ามาในอิสราเอลผ่านช่องผ่านแดน Rafah และอยู่ระหว่างการเดินทางไปยังจุดคัดกรองที่ฐานทัพอากาศ Hatzerim ทั้งนี้ในเบื้องต้นยังไม่ทราบเพศและชื่อตัวประกันที่ถูกปล่อยตัว
ในเบื้องต้นนี้ ทั้ง 10 คน จะถูกนำไปที่โรงพยาบาล Shamir Medical Center (Assaf Harofeh) โดยเจ้าหน้าที่สถานเอกอัครราชทูตฯ จะเดินทางไปพบที่โรงพยาบาล ซึ่งทั้ง 10 คนดังกล่าวจะอยู่ภายใต้การดูแลของทีมแพทย์และพยาบาล โดยห้ามพบบุคคลภายนอกเป็นเวลาอย่างน้อย 48 ชั่วโมง
กระทรวงการต่างประเทศขอแสดงความยินดีอย่างยิ่งกับพี่น้องแรงงานไทยและครอบครัวของทั้ง 10 คนที่ได้รับการปล่อยตัวจากการถูกจับกุมในวันนี้ และจะเร่งนำทุกคนกลับประเทศไทยอย่างปลอดภัย
รัฐบาลไทยขอขอบคุณรัฐบาลกาตาร์ อิสราเอล อียิปต์ อิหร่าน มาเลเซีย และ ICRC รวมถึงผู้มีส่วนเกี่ยวข้องในการเจรจาทุกฝ่ายในการช่วยเหลือตัวประกันชุดแรก และหวังเป็นอย่างยิ่งว่าตัวประกันที่เหลือทั้งหมดจะได้รับการดูแลและปล่อยตัวอย่างปลอดภัยโดยเร็วที่สุด
*10 คน (ตัวเลขที่ได้รับการแจ้งยืนยันพร้อมรายชื่อล่าสุด ซึ่งเปลี่ยนจากเดิมที่มีรายงานว่า 12 คน)
วัตถุประสงค์และหลักการให้วัคซีน HPV
1. วัตถุประสงค์
เพื่อสร้างเสริมภูมิคุ้มกันต่อเชื้อไวรัส HPV ในกลุ่มเป้าหมาย มุ่งหวังผลในการลดการเจ็บป่วยและเสียชีวิตด้วยมะเร็งปากมดลูกในหญิงไทย
2. หลักการให้วัคซีน HPV
2.1 หลักการให้วัคซีน HPV ตามคำแนะนำคณะอนุกรรมการสร้างเสริมภูมิคุ้มกันโรค แนะนำให้ หญิง อายุ 11 – 20 ปีให้วัคซีน HPV จำนวน 2 เข็ม ห่างกันอย่างน้อย 6 เดือน ทั้งนี้ สามารถสับเปลี่ยนชนิดวัคซีน HPV ระหว่างเข็มที่ 1 และเข็มที่ 2 ได้
2.2 คำแนะนำการให้วัคซีน HPV ตามนโยบายเร่งรัด 100 วัน ของกระทรวงสาธารณสุข
เร่งรัดฉีดวัคซีนคนละ 1 เข็ม (เป็นเข็มที่ 1 หรือ 2 ตามประวัติการได้รับวัคซีนของกลุ่มเป้าหมายและคำแนะนำของคณะอนุกรรมการสร้างเสริมภูมิคุ้มกันโรค)
3. เป้าหมายการดำเนินงาน
ตามนโยบายเร่งรัด 100 วัน ของกระทรวงสาธารณสุข ผลการฉีดวัคซีน HPV อย่างน้อย 1 ล้านโดส ใน 100 วันแรก
4. กลุ่มเป้าหมาย
หญิงไทยอายุ 11 – 20 ปี (หญิงไทยที่เกิดวันที่ 1 ม.ค. 2546– 31 ธ.ค. 2555 ) ที่ยังไม่ได้รับวัคซีนครบ 2 เข็ม
5. พื้นที่ดำเนินการ
ดำเนินการพร้อมกัน 76 จังหวัด และกรุงเทพมหานคร
คู่มือการใช้งาน ระบบการแจ้งราคา ค่าบริการรักษาพยาบาล โดยกรมการค้าภายใน
ระบบการแจ้งราคา ยารักษาโรค เวชภัณฑ์ ค่าบริการรักษาพยาบาล บริการทางการแพทย์ และบริการอื่นของสถานพยาบาล
นโยบาย แก้หนี้ เสริมกำลังใจ ให้คนสาธารณสุข โดย นายแพทย์ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข
“ผมพร้อมรับฟังทุกความคิดเห็น ทุกปัญหาอุปสรรค และมีความจริงใจที่จะเข้ามาร่วมแก้ไขปัญหาให้กับบุคลากร อย่างเรื่องเงินค่าตอบแทนเสี่ยงภัยโควิด 19 ที่รองบประมาณเพิ่มเติมจาก ครม. ก็ได้ติดตามมาตลอด, เรื่องตำแหน่งงาน มีการช่วยเหลือบรรจุให้เสมอภาคทางสายอาชีพ ความก้าวหน้าทางสายงาน เช่น การกำหนดตำแหน่งพยาบาลวิชาชีพระดับชำนาญการพิเศษ การบรรจุผู้ได้รับจ้างงานอื่นตำแหน่งพยาบาลวิชาชีพเข้ารับราชการ รวมทั้งการแยกตัวออกจากสำนักงานคณะกรรมการข้าราชการพลเรือน (ก.พ.) ซึ่งต้องใช้ระยะเวลา แต่กำลังเร่งดำเนินการ เพื่อให้อนาคตมีความคล่องตัวในการบริหารจัดการกรอบอัตรากำลัง การทำผลงานวิชาการ ส่วนเรื่องภาระงานล้น บุคลากรน้อย การนำเทคโนโลยีเข้ามาเพิ่มความสะดวกรวดเร็วในการทำงาน จะช่วยลดภาระงานได้ส่วนหนึ่ง” นพ.ชลน่านกล่าว
ทั้งนี้ ด้วยความก้าวหน้าของเทคโนโลยีดิจิทัลในปัจจุบัน ทำให้มีการนำเทคโนโลยี AI เข้ามาช่วยเพิ่มประสิทธิภาพและขีดความสามารถของการตรวจเอกซเรย์คอมพิวเตอร์ช่องอก เพื่อตรวจหาก้อนเนื้อในปอดซึ่งอาจเป็นตัวบ่งชี้มะเร็งปอดในระยะเริ่มต้นที่อาจมีขนาดเล็กหรือมองเห็นได้ยากภายในระยะเวลาเพียง 3 นาที ร่วมไปกับการตรวจสอบยืนยันผลจากรังสีแพทย์ เพื่อให้ได้ผลการตรวจที่แม่นยำที่สุด ซึ่งที่ผ่านมา ได้มีการใช้เทคโนโลยี AI เพื่อตรวจหามะเร็งปอดเบื้องต้น และโรคอื่นๆ ในปอดให้กับโรงพยาบาลพระปกเกล้าและโรงพยาบาลโป่งน้ำร้อนแล้วกว่าพันราย ในจำนวนดังกล่าว มีผู้ตรวจพบรอยโรคที่สงสัยก้อนเนื้อในปอด มากกว่า 50% และพบรอยโรคที่สงสัยก้อนเนื้อในปอดที่มีโอกาสความน่าจะเป็นในการเป็นโรคมะเร็งปอดสูงถึง 0.8%
ภาพประกอบ : ภาพการติดตั้ง CXR AI ที่โรงพยาบาลพระปกเกล้า และ โรงพยาบาลอำเภอโป่งน้ำร้อน
อาการสำลัก อันตรายใกล้ตัวที่ไม่ควรมองข้าม
คนเราไม่ว่าจะอยู่ในช่วงวัยใดก็ “สำลัก” น้ำและอาหารกันได้ แต่ก็มักเกิดขึ้นเป็นครั้งคราว และมักไม่อันตรายมากนัก (หากแก้อาการและได้รับความช่วยเหลือได้ทันท่วงที) แต่อาการสำลักที่น่าห่วงใยและเราควรใส่ใจเป็นพิเศษคือการสำลักที่เกิดขึ้นในผู้สูงอายุ ผู้มีอาการกล้ามเนื้อคออ่อนแรง ผู้ป่วยระบบประสาทที่กล้ามเนื้อทำงานไม่ประสานกัน เช่น คนไข้โรคพาร์กินสัน และผู้มีภาวะกลืนยาก (1 ใน 3 ของผู้สูงวัยมีภาวะกลืนยาก และครึ่งหนึ่งของผู้ป่วยโรคทางสมองมีภาวะกลืนยาก)
“ผู้สูงวัยบางรายมีปัญหาเรื่องการกลืนยากและมีความเสี่ยงที่จะสำลักสูง จนแพทย์วินิจฉัยว่า เขาถึงจุดที่ควรใส่สายให้อาหารทางจมูก หรือเจาะหน้าท้องให้อาหารได้แล้ว แต่ครอบครัวคนไทยส่วนใหญ่กลัวการทำแบบนี้ และมักให้เหตุผลว่า สงสารผู้สูงวัย แต่ความสงสารนี้นำมาซึ่งความเสี่ยงที่สูงมาก ๆ” ศ.นพ.รุ่งโรจน์ อธิบาย
“ปัญหาหนึ่งของผู้สูงวัย คือ การกลืนไม่หมด มีการตกค้างของเศษอาหารในช่องปาก ยกตัวอย่าง อาหารหนึ่งคำ จะมีทั้งข้าวและกับข้าว ซึ่งผู้สูงวัยหรือผู้ป่วยอาจกลืนให้หมดไม่ได้ในครั้งเดียว แพทย์จะแนะนำให้ผู้ดูแลบอกให้ผู้ป่วยกลืนซ้ำรอบที่ 2 หรือบางคนอาจต้องกลืนซ้ำเป็นรอบที่ 3 เพื่อกลืนอาหารให้หมด นอกจากนี้ ผู้ดูแลยังต้องตรวจสอบในช่องปากผู้ป่วยทุกครั้งด้วยว่ามีเศษอาหารหลงเหลืออยู่หรือไม่ เพราะหากมีเศษอาหารหลงเหลืออยู่ในช่องปาก มันจะทำให้ผู้ป่วยสำลักได้ในภายหลัง”
การสำลักภายหลัง (Delay Aspiration) อาจเกิดเพียงไม่กี่นาทีหลังจากการกลืนอาหาร แต่ก็มีโอกาสเกิดขึ้นได้ภายหลังการรับประทานอาหารในช่วง 1 ชั่วโมงได้เช่นกัน
ศ.นพ.รุ่งโรจน์ อธิบายให้เห็นภาพอาการสำลักภายหลังว่า “มันจะคล้าย ๆ กับกลืนอาหารจนหมดแล้ว แต่จริง ๆ ยังแอบมีเศษอาหารหลงติดอยู่ในช่องปาก เมื่อผู้ป่วยนอนหงาย เศษอาหารก็จะตกลงมา ทำให้มีอาการไอ และสำลักตามมา”
นอกจากนี้ ยังมี อาการสำลักเงียบ (Silence Aspiration) หมายถึงการสำลักแบบไม่มีอาการไอ ไม่แสดงอาการใด ๆ แต่เศษอาหารเล็ก ๆ หรือน้ำลายของผู้ป่วยที่มีเชื้อแบคทีเรีย ในช่องปากได้ไหลลงในหลอดลมเรียบร้อย จนเป็นสาเหตุทำให้ปอดติดเชื้อ ปอดบวม ผู้ป่วยจะปรากฏอาการผิดปกติให้เห็นก็ต่อเมื่องเกิดอาการรุนแรงของภาวะปอดอักเสบ เช่น ไอ มีไข้ หายใจลำบาก แน่นหน้าอก จนต้องเข้าโรงพยาบาล
กทม. ร่วมรณรงค์ “ให้ชุมชนนำทาง” สร้างความรู้เรื่อง HIV มุ่งสู่การยุติเอดส์ ในกิจกรรมวันเอดส์โลก
รศ.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร เป็นประธานเปิดกิจกรรมวันเอดส์โลก ภายใต้หัวข้อ “Let Communities Lead : ให้ชุมชนนำทาง” ซึ่งมีวัตถุประสงค์เพื่อรณรงค์สร้างความรู้ ความตระหนักลดจำนวนผู้ติดเชื้อเอชไอวี/เอดส์ โดยมูลนิธิเพื่อนพนักงานบริการ (SWING) สำนักงานโรคติดต่อทางสาธารณสุข สำนักอนามัย ศูนย์บริการสาธารณสุข 41 คลองเตย สำนักงานเขตคลองเตย สภาเด็กและเยาวชนกทม. สภาเมืองคนรุ่นใหม่ และภาคีเครือข่าย ร่วมกันจัดขึ้นในวันที่ 30 พ.ย. 66 ณ ศูนย์นันทนาการ คลองเตย ภายในงานมีกิจกรรมการแสดง การเดินรณรงค์เรื่อง HIV/เอดส์และบูธนิทรรศการจากชุมชนและภาคีเครือข่าย
หลักสูตร การจัดการการท่องเที่ยวอย่างยั่งยืน (Sustainable Tourism Management)
ในหลักสูตรนี้จะทำให้ผู้เรียนมีความรู้และความเข้าใจต่อการจัดการด้านการท่องเที่ยวอย่างยั่งยืนที่สอดคล้องกับกระแสการท่องเที่ยวในปัจจุบัน ซึ่งเป็นรูปแบบการท่องเที่ยวศักยภาพสูงในประเทศไทย ได้แก่ การท่องเที่ยวเชิงธุรกิจ (MICE) การท่องเที่ยวเชิงสุขภาพ การท่องเที่ยวโดยชุมชน การท่องเที่ยวเชิงสร้างสรรค์ และการท่องเที่ยวเชิงนิเวศ โดยให้ความรู้ในเรื่องของความหมายและบทบาทของการท่องเที่ยวในรูปแบบต่าง ๆ ผู้เรียนจะได้เห็นมุมมองใหม่ ๆ ที่มีความหลากหลาย เพื่อกระตุ้นให้เกิดการสร้างสรรค์ออกแบบประสบการณ์การท่องเที่ยวที่มีเอกลักษณ์ และสามารถปรับใช้ให้เชื่อมโยงกับชุมชนท้องถิ่นของตนเอง รวมถึงผู้เรียนจะได้เห็นแนวทางที่จะช่วยลดความเสี่ยงในรูปแบบต่าง ๆ เช่น การท่องเที่ยวนอกฤดูกาล การใช้ทรัพยากรสิ่งแวดล้อมอย่างคุ้มค่าเพื่อการท่องเที่ยวที่ยั่งยืน การรักษาความสมดุลระหว่างนักท่องเที่ยวชาวไทย นักท่องเที่ยวชาวต่างชาติ และขีดความสามารถของทรัพยากรในการรองรับนักท่องเที่ยว เป็นต้น
ซึ่งหลักสูตรนี้จัดทำขึ้นเพื่อให้ผู้เรียนสามารถนำความรู้ไปใช้เพิ่มมูลค่าของสินค้าหรือบริการด้านการท่องเที่ยว และมุ่งหวังในการผลักดันให้เกิดการจัดการการท่องเที่ยวอย่างยั่งยืนที่จะนำไปสู่ความตระหนักรู้ถึงความสำคัญของการท่องเที่่ยวอย่างมีความรับผิดชอบ


ด้าน ศ.เกียรติคุณ พญ.สมศรี เผ่าสวัสดิ์ ผู้อำนวยการสำนักงานแพทยสมาคมฯ และนายกแพทยสภา เปิดเผยว่า “โครงการให้ความรู้ประชาชนกลุ่มเสี่ยงต่อโรคระบบทางเดินหายใจที่สามารถติดต่อได้ อยู่ภายใต้โครงการ #รู้ว่าเสี่ยง เลี่ยงเสียศูนย์ (#KnowMyRisk) มีวัตถุประสงค์เพื่อส่งเสริมความรู้ สร้างความเข้าใจ ให้รายละเอียดข้อมูลต่าง ๆ แก่ประชาชนกลุ่มเสี่ยงในพื้นที่กรุงเทพมหานคร และจังหวัดต่าง ๆ ทั่วประเทศเพื่อสร้างความตระหนัก และทันต่อสถานการณ์ในเรื่องการเฝ้าระวัง ดูแลตนเอง การเข้าถึงการดูแลรักษาที่ถูกต้องจนไปถึงการฟื้นฟูตัวเองได้อย่างเหมาะสม สอดรับกับการเข้าสู่การดำเนินชีวิตรูปแบบใหม่และเป็นการรองรับเฝ้าระวังการระบาดที่อาจเกิดขึ้นได้อย่างมีประสิทธิภาพต่อไป โดยโครงการนี้ฯ ได้รับความร่วมมือร่วมใจจากหน่วยงานเครือข่ายพันธมิตร และชุมชนกลุ่มคนไข้ ได้แก่ ชมรมเบาหวานโรงพยาบาลจุฬาฯ ชมรมผู้ป่วยมะเร็งเต้านมแห่งประเทศไทย ชมรมผู้ป่วยมะเร็งแห่งประเทศไทย (อาร์ต ฟอร์ แคนเซอร์ บายไอรีล) และชมรมผู้ป่วยโรครูมาตอยด์ ภายใต้การสนับสนุนของ บริษัท ไฟเซอร์ (ประเทศไทย) จำกัด ซึ่งได้เตรียมแผนสนับสนุนกิจกรรมเพื่อการสื่อสารหลายรูปแบบ อาทิ การทำประชาสัมพันธ์ สื่อให้ความรู้ผ่านช่องทาง Social Media กิจกรรมสัญจรลงพื้นที่ให้ความรู้แก่ประชาชนกลุ่มเสี่ยง ทั้งในชุมชน สถานศึกษา องค์กรการปกครองส่วนท้องถิ่น สาธารณสุขอำเภอ รพสต. อสม. อสส. เป็นต้น ทั่วประเทศ โดยในเดือนธันวาคมจะเริ่มโครงการให้ความรู้ฯ ในพื้นที่ชุมชน ได้แก่ กรุงเทพฯ และราชบุรี โดยจะขยายไปยังจังหวัดอื่น ๆ ตั้งแต่ปี 2567 ในอีกหลายจังหวัดทั่วทุกภาค โดยหวังว่าการจัดกิจกรรมในครั้งนี้จะสามารถให้ความรู้ถึงกลุ่มเป้าหมายหลักได้ คือ ผู้ที่อยู่กลุ่มเสี่ยงต่อโรคระบบทางเดินหายใจที่สามารถติดต่อได้ หรือ กลุ่มเปราะบาง ให้สามารถเข้าถึงการป้องกันด้วยวัคซีน และเข้ารับการรักษาฟื้นฟูตนเองได้อย่างเหมาะสมตามแนวทางการดูแลรักษาโรค”
คลินิกแพทย์แผนไทย รพ.สต.บางขะแยง ฟรี ‼️ไม่มีค่าใช้จ่าย
ฟรี ‼️ไม่มีค่าใช้จ่าย
ขอเชิญชวนเข้ารับบริการคลินิกแพทย์แผนไทย
บริการตรวจ/วินิจฉัยโรค ด้วยศาสตร์การแพทย์แผนไทย
นวดรักษา ประคบสมุนไพร อบไอน้ำสมุนไพร ยาสมุนไพรและการพอกยาสมุนไพรบรรเทาอาการปวด
ติดต่อ/สอบถามหรือจองคิวได้ที่
คลินิกแพทย์แผนไทย รพ.สต.บางขะแยง
โทร.02-5982723 หรือ 066-0586616
Line Official ID : @404qikcv
วันจันทร์-ศุกร์ เวลารับบริการ 08.30-16.30 น.
แพร่ คิกออฟ ลงทะเบียน 12 ธันวาคม 2566
12 ธันวาคม 2566 จังหวัดแพร่จัดกิจกรรม Kick Off ลงทะเบียนบัตรประชาชนใบเดียวรักษาได้ทุกที่ (Health ID) ณ ลานวัฒนธรรมกาดสามวัย (เทศบาลเมืองแพร่)
13 ธ.ค. 66 สำนักงานสาธารณสุขจังหวัดแพร่ ร่วมกับ องค์การบริหารส่วนจังหวัดแพร่ จัดอบรมทีมเจ้าหน้าที่พิสูจน์และยืนยันตัวตน ณ ห้องประชุมสภา อบจ.แพร่ เพื่อเตรียมออกพื้นที่ให้บริการประชาชนเชิงรุก ในการอำนวยความสะดวกและพิสูจน์ ยืนยันตัวตน Health ID
กรุงเทพฯ ฉีดได้ที่รพ.สังกัดกทม. และศูนย์ฯสาธารณสุข 69 แห่ง (50 เขต)
โรงพยาบาลที่ให้บริการ
รพ.กลาง ห้องฉีดยายาชั้น 3
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.ดากสิน อนามัยชุมชน ชั้น 2 อาคารสมเด็จพระเจ้าตากสินมหาราช
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.เจริญกรุงประชารักษ์ ห้องตรวจนรีเวช ชั้น 3 อาคาร 7 2 พรรษา
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.หลวงพ่อกวีศักดิ์ฯ ห้องฉีดยา อาคารเมตตาธรรม
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.เวชการุณย์รัศมิ์ คลินิกวัคชีนผู้ใหญ่
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.ลาดกระบังกรุงเทพมหานคร คลินิกวัคซีน
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.ราชพิพัฒน์ คลินิกวัดชีนชั้น 1 อาคารเฉสมพระเกียรติ
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.คลองสามวา ตึกผู้ป่วยนอก
วันจันทร์ -วันศุกร์ เวลา 08.00-16.00 น.
รพ.สิรินธร ห้องประชุมคุณหญิงหรั่งกันตารัติ ชั้น 2 ทุกวันศุกร์ เวลา 13.00-15.00 บ.
รพ.ผู้สูงอายุบางขุนเทียน ห้องตรวจนรีเวชกรรม อาคารผู้ป่วยนอกชั้น 2
วันจันทร์ - วันศุกร์ เวลา 13.00 - 15.00 บ.
รพ.บางนากรุงเทพมหานคร คลินิกวัดซีน ชั้น 1
ทุกวันพุธ เวลา 09.00- 14.00 น.
รพ.วชิรพยาบาล
ห้องตรวจกุมารเวชกรรม ชั้น 4 อาคารก็ปังกรรัคมีโชติ
วันจันทร์ - วันศุกร์ เวลา 13.00 - 15.00 น.
ศูนย์สุขภาพพร้อม ปัจจุบัน 6 สาขา (ธันวาคม)

จากการสำรวจพบว่าคนส่วนใหญ่ที่เผชิญปัญหาการนอน มักจะแก้ปัญหาเหล่านั้นด้วยการฟังเพลง ฟังพอดแคสต์ โดยอาจเปิดเสียงน้ำตก เสียงธรรมชาติมากถึง 53.9% หรือการทำสมาธิก่อนนอน เพื่อให้สามารถนอนหลับอย่างไร้กังวลได้ในแต่ละวัน ซึ่งการแก้ปัญหาเหล่านี้เป็นเพียงการแก้ไขปัญหาในระยะสั้น แต่สิ่งที่จะช่วยแก้ไขปัญหาการนอนหลับในระยะยาวได้จริงๆ คือ พฤติกรรมบำบัด (Behavior Therapy) การปรับท่านอนที่ถูกกับสรีระของตนซึ่งเป็นการแก้ไขปัญหาได้อย่างมีประสิทธิภาพมากที่สุด ตลอดจนการสร้างบรรยากาศการนอน ทั้งการควบคุมเสียงให้เกิดความเงียบ การควบคุมแสง รวมถึงการควบคุมอุณหภูมิที่พอดี และการใช้กลิ่นหอมบำบัด (Aroma Therapy) ที่จะช่วยลดความเครียดและช่วยปรับสมดุลให้จิตใจสงบ เพื่อการนอนหลับได้ดียิ่งขึ้น นอกจากนี้ยังควรหลีกเลี่ยงเครื่องดื่มที่มีแอลกอฮอล์และคาเฟอีน เนื่องจากเครื่องดื่มเหล่านี้ จะทำให้ร่างกายตื่นตัว รวมถึง อาจใช้วิธีในการปรับอุณหภูมิร่างกาย โดยการแช่น้ำอุ่นอย่างน้อย 1-2 ชั่วโมง เพื่อช่วยให้ร่างกายได้ผ่อนคลายจากความอ่อนล้าในแต่ละวัน สิ่งต่างๆ เหล่านี้จะสามารถช่วยให้นอนหลับได้ง่ายขึ้น และช่วยแก้ไขปัญหาในการนอนแบบระยะยาวได้อย่างดีอีกด้วย ส่วนผู้ที่ไม่มีปัญหาเกี่ยวกับการนอนหลับมีตัวเลขเพียง 15.6% ล้วนแต่มีสุขภาวะที่ดี จากการออกกำลังกายและรับประทานอาหารที่ถูกสุขอนามัย
การเปลี่ยนสถานพยาบาล
เลือกเปลี่ยนได้ ตั้งแต่วันนี้ ถึง 31 มี.ค. 67 ยื่นเรื่องผ่าน 3 ช่องทาง
รพ.ไอเอ็มเอช ธนบุรี กรุงเทพ
โรงพยาบาล IMH ธนบุรี (ในเครือกลุ่มโรงพยาบาล IMH) เปิดให้บริการ 24 ชม. ทุกวัน จันทร์ - อาทิตย์ ✅ ยินดีรับคนไข้ สิทธิบัตรทอง ✅ ยินดีรับคนไข้ สิทธิประกันสังคม ✅ ยินดีรับคนไข้ พรบ. ประกัน และ เงินสด คลินิกในเครือ รพ.ฯ ดังนี้ (รับสิทธิบัตรทอง & เงินสด) 1) คลินิกเวชกรรม ไอเอ็มเอช สุขสวัสดิ์ 36 2) คลินิกเวชกรรม ไอเอ็มเอช ราษฎร์บูรณะ 27 3) คลินิกเวชกรรม ไอเอ็มเอช วิเศษสุขนคร 25 4) คลินิกเวชกรรม ไอเอ็มเอช เพชรเกษม 65. Walk-in เข้ามารักษาได้เลย โดยไม่มีค่าใช้จ่าย. โทร 02-427-9966 ต่อ 104 หรือ 220 หรือ 222
ศาสตราจารย์เกียรติคุณ แพทย์หญิงแสงสุรีย์ จูฑา รางวัลแพทย์สตรีตัวอย่าง 2566
ศาสตราจารย์เกียรติคุณ แพทย์หญิงแสงสุรีย์ จูฑา อายุ 77 ปี
ปัจจุบัน อาจารย์พิเศษ ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี , ประธานคณะกรรมการปลูกถ่ายเซลล์ต้นกำเนิดเม็ดโลหิต สำนักงานหลักประกันสุขภาพแห่งชาติ
ท่านเคยดำรงตำแหน่ง ประธานโครงการปลูกถ่ายเซลล์ต้นกำเนิดเม็ดโลหิต ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ , หัวหน้าภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี , ศาสตราจารย์เกียรติคุณ กองบรรณาธิการ วารสารโลหิตวิทยา , คณะกรรมการวิชาการ สมาคมโลหิตวิทยาแห่งประเทศไทย , นายกสมาคมโลหิตวิทยาแห่งประเทศไทย , President, the International Society of Hematology
ท่านเป็นผู้ริเริ่มโครงการปลูกถ่ายไขกระดูกในโรงพยาบาลรามาธิบดีเป็นครั้งแรกในปี พ.ศ. 2532 และโครงการนี้ได้ริเริ่ม การรักษาหลายชนิดเป็นแห่งแรกในประเทศไทย เช่น การปลูกถ่าย เซลต้นกำเนิด รวมไปถึงการปลูกถ่ายเซลต้นกำเนิดในผู้ป่วยที่ได้รับ การปลูกถ่ายไตโดยหวังผลลดภูมิต้านทานของผู้ป่วยต่อไต
ท่านเป็นสตรีคนแรกของโลกที่ได้รับตำแหน่ง Chair of the Council ของ
the International Society of Hematology
ท่านได้ผลักดันให้มีโครงการช่วยเหลือผู้ป่วยโรค มะเร็งเม็ดเลือดขาวชนิดเรื้อรัง ผ่านมูลนิธิแมกซ์ (โครงการ GIPAP) ทำให้ผู้ป่วยในโครงการหลักประกันสุขภาพแห่งชาติสามารถได้รับ ยา target therapy ซึ่งมีราคาสูงมาก ส่งผลให้ผู้ป่วยมีชีวิตยืนยาว ออกไปจาก 3 - 5 ปี เป็น 25 - 30 ปี
ภาพและข้อมูล จาก
วารสาร คณะแพทยศาสตร์ รพ.รามาธิบดี ,
TMWAฤกษ์ออกรถปี 2567
ฤกษ์ออกรถปี 2567 เดือนมกราคม
วันจันทร์ที่ 9 มกราคม
วันอังคารที่ 17 มกราคม
วันเสาร์ที่ 21 มกราคม
วันพุธที่ 25 มกราคม
วันอาทิตย์ที่ 29 มกราคม
ฤกษ์ออกรถปี 2567 เดือนกุมภาพันธ์
วันพฤหัสบดีที่ 9 กุมภาพันธ์
วันอังคารที่ 14 กุมภาพันธ์
วันพุธที่ 15 กุมภาพันธ์
วันอาทิตย์ที่ 19 กุมภาพันธ์
วันพฤหัสบดีที่ 23 กุมภาพันธ์
วันอังคารที่ 28 กุมภาพันธ์
ฤกษ์ออกรถปี 2567 เดือนมีนาคม
วันพุธที่ 1 มีนาคม
วันอาทิตย์ที่ 5 มีนาคม
วันพุธที่ 8 มีนาคม
วันพฤหัสบดีที่ 9 มีนาคม
วันเสาร์ที่ 11 มีนาคม
วันอาทิตย์ที่ 12 มีนาคม
วันพฤหัสบดีที่ 16 มีนาคม
วันศุกร์ที่ 17 มีนาคม
วันเสาร์ที่ 25 มีนาคม
วันพฤหัสบดีที่ 30 มีนาคม
วันศุกร์ที่ 31 มีนาคม
ฤกษ์ออกรถปี 2567 เดือนเมษายน
วันเสาร์ที่ 1 เมษายน
วันอังคารที่ 4 เมษายน
วันจันทร์ที่ 10 เมษายน
วันอาทิตย์ที่ 16 เมษายน
วันจันทร์ที่ 17 เมษายน
วันอังคารที่ 18 เมษายน
วันจันทร์ที่ 24 เมษายน
วันอาทิตย์ที่ 30 เมษายน
ฤกษ์ออกรถปี 2567 เดือนพฤษภาคม
วันจันทร์ที่ 1 พฤษภาคม
วันอังคารที่ 2 พฤษภาคม
วันศุกร์ที่ 5 พฤษภาคม
วันพุธที่ 10 พฤษภาคม
วันพฤหัสบดีที่ 11 พฤษภาคม
วันจันทร์ที่ 22 พฤษภาคม
วันอังคารที่ 30 พฤษภาคม
ฤกษ์ออกรถปี 2567 เดือนมิถุนายน
วันพฤหัสบดีที่ 6 มิถุนายน
วันพุธที่ 7 มิถุนายน
วันอาทิตย์ที่ 11 มิถุนายน
วันพุธที่ 21 มิถุนายน
วันอาทิตย์ที่ 25 มิถุนายน
ฤกษ์ออกรถปี 2567 เดือนกรกฏาคม
วันพฤหัสบดีที่ 6 กรกฏาคม
วันอังคารที่ 11 กรกฏาคม
วันพุธที่ 12 กรกฏาคม
วันอาทิตย์ที่ 16 กรกฏาคม
วันพุธที่ 19 กรกฏาคม
วันพฤหัสบดีที่ 20 กรกฏาคม
วันเสาร์ที่ 22 กรกฏาคม
วันพฤหัสบดีที่ 27 กรกฏาคม
ฤกษ์ออกรถปี 2567 เดือนสิงหาคม
วันเสาร์ที่ 5 สิงหาคม
วันพฤหัสบดีที่ 10 สิงหาคม
วันศุกร์ที่ 11 สิงหาคม
วันเสาร์ที่ 12 สิงหาคม
วันอังคารที่ 15 สิงหาคม
วันจันทร์ที่ 21 สิงหาคม
วันอาทิตย์ที่ 27 สิงหาคม
วันจันทร์ที่ 28 สิงหาคม
วันอังคารที่ 29 สิงหาคม
ฤกษ์ออกรถปี 2567 เดือนกันยายน
วันศุกร์ที่ 1 กันยายน
วันพุธที่ 6 กันยายน
วันพฤหัสบดีที่ 7 กันยายน
วันศุกร์ที่ 15 กันยายน
วันพุธที่ 20 กันยายน
วันพฤหัสบดีที่ 21 กันยายน
ฤกษ์ออกรถปี 2567 เดือนตุลาคม
วันจันทร์ที่ 2 ตุลาคม
วันอังคารที่ 10 ตุลาคม
วันเสาร์ที่ 14 ตุลาคม
วันพุธที่ 18 ตุลาคม
วันอาทิตย์ที่ 22 ตุลาคม
ฤกษ์ออกรถปี 2567 เดือนพฤศจิกายน
วันพฤหัสบดีที่ 2 พฤศจิกายน
วันอังคารที่ 7 พฤศจิกายน
วันพุธที่ 8 พฤศจิกายน
วันอาทิตย์ที่ 12 พฤศจิกายน
วันพฤหัสบดีที่ 16 พฤศจิกายน
วันอังคารที่ 21 พฤศจิกายน
วันพุธที่ 22 พฤศจิกายน
วันพุธที่ 29 พฤศจิกายน
วันพฤหัสบดีที่ 30 พฤศจิกายน
ฤกษ์ออกรถปี 2567 เดือนธันวาคม
วันเสาร์ที่ 2 ธันวาคม
วันอาทิตย์ที่ 3 ธันวาคม
วันพฤหัสบดีที่ 7 ธันวาคม
วันศุกร์ที่ 8 ธันวาคม
วันเสาร์ที่ 16 ธันวาคม
วันศุกร์ที่ 22 ธันวาคม
วันเสาร์ที่ 23 ธันวาคม
สิ่งที่จะเกิดขึ้นจากสิทธิบัตรทองในปี 2567
White Paper การพิสูจน์และยืนยันตัวตนด้วยระบบไบโอเมตริก PERSONAL VERIFICATION USING BIOMETRIC SYSTEMS โดย สำนักงานพัฒนาธุรกรรมทางอิเล็กทรอนิกส์
เทคโนโลยีไบโอเมตริก (Biometrics) [
pdf] ถือเป็นสิ่งที่ใช้เพื่อการพิสูจน์และยืนยันตัวบุคคลรูปแบบหนึ่งที่ถือเป็น ลักษณะเฉพาะทางสรีรวิทยา หรือ Physiological Characteristics และลักษณะเฉพาะทางพฤติกรรม หรือ Behavioral Characteristics ที่เน้นการใช้งานเพื่อบริการประชาชน ซี่งในรายงานฉบับนี้ได้มีการรวบรวมและนำเสนอเทคโนโลยี ไบโอเมตริก โดยแบ่งออกเป็น 6 ลักษณะเฉพาะที่เป็นที่นิยมในปัจจุบัน คือ ใบหน้า ลายนิ้วมือ ลายม่านตา ลายเส้นเลือด ลายเซ็น และเสียงพูด ซึ่งแต่ละแบบจะมีข้อดีและข้อด้อยที่แตกต่างกันไป ซึ่งคุณลักษณะที่สำคัญ เช่น ความเป็น เอกลักษณ์เฉพาะ ความคงทนถาวรในการใช้งาน การมีในมนุษย์ทุกคน การตรวจวัดได้ ประสิทธิภาพในการใช้งาน การยอมรับของผู้ใช้งาน และความยากในการปลอมแปลง โดยในรายงานฉบับนี้ จะแบ่งออกเป็น 5 บท เริ่มตั้งแต่บทที่ 1 ที่จะนำเสนอการศึกษาและวิเคราะห์ลักษณะเฉพาะ ของไบโอเมตริกในแต่ละแบบ ที่จะช่วยตอบข้อสงสัยของหลายคนเกี่ยวกับหลักการทำงานเพื่อการรู้จำและแยกแยะ ลักษณะของบุคคลในแต่ละแบบ จะช่วยเพิ่มความเข้าใจลักษณะในแต่ละแบบได้อย่างเด่นชัดมากขึ้น โดยมีอัลกอริทึม ที่ได้รับความนิยมในลักษณะเฉพาะแต่ละแบบ เช่น การรู้จำใบหน้า จะเป็นอัลกอริทึมการเรียนรู้ชิงลึก (Deep Learning) ที่ทำให้คอมพิวเตอร์มีความสามารถในการพัฒนาตนเองได้ โดยการเรียนรู้ข้อผิดพลาดที่สอนโดยข้อมูล ที่มนุษย์กำหนดให้ ซี่งจะเห็นได้ว่าในปัจจุบันมีหลายองค์กรที่นำเทคโนโลยีนี้ไปใช้ เนื่องจากมีความแม่นยำ ราคาไม่แพง ผู้ใช้ยอมรับ และปลอดภัย เพราะมีระยะห่างระหว่างบุคคล และอุปกรณ์ เป็นต้น
บทที่ 2 จะมีการยกตัวอย่างหรือ Used Cases เพื่อให้เห็นการนำเอาไบโอเมตริกไปใช้งานในรูปแบบ การให้บริการประชาชนอย่างเป็นรูปธรรมในโครงการต่างๆ ที่โครงการส่วนใหญ่เกิดขึ้นเพื่อช่วยแก้ปัญหาของประเทศ ในมิติต่าง ๆ และความสำเร็จส่วนหนึ่งมาจากความร่วมมือกันระหว่างหน่วยงานสำคัญที่เกี่ยวข้อง
นบทที่ 3 จะเน้นประเด็นที่เกี่ยวข้องกับการใช้งานไบโอเมตริกกับข้อมูลส่วนบุคคล ซึ่งได้มีการอ้างอิงถึง กฎหมายในประเทศไทย 2 ฉบับ คือ พระราชบัญญัติคุ้มครองข้อมูลส่วนบุคคล พ.ศ. 2562 และ พระราชบัญญัติ ข้อมูลข่าวสารทางราชการ พ.ศ. 2540 รวมถึงประเด็นเทคโนโลยีไบโอเมตริกที่เกี่ยวข้องกับสิทธิส่วนบุคคลและ ข้อมูลส่วนบุคคลในต่างประเทศ เช่น ประเด็นการถูกฟ้องจากการละเมิดข้อมูลส่วนบุคคลของ Facebook และ Google เป็นต้น ที่จะรวมไปถึงประเด็นการใช้งานในกลุ่มผู้สูงอายุ และเด็ก พร้อมทั้งประเด็นทางด้านจริยธรรม ซึ่งในบทนี้ จะทำให้เห็นว่าประเทศไทยมีกฎหมายรองรับการคุ้มครองสิทธิส่วนบุคคลที่เป็นแนวทางเดียวกับสากล แต่ยังไม่มีในมุมของ การคุ้มครองสิทธิข้อมูลไบโอเมตริก
บทที่ 4 จะกล่าวถึง ภูมิทัศน์ของมาตรฐานไบโอเมตริกโดยรวม ซึ่งจะอธิบายถึงมาตรฐานสากล ISO/IEC JTC 1/SC37 ซึ่งเป็นมาตรฐานหลักที่เกี่ยวข้องกับไบโอเมตริกที่ใช้ในการบริการประชาชน และมาตรฐาน ANSI/NIST ITL ซึ่งเป็นมาตรฐานไบโอเมตริกที่ใช้กับงานทางด้านนิติวิทยาศาสตร์ ที่จะทำให้ผู้สนใจเข้าใจถึง วัตถุประสงค์และเป้าหมายของแต่ละมาตรฐานได้อย่างชัดเจนมากขึ้น
บทที่ 5 จะเป็นการนำเสนอแนวทางการวัดสมรรถนะของระบบไบโอเมตริกเพื่อเปรียบเทียบ ประสิทธิภาพของระบบในการนำไปใช้งาน ซึ่งแบ่งเป็นการวัดประสิทธิภาพระบบยืนยันตัวบุคคล การวัดประสิทธิภาพ ระบบค้นหาตัวบุคคล การวัดประสิทธิภาพการนำเข้าข้อมูล รวมถึงหน่วยงานอิสระต่าง ๆ ที่เปรียบเทียบประสิทธิภาพ ของระบบไบโอเมตริกในปัจจุบัน พร้อมการแสดงให้เห็นถึงความแตกต่างของการประเมินสมรรถนะของระบบไบโอ เมตริกในแต่ละระดับ ทั้งการประเมินในระดับเทคโนโลยี ระดับการจำลองประยุกต์ใช้งาน และระดับปฏิบัติการ
สำนักงานบรรเทาทุกข์และประชานามัยพิทักษ์ สภากาชาดไทย
สาระสำคัญของงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567
ร่างพระราชบัญญัติงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 มีวงเงินงบประมาณทั้งสิ้น 3,480,000 ล้านบาท จำแนกเป็นรายจ่ายประจำ จำนวน 2,532,826.9 ล้านบาท หรือคิดเป็นร้อยละ 72.8 รายจ่ายเพื่อชดใช้เงินคงคลัง 118,361.1 ล้านบาท หรือคิดเป็นร้อยละ 3.4 รายจ่ายลงทุน จำนวน 717,722.2 ล้านบาท หรือคิดเป็นร้อยละ 20.6 และรายจ่ายชำระคืนต้นเงินกู้ จำนวน 118,320.0 ล้านบาท หรือคิดเป็นร้อยละ 3.4 ทั้งนี้รายจ่ายชำระคืนต้นเงินกู้เป็นรายจ่ายลงทุนกรณีการกู้เพื่อการลงทุนของรัฐวิสาหกิจ จำนวน 7,230.2 ล้านบาท
น.ส.แพทองธาร กล่าวว่า ประเทศไทยขับเคลื่อนนโยบาย 30 บาท รักษาทุกโรค มาตั้งแต่ปี 2544 เป็นสิทธิขั้นพื้นฐานของคนไทยในการรับบริการสุขภาพเมื่อเจ็บป่วยและส่งเสริมสุขภาพป้องกันโรค ถือเป็นนโยบายสาธารณสุขที่สำคัญและมีการดำเนินการมาอย่างต่อเนื่อง ช่วยให้ประชาชนคลายความกังวลเรื่องภาระค่าใช้จ่ายทางสุขภาพ สามารถลดครัวเรือนที่ยากจนจากรายจ่ายด้านสุขภาพจาก 250,000 ครัวเรือนในปี 2531 เป็น 49,300 ครัวเรือน ในปี 2564 ซึ่งการขับเคลื่อนต่อจากนี้ คือ การยกระดับเป็น 30 บาท รักษาทุกที่ด้วยบัตรประชาชนใบเดียว โดยนำเทคโนโลยีดิจิทัลมาใช้ เพื่อให้คนไทยเข้ารับบริการสุขภาพได้อย่างสะดวก รวดเร็ว ด้วยบัตรประชาชนใบเดียวเข้ารับบริการได้ทั้งโรงพยาบาลของรัฐ เอกชน คลินิก แล็บและร้านยาใกล้บ้าน เชื่อว่านโยบายนี้จะทำให้คนไทยทุกคนได้รับการส่งเสริมสุขภาพ ควบคุม ป้องกันโรค รักษาพยาบาล และฟื้นฟูสุขภาพ ด้วยเทคโนโลยีดิจิทัลที่ทันสมัย เท่าเทียม ลดความเหลื่อมล้ำ เพิ่มการเข้าถึงบริการสาธารณสุข
แถลงการณ์เขียนอนาคตกัญชาไทย ผิดหวังต่อร่างกฏหมายใหม่
เพจเขียนอนาคตกัญชาไทย ที่มีบทบาทในการเคลื่อนไหว เกี่ยวกับร่างกฏหมายกัญชาฉบับใหม่ ร่วมกับรัฐบาลชุดใหม่มาอย่างต่อเนื่อง ได้ออกแถลงการณ์ต่อร่างกฏหมายที่ลงนามโดย รมว.กระทรวงสาธารณสุข โดยมีเนื้อหาดังนี้
...
ตามที่นายแพทย์ชลน่าน ศรีแก้ว ได้รับปากเครือข่ายเขียนอนาคตกัญชาไทยเมื่อครั้งหารือร่วมกันว่า ก่อนการนำร่างเข้าสู่การพิจารณาของคณะรัฐมนตรีจะเปิดเวทีรับฟังความเห็นของประชาชนก่อนเพื่อทำให้มาตรการต่างๆตั้งอยู่บนข้อเท็จจริง
แต่ปรากฎตามสื่อมวลชนหลายฉบับรายงานข่าวว่าเมื่อวานคือวันที่6มกราคม 2567 รัฐมนตรีชลน่านได้ลงนามร่าง พ.ร.บ.กัญชาส่งไปยังคณะรัฐมนตรีแล้ว
ท่านรัฐมนตรีชลน่าน ศรีแก้ว เหตุใดจึงไม่รักษาคำพูด ท่านเป็นแบบนี้บ่อยครั้งมากจนเราคิดว่านี่อุปนิสัยของท่าน การรับฟังนั้นจะต้องทำก่อนการนำส่งร่าง มิใช่ว่านำส่งร่างไปแล้วมารับฟังทีหลัง
กฎหมายของท่านเรายังไม่เห็นว่ากำหนดมาตรการทั้งหมดว่าอย่างไร แต่จากการให้สัมภาษณ์ของท่านเราคิดว่าหลายมาตรการมีปัญหา ไม่ตั้งอยู่บนข้อเท็จจริง
1.ท่านให้สัมภาษณ์ว่า การสูบในบ้านจะต้องมีหมออนุญาต คำถามคือว่าเมื่อดอกกัญชาไม่เป็นยาเสพติดเหตุใดต้องมีหมอวินิจฉัย สถานะของกัญชาตอนนี้คือเป็นพืชสมุนไพร หากท่านห้ามสูบสมุนไพรที่ชื่อกัญชา เช่นนั้นแล้วท่านต้องออกกฎหมายห้ามสูบดอกปีบ ใบชุมเห็ด ใบตอง ที่เป็นสมุนไพรให้หมดเช่นนั้นใช่หรือไม่
2.หลายคนใช้การสูบเพื่อรักษามะเร็ง ท้องอืด ไมเกรน และอีกหลายโรคที่หมอแผนปัจจุบันจ่ายยาแผนปัจจุบันแล้วไม่เคยหาย หากคนเหล่านี้ใช้กัญชาแล้วตำรวจมาจับ คำถามก็คือว่า ทำไมยาบ้า 5 เม็ดครอบครองได้
3.มาตรการการปลูกที่ท่านตัดสิทธิการปลูกของครัวเรือนออกไปนั้น ท่านคิดว่ากระทำเช่นนี้เป็นการสมควรแล้วใช่หรือไม่
นอกจากนี้ยังมีมาตรการอีกหลายอย่างที่พรรคเพื่อไทยอาจจะเขียนลงไปใน พรบ.ที่เป็นประโยชน์ต่อพวกพ้องและละเลยประชาชน เครือข่ายเขียนอนาคตกัญชาไทยจึงขอให้กระทรวงสาธารณสุขกลับมากำหนดมาตรการตามข้อเท็จจริงดังนี้
รัฐมนตรีว่าการกระทรวงสาธารณะสุขต้องกลับมาใช้ข้อเท็จจริงมากำหนดมาตรการที่ท่านเห็นว่าสิ่งนั้นเป็นอันตรายต่อประชาชน แต่ก่อนหน้านี้ท่านอนุญาตให้ครอบครองยาบ้า ซึ่งคือยาเสพติดที่ฆ่าชีวิตคน ทำลายครอบครัว และสังคม นอกจากนี้ยังอนุญาตการเปิดสถานบันเทิงตี4เพื่อให้คนกินเหล้า คำถามคือเครื่องดื่มแอลกอฮอล์นั้นก่อเกิดโรคมาแล้วกี่โรค การตายจากอุบัติเหตุจากสุรามีมากมายเท่าไหร่
ฉะนั้นเครือข่ายเขียนอนาคตกัญชาไทยขอให้กระทรวงสาธารณสุขทำข้อมูลเปรียบเทียบข้อดีข้อเสียระหว่าง ยาบ้า กัญชา สุรา ว่าทั้งสามชนิดสิ่งใดมีคุณสมบัติรักษามนุษย์ สิ่งใดมีคุณสมบัติทำลายมนุษย์ แล้วใช้คุณสมบัติเหล่านั้นมากำหนดมาตรการ
กัญชาเป็นยามานับหมื่นปีตามหลักฐานทางวิทยาศาสตร์ แต่ห้ามสูบ
ยาบ้าทำลายชีวิตคนมามาก ครอบครองได้แบบถูกกฎหมาย
ทั้งยังส่งเสริมการดื่มสุราด้วยการเปิดสถานบันเทิงตี 4
หากกระทรวงสาธารณสุขยังกำหนดทุกอย่างภายใต้การเมือง ไม่นำข้อเท็จจริงมากำหนด เครือข่ายเขียนอนาคตกัญชาไทยจะกำหนดการเคลื่อนไหวต่อไป เพื่อให้ประเทศนี้กำหนดนโยบายจากข้อเท็จจริง
เครือข่ายเขียนอนาคตกัญชาไทย
รายชื่อหน่วยบริการเอกชนบัตรประชาชนใบเดียวรักษาทุกที่
ด้าน รศ.ดร. รินา ภัทรมานนท์ หัวหน้าโครงการวิจัยฯ กล่าวถึง โครงการวิจัยแนวทางเพิ่มศักยภาพการเข้าถึงสวัสดิการทางสังคม และการใช้ประโยชน์เทคโนโลยีดิจิทัลในกลุ่มผู้สูงอายุ ที่ดำเนินการโดยคณะวิทยาศาสตร์ มหาวิทยาลัยขอนแก่น เกิดขึ้นภายใต้วัตถุประสงค์ที่ต้องการพัฒนาการเข้าถึงสวัสดิการทางสังคมและการใช้ประโยชน์จากเทคโนโลยีดิจิทัลในกลุ่มผู้สูงอายุ จึงได้มีการศึกษาถึงปัญหาและอุปสรรคการเข้าถึงสวัสดิการทางสังคมในกลุ่มผู้สูงอายุ ภาระหน้าที่หน่วยงานภาครัฐที่เกี่ยวข้องกับการให้บริการสวัสดิการทางสังคมกับผู้สูงอายุ รวมถึงวิเคราะห์สวัสดิการทางสังคมที่มีอยู่ในปัจจุบัน เพื่อจัดทำแนวทางการเพิ่มศักยภาพการเข้าถึงสวัสดิการทางสังคมด้วยเทคโนโลยีดิจิทัลในกลุ่มผู้สูงอายุ โดยการพัฒนาสถานการณ์จำลองหรือระบบนำร่องของบริการสวัสดิการทางสังคมบนพื้นฐานเทคโนโลยีดิจิทัลที่เหมาะสมกับสังคมผู้สูงอายุ
สถาบันปัญญาประดิษฐ์มหิดล (Mahidol AI Center)
สถาบันปัญญาประดิษฐ์มหิดล (Mahidol AI Center) ตั้งอยู่ ณ ลาน Innovative Space ชั้น 1 อาคารคณะ ICT มหาวิทยาลัยมหิดล วิทยาเขตศาลายา โดยสถาบันฯ นี้จัดตั้งขึ้นเพื่อขับเคลื่อนการค้นคว้า และวิจัยด้านการแพทย์ โดยมุ่งเน้นที่จีโนมิกส์ โปรตีโอมิกส์ พยาธิวิทยา และรังสีวิทยา ซึ่งจะช่วยให้เกิดความร่วมมือด้านการวิจัยแบบ Federated Learning และช่วยให้นักวิจัยสามารถแก้ปัญหาที่ท้าทายบนแพลตฟอร์มที่ทันสมัยทั้งฮาร์ดแวร์และซอฟต์แวร์ โดยในขั้นต้น สถาบันฯ จะสนับสนุนโครงการต่าง ๆ จากกลุ่มความเป็นเลิศด้านการวินิจฉัยทางการแพทย์ด้วยเทคโนโลยีปัญญาประดิษฐ์ (AI), ศูนย์ปฏิบัติการด้านชีววิทยาศาสตร์คอมพิวเตอร์ และแพลตฟอร์มการค้นคว้ายาแบบบูรณาการด้วยปัญญาประดิษฐ์ โดยในระยะเริ่มต้น เป็นความร่วมมือระหว่างคณะเทคโนโลยีสารสนเทศและการสื่อสาร คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี คณะแพทยศาสตร์ศิริราชพยาบาล คณะเภสัชศาสตร์ คณะทันตแพทยศาสตร์ คณะเวชศาสตร์เขตร้อน และวิทยาลัยราชสุดา และจะขยายไปยังคณะและสถาบันอื่น ๆ ภายในมหาวิทยาลัยต่อไป
facebook.com/MahidolAICenter/
นพ.ดิตถพงษ์ บุญอำพล เผยว่า งานนี้เป็นงานแรกของปีที่เกี่ยวกับการฝึกอบรมแพทย์เฉพาะทางด้านกระดูกสันหลังโดยจะเน้นเรื่องเทคนิคการผ่าตัดรักษาโดยการใช้กล้องเอ็นโดสโคป แบบไม่ต้องผ่าตัดใหญ่แต่ได้ผลลัพธ์เหมือนกับการผ่าตัดใหญ่ ซึ่งคนไข้นอนโรงพยาบาลเพียงแค่ 1 คืน โดยที่เทคนิคนี้จะเป็นเทคนิคที่ค่อนข้างเฉพาะและพิเศษกว่า ซึ่งโดยปกติแพทย์ทั่วไปยังทำไม่ได้ ต้องมีการฝึกอบรมที่นานพอสมควร ดังนั้นการอบรมในวันนี้ถือว่าเป็นหลักสูตรนานาชาติ เพราะมีแพทย์จากหลายๆ ประเทศเข้ามารับฟัง จึงถือได้ว่างานนี้เป็นการเผยแพร่องค์ความรู้ของเราให้ต่างชาติ เพราะโรงพยาบาลเอส สไปน์ เป็น Training Center โดยเราเป็นศูนย์ศึกษาค้นคว้าวิจัยด้านการรักษาใหม่ๆ โดยใช้เทคนิคใหม่ๆ ทำให้แพทย์ของเรามีความสามารถและพัฒนามากขึ้น
สำหรับคนไข้ที่มารักษากับเราจะได้รับการรักษาด้วยเทคนิคใหม่เสมอ เพราะแพทย์ของเราต้องเรียนรู้เพิ่มเติมค่อนข้างเยอะสำหรับการผ่าตัดกระดูกสันหลัง ซึ่งจากเดิมต้องเปิดแผลขนาดใหญ่ๆ ต้องนอนโรงพยาบาลหลายวัน เวลาผ่าตัดกระดูกสันหลังถ้ามีการสูญเสียความแข็งแรงของกล้ามเนื้อเยอะก็จะต้องใส่เหล็กดาม แต่ในปัจจุบันเราสามารถเจาะรูเล็กๆ เข้าไปจัดการในส่วนที่มีปัญหาโดยไม่ต้องสูญเสียความแข็งแรงแต่ได้ผลลัพธ์เหมือนการผ่าตัดใหญ่ ซึ่งโดยปกติเทคนิคนี้ เป็นการรักษาที่ค่อนข้างซับซ้อน เราคิดว่าถ้าการรักษาจากแพทย์ที่มีประสบการณ์และได้รับการรักษาจากสถานพยาบาลที่มีอุปกรณ์ครบครัน จะเป็นสิ่งที่ช่วยการันตีความสำเร็จของการรักษา ซึ่งโรงพยาบาลที่ทำได้จะเป็นรพ.เฉพาะทางด้านนี้โดยตรง
ประเด็นข่าวเกี่ยวเนื่อง คลังเสนอ ครม.ปรับโครงสร้างภาษี เหล้าและกิจการบันเทิง
ร่าง พ.ร.บ. (19 หน้า)
บันทึกหลักการและเหตุผลประกอบร่างพระราชบัญญัติกัญชา กัญชง พ.ศ. ....
หลักการให้มีกฎหมายว่าด้วยกัญชา และกัญชงเหตุผลโดยที่กัญชาและกัญชงเป็นพืชที่มิได้ถูกกําหนดให้เป็นยาเสพติดตามประมวลกฎหมายยาเสพติด ประชาชนอาจสามารถครอบครอง บริโภค และใช้กัญชาและกัญชงได้อย่างแพร่หลาย ซึ่งจะส่งผลกระทบต่อสุขภาพของประชาชน ตลอดจนเศรษฐกิจและสังคมของประเทศ แต่อย่างไรก็ตามกัญชาและกัญชงเป็นพืชที่มีประโยชน์ในทางการแพทย์และสุขภาพ ซึ่งมีมูลค่าในทางเศรษฐกิจ จึงสมควรกําหนดให้มีมาตรการในการควบคุม กํากับและดูแลการนํากัญชาและกัญชงไปใช้ในทางที่เหมาะสม ตลอดจนส่งเสริมให้มีการพัฒนากัญชาและกัญชงเพื่อให้เกิดประโยชน์ทางเศรษฐกิจของประเทศมากที่สุด รวมทั้งกําหนดให้มีระบบคณะกรรมการเพื่อเป็นกลไกในการขับเคลื่อนการควบคุมและส่งเสริมการใช้กัญชาและกัญชง จึงจําเป็นต้องตราพระราชบัญญัตินี้
สารบัญหมวด
บทความเกี่ยวเนื่อง
คู่มือประชาชนเลี้ยงสุนัข กรมควบคุมโรค
คู่มือประชาชนเลี้ยงสุนัข จัดทำโดยงานโรคติดต่อระหว่างสัตว์และคน กลุ่มพัฒนาวิชาการโรคติดต่อ กองโรคติดต่อท่ัวไป กรมควบคุมโรค กระทรวงสาธารณสุข โทร 0 2590 3177-8
อ่าน/ดาว์นโหลดได้ตามลิงค์
คู่มือประชาชนคนเลี้ยงสุนัข จัดทำขึ้นเพื่อให้ความรู้ เกี่ยวกับการ เลี้ยงสุนัขอย่างถูกต้องตามหลักสังคม และวิธีการลดหรือ หลีกเลี่ยงไม่ให้ถูกสุนัขกัด เพื่อให้คนและสุนัขอยู่ร่วมกันอย่างมีความสุข ปลอดภัยไร้โรคพิษสุนัขบ้า โดยทุกภาคส่วน ร่วมมือกันป้องกัน และ กำจัดโรคพิษสุนัขบ้าให้หมดไป ซึ่งตรงกับเป้าหมายขององค์การ อนามัยโลก และองค์การโรคระบาดสัตว์ระหว่างประเทศที่จะกวาดล้างโรคพิษสุนัขบ้า ให้หมดไปภายในปี 2563 และกำหนดให้วันที่ 28 กันยายน ของทุกปี เป็น "วันป้องกัน โรคพิษสุนัขข้าโลก (World Rabies Day)" ถึงเวลาแล้ว ที่ทุกคนต้องให้ความสำคัญ ใส่ใจ และให้ความร่วมมือกำจัดโรคพิษสุนัขบ้าให้หมดไปโดยเร็ว
คู่มือประชาชนคนเลี้ยงสุนัข ได้ผ่านการตรวจประเมินและรับรอง มาตรฐานผลิตภัณฑ์เพื่อการเฝ้าระวัง ป้องกัน ควบคุมโรคและภัยสุขภาพ กรมควบคุมโรคแล้ว ณ วันที่ 23 กันยายน 2563 Rattana Theerawat, Wimwiga Sakchainanon, Onpirun Yurachai, Ratanaporn Tangwangvivat, Jesadakorn Sripaoson. Dog owner hand- book. 2nd ed. Nonthaburi):Department of Disease Control; 2020
แบบทดสอบสุขภาพใจกับคุณหมอพอดี ปัญญาประดิษฐ์ประเมินระดับความซึมเศร้า@DMIND
แบบทดสอบ โรคซึมเศร้าจาก DMIND ทำงานผ่าน "คุณหมอพอดี" ที่เป็นระบบ AI ปัญญาประดิษฐ์ ที่ออกแบบมาเป็นเพื่อนที่พร้อมรับฟัง ทุกความรู้สึกของคุณ และเช็กโรคซึมเศร้า
โรคซึมเศร้าคืออะไร ทำไมต้องเราต้องเช็กโรคซึมเศร้า? โรคซึมเศร้า คือ โรค อาการที่เกิดจากความรู้สึกผิดหวัง เสียใจอย่างรุนแรงแบบที่ไม่เคยเจอมาก่อนหรือเจอกับความเครียดความกดดันเป็นเวลานาน ทำให้ความผิดหวังเสียใจ หรือความต้องการโต้แย้งนั้นเป็นยาวนานกว่าอารมณ์ปกติ และส่งผลให้มีอาการทางร่างกาย
หมอพอดี ต่างจากแบบประเมินซึมเศร้าทั่วไปยังไง? มากกว่าแบบประเมินทั่วไปหมอพอดีสามารถวิเคราะห์น้ำเสียงและการแสดงสีหน้าของคุณได้ ในรูปแบบของ การพูดคุย ทำให้รู้สึกเหมือน ได้ระบายกับคนจริง ๆ
ปรึกษาหมอพอดีตอนไหนดี? สามารถปรึกษาได้ตลอด หากคุณรู้สึกไม่สบายใจ รู้สึกเศร้าคุยกับหมอพอดี เพื่อ ประเมินระดับความเสี่ยง โดยทำแบบทดสอบ โรคซึมเศร้า ก่อนปรึกษานักจิตวิทยา หรือ จิตแพทย์ ก็ได้เหมือนกัน
จะคุยกับหมอพอดียังไง สามารถคุยกับหมอพอดีได้ ผ่านลิงก์ด้านล่าง หรือ ช่องทางแอปพลิเคชั่นหมอ พร้อม และไลน์ แอด “หมอพร้อม” เพียงเลือกเมนู “ตรวจสุขภาพใจ” ก็จะพบกับแบบ ประเมินสั้น ๆ และหมอพอดีที่รอคอยจะรับฟังเรื่องราว ของคุณ พร้อมประเมินระดับความซึมเศร้าให้คุณได้. [
Agnos]
เจาะแนวคิดของศูนย์


แนวคิดสำคัญของ
ศูนย์บริการสุขภาพผู้สูงอายุ ศิริราช-สมุทรสาคร คือ
โรงพยาบาล - ศูนย์ผู้สูงอายุ - บ้าน
3 ประสานเพื่อการดูแลวัยเก๋าเป็นหนึ่งเดียว
เมื่อชีวิตก้าวเข้าสู่ “วัยเก๋า” การปรับตัวให้เข้ากับการเปลี่ยนแปลงในเรื่องต่าง ๆ เป็นสิ่งที่คนวัยนี้ต้องพบเจอ ไหนจะสภาพร่างกายที่เริ่มถดถอย เจ็บป่วยได้ง่าย โดยเฉพาะผู้สูงอายุที่เพิ่งผ่านพ้นจากการเจ็บป่วยเฉียบพลัน จำเป็นต้องมีการดูแล เอาใจใส่ ทั้งด้านร่างกายและจิตใจ พร้อมให้ความช่วยเหลือที่ถูกต้อง
“ศูนย์บริการสุขภาพผู้สูงอายุ ศิริราช-สมุทรสาคร”
จึงเป็นพื้นที่ที่จะเข้ามาช่วยดูแลและฟื้นฟูผู้สูงอายุที่เพิ่งพ้นอาการเจ็บป่วยให้กลับมาแข็งแรงพร้อมกลับบ้าน รวมทั้งดูแลผู้ป่วยสูงอายุที่มีปัญหาซับซ้อนด้วย
หอผู้ป่วยเพื่อการดูแลระยะกลาง (Intermediate Care) คืออะไรนะ?
เป็น “รอยต่อ” ที่ช่วยดูแลและฟื้นฟูผู้ป่วยสูงอายุที่เพิ่งพ้นจากการเจ็บปวดระยะวิกฤต ให้กลับมาแข็งแรง ทั้งภายนอกและภายใน รวมไปถึงการให้ความรู้ความเข้าใจและเตรียมความพร้อมในการดูแลแก่ญาติ เพื่อป้องกันไม่ให้ผู้สูงอายุกลับมานอนโรงพยาบาลซ้ำ
Screening ตรวจก่อนได้เปรียบ!
เรามีทั้งคลินิกตรวจคัดกรองภาวะสุขภาพสำหรับผู้ที่มีสุขภาพดี และคลินิกคัดกรองภาวะที่พบบ่อยในผู้สูงอายุ เพื่อตรวจหาโรคหรือความผิดปกติที่ยังไม่แสดงอาการ หากพบความผิดปกติก็จะได้หาวิธีรับมือและรักษาได้อย่างรวดเร็ว
แข็งแรงไปด้วยกัน กับ Health Promotion
เพราะสุขภาพเป็นสิ่งสำคัญที่สุด เราพร้อมส่งเสริม ให้คำแนะนำ รวมไปถึงการให้ความรู้แก่คนทั่วไปในการดูแลสุขภาพ โดยเฉพาะผู้สูงอายุให้แข็งแรงทั้งกายและใจ พร้อมใช้ชีวิตในช่วงวัยเก๋าได้อย่างแฮปปี้
เครือข่ายร้านยาใกล้บ้าน รพ.ระยอง
เขตอำเภอเมือง
โซนใกล้ โรงพยาบาลระยอง
ร้านไพบูลย์เกสัช (ตรงข้าม TOT ระยอง)
โซนชากใหญ่
ร้านบ้านยามีสุข เชิงเนิน (ตรงข้าม ปดท.ชากใหญ่)
โซนทับมา
ร้านไออุ่นเภสัช (หน้าหมู่บ้านสวนแก้ว หลังแมคโครทับมา)
โซนแยกเกาะกลอย
ร้านเพรียว บิ๊กซี สาขาระยอง
โซนนาตาขวัญ
ร้านฟาร์ม่าโปร สาซานาตาชวัญ
ร้านบ้านยานาชวัญ (ใกล้ CI Supermarket)
โซนบางจาก/ปากน้ำ
ร้านฟาร์ม่าโปร (เยื้องคอนโดสุภาลัย)
ร้านปากน้ำล้านยา (เยื้องตลาดปากน้ำ)
โซนตะพง
ร้านยาดีดี (กิดถนมสุขุมวิท ใกล้ 7-11 ยายตา)
โซนสี่แยกพีเอ็มวาย
ร้านฟาร์ม่าฮับ (ข้างศูนย์รถยนต์มิดซู)
โซนหนองมะหาด
ร้านไอริณเกลัช (ตรงข้าม 7-11 หนองมะหาด)
โซนวัดโขดหิน
ร้านภพเพ ฟาร์มาซี (ข้างวัดโขดหิน-เขาไฟ)
โซนครัวแกงเผ็ด
ร้านอินฟาร์ม่า (เยื้องร้านครัวแกงเผ็ด ใกล้โลตัสโกเฟรซ)
SMC Clinic คลินิกอายุรกรรม นอกเวลาราชการ รพ.แกลง
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนมกราคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนมกราคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 3 ม.ค. เขตจตุจักร
- 4 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนผู้ใหญ่ชม เขตคันนายาว / 9-12.00 น. สถานที่ วัดเทวีวรญาติ เขตป้อมปราบฯ [แผนที่]
- 5 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนนำไกร เขตลาดกระบัง / 9-12.00 น. สถานที่ ชุมชนสินทรัยพ์นคร เขตบางเขน
- 9 ม.ค. เวลา 9-12.00 น. สถานที่ ซอยมัสยิดบ้านสมเด็จ เขตธนบุรี / 9-12.00 น. สถานที่ ตลาดบางพัฒนา เขตบางพลัด
- 10 ม.ค. เวลา 9-12.00 น. สถานที่ วันจันทน์ใน เขตบางคอแหลม / 9-12.00 น. สถานที่ วัดทุ่งครุ เขตทุ่งครุ
- 11 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนนูรุ้ลอิสลาม เขตมีนบุรี / 9-12.00 น. สถานที่ ชุมชนโฟร์โมสต์ เขตบางขุนเทียน
- 12 ม.ค. เวลา 8-14.00 น. สถานที่ ศูนย์นันทนาการคลองเตย เขตคลองเตย
- 16 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนปรีชา เขตยานนาวา / 9-12.00 น. สถานที่ ชุมชนสามัคคี 53 เขตบึงกุ่ม
- 17 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนร่วมกันสร้าง เขตบางกะปิ / 9-12.00 น. สถานที่ ชุมชนหมู่บ้านรางไผ่ เขตบางบอน
- 18 ม.ค. เวลา 9-12.00 น. สถานที่ หมู่บ้านซิลค์วิลเลจ เขตสายไหม / 9-12.00 น. สถานที่ ศูนย์ฯ 45 เขตลาดกระบัง
- 19 ม.ค. เวลา 9-12.00 น. สถานที่ โรงเรียนมะเซาะฮะดุดดีน 2 เขตสะพานสูง
- 23 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนแฟลต 11-18 เขตคลองเตย / 9-12.00 น. สถานที่ วัดสวัสดิ์วารีสีมาราม เขตดุสิต
- 24 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนเคหะทุ่งสองห้อง 310 เขตหลักสี่ / 9-12.00 น. สถานที่ หมู่บ้านเคซีการเด้นโฮม เขตคลองสามวา
- 25 ม.ค. เวลา 9-12.00 น. สถานที่ ตลาดผู้ใหญ่อ้วน เขตลาดพร้าว
- 26 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนศาลเจ้าพ่อเสือ เขตพระนคร / 9-12.00 น. สถานที่ สวนเฉลิมพระเกียรติใต้สะพานตากสิน (ลงทะเบียนหน้างาน) เขตคลองสาน
7 เครื่องสำอาง มีสารต้องห้าม ตามประกาศ อย.
ตำแหน่งที่เปิดรับ โรงพยาบาลราชธานี โรจนะ
โรงพยาบาลราชธานี โรจนะ ประกาศรับสมัครงาน ด่วนมาก ส่งเอกสาร/ใบสมัครผ่านทาง Email hr@rajthanee-rojana.com ติดต่อสอบถามฝ่ายบุคคลโทร 035-249249 ต่อ 710
ตำแหน่งงานที่ รพ. สินแพทย์ นครปฐม เปิดรับ LINK
ผู้จัดการบัญชี/หัวหน้าบัญชี 1 อัตรา
(คุณสมบัติผู้สมัคร 1. วุฒิการศึกษา ปริญญาตรีขึ้นไป สาขาการบัญชี หรือสาขาอื่นที่เกี่ยวข้อง 2. มีประสบการณ์ในงานด้านบัญชี 7 ปีขึ้นไป และมีประสบการณ์ในตำแหน่งระดับบริหารอย่างน้อย 3ปี 3. หากผ่านงานบริษัทมหาชนหรือบริษัทที่จดทะเบียนในตลาดหลักทรัพย์ จะได้รับการพิจารณาเป็นพิเศษ)
เภสัชกร 2 อัตรา
(คุณสมบัติผู้สมัคร เภสัชกร 1. วุฒิการศึกษา ปริญญาตรี สาขาเภสัชศาสตรบัณฑิต 2. ต้องมีใบประกอบวิชาชีพ 3. เพศหญิง/เพศชายอายุ 22 - 35 ปี 4. หากมีประสบการณ์จะได้รับการพิจารณาเป็นกรณีพิเศษ)
ประกาศรับสมัครงานโรงพยาบาลปทุมธานี
ประกาศรับสมัครงาน
ทำบัตรผู้ป่วยใหม่ โรงพยาบาลปทุมธานี ผ่านไลน์ ID Line : @pathumhos LINK
โรงพยาบาลปทุมธานี ช่วยอำนวยความสะดวกผู้ป่วยใหม่ ไม่ต้องรอคิวทำบัตร สามารถ “ทำบัตรผู้ป่วยใหม่ เพียง Add ID Line : @pathumhos (อย่าลืมเติม @ นำหน้า)"
กรอกข้อมูล
✅เลขบัตรประชาชน 13 หลัก
✅วันเดือนปีเกิด
✅เบอร์โทรศัพท์
บริการนี้ควรลงทะเบียนไว้ล่วงหน้าก่อนอย่างน้อย 5 วัน
โรงพยาบาลปทุมธานี 02-598-8888
ปฏิทินกิจกรรมเดือนกุมภาพันธ์ 2567


ศ.พิเศษ นพ.ธีรวุฒิ คูหะเปรมะ ผู้อำนวยการโรงพยาบาลมะเร็งกรุงเทพวัฒโนสถ กล่าวว่า “งานแถลงข่าวในครั้งนี้เป็นกิจกรรมที่จัดขึ้นเพื่อสนับสนุนการรณรงค์วันมะเร็งโลกหรือ World Cancer Day ซึ่งในปีนี้องค์การอนามัยโลกหรือ WHO ให้ความสำคัญกับการ “Close the care gap” หรือการปิดช่องว่างในการดูแลรักษาโรคมะเร็ง ซึ่งทางโรงพยาบาลเน้นในเรื่องของมะเร็งปอด เนื่องจากปัจจุบันเราพบผู้ป่วยโรคมะเร็งปอดสูงขึ้นเป็นอย่างมากในคนที่ไม่สูบบุหรี่ และมีภัยคุกคามต่าง ๆ ในชีวิตประจำวันที่เพิ่มความเสี่ยงของการเกิดโรคมะเร็งปอดในผู้ที่ไม่สูบบุหรี่ เช่น ฝุ่น PM2.5 ซึ่งมีความสัมพันธ์กับการเปลี่ยนแปลงของเซลล์เยื่อบุระบบทางเดินหายใจโดยเฉพาะในผู้ที่มียีนกลายพันธุ์ EGFR หรือ KRAS และในปัจจุบันยังไม่มีแนวทางการตรวจคัดกรองในมะเร็งปอดในกลุ่มที่ไม่เคยสูบบุหรี่ ดังนั้น การที่จะปิดช่องว่างหรือ Close the care gap ในเรื่องนี้ จำเป็นต้องอาศัยเทคโนโลยีใหม่ ๆ ที่ทันสมัยเข้ามาช่วยเสริม เช่น การนำปัญญาประดิษฐ์หรือ A.I. มาช่วยในการวินิจฉัยภาพเอกซเรย์รังสีทรวงอกในผู้ที่เข้ารับการตรวจสุขภาพประจำปี และโรงพยาบาลนำชุดตรวจหาสารพันธุกรรมของเซลล์มะเร็งในร่างกายจากเลือด (Circulating Tumor DNA : ctDNA) โดยใช้เทคโนโลยี Next-Generation Sequencing ที่สามารถตรวจหามะเร็งหลายชนิดพร้อมกัน เพื่อค้นหาโรคมะเร็งตั้งแต่ก่อนเป็นจนถึงระยะเริ่มต้น ซึ่งช่วยเสริมการตรวจคัดกรองประเมินความเสี่ยงโรคมะเร็งเฉพาะบุคคล พร้อมทั้งช่วยให้แพทย์วางแผนการรักษาได้อย่างเหมาะสมกับผู้ป่วยแต่ละราย”
เครือข่ายการแพทย์ของเครือโรงพยาบาลเปาโล เปิดรับผู้ประกันตนรวมกว่า 860,000 คน LINK
ในปี 2567 ด้วยเครือข่ายการแพทย์ของเครือโรงพยาบาลเปาโล เปิดรับผู้ประกันตนรวมกว่า 860,000 คน
- โรงพยาบาลเปาโล โชคชัย 4 รับผู้ประกันตนได้ 249,550 คน
- โรงพยาบาลเปาโล สมุทรปราการ รับผู้ประกันตนได้ 303,025 คน
- โรงพยาบาลเปาโล เกษตร รับผู้ประกันตนได้ 207,000 คน
- โรงพยาบาลเปาโล พระประแดง รับผู้ประกันตนได้ 106,950 คน
ผู้ประกันตนสามารถเปลี่ยนสถานพยาบาลประกันสังคมได้ตั้งแต่ วันที่ 16 ธันวาคม 2566 จนถึง 31 มีนาคม 2567
สอบถามเพิ่มเติม โรงพยาบาลเปาโล พระประแดง โทร. 02-818-9000
เปิดรับสมัคร พนักงาน จำนวนมาก หลายตำแหน่ง LINK
ตำแหน่งที่เปิดรับ
รองผอ.รพ.ฝ่ายการพยาบาล
เภสัชกร
พยาบาลวิชาชีพ
พยาบาลวิชาชีพ ห้องคลอด
ผู้ช่วยพยาบาล PN
ผู้ช่วยเหลือผู้ป่วย NA
ผู้จัดการแผนกการตลาด
ผู้จัดการแผนกขาย
เจ้าหน้าที่การตลาด
เจ้าหน้าที่บัญชี
เจ้าหน้าที่คลังสินค้า
พนักงานรักษาความปลอดภัย
โทรศัพท์ : 092-1318075 แผนกทรัพยากรบุคคล
พรบ. รถไว้ สามารถ เบิกค่ารักษาจากอุบัติเหตุได้ถึง 30,000 บาท
พรบ. รถไว้ สามารถ เบิกค่ารักษาจากอุบัติเหตุได้ถึง 30,000 บาท ไม่ต้องกังวลเรื่อง ค่าใช้จ่าย โรงพยาบาลเบญจรมย์ มีบริการเคลื่อนย้ายผู้ป่วย
โทร 036-412-160 หรือ 036-413-933
++ กรุงเทพ ++
หลักสูตรเปิดสอนดนตรีบำบัด
นายณรงค์ ปรางค์เจริญ คณบดีวิทยาลัยดุริยางคศิลป์ ม.มหิดล กล่าวถึงการเรียนดนตรีบำบัดว่า ตอนนี้ส่วนมากในประเทศไทยจะเปิดสอนในระดับปริญญาโท แต่วิทยาลัยฯ กำลังเตรียมเปิดหลักสูตรดนตรีบำบัดระดับปริญญาตรี ซึ่งจะมีความเข้มข้นกว่า เพราะต้องเรียนจิตวิทยา เรียนหลายเรื่องทางด้านการแพทย์ด้วย ในอนาคตคิดว่าจะพัฒนาถึงปริญญาเอก และหวังว่าสุดท้ายคือ จะมีใบประกอบโรคศิลป์ ซึ่งตอนนี้เราก็บังคับอาจารย์ให้ไปได้รับการรับรองจากต่างประเทศ (Board Certified) กันหมด ก็มีอาจารย์บางคนจบปริญญาเอกแล้ว ก็บอกว่าให้ไปใหม่กลับไปเอา Board Certified กลับมาให้เราให้ได้
ศูนย์บริการคนพิการกรุงเทพมหานคร สาขาลาดกระบัง LINK
ศูนย์บริการคนพิการกรุงเทพมหานคร สาขาลาดกระบัง เป็นหน่วยงานในความดูแลของกรมส่งเสริมและพัฒนาคุณภาพชีวิตคนพิการ (พก.) กระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์ (พม.) ตั้งอยู่ที่ 722 ศูนย์ชุมชนบ้านเอื้ออาทรลาดกระบัง 1 ถนนหลวงแพ่ง แขวงทับยาว เขตลาดกระบัง กรุงเทพ 10520 โทร. 02-3647772
www.facebook.comคลินิกแพทย์แผนจีน เปิดทุกวันพุธ-พฤหัสบดี 8.00-16.00 น.
โรงพยาบาลนคราภิบาล สำนักการแพทย์ เปิดบริการคลินิกแพทย์แผนจีน ทุกวันพุธ-พฤหัสบดี 8.00-16.00 น. โรคไหนเหมาะกับแผนจีน 1.ปวดคอบ่าไหล่ 2.ปวดหลังร้าวลงขา 3.อัมพฤกษ์ อัมพาต 4.ปรับสมดุลฮอร์โมน 5.ฝังเข็ม 6.พอกหน้าความงาม ปรึกษาปัญหาสุขภาพ ฟรี สอบถาม นัดคิว 02-3269995 ต่อ 292
ห้องปลอดฝุ่น คืออะไร
ห้องปลอดฝุ่น เป็นห้องที่เตรียมไว้เพื่อลดการสัมผัสฝุ่นละอองขนาดเล็ก เพื่อลดผลกระทบต่อสุขภาพ มีหลักการคือ
ป้องกันฝุ่นจากภายนอกเข้าไปภายในห้อง
ป้องกันการเกิดฝุ่นในห้อง เช่น จุดธูป สูบบุหรี่
ป้องกันการสะสมฝุ่นตามผนังห้อง วัสดุ อุปกรณ์ และพื้นผิวห้อง
กำจัดอนุภาคของฝุ่นที่อยู่ในห้อง
2567 คือ Year of Transformation พัฒนา 5 เสาหลัก
โรงพยาบาลบำรุงราษฎร์จึงได้วางกลยุทธ์การดำเนินธุรกิจปี 2567 ให้เป็น Year of Transformation โดยมุ่งมั่นพัฒนา 5 เสาหลัก ได้แก่ 1) Clinical Transformation, 2) Safety and Quality Transformation, 3) Operation Process Transformation, 4) Service Excellence Transformation, 5) People Transformation
เจตนารมณ์ กระทรวงสาธารณสุข
กระทรวงสาธารณสุข มีเจตนารมณ์และให้ความสําคัญกับการดําเนินการให้ผู้ป่วยยาเสพติดได้รับการ ดูแลเท่าเทียมกับผู้ป่วยโรคอื่นและให้สามารถเข้าถึงบริการได้อย่างทั่วถึง และครอบคลุม สร้างหลักประกันว่า ผู้ป่วยยาเสพติดจะได้รับบริการที่มีคุณภาพและมาตรฐานที่ดี โดยถือว่า ผู้เสพ ผู้ติด คือ “ผู้ป่วย” เป็นโรคเรื้อรังทาง สมองที่อาจมีการติดซ้ำได้ (Chronic relapsing Disease) ที่จําเป็นต้องเข้ารับการบําบัดรักษาฟื้นฟู และพัฒนา คุณภาพชีวิตให้สามารถกลับมาใช้ชีวิตได้ตามปกติโดยมีเป้าหมายสูงสุดในการบําบัดรักษาและฟื้นฟูสมรรถภาพ ผู้ป่วยยาเสพติดให้เลิกยาเสพติดได้ สําหรับกลุ่มผู้ป่วยที่ยังไม่สามารถเลิกได้ตามทิศทางนโยบายยาเสพติดในระดับ สากล ใช้แนวทางการลดอันตรายจากการใช้ยาเสพติด (Harm Reduction) ในการดูแลผู้ป่วยกลุ่มนี้ ใช้หลักการ สาธารณสุขและสิทธิมนุษยชน มุ่งเน้นไปที่การลดผลกระทบทางลบ และอันตรายต่างๆ ที่เกิดจากการใช้ยาเสพติด มากกว่าการให้เลิกยาเสพติดอย่างเด็ดขาดในขณะที่ยังไม่พร้อม เป็นกระบวนการช่วยให้ผู้ป่วยเข้าสู่ระบบการดูแล สุขภาพ สมัครใจเข้ารับการบําบัดรักษายาเสพติดเพิ่มขึ้น เป็นการส่งเสริมให้ผู้ป่วยคงอยู่ในระบบการบําบัดรักษา อย่างต่อเนื่อง และหยุดใช้ยาเสพติดได้นานที่สุด จนเลิกใช้ยาเสพติดได้ในที่สุด ซึ่งบุคลากรสาธารณสุขและ ผู้เกี่ยวข้องในทุกพื้นที่ ต้องเร่งรัดการดําเนินงานให้เป็นรูปธรรม ด้วยความรู้ความเข้าใจที่ถูกต้อง ปรับทัศนคติและ เป้าหมายให้เป็นไปในทิศทางเดียวกัน ในการดําเนินงานจัดบริการตามมาตรการลดอันตรายจากการใช้ยาเสพติด
คู่มือการจัดบริการลดอันตราย จากการใช้ยาเสพติดสําหรับผู้ให้บริการ สถาบันบําบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี
ทางเครือข่ายสถานพยาบาลฯมีข้อเสนอแนะ ดังนี้
ก. ใช้เงินจากกองทุนรายได้สูง (ต่ำ) กว่ารายจ่ายสะสม เนื่องจากเป็นการให้บริการเกินเป้าหมายจริง
ข. ค่ารักษาส่วนที่เกินจากการประมาณการ สปสช.ควรแสดงความรับผิดชอบและมีมาตรการในการจัดหางบประมาณมาชดเชยให้หน่วยบริการ มิใช่ผลักภาระให้หน่วยบริการดังที่เคยปฏิบัติมาเป็นประจำ
ค. สปสช.ต้องลงบัญชีเป็นลูกหนี้ของโรงพยาบาลจากเงินที่เคยเรียกคืน ไม่ใช่ลงบัญชีว่าโรงพยาบาลเป็นลูกหนี้ของ สปสข. ดังเช่นปัจจุบัน
ง. สปสช. ต้องลดขั้นตอนและลดการกำหนดข้อมูลที่มากเกินความจำเป็น รวมทั้งลดขั้นตอนเหลือเท่าที่จำเป็น เพื่อลดภาระของหน่วยบริการและลดการส่งชุดข้อมูลหลายระบบ โรงพยาบาลทุกแห่งจัดส่งข้อมูลผ่านกระทรวงสาธารณสุขเท่านั้น
3. สนับสนุนและขอให้เร่งรัดจัดตั้งเครือข่ายสถานพยาบาลฯ หรือ Provider Board ซึ่งเป็นผู้ให้บริการจริงเพื่อให้เกิดความเป็นธรรมกับทุกฝ่าย เพื่อการอภิบาลระบบสุขภาพของประเทศ ให้มีความโปร่งใสและธำรงอยู่อย่างยั่งยืนต่อไปได้ มีการถ่วงดุลอำนาจระหว่างกองทุนและหน่วยบริการ ใช้ข้อมูลการบริการจริงในการคำนวณวงเงินงบประมาณ บนหลักความสมเหตุผลทางการแพทย์ ร่วมไปกับความสมเหตุสมผลทางการเงิน ไม่ถ่ายโอนความเสี่ยงโดยเฉพาะความเสี่ยงทางการเงินไปให้ฝ่ายใดฝ่ายหนึ่งอย่างไม่มีธรรมาภิบาลหรือสมเหตุสมผล หรือไม่ผ่านการตกลงร่วมกัน
ลงนามโดย
นายแพทย์เกรียงไกร นามไธสง
ผู้อำนวยการโรงพยาบาลนพรัตนราชธานี
ประธานชมรมโรงพยาบาลสถาบันกรมการแพทย์
แพทย์หญิงนันทวัน ชอุ่มทอง
นายกสมาคมคลิกนิกชุมชนอบอุ่น
นายแพทย์อนุกูล ไทยถานันดร์
ประธานชมรมโรงพยาบาลศูนย์/โรงพยาบาลทั่วไป
รองศาสตราจารย์ นายแพทย์สุรศักดิ์ ลีลาอุดมลิปิ
ประธานคณะกรรมการอำนวยการเครือข่าย
โรงพยาบาลกลุ่มสถาบันแพทยศาสตร์แห่งประเทศไทย
โครงการบัตรประชาชนใบเดียว รักษาทุกที่ ที่พังงา
คุณศิริญา เทพเจริญ รองประธานเจ้าหน้าที่บริหาร สายการตลาด บริษัท ณุศาศิริ จำกัด (มหาชน) ผู้ดำเนินธุรกิจพัฒนาอสังหาริมทรัพย์ จึงพลิกสถานการณ์เพื่อก้าวทันโลก โดยได้ลงนามความร่วมมือกับ พว.นิตยา ชไนศวรรย์ ประธานเจ้าหน้าที่บริหาร (CEO) กลุ่มบริษัท บางกอกเฮลท์เเคร์ เซอร์วิส จำกัด (BHS Group) และ AgyHero ถือว่าเป็น Nursing Home Expert Solutions สำหรับบริหารจัดการ Nursing Home ที่สมบูรณ์เเบบและครบวงจรที่สุดในประเทศไทย ด้วยประสบการณ์ในธุรกิจดูเเลผู้สูงอายุ กว่า 20 ปี ได้รับรางวัลระดับ Best Practice และการรับรองมาตรฐานจากหลายหน่วยงานจากภาครัฐเเละเอกชน ทำให้มั่นใจได้ว่าความร่วมมือที่เกิดขึ้นจะทำให้ Parc Exo Care เป็นที่อยู่อาศัยเพื่อผู้สูงอายุ ที่มีความพร้อมระดับมืออาชีพดูเเลอย่างครบวงจรเพื่อกลุ่มผู้สูงอายุ
BKK Pride Clinic ทำอะไรได้บ้าง ให้คำปรึกษา ช่วยเหลือ ด้านใดบ้าง
ขอบคุณที่ร่วมเป็นส่วนหนึ่งที่ทำให้สังคมไทยเดินหน้าโดยไม่ทิ้งใครไว้ข้างหลัง - นายวราวุธ ศิลปอาชา
นายวราวุธ ศิลปอาชา รัฐมนตรีว่าการกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ กล่าวว่า ศูนย์สุขภาพสงเคราะห์ จ.นนทบุรี แห่งนี้ เป็นสถานที่ดำเนินงานโครงการทันตกรรมปากเกร็ด ที่เน้นให้บริการทันตกรรมแก่กลุ่มเป้าหมายที่อยู่ในความดูแลของกระทรวงพม. ในพื้นที่ปากเกร็ดมาอย่างต่อเนื่อง ต้องขอขอบคุณกลุ่มบริษัทกัลฟ์ และทีมผู้บริหาร บุคลากร นิสิตทันตแพทย์ คณะทันตแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย รวมไปถึงเทศบาลนครปากเกร็ด และภาคีเครือข่าย ที่ร่วมเป็นส่วนหนึ่งที่ทำให้สังคมไทยเดินหน้าโดยไม่ทิ้งใครไว้ข้างหลัง ทำให้ทุกคนได้รับการดูแลอย่างมีเกียรติและศักดิ์ศรีในสังคมที่เท่าเทียม ซึ่งคนพิการมีข้อจำกัดในการปฏิบัติกิจวัตรประจำวัน ประกอบกับมีอุปสรรคในด้านต่าง ๆ จึงมีความจำเป็นต้องได้รับการช่วยเหลือพิเศษ เพื่อให้สามารถใช้ชีวิตและมีส่วนร่วมทางสังคมอย่างบุคคลทั่วไป โดยกิจกรรมในโครงการนี้ นอกจากอำนวยความสะดวกในการส่งเสริมคุณภาพชีวิตของกลุ่มเป้าหมายให้ดีขึ้นแล้ว ยังสามารถทำให้กลุ่มเป้าหมายได้รับการดูแลอย่างเป็นองค์รวมด้วย
การจ่ายเบี้ยยังชีพผู้สูงอายุปัจจุบัน
ข้อมูลจาก
กรมกิจการผู้สูงอายุ กระทรวงพัฒนาสังคมและมนุษย์ ระบุว่า ปัจจุบันการจ่ายเบี้ยยังชีพผู้สูงอายุ เป็นแบบขั้นไดตามช่วงอายุ คือ
- อายุ 60 - 69 ปี ได้รับเบี้ยยังชีพผู้สูงอายุ เดือนละ 600 บาท
- อายุ 70 - 79 ปี ได้รับเบี้ยยังชีพผู้สูงอายุ เดือนละ 700 บาท
- อายุ 80 - 89 ปี ได้รับเบี้ยยังชีพผู้สูงอายุ เดือนละ 800 บาท
- อายุ 90 ปีขึ้นไป ได้รับเบี้ยยังชีพผู้สูงอายุ เดือนละ 1,000 บาท
การคำนวณอายุของผู้สูงอายุรายเดิม จะคำนวณตามปีงบประมาณ (การเลื่อนรับเบี้ยยังชีพผู้สูงอายุรายเดิมแบบขั้นบันไดจะเลื่อนตามปีงบประมาณ ไม่มีการเพิ่มเบี้ยยังชีพผู้สูงอายุในระหว่างปีงบประมาณ)
หากผู้สูงอายุมีข้อสงสัยเพิ่มเติมสามารถสอบถามได้ทางหน่วยงานที่ลงทะเบียนรับเบี้ยยังชีพผู้สูงอายุไว้ โดยในกรุงเทพมหานครสามารถสอบถามได้ที่สำนักงานเขต ส่วนต่างจังหวัดสอบถามได้ที่เทศบาลและองค์การบริหารส่วนตำบลในท้องถิ่น หรือติดต่อ กรมส่งเสริมการปกครองท้องถิ่น เบอร์ 02-2419000 ต่อ 4131
ปี 2566
เทศกาลงานวัดเขาวงพระจันทร์ 3,790 ขั้น พิสูจน์ศรัทธา ปี 2566 จัดวันที่ 22 มกราคม – 5 กุมภาพันธ์ 2566 ณ วัดเขาวงพระจันทร์ อำเภอโคกสำโรง จังหวัดลพบุรี
อรรถาธิบายเพิ่มเติม โดย Center for Medical Genomics ม.มหิดล
คลิปวิดีโอ ในชื่อ “White clots common” หรือ "แท่งย้วยสีขาว” ของ ดร.จอห์น แคมป์เบลล์ (John Cambell) ซึ่งเผยแพร่ในยูทูบเมื่อวันที่ 8 กุมภาพันธ์ 2567 และมีผู้เข้าชมถึง 1.4 ล้านคนถือว่าเป็นข้อมูลเท็จ (Fake news) หรือไม่?
ปี 2565 หรือ 2 ปีที่แล้วมีวิดีโอที่ชื่อ "เสียชีวิตกะทันหัน 2022 (died suddenly 2022) " เผยแพร่สะพัดบนโซเชียลมีเดีย ทั้งยูทูบ และ เน็ตฟลิกซ์ คลิปวิดีโอความยาว 1 ชั่วโมงได้อ้างว่าพบลิ่มเลือดหลังการชันสูตรศพเป็นหลักฐานสำคัญแสดงให้เห็นว่าฝ่ายหนึ่งมีแผนลดจำนวนประชากรโลกโดยใช้การฉีดวัคซีนป้องกันโควิด-19 แต่ไม่มีหลักฐานที่สนับสนุนทฤษฎีนี้
วิดีโอดังกล่าวนำเสนอว่ามีผู้ฉีดยารักษาศพและผู้อำนวยการงานศพจำนวนหนึ่งเปิดเผยว่าพบลิ่มเลือดขนาดใหญ่ในศพถือเป็นความผิดปกติที่ไม่เคยพบมาก่อน และคาดว่าเกิดจากการฉีดวัคซีนป้องกันโควิด-19 แต่ผู้เชี่ยวชาญหลายคนได้หักล้างคำกล่าวอ้างเหล่านี้ โดยระบุว่าลิ่มเลือดดังกล่าวดูเหมือนจะเป็นลิ่มเลือดที่พบบ่อยหลังการชันสูตรพลิกศพ
วิดีโอดังกล่าวได้นำฟุตเทจที่ได้ตัดต่อมาจากวิดีโอการศึกษาทางการแพทย์ที่โพสต์บน YouTube ในเดือนเมษายน 2019 ซึ่งแสดงให้เห็นขั้นตอนที่เรียกว่าการผ่าตัดเอาหลอดเลือดอุดตันในปอดออกมา ซึ่งไม่เกี่ยวข้องกับการฉีดวัคซีนป้องกันโควิด-19 แต่อย่างใด
องค์กรอิสระ FactCheck ได้ตรวจสอบคลิปวิดีโอดังกล่าวแล้วพบว่า “ เป็นข้อมูลที่ไม่ถูกต้อง (fake news)”
ต่อมานายทหารอากาศสหรัฐนอกราชการ พันตรี โธมัส ฮาวิแลนด์ (Thomas Haviland) ได้นำแนวคิดคล้ายกับวิดีโอดังกล่าว “มาทำโพล” ที่ไม่แสดงแหล่งอ้างอิง สอบถามไปยังผู้ที่มีส่วนเกี่ยวข้องในการฉีดยารักษาศพ และส่งข้อมูลที่สรุปได้ไปยังหน่วยงานด้านสาธารณสุขในสหรัฐ กล่าวคือ US NIH, US CDCม และ US FDA ให้พิจารณาถึงความปลอดภัยของวัคซีนป้องกันโควิด-19 รวมทั้งให้สัมภาษณ์ในรายการของดร.จอห์น แคมป์เบลล์ (John Cambell) อินฟลูเอนเซอร์ชื่อดังของอังกฤษในด้านสุขภาพ มียอดผู้เข้าชมคลิปการสัมภาษณ์ถึง 1.4 ล้านครั้ง ตั้งแต่ 8 กุมภาพันธ์ 2567 ที่ผ่านมา
อย่างไรก็ดีคลิปการสัมภาษณ์ของรายการดังกล่าวยังไม่มีองค์กรอิสระอย่าง “Factcheck” มาตรวจสอบว่าถูกต้องหรือไม่เพียงใด อาจต้องรอผลการศึกษาวิจัยและการตีพิมพ์ในวารสารวิชาการที่มีผู้เชี่ยวชาญร่วมตรวจสอบ (Peer review) ดังนั้นคลิปการสัมภาษณ์และข้อมูลที่นำเสนอในรายการดังกล่าวไม่อาจระบุได้ว่าเป็นข้อมูลที่คลาดเคลื่อนหรือไม่ถูกต้อง (fake new) ปัจจุบันจัดอยู่ในหมวดข้อมูลที่ต้องรอการพิสูจน์
การพิสูจน์เบื้องต้นสามารถทำโพลสอบถามผู้ที่มีหน้าที่ฉีดยารักษาศพได้เช่นกัน โดยอาจพิจารณาสอบถามในเบื้องต้นว่าในประเทศไทย
• ก่อนปี 2019/2562 พบลิ่มเลือดในหลอดเลือดของศพหรือไม่ (ยังไม่เกิดการระบาดของโควิด-19)
• ปี 2020/2563 พบลิ่มเลือดในหลอดเลือดของศพหรือไม่ (ไวรัสอู่ฮั่นและไวรัสอัลฟา ระบาด ยังไม่มีวัคซีนใช้)
• ปี 2021-2022 /2564-2565 พบลิ่มเลือดในหลอดเลือดของศพหรือไม่ (มีการระดมฉีดวัคซีนโควิด-19 มีผู้เข้ารับการฉีดถึง 80%)
• ปี 2023/2024 พบลิ่มเลือดในหลอดเลือดของศพหรือไม่ (มีการฉีดวัคซีนโควิด-19 ลดลง) หากพบมีมากหรือน้อยเมื่อเทียบกับปี 2021-2022
หากในปี 2019-2020 ไม่พบแท่งย้วยสีขาวหรือพบจำนวนไม่ต่างกันในหลอดเลือดของศพ แต่กลับพบเป็นจำนวนมากขึ้นในปี 2021-2022 และมีลดลงในปี 2023-2024 อาจเป็นข้อมูลเบื้องต้นให้ควรมีการวิจัยอย่างเป็นระบบต่อไป
ผลข้างคียงจากวัคซีนไม่ว่าจะน้อยหรือมาก ควรได้รับความสนใจเพราะประชากรส่วนใหญ่ของโลกได้รับการฉีดวัคซีน
Center for Medical Genomics
22 กุมภาพันธ์ 20243 เคล็ดลับ เลือกซื้ออาหารถวายพระ
อย. แนะชาวพุทธทำบุญตักบาตร เลือกหาซื้ออาหารถวายพระ ใช้หลัก 3 เคล็ดลับ “2 สังเกต 1 เลี่ยง” สังเกตฉลาก GDA และสังเกตสัญลักษณ์โภชนาการ “ทางเลือกสุขภาพ” (Healthier Choice) หลีกเลี่ยงอาหาร หวาน มัน เค็ม เพื่อสุขภาพที่ดีของพระสงฆ์
2 สังเกต
1. สังเกตข้อมูลฉลากโภชนาการแบบจีดีเอ (Guideline Daily Amounts ; GDA) ที่แสดงปริมาณค่าของพลังงาน น้ำตาล ไขมัน และโซเดียม ในหน่วยเมตริก (หน่วยของพลังงานเป็นกิโลแคลอรี่) ของอาหารทั้งบรรจุภัณฑ์ (1 ซอง/ 1 กล่อง) ในรูปทรงกระบอกเรียงติดกัน 4 รูป และช่วงล่างใต้รูปทรงกระบอกแสดงค่าร้อยละของปริมาณสูงสุดที่บริโภคได้ต่อวัน ซึ่งอยู่บริเวณด้านหน้าของฉลากผลิตภัณฑ์อาหาร
2. สังเกตสัญลักษณ์โภชนาการ “ทางเลือกสุขภาพ” (Healthier Choice) ซึ่งเป็นเครื่องหมายแสดงว่าผลิตภัณฑ์อาหารนั้นมีปริมาณน้ำตาล ไขมัน และโซเดียม ผ่านเกณฑ์ที่กำหนดของกลุ่มอาหารนั้น ๆ เป็นตัวช่วยสำคัญให้เราเลือกซื้ออาหารที่ลดหวาน มัน เค็ม ให้เหมาะสมต่อสุขภาพ ลดปัจจัยเสี่ยงต่อการเกิดโรคไม่ติดต่อเรื้อรัง ให้กับพระสงฆ์ได้
1 เลี่ยง
เลี่ยงอาหาร หวาน มัน เค็ม เพื่อสุขภาพที่ดีของพระสงฆ์
อย.ระบุว่า ปัจจุบันอาหารที่นำมาถวายพระ มีจำนวนไม่น้อยที่มีไขมันสูง มีรสเค็มจัด หรือมีน้ำตาลเป็นส่วนประกอบ่ในปริมาณสูง เช่น กาแฟปรุงสำเร็จ ชนิดผง เครื่องดื่มช็อกโกแลตปรุงสำเร็จ ชนิดผง ประเภท 3in1 ผลิตภัณฑ์ขนมอบกรอบ บะหมี่กึ่งสำเร็จรูป เป็นต้น ซึ่งเหล่านี้ อาจเป็นสาเหตุให้พระสงฆ์ได้รับสารอาหารเกินความต้องการของร่างกาย เสี่ยงต่อการเกิดปัญหาสุขภาพ หรือโรคไม่ติดต่อเรื้อรัง (NCDs) และโรคอื่น ๆ ตามมา
อย.แนะนำให้ชาวพุทธทุกคนคำนึงถึงคุณค่าทางอาหารที่เป็นประโยชน์ เหมาะสำหรับนำไปถวายพระสงฆ์ โดยก่อนเลือกซื้ออาหารที่อยู่ในภาชนะบรรจุพร้อมจำหน่ายมาใส่บาตรหรือถวายสังฆทาน ให้ยึดหลัก 2 สังเกต 1 เลี่ยง ที่กล่าวถึงข้างต้น
กิจกรรมทำหมัน มูลนิธิแฮนด์ทูพอว์ ปี 2567 LINK
การรับบริการ ต้องลงทะเบียนล่วงหน้า ซึ่งทำได้ 2 วิธี
1. สาธารณสุข ณ เทศบาลที่จัด
2. มูลนิธิฯ เบอร์ 080 673 1770 ตามวันเวลาราชการเท่านั้น
ผู้ที่ลงทะเบียนแล้ว จึงจะไปรับบัตรคิวหน้างาน ช่วงเวลา 08.30-11.00 น.
ผู้ที่ลงทะเบียน ต้องต้องแน่ใจว่ามาได้เท่านั้น
ตารางการผ่าตัดทำหมันเดือนปี 2567
- อาทิตย์ 21 ม.ค. 67 ณ ห้องประชุมอาคารอเนกประสงค์รร.อนุบาลเทศบาลตำบลสันกำแพง(บ้านคำซาว) เฉพาะสุนัขในพื้นที่เทศบาลตำบลสันกำแพง สุนัขเพศเมีย น้ำหนัก 10-20 กิโลรัม
- อาทิตย์ 28 ม.ค. 67 ณ ทต.สันพระเนตร เฉพาะสุนัขในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด สุนัขเพศเมียและเพศผู้ น้ำหนัก 10-20 กิโลรัม
- อาทิตย์ ที่ 4 ก.พ. 67 เทศบาลตำบลหนองแหย่ง เฉพาะสุนัขในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด สุนัขเพศเมียและเพศผู้ น้ำหนัก 10-20 กิโลกรัม
- อาทิตย์ ทึ่ 11 กุมภาพันธ์ 67 เทศบาลตำบลแม่ปูคา เฉพาะสุนัขในพื้นที่ ตำบลแม่ปูคา ตำบลสันกำแพง ตำบลต้นเปา เท่านั้น สุนัขเพศเมีย น้ำหนัก 10-20 กิโลกรัม
- อาทิตย์ ทึ่ 18 กุมภาพันธ์ 67 เทศบาลเมืองต้นเปา เฉพาะสุนัขในพื้นที่ ตำบลแม่ปูคา ตำบลสันกำแพง ตำบลต้นเปา เท่านั้น สุนัขเพศเมีย น้ำหนัก 10-20 กิโลกรัม
- เสาร์ ที่ 24 กุมภาพันธ์ 2567 เทศบาลตำบลสันมหาพน อำเภอแม่แตง สุนัขเพศเมียและเพศผู้ น้ำหนัก 10-20 กิโลกรัม
- อาทิตย์ 3 มีนาคม 2567 ทำหมันสุนัขฟรี ณ สนามกีฬาดอยสะเก็ด(สนามวัวชน) อ.ดอยสะเก็ด ลงทะเบียน 0806731770
- อาทิตย์ 10 มีนาคม 2567 ณ เทศบาลเมืองแม่โจ้ อ.สันทราย ลงทะเบียนได้ที่เบอร์ 0806731770
- อาทิตย์ 17 มีนาคม 2567 แม่ริม เทศบาลตำบลสันโป่ง สุนัขในเขต แม่ริม สันทราย ดอยสะเก็ด และ สันกำแพง เฉพาะ ตำบลแม่ปูคา ตำบลสันกำแพง ตำบลต้นเปา สุนัขเพศผู้และเพศเมีย น้ำหนัก 10-20 กิโลกรัม / ลงทะเบียนฉีดวีคซีน 6 โรค สุนัขฟรี สำหรับสุนัข อายุ 3 เดือน ขึ้นไป 09.30-11.00 น ลงทะเบียนได้ที่ เบอร์ 0806731770
- อาทิตย์ 31 มีนาคม 2567 แม่แตง ฝ่ายส่งน้ำและบำรุงรักษาแม่แตง
- เสาร์ ที่ 6 เมษายน 2567 เทศบาลตำบลตลาดใหญ่ อำเภอดอยสะเก็ด
- เสาร์ ที่ 20 เมษายน 2567 เทศบาลตำบลสันมหาพน อำเภอแม่แตง
- อาทิตย์ ที่ 21 เมษายน 67 เทศบาลตำบลแม่แรม อำเภอแม่ริม
- วันอาทิตย์ ที่ 12 พฤษภาคม 2567 ณ เทศบาลตำบลสันทรายหลวง สันทราย ผ่าตัดทำหมันสุนัขฟรี น้ำหนัก 10-20 กิโลกรัม ทำหมันแมวจร เพศเมียฟรี จำนวน 10 ตัว
- วันอาทิตย์ ที่ 19 พฤษภาคม 2567 ณ วัดน้ำตกแม่สา แม่ริม ผ่าตัดทำหมันสุนัขฟรี จำนวน 70 ตัว น้ำหนัก 10-20 กิโลกรัม ลงทะเบียน ได้ที่เบอร์ 0806731770
ตารางการผ่าตัดทำหมันเดือนมิถุนายน - สิงหาคม 2567
- อาทิตย์ที่ 9 มิถุนายน 2567 ทำหมันสุนัขฟรี ณ เทศบาลตำบลเจดีย์แม่ครัว ฉีดวัคซีน 6 โรคสุนัข ฟรี ลงทะเบียน ได้ที่เบอร์ 0806731770
- อาทิตย์ 23 มิถุนายน 2567 ทำหมันสุนัขฟรี ณ คณะเกษตรฯ ม.ราชภัช สะสวง รับบัตรคิว 08.30 - 11.00 ฉีดวัคซีน รับบัตรคิว 09.30-12.00
- เสาร์ที่ 29 มิถุนายน 2567 ทำหมันสุนัขฟรี สันมหาพน แม่แตง ณ เทศบาลตำบลสันมหาพน แม่แตงได้ที่เบอร์ 0806731770
- อาทิตย์ที่ 14 กรกฎาคม 2567 ทำหมันสุนัขเพศผู้-เมีย ฟรี ณ เทศบาลตำบลสำราญราษฎร์ ลงทะเบียนได้ที่เบอร์ 0806731770
- เสาร์ที่ 20 กรกฎาคม 2567 ณ เทศบาลเมืองแม่โจ้ แมวในพื้นที่แม่โจ้ ติดต่อสาธารณสุขเทศบาลเมืองแม่โจ้ นอกพื้นที่ลงทะเบียนที่เบอร์ 0806731770
- อาทิตย์ที่ 21 กรกฎาคม 2567 ทำหมันสุนัขฟรี ณ เทศบาลเมืองต้นเปา #สันกำแพง เฉพาะ ต.ต้นเปา ต.สันกำแพง ต.แม่ปูคา แม่ริม สันทราย ลงทะเบียนได้ที่ 0806731770
- เสาร์ที่ 10 สิงหาคม 2567 ผ่าตัดทำหมันสุนัขฟรี สำหรับสุนัขในพื้นที่อำเภอแม่แตง ลงทะเบียน โทร 0806731770 เวลา 18.00-20.00 น.
- อาทิตย์ ที่ 18 สิงหาคม 2567 ผ่าตัดทำหมันสุนัขฟรี ณ เทศบาลเมืองแม่โจ้ ลงทะเบียน โทร 0806731770 เวลา 18.00-20.00 น.
- อาทิตย์ที่ 25 สิงหาคม 2567 ผ่าตัดทำหมันสุนัขฟรี ณ เทศบาลตำบลแม่คือ ลงทะเบียน โทร 0806731770 เวลา 18.00-20.00 น.
ระวังภัยจากอาหารและโรคทางเดินอาหาร
อากาศร้อน ระวังโรคอุจจาระร่วง และอาหารเป็นพิษ
ระวัง! อาหาร
- ที่มีกะทิเป็นส่วนประกอบและอาหารประเภทยำ
- ปรุงสุกๆ ดิบๆ เช่น ลาบ ก้อย พล่า ฯลฯ
- ที่มีฟองอากาศ กลิ่นเหม็นบูด รสชาติเปรี้ยวผิดปกติ
ข้อแนะนำ
- ควรนำอาหารมาอุ่นให้เดือดก่อนรับประทานอาหาร
- หากอาหารที่อุ่นไม่ได้ให้ทำในปริมาณที่พอรับประทานแต่ละมื้อ
- หลีกเลี่ยงอาหารที่มีกะทิเป็นส่วนประกอบและเมนูที่ไม่ผ่านการทำให้สุกด้วยความร้อน หรือปรุงสุกๆ ดิบๆ
- สังเกตสภาพอาหารก่อนรับประทานทุกครั้ง
- เลือกน้ำดื่มบรรจุขวดที่ได้มาตรฐานน้ำบริโภค และมี อย.
- เลือกน้ำแข็งที่ผลิตเพื่อการบริโภคและได้มาตรฐาน รับรอง GMP และ อย. เท่านั้น
รู้จัก รถจักรไอน้ำแบบแปซิฟิค หมายเลข 824 และ 850 คุณปู่ที่ยังฟิตปั๋ง
รู้จัก รถจักรไอน้ำแบบแปซิฟิค หมายเลข 824 และ 850 สักหน่อยเป็นไร ที่บางคนแซวว่า เป็นคุณปู่ แต่ก็เป็นคุณปู่ที่ยังฟิตปั๋ง นะขอบอก
รถจักรไอน้ำแบบแปซิฟิค ทั้งสองคัน เป็นรถจักรไอน้ำที่ ถูกใช้การหลังสงครามโลกครั้งที่ 2 เพื่อทดแทนรถจักรที่เสียหายจากสภาวะสงคราม เป็นการสั่งรถจักรไอน้ำเข้ามาใช้งานเป็นครั้งสุดท้ายด้วย รถจักรรุ่นนี้ถูกสร้างขึ้นมาจำนวน 30 คัน (หมายเลข 821-850) ระหว่าง พ.ศ.2492-2493 โดยสมาคมอุตสาหกรรมรถไฟแห่งประเทศญี่ปุ่น มีการจัดวางล้อแบบ 4-6-2 เรียกว่า “แปซิฟิค” คือ มีล้อนำ 4 ล้อ – ล้อกำลัง 6 ล้อ – ล้อตาม 2 ล้อ ใช้สำหรับลากจูงขบวนรถที่ใช้ความเร็ว น้ำหนักน้อย
รถจักรไอน้ำทั้ง 2 คันนี้ ผลิตจากบริษัทนิปปอน ชาร์เรียว โดยหมายเลข 824 นำมาใช้งานในเดือนสิงหาคม 2492 ใช้ฟืนเป็นเชื้อเพลิง ต่อมาได้ดัดแปลงให้ใช้น้ำมันเตาเป็นเชื้อเพลิงแทนในปี 2514
ส่วนหมายเลข 850 นั้น ถูกนำมาใช้งานเมื่อเดือนมีนาคม 2494 เป็น 1 ใน 5 คันของรถจักรต้นแบบจากผู้ผลิตที่ติดตั้งระบบการใช้น้ำมันเตาเป็นเชื้อเพลิงในการเผาไหม้แทนฟืน เพื่อลดปัญหาการขาดแคลนไม้ฟืน
ในปี 2555 การรถไฟฯ ได้ทำการซ่อมบำรุงหนักทุกส่วนของรถจักรไอน้ำ 2 คันนี้ โดยเปลี่ยนหม้อน้ำใหม่เพื่อให้เกิดความปลอดภัยต่อการใช้งาน ทั้งยังติดตั้งระบบห้ามล้อใหม่จากเดิมที่เป็นระบบสุญญากาศ ให้เป็นระบบลมอัด เพื่อความคล่องตัวในการจัดรถพ่วงที่ใช้ห้ามล้อระบบลมอัดได้ด้วย ซึ่งลดปัญหาการจัดหารถพ่วงที่นำมาต่อขบวนได้เป็นอย่างดี โดยนำมาใช้การอีกครั้งในการเดินรถพิเศษวันที่ 5 ธันวาคม 2555
ปัจจุบัน รถจักรไอน้ำทั้ง 2 คัน ถูกเก็บรักษาอยู่ที่ “โรงรถจักรธนบุรี” เพื่อใช้ในภารกิจการลากจูงขบวนรถที่จัดเดินในโอกาสพิเศษต่างๆ รวมถึงการถ่ายทำภาพยนตร์อีกด้วย
ข้อมูลรถจักรไอน้ำแปซิฟิค หมายเลข 824 และ 850
- น้ำหนักรถจักร : 58,000 กิโลกรัม (58 ตัน)
- น้ำหนักรถลำเลียง : 38,900 กิโลกรัม (38.9 ตัน)
- รวมน้ำหนักรถจักร และรถลำเลียง : 96,900 กิโลกรัม (96.9 ตัน)
- ปริมาตรความจุน้ำในรถลำเลียง : 15,000 ลิตร
- ความยาวรถจักร : 19,335 มิลลิเมตร (19.3 เมตร)
- ความจุน้ำมันเตาเพื่อการเผาไหม้ : 4,200 ลิตร
- กำลังไอ : 13 กิโลกรัม / ตารางเซนติเมตร
ข้อมูลจากเพจ ทีมพีอาร์การรถไฟแห่งประเทศไทย
พระราชพิธีปฐมฤกษ์เปิดเดินรถไฟหลวง วันที่ 26 มีนาคม 2439
วันสถาปนารถไฟหลวงนับเอาเมื่อวันที่ 26 มีนาคม 2439 อันเป็นวันที่มี "พระราชพิธีปฐมฤกษ์เปิดเดินรถไฟหลวง" โดย พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว และสมเด็จพระนางเจ้าเสาวภาผ่องศรี พระบรมราชินีนาถ เสด็จพระราชดำเนิน ทำพิธีที่พลับพลาที่ประดับ บริเวณที่ทรงขุดกระทำพระฤกษ์ เริ่มการก่อสร้าง เมื่อวันที่ 9 มีนาคม พ.ศ. 2434
ทรงตรึงหมุดที่รางทองรางเงินข้างเหนือ ให้ติดกับหมอนไม้มริดคาดเงิน มีอักษรจารึก เป็นพระฤกษ์ จากนั้น สมเด็จพระนางเจ้า พระบรมราชินีนาถ จึงทรงตรึงรางเงินรางทอง ลงเหนือหมอนไม้มริดคาดเงิน มีอักษรจารึก ซึ่งทอดไว้
ทางด้านใต้ แล้วทรงพระกรุณาโปรดเกล้าฯ ให้พระบรมวงศานุวงศ์ ข้าราชการ และทูตานุทูต ทั้งชายหญิง ช่วยกันตรึงต่อไป จนเสร็จทั้ง 2 ราง ซึ่งนับว่าทางรถไฟ ในระหว่างกรุงเทพฯ กับกรุงเก่าติดต่อกันแล้ว ตั้งแต่บัดนั้นเป็นต้นมา
อ่านประวัติการสถาปนารถไฟหลวงแบบเต็ม ๒.๒ สภาพปัญหาในปัจจุบัน จำแนได้ตามด้านต่าง ๆ ได้แก่ ด้านกลไกการจัดทำแผน
ด้านกระบวนการ/เงื่อนเวลา ด้านงบประมาณ ด้านการทำงานร่วมกับภาคีเครือข่าย ด้านการมอบอำนาจ
การตัดสินใจและการบูรณาการฐานข้อมูลชุมชน
๓. แนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน
๓.๑ แนวทางแบบเป็นทางการ (formal) คือ บูรณาการการทำงานกับหน่วยงานภาครัฐ
ที่เกี่ยวข้องเพื่อเชื่อมโยงการทำงาน และสร้างเอกภาพของการบริหารราชการแผ่นดิน (แนวดิ่ง)
เป็นไปตามพระราชกฤษฎีกาว่าด้วยการบริหารงานเชิงพื้นที่แบบบูรณาการ พ.ศ. ๒๕๖๕ และระเบียบ
กระทรวงมหาดไทยว่าด้วยการจัดทำแผนและประสานแผนพัฒนาพื้นที่ในระดับอำเภอและตำบล พ.ศ. ๒๕๖๒
๓.๒ แนวทางแบบกึ่งทางการ (semi-formal) คือ การยกระดับการมีส่วนรวม
ของประชาชนในการบริหารราชการไปสู่การบริหารราชการบ้านเมืองแบบร่วมมือกันในพื้นที่
(Collaborative Governance) ที่เน้นการทำงานร่วมกันของทุกภาคส่วน คือ สร้างความร่วมมือจาก
ภาคประชาชน ภาคประชาสังคม ภาคธุรกิจ/ภาคเอกชน นักวิชาการ สื่อสารมวลชน ฯลฯ
(แนวระนาบ) เพื่อให้เกิดการประสานและเชื่อมโยงการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน
ในรูปแบบทางการ (formal ผ่านกลไกการบูรณาการในพื้นที่ระดับตำบล ทั้งนี้ จากการศึกษา พบว่า
ตำบลห้วยงู มีระบบการจัดการตำบลเข้มแข็ง ในรูปแบบไม่เป็นทางการ คือ บริษัท สร้างสุขตำบลห้วย
ซึ่งเป็นการจำลองการทำงานรูปแบบบริษัท ทำหน้ที่เป็นศูนย์กลางการบริหารและประสานความร่วมมือ
และเป็นกลไกขับเคลื่อนความร่วมมือระดับตำบลในการสร้างนวัตกรรมเพื่อแก้ปัญหาชุมชน จึงได้นำมาเป็น
ต้นแบบสำหรับการจัดทำคู่มือการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน เพื่อขยายผลไปยังพื้นที่อื่น ๆ
ต่อไป
๔. ข้อเสนอการแปลงแนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วนไปสู่การปฏิบัติ
มุ่งเน้นไปที่แนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน ในรูปแบบกึ่งทางการ (semi-formal)
อยกระดับการมีส่วนร่วมของประชาชนในการบริหารราชการไปสู่การบริหารราชการ
แบบร่วมมือกันในพื้นที่ (Collaborative Governance) ที่เน้นการทำงานร่วมกันของทุกภาคส่วน
คือ สร้างความร่วมมือจากภาครัฐ ภาคประชาชน ภาคประชาสังคม ภาคธุรกิจ/ภาคเอกชน นักวิชาการ
สื่อสารมวลชน ฯลฯ (แนวระนาบ โดยนำไปสู่การประสานและเชื่อมโยงการบริหารจัดการตำบลเข้มแข็ง
แบบหุ้นส่วน ในรูปแบบทางการ (formal) ต่อไป
๔.๑ ระยะแรก : การจัดทำแนวทาง (Guideline) การบริหารจัดการตำบลเข้มแข็ง
แบบหุ้นส่วน เพื่อมุ่งเน้นการนำแนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน ในรูปแบบ
กึ่งทางการ (semi-formal ไปสู่การปฏิบัติ โดยประยุกต์ต้นแบบของบริษัทสร้างสุขตำบลห้วย
ของเทศบาลตำบลห้วยงู อำเภอหันคา จังหวัดชัยนาท และกรณีศึกษาต่าง ( มาสร้างเป็น
แนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน เพื่อให้หุ้นส่วนในพื้นที่สามารถนำไปปฏิบัติ
างเป็นรูปธรรม จึงกำหนดหลักณฑ์หรือรายการว่าการดำเนินงานแต่ละเรื่องควรมีองค์
ที่สำคัญ (Checklist) เพื่อให้เป็นข้อมูลกลางหรือแนวทางที่ทุกหน่วยงานสามารถนำไปปรับใช้ได้
ตามองค์ประกอบ ๙ ประการ ดังนี้ (๑) หลักคิดและความมุ่งมั่น (๒) โครงสร้าง กลไก องค์กร (๓) คนและ
ทุนทางสังคม (๔) การเงินและทรัพยากร (๕) ข้อมูล เทคโนโลยี (๖) การสื่อสาร เรียนรู้ (๗) การจัดการ
กิจกรรมงานสงกรานต์ 2567 ที่สำคัญๆ ทั่วไทย
1. ถนนข้าวสาร กรุงเทพฯ
อีกหนึ่งที่เที่ยวสงกรานต์ 2567 ยอดนิยมทั้งในกลุ่มนักท่องเที่ยวไทยและต่างชาติ โดยในแต่ละปีจะมีการเล่นน้ำตลอดทั้งสาย ใครที่อยากเที่ยวในเมืองกรุง ที่นี่ก็สนุกครบรส
2. สยามสแควร์ จ.กรุงเทพฯ
ใครที่ไม่ได้เดินทางกลับต่างจังหวัด ก็สามารถมาร่วมงานสงกรานต์ สืบสานประเพณีไทยกันได้ ณ บริเวณสยามสแควร์ โดยภายในงานก็จะมีกิจกรรมที่น่าสนใจเป็นประจำทุกปี
3. บางแสน จ.ชลบุรี
หากพูดถึงกิจกรรมวันไหลที่ได้รับความนิยมในทุกๆ ปี หลายคนก็อาจจะนึกถึงชายหาดบางแสน ที่จะมีการจัดกิจกรรมเล่นน้ำ ก่อเจดีย์ทราย สรงน้ำพระ และอื่นๆ อีกด้วย
4. องค์พระปฐมเจดีย์ จ.นครปฐม
เป็นประจำทุกปี ที่จะมีการจัดกิจกรรมเล่นน้ำสงกรานต์บริเวณรอบองค์พระปฐมเจดีย์ นอกจากจะได้ชุ่มฉ่ำกับน้ำเย็นๆ แล้ว ใครที่อยากขอพรเสริมสิริมงคลในวันปีใหม่ไทย ก็สามารถไปนมัสการองค์พระและทำบุญกันได้อีกด้วย
5. พระประแดง จ.สมุทรปราการ
อีกหนึ่งสถานที่จัดงานสงกรานต์สุดยิ่งใหญ่ ในแต่ละปีจะมีการจัดกิจกรรมเล่นน้ำ รวมไปถึงกิจกรรมประกวดนางสงกรานต์ พิธีสรงน้ำพระ การละเล่นและการแสดงพื้นบ้านให้นักท่องเที่ยวได้มาสัมผัสกับวัฒนธรรมท้องถิ่นอีกด้วย
6. งานสงกรานต์ จ.เชียงใหม่
ใครที่อยากสัมผัสบรรยากาศปีใหม่ไทยตามแบบฉบับทางเหนือ แนะนำงานสงกรานต์ที่ จ.เชียงใหม่ จัดเต็มความสนุกสนาน บรรยากาศรื่นเริง และกิจกรรมประเพณีสงกรานต์ที่ยังคงกลิ่นอายความเป็นล้านนาไว้
7. งานสงกรานต์ จ.ขอนแก่น
อีกหนึ่งงานสงกรานต์สุดยิ่งใหญ่ จัดขึ้นเป็นประจำทุกปี บริเวณศาลหลักเมืองขอนแก่น ถนนข้าวเหนียว และบึงแก่นนคร นักท่องเที่ยวจะได้สนุกสนานไปกับการแสดง การประกวด กิจกรรมเล่นน้ำ รวมไปถึงกิจกรรมพื้นบ้าน
8. หาดใหญ่ จ.สงขลา
ใครที่กำลังมองหาที่เที่ยวสวยๆ นั่งชิมวิวทะเลได้ ในช่วงเทศกาลสงกรานต์ แนะนำงานสงกรานต์ที่หาดใหญ่ เพราะจะได้สนุกไปกับวงดนตรีและการเล่นน้ำ รวมไปถึงยังพักผ่อนหย่อนใจไปบรรยากาศดีๆ ริมทะเลได้อีกด้วย
9. พัทยา จ.ชลบุรี
สงกรานต์ 2567 เที่ยวไหนดีที่ไม่ไกลจากกรุงเทพฯ เดินทางง่าย ใช้เวลาไม่นาน พัทยาก็เป็นอีกหนึ่งตัวเลือกที่น่าสนใจ นอกจากกิจกรรมการเล่นน้ำแล้ว ยังมีกิจกรรมอื่นๆ ที่พร้อมมอบความสนุกสนานให้นักท่องเที่ยวอีกเพียบ
10. งานสงกรานต์ จ.พระนครศรีอยุธยา
ปิดท้ายที่เที่ยวสงกรานต์ใกล้เมืองกรุง นักท่องเที่ยวจะได้สัมผัสกับงานสงกรานต์สไตล์เมืองกรุงเก่า มีทั้งกิจกรรมการเล่นน้ำ แห่นางสงกรานต์ สรงน้ำพระ ตลอดจนแห่พระพุทธรูปคู่บ้านคู่เมือง เพื่อความเป็นสิริมงคลอีกด้วย
เทศกาลฯ ออกแบบเพื่อใคร?
เทศกาลงานออกแบบกรุงเทพฯ เป็นเทศกาลสำคัญที่ได้รับการบรรจุไว้ในปฏิทินกิจกรรมของกรุงเทพมหานคร ทั้งยังเป็นส่วนหนึ่งของการขับเคลื่อนเศรษฐกิจสร้างสรรค์ รวมถึงมีส่วนผลักดันให้กรุงเทพฯ ได้รับการคัดเลือกเป็นเครือข่ายเมืองสร้างสรรค์ยูเนสโก (UNESCO Creative City Network) สาขาการออกแบบ (Bangkok City of Design) เมื่อปี 2562 กล่าวคือ ‘เทศกาลฯ’ เป็นของทุกคนที่ต้องการทำให้ ‘กรุงเทพฯ’ เป็นเมืองที่ทั้ง ‘น่าอยู่’ ‘น่าลงทุน’ และ ‘น่าเที่ยว’ ผ่านการออกแบบใน 4 มิติ ได้แก่
World Best Hospitals 2024
จาก 250 อันดับ
โรงพยาบาลที่ดีที่สุดในโลก ปี 2024 โดย Newsweek ปีนี้มีข้อมูลน่าสนใจดังนี้
- ปี 2024 มีโรงพยาบาลจาก 30 ประเทศเข้าพิจารณา มีน้องใหม่ คือ ชิลี และมาเลเซีย
การประกวดผลงานวิชาการด้านสมุนไพร
การประกวดผลงานวิชาการด้านสมุนไพร การแพทย์แผนไทย การแพทย์พื้นบ้าน และการแพทย์ทางเลือก
ในงานมหกรรมสมุนไพรแห่งชาติ ครั้งที่ 21
ระหว่าง 3-7 กรกฏาคม 2567
เปิดรับผลงานวิชาการ ถึงวันที่ 29 กุมภาพันธ์ 2567
สอบถาม
กลุ่มงานวิชาการและคลังความรู้
กองวิชาการและแผนงาน
กรมการแพทย์แผนไทยและการแพทย์ทางเลือก
โทร 021495649
ประกาศเชิญชวนรับบริการ สถานีสุขภาพข่วงเมืองน่าน ฟรี
ขอเชิญนักท่องเที่ยว พี่น้องชาวน่าน ที่มาเที่ยวถนนคนเดิน ข่วงเมืองน่าน
...หากมีปัญหาสุขภาพ ขอเชิญเข้ารับบริการ...
สถานีสุขภาพ (HEALTH STATION) สาขาถนนคนเดิน ข่วงเมืองน่าน
ดำเนินงานโดย...ชมรมอสม.เขตเทศบาลเมืองน่าน
ให้บริการ... วัดความดันโลหิต * วัดไข้ ㆍ เจาะเลือดวัดระดับน้ำตาล
* ปฐมพยาบาลเบื้องต้น
* จ่ายยาสามัญประจำบ้าน
* ให้คำปรึกษาด้านสุขภาพ
เข้ารับบริการฟรี...โดยไม่มีค่าใช้จ่าย !
**เปิดบริการทุกวันศุกร์ - วันอาทิตย์ ตั้งแต่เวลา 17.00 - 20.00 น.
ศูนย์เต้านม บำรุงราษฎร์ ดูแลผู้ป่วยได้อย่างครบวงจรแบบองค์รวม
รศ. นพ. วิชัย วาสนสิริ หัวหน้าศูนย์เต้านม โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ที่ศูนย์เต้านม โรงพยาบาลบำรุงราษฎร์ เราดูแลผู้ป่วยได้อย่างครบวงจรแบบองค์รวม โดยเราให้คำปรึกษา ตรวจวินิจฉัย และดูแลรักษาผู้ป่วยที่มีปัญหาเกี่ยวกับเต้านมในทุกมิติ เช่น มะเร็งเต้านม ก้อนที่เต้านม อาการเจ็บเต้านม พังผืดและถุงน้ำที่เต้านม ภาวะเต้านมอักเสบ และปัญหาอื่นๆ โดยมีการทำงานร่วมกันเป็นทีม ระหว่างทีมแพทย์ด้วยกันเองและทีมแพทย์กับสหสาขาวิชาชีพ ได้แก่ ศัลยแพทย์ด้านเต้านม, แพทย์รังสีวินิจฉัย, อายุรแพทย์ด้านโรคมะเร็ง, แพทย์รังสีรักษาและมะเร็งวิทยา, พยาธิแพทย์, เจ้าหน้าที่ห้องปฏิบัติการ, นักรังสีเทคนิค, นักกายภาพบำบัด, พยาบาลวิชาชีพ, นักโภชนาการและเภสัชกร ผ่านการประชุม Multidisciplinary Team Breast Conference เพื่อการรักษาที่ตรงจุด แม่นยำ เกิดผลข้างเคียงน้อย และให้ผลการรักษาที่ดีขึ้น โดย 3 หัวใจหลักของการรักษามะเร็งเต้านมที่บำรุงราษฎร์ คือ วินิจฉัยเร็ว (Fast Diagnosis), รักษาเร็ว (Fast Treatment) และผลลัพธ์การรักษาเป็นเลิศและมีความปลอดภัย (Excellent Outcome)
คำจำกัดความ
คำจำกัดความสถานชีวาภิบาล มี 2 ระดับ ได้แก่
1. ศูนย์ชีวาภิบาลในโรงพยาบาลหมายถึง ศูนย์ที่จัดตั้งขึ้นเพื่อสร้างระบบชีวาภิบาลในโรงพยาบาล โดยบูรณาการระบบริการดูแลผู้สูงอายุ (Elderly Care) การดูแลระยะยาว (Long-Term Care) การดูแล ประคับประคอง/ระยะท้าย (Palliative Care) และเชื่อมโยงระบบบริการปฐมภูมิ (Primary Health Care) ตั้งแต่ การดูแลในโรงพยาบาลจนถึงบ้าน/ชุมชน
2. สถานชีวาภิบาลในชุมชน หมายถึง สถานที่ให้การดูแลผู้มีภาวะพึ่งพิง และการดูแลประคับประคอง/ ระยะท้าย (Long-Term Care and Palliative Care facility) ที่อยู่ในชุมชน มีมาตรฐานด้านสถานที่ ด้านความปลอดภัย และด้านบริการตามมาตรฐานของกรมสนับสนุนบริการสุขภาพ หรือ กรมอนามัย หรือ กระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์ หรือ องค์กรปกครองส่วนท้องถิ่นที่มีอำนาจหน้าที่ในการกำกับ ดูแล
ทั้งนี้อาจแบ่งรูปแบบการให้บริการ เป็น 2 ประเภท ได้แก่
1) บริการระหว่างวัน โดยไม่พักค้างคืน (day care)
2) บริการโดยให้พักค้างคืน
อาจเป็นสถานประกอบการของรัฐ ท้องถิ่น เอกชน องค์กรศาสนาหรือองค์กรอื่นๆ โดยสถานชีวาภิบาล ควรได้รับการรับรองจากกรมสนับสนุนบริการสุขภาพ หรือ กรมอนามัย หรือ กระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์องค์กรปกครองส่วนท้องถิ่นที่มีอำนาจหน้าที่ในการกำกับดูแล มีศักยภาพการดูแลผู้มีภาวะพึ่งพิง ผู้ป่วยระยะประคับประคอง/ระยะท้าย และ/หรือ มีระบบบริหารจัดการผู้ดูแล (caregiver) สำหรับผู้ที่ต้องการ การดูแลที่บ้านได้(Home care) ทั้งนี้เพื่อแบ่งเบาภาระครอบครัว โดยมีกลไกการกำกับดูแลโดยกรมสนับสนุน บริการสุขภาพ หรือ กรมอนามัย หรือ กระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์ หรือ องค์กรปกครอง ส่วนท้องถิ่นที่มีอำนาจหน้าที่ในการกำกับดูแล
[6/3/2024] สมัครงานได้ด้วยตนเองได้ที่ โรงพยาบาลบางกรวย โทร 02-4471999 ต่อ 8200 งานการเจ้าหน้าที่
บริการพอกเข่าลดอาการปวด ฟรี ไม่มีค่าใช้จ่าย
บริการพอกเข่าลดอาการปวด ฟรี ไม่มีค่าใช้จ่าย คลินิกแพทย์แผนไทย โรงพยาบาลปากเกร็ด ทั้งสองแห่ง
•. ที่แผนกผู้ป่วยนอกโรงพยาบาลปากเกร็ด ข้างเทศบาล
•. ที่โรงพยาบาลปากเกร็ดถนน345
ทุกวันจันทร์ถึงวันศุกร์ เวลา 8.00 น. - 15.30 น ทั้งสองแห่ง
แผนที่ท่องเที่ยวภายในกองบิน 5 อ่าวมะนาว
มาเที่ยวอ่าวมะนาวแล้ว ก็ต้องไปเที่ยวให้ทั่ว กิจกรรมให้ครบ สนุกได้ทั้งวัน จบทริปในที่เดียว @กองบิน 5
สถานที่ท่องเที่ยวภายในกองบิน 5
- สักการะศาลเจ้าพ่อเขาล้อมหมวก
- ชมค่างแว่นถิ่นใต้ (ป๋มชอบกินถั่วต้ม เตรียมมาให้ด้วยนะคัฟ)
- พักผ่อนริมชายหาด (เตียงชายหาด ตัวละ 20 บาท) หรือนำเสื่อและเก้าอี้มาเอง
- พายซับบอร์ด
- เรือท่องเที่ยว
- บานาน่าโบ๊ท
- รถ atv
- ยิงธนู
- ให้อาหารแพะ นกกระจอกเทศ
ที่พักภายในกองบิน 5
โรงพยาบาลศรีสังวาลย์ แม่ฮ่องสอน รายงานสถานการณ์ฝุ่น เข้าขั้นรุนแรง
อบต.บ้านใหม่ อำเภอพระนครศรีอยุธยา ตั้งแต่วันที่ 15 กุมภาพันธ์ ถึง 31 มีนาคม 2567
ประชาสัมพันธ์ กองงานสาธารณสุข โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าตามพระปณิธานศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒนวรขัตติยราชนารี ประจำปีงบประมาณ 2567 ติดต่อขอรับวัคซีนได้ที่ สำนักปลัด
องค์การบริหารส่วนตำบลบ้านใหม่ อำเภอพระนครศรีอยุธยา ตั้งแต่วันที่ 15 กุมภาพันธ์ ถึง 31 มีนาคม 2567
ทำไมต้องฉีดวัคซีนที่รพ.เขตร้อนด้วยล่ะ
เหตุผลเด็ดๆ 5 ข้อ ตอบความคำถามนี้ได้ตรงๆ เพราะว่า
1.โรงพยาบาลเวชศาสตร์เขตร้อนมีวัคซีนทุกชนิด (ที่มีในประเทศไทย)
2. ราคามาตรฐาน
3. เป็นโรงพยาบาลรัฐฯ สังกัดมหาวิทยาลัยมหิดล มีแพทย์และผู้เชี่ยวชาญให้บริการ
4. นัดหมายได้ เข้ารับบริการสะดวก ไม่ต้องรอนาน
5. ใกล้อนุสาวรีย์ชัยสมรภูมิ เดินทางมาได้หลายวิธี
นิทรรศการเนื่องในวันนอนหลับโลก World Sleep Day ประจำปี 2567 โรงพยาบาลศิริราช
15 มี.ค. 67 เวลา 09.00 น. ศ. ดร. นพ.ยงยุทธ ศิริวัฒนอักษร ผู้อำนวยการโรงพยาบาลศิริราช เป็นประธานเปิดงานนิทรรศการเนื่องในวันนอนหลับโลก World Sleep Day ประจำปี 2567 "Good Sleep Good Life นอนดี ชีวีมีสุข " ร่วมด้วย พญ.นงนุช ภัทรอนันตนพ ผู้ช่วยอธิบดีกรมอนามัย และผู้อำนวยการศูนย์อนามัยที่ 1 เชียงใหม่ รศ. นพ.ทายาท ดีสุดจิต นายกสมาคมโรคจากการหลับแห่งประเทศไทย รศ. นพ.วัฒนชัย โชตินัยวัตรกุล ประธานศูนย์นิทรรักษ์ศิริราช แพทย์ พยาบาล และประชาชน เข้าร่วมพิธี ณ ศาลาศิริราช ๑๐๐ ปี โรงพยาบาลศิริราช
กิจกรรมเนื่องในวันนอนหลับโลก World Sleep Day คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล โดยศูนย์นิทรรักษ์ศิริราช (Siriraj Sleep Center) จัดขึ้นเพื่อสร้างความรู้ความเข้าใจ เกี่ยวกับโรคการนอนผิดปกติ การประเมินความเสี่ยงต่อการเกิดโรคและสร้างวัฒนธรรมองค์กรที่ดีในการสร้างประโยชน์ให้แก่ชุมชน ในการดูแลสุขภาพตนเองให้มีความรู้ความเบื้องต้น โดยภายในงานพบกับ การเสวนาให้ความรู้เกี่ยวกับการนอนหลับ โดยแพทย์ผู้เชี่ยวชาญ การประกวดคำขวัญวันนอนหลับโลก นิทรรศการให้ความรู้เกี่ยวกับการนอนหลับ Miniconcert และบูธจำหน่ายอุปกรณ์เกี่ยวกับการนอน และกิจกรรมให้ความรู้ต่าง ๆ มากมาย
เกี่ยวกับศูนย์วิชาการเฝ้าระวังและพัฒนาระบบยา (กพย.)
ศูนย์วิชาการเฝ้าระวังและพัฒนาระบบยา (กพย.) เริ่มก่อตั้งครั้งแรกในชื่อ แผนงานสร้างกลไกเฝ้าระวังและพัฒนาระบบยา (กพย.) ได้ดำเนินการด้านระบบยามาอย่างต่อเนื่อง และได้รับทุนสนับสนุนจาก สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) ในการจัดทำรายงานแผนพัฒนาระบบยาเพื่อการคุ้มครองผู้บริโภคปี 2550 ด้วยเล็งเห็นความสำคัญของผลกระทบจากความเสี่ยงที่เกิดจากระบบยาที่มีต่อ สุขภาพ หากมีกลไกที่เข้มแข็งในการติดตามเฝ้าระวัง และจัดการความรู้เพื่อพัฒนาระบบยา จะสามารถลดความเสี่ยงและป้องกันอันตรายที่จะเกิดขึ้นได้ เป็นประโยชน์ต่อการสร้างเสริมสุขภาพ
ในการดำเนินงานระยะที่ 2 กพย. ได้เปลี่ยนชื่อเป็น "แผนงานพัฒนากลไกเฝ้าระวังระบบยา" เพื่อสร้างต้นแบบระบบเฝ้าระวังการดำเนินงานตามนโยบายแห่งชาติด้านยาและยุทธศาสตร์พัฒนาระบบยาแห่งชาติ ด้วยการผนึกกำลังภาคีเครือข่าย โดยเฉพาะจากภาควิชาการ ภาควิชาชีพ และภาคประชาสังคม ทำหน้าที่เป็นกลไกเฝ้าระวังระบบยาแบบครบวงจร สะท้อนสภาพปัญหาจากพื้นที่ พร้อมทั้งจัดการความรู้เรื่องนี้อย่างต่อเนื่อง โดยร่วมกับฝ่ายวิชาการ เพื่อเสนอแนะอย่างเป็นรูปธรรมต่อหน่วยงานที่เกี่ยวข้องใน 3 ประเด็นนโยบายสำคัญ คือ เรื่องยาที่มีประสิทธิผลและปลอดภัย การเข้าถึงยา และการใช้ยาอย่างสมเหตุผล ซึ่งเป็นประเด็นที่หลายภาคส่วนร่วมกันให้ความเห็นว่าเป็นประเด็นที่มีความสำคัญเร่งด่วน นอกจากนี้ จะได้พัฒนาข้อเสนอแนะเพื่อเตรียมการพัฒนาให้เกิดกองทุนเฝ้าระวังและส่งเสริมการใช้ยาอย่างสมเหตุผล เพื่อลดปัจจัยเสี่ยงด้านยาของประชาชน และส่งเสริมการดำเนินงานตามมติสมัชชาสุขภาพแห่งชาติรวมถึงมติคณะรัฐมนตรีที่เกี่ยวข้องในเรื่องนี้
ในการดำเนินงานระยะที่ 3 นี้ กพย. ได้เปลี่ยนชื่อเป็น ศูนย์วิชาการเฝ้าระวังและพัฒนาระบบยา
อาหารโซเดียมสูง...ความดันสูง
ความเสี่ยงการเกิดโรคลมแดด
ความเสี่ยงการเกิดโรคลมแดด
เผชิญอากาศร้อนจัด
มีโรคประจำตัว เช่น โรคเบาหวาน โรคอ้วน โรคความดันโลหิตสูง
ใช้ยาบางชนิด เช่น ยารักษาความดันโลหิตสูง ยาขับปัสสาวะ ยานอนหลับ
ดื่มน้ำไม่เพียงพอ ดื่มแอลกอฮอล์
ออกกำลังหนักในภาวะอากาศร้อน
ใส่เครื่องแต่งกายที่มิดชิด ไม่ระบายความร้อน
อาการ
ตัวร้อนขึ้นเรื่อย ๆ จนทำให้ความร้อนในร่างกายสูงถึง 40 องศา แต่ไม่มีเหงื่อออก **
อ่อนเพลีย ไม่มีแรง
คลื่นไส้ อาเจียน
แห้งแดง ปวดศีรษะ
หน้ามืด ความดันโลหิตต่ำ
หายใจถี่ ชีพจรเต้นแรง
รู้สึกกระหายน้ำมาก
ชักเกร็ง หมดสติ
การปฐมพยาบาลเบื้องต้น
รีบผู้ป่วยนำเข้าที่ร่ม ที่อากาศถ่ายเทได้สะดวก
นอนราบ ยกเท้าทั้งสองข้างขึ้นสูง
สวมเสื้อผ้าโปร่งสบาย ถอดเสื้อผ้าให้เหลือน้อยชิ้น คลายชุดชั้นใน
พ่นตัวด้วยละอองน้ำ หรือใช้ผ้าชุบน้ำเย็นเช็ด จากปลายแขนขาเข้าไปกลางลำตัว ย้อนแนวรูขุมขน
ใช้น้ำแข็งประคบตามซอกคอ หน้าผาก รักแร้ ขาหนีบ
พัดหรือใช้พัดลมเป่า
หากไม่หมดสติให้ดื่มน้ำเปล่ามากๆ
นำส่งโรงพยาบาลโดยเร็วที่สุด
การป้องกัน
หลีกเลี่ยงการอยู่ในที่ร้อนจัด
หากเผชิญอากาศร้อนจัด และมีความเสี่ยงจะเกิดโรคลมแดด ให้ดื่มน้ำบ่อย ๆ
เช็ดหน้าด้วยผ้าเย็น
** หากมีอาการผิดปกติ หรือสงสัยพบผู้ป่วยสงสัยเป็นโรคลมแดด ให้รีบปฐมพยาบาลและนำส่งรพ.ทันที **
โดย น.ท.หญิง เพ็ชชรี พลมณี อาจารย์แพทย์ กองอายุรกรรม โรงพยาบาลภูมิพลอดุลยเดช พอ.
รพ.ราชวิถี แนะนำวิธีรับมือกับอากาศร้อน โรคลมแดด และ ฮีทสโตรก
ถาม-ตอบเกี่ยวกับโรคแอนแทรกซ์ กรมปศุสัตว์
สถานการณ์ของโรคแนแทรกซ์ในประเทศไทย และในประเทศเพื่นบ้านเป็นอย่างไร ?
ประเทศไทย ปัจจุบันไม่มีรายงานการเกิคโรคแอนแทรกซ์ภายในประเทศ โดยมีรายงานครั้งสุดท้ายที่จังหวัดพิจิตร
ในปี พ.ศ. 2543 ซึ่งมีรายงานคนและแพะป่วย และในปี พ.ศ. 2560 ตรวจพบเชื้อในซากแพะที่นำเข้ามาจากประเทศเมียนมา ที่อำเภอแม่สอด จังหวัดตาก แต่ไม่พบการระบาดของโรคแอนแทรกซ์ในคนและสัตว์ภายในประเทศแต่อย่างใด
สาธารณรัฐประชาชนลาว พบผู้ป่วยโรคแอนแทรกซ์จำนวน 3 ราย ที่เมืองสุขุมา แขวงจำปาสัก ทางตอนใต้ของ สปป.ลาว โดยมีสาเหตุจากการบริโภคเนื้อโค-กระบือดิบที่ตายโดยไม่ทราบสาเหตุ มีสัตว์ตายรวมทั้งสิ้น 54 ตัว สถานการณ์ปัจจุบัน ไม่พบสัตว์ป่วยตายเพิ่มเติม
อาการของโรคแอนแทรกซ์เป็นอย่างไร ?
อาการในสัตว์ ในสัตว์เคี้ยวเอื้อง มักแสดงอาการและตายแบบเฉียบพลัน ไข้สูง ไม่กินหญ้า แต่ยืนเคี้ยวเอื้อง มีน้ำลายปนเลือด หายใจลำบาก ยืนโซเซ กล้ามเนื้อกระตุก บางครั้งพบการบวมน้ำของชั้นใต้ผิวหนัง พบเลือดไหลออกจากปาก จมูก และรูทวาร อวัยวะเพศ เลือดมีลักษณะเป็นสีดำๆ ไม่แข็งตัว กลิ่นเหม็นคาวจัด ซากสัตว์จะนิ่ม และเน่าอืดเร็ว
อาการในคน อาการของโรคพบได้ 3 ลักษณะตามวิธีการติดต่อของโรค คือ
- อาการทางผิวหนัง เริ่มแรกเป็นรอยนูนแดง เมื่อแตกจะกลายเป็นแผลปกคลุมด้วยเนื้อตายสีดำๆ ขอบแผลจะนูนเป็นวงโดยรอบ
- อาการทางระบบทางเดินอาหาร เกิดแผลหลุมในทางเดินอาหาร เลือดออก เยื่อเมือกทางเดินอาหารลอกหลุด มีไข้ ท้องเสีย ถ่ายเหลวปนเลือดเก่า อาเจียน ปวดท้องมาก ท้องอืด และมีท้องมาน สุดท้ายจะช็อคแล้วเสียชีวิต
- อาการทางระบบทางเดินหายใจ คล้ายเป็นหวัด มีไข้ ตัวสั่น ไอ เจ็บหน้าอก หายใจลำบาก มักเสียชีวิตภายใน 1-2 วัน
หากพบสัตว์แสดงอาการป่วยหรือตายผิคปกติโคยไม่ทราบสาเหตุหรือสงสัยโรคแอนแทรกซ์ ต้องทำอย่างไร และแจ้งที่ไหน ?
ห้ามเปิดผ่าซาก ห้ามเคลื่อนย้ายซากหรือชำแหละเพื่อการบริโภค
ให้รีบแจ้งเจ้าหน้าที่ปศุสัตว์ อาสาปศุสัตว์ กำนัน ผู้ใหญ่บ้าน หรือเจ้าหน้าที่องค์การบริหารส่วนตำบล (อบต.) เทศบาล ในพื้นที่ หรือ ผ่านทาง Application DLD 4.0 หรือโทรศัพท์สายด่วน 063-225 -6888 เพื่อให้การช่วยเหลือเกษตรกรได้อย่างทันท่วงที
ป้องกันสัตว์ของตนเองจากโรคแอนแทรกซ์ได้อย่างไร ?
- หากนำสัตว์เข้ามาเลี้ยงใหม่ ควรเป็นสัตว์ที่ทราบแหล่งที่มา กักสัตว์เพื่อเฝ้าระวังดูอาการอย่างน้อย 14 วันก่อนก่อนนำสัตว์เข้ารวมฝูง
- ไม่อนุญาตให้บุคคลภายนอกเข้ามาภายในฟาร์ม โดยเฉพาะพ่อค้ารับซื้อโค-กระบือ หากจำเป็น ต้องเปลี่ยนรองเท้าซึ่งผ่านการฆ่าเชื้อทุกครั้งก่อนเข้าฟาร์มหรือสถานที่เลี้ยงสัตว์
- ไม่อนุญาตให้ยานพาหนะทุกชนิคจากภายนอกเข้ามาในฟาร์ม โดยเฉพาะรถขนส่งสัตว์ ในกรณีจำเป็น ต้องทำการพ่นยาฆ่าเชื้อก่อน
- ไม่นำเนื้อสัตว์หรือซากสัตว์ที่ไม่ทราบแหล่งที่มาหรือสัตว์ที่ตายโดยไม่ทราบสาเหตุ มาชำแหละหรือบริโภคภายในสถานที่เลี้ยงสัตว์
จำเป็นต้องฉีควัคซีนป้องกันโรคแอนแทรกซ์ใน โค กระบือ แพะแกะ หรือไม่?
วัคซีนป้องกันโรดแอนแทรกซ์ในโค กระบือ แพะ แกะ ใช้ฉีคกรณีที่ควบคุมโรค หรือพื้นที่เคยเกิคโรคในระยะเวลา 5 ปี ภายหลังการเกิดโรคเท่านั้น ซึ่งการฉีดจะดำเนินการโดยเจ้าหน้าที่หรืออยู่ภายใต้การควบคุมของเจ้าหน้าที่กรมปศุสัตว์เท่านั้น เนื่องจากเป็นวัคซีนเชื้อเป็น และเชื้อมีโอกาสติดต่อสู่คนได้ทางผิวหนังที่มีบาดแผล หรือการกินได้
กรมปศุสัตว์มีการเตรียมความพร้มเรื่องวัคซีนป้องกันโรคแอนแทรกซ์อย่างไร?
กรมปศุสัตว์ได้มีการสำรองวัคซีนในกรณีเกิดโรคฉุกเฉิน ที่เป็นวัดซีนที่ผลิตโดยสำนักเทคโนโลยีชีวภัณฑ์สัตว์ กรมปศุสัตว์ ซึ่งมีประสิทธิภาพ ความปลอดภัย และไม่มีค่าใช้จ่าย
Use case การใช้เอไอในทางการแพทย์ของรพ.บำรุงราษฎร์
รพ.บำรุงราษฎร์ นำเอาเอไอมาใช้ในหลายแผนก อาทิ
งาน CRA open House เปิดบ้านราชวิทยาลัยจุฬาภรณ์
ศาสตราจารย์ แพทย์หญิงยุวเรศมคฐ์ สิทธิชาญบัญชา รักษาการรองเลขาธิการราชวิทยาลัยจุฬาภรณ์ งาน CRA open House เปิดบ้านราชวิทยาลัยจุฬาภรณ์ ต้อนรับครู อาจารย์ สาขาแนะแนวการศึกษาและสาขาอื่น ๆ จากโรงเรียนระดับมัธยมศึกษา โครงการนี้จัดขึ้นเป็นครั้งแรก โดยมีวัตถุประสงค์เพื่อสร้างความสัมพันธ์ภาคีเครือข่ายสถานศึกษาระหว่างราชวิทยาลัยจุฬาภรณ์ร่วมกับสถานศึกษาระดับมัธยมศึกษาทั่วประเทศ เพื่อเป็นการขับเคลื่อนพันธกิจของราชวิทยาลัยจุฬาภรณ์ ในด้านการผลิตบัณฑิตการแพทย์ พยาบาลและการสาธารณสุข ที่มีคุณภาพทางวิชาการและสมรรถนะทางวิชาชีพที่เป็นเลิศ ตลอดจนประชาสัมพันธ์หลักสูตรที่ปัจจุบันราชวิทยาลัยจุฬาภรณ์ จัดการเรียนการสอนในสายวิทยาศาสตร์สุขภาพเพื่อเป็นทางเลือกในการเข้าศึกษาต่อในระดับอุดมศึกษาของนักเรียนในระดับมัธยมศึกษาตอนปลายต่อไป
โรงพยาบาลเพชรบูรณ์ได้จัดพิธีเปิดโครงการยกระดับ 30 บาทรักษาทุกที่
30 มีนาคม 2567 เวลา 18.00 น. โรงพยาบาลเพชรบูรณ์ได้จัดพิธีเปิดโครงการยกระดับ 30 บาทรักษาทุกที่ด้วยบัตรประจำตัวประชาชนใบเดียว ร่วมกับหน่วยงานที่เกี่ยวข้องพร้อมกับอีก 8 จังหวัดนำร่อง (ระยะที่ 2) ณ สนามกีฬากลาง มหาวิทยาลัยการกีฬาแห่งชาติ วิทยาเขตเพชรบูรณ์ จังหวัดเพชรบูรณ์ โดยมี นพ.โสภณ เอี่ยมศิริถาวร ผู้ตรวจราชการกระทรวงสาธารณสุขเขตสุขภาพที่ 2 เป็นประธานเปิดกิจกรรม พร้อมคณะผู้บริหารและเจ้าหน้าที่จากหน่วยราชการ หน่วยงานสาธารณสุข และอสม. จังหวัดเพชรบูรณ์
รายชื่อ สอน. ทั่วประเทศ
รายชื่อสถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี ทั่วประเทศสรุปภาพรวมถ่ายโอนภารกิจ
สรุปภาพรวมถ่ายโอนภารกิจ สอน./รพสต. สู่ อปท. ปี 2551 - ปัจจุบัน ข้อมูล ณ 19 ก.พ. 2567
องค์การบริหารส่วนจังหวัด
- จำนวน อบจ. 76 แห่ง
- รับถ่ายโอน 62 แห่ง
- ไม่รับถ่ายโอน 14 แห่ง
หน่วยบริการแม่ข่าย(CUP)
- จำนวนแม่ข่าย(CUP) 925 แห่ง
- CUP มีลูกข่ายถ่ายโอน 646 แห่ง
- CUP ไม่มีลูกข่ายถ่ายโอน 279 แห่ง
หน่วยบริการลูกข่ายข่าย(สอน./รพสต.)
- รพ.สต.ทั้งหมด 9,872 แห่ง
- ถ่ายโอน 4,276 แห่ง (ถ่ายโอนไป อบจ. 4,196 แห่ง)
- บุคลากรถ่ายโอนไป อบจ. 28,990 คน
- กลุ่ม1(ขรก./ลจป./พนร.) 16,418 คน
- กลุ่ม2(พกส/ลูกจ้างทั่วไป) 12,572 คน
- ไม่ถ่ายโอน 5,596 แห่ง
หน่วยงานสังกัด รพสต.ปัจจุบัน
- กระทรวงสาธารณสุข 5,596 แห่ง
- อบจ. 4,196 แห่ง
- เทศบาลตำบล 33 แห่ง
- องค์การบริหารส่วนตำบล 27 แห่ง
- เทศบาลเมือง 11 แห่ง
- เทศบาลนคร 8 แห่ง
- เมืองพัทยา 1 แห่ง
กิจกรรมเชิงรุกในการเร่งป้องกันโรคพิษสุนัขบ้า จ.จันทบุรี
คาดการณ์ดัชนีความร้อนในกรุงเทพมหานคร ช่วงสงกรานต์2567 LINK
คาดการณ์ดัชนีความร้อนในกรุงเทพมหานคร ช่วงสงกรานต์2567พบว่ามีความร้อนระดับอันตราย และ อันตรายมาก คือ มีอุณหภูมิระดับ 42-51 องศาเซลเซียส ในวันที่ 9, 10, 13-15 เมษายน ขณะที่วันที่ 11-12 เมษายน จะร้อนจัดระดับอันตราย ที่สูงกว่า 52 องศาเซลเซียส
จัดบ้านอย่างไรให้เหมาะกับผู้สูงอายุ ในช่วงหน้าร้อน
จัดบ้านอย่างไรให้เหมาะกับผู้สูงอายุ
- ควรมีต้นไม้บังแดดเพื่อลดอุณหภูมิ
- มีม่านสีอ่อนป้องกันรังสียูวี
- เตรียมน้ำดื่ม และอุปกรณ์ช่วยเหลือให้พร้อม
- ควรอยู่ในสถานที่ที่มีเครื่องปรับอากาศ หากไม่มีเครื่องปรับอากาศ แนะนำใช้พัดลมเปิดแบบส่าย เพื่อระบายอากาศที่ร้อน
- หากมีเหตุฉุกเฉินให้รีบติดต่อสถานพยาบาลที่ใกล้ที่สุด หรือติดต่อสายด่วน 1669
อย่าปล่อยให้ผู้สูงอายุ อยู่ในรถที่จอดตากแดดตามลำพังโดยเด็ดขาด
รมช.สันติ เปิดประเด็นโครงการผลิตแพทย์เพื่อป้อนลงสู่ รพ.สต.ทั่วประเทศ
เกี่ยวกับโครงการผลิตแพทย์เพื่อป้อนลงสู่ รพ.สต.ทั่วประเทศ เริ่มขึ้น เมื่อ นายสันติ พร้อมพัฒน์ รมช.สาธารณสุข กล่าวในช่วงหนึ่งของการประชุมมอบนโยบายกระทรวงสาธารณสุข ปี 2567 ให้กับผู้บริหารระดับสูง สธ. ส่วนกลางและส่วนภูมิภาคทั้ง 12 เขตสุขภาพ และหน่วยงานที่เกี่ยวข้อง เมื่อวันที่ 22 ก.ย. 2566 ว่า ที่ผ่านมาเรามีโรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.) มานาน แต่ไม่เคยมีแพทย์ประจำอยู่เลย ดังนั้น การยกระดับ รพ.สต. ด้วยการให้มีแพทย์ประจำเพื่อดูแลประชาชนจึงเป็นเรื่องสำคัญ อีกทั้งได้มีการหารือกับ นพ.ชลน่าน ศรีแก้ว รมว.สธ. แล้ว ซึ่ง นพ.ชลน่าน ก็พร้อมจะสนับสนุนอย่างเต็มที่ ในการเติมบุคลากรแพทย์เข้าไปอยู่ใน รพ.สต.ทั้ง 8,500 แห่งทั่วประเทศ โดยคาดว่าจะต้องมีแพทย์ 2.5 หมื่นคน คอยประจำและหมุนเวียนการทำงานใน รพ.สต. แห่งละ 3 คน
นายสันติ กล่าวว่า ในส่วนแนวทางการหาบุคลากรแพทย์ไปประจำ รพ.สต. จำเป็นต้องมีการผลิตแพทย์เข้าสู่โครงการ โดยตั้งเป้าผลิตแพทย์ให้ได้จำนวน 2.5 หมื่นคนในระยะเวลา 12 ปี และจะครอบคลุม รพ.สต.ทั่วประเทศ โดยโครงการดังกล่าวจะใช้งบประมาณราว 1 แสนล้านบาทเพื่อผลิตแพทย์ให้ได้ตามจำนวน ด้วยงบประมาณนี้อาจมองว่ามากเกินไป หรือเป็นเงินจำนวนมาก
อย่างไรก็ตาม ต้องบอกว่าการผลิตแพทย์ 1 คนต้องใช้เวลาอย่างน้อย 6 ปี และต้องใช้เงินประมาณ 4 ล้านบาทต่อคน ฉะนั้นหากจะทำให้ครบตามโครงการก็ต้องใช้เงินประมาณ 1 แสนล้านบาท แต่ผลที่ได้จะคุ้มค่า เพราะ สธ. จะคัดเลือกเด็กในภูมิลำเนาเพื่อให้มาเรียนแพทย์ เรียนจบแล้วก็กลับไปเป็นแพทย์ประจำ รพ.สต. ในภูมิลำเนาของตัวเอง ซึ่งจะทำให้ รพ.สต.มีแพทย์คอยดูแลรักษา และส่งเสริมป้องกันโรคให้กับคนในท้องถิ่น [
the coverage]ศูนย์บัญชาการเพื่อการเฝ้าระวังโรคพิษสุนัขบ้า LINK
ศูนย์บัญชาการเพื่อการเฝ้าระวังโรคพิษสุนัขบ้า เป็นหน่วยกลางที่เก็บรวบรวมข้อมูลสำรวจประชากรสุนัขและแมว จากทั่วประเทศ โดยหน่วยงานปกครองท้องถิ่นได้รายงานเข้าระบบออนไลน์
Rabies One Data เริ่มดำเนินการตั้งแต่ปี 2564 ข้อมูลที่น่าสนใจติดตาม อาทิ ข้อมูลสำรวจประชากรสุนัขและแมว ทั้งประเทศและรายจังหวัด ตั้งแต่ปี 2562 ถึงปัจจุบัน
หรือ ดาวน์โหลดข้อมูลสัตว์ที่สำรวจได้จำแนกรายจังหวัด ประเภทและปีได้ (ไฟล์ pdf)
การรายงานสำรวจ จะทำปีละ 2 รอบ รอบแรกช่วงเดือน มิถุนายน และรอบสอง เดือนธันวาคม ของทุกปี
หลักการโครงการ
ครม.เห็นขอบกรอบหลักการโครงการฯ ตามมติ ของ คณะกรรมการนโยบายฯ ในคราวประชุมครั้งที่ 3/2567 เมื่อวันที่ 10 เมษายน 2567 ซึ่งมีสาระสำคัญสรุปได้ ดังนี้
ประโยชน์ของโครงการ
จะช่วยกระตุ้นเศรษฐกิจ โดยเพิ่มเงินหมุนเวียนในระบบเศรษฐกิจให้กระจายตัวไปสู่ท้องถิ่นและชุมชน โดยการดำเนินโครงการฯ ที่มีขอบเขตและเงื่อนไขที่เหมาะสมกับบริบทเศรษฐกิจในปัจจุบัน ซึ่งจะส่งผลดีต่อระบบเศรษฐกิจในภาพรวมและช่วยดูแลความเป็นอยู่ของประชาชนให้ดียิ่งขึ้น ทั้งนี้ คณะกรรมการนโยบายฯ ได้พิจารณากำหนดกรอบการดำเนินโครงการฯ ที่ระมัดระวังและป้องกันความเสี่ยงทางด้านการคลัง เพื่อประโยชน์สูงสุดของประเทศและประชาชนโดยรวม ตลอดจนรักษาวินัยการเงินการคลังของรัฐอย่างเคร่งครัดตามติดการดำเนินการ เพื่อร่วมกันขจัดภัยโรคพิษสุนัขบ้า ในแต่ละจังหวัด
เปิดงานอย่างเป็นทางการ 4 พฤษภาคม 2567
4 พฤษภาคม 2567 เวลา 11.00 น. มีพิธีเปิดงานอย่างเป็นทางการ ศิริราช EXPO 2024 กับงานนิทรรศการ WE ARE READY ในบรรยากาศสุดคึกคัก ได้รับความสนใจเข้าร่วมงานจำนวนมาก ชมภาพบรรยากาศได้จาก
เพจศิริราชงานเภสัชกรแห่งชาติ 30 ปี 30 ท่าน 30 เรื่องราวร้อยเรียงวิชาชีพเภสัชกรรม LINK
งานเลี้ยงภาคค่ำเพื่อเฉลิมฉลองวาระโอกาสอันยิ่งใหญ่ของสภาวิชาชีพ ; งานเภสัชกรแห่งชาติ 30 ปี 30 ท่าน 30 เรื่องราวร้อยเรียงวิชาชีพ .. เภสัชกรรม
โอกาสอันสำคัญ และจะถูกบันทึกเป็นประวัติศาสตร์การก่อตั้งสภาวิชาชีพ เรียนเชิญเภสัชกรทุกแขนง สาขาวิชาชีพ เข้าร่วมงานเลี้ยงภาคค่ำ ของงาน ”เภสัชกรแห่งชาติ“ ภายในงานเลี้ยงภาคค่ำ เตรียมพบการรูปแบบการนำเสนอเรื่องราวร้อยเรียงแห่งวิชาชีพตลอดระยะเวลา 30 ปีแห่งการก่อตั้ง ผ่านเภสัชกรแห่งชาติทั้ง 30 ท่าน .. ร่วมแสดงความปีติยินดีแก่ทุกท่านที่ได้รับรางวัล 30 ท่าน ทั้งที่ท่านที่ยังมีชีวิตอยู่ หรือ ท่านที่ล่วงลับไปแล้ว และร่วมเป็นเกียรติยศอันสูงสุด ร่วมชื่นชมกับรางวัลนี้ รางวัลแห่งวิชาชีพ แก่ทุกท่าน และวงศ์ตระกูลของท่านเหล่านั้น ที่ได้รับรางวัลนี้
“เพราะทุกท่านมีความสำคัญกับวิชาชีพของเรา .. วิชาชีพเภสัชกรรมไทย”
รายละเอียด
งานจัดขึ้น วัน เสาร์ ที่ 29 มิถุนายน 2567
งานเริ่ม 18:00 น. เป็นต้นไป (ต่อเนื่องจากงานภาคเช้า งาน มหกรรมนวัตกรรมวิชาชีพเภสัชกรรม 10:00-18:00 น.)
สถานที่ . ศูนย์ประชุมอิมแพ็ค ฟอรั่ม เมืองทองธานี
บัตรเข้างานราคา . 2,000 บาท
เริ่มจำหน่ายบัตร . 15 พฤษภาคม 2567 เป็นต้นไป
ซื้อบัตรได้ที่
https://www.eventpass.co/
หรือ ทาง inbox เพจ “สภาเภสัชกรรม : The Pharmacy Council”
สอบถามรายละเอียดเพิ่มเติมได้ที่ . 02-591-9992 (คู่สายอัตโนมัติ)
คลินิกทันตกรรม ลาดพร้าว ที่ไหนดี ที่มีมาตรฐานและปลอดภัย
++ กิจกรรมในปีที่ผ่านไป ++
ศ.นพ. สุเทพ กลชาญวิทย์ ประธานจัดงาน FNM 2024 หัวหน้าศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร จุฬาลงกรณ์มหาวิทยาลัย และหัวหน้าศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร โรงพยาบาลบำรุงราษฎร์ กล่าวว่า FNM 2024 เป็นงานประชุมวิชาการระดับนานาชาติด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร ซึ่งเกิดขึ้นจากความร่วมมือขององค์กรชั้นนำทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร ได้แก่ the American Neurogastroenterology and Motility Society (ANMS), the European Society of Neurogastroenterology and Motility (ESNM), the Asian Neurogastroenterology and Motility Association (ANMA), Australasian Neurogastroenterology & Motility Association (ANGMA) และ Sociedad Latinoamericana de Neurogastroenterología (SLNG)
บริการ "คาราวานตรวจสุขภาพ ฟรี!" จุดตรวจโรงพยาบาลเวชการุณย์รัศมิ์ LINK
บริการ "คาราวานตรวจสุขภาพ ฟรี!" จุดตรวจโรงพยาบาลเวชการุณย์รัศมิ์ Walk in ลงทะเบียนได้ที่ บริเวณโถงบริการผู้ป่วยนอก / UMSC ชั้น 2 ทุกวันจันทร์-ศุกร์ เวลา 08.00-12.00 น. ติดต่อสอบถามข้อมูลเพิ่มเติม Line: @wkr1 สายด่วน UMSC โทร. 0-2543-2090, 066-143-0145
โรงพยาบาลเวชการุณย์รัศมิ์ 38/2 ถนนเลียบวารี แขวงกระทุ่มราย เขตหนองจอก กทม.10530
โทร 02 543 1150, 02 988 4100-1, 02 988 4097-9
ตารางแพทย์ออกหน่วยวันอังคาร
ตารางแพทย์ออกหน่วยวันพฤหัสบดี
ตารางแพทย์ออกหน่วยวันศุกร์
มาตรฐาน 5 ด้าน ร้านยาคุณภาพ
ร้านยาคุณภาพ มีการบริการที่เน้นการบริการแบบวิชาชีพทั้งในส่วนของผลิตภัณฑ์ (Product service) และในส่วนของบริการข้อมูลและข้อแนะนำ (Information service) โดยร้านยาคุณภาพที่ผ่านการรับรองจากสภาเภสัชกรรมแล้ว จะให้บริการที่ดี มีคุณภาพ ในมาตรฐาน 5 ด้าน คือ
- ด้านสถานที่ อุปกรณ์ และสิ่งสนับสนุนบริการ
- ด้านการบริหารจัดการเพื่อคุณภาพ
- ด้านการบริการเภสัชกรรมที่ดี
- ด้านการปฏิบัติตามกฎ ระเบียบ และจริยธรรมจรรยาบรรณทางวิชาชีพ
- ด้านการมีส่วนร่วมในชุมชน และสังคม
ร้านยาคุณภาพที่ดำเนินการตามมาตรฐานร้านยาจึงมีความแตกต่างจากร้านยาทั่วไป ทั้งในด้านภาพลักษณ์ สิ่งสนับสนุนในการให้บริการ การจัดรูปแบบของร้าน และการบริการที่มีคุณภาพของเภสัชกร ที่มีขั้นตอนการดูแลสุขภาพของผู้ป่วยอย่างเป็นระบบ (Pharmacist approach) เริ่มต้นจากการสัมภาษณ์ผู้ป่วย การคัดกรอง หรือการประเมินภาวะความเจ็บป่วยเบื้องต้น (Screening or pharmacy diagnosis) การแปลผลจากการตรวจร่างกาย (โดยแพทย์) และจากผลการตรวจทางห้องปฏิบัติการ เพื่อให้มีการจ่ายยาที่เหมาะสมกับผู้ป่วยแต่ละรายตามหลักฐานทางวิชาการ โดยมีการแนะนำที่ถูกต้องทั้งการใช้ยาและแนวทางการปฏิบัติตัว พร้อมมีการติดตามผลของการใช้ยา และคำนึงถึงอาการไม่พึงประสงค์ หรือปัญหาปฏิกิริยาระหว่างกันของยากับยา หรือผลิตภัณฑ์สุขภาพอื่นๆ เป็นการค้นหาแก้ไขและป้องกันปัญหาของการรักษาด้วยยา (Drug-therapy problem) ในรายที่จำเป็นต้องติดตามต่อเนื่องจะมีการบันทึก และให้คำแนะนำปรึกษาอย่างเป็นระบบที่ส่งผลให้การส่งต่อมีคุณภาพ นอกจากนี้ ร้านยาคุณภาพจะต้องมีการปฏิบัติที่สอดคล้องกับกฎหมายที่เกี่ยวข้อง มีการปฏิบัติที่เป็นไปตามจรรยาบรรณแห่งวิชาชีพ และมีบริการอื่นๆ ที่ช่วยส่งเสริมด้านสุขภาพ และมีบริการที่มีส่วนร่วมกับชุมชนโดยเฉพาะที่ร้านยาตั้งอยู่
การดำเนินการใดๆ เกี่ยวกับ “ร้านยาคุณภาพ” เป็นไปตามกฎหมาย “ข้อบังคับสภาเภสัชกรรม ว่าด้วยการรับรองคุณภาพการประกอบวิชาชีพเภสัชกรรมในร้านยา พ.ศ. 2546” ประกาศ ณ วันที่ 29 กรกฎาคม พ.ศ. 2546 ในสมัยที่ ภญ.รศ.ธิดา นิงสานนท์ เป็นนายกสภาเภสัชกรรม และมีการบริหารงานโดยสำนักงานรับรองคุณภาพร้านยา (ส.ร.ร.) หรือ The Office of Pharmacy Accreditation (Thailand) และมี ภก.กิตติ พิทักษ์นิตินันท์ เป็นผู้อำนวยการคนแรก ตามคำสั่งสภาเภสัชกรรมที่ 19/2546 เรื่อง แต่งตั้งผู้อำนวยการสำนักงานรับรองคุณภาพร้านยา (ส.ร.ร.) เมื่อวันที่ 26 กันยายน พ.ศ. 2546 และในปัจจุบันได้มีการแก้ไขข้อบังคับเพื่อให้สอดคล้องกับความเหมาะสมในบริบทคุณภาพร้านยาประกาศใช้เมื่อวันที่ 24 พฤศจิกายน พศ. 2558
คลินิกนอกเวลาราชการ ศัลยกรรมระบบประสาทสมองไขสันหลัง รพ.สมเด็จพระเจ้าตากสิน LINK
คลินิกศัลยกรรมระบบประสาทสมองและไขสันหลัง (คลินิกพิเศษเฉพาะทางนอกเวลาราชการ) โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช จ.ตาก เปิดให้บริการตั้งแต่วันที่ 5 ธันวาคม 2563
วันเสาร์ 9.00-11.00 โทรนัดหมายล่วงหน้า 055-516332, 055-513982 ต่อ 1000
ตรวจรักษา
- โรคทางสมองและระบบประสาท
- ด้านการผ่าตัดสมองและระบบประสาท
การผ่าตัดเนื้องอกฐานกะโหลกศีรษะ
การผ่าตัดเนื้องอกสมองด้วยวิธีส่องกล้อง
- โรคหลอดเลือดสมองโป่งพอง
การผ่าตัดหลอดเลือดสมอง
- โรคทางกระดูกไขสันหลัง
การผ่าตัดกระดูกสันหลัง
การผ่าตัดด้วยวิธีส่องกล้องกระดูกสันหลัง
โดย
- นพ.อตินาท ศรีรัตน์
วว. สาขาประสาทศัลยศาสตร์(Neurological Surgery)
- นพ.เอื้ออังกูรยิ์ สิทธิมงคล
วว. สาขาประสาทศัลยศาสตร์(Neurological Surgery)
- นพ.กัณโชติ ชาญวนิชย์กุลชัย
วว. สาขาประสาทศัลยศาสตร์(Neurological Surgery)
วว.อนุสาขารังสีร่วมรักษาระบบประสาท(Interventional Neuroradiology)
วันเสาร์ 9.00-11.00
โทรนัดหมายล่วงหน้า 055-516332, 055-513982 ต่อ 1000
คลินิกพิเศษอายุรกรรม นอกเวลา
รพ.สุโขทัยเปิดให้บริการคลินิกเฉพาะทางนอกเวลาราชการ เลือกพบแพทย์อายุรกรรมและกุมารแพทย์และแพทย์ออร์โธปิดิกส์ได้ตามวันเวลาที่กำหนด ใช้ระบบนัดหมายล่วงหน้า สะดวกสบายไม่เสียเวลา เสียค่าใข้จ่าย 300 บาท (ต้นสังกัดเบิกคืนได้ 50 บาท)ค่ายาและค่าตรวจอื่นๆ เบิกได้ตามสิทธ์ โทรนัดหมายที่เบอร์ 065-4721635
คนไทยใส่ใจสิ่งแวดล้อมหรือไม่
ครบรอบ 120 ปี โรงพยาบาลตากสิน 12 ทศวรรษ 6 รัชกาล
120 ปี โรงพยาบาลตากสิน 12 ทศวรรษ 6 รัชกาล Moving to the new gen
สิทธิประโยชน์หลัก ที่คุณจะได้รับ
สิทธิประโยชน์ที่คุณจะได้รับ
1. คลินิกนอกเวลาไม่มีค่าใช้จ่าย*
2. รักษาพยาบาล ผู้ป่วยนอกและผู้ป่วยใน*
3. ทันตกรรม วงเงิน 900 บาท* ไม่ต้องสำรองจ่าย (ผู้ประกันตนสิทธิ์โรงพยาบาลอื่น สามารถเข้ารับบริการได้)
4. ตรวจสุขภาพประจำปี ตามสิทธิ์ผู้ประกันตน* ไม่เสียค่าใช้จ่าย (สิทธิ์ประกันสังคม ทุกโรงพยาบาล เข้ารับบริการได้ ตามเกณฑ์ที่สำนักงานประกันสังคมกำหนด)
5. อื่นๆ
ทีมแพทย์ ศูนย์ตรวจรักษาและผ่าตัดผ่านกล้อง โรงพยาบาลเจริญกรุงประชารักษ์
นายแพทย์วันชัย จันทราพิทักษ์ ออกตรวจคลินิกในเวลา วันพุธที่ 15 พฤษภาคม 2567 เวลา 8.00-16.00 น.
5 รางวัลนวัตกรรมสิ่งประดิษฐ์
สำหรับผลงานจากอาจารย์ อาจารย์แพทย์ และนักวิจัยของราชวิทยาลัยจุฬาภรณ์ที่ได้รับรางวัลในการประกวดนวัตกรรมและสิ่งประดิษฐ์ในเวทีระดับนานาชาติ The 49th International Exhibition of Inventions Geneva ณ นครเจนีวา สมาพันธรัฐสวิส ประกอบด้วย
(ภาพ ทีมงานราชวิทยาลัยจุฬาภรณ์ ทีได้รับรางวัล)
WHO กับกิจกรรมวันงดสูบบุหรี่โลกปี 2024
วันงดสูบบุหรี่โลกปี 2024 จะเป็นเวทีให้กับคนหนุ่มสาวทั่วโลก ซึ่งกำลังเรียกร้องให้รัฐบาลต่างๆ ปกป้องพวกเขาจากกลยุทธ์การตลาดยาสูบที่กินสัตว์อื่น อุตสาหกรรมมุ่งเป้าไปที่เยาวชนเพื่อผลกำไรตลอดชีวิต ก่อให้เกิดคลื่นลูกใหม่ของการเสพติด เด็กใช้บุหรี่ไฟฟ้าในอัตราที่สูงกว่าผู้ใหญ่ในทุกภูมิภาค และเยาวชนอายุ 13-15 ปีทั่วโลกประมาณ 37 ล้านคนสูบบุหรี่
World No Tobacco Day youth rally ถึงเวลาก้าวเข้ามาและยืนหยัดเพื่ออนาคตที่ดี! ผู้สนับสนุนเยาวชนทั่วโลกยืนหยัดต่อต้านอุตสาหกรรมยาสูบ และปฏิเสธอิทธิพลที่ทำลายล้างและกลยุทธ์ทางการตลาดที่บงการซึ่งมุ่งเป้าไปที่คนรุ่นใหม่ เข้าร่วมการชุมนุมเยาวชนออนไลน์ของเราเพื่อรับฟังความคิดเห็นจากผู้สนับสนุนเยาวชน WHO, STOP, รณรงค์เพื่อเด็กที่ไม่สูบบุหรี่ และกรอบอนุสัญญาว่าด้วยการควบคุมยาสูบ เกี่ยวกับสิ่งที่จะเกิดขึ้นในวันงดสูบบุหรี่โลกในปีนี้ และความพยายามล่าสุดของพวกเขาในการควบคุมยาสูบ
หมายเหตุสำหรับผู้เข้าร่วม: อาจมีสื่อมวลชนเข้าร่วมในงานออนไลน์นี้
รายงาน Hooking the next generation: how the tobacco industry captures young customers
รายงาน Hooking the next generation: how the tobacco industry captures young customers
อุตสาหกรรมยาสูบดึงดูดลูกค้ารุ่นเยาว์ได้อย่างไร
คนหนุ่มสาวทั่วโลกเรียกร้องให้รัฐบาลปกป้องพวกเขาจากกลยุทธ์การตลาดยาสูบที่กินสัตว์อื่น อุตสาหกรรมมุ่งเป้าไปที่เยาวชนเพื่อผลกำไรตลอดชีวิต ก่อให้เกิดคลื่นลูกใหม่ของการเสพติด ข้อมูลล่าสุดแสดงให้เห็นว่าเด็ก ๆ ใช้บุหรี่ไฟฟ้าในอัตราที่สูงกว่าผู้ใหญ่ในหลายประเทศ และเยาวชนอายุ 13-15 ปีทั่วโลกประมาณ 37 ล้านคนใช้ยาสูบ
ดาวน์โหลดครั้งแรก เมื่อกันยายน ปี 2566 ในโอกาสวันป้องกันโรคพิษสุนัขบ้าโลก
7-11 ซีพีออลล์ เคยจัดกิจกรรม ทำหมันน้องหมาน้องแมว ฟรี ครั้งแรก ในโอกาสวันป้องกันโรคพิษสุนัขบ้าโลก World Rabies Day 2023 วันที่ 28 กันยายน 2566 จัดที่ ลานหน้าร้านเซเว่น อีเลฟเว่น สาขา 18555 แยกนนทบุรี-รัตนาธิเบศร์ มีกิจกรรม ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ได้รับการตอบรับจากชาวนนทบุรี และพื้นที่ใกล้เคียง เป็นอย่างมาก
คลินิกพิเศษศัลยกรรมทางเดินปัสสาวะ รพ.สมุทรปราการ
คลินิกพิเศษศัลยกรรมทางเดินปัสสาวะ เปิดบริการทุกวันพุธ
บริการผ่าตัดนอกเวลา
- ส่องกล้องกระเพาะปัสสาวะ
- ขลิบหนังหุ้มปลายอวัยวะเพศ
- ผ่าตัดทำหมันชาย
- ผ่าตัดก้อนที่อวัยวะเพศ
- ผ่าตัดต่อมลูกหมาก
- ผ่าตัดหนังหุ้มองคชาติ
สอบถามโทร 02-7018132 ถึง 7 ต่อ 2163
คลินิกพิเศษทันตกรรมเฉพาะทางนอกเวลา โรงพยาบาลอุตรดิตถ์
โครงการต่อเนื่องหลายปี
กิจกรรมการบริการทำหมันสุนัขและแมวในพื้นที่ เมืองกระทู้ นี้ เทศบาลเมืองกะทู้ ร่วมกับ มูลนิธิสุนัขในซอย (Soi Dog) ริเริ่มให้บริการมาอย่างต่อเนื่องตั้งแต่ปี 2561 ถือเป็นกิจกรรมสำคัญในการมีส่วนร่วมใน วันป้องกันโรคพิษสุนัขบ้าโลก ที่จัดขึ้นทุกปี ซึ่งที่ผ่านมาได้ผ่าตัดทำหมันสุนัขแมว ไปแล้วหลายร้อยตัว ด้วยหวังให้จ.ภูเก็ต เป็นจังหวัดที่ปลอดภัยจากพิษสุนัขบ้าและจำกัดจำนวนสุนัขจรจัด และควบคุมประชากรสุนัขได้อย่างมีประสิทธิภาพหมวดหมู่รางวัล Healthcare Asia Awards
Healthcare Asia Awards 2024 ได้จำแนก หมวดหมู่รางวัล เป็น 2 กลุ่ม หลักๆ แต่ละกลุ่ม มีหมวดย่อย ดังนี้
ผู้ให้บริการด้านการดูแลสุขภาพ
- ซีอีโอแห่งปี
- โรงพยาบาลแห่งปี
- โรงพยาบาลรองแห่งปี
- โรงพยาบาลพิเศษแห่งปี
- คลินิกเฉพาะทางแห่งปี
- โรงพยาบาลการท่องเที่ยวเชิงการแพทย์แห่งปี
- ผู้ให้บริการการวินิจฉัยแห่งปี
- ผู้ให้บริการดูแลปฐมภูมิแห่งปี
ประเภทโครงการสนับสนุน:
- โครงการสหพันธ์สุขภาพแห่งปี
- โครงการริเริ่มการบริการทางคลินิกแห่งปี
- โครงการริเริ่มการบริการลูกค้าแห่งปี
- ความผูกพันของพนักงานแห่งปี
- โครงการ ESG แห่งปี
- โครงการริเริ่มการปรับปรุงสิ่งอำนวยความสะดวกแห่งปี
- โครงการริเริ่มด้านสุขภาพและความสมบูรณ์แข็งแรงแห่งปี
- โครงการส่งเสริมสุขภาพแห่งปี
- โครงการริเริ่มการดูแลบ้านแห่งปี
- โครงการริเริ่มด้านไอซีทีแห่งปี
- นวัตกรรมการจัดการแห่งปี
- โครงการริเริ่มทางการตลาดแห่งปี
- โครงการริเริ่มการท่องเที่ยวเชิงการแพทย์แห่งปี
- โรงพยาบาลชุมชนที่มีการปรับปรุงมากที่สุดแห่งปี
- โครงการริเริ่มการดูแลผู้ป่วยแห่งปี
- โครงการริเริ่มความปลอดภัยของผู้ป่วยแห่งปี
- ความร่วมมือด้านการดูแลสุขภาพภาครัฐและเอกชนแห่งปี
- โครงการริเริ่มนวัตกรรมการส่งมอบบริการแห่งปี
- นวัตกรรมการบริการแห่งปี
- โครงการโรงพยาบาลอัจฉริยะแห่งปี
- นวัตกรรมเทคโนโลยีแห่งปี
- การส่งมอบวัคซีนแห่งปี
- โครงการริเริ่มการปฏิรูปแรงงานแห่งปี
- ติดตามข้อมูลงานไบค์ในไทยแลนด์ได้แบบเกาะติดที่เพจงานไบค์
การเรียนแพทย์แบบก้าวกระโดด 1-2-10 Med Ed Exponential
คณะแพทย์ฯ พัฒนา Online Learning Platform ภายใต้ชื่อ
“MedUMORE” โดยในการจัดงานครั้งนี้ นำเสนอภายใต้แนวคิด 1-2-10 (1 to 10) Med Ed Exponential ซึ่ง เลขแต่ละตัว มีความหมาย ดังนี้
1 หมายถึงวิสัยทัศน์ของ ในการเป็นผู้นำด้านคลังความรู้ออนไลน์ด้าน สุขภาพการแพทย์และสาธารณสุขที่ใหญ่ที่สุดในประเทศไทย
2 หมายถึงการดำเนินงาน มาเป็นปีที่ 2 และมีการเข้าชมกว่า 2 ล้านครั้ง สามารถรองรับการใช้งานทุกรูปแบบ ตอบโจทย์วิถีชีวิตคนรุ่นใหม่และการเรียนรู้ที่ไม่จำกัดเพียงแค่ในตำรา โดยรวบรวมเนื้อหา จากผู้เชี่ยวชาญเฉพาะทาง ทั้งในระดับประเทศและระดับโลก ตลอดจนการประชุมวิชาการ และ
10 หมายถึงการเติบโตอย่างก้าวกระโดดของการศึกษาทางด้านการแพทย์ หรือแบบ Exponential
โดยการมีภาคีเครือข่ายเข้าร่วมให้ความรู้ทางการแพทย์และประสบการณ์ ความเชี่ยวชาญของบุคลากรจาก 10 องค์กรแพทย์ ส่งเสริมให้ MedUMORE เป็น นวัตกรรมและเทคโนโลยีทางการแพทย์ สู่การเผยแพร่องค์ความรู้ทุกมิติบน Digital Platform ที่มีมาตรฐานเชื่อมต่อผู้ใช้งานทั่วโลก ให้สามารถเข้าถึงได้สะดวกรวดเร็ว ต่อเนื่องและปลอดภัย
หนูทำค่ายรากแก้วมาตั้งแต่อยู่ปี 1 - นางสาวจิรัฐิตินันท์ บุญกิจ หรือน้องเจนนี่
“หนูทำค่ายรากแก้วมาตั้งแต่อยู่ปี 1 ตอนนั้นทำตำแหน่งเลขา ซึ่งหนูชอบทุกอย่างที่เกี่ยวกับค่ายเลย ทั้งแนวทางการจัดค่าย ทั้งกิจกรรม ปีนี้ได้มีโอกาสมาเป็นประธานค่าย หนูกับเพื่อนจึงตั้งใจออกแบบค่ายให้น้องๆ สามารถเต็มที่ทั้งกิจกรรมวิชาการ และได้ทำความรู้จักกับเพื่อนใหม่ไปพร้อมกัน โดยสิ่งที่อยากให้น้องๆ ได้กลับไปไม่ใช่แค่การมีโอกาสเข้าห้องแล็บหรือจับอุปกรณ์ของจริงเท่านั้น แต่เรายังให้ความสำคัญกับกิจกรรมแนะแนวด้วย” นางสาวจิรัฐิตินันท์ บุญกิจ หรือน้องเจนนี่ นิสิตชั้นปีที่ 2 คณะเภสัชศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ประธานค่ายโครงการค่ายวิทยาศาสตร์ – คณิตศาสตร์ “รากแก้ว” ครั้งที่ 33 กล่าวถึงกิจกรรมภายในค่ายเพิ่มเติมว่า
สมาคมโรคเบาหวานแห่งประเทศไทยฯ สำนักการแพทย์ กรุงเทพมหานคร และ ซาโนฟี่ ประเทศไทย ได้เล็งเห็นความสำคัญและมุ่งรณรงค์เพื่อสร้างความตระหนักรู้เกี่ยวกับเบาหวานในเด็ก จึงได้จัดดำเนิน โครงการ “โรงเรียนสุขสันต์ รู้ทันเบาหวาน” (Kids & Diabetes in School: KiDS) ผ่านการจัดเวิร์คช้อปให้แก่ผู้ทำงานที่เกี่ยวข้องกับเด็กและเยาวชน ได้แก่ ครู/อาจารย์ พยาบาลวิชาชีพ กุมารแพทย์ ครอบครัวผู้เป็นเบาหวาน ผู้กำหนดนโยบาย ให้ความรู้เกี่ยวกับการดูแลและป้องกันเบาหวานในเด็กและวัยรุ่น สร้างความตระหนักรู้ และดูแลจัดการเบาหวานในโรงเรียน เพื่อช่วยให้โรงเรียนสามารถบริหารจัดการสภาพแวดล้อมที่ปลอดภัยสำหรับเด็กที่เป็นเบาหวานชนิดต่างๆ ลดการแบ่งแยกและตีตรา และให้ความรู้ในการใช้สื่อและเครื่องมือต่างๆ เพื่อส่งเสริมภาวะโภชนาการที่สมดุล การนอนหลับ และการออกกำลังกายที่เหมาะสม เพื่อป้องกันโรคเบาหวานชนิดที่ 2 ในเด็ก อีกทั้งยังส่งเสริมนิสัยรักสุขภาพและป้องกันโรคตั้งแต่วัยเด็ก โดยมุ่งหวังให้ทุกภาคส่วนที่มีส่วนเกี่ยวข้องนำองค์ความรู้ในโครงการฯ นี้ไปขยายผลเพื่อให้เกิดเป็นรูปธรรม


นายแพทย์ธงชัย กีรติหัตถยากร อธิบดีกรมควบคุมโรค กระทรวงสาธารณสุข กล่าวว่า “ยอดผู้ป่วยไข้เลือดออกในประเทศไทยอาจพุ่งสูงขึ้น อันเนื่องมาจากปรากฏการณ์เอลนีโญ (El Nino) ทำให้อุณหภูมิ ปริมาณน้ำฝน และความชื้นเพิ่มสูงขึ้น ส่งผลต่อการระบาดของยุงลายซึ่งเป็นพาหะของโรคไข้เลือดออก ผู้ป่วยไข้เลือดออกสะสมในประเทศไทย ตั้งแต่เดือน มกราคม-พฤษภาคม 2567 [1] เข้าใกล้ 30,000 ราย มียอดผู้เสียชีวิต 29 ราย และคาดการณ์ว่าอาจสูงถึง 280 รายในปีนี้ เพิ่มสูงสุดในรอบ 5 ปีอีกด้วย สำหรับแนวทางการป้องกันและวินิจฉัยแล้ว นอกเหนือจากนวัตกรรมชุดตรวจเร็วสำหรับไข้เลือดออก (NS1) และกับดักไข่ยุงลาย กระทรวงสาธารณสุขยังได้ออกนโยบายเร่งรัดการป้องกันการแพร่ระบาดโรคไข้เลือดออก4 ด้าน 1) ด้านการเฝ้าระวังโรค 2) ด้านการป้องกันควบคุมโรค 3) ด้านการวินิจฉัยรักษา และ 4) ด้านการสื่อสารความเสี่ยง ที่เป็นแนวทางให้หน่วยงานภาครัฐและประชาชนทุกภาคส่วนได้ปฏิบัติตามเพื่อป้องกันไข้เลือดออก การต่อสู้กับโรคไข้เลือดออกเพื่อหยุดวงจรไข้เลือดออกให้หมดไป และการเห็นถึงคุณค่าของการสร้างเสริมภูมิคุ้มกันด้วยนวัตกรรมการป้องกันต่างๆ ทั้งนี้ สิ่งสำคัญที่สุดก็คือ การร่วมมือกันในทุกภาคส่วน จึงอยากเชิญชวนประชาชนให้มีสุขภาพดีไปด้วยกันด้วยการร่วมเป็นฮีโร่ในการป้องกันไข้เลือดออก ช่วยกันบอกต่อแนวทางการป้องกันไข้เลือดออกให้กับคนใกล้ตัว เพื่อเป็นการกระจายความรู้ออกไปเป็นวงกว้างอีกด้วย”
คลินิกสัตว์เล็ก เทศบาลนครภูเก็ต เปิดให้บริการ 2 ช่วงเวลา เช้าและบ่าย
เทศบาลนครภูเก็ต ได้จัดตั้งที่ทำการงานสัตวแพทย์ (คลินิกสัตว์เล็ก) ขึ้น เพื่อให้การดูแลสัตว์เลี้ยงและสัตว์จรจัด การป้องกันโรคพิษสุนัขบ้า ลดการปล่อยสัตว์เลี้ยงที่ไม่พึงประสงค์ในสถานที่สาธารณะ ให้การช่วยเหลือสัตว์จรจัดที่ได้รับบาดเจ็บ ให้คำปรึกษา แนะนำการดูแลสัตว์เลี้ยงอย่างถูกต้อง การทำหมันเพื่อควบคุมประชากรและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การเคลื่อนย้ายสัตว์จรจัดที่ก่อให้เกิดปัญหาในพื้นที่ไปยังสถานกักกันที่จัดไว้ (บ้านพักสุนัขจรจัด)
คลินิกสัตว์เล็ก เปิดให้บริการในวันราชการ 2 ช่วงเวลา ดังนี้
- ช่วงเช้า เวลา 09.00 – 12.00 น.
- ช่วงบ่าย เวลา 13.00 – 15.00 น.
ณ ที่ทำการงานสัตวแพทย์ (คลินิคสัตว์เล็ก) เทศบาลนครภูเก็ต (สำนักงานตั้งอยู่บริเวณประตูทางออกสำนักงานเทศบาล)
สำหรับการให้บริการไม่มีค่าใช้จ่ายใดๆ
สอบถามรายละเอียดเพิ่มเติมได้ที่ :
กองสาธารณสุขและสิ่งแวดล้อม โทร. 076 – 211570
งานเทศกิจ โทร. 1132
ให้บริการ ในเขตเทศบาลนครภูเก็ต ดังนี้
- ให้คำปรึกษา แนะนำ การดูแล เลี้ยงดูสัตว์เลี้ยง เช่น สุนัข แมว
- ปฐมพยาบาลเบื้องต้นให้แก่สัตว์เลี้ยง เช่น สุนัข แมว
- จัดการปัญหาสัตว์จรจัด เช่น รับแจ้งช่วยเหลือสัตว์จรจัดบาดเจ็บ - รับแจ้งเคลื่อนย้ายสัตว์มีปัญหา - จัดการสวัสดิภาพสัตว์จรจัด เช่น ทำหมัน
- งานโรงฆ่าสัตว์ การออกใบอนุญาตฆ่าสุกร
คุณมีชัย วีระไวทยะ อดีตนักการเมือง นักขับเคลื่อนสังคม และผู้ก่อตั้งและนายกสมาคมพัฒนาประชากรและชุมชน และ โรงเรียนมีชัยพัฒนา (Bamboo School) ที่มาเล่าเรื่องราวที่สร้างแรงบันดาลใจเกี่ยวข้องการขับเคลื่อนการวิสาหกิจเพื่อสังคมโดยสมาคมพัฒนาประชากรและชุมชน นับตั้งแต่ปี 2518 สมาคมได้ระดมทุนและลงทุนพัฒนาธุรกิจที่ส่งเสริมการพัฒนาชนบทโดยไม่มีการแบ่งผลกำไรกลับคืนแก่ผู้ถือหุ้น แต่นำผลกำไรไปลงทุนในการศึกษา การอนุรักษ์ การดํารงชีวิต และกิจกรรมการกุศล สิ่งที่น่าสนใจคือสมาคมดึงดูดนักลงทุนอย่างไรทั้งที่ไม่กำไรเป็นสิ่งจูงใจ สมาคมจะรับประกันกับผู้ลงทุนว่าเงินทุนจะผลิดอกออกผลแน่นอน กล่าวคือสมาคมจะปลูกต้นไม้เพื่อตอบแทนการลงทุนทุกๆ 100 บาท ในปัจจุบัน วิสาหกิจเพื่อสังคมของสมาคมเช่น ร้านอาหาร ร้านขายของที่ระลึก ร้านขายผลิตผลในท้องถิ่น โรงแรม รีสอร์ท และการมอบทุนการศึกษา ล้วนช่วยยกระดับความเป็นอยู่ของชุมชน
คุณมีชัย ได้เน้นย้ําถึงการจัดตั้งโรงเรียนมีชัยพัฒนา (Bamboo School) ซึ่งอุทิศตนเพื่อฝึกอบรมผู้ประกอบการทางสังคมและผู้นําการพัฒนาชุมชนรุ่นใหม่และอนาคต โครงการนี้มีวัตถุประสงค์เพื่อส่งเสริมผู้ประกอบการเพื่อสังคมรุ่นใหม่ โรงเรียนมีชัยพัฒนา ไม่ได้เป็นเพียงโรงเรียนสําหรับนักเรียน แต่เป็นศูนย์กลางการพัฒนาความเป็นอยู่ของชุมชนทั้งหมดซึ่งผู้ปกครองจ่ายค่าเล่าเรียนของเด็กด้วยการปลูกต้นไม้และนักเรียนดูแลทรัพย์สินและการเงินของโรงเรียนตลอดจนสัมภาษณ์ผู้สมัครเพื่อจ้างครูและตําแหน่งอาจารย์ใหญ่
กิจกรรม ปี 2566
1. วันอาทิตย์ที่ 21 พฤษภาคม 2566
2. วันอาทิตย์ที่ 11 มิถุนายน 2566
3. วันอาทิตย์ที่ 9 กรกฎาคม 2566
4. วันอาทิตย์ที่ 20 สิงหาคม 2566
5. วันอาทิตย์ที่ 10 กันยายน 2566
6. วันอาทิตย์ที่ 8 ตุลาคม 2566
7. วันอาทิตย์ที่ 12 พฤศจิกายน 2566
8. วันอาทิตย์ที่ 17 ธันวาคม 2566
ตารางกิจกรรม ปี 2567
วันที่จัดกิจกรรม
1. วันอาทิตย์ที่ 7 มกราคม 2567
2. วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567
3. วันอาทิตย์ที่ 10 มีนาคม 2567
4. วันอาทิตย์ที่ 21 เมษายน 2567
5. วันอาทิตย์ที่ 19 พฤษภาคม 2567
6. วันอาทิตย์ที่ 9 มิถุนายน 2567
7. วันอาทิตย์ที่ 14 กรกฏาคม 2567
8. วันอาทิตย์ที่ 4 สิงหาคม 2567
9. วันอาทิตย์ที่ 8 กันยายน 2567
10. วันอาทิตย์ที่ 6 ตุลาคม 2567
11. วันอาทิตย์ที่ 10 พฤศจิกายน 2567
12. วันอาทิตย์ที่ 15 ธันวาคม 2567
โรงพยาบาลวิมุต เชิญทุกท่านเข้าร่วมตรวจสุขภาพฟรี
โรงพยาบาลวิมุต ได้เป็นส่วนหนึ่งในการเข้าร่วมจัดงานกับทางบริษัทบีทีเอส จัดงานคลินิกลอยฟ้า ปีที่ 19 เฉลิมพระเกียรติฯ โดยในพิธีเปิดงานได้รับเกียรติจากคุณอรนุช จิยะจันทน์ ผู้อำนวยการฝ่ายการตลาด โรงพยาบาลวิมุต ได้เข้าร่วมเปิดงาน ในวันที่ 9 กรกฎาคม 2567
โรงพยาบาลวิมุต ขอเรียนเชิญทุกท่านเข้าร่วมตรวจสุขภาพฟรี! ไฮไลท์สำคัญมีดังนี้ ตรวจวัดน้ำตาลในเลือด ตรวจมวลร่างกายด้วยเครื่อง Inbody และให้คำปรึกษาการรับประทานอาหาร โดยนักโภชนาการ ตั้งแต่วันที่ 9 - 12 กรกฎาคม 2567 เวลา 10:00 - 16:00 น. ณ สถานีวัดพระศรีมหาธาตุ รถไฟฟ้าบีทีเอส และรถไฟฟ้ามหานคร สายสีชมพู
ติดต่อเราเพื่อปรึกษาปัญหาสุขภาพ Call center : 02-079-0000
นพ. ปรีชา เลาหคุณากร หัวหน้าศูนย์กุมารเวช และแพทย์ผู้ชำนาญการเฉพาะทางกุมารเวชศาสตร์ กุมารแพทย์โรคหัวใจในเด็ก โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรคหัวใจพิการแต่กำเนิด เป็นความพิการแต่กำเนิดที่พบเป็นอันดับ 1 ในบรรดาความพิการแต่กำเนิดทั้งหมด และเป็นสาเหตุอันดับ 1 ของการเสียชีวิตในทารกที่มีความพิการแต่กำเนิด กว่า 25% ของทารกเหล่านี้ต้องได้รับการผ่าตัดหรือการสวนหัวใจเพื่อช่วยชีวิต และกว่า 15% ของเด็กที่มีหัวใจพิการแต่กำเนิดไม่อาจอยู่รอดจนถึงวัยผู้ใหญ่ ถึงแม้สาเหตุของการเกิดโรคหัวใจพิการยังไม่เป็นที่ทราบแน่ชัด แต่มีปัจจัยแวดล้อมที่ช่วยเสริม เช่น กรรมพันธุ์ หรือ ระหว่างที่มารดาตั้งครรภ์ ป่วยเป็นหัดเยอรมัน เบาหวานไม่ได้รับการควบคุม หรือทานยาบางประเภท
ความผิดปกติของหัวใจมีตั้งแต่ผิดปกติเพียงเล็กน้อย เช่น รูรั่วที่ผนังหัวใจ จนถึงผิดปกติที่ซับซ้อนมาก เช่น ความผิดปกติของลิ้นหัวใจ หลอดเลือด ขนาด และจำนวนห้องหัวใจ เป็นต้น ในกรณีที่มีความผิดปกติเพียงเล็กน้อย และไม่มีผลต่อการทำงานของหัวใจ การเจริญเติบโต หรือการใช้ชีวิตในระยะยาว ไม่จำเป็นต้องรักษาแก้ไขความผิดปกตินั้น เพียงแค่ติดตามสุขภาพเป็นระยะ ๆ ส่วนรายที่มีความผิดปกติมาก มักจะมีอาการหายใจเร็ว หายใจลำบาก เหนื่อยง่าย ออกซิเจนในเลือดต่ำ รวมถึงมีการเจริญเติบโตช้า ซึ่งผู้ป่วยเหล่านี้ต้องได้รับการผ่าตัดแก้ไข ส่วนบางรายอาจแก้ไขได้ด้วยวิธีการสวนหัวใจ
การผ่าตัดหัวใจเป็นการผ่าตัดใหญ่ซึ่งต้องใช้ทีมศัลยแพทย์ที่มีความชำนาญเฉพาะทาง ที่โรงพยาบาลบำรุงราษฎร์มีแพทย์ผู้เชี่ยวชาญในด้านหัวใจเด็กและศัลยแพทย์หัวใจเด็กที่ทำงานร่วมกันเป็นทีม สามารถทำการวินิจฉัยและวางแนวทางการรักษาผ่าตัดได้ภายในระยะเวลาที่รวดเร็ว
จากสถิติของประเทศไทยพบว่า ในแต่ละปี จะจากการสำรวจพบว่า มีเด็กที่ป่วยด้วยโรคหัวใจพิการแต่กำเนิดกว่า 8,000 คนต่อปี และเสียชีวิตก่อนวัยอันควรถึง 3,000 - 4,000 คนต่อปี โดยโรงพยาบาลบำรุงราษฎร์ ได้ทำการผ่าตัดเด็กที่ป่วยด้วยโรคหัวใจพิการแต่กำเนิดไปแล้วมากกว่า 1,500 ราย ซึ่งในจำนวนนั้น มีเด็กด้อยโอกาสโรคหัวใจพิการแต่กำเนิดถึง 827 ราย ที่ได้รับความช่วยเหลือในการผ่าตัดโดยไม่มีค่าใช้จ่ายผ่านโครงการ “รักษ์ใจไทย” ภายใต้การดำเนินงานของ มูลนิธิโรงพยาบาลบำรุงราษฎร์และโรงพยาบาลบำรุงราษฎร์ ร่วมกับมูลนิธิเด็กโรคหัวใจในพระอุปถัมภ์ของสมเด็จพระเจ้าพี่นางเธอฯ ตั้งแต่ปี 2546 ต่อเนื่องมาจนถึงปัจจุบัน
ศาสตราจารย์ แพทย์หญิงยุวเรศมคฐ์ สิทธิชาญบัญชา รักษาการรองเลขาธิการราชวิทยาลัยจุฬาภรณ์ ได้กล่าวถึงกิจกรรม “โครงการนี้จัดขึ้นโดยมีวัตถุประสงค์เพื่อสร้างความสัมพันธ์ภาคีเครือข่ายสถานศึกษา ระหว่างราชวิทยาลัยจุฬาภรณ์ร่วมกับสถานศึกษาระดับมัธยมศึกษาทั่วประเทศ เพื่อสร้างการรับรู้ถึงพันธกิจของราชวิทยาลัยจุฬาภรณ์ ในด้านการผลิตบัณฑิตแพทย์ พยาบาล และสาขาวิทยาศาสตร์สุขภาพ ที่มีคุณภาพทางวิชาการและสมรรถนะทางวิชาชีพที่เป็นเลิศ ตลอดจนแนะนำหลักสูตรระดับปริญญาบัณฑิตจากทุกคณะวิชาของราชวิทยาลัยจุฬาภรณ์ ประกอบด้วย วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ และคณะวิทยาศาสตร์ เพื่อเป็นทางเลือกในการเข้าศึกษาต่อในระดับอุดมศึกษาของนักเรียนในชั้นมัธยมศึกษาตอนปลายต่อไป”
++ เขตปทุมวัน ++
โรงพยาบาลสัตว์ คลินิครักษาสัตว์ ในเขตปทุมวันมีหลายแห่งดังนี้1.อุตสาหกรรมนี้ ออกแบบผลิตภัณฑ์ที่ดึงดูดเด็ก และทำการตลาดอย่างจริงจัง
ย้อนหลังไปถึงทศวรรษ 1970 เอกสารภายในของอุตสาหกรรมยาสูบ แสดงให้เห็นว่า บริษัทยาสูบมองเด็กและเยาวชนเป็น "ผู้สูบบุหรี่ทดแทน" "ผู้สูบบุหรี่ก่อนวัย" (ผู้สูบหน้าใหม่ - ผู้แปล) เป็นตลาดที่สำคัญ ที่จะช่วยรักษาธุรกิจและอนาคตของแบรนด์ของพวกเขาไว้ได้
ปัจจุบันอุตสาหกรรมยาสูบและอุตสาหกรรมที่เกี่ยวข้องขยายตัวมากขึ้น ทั้งสินค้า ช่องทางการสื่อสารและ ช่องทางการจำหน่าย เหล่านี้ คือตัวช่วยชั้นดี ที่ทำให้พวกเขาเข้าถึงเยาวชนได้มากขึ้นกว่าเดิม มีการผลิตและจำหน่ายผลิตภัณฑ์ที่เป็นที่รู้จักอย่างกว้างขวาง อย่างต่อเนื่อง เพื่อดึงดูดเด็กและเยาวชน รวมทั้ง ผลิตภัณฑ์ยาสูบแบบใช้ความร้อน (Heated tobacco products - HTPs หรือ Heat Not Burn Tobacco (HNB) ผลิตภัณฑ์ยาสูบที่ผลิตละอองที่มีนิโคติน และ สารเคมีอื่นๆ ใช้การสูบเข้าทางปากเลียนแบบการสูบบุหรี่ปกติ) ผลิตภัณฑ์ยาสูบถุงนิโคติน (Nicotine Pouches) และบุหรี่ไฟฟ้า
บริษัทต่างๆ ออกแบบผลิตภัณฑ์เหล่านี้ให้ดึงดูดใจเยาวชน ควบคู่การทำการตลาดเชิงรุก ผ่านสื่อดิจิทัล ที่สามารถพุ่งเป้าเข้าถึงกลุ่มเป้าหมายได้ง่าย โดยตรงแม่นยำ
แพลตฟอร์มดิจิทัลมีความซับซ้อนในการตรวจสอบ เฝ้าระวังและควบคุม ทำให้อุตสาหกรรมมีกลยุทธ์เทคนิคมากมาย ที่จะเลี่ยงหลบหลีกข้อกฏหมายไปได้ อย่างเช่น กฏหมายที่การห้ามการโฆษณายาสูบ การส่งเสริมการขาย และการสนับสนุน (tobacco advertising, promotion and sponsorship - TAPS) ใดที่พุ่งเป้าโดยตรงกับคนหนุ่มสาว แม้กระทั่ง ขายตรงให้กับพวกเขา
และนั่นส่งผลกระทบชัดเจน: ดูได้จากผลสำรวจในกลุ่มเด็กอายุ 15–30 ปี ใน 4 ประเทศที่จำกัดการโฆษณาบุหรี่ พบว่า 85% เคยเห็นการโฆษณาบุหรี่ไฟฟ้าบนแพลตฟอร์มสื่อต่างๆ และ การมองเห็นสื่อที่สูงขึ้นนี้ สอดคล้องกับอัตราการใช้บุหรี่ไฟฟ้าที่เพิ่มมากขึ้นด้วย [4]
โฆษณาอุตสาหกรรมยาสูบเข้าถึงเยาวชนหลายล้านคนบน Instagram เฟสบุ๊ค เอ็กซ์ และติ๊กต๊อก
ตามรายงานของแคมเปญรณรงค์เพื่อเด็กปลอดยาสูบ #SponsoredByBigTobacco เนื้อหาที่ส่งเสริม บุหรี่ไฟฟ้า ถุงนิโคติน และผลิตภัณฑ์ยาสูบแบบใช้ความร้อนจาก British American Tobacco (BAT) และ Philip Morris International มีผู้เข้าชมมากกว่า 3.4 พันล้านครั้งบนแพลตฟอร์มโซเชียลมีเดีย โดยที่ เนื้อหาทางการตลาดของทั้งสามแบรนด์ ได้แก่ Vuse, Velo และ IQOS เข้าถึงเยาวชนอายุต่ำกว่า 25 ปี มากกว่า 150 ล้านคน [13]
ประเภทสถานสงเคราะห์สัตว์
26 ธันวาคม 2566 เปิดตัวสาขาแรก โรงพยาบาลสิริเวช จันทบุรี
26 ธันวาคม 2566 ได้มีการจัดงาน Grand Opening พิธีเปิดร้านยา THHealth Pharma ณ โรงพยาบาลสิริเวช จันทบุรี เป็นร้านขายยาสาขาแรกในโรงพยาบาล ของเครือ ธนบุรี เฮลท์แคร์ กรุ๊ป โดยได้รับเกียรติจาก ภก.นที ตั้งจิตรสดใส CEO บริษัท ที เอช เฮลท์ จำกัด คุณอัญชลี ชวลิตจารีธรรม CFO and Director of Group Accounting (THG) และ พลตำรวจตรีอมร สุวพันธ์ ประธานคณะกรรมการ บริษัท สิริเวช จันทบุรี จำกัด (มหาชน) นายแพทย์ประเสริฐ ริมชลา ผู้อำนวยการโรงพยาบาล แพทย์หญิงดารณี สุวพันธ์ รองผู้อำนวยการโรงพยาบาล พร้อมคณะกรรมการบริหาร มาร่วมเป็นประธานพิธีเปิดร้านยา TH Health Pharma สาขาโรงพยาบาลสิริเวช จันทบุรี
ภายในร้านยา THHealth Pharma สาขาโรงพยาบาลสิริเวช จันทบุรี มีจำหน่ายยา วิตามิน ผลิตภัณฑ์อาหารเสริม ผลิตภัณฑ์บำรุงผิวหน้า-ผิวกาย อุปกรณ์ทางการแพทย์ รถเข็นผู้ป่วย เตียงผู้ป่วย ไม้เท้าช่วยพยุงฯลฯ วัสดุทางการแพทย์ และสินค้าเพื่อสุขภาพอื่นๆ อีกมากมาย พร้อมบริการส่งถึงบ้าน


ศาสตราจารย์เกียรติคุณ นายแพทย์รัชตะ รัชตะนาวิน รักษาการรองเลขาธิการราชวิทยาลัยจุฬาภรณ์ แถลงถึงการดำเนินงานจัดโครงการเฉลิมพระเกียรติ ฯ ของราชวิทยาลัยจุฬาภรณ์ เพื่อน้อมนำแนวพระราชปณิธาน พระราชดำริ และพระบรมราโชบายของพระบาทสมเด็จพระเจ้าอยู่หัวเกี่ยวกับการดูแลสุขภาพพลานามัยของประชาชน อันเป็นปัจจัยสำคัญต่อการสร้างสรรค์ทรัพยากรบุคคลที่มีคุณภาพและเป็นพลังในการพัฒนาประเทศชาติ โดยราชวิทยาลัยจุฬาภรณ์ได้เสนอจัดทำโครงการในนามราชวิทยาลัยจุฬาภรณ์ภายใต้แนวคิด สืบสาน–รักษา-ต่อยอด พระราชปณิธาน สร้างสรรค์นวัตกรรมบริการสุขภาพเพื่อปวงชนเข้าร่วมเป็นโครงการและกิจกรรมร่วมเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ๒๘ กรกฎาคม ๒๕๖๗ กับทางรัฐบาล จำนวน ๘ โครงการ ครอบคลุมการดำเนินงานในทุกมิติของราชวิทยาลัยจุฬาภรณ์ทั้งด้านการให้บริการวิชาการและวิชาชีพด้านสุขภาพ การจัดการศึกษาสร้างบุคลากรที่มีความสำคัญและตอบสนองต่อความต้องการของประเทศ การวิจัยสร้างองค์ความรู้และนวัตกรรมเพื่อนำไปพัฒนาระบบบริการสุขภาพ ตลอดจนสืบสานพระปณิธานใน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี องค์ประธานและนายสภาราชวิทยาลัยจุฬาภรณ์ ในการช่วยเหลือประชาชนให้มีสุขภาพที่ดีและมีคุณภาพชีวิตที่ได้มาตรฐาน โดยมีเป้าหมายคือการนำวิทยาการขั้นสูงและนวัตกรรมไปใช้ในการสร้างสุขภาวะที่ดี ภายใต้ปรัชญา เป็นเลิศเพื่อทุกชีวิต โดยโครงการเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ในนามราชวิทยาลัยจุฬาภรณ์ จำนวน ๘ โครงการ
ด้านเชฟชุมพล กล่าวว่า สำหรับท่านที่ยังไม่เคยลองทาน รสชาติปลาหมอคางดำจะคล้ายกับปลานิล แต่อาจจะมีความกระด้างกว่าเล็กน้อย เพราะเขาเป็นปลาสายพันธุ์ปลานักสู้/ปลานักล่าเช่นเดียวกับปลาช่อนหรือปลากะพง ข้อดีคือเป็นปลาที่มีโปรตีนสูง เชื่อว่าด้วยภูมิปัญญาในการทำอาหารหลากหลายชนิดของคนไทย ทั้งนำปลาตัวใหญ่ไปทำอาหาร และนำปลาตัวเล็กไปทำปลาร้า ซึ่งจะสร้างมูลค่าเพิ่มได้มาก และจะลดจำนวนได้อย่างรวดเร็ว เชื่อว่าประมาณ 3 เดือน อาจจะหาจับได้ยากและราคาสูงขึ้น
เชฟชีส กล่าวว่า ปลาหมอคางดำทานได้ แม้รสชาติของเนื้อปลาจะน้อยกว่าปลาที่มีลักษณะคล้ายกัน แต่เมื่อนำมาทำอาหารไทยซึ่งมีรสชาติเข้มข้น จะทำให้สามารถทานได้เหมือนปลากะพงหรือปลานิลทั่วไป โดยมีข้อสังเกตระหว่างปลาตัวผู้กับปลาตัวเมียที่ขนาดตัว คือ ปลาตัวผู้จะตัวเล็กกว่า เนื้อกระด้างกว่าเล็กน้อย เพราะมีหน้าที่รับฝากไข่ ส่วนปลาตัวเมียจะตัวใหญ่
ผู้ว่าราชการกรุงเทพมหานคร กล่าวสรุปด้วยว่า กรุงเทพมหานครทำเต็มที่ในส่วนที่สามารถทำได้ ส่วนเรื่องการจำกัดโซน การปล่อยปลาผู้ล่า จะต้องฝากทางกรมประมง ทางรัฐบาล มาร่วมกัน ซึ่งเราพร้อมที่จะเดินตามนโยบายอย่างเต็มที่
สรุปรายละเอียดโครงการ BKK Food Bank
อยากทำบุญนึกถึง BKK FOOD BANK CENTER คนให้อิ่มบุญ คนรับอิ่มท้อง
กรุงเทพมหานคร
ริเร่ิมโครงการ BKK Food Bank นำร่อง ใน 4 เขต ได้แก่ เขตห้วยขวาง เขตบางขุนเทียน เขตบางพลัด เขตพระโขนง
- โครงการพัฒนาต้นแบบ BKK Food Bank ส่งต่ออาหารให้กลุ่มเปราะบางอย่างเป็นรูปธรรม
- แก้ปัญหาอาหารส่วนเกิน โดยส่งต่อแก่ผู้ที่ขาดแคลน กลุ่มเปราะบาง กลุ่มคนจนเมือง หรือผู้ที่ได้รับผลกระทบจากภัยพิบัติและสาธารณภัยในสถานการณ์ฉุกเฉิน
- สร้างกลไกส่งต่อความช่วยเหลือระหว่างผู้ให้และผู้รับอย่างยั่งยืน
- แก้ปัญหาอาหารเหลือทิ้ง (Food Waste)
- รวบรวมส่งต่อวัตถุดิบอาหารส่วนเกิน (Food Surplus) จาก ผู้บริจาค สู่ ผู้รับ
กลุ่มเป้าหมายที่โครงการนี้จะส่งต่ออาหารสิ่งของให้ ดังนี้
- กลุ่มผู้สูงอายุ
- กลุ่มผู้ป่วยติดเตียง
- กลุ่มผู้พิการ
- กลุ่มเปราะบาง
- กลุ่มผู้ด้อยโอกาส
- กลุ่มประชาชนผู้มีรายได้น้อย
- กลุ่มผู้ได้รับผลกระทบจากภัยพิบัติ
โครงการ BKK Food Bank เชื่อว่าผู้รับทุกคนมีสิทธิเลือกสิ่งของที่ต้องการอย่างอิสระ ไม่ต่างจากการไปใช้จ่ายในมินิมาร์ททั่วไป แนวทางนี้ช่วยส่งเสริมศักดิ์ศรีความเป็นมนุษย์ ช่วยให้ผู้รับรู้สึกมีคุณค่าและสามารถตัดสินใจเลือกสิ่งที่เหมาะสมกับความต้องการของตัวเอง เพื่อให้ของบริจาคไม่เป็นของเหลือทิ้งอีกต่อหนึ่ง
ชอปอะไรได้บ้างใน BKK Food Bank
- อาหารแห้ง: ข้าวสาร อาหารกึ่งสำเร็จรูป บะหมี่กึ่งสำเร็จรูป ปลากระป๋อง
- ของใช้จำเป็น: สบู่ แชมพู ยาสีฟัน ทิชชู่เปียก ยาพาราเซตามอล
ขั้นตอนการชอปที่ BKK Food Bank
- รายงานตัวรับพาสปอร์ตและคูปอง เพื่อใช้ในการคำนวณวันเข้ารับบริการ
- เลือกสินค้าตามความต้องการ
- รับสินค้ากลับบ้าน
มากกว่าแค่การบริจาค เพราะ BKK Food Bank ไม่ได้เป็นเพียงจุดรับอาหารเท่านั้น แต่เป็นการต่อยอดนโยบายของ กทม. รวมถึงเพิ่มการเข้าถึงสวัสดิการ โดยการเป็นจุดเชื่อมต่อให้ผู้รับเข้าถึงข้อมูลข่าวสารด้านสวัสดิการรัฐจากสำนักงานเขต พร้อมขยายศูนย์ให้บริการอีก 50 เขตในอนาคต
ร่วมเป็นส่วนหนึ่งในการให้ ได้แล้ววันนี้ ที่ 4 เขตนำร่อง ได้แก่ เขตห้วยขวาง เขตพระโขนง เขตบางขุนเทียน เขตบางพลัด สอบถามข้อมูลเพิ่มเติมได้ที่
- ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม เขตห้วยขวาง โทร. 0 2275 4234
- ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม เขตบางขุนเทียน โทร. 0 2416 5406
- ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม เขตพระโขนง โทร. 0 2332 9453
- ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม เขตบางพลัด โทร. 0 2434 6370
ภาพรวมของการระบาดของไข้หวัดนก H5N1 ในประเทศกัมพูชา
Center for Medical Genomics สรุปภาพรวมของ
การระบาดของไข้หวัดนก H5N1 ในประเทศกัมพูชา ในปีนี้ จากมกราคมจนถึงเดือนกรกฎาคม พ.ศ. 2567 ประเทศกัมพูชาได้รายงานผู้ป่วยไข้หวัดนก H5N1 ในมนุษย์ทั้งสิ้น 6 ราย ต่อไปนี้เป็นรายละเอียดโดยสังเขปของแต่ละกรณี:
1. มกราคม พ.ศ. 2567: เด็กชายวัย 3 ขวบ จากอำเภอกำปงตระแบก จังหวัดไพรแวง
- อาการแสดง: มีไข้สูง ไอ และน้ำมูกไหล
- ผลการรักษา: หายเป็นปกติ
- ที่มาของการติดเชื้อ: พบซากไก่ตายรอบบริเวณที่อยู่อาศัย
- ผลการตรวจวินิจฉัย: ตรวจพบเชื้อ H5N1 ด้วยวิธี RT-qPCR และได้รับการยืนยันผลโดยสถาบันปาสเตอร์แห่งกัมพูชา (IPC)
2. มกราคม พ.ศ. 2567: ผู้ป่วยชายอายุ 69 ปี จากอำเภอพวก จังหวัดเสียมราฐ
- อาการแสดง: มีไข้ ไอ และหายใจลำบาก
- ผลการรักษา: หายเป็นปกติ
- ที่มาของการติดเชื้อ: เลี้ยงสัตว์ปีกในบ้านและไก่ชน
- ผลการตรวจวินิจฉัย: ตรวจพบเชื้อ H5N1 ด้วยวิธี RT-PCR และได้รับการยืนยันผลโดย IPC
3. กุมภาพันธ์ พ.ศ. 2567: เด็กอายุ 9 ปี จากจังหวัดกระแจะ
- อาการแสดง: ไม่มีการระบุรายละเอียด
- ผลการรักษา: เสียชีวิต
- ที่มาของการติดเชื้อ: สัตว์ปีกที่บ้านของผู้ป่วยตายและถูกนำมาประกอบอาหาร
- ผลการตรวจวินิจฉัย: ไม่ได้ระบุไว้ แต่การวิเคราะห์ทางพันธุกรรมชี้ว่าเป็นเชื้อ H5N1 สายพันธุ์เก่า (2.3.2.1c)
4. กุมภาพันธ์ พ.ศ. 2567: เด็กหญิงอายุ 17 ปี จากจังหวัดกัมปอต
- อาการแสดง: มีไข้ ไอ อ่อนเพลีย และหายใจลำบาก
- ผลการรักษา: อาการดีขึ้นหลังได้รับการดูแลในหอผู้ป่วยวิกฤต
- ที่มาของการติดเชื้อ: พบไก่ตายที่บ้านจำนวน 7 ตัว
- ผลการตรวจวินิจฉัย: ตรวจพบเชื้อ H5N1
5. มีนาคม พ.ศ. 2567: เด็กชายวัย 3 ขวบ จากอำเภอคีรีวงศ์ จังหวัดตาแก้ว
- อาการแสดง: มีไข้ ไอ อ่อนเพลีย และหายใจลำบาก
- ผลการรักษา: อยู่ระหว่างการรักษาในหอผู้ป่วยวิกฤต อาการมีแนวโน้มดีขึ้น
- ที่มาของการติดเชื้อ: สัมผัสและอุ้มซากไก่ที่ตายแล้ว
- ผลการตรวจวินิจฉัย: ตรวจพบเชื้อ H5N1
6. วันที่ไม่ระบุ: กรณีผู้ป่วยรายที่ 6 ในปี พ.ศ. 2567
- รายละเอียด: ไม่มีข้อมูลเพิ่มเติมจากแหล่งข้อมูล แต่เป็นส่วนหนึ่งของผู้ป่วย 6 รายที่ได้รับรายงานในปีนี้
สวทช. เปิดตัว 8 นวัตกรรมสุดล้ำ และโอกาสในการร่วมลงทุน
ในงาน Thailand Tech Show 2024 อว.แฟร์ อว.แฟร์ SCI-POWER For Future ปีนี้ สวทช. เตรียมเปิดตัว 8 โครงการนวัตกรรมสุดเด่นสุดล้ำ นำมาอวดในงาน กับเปิดโอกาสสำหรับการลงทุนธุรกิจเทคโนโลยี ร่วมกับนักวิจัยเจ้าของผลงาน ที่พร้อมถ่ายทอดผลงานให้กับผู้ประกอบการ เพื่อต่อยอดสู่ตลาดและผู้บริโภค โดยทั้ง 8 โครงการ ได้แก่
1. ไซโปร®️ : สายพันธุ์ยีสต์และกระบวนการผลิตไซลิทอล
2. AgriPV: แผงโซลาร์เซลล์ ลดรังสียูวีและสะท้อนความร้อนเพื่อการเกษตร
3. เปปไทด์จากจิ้งหรีด: โปรตีนทางเลือกใหม่
4. NomadML: แพลตฟอร์ม AI สัญชาติไทย
5. Nano Cool Paint: สีทาบ้าน ลดอุณหภูมิ
6. ข้อเข่าเทียมสุนัขสำหรับรักษากระดูกสะบ้าเคลื่อนหลุด: นวัตกรรมเพื่อสัตว์เลี้ยง
7. Ross (รอส) Motion-Assist Exosuit: ผู้ช่วยคนใหม่ของเหล่าผู้ดูแล
8 โครงการนวัตกรรม
พบกัน 8 โครงการนวัตกรรม สวทช. บนเวที Investment Pitching วันที่ 23 กรกฎาคม 2567 เวลา 9:00 - 12:00 น. เวทีกลาง Hall 3 งาน อว.แฟร์ SCI-POWER For Future ศูนย์การประชุมแห่งชาติสิริกิติ์
8 โครงการนวัตกรรม ได้แก่
ตรวจสุขภาพกับ Check-Up Clinic รพ.มหาวิทยาลัยนเรศวร LINK
ตรวจสุขภาพกับ Check-Up Clinic รพ.มหาวิทยาลัยนเรศวร
ให้บริการตรวจสุขภาพประจำปี โดยอาจารย์แพทย์ผู้เชี่ยวชาญ จากคณะแพทยศาสตร์ รพ.มหาวิทยาลัยนเรศวร
1. เลือก
โปรแกรมตรวจสุขภาพ ที่ใช่สำหรับคุณ
-
- โปรแกรมตรวจสุขภาพ วางแผนสุขภาพดี เอาใจสายชิล
- โปรแกรมตรวจสุขภาพ วางแผนสุขภาพดี เอาใจสายแข็ง
- โปรแกรมตรวจสุขภาพสำหรับสิทธิ์ประกันสังคม และบุคลากรมหาวิทยาลัยนเรศวร
- โปรแกรมตรวจสุขภาพสำหรับพนักงานรัฐวิสาหกิจ และพนักงานประจำ
- โปรแกรมตรวจสุขภาพสำหรับข้าราชการ/ลูกจ้างประจำ
- โปรแกรมตรวจสุขภาพสำหรับบุคคลทั่วไป
2. โทรศัพท์จองคิว เลือกโปรแกรมตรวจสุขภาพ พร้อมรับคำแนะนำจากเจ้าหน้าที่ 0 5596 5638 ????(กรณีติดต่อไม่ได้ หรือไม่มีคนรับสายคู่สายอาจชนกัน หรือเจ้าหน้าที่ติดสายอื่นอยู่ สามารถเว้นระยะและติดต่ออีกครั้งค่ะ)
3. เข้ารับบริการตามวันและเวลานัดหมาย
ตรวจสุขภาพประจำปีวันนี้ เพื่อวางแผนใช้ชีวิตเต็มที่ทุกวัน
คลินิกตรวจสุขภาพประจำปี รพ.ม.นเรศวร สอบถาม/จองคิวล่วงหน้า
โทรศัพท์ : 055-965638
เพจ : ClinicCheckUp.nuh
ครอบครัวอบอุ่น ห่างไกล…บุหรี่ไฟฟ้า
ประเทศไทยกับโอกาสของการขับเคลื่อนเศรษฐกิจสุขภาพ
ประเทศไทยได้รับการยกย่องว่าเป็นจุดหมายปลายทางการท่องเที่ยวชั้นนำมายาวนาน เนื่องจากมีขีดความสามารถทางการท่องเที่ยวที่ตอบสนองความต้องการของนักท่องเที่ยวทุกกลุ่มวัย โดยเฉพาะในด้านการท่องเที่ยวเชิงสุขภาพที่ประเทศไทยมีชื่อเสียงติดอันดับโลกด้านบริการการแพทย์และกิจกรรมส่งเสริมสุขภาพ ที่ส่งมอบประสบการณ์และบริการที่ประทับใจในสภาพแวดล้อม เชิงวัฒนธรรมความเป็นไทย ซึ่งส่งเสริมให้ผู้รับบริการได้เรียนรู้และปฏิบัติ เพื่อการมีชีวิตที่ดี อยู่ดีมีสุข สุขภาพองค์รวมแข็งแรง เศรษฐกิจด้านสุขภาพ ตามคำจำกัดความของ Global Wellness Institute (GWI) นั้นมีขอบข่ายที่กว้างขวางและหลากหลาย ประกอบด้วยกิจกรรมผู้บริโภคและการใช้จ่ายหลายประเภท รวมถึงผลิตภัณฑ์ บริการการเดินทางและเทคโนโลยี เศรษฐกิจด้านสุขภาพของทุกประเทศมีเอกลักษณ์เฉพาะตัว มีความแตกต่างในเชิงบริบทและองค์ประกอบ ขึ้นอยู่กับพัฒนาการและการเปลี่ยนผ่านตามช่วงเวลา วัฒนธรรม สภาพเศรษฐกิจและสังคมและนโยบายของรัฐบาล
โปรแกรมท่องเที่ยว SRT Royal Blossom ทริปแรก 17 สิงหาคม 2567
รูปที่ 2 ความสนใจซื้อสินค้าและบริการด้านสุขภาพในแต่ละช่วงวัย
กลุ่ม Baby Boomer ที่มีอายุตั้งแต่ 60 ปีขึ้นไป ยังเป็นกลุ่มที่มีนำหนักมากที่สุด 65% รองลงมาคือกลุ่ม Gen X วัย 45-59 ปี อยู่ที่ 63% ตามมาด้วย กลุ่ม Gen Y (อายุ 24-44 ปี) และ Gen Z อายุน้อยกว่า 24 ปี ที่นำหนักเท่ากันคือ 60%
มูลนิธิรามาธิบดีฯ ยึดมั่นในบทบาท สะพานแห่งการให้
คุณพรรณสิรี คุณากรไพบูลย์ศิริ ผู้จัดการมูลนิธิรามาธิบดีฯ กล่าวว่า “มูลนิธิรามาธิบดีฯ ยึดมั่นในบทบาท ‘สะพานแห่งการให้’ มาตลอดระยะเวลากว่าครึ่งศตวรรษเพื่อเป็นที่พึ่งให้คนไทยเสมอมา ในปีนี้ มูลนิธิฯ สานต่อโครงการ Rama X Gamers “Fun For Fund”+1 ซีซั่น 2 #RamaFunforFund ผ่านความร่วมมือกับสโมสรอีสปอร์ต ‘Bacon Time’ #RamaxBaconTime ตั้งเป้าหมายประชาสัมพันธ์การระดมทุนโครงการก่อสร้างอาคารแห่งใหม่ของโรงพยาบาลรามาธิบดี ไปยังกลุ่มคนเจเนอเรชั่นใหม่โดยเฉพาะกลุ่มแฟนเกมที่ชื่นชอบในกีฬาอีสปอร์ต พร้อมส่งเสริมให้ผู้เล่นได้สนุกสนานและเพลิดเพลินไปพร้อมกับนักกีฬา ควบคู่ไปกับการสร้างเสริมความรอบรู้เรื่องสุขภาพ (Health Literacy) และสุขภาวะที่ดีทางจิตใจ ซึ่งสอดคล้องไปกับพันธกิจหลักของมูลนิธิรามาธิบดีฯ ในการสร้างสุขภาพที่ดีของคนไทยอย่างยั่งยืน โดย การระดมทุนโครงการอาคารโรงพยาบาลรามาธิบดีและย่านนวัตกรรมโยธี มีวัตถุประสงค์เพื่อเพิ่มพื้นที่ เพิ่มโอกาสให้ประชาชนไทยทุกคนเข้าถึงการรักษาพยาบาลที่มีคุณภาพได้อย่างทัดเทียมและทั่วถึง”
ทีมเบคอนไทม์ ยินดีที่จะร่วมเป็นผู้นำขับเคลื่อนโครงการ


คุณสุรศักดิ์ วินิจ Co-Founder และ Vice Present of Talents บริษัท Ampverse Digital กล่าวว่า “ทีมเบคอนไทม์ สโมสรกีฬาอีสปอร์ตชั้นนำของประเทศไทย ภายใต้สังกัดแอมป์เวิร์ส (Ampverse) บริษัทผู้ให้บริการด้านธุรกิจเกมมิงและอีสปอร์ตครบวงจรระดับโลก เบคอนไทม์ #ทีมBaconTime มีความยินดีที่จะร่วมเป็นผู้นำของอุตสาหกรรมเกมที่ขับเคลื่อนโครงการ Rama X Gamers “Fun For Fund”+1 ซีซั่น 2 #RamaxBaconTime เพื่อระดมทุนสร้างโรงพยาบาลรามาธิบดีแห่งใหม่ โดยส่งนักกีฬาอีสปอร์ตแบบฟลูทีมมาจัดสตรีมการกุศล ‘BAC Clinic #เบคคลินิก’ ร่วมกับบุคลากรทางการแพทย์จากโรงพยาบาลรามาธิบดี เพื่อมอบความสุขและความสนุกให้แฟนคลับได้อิ่มอกอิ่มใจและอิ่มบุญไปพร้อมกัน ตอกย้ำจุดยืนของเบคอนไทม์กับการเป็นแบรนด์อีสปอร์ต-เอนเตอร์เทนเมนต์ ที่ไม่เพียงนำเสนอเนื้อหา การแข่งขันกีฬาอีสปอร์ตเท่านั้น แต่นำเสนอเนื้อหาที่เต็มเปี่ยมไปด้วยความสนุกสนานและสร้างสรรค์ พร้อมเปิดโอกาสให้แฟนคลับเข้ามามีส่วนร่วมในการสร้างสิ่งที่ดีสู่สังคมร่วมกัน เบคอนไทม์จะยังคงมุ่งมั่นในการส่งเสริมคอมมูนิตี้เกมให้เป็นพื้นที่ของการเล่นเกมที่เต็มไปด้วยความสนุกสนาน ความสร้างสรรค์ และเป็นพื้นที่ที่ปลอดภัยสำหรับทุกคน”
ชุดตรวจ THC แบบพกพา ใช้ง่าย วัดค่าสารอันตรายได้ในระดับนาโน
ดร.สุดเขตกล่าวว่าแม้โครงสร้างทางเคมีของ CBD และ THC ในกัญชาจะมีความคล้ายคลึงกัน อีกทั้งกัญชาแต่ละสายพันธุ์มีปริมาณสาร CBD และ THC ไม่เท่ากัน แต่สตริปเทสเคมีไฟฟ้าสำหรับตรวจประเมินปริมาณของ THC ก็มีความไวในการตรวจวัดค่า THC ได้อย่างแม่นยำ และใกล้เคียงกับการตรวจวิเคราะห์โดยใช้เทคนิค High Performance Liquid Chromatography (HPLC) ซึ่งเป็นวิธีมาตรฐานที่ใช้ในการตรวจปริมาณ THC
“ชุดตรวจนี้ทำหน้าที่เป็นเซนเซอร์ที่ตรวจวัดปริมาณ THC ในอาหารหรือเครื่องดื่มได้อย่างรวดเร็วและมีความไวในการตรวจ แม้จะมีสาร THC ในปริมาณเพียง 1.3 นาโนกรัมต่อมิลลิลิตร ก็ตรวจเจอได้”
ทั้งนี้ ดร.สุดเขตเผยว่าประสิทธิภาพของชุดตรวจมาจากการบูรณาการสองศาสตร์เข้าด้วยกัน กล่าวคือการตรวจวัดที่รวดเร็วของแถบทดสอบอิมมูโนแอสเสย์แบบการไหลด้านข้าง และการตรวจวัดด้วยความไวสูงของเทคนิคทางเคมีไฟฟ้า
“ชุดตรวจใช้หลักการเดียวกับ ATK ตรวจโควิด-19 จึงใช้ง่าย ไม่ยุ่งยาก เพียงเรานำสารสกัดจากกัญชาในอาหารหรือเครื่องดื่มไปผสมกับน้ำยาที่มีความจำเพาะกับสตริปเทส แล้วหยดลงบนสตริปเทส เพียงแค่ 2 หยด รอประมาณ 6 นาทีก็สามารถอ่านผลได้จากสมาร์ทโฟนที่เชื่อมต่อกับอุปกรณ์”
ชุดตรวจแถบทดสอบเคมีไฟฟ้าเป็นอุปกรณ์ที่สะดวกต่อการพกพา ใช้ง่าย ราคาไม่แพง (ชิ้นละ 20 บาท) ดร.สุดเขตหวังให้เป็นหนึ่งทางเลือกในการตรวจประเมินปริมาณ THC นอกห้องปฏิบัติการ ซึ่งจะเหมาะกับผู้ใช้งานในกลุ่มที่มีความจำเป็นต้องใช้ผลิตภัณฑ์กัญชา และเจ้าหน้าที่ที่มีหน้าที่ตรวจสอบและควบคุมปริมาณ THC ในผลิตภัณฑ์ที่มีส่วนผสมของกัญชา
“สตริปเทสเคมีไฟฟ้านี้จะเป็นตัวช่วยกรองให้ประชาชนไม่บริโภคสิ่งที่เป็นโทษเข้าไปโดยไม่ได้ตั้งใจ ควบคุมปริมาณกัญชาให้อยู่ในเกณฑ์ที่ไม่เป็นโทษต่อร่างกาย นอกจากนี้ยังช่วยลดความเสี่ยงการเกิดอุบัติเหตุหรืออันตรายต่อร่างกายจากสาร THC อีกด้วย” ดร.สุดเขตกล่าว
นวัตกรรมนี้ได้รับรางวัลผลงานประดิษฐ์คิดค้น ประจำปี 2567 จากสำนักงานคณะกรรมการวิจัยแห่งชาติ (วช.)
ท่าทีฝ่ายต่างๆ
ทันทีที่ข่าวการสั่งดำเนินการยุติการนำกัญชากลับสู่ยาเสพติด และผลักดันพ.ร.บ.กัญชา กัญชง ของนายกฯ ได้เป็นที่รับรู้ ฝ่ายต่างๆ มีการเคลื่อนไหวในทิศทางของตนทันที
แถลงการณ์เครือข่ายเขียนอนาคตกัญชาไทย
- เมื่อสถานะกัญชาถูกกำหนดว่าให้ควบคุมโดยกฎหมายเฉพาะในระดับพระราชบัญญัติโดยไม่กลับไปเป็นยาเสพติดอีก หัวใจสำคัญนับจากนี้คือการสร้างกฎหมายแม่บทการควบคุมกัญชาเชิงระบบในประเทศไทย จึงขอให้ชาวกัญชาและประชาชนโปรดติดตามกระบวนการเดินหน้าจัดทำ พ.ร.บ.กัญชานับตั้งแต่นี้เพราะกฎหมายฉบับนี้จะมีความสำคัญในการกำหนดโครงสร้างเชิงระบบเกี่ยวกับการควบคุมกัญชาในประเทศไทย
- เครือข่ายเขียนอนาคตกัญชาไทยยังคงขับเคลื่อนตามแผนปฏิบัติการจนกว่าพระราชบัญญัติกัญชาจะได้รับความเห็นชอบจากรัฐสภาและบังคับใช้
- ขอบคุณนายกรัฐมนตรีและผู้รับผิดชอบทุกฝ่ายที่เห็นแก่ข้อเท็จจริงรอบด้านสั่งให้การควบคุมกัญชากระทำโดยการใช้กฎหมายพระราชบัญญัติ อีกทั้งขอบคุณพรรคภูมิใจไทยที่ยืนหยัดปกป้องนโยบายกัญชาเพื่อให้การควบคุมกัญชาเป็นไปภายใต้กฎหมายพระราชบัญญัติกัญชา
ความสำเร็จคราวนี้ย่อมเกิดขึ้นจากจิ๊กซอทุกตัวที่เชื่อมต่อกันจนเป็นพลัง ทั้งที่แสดงตนและไม่แสดงตน ทั้งภาควิชาการ ภาคการเมือง ภาคประชาชน ถือเป็นการปฏิบัติภารกิจร่วมกันในการกำหนดนโยบายกัญชาที่ถูกต้องให้กับประเทศไทย
ปานเทพ พัวพงษ์พันธ์
ระบุว่า มหาวิทยาลัยรังสิต ขอสนับสนุนแนวทางดังกล่าวพร้อมเปิดเวทีให้ภาคประชาชนในการระดมรวบรวมหลักฐานในข้อเท็จจริง และร่วมงานวิชาการเพื่อทำให้ความจริงปรากฏต่อสังคมไทย และพร้อมจะมีส่วนร่วมในการขับเคลื่อนเพื่อนำความจริงไปสู่การกำหนดนโยบายกัญชาและช่วยชี้นำหนทางที่ถูกต้องต่อไปในสังคมไทย
รมช. สันติ เปิดโครงการพาหมอไปหาประชาชน เฉลิมพระเกียรติฯ ในพื้นที่ห่างไกล อ.ชนแดน จ.เพชรบูรณ์
29 กรกฎาคม 2567. ที่ โรงเรียนดงขุยวิทยาคม ตำบลดงขุย อำเภอชนแดน จังหวัดเพชรบูรณ์ นายสันติ พร้อมพัฒน์ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข เป็นประธานเปิด “โครงการพาหมอไปหาประชาชนเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567” จังหวัดเพชรบูรณ์ โดยมี นพ.โสภณ เอี่ยมศิริถาวร ผู้ตรวจราชการกระทรวงสาธารณสุข เขตสุขภาพที่ 2 นพ.สุรศักดิ์ จันทร์เกตุ ผู้อำนวยการโรงพยาบาลชนแดน ผู้บริหารกระทรวงสาธารณสุขและประชาชน เข้าร่วมงาน
นายสันติกล่าวว่า เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา พระบาทสมเด็จพระเจ้าอยู่หัว 6 รอบ 28 กรกฎาคม 2567 บุคลากรกระทรวงสาธารณสุขได้พร้อมใจจัดโครงการพาหมอหาประชาชนเฉลิมพระเกียรติฯ พร้อมกันในทุกเขตสุขภาพ โดยเขตสุขภาพที่ 2 จัดที่ อ.ชนแดน ซึ่งอยู่ไกลจากตัวเมืองประมาณ 60 กิโลเมตร ประชาชนที่จำเป็นต้องเดินทางไปรับบริการยังโรงพยาบาลเพชรบูรณ์จะมีความลำบากและมีภาระค่าใช้จ่าย ทั้งนี้ จากข้อมูลการรับบริการของโรงพยาบาลชนแดน พบว่าผู้ป่วยในพื้นที่มีปัญหาสุขภาพที่สำคัญ คือ โรคไม่ติดต่อเรื้อรัง เช่น โรคหัวใจ ไตวายเรื้อรัง โรคปอดอุดกั้นเรื้อรัง ซึ่งเกิดจากพฤติกรรมเสี่ยง และยังพบวัณโรคปอด โรคในสังคมผู้สูงอายุ เช่น โรคทางตา โรคหูคอจมูก โรคทางกระดูกและข้อ โรคทางอายุรกรรม โรคทางช่องปาก มะเร็งชนิดต่างๆซึ่งหากได้รับการตรวจคัดกรองรักษาอย่างทันท่วงทีจะสามารถป้องกันภาวะแทรกซ้อน ลดความรุนแรงของโรคและลดโอกาสเสียชีวิตได้
“ประชาชนในพื้นที่ห่างไกล การเดินทางไปโรงพยาบาลใช้เวลานาน เช่นที่ อำเภอชนแดน และอำเภอวังโป่ง การมีทักษะในการช่วยชีวิตขั้นพื้นฐานเป็นเรื่องสำคัญมาก โครงการพาหมอไปหาประชาชนฯ ในวันนี้ จึงมีการจัดอบรมการช่วยชีวิตขั้นพื้นฐานให้กับประชาชนที่มารับบริการด้วย เพื่อให้สามารถช่วยชีวิตผู้ป่วยได้อย่างทันท่วงทีในกรณีที่เกิดเหตุเจ็บป่วยฉุกเฉิน เช่น ถูกไฟฟ้าซ๊อต จมน้ำ หมดสติขณะเล่นกีฬา สำลักอาหารอุดกั้นหลอดลม เป็นต้น”นายสันติกล่าว
ส่วนต่างๆ ของการวิจัยประเมินผลนโยบายการถ่ายโอน
การวิจัยประเมินผลนโยบายการถ่ายโอนโรงพยาบาลส่งเสริมสุขภาพตำบลไปสู่องค์การบริหารส่วนจังหวัด ประกอบด้วยงานวิจัยหลายส่วน ดังนี้
ปฏิกิริยาจากนักกีฬาและองค์กรที่เกี่ยวข้อง
หนังสารคดีซีรีส์ เกี่ยวกับการแพทย์สุขภาพ บน Netflix
ชุดสารคดี Docuseries บน Netflix จะซีเรียสจริงจังในระดับหนึ่ง ด้วยเป็นเนื้อหาที่ต้องอ้างอิงข้อมูลที่แม่นยำ ถูกต้องและไม่บิดเบือนผิดพลาด เนื้อหาจะมีตั้งแต่ แนวทางการดูแลสุขภาพ เรื่องการแพทย์สาธารณสุขที่เป็นประโยชน์ บางส่วนเป็นแนวสืบสวนเจาะลึกล้วงลับข้อมูลที่ปกปิดออกมาเปิดเผย บ้างก็มาแนวตีแผ่กันจัดๆ หนักๆ และในที่นี้เรารวมเอาเรื่องที่เกี่ยวกับ
การกีฬาไว้ด้วย (ด้านล่าง) เรียกว่ามีหลายระดับความเข้มข้นให้เลือกชมตามสไตล์ผู้ชมแต่ละกลุ่มแต่ละระดับกันเลย
- Bad Surgeon Love Under the Knife (2023) เรื่องฉาวๆ เกี่ยวกับการผ่าตัดและแพทย์ ที่ทำการอย่างน่าสงสัยและมีข้อกังขา มีเหยื่อจากหลายเหตุการณ์ การขุดคุ้ยที่ต้องตีแผ่
- Capturing the Killer Nurse (2022) คดีดังสุดสะเทือนขวัญ คนร้ายในฐานะพยาบาลฆ่าคนไข้คนแล้วคนเล่าในโรงพยาบาลและที่บ้านพักคนชราอย่างแนบเนียน กระทั่งความจริงถูกเปิดเผยในที่สุด สร้างจากหนังสือ The Good Nurse ปี 2013
- Bad Vegan Fame , Fraud , Fugitives (2022) เปิดโปงความร้ายของสองเจ้าของร้านอาหารมังสวิรัติที่ร่วมกับก่อเรื่องสุดฉาวเกินคาดคิด
- Diagnosis
- You Are What You Eat : A Twin Experiment (2024) ปฏิบัติการคู่แฝดเพื่อทดสอบ ทดลอง เกี่ยวกับอาหาร การออกกำลังกาย และอื่นๆ เพื่อดูว่า มีผลต่อชิวิตอย่างไร
- Salt Fat Acid Heat (2018) เซฟคนดัง ซามิน นอสรัท พาทัวกินในหลายประเทศ ภายใต้คำนิยามเกี่ยวกับสี่รสชาติตามชื่อเรื่อง
- Live to 100 Secrets of the Blue Zones (2023) อยากอยู่ยืนยาวถึงร้อยปี ก็ต้องมีเคล็ดลับสิ
- Big Vape The Rise and Fall of JUUL (2023) การเกิดขึ้น รุ่งเรือง และดับไป ของยี่ห้อบุหรี่ไฟฟ้าชื่อดัง
- Hack Your Health (2024) ระบบย่อยอาหารของมนุษย์สำคัญมาก แต่เรารู้จัดดีแค่ไหน ห่วงใยมันเพียงพอหรือยัง
- Poisoned The Dirty Truth About Your Food (2023) ที่แท้แล้ว อาหารที่เรากิน มันสะอาดเหรอ คำถามที่สารคดีเรื่องนี้พยายามตอบ
- The Game Changers (2018) การควบคุมจำกัดอาหารนั้น แค่ไหนถึงจะเหมาะสม ฟังคำตอบจากนักวิทยาศาสตร์ นักโภชนาการ แพทย์ นักกีฬาระดับโลกในหลายสาขา มาแบ่งประสบการณ์ให้ฟัง
- What The Health (2017) ความเชื่อมโยงระหว่างการอดอาหารกับโรคภัย และเงินทุนมหาศาลที่ทุ่มลงไปในธุรกิจสุขภาพ เวชภัณฑ์ และอาหาร เพื่ออะไร
- The Mind Explain (2021) เคยสงสัยมั๊ย อะไรอยู่ในหัวสมองเรา อะไรทำให้เราคิด วิตก ฝันเฟื่อง กังวล ดีใจเริงร่า สมองทำให้เราเกิดรู้สึกอาการเหล่านั้นได้อย่างไร และทำไม
- Human The World Within (2021) สำรวจความอัศจรรย์น่าทึ่งที่ร่างกายมนุษย์ถูกสร้างขึ้นมาด้วยพลังจากธรรมชาติ ศักยภาพที่เราไม่รู้และไม่คาดคิด
- Street Food Asia (2019) สตรีทฟูดในเอเซีย เลื่องชื่อมานาน หลายประเทศมีของดีของเด็ดต่างกันไป ตามไปดู
- Rotten (2019) เจาะลึกลงไปยังห่วงโซ่การผลิตอาหารในโลกปัจจุบัน กว่าจะมาเป็นอาหารบนจานของเรา ต้องผ่านอะไรมาบ้าง
- Street Food USA (2022) สตรีทฟูดอเมริกา หน้าตาเป็นอย่างไร ตามไปดู
- CowSpiracy (2014) แฉว่าการทำปศุสัตว์ส่งผลกระทบต่อโลกอย่างไร
- Unwind Your Mind (2021) ปรับใจ ปรับกาย สร้างสมาธิ เพื่อสู่ความโล่งเบาสบาย
- How To Change Your Mind (2022) เรื่องราวจากหนังสือขายดีของ New York Times ปี 2018
- Headspace Guide to Sleep (2021)
- Cooked (2016)
- Chef’s Table (2019)
- The Surgeon’s Cut (2020) เรื่องราวประสบการณ์หมอผ่าตัดระดับเทพกับภารกิจช่วยเหลือคนไข้
- Extreme (2016)
- Convergence Courage in a Crisis (2021)
- End Game (2018)
- Heroin(e) (2017)
- A Lion in the House (2006)
แรงผลักดันการนำเทคโนโลยีมาใช้ในองค์กร (Tech adoption)
การนำเทคโนโลยีมาใช้ในองค์กรมักถูกอธิบายตามกราฟเส้นโค้งรูปตัว S (ด้านบน) ที่อธิบายระยะพัฒนาการตามรูปแบบต่อไปนี้: เริ่มจาก 1) นวัตกรรมทางเทคนิคและการสำรวจ (ความเป็นไปได้) (Frontier innovation) ไปสู่ 2) การทดลองกับเทคโนโลยี (Experimenting) ไปยัง 3) การทดลองเบื้องต้นในธุรกิจ (Piloting) หากไปได้ก็จะกระโดดเข้าสู่โหมด 4) การขยายธุรกิจ (Scaling) และ ในที่สุด 5) การนำไปใช้อย่างเต็มรูปแบบ (Fully scaled) แบบแผนกระบวนการนี้เห็นได้ชัดจากการสำรวจในปีนี้เกี่ยวกับการนำเทคโนโลยี 15 ประเภทมาใช้ในองค์กร ระดับการนำเทคโนโลยีมาใช้แตกต่างกันไปในแต่ละอุตสาหกรรมและขนาดบริษัท เช่นเดียวกับความคืบหน้าที่รับรู้ได้ในการนำไปใช้
เราพบว่าเทคโนโลยีในช่วงเริ่มต้นของนวัตกรรมและการทดลองของเส้นโค้งรูปตัว S นั้นอยู่ในระดับแนวหน้าของความก้าวหน้า (leading edge of progress) เช่น เทคโนโลยีควอนตัมและหุ่นยนต์ หรือมีความเกี่ยวข้องกับกลุ่มอุตสาหกรรมเฉพาะ เช่น วิศวกรรมชีวภาพและอวกาศ
ปัจจัยที่อาจส่งผลต่อการนำเทคโนโลยีเหล่านี้มาใช้ ได้แก่ ต้นทุนที่สูง แอปพลิเคชันเฉพาะทาง และการสร้างสมดุลระหว่างการลงทุนในเทคโนโลยีที่หลากหลายกับการมุ่งเน้นไปที่เทคโนโลยีเพียงไม่กี่อย่างที่อาจให้ข้อได้เปรียบที่สำคัญสำหรับผู้บุกเบิก
เมื่อเทคโนโลยีเริ่มได้รับการยอมรับและก้าวข้ามการทดลอง อัตราการนำไปใช้ก็เริ่มเร่งตัวขึ้น และบริษัทต่างๆ ก็ลงทุนมากขึ้นในการนำร่องและขยายขนาด เราเห็นการเปลี่ยนแปลงนี้ในเทรนด์ต่างๆ เช่น การพัฒนาซอฟต์แวร์รุ่นถัดไปและการใช้ไฟฟ้า ความก้าวหน้าอย่างรวดเร็วของ Gen AI รุ่นก่อนๆ นั้นนำหน้าเทรนด์ที่วิเคราะห์ไว้ โดยผู้ตอบแบบสอบถามประมาณหนึ่งในสี่รายงานด้วยตนเองว่าพวกเขากำลังขยายขนาดการใช้งาน เทคโนโลยีอิ่มตัวแล้ว (mature technology) เช่น คลาวด์และเอจคอมพิวติ้ง และการเชื่อมต่อขั้นสูง ยังคงถูกนำไปใช้เพิ่มขึ้นเรื่อยๆ และทำหน้าที่เป็นตัวช่วยสำหรับการนำเทคโนโลยีใหม่ๆ มาใช้ด้วยเช่นกัน
นายก Kick Off 30 บาทรักษาทุกที่ กรุงเทพมหานคร 26 สิงหาคม นี้
นายสมศักดิ์ เปิดเผยว่า ในวันจันทร์ ที่ 26 สิงหาคม 2567 จะมีการ Kick Off โครงการ 30 บาทรักษาทุกที่ กรุงเทพมหานคร “30 บาทรักษาทุกที่ เพื่อคนไทยสุขภาพดีถ้วนหน้า” โดยจะเป็นจังหวัดนำร่องที่ 46 ตามนโยบาย 30 บาทรักษาทุกที่ หลังได้รับความร่วมมือจากทุกหน่วยงานที่เกี่ยวข้อง ทำให้เกิดความพร้อมที่จะให้บริการในพื้นที่กรุงเทพฯได้
กิจกรรมการ Kick Off จัดที่ลานอเนกประสงค์ ชั้น 2 ศูนย์ราชการเฉลิมพระเกียรติฯ อาคารบี ถ.แจ้งวัฒนะ กทม. โดยได้รับเกียรติจาก นายเศรษฐา ทวีสิน นายกรัฐมนตรี เป็นประธาน พร้อมด้วย นางสาวแพทองธาร ชินวัตร รองประธานคณะกรรมการพัฒนาระบบสุขภาพแห่งชาติ และ นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร พร้อมจะมีการเปิดตัวตราสัญลักษณ์ (Logo) “30 บาทรักษาทุกที่” เพื่อใช้ในการรับรองคุณภาพและการเข้าร่วมโครงการฯ ของหน่วยบริการทั่วประเทศ รวมถึงการสื่อสารประชาสัมพันธ์ในการเข้ารับบริการของประชาชน
“การ Kick Off จะเป็นการตอกย้ำการเดินหน้านโยบายนี้ของรัฐบาล โดยท่านนายกรัฐมนตรี นอกจากจะมอบป้ายและโล่ตราสัญลักษณ์ 30 บาทให้ผู้แทน 7 หน่วยนวัตกรรมบริการแล้ว ยังจะปาฐกถาพิเศษ “30 บาทรักษาทุกที่ เพื่อคนไทยสุขภาพดีถ้วนหน้า” ขณะที่ นางสาวแพทองธาร จะกล่าวปาฐกถา “จาก 30 บาทรักษาทุกโรค สู่ 30 บาทรักษาทุกที่” เพื่อให้เห็นการผลักดันโครงการที่ทำมาอย่างต่อเนื่อง โดยทั้งหมดนี้ เป็นการสะท้อนถึงความมุ่งมั่นและตั้งใจของรัฐบาล ในการดูแลสุขภาพประชาชนไทย พร้อมเพิ่มความสะดวกให้กับประชาชน ในการเข้าถึงสิทธิและบริการภายใต้ระบบหลักประกันสุขภาพแห่งชาติ หรือ บัตรทอง 30 บาท” รมว.สาธารณสุข กล่าว
ขณะที่ นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวว่า ในส่วน สปสช. ที่ร่วมขับเคลื่อนนโยบายฯในพื้นที่ กทม. ที่ผ่านมา ได้ดำเนินการภายใต้บทบาทและหน้าที่ของ สปสช. ทั้งการเพิ่มหน่วยบริการนวัตกรรม ให้ครอบคลุมทั่วถึงทุกพื้นที่ การจัดหาหน่วยบริการทุติยภูมิเพิ่มเติม เพื่อลดความแออัดหน่วยบริการตติยภูมิ ยกระดับ Contact Center 1330 เพื่ออำนวยความสะดวกและช่วยแก้ปัญหาต่างๆให้กับประชาชนและหน่วยบริการ พร้อมเชื่อมโยงข้อมูลสุขภาพของหน่วยบริการในพื้นที่ กทม. เพิ่มเติม นอกจากนี้ ยังได้ขับเคลื่อนระบบบริการสร้างเสริมสุขภาพและป้องกันโรคเชิงรุก รวมถึงการจัดระบบสนับสนุนเพิ่มเติม เพื่อเพิ่มประสิทธิภาพการดำเนินงาน
เลขาธิการ สปสช. กล่าวต่อว่า ส่วนการเข้ารับบริการของประชาชน นอกจากการเข้ารับบริการที่หน่วยบริการปฐมภูมิ/ประจำตามสิทธิของท่านแล้ว ยังสามารถไปรับบริการที่หน่วยบริการนวัตกรรม 7 แห่ง ประมาณ 1,500 แห่ง โดยสังเกตตราสัญลักษณ์ที่จะมีการเปิดตัว ได้แก่ ร้านยาคุณภาพ คลินิกเวชกรรมชุมชนอบอุ่น คลินิกทันตกรรมชุมชนอบอุ่น คลินิกพยาบาลชุมชนอบอุ่น คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น คลินิกกายภาพบำบัดชุมชนอบอุ่น และคลินิกแพทย์แผนไทยชุมชนอบอุ่น นอกจากนี้ ยังมีการเพิ่มเติมบริการที่ช่วยอำนวยความสะดวก และลดความแออัดได้อีก ซึ่งจะเปิดตัวในวันที่ 26 สิงหาคม นี้ เช่น บริการการแพทย์ทางไกล เจาะเลือดที่บ้าน รถรับส่งผู้ป่วย รถทันตกรรมเคลื่อนที่ และตู้เทเลเมดดูแลสุขภาพประชาชนในชุมชน เป็นต้น ทั้งนี้ในส่วนของโรงพยาบาลรัฐสังกัดต่างๆนั้น จะเป็นหน่วยบริการรับส่งต่อผู้ป่วย
สรุปรายงานการปฏิบัติงาน 2550-2566
| ปี |
ผู้บริจาค/สะสม |
ผู้ป่วยรอ/สะสม
*จำนวนสะสมไม่ใช่จำนวนรวม แต่หักจำนวนผู้เสียชีวิตระหว่างรอ |
ผู้ได้รับการปลูกถ่าย |
แสดงความจำนงบริจาค |
| 2550 |
93
สะสม 932 |
811
สะสม 2,241 |
201 |
38,127 |
| 2551 |
81
สะสม 1,025 |
1,349
สะสม 2,392 |
201 |
36,740 |
| 2552 |
87
สะสม 1,106 |
659
สะสม 2,469 |
219 |
42,065 |
| 2553 |
87
สะสม 1,193 |
777
สะสม 2,717 |
215 |
41,232 |
| 2554 |
113
สะสม 1,280 |
970
สะสม 3,166 |
276 |
45,938 |
| 2555 |
136
สะสม 1,393 |
1,176
สะสม 3,156 |
334 |
47,182 |
| 2556 |
158
สะสม 1,529 |
1,231
สะสม 4,081 |
376 |
40,608 |
| 2557 |
188
สะสม 1,687 |
1,254
สะสม 4,431 |
432 |
38,571 |
| 2558 |
206
สะสม 1,875 |
1,405
สะสม 5,018 |
463 |
46,640 |
| 2559 |
220
สะสม 2,081 |
1,612
สะสม 5,581 |
512 |
55,881 |
| 2560 |
294
สะสม 2,375 |
1,471
สะสม 5,851 |
670 |
89,636 |
| 2561 |
261
สะสม 2,636 |
สะสม 6,401 |
585 |
100,014 |
| 2562 |
301
สะสม 2,937 |
สะสม 6,417 |
685 |
109,392 |
| 2563 |
315
สะสม 3,252 |
สะสม 5,735 |
697 (+12) |
126,400
สะสม 1,277,173 |
| 2564 |
190
สะสม 3,442 |
สะสม 5,817 |
429 (-268) |
135,619
สะสม 1,412,792 |
| 2565 |
303
สะสม 3,745 |
สะสม 6,279 (+1,273) |
677 (+248) |
105,743 (-29,876)
สะสม 1,518,535 |
| 2566 |
446
สะสม 4,191 |
สะสม 6,634 (+1,981) |
936 (+259) |
127,934 (+22,191)
สะสม 1,646,469 |
References
อยากรับน้องหมาน้องแมวไปเลี้ยง เชิญ
เปลี่ยนจากประกันสังคมมาเป็นสิทธิบัตรทองหรือบัตร 30 บาท รู้สู้โรค ThaiPBS
ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ ให้ข้อมูลเกี่ยวกับ เปลี่ยนจากประกันสังคมมาเป็นสิทธิบัตรทองหรือบัตร 30 บาท ในรายการ
รู้สู้โรค ThaiPBS 1 กันยายน 2566 (2023) เนื้อหาสำคัญ
- สิทธิการรักษาพยาบาลหลักๆ ของคนไทยมี 3 สิทธิ พื้นฐานคือ บัตรทอง ทุกคนมีแต่เกิด หากเป็นข้าราชการ จะได้สิทธิราชการ (ครอบครัว พ่อแม่ ได้สิทธิด้วย) หากเป็นคนทำงาน มีนายจ้าง จะอยู่ในสิทธิประกันสังคม (เป็นสิทธิเฉพาะตัว) ต้องส่งเงินสมทบ
- สิทธิบัตรทอง มี 2 กลุ่มคือสิทธิการรักษาพยาบาล และสิทธิสร้างเสริมสุขภาพป้องกันโรค (ฉีดวัคซีน เคลือบหลุมร่องฟัน ตรวจคัดกรองมะเร็ง ตรวจยืนมะเร็งเต้านม ฯลฯ) คนไทยใช้สิทธิเหล่านี้ได้
- ประกันสังคม ต้องจ่ายเงินสมทบ ดูแล 2 ส่วนคือ รักษาพยาบาล และดูแลจากการทำงาน (ว่างงาน ออกจากงาน อุบัติเหตุ เกษียณ ตาย)
- สิทธิบัตรทอง กับ สิทธิประกันสังคม ใช้ร่วมกันไม่ได้ ตามกฏหมาย
- ประกันสังคม ม.33 หากลาออก (หรือว่างงาน) แล้วไม่ส่งสมทบใน 6 เดือน จะปรับเป็นสิทธิบัตรทองอัตโนมัติ [คลิป]
- หากเดิมทีประกันสังคม โรงพยาบาลเดิมอยู่ แล้ว เปลี่ยนสิทธิเป็นบัตรทอง จะคงโรงพยาบาลเดิมได้หรือไม่ คำตอบคือ ได้ เว้นว่า หากมีเหตุฉุกเฉินระหว่างนั้น ต้องใช้โรงพยาบาลอื่น อาจต้องเปลี่ยนโรงพยาบาล แต่กระนั้น ก็สามารถเปลี่ยนใหม่ในภายหลังได้เช่นกัน (ปีละ 4 ครั้ง)
- การใช้สิทธิรักษาทำอย่างไร ให้ไปคลินิกใกล้บ้าน หากรุนแรงจะมีระบบส่งตัว
- บัตรทองหากเจ็บป่วยฉุกเฉิน ใช้สิทธิฉุกเฉินได้ หากรุนแรงถึงชีวิต มีระบบ UCEP ดูแลผู้ป่วยวิกฤตสีแดง เข้าได้ทุกโรงพยาบาล
- เช็คสิทธิได้ที่ สปสช. 1330 หรือ Line @nhso (เช็คได้ทุกสิทธิ)
พรรณสิรี คุณากรไพบูลย์ศิริ ผู้จัดการมูลนิธิรามาธิบดีฯ กล่าวว่า “แต่ละปีจะมีการมอบทุนการศึกษาประจำปีให้แก่นักศึกษารามาธิบดี มูลนิธิรามาธิบดีฯ จึงได้เปิดระดมทุน โครงการทุนการศึกษารามาธิบดี ให้ผู้มีจิตศรัทธาได้ร่วมบริจาคเพื่อเติมเต็มความฝัน ส่งต่อแรงบันดาลใจให้กับน้อง ๆ เนื่องด้วยสภาพเศรษฐกิจในปัจจุบันที่ไม่สู้ดีนัก ทำให้คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี และมูลนิธิฯ อยากช่วยแบ่งเบาภาระให้กับครอบครัวน้อง ๆ ผ่านเงินบริจาคของผู้มีจิตศรัทธา ด้วยการสนับสนุนทุนการศึกษาให้กับนักศึกษารามาธิบดีทั้ง 4 หลักสูตร ถือเป็นการร่วมส่งต่อโอกาสให้กับนักศึกษาทางการแพทย์ให้เติบโตเป็นบุคลากรทางการแพทย์ที่จะมาช่วยชีวิตพวกเราทุกคน”
ช่องทางบริจาคอวัยวะ ศูนย์รับบริจาคอวัยวะ สภากาชาดไทย
สำหรับผู้ที่สนใจร่วมบริจาคอวัยวะสามารถบริจาคผ่านช่องทางได้ดังนี้
บริจาคออนไลน์ :
บริจาคด้วยตนเอง :
- ศูนย์รับบริจาคอวัยวะ สภากาชาดไทย อาคารเทิดพระเกียรติสมเด็จพระญาณสังวร (เจริญ สุวฑฺฒโน) ชั้น 5 ถนนอังรีดูนังต์ ปทุมวัน กรุงเทพฯ
- บริจาคผ่านเครือข่ายฯ อาทิสำนักเหล่ากาชาดจังหวัด หรือ สำนักงานกิ่งกาชาด ทุกจังหวัด, โรงพยาบาลประจำจังหวัดในสังกัด กระทรวงสาธารณสุข และโรงพยาบาลในสังกัดสถาบันอุดมศึกษาของรัฐ, สำนักงานเขต เทศบาล และเมืองพัทยา ที่ให้บริการทำบัตรประจำตัวประชาชน
- กรมการขนส่งทางบก โดยผู้แสดงความจำนงบริจาคอวัยวะแล้วสามารถขอเพิ่มสัญลักษณ์ ของสภากาชาดไทย “กากบาทแดงบนพื้นสีขาว” และเพิ่มข้อความ “บริจาคอวัยวะ” ให้แสดงบนหน้าใบอนุญาตขับรถ
และในเร็วๆ นี้ยังสามารถแสดงความจำนงผ่าน แอปพลิเคชัน“หมอพร้อม” ได้ด้วย
ส่วนการบริจาคร่างกาย สามารถแสดงความจำนงได้ที่
anatomydonate.kcmh.or.th
โรคฝีดาษวานร (Monkeypox) ทั่วโลกปี 2022
ย้อนเวลามองการระบาดโรคฝีดาษวานรปี 2022 (2565)
คลินิกตรวจโรค จันทร์ - ศุกร์ 08.00 - 12.00 น. (นอกเวลาราชการ จันทร์ - ศุกร์ 16.00 - 20.00 น.)
คลินิกตรวจโรค
วัน - เวลาทำการ
ในเวลาราชการ จันทร์ - ศุกร์ 08.00 - 12.00 น.
นอกเวลาราชการ จันทร์ - ศุกร์ 16.00 - 20.00 น.
นอกเวลาราชการ เสาร์ - อาทิตย์ 08.00 - 12.00 น.
บริการเจาะเลือดชุดใหญ่ (ตามนัด) ทุกวันอังคาร และ พฤหัสบดี 08.00 - 10.00 น.
โทรศัพท์ 0 - 2842331 ต่อ 100
ขอบเขตการให้บริการ
- คัดกรองความเสี่ยงด้านสุขภาพในผู้รับบริการทุกกลุ่มวัย ผู้ประกอบอาหาร ผู้สมัครงาน
- ตรวจ วินิจฉัยปัญหาความรุนแรงของอาการป่วยในผู้ป่วยโรคทั่วไป โรคเรื้อรัง โรคระบาดตามฤดูกาล
- ให้การรักษาผู้ป่วยตามมาตรฐานแบบองค์รวมอย่างเวชศาสตร์ครอบครัว
- บริการให้คำปรึกษาด้านสุขภาพ นัดตรวจเจาะเลือดตามข้อบ่งชี้ของโรค
- ประสานส่งต่อโรงพยาบาล ตรวจ รักษา วินิจฉัยเพิ่มเติม กรณีอาการซับซ้อน ฉุกเฉิน
- ออกใบรับรองตรวจสุขภาพ สมัครงาน สมัครเรียน ออกใบรับรองความพิการ
โปรแกรมดอกเตอร์อีส (Doctor Ease)
ดอกเตอร์อีส เป็นโปรแกรมบริหารคลินิกออนไลน์ครบวงจร มีฟังก์ชั่นมากหลายในการจัดการคลินิค ได้แก่ เวชระเบียน Paperless , ระบบตารางแพทย์และคนไข้ ระบบสร้างคอร์สและแพ็กเกจ ระบบรับชำระเงินผ่านช่องทางต่างๆ (QR PromptPay, บัตรเครดิต) ระบบCRM บริหารความสัมพันธ์ลูกค้า เช่น เก็บข้อมูลลูกค้า สะสมแต้ม และจัดการสมาชิก เป็นต้น และระบบบริหารสินค้าคงคลังพร้อมรายงานสรุป
จุดเด่นอื่นๆ ของ ดอกเตอร์อีส อาทิ การรองรับคลินิกหลายประเภทนอกเหนือจากคลินิกความงาม เช่น คลินิกเวชกรรม, ทันตกรรม, สหคลินิก, หูคอจมูก, กายภาพบำบัด, แผนไทย, จีน, สูตินารีเวช, ดูแลผู้สูงอายุ, ชะลอวัย, ฯลฯ ดอกเตอร์อีส มีเวอร์ชั่นสำหรับใช้งานบนไอแพด มี OPD paperless ใช้งานได้เหมือนแฟ้มระเบียนจริง ช่วยคนทำงานสะดวกทั้งแพทย์พยาบาลและบุคลากร มีระบบฟังก์ชั่นให้คนไข้ทำนัดได้เองตลอด 24 ชั่วโมง มีระบบแนบสลิปโอนเงินและตรวจสอบอัตโนมัติ แถมด้วยการพ่วงระบบวิเคราะห์เจาะลึกด้านการตลาด (marketing insights) ที่ช่วยนำทางธุรกิจสู่ลูกค้าใหม่ๆ ได้
ดอกเตอร์อีส มีบริการให้ชมเดโม่ก่อนตัดสินใจได้
ข้อมูลเพิ่มเติม โทร 0924696254
ข้อมูลอุทยานแห่งชาติ
พิธีเปิดยิ่งใหญ่ Thailand wellness & Healthcare Expo 2024
16 สิงหาคม 2567 เปิดฉากแล้ว สำหรับงาน Thailand wellness & Healthcare Expo 2024 จัดเต็มกับทัพสินค้า บริการ นวัตกรรมเพื่อสุขภาพความงาม เวลเนส สปา และท่องเที่ยวครบวงจร รวมกว่า 170 แบรนด์ พร้อมด้วยเจรจาจับคู่ธุรกิจทั้งในและต่างประเทศ กิจกรรมร่วมสนุกลุ้นรับของรางวัลมากมาย รวมทั้งเสวนาให้ความรู้จากผู้เชี่ยวชาญอัพเดทเทรนด์สุขภาพและเทคโนโลยีการแพทย์สมัยใหม่ตลอดงาน โดยงานเริ่มวันนี้วันแรกและจัดต่อเนื่องไปจนถึงวันที่ 18 สิงหาคมนี้ ณ ฮอลล์ 99 ไบเทค บางนา คาดเม็ดเงินสะพัดในงานกว่า 100 ล้านบาท
นายวุฒิไกร ลีวีระพันธุ์ ปลัดกระทรวงพาณิชย์ กล่าวว่า “Wellness & Healthcare เป็นเทรนด์ระดับโลก และตลาดเติบโตอย่างต่อเนื่อง สำหรับประเทศไทยนั้น ข้อมูลจากกรมพัฒนาธุรกิจการค้า ณ วันที่ 30 มิถุนายนที่ผ่านมาระบุว่า มีนิติบุคคลด้านบริการสุขภาพและความงามที่ดำเนินกิจการจำนวนกว่า 28,000 ราย มีมูลค่าทุนจดทะเบียนรวมกว่า 348 ล้านบาท โดยในปี 2566 มีรายได้รวมกว่า 1.093 ล้านล้านบาท กระทรวงพาณิชย์เองได้มีส่วนร่วมในการส่งเสริมขีดความสามารถของในกลุ่ม Wellness & Healthcare ภายในงานนี้ด้วย
โดยกรมพัฒนาธุรกิจการค้าได้ร่วมออกบูธพาวิลเลี่ยน DBD Wellness พร้อมกิจกรรมร่วมสนุกแจกของรางวัลมากมาย และยังเชิญ Influencer ด้านสุขภาพมาร่วมสร้างสีสันอีกด้วย ส่วนกรมการค้าต่างประเทศได้คัดผู้ประกอบการเกษตรสุขภาพมาร่วมออกบูธภายใต้แนวคิด “Agri Plus: Innovated and Inspired for Better Life” พร้อมกิจกรรมเสวนาให้ความรู้โดยผู้เชี่ยวชาญด้านการตลาด และผู้ประกอบการสินค้าเกษตรนวัตกรรมไทยที่ประสบความสำเร็จในตลาดโลกมาร่วมแลกเปลี่ยนประสบการณ์ รวมทั้งยังมีพิธีลงนามความร่วมมือ ว่าด้วยการส่งเสริมการเพิ่มขีดความสามารถในการแข่งขันสินค้าเกษตรนวัตกรรมร่วมกับ 7 หน่วยงานภาคีเครือข่าย ประกอบด้วย กรมการค้าต่างประเทศ กรมพัฒนาธุรกิจการค้ากรมเจรจาการค้าระหว่างประเทศ กรมทรัพย์สินทางปัญญา กรมส่งเสริมการค้าระหว่างประเทศ หน่วยบริหารและจัดการทุนด้านการเพิ่มความสามารถในการแข่งขันของประเทศ (บพข.) สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ และ สำนักงานนวัตกรรมแห่งชาติ (องค์การมหาชน)
ศาสตราจารย์เกียรติคุณ ดร.นายแพทย์สมอาจ วงศ์ขมทอง ประธาน บริษัท กิจการร่วมค้า พีเอ็มจี-ไทยพัฒนา จำกัด กล่าวถึงวัตถุประสงค์ของการจัดงานในครั้งนี้ว่า “งาน Thailand wellness & Healthcare Expo 2024 จัดโดยบริษัท กิจการร่วมค้า พีเอ็มจี-ไทยพัฒนา จำกัด ร่วมกับหน่วยงานพันธมิตร ได้แก่ สำนักงานส่งเสริมการจัดประชุมและนิทรรศการ กรมสนับสนุนการบริการสุขภาพ กรมพัฒนาธุรกิจการค้า กรมการค้าต่างประเทศ กรมส่งเสริมอุตสาหกรรม การท่องเที่ยวแห่งประเทศไทย สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ สำนักงานการวิจัยแห่งชาติ สำนักงานพัฒนาการวิจัยการเกษตร (องค์การมหาชน) บริษัท ไบโอแอคทีฟ จำกัด เครือสหพัฒน์ บรรษัทประกันสินเชื่ออุตสาหกรรมขนาดย่อม และธนาคารเพื่อการส่งออกและนำเข้าแห่งประเทศไทย ร่วมสร้างเวทีให้ผู้ประกอบการไทยได้แสดงศักยภาพในธุรกิจด้านสุขภาพ รวมถึงนำเสนอนวัตกรรมบริการสุขภาพและการแพทย์ที่ล้ำสมัย เพื่อสนับสนุนนโยบายรัฐบาลในการผลักดันให้ประเทศไทยเป็นศูนย์กลางการบริการสุขภาพและการแพทย์ระดับโลก ตลอดจนสร้างความตระหนักรู้ด้านการดูแลสุขภาพเพื่อให้คนไทยมีสุขภาพแข็งแรงและคุณภาพชีวิตที่ดียิ่งขึ้น
นางสาวณรินณ์ทิพ วิริยะบัณฑิตกุล ประธานเจ้าหน้าที่บริหาร บริษัท กิจการร่วมค้า พีเอ็มจี-ไทยพัฒนา จำกัด ให้รายละเอียดการจัดงานว่า “ การจัดงานในครั้งนี้รวบรวมสินค้า บริการ นวัตกรรมสุขภาพ เวลเนส สปา และท่องเที่ยวครบวงจร กว่า 170 แบรนด์มาจัดโปรโมชั่นลดราคาพิเศษกลางปี ประกอบด้วย 5 กลุ่มธุรกิจ ได้แก่ WELLNESS, HEALTHCARE & BEAUTY, SILVER CARE BUSINESS, DIGITAL HEALTH, MEDICAL INDUSTRY และ BANKER & INVESTOR พิเศษงานนี้ยังมีกิจกรรมการมอบรางวัล Thai World Class Spa และนวดไทยพรีเมี่ยม ปี 2566 โดยอธิบดีกรมสนับสนุนการบริการสุขภาพ มีผู้ประกอบการที่ได้รับรางวัลจำนวน 139 ราย”
นอกจากนี้การท่องเที่ยวแห่งประเทศไทย ยังได้นำกลุ่มผู้ประกอบการสปา เวลเนส โรงแรม และท่องเที่ยว มาจัดแคมเปญลดพิเศษ กรมสนับสนุนบริการสุขภาพก็ยังคัดเลือกผู้ประกอบการสปาระดับพรีเมี่ยมและโรงพยาบาลชั้นนำมาออกบูธแบบจัดเต็มอีกด้วย ที่สำคัญงานนี้ยังโชว์ความล้ำสมัยด้านเทคโนโลยีสุขภาพ เช่น เทคโนโลยีถอดรหัสดีเอ็นเอเพื่อไขปัญหาสุขภาพ และนวัตกรรมทางการแพทย์มากมายจากไบโอแอคทีฟมาจัดแสดงให้ชม รวมทั้งเครือสหพัฒน์ยังขนสินค้าอุปโภคบริโภคมากมายจัดแคมเปญลดราคาพิเศษในงานอีกด้วย ที่สำคัญงานนี้ยังมีเสวนาอัพเดทเทรนด์สุขภาพและเวลเนสอย่างต่อเนื่องตลอดทั้งงาน
อีกหนึ่งกิจกรรมเด่นในงานคือเจรจาจับคู่ธุรกิจทั้งในและต่างประเทศ ที่ได้รับการสนับสนุนโดย สำนักงานส่งเสริมการจัดประชุมและนิทรรศการ ประกอบด้วย โมเดิร์นเทรด, แพลตฟอร์มค้าออนไลน์, ร้านค้าปลีก, ทำเลการค้า และ ผู้ค้าจากต่างประเทศ อาทิ กลุ่มประเทศตะวันออกกลาง อินเดีย คาซัคสถาน จีน กัมพูชา เวียดนาม เมียนมาร์ และกลุ่มประเทศแอฟริกา ร่วมด้วยคณะนักธุรกิจด้านการท่องเที่ยวเชิงสุขภาพ และ สปาจากตะวันออกกลาง และ รัสเซีย โดยการท่องเที่ยวแห่งประเทศไทย และ คณะนักธุรกิจอินเดีย โดย สถานกงสุลใหญ่ ณ เมืองมุมไบ ที่เดินทางมาเยี่ยมชมธุรกิจและร่วมกิจกรรมภายในงานนี้ด้วย คาดว่างานนี้จะสร้างเม็ดเงินสะพัดรวมกว่า 100 ล้านบาท” คุณณรินท์ทิพกล่าวทิ้งท้าย
รู้จัก หุ่นยนต์ช่วยผ่าตัด Davinci โดยละเอียด
หุ่นยนต์ช่วยผ่าตัด Davinci เครื่องแรกของกระทรวงสาธารณสุข โดยกรมการแพทย์ ตั้งอยู่ที่ ศูนย์ผ่าตัดด้วยหุ่นยนต์ งานศัลยศาสตร์ระบบทางเดินปัสสาวะ โรงพยาบาลราชวิถี ควบคุมปฏิบัติการโดย ผศ.(พิเศษ) นพ.ธเนศ ไทยดำรงค์ นายแพทย์เชี่ยวชาญ งานศัลยศาสตร์ระบบทางเดินปัสสาวะ
รายชื่อจุดจอดรถ Motorlance จำนวน 30 แห่งแรก
ตรวจสอบรายชื่อและตำแหน่งจุดจอดรถ Motorlance จำนวน 30 แห่ง
บน HealthMap
1 จุดจอดรถ Motorlance สำนักงานเขตบางแค จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
2 จุดจอดรถ Motorlance สำนักงานเขตทวีวัฒนา จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
3 จุดจอดรถ Motorlance โรงพยาบาลพระมงคลเทพมุนี สำนักงานเขตภาษีเจริญ จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
4 จุดจอดรถ Motorlance สำนักงานเขตตลิ่งชัน จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
5 จุดจอดรถ Motorlance โรงพยาบาลราชพิพัฒน์ จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
6 จุดจอดรถ Motorlance โรงพยาบาลตากสิน จำนวน 4 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
7 จุดจอดรถ Motorlance โรงพยาบาลกลาง จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
8 จุดจอดรถ Motorlance โรงพยาบาลรามาธิบดี จำนวน 2 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
9 จุดจอดรถ Motorlance โรงพยาบาลราชวิถี จำนวน 2 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
10 จุดจอดรถ Motorlance โรงพยาบาลเลิดสิน จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
วันป้องกันโรคพิษสุนัขบ้าโลก หรือ World Rabies Day
วันป้องกันโรคพิษสุนัขบ้าโลก หรือ World Rabies Day ได้ถือกำเนิดขึ้นโดยองค์กร Global Alliance for Rabies Control (GARC) กำหนดให้วันที่ 28 กันยายนของทุกปี เพื่อเป็นการระลึกถึงนายหลุยส์ ปาสเตอร์ ชาวฝรั่งเศส ผู้คิดค้นวัคซีนป้องกันโรคพิษสุนัขบ้า เป็นวันสำคัญในการสร้างความเข้าใจถึงอันตรายของโรคพิษสุนัขบ้าและความสำคัญของการให้วัคซีนป้องกันโรคพิษสุนัขบ้า ซึ่งในปีพ.ศ.2567 นี้ ทางสถานเสาวภา สภากาชาดไทย เป็นเจ้าภาพจัดงาน
กิจกรรมที่ผ่านมา
ที่ผ่านมาแต่ละปี มีกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ดังนี้
หมายเหตุ : การจัดกิจกรรมงานวันป้องกันโรคพิษสุนัขบ้าโลกในประเทศไทย โดยเจ้าภาพ 6 องค์กร หมุนเวียนกันไปนั้น เป็นงานหลักที่จัดในกรุงเทพ ในขณะเดียวกัน ในระดับภูมิภาคและท้องถิ่น ก็มีการจัดงานร่วมด้วยในหลายพื้นที่ โดยองค์กรส่วนท้องถิ่น หรือปศุสัตว์จังหวัด/อำเภอเป็นเจ้าภาพ
กิจกรรมดีๆ เพื่อสังคม โรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์
เศรษฐกิจไทยในไตรมาสที่สองของปี 2567
การอุปโภคบริโภคภาคเอกชน ขยายตัวร้อยละ 4.0 ชะลอลงจากร้อยละ 6.9 ในไตรมาสก่อน โดยการใช้จ่ายหมวดบริการขยายตัวร้อยละ 6.0 ชะลอลงจากร้อยละ 13.7 ในไตรมาสก่อนหน้า ตามการชะลอลงของการใช้จ่ายในกลุ่มโรงแรมและภัตตาคาร กลุ่มบริการทางการเงิน การบริการด้านการศึกษา และกลุ่มสถานบันเทิงอื่น ๆ
การใช้จ่ายหมวดสินค้าไม่คงทนขยายตัวร้อยละ 3.6 ชะลอลงจากร้อยละ 4.7 ตามการชะลอลงของการใช้จ่ายกลุ่มอาหารและเครื่องดื่มไม่มีแอลกอฮอล์และการใช้จ่ายกลุ่มเครื่องดื่มที่มีแอลกอฮอล์
ส่วนการใช้จ่ายหมวดสินค้าคงทนลดลงร้อยละ 6.5 ต่อเนื่องจากการลดลงร้อยละ 6.7 ในไตรมาสก่อนหน้า ตามการลดลงของการใช้จ่าย เพื่อซื้อยานพาหนะซึ่งส่วนหนึ่งเป็นผลจากการตัดสินใจชะลอการซื้อรถยนต์ไฟฟ้า ในช่วงที่การแข่งขันด้านราคามีความรุนแรงมากขึ้น
การใช้จ่ายในหมวดสินค้ากึ่งคงทนขยายตัวร้อยละ 4.3 ตามการขยายตัวของการใช้จ่ายเพื่อซื้อเฟอร์นิเจอร์และการใช้จ่ายกลุ่มเสื้อผ้าและรองเท้า สำหรับดัชนีความเชื่อมั่นของผู้บริโภคเกี่ยวกับภาวะเศรษฐกิจโดยรวมในไตรมาสนี้ อยู่ที่ระดับ 54.3 ลดลงจากระดับ 57.2 ในไตรมาสก่อนหน้า
การใช้จ่ายเพื่อการอุปโภคของรัฐบาลขยายตัวร้อยละ 0.3 ปรับตัวดีขึ้นจากการลดลงร้อยละ 2.1 ในไตรมาสก่อนหน้า โดยรายจ่ายการโอนเพื่อสวัสดิการสังคมที่ไม่เป็นตัวเงินสำหรับสินค้าและบริการในระบบตลาดเพิ่มขึ้น ร้อยละ 6.9 เทียบกับการลดลงร้อยละ 10.7 ในไตรมาสก่อนหน้า และค่าตอบแทนแรงงาน (เงินเดือน ค่าบำเหน็จบำนาญ) ขยายตัวร้อยละ 0.8 ขณะที่ค่าซื้อสินค้าและบริการลดลงร้อยละ 3.8 ส าหรับอัตราการเบิกจ่ายงบประมาณรายจ่ายประจำในไตรมาสนี้อยู่ที่ร้อยละ 27.7 (สูงกว่า อัตราเบิกจ่ายร้อยละ 19.2 ในไตรมาสก่อนหน้า และร้อยละ 24.3 ในไตรมาสเดียวกันของปีก่อน)
รวมครึ่งแรกของปี 2567 การอุปโภคบริโภคภาคเอกชนขยายตัวร้อยละ 5.4 ขณะที่การใช้จ่ายเพื่อการอุปโภคของรัฐบาลลดลงร้อยละ 0.9
การลงทุนรวม ลดลงต่อเนื่องเป็นไตรมาสที่สามร้อยละ 6.2 โดยการลงทุนภาคเอกชนลดลงร้อยละ 6.8 ตามการลดลงของการลงทุนในหมวดเครื่องจักรเครื่องมือร้อยละ 8.1 สอดคล้องกับการลดลงของการลงทุนในหมวดยานพาหนะร้อยละ 22.5 และการชะลอตัวของปริมาณการนำเข้า สินค้าทุน ส่วนการลงทุนหมวดก่อสร้างลดลงร้อยละ 2.2 ตามการลดลงของการก่อสร้างที่อยู่อาศัย และการก่อสร้างอาคารพาณิชย์เป็นสำคัญ ขณะที่การก่อสร้างโรงงานขยายตัวต่อเนื่อง
การลงทุนภาครัฐ ลดลงร้อยละ 4.3 เทียบกับการลดลงร้อยละ 27.7 ในไตรมาสก่อนหน้า โดยการลงทุนของรัฐบาลลดลงร้อยละ 12.8 ขณะที่การลงทุนของรัฐวิสาหกิจขยายตัวร้อยละ 10.1 สำหรับอัตราการเบิกจ่ายงบประมาณรายจ่ายลงทุนในไตรมาสนี้อยู่ที่ ร้อยละ 24.0 (สูงกว่าอัตราเบิกจ่ายร้อยละ 5.7 ในไตรมาสก่อนหน้า และร้อยละ 19.0 ในไตรมาสเดียวกันของปีก่อน)
รวมครึ่งแรกของปี 2567 การลงทุนรวมลดลงร้อยละ 5.1 โดยการลงทุนภาคเอกชนลดลงร้อยละ 0.9 และการลงทุนภาครัฐลดลงร้อยละ 16.7
การส่งออกสินค้า มีมูลค่า 73,315 ล้านดอลลาร์ สรอ. เพิ่มขึ้นร้อยละ 4.5 ปรับตัวดีขึ้นจากการลดลงร้อยละ 1.1 ในไตรมาสก่อนหน้า โดยปริมาณส่งออกเพิ่มขึ้นร้อยละ 2.7 ตามการขยายตัวของปริมาณ การส่งออกสินค้าอุตสาหกรรมและสินค้าเกษตร ขณะที่ราคาส่งออกเพิ่มขึ้น ร้อยละ 1.7
กลุ่มสินค้าที่มีมูลค่าส่งออกเพิ่มขึ้น เช่น ข้าว (ร้อยละ 53.0) ยางพารา (ร้อยละ 37.3) คอมพิวเตอร์ (ร้อยละ 147.9) อุปกรณ์สื่อสาร โทรคมนาคม (ร้อยละ 58.5) ยานยนต์ (ร้อยละ 3.3) และชิ้นส่วนและอุปกรณ์คอมพิวเตอร์ (ร้อยละ 22.5) เป็นต้น
กลุ่มสินค้าที่มีมูลค่าส่งออกลดลง เช่น ทุเรียน (ลดลงร้อยละ 1.0) น้ำตาล (ลดลงร้อยละ 26.3) ผลิตภัณฑ์ยาง (ลดลงร้อยละ 10.5) แผงวงจรรวมและชิ้นส่วน (ลดลงร้อยละ 14.5) ชิ้นส่วนและอุปกรณ์ยานยนต์ (ลดลงร้อยละ 0.6) และชิ้นส่วนเครื่องใช้ไฟฟ้า (ลดลงร้อยละ 12.8) เป็นต้น
รวมครึ่งแรกของปี 2567 การส่งออกสินค้ามีมูลค่า 142,908 ล้านดอลลาร์ สรอ. เพิ่มขึ้นร้อยละ 1.7 โดยปริมาณและราคาส่งออกเพิ่มขึ้น ร้อยละ 0.2 และร้อยละ 1.5 ตามลำดับ
สาขาเกษตรกรรม การป่าไม้ และการประมง ลดลงร้อยละ 1.1 ต่อเนื่องจากการลดลงร้อยละ 2.7 ในไตรมาสก่อนหน้า โดยผลผลิต สินค้าเกษตรลดลงร้อยละ 1.7 ต่อเนื่องจากการลดลงร้อยละ 2.9 ในไตรมาสก่อนหน้า ตามการลดลงของผลผลิตสินค้าสำคัญ ๆ อาทิ ข้าวเปลือก (ลดลงร้อยละ 13.0) กลุ่มไม้ผล (ลดลงร้อยละ 8.0) มันสำปะหลัง (ลดลงร้อยละ 8.4) กุ้งขาวแวนนาไม (ลดลงร้อยละ 17.6) และยางพารา (ลดลงร้อยละ 0.6) ตามลำดับ ในขณะที่ผลผลิตสินค้าเกษตรที่ปรับตัวเพิ่มขึ้น อาทิ อ้อย (ร้อยละ 41.9) ปาล์มน้ ามัน (ร้อยละ 40.8) ข้าวโพดเลี้ยงสัตว์ (ร้อยละ 11.1) โคเนื้อ (ร้อยละ 4.8) และไก่เนื้อ (ร้อยละ 1.1) ตามลำดับ ส่วนราคาสินค้าเกษตรเพิ่มขึ้นร้อยละ 10.7 เร่งขึ้นจากร้อยละ 5.5 ตามการเพิ่มขึ้นของดัชนีราคาสินค้าเกษตรสำคัญ ๆ เช่น ยางพารา (ร้อยละ 68.6) กลุ่มผลไม้ (ร้อยละ 22.6) ข้าวเปลือก (ร้อยละ 8.4) อ้อย (ร้อยละ 28.6) และไข่ไก่คละ (ร้อยละ 3.5) ขณะที่ดัชนีราคาสินค้าเกษตรส าคัญบางรายการปรับตัวลดลง เช่น สุกร (ลดลงร้อยละ 16.9) มันส าปะหลัง (ลดลงร้อยละ 21.9) และปาล์มน้ำมัน (ลดลงร้อยละ 18.4) ตามลำดับ การเพิ่มขึ้นของดัชนีราคาสินค้าเกษตร ส่งผลให้รายได้เกษตรกรโดยรวมเพิ่มขึ้นต่อเนื่อง เป็นไตรมาสที่ 3 ร้อยละ 8.9 รวมครึ่งแรกของปี 2567 สาขาเกษตรกรรม การป่าไม้ และการประมงลดลงร้อยละ 1.9มาทำฟัน ที่คลินิกนอกเวลาราชการ โรงพยาบาลทันตกรรมใช้สิทธิการรักษา ต่างๆได้
มาทำฟัน ที่คลินิกนอกเวลาราชการ โรงพยาบาลทันตกรรมใช้สิทธิการรักษา ต่างๆได้ ดังนี้
1. สวัสดิการรักษาพยาบาลข้าราชการ (เบิกจ่ายตรง)
2. สิทธิ อปท. (สิทธิสวัสดิการรักษาทันตกรรมของพนักงานส่วนท้องถิ่น)
3. สิทธิประกันสังคม
คลินิกพิเศษนอกเวลาราชการ รพ. ทันตกรรม ม.นเรศวรเปิดให้บริการตรวจรักษาทางทันตกรรมในวันจันทร์-ศุกร์ 17.00-20.00 น. และเสาร์-อาทิตย์ 9:00-15:30 น. ค่ะ
การนัดหมายจองคิวรักษากับอาจารย์ทันตแพทย์ (คลินิกพิเศษ) อาจต้องมีการติดต่อเพื่อคัดกรองตามเกณฑ์คัดกรองของโรงพยาบาลในเบื้องต้นนะคะ คนไข้สามารถโทรสอบถาม คัดกรองสอบถามคิวการรักษากับอาจารย์ทันตแพทย์โดย
055966866 ด้วยตัวท่านเองเพื่อสอบถามจองคิวจะสะดวกและรวดเร็วที่สุดค่ะ (**ติดต่อ 055967481 ได้ในช่วงจันทร์-ศุกร์ 17.00-20.00 น. และเสาร์-อาทิตย์ 9:00-15:30 น.)
Ing Shinawatra on Facebook
ดิฉันจะทำงานร่วมกับทีมทำงานทุกภาคส่วน เพื่อผลักดันนโยบายต่างๆ ให้สำเร็จลุล่วง ขอให้ทุกท่านติดตามการแถลงนโยบายที่จับต้องได้ ทำได้จริง ภายในเดือนกันยายนนี้แน่นอน
ในฐานะนายกรัฐมนตรีคนที่ 31 ของประเทศไทย..
ในฐานะแม่ ลูก และ เพื่อน
ขอสัญญาว่าจะใช้เรี่ยวแรงและพลังงานทั้งหมดที่มี เพื่อส่งให้ทุกตารางนิ้วบนแผ่นดินไทย กลายเป็นพื้นที่แห่งโอกาส ให้คนไทยได้กล้าฝัน กล้าสร้างสรรค์ และกล้ากำหนดอนาคตของตัวเองค่ะ
Ing Shinawatra 18 สิงหาคม 2567
IP Fair 2024 มหกรรมทรัพย์สินทางปัญญา
IP Fair 2024 มหกรรมทรัพย์สินทางปัญญา เสวนาเปิดจักรวาลแห่ง ความคิดสร้างสรรค์และนวัตกรรม ที่จะสร้างรายได้ สร้างมูลค่าและแรงบันดาลใจให้กับธุรกิจของคุณ พร้อมทั้งบริการให้คำปรึกษาด้านทรัพย์สินทางปัญญาครบวงจร จัดระหว่างวันที่ 16 - 18 สิงหาคม 2567 ณ สามย่านมิตรทาวน์ฮอลล์
ข้อมูล mpox โดย ดร.อนันต์ จงแก้ววัฒนา
ดร.อนันต์ จงแก้ววัฒนา ผู้อำนวยการกลุ่มวิจัยนวัตกรรมสุขภาพสัตว์และการจัดการ ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (Biotec) ให้ข้อมูลเกี่ยวกับโรค mpox มาอย่างต่อเนื่อง นับตั้งแต่ที่ WHO ประกาศให้ mpox หรือ ฝีดาษลิง เป็นโรคระบาดในภาวะฉุกเฉินที่น่ากังวล ผ่านเพจ
Anan Jongkaewwattana
15 สิงหาคม 2024 WHO เพิ่งประกาศให้ mpox หรือ ฝีดาษลิง เป็นโรคระบาดในภาวะฉุกเฉินที่น่ากังวล( Public health emergency of international concern) จากการแพร่กระจายของเชื้อที่รวดเร็วกว่าเดิมมากในทวีปแอฟริกาทำให้เชื่อได้ว่าเชื้อไวรัสที่ระบาดอยู่ในขณะนี้มีศักยภาพในการแพร่ไปสู่มนุษย์ได้ดีขึ้น พูดง่ายๆคือเชื้ออาจเปลี่ยนแปลงไปติดคนง่ายขึ้น จำเป็นต้องเฝ้าระวังอย่างใกล้ชิด
นอกจากนี้ mpox ที่ระบาดตอนนี้ไม่จำกัดไปที่สายพันธุ์ที่หลุดออกมานอกทวีปแล้วกระจายไปหลายประเทศ รวมถึงประเทศไทยเมื่อ 2 ปีก่อน แต่รวมถึงสายพันธุ์รุนแรง (Clade1) ที่เมื่อก่อนพบแต่ใน DRC หรือ คองโก แต่ตอนนี้พบแพร่ออกไปยังหลายประเทศเพื่อนบ้านแล้ว Clade1 mpox มีความรุนแรงสูงกว่า โดยเฉพาะผู้ป่วยที่เป็นเด็ก พบอัตราเสียชีวิตสูงกว่า Clade 2 ที่พบกระจายตัวเช่นกัน
ถึงตอนนี้เชื้อยังระบาดหนักในทวีปแอฟริกาแต่บทเรียนเมื่อ 2 ปีก่อนบอกว่า การหลุดรอดของเชื้อออกมาส่วนอื่นของโลกไม่ยากนัก ยิ่งจำนวนเคสมีเยอะ ระยะฟักตัวนาน เชื้ออาจติดมาจากนักท่องเที่ยวโดยไม่รู้ตัว และ ออกมานอกทวีปแอฟริกาได้ WHO จึงออกคำเตือนว่า mpox ไม่ไกลตัวอย่างที่คิด และ รอบนี้อาจน่ากังวลกว่าเดิม
ป้องกันไว้ดีกว่าแก้ไขครับ ดูทรงแล้วอาจพบเคสใหม่นอกแอฟริกาอีกไม่นาน
16 สิงหาคม 2024 ไวรัสฝีดาษลิง หรือ mpox Clade I เป็นสายพันธุ์ที่รุนแรงกว่า Clade II ที่ระบาดอยู่ในช่วงสองปีก่อนในหลายประเทศนอกแอฟริกา แต่ที่เป็นประเด็นร้อนคือ Clade I ซึ่งมีพื้นที่จำกัดอยู่แต่ในประเทศคองโก (DRC) พบการแพร่กระจายไปในหลายประเทศเพื่อนบ้าน ความกังวลคือ ไวรัสอาจมีการเปลี่ยนแปลงไปติดคน และ แพร่กระจายง่ายขึ้น..
ที่สำคัญไวรัส Clade I นี้จะออกมานอกแอฟริกาได้
ซึ่งเป็นไปตามคาด ประเทศสวีเดนเป็นที่แรกที่ประกาศพบผู้ป่วย mpox Clade I ในประเทศ เป็นคนแรกนอกทวีปแอฟริกา...ข่าวนี้สร้างความ panic พอสมควรทีเดียว แต่เอาจริงๆ บทเรียนจากการระบาดของ Clade II เมื่อ 2 ปี ก่อน บอกว่ามันคงเกิดขึ้นไม่เร็วก็ช้า แต่การรับมือต้องไว และ มีประสิทธิภาพครับ
โรงพยาบาลชั้นนำมีเครื่อง PET CT Scan พร้อมบริการ
โรงพยาบาลระดับนำทั้งโรงพยาบาลรัฐ และ โรงพยาบาลเอกชน ปัจจุบันมีเครื่อง PET CT Scan นี้ ให้บริการ ทำให้การตรวจวินิจฉัยทำได้อย่างมีประสิทธิภาพ ผู้ป่วยมีทางเลือกมากขึ้นที่จะเลือกรับบริการได้สะดวกและเหมาะกับตนได้ เช่น เดินทางสะดวก หรือสอดคล้องกับเวลาที่เหมาะสมในการกำหนดตารางการรักษา เป็นต้น แม้ว่าค่าใช้จ่ายจะยังคงสูง และต้องอยู่ภายใต้การกำกับดูแลและสั่งของแพทย์ แต่โดยภาพรวมเป็นความก้าวหน้าในเทคโนโลยีการแพทย์มารับใช้ประชาชนที่ดีมากรูปแบบหนึ่ง บริการคลินิกฝากครรภ์ รายใหม่ รพ.สามโคก
บริการคลินิกฝากครรภ์ รายใหม่ ณ ห้องคลอด อาคารอุบัติเหตุฉุกเฉิน ชั้น 1 เวลา 8.00 -16.00 น. สอบถามโทร 02-199-3791 ต่อ ห้องคลอด 104 แผนกผู้ป่วยนอก ต่อ 104
สิทธิข้าราชการ คลอดเบิกได้จ่ายตรงจากกรมบัญชีกลาง
โรงพยาบาลหริภุญชัยฯ ทำข้อตกลงร่วมกับกรมบัญชีกลาง กระทรวงการคลัง เพื่ออำนวยความสะดวก สำหรับผู้มีสิทธิข้าราชการ , ลูกจ้างประจำของหน่วยงานราชการ, ผู้รับเบี้ยหวัด/บำนาญ หรือบุคคลในครอบครัวของผู้มีสิทธิ ให้มีความสะดวกสบายมากยิ่งขึ้น โดยเฉพาะคุณแม่ตั้งครรภ์ ด้วยการเบิกได้จ่ายตรงจากกรมบัญชีกลาง คลอด ร่วมจ่าย 7,000 บาท, ผ่าคลอด (มีข้อบ่งชี้ทางการแพทย์) ร่วมจ่าย 10,000 บาท หากไม่เข้าเกณฑ์ผ่าคลอด เหมาผ่าคลอด 35,000 บาท
คลอดที่หริภุญชัย ฉลาดได้ทุกคน พร้อมทีมสูติแพทย์และดูแลทารกแรกเกิด โดยกุมารแพทย์ หมอ New Born ดูแล ใส่ใจ ให้คำปรึกษาอย่างใกล้ชิด เริ่มตั้งแต่วันแรกของการฝากครรภ์ พร้อมกับโครงการมหัศจรรย์ 1,000 วัน, จัดห้อง Happy Birthday, สมุดขาว-ดำ กระตุ้นพัฒนาการตั้งแต่ 0-3 เดือน ทั้งหมดนี้เพื่อให้ลูกน้อยแข็งแรง คุณแม่ปลอดภัย ครอบครัวประทับใจ ที่โรงพบาลหริภุญชัยฯ
สอบถามเพิ่มเติมได้ที่แผนกการเงิน โทร 053-581600-4 ต่อ 3203 , 3302
การบริหารกล้ามเนื้อ 6 ส่วน
การบริหารกายเพื่อสร้างความแข็งแรงและทนทานของกล้ามเนื้อ 6 ส่วน โดยทำในช่วงเวลาว่าง ๆ ได้ดังนี้
- บริหารกล้ามเนื้อหัวไหล
หมายเหตุ : น้ำหนักที่เหมาะสม คือน้ำหนักที่ยก 8-12 ครั้ง แล้วรู้สึกเมื่อยล้าและ หมดแรงพอดี ไม่สามารถยกต่อไปได้อีก
- บริหารกล้ามเนื้อสะบัก
- บริหารกล้ามเนื้อแขนส่วนล่าง
- บริหารกล้ามเนื้อลำตัว
- บริหารกล้ามเนื้อสะโพก และกล้ามเนื้อต้นขาด้านหน้า ข้อควรระวัง : ผู้ที่มีอาการปวดเข่า ปวดหลัง อาการหมอนรองกระดูก สันหลังปลิ้น ทับรากประสาท หน้ามืด เวียนศีรษะ สูญเสียการทรงตัวไม่ควรฝึกท่านี้
- บริหารกล้ามเนื้อลำตัว
ราชกิจจานุเบกษา ประกาศกระทรวงสาธารณสุข
ขั้นตอน/เอกสาร Diagnostic tests for Monkeypox LINK
เครื่องมือแพทย์สำหรับวินิจฉัยภายนอกร่างกาย (IVD) ประเภท Diagnostic tests for Monkeypox จัดเป็นเครื่องมือแพทย์ที่ต้องแจ้งรายการละเอียด
กองควบคุมเครื่องมือแพทย์โดยงานเครื่องมือแพทย์วินิจฉัยภายนอกร่างกายได้จัดทำแบบประเมินข้อมูลด้านประสิทธิภาพและความปลอดภัยสำหรับ Diagnostic tests for Monkeypox เพื่ออำนวยความสะดวกให้ผู้ประสงค์ขอขึ้นทะเบียนได้ทราบแนวทางการประเมินเบื้องต้น
อย่างไรก็ตาม ชุดตรวจและน้ำยาที่เกี่ยวข้องกับการวินิจฉัยการติดเชื้อ Monkeypox ยังคงมีข้อจำกัดเชิงวิชาการ นอกจากนี้ชุดตรวจฯดังกล่าวยังไม่ได้ถูกขึ้นทะเบียนเพื่อจำหน่ายเชิงพาณิชย์อย่างแพร่หลาย ดังนั้น ข้อมูลประกอบการพิจารณาอาจมีการปรับปรุงให้มีความเหมาะสมมากขึ้นในภายหลัง
สรุปขั้นตอนการขอแจ้งรายการละเอียด Diagnostic tests for Monkeypox
ภาพความสำเร็จผู้เข้าอบรมรุ่นแรก (ปี 2565-66)


พิธีมอบวุฒิบัตรผู้ผ่านการอบรมโครงการส่งเสริมสุขภาพแบบองค์รวมสำหรับผู้สูงอายุเมืองพัทยา "โรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข" รุ่นที่ 1 โดยมีนายปรเมศวร์ งามพิเชษฐ์ นายกเมืองพัทยา เป็นประธาน จากนั้นเรือตรีปราโมทย์ ทับทิม ปลัดเมืองพัทยา กล่าวรายงานวัตถุประสงค์การจัดกิจกรรมฯ ซึ่งมีนางสาวทิฐิพันธ์ เพ็ชรตระกูล รองนายกเมืองพัทยา พร้อมด้วยเลขานุการนายกเมืองพัทยา ผู้ช่วยเลขานุการนายกเมืองพัทยา รองประธานสภาเมืองพัทยา ผู้ช่วยเลขานุการประธานสภาเมืองพัทยา สมาชิกสภาเมืองพัทยา หัวหน้าส่วนราชการ เข้าร่วมพิธี ณ ห้องประชุมทัพพระยา ศาลาว่าการเมืองพัทยา ด้วยนโยบาย Better Pattaya ด้านการพัฒนาคุณภาพชีวิตผู้สูงวัยเป็น "Smart Senior" และเป็นเมืองต้นแบบด้านการดูแลผู้สูงอายุ สำนักสาธารณสุขและสิ่งแวดล้อม ส่วนส่งเสริมสุขภาพ ฝ่ายส่งเสริมสุขภาพ ได้ดำเนินงาน "โรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข" รุ่นที่ 1 ขึ้น ในหลักสูตรการเรียนการสอน สัปดาห์ละ 1 วัน ในทุกวันอังคาร เริ่มดำเนินการตั้งแต่ 31 ตุลาคม 2565 ถึงปัจจุบัน รวมระยะเวลาประมาณ 5 เดือน และได้รับเกียรติจาก อาจารย์ ดร.จิราวัฒน์ ปรัตถกรกุล สังกัด มหาวิทยาลัยมหิดล ที่มีความเชี่ยวชาญด้านกระบวนการจิตตปัญญาเป็นวิทยากรหลักและร่วมจัดหลักสูตรการเรียนการสอนที่มุ่งเน้นการส่งเสริมสุขภาพผู้สูงอายุ ด้านกาย จิตสังคม และปัญญา รวมถึงในหลักสูตรยังมีกิจกรรมที่ผู้สูงอายุสามารถเลือกได้ ตามความถนัดและความสนใจ อาทิ ศิลปะประดิษฐ์ การออกกำลังกาย ไลน์แดนซ์ ตาราง 9 ช่อง เพื่อฝึกสมองป้องกันสมองเสื่อม รวมถึงได้เปลี่ยนบรรยากาศนอกสถานที่ โดยอบรม ศึกษาดูงาน เส้นทางวิถีวัฒนธรรม ตามแนวปรัชญาเศรษฐกิจพอเพียง ณ ชุมชนตะเคียนเตี้ย ซึ่งมีผู้เข้าร่วมโครงการ จำนวน 96 คน นอกจากนี้ยังได้มอบประกาศให้กับนักเรียนดีเด่นโดยประเมินจากความมุ่งมั่น ตั้งใจในการมาเรียนครบทุกครั้ง จำนวน 14 คน เพื่อเป็นการเชิดชูเกียรติและเป็นขวัญกำลังใจต่อผู้เข้าร่วมโครงการ ซึ่งตลอดระยะเวลาการดำเนินโครงการนี้ พบว่า ผู้สูงอายุ หรือผู้เข้ารับการอบรมให้ความร่วมมือในกิจกรรมของหลักสูตร เป็นอย่างดียิ่ง และต่อเนื่อง สม่ำเสมอเกิดเป็นสังคมผู้สูงอายุ ที่มีความสุขมีความสนุกสนาน กับเพื่อนวัยเดียวกัน เกิดเป็นสังคมแห่งกัลยาณมิตรอย่างแท้จริง [
ภาพข่าวและบรรยากาศ]
อธิบดีกรมควบคุมโรค เน้น ไม่ต้องฉีดทุกคน ฉีดเฉพาะกลุ่มเสี่ยง วัคซีนราคาสูง ไม่อยู่ในชุดสิทธิประโยชน์
นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมควบคุมโรค กล่าวถึงความจำเป็นในการฉีดวัคซีนป้องกันโรคฝีดาษวานร ว่า ขณะนี้ยังไม่มี วัคซีนฝีดาษวานร ในประเทศไทย เพราะยังไม่มีการขออนุญาตจากสำนักงานคณะกรรมการอาหารและยา(อย.) ก่อน ส่วนที่มีการประกาศให้บริการ ถือเป็นกรณีพิเศษเพื่อศึกษา
เมื่อถามว่าวัคซีนป้องกันฝีดาษวานร ขณะนี้ยังไม่ใช่วัคซีนป้องกันโรคฝีดาษวานรโดยตรงใช่หรือไม่ นพ.ธงชัย กล่าวว่า ใช่ แต่ป้องกันได้เหมือนกัน อย่างของกรมควบคุมโรค มีการเตรียมพร้อมกรณีการระบาด แต่ปัจจุบันยังไม่ระบาด โดยวัคซีนที่ใช้เป็น วัคซีนไข้ฝีดาษ ซึ่งป้องกันฝีดาษวานรได้เหมือนกัน ขณะนี้เก็บรักษาอยู่หากมีการระบาดก็พร้อมนำมาทำเป็นวัคซีน ส่วนสายพันธุ์ที่แตกต่างกัน ไม่มีปัญหา สามารถนำมาใช้ได้ สิ่งสำคัญตอนนี้ยังไม่ได้เกิดการระบาดเหมือนโควิด จึงยังไม่ต้องนำมาใช้
“ขณะนี้วัคซีนที่ใช้ป้องกันฝีดาษวานร ต้องบอกว่าไม่ได้อยู่ในชุดสิทธิประโยชน์ จึงต้องจ่ายเอง และค่อนข้างมีราคาสูง ดังนั้น หากไม่ใช่กลุ่มเสี่ยง ที่ต้องมีการสัมผัสใกล้ชิด ก็ขอให้อย่ากังวล อย่างบุคลากรสาธารณสุขด่านหน้า ขณะนี้ก็ยังไม่ต้องใช้วัคซีน ซึ่งไม่ต้องห่วง กรมควบคุมโรค มีระบบเฝ้าระวังติดตามสถานการณ์เพื่อป้องกันการระบาดของโรค พร้อมทั้งประสานข้อมูลกับนานาประเทศตลอด” อธิบดีกรมควบคุมโรค กล่าว [
hfocus]
มาตรการคัดกรอง โรคฝีดาษวานร สำหรับการรับบริจาคโลหิต
สภากาชาดไทย
อธิบายมาตรการคัดกรอง โรคฝีดาษวานร สำหรับการรับบริจาคโลหิต
- ผู้สัมผัสเสี่ยงสูง งดบริจาคชั่วคราว อย่างน้อย 21 วัน
- ผู้ป่วยที่ได้รับการวินิจฉัยว่าติดเชื้อฝีดาษวานร ต้องหายป่วยแล้ว อย่างน้อย 21 วัน นับตั้งแต่วันที่เริ่มมีอาการ ต้องไม่มีอาการต่างๆ รวมทั้งผื่นหลงเหลืออยู่ อย่างน้อย 14 วัน
- ผู้ที่ได้รับวัคซีนป้องกันโรคฝีดาษวานร Jynneos vaccine (Non-replicating vaccine) สามารถบริจาคโลหิตได้ เมื่อหายจากอาการข้างเคียง
การบริจาคดวงตา อวัยวะ และร่างกาย ได้ประโยชน์สูง
เพียงแสดงความจำนงครั้งเดียว บริจาคได้ทั้งดวงตาและอวัยวะ
การบริจาคอวัยวะเป็นการสร้างประโยชน์และสร้างบุญกุศลอันยิ่งใหญ่ ส่งต่อให้ผู้ป่วยที่รอคอยการปลูกถ่ายอวัยวะเพื่อให้มีชีวิตอยู่กับครอบครัวต่อไป
เทศบาลตำบลแหลมฟ้าผ่า LINK
เทศบาลตำบลแหลมฟ้าผ่า
เลขที่ 999 หมู่ 5 ต.แหลมฟ้าผ่า อ.พระสมุทรเจดีย์ จ.สมุทรปราการ 10290
โทรศัพท์ : 02-4537136-37
นายกเทศมนตรี : 02-453-7136-7 ต่อ102
สำนักปลัด : 02-453-7136-7 ต่อ 111,115
กองคลัง : 02-453-7136-7 ต่อ 121,123
กองช่าง : 02-453-7136-7 ต่อ 141,145
กองยุทธศาสตร์ฯ : 02-453-7136-7 ต่อ 161,163
กองการศึกษา : 02-453-7136-7 ต่อ 151
กองสวัสดิการสังคม : 02-453-7136-7 ต่อ 171,173
กองสาธารณสุขฯ : 02-453-7136-7 ต่อ 131,133
ออกกำลังกายยังไง ให้ปลอดภัยขณะตั้งครรภ์
กรมอนามัย กระทรวงสาธารณสุข แนะคุณแม่สายเฟิร์ม ออกกำลังกายเบาๆ วันละนิด ช่วยลดภาวะแทรกซ้อนระหว่างตั้งครรภ์ได้ ลดความเสี่ยงจากการคลอดได้ แต่ยังไงซะ ก็ต้องไม่หนักเกินไปด้วยนะ โดยมี 7 ข้อที่ต้องพึงระหว่างเพื่อให้ปลอดภัยขณะตั้งครรภ์ ดังนี้
- ไม่ออกกำลังกายในที่ร้อนและชื้น โดยเฉพาะช่วง 3 เดือนแรก
- เลี่ยงการออกกำลังกาย แบบเกร็งค้างไว้ หรือกลั้นหายใจ
- อย่าให้ร่างกายขาคน้ำ ระหว่างออกกำลังกาย
- ตั้งครรภ์ 4 เดือน ออกกำลังกายได้ปกติ ตั้งครรภ์ 6-9 เดือน ไม่ควรออกกำลังกายด้วยท่านอนหงาย
- ไม่ควรออกกำลังกายที่เสี่ยง ต่อการบาดเจ็บหรือหกล้ม เช่น วิ่ง ขี่ม้า ดำน้ำ
- ไม่ออกกำลังกายหนัก หรือเหนื่อยเกินไป เช่น ยกน้ำหนัก
- หากออกกำลังกายแล้ว หายใจไม่ทัน เจ็บหน้าอก หน้ามืด ควรหยุดออกกำลังกายทันที และรีบพบสูตินรีแพทย์
บริการตรวจสุขภาพออกใบรับรองแพทย์ โรงพยาบาลสิรินธร กรุงเทพมหานคร
บริการ ตรวจสุขภาพ ใบรับรองแพทย์
- 5 โรคสำหรับสมัครงานหรือทำธุรกรรมต่างๆ
- สมัครเรียน
- ผู้สัมผัสอาหาร (สณ 11)
- ต่อใบขับขี่รถยนต์
- อุปสมบท
- ต่อใบอนุญาตการทำงาน (Work permit)
ตรวจสุขภาพประจำปี
สามารถเข้ารับบริการได้ที่คลินิกตรวจสุขภาพ เปิดให้บริการทุกวันจันทร์ อังคาร และพฤหัสบดี เวลา 08.00 - 12.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์) ณ ห้องตรวจศัลยกรรม เบอร์ 11
สอบถามเพิ่มเติม 02-3286900 ถึง 19 ต่อ 11448 11434
"**หมายเหตุ ผู้รับบริการอายุตั้งแต่ 15 ปีขึ้นไป และใช้สิทธิ์ชำระเงินสด
คลินิกฝากครรภ์ - ศูนย์บริการสาธารณสุข 1 สะพานมอญ
บริการวันจันทร์ 13.00 - 16.00 น.
โทร 02-222-7874 02-226-5897
ให้บริการวันจันทร์ เวลา 13.00 – 16.00 น. ยกเว้นวันหยุดนักขัตฤกษ์
โทรสอบถามเพิ่มเติม 02-2517735 – 37 กด 21 คลินิกฝากครรภ์
การให้บริการ
- ซักประวัติประเมินความเสี่ยงที่อาจต้องส่งต่อโรงพยาบาล
- ตรวจร่างกายทั่วไป ตรวจครรภ์ ตรวจเต้านม ตรวจสุขภาพช่องปาก ประเมินสุขภาพจิต ให้คำปรึกษาก่อนเจาะเลือด
- ตรวจทางห้องปฏิบัติการ เจาะเลือด หญิงตั้งครรภ์ และสามี ในการฝากครรภ์ครั้งแรก หากมีผลเลือดจากสถานฝากครรภ์เดิมครบถ้วนแล้วไม่ต้องเจาะใหม่
- ให้คำแนะนำ ให้สุขศึกษา ตอบข้อซักถาม ส่งเสริมการเลี้ยงลูกด้วยนมแม่
ให้บริการในทุกวันจันทร์ เวลา 13.00 - 15.30 น. ยกเว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์
ติดต่อห้องเวชระเบียน ชั้น 2 (อาคารใหม่ 5 ชั้น) โทร 025870873
เปิดให้บริการ - พบแพทย์ ตรวจครรภ์โดยพยาบาล (โดยใช้เครื่อง fetal heart sound) จ่ายยา Triferdine, Calcium สอนสุขศึกษา ฝากครรภ์แก่หญิงตั้งครรภ์ อายุ 20 - น้อยกว่า 35 ปี ไม่เคยมีประวัติทารกเสียชีวิตในครรภ์ หรือมีประวัติแท้ง คลอดบุตรน้ำหนักน้อยกว่า 2,500 กรัม หรือมากกว่า 4,000 กรัม หรือภาวะผิดปกติต่างๆ
หมายเหตุ กรณีผู้ป่วยใหม่ต้องกรองข้อมูลส่วนบุคคลเพื่อทำเวชระเบียน
คลินิกฝากครรภ์ - ศูนย์บริการสาธารณสุข 4 ดินแดง
บริการวันจันทร์ 13.00 - 16.00 น.
โทร 02-246-1553
คลินิกฝากครรภ์ - ศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์
บริการวันจันทร์ 13.00 - 16.00 น.
โทร 02 214 1057 ไลน์ @woi9225m
ซอยจุฬา 36 ถนนบรรทัดทอง
วัน-เวลาทำการ ทุกวันจันทร์ 13.00 น. - 16.00 น. ( แนะนำจับบัตรคิว เวลา 12.30 น. )
เบอร์ติดต่อ 022842331 ต่อ 108
ขอบเขตการให้บริการ
1.ผู้รับบริการรายใหม่ (ฝากครรภ์ครั้งที่ 1)
- ซักประวัติการตั้งครรภ์ ตรวจร่างกายทั่วไป
- ให้คำปรึกษาโดยแพทย์-พยาบาล-นักสังคมสงเคราะห์
- เจาะเลือดตรวจโรคติดต่อทางเพศสัมพันธ์และโรคทางพันธุกรรมธาลัสซีเมีย
- บริการฉีดวัคซีนป้องกันโรคคอตีบ - บาดทะยัก
- ตรวจครรภ์โดยแพทย์-พยาบาลเวชปฏิบัติ
2. ผู้รับบริการรายเก่า (ฝากครรภ์ครั้งที่ 2)
- ตรวจร่างกายทั่วไป ได้แก่ ชั่งน้ำหนัก วัดความดันโลหิต ตรวจปัสสาวะ
- ให้ความรู้เรื่องเตรียมความพร้อมสู่การเป็นพ่อ-แม่
- ให้ความรู้เรื่องทันตสุขภาพ ตรวจสุขภาพในช่องปากและขูดหินปูนโดยทันตแพทย์ (ฟรี)
- ตรวจครรภ์ และให้คำปรึกษาโดยพยาบาลวิชาชีพ
คลินิกฝากครรภ์ - ศูนย์บริการสาธารณสุข 8
ทุกวันจันทร์ เวชา 13.00 น. - 16.00 น. ให้บริการหญิงตั้งครรภ์อายุ 18 - 34 ปี
สอบถามเพิ่มเติม 02-361-6760 ต่อ 0
เปิดให้บริการ วันจันทร์ของทุกสัปดาห์ เวลา 13.00 – 16.00 น.
โทร 02-2828494 02-2817861
ถนนประชาธิปไตย แขวงพานถม เขตพระนคร กรุงเทพมหานคร 10200
งานวิ่งของคนรวยน้ำใจ
กิจกรรมวิ่งการกุศล Run Together For Autism วิ่งด้วยกันรันเพื่อ...น้อง นอกจากจะมีกิจกรรมวิ่งเป็นไฮไลท์แล้ว ภายในงานมีการจัดนิทรรศการจากสถาบันแห่งชาติเพื่อพัฒนาเด็กและครอบครัว คณะครู นักวิชาชีพสาขาต่างๆจัดซุ้มให้ความรู้ด้านออทิสติกอย่างครบถ้วน อาทิ THAI model (home program for autism) หนังสือนิทานสำหรับเด็ก กิจกรรมดนตรี เพื่อการเรียนร่วม และ เพิ่มสีสันสร้างความอิ่มเอมใจให้กับผู้ร่วมงาน และมี 4 กิจกรรมเวิร์คช็อปโดยยุวชนนักเรียน High school จิตอาสาในกลุ่ม Beyond the Spectrum ร่วมสร้างสีสัน อาทิ กิจกรรมร้อยลูกปัด ส่งเสริมสมาธิ ฝึกทักษะการใช้มือสองข้างและกล้ามเนื้อมัดเล็ก “Art Painting D.I.Y.” การจุ่มสี..ให้น้องหมี ด้วยสีรักษ์โลก TOA Organic Care สร้างสรรค์น้องหมี Bear Brick หนึ่งเดียวในสไตล์คุณ ลูกโป่งใสไฟ LED ของขวัญสุขใจผู้ให้ถูกใจผู้รับ กระบองเพชรDIY สร้างเสริมจินตนาการ
23 พฤษภาคม 2566 พิธีเปิดอาคารศูนย์สุขภาพสัตว์เลี้ยง CMU


วันอังคารที่ 23 พฤษภาคม พ.ศ. 2566 ศาสตราจารย์ ดร.นพ.พงษ์รักษ์ ศรีบัณฑิตมงคล อธิการบดีมหาวิทยาลัยเชียงใหม่ เป็นประธานในการเปิดอาคารศูนย์สุขภาพสัตว์เลี้ยง (Pet Wellness Center, CMU) โดยมี ศาสตราจารย์ ดร.น.สพ.กรกฎ งานวงศ์พาณิชย์ คณบดีคณะสัตวแพทยศาสตร์ กล่าวรายงาน เพื่อเป็นศูนย์การให้บริการดูแลป้องกันโรคให้แก่การตรวจสุขภาพประจำปี ฉีดวัคซีน ถ่ายพยาธิ ออกใบรับรองสุขภาพสัตว์เลี้ยง รวมถึงติดตั้งไมโครชิพเพื่อช่วยในการติดตามและค้นหาสัตว์เลี้ยงในกรณีที่สูญหายเปิดให้บริการทุกวัน ตั้งแต่เวลา 08.30 – 16.30 น. ซึ่งเป็นอีกทางเลือกของเจ้าของสัตว์สุขภาพดีในการดูแลป้องกันการเกิดโรคแก่สัตว์ และร่วมกันสร้างความเข้มแข็งในวงวิชาชีพสัตวแพทย์ และการนำองค์ความรู้ในวิชาชีพสร้างผลงานตามพันธกิจและรับใช้สังคมให้สอดคล้องกับยุทธศาสตร์ของมหาวิทยาลัยเชียงใหม่ อันจะเกื้อหนุนให้ทั้งคณะและมหาวิทยาลัยยั่งยืน พร้อมด้วยผู้บริหารและผู้แทนจากเครือข่ายภาคเอกชน จาก บริษัท โซเอทิส (ประเทศไทย) จำกัด บริษัท เบสท์ อะโกร คอมพาเนี่ยน จำกัด บริษัท ด๊อกเตอร์นก ดิสทริบิวชั่น จำกัด และ บริษัท โรยัล คานิน (ประเทศไทย) จำกัด คณะผู้บริหาร คณาจารย์ และบุคลากร คณะสัตวแพทยศาสตร์ สืบ ต่อไป ณ ศูนย์สุขภาพ สัตว์เลี้ยง (Pet Wellness Center, CMU) คณะสัตวแพทยศาสตร์ [
ข่าวและภาพ]
รู้จัก เอทิลแอลกอฮอล์ vs เมทิลแอลกอฮอล์ และไอโซโพรพิลแอลกอฮอล์
แอลกอฮอล์ เป็นสารอินทรีย์ที่มีองค์ประกอบหลักคือธาตุคาร์บอน ไฮโดรเจน และอ๊อกซิเจน ส่วนมากผู้คนจะคุ้นหูกับแอลกอฮอล์ที่มีการนำมาใช้งานอยู่ 3 ชนิด คือ เมทิลแอลกอฮอล์ เอทิลแอลกอฮอล์ และไอโซโพรพิลแอลกอฮอล์
เมทิลแอลกอฮอล์ หรือ เมทานอล (Methanol)
- ผลิตจาก กระบวนการทางเคมี
- การนำไปใช้ เพื่อเป็นต้วทำละลายในอุตสาหกรรมเฟอร์นิเจอร์ เช่น สีทาไม้ น้ำมันเคลือบเงา ยาลอก
- พิษต่อร่างกาย หากดื่มเข้าไป จะเกิดอาการคลื่นไส้ อาเจียน ท้องเดิน เห็นภาพไม่ชัด มีผลต่อประสาทตา และอาจทำให้ตาบอดได้ หอบเหนื่อย หายใจเร็ว ทำให้ไตอักเสบ หรือ โลหิตเป็นพิษ ซึ่งอันตรายถึงชีวิต
เอทิแอลกอฮอล์ หรือ เอทานอล (Ethanol)
- ผลิตจาก กระบวนการหมักพืชผลทางการเกษตรที่มีองค์ประกอบของแป้งหรือนำ้ตาลสูง และกลั่นให้บริสุทธิ์
- การนำไปใช้ นำไปบริโภคหรือใช้ทางการแพทย์ได้
- พิษต่อร่างกาย ทำให้ผิวแห้ง แต่ไม่ระคายเคือง บริเวณเยื่อบุจมูก คอ และตา แต่จะน้อยกว่า ไอโซโพรพิลแอลกอฮอล์
ไอโซโพรทานอล (Isopropanol)
- ผลิตจาก การเติมน้ำไปในแก๊สโพรพีน ด้วยกลไกทางเคมี ซึ่งเป็นหนึ่งในกระบวนการทางปิโตรเคมี
- สามารถนำมาใช้ทำความสะอาดฆ่าเชื้อโรคบนพื้นผิวอุปกรณ์ต่างๆ ได้
- พิษต่อร่างกาย ทำให้ระคายเคืองผิวหนัง ผิวแห้ง แตกลอก เกิดผื่นแพ้ ระคายเคืองเยื่อบุตา และเป็นแผลที่กระจกตา
THAMC ห้างสรรพสินค้าฟิวเจอร์พาร์ค รังสิต
เตรียมพบกันอีกครั้ง..ที่บูธ "ศูนย์การแพทย์ธรรมศาสตร์" #THAMC ห้างสรรพสินค้าฟิวเจอร์พาร์ค รังสิต (ชั้น G บริเวณ Uniqlo / KFC) วันเสาร์ที่ 24 และวันอาทิตยที่ 25 สิงหาคม 2567 ✅ แนะนำข้อมูลบริการของศูนย์การแพทย์ฯ ✅ ฟรี!! กิจกรรมรับรางวัลพิเศษจาก THAMCตำแหน่ง "พนักงานทั่วไป" 3 อัตรา
ตำแหน่ง "พนักงานทั่วไป" 3 อัตรา
คุณสมบัติ
✅️วุฒิการศึกษา ม.3 หรือ ม.6
✅️อายุ 18 - 35 ปี
✅️สามารถใช้คอมพิวเตอร์ และโปรแกรม Microsorf office
ให้บริการผู้ป่วยทำประวัติและงานสิทธิ
สถานการณ์แรงงาน
การจ้างงานในไตรมาสสอง ปี 2567 ลดลงตามการจ้างงานภาคเกษตรกรรมที่หดตัว ต่อเนื่อง ขณะที่สาขานอกภาคเกษตรกรรมมีการจ้างงานเพิ่มขึ้นในทุกสาขา โดยเฉพาะ สาขาการขนส่งและเก็บสินค้า ทั้งนี้ ต้องให้ความสำคัญกับการเพิ่มทักษะการประยุกต์ใช้ AI และทักษะที่จะเปลี่ยนแปลงในอนาคต รวมถึงต้องเฝ้าระวังการขาดสภาพคล่องของ SMEs ซึ่งอาจส่งผลต่อการจ้างงาน
- ไตรมาสสอง ปี 2567 ภาพรวมการจ้างงานปรับตัวลดลง โดยผู้มีงานทำมีจ านวนทั้งสิ้น 39.5 ล้านคน
- จากการจ้างงานภาคเกษตรกรรมหดตัวลงต่อเนื่องจากไตรมาสที่ผ่านมา จากปัญหาการขาดแคลนน้ำในบางพื้นที่ เช่นเดียวกับกำลังแรงงานรอฤดูกาลที่เพิ่มขึ้น
- การจ้างงานในสาขานอกภาคการเกษตรยังคงขยายตัวได้ทุกสาขา
• สาขาการขนส่งและเก็บสินค้าปรับตัว ดีขึ้น
• สาขาโรงแรมและภัตตาคารยังคงขยายตัวได้ดี มีปัจจัยสำคัญจากการท่องเที่ยวในช่วงเทศกาลสงกรานต์ โดยในเดือนเมษายน 2567 มีนักท่องเที่ยวต่างชาติเดินทางเข้าประเทศไทย เพิ่มขึ้นจากปีก่อนกว่าร้อยละ 26.4
• สาขาการผลิตที่ปรับตัวดีขึ้น ตามสถานการณ์การส่งออกที่ขยายตัว ดีขึ้น
• สาขาการค้าส่งและค้าปลีกยังขยายตัวได้ไม่มากนัก
• สาขาการก่อสร้าง ขยายตัวร้อยละ 1.5 ชะลอลงกว่าไตรมาสก่อนหน้า ซึ่งอาจเป็นผลต่อเนื่องจากการหดตัวของอุปสงค์ต่อที่อยู่อาศัย ที่ทำให้อุปทานทั้งใบอนุญาตจัดสรรที่ดินและพื้นที่อนุญาตก่อสร้างที่อยู่อาศัยลดลงตามไปด้วย
- ชั่วโมงการทำงานค่อนข้างทรงตัวเฉลี่ย ในภาพรวมอยู่ที่ 42.8 ชั่วโมงต่อสัปดาห์ ขณะที่ชั่วโมงการทำงานเฉลี่ย ของภาคเอกชนอยู่ที่ 46.6 ชั่วโมงต่อสัปดาห์ ผู้ทำงานล่วงเวลาหรือผู้ที่มีชั่วโมง การท างาน 50 ชั่วโมงต่อสัปดาห์ขึ้นไป เพิ่มขึ้นร้อยละ 2.5
- ค่าจ้างแรงงานภาคเอกชนอยู่ในระดับเดียวกันกับปีก่อน โดยเฉลี่ยอยู่ที่ 14,032 บาทต่อคนต่อเดือน
ขณะที่ค่าจ้างเฉลี่ยในภาพรวมของกลุ่มแรงงานในระบบ (ตามการจัดเก็บข้อมูลแบบเดิม) อยู่ที่ 15,329 บาทต่อคน ต่อเดือน ลดลงจากไตรมาสสอง ปี 2566 เล็กน้อย
หากพิจารณาระดับค่าจ้างของกลุ่มแรงงาน ประกอบอาชีพอิสระร่วมด้วย จะพบว่า ค่าจ้างเฉลี่ยในภาพรวมปรับเพิ่มขึ้นเป็น 16,284 บาทต่อคนต่อเดือน นอกจากนี้ ผลของเงินเฟ้อที่เร่งตัวขึ้น ส่งผลให้ค่าจ้างที่แท้จริงของแรงงานลดลง
- ผู้ว่างงาน 4.3 แสนคน คิดเป็นอัตราว่างงานร้อยละ 1.07 ถือเป็นการเพิ่มขึ้นครั้งแรกนับจากการฟื้นตัวจากการแพร่ระบาดของ COVID-19 เมื่อปี 2565 โดยเป็น การเพิ่มขึ้นจากกลุ่มที่เคยทำงานมาก่อน ขณะที่กลุ่มที่ไม่เคยทำงานมาก่อนมีจำนวนลดลง โดยเฉพาะกลุ่มที่จบ การศึกษาระดับอุดมศึกษา
สำหรับผู้ว่างงานระยะยาวยังคงลดลงต่อเนื่อง โดยไตรมาสสอง ปี 2567 มีประมาณ 7 หมื่นคน
อัตราการว่างงานในระบบ อยู่ที่ร้อยละ 1.92 ของผู้ประกันตนมาตรา 33 โดยมีผู้ขอรับประโยชน์ทดแทนกรณีว่างงานทั้งสิ้น 2.3 แสนคน ลดลงร้อยละ 7.8 จากช่วงเวลาเดียวกันของปีก่อน
ประเด็นด้านแรงงานที่ต้องให้ความส าคัญในระยะถัดไป ได้แก่
1. การปรับตัวของแรงงานให้มีทักษะที่สอดคล้องกับทักษะที่จำเป็นในอนาคต โดยปัจจุบัน ภาคธุรกิจให้ความสำคัญกับการนำเทคโนโลยีดิจิทัลมาช่วยในการพัฒนาการทำงานเพื่อรักษาความสามารถ ในการแข่งขันทั้งกับคู่แข่งภายในและภายนอกประเทศ คาดว่า ภายในปี 2027 งานในภาคธุรกิจกว่าร้อยละ 42 จะถูกทดแทนด้วยระบบอัตโนมัติ และจะนำไปสู่การเลิกจ้างแรงงานจำนวนมาก แรงงานจึงต้องปรับตัวให้ทันเพื่อลดผลกระทบจากการเปลี่ยนแปลงดังกล่าว
ทักษะที่จำเป็นต่อการปรับตัว คือ ทักษะหลัก (Core Skill) ในด้านการคิด วิเคราะห์ (Analytical Thinking) และทักษะความคิดสร้างสรรค์ (Creative Thinking) ขณะที่ทักษะด้านความรู้เกี่ยวกับเทคโนโลยี (Technological Literacy) เป็นทักษะที่มี ความสำคัญมากขึ้นเป็นอันดับที่ 3
จาการสำรวจความเห็นผู้บริหารในไทยกว่าร้อยละ 74 ไม่ต้องการจ้างพนักงานที่ไม่มีทักษะ ทางด้าน AI และกว่าร้อยละ 90 เลือกที่จะจ้างพนักงานที่มีประสบการณ์น้อยแต่มีทักษะด้านการใช้ AI แทนการเลือกพนักงานที่มีประสบการณ์สูงกว่าแต่ขาดทักษะในด้านนี้
2. ผลกระทบของการขาดสภาพคล่องของ SMEs และปัจจัยเสี่ยงทางเศรษฐกิจที่มากขึ้นต่อการจ้างงาน SMEs เป็นกลุ่มธุรกิจที่รองรับแรงงานไว้มาก และในปี 2566 มีสัดส่วน GDP ถึงร้อยละ 35.2 แต่ ปัจจุบัน SMEs กำลังประสบปัญหาด้านสภาพคล่อง สะท้อนจากสัดส่วนหนี้เสีย (NPLs) ต่อสินเชื่อรวมของ SMEs ในไตรมาสสี่ ปี 2566 ที่อยู่ที่ร้อยละ 7.2 เพิ่มขึ้นจากร้อยละ 4.6 ในไตรมาสหนึ่ง ปี 25623 โดยเป็นผลมาจาก
- กำลังซื้อภายในประเทศที่ชะลอตัวลงเนื่องจากสภาพเศรษฐกิจ
- ระดับหนี้ครัวเรือน ส่งผลให้ผู้บริโภคระมัดระวังการใช้จ่าย
- สถาบันการเงินมีความเข้มงวดในการให้สินเชื่อแก่ภาคธุรกิจมากขึ้น
- การปรับเพิ่มอัตราดอกเบี้ยนโยบายยังส่งผลต่อต้นทุนและเป็นข้อจำกัดในการรักษาสภาพคล่องของธุรกิจ
- นอกจากนี้ โดยดัชนีต้นทุนของธุรกิจรายย่อย (Micro) และธุรกิจขนาดกลาง (Medium) ในปี 2566 เพิ่มขึ้น ทำให้ SMEs ทำกำไรได้ลดลง
สถานการณ์เช่นนี้อาจส่งผลต่อเนื่องไปสู่การเลิกจ้าง แรงงาน SMEs ได้ จึงอาจต้องมีการดำเนินนโยบายที่สามารถสร้างกำลังซื้อได้อย่างยั่งยืน รวมถึงการควบคุมต้นทุน ด้านต่าง ๆ ตลอดจนการสร้างองค์ความรู้ในการบริหารจัดการโดยเฉพาะด้านการเงินให้แก่ SMEs
3. ผลกระทบของอุทกภัยต่อผลผลิตทางการเกษตรและรายได้ของเกษตรกร สถานการณ์อุทกภัยระหว่างวันที่ 16 กรกฎาคม – 1 สิงหาคม 2567 มีจังหวัดที่ได้รับผลกระทบด้านการเกษตรจ านวน 15 จังหวัด ครอบคลุม เกษตรกร 47,944 ราย รวมพื้นที่ 308,238 ไร่ ทั้งนี้ กรมอุตุนิยมวิทยา ยังได้คาดการณ์ว่าในช่วงกลางเดือน กรกฎาคม – กันยายน 2567 ประเทศไทยอาจมีน้ำท่วมฉับพลันในหลายพื้นที่ เป็นความเสี่ยงที่พื้นที่การเกษตรจะได้รับความเสียหาย โดยจะส่งผลต่อรายได้ของเกษตรกร รวมถึงต้นทุนในการลงทุนเพาะปลูกใหม่ และอาจกระทบต่อเนื่อง ไปถึงความสามารถในการชำระหนี้ของเกษตรกร หน่วยงานจึงต้องมีการเตรียมพร้อมมาตรการป้องกันและบรรเทา สถานการณ์อุทกภัยทั้งที่กำลังเกิดขึ้นและที่จะเกิดในอนาคต
จะเห็นได้ว่าการคุกคามทางเพศออนไลน์เกิดขึ้น ได้หลายรูปแบบ และในบางกรณีผู้กระทำอาจไม่ได้คำนึงถึงผลกระทบต่อผู้ถูกกระทำเท่าที่ควร ซึ่งพฤติกรรม ดังกล่าวส่วนหนึ่งเกิดจากการเลียนแบบจากสิ่งที่พบเห็น ในชีวิตประจำวัน รวมถึงในสื่อต่าง ๆ
โดยงานวิจัยเกี่ยวกับ การสื่อสารเนื้อหาไม่เหมาะสมด้านการคุกคามทางเพศ ในรายการเพื่อความบันเทิงไทยปี 2566 พบว่า ผู้รับชมรายการบันเทิงรับรู้ถึงเนื้อหาไม่เหมาะสมด้านการคุกคามทางเพศแบบชายคุกคามหญิงบ่อยๆ ร้อยละ 38.59 และ เป็นประจำร้อยละ 29.18 ซึ่งรูปแบบการคุกคามทางเพศที่พบได้มากที่สุด คือ การวิจารณ์ถึงสรีระ การแต่งกาย รวมทั้งการใช้คำพูดที่ตีความในเชิงเพศได้ ซึ่งเป็นการส่งเสริมการคุกคามทางเพศ โดยการสื่อสารข้อมูลดังกล่าว อย่างต่อเนื่องของสื่อนำไปสู่การทำให้เป็นปกติ (Normalization) ที่สามารถพบได้ทั่วไป
ขณะเดียวกัน นอกจากการรับรู้ที่พบได้ในชีวิตประจำวันแล้ว การขาดความรู้ถึงเรื่องสิทธิคุกคามทางเพศของเด็กและผู้ปกครอง ยังเป็นอีกประเด็นที่ทำให้เกิดความละเลยต่อการรับรู้ถึงการคุกคามทางเพศที่เกิดขึ้นในชีวิตประจำวัน โดยจากงานวิจัยเรื่อง “ประสบการณ์การคุกคามทางเพศบนเครือข่ายสังคมออนไลน์ และแนวทางป้องกัน” ปี 2565 พบมุมมองด้านความคิด ความเชื่อ และทัศนคติของเด็กและเยาวชนว่า การหยอกล้อเกี่ยวกับเรื่องเพศเป็นเรื่องปกติ และสามารถสื่อสารได้อย่างอิสระโดยปราศจากความผิด
ขณะที่ผู้ปกครองบางส่วนมีช่องว่างทางความเข้าใจเกี่ยวกับรูปแบบการสื่อสารทางออนไลน์และกฎหมายที่เกี่ยวข้อง ส่งผลให้ขาดการรับรู้ถึงการถูกคุกคามของเด็กและเยาวชน
นอกจากนี้ รายงานของสำนักงานคณะกรรมการดิจิทัลเพื่อเศรษฐกิจและสังคมแห่งชาติ (สดช.) 42 พบว่า ความตระหนักรู้ในกฎหมายดิจิทัลของภาคประชาชนยังอยู่ในระดับที่ต่ำ ได้แก่ พระราชบัญญัติการรักษาความมั่นคงปลอดภัยทางไซเบอร์ ร้อยละ 43.4 พระราชบัญญัติคุ้มครองข้อมูลส่วนบุคคล คิดเป็นร้อยละ 40.9 และพระราชบัญญัติว่าด้วยการกระทำความผิดเกี่ยวกับคอมพิวเตอร์ คิดเป็นร้อยละ 40.7 ตามลำดับ
อีกทั้ง จากรายงานสมัชชาเด็กและเยาวชน ปี 2566 ที่สำรวจเด็กและเยาวชนอายุอายุระหว่าง 10 - 25 ปี จำนวน 33,580 คน ได้ระบุว่า เด็กและเยาวชนกว่าร้อยละ 54 ไม่ทราบหรือไม่แน่ใจถึงช่องทางการช่วยเหลือ หากประสบกับปัญหาในโลกออนไลน์
สอดคล้องกับรายงานของ UNICEF ปี 2565 ที่พบว่า เด็กและเยาวชนในประเทศไทย อายุระหว่าง 12 – 17 ปี ร้อยละ 47 ไม่ทราบถึงช่องทางการช่วยเหลือหากตนเองหรือเพื่อนถูกล่วงละเมิด/คุกคาม ทางเพศออนไลน์
ซึ่งสาเหตุส่วนหนึ่งเกิดจากการที่เด็กและเยาวชนมีความรู้สึกอับอาย ทำให้ไม่ต้องการเปิดเผยข้อมูล หรือเด็กที่เป็นเหยื่อบางส่วนมองว่าตนเองไม่ได้เป็นผู้เสียหาย ขณะที่ผู้ปกครองแจ้งความดำเนินคดีมีเพียง ร้อยละ 17 เนื่องจากไม่ทราบถึงการถูกคุกคามทางเพศของเด็กและเยาวชน
พิษจากเมทานอล หรือสุราเถื่อน
สุรา/เหล้าเถื่อน ส่วนใหญ่เกิดจากการดื่มสุราที่มี สารเมทานอลปนเปื้อนอยู่ มักจะพบในสุราปลอม หรือ เหล้าเถื่อนที่ต้มกลั่นเอง
สารเมทอล (Methanol หรือ Wood alcohol) จะเป็นแอลกอฮอล์ชนิดเชื้อเพลิง เป็นสารพิษที่ใช้ในงานอุตสาหกรรม ไม่ควรนำมาบริโภค
อาการ
- มีอาการแฮงค์เหมือนดื่มเหล้าทั่วไป ร่วมกับมึนเวียนศรีษะ ปวดท้อง คลื่นไส้ อาเจียนรุนแรง
- มีอาการตาพร่ามัว อาจมองไม่เห็น หรือมองเห็นผิดปกติทั้งสองข้าง
- อาจมีอาการชักเกร็ง กระตุกทั้งตัว ซึม และ เสียชีวิต จากภาวะเลือดเป็นกรดรุนแรง และระบบร่างกายต่างๆ ทำงานล้มเหลว
การรักษา ทำได้โดยการประคับประคอง และอาจร่วมการรักษาโดยใช้เอทานอล ซึ่งไม่ได้เป็นยาต้านพิษโดยตรง เพียงแต่จะชะลอการเกิดพิษของเมทานอล
สิ่งที่ช่วยได้ดีที่สุดคือ การล้างไต
ขั้นตอนการดำเนินงานกู้ยืมเงินทุนประกอบอาชีพ รายบุคคล
Reference info
[Infographic] ดมยาดมบ่อยๆ ...อันตรายหรือไม่
ดมยาดมบ่อยๆ ...อันตรายหรือไม่ ข่าวสารด้านยา ผลิตภัณฑ์สุขภาพ สำนักอนามัย กรุงเทพมหานคร
ศ.นพ.ธานินทร์ อินทรกำธรชัย ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ประธานชมรมโรคมะเร็งต่อมน้ำเหลืองแห่งประเทศไทย กล่าวว่า โรคมะเร็งต่อมน้ำเหลืองเป็นมะเร็งทางโลหิตวิทยาที่พบได้บ่อยติดอันดับ 1 ใน 7 ของโรคมะเร็งที่พบบ่อยในคนไทย ปัจจุบันพบว่ามีผู้ป่วยใหม่ที่ได้รับการวินิจฉับว่าเป็นโรคมะเร็งต่อมน้ำเหลืองปีละกว่า 6000 ราย หรือเทียบเท่ากับ 16 รายต่อวันโรคมะเร็งต่อมน้ำเหลืองสามารถแบ่งออกได้เป็น 2 ชนิดหลัก คือ Non-Hodgkin Lymphoma (NHL) เเละ Hodgkin Lymphoma (HL) ในคนไทย NHL เป็นมะเร็งที่พบได้บ่อย และสามารถแบ่งออกได้เป็น 2 ประเภทย่อย คือ ชนิดค่อยเป็นค่อยไป (Indolent) และ ชนิดรุนแรง (Aggressive) โดยชนิดที่พบมากที่สุด คือ DLBCL คิดเป็นสัดส่วน 58% ของมะเร็งต่อมเหลืองในประเทศไทย อย่างไรก็ตาม โรคมะเร็งต่อมน้ำเหลืองเป็นมะเร็งที่มีโอกาสหายขาดได้ โดยหากพบในระยะที่ 1 โอกาสหายขาดประมาณ 70-90% กรณีพบในระยะที่ 2-4 โอกาสหายขาดอยู่ที่ 60%
ดังนั้นเพื่อการตระหนักถึงตัวโรคมะเร็งต่อมน้ำเหลืองจึงควรสังเกตอาการของตนเองในระยะเริ่มแรก ส่วนใหญ่จะมี 10 สัญญานเตือน
1. พบก้อนที่บริเวณต่าง ๆ ของร่างกาย เช่น คอ รักแร้ ขาหนีบ หรือเต้านม โดยที่ก้อนเหล่านั้นมักจะไม่มีอาการเจ็บ ซึ่งต่างจากการติดเชื้อที่มักจะมีอาการเจ็บที่ก้อน
2. มีไข้ หนาวสั่น
3. เหงื่อออกมากเวลากลางคืน
4. เบื่ออาหาร น้ำหนักลด
5. อ่อนเพลียโดยไม่ทราบสาเหตุ
6. ไอเรื้อรัง
7. หายใจไม่สะดวก
8. ต่อมทอนซิลโต
9. มีอาการคันทั่วร่างกาย
10. ปวดศีรษะ (มักพบในผู้ป่วยมะเร็งต่อมน้ำเหลืองในระบบประสาท)
อย่างไรก็ตาม สัญญาณเตือน ข้างต้นเป็นเพียงจุดสังเกตง่าย ๆ ที่สามารถเช็คร่างกายได้ด้วยตัวเอง แต่อย่างไรก็ดี การคลำได้ก้อนในร่างกายอาจไม่ใช่มะเร็งเสมอไป โดยอาจเป็นเรื่องของการอักเสบจากการติดเชื้อ หรือเป็นเนื้องอกชนิดไม่ร้าย สามารถผ่าตัดให้หายได้ หรือในกรณีที่ก้อนนั้นเป็นเซลล์มะเร็งก็ตามที การตรวจพบสัญญาณของโรคในระยะเริ่มต้นก็มีโอกาสรักษาให้หายได้เช่นกัน
ดร. มาร์ค เบอร์บี รองประธานกลุ่มธุรกิจ Health Systems ฟิลิปส์ ประจำภูมิภาคเอเชียแปซิฟิก กล่าวว่า “ปัญหาผู้ป่วยต้องรอนานเพื่อเข้ารับบริการด้านสาธารณสุขและปัญหาการขาดแคลนบุคลากรทางการแพทย์ ทำให้ผู้ป่วยไม่ได้รับการดูแลรักษาได้อย่างทันท่วงทีและเข้าถึงระบบสาธารณสุขได้ยาก ดังนั้น เราจึงเห็นผู้นำในวงการเฮลท์แคร์พยายามที่จะพัฒนาและเปลี่ยนแปลง เพื่อส่งมอบบริการและการดูแลรักษาที่ดีขึ้นให้กับผู้คนได้มากขึ้น โดยเฉพาะความพยายามที่จะเอาชนะอุปสรรคในการเชื่อมต่อข้อมูล และก้าวไปสู่อีกขั้นในการใช้เทคโนโลยี AI เพื่อสนับสนุนการทำงานของบุคลากรทางการแพทย์และการเพิ่มประสิทธิภาพในการดูแลรักษาผู้ป่วยให้ดียิ่งขึ้น”
คลินิกทันตกรรมพิเศษเฉพาะทางนอกเวลา
คลินิกทันตกรรมพิเศษเฉพาะทางนอกเวลา ให้บริการ อุดฟันขูดหินปูน ถอนฟัน ผ่าฟันคุด และรักษาโรคปริทันต์ รวมถึงรักษารากฟัน เปิดให้บริการทุกวันพุธ 16.30-20.00 น นะคะ (รับเฉพาะผู้ป่วยนัด) สำหรับผู้มารับบริการในวันแรก จะได้รับของที่ระลึกจากกลุ่มงานทันตกรรมด้วยค่า สนใจโทรมาจองคิวได้นะคะ 038-814375-8 ต่อ 1260-3 หรือมาติดต่อได้ที่ทันตกรรม รพ พุทธโสธรได้ค่า ชั้น 6 อาคารอุบัติเหตุฉุกเฉิน
บริการคลินิกพิเศษเฉพาะทางนอกเวลาราชการ เฉพาะทาง ส่องกล้องทางเดินอาหาร
บริการคลินิกพิเศษเฉพาะทาง ส่องกล้องทางเดินอาหาร นอกเวลาราชการ
การใช้กล้อง Endoscopy เพื่อการวินิจฉัยรักษา
▪️อายุรกรรมทางเดินอาหารและตับ
▪️ศัลยกรรมระบบทางเดินอาหาร
▪️ศัลยกรรมระบบทางเดินปัสสาวะ
Special Medical Clinic: SMC เวลา 16:00 - 20:00น.
คลินิกนอกเวลา ศัลยกรรมทั่วไป (SURS) LINK
คลินิกนอกเวลา ศัลยกรรมทั่วไป (SURS) เปิดบริการ อังคาร พุธ พฤหัสบดี 16.30-20.30 น. แพทย์ผู้ออกตรวจ นพ.ธวัชชัย ไตรมิตรวิทยากุล วันอังคาร และพฤหัสบดี นพ.ธนภพ ธีรพงศ์ธาดา วันพุธ สอบถามโทร 039-511040-1 ต่อ 151
จำแนกตามพื้นที่ กรุงเทพ ปริมณฑล (นนทบุรี ปทุมธานี สมุทรปราการ) รอบกรุงเทพ (นครปฐม สมุทรสาคร สมุทรสงคราม) ภาคกลาง ภาคเหนือ ภาคอีสาน
กิจกรรมน่าสนใจช่วงเทศกาลบั้งไฟพญานาค
โรคผิวหนังจากการประกอบอาชีพ (กรมควบคุมโรค)
โรคผิวหนังจากการประกอบอาชีพ (Occupational Skin Diseases) สถาบันราชประชาสมาสัย กรมควบคุมโรค
Rajpracha News บริการของคลินิกโรคจากการทำงาน โรงพยาบาลระยอง
บริการตรวจสุขภาพ
3 ประเภท ได้แก่
• ตรวจสุขภาพแรงงานข้ามชาติ
• ตรวจสุขภาพในโรงพยาบาล
• ตรวจสุขภาพเคลื่อนที่
สร้างเสริมสุขภาพ
• ประเมินความสามารถในการทำงาน
• ประเมินก่อนกลับเข้าทำงาน
• สร้างเสริมสุขภาพปรับเปลี่ยนพฤติกรรมสุขภาพวัยทำงาน
วินิจฉัยโรคจากการทำงาน
การเตรียมตัวก่อนมาวินิจฉัยโรคจากการทำงาน
1.ข้อมูลประวัติการเจ็บป่วยที่ได้รับการรักษา (โรงพยาบาลอื่น)
2.ข้อมูลลักษณะงานที่สงสัยว่าทำให้เกิดโรคจากการทำงาน (ภาพถ่ายหรือวีดีโอ)
3.ข้อมูลการตรวจวัดสิ่งแวดล้อม
4.บริษัทเขียนใบส่งตัว กท.44
5.เจ้าหน้าที่ความปลอดภัยหรือหัวหน้างาน มาพร้อมกับพนักงานด้วย
การเดินสำรวจสถานประกอบการ
• ประเมินความเสี่ยง/ สอบสวนโรค/ จัดโปรแกรมตรวจสุขภาพตามความเสี่ยง
• สื่อสารความเสี่ยงแกนนำ/ประชาชน
คลินิกโรคจากการทำงานโรงพยาบาลสุรินทร์ ให้บริการวันที่ 1 มิถุนายน 2565
คลินิกโรคจากการทำงานโรงพยาบาลสุรินทร์ เริ่มเปิดให้บริการวันที่ 1 มิถุนายน 2565 เป็นต้นไป ให้บริการตรวจตามความเสี่ยง สมรรถภาพการได้ยิน การมองเห็นและตรวจสมรรถภาพปอดเพื่อเตรียมเข้าทำงานหรือทำงานอยู่แล้วก็ตาม
ต้องการใช้บริการ ติดต่อ สำรอง วันและเวลาตรวจ ได้ที่โทร. 044-511757 ต่อ 22652
สถานที่ คลินิกโรคจากการทำงาน ชั้น 6 อาคาร 100 ปี การสาธารณสุขไทย รพ.สุรินทร์
โปรโมชั่น ฉลองก้าวเข้าสู่ปีที่ 6 ของศูนย์เลสิก ม.อ. วันนี้ - 31 ต.ค.67 เท่านั้น LINK
ฉลองก้าวเข้าสู่ปีที่ 6 ของศูนย์เลสิก ม.อ. - PSU LASIK CENTER
ในโอกาสดีๆแบบนี้แอดมีโปรโมชั่นราคาสุดสุดพิเศษ‼️
✔️ PRK เหลือเพียง 45,000.-
(จากราคาปกติ 55,000.-)
✔️ Blade Lasik เหลือเพียง 52,000.-
(จากราคาปกติ 62,000.-)
✔️ Femto Lasik เหลือเพียง 69,000.-
(จากราคาปกติ 82,000.-)
✔️ ReLex smile เหลือเพียง 95,000.-
(จากราคาปกติ 102,000.-)
โปรโมชั่นนี้ !! รวมค่ายา ค่าตรวจตาอย่างละเอียดและค่าติดตามอาการ 5 ครั้ง รวมมูลค่ากว่า 6,250.- ฟรีไปเลย
ตั้งแต่วันนี้ - 31 ต.ค.67 เท่านั้น
เงื่อนไข
1. ราคาโปรโมชั่นนี้ รวมค่ายา, ค่าตรวจสายตาอย่างละเอียดและค่าติดตามอาการ 5 ครั้ง มูลค่า 6,250 บาท
2. สำหรับการผ่าตัดรูปแบบ PRK กรณีมีค่ายาเพิ่มเติมเกิน มูลค่า 1,500 บาทขึ้นไป ส่วนต่างที่เหลือลูกค้าจะเป็นผู้รับผิดชอบค่าใช้จ่าย
4. การชำระเงินและผ่าตัด ไม่เกินวันที่ 31 ต.ค. 2567
5. เงื่อนไขอาจจะมีการเปลี่ยนแปลงโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
6. ควรนัดหมายล่วงหน้า เพื่อความสะดวกในการเข้ามาใช้บริการ
จองคิวหรือสอบถามเพิ่มเติมได้ที่
074-451746
เปิดบริการทุกวัน
08.00 - 16.00 น.
ศูนย์เลสิก ม.อ. ชั้น 5 อาคารศรีเวชวัฒน์ โรงพยาบาลสงขลานครินทร์ เวชวิวัฒน์
ความรู้เบื้องต้นเกี่ยวกับต่อมไทรอยด์
หน่วยเวชศาสตร์ชันสูตรฉุกเฉินและฮอร์โมน สาขาวิชาพยาธิวิทยา
ขอเชิญร่วมกิจกรรม วันมหิดล 2567
ความรู้เบื้องต้นเกี่ยวกับต่อมไทรอยด์
วันที่ 23 กันยายน 2567 เวลา 8.30 - 15.30 น.
ชั้น 1 โรงพยาบาลสงขลานครินทร์ (บริเวณเวทีสุขภาพ)
หน่วยเวชศาสตร์ชันสูตรฉุกเฉินและฮอร์โมน สาขาวิชาพยาธิวิทยา
โทร 074-451500 ต่อ 170258
ทีมปฏิบัติการฉุกเฉิน เข้าพื้นที่อุทกภัย ดินโคลนถล่ม จ.เชียงใหม่ จ.เชียงราย
11 กันยายน 2567 นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข เปิดเผยความคืบหน้าการช่วยเหลือด้านการแพทย์และสาธารณสุข ประชาชนผู้ประสบอุทกภัยและดินโคลนถล่ม ในพื้นที่ อ.แม่อาย อ.ฝาง จ.เชียงใหม่ และที่ อ.แม่สาย อ.แม่ฟ้าหลวง อ.เมือง อ.แม่จัน จ.เชียงราย ว่า นายสมศักดิ์ เทพสุทิน รัฐมนตรีว่าการกระทรวงสาธารณสุข มีความห่วงใยและได้กำชับให้หน่วยบริการสาธารณสุขในพื้นที่เข้าดูแลและช่วยเหลือประชาชนอย่างเต็มที่ โดยเฉพาะผู้ป่วยติดบ้านติดเตียง รวมถึงดูแลบุคลากรสาธารณสุขที่ส่วนหนึ่งเป็นผู้ได้รับผลกระทบจากเหตุการณ์ด้วย ซึ่งกระทรวงสาธารณสุขได้เตรียมแผนสนับสนุนทีมปฏิบัติการฉุกเฉินทางการแพทย์ (Medical Emergency Response Team : MERT) ไว้แล้ว สามารถลงพื้นที่ได้ทันทีที่ได้รับการร้องขอ โดยในระยะเร่งด่วน จะส่งทีม MERT จากพิษณุโลก เป็นแม่ข่ายนำทีม และทีม Mini MERT ของเขตสุขภาพที่ 2 เป็นลูกข่าย ซึ่งอยู่ใกล้สุดลงพื้นที่ ระยะที่ 2 สนับสนุนทีม MERT จากสระบุรี เป็นแม่ข่าย และทีม Mini MERT เขตสุขภาพที่ 4 เป็นลูกข่าย ส่วนระยะที่ 3 สนับสนุนทีม MERT จากฝั่งอีสานลงพื้นที่ให้การช่วยเหลือ
นพ.โอภาสกล่าวต่อว่า ได้รับรายงานจาก นพ.สราวุฒิ บุญสุข ผู้ตรวจราชการกระทรวงสาธารณสุข เขตสุขภาพที่ 1 ว่า ขณะนี้ได้ส่งทีมช่วยเหลือเยียวยาจิตใจผู้ประสบภาวะวิกฤต (Mental Health Crisis Assessment and Treatment Team : MCATT) จากสำนักงานสาธารณสุขจังหวัดเชียงราย และโรงพยาบาลแม่สาย ลงพื้นที่ศูนย์พักพิงเทศบาลแม่สายและวัดพรหมวิหาร ซึ่งมีผู้ประสบภัย 71 คน ให้การดูแลสุขภาพเบื้องต้นทั้งด้านร่างกายและจิตใจ ส่วนที่จังหวัดเชียงใหม่ ได้ส่งทีมดูแลต่อเนื่อง (COC) และ MCCAT ประสานงานกับผู้ป่วยและเจ้าหน้าที่ในพื้นที่ประสบเหตุเพื่อติดตามอาการและวางแผนให้ความช่วยเหลือ โดยได้นำส่งผู้ป่วยติดเตียงไปอยู่ในพื้นที่ปลอดภัยแล้ว ทั้งนี้ มีเจ้าหน้าที่สาธารณสุขได้รับผลกระทบเรื่องบ้านเรือนและการเดินทาง ประมาณ 20 ราย ซึ่งได้ให้ความช่วยเหลือเบื้องต้นแล้วเช่นกัน ส่วนโรงพยาบาลฝาง ซึ่งอยู่ในเขตน้ำท่วมขัง ขณะนี้ยังสามารถเปิดให้บริการได้ตามปกติ ได้วางแผนสำรองน้ำไว้เพื่อให้ใช้ได้ถึง 48 ชั่วโมง และวางแผนหาแหล่งน้ำอื่นสำรองหากประปาอำเภอฝางต้องหยุดจ่ายน้ำ
นพ.โอภาสกล่าวอีกว่า นอกจากนี้ ศูนย์อนามัยที่ 1 เชียงใหม่ ยังได้สำรองชุด V clean สำหรับทำน้ำสะอาดและกำจัดเชื้อโรค 200 ชุด พร้อมส่งเข้าช่วยเหลือพื้นที่อุทกภัย และเตรียมเพิ่มไว้อีก 400 ชุด รวมทั้งกำลังผลิต EM ball อีก 3,000 ลูก เพื่อรองรับสถานการณ์น้ำท่วมขังต่อเนื่อง ทั้งนี้ ได้เน้นย้ำเจ้าหน้าที่ที่ปฏิบัติงานในพื้นที่น้ำท่วมให้ดำเนินการด้วยความระมัดระวัง เพื่อให้การช่วยเหลือเป็นไปอย่างมีประสิทธิภาพและปลอดภัยสูงสุด
2024 ปีแห่งความท้าทายสู่การเปลี่ยนแปลงที่เหนือกว่าของไวทัลไลฟ์
ปี 2024 นับเป็นปีแห่งความท้าทายสู่การเปลี่ยนแปลงที่เหนือกว่าของไวทัลไลฟ์ เพื่อก้าวไปสู่ความสำเร็จอีกขั้น โดยได้มีการปรับเปลี่ยนในหลายมิติ ภายใต้การนำทีมของ ผศ.นพ. พลกฤต ทีฆคีรีกุล Chief Executive Officer ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์และเอสเพอรานซ์ และ Chief Science Officer โรงพยาบาลบำรุงราษฎร์และศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ซึ่งปฏิวัติวงการในการดูแลสุขภาพด้วยนวัตกรรมและเทคโนโลยี AI ที่ล้ำสมัย มุ่งเน้นการสร้างการดูแลสุขภาพแบบเฉพาะบุคคลเพื่อให้ผู้คนมีอายุยืนยาวอย่างมีคุณภาพอย่างยั่งยืน รวมถึงการปรับรูปโฉมใหม่ของไวทัลไลฟ์และการให้บริการแบบบูรณาการครอบคลุมทุกมิติ โดยย้ายมาที่ตึก D ของโรงพยาบาลบำรุงราษฎร์ ภายใต้การออกแบบที่หรูหราและทันสมัย อีกทั้งยังได้ปรับทัพทีมผู้บริหารและทีมแพทย์เพื่อให้สอดรับการเติบโตด้านเวชศาสตร์การมีอายุยืนยาว ซึ่งเป็นเมกะเทรนด์ทางการแพทย์
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ตุลาคม 2567
เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
โรคโกเชร์ (Gaucher Disease) เกิดจากความผิดปกติทางพันธุกรรม
โรคโกเชร์ (Gaucher Disease) เกิดจากความผิดปกติทางพันธุกรรม โดยส่วนใหญ่มักแสดงอาการตั้งแต่เด็ก หรือในบางคนอาจแสดงอาการตอนเป็นผู้ใหญ่ โรคโกเชร์ แบ่งออกเป็น 3 ชนิด อาการแสดงของโรคโกเชร์รวมถึง ตับม้ามโต อาการทางกระดูก และระบบประสาท ส่วนใหญ่คนไทยมักจะเป็นโกเชร์ชนิดที่ 1 และชนิดที่ 3 โดยแรกคลอดจะดูปกติ แต่พออายุ 1-2 ขวบ อาจสังเกตได้ว่าท้องจะมีขนาดใหญ่ขึ้น เนื่องจากตับและม้ามโต พบภาวะซีด เกล็ดเลือดต่ำ โดยทั่วไปแพทย์อาจจะนึกถึงโรคธาลัสซีเมียซึ่งเป็นโรคที่มีอาการใกล้เคียงกันและคนไทยเป็นมากกว่าทำให้ไม่ได้นึกถึงโรคโกเชร์ นอกจากนี้โรคโกเชร์ที่แสดงอาการในเด็ก ส่วนใหญ่เป็นชนิดที่ 3 มีอาการรุนแรงกว่าโรคโกเชร์ที่แสดงอาการในผู้ใหญ่ จึงขอฝากถึงแพทย์ทั่วไปว่าหากตรวจแล้วพบอาการโรคที่ไม่ตรงไปตรงมา ให้สงสัยได้ว่าคนไข้อาจเป็นโรคหายากโรคใดโรคหนึ่ง หรือโรคโกเชร์ ควรส่งต่อให้แพทย์ด้านพันธุกรรมหรือแพทย์โรคเลือด เพื่อนำเข้าสู่กระบวนการวินิจฉัยและรักษาต่อไป
ปัจจุบันสามารถตรวจยืนยันว่าเป็นโรคโกเชร์ ได้ถึง 3 วิธีคือ
1) นำเลือดมาตรวจเอนไซม์เม็ดเลือดขาว โดยโรงพยาบาลรามาธิบดี สามารถตรวจได้ภายใน 2-3 วันก็ทราบผล
2) ตรวจสารในเลือด หรือตรวจ Lyso-Gb1 เป็นสารที่บ่งชี้ว่าเป็นโรคโกเชร์ ซึ่งผู้ป่วยโกเชร์จะมีสารชนิดนี้สะสมอยู่ในเลือด และ
3) ตรวจความผิดปกติของยีนเพื่อยืนยันโรคโกเชร์ ทั้งนี้ หากตรวจพบ 1 ใน 3 หรือ 2 ใน 3 วิธีนี้ก็สามารถยืนยันได้ว่าเป็นโรคโกเชร์ ปัจจุบันแพทย์จะแนะนำให้ครอบครัวที่มีประวัติหรือมีญาติที่ป่วยเป็นโกเชร์ เข้ารับการตรวจเพราะเป็นกลุ่มเสี่ยง เนื่องจากโรคโกเชร์เกิดจากพันธุกรรมจากความผิดปกติของยีนซึ่งมักพบยีนแฝง (หรือพาหะ) ในทั้งพ่อและแม่ จากงานวิจัยในคนไทยตรวจพบคนเป็นพาหะโรคโกเชร์ 1 คน จาก 200 คน หรือคิดเป็น 0.5%
เสียงจากผู้ป่วย “น้องฟาง” กับความฝันที่พร้อมไปต่อ
แม้ปัจจุบัน โรค SMA จะเริ่มเป็นที่กล่าวถึงกันมากขึ้น แต่สำหรับผู้ป่วยและครอบครัวผู้ป่วยยังต้องเผชิญกับอุปสรรคและหนทางอีกยาวไกลเพื่อเดินหน้าสร้างความตระหนักรู้ในโรค SMA ดังเรื่องราวของ “น้องฟาง” ณัฐภากร พรลี้เจริญ ผู้ป่วย SMA Type3 ที่มุ่งมั่นเป็นตัวแทนและเป็นกระบอกเสียงของกลุ่มครอบครัวผู้ป่วย SMA โดยน้องฟางได้เล่าว่า ตอนเด็กๆ ยังสามารถเดินได้ แต่ไม่ปกตินัก เรียกได้ว่าเดินคล้ายเพนกวิน ทางพ่อและแม่ของน้องฟางได้พาไปตรวจหลายครั้ง แต่มองย้อนไปช่วงเวลานั้น โรค SMA ยังไม่เป็นที่รู้จักแพร่หลาย การตรวจวินิจฉัยอย่างชัดเจนและตรงจุดว่าเป็นโรค SMA จึงล่วงเลยไปจนถึงวันที่น้องฟางอายุ 18 ปี
นายแพทย์สุวาณิช เตรียมชาญชูชัย รองประธานเจ้าหน้าที่บริหาร บริษัท โรงพยาบาลวิมุต โฮลดิ้ง จำกัด กล่าวว่า “โรงพยาบาลวิมุต ยังคงมอบบริการด้านสุขภาพแบบองค์รวม พร้อมยกระดับการดูแลรักษาโรคให้ครอบคลุมด้วยศูนย์เฉพาะทางที่เพียบพร้อมด้วยแพทย์ผู้ชำนาญการและนวัตกรรมทางการแพทย์ที่ตอบโจทย์การรักษา เพื่อความปลอดภัยและความอุ่นใจของผู้ใช้บริการ รพ. วิมุต ยังคงเดินหน้ามอบบริการทางการแพทย์ที่มีประสิทธิภาพ ปลอดภัย และสะดวกสบายตอบโจทย์ผู้ใช้บริการเพื่อให้ทันกับยุคสมัยใหม่ที่รองรับการเปลี่ยนแปลงที่เปลี่ยนไป”
“รพ. วิมุต เล็งเห็นว่าเพศชายมีความเสี่ยงต่อหลากหลายโรคที่มีความซับซ้อน โดยเฉพาะเมื่ออายุมากขึ้น ซึ่งภาวะต่อมลูกหมากโต เป็นอีกหนึ่งภัยเงียบที่ส่งผลกระทบต่อการใช้ชีวิตของผู้ชายทั่วโลกอย่างมาก โดยสถิติพบว่าโรคต่อมลูกหมากโต พบได้ถึง 50% ในผู้ชายอายุ 60 ปีขึ้นไป และถึง 80% ในผู้ชายอายุ 70 ปีขึ้นไป เราจึงอยากสร้างความตระหนักรู้ถึงภัยของโรคนี้ที่ถึงแม้ไม่ได้เป็นโรคร้ายแรงจนทำให้เสียชีวิต แต่อาการแทรกซ้อนจากโรคนี้ ทำให้ผู้ชายเสี่ยงต่อการเสียชีวิตได้เช่นกัน ยิ่งข้อมูลจากสำนักงานสถิติแห่งชาติ ชี้ให้เห็นว่า ผู้ชายมีอายุเฉลี่ยที่ 73.5 ปี ในขณะที่ผู้หญิงมีอายุเฉลี่ยถึง 80.5 ปี ซึ่งแน่นอนว่ามาจากหลายปัจจัย แต่หนึ่งในนั้นคือโรคเรื้อรังจากพฤติกรรมและโรคเฉพาะทาง โดยเฉพาะความผิดปกติของต่อมลูกหมากและมะเร็งต่อมลูกหมาก ที่ชายไทยเป็นจำนวนมาก และการเปิดศูนย์ระบบทางเดินปัสสาวะและการเผยนวัตกรรม UROLIFT เพื่อนำมาใช้ในโรงพยาบาลเป็นแห่งแรก ๆ ในประเทศไทยนั้น สอดคล้องกับความตั้งใจของเราในการยกระดับการดูแลรักษาโรคเฉพาะทางให้มีประสิทธิภาพและตอบโจทย์ความต้องการของผู้รับบริการทุกเพศทุกวัย” นายแพทย์สุวาณิช เตรียมชาญชูชัย อธิบาย
ไทยติดเชื้อเพียบ ตายสูงสุดในอาเซียน กลุ่ม 608 ยังเสี่ยงสูง
รองศาสตราจารย์ นายแพทย์ภิรุญ มุตสิกพันธุ์นายกสมาคมโรคติดเชื้อแห่งประเทศไทย เปิดเผยถึงสถานการณ์ของ โควิด-19 และภาระโรคในประชากรกลุ่มเสี่ยงว่า การระบาดของโควิด-19 ยังคงมีอัตราสูง โดยตั้งแต่ต้นปี 2567 จนถึงปัจจุบัน (16 กันยายน 2567) มีผู้ติดเชื้อไปแล้วมากกว่า 7 แสนราย ต้องเข้ารักษาตัวในโรงพยาบาลกว่า 48,000 ราย และเสียชีวิต 205 ราย ถือว่าเป็นสถิติการติดเชื้อและเสียชีวิตสูงสุดในเอเชียตะวันออกเฉียงใต้
“เมื่อเทียบกับไข้หวัดใหญ่ ที่ตั้งแต่ต้นปี 2567 จนถึงปัจจุบัน จำนวนผู้ป่วยประมาณ 490,000 ราย และเสียชีวิต 36 รายแล้ว โควิด-19 ถือว่ามีความรุนแรงที่มากกว่า ทั้งจำนวนผู้ป่วย และเสียชีวิตที่มากกว่าอย่างชัดเจน โดยผู้เสียชีวิตนั้น ร้อยละ 80-90 เป็นผู้อยู่ในกลุ่มเสี่ยงกลุ่ม 608 ซึ่งหมายถึงผู้มีอายุ 60 ปีขึ้นไปและผู้มีโรคประจำตัวเรื้อรัง 7 กลุ่มโรค ได้แก่ โรคทางเดิน หายใจเรื้อรัง โรคหัวใจและหลอดเลือด โรคไตเรื้อรัง โรคหลอดเลือดสมอง โรคมะเร็ง โรคเบาหวานและโรคอ้วน รวมทั้งสตรีมี ครรภ์ด้วย การที่ประชากรส่วนใหญ่ห่างหายจากการฉีดวัคซีนเข็มกระตุ้นไปนาน ถึงแม้หลาย ๆ คนอาจเคยติดเชื้อไปแล้ว แต่ ภูมิคุ้มกันก็อยู่ไม่นาน ประกอบกับเชื้อมีการกลายพันธุ์ไป สาเหตุต่าง ๆ เหล่านี้ อาจทำให้เกิดการติดเชื้อขึ้นในวงกว้าง และส่งผล กระทบต่อกลุ่มเปราะบาง เกิดโรครุนแรงภาวะแทรกซ้อนได้” รศ. นพ.ภิรุญ กล่าว
รศ. นพ.ภิรุญ เผยต่อไปว่ากลุ่มที่กล่าวมาแล้วข้างต้น เมื่อป่วยเป็นโควิด-19 มีความเสี่ยงที่จะป่วยหนักสูงขึ้นประมาณ 2 ถึง 3 เท่า โอกาสเสียชีวิตสูงขึ้นประมาณ 2 ถึง 10 เท่า เมื่อเทียบกับผู้มีอายุน้อยกว่าหรือผู้ที่ไม่ได้มีโรคร่วม “ไม่เพียงแต่เมื่อ ติดเชื้อแล้วจะมีอาการรุนแรงขึ้น แต่ยังส่งผลต่อภาวะโรคที่คนไข้เป็นอยู่ เพราะโควิด-19 ไม่ใช่โรคของทางเดินหายใจเท่านั้น แต่ เป็นโรคที่สามารถมีอาการแสดงได้ในหลายอวัยวะ เนื่องจากเชื้อสามารถแพร่ไปได้ทั่วร่างกาย ก่อให้เกิดภาวะแทรกซ้อนต่อ ระบบอวัยวะต่าง ๆ เช่น ลิ่มเลือดอุดตัน กล้ามเนื้อหัวใจอักเสบ หัวใจล้มเหลว ไตวาย ทำให้เพิ่มความเสี่ยงต่อการเสียชีวิต เพิ่มขึ้น”
นายแพทย์ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก และ บีดีเอ็มเอส เวลเนส รีสอร์ท บริษัท กรุงเทพดุสิตเวชการ จำกัด มหาชน กล่าวว่า
“แม้ว่าโรค NCDs ต่าง ๆ รวมถึงมะเร็งจะสามารถส่งต่อได้ผ่านทางพันธุกรรม แต่ปฏิเสธไม่ได้เลยว่าพฤติกรรมการใช้ชีวิตของเราทุกคน คือหนึ่งในปัจจัยหลักที่สามารถช่วยลดหรือเพิ่มความเสี่ยงของการเกิดโรคมะเร็งได้เช่นเดียวกัน ดังนั้นการป้องกันที่ดีที่สุดคือการปรับเปลี่ยนพฤติกรรมการใช้ชีวิต โดยเริ่มจากการดูแลน้ำหนักตัวให้เหมาะสม รับประทานอาหารที่มีประโยชน์ ออกกำลังกายเป็นประจำ พักผ่อนให้เพียงพอ ไม่สูบบุหรี่และเครื่องดื่มแอลกอฮอล์ รวมถึงจัดการความเครียด ตามหลักเวชศาสตร์วิถีชีวิต (Lifestyle Medicine) อย่างไรก็ตาม เนื่องจากมะเร็งเป็นโรคที่หากไม่มีการตรวจคัดกรอง อาจไม่สามารถทราบถึงรอยโรคในระยะแรกได้ ดังนั้นนอกจากการดูแลสุขภาพอย่างเคร่งครัดแล้ว การตรวจคัดกรองเป็นประจำทุกปีเพื่อให้แพทย์สามารถวางแผนการรักษาได้อย่างทันท่วงทีในกรณีที่ตรวจพบก็เป็นสิ่งที่สำคัญ”
“BDMS Wellness Clinic มุ่งมั่นเป็นส่วนหนึ่งในการลดอัตราการเกิดโรคมะเร็งเต้านม ในปีนี้ เราจึงร่วมมือกับโรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ จัดงาน Voice of Care for Breast Cancer เพื่อมอบความตระหนักรู้เกี่ยวกับการป้องกันการเกิดโรคมะเร็งให้กับทุกคน ตลอดจนส่งมอบบริการการดูแลผู้ป่วยมะเร็งเต้านมครบวงจรในทุกมิติ ตั้งแต่การป้องกัน การตรวจคัดกรอง การวินิจฉัย การรักษา ไปจนถึงการฟื้นฟูดูแลผู้ป่วยหลังการรักษา ซึ่งเป็นส่วนหนึ่งของ Cancer Wellness ด้วยโปรแกรม Breast Cancer Healing มุ่งมั่นที่จะยกระดับคุณภาพชีวิตให้ผู้ป่วยสามารถกลับมาใช้ชีวิตได้อย่างมีคุณภาพที่สุด”
นพ.โสภณ เอี่ยมศิริถาวร ผู้ตรวจราชการกระทรวงสาธารณสุข เขตสุขภาพที่ 2 กล่าวว่า “การประชุมครั้งนี้นับเป็นโอกาสสำคัญในการหารือเกี่ยวกับปัญหาโรคหัวใจและหลอดเลือด ซึ่งเป็นสาเหตุการเสียชีวิตอันดับต้นๆ ของประเทศไทยและทั่วโลก จากข้อมูลสถิติของกรมการแพทย์ กระทรวงสาธารณสุข พบว่าอัตราการเกิดโรคหัวใจและหลอดเลือดมีแนวโน้มเพิ่มขึ้นทุกปี โดยเฉพาะในกลุ่มอายุ 60 ปีขึ้นไป และกลุ่มวัยทำงานที่อายุน้อยลง กระทรวงสาธารณสุขได้ตระหนักถึงความรุนแรงของปัญหานี้ และกำหนดให้เป็นหนึ่งในยุทธศาสตร์หลักของกระทรวงสาธารณสุข โดยเน้นความร่วมมือระหว่างภาครัฐ ภาคเอกชน และสถาบันการแพทย์ ในการสร้างโครงการและนวัตกรรมใหม่ ๆ เช่น การจัดตั้งคลินิกโรคหัวใจล้มเหลว และการพัฒนาแอปพลิเคชันต่างๆ เพื่อเพิ่มประสิทธิภาพการตรวจคัดกรอง ติดตาม และให้คำแนะนำผู้มีปัจจัยเสี่ยงต่อโรคหัวใจและหลอดเลือด ในโอกาสนี้ ขอแสดงความยินดีกับทีมแพทย์และผู้เชี่ยวชาญที่ได้รับรางวัลจากสมาคมโรคหัวใจแห่งสหรัฐอเมริกา เป็นการยืนยันถึงความมุ่งมั่นในการยกระดับมาตรฐานการดูแลผู้ป่วยภาวะหัวใจล้มเหลวอย่างมีประสิทธิภาพและยั่งยืน”
แผ้ว ภิรมย์ ผู้จัดการแคมเปญระบบอาหาร องค์กรพิทักษ์สัตว์แห่งโลก ประเทศไทย กล่าวถึงความสำเร็จของโครงการ “ฟาร์มแชมเปี้ยน” ว่า องค์กรมีเป้าหมายในการสร้างต้นแบบการทำฟาร์มที่เน้นสวัสดิภาพสัตว์เป็นหลัก โดยได้รับการสนับสนุนจากมหาวิทยาลัยเทคโนโลยีสุรนารี และเกษตรกรรายย่อยจาก 11 ฟาร์มใน 6 จังหวัด ซึ่งร่วมกันส่งมอบไก่สายพันธุ์ใหม่จากงานวิจัย คือ
“ไก่โคราช” ให้กับฟาร์มที่เข้าร่วมโครงการ เพื่อทดสอบและพัฒนาแนวทางการเลี้ยงที่ใส่ใจทั้งสวัสดิภาพและความยั่งยืน ช่วยให้สัตว์ เกษตรกร และผู้บริโภคมีความสุขไปพร้อมกัน จากความสำเร็จนี้ องค์กรมีแผนต่อยอดทันที โดยตั้งเป้าขยายผลเพิ่มเป็น 35 ฟาร์มในปีหน้า และขยายไปยังภูมิภาคอื่น ๆ ทั่วประเทศ นอกจากการส่งเสริมฟาร์มที่มีการเลี้ยงไก่ด้วยสวัสดิภาพสูงแล้ว โครงการนี้ยังย้ำแนวคิด "Good Life Standards" ที่มุ่งยกระดับคุณภาพชีวิตของผู้บริโภคให้ดียิ่งขึ้นอีกด้วย
คุณหมอเจี๊ยบ ลลนา ก้องธรนินทร์ คุณหมอผู้สร้างพลังบวก
งานวันนี้ เราพบว่ามีหลากหลายสาขาอาชีพที่น่าสนใจ ฟังพี่พยาบาล แล้วก็ นักรังสีเทคนิค ฯลฯ รู้สึกดีใจแล้วก็ตื่นเต้นแทนน้องๆ เพราะทุกหลักสูตรน่าสนใจไปหมดเลย มีข้อดี มีคุณค่าในแต่ละสาขาอาชีพของตัวเอง อย่างตอนนี้ที่เจี๊ยบคิดว่าเป็นสาขาอาชีพใหม่ ที่น้องๆ รุ่นใหม่ให้ความสนใจกันมากทีเดียว คือ พาราเมดิก หรือ นักฉุกเฉินการแพทย์ เป็นอาชีพที่ออกไปกับรถฉุกเฉิน ไปดูว่ารักษาคนไข้ในจุดเกิดเหตุ แล้วนำกลับมาส่งต่อให้กับทางโรงพยาบาล
มะเร็งเต้านม เป็นได้ ก็รักษาหายได้


นพ. พรสิระ หงสกุล ศูนย์มะเร็ง โรงพยาบาลศิริราชปิยมหาราชการุณย์ คณะแพทยศาสตร์ศิริราชพยาบาล เปิดเผยว่า ปัจจุบันโรคมะเร็งเต้านมเป็นโรคที่เกิดขึ้นในผู้หญิงไทยเป็นจำนวนมาก ไม่ว่าจะจากปัจจัยเสี่ยง อาทิ พันธุกรรม ยาฮอร์โมน หรือการได้รับรังสีก็ตาม แต่อยากให้ทุกคนตรวจด้วยตนเองเป็นประจำทุกเดือน เนื่องจากระยะการเติบโตของโรคนั้นมีลักษณะการเติบโตเป็นเดือน การรอตรวจสุขภาพประจำปีอาจจะช้าและไม่ทันท่วงที ดังนั้น การตรวจด้วยตนเองในทุกเดือนจึงเป็นสิ่งสำคัญ “เมื่อคลำพบสิ่งแปลกปลอมในเต้านมควรพบแพทย์เพื่อตรวจรักษา โดยหากพบว่าเป็นมะเร็งเต้านม และรักษาตั้งแต่ระยะแรกเริ่ม โอกาสในการรักษาหายจะมีสูงมาก ซึ่งปัจจุบัน แนวทางและยาในการรักษามะเร็งเต้านมมีความหลากหลาย ไม่ว่าจะเป็นยาเคมีบำบัด ยามุ่งเป้า หรือว่าการผ่าตัด ขึ้นอยู่กับข้อบ่งชี้ในการรักษาของคนไข้แต่ละคน และมีการนอนพักรักษาในโรงพยาบาลที่สั้นลง แผลเป็นลดลง ทั้งนี้ หากกล่าวถึงการผ่าตัดที่ผู้ป่วยอาจมีความกังวลนั้น นวัตกรรมทางการแพทย์ในปัจจุบัน ผลข้างเคียงจากการรักษาไม่ว่าจะเป็นการผ่าตัดหรือการใช้ยาในการรักษาลดลง โดยผู้ป่วยที่ตรวจพบมะเร็งในระยะเริ่มต้นหรือระยะแรก สามารถรักษาให้หายขาดได้มากกว่า 90%”
ทั้งนี้ บุคลากรทางการแพทย์ที่ได้มาร่วมเผยมุมมองที่หลากหลายเกี่ยวกับปัญหาสุขภาพที่อาจส่งผลกระทบต่อการมีอายุยืนยาวของประชากรในภูมิภาคอาเซียน ประกอบด้วย นางอัญชลี สาสติ อาจารย์อาวุโสของสถาบันบริหารธุรกิจ เอ็มไอที สโลน ศ.นพ.วีรศักดิ์ เมืองไพศาล หัวหน้าสาขาเวชศาสตร์ผู้สูงอายุ ภาควิชาเวชศาสตร์ป้องกันและสังคม คณะแพทยศาสตร์ศิริราชพยาบาล และผศ.นพ.พลกฤต ทีฆคีรีกุล Chief Executive Officer ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ โรงพยาบาลบำรุงราษฎร์ โดยบุคลากรทางการแพทย์เหล่านี้ต่างได้ร่วมกันชี้ให้เห็นถึงความท้าทายในปัจจุบันและแนวโน้มความต้องการของประชากรในอนาคต รวมถึงเผยข้อมูลเชิงลึกที่สำคัญต่อการยกระดับคุณภาพชีวิตของผู้สูงอายุในภูมิภาคนี้
“เถ้าดี Feed สู่ Farm” เป็นการเปลี่ยนขี้เถ้าจากเตาเผาชีวมวลในกระบวนการที่ใช้ไอน้ำของโรงงานผลิตอาหารสุกร สู่ขี้เถ้าสำหรับฆ่าเชื้อแบคทีเรียแทนการใช้ปูนขาวในฟาร์มสุกรของเกษตรกรโครงการคอนแทรคฟาร์มมิ่ง โดยบริษัททำการทดลองและเก็บตัวอย่าง ส่งตรวจวิเคราะห์ผลกับห้องปฏิบัติการ AHDC และทำการทดลองร่วมกับ สำนักงานกรมโรงงานอุตสาหกรรมจังหวัดปราจีนบุรี กระทั่งได้รับใบอนุญาตให้สามารถนำไปใช้ประโยชน์ได้ เป็นเถ้าดีที่ใช้ในฟาร์มต่างๆ ช่วยให้เกษตรกรลดค่าใช้จ่ายในการซื้อปูนขาวได้ถึงกว่า 3 แสนบาทต่อฟาร์ม/ปี
จัดหน่วยเคลื่อนที่ลงพื้นที่ฉีดวัคซีน เขตประเวศ
สำนักอนามัย กรุงเทพมหานคร ได้เร่งตอบสนองต่อการป้องกัน ทันที โดย กำหนดจัดหน่วยสัตวแพทย์เคลื่อนที่ ออกให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สำหรับสัตว์เลี้ยง ในพื้นที่เขตประเวศ บริเวณรอบจุดพบสุนัขติดเชื้อโรคพิษสุนัขบ้า ในช่วงวันที่ 23-28 พฤศจิกายน 2567 จุดต่างๆ ดังนี้
23 พฤศจิกายน 2567 ชุมชนสามัคคีธรรม
23 พฤศจิกายน 2567 ชุมชนเทพรักษา เกาะมุสลิม
23 พฤศจิกายน 2567 แฟลต 1 , 2
23 พฤศจิกายน 2567 หมู่บ้านจัดสรร ชุมชนสามัคคีธรรม
23 พฤศจิกายน 2567 ชุมชนเทพรักษา เกาะมุสลิม
23 พฤศจิกายน 2567 ชุมชนต่อจากคลองสองห้อง
23 พฤศจิกายน 2567 ชุมชนร่วมใจพัฒนา
จดหมายเปิดผนึก (ฉบับที่ 2)
จดหมายเปิดผนึก (ฉบับที่ 2)
กรณีการฟ้องศาลปกครองเกี่ยวเนื่องกับโครงการดูแลอาการเจ็บป่วยเล็กน้อย 16 อาการโดยเภสัชกรร้านยา ในระบบหลักประกันสุขภาพแห่งชาติ
ตามปรากฏเป็นข่าว ทางสื่อมวลชน ต่อกรณี แพทยสภา ฟ้อง สปสช. และสภาเภสัชกรรม เกี่ยวกับโครงการ ดูแลอาการเจ็บป่วยเล็กน้อย 16 กลุ่มอาการ โดยร้านยาคุณภาพ และทางสภาเภสัชกรรมได้ออกจดหมายเปิดผนึก ฉบับแรกในวันที่ 12 พฤศจิกายน 2567 แล้วนั้น ปรากฏว่าได้มีการแสดงความคิดเห็น ให้ข้อมูล จากส่วนต่างๆ ทางสื่อ สังคมออนไลน์อย่างแพร่หลายนั้น สภาเภสัชกรรมในฐานะตัวแทนของผู้ประกอบวิชาชีพเภสัชกรรม พร้อมร่วมหาทางออกในปัญหาความไม่ เข้าใจดังกล่าว ที่ปรากฎในสื่อ และพร้อมให้ความร่วมมือในการพัฒนาบริการสาธารณสุขในระบบหลักประกันสุขภาพ แห่งชาติ เพื่อเพิ่มการเข้าถึงยาและการดูแลสุขภาพของประชาชน ทั้งนี้ สภาเภสัชกรรมขอยืนยัน ข้อเท็จจริงที่สำคัญ เพื่อการสื่อสารที่ถูกต้อง ไม่เกิดความเข้าใจที่คลาดเคลื่อน ดังต่อไปนี้
1. การดำเนินการในโครงการดูแลอาการเจ็บป่วยเล็กน้อย ฯ โดยเภสัชกรในร้านยาคุณภาพ เป็นไปอย่างถูกต้องตามกฎหมาย
แพทยสภา สปสช. และสภาเภสัชกรรม ซึ่งเป็นตัวแทนในคณะกรรมการดำเนินการของ สปสช ได้มีการพูดคุย หารือประเด็นงานบริการดูแลอาการเจ็บป่วยเล็กน้อย ในประเด็นที่แพทย์บางท่านไม่เข้าใจในกฎหมายในส่วนของพระราชบัญญัติยา และบทบาทหน้าที่ของเภสัชกรร้านยา แพทย์หลายท่านมีความเข้าใจ แต่ก็มีบางท่านที่ไม่ได้มาพูดคุยหารือด้วย และไม่เข้าใจ ว่า เภสัชกรจำเป็นต้องชักประวัติเพื่อทราบข้อมูล เพื่อคัดกรองอาการของผู้ป่วย ตามบทบาทหน้าที่ของเภสัชกรตามพระราชบัญญัติยาและพระราชบัญญัติวิชาชีพเภสัชกรรม มิได้เป็นการก้าวล่วงวิชาชีพเวชกรรมแต่อย่างใด โดยก่อนที่จะมีการฟ้องศาลปกครอง แพทยสภา สภาเภสัชกรรม และ สปสปสช. ได้มีการหารือในประเด็นที่ทางแพทยสภามีปัญหาว่า โครงการนี้เป็นการก้าวล่วงวิชาชีพเวชกรรม ซึ่งสภาเกสัชกรรมก็ได้ ชี้แจงว่า การดำเนินการดังกล่าวร้านยามีการดำเนินการมามากกว่า 50 ปีแล้ว ตั้งแต่มีพระราชบัญญัติยา ไม่ได้มีการก้าวล่วงวิชาชีพเวชกรรม การชักประวัติของเภสัชกรเพื่อการเลือกสรรยาที่ถูกต้องกับอาการเจ็บป่วย และเป็นการดำเนินการถูกต้องตามพระราชบัญญัติยา พ.ศ. 2510 และพระราชบัญญัติวิชาชีพเภสัชกรรม พ.ศ. 2537 ซึ่งท้ายสุด นายกแพทยสภายังสรุปว่าก็ไม่น่าจะเป็นการก้าวล่วงวิชาชีพเวชกรรม และก็เป็นการดำเนินการเฉพาะร้านยาคุณภาพที่สภาเภสัชกรรมรับรอง ไม่ใช่ร้านยาทุกร้าน แต่มีกรรมการแพทยสภาท่านหนึ่งเสนอว่า อย่างน้อยก็ อยากให้ขอความเห็นคณะกรรมการกฤษฎีกาจะได้เกิดความชัดเจน ซึ่ง แพทยสภา สภาเภสัชกรรม และ สปสช. ก็ได้ไปชี้แจง ข้อมูลกับคณะกรรมการกฤษฎีกา คณะที่ 10 ท้ายสุดคณะกรรมการกฤษฎีกา คณะที่ 10 ก็ได้มีหนังสือแจ้งกลับมาว่า รับข้อหารือไว้พิจารณา แต่ได้ให้ความเห็นมาว่า เรื่องดังกล่าวเป็นประเด็นปัญหาที่มีความเกี่ยวข้องกับการดำเนินการของผู้ประกอบวิชาชีพเวชกรรมและผู้ประกอบวิชาชีพเภสัชกรรมตามมาตรฐานวิชาชีพของตนภายใต้กรอบกฎหมายของแต่ละวิชาชีพ และการแก้ไขปัญหาดังกล่าว เป็นเรื่องที่กระทรวงสาธารณสุข แพทยสภา สภาเภสัชกรรม และสำนักงานหลักประกันสุขภาพแห่งชาติ จะต้องร่วมกันพิจารณาเกี่ยวกับขอบเขตการดำเนินการของแต่ละวิชาชีพ และเสนอแนวทางแก้ไขที่เหมาะสม เพื่อให้เกิดความร่วมมือในการปฏิบัติงานด้านการแพทย์และสาธารณสุข ถึงประโยชน์สูงสุดและความปลอดภัยของประชาชนเป็นสำคัญ นอกจากนี้ยังได้มีการไปชี้แจงรายละเอียดโครงการฯ ต่อกรรมาธิการสาธารณสุข วุฒิสภา ซึ่งกรรมาธิการสาธารณสุขก็ไม่ได้มีประเด็นอะไร นอกจากนั้นกรรมาธิการยังมีความเห็นว่ายินดี ที่ สปสช.ได้จัดให้มีโครงการดูแลอาการเจ็บป่วยเล็กน้อย 16 อาการ ที่ร้านยา เพราะได้สนใจศึกษาเรื่องการบริการปฐมภูมิมาอย่างต่อเนื่อง และเห็นว่าร้านยามีบทบาทในการให้บริการปฐมภูมิมาตลอด ตอนนี้ได้มีส่วนร่วมในการให้บริการในสิทธิบัตรทอง ก็เป็นสิ่งที่ดี และหลังจากนั้น สภาเภสัชกรรม จึงทราบว่า แพทยสภาได้มีการฟ้อง สปสช.และสภาเภสัชกรรมไปยังศาลปกครอง
นางสาวยูเจีย ผู้จัดการสำนักงานประจำประเทศไทย พร้อม คุณสุทธิดา เกษมสันต์ ณ อยุธยา
นางสาวยูเจีย ผู้จัดการสำนักงานประจำประเทศไทย เผยว่า “โรงพยาบาลมะเร็งสมัยใหม่แสตมฟอร์ดกว่างโจว เป็นโรงพยาบาลขนาดใหญ่ 500 เตียง ตั้งอยู่ที่เมืองกว่างโจว เขตเทียนเหอ ประเทศสาธารณรัฐประชาชนจีน เปิดดำเนินการมาแล้ว 20 ปี เน้นการใช้นวัตกรรมเทคโนโลยีขั้นสูงที่ผ่านรับรองมาตรฐานจาก JCI ประเทศสหรัฐอมเริกา โดยมีแพทย์ผู้เชี่ยวชาญเฉพาะทางด้านการรักษามะเร็งด้วยวิธีบาดแผลเล็กมากถึง 18 วิธี เช่น เทคโนโลยีคีโมเฉพาะจุด เทคโนโลยีความเย็น เทคโนโลยีนาโนไนฟ์ (Nano Knife) และเทคโนโลยีภูมิคุ้มกันบำบัด เป็นต้น ปัจจุบันมีผู้เข้ารับการรักษามะเร็งจากทั่วโลก รวมทั้งผู้ป่วยจากประเทศไทย
ตลอดระยะเวลาที่ผ่านมา นายแพทย์ตนุพลไม่เพียงเป็นแพทย์ที่เปี่ยมไปด้วยประสบการณ์ในการดูแลผู้ป่วยเท่านั้น แต่ยังมุ่งมั่นยกระดับคุณภาพชีวิตของทุกคน ผ่านการมอบความรู้ด้านการวางแผนปรับเปลี่ยนไลฟ์สไตล์ตามหลักเวชศาสตร์วิถีชีวิตให้กับทั้งประชาชนคนไทยและชาวต่างชาติ ผ่านงานเขียนอันโดดเด่นเป็นหนังสือหลายเล่มที่ให้ความรู้ด้านการดูแลสุขภาพเชิงป้องกัน และแนวทางในการดูแลสุขภาพอย่างมีประสิทธิภาพ อีกทั้งยังมอบความรู้ด้านการป้องกันโรคต่าง ๆ โดยเฉพาะโรค NCDs ให้กับทุกคนผ่านช่องทาง YouTube ภายใต้ชื่อ DrAmp Team ที่มีผู้ติดตามกว่า 1 ล้านราย
บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) หรือ BDMS จัดงานงานประชุมวิชาการขึ้นเป็นประจำทุกปี เพื่อการพัฒนาแลกเปลี่ยนความรู้และประสบการณ์ทางวิชาการให้แก่บุคลากรทางการแพทย์ในแต่ละสาขา ร่วมถึงผู้ที่สนใจองค์ความรู้ด้านสุขภาพ โดยในปีนี้ BDMS ACADEMIC ANNUAL MEETING มีแนวคิดหลักคือ A ROAD TO LIFE-LONG WELL-BEING: EP 2 UNLOCK THE HEALTHY LONGEVITY มุ่งเน้นไปที่แนวโน้มการเปลี่ยนแปลงของโลกในด้านต่าง ๆ โดยเฉพาะด้านสิ่งแวดล้อมและด้านประชากร
BDMS Wellness Clinic ในฐานะศูนย์สุขภาพเชิงป้องกันในเครือ บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) หรือ BDMS มุ่งมั่นส่งมอบความรู้ด้านเวชศาสตร์ป้องกัน หรือ Preventive Medicine ให้กับผู้เข้าร่วมงานประชุมให้มีสุขภาพที่ดีอย่างยั่งยืน นำโดย นายแพทย์ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร BDMS Wellness Clinic และ BDMS Wellness Resort บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ร่วมกับ พิธีกรรับเชิญ คุณเคน - นครินทร์ วนกิจไพบูลย์ ที่ได้มาบรรยายภายใต้หัวข้อ New Era Wellness Hub of Thailand และแขกรับเชิญอันทรงเกียรติอีกมากมายที่ได้มาร่วมมอบความรู้ภายในงานตลอดวัน
ศ. ดร.นายแพทย์ ประกิตพันธุ์ ทมทิตชงค์ นายกแพทยสมาคมแห่งประเทศไทย ในพระบรมราชูปถัมภ์ ในฐานะประธานข้อตกลงความร่วมมือในครั้งนี้ กล่าวว่า “สำหรับ Rare Disease MOU ระยะที่ 2 นี้ แพทยสมาคมแห่งประเทศไทยฯ ที่ได้ทำงานร่วมกันกับบุคลากรทางการแพทย์และโรงเรียนแพทย์ จะมุ่งเน้นการวินิจฉัยและการรักษาผู้ป่วยโรคหายากอย่างถูกต้องและรวดเร็ว ผ่านการให้ความรู้แก่กลุ่มแพทย์และนักเรียนแพทย์ พร้อมทั้งให้ได้ศึกษาเคสโรคหายากมากยิ่งขึ้น เพื่อเพิ่มจำนวนแพทย์ผู้เชี่ยวชาญโรคหายากให้กระจายอยู่ทุก ๆ ภูมิภาคทั่วประเทศ และช่วยเพิ่มความตระหนักรู้ให้แก่ประชาชนในพื้นที่ต่าง ๆ ขณะเดียวกันแพทยสมาคมฯ ยังมุ่งผลักดันข้อเสนอเชิงนโยบายด้านโรคหายาก เพื่อยกระดับระบบสาธารณสุขในประเทศให้รองรับผู้ป่วยกลุ่มนี้ได้อย่างมีประสิทธิภาพ”
คำสั่งทางการ : การถอนสหรัฐฯ ออกจากองค์การอนามัยโลก
การถอนสหรัฐฯ ออกจากองค์การอนามัยโลก [source]
ด้วยอำนาจที่มอบให้ข้าพเจ้าในฐานะประธานาธิบดีตามรัฐธรรมนูญและกฎหมายของสหรัฐอเมริกา ข้าพเจ้าจึงสั่งการดังนี้:
มาตรา 1 วัตถุประสงค์ สหรัฐฯ แจ้งการถอนตัวออกจากองค์การอนามัยโลก (WHO) ในปี 2020 เนื่องจากการจัดการขององค์กรเกี่ยวกับการระบาดของ COVID-19 ซึ่งเกิดจากเมืองอู่ฮั่น ประเทศจีน และการจัดการด้านวิกฤตสุขภาพทั่วโลกอื่นๆ ประสบความล้มเหลวในการปฏิรูปที่จำเป็นเร่งด่วน และไม่สามารถแสดงความเป็นอิสระจากอิทธิพลทางการเมืองที่ไม่เหมาะสมของประเทศสมาชิกของ WHO ได้ นอกจากนี้ WHO ยังคงเรียกร้องเงินชดเชยที่ไม่เป็นธรรมจากสหรัฐฯ ซึ่งไม่สมดุลกับเงินชดเชยที่ประเมินแล้วของประเทศอื่นๆ จีนซึ่งมีประชากร 1,400 ล้านคน มีประชากรมากกว่า 300 เปอร์เซ็นต์เทียบกับประชากรสหรัฐฯ แต่มีส่วนสนับสนุน WHO น้อยกว่าเกือบ 90 เปอร์เซ็นต์
มาตรา 2 การดำเนินการ (ก) สหรัฐอเมริกามีเจตนาที่จะถอนตัวออกจากองค์การอนามัยโลก จดหมายของประธานาธิบดีถึงเลขาธิการองค์การสหประชาชาติซึ่งลงนามเมื่อวันที่ 20 มกราคม 2021 ซึ่งเพิกถอนการแจ้งเตือนการถอนตัวของสหรัฐอเมริกาเมื่อวันที่ 6 กรกฎาคม 2020 ถูกเพิกถอน
(ข) คำสั่งฝ่ายบริหาร 13987 ลงวันที่ 25 มกราคม 2021 (การจัดระเบียบและระดมพลรัฐบาลสหรัฐอเมริกาเพื่อให้มีการตอบสนองที่เป็นหนึ่งเดียวและมีประสิทธิผลในการต่อสู้กับ COVID-19 และเพื่อให้สหรัฐอเมริกาเป็นผู้นำด้านสุขภาพและความมั่นคงระดับโลก) ถูกเพิกถอน
(ค) ผู้ช่วยประธานาธิบดีฝ่ายกิจการความมั่นคงแห่งชาติจะจัดตั้งผู้อำนวยการและกลไกการประสานงานภายในกลไกของสภาความมั่นคงแห่งชาติตามที่เขาเห็นว่าจำเป็นและเหมาะสมเพื่อปกป้องสุขภาพของประชาชนและเสริมสร้างความปลอดภัยทางชีวภาพ
(ง) รัฐมนตรีว่าการกระทรวงการต่างประเทศและผู้อำนวยการสำนักงานบริหารและงบประมาณจะต้องใช้มาตรการที่เหมาะสมและรวดเร็วที่สุดเท่าที่จะทำได้ เพื่อ:
(i) ระงับการโอนเงินทุน การสนับสนุน หรือทรัพยากรของรัฐบาลสหรัฐฯ ในอนาคตไปยังองค์การอนามัยโลก
(ii) เรียกตัวและมอบหมายงานใหม่ให้กับบุคลากรหรือผู้รับเหมาของรัฐบาลสหรัฐฯ ที่ปฏิบัติงานในตำแหน่งใดๆ กับองค์การอนามัยโลก และ
(iii) ระบุพันธมิตรที่น่าเชื่อถือและโปร่งใสในสหรัฐฯ และต่างประเทศ เพื่อดำเนินกิจกรรมที่จำเป็นซึ่งองค์การอนามัยโลกได้ดำเนินการไปแล้ว
(จ) ผู้อำนวยการสำนักงานนโยบายการเตรียมพร้อมและตอบสนองต่อการระบาดใหญ่ของทำเนียบขาวจะต้องทบทวน ยกเลิก และเปลี่ยนกลยุทธ์ความมั่นคงด้านสุขภาพระดับโลกของสหรัฐฯ ปี 2024 โดยเร็วที่สุด
นายแพทย์ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก และ บีดีเอ็มเอส เวลเนส รีสอร์ท บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) กล่าวว่า “ประเทศไทยเป็นหนึ่งในประเทศยุทธศาสตร์ด้านธุรกิจท่องเที่ยวที่สำคัญของโลก และมีปัจจัยหลักในการดึงดูดชาวต่างชาติคุณภาพสูงให้เข้ามาพำนักระยะยาว ได้แก่ ธรรมชาติและสิ่งแวดล้อมที่งดงาม อาหารไทยที่มีเอกลักษณ์ วัฒนธรรมไทยและการบริการที่มีคุณภาพ การแพทย์แผนไทยที่ผสานสมุนไพรอย่างมีประสิทธิภาพ และความก้าวหน้าด้านการแพทย์ที่เทียบเท่ามาตรฐานสากล ปัจจัยเหล่านี้ช่วยสร้างความได้เปรียบทางการแข่งขัน และผลักดันให้ประเทศไทยเป็นจุดหมายปลายทางชั้นนำสำหรับการท่องเที่ยวเชิงสุขภาพ ความร่วมมือในครั้งนี้ จะถือเป็นก้าวสำคัญที่จะส่งเสริมภาพลักษณ์ด้านศักยภาพการแพทย์ไทยสู่กลุ่มชาวต่างชาติที่มีกำลังซื้อสูงและมีคุณภาพ ส่งผลให้ประเทศไทยเป็นจุดหมายปลายทางสำคัญสำหรับการท่องเที่ยวเชิงสุขภาพและการพำนักระยะยาว
ปัจจุบัน โลกของเรากำลังก้าวเข้าสู่ยุคสมัยของสังคมผู้สูงอายุอย่างเต็มรูปแบบ (Aged Society) ประกอบกับเทรนด์การดูแลสุขภาพที่ได้เติบโตขึ้นอย่างก้าวกระโดดท่ามกลางคนรุ่นใหม่ ส่งผลให้ผู้คนทั่วโลก หันมาใส่ใจกับการดูแลสุขภาพแบบ Preventive Medicine หรือการป้องกันก่อนเกิดโรคมากขึ้น โดยเฉพาะโรคไม่ติดต่อเรื้อรัง หรือ Non-Communicable Diseases (NCDs) เช่น โรคความดัน โรคเบาหวาน โรคเส้นเลือดในสมองตีบ/แตก/ตัน โรคอ้วน โรคเครียด และโรคมะเร็ง”
บีดีเอ็มเอส เวลเนส คลินิก ในฐานะศูนย์ดูแลสุขภาพเชิงป้องกัน เล็งเห็นโอกาสในการเป็นส่วนหนึ่งที่ช่วยผลักดันประเทศไทย สู่การเป็น Wellness Destination of the World ผ่านการให้บริการการดูแลสุขภาพด้วยหลัก Scientific Wellness และเทคโนโลยีการตรวจสุขภาพเชิงป้องกันที่ทันสมัย ตอบโจทย์ความต้องการด้านการดูแลสุขภาพของคนรุ่นใหม่ในมิติที่หลากหลาย
นอกจากนี้ นายแพทย์ตนุพล กล่าวเพิ่มเติมว่า “ความร่วมมือกับ ไทยแลนด์ พริวิเลจ คาร์ด ในครั้งนี้ ถือเป็นอีกหนึ่งก้าวสำคัญที่จะช่วยผลักดันให้ประเทศไทยมุ่งสู่จุดหมายปลายทางทางด้านการท่องเที่ยวเชิงสุขภาพระดับโลก ผู้ถือบัตร ไทยแลนด์ พริวิเลจ คาร์ด จะสามารถเข้าถึงสิทธิประโยชน์ด้านการดูแลสุขภาพในหลากหลายมิติ เช่น การตรวจสุขภาพระดับเซลล์ การตรวจความยาวเทโลเมียร์เพื่อประเมินอายุเซลล์ การตรวจ Epigenetics เพื่อหาความเสี่ยงในการเกิดโรคต่าง ๆ ในอนาคต การตรวจสมดุลฮอร์โมน วิตามิน แร่ธาตุ และสารต้านอนุมูลอิสระ รวมถึงการออกแบบการดูแลสุขภาพเฉพาะบุคคล (Personalized Medicine) ตามหลักเวชศาสตร์วิถีชีวิต (Lifestyle Medicine) และการปรุงวิตามินเฉพาะบุคคล (Personalized Supplements)”
การปลูกถ่ายอวัยวะ เปรียบเสมือนความหวังใหม่ของผู้ป่วย - รศ.นพ. ทวีสิน ตันประยูร
รศ.นพ. ทวีสิน ตันประยูร ประธานปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ ได้เปิดเผยในงานแถลงข่าว ‘Bumrungrad Transplant Services: Where Life Gets a Second Chance’ ว่า การปลูกถ่ายอวัยวะ เปรียบเสมือนความหวังใหม่และอีกโอกาสที่ทำให้ผู้ป่วยสามารถกลับมามีชีวิตใหม่ที่สมบูรณ์มากขึ้น
รายชื่อศิลปินแสดงวันที่ 7 มีนาคม (3 เวที)
ตารางศิลปินแสดงคอนเสิร์ต งานย่าโม68 ศิลปินเบอร์ใหญ่ทั้งนั้น พลาดไม่ได้
ตารางศิลปินแสดงคอนเสิร์ตงานย่าโม68 วันที่ 23 มีนาคม - 3 เมษายน 2568 ณ บริเวณหน้าศาลากลางจังหวัดนครราชสีมา
- 23 มีนาคม SEK LOSO
- 24 มีนาคม ONLY MONDAY
- 25 มีนาคม PUN / เล็ก รัชเมศฐ์
- 26 มีนาคม TILLY BIRDS
- 27 มีนาคม ตั๊กแตน ชลดา
- 28 มีนาคม BIG ASS
- 29-30 มีนาคม กิจกรรมพิเศษจากจังหวัด
- 31 มีนาคม มนต์แคน แก่นคูณ / ไรอัล กาจบัณฑิต
- 1 เมษายน THREE MAN DOWN
- 2 เมษายน พงษ์สิทธิ์ คัมภีร์
- 3 เมษายน (รอคอนเฟิร์ม)


วันที่ 30 มกราคม 2568 – ส่งต่อสุขภาพดีรับปีใหม่! นายแพทย์ตนุพล วิรุฬหการุญ หรือ คุณหมอแอมป์ ประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก และบีดีเอ็มเอส เวลเนส รีสอร์ท บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ร่วมกับ RoyalLife Wellness Clinic และโรงพยาบาลกรุงเทพอุดร นำทัพสายเฮลตี้เช็กอินจังหวัดอุดรธานี จัดงาน RoyalLife Health Talk ส่งมอบความรู้และแนวทางการดูแลสุขภาพ ภายใต้หลักเวชศาสตร์วิถีชีวิต (Lifestyle Medicine) เดินหน้าสร้างคอมมูนิตี้สุขภาพดีทั่วไทย ณ ศูนย์การค้าเซ็นทรัล อุดร เมื่อวันที่ 28 มกราคม 2568 ที่ผ่านมา โดยมี นายราชันย์ ซุ้นหั้ว ผู้ว่าราชการจังหวัดอุดรธานี นายสยาม ศิริมงคล อธิบดีกรมการพัฒนาชุมชน และ แพทย์หญิง ชนมพรรษ์ กระแสร์ ผู้อำนวยการศูนย์เวชศาสตร์ป้องกัน โรงพยาบาลกรุงเทพอุดร แพทย์หญิงณัฏฐ์นรี บุญศิรภัสสร แพทย์ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน บีดีเอ็มเอส เวลเนส คลินิก ให้เกียรติเข้าร่วมงาน การจัดงานในครั้งนี้ถือเป็นการร่วมมือครั้งสำคัญระหว่างองค์กรในเครือ BDMS ผนึกกำลังกับสภาอุตสาหกรรมจังหวัดอุดรธานีและสำนักงานสาธารณสุขจังหวัดอุดรธานี ถือเป็นก้าวสำคัญในการขับเคลื่อนอุตสาหกรรมการท่องเที่ยวเชิงสุขภาพจังหวัดอุดรธานี หรือ อุดรธานีเวลเนส (Udon Thani Wellness) เพื่อส่งเสริมจังหวัดอุดรธานีสู่ศูนย์กลางแห่งการส่งเสริมสุขภาพและความสมดุลในชีวิต ซึ่งถือเป็นก้าวสำคัญที่ช่วยผลักดัน Wellness Hub Thailand ให้ประเทศไทยขึ้นเป็นท็อป 5 ของ Wellness Destination of the World จุดหมายปลายทางด้านการท่องเที่ยวเชิงสุขภาพระดับโลกอีกด้วย
สำหรับโครงการที่มูลนิธิรามาธิบดีฯ ให้ความสำคัญในปีนี้ ได้แก่ โครงการก่อสร้างอาคารโรงพยาบาลรามาธิบดีและย่านนวัตกรรมโยธี โดยมีเป้าหมายเพื่อเพิ่มศักยภาพในการรักษาพยาบาลผ่านเทคโนโลยีและทีมแพทย์ที่เชี่ยวชาญ พร้อมส่งเสริมการบูรณาการทางการแพทย์สำหรับการวิจัยโรคซับซ้อน สู่การเป็นต้นแบบการรักษาในอนาคต เพื่อสร้างมาตรฐานใหม่ในการดูแลสุขภาพประชาชน โครงการนี้คาดการณ์ว่าจะแล้วเสร็จพร้อมเปิดให้บริการประชาชนในปี 2573
รายละเอียดหนังทั้งหมด
ตารางการรับอาสาสมัคร+รายละเอียดของทุกกิจกรรม
กิจกรรมเด่น
มะเร็งปากมดลูก
มะเร็งปากมดลูกส่วนใหญ่เกิดจาก เชื้อไวรัสชนิดฮิวแมนแปปปิโลมาไวรัส (Human Papillomavirus) หรือ เอชพีวี (HPV) ซึ่งมักจะติดต่อทางเพศสัมพันธ์ โดยจะมีอาการที่เราสังเกตด้วยตัวเองได้ดังนี้
อาการ
โดยอาการในระยะเริ่มต้น จะไม่มีอาการอะไร แต่ให้เราสังเกตตัวเองไปเรื่อย ๆ เพราะจะมีสัญญาณเตือน เมื่อมีเลือดออกผิดปกติทางช่องคลอด โดยเฉพาะมีเลือดออกหลังจากหมดประจำเดือนแล้ว รวมถึงอาการตกขาวอาจจะมีเลือดปน ปวดท้องน้อย หากพบอาการเหล่านี้ให้รีบพบสูตินรีแพทย์เพื่อนวินิจฉัยทันที
เมื่อรู้ว่าเสี่ยง
มีเพศสัมพันธ์ที่อายุต่ำกว่า 20 ปี มีคู่นอนหลายคน หรือ มีประวัติเคยติดโรคทางเพศสัมพันธ์ ควรพบแพทย์เพื่อตรวจหาเชื้อ HPV และการวินิจฉัยในการรับชนิดวัคซีน HPV
อย่าลืมสังเกตอาการ หมั่นตรวจสอบสุขภาพร่างกาย อย่าเขินอายที่จะไปกับแพทย์ ตรวจให้ครบ พร้อมรับวัคซีนเพื่อป้องกันเชื้อ HPV เพื่อลดความเสี่ยงในการเป็นมะเร็งปากมดลูก
คลินิกที่เปิดบริการและวันที่เปิด
คลินิกอายุรกรรมโรคไต - อังคาร พุธ พฤหัสบดี
คลินิกเบาหวาน/ต่อมไร้ท่อ - อังคาร พุธ พฤหัสบดี
คลินิกอายุรกรรมโรคหัวใจ - จันทร์ อังคาร พุธ พฤหัสบดี
คลินิกอายุรกรรมโรคเลือด - พุธ พฤหัสบดี
คลินิกระบบทางเดินอาหาร - อังคาร พฤหัสบดี
คลินิกอายุรกรรม - จันทร์ อังคาร พุธ
คลินิกอายุรกรรมโรคมะเร็ง - พุธ
คลินิกอายุรกรรมโรคปอด - จันทร์ อังคาร พุธ พฤหัสบดี
คลินิกอายุรกรรมระบบประสาท - พุธ
คลินิกผิวหนัง - จันทร์ อังคาร พุธ
คลินิกเลเซอร์ผิวหนัง - พุธ พฤหัสบดี ศุกร์
คลินิกเวชศาสตร์ฟื้นฟู - พุธ
คลินิกหู-คอ-จมูก - จันทร์ อังคาร พุธ
คลินิกจักษุ - จันทร์ อังคาร พุธ พฤหัสบดี
คลินิกกุมารเวชกรรม ทั่วไป - จันทร์ อังคาร พุธ
คลินิกกุมารเวชกรรม (โรคภูมิแพ้) - จันทร์
คลินิกระงับปวด - จันทร์ อังคาร
คลินิกศัลยกรรมระบบประสาท - จันทร์ พุธ
คลินิกศัลยกรรมตกแต่ง - พุธ
คลินิกศัลยกรรมทางเดินปัสสาวะ - จันทร์ อังคาร พุธ
คลินิกศัลยกรรมลำไส้ใหญ่และทวารหนัก - พุธ
คลินิกศัลยกรรมทั่วไป - จันทร์ อังคาร พุธ
คลินิกศัลยกรรมเด็ก - อังคาร
คลินิกศัลยกรรมหลอดเลือด - อังคาร
คลินิกศัลยกรรมกระดูกและข้อ - จันทร์ อังคาร พุธ พฤหัสบดี
คลินิกนรีเวชกรรม - จันทร์ อังคาร พุธ พฤหัสบดี
สินค้า GI ภาพรวม การจำแนกตามภูมิภาค และประเภทสินค้า
ภาพรวม สินค้า GI ในประเทศไทย [
ประกาศขึ้นทะเบียน]
- ข้อมูล ณ ธันวาคม 2567 ประกาศขึ้นทะเบียนสิ่งบ่งชี้ทางภูมิศาสตร์ แล้ว 224 สินค้า ครอบคลุม 77 จังหวัดของไทย จำแนกเป็น มีตราสัญลักษณ์ GI (มีระบบควบคุมคุณภาพแล้ว) 182 สินค้า และมีตรารับรองระบบควบคุมภายนอก 29 สินค้า
- จำแนกตามภาคได้แก่ ภาคเหนือ 54 สินค้า ภาคกลาง 52 สินค้า ภาคตะวันออกเฉียงเหนือ 49 สินค้า ภาคใต้ 47 สินค้า ภาคตะวันออก 22 สินค้า
- จำแนกตามประเภทสินค้า ได้แก่ ข้าว (23) ประมง (13) พืชผักผลไม้ (15) อาหาร (31) ผ้า (16) ไวน์สุรา (2) ปศุสัตว์ (1) หัตถกรรม (23)
- สินค้า GI ไทย ที่ขึ้นทะเบียนในต่างประเทศ จำนวน 8 ประเทศ ได้แก่ สหภาพยุโรป จีน ญี่ปุ่น เวียดนาม กัมพูชา อินเดีย มาเลเซีย อินโดนีเซีย ในสินค้า 15 รายการ
ประกาศขึ้นทะเบียนสิ่งบ่งชี้ทางภูมิศาสตร์ ปี 2568
- 247 ละมุดสุโขทัย 4 กุมภาพันธ์ 2568
- 246 ส้มโอขาวน้ำผึ้งเมืองลอง 9 มกราคม 2568
- 245 ฝรั่งสามพราน วั9 มกราคม 2568
- 244 หอยนางรมท่าโสม 2 มกราคม 2568
- 243 มะม่วงแรดแปดริ้ว 2 มกราคม 2568
- 242 มะม่วงขายตึกแปดริ้ว 2 มกราคม 2568
การสูบบุหรี่ไฟฟ้าในวัยรุ่นหญิง ปัญหาใหญ่ที่ท้าทายสังคมไทย - ศ.นพ.ประกิต วาทีสาธกกิจ
การสูบบุหรี่ไฟฟ้าในวัยรุ่นหญิง ปัญหาใหญ่ที่ท้าทายสังคมไทย
ผมไม่ได้เขียนถึง ปัญหาการใช้ยาสูบของหญิงไทยในวันสตรีสากล 8 มีนาคม มาหลายปีแล้ว เพราะหญิงไทยอายุ 15 ปีขึ้นไป สูบบุหรี่เพียง 1.3% (ปี 2564)
ข้อมูลจาก เครือข่ายรณรงค์ไม่สูบบุหรี่อาเซียน SEATCA ทั่วโลกมีเพศหญิงอายุ 15 ปีขึ้นไป 224 ล้านคนที่สูบบุหรี่มวน 103 ล้านคนที่เคี้ยวยาสูบ และวัยรุ่นหญิงที่สูบบุหรี่ไฟฟ้าน่าจะมีนับล้านคน
ที่น่ากังวลมากที่สุดคือ วัยรุ่นหญิงไทยมีอัตราการสูบบุหรี่ไฟฟ้า เท่ากับหรือสูงกว่าของวัยรุ่นชาย ในหลาย ๆ การสำรวจ คืออยู่ที่ 20-30% สูงกว่าอัตราการสูบบุหรี่มวน ของหญิงไทยวัยผู้ใหญ่มากกว่า 10 เท่า
อันตรายของยาสูบในเพศหญิง มีมากกว่าในผู้ชาย
เพราะหญิงที่สูบบุหรี่ นอกจากเสี่ยงที่จะเป็นโรคต่าง ๆ เหมือนกับที่เป็นในเพศชายแล้ว เพศหญิงยังมีอวัยวะที่เพศชายไม่มี คือมดลูกที่ทำหน้าที่เจริญพันธุ์
นิโคตินจากยาสูบทุกชนิด เป็นอันตรายต่อการตั้งครรภ์ ต่อทารกในครรภ์ และการคลอด แต่แม้พยายามจะ เลิก หญิงที่ตั้งครรภ์จำนวนมากก็เลิกสูบไม่ได้
ในอังกฤษมีข้อมูลว่า ในจำนวนหญิงตั้งครรภ์ 5 แสนคน ในแต่ละปี มี 7.4% ใน ปีค.ศ.2023-2024 หรือเท่ากับ 37,000 คน ที่ไม่สามารถจะเลิกสูบบุหรี่ได้จนถึงวันคลอด แม้จะมีโปรแกรมพิเศษที่ช่วยให้หญิงตั้งครรภ์เลิกสูบบุหรี่
หลักฐานจนถึงปัจจุบัน วัยรุ่นที่เสพติดบุหรี่ไฟฟ้า เสพติดนิโคตินรุนแรงกว่าวัยรุ่นที่สูบบุหรี่มวนและเลิกยากกว่า การปกป้องวัยรุ่นหญิงไทยจากการเสพติดบุหรี่ไฟฟ้า จึงมีความสำคัญยิ่ง
จึงขอร่วมเห็นด้วยกับที่ รศ.ดร.วิทยา กุลสมบูรณ์ กรรมการผู้ทรงคุณวุฒิ สสส. ที่เขียน “บทบาทผู้นำสตรีไทย ในการปกป้องเยาวชนจากบุหรี่ไฟฟ้า” ชื่นชมนายกรัฐมนตรีแพทองธาร ชินวัตร รมต.ประจำสำนักนายก จิราพร สินธุไพร และ รศ.ทวิดา กมลเวชช รองผู้ว่า กทม. ที่แสดงความมุ่งมั่นเอาจริงในการควบคุมบุหรี่ไฟฟ้า
ทำให้เรามีความหวังมาก ที่จะเห็นรัฐบาลแก้ปัญหาบุหรี่ไฟฟ้าอย่างจริงจังต่อเนื่อง เพื่ออนาคตของเด็กไทย โดยเฉพาะเด็กหญิง
ศ.นพ.ประกิต วาทีสาธกกิจ มูลนิธิรณรงค์ เพื่อการไม่สูบบุหรี่ 8 มีนาคม 2568
ปลดล็อกขายเหล้าในสื่อต่างๆ
กองทัพบก ส่งกำลังพล ช่วยเหลือเหตุเพลิงไหม้ รพ.รามาธิบดี
เมื่อวันที่ 11 มีนาคม 2568 เวลา 20.30 น. กำลังพลจิตอาสาพระราชทานจาก ส.พัน.12 และ พัน.สห.11 ได้เข้าปฏิบัติภารกิจช่วยเหลือเหตุเพลิงไหม้ภายในอาคาร 9 ชั้นของโรงพยาบาลรามาธิบดี โดยให้การสนับสนุนภารกิจดังนี้ ✅ อำนวยความสะดวกด้านการจราจร ร่วมกับเจ้าหน้าที่ตำรวจ สน.พญาไท ✅ จัดจุดจอดรถชั่วคราว เพื่อรองรับผู้มารับบริการ ✅ ช่วยเหลือผู้ป่วยและประชาชน ในพื้นที่โรงพยาบาล ✅ สนับสนุนเจ้าหน้าที่พยาบาล ในการเคลื่อนย้ายผู้ป่วยไปยังพื้นที่ปลอดภัย ภารกิจดำเนินไปด้วยความเรียบร้อย กองทัพบกยังคงพร้อมสนับสนุนการช่วยเหลือประชาชนในทุกสถานการณ์1 ตุลาคม วันผู้สูงอายุสากล International Day of Older Persons
องค์การสหประชาชาติ เป็นผู้กำหนดให้ทุกวันที่ 1 ตุลาคม ของทุกปี เป็น
“วันผู้สูงอายุสากล” หรือ
“International Day of Older Persons” โดยกำหนดขึ้นเป็นครั้งแรกในวันที่ 1 ตุลาคม ค.ศ. 1991 หรือ พ.ศ. 2534 พร้อมให้ความหมายของคำว่า “ผู้สูงอายุ” ว่า คือบุคคลที่มีอายุตั้งแต่ 60 ปี ขึ้นไปทั้งชายและหญิง แบ่งเป็น 2 กลุ่มคือ ผู้สูงอายุตอนต้น คือ บุคคลที่มีอายุ 60-69 ปี ทั้งชายและหญิง และผู้สูงอายุตอนปลาย คือ บุคคลที่มีอายุ 70 ปี ขึ้นไปทั้งชายและหญิง [
โรงพยาบาลบุรีรัมย์]
1 ตุลาคม 65 เยาวชนเสพกัญชา / เปิดผลวิจัยกัญชา
เยาวชนเสพกัญชา
- ความคืบหน้ากรณีเพจสมาคมสื่อมวลชนนครศรีธรรมราช เผยแพร่คลิปภาพกลุ่มนักเรียนมัธยมชื่อดังแห่งหนึ่งนั่ง รวมกลุ่มกันเสพกัญชา แชร์ในโลกโซเชียล ล่าสุด นายสมพงษ์ ปานหงษ์ ผู้อำนวยการโรงเรียนโยธินบำรุง อ.เมือง จ. นครศรีธรรมราช กล่าวว่า ได้พูดคุยทำความเข้าใจกับทั้งเด็ก ผู้ปกครอง และทุกฝ่ายที่เกี่ยวข้อง และจะเพิ่มมาตรการการดูแล ให้เข้มข้นกว่าเดิม ซึ่งเด็กยอมรับว่าอยากลองตามธรรมดาของเด็กวัยนี้ทุกฝ่ายต้องช่วยกันแก้ปัญหา ขอความร่วมมือทุกฝ่าย ช่วยเป็นหูเป็นตากับโรงเรียนด้วย ส่วนบรรยากาศภายในโรงเรียนยังคงมีการเรียนการสอนตามปกติจากการสอบถามเพื่อน นักเรียนส่วนใหญ่เห็นว่าเป็นการทดลอง เพราะอยากรู้มากกว่าที่จะตั้งใจเสพแต่บังเอิญว่ามีคนเห็น
เปิดผลวิจัยกัญชา
- งานวิจัยในปี 2554 เสนอผ่านวารสารการเสพติดยาและแอลกอฮอล์ Drug and Alcohol dependence เป็นงานวิจัยที่ ศึกษากลุ่มประชากรขนาดใหญ่ โดยสำรวจตัวอย่างผู้สูบบุหรี่ 15,918 คน, แอลกอฮอล์ 28,907 คน และกัญชา 7,389 คน พบว่า นับตั้งแต่ใช้ครั้งแรกจะมีโอกาสเสพติดบุหรี่สูงสุด 67.5%, ดื่มเหล้ามีโอกาสติดสูงสุด 22.7% ส่วนกัญชาจะมีโอกาสติด สูงสุดเพียง 8.9% ซึ่งน้อยกว่าการติดเหล้า 2.5 เท่าตัว และน้อยกว่าบุหรี่ 7.5 เท่าตัว อีกทั้งเหล้า บุหรี่สามารถซื้อขายได้ตาม ร้านค้าทั่วไป และร้านสะดวกซื้อ แม้กัญชาและสุราจะทำให้มึนเมา ออกฤทธิ์ทางจิตประสาทได้เหมือนกัน แต่ออกฤทธิ์ตรงกัน ข้าม หากบริโภคเกิน กัญชาจะทำให้เมาเย็น เกิดความหวาดกลัว และทำให้หลับ แต่สุราทำให้เมาร้อน จึงมีโอกาสที่จะทำให้ เกิดการทะเลาะวิวาทได้ง่าย และมีโอกาสก่ออาชญากรรมได้มากกว่าการเมากัญชา นอกจากนี้กัญชายังอาจมีส่วนช่วยลดการดื่มแอลกอฮอล์ได้ด้วย โดยงานวิจัยของแคนาดาตีพิมพ์ในเว็บไซต์ Sciencedirect ฉบับเดือนธันวาคม พ.ศ. 2563 พบว่าผู้ที่ใช้กัญชาทางการแพทย์ในแคนาดานั้น มีแนวโน้มที่จะลดการดื่มสุรา ลงด้วย ตรงกับการอภิปรายในการประชุมคณะกรรมาธิการวิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.. สภาผู้แทนราษฎร ที่พบว่ากรรมาธิการฯ ผู้ที่ใช้ประโยชน์จากกัญชาลดการดื่มแอลกอฮอล์ลงอย่างชัดเจน จึงเป็นที่น่าสงสัยว่า แพทย์บางคนที่เป็น กรรมการในบริษัทขายเหล้าและเบียร์ จึงออกมาต่อต้านกัญ2 ตุลาคม 65 The straitstimes เผยแพร่บทสัมภาษณ์ รมว.สธ.ประเด็นกัญชา
- The straitstimes สื่อชื่อดังของประเทศสิงคโปร์ เผยแพร่บทสัมภาษณ์ของนายอนุทิน ชาญวีรกูล รองนายกฯ และ รมว.สธ. เกี่ยวกับการเดินหน้านโยบายกัญชาทางการแพทย์ว่า ยังยืนยันจุดยืนเรื่องการใช้เพื่อการแพทย์ สำหรับสารสกัดที่มี ค่า THC สูงกว่า 0.2% จึงเป็นสิ่งที่ผิดกฎหมาย ส่วน พ.ร.บ.กัญชา ที่ถูกส่งเข้าไปพิจารณาในสภา ได้ถูกตีกลับให้มาพิจารณา ใหม่ ด้วยข้ออ้างว่ามีการควบคุมการใช้ที่ยังไม่เพียง ซึ่งนายอนุทินให้คำตอบกับเรื่องนี้ว่า “มันเป็นเรื่องของการเมือง”Thailand Coffee Hub 2024 @เซ็นทรัลเวิลด์ 2 - 8 ต.ค. 2567
งาน Thailand Coffee Hub ที่คนรักกาแฟรอคอย ในธีม Coffee Universe “จักรวาลกาแฟที่ใหญ่ที่สุดใจกลางเมือง” 2-8 ตุลาคม 2567 ชั้น 1-3 (เต็มพื้นที่) ศูนย์การค้าเซ็นทรัลเวิลด์ ชวนคนกาแฟ มาท่องประสบการณ์กาแฟที่ไม่เหมือนใคร ตื่นตาตื่นใจไปกับบูทจากร้านกาแฟพิเศษชั้นนำ คัดสรรมาจากทั่วไทยและต่างประเทศ
3 ตุลาคม 65 เกษตร MOU จุฬา ความร่วมมือทางวิชาการกัญชา กัญชง
- นางสาวมนัญญา ไทยเศรษฐ์ รมช.เกษตรและสหกรณ์ เปิดเผยภายหลังเป็นประธานพิธีอ่านสารเนื่องในโอกาสวัน สถาปนากรมวิชาการเกษตร ครบรอบ 50 ปี พร้อมเป็นสักขีพยานการลงนามความร่วมมือทั้ง 2 ประเด็นสำคัญ ว่า ได้บันทึก ข้อตกลงความร่วมมือการพัฒนาโครงการที่เกี่ยวข้องกับการจัดการก๊าซเรือนกระจก ร่วมกับองค์การบริหารจัดการก๊าซเรือน กระจก และความร่วมมือทางวิชาการกัญชา กัญชง เพื่อประโยชน์ในทางการแพทย์และเชิงพาณิชย์อย่างครบวงจรร่วมกับ จุฬาลงกรณ์มหาวิทยาลัย ถือเป็นจุดเริ่มต้นที่ดีจะพัฒนาประเทศสู่การเป็นผู้นำความเป็นเลิศทางวิชาการของเอเชีย สู่การ สร้างโอกาสทางเศรษฐกิจและสร้างรายได้ให้แก่ประเทศในอนาคตต่อไปThailand International Pet Variety Exhibition 2024 (3 – 6 ตุลาคม 2567)
SmartHeart presents Thailand International Pet Variety Exhibition สถานที่ อาคาร 7-8 อิมแพ็ค เมืองทองธานี วันแสดงงาน 3 – 6 ตุลาคม 2567 เวลา 10:00 น. – 20.00 น.
4 ตุลาคม 65 หนุนร่างฯ พ.ร.บ.กัญชา
-สมาคมวิจัยแห่งประเทศไทย เครือข่ายวิสาหกิจชุมชนพืชสมุนไพรทางการแพทย์เพื่อสังคม สมาคมอุตสาหกรรมกัญชา กันชง กลุ่มสายเขียว และสมาคมแพทย์แผนไทยแห่งประเทศไทย ยื่นหนังสือสนับสนุนร่าง พ.ร.บ. กัญชา กัญชง (ฉบับที่...) พ.ศ. ... ต่อนายชวน หลีกภัย ประธานสภาผู้แทนราษฎร ผ่าน นพ.สุกิจ อัถโถปกรณ์ ที่ปรึกษาประธานสภาผู้แทนราษฎร และ นายศุภชัย ใจสมุทร ส.ส.บัญชีรายชื่อ พรรคภูมิใจไทย (ภท.) ประธานกรรมาธิการวิสามัญพิจารณาร่างพ.ร.บ.กัญชาฯ รวมถึง เรียกร้องให้ทางสภาพิจารณาให้ร่าง พ.ร.บ.ฉบับดังกล่าวผ่านวาระ 2 และ 3 รวมถึงให้ผ่านที่ประชุมวุฒิสภาและมีการ ประกาศใช้เป็นกฎหมาย
-นายศุภชัย ใจสมุทร ประธานคณะกรรมาธิการ พิจารณาร่าง พ.ร.บ. กัญชา กัญชง พ.ศ.... เผย หลังจากที่ประชุมสภา มีมติให้ถอนร่าง พ.ร.บ.กัญชาฯ ออกจากวาระการประชุมสภา ทาง กมธ.ได้มีการประชุมครั้งสุดท้าย หลังจากที่ได้รับประเด็น ข้อสงสัย และข้อห่วงใยจากพรรค ปชป. และพรรค พท. ซี่งจากที่พิจารณาประเด็นเหล่านั้น พบสิ่งที่ห่วงใยไม่ได้อยู่ นอกเหนือจากในร่าง พ.ร.บ.ที่นำเสนอต่อสภาฯ อย่างน้อยแสดงให้เห็นว่าไปในทิศทางเดียวกัน ทั้งนี้ หวังว่าหลัง กมธ.ทบทวน และนำเสนอเข้าสู่สภาฯ อีกครั้ง ทางสภาฯ จะบรรจุเป็นระเบียบวาระ แล้วจะพิจารณาให้เสร็จสิ้นโดยเร็ว5 ตุลาคม 65 นำส่งด่วน เด็กหญิงอายุ 1 ปี ล้มศีรษะกระแทกพื้นมีอาการชักเกร็ง จาก อ.อมก๋อย มารักษาที่รพ.นครพิงค์
5 ตุลาคม 2565 เวลา 11.38 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนันสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยเด็กหญิง อายุ 1 ปี หกล้มศรีษะกระแทกพื้น หลังจากนั้นมีอาการชักเกร็ง อาเจียน1 ครั้ง
ทีมแพทย์วินิจฉัย การบาดเจ็บที่ศีรษะระดับปานกลางร่วมกับอาการชัก (Moderate Head Injury With Seizure) เพื่อส่งผู้ป่วยจากโรงพยาบาลส่งเสริมสุขภาพตำบลบ้านอูตูม ตำบลนาเกียง อำเภออมก๋อย จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์เชียงใหม่ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก ขอสนับสนุนอากาศยาน และนักบิน ประเภทอากาศยานเฮลิคอปเตอร์ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศจากโรงพยาบาลนครพิงค์เชียงใหม่ จังหวัดเชียงใหม่
การลำเลียงผู้ป่วยลุล่วงด้วยดีขณะนี้ผู้ป่วยอยู่ในความดูแลของทีมแพทย์รพ.นครพิงค์แล้ว
ขอขอบคุณ สำนักงบประมาณ กระทรวงสาธารณสุข สถาบันการแพทย์ฉุกเฉินแห่งชาติ -สพฉ.1669 กองบัญชาการกองทัพไทย กองทัพบก Royal Thai Army กองทัพบก โรงพยาบาลนครพิงค์ @โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านอูตูม โรงพยาบาลนครพิงค์ หน่วยงานภาคีเครือข่ายที่เกี่ยวข้อง
5 ตุลาคม 65 พ.ร.บ.กัญชา กัญชง พ.ศ....
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า ต้องขอความเมตตาจากประธานสภาฯ ให้บรรจุร่างกฎหมาย พ.ร.บ.กัญชา เข้าสู่การพิจารณา ได้แก้ไขตามข้อกังวล เนื้อหาล้วนอยู่ใน กม.ฉบับเดิมหมด จึงไม่มีเรื่องให้ต้องล่าช้า MOU วิจัยและพัฒนาสายพันธุ์กัญชา-กัญชง สื่อนำเสนอ : เว็บไซต์(สยามรัฐ, hooninside, bluechipthai) - ซาลัส ไบโอซูติคอล ลงนาม MOU ร่วมกับกรมวิทยาศาสตร์การแพทย์ และวิสาหกิจชุมชน เร่งวิจัยและพัฒนาสายพันธุ์ กัญชา-กัญชงให้เป็นที่ยอมรับทั้งในประเทศและต่างประเทศ ตั้งแต่การปลูก คัดเลือกสายพันธุ์และการสกัด ต5-8 ตุลาคม : West Side Story
West Side Story
Main Hall, Thailand Cultural Centre
Date and Time :
• Thursday 5 October 2023 at 7:00 PM
• Friday 6 October 2023 at 7:00 PM
• Saturday 7 October 2023 at 2:30 PM
• Saturday 7 October 2023 at 7:00 PM
• Sunday 8 October 2023 at 7:00 PM
• Sunday 8 October 2023 at 2:30 PM
Ticket Price : 5,000 / 4,000/ 3,500/ 2,700/ 1,800 THB
ละครเพลงบรอดเวย์คลาสสิกยอดฮิต West Side Story ที่จะมาจัดการแสดงที่ไทยเพียง 6 รอบเท่านั้น! เรื่องราวความรักท่ามกลางความขัดแย้งของสองแก๊งคู่อริต่างเชื้อชาติแห่งนครนิวยอร์ก เมื่อโทนี่ หนุ่มหล่อแห่งแก๊ง Jets กับ มาเรีย สาวสวยเปอร์โตริกันแห่งแก๊ง Sharks บังเอิญมาตกหลุมรักกันจนเกิดเป็นโศกนาฏกรรมครั้งใหญ่
ผลงานของสี่ตำนานแห่งบรอดเวย์ ที่ได้แรงบันดาลใจมาจากตำนานรักสุดสะเทือนใจอย่าง Romeo & Juliet เปิดแสดงครั้งแรกใน ค.ศ. 1957 และถูกหยิบยกขึ้นมาทำใหม่หลายต่อหลายครั้งทั้งในรูปแบบละครและภาพยนตร์
โดยโปรดักชั่นใหม่ล่าสุด ที่ใช้ท่าเต้นฉบับดั้งเดิมของ Jerome Robbins นี้ เลือก กรุงเทพฯ เป็นหนึ่งในจุดหมายแรกที่เปิดการแสดง และมาพร้อมกับโปรดักชั่นเต็มรูปแบบ คณะนักแสดงจากอเมริกา และทีมงานมากประสบการณ์จากนิวยอร์ก ทั้งผู้กำกับเจ้าของรางวัลเอมมี่ อย่าง Lonny Price และนักออกแบบท่าเต้น Julio Monge ที่เป็นที่ปรึกษาฝ่ายศิลป์ให้กับเวอร์ชั่นภาพยนตร์โดย Stephen Spielberg อีกด้วย
วันที่ 5 ตุลาคม 2566 เวลา 19.00 น.
วันศุกร์ที่ 6 ตุลาคม 2566 เวลา 19.00 น.
วันเสาร์ที่ 7 ตุลาคม 2566 เวลา 14.30 น. และ 19.00 น.
วันอาทิตย์ที่ 8 ตุลาคม 2566 เวลา 14.30 น. และ 19.00 น.
สนับสนุนโดย สถานเอกอัครราชทูตสหรัฐอเมริกา
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
SmartHeart presents Thailand International Pet Variety Exhibition 5-8 ตุลาคม 2566
SmartHeart presents Thailand International Pet Variety Exhibition ครั้งที่ 13 วันที่ 5-8 ตุลาคม 2566 อาคาร 7-8 อิมแพ็ค เมืองทองธานี เวลา 10.00 - 20.00 น. มหกรรมคนรักสัตว์เลี้ยงอันดับ 1 ของประเทศไทย กับงานที่ทุกคนรอคอย พบกับสินค้าและบริการสำหรับสัตว์เลี้ยงทุกรูปแบบ ตั้งแต่อาหาร ของใช้ แฟชั่น ของเล่น บริการตัดขน บริการตรวจสุขภาพสัตว์เลี้ยงฟรี! รวมถึงบริการอื่นๆอีกมากมาย ในราคาสุดพิเศษ กว่า 200 บูธ อีกทั้งขอชวนสายคอนเทนต์...พาเหล่าสัตว์เลี้ยงที่มาบ้านมาลุยกับกิจกรรมแข่งขันสนุกๆอย่าง แข่งขันกินขนม “แมวเลีย” และ แข่งวิ่ง “มาหาแม่มา” ที่ได้รับความนิยมเป็นอย่างมาก ที่สำคัญไม่เสียค่าสมัคร!
สำหรับแฟนคลับสัตว์แปลก (Exotic Pets) สามารถแวะมาถ่ายรูปพร้อมสัมผัสเหล่าสัตว์แปลกกันได้อย่างใกล้ชิด พร้อมกับปีนี้เป็นปีแรกกับเวที การประกวดไก่ และ ประกวดนกหงษ์หยก จากทางสมาคมฯ
ไทยแลนด์ เบบี้ แอนด์ คิดส์ เบสท์ บาย ครั้งที่ 53 วันที่ 5-8 ตุลาคม 2566 อิมแพ็ค
งาน Thailand Baby & Kids Best Buy ครั้งที่ 53 หรือที่รู้จักกันทั่วไปในชื่องาน BBB ศูนย์รวมสินค้าแม่และเด็กล้วน ๆ นับล้าน ๆ รายการ นับเป็นงานมหกรรมแสดงสินค้าและบริการสำหรับแม่และเด็กที่ยิ่งใหญ่ที่สุดในประเทศไทย มีผู้เข้าร่วมงานมากที่สุด มีสินค้าและบริการหลากหลายที่สุด มียอดการจับจ่ายในงานสูงที่สุด และมีชื่อเสียง เป็นที่รู้จักของพ่อแม่นักช็อปอย่างแพร่หลายที่สุดในประเทศไทย ช็อปสนุก จัดเต็ม ส่วนลดสูงสุดถึง 90% พร้อมสนุกสนานกับกิจกรรม "Baby กะดึ๊บ กะดึ๊บ" กิจกรรมแข่งคลานสำหรับน้อง ๆ หนู ๆ วัย 6-12 เดือน ตื่นเต้นเร้าใจไปกับกิจกรรม "Baby บะรื๊น บะรื๊น" กิจกรรมแข่งซิ่งความเร็ว ทั้งรุ่นรถหัดเดิน และ รถขาไถ สำหรับน้อง ๆ หนู ๆ วัย 1-2 ปี และดุ๊กดิ๊กไปกับความน่ารักใน "Baby แดนซ์ แดนซ์" กิจกรรมสำหรับนักเต้นเท้าไฟรุ่นจิ๋ว วัย 1-3 ปี แล้วพบกันที่งาน Thailand Baby & Kids Best Buy ครั้งที่ 53 วันที่ 5-8 ตุลาคม 2566 ที่อิมแพ็ค เมืองทองธานี ชาเลนเจอร์ ฮอลล์ 3
เดิน วิ่ง ปั่น เพื่อน้อง หลวงพ่อคูณมินิมาราธอนครั้งที่ 15 วันที่ 5 ตุลาคม 2567 LINK
โครงการ "หลวงพ่อคูณมินิมาราธอนครั้งที่ 15" เดิน วิ่ง ปั่น เพื่อน้อง ในวันที่ 5 ตุลาคม 2567 ที่บริเวณด้านหน้าเทศบาลด่านขุนทด การวิ่งมี 2 ประเภท ได้แก่ ประเภทที่ 1 ฟันรันระยะทาง 5 กิโลเมตร ในระยะนี้จะแบ่งออกเป็นการวิ่งและแฟนซีโดยแบ่ง เป็นหลายช่วงอายุ ส่วนประเภทที่ 2 เป็นการวิ่งมินิมาราธอน ระยะทาง 10.5 กิโลเมตร แบ่งกันวิ่งแยกชายหญิงและหลายช่วงอายุ ผู้สูงอายุ 70 ปีขึ้นไป วิ่งเพื่อสุขภาพ ไม่มีค่าสมัคร และยังมีกิจกรรมที่สำคัญ คือการเดิน 3 กิโลเมตร และการปั่นจักรยาน 30 กม. สำหรับกิจกรรมดังกล่าวจะจัดขึ้น กำหนดการ
- เวลา 05.30 น. พิธีเปิด
- 05.45 ปล่อยตัว 10.5 km
- 06.00 ปล่อยตัว 5 km
- 06.15 ปล่อยตัวปั่นจักรยาน
- 06.30 ปล่อยตัวเดินเพื่อสุขภาพ
รายได้จะนำไปช่วยเหลือนักเรียนที่ประสบเหตุหรือประสบภัยต่างๆ และซ่อมแซมบ้านพักนักเรียนที่ผุพัง โดยโรงเรียนในสังกัดสำนักงานเขตพื้นที่มีทั้งหมด 208 แห่งครอบคลุม 6 อำเภอคือ ด่านขุนทด เทพารักษ์ โนนไทย พระทองคำ ขามทะเลสอ และขามสะแกแสง
6 ตุลาคม 65 กัญชาทางการแพทย์
กัญชาทางการแพทย์
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. รับมอบชุดตรวจ Test Kann (เทส กัญ) จากกรมวิทยาศาสตร์การแพทย์ จำนวน 12,000 ชุด รู้ผลใน 15 นาที ส่งต่อให้ทุกเขตสุขภาพใช้ตรวจ THC ในสารสกัดและน้ำมันกัญชาเกิน 0.2% หรือไม่ ช่วยคุ้มครองผู้บริโภคให้ปลอดภัยจากการใช้ผลิตภัณฑ์สารสกัดและน้ำมันกัญชา มุ่งหวังให้คนที่ทำสารสกัดหรือน้ำมันกัญชานำ ชุดทดสอบมาใช้เพื่อปรับปรุงผลิตภัณฑ์ให้ถูกกฎหมาย ทั้งนี้เป็นการตรวจสอบเบื้องต้น ไม่สามารถใช้ทางคดีได้
- นพ. ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วยรัฐมนตรีประจำสำนักนายกรัฐมาตรี ประชุมคณะกรรมการขับเคลื่อนนโยบายกัญชา เสรีทางการแพทย์ เพื่อติดตามความก้าวหน้าการดำเนินงานและผลกระทบที่สังคมมีความกังวล โดยกรมการแพทย์ได้นำเสนอ ข้อมูลผู้ป่วยที่ได้รับพิษเฉียบพลันจากกัญชา พบว่า ก่อนการปลดกัญชาออกจากรายการยาเสพติด จำนวนผู้ป่วยที่เกิดพิษ เฉียบพลันจากกัญชาไม่ได้มีจำนวนเพิ่มขึ้นอย่างมีนัยสำคัญ และยังไม่พบผู้ป่วยที่เสียชีวิตจากพิษเฉียบพลัน ผู้ป่วยร้อยละ 81 อาการดีขึ้นหลังรักษา นอกจากนี้จากการทบทวนข้อมูลทางวิชาการในต่างประเทศ เช่นแคนาดา พบกัญชามีประโยชน์กว่ายา เสพติดหลายชนิด จึงจัดกัญชาเป็น soft drug ทั้งนี้ที่ประชุมมีข้อสรุป เร่งดำเนินการ 4 เรื่อง คือ การสื่อสารสร้างความเข้าใจ จากข้อเท็จจริงอย่างรอบด้าน การวิจัยเพื่อสนับสนุนยาและผลิตภัณฑ์กัญชา การเข้าถึงการใช้ทางการแพทย์ของผู้ป่วย และ การควบคุมกำกับที่เหมาะสมตามหลักวิชาการและวิถีชีวิต
- รศ.นพ.ชวนันท์ ชาญศิลป์ นายกสมาคมจิตแพทย์แห่งประเทศไทย ยื่นหนังสือถึงสำนักงานว่าด้วยยาเสพติดและ อาชญากรรมแห่งสหประชาชาติ หรือ UNODC เรื่องการควบคุมกัญชาในประเทศไทย โดยระบุว่า มีข้อกังวลเรื่องการปลดล็อก กัญชาออกจากบัญชียาเสพติด ที่พบว่ามีการใช้กัญชาในลักษณะอื่น ๆ มากขึ้น และอาจสร้างปัญหาให้กับสังคมได้จึงมายื่น หนังสือกับ UNODC ที่มีความเชี่ยวชาญด้านการใช้ยาเสพติด และสามารถให้คำแนะนำที่เหมาะสมกับคณะกรรมาธิการ หรือ หน่วยงานที่เกี่ยวข้องในการตีกรอบกฎหมายให้เหมาะสมได้โรงพยาบาลพุทธโสธร รับสมัคร ผู้ช่วยแพทย์แผนไทย 5 อัตรา LINK
โรงพยาบาลพุทธโสธร รับสมัคร ผู้ช่วยแพทย์แผนไทย 5 อัตรา
เพศชาย/หญิง อายุ 20-55 ปี
ผ่านการอบรมหลักสูตร ผู้ช่วยแพทย์แผนไทย 330 ชม. / 370 ชม. (จากสถาบันที่ผ่านการรับรองจากสภาการแพทย์แผนไทย)
ลักษณะงาน ให้บริการนวดและประคบเพื่อการส่งเสริมสุขภาพ ป้องกันโรค ตามความรู้ที่ผ่านการอบรม และงานอื่น ๆที่ได้รับมอบหมาย
ค่าตอบแทน แบ่งตามเปอร์เซนต์
สอบถามโทร. 038-814375 - 78 ต่อ 1300 1301
ฮ.Bell 212 บินรับชายต่างด้าว 73 ปี หายใจลำบากจากแม่สะเรียง ส่งรพ.ศรีสังวาลย์
6 ตุลาคม 2566 เวลา 09.12 น.สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายต่างด้าว อายุ 73 ปี มีอาการหายใจเหนื่อยหอบ ไม่ทราบโรคประจำตัว, อัตราการหายใจ(RR) 24 ครั้ง/นาที, ความเข้มข้นออกซิเจนภายในเลือด(O2Sat) 93% วินิจฉัย ภาวะหายใจลำบาก (Respiratory distress) เพื่อส่งผู้ป่วยจากโรงพยาบาลส่งเสริมสุขภาพตำบลปอหมื้อ ตำบลแม่คง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ไป โรงพยาบาลแม่สะเรียง ตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานงานกับกองทัพบก เพื่อขอสนับสนุนอากาศยานโดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212
ชุดปฏิบัติการลำเลียงทางอากาศโดยทีมโรงพยาบาลศรีสังวาลย์
ฮ.Bell 212 บินรับชายไทย 32 ปี ภาวะช็อกจากการติดเชื้อ ส่งรพ.แม่สะเรียง
6 ตุลาคม 2566 เวลา 09.46 น.สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 32 ปี มาด้วยอาการหนาวสั่น ปวดศีรษะ อาเจียน มีอาการไข้สูง 39.5 องศาเซลเซียส ความดัน 80/60 มิลลิเมตรปรอท วินิจฉัย ภาวะช็อกจากการติดเชื้อ (Septic shock) เพื่อส่งผู้ป่วยจากโรงพยาบาลส่งเสริมสุขภาพตำบลบ้านเสาหิน ตำบลเสาหิน อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน ไป โรงพยาบาลแม่สะเรียง ตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานงานกับกองทัพบก เพื่อขอสนับสนุนอากาศยานโดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดยทีมโรงพยาบาลศรีสังวาลย์
ฮ.Bell 212 รับเด็กชาย 1 เดือน ติดเชื้อชนิดรุนแรงร่วมกับภาวะช็อก จากอ.ฝาง เร่งส่งรพ.นครพิงค์
6 ตุลาคม 2566 เวลา 13.07 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยเด็กผู้ชาย สัญชาติไทย อายุ 1 เดือน มาด้วยอาการหายใจหอบเหนื่อย วินิจฉัย ภาวะติดเชื้อชนิดรุนแรงร่วมกับมีภาวะช็อกจากการติดเชื้อร่วมกับมีภาวะไตวายเฉียบพลัน (Severe sepsis with Septic shock with Acute renal failure) เพื่อส่งผู้ป่วยจากโรงพยาบาลฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่ ไป โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานงานกับกองทัพบก เพื่อขอสนับสนุนอากาศยานโดยประเภทอากาศยานเฮลิคอปเตอร์ที่ให้บริการคือ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศโดยทีมโรงพยาบาลนครพิงค์ จังหวัดเชียงใหม่
7 ตุลาคม วันมะเร็งเต้านม World Breast Cancer Day
วันมะเร็งเต้านมสากล (World Breast Cancer Day) ตรงกับวันที่ 7 ตุลาคม ของทุกปี เพื่อการรณรงค์ให้สตรีไทยไกลโรคมะเร็งเต้านม โรงพยาบาลจุฬาภรณ์ มีคำแนะนำการป้องกันมะเร็งเต้านมที่ดีที่สุด คือ การสังเกตอาการตนเอง หมั่นตรวจคลำเต้านมด้วยตนเองทุกๆ เดือน หากคลำพบก้อนก็ควรรีบพบแพทย์ การตรวจคัดกรองความเสี่ยงและการค้นพบปัญหาตั้งแต่แรกเริ่มจะสามารถช่วยรักษาชีวิตของผู้ป่วยได้ และหากสตรีที่อายุ 40 - 45 ปีขึ้นไปก็ควรมาตรวจแมมโมแกรม เพื่อดูแลป้องกันให้ปลอดภัยจากมะเร็งเต้านม
7 ตุลาคม 65 กัญชาเสรี
- นายนิพิฏฐ์ อินทรสมบัติ รองหัวหน้าพรรคสร้างอนาคตไทย โพสต์ถึงนายกฯ ประยุทธ์ต้องการคุยกับนายกฯ ว่ายาเสพติด ระบาดทั่วประเทศชนิดไม่เคยมีมาก่อน เกิดการฆาตกรรมเพราะฤทธิ์ยาเสพติด เป็นเพราะส่งสัญญาณผิดเรื่องกัญชาเสรี คำนี้ มาพร้อมกับความรู้สึกว่าไม่เอาจริงกับยาเสพติด จนคนรู้สึกว่ายาเสพติดมีความเสรีมากขึ้นกว่ายุคก่อนๆ7 ต.ค.แถลงการณ์ของไทยต่อสถานการณ์การโจมตีอิสราเอล
ตามที่เกิดเหตุการณ์การส่งอากาศยานต่อสู้ไร้คนขับและจรวดจากฉนวนกาซาเข้าโจมตีอิสราเอล เมื่อวันที่ ๗ ตุลาคม ๒๕๖๖
ในนามของรัฐบาลและประชาชนคนไทย กระทรวงการต่างประเทศขอแสดงความเสียใจอย่างสุดซึ้งต่อรัฐบาลและประชาชนอิสราเอล สำหรับเหตุการณ์ที่เกิดขึ้นอย่างไม่คาดคิด ซึ่งก่อให้เกิดการสูญเสียชีวิตของผู้บริสุทธิ์และความเสียหายต่อทรัพย์สิน ฝ่ายไทยขอแสดงความห่วงใยอย่างยิ่งต่อผู้บาดเจ็บ โดยเฉพาะคนไทยที่ทำงานอยู่ในอิสราเอลที่ได้รับผลกระทบจากเหตุการณ์การใช้ความรุนแรงและการโจมตีที่ไร้ซึ่งมนุษย์ธรรมในครั้งนี้
รัฐบาลไทยขอเรียกร้องให้ทุกฝ่ายที่เกี่ยวข้องหลีกเลี่ยงการกระทำใดๆ ที่จะสร้างความตึงเครียดเพิ่มขึ้น และขอร่วมกับประชาคมระหว่างประเทศในการประณามการใช้ความรุนแรงและการโจมตีในครั้งนี้ รวมทั้งขอแสดงความหวังให้รัฐบาลอิสราเอลสามารถควบคุมสถานการณ์ให้กลับคืนสู่ปกติโดยเร็ว
Thailand’s statement on the incident in Israel on 7 October 2023
Following the unfortunate incident involving the deployment of unmanned combat aircraft and rockets from the Gaza Strip to attack Israel on 7 October 2023, the Royal Thai Government wishes to express our deepest condolences to the Government and people of Israel on the unfortunate loss of lives and injuries from this inhumane and indiscriminate act. The Thai Government is deeply concerned with the safety of Thai nationals working in Israel who have been affected by such violent incidents.
Thailand calls upon all parties involved to refrain from any actions that would further escalate tensions and joins the international community in condemning any use of violence and indiscriminate attacks. We hope that the situation in Israel will soon return to normalcy.
รพ.ธรรมศาสตร์ฯ ชวนคุณแม่มือใหม่ร่วมกิจกรรม ตั้งครรภ์คุณภาพ ฟรี 8 ตุลาคม 2566 LINK
โอกาสเสริมเติมความรู้ในการดูแลลูกน้อยสำหรับคุณแม่มือใหม่ มาถึงอีกแล้ว โดยโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ขอเรียนเชิญคุณแม่ตั้งครรภ์ที่สนใจเข้าร่วมกิจกรรมเสวนาและ workshop "ตั้งครรภ์คุณภาพ ดูแลทุกไตรมาสของการตั้งครรภ์" วันอาทิตย์ที่ 8 ตุลาคม 2566 เวลา 9.00-12.00 น. ณ แผนกสูตินรีเวช ชั้น 2 อาคาร มรว. สุวพรรณ โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ฟรี ไม่มีค่าใช้จ่าย
สาธารณสุขเตรียมพร้อมดูแลคนไทยเดินทางกลับจากอิสราเอล
สาธารณสุขเตรียมพร้อมดูแลคนไทยเดินทางกลับจากอิสราเอล
9 ตุลาคม 65 นำส่งชายวัย 67 ปี หัวใจขาดเลือดเฉียบพลัน จาก อ.แม่แจ่มส่ง รพ.นครพิงค์
9 ตุลาคม 2565 เวลา 09.30 ศูนย์รับแจ้งแหตุและสั่งการจังหวัดเชียงใหม่ ได้รับแจ้งขอสนับสนุนการลำเลียงทางอากาศสำหรับผู้ป่วยเพศชาย อายุ 67 ปี มีภาวะลิ่มเลือดอุดตันในปอด และภาวะหัวใจขาดเลือดเฉียบพลัน จากโรงพยาบาลเทพรัตนเวชชานุกูล เฉลิมพระเกียรติ 60 พรรษา
โดยได้ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองกำลังผาเมือง ต้นทางสนามกีฬาโรงเรียนบ้านเนินวิทยาคม อำเภอแม่แจ่ม จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลนครพิงค์ ได้รับการสนับสนุนอากาศยานจากกองกำลังผาเมือง รุ่น Bell 212
ชุดปฏิบัติการบินประกอบด้วย ร.อ.อนุชิต โฆษิตสุรังคกถล, ร.ท.ดำรงศักดิ์ จินตวรณ์, จ.ส.อ.สุรัติพงษ์ กังวลงาน, จ.ส.อ.สุริยา พรมชาติ
ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ประกอบด้วย นายแพทย์ประสาน เปี่ยมอนันต์, แพทย์หญิงพัณณ์ชิตา ชำนาญกิจวณิชย์, นางสาว.อรภา ปาระมี นางสาวพิชญา ศรีนิล
การลำเลียงผู้ป่วยครั้งนี้ลุล่วงไปด้วยดี
9 ตุลาคม 65 รับผู้ป่วยฉุกเฉินดญ.ชาวอิสราเอล จากเกาะพะงัน ส่งต่อ รพ.สุราษฎร์ธานี LINK
9 ตุลาคม 2565 เวลา 13.21 น. โรงพยาบาลเกาะพะงัน และศูนย์กู้ชีพนเรนทรอ่าวไทย ได้ร้องขอการ สนับสนุนเฮลิคอปเตอร์เพื่อส่งต่อผู้ป่วยฉุกเฉินเด็กหญิงชาวอิสราเอล อายุ 6 ปี 11 เดือน มีประวัติสัมผัสแมงกะพรุนกล่อง มีอาการปวดแสบปวดร้อนบริเวณแขนและขาทั้งสองข้าง หลังจากนั้นหัวใจหยุดเต้น วินิจฉัยเป็น Post cardiac arrest from Box Jellyish Venom (ภาวะหัวใจหยุดเต้นหลังสัมผัสพิษแมงกะพรุนกล่อง) จำเป็นต้องได้รับการ รักษาและดูแลใกล้ชิดโดยกุมารแพทย์ ซึ่งเกินศักยภาพในการรักษาของโรงพยาบาลเกาะพะงัน นพ.ฐานุวัตร ทิพย์พินิจ แพทย์เจ้าของไข้ ได้ประสานงานส่งต่อ รพ.สุราษฎร์ธานี แพทย์ผู้ให้การรักษาคือ พญ,นพวรรณ พงศ์โสภา กุมารแพทย์ ทารกแรกเกิด แพทย์อำนวยการปฏิบัติการฉุกเฉินท้องที่และหัวหน้าทีมปฏิบัติการทางการแพทย์ คือ พญ.ธัญวรรณ กุศลชู ประสานงานผ่านศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติเพื่อแจ้งขอสนับสนุนอากาศยานจากหน่วยกองบิน7 จังหวัดสุราษฎร์ธานี ประเภทอากาศยานเฮลิคอปเตอร์ EC725 มีชุดปฏิบัติการบินประกอบด้วย น.ต.ปิยะวัฒน์ ด้วงพิบูลย์ และ ร.อ.เอกลักษณ์ จำปาม่วง ชุดลำเลียงทางอากาศประกอบด้วย พ.ว.รัชนาภรณ์ ฟูแก้ว โรงพยาบาลสุราษฎร์ธานี น.ท.หญิง เหมวรรณ หมายสุข และ พ.อ.อ.กิตติชัย พางาม โรงพยาบาลกองบิน 7 เมื่อเวลา 16.54 น. ผู้ป่วยได้ส่งต่อ เข้ารับการรักษาที่หออภิบาลผู้ป่วยเด็กวิกฤตเป็นที่เรียบร้อย การส่งต่อครั้งนี้ได้รับการสนับสนุนงบประมาณจากสถาบัน การแพทย์ฉุกเฉินแห่งชาติ
กิจกรรมเสวนาความรู้บนเวทีกลาง มีตลอดงาน
กิจกรรมเสวนาความรู้บนเวทีกลาง มีตลอดงาน จากหน่วยงาน องค์กร ชุมชน ผู้ประกอบการ เวียนกันมาให้ข้อมูลความรู้ ได้รับความสนใจมาก โดยเฉพาะช่วงเย็นๆ
ความเป็นมาของกัญชาทางการแพทย์ - นพ.ชลทิศ อุไรฤกษ์กุล LINK
คู่มือในข้อ 4 กำหนด โรคหรือภาวะที่มีช้อมูลเชิงประจักษ์ 4 โรคว่าการใช้กัญชาเพื่อการรักษามีประสิทธิผล และควรนำกัญชามาใช้ในกรณีที่รักษาด้วยวิธีการเดิมแล้วไม่ได้ผล (second choice) ไม่ใช่เลือกกัญชาเป็นลำดับแรก (First Choice) และต้องได้รับความยินยอมจากผู้ป่วย ได้แก่
- ภาวะคลื่นไส้อาเจียนจากเคมีบำบัด (Chemotherapy induced nausea vomitting)
- โรคลมชักที่รักษายาก หรือโรคลมชักที่ดื้อต่อการรักษา (Intractable Epilepsy)
- ภาวะกล้ามเนื้อหดเกร็ง (spasticity) ในผู้ป่วยโรคปลอกประสาทเสื่อมแข็ง (Multiple Sclerosis)
- ภาวะปวดประสาท (Neurotic pain)
คู่มือในข้อ 4 กำหนดว่า ผลิตภัณฑ์กัญชาน่าจะได้ประโยชน์ (มีข้อมูลการศึกษาจำกัด ซึ่งต้องได้รับการศึกษาวิจัยถึงประสิทธิผลอย่างมีหลักฐานเชิงประจักษ์เพื่อสนับสนุนต่อไป) ในการควบคุมอาการ แต่ไม่ได้รักษาให้โรคหายขาด อีก 6 โรค/ภาวะ ได้แก่
- ผู้ป่วยที่ได้รับการดูแลแบบประคับประคอง (Paliative Care)
- ผู้ป่วยมะเร็งระยะสุดท้าย (End stage cancer)
- โรคพาร์กินสัน
- โรคอัลไซเมอร์
- โรควิตกกังวลทั่วไป (Generalized Anxiety Disorder)
- โรคปลอกประสาทอักเสบ (Demyelinated Diseases) อื่นๆ อาทิ Neuromyelitis optica และ Auto immune encephalitis
ในประเทศไทยไข้หวัดใหญ่จะมีช่วงแพร่ระบาดในฤดูฝน ช่วงเดือนพ.ค. มิย. เป็นช่วงเวลาที่มีการบ่มเชื้อโรคมากที่สุด เพราะเป็นช่วงเปิดเทอม เด็กออกไปทำกิจกรรมใกล้ชิดกัน และกลับมาเป็นพาหะพาเชื้อสู่ครอบครัว ติดผู้สูงอายุในบ้าน เช่น ปู่ย่า ตายาย ดังนั้น 2 กลุ่มหลักที่ควรสร้างภูมิคุ้มกันด้วยการฉีดวัคซีน คือ 1. กลุ่มเด็กที่จะเป็นกลุ่มติดเชื้อเยอะและเป็นแหล่งของการแพร่กระจาย 2. กลุ่มผู้สูงอายุ และกลุ่มเสี่ยงที่มีโรคประจำตัว เช่น เบาหวาน โรคหัวใจ ปอด ไต และโรคสมอง เพื่อป้องกันการอันตรายถึงชีวิต”
จากสถิติขององค์การอนามัยโลก (WHO) เผยว่าหากไม่มีการฉีดวัคซีนฯ ผู้ใหญ่จะมีการติดเชื้อไข้หวัดใหญ่ 5-10% ส่วนเด็กจะอยู่ที่ 20-30% ต่อปีของประชากรทั้งหมด โดยเมื่อคำนวณจากประชากรโลกที่มีทั้งสิ้น 7,000 ล้านคน แสดงว่าผู้ใหญ่ทั่วโลกอาจะติดไข้หวัดใหญ่ได้ถึง 700 ล้านคน และจำนวนนี้จะมีอาการป่วยหนักเข้านอนในโรงพยาบาล หรือเข้ารักษาใน ICU ประมาณ 5 ล้านคน และอัตราการเสียชีวิตประมาณ 5 แสนคน ซึ่งนับเป็นตัวเลขที่สูงมาก แต่หากเราสามารถให้วัคซีนกับคนทั่วโลกในทุกปี ได้ อัตราตัวเลขนี้ต่างๆ ก็จะลดลง
สำหรับประเทศไทย ในแต่ละปีจะมีการเตรียมวัคซีนแบ่งเป็น 2 แบบ คือ 1.แบบที่ภาครัฐดำเนินการจัดหาให้ประชาชนฉีดฟรีประมาณ 6 ล้านโดส (ประชากรกลุ่มเสี่ยง กลุ่มประกันสังคม และบุคลากรทางการแพทย์) โดยเน้นไปที่กลุ่มเสี่ยงก่อน และ 2. ภาคเอกชนดำเนินการจัดซื้อเอง ประมาณ 3 ล้านโดส นั่นหมายถึงคนไทยจะได้ฉีดวัคซีนไข้หวัดใหญ่ปีละประมาณ 9 ล้านคน หรือคิดเป็น 12-14% ของประชากร ซึ่งในปี 2565 ประเทศไทยมีจำนวนผู้สูงอายุเกิน 60 ปีขึ้นไป รวมทั้งผู้ที่มีโรคประจำตัวประมาณ 13 ล้านคน หรือคิดเป็น 19% ของประชากรทั้งประเทศ การเตรียมวัคซีนจึงยังไม่เพียงพอต่อความต้องการทั้งในกลุ่มเด็กที่เป็นแหล่งแพร่ระบาด และกลุ่มผู้สูงอายุเกิน 60 ปีขึ้นไป และยังรวมถึงกลุ่มเสี่ยงโรคหัวใจและหลอดเลือด เบาหวาน หลอดเลือดสมอง ปอดอุดกั้นเรื้อรัง จึงเป็นหน้าที่ผู้เกี่ยวข้องกับการดูแลสุขภาพของประชาชน และต้องเร่งดำเนินการมากขึ้น
โรงพยาบาลกลาง เปิดหน่วยฉีดวัคซีนโควิด-19 ณ ศูนย์การค้า MBK Center
โรงพยาบาลกลาง หน่วยฉีดวัคซีน COVID-19 ณ บริเวณชั้น 6 โซน D ศูนย์การค้า MBK Center ให้บริการฉีดวัคซีน COVID-19 Moderna (Bivalent) จำกัด 500 คน/วัน เริ่มวันศุกร์ที่ 28 เมษายน ถึง วันอาทิตย์ที่ 14 พฤษภาคม 2566 เวลา 09.00 - 15.00 น. หลังจากนั้นฉีดทุกวันเสาร์-อาทิตย์ (20,21,27,28 เดือนพฤษภาคม) **ปิดให้บริการช่วงวันเลือกตั้ง 13-14 พฤษภาคม 2566**
ราชวิถี เปิดให้บริการฉีดวัคซีนไข้หวัดใหญ่แก่ผู้ประกันตน อายุตั้งแต่ 50 ปีขึ้นไป เริ่ม 1 พฤษภาคม LINK
โรงพยาบาลราชวิถี จะเปิดให้บริการฉีดวัคซีนไข้หวัดใหญ่แก่ผู้ประกันตนสิทธิประกันสังคมโรงพยาบาลราชวิถี ที่มีอายุตั้งแต่ 50 ปีขึ้นไป ตามประกาศของประกันสังคม โดยจะเริ่มฉีดตั้งแต่วันที่ 1 พฤษภาคม – 31 สิงหาคม 2566 ในเวลา 08.00 – 16.00 น. ณ ห้องฉีดยา ชั้น 1 อาคารทศมินทราธิราช โรงพยาบาลราชวิถี (ยกเว้นวันหยุด เสาร์ อาทิตย์ และวันหยุดนักขัตฤกษ์) ผู้ที่สนใจสามารถลงทะเบียนได้ตั้งแต่วันที่ 21 เมษายน 2566 เป็นต้นไป ทาง QR Code หรือ Website โรงพยาบาลราชวิถี :
rajavithi.go.th/regisInfVcc_2020/หมายเหตุ :
1. เอกสารที่ต้องนำมาในการยื่นฉีดยา : บัตรประจำตัวประชาชน
2. ผู้ที่จะเข้ารับบริการฉีดยาวัคซีนไข้หวัดใหญ่ ต้องไม่เคยรับวัคซีนไข้หวัดใหญ่ภายใน 6 เดือนที่ผ่านมา
สอบถามข้อมูลเพิ่มเติมได้ที่ : 02-2062900 ต่อ 60211
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ
บริการตรวจสุขภาพ สำหรับผู้มีอายุต่ำกว่า 35 ปี ราคา 380 บาท
ตรวจ 4 รายการ ได้แก่ ตรวจเอกซเรย์ทรวงอก ตรวจปัสสาวะ ตรวจอุจจาระ ตรวจความสมบูรณ์เม็ดเลือด
ภาพประกอบ : ภาพตัวอย่างการใช้ CXR AI ทำให้สามารถพบความผิดปกติ ในระยะ 1 และนำสู่การรักษาที่หายขาดมะเร็งปอดได้
โรงพยาบาลที่สามารถบริจาคโลหิต
โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัยให้บริการทางการแพทย์เพื่อการรักษาสัตว์เลี้ยงอันได้แก่ สุนัข แมว สัตว์ปีก สัตว์เลื้อยคลาน และสัตว์เลี้ยงพิเศษอื่น ๆ ภายในโรงพยาบาลประกอบด้วย หน่วยเวชศาสตร์ฉุกเฉินและหออภิบาลสัตว์ป่วยวิกฤต ศูนย์บริการโลหิตเพื่อสุนัขและแมว แผนกอายุรกรรมทั่วไปและเวชศาสตร์ป้องกัน แผนกคลินิกเฉพาะทาง แผนกศัลยกรรม หน่วยภาพวินิจฉัย แผนกสูติกรรม และแผนกชันสูตรโรคสัตว์
- เปิดบริการทุกวัน และเปิดรับบัตรเวลา 7.00 – 11.30 น. และ 13.00 – 15.00 น. คลินิกนอกเวลา 17.00 – 20.00 น.
- ตั้งอยู่ที่ 39 ถ.อังรีดูนังต์ ปทุมวัน กรุงเทพ 10330 โทร. 02-2189715
- Website | Facebook | @healthserv.net
จากการจัดอันดับโลกด้านเศรษฐกิจสุขภาพ ประเทศไทยมีอันดับของการเติบโตด้านเศรษฐกิจสุขภาพเปรียบเทียบใน 218 ประเทศทั่วโลก ดังแสดงในแผนภาพที่ 1 (ที่มา: Global Wellness Institute.2020)
กระบวนการขยายขนาดการนำเทคโนโลยีมาใช้ยังต้องมีระบบนิเวศภายนอกที่เอื้ออำนวย ซึ่งความไว้วางใจและความพร้อมของผู้ใช้ เศรษฐศาสตร์ของรูปแบบธุรกิจ สภาพแวดล้อมด้านกฎระเบียบ และความพร้อมของบุคลากรมีบทบาทสำคัญ เนื่องจากปัจจัยของระบบนิเวศเหล่านี้แตกต่างกันไปตามภูมิศาสตร์และอุตสาหกรรม เราจึงเห็นสถานการณ์การนำเทคโนโลยีมาใช้ที่แตกต่างกันเกิดขึ้น ตัวอย่างเช่น ในขณะที่ธนาคารชั้นนำในละตินอเมริกามีมาตรฐานเทียบเท่ากับธนาคารในอเมริกาเหนือในการใช้ AI ทั่วไป การนำหุ่นยนต์มาใช้ในภาคการผลิตนั้นแตกต่างกันอย่างมากเนื่องจากต้นทุนแรงงานที่แตกต่างกันซึ่งส่งผลต่อกรณีทางธุรกิจของระบบอัตโนมัติ
ในขณะที่ผู้บริหารต้องรับมือกับความซับซ้อนเหล่านี้ พวกเขาควรปรับกลยุทธ์การนำเทคโนโลยีมาใช้ในระยะยาวให้สอดคล้องกับทั้งความสามารถภายในและเงื่อนไขของระบบนิเวศภายนอก เพื่อให้แน่ใจว่าการบูรณาการเทคโนโลยีใหม่เข้ากับรูปแบบธุรกิจของตนจะประสบความสำเร็จ ผู้บริหารควรตรวจสอบเงื่อนไขของระบบนิเวศที่อาจส่งผลต่อกรณีการใช้งานที่มีลำดับความสำคัญ เพื่อตัดสินใจเกี่ยวกับระดับการลงทุนที่เหมาะสมในขณะที่รับมือกับความไม่แน่นอนและข้อจำกัดด้านงบประมาณระหว่างทางไปสู่การนำมาใช้เต็มรูปแบบ (ดูหัวข้อ "พัฒนาการในการนำมาใช้ทั่วโลก" ภายในแต่ละแนวโน้มหรือกรณีการใช้งานเฉพาะที่ผู้บริหารควรตรวจสอบ) ผู้นำที่มีมุมมองในระยะยาว ซึ่งได้แก่ การสร้างบุคลากร การทดสอบและการเรียนรู้ว่าจะพบผลกระทบได้ที่ไหน และการคิดใหม่เกี่ยวกับธุรกิจสำหรับอนาคต อาจสามารถก้าวไปข้างหน้าได้เหนือกว่าคู่แข่ง
17 สิงหาคม 2024 ไวรัส Mpox ที่กำลังเป็นที่สนใจในขณะนี้จะเป็นคนละสายพันธุ์กับที่ระบาดในหลายประเทศเมื่อ 2 ปีก่อน โดยตอนนั้นเป็น Clade II แต่ตัวที่กำลังเป็นที่จับตามองเป็นสายพันธุ์ Clade Ib ซึ่งเป็นกลุ่มย่อยในกลุ่ม Clade I โดยในกลุ่มนี้จะแบ่งออกเป็น 2 กลุ่มใหญ่ คือ Clade Ia และ Clade Ib โดยไวรัสในกลุ่ม Clade Ib เป็นไวรัสเพิ่งค้นพบใหม่เมื่อปีที่แล้วใน South Kivu ในประเทศ DRC หรือ สาธารณรัฐประชาธิปไตยคองโก ซึ่งเป็นประเทศที่มีการระบาดของ Clade I มานานแล้ว เหตุการณ์ตอนนี้ไวรัส Clade Ib จาก DRC พบการระบาดอย่างต่อเนื่อง และ แพร่กระจายต่อไปยังประเทศข้างเคียง ข้อมูลไวรัสที่เก็บจากผู้ป่วยใน DRC พบความแตกต่างระหว่าง Clade Ia และ Clade Ib อย่า่งมีนัยสำคัญ มีประเด็นสำคัญคือ
1. สายพันธุ์ Clade Ib ในการศึกษานี้มาจากผู้ป่วยที่ติดเชื้อในปี 2024 ในจังหวัด South Kivu ซึ่งบ่งชี้ว่า Clade Ib เป็นการพัฒนาที่ค่อนข้างใหม่ใน DRC
2. Clade Ib พบเฉพาะในภาคตะวันออกของ DRC โดยเฉพาะในจังหวัดเซาท์คิวู ซึ่งแตกต่างจากการกระจายตัวที่กว้างขวางของ Clade Ia ทั่วประเทศ
3. เชื่อว่าไวรัส Clade Ia ที่พบในผู้ป่วยจะเกิดจากการเชื้อจากสัตว์สู่คนโดยตรง ทำให้เกิดความหลากหลายพันธุกรรมของไวรัสสูงมาก เพราะมีการติดเชื้อจากสัตว์หลาย source หลายเวลา ส่วน Clade Ib มีความแตกต่างทางพันธุกรรมน้อยกว่ามาก ซึ่งเชื่อมโยงกับการแพร่เชื้อจากคนสู่คนอย่างต่อเนื่อง ซึ่งเป็นการเปลี่ยนแปลงที่สำคัญในระบาดวิทยาของ mpox ในภูมิภาคนี้
4. การศึกษาพบการกลายพันธุ์ที่เกิดจาก APOBEC3 ใน Clade Ib ซึ่งบ่งชี้ถึงการแพร่เชื้อจากคนสู่คน นี่เป็นหลักฐานทางโมเลกุลที่สนับสนุนข้อสังเกตทางระบาดวิทยา ปกติการกลายพันธุ์ที่เกิดจาก APOBEC3 จะเป็นสัญญาณที่ไวรัสอยู่ในประชากรมนุษย์เป็นเวลาสักระยะหนึ่ง ถ้าพบการเปลี่ยนแปลงเยอะก็หมายถึงไวรัสปรับตัวเองเข้าสู่มนุษย์ได้ดีขึ้น
5. การศึกษาระบุว่าข้อมูลทางคลินิกและระบาดวิทยาสนับสนุนความเป็นไปได้ที่ไวรัส Clade Ib กำลังแพร่กระจายผ่านการสัมผัสทางเพศ ซึ่งเป็นการเปลี่ยนแปลงที่สำคัญจากรูปแบบการแพร่เชื้อ mpox แบบดั้งเดิมใน DRC ซึ่งมักเกิดจากการสัมผัสเชื้อโดยตรง
6. การระบาดของ Clade Ib ในภาคตะวันออกของ DRC ได้แพร่กระจายไปยังเมืองอื่นๆ ในจังหวัดเซาท์คิวู (บูกาวูและอูวิรา) และจังหวัดนอร์ทคิวู (โกมา) รวมถึงประเทศเพื่อนบ้านอย่างรวันดา ยูกันดา เคนยา และบุรุนดี การเกิดขึ้นและการแพร่กระจายของ Clade Ib เป็นความกังวลด้านสาธารณสุขที่สำคัญ นำไปสู่การประกาศภาวะฉุกเฉินด้านสาธารณสุขระหว่างประเทศ (PHEIC) โดยศูนย์ควบคุมและป้องกันโรคแห่งแอฟริกา
7. การแพร่เชื้อจากคนสู่คนอย่างต่อเนื่องของ Clade Ib ทำให้เกิดคำถามเกี่ยวกับการปรับตัวของไวรัสที่อาจช่วยให้การแพร่กระจายในรูปแบบนี้เป็นไปได้ง่ายขึ้น
8. ความรุนแรงของเชื้อระหว่าง Clade Ia และ Ib ใกล้เคียงกัน และ มีความรุนแรงที่สูงกว่า Clade II แต่ทั้งนี้ตัวเลขความรุนแรงที่มีอัตราเสียชีวิต 5% เป็นการเก็บข้อมูลในประเทศที่ระบบสาธารณสุขไม่ค่อยดี และ มีการติดเชื้อ HIV เป็นวงกว้างส่งผลให้ภูมิคุ้มกันของผู้ป่วยไม่ดี ข้อมูลจึงอาจต้องพิจารณาปัจจัยดังกล่าวด้วย
9. เนื่องจาก Clade I ยังมีอยู่ในแอฟริกา และ วัคซีนที่พัฒนาขึ้นจะทดสอบกับ Clade II ข้อมูลยังไม่ชัดเจนว่า ประสิทธิภาพการป้องกันโรคต่อ Clade I จะดีเท่ากับที่รายงานใน Clade II หรือไม่
*** Clade I อ่านว่า เคลดวัน และ Clade II อ่านว่า เคลดทู ตามตัวเลขโรมัน ของ 1 และ 2 อย่าอ่านว่า เคลดไอ ซึ่งจะมีปัญหาเรื่องการสื่อสาร
บริการตรวจสุขภาพแรงงานข้ามชาติ
2. เภสัชกรรักษามาตรฐานความปลอดภัยในการดูแลอาการเจ็บป่วยเล็กน้อยและการใช้ยาของประชาชน
บุคลากรด้านสุขภาพทุกวิชาชีพล้วนให้ความสำคัญเรื่องความปลอดภัยของประชาชนอย่างเท่าเทียมกัน ในการดูแล อาการเจ็บป่วยเล็กน้อยนั้น ประชาชนอาจเลือกดูแลตนเอง อาจพบเภสัชกรเพื่อขอคำปรึกษาตามโครงการนี้ ซึ่งเป็นบริการของรัฐที่ให้กับประชาชนโดยไม่เสียค่าใช้จ่าย หรืออาจเลือกพบแพทย์ก็ได้ ดังนั้นการเพิ่มโอกาสการเข้าถึงการดูแลอาการเจ็บป่วยเล็กน้อยของประชาชนโดยเกสัชกรที่เป็นผู้มีความรู้เรื่องยาโดยตรงจึงเป็นสิ่งสำคัญ มีประโยชน์และเป็นการเพิ่มคุณภาพชีวิตของประชาชนให้ดีขึ้น และวิชาชีพเภสัชกรรมก็มีกระบวนการและมาตรฐานในการประเมินความเหมาะสมในการจ่ายยาให้กับผู้ป่วยเพื่อให้เกิดการใช้ยาที่ถูกต้อง สมเหตุสมผล และไม่เกิดปัญหาที่เกี่ยวเนื่องกับการใช้ยา การดำเนินการในโครงการดูแลอาการเจ็บป่วยเล็กน้อยนี้จึงมิได้เป็นการลดมาตรฐานความ ปลอดภัยแต่อย่างใด แต่เป็นการเพิ่มทางเลือกที่ยังคงรักษามาตรฐานด้านความปลอดภัยอีกทางหนึ่ง
3. เภสัชกรเป็นผู้ที่มีความรู้ด้านยาเป็นอย่างดี
วิชาชีพเภสัชกรรมเป็นหลักสูตรการศึกษา 6 ปี มีความรู้เรื่องยาในทุกมิติ สามารถผลิตยา ควบคุมและประกับคุณภาพ ยา เลือกสรรยา จ่ายยาและให้การบริบาลทางเภสัชกรรม ให้คำแนะนำการใช้ยาที่สมเหตุสมผล ตลอดจนการติดตามอาการที่ไม่พึงประสงค์จากการใช้ยาและการคุ้มครองผู้บริโภค และมีการควบคุมคุมกำกับดูแลด้านจรรยาบรรณอย่างเข้มงวด ในการประกอบวิชาชีพ โดยสภาเภสัชกรรม อีกทั้งในโครงการดูแลอาการเจ็บป่วยเล็กน้อยๆโดยร้านยาคุณภาพ ก็มีการควบคุม กำกับ ติดตามโดยสภาเภสัชกรรมและ สปสช. เพื่อให้มั่นใจในคุณภาพของการดูแลผู้ป่วย และความถูกต้องของกรอบการดำเนินงานของ "ร้านยาคุณภาพ" และประชาชนได้รับยาอย่างเหมาะสม นอกจากนี้ เภสัชกรในโครงการร้านยาคุณภาพ ยังมีการติดตามผลการใช้ยาเมื่อครบ 72 ชั่วโมง หากมีปัญหาใดๆ ก็สามารถส่งต่อ ผู้ป่วยไปยังโรงพยาบาลในเครือข่ายเพื่อรักษาต่อได้ เภสัชกรในโครงการร้านยาคุณภาพยังมีมาตรฐานในการจ่ายยา อาทิ ยาที่จำยเป็นแผงระบุชื่อยา ความแรง วันหมดอายุ มีฉลากยาครบถ้วน ซึ่งถือว่ามาตรฐานดีที่สุด ทำให้ประชาชน ทราบข้อมูลของยาที่ได้รับอย่างชัดเจน สามารถตรรจสอบ และตรวจสอบยัอนกลับได้
ในฐานะที่บำรุงราษฎร์เป็นโรงพยาบาลที่ให้การรักษาในระดับจตุตถภูมิ (Quaternary Care) เราได้พัฒนาศูนย์ความเป็นเลิศทางการแพทย์เพื่อให้การบริบาลดูแลผู้ป่วยอย่างครอบคลุมเพื่อส่งมอบผลลัพธ์ที่ดีที่สุดมาอย่างต่อเนื่อง ด้วยทีมแพทย์และสหสาขาวิชาชีพที่มีประสบการณ์ในการผ่าตัดปลูกถ่ายอวัยวะสำคัญ ปัจจุบัน บำรุงราษฎร์เป็นโรงพยาบาลเอกชนที่ได้รับให้เป็นศูนย์การปลูกถ่ายอวัยวะหัวใจ ไต ตับ และกระจกตา จากศูนย์รับบริจาคอวัยวะสภากาชาดไทย และสามารถปลูกถ่ายอวัยวะได้ครบทั้ง 3 อวัยวะ และ 1 เนื้อเยื่อ ได้แก่ ‘หัวใจ ไต ตับ และกระจกตา’ ซึ่งการปลูกถ่ายอวัยวะถือเป็นการผ่าตัดที่มีความซับซ้อน จำเป็นต้องอาศัยความชำนาญการของทีมแพทย์และเทคโนโลยีที่ทันสมัย และทำในสถาบันที่มีมาตรฐานและมีประสบการณ์สูง
เขตกรุงเทพกลาง
กลุ่มเขตกรุงเทพกลาง 9 เขต 1. เขตป้อมปราบศัตรูพ่าย 2. เขตวังทองหลาง 3. เขตสัมพันธวงศ์ 4. เขตพญาไท 5. เขตดินแดง 6. เขตดุสิต 7. เขตพระนคร 8. เขตห้วยขวาง 9. เขตราชเทวี (คลินิกที่ต้องการเพิ่มลิงค์ Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com )
พระนคร
- คลินิกทันตกรรม ฟ.ฟันสะอาด info&map
- คลินิกทันตกรรมเด็นทัลไทม์ สาขาข้าวสาร
ป้อมปราบฯ
- คลินิกทันตกรรม เอส เอ็ม แอล info&map
- คลินิกทันตกรรมสปาร์ก
- คลินิกทันตกรรมสุขภาพฟันเจริญกรุง
- ศิริลักษณ์ทันตแพทย์คลินิกทันตกรรม
สัมพันธวงศ์
- คลินิกทันตกรรมเดนทรีต
- คลินิกฟ.ฟันสุขภาพคลินิกทันตกรรม
ดุสิต
วังทองหลาง
- คลินิกทันตกรรมเกษม
- คลินิกทันตกรรมคลาส สาขาโชคชัย 4
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขาโชคชัย 4
- คลินิกทันตกรรมไตรเด็นท์
- คลินิกทันตกรรมฟีนิกซ์ info&map
- คลินิกทันตกรรมมูลนิธิทันตนวัตกรรมในพระบรมราชูปถัมภ์ info&map
- คลินิกทันตกรรมลาดพร้าวสไมล์
- คลินิกทันตกรรมสไมล์พลัส 98
- คลินิกทันตกรรมสาธิต
- คลินิกทันตกรรมแฮปปี้ไทม์
- ลูกหมีเด็นทัลคลินิกทันตกรรม
ดินแดง
- คลินิกทันตกรรมเด็นทัลไทม์
- คลินิกทันตกรรมฟันงาม พ.7
พญาไท
- คลินิกทันตกรรมซีสเตชั่น
- คลินิกทันตกรรมเด้นท์โฮม สาขาสะพานควาย
- คลินิกทันตกรรมพลัส
- คลินิกทันตกรรมพีเอสเค info&map
- คลินิกทันตกรรมมูลนิธิทันตนวัตกรรมในพระบรมราชูปถัมภ์
- คลินิกทันตกรรมสไมล์ซีซันส์
- เด็นทัลแลนด์คลินิกทันตกรรม
ราชเทวี
- คลินิกทันตกรรมเด้นท์คลีนิค
- คลินิกทันตกรรมเดนท์อินดี๊ด
- คลินิกทันตกรรมวินัยทันตแพทย์
- คลินิกทันตกรรมสไมล์ลอฟท์ info&map
- คลินิกทันตกรรมสไมล์เวิร์ค
- ไวทัลสลีปสหคลินิก
- ไอดีเด็นทัลคลินิกทันตกรรม
ห้วยขวาง
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขาห้วยขวาง
- คลินิกทันตกรรมสไมลี่ย์ info&map
- บ้าน ฟ.ฟัน คลินิกทันตกรรม
Canna Pharma 2022 October 12-13, 2022, San Diego, CA
Canna Pharma 2022
October 12-13, 2022, San Diego, CA
เน้นไปสายกัญชาทางการแพทย์ เภสัช เวชภัณฑ์ การบำบัด ฯลฯ ระดับมืออาชีพสายการแพทย์ วิทยาศาสตร์ และเทคโนโลยีขั้นสูง
12 ตุลาคม 65 สารออกฤทธิ์ในกัญชา กัญชากับยาเสพติด พ.ร.บ.กัญชาฯ
สารออกฤทธิ์ในกัญชา
- นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ กล่าวว่า กัญชาเป็นพืชสกุล Cannabis ที่มีสารประกอบแคนาบินอยด์ มี ฤทธิ์ทางเภสัชวิทยาและสรรพคุณในการรักษาโรค โดยสารออกฤทธิ์ที่สำคัญในกัญชา คือ THC, CBD และ Terpenes มี สรรพคุณต้านการอักเสบ ทำให้เริ่มมีการนำกัญชามารักษาโรคที่เกี่ยวกับการอักเสบของผิวหนัง และใช้เป็นส่วนประกอบของ ผลิตภัณฑ์เวชสำอาง
กัญชากับยาเสพติด
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมต.ประจำสำนักนายกฯ ประธาน คกก.ขับเคลื่อนนโยบายกัญชาเสรีทางการแพทย์ กล่าวถึงความสำคัญของการลดอันตรายจากการใช้ยาเสพติดที่รุนแรง เช่น ยาบ้า โดยได้จัดตั้งคณะทำงานที่เกี่ยวข้องมา ช่วยกันพัฒนาจัดทำแนวทางลดอันตรายจากยาเสพติด (Harm Reduction) อย่างจริงจัง เพื่อรวบรวมพัฒนาต่อยอดองค์ ความรู้ด้านกัญชาทางการแพทย์ของไทย ระบุ ยาบ้าไม่เท่ากับกัญชา เมื่อเทียบกับยาบ้าแล้ว กัญชาไม่เป็นปัญหายาเสพติด แต่ ยาบ้าเป็นปัญหาหลักของยาเสพติด
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า หากมีการค้นหาเชิงรุกตามหมู่บ้านและเจอผู้เสพยาจำนวนมาก อาการของผู้ป่วยแต่ละคนแตกต่างกัน หากไม่มากก็จะบำบัดรักษา ทำความเข้าใจและให้ความรู้ แต่หากอาการหนักต้องเข้ารับ รักษาทางการแพทย์ ซึ่ง สธ.เป็นฝ่ายสนับสนุนอยู่แล้ว ยาบ้าเป็นยาเสพติด ยืนยันว่าวันนี้กัญชาไม่ใช่ยาเสพติดหลังจาก ป.ป.ส. เห็นชอบถอดกัญชาออกจากบัญชียาเสพติดประเภทที่ 5 แล้ว เป็นคนละเรื่องกัน
พ.ร.บ.กัญชาฯ
- นายศุภชัย ใจสมุทร ประธาน กมธ. ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... กล่าวถึง ความคืบหน้าในการพิจารณา พ.ร.บ. กัญชาฯ โดยได้ส่งให้ประธานสภา เพื่อให้บรรจุเข้าระเบียบวาระให้ทัน พ.ย.นี้ ขออย่าทำเรื่องนี้เป็นเรื่องการเมือง เร่งออก กฎหมายคุ้มครอง เด็ก เยาวชน และสตรีมีครรภ์ เป็นประโยชน์ต่อบ้านเมือง และทิศทางของโลกกำลังยอมรับกัญชามากขึ้น ดังเช่นประธานาธิบดี โจ ไบเดน ของสหรัฐฯ ใช้อำนาจออกนิรโทษกรรมผู้ต้องขังที่มีความผิดฐานมีกัญชาไว้ในครอบครองออก จากเรือนจำทั้งหมด
12 ตุลาคม 65 เทศกาลสายเขียว ครั้งที่ 1 LINK
กรมการแพทย์แผนไทยฯ ร่วมกับ เครือข่ายวิสาหกิจชุมชนนิคมสมุนไพรสัมพันธ์ตะวันตก จ.กาญจนบุรี จัดงาน “เทศกาลสายเขียว มาตรฐานทางการแพทย์” ครั้งที่ 1 เพื่อให้ความรู้ด้านกฎหมายการปลูกกัญชาทางการแพทย์ รวมถึงการ ต่อยอดธุรกิจ และกระตุ้นเศรษฐกิจในพื้นที่ระหว่างวันที่ 17-20 พ.ย.65 ตั้งแต่ 09.00 น. ที่หุบเขา 350 ไร่ โรงปลูกกัญชาแบบ ปิดและกลางแจ้งที่ใหญ่ที่สุดในโลก ในนิคมอุตสาหกรรมกัญชาทางการแพทย์แห่งประเทศไทย เลขที่ 192 หมู่ที่ 2 ต.วัง กระแจะ อ.ไทรโยค จ.กาญจนบุรี ดูรายละเอียดได้ที่ www.cannabisriverkwai.com
12 ตุลาคม : Gala Performance by Stuttgart Ballet
Gala Performance by Stuttgart Ballet
Main Hall, Thailand Cultural Centre
Date and Time : Thursday 12 October 2023 at 7:00 PM
Ticket Price : 5,000/ 4,000/ 3,500/ 2,700/ 1,800 THB
Gala Performance การแสดงบัลเลต์ที่รวบรวมผลงานที่มีชื่อไว้ในหนึ่งค่ำคืน เพลิดเพลินไปกับท่วงท่าของบัลเลต์ที่สะกดใจผู้ชมกว่าสิบชุด โดยนักเต้นระดับท็อปของคณะที่กวาดรางวัลมากมาย ประกอบการบรรเลงเพลงจากวงออร์เคสตรา เพื่อให้ค่ำคืนอันแสนพิเศษนี้เป็นค่ำคืนที่น่าจดจำ
Stuttgart Ballet คณะบัลเลต์ชื่อดังของเยอรมนี และเป็นหนึ่งในคณะบัลเลต์อันดับต้นของโลกก่อตั้งใน ค.ศ. 1609 เจ้าของรางวัล Laurence Olivier Award for Outstanding Achievement in Dance คณะฯ ที่ผลิตนักออกแบบท่าเต้นที่มีชื่อเสียงระดับโลกมากมาย
ในครั้งนี้ Stuttgart Ballet เลือกที่จะเสนอการแสดงบัลเลต์ทั้งเรื่องคลาสสิกอย่าง Romeo & Julie, Don Quixote และหนึ่งในผลงานที่โด่งดังที่สุดของคณะ Onegin ไปจนถึงบัลเลต์ร่วมสมัยอย่าง Blake Works รวมถึงการแสดงเดี่ยวชิ้นอมตะ Dying Swan การผสมผสานหลากรสหลายสไตล์เหล่านี้ จะทำให้คุณเพลินเพลิดจนไม่อยากให้การแสดงนี้จบลง
วันพฤหัส 12 ตุลาคม 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
สนับสนุนโดยสถานเอกอัครราชทูตเยอรมนี และ GTCC
12 ต.ค.แจ้งเตือนจากกระทรวงการต่างประเทศ
13 ตุลาคม 65 ราชกิจจาฯ ประกาศกรมปศุสัตว์ แนวทางการนำกัญชง กัญชา มาใช้เป็นอาหารสัตว์ควบคุม
แนวทางกัญชง-กัญชาเป็นอาหารสัตว์ควบคุมเฉพาะ
- เว็บไซต์ราชกิจจานุเบกษา เผยแพร่ประกาศกรมปศุสัตว์ เรื่อง แนวทางการนำกัญชง กัญชา มาใช้เป็นอาหารสัตว์ควบคุม เฉพาะ หรือเป็นส่วนผสมในอาหารสัตว์ควบคุมเฉพาะ พ.ศ. 2565 ย้ำห้ามนำส่วนยอด ช่อดอก หรือเมล็ด มาใช้
14 ตุลาคม 65 ร่วมแก้ไข "สุญญากาศ" กฎหมายกัญชา / ลุยกัญชาไทย เปิดผลิตภัณฑ์-คลินิก
- พล.ต.อ.อดิศร์ งามจิตสุขศรี ที่ปรึกษาของผู้ว่าฯ กทม. ร่วมประชุมรับฟังคำแนะนำข้อกฎหมายและแนวทางการบังคับใช้ กฎหมายตามพ.ร.บ.คุ้มครอง และส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ. 2542 และประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ. 2565 ร่วมกับนพ.ขวัญชัย วิศิษฐานนท์ รองอธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก และ ผู้เกี่ยวข้อง โดยนำปัญหาในการปฏิบัติงานของเจ้าหน้าที่สำนักงานเขต เจ้าหน้าที่เทศกิจและเจ้าหน้าที่ตำรวจ เสนอให้กรมการ แพทย์แผนไทยฯ และ สธ. หาแนวทางจัดทำเป็นคู่มือการปฏิบัติงานที่ถูกต้องตามกฎหมาย แก้ไขช่องว่างทางกฎหมายที่ทำให้ เจ้าหน้าที่ไม่สามารถปฏิบัติงานได้ รวมถึงเตรียมจัดตั้งคณะทำงานลงพื้นที่ให้คำแนะนำ ตรวจสอบร้านจำหน่ายกัญชงกัญชา และการพิจารณาแนวทางแต่งตั้งให้เจ้าหน้าที่ของกทม.ซึ่งเป็นเจ้าพนักงานท้องถิ่น เป็นเจ้าพนักงานตามกฎหมายในประกาศ สธ. โดยจะมีการประชุมหารืออย่างใกล้ชิดต่อไป
ลุยกัญชาไทย เปิดผลิตภัณฑ์-คลินิก
- นายพรประสิทธิ์ สีบุญเรือง กรรมการผู้จัดการ บริษัท 88 แคนนาเทค จำกัด เผย โมเดลธุรกิจครบวงจรตั้งแต่ปลูก-สกัดแปรรูป โดยต้นน้ำมีพันธมิตรคือบริษัทไฟลอสไบโอซายน์ ผลิตเมล็ดพันธุ์กัญชา กัญชง จากอเมริกา นำเข้าเมล็ดพันธุ์กัญชงในปี นี้ประมาณ 1 แสนเมล็ด ปลูกในพื้นที่โรงเรือนของบริษัทที่ จ.เชียงราย และคอนแทรคฟาร์มมิ่ง กลางน้ำได้ร่วมกับกรมการ แพทย์แผนไทยฯ ทำโรงสกัดสาร CBD และปลายน้ำ เปิดตัวผลิตภัณฑ์ดูแลผิวหน้า แบรนด์ CannBE ช่วงแรกวางตลาด 3 ชนิด ได้แก่ ซีบีดี แอนตี้ แอคเน่ เซรั่ม และครีม กลุ่มเป้าหมายวัยรุ่น และซีบีดี แอนตี้ เอจจิ้ง เซรั่ม และเปิดตัว คลินิก CannaHealth คลินิกการแพทย์และการดูแลสุขภาพองค์รวมที่ใช้กัญชงและกัญชาร่วมกับการรักษาของแพทย์แผนไทย ประยุกต์ครบวงจรแห่งแรก ตั้งเป้ารายได้ 1,000 ล้านบาท ภายในปี 2566 และกำลังระดมทุนขยายเฟส 2 ผ่านบริษัท สิน วัฒนา คราวด์ฟันดิง จำกัด14 ตุลาคม : The Magnificent Six
The Magnificent Six
Main Hall, Thailand Cultural Centre
Date and Time : Saturday 14 October 2023 at 7:00 PM
Ticket Price : 4,000/ 3,500/ 3,000/ 2,500/ 1,800 THB
เธอทำได้ไง? เตรียมพร้อมที่จะถามตัวเองซ้ำแล้วซ้ำอีกในค่ำคืนแสนมหัศจรรย์ ที่เต็มไปด้วยกลลวงที่น่าทึ่งจนเหมือนกับเสกมนตร์
ครั้งแรกที่ 6 นักมายากลหญิงอันดับต้นของโลก จะเดินทางมาแสดงร่วมกันบนเวทีเดียว โดยการกำกับของประธานสมาคมนักมายากลนานาชาติ นิวยอร์ก ที่บินตรงมาเพื่อเนรมิตการแสดงครั้งนี้ที่ กรุงเทพฯ โดยเฉพาะ ก่อนจะนำไปออกอากาศที่อเมริกาต่อไป
พบกับกลลวงตาที่น่าตื่นตะลึง ทั้งลึกลับและเร้าใจ และการประชันฝีมือของสุดยอดนักมายากลหญิงแบบไม่มีใครยอมใคร ที่จะทำให้คุณและครอบครัวไม่อยากจะเชื่อสายตาตัวเอง
วันเสาร์ 14 ตุลาคม 2566 เวลา 19:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
สนับสนุนโดย ไอคอนสยาม
การแสดงแสงเสียงตำนานอุ้มพระดำน้ำ 14 - 17 ตุลาคม 2566
งานอุ้มพระดำน้ำที่ไม่ควรพลาด การแสดงแสงเสียงตำนานอุ้มพระดำน้ำ “พระพุทธมหาธรรมราชา ก้องปฏพี เรืองรุจีเพชบุระ" ค่ำคืนวันที่ 14 - 17 ตุลาคม 2566 ชมการแสดงโหมโรง เวลา 19.00 น. เป็นต้นไป ณ เวทีกลาง หน้าห้องสมุดเฉลิมราชกุมารี แบ่งออกเป็น 4 องก์ ประกอบด้วย
องก์ที่ 1 กำเนิดพระพุทธมหาธรรมราชา
องก์ที่ 2 พ่อขุนผาเมืองผู้กล้าแห่งเมืองราด
องก์ที่ 3 บุญฤทธิ์พระพุทธมหาธรรมราชา
องก์ที่ 4 ลือเลื่องประเพณีอุ้มพระดำน้ำ
เที่ยวพิษณุโลก เพชรบูรณ์
เปิดทำการวันจันทร์-ศุกร์เวลา 08.30 - 16.30 น.
โทร. 055 252 742-3 / 097 072
16 ตุลาคม 65 ร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. ...
-นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึงการเสนอ ร่าง พ.ร.บ.กัญชา ที่จะเข้าพิจารณาในสภาถือว่า สมบูรณ์แบบ ซึ่งกรรมาธิการฯ ได้ส่งวาระบรรจุเข้าไปแล้ว หลังได้รับข้อแนะนำและข้อห่วงใยต่างๆ จากพรรคที่ไม่รับหลักการ ให้บรรจุในวาระ 2 ก่อนหน้านี้ ทางกมธ.ชี้แจงว่าที่แนะนำเข้ามาอยู่ในร่างแล้ว ดังนั้น ไม่มีเหตุผลที่จะไม่รับ หากไม่รับก็ต้องไป ชี้แจงกับประชาชน ไม่ใช่ชี้กลับมาที่เจ้าของนโยบาย เพราะทำหน้าที่ตามสัญญากับประชาชนแล้ว ในการปลดออกจากยาเสพ ติด ใช้เพื่อการแพทย์เท่านั้น ไม่มีสันทนาการ มีกฎระเบียบควบคุมตามข้อห่วงใยทั้งหมด จึงต้องถือว่าตัวแทนประชาชนควร สนับสนุนให้กฎหมายออกมาโดยเร็ว รวมทั้งการวิพากษ์วิจารณ์ว่าการใช้กัญชาที่ไม่มีการควบคุมจะเป็นตัวกระตุ้นให้ปัญหา ความรุนแรงมากขึ้น ยังไม่มีการศึกษาทางการแพทย์ที่พบคนที่ใช้กัญชาทางการแพทย์ ใช้ถูกวิธีตามกฎหมายจะมีอาการคลุ้ม คลั่ง ก่อเหตุรุนแรง17 ตุลาคม 65 ควบคุมกัญชา
- ปัจจุบันกัญชาจัดเป็นสมุนไพรควบคุม แต่ยังไม่มี พ.ร.บ.กัญชา กัญชง จึงจำเป็นที่ สธ.ต้องออกประกาศเพิ่มเติมมา ควบคุม โดยเฉพาะการกำหนดจำนวนปริมาณครอบครอง เช่นกำหนดว่าผู้ใดประสงค์เพาะปลูกกัญชาใช้ประโยชน์ในครัวเรือน ไม่เกิน 15 ต้น รวมทั้งคุมการโฆษณาในส่วนผลิตภัณฑ์กัญชา โดยเฉพาะผ่านช่องทางออนไลน์ที่เด็กเยาวชนเข้าถึง การห้ามใช้ นันทนาการภายในบ้าน เพื่อไม่ให้ขัดอนุสัญญาระหว่างประเทศเรื่องกัญชา เนื่องจากมีกฎหมายควบคุมASEAN Healthcare Beauty Wellness 2024 วันที่ 17-19 ตุลาคม 2567
งาน
Healthcare Beauty Wellness Expo 2024 เวทีสำคัญสำหรับอุตสาหกรรมสุขภาพและความงาม มีผู้เข้าร่วมงานจากทุกภูมิภาคทั่วโลก โอกาสพบปะกับคู่ค้าทางธุรกิจที่มีศักยภาพ *ผู้จัดมีการปรับเปลี่ยนกำหนดการแสดงงาน จาก 23 - 25 wฤษภาคม เป็น 17 - 19 ตุลาคม 2567
18 ตุลาคม 65 ยื่นยุบพรรคการเมือง อ้างกัญชา, ควบคุมกัญชาเสรี
ยื่นยุบพรรค ภท. ปมนโยบายกัญชาเสรี
- นพ.ชลน่าน ศรีแก้ว ส.ส.พรรคเพื่อไทย เผยเตรียมยื่น กกต. ให้ยุบพรรคภูมิใจไทย กรณีประกาศนโยบายกัญชาเสรีเข้าข่ายพฤติกรรมลวงคะแนนนิยมหาเสียงเลือกตั้ง อยู่ระหว่างฝ่ายกฎหมายของพรรคฝ่ายค้านพิจารณารายละเอียด และคาดว่า 1 พ.ย.65 จะทราบความชัดเจน นอกจากนี้จะยื่นศาลปกครองให้มีคำสั่งคุ้มครองและคำสั่งให้ประกาศ สธ. เรื่อง ระบุชื่อยาเสพติดให้โทษประเภท 5 พ.ศ.2565 ที่ทำให้ทุกส่วนของกัญชากัญชงไม่เป็นยาเสพติดนั้นไม่ชอบตามกฎหมาย เพราะสร้าง
ความเข้าใจคลาดเคลื่อนให้กับประชาชนและมีผลกระทบต่อสังคม
- นายภราดร ปริศนานันทกุล โฆษกพรรคภูมิใจไทย เผยพรรคได้ประกาศนโยบายกัญชาตั้งแต่การหาเสียงเลือกตั้งปี 2562 จนถึงตอนนี้ 2565 และใกล้จะถึงการเลือกตั้งครั้งใหม่ พรรคภูมิใจไทยสามารถทำสิ่งที่พูดไว้กับประชาชนให้เกิดขึ้นจริงได้ จุดนี้หรือไม่ที่พรรคเพื่อไทยกลัวจนต้องยื่นยุบพรรค ทั้งนี้ได้คุยกับนายศุภชัย ใจสมุทร ไม่ได้หนักใจกับกรณีดังกล่าว
- เพจสำนักข่าวราษฎร โพสต์ว่า สมศักดิ์ เจียมธีรสกุล ไม่เห็นด้วยกรณีฝ่ายค้านยื่นยุบพรรคภูมิใจไทย ถือเป็นมาตรการของ เผด็จการ เรียกร้องให้ถอนเรื่องทันที - น.ส.ลักขณา ปันวิชัย (แขก) พิธีกรชื่อดัง ผู้สนับสนุนพรรคเพื่อไทย ใช้ทวิตเตอร์ชื่อ @kamphaka ทวีตไม่เห็นด้วยกรณี พรรคเพื่อไทยยื่นยุบพรรคภูมิใจไทยว่ากฎหมายยุบพรรคถูกออกแบบมาเพื่อทำลายประชาธิปไตย เป็นกฎหมายที่ไม่ชอบด้วย หลักการประชาธิปไตยและควรถูกยกเลิก
ควบคุมกัญชาเสรี
- ทวีตว่า ทนายรณณรงค์ แก้วเพ็ชร์ ประธานเครือข่ายรณรงค์ทวงคืนความยุติธรรมในสังคม โพสต์ถามต้องการให้ หน่วยงานของรัฐออกมาควบคุมกัญชาเสียที จะปล่อยให้ขายกัญชาเป็นตันอย่างนี้เลยหรือ หลังมีสาวถูกกลุ่มวัยรุ่นถืออาวุธ สงครามบุกบ้านปล้นกัญชา เนื่องจากได้นำกัญชา 500 กิโลกรัมกลับมาขาย
ASIA Fitness Conference 2024: AFC2024 - 18-20 October 2024
Asia Fitness Conference 2024 Date 18-20 October 2024 BITEC, Bangkok – Thailand AFC is the place for ASIA’s fitness community to be inspired by world-renowned fitness educators.
Medlab Asia and Asia Health 2022 วันที่ 19 - 21 ตุลาคม 2022
Medlab Asia & Asia Health 2022 – งานแสดงเครื่องมือแพทย์และประชุมวิชาการทางการแพทย์นานาชาติ รวบรวมผู้ประกอบการด้านเครื่องมือแพทย์และห้องปฏิบัติการทางการแพทย์จากกลุ่มประเทศอาเซียนเข้าด้วยกัน ผลักดันให้เกิดการทำธุรกิจและเรียนรู้ผ่านประชุมวิชาการที่มีคะแนนศึกษาต่อเนื่องของแพทย์ภายในงานเดียว
19 ตุลาคม 65 Sky doctor รับเด็กชายวัย 1 ปี ติดเชื้อในปอด ต้องใส่ท่อช่วยหายใจจากอมก๋อย
เด็กชายวัย 1 ปี ติดเชื้อในปอด ต้องใส่ท่อช่วยหายใจ Sky doctor นำส่งจากอมก๋อย มารักษาต่อที่รพ.นครพิงค์ ‼️
วันที่ 17 ตุลาคม 2565 เวลา 11.20 น. ศูนย์รับแจ้งแหตุและสั่งการจังหวัดเชียงใหม่ ได้ขอรับการสนับสนุนการลำเลียงทางอากาศสำหรับผู้ป่วยเด็กชาย อายุ 1 ปี วินิจฉัยโรคปอดบวม จากโรงพยาบาลอมก๋อย อำเภออมก๋อย จังหวัดเชียงใหม่ ส่งรักษาต่อปลายทางโรงพยาบาลนครพิงค์
โดยการประสานงานของศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากหน่วยเฉพาะกิจกรมทหารราบที่ 7 ต้นทางสนามกีฬาเทศบาลอมก๋อย สนามจอดส่งผู้ป่วยปลายทางกองพลทหารราบที่ 7 ได้รับการสนับสนุนอากาศยานหน่วยเฉพาะกิจกรมทหารราบที่ 7 รุ่น Bell 212
ชุดปฏิบัติการบินประกอบด้วยพ.ท. ประสิทธิ์ ตอสกุล, ร.ท. ณัฏฐพร จารยุ้ย, จ.ส.อ. สุวคุณ สุวัสส์, จ.ส.ท. เมธี ขจรจิตร
ชุดปฏิบัติการบิน Sky Doctor โรงพยาบาลนครพิงค์ ประกอบด้วยนายแพทย์กรีฑา คำเนียม, นางสาวนิภาภรณ์ ปองพาณิชย์พัฒนา, นายอุเทน เขิ่งภักดี
การลำเลียงผู้ป่วยในครั้งนี้ลุล่วงด้วยดี ผู้ป่วยอยู่ในการดูแลของทีมกุมารแพทย์โรงพยาบาลนครพิงค์แล้ว
19 ตุลาคม 65 ศักยภาพกัญชาทางการแพทย์
- นพ.รุ่งเรือง กิจผาติ หัวหน้าที่ปรึกษาระดับกระทรวง (นพ.ทรงคุณวุฒิ 11) เผยปี 2565 ขยายบริการคลินิกกัญชาทาง การแพทย์ภายใต้สังกัดสำนักงานปลัดกระทรวงสาธารณสุข กรมวิชาการ และสถานพยาบาลเอกชน รวม 1,026 แห่งทั่ว ประเทศ มีผู้ป่วยได้รับการรักษาด้วยยากัญชาทางการแพทย์เพิ่มขึ้นถึงร้อยละ 142.18 โดยมีผลงานวิจัยหลายฉบับพบว่า ยา กัญชาช่วยเพิ่มคุณภาพชีวิตในผู้ป่วยมะเร็งระยะท้าย เตรียมศึกษาต่อยอดนำไปใช้รักษา “มะเร็ง-นอนไม่หลับ” พร้อมกำกับ ติดตามผลกระทบจากนโยบายกัญชาทางการแพทย์อย่างต่อเนื่องโรงพยาบาลบางพลี ประกาศรับสมัครงานหลายตำแหน่ง (ตค 65) LINK
โปรดเข้ามาติดต่อด้วยตนเองเท่านั้น ที่กลุ่มงานทรัพยากรบุคคล ชั้น 9 เวลา 9.00 - 15.00 น.
หลักฐานที่ต้องเตรียม
- สำเนาบัตรประชาชน
- สำเนาทะเบียนบ้าน
- สำเนาวุฒิการศึกษา
- รูปถ่าย 1 นิ้ว 1 รูป สัมภาษณ์ผ่าน พร้อมเริ่มงานทันที
(เมื่อสัมภาษณ์ผ่าน ต้องตรวจสุขภาพกับรพ.บางพลี จะเสียค่าใช้จ่ายเอง) [19/10/2565]
19 ตุลาคม พ.ศ.2566 - คุณภาพอากาศอยู่ในระดับ คุณภาพดีมากถึงเริ่มมีผลกระทบต่อสุขภาพ LINK
คุณภาพอากาศอยู่ในระดับ คุณภาพดีมากถึงเริ่มมีผลกระทบต่อสุขภาพ
สารมลพิษทางอากาศที่ตรวจพบเกินมาตรฐานได้แก่ ฝุ่นละออง ขนาดไม่เกิน 2.5 ไมครอน (PM2.5) ตรวจพบค่าระหว่าง 6 - 48 ไมโครกรัมต่อลูกบาศก์เมตร (µg/m3) เกินมาตรฐานที่บริเวณต.มุกดาหาร อ.เมือง จ.มุกดาหาร, ต.ในเมือง,อ.เมือง จ.ยโสธร, ต.หน้าพระลาน อ.เฉลิมพระเกียรติ จ.สระบุรี, ริมถนนดินแดง เขตดินแดง จ.กรุงเทพฯ, ต.มีชัย อ.เมือง จ.หนองคาย, ต.ในเมือง อ.เมือง จ.อุบลราชธานี, ต.ในเมือง อ.เมือง จ.นครพนม,
ในกรุงเทพฯ พบที่ แขวงคลองกุ่ม เขตบึงกุ่ม, สวนเสรีไทย เขตบึงกุ่ม, ริมถนนลาดพร้าว ซอยลาดพร้าว 95 เขตวังทองหลาง จ.กรุงเทพฯ, ริมถนนพระรามที่ 4 หน้าสามย่านมิตรทาวน์ เขตปทุมวัน จ.กรุงเทพฯ, ริมถนนนราธิวาส เขตบางรัก จ.กรุงเทพฯ, แขวงทุ่งวัดดอน เขตสาทร จ.กรุงเทพฯ, ริมถนนพระราม 3 เขตยานนาวา จ.กรุงเทพฯ, ริมถนนบางนา-ตราด เขตบางนา จ.กรุงเทพฯ, ริมถนนศรีนครินทร์ เขตประเวศ จ.กรุงเทพฯ, ริมถนนเจริญนคร เขตคลองสาน จ.กรุงเทพฯ, ริมถนนแยกท่าพระ เขตบางกอกใหญ่ จ.กรุงเทพฯ, ริมถนนซอยนิคมบ้านพักรถไฟธนบุรี 5 เขตบางกอกน้อย จ.กรุงเทพฯ, แขวงคลองเตย เขตคลองเตย จ.กรุงเทพฯ
สุโขทัย มาราธอน ครั้งที่ 2 วันที่ 19-20 ตุลาคม 2567 อุทยานประวัติศาสตร์สุโขทัย LINK
สุโขทัย มาราธอน Sukhothai Marathon ครั้งที่ 2 วันที่ 19-20 ตุลาคม 2567 อุทยานประวัติศาสตร์สุโขทัย จ.สุโขทัย
เสาร์ 19 ตุลาคม 2567 อุทยานประวัติศาสตร์สุโขทัย จ.สุโขทัย วิ่ง ระยะ แฟมิลี่แรลลี่รัน 2.7 กม.
อาทิตย์ 20 ตุลาคม 2567 อุทยานประวัติศาสตร์สุโขทัย จ.สุโขทัย วิ่ง ระยะ มาราธอน 42.195 กม. / ฮาร์ฟ มาราธอน 21.5 กม. / มินิ มาราธอน 10 กม. / ฟันรัน 5 กม.
แถลงการณ์ของราชวิทยาลัย ต่างๆ
แถลงการณ์ของราชวิทยาลัย ต่างๆ
- ราชวิทยาลัยกุมารแพทย์ ฯ ได้ออกแถลงการณ์ สรุปได้ว่า ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย จึงมีมติว่ายังไมส่มควรนํากัญชาและสารสกัดจากกัญชาใดๆ มารักษาโรคในผ้ปู่วยเด็กและวยัรุ่น จนกว่าจะมีข้อมลูการศึกษาวิจัยที่มากพอ ยืนยันถึงประสิทธิภาพและความ ปลอดภัยของการใช้สารสกัดกัญชารักษาในเด็กรวมทั้งมีประกาศในแนวทางการรักษาผ้ปู่วย แถลงการณ์ จุดยืนของราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย เรื่องการใช้กัญชาทางการแพทย์ในเด็กและวัยรุ่น
- ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย สรุปว่า การศึกษาผลของกัญชาในโรคต้อหิน ได้แสดงให้เห็นผลประโยชน์ต่อความดันลูกตา เพียงในระยะสั้น (ชั่วโมง) ชี้ให้เห็นศักยภาพที่จำกัด สำหรับ cannabinoids ในการรักษาโรคต้อหิน” นอกจากนี้ กรรมการราชวิทยาลัย เห็นว่า รูปแบบ ขนาดและความเข้มข้นที่พอเหมาะ ของสารสกัดจากกัญชา ยังไม่เคยมีการวิจัยรองรับ ทางชมรมต้อหิน ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย ยินดีที่จะทำวิจัยเรื่องนี้ ในอนาคตอันใกล ความเห็นทางวิชาการเกี่ยวกับการใช้กัญชาทางการแพทย์ (จักษุ)
- ราชวิทยาลัยจิตแพทย์แห่งประเทศไทยข้อมูลทางการแพทย์ (Evidence Base) ที่เกี่ยวกับกัญชาทางการแพทย์ สรุปได้ว่า การใช้สารสกัดจากกัญชาในผู้ป่วยที่มีปัญหาสุขภาพจิตยังมีข้อจำกัดในด้านประโยชน์สำหรับผู้ป่วยโรคจิต โรคอารมณ์ผิดปกติทั้งโรคซึมเศร้า (Depressive Disorder) และอารมณ์แมเนีย (Mania) กลุ่มโรควิตกกังวล (Anxiety Disorder) และปัญหานอนไม่หลับ (insomnia) กลุ่มเหล่านี้มีความเสี่ยงสูง และมักแสวงหาความสุขช่วงสั้น (getting High) จากการใช้กัญชา และเกิดผลเสียจากการใช้ เช่่นอารมณ์โรคจิต และอาการมาเนียกำเริบ หรือเสี่ยงต่อการฆ่าตัวตาย อีกทั้งเสี่ยงต่อการเสพติดสารเสพติด อย่างไรก็ตาม ปัจจุบันยังขาดข้อมูลหลักฐานเชิงประจักษ์ที่ดีพอในการนำกัญชามาใช้ในทางการแพทย์ในโรคทางจิตเวช จึงเห็นสมควรให้การสนับสนุนในการทำวิจัยในเรื่องนี้ตามระเบียบวิธีการทางวิทยาศาสตร์ต่อไป และในโรคที่มียารักษาได้ผลดีอยู่แล้ว ไม่สนับสนุนการเปลี่ยนมาใช้กัญชาในการรักษา ข้อมูลทางการแพทย์ (Evidence Base) ที่เกี่ยวกับกัญชาทางการแพทย์
20 ตุลาคม 65 ร่าง พ.ร.บ.กัญชา
-นายมงคลกิตติ์ สุขสินธารานนท์ ส.ส.บัญชีรายชื่อ และหัวหน้าพรรคไทยศรีวิไลย์ กล่าวว่า ไม่เห็นด้วยที่จะยื่นยุบพรรคจาก นโยบายกัญชาเสรี เพราะเป็นนโยบายพรรคที่สามารถทำได้ ส่วนทำแล้วเกิดผลกระทบก็ต้องแก้กฎหมายให้กัญชาเป็นยาเสพ ติดเหมือนเดิมและให้ใช้ได้ทางการแพทย์เพื่อรักษาโรคเท่านั้น ควรแก้ไขในระบบรัฐสภา อย่างไรก็ตาม ตนอาจรวบรวมรายชื่อ ส.ส. 20 รายชื่อเพื่อขอแก้ไขกฎหมายให้กัญชากลับไปเป็นยาเสพติดเหมือนเดิม
- สภาผู้แทนราษฎร เตรียมนัดประชุม 2-3 พฤศจิกายน วาระที่ต้องจับตา คือการพิจารณาร่าง พ.ร.บ. กัญชา กัญชง พ.ศ.... ที่กรรมาธิการวิสามัญพิจารณาแล้วเสร็จต่อเนื่องในวาระสองและวาระสาม ประเด็นกัญชาถือเป็นการเปิดหน้ารบ ระหว่าง พรรคภูมิใจไทยกับพรรคเพื่อไทย ซึ่งร่วมกับพรรคประชาธิปัตย์และพรรคพลังประชารัฐ เพราะนโยบายกัญชาคือ สิ่งที่เป็นแต้ม ต่อ เพิ่มคะแนนนิยมให้กับกลุ่มเนวิน-อนุทิน เพราะสามารถผันนโยบายกัญชาที่หาเสียงในปี2562 ให้เป็นสิ่งที่จับต้องได้จริง ล่าสุดพรรคภูมิใจไทยได้ยื่นองค์กรอิสระให้ตรวจสอบและอาจขยายวงไปถึงการยุบพรรค หากมีข้อเท็จจริงที่พิสูจน์ได้ว่า แกน นำพรรคภูมิใจไทยใช้นโยบายลวงเอาคะแนนนิยมจากผู้มีสิทธิเลือกตั้ง เพื่อหวังได้มาซึ่งอำนาจการปกครองที่มิชอบ ปฏิเสธ ไม่ได้ว่า ร่างพ.ร.บ.กัญชาฯ คือ สิ่งที่จะเป็นเครื่องมือยืนยันนโยบายหาเสียงของพรรคภูมิใจไทยว่า พูดแล้วทำได้จริง โดยเฉพาะ การทำให้กัญชาเป็นพืชเศรษฐกิจ ยกระดับความร่ำรวยให้ชาวบ้าน จากการได้สิทธิการปลูกกัญชาตามจำนวนที่กฎหมาย กำหนด แต่หากเกมการเมืองจ้องสกัดคู่แข่งทางการเมือง ผลที่อาจจะเกิดขึ้นคือความขัดแย้ง ทั้งในวงของพรรคร่วมรัฐบาล ที่ อาจเร่งเกมเร็วเพื่อนำไปสู่ยุบสภาก็เป็นได้
- ในขณะที่ร่าง พ.ร.บ.กัญชายังค้างอยู่ในวาระ 2 ของการพิจารณาในสภาผู้แทนฯ และหลายพรรคแสดงปฏิกิริยาไม่เห็นด้วย กับผลที่ตามมาหลังเปิดให้ใช้กัญชา ข้อมูล สธ.ปี 2565 มีผู้ป่วยรักษาด้วยกัญชาเพิ่มขึ้นร้อยละ 142.18 อย่างไรก็ตาม ต้อง ยอมรับว่านโยบายกัญชายังขาดมุมมองในด้านการควบคุมเพื่อความปลอดภัยของสังคม ซึ่งร่าง พ.ร.บ.กัญชาฯ ที่ค้างอยู่ น่าจะ มีส่วนอุดช่องว่างได้ระดับหนึ่ง แต่ในสภาพการเมืองที่ใกล้การเลือกตั้ง ทำให้อุปสรรคในการให้กฎหมายนี้ผ่านสภามีมากขึ้น และจะยุ่งยากมากขึ้นหากช่องว่างนี้ยังดำเนินต่อไป แทนที่จะมีกฎหมายเข้ามาช่วยทำหน้าที่ลดความกังวลของประชาชน 11 ก.พ. 2566 เจ้าหน้าที่สถานเอกอัครราชทูต ณ กรุงอังการา ได้ช่วยประสานงานกับทางการตุรกีที่เกี่ยวข้องในการส่งอุปกรณ์จากประเทศไทยรอบที่สองไปยังฐานปฏิบัติการชั่วคราวของทีม USAR ประเทศไทยที่เมือง Hatay ซึ่งได้รับผลกระทบมากที่สุดเมืองหนึ่งจากเหตุแผ่นดินไหวที่ตุรกี
เวลา 18.00 น. (เวลาท้องถิ่นตุรกี) เจ้าหน้าที่สถานเอกอัครราชทูต ณ กรุงอังการา ได้พาทีมข่าว 3 มิติ มาถึงบริเวณแคมป์ของทีมกู้ภัย USAR ประเทศไทย ที่เมือง Hatay
ผู้ใช้สิทธิ์ประกันสังคม รพ.ชลบุรี ฉีดวัคซีนไข้หวัดใหญ่ ฟรี LINK
ผู้ใช้สิทธิ์ประกันสังคม รพ.ชลบุรี ฉีดวัคซีนไข้หวัดใหญ่ ฟรี ตั้งแต่ 1 พ.ค. 66 - 31 ส.ค. 66 เป็นต้นไป รพ.ชลบุรี ให้บริการ "ฉีดวัคซีนไข้หวัดใหญ่ ฟรี" แก่ประชาชน ผู้ใช้สิทธิ์ประกันสังคม ที่มีอายุ 50 ปี ขึ้นไป ▶️ ให้บริการทุกวันราชการ เวลา 08.30 น. - 15.00 น. ▶️ ติดต่องานประกันสังคม อาคารผู้ป่วยนอก ชั้น 3 พร้อมบัตรประชาชน ▶️ สอบถามเพิ่มเติม โทร 038-931078 ถึง 9
งานไหลเรือไฟ จังหวัดนครพนม ประจำปี 2566 วันที่ 20-30 ตุลาคม 2566
งานไหลเรือไฟ จังหวัดนครพนม ประจำปี 2566 กำหนดจัดขึ้นระหว่างวันที่ 20-30 ตุลาคม 2566 (รวม 11 วัน 11 คืน) โดยมีกิจกรรมไฮไลท์ในคืนวันออกพรรษา วันที่ 29 ตุลาคม 2566 ขึ้น 15 ค่ำเดือน 11 ไหลเรือไฟจาก 12 อำเภอ จำนวน 12 ลำ จังหวัดนครพนมได้กำหนดให้มีกิจกรรมในทุกค่ำคืน ได้แก่ การไหลเรือไฟโชว์คืนละ 1-2 ลำ การปล่อยกระทงสายวันละ 25,000 ดวง การแสดงศิลปวัฒนธรรมท้องถิ่น การจัดทำเรือไฟโบราณ การแสดงซุ้มวิถีคนทำเรือไฟของ 12 อำเภอ และมหกรรมสินค้า OTOP คาราวานสินค้า การแสดงมหรสพตามประเพณี
20 ตุลาคม พ.ศ.2566 - คุณภาพอากาศอยู่ในระดับ ดีมาก ถึง เริ่มมีผลกระทบต่อสุขภาพ
คุณภาพอากาศอยู่ในระดับ ดีมาก ถึง เริ่มมีผลกระทบต่อสุขภาพ
สารมลพิษทางอากาศที่ตรวจพบเกินมาตรฐานได้แก่ฝุ่นละออง ขนาดไม่เกิน 2.5 ไมครอน (PM2.5) เกินมาตรฐานที่บริเวณ
ต.ในเมือง อ.เมือง, อุบลราชธานี, ต.มีชัย อ.เมือง, หนองคาย,ต.หน้าพระลาน อ.เฉลิมพระเกียรติ, สระบุรี,ต.มหาชัย อ.เมือง, สมุทรสาคร,ต.อ้อมน้อย อ.กระทุ่มแบน, สมุทรสาคร,ต.ปากน้ำ อ.เมือง, สมุทรปราการ,ต.ทรงคนอง อ.พระประแดง, สมุทรปราการ,ต.เมืองเหนือ อ.เมือง, ศรีสะเกษ,ต.มาบตาพุด อ.เมือง, ระยอง,ต.มุกดาหาร อ.เมือง, มุกดาหาร,ต.บางพูด อ.ปากเกร็ด, นนทบุรี,ต.ในเมือง อ.เมือง, นครพนม,เขตสะพานสูง, กรุงเทพฯ,ริมถนนพหลโยธิน เขตบางเขน, กรุงเทพฯ,แขวงทุ่งสองห้อง เขตหลักสี่, กรุงเทพฯ,แขวงบางซื่อ เขตบางซื่อ, กรุงเทพฯ,แขวงคลองเตย เขตคลองเตย, กรุงเทพฯ,เขตห้วยขวาง, กรุงเทพฯ,ริมถนนประชาอุทิศ เขตทุ่งครุ, กรุงเทพฯ,ริมถนนเอกชัย เขตบางบอน, กรุงเทพฯ,ริมถนนมาเจริญ เพชรเกษม 81 เขตหนองแขม, กรุงเทพฯ,ริมถนนเพชรเกษม เขตภาษีเจริญ, กรุงเทพฯ,ริมถนนคลองทวีวัฒนา เขตทวีวัฒนา, กรุงเทพฯ,ริมถนนพุทธมณฑล 1 เขตตลิ่งชัน, กรุงเทพฯ,ริมถนนซอยนิคมบ้านพักรถไฟธนบุรี 5 เขตบางกอกน้อย, กรุงเทพฯ,ริมถนนแยกท่าพระ เขตบางกอกใหญ่, กรุงเทพฯ,ริมถนนเจริญนคร เขตคลองสาน, กรุงเทพฯ,ริมถนนรัชดาภิเษก-ท่าพระ เขตธนบุรี, กรุงเทพฯ,ริมถนนศรีนครินทร์ เขตประเวศ, กรุงเทพฯ,ริมถนนสีหบุรานุกิจ เขตมีนบุรี, กรุงเทพฯ,ริมถนนลาดกระบัง เขตลาดกระบัง, กรุงเทพฯ,แยกสวนสยาม-รามอินทรา เขตคันนายาว, กรุงเทพฯ,ริมถนนนวมินทร์ แยกบางกะปิ เขตบางกะปิ, กรุงเทพฯ,ริมถนนพหลโยธิน แยก ม.เกษตรศาสตร์ เขตจตุจักร, กรุงเทพฯ,ริมถนนบางนา-ตราด เขตบางนา, กรุงเทพฯ,ริมถนนพัฒนาการ เขตสวนหลวง, กรุงเทพฯ,ริมถนนซอยสุขุมวิท 63 เขตวัฒนา, กรุงเทพฯ,ริมถนนพระราม 3 เขตยานนาวา, กรุงเทพฯ,แขวงทุ่งวัดดอน เขตสาทร, กรุงเทพฯ,ริมถนนนราธิวาส เขตบางรัก, กรุงเทพฯ,ริมถนนพระรามที่ 4 หน้าสามย่านมิตรทาวน์ เขตปทุมวัน, กรุงเทพฯ,ริมถนนลาดพร้าว ซอยลาดพร้าว 95 เขตวังทองหลาง, กรุงเทพฯ,ริมถนนพระราม 6 เขตพญาไท, กรุงเทพฯ,ริมถนนตรีมิตร วงเวียนโอเดียน์ เขตสัมพันธวงศ์, กรุงเทพฯ,ริมถนนกรุงเกษม เขตป้อมปราบศัตรูพ่าย, กรุงเทพฯ,ริมถนนพระราม 5 เขตดุสิต, กรุงเทพฯ,ริมถนนพญาไท เขตราชเทวี, กรุงเทพฯ,ริมถนนราษฎร์บูรณะ, เขตราษฎร์บูรณะ, กรุงเทพฯ,ริมถนนสุขุมวิท เขตพระโขนง, กรุงเทพฯ,ริมถนนวิภาวดีรังสิต, เขตดินแดง, กรุงเทพฯ,สวนหลวงพระราม 8 เขตบางพลัด,สวนกีฬารามอินทรา เขตบางเขน,สวนพระนคร เขตลาดกระบัง,สวนทวีวนารมย์ เขตทวีวัฒนา,สวนบางแคภิรมย์ เขตบางแค,สวนเสรีไทย เขตบึงกุ่ม,สวนเบญจกิติ เขตคลองเตย,สวนธนบุรีรมย์ เขตทุ่งครุ,อุทยานเบญจสิริ เขตคลองเตย,สวน 60 พรรษาสมเด็จพระนางเจ้าพระบรมราชินีนาถ เขตลาดกระบัง,สวนหลวง ร.9 เขตประเวศ,เขตบางคอแหลม, กรุงเทพฯ,ริมถนนพระราม 2 เขตบางขุนเทียน, กรุงเทพฯ,ริมถนนจรัญสนิทวงศ์ เขตบางพลัด, กรุงเทพฯ,เขตจอมทอง, กรุงเทพฯ,เขตคลองสามวา, กรุงเทพฯ,แขวงคลองกุ่ม เขตบึงกุ่ม,ริมถนนดินแดง เขตดินแดง, กรุงเทพฯ,ริมถนนลาดพร้าว เขตวังทองหลาง, กรุงเทพฯ,ริมถนนพระราม 4 เขตปทุมวัน, กรุงเทพฯ,แขวงบางนา เขตบางนา, กรุงเทพฯ,ริมถนนกาญจนาภิเษก เขตบางขุนเทียน, กรุงเทพฯ,แขวงหิรัญรูจี เขตธนบุรี, กรุงเทพฯ
พว.นิตยา ชไนศวรรย์ ประธานเจ้าหน้าที่บริหาร (CEO) กลุ่มบริษัท บางกอกเฮลท์เเคร์ เซอร์วิส จำกัด (BHS Group) และ AgyHero คลินิกศาลาแดงสัตวแพทย์ ถ.บรรทัดทอง
คลินิกศาลาแดงสัตวแพทย์ ตั้งอยู่บนถนนบรรทัดทอง ใกล้ซอยจุฬา16 แขวงวังใหม่ เขตปทุมวัน เปิดให้บริการจันทร์-เสาร์ เวลา 9.00-20.00 น. Tel 022151068
Facebook |
@healthserv.netKhaoyai Half Marathon 20 ตุลาคม 2567
Khaoyai Half Marathon 20 ตุลาคม 2567 ณ Chante Cafe เปิดรับสมัคร : 17 มิถุนายน 2567 ปิดรับสมัคร : 10 ตุลาคม 2567
Baxter Run For Fund 2024 วันที่ 20 ตุลาคม 2567 สวนวชิรเบญจทัศ (สวนรถไฟ)
งานวิ่งการกุศล Baxter Run For Fund 2024 วันอาทิตย์ที่ 20 ตุลาคม 2567 สวนวชิรเบญจทัศ (สวนรถไฟ) 1.เพื่อรณรงค์ให้ประชาชนตระหนักถึงความสำคัญของการรักษาสุขภาพ และเสริมสร้างโอกาสให้ประชาชนได้ออกกำลังกาย เพื่อสุขภาพที่แข็งแรง ห่างไกลโรคไต และโรคที่เกี่ยวข้องกับไต 2.เพื่อสร้างความสัมพันธ์ระหว่างองค์กรทางภาครัฐและเอกชนที่เกี่ยวข้องในสายงานด้านสุขภาพและสาธารณชนเข้าใจถึงบทบาทความรับผิดชอบต่อสังคมเกี่ยวกับโรคไต 3.เพื่อนำรายได้ทั้งหมดโดยไม่หักค่าใช้จ่ายจากการจัดกิจกรรม บริจาคให้แก่มูลนิธิโรคไตแห่งประเทศไทย และ สมาคมเพื่อนโรคไตแห่งประเทศไทย เพื่อช่วยเหลือผู้ป่วยโรคไตของประเทศไทย
4. โครงการดูแลอาการเจ็บป่วยเล็กน้อยโดยเกสัชกรเป็นรูปแบบบริการสาธารณสุขที่ใช้กันอย่างได้ผลและปลอดภัยในระดับนานาชาติ
รูปแบบการให้บริการนี้สอดคล้องกับทิศทางการบริการสาธาธารณสุขในระดับนานาชาติ เช่น ประเทศสหราชอาณาจักร ภาครัฐมีดำเนินการโครงการ "Pharmacy first เพื่อให้ประชาชนพบเภสัชกรเพื่อรับยากรณีการเจ็บป่วยเล็กน้อย คล้ายคลึงกับโครงการของประเทศไทย และยังสามารถจ่ายยาปฏิชีวนะ ซึ่งถือเป็นยาควบคุมพิเศษของประเทศสหราชอาณาจักรได้อีกด้วย ซึ่งสามารถดูรายละเอียดและกรอบของโครงการได้เพื่อให้ได้รับข้อมูลและความเข้าใจที่ถูกต้อง www.fip.org/file/5624 ซึ่งของประเทศไทย เภสัชกรร้านยาคุณภาพ จ่ายเฉพาะยาอันตรายที่เภสัชกรสามารถจ่ายยาเองได้ โดยไม่ต้องมีใบสั่งยาจากแพทย์ นอกจากนี้ แนวโน้มของประเทศต่างๆ ก็เป็นไปในทิศทาง เดียวกัน อาทิเช่น ประเทศออสเตรเลีย แคนาดา นิวชีแลนด์ และประเทศต่างๆ ทั่วโลกอีกหลายประเทศ อีกทั้งยังมีการให้บริการที่กว้างขวางขึ้นในร้านยารวมถึงการฉีดวัคชีน และที่ผ่านมาในช่วงการระบาดของโรคติดเชื้อ COVID-19 เภสัชกรร้านยาคุณภาพของประเทศไทย ก็ได้มีบทบาทบาทช่วยเหลือประชาชนให้เข้าถึงการคัดกรองตลอดจนการดูแลรักษาผู้ป่วยที่อาการไม่รุนแรงให้ได้รับคำแนะนำที่เหมาะสม และช่วยลดภาระของโรงพยาบาลได้อย่างมาก
5. การประเมินผลการให้บริการในโครงการนี้พบว่าเป็นที่น่าพอใจและให้ผลดีกับระบบสุขภาพของไทย
ในการให้บริการที่ผ่านมาตามโครงการนี้ ตั้งแต่ 31 ตุลาคม 2566 ถึง ปัจจุบัน ได้มีการการดำเนินการอย่างรอบคอบ และค่อยๆ ขยายพื้นที่ในการให้บริการ มีผู้ที่ได้รับบริการแล้วทั้งสิ้นจนถึงวันที่ 17 พฤศจิกายน 2567 จำนวน 1,771,758 คน และ 4,912,114 ครั้ง ไม่มีประชาชนคนใดเสียชีวิตจากการให้บริการจากโครงการดูแลอาการเจ็บป่วยเล็กน้อยโดยร้านยาคุณภาพแต่อย่างใด และสภาเภสัชกรรมได้ตรวจสอบการให้บริการแล้วว่าประชาชน ปลอดภัย ได้รับประสิทธิภาพการดูแลอาการตามมาตรฐานที่กำหนดไว้ในทุกกรณี นอกจากนี้ สภาเภสัชกรรม ได้ทำการสำรวจความคิดเห็นของประชาชนที่เข้ารับบริการในโครงการนี้พบว่ามีความพึงพอใจในระดับมากที่สุด จึงได้มีการขยายกรอบโครงการจากที่ครอบคลุม 16 กลุ่มอาการ เป็น 32 กลุ่มอาการ เพื่อให้บริการที่ดีขึ้น ซึ่งขัอมูลนี้ สอดคล้องกับผลการสำรวจความเห็นของประชาชนต่อเกสัชกร ซึ่งเป็นโครงการวิจัยร่วมของคณะเภสัชศาสตร์ มหาวิทยาลัยพะเยา และสภาเภสัชกรรม ที่พบว่าประชาชนให้ความเชื่อถือและมั่นใจในการปรึกษาปัญหายากับเภสัชกรอย่างมาก
ท้ายที่สุดนี้ สภาเภสัชกรรม มีความเห็นโดยสุจริตว่า ในการดำเนินการใดๆ สภาเภสัชกรรมจะคำนึงถึงถึงถึง พระราชดำรัสของพระราชบิดาที่ว่า "ขอให้ถือผลประโยชน์ส่วนตัวเป็นที่สอง ประโยชน์ของเพื่อนมนุษย์เป็นกิจที่หนึ่ง" เป็นสำคัญ และ ทางสภาเภสัชกรรม ขอความร่วมมือสมาชิกเกสัชกรร่วมกันสร้างบรรยากาศอันดี มีการแสดง ความเห็นในสื่อสังคมออนไลน์อย่างสุภาพ มุ่งเน้นการสร้างความร่วมมือระหว่างวิชาชีพ อันจะเป็นประโยชน์สูงสุดแก่ ผู้ป่วยและประชาชน
สภาเภสัชกรรม
เขตกรุงเทพเหนือ
กลุ่มเขตกรุงเทพเหนือ 1. เขตสายไหม 2. เขตจตุจักร 3. เขตหลักสี่ 4. เขตดอนเมือง 5. เขตบางซื่อ 6. เขตลาดพร้าว 7. เขตบางเขน (คลินิกที่ต้องการเพิ่มลิงค์ Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com)
จตุจักร
- คลินิกทันตกรรมกิฟสไมล์
- คลินิกทันตกรรมเกษตรเด็นทัล
- คลินิกทันตกรรมโคซี่สไมล์ลาดพร้าว info&map
- คลินิกทันตกรรมดีซีเดนทัลโฮม
- คลินิกทันตกรรมฟันดี
- คลินิกทันตกรรมยัวร์สไมล์ เสนานิคม
- คลินิกทันตกรรมสตอรี่เดนทรัลโฮม info&map
- คลินิกทันตกรรมสไมล์ซีซันส์ สาขาเมเจอร์รัชโยธิน
- เดนทัลแกลอรี่คลินิกทันตกรรม
- เดนทัลทูมอร์โรว์คลินิกทันตกรรม
- สไมล์ซิกเนเจอร์คลินิกทันตกรรม สาขาอเวนิวรัชโยธิน
- ไอเดนทิสแอทแชบเตอร์วันคลินิกทันตกรรม
ดอนเมือง
- คลินิกทันตกรรมต้นแค
- คลินิกทันตกรรมวีเดนท์แอทนาวง
- รักษ์ฟันคลินิกทันตกรรม
หลักสี่
- คลินิกทันตกรรมไนซ์
- คลินิกทันตกรรมสยามสไมล์ info&map
- ไอเดนทิสคลินิกทันตกรรม สาขาพลัมคอนโดแจ้งวัฒนะ
สายไหม
- คลินิกทันตกรรมคู้ทส์
- คลินิกทันตกรรมบ้านฟันดี
- คลินิกทันตกรรมบ้านฟันดี สาขาสายไหม
- คลินิกทันตกรรมบ้านรักฟัน
- คลินิกทันตกรรมพี-เดนท์
- คลินิกทันตกรรมแมกไม้ info&map
- คลินิกทันตกรรมเอซีสายไหมเดนทัลโฮม
- คลินิกทันตกรรมโอเค
- เอ็มสไมล์เด็นทัลคลินิกทันตกรรม
บางซื่อ
- คลินิกทันตกรรมทูธเพลส
- คลินิกทันตกรรมมิสเตอร์สไมล์
บางเขน
- คลินิกทันตกรรม ไดมอนด์
- คลินิกทันตกรรมเดนทัลคลับ
- คลินิกทันตกรรมบ้านเธียรสวน
- คลินิกทันตกรรมบิ๊กสไมล์
- คลินิกทันตกรรมเพิร์ลลี่ไวท์ info&map
- คลินิกทันตกรรมวีแอนด์เอส
- เดนทัลทูมอร์โรว์คลินิกทันตกรรม สาขาสะพานใหม่
- คลินิกทันตกรรม
- สไมล์ เดนทัล คลินิกทันตกรรม
- สายหยุดสหคลินิก
ลาดพร้าว
- คลินิกทันตกรรมกรุงเทพเดนทัล
- คลินิกทันตกรรมซียู
- คลินิกทันตกรรมรัตตินันท์ info&map
21 ตุลาคม วันพยาบาลแห่งชาติ และวันทันตสาธารณสุขแห่งชาติ
21 ตุลาคม เป็นวันคล้ายวันพระราชสมภพ สมเด็จพระศรีนครินทราบรมราชชนนี "สมเด็จย่า"
21 ตุลาคม 65 กรมการแพทย์เผยงานวิจัยการใช้สารสกัด จากกัญชา CBD
นพ.ธงชัย กีรติหัตถยากร รก.แทนอธิบดีกรมการแพทย์เผยงานวิจัยหลายชิ้นแสดงให้เห็นผลสำเร็จของการใช้สารสกัด จากกัญชา CBD ทางการแพทย์ เช่น โรคปลอกประสาทอักเสบ โรคลมชักบางชนิดในเด็ก ดังนั้น สบยช. และรพ.ธัญญารักษ์ ภูมิภาคทั้ง 6 แห่ง จึงได้ทำแผนการศึกษาวิจัยใช้สารสกัด CBD ชนิดหยอดใต้ลิ้น เพื่อลดอาการถอนเมทแอมเฟตามีน (ยาบ้า) เป็นอีกทางเลือกในการบำบัดรักษาผู้เสพยา ลดการกลับไปเสพซ้ำ ลดการนำเข้ายาจากต่างประเทศ เนื่องจากการวิจัยนี้ใช้ CBD ที่สามารผลิตได้ในไทย
นายปานเทพ พัวพงษ์พันธ์ โฆษก คกก.สื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ ระบุ ถือเป็นความก้าวหน้าที่ สำคัญของ สธ. ที่นำข้อมูลและถอดบทเรียนจากประเทศที่ใช้กัญชาทั่วโลกเพื่อทำให้กัญชาลดปัญหายาบ้า
21 ตุลาคม 65 กรรมการสิทธิมนุษยชน แนะจัดทำกฏหมายกัญชาต่อสภาและครม. พรรคการเมืองโวยแจกกัญชาหาเสียง
น.ส.สุภัทรา นาคะผิว กรรมการสิทธิมนุษยชนแห่งชาติ (กสม.) มีข้อเสนอแนะการจัดทำกฎหมายกัญชาต่อรัฐสภาและ ครม. คือ ครม.ควรมอบหมาย สธ.และหน่วยงานที่เกี่ยวข้องบังคับใช้มาตรการคุ้มครองสุขภาพตามประกาศต่าง ๆ ให้เกิด ประสิทธิผล ควบคุมการผลิตและจำหน่ายหรือใช้กัญชา กัญชง ที่ไม่ใช่ทางการแพทย์อย่างเคร่งครัด ทั้งปริมาณที่ใช้ในอาหาร เครื่องดื่มและผลิตภัณฑ์ต่าง ๆ ส่วนรัฐสภาควรพิจารณาให้มี พ.ร.บ.ที่รวบรวมมาตรการเกี่ยวกับการใช้กัญชา กัญชง ให้อยู่ใน ฉบับเดียวกัน รวมทั้ง ครม. ควรมอบหมาย สธ., คค. ปรับปรุงกฎหมายเพื่อป้องกันอุบัติเหตุจากการใช้กัญชา กัญชง
นายนิพิฏฐ์ อินทรสมบัติ รองหัวหน้าพรรคสร้างอนาคตไทย โพสต์อ้างว่าเห็นผู้สมัครฯ พรรคการเมืองหนึ่งเดินหาเสียง และแจกเมล็ดกัญชาบรรจุซอง 10 เมล็ด พันธุ์หางกระรอก ตั้งคำถามเมล็ดกัญชาที่แจกต้องได้รับอนุญาตให้ปลูกใช่หรือไม่ เรียกร้องให้ ปลัด สธ. อธิบดี ที่รู้แต่ไม่สนใจ ละเมิดจริยธรรมวิชาชีพแพทย์ ควรออกมาชี้แจงการกระทำดังกล่าวว่าผิด กฎหมายหรือไม่ หากต้องการภาพมากกว่านี้ให้ติดต่อตนได้ตลอดเวลา
โรงพยาบาลชลบุรี เปิดรับสมัครงาน ตำแหน่งนักวิชาการสถิติ
โรงพยาบาลชลบุรี เปิดรับสมัครงาน ตำแหน่งนักวิชาการสถิติ - สมัครได้ตั้งแต่บัดนี้ - 11 พฤศจิกายน 2565 - สถานที่สมัคร : กลุ่มงานทรัพยากรบุคคล ชั้น 2 อาคารอำนวยการ
21 ตุลาคม : Anna Karenina by Eifman Ballet
Anna Karenina by Eifman Ballet
Main Hall, Thailand Cultural Centre
Date and Time :
• Saturday 21 October 2023 at 7:00 PM
• Sunday 22 October 2023 at 4:00 PM
Ticket Price : 4,500/ 4,000/ 3,500/ 2,700 / 1,800 THB
การแสดงจากเซนต์ปีเตอส์เบิร์ก Eifman Ballet ที่นำผลงานบัลเลต์ชิ้นเอกอย่าง อันนา คาเรนินา มาจัดแสดงซึ่งได้สร้างความฮือฮามาแล้วทั่วโลก
ดัดแปลงจากนวนิยายเลื่องชื่อของ ตอลสตอย กับเรื่องราวความรักต้องห้ามในสมัยจักรวรรดิรัสเซีย เมื่อสาวงามดาวเด่นในสังคมชั้นสูงอย่าง อันนา คาเรนินา ไปตกหลุมรัก เคานท์ วรอนสกี้ ทั้งที่ตัวเองแต่งงานแล้ว ความรักที่ไม่อาจได้รับการยอมรับ ข้อกำหนดของสังคม และแรงกดดันจากคนรอบข้าง นำพาให้ต้องพบกับชะตากรรมอันน่าเศร้า
ออกแบบท่าเต้นโดยศิลปินมากรางวัล Boris Eifman ประกอบดนตรีของนักประพันธ์ระดับตำนานอย่างไชคอฟสกี ออกมาเป็นบัลเต์ที่เปิดการแสดงมาแล้วทั้งในยุโรปและอเมริกา และได้รับการยอมรับอย่างกว้างขวางในเอกลักษณ์ไม่เหมือนใคร โดย Eifman เน้นเจาะลึกการตีความวรรณกรรม ทำให้ท่าเต้นของเขา นอกจากจะงดงามทรงพลังแล้ว ยังสะท้อนจิตวิญญาณและแรงปรารถนาของตัวละครได้อย่างเต็มเปี่ยม
วันเสาร์ 21 ตุลาคม 2566 เวลา 19:00 น. และ วันอาทิตย์ 22 ตุลาคม 2566 เวลา 16:00 น.
หอประชุมใหญ่ ศูนย์วัฒนธรรมแห่งประเทศไทย
งานประเพณีเเห่ปราสาทผึ้ง จังหวัดสกลนคร ประจำปี 2566 วันที่ 23 - 29 ต.ค. 2566
งานประเพณีเเห่ปราสาทผึ้ง จังหวัดสกลนคร ประจำปี 2566 กำหนดจัดงานวันที่ 23 - 29 ต.ค. 2566 บริเวณสวนเฉลิมพระเกียรติฯ 80 พรรษา เเละวัดพระธาตุเชิงชุมวรวิหาร อำเภอเมือง จังหวัดสกลนคร การเเสดงปราสาทผึ้งประยุกต์เเละปราสาทผึ้งโบราณ กิจกรรมเเสดงวิถีชีวิตชนเผ่าจังหวัดสกลนคร,กิจกรรมติดดอกผึ้ง, นิทรรศการปรสาทผึ้ง เเละขบวนเเห่ปราสาทผึ้งจากสวนเฉลิมพระเกียรติฯ80พรรษาไปยังวัดพระธาตุเชิงชุมฯ เพื่อถวายพระธาตุเชิงชุมเเละหลวงพ่อพระองค์เเสน (28 ตุลาคม วันแห่ปราสาทผึ้ง)
Green Technology Expo 2024 วันที่ 24-26 ตุลาคม 2567
Green Technology Expo 2024 ที่จะจัดขึ้นระหว่างวันที่ 24-26 ตุลาคม 2567 ณ ศูนย์นิทรรศการและการประชุมไบเทค บางนา ฮอลล์ 101-102 งานที่รวบรวมเทคโนโลยีและนวัตกรรมสีเขียวที่หลากหลายและครอบคลุมที่สุดมาไว้ในที่เดียวกัน งานที่ไม่ได้เป็นเพียงนิทรรศการ แต่เป็นแพลตฟอร์มสำหรับการแลกเปลี่ยนความรู้ นวัตกรรม และเทคโนโลยีใหม่ๆ ที่ผู้ประกอบการที่ต้องการยกระดับอุตสาหกรรมและเปลี่ยนผ่านสู่สังคมคาร์บอนต่ำไม่ควรพลาด ไม่ว่าคุณจะเป็นผู้ประกอบการที่กำลังมองหาเทคโนโลยีใหม่ๆ ที่จะช่วยลดต้นทุนการผลิต ลดการใช้พลังงานและทรัพยากร รวมถึงลดการปล่อยมลพิษ เพื่อการพัฒนาธุรกิจอย่างยั่งยืนและเป็นมิตรต่อสิ่งแวดล้อม หรือเป็นผู้บริโภคที่กำลังมองหาผลิตภัณฑ์และบริการที่รักษ์โลก เพื่อสร้างทางเลือกในการดำเนินชีวิตอย่างยั่งยืนแล้วหละก็ต้องไม่พลาดงานนี้
งานประเพณีออกพรรษา ลอยประทีปบูชา พุทธกตัญญู จ. ขอนแก่น 25-28 ตุลาคม 2566
จังหวัดขอนแก่นโดยเทศบาลนครขอนแก่น ได้จัดงานประเพณีออกพรรษา ไต้ประทีปโคมไฟและวิถีชีวิตอีสาน ระหว่างวันที่ 25-28 ตุลาคม ของทุกปี ณ บริเวณบึงแก่นนคร โดยมีวัตถุประสงค์เพื่อส่งเสริมการท่องเที่ยว ส่งเสริมอาชีพของประชาชนในท้องถิ่น และอนุรักษ์สืบสานวัฒนธรรมอันเป็นเอกลักษณ์ของท้องถิ่นอันดีงามของวิถีชีวิต คนอีสาน กิจกรรมสำคัญในงานประกอบด้วย จัดพิธีทางศาสนา ออกร้านจำหน่ายอาหารและสินค้าพื้นเมือง จัดแสดงนิทรรศการของเก่าน่าสะสม พระเครื่อง ประกวดและโชว์บอนไซ จัดแสดงวรรณกรรมเรื่อง"สินไซ" มหกรรมอาหารของดีเมืองขอนแก่น ประกวดขบวนแห่ประทีปโคมไฟ ประกวดฮ้านประทีป ประกวดสรภัญญะ การแสดงวัฒนธรรม 5 ภาค จัดประกวดนกกรงหัวจุก การแสดงวัฒนธรรมนานาชาติ การแข่ง X-Game การประกวดกวนข้าวทิพย์ การแสดงดนตรีลูกทุ่งของโรงเรียนต่าง ๆ การแสดงคนตรีพื้นเมือง และการแสดงคอนเสิร์ตลูกทุ่งหมอลำ
Pet Fair South East Asia 25-27 ตุลาคม 2566
Pet Fair South East Asia 2023 จะจัดขึ้นระหว่างวันที่ 25-27 ตุลาคม 2023 ณ ศูนย์ประชุมไบเทค บางนา งานที่จะนำเสนออุตสาหกรรมสัตว์เลี้ยงระดับนานาชาติด้วยศูนย์กลางความร่วมมือ B2B สำหรับการจัดจำหน่าย การค้าปลีก และการจัดหา ด้วยผู้เข้าชมงานจากกว่า 60 ประเทศที่เข้าร่วมงานเปิดตัวครั้งแรกปี 2022 งานแสดงสินค้าอุตสาหกรรมสัตว์เลี้ยงที่จัดขึ้นเป็นเวลา 3 วันได้พิสูจน์ให้เห็นว่าการเข้าถึงผู้ซื้อนั้นไปไกลกว่าภูมิภาคเอเชียตะวันออกเฉียงใต้ โดยครอบคลุมตลาดที่มีการเติบโตที่สำคัญเพิ่มเติม เช่น ตะวันออกกลาง อินเดีย โอเชียเนียและอีกมากมาย!. ฉบับปี 2023 จะจัดขึ้นระหว่างวันที่ 25-27 ตุลาคม 2566 ที่ไบเทค และถูกกำหนดให้มีขนาดใหญ่เป็นสองเท่าเมื่อเทียบกับฉบับปี 2022 ครั้งแรก อุตสาหกรรมสัตว์เลี้ยงระดับนานาชาติกำลังกลับมาสู่กรุงเทพฯ เมืองอันน่าตื่นเต้นอีกครั้งในเดือนตุลาคมนี้!
ผู้ประกันตน รพ.ธรรมศาสตร์ฯ ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ ไม่มีค่าใช้จ่าย LINK
ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ ชนิด 4 สายพันธุ์ (1 ครั้ง / ปี โดยไม่มีค่าใช้จ่าย)เฉพาะผู้ประกันตน รพ.ธรรมศาสตร์เฉลิมพระเกียรติ (อายุ 50 ปี ขึ้นไป) เท่านั้น ตั้งแต่บัดนี้ - 31 สิงหาคม 2565
เปิดให้บริการ : ทุกวันจันทร์-ศุกร์ (ยกเว้นวันหยุดนักขัตฤกษ์)
เวลาให้บริการ : 13.00-15.00 น.
สถานที่ให้บริการ : ศูนย์ตรวจสุขภาพธรรมศาสตร์ ชั้น 1 อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
สอบถามเพิ่มเติมโทร. 029269898 (วันและเวลาราชการ)
.. โปรดนำบัตรประชาชน (ตัวจริง) มาด้วยก่อนเข้ารับบริการ ..
ASEAN Café Show 26-29 October 2023
The “ASEAN Café Show (ACS)” is a new name covering “Thailand Coffee, Tea & Drinks (TCTD)” and “Thailand Bakery & Ice Cream (TBI)”, a trade fair for coffee, tea, beverages, bakery, ice. cream and cocoa The longest established in Thailand for more than 16 years, this new name reflects the industry. The rapid growth and potential growth of both jobs. and to help drive relevant industries into the wider regional market ever-growing coffee, tea, drinks, bakery, and ice cream industry in Thailand and ASEAN.
ASEAN Café Show (ACS) is a complete "one-stop café solution" event. Equipment for the cafe Bakery and F&B, modern hotels and quality ingredients. including one-stop shop solutions Meet over 20,000+ target customers from 54+ countries in just 4 days.
รพ.บ้านแพ้วองค์การมหาชน แจ้งการฉีดวัคซีนไข้หวัดใหญ่ ผู้ประกันตน ปี 2566 LINK
ขอเชิญกลุ่มเสี่ยง (เฉพาะสิทธิ์บัตรทองโรงพยาบาลบ้านแพ้วเท่านั้น) ฉีดวัคซีนไข้หวัดใหญ่ ตามฤดูกาล 2566 ด่วน วัคซีนมีจำนวนจำกัด ! แจ้งชื่อและรับบริการวัคซีนไข้หวัดใหญ่ ได้ที่คลินิก หมอครอบครัว รพ.บ้านแพ้ว สำนักงานใหญ่ เปิดให้บริการ วันจันทร์ ที่ 1 ถึงวันพุธ ที่ 3 พฤษภาคม 2566 ตั้งแต่เวลา 08.00-15.00 น. (หรือจนกว่าวัคซีนจะหมด)
โรงพยาบาลสรรพสิทธิประสงค์ รับสมัครบุคคล LINK
โรงพยาบาลสรรพสิทธิประสงค์ เรื่อง รับสมัครบุคคลเพื่อสรรหาและเลือกสรรเป็นพนักงานกระทรวงสาธารณสุขทั่วไป ตำแหน่ง เจ้าพนักงานโสตทัศนศึกษา เจ้าพนักงานธุรการ ผู้ช่วยทันตแพทย์ พนักงานบริการ และพนักงานบริการเอกสารทั่วไป รับสมัครตั้งแต่วันที่ 1 - 7 พฤศจิกายน 2565 ในวันและเวลาราชการ
28 ตุลาคม 65 รับเด็กชาย 2 เดือน หัวใจล้มเหลว จากแม่ฮ่องสอน รักษาต่อที่ รพ.นครพิงค์
28 ตุลาคม 2565 เวลา 11.53 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนันสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยเด็กชายอายุ 2 เดือน มีอาการหายใจเหนื่อยหอบ วินิจฉัย โรคหัวใจพิการแต่กำเนิดร่วมกับภาวะหัวใจล้มเหลว (large PM VSD with CHF) เพื่อส่งผู้ป่วยจากโรงพยาบาลศรีสังวาลย์ ตำบลจองคำ อำเภอเมืองแม่ฮ่องสอน จังหวัดแม่ฮ่องสอน ไปโรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่ ศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้ดำเนินการประสานกองทัพบก ขอสนับสนุนอากาศยาน และนักบิน ประเภทอากาศยานเฮลิคอปเตอร์ Bell 212 ชุดปฏิบัติการลำเลียงทางอากาศจากโรงพยาบาลศรีสังวาลย์ จังหวัดแม่ฮ่องสอน การลำเลียงผู้ป่วยลุล่วงไปด้วยดี
พิจารณาเปลี่ยนใจกลับประเทศโดยเร็วที่สุด
สถานการณ์ความรุนแรงในอิสราเอล - กาซาตั้งแต่วันที่ 7 ตุลาคม 2566 และกระทรวงการต่างประเทศได้ออกประกาศเตือนคนไทยและเรียกร้องให้เดินทางกลับประเทศไทยเป็นระยะ นั้น
ขณะนี้ กองทัพอิสราเอลได้เพิ่มปฏิบัติการภาคพื้นดินในบริเวณฉนวนกาซาอย่างเข้มข้นขึ้น ซึ่งน่าจะส่งผลให้สถานการณ์สู้รบที่รุนแรงยิ่งขึ้น และเป็นอันตรายต่อชีวิตและความปลอดภัยของชาวไทยในอิสราเอล รวมถึงมีความเป็นไปได้ว่า การสู้รบจะขยายพื้นที่ซึ่งอาจส่งผลต่อการเดินทางภายในประเทศ และกระทบต่อกระบวนการอพยพอย่างมีนัยสำคัญ
รัฐบาลมีความห่วงใยพี่น้องคนไทยในอิสราเอลเป็นอย่างยิ่ง และขอเรียกร้องให้คนไทยในอิสราเอล เดินทางกลับประเทศไทยโดยเร็วที่สุด และขอเชิญชวนให้ญาติพี่น้องที่อยู่ในประเทศไทย ช่วยแจ้งให้พี่น้องแรงงานที่ยังตัดสินใจอยู่ในอิสราเอล พิจารณาเปลี่ยนใจกลับประเทศโดยเร็วที่สุด
ทั้งนี้ ท่านที่ประสงค์จะเดินทางกลับ สามารถแจ้งสถานทูตฯ หรือเดินทางมายังศูนย์พักพิงได้ทันที ที่:
รร. David InterContinental, Kaufmann Street 12, Tel Aviv- Yafo, 61501
โทรศัพท์ศูนย์พักพิง : 053-557-4115, 050-443 8094
โทรศัพท์สถานทูตฯ : 055-271 2201, 053-245 2826, 054-636 8150
29 ตุลาคม วันอัมพาตโลก World Stroke Day
องค์การอัมพาตโลก (World Stroke Organization :
WSO) ได้กำหนดให้วันที่ 29 ตุลาคมของทุกปีเป็นวันรณรงค์อัมพาตโลก (World Stroke Day) เริ่มครั้งแรกเมื่อปี 2006 เพื่อให้ประชาชนเกิดความตื่นตัว และตระหนักถึงความสำคัญของโรคหลอดเลือดสมอง ซึ่งปัจจุบันเป็นปัญหาสาธารณสุขระดับโลก รวมถึงเป็นสาเหตุสำคัญของการเสียชีวิต
29 ตุลาคม วันภูมิปัญญาการแพทย์แผนไทย


กำหนดขึ้นตามมติครม. 16 มิถุนายน 2558 เพื่อเทิดพระเกียรติ พระบาทสมเด็จพระนั่งเกล้าเจ้าอยู่หัว พระมหาเจษฏาราชเจ้า มีพระมหากรุณาธิคุณล้นเกล้าล้นกระหม่อม แก่ปวงชนชาวไทยนานัปการ พระราชกรณียกิจที่สำคัญยิ่งประการหนึ่ง คือ การรวบรวมองค์ความรู้ ด้านการแพทย์แผนไทยมาเผยแพร่ในวงกว้าง ทำให้ภูมิปัญญาการแพทย์แผนไทยเป็นรากฐานของชาติไทย และตามหลักฐานจารึกแผ่นศิลาว่าด้วยการปฏิสังขรณ์วัดพระเชตุพนวิมลมังคลาราม ราชวรมหาวิหาร และได้ทอดพระเนตรเห็นพระอุโบสถ พระวิหาร พระระเบียง กุฏิเสนาสนะต่างๆ ชำรุดปรักหักพังมาก จึงมีพระราชศรัทธาจะปฏิสังขรณ์และขยายพื้นที่ให้มากกว่าเดิมและมีพระบรมราชโองการให้รื้อพระอุโบสถเดิม และก่อเสนาสนะสงฆ์ต่างๆ มีการจารึกตำราการแพทย์แผนไทยติดประดับไว้ตามศาลาราย เช่น แผนฝีดาษ ฝียอดเดียว แผนชัลลุกะ แผนลำบองราหู แผนกุมารและแม่ซื้อ อีกทั้ง มีกาาจัดสร้างรูปฤๅษีดัดตน ตั้งไว้ศาลาละ 4 - 5 รูป รวม 16 หลัง ซึ่งองค์การการศึกษาวิทยาศาสตร์และวัฒนธรรมแห่งสหประชาชาติ (UNESCO) ได้ประกาศรับรองให้ศิลาจารึกวัดพระเชตุพนวิมลมังคลาราม ราชวรมหาวิหาร เป็นมรดกความทรงจำแห่งโลก เมื่อวันที่ 27 พฤษภาคม 2554 นับเป็นพระมหากรุณาธิคุณที่ทำให้การแพทย์แผนไทยมีความเจริญ รุ่งเรือง เกิดคุณูปการแก่ประชาชนในวงกว้าง ด้วยสำนึกในพระมหากรุณาธิคุณและเพื่อเป็นการเทิดพระเกียรติและแสดงถึงความกตัญญูกตเวที กระทรวงสาธารณสุขจึงเห็นสมควรถวายพระราชสมัญญา "พระบิดาแห่งการแพทย์แผนไทย" แด่ พระบาทสมเด็จพระนั่งเกล้าเจ้าอยู่หัว พระมหาเจษฏาราชเจ้า และกำหนดให้วันที่ ๒๙ ตุลาคม ของทุกปี เป็น "วันภูมิปัญญาการแพทย์แผนไทยแห่งชาติ"
งานมหัศจรรย์มุกดาหาร 3 พิภพ ณ สะพานมิตรภาพไทย - ลาว แห่งที่ 2 (มุกดาหาร - สะหวันนะเขต) 29-30 29 ตุลาคม 2566
งานมหัศจรรย์มุกดาหาร 3 พิภพ ณ สะพานมิตรภาพไทย - ลาว แห่งที่ 2 (มุกดาหาร - สะหวันนะเขต) , สี่เเยกหอนาฬิกา ,วัดบรรพตมโนรมย์ เเละ วัดรอยพระพุทธบาทภูมโนรมย์ อำเภอเมือง จังหวัดมุกดาหาร
- วันที่ 29 ตุลาคม 2566 กิจกรรมสวดมนต์เมือง ฟังธรรมกลางลำน้ำโขง ลอยกระจู้ บูชาพญานาค ณ สะพานมิตรภาพไทย - ลาว แห่งที่ 2 (มุกดาหาร - สะหวันนะเขต)
- วันที่ 30 ตุลาคม 2566 งานบวงสรวงและทอดกฐินพญานาค 3 พิภพ วัดศรีบุญเรือง อำเภอเมือง จังหวัดมุกดาหาร
- วันที่ 30 ตุลาคม 2566 กิจกรรมจุดเทียนขึ้นภู บูชาพระใหญ่ ณ วัดรอยพระพุทธบาทภูมโนรมย์ อำเภอเมือง จังหวัดมุกดาหาร
การใช้กัญชาในทางการแพทย์ - ศ.นพ.ธีรวัฒน์ เหมะจุฑา
ศ.นพ.ธีรวัฒน์ เหมะจุฑา เป็นอาจารย์ที่สนับสนุนการนำกัญชามาใช้ในทางการแพทย์ จึงนำผลสรุปที่อาจารย์บรรยายในงานมติชน Health Care 2562 ดังนี้
- กัญชาสามารถรักษาได้ โดยไทยมีตำรับยาที่มีส่วนผสมกัญชามาตั้งแต่โบราณ ขณะที่ทางวิทยาศาสตร์พิสูจน์ได้ว่าร่างกายมนุษย์ยังมีสารสำคัญ ที่มีอยู่ในกัญชา
- กัญชามีสาร 2 ตัว คือ สารที่ทำให้เมาคือ THC และสารที่ไม่เมาคือ CBD
- มีความพยายามที่จะสกัดสารจากัญชาเพื่อรักษาโรค ซึ่งบางคนใช้แล้วหาย บางคนใช้แล้วไม่หาย บางคนหายภายหลังใช้ 10 วัน จากประสบการณ์การรักษา พบว่าผู้ป่วยหลายรายมีอาการดีขึ้นภายหลังใช้กัญชาเพื่อการรักษา
- ระหว่างที่สารสกัดกัญชาถูกกฎหมายยังไม่มี ปัจจุบันกรมการแพทย์แผนไทยและแพทย์ทางเลือกอยู่ระหว่างปรุงยาตำรับไทยที่มีส่วนผสมกัญชา ซึ่งอีก 3-4 เดือนข้างหน้า (ปลายปี 2562) แพทย์ที่ผ่านการอบรมจะสามารถนำกัญชามาใช้ทางการแพทย์ได้ (กรมการแพทย์ได้ออกแนวทางในการใช้กัญชาทางการแพทย์ )
- วิธีการใช้ ตอนเริ่มต้นให้ใช้แต่น้อยก่อน แล้วค่อยปรับการใช้ ซึ่งธรรมชาติของกัญชา หากใช้แบบดูดจะออกฤทธิ์เร็ว ทำให้ปริมาณดูดซึมไม่คงที่ หอกใช้หยอดซอกฟันจะออกฤทธิ์ภายใน 4-8 ชั่วโมง ถ้าหยอดใต้ลิ้น จะออกฤทธิ์ภายใน 1-4 ชั่วโมง แต่ทุกวันนี้ส่วนใหญ่ใช้กิน ซึ่งไม่ออกฤทธิ์ทันที ทำให้ผู้ป่วยหยดอีก ทำให้ขนาดเกิน จึงเกิดอาการเมากัญชา ได้แก่ เวียนหัว คลื่นไส้ อาเจียน ความดันโลหิตตก
- การใช้กัญชาเพื่อการรักษานั้น ต้องใช้ควบคู่กับการรักษาแผนปัจจุบัน ห้ามใช้กัญชาเดี่ยวๆ กัญชาสามารถรักษาหรือชลออาการได้ 7 ชนิดได้แก่ 1.ภาวะแข็งเกร็ง 2.เบื่ออาหาร 2.ทานอาหารไม่ได้ 4.ภาวะโรคเคมีบำบัด 5. พาร์กินสัน 6.สมองเสื่อม 7.ภาวะคล้ายสมองเสื่อม และบางอาการเช่น ผมร่วง โรคสะเก็ดเงิน อัลไซเมอร์
- การใช้กัญชา ต้องมีความรู้ ว่าใช้อย่างไร ต้องใช้ให้ถูกวิธี และต้องมีวิธีการควบคุมไม่ให้ใช้ผิดประเภท โดยต้องไม่ท้ิงยาแผนปัจจุบัน และไม่ใช้ทุกคนจะได้ผลดีจากกัญชาเหมือนกันหมด
- การใช้กัญชาทำให้เกิดโรคจิตหรือเป็นบ้าหรือไม่ การศึกษาในปี 2018 พบว่า พบในกลุ่มที่เป็นบ้าก่อนที่จะรักษา คือ เสพกัญชาเพื่อให้เมา จากนั้นเพิ่มปริมาณการสูบ ทำให้เกิดการเปลี่ยนแปลงในเนื้อสมอง จึงเกิดอาการทางจิต โดยเฉพาะคนที่ติดจะมีรหัสพันธุกรรมจำเพาะ จึงไม่สนับสนุนในการสูบเพื่อเมา เพราะจะทำให้เกิดการติดและตามมาด้วยโรคทางจิตเวช การจะใช้กัญชาเพื่อรักษาจึงต้องรู้ข้อจำกัด ถึงจะเกิดประโยชน์เต็มที่จากกัญชา
18 สิงหาคม 2024 อัตราการเสียชีวิตจากไวรัส Mpox Clade I ในแอฟริกาสูงถึง 10% จริงๆหรือ? นั่นหมายความว่า ติด 10 คน เสียชีวิต 1 คน...มีตัวเลขนี้ใช้อ้างอิงต่อๆกันเยอะมากแต่ยังไม่มีเอกสารอะไรยืนยันโดยเฉพาะกับสถานการณ์การระบาดในปัจจุบัน ลองเอาตัวเลขอย่างเป็นทางการที่มีการยืนยันจากหน่วยงานที่เชื่่อถือได้อย่าง Africa CDC มาวิเคราะห์ จะเห็นอะไรที่ชัดขึ้นมากเลยครับ
ผมขอยกตัวเลขจาก 2 ประเทศ คือ DRC และ เบอรุนดีซึ่งเป็นประเทศเล็กๆข้าง DRC และ ไม่เคยมี MPOX ระบาดมาก่อนเพิ่งมีเคสเพิ่มขึ้นอย่างรวดเร็วและแทบทั้งหมดของเคสในประเทศนี้คือ Mpox Clade Ib (สายพันธุ์ที่เป็นที่น่ากังวลกันตอนนี้)
ข้อเท็จจริงแรกคือ DRC มีผู้ติดเชื้อไวรัส Mpox อยู่มากที่สุด และสายพันธุ์เป็น Clade I ซึ่งรวมถึง Clade Ia และ Clade Ib ตรงนี้สำคัญมากเพราะ Clade Ia เป็นไวรัสสายพันธุ์เดิมที่เชื่อว่าเกิดจากการติดเชื้อจากสัตว์ตัวกลางสู่คนโดยตรง แต่ความสามารถในการติดจากคนสู่คนจะน้อย ไวรัส Clade Ia นี่แหล่ะครับที่เป็นที่มาของ 10% เพราะไวรัสจากสัตว์สู่คนมักมีอาการรุนแรงแต่แพร่ต่อไม่ดี คราวนี้เมื่อดูตัวเลขของ DRC ในปัจจุบัน อัตราการเสียชีวิต (CFR) ของผู้ป่วยอยู่ที่ 2.4% ซึ่งเป็นตัวเลขของผู้ป่วยที่ติดเชื้อทั้ง Clade Ia และ Ib รวมกัน ซึ่งใกล้เคียงกับตัวเลขโดยรวมของทั้งทวีปคือ 2.9% ตัวเลขไม่ได้สูงเท่ากับที่เข้าใจกันจากสื่อ
ข้อเท็จจริงที่สองคือ เบอรุนดี ยังไม่มีเคส Clade Ia พบในผู้ป่วยในประเทศ ปัจจุบันมีการติดเชื้อค่อนข้างรวดเร็วโดยเป็น Clade Ib ทั้งหมด ซึ่งเป็นสัญญาณที่ชัดเจนว่า Clade Ib เป็นสายพันธุ์ที่แพร่กระจายจากคนสู่คนได้อย่างรวดเร็วกว่า Clade Ia ซึ่งเกิดจากการเปลี่ยนแปลงของไวรัสเอง แต่เมื่อดู CFR ของเคสในเบอรุนดีตอนนี้คือ ที่สงสัย ประมาณ 300 คน และ ยืนยันผลแล้ว 100 คน เป็นเคสเด็กประมาณ 38.6% แต่ยังไม่มีเคสเสียชีวิต นั่นคือ CFR ของ Clade Ib ยังเป็น 0 ในเบอรุนดี ซึ่งถ้าการระบาดมีมากขึ้นก็คาดว่าจะมีเคสเสียชีวิตได้ แต่ตัวเลขไม่ใช่ 2.4% เหมือน DRC
จากข้อเท็จจริงที่ตรวจสอบตอนนี้ Mpox Clade Ib ติดเชื้อจากคนสู่คนได้ดีมาก และ เนื่องจากผู้ป่วยเป็นเด็กมีเยอะช่องทางการติดเชื้ออาจจะไม่ใช่ผ่านทางเพศสัมพันธ์เป็นหลักเหมือน Clade II แต่อาการของผู้ป่วยมีแนวโน้มจะไม่รุนแรงเท่า Clade Ia ซึ่งเป็นสายพันธุ์เก่าและยังไม่ปรับในคนได้ดีเท่า การใช้อัตราการเสียชีวิตต่อ Clade Ib ตอนนี้จึงเหมือนสูงเกินข้อเท็จจริงครับ...WHO ประกาศภาวะฉุกเฉินเพราะไวรัสแพร่กระจายอย่างรวดเร็ว แต่ไม่ใช่ไวรัสมีความรุนแรงสูงครับ
ข้อมูลจำนวนองค์กรปกครองส่วนท้องถิ่นแยกรายจังหวัด
|
ลำดับ
|
จังหวัด |
จำนวน (แห่ง) |
รวม (แห่ง) |
|
อบจ.
|
ทน.
|
ทม.
|
ทต.
|
อบต.
|
| 1 |
กระบี่ |
1 |
- |
1 |
14 |
46 |
62 |
| 2 |
กาญจนบุรี |
1 |
- |
3 |
46 |
72 |
122 |
| 3 |
กาฬสินธุ์ |
1 |
- |
2 |
77 |
71 |
151 |
| 4 |
กำแพงเพชร |
1 |
- |
3 |
22 |
64 |
90 |
| 5 |
ขอนแก่น |
1 |
1 |
6 |
77 |
140 |
225 |
| 6 |
จันทบุรี |
1 |
- |
5 |
42 |
34 |
82 |
| 7 |
ฉะเชิงเทรา |
1 |
- |
1 |
33 |
74 |
109 |
| 8 |
ชลบุรี |
1 |
2 |
10 |
36 |
49 |
98 |
| 9 |
ชัยนาท |
1 |
- |
1 |
38 |
20 |
60 |
| 10 |
ชัยภูมิ |
1 |
- |
1 |
35 |
106 |
143 |
| 11 |
ชุมพร |
1 |
- |
2 |
26 |
50 |
79 |
| 12 |
เชียงราย |
1 |
1 |
- |
72 |
70 |
144 |
| 13 |
เชียงใหม่ |
1 |
1 |
4 |
116 |
89 |
211 |
| 14 |
ตรัง |
1 |
1 |
1 |
20 |
77 |
100 |
| 15 |
ตราด |
1 |
- |
1 |
13 |
29 |
44 |
| 16 |
ตาก |
1 |
1 |
1 |
17 |
49 |
69 |
| 17 |
นครนายก |
1 |
- |
1 |
5 |
3 |
46 |
| 18 |
นครปฐม |
1 |
1 |
5 |
20 |
90 |
117 |
| 19 |
นครพนม |
1 |
- |
1 |
21 |
81 |
104 |
| 20 |
นครราชสีมา |
1 |
1 |
4 |
85 |
243 |
334 |
| 21 |
นครศรีธรรมราช |
1 |
1 |
3 |
50 |
130 |
185 |
| 22 |
นครสวรรค์ |
1 |
1 |
2 |
18 |
121 |
143 |
| 23 |
นนทบุรี |
1 |
2 |
7 |
11 |
25 |
46 |
| 24 |
นราธิวาส |
1 |
- |
3 |
13 |
72 |
89 |
| 25 |
น่าน |
1 |
- |
1 |
18 |
80 |
100 |
| 26 |
บุรีรัมย์ |
1 |
- |
3 |
59 |
146 |
209 |
| 27 |
บึงกาฬ |
1 |
- |
- |
18 |
41 |
60 |
| 28 |
ปทุมธานี |
1 |
1 |
9 |
17 |
37 |
65 |
| 29 |
ประจวบคีรีขันธ์ |
1 |
- |
2 |
14 |
44 |
61 |
| 30 |
ปราจีนบุรี |
1 |
- |
1 |
12 |
56 |
70 |
| 31 |
ปัตตานี |
1 |
- |
2 |
15 |
96 |
114 |
| 32 |
พระนครศรีอยุธยา |
1 |
1 |
5 |
30 |
121 |
158 |
| 33 |
พังงา |
1 |
- |
2 |
13 |
36 |
52 |
| 34 |
พัทลุง |
1 |
- |
1 |
48 |
24 |
74 |
| 35 |
พิจิตร |
1 |
- |
3 |
25 |
73 |
102 |
| 36 |
พิษณุโลก |
1 |
1 |
1 |
24 |
76 |
103 |
| 37 |
เพชรบุรี |
1 |
- |
2 |
13 |
69 |
85 |
| 38 |
เพชรบูรณ์ |
1 |
- |
3 |
22 |
102 |
128 |
| 39 |
แพร่ |
1 |
- |
1 |
25 |
57 |
84 |
| 40 |
พะเยา |
1 |
- |
2 |
33 |
36 |
72 |
| 41 |
ภูเก็ต |
1 |
1 |
2 |
9 |
6 |
19 |
| 42 |
มหาสารคาม |
1 |
- |
1 |
18 |
123 |
143 |
| 43 |
แม่ฮ่องสอน |
1 |
- |
1 |
6 |
42 |
50 |
| 44 |
มุกดาหาร |
1 |
- |
1 |
24 |
29 |
55 |
| 45 |
ยะลา |
1 |
1 |
2 |
13 |
47 |
64 |
| 46 |
ยโสธร |
1 |
- |
1 |
23 |
63 |
88 |
| 47 |
ร้อยเอ็ด |
1 |
- |
1 |
72 |
129 |
203 |
| 48 |
ระนอง |
1 |
- |
2 |
10 |
18 |
31 |
| 49 |
ระยอง |
1 |
1 |
2 |
27 |
37 |
68 |
| 50 |
ราชบุรี |
1 |
- |
4 |
31 |
76 |
112 |
| 51 |
ลพบุรี |
1 |
- |
3 |
20 |
102 |
126 |
| 52 |
ลำปาง |
1 |
1 |
3 |
38 |
60 |
103 |
| 53 |
ลำพูน |
1 |
- |
1 |
39 |
17 |
58 |
| 54 |
เลย |
1 |
- |
2 |
27 |
71 |
101 |
| 55 |
ศรีสะเกษ |
1 |
- |
2 |
35 |
179 |
217 |
| 56 |
สกลนคร |
1 |
1 |
- |
65 |
74 |
141 |
| 57 |
สงขลา |
1 |
2 |
11 |
35 |
92 |
141 |
| 58 |
สตูล |
1 |
- |
1 |
6 |
34 |
42 |
| 59 |
สมุทรปราการ |
1 |
1 |
6 |
14 |
27 |
49 |
| 60 |
สมุทรสงคราม |
1 |
- |
1 |
8 |
26 |
36 |
| 61 |
สมุทรสาคร |
1 |
2 |
2 |
10 |
23 |
38 |
| 62 |
สระบุรี |
1 |
- |
4 |
34 |
70 |
109 |
| 63 |
สระแก้ว |
1 |
- |
3 |
13 |
49 |
66 |
| 64 |
สุพรรณบุรี |
1 |
- |
2 |
43 |
81 |
127 |
| 65 |
สิงห์บุรี |
1 |
- |
2 |
6 |
33 |
42 |
| 66 |
สุโขทัย |
1 |
- |
3 |
18 |
69 |
91 |
| 67 |
สุราษฎร์ธานี |
1 |
2 |
3 |
35 |
97 |
138 |
| 68 |
สุรินทร์ |
1 |
- |
1 |
27 |
144 |
173 |
| 69 |
หนองคาย |
1 |
- |
2 |
17 |
48 |
68 |
| 70 |
หนองบัวลำภู |
1 |
- |
1 |
23 |
43 |
68 |
| 71 |
อ่างทอง |
1 |
- |
1 |
20 |
43 |
65 |
| 72 |
อุดรธานี |
1 |
1 |
3 |
67 |
109 |
181 |
| 73 |
อุตรดิตถ์ |
1 |
- |
1 |
25 |
53 |
80 |
| 74 |
อุทัยธานี |
1 |
- |
1 |
13 |
49 |
64 |
| 75 |
อุบลราชธานี |
1 |
1 |
4 |
54 |
179 |
239 |
| 76 |
อำนาจเจริญ |
1 |
- |
1 |
23 |
39 |
64 |
| |
รวม |
76 |
30 |
187 |
2,237 |
5,320 |
7,850 |
ข้อมูล ณ วันที่ ๑๕ มิถุนายน ๒๕๖๓ โดย กลุ่มงานกฎหมายและระเบียบท้องถิ่น ๒ กองกฎหมายและระเบียบท้องถิ่น
เขตกรุงเทพตะวันออก
กลุ่มเขตกรุงเทพตะวันออก 1.เขตสะพานสูง 2.เขตหนองจอก 3.เขตบางกะปิ 4.เขตประเวศ 5.เขตลาดกระบัง 6.เขตบึงกุ่ม 7.เขตคันนายาว 8.เขตมีนบุรี 9.เขตคลองสามวา
คลองสามวา
- คลินิกทันตกรรมคู้ซ้ายร่วมใจ info&map
- คลินิกทันตกรรมดีไลท์
- คลินิกทันตกรรมมีเมาธ
- คลินิกทันตกรรมเมืองประชา
- คลินิกทันตกรรมยิ้มฟันใส สาขาหทัยราษฎร์
- คลินิกทันตกรรมสไมล์คอนเนคท์
- คลินิกทันตกรรมอะไลฟ์
สะพานสูง
หนองจอก
- คลินิกทันตกรรมฟอร์จูน
- คลินิกทันตกรรมสมายล์แฟมิลี่
ประเวศ
- คลินิกทันตกรรม เมืองทองทันตแพทย์
- คลินิกทันตกรรมคลาส
- คลินิกทันตกรรมมอสศรีนครินทร์
- คลินิกทันตกรรมเมกาสไมล์
- คลินิกทันตกรรมรักสุข info&map
- คลินิกทันตกรรมสรัญญา
- คลินิกทันตกรรมเสรีแฟมิลี่เดนตัลแคร์
- คลินิกทันตกรรมหมอเปิ้ล สาขาอุดมสุข 60
- คลินิกทันตกรรมเอ็กซ์ดีซี สาขาศรีนครินทร์
- สไมล์ซิกเนเจอร์คลินิกทันตกรรม สาขาซีคอนศรีนครินทร์
บึงกุ่ม
- คลินิกทันตกรรม พี เอส ทันตแพทย์
- เดนเทลสหคลินิก
- ทันตแพทย์อินทรารักษ์คลินิกทันตกรรม
- ลัคกี้ทูธเด็นทัลคลินิกคลินิกทันตกรรม info&map
บางกะปิ
- คลินิกทันตกรรมชลิดาเด็นทัลเฮาส์
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขารามคำแหง
- คลินิกทันตกรรมบางกอกสไมล์
- คลินิกทันตกรรมบ้านรักยิ้ม
- คลินิกทันตกรรมบ้านรักษ์ฟัน
- คลินิกทันตกรรมบูทีคเดนทัล
- คลินิกทันตกรรมพลัส สาขาเดอะมอลล์บางกะปิ
- คลินิกทันตกรรมมอส แฮปปี้แลนด์
- คลินิกทันตกรรมเมตาเดนเต้
- คลินิกทันตกรรมยิ้มหวาน info&map
- คลินิกทันตกรรมศรีกรีฑา
- คลินิกทันตกรรมสไมล์วิธมี
- คลินิกทันตกรรมออเร้นจ์สมาย
- คลินิกทันตกรรมออเร้นจ์สมาย สาขารามคำแหง
- ทัชสไมล์คลินิกทันตกรรม
- ฟันดีคลินิกทันตกรรม
- ศูนย์ทันตกรรมฟันดีเซนเตอร์คลินิกทันตกรรม
- เฮลตี้ทีธคลินิกทันตกรรม
- แฮปปี้แลนด์คลินิกทันตกรรม
มีนบุรี
- คลินิกทันตกรรมบูม
- คลินิกทันตกรรมฟอร์จูนเดนทัลโฮม
- คลินิกทันตกรรมเฟิร์สสไมล์ สาขามิงเกิลฮิลล์ มีนบุรี
- คลินิกทันตกรรมมีเมาธ
- คลินิกทันตกรรมยิ้มฟันใส สาขารามอินทรา 109
- คลินิกทันตกรรมราษฎร์ร่วมใจ info&map
- คลินิกทันตกรรมออเร้นจ์สมาย สาขาตลาดมีนบุรี
- ดีโอ้เดนทัลคลินิกทันตกรรม สาขาร่มเกล้า
ลาดกระบัง
- คลินิกทันตกรรมพลัส สาขาลาดกระบัง
- คลินิกทันตกรรมวีสไมล์ info&map
- คลินิกทันตกรรมออเร้นจ์สมาย สาขาร่มเกล้า
เตรียมพร้อมก่อนมาบริจาค
เตรียมพร้อมก่อนมาบริจาค
- นอนหลับพักผ่อนให้เพียงพอ ไม่น้อยกว่า 5 ชม.
- สุขภาพแข็งแรง พร้อมที่จะบริจาคโลหิต งดบริจาคเมื่อรู้สึกไม่สบาย
- หากอยู่ระหว่างรับประทานยารักษาโรค ให้แจ้งแพทย์/พยาบาล ผู้ตรวจคัดกรองสุขภาพทุกครั้ง
- ดื่มน้ำ 300-500 ซีซี ก่อนบริจาคโลหิต ช่วยลดภาวะอาการแทรกซ้อนระหว่างและหลังบริจาคโลหิต
- รับประทานอาหารประจำมื้อก่อนมาบริจาคโลหิต หลีกเลี่ยงอาหารที่มีไขมันสูง เช่น ข้าวขาหมู ข้าวมันไก่ แกงกะทิ ก่อนมาบริจาคโลหิต 6 ชม.
- งดสูบบุหรี่ ก่อนและหลังบริจาคโลหิต 1 ชม.
- งดเครื่องดื่มแอลกอฮอล์ก่อนและหลังบริจาคโลหิต 24 ชม.
- ไม่มีพฤติกรรมเสี่ยงทางเพศ
ส่วนตัว สำหรับคำแนะนำ คนที่อยากเรียนแพทย์ อย่างแรกเลย ถามตัวเองก่อน เราอยากจะดูแลผู้ป่วยจริงๆ ไหม? อยากให้มาจากใจก่อนที่เราจะอยากเป็นเพราะว่าอาชีพนี้ต้องทุ่มเททั้งการเรียน ทั้งแรงกาย แรงใจมาก ถ้าเกิดน้องๆ ศึกษาแล้ว ชอบสาขานี้จริงๆ น้องก็จะมุ่งมั่นแล้วก็มีความสุขกับมัน ถามว่าเรียนแพทย์ยากไหม? เจี๊ยบว่า ถ้าเกิดคุณสอบติดแล้วเชื่อว่าทุกคนน่าจะเรียนไหวแน่นอน แต่ว่าสิ่งที่ยากกว่าคือความรับผิดชอบ จากประสบการณ์ตัวเองกว่าจะผ่านมาได้ก็กระอักเลือดอยู่นะคะ เจี๊ยบเคยเป็นเด็กเกเรมาก่อน แต่สุดท้ายเรารู้ว่าอาชีพนี้ต้องอาศัยความรับผิดชอบเพราะว่ามันเกี่ยวกับชีวิตคน หลังจากนั้นจึงเปลี่ยนมาตั้งใจและอยากทำทุกนาทีให้เต็มที่ที่สุด สำหรับน้องๆ ที่ยังลังเลอยู่นะว่าเราจะเรียนอะไร?ประกอบอาชีพไหน?อย่างที่บอกจริงๆ แล้วทุกอาชีพมีความสำคัญแล้วก็มีคุณค่าในสาขาวิชาชีพตัวเอง ลองถามตัวเองดู แล้วก็มางานโอเพ่นเฮ้าส์แบบนี้จะได้เห็นทุกอย่าง มีประสบการณ์จริง แล้วก็จะตัดสินใจได้ง่ายขึ้นค่ะ
เขตกรุงเทพใต้
กลุ่มเขตกรุงเทพใต้ 1.เขตวัฒนา บ 2.เขตสวนหลวง 3.เขตพระโขนง 4.เขตสาทร 5.เขตคลองเตย 6.เขตบางคอแหลม 7.เขตปทุมวัน 8.เขตบางรัก 9.เขตยานนาวา 10.เขตบางนา
วัฒนา
- คลินิกทันตกรรมธัชสราเด็นตัลเซ็นเตอร์
- คลินิกทันตกรรมบางกอกเดนทัลแคร์
- คลินิกทันตกรรมสไมล์ซีซันส์ สาขาอ่อนนุช
- คลินิกทันตกรรมหมอฟัน 71
- ยศไพบูลย์คลินิกทันตกรรม info&map
พระโขนง
- คลินิกทันตกรรม วี เด็นทิส
- คลินิกทันตกรรมเซตสไมล์
- คลินิกทันตกรรมบางกอกเดนทัลแคร์ สาขาบางจาก
- คลินิกทันตกรรมบ้าน ฟ.ฟัน
- คลินิกทันตกรรมบ้านฟันฟ้าใส
สาทร
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขาเซนต์หลุยส์
- คลินิกทันตกรรมบ้านฟัน จันทน์ 43
- คลินิกทันตกรรมบ้านหมอหน่อย สาขาถนนจันทน์
- คลินิกทันตกรรมพลัส สาขาสาทร
- คลินิกทันตกรรมพีช
- คลินิกทันตกรรมเพื่อชุมชนมูลนิธิกัลยาณวิสุทธิ์ info&map
- คลินิกทันตกรรมสไมล์โฟกัส สาขาถนนจันทน์
คลองเตย
- คลินิกทันตกรรมเดนท์ ดีไฟน์
- คลินิกทันตกรรมบางกอกสไมล์ สาขาพระโขนง
- คลินิกทันตกรรมพลัส สาขาอโศก
- มอสเด็นตัลคลินิกทันตกรรม
บางรัก
- คลินิกทันตกรรมดีซี เดนทัลโฮม สาขาบางรัก
- คลินิกทันตกรรมสไมล์ซีซันส์ สาขาสีลมคอมเพล็กซ์
- ดีโอ้เดนทัลคลินิกทันตกรรม สาขาสีลม
บางนา
- คลินิกทันตกรรม105
- คลินิกทันตกรรมพลัส สาขาอุดมสุข
- คลินิกทันตกรรมพิมสไมล์ info&map
- คลินิกทันตกรรมแฟมิลี่เดนท์
- คลินิกทันตกรรมยิ้มฟันดี
บางคอแหลม
- คลินิกทันตกรรมพลัส สาขาเทอร์มินอล พระราม 3
ปทุมวัน
- คลินิกทันตกรรมคริสตัล info&map
- คลินิกทันตกรรมทันตแพทย์โลตัส
- คลินิกทันตกรรมพลัส สาขาสยาม
- คลินิกทันตกรรมออลเวย์สสไมล์ สาขาโลตัสพระราม 1
ยานนาวา
- ดำรงค์-เพ็ญประภา คลินิกทันตกรรม
สวนหลวง
- คลินิกเฉพาะทางด้านทันตกรรมสไมล์เฮาส์
- คลินิกทันตกรรมพลัส สาขาอ่อนนุช
- คลินิกทันตกรรมพีพีเค
- คลินิกสุรชัยทันตแพทย์
- สไมล์ซิกเนเจอร์คลินิกทันตกรรม สาขาสุขุมวิท 77
ทีมแพทย์ผู้เชี่ยวชาญ มากประสบการณ์
ทีมแพทย์ผู้เชี่ยวชาญ มากประสบการณ์
- รศ. นพ. ชาติชัย ศรีสมบัติ สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์และการผ่าตัดด้วยกล้อง โรงพยาบาลบำรุงราษฎร์
- พญ. ณหทัย ภัคธินันท์ สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์ โรงพยาบาลบำรุงราษฎร์
- ผศ. พญ. ชนัญญา ตันติธรรม สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์ โรงพยาบาลบำรุงราษฎร์
- ผศ. นพ. พลกฤต ทีฆคีรีกุล แพทย์ผู้ชำนาญการด้านเวชพันธุศาสตร์ โรงพยาบาลบำรุงราษฎร์
และทีมงานเจ้าหน้าที่ด้านเทคนิค ผู้ช่วยแพทย์ พยาบาล นักวิทยาศาสตร์และด้านอื่นๆ ที่ร่วมอยู่ในทีม
รพ.เชียงรายประชานุเคราะห์ เชิญชวนผู้ประกันตนสิทธิประกันสังคม LINK
โรงพยาบาลเชียงรายประชานุเคราะห์ เชิญชวนผู้ประกันตนสิทธิประกันสังคม อายุ 50 ปีขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ประจำปี 2566 เข้ารับบริการได้ที่ รพ.เชียงราย 2 (ตึกเหลือง) แสดงบัตรประชาชนทุกครั้ง ไม่เสียค่าใช้จ่าย ตั้งแต่ 1 พ.ค. - 31 .ส.ค. 2566 ติดต่อสอบถาม ห้องตรวจประกันสังคม รพ.เชียงรายฯ 2 ตึกเหลือง โทร.053-910600 ต่อ 7505 7506 วันและเวลาราชการ
เส้นทางการรักษาของผู้ป่วยในระบบชีวาภิบาล
15 เทรนด์เทคโนโลยี
รายงานนี้ระบุถึงการพิจารณาเทรนด์เทคโนโลยีทั้ง 15 เทรนด์ เพื่อให้พิจารณาเทรนด์ที่เกี่ยวข้องได้ง่ายขึ้น เราได้จัดกลุ่มเทรนด์เหล่านี้ไว้ใน 5 หมวดหมู่ที่กว้างขึ้น ได้แก่
- การปฏิวัติ AI (The AI revolution)
- การสร้างอนาคตดิจิทัล (Building the digital future)
- ขอบเขตการประมวลผลและการเชื่อมต่อ (Compute and connectivity frontiers)
- วิศวกรรมที่ล้ำสมัย (Cutting-edge engineering)
- โลกที่ยั่งยืน (A sustainable world)
แน่นอนว่าการพิจารณากลุ่มเหล่านี้เมื่อพิจารณาการผสมผสานเทรนด์นั้นมีพลังและศักยภาพอย่างมาก เพื่ออธิบายสถานะของแต่ละเทรนด์ เราได้พัฒนาคะแนนสำหรับนวัตกรรม (โดยอิงจากสิทธิบัตรและการวิจัย) และความสนใจ (โดยอิงจากข่าวสารและการค้นหาทางเว็บ) นอกจากนี้ เรายังวัดขนาดการลงทุนในเทคโนโลยีที่เกี่ยวข้องและให้คะแนนระดับการนำไปใช้โดยองค์กรต่างๆ
15 เทรนด์เทคโนโลยีใน 5 หมวดหมู่ เหล่านั้นได้แก่
- Generative AI - AI เชิงสร้างสรรค์
- Applied AI - AI เชิงประยุกต์
- Industrializing machine learning - การเรียนรู้ของเครื่องจักรเชิงอุตสาหกรรม
- Next-generation software development - การพัฒนาซอฟต์แวร์รุ่นถัดไป
- Digital trust and cybersecurity - ความน่าเชื่อถือทางดิจิทัลและความปลอดภัยทางไซเบอร์
- Advanced connectivity - การเชื่อมต่อขั้นสูง
- Immersive-reality technologies - เทคโนโลยีความจริงเสมือน
- Cloud and edge computing - คลาวด์และคอมพิวเตอร์แบบเอจ
- Quantum technologies - เทคโนโลยีควอนตัม
- Future of robotics - อนาคตของหุ่นยนต์
- Future of mobility - อนาคตของการเคลื่อนที่
- Future of bioengineering - อนาคตของวิศวกรรมชีวภาพ
- Future of space technologies - อนาคตของเทคโนโลยีอวกาศ
- Electrification and renewables - การใช้ไฟฟ้าและพลังงานหมุนเวียน
- Climate tech beyond electrification and renewables - เทคโนโลยีด้านภูมิอากาศที่ก้าวข้ามการใช้ไฟฟ้าและพลังงานหมุนเวียน
18 สิงหาคม 2024 กราฟนี้แสดงข้อมูลเรื่องความรุนแรงของไวรัส mpox clade I ใน DRC ออกมาในรูปของอัตราการเสียชีวิต (CFR) ค่อนข้างชัดเจน เส้นกราฟสีเขียวคือข้อมูลอัตราการเสียชีวิตในช่วงปี 1970-1980 ส่วนกราฟสีม่วงคือ อัตราการเสียชีวิตหลังปี 2020 หรือ ในช่วงปัจจุบัน สิ่งที่เห็นจากกราฟคือ CFR จะสูงสุดในเด็กเล็ก และ จะลดน้อยลงเมื่ออายุมากขึ้น ซึ่งชัดเจนว่ากลุ่มที่มีความเสี่ยงต่ออาการรุนแรงของการติดเชื้อคือเด็กเล็ก
ข้อมูลในกราฟนี้มีอีกอย่างที่น่าสนใจคือ กราฟสีม่วงลดต่ำลงมาจากกราฟสีเขียวชัดเจน แม้ในกลุ่มที่ไม่เคยฉีดวัคซีน ซึ่งหมายความว่า CFR จากการติดเชื้อไวรัสสายพันธุ์ปัจจุบันใน DRC ซึ่งประกอบไปด้วย Clade Ia และ Clade Ib เทียบกับในอดีตซึ่งมีแต่ Clade Ia มีแนวโน้มที่จะน้อยลงในทุกช่วงอายุ
ข้อมูลนี้บอกว่า ไวรัส Clade Ib ที่เริ่มระบาดในปี 2020 เป็นต้นมาอาจมีความรุนแรงน้อยลง กว่าสายพันธุ์ Clade 1a ในอดีต แต่ทั้งนี้ยังสรุปไม่ได้แบบฟันธงถ้าไม่มีการเปรียบเทียบไวรัสทั้งสองสายพันธุ์แบบตัวต่อตัวในสัตว์ทดลองเป็นต้น เพราะค่า CFR ที่ลดลงในปัจจุบันอาจจะมาจาก การรักษาพยาบาลที่ดีขึ้นกว่าเมื่อก่อน หรืออาจจะเป็นเพราะความสามารถของเทคโนโลยีการการตรวจหาผู้ป่วยอาการน้อยๆได้เยอะขึ้น ทำให้ตัวหารที่ใช้คำนวณ CFR มากขึ้นก็เป็นได้
ประเด็นที่สำคัญคือการสื่อสารตัวเลขความรุนแรงของไวรัสสายพันธุ์ปัจจุบันต้อง update ตามข้อมูล ไม่ควรใช้ตัวเลขในกราฟสีเขียวซึ่งสูงเกินความจริงมาอธิบายในปัจจุบันเพราะการสื่อสารจะสร้างความกลัวโดยไม่จำเป็น
Note: กราฟนี้บอกถึงบทบาทของวัคซีนในการป้องกันไวรัส Clade I เช่นเดียวกัน แต่เนื่องจาก study size ที่เล็กมาก เราตอบอะไรจากข้อมูลนี้ยังไม่ได้ครับ
เขตกรุงธนเหนือ
กลุ่มเขตกรุงธนเหนือ 1.เขตบางพลัด 2.เขตบางกอกน้อย 3.เขตบางกอกใหญ่ 4.เขตตลิ่งชัน 5.เขตทวีวัฒนา 6.เขตจอมทอง 7.เขตธนบุรี 8.เขตคลองสาน
บางพลัด
- คลินิกทันตกรรมดับเบิ้ลเอ็น
- คลินิกทันตกรรมมอสจรัญสนิทวงศ์
- คลินิกทันตกรรมสไมล์ลอฟท์ สาขาปิ่นเกล้า
- วันเดอร์สไมล์คลินิกทันตกรรม info&map
บางกอกน้อย
- คลินิกเฉพาะทางด้านทันตกรรมจัดฟัน พี เอส ดี ซี
- คลินิกทันตกรรมทูธแอนด์โก
- คลินิกทันตกรรมบางขุนศรีทันตแพทย์
- คลินิกทันตกรรมบ้านหมอปิ๋ม info&map
- คลินิกทันตกรรมพลัส สาขาปิ่นเกล้า
- คลินิกทันตกรรมมงคลทันตแพทย์ คลินิกทันตกรรมสุรชัย
- เจริญคลินิกทันตกรรม
บางกอกใหญ่
- คลินิกทันตกรรมดับเบิ้ลเอ็น สาขา MRT ท่าพระ
- คลินิกทันตกรรมต้นไทรทันตแพทย์อิสรภาพ
- สว่างทันตกรรมคลินิก
ตลิ่งชัน
ทวีวัฒนา
- คลินิกทันตกรรมโปรเด็นท์ สาขาสาย 3
- คลินิกทันตกรรมสไมล์วิลล่า
- คลินิกทันตกรรมโฮมมี่ info&map
จอมทอง
- คลินิกทันตกรรมยิ้ม
- สหคลินิกพีเอ็มจีบางขุนเทียน
ธนบุรี
- คลินิกทันตกรรมเฟิร์สสไมล์ สาขาเดอะมอลล์ท่าพระ
- คลินิกทันตกรรมมิสเตอร์สไมล์
- คลินิกทันตกรรมสไมล์ซีซันส์ สาขาท่าพระ
- ออร่าสไมล์คลินิกทันตกรรม
คลองสาน
- คลินิกต้นไทรทันตแพทย์1
- คลินิกทันตกรรมมอสเจริญนคร
- สไมล์เมทแอ็ทแพลทฟอร์มคลินิกทันตกรรม
เขตกรุงธนใต้
กลุ่มเขตกรุงธนใต้ 1.เขตบางขุนเทียน 2.เขตบางแค 3.เขตหนองแขม 4.เขตภาษีเจริญ 5.เขตบางบอน 6.เขตทุ่งครุ 7.เขตราษฎร์บูรณะ
ทุ่งครุ
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขาประชาอุทิศ
- คลินิกทันตกรรมบ้านรักฟัน
- คลินิกทันตกรรมโอล่าเดนทัลโฮม info&map
- ไอดีเด็นทัลคลินิกทันตกรรม
บางขุนเทียน
- คลินิกทันตกรรม ฟ.ฟัน สะอาดจัง
- คลินิกทันตกรรมดีซีเดนทัลโฮม สาขาพระราม 2
- คลินิกทันตกรรมเด้นท์แคร์
- คลินิกทันตกรรมเด็นเมด
- คลินิกทันตกรรมบางกระดี่ info&map
- คลินิกทันตกรรมบ้านทันตแพทย์
- คลินิกทันตกรรมบ้านฟัน
- คลินิกทันตกรรมบ้านฟันฟ้า
- คลินิกทันตกรรมพลัส สาขาพระราม 2
- คลินิกทันตกรรมเฟิร์สสไมล์
- สหคลินิกพระราม 2 (แพทย์แผนไทยประยุกต์ ทันตกรรม)
บางแค
- คลินิกทันตกรรม ดีทีฮับ สาขา2
- คลินิกทันตกรรมไคนด์แอนด์แคร์
- คลินิกทันตกรรมดิออเร้นจ์ info&map
- คลินิกทันตกรรมทูธแคมป์
- คลินิกทันตกรรมบ้านรักษ์ฟัน
- คลินิกทันตกรรมโมเดิร์นสไมล์
- คลินิกทันตกรรมรักฟัน
- ยูมีคลินิกทันตกรรม สาขาบางแค
บางบอน
- คลินิกทันตกรรมเด้นท์แคร์พลัส
- คลินิกทันตกรรมเด้นท์สไมล์
- คลินิกทันตกรรมสมายล์เจอร์นีย์
- คลินิกทันตกรรมสไมล์ คอนเนค
- บ้านฟอฟันคลินิกทันตกรรม info&map
- บ้านหมอฟันคลินิกทันตกรรม
- บีเอสคลินิกทันตกรรม
- ปิ่นทองทันตแพทย์คลินิกทันตกรรม
- สหคลินิกพีเอ็มจีบางขุนเทียน(บางบอน)
ภาษีเจริญ
- 28 คลินิกทันตกรรม info&map
- คลินิกทันตกรรมบีเคเค 48
- คลินิกทันตกรรมบุญชัยทันตแพทย์
- คลินิกทันตกรรมพลัส สาขาซีคอนบางแค
- คลินิกทันตกรรมพาณิชย์ธน
- คลินิกทันตกรรมสาย 1
ราษฎร์บูรณะ
- คลินิกทันตกรรมวีสไมล์ บางปะกอก
- ยูมีคลินิกทันตกรรม
หนองแขม
- คลินิกทันตกรรม ดีทีฮับ
- คลินิกทันตกรรมจัสท์สมายล์ info&map
- คลินิกทันตกรรมซัมเมอร์สไมล์
- คลินิกทันตกรรมทันตแพทย์สุกัญญา
- คลินิกทันตกรรมทันตสิริ
- คลินิกทันตกรรมโปรเด็นท์ สาขาเพชรเกษม 79
- คลินิกทันตกรรมพลอยเพลิน
- คลินิกทันตกรรมพีสไมล์
- ฟ.ฟัน คลินิกทันตกรรม
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตสายไหม
บทความเกี่ยวข้องกับ Palliative Care
พรบ.สถานประกอบการเพื่อสุขภาพและกฎหมายที่เกี่ยวข้อง LINK
- 001-พรบ.สถานประกอบเพื่อสุขภาพ-2559 – ดาวน์โหลด
- 002-พรบ.สาธารณสุข-2535 – ดาวน์โหลด
- 003-พรบ.การสาธารณสุขฉบับที่-2-2550 – ดาวน์โหลด
- 004-ประกาศกรมหลักเกณฑ์การใช้ชื่อสถานประกอบการเพื่อสุขภาพ – ดาวน์โหลด
- 005-กฎกระทรวงกำหนดบริการอื่นในกิจการสปา – ดาวน์โหลด
- 006-กฎกระทรวงกำหนดค่าธรรมเนียม – ดาวน์โหลด
- 007-ประกาศกรมสถานประกอบการต้องมีผู้ดำเนินการ – ดาวน์โหลด
- 008-กฎกระทรวงการอนุญาตประกอบกิจการสถาน – ดาวน์โหลด
- 009-กฎกระทรวงการอนุญาตเป็นผู้ดำเนินการ – ดาวน์โหลด
- 010-กฎกระทรวงกำหนดมาตรฐานด้านสถานที่ – ดาวน์โหลด
- 011-กฎกระทรวงการขึ้นทะเบียนผู้ให้บริการ – ดาวน์โหลด
- 012-ประกาศคณะกรรมการหลักเกณฑ์การรับรองวุฒิบัตร – ดาวน์โหลด
- 013 ประกาศกระทรวงสาธารณสุข เรื่อง แต่งตั้งพนักงานเจ้าหน้าที่เพื่อปฏิบัติการฯ – ดาวน์โหลด
- 014 ประกาศคณะกรรมการสถานประกอบการเพื่อสุขภาพ เรื่อง หลักเกณฑ์การทดสอบและประเมินความรู้ความสามารถของผู้ดำเนินการ พ.ศ. ๒๕๕๙ – ดาวน์โหลด
- 015 คำสั่งกรมสนับสนุนบริการสุขภาพที่ 840/2560 มอบหมายให้ข้าราชการเป็นผู้แทนอธิบดีกรมสนับสนุนบริการสุขภาพฯ – ดาวน์โหลด
- 016 คำสั่งกรมสนับสนุนบริการสุขภาพที่ 173/2560 เรื่อง มอบหมายให้ข้าราชการเป็นผู้อนุญาตแทน – ดาวน์โหลด
- 017 ประกาศกรมสนับสนุนบริการสุขภาพ เรื่อง การกำหนดแบบตามกฎกระทรวงซึ่งออกตาม พระราชบัญญัติสถานประกอบการเพื่อสุขภาพ พ.ศ. ๒๕๕๙ – ดาวน์โหลด
- 018 ประกาศกรมสนับสนุนบริการสุขภาพ เรื่อง แบบบัตรประจำตัวพนักงานเจ้าหน้าที่ฯ – ดาวน์โหลด
- 019 ประกาศกรมสนับสนุนบริการสุขภาพ เรื่อง หลักเกณฑ์ และวิธีการในการเปรียบเทียบ ฯ – ดาวน์โหลด
- 020 ประกาศกระทรวงสาธารณสุข เรื่องกิจการที่เป็นอันตรายต่อสุขภาพ ( ฉบับที่ 2) – ดาวน์โหลด
กิจวัตรสำคัญ 7 ย่าง (IADL)
กิจวัตรสำคัญ 7 ย่าง (IADL*) ได้แก่
- อยู่คนเดียวได้ หมายความว่าทนเหงาได้
- ขนส่งตัวเอง เช่นถีบรถ ขับรถ หรือไปขึ้นรถเมล์ ได้
- ทำอาหารกินเองได้
- ช้อปปิ้งเองได้
- บริหารที่อยู่ตัวเองได้ เช่นปัดกวาดเช็ดถู
- บริหารยาตัวเองได้
- บริหารเงินของตัวเองได้
* IADL - Instrumental Activities of Daily Living
1. เที่ยวในประเทศกลายเป็นตัวเลือกแรก
เที่ยวนอกประเทศลำบาก เที่ยวในประเทศจึงเป็นตัวเลือกแรก ในช่วงที่วัคซีนยังไม่ถูกค้นพบหรือกระจายแพร่หลาย ในหลายประเทศมีมาตรการจำกัดการเดินทางเข้าประเทศจากต่างประเทศ เพื่อควบคุมการระบาดของโรค ทำให้การเดินทางไปต่างประเทศ ไม่ว่าไปจะเที่ยวพักผ่อนหรือติดต่อธุรกิจทำได้ยาก แม้จะเที่ยวนอกประเทศได้ แต่คนก็ยังอยำกเที่ยวในประเทศกันอยู่ แม้จะไม่มีผลสำรวจในไทยโดยตรง แต่ผลการสำรวจจากต่างประเทศ ก็พอทำให้เราคาดการณ์พฤติกรรมของคนไทยได้ โดยจากผลสำรวจของ McKinsey ต่อกลุ่มนักท่องเที่ยวจีนในเดือนพฤษภาคม 2020 โดยมีการถามว่า ในการท่องเที่ยวเพื่อพักผ่อนในครั้งถัดไป คิดว่าจะท่องเที่ยวในที่ที่ไกลเพียงใด ซึ่งการท่องเที่ยวต่างประเทศถูกรวมอยู่ในคำถามนี้ด้วย ผลปรากฎว่า ผู้ตอบแบบสอบถาม 55% คิดว่าจะเที่ยวในประเทศก่อน ซึ่งความต้องการเที่ยวในประเทศดังกล่าวอาจมาจากท้ังเหตุผลเรื่องเศรษฐกิจ และเหตุผลเรื่องความเสี่ยงจากการติดเชื้อโควิด-19 จากการไปเที่ยวต่างประเทศ
อัตราค่าห้องพัก 7 แบบ LINK
อัตราค่าห้องพัก 7 แบบ
- Executive
- Deluxe (VIP)
- Deluxe (City View)
- Deluxe
- VIP B
- พิเศษรวม (4 เตียง)
- พิเศษรวม (2 เตียง จักษุ)
ศูนย์การุณรักษ์ กับกิจกรรม World Hospice and Palliative Care Day 2020 LINK
วันเสาร์ที่สองของเดือนตุลาคมของทุกๆ ปี ได้ถูกกำหนดให้เป็น World Hospice and Palliative Care Day ซึ่งในปีนี้ตรงกับวันที่ 10 ตุลาคม 2563 มาใน theme : MY CARE, MY COMFORT
ศูนย์การุณรักษ์ขอเป็นส่วนหนึ่งในการร่วมเฉลิมฉลองและเป็นฟันเฟืองหนึ่งในการผลักดันให้ประชาชนคนไทยทุกคนสามารถเข้าถึงบริการการดูแลแบบประคับประคอง (Palliative Care)
ทำไมถึงต้อง Palliative Care?
Palliative Care หรือ การดูแลแบบประคับประคอง มุ้งเน้นดูแลคุณภาพชีวิตของผู้ป่วยและครอบครับหรือคนรอบข้าง ที่กำลังเผชิญกับภาวะที่คุกคามต่อชีวิต
การดูแลประคับประคองมีบทบาทในการช่วยให้ผู้ป่วยมีชีวิตที่มีคุณภาพ ปราศจากอาการเจ็บปวดทางกายทุกประเภท รวมไปถึงการดูแลความทุกข์ทรมานในด้านอื่นๆ ด้วย เช่น ด้านจิตใจ ด้านสังคมไปจนถึงด้านจิตวิญญาณ ทั้งของผู้ป่วยเองและคนรอบข้าง เพราะเราทราบดีว่า ความสุขสบายของคนไข้และสุขภาพและกำลังใจของผู้ดูแล มีผลเกี่ยวเนื่องกัน
MY CARE, MY COMFORT
ความเจริญก้าวหน้าทางเทคโนโลยีทางการแพทย์และการรักษาในปัจจุบัน ทำให้หลายๆ โรคในอดีตที่เชื่อว่ารักษาได้ยากลำบาก ในปัจจุบันดูมีความหวังมากขึ้น แต่เราทุกคนต่างรู้ดีว่าเรามีวันนั้นของเราเองทุกคน ทำอย่างไรให้การดูแลในวันที่เรายังมีกันและกันอยู่นั้นเต็มไปด้วยคุณค่าและความหมายที่ดีที่สุด
ไม่ว่าเราจะเจ็บป่วยด้วยโรคอะไรก็ตาม ประชาชนทุกคนมีสิทธิ์และควรได้รับการเข้าถึงการดูแลให้สุขสบาย บุคลากรทางการแพทย์จึงมีหน้าที่ในการให้การดูแลเพื่อให้ผู้ป่วยสุขสบายตลอดการรักษาไม่เฉพาะกับช่วงท้ายของชีวิต ในขณะเดียวกัน ผู้ป่วยก็มีสิทธิ์ที่จะขอรับการรักษาให้ตนไม่ทุกข์ทรมานจากความเจ็บป่วยทุกชนิดเช่นกัน
==========
ในโอกาสวันพิเศษ World Hospice and Palliative Care Day ปี 2020 นี้ ศูนย์การุณรักษ์ของเชิญชวนทุกๆ ท่านร่วมกันแสดงออกเพื่อทำให้ Palliative Care เป็นที่รู้จักมากขึ้น และสร้างความตระหนักรู้และความเข้าใจให้กับบุคลากรทางการแพทย์ทุกกระดับ เพื่อนำไปสู่นโยบายการจัดบริการและการเข้าถึงการดูแลแบบประคับประคองในระดับประเทศต่อไป
ทุกๆ ท่านสามารถร่วมกิจกรรมได้ โดยการเขียนเล่าเรื่องประสบการณ์ที่เราได้เกี่ยวข้างกับการดูแลแบบประคับประคอง พร้อมทั้งใส่ hash tag #MYCAREMYCOMFORT
ตลอด 1 สัปดาห์นี้ ทีมงานแพทย์ พยาบาลการุณรักษ์ จะขอร่วมเขียน reflection ร่วมกับทุกๆ ท่านด้วยเช่นกัน เรามาร่วมกิจกรรมนี้ไปด้วยกันครับ ^^
Superior River View
ห้องพักส่วนตัวที่มีความกว้างขวาง โปร่ง โล่ง สบาย ให้ความรู้สึกผ่อนคลาย สามารถฟื้นฟูสุขภาพได้อย่างดีเยี่ยม ด้วยวิวโค้งน้ำเจ้าพระยาและคุ้งบางกระเจ้า พื้นที่สีเขียวที่ใหญ่ที่สุดและเป็นปอดของกรุงเทพฯ
พื้นที่ห้อง 45 Sq.M.
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- ตู้เย็น
- ไมโครเวฟ
- ทีวี
- อุปกรณ์ในห้องน้ำ
- ตู้เซฟ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 8,700 บาท
- ค่าอาหาร 1,500 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 1,000 บาท
รวม 14,400 บาท
ศูนย์บริการพิเศษศรีเวชวัฒน์ (Srivajchavat Premium Center) LINK
ศูนย์บริการพิเศษศรีเวชวัฒน์
ชั้น 1 อาคารศรีเวชวัฒน์ โรงพยาบาลสงขลานครินทร์
15 ถ.กาญจนวณิชย์ ต.หาดใหญ่ อ.หาดใหญ่ จ.สงขลา 90110
โทรศัพท์ : 074-451822 074-451827-8 หมายเลขภายใน : 1822, 1827-8
ให้บริการ
- คลินิกตรวจสุขภาพ
- คลินิกอายุรกรรม
- คลินิก หู คอ จมูก
- คลินิกกระดูกและข้อ
- คลินิกศัลยกรรม
- คลินิกเด็ก
- คลินิกนรีเวช
- คลินิกระงับปวด
- ศูนย์เลสิก
- คลินิกผิวหนัง
- คลินิกตา
- คลินิกนิ้วล็อค
- คลินิกเวชปฏิบัติครอบครัว
- คลินิกทดสอบภูมิแพ้
- คลินิกจิตเวช
Line : premium.ok
มีพื้นที่จอดรถฟรี : สำหรับผู้เข้ารับบริการ
ข้าราชการสามารถเบิกได้ ตามสิทธิ์กรมบัญชีกลาง
(ทุกสิทธิ์สำรองจ่ายเงินสด แล้วนำไปเบิกตามสิทธิ์)
ข้อมูลการประกันสุขภาพ
ศูนย์การแพทยปัญญานันทภิกขุ ชลประทาน ให้บริการสำหรับท่านที่มีประกันสุขภาพและประกันอุบัติเหตุ และแฟกซ์เคลมเซอร์วิส โดยท่านสามารถใช้สิทธิ์ได้ดังนี้
ลำดับ/ชื่อบริษัท
- กรุงไทยแอกซ่า ประกันชีวิต
- ทิพยประกันภัย
- ไทยประกันชีวิต
- ไทยพาณิชย์ประกันชีวิต
- อลิอันซ์ อยุธยา ประกันชีวิต
เมื่อท่านเข้ารับบริการ สิ่งที่ควรเตรียมมา ดังนี้
- บัตรกรมธรรม์
- บัตรประชาชน หรือบัตรที่มีรูปถ่ายที่ออกโดยราชการ
สอบถามข้อมูลเพิ่มเติม
Tel. +66 502 2345
ศูนย์นมแม่ โรงพยาบาลเจริญกรุงประชารักษ์ LINK
ให้คำปรึกษาการเลี้ยงลูกด้วยนมแม่ โทร 02.289-7134
- ปรึกษาทางโทรศัพท์ วันจันทร์ - วันศุกร์ เวลา 08.00 - 16.00 น.
- ปรึกษาด้วยตนเอง วันอาทิตย์ - วันศุกร เวลา 08.00 - 16.00 น.
**ยกเว้นวันหยุตรายการและวันนักหยุตนักขัตฤกษ์* *
ปัญหาที่รับปรึกษา
การฝึกลูกเข้าเต้า หัวนมสั้น หัวนมบอด-แบน-บุ๋ม เต้านมคัด หัวนมแตก ลูกดูดนมแม่แล้วเจ็บหัวนม ท่อน้ำนมอุดตัน เต้านมอักเสบ เต้านมเป็นฝี น้ำนมลดลง การใช้ยาในแม่ตั้งครรภ์ให้นมบุตร การเลี้ยงลูกด้วยนมแม่ในแม่ทำงาน และทุกปัญหาของการเลี้ยงลูกด้วยนมแม่
ศูนย์ความเป็นเลิศ : ศูนย์จักษุกรรม LINK
ศูนย์จักษุกรรม
เป็นหน่วยตติยภูมิชั้นสูงที่มีการให้บริการตรวจวินิจฉัยและรักษา ด้วยเครื่องมือพิเศษที่ทันสมัยและด้วยจักษุแพทย์ที่มีความเชี่ยวชาญเฉพาะด้านซึ่งประกอบด้วย
- ศูนย์จอตาและจุดภาพชัด R-MaC (Retina and Macular Center)
- ศูนย์รักษาสายตา (Refractive Surgery Center)
- ศูนย์ต้อหิน (Glaucoma Center)
- งานด้านศัลยกรรมตกแต่งเสริมสร้างทางตาและโพรงเบ้าตา (Oculoplastic Surgery)
ศูนย์รักษาสายตา (Refractive Surgery Center) ให้บริการแก้ไขความผิดปกติของสายตา (สั้น ยาว เอียง) ครบวงจร ด้วยวิธี PRK (Photorefractive Keratectomy), FemtoLASIK (Bladeless LASIK) และ ReLEx (Refractive Lenticule Extraction) ซึ่งเป็นเทคโนโลยีใหม่ล่าสุดในการแก้ไขภาวะสายตาสั้นและเอียง
นอกจากนี้ยังมีการผ่าตัดใส่เลนส์เสริม (Phakic IOL) ในกรณีที่คนไข้มีสายตาสั้น ยาว เอียงมาก หรือมีกระจกตาที่ไม่เหมาะสม ในการรักษาด้วยวิธีการใช้แสงเลเซอร์ และมีการผ่าตัดใส่วงแหวนในกระจกตา (Intracorneal Ring) ในการปรับความโค้งและเพิ่มความแข็งแรงให้กระจกตา เพื่อรักษากลุ่มโรคกระจกตาผิดปกติ ทำให้ผู้ป่วยมีโอกาสในการมองเห็นที่ดีขึ้น
กรุงเทพ 29 ตุลาคม 2563 –
โรงแรมอลอฟท์ กรุงเทพ สุขุมวิท 11 บริหารโดยแมริออท อินเตอร์เนชั่นแนล ชวนพักผ่อนอย่างปลอดภัย มีสไตล์ใจกลางกรุงเทพกับแพ็กเกจกักตัวทางเลือกหรือ ASQ สุดคุ้มค่า
หลังจากผ่านการตรวจประเมินโรงแรมที่ใช้เป็นสถานที่กักตัวทางเลือก (Alternative State Quarantine) หรือ ASQ โดยกระทรวงสาธารณสุขและกระทรวงกลาโหมแล้ว โรงแรมอลอฟท์ กรุงเทพ สุขุมวิท 11 พร้อมเสนอตัวเป็นสถานที่กักตัวทางเลือกสำหรับผู้ที่กำลังเดินทางกลับจากต่างประเทศสู่ประเทศไทย ด้วยความร่วมมือกับโรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนลซึ่งเป็นโรงพยาบาลคู่สัญญาที่มีมาตรฐานระดับสากล ลูกค้าจะอุ่นใจกับบริการที่ดีที่สุดจากโรงแรม นอกจากนี้ยังได้รับการดูแล การคัดกรอง การกักตัวเฝ้าระวังอาการ การตรวจหาเชื้อจากบุคลากรทางการแพทย์ผู้ชำนาญการของโรงพยาบาลคู่สัญญาตลอดระยะเวลาที่กักตัว
กรณีที่ 2 ด่านพรมแดนทางบก (แวะพัก)
หมายเหตุ
- รถมินิบัส/ รถบัสมีห้องน้ำ (วิ่งระยะทางไกล) ต้องมี 2 ประตู
- แยกพนักงานขับรถกับผู้โดยสาร ให้ปฏิบัติตามมาตรฐานความปลอดภัยด้านสุขอนามัย (Amazing Thailand Safety and Health Administration: SHA) ของการท่องเที่ยวแห่งประเทศไทย
- ต้องมีพนักงานขับรถอย่างน้อย 2 คน
- รถโดยสารสามารถจอดเติมน้ำมัน/ จอดพักรถได้โดยต้องแจ้งจุดพักรถมายังกรมสนับสนุนบริการสุขภาพให้รับทราบด้วย
"#Thailand is an excellent example that with a whole-of-government, whole-of-soc"iety, comprehensive approach, this virus can be contained – even without a vaccine"-
@DrTedros
---
"#Thailand’s numbers speak for themselves. Although it was the first country outside #China to report a case of
#COVID19, it has reported less than 4000 cases & just 60 deaths, with a population of 70 million & one of the world’s largest & most crowded cities"-
@DrTedros
---
"The country’s network of 1M+ village health volunteers, who are the eyes & ears of the health system in communities, played a critical role in the
#COVID19 response.
Flag of Thailand has also learned the lessons of the past, including its experience with SARS in 2003""-
@DrTedros
รายชื่อผู้แต่ง
- แพทย์หญิงคุณนันทา มาระเนตร์
สาขาวิชาโรคระบบการหายใจและวัณโรค
ภาควิชาอายุรศาสตร์ศิริราชพยาบาล
- แพทย์หญิงพิมล รัตนาอัมพวัลย์
ศูนย์นิทรรักษ์ศิริราชโรงพยาบาลศิริราช
- นายแพทย์ธีรเดช คุปตานนท์
ศูนย์โรคการนอนหลับ โรงพยาบาลรามาธิบดี
- แพทย์หญิงวิสาข์สิริ ตันตระกูล
ศูนย์โรคการนอนหลับ โรงพยาบาลรามาธิบดี
- นายแพทย์ณัฐพงษ์ เจียมจริยธรรม
ศูนย์นิทราเวชโรงพยาบาลจุฬาลงกรณ์
- แพทย์หญิงกัลยา ปัญจพรผล
สถาบันโรคทรวงอก
- แพทย์หญิงนฤชา จิรกาลวสาน
ศูนย์นิทราเวชโรงพยาบาลจุฬาลงกรณ
เริ่มใช้ใน กทม และปริมณฑลเท่านั้น ยังไม่รวมถึงต่างจังหวัด
4 ขั้นตอนการใช้เครื่อง AED [รฟม]
4 ขั้นตอนการใช้เครื่อง AED
- เปิดเครื่อง - กดปุ่มเปิดหรือเปิดฝาเครื่องจะทำงานอัตโนมัติ
- แปะแผ่นนำกระแสไฟฟ้า - แต่ละแผ่นจะมีภาพแสดงตำแหน่งการติดที่หลังแผ่น แผ่น 1 ติดที่หน้าอก แผ่น 2 ติดที่ชายโครงสีข้างด้านซ้าย
- วิเคราะห์ - AED จะทำการวิเคราะห์คลื่นไฟฟ้าหัวใจของผู้ป่วยอัตโนมัติทันที
- ทำการช็อค - กรณีที่ AED วิเคราะห์ว่าจำเป็นต้องช็อคด้วยกระแสไฟฟ้า เครื่องจะแสดงสัญญาณไฟกระพริบที่ปุ่ม "ช็อค" แล้วจึงกดปุ่ม ช็อคทันที จากนั้นไปทำ CPR ต่อไป
วิธีที่ 2 - ทำเรื่องผ่านเว็บไซต์ประกันสังคม www.sso.go.th
ตามขั้นตอนดังนี้ (ดูภาพประกอบ)
- เข้าไปที่เว็บไซต์สำนักงานประกันสังคม ไปที่ ส่วนผู้ประกันตน และ ล็อกอินเข้าระบบ
- เลือกเมนู ยื่นแบบขอเปลี่ยนสถานพยาบาล
- เลือกโรงพยาบาลที่ต้องการ
- กดยอมรับข้อตกลงและบันทึก
(ภาพจากรพ.เกษมราษฎร์)
Timeline ผู้ป่วยเพศหญิง อายุ 26 ปี กรุงเทพมหานคร
Timeline ผู้ป่วยเพศหญิง อายุ 26 ปี กรุงเทพมหานคร ตรวจพบติดเชื้อโควิด-19 วันที่ 4 ธันวาคม 2563
ฮ่องกงเตรียมซื้อวัคซีน COVID-19 แจกประชาชนทุกคนฟรี
ฮ่องกงเตรียมซื้อวัคซีน COVID-19 แจกประชาชนทุกคนฟรี จาก 3 บริษัท
- Sinovac จำนวน 1 ล้านชุด
- Pfizer and BioNTech จำนวน 1 ล้านชุด
- AstraZeneca จำนวน 7.5 ล้านชุด
ที่มา: สำนักข่าวกรองแห่งชาติ
เยอรมันประกาศเพิ่มความเข้มงวดควบคุมการระบาดช่วงปีใหม่
สหพันธ์สาธารณรัฐเยอรมนี ประกาศเพิ่มความเข้มงวดของมาตรการควบคุมการระบาดของโรค COVID-19 โดยกำหนดให้ร้านค้าที่ไม่สำคัญ ร้านทำผม ปิดทั่วประเทศ และการจัดงานปีใหม่ การขายพลุดอกไม้ไฟ การดื่มแอลกอฮอล์ในที่สาธารณะ จะถูกห้าม และการรวมตัวในที่สาธารณะ ถูกจำกัดไม่ให้เกิน 5 คน จากไม่เกิน 2 ครัวเรือน
ไต้หวันขยายเวลา ห้ามนำเข้าแรงงานอินโดนีเซียอไม่มีกำหนด
Reuters รายงานว่า รัฐบาลไต้หวันประกาศขยายระยะเวลาห้ามนำเข้าแรงงานอินโดนีเซียอย่างไม่มีกำหนด เนื่องจากตรวจพบแรงงานอินโดนีเซียหลายรายที่เดินทางไปทำงานที่ไต้หวันติดเชื้อ COVID-19 รวมทั้งไม่ได้รับความร่วมมือจากรัฐบาลอินโดนีเซียในการออกเอกสารรับรองผลการตรวจเชื้อ COVID-19 ทั้งนี้ ตั้งแต่ ต.ค.63 ไต้หวันตรวจพบแรงงานอินโดนีเซียที่เพิ่งเดินทางเข้าไปทำงานติดเชื้อ COVID-19 จำนวน 132 ราย โดยมี 76 ราย ตรวจพบว่าติดเชื้อทันทีที่เดินทางถึงไต้หวัน
ข่าวแหล่งอื่นๆ
ข่าวแหล่งอื่นๆ
นครปฐม
นครปฐม
สำนักงานประชาสัมพันธ์จังหวัดนครปฐม มีประกาศ วันที่ 19 ธค 63 ดังนี้
"ด่วน ! ขอให้ประชาชนจังหวัดนครปฐม ที่มีประวัติการเดินทางไป ตลาดค้าส่งสัตว์น้ำในพื้นที่จังหวัดสมุทรสาคร ระหว่างวันที่ 15 พ.ย. - 19 ธ.ค. 2563 กรุณาลงทะเบียนออนไลน์ผ่านโทรศัพท์มือถือ หรือแจ้ง รพ.สต. /สสอ.ใกล้บ้าน ภายในวันที่ 26 ธ.ค.2563
และหากท่านหรือบุคคลใกล้ชิดท่าน มีอาการไข้ร่วมกับ เจ็บคอ มีน้ำมูก หอบเหนื่อย หายใจลำบาก ขอให้ไปพบแพทย์โดยด่วน ณ โรงพยาบาลใกล้บ้าน"
1. การผ่าตัดปลูกถ่ายตับในผู้ป่วยโรคตับแข็งระยะกลางและระยะท้าย
การผ่าตัดปลูกถ่ายตับในผู้ป่วยโรคตับแข็งระยะกลางและระยะท้าย โดยระบบบริการในประเทศไทยมีศักยภาพในการปลูกถ่ายได้ปีละ 100 ราย ขณะที่การคาดการณ์ความต้องการของผู้ป่วยอยู่ที่ปีละ 50 ราย แต่เบื้องต้นบอร์ด สปสช. ตั้งเป้านำร่องให้บริการปีละ 25 รายก่อน คิดเป็นงบประมาณ 17.5 ล้านบาท
ด่วน! เชียงใหม่ สั่งล็อกดาวน์ 3 ตำบล อ.แม่อาย LINK
ด่วน! เชียงใหม่ สั่งล็อกดาวน์ 3 ตำบล อ.แม่อาย
เชียงใหม่มีคำสั่งให้ผู้มาจากสมุทรสาครต้องกักตัว 14 วัน พร้อมล็อกดาวน์ 3 ตำบล อ.แม่อาย
ผู้สื่อข่าวรายงานว่า วันที่ 21 ธันวาคม 2563 นายเจริญฤทธิ์ สงวนสัตย์ ผู้ว่าราชการจังหวัดเชียงใหม่ ในฐานะ ประธานคณะกรรมการโรคติดต่อจังหวัดเชียงใหม่ และผู้กำกับการบริหารราชการในสถานการณ์ฉุกเฉินจังหวัดเชียงใหม่ ออกคำสั่งคณะกรรมการโรคติดต่อจังหวัดเชียงใหม่ ที่ 32/2563 เรื่อง การดำเนินการป้องกันการแพร่ระบาดโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรคโควิด 19 กรณีจังหวัดสมุทรสาคร โดยระบุว่า
ด้วยเมื่อวันที่ 19 ธันวาคม 2563 ศูนย์บริหารสถานการณ์โควิด-19 (ศบค.) ได้แถลงพบผู้ติดเชื้อไวรัสโคโรน่า 2019 (โควิด-19) ที่จังหวัดสมุทรสาครเพิ่มขึ้น ภายหลังเมื่อวันที่ 17 ธันวาคม 2563 พบผู้ติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) ในจังหวัด ซึ่งอยู่ระหว่างการสอบสวนโรคและติดตามผู้สัมผัสใกล้ชิดผู้ติดเชื้อ ควบคู่ไปกับการดำเนินการตรวจคันหาเชื้อเชิงรุก พบว่ามีผู้ติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) เพิ่มขึ้น รวมทั้งสิ้น จำนวน 548 ราย โดยผู้ติดเชื้อส่วนใหญ่ไม่แสดงอาการและเป็นแรงงานต่างด้าว
ประชาชาติ
21 ธค 63
จ.ประจวบฯ ตรึงกำลังเข้ม 24 ชม.แนวตะเข็บชายแดนไทย-เมียนมา LINK
จ.ประจวบฯ เพิ่มความเข้มงวดมาตรการเฝ้าระวังป้องกันการแพร่ระบาดโรคโควิด 19 ตลอด 24 ชม.ทั้งพื้นที่ตามแนวชายแดนไทย-เมียนมา และพื้นที่ชั้นใน
นายพัลลภ สิงหเสนี ผู้ว่าราชการจังหวัดประจวบคีรีขันธ์ เปิดเผยว่า จากกรณีการตรวจพบผู้ติดเชื้อโควิด 19 จำนวนมากในพื้นที่ จ.สมุทรสาคร ในส่วนของ จ.ประจวบฯ ได้ปรับเพิ่มความเข้มงวดมาตรการเฝ้าระวังป้องกันการแพร่ระบาดของเชื้อโควิด 19 ในพื้นที่ โดยออกตรวจโรงงาน สถานประกอบการต่างๆ ในทุกอำเภอที่มีการใช้แรงงานต่างด้าวจากประเทศเพื่อนบ้านเพื่อสุ่มตรวจหาเชื้อโควิด 19 และระงับการแจ้งเข้าเรือประมงที่มาจาก จ.สมุทรสาคร ชั่วคราว จนกว่าจะมีคำสั่งเปลี่ยนแปลง
ส่วนพื้นที่ตามแนวตะเข็บชายแดนไทย-เมียนมา ยังคงตรึงกำลังเข้มตลอด 24 ชม.เพื่อป้องกันคนต่างด้าวลักลอบข้ามแดนผ่านช่องทางธรรมชาติ รวมทั้งได้มีการตั้งจุดตรวจคัดกรองโควิด 19 บนเส้นทางสายหลัก 3 จุด ได้แก่ จุดตรวจบ้านบ่อฝ้าย ถ.เพชรเกษม อ.หัวหิน จุดตรวจบริเวณหน้ามูลนิธิเพชรเกษมหัวหิน ถ.บายพาสชะอำ-ปราณบุรี และจุดตรวจไชยราช ถ.เพชรเกษม อ.บางสะพานน้อย และขอความร่วมมือผู้ที่มีประวัติเดินทางไปที่ตลาดกลางกุ้งมหาชัยหรือตลาดทะเลไทย จ.สมุทรสาคร ตั้งแต่วันที่ 1 ธ.ค.63 แจ้งข้อมูลกับเจ้าหน้าที่สาธารณสุขในพื้นที่
ประชาสัมพันธ์เขต 1
21 ธค 63
สวมหน้ากากผิดวิธี ไม่ป้องกันไวรัสโคโรนา 19
สวมหน้ากากผิดวิธี ไม่ป้องกันไวรัสโคโรนา 19
มาสวมให้ถูกกันดีกว่า
- ล้างมือก่อนสวมหน้ากากอนามัย
- ให้ด้านสีเข้มหรือมันวาวอยู่ด้านนอก เพราะช่วยกันน้ำ
- คลุมให้ปิดจมูก ปาก คางและคล้องหูให้พอดี
- กดลวดขอบบนให้สนิทกับสันจมูก
- หน้ากากที่่ใช้แล้ว ให้พับและมัดก่อนทิ้ง
- ทิ้งลงในภาชนะที่มีฝาปิด เพื่อป้องกันการแพร่เชื้อ
เซฟเก็บไว้ในมือถือ ส่งต่อให้เพื่อน แจกจ่ายและแชร์ออกไปให้กว้างขวาง
ผลตรวจเชื้อโควิด “อนุทิน” เป็นลบ แต่เข้มมาตรการขอกักตัว 14 วัน LINK
“สาธิต ปิตุเตชะ” แถลงกรณี อนุทิน ชาญวีรกูล กักตัวเอง 14 วัน หลังผู้ว่าฯสมุทรสาครติดโควิด-19 เบื้องต้นผลตรวจเชื้อรองนายกฯ เป็นลบ แต่เข้มมาตรการกักตัว 14 วันและรอตรวจเชื้อซ้ำอีกวันที่ 3 หลังจากนี้ ขณะที่อธิบดีกรมต่างๆ ที่ลงพื้นที่ตรวจงานสมุทรสาคร ติดตามอาการ รอผลตรวจยืนยันอีกครั้ง
เมื่อวันที่ 28 ธ.ค. 2563 ที่กระทรวงสาธารณสุข (สธ.) นายสาธิต ปิตุเตชะ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข(สธ.) แถลงกรณีนายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข(สธ.) กักตัวเอง ภายหลังกรณีผู้ว่าราชการจังหวัดสมุทรสาคร ติดโรคโควิด-19 ว่า ขณะนี้ท่านอนุทิน ได้ตรวจหาเชื้อเบื้องต้นเป็นลบ แต่ด้วยความรับผิดชอบและตามมาตรการกรมควบคุมโรค และเพื่อความปลอดภัยในการแพร่ระบาดเชื้อ ท่านอนุทิน ได้กักตัวเอง 14 วัน เริ่มต้นตั้งแต่วันนี้ และจะตรวจอีกครั้งหลังจากนี้ไปอีก 3 วัน เพื่อยืนยันเชื้อเป็นไปตามหลักทางการวิชาการว่า เชื้อจะฟักตัว 5-7 วัน โดยจะตรวจซ้ำอีกครั้ง แต่ช่วงเวลานี้จะกักตัวจนครบ 14 วัน และทำงานนิวนอร์มอล สั่งงานผ่านไลน์ ประชุมผ่านโซเชียลมีเดีย จึงขอยืนยันว่า ท่านตัดสินใจกักตัวเอง และจะมีไทม์ไลน์ของตัวท่านออกมา
ผู้สื่อข่าวถามว่าเกิดความกังวลหลังจากเมื่อวานมีภาพท่านอนุทิน และผู้บริหารสธ. รวมทั้งประชาชนที่ใกล้ชิด สื่อมวลชนอยู่ในงานแถลงกินอาหารทะเลได้ ต้องกักตัวทั้งหมดหรือไม่ นพ.โอภาส กล่าวว่า คนที่สัมผัสทั้งหมดต้องเฝ้าระวัง 14 วัน และต้องตรวจเชื้อเป็นระยะๆ แต่ก็ต้องประเมินว่าเสี่ยงสูง หรือเสี่ยงต่ำ ซึ่งมีนิยามที่แจ้งมานานแล้ว ไม่ใช่เพิ่งแจ้ง และยืนยันว่าทำตามหลักฐานวิชาการ โดยท่านรองนายกฯ ได้ดำเนินการตามมาตรการทั้งหมด
“ส่วนผมก็ตรวจเชื้อกำลังรอลุ้นผล อย่างไรก็ตาม ส่วนการจะกักตัว 14 วันหรือไม่ ก็ขึ้นอยู่กับเสี่ยงสูงเสี่ยงต่ำ แต่ตอนนี้คือ ท่านที่เกี่ยวข้องควรเว้นระยะห่าง สวมหน้ากากอนามัย ล้างมือบ่อยๆ และหากมีอาการผิดปกติให้รีบพบแพทย์ ส่วนอธิบดีจะต้องกักตัวก 14 วันหรือไม่ ก็ต้องมาประเมินว่า เสี่ยงสูงหรือเสี่ยงต่ำ ตามนิยามผู้สัมผัสเสี่ยงสูง แต่หากเสี่ยงต่ำก็ไม่ต้องกัก 14 วันแต่ต้องเว้นระยะห่าง ล้างมือบ่อยๆ สวมหน้ากากอนามัย” นพ.โอภาส กล่าว
2. บริการเจาะเลือดที่บ้าน LINK
บริการเจาะเลือดที่บ้าน และ บริการเจาะเลือดใกล้บ้านคุณ
"สะดวก ไม่ต้องรอคิวนาน"
เพียงจองคิวเจาะเลือดผ่านแอพพลิเคชั่น NHealthLabOnline
- iOS
- Android หรือ
- โทร 02-762-4000 กด 1 หรือ
- อีเมล customerservices@nhealth-asia.com
ค่าบริการเจาะเลือดที่บ้าน (ในเขตพื้นที่กทม. ปทุมธานี และสมุทรปราการ) 450 – 1,000 บาท / 1 ท่าน
*อัตราค่าบริการขึ้นอยู่กับระยะทาง
เจาะเลือดใกล้บ้าน 300 บาท / 1 ท่าน
ที่ศูนย์แล็บ N Health (ซ.เพชรบุรี 47 ถ.เพชรบุรีตัดใหม่)
แผนที่ สนใจรับบริการ สอบถามข้อมูลเพิ่มเติม โทร 02-762-4000 กด 1
หมายเหตุ :
- ค่าบริการตรวจเลือดเบิกจ่ายได้ตามสิทธิของผู้ป่วย ยกเว้นสิทธิจ่ายตรง (ต้องจ่ายเงินสดแล้วนำใบเสร็จไปเบิกทีหลัง)
- ควรเจาะเลือดล่วงหน้าไม่เกิน 1 สัปดาห์ ก่อนถึงวันนัดพบแพทย์ โดยการนัดหมายผ่านแอพ หรือโทร 02 762 4000 กด 1 (ตลอด 24 ชั่วโมง) หรือทางอีเมล์ customerservices@nhealth-asia.com
2.บริษัท Moderna
เป็นวัคซีนชนิด mRNA เช่นกัน ต้องฉีด 2 ครั้ง ห่างกัน 28 วัน และเก็บในอุณหภูมิ -20 องศา
อาการข้างเคียง พบเกิดอาการข้างเคียงรุนแรงในการทดลอง คือ คลื่นไส้อาเจียน รุนแรง
เลือดสำรองขาดทุกกรุ๊ป งานธนาคารเลือด รพ.ลำปาง LINK
เลือดสำรองขาดทุกกรุ๊ป งานธนาคารเลือด โรงพยาบาลลำปาง
เชิญชวน “ส่งความสุข? มอบโลหิต? เป็นของขวัญปีใหม่”
บริจาคโลหิต ผ่านวิกฤตโรคระบาด ส่งต่อโลหิตที่ปลอดภัยให้กับผู้ป่วย
- พิเศษ ผู้บริจาคโลหิตจะได้รับของที่ระลึก
- ณ ห้องรับบริจาคโลหิต โรงพยาบาลลำปาง เปิดทำการทุกวัน ไม่เว้นวันหยุด ตั้งแต่เวลา 8.00 - 20.00 น.
โทร 054 237 401
- กรุณาแสดงบัตรประชาชนก่อนบริจาคโลหิตทุกครั้ง
ขาดเลือดขั้นวิกฤต งานธนาคารเลือด ร.พ.พหลพลพยุหเสนา (5/1/64) LINK
ขอเชิญชวนพี่น้องประชาชนบริจาคโลหิตเพื่อช่วยเหลือชีวิตผู้ป่วยที่ต้องการโลหิตในภาวะต่างๆ เช่น อุบัติเหตุ ผ่าตัด และโรคที่จำเป็นต้องรักษาด้วยโลหิต
ห้องรับบริจาคโลหิต งานธนาคารเลือด โรงพยาบาลพหลพลพยุหเสนา
เปิดทำการ วันจันทร์-วันศุกร์ และวันอาทิตย์
ปิดวันเสาร์และวันหยุดนักขัตฤกษ์
เวลา 8.00-15.30 น. (พักเที่ยง)
โทร 034-587800 ต่อ 6090
ออกหน่วยเดือน มค 64
7 มค 64 ที่ว่าการ อ.ทามะกา 9-12 น.
12 มค 64 ที่ว่าการ อ.ด่านมะขามเตี้ย 9-12 น.
28 มค 64 อบต.ทุ่งสมอ 9-12 น.
ธนาคารไทยพาณิชย์
ธนาคารไทยพาณิชย์
แจ้งเปลี่ยนเวลาปิดทำการสาขาในห้างสรรพสินค้า
เนื่องจากสถานการณ์ COVID-19
ธนาคารไทยพาณิชย์ขอแจ้งเปลี่ยนเวลาปิดทำการสาขา
ในห้างสรรพสินค้าทั่วประเทศ
เป็นเวลา 18.00 น.
ตั้งแต่วันที่ 4 มกราคม 2564 เป็นต้นไป
A เป็นผู้ติดเชื้อที่ตรวจเจอ และได้รับการรักษา
ลพบุรี บริจาคเลือด แจกเสื้อสีชมพูสวยสดใส LINK
ขณะนี้เสื้อยืดที่ระลึกยังรอผู้ใจบุญทุกท่านอยุ่นะคะ
ขอขอบคุณผู้บริจาคโลหิตทุกท่าน ร่วมส่งต่อโลหิตที่ปลอดภัยให้กับผู้ป่วย
พิเศษ ผู้บริจาคโลหิตตั้งแต่ 2 ครั้งขึ้นไป ณ ภาคบริการโลหิตแห่งชาติที่ 2 จังหวัดลพบุรี บริจาคโลหิตรับเสื้อยืดที่ระลึกสำหรับ 100 ท่านแรก เท่านั้น
เงื่อนไข นับจำนวนครั้งสะสมตั้งแต่ 1 มกราคม 2563 จนถึงวันที่บริจาค
ศูนย์บริการสาธารณสุข 59 ทุ่งครุ
รายละเอียดการให้บริการ
ชตารางการให้บริการตรวจรักษาโรคทั่วไปและทันตกรรมในเวลาราชการและคลินิกส่งเสริมสุขภาพ
คลินิกตรวจรักษาโรคทั่วไปและทันตกรรมช่วงเช้า (8.00 - 12.00 น.)
จันทร์ – ศุกร์ ให้บริการ คลินิกตรวจโรคทั่วไป คลินิกทันตกรรม คลินิกกายภาพบำบัด
จันทร์ – อังคาร ให้บริการ คลินิกกระตุ้นพัฒนาการเด็กแรกเกิด - 5 ปี
คลินิกส่งเสริมสุขภาพช่วงบ่าย (13.00 - 16.00 น.)
จันทร์ คลินิกฝากครรภ์
อังคาร คลินิกสุขภาพเด็กดี
พุธ คลินิกวางแผนครอบครัว
พฤหัสบดี คลินิกสุขภาพเด็กดี
ศุกร์ คลินิกให้บริการฉีดวัคซีนป้องพิษสุนัขบ้าในสัตว์เลี้ยง
รายชื่อแพทย์ผู้ให้บริการตรวจรักษาโรคทั่วไป
คลินิกในเวลาราชการ
วันจันทร์ – วันศุกร์ ๘.๐๐ - ๑๒.๐๐ แพทย์หญิงกฤชยา มาลา
วันจันทร์ – วันพุธ ๘.๐๐ - ๑๒.๐๐ แพทย์หญิงณัฐกา กาญจนพนัง
วันพฤหัสบดี – วันศุกร์ ๘.๐๐ - ๑๒.๐๐ แพทย์หญิงรัดเกล้า สายเสน
คลินิกนอกเวลาราชการ
วันจันทร์ / วันพฤหัสบดี / วันศุกร์ ๑๖.๐๐ - ๒๐.๐๐ แพทย์หญิงมณีรัตน์ สุระวงษ์สิน
วันอังคาร / วันพุธ ๑๖.๐๐ - ๒๐.๐๐ แพทย์หญิงณัฐกา กาญจนพนัง
1. เช็คสถานการณ์โควิดประเทศปลายทาง
1. เช็คสถานการณ์โควิดประเทศปลายทาง
ศึกษาสถานการณ์ ความรุนแรง ความเสี่ยง อย่างละเอียดและต่อเนื่อง เนื่องจากสถานการณ์เกี่ยวกับโรคในแต่ละประเทศ สามารถเปลี่ยนแปลงอย่างรวดเร็ว แหล่งข้อมูลสำคัญคือ
เว็บไซต์หรือเฟซบุ๊คของสถานทูต สถานกงศุลไทย ในแต่ละประเทศ เพราะมีความรวดเร็ว ทันเหตุการณ์ อีกเป็นข้อมูลที่เชื่อถือสูงสุด ตลอดจนคำแนะนำต่างๆ จะเป็นแนวปฏิบัติสากลที่เป็นที่ยอมรับ
ประเด็นที่ต้องศึกษาคือ
- ประเทศปลายทางเปิดให้คนต่างชาติ เดินทางเข้าประเทศหรือไม่
- ถ้าเปิดแล้วเปิดให้คนทุกชาติหรือไม่ หรือผ่อนปรนให้คนจากบางประเทศเท่านั้น
- ประเทศปลายทางผ่อนปรนให้คนกลุ่มไหนเข้าประเทศได้บ้าง ในบางประเทศเขาอาจจะผ่อนปรนให้คนต่างชาติเข้าประเทศเขาได้ แต่ต้องเป็นกรณีเฉพาะ เช่นต้องมี Re-entry permit หรือมีถิ่นพำนักในประเทศเขาอยู่แล้ว
- จุดประสงค์การเดินทางไปประเทศปลายทาง คืออะไร บางประเทศอาจมีการผ่อนปรนให้เข้าประเทศเขาได้เฉพาะบางกิจกรรม เช่น ต้องไปทำธุรกิจ/ธุระสำคัญ หรือต้องได้รับคำเชิญจากหน่วยงานประเทศนั้นๆ หรือเข้าไปได้เฉพาะความจำเป็นของครอบครัว เท่านั้น ตรงนี้ต้องดูดีๆครับ ส่วนใหญ่ประเทศต่างๆยังไม่ได้อนุญาตให้เข้าไปท่องเที่ยว
High surveillance areas
High surveillance areas (14 provinces, down from 17): (region by region) Central: Ayutthaya, Nakhon Nayok, Saraburi, and Suphan Buri; East: Chachoengsao, Chon Buri, and Rayong; South: Chumphon, Narathiwat, Ranong, Songkhla, and Yala, and West: Kanchanaburi, and Phetchaburi.
High surveillance areas
Reopening with strict disease control measures allowed for:
- Entertainment venues of all types including pubs, bars and karaoke shops, but dining-in and the sale and consumption of alcoholic drinks must stop at 24.00 Hrs.
- Restaurants and eateries, but dining-in and sales and consumption of alcoholic beverages must end at 24.00 Hrs.
- Shopping malls, department stores, community malls, supermarkets and convenience marts can resume normal operating hours, but crowd activities are prohibited.
- Screening in place for Thai travellers, especially those from the maximum and high controlled areas.
- Bath and massage parlours, but with a limited number of customers.
- Spas and Thai traditional massage shops, but with a limited number of customers.
- Indoor and outdoor gyms and fitness centres and boxing stadiums. Competitions can be organised with a number of audiences in accordance with the rules and regulations.
Closure orders remain in place for:
X Gambling venues of all types, including fighting cock and bull venues.
ความสำเร็จแห่งแรกเริ่มต้นที่โรงพยาบาลบ้านตาก
ความสำเร็จปฐมฤกษ์เริ่มต้นที่
โรงพยาบาลบ้านตาก จ.ตาก ส่งมอบและเปิดระบบจ่ายไฟ ในเดือน มีนาคม 2563 ต่อมาแห่งที่สอง คือโรงพยาบาลแก่งคอย ที่มีผู้มีจิตศรัทธาในพื้นที่ติดต่อขอบริจาคตั้งต้น 1 ล้านบาท และมาต่อที่โรงพยาบาลทุ่งศรีอุดม อ.ทุ่งศรีอุดม จ.อุบลราชธานี เป็นการรวบรวมเงินบริจาคโดยพระครูวิมลปัญญาคุณเป็นเจ้าภาพติดตั้งโซล่าร์เซลล์ขนาด 30 กิโลวัตต์
หน้าที่ของ ECS
มนุษย์มีระบบตัวรับสารแคนนาบินอยด์โดยเฉพาะ เช่นเดียวกับกรณีของระบบโอปิ ออยด์ที่ตอบสนองต่อสารโอปิออยด์ต่างๆ (มอร์ฟีน โคเดอีน) ส่วนระบบเอ็นโดแคนนาบินอยด์ (ECS) ประกอบไปด้วยตัวรับสารแคนนาบินอยด์ (CB) และส่งผลต่อกิจกรรมของระบบร่างกายต่าง ๆ มากมาย สารไฟโตแคนนาบินอยด์ ในต้นกัญชาทำงานเช่นเดียวกับเอ็นโดแคนนาบินอยด์ที่ผลิตขึ้นเองในร่างกาย
สมองของมนุษย์และอวัยวะอื่นๆ มีตัวรับสารแคนนาบินอยด์ (CB) ที่เกิดขึ้นเองตามธรรมชาติ และสารเคมีที่จับกับตัวรับเหล่านั้น เราเรียกระบบนี้ว่า ระบบเอ็นโดแคนนาบินอยด์ของมนุษย์ (ECS) หน้าที่ของ ECS คือการรักษาความสมดุลของร่างกายให้ทำงานเป็นปกติ โดยการควบคุมการทำงานของระบบต่างๆ ระบบนี้มีหน้าที่สำคัญในระบบประสาทของเรา และควบคุมหลาย ๆ กระบวนการทางกายภาพซึ่งรวมถึงการปรับเปลี่ยนอาการตอบสนองต่อความปวด ความอยากอาหาร การย่อยอาหาร การนอน อารมณ์ การอักเสบ และการจดจำ ECS ยังช่วยลดระดับชัก (หรือโรคลมชัก) รวมถึงส่งผลต่อการทำงานร่วมกัน และกระบวนการอื่น ๆ เช่น ระบบภูมิคุ้มกัน การทำงานของหัวใจ ระบบประสาทสัมผัส (การสัมผัส ความสมดุล การรับรู้พื้นที่) การเจริญพันธุ์ สรีระของกระดูก และระบบตอบสนองต่อความเครียดส่วนกลาง (HPAA) การพัฒนาระบบประสาท และความดันลูกตา
ในร่างกายมนุษย์สามารถสร้างสารแคนนาบินอยด์เองได้ คือสารเอ็นโดแคนนาบินอยด์ สารชนิดนี้สามารถออกฤทธิ์หรือกระตุ้นตัวรับแคนนาบินอยด์ ซึ่งมีกลไกการทำงานเช่นเดียวกับสารไฟโตแคนนาบินอยด์ ซึ่งจับกับตัวรับเหล่านั้น
สารแคนนาบินอยด์ที่ได้จากพืชมีชื่อเรียกว่าสารไฟโตแคนนาบินอยด์ ซึ่งเป็นส่วนประกอบเฉพาะที่พบในต้นกัญชา โดยมีสารเตตร้าไฮโดรแคนนาบินอล (THC) และแคนนาบิไดออล (CBD) เป็นองค์ประกอบหลัก เรายังพบสารแคนนาบินอยด์ชนิดอื่น ๆ แต่ยังไม่มีรายละเอียดที่ชัดเจนในปัจจุบัน
[Cannabit Addict]
กลไกในการออกฤทธิ์ของสารประกอบในกัญชาในร่างกาย LINK
การค้นพบ Endocannabinoid systems ซึ่งเป็นระบบกุญแจสำคัญที่ปลดล้อกนำสารเข้าสู่ร่างกาย ช่วยเพิ่มความก้าวหน้าในการใช้สารกลุ่มนี้เพื่อป้องกันและรักษาความปกติต่างๆ ทางสมองได้ดียิ่งขึ้น รวมทั้งช่วยให้นักวิทยาศาสตร์สามารถเข้าใจกลไกการออกฤทธิ์ของสารกัญชาในกลุ่มนี้ได้มากขึ้นอีกด้วย
Endocannabinoid system (ECS) เป็นระบบทางสรีรวิทยาที่พบทั่วไปในร่างกาย ทั้งในระบบประสาทส่วนกลางและระบบส่วนปลายโดย ECS มีบทบาทสำคัญต่อการควบคุมการทำงานทั้งหมด มีบทบาทสำคัญต่อการควบคุมสมดุลของพลังงานในร่างกาย ผ่านทางการควบคุมของระบบประสาทส่วนกลางต่อการกินอาหาร และผ่านทางการควบคุมของระบบส่วนปลายต่อการสร้างไขมัน
เนื่องจากสารประกอบ cannabinoids ที่อยู่ในกัญชาสามารถใช้ในการรักษาโรคได้ โดยสารที่ออกฤทธิ์หลักที่นำมาใช้ในทางการแพทย์ คือ delta-9-Tetrahydrocannabinol (THC) ที่ออกฤทธิ์ต่อจิตประสาท และ cannabidiol (CBD) ที่ไม่มีฤทธิ์เสพติด สารประกอบ cannabinoids ออกฤทธิ์ผ่าน cannabinoid receptor หลัก 2 ชนิด คือ CB1 receptor ซึ่งพบมากในสมองและร่างกาย มีความสัมพันธ์กับการตัดสินใจ ความจำ ความเข้าใจ อารมณ์ การรับรู้ความปวดและการเคลื่อนไหว ส่วน CB2 receptor พบที่ระบบภูมิคุ้มกัน และระบบประสาทส่วนปลาย ม้าม ทอนซิล ต่อมไทมัส กระดูก ผิวหนัง และเลือด monocyte, macrophages, B-cells และ T-cells
ในร่างกายสามารถสร้าง endocannabinoid ซึ่งเป็น cannabinoids โดยธรรมชาติ (ที่มีการศึกษาส่วนใหญ่ คือ anandamide และ arachidonoyl-glycerol (2-AG)) endocannabinoid ถูกสร้างขึ้น เพื่อกำกับการทำงานต่างๆ ของร่างกายโดยจะไปจับกับ CB1 และ CB2 receptor นอกจากนี้การศึกษาต่างๆ พบว่า endocannabinoids ส่งผลเกี่ยวข้องกับการทำงานของร่างกาย อาทิ ความจำ อารมณ์ ความอยากอาหาร การนอนหลับ ความปวด ความเครียด การติดยา และการอักเสบ รวมถึงอาจมีบทบาทในการป้องกันที่เกี่ยวข้องกับการทางานของสมอง ระบบ metabolism ของร่างกาย อาทิ lipolysis, glucose metabolism และ energy balance
โดย CB1 นั้นจะพบอยู่ในสมองและไขสันหลังส่วน Cortex, nucleus accumbens, basal ganglia, hypothalamus, cerebellum, hippocampus, amygdala and spinal cord ปอด เส้นเลือด กล้ามเนื้อ ทางเดินอาหาร ไขมัน และอวัยวะเพศ
การจับของ endocannabinoid ที่ CB1 receptor ในระบบประสาทส่วนกลางจะมีบทบาทต่อการควบคุมการกินอาหาร ความอิ่ม ความเจ็บปวด ความจำ การติดยา และการเคลื่อนไหว นอกจากนี้ การจับของ endocannabinoid ที่ CB1 receptor ที่อวัยวะรอบนอก เช่น ตับ กล้ามเนื้อ ทางเดินอาหาร เนื้อเยื่อไขมัน และ Islets of Langerhans ของตับอ่อน มีบทบาทต่อการควบคุมกระบวนการเมแทบอลิซึมของไขมันและกลูโคส เพื่อรักษาสมดุลของพลังงานในร่างกาย
CB2 พบในอยู่ในเซลล์เกลีย (Glial cell) ของสมองซึ่งทํางานร่วมกับเซลล์ประสาท ส่วนอวัยวะที่มีทั้ง CB1 และ CB2 ประกอบด้วย ก้านสมอง ระบบภูมิคุ้มกัน ตับ ไขกระดูก และตับอ่อน การจับของ endocannabinoid ที่ CB2 receptor ในระบบภูมิคุ้มกัน ไม่มีบทบาทควบคุมการกินอาหาร แต่มีผลควบคุมการหลั่ง cytokine ในระบบภูมิคุ้มกัน
ระบบ Endocannabinoid ทำการควบคุมระบบต่างๆเหล่านี้ เมื่อร่างกายเกิดอาการผิดปกติ ระบบ endocannabinoid ก็จะพยายามปรับร่างกายสู่การทำงานปกติ หรือร่างกายเสื่อมลงการทำงานเดิมไม่สมบูรณ์ ตัวยากัญชาที่มี cannabinoid ก็จะเข้ามาช่วยทำงานเสริมได้อย่างสมบูรณ์ เนื่องจากเข้าในระบบของเราได้ทันที
- ความจำ
- ความอยากอาหาร
- การนอนหลับ
- ความเครียด
- การปวด
- ระบบความจำ และการเรียนรู้
- การรักษาสมดุลย์ของร่างกาย
- ความวิตกกังวล
- ระบบภูมิคุ้มกัน
- การสืบพันธ์
- การทำงานของกล้ามเนื้อ
- ระบบประสาท และผิวหนัง
- การควบคุมอุณหภูมิ การควบคุมพลังงาน
- อื่นๆ
กลไกในการออกฤทธิ์ของสารประกอบในกัญชาในร่างกายมีความแตกต่างกัน โดย CBD มีสัมพรรคภาพ (affinity) กับ CB1 และ CB2 ต่ำมาก แต่ตัวจับสัญญาณกัญชาสองตัวนี้จะจับกับ THC ได้เป็นอย่างดี และเมื่อออกฤทธิ์ในสมองส่วน rewarding pathway ทําให้เกิดการมึนเมาและเสพติด ส่วน CBD จะไม่จับตัวจับสัญญาณ นอกจากนั้นมันยังไปลดการส่งสัญญาณของ CB1 อีกด้วย ผลลัพธ์ก็คือสมองจะสั่งการให้เพิ่มการปล่อย GABA ซึ่งเป็นสารกดระบบไฟฟ้าของสมองและน่าจะเป็นส่วนหนึ่งของกลไลการช่วยลดปวด ควบคุมลมชัก และลดการกระวนกระวาย ข้อดีอีกอย่างหนึ่งของ CBD ก็คือ ไม่มีผลต่อความคิด ความเฉียบแหลมของสมองและความผิดปกติของการเคลื่อนไหวควบคุมร่างกาย
[]
เครื่องดื่มน้ำกัญชัญชา Cannabis with Lime Butterfly pea drink
เครื่องดื่มน้ำกัญชัญชา Cannabis with Lime Butterfly pea drink
ส่วนประกอบ น้ำอัญชัญมะนาว น้ำใบกัญชา
ช่วยบำรุงสมองและสายตา สดชื่น
พร้อมคำแนะนำผู้ที่ควรหลีกเลี่ยง
ศ.ดร.นพ.ประสิทธิ์ วัฒนาภา
คณบดีคณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล
ขอให้ข้อมูลดังนี้ ตามที่แอสตร้าเซนเนก้า ได้ส่งมอบวัคซีน Batch ABV5300 จำนวน 1 ล้านโดส 17 ประเทศในสหภาพยุโรป ปรากฏว่าในเดนมาร์ค มีผู้ป่วย 1 ราย เสียชีวิต และหลายรายเกิดลิ่มเลือดเกิดขึ้นตามหลอดเลือดต่างๆ ทำให้รัฐบาลเดนมาร์คประกาศชะลอการฉีด 2 สัปดาห์ เพื่อสืบสวนสาเหตุ ซึ่งการสั่งชะลอการดำเนินการนี้ เป็นแนวทางด้านความปลอดภัยโดยทั่วไป ในกรณีเมื่อเกิดเหตุการณ์ขึ้น และการชะลอนี้ ไม่ใช่ข้อสรุปว่ามีความเกี่ยวข้องกับการฉีดวัคซีน
ขณะเดียวกันมีผลตามมาคือ ไอซ์แลนด์ ไอร์แลนด์ และนอร์เวย์ ได้ประกาศหยุดเช่นกัน ทั้งนี้ ไอซ์แลนด์ ประกาศว่าไม่ได้เกิดเหตุการณ์อย่างลิ่มเลือด แต่ประกาศชะลอเพื่อความปลอดภัย และติดตามผล โดยรอผลการตรวจสอบจาก
EMA (European Medicines Agency) ซึ่ง EMA ได้ออกประกาศเมื่อ 11 มีค 64 ว่า EMA มิได้เป็นผู้ประกาศให้มีการชะลอการใช้ และยืนยันว่าวัคซีนแอสตร้าเซนเนก้านั้นปลอดภัย แต่เมื่อปรากฏเหตุการณ์นี้ จึงจะทำการตรวจสอบอีกครั้ง
ขณะเดียวกันหลายประเทศได้ประกาศชะลอการใช้วัคซีน อาทิ ออสเตรีย ลิธัวเนีย เอสโตเนีย ลักเซมเบิร์ก ลัทเวีย ซึ่งได้รับวัคซีน Batch เดียวกัน (ABV5300)
สรุปสั้นๆ คือ เมื่อเหตุการณ์เกิดขึ้นกับผู้ที่ได้รับวัคซีนและเกิดอะไรขึ้น จะมีการสืบค้น EMA ได้ประเมินอุบัติการณ์การเกิดลิ่มเลือด เทียบกับคนที่ไม่ได้ฉีดวัคซีนในกลุ่มประเทศทางยุโรป ได้ตัวเลขไม่แตกต่างกัน นี่เป็นหนึ่งในเหตุผลที่ EMA ระบุว่าไม่สัมพันธ์กับการฉีดวัคซีนตัวนี้
ทั้งนี้เพื่อความปลอดภัย โดยหลักแล้ว ทันทีที่เกิดเหตุการณ์แบบนี้ ซึ่งไม่เฉพาะการฉีดวัคซีน เมื่อมีการรายงานแบบนี้ จะหยุด/ชะลอการใช้ก่อน แล้วสืบค้น เมื่อปลอดภัยจึงกลับมาใช้ต่อ
ร้านเปิดนานหรือยัง
เปิดมา 2 ปีแล้วค่า แต่เพิ่งเริ่มมีเมนูกัญชาเข้ามาได้ 3 อาทิตย์กำหนดการให้วัคซีนตามแผนงานสร้างเสริมภูมิคุ้มกันโรค ของกระทรวงสาธารณสุข ปี 2560
สรรพคุณของสาร CBD กับสาร THC
OOCA - platform ปรึกษาจิตแพทย์ออนไลน์
อูก้าคือ platform ปรึกษาจิตแพทย์ออนไลน์ ที่ช่วยให้คุณสามารถพูดคุยปัญหาคาใจกับจิตแพทย์และนักจิตวิทยาได้ผ่าน video call โดยเข้าใช้งานได้อย่างเป็นส่วนตัวและปลอดภัย ทุกที่ ทุกเวลา ผ่านคอมพิวเตอร์หรือโทรศัพท์มือถือของคุณ
ทำไมต้องอูก้า
เรายกระดับการปรึกษาปัญหาใจทางไกลเพื่อความพึงพอใจของคุณ
- ไม่จำกัดสถานที่ คุณสามารถพูดคุยกับจิตแพทย์ ได้จากที่บ้านหรือที่ไหนก็ได้ อย่างสะดวกสบาย
- มั่นใจได้ว่าเป็นความลับ ไม่ต้องรู้สึกกลัวคนอื่นมองไม่ดี เพราะด้วยระบบการปรึกษาผ่าน video call จะทำให้คุณสบายใจ
- ไม่เสียเวลารอ แทนที่จะต้องนั่งรอพบแพทย์ที่โรงพยาบาล คุณสามารถเลือกพบแพทย์ในเวลาไหนก็ได้ที่คุณสะดวก
บริการของเรา
นอกจากอูก้าจะช่วยให้คุณเชื่อมต่อกับผู้ให้คำปรึกษาแล้ว คุณยังสามารถลองทำแบบทดสอบ หรือมอบอูก้าเป็นของขวัญให้คนที่คุณรักได้
- บริการให้คำปรึกษา เรามุ่งมั่นให้บริการอย่างมีคุณภาพและรับประกันความพึงพอใจ เพื่อให้การปรึกษาทางไกลทำให้คุณภาพชีวิตของคุณดีขึ้น
- ที่ปรึกษามืออาชีพ เลือกทีมจิตแพทย์ และนักจิตวิทยามากประสบการณ์ พร้อมให้คำปรึกษา ร่วมทางไปกับคุณเสมอ
- แบบทดสอบความเครียด หากไม่แน่ใจว่าคุณจำเป็นต้องปรึกษาจิตแพทย์หรือไม่ ลองทำแบบประเมินด้วยตนเองก่อนเพื่อช่วยตัดสินใจ
- gift for you ให้อูก้าเป็นของขวัญแก่คนที่คุณรัก ให้เราช่วยส่งต่อความหวังดีแด่คนสำคัญของคุณ ด้วยบัตรของขวัญอูก้า
ค่าบริการ
- สำหรับบุคคลทั่วไป เพื่อสุขภาวะที่ดีของคุณ
- สำหรับองค์กรและหน่วยงาน เพื่อความสุขของพนักงาน
[ยกเลิก] บุรีรัมย์ อะเมซิ่ง สงกรานต์ สาดแสง สาดสี สาดของดีบุรีรัมย์ แต่ไม่สาดน้ำ
ประกาศยกเลิก
6-15 เม.ย. 2564 อะเมซิ่ง สงกรานต์บุรีรัมย์ พรีเซ็นเต็ด บาย เครื่องดื่มตราช้าง” (AMAZING SONGKRAN BURIRAM PRESENTED BY CHANG) ภายใต้คอนเซ็ปต์ “สาดแสง สาดสี สาดของดีบุรีรัมย์ แต่ไม่สาดน้ำ” ระหว่างวันที่ 6-15 เม.ย. 2564 ที่จังหวัดบุรีรัมย์ พื้นที่การจัดงานจะอยู่ที่สนามฟุตบอลช้างอารีนา กิจกรรมไฮไลต์ต่างๆ เช่น ขบวนจักรยาน “บุรีรัมย์ ไบค์ไนท์” ขบวนจักรยานพาเหรดที่ประดับไฟแสงสีสวยงาม กิจกรรม “เทศกาลประกวดโคมไฟ” โชว์ไอเดียการคิดประดิษฐ์โคมไฟแต่ละอำเภอ ที่สะท้อนความเป็นวิถีของชาวบุรีรัมย์ และ “บุรีรัมย์ สตรีทฟูด” นำอาหารขึ้นชื่อของจังหวัดมารวมไว้ที่นี่มากมายหลากหลายเมนู ชนิดที่ไม่เคยพบเห็นที่ไหนมาก่อน พร้อมทั้งมีการจำหน่ายสินค้าพื้นถิ่น ของดีบุรีรัมย์
- 10 เม.ย. คอนเสิร์ต “ช้าง มิวสิค คอนเนกชัน” ในสนามช้างอารีนา
- 12 เม.ย. บุรีรัมย์มาราธอน พรีเซ็นเต็ด บาย เครื่องดื่มตราช้าง “ระยะฟันรัน” ในรูปแบบไนต์รัน ประดับไฟสุดยิ่งใหญ่ตลอดระยะทาง 4.4 กม. + TWINKLE TUNNEL อุโมงค์ไฟระย้า
ผลิตภัณฑ์จากกัญชา
กัญชาเป็นสมุนไพรที่ช่วยปรับสมดุลของธาตุลม เช่น อาการปวด นอนไม่หลับและท้องอืด ท้องเฟ้อ โดยสามารถนำมาใช้ปรับสมดุลได้ทั้งในรูปแบบผลิตภัณฑ์สำหรับสปาและอาหาร
ผลิตภัณฑ์ได้แก่ ลูกประคบ ผงขัดและพอกผิว สมุนไพรสำหรับแช่ น้ำมันอโรมาสำหรับนวดตัว ชาอุ่นใจ ผงปรุงรสสี่เกลอ เกลือแช่เท้า
ชลบุรี - เข้าได้ ไม่กักตัว LINK
9 เมษายน 2564
มติเบื้องต้นการประชุม คกก.โรคติดต่อจังหวัดชลบุรี ครั้งที่ 7/2564
- ให้ปิดสถานบริการ ผับ บาร์ คาราโอเกะ สถานที่อาบน้ำ อบไอน้ำ อาบอบนวด สถานที่จัดเลี้ยง โรงมหรสพ โรงละครและโรงภาพยนต์ ร้านอาหาร เครื่องดื่ม รถเข็น หาบเร่ แผงลอย ภัตตาคาร สวนอาหาร ศูนย์อาหาร โรงอาหาร (เว้นในสถานศึกษา และสถานพยาบาล) เปิดขายเพื่อบริโภคที่ร้านได้ตั้งแต่ 5-22 น. หลังจากนั้นให้เปิดขายเฉพาะนำกลับ ตั้งแต่วันที่ 10 เมษายน 2564 จนกว่าจะมีคำสั่งเปลี่ยนแปลง
- สามารถเดินทางเข้า-ออก พื้นที่จังหวัดชลบุรีได้
- กรณีเดินทางเข้ามาในจังหวัดชลบุรีไม่ต้องกักตัว ส่วนเดินทางออกไปต่างจังหวัดให้ตรวจสอบมาตรการของจังหวัดปลายทางที่จะเดินทางและปฏิบัติตามมาตรการของจังหวัดนั้นๆ
- ร้านอาหารเครื่องดื่ม เปิดได้ไม่เกิน 22.00 น.
- ห้ามรวมกลุ่มดื่มเครื่องดื่มแอลกอฮอร์
- ให้ทุกอำเภอเตรียม รพ.สนาม และ Local Quarantine รองรับจำนวนผู้ติดเชื้อที่เพิ่มขึ้น
ประสานการตรวจหาเชื้อโควิด-19 ได้ที่
สสอ.เมืองชลบุรี (038282148)
สสอ.บางละมุง (038221925)
สสอ.ศรีราชา (038322503)
สสอ.สัตหีบ (038245330)
สสอ.บ้านบึง (038443209)
สสอ.บ่อทอง (038211277)
สสอ.พนัสนิคม (0972322372)
สสอ.พานทอง (038451712)
สสอ.หนองใหญ่ (038219232)
สสอ.เกาะจันทร์ (038166264)
สสอ.เกาะสีชัง (0646648088)
รพ ชลบุรี โทร 038 931 000
รพ บางละมุง โทร 038 411 551
ชัวร์ก่อนฉีด ฟรี! ประกันผลกระทบในการฉีดวัคซีนโควิด-19 - สิทธิพิเศษสำหรับลูกค้าเอไอเอ ประเทศไทย LINK
เอไอเอ ประเทศไทย มอบผลประโยชน์พิเศษเพิ่มเติมจากกรณีได้รับผลกระทบในการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19)
ภายใต้ชื่อโครงการ “ชัวร์ก่อนฉีด ฟรี! ประกันผลกระทบในการฉีดวัคซีนโควิด-19” สิทธิพิเศษสำหรับลูกค้าเอไอเอที่ลงทะเบียนผ่าน แอปพลิเคชัน AIA iService
- ลงทะเบียนรับสิทธิ ผ่านแอปพลิเคชัน AIA iService เวอร์ชันใหม่เท่านั้น
- โดยเริ่ม ลงทะเบียนรับสิทธิ์ได้ตั้งแต่วันที่ 19 เมษายน ถึง 30 มิถุนายน 2564
- ลูกค้ามีข้อสงสัยเพิ่มเติม สามารถติดต่อ AIA Call Center 1581
สำหรับลูกค้าที่ได้รับสิทธิพิเศษดังกล่าว จะเป็นลูกค้าที่กรมธรรม์ยังมีผลบังคับ ยกเว้นลูกค้าประกันชีวิตเพื่อคุ้มครองสินเชื่อ (Credit Life) โดยลูกค้าจะมีสิทธิได้รับผลประโยชน์หากมีอาการแพ้หรือผลกระทบข้างเคียงจากการได้รับการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) ในประเทศไทย1 โดยมีรายละเอียดเงื่อนไขดังนี้
1. บริษัทจะจ่ายผลประโยชน์ค่าชดเชยรายวัน
ตามเงื่อนไขดังต่อไปนี้
1.1 ผู้เอาประกันภัยได้รับการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) ในประเทศไทย ในช่วงวันที่ 19 เมษายน 2564 ถึงวันที่ 31 ธันวาคม 2564 และ
1.2 ผู้เอาประกันภัยเข้ารับการรักษาในโรงพยาบาลในฐานะผู้ป่วยในตามความจำเป็นทางการแพทย์ เนื่องจากอาการแพ้หรือผลกระทบข้างเคียงจากการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) ภายใน 60 วันนับจากวันที่ได้รับการฉีดวัคซีนในแต่ละครั้ง และ
1.3 บริษัทจะคุ้มครองผลประโยชน์ค่าชดเชยรายวัน จากการเข้ารับการรักษาตัวเป็นผู้ป่วยใน สูงสุดไม่เกิน 1 ครั้งต่อการฉีดวัคซีนแต่ละครั้ง และไม่เกิน 2 ครั้งต่อรายชีวิต โดยบริษัทจะจ่ายผลประโยชน์ค่าชดเชยรายวันเป็นจำนวนเงิน 1,000 บาทต่อวัน2 (สูงสุดไม่เกิน 14 วัน) ต่อการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) ในแต่ละครั้งให้แก่ผู้เอาประกันภัย
2. บริษัทจะจ่ายผลประโยชน์กรณีเสียชีวิต
ตามเงื่อนไขดังต่อไปนี้
หากผู้เอาประกันภัยเสียชีวิตภายใน 60 วันนับจากวันที่ได้รับการฉีดวัคซีน และต้องเสียชีวิตไม่เกินวันที่ 31 ธันวาคม 2564 เนื่องจากอาการแพ้หรือผลกระทบข้างเคียงจากการได้รับการฉีดวัคซีนป้องกันเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) ในประเทศไทย ในช่วงวันที่ 19 เมษายน 2564 ถึงวันที่ 31 ธันวาคม 2564 โดยบริษัทจะจ่ายผลประโยชน์ในกรณีนี้ เป็นจำนวนเงิน 200,000 บาท3 ให้แก่ทายาทโดยธรรมของผู้เอาประกันภัย
หมายเหตุ:
1 ลูกค้าที่ได้รับสิทธิพิเศษในโครงการ ต้องลงทะเบียนผ่านแอปพลิเคชัน AIA iService ก่อนการฉีดวัคซีนโควิด-19 เท่านั้น
2 บริษัทจะไม่จ่ายผลประโยชน์ในข้อนี้ในกรณีที่ผู้เอาประกันภัยเริ่มเข้ารับการรักษาในโรงพยาบาลเป็นผู้ป่วยในก่อนวันที่ 19 เมษายน 2564 หรือหลังจากวันที่ 31 ธันวาคม 2564
3 ในกรณีที่ผู้เอาประกันภัยเสียชีวิตภายหลังจากที่มีการจ่ายผลประโยชน์ค่าชดเชยรายวันตามข้อ 1. แล้ว บริษัทจะยังคงจ่ายผลประโยชน์กรณีเสียชีวิตตามเงื่อนไขข้างต้น
4 แม้ว่าผู้เอาประกันภัยจะมีบันทึกสลักหลังผลประโยชน์พิเศษเพิ่มเติมจากกรณีได้รับผลกระทบในการฉีดวัคซีนป้องกันเชิ้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) มากกว่าหนึ่งฉบับ บริษัทจะจ่ายผลประโยชน์นี้ให้เพียงหนึ่งฉบับเท่านั้น
คำแนะนำเมื่อใกล้ชิด ผู้ป่วยติดเชื้อโควิด-19 LINK
คำแนะนำเมื่อใกล้ชิด ผู้ป่วยติดเชื้อโควิด-19
ผู้ป่วยติดเชื้อโควิด-19
เข้ารับการรักษาที่โรงพยาบาล โดยหยุดงานอย่างน้อย 10-14 วันหรือจนกว่าจะไม่มีอาการ
สวมหน้ากากอนามัย ล้างมือบ่อย ๆ และเว้นระยะห่างเสมอ
ผู้สัมผัสเสี่ยงสูง ใกล้ชิดกับผู้ติดเชื้อโดยไม่มีการป้องกัน
หยุดงานทันทีเมื่อทราบข่าว อย่างน้อย 14 วัน นับจากวันที่สัมผัสครั้งสุดท้าย
ควรตรวจหาเชื้อหลังสัมผัสผู้ป่วยติดเชื้อ 3-5 วัน
สังเกตอาการทางระบบทางเดินหายใจและวัดไข้ทุกวันหากผิดปกติให้รีบมาพบแพทย์ทันที
สวมหน้ากากอนามัย ล้างมือบ่อย ๆ และเว้นระยะห่างเสมอ
ผู้สัมผัสบุคคลที่มีความเสี่ยงสูง ที่ยังตรวจไม่พบเชื้อ
ยังไม่ต้องหยุดงาน แต่ให้เว้นระยะห่าง งดไปที่ชุมชน
สวมหน้ากากอนามัยตลอดเวลาและล้างมือเป็นประจำ
เฝ้าสังเกตอาการ หากผิดปกติให้รีบไปพบแพทย์ทันที
คนทั่วไปที่ไม่มีประวัติเสี่ยงและไม่มีอาการ
เว้นระยะห่างระหว่างบุคคล
สวมหน้ากากอนามัยตลอดเวลา
ล้างมือเป็นประจำ
งดเว้นเดินทางไปที่ที่มีคนหนาแน่นและระบายอากาศไม่ดี
ข้อมูล ณ วันที่ 11 เมษายน 2564
ที่มา : อ. ดร. พญ.วรรษมน จันทรเบญจกุล
คำแนะนำการปฏิบัติตัว ผู้สัมผัสเสี่ยงสูง
ความสงสัยทั้งตัวเองและคนเดินไปเดินมา เป็นวิธีที่ถูกต้อง
เมื่อเกิดเรื่องตรงนี้ (คลัสเตอร์ทองหล่อ) ทุกคนที่เดินไปเดินมา ณ ขณะนี้ เราเรียกว่ามีเสี่ยงหมด ผมเองก็ต้องสงสัยว่าคุณหนุ่มติดหรือเปล่า ผมก็สงสัยตัวเองว่าติดหรือเปล่า ขณะนี้มีความสงสัยทั้งตัวเองและคนเดินไปเดินมา เป็นวิธีที่ถูกต้อง ดังนั้นเราต้องป้องกันตัวเองจากเชื้อที่มาจากข้างนอก และขณะเดียวกันต้องป้องกันตัวเองไม่ให้เชื้อที่เราครองอยู่ไปหาคนอื่น นั่นคือต้องรักษาตัวเองและรักษาระยะห่าง ถ้าเราทำแบบนี้ในคนไทยทุกคน ตั้งแต่วันนี้เป็นต้นไป ประเทศไทยสงบได้เลย ที่ติดแล้ว ณ ขณะนี้ที่เรียนถามท่านรองผอ. รพ. บำราศนราดูร อ.วิศิษฎ์ ตอนนี้ในรพ. บำราศนราดูรนั้น ติดเต็มหมดเลย แต่จะมีผู้ที่มีอาการอยู่ 5 เปอร์เซ็นต์ ถ้าเราหยุดยั้งตรงนี้ได้ ไม่ให้คนติดเชื้อหนักขึ้น หนักถึงขั้นเข้าไอซียู และหนักวิกฤต ตรงนั้นเราชนะ แต่ถ้ายังปล่อยให้ระบาดไปเรื่อยๆ เนียนๆ ไปอย่างนี้ ลักษณะพัฒนาการของโรคจะรุนแรงมากขึ้น และในที่สุดเตียงที่อยู่ในรพ. ซึ่งเป็นผู้ไม่มีอาการ ก็จะไม่มีเตียงให้สำหรับผู้มีอาการจริงๆ และต้องช่วยชีวิต - รายการโหนกระแส 14 เมย 64เครื่อง Hemoperfusion
เครื่อง Hemoperfusion ใช้สำหรับกำจัดสารก่อการอักเสบ ในผู้ป่วยที่มีอาการวิกฤต หนึ่งในเครื่องมือที่ได้รับการบริจาคจากประชาชนผ่านโครงการก้าวคนละก้าว
*ภาพจากเพจ รพ.นครพิงค์2.หากมีประวัติคนใกล้ชิดติดเชื้อ ให้ประเมินและปฏิบัติตัวตามนี้
A ผู้ติดเชื้อโควิด-19 ที่ได้รับการพิสูจน์แล้ว
ให้ไปโรงพยาบาลเพื่อรักษา
B ผู้ที่สัมผัสกับ A
ควรตรวจโควิด-19 เพื่อให้แน่ชัดหรือกักตัว 14 วัน เพื่อสังเกตอาการ
C เช็คอาการของ B
หาก B ติด ให้ C ทำตามคำแนะนำของ B คือกักตัวสังเกตอาการหรือตรวจโควิด-19
หาก B ไม่ติด C ไม่ต้องกักตัวเอง แต่ให้ระมัดระวังตัว ไม่เข้าใกล้ความเสี่ยงอีก
D เช็คอาการของตัวเอง แต่ไม่ต้องกักตัวเอง
ชัยภูมิ คำสั่งจังหวัด 17 เมษายน 2564 LINK
ย้ำ!! ออกจากบ้าน ต้องสวมหน้ากากผ้าหรือหน้ากากอนามัยทุกครั้ง
หากไม่สวมหน้ากากผ้าหรือหน้ากากอนามัย เมื่อออกจากเคหสถาน อาจมีความผิดตามมาตรา 51 แห่ง พ.ร.บ.โรคติดต่อ พ.ศ. 2558 ต้องระวางโทษปรับไม่เกิน 20,000 บาท ตามคำสั่งจังหวัดชัยภูมิ ที่ 3161/2564 ลงวันที่ 17 เมษายน 2564
24 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 2,839 ราย
ผู้ป่วยยืนยันสะสม 53,022 ราย
หายป่วยแล้ว 30,566 ราย
เสียชีวิตสะสม 129 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 23 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 1,095,445 ราย
------------------------------
วันที่ 23 เมษายน 2564 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 100,367 ราย
เข็มที่ 2 จำนวน 30,253 ราย
คู่มือฯ สำหรับชาวต่างชาติ LINK
กระทรวงสาธารณสุข
พฤศจิกายน 2562
ISBN : 978-616-11-4180-6
รูปแบบ pdf จำนวน 173 หน้า
จัดทําโดย กองบริหารการสาธารณสุข อาคาร 3 ชั้น 6 ตึกสํานักงานปลัดกระทรวงสาธารณสุข
ถ.ติวานนท ต.ตลาดขวัญ อ.เมือง จ.นนทบุรี 11000
โทร 0 2590 1742 โทรสาร 0 2590 1745
หมอพร้อม v.2 iOS Apple store LINK
คำแนะนำการใช้แอป
ผู้ที่สามารถ Login เข้าใช้งานได้ จำเป็นต้องมีข้อมูล 13 หลัก และ เบอร์โทรศัพท์
อยู่ในฐานข้อมูลของกระทรวงสาธารณสุข Moph Immunization เท่านั้น
แอพพลิเคชั่นสำหรับตรวจสอบการฉีดวัคซีนของผู้รับบริการ มีฟังก์ชั่นการทำงาน ดังนี้
- จองวัคซีน
- นัดรับวัคซีน
- แสดงประวัติการรับวัคซีน
- แสดงใบรับรองการฉีดวัคซีน
- ตรวจสอบใบรับรองของการฉีดวัคซีน
ปรับเป็น 3 ระดับ คือ สีแดงเข้ม สีแดง และสีส้ม
Q : รพ. ที่รับการรักษาเป็น รพ.เอกชน จะมีวัคซีนพร้อมฉีดให้โดยไม่เสียค่าใช้จ่ายหรือไม่? ถ้ามี อาการแพ้วัคซีน รักษาที่ รพ.เอกชน ที่ฉีดด้วยหรือไหม??
Q : รพ. ที่รับการรักษาเป็น รพ.เอกชน จะมีวัคซีนพร้อมฉีดให้โดยไม่เสียค่าใช้จ่ายหรือไม่? ถ้ามี อาการแพ้วัคซีน รักษาที่ รพ.เอกชน ที่ฉีดด้วยหรือไหม??
A : วัคซีนโควิด รัฐบาลจัดสรรให้โดยไม่เสียค่าใช้จ่าย ซึ่งมี รพ.เอกชน ร่วมช่วยฉีด กรณีเกิดการแพ้จากวัคซีน รพ.นั้นเป็นผู้ทำการรักษา โดยรัฐบาลจะสนับสนุนค่าใช้จ่ายในส่วนนี้ให้กับ รพ. นั้น
2.แสดงผลที่อยู่ตามทะเบียนบ้านให้ตรวจสอบ
ระบบจะแสดงผลที่อยู่ตามทะเบียนบ้านให้ตรวจสอบ และกดตอบรับว่า ตรง หรือ ไม่ตรง
กรณี ตรง จะไปยังขั้นตอน 3 และ 4 5 6
กรณี ไม่ตรง จะไปยังขั้นตอน 3 + 3.1 +3.2 จึงจะเป็น 4 5 6
2.กดเมนู เปลี่ยนหน่วยบริการด้วยตนเอง
กดเมนู เปลี่ยนหน่วยบริการด้วยตนเอง
ขั้นที่ 1 : ฝึกกะบังลมหายใจเข้า
ขั้นที่ 1 : ฝึกกะบังลมหายใจเข้า
เริ่มจากการนั่งตัวตรง
หากนั่งไม่ไหวอาจพิงหมอนหรือพนักพิงได้บ้าง
หากนั่งไม่ไหวจริงๆ สามารถทำในท่านอนได้เช่นเดียวกัน
1.1 เริ่มจากวางมือข้างหนึ่งในระดับหน้าอก และมืออีกข้างหนึ่งในระดับหน้าท้อง
1.2 หายใจเข้าช้าๆ โดยระหว่างการหายใจเข้า ให้ทั้งหน้าอกและหน้าท้องขยายขึ้นพร้อมๆ กัน สังเกตการขยับของมือทั้งสองข้าง
1.3 ในระหว่างการหายใจออก ให้หน้าอกและหน้าท้องแฟบลงพร้อมๆ กัน สังเกตการขยับมือทั้งสองข้างเช่นเดียวกัน
1.4 ให้ทำซ้ำช้าๆ ในจังหวะที่รู้สึกสบาย
1.5 หากหายใจลึกๆ แล้วมีอาการแน่นหรือมีอาการไอ ให้หายใจในจังหวะที่ช้ากว่าเดิม จะทำได้ดีขึ้น
1.6 เมื่อฝึกทำจนคล่องแล้ว ตอนหายใจเข้าสุด ให้กลั้นหายใจ และนับในใจ 1-5 หรือ 1-10 เท่าที่ไหว ก่อนที่จะหายใจออก
Pharmaceutical Inspection Co-operation Scheme LINK
Leading the international development, implementation and maintenance of harmonised
GMP standards and quality systems of Inspectorates in the field of medicinal products
List of country member
Argentina
Australia
Austria
Belgium
Brazil
Canada
Chinese Taipei
Croatia
Cyprus
Czech Republic
Denmark
Estonia
Finland
France
Germany
Greece
Hong Kong
Hungary
Iceland
Indonesia
Iran
Ireland
Israel
Italy
Japan
Korea, Republic of
Latvia
Liechtenstein
Lithuania
Malaysia
Malta
Mexico
Netherlands
New Zealand
Norway
Poland
Portugal
Romania
Singapore
Slovakia
Slovenia
South Africa
Spain
Sweden
Switzerland
Thailand
Turkey
Ukraine
United Kingdom
United States
แมคพร้อม หยุดเชื้อเพื่อชาติ LINK
แมคพร้อม! หยุดเชื้อเพื่อชาติ
แมคโดนัลด์ ร่วมสนับสนุนคนไทยฉีดวัคซีน
เพียงโชว์ใบรับรองการฉีดวัคซีน รับฟรี! เฟรนช์ฟรายส์ ที่แมคโดนัลด์ทุกสาขา
แมคโดนัลด์ขอมอบสิทธิพิเศษแทนคำขอบคุณในการร่วมกันฝ่าฟันวิกฤติโควิด-19 นี้ สำหรับผู้ที่ผ่านการฉีดวัคซีนป้องกันโควิด-19 เพียงแสดงบัตรรับรองการฉีดวัคซีน รับฟรี! เฟรนช์ฟรายส์ขนาดปกติ 1 ที่ จำนวน 50,000 สิทธิ์ มูลค่า 1,750,000 บาท
ตั้งแต่วันที่ 17 พฤษภาคม 2564 เป็นต้นไป หรือจนกว่าจะมีการเปลี่ยนแปลง ที่ร้านแมคโดนัลด์ทุกสาขาที่ร่วมรายการทั่วประเทศ ทั้งเคาน์เตอร์หน้าร้าน และบริการไดร์ฟทรู *ยกเว้นสาขาในสนามบิน และบริการจัดส่งถึงบ้านไม่ร่วมรายการ
สมุทรปราการ พบผู้ป่วยรายใหม่ จำนวน 253 ราย เสียชีวิต 2 ราย
Update สถานการณ์ Covid-19 จังหวัดสมุทรปราการ
ณ วันที่ 1 มิถุนายน 2564 เวลา 13.00 น.
พบผู้ป่วยรายใหม่ จำนวน 253 ราย
ในพื้นที่ จำนวน 214 ราย
เมือง 120 ราย
บางพลี 23 ราย
พระประแดง 15 ราย
พระสมุทรเจดีย์ 2 ราย
บางบ่อ 50 ราย
บางเสาธง 4 ราย
รับมารักษาต่อในจังหวัดสมุทรปราการ 39 ราย
เสียชีวิต 2 ราย
ตารางที่ 2 – ประสิทธิผลของ COVID-19 Vaccine AstraZeneca ในการป้องกันโรคโควิด-19
TousAntiCovid ใบรับรองของฝรั่งเศส
ฝรั่งเศส ออกใบรับรองเป็นเอกสารพร้อม QR Code สามารถสแกนเก็บผ่านแอป TousAntiCovid พร้อมปธน.เอ็มมานูแอล มาครง ประกาศว่า ตั้งแต่ 9 มิถุนายน เป็นต้นไป ใบรับรองนี้จะใช้เป็นบัตรผ่านสำหรับกิจกรรมต่างๆ และการเดินทางไปต่างประเทศ
ใบรับรองจะออกให้กับชาวฝรั่งเศสทุกคนที่ที่ได้รับวัคซีนครบโดสที่กำหนดแล้ว (2 โดสของ AZ, Pfizer-BioNTech & Moderna หรือ 1 เข็มของ J&J)
ในแอปจะมีส่วน Carnet ใช้เก็บผลตรวจ PCR และใบรับรองการฉีดวัคซีน ซึ่งจะเริ่มออกให้ตั้งแต่กลางเดือนพ.ค. เป็นต้นมา
สำหรับผู้ที่ไม่ใช้สมาร์ทโฟนและแอป สามารถรับใบรับรองทางไปรษณีย์ได้
นพ. สิระ กอไพศาล อายุรแพทย์ต่อมไร้ท่อและผู้ชำนาญการด้านฮอร์โมน โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ความรู้ความเข้าใจที่ถูกต้องในกลุ่มบุคคลที่มีความหลากหลายทางเพศเป็นเรื่องสำคัญ เช่น ยังมีความเข้าใจผิด และมีความเสี่ยงในการซื้อยาคุมกำเนิดมารับประทานเอง เพื่อทดแทนฮอร์โมนในเพศหญิง ซึ่งก่อให้เกิดอันตรายต่อสุขภาพได้ “Pride Clinic” จึงได้รับการออกแบบให้เกิดการบริบาลแก่กลุ่มหลากหลายทางเพศที่ปลอดภัย โดยดูแลตั้งแต่ การใช้ฮอร์โมนบำบัดเพื่อปรับลักษณะทางกายภาพหรือเตรียมความพร้อมเพื่อปรับเพศสภาพ (Hormone Therapy), ศัลยกรรมเพื่อปรับลักษณะทางกายภาพ (Masculinizing / Feminizing Procedures), การผ่าตัดเปลี่ยนเพศ (Gender-Affirming Surgery), การฝึกพูดเพื่อเปลี่ยนเสียงเป็นเพศหญิง (Voice Feminizing Therapy) และการผ่าตัดกล่องเสียง (Voice Feminizing Surgery), การดูแลรักษาด้านผิวพรรณ ความงามและรูปร่าง (Aesthetic and Skin) การดูแลสุขภาพจิต (Mental health) รวมถึงการออกแบบโปรแกรมสุขภาพแบบจำเพาะสำหรับผู้มีความหลากหลายทางเพศ (Check-up Program for Unisex) ในทุกช่วงวัย เป็นต้น ซึ่งดูแลโดยทีมแพทย์ผู้ชำนาญการในทุกขั้นตอน
ที่สำคัญทีมศัลยแพทย์ที่ต้องใช้หัตถการในการผ่าตัดเปลี่ยนเพศ ยังมีประสบการณ์มากกว่า 20 ปี และทำการผ่าตัดมาแล้วไม่น้อยกว่า 1,000 ราย ซึ่งแพทย์เฉพาะทางนี้ได้จบด้านศัลยกรรมตกแต่งหรือศัลยกรรมพลาสติก (Certified Board Plastic Surgeons) ในขณะที่ประเทศไทย ยังมีแพทย์ผู้ชำนาญการด้านการรักษาด้วยฮอร์โมนบำบัดจำนวนไม่มากนัก ซึ่งแพทย์ที่สามารถปฏิบัติงานควรเป็นแพทย์ที่มีประสบการณ์ มีความเข้าใจและใส่ใจในสุขภาพของคนกลุ่มบุคคลที่มีความหลากหลายทางเพศโดยเฉพาะ จึงจะสามารถให้คำปรึกษาด้านสุขภาพได้ ซึ่ง Pride Clinic ตอบโจทย์ได้ทุกความต้องการ
สถานีอนามัยชั้นหนึ่ง
สถานีอนามัยชั้นหนึ่งที่สร้างเป็นแห่งแรก(พ.ศ.2509) ในอำเภอบ้านแหลม และอำเภอท่ายาง(พ.ศ.2511) และในเวลาต่อมาก็ได้รับการยกฐานะเป็นโรงพยาบาลชุมชน ปัจจุบันจังหวัดเพชรบุรี มีโรงพยาบาลชุมชนครบทุกอำเภอ ดังนี้
โรงพยาบาลท่ายาง ขนาด 30 เตียง(รับอนุมัติให้ก่อสร้างเพิ่มเติมเป็นโรงพยาบาลขนาด 60 เตียง ในปีงบประมาณ 2539)
โรงพยาบาลชะอำ ขนาด 30 เตียง (รับอนุมัติให้ก่อสร้างเพิ่มเติมเป็นโรงพยาบาลขนาด 60 เตียง ในปีงบประมาณ 2547)
โรงพยาบาลเขาย้อย ขนาด 30 เตียง
โรงพยาบาลบ้านแหลม ขนาด 30 เตียง
โรงพยาบาลหนองหญ้าปล้อง ขนาด 10 เตียง(รับอนุมัติให้ก่อสร้างต่อเติมเป็นโรงพยาบาลขนาด 30 เตียง ในปีงบประมาณ 2539)
โรงพยาบาลบ้านลาด ขนาด 10 เตียง(รับอนุมัติให้ก่อสร้างต่อเติมเป็นโรงพยาบาลขนาด 30 เตียงในปี พ.ศ.2539)
โรงพยาบาลแก่งกระจาน ขนาด 10 เตียง(รับอนุมัติให้ก่อสร้างต่อเติมเป็นโรงพยาบาลขนาด 30 เตียงในปีงบประมาณ 2541)
สุขศาลาชั้นสอง ในช่วง พ.ศ.2483-2493 จังหวัดเพชรบุรี ได้มีการก่อสร้าง สุขศาลาชั้นสอง ดังนี้
สุขศาลาชั้นสองเขาย้อย อ.เขาย้อย
สุขศาลาชั้นสองบ้านแหลม อ.บ้านแหลม
สุขศาลาชั้นสองบ้านลาด อ.บ้านลาด
สุขศาลาชั้นสองท่ายาง อ.ท่ายาง
สุขศาลาชั้นสองชะอำ อ.ชะอำ
ต่อมาสุขศาลาชั้นสองได้เปลี่ยนชื่อเป็น ”สถานีอนามัยชั้นสอง” และในปีพ.ศ.2515 เป็น ”สถานีอนามัย” จังหวัดเพชรบุรี มีสถานีอนามัย จำนวน 118 แห่ง
สถานีอนามัยในยุคทศวรรษแห่งการพัฒนา(พ.ศ.2535-2539) เริ่มต้นด้วยการ
เพิ่มจำนวนสถานีอนามัยให้ครอบคลุมทุกตำบลารยกฐานะสถานีอนามัยทั่วไปขึ้นเป็นสถานีอนามัยขนาดใหญ่ด้วยการเพิ่มเนื้อที่ใช้สอยภายในสถานีอนามัยจาก 70 ตรม. เป็น 150 ตรม. ในสถานีอนามัยทั่วไป และ 220 ตรม.ในสถานีอนามัยขนาดใหญ่ จังหวัดเพชรบุรีมีสถานีอนามัยขนาดใหญ่ 19 แห่ง ที่เหลือเป็นสถานีอนามัยทั่วไป 99 แห่ง ในปีงบประมาณ 2546
อบจ.ลำปาง เปิดลงทะเบียน ผ่านช่องทางออนไลน์ และ Call Center 5-9 กค นี้ LINK
อบจ.ลำปาง เปิดลงทะเบียนจองฉีดวัคซีนทางเลือก ชิโนฟาร์ม... ฟรี!!! ไม่มีค่าใช้จ่าย
ช่องทางการลงทะเบียน
(1.) ผ่านช่องทางออนไลน์
(2.) ผ่าน Call Center
เปิดลงทะเบียน วันที่ 5 กรกฎาคม 2564 ตั้งแต่เวลา 08.30 น.
ปิดลงทะเบียน วันที่ 9 กรกฎาคม 2564
เงื่อนไข
- อายุ 18 ปีขึ้นไป
- มีทะเบียนบ้านในพื้นที่จังหวัดลำปาง
- ยังไม่ได้ฉีดวัคซีนโควิดทุกชนิด
- ยังไม่เคยลงทะเบียนในระบบอื่น
สอบถามโทร 054-237629, 054-237699
2 หากใช้ไปแล้ว 2 วัน อาการไม่ดีขึ้น
2 ถ้ายังมีอาการเจ็บคอ มีไข้ หรือ ครั่นเนื้อตัว แม้ไม่มีไข้, ปวดศีรษะ, ปวดเมื่อยเนื้อตัว หลังใช้ฟ้าทะลายโจรไปแล้วในวันที่ 2 ไม่ดีขึ้น กดไข้ลงไม่ได้ ให้ทำการเพิ่มปริมาณฟ้าทะลายโจรเป็น 2 เท่าและติดตามผล ไปอีก 3 วัน จนครบ 5 วัน หากไม่ดีขึ้นหรือมีอาการเริ่มหอบ เหนื่อยหายใจยาก ให้ส่งตัวไปที่โรงพยาบาลโดยเร็วที่สุด ไม่เกินวันที่ 4 นับตั้งแต่เริ่มมีอาการ
ใบจำหน่ายพืช ออกโดย วิสาหกิจชุมชน
เอกสารฉบับนี้ เป็นเอกสาร ที่ออกระหว่าง วิสาหกิจชุมชน ให้แก่ผู้ซื้อ โดยจะมี ข้อมูลของวิสาหกิจชุมชน และ ผู้ซื้อ โดยละเอียด วันที่ จำนวน และราคา
ยาขมิ้นชันแคปซูลและยาฟ้าทะลายโจรแคปซูล LINK
การพัฒนารูปแบบยาแผงในยา 2 รายการเสร็จเรียบร้อยแล้วนะคะ ได้แก่ยาขมิ้นชันแคปซูลและยาฟ้าทะลายโจรแคปซูล ทำให้สะดวกแก่การพกพาและมั่นใจในคุณภาพในการเก็บรักษายาอย่างมีคุณภาพตลอดอายุของยา
คำแนะนำผู้ที่มีอาการไอและหายใจลำบาก
จุด Drop Point ในปั้ม ปตท.
จุด Drop Point ของ “Youเทิร์น” ที่ตั้งอยู่ในสถานีบริการน้ำมัน ปตท. สถานีละ 1 Drop point ได้แก่
- สถานี ปตท. สาขาแยกประชาอุทิศ-ลาดพร้าว
- สถานี ปตท. สาขาวิภาวดี
- สถานี ปตท. สาขาราม อินทรา กม. 6.5
- สถานี ปตท. บจ.ที.เค.ที่ คอมเมอร์เชียล
- สถานี ปตท. สาขามีนบุรี
- สถานี ปตท. สาขายานนาวา
- สถานี ปตท. สาขาจอมทอง
วิธีตรวจ : RT-PCR
เวลาทำการ : [07:00-15:45]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-28] ถึง [2021-07-30]
ปริมาณตรวจ : 500 คิว/วัน/วัน
สถานะ : ไม่ว่าง
โทรศัพท์ : 023544212
หมายเหตุ
1.แจกคิววันต่อวัน หน้าจุดตรวจตั้งแต่ 7:00 น.
2.นำบัตรประชาชนพร้อมสำเนา และปากกาส่วนตัว ใช้ลงทะเบียน
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 22:31 (9 ชั่วโมงที่แล้ว)
ลานจอดรถ สำนักงานเขตพระนคร [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-15:57]
วันทำการ : [ส. อา. ]
วันที่ให้บริการ : [2021-07-31] ถึง [2021-08-01]
ปริมาณตรวจ : 400 คิว/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 022141044, 022141330
หมายเหตุ
1.แจกคิวล่วงหน้า 1 วัน App QueQ 400 คิว 8:00 น.
2.นำบัตรประชาชนพร้อมสำเนา และปากกาส่วน ใช้ลงทะเบียน
บันทึกข้อมูลล่าสุดเมื่อ: 27 ก.ค. 64 10:03 (3 วันที่แล้ว)
โรงพยาบาลมาสเตอร์พีซ (Masterpiece Hospital) [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:30-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. ]
วันที่ให้บริการ : [2021-07-30] ถึง [2021-10-31]
ปริมาณตรวจ : 400 คน/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 021054370
หมายเหตุ
รับ 400 คน/วัน อายุ 7 ขึ้นไป ลงทะเบียนล่วงหน้า 1-2 วัน
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 03:06 (4 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [8:00-20:00] [8:00-16:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ] [ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 022443000
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง
โรงพยาบาลรามาธิบดี
วิธีตรวจ : RT-PCR
เวลาทำการ : [5:00-]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 022011000
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง - นำบัตรประชาชนมารับบัตรคิว -เปิดรับบัตรคิว 5:00 รับ 80 คิวต่อวัน
โรงพยาบาลราชวิถี
วิธีตรวจ : RT-PCR
เวลาทำการ : [8:00-14:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 02-2062900
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง - เฉพาะคนไข้ที่ใช้สิทธิโรงพยาบาลราชวิถี - ใช้บัตรประชาชน - วันละ 30 คิว
หน่วยบริการตรวจเชิงรุก วัดด่าน แขวงบางโพงพาง [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-16:15]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-27] ถึง [2021-08-03]
ปริมาณตรวจ : 500 คิว/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 02-2942393, 02-2942397
หมายเหตุ
1.แจกคิวล่วงหน้า 1 วันผ่าน App QueQ ตั้งแต่เวลา 6:00 น. จำนวน 500 คน
2.แจกคิววันต่อวัน สำหรับผู้สูงอายุ หน้าจุดตรวจ 8:00 น. จำนวน 100 คน
3.นำบัตรประชาชน พร้อมสำเนา และปากกาส่วนตัวใช้ลงทะเบียน
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 17:47 (14 ชั่วโมงที่แล้ว)
คลินิกเวชกรรมพระโขนง 48 [แผนที่]
วิธีตรวจ : Rapid, RT-PCR
เวลาทำการ : [11:00-12:00] [15:00-16:00] [11:00-16:00] [15:00-17:00]
วันทำการ : [จ. ] [จ. ] [พ. ] [ส. ]
วันที่ให้บริการ : [2021-07-28] ถึง [2021-08-31]
ปริมาณตรวจ : -/วัน
สถานะ : ไม่ว่าง
โทรศัพท์ : 023925310
หมายเหตุ
จองคิวผ่าน LINE : @clinic48 ราคา 1,050 - 3,090
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 12:47 (19 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-20:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 023910011
หมายเหตุ
- คิว Drive-Thru เต็มถึงวันที่ 21 ก.ค. 64 (จองคิวตรวจผ่านเว็บไซต์)
วิธีตรวจ : Real-Time PCR
เวลาทำการ :
วันทำการ :
วันที่ให้บริการ :
ปริมาณตรวจ : 200คน/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 021295555
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง -เปิดจองตั้งแต่ 24ก.ค.64 เป็นต้นไป ผ่านการลงทะเบียนออนไลน์ http://bpkconnect.com/.../survey-phy-register_drive_thru -เริ่มเปิดให้บริการตรวจ 26ก.ค.64 ตั้งแต่เวลา 09.00-18.00 น. -บริเวณด้านข้างแผนกฉุกเฉิน
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 01:39 (1 วันที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [09:00-19:30]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 027439999
หมายเหตุ
- เปิดเฉพาะตรวจเพื่อเดินทางต่างประเทศ - ใช้ passport และตํ๋วเดินทางยืนยัน
บันทึกข้อมูลล่าสุดเมื่อ: 28 ก.ค. 64 10:12 (2 วันที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-15:00] [08:00-15:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ] [ส. อา. ]
วันที่ให้บริการ : [2021-07-12] ถึง [2021-07-22]
ปริมาณตรวจ : 2000/วัน
สถานะ : ว่าง
โทรศัพท์ :
หมายเหตุ
- ลงทะเบียนล่วงหน้าผ่านเว็บสำนักงานประกันสังคม
หวนจียีนเทคโนโลยี คลีนิคเทคนิคการแพทย์ [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:30-16:30]
วันทำการ : []
วันที่ให้บริการ :
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 020245552
หมายเหตุ
รู้ผลภายใน 24 ชั่วโมง
บันทึกข้อมูลล่าสุดเมื่อ: 28 ก.ค. 64 21:32 (1 วันที่แล้ว)
โรงพยาบาลเกษมราษฎร์ ประชาชื่น [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ : [7:00-]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ไม่ว่าง
โทรศัพท์ : 029101600
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง (ต้องมีประกันสังคม) - รับตรวจวันละ 50 คิวต่อวัน
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 13:45 (18 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-30] ถึง [2021-10-31]
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 025611111
หมายเหตุ
รับตรวจ 200 คน/วัน (Drive-Thru)
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 02:50 (5 ชั่วโมงที่แล้ว)
วิธีตรวจ : RT-PCR
เวลาทำการ : [08:30-17:30]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-30] ถึง [2021-09-30]
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 026614431
หมายเหตุ
-
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 02:15 (5 ชั่วโมงที่แล้ว)
คลินิกเทคนิคการแพทย์แบงคอกจีโนมิกส์ [แผนที่]
วิธีตรวจ : Rapid , RT-PCR
เวลาทำการ : [08:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. ]
วันที่ให้บริการ :
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
หมายเหตุ
-
บันทึกข้อมูลล่าสุดเมื่อ: 29 ก.ค. 64 23:49 (8 ชั่วโมงที่แล้ว)
โปรเฟสชั่นแนล ลาโบราทอรี่ แมเนจเมนท์ [แผนที่]
วิธีตรวจ : Rapid / RT-PCR Walk-In
เวลาทำการ : [08:00-15:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : -/วัน
สถานะ : ว่าง
โทรศัพท์ : 027708700
หมายเหตุ
-
บันทึกข้อมูลล่าสุดเมื่อ: 30 ก.ค. 64 02:01 (10 ชั่วโมงที่แล้ว)
วัคซีนไฟเซอร์’จากสหรัฐฯ 1.5 ล้านโดส จะนำไปฉีดใครบ้าง?
กราฟฟิค Positioning
เลขหมายประจำเขต กรุงเทพกลาง
เลขหมายประจำเขต กรุงเทพกลาง
อบจ.นครสวรรค์ เปิดสายด่วน อบจ_พากลับบ้าน พร้อมบริการรับส่งผู้ป่วย ฟรี!! LINK
อบจ.นครสวรรค์ เปิดโครงการ
อบจ.อาสาพากลับบ้าน พร้อมบริการเคลื่อนย้ายผู้ป่วยภายในจังหวัดนครสวรรค์ หรือ รับส่งผู้ป่วยที่หายแล้วกลับบ้าน ฟรี!!
สรุปยอด อบจ.อาสาพากลับบ้าน (ถึง 8 สค 64)
ยอดรวม 689 คน
เป็นชาย 338 คน หญิง 351 คน
แบ่งเป็นเดินทางโดยรถตู้ 439 คน และเดินทางเอง 250 คน
เมื่อเดินทางกลับมาแล้ว เข้าจุดกักตัว ต่างๆ อาทิ
โรงแรมบึงบอระเพ็ด ศูนย์กักตัวชุมชน ศรีสวรรค์-อบจ. (โดยรพ.ศรีสวรรค์) ศูนยกักตัวของรัฐ (LQ) ราชภัฎย่านมัทรี รพ.สนามราชภัฏ และส่งต่อที่อื่นๆ ด้วย
เป็นความร่วมมือของหน่วยงานต่างๆ ได้แก่
ม.ราชภัฎนครสวรรค์ รพ.ศรีสวรรค์ สปสช.เขต 3 นครสวรรค์ ศูนย์ฝึกอบรมตำรวจภูธรภาค 6 ตำรวจภูธรจังหวัดนครสวรรค์ สคร.3 นครสวรรค์ สสจ.นครสวรรค์ ศูนย์อนามัยที่ 3 นครสวรรค์ บ.โทรคมนาคมแห่งชาติ และ อบจ.นครสวรรค์
ล่าสุด 9 สค 64 นายกอบจ.นครสวรรค์ ประกาศ "กำนัน และ ผู้ใหญ่บ้านที่ต้องการเพิ่มเตียง ขยายพื้นที่รองรับคนกลับบ้าน อบจ.พร้อมสนับสนุนอย่างเต็มที่ สามารถติดต่อผ่าน สจ. ในพื้นที่ได้เลย" โทร 056-803569 ต่อ 200
ติดต่อรับบริการ โทร 056-803522 (สำหรับพื้นที่ต่างจังหวัด)
หรือ 1131 (ภายในจังหวัดนครสวรรค์)
LINE @068kcrfx (มี@) หรือสแกน QR Code
โรงพยาบาลเมดพาร์ค ได้รับการจัดสรรวัคซีน MODERNA เพียงพอให้กับทุกท่าน และคาดว่าจะสามารถเริ่มให้บริการฉีดได้ในไตรมาสที่ 4/2564 LINK
โรงพยาบาลเมดพาร์ค ได้รับการจัดสรรวัคซีน MODERNA เพียงพอให้กับทุกท่านที่ได้รับอีเมลยืนยันการจ่ายเงิน และรหัสส่วนตัว (Reservation CODE) และคาดว่าจะสามารถเริ่มให้บริการฉีดได้ในไตรมาสที่ 4/2564
โรงพยาบาลจะติดต่อสอบถามประวัติการได้รับวัคซีน Covid-19 ที่ผ่านมาของท่านทางอีเมล เพื่อกำหนดวัน-เวลานัดรับวัคซีนที่เหมาะสมในลำดับต่อไป
* ทางโรงพยาบาลจะแจ้งวันนัดหมายฉีดของท่านเมื่อวัคซีนถูกจัดสรรถึงโรงพยาบาล และโรงพยาบาลได้รับประวัติการฉีดวัคซีน Covid-19 ของแต่ละท่านเรียบร้อยแล้ว
สอบถามเพิ่มเติมได้ที่
Covid Vaccine Center 02-0903170, 72-73
ทุกวัน ตั้งแต่ 8:00 - 20:00 น.
นอกเวลาทำการ ติดต่อ 02-0233333
สระบุรี ลงทะเบียนผ่านเว็บ สสจ.สระบุรี หรือสแกน QR Code ล่วงหน้า 2 สัปดาห์ LINK
โรงพยาบาลพระพุทธบาท สระบุรี แนวทางการลงทะเบียนสำหรับประชาชนที่ไปฉีดวัคซีนป้องกันโควิด-19 เข็ม 1 จาก "บางซื่อ" และประสงค์จะฉีดวัคซีน เข็ม 2 ที่สระบุรี
1. ลงทะเบียนผ่านหน้าเว็บไซต์ สสจ.สระบุรี หรือ สแกน QR Code
*** จำเป็นต้องลงทะเบียนก่อนวันนัดเข็ม 2 อย่างน้อย 2 สัปดาห์ ***
2. สสจ.สระบุรี รวบรวมจำนวนรายชื่อเพื่อขอสนับสนุนวัคซีนจากส่วนกลาง + เบิกจ่ายวัคซีนและส่งรายชื่อให้กับหน่วยบริการ
3. เริ่มให้บริการฉีดวัคซีน 6 กันยายน 2564 – 29 ตุลาคม 2564
4. หน่วยบริการที่ให้บริการ :
รพ. พระพุทธบาท ให้บริการทุกวันพฤหัสบดี
สอบถามสายด่วนโควิด 096-9099179
airasia Super App LINK
มาเตรียมความพร้อมก่อนออกเดินทาง บินมั่นใจสู่ปลายทางไปด้วยกันค่ะ และขอความร่วมมือเผื่อเวลาเดินทางถึงสนามบินก่อนเวลา เพื่อเข้ารับการตรวจเอกสารประกอบการเดินทางนะคะ อย่าลืมสวมหน้ากากอนามัย เเละปฏิบัติตามมาตรการด้านสุขอนามัยร่วมกันนะคะ
แนวทางการให้วัคซีน กรมควบคุมโรค (ฉบับปรับปรุงครั้งที่ 2) สิงหาคม 2564 LINK
หน้า 65 ข้อ 11 ข้อคำถามที่พบบ่อย
เรียบเรียงโดย
ศ.พญ.กุลกัญญา โชคไพบูลย์กิจ คณะแพทยศาสตร์ศิริราชพยาบาล
ศ.พญ.ศศิโสภิณ เกียรติบูรณกุล คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี
พญ.จุไร วงศ์สวัสดิ์ นายแพทย์ทรงคุณวุฒิ กรมควบคุมโรค
กองโรคติดต่อทั่วไป กรมควบคุมโรค
11. ผู้ที่เคยมีประวัติเป็นโรคโควิด 19 มาก่อนยังจำเป็นต้องได้รับวัคซีนโควิด 19 หรือไม่
ตอบ ผู้ที่ยังไม่เคยฉีดวัคซีนมาก่อน หรือฉีดยังไม่ครบ 2 เข็ม หากป่วยเป็นโรคโควิด 19 ให้ฉีดวัคซีนชนิดใดก็ได้ เพิ่มอีก 1 เข็ม ภายใน 1-3 เดือนหลังจากเริ่มป่วย คนที่เคยได้ครบ 2 เข็มแล้ว ไม่ต้องฉีดเพิ่มอีก แต่ไม่จำเป็นต้องตรวจ การติดเชื้อก่อนฉีดวัคซีน เพราะแม้เคยเป็นมาก่อนโดยไม่รู้ตัว ก็ไม่ทำให้มีอันตรายจากการฉีดวัคซีน
ขั้นตอนที่ 2 เตรียมแผ่นทดสอบ
ขั้นตอนที่ 2 ฉีกซองและนำแผ่นทดสอบออกมา เมื่อเปิดแล้วควรทดสอบภายใน 1 ชั่วโมง วางแผ่นทดสอบบนโต๊ะที่เรียบ ลอกสติกเกอร์ป้องกันของกาวสองหน้าออก
สวมหน้ากากอนามัย ทับด้วยหน้ากากผ้าตลอดเวลา สวมทุกที่แม้อยู่ในบ้าน
กรุงเทพมหานคร และนนทบุรี
กรุงเทพมหานคร และนนทบุรี
กองโรคติดต่อทั่วไป -เบอร์โทรศัพท์: 02 590 3234-35
-เว็บไซต์: https://ddc.moph.go.th/dcd/
http://vpassport.ddc.moph.go.th
สถาบันบำราศนราดูร -เบอร์โทรศัพท์: 02 590 3430
-เว็บไซต์: https://ddc.moph.go.th/bidi/
สถาบันป้องกันควบคุมโรคเขตเมือง -เบอร์โทรศัพท์: 02 521 1668
-เว็บไซต์: http://vacn.ddc.moph.go.th/
คาเฟ่กัญชา สุขุมวิท101/1 - 162 Cbd Cannabis Tea Cafe
ชื่อยาวสักหน่อย แต่บอกทุกสิ่งในนั้นแล้ว ทั้งที่ตั้งและสรรพคุณ ร้านเขี้ยวเขียวร้านนี้ ช่วงนี้เน้นเครื่องดื่ม
FacebookThe Chateau Palace Hotel ปิ่นเกล้า เปิดให้บริการ Hospitel ร่วมกับ โรงพยาบาลหัวเฉียว
โรงพยาบาลหัวเฉียว ได้ร่วมกับ The Chateau Palace Hotel ปิ่นเกล้า (มาตรฐานบริการโดยโรงแรมโอ๊ควู๊ด) เปิดให้บริการ Hospitel รองรับการดูแลรักษาผู้ป่วยติดเชื้อ COVID-19 ด้วยมาตรฐานและความใหม่ สะอาด กว้างสบาย ภายในมีทั้งไมโครเวฟ Smart TV 43 นิ้ว ตู้เย็น กาต้มน้ำร้อน เครื่องทำน้ำอุ่น เครื่องปรับอากาศ WIFI พร้อมอาหารอร่อย ถูกสุขลักษณะ ครบ 3 มื้อ (บริการอาหารอิสลาม มังสวิรัติ)
ผู้ป่วยที่จะใช้บริการ สามารถใช้ได้ทุกสิทธิการรักษา : ประกันสังคม / บัตรทอง / ประกันชีวิตและสุขภาพ / ประกันโควิด โดยมีเงื่อนไข คือ ผู้มีผลตรวจแบบ RT-PCR แล้วพบติดเชื้อโควิด-19 ติดต่อโรงพยาบาลหัวเฉียวเพื่อดูแลท่าน สอบถามเพิ่มเติมได้ที่ แผนกรับผู้ป่วยใน โทร.02-223-1351 ต่อ 3122, 3123 ตลอด 24 ชั่วโมง
2. เตรียมเครื่องสูบน้ำให้พร้อมใช้งาน
2. เตรียมเครื่องสูบน้ำให้พร้อมใช้งาน และจัดเจ้าหน้าที่ พร้อมแก้ไขน้ำท่วมขังทันที ตามจุดที่เสี่ยงน้ำท่วม
เขตดุสิต สร้างสะพานไม้ให้ชุมชนราชผาทับทิม LINK
29 ก.ย. 64
สำนักงานเขตดุสิตโดย นางสาวอรอนงค์ น้อยเสวก ผู้ช่วยผู้อำนวยการเขต รักษาราชการแทนผู้อำนวยการเขตดุสิต มอบหมายให้เจ้าหน้าที่ฝ่ายโยธา ลงพื้นที่สร้างสะพานไม้ ระยะทางยาวประมาณ 50 เมตร บริเวณชุมชนราชผาทับทิม ซึ่งส่วนใหญ่บ้านปลูกติดริมแม่น้ำ จึงได้รับผลกระทบหลังจากน้ำในเเม่น้ำเจ้าพระยาเพิ่มสูงขึ้น ทั้งนี้เพื่อเป็นการบรรเทาความเดือดร้อน ทางสำนักงานเขตฯ จึงเร่งเสริมสะพานไม้ชั่วคราว เพื่ออำนวยความสะดวกให้ชาวชุมชนใช้สัญจรไปมาระหว่างช่วงน้ำขึ้น
ข้อควรปฏิบัติกับสัตว์เลี้ยงเมื่อท่านป่วยด้วยโรค COVID 19 กรณีที่ท่านเป็นเจ้าของสัตว์เลี้ยงแต่เพียงผู้เดียว และจำเป็นต้องนำสัตว์เลี้ยงไปฝากที่สถานพยาบาลสัตว์
2.น้ำมันกัญชาหยอดใต้ลิ้น 5 ml CBD
น้ำมันกัญชาหยอดใต้ลิ้น 5 ml CBD (CBD 10%W/V ( 100 mg/ml) (2.94 mg/drop))
รหัส SAS6
ส่วนประกอบ CBD 10%W/V ( 100 mg/ml) (2.94 mg/drop)
ขนาดบรรจุ 5 มิลลิลิตร/ขวด
รูปแบบของผลิตภัณฑ์ น้ำมันกัญชาหยดใต้ลิ้น
ข้อบ่งใช้
โรคและกลุ่มอาการพาร์กินสันที่ไม่ตอบสนองต่อยาแผนปัจจุบัน โรคลมชักที่ดื้อต่อยาแผนปัจจุบัน
โรคอื่นๆ ที่มีหลักฐานการใช้ว่าได้ประโยชน์และอยู่ในการพิจารณาของแพทย์ผู้ทำการรักษา
ผู้ผลิต โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ประเภทใบอนุญาต ผลิต (แปรรูปหรือสกัด) ซึ่งยาเสพติด
ให้โทษในประเภท 5
เลขที่ใบอนุญาต 10/2562
รายละเอียด
ผลิตภัณฑ์กัญชานี้ได้รับยกเว้นการรับรองต้ารับจากส้านักงาน อย. เพื่อใช้ส้าหรับผู้ป่วยเฉพาะราย ภายใต้รูปแบบพิเศษของการเข้าถึงยา ( Special access scheme ) ต้องสั่งจ่ายโดยแพทย์ที่ผ่านการอบรมหลักสูตรการใช้กัญชาและสารสกัดจากกัญชาในทางการแพทย์จากกระทรวงสาธารณสุขและต้องได้รับการยินยอมจากผู้ป่วยหรือผู้ดูแลผู้ป่วย โดยการลงนามเป็นลายลักษณ์อักษรในเอกสารแสดงความยินยอม
เทศกาลกินเจหาดใหญ่ กินเจ ถูกปาก ถูกใจ ถูกอนามัย ไร้แอลกอฮอล์ 5-14 ตุลาคม 2564
เทศกาลกินเจหาดใหญ่ ประจำปี 2564 จัดขึ้นในวันที่ 5 - 14 ตุลาคม 2564 จะจัดขึ้น ณ บริเวณสวนหย่อมศุภสารรังสรรค์ (ตรงข้ามมูลนิธิท่งเซียเซี่ยงตึ้ง) อ.หาดใหญ่ จ.สงขลา มาพร้อมมาตรการ "กินเจ ถูกปาก ถูกใจ ถูกอนามัย ไร้แอลกอฮอล์" ท่ามกลางมาตรการคุมเข้ม COVID-19 ตามข้อกำหนดและนโยบายที่ ศบค.และคณะกรรมการโรคติดต่อจังหวัดสงขลาอย่างเคร่งครัด โดยอาหารที่จำหน่ายภายในงานจะเป็นอาหารเจที่เน้นความอร่อย สดสะอาด คุณภาพดี เน้นการซื้อกลับบ้าน เทศบาลนครฯ ได้จัดให้มีการตรวจเชิงรุก Swab ด้วยชุดตรวจ Antigen Test Kit ให้แก่ แม่ค้า ผู้ประกอบการขายอาหารเจ
กิจกรรมภายในงานจะมีพิธีแห่พระประจำปีและกิจกรรมของศาลเจ้า ในวันที่ 11 ตุลาคม 2564 (ชิวลัก) เวลา 16.00 น. ณ ถนนศุภสารรังสรรค์ อำเภอหาดใหญ่ จังหวัดสงขลา
การเพิ่มศักดิ์ศรีและศักยภาพเชิงวิชาการของหมอชุมชน
การก่อตั้งราชวิทยาลัยแพทย์เวชปฏิบัติทั่วไป (Royal College of General Practitioner: RCGP)
องค์กรแรกที่มีการก่อตั้งเพื่อเพิ่มศักดิ์ศรีเชิงวิชาการให้กับหมอชุมชม (แพทย์เวชปฏิบัติทั่วไป) คือ ราชวิทยาลัยแพทย์เวชปฏิบัติทั่วไป (Royal College of General Practitioner ในช่วงแรกของการก่อตั้งมีลักษณะเป็นวิทยาลัยก่อน) ซึ่งก่อตั้งขึ้นในปี ค.ศ.1952 โดยมีวัตถุประสงค์ของการก่อตั้ง “... เพื่อส่งเสริมให้มีการพัฒนาคุณภาพ ศิลปะ ทักษะการให้บริการของแพทย์เวชปฏิบัติทั่วไป ด้วยการตั้งมาตรฐานไว้ในระดับสูง พร้อมกับสนับสนุนและช่วยให้แพทย์เวชปฏิบัติทั่วไปพัฒนาไปให้ถึง และคงมาตรฐานระดับสูงนั้นไว้... (…to improve the quality, the art, the skill of general practitioners by setting a high standard and by encouraging and
helping general practitioners to reach and maintain it…)”
ในช่วงแรกของการก่อตั้ง ผู้ที่เป็นสมาชิก (Membership: มีตัวย่อต่อท้ายชื่อว่า MRCGP) จะต้องเป็นผู้ที่มีประสบการณ์ของการเป็นแพทย์เวชปฏิบัติทั่วไปในชุมชนมาเป็นเวลาอย่างน้อย 5 ปี ต่อมาในปี ค.ศ.1965 การเป็นสมาชิกต้องผ่านการสอบ ในปีค.ศ.1967 เริ่มมีระบบของการเป็นสมาชิกที่มีผลงานดีเด่น (Fellowship: มีตัวย่อต่อท้ายชื่อว่า FRCGP) โดยการประเมินจากการเสนอขึ้นมา (Recommendations) ของสมาชิกทั่วไป จนกระทั่งตั้งแต่ ค.ศ.1989 เป็นต้นมา มีกลุ่มที่ทำการประเมิน (Assessment groups) เพื่อที่จะให้FRCGP แก่สมาชิก
ปัจจุบันราชวิทยาลัยแพทย์เวชปฏิบัติทั่วไป มีศักดิ์ศรีไม่แตกต่างไปจากราชวิทยาลัยที่สำคัญอื่นๆ เช่น ราชวิทยาลัยศัลยแพทย์ราชวิทยาลัยอายุรแพทย์ราชวิทยาลัยกุมารแพทย์และอื่นๆ
การเกิดขึ้นของภาควิชาเวชปฏิบัติทั่วไปในโรงเรียนแพทย์
การเรียนการสอนเวชปฏิบัติทั่วไป โดยเชิญแพทย์ที่อยู่ในชุมชนมาเป็นผู้สอน (Guest lecturer) ที่โรงเรียนแพทย์ และส่งนักศึกษาแพทย์ไปเรียน (ดูงาน) กับแพทย์เวชปฏิบัติทั่วไปในชุมชน อยู่คู่กับการเรียนการสอนนักศึกษาแพทย์ในประเทศสหราชอาณาจักรมานานกว่า 200 ปี
จนกระทั่งในปี ค.ศ.1956 จึงมีภาควิชาเวชปฏิบัติทั่วไปอย่างเป็นทางการแห่งแรกที่ Edinburgh Universityโดยภาควิชานี้ใช้สถานที่ที่เป็นคลินิกของแพทย์เวชปฏิบัติทั่วไปมาก่อน เป็นสถานที่ตั้งของภาควิชา จนกระทั่งในปีค.ศ.1986 จึงมีภาควิชาเวชปฏิบัติทั่วไปเกิดขึ้นในทุกโรงเรียนแพทย์ของประเทศสหราชอาณาจักร โดยที่จะมีสถานบริการที่ให้บริการปฐมภูมิที่ให้บริการโดยทีมแพทย์เวชปฏิบัติทั่วไปและทีมงาน โดยผู้ให้บริการทั้งหมดเป็นบุคลากรของโรงเรียนแพทย์
อย่างไรก็ตาม นอกจากสถานบริการปฐมภูมิที่เป็นของโรงเรียนแพทย์เป็นสถานที่สำหรับฝึกปฏิบัติงานของนักศึกษาแพทย์แล้ว คลินิกหรือสถานบริการของแพทย์เวชปฏิบัติทั่วไปที่ทำงานอยู่ในชุมชนจำนวนมาก ยังคงเป็นสถานที่ฝึกปฏิบัติงานของนักศึกษาแพทย์ด้วยเช่นกัน
3. คุณภาพบริการ
3.1 ธรรมาภิบาลทางคลินิก (Clinical governance)
กลไกคุณภาพปัจจุบันใช้หลักการ “ธรรมมาภิบาลทางคลินิก (Clinical governance)” เป็นแนวทางสำคัญ ทั้งเพื่อกำหนดมาตรฐาน ประกันคุณภาพ และพัฒนาคุณภาพบริการ โดยใช้ควบคุมสถานบริการทั้งหมดทั้งที่รับเงินผ่านและไม่รับเงินผ่าน NHS โดยมีการตั้งหน่วยงานขึ้นมาใหม่เพื่อควบคุมดูแล และกระตุ้นให้เกิดการพัฒนาคุณภาพ หน่วยงานนี้มีชื่อว่า Health Care Commission และมีทีมสนับสนุนให้เกิดกระบวนการ Clinical governance เรียกว่า Clinical governance support team
การนำแนวคิดเรื่อง Clinical governance มาใช้ ถือเป็นปฏิกิริยาที่ตอบสนองต่อเสียงสะท้อนของสาธารณะ ที่ตั้งคำถามมาอย่างต่อเนื่องถึงคุณภาพเชิงคลินิก (Clinical quality) หลังจากที่มีและทำการพัฒนา NHS มากว่า 50 ปี ซึ่งดูเหมือนว่าคุณภาพเชิงคลินิกค่อยๆ ถูกบ่อนเซาะจนกระทั่งมีผลกระทบต่อความเชื่อมั่นของสาธารณะ เหตุผลสำคัญที่เป็นประเด็นที่ทำให้เกิดการวิพากษ์วิจารณ์มากที่สุดคือ การเกิดขึ้นของความรู้สึกที่ว่า เงินเป็นเรื่องเด่นที่มีการพูดถึงหรือให้ความสำคัญมากกว่าเรื่องใดๆ มาตลอด จึงจำเป็นที่ NHS ต้องสร้างสมดุลด้วยการพัฒนาและเพิ่มคุณภาพบริการให้เห็นจนเป็นที่ประจักษ
กิจกรรมสำคัญที่เป็นกลไกทำให้เกิด Clinical governance พัฒนาขึ้นมาจากกระบวนการที่เป็นกลไกพื้นฐานเพื่อการพัฒนาคุณภาพบริการที่มีอยู่แล้ว (ดังภาพ) เช่น การตรวจสอบเชิงคลินิก
(Clinical audit), การบริหารจัดการความเสี่ยง (Risk management) และผสมผสานกับกลไกอื่นๆ เช่น เสียงสะท้อนและการร้องเรียนจากผู้ป่วยหรือผู้รับบริการ (Patient feedback and complaints) การตรวจสอบภายในองค์กร (Organisational audit) การนำตัวชี้วัดที่เป็นตัวอย่างของความสำเร็จของบางองค์กรมาใช้เปรียบเทียบระหว่างองค์กร (Benchmarking) เป็นต้น ถือเป็นการพัฒนากลไกคุณภาพเชิงกว้าง เพื่อเพิ่มการมีส่วนร่วมพัฒนาและร่วมรับรู้ของบุคลากรหรือผู้ให้บริการที่อยู่ในระบบและประชาชนทั่วไป ทั้งนี้การกำหนดเป้าหมายโดยรัฐ การพัฒนาและกำหนดมาตรฐานบริการเป็นเพียงส่วนหนึ่งของการกระตุ้นเพื่อให้เกิดการพัฒนาคุณภาพบริการ
3.2 กรอบการเชื่อมผลลัพธ์ทางคุณภาพกับการจ่ายค่าตอบแทน (Quality Outcome Framework: QOF)
QOF คือโปรแกรมที่พยายามเชื่อมคุณภาพบริการทางคลินิก กับค่าตอบแทนของแพทย์เวชปฏิบัติครอบครัว (เวชปฏิบัติทั่วไป) เริ่มต้นแบบสมัครใจตั้งแต่ปี2004 ด้วยการวัดคุณภาพออกมาเป็นคะแนน มีคะแนนเต็ม 1,000 คะแนน โดยให้ค่าตอบแทนคะแนนละ 124.60 ปอนด์ มี 135 ตัวชี้วัดที่เป็นการวัดผลการปฏิบัติงานโดยตรง และอีก 1 ตัวชี้วัดเป็นการวัดผลรวมของบริการ
ซึ่งสามารถแบ่งออกเป็นหมวด (Domains) ได้ดังนี้
- หมวดที่เป็นการวัดจากการให้บริการทางคลินิก (Clinical domain) คิดเป็น 655 คะแนน
- หมวดที่เป็นการวัดจากการจัดการในองค์กร (Organizational domain) คิดเป็น 181 คะแนน
- หมวดที่เป็นการวัดจากประสบการณ์ของผู้รับบริการ (Patient experience domain) คิดเป็น 108 คะแนน
- หมวดที่เป็นการวัดจากการให้บริการเพิ่มเติม (Additional services domain) คิดเป็น 36 คะแนน
- หมวดที่เป็นการวัดจากให้บริการแบบองค์รวม (Holistic care domain) คิดเป็น 20 คะแนน
หมวดที่เป็นการวัดจากการให้บริการทางคลินิกมี 80 ตัวชี้วัด จาก 19 clinical areas ในทางปฏิบัติมีโปรแกรมสำเร็จรูปที่ช่วยเตือนแพทย์เวชปฏิบัติทั่วไป ให้ปฏิบัติตามตัวชี้วัดดังกล่าวซึ่ง
ประกอบไปด้วย
- Coronary heart disease (10 ตัวชี้วัด)
- Heart failure (3 ตัวชี้วัด)
- Stroke and transient ischaemic attack (8 ตัวชี้วัด)
- Hypertension (3 ตัวชี้วัด)
- Diabetes mellitus (16 ตัวชี้วัด)
- Chronic obstructive pulmonary disease (5 ตัวชี้วัด)
- Epilepsy (4 ตัวชี้วัด)
- Hypothyroidism (2 ตัวชี้วัด)
- Cancer (2 ตัวชี้วัด)
- Palliative care (2 ตัวชี้วัด)
- Mental Health (6 ตัวชี้วัด)
- Asthma (4 ตัวชี้วัด)
- Dementia (2 ตัวชี้วัด)
- Depression (2 ตัวชี้วัด)
- Chronic kidney disease (4 ตัวชี้วัด)
- Atrial fibrillation (3 ตัวชี้วัด)
- Obesity (1 ตัวชี้วัด)
- Learning disabilities (1 ตัวชี้วัด)
- Smoking (2 ตัวชี้วัด)
หมวดที่เป็นตัวชี้วัดเกี่ยวกับการจัดการในองค์กรมี 43 ตัวชี้วัด จาก 5 Organisational areas ประกอบด้วย
- การบันทึกและข้อมูลข่าวสาร (12 ตัวชี้วัด)
- ข้อมูลสำหรับผู้ป่วย (4 ตัวชี้วัด)
- การศึกษาและฝึกอบรมของเจ้าหน้าที่ (8 ตัวชี้วัด)
- การจัดการในสถานบริการ (10 ตัวชี้วัด)
- การบริหารจัดการยา (9 ตัวชี้วัด)
หมวดที่เป็นการวัดจากประสบการณ์ของผู้รับบริการมี 4 ตัวชี้วัด ซึ่งเกี่ยวข้องกับกับระยะเวลาที่แพทย์ตรวจ การให้คำปรึกษาและการสำรวจความคิดเห็นของคนไข้
หมวดที่เป็นการวัดจากการให้บริการเพิ่ม มี8 ตัวชี้วัดจาก 4 กลุ่ม ประกอบด้วย
- การให้บริการตรวจหามะเร็งปากมดลูก (Cervical screening: 4 ตัวชี้วัด)
- การเฝ้าระวังสุขภาพเด็ก (Child health surveillance: 1 ตัวชี้วัด)
- การให้บริการแม่ (Maternity services: 1 ตัวชี้วัด)
- การให้บริการวางแผนครอบครัว (Contraceptive services: 2 ตัวชี้วัด)
หมวดที่เป็นการวัดจากการให้บริการแบบองค์รวม วัดจากผลรวมของทุกตัวชี้วัดในกลุ่มการให้บริการทางคลินิก เช่น ถ้าในการดูแลคนไข้ได้คะแนนสูงสุดในเกือบทุกตัวชี้วัด ก็จะได้คะแนนในหมวดนี้สูงไปด้วย
หมายเหตุ รายได้ที่เกิดจากการให้บริการตาม QOF เป็นรายได้ของสถานบริการ (Practice) ไม่ใช่รายได้ของรายบุคคล เงินที่ได้ตามกรอบ QOF นี้คิดเป็นประมาณ 20% ของเงินทั้งหมดที่แต่ละPractice จะได้รับ ถ้า Practice ไหนทำคะแนนได้น้อยกว่า 30% (น้อยกว่า 300 คะแนน) Practice นั้นจะถูกยกเลิกสัญญา ที่ผ่านมายังไม่เคยมีการยกเลิกสัญญาเนื่องจากได้คะแนนน้อย
3.3 ระบบข้อมูลสารสนเทศ (Information Technology)เพื่อควบคุมกำกับ พัฒนาคุณภาพบริการ และจ่ายเงินตาม QOF
ก่อนที่จะนำ Computer มาใช้ในการให้บริการปฐมภูมิNHS ใช้ข้อมูลที่มีการบันทึกลงในใบสั่งยาเป็นหลัก (บันทึกด้วยการเขียน) ในการนำมาวิเคราะห์ เพื่อใช้ควบคุมกำกับและประเมินผลการใช้บริการปฐมภูมิของประชาชน พร้อมกับเก็บข้อมูลแนวทางการให้บริการและการจ่ายยาของแพทย์เวชปฏิบัติทั่วไป พร้อมกับส่งกลับไปยังแต่ละสถานบริการเพื่อให้สถานบริการและผู้ให้บริการได้รับรู้
Computer เริ่มถูกนำมาใช้ในการบันทึกข้อมูลของผู้รับบริการที่สถานบริการ (Practices or Health Centres) ตั้งแต่ปี1990 (ถูกนำมาใช้เป็นเครื่องมือเพื่อการวิเคราะห์ข้อมูลก่อนหน้านี้) พร้อมกับมีการพัฒนา Software ให้มีความเหมาะสมในการบันทึกข้อมูลผู้รับบริการทุกราย จนกระทั่งในปี2004 สถานบริการทุกแห่งใช้ Computer เพื่อบันทึกข้อมูลผู้รับบริการทุกราย การพัฒนาระบบข้อมูลเพื่อจ่ายเงินตาม QOF จึงเป็นการพัฒนาขึ้นมาจากการใช้Computer บันทึกข้อมูลผู้รับบริการทุกรายดังกล่าว
ปัจจุบันการนำข้อมูลจาก Computer ของแต่ละ Health Centre ไปใช้ประโยชน์ แบ่งเป็นสองระบบใหญ่ๆ คือ 1) ระบบที่เป็นการส่งข้อมูลไปยังศูนย์ข้อมูลกลาง (Central Egton Groups: CEG) เพื่อนำข้อมูลไปใช้ประโยชน์ด้านต่างๆ ดังกล่าวมาบ้างแล้วข้างต้น เรียกระบบการใช้และการไหลเวียนของข้อมูลในลักษณะนี้ว่า Egton Medical Information Systems (EMIS) และ 2) ระบบที่เป็นการส่งข้อมูลไปยัง Primary Care Trusts (PCTs) เพื่อนำไปคิดคะแนนและจ่ายค่าตอบแทนตาม QOF เรียกการใช้และการไหลเวียนของข้อมูลในลักษณะนี้ว่า Quality Management Analysis System (QMAS)
ถึงแม้แต่ละ Health Centre อาจใช้Software ที่ต่างกันแต่ทุก Software ใช้รหัสเป็นระบบเดียวกัน เช่น การกำหนดรหัสโรค รหัสกิจกรรมการให้บริการ และอื่นๆ เหมือนกัน ดังนั้นจึงไม่มีปัญหาในการเชื่อมต่อและวิเคราะห์ข้อมูลทั้งในระบบ EMIS และQMIS
หมายเหตุ ในระบบที่เป็นการบันทึกข้อมูลที่เชื่อมกับการได้รับค่าตอบแทน (QMAS) จะมีการสุ่มตรวจเพื่อดูว่าข้อมูลที่บันทึกไปนั้นเป็นความจริงหรือไม่ ถ้าพบว่าไม่เป็นความจริง (บันทึกเพียงหวังเพื่อให้ได้ค่าตอบแทน) ผู้บันทึก (ผู้ให้บริการ) จะถูกยึดใบประกอบโรคศิลป์ หรือใบอนุญาตให้เป็นผู้ปฏิบัติงานในระบบบริการ
นักท่องเที่ยว สีฟ้า Sandbox
Thonburi Healthcare Group คำแนะนำการรับวัคซีนทางเลือก Moderna
Thonburi Healthcare Group คำแนะนำการรับวัคซีนทางเลือก Moderna
*ข้อมูล ณ วันที่ 25 สิงหาคม 2564
ความปลอดภัยและความเป็นส่วนตัว
1. ข้อมูลส่วนตัวของท่านบนระบบ Thailand Pass ปลอดภัยหรือไม่
- ข้อมูลส่วนตัวของท่านบนระบบ Thailand Pass จะได้รับการเข้ารหัสเพื่อความปลอดภัยของข้อมูล ทั้งนี้ ข้อมูลของท่านจะถูกใช้เพื่อการพิจารณาอนุมัติการเดินทางเข้าประเทศไทยของท่านเท่านั้น
2. หากมีคำถามเกี่ยวกับการลงทะเบียนบน Thailand Pass หรือการเดินทางเข้าประเทศไทย จะสามารถหาข้อมูลเพิ่มเติมได้จากที่ใด
- ท่านสามารถหาข้อมูลเพิ่มเติมได้จากเว็บไซต์ของกรมการกงสุล กระทรวงการต่างประเทศ (https://consular.mfa.go.th) หรือจากสถานเอกอัครราชทูตและสถานกงสุลใหญ่ของไทยในพื้นที่ของท่าน
- ระบบ Thailand Pass ได้รับการออกแบบให้ใช้งานได้ง่าย โดยระบบจะอธิบายวิธีลงทะเบียนให้กับท่านในแต่ละขั้นตอนเพื่อความสะดวกในการลงทะเบียนอย่างถูกต้อง
กดเลือก "ขอหนังสือรับรอง" ปุ่มสีเหลือง
คลินิกสูงวัยและความจำ โรงพยาบาลจุฬาภรณ์ LINK
โรงพยาบาลจุฬาภรณ์ เปิดให้บริการ คลินิกสูงวัยและความจำ สำหรับบริการตรวจวินิจฉัย โรคอัลไซเมอร์ ภาวะสมองเสื่อม ภาวะหลงลืมง่าย โรคทางจิตเวช โดยแพทย์ผู้เชี่ยวชาญเฉพาะด้าน การตรวจรักษาหรือสมองเสื่อมโดยตรง ขอบเขตบริการดังนี้
- ผู้ที่สงสัยภาวะหลงลืมง่ายและ/หรือการรู้คิดของสมองบกพร่องเล็กน้อย
- ผู้ที่สงสัยภาวะสมองเสื่อม ที่สามารถเดินได้เองหรือใช้เครื่องช่วยเดิน ยกเว้นผู้ป่วยหนักฉุกเฉินและ/หรือติดเตียง
- ผู้ที่สงสัยภาวะหลงลืมง่ายและ/หรือการรู้คิดของสมองบกพร่องเล็กน้อย และผู้ป่วยภาวะสมองเสื่อมในกลุ่มทีต้องการยืนยัน การวินิจฉัยโรคในทางคลินิกให้แม่นยำถูกต้องตั้งแต่ในระยะเริ่มแรก
- ผู้ป่วยภาวะสมองเสื่อมที่มีประวัติโรคสมองเสื่อมหลายคนในครอบครัว และสงสัยว่ามีการถ่ายทอดพันธุกรรมที่ผิดปกติของโรคสมองเสื่อมในครอบครัว เพื่อการประเมินในทางคลินิกทั้งในผู้ป่วยที่เป็นโรค รวมถึงบุตร และญาติที่เกี่ยวข้องทางสายเลือดโดยตรงทั้งที่สงสัยว่าเริ่มมีอาการและไม่มีอาการ
Phone: 06 4585 5189, 0 2576 6060 0 2576 6068
Service Hours : วันอาทิตย์ : 08.00 - 18.00 น.
วันเสาร์ ที่ 1 และ 3 ของเดือน : 08.00 - 18.00 น.
กดที่ช่องประเทศ เลือกประเทศไทย เพื่อเลือกดูข้อมูลโครงการทั้งหมดของไทย
*หากต้องการเจาะจงจังหวัดใดหรือเรื่องใด สามารถระบุเพิ่มในช่อง condition or disease , other terms ได้
เมืองพัทยา เชิญเที่ยวงานประเพณีลอย พัทยากลาง 19 พ.ย. LINK
เมืองพัทยาเชิญเที่ยวงานประเพณีลอยกระทงศุกร์ที่ 19 พฤศจิกายน 2564 เพื่อส่งเสริมการท่องเที่ยวเชิงวัฒนธรรม ประจำปี 2564 ณ บริเวณลานกิจกรรมพัทยากลาง โดยภายในงานท่านจะได้พบกิจกรรมมากมาย เช่น การประกวดกระทงประดิษฐ์ การแสดงศิลปวัฒนธรรมไทย วงดนตรี Sea Dog Band คอนเสิร์ตจากนักร้องเสียงหวาน ลุลา - เจ้าหญิง Bossa สอบถามรายละเอียดเพิ่มได้ที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
บรรยากาศลอยกระทงหลายจุดใน กทม. คึกคัก (The Standard) LINK
ลอยกระทง หลายจุดใน กทม. คึกคัก ประชาชน-นักท่องเที่ยว ตบเท้าเที่ยวงานตลอดคืน
หลังจากเทศกาลลอยกระทง ประจำปี 2564 ได้รับการอนุมัติให้จัดกิจกรรม ‘ลอยกระทง’ ได้ตามปกติทั่วประเทศ ภายใต้ข้อปฏิบัติตามมาตรการสาธารณสุขอย่างเคร่งครัด
ช่างภาพ THE STANDARD สำรวจพื้นที่บรรยากาศเทศกาลวันลอยกระทงประจำปี 2564 ตามแลนด์มาร์กหลักของกรุงเทพมหานคร (กทม.) พบว่า ตลอดช่วงพลบค่ำเป็นต้นมา บริเวณสวนสันติภาพ และสวนสันติชัยปราการ นับเป็นอีกสถานที่ที่ผู้คนทยอยเข้าร่วมงานอย่างคึกคัก ซึ่งมีทั้งคนในพื้นที่ รวมถึงชาวต่างชาติที่เดินทางเข้ามาท่องเที่ยว หลังประเทศไทยประกาศเปิดประเทศรับนักท่องเที่ยวต่างชาตินับตั้งแต่วันที่ 1 พฤศจิกายนที่ผ่านมา
โรงพยาบาลยุวประสาทไวทโยปถัมภ์ เปิดลงทะเบียนฉีดเข็ม 1 และเข็ม 3
โรงพยาบาลยุวประสาทไวทโยปถัมภ์ ประกาศเปิดให้บุคคลทั่วไป ลงทะเบียนรับการฉีดเข็ม 1 และเข็ม 3 (แอสตร้าเซเนก้าทั้งสองแบบ) ผ่าน QR Code เงื่อนไขดังนี้
รับเข็มที่ 1 ต้องมีอายุ 18 ปีขึ้นไป
รับเข็มที่ 3 ต้องได้รับวัคซีน ซิโนแวค หรือ ซิโนฟาร์ม ครบ 2 เข็ม เท่านั้น และมีระยะห่างอย่างน้อย 4 สัปดาห์
วันเวลาที่จะได้รับวัคซีน รพ.จะแจ้งผ่านหน้าเพจ ตรวจสอบรายชื่อได้ก่อนวันนัดรับวัคซีน อย่างน้อย 3 วัน
รพ.สมุทรปราการ เปิด walk in ฉีดวัคซีนสูตรไขว้ AZ+ PZ วันที่ 27 พย จำนวน 1,000 คน LINK
โรงพยาบาลสมุทรปราการ เปิดให้บริการ walk in ฉีดวัคซีนสูตรไขว้ AstraZenaca 1 เข็ม ตามด้วย Pfizer 1 เข็ม (4 สัปดาห์) สำหรับบุคคลทั่วไป อายุ 18 ปีขึ้นไป ไม่จำกัดภูมิลำเนา (เฉพาะคนไทยที่ยังไม่ได้รับวัคซีนใดๆมาก่อน) วันที่ฉีด 27 พฤศจิกายน 64 จำนวน 1000 คน ตั้งแต่ 7-15 น. นำบัตรประชาชนมาด้วย หากเคยติดเชื้อโควิด รักษาหาย ออกจากรพ.ครบ 1 เดือน ให้นำใบรับรองแพทย์มาด้วย
บางส่วนความคิดเห็น
ใน กทม เดินสายฉีดถึงบ้านเลย เพราะบางคนไม่สามารถเดินทางได้ ในเมื่อเขาไม่ไปหา เราก็ไปหาเขาค่ะ
รถแห่ ประกาศเลยค่ะ. บางคนเข้าไม่ถึง social media
แค่วัคซีนเข็มแรกเป็นmRNA คนก็แย่งกันมาฉีดแล้วค่ะ
ให้ฉีด
ไฟเชอร์ชิค่ะ
รับรอง เยอะแน่นอน10000000000%
กระจายวัคซีนไปยังสถานพยาบาลทีประชาชนเข้าถึงง่ายค่ะ/อสม.นำไปฉีดให้ถึงทีบ้านเลยค่ะ
ขอประสิทธิภาพวัคซีนที่ดี เพื่อประชาชนจะได้ไม่กลัว
ให้เขาเลือกวัคซีนที่เขาอยากฉีดได้ และฉีดที่ไหนก็ได้ใกล้บ้าน แค่นี้เขาก็เปิดใจแล้ว
เลิกฉีดไขว้ เลือกวัคซีนได้ ลดความแออัดจุดฉีด
ตรวจหาภูมิฟรีสำหรับคนที่ฉีดครบ 2 เข็ม และเมื่อภูมิตก มีสิทธิ์เลือกรับเข็มที่ 3 ได้ตามที่อยากได้
ดูจังหวัดบุรีรัมย์ครับ ว่าทำไมเขาภึงฉีดไฟเซอร์เข็มแรกได้ และถามกลับครับว่าทำไมจังหวัดใหญ่อย่างเราถึงทำไมไม่ได้
ไฟเซอร์+ไฟเซอร์ จะรีบไปเลยค่ะ
กระจายไปอนามัย สะดวกในการเข้าถึง และเดินทาง
ให้หน่วยงานเข้าไปฉีดแต่ละหมู่บ้านเลยค่ะฉีดที่ละหมู่บ้านมีกี่คน..คราวนี้ก็สำรวจใด้ว่าแต่ละตำบลแต่ละอำเภอฉีดกันครบหรือยัง....ชาวบ้านจะได้ใม่ต้องมาเข้าคิวเข้าแถวให้แออัดด้วย
walk in รพ.ใกล้บ้าน/รพ.สต. ได้หมดคะ
ให้รพ.ซมร ที่จอง Moderna ไว้ คืนเงินสิ่คะ หลายพันคนติดอยู่ตรงนี้ค่ะ
ไฟเซอร์ โมเดอน่า จะรีบไปด่วนนนน
เลิกฉีดไขว้ค่าาาาา
เขากลัวคะฉีดวัคซีนแล้ว น๊อตขึ้นมาไม่มีใครรับผิดชอบ ที่ฉีดแล้วเสียชีวิตก็มี ก็ไม่มีใครออกมาพุด เพราะไม่มีประโยชน์
เลิกไขว้สูตรทิพย์จ้าา ไฟเซอร์ โมเดอร์น่าทั้งสองเข็มเค้าก็แห่ไปฉีดกันแล้ว
เลิกไขว้และเอาซิโนแวคออกไปค่ะ
มีจัดตามหมู่บ้านห่างไกลค่ะ
เพราะเค้าไม่ต้องการสูตรไขว้ไงคะ
กระจายการฉีดวัคซีนไปตามรพ.สต.ให้มากขึ้น และให้ของสมนาคุณ เช่น ชุดยาสามัญประจำบ้าน ปฏิทินปีใหม่ ข้าวสารอาหารแห้ง แก่ผู้เข้ารับบริการฉีดวัคซีนครับ
อยากให้มีทางเลือกในการฉีดวัคซีนครับคือเราสามารถเลือกวัคซีนที่จะฉีดเองได้
อย่างเช่นไฟเซอร์หรือโมเดอร์น่า คนที่จะมาฉีดจะได้มั่นใจ
ในประสิทธิภาพของวัคซีน
ที่ผ่านมาหลายคนที่ฉีดวัคซีน
สูตรไขว้ แล้วมีผลข้างเคียงตามมาอาจจะทำให้หลายคนที่ติดตามข่าวเกิดความกลัวหรือกังวลไม่เชื่อมั่นในประสิทธิภาพของวัคซีน เลยไม่กล้าที่จะมาฉีด
ง่ายๆครับ
1.กระจายหน่วยฉีด ให้มากเท่าที่จะทำได้ ในแต่ละโซน
2. SV AZ ลืมไปเถอะ ณ.เวลานี้ pfz ให้เป็นเข็มแรก เข็มสอง เข็มสาม
ถ้าทำได้สองข้อนี้ รับรองวัคซีนเต็มแขนคนโคราชไวแน่นอน
ถ้าให้ดีลงประกาศทั่วประเทศ ใครๆ walkin มาได้ เป็นส่งเสริมการท่องเที่ยวโคราชไปในตัว
ลดเงื่อนไข ที่มากมาย ให้เหลือ แค่ ประชาชนทั่วไปอายุตั้งแต่ 12 ปีขึ้น สามารถ walk in ฉีด pfizer เข็ม 1 ได้ตั้งแต่วันนี้
และ ผู้ที่เคยได้รับ astra เข็ม 1 ไม่ว่าช่วงเดือนไหนก็ตาม เข็ม 2 จะต้องเปลี่ยนเป็น pfizer ทั้งหมด
ผมว่า ทางโรงพยาบาล รับรู้ปัญหาและสาเหตุดี แต่ ไม่แก้ไข เพราะอะไรอันนี้ผมไม่ทราบ แต่ผมคิดว่า ทางโรงพยาบาล น่าจะทราบดี
ผมเดาว่า ที่ทางโรงพยาบาล โพสข้อความนี้ เพื่อต้องการความเห็นประชาชน แล้วจะแคป ข้อความ หรือคอมเมนท์ ต่างๆ ไปเข้าที่ประชุม
เข็มแรกไปทำธุระที่บุรีรัมย์ ฉีดที่สนามช้าง พอเข็ม2จะฉีด ที่ เซ็นทรัลโคราช โดนไล่ให้กลับไปฉีด บุรีรัมย์ เลยฉีด ครบ3เข็ม บุรีรัมย์ ทั้งๆเป็นคนโคราช ทะเบียนบ้านก็อยู่โคราช ขั้นตอน ของโคราชยุ่งยาก ซับซ้อน เรื่องมาก บุรีรัมย์ ไม่ยุ่งไม่ถาม ไปดูงานเขาซิครับ
บุรีรัมย์ ได้ไฟเซอร์ กันหมดแล้วววววว
ฉีดครบ 2 เข็ม รับคูปองชิงโชค แจกมอเตอร์ไซค์
อยากเลือกวัคซีนได้ค่ะ azผลข้างเคียงจากเข็มแรกหนักมาก กลัว การไปฉีดเข็ม2 มากเลย นี่กะจะเท แล้ว ที่เหลือกเข้ม2เป็นazเพราะไม่อยากไขว้ แต่เข็มแรก ทรมานมาก
ให้ประชาชนมีสิทธิ์ที่จะเลือกรับวัคซีนที่ประชาชนแต่ละคนต้องการ และวัคซีนน่าจะต้องไปหาประชาชนมากกว่าที่จะให้ประชาชนเข้ามาหาวัคซีน เช่น บ้างพื้นที่มี อบต. ก็น่าจะจัดเป็นจุดรับวัคซีนประจำตำบล เพื่อลดประชากรที่มาเข้ารับวัคซีนไม่ให้แออัดจนเกินไป ผมว่าก็โอเคนะ
1.ควรให้ประชาชนเลือกวัคซีนเองได้
2.ให้คนที่ฉีดแล้วช่วยกันให้ข้อมูล สำหรับผู้ที่กำลังตัดสินใจฉีด
3.การเยียวยาเรื่องผลข้างเคียงจากวัคซีน ซึ่งตรงนี้เป็นจุดที่หลายคนกลัวที่จะฉีดเพราะกรณีเสียชีวิตก็จะมุ่งไปที่โรคประจำตัว
ต้องเป็น pfizer ค่ะ เป็นวัคซีนดีๆไปเลย ไม่ต้องมีเงื่อนไขมากมาย ประชาชนทั่วไป ตั้งแต่อายุ12ปีขึ้นไป ฉีดได้ทุกคน แบบนี้ยังไงก็ฉีดค่ะ
ลองทำแบบบุรีรัมย์ดูน่ะคะ PZได้หมดไม่มีข้อแม้ เชื่อเถอะคะชาวโคราชจะมาฉีดจนหมอไม่ว่างกินข้าวแน่นอน ??? โคราชเมืองใหญ่มากกก น่าจะทำออกมาได้ดี
เอาวัคซีนไฟเซอร์มาเป็นเข็มแรก แล้วประชาสัมธ์ทางฝ่ายปกครองทุกอำเภอ
ลงตามหมู่บ้าน เพราะหลายคนเดินทางลำบาก
ล็อตเตอรี่สักใบ
คนสูงอายุ ที่ลูกหลานต้องไปทำงานไกล คนยากจน คนที่ยังเข้าไม่ถึงการสื่อสาร ยังมีอีกเยอะ ใช่ว่าเขาไม่ยอมฉีด แต่ด้วยความลำบากยากจนบางครั้งแม้เอกสารประจำตัวยังหาไม่เจอ ถ้าจะมานั่งรอให้คนเหล่านี้มามาให้ฉีด ก็คงยากครับ ต้องใช้วิธีให้ผู้ใหญ่บ้าน อบต. สำรวจจำนวนคนที่ยังเข้าไม่ถึง แล้วจัดรถ mobile ลงไปในแต่ละพื้นที่ อาจต้องมีรถรับส่งคนเฒ่าคนแก่ ผู้พิการมายังจุดฉีด เหมือนขนคนไปลงคะแนนแม้ผิดกฎหมายยังทำกันได้เลย การดูแลคนยากลำบากมันต้องคิดให้ครบว่าอุปสรรคของพวกเขาเหล่านั้นมีอะไรบ้าง มันไม่ได้อยากเย็นอะไรเลยจริงๆ นะ ถ้าจะทำนะ ขอกราบอนุโมทนาล่วงหน้าด้วย
ไม่อยากไปคอยคิวนานๆมาก
ทิ้งชิโนแวค เลิกไขว้ ไม่บังคับ
อายุต่ำกว่า 40ปี มี pf / md ให้เลือก
อายุเกิน 40ปี pf /md /az แล้วแต่จะเลือก
กลัวผลข้างเขียงการฉีดซิโนแวคเข็มแรก
เคาะประตูทุกบ้านเลยค่ะ
คิดว่าต้องกระจายข่าวสารให้ผู้น้ำชุมทราบค่ะโดยมีการให้ความรู้และประโยชน์ของการรับวัคซีน และหากไม่รับจะได้รับความเสี่ยงยังไง . ปัจจัยการเดินทางอาจมีส่วนค่ะ ถ้าซัพพอร์ตเรื่องนี้ได้โดยวิธีต่างๆ เช่น ขอความร่วมมือจากรถทหาร (ถ้าทำได้) ก็น่าจะมีส่วนกระตุ้นมากขึ้น .
เลิกเอาชิโนแวคมาฉีดครับ
เอาไรมาให้เขาฉีด กุไป ฉีด วอค อิน เขม แแรก ไฟเซอร บัตร ประชาชน ใบเดียว บุรีรัมย์
ให้ผู้ใหญ่บ้าน หรือ อสม.ประจำหมู่บ้าน ออกสำรวจคนที่ยังไม่ได้ฉีดวัคซีนโควิดแล้ว นัดหมายวันฉีด ถ้ามีคนป่วยติดเตียงก็ไปฉีดให้ที่บ้าน ให้คุณหมอประจำอำเภอ เข้าไปฉีดวัคซีนให้ในแต่ละหมู่บ้าน อาจใช้สถานที่โรงเรียนหรือวัด ก็ได้ค่ะ
จริงคะเคาะประตูบ้านค่ะ เราคนหนึ่งและยังไม่ได้สักเข็ม
เข้าใจว่ารพ.ก็ต้องทำตามกระทรวง แต่ก่อนจะถามกลยุทธ์ทางรพ.ต้องบอกมาก่อนค่ะว่ามีข้อจำกัดอะไรบ้าง ทำอะไรได้ ทำอะไรไม่ได้ มีวัคซีนกี่ชนิดและจำนวนเท่าไหร่ ต่อให้เสนอกลยุทธ์ไปแต่ทำตามไม่ได้ก็เปล่าประโยชน์
ปล.ที่ตปท.มีแจกเงิน บุรีรัมย์มีแจกเสื้อบอล/ตั๋วบอล โคราชจะแจกอะไรคะ
อังกฤษสั่งแบน 6 ประเทศแอฟริกา LINK
รัฐมนตรีสาธารณสุขของอังกฤษ ซายิด จาวิด ทวีตเมื่อเช้ามืดวันที่ 26 พ.ย.ว่า ทางการอังกฤษกำลังสืบสวนไวรัสกลายพันธุ์ตัวนี้อยู่ ข้อมูลยังมีไม่มาก ทางการจึงต้องเฝ้าระวัง
ตั้งแต่พรุ่งนี้ (26 พ.ย.) เที่ยงวันเป็นต้นไป 6 ประเทศแอฟริกาจะถูกจัดไปอยู่กลุ่มประเทศสีแดง มีผลให้เที่ยวบินที่มาจากประเทศเหล่านี้จะถูกห้ามบินเข้าชั่วคราว และชาวอังกฤษที่เดินทางจากประเทศเหล่านั้นจะต้องถูกกักตัว
ทั้ง 6 ประเทศประกอบด้วย แอฟริกาใต้ เลโซโท บอตสวานา นามิเบีย เอสวาตินี และซิมบับเว ตั้งแต่ 4 น. เป็นต้นไป
รมต.สธ.ระบุเพิ่มเติมว่า ยังไม่พบผู้ป่วยจากสายพันธุ์นี้ในอังกฤษ
มาตรการประเทศในยุโรป LINK
เดนมาร์ค ประกาศห้ามการเดินทางที่ไม่จำเป็นไปยังแอฟริกาใต้ และหลายประเทศแถบนั้น หน่วยงานสาธารณสุขของประเทศระบุได้ทำการตรวจเคสโควิดทั้งหมดและไม่พบไวรัสสายพันธุ์ใหม่
กรีซ จำกัดผู้เดินทางจากกลุ่มประเทศแถบแอฟริกาใต้ จะอนุญาตเฉพาะกรณีจำเป็นและต้องมีผลตรวจเป็นลบเท่านั้น ผู้ที่เดินทางจาก แอฟริกาใต้ บอตสวานา ซิมบับเว นามิเบีย เลโซโธ เอสวาตินี โมซัมบิค และมาลาวี จะต้องกักตัวและตรวจหาเชื้อ 2 ครั้งคือเมื่อมาถึงและวันที่ 10
อิตาลี ประกาศห้ามการเดินเข้าประเทศ สำหรับผู้ที่อยู่ใน แอฟริกาใต้ เลโซโธ บอตสวานา ซิมบับเว โมซัมบิค นามิเบีย และ เอสวาตินี ในช่วง 2 สัปดาห์ที่ผ่านมา รัฐมนตรีสาธารณสุขระบุว่า กำลังทำการศึกษาไวรัสตัวใหม่นี้อยู่ และจะดำเนินมาตราเฝ้าระวังในระดับสูงสุด
ฝรั่งเศส ประกาศห้ามเที่ยวบินจากกลุ่มประเทศแถบแอฟริกาตอนใต้ เป็นเวลา 48 ชั่วโมง
สาธารณรัฐเชค ประกาศห้ามกลุ่มประเทศแถบแอฟริกาตอนใต้ รวมถึงพลเมืองประเทศใดก็ตามที่เคยไปยังประเทศเหล่านั้นในรอบ 12 ชั่วโมง และได้เพิ่มประเทศ "แซมเบีย" เป็นอีก 1 ประเทศในต้องห้ามด้วย มาตรการนี้มีผลวันเสาร์ที่ 27 พ.ย.
สเปน ประกาศจะจำกัดเที่ยวบินจากเพียง 2 ประเทศ คือ แอฟริกาใต้และบอตสวานา "ขณะนี่เฝ้าระวังประเทศอื่นๆ ด้วย" ตามคำแถลงของรัฐมนตรีสาธารณสุขสเปน แคโรลิน่า ดารีอาส
สวิตเซอร์แลนด์ สั่งห้ามเที่ยวบินจากแอฟริกาใต้และประเทศในภูมิภาคเดียวกัน
รัสเซีย ประกาศจำกัดการเดินทางของชาวต่างชาติจากประเทศแอฟริกา และฮ่องกง มีผล 28 พ.ย. ไม่พบรายงานผู้ติดเชื้อชนิดใหม่ในรัสเซีย
ยีนของไวรัสโคโรนา 2019 ที่ชุดตรวจ PCR นิยมใช้เป็นเป้าหมายในการออกแบบตัวตรวจตาม (PCR primer) มีหลายยีน เช่น M,N,S,E,Orf1ab, RdRp, Orf8, และ Nsp2 (ภาพ บน)
อบจ.ลพบุรี LINK
องค์การบริหารส่วนจังหวัดลพบุรี ร่วมกับ เหล่ากาชาดจังหวัดลพบุรี ในสังกัดสภากาชาดไทย สำนักงานสาธารณสุขจังหวัดลพบุรี และสำนักงานจังหวัดลพบุรี ได้ดำเนินการฉีดวัคซีน "โมเดอร์น่า" ให้กับกลุ่มเป้าหมายผู้พิการ ผู้ป่วยติดเตียงและผู้สูงอายุ 70 ปีขึ้นไป ตามโครงการป้องกันและควบคุมโรคติดต่อไวรัสโคโรนา 2019 (Covid - 19) ด้วยวัคซีน "Moderna" ระหว่างวันที่ 15 -19 พฤศจิกายน 2564 จำนวน 800 คน แบ่งเป็น เขตพื้นที่
1) อำเภอเมือง
2) อำเภอพัฒนานิคม
3) อำเภอ โคกสำโรง
4) อำเภอชัยบาดาล
5) อำเภอท่าวุ้ง
6) อำเภอบ้านหมี่
7) อำเภอท่าหลวง
8 ) อำเภอสระโบสถ์
9) อำเภอโคกเจริญ
10) อำเภอลำสนธิ
11) อำเภอหนองม่วง
โดยโครงการดังกล่าวสำเร็จลุล่วงไปได้ด้วยดี
เจ้าชายวิลเลี่ยม
อายุ 38 ปี ผลตรวจโควิดเป็นบวก ช่วงเมษายน แต่ไม่เปิดเผยต่อสาธารณะ เพราะพระองค์ "เกรงว่าจะทำให้เกิดความกังวลกัน" เป็นช่วงเวลาเดียวกันที่พระบิดาคือเจ้าฟ้าชายชาลส์ ก็มีผลตรวจว่าติดโควิดเช่นกัน
หนองคายได้โควต้าโมเดอร์นาบริจาค 5,370 โดส walk in รับได้ 28-30 พ.ย.
สสจ.หนองคาย ประกาศเชิญชวนฉีดโมเดอร์นาบริจาค 5,370 โดส walk in รับได้ 28-30 พ.ย. สำหรับประชาชนอายุ 18 ปีขึ้นไแ และสตรีมีครรภ์ ขอหนังสือรับรองฉีดวัคซีนแล้ว - จะไปต่างประเทศ LINK
ติดต่อ สสจ. หนองคาย โทร 042-413354 ต่อ 136
หนังสือรับรองใช้เวลาออกเล่ม 5 วัน
ต้องยื่นเอกสารในวันเวลาราชการ
เอกสารที่ใช้
บัตรประชาชน ตัวจริง+สำเนา 1 ชุด
หนังสือเดินทาง ตัวจริง+สำเนา 1 ชุด
เอกสารรับรองการฉีดวัคซีน
เอกสารยืนยันการจะต้องไปต่างประเทศ
ค่าธรรมเนียม 50 บาท
ศูนย์ปฏิบัติการตอบโต้ภาวะฉุกเฉิน COVID-19 จังหวัดอุบลราชธานี LINK
ศูนย์ปฏิบัติการตอบโต้ภาวะฉุกเฉิน COVID-19 จังหวัดอุบลราชธานี
โทร 09-6693-2139
โทร 09-6937-1783
ทุกวัน ระหว่างเวลา 08.30 - 16.30 น.
สอบถามข้อมูลการจองวัคซีนเพิ่มเติมได้ที่
โทร 08-2648-9270
โทร 045-244801-111
ทุกวันจันทร์-วันศุกร์ ระหว่างเวลา 08.30 - 16.30 น.
หรือสามารถลงทะเบียนฉีดวัคซีน COVID-19
ผ่านทาง
รพ.ที่ท่านรักษาอยู่ / สถานพยาบาลใกล้บ้าน
เดินทางเข้าเลย ปฏิบัติดังนี้
ลงทะเบียนแอปไทยชนะ
รายงานตัวต่อเจ้าพนักงาน/กำนัน/ผู้ใหญ่บ้าน/จนท.สธ./อสม.
รายงานตัวทางโทร.
ต้องการโหลดใบรับรองการได้รับวัคซีนโควิด-19 LINK
ผู้ที่ต้องการดาวน์โหลดใบนัดฉีดวัคซีนเข็ม 2
และใบรับรองการได้รับวัคซีนโควิด-19
สามารถดาวน์โหลดได้ทาง BRH Connect
หากพบปัญหาในการดาวน์โหลดข้อมูล
ติดต่อได้ที่ 044-615002 (ในวันและเวลาราชการ)
เรียกเราว่า โอไมครอน หรือ โอมิครอนก็ได้ แล้วแต่เธอ
โรคอัลไซเมอร์หรือโรคสมองเสื่อม เป็นปัญหาสุขภาพที่สามารถเกิดได้จากหลายสาเหตุ โดยระยะหลังเราเริ่มพบอาการความจำเสื่อมในผู้ป่วยที่มีอายุน้อยลง และผู้ป่วยหลายคนมาพบแพทย์ในช่วงที่มีอาการมากแล้ว ทั้งนี้เนื่องมาจากการแสดงอาการของโรคจะเป็นไปอย่างช้า ๆ เพราะมีระยะเวลาก่อโรคนานถึง 15 – 20 ปี จะดีกว่าไหมถ้าเราสามารถรับรู้และป้องกันภาวะโรคอัลไซเมอร์ก่อนที่จะสายเกินแก้
ด้วยสุดยอดนวัตกรรมอย่างเครื่อง PET Scan ที่สามารถยืนยันความผิดปกติของสมองผ่านกระบวนการวินิจฉัยที่รวดเร็ว ทำให้ผู้ป่วยสามารถรู้ตัวล่วงหน้าว่าตัวเองมีความเสี่ยงหรือไม่ เพื่อวางแผนปรับพฤติกรรมการดำเนินชีวิต ลดความเสี่ยงภาวะสมองเสื่อมตั้งแต่เนิ่น ๆ
ศูนย์สมองและระบบประสาท
Bangkok International Hospital
โทร. 02 310 3011 หรือ 1719
จากข่าวล่าสุดและเป็นกระแสทั่วโลกตอนนี้ เรื่องโคโรนาไวรัสสายพันธุ์ใหม่ "โอไมครอน" (Omicron) ซึ่งเพิ่งถูกค้นพบและได้รับการยืนยันอย่างเป็นทางการจากองค์การอนามัยโลก(WHO) เป็นที่เรียบร้อยว่า เป็นไวรัสโควิด-19 กลายพันธุ์ชนิดที่ 5 และถูกจัดให้เป็นเรื่องที่ "น่ากังวล" เนื่องจากยอดผู้ติดเชื้อสายพันธุ์นี้พุ่งสูงขึ้นในทวีปแอฟริกาใต้ และตรวจสอบพบแล้วในประเทศอื่นๆ ทั้งทางยุโรป ร่วมเอเชียด้วยเช่นกัน
คาดการณ์ว่า มีการเปลี่ยนแปลงทางพันธุกรรม หรือ ผลกระทบที่เกิดขึ้นจากลักษณะของไวรัส เช่น การส่งผ่านเชื้อโรค, ความรุนแรงของโรค, การหลบหลีกภาวะภูมิต้านทานของร่างกาย, การวินิจฉัยโรค หรือ การหลบหลีกการบำบัดรักษา **(เนื่องด้วยเป็นสายพันธุ์ที่พึ่งถูกค้นพบ อาจจะมีข้อมูลเปลี่ยนแปลงได้ตลอดเวลา) ซึ่งนักวิจัยก็คงดำเนินการหาข้อพิสูจน์จนถึงตอนนี้ และจากหลักฐานเบื้องต้น พบความเสี่ยงที่อัตราการติดเชื้อจากสายพันธุ์นี้จะสูงขึ้น มากกว่าสายพันธุ์อื่นๆ อีกด้วย แต่อย่างไรทาง WHO ก็ระบุว่า ต้องใช้เวลาอีก 2-3 สัปดาห์ จนกว่าจะทราบถึงผลกระทบของโควิดสายพันธุ์นี้ ถึงจะออกมาประกาศอีกครั้ง
และเนื่องจากวัคซีนที่เราไปฉีดไปแล้วก็น่าจะช่วยปกป้องเราได้ในระดับหนึ่ง แต่นอกเหนือจากนั้น
ทางโรงพยาบาลสินแพทย์ เสรีรักษ์ ก็อยากให้ทุกคน สวมหน้ากาก, หลีกเลี่ยงการเข้าไปอยู่ในที่คนเยอะๆ, ล้างมือบ่อยๆ เว้นระยะห่างต่อไป เพื่อความปลอดภัยของตนเองและบุคคลรอบข้างค่ะ
กรณีจัดงานมีผู้ร่วมงานเกิน 1,000 คน
มาตรการเข้าจังหวัดน่าน ผ่านจุดผ่านแดนห้วยโก๋น อ.เฉลิมพระเกียรติ
มาตรการเข้าจังหวัดน่าน ผ่านจุดผ่านแดนห้วยโก๋น อ.เฉลิมพระเกียรติ
- ลงทะเบียน "น่านปลอดภัย" ก่อนเดินทาง 4 ชั่วโมง มาแสดง ณ ด่านตรวจ
- รายงานตัวใน 24 ชั่วโมง ณ เทศบาลน่าน/สสอ.เมืองน่าน/ผู้ใหญ่บ้าน/อสม./เจ้าของห้องพัก
- กักตัวเอง 14 วัน ในบ้านหรือที่พัก/โรงแรม
- ส่งผลตรวจโควิด ภายใน 3-5วัน
ติดต่อสื่อสารโควิดน่าน 054-719623-6 ต่อ 312, 313 โทร 084-2128070, 062-3321073 (วัคซีน)
กลุ่มเด็กเล็ก อายุ 0-5 ปี
กลุ่มเด็กเล็ก อายุ 0-5 ปี มีสิทธิประโยชน์รับบริการดังนี้ ฉีดวัคซีนป้องกันวัณโรค ตับอักเสบบี บาดทะยัก คอตีบ ไอกรน โปลิโอ เยื่อหุ้มสมองอักเสบ อุจจาระร่วงจากเชื้อไวรัสโรต้า หัด หัดเยอรมัน คางทูม ไข้หวัดใหญ่และไข้สมองอักเสบเจอี ตรวจเลือดคัดกรองภาวะพร่องไทรอยด์ (โรคเอ๋อ) ภาวะโลหิตจาง การติดเชื้อเอชไอวี ชั่งน้ำหนักวัดส่วนสูงเพื่อติดตามการเจริญเติบโต ตรวจคัดกรองพัฒนาการ ตรวจช่องปากและฟัน เคลือบฟลูออไรด์ การให้ยาไทรอกซินป้องกันภาวะพร่องไทรอยด์ ยาบำรุงเสริมธาตุเหล็ก ยาต้านไวรัสเอชไอวี สมุดบันทึกสุขภาพ/บันทึกพัฒนาการ และแว่นตาหากมีภาวะสายตาผิดปกติ
Zone : 1 ไขรหัสสุขภาวัฒนะ
โซนนี้จะต้อนรับคุณด้วยผนังที่ตกแต่งด้วยการฉลุอย่างสวยงามพร้อมกับฉายวีดิทัศน์สุขภาวัฒนะ
ทำไม? Plant-based Food จึงเป็นโอกาสทองของธุรกิจอาหาร
หากพูดถึงแรงผลักดันที่ทำให้กระแส Plant-based Food กลายเป็นเทรนด์แรงระดับโลก เชื่อว่ามาจาก 3 ประเด็นหลักๆ ดังนี้
1. ผู้บริโภคให้ความสำคัญกับสุขภาพมากขึ้น
ทุกวันนี้จะเห็นได้ว่า ผู้บริโภคให้ความสำคัญกับการเลือกบริโภคในสิ่งที่ดีต่อสุขภาพมากขึ้นเรื่อยๆ ด้วยการหันมาบริโภคพืชผักผลไม้มากขึ้น ในขณะเดียวกันก็พยายามที่จะลดการบริโภคเนื้อสัตว์ลง เพราะความกังวลด้านสุขภาพ เนื่องจากความเจ็บปวยที่เกิดจากการบริโภคอาหารจากเนื้อสัตว์นั่นเอง อีกทั้งการแพร่ระบาดของไวรัส COVID-19 ยิ่งทำให้คนตื่นตัวและเลือกรับประทานอาหาร
ที่สะอาด ปลอดภัย ตลอดจนลดการบริโภคเนื้อสัตว์ลง เพราะมองว่าอาจเป็นที่มาของการแพร่เชื้อนั่นเอง ยกตัวอย่าง ผู้บริโภคในสหรัฐอเมริกามีถึง 23 เปอร์เซ็นต์ที่เลือกบริโภคอาหารจากพืชมากขึ้นในช่วงการระบาดของ COVID-19
2. แรงหนุนจากเทรนด์รักษ์โลกใส่ใจสิ่งแวดล้อม
ไม่เพียงแต่กระแสรักสุขภาพที่เป็นตัวกระตุ้นทำให้ตลาด Plant-based Food ขยายตัวในเวลาอันรวดเร็ว ผู้บริโภคที่ตระหนักถึงสวัสดิภาพสัตว์ (Animal Welfare) และคำนึงถึงผลกระทบต่อสิ่งแวดล้อม ถือเป็นอีกกลุ่มก้อนใหญ่ที่ช่วยออกแรงผลักดันทำให้เทรนด์ Plant-based Food ติดลมบนด้วยเช่นกัน ทั้งนี้ หากดูผลกระทบจากการผลิตอาหารที่มีต่อสิ่งแวดล้อม จะพบว่าผลิตภัณฑ์จากสัตว์ส่งผลกระทบต่อสิ่งแวดล้อมมากกว่าผลิตภัณฑ์จากพืช อีกทั้ง การผลิตและบริโภคเนื้อจากพืช ยังช่วยลดโลกร้อนได้ด้วย เนื่องจากกระบวนการผลิตเนื้อจากพืชนั้นจะปล่อยก๊ซเรือนกระจกน้อยกว่ากระบวนการผลิตเนื้อสัตว์จริง 30-90 เปอร์เซ็นต์ นั่นจึงทำให้เชื่อว่า การบริโภคเนื้อจากพืชจะช่วยลดโลกร้อนนั่นเอง
นอกจากนี้ ประเด็นในเรื่องของ Food Security หรือความมั่นคงทางด้านอาหาร นับเป็นอีกปีเหนึ่งที่ถูกหยิบยกขึ้นมาพูดถึงในวงกว้างมากขึ้น และคนเริ่มตระหนักในเรื่องนี้อย่างจริงจัง
เพราะจากประมาณการจำนวนประชากรโลกในอีก 30 ปีข้างหน้า ซึ่ง UN คาดว่าประชากรโลกจะเพิ่มขึ้นเป็น 9.7 พันล้านคนในปี 2050 จะยิ่งมีผลกระทบต่อ Food Security ในอนาคตทำให้ Plant-based Food ยิ่งมีความจำเป็น เพราะจะเป็นทางเลือกหนึ่งในการแก้ปัญหา Food Security
โซน 1 นวัตกรรมกัญชาไทย
เริ่มต้นโซน 1 ด้วยนวัตกรรมกัญชาไทย สินค้า บริการและเทคโนโลยีใหม่ๆ กำลังค่อยเติบโตไปในอุตสาหกรรมกัญชาประเทศไทย
Cannabis Excellent
Cannabis Excellent ต้อนรับผู้เข้าเยี่ยมชมงานด้วยนวัตกรรมและผลิตภัณฑ์จากกัญชา กัญชง กระท่อม ต้องบอกว่าสินค้าเหล่านี้เริ่มมีมากและหลากหลายขึ้น และตลาดจะต้องคึกคัก
กองพัฒนายาแผนไทยและสมุนไพร จัดเต็มด้วยตัวอย่างสินค้าต้นแบบน่าสนใจหลายตัวทีเดียว และเจ้าของ 3 ตำรับน้ำมันกัญชา ที่จ่ายให้ในคลินิกกัญชาทางการแพทย์ทั่วประเทศ
ตัวอย่างผลิตภัณฑ์เครื่องสำอางค์ สูตร CBD กัญชง
ผลิตภัณฑ์เครื่องสำอางค์ สารสกัด กัญชา กัญชง
Hotline
โทร 043 019 760 ต่อ 128-130
รายที่ 10131 นักเรียนหญิง อายุ 16 ปี อยู่อ.นามน 12 และ 17 ธันวาคม ไปร้านคิกคาปู้
รายที่ 10131 นักเรียนหญิง อายุ 16 ปี อยู่อ.นามน
12 ธันวาคม 22-23 น. ไปกินข้าวที่ร้านคิกคาปู้ กับพี่สาว และเพื่อนอีก 3 คน จากนั้นกลับห้องพัก
17 ธันวาคม 22-23 น. ไปตลาดโรงสี กับพี่สาว 2 คน ไปร้านคิกคาปู้บาร์ สวมหน้ากากตลอดเวลา กลับห้องพักเวลา 23 น.
20 ธันวาคม 13 น. เป็นต้นไป ไปหาเพื่อน ที่เป็นผู้ป่วยยืนยัน ที่ห้องพัก
23 ธันวาคม มีอาการ ไอ เจ็บคอ มีเสมหะ
24 ธันวาคม ผู้ป่วยกับพี่สาวไปตรวจคัดกรอง ATK ผลเป็นบวก จึงไปตรวจ RT-PCR ที่รพ.นามน
25 ธันวาคม ผลตรวจ RT-PCR ยืนยันติดเชื้อโควิด รักษาที่รพ.นามน
นอกจากนี้การให้บริการกลุ่มโรงพยาบาลมีการแข่งขันค่อนข้างสูง โรงพยาบาลวิมุตต้องการสร้างความแตกต่าง โดยยึดหลักพื้นฐานการดูแลรักษาด้วยความใส่ใจ และเป็นโรงพยาบาลสำหรับทุกคน (People Hospital) เป็นจุดยืน โดยยึดหลักแนวคิด ความเข้าใจในผู้คน ผู้ป่วยเป็นสำคัญ ตลอดจนถึงการให้บริการของทีมแพทย์และบุคลากรที่มีประสบการณ์ ทำงานร่วมกันเป็นทีม ตลอดจนกำหนดแนวทางการปฏิบัติหาแนวทางการรักษาที่มีประสิทธิภาพ ในราคาที่เข้าถึงได้
ดังนั้นเพื่อการตอบโจทย์การใช้ชีวิตของผู้บริโภคมากขึ้น แคมเปญ “ของหวานไกลเบาหวาน” ถือเป็นการทำงานที่ท้าทายมากสำหรับธุรกิจโรงพยาบาล ที่แบรนด์แสดงให้เห็นถึงความเข้าใจปัญหา pain point และ ความต้องการของผู้ป่วยเบาหวานโดยตรง ซึ่งปัญหาหลักของผู้ป่วยเบาหวาน คือเบาหวานเป็นโรคเรื้อรัง ต้องเลือกต้องใช้ความระมัดระวังเป็นอย่างมากในการรับประทานอาหาร และที่สำคัญความกังวลที่กลายเป็นความกลัวที่จะนำไปสู่ปัญหาสุขภาพอื่น ๆ ที่ร้ายแรง ในบางกรณีกังวลมากจนมีผลทั้งสุขภาพกายและจิตใจ ทำให้เป็นทุกข์
ดังนั้นโจทย์นี้ จึงเป็นโอกาสที่ดีให้กับโรงพยาบาลวิมุตแสดงความเชี่ยวชาญ ไม่ใช่แค่เพียงการดูแล รักษาให้หายป่วย แต่เน้นการดูแลสุขภาพ ให้กลับมาใช้ชีวิตเป็นปกติ และมีความสุขได้ในทุกวัน จึงเป็นที่มาของแคมเปญ The Joy of Living ที่ได้ร่วมกับ 4 ร้านดัง ครั้งแรกของประเทศไทย กับการ cross category ระหว่างธุรกิจโรงพยาบาล และ ธุรกิจขนม เครื่องดื่ม ในการรังสรรค์สุดยอดเมนูของหวานสุดพิเศษ “ของหวานไกลเบาหวาน” ให้ร่วม Enjoy กันได้อย่างมีความสุข ซึ่งถือเป็นจุดเริ่มต้นที่ตอกย้ำโรงพยาบาลวิมุต ให้เป็นแบรนด์เรื่องการดูแลสุขภาพผ่านแพลตฟอร์มต่าง ๆ เพื่อเข้าถึงและดูแลสุขภาพผู้บริโภคได้มากยิ่งขึ้น
ศูนย์ดำรงธรรมจังหวัดปราจีนบุรี
ชาวชลบุรี ตรวจเจอโควิด-19 และต้องการความช่วยเหลือ โทร.ตามเบอร์นี้
ประชาชนชาวชลบุรี ตรวจเจอโควิด-19 และต้องการความช่วยเหลือ ☎️ ท่านผู้ว่าราชการจังหวัด สั่งการทุกอำเภอติดตั้งสายด่วนเพื่อเพิ่มช่องทางการสื่อสารกับประชาชน โดยเฉพาะกรณีที่ประชาชนตรวจพบว่ามีการติดเชื้อโควิด-19 แล้วยังไม่สามารถเข้าสู่ระบบการรักษาได้ สามารถติดต่อเจ้าหน้าที่ของแต่ละอำเภอตามหมายเลขโทรศัพท์ด้านล่างนี้ได้ตลอด 24 ชั่วโมง ที่มา : ศูนย์ประชาสัมพันธ์สนับสนุนการแก้ไขสถานการณ์โควิด-19 จ.ชลบุรี
ซากุระเมืองไทย สองข้างทางขึ้นดอยอ่างขาง เชียงใหม่
เดือนธันวาคม-มกราคม ยลโฉมดอกนางพญาเสือโคร่งบานเรียงรายริมสองข้างทางขึ้นดอยอ่างขาง อ.ฝาง จ.เชียงใหม่ ได้ขึ้นชื่อว่าเป็นสถานที่แห่ง "ซากุระเมืองไทย" เป็นอีกหนึ่งถนนที่สวยที่สุดในประเทศไทย
ร้านแล้วแต่..บาร์ นครสวรรค์ (ข้างอุทยานสวรรค์) ระหว่างวันที่ 30 ธันวาคม 2564 เวลา 20.00 - 23.00 น. ถึงวันที่ 1 มกราคม 2565 เวลา 20.00 - 23.00 น. LINK
#ประชาสัมพันธ์สำนักงานสาธารณสุขจังหวัดนครสวรรค์
?❗️ขอให้ประชาชนที่ไปรับประทานอาหารที่ “ร้านแล้วแต่..บาร์ นครสวรรค์ (ข้างอุทยานสวรรค์)” ระหว่างวันที่ 30 ธันวาคม 2564 เวลา 20.00 - 23.00 น. ถึงวันที่ 1 มกราคม 2565 เวลา 20.00 - 23.00 น.
#ติดต่อเข้ารับการตรวจหาเชื้อ COVID-19 ณ คลินิกไข้หวัด โรงพยาบาลของรัฐใกล้บ้าน หรือ ณ คลินิกไข้หวัด โรงพยาบาลสวรรค์ประชารักษ์ เปิดตรวจทุกวัน ระหว่างเวลา 08:30 – 22:00 น.
#โดยสวมหน้ากากอนามัยและใช้รถส่วนตัวในการเดินทาง
☎สอบถามเพิ่มเติมที่สายด่วน COVID-19 โทร. 081-3527696
⚠ และขอความร่วมมือผู้รับบริการทุกท่าน ไม่ปกปิดข้อมูลประวัติการเดินทาง หรือการสัมผัสกลุ่มเสี่ยง เพื่อความปลอดภัยของท่านและทุกคน ตลอดจนบุคคลากรทางการแพทย์
เช็ก 6 อาการ โอมิครอน (Omicron) โรงพยาบาลเปาโล พระประแดง LINK
เช็ก 6 อาการ โอมิครอน (Omicron) หรือ B.1.1.529 จากสถานการณ์ไวรัสโควิด 19 ที่มีการกลายพันธุ์เป็น "โอมิครอน" ซึ่งสายพันธุ์นี้ มีความพิเศษตรงที่ สามารถแพร่กระจายได้ง่ายและรวดเร็วกว่าเดิม อีกทั้งยังมีผู้คนติดเชื้อสายพันธุ์นี้มากขึ้นเรื่อยๆ หากคุณมีอาการเบื้องต้นที่ใกล้เคียง แนะนำให้กันตนเองออกจากบุคคลใกล้ชิด หลีกเลี่ยงหรืองดเดินทาง งดเข้าร่วมกิจกรรมต่างๆ และตรวจหาเชื้อไวรัสโควิด ชุดตรวจต้องสามารถรองรับตรวจหาสายพันธุ์ "Omicron" เพื่อยืนยันผล ก่อนที่จะเข้าร่วมกิจกรรม
แนวทางการรับรองตนเองด้วยชุดตรวจประเภท Self-test (Antigen Test Kit หรือ ATK)
สปส. กรุงเทพมหานครพื้นที่ 1 LINK
อาคารกรมสวัสดิการและคุ้มครองแรงงาน ชั้น 4 ถนนอัษฎางค์ แขวงวัดราชบพิธ เขตพระนคร กทม. 10200
Tel. 02-6222500-17, 02-6222518, 02-6222520, 02-6222522, 02-6222528, 02-6222525
Fax 02-6222519, 02-6222521, 02-6222523, 02-622-2529, 02-6222526
โรงพยาบาลสบเมย อำเภอสบเมย จังหวัดแม่ฮ่องสอน ปรับเปลี่ยน เวลา การให้บริการตรวจคัดกรองโควิด-19 ให้กับผู้สัมผัสใกล้ชิดเสี่ยงสูง LINK
โรงพยาบาลสบเมย อำเภอสบเมย จังหวัดแม่ฮ่องสอน ปรับเปลี่ยน เวลา การให้บริการตรวจคัดกรองโควิด-19 ให้กับผู้สัมผัสใกล้ชิดเสี่ยงสูง
>>จากเดิม เวลา 14.00-16.00 น.
>>ปรับใหม่ เป็น 09.00-11.00 น.
ทุกวัน ไม่เว้นวันหยุดราชการ ตั้งแต่วันที่ 4 มกราคม 2565 เป็นต้นไป
>>โดยผู้สัมผัสใกล้ชิดเสี่ยงสูง หมายถึง ผู้สัมผัสที่มีโอกาสสูงในการรับหรือแพร่เชื้อกับผู้ป่วยที่มีโอกาสสัมผัสสารคัดหลั่งจากทางเดินหายใจของผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 โดยในช่วง 14 วันที่ผ่านมา มีประวัติอย่างน้อย 1 ข้อดังต่อไปนี้
.
1. อาศัย/พบปะกับผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 ในขณะมีอาการ และมีประวัติอาจสัมผัสสารคัดหลั่งจากทางเดินหายใจ หรือโดนไอ จาม จากผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019
.
2. อยู่ในชุมชนเดียวกันกับผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 และมีประวัติอาจสัมผัสสารคัดหลั่งจากทางเดินหายใจ หรือโดนไอ จาม
.
3.เดินทางในกลุ่มทัวร์เดียวกันกับผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019
.
4. เดินทางด้วยยานพาหนะโดยสารเดียวกันผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 ซึ่งรวมระยะเวลาที่ไม่ได้ใส่หน้ากากอนามัย/ หน้ากากผ้า นานกว่า 5 นาที กรณีของยานพาหนะขนาดใหญ่ เช่น รถไฟ รถทัวร์ 2 ชั้น เรือเฟอร์รี่ ให้จำกัดเฉพาะผู้ที่อยู่ในตู้เดียวกันหรือในห้องโดยสารชั้นเดียวกัน กรณีเครื่องบิน คือ ผู้ที่นั่งใกล้ผู้ป่วย (ในแถวเดียวกัน และในระยะ 2 แถวหน้าและ 2 แถวหลัง) พนักงานบริการที่ให้บริการในโซนที่ผู้ป่วยนั่ง
.
5. บุคคลนอกเหนือจาก 1 - 4 ที่อยู่ในระยะห่างไม่เกิน 1 เมตร จากผู้ป่วย ซึ่งรวมระยะเวลาที่ไม่ได้ใส่หน้ากากอนามัย/หน้ากากผ้า นานกว่า 5 นาที ติดต่อสอบถามเพิ่มเติม โทร 053-618080-441 โรงพยาบาลสบเมย
ศูนย์ปฏิบัติการ CoviD & Home Isolation (HI) ประจำอำเภอ
1.ติดต่อ ศูนย์ปฏิบัติการ CoviD & Home Isolation (HI) ประจำอำเภอ หรือ เจ้าหน้าที่สาธารณสุขในสถานพยาบาลใกล้บ้าน
2.เจ้าหน้าที่ประเมินอาการและความพร้อมในการดูแลตัวเองที่บ้าน(Home Isolation HI)
3.ถ้าเข้าเกณฑ์ท่านจะได้รับการดูแลตัวเองที่บ้าน (HI) ภายใต้มาตรฐานการดูแลของแพทย์และบุคลากรทางการแพทย์ จนครบ 7-10 วัน
ติดต่อศูนย์ ปฏิบัติการ CoviD &Home Isolation อำเภอต่างๆ ดังนี้
- เมือง เบอร์โทร. 054-019998, 054-222225
- แม่เมาะ เบอร์โทร.064-8956128
- เกาะคา เบอร์โทร.063-3237189
- เสริมงาม เบอร์โทร.098-0539923
- งาว เบอร์โทร.065-4724186
- แม่ทะ เบอร์โทร.065-6168720
- แจ้ห่ม เบอร์โทร.082-6244238
- วังเหนือ เบอร์โทร.088-7809017
- สบปราบ เบอร์โทร.065-8233702
- เถิน เบอร์โทร.086-3098900
- แม่พริก เบอร์โทร.093-2607628
- ห้างฉัตร เบอร์โทร.081-2874289
- เมืองปาน เบอร์โทร.095-4546786
“เห็นด้วยกับการนำพืชและผลิตภัณฑ์กัญชามาใช้เพื่อประโยชน์ทางการแพทย์ แต่พืชหรือผลิตภัณฑ์กัญชาที่มี THC เกิน 0.2% ก็ยังควรถูกควบคุมการผลิตและใช้อยู่”
-----------------
ศ.นพ.มานิต ศรีสุรภานนท์
ภาควิชาจิตเวชศาสตร์ คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ และประธานราชวิทยาลัยจิตแพทย์แห่งประเทศไทย
ศาสตราจารย์ ดร.กอตอลิน กอริโก (Katalin Karikó, Ph.D.)
รองประธานอาวุโส บริษัทไบโอเอ็นเทค อาร์เอนเอ ฟาร์มาซูติคอล สหพันธรัฐเยอรมนี
รองศาสตราจารย์สมทบ คณะแพทยศาสตร์ มหาวิทยาลัยเพนซิลวาเนีย ฟิลาเดลเฟีย
สหรัฐอเมริกา / ฮังการี
ศาสตราจารย์เกียรติคุณนายแพทย์ฮารัลด์ ซัวร์ เฮาเซ่น (Professor Harald zur Hausen)
ศาสตราจารย์เกียรติคุณนายแพทย์ฮารัลด์ ซัวร์ เฮาเซ่น จากสหพันธ์สาธารณรัฐเยอรมนี ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการแพทย์ ประจำปี 2548 จากการค้นพบเชื้อไวรัสที่เป็นสาเหตุของมะเร็งปากมดลูก ต่อมาได้รับรางวัลโนเบล สาขาการแพทย์ ประจำปี 2551 จากการค้นพบเดียวกัน
ก.ผู้ป่วยรายเดิม (ก่อน 1 ก.พ.2565)
ส่วนหนึ่งของสวนสาธารณะที่มีต้นไม้ขนาดใหญ่จำนวนมากไว้เป็นที่สำหรับซ้อมดนตรี เช่น เป่าแซ็กโซโฟน ซ้อมทรัมเป็ต
โรงพยาบาลหัวเฉียว เชิญร่วมบริจาคโลหิต ในวันศุกร์ที่ 4 กุมภาพันธ์ 2565 LINK
โรงพยาบาลหัวเฉียว ร่วมกับ สภากาชาดไทย ขอร่วมเป็นหนึ่งในการส่งต่อชีวิต .. 1 คนให้ หลายคนรับ เพื่อช่วยเหลือเพื่อนมนุษย์ ในวันศุกร์ที่ 4 กุมภาพันธ์ 2565 ตั้งแต่เวลา 09.00 – 15.00 น. ณ บริเวณหน้าห้องประชุม ชั้น 2 อาคาร 1 โรงพยาบาลหัวเฉียว
สอบถามรายละเอียดเพิ่มเติมที่ แผนกลูกค้าสัมพันธ์ โทร. 0-2223-1351 ต่อ 3126
สถาบันการแพทย์จักรีนฤบดินทร์ เชิญชวนลงทะเบียนรับวัคซีน COVID-19 เข็ม 3 (Pfizer) ฉีด 1-17 กุมภาพันธ์ 2565 LINK
ขอเชิญชวนประชาชนลงทะเบียนเพื่อเข้ารับวัคซีน COVID-19 เข็ม 3 (Pfizer)
เปิดให้บริการเฉพาะผู้ที่ได้รับวัคซีน AstraZeneca
ครบทั้ง 2 เข็ม ก่อนวันที่ 6 พฤศจิกายน 2564
เพื่อเข้ารับวัคซีนตั้งแต่วันที่ 1-17 กุมภาพันธ์ 2565
วันจันทร์-ศุกร์ เวลา 09.30-14.00 น.
งดให้บริการวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์
สำหรับผู้ที่สนใจรับวัคซีนสามารถติดต่อลงทะเบียนได้ที่ จุดบริการวัคซีนชั้น 3 โซน A
อาคารโรงพยาบาลรามาธิบดีจักรีนฤบดินทร์
สอบถามข้อมูลเพิ่มเติมได้ที่ 0 2839 6336, 0 2839 6000 ในวันและเวลาทำการ
Package Basic Program (สำหรับอายุ 25 - 35 ปี)
ยาฟ้าทะลายโจร ลดไข้ ต้านการอักเสบ LINK
ยาสมุนไพร ฟ้าทะลายโจร มีข้อบ่งใช้ตามบัญชียาหลักแห่งชาติคือ บรรเทาอาการเจ็บคอ และบรรเทาอาการของโรคหวัด (common cold) โดยมีข้อมูลการศึกษาวิจัยพรีคลินิก/คลินิก พบว่า ฟ้าทะลายโจรทำให้ความรุนแรงอาการต่าง ๆ ของไข้เจ็บคอ และโรคหวัดที่เกิดจากเชื้อไวรัสลดลง และหายเร็วขึ้น
งานกายอุปกรณ์ กองออร์โธปิดิคส์และกายอุปกรณ์ โรงพยาบาลทหารผ่านศึก LINK
งานกายอุปกรณ์ กองออร์โธปิดิกส์และกายอุปกรณ์ โรงพยาบาลทหารผ่านศึก ให้บริการกายอุปกรณ์เทียมและเสริมที่ใช้ภายนอกร่างกาย สำหรับใช้ทดแทนส่วนของร่างกายที่สูญหายหรือบกพร่องตามแพทย์วินิจฉัยสั่งการรักษา งานกายอุปกรณ์ โรงพยาบาลทหารผ่านศึก เปิดให้บริการในวันและเวลาราชการ ซึ่งนอกเหนือจากการให้การสงเคราะห์ทหารผ่านศึกและครอบครัวทหารผ่านศึกแล้ว โรงพยาบาลฯ ยังให้บริการแก่ทหารประจำการและประชาชนทั่วไป ผู้มีสิทธิจ่ายเงินสด สิทธิกรมบัญชีกลาง สิทธิข้าราชการ สิทธิ กทม. สิทธิ สปสช. สิทธิผู้พิการ สิทธิ สปสช. โรงพยาบาลทหารผ่านศึก เป็นต้น
ติดต่อสอบถาม/ขอรายละเอียดเพิ่มเติม
อาคาร 2 ชั้น 1 (อาคารเวชศาสตร์ฟื้นฟูฯ)
02-644-9400
02-644-9416
02-245-0658 ต่อ 20100 หรือ 20115
โรงพยาบาลราชวิถี เปิดลงทะเบียน ตั้งแต่วันที่ 7 ก.พ. 65 ผ่าน QR Code LINK
โรงพยาบาลราชวิถี เปิดให้ "ลงทะเบียน" จองฉีดวัคซีน Pfizer เข็มที่ 1 สำหรับ "เด็ก" ที่มีอายุ 5-11 ปี และเด็กที่มีโรคประจำตัว 7 กลุ่มโรค และเข็มกระตุ้น (รายละเอียดเพิ่มเติมตามโปสเตอร์ประชาสัมพันธ์) หมายเหตุ : ข้อมูลกลุ่มโรคอ้างอิงตามฐานข้อมูลของกระทรวงสาธารณสุข สามารถลงทะเบียนได้ตั้งแต่วันที่ 7 กุมภาพันธ์ 2565 เป็นต้นไป
รพ.ศิริราช LINK
ศูนย์ความเป็นเลิศด้านโรคมะเร็ง คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล
หน่วยประสานงานผู้ป่วยมะเร็ง (Ramathibodi Hospital Cancer Coordinator)
ศูนย์การแพทย์สมเด็จพระเทพรัตน์ ชั้น 2 โซน F
Tel: 02-200-3633, 02-200-3672 (วันและเวลาราชการ)
รพ.จุฬาภรณ์ LINK
ขั้นตอนการเข้ารักษาผ่านไลน์
- ปรึกษาทางไกล Tele-oncology ทางไลน์รพ.จุฬาภรณ์ โดยแอดไลน์ @chulabhornhospital
- กดเมนู ปรึกษาโรคมะเร็ง
- ส่งเอกสาร
ภาวะซึมสับสนเฉียบพลัน (delirium)
ภาวะซึมสับสนเฉียบพลัน เป็นภาวะที่พบได้บ่อยในผู้สูงอายุ โดยเกิดจากความผิดปกติทางกาย ซึ่งอาจมีหลายสาเหตุด้วยกัน ในทางปฏิบัติส่วนใหญ่เกิดจากความผิดปกติของโรคทางเมทาบอลลิค การติดเชื้อ ผลไม่พึงประสงค์จากยาและการลดลงของการไหลเวียนเลือดและออกซิเจนที่ไปเลี้ยงสมอง เช่น ภาวะหายใจวาย หรือภาวะหัวใจวาย เป็นต้น ผู้ป่วยที่มีความผิดปกติของสมองอยู่เดิมจะมีความเสี่ยงต่อการเกิดภาวะนี้สูงขึ้น และถูกกระตุ้นจากสาเหตุอื่นๆที่ไม่รุนแรงได้ ส่วนผู้ป่วยสูงอายุที่แข็งแรงดีมักต้องมีปัจจัยกระตุ้น (precipitating factor) ที่ชัดเจน ร้อยละ 50 ของผู้สูงอายุที่มีภาวะซึมสับสนเฉียบพลันจะเป็นชนิด hypoactive โดยอาจมีการนอนหลับมากขึ้น คิดช้าทำช้า ทำให้บางครั้งแพทย์อาจวินิจฉัยไม่ได้ อ่านรายละเอียดเพิ่มเติมของภาวะซึมสับสนเฉียบพลันได้ในบท การป้องกันภาวะซึมสับสนเฉียบพลัน
1) Critical care การรักษาโรควิกฤต
Critical care การรักษาโรควิกฤต บำรุงราษฎร์มีทีมแพทย์เวชบำบัดวิกฤตที่ได้รับการรับรองจาก American Board of Critical Care Medicine จากสหรัฐอเมริกา และเป็นทีมที่เข้มแข็งและเป็นเสาหลักของโรงพยาบาล ที่พร้อมดูแลผู้ป่วยตลอด 24 ชั่วโมง พร้อมด้วยเทคโนโลยีที่ทันสมัยและการจัดการอย่างมีระบบ
ระวังโรคมิสซี(MIS-C) ‼️ แม้เด็กหายป่วยจากโควิด ยังมีอันตรายถึงชีวิต - โรงพยาบาลนครพิงค์ LINK
MIS-N (Multisystem Inflammatory Syndrome in Neonate) และ
MIS-C (Multisystem Inflammatory Syndrome in Children)
หรือ กลุ่มอาการอักเสบหลายระบบที่เกี่ยวข้องกับโรคโควิด-19 ในทารกแรกเกิดและในเด็ก
เป็นภาวะแทรกซ้อนสำคัญที่เกิดตามหลังการติดเชื้อโควิด-19 ส่งผลให้เกิดการอักเสบของระบบอวัยวะต่างๆ ทั่วร่างกาย ซึ่งภาวะแทรกซ้อนที่รุนแรงนี้ จะเกิดขึ้นตามหลังการติดเชื้อโควิดหรือทารกที่เกิดจากมารดาที่เคยติดเชื้อโควิดมาแล้ว 2-6 สัปดาห์ ตามสถิติในประเทศสหรัฐอเมริกาพบ MIS-C ได้ประมาณ 316 คน ใน 1ล้านคน (0.0316%) โดยอายุเฉลี่ยประมาณ 9 ปี
ภาวะดังกล่าวถูกรายงานเป็นครั้งแรกปลายเดือนเมษายน พ.ศ. 2563 จากสหราชอาณาจักร และอีกหลายๆประเทศตามมา ได้แก่ สหรัฐอเมริกา อิตาลี ฝรั่งเศส และประเทศอื่นๆทั่วโลกรวมถึงประเทศไทย จากข้อมูลล่าสุดจากชมรมโรคหัวใจเด็กแห่งประเทศไทยเมื่อวันที่ 13 ธันวาคม พ.ศ. 2564 มีจำนวนผู้ป่วย MIS-C จำนวน 109 ราย และ MIS-N จำนวน 11 ราย ในขณะที่มีผู้ป่วยคนไข้เด็กที่ติดเชื้อโควิดประมาณ 332,918 ราย คิดเป็น 360.5 คน ใน 1 ล้านคน (0.036%)
ตั้งแต่เดือนธันวาคม พ.ศ.2564 ที่ผ่านมา จังหวัดเชียงใหม่พบผู้ป่วยเด็กที่ได้รับการวินิจฉัย MIS-N 3 ราย และ MIS-C อย่างน้อย 6 ราย โดยทั้งหมดไม่มีโรคประจำตัวใดมาก่อน มาด้วยอาการช็อค หายใจเหนื่อย อาจมีผื่นขึ้นตามร่างกาย ปวดท้อง ถ่ายเหลว และตรวจพบการบีบตัวของหัวใจแย่ลง หัวใจเต้นผิดจังหวะ บางรายมีหลอดเลือดแดงที่เลี้ยงกล้ามเนื้อหัวใจโป่งพองร่วมด้วย ซึ่งทุกรายต้องได้รับการรักษาในหอผู้ป่วยหนัก (NICU หรือ PICU) ระยะเวลาการนอนในโรงพยาบาล 10 วันถึง 1 เดือน และมี 1 รายที่เสียชีวิต
อาการของเด็กที่สงสัย MIS-C คือ มีไข้สูงมากกว่า 38 องศาเซลเซียส นานเกิน 24 ชั่วโมง ร่วมกับ อาการอย่างน้อย 2 ระบบ เช่น
- ผื่น มือเท้าบวมแดง ตาแดง ต่อมน้ำเหลืองโต
- ปวดท้อง อาเจียน ถ่ายเหลว
- หัวใจเต้นผิดปกติ ความดันโลหิตต่ำหรือช็อก กล้ามเนื้อหัวใจอักเสบ
- อาการทางเดินหายใจ เช่น ปอดอักเสบ ลิ่มเลือดในปอด
- ซึม ความรู้สึกตัวน้อยลง เยื่อหุ้มสมองอักเสบ หรือมีอาการทางหลอดเลือดสมอง
- ภาวะเลือดออกง่ายจากการแข็งตัวของเลือดผิดปกติ
- อาการไตวายเฉียบพลัน
การรักษา คือการให้ยา intravenous immunoglobulin (IVIG) และ/หรือยาลดการอักเสบของร่างกาย
วิธีการป้องกันโรค MIS-C และ MIS-N ได้ดีที่สุด คือการป้องกันไม่ให้เด็กและหญิงตั้งครรภ์ติดโควิด-19 ซึ่งได้แก่ หลีกเลี่ยงการอยู่ในที่ชุมชน หากจำเป็นต้องอยู่ในที่ชุมชนก็ต้องสวมหน้ากากอนามัยตลอดเวลา ปฏิบัติตามมาตรการ D-M-H-T-T อย่างเคร่งครัดและรับวัคซีนป้องกันโควิดในเด็กที่อายุตั้งแต่ 5 ปีขึ้นไป รวมถึงหญิงตั้งครรภ์
ถึงแม้ตอนนี้การระบาดในจังหวัดเชียงใหม่เป็นสายพันธุ์โอมิครอนที่มีอาการไม่รุนแรงในช่วงที่มีการติดเชื้อในช่วงแรก แต่ในเด็กทำให้มีภาวะ MIS- C (มิสซี) หลังจากที่หายจากโรคโควิดแล้วได้ จากข้อมูลจากโรงพยาบาลเด็ก70แห่งในประเทศสหรัฐอเมริกามีการศึกษาว่าเด็กอายุ 12-18 ปีที่ได้รับวัคซีนชนิด mRNA สามารถป้องกันการเกิด MIS-C ได้เทียบกับกลุ่มที่ไม่ได้รับถึง 90% และจากข้อมูลจากกรมควบคุมโรคของไทยพบว่าช่วงอายุ 12-17 ปีมีผู้ที่เสียชีวิตจากโรคโควิด-19 พบ 260 คนในหนึ่งล้านคน แต่ผู้เสียชีวิตจากการฉีดวัคซีนป้องกันโควิด พบเพียง 0.18 คนในหนึ่งล้านคน
จึงขอเชิญชวนให้ผู้ปกครองนำบุตรหลานของท่านมารับการฉีดวัคซีน ในกลุ่มเด็กอายุ 5-11ปี ฉีดวัคซีนป้องกันโควิด-19
โดยจะเริ่มฉีดวัคซีนเฉพาะเด็กที่มีโรคประจำตัว 7 กลุ่มก่อน ดังนี้
- โรคอ้วน (น้ำหนักเทียบความสูง (weight for height) มากกว่า + 3SD)
- โรคทางเดินหายใจเรื้อรัง
- โรคหัวใจและหลอดเลือดสมอง
- โรคไตวายเรื้อรัง
- โรคมะเร็งและภูมิคุ้มกันต่ำ
- โรคเบาหวาน
- กลุ่มโรคพันธุกรรม รวมทั้งกลุ่มอาการดาวน์ เด็กที่มีภาวะบกพร่องทางระบบประสาทอย่างรุนแรง และเด็กที่มีพัฒนาการช้า
เปิดให้บริการเฉพาะที่โรงพยาบาลนครพิงค์ ระหว่าง 7-28 กุมภาพันธ์ 2565 ( หรือจนกว่าวัคซีนจะหมด) เฉพาะจันทร์ถึงศุกร์ เว้นวันหยุดราชการ
จำกัดจำนวน 100 คนต่อวัน
วัคซีนไฟเซอร์(ฝาสีส้ม)
ฟรี!! ไม่มีค่าใช้จ่าย
บทความโดย :
พญ.นันทวัน สุอังคะ
นพ.ชัชวาลย์ เชวงชุติรัตน์
กุมารแพทย์ สาขาโรคหัวใจ
โรงพยาบาลนครพิงค์
Reference:
- CDC COVID-19 Response Team. Coronavirus disease 2019 in children—United States, February 12–April 2, 2020. Morb. Mortal. Wkly. Rep. 2020, 69, 422–426. [CrossRef] [PubMed]
- Parri, N.; Lenge, M.; Buonsenso, D. Children with Covid-19 in Pediatric Emergency Departments in Italy. N. Engl. J. Med. 2020. [CrossRef] [PubMed]
- Riphagen, S.; Gomez, X.; Gonzalez-Martinez, C.; Wilkinson, N.; Theocharis, P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet 2020. [CrossRef]
- Verdoni, L.; Mazza, A.; Gervasoni, A.; Martelli, L.; Ruggeri, M.; Ciuffreda, M.; Bonanomi, E.; D’Antiga, L. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: An observational cohort study. Lancet 2020. [CrossRef]
- CDC Health Alert Network. Mulitsystem Inflammatory Syndrome in Children (MIS-C) Associated with Coronavirus Disease 2019 (COVID-19). Available online: https://emergency.cdc.gov/han/2020/han00432.asp (accessed on 23 May 2020).
- Zambrano LD, Newhams MM, Olson SM, et al. Effectiveness of BNT162b2(Pfizer-BioNTech) mRNA Vaccination Against Multisystem Inflammatory Syndrome in Children Among Persons Aged 12-18 Years –United States, July-December 2021. MMWR Morb Mortal Wkly Rep2022:71:52-58.
ตรวจ ATK แล้วขึ้น 2 ขีด ติดเชื้อโควิด-19 ต้องทำอย่างไร สปสช. LINK
ตรวจ ATK แล้วขึ้น 2 ขีด ติดเชื้อโควิด-19 ต้องทำอย่างไร
หากไม่มีอาการ-อาการเล็กน้อย รักษาตามอาการ เช่น ยาลดไข้ ยาแก้ไอ ดื่มน้ำมากๆ และกักตัวอยู่ที่บ้าน 10 วัน ตามแนวทางใหม่ของกระทรวงสาธารณสุข (สธ.)
แต่หากต้องการรักษาตามแนวทางเจอ แจก จบ ของ สธ. สามารถไปสถานพยาบาลตามสิทธิ-ใกล้บ้านได้ แนะนำโทร.นัดหมายก่อน
หรือยืนยันต้องการลงทะเบียนรักษาที่บ้าน (Home Isolation)
หรือ
ไลน์ สปสช. โดยเพิ่มเพื่อน พิมพ์ @nhso หรือคลิก https://lin.ee/zzn3pU6
***กรณีลงทะเบียนเกิน 6 ชั่วโมง แต่ไม่ได้รับการติดต่อกลับจากสถานพยาบาล แนะนำไปสถานพยาบาลตามสิทธิ-ใกล้บ้าน (โทร.นัดหมายก่อน) เพื่อรับบริการผู้ป่วยนอกตามแนวทางเจอ แจก จบ ของกระทรวงสาธารณสุข
4.โรงพยาบาลการแพทย์แผนไทยและการแพทย์พื้นบ้านไทย จ.อุดรธานี
โรงพยาบาลการแพทย์แผนไทยและการแพทย์พื้นบ้านไทย
เขตสุขภาพที่ 8 จ.อุดรธานี
โทร.042-180880
เปิดทุกวัน จันทร์-อาทิตย์ เวลา 8.30-16.30 น.
เว้นวันหยุดราชการ
4. ขั้นตอนการจัดทำแผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ “การแก้ไขปัญหามลพิษด้านฝุ่นละออง”
กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมได้มีการดำเนินงาน โดยสรุปได้ดังนี้
- 4.1 กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมได้จัดทำแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ในกรุงเทพมหานครและปริมณฑล โดยแบ่งเป็น 3 ระยะ ได้แก่ ระยะเร่งด่วน ระยะปานกลาง (พ.ศ. 2562 - 2564) และระยะยาว (พ.ศ. 2565 - 2567) เพื่อนำ ไปสู่เป้าหมายในการ “สร้างอากาศดีเพื่อคนไทย และผู้มาเยือน”
- 4.2 คณะกรรมการสิ่งแวดล้อมแห่งชาติในการประชุมครั้งที่ 2/2562 (นัดพิเศษ) เมื่อวันที่ 4 กุมภาพันธ์ 2562 มีมติ
1) เห็นชอบกับแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ในกรุงเทพมหานครและปริมณฑลระยะเร่งด่วน ตามที่กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมเสนอ
2) ให้กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม โดยกรมควบคุมมลพิษ นำ ความเห็นของคณะกรรมการสิ่งแวดล้อมแห่งชาติไปปรับปรุงมาตรการระยะกลางและระยะยาว เสนอคณะกรรมการควบคุมมลพิษพิจารณาในรายละเอียด พร้อมทั้งประสานหน่วยงานที่เกี่ยวข้องก่อนนำ เสนอคณะกรรมการสิ่งแวดล้อมแห่งชาติพิจารณาต่อไป และ
3) มอบหมายให้กระทรวงทรัพยากรธรรมชาติ และสิ่งแวดล้อม โดยกรมควบคุมมลพิษ นำ เสนอคณะรัฐมนตรีเพื่อทราบเป็นวาระเร่งด่วนในวันที่ 5 กุมภาพันธ์ 2562
- 4.3 กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมได้นำ มติและความเห็นของคณะกรรมการสิ่งแวดล้อมแห่งชาติ ไปปรับปรุงแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ในกรุงเทพมหานคร/ปริมณฑลและผนวกพื้นที่ จังหวัดอื่นเข้ามาด้วย และนำ เสนอต่อคณะรัฐมนตรีเพื่อทราบเป็นวาระเร่งด่วน
- 4.4 คณะรัฐมนตรีในการประชุมเมื่อวันที่ 5 กุมภาพันธ์2562 มีมติ
1) รับทราบแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ในกรุงเทพมหานคร/ปริมณฑลและในพื้นที่จังหวัดต่างๆ ตามที่กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมเสนอ ทั้งนี้ให้กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมและหน่วยงานที่เกี่ยวข้อง ปรับปรุงแนวทางและมาตรการฯ ให้มีความเหมาะสมมากยิ่งขึ้น โดยในส่วนของมาตรการระยะเร่งด่วน ขั้นปฏิบัติการ ระดับที่ 2 ระดับที่ปริมาณฝุ่นละอองขนาดเล็ก PM2.5 มีค่ามากกว่า 50 ไมโครกรัมต่อลูกบาศก์เมตร ให้พิจารณากำหนดแนวทางและมาตรการเพิ่มเติมเพื่อขอความร่วมมือให้ประชาชนใช้รถยนต์ดีเซลเท่าที่จำเป็นเท่านั้น เนื่องจากไอเสียของเครื่องยนต์ดีเซลเป็นสาเหตุสำ คัญประการหนึ่งของการเกิดฝุ่นละอองขนาดเล็ก PM2.5 รวมทั้งให้ปรับเพิ่มแนวทางและมาตรการฯ ให้ครอบคลุมถึงการดำเนินการด้านสาธารณสุขในการป้องกันและดูแลสุขภาพของประชาชนที่ได้รับผลกระทบจากฝุ่นละอองขนาดเล็ก PM2.5 ด้วย และ
2) ให้กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม กระทรวงสาธารณสุขและหน่วยงานที่เกี่ยวข้องเร่งดำเนินการสร้างความเข้าใจแก่ประชาชนให้ถูกต้องและชัดเจนเกี่ยวกับการดำเนินการตามแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ดังกล่าว รวมทั้งมาตรการเร่งด่วนต่างๆ ที่ได้ดำเนินการไปแล้ว เช่น กรณีการปิดสถานศึกษาของกระทรวงศึกษาธิการและกรุงเทพมหานคร มิใช่เป็นการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 หรือลดสาเหตุของการเกิดฝุ่นละอองขนาดเล็กโดยตรง แต่มีเจตนารมณ์สำ คัญที่จะปกป้องคุ้มครองเด็กที่ถือเป็นกลุ่มเสี่ยงที่มีความเปราะบางและอาจเกิดผลกระทบต่อสุขภาพในระยะยาว และกรณีการฉีดพ่นละอองน้ำ ในอากาศจากอาคารสูงและโดยเครื่องบินในพื้นที่ต่างๆ อาจไม่สามารถลดปริมาณฝุ่นละอองขนาดเล็ก PM2.5 ได้โดยตรงแต่เป็นการดำเนินการควบคู่ไปพร้อมกับมาตรการอื่นอีกหลายมาตรการที่หน่วยงานต่างๆ ดำเนินการอยู่ซึ่งจะช่วยให้ลดปริมาณฝุ่นละอองในภาพรวมลงได้
- 4.5 คณะรัฐมนตรีในการประชุมเมื่อวันที่ 12 กุมภาพันธ์ 2562 พิจารณาเห็นว่าปัญหาฝุ่นละอองสูงเกินกว่าค่ามาตรฐานที่เกิดขึ้นในหลายพื้นที่รวมทั้งกรุงเทพมหานครและปริมณฑลกำลังเป็นปัญหาสำคัญ ซึ่งส่งผลกระทบโดยตรงต่อสิ่งแวดล้อมและสุขภาพของประชาชน และมีแนวโน้มที่จะขยายตัวไปยังจังหวัดอื่นในภูมิภาคอีกด้วย การแก้ไขปัญหาดังกล่าวจึงจำเป็นต้องดำเนินการอย่างเร่งด่วน เป็นระบบ โดยความร่วมมือของหน่วยงานภาครัฐ เอกชน และประชาชน คณะรัฐมนตรีจึงมีมติให้การแก้ไขปัญหามลพิษด้านฝุ่นละอองเป็นวาระแห่งชาติเพื่อให้การดำเนินการแก้ไขปัญหาดังกล่าวเป็นไปอย่างมีประสิทธิภาพและประสิทธิผล ทั้งนี้ให้คณะกรรมการสิ่งแวดล้อมแห่งชาติเป็นกลไกหลักร่วมกับกระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมและหน่วยงานที่เกี่ยวข้องดำเนินการขับเคลื่อนวาระแห่งชาติดังกล่าวให้เกิดผลเป็นรูปธรรมโดยเร็วต่อไป
- 4.6 กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม ได้นำ มติคณะรัฐมนตรีในการประชุมเมื่อวันที่ 5 กุมภาพันธ์ 2562 ยกร่างแนวทางและมาตรการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก PM2.5 ในกรุงเทพมหานคร/ปริมณฑล และในพื้นที่จังหวัดต่างๆ เสนอคณะกรรมการควบคุมมลพิษในคราวการประชุมเมื่อวันที่ 25 กุมภาพันธ์ 2562 ซึ่งคณะกรรมการควบคุมมลพิษมีมติให้กรมควบคุมมลพิษนำ ความเห็นและข้อเสนอแนะของคณะกรรมการควบคุมมลพิษไปปรับปรุงและจัดทำเป็นแผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ “การแก้ไขปัญหามลพิษด้านฝุ่นละออง”
- 4.7 นายกรัฐมนตรีได้มีคำ สั่งเห็นชอบ/ดำเนินการตามที่คณะกรรมการที่ปรึกษาผู้ทรงคุณวุฒิพิเศษของนายกรัฐมนตรีเห็นชอบแนวทางการแก้ไขปัญหาฝุ่นละอองขนาดไม่เกิน 2.5 ไมครอนเกินมาตรฐาน และเสนอให้ปี 2562 เป็น “ปีแห่งความร่วมมือต่อต้านการเกิดมลพิษทางอากาศของอาเซียน”
- 4.8 กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมโดยกรมควบคุมมลพิษ ได้นำ ความเห็นและข้อเสนอแนะของคณะกรรมการควบคุมมลพิษไปปรับปรุงและจัดทำร่างแผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ“การแก้ไขปัญหามลพิษด้านฝุ่นละออง” โดยได้มีการประชุมร่วมกับหน่วยงานที่เกี่ยวข้อง ได้แก่ กรมการขนส่งทางบก กรมอนามัย กรมควบคุมโรค กรมส่งเสริมการเกษตร กรมวิชาการเกษตร กองบังคับการตำ รวจจราจร กรมธุรกิจพลังงาน สำนักงานนโยบายและแผนพลังงาน กรมอุตุนิยมวิทยา กรมฝนหลวงและการบินเกษตร กรมอุทยานแห่งชาติสัตว์ป่าและพันธุ์พืช กรมป่าไม้กรมทางหลวง กรมการปกครอง พิจารณาให้ความเห็นชอบในหลักการแผนปฏิบัติการขับเคลื่อนวาระแห่งชาติฯ แล้ว เมื่อวันที่ 22 มีนาคม 2562
- 4.9 กรมควบคุมมลพิษ ได้นำ ร่างแผนปฏิบัติการฯ เสนอคณะกรรมการควบคุมมลพิษในการประชุมเมื่อวันที่ 26 มีนาคม 2562 โดยคณะกรรมการควบคุมมลพิษ มีมติเห็นชอบและให้รับข้อสังเกตของคณะกรรมการควบคุมมลพิษ ไปปรับปรุงและแจ้งเวียนให้หน่วยงาน และเสนอคณะกรรมการสิ่งแวดล้อมแห่งชาติต่อไป โดยกรมควบคุมมลพิษได้ปรับปรุงตามความเห็นและข้อสังเกตของคณะกรรมการควบคุมมลพิษ
- 4.10 วันที่ 22 เมษายน 2562 รัฐมนตรีว่าการกระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม ได้มอบแนวทางในการปรับปรุงร่างแผนปฏิบัติการฯ โดยให้กรมควบคุมมลพิษปรับแก้ไขมาตรการให้ชัดเจน กำหนดบทบาทหน้าที่ของหน่วยงาน วิธีการดำเนินงาน และกรอบเวลา และเสนอเข้าคณะกรรมการควบคุมมลพิษ และคณะกรรมการสิ่งแวดล้อมแห่งชาติเพื่อเสนอคณะรัฐมนตรีต่อไป
- 4.11 วันที่ 15 พฤษภาคม 2562 คณะกรรมการควบคุมมลพิษให้ความเห็นชอบร่างแผนปฏิบัติการฯ และให้ปรับแก้ไขตามความเห็นและข้อเสนอแนะของคณะกรรมการฯ และนำ เสนอคณะกรรมการสิ่งแวดล้อมแห่งชาติและคณะรัฐมนตรีพิจารณาต่อไป
ผลิตภัณฑ์บำรุงผิว
ผลิตภัณฑ์บำรุงผิว
- ครีมบำรุงผิวเพิ่มความเนียนนุ่ม ผสมวิตามีนอี (2%)
- RAMA 5 URICH CREAM 80 g ครีมบำรุงเพิ่มความชุ่มชื้นให้ผิว ผสมยูเรีย (5%)
- ครีมบำรงผิวเพิ่มความเนียนนุ่ม ผสมวิตามีนอีเข้มข้น (10%)
- RAMA GENTLE TOP TO TOE 240 ml ผลิตภัณฑ์ทำความสะอาด สูตรอ่อนโยน
- RAMA CREAM BASE 50 g ครีมบำรุงผิวสูตรปราศจากน้ำหอม
- RAMA COLD CREAM 50 g ครีมบำรุงผิวสูตรสำหรับผิวแห้ง
- RAMA PETROLEUM JELLY 50 g เจลลี่บำรงริมฝีปาก และผิวที่แห้งกร้าน
ศูนย์สมองและระบบประสาท LINK
ศูนย์สมองและระบบประสาท
“ศูนย์สมองและระบบประสาท” โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนลพร้อมดูแลรักษาทุกปัญหาที่เกี่ยวกับสมอง และระบบประสาท โดยทีมแพทย์ผู้ชำนาญการเฉพาะทางด้านสมองและระบบประสาท รวมถึงแพทย์สหสาขาวิชาด้านอื่น ๆ พยาบาล เภสัชกร นักกายภาพบำบัด นักโภชนาการที่มีความชำนาญในการดูแลผู้ป่วยโรคสมองและระบบประสาท พร้อมด้วยเครื่องมือ เทคโนโลยี และวิธีการรักษาที่ทันสมัย โดยมุ่งเน้นให้ความสำคัญกับการรักษาที่ต้นเหตุและป้องกันไม่ให้กลับมาเป็นซ้ำ ร่วมกับการฟื้นฟูสมองโดยคำนึงถึงผู้ป่วยทั้งทางด้านร่างกายและจิตใจ
บริการของศูนย์สมองและระบบประสาท ครอบคลุม
โรคหลอดเลือดสมอง
โรคปวดศีรษะ
โรคลมชัก
โรคเกี่ยวกับการนอนหลับที่ผิดปกติ
โรคพาร์กินสันและการเคลื่อนไหวผิดปกติ
โรคเกี่ยวข้องกับความจำ เช่น อัลไซเมอร์
เนื้องอกในสมอง
ศัลยกรรมประสาทและโรคทางระบบประสาทอื่น ๆ
นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวแสดงวิสัยทัศน์ผ่านวิดีทัศน์ที่จัดทำขึ้นเป็นพิเศษสำหรับงานนี้ว่า "กระทรวงสาธารณสุขได้ตระหนักถึงการรณรงค์ให้ความรู้เกี่ยวกับโรคไบโพลาร์ รวมถึงโรคทางจิตเวชอื่นๆ เพื่อให้สังคมเข้าใจและเปิดใจยอมรับเพื่อการอยู่ร่วมกันอย่างปกติสุข นอกจากนี้ ในช่วงการแพร่ระบาดของโควิด-19 ทำให้ผู้ป่วยไม่สะดวกในการเดินทางมาพบแพทย์เพื่อติดตามผลการรักษาได้อย่างต่อเนื่อง ซึ่งส่งผลกระทบต่อครอบครัวผู้ป่วยด้วย กระทรวงสาธารณสุขจึงได้มีนโยบายสนับสนุนหน่วยบริการด้านสุขภาพจิต โดยมีบทบาทสำคัญในการพัฒนาบริการให้มีความก้าวหน้าทันสมัย สามารถให้บริการจิตเวชทางไกลได้อย่างมีประสิทธิภาพต่อผู้ป่วยไบโพลาร์ เพื่อได้รับการบำบัดรักษาอย่างต่อเนื่อง และฟื้นฟูกลับมาเป็นกำลังสำคัญของประเทศชาติต่อไป"
Q&A ถาม-ตอบ เรื่อง สเตียรอยด์
ถาม สเตียรอยด์ คืออะไร
ตอบ สเตียรอยด์ เป็นกลุ่มฮอร์โมนชนิดหนึ่งที่ร่างกายสร้างขึ้นได้เอง ในปริมาณเพียงเล็กน้อย เพื่อทำหน้าที่ในกระบวนการต่างๆของร่างกายให้เป็นปกติ ตัวอย่าง เช่น ต้านการอักเสบ ลดอาการปวด ทำให้ภูมิคุ้มกันของร่างกายทำงานเป็นปกติ เป็นต้น เนื่องด้วยคุณสมบัติของสารสเตียรอยด์ที่จำเป็นต่อร่างกาย จึงทำให้มีการผลิตสเตียรอยด์สังเคราะห์ขึ้นเพื่อใช้ทางการแพทย์ มีหลายชนิด และหลายรูปแบบทั้งยาฉีด ยาเม็ด และยาครีม
สำหรับสเตียรอยด์สังเคราะห์ 2 ชนิดที่ตรวจพบว่ามักนำมาปนปลอมในยาแผนโบราณ มีชื่อว่า เด็กซาเมทาโซน (Dexamethasone) และ เพร็ดนิโซโลน (Prednisolone) เป็นยาแผนปัจจุบันในรูปแบบยาเม็ด โดยมีการนำมาบดผสมในยาแผนโบราณ เนื่องจากสเตียรอยด์มีฤทธิ์ต่อหลายระบบในร่างกาย ระยะแรกที่ได้รับสเตียรอยด์อาจรู้สึกว่าทำให้อาการโรคดีขึ้น ผู้รับประทานจึงหลงเชื่อและรับประทานต่อเนื่อง ซึ่งเป็นอันตรายอย่างมาก เนื่องจากเป็นการได้รับยาที่ไม่ได้บ่งใช้โดยแพทย์ เนื่องจากสเตียรอยด์เป็นยาอันตราย มีผลข้างเคียงมาก การใช้ยาต้องมีการติดตามและปรับขนาดยาให้เหมาะสม มักไม่ใช้ต่อเนื่องนานโดยไม่จำเป็นและแพทย์ต้องดูแลใกล้ชิด
ถาม สเตียรอยด์มีอันตรายอย่างไร
ตอบ เนื่องจากสเตียรอยด์มีฤทธิ์ต่อหลายระบบของร่างกาย จึงมีผลได้ทั่วร่างกาย เช่น
ผลกดภูมิคุ้มกันของร่างกายทำให้ภูมิคุ้มกันลดลง จึงติดเชื้อง่าย
ทำให้เยื่อบุในกระเพาะอาหารบางลงและยับยั้งการสร้างเนื้อเยื่อกระเพาะอาหารใหม่ อาจทำให้กระเพาะอาหารทะลุ หรือเลือดออกในกระเพาะอาหารโดยไม่มีอาการปวดท้องมาก่อน
ทำให้กระดูกพรุน ในผู้ป่วยเบาหวานจะไม่สามารถควบคุมระดับน้ำตาลให้อยู่ในช่วงปกติได้
ผู้ป่วยความดันโลหิตไม่สามารถควบคุมระดับความดัน ให้อยู่ในช่วงปกติได้ จะมีระดับความดันโลหิตสูง แต่ไม่มีอาการเตือน เป็นภัยเงียบที่อาจทำให้เกิดเส้นเลือดในสมองแตก เสี่ยงเป็นอัมพฤต-อัมพาตได้
นอกจากนี้การได้รับสเตียรอยด์ในขนาดสูง เป็นเวลานาน จะทำให้เกิดอาการที่เรียกว่า “คุชชิ่ง ซินโดรม (Cushing Syndrome)” ซึ่งเป็นลักษณะเฉพาะที่สังเกตได้ คือ ใบหน้ากลมคล้ายพระจันทร์ มีไขมันพอกที่ต้นคอ ด้านหลังเป็นหนอก ผิวหนังบาง มีรอยแตกสีม่วงแดงตามผิวหนังที่หน้าท้องและต้นขา
สิ่งที่อันตรายอย่างยิ่งคือ เมื่อร่างกายได้รับสารสเตียรอยด์เป็นเวลานาน ร่างกายจะหยุดสร้างสเตียรอยด์ตามธรรมชาติ ที่เคยสร้างเองได้ หากหยุดใช้อย่างกะทันหันจะทำให้ร่างกายขาดสเตียรอยด์อย่างฉับพลัน อาจเกิดภาวะช็อก หมดสติและเสียชีวิตได้หากนำส่งโรงพยาบาลไม่ทัน ดังนั้นหากสงสัยว่าได้รับสเตียรอยด์จากการซื้อมาเอง ไม่ใช่โดยแพทย์สั่งใช้ อย่าเพิ่งหยุดยาเอง ขอให้รีบมาพบแพทย์เพื่อหาทางลดยา และการรักษาที่ถูกต้อง
ถาม ปัจจุบันมีการตรวจพบสเตียรอยด์ในผลิตภัณฑ์อะไรบ้าง
ตอบ สเตียรอยด์ชื่อว่า เด็กซาเมทาโซน (Dexamethasone) และ เพร็ดนิโซโลน (Prednisolone) พบการปนปลอมในยาชุด ยาแผนโบราณที่ไม่มีเลขทะเบียน หรือทะเบียนปลอม พบได้ในทุกรูปแบบยาทั้ง ยาลูกกลอน ยาผง ยาน้ำ ยาเม็ด ที่กล่าวอ้างสรรพคุณการรักษาแบบครอบจักรวาล เช่น แก้ปวดเข่า ปวดข้อ ปวดหัว แก้แพ้ทุกชนิด แก้หอบ หืด แพ้อากาศ อัมพฤกษ์ อัมพาต ช่วยเจริญอาหาร ถ้าพบยาที่สรรพคุณดีขนาดนี้ขอให้สงสัยไว้ก่อนว่าอาจปนปลอมเสตียรอยด์ และผลตรวจในห้องปฏิบัติการพบว่ามักลักลอบใส่ในปริมาณมากเพื่อหวังให้เห็นผลชัดเจน ทำให้ประชาชนรู้สึกว่ายาดี กินแล้วหายเป็นปลิดทิ้ง ซึ่งในความจริงคือ ด้วยฤทธิ์ของสเตียรอยด์ที่มีผลต่อหลายระบบของร่างกาย ในช่วงแรกที่รับประทานยาผู้ป่วยจะรู้สึกว่ามีอาการดีขึ้นอย่างรวดเร็ว แต่เมื่อได้รับยาเป็นเวลานานจะเกิดผลข้างเคียงของสเตียรอยด์ ซึ่งบางกรณีรุนแรงถึงขั้นเสียชีวิต
นอกจากนี้ยังพบว่ามีการผสมสเตียรอยด์ ในเครื่องสำอางประเภทครีม โดยมีการโฆษณาว่ารักษาสิวได้อย่างรวดเร็ว ทำให้หน้าขาวใส แต่ชุดทดสอบนี้ไม่สามารถใช้ตรวจยาครีมได้ เนื่องจากชุดทดสอบนี้ไม่จำเพาะต่อสเตียรอยด์ที่ลักลอบใส่ในครีมซึ่งมีได้หลายชนิด
ถาม วิธีการใช้งานชุดทดสอบสเตียรอยด์ในยาแผนโบราณ
ตอบ ขณะนี้กรมวิทยาศาสตร์การแพทย์ได้คิดค้นชุดทดสอบอย่างง่าย เป็นชุดทดสอบที่ใช้หลักการอิมมูโนโครมาโทกราฟี ชุดทดสอบนี้ใช้ตรวจได้ทั้งเด็กซาเมทาโซน และเพรดนิโซโลน การใช้งานง่าย โดยนำยาแผนโบราณแบ่งมาผสมกับน้ำยาในหลอดทดสอบที่มีให้ในชุด ตั้งทิ้งไว้จนน้ำยาตกตะกอน แล้วดูดส่วนใสมาหยดบนชุดทดสอบ ทิ้งไว้ 10 นาทีจึงอ่านผล การอ่านผลดูจากจำนวนเส้นที่ปรากฏขึ้น ถ้าขึ้น 2 ขีดคือผลเป็นลบแสดงว่าไม่พบสเตียรอยด์ หากขึ้น 1 ขีดคือผลเป็นบวกแสดงว่าพบเสตียรอยด์ ซึ่งชุดทดสอบมีค่าความไวในการตรวจพบได้ในระดับไมโครกรัม ซึ่งถือว่ามีความไวสูง และมีความถูกต้องแม่นยำมาก
ถาม คำแนะนำสำหรับประชาชนจากอันตรายของสเตียรอยด์
ตอบ หลีกเลี่ยงการซื้อยาแผนโบราณที่ไม่ได้ขึ้นทะเบียนตำรับยา ในการเลือกซื้อให้ตรวจดูฉลากที่ปิดผนึกบนภาชนะบรรจุ ว่าจะต้องมีเลขทะเบียนตำรับยาซึ่งแสดงว่าได้รับอนุญาตจากสำนักงานคณะกรรมการอาหารและยา โดยเลขทะเบียนดังกล่าวขึ้นต้นด้วยตัวอักษร “G” สำหรับยาแผนโบราณที่ผลิตในประเทศ หรือ “K” สำหรับยาแผนโบราณที่นำเข้ามาในประเทศ
นอกจากนี้ฉลากจะต้องมีรายละเอียดอื่น ๆ ได้แก่ ชื่อยา สูตรยา ชื่อและจังหวัดที่ตั้งของผู้ผลิตยา วันเดือนปีที่ผลิตยา เลขที่หรืออักษรแสดงครั้งที่ผลิตยา ปริมาณยาที่บรรจุ เนื่องจากหากเป็นทะเบียนยาปลอมรายละเอียดจะไม่ครบถ้วน เนื่องจากเป็นข้อกำหนดทางกฎหมายที่ต้องแจ้งให้ทราบ
กรมวิทยาศาสตร์การแพทย์
SANDBOX
ㆍพำนักในพื้นที่ Sandbox 5 วัน จึงสามารถเดินทางไปยังพื้นที่อื่นๆ ได้
ㆍ ปัจจุบัน พื้นที่ Sandbox ได้แก่ ภูเก็ต กระบี่ พังงา สุราษฎร์ธานี (เกาะสมุย เกาะเต่า และเกาะพะงัน) ชลบุรี (เมืองพัทยา และบางอำเภอ) และตราด (เกาะช้าง)
เอกสารประกอบการลงทะเบียน
1.หนังสือเดินทาง
2.หลักฐานการได้รับวัคซีน
อายุ 18 ปีขึ้นไป ต้องได้รับวัคซีนครบตามข้อกำหนด
อายุต่ำกว่า 18 ปี ดังนี้
หากเดินทางพร้อมผู้ปกครอง/ผู้ดูแลไม่จำเป็นต้องได้รับวัคซีน
หากเดินทางคนเดียว
- อายุต่ำกว่า 12 ปี ต้องได้รับวัคชื่นครบตามข้อกำหนด
- อายุ 12-17 ปี ต้องได้รับวัคซีนอย่างน้อย 1 โดส
3.หลักฐานการชำระเงินค่าโรงแรม SHA Extra+/AQ จำนวน 5 วัน และค่าตรวจ RT-PCR 1 ครั้ง ชุดตรวจ ATK self-test 1 ชุด และพาหนะรับส่งจากสนามบิน
4.ประกันภัยที่ครอบคลุมค่ารักษาพยาบาลในวงเงินไม่น้อยกว่า USD 20,000 (ผู้มีสัญชาติไทยไม่ต้องมีประกันและชาวต่างชาติที่มีถิ่นพำนัก สามารถใช้เอกสารประกันสังคมหรือเอกสารรับรองจากนายจ้าง หน่วยงานในไทยแทนได้)
*ตวรจหาเชื้อแบบ RT-PCR ในวันที่ 0-1
Test and Go
ELIGIBILITY
Fully vaccinated* travelers from all countries/ territories
*Only vaccines registered by the Food and Drug Administration of Thailand or approved by the Ministry of Public Health or the WHO. Must be fully vaccinated at least 14 days prior to departure
REQUIRED DOCUMENTS
1.Passport
2.Certificate of Vaccination
Ages 18 and above must be fully vaccinated
Ages below 18
Traveling accompanied by parents/legal guardian Full vaccination not required
ㆍ Traveling unaccompanied
- Ages below 12 must be fully vaccinated
- Ages 12 - 17 must receive one dose of vaccination
3.Paid SHA Extrat / AQ Hotel booking confirmation for 1 day including the fee
for 1RT-PCR test, 1 ATK self-test kit and airport transfer
4.Insurance with minimum coverage of USD 20,000 for medical expenses (not required for Thai nationals and foreign nationals who have Thai social security/confirmation letters from employer in Thailand)
REGISTRATION
1.Register free on Thailand Pass (processing time is 3 to 7 days)
2.Travel from port of arrival to your hotel via sealed-route (transportation arranged by hotel)
3.Undergo a RT-PCR test and wait for test result at your hotel
4.Take an ATK self-test on Day 5-6 and report the test result as instructed by the Ministry of Public Health
REMARK
Pre-departure RT-PCR test for entry into Thailand is no longer required.
However, travelers are advised to verify airline policies and entry requirements of transiting|countries.
MrVop ผู้ดูแลเว็บ ภัยพิบัติ ดอท คอม ให้คำอธิบาย LINK
@MrVop Twitter ผู้ดูแลเว็บ ภัยพิบัติ ดอท คอม ให้คำอธิบายและรวบรวมข้อมูลเกี่ยวกับเหตุนี้ไว้ ดังนี้
"ทำไมอยู่ดีๆอากาศหนาวต้นเดือนเมษา มีหย่อมความกดอากาศสูง 3 หย่อมในจีนและ 1 หย่อมในแปซิฟิก ส่งผลให้เกิดลมตะวันออกเฉียงเหนือพัดแรง นำความเย็นต้นฤดูใบไม้ผลิลงมา หน้าหนาวธรรมดาตอนบ่ายแดดแรงทำไมวันสองวันนี้เย็นทั้งวัน มีเมฆอัลโตสเตรตัสปกคลุมทั่วท้องฟ้าทำให้แดดส่องลงไม่ถึงพื้น" [
Twitter]
"ธรรมดาหน้าหนาวอากาศจะแห้งท้องฟ้าไม่มีดมฆ แล้วนี่เมฆอัลโตสเตรตัสที่ปกคลุมทั่วท้องฟ้ามาจากไหน เมฆพวกนี้มาจากหย่อมความกดอากาศต่ำที่หลงเหลือจากการสลายตัวของพายุดีเปรสชั่น 01W ซึ่งส่งผลให้มีฝนตกทั่วอีสานสองวันที่ผ่านมาด้วย" [
Twitter]
เหตุการณ์นี้คล้ายกับภาวะอากาศหนาวฉับพลัน 27-31 มีนาคม 2554
แต่ครั้งนั้นมีเหตุจาก Ao index มีค่าติดลบ รอบนี้กราฟจาก NOAA ยังไม่ออก ต้องรออีกหลายวันถึงจะรู้ว่าหย่อมความกดอาศสูงผิดฤดูในจีนและแปซิฟิกมันมาจากไหน
ผมเคยบันทึกเหตุการณ์ครั้งนั้นไว้ [
Twitter]
รพ.นครธน จัดโปรแกรมตรวจลองโควิด เริ่มต้น 4,900 บาท
รพ.นครธน จัดโปรแกรมตรวจ ลองโควิด (Long COVID) สำหรับผู้ที่เพิ่งหายจากโควิด-19 สามารถประเมินอาการ และตรวจสุขภาพ ราคาเริ่มต้นที่ 4,900 บาท ติดต่อสอบถามรายละเอียดได้ที่ Contact Center โทร. 0-2450-9999
บางปะกอก 9 อินเตอร์ฯ บริการตรวจ แบบ Drive Thru 2500 บาท
รพ.บางปะกอก 9 อินเตอร์ฯ ให้บริการ ตรวจหาเชื้อ COVID-19 แบบ DRIVE THRU ราคา 2,500.- (รวมค่าบริการโรงพยาบาลฯและใบรับรองแพทย์) บริเวณ ลานจอดรถด้านหลังโรงพยาบาล จำกัดจำนวน วันละ 500 ท่าน และเฉพาะผู้ลงทะเบียนล่วงหน้าเท่านั้น สอบถาม, นัดหมาย Call center 1745
HOME ISOLATION@เกษมราษฎร์ ประชาชื่น LINK
โรงพยาบาลเกษมราษฎร์ ประชาชื่น บริการ HOME ISOLATION กับผู้ป่วยกลุ่มอาการสีเขียว คือ ไม่มีอาการหรือมีอาการเล็กน้อย หรือ สามารถกักตัวที่บ้านได้ อยู่ในเขตกรุงเทพมหานคร และ อายุไม่เกิน 60 ปี มีโรคประจำตัวที่สามารถควบคุมได้
ผู้ป่วยที่ผล ATK+ หรือ RT-PCR Detected ที่ต้องการเข้าโครงการ Home Isolation กับทางโรงพยาบาลเกษมราษฎร์ ประชาชื่น "PCC Home Isolation" ติดต่อด้วยตัวเองที่ จุดประสานงานผู้ป่วยกักตัวที่บ้าน (ทางเข้าด้านหน้ารพ.ซ้ายมือ)
เตรียมเอกสาร : 1) บัตรประชาชนตัวจริง/สูติบัตร พร้อมสำเนา 1 ชุด กรณีอายุต่ำกว่า 18 ปี ต้องเอกสารหลักฐานผู้ปกครอง 1 ชุด 2) เอกสารผลตรวจ ATK ที่เป็นบวกหรือ RT-PCR (ถ้ามี) ยกเว้นกรณีผู้ป่วยประสงค์ตรวจแบบชำระเงิน
สอบถามโทร : 1218 กด 4 หรือ02-910-1600-45
รพ.เกษมราษฎร์ บางแค วัคซีนป้องกันโรคพิษสุนัขบ้า
วัคซีนป้องกันโรคพิษสุนัขบ้า รพ.เกษมราษฎร์ บางแค ราคา 1,500 บาท (แพคเกจ 2 เข็ม) *ราคารวมค่าบริการพยาบาลและค่าบริการโรงพยาบาลแล้ว แต่ยังไม่ร่วมค่าแพทย์ ราคาเฉพาะผู้ป่วยนอก-ในคนไทยเท่านั้น กรณีมีค่ายาหรือการรักษาอื่นๆ นอกเหนือแพคเกจ โรงพยาบาคิดค่าใช้จ่ายส่วนเินตามจริง สอบถามโทร 1218 กด 3 (สาขาบางแค)
บางปะกอก8 เปิดขายวัคซีน Moderna พร้อมฉีด 1,650 บาท
โรงพยาบาลบางปะกอก8 เปิดขายวัคซีนทางเลือก Moderna พร้อมฉีด‼️ ราคา 1,650 บาท/เข็ม ✅ ฉีดได้ทันทีไม่ต้องรอ ตั้งแต่อายุ 12 ปีขึ้นไป *หมายเหตุ ชำระค่าบริการเต็มจำนวนที่จุดฉีด ให้บริการวันพุธ วันพฤหัสบดี และวันศุกร์ เวลา 08.00-16.00 น.
โรงพยาบาลบางปะกอก 8 ชั้น 1 อาคาร 1 จุดฉีดวัคซีนโควิด-19 ติดต่อสอบถามเพิ่มเติม 02-1098111 ต่อประชาสัมพันธ์
หนังสือ Health Brings Wealth ถูกรังสรรค์ขึ้น เพื่อรวบรวมความรู้ มุมมอง แง่คิด และประสบการณ์จริงจาก 4 แพทย์ผู้เชี่ยวชาญ ทั้งทางด้านหัวใจ ด้านสมอง ด้านการออกกำลังกาย รวมทั้ง ด้านโภชนาการและการชะลอวัย เพื่อเป็นประโยชน์ต่อผู้อ่านนำไปปฏิบัติได้จริง โดยมี นายแพทย์ปราเสริฐ ปราสาททองโอสถ เป็นแรงบันดาลใจที่สำคัญ และเป็นบุคคลที่ประสบความสำเร็จ ทั้งสุขภาพที่ดี (Health) ความมั่งคั่ง (Wealth) และอายุยืนอย่างมีคุณภาพ (Longevity)
รพ.พระนั่งเกล้า เปิดลงทะเบียนฉีดเข็ม 2-4 LINK
ขอเชิญประชาชนทั่วไป อายุ 12 ปีขึ้น ที่มีความต้องการฉีดวัคซีนเข็ม 2 - 4 ลงทะเบียนเพื่อรับวัคซีน สถานที่รับวัคซีน : อาคารเจ้าสัว โรงพยาบาลพระนั่งเกล้า
วันและเวลา : วันศุกร์ที่ 8 เมษายน 2565 ตั้งแต่เวลา 8.00 - 12.00 น. โดย
- ผู้ที่จะรับเข็ม 2 จะต้องฉีด Sinovac, Sinopharm, Pfizer มาแล้วอย่างน้อย 1 เดือน หรือฉีด Astra Zeneca มาแล้วไม่น้อยกว่า 3 เดือน
- ผู้ที่จะรับเข็ม 3 จะต้องฉีดวัคซีนเข็ม 2 มาแล้วไม่น้อยกว่า 3 เดือน ยกเว้น หากฉีด Sinovac หรือ Sinopharm ให้ฉีดเข็ม 2 มาแล้วไม่น้อยกว่า 1 เดือน
- ผู้ที่จะรับเข็ม 4 จะต้องฉีดเข็ม 3 มาแล้วไม่น้อยกว่า 4 เดือน
แผนการตลาด... ความมั่งคั่งสีเขียว
- รายได้ส่วนลดพิเศษ (Fast Start Bonus) จากการ ซื้อต้นไม้มหัศจรรย์ 10,000 บาท สมาชิกจะได้รับNMYZ Token จํานวน 10,000 Token ซึ่งสามารถนําไปซื้อผลิตภัณฑ์ ใน Miracle Shop ได้ ในมูลค่า 20,000 บาท สามารถสร้างกําไรทันที 10,000 บาท หรือ กําไร 100%
- รายได้ผลตอบแทนจากการใช้จ่ายของท่านและเพื่อนของท่าน ในอัตรา 20%-25% โดยระบบจะคํานวณและจ่ายผลตอบแทนให้แก่ท่านในรูปของ NMYZ Token
- สมาชิกจะได้รับ Digital Voucher บัตรเข้าพักโรงแรม ดีวารี พัทยา มูลค่า 5,000 บาท ทันที Free !!
- สิทธิพิเศษในการใช้ NMYZ Token ชําระค่าสินค้าและบริการบริษัทในเครือในราคาที่ตํ่ากว่าถึง 10%-30%เมื่อเทียบกับการชําระด้วยเงินสด เช่น การชําระค่าโรงแรม My Ozone การซื้อสินค้าและบริการที่ DNA Clinicและการเข้าใช้บริการในโรงพยาบาลพานาซีและคลินิกในเครือพานาซี เป็ นต้น
- อุ่นใจกับ Miracle Health ปรึกษาปั ญหาสุขภาพกับแพทย์ฟรี ไม่มีค่าใช้จ่ายตลอดอายุสมาชิก
- โอกาสทางธุรกิจ ท่านสามารถมีร้านขายยาออนไลน์แบบถูกต้องตามกฎหมายโดยไม่ต้องลงทุนแม้แต่บาทเดียวสมาชิกสามารถเปิ ดร้านได้ทันที ด้วยระบบ CSR Family สมาชิกจะมีแพทย์เป็ นที่ปรึกษา และจ่ายยาให้กับลูกค้าของท่าน โดยไม่มีค่าใช้จ่ายเพิ่มเติมแต่อย่างใด
- หากท่านเป็นแพทย์ โอกาสในการเป็นเจ้าของคลินิกออนไลน์ มีใบอนุญาต Telemed หรือ แพทย์ทางไกลโดยไม่ต้องลงทุนเปิ ดคลินิก ไม่ต้องสต็อกยา ไม่ต้องจ้างบุคลากร ด้วยระบบบริหารของ CSR สมาชิกในเครือข่ายจะแนะนําคนไข้มาให้ท่าน โดยไม่ท่านไม่ต้องทําการตลาด
- สิทธิในการเข้าชม มหัศจรรย์เมืองกัญชา พร้อมรับส่วนลด 10%-50% เมื่อซื้อสินค้าและบริการภายในเมืองมหัศจรรย์
- โอกาสในการเติบโตสู่ความมั่งคั่งไปพร้อมๆ กับบริษัท
ข้อมูลจาก
เอกสารเผยแพร่ของ NUSA CSR
จุดตรวจโควิดของรพ.สรรพสิทธิประสงค์ อุบลฯ
รพ.เอกชนภาคกลาง ตะวันตก และตะวันออก
| โรงพยาบาล |
คลินิกเครือข่าย |
ภาคกลาง
|
| รพ.เทพากร |
(034) 273 463 |
| รพ.การุญเวช อยุธยา |
|
| รพ.เอเชียอินเตอร์เนชั่นแนล |
(035) 904478 |
| รพ.วิชัยเวช อินเตอร์เนชั่นแนล อ้อมน้อย |
(02) 4417899 |
| รพ.วิชัยเวช อินเตอร์เนชั่นแนล สมุทรสาคร |
(034) 82670929 |
| รพ.มหาชัย 3 |
(034) 429111 |
| รพ.เอกชัย |
(034)417999 |
| รพ.เกษมราษฏร์ สระบุรี |
|
| รพ.ธนบุรีอู่ทอง |
(035)551673 |
ภาคตะวันตก
|
| รพ. สินแพทย์ กาญจนบุรี |
(034)5209115 |
| รพ.กรุงเทพเมืองราช |
(032)3227480 |
| รพ.กรุงเทพเพชรบุรี |
(032)897888 |
ภาคตะวันออก
|
| รพ.เกษมราษฎร์ ฉะเชิงเทรา |
(038)812702 |
| รพ.จุฬารัตน์ ชลเวช |
(038)2843545 |
| รพ.เอกชล 2 |
(038) 939888ต่อ5218,5308 |
| รพ.จุฬารัตน์ 304 อินเตอร์ |
(037) 2186545 |
| รพ.เกษมราษฎร์ ปราจีนบุรี |
(037) 627000 |
| รพ.มงกุฎระยอง |
|
| รพ.เกษมราษฎร์ อินเตอร์เนชั่นแนล อรัญประเทศ |
(037)640000 |
ระดับเอเซีย ไทยอยู่อันดับ 4
สถานการณ์ระดับเอเซีย ไทยอยู่อันดับ 4 ตามหลัง เกาหลีใต้ ญี่ปุ่น และเวียดนาม ขณะที่อันดับถัดจากไทยลงไป มีจำนวนเคส ทิ้งห่างอย่างมาก (เกิน 50%) นับว่ายังน่ากังวลอยู่
ประชาชนในพื้นที่ มาบตาพุด ติดต่อ รพ.เฉลิมพระเกียรติ สมเด็จพระเทพฯ 081-3708248
วันที่ 11 เม.ย.65 - บาดเจ็บ 4 ราย เสียชีวิต 1 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 11 เม.ย.65) เกิดอุบัติเหตุ 4 ครั้ง บาดเจ็บ 4 ราย เสียชีวิต 1 ราย “ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
คลินิกแพทย์แผนจีน ทุกวันศุกร์
ประชาชนในอ.เสริมงาม ติดต่อ รพ.สต.
ประชาชนในอ.แม่เมาะ ติดต่อ รพ.สต.ดังนี้
ประชาชนในอ.แจ้ห่ม ติดต่อ รพ.สต.ดังนี้
ประชาชนในอ.งาว ติดต่อ รพ.สต.ดังนี้
ประชาชนในอ.วังเหนือ ติดต่อ รพ.สต.ดังนี้
มิสเตอร์มอเตอร์เอ็กซ์โป เผย 4 เทคนิคขับรถประหยัดน้ำมัน
Mr.Motor Expo แนะ 4 เทคนิคดังนี้
1.เหยียบคันเร่งเบาๆ
2.ใช้ความเร็วคงที่
3.ประเมินสถานการณ์ล่วงหน้า
4.เติมลมยางตามกำหนด
ซูซูกิ บอก ขับรถให้ประหยัดน้ำมันง่ายนิดเดียว
6 ขับรถให้ประหยัดน้ำมันง่ายนิดเดียว จาก ซูซูกิ
1.ขับรถด้วยความเร็วคงที่
2.ไม่เร่งเครื่องยนต์ขณะออกตัว
3.ไม่เร่งเครื่องเกินความจำเป็น
4.ไม่เบรกกระทันหัน
5.ชะลอรถแทนการเบรค
6.ไม่บรรทุกของหนักจนเกินไป
เทคนิคการขับรถให้ปลอดภัยและประหยัดน้ำมันช่วงเทศกาล สถาบันวิจัยและพัฒนาพลังงาน นครพิงค์ ม.เชียงใหม่
1. ขับรถไม่เกิน 90 กม./ชม. จะช่วยประหยัดน้ำมันได้ถึง 10-15 % และยังช่วยลดความเสี่ยงการเกิดอุบัติเหตุอีกด้วย
2. วางแผน จุดหมายปลายทาง ให้ชัดเจน
3. การอุ่นเครื่องยนต์ในตอนเช้า ก่อนออกเดินทาง 2 – 3 นาที จะทำให้ระบบหล่อลื่นทำงานดีขึ้น
4. ตรวจเช็คสภาพรถยนต์อยู่เป็นประจำ
5. ตรวจวัดลมยางอยู่เสมอควรเติมลมยางให้ได้ตามกำหนดมาตรฐาน
6. อย่าบรรทุกน้ำหนักเกินพิกัดรถยนต์
7. ทางเดียวกันไปด้วยกัน ช่วยประหยัดน้ำมันได้อีกเยอะ
8. ง่วงและเมาไม่ขับ ซึ่งอาจจะนำมาสู่ปัญหาของอุบัติเหตุ และการสูญเสียทรัพย์สินได้
มาตรา ๑ พระราชบัญญัตินี้เรียกว่า "พระราชบัญญัติกัญชา กัญชง พ.ศ....
มาตรา ๒ พระราชบัญญัตินี้ให้ใช้บังคับตั้งแต่วันถัดจากวันประกาศในราชกิจจานุเบกษาเป็นต้น
มาตรา ๓ ให้กัญชา กัญชง ที่ดำเนินการตามพระราชบัญญัตินี้แล้ว ไม่ถือเป็นยาเสพติดให้โทษตามกฎหมายว่าด้วยยาเสพติดให้โทษ หรือประมวลกฎหมายยาเสพติด
มาตรา ๔ ในพระราชบัญญัตินี้
"กัญชา" หมายความว่า พืชในสกุล Cannabis และวัตถุหรือสารต่าง ๆ ที่มีอยู่ในพืชกัญชา เช่น ยาง น้ำมัน
"กัญชง" หมายความว่า พืชในสกุล Cannabis และวัตถุหรือสารต่าง ๆ ที่มีอยู่ในพืชกัญชง เช่น ยาง น้ำมัน และมีสารเตตราไฮโดรแคนนาบิ่นอล (tetrahydrocannabinol, THC) ไม่เกินปริมาณตามที่คณะกรรมการกำหนดโดยประกาศในราชกิจจานุเบกษา
"สารสกัด" หมายความว่า สารที่ได้จากกระบวนการสกัดทุกส่วนของกัญชา หรือกัญชง
"ผลิต" หมายความว่า เพาะ ปลูก ทำ ผสม ปรุง แปรสภาพ เปลี่ยนรูป สังเคราะห์ทาง
วิทยาศาสตร์ และให้หมายความรวมถึงการแบ่งบรรจุหรือรวมบรรจุด้วยเพื่อขาย ไม่รวมการแปรรูปอย่างง่าย
"ขาย" หมายความว่า จำหน่าย จ่าย แจก หรือแลกเปลี่ยน ทั้งนี้ เพื่อประโยชน์ในทางการค้า
หรือให้โดยมีสิ่งตอบแทนหรือผลประโยชน์อย่างอื่น และให้หมายความรวมถึงการมีไว้เพื่อขาย
"ส่งออก" หมายความว่า นำหรือส่งออกนอกราชอาณาจักร
"นำเข้า" หมายความว่า นำหรือสั่งเข้ามาในราชอาณาจักร
"บริโภค" หมายความว่า กิน เคี้ยว ดื่ม อม หรือนำเข้าสู่ร่างกายไม่ว่าด้วยวิธีใด ๆ หรือใน
รูปลักษณะใด ๆ
"ผู้อนุญาต" หมายความว่า เลขาธิการคณะกรรมการอาหารและยา หรือผู้ซึ่งเลขาธิการ
คณะกรรมการอาหารและยามอบหมาย สำหรับการอนุญาตให้ผลิต และการนำเข้าหรือส่งออก ขาย หรือการโฆษณากัญชา กัญชง
"ผู้รับจดแจ้ง" หมายความว่า
(๑) ผู้ว่าราชการกรุงเทพมหานคร หรือผู้ซึ่งผู้ว่าราชการกรุงเทพมหานครมอบหมาย สำหรับการจดแจ้งเพื่อใช้ประโยชน์จากกัญชา กัญชงในครัวเรือน ในกรุงเทพมหานคร
(๒) นายกองค์การบริหารส่วนจังหวัด หรือผู้ซึ่งนายกองค์การบริหารส่วนจังหวัดมอบหมายสำหรับการจดแจ้งเพื่อใช้ประโยชน์จากกัญชา กัญชงในครัวเรือน ในส่วนภูมิภาค
"การใช้ประโยชน์จากกัญชา กัญชงในครัวเรือน" หมายความว่า การเพาะ ปลูก เพื่อการบริโภคส่วนบุคคล เพื่อดูแลรักษาสุขภาพของตนเองและครอบครัวที่อาศัยอยู่ในที่อยู่อาศัยเดียวกัน ทั้งนี้ ไม่เกินปริมาณที่กำหนดในกฎกระทรวง
"กระบวนการพิจารณาอนุญาต " หมายความว่า การพิจารณาคำขอ การตรวจสอบความถูกต้องของเอกสาร การประเมินเอกสารทางวิชาการ การตรวจวิเคราะห์ การตรวจสถานที่ผลิต นำเข้า ส่งออก ขาย หรือการตรวจสอบ เพื่อออกใบอนุญาต หรือใบรับจดแจ้ง ตลอดจนการพิจารณาใด ๆ เกี่ยวกับกัญชา กัญชง
"โฆษณา" หมายความว่า การกระทำไม่ว่าโดยวิธีใด 1 ให้ประชาชนเห็น ได้ยิน หรือทราบข้อความ เพื่อประโยชนในทางการค้า
"ผู้รับอนุญาต" หมายความว่า ผู้ได้รับใบอนุญาตตามพระราชบัญญัตินี้ และในกรณีนิติบุคคลเป็นผู้ได้รับใบอนุญาต ให้หมายความรวมถึงผู้แทนนิติบุคคลหรือผู้มีอำนาจทำการแทนนิติบุคคล ซึ่งเป็นผู้ได้รับใบอนุญาต
"ผู้จดแจ้ง" หมายความว่า ผู้ได้รับใบรับจดแจ้งเพื่อใช้ประโยชน์จากกัญชา กัญชงในครัวเรือนตามพระราชบัญญัตินี้
"พนักงานเจ้าหน้าที่" หมายความว่า ผู้ซึ่งรัฐมนตรีแต่งตั้งให้ปฏิบัติการตามพระราชบัญญัตินี้
"คณะกรรมการ" หมายความว่า คณะกรรมการกัญชา กัญชง
"รัฐมนตรี" หมายความว่า รัฐมนตรีผู้รักษาการตามพระราชบัญญัตินี้
มาตรา ๕ ให้รัฐมนตรีว่าการกระทรวงสาธารณสุขรักษาการตามพระราชบัญญัตินี้ และให้มีอำนาจแต่งตั้งพนักงานเจ้าหน้าที่ กับออกกฎกระทรวงกำหนดค่าธรรมเนียมต่าง ๆ ที่เจ้าหน้าที่ใด้ให้บริการ รวมทั้งกำหนดอัตราค่าธรรมเนียมไม่เกินอัตราตามบัญชีท้ายพระราชบัญญัตินี้ ลดหรือยกเว้นค่าธรรมเนียม และกำหนดกิจการอื่น รวมทั้งออกประกาศเพื่อปฏิบัติการตามพระราชบัญญัตินี้
กฎกระทรวงและประกาศนั้น เมื่อได้ประกาศในราชกิจจานุเบกษาแล้วให้ใช้บังคับได้
มาตรา ๗ การดำเนินการผลิตผลิตภัณฑ์สมุนไพร ยา อาหาร เครื่องสำอาง เครื่องมือแพทย์ วัตถุอันตรายที่ใช้ในบ้านเรือนและสาธารณสุขโดยใช้กัญชา กัญชงเป็นวัตถุดิบหรือส่วนประกอบในผลิตภัณฑ์สำเร็จรูปของผู้ผลิตให้เป็นไปตามกฎหมายว่าด้วยการนั้น โดยไม่ต้องดำเนินการตามพระราชบัญญัตินี้
สถานีกาชาดที่ 5 สวางคนิวาส เปิด walk in 25 และ 29 เมษายน LINK
สถานีกาชาดที่ 5 สวางคนิวาส เปิด walk in 25 และ 29 เมษายน 2565
บริการวันละ 400 คิว เวลา 8-14 น.
เริ่มแจกคิว เวลา 7 น.
เงื่อนไข สำหรับแต่ละเข็ม ตามภาพ
เอกสารที่ต้องเตรียม
บัตรประชาชน หากเป็นต่างชาติใช้บัตรชมพู/พาสปอร์ต
ใบรับรองการฉีดวัคซีนหรือหมอพร้อม
ปากกา
ใบรับรองการฉีดจะพิมพ์ให้ เฉพาะผู้ที่นำใบประวัติการรับวัคซีนมาเท่านั้น
ผู้ที่แสดงประวัติในหมอพร้อม หลังจากฉีดแล้ว 1 ชั่วโมง จะอัพเดตข้อมูลเข้าหมอพร้อม
วันที่ 27 ธันวาคม 2564 พบการติดเชื้อโควิดสายพันธุ์โอไมครอน 92 ราย กระทรวงสาธารณสุขแถลงเตือนภัยโรคโควิด 19 ในระดับ 3 โดยเป็นสัญญาณเตือนว่ามีการติดเชื้อจากต่างประเทศ และวันที่ 1 มกราคม 2565 ได้ปรับพื้นที่สีของจังหวัดตามระดับสถานการณ์ ปรับมาตรการเข้าราชอาณาจักรและการตรวจหาเชื้อโควิดทั้งในรูปแบบ Sandbox Programme และ Test and Go และได้ยกระดับการเตือนภัยโรคโควิด 19 เป็นระดับที่ 4 ในวันที่ 9 มกราคม 2565 โดยมีการปรับพื้นที่สีของจังหวัดตามระดับสถานการณ์ ให้สถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ เปิดในรูปแบบร้านอาหารได้โดยต้องได้รับอนุญาตจากคณะกรรมการโรคติดต่อจังหวัด ต่อมามีการแพร่ระบาดเป็นกลุ่มก้อนในจังหวัดกาฬสินธุ์ จังหวัดอุบลราชธานี และพบการแพร่ระบาดไปหลายจังหวัดทั่วประเทศ ทั้งนี้ พบว่าอาการของผู้ป่วยโควิด 19 สายพันธุ์โอไมครอน ผู้ติดเชื้อส่วนใหญ่มีอาการไม่รุนแรง อาจไม่จําเป็นต้องได้รับการดูแลรักษาแบบผู้ป่วยในของโรงพยาบาล หรืออยู่โรงพยาบาลเพียงระยะสั้น ๆ แล้วไปพักฟื้นต่อที่บ้านหรือสถานที่รัฐจัดให้ จึงปรับการบริหารจัดการโรคโควิด 19 สู่โรคประจําถิ่น (Endemic) ด้วย 4 มาตรการหลัก คือ มาตรการสาธารณสุขมีเป้าหมายเพื่อให้อัตราการติดเชื้ออยู่ในระดับที่สามารถรองรับได้และประชากรมีภูมิคุ้มกันมากขึ้น
การระบาดระลอกมกราคม 2565 ตั้งแต่วันที่ 1 มกราคม 2565 ถึง 29 มีนาคม 2565 พบผู้ติดเชื้อในประเทศรวม 1,351,963 ราย เสียชีวิต 3,260 ราย (ร้อยละ 0.24) หายป่วยสะสม 1,136,792 ราย ผู้ป่วยกําลังรักษา 245,154 ราย สถานการณ์โรคโควิด 19 ประเทศไทย มีแนวโน้มพบผู้ติดเชื้อในระดับสูงคงตัวแนวโน้มสถานการณ์ยังสอดคล้องกับการคาดการณ์ตามฉากทัศน์ ยังคงระดับการเตือนภัยในระดับที่ 4 ทั่วประเทศ และเร่งดําเนินมาตรการ SAVE 608 by booster dose รวมทั้งกํากับมาตรการป้องกันควบคุมโรค VUCA โดยเฉพาะในสถานที่เสี่ยง เพื่อลดความเสี่ยงต่อการระบาดเป็นวงกว้าง หรือแพร่โรคไปยังกลุ่มเสี่ยง
ประเทศไทยและทั่วโลกต้องเผชิญกับวิกฤติการแพร่ระบาดของโรคโควิด 19 ตั้งแต่ต้นปี 2563 จนถึงปัจจุบัน ซึ่งส่งผลต่อประชาชนทั้งด้านสุขภาพ สังคม และเศรษฐกิจ สําหรับประเทศไทยพบผู้ติดเชื้อในประเทศรวม 3,575,398 ราย ผู้เสียชีวิต 24,958 ราย คิดเป็นอัตราป่วยตาย ร้อยละ 0.7 (ข้อมูล ณ 29 มีนาคม 2564) อย่างไรก็ตาม สถานการณ์โรคโควิด 19 ประเทศไทย มีแนวโน้มพบผู้ติดเชื้อเพิ่มขึ้น ในขณะที่การเปรียบเทียบอัตราป่วยตาย หรืออัตราส่วนผู้ติดเชื้อต่อผู้เสียชีวิตด้วยโรคโควิด 19 สายพันธุ์ Omicron ต่ํากว่า สายพันธุ์ Delta ถึง 4 เท่า ประกอบกับความครอบคลุมในการฉีดวัคซีน ซึ่งให้บริการฉีดวัคซีนแล้ว 126,431,235 โดส ความครอบคลุมเข็ม 1 ร้อยละ 79.5 เข็ม 2 ร้อยละ 72.2 และเข็ม 3 ขึ้นไป ร้อยละ 33.3 (ข้อมูลกรมควบคุมโรค ณ วันที่ 28 มีนาคม 2565) รวมทั้งประชาชนให้ความร่วมมือปฏิบัติตามมาตรการป้องกันโรคส่วนบุคคล เป็นอย่างดี กระทรวงสาธารณสุข จึงปรับการบริหารจัดการโรคโควิด 19 สู่โรคประจําถิ่น (Endemic) เพื่อให้ประชาชนกลับมาใช้ชีวิตได้ตามปกติ
ด้านการวิจัย
เพื่อพัฒนาองค์ความรู้ด้านโรคที่รักษายาก ผ่านการพัฒนานวัตกรรมและการวิจัยตัวอย่างงานวิจัยที่โดดเด่น เช่น การวิจัยด้านนวัตกรรมสร้างอวัยวะเทียมที่มีชีวิต (Tissue Regeneration) ซึ่งทำให้เกิดการผลิตกระดูกเทียมเยื่อหุ้มสมองเทียม การรักษาโรคด้วยเม็ดเลือดขาวซึ่งกระตุ้นภูมิต้านทานต่อเซลล์มะเร็ง การปลูกถ่ายอวัยวะ เช่น ตับ และไต สำหรับไตได้ ดำเนินการไปแล้วกว่า 2.9 พันราย ซึ่งถือว่ามากที่สุดในประเทศไทย การปลูกถ่ายอวัยวะตับจากพ่อแม่สู่ลูกที่มีภาวะตับวาย โดยทำสำเร็จเป็นรายแรกในประเทศไทย เปลี่ยนลิ้นหัวใจเทียมโดยไม่ต้องผ่าตัด และนวัตกรรมรักษาลิ้นหัวใจรั่วด้วยการใช้คลิปหนีบ เป็นต้นด้านการรักษาและสร้างสุขภาพ
รามาธิบดีมีการส่งเสริมแนวทางการรักษาโรคและดูแลสุขภาพในการแพทย์ยุคใหม่ ที่ตอบโจทย์ความท้าทายเชิงระบบ โดยมีแนวคิดว่าการรักษาหลายอย่างสามารถทำได้ที่ “บ้าน” ซึ่งตัวอย่างนวัตกรรมการรักษาที่โดดเด่น ได้แก่ นวัตกรรมระบบการให้บริการผู้ป่วยนอกผ่าน Telemedicine ซึ่งคณะแพทยศาสตร์โรงพยาบาลรามาธิบดีเป็นผู้นำด้านนี้ รวมถึงนวัตกรรมเคมีบำบัดที่บ้านสำหรับผู้ป่วยมะเร็ง ที่ช่วยให้เกิดการรักษาด้วยเคมีบำบัดอย่างตรงเวลาและลดการใช้เตียงในโรงพยาบาล ซึ่งนำมาสู่การผลักดันเชิงนโยบายสาธารณสุขของประเทศไทย ที่ส่งผลให้เกิดการประหยัดค่าใช้จ่ายเชิงสาธารณสุขอย่างมาก
ep. 1.1 “พนักงาน ไม่ใช่ ผู้ควบคุมข้อมูลส่วนบุคคล”
11.การเก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลส่วนบุคคลที่มีความละเอียดอ่อน
Hospitel โรงพยาบาลหัวเฉียว
โรงพยาบาลหัวเฉียว ร่วมกับ The Chateau Palace Hotel ปิ่นเกล้า (มาตรฐานบริการโดยโรงแรมโอ๊ควู๊ด) เปิดให้บริการ Hospitel รองรับการดูแลรักษาผู้ป่วยติดเชื้อ COVID-19
ผู้ที่มีผลตรวจ ATK หรือ RT-PCR เป็นบวก รักษาฟรี ไม่มีค่าใช้จ่าย
ห้องผู้ป่วยพิเศษรับส่งต่อผู้ติดเชื้อ ด้วยมาตรฐานการดูแลรักษาผู้ป่วย COVID-19 ภายใต้การดูแลของทีมแพทย์ พยาบาล โรงพยาบาลหัวเฉียว
ผู้ป่วยสามารถใช้สิทธิประกันสุขภาพ ประกันโควิด ประกันสังคม หรือสิทธิบัตรทอง *โดยไม่เสียค่าใช้จ่าย
ห้องพักตามมาตรฐานโรงแรมชั้นนำ สิ่งอำนวยความสะดวก - เครื่องปรับอากาศ กาต้มน้ำร้อน ไมโครเวฟ เครื่องทำน้ำอุ่น Smart TV 43 นิ้ว High Speed WIFI ตู้เย็น อาหาร 3 มื้อ (บริการอาหารอิสลาม มังสวิรัติ) ดูแลโดยทีมบุคลากรทางการแพทย์ ตลอด 24 ชั่วโมง
สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกรับผู้ป่วยใน โทร. 0-2223-1351 ต่อ 3122, 3123 : ตลอด 24 ชั่วโมง
ลิงค์
รพ.หัวเฉียวประวัติศาสตร์วัณโรค และการรณรงค์ในประเทศไทย
วันที่ 24 มีนาคม ค.ศ. 1882 ดร.โรเบิร์ต คอช (Dr. Robert Koch) ประกาศการพบสาเหตุของ วัณโรค คือเชื้อแบคทีเรีย Tubercle bacillus เป็นครั้งแรก ซึ่งอยู่ในช่วงที่วัณโรคได้แพร่กระจายไปทั่วยุโรปและอเมริกา การค้นพบของเขาจึงช่วยเบิกทางการวิเคราะห์คิดค้นวิธีรักษาวันโรค ต่อมาในปี ค.ศ. 1982 ในโอกาสครบรอบ 100 ปี การประกาศของเขา สหพันธ์องค์กรต่อต้านวัณโรคและโรคปอดนานาชาติ (IUATLD: International Union Against Tuberculosis and Lung Disease) เสนอให้กำหนด 24 มีนาคม ของทุกปีเป็นวันวัณโรคโลก (World TB Day) อย่างเป็นทางการเพื่อร่วมกัน ต่อต้านวันโรคและย่ำเตือนให้ประชากรทั่วโลกตระหนักว่าวัณโรคยังคงระบาดทั่วโลกเป็น สาเหตุการเสียชีวิตกว่า 1.75 ล้านคนต่อปี องค์การอนามัยโลกจึงได้ร่วมกับ IUATLD และองค์กรที่เกี่ยวข้องช่วยกันรณรงค์ให้ทั่วโลกเห็นความสำคัญและร่วมกันต่อด้านวัณโรค
วัณโรคเป็นโรคติดต่อสำคัญที่ยังเป็นปัญหาสาธารณสุขทั่วโลก จากข้อมูลองค์การอนามัยโลก (WHO) วันโรคยังคงเป็นโรคติดต่อที่เป็นนักฆ่าที่อันตรายที่สุดในโลก โดยในแต่ละวันจะมีคนเสียชีวิตจากวัณโรคมากกว่า 4, 100 คน และเกือบ 28,000 คน ล้มป่วยด้วยวันโรค ส่วนประเทศไทย ปี พ.ศ. 2564 ที่ผ่านมา องค์การอนามัยโลก (WHO) ประมาณการว่ามีผู้ป่วยวันโรครายใหม่ 105,000 รายต่อปี และมีการเสียชีวิตเนื่องจากวันโรคมากถึง 10,000 รายต่อปี กระทรวงสาธารณสุข กรมควบคุมโรค ได้ตระหนักถึงปัญหานี้มาโดยตลอด และได้ดำเนินงานควบคุมวัณโรคตามแผนปฏิบัติการระดับชาติด้านการต่อต้านวัณโรคให้เป็นไปตามข้อตกลงนานาชาติของการประชุม United Nations High-Level Meeting (UNHLM) ประชุมปี 2561 และเป็นไปตามเป้าหมายการพัฒนาที่ยั่งยืน (SDGร ปี พ.ศ. 2573 ซึ่งสอดคล้องกับยุทธศาสตร์ยุติวัณโรค (End TB Strategy) ในปี พ.ศ.2578
การดำเนินงานให้ประสบความสำเร็จนั้น ต้องอาศัยเครือข่ายการประสานความร่วมมือของหน่วยงานและสถานบริการสาธารณสุขทุกระดับทั้งภาครัฐและเอกชนในการมีส่วนร่วมในการควบคุมวัณโรค ได้แก่ การค้นหา การรักษา การส่งต่อ การรายงานข้อมูลผู้ป่วย รวมถึงการเผยแพร่ประชาสัมพันธ์ความรู้วัณโรคสู่ประชาชน ส่งเสริมการให้ความรู้แก่ผู้ป่วย ครอบครัวและชุมชนก่อให้เกิดความร่วมมือในการควบคุมวัณโรคของทุกภาคส่วนเป็นไปอย่างมีประสิทธิภาพและได้มาตรฐานการดำเนินงานวัณโรคแห่งชาติ และเป็นที่ยอมรับในระดับสากล
กระทรวงสาธารณสุข โดยกรมควบคุมโรค ขอความร่วมมือหน่วยงานภาคีเครือข่ายทั้งภายในและภายนอกสังกัดกระทรวงสาธารณสุข ทั้งภาครัฐและเอกชน ร่วมจัดกิจกรรมรณรงค์ ในวันวัณโรคสากลประจำปี พ.ศ. 2565 (World TB Day 2022) พร้อมกันทั่วประเทศ ในวันที่ 24 มีนาคม 2565 ภายใต้ Theme รณรงค์ โดยปีนี้ ทาง Stop TB Partnership และองค์กรต่างๆระดับนานาชาติ ได้ใช้ Theme "INVEST TO END TB. SAVE LIVES." "ร่วมพลัง ต่อชีวิต เพื่อภารกิจยุติวัณโรค" เพื่อเป็นข้อความสื่อไปถึงทุกภาคส่วนร่วมกันรณรงค์ไปในทิศทางเดียวกัน
"ร่วมพลัง ต่อชีวิต เพื่อภารกิจยุติวัณโรค"
"INVEST TO END TB. SAVE LIVES."
การดำเนินงานเพื่อยุติวันโรค ให้ประสบความสำเร็จนั้น ต้องอาศัยความร่วมมือของหน่วยงานภาคีเครือข่ายของทุกภาคส่วน ทั้งภายในและภายนอกสังกัดกระทรวงสาธารณสุข ทั้งภาครัฐและเอกชน หน่วยงานสถานบริการสาธารณสุขทุกระดับร่วมมือประสานงาน รวมพลังมุ่งมั่นทุ่มเท ทั้งทรัพยากร บุคลากร และงบประมาณกับการกิจหลักด้านการค้นหาผู้ป่วยวัณโรคและผู้ติดเชื้อวัณโรคระยะแฝง ด้านการตรวจวินิจฉัยด้วยเทคโนโลยีที่ทันสมัยด้านการดูแลรักษาที่ได้มาตรฐาน ด้านการป้องกันวันโรค ตลอดจนการศึกษาวิจัยและพัฒนาเทคโนโลยีใหม่ๆ เพิ่มโอกาสการเข้าถึงการวินิจฉัยแก่ประชากรกลุ่มเสี่ยงต่าง ๆ ที่สำคัญ เข้าสู่กระบวนการรักษาทุกรายให้หายด้วยเทคนิคการดูแลรักษาผู้ป่วยเป็นศูนย์กลาง Patient Centered Care และ DOT เสริมสร้างความรอบรู้ให้ประชาชนมีพฤติกรรมที่เหมาะสม ลดการรังเกียจตีตราและเลือกปฏิบัติ โดยมีเป้าหมายเพื่อช่วยเหลือชีวิต ลดอัตราการป่วย และอัตราการตายจากวัณโรคให้มากที่สุด เพื่อยุติปัญหาวัณโรคของประเทศ" ตามเป้าหมายการยุติวัณโรคของแผนปฏิบัติการระดับชาติ อันจะนำไปสู่จุดมุ่งหมายอันสูงสุด (Vision) คือ TB-Free Thailand For TB-Free World "เมืองไทยปลอดวันโรค เพื่อโลกปลอดวัณโรค" ต่อไป
Key message
"รู้เร็ว รักษาหาย ไม่แพร่กระจาย" สำหรับการรณรงค์ให้ประชาชนทั่วประเทศ ให้พึงตระหนักถึงวัณโรคอยู่ตลอดเวลา ตรวจหาวัณโรคทันทีเมื่อรู้ว่าเป็นผู้สัมผัส หรือเมื่อมีอาการ หรืออย่างน้อยปีละ 1 ครั้งเพื่อเข้าสู่กระบนการรักษาไม่ให้เกิดความล่าช้ (Delay Treatment) ดูแลรักษาตนเองอย่างเคร่งครัด เพราะวัณโรครักษาหายได้ ลดการแพร่กระจายเชื้อไปสู่บุคคลอื่นต่อไป
ศูนย์นิทราเวช รพ.จุฬาลงกรณ์ ศูนย์รักษาโรคที่เกิดจากการนอนหลับ LINK
ศูนย์นิทราเวช รพ.จุฬาลงกรณ์ ก่อตั้งมาตั้งแต่ปี พ.ศ. 2547 บริการ ตรวจวิเคราะห์และวินิจฉัยโรคต่างๆ แก่ผู้ป่วยที่มีความผิดปกติจากการนอนหลับ ให้คำปรึกษา ตรวจวินิจฉัย ตรวจวิเคราะห์ทางห้องปฏิบัติการ ตลอดจนรักษาอาการ ที่เกี่ยวกับโรคความผิดปกติที่เกิดจากการหลับ เช่น ภาวะหยุดหายใจขณะหลับจากการอุดกั้นและภาวะนอนกรน อาการง่วงนอนผิดปกติเวลากลางวัน โรคนอนไม่หลับ ละเมอ ฝันร้าย ปัสสาวะรดที่นอนขณะหลับ เป็นต้น
การให้บริการ
คลินิกโรคความผิดปกติจากการหลับ ทุกวันจันทร์ – อังคาร เวลา 13.00 – 16.00 น.
คลินิกเครื่องอัดอากาศแรงดันบวก (PAP Clinic) ทุกวันจันทร์ – ศุกร์ เวลา 9.00 – 16.00 น.
ห้องปฏิบัติการตรวจการนอนหลับ (Polysomnography Test) ทุกวัน เวลา 20.00 – 07.00 น.
ศูนย์นิทราเวช ชั้น 5 อาคารผู้ป่วยในพิเศษ 14 ชั้น
คลินิกโรคความผิดปกติจากการหลับ (OPD) ศูนย์นิทราเวช อาคารภูมิสิริมังคลานุสรณ์ ชั้น 21 โซน C
รมช.สธ.พร้อมผู้บริหาร สธ. ร่วมกิจกรรมวิ่งเทรล Amazean Jungle Tiail 2022
ร่วมกิจกรรมวิ่งเทรล Amazean Jungle Tiail 2022 6-8 พ.ค. 2565 อ.เบตง จ.ยะลา
รมช.สารารณสุข พร้อมด้วย นพ.รงชัย เลิศวิไลรัตนพงศ์ รองปลัดกระทรวงสาธารณสุข นผ.มณเทียร คณาสวัสดิ์ รองอธิบดีกรมอนามัย นพ.สุเทพ เพชรมาก ผู้ตรวจราชการฯเขตสุขภาพที่ 12 นพ.วิเศษ สิรินทรโสภณ นพ.สสจ.ยะลา นพ.อรรถสิทธิ์ แดงมณี ผอ.ศูนย์อนามัยที่ 12 ยะลา นพ.สมบัติ ผดุงวิทย์วัฒนา นพ.สสจ.สตูล นพ.อินทร์ จันแดง ผอ.รพ.ยะลา นพ.สวรรค์ กาญจนะ ผอ.รพ.เบตง และผู้บริหาร-บุคลากรทางการแพทย์และสารารณสุขหน่วยงานในส่วนกลาง/ขตสุขภาพที่ 12 ร่วมพิธีการปล่อยตัวนักวิ่งและร่วมกิจกรรมวิ่งAmazaen Jungle Trail 2020 เปิดผืนป่า "อเมซอลแห่งอาเชียน" โดย นายพิพัฒน์ รัชกิจประการ รมว.การท่องเที่ยวและกีฬา เป็นประธานพิธีการปล่อยตัวนักวิ่ง 100 กม.(นักวิ่งกว่า 170 คน) ในเวลาต่อมา ผลเรือตรี สมเกียรติ ผลประยูs เลขาธิการศอ.บต.เป็นประธานพิธีการปล่อยตัวนักวิ่ง 50 กม. (นักวิ่งกว่า 400 คน) ซึ่งแบ่งประเภทการวิ่งออกเป็น 3 ประเภท ระยะทาง 100 กิโลเมตร 50 กิโลเมตรและ 25 กิโลเมตร นอกจากนี้ในช่วงเย็น จะมีการปล่อยตัวนักวิ่งประเภท Fun เนn ในระยะ SAT 5 K และระยะ SAT 10 K ทั้งนี้มีนักวิ่งจาก 13 ประเทศ ทั่วโลก รวมกว่า 1,300 คน ร่วมงานฯ เป้าหมายเพื่อยกระดับมาตรฐานเมืองท่องเที่ยวเบตงด้านกีฬาไปสู่ระดับนานาชาติและเพิ่มมูลค่าเศรษฐกิจในพื้นที่และเมืองท่องเที่ยวให้เป็นแหล่งรายได้ใหม่ของประเทศ สสจ.ยะลา และเครือข่ายบริการ ตลอดจนหน่วยงานที่เกี่ยวข้อง ร่วมดำเนินการในส่วนของการจัดระบบความปลอดภัย ดูแลประชาชน และนักท่องเที่ยวที่มาร่วมงานในครั้งนี้ ทั้งในส่วนของการควบคุมป้องกันโรค COVID-19 และความพร้อมด้านการแพทย์ และการช่วยเหลือฉุกเฉิน ตลอดการจัดกิจกรรมฯ
1. โปรตีนที่เพียงพอ ช่วยชะลอการสูญเสียกล้ามเนื้อ
การเพิ่มมวลกล้ามเนื้อช่วยรักษาคุณภาพชีวิตและความแข็งแรงของร่างกาย เสริมสร้างการทำงานของภูมิคุ้มกันและลดเวลาการเจ็บป่วย ผู้สูงอายุที่ไม่มีโรคไตเรื้อรัง ควรบริโภคโปรตีนประมาณ 1-1.2 กรัมต่อน้ำหนักตัวหนึ่งกิโลกรัมต่อวัน จากแหล่งโปรตีนที่ย่อยง่าย เช่น เนื้อปลา เต้าหู้ ถั่วเมล็ดแห้งต่างๆ เช่น ถั่วเหลือง ถั่วลูกไก่ ถั่วเขียว ถั่วแดง เพราะไม่เพียงให้โปรตีนสูงและย่อยง่าย แต่ถั่วต่างๆ ยังมีสารไอโซฟลาโวน (Isoflavones) ซึ่งเป็นสารต้านอนุมูลอิสระ ช่วยลดการเกิดโรคเรื้อรัง เช่น โรคหัวใจและหลอดเลือด มะเร็งเต้านม และมะเร็งต่อมลูกหมาก ร่วมถึงช่วยลดอาการหลังหมดประจำเดือนในผู้หญิงได้
2. แคลเซียมและวิตามินดี เสริมสร้างกระดูกให้แข็งแรง
ผู้สูงอายุต้องการแคลเซียมเพิ่มมากขึ้นอย่างน้อยวันละ 1,000 มิลลิกรัม เพื่อรักษามวลกระดูก อาหารที่เป็นแหล่งของแคลเซียม เช่น เต้าหู้แข็ง ผักใบเขียว ปลาที่มีกระดูกอ่อน หรืออาหารที่มีการเสริมแคลเซียม เช่น นมถั่ว โยเกิร์ตจากพืช หากได้รับจากอาหารไม่เพียงพอผู้สูงอายุบางรายอาจเลือกรับประทานแคลเซียมเสริม และเพื่อให้การดูดซึมแคลเซียมมีประสิทธิภาพมากขึ้น ร่างกายจึงต้องการวิตามินดีที่เพียงพอ ผู้สูงอายุจึงควรออกไปรับแสงแดดอ่อนๆ ตอนเช้าหรือตอนเย็นประมาณ 10 – 15 นาทีต่อวัน ร่วมกับรับประทานปลาและเห็ดซึ่งเป็นแหล่งของวิตามินดี อย่างไรก็ตาม ผู้สูงอายุควรปรึกษาแพทย์เพื่อตรวจระดับวิตามินดีและได้รับการเสริมวิตามินดีอย่างเหมาะสมภ
ท่องเที่ยวแปลงปลูกกัญชา สกลนคร
สิทธิประกันสังคม ผู้ประกันตนกับ รพ.มทส.
กรณีเจ็บป่วยทั่วไป เจ็บป่วยฉุกเฉิน เข้ารับบริการได้ตลอด 24 ชั่วโมง
การบริการที่จะได้รับกรณีเจ็บป่วยหรือประสบอันตราย
โรงพยาบาลให้การตรวจวินิจฉัยและรักษาแก่ผู้ประกันตนตามมาตรฐานทางการแพทย์ รวมถึงรับผิดชอบค่าใช้จ่ายในกรณีที่ทางโรงพยาบาลไม่สามารถให้บริการได้ และมีการส่งตัวไปรับการรักษายังสถานพยาบาลอื่นที่มีศักยภาพสูงกว่า
โปรแกรมตรวจสุขภาพ ข้าราชการ
โปรแกรมตรวจสุขภาพ 1 (หญิง<35 ปี) (ราชการ)
ราคารวม 1025 บาท
ส่วนต่างชำระเอง 605 บาท
โปรแกรมตรวจสุขภาพ 2 (ชาย < 35 ปี) (ราชการ)
ราคารวม 420 บาท
ส่วนต่างชำระเอง 110 บาท
โปรแกรมตรวจสุขภาพ 3 (หญิง >= 35 ปี) (ราชการ)
ราคารวม 1445 บาท
ส่วนต่างชำระเอง 605 บาท
โปรแกรมตรวจสุขภาพ 4 (ชาย >= 35 ปี) (ราชการ)
ราคารวม 840 บาท
ส่วนต่างชำระเอง 110 บาท แนวทางหากตรวจ ATK เป็นบวก ขึ้นสองขีด
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3172-2564
ชื่อ มอก. : สารสกัดจากกัญชงที่มีปริมาณแคนนาบิไดออลรวม ไม่น้อยกว่า 30% โดยมวล
TIS NAME : Hemp extract containing total cannabidol not less than 30% by mass
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 8 กันยายน 2564
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 138ตอน พิเศษ 211 งวันที่ 8 กันยายน 2564
ประกาศกระทรวง :
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานผลิตภัณฑ์อุตสาหกรรมนี้ ครอบคลุมเฉพาะ สารสกัดจากกัญชง ที่มีปริมาณแคนนาบิไดออลรวม(total cannabidiol, CBD และ CBDA) ไม่น้อยกว่า 30 % โดยมวล และมีปริมาณเตตราไฮโดรแคนนาบินอลรวม (total tetrahydrocannabinol, THC และ THCA) ไม่เกิน 0.2% โดยมวลเพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม
Abstract : This standard specific coverage hemp extract with total cannabidiol (total cannabidiol, CBD and CBDA) not less than 30% by mass and total tetrahydrocannabinol (total tetrahydrocannabinol, THC and THCA) not more than 0.2% by mass to be used as raw materials in industry.
1.ขยายโครงการโรงพยาบาล 10,000 เตียง
ประโยชน์คนกรุงฯ
- ลดภาระค่าใช้จ่ายในการเดินทางและค่ารักษาพยาบาลในสถานพยาบาล
- ยกระดับการเข้าถึงการรักษาพยาบาลคุณภาพดี
รายละเอียด
ส่งเสริมและต่อยอดการดำเนินการของ
โครงการ BMA Home Ward การดูแลผู้ป่วยจากสถานพยาบาลหลักร่วมกับการดูแลติดตามโดยศูนย์บริการสาธารณสุข (ศบส.) และเครือข่ายอาสาสมัครสาธารณสุขกรุงเทพมหานคร (อสส.) ในชุมชนกว่า 2,000 แห่ง เพื่อลดค่าใช้จ่ายในการเดินทางมายังสถานพยาบาลของผู้ป่วยและครอบครัว และลดค่าใช้จ่ายในการรักษาพยาบาล ตลอดจนลดภาระงานของเจ้าหน้าที่แพทย์เฉพาะทางในโรงพยาบาล ลดปัญหาเตียงเต็มและความแออัด
กทม.จะดำเนินการส่งเสริมการอบรมหลักสูตรการดูแลผู้สูงอายุ Care Giver (CG) ใน อสส. รวมถึงการอบรม CG ในสมาชิกครอบครัวของผู้ป่วย ผสมผสานการติดตามและดูแลการรักษาจากเจ้าหน้าที่ทางการแพทย์ด้วยอุปกรณ์เทคโนโลยีดิจิทัลทันสมัย (remote monitoring) ทั้ง
- Telemedicine พบหมอได้จากที่บ้าน
- นำหมอไปหาชุมชนและแหล่งที่อยู่อาศัยด้วย Mobile Medical Unit
- แอพพลิเคชันในการเก็บข้อมูลผู้ป่วยตามบ้านให้อยู่ในระบบเดียวกับศูนย์บริการสาธารณสุข
- แอพพลิเคชันอำนวยความสะดวกให้ อสส. สามารถประเมินและคัดกรองโรคของผู้ป่วยได้เบื้องต้น
กลุ่มเป้าหมาย จากเดิมที่ดูแลรักษากลุ่มผู้ป่วยติดเตียง (long-term care) และการดูแลกลุ่มผู้ป่วยระยะสุดท้าย (palliative care) เช่น โรคมะเร็ง โรคไต โรคสมองเสื่อม และโรคหลอดเลือดสมอง (stroke) ขยายโครงการและการดูแลสู่กลุ่มผู้สูงอายุที่อยู่ในภาวะพึ่งพิงหรือต้องมีคนช่วยดูแลในกลุ่มโรคอื่น และคนที่มีโรคเรื้อรังที่ต้องรักษาในระยะยาว เช่น กลุ่มโรคไม่ติดต่อเรื้อรัง (NCDs) เช่น ความดันโลหิตสูง ไขมันในเลือด และเบาหวาน
อาหารแบบไหนกินได้ แบบไหนควรหลีกเลี่ยง
อาหารที่ทานได้ จำไว้เลยว่าต้องเป็นอาหารสีจืดๆ ชีวิตก็จะค่อนข้างเรียบง่ายหน่อย ไม่หวือหวา
จืดๆ เช่น เนื้อสัตว์ ได้แก่ ไก่ ปลา เต้าหู้ หากเป็นผักผลไม้ ควรเป็นที่สีไม่จัด ไม่หวานมาก เช่น ผักกาดขาว ฟัก ผลไม้เป็นพวกแอปเปิ้ล สาลี่ อาจจะดูไม่ค่อยอร่อย แต่ดีต่อสุขภาพ
ควรหลีกเลี่ยงอาหาร ผักและผลไม้ที่มีสีเข้ม เพราะอาจจะมีโพแทสเซียมและฟอสฟอรัสสูง
ทั้งนี้ หากผู้ป่วยต้องการที่จะรับประทานผักสีเข้ม ยกตัวอย่างเช่น ผักบุ้ง จะต้องปรับเปลี่ยนวิธีการปรุงอาหาร โดยการนำผักไปต้มในน้ำประมาณ 5 นาที เพื่อให้โพแทสเซียมที่อยู่ในผักลงไปอยู่ในน้ำ พร้อมรินน้ำที่มีเกลือแร่เหล่านั้นทิ้งไปก่อนดำเนินการประกอบอาหารขั้นต่อไป
กระทรวงสาธารณสุขเปิดงาน “บัญชียาหลักแห่งชาติด้านสมุนไพร” 12 พฤษภาคม 2565 LINK
12 พฤษภาคม 2565 นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข นายแพทย์เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข รศ.ดร.ภญ.จิราพร ลิ้มปานานนท์ ประธานคณะอนุกรรมการพัฒนาบัญชียาหลักแห่งชาติด้านสมุนไพร พร้อมด้วย นายแพทย์ไพศาล ดั่นคุ้ม เลขาธิการคณะกรรมการอาหารและยา ร่วมเปิดงาน “บัญชียาหลักแห่งชาติด้านสมุนไพร” ภายใต้แนวคิด “เข้าถึงถ้วนหน้า ต่อยอด ภูมิปัญญา พึ่งพาตนเอง”
นายอนุทิน ชาญวีรกูล ในฐานะประธานคณะกรรมการพัฒนาระบบยาแห่งชาติ เปิดเผยว่า กระทรวงสาธารณสุขมุ่งเน้นให้คนไทยเข้าถึงยาจำเป็นด้านสาธารณสุข ไม่เพียงแต่ยาแผนปัจจุบันเท่านั้น ยังผลักดันให้มีการใช้ยาสมุนไพรตามภูมิปัญญาการแพทย์แผนไทยในระบบบริการสาธารณสุข เพื่อความมั่นคงทางยาและสนับสนุนการพึ่งพาตนเอง โดยกำหนดให้มีรายการยาในบัญชียาหลักแห่งชาติด้านสมุนไพรครอบคลุมยาจำเป็นที่ต้องใช้ในการป้องกันและแก้ไขปัญหาสุขภาพของประชาชน ซึ่งปัจจุบันมีรายการยาจากสมุนไพรอยู่ในบัญชียาหลักแห่งชาติ จำนวน 94 รายการ รวมไปถึงยาจากกัญชา 8 รายการ ประกอบด้วย ตำรับยาแผนไทย 3 รายการ คือ ยาแก้ลมแก้เส้น ยาศุขไสยาศน์ และยาทำลายพระสุเมรุ และ ยาน้ำมันกัญชา 5 รายการ เช่น ยาน้ำมันกัญชาที่มี CBD : THC (1:1) ในผู้ป่วยมะเร็งระยะสุดท้ายที่มีอาการนอนไม่หลับ เบื่ออาหาร หรือมีอาการปวด และยาน้ำมันกัญชาที่มี CBD : THC (20:1) ในผู้ป่วยลมชักรักษายาก เป็นส่วนหนึ่งในการช่วยเพิ่มคุณภาพชีวิตให้กับผู้ป่วยที่เข้าถึงยาได้ นอกจากนั้น ยังมียาฟ้าทะลายโจร สำหรับผู้ป่วยในช่วงสถานการณ์โควิด ส่งผลให้ประชาชนที่มีสิทธิ์ตามระบบหลักประกันสุขภาพแห่งชาติ สามารถเข้าถึงยาที่มีคุณภาพได้โดยไม่มีค่าใช้จ่าย
ทั้งนี้ การขับเคลื่อนให้ระบบบริการสุขภาพหันมาใช้ประโยชน์จากยาสมุนไพรนั้น นอกจากช่วยลดความเหลื่อมล้ำในการเข้าถึงยาทั้งในภาวะปกติและภาวะฉุกเฉินแล้ว ยังเป็นการสร้างความเชื่อมั่นให้กับผู้ป่วย ประชาชน และชุมชน ในการใช้ยาจากสมุนไพรดูแลสุขภาพ อันเป็นการพึ่งตนเองตามหลักปรัชญาวิถีชีวิตพอเพียงโดยใช้ภูมิปัญญาไทย และเป็นการสร้างรายได้ให้แก่เกษตรกรผู้ปลูกสมุนไพร ตั้งแต่การพัฒนาสายพันธุ์ การเพาะปลูก และการเก็บเกี่ยวพืชสมุนไพรของชุมชน เพื่อใช้เป็นวัตถุดิบในการผลิตยาจากสมุนไพรไทย สร้างการหมุนเวียนเศรษฐกิจภายในประเทศอีกด้วย
นายอนุทิน ชาญวีรกูล กล่าวต่อไปว่า ในปี 2565 นี้ คณะอนุกรรมการพัฒนาบัญชียาหลักแห่งชาติด้านสมุนไพรจะเร่งดำเนินการพิจารณาคัดเลือกยาจากสมุนไพรที่มีสรรพคุณหรือข้อบ่งใช้ที่ชัดเจน มีส่วนประกอบเป็นสมุนไพรที่สามารถผลิตหรือปลูกได้ในประเทศเป็นหลัก และมีหลักประกันคุณภาพมาตรฐาน เพื่อให้ประชาชนสามารถเข้าถึงยาจากสมุนไพรได้เพิ่มมากขึ้น และเพื่อขับเคลื่อนให้เกิดการใช้ยาจากสมุนไพรในระบบบริการสาธารณสุขอย่างสืบเนื่องต่อไป
2.แนวโน้มความต้องการใช้จ่ายของคนไทย
แนวโน้มการใช้จ่ายคงที่ แต่มากขึ้นโดยเฉพาะสาวๆ ข้อสังเกต คือ เน้นช้อปสิ่งจำเป็นเพื่อความสะดวกสบายของครอบครัวโดยช่วงนี้จะเป็นการเตรียมช้อปเพื่อหน้าเทศกาลสังสรรค์อย่างสงกรานต์ และ ไหว้บรรพบุรุษในครอบครัวเชื้อสายจีน อย่างไหนก็ตาม การบริโภคน้ำมัน ขยับขึ้นมาติดอันดับเป็นครั้งแรก ถึงแม้ว่าจะมีราคาที่ถูกขึ้นเกือบทุกวัน แต่เป็นสิ่งจำเป็นเพื่อหาเลี้ยงชีพ
แยกประเภท Top10
1. อาหาร 25% (เพิ่มขึ้น 5%)
2. ของใช้จำเป็นในชีวิตประจำวัน 15% (เพิ่มขึ้น 2%)
3. โทรศัพท์มือถือ/สมาร์ทโฟน 11% (คงที่)
4. เสื้อผ้า 6% (ลดลง 1%)
5. ตู้เย็น, เครื่องซักผ้า 5% (เพิ่มขึ้น 1%)
6. ท่องเที่ยว 4% (ลดลง 1%)
7. ผลิตภัณฑ์เสริมความงาม 4% (ลดลง 2%)
8. คอมพิวเตอร์,แท็บเล็ต 3% (ลดลง 1%)
9. รถยนต์ 4% (เพิ่มขึ้น 2%)
10. ของใช้จำเป็นในห้องนอน 3% (คงที่)
หลักการทำงานเครื่อง ECMO

"หลักการทำงานของเครื่องจะดึงเลือดออกจากตัวคนไข้ ด้วยการใส่ท่อพลาสติกที่มีขนาดใหญ่เท่าหัวแม่มือผ่านหลอดเลือดตามแขน คอ หรือขา ในบางกรณีอาจใส่ตรงเข้าไปในหัวใจก็ได้โดยการเปิดหน้าอกเข้าไป แต่ส่วนใหญ่แล้วมักจะใส่จากที่ขาหนีบขึ้นไปถึงหัวใจ ซึ่งการใส่จะต้องไม่ทำอันตรายกับหลอดเลือดและไม่ไปทะลุเข้าหัวใจ"
ท่อที่ใส่นี้จะใส่อย่างน้อย 2 ท่อ ท่อหนึ่งจะเป็นการเอาเลือดออกจากร่างกาย
ส่วนอีกท่อหนึ่งจะเอาเลือดกลับเข้าร่างกาย
เมื่อเอาเลือดออกจากร่างกายเข้ามาในตัวเครื่องแล้ว ตัวเครื่องจะเติมออกซิเจนแล้วมีการปรับอุณหภูมิให้เหมาะสม ในการปรับอุณหภูมิ อย่างในกรณีที่คนไข้มีไข้ หรือในกรณีที่คนไข้หัวใจหยุดเต้นมาเป็นเวลานาน ต้องการให้อุณหภูมิในร่างกายต่ำเพื่อที่จะรักษาเซลล์ในสมอง ก็จะใช้การควบคุมอุณหภูมิจากตัวเครื่อง
ส่วนการเติมออกซิเจน ในบางกรณีเจอคนไข้โรคปอดที่ทำให้ปอดไม่ยอมทำงาน เช่น การติดเชื้อโควิด-19 โดยคนไข้โควิด-19 บางส่วน มีเชื้อโรคเข้าไปทำลายปอดทำให้ปอดหยุดทำงานไปชั่วขณะหนึ่ง อาจจะเป็นอาทิตย์ๆ การใช้เครื่องตัวนี้ก็จะช่วยได้ โดยมีการเติมออกซิเจนเข้าไปทดแทนปอด ก็คือ ดึงเอาเลือดออกมาแล้วเติมออกซิเจนข้างนอกด้วยการผ่านตัวปั๊มแล้วส่งกลับคืนเข้าสู่ร่างกายอีกทีหนึ่ง ซึ่งจะพบได้ในคนไข้โรคปอด ไม่ว่าจะเป็นปอดติดเชื้อ ปอดเกิดการอักเสบจากสาเหตุต่างๆ ก็สามารถใช้เครื่องตัวนี้ช่วยชีวิตคนไข้ได้
เมื่อเติมออกซิเจนเสร็จก็ต้องผ่านตัวปั๊ม โดยตัวปั๊มจะมีหน้าตาเหมือนกรวยจะทำการปั่นเลือดแล้วคืนกลับเข้าสู่ร่างกายคนไข้ ซึ่งตัวปั๊มนี้สามารถใช้ทดแทนการทำงานของหัวใจได้
ฉะนั้น ในกรณีหัวใจไม่ยอมเต้น เช่น หัวใจวาย หรือคนไข้ที่หลอดเลือดหัวใจตีบที่ทำให้กล้ามเนื้อหัวใจตายแล้วไม่ยอมทำงาน ก็สามารถใช้เครื่องมือนี้ทดแทนการทำงานของหัวใจได้เช่นกัน
"ในระหว่างที่นำคนไข้มาปั๊มหัวใจ หรือสวนหัวใจ รวมทั้ง ทำการรักษา เตรียมการผ่าตัด สามารถใช้เครื่องมือนี้ซื้อเวลาให้คนไข้มีความดันอยู่ในหลอดเลือดในปริมาณที่พอจะเลี้ยงสมองและอวัยวะต่างๆ ได้ก่อน"
สำหรับประสิทธิภาพในการทำงานของเครื่องนี้ว่า
"หากไส้กรอง หรือ Membrane นี้มีการทำงานที่ยืนยาวมากขึ้น จะสามารถใช้ทดแทนปอดในคนไข้ที่มีความจำเป็นที่จะใช้ปอดเทียมในระยะยาวๆ ได้ เช่น โรคถุงลมโป่งพองชนิดที่ว่าไม่สามารถฟื้นตัวได้ด้วยตัวเอง หรือปอดเป็นพังผืดชนิดที่ไม่กลับมาแล้ว บางรายต้องอาศัยการผ่าตัดเปลี่ยนปอดแต่ก็หาผู้บริจาคได้ยาก ซึ่งถ้าท่อตัวนี้สามารถใช้ได้ยาวนานขึ้น หลายๆ เดือน หรือเป็นปี ก็จะช่วยในการรักษาผู้ป่วยได้"
QSNCC ศูนย์การประชุมแห่งชาติสิริกิติ์ (ศูนย์ฯ สิริกิติ์) LINK
ศูนย์การประชุมแห่งชาติสิริกิติ์ (ศูนย์ฯ สิริกิติ์) THE ULTIMATE INSPIRING World Class Event Platform for All - แลนด์มาร์กที่โดดเด่นใจกลางกรุงเทพฯ รองรับการจัดงานทุกประเภท ออกแบบด้วยดีไซน์ล้ำสมัยเพื่อตอบโจทย์ทุกความต้องการ ทั้งในปัจจุบันและอนาคต บนพื้นที่กว่า 280,000 ตารางเมตร มีพื้นที่จัดแสดงงานมากถึง 78,500 ตารางเมตร เพียบพร้อมด้วยสิ่งอำนวยความสะดวกและเทคโนโลยีระดับโลก ผู้เข้าร่วมงานจะได้รับประสบการณ์ใหม่ๆ ใกล้ชิดกับธรรมชาติแม้อยู่ภายในอาคาร รับแสงธรรมชาติชมวิวทะเลสาบและสวนป่าเบญจกิติ ผ่านทางหน้าต่างและระเบียง ผ่อนคลายด้วยการเดินเล่นในสวนป่าเบญจกิติ พื้นที่สีเขียวแห่งใหม่ล่าสุดของกรุงเทพฯ
ราคาใบกัญชงแห้ง
เงื่อนไขการรับซื้อใบกัญชงแห้ง
- ราคาขึ้นอยู่กับระยะเวลาในการเก็บเกี่ยว (อายุของใบ)
- ราคาขึ้นอยู่กับปรมิาณสารสำคัญที่ตรวจพบ (สารสำคัญ)
- ราคาขึ้นอยู่กับชนิดของใบ อาทิ sugar leaf / fan leaf
- ใช้เกณฑ์ของการตรวจวิเคราะห์มาตรฐานของฟาร์มร่วมด้วย อาทิเช่น gap organic thailand etc.
- ปริมาณสารปนเปื้้อนควรเป็นไปตามมาตรฐานแบบเดียวกับช่อดอกแห้ง คืออยู่ในเกณฑ์ของ thai herbal pharmacopoeia (THP)
โครงการป่วยให้ยืม มูลนิธิกระจกเงา โทร.092-252-5454 LINK
โครงการป่วยให้ยืม มีแนวคิดรับบริจาคอุปกรณ์ทางการแพทย์ที่ไม่ใช้งานแล้วตามบ้าน นำมาหมุนเวียนให้เกิดประโยชน์ต่อผู้อื่น โดยส่งต่อให้กับผู้ป่วยที่มีความต้องการใช้งาน
รายการอุปกรณ์ทางการแพทย์ที่โครงการป่วยให้ยืมขอรับบริจาค มีดังนี้
1. เตียงผู้ป่วย
2. เครื่องดูดเสมหะ
3. เครื่องผลิตออกซิเจน
4. เสาน้ำเกลือ
5. วีลแชร์
6. ไม้-คอกค้ำยัน
7. โถปัสสาวะ
ผู้มีอุปกรณ์ทางการแพทย์ไม่ใช้งานแล้ว
สามารถบริจาคได้ที่โครงการป่วยให้ยืม มูลนิธิกระจกเงา
เลขที่ 191 ซอย วิภาวดีรังสิต 62 แยก 4-7 แขวงตลาดบางเขน เขตหลักสี่ กทม. 10210
ผู้สนใจสนับสนุนภารกิจป่วยให้ยืม
บริจาคได้ที่บัญชี มูลนิธิกระจกเงา
เลขที่ 040 - 2 -37446 - 1 ธนาคารไทยพาณิชย์
PAÑPURI WELLNESS ผ่อนคลายในทุกมิติ แรงบันดาลใจจากกัญชา LINK
ปัญญ์ปุริ แบรนด์สปาไทยแต่ชื่อเสียงระดับโลก เสนอบริการด้าน Spa wellness "ที่ได้แรงบันดาลใจจากกัญชา" ใน 3 รูปแบบ ได้แก่
•
Soothing Herbal Bath บ่อออนเซ็นกัญชาแห่งแรกของประเทศไทย มาพร้อมกับความพิเศษของ Herbal Bag ประกอบไปด้วยใบกัญชา ไพล ตะไคร้ และขมิ้นอ้อย ช่วยลดการปวดเมื่อย เพิ่มความสดชื่นและกลับมามีชีวิตชีวาอีกครั้ง
•
Steam Room มาพร้อมกับ Herbal Bowl ประกอบด้วยใบกัญชาและกลิ่นอายของ Haze of Grass Terpene Blend Oil ช่วยให้รู้สึกผ่อนคลาย Himalayan Salt Sauna ช่วยคลายความเหนื่อยล้า เสริมด้วยไอความร้อนจากเกลือ Himalayan พร้อมสัมผัสกลิ่นผ่อนคลายของ Haze of Grass Terpene Blend Oil
•
WELLNESS BAR มาพร้อมกับอาหารและเครื่องดื่มเมนูพิเศษที่มีส่วนผสมของใบกัญชา* ผสานกับวัตถุดิบที่มีคุณภาพจากแหล่งเพาะปลูกที่ยั่งยืนในภาคเหนือ เพื่อให้คุณได้ลิ้มลองเมนูที่มีรสชาติอร่อยและมีเอกลักษณ์
*Cannabis Onsen ให้บริการทุกวันศุกร์ - อาทิตย์ ส่วนเมนูพิเศษจาก Cannabis WELLNESS BAR ให้บริการทุกวัน *กัญชามีข้อจำกัดในการใช้และให้บริการ ศึกษาเพิ่มเติมจากผู้ให้บริการ โทร.02-253-5959 (วันทำการ 10.00 น. – 18.00 น.)
ศาสตราจารย์ ดร. นายแพทย์ประสิทธิ์ วัฒนาภา
ศาสตราจารย์ ดร. นายแพทย์ประสิทธิ์ วัฒนาภา คณบดีคณะแพทยศาสตร์ศิริราชพยาบาล กล่าวถึง กัญชากับมุมมองการใช้ทางการแพทย์ปัจจุบันและอนาคต ว่า ในทางการแพทย์กัญชามีประโยชน์ก็จริง แต่การใช้จะต้องมีการควบคุมจากแพทย์หรือเภสัชกร หากมีการใช้ในปริมาณที่ไม่ถูกต้องก็อาจจะนำมาซึ่งโทษมากกว่าประโยชน์ ควรจะมีแหล่งผลิตที่ถูกต้อง ปลอดภัย มีการควบเรื่องการสกัด ต้องมีข้อบ่งใช้ผลิตภัณฑ์ที่ถูกต้อง รวมไปถึงจะต้องมีการให้ข้อมูล ให้ความรู้กับประชาชนอย่างถูกต้องด้วย
ตารางกิจกรรมการสัมมนาทางวิชาการด้านกัญชาทางการแพทย์
ตัวอย่างหน้าจอแอปปลูกกัญ บนสมาร์ทโฟนที่จะออกมาให้บริการในเร็วๆ นี้
1 มิถุนายน 2565 กรมอนามัย เล็งชี้แจงท้องถิ่น หลังร่าง ผ่านมติเห็นชอบ
นายแพทย์สุวรรณชัย วัฒนายิ่งเจริญชัย อธิบดีกรมอนามัย เปิดเผยว่า จากการที่กรมอนามัยได้เสนอร่างคำแนะนำของคณะกรรมการสาธารณสุข เรื่อง คำแนะนำของคณะกรรมการสาธารณสุข เรื่อง แนวทางควบคุมเหตุรำคาญ จากการกระทำให้เกิดกลิ่น หรือควันกัญชา กัญชง หรือพืชอื่นใด พ.ศ. .... เพื่อเป็นแนวทางสำหรับราชการส่วนท้องถิ่นใช้ควบคุมเหตุรำคาญและเสนอร่างประกาศกระทรวงสาธารณสุข เรื่อง กำหนดให้การกระทำให้เกิดกลิ่น หรือควันกัญชา กัญชง หรือพืชอื่นใด เป็นเหตุรำคาญ พ.ศ. .... ต่อคณะกรรมการสาธารณสุขในการประชุม ครั้งที่ 137-2/2565 วันที่ 30 พฤษภาคม 2565 ที่ผ่านมา ซึ่งคณะกรรมการสาธารณสุขมีมติเห็นชอบร่างคำแนะนำฯ ดังกล่าว โดยหลังจากนี้ กรมอนามัยจะได้ชี้แจงให้กับท้องถิ่นเพื่อถือปฏิบัติต่อไป
ทั้งนี้ ร่างคำแนะนำ ต่อราชการส่วนท้องถิ่นได้กำหนดให้การควบคุมเหตุรำคาญตามอำนาจหน้าที่ของเจ้าพนักงานตามกฎหมายว่าด้วยการสาธารณสุข มีดังนี้
1) ควบคุมการใช้กัญชา กัญชง หรือพืชอื่นใดในทำนองเดียวกัน โดยไม่ก่อเหตุรำคาญจากกลิ่น หรือ ควันรบกวนประชาชนที่อาศัยอยู่ในบริเวณใกล้เคียง
2) เมื่อได้รับแจ้งเรื่องร้องเรียนเหตุรำคาญ เรื่อง กลิ่นหรือควันจากการสูบกัญชา กัญชง หรือพืชอื่นใด ให้เจ้าพนักงานดำเนินการตรวจสอบข้อเท็จจริงและข้อกฎหมาย โดยศึกษาข้อมูลเบื้องต้น เช่น สถานที่หรือบริเวณที่ถูกร้องเรียน สถานที่ที่ประชาชนร้องเรียน แหล่งกำเนิดกลิ่นหรือควัน ลักษณะกลิ่น ช่วงเวลาที่ได้รับผลกระทบ เป็นต้น
3) ดำเนินการตรวจสอบข้อเท็จจริง หากพบว่าเรื่องร้องเรียนไม่เป็นเหตุรำคาญตามมาตรา 25 แห่งพระราชบัญญัติการสาธารณสุข พ.ศ. 2535 และที่แก้ไขเพิ่มเติม ให้เจ้าพนักงานท้องถิ่นแจ้งผู้ร้องเรียนทราบ และยุติเรื่อง
กรณีพบว่าเรื่องร้องเรียนนั้น เข้าข่ายเป็นเหตุรำคาญตามมาตรา 25 แห่งพระราชบัญญัติการสาธารณสุข พ.ศ. 2535 และที่แก้ไขเพิ่มเติม ให้เจ้าพนักงานพิจารณาออกคำแนะนำ เพื่อให้ผู้ก่อเหตุปรับปรุงแก้ไขปัญหาเหตุรำคาญ โดยให้ระบุข้อเท็จจริงที่ตรวจพบ รวมทั้งระบุมาตรการหรือวิธีการที่ใช้ในการแก้ไข หรือปรับปรุงให้เหตุรำคาญนั้นระงับไปภายในระยะเวลาที่กำหนด
4) ให้เจ้าพนักงานติดตามตรวจสอบการดำเนินการตามคำแนะนำของเจ้าพนักงานที่กำหนดให้ผู้ถูกร้องเรียนต้องปฏิบัติ หากผู้ถูกร้องเรียนไม่ดำเนินการตามคำแนะนำ ให้ เจ้าพนักงานท้องถิ่นออกคำสั่งทางปกครอง โดยอาศัยอำนาจตามมาตรา 27 หรือ มาตรา 28 แห่งพระราชบัญญัติการสาธารณสุข พ.ศ. 2535 และที่แก้ไขเพิ่มเติม แล้วแต่กรณี เพื่อให้ผู้ก่อเหตุดำเนินการปรับปรุงแก้ไข หรือระงับเหตุรำคาญ
“กรณีผู้ถูกร้องเรียนไม่ปฏิบัติตามคำสั่งทางปกครอง ให้เจ้าพนักงานดำเนินการส่งเรื่องให้ผู้มีอำนาจเปรียบเทียบ ตามกฎหมายว่าด้วยการสาธารณสุข โดยอัตราโทษกรณีไม่ปฏิบัติตามคำสั่งของเจ้าพนักงานท้องถิ่นดังกล่าวข้างต้น ต้องระวางโทษจำคุกไม่เกินสามเดือน หรือปรับไม่เกินสองหมื่นห้าพันบาทถ้วน หรือทั้งจำทั้งปรับ ส่วนกรณีผู้ถูกร้องเรียนปฏิบัติตามคำสั่งทางปกครอง เรื่องยุติ ให้เจ้าพนักงานแจ้งผลการดำเนินการให้ผู้ร้องเรียนทราบต่อไป” อธิบดีกรมอนามัย กล่าวในที่สุด
นพ. อลงกรณ์ เกียรติดิลกรัฐ
นพ. อลงกรณ์ เกียรติดิลกรัฐ รองหัวหน้าแผนกรังสีวิทยา และแพทย์ชำนาญการด้านรังสีวิทยา โรงพยาบาลบำรุงราษฎร์ เปิดเผยว่า
“ล่าสุด บำรุงราษฎร์ได้มีการนำ Radiology AI ปัญญาประดิษฐ์ทางรังสีวิทยาเข้ามาใช้ในโรงพยาบาล เสมือนเป็นผู้ช่วยรังสีแพทย์ทั้งในส่วนของการคัดกรอง การวิเคราะห์ และการวินิจฉัย พร้อมระบุตำแหน่งภาวะความผิดปกติของปอด และมะเร็งเต้านมระยะแรกเริ่ม โดย Radiology AI ถือเป็น Deep Learning AI ซึ่งเป็นโมเดลการเรียนรู้ในเชิงลึก เป็นอัลกอรึทึมที่ใช้โครงข่ายใยประสาทเสมือน ด้วยการเลียนแบบการทำงานระบบประสาทของมนุษย์ที่มีเซลล์ประสาทเชื่อมต่อกัน ฉะนั้น Radiology AI จะสื่อสารโดยการประมวลผลที่ละเอียดลึกซึ้งกว่า Machine Learning รวมถึงสามารถประมวลผลต่อได้เอง ซึ่งเทคโนโลยีนี้ได้รับการรับรองจากองค์การอาหารและยาแห่งสหรัฐอเมริกาในปี 2564 ที่สำคัญ Radiology AI มีความล้ำทันสมัยในการวินิจฉัย มีความเสถียร แม่นยำ และรวดเร็ว ด้วยการใช้ Microsoft Azure แพลตฟอร์มคลาวด์คอมพิวติ้ง ซึ่งเป็นที่ยอมรับในระดับโลก
โรงพยาบาลซีจีเอช ลำลูกกา จ.ปทุมธานี LINK
โรงพยาบาลซีจีเอช ลำลูกกา จ.ปทุมธานี เป็นโรงพยาบาลเอกชนขนาดกลาง ขนาด 100 เตียง ในอำเภอลำลูกกา ปทุมธานี เปิดให้บริการตั้งแต่ปี 2557 และเติบโตขึ้นอย่างรวดเร็วตามการเติบโตของพื้นที่อำเภอลำลูกกา และชุมชนโดยรอบ มีทีมแพทย์ผู้ชำนาญการเฉพาะด้าน ครอบคลุมในด้านการรักษา อาทิ แผนกอุบัติเหตุฉุกเฉิน 24 ชั่วโมง ที่พร้อมคุ้มครองสิทธิ์ผู้ถือบัตรประกันสังคม แผนกสูตินรีเวช ตรวจสุขภาพประจำปี ฯลฯ
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลซีจีเอช ลำลูกกา สามารถรับผู้ประกันตนเพิ่มได้อีก 14,435 ราย
โรงพยาบาลซีจีเอช ลำลูกกา มีคลินิกเครือข่ายประกันสังคม เป็นสถานพยาบาลในระดับสูง ได้แก่ โรงพยาบาลภูมิพลอดุลยเดช โรงพยาบาลมหาวชิราลงกรณธัญบุรี ศูนย์การแพทย์สมเด็จพระเทพ รัตนราชสุดาฯ โรงพยาบาลศรีธัญญา กรมสุขภาพจิต สถาบันโรคทรวงอก กรมการแพทย์
โรงพยาบาลซีจีเอช ลำลูกกา มีโรงพยาบาลในเครืออีกแห่งที่ให้บริการดูแลผู้ประกันตน คือ โรงพยาบาลซีจีเอช สายไหม
3 มิ.ย. สำรวจจุดเสี่ยง ถ.รัชดา LINK
ผู้ว่าชัชชาติ ลงพื้นที่ตรวจสอบบริเวณถนนรัชดาภิเษก ขาเข้า ตรงข้ามศาลอาญา หลังช่วงเช้าวันนี้เกิดอุบัติเหตุรุนแรงจนมีผู้บาดเจ็บและเสียชีวิต "การป้องกันแก้ไขอาจจะต้องจำกัดความเร็ว มีป้ายบอกให้ชัดเจน เพิ่มตัวจับความเร็วอัตโนมัติเพื่อเตือนคนขับ อย่างไรก็ตามถ้าขับเร็วเกินกำหนดก็ยากที่จะออกแบบให้ได้มาตรฐาน ดังนั้นต้องช่วยกันสองทาง โดยคนขับก็ต้องชะลอความเร็วด้วย"
“เวลาเราจะแก้ปัญหาเราต้องเริ่มจากจุดเสี่ยงที่มีความเสี่ยงสูงก่อน ทั้งในแง่อาชญากรรม อุบัติเหตุ น้ำท่วม จุดรถติด โดยเราสามารถนำข้อมูลเหล่านี้กำหนดจุดลงในแผนที่ให้เห็นว่ามีจุดเสี่ยงตรงไหนบ้าง จุดไหนมีอุบัติเหตุมาก-น้อยแค่ไหน จุดที่เกิดอุบัติเหตุบ่อยก็จะเป็นสีแดงขึ้น และสามารถเข้าไปเร่งรัดปรับปรุงแก้ไขในจุดนั้นๆได้”
การกำหนดแผนที่จุดเสี่ยงดังกล่าว เป็นหนึ่งในนโยบาย 214 ข้อ ซึ่งเป็นการรวบรวมข้อมูลสถิติอาชญากรรมและข้อมูลการรายงานจุดเสี่ยงที่รวบรวมมาจากฐานข้อมูลในแผนที่ความเสี่ยงกรุงเทพฯ (Bangkok Risk Map) เพื่อให้มีการวิเคราะห์และนำข้อมูลเหล่านั้นมาพัฒนาสภาพแวดล้อม การบริหารจัดการต่าง ๆ ของพื้นที่ที่มีความเสี่ยงสูง ให้มีความปลอดภัยมากยิ่งขึ้น เช่น การปรับปรุงและเพิ่มแสงสว่าง กล้องวงจรปิด การจัดจุดตรวจเวรยามเทศกิจหมุนเวียน หรือประสานงานการทำงานร่วมกับตำรวจในการยกระดับความปลอดภัย เพื่อป้องกันการเกิดอาชญากรรม สร้างเมืองที่ปลอดภัยสำหรับทุกคน
โรงพยาบาลเกษมราษฎร์ รามคำแหง กรุงเทพ
โรงพยาบาลเกษมราษฎร์ รามคำแหง เป็นโรงพยาบาลเอกชนขนาด 139 เตียง ตั้งอยู่ที่ 99/9 ถนนรามคำแหง แขวงสะพานสูง เขตสะพานสูง กรุงเทพฯ 10240 ดำเนินการภายใต้การบริหารของบริษัทบางกอกเชน ฮอสปิทอล จำกัด (มหาชน) เปิดดำเนินการเมื่อปี 2539 รับผู้ป่วยได้ 100 เตียง ต่อมาปี 2561 ได้ขยายเป็น 139 เตียง 39 ห้องตรวจ เพื่อรองรับการเพิ่มขึ้นของประชากรในฝั่งตะวันออกของกรุงเทพ ปัจจุบันให้บริการ 24 ชั่วโมง ครอบคลุมบริการแพทย์ 4 มิติ ได้แก่ ป้องกัน รักษา ส่งเสริมสุขภาพและฟื้นฟูสมรรถภาพในศูนย์การแพทย์แบบครบวงจร
Non – Immigrant Visa “O - X” (Long Stay 10 years) LINK
Non-Immigrant Visa “O-X” (Long Stay)
On 22 November 2016, the Cabinet of Thailand approved new scheme which allows nationals from 14 countries to stay in Thailand for the maximum period of 10 years. In order to enjoy this new scheme, the applicants must apply for Non-Immigrant Visa “O-X” (Long Stay) or so called Non-O-X Visa at the Royal Thai Embassy/Royal Thai Consulate-General (when applying outside Thailand) or the Immigration Bureau (when applying in Thailand).
The purpose of this type of visa is to promote long stay for foreign traveler to Thailand. Nationals from 14 countries with the age of 50 years old or over can apply for a multiple-entry Non-O-X visa and stay in the Kingdom for the maximum period of 10 years
(5 years according to visa validity plus an extension for another 5 years). The visa fee is 10,000 Baht (or local currency equivalent if applying outside Thailand).
In accordance with the Notification of the Ministry of Interior Re: Authorization for Certain Groups of Aliens to Enter the Kingdom on an exceptional case on Long-Stay Purpose in accordance with the Cabinet Resolution, dated 22 November B.E. 2559 (2016) (effective from 11 August 2017), foreigners with the following qualifications and supporting documents may apply for a multiple-entry Non-O-X visa:
Applicants’ qualifications
1. Age of 50 years old or over
2. Applicants must hold passport and nationality of (1) Japan (2) Australia (3) Denmark (4) Finland (5) France (6) Germany (7) Italy (8) Netherlands (9) Norway (10) Sweden (11) Switzerland (12) United Kingdom (13) Canada (14) United States of America
3. Financial qualifications
(a) Applicants must have money deposited in Thai bank located in Thailand with the amount of not less than 3 million Baht; or
(b) Applicants must have money deposited in Thai bank located in Thailand with the amount of not less than 1.8 million Baht and have income with the amount of not less than 1.2 million Baht per year. Once the applicants enter Thailand, they must have accumulated money deposited in Thai bank located in Thailand not less than 3 million Baht within 1 year.
The money in (a) and (b) must be kept in bank account at least 1 year before withdrawing and, within another next year, the money must be left in the account with the amount of not less than 1.5 million Baht and can only be spent in Thailand.
4. Applicants must have no forbidden diseases according to the Ministerial Regulation No. 14 (B.E. 2535) which include Leprosy, Tuberculosis, Elephantiasis, drug addiction and third stage of Syphilis.
5. Applicants must have Thai medical insurance during their stay in Thailand (per the approval of the Office of Insurance Commission) and medical claims for outpatient must not be less than 40,000 Baht, for inpatient must not be less than 400,000 Baht.
Required Documentation
1. Passport must be valid for at least six months from the date of travel.
2. Three (3) application forms and 3 photographs (size 4 X 6 cm. taken within the last 6 months)
3. One (1) biography
4. Financial evidence
4.1 Certificate of bank deposit stating bank contact information, copy of bank book and bank statement which shows fixed deposit with the amount of not less than 3 million Baht deposited in Thai bank located in Thailand;
OR
4.2 Certificate of bank deposit stating bank contact information, copy of bank book and bank statement which shows fixed deposit with the amount of not less than 1.8 million Baht deposited in Thai bank located in Thailand and certificate of annual income with the amount of not less than 1.2 million Baht (local currency equivalent) per year. (Once the applicants enter Thailand, they must have accumulated money deposited in Thai bank located in Thailand not less than 3 million Baht within 1 year.)
5. Certificate of criminal record clearance from the country of nationality. In case the applicants have permanent residence in other country, they must provide the aforementioned document from both country of nationality and country of permanent residence.
6. Medical certificate from the country where the applicants apply visa stating that applicants don’t have any prohibited diseases according to the Ministerial Regulation No. 14 (B.E.2535) which include Leprosy, Tuberculosis, Elephantiasis, drug addiction, third stage of Syphilis. The medical certificate must not be issued over 3 months.
7. Copy of evidence stating that applicants have insurance as per stipulated by the Office of Insurance Commission and health insurance of Thailand which has insurance money for outpatient not less than 40,000 Baht and for inpatient not less than 400,000 Baht.
Please check < http://longstay.tgia.org > for more information regarding the insurance requirement.
8. Visa fee: 10,000 Baht (local currency equivalent)
Spouse and child, age under 20 years old, can apply for Non-O-X visa and must have the following required documents
9. Spouse (no age restriction) must show a copy of marriage certificate together with documents
stated in 1-8.
10. Child age under 20 years old must show a copy of birth certificate or proof of legitimate child and also have to submit documents number 1-3, 7 and 8
How to Apply for Non-O-X Visa (in case of applying outside Thailand)
1. Foreigners who have the required qualifications and supporting documents as stated above may apply for Non-O-X Visa at the Royal Thai Embassy/Royal Thai Consulate-General in the country of their nationality or where they have permanent residence.
2. The Royal Thai Embassy/Royal Thai Consulate-General examines the qualifications and supporting documents and informs the result to the applicants.
3. In case that the visa is approved, foreigners (main applicant, spouse, and lawful child under 20 years old) will obtain a multiple-entry Non-O-X visa with visa validity of 5 years
4. Upon arrival in Thailand, the immigration officer will grant the Non-O-X visa holders the stay permit in the Kingdom for the period of not exceeding 5 years according to visa validity.
Other Useful Information
- Benefits of the Non-O-X visa holders
1) Can work as a volunteer (in accordance with the list of volunteer work as stipulated by the Department of Employment).
2) Can purchase vehicle (under the provision of laws on motor vehicles).
3) Can purchase condominium (proceed in accordance with the Condominium Act).
- Foreigners who enter Thailand with other type of Visa/Visa Exemption may contact the Immigration Bureau and apply for Non-O-X visa.
- Foreigners who enter Thailand with Non-O-X visa may change from Non-O-X to other type of Visa by submitting request to the Immigration Bureau. Spouse and child’s visa approval will be changed according to status of the main applicant. However, spouse can apply for Non-O-X by himself/ herself if he/she meets the qualifications.
- Spouse/child who does not qualify for Non-O-X visa may apply for other type of non-immigrant visa in order to stay in Thailand with the Non-O-X visa holder.
- Upon the completion of 90 days stay period in Thailand, foreigners must notify the Immigration Bureau of their residence in Thailand and shall repeat at every 90 days interval.
- Foreigners must report, in person, to the immigration officer every 1 year for the examination of the qualifications and supporting documents.
- Stay permit of the Non-O-X visa holders may be revoked due to following conditions:
1) Foreigners do not have financial evidence as per stipulated by above qualifications such as:
- The sum of money in the bank account is less than 3 million Baht at the end of the first year of stay period in Thailand.
- the sum of money in the bank account is less than 1.5 million Baht at the end of the second year of stay period in Thailand, and/or the money in said account was spent outside Thailand.
2) Foreigners do not have insurance as per stipulated by above qualifications.
3) Foreigners pose threat to peace and security of Thailand.
4) Foreigners work without permission.
กลุ่มลูกค้า (ผู้ป่วย) สัดส่วนรายได้ การครองเตียง
กลุ่มลูกค้า ผู้ป่วย ณ ปี 2017 หลักคือคนไทย 93% ที่เหลือเป็นต่างชาติ ราว 7% ประมาณ 1.62 ล้านคน ในจำนวนนี้ จำแนกได้เป็นเดินทางมาท่องเที่ยวและรักษาพยาบาล 5.5% ที่เหลือเป็นชาวต่างชาติที่ทำงานในไทย 1.4%
จำนวนผู้ป่วยต่างชาติมารักษาในไทย เพิ่มขึ้นทุกปี ตั้งแต่ปี 2014 และสูงสุดคือก่อนโควิดปี 2019 ที่ 2.16 ล้านคน เติบโต 19.9% จากปีก่อนหน้า ขณะที่ปี 2020 หดตัว 97.7% ปี 2021 อยู่เพียง 60% เท่านั้น (*ประเมินโดยกรุงศรี)
สัดส่วนค่าใช้จ่าย หลักคือค่ายา รองลงมาคือค่าบริการแพทย์ ค่าใช้จ่ายอื่นๆ ค่าแลปและเอ็กซเรย์ 14% ส่วนค่าห้องเพียง 8% เท่านั้น
แอป D.DOPA Digital ID โดยกรมการปกครอง
ระบบพิสูจน์และยืนยันตัวตนทางดิจิทัล (Digital ID) ที่ กรมการปกครอง กระทรวงมหาดไทย พัฒนาขึ้นมา เข้าใจง่ายๆ คือบัตรประชาชนดิจิตัลนั่นเอง
ลิงค์สำหรับดาวน์โหลด
iOS apple iPhone
Google Play
Official infoเงื่อนไขการนำของเหลว เจล สเปรย์ ขึ้นเครื่องบิน
ทัณฑสถานโรงพยาบาลราชทัณฑ์ (ปี 2563)
ทัณฑสถานโรงพยาบาลราชทัณฑ์ เป็นสถานพยาบาลในการดูแลของกรมราชทัณฑ์ กระทรวงยุติธรรม ปกติในการดูแลเรื่องสวัสดิการบุคคลของกรมราชทัณฑ์ และผู้ต้องขังของเรือนจำ/ทัณฑสถานทุกแห่ง ได้ขยายการให้บริการมาสู่ประชาชน
ทัณฑสถานโรงพยาบาลราชทัณฑ์ แบ่งงานแพทย์ออกตรวจเป็น
- แพทย์ออกตรวจภายในทัณฑสถานโรงพยาบาลราชทัณฑ์ จุดประสงค์ เพื่อทำการตรวจรักษาผู้ต้องขังที่ส่งมาตรวจทั่วประเทศ และตรวจผู้ต้องขังป่วยที่นอนรักษาตัวภายใน
- แพทย์ออกตรวจตามเรือนจำ/ทัณฑสถานลูกข่ายทัณฑสถานโรงพยาบาลราชทัณฑ์ จุดประสงค์ เพื่อตรวจผู้ต้องขังที่ป่วย และถ้าอาการหนักทำการส่งต่อ ทัณฑสถานโรงพยาบาลราชทัณฑ์
- แพทย์ออกตรวจคลินิก ณ.อาคารชวนชม จุดประสงค์ ให้บริการประชาชนทั่วไป และครอบครัวกรมราชทัณฑ์ และจ่ายยาตามใบสั่งแพทย์ ที่ออกให้ตามเรือนจำ/ทัณฑสถานลูกข่าย
สอบถามเพิ่มเติมโทร. 02-9533999
นพ. เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข
นพ. เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข กล่าวว่า กระทรวงสาธารณสุขมีนโยบายสนับสนุนการใช้ประโยชน์จากกัญชา กัญชง โดยมีเป้าหมายหลักเพื่อประโยชน์ทางการแพทย์ ลดการนำเข้ายาจากต่างประเทศ ส่งเสริมภูมิปัญญาการแพทย์แผนไทย โดยได้นำตำรับยากัญชาบรรจุในบัญชียาหลักแห่งชาติแล้ว 8 ตำรับ
นอกจากนั้นกัญชายังสามารถนำมาต่อยอดในผลิตภัณฑ์ต่าง ๆ ทำให้เกิดประโยชน์ทางเศรษฐกิจและอุตสาหกรรม รวมถึงเพื่อให้ประชาชนมีทางเลือกในการดูแลสุขภาพของตนเอง
ตั้งแต่วันที่ 9 มิถุนายน 2565 พืชกัญชากัญชงไม่ใช่ยาเสพติดอีกต่อไป ถือเป็นการเปิดประวัติศาสตร์หน้าใหม่ของกัญชากัญชงในประเทศไทย และเป็นจุดเปลี่ยนสำคัญที่ต้องทำความเข้าใจ เพื่อให้ก้าวไปด้วยกันอย่างถูกต้องว่า ประชาชนจะสามารถปลูกพืชกัญชากัญชง เพื่อประโยชน์ในการรักษาและดูแลสุขภาพ และเมื่อปลูกแล้วยังสามารถแสดงตนด้วยการจดแจ้งผ่านระบบแอปฯ ปลูกกัญของ อย. ได้ด้วย
ทั้งนี้ กระทรวงสาธารณสุขเองได้มีการเตรียมความพร้อมรองรับในเรื่องผลกระทบที่อาจเกิดขึ้นกับประชาชนในการนำกัญชากัญชงไปใช้ในทางที่ไม่เหมาะสม เช่น ห้ามจำหน่ายให้ใช้ในสตรีมีครรภ์ สตรีให้นมบุตร และผู้ที่มีอายุต่ำกว่า 20 ปี การออกประกาศกำหนดให้กลิ่นควันกัญชากัญชงเป็นเหตุรำคาญ นโยบายนี้ไม่ครอบคลุมถึงการสูบหรือการบริโภคเพื่อความบันเทิงหรือนันทนาการ เพราะไม่ใช่วัตถุประสงค์ของกระทรวงสาธารณสุข
แอปปลูกกัญ โหลดได้แล้ว LINK
แอปปลูกกัญ เป็น application ที่ใช้ในการจดแจ้ง การปลูกกัญชา กัญชง เพื่อดูแลสุขภาพ สำหรับประชาชนทั่วไป เพื่อดูแลผู้ป่วยของการแพทย์แผนไทยและการแพทย์พื้นบ้าน รวมทั้งการขออนุญาต ปลูกในเชิงพาณิชย์ ตั้งแต่วันที่ 9 มิถุนายน 2565 เป็นต้นไป
สามารถดาวน์โหลดได้
Android ปลดล็อกกัญชา 9 มิ.ย. อะไรทำได้ อะไรทำไม่ได้ - ไตรศุลี ไตรสรณกุล LINK
9 มิ.ย. 2565 ประชาชนทั่วไปจะสามารถปลูกกัญชาได้ รวมถึงการเสพ การสูบ การบริโภค กัญชา กัญชง สามารถทำได้โดยถูกกฎหมาย ขณะที่การผลิตสารสกัดจากกัญชา กัญชง ที่มีค่า THC ไม่เกินร้อยละ 0.2 จะไม่เป็นยาเสพติด
ทั้งนี้ นายวิษณุ เครืองาม รองนายกรัฐมนตรี รายงานต่อที่ประชุม ครม. ว่าในระหว่างที่ พ.ร.บ.กัญชา กัญชง พ.ศ... ซึ่งจะเป็นกฎหมายวางแนวทางปฏิบัติเพื่อดูแลการใช้กัญชากัญชงอยู่ในขั้นตอนการพิจารณาของสภาผู้แทนราษฎร เพื่อให้เมื่อประกาศกระทรวงสาธารณสุขฯ มีผลบังคับเป็นไปด้วยความเรียบร้อย
รัฐบาลเตรียมตั้ง คณะกรรมการบูรณาการนโยบายพืชกัญชาและกัญชง โดยคำสั่งนายกรัฐมนตรี โดยมีองค์ประกอบคณะกรรมการ ประกอบด้วยรองนายกรัฐมนตรี รมว.สาธารณสุข รมว.ยุติธรรม คณะกรรมการ ป.ป.ส. ปลัดกระทรวง กระทรวงต่างๆ อาทิ การต่างประเทศ เกษตรและสหกรณ์ พัฒนาสังคมและความมั่นคงของมนุษย์ อธิบดีกรมศุลกากร ตำรวจ คณบดีคณะแพทย์ศาสตร์จุฬาฯ รามาธิบดี ศิริราช นักวิชาการ และภาคประชาชน
คณะกรรมการบูรณาการนโยบายพืชกัญชาฯ จะทำหน้าที่ในประเด็นต่างๆ อาทิ
1. การรับคำร้องทุกข์ การหามาตรการทางกฎหมายเพื่อดูแลปัญหาที่อาจจะเกิดขึ้นในระหว่างวันที่ 9 มิ.ย. 2565 ไปจนกว่า พ.ร.บ.กัญชาฯ จะมีผลใช้บังคับ
2. รวมถึงการทำความเข้าใจกับองค์กรระหว่างประเทศ โดยเฉพาะInternational Narcotic Control Board หรือ INCB ถึงนโยบายและแนวทางปฏิบัติในประเทศไทยระหว่างที่ พ.ร.บ.กัญชาฯ ยังไม่มีผลบังคับ
3. ทำความเข้าใจกับประเทศเพื่อนบ้าน ซึ่งมีชายแดนติดกับประเทศไทย เพื่อไม่ให้เกิดปัญหากัญชาล้นทะลักระหว่างกันภายหลังเปิดกัญชาเสรี
4. การทำความเข้าใจกับประชาชนเกี่ยวกับพิษภัยของกัญชา กัญชง ที่มีอยู่ ซึ่งมีพฤติการณ์หลายอย่างที่รัฐจะยังควบคุม แม้ตามกฎหมายกัญชา กัญชงจะไม่เป็นยาเสพติดแล้ว เช่น การสูบ เสพจะต้องไม่สร้างความรำคาญแก่ผู้อื่นไม่เช่นนั้นจะเป็นความผิด หรือเสพแล้วขับรถก็จะมีความผิดตามกฎหมายจราจร การขายกัญชา กัญชงให้เด็กและสตรีมีครรภ์ จะมีความผิดตามกฎหมายอื่นได้ แนวทางการใช้ช่อดอกกัญชาที่ต้องระวัง รวมถึงกรณีการนำกัญชาไปแปรรูปอาจจะเสียภาษีตามกฎหมายที่เกี่ยวข้องได้ เป็นต้น
คราฟต์ซ่ากัญชา ขวดพร้อมดื่ม ชิลล์ๆ
น้ำชาญา ช่วยขับลม กระจายลม อุดมด้วยแร่ธาตุ LINK
ใบกัญชา : ช่วยปรับสมดุลลมในร่างกาย ผสมผสานเครื่องเทศกลิ่นหอมละมุนอย่างลงตัว ช่วยในการขับลม กระจายลม อุดมด้วยแร่ธาดุ มี THCA
น้ำชาญา 1 แก้ว มีกัญชา 2 ใบ
มาดื่มกัญ...
ไชรัปกัญ 45 ml.
น้ำมะนาว 5 ml.
น้ำเครื่องเทศ 15 ml.
น้ำกัญชาค้นสด 20 ml.
โซดา 80 ml.
เกลือเล็กน้อย
ส่วนประกอบ
สมุนไพรให้สีเขียว : ใบกัญชาคั้นสด
สมุนไพรให้สีเหลืองและเครื่องเทศ : ขมิ้นชัน ชิง กระชายเหลือง ลูกจันทน์ ดอกจันทน์ กระวาน กานพลู อบเชย ลูกผักชี
สมุนไพรให้สีแดง : กระเจี๊ยบ ลูกหม่อน ใบโรสแมรี
สมาชิกวุฒิสภา วอนนายกรัฐมนตรี ใช้อำนาจบริหาร ปิดช่องว่างกัญชาเสรี
นพ.อำพล จินดาวัฒนะ สมาชิกวุฒิสภา เผยแพร่ข้อคิดเห็น (11 มิถุนายน 2565) ต่อการเปิดเสรีการใช้กัญชา "วอนนายกรัฐมนตรี ใช้อำนาจบริหาร ปิดช่องว่างกัญชาเสรี หยุดผลกระทบต่อเด็กและเยาวชน"
ตั้งแต่ 9 มิ.ย.65 กฎหมายปลดล็อคให้กัญชาเสรีแล้ว แต่เกิดช่องว่าง ไม่มีกฎหมายควบคุมการบริโภคกัญชา จะมีผลกระทบต่อเด็กและเยาวชนอย่างมาก สถาบันทางการแพทย์ออกมาเตือนทุกทิศทาง จะรอกฎหมายควบคุมกัญชง กัญชา ก็อีกนาน
ขอเสนอแนะ นรม.ใช้อำนาจบริหาร เช่น ออกพระราชกำหนด หรือคำสั่งนายกรัฐมนตรี จัดกลไกควบคุมกำกับการบริโภคภัญชาโดยด่วน
++++
รีบปิดสูญญากาศ “กัญชาเสรี”
ตั้งแต่วันที่9มิย.65 ที่ผ่านมา รัฐบาล โดย กสธ.ปลดล๊อคให้ “กัญชาเสรี” แล้ว
เป็นไปตามนโยบายพรรคการเมืองพรรคหนึ่ง ที่ได้เข้าร่วมรัฐบาล คุมบังเหียนกระทรวงสาธารณสุข (ซึ่งมีหน้าที่หลักในการดูแลสุขภาพประชาชน มากกว่าเศรษฐกิจ)
ใครใคร่ปลูก -ปลูก, ใครใคร่เสพ-เสพ ไม่ว่าจะเป็นเด็กหรือผู้ใหญ่
เพราะยังไม่มีกฎหมายควบคุมการบริโภคกัญชา
เป็น “สูญญากาศ” เกิดขึ้นทันที
สถาบันทางการแพทย์ที่เกี่ยวข้อง ได้แก่ ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย และราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย ออกแถลงการณ์ห่วงใยผลกระทบต่อเด็ก เยาวชน และสังคมที่จะตามมา
จึงขอเรียกร้องนายกรัฐมนตรี ทำอะไรได้ ทำด่วนเลยครับ
อย่ารอการออกกฎหมายควบคุมตามขั้นตอน ซึ่งใช้เวลาอีกนาน
“กว่าถั่วจะสุก” ระวัง “งาจะไหม้หมด” นะครับ
บันทึกสว.(601)
สว.อำพล: 11มิย.65
โรงพยาบาลสิรินธร บริการวัคซีนไข้หวัดใหญ่ตามฤดูกาล ปี 2565
โรงพยาบาลสิรินธร ให้บริการฉีดวัคซีนไข้หวัดใหญ่ตามฤดูกาล ประจําปี 2565 โดยให้บริการวันที่ 7, 8, 14 และ 15 มิถุนายน 2565 แก่บุคลากรทางการแพทย์ เพื่อสร้างภูมิคุ้มกันโรคไข้หวัดใหญ่ ณ ห้องประชุมคุณหญิงหรั่ง กันตารัติ ชั้น 2 โรงพยาบาลสิรินธร สำนักการแพทย์ กรุงเทพมหานคร
นพ. สมบัติ โรจน์วิโรจน์ ศัลยแพทย์กระดูกและข้อ เฉพาะทางด้านข้อสะโพกและข้อเข่า
นพ. สมบัติ โรจน์วิโรจน์ ศัลยแพทย์กระดูกและข้อ เฉพาะทางด้านข้อสะโพกและข้อเข่า ศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล อธิบายว่า โรคข้อเข่าเสื่อม (Knee Arthritis) จะมีอาการปวดเข่า เข่าบวม เข่าอักเสบ เดินแล้วมีเสียงก๊อบแก๊บในข้อเข่า ไม่สามารถยืดหรือเหยียดขาได้สุด รวมทั้งการเดินขึ้นลงบันไดที่ลำบาก เกิดปัจจัยเสี่ยง ได้แก่ อายุที่เพิ่มมากขึ้น เพศหญิง การที่มีน้ำหนักตัวเกิน ซึ่งในเพศหญิงมีความเสี่ยงมากกว่าผู้ชาย การได้รับแรงกระแทกซ้ำ ๆ ที่ข้อเข่า การเกิดอุบัติเหตุที่บริเวณข้อเข่าและพันธุกรรม ถ้าผิวของข้อเข่าได้รับความเสียหายอย่างรุนแรงจากการอักเสบของข้อเข่าหรืออุบัติเหตุ จะรู้สึกปวดแม้ขณะนั่งหรือนอน แพทย์จะการตรวจวินิจฉัยข้อเข่าเสื่อม ทำได้โดย การซักประวัติสุขภาพ รวมทั้ง การตรวจร่างกาย ตรวจการทำงานของเข่า เช่น X-ray เพื่อดูพยาธิสภาพ ความเสียหายของเข่าที่เสื่อม การตรวจคลื่นแม่เหล็กไฟฟ้า (MRI) เพื่อดูสภาพของกล้ามเนื้อ และเนื้อเยื่อต่างๆ รอบกระดูก
โรงพยาบาลสิรินธร โทร.02-3286900 - 15 ต่อ 10294
โรงพยาบาลสิรินธร ให้บริการ ณ ห้องประชุมคุณหญิงหรั่ง กันตารัติ ชั้น 2 โรงพยาบาลสิรินธร สำนักการแพทย์ กรุงเทพมหานคร
ติดต่อ กลุ่มงานเวชศาสตร์ชุมชน โทร.02-3286900 - 15 ต่อ 10294
เวลา 8-16 น. วันและเวลาราชการ
ผู้ที่ไม่ได้ลงทะเบียนจองสิทธิล่วงหน้า อาจไม่ได้รับวัคซีนในวันนั้น เนื่องจากวัคซีนมีจำกัดและจัดสรรไว้ให้กับผู้ที่จองล่วงหน้าก่อน
โรงพยาบาลตากสิน บริการฉีดวัคซีนไข้หวัดใหญ่ (ประชาชน 7 กลุ่มเสี่ยง) LINK
เปิดบริการฉีดวัคซีนไข้หวัดใหญ่ (ประชาชน 7 กลุ่มเสี่ยง)
จองคิวผ่านแอปเป๋าตัง วันละ 30 คน และ รับ walk in วันละ 30 คน
ฉีดเฉพาะ จันทร์ - ศุกร์ เวลา 8.00-15.00 น.
ตั้งแต่วันที่ 1 พฤษภาคม 2565 - 31 สิงหาคม 2565 หรือจนกว่าวัคซีนจะหมด
ติดต่อสอบถาม อนามัยชุมชน โรงพยาบาลตากสิน 02 437 0123 ต่อ 1115
เขตสุขภาพที่ 1
ลำปาง
- คลินิกเวชกรรมไทย ศูนย์ส่งเสริมฯ สส จ.ลำปาง สส จ. 054-227-527-8 พุธ 08.30 - 16.00 น.
- รพ.เกาะคารพช.054-281-393 พุธ 08.30 - 16.00 น.
- รพ.งาวรพช.054-261-253 พุธ 08.30 - 16.00 น.
- รพ.แจ้ห่มรพช.054-271-005-6 พุธ 08.30 - 16.00 น.
- รพ.เถินรพช.054-291-585 พุธ 08.30 - 16.00 น.
- รพ.มะเร็งลำปางรพ.สังกัดกรม 0 5433 5262 พ. 08.00 - 16.00 น.
- รพ.เมืองปานรพช.054-276-345-6 พุธ 08.30 - 16.00 น.
- รพ.แม่ทะรพช.054-289-184 พุธ 08.30 - 16.00 น.
- รพ.แม่พริกรพช.054-299-324 พุธ 08.30 - 16.00 น.
- รพ.แม่เมาะรพช.054-266-032 พุธ 08.30 - 16.00 น.
- รพ.ลำปางรพศ054-237-400 ต่อ 8364 พุธ 08.30 - 16.30 น.
- รพ.วังเหนือรพช.054-279-100 พุธ 08.30 - 16.00 น.
- รพ.สต.แจ้ซ้อนเหนือรพ.สต.
- รพ.สต.สะเลียมหวานรพ.สต.054 241 562
- รพ.สบปราบรพช.054-296-085 พุธ 08.30 - 16.00 น.
- รพ.เสริมงามรพช.054-286-117 พุธ 08.30 - 16.00 น.
- รพ.ห้างฉัตรรพช.054-269-506 พุธ 08.30 - 16.00 น.
ลำพูน
- รพ.ทุ่งหัวช้างรพช.053-975-201 พุธ 13.00 - 16.00 น.
- รพ.บ้านธิรพช.053-984-325 จันทร์ 13.00 - 16.00 น.
- รพ.บ้านโฮ่งรพช.053-980-377 จ. 13.00 - 16.00 น.
- รพ.ป่าซางรพช.053-555-258 จันทร์และอังคาร 08.30 - 12.00 น.
- รพ.แม่ทารพช.053-976-000 จ-ศ 08.30-16.30 น.
- รพ.ลำพูนรพท053-569-100 จันทร์ - ศุกร์ 13.00 - 16.00 น.
- รพ.ลี้รพช.053-596-513 อังคาร 13.00 -16.00 น.
- รพ.เวียงหนองล่องรพช.053-504-043 จันทร์- ศุกร์ 08.00 - 16.00น.
- รพ.สต.บ้านหลุกรพ.สต. รอยืนยัน
- รพ.สต.ริมปิงรพ.สต. รอยืนยัน
- รพ.สต.เหล่ายาวรพ.สต.
- รพ.สต.อุโมงค์รพ.สต. รอยืนยัน
- สอน.ป่าซางรพ.สต.
เชียงใหม่
- รพ.จอมทองn/a
- รพ.ไชยปราการรพช.053 870 444 ศุกร์ 08.30-16.30 น.
- รพ.ดอยสะเก็ดn/a
- รพ.นครพิงค์รพศ053-999-200 พุธ 13.00-16.00 น.
- รพ.ประสาทเชียงใหม่รพ.สังกัดกรม 0 5322 1676,0 5321 7704 รอยืนยัน
- รพ.ฝางรพท053-451444 พุธ 08.30-12.00 น.
- รพ.มหาราชนครเชียงใหม่ มหาวิทยาลัยเชียงใหม่ก.ศึกษา053-936150
- รพ.แม่วางรพช.053-928-044 พุธ 13.00-16.30 น.
- รพ.แม่ออนรพช.053-880-745จ สัปดาห์ที่ 1,3 13.00-16.30 น.
- รพ.สต.บ้านเจ็ดยอดรพ.สต.
- รพ.สต.บ้านป่าแดงรพ.สต.
- รพ.สต.บ้านหนองผึ้งรพ.สต.
- รพ.สต.ยางเนิ้งรพ.สต.
- รพ.สวนปรุงรพ.สังกัดกรม053-908-500อังคารและ พฤหัสบดี 08.30-16.30 น.
- รพ.สันป่าตองn/a
- รพ.สารภีรพช.053-321179 053-321062อ. พฤ. 13.00 - 16.30 น.
- รพ.ฮอดn/a
- ศูนย์การแพทย์แผนไทยและการแพทย์ผสมผสาน คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ก.ศึกษา053-93489808.00 - 16.00 น.
เชียงราย
- รพ.ขุนตาลรพช.053-606-221 พุธ 13.00 - 16.00 น.
- รพ.เชียงรายประชานุเคราะห์รพศ053-910-600 จ พฤ 08.00-16.00 น. และพ. 13.00-16.00
- รพ.เชียงแสนรพช.053 777 017 พฤ 08.30-16.30 น.
- รพ.ดอยหลวงรพช.053 790 056 จันทร์ 08.30-16.30 น.
- รพ.เทิงรพช.053-795-259 รอยืนยัน
- รพ.ป่าแดดรพช.053-761-019 จ-ศ 08.30-16.30 น.
- รพ.พญาเม็งรายรพช.053-799-033 พุธ 08.30-16.30 น.
- รพ.พานรพช.053-721-3450 8.00 - 16.00 น.
- รพ.มหาวิทยาลัยแม่ฟ้าหลวงก.ศึกษา0 5391 7563 พฤ. 08.00 - 12.00 น.
- รพ.แม่จันรพช.053-771-300จ-ศ 08.30-16.30 น.
- รพ.แม่ฟ้าหลวงรพช.0 5373 0357-8087-5787899
- รพ.แม่ลาวรพช.053-603-100 จันทร์และ ศุกร์ 08.00 - 16.00 น.
- รพ.แม่สรวยรพช.053-786-017 จันทร์ - ศุกร์ 08.00 - 16.00 น.
- รพ.แม่สายรพช.053-731300 ต่อ 2444 จันทร์ - ศุกร์ 08.30 -16.30 น.
- รพร.เชียงของรพช.053-791-206 จันทร์ - ศุกร์ 08.00 - 12.00 น.
- รพ.เวียงแก่นรพช.053-603-14008.00 - 16.00 น.
- รพ.เวียงเชียงรุ้งรพช.0 5395 3137-8 อ. และ พฤ. 08.30 - 16.00 น.
- รพ.เวียงป่าเป้ารพช.053-781-342 ศุกร์ 13.00-16.00 น.
- รพ.สต.บัวสลีรพ.สต.053 673 47908.30 - 16.30 น.
- รพ.สต.แม่เจดีย์ใหม่รพ.สต.053 679 35708.30 - 16.30 น.
- รพ.สมเด็จพระญาณสังวรรพช. 053-603-123 ศุกร์ 08.00 - 12.00 น.
แพร่
- รพ.แพร่รพท054-533-500 ต่อ 1205พ 13.00-16.30 น.
- รพร.เด่นชัยรพช.054-613-134, 054-613-354 ต่อ 608,716 ศุกร์ 08.30 – 12.00 น.
- รพ.ร้องกวางรพช.054 597 298อ 08.30-16.30 น.
- รพ.ลองรพช.054 581 479 ต่อ 1096ศ. 08.30 - 12.00 น.
- รพ.วังชิ้นรพช.054-589-252-4ศ. 08.30 - 16.30 น.
- รพ.สต.พระหลวงรพ.สต.054 543 451ศ. 08.30 - 16.30 น.
- รพ.สองรพช.054-591-575อังคาร 08.30 - 12.00 น.
- รพ.สูงเม่นรพช.054-541-299, 054-541-430อ. 13.00-16.30 น.
- รพ.หนองม่วงไข่รพช.054-647-458-9ศ. 08.30 - 16.30 น.
- สอน.แม่จั๊วะรพ.สต.054 613 395อ. 08.30 - 12.00 น.
พะเยา
- รพ.จุนรพช.054-409-200 พุธ 13.00-16.00 น.
- รพ.เชียงคำรพท054-409-000 พุธ 13.00-16.00 น.
- รพ.เชียงม่วนรพช.054-495-018จ-ศ 08.00-16.00 น.
- รพ.ดอกคำใต้รพช.054-409-500 พุธ 13.00 - 16.00 น.
- รพ.ปงรพช.054-497-030จ-ศ 08.00-16.00 น.
- รพ.พะเยารพท054-409-300 จันทร์ 13.00-16.00 น.
- รพ.แม่ใจรพช.054-409-600 จันทร์ - ศุกร์ 08.00 - 16.00 น.
- รพ.สต.พระธาตุขิงแกงรพ.สต.
- สอน.อนาลโยรพ.สต.
น่าน
- รพ.เฉลิมพระเกียรติn/a
- รพ.เชียงกลางรพช.054 797 111 รอยืนยัน
- รพ.ท่าวังผารพช.054-059-666 พุธ 13.30-16.00 น.
- รพ.ทุ่งช้างn/a
- รพ.น่านรพท054-719-000ศ 09.00-12.00 น.
- รพ.นาน้อยรพช.054-718-196 พฤหัสบดี 08.30 - 16.30 น.
- รพ.นาหมื่นรพช.054-787-013-4 พฤ. 13.00 - 16.00 น.
- รพ.บ่อเกลือรพช.0 5477 8066พ. 13.00 - 16.30 น.
- รพ.บ้านหลวงn/a
- รพ.ภูเพียงรพช.0-5460-1166พ. 13.00 - 16.30 น.
- รพ.แม่จริมรพช.054-771-493 พุธ 08.30 - 16.30 น.
- รพร.ปัวรพช.054-791-701 ต่อ 2232อ. 13.00-16.00 น.
- รพ.เวียงสารพช.054 690810พ. 08.30 - 12.00 น.
- รพ.สต.ปางค่ารพ.สต. รอยืนยัน
- รพ.สองแควรพช.054 718 817 พุธ สัปดาห์ที่ 2 ของเดือน 08.00-12.00 น.
- รพ.สันติสุขรพช.054 767 168 พฤ 13.00-16.00 น.
- สอน.สถานรพ.สต.054-719305 พฤหัสบดี 08.30 - 16.30 น.
8 ข้อแนะนำ การใช้กัญชา ม.มหิดล
มหาวิทยาลัยมหิดล มีความห่วงใยต่อความปลอดภัยของประชาชน และสังคม จึงมีข้อแถลงการณ์ และข้อเสนอแนะ ดังนี้
1. ไม่ใช้กัญชาในหญิงตั้งครรภ์ หญิงให้นมบุตร เด็ก และเยาวชนอายุไม่เกิน 20 ปี โดยเด็ดขาด เพราะมีผลต่อการพัฒนาการของสมองทั้งในแม่และเด็ก
2. ไม่ใช้กัญชาเพื่อการสันทนาการโดยเด็ดขาด เพราะอาจเกิดผลกระทบต่อสุขภาพได้ทั้งในระยะสั้น และระยะยาว เช่น อาการทางจิต และระบบการทำงานต่างๆ ของร่างกาย
3. ไม่ใช้ "ช่อดอกกัญชา" เพื่อผสมในอาหาร และเครื่องดื่ม หากมีการผสมส่วนใดๆ ของ "กัญชา" ในอาหารและเครื่องดื่ม ต้องแจ้งให้ผู้บริโภคทราบล่วงหน้าอย่างชัดเจน
4. ผู้ที่ใช้กัญชา ไม่ควรขับรถ หรือทำงานกับเครื่องจักร ในระยะ 6 ชั่วโมงหลังใช้กัญชา เพราะมีโอกาสเกิดอุบัติเหตุรุนแรงได้สูง
5. ผู้ที่มีโรคประจำตัว เช่น โรคจิตประสาท โรคระบบหัวใจ และหลอดเลือด ขอให้ปรึกษากับแพทย์ ที่ให้การรักษาก่อนใช้กัญชาเสมอ เพราะอาจมีผลต่อยา และการรักษาที่ได้รับอยู่
6. ผู้ปกครองและสถานศึกษา ควรดูแลให้เด็ก และเยาวชนห่างไกลจากกัญชา รวมถึงประชาชน ควรร่วมสร้างสังคมที่ปลอดภัยจากอันตรายของกัญชา
7. ขอให้ภาครัฐ และภาคสังคม มุ่งให้ความรู้ ความเข้าใจที่ถูกต้องเกี่ยวกับการใช้กัญชา และอันตรายที่อาจเกิดขึ้น
8. ขอให้ภาครัฐ เร่งออกกฎหมายที่เกี่ยวข้อง รวมถึงจัดให้มีมาตรการ และหน่วยงานที่รับผิดชอบ ในการติดตามดูแลการใช้กัญชาอย่างเหมาะสม เพื่อให้เกิดสวัสดิภาพที่ดีแก่ประชาชนและสังคม
กรมการแพทย์ ใช้ในทางที่ผิด ระวังผลต่อสุขภาพ เสี่ยงเกิดอาการทางจิต
กรมการแพทย์ โดยสถาบันบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี (สบยช.) เตือนการนำกัญชา ไปใช้ในทางที่ผิด ระวังผลต่อสุขภาพ เสี่ยงเกิดอาการทางจิต พร้อมแนะนำผู้ปกครองหมั่นสังเกตพฤติกรรมบุตรหลานหรือคนใกล้ชิด หากพบมีพฤติกรรมเสี่ยงต้องรีบพูดคุย หากมีอาการหลังจากใช้กัญชาให้รีบปรึกษาแพทย์ในโรงพยาบาลใกล้บ้าน
การได้รับสาร THC และผลต่อ ระบบจิตประสาท - โรงพยาบาลศรีธัญญา LINK
การได้รับสาร THC จากกัญชาเข้าสู่ร่างกายสามารถเกิดผลต่อ "ระบบจิตประสาท"
THC 2-5 mg เทียบเท่ากับกัญชา 6 ใบ
อาการ..กดประสาท
<1mg รู้สึกสบาย สงบสุขคนเดียวได้
2-5 mg ง่วง อยากนอน ไม่มีแรงจูงใจทำอะไร
5mg ขึ้นไป หลับลึกไม่ค่อยรู้ตัว
อาการ..กระตุ้นประสาท
<1mg กระชุ่มกระชวย สมาธิดี ไม่หิวไม่เหนื่อย
2-5 mg กระสับกระส่าย กลัว ตื่นตระหนก
5mg ขึ้นไป หัวใจเต้นเร็วมาก อุณหภูมิร่างกายสูงขึ้นมาก
อาการ..หลอนประสาท
<1mg เคลิ้ม ฝันกลางวัน
2-5 mg วิตกกังวล กลัว ไม่ออกไปไหน
5mg ขึ้นไป ยิ้ม พูดคนเดียว หูแว่ว ระแวง
อาการทางจิตประสาทอาจขึ้นอยู่กับสภาพร่างกายและการตอบสนองของแต่ละบุคคล
โปรตีนจากพืชดีอย่างไร
“โปรตีนจากพืชดีอย่างไร ทำไมเอามาแทนโปรตีนเนื้อสัตว์ มีงานวิจัยมากมายที่ชี้ให้เห็นว่า ช่วยลดอัตราการก่อโรคได้มากมายโดยเฉพาะโรคไม่ติดต่อเรื้อรังต่างๆ (NCDs) ทั้งโรคหัวใจและหลอดเลือด โรคเบาหวาน โรคมะเร็ง” คุณหมอแอมป์ชี้ให้เห็นข้อดีของการรับประทานอาหารแบบ Plant based diet
การเปลี่ยนมารับประทานอาหารแบบPlant-based diet จะช่วยลดไขมันอิ่มตัว เพิ่มใยอาหารและสารพฤกษเคมี (phytochemical) ซึ่งเป็นสารเคมีที่พบเฉพาะในพืช มีการศึกษามากมายที่รับรองว่า การรับประทานอาหารแบบ Plant-based diet มีประโยชน์ต่อสุขภาพ
ลดความเสี่ยงโรคหัวใจและหลอดเลือด จากการได้รับไขมันอิ่มตัวและระดับ TMAO (Trimethylamine N-oxide) จากเนื้อสัตว์น้อยลง งานวิจัยเกี่ยวกับการรับประทานอาหารจากพืชเพื่อเป็นทางเลือกในการรักษาโรคหัวใจและหลอดเลือด เริ่มต้นตั้งแต่ ค.ศ. 1998 ตีพิมพ์ลงในวารสาร The American Journal of Cardiology โดยคุณหมอ Ornish ผู้ก่อตั้ง Preventive Medicine Research Institute คุณหมอทำการวิจัยเป็นแบบสุ่มและมีกลุ่มควบคุม (randomized controlled trial) โดยดำเนินการพร้อมกัน 8 แห่ง จำนวนคนเข้าร่วม 333 คน เพื่อเปรียบเทียบระหว่าง การรักษาด้วยการเปิดหลอดเลือดที่อุดตัน (Revascularization) และ การปรับพฤติกรรมแบบองค์รวม ตั้งแต่การรับประทานอาหารรูปแบบมังสวิรัติที่มีใยอาหารสูง น้ำตาลต่ำ ไขมันต่ำ การออกกำลังกายเป็นประจำ และการจัดการกับความเครียด
คลินิกสร้างเสริมและฟื้นฟูระบบกล้ามเนื้อและกระดูก
ให้บริการที่มุ่งเน้นการฟื้นฟูสมรรถภาพของร่างกาย กายภาพบำบัด การฝึกออกกำลังกายฟื้นฟูร่างกายหลังการผ่าตัด และหัตถบำบัด เฝ้าตรวจสอบสุขภาพไปพร้อมกัน ทั้งการเผาผลาญ ระบบร่างกาย กล้ามเนื้อ หัวใจ ระบบเลือด ฯลฯ
เป็นเลิศเพื่อทุกชีวิต
นอกจากความเป็นเลิศด้านหลักสูตร วิชาการและมาตรฐานแล้ว จะมุ่งไปยังการนำสรรพความรู้และผลงานวิจัย ไปต่อยอดและใช้ประโยชน์เชิงพาณิชย์ รวมถึงสาธารณประโยชน์ ให้บริการทางวิชาการ วิชาชีพด้านวิทยาศาสตร์สุขภาพบนพื้นฐานของมาตรฐานวิชาชีพและการสร้างทุนทางปัญญาเพื่อพัฒนาคุณภาพชีวิตที่ดีของประชาชน อนุรักษ์ฟื้นฟูสืบสานและเผยแพร่ภูมิปัญญาการสร้างองค์ความรู้และทำความเข้าใจวัฒนธรรมวิถีชีวิตและสืบสานพระปณิธานใน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี องค์ประธานราชวิทยาลัยจุฬาภรณ์ ที่ทรงมุ่งหวังให้วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ซึ่งเป็นหน่วยงานภายใต้การกำกับของราชวิทยาลัยจุฬาภรณ์ เป็นศูนย์กลางการศึกษาและวิจัยสู่ความเป็นเลิศด้านวิชาการและวิชาชีพเพื่อบริการมวลมนุษยชาติอย่างยั่งยืน ภายใต้ปรัชญา “เป็นเลิศเพื่อทุกชีวิต”
แก้เมากัญชา ด้วยพืชผัก
หากมีอาการผิดปกติ เช่น วิงเวียน คลื่นไส้ อาเจียน สามารถใช้สมุนไพรใกล้ตัวบรรเทาอาการได้
ขิง : กินชาชงขิง หรือน้ำขิง 1 แก้วได้
มะนาว : บีบน้ำมะนาว ผสมเกลือเล็กน้อย หรือผสมน้ำผึ้งจิบ หรือจะหั่นเป็นชิ้นเล็กๆ เคี้ยวกินเลยก็ได้เช่นกัน
พริกไทย : เคี้ยวพริกไทย หายชัวร์
เกลือ : ใช้เกลือหยิบมือ อมไว้ใต้ลิ้น แล้วนอนพัก
*สอบถาม สำนักงานจัดการกัญชาและกระท่อมฯ โทร 021495647
ภายในโครงการแบ่งออกเป็นหลายโซน เช่น อาคารฝึกอบรม ที่ให้บริการการตรวจเช็คสุขภาพ กายภาพบำบัด ธาราบำบัด มีคอร์สการอบรมต่าง ๆ ที่จำเป็นต่อผู้สูงอายุ เช่น การดูแลผู้ป่วยติดเตียง มีโซนพื้นที่สวน ที่ผู้สูงอายุสามารถมาเดินออกกำลังกาย หรือพักผ่อน มีศูนย์อาหารที่เน้นโภชนาการที่ดีสำหรับผู้สูงอายุ เป็นต้น ที่นี่จึงเป็นพื้นที่รวมองค์ความรู้ที่คาดว่าจะช่วยย้อนวัย และยืดวัยให้แก่ผู้สูงอายุราว 60,000 คนต่อปี ส่งเสริมให้สังคมผู้สูงวัยในอนาคตให้เป็นสังคมที่มีคุณภาพมากยิ่งขึ้น โดยเตรียมเปิดให้บริการเร็วๆ นี้
สวนหลวง ร.9 พื้นที่ 500 ไร่
สวนหลวง ร.9 พื้นที่ประมาณ 500 ไร่ อยู่ในแขวงหนองบอน เขตประเวศ เป็นสวนสาธารณะที่ใหญ่ที่สุดในกรุงเทพมหานคร สร้างเพื่อน้อมเกล้าถวายในหลวงรัชกาลที่ 9 ในศุภมงคลสมัยเจริญพระชนมพรรษา 60 พรรษา 5 ธันวาคม พ.ศ. 2530 เปิดให้บริการเมื่อ 1 ธันวาคม พ.ศ. 2530 มีจุดเด่นคือ หอรัชมงคล ซึ่งจัดเป็นสัญลักษณ์สำคัญของสวนหลวง ร.9 สวนหลวง ร.9 เปิดให้บริการทุกวัน เวลา 05.00 - 19.00 น. [ภาพ Supanut Arunoprayote
Wikipedia]
สหัสขันธ์ไดโนโรดโฮมสเตย์ อ.สหัสขันธ์ จ.กาฬสินธุ์
สหัสขันธ์ไดโนโรดโฮมสเตย์ กวาดรางวัลมามากมายและอย่างต่อเนื่อง ตั้งแต่ รางวัล โฮมสเตย์มาตรฐานอาเซียน ปี พ.ศ.2561. มาตรฐานไทย ปี2559, 2563. 1 ใน10. GSB สมาร์ทโฮมสเตย์ ปี 2562. home lodge. ปี2563 รางวัลเหล่านี้บ่งบอกถึงคุณภาพและความตั้งใจของโฮมสเตย์ แห่งเมืองไดโนเสาร์ กาฬสินธุ์ ใจกลางแผ่นดินอีสานได้เป็นอย่างดี
สหัสขันธ์ไดโนโรดโฮมสเตย์ โฮมสเตย์เพื่อสุขภาพ เมืองไดโนเสาร์ เมืองอบอุ่น วิถีบุญวิถีธรรม เสมือนบ้านญาติ จำนวนห้องพัก 10 ห้อง ในราคาที่เป็นธรรม พร้อมบริการนำเที่ยว ต้อนรับทุกกลุ่มท่องเที่ยว (กลุ่มครอบครัว - กลุ่มผู้สูงอายุ - กลุ่มวัยทำงาน - กลุ่มนักเรียนนักศึกษา / เยาวชน / วัยรุ่น - กลุ่มสตรี - กลุ่มคู่รัก / คู่แต่งงาน)
ที่อยู่ 40 หมู่ 11 ตำบล โนนบุรี อำเภอสหัสขันธ์ จังหวัดกาฬสินธุ์ 46140
โทร. 0819536804
www.facebook.com/homestay.dino/
จากกลุ่มตัวอย่างทั้งหมด พบว่าโดยเฉลี่ยแล้วคนไทยมีค่าใช้จ่ายอยู่ประมาณ 70% เมื่อเทียบกับรายได้ทั้งหมดต่อเดือน และมีเงินออมประมาณ 30%
อย่างไรก็ตาม ประชากรในภาคอีสาน และภาคใต้ มีแนวโน้มที่จะประสบปัญหาทางการเงินมากกว่าผู้บริโภคในภาคอื่นๆ เนื่องจากค่าใช้จ่ายต่อเดือนสูงถึง 80% ของรายได้
และเมื่อพิจารณาสัดส่วนค่าใช้จ่าย พบว่าคนไทยส่วนใหญ่ใช้เงินไปกับค่าอาหาร และของใช้ภายในบ้าน มากที่สุดถึง 1 ใน 4 ของรายจ่ายทั้งหมด รองลงมาเป็นค่าสาธารณูปโภค เช่น ค่าไฟฟ้า, ค่าน้ำ, ค่า WiFi / อินเตอร์เนท (13%), ค่าช้อปปิ้งของใช้ส่วนตัว หรือการดูแลสุขภาพ ความสวยความงาม (9%) หรือค่าผ่อนบ้าน, ค่าเช่าบ้าน หรือค่าใช้จ่ายเกี่ยวกับที่พักอาศัย (9%) เป็นต้น
การได้กลับมาใช้ชีวิตเป็นปกติอีกครั้งถือเป็นสัญญาณที่ดี - ณัฐกานต์ วัฒนมงคลศิลป์
“การที่คนไทยจะได้กลับมาใช้ชีวิตเป็นปกติอีกครั้งถือเป็นสัญญาณที่ดี ได้ออกมาจับจ่ายซื้อของตามต้องการ โดยไม่ต้องกังวลต่อเรื่องใดมันจะส่งผลดีต่ออะไรอีกหลาย ๆ ด้าน ในอนาคตอย่างแน่นอน เช่นเรื่องความสุขของคนไทย จากผลสำรวจ คนไทยมีอัตราความสุขที่สูงขึ้น คนต้องการซื้อของเพื่อตอบสนองความต้องการของตนเองและเพื่อครอบครัวถึงแม้ยังจะไม่มากแต่ก็ถือว่าเป็นเรื่องที่ดี” คุณ ณัฐกานต์ วัฒนมงคลศิลป์ ตำแหน่ง ผู้อำนวยการฝ่ายวางแผนกลยุทธ์ บริษัท สปา-ฮาคูโฮโด กล่าวเสริม ผลการวิจัยประจำเดือนมิถุนายน พ.ศ. 2565 ของสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) ระบุว่า ข่าวเรื่องการระบาดของโควิด-19 ไม่ใช่อันดับหนึ่งในสิ่งที่น่าสนใจและเป็นที่พูดถึงมากที่สุด แต่กลับเป็นเรื่องของหัวข้อข่าว อาชญากรรม บ้านเมือง นับได้ว่านี่เป็นครั้งแรกในรอบปีที่โควิด-19 ไม่ใช่ประเด็นที่คนไทยให้ความสำคัญมากเป็นอันดับหนึ่งอีกต่อไป คนไทยเริ่มหันมาสนใจสิ่งต่าง ๆ รอบตัวเพื่อเตรียมพร้อมกลับมาใช้ชีวิตปกติและเน้นถึงความสุขปัจจุบันมากกว่าอนาคต
แม่โจ้ ขายต้นพันธุ์กัญชาแม่โจ้ MJU03 ต้นละ 30 บาท LINK
มหาวิทยาลัยแม่โจ้ เปิดจำหน่ายต้นพันธุ์กัญชา
1. ต้นพันธุ์กัญชา จำหน่ายต้นละ 30 บาท
เป็นต้นกล้าพันธุ์กัญชาอินทรีย์ สายพันธุ์แม่โจ้ MJU03 อายุประมาณ 15-20 วัน (ไม่รู้เพศ)
มีพร้อมจำหน่าย 1 ล้านต้น จำกัดให้ได้รายละไม่เกิน 5 ต้น
2. เมล็ดพันธุ์กัญชา เมล็ดละ 20 บาท
วิธีการสั่งจองซื้อต้นพันธุ์กัญชา
ผู้ที่สนใจสามารถติดต่อซื้อหรือสอบถามรายละเอียดได้ที่ศูนย์วิจัยและพัฒนาเกษตรธรรมชาติ มหาวิทยาลัยแม่โจ้ โทร. 053-873730, 084-4888305
ลงทะเบียนจอง "ต้นกล้ากัญชาอินทรีย์ MJU03"
ความสำคัญของ NK Cell
พญ.จิรา ถาวรประดิษฐ์ ผู้อำนวยการคลินิกรอยัลไลฟ์ เวลเนส คลินิก (RoyalLife Wellness Clinic) กล่าวว่า ระบบภูมิคุ้มกัน (Immune System) เป็นหนึ่งในกลไกการทำงานของร่างกายซึ่งมีหน้าที่ดูแลและป้องกันไม่ให้เกิดการติดเชื้อในร่างกายมนุษย์ไม่ว่าจะเป็นเชื้อไวรัส เชื้อแบคทีเรีย หรือเชื้อโรคอื่นๆ หนึ่งในนั้นคือ ระบบภูมิคุ้มกันที่ชื่อว่า “NK Cell” หรือ Natural Killer Cell เป็นด่านหน้าป้องกันการรุกล้ำของเชื้อไวรัสหรือเซลล์ผิดปกติในร่างกาย
1.LAAB ย่อมาจากอะไร
LAAB ย่อมาจาก Long-acting Antibody หรือ ยาแอนติบอดีออกฤทธิ์ยาวแบบผสม ใช้เพื่อการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-19 ซึ่งสามารถลบล้างฤทธิ์เชื้อไวรัสสายพันธ์ย่อยโอมิครอน BA.1, BA.1.1, BA.2, BA.3, BA.4 และ BA.5 ได้ รวมไปถึงยังสามารถลดความเสี่ยงของการติดเชื้อโควิด-19 แบบมีอาการได้อีกด้วย
ตรวจมะเร็งเต้านม LINK
วิธีการตรวจมะเร็งเต้านม
การตรวจเต้านมด้วยดิจิตอลแมมโมแกรมร่วมกับการอัลตราซาวน์เต้านม (Digital Mammogram with Ultrasound Breast)
เป็นวิธีคัดกรองมะเร็งเต้านมที่ดีที่สุดในปัจจุบัน
สามารถตรวจพบมะเร็งเต้านมได้ตั้งแต่ระยะเริ่มแรก
ใช้เวลาตรวจไม่นาน ไม่ต้องงดน้ำ-อาหารก่อนตรวจ
การตรวจเต้านมโดยแพทย์หรือพยาบาล
การตรวจเต้านมด้วยตนเอง
โรงเรียนนักอัลตราซาวด์ทางการแพทย์
ในปีการศึกษา 2565 นี้ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ จัดการเรียนการสอนในระดับปริญญาตรี ปริญญาโท และหลักสูตรระยะสั้นผลิตบุคลากรในสาขาวิชาชีพที่ขาดแคลน ซึ่งแต่ละหลักสูตรได้นำเสนอการเรียนการสอนและเทคโนโลยีที่ทันสมัย ประกอบด้วย
โรงเรียนนักอัลตราซาวด์ทางการแพทย์ จัดทำหลักสูตรโดยความร่วมมือในการจัดทำหลักสูตรอัลตราซาวด์ทางการแพทย์ ระหว่างวิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ และ Monash University ประเทศออสเตรเลีย เพื่อให้เป็นหลักสูตรต้นแบบมุ่งผลิตนักอัลตราซาวด์ที่มีความรู้ ความเชี่ยวชาญ และมีประสิทธิภาพ เพื่อเข้ามาเป็นส่วนร่วมในการเสริมการบริการและวิชาการ ทางด้านอัลตราซาวด์ทางการแพทย์ของประเทศ
หลักสูตรมีวัตถุประสงค์เพื่อส่งเสริมให้นักรังสีเทคนิค แพทย์ พยาบาล และผู้ที่เกี่ยวข้องทางด้านอัลตราซาวด์ทางการแพทย์สามารถเรียนรู้ตลอดชีวิตได้ในทุกที่ ทุกเวลาทุกโอกาส
ทั้งยังส่งเสริมการศึกษานอกระบบและการศึกษาตามอัธยาศัยให้สามารถเข้าสู่การศึกษาในระบบมากยิ่งขึ้น ทั้งนี้ในกิจกรรมการเยี่ยมชมมีการทำอัลตราซาวด์แสดงให้เห็นถึงการตรวจในแต่ละส่วนของร่างกายที่มากกว่าแค่การตรวจอัลตราซาวด์ภายในช่องท้อง หรือการอัลตราซาวด์ทางสูติศาสตร์ นอกจากนี้หลักสูตรฯ ยังส่งเสริมให้ผู้เรียนมีทักษะการถ่ายทอดความรู้ให้แก่ผู้อื่น สอดคล้องกับปรัชญาของคณะฯในการ “สร้างครูผู้สร้าง”
สถานเอกอัครราชทูต ณ กรุงโซล เตือนคนไทยที่จะเดินทางมาหรือพำนักอยู่ในเกาหลีใต้ LINK
ประกาศ เตือนคนไทยที่จะเดินทางมาหรือพำนักอยู่ในเกาหลีใต้ ห้ามนำเข้า กัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของพืชชนิดดังกล่าวเข้ามาในประเทศเกาหลีใต้
หากฝ่าฝืน จะมีโทษตามกฎหมายเกาหลีใต้
ลักลอบนำเข้า - จำคุก 5 ปีขึ้นไป หรือตลอดชีวิต
ปลูกหรือจำหน่าย - จำคุกอย่างน้อย 1 ปี
มีไว้ครอบครองหรือเสพ - จำคุกไม่เกิน 5 ปี และ ถูกเนรเทศห้ามเดินทางเข้าเกาหลีใต้อีก
ภก.ศศิพงค์ ทิพย์รัชดาพร คว้ารางวัล เภสัชกรอุตสาหการรุ่นใหม่ดีเด่น ประจำปี 2564
ภก.ศศิพงค์ ทิพย์รัชดาพร คว้ารางวัล เภสัชกรอุตสาหการรุ่นใหม่ดีเด่น ประจำปี 2564 จากสมาคมเภสัชกรอุตสาหการ (ประเทศไทย)
สมาคมเภสัชกรอุตสาหการ (ประเทศไทย) ได้คัดเลือกเภสัชกรอุตสาหการรุ่นใหม่ดีเด่น สำหรับเภสัชกรที่ทำงานในวิชาชีพเภสัชกรรมอุตสาหการ ที่ทำคุณประโยชน์ให้แก่วิชาชีพเภสัชกรรมอุตสาหการ และมีส่วนร่วมในกิจกรรมต่างๆ ขององค์กรวิชาชีพ เพื่อแสดงให้ประชาชนได้ประจักษ์ถึงบทบาท หน้าที่และความรับผิดชอบของเภสัชกรอุตสาหการที่มีต่อสังคม โดยคณะกรรมการพิจารณาผลงาน พร้อมประกาศเกียรติคุณรางวัล“เภสัชกรอุตสาหการรุ่นใหม่ดีเด่น” ประจำปี 2564 ให้แก่ นายศศิพงค์ ทิพย์รัชดาพร เภสัชกรชำนาญการ
เภสัชกรศศิพงค์ ทิพย์รัชดาพร หรือ “แชมพ์” ปัจจุบันรับราชการ ตำแหน่งเภสัชกรชำนาญการ หัวหน้างานพัฒนาวิชาการ นวัตกรรมและการผลิตยาสมุนไพร กลุ่มงานเภสัชกรรมและคุ้มครองผู้บริโภค โรงพยาบาลพระอาจารย์ฝั้น อาจาโร อ.พรรณานิคม จ.สกลนคร สำเร็จการศึกษาเภสัชศาสตรบัณฑิต (เกียรตินิยม อันดับ 2)คณะเภสัชศาสตร์ มหาวิทยาลัยอุบลราชธานี ปี 2550 และสำเร็จการศึกษาเภสัชศาสตรมหาบัณฑิต (เภสัชกรรมคลินิก) คณะเภสัชศาสตร์ มหาวิทยาลัยมหาสารคาม
ด้านสาขาวิชาที่มีความชำนาญพิเศษ งานผลิตยาสมุนไพร งานคุ้มครองผู้บริโภค งานบริบาลเภสัชกรรม ซึ่งเป็นวิทยากรบรรยาย การใช้ยาสมุนไพรในบัญชียาหลักแห่งชาติอย่างถูกต้อง ปลอดภัย สมเหตุผล อ้างอิงจากหลักฐานเชิงประจักษ์และงานวิจัยทางคลินิก
ภก.ศศิพงค์ ทิพย์รัชดาพร เป็นศิษย์เก่า รุ่นที่ 10 คณะเภสัชศาสตร์ มหาวิทยาลัยอุบลราชธานี [
ข้อมูล]
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาดินแดง
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาดินแดง
ที่อยู่ : 4835, 4837 ถนนประชาสงเคราะห์ แขวงดินแดง เขตดินแดง กรุงเทพฯ 10400
[แผนที่]
เวลาเปิดทำการ
วันจันทร์ - ศุกร์ 08.00 - 19.00 น.
วันเสาร์ - อาทิตย์ 09.00 - 18.00 น.
แพทย์ประจำ สาขาดินแดง
1.แพทย์หญิงหัทยา เทียมเพ็ชร
แพทยศาสตรบัณฑิต คณะแพทยศาสตร์ ธรรมศาสตร์มหาวิทยาลัย สาขาเวชกรรมทั่วไป พ.ศ.2554
อบรมหลักสูตรระยะสั้น เวชศาสตร์ครอบครัว รุ่น 10 พ.ศ. 2561
ตารางออกตรวจ
วันจันทร์ - ศุกร์ เวลา 08.00 - 19.00 น.
วันเสาร์ - อาทิตย์ เวลา 09.00 - 16.00 น.
2. แพทย์หญิงภัทราพร เอี้ยงลี
ตารางออกตรวจ
วันเสาร์ เวลา 09.00 - 18.00 น.
คลินิกเวชกรรม สวท บางเขน กทม. LINK
คลินิกเวชกรรม สวท บางเขน
เลขที่ 8 ซอยวิภาวดีรังสิต 44 ถนนวิภาวดีรังสิต แขวงลาดยาว เขตจตุจักร กรุงเทพฯ
เปิดทำการ : จันทร์.-ศุกร์ เวลา 8.30-16.30 น.
ปิดทำการ : วันเสาร์, อาทิตย์ และวันหยุดนักขัตฤกษ์
0-2941-2320 ต่อ 181-182
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 54 ทัศน์เอี่ยม LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 54 ทัศน์เอี่ยม
ให้บริการทุกวันพุธ ช่วงเวลา 13.00 น.- 16.00 น. สอบถามเพิ่มเติมได้ที่ 02 426 3514
ให้บริการ
1.ตรวจมะเร็งเต้านม
2.บริการตรวจภายใน
3.มะเร็งปากมดลูก
4.ฉีดยาคุมกำเนิด
5.จ่ายยาคุมกำเนิดแบบเม็ด
FAQ ใช้ Spring Up ข้อมูลออกกำลังกาย
ระบบการคัดสรรวิดีโอฟิตเนสที่เหมาะกับฉันทำงานอย่างไร?
เราคัดสรรวิดีโอออกกำลังกายที่เหมาะสำหรับคุณโดยการประมวลผลจากข้อมูลต่างๆ ได้แก่: อายุเพศ, น้ำหนัก, ส่วนสูง, ความถี่ในการออกกำลังกาย, ส่วนที่เน้นดูแล ความคิดเห็นของคุณหลังการดูวิดีโอฟิตเนสในแต่ละวันเมื่อได้ข้อมูลดังกล่าวแล้ว ระบบจะวิเคราะห์ข้อมูลทั้งหมดของคุณและเลือกสรรวิดีโอฟิตเนสที่เหมาะกับคุณมากที่สุด
ฉันสามารถเชื่อมต่อนาฬิกาสุขภาพกับแอป Spring Up ได้หรือไม่?
คุณสามารถทำได้ โดยไปที่ "โปรไฟล์ของฉัน" > "การตั้งค่า" > "แอป & อุปกรณ์" แล้วกดอนุญาตให้แอป Spring Up สามารถเชื่อมต่อกับแอปนาฬิกาสุขภาพของคุณ
ฉันควรทำอย่างไรหากวิดีโอฟิตเนสที่ระบบแนะนำให้ง่ายหรือยากเกินไป?
เราจะสอบถามความเห็นของคุณหลังจากที่ดูวิดีโอฟิตเนสในแต่ละวันจบ โปรดบอกเราหากวิดีโอฟิตเนสของวันนั้นง่ายหรือยากเกินไปสำหรับคุณ เพื่อให้ระบบจัดแผนออกกำลังกายที่เหมาะสำหรับคุณในวันถัดไป นอกจากนี้ ทุกวิดีโอจะมีเทรนเนอร์ 3 คนแสดงวิธีการออกกำลังกายในระดับความยากง่ายแตกต่างกัน ขอแนะนำให้คุณทำตามเทรนเนอร์ที่เหมาะกับระดับของคุณ
ฉันสามารถไปสู่ระดับที่สูงขึ้นได้อย่างไร?
คุณจะได้รับคะแนนสะสมทุกครั้งที่ดูวิดีโอฟิตเนสจนจบ และอัปเกรดสู่ระดับที่สูงขึ้นเมื่อคุณสะสมคะแนนครบ รับโบนัสพิเศษ! เป็นคะแนนสะสมเพิ่มทันทีเมื่อทำภารกิจฟิตเนสประจำวันครบทุกวิดีโอ
ฉันสามารถดาวโหลดวิดีโอฟิตเนสเก็บไว้ได้หรือไม่?
วิดีโอฟิตเนสทุกวิดีโอมีลิขสิทธิ์ ไม่สามารถดาวน์โหลดได้
ถ้าฉันไม่สามารถทำท่าออกกำลังกายตามวิดีโอฟิตเนสได้ จะทำอย่างไร?
ขอแนะนำให้คุณออกกำลังกายตามเทรนเนอร์สำหรับระดับเริ่มต้นก่อน
มีวิดีโอแบบเต้นออกกำลังกายหรือไม่?
ระบบยังไม่ให้บริการวิดีโอแบบเต้นออกกำลังกายในขณะนี้
ถ้าฉันไม่สามารถดูวิดีโอฟิตเนสของวันนั้นได้ สามารถเลื่อนไปดูวันถัดไปได้หรือไม่?
วิดีโอฟิตเนสของแต่ละวันถูกกำหนดไว้ล่วงหน้า จึงไม่สามารถเปลี่ยนแปลงได้ แต่คุณสามารถกลับไปออกกำลังกายย้อนหลังได้ภายใน 2 วัน
ฉันต้องเตรียมอุปกรณ์ออกกำลังกายสำหรับแต่ละวิดีโอหรือไม่?
ทุกวีดิโอที่มีในแอปขณะนี้ไม่จำเป็นต้องใช้อุปกรณ์ใดๆ ในการออกกำลังกาย
ใช้เวลาออกกำลังกายต่อวันนานเท่าไร?
ขอแนะนำให้คุณออกกำลังกายประมาณ 20-40 นาทีต่อวัน (4-8 วิดีโอ) โดยขึ้นอยู่กับสมรรถภาพทางกายของแต่ละบุคคล
27 มีนาคม 2565 เรือบรรทุกน้ำมันระเบิดกลางแม่น้ำเจ้าพระยา ดับ 1 เจ็บสาหัส 1 ที่ จ.สมุทรปราการ LINK
27 มีนาคม 2565 เวลา 13.40 น. เกิดเหตุเพลิงไหม้เรือบรรทุกน้ำมันเชื้อเพลิงระเบิดกลางแม่น้ำเจ้าพระยา บริเวณเทียบท่าเรือใกล้ป้อมพระจุล สะพาน 2 จังหวัดสมุทรปราการ มีผู้ได้รับบาดเจ็บจากเหตุการณ์ในครั้งนี้จำนวน 1 ราย และเสียชีวิต 1 ราย นายสุชาติ ชมกลิ่น รัฐมนตรีว่าการกระทรวงแรงงาน ได้แสดงความห่วงใยและเสียใจต่อเหตุการณ์ที่เกิดขึ้น พร้อมสั่งการด่วนให้ สำนักงานประกันสังคมเร่งตรวจสอบ และให้การช่วยเหลือลูกจ้างผู้ประสบเหตุทันที
จากการตรวจสอบเรือบรรทุกน้ำมันเชื้อเพลิงที่ประสบเหตุลำดังกล่าวเป็นของบริษัท อยุธยา ดีเวลลอปเม้นท์ ลิซซิ่ง จำกัด เรือชื่อ อัมภา 8 สัญชาติไทย มีลูกจ้างประสบเหตุได้รับบาดเจ็บ 1 ราย และ เสียชีวิต 1 ราย ซึ่งเป็นลูกจ้างของบริษัท พี.เอส.วี. ซัพพลาย จำกัด ตั้งอยู่เลขที่ 932 ถนนพระราม 3 แขวงบางโพงพาง เขตยานนาวา กรุงเทพฯ อยู่ในความรับผิดชอบของสำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 11 ลูกจ้างที่ได้รับบาดเจ็บสาหัส 1 ราย ชื่อ นายณัชพิษณุพงศ์ มาเนียม อายุ 26 ปี มีอาการบาดเจ็บสาหัส ร่างกายถูกไฟไหม้ถึง 50% ถูกนำตัวส่งเข้ารักษาที่โรงพยาบาลสินแพทย์ เทพารักษ์ จังหวัดสมุทรปราการ ขณะนี้ยังอยู่ในห้อง ICU ทั้งนี้ สำนักงานประกันสังคมจะดูแลช่วยเหลือด้านสิทธิประโยชน์ให้กับผู้ประกันตนที่ได้รับบาดเจ็บ แยกเป็นการประสบอันตรายเนื่องจากการทำงาน จะได้รับสิทธิความคุ้มครองจากกองทุนเงินทดแทน เป็นค่ารักษาพยาบาลเท่าที่จ่ายจริงตามความจำเป็น และค่าทดแทนกรณีหยุดพักรักษาตัว ร้อยละ70 ของค่าจ้างรายเดือน สำหรับกรณีที่ลูกจ้างต้องสูญเสียสมรรถภาพในการทำงานของร่างกาย จะจ่ายร้อยละ70 ของค่าจ้างรายเดือน ตามระยะเวลาที่ประกาศกระทรวงแรงงานกำหนดแต่ไม่เกิน 10 ปี สำหรับลูกจ้างที่เสียชีวิตในที่เกิดเหตุ 1 ราย ชื่อ นายประสิทธิ์ สุภัทร์วัน อายุ 44 ปี ทายาทผู้เสียชีวิตจะได้รับสิทธิค่าทำศพ 50,000 บาท เงินทดแทนกรณีตาย 1,680,000 บาท และเงินบำเหน็จชราภาพจากกองทุนประกันสังคม 151,504.34 บาท รวมเป็นจำนวนเงินทั้งสิ้น 1,881,504.34 บาท
งานประกันสังคมกรุงเทพมหานครพื้นที่ 11 ชี้แจงสิทธิประโยชน์ การรักษาพยาบาลจากกองทุนเงินทดแทน ให้กับญาติของลูกจ้างที่ได้รับบาดเจ็บจากการทำงาน พร้อมติดต่อทายาทของลูกจ้างที่เสียชีวิต ซึ่งทราบว่ามีภูมิลำเนาบ้านเกิดอยู่ในจังหวัดเชียงราย ให้ได้รับสิทธิกรณีเสียชีวิตอย่างครบถ้วน
1. เตรียมบัตรประชาชนให้พร้อม พร้อมด้วยหน้ากากอนามัย และเจลล้างมือ
เตรียมบัตรประชาชนให้พร้อม ความสะอาดก็ต้องมี การป้องกันตัวก็ต้องพร้อมด้วยหน้ากากอนามัย และเจลล้างมือ
กลุ่มที่มีความเสี่ยงอันดับต้นๆ
นพ. เขษม์ชัย เสือวรรณศรี รองประธานอาวุโสปฏิบัติการด้านการแพทย์ และแพทย์ชำนาญการด้านประสาทวิทยา โรงพยาบาลบำรุงราษฎร์ กล่าวว่า คลินิกคุณภาพการนอนหลับ โรงพยาบาลบำรุงราษฎร์ ให้บริการครอบคลุมในทุกปัญหาของการนอน ตั้งแต่การประเมินซักถาม การตรวจวินิจฉัย เพื่อหาสาเหตุของปัญหาการนอนของแต่ละบุคคล และสามารถรักษาถึงต้นเหตุของปัญหาได้อย่างตรงจุด ด้วยทีมแพทย์ผู้ชำนาญการเฉพาะทางในสาขาที่เกี่ยวข้อง เช่น ด้านเวชศาสตร์การนอนหลับ ด้านระบบทางเดินหายใจ ด้านหู คอ จมูก ด้านระบบประสาท ด้านทันตกรรม และจิตแพทย์ รวมถึงมีบริการตรวจวินิจฉัยในระดับมาตรฐานสากลที่มีความละเอียดแม่นยำสูง รวมถึงให้บริการการรักษาที่ครอบคลุมทั้งอาการและโรคต่างๆ ที่สัมพันธ์หรือเกิดจากปัญหานอนได้อย่างครอบคลุมแบบองค์รวม
กลุ่มที่มีความเสี่ยงและควรมาปรึกษาแพทย์เป็นอันดับต้นๆ คือ
1. กลุ่มที่มีโรคประจำตัว เช่น โรคหลอดเลือดหัวใจ โรคไตวาย โรคความดันโลหิตสูง โรคเบาหวาน โรคความจำเสื่อม โรคอ้วน หรือมีดัชนีมวลกาย (BMI) เกิน 30 ขึ้นไป ซึ่งคนที่มีโรคประจำตัวดังกล่าว จะมีโอกาสสูงถึง 50% ที่จะมีภาวะนอนกรนหยุดหายใจขณะหลับร่วมด้วย
2. กลุ่มที่มีภาวะนอนกรนหยุดหายใจขณะหลับ
3. กลุ่มที่มีอาการง่วงนอนสูงในระหว่างวัน
4. กลุ่มที่มีอาการนอนไม่หลับ เช่น สัปดาห์หนึ่งเกิน 3 วัน นานติดต่อกันเกิน 1 - 3 เดือน ก็ควรมาพบแพทย์เพื่อหาสาเหตุ หรือกลุ่มที่ไม่สามารถทำกิจวัตรประจำวันได้เหมือนเดิม หรือมีภาวะอารมณ์ผิดปกติ หรือภาวะซึมเศร้า
รายชื่อร้านยาในเขตปริมณฑล + นครปฐม สมุทรสาคร
กลุ่มผู้ปลูก ขนต้นกัญชา ต้นอ่อนกัญชา ต้นพันธุ์กัญชา มาจำหน่ายเพียบ
กลุ่มผู้ปลูกหลายแห่ง ขนต้นกัญชา ต้นอ่อนกัญชา ต้นพันธุ์กัญชา มาจำหน่ายเพียบ นำโดยม.แม่โจ้ ขนมา 3 ขนาดต้นพันธุ์ เล็ก กลาง ใหญ่ ราคา 60, 100 และ 200 บาท ใครที่อยากได้ ไม่อยากจองคิวรอนาน มาซื้อในงานเอากลับบ้านไปได้เลย แต่ถ้ามาช้าน่าจะอด เพราะดูด้วยตาแล้ว จำนวนจำกัดมาก
ผู้ปลูกอื่นๆ อย่างวิสาหกิจชุมชน บริษัท หรือกลุ่มเกษตรกร ก็จัดมาจำหน่ายกันมากมาย หลายระดับราคา ตามขนาดต้น ชนิดพันธุ์ คุณภาพและ ฯลฯ เลือกซื้อหากันได้ตามต้องการ
Home Isolation แต่ละอำเภอ (จากสสจ.ลพบุรี) LINK
แนวทางตรวจวินิจฉัย
1.ตรวจ ATK ด้วยตนเองหรือกับหน่วยบริการ
2.ผลเป็นบวก แจ้งเจ้าหน้าที่ รพ.สต.ใกล้บ้าน หรือ โทร.081-2342730
3. แยกรักษาตามลักษณะอาการ
3.1 ไม่มีอาการ เข้าระบบ เจอ-แจก-จบ ผู้ป่วยนอก แยกกักตัวที่บ้าน
3.2 อาการน้อย แยกกักตัวที่บ้านหรือไปกักในชุมชน รพ.สนาม
3.3 มีอาการ มีปัจจัยเสี่ยง (เป็นโรค) ส่งรักษาที่โรงพยาบาล
4. หากตรวจเป็นลบ แต่มีอาการ จะตรวจซ้ำ เพื่อยืนยันผล ที่รพ.ใกล้บ้าน ถ้าเป็นบวก จะเข้าตามระบบ 3. แต่หากเป็นลบ จะแนะนำกักตัวและตรวจซ้ำในอีก 7 วัน แล้วกักตัวอีก 3 วัน จนครบ 10 วัน
โรคเหงือกและปริทันต์อักเสบคืออะไร จัดการอย่างไร
แนวปฏิบัต ผู้ติดเชื้อโควิด สิทธิบัตรทอง ต้องทำอย่างนี้
สิทธิบัตรทอง ติดเชื้อโควิด 19 ต้องทำยังไงบ้างนะ??
- มีอาการเข้าข่ายติดเชื้อโควิด 19
- ตรวจ ATK ขึ้น 1 ขีด ไม่พบเชื้อ ไม่ติดโควิด 19 แต่ถ้าเสี่ยงสูงต้องกักตัว 5+5 วัน
- ตรวจ ATK ขึ้น 2 ขีด พบเชื้อโควิด 19 รักษาตามแนวทางดังนี้
รักษาตามแนวทาง "เจอ แจก จบ" ของกระทรวงสาธารณสุข
- ไปที่หน่วยบริการประจำ หรือหน่วยบริการปฐมภูมิตามนโยบาย 30 บาทรักษาทุกที่
- หรือ โทร.ประสานร้านขายยาที่เข้าร่วมโครงการ ‘รับยา-แนะนำการใช้ยา’
ดูรายชื่อร้านยาที่
https://www.nhso.go.th/downloads/197
ดูตำแหน่ง “ร้านยาดูแลผู้ป่วยโควิดสีเขียว” บนแผนที่ดิจิทัลกับ NOSTRA Map ที่
https://map.nostramap.com/NostraMap/?layer/covid19pharmacy,feed/th
ร้านขายยารับเฉพาะผู้ป่วยสิทธิบัตรทองหรือสิทธิหลักประกันสุขภาพแห่งชาติเท่านั้น กักตัว 7+3 วัน
กรณีเป็นกลุ่มเสี่ยง กลุ่ม 608 หรือมีอาการรุนแรง
- รับการรักษาตามดุลพินิจแพทย์ ไม่เสียค่าใช้จ่าย (ไม่ว่าจะเป็นรักษาแบบผู้ป่วยใน หรือแพทย์สั่งให้รักษาที่บ้าน Home ward)
- เข้ารักษาที่หน่วยบริการประจำหรือหน่วยบริการปฐมภูมิตามนโยบาย 30 บาทรักษาทุกที่
- กลุ่ม 608 คือ ผู้สูงอายุมากกว่า 60 ปี, ผู้ป่วย 7 โรคเรื้อรัง โรคทางเดินหายใจเรื้อรัง, โรคหัวใจและหลอดเลือด, โรคไตวายเรื้อรัง, โรคหลอดเลือดสมอง, โรคอ้วน, โรคมะเร็ง และโรคเบาหวาน และหญิงตั้งครรภ์
เจ็บป่วยฉุกเฉินวิกฤติ สีแดง
- อาการ ได้แก่ หอบเหนื่อยหนักมาก พูดไม่เป็นประโยค แน่นหน้าอก หายใจเจ็บหน้าอก ปอดอักเสบรุนแรง อ่อนเพลีย ตอบสนองช้า ไม่รู้สึกตัว มีภาวะช็อก/โคม่า ซึมลง ไข้สูงกว่า 39 องศาเซลเซียส ค่าออกซิเจนต่ำกว่า 94
- ใช้สิทธิ UCEP เจ็บป่วยฉุกเฉินวิกฤติมีสิทธิทุกที่ เข้ารักษาโรงพยาบาลที่อยู่ใกล้ที่สุดได้โดยไม่เสียค่าใช้จ่าย
สอบถามเพิ่ม สายด่วน สปสช. 1330
ผู้ติดเชื้อโควิด -19 สิทธิบัตรทอง
ข่าวบิดเบือน ไม่ดื่มน้ำเปล่าติดต่อกันหลายปีจะทำให้กลายเป็นอัมพฤกษ์ LINK
ตามที่มีข้อความในสังคมออนไลน์เกี่ยวกับประเด็นเรื่องไม่ดื่มน้ำเปล่าติดต่อกันหลายปีจะทำให้กลายเป็นอัมพฤกษ์ ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสถาบันประสาทวิทยา กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลบิดเบือน
จากกรณีที่มีข้อความบนสังคมออนไลน์ระบุว่าไม่ดื่มน้ำเปล่าติดต่อกันหลายปีจะทำให้กลายเป็นอัมพฤกษ์ ทางสถาบันประสาทวิทยา กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่า การไม่ดื่มน้ำเปล่าติดต่อกันเป็นเวลานาน และดื่มน้ำอัดลมแทนน้ำเปล่า ซึ่งน้ำอัดลมมีน้ำตาลเป็นส่วนประกอบมีความหวานแล้วแต่เครื่องดื่ม อาจทำให้ระดับน้ำตาลในเลือดสูง บางรายที่มีแนวโน้มเป็นโรคเบาหวานหรือเป็นเบาหวานอยู่แล้วอาจทำให้ระดับน้ำตาลในเลือดสูงเป็นอันตรายต่อหลอดเลือดสมองและหลอดเลือดหัวใจได้
อย่างไรก็ตามการที่บอกว่าไม่ดื่มน้ำเปล่าติดต่อกันหลายปีจะทำให้เป็นอัมพฤกษ์อัมพาตนั้น อาจจะไม่ถูกต้องทั้งหมด ยังมีปัจจัยเสี่ยงอีกหลายอย่างที่ทำให้เป็นโรคอัมพฤกษ์อัมพาต เช่น มีโรคความดันโลหิตสูง โรคไขมันในเลือดสูง สูบบุหรี่ ดื่มสุรา โรคอ้วน การไม่ออกกำลังกาย อายุที่มากขึ้น เป็นต้น
บทสรุปของเรื่องนี้คือ : การไม่ดื่มน้ำเปล่าติดต่อกันหลายปีจะทำให้อัมพฤกษ์อัมพาตนั้น อาจจะไม่ถูกต้องทั้งหมด ยังมีปัจจัยเสี่ยงอีกหลายอย่างที่ทำให้เป็นโรคอัมพฤกษ์อัมพาต
ขั้นที่ 1 ลงชื่อผ่าน QR code หรือ แอดไลน์
KNT Health App แอปสุขภาพ โรงพยาบาลกล้วยน้ำไท LINK
KNT Health App แอปเดียวจบ..6 ฟีเจอร์ เด่น อาทิ
- รู้คิวรอและแจ้งเตือน
- ดูวันนัด / นัดหมายแพทย์ล่วงหน้า
- ดูประวัติการรักษา ผลตรวจสุขภาพ
- ระบบแจ้งเตือนให้ทานยา
- ประเมินสุขภาพเบื้องต้น
- ข่าวสาร แพ็กเกจ และโปรโมชั่นด้านสุขภาพ
โหลดได้ทั้ง
iOS และ
Andriod
Rama App LINK
Rama App เป็นแอปพลิเคชันที่อำนวยความสะดวกในการเข้ารับบริการให้กับประชาชน โดยผู้ใช้งานสามารถตรวจสอบข้อมูลเวชระเบียนของตนเอง เรียกดูและจัดการนัดหมายของตนเอง รวมถึง Check-in และขอทำนัดหมายใหม่ ไปจนถึงรับชำระค่าบริการผ่าน Mobile Application ได้ นอกจากนี้ยังรองรับการส่งไฟล์ภาพเอกสารเพื่อขอรับรองสิทธิล่วงหน้า สามารถตรวจสอบสถานะการรับยา แผนที่จุดให้บริการ ข้อมูลข่าวสารและข้อมูลเกี่ยวกับโรงพยาบาล เพื่อให้ผู้เข้ารับบริการได้รับประสบการณ์การบริการที่ดีมากยิ่งๆขึ้นไป
Rama App V.3 พร้อมให้ท่านอัปเดตแล้ววันนี้ โดยเพิ่มฟังก์ชันการทำงานที่ท่านสามารถใช้งานได้ ดังนี้
1.ขอเปลี่ยนนัดหมายจากตรวจที่โรงพยาบาลเป็นตรวจทางไกล หรือเปลี่ยนนัดหมายจากตรวจทางไกลเป็นตรวจที่โรงพยาบาลได้
2.ส่งภาพ/ไฟล์ ที่เกี่ยวข้องกับการรักษาผ่านนัดหมายได้
3.กรณีขอรับยาทางไปรษณีย์ ในการนัดตรวจทางไกล ท่านสามารถยืนยันที่อยู่หรือเปลี่ยนเบอร์โทรศัพท์ครั้งนั้นได้
4.ขอทำนัดหมายกับทางโรงพยาบาลได้ในทุกกรณี
5.ขอเติมยาทางไปรษณีย์ได้
6.รองรับระบบปฏิบัติการ iOS ตั้งแต่เวอร์ชัน 11.0 เป็นต้นไป
รองปลัดฯ เผยเจตนารมย์ของการใช้ทางการแพทย์
นพ.สุระ วิเศษศักดิ์ รองปลัดกระทรวงสาธารณสุข กล่าวว่า กระทรวงสาธารณสุขได้เริ่มนำกัญชามาใช้ทางการแพทย์ ตั้งแต่ปี 2562 โดยมีเจตนารมณ์ในการนำมาใช้ทางการแพทย์และการวิจัย ซึ่งที่ผ่านมาได้ดำเนินการเปิดคลินิกกัญชาทั่วประเทศ 938 แห่ง เป็นหน่วยงานในสังกัดกระทรวงสาธารณสุข 860 แห่ง และเอกชน 78 แห่งมีแพทย์ที่ผ่านการอบรม 7,500 คน และแพทย์แผนไทย 7,860 คนที่ผ่านการอบรม สามารถจ่ายยา ทั้งแผนไทยและปัจจุบันให้กับผู้ป่วย ผลงานที่ผ่านมาตั้งแต่ปี 2562 ถึงปัจจุบัน จ่ายยากัญชาไปแล้วกว่า 453,000 ครั้ง ดูแลรักษาผู้ป่วย 143,000 คน
นอกจากนี้ได้มีการนำกัญชาไปใช้ในการวิจัยตั้งแต่ ต้นน้ำ กลางน้ำ ปลายน้ำ เกี่ยวกับ การปลูก แปรรูป นำไปใช้ประโยชน์ และการบริหารจัดการมากกว่า 60 งานวิจัย หากผลการศึกษาออกมาเป็นที่น่าพอใจจะสามารถนำใช้กับผู้ป่วยต่อไป
พญ.สมจินตนา เอี่ยมสรรพางค์ ผู้อำนวยการแผนกฉุกเฉิน โรงพยาบาลกรุงเทพ กล่าวว่า สำหรับผู้ป่วยฉุกเฉินโดยเฉพาะผู้ที่มีภาวะหัวใจหยุดเต้นนั้น ทุกวินาทีมีค่าสำหรับผู้ป่วยมากๆ การรับรู้ภาวะฉุกเฉิน การขอความช่วยเหลือ และการช่วยชีวิตทันทีที่พบเหตุโดยประชาชนระหว่างรอบุคลากรการแพทย์นั้นเป็นปัจจัยที่สำคัญอย่างยิ่ง ในการเพิ่มโอกาสรอดชีวิตให้ผู้ป่วยได้ ในปัจจุบันมีหน่วยงานต่าง ๆ ได้ออกมาให้ความรู้แก่ประชาชนมากขึ้น แต่ก็ยังมีผู้ป่วยฉุกเฉินอีกเป็นจำนวนมากที่ไม่ได้รับการช่วยเหลืออย่างทันท่วงที และเสียโอกาสที่จะรอดชีวิต
โครงการ “BDMS อบรมการช่วยชีวิต” มีความมุ่งหวังที่จะเป็นส่วนหนึ่งในการ สร้างการรับรู้ และส่งเสริมให้ประชาชนสามารถช่วยชีวิตผู้ป่วยฉุกเฉินได้อย่างรวดเร็ว มีประสิทธิภาพ และปลอดภัย โดยทีมวิทยากรที่มีจิตอาสา และมีประสบการณ์ ในการให้ความรู้เกี่ยวกับการกู้ชีพระดับพื้นฐาน (BLS Instructor) มาบรรยาย และให้ประชาชนได้ฝึกปฏิบัติกับหุ่นในการปั๊มหัวใจ การช่วยคนที่สำลัก การใช้เครื่องกระตุกไฟฟ้าหัวใจอัตโนมัติ และการปฐมพยาบาลเบื้องต้น
โปรแกรมนวดนักกีฬา LINK
สำหรับนักกีฬา มีข้ันตอนบริการ เป็น ลำดับ คือ 1) วิเคราะห์สาเหตุ 2) นวดน้ำมันสปอร์ต 3) ยีดร่างกาย stretching
ค่าบริการ ครั้งละ 400 บาท
สอบถามโทร 053-917589
มุมประกันสังคมสมายล์ คอนเนอร์ LINK
โรงพยาบาลรวมชัยประชารักษ์ ได้จัดมุม "ประกันสังคมสมายล์ คอนเนอร์" เพื่อเป็นมุมพักผ่อนสำหรับผู้ประกันตนที่มารอรับบริการ มีจุดบริการเครื่องดื่ม และที่นั่งพัก เพื่อช่วยให้ผ่อนคลาย ระหว่างรอรับบริการหรือหลังการให้บริการ #ประกันสังคมสมายล์คอนเนอร์ #โรงพยาบาลรวมชัยประชารักษ์
Day 13 - Day 24
สังเกตปะว่า ช่วง 12 วันแรก ให้งดช่วงเช้า พอ 12 วันหลัง เริ่มให้งดช่วงบ่ายแทน หรืองดยาวมาถึงช่วงบ่ายเพิ่ม เปรียบเหมือนเริ่มวิ่งมาสักพัก ร่างกายเริ่มอึด ก็วิ่งได้นานขึ้น การอดโซเชียลก็เช่นกัน เมื่อเริ่มลดละได้บ้าง ก็เริ่มลดลดให้นานขึ้น ความอยากในโซเชียลก็ลดลง พอถึงซักวันที่ 16 ที่สามารถจะ "ไม่เล่นมือถือ ตอนกินข้าวทุกมื้อได้" นี่แหละเส้นชัยครึ่งสนามแรกละ เชื่อเลยว่ามาถึงช่วงนี้ จะรู้สึกร่างกายฟิต ชีวิตมีมิติอย่างใหม่ เหมือนมีพลังบางอย่างทำให้เราสดชื่น ไร้สิ่งผูกมัด ทีนี้พอเข้าช่วง 15 วันหลัง ที่จะยืดเวลาเล่นไปยาวๆ ถึงช่วงบ่ายๆ เย็นๆ บอกเลยว่า ความอยากเล่น มันลดลงไปเยอะแล้ว ที่เห็นว่างดหลัง บ่าย 3 บ้าง 5 โมงบ้าง หรืองด 1 วัน เอาเข้าจริงอาจจะกลายเป็นงดได้หลายวันรัวๆ เลยก็ได้ หรือถ้าจะเล่น ก็หยิบมาแตะๆ ปัดๆ เท่านั้น ใจมันปล่อยวางซะแล้ว บอกตัวเองได้ว่า ไม่จำเป็นต้องตามอะไรทุกเรื่อง ทุกวินาทีหรอก ไม่จำเป็นขนาดนั้น เมื่อนั้น โซเชียล ก็เหมือนแค่เครื่องคิดเลข ที่หยิบใช้เมื่อจำเป็นเท่านั้น เสร็จแล้วก็วาง (เปรียบเว่อไปมะเนี่ย)
ประเทศไทยเป็นหนึ่งในจุดหมายปลายทางที่นิยมของนักท่องเที่ยวหลากหลายกลุ่มมาอย่างยาวนาน ประกอบกับ BDMS เล็งเห็นศักยภาพในการเติบโตของตลาดธุรกิจ Wellness จึงได้ผนวกความร่วมมือระหว่าง BDMS Wellness Clinic ซึ่งมีความชำนาญการในด้านการดูแลสุขภาพ เวชศาสตร์ป้องกันและการแพทย์เฉพาะบุคคล กับ Celes Samui ที่ตั้งอยู่ท่ามกลางธรรมชาติและทะเลที่สวยงามของเกาะสมุย จ.สุราษฎร์ธานี เพื่อจัดทำโครงการ BDMS Wellness Clinic Retreat ตอบโจทย์นักท่องเที่ยวเชิงสุขภาพ ที่จะเข้ามาพักผ่อนในประเทศไทยและเลือกพำนักที่เกาะสมุย ไม่ว่าจะเป็นนักท่องเที่ยวกลุ่ม Silver age (ช่วงอายุ 50 ปีขึ้นไป) ที่มีทั้งความพร้อมและเวลาหรือนักท่องเที่ยวเชิงสุขภาพที่หลงใหลในความสวยงามของทะเลและธรรมชาติของสมุย ที่ต้องการดูแลร่างกาย ตรวจสุขภาพและทำกิจกรรมต่างๆ อาทิเช่น การออกกำลังกาย การทำสปา นวดไทยหรือรับประทานอาหารสุขภาพ
อันดับที่ 1 รพ.บำรุงราษฏร์ อินเตอร์ฯ 94.79%
รพ.บำรุงราษฏร์ อินเตอร์ฯ ครองอันดับที่ 1 ด้วยคะแนนประเมิน 94.7% ทิ้งห่างอันดับสอง พอสมควร สมศักดิ์ศรีการเป็นโรงพยาบาลเอกชนอันดับ 1 ของประเทศไทย ที่มีความสมบูรณ์พร้อมในทุกด้านการบริการสุขภาพ โรงพยาบาลที่มีระบบเทคโนโลยีและอุปกรณ์การแพทย์ที่ทันสมัยอยู่เสมอ ไม่แพ้ในยุโรปหรืออเมริกา ทำให้รพ.บำรุงราษฎร์จึงมีศักยภาพสูงและดีพอจะรอรับการบริการในกลุ่มผู้ใช้บริการจากนานาชาติได้อย่างต่อเนื่อง แข่งขันกับนานาประเทศในภูมิภาคได้ ซึ่งไม่เพียงแต่การมีเทคโนโลยีเพียงอย่างเดียว แต่หมายถึงการมีบุคลากรทางการแพทย์และบุคลากรเกี่ยวเนื่องในอุตสาหกรรม ที่มีความรู้ความเชี่ยวชาญในระดับสูงด้วยเช่นกัน ซึ่งเป็นปัจจัยสำคัญต่อการเป็นตัวเลือกที่่สำคัญต่อการใช้บริการของผู้ป่วย และจากศักยภาพอันยอดเยี่ยมนี้ ยังช่วยยกระดับภาพรวมการบริการสุขภาพของประเทศไทย ไปสู่การยอมรับในระดับสากลมาขึ้นอย่างไม่อาจปฏิเสธได้
- HR Officer Chiang Rai Human Resource
- Cultivation Managers At Narong, BKK / Chiang Rai Cultivation
- Growers At Narong, BKK / Chiang Rai Cultivation
- Senior Finance & Accounting Manager Sukhumvit 36 (BTS Thonglor) Accounting
- Senior Accounting Officer Sukhumvit 36 (BTS Thonglor) Accounting
มูลนิธิศูนย์ข้อมูลจราจรอัจฉริยะไทย Thai Traffic Foundation (iTIC) LINK
“มูลนิธิศูนย์ข้อมูลจราจรอัจฉริยะไทย” หรือ “Intelligent Traffic Information Center” (iTIC) เป็นองค์กรไม่แสวงหากำไร ได้รับอนุมัติการจดทะเบียนจากกระทรวงมหาดไทย เมื่อวันที่ 14 มิถุนายน พ.ศ.2553 ด้วยเงินทุนจดทะเบียน 5 แสนบาท โดยได้รับการสนับสนุนจาก “สมาคมระบบขนส่งและจราจรอัจฉริยะไทย” หรือ “Thai ITS Association”
มูลนิธิฯ ทำหน้าที่เป็นศูนย์รวมข้อมูลจราจรจากภาครัฐและภาคเอกชน เพื่อพัฒนาคุณภาพข้อมูลจราจรให้มีความถูกต้อง ทันต่อสถานการณ์มากยิ่งขึ้น เพื่อช่วยลดปัญหาจราจร เพิ่มความปลอดภัยบนท้องถนน ตลอดจนพัฒนาประสิทธิภาพระบบโลจิสติกส์ของประเทศ โดยมูลนิธิฯ จะทำหน้าที่เป็นองค์กรที่มุ่งสร้างประโยชน์ให้กับสังคมโดยมิได้หวังผล กำไร ภายใต้ความร่วมมือของผู้มีส่วนเกี่ยวข้องในภาคส่วนต่างๆ
มูลนิธิฯ ได้เชิญบุคลากรที่เกี่ยวข้องในระบบขนส่งและจราจรอัจฉริยะไทย(ITS) เข้ามาช่วยบริหารภายใต้วัตถุประสงค์ของมูลนิธิฯ โดยนำข้อมูลจราจรสาธารณะจากภาครัฐ (CCTV) เข้ามาผสมกับข้อมูลจาก Probe ของภาคเอกชน ซึ่งได้แก่ Taxi Probe, Bus Probe, Logistic Probe และ Mobile Phone Probe แล้วประมวลผลเพื่อสร้างมูลค่าเพิ่ม ก่อนนำไปเผยแพร่ให้เกิดประโยชน์ต่อสาธารณะ
การจัดหาทุนของมูลนิธิฯ มาจากการบริจาค และการสนับสนุนจากหน่วยงานต่างๆ ทั้งภาครัฐและเอกชน เพื่อใช้ในการบริหารข้อมูลจราจรสู่สาธารณะ ตลอดจนพัฒนาปรับปรุงการให้บริการ โดยจะไม่มีการจัดสรร หรือแบ่งปันผลกำไรให้กับผู้เกี่ยวข้องแต่อย่างใด
วัตถุประสงค์ของมูลนิธิศูนย์ข้อมูลจราจรอัจฉริยะไทย
เป็นศูนย์รวมของข้อมูลจราจรที่นำไปเผยแพร่ให้กับสาธารณะเพื่อประโยชน์สูงสุด ในการที่จะลดปัญหาจราจร และเพิ่มความปลอดภัยบนท้องถนน
ประโยชน์ต่อสังคมไทย
เพื่อให้เกิดความร่วมมือระหว่างภาครัฐและภาคเอกชนในการนำข้อมูลจราจรมาเผย แพร่ให้ประชาชนนำไปใช้ประโยชน์ในการเดินทาง และการขนส่งอย่างมีประสิทธิภาพ
เพื่อคลี่คลายปัญหาจราจร และเพิ่มความสะดวกสบายในการเดินทาง
เพื่อส่งเสริมความปลอดภัยบนท้องถนน
9 ประเภทคลินิกและผู้ประกอบโรคศิลปะต้องมี
คลินิกหมายถึง สถานพยาบาลประเภทไม่รับผู้ป่วยไว้ค้างคืน ซึ่งตามกฎกระทรวง พ.ศ.2558 แบ่งไว้ 9 ลักษณะ โดยแสดงแผ่นป้ายสีขาว ตัวอักษรชื่อ และ เลขที่ใบอนุญาต 11 หลัก ตามที่กระทรวงกำหนด
1. คลินิกเวชกรรม
2. คลินิกทันตกรรม
3. คลินิการพยาบาลและการผดุงครรภ์
4. คลินิกกายภาพบำบัด
5. คลินิกเทคนิคการแพทย์
6. คลินิกการแพทย์แผนไทย คลินิกการแพทย์แผนไทยประยุกต์
7. คลินิกประกอบโรคศิลปะ 7 สาขา ได้แก่
กิจกรรมบำบัด
แก้ไขความผิดปกติของการสื่อความหมาย
เทคโนโลยีหัวใจและทรวงอก
รังสีเทคนิค
จิตวิทยาคลินิก
กายอุปกรณ์
การแพทย์แผนจีน
8. คลินิกเฉพาะทางด้าน เวชกรรม ทันตกรรม การพยาบาลและการผดุงครรภ์
9. คลินิกสหคลินิก คือ คลินิกที่จัดให้มีการประกอบวิชาชีพตั้งแต่ 2 ลักษณะขึ้นไป
ถนนคนเดินคลองโอ่งอ่าง 12-14 ส.ค.
ถนนคนเดินคลองโอ่งอ่าง 12-14 ส.ค. บ่ายสองถึง4ทุ่ม บรรยากาศชิลๆ ชิม ช็อป เพลินกับร้านค้าหลากหลาย ดนตรี ศิลปะ ตั้งแต่ช่วง
สะพานดำรงสถิต (ถนนเจริญกรุง) ยาวไปถึง
สะพานบพิตรพิมุข (ราชมงคลบพิตรพิมุข) เลยทีเดียว มาที่เดียวเที่ยวได้เพลินทั้งคืน
ค้นหาหน่วยบริการออกใบรับรองสุขภาพดิจิทัล
ค้นหาหน่วยบริการออกใบรับรองสุขภาพดิจิทัลบนหมอพร้อม ได้แล้ววันนี้
รองรับการออกใบรับรองสุขภาพดิจิทัล อาทิ
????ใบรับรองแพทย์สำหรับตรวจสุขภาพ
????ใบแสดงความเห็นแพทย์
????ใบรับรองแพทย์สำหรับใบอนุญาตขับรถ
????ใบรับรองแพทย์กรณีผู้ติดเชื้อโควิด 19
????ใบรับรองการตรวจหาเชื้อโควิด 19 ด้วย ATK และ RT-PCR
คันนายาว ลุยตรวจสถานประกอบการเข้มความปลอดภัยด้านอัคคีภัย LINK
วันที่ 9 สิงหาคม 2565 นายกรณิศ บัวจันทร์ ผู้อำนวยการเขต คันนายาว พร้อมด้วยนายสมชาย ธรรมวิโมกข์ หัวหน้าฝ่ายปกครอง นางสาวสุธาสินี สีหนาท หัวหน้าฝ่ายโยธา นางสาวนิรชร เทพหนู หัวหน้าฝ่ายสิ่งแวดล้อมและสุขาภิบาล เจ้าหน้าที่ฝ่ายเทศกิจ เจ้าหน้าที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เจ้าหน้าที่ฝ่ายโยธา เจ้าหน้าที่ป้องกันและบรรเทาสาธารณภัย สถานีดับเพลิงและกู้ภัยบางชัน สำนักป้องกันและบรรเทาสาธารณภัย กรุงเทพมหานคร รวมทั้งเจ้าหน้าที่ตำรวจสถานีตำรวจนครบาลคันนายาว บางชัน และบึงกุ่ม
โดยลงพื้นที่ตรวจสถานบันเทิงร้านตรวจสถานประกอบการตามคำสั่ง คสช. จำนวน 7 เเห่ง ได้แก่ ร้านดริ้งกลิ้งบาร์ ร้านดิออฟฟิตสปอร์ตบาร์ ร้านพรรคพวกอาหารใต้ซีฟู้ด ร้านครัวหนังตะลุง ร้านตามใจปรารถนา ร้านบึงนวมินทร์ และร้าน 95 เทอเรส ซึ่งเป็นสถานประกอบการที่เปิดบริการในลักษณะที่คล้ายกับสถานบริการ ทั้งนี้ เพื่อตรวจแนะนำเรื่องการป้องกันอัคคีภัยในสถานบริการ ตรวจเฝ้าระวังการปฎิบัติตามคำสั่งหัวหน้าคณะรักษาความสงบแห่งชาติที่ 22 / 2558 เรื่องมาตรการในการป้องกันและแก้ไขปัญหาการแข่งรถยนต์และรถจักรยานยนต์ในทางและควบคุมสถานบริการหรือสถานประกอบการที่เปิดให้บริการในลักษณะที่คล้ายกับสถานบริการ รวมทั้งตรวจสอบการตรวจตามมาตรการป้องกันการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 ตามที่ราชการกำหนดรวมถึงกฎหมายอื่น ที่เกี่ยวข้องอีกด้วย
คลินิกส่งเสริมสุขภาพเด็กดี ศบส1 สะพานมอญ
คลินิกฝากครรภ์ ศบส1 สะพานมอญ
ใช้สิทธิประกันสังคมตรวจสุขภาพประจำปี ฟรี กับโรงพยาบาลลำพูนใกล้หมอ LINK
อย่ารอช้า ใช้สิทธิประกันสังคมตรวจสุขภาพประจำปี ฟรี
- สามารถตรวจได้ตั้งแต่อายุ 15 ปีขึ้นไป
- ผู้ประกันตนสามารถใช้สิทธิโดยไม่ต้องเสียค่าใช้จ่าย
- ผู้ประกันตนที่ไม่ใช่ประกันสังคมโรงพยาบาลเชียงใหม่ใกล้หมอก็สามารถใช้สิทธิเข้ารับบริการได้
- ใช้เพียงบัตรประชาชนใบเดียวเท่านั้น
เปิดบริการทุกวัน เวลา 08.00 -17.00 น.
ติดต่อสอบถามข้อมูลได้ที่ 053-581998 , 065-4598546
ประกันสังคมอุ่นใจ ติดโควิดต้องการกักตัว ผู้ป่วยติดเชื้อโควิด19 โรงพยาบาลลานนา3
ประกันสังคมอุ่นใจ ติดโควิดต้องการกักตัว ผู้ป่วยติดเชื้อโควิด19 โรงพยาบาลลานนา3
#สิทธิประกันสังคมทุกโรงพยาบาล ติดเชื้อโควิด-19 #ไม่สะดวกกักตัวที่บ้าน โรงพยาบาลลานนา มีบริการห้องพักสำหรับผู้ป่วยติดเชื้อโควิด-19 หากตรวจ ATK ด้วยตนเอง ขึ้น 2 ขีดแล้ว #รีบเข้ามารายงานตัวเพื่อพบแพทย์ ณ คลินิก ARI #โรงพยาบาลลานนา3 #ประกันสังคมทุกโรงพยาบาลใช้สิทธิได้
ต้องมาพบแพทย์ และตรวจยืนยันการติดเชื้อ ด้วยวิธี PCR ก่อนเข้าพักกักตัวทุกราย
ตรวจ PCR แบบปกติ รู้ผลภายใน 24 ชั่วโมง #ไม่มีค่าใช้จ่าย
ตรวจ PCR แบบด่วน รู้ผลภายใน 6 ชั่วโมง ราคา 2,500 บาท
✅พักห้องพักเดี่ยว 7 วัน ราคา 14,000 บาท
✅ห้องพักคู่ 7 วัน คนแรก ราคา 14,000 บาท /คนที่ 2 ราคา 7,000 บาท
หมายเหตุ
* ราคานี้ รวมค่าตรวจเอกซเรย์ และยารักษาโรคโควิด-19 ตามอาการ
** ไม่รวมค่าใช้จ่ายที่อาจเกิดจากโรคประจำตัวเดิมหรือการรักษาโรคแทรกซ้อน ขณะรักษาตัวด้วยโรคโควิด-19
*** ราคาและเงื่อนไข อาจมีการเปลี่ยนแปลง ตามประกาศสำนักงานประกันสังคม
สอบถามข้อมูลเพิ่มเติม เรื่องห้องพักกักตัวผู้ป่วยโควิด #สิทธิประกันสังคม : ติดต่อ #แผนกลูกค้าสัมพันธ์ โทร.134-777 ต่อ 1174,1194
ธนาคารเลือด โรงพยาบาลภูมิพลอดุลยเดช พอ. เชิญชวนบริจาคโลหิต LINK
ขอเชิญพสกนิกรทุกท่านร่วมบริจาคโลหิต ในโครงการ "90 พรรษา 90 ล้านซีซี " เพื่อถวายเป็นราชสดุดี 90 พรรษา สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง สภานายิกาสภากาชาดไทย เนื่องในโอกาสทรงเจริญพระชนมพรรษา 90 พรรษา พิเศษ‼️ สำหรับทุกท่านที่บริจาคโลหิต วันที่ 8-11 สิงหาคม 2565 จะได้รับ "เสื้อยืด 90 พรรษา 90 ล้านซีซี" ติดต่อบริจาคโลหิตได้ที่...กองบริการโลหิต อาคารศูนย์มะเร็ง ชั้น 3 สอบถามเพิ่มเติม 0 2534 7838
โครงข่าย-เครือข่าย รพ.กล้วยน้ำไท LINK
ผู้ประกันตน ใช้บริการที่ไหนได้บ้าง
ผู้ประกันตนกับโรงพยาบาลกล้วยน้ำไทสามารถใช้สิทธิ์ประกันสังคมเข้ารับการรักษาได้ตามสิทธิ์ที่มี ในสถานพยาบาลโครงข่ายกล้วยน้ำไท และเครือข่าย ดังนี้
โรงพยาบาลกล้วยน้ำไท 1 (ถนนพระราม 4)
โรงพยาบาลผู้สูงอายุขนาดกลาง กล้วยน้ำไท 2
คลินิกเวชกรรมกล้วยน้ำไท, เคคลินิกเวชกรรม และเคสหคลินิก ทั้ง 30 สาขา
เครือข่ายทั้ง 8 แห่ง
อีก 6 สาขาที่กำลังจะเปิดเร็วๆ นี้
คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดกระบัง 50
คลินิกเวชกรรมกล้วยน้ำไท สาขาศรีนครินทร์
คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดพร้าว 101
คลินิกเวชกรรมกล้วยน้ำไท สาขาเลียบคลองสอง
คลินิกเวชกรรมกล้วยน้ำไท สาขาหทัยราษฎร์
คลินิกเวชกรรมกล้วยน้ำไท สาขาตลาดมหาสิน
รายชื่อสถานพยาบาลเครือข่าย โรงพยาบาลนวมินทร์ประจำปี 2565
เข้าสู่ระบบ ระบบสารสนเทศการสร้างหลักประกันสุขภาพ (สำหรับหน่วยบริการ)
เข้าระบบด้วยชุดข้อมูลที่สปสช.จัดให้แต่ละหน่วยงาน
ผศ.ดร.เอนก เจริญภักดี รองอธิการบดีฝ่ายกิจการพิเศษ มทร.อีสาน กล่าวว่า โครงการศึกษาวิจัยการปลูกกัญชาเพื่อใช้ประโยชน์ทางการแพทย์ที่ได้ดำเนินการมาตั้งแต่ปี 2562 ในพื้นที่ของมหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสกลนคร ซึ่งเป็นพื้นที่ต้นแบบและเป็นแหล่งรวบรวมองค์ความรู้ในการปลูกและดูแลพืชกัญชาที่ได้รับการยอมรับและเป็นศูนย์เรียนรู้ที่สำคัญที่ให้บริการกับหน่วยงานและผู้ที่สนใจจากทั่วประเทศ
โครงการดำเนินการภายใต้กรอบพันธกิจหลักของมหาวิทยาลัยฯ ที่เป็นสถาบันการศึกษาที่จัดการเรียนการสอนและให้บริการทางวิชาการตลอดจนทักษะวิชาชีพต่าง ๆ ให้กับนักศึกษารวมถึงองค์กร ชุมชน เกษตรกร ผู้ประกอบการและผู้ที่สนใจทั่วไปที่ต้องการความรู้ ทักษะ และนวัตกรรมต่างๆ ที่จะนำไปใช้ประกอบอาชีพและสร้างรายได้ให้กับองค์กร หน่วยงาน ชุมชน และครอบครัว
มหาวิทยาลัยฯ หวังให้เกิดการนำองค์ความรู้ทางด้านเกษตรและเทคโนโลยีมาใช้ในการขับเคลื่อนการพัฒนาสมุนไพรและพืชเศรษฐกิจใหม่โดยเฉพาะกัญชา ซึ่งถือเป็นพืชเศรษฐกิจที่สำคัญที่จะสามารถสร้างรายได้และเพิ่มมูลค่าเศรษฐกิจให้กับเกษตรกร ผู้ประกอบการ และประเทศได้ อีกทั้งยังเป็นการขยายโอกาสให้ประชาชนในพื้นที่ภาคอีสานได้รับความรู้ความเข้าใจและสร้างทักษะในการปลูกและการดูแลรักษาพืชกัญชา และการนำไปใช้ประโยชน์ทั้งในทางการแพทย์และการรักษา รวมถึงเพื่อดูแลสุขภาพ และการใช้ประโยชน์ด้านอื่นได้อย่างเต็มตามประสิทธิภาพและคุณประโยชน์ของพืชกัญชา และรองรับการเป็นแหล่งผลิตพืชกัญชาคุณภาพของภาคอีสาน อันจะนำมาซึ่งรายได้และมูลค่าเพิ่มทางเศรษฐกิจให้กับชุมชนและประเทศได้อย่างยั่งยืนต่อไปในอนาคต
ศบค.ขยายเวลาพำนักของชาวต่างชาติ เป็นไม่เกิน 45 วัน
ศบค. ขยายเวลาพำนักของชาวต่างชาติเดินทางเข้าไทย
1. ผู้ได้ยกเว้นการตรวจลงตราเข้าประเทศ จากไม่เกิน 30 วัน เป็นไม่เกิน 45 วัน
2. ผู้ได้รับ Visa on Arrival จากไม่เกิน 15 วัน เป็นไม่เกิน 30 วัน
เริ่ม 1 ต.ค. 65 - 31 มี.ค. 66
ศบค.ขยายระยะเวลาการพำนักของผู้เดินทางเข้าราชอาณาจักร
เพื่อฟื้นฟูเศรษฐกิจ เพิ่มรายได้ทางการท่องเที่ยว โดยกระตุ้นให้เกิดการเดินทาง และเพิ่มค่าใช้จ่ายของนักท่องเที่ยว ดังนี้
1. ขยายระยะเวลาพำนักสำหรับผู้ได้รับการยกเว้นการตรวจลงตราในการเข้าประเทศ (ผ.30)
ทั้งที่ไทยให้แต่ฝ่ายเดียว และที่มีความตกลงระหว่างกัน จากไม่เกิน 30 วัน เป็นไม่เกิน 45 วัน (ผ.45)
2. ขยายระยะเวลาพำนักสำหรับผู้ได้รับ Visa on Arrival จากไม่เกิน 15 วันเป็นไม่เกิน 30 วัน
การขยายระยะเวลาพำนักของผู้เดินทางเข้าราชอาณาจักรในข้อข้างต้นให้มีผลตั้งแต่ 1 ตุลาคม 2565 - 31 มีนาคม 2566 โดยมอบหมาย มท. กต. สตม. และหน่วยงานที่เกี่ยวข้องพิจารณาดำเนินการตามมติ ศบค. ต่อไป
RakCann Cafe รักกัญ คาเฟ่ ทาวน์อินทาวน์
ร้านกว้างขวางกับสเปซสุดสบาย ตกแต่งบรรยากาศขรึมๆ หล่อๆ แต่อบอุ่น ที่น่าสนใจคือ เมนูน่ารักน่าชิม ไล่ไปตั้งแต่ คอนเฟลคคุ๊กกี้กัญชา ช็อกร๊อกกี้โรด บราวนี่กัญชาช็อคสายเขียวน่ากัดสุดๆ หรือบราวนี่ไวท์ช็อค+อัลมอนด์ ก็ไม่เลว แอปเปิ้ลเขียวผสมกัญสกัดเข้มข้นปั่น แอปเปิล มินท์โซดา ผสมกัญสกัดเข้มข้น มะม่วงโซดา ผสมกัญสกัดเข้มข้น วุ้นกัญแท้จากน้ำสกัดกัญชาเข้มข้นผสมใบกัญปั่น พิมพ์สวยลายละเอียด น่าเก็บมากกว่าน่ากิน เสริฟพร้อมชากัญ หรือ กาแฟอเมริกาโน่ หรือคาปูชิโน่กัญ อาราบิก้าผสมกัญสกัดเข้มข้น เมนูเค้าเยอะไปหมด
ทาวน์อินทาวน์ เลียบทางด่วนรามอินทรา ตรงข้ามโครงการเดอะซีน อยู่ชั้น 2 ของร้านอาหาร จกเตี๋ยวหมู โทรศัพท์: 099-2195445
ร้านเขียวไข่กา l Kiew Kai Ka ซอยนาคนิวาส
ร้านอาหารชั้นนำร้านแรกๆ ที่นำกัญชามาทำอาหารหลายสำรับ แนะนำลูกค้าเรียกว่าตื่นเต้นกันไม่น้อย ล่าสุดเปิดตัว "ใบกัญชาทอดโรยผงนัว" น่าเคี้ยวเหมือนเดิม ส่วนเมนูอื่น มี่ยงกระพงกรอบกัญชาหวาน,แกงเขียวหวาน (เจี๊ยบ), ใบเหลียงผัดไข่ใบกัญชา, ไข่เจียว อารมณ์ดี, กุ้งทอดสะเดาน้ำปลาหวาน (เจี๊ยบ), ข้าวยำบูดูใบกัญชา,ต้มไก่บ้านมะขามอ่อนใบกัญชา และ ยำใบกัญชากรอบ ยังคงอยู่ครบครัน
มี 3 สาขา แล้ว คือ ซอยนาคนิวาส ลาซาลและเชียงใหม่
สังคมสงเคราะห์
เนื่องจากนักสังคมสงเคราะห์ มีหน้าที่ให้การสงเคราะห์ แก่ผู้รับบริการแก้ไขปัญหาสังคม และพัฒนาสังคม ฉะนั้น จึงมีวิธีการปฏิบัติงาน เพื่อให้บรรลุถึงปรัชญาที่ว่า ช่วยให้เขาสามารถช่วยตนเองได้ ด้วยวิธีทำงานกับเขา มิใช่ทำงานเพื่อเขา เพื่อที่เขาจะได้มีส่วนร่วมในการพัฒนาประเทศชาติได้
เวลาทำการและให้คำปรึกษา
09.00 - 16.00
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สัตว์เลี้ยง
การฉีดวัคซีนต้องทำเป็นประจำทุกปี
มีเจ้าของลูกสุนัขหลายคนเชื่อว่าถ้าลูกสุนัขได้รับวัคซีนไปตั้งแต่เล็กตามกำหนดที่หมอบอกแล้ว ภูมิคุ้มกันนี้จะอยู่ไปตลอดชีวิต แต่จริง ๆ แล้วไม่ใช่อย่างนั้น เราต้องฉีดวัคซีนกระตุ้นอย่างสม่ำเสมอ หากไม่มีการฉีดวัคซีนกระตุ้นเป็นประจำทุกปีแล้ว สุนัขจะไม่มีภูมิคุ้มกันที่จะป้องกันโรค ร้ายแรงบางชนิดได้ และมักพบว่าสัตว์เลี้ยงที่เสียชีวิตด้วยสาเหตุจากโรคดังกล่าวมีอยู่เป็นประจำ ซึ่งเป็นเรื่องน่าเศร้าเพราะโรคเหล่านี้เราสามารถ ป้องกันได้โดยง่ายเพียงแค่การฉีดวัคซีนประจำปี
โรคอะไรบ้างที่เราสามารถใช้วัคซีนป้องกันได้
ในปัจจุบันโรคติดต่อที่สำคัญในสุนัข คือ โรคลำไส้อักเสบในสุนัข โรคไข้หัดสุนัข โรคตับอักเสบติดต่อในสุนัข โรคเลปโตสไปโรซีสโรคไข้หวัดในสุนัข และ โรคพิษสุนัขบ้า ทุกโรคดังกล่าว สามารถป้องกันได้โดยการให้วัคซีน
วันและเวลาให้บริการ
ทุกวันศุกร์ เวลา 13.00 - 16.00 น.
คลินิกวางแผนครอบครัว
1.ให้ความรู้เรื่องโรคมะเร็งเต้านมโดยสร้างแรงจูงใจในการตรวจเต้านม
2.สอนและฝึกทักษะการตรวจเต้านมด้วยตนเองโดยใช้โมเดลการตรวจเต้านมประเมินทักษะการตรวจเต้านมด้วยตนเองและแบบประเมินแก่ผู้มารับบริการทุกราย
3.แจกแผ่นพับการตรวจเต้านมด้วยตนเองและแบบบันทึกการตรวจเต้านมด้วยตนเองให้ผู้มารับบริการนำกลับไปใช้บันทึกการตรวจเต้านมด้วยตนเอง
4.ติดตามผลการปฏิบัติการตรวจเต้านมด้วยตนเองในการมารับบริการครั้งต่อไป
5.ให้ผู้รับบริการสาธิตการตรวจเต้านมด้วยตนเองทุกครั้งที่มารับบริการ
วันและเวลาให้บริการ
ทุกวันพุธ เวลา 13.00 - 16.00 น.
คลินิกสุภาพสตรีวัยทอง
คลินิกวัยทองได้ถูกจัดตั้งขึ้นมาเพื่อส่งเสริมให้ผู้สูงอายุมีชีวิตที่เป็นสุขทั้งกายและใจ เพราะในวัยสูงอายุจะมีการเปลี่ยนแปลงทั้งทางด้านร่างกายและจิตใจ ซึ่งอาจส่งผงกระทบถึงสุขภาพกาย สุขภาพใจ รวมทั้งการใช้ชีวิตประจำวันด้วย
คลินิกวัยทองนี้จะให้บริการกับผู้สูงอายุ ไม่ว่าจะเป็นบริการตรวจสุขภาพทั่วไปและการตรวจรักษาด้านจิตเวช การรักษาด้านสุขภาพทั่วไป ได้แก่ การตรวจวัดความดันโลหิต วัดการเต้นของหัวใจ ตรวจหาน้ำตาลในเลือด หรือปัสสาวะ ตรวจนับเม็ดเลือด ตรวจการทำงานของไต ตรวจหาโรคเก๊าท์ ตรวจไขมัน ตรวจการทำงานของตับ และให้คำปรึกษาแนะนำในการดูแลด้านสุขภาพ ด้านสุขภาพจิตและจิตเวชนั้น มีการให้บริการตรวจความจำ การหลงลืม ตรวจภาวะความคิด ความวิตกกังวลและภาวะซึมเศร้า ตรวจภาวะการพูด และภาวะทั่วไปในเรื่องวัน เวลา สถานที่ด้วย
วันและเวลาให้บริการ
ทุกวันพุธ เวลา 13.00 - 16.00 น.
คลินิกสุขภาพเด็กดี
1.ส่งเสริมการให้วัคซีนในคลินิกสุขภาพเด็กดีตั้งแต่อายุแรกเกิด – 5 ปีตามแผนการให้วัคซีนอย่างครบถ้วน
2.คัดกรองเด็กที่มีความผิดปกติด้านพัฒนาการ
3.ติดตามและเฝ้าระวังเด็กที่สงสัยพัฒนาการล่าช้าที่ไม่มาตรวจรักษาอย่างต่อเนื่อง
4.เด็กที่มารับบริการได้รับการประเมินและส่งเสริมภาวะโภชนาการตามวัย
วันและเวลาให้บริการ
ทุกวันอังคาร และวันพฤหัสบดี เวลา 13.00 - 16.00 น.
Ms. Prompohn Supataravanich, Associate Director - Market Research & Strategy at Hakuhodo Institute of Life and Living ASEAN (Thailand), suggested the following actions for brands:
Brands should launch campaigns to encourage consumers to be the “Best Version of Me” for the happiness of themselves and families.
The desire to shop and level of happiness has never been higher. Brands can offer consumers opportunities to shop in a way that allows them to make the most of life, improving their physical image with clothing and cosmetics or upskilling through learning and buying work equipment.
They can also launch campaigns to celebrate the ‘return to the world’ during Mother’s Day, birthdays, or long holidays. These opportunities will allow consumers to go out and travel, work, and find ways to put happiness at the forefront.
Be honest and transparent with consumers, especially during hard times
Although prices are soaring, essentials remain necessary, and consumers inevitably face higher expenses. Brands should communicate clearly to customers if they need to increase prices and show that they have made all reasonable attempts to maintain the original prices.
เครื่องผ่าตัดสมองและเส้นประสาท
ข้อมูลประชากรกลางปี LINK
กองยุทธศาสตร์และแผนงาน สำนักงานปลัดกระทรวงสาธารณสุข ได้รวบรวม วิเคราะห์ข้อมูลประชากรตามประกาศฯ ของสำนักบริหารการทะเบียน กรมการปกครอง กระทรวงมหาดไทย และจัดทำเอกสาร ข้อมูลประชากรกลางปี ในรูปของ excel file เผยแพร่บนเว็บไซต์กองยุทธศาสตร์และแผนงาน สำนักงานปลัดกระทรวงสาธารณสุข (https://bps.moph.go.th/)
ที่มา: กองยุทธศาสตร์และแผนงาน สำนักงานปลัดกระทรวงสาธารณสุข
1.โควิด-19 กับการทำงานที่บ้าน (work from home) และผลกระทบ
แม้ว่าการทำงานที่บ้านจะส่งผลดีหลายประการ เช่น ลดความเสี่ยงในการติดเชื้อ และเพิ่มประสิทธิภาพการทำงาน แต่ก็อาจส่งผลกระทบด้านสุขภาวะต่อคนจำนวนไม่น้อย โดนเฉพาะความเครียดและภาวะซึมเศร้า
โรงพยาบาลกลาง ศูนย์บริการคนพิการแบบเบ็ดเสร็จ (One Stop Service) LINK
ศูนย์บริการคนพิการแบบเบ็ดเสร็จ (One Stop Service) โรงพยาบาลกลาง รับทำบัตรคนพิการ
วันจันทร์-ศุกร์ เว้นวันหยุดราชการ
เวลา 08.00-16.00 น.
ณ ศูนย์บริการคนพิการแบบเบ็ดเสร็จ (One Stop Service) ชั้น 1 อาคารอนุสรณ์ 100 ปี โรงพยาบาลกลาง
ติดต่อสอบถาม งานสังคมสงเคราะห์
กลุ่มงานเวชศาสตร์ชุมชน โรงพยาบาลกลาง
โทร 0-2220-8000 ต่อ 10809 / 10810
รถทันตกรรมเคลื่อนที่
รถทันตกรรมเคลื่อนที่ฟันดีมีสุข กองทันตสาธารสุข ให้บริการทันตกรรมเบื้องต้น ตรวจฟัน ขูดหินปูน ถอนฟัน พร้อมทั้งให้ทันตสุขศึกษาไปพร้อมกัน และไม่เพียงแต่รถทันตกรรมทั่วไป แต่ยังมีรถทันตกรรมเคลื่อนที่เฉพาะสำหรับผู้สูงอายุ ผู้พิการที่ใช้เก้าอี้รถเข็น ให้บริการอีกด้วย
กัญชาทางการแพทย์ - พญ.เชิดชู อริยศรีวัฒนา LINK
กัญชาเป็นพืชที่มีผลออกฤทธิ์ต่อจิตประสาท และใช้เป็นยารักษาโรคมาตั้งแต่ยุคโบราณหลายพันปีมาแล้วก่อนการเกิดศาสนา ซึ่งมีหลักฐานทางโบราณคดีที่เชื่อว่ามนุษย์ในสมัยนั้นใช้กัญชาเพื่อเหตุผลทางจิตวิญญาณ จากการขุดค้นพบโครงกระดูกมนุษย์อายุราว 10,000 ปี สันนิษฐานว่ามนุษย์ในยุคนั้นใช้กัญชาเผาไฟที่ด้านในสุดของถ้ำ เพื่อสูดดมควันจากการเผาไหม้ของกัญชา นอกจากนั้นยังมีหลักฐานทางประวัติศาสตร์ที่บ่งชี้ว่ามีการใช้กัญชาเพื่อประโยชน์ในทางการแพทย์ ทั้งจากประเทศอังกฤษที่มีหนังสือกล่าวถึงการใช้กัญชาในการรักษาโรคซึมเศร้า รักษาอาการปวดประจำเดือน
ในปี พ.ศ. 2517 มีรายงานจากรัฐเวอร์จีเนีย สหรัฐอเมริกา ว่าในกัญชาที่มีการแปรรูปแบบความเข้มข้นสูงจะโจมตีเซลล์มะเร็งในร่างกายและยังคงรักษาเซลล์ที่ดีไว้ โดยทีมวิจัยสรุปว่ามันอาจเป็นการรักษาที่ถูกต้องสำหรับมะเร็ง เพราะมันทำงานได้อย่างรวดเร็วและทำงานได้เป็นอย่างดี
การใช้ยาตามตำรับยาการแพทย์แผนไทย
สถาบันการแพทย์แผนไทย กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ได้เผยแพร่ข้อมูลตำรับยาในทางการแพทย์แผนไทย 16 ตำรับ ตัวอย่างเช่น
- ตำรับยาศุขไสยาสน์ มีที่มาจากคัมภีร์ธาตุพระนารายณ์ ทั้งนี้พระนารายณ์มหาราชเป็นกษัตริย์ลำดับที่ 27 ในสมัยกรุงศรีอยุธยา
ข้อบ่งใช้ ช่วยให้นอนหลับ เจริญอาหาร ฟื้นฟูกำลังผู้ป่วยเรื้อรัง
ข้อห้ามใช้ ห้ามใช้ในสตรีมีครรภ์ ผู้ที่ไข้สูง
- ยาน้ำมันสนั่นไตรภพ มีที่มาจากตำรายาจารึกในวัดพระเชตุพนวิมลมังคลาราม
ข้อบ่งใช้ แก้กษัยเหล็ก ลดอาการแทรกซ้อนในผู้ป่วยมะเร็งรังไข่ มะเร็งมดลูก มะเร็งตับในระยะเริ่มต้น
ข้อห้ามใช้ ห้ามใช้ในผู้ป่วยโรคตับระยะสุดท้ายที่มีภาวะเส้นเลือดแตกเป็นใยแมงมุม ห้ามใช้ในผู้ป่วยที่มีตับวาย ห้ามใช้ในผู้ป่วยที่ใช้ยาละลายลิ่มเลือด
และยังมียาตามตำรับการแพทย์แผนไทยอีก 14 ตำรับที่กรมแพทย์แผนไทยได้รับรองตามตำรับเดิมของคัมภีร์แพทย์แผนไทยโบราณของขุนโสภิตบรรณลักษณ์ ตำรายาจารึกในวัดพระเชตุพนวิมลมังคลาราม ตำราแพทย์ศาสตร์สงเคราะห์พระยาพิศณุประสาทเวช ร.ศ. 128 ตำรับยาอายุรเวทศึกษา (ขุนนิทเทสสุขกิจ ตำรับยาเวชศาสตร์วัณ์ณณา ตำรับยาคัมภีร์ธาตุพระนารายณ์)
เภสัชวิทยาคลินิกของกัญชาทางการแพทย์ (Clinical pharmacology of medical cannabis)
กัญชาประกอบด้วยสารอย่างต่ำ 60 ชนิด ส่วนสำคัญที่รู้จักกันดีก็คือ cannabinoids ซึ่งเป็น active component ของกัญชา ได้แก่ delta-9 tetrahydrocannabinol (THC) ซึ่งออกฤทธิ์ต่อจิตประสาท ทำให้เกิดการเสพติด
ส่วนสารอีกประเภทหนึ่งคือ cannabidiol (CBD) นั้นไม่ทำให้เสพติด และมีรายงานการศึกษาว่ามีฤทธิ์ต้านการอักเสบ มีฤทธิ์ปกป้องการเสื่อมของเซลล์ประสาท และต้านการชัก
การศึกษาในห้องปฏิบัติการและการทดสอบฤทธิ์ทางชีวภาพกับสัตว์ทดลองพบว่า THC และ CBD แสดงฤทธิ์ยับยั้งเซลล์มะเร็งหลายชนิด เช่น มะเร็งเม็ดเลือดขาว มะเร็งช่องปาก มะเร็งเต้านม มะเร็งปากมดลูก (Sledzinski, 2018) นอกจากนี้ยังมีฤทธิ์ต้านการอักเสบ (anti-inflammatory Hasenoehr, 2017) และฤทธิ์ต้านเชื้อแบคทีเรีย (Appendino, 2008)
การใช้ประโยชน์ทางยาของกัญชา
Nabizmols หรือชื่อทางการค้าว่า Sativex คือสารสกัดของ THC และ CBD ในอัตราส่วน 1:1 ใช้รักษาอาการปวดของเส้นประสาท (neuropathic pain), ภาวะกล้ามเนื้อหดเกร็ง (spasticity), ภาวะกระเพาะปัสสาวะบีบตัวไวเกิน (overactive bladder; OAB), รักษาอาการอาเจียน (antiemetic effect) และโรคปลอกประสาทเสื่อมแข็ง (multiple sclerosis; MS) (Deiana, 2018)
มีการใช้กัญชาเพื่อประโยชน์ทางการแพทย์ในหลายประเทศ และหลายรูปแบบ ได้แก่ การสูบ การใช้สารสกัดกัญชาหยอดใต้ลิ้น การรักษาโรคทางผิวหนังก็ใช้การทา ในการรักษาริดสีดวงหรือมะเร็งปากมดลูกก็ใช้การเหน็บทางทวารหรือช่องคลอด
ในปัจจุบันกระทรวงสาธารณสุขได้รับรองการรักษาผู้ป่วยโดยการแพทย์แผนปัจจุบัน โดยประกาศกระทรวงสาธารณสุขที่พิสูจน์แล้วว่าอาการหรือโรคที่รักษาแล้วได้ผลดีคือ
- Nausea and vomiting from chemotherapy อาการคลื่นไส้อาเจียนจากเคมีบำบัด
- Epilepsy ลมชักรักษายาก
- Multiple sclerosis อาการเกร็งจากปลอกหุ้มประสาทอักเสบ
- Neuropathic painปวดระบบประสาท
ส่วนการรักษาที่น่าจะได้ประโยชน์ คือ
- พาร์กินสัน (Parkinson)
- อัลไซเมอร์ (Alzheimer)
- ปลอกประสาทอักเสบ (Multiple sclerosis)
- โรควิตกกังวล (Anxiety disorder)
- มะเร็งระยะสุดท้าย (Cancer, end stage)
- โรคอื่น ๆ ระยะสุดท้าย (Severe diseases, end stage)
ส่วนการรักษาที่ต้องการการวิจัยเพิ่มคือ โรคมะเร็ง
ในปัจจุบันกระทรวงสาธารณสุขโดยกรมการแพทย์แผนไทยได้ส่งเสริมและสนับสนุนให้โรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.)150 แห่งปลูกกัญชาทางการแพทย์ ร่วมกับวิสาหกิจชุมชน ปลูกกัญชาตำบลละ 50 ต้น เพื่อนำมาใช้ประโยชน์ในทางการแพทย์ในแต่ละชุมชน
สรุป การใช้กัญชาในทางการแพทย์ของไทยยังมีช่องทางที่จะพัฒนาต่อยอดได้อีกมาก เพื่อจะได้มีการวิเคราะห์/วิจัยเพิ่มเติมในสารอื่น ๆ ที่เป็นส่วนประกอบสำคัญของกัญชา และการสกัดสารที่มีสรรพคุณทางยาเพื่อนำไปวิจัยในการนำไปใช้เพื่อผลการรักษาในทางการแพทย์ หรือที่มีผลต่อสรีรวิทยา หรือการรักษาโรคหรือสภาวะต่าง ๆของร่างกาย เพื่อขยายความครอบคลุมและสรรพคุณในการใช้กัญชาทางการแพทย์ได้มากขึ้น เพื่อนำไปใช้ในการรักษาโรคที่ยังไม่มีผลการวิจัยมายืนยันการรักษา เพราะยังสามารถทำการศึกษาวิจัยในการสกัดสารสำคัญต่าง ๆ อีกหลายชนิดของกัญชาว่าจะมีผลต่อการรักษาโรคอะไรได้อย่างมีประสิทธิผลมากขึ้น และอาจนำมาใช้แทนยาทางเคมีในปัจจุบันได้อีกด้วย ซึ่งจะช่วยลดต้นทุนในการสั่งยาจากต่างประเทศ และอาจลดภาระค่ารักษาพยาบาลของผู้ป่วย ได้ในอนาคต
[
wongkarnpat.com]
สวัสดีคลินิกเวชกรรม กรุงเทพ
คลินิกที่มีความเชี่ยวชาญกัญชาทางแพทย์ และกล่าวได้ว่าเป็นคลินิกกัญชารุ่นแรกๆ ในประเทศก็ว่าได้ โดยการบริการและดูแลโดยแพทย์ผู้เชี่ยวชาญ
พญ.จินตนา มโนรมย์ภัทรสาร แพทย์ผู้เชี่ยวชาญเวชศาสตร์ฟื้นฟู ที่มีประสบการณ์การใช้กัญชาในผู้ป่วยมายาวนาน
สวัสดีคลินิกเวชกรรม ได้ระบุถึงกลุ่มโรค/ภาวะอาการที่มีการนำยากัญชาไปใช้แพร่หลาย และในแพทย์แผนไทย ได้แก่ เครียด ซึม เศร้า นอนไม่หลับ ไมเกรน Office Syndrome สะเก็ดเงิน ภูมิแพ้ผิวหนัง งูสวัด อาการผิวหนังอักเสบอื่นๆ เช่น จากการแพ้เคมีบำบัด หรือสิว ลดอาการปวดเรื้อรังจากกระดูกและกล้ามเนื้อ ปวดประจำเดือน ลดระดับน้ำตาลในเลือดและความดันโลหิตสูง ต้อหิน อาการแข็งเกร็งจากอัมพฤกษ์อัมพาต ภาวะทางเดินอาหารอักเสบเรื้อรัง ไวรัสตับอักเสบซี อาการติดยาเสพติด
สวัสดีคลินิกเวชกรรม ตั้งอยู่ที่ ซ.พหลโยธิน 63 บางเขน กทม. เปิดทำการทุกวัน เวลา 8.00-17.30น. โทร.02-9724013 02-9724014 02-9723981
การแพทย์จีโนมิกส์ (Genomics Medicine)


ทั้งนี้ การแพทย์จีโนมิกส์ (Genomics Medicine) เป็นนวัตกรรมการบริการทางการแพทย์ที่ใช้ข้อมูลพันธุกรรมเฉพาะบุคคลร่วมกับข้อมูลทางสุขภาพอื่นๆ มาใช้ในการวินิจฉัย รักษา และทำนายปัจจัยเสี่ยงที่ทำให้เกิดโรค ทำให้สามารถรักษาผู้ป่วยได้ตรงจุด แม่นยำ และเหมาะสมสำหรับผู้ป่วยแต่ละรายมากขึ้น ซึ่งนับเป็นจุดเปลี่ยนของวงการแพทย์อย่างก้าวกระโดดในการสร้างสุขภาพที่ดีของประชากรตั้งแต่ก่อนตั้งครรภ์จนกระทั่งเสียชีวิต ตลอดจนการต่อยอดสู่อุตสาหกรรมการแพทย์ของประเทศ ปัจจุบันการแพทย์จีโนมิกส์มีบทบาทสำคัญกับระบบสาธารณสุข และเริ่มมีการให้บริการในหลายประเทศภายใต้การสนับสนุนโครงสร้างพื้นฐานจากภาครัฐ เช่น อังกฤษ สหรัฐฯ และสิงคโปร์ เป็นต้น สำหรับประเทศไทย ปัจจุบันได้มีการจัดทำแผนปฏิบัติการบูรณาการจีโนมิกส์ประเทศไทย (Genomics Thailand) ปี พ.ศ. 2563–2567 ภายใต้ความร่วมมือของกระทรวงสาธารณสุข กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม และหน่วยงานภาคีเครือข่าย โดยมีเป้าหมายเพื่อขับเคลื่อนการพัฒนาการแพทย์จีโนมิกส์ของประเทศ เพื่อให้คนไทยสามารถเข้าถึงการบริการทางการแพทย์จีโนมิกส์ รวมถึงเกิดโครงสร้างพื้นฐานของประเทศซึ่งจะเป็นพื้นฐานสำคัญที่จะต่อยอดไปสู่การเป็นผู้นำศูนย์กลางอุตสาหกรรมและบริการการแพทย์ในภูมิภาคอาเซียน
คลินิกพิเศษเฉพาะทางอายุรกรรม นอกเวลาราชการ LINK
โรงพยาบาลสงขลา(เกาะยอ) เปิดให้บริการ คลินิกพิเศษเฉพาะทางอายุรกรรมนอกเวลาราชการ ทุกวันจันทร์-วันศุกร์ เวลา 16:00-20:00 น. #เว้นวันหยุดนักขัตฤกษ์ #ค่าทำเนียมบริการนอกเวลา 300 บาท สอบถามรายละเอียดเพิ่มเติมได้ที่ : คลินิกอายุรกรรม หรือโทร 074-338100 ต่อ 1015 (ในเวลาราชการ)
แอป EMS1669 LINK
ระบบรับแจ้งเหตุฉุกเฉิน ประกอบด้วย
- รับแจ้งเหตุผ่าน 1669 โดยมีการส่งข้อมูลได้แก่ ชื่อ-สกุล, หมายเลขโทรศัพท์, อีเมล, เพศ, ปีเกิด หรือ ข้อมูลส่วนตัวเช่น โรคประจำตัว,การแพ้ยา เป็นต้น
- ระบุพิกัดที่เกิดเหตุ (latitude, longitude)
- ส่งภาพถ่ายสถานที่เกิดเหตุ
แอป หมอ กทม.ปรึกษาหมอ 11 โรงพยาบาล
แอปพลิเคชัน “หมอ กทม.” พัฒนาโดย สำนักการแพทย์ กรุงเทพมหานคร สำหรับใช้ใน 11 โรงพยาบาลสังกัดกรุงเทพมหานคร ได้แก่ โรงพยาบาลกลาง โรงพยาบาลตากสิน โรงพยาบาลเจริญกรุงประชารักษ์ โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ โรงพยาบาลเวชการุณย์รัศมิ์ โรงพยาบาลลาดกระบังกรุงเทพมหานคร โรงพยาบาลราชพิพัฒน์ โรงพยาบาลสิรินธร โรงพยาบาลผู้สูงอายุบางขุนเทียน . โรงพยาบาลคลองสามวา และโรงพยาบาลบางนากรุงเทพมหานคร รวมถึงศูนย์บริการการแพทย์ฉุกเฉินกรุงเทพมหานคร (ศูนย์เอราวัณ)
ฟังก์ชั่นเด่น ของแอป หมอ กทม.
• ตรวจรักษาออนไลน์ ด้วยระบบโทรเวชกรรม (Tele-medicine) โดยสามารถตรวจรักษา ติดตามอาการ ตลอดจนได้รับคำแนะนำในการใช้ยาจากแพทย์ผ่านระบบวีดีโอคอล (VDO Call) โดยไม่ต้องมาโรงพยาบาล ผู้ใช้บริการสามารถรับยาผ่านไปรษณีย์ หรือรับด้วยตนเองที่ร้านยาใกล้บ้าน
• แจ้งเหตุฉุกเฉินกับศูนย์เอราวัณ รับการช่วยเหลือเหตุเจ็บป่วยฉุกเฉินตลอด 24 ชั่วโมง โดยระบบจะประสานงานไปยังหน่วยงานที่อยู่ใกล้เคียงพิกัดของผู้ใช้งาน ณ ขณะแจ้งเหตุผ่าน แอปพลิเคชัน เพื่อส่งทีมปฏิบัติการการแพทย์ฉุกเฉินเข้าไปให้การช่วยเหลือ ดูแลรักษา และนำส่งผู้เจ็บป่วยฉุกเฉินนั้นไปยังสถานพยาบาลที่เหมาะสมต่อไป
• ตรวจสอบประวัติการรักษา เชื่อมโยงข้อมูลด้านสุขภาพส่วนบุคคลกับระบบระเบียนสุขภาพอิเล็กทรอนิกส์ส่วนบุคคล (Personal Health Record: PHR) ทั้งผลวินัจฉัยโรค ประวัติการแพ้ยา/วัคซีน ประวัติรับยา ผลแล็บ การผ่าตัด ทำให้ผู้ใช้บริการสามารถรับบริการจากสถานพยาบาลอื่นได้อย่างสะดวก โดยสามารถเรียกดูข้อมูลการรักษาได้เองโดยไม่ต้องมาโรงพยาบาล ส่วนบุคลากรทางการแพทย์ก็ได้ข้อมูลที่ครบถ้วนประกอบการรักษา
• บริการทั่วไป เช่น นัดหมายแพทย์ล่วงหน้า ตรวจสอบจำนวนคิวรอตรวจ การชำระเงิน ตรวจสอบสิทธิ์รักษา ลงทะเบียนตรวจรักษา ฯลฯ
ฟีเจอร์เด่นบนแอปพลิเคชัน
• นัดหมายพบแพทย์ – ตรวจสอบรายการนัดหมาย แจ้งเตือนการนัดหมาย และกดรับบัตรคิวในแอป
• ตรวจสอบสิทธิ์ – สามารถตรวจสอบสิทธิ์การรักษาพยาบาล อาทิ สิทธิ์บัตรทอง สิทธิ์ประกันสังคม และ สิทธิข้าราชการ
• Telemedicine – ตรวจรักษาออนไลน์ พร้อมบริการจัดส่งยาที่ร้านยาใกล้บ้าน หรือทางไปรษณีย์
• ตรวจสอบสถานะคิวตรวจ – แจ้งลำดับคิว และขั้นตอนการใช้บริการในโรงพยาบาล
• ลงทะเบียนตรวจรักษา – บริการลงทะเบียนตรวจรักษาโรค
• แจ้งเหตุเจ็บป่วยฉุกเฉิน – บริการแจ้งเหตุเจ็บป่วยฉุกเฉิน พร้อมแชร์โลเคชันเพื่อขอรับการช่วยเหลือจากศูนย์เอราวัณ
• ชำระเงิน – สามารถชำระค่ารักษาพยาบาลผ่านช่องทาง K PLUS โอนเงินผ่าน Thai QR Code หรือชำระผ่านบัตรเครดิต บัตรเดบิต
ศูนย์รักษาโรคด้วยกัญชา โรงพยาบาลยันฮี
ศูนย์รักษาโรคด้วยกัญชา โรงพยาบาลยันฮี จัดอยู่ในสายการแพทย์ทางเลือก ที่ดูแลโดยแพทย์ผู้เชี่ยวชาญ การใช้สารสกัดกัญชาในการบรรเทารักษาโรคหลายชนิด อาทิ สะเก็ดเงิน นอนไม่หลับ เป็นต้น สอบถามเพิ่มเติมโทร. 1723
กษัตริย์พระองค์ใหม่ กษัตริย์ชาร์ลส์ ที่ 3
หลังจาก สมเด็จพระราชินีนาถเอลิซาเบธที่ 2 ของอังกฤษเสด็จสวรรคตแล้ว เมื่อวันที่ 9 ก.ย.2565 (ตามเวลาในประเทศไทย) รัชทายาทที่จะขึ้นครองราชย์ต่อจากพระองค์ในทันทีคือ เจ้าชายแห่งเวลส์
เจ้าฟ้าชายชาร์ลส์ มกุฎราชกุมาร ทรงเป็นพระราชโอรสพระองค์โตของสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 ปี พระราชสมภพเมื่อปี 1948
ทรงอภิเษกสมรสเมื่อปี 1981 กับเลดี้ไดอานา สเปนเซอร์ ซึ่งต่อมาดำรงพระยศเจ้าหญิงแห่งเวลส์ ทั้งสองมีพระโอรสคือ เจ้าชายวิลเลียมและเจ้าชายแฮร์รี ก่อนจะทรงหย่ากันในปี 1996
หลังเจ้าหญิงแห่งเวลส์สิ้นพระชนม์ ด้วยอุบัติเหตุทางรถยนต์ในกรุงปารีส เมื่อปี 1997 เจ้าชายแห่งเวลส์ทรงอภิเษกสมรสอีกครั้ง กับนางคามิลลา พาร์กเกอร์ โบลส์ ดัชเชสแห่งคอร์นวอลล์ ในปี 2005
ซึ่งก่อนหน้านี้ สำนักพระราชวัง เคยเผยแพร่แถลงการณ์ของสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 เนื่องในโอกาสที่พระองค์ทรงครองสิริราชสมบัติครบ 70 ปี เนื้อหาตอนหนึ่ง ระบุว่า
“พระองค์มีพระราชปรารถนาให้ "คามิลลา" ดัชเชสแห่งคอร์นวอลล์ พระชายาในเจ้าฟ้าชายชาลส์ มกุฎราชกุมาร ได้รับการสถาปนาเป็นสมเด็จพระราชินี เมื่อเจ้าฟ้าชายชาลส์เสด็จขึ้นครองราชย์ในอนาคต”
เนื่องจากตลอดหลายปีที่ผ่านมา หลายฝ่ายคาดการณ์ว่า ดัชเชสแห่งคอร์นวอลล์จะได้รับการสถาปนาเป็นเพียงเจ้าหญิงพระราชชายาเท่านั้น [ThaiPBS]
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบางแค กรุงเทพ
ศูนย์พัฒนาการจัดสวัสดิการสวัสดิการสังคมผู้สูงอายุบ้านบางแค
813 ถ.เพชรเกษม แขวงบางหว้า เขตภาษีเจริญ กรุงเทพมหานคร 10160
เบอร์โทรศัพท์ 0-24131141 เบอร์แฟกซ์: 0-2455-1590
บ้านบางแค เดิมใช้ชื่อว่า สถานสงเคราะห์คนชราบ้านบางแค ได้ก่อตั้งขึ้นเมื่อวันที่ 1 มิถุนายน 2496 ในสมัยจอมพล ป. พิบูลสงคราม เป็นนายกรัฐมนตรี การจัดตั้งสถานสงเคราะห์แห่งนี้นับเป็นสถานสงเคราะห์ผู้สูงอายุแห่งแรกของประเทศไทย เพื่อให้การสงเคราะห์ผู้สูงอายุตามนโยบายสวัสดิการสังคมของรัฐ โดยเริ่มเปิดดำเนินการในสมัยของนายปกรณ์ อังศุสิงห์ เป็นอธิบดีกรมประชาสงเคราะห์ จนกระทั่งเมื่อวันที่ 30 ธันวาคม 2546 บ้านบางแค ได้ปรับบทบาทจากหน่วยงานปฏิบัติการดูแลผู้สูงอายุ มาเป็นงานส่งเสริม สนับสนุน การดำเนินงานด้านการจัดสวัสดิการสังคมผู้สูงอายุ และในวันที่ 2 พฤศจิกายน 2548 ได้เปลี่ยนชื่อเป็น ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบางแค
ภารกิจ 4 ด้าน
1.ภารกิจการจัดสวัสดิการสังคมผู้สูงอายุแบบสถาบัน
ภารกิจการจัดสวัสดิการสังคมผู้สูงอายุแบบสถาบัน หมายถึง การจัดบริการสวัสดิการสังคมแก่ผู้สูงอายุในรูปแบบของสถานดูแลผู้สูงอายุ เป็นการจัดบริการให้แก่ผู้สูงอายุที่ประสบปัญหาทางสังคม ทุกข์ยากเดือดร้อน ขาดผู้อุปการะดูแล ไม่มีที่อยู่อาศัย รวมถึงการให้บริการแก่ผู้สูงอายุทั่วไป โดยมีการจัดบริการใน 2 รูปแบบ ได้แก่
- การจัดบริการสวัสดิการสังคมและคุ้มครองผู้สูงอายุแบบเต็มเวลา
เป็นการให้บริการดูแลผู้สูงอายุ โดยการกำหนดคุณสมบัติของผู้รับบริการ การเข้ารับบริการ หน้าที่ของผู้รับบริการตามระเบียบกรมกิจการผู้สูงอายุ ว่าด้วยการให้บริการผู้สูงอายุ พ.ศ. 2558 หรือระเบียบที่เกี่ยวข้องของหน่วยงานที่ให้บริการ
- การจัดบริการสวัสดิการสังคมและคุ้มครองผู้สูงอายุแบบบริการทางสังคม
เป็นการให้บริการดูแลผู้สูงอายุในตอนกลางวัน แบบเช้าไป-เย็นกลับ โดยการจัดกิจกรรมเพื่อพัฒนาคุณภาพชีวิตผู้สูงอายุใน 4 มิติ ได้แก่ มิติด้านสุขภาพ มิติด้านสังคม มิติด้านเศรษฐกิจ มิติด้านสภาพแวดล้อม เทคโนโลยี และนวัตกรรม
2.ภารกิจการจัดสวัสดิการสังคมผู้สูงอายุในชุมชน
ภารกิจการจัดสวัสดิการสังคมผู้สูงอายุในชุมชน หมายถึง การส่งเสริมและสนับสนุนการจัดสวัสดิการสังคมให้แก่ผู้สูงอายุในชุมชน การส่งเสริมสนับสนุนให้อาสาสมัคร ชุมชน และท้องถิ่นมีส่วนร่วมในการจัดสวัสดิการสังคมสำหรับผู้สูงอายุ การส่งเสริมสนับสนุนองค์ความรู้ การจัดกิจกรรม การนำเทคโนโลยีนวัตกรรมสมัยใหม่ และนวัตกรรมทางภูมิปัญญามาใช้ในการดูแล ช่วยเหลือ และพัฒนาศักยภาพผู้สูงอายุ เพื่อการพัฒนาคุณภาพชีวิตผู้สูงอายุทุกกลุ่มวัย รวมถึงการส่งเสริมสนับสนุนให้ชุมชนและสังคมมีทัศนคติเชิงบวกกับผู้สูงอายุ
3.ภารกิจให้บริการศูนย์การเรียนรู้ด้านผู้สูงอายุ
ภารกิจให้บริการศูนย์การเรียนรู้ด้านผู้สูงอายุ หมายถึง การให้บริการ ส่งเสริมสนับสนุนการศึกษาดูงาน ฝึกอบรม สัมมนา จัดกิจกรรม พัฒนาหลักสูตรการอบรม วิธีการฝึกอบรม การนิเทศติดตามและประเมินผล การสนับสนุนการวิจัยและพัฒนาด้านการจัดสวัสดิการผู้สูงอายุในพื้นที่ การจัดการความรู้ พัฒนาคู่มือ หลักสูตร องค์ความรู้ ภูมิปัญญาด้านผู้สูงอายุ การพัฒนาคุณภาพชีวิตผู้สูงอายุ ทั้งการดูแลผู้สูงอายุ การพัฒนาศักยภาพ การถ่ายทอดความรู้เสริมสร้างรายได้ อาชีพ และภูมิปัญญาผู้สูงอายุ การจัดสวัสดิการสังคมสำหรับผู้สูงอายุ การเตรียมความพร้อมก่อนเข้าสู่วัยสูงอายุ รวมถึงการพัฒนาบุคลากร และองค์กรเครือข่ายด้านการจัดสวัสดิการสังคมผู้สูงอายุ
4.ภารกิจให้บริการด้านข้อมูลและให้คำปรึกษาด้านผู้สูงอายุ
ภารกิจให้บริการด้านข้อมูลและให้คำปรึกษาด้านผู้สูงอายุ หมายถึง การให้บริการด้านข้อมูลสารสนเทศด้านผู้สูงอายุในพื้นที่บริการ การรวบรวมจัดเก็บข้อมูลสารสนเทศและเผยแพร่ข้อมูลข่าวสารด้านผู้สูงอายุ การรวบรวมข้อมูลทำเนียบเครือข่ายดำเนินงานด้านผู้สูงอายุในพื้นที่บริการ ทำเนียบคลังปัญญาผู้สูงอายุ สถานการณ์สถิติข้อมูล องค์ความรู้ด้านผู้สูงอายุ ข้อมูลผู้รับบริการ ข้อมูลการให้บริการ หรือผลการดำเนินงานของหน่วยงาน การพัฒนาระบบการให้บริการข้อมูลสารสนเทศและการสื่อสารผ่านช่องทางต่าง ๆ ทั้งภายในและภายนอกหน่วยงานด้วยเทคโนโลยีและนวัตกรรม รวมถึงการให้บริการให้คำปรึกษาแนะนำ ให้ความช่วยเหลือแก่ผู้สูงอายุและประชาชนผ่านช่องทางต่าง ๆ ประสานงานและส่งต่อหน่วยงานที่เกี่ยวข้อง ในการให้ความช่วยเหลือผู้สูงอายุที่ประสบปัญหา
คุณสมบัติของผู้รับบริการ
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบางแค ให้ความอุปการะผู้สูงอายุชายหญิง สัญชาติไทย อายุ 60 ปีขึ้นไป ที่มีความสมัครใจ ประสบปัญหาความเดือดร้อน เช่น ขาดผู้อุปการะเลี้ยงดู ไม่สามารถประกอบอาชีพเลี้ยงตนเองได้ ไม่มีที่อยู่อาศัย ฐานะยากจนที่ไม่เป็นโรคติดต่อร้ายแรง ไม่มีความพิการทุพพลภาพ หรือจิตฟั่นเฟือนและ ต้องไม่อยู่ระหว่างการดำเนินคดีอาญา
การสมัครเข้ารับบริการ
1. ผู้ที่มีภูมิลำเนาอยู่ในกรุงเทพมหานคร ให้ยื่นใบสมัครได้ที่สำนักงานพัฒนาสังคมและสวัสดิการกรุงเทพ (หรือสำนักงานประชาสงเคราะห์เขตพื้นที่เดิมทุกเขต)
2. ผู้ที่มีภูมิลำเนาอยู่ในต่างจังหวัดให้ยื่นใบสมัครได้ที่สำนักงานพัฒนาสังคมและ ความมั่นคงของมนุษย์จังหวัดที่ตนอยู่(หรือสำนักงานประชาสงเคราะห์จังหวัดเดิม)
ประเภทของผู้รับบริการ
1. ประเภทสามัญ ให้การอุปการะเลี้ยงดูผู้สูงอายุโดยไม่ต้องเสียค่าบริการใด ๆ ทั้งสิ้น
2. ประเภทเสียค่าบริการแบบหอพัก แบ่งออกเป็นห้องเดี่ยว เสียค่าบริการคนละ 1,500 บาทต่อเดือน และห้องคู่เดือนละ 2,000 บาท มีบริการทั้งหมด 40 ห้อง
3. ประเภทพิเศษ (บังกะโล) เป็นบ้านเดี่ยวที่ปลูกสร้างตามแบบแปลนที่กำหนดในที่ดินของศูนย์พัฒนาฯ โดยผู้ปลูกสร้างสามารถพักอาศัยอยู่ได้จนถึงแก่กรรม
- ค่าบำรุงแรกเข้า เป็นเงิน 300,000 บาท (สามแสนบาทถ้วน) เพื่อนำเงินดังกล่าวมาใช้ในการปรับปรุงซ่อมแซมบังกะโลที่จะเข้าพัก
- ค่าบริการรายเดือนกรณีพักคนเดียว เดือนละ 1,500 บาท และในกรณีเข้าพัก 2 คน เช่น คู่สามีภรรยา หรือพี่น้องเพศเดียวกัน เดือนละ 2,000 บาท
- ค่าน้ำประปา เดือนละ 100 บาทต่อคน และค่าไฟฟ้าคิดค่าใฃ้จ่ายตามจริง
**สอบถามรายละเอียด ที่นักสังคมสงเคราะห์ 0 2455 1593**
แพคเกจตรวจสุขภาพ ชาย 13 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
แพคเกจตรวจสุขภาพ หญิง 14 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
เหตุผลที่เพื่อไทย ประกาศคว่ำร่างพรบ.กัญชา
นพ.ชลน่าน กล่าวว่า ร่างฉบับนี้ถูกนำเสนอต่อสภาฯ ด้วยเหตุผลที่สำคัญคือ นำกัญชง กัญชา มาใช้ทางการแพทย์ และสร้างมูลค่าเพิ่มทางเศรษฐกิจ เป็นเหตุผลที่พรรคเพื่อไทยรับหลักการร่างพ.ร.บ.ฉบับนี้ ช่วงที่มีการพิจารณาร่างพ.ร.บ.ดังกล่าว ภาคีเครือข่ายที่เกี่ยวข้องไม่ว่าจะด้านการแพทย์ การศึกษา ได้ออกมาแสดงความเห็นจนนำมาสู่ท่าทีของพรรคเพื่อไทย พิจารณาแล้วเห็นว่า แต่เดิมเราหวังว่ากฎหมายฉบับนี้จะเป็นตัวกฎหมายที่ใช้ควบคุมการใช้กัญชาให้เกิดประโยชน์อย่างแท้จริงทางการแพทย์ และสร้างมูลค่าทางเศรษฐกิจ แต่ปรากฎว่าในชั้นกมธ.มีการปรับแก้อย่างมาก ไม่ตอบโจทย์ว่าจะควบคุมเรื่องที่หลายฝ่ายเป็นห่วงได้อย่างไร โดยเฉพาะการนำกัญชามาใช้ทางสันทนาการ พรรคเพื่อไทยจึงมีมติว่าจะไม่ให้ความเห็นชอบร่างพ.ร.บ.กัญชา กัญชง ในวาระ 2 – 3 และจะเป็นเรื่องดีหากมีการถอนร่างไปปรับปรุง สิ่งสำคัญอีกประการ คือต้องเข้าสู่กระบวนการทบทวนสถานะของกัญชาว่าจะเป็นอย่างไรในกฎหมายว่าด้วยยาเสพติด ซึ่งมีความจำเป็นต้องกลับมาอยู่ในกฎหมายยาเสพติดหรือไม่นั้นจะต้องไปดูในรายละเอียด
อ่านเต็มๆ ที่
ThaiPost1.ประเภทบริหาร
1.ประเภทบริหาร คือ ดร.นพ.อุทัย สุดสุข ประธานที่ปรึกษามูลนิธิอุทัย สุดสุขเป็นผู้บริหารของกระทรวงสาธารณสุขคนแรกของประเทศไทยและเอเชียตะวันออกเฉียงใต้ที่ได้รับเลือกเป็นประธานคณะกรรมการบริหารองค์การอนามัยโลก (WHO Executive Board) นำเทคนิคการวางแผนโครงการพัฒนาการสาธารณสุขระดับจังหวัด “Project Systems Analysis” (PSA) มาใช้ร่วมกับเทคนิคการวางแผนพัฒนาการสาธารณสุขระดับชาติขององค์การอนามัยโลก “Country Health Programming” (CHP) ในการจัดทำแผนฯ ระดับชาติเป็นครั้งแรก และยังได้รับเหรียญรางวัลผู้นำสุขภาพดีถ้วนหน้าดีเด่นขององค์การอนามัยโลก จากผลงานการพัฒนาโครงการสาธารณสุขมูลฐาน (Primary Health Care) รวมถึงยังร่วมก่อตั้งและพัฒนาโรงพยาบาลสมเด็จพระยุพราชและสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี (สอน.) รวมถึงมูลนิธิอุทัย สุดสุข เพื่อส่งเสริมการศึกษา วิจัย และเผยแพร่ความรู้ด้านการแพทย์ การสาธารณสุข การแพทย์แผนไทยและการแพทย์ทางเลือก
โรงพยาบาลบ้านตาขุน ขอเชิญกลุ่มสตรี อายุ 30-70 ปี เข้ารับการตรวจ คัดกรองมะเร็งเต้านมเบื้องต้น
โรงพยาบาลบ้านตาขุน ขอเชิญกลุ่มสตรี อายุ 30-70 ปี เข้ารับการตรวจ #คัดกรองมะเร็งเต้านมเบื้องต้น ซึ่งหากพบก้อนผิดปกติจะได้รับการตรวจยืนยันด้วยเครื่องเอกซเรย์แมมโมแกรม #ฟรี สามารถเข้ารับการตรวจคัดกรองเบื้องต้นได้ที่กลุ่มงานเวชฯ รพ.บ้านตาขุน หรืออนามัยใกล้บ้าน ตั้งแต่วันนี้ - 10 ส.ค. 2565 ตั้งเเต่เวลา 08.30 - 16.00 (เว้นวันหยุดราชการ) #รับจำนวนจำกัด ติดต่อสอบถาม 064-4030761 หรือ 086-2785818
เป้าหมาย GREEN BANGKOK 2030
เพิ่มพื้นที่สีเขียว
ปี 2573 10 ตารางเมตร/คน
ปัจจุบัน 7.58 ตารางเมตร/คน
เพิ่มพื้นที่สาธารณะ เข้าถึงได้ภายใน 5 นาที หรือระยะ 400 เมตร
ปี 2573 มากกว่า 50%
ปัจจุบัน 13%
เพิ่มพื้นที่ร่มไม้ (Urban Tree Canopy) ต่อพื้นที่เมือง
ปี 2573 มากกว่า 30%
ปัจจุบัน 14%
ปัจจุบัน กรุงเทพมหานครมีสวนสาธารณะและพื้นที่สีเขียวอื่นๆ รวมกว่า 8,900 แห่ง คิดเป็นเนื้อที่ประมาณ 26,158 ไร่ แบ่งเป็น
สวนสาธารณะหลัก 39 แห่ง
สวนสาธารณะรอง 68 แห่ง
คิดเป็น 7.58 ตารางเมตร/คน
ซึ่งยังน้อยกว่าเกณฑ์มาตรฐานขององค์การอนามัยโลกที่กำหนดให้แต่ละเมืองควรมีพื้นที่สีเขียวอย่างน้อย 9 ตารางเมตร/คน
กรุงเทพมหานครจึงยังคงเดินหน้าเพิ่มพื้นที่สีเขียวอย่างต่อเนื่อง
ข้าวผัดป่ากัญชา เชฟจรินทร์ธร ชนะธีรโรจน์
ข้าวผัดป่ากัญชา
เชฟ/เจ้าของ: จรินทร์ธร ชนะธีรโรจน์
ร้าน: ปานามา คาเฟ่ อิน
สรรพคุณทางยา:
“ข้าวผัดป่ากัญชา” เมนูที่อุดมไปด้วยสารอาหารครบทั้ง 5 หมู่ ประกอบด้วยอาหารทะเลหลากหลายชนิดที่ให้โปรตีนซึ่งมีประโยชน์ต่อร่างกาย นอกจากนี้ ยังมีพริกขี้หนูที่ช่วยบรรเทาอาการหวัด และมะเขือเทศที่มีเบต้าแคโรทีนสูง ช่วยต้านอนุมูลอิสระ และใบกัญชาที่นำมาเป็นส่วนผสมมีคุณสมบัติช่วยลดอาการคลื่นไส้ และบรรเทาอาการปวด
ที่อยู่: Panamacafe’in 56, 13 ถนนลาดพร้าว แขวงคลองเจ้าคุณสิงห์ เขตวังทองหลาง กรุงเทพมหานคร 10310
Tel. 09-3064-2727
ไข่ฟูใบกัญชากรอบ LINK
เครื่องปรุง
ใบกัญชา 1 ใบ / ไข่ไก่ 3 ฟอง / น้ำปลา 10 กรัม / น้ำมัน 20 กรัม / ซอสศรีราชา 25 กรัม
วิธีทำ
1. ตอกไข่ไก่ใส่ถ้วยและปรุงรสด้วยน้ำปลา
2. ตีไข่ให้เข้ากันแล้วใส่ใบกัญชาลงไป
3. ตั้งกระทะน้ำมัน รอจนน้ำมันร้อน แล้วเทไข่ไก่ลงไปทอดจนสุก
4. จัดใส่จานพร้อมเสริ์ฟ
ตำแหน่งที่ตั้งของคณะแพทย์ และโรงพยาบาล
ตรวจคัดกรองมะเร็งต่อมลูกหมาก
มะเร็งต่อมลูกหมากเป็นโรคที่มักพบในผู้ชายอายุมากกว่า 60 ปีขึ้นไป ซึ่งโดยปกติแล้ว ผู้ชายที่มีอายุมากกว่า 50 ปี ขึ้นไปก็มักจะมีต่อมลูกหมากโตอยู่แล้ว อาจทำให้เกิดอาการ ปัสสาวะลำบาก ปัสสาวะไม่พุ่งแรง ปัสสาวะบ่อย ถ้าอาการเป็นมากอาจทำให้ปัสสาวะไม่ออกซึ่งอาการเหล่านี้แยกได้ยากกับโรคมะเร็งต่อมลูกหมากจึงจำเป็นต้องตรวจดูว่าเป็นมะเร็งต่อมลูกหมากหรือไม่โดยใช้วิธีดังนี้
1. การตรวจทางทวารหนัก
เป็นการตรวจโดยแพทยย์จะใช้นิ้วมือสอดเข้าทางทวารหนักเพื่อคลำต่อมลูกหมากที่อยู่ทางด้านหน้าช่วยในการแยกต่อมลูกหมากโตและมะเร็งต่อมลูกหมากได้ในบางรายควรปีละครั้ง
2. การตรวจเลืออเพื่อดูระดับ พี-เอส-เอ (PSA= Prostatic Specific Antigen) ระดับ พี-เอส-เอ ในเลือดจะสัมพันธ์กับโรคของต่อมลูกหมาก โดยถ้ามีระดับสูง มากกว่าค่าปกติมากจะช่วยบ่งชี้ว่าเป็นโรคมะเร็งต่อมลูกหมาก ควรรับการตรวจปีละครั้ง
3. การตรวจโดยวิธีอัลตร้าซาวนด์ผ่านเข้าทางทวารหนัก (Transrectal ultrasound) แพทย์จะใช้วิธีตรวจนี้เมื่อมีข้อสงสัย, ไม่ได้ใช้ตรวจในผู้ป่วยทุกราย เช่น เมื่อตรวจทาง ทวารหนักแล้วพบความผิดปกติ การตรวจจะทำโดยสอดหัวตรวจขนาดเล็กเข้าไปในทวารหนักแล้วดูภาพการสะท้อนของคลื่นในจอคอมพิวเตอร์
แผนผังกลุ่มอาคารศูนย์ ECH
1.อาคารต้อนรับส่วนกลาง
2.อาคารผู้ป่วยนอก
คลินิกผู้สูงอายุ
คลินิกเวชศาสตร์ฟื้นฟูและกายภาพบำบัด
ศูนย์ดูแลผู้สูงวัยเฉพาะช่วงกลางวัน
3.อาคารผู้ป่วยใน
การบริบาลผู้ป่วยระยะฟื้นฟูและกาย ภาพบำามัด
การบริบาลผู้ป่วยสมองเสื่อม
การบริบาลผู้ป่วยแบบประดับประคอง
4.อาคารผู้ป่วยระยะท้าย
5.ศูนย์วิจัยและฝึกอบรมและหอพักบุคลากร
6.ศาลาปฏิบัติธรรม
7.อาคารโภชนาการและโรงอาหาร
8.ศาลาพิธีศพ
คลินิกพิเศษนอกเวลาราชการ ด้านอายุรกรรมประสาท
คลินิกพิเศษนอกเวลาราชการ "ด้านอายุรกรรมประสาท" อังคารที่2 และพุธที่3 ของเดือน ตั้งแต่เวลา 16.30-20.30 น. จองคิวโทร.0922672029
จำนวนประชากร กลุ่มสูงอายุ 60 ปีขึ้น
- อายุ 60-69 ปี รวม 7,143,492 คน
- อายุ 70-79 ปี รวม 3,612,711 คน
- อายุ 80-89 ปี รวม 1,462,564 คน
- อายุ 90-99 ปี รวม 281,235 คน
- อายุ 100 ปี รวม 6,314 คน
- อายุเกิน 100 ปี รวม 26,801 คน
รวมประชากรกลุ่มสูงอายุ รวม 12,533,117 คน
คิดเป็น 18.95% ของประชากรไทยทั้งหมด 66,104,104 คน
รพ.เมดพาร์ครับรางวัลชนะเลิศ Creativity Gold Award LINK
รพ.เมดพาร์ค รับรางวัลชนะเลิศ Creativity Gold Award ในโครงการ Muang Thai Life Assurance Hospital Awards 2021 ครั้งที่ 6 ที่บริษัท เมืองไทยประกันชีวิต จัดขึ้นเพื่อเชิดชูพันธมิตรทางธุรกิจ จากการส่งโครงการ Brachytherapy for Prostatic Cancer และโครงการไม้เท้าอัจฉริยะ Smart Cane for Parkinsonism เข้าประกวด
ศาสตราจารย์ ดร. แพทย์หญิงจิรายุ เอื้อวรากุล คณบดีวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์
โครงการ Deep Space Food Challenge เป็นการแข่งขันที่จัดขึ้นโดย องค์การบริหารการบินและอวกาศแห่งชาติ (NASA) และองค์การอวกาศแคนาดา (Canadian Space Agency) โดยมีโจทย์สุดท้าทายคือ ให้ผู้เข้าร่วมแข่งขันสร้างระบบที่สามารถผลิตอาหารได้ในระยะยาว โดยไม่ต้องพึ่งการขนส่งไปเติมเพิ่ม เพื่อเตรียมพร้อมสำหรับภารกิจเดินทางไป-กลับดาวอังคารของนักบินอวกาศ ทีม KEETA (กีฏะ) ใช้จุดเด่นของวัฒนธรรมอาหารไทยอย่างโดยใช้ประโยชน์จากแมลงผสมผสานกับเทคโนโลยีเครื่องพิมพ์ 3 มิติ เพื่อสร้างระบบผลิตอาหารที่มีรูปลักษณ์และคุณสมบัติตามต้องการ จนแนวคิดนี้ไปถูกใจคณะกรรมการและได้เป็น 1 ใน 9 ทีมที่ผ่านเข้าเฟส 2 ของรอบการแข่งขัน โดยในที่สุดจะมีการคัดเลือกเหลือ 3 ทีมสุดท้ายในต้นปี 2566
วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ มีความภูมิใจที่ได้เป็นส่วนหนึ่งในการสนับสนุน อาจารย์ ดร.วเรศ จันทร์เจริญ และ ทีม KEETA (กีฏะ) ในการสร้างชื่อเสียงให้กับประเทศชาติสู่เวทีนานาชาติครั้งนี้ ซึ่งเป็นการส่งเสริมให้นักวิจัยรุ่นใหม่ได้ทำผลงานวิจัยที่นำไปพัฒนาต่อยอดและนำไปใช้ได้จริง
พญ.เมธินี ไหมแพง รองประธานคณะผู้บริหาร กลุ่ม 1 และ ผู้อำนวยการโรงพยาบาลกรุงเทพ กล่าวว่า โรงพยาบาลกรุงเทพให้ความสำคัญกับลูกค้าเป็นหลัก และสร้างความมั่นใจให้ผู้มารับบริการได้รับประสบการณ์ การดูแลและรักษาพยาบาลที่ดีที่สุด เพื่อสุขภาพที่แข็งแรงและมีคุณภาพชีวิตที่ดีในระยะยาว เราจึงนำเทคโนโลยีดิจิทัลมาพัฒนาระบบการให้บริการในทุกมิติ บนมาตรฐานระดับสากล ยกระดับการทำงานเป็นโรงพยาบาลอัจฉริยะรู้ใจทุกเรื่องสุขภาพ Your Healthcare Intelligence เราไปไกลกว่าการรักษา เสริมศักยภาพการดูแลผู้ป่วยอย่างไร้ขีดจำกัดมากยิ่งขึ้น นำ 2 ระบบเอไออัจฉริยะในการดูแลผู้ป่วยเข้ามาให้บริการเพิ่มเติม คือ
กรุงเทพกลาง
- เขตดินแดง 083-0037343 , 083-0037381 , 083-0027959
- เขตดุสิต 02-1117921
- เขตป้อมปราบศัตรูพ่าย 02-1117922 , 083-0071560 , 083-0068586 , 083-0061512
- เขตพญาไท 083-0117971 , 083-0119561 , 080-9986397
- เขตพระนคร 02-1117924 , 089-6767192
- เขตราชเทวี 02-1117925
- เขตวังทองหลาง 02-1117926
- เขตสัมพันธวงศ์ 02-1117927 , 02-2343460
- เขตห้วยขวาง 084-9899161
ข่าวปลอม! สมุนไพรขันทองพยาบาทใช้รักษาโรคมะเร็ง LINK
ตามที่มีข้อมูลแนะนำในสื่อออนไลน์เกี่ยวกับประเด็นเรื่องสมุนไพรขันทองพยาบาทใช้รักษาโรคมะเร็ง ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีการแชร์สรรพคุณของสมุนไพรขันทองพยาบาท ว่าสามารถใช้รักษาโรคมะเร็งได้ ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ ได้ตรวจสอบข้อมูลและชี้แจงว่า จากการตรวจสอบข้อมูลทางวิชาการพบว่าขันทองพยาบาทไม่เกี่ยวข้องกับการรักษาโรคมะเร็ง และไม่สามารถนำมาใช้รักษามะเร็งได้ ซึ่งปัจจุบันการรักษาโรคมะเร็งหลัก ๆ มี 3 วิธี ได้แก่ การผ่าตัด การให้ยาเคมีบำบัด และรังสีรักษา โดยผู้ป่วยโรคมะเร็งควรอยู่ภายใต้การดูแลของแพทย์
สำหรับสมุนไพรขันทองพยาบาท (Suregada multiflora) เป็นพืชที่ถูกนำมาใช้ในตำหรับยาสมุนไพรพื้นบ้านมีกลุ่มสารต้านอนุมูลอิสระ เช่น อัลคาลอยด์ ซาโปนิน ฟลาโวนอยด์ เป็นต้น และจากผลการศึกษาวิจัยระดับเซลล์ในห้องปฏิบัติการ พบว่าสารนี้อาจมีส่วนในการยับยั้งเซลล์มะเร็งในหลอดทดลอง แต่ผลดังกล่าวเป็นเพียงงานวิจัยเบื้องต้น และยังไม่มีหลักฐานงานวิจัยทางคลินิกที่ยืนยันแน่ชัดว่าขันทองพยาบาทช่วยรักษาโรคมะเร็งในมนุษย์
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : จากการตรวจสอบข้อมูลวิชาการพบว่าขันทองพยาบาทไม่เกี่ยวข้องกับการรักษาโรคมะเร็งและไม่สามารถนำมาใช้รักษามะเร็งได้
ตำราพระโอสถพระนารายณ์ กองเภสัชกรรม โรงพยาบาลอานันทมหิดล LINK
ตำราพระโอสถพระนารายณ์ ฉบับพิมพ์ครั้งที่ 7
หลวงอนุการนพกิจ พิมพ์แจกเป็นอนุสรณ์ในงานฌาปณกิจศพ นางเกษ สุรัสวดี ณ วัด ขุนก้อง อำเภอนางรอง จังหวัดบุรีรัมย์ วันที่ 19 เมษายน พ.ศ.2502
พิมพ์ที่โรงพิมพ์มหาดไทย กรมราชทัณฑ์ กระทรวงมหาดไทย
หลวงอนุการนพกิจ ได้มาแจ้งความประสงค์แก่เจ้าหน้าที่แผนกค้นคว้า กองวรรณคดีและประวัติศาสตร์กรมศิลปากรว่า ประสงค์จะจัดพิมพ์หนังสือเรื่องตำราพระโอสถพระนารายณ์ เพื่อแจกเป็นอนุสรณ์ในงานฌาปณกิจศพ นางเกษ สุรัสวดี ผู้เป็นมารดา กำหนดวันที่ 19 เมษายน พ.ศ.2502 ณ อำเภอนางรอง จังหวัดบุรีรัมย์ กรมศิลปากรยินดีอนุญาตให้จัดพิมพ์ได้ดังประสงค์
กรมศิลปากร
3 กุมภาพันธ์ 2502
จากเว็บ โรงพยาบาลอานันทมหิดล
หลายคนอาจยังกังวลว่าต้องรักษายืดเยื้อหรือเสียค่าใช้จ่ายสูงหรือไม่ จึงยังลังเลที่จะมาพบแพทย์ “ขอบอกว่าไม่ต้องกังวลขนาดนั้น แม้ระยะเวลาในการฟื้นฟูจะขึ้นอยู่กับแต่ละเคสว่ามีปัญหามากแค่ไหน แต่จริง ๆ แล้ว แพ็กเกจที่ทางวิมุตแนะนำ ส่วนมากจะเป็นการมาพบหมอแค่ครั้งเดียว และที่เหลือคือการแนะนำให้ออกกำลังกายอยู่ที่บ้าน ส่วนเคสไหนที่ต้องมีการติดตามผลต่อเนื่อง ก็จะแนะนำให้เข้ามารับโปรแกรมระยะเวลาประมาณ 1-2 เดือนเท่านั้น” พญ. พิชชาพร เมฆินทรพันธุ์ กล่าวทิ้งท้าย
ศูนย์สหสาขามะเร็งภูเก็ต
ศูนย์สหสาขามะเร็ง ให้การดูแลรักษาโรคมะเร็งแบบบูรณาการจากทีมบุคลากรทางการแพทย์ผู้เชี่ยวชาญด้านโรคมะเร็ง ตลอดจนทีมแพทย์สหสาขาวิชาชีพ จากโรงพยาบาลกรุงเทพภูเก็ต โรงพยาบาลกรุงเทพสิริโรจน์ และโรงพยาบาลดีบุก ให้การตรวจวินิจฉัยด้วยเครื่องมือและเทคโนโลยีชั้นสูง โดยให้ความสำคัญทั้งทางด้านร่างกายและจิตใจของผู้ป่วยจากการรักษาแบบครบทุกขั้นตอนอย่างมีประสิทธิภาพ เพิ่มคุณภาพชีวิตตลอดจนลดอัตราการเสียชีวิตของผู้ป่วยได้ โดยที่ผู้ป่วยสามารถมั่นใจได้ว่าจะได้รับการรักษาที่ถูกต้องและอย่างทันท่วงที
เวลาทำการ
ศูนย์สหสาขามะเร็ง
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 16.00 น.
ติดต่อสอบถาม
โทร: 076 254 425 ต่อ 8609,
076 361 000 ต่อ 8609,
076 655 000 ต่อ 8609
4 สูตรยาสารสกัดกัญชาแผนปัจจุบัน
4 สูตรยาสารสกัดกัญชาแผนปัจจุบัน ได้แก่
1. สูตร THC เด่น มี THC 0.5 มกฦ/หยด
2. สูตร CBD เด่น มี CBO:THC มากกว่า 20:1
3. สูตร THC:CBD แบบ 1:1 คือมี THC 1 มก.และ CBD 1 มก./หยด
4. สูตร THC สูง THC 3 มก./หยด
การลดความเสี่ยงภาวะสมองเสื่อม - ศาสตราจารย์ นายแพทย์ คีธ แบล็ค
ศาสตราจารย์ นายแพทย์ คีธ แบล็ค แพทย์ผู้เชี่ยวชาญด้านสมองและระบบประสาทระดับโลก กล่าวถึงความสำคัญของสมอง ซึ่งเป็นศูนย์กลางของระบบประสาททำหน้าที่ควบคุมและสั่งการการเคลื่อนไหว พฤติกรรม รวมไปถึงการรักษาสมดุลในร่างกายว่า นอกจากโรคอัลไซเมอร์ยังมีภาวะสมองเสื่อมที่กำลังเป็นที่น่าวิตก ปัจจุบันทั่วโลกมีผู้ป่วยภาวะสมองเสื่อมสูงถึง 50 ล้านคน และเพิ่มจำนวนขึ้นเกือบ 10 ล้านคนต่อปี ส่งผลให้มีผู้ที่เสียชีวิตจากโรคอัลไซเมอร์สูงเป็นอันดับที่ 5 ของโลก การดูแลสมองจึงเป็นเรื่องที่ต้องดูแลและให้ความใส่ใจ เพื่อป้องกันและชะลอไม่ให้เป็นโรคอัลไซเมอร์
การลดความเสี่ยงภาวะสมองเสื่อมต้องเริ่มจากการดูแลสุขภาพตนเองแต่เนิ่นๆ เนื่องจากเซลล์สมองเมื่อตายแล้วไม่สามารถสร้างใหม่ขึ้นมาทดแทนได้อีก ต้องป้องกันตั้งแต่อายุ 30-50 ปี ก่อนที่จะเกิดอาการและสูญเสียความจำไปอย่างถาวร ไม่ว่าจะเป็นเรื่องของการรับประทานอาหาร การออกกำลังกาย การนอน การดูแลให้มีน้ำหนักตัวที่เหมาะสม รวมไปถึงการเรียนรู้สิ่งใหม่ๆ เพื่อให้สมองได้ทำงาน ตลอดจนการนั่งสมาธิ ซึ่งเป็นการเปิดสมองอีกแนวทางหนึ่ง
หัวใจของโรงพยาบาลอัจฉริยะ ต้องให้ “คนไข้เป็นศูนย์กลาง”
ขณะที่ ศ.คลินิก นพ.วิศิษฎ์ วามวาณิชย์ ผู้อำนวยการโรงพยาบาลศิริราช กล่าวว่า “ในฐานะโรงเรียนแพทย์เก่าแก่ ศิริราชมุ่งมั่นที่จะพัฒนาวิธีการรักษาที่ดีที่สุด ด้วยสรรพกำลังที่มีความพร้อม เราจะเปลี่ยนตัวเองเป็นโรงพยาบาลที่เป็นต้นแบบในรูปแบบการรักษาพยาบาล โดยใช้คำว่า Smart เป็นหลักคิด โจทย์ของศิริราชคือ ความแออัด การเข้าไม่ถึงบริการ ตั้งต้นจากข้อมูลของผู้ป่วยที่มารับบริการที่ศิริราช เฉลี่ยปีละ 3 ล้านครั้ง และเพิ่มจำนวนขึ้นทุกปี ปีละ 1% เนื่องจากโรงพยาบาลมีความแออัด โดยพบว่าผู้ป่วยหนึ่งรายจะมารับบริการที่ศิริราชเฉลี่ยคนละ 5 ครั้งต่อปี ขณะที่บางรายมาโรงพยาบาลโดยไม่จำเป็น เป็นความไม่สมดุลของการรับบริการและการให้บริการ
“ จึงเป็นที่มาของการทำโครงการ Smart Hospital โดยนำเทคโนโลยีมาออกแบบระบบการให้บริการเพื่อลดปัญหาความแออัด และเพิ่มประสิทธิภาพการรักษา แก้ปัญหาโดยใช้คนไข้เป็นศูนย์กลาง ทำให้คนไข้เข้าถึงการรักษาที่เหมาะสม ในเวลาที่เหมาะสม ในสถานที่เหมาะสม ในราคาที่คุ้มค่าเหมาะสม และทำให้เกิดความพึงพอใจมากที่สุด
ศ.คลินิก นพ.วิศิษฎ์ อธิบายเพิ่มเติมว่า การทำ Smart Hospital อย่างแรกต้องทำให้เกิดการเข้าถึงที่ดีขึ้น (Smart Access) ในที่นี้หมายถึงเข้าถึงเมื่อจำเป็นต้องเข้าถึงได้ สองระบบการรับบริการที่ราบรื่น ไม่ต้องรอ หรือรอคอยน้อยที่สุด (Smart Operation) สามข้อมูลต้องทั่วถึงทั้งผู้ให้และผู้รับบริการ (Smart Information) ไม่ว่าจะเป็นข้อมูลการรักษาพยาบาลหรือข้อมูลเรื่องของโรคต่างๆ เรื่องถัดมาคือคนของศิริราชก็ต้องสมาร์ท (Smart People) บุคลากรในศิริริราชต้องใช้เครื่องไม้เครื่องมือเป็นและต่อยอดข้อมูลได้
“เราคลี่กระบวนการของคนไข้ ตั้งแต่ก่อนมาถึงโรงพยาบาล ระหว่างมารับบริการ และหลังรับการรักษา เราใช้เทคโนโลยีเข้ามาจับเพื่อลดขั้นตอน ลดเวลา ลดข้อผิดพลาด และให้การรักษาที่ถูกต้องแม่นยำ ทำให้เกิดสมดุลระหว่างผู้ให้และผู้รับบริการ รวมทั้งสามารถติดตามอาการของคนไข้ได้ต่อเนื่อง เราจึงเข้าโครงการ 5G ของรัฐบาลเพื่อสร้างต้นแบบในการทำ Smart Hospital ให้เป็นรูปธรรม จึงจำเป็นต้องมีพันธมิตรจากหลากหลายสาขา ทั้งเทคโนโลยี วิศวกรรม การพัฒนาสิ่งประดิษฐ์ ไอที รวมถึงสตาร์ตอัพ ตอนนี้เราอยู่ในช่วงขยายผลไปสู่พันธมิตรเพื่อให้เกิดประโยชน์สูงสุดกับคนไข้” ศ.คลินิก นพ.วิศิษฎ์ กล่าว
Prof. Jirí Dvorák, M.D.
BDMS Wellness Clinic Executive Advisor | Musculoskeletal and Rehabilitation Clinic
Senior Consultant in Neurology and Research at the Spine Center, Schulthess Clinic, Zurich, where he previously served as Chairman for 35 years. A Professor of Neurology at the University of Zurich, former Chief Medical Officer at FIFA, and a Consultant at BDMS Wellness Clinic, Bangkok. Prof. Dr. Jirí Dvorák is a Senior Advisor of the British Journal of Sports Medicine, a previous Deputy Editor of SPINE, and is widely published with 462 original articles. His immense contributions to spine research on clinical biomechanics and to sports medicine on injury prevention have resulted in numerous awards. His current research activities are focused on prevention of communicable and non-communicable diseases, and he is also developing a national-level Lifestyle Medicine Diploma for Thailand. An Honorary Member of EUROSPINE, which he co-founded in 1990, also at the International Society of Arthroscopy, Knee Surgery and Orthopedic Sports Medicine, and the Czech Medical Academy.


ผศ.ดร.วรจิตต์ เศรษฐพรรค์ รองผู้อำนวยการ หน่วยบริหารและจัดการทุนด้านการพัฒนากำลังคนและทุนด้านการพัฒนาสถาบันอุดมศึกษาการวิจัยและการสร้างนวัตกรรม (บพค.) เผยว่า “ทาง บพค. มีหน้าที่หลักในการจัดสรรทุนด้านการพัฒนากำลังคนในสาขาที่จำเป็นต่อการพัฒนาประเทศตามนโยบายและยุทธศาสตร์การอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม และนโยบายของรัฐบาล และเพื่อตอบสนองการเปลี่ยนแปลงโครงสร้างทางสังคมที่จะเกิดขึ้น ทางบพค. ได้ร่วมสนับสนุนโครงการ วิจัยและพัฒนาในหัวข้อ : Public Involvement and Engagement assessment framework to reflect Thai older adult needs: Innovative monitoring and evaluation of social science, humanities, and arts (SHA) research เพื่อมุ่งเน้นการมีส่วนร่วมของชุมชนและประชากรผู้สูงอายุ ในการสะท้อนความต้องการที่แท้จริงของผู้สูงอายุในการพัฒนาสร้างสรรค์นวัตกรรมและวิจัยทางการแพทย์ และพัฒนาทีมงานในการดูแลผู้สูงอายุของประเทศไทย ซึ่งตลอดโครงการทางผู้วิจัยได้จัดกิจกรรมเพื่อสะท้อนและรับฟังความเห็นของผู้สูงอายุอย่างประสบความสำเร็จรวมทั้งได้รวบรวมองค์ความรู้ที่สำคัญนี้เพื่อเป็นแนวทางสำหรับนักวิจัยท่านอื่นในไทยต่อไปอีกด้วย”
The topics include:


The Keys to long lasting brain health by Prof. Keith L Black, M.D. a world renowned neurosurgeon with a prolific body of work. With his expertise on brain diseases and tumors, he emphasized the important duty of the brain and how to optimize brain health and wellness as you age to prevent degenerating diseases such as Alzheimer’s, Dementia and Parkinson’s disease. The number of people getting Alzheimer’s disease is increasing as we live longer. It is the cause of medical conditions we are not getting treated for– like high blood pressure and diabetes. So, eating less processed sugar, managing and maintaining proper weight, and regular exercise - things you hear about that can decrease your risk of getting high blood pressure and diabetes, can also decrease your risk of getting Alzheimer’s disease. Dr. Black said “The good news is that a lifestyle change can interrupt the onslaught of Alzheimer’s and save countless lives. Alzheimer’s disease may be incurable, but simply adopting a healthy, balanced lifestyle can help keep your brain healthy far longer.
ขั้นตอนขอรับกล้าไม้
บัตรประชาชนใบเดียวก็ใช้รับกล้าไม้ได้แล้ว
ขั้นตอนดังนี้
1. เตรียมหลักฐาน - บัตรประชาชน + สำเนาสิทธิถือครองที่ดิน กรณีหน่วยงานรัฐ/เอกชน ใช้หนังสือจากหน่วยงาน และรายละเอียดโครงการ (กรณีขอรับจำนวนมาก)
2. ยื่นคำขอ - ที่ศูนย์เพาะชำกล้าไม้ หรือ สถานีเพาะชำกล้าไม้ใกล้เคียง
3. รับกล้าไม้ - พร้อมรับข้อมูลทางวิชาการ คำแนะนำ จากจนท.ผู้เชี่ยวชาญ
4. ตรวจติดตาม - จนท.จะสุ่มตรวจติดตามผลไม่น้อยกว่าร้อยละ 10 ของผู้มาขอรับกล้าไม้
อำนาจการจ่ายกล้าไม้
- ศูนย์เพาะชำกล้าไม้ ประชาชนทั่วไป 5,000 ต้น/ปี หน่วยงาน 20,000 ต้น/ปี
- สถานีเพาะชำกล้าไม้ ประชาชนทั่วไป 1,000 ต้น/ปี หน่วยงาน 10,000 ต้น/ปี
โดยในช่วงแรก การติดเชื้อ HPV ไม่ได้แสดงอาการให้เห็นชัดนัก การตรวจคัดกรองเชิงรุกจึงมีบทบาทสำคัญที่จะช่วยให้ประชาชนสามารถรู้ตัวและเข้ารับการรักษาได้ทันท่วงที ในประเทศไทย มีการตรวจหาเชื้อ HPV อยู่สองรูปแบบ ได้แก่
ตรวจ PAP Smear (แป๊บสเมียร์) กับสูตินรีแพทย์ ซึ่งเป็นวิธีตรวจผ่านการสอดเครื่องมือเข้าไปในช่องคลอดและนำเซลล์มดลูกส่งแล็บเพื่อตรวจหาเซลล์ที่ผิดปกติ
ตรวจ HPV DNA Testing เป็นการตรวจลึกถึงระดับดีเอ็นเอ ดูการติดเชื้อ HPV ซึ่งมีความแม่นยำสูง ช่วยให้ประเมินความเสี่ยงของโรคได้ตั้งแต่เริ่ม
ทำไมวัคซีนป้องกัน HPV จึงสำคัญ ในเมื่อร่างกายเราขจัดเชื้อได้เอง
1. การตรวจสุขภาพเพื่อคัดกรองความเสี่ยงของการเกิดโรคไม่ติดต่อเรื้อรัง
กลุ่มโรคไม่ติดต่อเรื้อรัง (Non-Communicable disease; NCDs) ได้แก่ โรคเบาหวาน, โรคความดันโลหิตสูง, โรคหลอดเลือดสมองและหลอดเลือดหัวใจ, โรคมะเร็ง, โรคถุงลมโป่งพอง, โรคอ้วน กลุ่มโรคเหล่านี้มักมีสาเหตุมาจากพฤติกรรมเสี่ยงในชีวิตประจำวัน ไม่ว่าจะเป็นการรับประทานอาหารที่ไม่ดีต่อสุขภาพ ขาดการออกกำลังกาย การสูบบุหรี่หรือการดื่มเครื่องดื่มแอลกอฮอล์ ไปจนถึงความเครียดเรื้อรัง (Chronic stress) ที่สั่งสมเป็นเวลานาน การตรวจสุขภาพด้วยวิธีการเจาะเลือด ตรวจปัสสาวะ ไปจนถึงการใช้เครื่องมือทางวิทยาศาสตร์ที่ทันสมัยมาช่วย เช่น MRI, CT scan, DEXA scan เป็นต้น ช่วยให้สามารถระบุภาวะสุขภาพในปัจจุบัน รวมถึงช่วยสร้างความตระหนักถึงความสำคัญของการดูแลสุขภาพ และการมีพฤติกรรมที่ดี อีกทั้งช่วยให้ทีมแพทย์วางแผนการรักษาเพื่อป้องกันการเกิดโรคในอนาคต
การตรวจคัดกรองโรคไม่ติดต่อเรื้อรัง
ได้แก่
การตรวจระดับน้ำตาลในเลือด เพื่อทำการคัดกรองโรคเบาหวานประเภทที่ 2 ซึ่งเกิดจากภาวะดื้ออินซูลิน (Insulin resistance) โดยทำการคัดกรองระดับน้ำตาลในเลือดหลังอดอาหาร และระดับน้ำตาลสะสม (Glycated hemoglobin A1C; HbA1C) ร่วมกับระดับฮอร์โมนอินซูลินในเลือด (Fasting Insulin) เพื่อใช้ในการวินิจฉัยหรือติดตามภาวะดื้อต่ออินซูลิน แม้ว่ายังไม่เคยมีอาการแสดงถึงโรคเบาหวานมาก่อนก็ตาม
การวัดระดับไขมันในเลือด คอเลสเตอรอลรวม (Total cholesterol), ไตรกลีเซอไรด์ (Triglyceride), ไขมันแอลดีแอล (LDL), และไขมันเฮชดีแอล (HDL), และการตรวจโปรตีนซึ่งเป็นองค์ประกอบหลักของคอเลสเตอรอล ได้แก่ Apolipoprotein A, Apolipoprotein B, Lipoprotein (a) ทำให้ทราบความเสี่ยงทางด้านสุขภาพ ระดับไขมันที่สูงเป็นระยะเวลานาน นำไปสู่การเกิดโรคหัวใจและหลอดเลือด (Cardiovascular disease) ทั้งโรคหัวใจและโรคหลอดเลือดสมอง (Stroke) ซึ่งเป็นสาเหตุสำคัญของการเกิดอัมพฤกษ์ อัมพาต และการเสียชีวิตอันดับหนึ่งในประเทศไทย
ความเสี่ยงของโรคหัวใจและหลอดเลือด ด้วยการตรวจ High Sensitivity C-Reactive Protein (hsCRP), ค่าการตกตะกอนของเม็ดเลือดแดง (ESR), ไฟบริโนเจน (Fibrinogen) และ เฟอร์ริติน (Ferritin) เป็นค่าบ่งชี้การอักเสบ หากค่าดังกล่าวในเลือดเพิ่มสูงขึ้น จะสัมพันธ์กับความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจ, การตรวจวัดระดับของโฮโมซิสเตอีน (Homocysteine) เพราะระดับโฮโมซิสเตอีนที่สูงกว่าค่าปกติ จะทำลายผนังด้านในของหลอดเลือด โดยเฉพาะหลอดเลือดขนาดเล็ก เพิ่มความเสี่ยงต่อการอุดตันของหลอดเลือด
การตรวจค่าการทำงานของตับ จากเอนไซม์ AST (SGOT) และ ALT (SGPT) ที่ร่างกายสร้างขึ้นเมื่อตับเกิดความเสียหาย เอนไซม์ Alkaline phosphatase (ALP), Gamma GT (GGT) และบิลิรูบิน (bilirubin) เพื่อดูความผิดปกติของตับและการอุดตันของท่อน้ำดี ร่วมกับการตรวจทางรังสีที่ตับและช่องท้อง ได้แก่ อัลตราซาวด์ช่องท้อง (Abdominal Ultrasound) โดยใช้คลื่นความถี่ และการตรวจด้วยเครื่องแม่เหล็กไฟฟ้า หรือการ MRI ช่องท้องความละเอียดสูงแบบไม่ฉีดสี (MRI Whole Abdomen Non-contrast) ช่วยในการประเมินความผิดปกติต่างๆ เช่น เปอร์เซ็นต์ไขมันพอกตับ, ภาวะไขมันพอกตับ (Fatty Liver) และภาวะไขมันพอกตับอ่อน (Fatty Pancreas), ก้อนเนื้อที่ผิดปกติ หรือเนื้องอกที่อาจพัฒนากลายเป็นมะเร็ง, ความผิดปกติที่ท่อน้ำดีและนิ่วในถุงน้ำดี, ฝีในตับ และการไหลเวียนของเส้นเลือดภายในช่องท้อง
การตรวจสุขภาพตับอย่างสม่ำเสมอ ช่วยให้สามารถวางแผนป้องกันไม่ให้ตับแข็ง และตับอ่อนแข็ง ซึ่งถือเป็นความเสียหายอย่างถาวรของเนื้อเยื่อตับ รวมถึงช่วยให้ค้นพบมะเร็งได้ตั้งแต่ระยะเริ่มต้น เพื่อให้เกิดการรักษาได้อย่างทันท่วงทีไม่ให้เกิดการแพร่กระจายของมะเร็ง
การตรวจการทำงานของไต สามารถประเมินได้จากโปรตีนที่รั่วออกมาในปัสสาวะ (Microalbuminuria), ระดับ BUN (Blood Urea Nitrogen) ในเลือด และค่าอัตราการกรองของไต หรือ eGFR (Estimated Glomerular Filtration Rate) หากไตมีความผิดปกติอาจพบโปรตีนในปัสสาวะ ค่า BUN เพิ่มสูงขึ้น หรืออัตราการกรองของไตเริ่มลดลง
2. นิยาม
การปฏิบัติราชการที่รองรับชีวิตและการทำงานวิถีใหม่ หมายถึง การปฏิบัติราชการรูปแบบใหม่ของภาครัฐที่มีความยืดหยุ่น คล่องตัว มีประสิทธิภาพ โดยใช้ประโยชน์จากเทคโนโลยีดิจิทัลในการปรับรูปแบบวิธีการทำงาน และรูปแบบการบริหารจัดการทรัพยากรให้เกิดประโยชน์สูงสุด เพื่อความเป็นเลิศในการปฏิบัติราชการและการให้บริการประชาชน รวมทั้งเสริมสร้างคุณภาพชีวิตที่ดีของผู้ปฏิบัติงาน นอกจากนี้ ยังหมายรวมถึงการปฏิบัติราชการภายใต้สถานการณ์ภาวะไม่ปรกติที่ส่งผลให้หน่วยงานของรัฐต้องปรับรูปแบบการปฏิบัติราชการให้เกิดความคล่องตัวและสามารถปรับตัวได้ทันต่อเหตุการณ์อีกด้วย
ซีซี รีสอร์ท
รีสอร์ทมีชายหาดส่วนตัว สระว่ายน้ำ ใกล้ท่าเรือปากบารา บรรยากาศดี
สถานที่ : อำเภอละงู จังหวัดสตูล
ดำเนินพวา รีสอร์ท
บูทิครีสอร์ท โอบล้อมด้วยธรรมชาติที่สมบูรณ์ ด้วยแนวคิดปรับสมดุลคืนกลับสู่ธรรมชาติ เพื่อรักษาไว้ซึ่งธรรมชาติที่ยั่งยืน
สถานที่ : อำเภอบางคนที จังหวัดสมุทรสงคราม
ลำพวา
ลำพวา อัมพวา รีสอร์ท เป็นรีสอร์ทสไตล์ Modern Chic มีทั้งหมด 56 ห้อง ที่อยู่ท่ามกลางธรรมชาติ ขนาด 8 ไร่ ติดคลองใหญ่ที่สามารถเชื่อมต่อไปยังแม่น้ำแม่กลอง เส้นที่ไปตลาดน้ำอัมพวา รายล้อมด้วยต้นไม้และลำน้ำที่ไหลผ่านทั่วรีสอร์ท และยังคงความเป็น อัมพวา ไว้ได้อย่างชัดเจน
สถานที่ : อำเภอเมืองสมุทรสงคราม จังหวัดสมุทรสงคราม
นริศภูวิวรีสอร์ท
นริศภูวิว รีสอร์ท บริการห้องพักและอาหารฮาลาล ห้องประชุม สัมมนาและสระว่ายน้ำ ที่ที่เป็นมากกว่า การพักผ่อน ที่ที่สร้างรอยยิ้มให้คุณกับครอบครัว, กลุ่มเพื่อนสนิท, คู่รักของคุณมีความสุข
สถานที่ : อำเภอควนโดน จังหวัดสตูล
โรงแรมฟอร์จูน ริเวอร์วิว เชียงของ
Fortune Riverview Hotel Chiang Khong has 147 rooms with air conditioner, non-smoking, 4 buildings with modern Lanna style, all nearby MeaKhong river. Finest romantic for natural environment with the sunrise that you able to see from the room. Hotel has certified about hygiene safety standards by SHA...
สถานที่ : อำเภอเชียงของ จังหวัดเชียงราย
เชียงของทีคการ์เด้น
โรงแรมเชียงของทีคการ์เด้นริเวอร์ฟร้อน ตั้งอยู่ในเขต อ.เชียงของ จ.เชียงราย ก้าวแรกของการต้อนรับ คุณจะได้สัมผัสกับบรรยากาศและกลิ่นอายผสมผสานระหว่างศิลปะล้านนากับความเป็นร่วมสมัย การพักผ่อนที่ร่มรื่นใต้หมู่ต้นสักอายุกว่าร้อยปี และทิวทัศน์ของแม่น้ำโขงที่ทอดยาวตามทิวเขาของสวป.ลาว โรงแรมมีห้องพักที่ออกแแบ...
สถานที่ : อำเภอเชียงของ จังหวัดเชียงราย
โรงแรมปิยะพรพาวิลเลี่ยน
ใกล้แหล่งช้อปปิ้งแม่สาย
สถานที่ : อำเภอแม่สาย จังหวัดเชียงราย
ม่อนฟ้าใส
โรงแรมม่อนฟ้าใส โฮม รีสอร์ท จ.เชียงราย รีสอร์ทท่ามกลางธรรมชาติวิวเนินเขา ริมทะเลสาบ บริการห้องพัก ห้องประชุม จัดเลี้ยง สัมมนา ใกล้สนามบินแม่ฟ้าหลวงเพียง 10 นาที ติดมหาวิทยาลัยราชภัฏเชียงราย 7 กม. จากตัวเมือง ธรรมชาติใกล้เมืองที่คุณสัมผัสได้ สะอาด ปลอดภัย ได้รับมาตรฐานจาก SHA+
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
โรงแรม วัน บัดเจท แอร์พอร์ต
โรงแรม วันบัดเจท เป็นโรงแรมเปิดใหม่ ตั้งอยู่ในพื้นที่ที่สะดวกสบายของจังหวัดเชียงราย ใกล้สนามบินแม่ฟ้าหลวง และเป็นโรงแรมราคาประหยัด โรงแรมของเราให้บริการห้องพัก 78 ห้อง มีห้องให้เลือก 2 แบบ คือแบบเตียงใหญ่ และ แบบเตียงคู่ ซึ่งทุกห้องมีระบบรักษาความปลอดภัยชั้นเยี่ยม ด้วยระบบคีย์การ์ดเข้าโรงแรมและห้องพ...
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
อิมพีเรียลริเวอร์เฮาส์ รีสอร์ท
ค้นพบเสน่ห์ของเชียงราย ที่โรงแรม ดิ อิมพีเรียล ริเวอร์เฮาส์ รีสอร์ท ด้วยห้องพักที่ได้รับการตกแต่งอย่างมีชั้นเชิง 39 ห้อง ห้องซูพีเรียร์ 3 ห้อง (สไตล์คอทเทจ) ห้องดีลักซ์กว้างขวาง ห้องดีลักซ์วิวแม่น้ำกว้างขวาง และห้องสวีทบัลโคนีวิวแม่น้ำ ที่ได้รับการออกแบบอย่างสวยงามแบบไทย แขกผู้เข้าพักจะหลงใหลในการผส...
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
ไชยนารายณ์ ริเวอร์ไซด์
ไชยนารายณ์ ริเวอร์ไซด์ เป็นอีกหนึ่งในสถานพักผ่อนของกองทัพบก โดยเป็นส่วนหนึ่งของสวัสดิการแก่กำลังพล และเปิดให้บริการแก่ภาคเอกชน และประชาชนทั่วไปด้วยเช่นกัน สไตล์ล้านนาที่เป็นเอกลักษณ์ การออกแบบเน้นการผสมผสานสถาปัตยกรรมอันสวยงามแบบล้านนา เข้ากับสถาปัตยกรรมแบบตะวันตก และอัญเชิญพระนามของ พระองค์ไชยน...
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
โรงแรมแสน โฮเทล
โรงแรมแสน โฮเทล ใจกลางเมืองเชียงรายไกล้เคียงหอนาฬิกา โรงเรียนสามัคคีวิทยาคม วัดมิ่งเมือง สิ่งอำนวยความสะดวกครบครัน
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
เลอ เมอริเดียน เชียงราย รีสอร์ท
ค้นพบความสงบสุขท่ามกลางขุนเขาในดินแดนอารยธรรมล้านนา โรงแรมเลอ เมอริเดียน เชียงราย รีสอร์ท ตั้งอยู่ริมฝั่งแม่น้ำกกใกล้กับสถานที่ท่องเที่ยวต่างๆ ของเมืองเชียงราย เมืองที่เต็มไปด้วยวัฒนธรรมและประวัติศาสตร์ที่น่าหลงใหลสำหรับนักเดินทางทุกท่าน ศิลปะแห่งรสชาติของอาหารและไวน์ชั้นเลิศจากยุโรปได้ถูกถ่ายทอดและ...
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
โมรา บูทีคโฮเทล
This luxury boutique hotel is located in the town of Chiang Rai. We welcome guests who would like to find a comfortable environment to relax.
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
โรงแรมแสนบูติก
โรงแรมแสนบูติก ไกล้เคียงวัดเชียงยืน(วัดแดง) ถ.สันโค้งหลวง บรรยากาศน่าพักผ่อน
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
เดือนฉายรีสอร์ท
ที่พริมแม่น้ำแควใกล้ๆตัวเมืองและคาเฟ่มากมาย ห้องพักแพติดแอร์ บังกะโลและโรงแรม
สถานที่ : อำเภอเมืองกาญจนบุรี จังหวัดกาญจนบุรี
ธารา วิลล่า ริเวอร์แคว รีสอร์ท
นอนเอนกาย ผ่อนคลายชิวๆริมแม่น้ำแคว ชมพระอาทิตย์ตก ใกล้ชิดธรรมชาติ ห้องพัก Pool Villa ริมเเม่น้ำเเควใหญ่ ดีไซน์สุด Cozy และถูกโอบล้อมไปด้วยธรรมชาติสุดร่มรื่น ทั้งสวนสวย ต้นไม้ใหญ่ และสายน้ำล้อมรอบ กับ TARA VILLA จ.กาญจนบุรี
สถานที่ : อำเภอเมืองกาญจนบุรี จังหวัดกาญจนบุรี
ภูชัย รีสอร์ท
บริการดุจญาติมิตร ใกล้ชิดธรรมชาติ
สถานที่ : อำเภอทับคล้อ จังหวัดพิจิตร
บ้านสวย รีสอร์ท
ห้องพักสะอาด บรรยากาศดี เงียบสงบ
สถานที่ : อำเภอทับคล้อ จังหวัดพิจิตร
บ้านสวน รีสอร์ท
บริการดุจญาติมิตร ใกล้ชิดธรรมชาติ
สถานที่ : อำเภอทับคล้อ จังหวัดพิจิตร
วิวไม้ รีสอร์ท
นอนสบาย ปลอดภัย ราคาถูก
สถานที่ : อำเภอทับคล้อ จังหวัดพิจิตร
ฟาร์มเฮ้าส์ระนอง (FarmHouse Ranong)
The FarmHouse Ranong is located in the center of Ranong city. FarmHouse : Hotel, Restaurant, Coffee, Dessert, Souvenir and Travel info. Welcome to Ranong
สถานที่ : อำเภอเมืองระนอง จังหวัดระนอง
สระบัวเดอะเทอเรส โฮมสเตย์
โฮมสเตย์ขนาดเล็ก ใกล้ชิดวิถีชุมชน บนแนวคิดที่เป็นมิตรกับสุขภาพและสิ่งแวดล้อม
สถานที่ : อำเภอเมืองอุทัยธานี จังหวัดอุทัยธานี
โรงแรม คาลิมา รีสอร์ท แอนด์ วิลล่า เขาหลัก
คาลิมา รีสอร์ท แอนด์วิลล่า เขาหลัก รีสอร์ทหรูหราและมีสไตล์ให้บริการที่พักระดับ 5 ดาวที่ตั้งอยู่ริมทะเลที่เงียบสงบเป็นส่วนตัว ด้านหนึ่งของรีสอร์ทเชื่อมต่อกับชายหาดเขาหลักซึ่งเป็นทิศตะวันตกจึงเป็นจุดชมพระอาทิตย์ตกที่สวยงามมาก และอีกด้านหนึ่งของรีสอร์ทจะอยู่ติดกับคลองน้ำธรรมชาติและป่าโกงกาง สถาปัตยก...
สถานที่ : อำเภอท้ายเหมือง จังหวัดพังงา
คาลิมา รีสอร์ท แอนด์ สปา ภูเก็ต
รีสอร์ตสุดหรูแห่งนี้มองเห็นวิวของอ่าวกะหลิมได้ อยู่ห่างจากหาดป่าตอง รวมถึงร้านค้าและร้านอาหารบนถนนบางลา 6 กม. และห่างจากท่าอากาศยานนานาชาติภูเก็ต 32 กม. ห้องพักและวิลล่าทันสมัยมีโต๊ะทำงาน ทีวีระบบช่องสัญญาณดาวเทียม และ Wi-Fi ฟรี รวมถึงตู้เย็นขนาดเล็ก เครื่องชงชาและกาแฟ ส่วนห้องพักที่อัปเกรดมีระเบีย...
สถานที่ : อำเภอกะทู้ จังหวัดภูเก็ต
สุขโฮเทล (SOOK Hotel)
โรงแรมสไตล์มินิมอลเป็นมิตรกับสุขภาพและสิ่งแวดล้อม อยู่บนถนนสายธุรกิจหลัก ถนนคนเดิน ใจกลางเมืองระนอง
สถานที่ : อำเภอเมืองระนอง จังหวัดระนอง
โนโวเทลชุมพร บีช รีสอร์ท แอนด์ กอล์ฟ
Novotel Chumphon Beach Resort and Golf ตั้งอยู่บนสนามกอล์ฟริมชายฝั่งตะวันออกเฉียงใต้ของประเทศไทย โรงแรมแห่งนี้ให้บริการที่พักอันทันสมัย และทิวทัศน์อ่าวไทยอันสวยงาม ห้องพักตกแต่งในสไตล์ร่วมสมัยมีเฟอร์นิเจอร์ไม้ สิ่งอำนวยความสะดวกหลายรายการ พื้นที่ทำงานกว้างขวาง บริการอินเทอร์เน็ต ระเบียงพร้อมทิวทั...
สถานที่ : อำเภอเมืองชุมพร จังหวัดชุมพร
โรงแรม เอเต้
เอเต้ ชุมพร โรงแรมแนวบูติกสไตล์ ภายใต้แนวคิด Relaxury Hotel ที่รวมความหรูหรา สะดวกสบาย และความสุขทุกการพักผ่อนไว้ด้วยกันอย่างลงตัว มาตรฐานการบริการของเราคือ การดูแลแขกทุกคนดั่งบุคคลพิเศษระดับวีไอพี พร้อมด้วยห้องพักตกแต่งเป็นพิเศษ มีเอกลักษณ์เฉพาะตัวให้คุณเอนกายหลับสบาย ด้วยเตียงนอนที่มีขนาดใหญ่ ได้ม...
สถานที่ : อำเภอเมืองชุมพร จังหวัดชุมพร
โคซี่ กระบี่ อ่าวนาง บีช
โคซี่ กระบี่ อ่าวนางบีช เป็นไลฟต์สไตล์โฮเทลแห่งใหม่ล่าสุดในกระบี่ ด้วยสไตล์ที่ทันสมัย เรียบง่าย และที่ตั้งที่ดีที่สุดใจกลางอ่าวนาง ให้โคซี่ กระบี่ อ่าวนางบีช มอบความสะดวกสบายให้กับการพักผ่อนในช่วงวันหยุดของคุณ ด้วยเทคโนโลยีที่ทันสมัยของสมาร์ทโฟนในการเชื่อมต่อกับสมาร์ททีวี เครดิตเงินสดสำหรับอาหารและเ...
สถานที่ : อำเภอเมืองกระบี่ จังหวัดกระบี่
ลาฟลอร่า เขาหลัก
LA FLORA KHAO LAK Only an hour away from Phuket International Airport, La Flora Khao Lak is a sustainable hideaway nestled in the shimmering sand of Bang Niang Beach. Our rooms are consciously designed with modern aesthetics for your comfort. We also integrated local elements into our unique accommo...
สถานที่ : อำเภอตะกั่วป่า จังหวัดพังงา
อ่าวนาง ปริ้นซ์วิลล์ วิลล่า รีสอร์ตเเอนด์สปา
อ่าวนาง ปริ้นซ์วิลล์ วิลล่า รีสอร์ทแอนด์สปา ตั้งอยู่หาดอ่าวนาง ซึ่งเป็นหาดที่มีชื่อเสียงระดับโลกของจังหวัดกระบี่ รีสอร์ทถูกออกเเบบให้มีกลิ่นอายผสมผสานศิลปะภาคใต้เเละความบูทีคได้อย่างลงตัว รวมถึงบรรยากาศในรีสอร์ทที่ร่มรื่นเขียวขจีด้วยพรรณไม้พื้นเมืองรายล้อมรอบสระว่ายน้ำที่มีดีไซน์โดดเด่นเป็นเอกลักษณ...
สถานที่ : อำเภอเมืองกระบี่ จังหวัดกระบี่
ครอสไวบ์บุรีรัมย์
โรงแรมครอส ไวบ์ บุรีรัมย์ ตั้งอยู่ในย่านช้อปปิ้งใจกลางเมืองบุรีรัมย์ที่มีชีวิตชีวา เหมาะสำหรับแฟนกีฬาที่ต้องการดูกีฬามอเตอร์สปอร์ตหรือเกมฟุตบอลบุรีรัมย์ยูไนเต็ด และการออกแบบที่ทันสมัยและบริการที่เป็นมิตรของโรงแรมจะทำให้คุณรู้สึกได้ถึงบรรยากาศที่ดีอย่างแน่นอน
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
พนมรุ้งปุรี
โรงแรมพนมรุ้งปุรี ตั้งอยู่ที่ อ.นางรอง จ. บุรีรัมย์ ระยะทางจากกรุงเทพฯถึงโรงแรมใช้เวลาเพียง 3.5 ชั่วโมง ด้วยถนน 4 เลนตลอดจนถึงหน้าโรงแรม ห่างจากปราสาทหินพนมรุ้งเพียง 20 นาที และห่างจากศูนย์ราชการต่างๆ โบราณสถาน ร้านอาหาร ร้านสะดวกซื้อ รวมถึงตลาดชุมชนในรัศมีไม่เกิน 5 กิโลเมตร โรงแรมได้ให้บริการห้องพ...
สถานที่ : อำเภอนางรอง จังหวัดบุรีรัมย์
โรงแรมฟรายเดย์
โรงแรมฟรายเดย์ เป็นโรงแรมชั้นหนึ่งใจกลางเมืองอุตรดิตถ์ เพียบพร้อมด้วยบริการอันอบอุ่น ห้องพักระดับมาตรฐานสากล หรูหรา กว้างขวาง สะอาด สะดวกสบาย ตั้งอยู่บนชั้น 5 อาคาร ฟรายเดย์สรรพสินค้า มุมพักผ่อนสบายๆ กับการรับประทานอาหารเลิศรส ภายใต้บรรยากาศเย็นสบาย ดนตรีไพเราะที่เดอะ การ์เด้น ผับ แอนด์ เรสโทรองต์ ห...
สถานที่ : อำเภอเมืองอุตรดิตถ์ จังหวัดอุตรดิตถ์
อีซี่โฮเทล2
อีซี่โฮเทล โรงแรมง่ายๆ สไตล์ลำพูน
สถานที่ : อำเภอเมืองลำพูน จังหวัดลำพูน
อีซี่โฮเทล
อีซี่โฮเทล โรงแรมง่ายๆ สไตล์ลำพูน ศูนย์กลางแหล่งท่องเที่ยวในเมืองลำพูน ติดถนนใหญ่ ห้องพักกว้างขวาง สะอาดและอบอุ่น
สถานที่ : อำเภอเมืองลำพูน จังหวัดลำพูน
42C The Chic Hotel Nakhonsawan
นอกจากที่พักจะได้รับการรับรองมาตรฐาน SHA ที่พักยังมีบริการ Wi-Fi ฟรีในทุกห้องพัก และที่จอดรถฟรี ที่พักตั้งอยู่ในย่านใจกลางเมืองนครสวรรค์ของนครสวรรค์ ผู้เข้าพักจึงได้อยู่ใกล้สถานที่ท่องเที่ยวน่าสนใจและร้านอาหารอร่อยๆ ทริปยังไม่จบถ้าไม่ได้แวะไปที่เที่ยวชื่อดังอย่าง สนามบินนครสวรรค์ ด้วยอีกสักที่ ที่พั...
สถานที่ : อำเภอเมืองนครสวรรค์ จังหวัดนครสวรรค์
บีช วอล์ค บูทีค รีสอร์ท
นอกจากที่พักจะได้รับการรับรองมาตรฐาน SHA ที่พักยังมีบริการ Wi-Fi ฟรีในทุกห้องพัก และที่จอดรถฟรี ที่พักตั้งอยู่ในย่านบางแสนของชลบุรี ผู้เข้าพักจึงได้อยู่ใกล้สถานที่ท่องเที่ยวน่าสนใจและร้านอาหารอร่อยๆ ทริปยังไม่จบถ้าไม่ได้แวะไปที่เที่ยวชื่อดังอย่าง หาดบางแสน ด้วยอีกสักที่ ที่พัก 3.5 ดาวคุณภาพสูงแห่งนี...
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
โรงแรมไพร์มไทม์ บางแสน
โรงแรมบางแสน ที่พักบางแสน ใกล้แยกไฟแดงบางแสน เดินทางสะดวกสบาย สงบเงียบเรียบง่ายสไตล์บูติค ห้องพักกว้างขวางเหมาะแก่การพักผ่อน เดินทางสะดวกสบายเพียง 40 เมตรจากแยกไฟแดงบางแสน
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
โรงแรม เดอะ กรีนวิว
โรงแรมเดอะกรีนวิว (THE GREEN VIEW HOTEL) เป็นโรงแรมที่ตั้งอยู่ในเขตพื้นที่อำเภอบางเสาธง จังหวัดสมุทรปราการ โดดเด่นด้วยโครงสร้างสถาปัตยกรรม รายล้อมด้วยต้นไม้นานาพรรณพร้อมทั้งพื้นที่สีเขียว และบริการที่ยอดเยี่ยมตามเอกลักษณ์ของความเป็นไทย ท่านจึงมั่นใจได้ว่าจะได้รับการบริการและประสบการณ์สุดพิเศษที่ยาก...
สถานที่ : อำเภอบางเสาธง จังหวัดสมุทรปราการ
โรงแรมออนป้า
ห้องพักใจกลางบางแสน ใกล้มหาวิทยาลัยบูรพา และชายหาดบางแสน
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
ออนปา โฮเต็ล แอนด์ เรสซิเดนซ์
ที่พักใจกลางบางแสน ใกล้มหาวิทยาลัยบูรพา และชายหาดบางแสน
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
ประธานาธิบดีเกาหลีใต้ ลงพื้นที่
ประธานาธิบดี ยุน ซุก-โยล เดินทางลงพื้นที่ประสบเหตุ หลังจากออกแถลงการณ์ผ่านทางสื่อทีวีในประเทศ ว่า ในฐานะของประธานาธิบดี ขอแสดงความเสียใจต่อเหตุการณ์ รัฐบาลจะดำเนินการทุกวถีทางโดยเร็วตั้งแต่วันนี้ เพื่อควบคุมสถานการณ์ ฟื้นฟูและติดตามมาตรการ รัฐบาลจะดูแลด้านพิธีศพให้กับผู้เสียชีวิต ดูแลด้านการแพทย์ให้กับผู้บาดเจ็บทุกราย และสนองตอบทุกความต้องการของทุกหน่วยงานในการแก้ไขสถานการณ์นี้ และที่สำคัญ ทางการจะทำการสอบสวนหาสาเหตุเพื่อกำหนดมาตรการป้องกัน ไม่ให้เกิดขึ้นอีก กำชับให้กระทรวงมหาดไทยและหน่วยงานที่เกี่ยวข้อง บังคับใช้มาตรการฉุกเฉินสำหรับเทศกาลอย่างฮัลโลวีนหรือเทศกาลอื่นที่จะจัดขึ้นในพื้นที่อื่นๆ ทั่วประเทศ ด้วยเป้าหมายด้านความปลอดภัยเป็นสำคัญ
ประธานาธิบดี สั่งให้ทางการลดธงครึ่งเสา ไว้อาลัยต่อเหตุการณ์และการสูญเสียครั้งนี้ [Yonhop]
ภาพ: Reuters "ศูนย์ปลูกถ่ายกระจกตา" โรงพยาบาลบำรุงราษฎร์ ให้บริการครอบคลุมในทุกการรักษาที่เกี่ยวกับกระจกตา อาทิ กระจกตาติดเชื้อ กระจกตาบวม กระจกตาโก่ง กระจกตาเสื่อมจากพันธุกรรม แผลเป็นที่กระจกตา รวมถึงการปลูกถ่ายกระจกตา ซึ่งผู้ป่วยกลุ่มนี้ควรได้รับการวินิจฉัยและการรักษาในเวลาที่เหมาะสม เพราะอาจส่งผลกระทบต่อการมองเห็น หรืออาจรุนแรงถึงขั้นสูญเสียการมองเห็นถาวรได้
การระบาดของโอไมครอนมีความหลากหลายในรูปแบบของการหมุนเวียนอยู่ในประชากรของโลก ซึ่งทำให้คาดเดาแนวโน้มการระบาดในอนาคตได้ยากขึ้น ดังนั้นผู้เชี่ยวชาญทั่วโลกจึงได้เปรียบการระบาดของโควิดในช่วงปีที่ 3 เสมือน ซุปโอไมครอนสายพันธุ์ย่อย (A soup of omicron subvariants) อันประกอบด้วยหลายหลายสายพันธุ์ย่อยเหมือนซุป เช่น BA.2.75, BA.2.75.2,BQ.1, BQ.1.1, BF.7, XBB, XBB.1,XBB.2, XBB.3,XBB.4, และ XBB.5 มีแข่งขันกันแพร่ระบาดเพื่อความอยู่รอด และเนื่องจากแต่ละสายพันธุ์ย่อยมีการรีไซเคิลตำแหน่งการกลายพันธุ์ของโอไมครอนดั้งเดิม เช่นในตำแหน่ง “R346, L452, K444, F486, N460”
U.S. CDC รายงานสัดส่วนโอไมครอน BA.5 และ BA.4.6 ลดลงอย่างต่อเนื่องเหลือ 49.6% และ 9.6% ในขณะที่ BQ.1 และ BQ.1.1 เพิ่มจำนวนขึ้นเป็น 14% และ 13.1% ตามลำดับ โดยจำนวนผู้ป่วยที่ต้องเข้ารักษาตังใน รพ. และเสียชีวิตจากการติดเชื้อโอไมครอนมิได้เพิ่มขึ้น
จากความท้าทายของตัวเลขเคสดื้อโบที่มีจำนวนเพิ่มขึ้นในปีที่ผ่านมา ศ.พญ.รังสิมา วณิชภักดีเดชา อาจารย์ประจำภาควิชาตจวิทยา คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ร่วมกับ รศ.ดร.นพ.ยุทธนา ศรีนวลประเสริฐ อาจารย์ประจำภาควิชาวิทยาภูมิคุ้มกัน คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล จึงพยายามที่จะแก้ไขวิกฤตของผู้บริโภคที่สงสัยเรื่องภาวะดื้อโบ ด้วยการริเริ่มก่อตั้งศูนย์วินิจฉัยภาวะดื้อต่อโบทูลินัมท็อกซิน โดยการคิดหาวิธีทดสอบวัดปริมาณแอนติบอดี หรือ ภูมิคุ้มกันในเลือดผู้ป่วยที่ส่งผลให้การรักษาด้วยโบทูลินัมท็อกซินเกิดความล้มเหลว รวมไปถึงพัฒนาชุดความรู้ใหม่ให้กับแพทย์ที่เกี่ยวข้องเพื่อช่วยป้องกันการรักษาที่อาจทำให้ร่างกายผู้ป่วยประสบภาวะดื้อโบทูลินัมท็อกซินมากกว่าเดิม
ภายในเว็บไซต์ แบ่งเป็น พื้นที่แสดงงาน 5 ส่วน
1. Information
2. Conference Program
3. Conference Room
4. Sponsor pre-recorded vdo
5. Sponsorship and exhibition area
ระดับปานกลาง 11 ขั้นตอน
เป็นท่าในการยืดกล้ามเนื้อ และฝึกความแข็งแรงของกล้ามเนื้อ และการทรงตัว
Hotel Art Fair - The Standard Bangkok Mahanakhon
Hotel Art Fair
3 - 6 พฤศจิกายน 65
The Standard Bangkok Mahanakhon
Hotel Art Fair ครั้งนี้จัดขึ้นเป็นครั้งที่ 7 แล้ว โดยได้ร่วมมือกับ The Standard, Bangkok ภายใต้คอนเซปต์การจัดงานที่มีชื่อว่า ‘NEW’ โอบรับสิ่งใหม่ไปกับฟาร์มกรุ๊ป ทั้งหมด 28 แกลเลอรีที่คัดสรรมาแล้วจากทั่วประเทศไทยและภาคพื้นเอเชียแปซิฟิก ร่วมด้วย Guest Celebrity Curators 2 ท่าน วันที่ 3-6 พฤศจิกายนนี้
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/HotelArtFairWalking through a Songline จัดแสดง TCDC Bangkok
Walking through a Songline
เริ่มตั้งแต่ 4 - 6 พฤศจิกายน 65
สถานที่จัดแสดง TCDC Bangkok
Walking through a Songline เป็นนิทรรศการสัญจรที่ชวนเข้าไปดื่มด่ำประสบการณ์ใหม่ในการชมผลงานศิลปะในรูปแบบดิจิทัลอาร์ต พร้อมปลุกประสาทสัมผัสอันหลากหลาย ผ่านการนำเสนอแสง สี เสียง ท่ามกลางบรรยากาศเสมือนจริง
นิทรรศการจะพาคุณร่วมตามรอยตำนานที่ขับขานของ Seven Sisters หรือเจ็ดศรีพี่น้องชาวอะบอริจิน ชนพื้นเมืองของออสเตรเลีย ที่โดนพ่อมดเจ้าเล่ห์ไล่ล่าไปทั่วทวีป พร้อมสัมผัสมนตราแห่งศิลปะและภูมิปัญญาโบราณของชาวอะบอริจินผ่านเทคโนโลยีสมัยใหม่ ที่นำเสนอได้อย่างน่าสนใจและลงตัว
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
www.tcdc.or.thบางกอกบานฉ่ำ คลองบางมด
บางกอกบานฉ่ำ
เริ่มตั้งแต่ 5 พฤศจิกายน - 11 ธันวาคม 65
สถานที่จัดงาน ตลอดคลองบางมด
บางกอกบานฉ่ำ เป็นเทศกาลที่สนับสนุนโดยกรุงเทพมหานคร เป็นการจัดเทศกาลศิลปะชุมชน เพื่อเพื่อส่งเสริมอัตลักษณ์ชุมชน ในการพัฒนาเป็นย่านสร้างสรรค์ และส่งเสริมกิจกรรมการท่องเที่ยวในพื้นที่กรุงเทพมหานครให้เป็นที่รู้จักในวงกว้าง
โดยได้จัดกิจกรรมตลอด 21 ย่าน ใน 14 เขตทั่วกรุงเทพมหานคร
สัปดาห์นี้จะเริ่มที่คลองบางมด ชุมชนที่ได้รับคัดเลือกให้เป็น 1 ใน 14 เขตที่ร่วมจัดงานนี้
สุดสัปดาห์นี้ เทศกาลศิลปะชุมชน #บางกอกบานฉ่ำ ที่ชาวชุมชนออกมาแสดงศิลปะจัดงานกัน 21 ย่านทั่วกรุงเทพฯ รวม 14 เขต เริ่มวันแรกเสาร์และอาทิตย์ที่ 5-6 พย. นี้ ชวนสัมผัสประสบการณ์ชุมชนบางมดผ่านการเดิน เล่น เต้น ช้อปที่รายลอ้มรอบด้วยธรรมชาติได้ตั้งแต่ 09.00-21.00น. เลย
รายละเอียดสามารถ กด Join Event พร้อมรับความสดชื่นไปด้วยกัน https://fb.me/e/31emSMQCk หรือ เซฟติสท์ฟาร์ม - SAFETist Farm
และข้อมูลเพิ่มเติมของบางกอกบานฉ่ำที่ กลุ่มดินสอสี dinsorsee creative group ได้เลย
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/events/ลอยกระทง พัทยา ลอยทั้งวัน มหัศจรรย์ทั้งคืน 8 วัน 8 คืน ที่ LegendSiam
ลอยกระทง พัทยา ลอยทั้งวัน มหัศจรรย์ทั้งคืน 8 วัน 8 คืน
5-12 พฤศจิกายน 2565 10 โมงเช้า-เที่ยงคืน ที่ LegendSiam
จัดเต็มความสนุกในบรรยากาศงานวัด แสงสีเสียง ลานเบียร์ และคอนเสริ์ตฟรี บอล เชิญยิ่ม ตั๊ก บริบูรณ์ มินตรา อินทิรา เพียง Champ the Voice all star การแสดงอารยธรรม นำวิถี ประเพณีสยาม
ประเพณียี่เป็งเชียงใหม่
"ประเพณียี่เป็งเชียงใหม่" ประเพณีอันยิ่งใหญ่แห่งดินแดนล้านนา ระหว่างวันที่ 7-9 พฤศจิกายน 2565 ณ บริเวณรอบคูเมืองเชียงใหม่ และภายในเทศบาลเมืองเชียงใหม่ จังหวัดเชียงใหม่ ร่วมสัมผัสบรรยากาศท่ามกลางแสง สี แห่งรัตติกาล สร้างสุขทุกดวงใจให้กับผู้มาเยือน ครั้งแรกกับเทศกาลยี่เป็งเชียงใหม่ บนโค้งแม่น้ำปิงที่ยาวที่สุด 6 ท่าน้ำ และอีก 1 สายน้ำชัยมงคล พร้อมกับกิจกรรมมากมาย
ICONSIAM Bangkok Illumination 2022
ICONSIAM Bangkok Illumination 2022 จุดประกายแสงไฟมหัศจรรย์ส่งท้ายปีด้วยแสงแห่งอนาคตกับเทศกาลประดับไฟตกแต่งอิลลูมิเนชั่นริมฝั่งแม่น้ำเจ้าพระยา ณ ริเวอร์ พาร์ค เฉลิมฉลองเทศกาลแห่งความสุข เทศกาลคริสต์มาส และส่งท้ายปีเก่าต้อนรับปีใหม่ ตอกย้ำความเป็น Global Landmark Destination ของไอคอนสยาม ได้ตั้งแต่วันที่ 1 พ.ย. 65 - 5 ม.ค. 66 ณ ริเวอร์ พาร์ค ไอคอนสยาม พิเศษ! ในวันที่ 1 พ.ย. 65 พบกับมินิคอนเสิร์ตจากอะตอม ชนกันต์ ที่จะมาเติมความสุขให้ทุกคนได้สนุกไปพร้อมกันท่ามกลางแสงสีและเสียงในแบบฉบับของ Global Destination เวลา 19.00 น.
ICONSIAM BANGKOK ILLUMINATION 2022
SMART SOLAR CHRISTMAS LIGHTS
1 พ.ย. 65 – 5 ม.ค. 66 ริเวอร์ พาร์ค ไอคอนสยาม
ศาสตราจารย์ แพทย์หญิงจิรพร เหล่าธรรมทัศน์ คณบดีคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ กล่าวว่า นอกจากจะผลิตนักศึกษาที่มีคุณภาพออกสู่สังคมเรายังมีความร่วมมือกับหลายภาคส่วน ไม่ว่าจะเป็นหน่วยงานภาครัฐ องค์กรท้องถิ่น หน่วยงานการศึกษา หน่วยงานวิจัย และเอกชน เพื่อช่วยกันขับเคลื่อนสังคมผู้สูงวัยไทยให้มีคุณภาพ โดยขณะนี้มีทั้งความร่วมมือกับ สำนักงานการวิจัยแห่งชาติ (วช.) ในการสร้าง Senior Playground หรือ สนามออกกำลังกายสำหรับผู้สูงอายุโดยเฉพาะ เพื่อที่จะได้สนามและเครื่องมือที่ดีมีความเหมาะสม ซึ่งจะได้ผลิตและกระจายสนาม รวมถึงเครื่องมือนี้ให้ไปอยู่ในบ้านผู้สูงวัยเพื่อให้มีสุขภาพที่ดี อีกโครงการหนึ่ง คือการร่วมมือกับมหาวิทยาลัยราชมงคลกรุงเทพ และเอกชนที่เชี่ยวชาญ ในการคิดค้นและผลิตร้องเท้าสำหรับผู้สูงวัย ที่เหมะสมกับเท้าคนไทย มีความคงทน ราคาไม่แพง เพื่อให้ผู้สูงวัยสามารถเดินได้อย่างปลอดภัย
นอกจากนั้นยังมีโรงเรียนนวัตกรรมการบริการสถานพยาบาล ที่มีหลักสูตรผู้บริบาลผู้สูงอายุ และมีโครงการทำสังคมเพื่อนช่วยเพื่อนเปลี่ยนเกษียณให้เป็นพลัง โดยการร่วมมือกับโรงเรียนผู้สูงอายุทั่วประเทศสร้างผู้สูงอายุผู้บริบาล เพื่อให้ผู้สูงอายุที่แข็งแรงได้ไปดูแลผู้สูงอายุที่ไม่สบาย เจ็บไข้ได้ป่วย ติดเตียง ซึ่งเริ่มดำเนินการแล้วขณะนี้ในพื้นที่ภาคเหนือ และต่อไปจะมีการขยายผลไปยังพื้นที่อื่นๆ ทั่วประเทศ
เขตธนบุรี ทำความสะอาด ล้างขัดท่าน้ำ เตรียมงานเทศกาลลอยกระทง
วันที่ 7 พฤศจิกายน 2565 ว่าที่ร้อยตรีเดชาธร แสงอำนาจ ผู้อำนวยการเขตธนบุรี นางสาวอัญชลี ศรีสวัสดิ์ ผู้ช่วยผู้อำนวยการเขตธนบุรี มอบหมายให้นางสาววีณา ทองประดิษฐ์ หัวหน้าฝ่ายรักษาความสะอาดฯ จัดเจ้าหน้าที่ทำความสะอาด เก็บขยะ ล้างจัดท่าน้ำ บริเวณท่าน้ำวัดเวฬุราชิน ท่าน้ำวัดราชคฤห์ ท่าน้ำวัดอินทาราม แขวงบางยี่เรือ
ถนนสวย (ปลูกต้นไม้ 1 ถนน 1 เขต)
ถนนสวย (ปลูกต้นไม้ 1 ถนน 1 เขต) ถนนสามวา ระยะทาง 2.2 กิโลเมตร กว้าง 5.5 เมตร ปลูกต้นทองอุไร 311 ต้น ต้นไทรย้อยใบแหลม 380 ต้น ต้นเฟื่องฟ้า 36,745 ต้น ต้นชาฮกเกี้ยน 9,800 ต้น การปลูกต้นไม้ล้านต้น เป้าหมาย 10,000 ต้น เริ่มดำเนินการเมื่อวันที่ 1 มิถุนายน 2565 ดำเนินการปลูกต้นไม้ จำนวน 14 จุด รวมทั้งสิ้น 7,847 ต้น (ไม้ยืนต้น 232 ต้น และไม้พุ่ม 7,615 ต้น)
ผู้สูงอายุในบ้านเราเป็นกลุ่มไหน?
ในปัจจุบันเราอาจแบ่งผู้สูงอายุเป็น 3 กลุ่ม ได้แก่
1. กลุ่มผู้สูงอายุที่ติดสังคม โดยเป็นผู้ที่ยังมีสุขภาพแข็งแรงดี สามารถออกไปทำงาน ใช้ชีวิตโดยอิสระ มีสังคมเพื่อนฝูง การดูแลผู้สูงอายุกลุ่มนี้จึงแทบไม่แตกต่างจากการดูแลสุขภาพทั่วไป
2. กลุ่มผู้สูงอายุที่ติดบ้าน ซึ่งการติดบ้านอาจไม่ได้แปลว่าเขาไม่อยากออกไปไหน แต่ด้วยสภาพร่างกายหรือปัจจัยอื่น ๆ ทำให้การใช้ชีวิตโดยอิสระเหมือนคนกลุ่มแรกเป็นไปได้ยากกว่า
3. กลุ่มผู้สูงอายุที่ติดเตียง คือผู้ที่มีความลำบากในการดูแลตัวเองขั้นพื้นฐาน เช่น การเข้าห้องน้ำ อาบน้ำแต่งตัว รับประทานอาหาร ซึ่งต้องมีผู้ดูแลอย่างใกล้ชิด
ผู้เป็นเบาหวาน ควรระวังและควบคุมเรื่องอาหาร
รศ. นพ. วิชาญ โชคธนะศิริ ผู้อำนวยการสถาบันการแพทย์จักรีนฤบดินทร์


รศ. นพ. วิชาญ โชคธนะศิริ ผู้อำนวยการสถาบันการแพทย์จักรีนฤบดินทร์ กล่าวว่า “สถาบันการแพทย์จักรีนฤบดินทร์ ก่อตั้งขึ้นเพื่อตอบสนองต่อพันธกิจ ทั้ง 4 ด้าน ได้แก่ การบริการรักษาพยาบาล การศึกษาวิจัย การบริการวิชาการและรับผิดชอบต่อสังคม และการสืบสานศิลปะวัฒนธรรม สำหรับการรักษาพยาบาล ปัจจุบันโรงพยาบาลรามาธิบดีจักรีนฤบดินทร์รองรับผู้ป่วยนอกวันละประมาณ 1,000 คน ในขณะที่เรามีศักยภาพรองรับผู้ป่วยนอกได้กว่า 3,000 คน ต่อวัน ในส่วนของการศึกษาวิจัย มีศูนย์การเรียนรู้ 1 และ 2 หรืออาคารพรีคลินิก ซึ่งรองรับการเรียนการสอนของทั้ง 4 หลักสูตร ซึ่งได้แก่ หลักสูตรแพทยศาสตร์บัณฑิต หลักสูตรพยาบาลศาสตร์ หลักสูตรเวชศาสตร์ฉุกเฉิน และหลักสูตรความผิดปกติของการสื่อความหมาย ซึ่งเป็นหลักสูตรเดียวในประเทศไทย การออกแบบสถาบัน รวมทั้งโรงพยาบาล เน้นให้ตอบสนองต่อการศึกษาวิจัย และ Campus Life (ชีวิตวิทยาเขต) ซึ่งก็คือการใช้ชีวิตร่วมกัน ระหว่างนักศึกษาทั้ง 4 หลักสูตร และบุคลากรทางการแพทย์ มีแอปพลิเคชัน “C Life” หรือ “CNMI Life” ช่วยอำนวยความสะดวกต่อการบริหารจัดการ และการดำเนินชีวิต อาทิเช่น การจองห้องประชุม การจองรถรับส่ง การจองสนามกีฬาและศูนย์ฟิตเนส ในพื้นที่อาคารสันทนาการ เป็นต้น เราเชื่อว่าสิ่งเหล่านี้จะเอื้อต่อการผลิตบุคลากรทางการแพทย์ ที่มีจิตใจเป็นผู้ให้ และสามารถเป็นที่พึ่งให้สังคมได้อย่างดียิ่ง”
ทางด้าน แม่บุตรศรี ศรีสุธีวรรณ อายุ 59 ปี อีกหนึ่งครอบครัวอุปการะ ชาวตำบลบุโพธิ์ อ.ปลายมาศ จ.บุรีรัมย์ ที่เข้าร่วมโครงการฯ มาแต่ปี 2549 เล่าว่าครอบครัวมีอาชีพทำนา ทำไร่อ้อย และเลี้ยงวัว ตนเองมีลูกสาว 2 คน ที่ผ่านมาได้อุปการะเด็กชายมาแล้ว 1 คน ซึ่งได้ไปเป็นบุตรบุญธรรมของครอบครัวต่างชาติแล้ว โดยปัจจุบันยังอุปการะเด็กชายอีก 2 คน ที่ตัดสินใจร่วมเป็นครอบครัวอุปการะเพราะอยากมีลูกชาย ซึ่งการเป็นพ่อแม่อุปการะมีความยากในช่วงแรกที่รับเด็กมาเลี้ยง เนื่องจากต้องปรับตัว เรียนรู้ซึ่งกันและกัน โดยการเลี้ยงดูไม่ได้แตกต่างจากการเลี้ยงลูกแท้ๆ จะเน้นเรื่องการมีเวลาให้กับเด็กอย่างเพียงพอ ให้ความรักและความอบอุ่นอย่างเต็มที่ เอาใจใส่ดูแล ไม่ปล่อยปะละเลย เพราะเชื่อว่าเด็กจะรับรู้ถึงความรักและความห่วงใยที่ครอบครัวมีให้ ซึ่งจะส่งผลให้เค้าเติบโตเป็นคนดีต่อไป ขอขอบคุณมูลนิธิฯ ที่ทำให้ครอบครัวได้มีลูกชายตามที่ต้องการ แม้จะไม่ได้รับเป็นบุตรบุญธรรม แต่ก็จะขอเลี้ยงดูพวกเขาให้ดีที่สุด ให้เติบโตเป็นคนดีมีอนาคตต่อไป
โครงการครอบครัวอุปการะในชุมชนวัฒนธรรม ถือเป็นตัวอย่างของความตระหนักรู้ถึงความสำคัญของ “ครอบครัว” ที่เป็นพื้นฐานสำคัญของเด็กที่จะเติบโตเป็นอนาคตของชาติ ซึ่งนอกเหนือจากครอบครัวเป็นฐานสำคัญในการสร้างความรัก ความอบอุ่นแล้วแล้ว ยังมีชุมชนเป็นเบ้าหล่อหลอม สร้างความผูกพัน เหมือนบ้านเกิดที่เขาจะรักและคิดถึง อยากกลับมาร่วมพัฒนาบ้านเกิด และมิติเชิงจิตวิทยาสังคมวัฒนธรรม การคิดถึง การเกื้อกูล การทำความดี ตอบแทนบุณคุณ การรู้กตัญญู ต่อผู้มีพระคุณ เป็นที่ยึดเหนี่ยวทางจิตใจอย่างมั่นคง เกิดการร่วมสร้างสรรค์สังคมที่ดี พัฒนาทรัพยากรมนุษย์ที่ดีสู่สังคม
เขตพระนคร บริการทุกวันเสาร์ ฟรี LINK
เขตพระนคร นัดทิ้ง นัดเก็บ ขยะชิ้นใหญ่ฯ ทุกวันเสาร์ บริการ ฟรี ไม่มีค่าใช้จ่าย
วันเสาร์ที่ 12 พ.ย.65 พบกันที่ชุมชนวัดนรนาถ เวลา 09.00 - 12.00 น.
สอบถามเพิ่มเติมได้ที่ฝ่ายรักษาความสะอาดฯ โทร. 0 2224 3157
เขตบางแค รับสมัครงาน อาสาสมัครพัฒนาชุมชน 47 อัตรา LINK
สำนักงานเขตบางแค เปิดรับสมัครสอบคัดเลือกบุคคลภายนอกเป็นอาสาสมัครพัฒนาชุมชน จำนวน ชุมชนละ 1 อัตรา รวม 47 อัตรา
โดยต้องเป็นคนบางแค ที่มีภูมิลำเนาหรืออาศัยอยู่ในชุมชนนั้นๆ
ผู้สนใจสามารถเตรียมหลักฐานคุณสมบัติเพื่อขอรับใบสมัครและยื่นใบสมัครด้วยตนเองได้ที่ ฝ่ายพัฒนาชุมชนฯ ชั้น 2 สำนักงานเขตบางแค ระหว่างวันที่ 8 - 15 พฤศจิกายน 2565‼️ ในวันและเวลาราชการ
ประกาศรายชื่อผู้มีสิทธิสอบคัดเลือก ในวันที่ 21 พ.ย. 65 นี้‼️
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายพัฒนาชุมชนฯ สำนักงานเขตบางแค โทร 0 2454 5849 ต่อ 5991
โรค IPD มักพบบ่อยในเด็กเล็ก ผู้สูงวัยก็นับว่าเป็นกลุ่มเสี่ยง - ศาสตราจารย์ แพทย์หญิงกุลกัญญา โชคไพบูลย์กิจ
ด้าน
ศาสตราจารย์ แพทย์หญิงกุลกัญญา โชคไพบูลย์กิจ นายกสมาคมโรคติดเชื้อในเด็กแห่งประเทศไทย กรรมการมูลนิธิวัคซีนเพื่อประชาชน กล่าวว่า “โรค IPD มักพบบ่อยในเด็กเล็ก โดยเฉพาะอย่างยิ่งในเด็กที่อายุน้อยกว่า 2 ปีที่สุขภาพดีไม่มีโรคประจำตัวใด ๆ ก็ตาม นอกจากนี้ยังพบบ่อยในเด็กที่มีโรคประจำตัวโดยไม่ขึ้นกับอายุ เช่น เด็กที่เป็นโรคภูมิคุ้มกันบกพร่อง จากสาเหตุต่าง ๆ ภาวะไม่มีม้ามหรือการทำงานของม้ามบกพร่อง โรคเรื้อรังของอวัยวะต่าง ๆ เช่น โรคปอด (รวมทั้งหอบหืดรุนแรง) โรคหัวใจ โรคตับ โรคไต โรคเบาหวาน และโรคที่เสี่ยงต่อเยื่อหุ้มสมองอักเสบ เช่น น้ำในกระดูกไขสันหลังรั่ว ใส่ชุดประสาทหูเทียม
จากข้อมูลอัตราการเกิดโรค IPD จะเห็นว่า เด็กที่เป็น IPD มีภาวะเสี่ยงเหล่านี้เพียงประมาณ 1/3 เท่านั้น อีก 2/3 เป็นเด็กเล็กที่ไม่ได้มีภาวะเสี่ยงอื่นใด นอกจากอายุน้อย โดยเฉพาะที่น้อยกว่า 1 ปี เพราะ IPD เป็นโรคของเด็กเล็กเป็นหลัก
นอกจากนี้ ผู้สูงวัยที่อายุเกิน 65 ปี ก็นับว่าเป็นกลุ่มเสี่ยง โดยเฉพาะถ้ามีโรคประจำตัว เช่น โรคปอด โรคหัวใจ ภูมิคุ้มกันต่ำจากสาเหตุต่าง ๆ และโรคเรื้อรังต่าง ๆ
ทางสมาคมโรคติดเชื้อในเด็กแห่งประเทศไทยจึงมีคำแนะนำให้ฉีดวัคซีน IPD ให้กับเด็ก โดยในเด็กทารกเริ่มฉีดได้เมื่ออายุ 2 เดือนขึ้นไป และฉีดเข็มต่อไปเมื่ออายุได้ 4 เดือน และ 6 เดือน และครั้งสุดท้ายในช่วงอายุ 12-15 เดือน วัคซีน IPD ที่ใช้ในปัจจุบันมีหลายชนิด แต่ละชนิดมีความสามารถในการครอบคลุมสายพันธุ์ของเชื้อ IPD ที่แตกต่างกันออกไป วัคซีนที่ครอบคลุมสายพันธุ์ก่อโรคในประเทศไทยได้มากกว่าจะป้องกันโรคได้กว้างกว่า
วัคซีนที่ใช้ในปัจจุบันทุกชนิดสามารถลดอุบัติการณ์การเกิดโรค IPD ของสายพันธุ์ที่บรรจุอยู่ในวัคซีนได้ดีมาก และเป็นวัคซีนที่มีความปลอดภัยสูง จึงทำให้หลายๆ ประเทศทั่วโลกต่างบรรจุวัคซีน IPD อยู่ในแผนการสร้างเสริมภูมิคุ้มกันโรค ซึ่งทำให้เด็ก ๆ ในประเทศเหล่านั้นเข้าถึงวัคซีนกันอย่างทั่วหน้า
และการที่เด็ก ๆ เข้าถึงวัคซีนได้มากกว่า 70% จะส่งผลให้เกิดภูมิคุ้มกันหมู่ ซึ่งหมายถึงผู้ที่ไม่ฉีดวัคซีนจะสามารถได้รับภูมิคุ้มกันทางอ้อมไปด้วย ก็จะส่งผลให้ผู้สูงอายุหรือผู้ที่มีโรคประจำตัวเรื้อรังซึ่งเป็นสมาชิกร่วมบ้านกับเด็กเล็ก และเป็นกลุ่มเสี่ยงของโรค IPD เช่นกัน ได้รับการป้องกันไปด้วย
ได้มีการวิเคราะห์ข้อมูลของประเทศไทยแล้วพบว่าการบรรจุวัคซีน IPD เข้าสู่แผนการสร้างเสริมภูมิคุ้มกันโรคจะมีความคุ้มค่าอย่างมาก ช่วยประหยัดงบประมาณของภาครัฐในการรักษาได้เป็นอย่างดี
ในขณะนี้ประเทศไทย มีเด็กไทยเพียงแค่ 10% เท่านั้นที่เข้าถึงวัคซีน IPD เนื่องจากยังไม่ถูกบรรจุอยู่ในแผนการสร้างเสริมภูมิคุ้มกันโรคซึ่งหมายถึงรัฐยังไม่ได้ให้ฟรี ยังคงเป็นวัคซีนที่คุณพ่อคุณแม่ ต้องเสียเงินซื้อเองอยู่
ดังนั้นจึงมีความจำเป็นอย่างยิ่งที่พวกเราทุกคนควรช่วยกันผลักดันให้เด็กไทยเข้าถึงวัคซีน IPD กันมากขึ้นซึ่ง ณ ปัจจุบัน กระทรวงสาธารณสุข โดยคำแนะนำจากผู้เชี่ยวชาญ ได้มีโครงการฉีดวัคซีน IPD นำร่องที่จังหวัดมหาสารคาม เพื่อเตรียมความพร้อมก่อนที่วัคซีน IPD จะบรรจุอยู่ในแผนการสร้างเสริมภูมิคุ้มกันโรคให้เด็กไทยทั่วประเทศ เด็กๆ ในจังหวัดมหาสารคามสามารถเข้าถึงวัคซีนได้ฟรีก่อนจังหวัดอื่น
นอกจากนี้ ทางกรุงเทพมหานคร กำลังดำเนินโครงการให้วัคซีน IPD แก่เด็กในกรุงเทพมหานครแล้ว ที่จริงแล้วหน่วยงานที่เกี่ยวข้องอื่น ๆ ก็สามารถมีบทบาทสำคัญในการผลักดัน หรือทำให้เด็กๆ ได้รับวัคซีนจำเป็นตัวนี้โดยเร็วที่สุดได้เช่นกัน เช่น องค์กรปกครองส่วนท้องถิ่น อาจจัดสรรงบประมาณบางส่วนมาซื้อวัคซีน IPD ให้เด็ก ๆ ในเขตปกครองของตนเช่นเดียวกับกรุงเทพมหานคร
และดังเช่นในวันนี้ สมาคมโรคติดเชื้อในเด็กแห่งประเทศไทย และมูลนิธิวัคซีนเพื่อประชาชน ก็ได้จัดทำโครงการที่สำคัญนี้โดยได้รับการสนับสนุนวัคซีนจากไฟเซอร์ เพื่อให้เด็ก ๆ ที่มีความเสี่ยงสูงต่อ IPD ได้เข้าถึงวัคซีน และได้รับการป้องกันมากขึ้น”
สายการบิน ANA
[ระหว่างประเทศ] ฉันสามารถนำยาขึ้นเครื่องได้หรือไม่ และสามารถนำยามาได้จำนวนเท่าไหร่ [
source]
- ท่านสามารถนำยาขึ้นเครื่องบินได้
- สำหรับยานอกเหนือจากจำนวนที่ต้องใช้ระหว่างเที่ยวบิน เราขอแนะนำให้ท่านใส่ในสัมภาระโหลดใต้ท้องเครื่อง
- เพื่อช่วยอำนวยความสะดวกในการคัดกรองความปลอดภัยที่ราบรื่นยิ่งขึ้น โปรดแจ้งเจ้าหน้าที่หากท่านมีเอกสารที่มีใบสั่งยาหรือใบรับรองแพทย์
- หากท่านไม่มีเอกสารประกอบดังกล่าว โปรดแสดงสมุดบัญชียาหรือคู่มือการใช้ยาของคุณหรือแจ้งเจ้าหน้าที่
- ยาและผลิตภัณฑ์ทางการแพทย์อื่นๆ ได้รับการยกเว้นจากข้อกำหนดของปริมาณของเหลว แต่ต้องผ่านการตรวจคัดกรองความปลอดภัย
- ท่านสามารถพกยาที่จำเป็น (ยาหยอดตา ยาหยอดจมูก เป็นต้น) ขึ้นเครื่องบินได้โดยไม่ต้องใส่ในถุงพลาสติกใส
- โปรดดูที่ สัมภาระที่ถูกจำกัด หน้าสัมภาระที่สามารถนำขึ้นเครื่องบินหรือเช็คอินได้ตามเงื่อนไขในรายการเครื่องสำอางหรือเภสัชภัณฑ์ที่ไม่มีสารกัมมันตรังสี (รวมถึงสเปรย์ฉีดผม) สำหรับปริมาณสุทธิต่อคนหรือภาชนะบรรจุ
[ระหว่างประเทศ] ของเหลวและสเปรย์ประเภทยาแก้คัน ยาฆ่าเชื้อ(Antiseptics) และอื่นๆ สามารถนำขึ้นเครื่องหรือใส่ในสัมภาระเช็คอินได้หรือไม่ [
source]
สิ่งของต่อไปนี้จัดเป็นสิ่งของเครื่องใช้ในห้องน้ำและยาสามารถนำขึ้นเครื่องบินหรือเช็คอินได้หากเป็นไปตามเงื่อนไข
- ยาแก้คัน (ของเหลว, สเปรย์), กันแมลง(ของเหลว, สเปรย์),
- ยาทำให้ปราศจากเชื้อ – ยาฆ่าเชื้อ (Antiseptics) (ของเหลว, สเปรย์)
- ยาแก้ปวด ต้านการอักเสบ (ของเหลว, สเปรย์)
เงื่อนไข
- อนุญาต ถือขึ้นเครื่อง ได้ - ต้องเป็นไปตามข้อกำหนดของเหลว เจล สเปรย์ (LAGs) ที่นำขึ้นเครื่อง
- อนุญาต ให้ถือเช็คอิน ได้
- ปริมาณต่อบรรจุภัณฑ์ เท่ากับหรือน้อยกว่า 0.5 ลิตร หรือ 0.5 กก. เท่ากับหรือน้อยกว่า
- ปริมาณต่อบุคคล เท่ากับหรือน้อยกว่า 2 ลิตร หรือ 2 กก. - จำนวนข้างต้นต่อบุคคลเป็นจำนวนรวมทั้งหมดของสิ่งของเครื่องใช้ในห้องน้ำ ยาและสเปรย์
หัวฉีดสเปรย์จะต้องได้รับการป้องกันด้วยฝาปิดหรือวิธีการอื่นที่เหมาะสมเพื่อป้องกันการปล่อยสารโดยไม่ได้ตั้งใจ
[หมายเหตุ] ยาฆ่าแมลงที่มีสารพิษจัดเป็นสินค้าอันตรายและไม่สามารถนำขึ้นเครื่องบินหรือเก็บในสัมภาระโหลดใต้ท้องเครื่องได้ตามกฎหมาย
ร้านกัญชาบนถนนสุขุมวิท
Mary Jane Bangkok
Thai Cannabis Club Nana Hotel
HighHerb Club - Cannabis Dispensary
Wonderland Bangkok
Happy Smile BKK
Weed shop
Thai Cannabis Club
Barnabis
Juicy Buds
Elevate BKK
Best Buds
Green Thumb 420
Dr Green Bangkok
Chopaka.shop
Four Twenty Dispensary High Garden
Buds and Brew
Kush House
WeedMan BKK
Sukhumweed
Fat Buds Weed Shop Ekkamai
Heaven of weed SOHO community
ReLeaf Cannabis Dispensary
Alchemi Botanics Cannabis
Weed Express
HollyWeed On Nut Cannabis - Weed Dispensary
*ขาดร้านใดไป แล้วอยากเพิ่มในลิสต์นี้ แจ้งมาที่ healthserv.net@gmail.com
วิธีสังเกต แบบไหนเป็นฟิชชิ่งหลอกลวง
1. ใช้อีเมล์/ผู้ส่ง/SMS ที่ไม่รู้จัก แต่คล้ายจริง
2. ใช้ภาษา ไม่เป็นทางการ ผิดไวยากรณ์ บางทีฟังดูเหมือนใช้โปรแกรมแปลภาษามา ไม่ใช่ภาษาเขียนแบบปกติทั่วไป
3. เนื้อหา เกี่ยวกับความผิดปกติ ที่ผิดวิสัย เกินจริง กับแนะนำ/ชี้นำ/หลอกล่อ ให้ทำหรือคลิกหรือเปิดไฟล์ที่แนบมา จุดนี้สำคัญและจำไว้ว่า "ห้ามทำอะไรใดๆ" ทั้งสิ้น ห้ามคลิก ห้ามเปิดดู เพราะเหล่านั้นจะทำให้เกิดอะไร จะไม่มีทางรู้ และอาจจะสายไป หากทำลงไป
4. ลิงค์ปลอม แทบทั้งหมดของอีเมล์ / SMS หลอกลวงจะมีลิงค์เพื่อให้คลิก วิธีเช็คคือ เอาเม้าส์ไปบนลิงค์ แต่ห้ามคลิกนะ แล้วดูว่าลิงค์นั้นไปยังชื่อเว็บไซต์ (URL) อะไร รู้จักไหม แต่ก็ต้องดูให้ดีๆ อีก เพราะส่วนใหญ่ก็เป็นชื่อเว็บไซต์ปลอม แบบปลอมเหมือนมาก เช่น สะกดต่างเล็กน้อย เปลี่ยนตัวสะกด เป็นต้น
5. เอกสารแนบ ถ้ามีไฟล์แนบไม่มีนามสกุลบ้าง นามสกุลไม่รู้จักบ้าง อันนี้ชัวร์ ห้ามคลิกเด็ดขาด
Mai Khao Weed
ร้านสดชื่นด้วยเถาไม้เลื้อย ภายโปร่งเบา Beach style ใต้ร่มธงนานาชาติ ที่ชวนเชิญมาเสพสันติภาพร่วมกัน ไม่สร้างสงคราม
ส่งต่อพลังให้แก่ผู้คน (Power to the People)
“แบรนด์ควรให้ความสำคัญกับผู้บริโภคมากกว่าเดิม ผู้บริโภคในปัจจุบันกำลังเปลี่ยนแปลงแบรนด์ด้วยเงินและเสียงของพวกเขา ซึ่งจะไม่จบเพียงแค่คำว่า ‘ลูกค้าเป็นฝ่ายถูกเสมอ’ อีกต่อไป เพราะผู้บริโภคกำลังร่วมลงทุน ร่วมสร้างสรรค์ และร่วมลงความเห็นในการตัดสินใจเพื่อการเปลี่ยนแปลงไปพร้อมกันกับแบรนด์ เพื่อตอบสนองต่อความต้องการดังกล่าวแบรนด์จึงต้องรับฟังและตอบสนอง ในขณะที่ยังคงให้ความสำคัญกับนวัตกรรมของตลาดในเวลาเดียวกัน
“ชุมชน NFT และ Web3 กำลังสร้างช่องทางใหม่ เพื่อรองรับการลงทุนจากผู้บริโภค เปิดโอกาสให้พวกเขาได้ร่วมเป็นเจ้าของแบรนด์ และเชื่อมตัวเองเข้ากับความสำเร็จและการเติบโตของแบรนด์ ในอนาคต แบรนด์จะมุ่งดูแลตัวตนเฉพาะของผู้บริโภคที่จงรักภักดีต่อแบรนด์และตัดสินใจลงทุนในแบรนด์ ซึ่งจะทำให้เอกลักษณ์โดยรวมของแบรนด์เปลี่ยนไปเป็นหน่วยธุรกิจขนาดเล็กลงที่สามารถตอบสนองความต้องการของผู้บริโภคได้ตรงจุดมากขึ้น”
เกษมราษฎร์ รามคำแหง จัดแพคเกจ ดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน HOME ISOLATION เริ่มต้น 2000 บาท LINK
โรงพยาบาลเกษมราษฎร์ รามคำแหง ให้บริการ ดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน แพ็กเกจนี้เหมาะสำหรับ
- ผู้ที่มีผลตรวจ ATK หรือ RT-PCR พบเชื้อ
- ผู้ป่วยอายุ 5-60 ปี
- ผู้ป่วยมีอาการไม่รุนแรง สามารถดูแลตนเองได้
- อยู่คนเดียว หรือมีที่พักอาศัยที่มีห้องแยก
- ผู้ป่วยไม่มีโรคประจำตัวรุนแรง
แพ็กเกจ HOME ISOLATION ดังนี้
✅ PACKAGE 1 ราคา 2,000 บาท
✅ PACKAGE 2 ราคา 3,500 บาท
✅ PACKAGE 3 ราคา 3,500 บาท
✅ PACKAGE 4 ราคา 4,000 บาท
✅ PACKAGE 5 ราคา 6,500 บาท
✅ แพ็กเกจยา ราคา 2,900 บาท
✅ แพ็กเกจยาและอุปกรณ์ ราคา 3,000 บาท
- ราคานี้สามารถซื้อได้ทั้งคนไทยและต่างชาติ
- ตั้งแต่วันนี้ - 31 ธันวาคม 2565 หรือจนกว่าจะมีการเปลี่ยนแปลง
สอบถามรายละเอียดเพิ่มเติม ได้ที่ คลินิกโรคติดเชื้อระบบทางเดินหายใจ (ARI Clinic)
โทร. 02-339-0000 ต่อ 1050-1051
ใจสั่น แน่นหน้าออก เหนื่อยง่าย
ปรึกษาแพทย์โรคหัวใจ
นพ.ศิรพัชร์ พูนวุฒิกุล
เติมวิตามินอย่างไรได้ประโยชน์สูงสุด
ปรึกษาแพทย์ศูนย์เวชศาสตร์ชะลอวัย
พญ.ธนพร เอี่ยมประไพ
ไอไม่หาย เหนื่อยง่าย หายใจไม่อิ่ม
ปรึกษาแพทย์เฉพาะทางโรคระบบทางเดินหายใจ
พญ.สุธาสินี กลั่นแก้ว
ปัสสาวะเป็นฟอง ตัวบวม เสี่ยงโรคไต
ปรึกษาแพทย์โรคไต
นพ.อำนวย ศิริโสภา
ปวดคอ ปวดหลังเรื้อรัง นานกว่า 3 เดือน
ต้องการหาแนวทางการรักษารูปแบบใหม่ ปรึกษาแพทย์เฉพาะทาง
นพ.บดินทร์ วโรดมวนิชกุล
11 พ.ย. 65 ฟ้องศาลปกครองถอนกัญชาเสรี
ฟ้องศาลปกครองถอนกัญชาเสรี
- นพ.สมิทธิ์ ศรีสนธิ์ กรรมการแพทยสภา และนายกสมาคมแพทย์นิติเวชแห่งประเทศไทย พร้อม ส.ส.พรรคฝ่ายค้านประกอบด้วย นายสุทิน คลังแสง รองหัวหน้าพรรคเพื่อไทย (พท.) นายณัฐวุฒิ บัวประทุม รองหัวหน้าพรรคก้าวไกล(ก.ก.) พ.ต.อ.ทวี สอดส่อง เลขาธิการพรรคประชาชาติ (ปช.) นายรัตน์ วรศสิริน รองหัวหน้าพรรคเสรีรวมไทย(สร.) และนายนิคม บุญวิเศษ หัวหน้าพรรคพลังปวงชนไทย(พลท.) เข้ายื่นฟ้อง นายอนุทิน ชาญวีรกูล รมว.สธ.และคณะกรรมการ ป.ป.ส. ต่อศาลปกครองกลาง เพื่อขอให้มีคำพิพากษาเพิกถอนประกาศกระทรวงสาธารณสุข (สธ.) ลงวันที่ 8 ก.พ. 2565 เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ.2565 โดยให้มีผลย้อนหลังไปถึงวันที่มีการออกประกาศดังกล่าว และให้กัญชาเป็นยาเสพติดให้โทษประเภทที่ 5 ตามประกาศ สธ.ลงวันที่ 8 ธ.ค. 2563 เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภทที่ 5 พ.ศ.2563 ดังเดิม พร้อมขอให้ศาลมีคำสั่งคุ้มครองชั่วคราวด้วยการทุเลาการบังคับ ตามประกาศ สธ.ดังกล่าวไว้เป็นการชั่วคราวก่อนการพิพากษาคดี เนื่องจากเห็นว่า ที่ รมว.สธ. และ ปป.ส.ออกประกาศ สธ.เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ.2565 เป็นผลให้กัญชาไม่เป็นยาเสพติดให้โทษต่อไป เป็นการกระทำที่ไม่สุจริตและเป็นการใช้ดุลพินิจโดยมิชอบ เพราะการออกประกาศไม่มีมาตรการทางกฎหมายออกมาควบคุม คุ้มครองผู้บริโภคเกี่ยวกับกัญชาโดยเฉพาะ ขัดนโยบายรัฐบาลที่แถลงไว้กับรัฐสภาว่าจะแก้ปัญหายาเสพติดอย่างจริงจังทั้งระบบ ข้อกำหนดที่ออกมาไม่ชัดเจนว่ากรณีใดเป็นการใช้ทางการแพทย์หรือนันทนาการ ประกาศดังกล่าวทำให้กัญชาเสรีจนเกินไป ไม่มีการใคร่ครวญอย่างละเอียด และไม่มีกฎหมายควบคุมจนเด็กและเยาวชนเข้าถึงได้ง่าย จึงเห็นว่า ควรจะทุเลาประกาศนี้ออกไปก่อน ซึ่งจะไม่มีผลต่อการใช้ทางการแพทย์ เพราะมีประกาศเดิมรองรับอยู่แล้ว
- นพ.วาโย อัศวรุ่งเรือง ส.ส. แบบบัญชีรายชื่อ พรรคก้าวไกล (ก.ก.) พร้อมด้วย นายชัยธวัช ตุลาธน เลขาธิการพรรค ยื่นหนังสือ ต่อผู้ตรวจการแผ่นดิน ร้องเรียนการไม่ปฏิบัติตามกฎหมาย หรือปฏิบัตินอกเหนือหน้าที่ของ รมว.สธ. และคณะกรรมการ ป.ป.ส. และเสนอแนะให้มีการปรับปรุงกฎหมาย จากกรณีการออกประกาศกระทรวงสาธารณสุข เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 เมื่อวันที่ 8 กุมภาพันธ์ 2565 ซึ่งมีผลในการปลดล็อกกัญชาออกจากเป็นพืชยาเสพติด แม้ว่าจะมีการควบคุมกัญชาเป็นสมุนไพรควบคุม แต่เด็ก และเยาวชน มีการเข้าถึงกัญชากันอย่างแพร่หลาย ทำให้สะท้อนเห็นภาพสภาพบังคับของกฎหมาย พ.ร.บ. ส่งเสริมการแพทย์แผนไทย ที่บัญญัติให้กัญชาเป็นพืชสมุนไพรควบคุม และยังไม่สามารถทำให้เกิดสภาพบังคับที่แท้จริงของกฎหมายได้
-รศ.ดร.โอฬาร ถิ่นบางเตียว อาจารย์ประจำคณะรัฐศาสตร์และนิติศาสตร์ ม.บูรพา กล่าวถึง ความเคลื่อนของพรรคก้าวไกล โดย นพ.วาโย ว่า เรื่องนี้พรรคก้าวไกลจะได้รับแรงต้านอย่างยิ่ง เพราะอย่าลืมว่า พรรคก้าวไกลเอง ก็เป็นพรรคหนึ่งที่สนับสนุนนโยบายกัญชา หัวหน้าพรรค ก็เคยพูดเรื่องการใช้กัญชาเพื่อสันทนาการ ในการกระตุ้นเศรษฐกิจ แล้วอยู่ดีๆ มาเปลี่ยนจุดยืน แบบนี้จะถูกมองได้ว่าเป็นการทำลายความไว้วางใจของประชาชน ต้องระมัดระวัง
-นายประพัฒน์ ปัญญาชาติรักษ์ ประธานสภาเกษตรกรแห่งชาติ แสดงความไม่เห็นด้วยกับการเคลื่อนไหวของพรรคฝ่ายค้าน โดยเฉพาะพรรคก้าวไกล ว่า แทนที่จะมาขัดขวางกัน ทำไมถึงไม่ให้ความรู้ประชาชนว่ากัญชาควรจะใช้อย่างไรให้เกิดประโยชน์ เพราะเรื่องร่าง พ.ร.บ.กัญชาฯ ก็หนุนให้ ผ่านวาระ 1 มาด้วยกัน ท่าทีก็สนับสนุนเรื่องให้ประชาชนเข้าถึงการใช้ประโยชน์จากกัญชา แต่มาวันนี้ นพ.วาโย กลับจะเอากัญชา กลับไปเป็นยาเสพติดอีกแล้ว
ร่าง พ.ร.บ.กัญชา กัญชง..
-นพ.ชลน่าน ศรีแก้ว หัวหน้าพรรคเพื่อไทย กล่าวว่า ร่าง พ.ร.บ.กัญชาฯ ที่อยู่ในสภา จะมีการพิจารณาวาระ 2 โดยจะพิจารณาเป็นรายมาตรา มี ส.ส.และกรรมาธิการ (กมธ.) ได้สงวนความเห็นและสงวนคำแปรญัตติไว้ หากคำสงวนนั้นสามารถสู้ได้ และสามารถปรับแก้คำแปรญัตติในรายมาตรานั้นได้ ก็อาจจะมีการพิจารณาลงมติในความเห็นชอบในมาตรานั้น แต่เท่าที่ดูกฎหมายเดิมมี 45 มาตรา ได้เพิ่มเป็น 95 มาตรา ฉะนั้นการแก้ไขรายมาตราเป็นเรื่องยาก และ กมธ.ไม่ได้รับข้อเสนอจากพรรค พท. พรรคประชาธิปัตย์ (ปชป.) และองค์กรแพทย์ฯ ไปปรับแก้เลย และมีการส่งร่างเดิมกลับเข้ามา หาก กมธ.เสียงข้างมากไม่ปรับแก้ในรายมาตรา ต้องโหวตไม่เห็นด้วยอยู่แล้ว และในวาระ 3 หากไม่มีการปรับแก้อะไร ไม่สามารถให้ความเห็นชอบได้ คือการคว่ำร่าง พ.ร.บ.ฉบับนี้
- น.ส.พิมพ์รพี พันธุ์วิชาติกุล ส.ส. บัญชีรายชื่อ พรรคประชาธิปัตย์ (ปชป.) กล่าวว่า ร่างกฎหมายฉบับนี้ยังมีช่องโหว่ ขาดความรัดกุม เพราะไม่ได้เน้นประโยชน์ทางการแพทย์อย่างที่มีการกล่าวอ้าง แต่กลับนำช่องว่างไปมอมเมาได้ และยังมุ่งในเชิงเศรษฐกิจมากกว่าการใช้เพื่อผู้ป่วย ดังจะเห็นได้จาก นายอนุทิน ชาญวีรกูล รองนายกฯ และ รมว. สธ. ใช้ตัวเองเป็นพรีเซ็นเตอร์ ถ่ายภาพคู่ กับไอศกรีมรสนมฮอกไกโด ผสมกัญชา พร้อมสุภาษิต "สองคนยลตามช่อง คนหนึ่งมองเห็นโคลนตม อีกคนตาแหลมคม เห็นดวงดาวอยู่แพรวพราว" ซึ่งไม่สามารถตีความเป็นอย่างอื่นไปได้ นอกจากการมุ่งไปที่การแสวงหาประโยชน์จากกัญชา ถือว่านอกขอบเขตกัญชาทางการแพทย์
กัญชาทางการแพทย์
-นพ.ณรงค์ อภิกุลวณิช รองปลัด สธ. ให้สัมภาษณ์ว่า ปัจจุบัน สธ.ได้กำหนดมาตรการ 5 ด้าน เพื่อสนับสนุนการใช้กัญชาอย่างปลอดภัย คือ 1.การส่งเสริมให้เกิดการใช้ที่เหมาะสม 2.การบังคับใช้กฎหมายอย่างมีประสิทธิภาพ 3.การเฝ้าระวังป้องกันการใช้ในทางที่ผิด 4.การวางระบบการดูแลรักษาพยาบาลและบำบัดรักษา และ 5.การกำกับติดตามผลการขับเคลื่อนตามมาตรการที่กำหนด นอกจากนี้ สธ.ยังได้ตั้งอนุกรรมการขับเคลื่อนนโยบายกัญชาทางการแพทย์ ที่มีบทบาทในการประสานความร่วมมือของหน่วยงานภายในกระทรวง เพื่อให้เกิดการกำกับ ติดตามนโยบายอย่างเป็นระบบ และรายงานต่อคณะกรรมการขับเคลื่อนกัญชาทางการแพทย์ ขณะที่ประชาชนก็มีความเคลื่อนไหวอย่างต่อเนื่อง โดยในวันที่ 14 พฤศจิกายน 2565 เครือข่ายภาคประชาชน นำโดยเครือข่ายเขียนอนาคตกัญชาไทย จะมีการแถลงข่าวที่สวนครูองุ่น ทองหล่อ ซอย 3 เพื่อประกาศจุดยืน ถึงความจำเป็นที่ต้องมีกฎหมาย พ.ร.บ.กัญชา เพื่อการควบคุมการใช้กัญชาในประเทศไทย รวมทั้งมีการเสวนาระดมความคิดเห็น ก่อนจะรวบรวมเพื่อนำเสนอต่อพรรคการเมืองในสภาผู้แทนราษฎรและวุฒิสภา ในนามเครือข่ายภาคประชาชนต่อไป
-นพ.ศักดา อัลภาชน์ ผู้ช่วยปลัด สธ. ในฐานะเลขาฯ อนุกรรมการขับเคลื่อนนโยบายกัญชาทางการแพทย์ กล่าวว่า เพื่อให้เกิดการนำข้อมูลไปใช้วางแผนและบริหารจัดการสถานการณ์ได้อย่างมีประสิทธิภาพ ศูนย์เทคโนโลยีสารสนเทศทางการแพทย์ก็เข้ามาช่วยวางระบบการรายงานผลการดำเนินงานและสื่อสารผ่านเครือข่ายสารนิเทศของกระทรวง และทำความเข้าใจกับพื้นที่ในการทำงาน ตอนนี้เราจึงมีข้อมูลที่จะจัดการปัญหาได้อย่างเป็นระบบ ในส่วนของข้อห่วงใยทางสังคม เรามีระบบการรับฟังปัญหาของสังคมผ่านทางช่องทางสื่อสารต่างๆ แบบเรียลไทม์ ที่จะทำให้เราสามารถจัดการกับความเข้าใจข้อห่วงใยของสังคมได้อย่างทันท่วงที ทำงานเป็นทีม ที่มีเป้าหมายตรงกัน คือให้คนไทยปลอดภัย ใช้กัญชาให้ถูก ให้เกิดประโยชน์ต่อสุขภาพ
-กัญชาทางการแพทย์ เป็นเรื่องใหม่สำหรับคนไทยแต่ถ้าทุกฝ่ายร่วมกันทำความรู้ ความเข้าใจ และนำไปใช้อย่างถูกวิธี ก็จะเกิดประโยชน์มหาศาลทั้งด้านการรักษาทางการแพทย์ ตลอดจนด้านเศรษฐกิจของประเทศในอนาคต
ผ่าตัดข้อเข่าเสื่อมด้วยหุ่นยนต์แบบแผลเล็ก ศูนย์กระดูกและข้อ โรงพยาบาลธนบุรี บำรุงเมือง
รพ.ธนบุรี บำรุงเมือง มีบริการแพ็กเกจผ่าตัดข้อเข่าเสื่อมด้วยหุ่นยนต์แบบแผลเล็กที่จะทำให้เจ็บน้อย ฟื้นตัวเร็ว และสามารถกลับไปใช้ชีวิตได้อย่างปกติ โดย ทีมแพทย์ผู้ชำนาญการมีประสบการณ์อย่างดีในการผ่าตัด สอบถามเพิ่มเติมได้ที่ ศูนย์กระดูกและข้อ ชั้น 3 โรงพยาบาลธนบุรี บำรุงเมือง
ตาราง Group B
| |
Group B |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
อังกฤษ |
2 |
2 |
1 |
0 |
9 |
2 |
7 |
7 |
| 2 |
สหรัฐอเมริกา |
2 |
1 |
2 |
0 |
2 |
1 |
1 |
5 |
| 3 |
อิหร่าน |
2 |
1 |
0 |
2 |
4 |
7 |
-3 |
3 |
| 4 |
เวลส์ |
2 |
0 |
1 |
2 |
1 |
6 |
-5 |
1 |
ชนะ สัมพลัง นายกสมาคมสถาปนิกสยาม
ชนะ สัมพลัง นายกสมาคมสถาปนิกสยาม ในพระบรมราชูปถัมภ์ กล่าวว่า เป็นปีแรกของการจัดงาน “WOW Festival 2022 อัศจรรย์เมืองน่าอยู่” ที่เรามีเป้าหมายหลักให้เป็นเทศกาลประจำปีของคนกรุงเทพฯ และนักท่องเที่ยวทั้งชาวไทยและต่างชาติ ที่สามารถเข้ามาร่วมงานเทศกาลในครั้งนี้ได้ โดยจัดแสดงเนื้อหาและกิจกรรมเกี่ยวกับคุณภาพชีวิตของคนเมือง ตั้งเป้าจัดงานเป็นประจำทุกปี เพื่อเป็นการสร้างประสบการณ์ของการมีเมืองที่น่าอยู่ ในอนาคตอาจมีการย้ายเทศกาลไปยังเมืองอื่นๆ ในประเทศเพื่อให้เกิดการตระหนัก และริเริ่มสร้างคุณภาพชีวิตที่ดีร่วมกัน ความน่าสนใจของงานในครั้งนี้นอกจากเป็นความร่วมมือจากหลายภาคส่วนแล้ว ตลอดการจัดงาน 5 วัน จะได้พบกับส่วนไฮไลต์ 9 Pavilions ผ่านกิจกรรมกว่า 20 กิจกรรม รวมถึงผู้เชี่ยวชาญเกี่ยวกับเมืองด้านต่างๆ กว่า 100 ราย ที่จะมาให้ความรู้และแลกเปลี่ยนทัศนคติเกี่ยวกับเมือง งานนี้จะเป็นพื้นที่สร้างประสบการณ์แห่งความสุข เปิดพื้นที่ให้คนทั่วไปได้มีประสบการณ์ร่วมกันว่า เมืองที่น่าอยู่ในมิติต่าง ๆ เป็นอย่างไร
2.2 Banner H เฉพาะหน้า homepage
ภาพแสดงตำแหน่งแบนเนอร์ Banner H แสดงเฉพาะหน้า homepage บนอุปกรณ์ต่างๆ (แบบที่ไม่มี Banner A ด้านบน)
• แบนเนอร์แนวนอน ขนาด 980x350 pixel
• แสดงเฉพาะที่หน้า Homepage
• รูปแบบการแสดง เป็น Fix banner (กรณีมีแบนเนอร์เดียว) หรือแบบสไลด์แบนเนอร์ (กรณีมีแบนเนอร์หลายอัน)
ด้าน ศ. คลินิก นพ.วิศิษฎ์ วามวาณิชย์ ผู้อำนวยการโรงพยาบาลศิริราช กล่าวเสริมว่า การระดมทุนเพื่อโรงเรียนกายอุปกรณ์สิรินธร นอกจากจะเป็นการสนับสนุนด้านการศึกษาเพื่อผลิตบุคลากรด้านกายอุปกรณ์แล้ว ยังมีส่วนช่วยในการจัดหาเครื่องมือวิจัยที่มีเทคโนโลยีทันสมัยและมีประสิทธิภาพสูงและเพิ่มคุณภาพทางการรักษา นอกจากนี้ เพื่อแก้ปัญหาคนพิการกว่า 40% เข้าไม่ถึงบริการด้านกายอุปกรณ์จากผู้มีความจำเป็นทั้งหมด 500,000 คน โรงเรียนฯ จำเป็นต้องพัฒนาระบบ
บริการกายอุปกรณ์ เพื่อการเข้าถึงสำหรับผู้ป่วยโดยการผสมผสานเทคโนโลยีและเครือข่ายการสื่อสารเข้ามาช่วยเสริม
“ไม่เพียงเท่านี้ โรงเรียนฯ ยังมีแผนงานปรับปรุงพื้นที่อาคารโรงเรียนกายอุปกรณ์สิรินธรตามหลักการออกแบบเพื่อคนทั้งมวล (Universal design for ALL) ที่เหมาะสมกับผู้ป่วยและพิการที่มีปัญหาในการเคลื่อนไหว ให้เป็นตัวอย่างของอารยสถาปัตย์ในหน่วยงานสาธารณสุข พร้อมสร้างความตระหนักให้สังคมว่า ‘คนพิการไม่ได้ต้องการความสงสารแต่ต้องการโอกาสในการอยู่ร่วมกับผู้อื่นในสังคม’ จึงมีความจำเป็นที่ทุกคนในสังคมต้องให้ความร่วมมือ ช่วยเหลือ ไม่ใช่เป็นภาระและหน้าที่ของหน่วยงานใดหน่วยงานหนึ่ง ต้องอาศัยพลังความร่วมมือทั้งภาครัฐและเอกชน จึงอยากเชิญชวนให้ทุกท่านมาร่วมกันบริจาคเพื่อผลักดันให้คนเหล่านี้มีที่ยืนในสังคมร่วมกับพวกเรา”
Set B Premium Wellness Set
Set B Premium Wellness Set
ราคา 3,900 บาท (จากราคาปกติ 4,429 บาท) พร้อมกระเป๋าผ้าลายพิเศษ จาก NaRaYa
ประกอบไปด้วย Cordyceps Mix C จำนวน 1 กล่อง ถั่งเช่าสายพันธุ์ Cordyceps sinensis มีผลการวิจัยทางวิทยาศาสตร์รองรับถึงสรรพคุณที่มีประโยชน์ต่อสุขภาพ จากการเพาะเลี้ยงในห้องปฏิบัติการที่มีการควบคุมอุณหภูมิ และความชื้น ผ่านการตรวจวิเคราะห์จุลินทรีย์ที่ทำให้เกิดโรค ชนิด อี.โคไล, ซัลโมเนลลา, สแตฟฟิโลคอคคัส ออเรียส, คลอสทรีเดียม, และโลหะหนักทั้งชนิดสารหนู, แคดเมียม, ตะกั่ว, และปรอท รวมถึงการปนเปื้อนของเชื้อราและยีสต์ ที่มีการควบคุมมาตรฐานถั่งเช่า สูตรผสมวิตามินซี มีส่วนในการทำหน้าที่ของระบบภูมิคุ้มกัน กระบวนการต่อต้านอนุมูลอิสระ และปกป้องเซลล์จากอนุมูลอิสระ ซึ่งความพิเศษสำหรับชุดของขวัญนี้ คือ ถั่งเช่าออร์แกนิกนำเข้าจากสหรัฐอเมริกา (USDA Organic) ผสมวิตามินซี ที่มีคุณสมบัติช่วยเพิ่มประสิทธิภาพการดูดซึมสารสำคัญในถั่งเช่า โดยจะผ่านการควบคุมอุณหภูมิและความบริสุทธิ์ของถั่งเช่าที่ได้มาตรฐานและเชื่อถือได้ พร้อมทั้ง Mushroom Extract with Beta Glucan จำนวน 1 กล่อง ช่วยเสริมสร้างภูมิคุ้มกันด้วยสารสกัดผสมจากเห็ดหลายชนิด (เห็ดชิตาเกะ เห็ดไมตาเกะ เห็ดหลินจือ เห็ดยามาบูชิตาเกะ) ผสมถั่งเช่า, เบต้ากลูแคน, กรดโฟลิค, วิตามินบี 1, 6, 12 และวิตามินซี
มินเนโซต้า สหรัฐอเมริกา
กำหนดจัดงาน ระหว่าง 15 พฤษภาคม - 15 สิงหาคม 2027
ธีมงาน Healthy People, Healthy Planet: Wellness and Well-being for All
มินเนโซต้า เสนอแนวคิดสอดคล้องไปกับเป้าหมายขององค์การสหประชาชาติที่มุ่งไปที่พิชิตปัญหาระดับโลก นั่นคือการสร้างความยั่งยืนและยกระดับคุณภาพชีวิต อุตสาหกรรมการแพทย์สาธารณสุขเป็นอุตสาหกรรมใหญ่ระดับล้านล้านเหรียญ มินเนโซต้า มุ่งหวังกับการได้เป็นเจ้าภาพครั้งนี้ บนพื้นฐานเดิมในการเป็นศูนย์กลางด้านการแพทย์และนวัตกรรมสุขภาพ ที่สำคัญแห่งหนึ่งของสหรัฐอเมริกาอยู่แล้ว เมื่อดูจากลิสต์บริษัทระดับโลกใน 500 อันดับแรกของนิตยสารฟอร์จูน จะพบว่ามีกว่า 10 บริษัท อยู่ในอุตสาหกรรมด้านสุขภาพ เทคโนโลยีการแพทย์ และเวลเนส ที่มีฐานอยู่ในมินเนโซต้า กับการจ้างงานกว่า 387,500 ตำแหน่ง มินเนโซต้า มั่นในในระบบโครงสร้างพื้นฐานของเมืองว่าทันสมัยไม่แพ้ใคร สนามบิน Minneapolis-Saint Paul International Airport (MSP) ระบบคมนาคม ที่ทำให้การเดินทางที่สะดวกสบาย ไร้รอยต่อระหว่างระบบขนส่งสาธารณะ รวมถึงการมีสถานที่พักและบริการครบครันที่พร้อมรองรับผู้มาเยือนชาวอเมริกันและชาวต่างประเทศทั่วโลก
Website:
expo2027.us
Facebook:
MinnesotsaUSAExpo2027 ในฐานะที่บำรุงราษฎร์เป็นโรงพยาบาลเอกชนที่ให้การบริบาลในขั้นจตุตถภูมิ (Quaternary Care) การก่อตั้ง ‘แผนกผู้ป่วยวิกฤตระบบประสาทและไขสันหลัง’ (Neurocritical Care Unit: NCCU) มีความสำคัญมากในการเสริมศักยภาพให้แผนกผู้ป่วยวิกฤต (ICU) เพื่อให้การดูแลผู้ป่วยวิกฤตมีประสิทธิภาพและได้ผลลัพธ์ที่ดีขึ้น โดยลดการบาดเจ็บทางสมองแบบทุติยภูมิ (Secondary brain injury) ซึ่งเป็นสาเหตุของความพิการและการเสียชีวิต หลังเกิดความบาดเจ็บของสมองแบบปฐมภูมิ (Primary brain injury) ขึ้นแล้วก่อนหน้านั้น นับเป็นการตอกย้ำความมุ่งมั่นของโรงพยาบาลบำรุงราษฎร์ในด้านความเป็นเลิศทางการแพทย์ เพื่อส่งมอบประสบการณ์ทางการรักษาที่ดีที่สุด ภายใต้คุณภาพมาตรฐานและความปลอดภัยของผู้ป่วยเป็นหัวใจสำคัญ
สารฟอกขาว (โซเดียมไฮโดรซัลไฟต์) LINK
ถั่วงอกที่ขาวอวบ ผ้าขี้ริ้วที่ดูขาวกรอบน่ารับประทานมักจะถูกฟอกขาวด้วยสารฟอกขาว นอกจาก จะมีการใช้สารฟอกขาวในถั่วงอกแล้วยังมีการใช้ในอาหารประเภท ทุเรียนกวน หน่อไม้ ขิงซอย ขนมจีน น้ำตาลทรายหรือสินค้าอาหารอื่นๆที่มีสีขาวให้ดูน่ารับประทานและดูใหม่อยู่เสมอ สารฟอกขาวหรือสารฟอกสีที่ใช้ในอาหารนั้นมีหลายชนิด ที่นิยมใช้กันในอุตสาหกรรมการผลิตอาหารก็คือสารเคมีในกลุ่มซัลไฟต์ได้แก่
1) สารประกอบซัลไฟต์ เช่น แคลเซียมซัลไฟต์ โซเดียมซัลไฟต์ โพแทสเซียมซัลไฟต์
2) สารประกอบไบซัลไฟต์ เช่น โพแทสเซียมไบซัลไฟต์ ซึ่งใช้ป้องกันการบูดเสียของอาหารได้ด้วยและ
3) สารประกอบเมตาไบซัลไฟต์ เช่น โซเดียมเมตาไบซัลไฟต์
สารฟอกสีเหล่านี้ เป็นสารเคมีที่อนุญาตให้ใช้เป็นวัตถุเจือปนในอาหารได้ แต่ต้องใช้ในปริมาณที่กำหนดตามชนิดของอาหาร ถ้าใช้เกินปริมาณที่กำหนดจะเกิดอันตรายได้ เช่น โซเดียมซัลไฟต์ถ้าใช้ในปริมาณที่เกินกำหนด จะมีสารกำมะถันตกค้างในอาหารในปริมาณสูงและเป็นอันตรายต่อผู้บริโภคถึงแก่ชีวิตได้ โดยเฉพาะผู้ที่ป่วยเป็นโรคหอบ หืด อ่อนเพลีย และผู้ที่ออกกำลังมาก
ส่วนสารฟอกขาวที่เป็นอันตราย กระทรวงสาธารณสุขไม่อนุญาตให้ใช้เจือปนในอาหาร คือ สารโซเดียมไฮโดรซัลไฟต์(Sodium hydrosulfite) หรือที่ชาวบ้านเรียกว่า ผงซักมุ้ง ชื่ออื่นๆ ได้แก่ Dithionous acid, disodium salt; Sodium dithionite hydrate; Sodium sulfoxylate; Reductone; Sulfoxylate; Virtex L; Hydrolin; D-Ox; Vatrolite; มีสูตรโมเลกุล : Na2O4S2 สารโซเดียมไฮโดรซัลไฟต์เป็นสารเคมีที่เป็น พิษ ลักษณะเป็นผงผลึกสีขาว มีกลิ่นฉุนกำมะถันอ่อนๆ ละลายได้ในน้ำ ไม่ละลายในแอลกอฮอล์ เป็นสารที่ใช้ในอุตสาหกรรมที่เกี่ยวกับการฟอกสี เช่น กระดาษ เส้นใยไหม แห อวน และเครื่องหนัง หากสัมผัสผิวหนังจะทำให้ผิวหนังอักเสบ เป็นผื่นแดง ถ้าบริโภคเข้าไปจะทำให้เกิดการอักเสบในอวัยวะที่สัมผัสอาหารเช่น ปาก ลำคอและกระเพาะอาหาร หากกินเข้าไปมากเกิน 30 กรัม จะทำให้เกิดอาการปวดท้อง เวียนศีรษะ อาเจียน อุจจาระร่วง ความดันโลหิตลดต่ำลง แน่นหน้าอก หายใจไม่สะดวก หลอดลมหดตัว ทำให้หอบหืด ในผู้ที่เป็นโรคนี้อยู่แล้วอาจช็อก หมดสติและเสียชีวิตได้
หากสงสัยว่า อาหารบางชนิด เช่น ถั่วงอก ผ้าขี้ริ้ว ตีนไก่ กระท้อนดอง ทุเรียนกวน ยอดมะพร้าวหรืออื่น ๆ มีสารฟอกขาว โซเดียมไฮโดรซัลไฟต์ ปนอยู่หรือไม่ สามารถใช้ชุดทดสอบโซเดียมไฮโดรซัลไฟต์(สารฟอกขาว)ในอาหาร ของกรมวิทยาศาสตร์การแพทย์ เพื่อทดสอบ น้ำยาที่ใช้ทดสอบโซเดียมไฮโดรซัลไฟต์ คือ สารละลายคอปเปอร์ซัลเฟต (CuSO4.5H2O) นั่นเอง ชุดทดสอบนี้สามารถตรวจสอบหาสารฟอกขาวที่เจือปนในอาหารทั้งที่เป็นของแข็งและของเหลว ซึ่งทำการทดสอบตามวิธีการง่าย ๆ ที่แนะนำไว้ในชุดทดสอบ
คำว่า ‘เปิด’ เป็นกิมมิคที่ใช้ช่วงนี้แล้วปัง!
การจับจ่ายในช่วงท้ายปี คนไทยกำลังอินกับการเปิดรับสิ่งใหม่ ไม่ใช่แค่ให้รางวัลกับตัวเองแต่ซื้อเพื่อเติมเต็มความรู้สึกของผู้อื่นด้วย เช่น การแสดงความขอบคุณ ความรัก หรือ reconnect กับครอบครัว เพื่อก้าวสู่ปีใหม่ที่ดีกว่าเดิม ดังนั้นแบรนด์ควรกระตุ้นให้คนออกมาเปิดหูเปิดตา ด้วยกิจกรรมใหม่ๆ โดยใช้ keyword ‘การเปิด’ เพื่อสร้างอารมณ์การมีส่วนร่วมกับแบรนด์ทั้งในด้านการสื่อสาร (communication) และการสร้างประสบการณ์ร่วม (engagement) เช่น เปิดตู้เสื้อผ้า อัพลุคใหม่ เปิดประตูออกเดินทางไปเที่ยว เปิดลิฟต์เสพบรรยากาศสวยๆบน rooftop
‘ผสมผสาน’ การคือกลยุทธ์การตลาดที่ต้องทำ
โควิดฯ ทำให้วิถีชิวิตคนไทยเปลี่ยนอย่างถาวร ช่องทางจับจ่ายเปลี่ยนไปจากสิ่งที่ไม่เคยทำจนเป็นเรื่องคุ้นเคย แบรนด์ต้องประเมินช่องทางสร้างประสบการณ์กับลูกค้า (touchpoint) ทุกมิติทั้งออนไลน์หรือออฟไลน์ และจัดกิจกรรมสร้างการมีส่วนรวม (Interaction) ช่องการจำหน่าย (Distribution) และการสื่อสาร (Communication) เป็นลูกผสมกันไปเพื่อปิดรอยรั่วในช่วงลูกค้าที่มีกำลังซื้อที่ไหลเข้ามา เช่น หากปัจจุบันเน้นที่ลูกค้า online เป็นหลัก อาจต้องพิจารณาเพิ่มกิจกรรมการหน้าร้าน (physical) เพื่อตอบสนองลูกค้าที่หันกลับมาเดินกันมากขึ้น
แพ็กเกจสุขภาพสุดคุ้ม สำหรับทุกคนในครอบครัว
โรงพยาบาลศรีสวรรค์ กรุงเทพมหานคร ราชพฤกษ์ แพ็กเกจสุขภาพสุดคุ้ม สำหรับทุกคนในครอบครัว วันนี้ - 31 ธันวาคม 2565 สอบถามโทร.1254
- โปรแกรมตรวจสุขภาพ Value คุ้มค่า ราคา 1,190 บาท
- ตรวจมวลกระดูก Bone Density ราคา 2,400 บาท (จากราคา 4,800 บาท)
- ตรวจเอกซเรย์คอมพิวเตอร์ ศีรษะ-ลำตัว ราคา 19,999 บาท (จากราคา 32,000 บาท)
- ตรวจคัดกรองมะเร็งปอด CT Scan Low Dose ราคา 2,500 บาท (จากราคา 4,990 บาท)
- ตรวจมะเร็งเต้านม Digital Mammogram with Ultrasound ราคา 2,500 บาท (จากราคา 3,550 บาท)
- ตรวจอัลตราซาวน์ ช่องท้องส่วนบน ราคา 1,500 บาท (จากราคา 2,500 บาท)
- วัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ ราคา 400 บาท (จากราคา 790 บาท)
- วัคซีนป้องมะเร็งปากมดลูก HPV 9 สายพันธุ์ 3 เข็ม ราคา 19,990 บาท (จากราคา 20,850 บาท)
ดูเเลคุณเเละคนที่คุณรักได้ตั้งเเต่วันนี้
Nurturing Value For Life "ศรีสวรรค์ สร้างสรรค์คุณค่าแห่งชีวิต"
.
โรงพยาบาลกรุงเทพสุราษฎร์ จ.สุราษฎร์ธานี LINK
โรงพยาบาลกรุงเทพสุราษฎร์ เป็นโรงพยาบาลเอกชนแห่งแรก ของจังหวัด ที่บริการผู้ประกันตน และแห่งที่ 3 ของจังหวัด ต่อจาก รพ.เกาะสมุย และ รพ.สุราษฎร์ธานี (ทั้งสอง สังกัดกระทรวงสาธารณสุข)
โรงพยาบาลกรุงเทพสุราษฎร์ เป็นหนึ่งในเครือข่ายโรงพยาบาลกรุงเทพ มีความพร้อมให้บริการทางการแพทย์ในหลายๆด้าน อาทิเช่น ศูนย์อุบัติเหตุฉุกเฉิน 24 ชั่วโมง, ศัลยกรรมทั่วไป, กระดูกและข้อ, หู คอ และจมูก, อายุรกรรมทั่วไป, ศัลยกรรมประสาทและสมอง, กุมารเวช, สูติ-นารีเวช, เวชศาสตร์ฟื้นฟู, ศูนย์ตรวจสุขภาพและเวชศาสตร์ครอบครัว ฯลฯ ซึ่งมีจำนวนเตียงรองรับผู้ป่วยในทั้งหมด 59 เตียง และจะขยายเพิ่มเติมเป็น 150 เตียงในอนาคตอันใกล้นี้
- 179, 179/1 หมู่ที่ 1 วัดประดู่ อำเภอเมืองสุราษฎร์ธานี สุราษฎร์ธานี 84000
- โทร. 1719 , 077-956789
- แผนที่
- facebook
พัทยาเคาท์ดาวน์ 2023 ณ แหลมบาลีฮาย-เกาะล้าน
ปักหมุดไว้เลยว่าส่งท้ายปีนี้ต้อนรับปีหน้า 2023 ต้องพัทยาเท่านั้น เตรียมนับถอยหลังไประเบิดความมันสุดๆ กับงานพัทยาเคาท์ดาวน์ 2023 29-31 ธันวาคม 2565 ณ ลานสีฟ้า ท่าเทียบเรือท่องเที่ยวเมืองพัทยา (แหลมบาลีฮาย) และ 31 ธันวาคม 2565 ณ เกาะล้าน
Central Phuket International Countdown 2023 มันส์ข้ามปีกับ Top international DJs, EDM เฟสติวัล
เซ็นทรัล ภูเก็ต ชวนทุกท่าน มาร่วมนับถอยหลังสู่ปี 2023 กับงาน “Central Phuket International Countdown 2023” แลนด์มาร์คเคานต์ดาวน์ที่ใหญ่ที่สุดในภูเก็ต เตรียมตัวมันส์ข้ามปีกับ Top international DJs, EDM เฟสติวัล พร้อมตื่นตาไปกับพลุสุดอลังการ ที่จะทำให้ทุกคนได้ต้อนรับปี 2023 แบบสนุกสุดเหวี่ยง !!
31 ธันวาคม 2565 ลานกิจกรรม Outdoor Arena ฝั่งฟลอเรสต้า เซ็นทรัล ภูเก็ต
นายอนุทิน กล่าวว่า กระทรวงสาธารณสุขเป็นประธานการประชุม และได้เป็นเจ้าภาพจัดการประชุมในครั้งนี้นับเป็นโอกาสสำคัญของประเทศไทยในการเป็นเจ้าภาพอีกครั้งในรอบ 14 ปี หลังจากที่เคยเป็นเจ้าภาพจัดการประชุม เมื่อปี 2551 นายอนุทิน กล่าวต่อว่า การหารือร่วมกับภาคีเครือข่ายในครั้งนี้ มีประเด็นสำคัญ ได้แก่ 1.การดำเนินงานขององค์กรโดยชุมชนเป็นแกนนำ 2.ความคืบหน้าของการดำเนินงาน Global Partnership เพื่อขจัดการตีตราและการเลือกปฏิบัติที่เกี่ยวข้องกับเอชไอวีทุกรูปแบบ 3.ผลการประเมินการดำเนินงาน UNAIDS และ 4.เอชไอวีกับชายที่มีความหลากหลายทางเพศในทุกรูปแบบ นอกจากนี้ภายในงานได้จัดนิทรรศการแสดงผล การดำเนินงานแก้ไขปัญหาเอดส์ของประเทศไทย ในเรื่องการลดการตีตราและการเลือกปฏิบัติ ที่ประเทศไทยเข้าร่วมโครงการสานพลังเพื่อขจัดการตีตราและเลือกปฏิบัติ (Partnership for Zero Discrimination) และเรื่องการจัดบริการด้านเอดส์ในระบบหลักประกันสุขภาพถ้วนหน้า
รายการที่ครม.อนุมัติ
รายการที่ครม.อนุมัติ
1.ค่าตอบแทน ค่าเสี่ยงภัยในการปฏิบัติงาน ดังนี้
- บุคลากรทางการแพทย์
- อาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.)
- กำนัน ผู้ใหญ่บ้าน แพทย์ประจำตำบล สารวัตกำนัน ผู้ช่วยผู้ใหญ่บ้าน และสมาชิกกองอาสารักษาดินแดน
ไตรมาส 2 ปี 2565 จำนวน 13,656.0322 ล้านบาท
ไตรมาส 4 ปี 2565 จำนวน 1,050.3060 ล้านบาท
รวมทั้งหมด 16,041.2832 ล้านบาท (คิดเป็น 90.74% ของวงเงินอนุมัติ)
2. แก้ไข ช่วยเหลือ ชดเชย เยียวยา ผู้ได้รับผลกระทบ
ไตรมาส 1 ปี 2565 จำนวน 1,334.9450 ล้านบาท
ไตรมาส 2 ปี 2565 จำนวน 150.6946 ล้านบาท
รวมทั้งหมด 1,485.6396 ล้านบาท (คิดเป็น 9.26% ของวงเงินอนุมัติ)
รางวัลรองชนะเลิศอันดับ 1 ทีม Dentograft
รองชนะเลิศอันดับ 1 ทีม Dentograft กับผลงาน “ การศึกษาความเป็นไปได้ทางธุรกิจของการทำ Autogenous tooth bone graft ” บริการแปลงสภาพฟันของผู้ป่วยเป็นวัสดุปลูกถ่ายกระดูกสำหรับการทำรากฟันเทียม และได้รับเงินรางวัลมูลค่า 30,000 บาท
สถาบันโรคหัวใจ โรงพยาบาลบำรุงราษฎร์ มุ่งมั่นที่จะเป็นผู้นำในการให้บริการสุขภาพระดับสากลของการรักษาโรคหัวใจผิดปกติเพื่อให้บริการดูแลสุขภาพแก่ผู้ป่วยทั่วโลก ซึ่งมาจากที่ใดก็ได้บนโลก แล้วก็โรคใดก็ได้ที่เกี่ยวกับหัวใจเต้นผิดปกติ ซึ่งหากที่ใดบนโลกทำได้ สถาบันโรคหัวใจบำรุงราษฎร์ ก็ทำได้แล้วก็ต้องทำให้ดีที่สุด ขณะเดียวกันผมก็ได้รับมอบหมายจากบำรุงราษฎร์ให้ทำวิจัยเพื่อที่จะหาแนวทางการรักษาใหม่ๆ เพื่อให้ได้ผลลัพธ์ในการรักษาที่ดีขึ้น และรักษาได้ดีกว่าที่ผ่านมา และหวังว่าจะเป็น ‘ศูนย์ความเป็นเลิศทางการแพทย์’ ในการรักษาโรคหัวใจเต้นผิดปกติ รวมถึงทุกปัญหาของโรคหัวใจได้อย่างครอบคลุม และต้องพิสูจน์ได้จริง และอีกประการสำคัญคือ บำรุงราษฎร์ลงทุนในเรื่องอุปกรณ์เทคโนโลยีทางการแพทย์สูงมาก ซึ่งบางอย่างก็ไม่อาจจะได้ผลตอบแทนอะไรกลับมา
7 เสาหลักในการดูแลรักษาของสถาบันโรคหัวใจ (HEART INSTITUTE)
1.โรคหัวใจขาดเลือด (Coronary artery disease)
โรคคุ้นหูที่พบได้บ่อย คือ ภาวะกล้ามเนื้อหัวใจขาดเลือดจากหลอดเลือดหัวใจอุดตันเฉียบพลัน ที่มาจากการรักษาโรคที่ไม่ติดต่อเรื้อรัง (NCDs) ไม่ดีหรืออายุที่มากขึ้น รักษาได้โดยการเปิดหลอดเลือด (revascilarization) การรักษานี้ทำได้ด้วยการใส่ขดลวด (stent) ผ่านสายสวน หรือการผ่าตัดบายพาสโดยทีมแพทย์ผู้ชำนาญการและการดูแลจากทีมพยาบาลเฉพาะทางด้านการบำบัดโรคหัวใจ
2.โรคหัวใจเต้นผิดจังหวะ(Cardiac arrhythmia)
เป็นภาวะความผิดปกติที่พบได้มากขึ้นเรื่อย ๆในผู้สูงอายุ โรคหัวใจเต้นผิดจังหวะรุนแรงที่อาจทำให้เสียชีวิตได้ทันที (Ventricular tachycardia, ventricular fibrillation) หรือโรคหัวใจห้องบนเต้นพริ้ว (Atrial fibrillation) ซึ่งเป็นปัจจัยเสี่ยงสำคัญที่ทำให้เกิดโรคอัมพฤกษ์อัมพาต แนวทางการรักษาที่มีประสิทธิภาพคือการศึกษาและการจี้ไฟฟ้าหัวใจ โดยทีมแพทย์ผู้ชำนาญการและมีประสบการณ์ในการรักษา
3.ภาวะหัวใจล้มเหลว (Heart failure)
คือภาวะที่กล้ามเนื้อหัวใจทำงานลดลง ส่งผลกระทบต่อการสูบฉีดเลือดไปเลี้ยงส่วนต่าง ๆของร่างกาย พบได้มากขึ้นเรื่อยๆ ตามการเปลี่ยนแปลงสู่สังคมผู้สูงอายุ แนวทางการรักษาคนไข้กลุ่มนี้เปลี่ยนแปลงไปมากในช่วงทศวรรษที่ผ่านมา การใช้ยาหรือการใช้เครื่องพยุงหัวใจในแบบต่าง ๆ ภายใต้การดูแลของแพทย์ผู้ชำนาญการด้านภาวะหัวใจล้มเหลว ผู้ป่วยสามารถเพิ่มคุณภาพชีวิต และลดอาการลงไปได้แม้ในรายที่มีภาวะรุนแรง
4.โครงสร้างของหัวใจผิดปกติ (structural heart disease)
นอกจากระบบหลอดเลือดหัวใจและระบบไฟฟ้าหัวใจแล้ว หัวใจยังประกอบด้วยโครงสร้างอื่น ๆ เช่น ลิ้นหัวใจและเยื่อบุเยื่อหุ้มหัวใจ ซึ่งอาจเกิดความผิดปกติขึ้นได้จากสภาวะความเสื่อมของร่างกาย การติดเชื้อหรือสาเหตุอื่น ๆ คนไข้กลุ่มนี้จำเป็นต้องได้รับการตรวจติดตามผลอย่างต่อเนื่องเพื่อรักษาหรือผ่าตัดแก้ไขให้ทันถ่วงทีในช่วงเวลาที่เหมาะสม ที่บำรุงราษฎร์เรามีทีมแพทย์ผ่าตัดผู้ชำนาญการ และทีมแพทย์อายุรกรรมหัวใจให้คำแนะนำแนวทางการรักษาในกรณีที่ไม่จำเป็นต้องทำการผ่าตัดแบบเปิดหน้าอก
5.โรคหัวใจที่ถ่ายทอดทางพันธุกรรม (Cardiogenetics)
ในปัจจุบัน ความก้าวหน้าของเทคโนโลยีและความรู้ทางพันธุศาสตร์ ทำให้สามารถระบุและตรวจหายีนที่มีโอกาสส่งผ่านโรคหัวใจในครอบครัวได้มากขึ้น เช่น โรคหัวใจเต้นผิดจังหวะ โรคไหลตาย โรคไขมันในเลือดสูงและโรคอื่น ๆ การระบุยีนก่อโรคเหล่านี้ สามารถช่วยชีวิตผู้ที่ยังไม่แสดงอาการของโรคหรือช่วยในการวางแผนครอบครัวได้ดี การพบแพทย์โรคหัวใจที่มีความรู้เฉพาะทางด้านพันธุศาสตร์จึงเป็นประโยชน์อย่างมากในการช่วยวางแผนและป้องกันการเกิดโรคหัวใจที่ถ่ายทอดทางพันธุกรรรมนี้
6.โรคหัวใจพิการแต่กำเนิด (Congenital heart disease)
โรคหัวใจพิการแต่กำเนิดจำเป็นต้องได้รับการรักษา และดูแลอย่างต่อเนื่องไปตลอดชีวิต ดังนั้นเป้าหมายของการรักษานอกจากการผ่าตัดแก้ไข (total correction) โดยแพทย์ผ่าตัดผู้ชำนาญการแล้ว เรายังมีความพร้อมให้การดูแลผู้ป่วยกลุ่มนี้ไปตลอดชีวิตโดยทีมสหสาขาวิชาชีพ ซึ่งประกอบด้วย แพทย์ พยาบาล เภสัชกร และทีมสนับสนุนอื่น
7.การคัดกรองและการส่งเสริมสุขภาวะของหัวใจ (Cardiac Preventive and enhancing)
ที่บำรุงราษฎร์เรามีบริการตรวจคัดกรองโรคหัวใจที่เฉพาะเจาะจงสำหรับผู้ที่มีความเสี่ยงโรคหัวใจ รวมถึงผู้ที่ต้องการเสริมสมรรถภาพการออกกำลังกาย เรามีทีมแพทย์โรคหัวใจที่มีความชำนาญด้านเวชศาสตร์การกีฬา (sport cardiology) โดยเฉพาะ เพื่อช่วยประเมินสุขภาพหัวใจ วางแผนการออกกำลังกายที่ถูกต้องและเหมาะสม อีกทั้งทีมแพทย์โรคหัวใจ และเวชพันธุศาสตร์ ที่มีความชำนาญในการถอดรหัสดีเอ็นเอและแปลผลได้อย่างแม่นยำ
ผู้บริหารเมืองพัทยาลงพื้นที่เยี่ยมเยียน พร้อมมอบผ้าอ้อมผู้ใหญ่สำเร็จรูปแก่ผู้ป่วยติดเตียง
14 ธ.ค.65 เมื่อช่วงเช้าวันนี้ นายวสันต์ สุขขี นายบรรจง บัณฑูรประยุกต์ และนายจิรวัฒน์ ปลุกใจ สมาชิกสภาเมืองพัทยา เขต 3 พร้อมด้วยนายศิวัช บุญเกิด รองปลัดเมืองพัทยา ลงพื้นที่ร่วมกับคณะกรรมการบริหารศูนย์สร้างเสริมสุขภาวะผู้สูงอายุเมืองพัทยา เจ้าหน้าที่สำนักสาธารณสุข Care Manager และ Caregiver เมืองพัทยา เยี่ยมผู้ป่วยและมอบผ้าอ้อมผู้ใหญ่สำเร็จรูป “โครงการสนับสนุนผ้าอ้อมผู้ใหญ่ สำหรับบุคคลที่มีภาวะพึ่งพิงและบุคคลที่มีปัญหาการกลั้นปัสสาวะหรืออุจจาระไม่ได้” ประจำปี 2566 ณ ชุมชนหนองอ้อ
โดยในวันนี้เป็นการเยี่ยมผู้ป่วย จำนวน 2 ราย ประกอบด้วย นางลุ้ย แซ่เอี๊ยว อายุ 99 ปี อยู่บ้านเลขที่ 202/43 ม.9 ต.หนองปรือ อ.บางละมุง จ.ชลบุรี มีโรคประจำตัวคือความดันโลหิตสูง ขาทั้งสองข้างอ่อนแรง และนางจงจิตต์ เจริญผล อายุ 79 ปี อยู่บ้านเลขที่ 323/2 หมู่ 9 ต.หนองปรือ อ.บางละมุง จ.ชลบุรี ป่วยด้วยโรคสมองเสื่อม และตาบอด
โครงการสนับสนุนผ้าอ้อมผู้ใหญ่ สำหรับบุคคลที่มีภาวะพึ่งพิงและบุคคลที่มีปัญหาการกลั้นปัสสาวะหรืออุจจาระไม่ได้ ประจำปี 2566 เป็นชุดสิทธิประโยชน์ด้านการสร้างเสริมสุขภาพของระบบหลักประกันสุขภาพแห่งชาติ เพื่อช่วยเหลือผู้ที่มีภาวะติดบ้าน ติดเตียง ที่มีระดับความสามารถสำหรับการดำเนินกิจวัตรประจำวัน (ADL) น้อยกว่า 6 คะแนน รวมถึงผู้ที่มีภาวะปัญหากลั้นปัสสาวะและอุจจาระไม่ได้ ให้สามารถเข้าถึงบริการสาธารณสุขอย่างทั่วถึงเพิ่มมากขึ้น และลดภาระค่าใช้จ่ายของครอบครัว ซึ่งเป็นโครงการดีๆ ที่เมืองพัทยาจะดำเนินการอย่างต่อเนื่อง
11.ศูนย์อภิบาลริเวอร์แควสหคลินิก(River Keaw Herbal Therapeutic center)
ประเภทสถานพยาบาล
เลขที่ 111/12 หมู่ที่ 4 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล ท่ามะขาม เขต/อำเภอ เมืองกาญจนบุรี จังหวัด กาญจนบุรี รหัสไปรษณีย์ 71000
เบอร์โทรศัพท์ : 034-910605 , 093-124-7175
12.สหคลินิกเรเมดี้ แคนน์ โคราช(Remedy Cann Korat)
ประเภทสถานพยาบาล
เลขที่ 725/2 หมู่ที่ - หมู่บ้าน/อาคาร โรงแรมเฮอร์มิเทจ ซอย - ถนน - แขวง/ตำบล ในเมือง เขต/อำเภอ เมืองนครราชสีมา จังหวัด นครราชสีมา รหัสไปรษณีย์ 30000
เบอร์โทรศัพท์ : 0969654615
13.อ่าวนาง ปริ้นซ์วิลล์ วิลล่า รีสอร์ท แอนด์ สปา (ปริ้นซ์วิลล์ สปา)(Aonang Princeville Villa Resort & Spa (Princeville Spa))
ประเภทนวดเพื่อสุขภาพ
เลขที่ 164 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 075637971-3
14.เดอะ ซีเครท การ์เดน สปา(The Secret Garden Spa)
ประเภทสปาเพื่อสุขภาพ
เลขที่ 219 หมู่ที่ 5 แขวง/ตำบล อ่างทอง เขต/อำเภอ เกาะสมุย จังหวัด สุราษฎร์ธานี รหัสไปรษณีย์ 84330
เบอร์โทรศัพท์ : 077243000
15.เทวารัณย์เวลเนส(Devarana Wellness)
ประเภทสปาเพื่อสุขภาพ
เลขที่ 1349 หมู่บ้าน/อาคาร โรงแรมดุสิตธานี ถนน เพชรเกษม แขวง/ตำบล ชะอำ เขต/อำเภอ ชะอำ จังหวัด เพชรบุรี รหัสไปรษณีย์ 76120
เบอร์โทรศัพท์ : 032-520009
16.แคลร์ เมดิคอลเซ็นเตอร์(Klaire Medical Center )
ประเภทสถานพยาบาล
เลขที่ 259/22 ซอย ปรีดีพนมยงค์ 15 ถนน สุขุมวิท 71 แขวง/ตำบล พระโขนงเหนือ เขต/อำเภอ เขตวัฒนา จังหวัด กรุงเทพมหานคร รหัสไปรษณีย์ 10110
เบอร์โทรศัพท์ : 022270600
17.โรงแรม เดอะ ซิลเวอร์ปาล์ม(The Silver Palm Wellness Resort)
ประเภทที่พักนักท่องเที่ยว
เลขที่ 69 ซอย สงบสุข ถนน พระราม 9 แขวง/ตำบล สวนหลวง เขต/อำเภอ เขตสวนหลวง จังหวัด กรุงเทพมหานคร รหัสไปรษณีย์ 10250
เบอร์โทรศัพท์ : 023223679
18.โรงแรมดุสิตธานี กระบี่ บีช รีสอร์ท(Dusit Thani Krabi Beach Resort)
ประเภทที่พักนักท่องเที่ยว
เลขที่ 155 หมู่ที่ 2 แขวง/ตำบล หนองทะเล เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 0857317855
19.โรงแรมดุสิตธานี กระบี่ บีช รีสอร์ท(Dusit Thani Krabi Beach Resort)
ประเภทสปาเพื่อสุขภาพ
เลขที่ 155 หมู่ที่ 2 แขวง/ตำบล *คลองขนาน เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81180
เบอร์โทรศัพท์ : 0857317855
20.โรงแรมอ่าวนางปริ้นซ์วิลล์ วิลล่า รีสอร์ท แอนด์ สปา(Aonang Princeville Villa Resort & Spa)
ประเภทที่พักนักท่องเที่ยว
เลขที่ 164 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81000
เบอร์โทรศัพท์ : 075-637971-3
21.โรงแรมอ่าวนางปริ้นซ์วิลล์ วิลล่า รีสอร์ท แอนด์ สปา (ปริ้นซ์วิลล์ สปา)(Aonang Princeville Villa Resort & Spa (Princeville Spa))
ประเภทสปาเพื่อสุขภาพ
เลขที่ 164 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81180
เบอร์โทรศัพท์ : 075-637971-3
22.โรงแรมอ่าวนางปริ้นซ์วิลล์ วิลล่า รีสอร์ท แอนด์ สปา (ไวท์ออคิด)(Aonang Princeville Villa Resort & Spa (White orchid Restaurant))
ประเภทภัตตาคาร ร้านอาหาร
เลขที่ 164 หมู่ที่ 2 หมู่บ้าน/อาคาร - ซอย - ถนน - แขวง/ตำบล อ่าวนาง เขต/อำเภอ เมืองกระบี่ จังหวัด กระบี่ รหัสไปรษณีย์ 81180
เบอร์โทรศัพท์ : 075-637971-3
ไม่เพียงแค่อาคารออกแบบมาสวยงาม เป็นเอกลักษณ์ และเป็นมิตรกับสิ่งแวดล้อมแล้ว ภายในปลูกพรรณไม้นานาชนิด สีสรรสวยงาม ส่วนใหญ่เป็นพันธุ์ไม้เมืองหนาว โดยใช้ความเย็นที่ได้จากกระบวนการผลิตก๊าช LNG หล่อเลี้ยงพันธุ์ไม้ จึงเสมือนเป็นดินแดนเมืองหนาว อันเป็นบ้านของพรรณไม้เหล่านั้นเลยทีเดียว
และแน่นอนว่าทิวลิปหลากสีสวยงาม ก็เติบโตและเบ่งบานในอาคารนิทรรศน์พรรณนี้ รอเราไปเยี่ยมชมเช่นกัน
กระทรวงการท่องเที่ยวและกีฬา (กก.)
กก. มอบของขวัญปีใหม่ ปี 2566 จำนวน 19 โครงการ/กิจกรรม แบ่งเป็น ด้านการท่องเที่ยว 14 โครงการ และด้านกีฬา 5 กิจกรรม ดังนี้
1. ด้านการท่องเที่ยว เช่น
1.1 มาตรการเพื่อกระตุ้นการท่องเที่ยวภายในประเทศเพื่อกระจายรายได้และยกระดับการท่องเที่ยวอย่างยั่งยืน เช่น มาตรการ “เราเที่ยวด้วยกัน เฟส 5” และมาตรการกระตุ้นการท่องเที่ยวเพื่อฟื้นฟูเศรษฐกิจของไทย (Tourism Stimulus Package) โดยมุ่งใช้ Soft Power
1.2 การจัดหลักสูตร “การให้บริการแก่นักท่องเที่ยวกลุ่มคนพิการและผู้สูงอายุ” ผ่านทางเว็บไซต์ของกรมการท่องเที่ยว โดยไม่เสียค่าใช้จ่าย
1.3 โครงการเพื่อส่งเสริมการท่องเที่ยวอย่างปลอดภัย ด้วยการประชาสัมพันธ์และรณรงค์สร้างความเชื่อมั่นด้านความปลอดภัย และโครงการพัฒนาระบบสายตรวจจักรยานอัจฉริยะและการฝึกอบรมยุทธวิธีการสายตรวจจักรยานระบบ E-Learning
1.4 กิจกรรมเพื่อส่งเสริมการท่องเที่ยวชุมชนและสร้างรายได้ให้แก่ชุมชน เช่น (1) ออกบูธในงาน FD Expo 2022 โดยมีกิจกรรมเวิร์คช็อปจากชุมชนและจำหน่ายผลิตภัณฑ์จากชุมชน (2) จัดงานเดินกินถิ่นนาเกลือ เมืองพัทยา จังหวัดชลบุรี (3) กิจกรรมกินลมชมว่าวนานาชาติ เทศกาลอาหารทะเลและอาหารพื้นบ้านตราด และ (4) โครงการพัฒนาผลิตภัณฑ์ด้วยการออกบูธนิทรรศการของชุมชนและ Business Matching ณ ลานวัฒนธรรมเชียงคาน จังหวัดเลย
2. ด้านกีฬา เช่น
2.1 โครงการปรับลดอัตราค่าบริการศูนย์วิทยาศาสตร์การกีฬาและการออกกำลังกาย ณ อาคารกีฬานิมิบุตร สนามกีฬาแห่งชาติ และศูนย์วิทยาศาสตร์การกีฬาและการออกกำลังกาย สนามกีฬาเฉลิมพระเกียรติ สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ 60 พรรษา จังหวัดปทุมธานี
2.2 การจัดกิจกรรมการส่งเสริมสุขภาพผู้ออกกำลังกาย โดยใช้หลักวิทยาศาสตร์การกีฬาพร้อมให้บริการ “Safe Stadium” ณ สนามกีฬาหัวหมาก ศูนย์กีฬาแห่งชาติ และสนามกีฬาจังหวัดที่การกีฬาแห่งประเทศไทยดูแลทั่วประเทศ
2.3 โครงการ 1 จังหวัด 1 Sport Event เพื่อกระตุ้นเศรษฐกิจและการจ้างงานในท้องถิ่นด้วยการใช้กลไกการท่องเที่ยวเชิงกีฬากระตุ้นให้เกิดการเดินทางท่องเที่ยวทั้งภายในและระหว่างจังหวัด
ที่ผ่านมา คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ ในฐานะหน่วยงานจัดการศึกษาด้านฉุกเฉินการแพทย์ระดับปริญญาในประเทศไทย ได้ร่วมกับสถาบันการแพทย์ฉุกเฉินแห่งชาติ มีนโยบายในเรื่องการจัดการศึกษาที่แตกต่างจากมาตรฐานการอุดมศึกษา นำมาสู่การบันทึกข้อตกลงความร่วมมือในการผลิตบัณฑิตฉุกเฉินการแพทย์ เพื่อตอบสนองนโยบายและยุทธศาสตร์การพัฒนาประเทศ ร่วมกันกับภาคีเครือข่าย 10 สถาบัน ผลิตบัณฑิตฉุกเฉินการแพทย์ โดย โครงการดังกล่าวมีระยะเวลาการดำเนินการปีงบประมาณ 2566 – 2575 (เริ่มรับผู้เรียนปีงบประมาณ 2566 – 2570 เริ่มมีผู้จบการศึกษาปี 2568 เป็นต้นไป) จำนวนบัณฑิตที่คาดว่าจะผลิต 15,000 คน ตั้งเป้าผลสัมฤทธิ์ บัณฑิตฉุกเฉินการแพทย์ที่จะสำเร็จการศึกษา ต้องสามารถปฏิบัติงานด้านฉุกเฉินการแพทย์ โดยครอบคลุมความรู้ทักษะ และความสามารถในระดับผู้ประกอบโรคศิลปะสาขาฉุกเฉินการแพทย์
รศ.ดร.ทวิดา กมลเวชช - ดูแลด้านภัยพิบัติและสาธารณสุข
"หลังจาก 99 วันที่ผ่านมา สิ่งหนึ่งที่พูดถึง คือ ทำอย่างไรให้เป้าหมายของผู้ว่าฯ ชัชชาติ จากนโยบาย 9 ด้าน 9 ดี เชื่อมโยงไปสู่ยุทธศาสตร์ การพัฒนากรุงเทพมหานคร 7 มิติ โดยออกมาเป็นเป้าหมายให้กับคนกรุงเทพฯ 74 เรื่อง นำไปสู่ 74 OKRs ของหน่วยงานเรียบร้อยแล้ว พร้อมกำหนด KPIs ของหน่วยงาน และให้ทำคำของบประมาณในปี 67 ใช้วิธีคิดงบประมาณฐานศูนย์ Zero Baseds เพื่อมองเป้าหมายที่ประชาชนจะได้ และพิจารณาว่าอะไรควรดำเนินการต่อเพื่อมุ่งไปสู่เป๋าหมายเมืองน่าอยู่สำหรับทุกคน"
รศ.ดร.ทวิดา กมลเวชช
รองผู้ว่าราชการกรุงเทพมหานคร
ดูแลด้านภัยพิบัติและสาธารณสุข
กล่าวในงานอัพเดทความคืบหน้านโยบาย 9 ด้าน 9 ดี ก้าวสู่ปี 66 กรุงเทพฯ เมืองน่าอยู่
21 ธันวาคม 2565
30 ธ.ค.2565 - นำร่างผู้เสียชีวิต 10 คน จากเหตุไฟไหม้กาสิโนปอยเปตกลับไทย LINK
30 ธ.ค.2565 ภารกิจค้นหาผู้สูญหาย จากเหตุเพลิงไหม้ "แกรนด์ไดมอน ซิตี้ ปอยเปต" ประเทศกัมพูชา เริ่มขึ้นตั้งแต่ช่วงเช้ามืดของวันนี้ หลังจากที่เมื่อวานนี้ (29 ธ.ค.) ต้องหยุดภารกิจชั่วคราว เพราะต้องประเมินความปลอดภัยของตัวอาคาร ที่เริ่มโน้มเอียงจากการถูกเพลิงไหม้เป็นระยะเวลานานหลายชั่วโมง ขณะที่ร่างของผู้เสียชีวิตที่ถูกส่งกลับมาถึงประเทศไทยเมื่อคืนนี้ ซึ่งมีญาติมาติดต่อรับศพตั้งช่วงเช้าที่ผ่านมา
ศบริเวณ กองอำนวยการศูนย์ประสานงานช่วยเหลือผู้ประสบเหตุไฟไหม้ มีญาติของผู้เสียชีวิตทยอยเดินทาง มาติดต่อ เพื่อขอรับศพ อย่างต่อเนื่อง หลังได้รับการยืนยันพิสูจน์เอกลักษณ์บุคคลจากทางการกัมพูชา
และเคลื่อนย้ายกลับเข้ามายังประเทศไทย เมื่อช่วงเวลา 01.00 น. ที่ผ่านมา ด้วยรถกู้ภัยกว่า 10 คัน มีรายงานว่า ร่างผู้เสียชีวิตทั้ง 10 คน จะถูกนำส่งไปยังสถานที่ 5 แห่ง เพื่อรอส่งมอบให้ญาติ คือ วัดประตูชัย 3 คน โรงเจ อรัญประเทศ 5 คน โรงพยาบาลสมเด็จพระยุพราช สระแก้ว 1 คน โรงพยาบาลอรัญประเทศ 1 คน
และล่าสุดมีรายงานว่า ยังมีร่างผู้เสียชีวิตอีก 3 ราย ที่ยังอยู่ระหว่างการพิสูจน์เอกลักษณ์บุคคล ในฝั่งประเทศกัมพูชา
สำหรับภารกิจการค้นหาผู้สูญหายวันนี้ เจ้าหน้าที่กู้ภัยไทย กับทีมกู้ภัยกัมพูชา รวมกันกว่า 60 คน ได้เริ่มทำการค้นหาผู้สูญหายอีกครั้ง โดยเฉพาะจุดที่เป็นอาคาร และเบื้องต้น พบร่างผู้เสียชีวิตเพิ่มภายในอาคาร
ส่วนในช่วงบ่ายของวันนี้ มีการวางแผนว่าจะเป็นการเข้าค้นหาผู้สูญหายในบริเวณกาสิโน ซึ่งจุดนี้ ทีมกู้ภัยต้องใช้ความระมัดระวังเป็นพิเศษ เนื่องจากโครงสร้างอาคาร เริ่มโน้มเอียง จากการถูกเพลิงไหม้เป็นระยะเวลาหลายชั่วโมง
ขณะเดียวกันช่วงเช้าที่ผ่านมา มีทีมวิศวกรเข้าประเมินสภาพอาคาร เพื่อเตรียมวางแผนรื้อถอนอาคารที่ถูกไฟไหม้ รวมไปถึงประเมินสภาพอาคารก่อนในอีกหลายจุด ก่อนที่จะให้ทีมกู้ภัย เข้าไปค้นหาผู้สูญหาย ซึ่งมีรายงานจากทีมกู้ภัย ว่า ยังคงมีร่างผู้เสียชีวิต ที่พบแล้วอย่างน้อยอีก 20 ราย แต่ยังไม่สามารถเข้าไปเคลื่อนย้ายออกจากตัวอาคารได้
บริการสุขภาพทางไกล Remote Healthcare
บริการสุขภาพทางไกล Remote Healthcare - Virtual Hospitals, Healthcare Communities, and Telehealth
บริการสุขภาพทางไกล เป็นการใช้เทคโนโลยีที่เติบโตขึ้นอย่างชัดเจนและก้าวกระโดดอย่างมากในยุคโรคระบาดโควิด จนกลายมาเป็นมาตรฐานใหม่ในยุคหลังโควิดไปแล้ว เพราะพิสูจน์แล้วถึงประสิทธิภาพและความสะดวกที่เกิดกับทุกฝ่ายอย่างแท้จริงในการให้และรับบริการ บริการสุขภาพทางไกล ช่วยลดอุปสรรคด้านระยะทาง พื้นที่ เวลา และแน่นอนว่าเป็นวิธีที่ช่วยประหยัดที่ให้ผลคุ้มค่าอย่างที่สุด
บริการสุขภาพทางไกล จำแนกออกได้ในหลายแขนง ตามระดับของผู้เกี่ยวข้อง ผู้ให้และผู้รับบริการ หากมองจากระดับประชาชนทั่วไปที่เป็นผู้ป่วยนอก บริการสุขภาพทางไกลช่วยให้ผู้ป่วยติดต่อแพทย์ พยาบาล เพื่อรับการบริการดูแลอย่างใกล้ชิดได้ทันทีและต่อเนื่อง ซึ่งในสหรัฐมีผลการศึกษาสนับสนุนในเชิงบวกอีกด้วย ว่าการบริการดูแลทางไกลส่งผลดีต่อการรักษา การฟื้นตัวของคนไข้ ทำได้ดีกว่าการเป็นผู้ป่วยในเสียด้วยซ้ำ และที่สำคัญคือความประหยัดที่เกิดขึ้นเป็นประโยชน์ต่อทุกฝ่ายอย่างมาก
สำหรับการแพทย์ทางไกล (Telemedicine) นั้น กินความในระดับที่กว้างขึ้นไปอีก ครอบคลุมตั้งแต่การพูดคุยปรึกษาและรับการวินิจฉัยโรคจากแพทย์โดยตรงผ่านระบบออนไลน์หรือแอป รวมทั้งการบันทึกประวัติ การสั่งจ่ายยาและการทำนัดต่างๆ
การแชร์ข้อมูลประวัติการรักษาของบุคคลระหว่างแพทย์ หรือองค์กรที่เกี่ยวข้อง ภายใต้การยินยอมของผู้ป่วย แม้จะยังไม่ชัดเจนจนเป็นมาตรฐาน แต่เป็นแนวทางที่จะมาถึงในอนาคตอย่างแน่นอน
ในระดับที่สูงขึ้นไปในระดับผู้เชี่ยวชาญชำนาญเฉพาะ การแพทย์ทางไกล หมายถึง การผ่าตัดทางไกลโดยควบคุมผ่านระบบหุ่นยนต์กลไกเฉพาะด้าน เพื่อให้แพทย์ที่อาจจะต่างพื้นที่ สามารถทำงานร่วมกันได้ในเคสใดๆ ที่อยู่ห่างออกไปในอีกซีกโลกหรือในห้องผ่าตัดที่กำหนดได้ เป็นต้น ตัวอย่างเหล่านี้ ปัจจุบันสามารถเห็นได้จากข่าวสารในโรงพยาบาลชั้นนำทั่วโลก เป็นความก้าวหน้าที่น่าทึ่งอย่างแท้จริง
ควาามเป็นไปได้ในอนาคตที่จะเกิดขึ้นจากบริการแพทย์ทางไกลที่น่าจับตา คือ "Virtual Hospital ward" หรือ "หอผู้ป่วยเสมือน" - เป็นวิธีการให้การสนับสนุนด้านการแพทย์สาธารณสุขแก่ผู้ที่ประสงค์หรือจำเป็นต้องได้รับบริการการแพทย์ที่ซับซ้อนในชุมชนที่อยู่ห่างไกลออกไป เป็นแนวคิดที่พัฒนาขึ้นในประเทศอังกฤษ เป็นการรวมเอาแพทย์ในสาขาที่เกี่ยวข้องกับโรคหรืออาการเพื่อการรักษาผู้ป่วยที่อยู่ในพื้นที่ห่างไกล หรือที่อื่นที่ไม่ใช่สถานพยาบาลที่แพทย์เหล่านั้นประจำอยู่ ซึ่งรูปแบบนี้ ไม่จำกัดเฉพาะกับการให้การรักษาเท่านั้น แต่ยังสามารถขยายขอบเขตไปในการแพทย์เชิงการป้องกันหรือรักษาเยียวยาเบื้องต้นให้กับคนไข้ได้ ผลดีที่คาดว่าจะได้รับ ก็คือการที่คนไข้จะสามารถดูแลรักษาตนเองเบื้องต้นได้ จะช่วยลดความจำเป็นที่ต้องมายังโรงพยาบาลหรือสถานพยาบาลจริงได้นั่นเอง
ธุรกิจเด่นอันดับ 1 ธุรกิจการแพทย์และความงาม
ปัจจัยสนับสนุน
1. การเติบโตของสังคมผู้สูงอายุ ทำให้ความต้องการใช้บริการด้านการแพทย์เพิ่มสูงขึ้น
2. การดูแลเรื่องของความสวยงาม และผิวพรรณของคนในปัจจุบันมีมาก
3. การกลับมาให้บริการเต็มรูปแบบของธุรกิจ Health & Wellness
4. ไทยมีสถนพยาบาลที่ได้รับการรับรองมาตรฐาน JC| มากถึง 59 แห่ง ซึ่งเมื่อรวมกับคำครองชีพและค่ารักษาพยาบาลที่ไม่สูงมากมือเทียบกับคู่แข่งในภูมิภาคเดียวกัน จึงทำให้ไทยมีศักยภาพเพียงพอที่จะสร้างรายได้จากการท่องเที่ยวเชิงการแพทย์ให้เติบโตต่อไปได้
5. จากนโยบายการเปิดประเทศคาดว่าท่องเที่ยวเชิงสุขภาพ (Medical Tourism) จะเริ่มทยอยกลับมาเข้าใช้บริการได้ ในปี 2565 น่จะอยู่ที่ประมาณ 130,000-180,000 ล้านคน หลักๆ จะเป็นชาวจีน ตะวันออกกลาง และยุโรป
ปัจจัยเสี่ยง
1. สถานการณ์ด้านร้ายได้ที่ลดลงมากเมื่อเทียบกับหนี้สินภาคครัวเรือนที่เพิ่มสูงขึ้นทำให้กำลังซื้อลดลง
2. กำลังซื้อในประเทศที่ถูกกดดันมากขึ้นจากปัญหาเงินเฟ้อ ซึ่งอาจกระทบต่อการตัดสินใจใช้จ่ายด้านสุขภาพของผู้บริโภค
3. ภาวะการแข่งขันที่รุนแรง การขาดแคลนบุคลากรทางการแพทย์ รวมถึงมาตรการควบคุมราคายา เวชภัณฑ์ และบริการทางการแพทย์ ที่ยังคงเป็นข้อจำกัดส่งผลให้ธุรกิจเติบโตต่ำกว่าที่คาดการณ์เอาไว้ได้
พ.ร.บ.ควบคุมเครื่องดื่มแอลกอฮอล์ ห้ามดื่มในสถานพยาบาล


พระราชบัญญัติควบคุมเครื่องดื่มแอลกอฮอล์ พ.ศ.2551 (มีผลบังคับตั้งแต่ วันที่ 14 กุมภาพันธ์ 2551 ) กำหนดสถานที่ห้ามขายเครื่องดื่มแอลกอฮอล์ดังนี้
ห้ามขายในสถานที่หรือบริเวณรัฐวิสาหกิจ และหน่วยงานอื่นของรัฐ ยกเว้นบริเวณที่จัดไว้เป็นร้านค้า หรือสโมสร
ห้ามขายเครื่องดื่มแอลกอฮอล์ในพื้นที่ประกอบกิจการโรงงานตามกฎหมายว่าด้วยโรงงาน โดยไม่ใช้บังคับกับโรงงานผลิตเครื่องดื่มแอลกอฮอล์ ที่ดำเนินการเป็นปกติธุระในทางการค้าของโรงงานผลิตเครื่องดื่มแอลกอฮอล์
ห้ามขายเครื่องดื่มแอลกอฮอล์ในสวนสาธารณะของรัฐวิสาหกิจหรือหน่วยงานอื่นของรัฐที่จัดไว้เพื่อการพักผ่อนของประชาชนโดยทั่วไป
ห้ามขายเครื่องดื่มแอลกอฮอล์ในพื้นที่ที่อยู่ในกำกับดูแล และใช้ประโยชน์ของราชการ นอกเหนือจากสถานที่ราชการตามมาตรา27(3)
ห้ามขายเครื่องดื่มแอลกอฮอล์ในพื้นที่ที่อยู่ในกำกับดูแลและใช้ประโยชน์ของ รัฐวิสาหกิจหรือหน่วยงานอื่นของรัฐ
ห้ามขายเครื่องดื่มแอลกอฮอล์ในบริเวณสถานีรถไฟ หรือในขบวนรถที่อยู่บนทางรถไฟตามกฎหมายว่าด้วยจัดวางการรถไฟและทางหลวง
ห้ามขายเครื่องดื่มแอลกอฮอล์ในบริเวณท่าเรือโดยสารสาธารณะ หรือบนเรือโดยสารสาธารณะประจำทาง
ห้ามขายเครื่องดื่มแอลกอฮอล์บนทางตามกฎหมายว่าด้วยการจราจรทางบก, ห้ามขายเครื่องดื่มแอลกอฮอล์บริเวณสถานีขนส่งตามกฎหมายว่าด้วยการขนส่งทางบก ผู้ใดฝ่าฝืนต้องระวางโทษจำคุกไม่เกินหกเดือน หรือปรับไม่เกินหนึ่งหมื่นบาท หรือทั้งจำทั้งปรับ
มาตรา 30 ห้ามขายเครื่องดื่มแอลกอฮอล์โดยวิธีการหรือในลักษณะ ดังต่อไปนี้
- ใช้เครื่องขายอัตโนมัติ ผู้ใดฝ่าฝืนต้องระวางโทษจำคุกไม่เกิน ๑ ปี หรือปรับไม่เกินสองหมื่นบาท หรือทั้งจำทั้งปรับ
- การเร่ขาย
- การลดราคาเพื่อประโยชน์ในการส่งเสริมการขาย
- ให้หรือเสนอให้สิทธิในการเข้าชมการแข่งขัน การแสดง การให้บริการ การชิงโชค การชิงรางวัล หรือสิทธิประโยชน์อื่นใดเป็นการตอบแทนแก่ผู้ซื้อเครื่องดื่มแอลกอฮอล์ หรือแก่ผู้นำหีบห่อหรือสลากหรือสิ่งอื่นใดเกี่ยวกับเครื่องดื่มแอลกอฮอล์มาแลกเปลี่ยนหรือแลกซื้อ
- โดยแจก แถม ให้ หรือแลกเปลี่ยนกับเครื่องดื่มแอลกอฮอล์ หรือกับสินค้าอื่น หรือการให้บริการอย่างอื่นแล้วแต่กรณี หรือแจกจ่ายเครื่องดื่มแอลกอฮอล์ในลักษณะเป็นตัวอย่างของเครื่องดื่มแอลกอฮอล์ หรือเป็นการจูงใจสาธารณชนให้บริโภคเครื่องดื่มแอลกอฮอล์ รวมถึงการกำหนดเงื่อนไขการขายในลักษณะที่เป็นการบังคับซื้อเครื่องดื่มแอลกอฮอล์โดยทางตรงหรือทางอ้อม
- โดยวิธีหรือลักษณะอื่นใดตามที่รัฐมนตรีประกาศกำหนดโดยคำแนะนำของคณะกรรมการ ผู้ใดฝ่าฝืน (2) (3) (4) (5) (6) ต้องระวางโทษจำคุกไม่เกิน ๖ เดือน หรือปรับไม่เกินหนึ่งหมื่นบาท หรือทั้งจำทั้งปรับ
มาตรา 31 ห้ามบริโภคเครื่องดื่มแอลกอฮอล์ในสถานที่หรือบริเวณดังต่อไปนี้
- วัดหรือสถานที่สำหรับปฏิบัติพิธีกรรมทางศาสนา
- สถานบริการสาธารณสุขของรัฐ สถานพยาบาลและร้านขายยา ยกเว้นบริเวณที่จัดไว้เป็นที่พักส่วนบุคคล
- สถานที่ราชการ ยกเว้นบริเวณที่จัดไว้เป็นที่พักส่วนบุคคล หรือสโมสร
- สถานศึกษา ยกเว้นบริเวณที่จัดไว้เป็นที่พักส่วนบุคคลหรือสโมสร หรือการจัดเลี้ยงตาม
ประเพณี หรือสถานศึกษาที่สอนการผสมเครื่องดื่มแอลกอฮอล์และได้รับอนุญาตตามกฎหมายว่าการศึกษาแห่งชาติ
- สถานีบริการน้ำมันเชื้อเพลิง หรือร้านค้าในบริเวณสถานีบริการน้ำมันเชื้อเพลิง
- สวนสาธารณะของทางราชการที่จัดไว้เพื่อการพักผ่อนของประชาชน
- สถานที่อื่นที่รัฐมนตรีประกาศกำหนด
7.1) ในบริเวณสถานีรถไฟ หรือในขบวนรถที่อยู่บนทางรถไฟ
7.2) ห้ามบริโภคเครื่องดื่มแอลกอฮอล์ในพื้นที่ดังต่อไปนี้ ยกเว้น บริเวณที่จัดไว้เป็นที่พักส่วนบุคคล หรือสโมสร หรือการจัดเลี้ยงตามประเพณี
7.2.1) พื้นที่ที่อยู่ในกำกับดูแลและใช้ประโยชน์ของราชการ
7.2.2) พื้นที่ที่อยู่ในกำกับดูแลและใช้ประโยชน์ของรัฐวิสาหกิจหรือหน่วยงานอื่นของรัฐ
7.3) ในบริเวณท่าเรือโดยสารสาธารณะหรือบนเรือโดยสารสาธารณะประจำทาง
7.4) บริเวณสถานีขนส่งตามกฎหมายว่าด้วยการขนส่งทางบก
7.5) บนทางในขณะขับขี่หรือในขณะโดยสารอยู่ในรถ หรือบนรถ
7.6) ในพื้นที่ประกอบกิจการโรงงานตามกฎหมายว่าด้วยโรงงาน โดยไม่ใช้บังคับกับการบริโภคเครื่องดื่มแอลกอฮอล์ที่เป็นขั้นตอนของการผลิตหรือรักษามาตรฐานการผลิตเครื่องดื่มแอลกอฮอล์
ผู้ใดฝ่าฝืนต้องระวางโทษจำคุกไม่เกิน 6 เดือน หรือปรับไม่เกิน 1 หมื่นบาท หรือทั้งจำทั้งปรับ
ช่วงเวลการเกิดอุบัติเหตุ
ห้วงเวลาเกิดอุบัติเหตุ เรียงตาม 5 ลำดับ แรก
- 19.00 - 19.59 น. 8.18% ราว 44 ราย
- 18.00 - 18.59 น. 7.62% ราว 40 ราย
- 15.00 - 15.59 น. 7.06% ราว 37 ราย
- 16.00 - 16.59 น. 6.69% ราว 35 ราย
- 17.00 - 17.59 น. 5.76% ราว 30 ราย
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส เขตปริมณฑล
จังหวัดนนทบุรี
รหัสสาขา 09988 ธารา สแควร์
รหัสสาขา 05164 เลี่ยงเมืองนนทบุรี 15
รหัสสาขา 08310 งามวงศ์วาน 25 ซอย 9
รหัสสาขา 11826 เรวดี 17
รหัสสาขา 09061 งามวงศ์วาน 18 จุด 2
รหัสสาขา 00574 ท่าอิฐ
รหัสสาขา 10203 นนทบุรี 48
รหัสสาขา 10951 เลี่ยงเมืองปากเกร็ด 37
รหัสสาขา 15269 สัมมากร ราชพฤกษ์
จังหวัดนครปฐม
รหัสสาขา 15316 ตลาดไฟฟ้า (นครชัยศรี)
จังหวัดปทุมธานี
รหัสสาขา 11681 ชุมชนบางกุฏีทอง (ติวานนท์)
รหัสสาขา 11041 ไทยสมบูรณ์ 3
รหัสสาขา 11742 บงกช ซอย 29
รหัสสาขา 06838 ตลาดเหรียญทอง
รหัสสาขา 11556 แพรมาพร รังสิตคลอง 11
จังหวัดสมุทรปราการ
รหัสสาขา 09688 กิ่งแก้ว 31/2
รหัสสาขา 08875 ม.ลัลลราวิลล์
รหัสสาขา 07251 กิ่งแก้ว 66
รหัสสาขา 13547 หมู่บ้านปรีชา (หนามแดง)
รหัสสาขา 15336 เดอะคอนเนคบางโฉลง
รหัสสาขา 13196 แบริ่ง ซอย 3
รหัสสาขา 00014 ตลาดด่านสำโรง
รหัสสาขา 13624 หมู่บ้านดีพร้อม (ซอยพุฒสี)
รหัสสาขา 13557 ตลาดนัดเมย์ มาร์เก็ต (ซอยวัดหลวงพ่อโต)
รหัสสาขา 16271 กิ่งแก้ว 25/1 (กลางซอย) จุด 2
รหัสสาขา 13909 ม.ลลิล (ซอยมังกร)
นนทบุรี
- รพ.พระนั่งเกล้า โทร. 025284567
- สถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพทางการแพทย์แห่งชาติ โทร. 029659186 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์
- รพ.ศรีธัญญา โทร. 025287800 ฟื้นฟูผู้ป่วยหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ จิตเวชผู้ใหญ่/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- มูลนิธิอนุเคราะห์คนพิการในพระบรมราชูปถัมภ์ ปากเกร็ด โทร. 025839597 ทำเครื่องดาม อุปกรณ์ช่วย/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ
- ศูนย์การศึกษาพิเศษ ประจำจังหวัดนนทบุรี โทร. 021475244 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.นนทเวช โทร. 02-596-7888 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ เตรียมความพร้อมการพูด
- คลินิกกิจกรรมบำบัด KIDS PLUS สาขาแจ้งวัฒนะ ปากเกร็ด โทร. 0830095547 กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- คลินิกการประกอบโรคศิลปะสาขากิจกรรมบำบัดเอ็มพาว นนทบุรีเวอร์ โทร. 0811923046 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- มีรักคลินิกโทร. 025894582 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ศูนย์บริการการแพทย์นนทบุรี บางกรวย โทร. 024326167 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน
- คลินิกการประกอบโรคศิลปะสาขากิจกรรมบำบัด 7senses samakkee โทร. 0922707629 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก


ประเทศไทยเป็นอีกหนึ่งประเทศที่เล็งเห็นถึงความสำคัญของการนำเทคโนโลยี AI มาประยุกต์ใช้ โดยเริ่มมีการพูดถึงในวงกว้างตั้งแต่ปี พ.ศ. 2562 เป็นต้นมา และมีการนำเทคโนโลยี AI มาใช้ในวงการแพทย์อย่างแพร่หลาย กระทรวงสาธารณสุขได้นำเสนอนโยบายเกี่ยวกับ ‘โครงการอนาคตแห่งประเทศไทยสู่การดูแลสุขภาพแบบองค์รวมและการดูแลสุขภาพขั้นสูงในปี (The future of Thailand towards holistic wellness care and advanced health promotion) พ.ศ. 2566-2570’[2] ภายใต้แผนพัฒนาเศรษฐกิจและสังคมแห่งชาติ ฉบับที่ 13 ซึ่งให้ความสำคัญกับเทคโนโลยี AI การคาดการณ์โรคล่วงหน้า (Health Prediction) และเทคโนโลยีด้านดิจิทัล ที่จะถูกกำหนดให้เป็นหนึ่งในโครงสร้างพื้นฐานของการบริการส่งเสริมสุขภาพและป้องกันโรคขั้นสูง เพื่อเพิ่มขีดความสามารถของระบบบริการและการเข้าถึงบริการของประชาชนในการดูแลสุขภาพและป้องกันโรค ด้วยเทคโนโลยีด้านการแพทย์และสาธารณสุขแบบจำเพาะและแม่นยำ นอกจากนี้กระทรวงสาธารณสุขยังตั้งเป้าพัฒนาโรงพยาบาลและสถานบริการด้านสาธารณสุขต่าง ๆ สู่การเป็น ‘Smart Hospital’ เพื่อลดภาระงานของบุคลากรทางการแพทย์ และยกระดับประสบการณ์การรักษาที่ดีให้แก่ผู้ป่วย โดยจากข้อมูลของกระทรวงสาธารณสุขในไตรมาส 4 ปีพ.ศ. 2564 พบว่ามากกว่าร้อยละ 45 ของหน่วยบริการทั้งหมดได้พัฒนาไปสู่การเป็น Smart Hospital แล้ว[3]
ในรายงาน Future Health Index ยังแสดงให้เห็นว่าระบบสาธารณสุขในภูมิภาคเอเชียแปซิฟิก มีการนำเทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้ามาใช้บ้างแล้ว โดยมากกว่าหนึ่งในสี่ (ร้อยละ 27) ของโรงพยาบาลหรือสถานพยาบาลนั้นเริ่มใช้เทคโนโลยีดังกล่าวแล้ว ในขณะที่ร้อยละ 44 กำลังอยู่ในระหว่างการเตรียมความพร้อมในการใช้งาน ซึ่งมากกว่าค่าเฉลี่ยทั่วโลกที่ร้อยละ 32 และเมื่อถามถึงการประยุกต์ใช้เทคโนโลยี AI และการนำเทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้ามาใช้ในส่วนใดที่มีประโยชน์สูงสุด ร้อยละ 91 บอกว่าใช้ในด้านคลินิก ในขณะที่ผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกมีระดับความเชื่อมั่นถึงร้อยละ 87 (เทียบกับทั่วโลกร้อยละ 71) ในการใช้เทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้าเชิงคลินิก และยังเห็นว่าเทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้ามีประโยชน์ต่อการบริการผู้ป่วยถึงร้อยละ 87 ผลลัพธ์ด้านสุขภาพร้อยละ 84 และมีผลที่ดีต่อประสบการณ์ของบุคลากรทางการแพทย์ร้อยละ 82
Happy Childrens Day 2023 โรงพยาบาลธนบุรี บำรุงเมือง LINK
โรงพยาบาลธนบุรี บำรุงเมือง จัด Happy Children’s Day 2023 มาแล้วกิจกรรมวันเด็กของน้องๆทุกคน งานนี้มีทั้งกิจกรรมสนุกสนานมากมาย พร้อมของรางวัลสุดเจ๋งที่ไม่ควรพลาด แล้วพบกันวันที่ 14 มกราคม 2566 ตั้งแต่เวลา 9:00 - 15:00 น. ศูนย์กุมารเวชกรรม ชั้น B1 โรงพยาบาลธนบุรี บำรุงเมือง กันนะคะ
ศูนย์บริการสาธารณสุขที่ 1 รัตนาธิเบศร์
- ที่อยู่ ศูนย์ราชการนนทบุรี ตำบล บางกระสอ ตำบล ตลาดขวัญ อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทร. 02-5914185
- แผนที่
- Facebook
บริการ
- คลินิกโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น.
- คลินิกฝังเข็ม วันจันทร์, อังคารและพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-16.30 น.
- คลินิกกายภาพบำบัด วันพุธและศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-16.30 น.
- คลินิกสุขภาพเด็กดี (สร้างเสริมภูมิคุ้มกันโรค) วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
- คลินิกวางแผนครอบครัว วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
หมายเหตุ ติดต่อนัดหมายคลินิกกายภาพบำบัด คลินิกสุขภาพเด็กดี และคลินิกวางแผนครอบครัว โทร 02-5914185 และ 02-5914186
คลินิกสูตินรีเวช ตรวจรักษาโรคสตรี ตรวจครรภ์
คลินิกสูตินรีเวช ตรวจรักษาโรคสตรี ตรวจครรภ์ โรคเกี่ยวกับเนื้องอก มดลูก ด้วยเครื่องมือทางการแพทย์ที่ทันสมัย
เปิดให้บริการ เฉพาะวันอังคาร
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์กระดูกและข้อ ให้บริการแบบครบวงจร
Tel: 052 089 864
Call Center: 1719
ศูนย์กระดูกและข้อ
" เปิดให้บริการวันจันทร์ – วันอาทิตย์ เวลา 07.00 – 20.00 น. "
ศูนย์กระดูกและข้อ โรงพยาบาลกรุงเทพเชียงใหม่ เป็นศูนย์การแพทย์ที่สามารถให้การดูแลรักษาความผิดปกติของกระดูก เอ็น ข้อ กล้ามเนื้อ และเส้นประสาท ได้อย่างครบถ้วน โดยให้บริการแบบครบวงจร
การให้บริการตรวจวินิจฉัยกระดูกและข้อ
- การตรวจด้วยเครื่องเอกซเรย์ (X-Ray) คือการใช้รังสีเอกซ์ซึ่งมีลักษณะเป็นคลื่นแม่เหล็กไฟฟ้าในการถ่ายภาพวินิจฉัยความผิดปกติของกระดูก สามารถใช้ดูความผิดปกติเบื้องต้น เช่น กระดูกแตกหัก หรือมีการติดเชื้อ ข้อต่ออักเสบ มะเร็งหรือเนื้องอกกระดูก
- การตรวจด้วยเครื่องเอกซเรย์คอมพิวเตอร์ (CT Scan) เป็นการตรวจดูรอยโรคของกระดูก ซึ่งเป็นการตรวจที่มีความไวสูง และใช้ในการตรวจคัดกรองโรคกระดูก และภาวะการบาดเจ็บของกระดูกได้
- การตรวจด้วยเครื่อง MRI เป็นการตรวจที่มีความละเอียดสูง มักใช้ในกรณีที่ประเมินผู้ป่วยที่มาพบแพทย์ด้วยอาการปวดกระดูกที่ไม่พบความผิดปกติจากการถ่ายภาพเอกซเรย์ หรือวินิจฉัยการหักของกระดูกในตำแหน่งที่ตรวจพบได้ยาก การตรวจพยาธิสภาพของกล้ามเนื้อ เส้นเอ็น และเส้นประสาท เป็นต้น
- การตรวจความหนาแน่นกระดูก (Bone Densitometry) เป็นการตรวจสุขภาพหรือความแข็งแรงของกระดูกว่าอยู่ในระดับปกติมากน้อยเพียงใด หรือเป็นโรคกระดูกพรุนหรือไม่
49&FRIENDS : สายรุ้ง ความเชื่อกับความจริง LINK
49&FRIENDS : สายรุ้ง ความเชื่อกับความจริง
49&FRIENDS : Rainbow, Belief and Reality
จากประวัติศาสตร์ของมนุษยชาติ เราอยู่กับสิ่งที่รู้และใช้ชีวิตกับสิ่งต่างๆ เหล่านั้นด้วย ‘ความเชื่อ’ ว่าสิ่งเหล่านั้นเป็นความจริง แต่เมื่อมนุษยชาติพัฒนาก้าวไปข้างหน้า เราค้นพบความจริงต่างๆ ที่เปลี่ยนแปลงไปตามกาลเวลา โดยบางครั้งความเชื่อเหล่านั้นอาจไม่ได้พัฒนาตามไป หรือไม่มีข้อมูลที่พิสูจน์ว่าความเชื่อเหล่านั้นยังเป็นสิ่งที่อธิบายได้อย่างถูกต้อง
ดังนั้น ความสําคัญในการตระหนักถึงความจริงในแต่ละยุคสมัย เพื่อให้เราสามารถใช้ชีวิตกับความจริงเหล่านั้นได้อย่างมิตรดีปรองดอง เราในฐานะผู้สร้างสรรค์จึงจะนําเสนอความจริงในแง่มุมต่างๆ และความสัมพันธ์ระหว่างความเชื่อ เพื่อให้ทุกคนก้าวไปสู่อนาคตที่สร้างสรรค์ด้วยกัน โดยตัวอย่างของความสัมพันธ์ระหว่างความจริงและความเชื่อในอดีตและปัจจุบัน เช่น รุ้งกินน้ําที่ในสมัยโบราณเชื่อว่าเป็นตัวแทนของความหวังสําหรับผู้พบเห็น แต่ความจริงในปัจจุบันการปรากฏตัวของรุ้งกินน้ําที่บ่อยขึ้นกลับแสดงออกถึงความรุนแรงของภาวะโลกร้อน หรือ Global Warming ที่กําลังเกิดขึ้นอย่างรุนแรงในปัจจุบัน อีกทั้งนําเสนอการพัฒนาของย่านผ่านความจริง ความคิดสร้างสรรค์ และเทคโนโลยี เช่น การนํา AI เข้ามาวิเคราะห์ในสิ่งที่เราไม่เคยเห็น เพื่อเข้ามาเติมเต็มให้คุณภาพชีวิตของผู้คนในย่านนี้ดีขึ้นไปด้วยกัน
ร่วมงานฟรี จำนวน 20 คน
* สงวนสิทธิ์เฉพาะผู้เข้าร่วมกิจกรรมที่ลงทะเบียนล่วงหน้า / ผู้เข้าร่วมกิจกรรมต้องส่งผลตรวจ ATK / ผู้เข้าร่วมกิจกรรมต้องสวมใส่หน้ากากอนามัยตลอดการทํากิจกรรม / ไม่มีค่าใช้จ่ายในการเข้าร่วม
เสาร์ 04 ก.พ. 2566 11:00 - 17:00
เสาร์ 11 ก.พ. 2566 11:00 - 17:00
โมเดลทดลองการจัดการสตรีทฟู้ดริมทางย่านเศรษฐกิจสร้างสรรค์ ซอยเจริญกรุง 32 LINK
Re-Vendor เจริญกรุง 32
Rethinking / Redesign / Reorganize street vendor community
โมเดลทดลองการจัดการสตรีทฟู้ดริมทางย่านเศรษฐกิจสร้างสรรค์ ซอยเจริญกรุง 32
แม้ว่าสตรีทฟู้ด (Street food) จะถือเป็นเสน่ห์ของกรุงเทพฯ ที่ใครๆ ต่างก็หลงใหล เพราะสามารถดึงดูดนักท่องเที่ยวจากทั่วโลกให้มาเดินชมเมืองพร้อมชิมอาหารรสเด็ด กระตุ้นให้เมืองคึกคัก มีชีวิตชีวาตลอดวัน แต่ก็ยังมีข้อถกเถียงในด้านการบริหารจัดการพื้นที่ระหว่างร้านค้า คนกิน และคนเดิน รวมถึงการจัดการของเสียและความสะอาดที่ส่งผลกระทบต่อผู้บริโภคและเมือง
โปรเจ็กต์เล็กๆ กึ่งทดลองครั้งนี้ จึงอยากใช้กระบวนการมีส่วนร่วม ความคิดสร้างสรรค์ และงานออกแบบ มาร่วมสร้างความเป็นไปได้ใหม่ให้กับสตรีทฟู้ดริมทาง โดยเฉพาะร้านค้าแผงลอย ให้เป็นมิตรกับเมืองมากยิ่งขึ้น ทั้งในแง่สิ่งแวดล้อม ธุรกิจ ชุมชน และผู้คนที่หลากหลายในเมือง
มาร่วมค้นหาแนวทางในการอยู่ร่วมกันอย่างเป็นมิตรกับเมืองของร้านค้าริมทางไปด้วยกัน
ซอยเจริญกรุง 32 ถนนเจริญกรุง บางรัก กรุงเทพฯ 10500
4 - 12 ก.พ.08:00 - 21:00
สิ่งที่สามารถตรวจสอบ หรือสอบถามจากทางคลินิก หรือโรงพยาบาลได้ในกรณีนี้ คือ
- ชื่อยี่ห้อของซิลิโคนที่ใช้ (เป็นสิ่งสำคัญที่สุด)
- เลข LOT/serial number ที่มาใน package ใหญ่ ซึ่งในอดีต โรงพยาบาล หรือ คลินิก อาจจะไม่ได้เก็บข้อมูลส่วนนี้ไว้ ดังนั้นหากขอตรวจสอบย้อนหลังจะทำได้ลำบาก แต่หากคนที่ต้องการเสริมใหม่ ควรจะสามารถขอดูและตรวจสอบได้
สำหรับกรณีที่ 2 หากซิลิโคนนั้น ทำมาเป็นแบบสำเร็จรูป หมายถึงขึ้นรูปมาจากโรงงานแล้ว ส่วนมากจะแยกเป็น package ย่อยๆ และ sterile ไว้แล้ว ในกรณีเช่นนี้ จะมีเลข LOT หรือ serial number แยกมาในแต่ละชิ้น ซึ่งสิ่งที่สามารถตรวจสอบได้คือ ชื่อยี่ห้อซิลิโคน และ เลข LOT/serial number ที่แยกมาเช่นเดียวกัน
ทั้งนี้ นพ. ธนัญชัย ยังกล่าวอีกว่า ในกรณีถุงซิลิโคน สำหรับเสริมหน้าอก หรือ เสริมก้น/สะโพก การตรวจสอบจะทำได้ง่ายกว่าซิลิโคนเสริมจมูกและคาง เพราะทางบริษัทจะมีกล่องแยกมาอย่างชัดเจน มีชื่อผลิตภัณฑ์ ขนาด เลข LOT/serial number ที่ชัดเจน และ ยังมี card หรือใบรับประกัน ทั้ง paper หรือ online ให้คนไข้เก็บไว้อีกด้วย
โรงพยาบาลแพทย์รังสิต 2
เนื่องจากตลอดระยะเวลาที่ผ่านมา โรงพยาบาลแพทย์รังสิต พัฒนามาตรฐาน การดูแลรักษาพยาบาลอย่างต่อเนื่อง จนเป็นที่ไว้วางใจ เชื่อมั่น และประทับใจของชาวจังหวัดปทุมธานีและกรุงเทพฯ ตอนเหนือเสมอมา จนทำให้มีผู้เข้ารับบริการมากขึ้น และเพื่อลดความแออัดของผู้มาเข้ารับบริการ จึงจัดตั้งโรงพยาบาลแพทย์รังสิต 2 ในปี 2562 เพื่อรองรับจำนวนผู้ป่วยที่มากขึ้น โดยให้มีการรักษาพยาบาลทุกสาขา โดยมุ่งเน้นแพทย์ชำนาญการเฉพาะด้านที่มีความรู้ความสามารถและนำเทคโนโลยีมาใช้เพื่อขยายขีดความสามารถในการรักษา อาทิ เทคโนโลยีการส่องกล้องทางเดินอาหาร เทคโนโลยีการจี้หัวใจไฟฟ้าแบบ 3D เป็นต้น เรามั่นใจว่าความเชี่ยวชาญในด้านต่างๆนี้ จะทำให้สามารถรองรับตลาด AEC ได้มากขึ้น
เนื่องจากสังคมไทยกำลังก้าวเข้าสู่สังคมผู้สูงอายุ และเพื่อสนับสนุนด้วยความใส่ใจดุจญาติมิตร เรามุ่งมั่นส่งเสริมให้ชาวจังหวัดปทุมธานี หรือบริเวณใกล้เคียง มุ่งสู่การมีสุขภาพที่ดีชีวิตยืน เน้นการป้องกันการโรค ความเสื่อมของสุขภาพ และเราจะเป็นส่วนหนึ่งในการขับเคลื่อนการให้บริการด้านสุขภาพ เพื่อให้ผู้รับบริการมีสุขภาพที่สมบูรณ์แข็งแรงให้ได้ยาวนานที่สุด เพื่อรองรับแนวโน้มสภาพสังคมในอนาคต
LAAB ต่างจากวัคซีนอย่างไร
คณะกรรมการแพทยสภา
มาตรา 14 ให้มีคณะกรรมการคณะหนึ่ง เรียกว่า “คณะกรรมการแพทยสภา” ประกอบด้วย ปลัดกระทรวงสาธารณสุข อธิบดีกรมการแพทย์ อธิบดีกรมอนามัย เจ้ากรมแพทย์ทหารบก เจ้ากรมแพทย์ทหารเรือ เจ้ากรมแพทย์ทางอากาศ นายแพทย์ใหญ่กรมตำรวจ คณบดีคณะแพทยศาสตร์ในมหาวิทยาลัย ผู้อำนวยการวิทยาลัยแพทยศาสตร์ เป็นกรรมการโดยตำแหน่ง และกรรมการซึ่งได้รับเลือกตั้งโดยสมาชกอีกจำนวนเท่ากับจำนวนกรรมการโดยตำแหน่งในขณะเลือกต้งแต่ละวาระ และให้เลขาธิการเป็นกรรมการและเลขานุการ
มาตรา 15 ให้ผู้ซึ่งเป็นกรรมการโดยตำแหน่ง และกรรมการโดยการเลือกตั้งประชุมกันเลือกกรรมการเพื่อดำรงตำแหน่งนายกแพทยสภา อุปนายกแพทยสภาคนที่หนึ่ง และอุปนายกแพทยสภาคนที่สอง ตำแหน่งละหนึ่งคน
ให้นายกแพทยสภาเลือกสมาชิกผู้มีคุณสมบัติตามมาตรา 17 เพื่อดำรงตำแหน่งเลขาธิการหนึ่งคนและเลือกกรรมการเพื่อดำรงตำแหน่งรองเลขาธิการ และเหรัญญิกอีกตำแหน่งละหนึ่งคน ทั้งนี้ โดยความเห็นชอบของที่ประชุมกรรมการ นายกแพทยสภา อุปนายกแพทยสภาคนที่หนึ่ง และอุปนายกแพทยสภาคนที่สอง ให้ดำรงตำแหน่งตามวาระของกรรมการซึ่งได้รับเลือกตั้ง และเลขาธิการ รองเลขาธิการ และเหรัญญิก ให้พ้นจากตำแหน่งตามนายกแพทยสภา
ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย The Royal College of Physicians of Thailand
ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย
The Royal College of Physicians of Thailand
อาคารเฉลิมพระบารมี 50 ปี ชั้น 7 เลขที่ 2 ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
โทรศัพท์ : 0-2716-6744 โทรศัพท์มือถือ : 08-1450-4719, 08-9139-4555 แฟกซ์ : 0-2718-1652
ดีอีเค DEK 420 น้ำกัญชา รสออริจินัล
น้ำกัญชารสออริจินัล DEK 420 ขนาด 250 มล. ผลิตจากใบกัญชาแท้ สายพันธุ์หางกระรอก ซึ่งเป็นสายพันธุ์กัญชาไทยแท้ที่ดีที่สุด อุดมด้วยสาร THC และ CBD ในระดับสูง ปราศจากน้ำตาล 0 แคลอรี่ ปราศจากสีสังเคราะห์และสารให้ความหวาน
คำเตือน **เด็กที่มีอายุต่ำกว่า 20ปี สตรีมีครรภ์ และสตรีให้นมบุตร ไม่ควรรับประทาน** หากมีอาการผิดปกติ ควรหยุดรับประทานทันที/ มีสาร THC ไม่เกิน 1.6 มิลลิกรัมต่อขวด/ ผู้ที่แพ้หรือไวต่อสาร THC และ CBD ควรระวังในการรับประทาน/ อาจทำให้ง่วงซึม ควรหลีกเลี่ยงการขับขี่ยานพาหนะหรือทำงานเกี่ยวกับเครื่องจักรกล/ ไม่ควรบริโภคเกินวันละ 2 ขวด
Pfizer COVID-19 first and booster dose For Tourists
Now Opened Online Reservations Pfizer COVID-19 first and booster dose For Tourists 12 years and above.
Walk-in Available
Every Friday
(Official working hours)
From 8.30 AM to 1.30 PM
at vaccination point Rajavithi Hospital
1,380 BAHT NET
included:
- OPD service: 300 THB
- Pfizer vaccine: 1,000 THB
- medical supplies 80 THB
Attention
• A passport or reservation document must be presented before vaccination.
• Please present at the vaccination point 15 mins before
• The vaccination point is closed outside the government’s official working hours.
1. หลักการของประกันสุขภาพถ้วนหน้า
สุขภาพเป็นปัจจัยพื้นฐานของความเป็นมนุษย์ ซึ่งการมีสุขภาพดีของบุคคล มีความสัมพันธ์กับการเข้าถึงบริการสุขภาพที่ครอบคลุมทั้ง 4 มิติ ทั้งการสร้างเสริม สุขภาพ การป้องกันโรค การรักษาพยาบาล และการฟื้นฟูสมรรถภาพที่จำเป็น ต่อสุขภาพและการดำรงชีวิต แนวคิดพื้นฐานที่สำคัญของการสร้างหลักประกัน สุขภาพ คือ การให้สิทธิประชาชนเข้าถึงบริการสุขภาพที่จำเป็นโดยไม่มีอุปสรรค ทางการเงิน หลักประกันสุขภาพถ้วนหน้าจึงเป็นเรื่องของการสร้างความมั่นคงด้าน สุขภาพให้กับทุกคน ตั้งแต่แรกเกิดและตลอดช่วงชีวิตให้มีสุขภาพที่ดี เมื่อเจ็บป่วย ได้รับการดูแลรักษาพยาบาลที่มีคุณภาพได้มาตรฐาน ซึ่งส่งผลต่อการเสริมสร้าง ศักยภาพทุนมนุษย์ให้มีความพร้อมขับเคลื่อนเศรษฐกิจและสังคมโดยรวม
ปัจจุบันประเทศไทยมีประกันสุขภาพภาครัฐ 5 ประเภท ได้แก่ 1) สิทธิหลัก ประกันสุขภาพแห่งชาติ 2) สิทธิประกันสังคม 3) สิทธิสวัสดิการการรักษาพยาบาล ของข้าราชการ 4) สิทธิสวัสดิการพนักงานส่วนท้องถิ่น และ 5) สิทธิหน่วยงาน รัฐอื่นๆ
อ่านเพิ่มเติม
ประเทศไทยก้าวสู่หลักประกันสุขภาพถ้วนหน้า (Universal Health Coverage, UHC) หลังจากรัฐบาลจัดให้มีกองทุนหลักประกันสุขภาพแห่งชาติ ตาม พ.ร.บ.หลักประกันสุขภาพแห่งชาติ พ.ศ. 2545 ทำให้ประชาชนคนไทยมีสิทธิ เข้าถึงบริการสาธารณสุขอย่างทั่วถึง และลดค่าใช้จ่ายด้านสุขภาพของครัวเรือน ไม่ต้องล้มละลายจากค่ารักษาพยาบาล
แอดเวนเจอร์ วอเตอร์ โซน สนุกกับสายน้ำ คายัค ซับบอร์ด ล่องแพยาง
การตัดคะแนน กรณีรู้ตัว/ไม่รู้ตัว ผู้ขับขี่
กรณีรู้ตัวผู้ขับขี่ - ให้ตัดคะแนนความประพฤติในการขับรถของผู้นั้น
กรณีไม่พบ/ไม่รู้ตัว ผู้ขับขี่ - เป็นใบสั่งที่ติดผูก หรือ แสดงไว้ที่รถ หรือ ส่งทางไปรษณีย์ ให้ตัดคะแนนตามชื่อ ที่ปรากฏในหลักฐานทางทะเบียนเป็นผู้ครอบครองรถ ตามกฏหมาย
ถ้าถูกตัดจนเหลือ 0 คะแนน จะถูกสั่งพักใบอนุญาตขับขี่ ทุกชนิด คราวละ 90 วัน
นั่นคือ "ห้ามขับรถทุกชนิด"
บทพิสูจน์ความสำเร็จมากมายในปี 2565 ที่ผ่านไป


ในปี 2565 บำรุงราษฎร์มีบทพิสูจน์ความสำเร็จมากมาย ซึ่งสะท้อนถึงความมุ่งมั่นในการรักษาผู้ป่วยภาวะวิกฤต และการดูแลโรคซับซ้อน ได้แก่ การเปิด ‘แผนกผู้ป่วยวิกฤตระบบประสาทและไขสันหลัง’ (Neurocritical Care Unit: NCCU), การเปิด ‘ศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร’ (Gastrointestinal Motility Center), การเปิด ‘ศูนย์ปลูกถ่ายกระจกตา’ (Cornea Transplant Center), การเปิด ‘คลินิกคุณภาพการนอนหลับ’ (Comprehensive Sleep Clinic), การพัฒนาคุณภาพของห้องปฏิบัติการทางการแพทย์ เพื่อให้บริการด้านจีโนมิกส์ด้วยเทคโนโลยี Next Generation Sequencing (NGS) ที่ช่วยในการถอดรหัสพันธุกรรมเพื่อทำนายโรค, การเปิดตัว Radiology AI นวัตกรรมที่เข้ามาช่วยรังสีแพทย์ในการวิเคราะห์และระบุตำแหน่งภาวะความผิดปกติของปอดและมะเร็งเต้านมระยะแรกเริ่มได้อย่างแม่นยำ รวมถึงการปรับตัวสู่การเป็น Digitized Hospital โดยนำประโยชน์ของเทคโนโลยีด้านดิจิทัลมาปรับใช้ในการบริการ มีการพัฒนา Bumrungrad Application ให้ครอบคลุมมากขึ้น โดยเพิ่มฟีเจอร์ Bumrungrad FastTrack Pay เพื่อความสะดวกในการชำระเงินผ่านแอปพลิเคชั่น โดยไม่จำเป็นต้องรอชำระเงินหน้าเคาน์เตอร์ เป็นต้น
30 มกราคม 2566
1. การเมืองไม่เกี่ยวข้องคำสั่งย้าย
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า รัฐมนตรีจะหารือกับปลัด สธ. เรื่องการแต่งตั้งโยกย้ายข้าราชการตั้งแต่ระดับ C10 ขึ้นไปเท่านั้น เนื่องจากต้องนำเรื่องเข้าสู่ที่ประชุมครม. ส่วนการแต่งตั้งโยกย้ายข้าราชการระดับต่ำกว่า C10 ลงไป จะเป็นอำนาจของปลัด สธ. เพราะถือว่าเป็นหัวหน้าส่วนราชการ รัฐมนตรีไม่มีส่วนเกี่ยวข้องและฝ่ายการเมืองไม่เข้าไปยุ่งเกี่ยวแน่นอน
- นายสมบูรณ์ คำแหง ประธาน คกก.ประสานงานองค์กรพัฒนาเอกชน (กป.อพช.) โพสต์ว่า เรื่องย้าย นพ.สุภัทร ออกจากพื้นที่อ.จะนะ เป็นการสมรู้ร่วมคิดและทำกันอย่างเป็นขบวนการตั้งแต่พรรคภูมิใจไทย พรรคประชาธิปัตย์และพรรคพลังประชารัฐ มีความพยายามย้ายหมอหลายครั้ง ครั้งแรกจากเมื่อปี 2555-2560 จากนพ.สุภัทรออกมาแสดงท่าทีคัดค้านโครงการโรงไฟฟ้าถ่านหินเทพา ซึ่งต้องย้อนไปดูว่าพรรคใดอยู่เบื้องหลังผลประโยชน์ ครั้งที่ 2 ปี 2564 นพ.สุภัทร ออกมาวิพากษ์โครงการนิคมอุตสาหกรรมจะนะ ผู้บริหาร ศอ.บต. คือ รองนายกฯ ประวิตร วงษ์สุวรรณ จนทำให้รัฐบาลต้องยอมรับข้อเสนอจัดทำ SEA และมีผลให้ยุติโครงการไว้ก่อน และครั้งนี้คือฝีมือของพรรคภูมิใจไทย หลัง นพ.สุภัทร ออกมาวิพากษ์วิจารณ์ รมต.อนุทิน ต่อความผิดพลาดในการบริหารจัดการวัคซีน และ ATK จนถึงนโยบายกัญชาเสรี การย้ายหมอสุภัทรเป็นเรื่องหนักใจของขรก.ระดับสูงเสี่ยงจะถูกฟ้องศาลปกครอง จึงมีการวางแผน เริ่มจากทำให้ตำแหน่ง ผอ.รพ.สะบ้าย้อยว่างลง ใช้ข้ออ้างมีปัญหามากไม่สามารถหาใครมาแก้ปัญหาได้ ประชาชนไม่ได้โง่ การย้ายครั้งนี้ไม่ใช่เรื่องปกติ
2. ไม่ทบทวนคำสั่งย้าย
- นพ.โอภาส การย์กวินพงศ์ ปลัด สธ. กล่าวว่า คำสั่งโยกย้ายเป็นไปตามระเบียบทางราชการ ผู้มีสิทธิพิจารณาทบทวนคำสั่งคือผู้ลงนาม มีการเปิดช่องให้ผู้ถูกโยกย้ายส่งเรื่องอุทธรณ์
- นพ.สวัสดิ์ อภิวัจนีวงศ์ ผู้ตรวจฯ เขต 12 กล่าวว่า ก่อนออกคำสั่งมีการพิจารณารอบคอบแล้วจะไม่มีการทบทวนคำสั่งอีกทั้งนี้ มีการคุยกันมานานแล้วตั้งแต่ ธ.ค.65 ซึ่ง รพ.สะบ้าย้อย มีปัญหาและต้องการคนเก่งเข้าไปพัฒนาจริงๆ
- เพจชมรมแพทย์ชนบท แชร์โพสต์ของ ผศ.ดร.นพ.สุธีร์ รัตนะมงคลกุล หัวหน้าภาควิชาเวชศาสตร์ป้องกันและสังคมคณะแพทยศาสตร์ มศว. ระบุ ปลัด สธ. จะปัดความรับผิดชอบไม่ได้
- เพจชมรมแพทย์ชนบท ระบุ ปลัด สธ.หาตัวช่วย พร้อมแชร์จดหมายข่าวของชมรมโรงพยาบาลศูนย์/โรงพยาบาลทั่วไปเป็นข้อคิดเห็นของ นพ.อนุกูล ไทยถานันดร์ ประธานชมรมโรงพยาบาลศูนย์/โรงพยาบาลทั่วไป ต่อกรณีคำสั่งโยกย้าย นพ.สุภัทร ว่าการโยกย้ายเป็นเรื่องปกติสำหรับ ขรก. ไม่ว่าจะทำงานที่ใดก็สามารถทำงานพัฒนา รพ.เพื่อประโยชน์สุขของประชาชนได้เหมือนกัน ถามว่าหากนพ.อนุกูล ถูกย้ายจาก ผอ.รพ.ราชบุรี ไปเป็น ผอ.รพ.บ้านโป่งซึ่งมีปัญหาสภาพคล่อง โดยไม่มีการพูดคุย จะเป็นธรรมหรือไม่
- นพ.จตุชัย มณีรัตน์ นพ.สสจ.เชียงใหม่ และประธานชมรม นพ.สสจ. กล่าวถึงกรณีนี้ว่า เป็นเรื่องปกติของข้าราชการมีทั้งย้ายในจังหวัด-ข้ามจังหวัด ทั้งสมัครใจและผู้บริหารพิจารณาตามเหมาะสมและเกิดประโยชน์กับทางราชการ การย้ายผอ.รพ.ชุมชน ไม่ต้องเสนอรัฐมนตรีหรือปลัดกระทรวง โดยผู้ตรวจราชการสามารถปฏิบัติหน้าที่แทนปลัด สธ. ได้ ตามที่ได้รับมอบอำนาจมา ซึ่งขั้นตอนคือ นพ.สสจ. พิจารณา และเสนอให้ผู้ตรวจราชการลงนามคำสั่ง
3. ไม่เห็นด้วยกับคำสั่งย้าย
- เครือข่ายสลัม 4 ภาค โพสต์ระบุ วันที่ 30 ม.ค.66 นัดรวมตัวคัดค้านคำสั่งโยกย้ายที่ไม่เป็นธรรมต่อ นพ.สุภัทร ณ บริเวณหน้าเสาธง กระทรวงสาธารณสุข เวลา 09.00 น.
- นายนิมิตร์ เทียนอุดม ที่ปรึกษา ผอ.มูลนิธิเข้าถึงเอดส์ กล่าวถึงกรณีคำสั่งย้ายหมอสุภัทรว่า ถ้าบอกว่าย้ายตามระบบคงไม่ใช่ เพราะ รพ.ชุมชน แตกต่างจาก รพ.จังหวัด รพ.ชุมชนต้องคลุกคลีกับชุมชน ทางที่ดีที่สุด ผู้บริหาร สธ. ควรอธิบายเหตุผล เพราะหากไม่ชัดเจนเกิดความสงสัย ย่อมไม่ส่งผลดีต่อระบบธรรมาภิบาลสาธารณสุขภาพรวม
- นายบรรจง นะแส ที่ปรึกษาสมาคมรักษ์ทะเลไทย และภาคประชาชนภาคใต้ เดินทางไปเรียกร้องที่ สสจ.สงขลาขอให้นพ.สวัสดิ์ อภิวัจนีวงศ์ผู้ตรวจราชการ สธ. ยกเลิกคำสั่งย้ายภายใน 3 วัน หากไม่คืบหน้าจะเคลื่อนไหวอีก โดยระบุว่าเป็นครั้งแรกที่เพิ่งมีระเบียบการย้ายออกมา เมื่อ 23 ม.ค. ที่ผ่านมาไม่เคยมีผู้ตรวจราชการ สธ. ย้าย ผอ.รพ.ชุมชนได้
- นายบรรจง นะแส ระบุ การย้าย นพ.สุภัทร ทางพฤตินัยส่อว่าเป็นการกลั่นแกล้ง นายกฯ ควรพิจารณาปัญหาแล้วยื่นมือเข้ามาแก้ไข ปัญหาที่ รพ.สะบ้าย้อย หากให้ รอง ผอ.ที่มีอยู่ในพื้นที่ รู้ปัญหาดีอยู่แล้ว เป็นผู้แก้ปัญหาจะตรงจุดกว่า
- น.ส.สุวดี พันธุ์พานิช คณะทำงานสาธารณสุข และว่าที่ผู้สมัคร ส.ส.พรรคไทยสร้างไทย กล่าวว่า ขอให้ สธ.ทบทวนคำสั่งโยกย้าย นพ.สุภัทร มีคนตั้งข้อสงสัยถึงกระบวนการโยกย้าย อย่าลืมว่าหากพบความผิดปกติ ไม่เป็นธรรม ผู้สั่งการก็จะมีความผิดตามกฎหมาย คำสั่งนี้ได้บั่นทอนกำลังใจบุคลากรทางการแพทย์ทั้งใหญ่เล็ก อย่าเปลี่ยนสีเสื้อกาวน์ อย่าเปลี่ยนขาวเป็นอย่างอื่น
- เครือข่ายเขียนอนาคตกัญชาไทย ออกแถลงการณ์ตอบโต้กรณีมีความพยายามเชื่อมโยงการย้าย นพ.สุภัทร กับการคัดค้านร่าง พ.ร.บ.กัญชา กัญชงฯ ว่า การพยายามสื่อสารปั่นกระแสเช่นนี้เท่ากับตอกย้ำว่า พ.ร.บ.ฉบับนี้ จะทำให้ใครมาขวางกัญชาเสรีถึงขั้นถูกย้าย การสร้างความเสียหายต่อการทำความเข้าใจที่ถูกต้องของประชาชนเป็นสิ่งที่ไม่ควรทำ
- เพจชมรมแพทย์ชนบท แชร์โพสต์ของ สารี อ๋องสมหวัง เลขาธิการสภาองค์ของผู้บริโภคว่า ย้าย นพ.สุภัทรทำไม หรือเป็นยุคมืด สธ. ปลัด สธ.ผู้มีส่วนร่วมในการออกคำสั่งนี้ต้องตอบคำถามประชาชนจะนะ
- เพจชมรมแพทย์ชนบท แชร์อินโฟกราฟิกของชมรมเภสัชชนบท เรียกร้อง สธ.ให้ทบทวนคำสั่งย้าย นพ.สุภัทร
- เพจชมรมแพทย์ชนบท แชร์อินโฟกราฟิกของ พล.ต.ต.สุรินทร์ ปาลาเร่ ส.ส.พรรคประชาธิปัตย์ จ.สงขลา ไม่เห็นด้วยกับการโยกย้าย นพ.สุภัทร และเป็นกำลังใจให้ทำงานเพื่อสังคมและประเทศชาติต่อไป
- เพจชมรมแพทย์ชนบท โพสต์แถลงการณ์องค์กรกิจกรรม นศ. มศว. วิทยาเขตปัตตานี ประณามคำสั่งย้ายว่าเป็นสิ่งเลวร้ายและยอมรับไม่ได้ ปิดกั้นเสรีภาพของข้าราชการในการแสดงออกต่อปัญหาทางสังคมและลดทอนคุณค่าประชาธิปไตย
4. ปมชุดตรวจ ATK
- นพ.เอกภพ เพียรพิเศษ ที่ปรึกษา กมธ.สธ. โพสต์ถึงการสอบสวนเรื่องการนำ ATK ที่พยายามให้มีการจัดซื้อแบบล็อกสเปคเอื้อประโยชน์บางบริษัท ว่า ตอนที่อภ.จัดซื้อ ATK เพื่อแจกจ่ายให้ประชาชน กระจายการเข้าถึง ATK ทำให้ตลาดลดราคาจาก 200-300 บาทต่อชุด เหลือเพียง 30-40 บาทในปัจจุบัน มีผู้สังเกตการณ์จาก สปสช. (แพทย์ชนบท 2 คน) ให้ข้อมูลที่ตั้งใจจะเอื้อประโยชน์ต่อบางบริษัทที่ขายในราคา 120 บาทต่อชุด พยายามปรับรายละเอียด TOR เพื่อล็อกสเปกให้กับบริษัทนี้ แต่สุดท้ายไม่สำเร็จ เพราะอภ.และ สธ. ไม่ทำตาม จุดที่น่าสงสัยคือ กมธ.สธ. ขอให้นพ.สุภัทร ผอ.รพ.จะนะ ส่งรายละเอียดการจัดซื้อจัดจ้างชุดตรวจ ATK ของรพ. มาให้ตรวจสอบ แต่ถูกปฏิเสธ เท่ากับยอมรับข้อกล่าวหาว่ามีการจัดซื้อชุดตรวจ ATK ด้วยอำนาจของ ผอ. ในราคาและยี่ห้อที่น่าจะเป็นยี่ห้อเดียวกับที่ทางกลุ่มเครือข่ายพยายามผลักดัน และนำมาใช้ในการคัดกรองในกทม. เพื่อให้มีการจัดซื้อจำนวนมาก ชาวจะนะจึงควรตั้งคำถามถึงการใช้งบประมาณในตอนนั้นว่า การจัดซื้อชุดตรวจ ATK มาตรวจในกทม. แทนที่จะใช้กับคนในพื้นที่ และเอาเวลาราชการมาดูแลคนในกทม. ทิ้งคนในพื้นที่ซึ่งกำลังประสบปัญหาโควิด เป็นเรื่องสมควรแล้วหรือไม่
- นพ.สุภัทร ฮาสุวรรณกิจ กล่าวถึง ประเด็น ATK เรื่องนี้กรรมาธิการเคยเชิญชมรมแพทย์ชนบทไปชี้แจงแล้ว จบไปแล้วตั้งแต่ปี 2564 แต่ช่วงปลายปี 2565 ประธานกรรมาธิการสาธารณสุข คือ ส.ส.พรรคภูมิใจไทย มีหนังสือเชิญให้ไปชี้แจงเรื่องเดิม แต่ตนติดภารกิจจึงทำหนังสือเลื่อน ยังไม่ได้ไปชี้แจง ส่วนกรณีแพทย์ชนบทบุกกรุงเป็นการดำเนินการเรื่องเงินบริจาค ได้ชี้แจงไปแล้ว รายละเอียดมีปรากฏในรายงานของกรรมาธิการแน่นอน
ฮอไรซอน คอฟฟี่ เทรนนิ่ง เปิดสอนทำกาแฟ COFFEE COURSE LINK
ศูนย์การเรียนชงกาแฟและเครื่องดื่ม ฮอไรซอน คอฟฟี่ เทรนนิ่ง เปิดสอนทำกาแฟ COFFEE COURSE รวมคอร์สเรียนทำกาแฟสด สำหรับเรียนรู้การชงกาแฟเพื่อการเปิดร้านกาแฟ คอร์สเรียนชงกาแฟ สำหรับผู้ที่สนใจเปิดร้านกาแฟด้วยตัวเอง สอนโดย บาริสต้า ที่เปิดร้านกาแฟหลายสาขา
- BASIC BARISTA COURSE เรียนชงกาแฟขั้นพื้นฐาน เรียนทำกาแฟสด advanced barista course
- ADVANCED BARISTA COURSE เรียนชงกาแฟสำหรับเปิดร้าน สอนชงก่าแฟ Cafe barista course
- CAFE OWNER COURSE เรียนชงกาแฟสำหรับเจ้าของคาเฟ่ เรียนรู้หลักการทำร้านกาแฟ จากประสบการณ์จริง แน่นด้วยเนื้อหาการเปิดร้าน เน้นให้คุณได้ปฏิบัติทุกเมนู
ศูนย์การเรียนชงกาแฟและเครื่องดื่ม ฮอไรซอน คอฟฟี่ เทรนนิ่ง สอนทำกาแฟสด barista course โทรศัพท์สมัครเรียนชงกาแฟที่ 085-1520371
เขตราชเทวี ห้องสมุดเพื่อการเรียนรู้ซอยพระนาง
ห้องสมุดวรรณกรรม แหล่งความรู้คู่ซอยพระนาง เป็นอาคาร คสล. 3 ชั้น ตั้งอยู่ที่ปากซอยพระนาง (ซอยราชวิถี 4) ถนนราชวิถี เขตราชเทวี รุงเทพมหานครพื้นที่รวม 2,587 ตารางเมตร เป็นที่ดินซึ่งกรุงเทพมหานครขอเช่าจากสำนักงานทรัพย์สินส่วนพระมหากษัตริย์ เริ่มดำเนินการเมื่อวันที่ 15 มกราคม 2512
ห้องสมุดประชาชนกรุงเทพมหานครซอยพระนาง เป็นห้องสมุดแห่งแรกของกรุงเทพมหานคร ที่ได้รับการปรับปรุงใหม่ให้เป็นห้องสมุดเพื่อการเรียนรู้ที่พร้อมจะให้บริการแก่เด็ก เยาวชน นักเรียน นักศึกษา และประชาชนทั่วไป
เวลาเปิด-ปิดห้องสมุด
วันอังคาร ถึง วันเสาร์ เวลา 08.30 น.ถึง 19.30 น.
วันอาทิตย์ 09.00 น. ถึง 17.00 น.
อาคาร 1
โซน 1 โถงต้อนรับ เคาน์เตอร์ประชาสัมพันธ์ มุมอ่านหนังสือพิมพ์วารสารและนิตยสาร บริการสืบค้นข้อมูล อินเทอร์เน็ต
โซน 2 บริการหนังสือยอดนิยม หนังสืออ้างอิง และหนังสือวิชาการต่างๆ ที่น่าสืบค้น
โซน 3 บริการหนังสือพิมพ์เพื่อความบันเทิง ทั้งนวนิยาย เรื่องสั้น เรื่องแปล ฯลฯ
อาคาร 2
โซน 1 ห้องสมุดสำหรับน้องๆ วัยซน และวัยอ่านทุกเพศ ทุกวัยกับนิทาน การ์ตูน และสื่อการสอนทันสมัย
โซน 2 บริการหนังสทอวิชาการ พร้อมที่นั่งทำการบ้านแสนสบาย
โซน 3 เพลิดเพลินกับหนังสือวรรณกรรมเยาวชน สนุกสนานกับการดูหนัง ฟังเพลงจาก CD VCD และ DVD ในห้องมินิเธียเตอร์
505 ถ. ราชวิถี แขวงถนนพญาไท เขตราชเทวี กรุงเทพมหานคร 10400
โทร. 022463517
website
bangkoklibrary.go.th
facebook
Soiprananglibrary
แผนที่
google mapสุขภาพจิตของนักศึกษา เป็นสิงที่น่ากังวลมากที่สุดและควรจะต้องเร่งแก้ไข
รศ.ดร. ญาณีพร พัชรวรโชติ รักษาการแทนผู้ช่วยอธิการบดีฝ่ายกิจการนักศึกษาและศิษย์เก่าสัมพันธ์ สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง กล่าวว่า ทางสจล. มองว่าเรื่องสุขภาพจิตของนักศึกษา เป็นสิงที่น่ากังวลมากที่สุดและควรจะต้องเร่งแก้ไข เนื่องจากผลสำรวจของสถาบันวิจัยสังคม จุฬาฯ พบว่านักศึกษา สจล. มีความเครียดสูงเพิ่มขึ้นถึงร้อยละ 60 และมีความคิดที่จะฆ่าตัวตาย สูงถึงร้อยละ 5 โดยที่ผ่านมา สจล. ได้มีการดำเนินงานเกี่ยวกับสุขภาพจิตของนักศึกษาอยู่แล้ว แต่พอได้เห็นผลสำรวจฯ ยิ่งตระหนักถึงปัญหานี้มากขึ้น และมีการวางแผนที่จะทำโครงการช่วยเหลือนักศึกษาและบุคลากรในด้านสุขภาพจิตให้เป็นรูปธรรมมากขึ้น
โครงการก่อสร้างอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี
โครงการใหม่ที่เพิ่งเปิดตัวไปเมื่อกลางเดือนธันวาคม พ.ศ. 2565 ที่ผ่านมา โดยเป็นอาคารโรงพยาบาลรามาธิบดีแห่งใหม่ที่จะทำหน้าที่ทดแทนอาคารเดิม ผู้ป่วยที่มาใช้บริการสามารถใช้สิทธิขั้นพื้นฐานได้อย่างเต็มศักยภาพเทียบเท่าอาคารเดิม มุ่งเน้นการเพิ่มประสิทธิภาพในการรักษา และความสะดวกสบายให้แก่ผู้ใช้บริการ ให้ได้รับการบริการทางการแพทย์ที่มีคุณภาพมากขึ้น โดยเฉพาะโรคที่มีความซับซ้อนซึ่งถือเป็นความเชี่ยวชาญของบุคลากรทางการแพทย์ของโรงพยาบาลรามาธิบดี เพื่อเป็นต้นแบบทางการรักษาให้กับโรงพยาบาลอื่น ๆ ต่อไป นอกจากนี้ยังตั้งเป้าให้โครงการนี้เป็นพื้นที่ผลิตบุคลากรทางการแพทย์ผู้เชี่ยวชาญในการรักษาโรคที่มีความซับซ้อน เพื่อร่วมพัฒนาต่อยอดในด้านสาธารณสุขของประเทศให้มีศักยภาพในระดับสากล สามารถแข่งขันได้ และเตรียมความพร้อมเข้าสู่ประชาคมเศรษฐกิจอาเซียน (ASEAN Economic Community) ได้ต่อไป
ขณะที่ คุณรัดดา เกื้อหนุน ในวัย อายุ 52 ตัดสินใจศัลยกรรมดึงหน้า และแม้ว่านี่จะเป็นการศัลยกรรมครั้งใหญ่ในชีวิต แต่เธอบอกว่ารู้สึกคุ้มค่ามากกับเงินที่เสียไป ครั้งแรกที่เห็นตัวเองหลังจากศัลยกรรม ทำให้ตนมีความสุข และตัวเองดูอายุลดลงไปอีก 20 ปี เหมือนเป็นรางวัลชีวิตที่เธอมีความสุขมากที่สุด
คลินิกผ่าตัดพิเศษ
ทางเลือกสำหรับผู้ต้องการความสะดวก รวดเร็ว ลดเวลารอคอย
ศูนย์ส่องกล้องทางเดินอาหารและศัลยกรรมทั่วไป
ศูนย์สลายต้อกระจกด้วยคลื่นอัลตร้าซาวด์และการผ่าตัดทางจักษุ
ศูนย์ผ่าตัดเปลี่ยนข้อเข่าและศัลยกรรมออร์โธปิดิกส์
แผนกห้องผ่าตัด ชั้น 4 อาคารอุบัติเหตุฉุกเฉิน
โทร. 032-601060 ถึง 4
สาขาอื่นๆ
วัดถ้ำพุหว้า อ.เมืองกาญจนบุรี LINK
วัดถ้ำพุหว้า ตั้งอยู่ ต.หนองหญ้า อ.เมือง จ.กาญจนบุรี เป็นสาขาหนึ่งของวัดปากน้ำ วัดถ้ำพุหว้าเป็นถ้ำลักษณะเป็นห้องโถงขนาดใหญ่ หน้าถ้ำมีปราสาทหินทรายรูปแบบศิลปะขอมโบราณประยุกต์ขนาดใหญ่สีน้ำตาลแดง มีลวดลายประณีตสวยงาม บรรยากาศโดยรอบมีลักษณะภูมิประเทศโอบล้อมด้วยภูเขาและป่าไม้ ร่มรื่น สะอาด สวยงาม เมื่อเข้าไปภายในถ้ำมีหินงอกหินย้อยงดงาม ว่ากันว่าเดิมทีเดียววัดแห่งนี้มีถ้ำเป็นอุโบสถ โดยภายในถ้ำมีพระพุทธรูปปางสมาธิประดิษฐานเป็นพระประธาน รวมทั้งเป็นที่ประดิษฐานพระบรมสารีริกธาตุที่อัญเชิญมาจากประเทศเมียนมา ให้นักท่องเที่ยวได้สักการะบูชาด้วยเช่นกัน ต่อมาได้รับการบูรณะครั้งใหญ่ด้วยการสร้างอุโบสถหินทรายครอบตัวถ้ำเอาไว้
นอกจากเป็นสถานที่เหมาะกับการปฎิบัติธรรมแล้ว ยังเป็นสถานที่เหมาะสำหรับการจัดกิจกรรมต่างๆ ให้กับหมู่คณะที่สามารถรองรับ ได้ถึง 500 คน เนื่องจากมีอาคารที่พัก โรงอาหาร และฐานผจญภัยต่างๆ พร้อมวิทยากรฝึกอบรม ติดต่อสอบถามเพิ่มเติมได้ที่ โทร. 087-1661819 , 034-511200, 087-1661819
ประเพณีบุญข้าวจี่ใหญ่วัดถ้ำสุวรรณคูหา หนองบัวลำภู 30 มกราคม - 5 กุมภาพันธ์ 66
งานสักการะหลวงพ่อพระไชยเชษฐาธิราช ประเพณีบุญข้าวจี่ใหญ่วัดถ้ำสุวรรณคูหา 30 มกราคม - 5 กุมภาพันธ์ 2566 ณ วัดถ้ำสุวรรณคูหา อำเภอสุวรรณคูหา จังหวัดหนองบัวลำภู ชมการแสดงจัดเต็ม 5 คืน
30 ม.ค. แสงดาว พิมมะศรี
1 ก.พ. วง ที เร็ก
3 ก.พ. หมอลำ เสียงวิหค
4 ก.พ. ผู้กองหน่าฮ่าน
5 ก.พ. เบียร์ พร้อมพงษ์
เทพพระราหูทรงครุฑ วัดบัวขวัญ พระอารามหลวง นนทบุรี LINK
วัดบัวขวัญ จังหวัดนนทบุรี มีเทพพระราหูทรงครุฑ ที่สวยงาม ศักดิ์สิทธิ์มาก และหาดูได้ยากเพราะเป็นความเชื่อในฝ่ายตำราโหราศาสตร์ไทยโบราณ ที่เชื่อว่าพระราหูมีครุฑเป็นพาหนะ เด่นในพุทธคุณด้านปัดเป่าเภทภัยกลับร้ายให้กลายเป็นดีได้ [ภาพและข้อมูลจาก
เพจคนรักองค์พญาครุฑ]
วัดบัวขวัญ เป็นพระอารามหลวงชั้นตรี ชนิดสามัญ สังกัดคณะสงฆ์ฝ่ายมหานิกาย เดิมเป็นเพียงสำนักสงฆ์ ต่อมาเมื่อมีพระสงฆ์มาจำพรรษา และปฏิบัติสังฆกรรมมากขึ้น จึงได้รับการพัฒนาขึ้นมาเป็นวัดเมื่อวันที่ 24 มิถุนายน พ.ศ. 2435 มีนามว่า "วัดสะแก" ในเวลาต่อมาจึงได้เปลี่ยนนามวัดเป็น "วัดบัวขวัญ" เพื่อเป็นเกียรติแก่ผู้บริจาคที่ดิน คือ นายบัว ฉุนเฉียว ผู้มีจิตศรัทธาบริจาคที่ดินให้กับวัด ได้รับพระราชทานวิสุงคามสีมาเมื่อวันที่ 24 มกราคม พ.ศ. 2506 ปัจจุบันวัดบัวขวัญมีความเจริญทั้งด้านถาวรวัตถุ ปรับปรุงภูมิทัศน์ ตลอดทั้งให้ความสำคัญด้านการศึกษาพระปริยัติธรรม กระทั่งมีการจัดตั้งโรงเรียนพระปริยัติธรรมแผนกบาลีประจำจังหวัดนนทบุรี แห่งที่ 1 ขึ้น และทรงพระกรุณาโปรดเกล้าฯ ให้ยกวัดราษฎร์ขึ้นเป็นพระอารามหลวง ชั้นตรี ชนิดสามัญ ในวันที่ 29 เดือน มิถุนายน พ.ศ. 2551
- เลขที่ 1 ซอยงามวงศ์วาน 23 ถนนงามวงศ์วาน ตำบลบางกระสอ อำเภอเมืองนนทบุรี นนทบุรี
- แผนที่ google map
MOCA Bangkok
MOCA Bangkok โมค่า แบงค็อก เป็นหนึ่งในพิพิธภัณฑ์ศิลปะไทยร่วมสมัย ของไทย ที่มีชื่อเสียงไปทั่วโลก เพราะเป็นพิพิธภัณฑ์ศิลปะที่รวมผลงานศิลปะชิ้นเยี่ยมล้ำค่ายิ่งของศิลปินไทยมากมาย ก่อตั้งโดยมหาเศรษฐีโทรคมนาคมชาวไทยผู้รักและเชิดชูงานศิลป์มายาวนาน กับรูปแบบอาคารสถาปัตยกรรมที่เป็นเอกลักษณ์ ที่บรรจงออกแบบเพื่อเป็นหอศิลป์ระดับสากลอย่างแท้จริง ปัจจุบันสามารถเดินทางได้โดยสะดวกด้วยรถไฟฟ้าสายสีแดง แนะนำว่าควรเผื่อเวลาไว้มากพอสมควรเพราะลำพังผลงานที่จัดแสดงทั้งหมดก็อาจทำให้คุณเพลิดเพลินจนลืมเวลา และการจะดูให้ครบถ้วน อาจไม่พอในวันเดียว และอย่าแปลกใจหากพบว่าหอศิลป์แห่งนี้จะคลาคล่ำไปด้วยนักท่องเที่ยวนานาชาติ เพราะ MOCA Bangkok เป็นหนึ่งในหมุดหมายที่เป็นที่แนะนำในระดับโลกเลยน่ะสิ
ค่าเข้าชมผู้ใหญ่ 250 บาท นักเรียน/นิสิต/นักศึกษา 100 บาท
ในประเด็นถัดไป คุณสิตาพัชญ์ รุจิธันยพัชร์ เจ้าหน้าที่วางแผนกลยุทธ์อาวุโส บริษัท ฮาคูโฮโด อินเตอร์เนชั่นแนล (จำกัด) จะเจาะลึกถึงเรื่องแนวโน้มความต้องการใช้จ่าย โดยอ้างอิงจากผลสำรวจจะแบ่งออกได้เป็นข้อๆ ให้เข้าใจได้ง่ายทั้งหมด 3 ข้อ ดังนี้
แกงส้ม อาหารเป็นยา เมนูติดบ้านของคนทุกพื้นที่
แกงส้ม เป็นอาหารไทยที่มีติดบ้าน แต่ละพื้นที่อาจมีการปรับเปลี่ยนส่วนประกอบ และ เครื่อง ที่หลากหลาย ตามภูมิภาค ฤดูกาล แต่โดยพื้นฐานแล้ว ถือเป็นเมนูสุขภาพที่ดีต่อระบบภูมิคุ้มกัน ทางเดินอาการและลำไส้
คนสมัยก่อน กินแกงส้ม แก้ไข้หัวลม ใส่ดอกแคและผักอื่นๆ ปรุงรสออกเปรี้ยวน้ำ เค็ม หวาน กำลังดี ช่วยปรับธาตุให้สมดุล นอกจากนี้ ในเครื่องพริกแกงส้ม ยังอุดมไปด้วยสารที่สำคัญ เช่น
- หอมแดง มีสารเควอซิทิ ที่โดดเด่นเรื่องการปรับภูมิคุ้มกัน ต้านการแพ้ ต้านหวัด
- พริก เป็นยาอายุวัฒนะ ให้ความเผ็ดร้อน มีงานวิจัยพบว่า การกินพริกช่วยยืดอายุ ลดอัตราการตายจากมะเร็งได้ จนมีคำเรียกว่า "กินพริก อายุยืน"
- กระชาย รสเผ็ดร้อน ช่วยเพิ่มไหลเวียนเลือด บำรุงร่างกาย และยังมีฤทธิ์เสริมภูมิคุ้มกัน ต้านไวรัส
- ข่า ขับลม แก้ปวด ต้านอักเสบ ฤทธิ์ต้านหวัด ต้านไวรัส
นอกจากนี้ ยังมีงานวิจัยที่ได้ทำขึ้นเพื่อทดสอบประสิทธิภาพการส่งเสริมการเจริญของโปรไบโอติก (จุลินทรีย์ที่ทำหน้าที่ดูแลระบบสุขภาพ ปรับสมดุลลำไส้ ช่วยส่งเสริมระบบภูมิคุ้มกัน) โดยทำการศึกษาในอาหารหมัก และ อาหารไทยบางชนิด พบว่า แกงส้ม เป็นเมนูที่ส่งเสริมการเจริญของเชื้อ โปรไบโอติก ได้ดีที่สุด เมื่อผ่านการย่อยด้วยเอนไซม์ในระบบทางเดินอาหาร โดยเฉพาะแกงส้มที่ใส่มะละกอ (รองลงมาคือ แกงเลียง แกงไตปลา แกงป่า และ แกงอ่อม) ส่วนแกงขนุนที่นำมาทดสอบด้วยนั้นกลับมีฤทธิ์ยับยั้งการเจริญของเชื้อโปรไบติกส์บางชนิด
แหล่งโปรตีนสำคัญ ไขมันต่ำ ประโยชน์สูงในแกงส้มคือ เนื้อปลา นิยมใส่เนื้อปลาลงไปในแกงส้ม ซึ่ง ปลามีโปรตีน เป็นสารอาหารที่ช่วยซ่อมแซมส่วนซึกหรอ และยังมีผลต่อการทำงานของระบบภูมคุ้มกัน
แกงส้ม มีหลายสูตรตำรับ ผักพื้นบ้านที่ใส่เน้นหลากหลายตามฤดูกาล ทำให้เป็นเมนูอาหารที่อุดมไปด้วยแหล่งวิตามิน สารโพลีแซกคาไรด์ และ กากใย ที่มีประโยชน์ต่อระบบขับถ่าย ช่วยลดการสะสมของเสียในลำไส้ได้อีกด้วย
เป็นอีกเมนุสุขภาพ ที่สามารถกินได้เรื่อยๆ นะคะ
บางพลัด พัดเรามาคู่กัน นิรันดร LINK
สำนักงานเขตบางพลัด ขอเชิญชวนคู่รัก จดทะเบียนสมรส ในวันแห่งความรัก 14 กุมภาพันธ์ 2566 สำหรับคู่รักที่กำลังมองหาสถานที่จดทะเบียนสมรส ในวันแห่งความรัก "14 กุมภา วันวาเลนไทน์" เขตบางพลัดขอเชิญชวนมาจดทะเบียนสมรส ณ สำนักงานเขตบางพลัด ภายใต้โครงการ "บางพลัด พัดเรามาคู่กัน นิรันดร" ตั้งแต่เวลา 08.00-16.00 น. ณ ห้องฝ่ายทะเบียน ชั้น 1 สำนักงานเขตบางพลัด พร้อมลุ้นรับของที่ระลึกแด่คู่สมรสทุกคู่ที่มาร่วมกิจกรรม
สามารถลงทะเบียนออนไลน์ล่วงหน้าได้แล้ววันนี้!! ตาม QR Code ที่แนบ หรือกด Link
https://forms.gle/ (หากประสงค์เดินทางมาตรวจสอบเอกสารก่อนล่วงหน้า สามารถ Walk-in ได้ที่สำนักงานเขตบางพลัดเลยนะคะ
แล้วไม้วิ่งผลัดก็ถูกส่งต่อ #JFF2023
แล้วไม้วิ่งผลัดก็ถูกส่งต่อ #JFF2023
2 ชั่วโมง 17 นาที R:13+
©2021 “And So The Baton Is Passed” Film Partners เด็กสาวกับแม่ที่ไม่ได้เกี่ยวข้องกันทางสายเลือด และลูกสาวกับพ่อ ความจริงที่แต่ละครอบครัวต่างโกหกพวกเธอนั้นคืออะไร เรื่องราวอันซาบซึ้งและน่าตกใจเมื่อทั้ง 2 ครอบครัวได้มาบรรจบพบกันกำลังรออยู่
ความเชื่อที่ไม่ถูกต้องเกี่ยวกับถุงยางอนามัย
ยังเชื่อกัน... แบบนี้อีกหรอ
ความเชื่อที่ไม่ถูกต้องเกี่ยวกับถุงยางอนามัย
- ใส่แล้วไม่เร้าใจ ปัจจุบันถุงยางใีความบางเฉียบ และยังมีลูกเล่นด้วยการเพิ่มกลิ่น และผิวสัมผัส
- ไซส์ใหญ่กว่าขนาดยิ่งดี เสี่ยงต่อการหลุดออกขณะมีเพศสัมพันธ์
- ใส่หลายชั้น ยิ่งปลอดภัย การใส่ถุงยางหลายชั้น อาจทำให้ถุงยางเสียดสีกัน มีโอกาสทำให้ฉีกขาด
- ใส่ด้านไหนก็เหมือนกัน ต้องใส่ด้านที่มีสารหล่อลื่นไว้ด้านนอก เพื่อลดการเสียดสีให้กับคู่นอนของคุณ
อันดับ 1. อุทยานแห่งชาติเขาใหญ่ จ.นครราชสีมา


ไม่แปลกใจ ที่อุทยานแห่งชาติเขาใหญ่ เป็นอันดับหนึ่งในใจคนไทยตลอดมาและจะยังคงเป็นต่อไปอีกนาน ด้วยความที่ใกล้กรุงเทพ และถนนหนทางสะดวกสบายในการเดินทางที่สามารถเข้าถึงได้จาก 3 จังหวัด 3 ทิศทาง นักท่องเที่ยวจึงไปเที่ยวได้แบบยกครอบครัว หรือหมู่คณะ แบบวันเดียวกลับ หรือหลายวันก็ได้ รายรอบพื้นที่เขาใหญ่ มีรีสอร์ท/จุดแคมป์ปิ้ง/บ้านพักหลายรูปแบบ หลายสไตล์ รองรับ
อุทยานแห่งชาติเขาใหญ่เป็นอุทยานแห่งชาติแห่งแรกของประเทศไทย และได้รับการขึ้นทะเบียนเป็นมรดกโลก (World Heritage Site) และ อุทยานมรดกแห่งอาเซียน (ASEAN Heritage Park) อีกด้วย ครอบคลุมพื้นที่ 4 จังหวัด (สระบุรี นครนายก ปราจีนบุรี นครราชสีมา) เป็นแหล่งธรรมชาติ สัตว์ป่า พันธุ์พืช และต้นน้ำสำคัญภูมิภาคตะวันออก ตะวันออกเฉียงเหนือ และภาคกลาง จุดเด่นของเขาใหญ่มีมากมาย ที่ขึ้นชื่อและน่าตื่นเต้นมากๆ คือ เป็นสถานที่ที่สามารถจะพบเห็นฝูงช้างในสภาพธรรมชาติได้อย่างใกล้ชิด รวมถึงสัตว์ป่าชนิดอื่นๆ ที่สำคัญ เช่นเลียงผา กวาง นกนานาชนิด ในอุทยานมีน้ำตกเหวนรกที่สูงใหญ่และน่าเกรงขาม น้ำตกเหวสุวัต มีจุดชมวิวหลายแห่ง อย่างผาเดียวดาย ผาตรอมใจ (เขาเขียว) มีจุดกางเต้นท์หลายจุดพร้อมรองรับสายแค้มป์ปิ้ง เช่น จุดกางเต็นท์ลำตะคอง จุดกางเต็นท์ผากล้วยไม้ จุดกางเต็นท์เขาร่ม เป็นต้น
หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา ฉะเชิงเทรา LINK
หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา ฉะเชิงเทรา (Regional Observatory for Public, Chachoengsao) ตั้งอยู่ที่ ต.วังเย็น อ.แปลงยาว จ.ฉะเชิงเทรา เปิดให้บริการในปี 2561 เปิดทุกวันยกเว้นวันจันทร์
เวลาทำการ:
วันจันทร์ ปิดทำการ
วันอังคาร 9:00–16:00
วันพุธ 9:00–16:00
วันพฤหัสบดี 9:00–16:00
วันศุกร์ 9:00–16:00
วันเสาร์ 9:00–22:00
วันอาทิตย์ 9:00–16:00
ส่วนที่ 2 คือการหาความเป็นไปได้ใหม่ โดยเราอยากเห็นว่าในย่านเดิมที่มีคนใหม่เข้ามาจะต้องมีการเปลี่ยนแปลงมากขึ้น ด้วยการใช้นิทรรศการนี้ในการสื่อสารรับความคิดเห็นของคนเดิมว่า อยากเห็นย่านนี้ในอนาคตแบบไหน โดยใช้การสื่อสารผ่านศิลปะเป็นตัวกระตุ้นความคิด การใช้แสงสีเพิ่มความสดใส มองเห็นง่าย เช่น บริเวณศาลเจ้า นำเทคโนโลยีมาประยุกต์ใช้ ออกแบบแผนที่ย่านตลาดพลู-วงเวียนใหญ่ ให้เข้าถึงงาน และ ในส่วนที่ 3 คือการเปิดพื้นที่ให้กลุ่มคนในชุมชนที่เป็นพลังขับเคลื่อนของย่านนี้ เข้ามาร่วมกันแลกเปลี่ยนความคิดเห็นและมุมมองว่าจะทำอย่างไรกับย่านที่อยู่อาศัยที่กำลังมีการเปลี่ยนแปลง
Memory Light Festival 2023 หัวหิน
หัวหินก็มีงานประดับไฟ ชื่องาน Memory Light Festival 2023 จัดที่ร้าน Memory House Cafe HuaHin งานไฟเปิด 18:00 - 22:00 น. (กลางวันเปิดขายปกติ) ราคาบัตรชมงานไฟกลางคืน 100 บาท ในงานมีอาหาร เครื่องดื่ม ป๊อปคอร์น พิซซ่า นาโชส์ เครื่องดื่ม ฯลฯ ร้านเปิดทุกวัน 10.00 - 22.00 น. ร้านอยู่ข้างอ่างเก็บน้ำเขาเต่า (ซ.หัวหิน 101) สอบถามโทร. 095-6632901
โปสเตอร์แบบที่ 2 จากสปอนเซอร์หลักของเรา BOOK☆WALKER ที่มาพร้อมกับ คาแรคเตอร์การ์ตูน 4 เรื่อง ด้วยกัน
- โตเกียวรีเวนเจอร์ส
- นินจาคาถา โอ้โฮเฮะ
- คุณอาเรียโต๊ะข้างๆ พูดรัสเซียหวานใส่ซะหัวใจจะวาย
และ โคนัน ยอดนักสืบจิ๋ว
ตารางการออกหน่วยให้บริการ เดือนกุมภาพันธ์ 2566
15 ก.พ. 66
เขตประเวศ ชุมชนร่วมพัฒนา
เขตจตุจักร ตลาดประชานิเวศน์
เขตบางบอน ชุมชนหนทางใหม่ ปิ่นทอง
16 ก.พ. 66
เขตประเวศ Health in Park
17 ก.พ. 66
เขตบางกอกน้อย วัดเจ้าอาม
20 ก.พ. 66
เขตบึงกุ่ม ชุมชนสินธนา 5
21 ก.พ. 66
เขตบึงกุ่ม มหาทรัพย์คอนโด
เขตจตุจักร ตลาดอมรทรัพย์
22 ก.พ. 66
เขตบึงกุ่ม หมู่บ้านสามัคคี 53
เขตบางบอน ชุมชนเกษตรบ้านนายผล
เขตมีนบุรี มัสยิดอัตตั้กวา
23 ก.พ. 66
เขตบึงกุ่ม บุญสิตาคอนโด
24 ก.พ. 66
เขตจตุจักร ศูนย์กีฬาประชานิเวศน์
27 ก.พ. 66
เขตราชเทวี กรมทรัพยากรธรณี
เขตบางเขน ชุมชนอนันต์สุขสันต์ รุ่น 18-20
28 ก.พ. 66
เขตบางเขน ตลาดถนอมมิตร
2.The Care-giver #แม่บุญทุ่ม
The Care-giver #แม่บุญทุ่ม ถือเป็น 11% จากผลสำรวจ คนกลุ่มนี้ชอบซื้อ (ให้คนอื่น) ซึ่ง motivation หลักในการช้อปคือเพื่อ CONNECT กับคนสำคัญ โดยเฉพาะอย่างยิ่งกับครอบครัว เพื่อต้องการ make sure ว่าพวกเขา “มีครบ” และ “มีสุข” อีกทั้ง การให้ คือเหตุผลในการจับจ่ายของคนกลุ่มนี้อีกด้วย ดังนั้นแบรนด์สามารถกระตุ้นการจับจ่ายด้วยการสร้างเหตุผลใหม่ๆ ให้แก่คนกลุ่มนี้ได้ซื้อและเกิดความรู้สึกอิ่มเอมใจในการให้เพิ่มขึ้นได้
ภาวะมีบุตรยาก คืออะไร
รศ. นพ. ชาติชัย ศรีสมบัติ สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์และการผ่าตัดด้วยกล้อง คลินิกรักษาผู้มีบุตรยาก บำรุงราษฎร์ อธิบายนิยาม "ภาวะมีบุตรยาก" (Infertility) คือ การที่คู่สมรสมีเพศสัมพันธ์กันอย่างสม่ำเสมอ อย่างน้อยสัปดาห์ละ 2-3 ครั้ง และไม่มีการคุมกำเนิดติดต่อกันประมาณ 1 ปี แล้วยังไม่เกิดการตั้งครรภ์จะเข้าข่ายภาวะมีบุตรยาก หรือผู้หญิงที่มีอายุเกิน 40 ปี ที่ยังอยู่ในขั้นตอนการตัดสินใจมีบุตร จะเริ่มเข้าสู่ภาวะมีลูกยากเช่นกัน
2. การเพิ่มทักษะด้านดิจิทัลผ่านการฝึกอบรมและการศึกษาอย่างต่อเนื่อง
ระบบการทำงานอัตโนมัติสามารถช่วยลดภาระงานที่มากเกินไปในแต่ละแผนกของโรงพยาบาลได้ แต่บุคลากรทางการแพทย์ยังจำเป็นต้องได้รับความรู้และการฝึกอบรมที่เหมาะสมเพื่อให้ทันกับความก้าวหน้าทางเทคโนโลยี
โดยพบว่า 1 ใน 5 ของบุคลากรทางการแพทย์ลาออกจากสายงานนี้ตั้งแต่เกิดการแพร่ระบาดของโควิด-19 [3] การฝึกอบรมบุคลากรใหม่ๆ อย่างเพียงพอจึงสำคัญอย่างยิ่งต่อความต่อเนื่องในการทำงาน ความปลอดภัยและคุณภาพของการดูแลรักษาผู้ป่วย และในอนาคต เราจะเห็นความต้องการ ‘บริการด้านการศึกษา’ เพิ่มมากขึ้น เพื่อสนับสนุนการเรียนรู้อย่างต่อเนื่อง รับการเปลี่ยนแปลงที่กำลังเกิดขึ้นด้านดิจิทัลในวงการเฮลท์แคร์
S2O Songkran Music Festival 2023 สงกรานต์มันส์สุดเหวี่ยง the Live Park Rama 9
เตรียมมันส์สุดเหวี่ยงในงาน S2O Songkran Music Festival 2023 สงกรานต์นี้ เตรียมชุดให้พร้อมแล้วมาสู้กับความสนุกสุดมันส์ในงานเทศกาลดนตรี S2O สงกรานต์ มิวสิคเฟสติวัล ตลอด 3 วันเต็ม มาร่วมเฉลิมฉลองเทศกาลสงกรานต์ที่ยิ่งใหญ่ที่สุดของโลก พร้อมบรรยากาศสุดชิคของกรุงเทพฯยามค่ำคืนภายใต้ความชุ่มฉ่ำและเพลิดเพลินไปกับเพลงสุดมันส์จากดีเจชั้นนำของโลก ณ the Live Park Rama 9 วันที่ 13-15 เมษายน 2566
*เช็คราคาตั๋วกับผู้จัด
เขตดุสิต LINK
เขตดุสิต แจ้งตารางฉีดวัคซีนน้องหมาน้องแมว สำนักงานเขตดุสิตร่วมกับศูนย์บริการสาธารณสุข 6 และ 38 มีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 13 - 24 มีนาคม 2566 เวลา 9.00 - 12.00 น. ประชาชนผู้ที่สนใจ โปรดนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาด้านล่างได้เลยจ้า
เขตลาดพร้าว LINK
ศูนย์บริการสาธารณสุข 66 ตำหนักพระแม่กวนอิม ตารางออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์ ประจำปี 2566 อย่าลืมพาน้องหมา น้องแมว มากันเยอะๆนะคะ ร่วมกันเป็นส่วนหนึ่งในการป้องกันโรคพิษสุนัขบ้าในสัตว์ และป้องกันตนเองจากอันตรายในกรณีที่โดนกัดหรือโดนข่วนด้วย

ในฐานะศูนย์ความเป็นเลิศทางการแพทย์ ของสถาบันโรคหัวใจบำรุงราษฎร์ เราได้ยกระดับความรู้ด้านการแพทย์และเทคโนโลยีที่ทันสมัยระดับโลก เพื่อให้ผลลัพธ์ในการรักษาผู้ป่วยมีประสิทธิภาพสูงสุด ศ. นพ. กุลวี ย้ำว่า “บำรุงราษฎร์มีความพร้อมทุกประการในการบริบาลผู้ป่วยอย่างดีที่สุด ทีมผู้บริหารมีวิสัยทัศน์และทำงานวิจัยเพื่อพัฒนาเทคนิคการรักษา งานวิจัยช่วยให้ทีมแพทย์ได้เรียนรู้ พัฒนา และค้นพบวิธีการรักษาใหม่ๆ ที่ดีขึ้น เราไม่เคยหยุดพัฒนาและมุ่งมั่นที่จะประสบความสำเร็จให้มากขึ้น”
จากความสำเร็จของบำรุงราษฎร์ ทีมผู้บริหารและ ศ. นพ. กุลวี เห็นตรงกันว่า งานวิจัย เทคโนโลยี นวัตกรรม เป็นปัจจัยสำคัญที่สนับสนุนให้สถาบันหัวใจบำรุงราษฎร์ พัฒนาต่อเนื่องอย่างไม่หยุดยั้ง ศ. นพ. กุลวี เสริมว่า “บำรุงราษฎร์ลงทุนกับเทคโนโลยีและอุปกรณ์ทางการแพทย์อย่างมหาศาล โดยอุปกรณ์ทางการแพทย์บางอย่าง ก็ไม่ได้ให้ผลตอบแทน เมื่อเรามีทีมแพทย์ชำนาญการที่พร้อมให้การรักษา สถาบันหัวใจบำรุงราษฎร์ จึงถือเป็นศูนย์ความเป็นเลิศทางการแพทย์ด้านหัวใจระดับโลกอย่างแท้จริง ตัวอย่างงานวิจัยที่ผ่านมา ได้แก่ โรคใหลตาย ทีมแพทย์ใช้เวลากว่า 30 ปีในการติดตามการรักษาโรคใหลตายด้วยการจี้พังผืดบริเวณพื้นผิวของหัวใจห้องขวาล่าง นอกจากนี้ เรายังทำวิจัยเรื่องประโยชน์และข้อจำกัดในการรักษาโรคหัวใจเต้นผิดจังหวะด้วยการจี้หัวใจผ่านสายสวนในผู้ป่วยสูงอายุที่มีภาวะหัวใจห้องบนสั่นพลิ้วอีกด้วย”
กสทช. ย้ำ เครื่องหมาย + นำหน้าเบอร์โทร รู้ไว้...ให้ระวัง เป็นเบอร์ที่โทรจากต่างประเทศ LINK
กสทช. กำหนดให้ผู้ให้บริการโทรศัพท์ระหว่างประเทศ ผู้ให้บริการ Call Termination และผู้ให้บริการโทรศัพท์เคลื่อนที่จะต้องเพิ่มเครื่องหมาย +698 นำหน้าสายที่โทรจากเบอร์โทรศัพท์ของไทยที่ใช้บริการโรมมิ่งโทรกลับมาจากต่างประเทศ (ยกเว้นกรณีสายที่มาจากประเทศที่ใช้งานรหัสประเทศ ตามที่สหภาพโทรคมนาคมระหว่างประเทศ (ITU) กำหนด ให้แสดงรหัสประเทศของประเทศนั้นๆ)
เพื่อให้ประชาชนทราบว่าเป็นสายที่โทรมาจากต่างประเทศ และใช้ความระมัดระวังในการรับสาย หากไม่มีญาติหรือคนรู้จักอยู่ต่างประเทศ สามารถปฏิเสธการรับสายนั้นได้ โดยเบอร์โทรศัพท์ที่นำหน้าด้วย +698 จะไม่สามารถโทรกลับได้ หากจะโทรกลับต้องตัด “+698” ออก แล้วเติมด้วย “0” และจะแสดงแค่หมายเลข แม้จะบันทึกชื่อและหมายเลขไว้ก็ตาม จึงขอให้ประชาชนสังเกตเบอร์ที่โทรเข้าก่อนรับสาย
ปัจจุบันมิจฉาชีพได้ปรับเปลี่ยนวิธีการหลอกลวงประชาชนอยู่ตลอดเวลา กสทช. จึงขอให้ประชาชนใช้ ความระมัดระวัง มีสติ อย่าตกใจ ไม่ให้ข้อมูลส่วนบุคคลหรือข้อมูลทางการเงิน และรหัสผ่านต่างๆ รวมทั้งอย่าหลงเชื่อ หากปลายสายบอกให้โอนเงิน ให้สันนิษฐานไว้ก่อนว่าเป็นมิจฉาชีพ หากมีการอ้างถึงหน่วยงานภาครัฐ สถาบันการเงิน หรือบริษัทขนส่งต่างๆ ให้ขอหมายเลขติดต่อกลับและวางสายและตรวจสอบข้อมูลไปยังหน่วยงานหรือสถาบันการเงินที่ถูกอ้างถึง
✖️ทั้งนี้ หน่วยงานของรัฐไม่มีนโยบายการติดตามหรือดำเนินคดีผ่านการโทรศัพท์หรือวีดีโอคอลหาประชาชน
รายละเอียดแต่ละประเภท (จาก 5 ประเภท)
ต่อมาในปี พ.ศ.2554 มีการตรวจสอบการปน เปื้อนสาร PFASs ในตัวอย่างน้ำจากระบบบำบัดน้ำ เสียชุมชน จำนวน 7 แห่ง ในพื้นที่กรุงเทพมหานคร โดยทั้งหมดเป็นระบบตะกอนเร่ง (Activated Sludge) ผลการศึกษาพบสารกลุ่ม PFCAs และ PFSAs 11 ชนิด ความเข้มข้นรวมในตัวอย่างน้ำเข้า และน้ำออกจากระบบบำบัดมีค่าระหว่าง 9.4-18.4 ng/L และ 12.7-63.6 ng/L ตามลำดับ ชนิดที่พบ การปนเปื้อนมากที่สุด คือ PFOS และ PFOA และ ผลการศึกษาสรุปว่ากระบวนการบำบัดน้ำเสียระบบ ตะกอนเร่งไม่มีประสิทธิภาพเพียงพอที่จะกำจัดสาร PFASs ออกจากน้ำเสียได้
นอกจากนี้ ในระหว่าง ปี พ.ศ. 2556-2557 มีการตรวจวัดสาร PFASs ใน ตัวอย่างน้ำผิวดินบริเวณปากแม่น้ำสายหลัก 4 สาย (แม่น้ำเจ้าพระยา แม่น้ำท่าจีน แม่น้ำแม่กลอง และ แม่น้ำบางปะกง) และบริเวณรอบนิคมอุตสาหกรรม จังหวัดสมุทรปราการ ลำพูน และระยอง
ผลการ ศึกษาตรวจพบการปนเปื้อนสาร PFOA ในแม่น้ำสาย หลักอยู่ระหว่าง 1.4-16.9 ng/L ส่วนสาร PFOS อยู่ระหว่างตรวจไม่พบจนถึง 53.5 ng/L
ส่วน ในตัวอย่างน้ำผิวดินบริเวณรอบนิคมอุตสาหกรรม ตรวจพบการปนเปื้อนสูงกว่าแม่น้ำสายหลักโดยสาร PFOA และ PFOS มีค่าอยู่ระหว่าง 11.7-118.7 ng/L และ 22.8-434.5 ng/L ตามลำดับ
และ ในปี พ.ศ. 2558 ศึกษาการปนเปื้อนสาร PFASs ในตัวอย่างน้ำประปาในพื้นที่ กทม. โดยตรวจพบ สารกลุ่ม PFCAs และ PFSAs จำนวน 6 ชนิด ความเข้มข้นรวมมีค่าระหว่าง 0.58-1.15 ng/L ผลการศึกษานี้พบว่ากระบวนการปรับปรุงคุณภาพ น้ำประปาทั่วไป ได้แก่ การสร้างตะกอน การรวม ตะกอน การกรองและการฆ่าเชื้อด้วยคลอรีนไม่ สามารถกำจัดสาร PFASs ออกจากน้ำดิบได้
ใน ขณะที่กระบวนการปรับปรุงคุณภาพน้ำขั้นสูง ได้แก่ การกรองด้วยถ่านกัมมันต์ (GAC) และรีเวิร์สออส โมสิส (RO) สามารถกำจัด PFASs ได้ประมาณ ร้อยละ 86
นอกจากผลการศึกษาในสิ่งแวดล้อม น้ำแล้ว มีการวิจัย PFASs ในตัวอย่างฝุ่นพื้นผิว ที่เก็บจากบ้านเรือนในพื้นที่กรุงเทพมหานครและ นครศรีธรรมราช โดยตรวจพบสารกลุ่ม PFCAs, PFSAs, FASAs และ FASEs จำนวน 8 ชนิด มีความเข้มข้นรวมระหว่าง 54-1,310 ng/g โดยชนิดที่พบการปนเปื้อนสูงสุดคือ EtFOSA
และในปี พ.ศ.2557 ศึกษาการปนเปื้อนสาร PFASs ในตัวอย่างอากาศในบรรยากาศทั่วไป (อากาศ ภายนอกอาคาร) จำนวน 8 แห่ง ได้แก่ บริเวณพื้นที่ ชุมชนในกรุงเทพมหานครและปริมณฑล บริเวณ ระบบบำบัดน้ำเสียรวมของนิคมอุตสาหกรรม รวมทั้ง ตัวอย่างอากาศภายในอาคารจำนวน 6 แห่ง ได้แก่ สำนักงาน บ้านพักอาศัย คอนโดมิเนียม ร้านถ่าย เอกสาร ร้านขายเฟอร์นิเจอร์ และห้องปฏิบัติการ ผลการศึกษาตรวจพบสารกลุ่ม FTOHs และ PFCAs จำนวน 10 ชนิด ความเข้มข้นรวมของ FTOHs มีค่า ตั้งแต่ 1,690- 13,030 pg/m3 ซึ่งสูงกว่าค่าความ เข้มข้นรวมของ PFCAs ที่มีค่าระหว่าง 4-10 pg/m3 โดยชนิดที่พบการปนเปื้อนสูงสุด คือ 10:2 FTOH
น้องแมวน้องหมากำลังบอกรักคุณ
เลียทำความสะอาดคุณ หรือกะพริบตาช้าๆ เมื่อสบตา - สำหรับเจ้าเหมียว ไม่ว่าจะเลียทำความสะอาดให้เจ้าของ กะพริบตาช้าๆ เมื่อหันมาสบตาเรา เดินคลอเคลีย รวมถึงใช้อุ้งเท้าน้อยๆ เหยียบนวดและย่ำไปตามตัวเรา ล้วนเป็นการแสดงความรักและความไว้ใจ
เย้าแหย่ ชวนวิ่งเล่น เลียหน้าคุณ - ท่าทางแบบนี้เรามักจะเห็นในน้องหมามากกว่าน้องแมว ไม่ว่าจะกระโดดสองขา ยืดตัวเกาะเจ้าของ คอยป้วนเปี้ยน กระเซ้าเย้าแหย่ หรือขึ้นมานอนบนเตียงเดียวกับเราก็เป็นอีกหนึ่งการแสดงความรัก ความไว้วางใจ เพราะเขารู้สึกปลอดภัยและงีบหลับได้โดยไม่กังวลเมื่ออยู่ข้างๆ เรา
เตรียมพร้อมลูกเข้าสู่ช่วงวัยรุ่น
ควรทำ
เล่าให้ลูกฟัง ว่าสิ่งที่ลูกต้องเผชิญเมื่อเข้าสู่ช่วงวัยรุ่นมีอะไรบ้าง
ให้กำลังใจ บอกลูกว่าไม่ต้องวิตกกังวล เพราะพัฒนาการเปลี่ยนแปลงร่างกายของแต่ละคนไม่เหมือนกัน บางคนเร็ว บางคนช้า และแต่ละคนก็มีการเปลี่ยนแปลงไม่เหมือนกันทั้งหมด
สอนทักษะที่สำคัญในการดูแลตัวเอง เช่น การล้างหน้าเพื่อป้องกันสิว การดูแลผิวหน้า การรักษาความสะอาดร่างกาย และการรับมือกับร่างกายที่เปลี่ยนแปลงไป
อย่าทำ
เพิกเฉยไม่สนใจความวิตกกังวลของลูก จะกลายเป็นการเปิดช่องให้ลูกไปหาข้อมูลเองในอินเทอร์เน็ต ซึ่งข้อมูลที่ได้อาจไม่ถูกต้อง และเด็กยังขาดวิจารณญาณที่จะแยกแยะ
ติดต่อจองเลี้ยงอาหาร
ติดต่อจองเลี้ยงอาหาร โทร. 02-5834246 02-5834522 02-5834818
ศูนย์ดูแลผู้สูงอายุ KIN Nursing Home
ศูนย์ดูแลผู้สูงอายุลาดพร้าว สถานพักฟื้นผู้ป่วย เป็นบ้านพักคนชรา ที่ออกแบบสถานที่ตกแต่งหรูหราแบบโรงแรม รีสอร์ท อากาศโปร่งโล่งสบาย มีต้นไม้ขนาดใหญ่อยู่กลางอาคาร มีพื้นที่สีเขียว การดูแลเหมือนอยู่โรงพยาบาล บรรยากาศเหมือนอยู่บ้าน อบอุ่น เป็นเอกลักษณ์ “KIN” (คิน) ให้ความอบอุ่นและเป็นกันเอง เพื่อสร้างความสุนทรีย์ต่อผู้เข้ารับบริการ ยกระดับมาตรฐานการให้บริการในระดับสากล มีอุปกรณ์เครื่องมือที่ทันสมัย เทียบเท่าโรงพยาบาลเอกชน นายปีเตอร์ สไตรเบิล กรรมการผู้จัดการ บริษัท ทาเคดา (ประเทศไทย) จำกัด กล่าวว่า “ตั้งแต่การลงนามในความร่วมมือเพื่อสร้างความตระหนักรู้และการป้องกันโรคไข้เลือดออกในประเทศไทย พันธมิตรได้บรรลุเป้าประสงค์ในการสร้างความตระหนักรู้ในเรื่องโรคไข้เลือดออกให้แก่ชุมชนและอาสาสมัครสาธารณสุขกรุงเทพมหานคร (อสส.) จำนวนกว่า 1,000 คน ในเขตมีการระบาดของไข้เลือดออกสูงผ่านกิจกรรมสร้างความตระหนักรู้และการปฏิบัติจริงในการป้องกันและควบคุมโรคไข้เลือดออก สำหรับโครงการฯ นี้ เรามุ่งเน้นไปที่กลุ่มนักเรียนซึ่งเป็นหนึ่งในกลุ่มที่มีความเสี่ยงสูงจากการติดเชื้อไข้เลือดออก ในการทำความเข้าใจเรื่องโรคและการป้องกันที่มีประสิทธิภาพ เพื่อนำไปต่อยอดและถ่ายทอดสู่โรงเรียนและชุมชนเพื่อให้ปลอดภัยจากโรคนี้ โดยตั้งเป้าสนับสนุนการดำเนินการอย่างต่อเนื่องโดยเฉพาะอย่างยิ่งในชุมชนที่มีการระบาดของไข้เลือดออกสูง พร้อมเปิดโอกาสให้นักเรียนได้แสดงความคิดสร้างสรรค์เพื่อนำเสนอโครงการในการป้องกันไข้เลือดออกอย่างยั่งยืน และมีความยินดีอย่างยิ่งที่ได้ร่วมกันทำงานกับกรุงเทพมหานคร สำนักอนามัย และสำนักการศึกษา เพื่อร่วมกันสร้างชุมชนปลอดไข้เลือดออก”
“ทั้งนี้พานาซีพร้อมแล้วที่จะก้าวสู่การเป็นผู้นำด้าน สเต็มเซลล์ โดยเราทุ่มทุนสร้างศูนย์เก็บสเต็มเซลล์ที่พานาซีพระราม2 เพื่อเป็นคลังเก็บรักษาสเต็มเซลล์จากเลือด เป็นนวัตกรรมขั้น ADVANCE ของสเต็มเซลล์จากที่เราเคยมีอยู่แล้ว เพื่อให้ผู้สนใจสามารถมาฝากสเต็มเซลล์จากเลือดในแลปของพานาซีที่มีระบบการดูแลรักษา ควบคุม ให้มีคุณภาพที่สมบูรณ์ที่สุดได้นานถึง 10 ปี ในอนาคตถ้าหากเราเจ็บป่วย เราสามารถนำสเต็มเซลล์ที่เรามาฝากไว้ในช่วงที่ร่างกายเรายังสมบูรณ์ เอาไปใช้สำหรับการรักษาพยาบาลได้ในอนาคต โดยนวัตกรรมนี้ เป็นความร่วมมือของ พานาซี กับ รพ.โชนัน คามาคูระ ญี่ปุ่น องค์ความรู้นี้ นอกจากจะนำมาช่วยคนไทยแล้ว เรายังสามารถเป็นเซ็นเตอร์ในการรักษาพยาบาลด้านโรคหลอดเลือด ซึ่งสามารถนำมาต่อยอดสร้างเศรษฐกิจด้าน Wellness ให้กับประเทศไทยเพิ่มขึ้นได้อีก”
เดือนมิถุนายน-กรกฎาคม-สิงหาคม 2566
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยาสาขา 1 ศูนย์เวชปฎิบัติครอบครัว
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยาสาขา 1 ศูนย์เวชปฎิบัติครอบครัว
ตั้งอยู่ที่ 194/10 ม.4 ต.ประตูชัย อ.พระนครศรีอยุธยา จ.พระนครศรีอยุธยา 13000
โทร. 089-9012863 035-244342
ศูนย์แพทย์ขนาดกลาง รับผิดชอบประชากร จำนวน 3,000 - 8,000 คน ครอบคลุมพื้นที่ หมู่ 4 ต.ประตูชัย อ.พระนครศรีอยุธยา
ไขข้อข้องใจ ให้ความรู้ ทุกปัญหาการนอนหลับ


กิจกรรม “จุฬาฯ สัปดาห์วันนอนหลับโลกปี 2566” ณ อาคารรัตนวิทยาพัฒน์ โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย มีกิจกรรมที่น่าสนใจหลากหลายรูปแบบ อาทิ นิทรรศการให้ความรู้เกี่ยวกับการนอน เช่น “ปัญหาที่ทำให้นอนไม่หลับ!” “การนอนกับสุขภาพร่างกายมีผลต่อกัน” “สุขภาพใจแบบใดมีผลต่อการนอนหลับ” “นาฬิกาชีวิตไม่ถูกใจสิ่งนี้!” “หยุดหายใจขณะหลับ เรื่องไม่เล็กที่อาจเกิดได้โดยไม่รู้ตัว” “ภาวะนอนกรน สัญญาณอันตรายที่พบบ่อย และคนข้างกายอาจรำคาญ!” “‘หลับตาซิที่รัก’ เทคนิคผ่อนคลายให้หลับสบายมีคุณภาพ” “พบแพทย์ พบคำปรึกษา หาหนทางเพื่อการนอนอย่างเป็นสุข” และ “สร้างสุขภาวะที่ดี และบรรยากาศที่เหมาะสมต่อการนอนหลับ” รวมถึงการจัดแสดงวิดีทัศน์บอกเล่าประสบการณ์ของผู้ป่วยที่เข้ารับการรักษาโรคจากการนอนหลับแล้วมีคุณภาพชีวิตที่ดียิ่งขึ้น ซึ่งไฮไลท์พิเศษของการจัดงานในปีนี้ คือการจัดทีมแพทย์ผู้เชี่ยวชาญออกตรวจพร้อมให้คำปรึกษากับผู้มีปัญหาเรื่องของการนอน โดยครอบคลุมทั้งกลุ่มผู้มีอาการ โรคนอนไม่หลับ (insomnia) ภาวะหยุดหายใจขณะหลับจากการอุดกั้น และปัญหาการใช้งานเครื่องอัดอากาศแรงดันบวก (CPAP) จบงานสัปดาห์วันนอนหลับโลกด้วยการเสวนาให้ความรู้ตลอดทั้งวัน ซึ่งเปิดให้ประชาชนร่วมทำกิจกรรม โดยเชิญผู้เชี่ยวชาญหลากหลายสาขามาแบ่งปันเทคนิคในการทำให้นอนหลับได้อย่างมีคุณภาพ เช่น โยคะฝึกลมหายใจ และออกกำลังกายเพื่อช่วยให้การนอนหลับดีมีประสิทธิภาพยิ่งขึ้น
ศ.นพ.ธีระพงษ์ ตัณฑวิเชียร ประธานคลัสเตอร์วิจัยอายุรศาสตร์เขตร้อน ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย


ศ.นพ.ธีระพงษ์ ตัณฑวิเชียร อาจารย์หน่วยโรคติดเชื้อ ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กล่าวว่า “สำหรับคนที่ไม่ฉีดวัคซีนไข้หวัดใหญ่ เมื่อติดเชื้ออาจจะมีอาการรุนแรงโดยเฉพาะปอดอักเสบ ต้องเข้ารักษาตัวในโรงพยาบาล หรือบางรายต้องเข้ารับการรักษาในหอผู้ป่วยหนัก โดยเฉพาะผู้สูงอายุ 60 ปีขึ้นไปและผู้ป่วยกลุ่มเสี่ยงที่มีโรคประจำตัวเรื้อรังเช่น โรคหัวใจหัวใจ ไตวาย โรคปอดเรื้อรัง ผู้ป่วยมะเร็ง ผู้ที่ได้รับยากดภูมิคุ้มกันแม้ว่าอายุจะน้อยกว่า 60 ปี รวมทั้งอาจพบการติดเชื้อรุนแรงในสตรีตั้งครรภ์ นอกจากนั้นผู้ป่วยไข้หวัดใหญ่ยังอาจพบมีการติดเชื้อร่วมกับเชื้อไวรัสก่อโรคอื่นๆ ทำให้ผู้ป่วยมีการติดเชื้อรุนแรงมากขึ้น เช่น โควิด-19 ไวรัสอาร์เอชวี และยังมีแบคทีเรียบางตัวเกาะในทางเดินหายใจ ในคอรอซ้ำเติม เช่น เชื้อแบคทีเรียนิวโมคอคคัส คนที่เสียชีวิตจากไข้หวัดใหญ่มักจะเป็นผู้สูงอายุ หรือผู้ที่มีโรคประจำตัวเรื้อรัง ซึ่งหากฉีดวัคซีนก็จะสามารถป้องกันการเจ็บป่วย หรือเสียชีวิตได้ จากสถิติตัวเลขในประเทศไทยพบว่า ผู้สูงอายุเสียชีวิตจากไข้หวัดใหญ่มากกว่าคนอายุน้อยถึงเกือบ 70 เท่า และผู้สูงอายุที่มีโรคเรื้อรังเมื่อป่วยไข้หวัดใหญ่และมีปอดอักเสบพบว่าเสียชีวิตมากกว่าคนอายุน้อยที่มีโรคประจำตัวเรื้อรังถึงเกือบ 30 เท่า
PM2.5 เกิดจากอะไร?
ฝุ่นพิษนี้ไม่ได้เพิ่งเกิดขึ้น แต่มันมีอยู่ในชีวิตประจำวันของพวกเรามานานแล้ว โดยทั่วไปจะมีมากในช่วงเปลี่ยนถ่ายของฤดูกาล กล่าวคือ ความกดอากาศสูงจากประเทศจีนลงมายังตอนบนของประเทศทำให้ลมมรสุมมีกำลังอ่อนลง เกิดภาวะลมสงบ ประกอบการเปลี่ยนแปลงของอุณหภูมิทำให้ฝุ่นกระจุกตัว อากาศถ่ายเทไม่ดี มีการสะสมของฝุ่น หมอกและควันในบรรยากาศ จนเกิดปรากฏการณ์ดังกล่าวอย่างที่เราเห็นนั่นเอง นอกจากเหตุผลด้านสภาพภูมิอากาศ กิจกรรมของมนุษย์ทั้งกลางแจ้งและในร่มก็ส่งเสริมให้เกิดฝุ่น PM 2.5 ได้เช่นกัน
สำหรับกิจกรรมกลางแจ้ง อนุภาคฝุ่นพิษนี้มักมาจากการปล่อยควันเสียของรถยนต์ทั่วไป รถบรรทุก รถประจำทาง และรถยนต์ที่ขับบนพื้นขรุขระ (รถก่อสร้าง รถหัวจักร) และจากการเผาไหม้เชื้อเพลิงอย่างไม้ถ่าน การเผาป่า การเผาเรือกสวนไร่นา การเผาหญ้า นอกจากนี้ยังมาจากปฏิกิริยาของแก๊สบนชั้นบรรยากาศจากโรงงานอุตสาหกรรม และโรงงานไฟฟ้านิวเคลียร์ได้อีกด้วย
สำหรับกิจกรรมในร่มหรือกิจกรรมในครัวเรือนนั้นก็ส่งผลให้เกิดฝุ่นพิษ PM2.5 ได้ เช่น การสูบบุหรี่ การประกอบอาหาร (ทอด ผัด ปิ้ง ย่าง) การจุดธูปเทียน ตะเกียง เตาผิง การใช้เครื่องถ่ายเอกสาร เป็นต้น
โปรแกรมตรวจสุขภาพ "พ่อแม่สุขกาย..ลูกหลานสุขใจ" กรุงเทพสนามจันทร์ LINK
โปรแกรมพิเศษแบบเย็นใจ พ่อแม่สุขกาย ราคาเพียง 1.999 บาท
✅พิเศษ!! ท่านที่ตรวจโปรแกรมหลัก 1,999 บาท
สามารถให้ลูกหลานตรวจเพิ่ม ด้วยโปรแกรม "ลูกหลาน..สุขใจ"
แบบสบายกระเป๋า ในราคาเพียง 999 บาท
มอบความแข็งแรงให้กับคนที่คนรัก
ด้วยโปรแกรมตรวจสุขภาพ
"พ่อแม่สุขกาย......ลูกหลานสุขใจ"
แข็งแรงกันไป ทั้งครอบครัว
วันนี้ - 9 เมษายน 2566
สงกรานต์สุดมันที่เซ็นทรัลสมุย
ชาวสมุยไปสนุกกับเทศกาลสงกรานต์ได้ที่เซ็นทรัลสมุย 13-14 เมษายน 2566 เตรียมกายเตรียมใจมาร่วมดับร้อนกับเพลง EDM และปาร์ตี้โฟม สุดมันส์
เชิญผู้ประกอบการร่วมส่งผลิตภัณฑ์สมุนไพรเข้าคัดเลือกรางวัล ผลิตภัณฑ์สมุนไพรคุณภาพ ครั้งที่ 2 ประจำปี 2566
ขอเชิญผู้ประกอบการร่วมส่งผลิตภัณฑ์สมุนไพรเข้าคัดเลือกรางวัล ผลิตภัณฑ์สมุนไพรคุณภาพ ครั้งที่ 2 ประจำปี 2566 ( Premium Herbal Products 2023 ) สมัครได้ตั้งแต่วันนี้ - 30 เมษายน 2566
สอบถาม กองสมุนไพรเพื่อเศรษฐกิจ. อาคาร 3 ชั้น 3 กรมการแพทย์แผนไทยและการแพทย์ทางเลือก. ตำบล ตลาดขวัญ อำเภอ เมืองนนทบุรี จังหวัดนนทบุรี 11000 ติดต่อสอบถามเพิ่มเติมที่ 063-3674154 02-5917007 ต่อ 3303 / 02-1495609
Bangkok Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ชื่นอุราตลอดโค้งน้ำเจ้าพระยาแห่งกรุงเทพมหานคร ท่องเที่ยวแบบยั่งยืนริมแม่น้ำสายวัฒนธรรม ณ 11 ท่าน้ำวิถีไทย สัมผัสวิถีชุมชน ผ่านศิลปะ อาหาร การแสดงกลิ่นอายวันวาน และกิจกรรมร่วมสมัย Bike Walk Talk Boat ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
1. ท่ายอดพิมาน
2. ท่าวัดโพธิ์ ซอยประตูนกยูง
3. ท่ามหาราช
4. ท่าวัดระฆังฯ
5. ท่าวัดอรุณฯ
6. ท่าวัดกัลยาฯ
7. ท่าวัดประยุรฯ
8. ท่าศาลเจ้ากวนอู คลองสาน
9. ท่าเดอะล้ง 1919
10. ท่าสุขสยาม ณ ไอคอนสยาม
11. ท่าเอเชียทีค เดอะ ริเวอร์ฟร้อนท์
ระหว่างวันที่ 13 - 16 เม.ย. 2566
บริการเรือรับส่งฟรี (11 ท่าน้ำวิถีไทย) Free Shuttle Boat ตั้งแต่เวลา 9.00 น. - 17.00 น.
กรุงเทพฯ – ภาคเหนือ
กรุงเทพฯ – ภาคเหนือ
- เส้นทางที่ 1 จากกรุงเทพฯ ไปรังสิต (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) - จ.พระนครศรีอยุธยา – จ.อ่างทอง – จ.สิงห์บุรี (ทางหลวงหมายเลข 32 ถนนสายเอเชีย) – อ.มโนรมย์ (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) จากนั้นมุ่งหน้าสู่จังหวัดนครสวรรค์
- เส้นทางที่ 2 จากกรุงเทพฯ ไป จ.นนทบุรี (ทางหลวงหมายเลข 340 บางบัวทอง – สุพรรณบุรี) –จ.สุพรรณบุรี (ทางหลวงหมายเลข 340 สุพรรณบุรี – ชัยนาท) – จ.ชัยนาท (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) จากนั้นมุ่งหน้า สู่จังหวัดนครสวรรค์
- เส้นทางที่ 3 จากกรุงเทพฯ ไป รังสิต – อ.วังน้อย – จ.สระบุรี – จ.ลพบุรี (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – อ.ตากฟ้า (ทางหลวงหมายเลข 11) จากนั้นมุ่งหน้าสู่จังหวัดพิษณุโลก พิจิตร สุโขทัย อุตรดิตถ์
- เส้นทางที่ 4 จากกรุงเทพฯ ไปรังสิต – ต่างระดับคลองหลวง (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – เชียงรากน้อย (ทางหลวงหมายเลข 3214) – ทางหลวงหมายเลข 347 – ทางหลวงหมายเลข 32 จากนั้นมุ่งหน้าเข้าสู่ภาคเหนือ
- เส้นทางที่ 5 จากกรุงเทพฯ ไปวงแหวนตะวันออก (ทางหลวงพิเศษระหว่างเมืองหมายเลข 9) – ต่างระดับมหาวิทยาลัยมหาจุฬาลงกรณราชวิทยาลัย (มจร.) – อ.วังน้อย (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – ถนนโรจนะ (ทางหลวงหมายเลข 309) จากนั้นมุ่งหน้าสู่ทางหลวงหมายเลข 32 เข้าสู่ภาคเหนือ
- เส้นทางที่ 6 จากกรุงเทพฯ ไปวงแหวนตะวันออก (ทางหลวงพิเศษระหว่างเมืองหมายเลข 9) - ทางหลวงหมายเลข 3214 (เส้นคลองหลวง - ธรรมศาสตร์) - ทางหลวงหมายเลข 347 มุ่งหน้าอำเภอบางปะหัน เข้าสู่ภาคเหนือ
- เส้นทางที่ 7 จากกรุงเทพฯ ลงทางด่วนอุดรรัถยา ลงด่านเก็บเงินค่าผ่านทางบางปะอิน แนะนำเลี้ยวซ้ายเข้าทางหลวงหมายเลข 347 มุ่งหน้าอำเภอบางปะหัน (เลี่ยงการจราจรตรงต่างระดับางปะอิน)
- เส้นทางที่ 8 จากกรุงเทพฯ ลงทางด่วนอุดรรัถยา ลงด่านเก็บเงินค่าผ่านทางเชียงราก ตรงมหาวิทยาลัยธรรมศาสตร์ แนะนำ เลี้ยวซ้ายเข้าทางหลวงหมายเลข 347 มุ่งหน้าอำเภอบางปะหัน (เลี่ยงการจราจรถนนพหลโยธิน)
โปรแกรมตรวจสุขภาพสำหรับผู้สูงวัย และครอบครัว LINK
โปรแกรมตรวจสุขภาพสำหรับผู้สูงวัย และครอบครัว ในเดือนเมษายน ต้อนรับเทศกาลสงกรานต์ หรือวันขึ้นปีใหม่ไทย มามอบของขวัญพิเศษให้กับตัวเองและคนที่คุณรักให้มีสุขภาพที่ดี ด้วยการตรวจเช็คสุขภาพประจำปีกันนะคะ ตั้งแต่วันที่ 1-30 เมษายน 2566
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ โทร 034-270080-5
ตารางออกตรวจแผนกสูตินรีเวชกรรม
Sea Glass Jewelry Workshop ทำเครื่องประดับแสนสวยจาก “Sea Glass” หรือ ขยะจากเศษแก้ว
เวิร์คช็อปนี้จะทำให้เราหลงรักธรรมชาติมากขึ้น เพียงแค่เปลี่ยนจากการเก็บเปลือกหอยและหินตามชายหาดที่อาจส่งผลกระทบต่อระบบนิเวศ มาเป็นการสังเกตหาขยะเศษแก้วสีสวย ซึ่งได้รับการเจียรนัยจากท้องทะเล ให้กลายมาเป็นวัตถุดิบในการทำเครื่องประดับที่มีเพียงชิ้นเดียวบนโลก . กิจกรรมน้อมรับความช่วยเหลือจากธรรมชาติ ผ่านขวดแก้วที่ผู้คนโยนลงทะเล สู่แก้วรูปทรงสวยที่ถูกขัดเกลาโดยน้ำหินดินทราย จนมีขนาดและรูปแบบที่หลากหลาย ผนวกกับความคิดสร้างสรรค์โดยศิลปินชาวเกาะ ปลาทู-อภิภู วิสมล จะทำให้เศษขยะที่ผู้คนมองข้าม กลายเป็นของตกแต่งประดับกาย . สำหรับกิจกรรมนี้ ผู้ร่วมงานจะได้ออกสำรวจหาขยะเศษแก้วตามหาดต่างๆ ไปจนถึงการออกแบบและลงมือทำเครื่องประดับตามสไตล์แต่ละคน . ร่วมสนุกไปกับการหาสมบัติเศษแก้วจากธรรมชาติ และใช้ไอเดียด้านศิลปะกับกิจกรรม Sea Glass Session ได้ที่บ้านทะเล ภายใต้งาน SPOTLIGHT Koh Tao
จุดรับส่งเส้นทางที่ 2 - วัดใต้ - โรงงานกระดาษ - ศาลหลักเมือง - แพหน้าเมือง
สถานีชาร์จ EleX ในกรุงเทพ
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา กระทรวงการคลัง
ที่อยู่: 14 ถ.พระรามที่6 แขวงสามเสนใน เขตพญาไท กรุงเทพมหานคร 10400
เวลาทำการ : ทุกวัน 08.00 – 16.30 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Homepro เอกมัย-รามอินทรา
ที่อยู่: 41 ถ.ประดิษฐ์มนูธรรม แขวงลาดพร้าว เขตลาดพร้าว กรุงเทพมหานคร 10230
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Homepro พระราม 9
ที่อยู่: 903 ถ.พระราม9 แขวงสวนหลวง เขตสวนหลวง กรุงเทพมหานคร 10250
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Homepro พระราม 3
ที่อยู่: 497/1 ถ.พระราม3 แขวงบางโคล่ เขตบางคอแหลม กรุงเทพมหานคร 10120
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Homepro จรัญสนิทวงศ์
ที่อยู่: 110/8 ถ.จรัญสนิทวงศ์ แขวงบ้านช่างหล่อ เขตบางกอกน้อย กรุงเทพมหานคร 10700
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Paradise Park
ที่อยู่: 61 ถนนศรีนครินทร์ แขวงหนองบอน เขตประเวศ กรุงเทพมหานคร 10250
เวลาทำการ : ทุกวัน 10.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา กองบัญชาการกองทัพเรือ พื้นที่วังนันทอุทยาน (สวัสดิการข้าราชการ)
ที่อยู่: วังนันทอุทยาน, ถนน อิสรภาพ แขวงบ้านช่างหล่อ เขตบางกอกน้อย กรุงเทพมหานคร 10700
เวลาทำการ : ทุกวัน 08.00 – 16.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา กองบัญชาการกองทัพเรือ พื้นที่พระราชวังเดิม (สวัสดิการข้าราชการ)
ที่อยู่: 1 ถ.วังเดิม แขวงวัดอรุณ เขตบางกอกใหญ่ กรุงเทพมหานคร 10600
เวลาทำการ : ทุกวัน 08.00 – 16.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา กองบัญชาการกองทัพอากาศ
ที่อยู่: แขวงสนามบิน เขตดอนเมือง กรุงเทพมหานคร 10210
เวลาทำการ : ทุกวัน 08.00 – 16.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ทำเนียบรัฐบาล (สำหรับข้าราชการและผู้มาติดต่อราชการ)
ที่อยู่: 1 ถนนพิษณุโลก แขวงดุสิต เขตดุสิต กรุงเทพมหานคร
เวลาทำการ : ทุกวัน 08.00 – 16.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
การคิดค่าบริการ ตาม On Peak และ Off Peak
อัตราค่าไฟ แบ่ง 2 ช่วงเวลา คือ On Peak และ Off Peak
- On Peak จันทร์-ศุกร์ เวลา 9.00-22.00 น. คิด 7.5 บาท/หน่วย
- Off Peak จันทร์-ศุกร์ 22.00-.00 น. คิด 4.5 บาท/หน่วย และวันเสาร์-อาทิตย์ วันหยุดราชการ (ไม่รวมวันหยุดชดเชย) ทั้งวัน
*ยกเว้นอัตราค่าบริการใบางพื้นที่เชิงพาณิชย์
หมอช้าง แนะ ทำบุญลงท้ายด้วยเลข 5 หรือ 19
หมอช้าง ทศพร ศรีตุลา แนะ เคล็ด ทำบุญรับดาวพฤหัสย้ายราศี วันที่ 19 เมษายน 2566 ทำบุญลงท้ายด้วยเลข 5 หรือ 19 เช่น บริจาคเงิน 55 , 119 บาท
ทำบุญแล้ว
กล่าวอธิฐาน ที่ เพจ รพ.สงฆ์โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ดินแดง2) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร ดินแดง2 เลขที่ 4095/26 ซอยมิตรไมตรี3 ถนนประชาสงเคราะห์ แขวงดินแดง เขตดินแดง กรุงเทพมหานคร 10400
- โทร.02-2451401 , 02-2465769
- Facebook
- เว็บไซต์
- แผนที่โรงเรียน
- เปิดทำการตามวันและเวลาราชการ 08.30–16.00 ปิดวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์
- รถประจำทาง 12 13 36 54 117 ปอ204
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ดินแดง2) สังกัด สำนักงานการส่งเสริมอาชีพ สำนักพัฒนาสังคม กรุงเทพมหานคร เปิดการเรียนรู้หลากหลายอาชีพ ดูหลักสูตรและวันเปิดการเรียนสอน ได้ที่
เว็บโรงเรียน
นครภัณฑ์ สาขาดินแดง2 ศูนย์แสดงสินค้า-ผลิตภัณฑ์ จำหน่ายผลงานนักศึกษาและงานบริการ เป็นพื้นที่ให้นักเรียนที่เรียนกับโรงเรียนฝึกอาชีพกรุงเทพมหานครได้ฝึกประสบการณ์วิชาชีพที่เรียนให้กับประชนทั่วไป ก่อนที่จะนำไปประกอบอาชีพของตนเอง เปิดให้บริการในวันจันทร์ – ศุกร์ เวลา 9.00 – 16.00น.
พื้นที่จัดกิจกรรมโดยรวม 21 จุด
เส้นทางไหว้พระเสริมสิริมงคล
5 งรูปแบบอาชญากรรมออนไลน์มาในหน้าร้อน
ภาคเหนือ “วิจิตร@เชียงราย หลงแสงเวียง ที่ เจียงฮาย Chiang Rai : Wiang of Light”
ภาคเหนือ : พบกับการแสดง แสง สี เสียง ภายใต้แนวคิด “วิจิตร@เชียงราย หลงแสงเวียง ที่ เจียงฮาย Chiang Rai : Wiang of Light” สร้างสีสันบรรยากาศให้สถานที่ท่องเที่ยวในจังหวัดเชียงราย เต็มไปด้วยมนต์เสน่ห์แห่งอารยธรรมเมืองล้านนา ผ่านการแสดง แสง สี เสียง เพื่อกระตุ้นการท่องเที่ยวและสร้างรายได้ให้กับสถานประกอบการในพื้นที่จัดงาน เชิญชวนไปแอ่วเมืองเหนือ ไปสัมผัสบรรยากาศอันอบอุ่นผ่านการจัดกิจกรรมการแสดง แสง สี ด้วยเทคนิค Mapping 3D, Light up, Light Installation และ Projection 3D สามารถเที่ยวชมงานได้ตั้งแต่วันที่ 20 – 28 พฤษภาคม พ.ศ.2566
น้องกระปุก - ด.ญ.ทัชสิวรรณ คุ้มไข่น้ำ
ด.ญ.ทัชสิวรรณ คุ้มไข่น้ำ หรือกระปุก อายุ 13 ปี นักเรียนชั้นมัธยมศึกษาปีที่ 2 โรงเรียนชุมชนบ้านพัฒนา กล่าวถึงความประทับใจในการเข้าร่วมกิจกรรม Dengue-zero School Project โรงเรียนติด Guard ห่างไกลไข้เลือดออกในครั้งนี้ว่า “ก่อนจะมาเข้าร่วมโครงการนี้ ยังไม่มีความรู้ในการป้องกัน และควบคุมปริมาณยุงลายสักเท่าไหร่ และคิดว่าโรคไข้เลือดออกเป็นเรื่องที่ไกลตัวมาก ๆ ไม่น่าจะติดกันได้ง่าย แต่หลังจากได้เข้าร่วมกิจกรรมนี้ก็ได้รู้ว่า จริง ๆ แล้วโรคไข้เลือดออกใกล้ตัวและน่ากลัวกว่าที่คิดมาก มันอยู่รอบตัวเรามาโดยตลอด จากในกิจกรรมได้รับความรู้มากมาย ซึ่งเป็นความรู้ใหม่ ๆ ที่เรียนรู้นอกห้องเรียน และหลังจากจบกิจกรรมในวันนี้ จะนำความรู้ที่ได้ไปใช้จัดบอร์ดที่โรงเรียนเพื่อประชาสัมพันธ์ให้เพื่อน ๆ ที่ยังไม่มีความรู้ ให้ได้รู้จักโรคไข้เลือดออกมากยิ่งขึ้น รวมไปถึงการป้องกันที่ถูกวิธีค่ะ”
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) มองเห็นมุมมองใหม่ที่น่าสนใจจากผลสำรวจประจำเดือนเมษายน พ.ศ. 2566 ว่า
- เทศกาลสงกรานต์กลับมาฮีลใจคนไทยได้อีกครั้ง คนกรุงเทพฯและภาคกลางทำ New High ต้องการใช้จ่ายสูง คนกรุงเทพฯ เน้นกินดื่ม เที่ยวในประเทศ และกิจกรรมนอกบ้าน พร้อมอัพลุคด้วย สินค้ากลุ่ม beauty เพื่อเสริมภาพลักษณ์ให้กับตนเองช่วงเทศกาลปีใหม่ไทย สำหรับคนภาคกลาง หลายจังหวัดมีแนวโน้มร้อนสุดในไทย จึงเน้นใช้จ่ายสิ่งของเพื่อดับร้อน เช่น เครื่องใช้ในบ้าน รวมถึงทริปเที่ยวคลายร้อนสำหรับตนเองและครอบครัว
- “เมื่อเทียบกับปีที่แล้ว ในปีนี้คุณอยากใช้ชีวิตอย่างไร” คำถามพิเศษของผลสำรวจประจำเดือนเมษายน คนไทยเกือบ 60% ต้องการเริ่มต้นใหม่หรืออยากเปลี่ยนแปลงให้ชีวิตมีแต่สิ่งใหม่ๆ ซึ่งมีจุดที่น่าสนใจคือความแตกต่างระหว่างเพศชายและหญิงในคำถามปลายเปิด สำหรับเพศหญิง ต้องการเริ่มจากสิ่งที่ตัวเองทำได้ในปัจจุบันมุ่งเน้นเรื่องจิตใจและเรื่องใกล้ตัว ในขณะที่เพศชายจะโฟกัสกับการทำงานเพื่อรายได้ที่มั่นคง หรือมีความคาดหวังเรื่องของการเปลี่ยนแปลงในระดับประเทศ
- ค่าความสุขลดลง (-2%) สวนทางกับแนวโน้มความต้องการใช้จ่ายที่สูงขึ้น เมื่อเทียบกับผลสำรวจเดือนกุมภาพันธ์ พ.ศ. 2566 ที่ผ่านมา ค่าความสุขของคนไทยลดลง (-2%) ด้วยปัญหารอบด้านที่รบกวนจิตใจ ไม่ว่าจะเป็นเรื่องของอากาศร้อนทะลุปรอท ปัญหามลพิษจากการเผาไฟ รวมไปถึงพิษของฝุ่น PM 2.5 ทำให้คนไทยหลายคนไม่ว่าจะเด็ก ผู้ใหญ่ หรือคนชรา ต้องประสบปัญหาเรื่องทางด้านสุขภาพไม่น้อย
โรงพยาบาลเจริญกรุงประชารักษ์ เปิดฉีดวัคซีน COVID-19 LINK
โรงพยาบาลเจริญกรุงประชารักษ์ ????
เปิดฉีดวัคซีน COVID-19
วัคซีนไฟเซอร์ (Pfizer) อายุ 12 ปี ขึ้นไป
วันจันทร์ - วันศุกร์ เวลา 09.00 - 14.30 น.
(พักเที่ยง เวลา 12.00 - 13.00 น.)
คลินิกวัคซีนโควิด ห้องหัตถการ ชั้น 2 อาคาร 72 พรรษา มหาราชินี โรงพยาบาลเจริญกรุงประชารักษ์
เตรียมหลักฐานดังนี้
1. บัตรประจำตัวประชาชน
2. หนังสือเดินทาง หรือบัตสีชมพู
3. ประวัติการฉีดวัคซีน
สอบถามเพิ่มเติ่มได้ที่ ศูนย์ BFC 0 2289 7986
เงื่อนไขการฉีด
• ฉีดเข็ม 2 ห่างจากเข็มที่ 1 ระยะเวลา 1 - 2 เดือน
• ฉีดเข็ม 3 ห่างจากเข็มที่ 2 ระยะเวลา 3 เดือน
• ฉีดเข็ม 4 ห่างจากเข็มที่ 3 ระยะเวลา 4 เดือน
• ฉีดเข็ม 5 ห่างจากเข็มที่ 4 ระยะเวลา 4 เดือน
• กรณีผู้ติดเชื้อโควิด 19 แนะนำให้ฉีดวัคซีนหลังจากการติดเชื้อ เป็นเวลา 3 เดือน
สอบถามโทร. 02-2897000 หรือ 0 2289 7986 (BFC)
ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ.2565
ศูนย์การแพทย์บูรณาการแอ็บโซลูทเฮลธ์
ศูนย์การแพทย์บูรณาการแอ็บโซลูทเฮลธ์ รับคำปรึกษาและบริการเพื่อสุขภาพ ออฟฟิศซินโครมดูแลทุกปัญหาอาการปวดและปัญหาออฟฟิศซินโครม พร้อมรับคำปรึกษาด้วยการรักษาแบบไม่ผ่าตัด ฟรี! ลดปวดคอ ปวดไหล่ ปวดหลัง ปวดเอว ด้วยคลื่นแม่เหล็กไฟฟ้า ฟรี! โปรแกรมตรวจสุขภาพ และทรีทเมนท์ในราคาสบายกระเป๋า
จะพบอะไรในงาน Money Expo 2023
- กลต นำเสนอกิจกรรมและความรู้ที่น่าสนใจมากมายภายในบูธ พิเศษ ผู้ที่เข้าชมบูธและร่วมกิจกรรม จะได้รับของที่ระลึกพิเศษสำหรับงาน Money Expo 2023 เท่านั้น
- โปรสุดคุ้ม จากบูธ บสย. มากมาย อาทิ Start up โครงการค้ำประกันสินเชื่อ PGS10 เพื่อนักศึกษาจบใหม่ อาชีพอิสระ - Small Biz โครงการค้ำประกันสินเชื่อ PGS10 เพื่อพ่อค้า แม่ขาย ร้านค้ารายย่อย และอาชีพอิสระ - Smart One โครงการค้ำประกันสินเชื่อ PGS10 สำหรับบุคคลธรรมดา - Smart Biz โครงการค้ำประกันสินเชื่อ SMEs ขนาดกลางและเล็ก #พิเศษ ฟรี ค่าดำเนินการค้ำประกัน เฉพาะผู้ลงทะเบียนที่บูธ บสย. ภายในงาน
- ซื้อประกันคุ้ม 2 ต่อ ที่บูธ TQM ที่ #งานมหกรรมการเงินกรุงเทพ2023 . พบโปรโมชั่นพิเศษเฉพาะงานนี้เท่านั้น ต่อที่ 1 ซื้อประกันประเภทใดก็ได้ครบ 5,000 บาท รับฟรี กระเป๋าถือ ต่อที่ 2 รับฟรี ประกันอุบัติเหตุ คุ้มครองสูงสุด 100,000 บาท
- โปรสุดคุ้ม จากบูธ UOB พร้อมสินเชื่อเด็ดๆ ได้แก่ สินเชื่อกู้ซื้อบ้านใหม่ สินเชื่อกู้ซื้อบ้านมือสอง รีไฟแนนซ์บ้าน สินเชื่อบ้านอเนกประสงค์ (Cash to Home) สินเชื่อทะเบียนรถยนต์ UOB SME Smart Choice
- ตรวจเครดิตบูโร ฟรี ผ่านตู้ตรวจเครดิตบูโรด้วยตนเอง พร้อมรับรายงานรูปแบบอิเล็กทรอนิกส์ (NCB e-Credit Reports) ทางอีเมลได้ทันที
- เอกสิทธิ์เหนือระดับมาก่อนใคร ฉีกทุกกฎแห่งการช้อปกับ Power Mall X Money Expo ช้อปก่อน คุ้มกว่า ลดสูงสุด 40% ‼ พร้อมสิทธิพิเศษกว่าที่เคยมี มาให้คุณช้อปสนุกสุดเหวี่ยงยิ่งกว่าใคร
- โปรสุดคุ้ม จากบูธ โรงรับจำนำอีซี่มันนี่ สถาบันสินเชื่อทางเลือก บริการสินเชื่อผ่านการจำนำทรัพย์มีค่า ไม่เช็กเครดิต ไม่ต้องมีคนค้ำ ใช้บัตรประชาชนใบเดียว พร้อมรับเงินสดกลับไปทันที และบริการสินค้ามือสองคุณภาพดี ราคาเหมาะสม
- โปรสุดคุ้ม จากบูธ SMEDBANK ยกทัพ เติมทุนคู้ความรู้ ติดเครื่อง SMs แนะนำสินค้าเพื่อ SME - สินเชื่อ BCG LOAN สินเชื่อ SME D พร้อม สินเชื่อ SME SPEED UP
- โปรสุดคุ้ม จาก SuperTraderRepublic สถาบันสอนการลงทุนอันดับ 1 ที่เป็นแหล่งการเรียนรู้ด้านการลงทุนที่ครอบคลุมทุกสินค้า รวมถึงเป็นพื้นที่สอนการลงทุนรูปแบบใหม่แห่งแรกที่สามารถรองรับการเรียนการสอนได้ทั้งสองรูปแบบ ทั้งการเรียนแบบ ONLINE และ OFFLINE อีกทั้งยังเป็นสถาบันที่สร้างสังคมนักลงทุนที่ใหญ่ที่สุดในประเทศไทย
- สินเชื่อสุดคุ้ม ที่บูธ ไมโครลิสซิ่ง อนุมัติง่าย ผ่อนสบาย ได้เงินเยอะ กับสินเชื่อคุ้ม 3 ต่อ ต่อที่ 1 ลงทะเบียนในงาน ฟรี! ค่าจัดสัญญา ต่อที่ 2 รับส่วนลดดอกเบี้ยพิเศษทันที! ต่อที่ 3 รับส่วนลดค่าเบี้ยประกันภัยทันที 10% และผ่อน 0%
- โปรโมชั่นเริ่ดสุดของบูธ ทิพยประกันภัย ช้อปประกันภัยที่ลงตัวกับทุกไลฟ์สไตล์พร้อมรับข้อเสนอสุดพิเศษเฉพาะงานนี้เท่านั้น - ลดเบี้ยประกันภัยสูงสุด 23% - เลือกของสมมนาคุณ รวมมูลค่ากว่า 300,000 บาท - ลุ้นชินที่พักเกาะสมุย รวมมูลค่ากว่า 60,000 บาท
- โปรปังๆ จากบูธ ไพร์มโซนบ้าน ทาวน์โฮม คอนโด ที่ดิน #ราคาพิเศษ - ผ่อนชำระดอกเบี้ย 0% นานสูงสุด 9 เดือน ลงทะเบียนรับเลย ส่วนลดสูงสุด 30,000 บาท
โรงพยาบาลตากสิน ร่วมกับ ICONSIAM และ ICS เปิดหน่วยบริการฉีดวัคซีนโควิด-19 แบบ Walk in
ICONSIAM และ ICS ร่วมกับกรุงเทพมหานคร โดยโรงพยาบาลตากสิน เปิดหน่วยบริการฉีดวัคซีนโควิด-19 แบบ Walk in ที่ ICS ชั้น 3 (ตรงข้ามไอคอนสยาม) ให้บริการฉีดวัคซีน Moderna (Bivalent) เข็มกระตุ้นตั้งแต่เข็มที่ 3 เป็นต้นไป รองรับ 2 สายพันธุ์ ฟรี! (ไม่มีค่าใช้จ่าย)
ตั้งแต่วันจันทร์ - อาทิตย์ ในระหว่างวันที่ 1 - 12 พ.ค. 2566
และให้บริการทุกวันเสาร์และอาทิตย์ ที่ 20-21 และ 27-28 พ.ค. 2566
เวลา 10:00-14:00 น. (รับคิวสุดท้าย 13:30 น.)
สิ่งที่ต้องเตรียมมา
คนไทย : บัตรประจำตัวประชาชนตัวจริงเท่านั้น
คนต่างชาติพำนัก หรือทำงานในประเทศไทย : พาสปอร์ต (Passport) ตัวจริง หรือ บัตรสีชมพู
หมายเหตุ ‼️
- กรณีเคยติดเชื้อ COVID-19 อย่างน้อย 3 เดือน หรือ ได้รับวัคซีนเข็มสุดท้ายอย่างน้อย 3 เดือน
- หรับนักท่องเที่ยวชาวต่างชาติ ให้บริการโดยมีค่าใช้จ่าย 380 บาท
ติดต่อสอบถามข้อมูลเพิ่มเติม
โรงพยาบาลตากสิน โทร 02-4370123 ต่อ 1115, 1169, 1220
หรือ ไอซีเอส โทร 1338
การถอดรหัสพันธุกรรมโควิด-19 จีโนมในประเทศไทย
จากการถอดรหัสพันธุกรรมโควิด-19 ทั้งจีโนมในประเทศไทย ระหว่างวันที่ 15 มีนาคม-29 เมษายน 2566 และอัปโหลดขึ้นบนฐานข้อมูลโควิดโลก จีเสส (GISAID) พบการระบาดของโอไมครอนสายพันธุ์ลูกผสม XBB 3 สายพันธุ์ย่อย คือ XBB.1.5, XBB.1.16 และ XBB.1.9.1 คิดเป็นร้อยละ 23, 16 และ 19 โดยพบการระบาดของ XBB.1.X คิดเป็นร้อยละ 80 ของโควิดทุกสายพันธุ์ที่ระบาดภายในประเทศ
โครงการ KEN by MEA การไฟฟ้านครหลวง LINK
KEN หรือ Key Energy Now by MEA
งานบริการธุรกิจเกี่ยวเนื่องของ MEA โดยทีมที่ปรึกษาที่มีความเชี่ยวชาญ และมีความเป็นมืออาชีพด้านธุรกิจไฟฟ้า เพื่อรองรับความต้องการของผู้ใช้ไฟฟ้าได้ครอบคลุม 4 บริการธุรกิจเกี่ยวเนื่องดังนี้
- ออกแบบติดตั้งระบบไฟฟ้า EPC (Engineering Procurement and Construction )
- บำรุงรักษาระบบไฟฟ้า PM (Preventive Maintenance)
- ติดตั้งโซลาร์เซลล์ (Solar Cell)
- ธุรกิจบริการเกี่ยวกับ EV (EV Charger)
โดยมุ่งเน้นการบริการและการบริหารลูกค้าที่เป็นเลิศ เน้นเรื่องความปลอดภัย บริการที่รวดเร็ว เข้าใจความต้องการของผู้ใช้ไฟฟ้า ทั้งด้านที่อยู่อาศัย อุตสาหกรรม พาณิชยกรรม และสอดรับกับชีวิตความเป็นอยู่ของเมืองมหานครสู่อนาคตอย่างยั่งยืน ด้วยบริการที่มีคุณภาพ สะดวก รวดเร็ว เข้าถึงง่าย standby 24 ชั่วโมง
ออกแบบติดตั้งระบบไฟฟ้า EPC
บริการออกแบบติดตั้งระบบไฟฟ้า EPC (Engineering Procurement and Construction) สำหรับการให้บริการออกแบบติดตั้งระบบไฟฟ้า ทั้งแรงดันต่ำ แรงดันกลาง และแรงดันสูง ครอบคลุมตั้งแต่บ้านพักอาศัยไปจนถึงโรงงานอุตสาหกรรมในทุกขนาด ให้บริการตั้งแต่การขอใช้ไฟใหม่ ออกแบบระบบไฟฟ้าทั้งหมด เดินสายทั้งภายในอาคารรวมถึงระบบไฟฟ้าใต้ดินของโครงการต่าง ๆ ไปจนถึงการให้บริการติดตั้งหม้อแปลง และก่อสร้างสถานีไฟฟ้าย่อยด้วยความเป็นมืออาชีพ สะดวก รวดเร็ว และปลอดภัย
บำรุงรักษาระบบไฟฟ้า PM
บริการบำรุงรักษาระบบไฟฟ้า PM (Preventive Maintenance) ให้บริการตรวจสอบบำรุงรักษาระบบไฟฟ้าในเชิงป้องกัน ซึ่งเป็นการตรวจสอบก่อนที่จะเกิดปัญหา เพื่อลดความเสียหายแบบทันทีทันใดของอุปกรณ์ไฟฟ้ารวมถึงคาดการณ์ความเสียหายของอุปกรณ์ไฟฟ้าที่จะเกิดขึ้นในอนาคต โดยให้บริการตรวจสอบครอบคลุมอุปกรณ์ที่เกี่ยวข้องกับไฟฟ้าทั้งหมดแม้ในจุดที่มองไม่เห็นด้วยตาเปล่า ผ่านเครื่องมือ Thermoscan เพื่อให้ระบบไฟฟ้าปลอดภัย
ติดตั้งโซลาร์เซลล์ (Solar Cell)
บริการติดตั้งโซลาร์เซลล์ (Solar Cell) ให้บริการติดตั้งโซลาร์เซลล์ ด้วยความเป็นมืออาชีพ เพื่อให้การผลิตไฟฟ้าทำงานได้เต็มประสิทธิภาพ ซึ่งเป็นปัจจัยสำคัญต่อความคุ้มค่า และส่งผลต่อความปลอดภัย ให้บริการติดตั้งโซลาร์เซลล์ในทุกขนาด ตั้งแต่ใช้ทั่วไปในบ้านพักอาศัย โรงงานอุตสาหกรรม ไปจนถึงการทำโซลาร์ฟาร์ม พร้อมให้บริการตั้งแต่การออกแบบระบบ คำนวณขนาดที่เหมาะสม ประเมินมุมแสงตกกระทบรวมถึงการป้องกันน้ำรั่วซึมจากหลังคาที่ติดตั้งแผง และที่สำคัญคือการติดตั้งให้สามารถบำรุงรักษาและทำความสะอาดได้ง่าย พิเศษสำหรับลูกค้าใช้บริการช่วงนี้มีโปรโมชันโดยมีโปรโมชันรับประกันผลการติดตั้ง และบำรุงรักษา เป็นเวลา 2 ปี แผงโซลาร์เซลล์คุณภาพสูง รับประกันคุณภาพแผง 12 ปี ประกันประสิทธิภาพ 25 ปี มั่นใจด้วย Inverter ที่ผ่านการรับรองจาก MEA ผู้ผลิตรับประกัน Inverter 12 ปี ฟรีค่าสำรวจ ออกแบบ ติดตั้ง และขออนุญาต หลังการติดตั้งรับสิทธิ์ตรวจสอบสุขภาพไฟฟ้าภายในบ้าน 2 ปี
ธุรกิจบริการเกี่ยวกับ EV (EV Charger)
ธุรกิจบริการเกี่ยวกับ EV (EV Charger) ให้บริการติดตั้งเครื่องชาร์จรถไฟฟ้า EV ทั้งในบ้านพักอาศัย จนถึงการติดตั้งสถานีชาร์จขนาดใหญ่ ทำงานบนความเป็นมืออาชีพ และให้ความสำคัญในเรื่องความปลอดภัย ให้บริการเดินสายเมนใหม่ เพื่อรองรับการใช้ไฟฟ้าสำหรับชาร์จจถ EV ที่เพิ่มสูงขึ้นโดยไม่กระทบกับระบบไฟฟ้าเดิม พร้อมติดตั้งอุปกรณ์ป้องกันไฟรั่วใน Spec สูงสุด พร้อมระบบสายดินเฉพาะ EV ตรวจสอบติดตั้งด้วยเครื่องทดสอบที่ทันสมัย เพื่อให้ได้รับความปลอดภัยในการใช้งาน
การดูแลสุขภาพทางไกล - โรงพยาบาลเสมือน ชุมชนการดูแลสุขภาพ และ Telehealth (Remote Healthcare - Virtual Hospitals, Healthcare Communities, and Telehealth)
การดูแลสุขภาพที่จัดส่งทางไกลเพิ่มขึ้นอย่างมากในช่วงที่เกิดโรคระบาด แม้ว่าโดยทั่วไปแล้ว การกลับมานัดหมายตามปกติแบบตัวต่อตัวตามปกติจะปลอดภัย แต่ผู้ป่วยและผู้ให้บริการจำนวนมากก็ตระหนักดีว่าในหลายๆ เงื่อนไข การดูแลสามารถให้บริการได้อย่างมีประสิทธิภาพและคุ้มค่ามากขึ้นเมื่ออยู่ห่างๆ
การดูแลสุขภาพทางไกลแบ่งออกเป็นหลายประเภท การดูแลที่บ้านเพิ่มขึ้นจากหลักฐานที่แสดงให้เห็นว่าสภาพแวดล้อมที่คุ้นเคยและความใกล้ชิดกับครอบครัวสามารถส่งผลในเชิงบวกต่อผลลัพธ์ของผู้ป่วย รวมทั้งประหยัดต้นทุนอย่างมากเมื่อเทียบกับการดูแลผู้ป่วยใน จากนั้นมีการแพทย์ทางไกลซึ่งครอบคลุมทุกอย่างตั้งแต่การโทรหาแพทย์ผ่านวิดีโอแทนการเยี่ยมชมการผ่าตัด ไปจนถึงการผ่าตัดทางไกล โดยศัลยแพทย์จะทำการผ่าตัดผู้ป่วยในสถานที่ห่างไกลโดยใช้เทคโนโลยีหุ่นยนต์ รูปแบบการรักษาพยาบาลทางไกลอีกรูปแบบหนึ่งคือหอผู้ป่วยในโรงพยาบาลเสมือน ซึ่งเกี่ยวข้องกับผู้ปฏิบัติงานในสถานที่ส่วนกลางที่ให้การดูแลผู้ป่วยทางไกลจำนวนมาก ซึ่งมักมีเงื่อนไขที่เกี่ยวข้องกัน ความคิดริเริ่มอีกประการหนึ่งเกี่ยวข้องกับการช่วยให้ผู้ป่วยสามารถทำตามขั้นตอนที่เกี่ยวข้องกับความเจ็บป่วยและการรักษาที่บ้านได้มากขึ้นก่อนที่จะเข้ารับการรักษาในโรงพยาบาล ตัวอย่างเช่น ในสหราชอาณาจักร มีการวางแผนว่าจะเปิดตัวในปี 2566 สำหรับผู้ป่วยทุกรายที่ต้องพักรักษาตัวในโรงพยาบาลเพื่อรับการผ่าตัด
นอกจากนี้ยังมีความเข้าใจที่เพิ่มขึ้นเกี่ยวกับความสำคัญของชุมชนออนไลน์ ซึ่งอาจเป็นผู้นำของผู้ป่วยมากกว่านำโดยผู้ประกอบวิชาชีพ หรืออาจดำเนินการโดยองค์กรการกุศลที่เชื่อมโยงกับสภาวะสุขภาพเฉพาะ ซึ่งผู้ใช้สามารถมารวมกันเพื่อแบ่งปันความช่วยเหลือและคำแนะนำที่เกี่ยวข้องกับ การรักษาและการฟื้นตัวของพวกเขา ตัวอย่างของสิ่งเหล่านี้ ได้แก่ ผู้ป่วยอย่างฉัน ความคิดเห็นของการดูแล และ cancer.org
ด้วยค่าใช้จ่ายในการให้บริการด้านการรักษาพยาบาลแบบตัวต่อตัวที่เพิ่มขึ้นอย่างต่อเนื่อง และการขาดแคลนผู้ประกอบวิชาชีพทางการแพทย์อย่างต่อเนื่องในหลายประเทศ จึงเป็นการเดิมพันที่ปลอดภัยว่าการรักษาพยาบาลทางไกลทุกประเภทจะมีแนวโน้มเพิ่มขึ้นในปี 2566
ปัญญาประดิษฐ์ (Artificial intelligence - AI)
การใช้อัลกอริธึมและแมชชีนเลิร์นนิงในการตรวจจับ วินิจฉัย และรักษาโรคได้กลายเป็นเครื่องมือสำคัญของการศึกษาด้านชีววิทยาศาสตร์ไปแล้ว
หลายคนเชื่อว่า การนำเอาปัญญาประดิษฐ์มาใช้ จะเป็นการปฏิวัติด้านการดูแลสุขภาพครั้งใหญ่ที่สุดในศตวรรษที่ 21
AI สามารถช่วยให้ตรวจพบโรคได้ตั้งแต่เนิ่นๆ ทำการวินิจฉัยได้แม่นยำกว่าวิธีการทั่วไป ในมะเร็งเต้านม AI ช่วยให้สามารถตรวจแมมโมแกรมได้เร็วขึ้น 30 เท่าโดยมีความแม่นยำเกือบ 100% ช่วยลดความจำเป็นในการตรวจชิ้นเนื้อ
บริษัทเทคโนโลยีด้านสุขภาพบางแห่ง เร่งพัฒนาอัลกอริธึมการเรียนรู้เชิงลึกที่จะใช้ตรวจหามะเร็งปอดในระยะเริ่มต้น ผลการทดสอบด้วยการใช้ AI ตีความผลเอ็กซ์เรย์ทรวงอก พบว่าให้ผลลัพธ์ที่แม่นยำกว่า การใช้การอ่านค่ารังสีวิทยาแบบทั่วไป ถึง 17% ขณะที่บริษัทระดับโลกบางแห่ง นำเอา AI มาใช้เพื่อลดอัตราการเสียชีวิตจากมะเร็งปอดทั่วโลก เป็นต้น
วัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ โรงพยาบาลหริภุญชัย เมโมเรียล LINK
เชิญชวนผู้ประกันตน รพ.หริภุญชัยฯ อายุตั้งแต่ 50 ปีขึ้นไป รับบริการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ 4 สายพันธุ์ ไม่มีค่าใช้จ่าย สำหรับผู้ประกันตน ม.33 และ ม.39 ขยายเวลาถึง 31 ธันวาคม 2565
กรณีผู้ประกันตนโรงพยาบาลอื่นสามารถโทรติดต่อเบอร์ โทร. 02-9562500 เพื่อขอรับ Code ก่อนเข้ารับบริการฉีด ณ รพ.หริภุญชัยฯ
ติดต่อสอบถามหรือนัดหมายได้ที่ รพ.หริภุญชัย ราม แผนก Supra ชั้น 2 โทร.053-581111 ต่อ 2403
สุขขะฤดาลัย สถานฌาปนกิจสัตว์เลี้ยง วัดคลองเตยใน
สุขขะฤดาลัย สถานฌาปนกิจสัตว์เลี้ยง วัดคลองเตยใน บริการเผาสัตว์เลี้ยง ทำพิธีนิมนต์พระสวด (มีบริการรับส่ง) มีพนักงานช่วยดำเนินการงานพิธี การเผา และการลอยอังคาร ติดต่อได้ตลอด 24 ชั่วโมง ช่วงเวลาทำการปกติ 8-20 น. สามารถเข้ามาติดต่อได้เลยไม่ต้องแจ้งล่วงหน้าก็ได้ แต่หากเกินเวลา ต้องโทรแจ้งเวลาที่จะเข้ามาเพื่อเตรียมการและดำเนินการต่างๆ
ทางวัดมีบริการรับส่งสัตว์เลี้ยง 24 ชั่วโมง ติดต่อ โทร. 02-2493364 090-8057119
แผนที่ google map -
facebook
ค่าใช้จ่ายในการเผาสัตว์เลี้ยง
1. ค่าน้ำมันบำรุงเตา
น้ำหนักไม่เกิน 20 กิโลกรัม 1500 บาท
น้ำหนัก 20 กิโลกรัมขึ้นไป 2000 บาท
2. ค่ารถรับส่ง 500 บาท ถ้าเจ้าของไม่สะดวกนำสัตว์เลี้ยงมาเองทางวัดมี
รถรับส่งสามารถรับได้ ทั้งในกรงเทพและปริมณฑล
3. ทำพิธีและนิมนต์พระสวด แล้วแต่จิตศรัทธา (จะทำพิธีสวดหรือไม่แล้วแต่เจ้าของ)
4. พนักงาน 2 คน แล้วแต่เจ้าของจะให้
5. ลอยอังคาร 300 บาท แล้วแต่เจ้าของ
*ภาพจากเพจสุขขะฤดาลัย
คลินิกแผนไทย
อาคารแพทย์แผนไทย ด้านทิศตะวันตกของโรงพยาบาล โทร. 044-615002 ต่อ 2105
คลินิกบริการแม่และเด็ก
ฝากครรภ์รายใหม่รับทุกวัน เวลา 08:00-14.00 น. อาคารแม่และเด็ก คลินิกฝากครรภ์ / วางแผนครอบครัว เบอร์โทรติดต่อ 044 – 615002 ต่อ 2106 / 2107 อาคาร 4 ข้างห้องคลอด คลินิกเวชศาสตร์มารดาและทารกในครรภ์ เบอร์โทรติดต่อ 044 – 615002 ต่อ 2214
เริ่มต้นโครงการรับบริจาคตั้งแต่ 25 ธันวาคม 2565
จุดเด่นของ “St.Carlos RECC” คือการใส่ใจในสภาพแวดล้อม - พญ.อัญชุลี หยองอนุกูล


ด้าน พญ.อัญชุลี หยองอนุกูล ผู้อำนวยการ โรงพยาบาลกรุงสยามเซนต์คาร์ลอส กล่าวเสริมว่า จุดเด่นของ “St.Carlos RECC” คือการใส่ใจในสภาพแวดล้อมที่พร้อมในการดูแลกลุ่มผู้ป่วยที่ต้องได้รับการฟื้นฟูสุขภาพร่างกายในโรงพยาบาลเป็นระยะเวลานาน โดยเราให้ความสำคัญกับการเตรียมองค์ประกอบในการดูแลผู้ป่วยทุกมิติทั้งกาย ใจ สังคม สิ่งแวดล้อม และความพร้อมด้านบุคลากรทีมแพทย์ โปรแกรมการดูแลผู้ป่วยที่ออกแบบเฉพาะบุคคล รวมไปถึงการมอบความไว้วางใจความสบายใจแก่ครอบครัวของผู้ป่วย เนื่องจากศูนย์ฯ ของเรามีห้องให้คำปรึกษาตรวจประเมินแรกรับโดยแพทย์ เพื่อให้คำแนะนำที่ถูกต้องตามหลักฐานทางการแพทย์กับทั้งผู้ป่วยและญาติ ตลอดจนการออกแบบโปรแกรมการดูแลผู้ป่วยเฉพาะบุคคลแบบองค์รวม เพื่อสุขภาวะที่ดีของผู้ป่วย ทั้งบริการกายภาพบำบัด แพทย์เยี่ยมเพื่อให้คำปรึกษา เจ้าหน้าที่ดูแลตลอด 24 ชั่วโมง อาหาร 3 มื้อ ดูแลอาหารโดยนักโภชนาการ บริการให้ยาโดยคำสั่งแพทย์ และแนะนำการใช้ยาโดยเภสัชกร ดูแลสุขอนามัยเบื้องต้น เช่น สระผม โกนหนวด ตัดผม ตัดเล็บ บริการชุดเสื้อผ้าของโรงพยาบาล ซัก อบ รีด มีห้องสันทนาการสำหรับทำกิจกรรมต่าง ๆ เพื่อให้ผู้ป่วยได้ผ่อนคลายไม่รู้สึกโดดเดี่ยว รวมถึงการอัพเดทอาการคนไข้รายวัน ผ่านไลน์ OA ข้อมูลเฉพาะบุคคล เพื่อคงไว้ถึงสายใยครอบครัว ด้วยแพ็กเกจห้องพักหลากหลายรูปแบบที่ตอบโจทย์ตามความต้องการของผู้ป่วยและญาติ
กรุงเทพมหานคร 33 เขต@16 พฤษภาคม 16.00 น.
เขต 1 เขตพระนคร เขตป้อมปราบศัตรูพ่าย เขตสัมพันธวงศ์ เขตดุสิต (ยกเว้นแขวงถนนนครไชยศรี) เขตบางรัก -- ก้าวไกล นายปารเมศ วิทยารักษ์ 28,500
เขต 2 เขตสาทร เขตปทุมวัน เขตราชเทวี -- ก้าวไกล นางสาวธิษะณา ชุณหะวัณ 27,055
เขต 3 เขตบางคอแหลม เขตยานนาวา -- ก้าวไกล นายจรยุทธ จตุรพรประสิทธิ์ 33,431
เขต 4 เขตคลองเตย เขตวัฒนา -- ก้าวไกล นายภัณฑิล น่วมเจิม 30,891
เขต 5 เขตห้วยขวาง เขตวังทองหลาง (ยกเว้นแขวงคลองเจ้าคุณสิงห์) -- ก้าวไกล นายเฉลิมชัย กุลาเลิศ 23,724
เขต 6 เขตพญาไท เขตดินแดง -- ก้าวไกล นายกัณตภณ ดวงอัมพร 15,377
เขต 7 เขตบางซื่อ เขตดุสิต (เฉพาะแขวงถนนนครไชยศรี) -- ก้าวไกล นางสาวภัสริน รามวงศ์ นางสาวภัสริน รามวงศ์ 10,371
เขต 8 เขตหลักสี่ (ยกเว้นแขวงตลาดบางเขน) เขตจตุจักร (ยกเว้นแขวงจันทรเกษม และแขวงเสนานิคม) -- ก้าวไกล นายชยพล สท้อนดี
นายชยพล สท้อนดี 13,860
เขต 9 เขตบางเขน (ยกเว้นแขวงท่าแร้ง) เขตจตุจักร (เฉพาะแขวงจันทรเกษม และแขวงเสนานิคม) เขตหลักสี่ -- ก้าวไกล นายศุภณัฐ มีนชัยนันท์ 27,558
เขต 10 เขตดอนเมือง
เขต 11 เขตสายไหม (ยกเว้นแขวงออเงิน) -- ก้าวไกล นางสาวศศินันท์ ธรรมนิฐิ 36,283
เขต 12 เขตสายไหม (เฉพาะแขวงออเงิน) เขตบางเขน (เฉพาะแขวงท่าแร้ง) เขตลาดพร้าว (เฉพาะแขวงจรเข้บัว) -- ก้าวไกล นายภูริวรรธก์ ใจสำราญ 33,215
เขต 13 เขตลาดพร้าว (ยกเว้นแขวงจรเข้บัว) เขตบึงกุ่ม (ยกเว้นแขวงคลองกุ่ม) -- ก้าวไกล เรือโทธนเดช เพ็งสุข 36,834
เขต 14 เขตวังทองหลาง (เฉพาะแขวงคลองเจ้าคุณสิงห์) เขตบางกะปิ -- ก้าวไกล นางสาวสิริลภัส กองตระก 39,145
เขต 15 เขตคันนายาว เขตบึงกุ่ม -- ก้าวไกล นายวิทวัส ติชะวาณิชย์ 27,910
เขต 16 เขตคลองสามวา (ยกเว้นแขวงสามวาตะวันออก และแขวงทรายกองดินใต้) -- ก้าวไกล นางสาวพิมพ์กาญจน์ กีรติ 11,329
เขต 17 เขตหนองจอก (ยกเว้นแข วงโคกแฝด แขวงลำผักชี และแขวงลำ ต้อยติ่ง) เขตคลองสามวา (เฉพาะแขวงสามวาตะวันออก และแขวงทรายกองดินใต้) -- ก้าวไกล นายวีรวุธ รักเที่ยง 19,107
เขต 18 เขตหนองจอก (เฉพาะแขวงโคกแฝด และแขวงลำต้อยติ่ง) เขตลาดกระบัง (เฉพาะแขวงลำปลาทิว) เขตมีนบุรี (เฉพาะแขวงแสนแสบ) -- ก้าวไกล นายธีรัจชัย พันธุมาศ 26,986
เขต 19 เขตมีนบุรี (ยกเว้นแขวงแสนแสบ) เขตสะพานสูง (ยกเว้นแขวงทับช้าง) -- ก้าวไกล นายกันต์พงษ์ ประยูรศักดิ์ 33,944
เขต 20 เขตลาดกระบัง (ยกเว้นแขวงลำปลาทิว) -- เพื่อไทย นางสาวธีรรัตน์ สำเร็จวาณิชย์ 34,749
เขต 21 เขตประเวศ (ยกเว้นแขวงหนองบอน) เขตสะพานสูง (เฉพาะแขวงทับช้าง) -- ก้าวไกล นายณัฐพงศ์ เปรมพูลสวั 38,218
เขต 22 เขตสวนหลวง เขตประเวศ (เฉพาะแขวงหนองบอน) -- ก้าวไกล นายสุภกร ตันติไพบูลย์ธนะ 34,285
เขต 23 เขตพระโขนง เขตบางนา -- ก้าวไกล นายปิยรัฐ จงเทพ 24,495
เขต 24 เขตธนบุรี (ยกเว้นแขวงวัดกัลป์ยาณ์ แขวงหิรัญรูจี และแขวงบางยี่เรือ) เขตคลองสาน เขตราษฎร์บูรณะ (เฉพาะแขวงบางปะกอก) -- ก้าวไกล นายเท่าพิภพ ลิ้มจิตรกร 45,739
เขต 25 เขตทุ่งครุ เขตราษฎร์บูรณะ (ยกเว้นแขวงบางปะกอก) -- ก้าวไกล นางสาวแอนศิริ วลัยกนก 26,909
เขต 26 เขตบางขุนเทียน (เฉพาะแขวงท่าข้าม) เขตจอมทอง (ยกเว้นแขวงบางขุนเทียน) -- ก้าวไกล นายไชยามพวาน มั่นเพียรจิตต์ 33,751
เขต 27 เขตบางบอน (เฉพาะแขวงบางบอนใต้ และแขวงคลองบางบอน) เขตบางขุนเทียน (ยกเว้นแขวงท่าข้าม) -- ก้าวไกล นายณัฐชา บุญไชยอินสวัสดิ์ 27,104
เขต 28 เขตจอมทอง (เฉพาะแขวงบางขุนเทียน) เขตบางบอน (ยกเว้นแขวงบางบอนใต้ และแขวงคลองบางบอน) เขตหนองแขม (เฉพาะแขวงหนองแขม) -- ก้าวไกล นางสาวรักชนก ศรีนอก 44,686
เขต 29 เขตบางแค (เฉพาะแขวงบางแคเหนือ และแขวงบางไผ่) เขตหนองแขม (ยกเว้นแขวงหนองแขม) -- ก้าวไกล นางสาวทิสรัตน์ เลาหพล 24,685
เขต 30 เขตบางแค (ยกเว้นแขวงบางแคเหนือ และแขวงบางไผ่) เขตภาษีเจริญ (เฉพาะแขวงบางหว้า แขวงบางด้วน และแขวงคลองขวาง) -- ก้าวไกล นายธัญธร ธนินวัฒนาธร 29,682
เขต 31 เขตทวีวัฒนา เขตตลิ่งชัน (ยกเว้นแขวงบางเชือกหนัง) -- ก้าวไกล นายสิริน สงวนสิน 46,152
เขต 32 เขตบางกอกน้อย (เฉพาะแขวงศิริราช) เขตบางกอกใหญ่ เขตภาษีเจริญ (ยกเว้นแขวงบางหว้า แขวงบางด้วน และแขวงคลองขวาง) เขตตลิ่งชัน (เฉพาะแขวงบางเชือกหนัง) เขตธนบุรี (เฉพาะแขวงวัดกัลป์ยาณ์ แขวงหิรัญรูจี และแขวงบางยี่เรือ) -- ก้าวไกล นางสาวปวิตรา จิตตกิจ 31,131
เขต 33 เขตบางพลัด เขตบางกอกน้อย (ยกเว้นแขวงศิริราช) -- ก้าวไกล นายพงศ์พันธ์ ยอดเมืองเจริญ 22,099
งานสำนักงาน ออฟฟิศ ทั่วไป ไม่ใช่ด้านการแพทย์ LINK
เปิดรับสมัครฝึกงาน ตำแหน่งพนักงานผู้ช่วยดูแลผู้ป่วย
เลขานุการ ฝ่ายบริหาร (ด่วน)
ผู้ตรวจการ (ด่วน)
เจ้าหน้าที่ส่งเสริมการตลาด แผนกส่งเสริมการตลาด
เจ้าหน้าที่บุคคล ส่วนงานค่าจ้าง (ด่วน)
เจ้าหน้าที่บัญชี แผนกบัญชี (ด่วน)
เจ้าหน้าที่เร่งรัดหนี้สิน แผนกการเงินนอก
เจ้าหน้าที่ต้อนรับ แผนกเวชระเบียน
เจ้าหน้าที่ทำบัตร แผนกเวชระเบียน
เจ้าหน้าที่บัตรบน แผนกเวชระเบียน
เจ้าหน้าที่การเงิน แผนกการเงินนอก
เจ้าหน้าที่ประเมินราคา แผนกการเงินใน
เจ้าหน้าที่การเงิน แผนกการเงินใน
เจ้าหน้าที่เวรเปล แผนกเวรเปล
เจ้าหน้าที่รับผู้ป่วยใน แผนกรับผู้ป่วยใน
เจ้าหน้าที่เวชสถิติ แผนกการเงินใน
พนักงานครัวอิสลาม แผนกโภชนาการ
พนักงานผู้ช่วยแม่บ้าน แผนกแม่บ้าน
พนักงานขับรถ แผนกยานพาหนะ
พนักงานต้อนรับ แผนกต้อนรับส่วนหน้า
พนักงานรับโทรศัพท์ แผนก OPERATOR
หัวหน้าฝ่ายอาคารและสถานที่
หัวหน้า แผนกซ่อมบำรุง (ด่วน)
ผู้ช่วยหัวหน้าช่าง แผนกซ่อมบำรุง (ด่วน)
ช่าง แผนกซ่อมบำรุง (ด่วน)
หัวหน้าแม่บ้าน แผนกแม่บ้าน
Supervisor แม่บ้าน แผนกแม่บ้าน
แม่บ้าน ICU-C อาคาร 3 (ด่วน)
ตรวจสุขภาพประจำปี รวมคัดกรองมะเร็ง 6 ชนิดฟรี สำหรับกลุ่มเสี่ยง
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
- ที่ผ่านมา สิทธิในการคัดกรองมะเร็งหลายโรคอยู่ในสิทธิบัตรทองอยู่แล้ว แต่ยังติดที่ต้องมีอาการบ่งชี้ก่อน จึงจะให้แพทย์สั่งตรวจได้ ยกเว้นมะเร็งปากมดลูก ทำให้มีประชาชนกลุ่มเสียง เข้าไม่ถึง และตกหล่นจากการคัดกรองมะเร็ง
- บรรจุสิทธิคัดกรองมะเร็งที่พบบ่อย 6 ชนิดลงในสิทธิตรวจสุขภาพบัตรทองตามความเสี่ยง ไม่ต้องรอแพทย์สั่ง เพื่อให้เข้าถึงการรักษามะเร็งตั้งแต่ระยะเริ่มต้น และมีค่าเดินทางเพื่อจูงใจให้ทุกคนเข้ามาตรวจสุขภาพ
พัฒนาสิทธิการคัดกรองมะเร็ง 6 ชนิด ให้เข้าถึงง่ายและดีขึ้น ดังนี้
มะเร็งเต้านม
- ปัจจุบันมีการตรวจ mammogram อยู่แล้ว แต่ต้องให้แพทย์เป็นผู้สั่งตรวจ การคัดกรองดังกล่าวจึงควรอยู่ในสิทธิการตรวจสุขภาพประจำปี ขึ้นกับความเสี่ยง ได้แก่
- ผู้หญิง 40 - 55 ปีที่ไม่มีอาการ ควรได้ตรวจ mammogram ทุก 1 ปี
- ผู้หญิงอายุ 55 ปีขึ้นไป ควรได้รับการตรวจ mammography ทุก 2 ปี
- กลุ่มเสี่ยงควรได้รับการตรวจทุกปี ไม่ว่าจะเป็นผุ้หญิงที่มีคนในครอบครัวที่เป็นมะเร็งเต้านม ผู้ที่เคยได้รับการฉายแสงบริเวณหน้าอกเพื่อรักษามะเร็งต่อมน้ำเหลือง ผู้มีประวัติการรับฮอร์โมนเสริมหลังหมดประจำเดือนติดต่อกันเกิน 5 ปี
มะเร็งปากมดลูก
- ปัจจุบันสิทธิในการตรวจ pap smear ในผู้หญิงอายุ 30 ปีขึ้นไป หรือเคยมีเพศสัมพันธ์ ครอบคลุมในสิทธิบัตรทองอยู่แล้ว ตามสิทธิเฝ้าระวังโรค แต่ผู้ที่ไม่ได้เข้าไปใช้สิทธิยังมีอีกมาก
- การระบุสิทธิคัดกรองมะเร็งปากมดลูกในการตรวจสุขภาพประจำปี และมีค่าเดินทางให้ จะช่วยจูงใจให้ทุกคนเข้าตรวจคัดกรองมากขึ้น
มะเร็งลำไส้ใหญ่
- ปัจจุบัน สิทธิในการคัดกรองมะเร็งลำไส้ใหญ่ตามบัตรทอง คือ การตรวจเลือดในอุจจาระ ซึ่งยังไม่แม่นยำ หากไม่ทำคู่กับการส่องกล้อง Colonoscopy ร่วมด้วย
- เพิ่มสิทธิในการตรวจส่องกล้องให้กับกลุ่มเสี่ยงมีญาติสายตรงเป็นมะเร็งลำไส้ใหญ่ โดยอายุเริ่มตรวจ นับจากอายุของผู้ที่เป็นมะเร็งในครอบครัว ลบ 10 ปี และตรวจทุก1 - 3 ปี
มะเร็งต่อมลูกหมาก
- ปัจจุบัน การเจาะเลือดดูค่า PSA เพื่อคัดกรองมะเร็งต่อมลูกหมากต้องให้แพทย์สั่งตามข้อบ่งชี้ ไม่สามารถเริ่มตรวจเองได้
- เพิ่มสิทธิการตรวจเข้าไปในการตรวจสุขภาพประจำปี ที่ต้องมีการเจาะเลือดเพื่อตรวจสุขภาพอยู่แล้ว
มะเร็งตับ
- การเจาะเลือดดูค่า AFP และการ ultra-sound ช่องท้องเป็นสิทธิบัตรทอง ปกติไม่จำเป็นต้องคัดกรองทุกคน ยกเว้นกลุ่มที่เป็นไวรัสตับอักเสบที่แพทย์จะต้องให้คัดกรองอยู่แล้ว
- เพิ่มสิทธิในกลุ่มเสี่ยง เช่น ในภาคอีสานจะมีมะเร็งตับอีกชนิด คือ Cholangiocarcinoma ที่เกิดจากพยาธิใบไม้ในตับที่มาจากปลาน้ำจืด ซึ่งกลุ่มเสี่ยงในพื้นที่ที่กินอาหารสุก ๆ ดิบ ๆ เป็นประจำ ควรจะต้องรับการคัดกรองมะเร็งส่วนนี้อย่างสม่ำเสมอ
มะเร็งปอด
- ปัจจุบันตามสิทธิบัตรทองมีทำเอ็กซเรย์ปอดแต่ยังขาดความแม่นยำในการคัดกรอง ควรใช้วิธีการคัดกรองด้วย CT ที่แม่นยำกว่า
- เพิ่มสิทธิในการตรวจ CT ในกลุ่มเสี่ยงที่จะเป็นมะเร็งปอด ได้แก่ กลุ่มที่อายุ 55 ปี ขึ้นไปที่เป็นผู้สูบบุหรี่จัดในอัตรา 30 pack-year เป็นต้นไป รวมถึงกลุ่มเสี่ยงในภูมิภาคมีปัญหาเรื่องฝุ่น PM 2.5 และมลพิษ ซึ่งเป็นพื้นที่ที่พบอุบัติการณ์ของโรคมะเร็งปอดมากขึ้นอย่างมีนัยสำคัญ
ยุทธศาสตร์ที่ 1 พัฒนาระบบและบริหารจัดการงานสร้างเสริมภูมิคุ้มกันโรคให้มีประสิทธิภาพทั้งในภาวะปกติและภาวะฉุกเฉิน
เป็นการมุ่งสร้างความมั่นคงด้านวัคซีนเพื่อให้ประชาชนเข้าถึงวัคซีนได้อย่างเป็นธรรมและทันการณ์ มีการพัฒนาระบบบริหารการจัดหาวัคซีนเพื่อให้มีวัคซีนสำรองที่เพียงพอและลดปัญหาการขาดแคลนวัคซีนที่จำเป็น
1. อัตราครอบคลุมของการได้รับวัคซีนของประชาชนกลุ่มเป้าหมาย
สามารถให้บริการวัคซีนพื้นฐานกับประชาชนกลุ่มเป้าหมาย (เด็กแรกเกิด-12 ปี) ได้ไม่น้อยกว่าร้อยละ 90 จำนวน 3 ชนิด (จาก 19 ชนิด)2 ได้แก่ วัคซีนป้องกันวัณโรค วัคซีนป้องกันโรคไวรัสตับอักเสบบี และวัคซีนป้องกันโรคคอตีบ-บาดทะยัก-ไอกรน เนื่องจากปัญหาความครบถ้วนของการรายงานผลการให้บริการที่สถานบริการแต่ละแห่งตามระบบการส่งข้อมูลเข้าส่วนกลาง รวมทั้งการรับบริการวัคซีนในพื้นที่ที่มีการเคลื่อนย้ายของแรงงานไทย แรงงานต่างชาติ และพื้นที่ชายแดน
2. จำนวนชนิดวัคซีนมีเพียงพอใช้ทั้งในภาวะปกติและภาวะฉุกเฉิน
- สามารถจัดหาวัคซีนป้องกันโรคมะเร็งปากมดลูกได้ จำนวน 800,000 โดส และคาดว่าจะสามารถจัดหาวัคซีนได้อย่างต่อเนื่อง
เพื่อให้บริการวัคซีนดังกล่าวแก่นักเรียนหญิงชั้นประถมศึกษาปีที่ 5
- ดำเนินการรณรงค์ให้ฉีดวัคซีนป้องกันโรคโปลิโอเสริมในพื้นที่เสี่ยงให้แก่เด็กไทยที่อายุต่ำกว่า 5 ปีและเด็กต่างชาติที่อายุต่ำกว่า 15 ปี ในพื้นที่จังหวัดชายแดนภาคใต้ตอนล่าง (จังหวัดยะลา ปัตตานี นราธิวาส และสงขลา) และพื้นที่อำเภอชายแดนไทย-เมียนมา (จังหวัดแม่ฮ่องสอน ตาก กาญจนบุรี และราชบุรี) รวมถึงรณรงค์ให้ฉีดวัคซีนป้องกันโรคหัดและโรคหัดเยอมัน3ให้แก่กลุ่มเป้าหมายกลุ่มผู้ใหญ่อายุ 20-40 ปี กลุ่มผู้ต้องขังรายใหม่และเจ้าหน้าที่เรือนจำทั่วประเทศ กลุ่มบุคลากรทางการแพทย์และสาธารณสุขภาครัฐและกลุ่มทหารเกณฑ์ที่ยังไม่ได้รับวัคซีนมาก่อน
3. บรรจุวัคซีนชนิดใหม่ในแผนงานสร้างเสริมภูมิคุ้มกันโรค
ไม่สามารถดำเนินการบรรจุวัคซีนโปลิโอชนิดฉีดอีก 1 โดส ไว้ในแผนงานสร้างภูมิคุ้มกันโรคได้ เนื่องจากปัญหาข้อจำกัดด้านงบประมาณในการจัดซื้อวัคซีนประกอบกับคำแนะนำขององค์การอนามัยโลกที่สามารถใช้วัคซีนโปลิโอชนิดฉีดแล้วตามด้วยวัคซีนโปลิโอชนิดรับประทานได้ตามเดิม
4. ความสำเร็จในการจัดซื้อวัคซีนในภาวะปกติและภาวะฉุกเฉิน
- มีการผลักดันให้มีการจัดซื้อวัคซีนแบบหลายปี (2 ปี) ที่เป็นผลสืบเนื่องมาจากปี 2564 จากการประเมินประสิทธิภาพการบริหารปริมาณวัคซีนคงคลัง 18 เดือน (ปริมาณวัคซีนที่ใช้ใน 12 เดือน รวมกับปริมาณวัคซีนสำรอง 6 เดือน มีประสิทธิภาพเพียงพอที่จะรองรับการใช้วัคซีนในประเทศ จึงไม่มีความจำเป็นต้องเพิ่มจำนวนวัคซีนสำรองจาก 6 เดือน เป็น 12 เดือน ในปีงบประมาณ พ.ศ. 2565
- การสำรองวัคซีนกรณีเกิดการระบาดใหญ่ของไข้หวัดใหญ่ในคลังผู้ผลิตยังไม่สามารถดำเนินการได้ เนื่องจากสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) ทั่วโลก ทำให้ไทยต้องจัดหาวัคซีนรองรับสถานการณ์ดังกล่าวเพื่อใช้ในการควบคุมป้องกันโรค โดยขยายกรอบการจัดหาวัคซีนโควิด-19 เป็นจำนวน 120 ล้านโดส (จากเดิม 103.5 ล้านโดส) เพื่อให้มีวัคซีนเพียงพอ
5. ข้อมูลชนิดและปริมาณความต้องการรายวัคซีนที่จำเป็นในแผนงานสร้างเสริมภูมิคุ้มกันโรคและวัคซีนที่ใช้ตอบโต้การระบาด
ในปีงบประมาณ พ.ศ. 2563-2564 สถาบันวัคซีนแห่งชาติ (สวช.) ได้นำเทคโนโลยีดิจิทัลมาใช้ในการพัฒนาระบบข้อมูลและบริหารจัดการวัคซีน เพื่อใช้ประโยชน์ในการสนับสนุนข้อมูลประกอบการตัดสินใจเชิงนโยบายเกี่ยวกับการวิจัยพัฒนา การผลิต และการสร้างเสริมภูมิคุ้มกันโรคของประเทศ เพื่อให้การดำเนินงานเป็นไปอย่างต่อเนื่อง ในปีงบประมาณ พ.ศ. 2565 สวช. ได้วางแผนพัฒนาและปรับปรุงระบบข้อมูลและบริหารจัดการวัคซีน รวมทั้งพัฒนาเครื่องมือการวิเคราะห์และสังเคราะห์ข้อมูลที่ช่วยในการแก้ปัญหาให้ข้อมูลมีคุณภาพ มีความน่าเชื่อถือ และสามารถนำไปประยุกต์ใช้ในการตัดสินใจในเชิงนโยบายได้อย่างเหมาะสมและมีประสิทธิภาพยิ่งขึ้น สำหรับการพัฒนาระบบเฝ้าระวังสอบสวนอาการภายหลังได้รับการสร้างภูมิคุ้มกันโรค ได้ดำเนินการแล้วเสร็จเมื่อปีงบประมาณ พ.ศ. 2564 โดยได้บูรณาการระบบดังกล่าวเข้ากับระบบงานเฝ้าระวังเหตุการณ์ไม่พึงประสงค์ภายหลังได้รับการสร้างเสริมภูมิคุ้มกันโรค จึงทำให้ไม่มีแผนการดำเนินงานในปีงบประมาณ พ.ศ. 2565
Cultural District 2023 สังคีตศาลา พิพิธภัณฑสถานพระนคร
กิจกรรมประจำจันทร์ - ศุกร์
Mini Exhibition : มหรสพต้นกรุงรัตนโกสินทร์ (10.00 – 20.00 น.)
Workshop : ร้องรำลึกระลึก Postcard / วาดหน้าลิง 18 มงกุฎ (10.00 – 18.00 น.)
Trip : 19 / 24 – 26 พ.ค.66 : ตามประวัติศาสตร์มหรสพไทย และมหรสพวังหน้า ณ ที่นั่งทักษิณาภิมุข และพระที่นั่งอิศเรศราชนุสรณ์ พิพิธภัณฑ์สถานแห่งชาติ พระนคร (14.00 – 16.00 น.)
Trip : 22 - 23 พ.ค.66 : ตามรอยชุมชนมหรสพต้นกรุง ณ พิพิธบางลำพู + ชุมชนบางลำพู (14.00 – 16.00 น.)
Show : การแสดงดนตรีไทย “เพลงต้นกรุง” (18.30 – 19.30 น.)
19 พ.ค.66 : วงเครื่องสายผสมซอสามสาย
22 พ.ค.66 : วงดนตรีเหนือ
23 พ.ค.66 : วงเครื่องสายไทย
24 พ.ค.66 : วงปี่พาทย์ไม้นวม
25 พ.ค.66 : วงปี่พาทย์ไม้แข็ง
26 พ.ค.66 : การบรรเลงขิมหมู่
Show : การแสดงนาฏศิลป์ร่วมสมัย (Contemporary Dance) ชุดนางละครนอก แสดงโดยคุณกัมปนาท เรืองกิตติวิลาศ(19.30 – 20.00 น.)
กิจกรรมวันเสาร์-อาทิตย์
Mini Exhibition : มหรสพต้นกรุงรัตนโกสินทร์ (10.00 – 20.00 น.)
Workshop : ร้องรำลึกระลึก Postcard / วาดหน้าลิง 18 มงกุฎ (10.00 – 18.00 น.)
Trip : 20 – 21 / 27 – 28 พ.ค.66 : ตามประวัติศาสตร์มหรสพไทย และมหรสพวังหน้า ณ พี่ที่นั่งทักษิณาภิมุข และพระที่นั่งอิศเรศราชนุสรณ์ พิพิธภัณฑ์สถานแห่งชาติ พระนคร (11.00-13.00 น.)
Trip : 20 – 21 / 27 – 28 พ.ค.66 : ตามประวัติศาสตร์มหรสพไทย และมหรสพวังหน้า ณ พี่ที่นั่งทักษิณาภิมุข และพระที่นั่งอิศเรศราชนุสรณ์ พิพิธภัณฑ์สถานแห่งชาติ พระนคร (14.00-16.00 น.)
Show : การแสดงมหรสพ (18.30 – 20.00 น.)
20 พ.ค.66 : ดนตรีไทย โหมโรง + การแสดงละครนอก การแสดงเบิกโรงรำฉุยฉาย รจนา แม่ลูกผูกพัน / สุวรรณหงส์ ตอนพรามณฺ์เกศสุยงรบกุมภณฑ์ / การแสดงเมรีตอนหลงเลห์พระรถเสน
21 พ.ค.66 : การแสดงรำฉุยฉายทศกัณฐ์ / รำฉุยฉายหนุมาน / รำหนุมานจับนางสุพรรณมัจฉา
27 พ.ค.66 : ดนตรีไทย โหมโรง + การแสดงละครใน อุณรุท ตอนศุภลักษณ์อุ้มสม / อิเหนา ตอนอิเหนาตัดดอกไม้ฉายกริช / รามเกียรติ์ ตอน ทศกัณฐ์เกี้ยวนางเบญจกาย
28 พ.ค.66 : ระบำเบ็ดเตล็ด รำรจนาเสี่ยงพวงมาลัย ,รำโนรา ,ฟ้อนน้อยไชยา,ฟ้อนเต้ยต่ำต้อด
1.อาหารจากพืชคือ อาหารที่ยั่งยืน
การเกษตรเชิงอุตสาหกรรม (Industrial agriculture) ส่งผลโดยตรงต่อคุณภาพดิน เกษตรกรรมเชิงอุตสาหกรรมได้ทำลายเชื้อจุลินทรีย์ในดิน ดูดเอาสารอินทรีย์และแร่ธาตุออกจากดินไปด้วยการทำฟาร์มแบบรุกราน สิ่งเหล่านี้ทำให้ที่ดินเพาะปลูกหลายแห่ง กำลังเผชิญกับปัญหาคุณภาพดินที่ลดลง ส่งผลให้จุลินทรีย์ที่ดีเข้าสู่ลำไส้ของเราน้อยลง รวมถึง วิตามิน และแร่ธาตุ ก็เข้าสู่ร่างกายของเราน้อยลงเช่นกัน
จากการศึกษาที่ถูกตีพิมพ์ใน International Journal of Food Sciences and Nutrition ปี พ.ศ. 2564 เปรียบเทียบปริมาณแร่ธาตุในผักและผลไม้ของสหราชอาณาจักร พบว่า ในช่วง 80 ปีที่ผ่านมา ปริมาณแร่ธาตุในผักและผลไม้ลดลงอย่างมาก โดยธาตุเหล็กและทองแดงลดลง มากถึงประมาณ 50 %, แมกนีเซียมลดลง 9.7%, โพแทสเซียมลดลง 4.7%, และแคลเซียมลดลง 2.5%, เช่นเดียวกับการศึกษาที่คล้ายกันในสหรัฐอเมริกา ที่ได้รับการตีพิมพ์ในปี พ.ศ. 2547 ใน Journal of the American College of Nutrition นักวิจัยตรวจสอบสารอาหารในพืชผล 43 ชนิด เปรียบเทียบกับที่มีการบันทึกไว้เมื่อปี พ.ศ.2493 ของ U.S. Department of Agriculture พบว่า โปรตีน แคลเซียม เหล็ก ฟอสฟอรัส วิตามิน B2 และ C ลดลงอย่างเห็นได้ชัด
สถานการณ์นี้ สอดคล้องกับการประเมินขององค์การอาหารและการเกษตรแห่งสหประชาชาติ (UN Food and Agriculture Organization, FAO) ที่ผู้คนมากถึง 2 พันล้านคนที่มีภาวะขาดวิตามินและแร่ธาตุ แม้จะได้รับพลังงานจากอาหารอย่างเพียงพอ หรือเรียกภาวะนี้ว่า Hidden Hunger
ขณะที่จำนวนประชากรกำลังเพิ่มขึ้นอย่างต่อเนื่อง ผู้คนเริ่มรับประทานอาหารแบบตะวันตกมากขึ้น องค์การอาหารและการเกษตรแห่งสหประชาชาติ (UN Food and Agriculture Organization หรือ FAO) คาดการณ์ว่าการผลิตเนื้อสัตว์ นม และไข่ จะเพิ่มขึ้นอีก 44% ภายในปี พ.ศ. 2593 ซึ่งไม่เพียงแต่ก่อให้เกิดปัญหาสุขภาพเท่านั้น แต่ยังก่อให้เกิดปัญหาทางด้านสิ่งแวดล้อมควบคู่ไปด้วย เพราะระบบอุตสาหกรรมอาหารในปัจจุบัน ปล่อยก๊าซเรือนกระจก สูงถึงประมาณ 1 ใน 4 ของโลก คิดเป็น 70% ของการใช้น้ำจืด และ 40% ของการใช้พื้นที่ทั้งหมด รวมถึงการใช้ปุ๋ยและสารเคมีที่ขัดขวางการหมุนเวียนของไนโตรเจนและฟอสฟอรัสซึ่งเป็นต้นเหตุของมลพิษส่วนใหญ่ในแม่น้ำและชายฝั่ง
ก๊าซเรือนกระจกส่วนใหญ่เกิดจากระบบการผลิตอาหาร ซึ่งประมาณ 30–50% มาจากห่วงโซ่อุตสาหกรรม ปศุสัตว์ รายงานจาก McKinsey Sustainability เดือนกันยายน ปี พ.ศ. 2564 กล่าวว่าสัตว์เคี้ยวเอื้อง อย่างวัวและแกะ ปล่อยก๊าซมีเทนในระหว่างการย่อยอาหาร พร้อมกับก๊าซคาร์บอนไดออกไซด์ และก๊าซอื่นๆ คิดเป็นสัดส่วนเกือบร้อยละ 70 ของการปล่อยมลพิษทางการเกษตร หากเปรียบเทียบสัตว์เหล่านี้เป็นประเทศ สัตว์มีส่วนรับผิดชอบต่อการปล่อยก๊าซคาร์บอนไดออกไซด์ มากกว่าทุกประเทศในโลก เป็นรองแค่ประเทศจีน
ในปี พ.ศ. 2562 กลุ่มนักโภชนาการ นักนิเวศวิทยา และผู้เชี่ยวชาญอื่นๆ ทั้งสิ้น 37 คนจาก 16 ประเทศ ซึ่งเป็นคณะกรรมาธิการด้านอาหารโลก ได้ออกรายงาน The EAT-Lancet Commission on Food, Planet, Health ที่เรียกร้องให้มีการปรับเปลี่ยนแนวทางการรับประทานอาหารในวงกว้าง โดยคำนึงถึงประโยชน์ทางด้านโภชนาการและสิ่งแวดล้อมควบคู่กันไป ได้สรุปมาว่า แนวทางการรับประทานอาหารแบบ “ยืดหยุ่น” (Flexitarian) โดยการรับประทานอาหารที่อุดมด้วยพืชเกือบทุกวัน สลับกับการรับประทานเนื้อหรือปลาเล็กน้อยเป็นบางครั้ง เป็นประโยชน์ต่อสุขภาพและสิ่งแวดล้อมไปพร้อมกัน win-win ทั้งเราและโลก
ถ้าโดยเฉลี่ยแล้ว หากทุกคนรับประทานอาหารที่มีพืชเป็นส่วนประกอบ (Plant-based diet) มากขึ้น และหยุดการปล่อยมลพิษจากภาคส่วนอื่นๆ มีโอกาสสูงถึง 50% ที่จะหยุดยั้งการเปลี่ยนแปลงสภาพภูมิอากาศของโลกได้ 1.5 องศาเซลเซียส ตามข้อตกลงที่ได้ทำร่วมกันไว้ และหากปรับปรุงระบบการผลิตอาหารออกไปในส่วนต่างๆ เช่น การลดขยะอาหาร (food waste) โอกาสที่จะทำข้อตกลงได้สำเร็จจะเพิ่มขึ้นเป็น 67 %
เพราะการให้ได้มาซึ่งเนื้อวัวหนึ่งกิโลกรัม ทำให้เกิดปล่อยก๊าซคาร์บอนไดออกไซด์เข้าสู่ชั้นบรรยากาศสูงถึง 60 กิโลกรัม ขณะที่ถั่วเหลืองก่อให้เกิดก๊าซคาร์บอนไดออกไซด์เพียง 0.9 กิโลกรัม เท่านั้น ซึ่งปริมาณต่างกันถึง 60 เท่า และทรัพยากรน้ำที่ถูกใช้ในสินค้าปศุสัตว์ก็มากกว่าอย่างเห็นได้ชัด ยกตัวอย่าง เนื้อวัว 1 กิโลกรัม ต้องใช้น้ำสูงถึง 15,415 ลิตร เนื้อหมู และ เนื้อไก่ ใช้น้ำ 5,988 และ 4,325 ลิตรตามลำดับ ในขณะที่การผลิตพืชผัก 1 กิโลกรัม ลดการใช้ทรัพยากรน้ำลงหลายเท่าตัว โดย ข้าวใช้น้ำ 1,673 ลิตร แอปเปิ้ล 822 ลิตร และมะเขือเทศใช้น้ำเพียง 287 ลิตร เท่านั้น
ผลสำรวจของ Mintel รายงานว่า พฤติกรรมของผู้บริโภคในปีช่วงหนึ่งปีที่ผ่านมา ตั้งแต่ พ.ศ. 2564 ถึงปี พ.ศ. 2565 มีแนวโน้มในการรับประทานเนื้อสัตว์และผลิตภัณฑ์จากนมสัตว์ลดลง ไม่เพียงแต่เหตุผล ทางด้านเศรษฐกิจและสิ่งแวดล้อม แต่ยังรวมถึงเหตุผลทางด้านสุขภาพด้วย แม้ว่าผู้ที่รับประทานมังสวิรัติ และวีแกน จะมีสัดส่วนคงที่ที่ 3% และ 1% ตามลำดับ แต่สัดส่วนของผู้บริโภคที่รับประทานเนื้อสัตว์เป็นหลัก (Carnivore) ลดลง จาก 33% เหลือ 28% และแนวโน้มการหันมารับประทานแบบยืดหยุ่น (Flexitarian) เพิ่มมากขึ้นจาก 10% เป็น 13%
สำหรับประเทศไทยเอง การหันมาหาวิถีชีวิตแบบดั้งเดิม อย่างการบริโภคพืชผักสวนครัวที่หาได้ตามท้องถิ่น หรือผักผลไม้ตามฤดูกาล ช่วยสนับสนุนแนวทางการรับประทานอาหารสุขภาพแบบยั่งยืนได้ เพราะสามารถลดการใช้น้ำ สารเคมี และการปล่อยก๊าซเรือนกระจกที่เกิดจากกระบวนการผลิตและการขนส่ง อีกทั้งการรับประทานอาหารพื้นบ้านแบบไทยๆ ที่อุดมไปด้วยผักและสมุนไพรหลากหลายชนิด ยังให้คุณประโยชน์ต่อสุขภาพ เพราะมีวิตามิน แร่ธาตุ สารต้านอนุมูลอิสระสูง และยังผ่านกระบวนการแปรรูปน้อยอีกด้วย
มีนาคม 2566
วันที่ 2 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 63 แห่ง ดังนี้
1.แสนสุขคลินิกเวชกรรม
2.รมย์รวินทร์คลินิกเวชกรรม สาขานางลิ้นจี่
3.โซอาร์คลินิกเวชกรรม
4.รุ่งรัชคลินิกเวชกรรม
5.เดอะคลีนิกค์คลินิกเวชกรรม สาขาสยามพารากอน
6.เดอะไบร์ทคลินิกเวชกรรม
7.อีเอสแอลคลินิกเวชกรรม
8.เฟรนลี่คลินิกเวชกรรม
9.ยุนแดคลินิกเวชกรรม
10.กาเกริคลินิกเวชกรรม
11.เลนยาคลินิกเวชกรรม
12.ราษฎร์พัฒนาคลินิกเวชกรรม
13.อทิตาคลินิกเวชกรรม สาขาสยามสแควร์
14.สิตาคลินิกเวชกรรม
15.เดอะแบร์ทัชคลินิกเวชกรรม
16.วรวัฒน์คลินิกเวชกรรม
17.คลินิกเวชกรรมแพทย์อภิชัย
18.เมิร์จคลินิกเวชกรรม
19.บีอีคิวคลินิกเวชกรรม
20.เวลคลินิกเวชกรรม
21.แคนดิล่าคลินิกเวชกรรม
22.ศูนย์พรหมวชิรญาณสหคลินิก สาขาวัดยานนาวา
23.เฌอคลินิกเวชกรรม สาขาอมอรินี่รามอินทรา
24.เฌอคลินิกเวชกรรม สาขาเดอะวอร์คเกษตรนวมินทร์
25.สิรินคลินิกเวชกรรม
26.เป็นที่รักคลินิกเวชกรรม สาขาพระราม 9
27.จีอาร์คลินิกเวชกรรม
28.เมธัชคลินิกเวชกรรม
29.พาวีคอนคลินิกเวชกรรม
30.ชองดัมคลินิกเวชกรรม
31.เรอแนซเซ็นซ์คลินิกเวชกรรม
32.สุประสงค์คลินิกเวชกรรม
33.เดอะบียอนคลินิกเวชกรรม
34.เอ็น ที คลินิกเวชกรรม
35.คลินิกเวชกรรมนายแพทย์อินเดอร์ซิงห์
36.อาคิคลินิกเวชกรรม
37.เมนเดลคลินิกเวชกรรม
38.ภราภิญคลินิกเฉพาะทางด้านเวชกรรมผิวหนัง
39.คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งบลอสซั่มพลาสติกเซอร์เจอรี่
40.เอช-อี พาโธ แล็บบอราทอรี่คลินิกเฉพาะทางด้านเวชกรรมพยาธิวิทยา
41.อินซ์คลินิกเฉพาะทางด้านเวชกรรมจักษุ
42.เทียนฟ้าประชาการุณย์คลินิกเฉพาะทางด้านเวชกรรมไตเทียม
43.คลินิกทันตกรรมลาดปลาเค้า
44.คลินิกทันตกรรมบลูทูธ
45.คลินิกทันตกรรมซอฟแอนด์สไมล์
46.ออลอะเบาท์ทีธคลินิกทันตกรรม สาขาสะพานใหม่
47.คลินิกทันตกรรมอิสระ
48.คลินิกทันตกรรมพราวสไมล์
49.เหยาเหยาคลินิก คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
50.รีริชเฮิร์บคลินิกการแพทย์แผนไทย
51.ศีลสมบูรณ์คลินิกการแพทย์แผนไทย
52.บีเฮลท์ตี้คลินิกกายภาพบำบัด
53.ภคพรคลินิกกายภาพบำบัด
54.คลินิกเทคนิคการแพทย์แบงคอกจีโนมิกส์
55.คลินิกเทคนิคการแพทย์แบงคอกจีโนมิกส์ สาขา 2
56.บางกอกไซโตเจเนติกซ์คลินิกเทคนิคการแพทย์
57.มนัสสหคลินิก
58.ทรัสต์สหคลินิก สาขาบางแค
59.โฮมเวลเนสสหคลินิก
60.ประชาราษฎร์อบอุ่นคลินิกเวชกรรม สาขาจรัญฯ 65 (นำส่ง OSS 1/3/66)
61.ประชาราษฎร์อบอุ่นคลินิกเวชกรรม สาขาเสนานิคม (นำส่ง OSS 1/3/66)
62.ลาดกระบัง ซ.1 คลินิกเวชกรรม (นำส่ง OSS 1/3/66)
63.Translated Lincence to Operate a Sanatorium “KOMUT CLINIC”
วันที่ 2 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 55 แห่ง ดังนี้
1.เดอะวีเว่คลินิกเวชกรรม
2.พระยาสุเรนทร์คลินิกเวชกรรม
3.นิติพลคลินิกเวชกรรม สาขาเดอะพรอนาด
4.คลินิกเวชกรรมแพทย์อ่อนนุช 44
5.คลินิกเวชกรรมบอนนี่ 99
6.ธานิศาคลินิกเวชกรรม
7.คลินิกเวชกรรมพหลโยธิน 48/1
8.เว้ลท์คลินิกเวชกรรม
9.จี เอ็น แอล คลินิกเวชกรรม
10.คลินิกเวชกรรมประเวศเมโมเรียล
11.คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดพร้าว 101
12.คลินิกเวชกรรมบางบอน 19
13.ธาระคลินิกเวชกรรม
14.เฌอคลินิกเวชกรรม สาขาเซ็นจูรี่อนุสาวรีย์
15.มุนอาร์คลินิกเวชกรรม
16.คินิก้าคลินิกเวชกรรม (นำส่ง OSS 9/3/66)
17.เดอะพีชเชสคลินิกเวชกรรม
18.คลินิกเวชกรรมแพทย์พัฒนาการ 13
19.คลินิกเวชกรรม 24/20
20.พฤกษาคลินิกเวชกรรม
21.ไอ เอฟ ที จี คลินิกเวชกรรม
22.ยูนิคคลินิกเวชกรรม
23.แฟรี่คลินิกเวชกรรม
24.ลิซ่าคลินิกเวชกรรม
25.คลินิกเวชกรรมวิชัยการแพทย์
26.คลินิกเวชกรรมราษฎร์อุทิศ
27.ลาเบลคลินิกเวชกรรม สาขาห้วยขวาง
28.เอเวอรี่เดย์คลินิกเวชกรรม
29.คลินิกเวชกรรมภาษีเจริญ
30.บีเจบีคลินิกเวชกรรม
31.ลิตเติ้ลเกิร์ลคลินิกเวชกรรม
32.มาคลินิกเวชกรรม
33.เคเอ็มบีคลินิกเวชกรรม
34.คลินิกเวชกรรมพิราศัยการแพทย์
35.คลินิกเวชกรรมหมอบัลลังก์ (นำส่ง OSS 9/3/66)
36.เอส แอนด์ ดับบลิว 2 คลินิกเวชกรรม (นำส่ง OSS 3/3/66)
37.บีรยาดาคลินิกเวชกรรม สาขาวิภาวดีรังสิต 60 (นำส่ง OSS 8/3/66)
38.รักษ์ศิริคลินิกเวชกรรม (นำส่ง OSS 9/3/66)
39.คลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์บางกอกไอวีเอฟลาดพร้าว
40.คลินิกทันตกรรมมิสเตอร์เด็นทิสต์ สาขาร่มเกล้า
41.คลินิกทันตกรรมสมายล์อัพ
42.คลินิกทันตกรรมพราวสไมล์
43.คลินิกทันตกรรมเดอะปริญ
44.คลินิกทันตกรรม นีโอเด้นท์
45.คลินิกทันตกรรม ก.ทันตเวช (นำส่ง OSS 8/3/66)
46.บริษัท ดี เอ็น เอ จำกัด คลินิกเทคนิคการแพทย์
47.หมอน้อยคลินิกการแพทย์แผนไทย สาขารัชดา 32
48.ธิติวงษ์คลินิกการแพทย์แผนไทย
49.คลินิกการแพทย์แผนไทยไทยสยาม
50.พีเอชซีสหคลินิก
51.เลอวีญ่าสหคลินิก สาขาพระราม 9
52.ตรัยญาสหคลินิก
53.สหคลินิกสินเนรมิต
54.ฟุตแคร์สหคลินิก
55.ไทม์เวลล์เนสสหคลินิก (นำเอกสารออกไปทำธุรกรรมแล้ว 8/3/66)
วันที่ 9 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 55 แห่ง ดังนี้
1.เดอะวีเว่คลินิกเวชกรรม
2.พระยาสุเรนทร์คลินิกเวชกรรม
3.นิติพลคลินิกเวชกรรม สาขาเดอะพรอนาด
4.คลินิกเวชกรรมแพทย์อ่อนนุช 44
5.คลินิกเวชกรรมบอนนี่ 99
6.ธานิศาคลินิกเวชกรรม
7.คลินิกเวชกรรมพหลโยธิน 48/1
8.เว้ลท์คลินิกเวชกรรม
9.จี เอ็น แอล คลินิกเวชกรรม
10.คลินิกเวชกรรมประเวศเมโมเรียล
11.คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดพร้าว 101
12.คลินิกเวชกรรมบางบอน 19
13.ธาระคลินิกเวชกรรม
14.เฌอคลินิกเวชกรรม สาขาเซ็นจูรี่อนุสาวรีย์
15.มุนอาร์คลินิกเวชกรรม
16.คินิก้าคลินิกเวชกรรม (นำส่ง OSS 9/3/66)
17.เดอะพีชเชสคลินิกเวชกรรม
18.คลินิกเวชกรรมแพทย์พัฒนาการ 13
19.คลินิกเวชกรรม 24/20
20.พฤกษาคลินิกเวชกรรม
21.ไอ เอฟ ที จี คลินิกเวชกรรม
22.ยูนิคคลินิกเวชกรรม
23.แฟรี่คลินิกเวชกรรม
24.ลิซ่าคลินิกเวชกรรม
25.คลินิกเวชกรรมวิชัยการแพทย์
26.คลินิกเวชกรรมราษฎร์อุทิศ
27.ลาเบลคลินิกเวชกรรม สาขาห้วยขวาง
28.เอเวอรี่เดย์คลินิกเวชกรรม
29.คลินิกเวชกรรมภาษีเจริญ
30.บีเจบีคลินิกเวชกรรม
31.ลิตเติ้ลเกิร์ลคลินิกเวชกรรม
32.มาคลินิกเวชกรรม
33.เคเอ็มบีคลินิกเวชกรรม
34.คลินิกเวชกรรมพิราศัยการแพทย์
35.คลินิกเวชกรรมหมอบัลลังก์ (นำส่ง OSS 9/3/66)
36.เอส แอนด์ ดับบลิว 2 คลินิกเวชกรรม (นำส่ง OSS 3/3/66)
37.บีรยาดาคลินิกเวชกรรม สาขาวิภาวดีรังสิต 60 (นำส่ง OSS 8/3/66)
38.รักษ์ศิริคลินิกเวชกรรม (นำส่ง OSS 9/3/66)
39.คลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์บางกอกไอวีเอฟลาดพร้าว
40.คลินิกทันตกรรมมิสเตอร์เด็นทิสต์ สาขาร่มเกล้า
41.คลินิกทันตกรรมสมายล์อัพ
42.คลินิกทันตกรรมพราวสไมล์
43.คลินิกทันตกรรมเดอะปริญ
44.คลินิกทันตกรรม นีโอเด้นท์
45.คลินิกทันตกรรม ก.ทันตเวช (นำส่ง OSS 8/3/66)
46.บริษัท ดี เอ็น เอ จำกัด คลินิกเทคนิคการแพทย์
47.หมอน้อยคลินิกการแพทย์แผนไทย สาขารัชดา 32
48.ธิติวงษ์คลินิกการแพทย์แผนไทย
49.คลินิกการแพทย์แผนไทยไทยสยาม
50.พีเอชซีสหคลินิก
51.เลอวีญ่าสหคลินิก สาขาพระราม 9
52.ตรัยญาสหคลินิก
53.สหคลินิกสินเนรมิต
54.ฟุตแคร์สหคลินิก
55.ไทม์เวลล์เนสสหคลินิก (นำเอกสารออกไปทำธุรกรรมแล้ว 8/3/66)
วันที่ 14 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 41 แห่ง ดังนี้
1.เบลล่า เฮ้าส์ คลินิกเวชกรร
2.มาเบลล่าคลินิกเวชกรรม
3.คลินิกเวชกรรมจรัญสนิทวงส์ 83/1
4.พรีเว่คลินิกเวชกรรม
5.นัดกับณัฐคลินิกเวชกรรม
6.ณัฏฐากรการแพทย์คลินิกเวชกรรม
7.คลินิกเวชกรรมรินทร์นภัส
8.เอสทีซีคลินิกเวชกรรม
9.คลินิกเวชกรรมไอเอ็มเอช วิเศษสุขนคร 25
10.คลินิกเวชกรรมไอเอ็มเอช ราษฎร์บูรณะ 27
11.คลินิกเวชกรรมบ้านนวมินทร์
12.คลินิกเวชกรรมกล้วยน้ำไท สาขาคู้บอน
13.เอส ที คลินิกเวชกรรม
14.กรวินคลินิกเวชกรรม
15.โมรียาคลินิกเวชกรรม
16.คลินิกชีวบำบัดเวชกรรม
17.มาเบลล่าคลินิกเวชกรรม
18.แอลคลินิกเวชกรรม
19.วีซีคลินิกเวชกรรม
20.คลินิกเวชกรรมคลองประปาการแพทย์
21.คอททอนวูลคลินิกเวชกรรม
22.รณภีร์คลินิกเวชกรรม สาขาพระราม 9
23.ไฮโซลคลินิกเวชกรรม
24.เซ็นเตอร์คลินิกเวชกรรม
25.นภาพรคลินิกเวชกรรม
26.รักษ์ชีวาคลินิกเวชกรรม (นำส่ง OSS 13/3/66)
27.เดอะมอร์นิ่งแคร์คลินิกเวชกรรม (นำส่ง OSS 13/3/66)
28.ชานิสาคลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง
29.คลินิกเฉพาะทางด้านเวชกรรมหมอเด็ก (นำส่งเอกสารให้ผู้ประกอบกิจการ 14/3/66)
30.คลินิกทันตกรรมสไมล์คอนเนอร์แอทสาย 1
31.บัณฑิตโกศลคลินิกทันตกรรม
32.คลินิกทันตกรรมพิมสไมล์
33.บ้านหมอฟันคลินิกทันตกรรม (นำส่งเอกสารให้ผู้ประกอบกิจการ 14/3/66)
34.คลินิกกิจกรรมบำบัดอิชิคลินิกการประกอบโรคศิลปะ สาขากิจกรรมบำบัด
35.วีแคร์คลินิกกายภาพบำบัด
36.โมชั่นเฮลท์คลินิกกายภาพบำบัด
37.คลินิกกายภาพบำบัดอิชิ สาขาเจริญนคร
38.มีนสิริสหคลินิก
39.ธนาสิริสหคลินิก
40.สยามเฟอร์ทิลิตี้สหคลินิก
41.สถานพยาบาลเวชกรรมตลาดหลักทรัพย์แห่งประเทศไทย (นอก พรบ.)
วันที่ 20 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 25 แห่ง ดังนี้
1.เฮอร์โมซ่าคลินิกเวชกรรม
2.รักสุขคลินิกเวชกรรม
3.ทเวนตี้โฟร์คลินิกเวชกรรม
4.เจมิลี่คลินิกเวชกรรม
5.คลินิกเวชกรรมไอเอ็มเอช สุขสวัสดิ์ 36
6.อุรา กรุงเทพ คลินิกเวชกรรม
7.ภาฎาคลินิกเวชกรรม
8.สยามการแพทย์คลินิกเวชกรรม
9.เดอะวิสดอม 88 คลินิกเวชกรรม
10.คลินิกเวชกรรมกล้วยน้ำไท สาขาตลาดมหาสิน
11.คลินิกเวชกรรมกล้วนน้ำไท สาขาสวนเพลิน
12.บีแกรมคลินิกเวชกรรม
13.พีเคแอลคลินิกเวชกรรม (นำส่ง OSS 15/3/66)
14.19 เด็นทัลคลินิกทันตกรรม
15.คลินิกทันตกรรมเด็นท์คลับ
16.คลินิกทันตกรรมด็อกเตอร์ทูธวีทรัส
17.คลินิกทันตกรรมเดย์ไทม์สไมล์ สาขาอ่อนนุช
18.ออร่าสไมล์คลินิกทันตกรรม
19.เดอะเนเบอร์ฮู้ดคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
20.หมอโอ ผิงคัง คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
21.พฤกษาคลินิกการแพทย์แผนไทย
22.บีเฮลท์ตี้คลินิกกายภาพบำบัด
23.บีแอลคลินิกกายภาพบำบัด (สมุดหาย)
24.ธนาพลัสสหคลินิก
25.เวลล์เนส สหคลินิก (เพิ่มผู้ปฏิบัติงานร่วมหลัก)
วันที่ 31 มีนาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 42 แห่ง ดังนี้
1.โรซีโกลคลินิกเวชกรรม
2.เมอร์ซี่คลินิกเวชกรรม สาขาสุขุมวิท 39
3.ลลิลคลินิกเวชกรรม
4.เดอะเพิร์สคลินิกเวชกรรม สาขาธนบุรี
5.แพร์คลินิกเวชกรรม
6.เคสหคลินิก (แบบรับแจ้ง สพ.อ.6)
7.เคสหคลินิก สาขาสุขุมวิท 93 (แบบรับแจ้ง สพ.อ.6)
8.เคสหคลินิก สาขาเดอะช็อปปส์แกรนด์พระราม 9 (แบบรับแจ้ง สพ.อ.6)
9.เคคลินิกเวชกรรม (แบบรับแจ้ง สพ.อ.6 )
10.เคคลินิกเวชกรรม สาขาอ่อนนุช (แบบรับแจ้ง สพ.อ.6)
11.เคคลินิกเวชกรรม สาขาสุภาพงษ์ 3 (แบบรับแจ้ง สพ.อ.6)
12.เคคลินิกเวชกรรม สาขาราม 2 (แบบรับแจ้ง สพ.อ.6)
13.คลินิกเวชกรรมกล้วยน้ำไท สาขาสวนเพลิน (แบบรับแจ้ง สพ.อ.6)
14.คลินิกเวชกรรมกล้วยน้ำไท (แบบรับแจ้ง สพ.อ.6)
15.คลินิกเวชกรรมกล้วยน้ำไท สาขานิคมลาดกระบัง (แบบรับแจ้ง สพ.อ.6)
16.คลินิกเวชกรรมกล้วยน้ำไท สาขาคู้บอน 20 (แบบรับแจ้ง สพ.อ.6)
17.คลินิกเวชกรรมกล้วยน้ำไท สาขาสวนสยาม (แบบรับแจ้ง สพ.อ.6)
18.คลินิกเวชกรรมกล้วยน้ำไท สาขาลาซาล (แบบรับแจ้ง สพ.อ.6)
19.คลินิกเวชกรรมกล้วยน้ำไท สาขาพัฒนาการ 20 (แบบรับแจ้ง สพ.อ.6)
20.คลินิกเวชกรรมกล้วยน้ำไท สาขารามคำแหง 14 (แบบรับแจ้ง สพ.อ.6)
21.คลินิกเวชกรรมกล้วยน้ำไท สาขารัชดาภิเษก 3 (แบบรับแจ้ง สพ.อ.6)
22.คลินิกเวชกรรมกล้วยน้ำไท สาขาคู้บอน (แบบรับแจ้ง สพ.อ.6)
23.คลินิกเวชกรรมกล้วยน้ำไท สาขารามอินทรา 68 (แบบรับแจ้ง สพ.อ.6)
24.คลินิกเวชกรรมกล้วยน้ำไท สาขาสะแกงาม (แบบรับแจ้ง สพ.อ.6)
25.คลินิกเวชกรรมกล้วยน้ำไท สาขาสุทธิสาร (แบบรับแจ้ง สพ.อ.6)
26.คลินิกเวชกรรมกล้วยน้ำไท สาขาลาดพร้าว 80 (แบบแจ้ง สพ.อ.6)
27.ภาคภูมิคลินิกเวชกรรม สาขาเพิ่มสิน
28.พรีมา เมดิกา คลินิกเวชกรรม
29.รัตนบัณฑิตคลินิกเวชกรรม
30.อินทัชแคร์คลินิกเวชกรรม สาขารามอินทรา กม.2
31.ลาริชคลินิกเวชกรรม
32.คลินิกเวชกรรมสุกัญญา (นำส่ง OSS 29/3/66)
33.ลิตเติ้ลเกิร์ลคลินิกเวชกรรม (นำส่ง OSS 30/3/66)
34.มาคลินิกเวชกรรม (นำส่ง OSS 30/3/66)
35.สยามเวลเนสคลินิกเวชกรรม (นำส่ง OSS 23/3/66)
36.รันเวยส์คลินิกเวชกรรม (นำส่ง OSS 30/3/66)
37.ที เอส แอล สหคลินิก
38.ชุมชนอบอุ่นสหคลินิก (เวชกรรมและการแพทย์แผนไทย)
39.โลตัส แอซเซอร์ เมดิคอล เซอร์วิส สหคลินิก (เปลี่ยนผู้ปฏิบัติงานร่วมหลัก)
40.ศศิรักษ์ สหคลินิก (เปลี่ยนผู้ปฏิบัติงานร่วมหลัก)
41.บอดี้ฟิกซ์สหคลินิก (เปลี่ยนผู้ปฏิบัติงานร่วมหลัก)
42.เลิฟลี่อายสหคลินิก (เปลี่ยนผู้ปฏิบัติงานร่วมหลัก) (นำส่ง OSS 31/3/66)
กุมภาพันธ์ 2565
วันที่ 28 มีนาคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 5 แห่งดังนี้
1.หัวตะเข้คลินิกเวชกรรม (ใบอนุญาต 10101015565)
2.วิโรจน์คลินิกเวชกรรม (ใบอนุญาต 10101016765) (นำส่ง OSS 24/3/65)
3.คลินิกเฉพาะทางด้านเวชกรรมผิวพรรณ (ใบอนุญาต 10102002865)
4.ผิวดีคลินิกคลินิกเฉพาะทางด้านเวชกรรมผิวหนัง สาขาเซ็นทรัลลาดพร้าว(ใบอนุญาต 10102002465)
5.ศูนย์ทันตกรรมฟันดีเซนเตอร์คลินิกทันตกรรม (ใบอนุญาต 10103009965)
วันที่ 21 กุมภาพันธ์ 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 27 แห่งดังนี้
1.เทียนทะเลคลินิกเวชกรรม (ใบอนุญาต 10101015865)
2.ฟุตแคร์คลินิกเวชกรรม (ใบอนุญาต 10101015965)
3.ธวลิดาคลินิกเวชกรรม (ใบอนุญาต 10101015665)
4.ดอกเตอร์ไลฟ์คลินิกเวชกรรม สาขาซีคอนสแควร์ศรีนครินทร์ (ใบอนุญาต 10101015765)
5.พันธมิตรรามอินทราคลินิกเวชกรรม (ใบอนุญาต 10101013765)
6.นาการ่าคลินิกเวชกรรม (ใบอนุญาต 10101014865)
7.คลินิกเวชกรรมหมอสุนทร (ใบอนุญาต 10101016565)
8.วิสดอมคลินิกเวชกรรม (ใบอนุญาต 10101013865)
9.ของขวัญคลินิกเวชกรรม สาขาเซ็นทรัลลาดพร้าว (ใบอนุญาต 10101016165)
10.คลินิกทันตกรรมเบบี้ทูเบรเซส (ใบอนุญาต 10103009365)
11.สมายล์ทิพย์คลินิกทันตกรรม (ใบอนุญาต 10103009565)
12.หน่วยบริการคลินิกทันตกรรม (ใบอนุญาต 10103009065)
13.คลินิกทันตกรรมนราธิวาส (ใบอนุญาต 10103008965)
14.คลินิกทันตกรรมส่งเสริมทันตสุขภาพ (ใบอนุญาต 10103008765)
15.คลินิกทันตกรรมรักฟันทันตแพทย์ สาขา 1 (ใบอนุญาต 10103008665)
16.คลินิกทันตกรรมลาดพร้าว 80 (ใบอนุญาต 10103008165)
17.ฟ.ฟันคลินิกทันตกรรม (ใบอนุญาต 10103008465)
18.เดนทิส ไอ นี้ด ยู คลินิกทันตกรรม (ใบอนุญาต 10103009265)
19.คลินิกทันตกรรมหมอเปิ้ล (ใบอนุญาต 10103009665)
20.คลินิกทันตกรรมพญาไทเดนทัล (ใบอนุญาต 10103009465)
21.คลินิกทันตกรรมอุดมกิจทันตแพทย์ (ใบอนุญาต 10103008865)
22.แย้มยิ้มคลินิกทันตกรรม (ใบอนุญาต 10103008365)
23.คลินิกทันตกรรมบ้านรักยิ้มทันตแพทย์ (ใบอนุญาต 10103008565)
24.ชูศักดิ์คลินิกการแพทย์แผนไทย (ใบอนุญาต 10108001165)
25.คงหอมคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108001365)
26.รวมบุญคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108001265)
27.คลินิกการแพทย์แผนไทยเป้ยจินถงเยิ๋นถัง (ประเทศไทย) สาขาถนนเยาวราช (ใบอนุญาต 10108001465)
วันที่ 14 กุมภาพันธ์ 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 16 แห่งดังนี้
1.ลากราซคลินิกเวชกรรม สาขาสีลมคอมเพล็กซ์
2.รสิตาคลินิกเวชกรรม
3.คลินิกเวชกรรมเอเพ็กซ์ สาขาพารากอน
4.คลินิกเวชกรรมเอเพ็กซ์ สาขาลาดพร้าว ชั้น 5
5.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 1
6.ด็อกเตอร์มายด์ คลินิกเวชกรรม
7.คลินิกเวชกรรมแพทย์สุวัฒน์ 2
8.คลินิกเวชกรรมสุขภาพดี
9.เดอะยังคลินิกเวชกรรม
10.สยามเลเซอร์คลินิกเวชกรรม สาขาเซ็นทรัลปิ่นเกล้า
11.บางชันคลินิกเวชกรรม
12.นายแพทย์ประภัทรคลินิกเวชกรรม
13.คาซาพรีม่าคลินิกเวชกรรม
14.คลินิกทันตกรรมยูดีไลท์
15.คลินิกทันตกรรมลาดพร้าววังหิน
16.คลินิกทันตกรรมด๊อกเตอร์หอม.
วันที่ 7 กุมภาพันธ์ 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 26 แห่งดังนี้
1.เลเซอร์คลินิกเวชกรรม (Biz) (ใบอนุญาต 10101008765)
2.วิลล่าคลินิกเวชกรรม (Biz) (ใบอนุญาต 10101008965)
3.หมอวัชคลินิกเวชกรรม (Biz) (ใบอนุญาต 10101008865)
4.ธีระสุคลินิกเวชกรรม สาขา 3 (ใบอนุญาต 10101008665)
5.เอ็นวายซี คลินิกเวชกรรม (ใบอนุญาต 10101008165)
6.คลินิกเวชกรรมแพทย์เวชศาสตร์กรุงเทพ (ใบอนุญาต 10101008265)
7.คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งอัมรินทร์ (ใบอนุญาต 10102001965)
8.คลินิกทันตกรรมบางนา 1 (ใบอนุญาต 10103018764)
9.คลินิกทันตกรรมบ้านทันตแพทย์บุญชัย (ใบอนุญาต 10103006665)
10.บ้านรักฟันดี คลินิกทันตกรรม (ใบอนุญาต 10103006565)
11.คลินิกทันตกรรมทันตแพทย์เจริญ (ใบอนุญาต 10103009865)
12.ลานบุญอาศรมคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108001065)
13.เดอะทัชสหคลินิก (ใบอนุญาต 10110001865)
14.เดอะทัชสหคลินิก สาขาเดอะพรอมานาด (ใบอนุญาต 10110001965)
15.อิมเมจินี่คลินิกเวชกรรม สาขาพระราม 9 (ใบอนุญาต 10101014565)
16.วิเชียรคลินิกเวชกรรม (ใบอนุญาต 10101014265)
17.สยามเลเซอร์คลินิกเวชกรรม สาขาเซ็นทรัลพระราม 9 (ใบอนุญาต 10101013965)
18.สยามเลเซอร์คลินิกเวชกรรม สาขาเซ็นทรัลลาดพร้าว (ใบอนุญาต 10101014365)
19.มคลินทร์คลินิกเวชกรรม สาขาพระราม 9 (ใบอนุญาต 10101014165)
20.เคดี้โกรว์คลินิกเวชกรรม (ใบอนุญาต 10101014065)
21.สปริงคลินิกเวชกรรม (ใบอนุญาต 10101014465)
22.คลินิกเฉพาะทางด้านเวชกรรมไตเทียมราชวัตรกรุงเทพกรีฑา (ใบอนุญาต 10102002365)
23.แจ่มจันทร์คลินิกเฉพาะทางด้านเวชกรรมผิวหนัง (ใบอนุญาต 10102002265)
24.เอส แอนด์ ฟัน คลินิกทันตกรรม (ใบอนุญาต 10103008065)
25.คลินิกทันตกรรมบ้านหมอหน่อย สาขาถนนจันทน์ (ใบอนุญาต 10103008265)
26.สุขุมวิท 11 คลินิกทันตกรรม (นำส่ง OSS 3/2/65) (ใบอนุญาต 10103007865)
ประเภทรางวัลประจำปี ด้านเครื่องสำอาง จำนวน 6 รางวัล
1 บริษัท คิงส์สเตลล่า แลบบอราทอรี่ จำกัด
2 บริษัท กรีนสวิลล์ จำกัด
3 บริษัท กิฟฟารีน สกายไลน์ แลบบอราทอรี่ แอนด์ เฮลท์แคร์ จำกัด
4 บริษัทไบเออร์สด๊อรฟ (ประเทศไทย) จำกัด
5 บริษัท จอห์นสัน แอนด์ จอห์นสัน (ไทย) จำกัด
6 บริษัท พรอคเตอร์ แอนด์ แกมเบิล แมนูเฟคเจอรี่ง (ประเทศไทย) จำกัด
ประเภทรางวัลประจำปี ด้านวัตถุอันตรายฯ จำนวน 3 รางวัล
1 บริษัท เอิร์ธ (ประเทศไทย) จำกัด
2 บริษัท ไบรด์ บิวตี้ แคร์ คอสเมติก จำกัด
3 บริษัท อิคาร เทรดดิ้ง (ประเทศไทย) จำกัด
ประเภทรางวัลประจำปี ด้านผลิตภัณฑ์สุขภาพชุมชน จำนวน 4 รางวัล
1 วิสาหกิจชุมชนกลุ่มแม่บ้านผลิตเครื่องแกงบ้านหนองตาม จ. นครศรีธรรมราช
3 วิสาหกิจชุมชนกลุ่มขนมบ้านบุญมี จ. ฉะเชิงเทรา
4 วิสาหกิจชุมชนกลุ่มแม่บ้านทฤษฎีใหม่ (ขิงแปรรูปนวลอนันต์) จ. เพชรบูรณ์
ประเภทรางวัลประจำปี ด้านเครื่องสำอางและวัตถุอันตรายฯ จำนวน 2 รางวัล
1 บริษัท สแตนดาร์ด แมนูแฟคเจอรี่ง จำกัด เครื่องสำอางและวัตถุอันตรายฯ
2 บริษัท โพสเฮลท์แคร์ จำกัด เครื่องสำอางและวัตถุอันตรายฯ
ประเภทรางวัลประจำปี ด้านเครื่องมือแพทย์และเครื่องสำอาง จำนวน 1 รางวัล
1 บริษัท ไมลอทท์ แลบบอราทอรีส์ จำกัด เครื่องมือแพทย์และเครื่องสำอาง
คลินิกทันตกรรมนอกเวลาราชการ ทุกวันอังคารและพฤหัสบดี
คลินิกทันตกรรมนอกเวลาราชการ เพิ่มบริการด้านฟันปลอมและครอบฟัน สนใจติดต่อสอบถาม 074609500 ต่อ 7400 ช่วงเวลาราชการ
อายุรกรรมโรคไต โดย พญ.นภัสนันท์ ทุกวันจันทร์
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกอายุรกรรมโรคทั่วไปและอายุรกรรมโรคไต ให้บริการตรวจอายุรกรรมโรคไต อายุรกรรมทั่วไป เบาหวาน ความดัน ไขมัน โดย พญ.นภัสนันท์ อภิรัตนพันธุ์ อายุรแพทย์โรคไต เปิดบริการ ทุกวันจันทร์ เว้นวันหยุดนักขัตฤกษ์ เวลา 16.30-20.30 น. ณ ห้องตรวจเบอร์ 6
"เราทำงานเพื่อความสุข และความรุ่งโรจน์ของสังคม" - พันธกิจหลัก อมรินทร์ คอร์เปอเรชั่นส์
นอกจากการดำเนินกิจการต่าง ๆ แล้ว สิ่งที่เราทำควบคู่มาตลอดเกือบครึ่งศตวรรษ ภายใต้พันธกิจหลัก “เราทำงานเพื่อความสุข และความรุ่งโรจน์ของสังคม” ภายในงาน AMARIN EXPO 2023 จะมีการเปิดตัวโครงการ “อมรินทร์ อาสา” 2 โครงการสำคัญในปีนี้ คือ โครงการ “หนึ่งหัวใจ สู่ชีวิตใหม่” ซึ่งเป็นความร่วมมือกับมูลนิธิโรงพยาบาลเด็ก โดยสถาบันสุขภาพเด็กแห่งชาติมหาราชินี, บริษัท ซีเจเวิร์ค จำกัด (CJ WORK) และค่ายเพลง WHAT THE DUCK ในโครงการ “หนึ่งหัวใจ สู่ชีวิตใหม่” ระดมทุน 50 ล้านบาท เพื่อช่วยเหลือเด็กที่ป่วยด้วยโรคหัวใจพิการแต่กำเนิดขั้นวิกฤต ผ่านรูปแบบมิวสิคแคมเปญ และโครงการ “อ่านพลิกชีวิต” ร่วมบริจาคหนังสือจำนวน 150,000 เล่ม ให้ห้องสมุดโรงเรียนกว่า 1,000 แห่งทั่วประเทศ เฮอร์บาไลฟ์ เอเชีย แปซิฟิก เอ็กซ์ตร้าวาแกนซ่า ประจำปี 2566
เนื่องจากการสนับสนุนด้านสุขภาพและความเป็นอยู่ที่ดีกำลังเป็นที่ต้องการมากขึ้น ผู้จำหน่ายอิสระเฮอร์บาไลฟ์ได้ผนึกกำลังกันสานต่อพันธกิจของบริษัทในการช่วยให้ผู้คนมีชีวิตที่ดีที่สุด ในงานเฮอร์บาไลฟ์ เอเชีย แปซิฟิก เอ็กซ์ตร้าวาแกนซ่า ซึ่งจัดขึ้นที่สิงคโปร์ระหว่างวันที่ 19-21 พฤษภาคม โดยมีผู้เข้าร่วมงานมากกว่า 20,000 คน ตลอดสามวันของงานมุ่งเน้นไปที่การเพิ่มขีดความสามารถของผู้จำหน่ายอิสระ ด้วยการมอบความรู้และเครื่องมือในการสร้างชุมชนที่มีสุขภาพดีรอบตัว ผ่านการให้คำแนะนำแบบตัวต่อตัวและระบบสนับสนุนที่สร้างแรงบันดาลใจให้ผู้คนโอบรับวิถีชีวิตที่ดีต่อสุขภาพและกระฉับกระเฉงมากขึ้น
ไฮไลต์สำคัญของงานคือการกล่าวสุนทรพจน์หลักโดยคุณไมเคิล โอ จอห์นสัน (Michael O Johnson) ประธานและซีอีโอของเฮอร์บาไลฟ์ ซึ่งมาร่วมแบ่งปันวิสัยทัศน์ของเขาเกี่ยวกับเฮอร์บาไลฟ์ ในขณะที่เฮอร์บาไลฟ์มีความมุ่งมั่นที่จะก้าวขึ้นเป็นบริษัทและชุมชนด้านสุขภาพและความเป็นอยู่ที่ดีระดับแนวหน้า นอกจากนั้นยังมีการกล่าวสุนทรพจน์ของดร. ลุยจิ แกรตตัน (Luigi Gratton) รองประธานฝ่ายฝึกอบรม ซึ่งเป็นผู้นำการฝึกอบรมเชิงปฏิบัติการเกี่ยวกับผลิตภัณฑ์เฮอร์บาไลฟ์ และมาร่วมพูดคุยเกี่ยวกับความสำคัญของการสร้างเสริมลักษณะนิสัยเชิงบวกด้านโภชนาการ เพื่อความเป็นอยู่ที่ดีในระยะยาว
ดร.พญ.อติยา รุ่งแจ้ง ผู้ช่วยผู้อำนวยการคลินิกรอยัลไลฟ์ เวลเนส คลินิก กรุงเทพ กล่าวว่า นอกจากการดูแลสุขภาพร่างกายในระหว่างพักผ่อนช่วงวันหยุดในช่วงหน้าร้อน การดูแลสุขภาพผิวก็เป็นสิ่งสำคัญไม่แพ้กัน โดยปัจจัยที่ทำให้ผิวโดนทำร้าย มีทั้งปัจจัยภายนอก ได้แก่ สารอนุมูลอิสระ แสงแดด มลภาวะ สารเคมี เครื่องสำอาง หรือครีมทาผิวต่างๆ ที่ทำให้เกิดการระคายเคือง และปัจจัยภายใน ได้แก่ ผิวแห้ง หน้าแห้งขาดความชุ่มชื้น จากอากาศแห้ง การล้างหน้าบ่อย หรือการล้างหน้าด้วยน้ำอุ่นเกินไป และการดื่มน้ำน้อย การนอนหลับพักผ่อนไม่เพียงพอ ทำให้ขาดโกรทฮอร์โมน การที่ฮอร์โมนไม่สมดุล และการขาดวิตามินบำรุงผิวบางชนิดในเลือด
“เคล็ดลับการดูแลผิวมีทั้งการทำความสะอาดผิวด้วยผลิตภัณฑ์สำหรับทำความสะอาดเครื่องสำอางโดยเฉพาะเพื่อการขจัดคราบเครื่องสำอางออกจากผิวได้หมด สำหรับคนผิวมัน ไม่ควรล้างหน้าบ่อยเกินไป เพราะผิวจะยิ่งผลิตน้ำมันมากขึ้น หลังจากทำความสะอาดแล้ว ควรหมั่นบำรุงผิวด้วยมอยส์เจอไรเซอร์ โดยเลือกใช้ครีมหรือโลชั่นที่เหมาะสำหรับหน้าร้อน โดยเลือกชนิดเนื้อบางเบาเพื่อดูดซึมเข้าสู่ผิวหนังได้เร็ว และควรทาบำรุงผิวทุกครั้งหลังอาบน้ำ นอกจากนี้ ยังต้องปกป้องผิวด้วยครีมกันแดดที่มี SPF 15 ขึ้นไป โดยเลือกชนิดที่ป้องกันได้ทั้ง UVA และ UVB และควรทาก่อนออกกลางแจ้งอย่างน้อย 30 นาที และทาซ้ำทุกๆ 2 ชั่วโมงถ้าอยู่กลางแจ้ง โดยวิธีทากันแดดให้ได้มีประสิทธิภาพ แนะนำให้บีบครีม 2 ข้อนิ้ว ซึ่งเป็นปริมาณที่เหมาะสม”
Thailand Earth Trail สนามที่ 1 @ชะอม สระบุรี LINK
WARRIX PRESENTED THAILAND EARTH TRAIL SERIES 2023 (TETS2023) (ไทยแลนด์ เอิร์ธ เทรล) สนามที่ 1 @
"หากคิดถึงบรรยากาศของฤดูฝน ให้เทรล "ชะอม" เปิดฤดูกาลของคุณ"
วันจัดงาน : 22-23 กรกฎาคม 2566
สถานที่จัดงาน : ลานรักแคมป์ ต.ชะอม อ.แก่งคอย จ. สระบุรี .
ระยะการแข่งขัน. 40K Category : SRI-Challence 40 15K Category : SRI-Trailblazer 15 8K Category : SRI-Lite 8
สมาคมกัญชาภูเก็ต เปิดลงชื่อค้านนำกัญชากลับสู่ยาเสพติด LINK
สมาคมกัญชาภูเก็ต (Phuket Cannabis Association) ร่วมกันลงชื่อเพื่อแสดงเจตนารมณ์การไม่เห็นด้วย กับการนำกัญชากลับสู่ยาเสพติด เราจะเปิดรับจนกว่าจะมีการแต่งตั้งรัฐมนตรีสาธารณสุขคนใหม่ ทุกอย่างออนไลน์ ไม่มีค่าใช้จ่ายทั้งสิ้น โดยที่ระบบจะส่งเป็นไฟล์ PDF ให้สมาคมทางอีเมล์อีกที เพื่อเราจะได้ปริ้นออกมาเพื่อไปยื่นทางกรมกับทีมเขียนอนาคตกัญชาไทยอีกทีครับ เป้าหมาย 100,000 รายชื่อ
คลินิกพิเศษนอกเวลาในรพ.ทั่วไป จำแนกตามเขตสุขภาพ
ประเทศไทยจำแนกเขตสุขภาพเป็น 13 เขต โดยเขต 13 คือเฉพาะกรุงเทพมหานคร ส่วนเขตสุขภาพ 1-12 เริ่มตั้งแต่ภาคเหนือลงสู่ภาคใต้
เขตสุขภาพที่ 1
เขตสุขภาพที่ 2
เขตสุขภาพที่ 3
เขตสุขภาพที่ 4
คลีนิกพิเศษเฉพาะทางนอกเวลาราชการ(แผนกรังสีวิทยา)
รพ.หัวหิน สาขา 3 (ซอย 89) LINK
ตรวจรักษาโรคทั่วไป เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 8.30-15.30 น.
( หยุด วันพุธ สัปดาห์ที่ 1 และสัปดาห์ที่ 4 ) ของเดือน
เจาะเลือดล่วงหน้าก่อนวันนัดพบแพทย์ วันจันทร์-วันศุกร์ เวลา 8.00-10.00 น.
ทันตกรรม เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 8.30 -12.00 น. (รับจำนวนจำกัด)
ฉีดยาทำแผล เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 13.00-15.30 น.
ฉีดวัคซีนป้องกันโรคในเด็ก ตามช่วงอายุ วันพุธ สัปดาห์ที่ 1 และ สัปดาห์ที่ 3 ของเดือน (โดยสามารถนัดหมายล่วงหน้าได้ที่โรงพยาบาลหัวหิน สาขา 3)
คลินิกกัญชา เปิดให้บริการ วันศุกร์ เวลา 8.30-12.00 น. สัปดาห์ที่1-4 ของเดือน
แพทย์แผนไทยและการแพทย์ทางเลือก เปิดให้บริการ วันจันทร์ – วันอาทิตย์ เวลา 8.30-18.00 น. (นัดหมายล่วงหน้า โทร. 064-6326436)
สำหรับผู้รับบริการที่ใช้สิทธิการรักษาที่โรงพยาบาลหัวหินสามารถเข้ารับบริการได้ โดยไม่เสียค่าบริการเพิ่ม สอบถามรายละเอียดเพิ่มเติมได้ที่ รพ.หัวหิน สาขา 3 บ่อฝ้าย โทร. 032- 654575
คลินิกพิเศษด้านอายุรกรรม ระบบประสาท
1. อาวุธยุทธภัณฑ์ Weaponization
ผู้ประสงค์ร้ายอาจปรับเปลี่ยนจุดประสงค์ของ AI ให้มีความสามารถในการทำลายล้างสูง นำเสนอความเสี่ยงที่มีอยู่ในตัวของมันเอง และเพิ่มความเป็นไปได้ที่จะทำให้เกิดความไม่มั่นคงทางการเมือง ตัวอย่างเช่น วิธีการเรียนรู้การเสริมกำลังเชิงลึกถูกนำไปใช้กับการต่อสู้ทางอากาศ และเครื่องมือการเรียนรู้ด้วยเครื่องค้นหายาสามารถใช้เพื่อสร้างอาวุธเคมีได้
ในช่วงไม่กี่ปีที่ผ่านมา นักวิจัยได้พัฒนาระบบ AI สำหรับการโจมตีทางไซเบอร์โดยอัตโนมัติ (Buchanan et al., 2020, Cary et al., 2020) ผู้นำทางทหารได้หารือเกี่ยวกับการให้ระบบ AI เข้าควบคุมไซโลนิวเคลียร์อย่างเด็ดขาด (Klare 2020) และมหาอำนาจของ โลกปฏิเสธที่จะลงนามในข้อตกลงห้ามอาวุธอิสระ AI ที่ได้รับการฝึกฝนเพื่อพัฒนายาถูกนำมาใช้ใหม่อย่างง่ายดายเพื่อออกแบบอาวุธชีวเคมีที่มีศักยภาพ (Urbina et al., 2022) GPT-4 ซึ่งเป็นโมเดลที่ได้รับการฝึกฝนเกี่ยวกับข้อความทางอินเทอร์เน็ตและการเข้ารหัส สามารถทำการทดลองและสังเคราะห์สารเคมีในห้องปฏิบัติการในโลกแห่งความเป็นจริงได้โดยอัตโนมัติ (Boiko et al., 2023) อุบัติเหตุจากระบบการตอบโต้อัตโนมัติอาจลุกลามอย่างรวดเร็วและก่อให้เกิดสงครามครั้งใหญ่ได้ เมื่อมองไปข้างหน้า เราทราบว่าเนื่องจากประเทศที่มีระบบ AI ที่ชาญฉลาดที่สุดอาจมีความได้เปรียบเชิงกลยุทธ์ จึงอาจเป็นเรื่องยากสำหรับประเทศต่างๆ ที่จะหลีกเลี่ยงการสร้างระบบ AI ที่ติดอาวุธที่ทรงพลังมากขึ้นเรื่อยๆ แม้ว่าประเทศมหาอำนาจทั้งหมดจะรับรองว่าระบบที่พวกเขาสร้างขึ้นนั้นปลอดภัยและตกลงที่จะไม่สร้างเทคโนโลยี AI ที่ทำลายล้าง แต่ผู้ก่อการอันธพาลก็ยังสามารถใช้ AI เพื่อก่อให้เกิดอันตรายได้ การเข้าถึงระบบ AI อันทรงพลังที่ง่ายดายจะเพิ่มความเสี่ยงจากการใช้งานที่เป็นอันตรายฝ่ายเดียว เช่นเดียวกับอาวุธนิวเคลียร์และอาวุธชีวภาพ ตัวแสดงที่ไร้เหตุผลหรือมุ่งร้ายเพียงตัวเดียวก็เพียงพอแล้วที่จะก่อให้เกิดอันตรายในวงกว้าง ไม่เหมือนกับอาวุธรุ่นก่อน ระบบ AI ที่มีความสามารถที่เป็นอันตรายสามารถเพิ่มจำนวนได้อย่างง่ายดายด้วยวิธีการทางดิจิทัล
รศ.ดร.ต่อตระกูล ยมนาค กรรมการมูลนิธินโยบายสาธารณะเพื่อสังคมและธรรมาภิบาลที่จะมาสัมมนาในเรื่องของ "การเปิดเผยข้อมูลมีส่วนสำคัญต่อความสำเร็จของการต่อต้าน ปราบปรามคอร์รัปชันของประเทศต่าง ๆ ที่ทำได้สำเร็จทุกประเทศคือต้องมีรัฐบาลที่เข้ามาโดยสุจริต ไม่ต้องลงทุนใช้จ่ายเงินสนับสนุนหรือต้องได้รับเงินสนับสนุนจากกลุ่มทุนขนาดใหญ่ทีต้องชดใช้บุญคุณเมื่อได้มีอำนาจอยู่ในมือ"
“ข้อมูลที่สำคัญคือข้อมูลของผู้แทนราษฎร นักการเมืองที่มีตำแหน่งในรัฐบาล ที่ชี้ให้เห็นว่าเมื่อตอนเข้ามารับตำแหน่งมีทรัพย์สินเท่าไหร่ เมื่อหมดวาระแล้วเพิ่มขึ้นขนาดไหน มันเห็นชัดเจน ที่ประชาชนควรรับทราบและติดตามได้ ซึ่งข้อมูลเหล่านี้อยู่ที่ ปปช. หากติดเรื่องข้อกฎหมายก็ต้องแก้ คนในตำแหน่งสูงมีอำนาจมีอิทธิพลไม่ว่าจะทำอะไร ก็ควรจะต้องนำข้อมูลม้าปิดเผย นี่คือสิ่งสำคัญที่อยากฝากไว้”
“การส่งต่อข้อมูลต้องเป็นมาตรฐาน ข้อมูลเป็น Digital data ที่ทำให้เข้าใจได้ง่ายขึ้น และข้อมูลต้องมีความสมบูรณ์ อัพเดตตลอดเวลา และมีครบทุกมิติ เมื่อข้อมูลถูกเปิดประชาชนก็จะเข้าถึงได้”
โครงการ Picture Book ได้ดำเนินการตั้งแต่เดือนตุลาคมปี 2564


สำหรับโครงการ Picture Book ได้ดำเนินการตั้งแต่เดือนตุลาคมปี 2564 จนถึงเดือนเมษายนที่ผ่านมา ซึ่งตลอดโครงการจะเห็นได้ว่านักเรียนสามารถฝึกคิดวิเคราะห์ได้ดียิ่งขึ้นผ่านสื่อการสอนอย่างหนังสือภาพ ด้านนางสาวพรสุรีย์ กอนันทา รองประธานกรรมการบริหาร ฝ่ายกิจการองค์กร บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด กล่าวเพิ่มเติมว่า “เราเล็งเห็นว่าความสำคัญของการอ่าน ไม่ใช่เพียงแต่ต้องอ่านออกเท่านั้น โดยการใช้หนังสือภาพสามารถช่วยส่งเสริมกระบวนการคิด วิเคราะห์ และการอ่านอย่างมีความหมายได้อย่างแท้จริง ดังนั้นเพื่อส่งเสริมกระบวนการคิดอย่างมีวิจารญานให้กับเด็กตั้งแต่อายุน้อย เราจึงได้ตั้งเป้าหมายไปที่กลุ่มนักเรียนระดับประถมศึกษาปีที่ 1- 4 จำนวนประมาณ 600 คน
ใน 16 โรงเรียนจาก 7 จังหวัดทั่วประเทศ โดยเรียนกับครูที่ผ่านการอบรมในโครงการ Chevon Enjoy Science จำนวน 32 คน ซึ่งปลายทางของโครงการดังกล่าว เราได้เห็นว่าเด็กๆ รักการอ่านมากขึ้น อีกทั้งยังสามารถแสดงความคิดวิเคราะห์ออกมาได้อย่างเป็นระบบ ซึ่งสอดคล้องกับเป้าหมายของโครงการ Chevron Enjoy Science ที่เน้นเตรียมความพร้อมด้านทักษะสะเต็มให้แก่เยาวชน เพื่อเติบโตมาเป็นพลังคนที่สำคัญแก่ประเทศชาติในอนาคต ตามความมุ่งมั่นของเชฟรอนที่เชื่อว่าการเปลี่ยนแปลงต้องเริ่มจากการศึกษา ซึ่งเป็นก้าวแรกที่สำคัญ”
กิโล Kilo Spirits สุรากลั่นจากฝั่งอันดามัน กระบี่ LINK
Kilo Spirits แบรนด์สุรากลั่นจากจังหวัดกระบี่ เริ่มก่อตั้งในปี 2017 โรงนี้ถือเป็นสุรากลั่นโรงที่ห้าในจังหวัดกระบี่ เริ่มต้นจากสามีชาวอังกฤษและภรรยาชาวไทยที่คบหากันมานานกว่า 20 ปี แต่มาเริ่มคิดจะทำสุรากลั่นจริงๆช่วงก่อนล็อคดาวน์ครั้งแรก ทำให้พวกเค้าต้องเรียนคลาสออนไลน์และเดินทางไปดูงานตามโรงเหล้าที่ต่างประเทศหลังจากคลายล็อคดาวน์
แบรนด์นี้มีเหล้าทั้งหมดสองตัวคือ จินและวอดก้า กำลังจะทดลองทำเหล้ารัมจากน้ำตาลเพิ่มอีกหนึ่งตัว เหล้าของโรงนี้ใช้น้ำอ้อยสดคั้นแล้ว จากเกษตรกรในจังหวัดกระบี่ ที่ทางโรงได้รับสมัครเกษตรกรเข้ามาเป็นพนักงาน และใช้น้ำอ้อยนั้นเป็นวัตถุดิบหลักในการหมักให้เกิดแอลกอฮอล์ จากนั้นนำไปกลั่นทั้งหมด 3 รอบเพื่อให้ได้แอลกอฮอล์95% แล้วจึงนำหัวเชื้อนี้ไปบ่มหรือเจือจางให้ได้กลิ่น ได้รสชาติ ได้ปริมาณแอลกอฮอล์ตามที่ต้องการต่อไป
ข้อมูลและภาพจากเพจประชาชนเบียร์
หลักสูตรด้าน ดิจิทัลเอไอ ปัญญาประดิษฐ์ (Digital AI) ปี 2566 LINK
- ITM123: Development of Communication Skills and Communication Management Processes in the Organization Effectively: การพัฒนาทักษะการสื่อสาร และกระบวนการบริหารจัดการการสื่อสารในองค์กรอย่างมีประสิทธิภาพ : ค่าเรียน 7,000 วันที่ฝึกอบรม : 07/12/2566 - 08/12/2566
- ITM123: Development of Communication Skills and Communication Management Processes in the Organization Effectively: การพัฒนาทักษะการสื่อสาร และกระบวนการบริหารจัดการการสื่อสารในองค์กรอย่างมีประสิทธิภาพ : ค่าเรียน 7,000 วันที่ฝึกอบรม : 30/10/2566 - 31/10/2566
- ITM103: IT Security and Cybersecurity Management: การบริหารจัดการความมั่งคงปลอดภัยด้านเทคโนโลยีสารสนเทศ และความมั่นคงปลอดภัยทางไซเบอร์ขององค์กร : ค่าเรียน 7,500 วันที่ฝึกอบรม : 07/09/2566 - 08/09/2566
- ITM027: การพัฒนากระบวนการบนมาตรฐาน ISO/IEC 27001:2022 : ค่าเรียน 14,445 วันที่ฝึกอบรม : 15/08/2566 - 18/08/2566
- ITM123: Development of Communication Skills and Communication Management Processes in the Organization Effectively: การพัฒนาทักษะการสื่อสาร และกระบวนการบริหารจัดการการสื่อสารในองค์กรอย่างมีประสิทธิภาพ : ค่าเรียน 7,000 วันที่ฝึกอบรม : วันที่ฝึกอบรม : 10/08/2566 - 11/08/2566
- [CSM3] หลักสูตรการบริหารจัดการและการรับมือกับภัยคุกคามทางไซเบอร์ รุ่นที่ 3 (Cyber Security Incident Management) : ค่าเรียน 34,900 วันที่ฝึกอบรม : 18/07/2566 - 21/07/2566
- CTS008: VMware NSX: Install Configure Manage : ค่าเรียน 26,750 วันที่ฝึกอบรม : 10/07/2566 - 14/07/2566
- DSA002: AI : Python for Data Analyst Programming : ค่าเรียน 14,445 10/07/2566 - 12/07/2566
- [SOC4] หลักสูตรศูนย์ปฏิบัติการเฝ้าระวังความมั่นคงปลอดภัยระบบเทคโนโลยีสารสนเทศ รุ่นที่ 4 (Security Operations Center: SOC) : ค่าเรียน 34,900 04/07/2566 - 07/07/2566
- IPP016: Deep Learning for Image Applications[DLI] : ค่าเรียน 12,500 14/06/2566 - 15/06/2566
- ITM115: IT Security Control and Audit Based on ISO/IEC 27001: การควบคุมและตรวจสอบความปลอดภัยของระบบเทคโนโลยีสารสนเทศตามมาตรฐาน ISO/IEC 27001 : ค่าเรียน 12,840 12/06/2566 - 15/06/2566
- ITM123: Development of Communication Skills and Communication Management Processes in the Organization Effectively: การพัฒนาทักษะการสื่อสาร และกระบวนการบริหารจัดการการสื่อสารในองค์กรอย่างมีประสิทธิภาพ : ค่าเรียน 7,000 วันที่ฝึกอบรม : 01/06/2566 - 02/06/2566
- DSA006: Data Science with Python and Jupyter : ค่าเรียน 11,770 วันที่ฝึกอบรม : 29/05/2566 - 31/05/2566
- IPP013: Chatbot Design for Business (Package A for Management) : ค่าเรียน 7,000 วันที่ฝึกอบรม : 23/05/2566 - 23/05/2566
- IPP013: Chatbot Design for Business (Package B for Developer) : ค่าเรียน 18,500 วันที่ฝึกอบรม : 23/05/2566 - 25/05/2566
- ITM027: การพัฒนากระบวนการบนมาตรฐาน ISO/IEC 27001:2022 : ค่าเรียน 13,500 วันที่ฝึกอบรม : 15/05/2566 - 19/05/2566
- SEC004: Cyber Security for Smart User : ค่าเรียน 9,095 วันที่ฝึกอบรม : 27/03/2566 - 28/03/2566
- [ITA18] หลักสูตร IT Audit for Non - IT Auditor รุ่นที่ 18 : ค่าเรียน 21,400 วันที่ฝึกอบรม : 20/03/2566 - 24/03/2566
- [DPO3] หลักสูตรฝึกอบรมเชิงปฏิบัติการ การตรวจติดตามของเจ้าหน้าที่คุ้มครองข้อมูลส่วนบุคคล เพื่อให้เป็นไปตามข้อกำหนดของ พ.ร.บ. คุ้มครองข้อมูลส่วนบุคคล รุ่นที่ 3 (PDPA Compliance Audit Workshop for DPOs) : ค่าเรียน 18,500 วันที่ฝึกอบรม : 22/02/2566 - 24/02/2566
- IPP017: การพัฒนาระบบบัญชีข้อมูลหน่วยงานโดยใช้แพลตฟอร์ม CKAN Open-D : ค่าเรียน 19,795 วันที่ฝึกอบรม : 14/02/2566 - 16/02/2566
- [PDPA5] หลักสูตรฝึกอบรมเชิงปฏิบัติการ การดำเนินการให้สอดคล้องกับ พ.ร.บ. คุ้มครองข้อมูลส่วนบุคคล รุ่นที่ 5 (Personal Data Protection Act - Compliance Workshop) : ค่าเรียน 18,500 วันที่ฝึกอบรม : 18/01/2566 - 20/01/2566
มุมมองของคนไทยต่ออุปกรณ์และเทคโนโลยีเพื่อการดูแลสุขภาพส่วนบุคคล
ร้อยละ 74 ของกลุ่มตัวอย่างในประเทศไทยเผยว่าพวกเขาพร้อมที่จะปรับเปลี่ยนพฤติกรรมการดูแลสุขภาพ หากพวกเขาสามารถเข้าถึงอุปกรณ์และเทคโนโลยีเพื่อการดูแลสุขภาพส่วนบุคคลได้ แบ่งเป็น ร้อยละ 86 ของกลุ่ม Gen X ร้อยละ 85 ของกลุ่ม Baby Boomers และร้อยละ 73 ของกลุ่ม Millennials
จากทฤษฎีหลักการทางวิทยาศาสตร์ เมื่อมีสิ่งของที่ใหญ่พอสมควรและอยู่นิ่งลงไปวาง แนวโน้มคือมีสิ่งมีชีวิตมาเกาะติด พร้อมสัตว์ทะเลเข้ามาอาศัยอยู่ โดยขาแท่นหลุ่มปิโตรเลียมที่นำไปจัดวางเป็นปะการังเทียมนั้นอยู่กับทะเลมายาวนานกว่า 30 ปี และเรียกได้ว่ากลายเป็นส่วนหนึ่งของท้องทะเลไปเสียแล้ว โดยจากลักษณะที่ซับซ้อน และวัสดุที่ทำจากเหล็กกล้าและมีพื้นที่ผิวแข็ง ทำให้มีคุณสมบัติเหมาะแก่การเป็นที่อยู่อาศัยและที่หลบภัยของสัตว์ทะเลเป็นอย่างดี โดยมีการวางแผนงานและนำกระบวนการจัดการให้เป็นไปตามมาตรฐานทางสิ่งแวดล้อมมาปรับใช้ในโครงการ ซึ่งส่วนของขาแท่นดังกล่าวไม่เคยสัมผัสกับปิโตรเลียมมาก่อน และเป็นวัสดุที่เป็นมิตรต่อสิ่งแวดล้อม
หมอคนที่ 2 คือหมอสาธารณสุข
หมอคนที่ 2 คือหมอสาธารณสุข จะประสานต่อทีมสุขภาพจิตเพื่อลงพื้นที่ประเมินอาการเบื้องต้นและประสานทีมตำรวจนำส่งผู้ป่วยเข้าสู่กระบวนการรักษา โดยมีทีมหอผู้ป่วยจิตเวช ช่วยดูแล บำบัด และฟื้นฟู ด้วยทีมสหวิชาชีพ พยาบาล เภสัชกรจิตเวชศาสตร์ นักจิตวิทยา และแพทย์ประจำตึก ซึ่งจะเป็นหมอคนที่ 3 ร่วมมือกัน
Gastronomy City ภูเก็ตเมืองสร้างสรรค์ด้านวิทยาการอาหาร
เสาที่ 1 Gastronomy City ภูเก็ตเมืองสร้างสรรค์ด้านวิทยาการ อาหารที่ปลอดภัย ดีต่อสุขภาพ และเป็นมิตรกับสิ่งแวดล้อม เพื่อเพิ่มมูลค่าทางเศรษฐกิจ 25 เมษายน 2566 ทำหมันสุนัขและแมวในเขตพื้นที่เทศบาลนครระยอง LINK
25 เมษายน 2566 เทศบาลนครระยอง โดยนายวิชิต ศรีชลา นายกเทศมนตรีนครระยอง ร่วมกับสำนักงานปศุสัตว์จังหวัดระยอง ร่วมจัดกิจกรรมทำหมันสุนัขและแมวในเขตพื้นที่เทศบาลนครระยอง
เพื่อส่งเสริมการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้า ณ ลานสนามหญ้าข้างถนนริมน้ำ โดยมีประชาชนเข้าร่วมโครงการจำนวน 25 ราย ทำหมันสุนัขและแมวรวมจำนวน 25 ตัว
ทั้งหมดเตรียมรับมือกับความท้าทายในวิชาชีพอย่างไร?
ธนทัต: ต้องเวิร์กไลฟ์บาลานซ์ ทั้งสุขภาพกายและสุขภาพจิต เพราะหากเราซึ่งเป็นผู้ที่จะไปดูแลรักษาคนไข้เป็นพยาบาลที่มีสุขภาพกายและสุขภาพจิตที่ดีแล้ว คนไข้ก็จะได้รับการพยาบาลที่ดีทั้งกายและใจด้วยเช่นกัน
ธนาคารกรุงเทพ : เริ่มยืนยันใบหน้าได้ตั้งแต่เมษายน 2566 ทุกสาขาทั่วประเทศ LINK
ธนาคารกรุงเทพเริ่มให้ยืนยันตัวตนด้วยใบหน้า เมื่อทำธุรกรรมผ่านโมบายแบงก์กิ้ง ตั้งแต่เดือนพฤษภาคม 2566 เป็นต้นไป สิ่งที่เจ้าของบัญชีต้องทำคือ
✅นำบัตรประชาชนไปอัปเดตข้อมูลให้เป็นปัจจุบัน
✅ถ่ายภาพใบหน้าได้ที่ธนาคารกรุงเทพ ทุกสาขาทั่วประเทศ
ธนาคารกรุงเทพ ยกระดับความปลอดภัยในการใช้งานแอปพลิเคชัน ดังนี้
1. จำกัดการใช้งานแอป 1 อุปกรณ์/ท่าน เท่านั้น
2. บล็อกการเข้าถึงแอปจากทางไกล
3. ปรับลดวงเงินตั้งต้น โอน / จ่าย / เติม จากเดิม 200,000 บาท/วัน เป็น 50,000 บาท/วัน
4. เพิ่มการยืนยันตัวตนด้วยใบหน้าในการทำธุรกรรม โอน / จ่าย / เติม ผ่านโมบายแบงก์กิ้ง ดังนี้ (เริ่มเมษายน 2566)
◾ รายการโอน / เติมเงิน e-Wallet ตั้งแต่ 50,000 บาท/รายการ ขึ้นไป
◾ รายการโอน / จ่าย / เติม ที่ทำให้ยอดสะสมต่อวัน ครบทุก 200,000 บาท
◾ การปรับเพิ่มวงเงินโอน / จ่ายเงิน ผ่านแอป
หากต้องการคำแนะนำ บริการ หรือความช่วยเหลือเพิ่มเติม สามารถติดต่อธนาคารได้ที่สาขาธนาคารกรุงเทพทั่วประเทศ หรือบัวหลวงโฟน โทร.1333 หรือ 02-6455555
ข้อมูลอ้างอิง Bangkok Bank เฟสบุ๊คธนาคารกรุงเทพ
201 คลองต้นสน
202 คลองตรง
203 คลองตรง(จอมทอง)
204 คลองตรง(บางขุนเทียน)
205 คลองตรงข้ามคลองครูเสงี่ยม
206 คลองตราชู
207 คลองตัน
208 คลองตากือ
209 คลองตากือ 1
210 คลองตาขาว
211 คลองตาเจริญ
212 คลองตาฉ่ำ
213 คลองตาฉุย
214 คลองตาโฉม
215 คลองตาช้าง
216 คลองตาเชื่อม
217 คลองตาแซ
218 คลองตาดา
219 คลองตาแดง
220 คลองตาตี่
221 คลองตาเตี้ย
222 คลองตาถึง
223 คลองตาทอง
224 คลองตาทอด
225 คลองตาเทียบ
226 คลองตาเทียม
227 คลองตาแท้
228 คลองตาโท้
229 คลองตาบ๊อ
230 คลองตาบัว
231 คลองตาปลั่ง(บางขุนเทียน)
232 คลองตาปลั่ง(หนองแขม)
233 คลองตาเปล่ง
234 คลองตาเปีย
235 คลองตาแป้น
236 คลองตาผิน
237 คลองตาแผลง
238 คลองตาพุก
239 คลองตาพุก(ลาดกระบัง)
240 คลองตาพูน (ทางเข้าวัดบุญยประดิษฐ์)
241 คลองตาเพชร
242 คลองตาเพิ่ม
243 คลองตาม่วง
244 คลองตาม่วง(จอมทอง)
245 คลองตามั่ง
246 คลองตามี
247 คลองตาเม้ง
248 คลองตาย้ง
249 คลองตายง(จอมทอง)
250 คลองตายง(บางขุนเทียน)
251 คลองตารุ่ง(จอมทอง)
252 คลองตารุ่ง(บางขุนเทียน)
253 คลองตาเร่ง(คันนายาว)
254 คลองตาเร่ง(บึงกุ่ม)
255 คลองตาเริก
256 คลองตาลิด
257 คลองตาวงษ์
258 คลองตาสอน
259 คลองตาสอนเก่า
260 คลองตาสาด (คลองคู้)
261 คลองตาสุข
262 คลองตาสุ่ม
263 คลองตาหนวด
264 คลองตาหนัง
265 คลองตาห่วง
266 คลองตาเหล็ก
267 คลองตาใหม่
268 คลองตาอูฐ
269 คลองเตย
270 คลองเตย
271 คลองเต้าปูน
272 คลองเตาอิฐ
273 คลองโต๊ะดำ
274 คลองโต๊ะนิล
275 คลองโต๊ะพุด
276 คลองโต๊ะยอ
277 คลองโต๊ะรอ
278 คลองทรงกระเทียม
279 คลองทรงเทวดา
280 คลองทวีวัฒนา
281 คลองท่อ
282 คลองทองหลาง
283 คลองทับช้างบน
284 คลองทับช้างล่าง
285 คลองทับยาว
286 คลองท่าวาสุกรี
287 คลองทุ่ง กม.11
288 คลองทุ่งบางซ่อน
289 คลองเทพยนต์
290 คลองเทพยนต์ 2
291 คลองเทพราช
292 คลองเทพา
293 คลองไทรชะมด
294 คลองนกกระจอก
295 คลองนกกระจิบ
296 คลองนกกระทุง
297 คลองนกเล็ก
298 คลองนครเนื่องเขต
299 คลองนา(ทวีวัฒนา)
300 คลองนา(บางขุนเทียน)
301 คลองนา(ประเวศ)
302 คลองนางชี
303 คลองนางปาน
304 คลองนางหงษ์
305 คลองนาซอง
306 คลองนาตับ
307 คลองนายเจริญ
308 คลองนายผล
309 คลองนายสนม
310 คลองนายโอ๋
311 คลองนาหมอน
312 คลองน้ำแก้ว
313 คลองน้ำดอกไม้
314 คลองน้ำตาล
315 คลองน้ำอ้อย
316 คลองเนตรนุสรณ์
317 คลองเนินทราย
318 คลองในซอยพุทธบูชา 44
319 คลองในตรอกกระจก
320 คลองบวรรังษี
321 คลองบัว
322 คลองบัว(จอมทอง)
323 คลองบัว(บางเขน)
324 คลองบัวคลี่
325 คลองบัวลอย
326 คลองบางกระดี่
327 คลองบางกระดี่น้อย
328 คลองบางกระบือ
329 คลองบางกอกใหญ่
330 คลองบางกะปิ
331 คลองบางขนุน
332 คลองบางขโมย
333 คลองบางขวด
334 คลองบางขวด (ตาเร่ง)
335 คลองบางขี้
336 คลองบางขี้เก้ง
337 คลองบางขี้แก้ง
338 คลองบางขุนเทียน
339 คลองบางขุนนนท์
340 คลองบางขุนพรหม
341 คลองบางเขน
342 คลองบางเขนใหม่
343 คลองบางค้อ
344 คลองบางคอแหลม
345 คลองบางคูเวียง(ทวีวัฒนา)
346 คลองบางคูเวียง(ลาดกระบัง)
347 คลองบางแค
348 คลองบางโคล่ - บ้านป่า
349 คลองบางโคล่น้อย
350 คลองบางโคล่วัด
351 คลองบางโคล่สาร
352 คลองบางโคล่ใหญ่
353 คลองบางโคลัด
354 คลองบางจาก
355 คลองบางจาก
356 คลองบางจาก(ทุ่งครุ)
357 คลองบางจาก(บางพลัด)
358 คลองบางจาก(พระโขนง 2)
359 คลองบางจาก-บางเพลี้ย
360 คลองบางจากล่าง
361 คลองบางชัน
362 คลองบางช้าง
363 คลองบางเชือกหนัง
364 คลองบางซ่อน
365 คลองบางซื่อ
366 คลองบางด้วน
367 คลองบางด้วนใต้ - ราชมนตรี
368 คลองบางด้วนเหนือ
369 คลองบางตลาด
370 คลองบางตาล(ตลิ่งชัน)
371 คลองบางตาล(ทวีวัฒนา)
372 คลองบางเตย
373 คลองบางทองหลาง
374 คลองบางน้อย(ตลิ่งชัน)
375 คลองบางน้อย(ทวีวัฒนา)
376 คลองบางนา
377 คลองบางนางจีน
378 คลองบางนางลี่
379 คลองบางน้ำชน
380 คลองบางบอน
381 คลองบางบอน
382 คลองบางบำหรุ
383 คลองบางบูน
384 คลองบางประทุน
385 คลองบางประทุน - คลองต้นสน
386 คลองบางประทุน - คลองบางระแนะ 2
387 คลองบางประทุน - บางระแนะ
388 คลองบางปะกอก
389 คลองบางปะแก้ว
390 คลองบางไผ่
391 คลองบางไผ่ตะวันตก
392 คลองบางไผ่ตะวันออก
393 คลองบางพรม
394 คลองบางพรหม
395 คลองบางพระครู
396 คลองบางพราน
397 คลองบางพลัด
398 คลองบางพลู
399 คลองบางพึ่ง
400 คลองบางพูด
ตอกย้ำพันธกิจของฟูจิฟิล์ม ที่มีต่อสังคม
การจัดงาน FUJIFILM NEVER STOP Running 2023 นับเป็นการตอกย้ำพันธกิจของฟูจิฟิล์มในการพัฒนานวัตกรรมและโซลูชันทางการแพทย์ล้ำสมัยเพื่อสร้างเสริมสุขภาพที่ดีขึ้นให้คนในสังคม มร. โซ มารูโอะ กรรมการผู้จัดการ บริษัท ฟูจิฟิล์ม (ประเทศไทย) จำกัด เผยถึงความสำเร็จในการจัดงานการกุศลและการตอบรับอย่างดีเยี่ยมจากผู้เข้าร่วม โดยกล่าวว่า “เรายินดีเป็นอย่างยิ่งที่ได้จัดงาน FUJIFILM NEVER STOP Running 2023 เพื่อส่งเสริมสังคมสุขภาพดีพร้อมส่งมอบรายได้โดยไม่หักค่าใช้จ่ายให้แก่มูลนิธิแพทย์อาสาสมเด็จพระศรีนครินทราบรมราชชนนี (พอ.สว.) เป็นจำนวนทั้งสิ้น 587,800 บาท เพื่อสนับสนุนการทำงานอย่างทุ่มเทของบุคลากรทางการแพทย์ในการเดินทางออกตรวจสุขภาพให้แก่ผู้คนในถิ่นทุรกันดาร เราภาคภูมิใจที่ได้ร่วมเป็นส่วนหนึ่งในการช่วยเหลือสังคมไทย” นอกจากนี้ กิจกรรมในครั้งนี้ยังส่งเสริมการสร้างความตระหนักรู้เกี่ยวกับความสำคัญของการตรวจสุขภาพเป็นประจำเพื่อเพิ่มโอกาสในการพบโรคได้อย่างทันท่วงทีอีกด้วย
ด้าน Mr. Michael James Massimino อดีตนักบินอวกาศ NASA ร่วมบอกเล่าประสบการณ์การใช้ชีวิตในสภาวะไร้น้ำหนัก และกล่าวว่า อาหารที่นักบินอวกาศต้องรับประทานนั้น ความปลอดภัยไร้สารตกค้างเป็นสิ่งสำคัญที่สุดเพราะจะส่งผลต่อสุขภาพนักบินอวกาศในระยะยาว และสารอาหารที่เหมาะสมก็มีผลอย่างมากต่อมวลกระดูกและกล้ามเนื้อของนักบินแต่ละคน ดังนั้นอาหารหมวดโปรตีนจึงต้องมีการจัดเตรียมเป็นพิเศษ และที่ผ่านมาอาหารส่วนใหญ่จะออกมาในรูปแบบอาหารแห้ง (dehydrate food) ที่ต้องเติมน้ำบนนั้น หรือแบบพร้อมทาน (ready-to-eat) ด้วยเทคโนโลยีรีทอร์ต (Retort) ที่สามารถแกะกินได้ทันที แต่สิ่งที่ต่างกับขณะอยู่บนพื้นโลก คือ ลักษณะของอาหารและซอสต่างๆจะมีความข้นเหนียว เพื่อให้มันติดกับช้อนให้คุณกินได้สะดวก หรือกินจากแพ็คเกจเลย และอีกสิ่งที่แตกต่าง คือ เรื่องประสาทสัมผัสการรับรสและกลิ่นของอาหารที่ลดลง ทำให้เรารับรู้รสชาติอาหารได้น้อยลง อาหารประเภท สไปซี่ฟู้ดจึงเป็นที่นิยมในหมู่นักบิน
"Thaifood Mission to Space เป็นโครงการที่ดี ซึ่งไม่เพียงแต่นักบินอวกาศจะได้บริโภคอาหารที่หลากหลายและปลอดภัย ยังเป็นการยกระดับความปลอดภัยทางอาหารแก่ผู้บริโภคทั่วโลก และเป็นการสร้างชื่อเสียงให้แก่เนื้อไก่ของไทยด้วย" Michael กล่าว
เพราะฉะนั้นผู้ป่วยที่เข้ามารับการรักษาที่โรงพยาบาลเอส สไปน์ สามารถที่จะพบแพทย์ท่านหนึ่ง แล้วรักษากับแพทย์อีกท่านได้ โดยเข้าใจได้ง่ายไม่ต้องสอบถามอะไรเพิ่มเติม และก็ยินดีที่จะช่วยดูเคสให้กันและกัน เป็นความเห็นที่ตรงกัน อันนี้ก็เป็นส่วนสำคัญหนึ่งที่ทำให้การรักษาของเรามีคุณภาพใกล้เคียงกัน โดยมีมาตรฐานเดียวกัน แล้วก็มีความเข้าใจที่ตรงกัน
การอบรมเดือนมิถุนายน 2566
แผนกฝึกอบรมมูลนิธิป่อเต็กตึ๊ง จัดอบรมเดือนมิถุนายน 2566 ทั้งหมด 5 หลักสูตร ดังนี้
1. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 5/66
- รับสมัครจำนวน 100 คน
- อบรมวันที่ 7 มิ.ย.66 เวลา 08.30-16.30 น."(ผ่านระบบ Google Meet)"
2. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (On-site) รุ่นที่ 4/66
- รับสมัครจำนวน 60 คน
- วันอบรม วันที่ 16 มิ.ย.66 เวลา 08.30 - 16.30 น."ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
3. หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 5/66
- รับสมัครจำนวน 60 คน
- วันอบรม
ภาคทฤษฎี (Online) วันที่ 9 มิ.ย. 66 เวลา 09.00 - 12.00 น. อบรมผ่านระบบ Google Meet
ภาคปฏิบัติ (On-site) วันที่ 17 มิ.ย.66 #มี2รอบให้เลือกเช้าหรือบ่าย เวลา 09.00-12.00 หรือ 13.00-16.00 "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
4.หลักสูตรนิติเวชเบื้องต้นและการจัดการศพเป็นจำนวนมาก รุ่นที่ 1
- รับสมัครจำนวน 60 คน
- อบรมทฤษฎีวันที่ 23 มิ.ย.66 “ณ มหาวิทยาลัยหัวเฉียวเฉลิมพระเกียรติ วิทยาเขตยศเส”
5.หลักสูตรพนักงานขับรถพยาบาลและขับขี่ปลอดภัย รุ่นที่2
- รับสมัครจำนวน 30 คน
- อบรมทฤษฎีวันที่ 9 มิ.ย. 66 07.00-19.00 น.
- อบรมทฤษฎีวันที่ 10 มิ.ย. 66 07.00-18.00 น.
*หลักสูตรที่ 4 และ 5 สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊งเท่านั้น !!!!!!!
วันอังคาร ทำท่า กาง-หุบขาในท่ายืน
ยืนเท้าชิด กางขาด้านซ้าย - ขวา สลับกันช้า ๆ ข้างละ 30 ครั้ง วันละ 3 ชุด
ภาพบรรยากาศภายในพิพิธภัณฑ์ราชทัณฑ์
*ภาพจากเพจพิพิธภัณฑ์ราชทัณฑ์
เส้นทางที่ 1 การแพทย์บูรณาการ การแพทย์แผนไทย-จีนควบคู่ศูนย์ดูแลผู้สูงอายุ
เส้นทางที่ 1 การแพทย์บูรณาการ การแพทย์แผนไทย-จีนควบคู่ศูนย์ดูแลผู้สูงอายุ ณ โรงพยาบาลการแพทย์แผนไทยและการแพทย์บูรณาการ วิทยาลัยสหเวชศาสตร์ มหาวิทยาลัยราชภัฏสวนสุนันทา (โทร. 034-773904) ที่เดียวครบจบเรื่องการแพทย์แผนไทย แผนจีน แพทย์แผนไทยประยุกต์ งานแพทย์สมุนไพร ต้นแบบแหล่งปลูกกัญชาทางการแพทย์ พร้อมสปาเพื่อสุขภาพ รับบริการสปาระดับเลิศ ที่สุนันทสมุทรสปา เรียนรู้ดูงานศูนย์ดูแลผู้สูงอายุ ที่เป็นแหล่งบ่มเพาะสร้างบุคลากรในสายงานการบริบาลผู้สูงอายุสู่สังคมมายาวนาน
ให้บริการวันจันทร์ - ศุกร์ เท่านั้น และต้องสำรองที่นั่ง-นัดหมายล่วงหน้าทุกจุดบริการ จำกัดจำนวนไม่เกินวันละ 30 ท่าน เพื่อการบริการที่ดีที่สุดสำหรับทุกท่านที่เข้าเยียมชมและใช้บริการ
คลินิกพยาบาลชุมชนอบอุ่น - สภาการพยาบาล TNMC
“คลินิกพยาบาลชุมขนอบอุ่น” คลินิกการพยาบาลและการผดุงครรภ์ซึ่งเป็นเครือข่ายหน่วยบริการร่วมให้บริการของสำนักงานหลักประกันสุขภาพแห่งชาติ
ตามที่ สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) มีนโยบายในการผลักดันให้ประชาชนเข้าถึงบริการสุขภาพที่มีคุณภาพอย่างทั่วถึงและเท่าเทียม จึงได้หาวิธีจัดบริการรูปแบบใหม่เพื่อให้ประชาชนสามารถรับบริการได้ในชุมชน โดยไม่ต้องเดินทางไปโรงพยาบาล ซึ่งนอกจากทำให้ประชาชนสะดวกขึ้นและลดค่าใช้จ่ายในการเดินทางแล้ว ยังช่วยลดความแออัดในโรงพยาบาลอีกด้วย เช่น โครงการให้ผู้ป่วยที่ต้องใช้ยาต่อเนื่องไปรับยาจากร้านยาในชุมชนซึ่งมีเภสัชกรประจำ การกำหนดให้ร้านยาซึ่งมีเภสัชกรทำงานประจำวันละไม่ต่ำกว่า 8 ชั่วโมง ขึ้นทะเบียนเป็นเครือข่ายหน่วยบริการร่วมให้บริการของสำนักงานหลักประกันสุขภาพแห่งชาติทำหน้าที่บริการในการให้คำปรึกษาด้านยาแก่ผู้ป่วยหัวใจ เบาหวาน เป็นต้น
รองศาสตราจารย์ ดร.ทัศนา บุญทอง นายกสภาการพยาบาล ในฐานะกรรมการหลักประกันสุขภาพแห่งชาติ ได้พิจารณาเห็นว่าผู้ประกอบวิชาชีพการพยาบาลเป็นบุคลากรกลุ่มใหญ่ในระบบสาธารณสุขและกระจายอยู่ในชุมชน ทุกระดับของประเทศ น่าจะได้มีส่วนในการแบ่งเบาภาระของโรงพยาบาลได้มากเช่นเดียวกัน โดยเฉพาะบริการต่าง ๆ ตามขอบเขตของวิชาชีพการพยาบาลและการผดุงครรภ์ ซึ่งจะตอบสนองความต้องการของประชาชนได้โดยไม่ต้องเดินทางไปโรงพยาบาล จึงเสนอให้คลินิกการพยาบาลและการผดุงครรภ์ที่เปิดให้บริการอยู่แล้วทั่วประเทศจำนวนกว่า 5,000 แห่ง ซึ่งมีศักยภาพเพียงพอที่จะให้บริการสุขภาพในระดับปฐมภูมิอย่างมีประสิทธิภาพ เข้าร่วมเป็นหน่วยบริการร่วมให้บริการในระบบหลักประกันสุขภาพแห่งชาติ ตามข้อบังคับคณะกรรมการหลักประกันสุขภาพแห่งชาติ ว่าด้วย หลักเกณฑ์ วิธีการและเงื่อนไข การขึ้นทะเบียนเป็นหน่วยบริการและเครือข่ายหน่วยบริการ พ.ศ. 2558 เพื่อเป็นกลไกหนึ่งที่จะช่วยให้ประชาชนโดยเฉพาะกลุ่มเสี่ยงต่าง ๆ เข้าถึงบริการสุขภาพใกล้บ้านได้อย่างสะดวก รวดเร็ว และทั่วถึง โดยในระยะแรกให้ดำเนินการนำร่องในพื้นที่กรุงเทพมหานคร เป็นส่วนหนึ่งของการขับเคลื่อนยุทธศาสตร์ระบบบริการสุขภาพเขตเมือง พ.ศ. 2561 – 2570 และในปีงบประมาณ 2564 มีแผนจะขยายผลไปยังพื้นที่ต่าง ๆ ทั่วประเทศ
เมื่อคณะกรรมการหลักประกันสุขภาพแห่งชาติ (สปสช.) เห็นชอบตามหลักการที่ รองศาสตราจารย์ ดร.ทัศนา บุญทอง เสนอแล้ว สภาการพยาบาลได้วางแผนการดำเนินงานโดยกำหนดเป็นโครงการพัฒนารูปแบบคลินิกการพยาบาลและการผดุงครรภ์เป็นหน่วยบริการร่วมให้บริการในระบบหลักประกันสุขภาพแห่งชาติ และตั้งคณะทำงานขึ้นมาทำงานร่วมกับผู้แทนของ สปสช. ในโครงการพัฒนารูปแบบคลินิกการพยาบาลและการผดุงครรภ์ดังกล่าว เพื่อการกำหนดหลักการ วิธีการ มาตรฐานของคลินิก ขอบเขต การให้บริการของคลินิก ฯลฯ รวมทั้งกำหนดให้คลินิกการพยาบาลและการผดุงครรภ์ที่ขึ้นทะเบียนเป็นเครือข่ายหน่วยร่วมบริการของสำนักงานหลักประกันสุขภาพแห่งชาติว่า “คลินิกพยาบาลชุมชนอบอุ่น”
ตาแดง รับยาและน้ำตาเทียมฟรีถึงบ้าน
Clicknic พร้อมดูแล ใครมีสิทธิบัตรทองหาหมอ รับยาฟรี! เฉพาะสิทธิบัตรทอง [บัตร 30 บาท] ที่อาศัยหรือทำงานในกรุงเทพฯ เท่านั้น หากมีอาการและคุณหมอวินิจฉัยว่าตาแดง รับยาและน้ำตาเทียมฟรีถึงบ้าน . ผู้มีสิทธิบัตรทองรับยา และน้ำตาเทียมฟรี เพียงแค่ 1. แจ้งชื่อ-นามสกุล เพื่อเช็กสิทธิบัตรทองได้ที่ Line : https://lin.ee/zUstzHN 2. เข้าแอป Clicknic กดช่อง “สำหรับ 42 กลุ่มโรคทั่วไป (สปสช.)” 3. พบหมอ พร้อมแจ้งอาการ เช่น แสบตา, แพ้ฝุ่น, น้ำตาไหล 4. รอรับน้ำตาเทียมและยาที่ได้บ้านได้เลย พบหมอได้ทุกวันตั้งแต่ 7.30 น.-19.30 น.
ติดโควิด Clicknic ช่วยรักษาฟรีทั่วประเทศ รอรับยาที่บ้าน
ติดโควิด Clicknic ช่วยรักษาฟรีทั่วประเทศ เพียงแค่มีสิทธิบัตรทอง หาหมอฟรี! และรอรับยาส่งถึงบ้านฟรี! ไม่ต้องเดินทาง ไม่ต้องรอคิวให้เสียเวลา
รับรักษาผู้ป่วยโควิด 3 กลุ่ม
- กลุ่มสีเขียว : ผู้ที่มีอาการไม่หนัก คล้ายไข้หวัด เช่น มีไข้ 37.5 องศาเซลเซียสขึ้นไป, ไอ, เจ็บคอ, มีน้ำมูก
- กลุ่มสีเหลือง : ผู้ที่มีอาการเสี่ยงรุนแรง หรือมีโรคร่วม เช่น ไอแล้วมีอาการเหนื่อย, แน่นหน้าอก หายใจลำบาก, ขับถ่ายเหลว
- กลุ่ม 608 : ผู้สูงอายุ 60 ปีขึ้นไป และผู้ที่มีโรคประจำตัวในกลุ่ม 7 โรค ได้แก่ โรคทางเดินหายใจเรื้อรัง, โรคหัวใจและหลอดเลือด, โรคไตวายเรื้อรัง, โรคหลอดเลือดสมอง, โรคอ้วน, โรคมะเร็ง, โรคเบาหวาน
ติดแล้วต้องทำไง?
1. ทัก Line Clicknic https://line.me/R/ti/p/%40652ixxpv
2. ส่งรูปภาพถ่ายคู่ ของบัตรประชาชนและ ATK ที่ขึ้น 2 ขีด
3. เจ้าหน้าที่ส่งรายละเอียดการลงทะเบียน พร้อมเงื่อนไขให้
4. คุยกับคุณหมอผ่าน VDO Call ในแอป คลิกนิก
5. กรุงเทพฯ รอรับยาใน 24-48 ชม. และต่างจังหวัดรอรับยาไม่เกิน 72 ชม.
*ผู้ป่วยจะได้รับยาตามดุลยพินิจของแพทย์
พบหมอได้ทุกวันตั้งแต่ 7.30น.-19.30น.
ความเป็นมาคลินิกพยาบาลชุมชนอบอุ่น
ความเป็นมา
ปี พ.ศ.2562 สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) มีนโยบายในการผลักดันให้ประชาชนเข้าถึงบริการสุขภาพ อย่างทั่วถึง เท่าเทียม มีคุณภาพ และสะดวก ไม่ต้องเดินทางไกล จึงได้พยายามหาวิธีจัดบริการรูปแบบใหมเพื่อให้ประชาชนสามารถ รับบริการได้ในชุมชนโดยไม่ต้องเดินทางไปโรงพยาบาล ซึ่งนอกจากทำให้ประชาชนสะดวกขึ้นและลดค่าใช้จ่ายในการเดินทางแล้ว ยังช่วยลดความแออัดในโรงพยาบาลอีกด้วย เช่น โครงการให้ผู้ป่วยที่ต้องใช้ยาต่อเนื่องไปรับยาจากร้านยาในชุมชนซึ่งมีเภสัชกร ประจำการกำหนดให้ร้านยาซึ่งมีเกสัชกรทางานประจำวันละไม่ต่ำกว่า 8 ชั่วโมง ขึ้นทะเบียนเป็นเครือข่ายหน่วยบริการร่วมให้ บริการของสานักงานหลักประกันสุขภาพแห่งชาติ ทำหน้าที่บริการในการให้คำปรึกษาด้านยาแกผู้ป่วยหัวใจ เบาหวาน เป็นต้น
รองศาสตราจารย์ คร.ทัศนา บุญทอง นายกสภาการพยาบาลและในฐานะกรรมการหลักประกันสุขภาพแห่งชาติในขณะนั้น ได้พิจารณาเห็นว่าผู้ประกอบวิชาชีพการพยาบาลเป็นบุคลากรกลุ่มใหญ่ในระบบสาธารณสุขและกระจายอยู่ในชุมชนทุกระดับของ ประเทศ น่าจะได้มีส่วนในการแบ่งเบาภาระของโรงพยาบาลได้มากเช่นเดียวกัน โดยเฉพาะบริการต่าง 1 ตามขอบเขตของวิชาชีพ การพยาบาลและการผดุงครรภ์ ซึ่งจะตอบสนองความต้องการของประชาชนได้โดยไม่ต้องเดินทางไปโรงพยาบาล จึงเสนอให้คลินิก การพยาบาลและการผดุงครรภ์ที่เปิดให้บริการอยู่แล้วทั่วประเทศจำนวนกว่า 5,000 แห่ง ซึ่งมีศักยภาพเพียงพอที่จะให้บริการ สุขภาพในระดับปฐมภูมิอย่างมีประสิทธิภาพ เข้าร่วมเป็นหน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ ตามข้อบังคับคณะ กรรมการหลักประกันสุขภาพแห่งชาติ ว่าด้วย หลักเกณฑ์ วิธีการและเงื่อนไข การขึ้นทะเบียนเป็นหน่วยบริการและเครือข่ายหน่วย บริการ พ.ศ. 2558 เพื่อเป็นกลไกหนึ่งที่จะช่วยให้ประชาชนโดยเฉพาะกลุ่มเสี่ยงต่าง 1 เข้าถึงบริการสุขภาพใกล้บ้านได้อย่างสะดวก รวดเร็ว และทั่วถึง โดยในรปิงบประมาณ 2563 ได้ดำเนินการนำร่องในพื้นที่กรงเทพมหานคร เป็นส่วนหนึ่งของการชับเคลื่อน ยุทธศาสตร์ระบบบริการสุขภาพเขตเมือง พ.ศ. 2561 - 2570 ต่อมาจึงขยายไปในทุกเขตสุขภาพ
คลินิกพยาบบาลชุมชนอบอุ่น
เมื่อคณะกรรมการหลักประกันสุขภาพแห่งชาติ เห็นชอบตามหลักการที่ รองศาสตราจารย์ คร ทัศนา บุญทอง เสนอแล้ว สภาการพยาบาลวางแผนการดำเนินงานโดยกำหนดเป็นโครงการพัฒนารูปแบบคลินิก การพยาบาลและการผ่ดงครรภ์เป็นหน่วย บริการร่วมให้บริการในระบบหลักประกันสุขภาพแห่งชาติ ใด้ตั้งคณะทำงานขึ้นชุดหนึ่งโดยมี ผู้ช่วยศาสตราจารย์ ดรวัลลา ตันตโย ทัย อาจารย์ลัดดาวัลย์ ไวยสุระสิงห์ ผู้ช่วยศาสตราจารย์ ครเวหา เกษมสุข และท่านอื่น ๆ เพื่อทำงานในโครงการพัฒนารูปแบบ คลินิกการพยาบาลและการผดุงครรภ์ดังกล่าว โดยได้ประชุมร่วมกับผู้แทนของ สปสซ. เพื่อการกำหนดหลักการ วิธีการ มาตรฐาน ของคลินิก ขอบเขตการให้บริการของคลินิก ฯลฯ รวมทั้งกำหนดให้คลินิกการพยาบาลและการผคงครรภ์ที่ขึ้นทะเบียนเป็นหน่วย บริการของสานักงานหลักประกันสุขภาพแห่งชาติว่า "คลินิกพยาบาลชุมชนอบอุ่น"
คลินิกพยาบาลชุมชนอบอุ่น ต่างจาก คลินิกการพยาบาลและการผคุงครรภ์ที่ไม่ได้เข้าร่วมเป็นเครือข่ายหน่วยร่วมบริการของ สปสช. อย่างไร
คลินิกพยาบาลชุมชนอบอุ่น เป็นคลินิกการพยาบาลและการผ่ดงครรภ์ ซึ่งได้ขึ้นทะเบียนเป็นสถานพยาบาลตามกฎหมาย สถานพยาบาล และผ่านการประเมินมาตรฐานจากสภาการพยาบาลและ สปสช. แล้ว ตามเกณฑ์ที่กำหนด และได้ทำสัญญาขึ้น ทะเบียนเป็นหน่วยบริการของสปสช.สามารถให้บริการสุขภาพตามกฎหมายการประกอบวิชาชีพการพยาบาลและการผดงครรภ์ โดยที่การให้บริการสุขภาพโดยเฉพาะในขอบเขตและกิจกรรมที่ สปสช. กำหนดไว้สำหรับผู้ป่วยในระบบหลักประกันสุขภาพแห่งชาติ (UC คือ ผู้ป่วยบัตรทอง ซึ่งรับบริการที่คลินิกพยาบาลชุมชนอบอุ่น คลินิกพยาบาลที่ให้บริการไม่ต้องเก็บค่าบริการจากประชาชนผู้ มารับบริการ แต่สามารถเรียกเก็บจากสำนักงานหลักประกันสุขภาพแห่งชาติโดยตรง สำหรับอัตราค่าบริการในแต่ละกิจกรรมบริการ เป็นไปตามที่ สปสช. ประกาศกำหนดไว้แล้ว
นอกจากนี้สภาการพยาบาลได้จัดการอบรมฟื้นพูทักษะการให้บริการของผู้ดำเนินการคลินิกการพยาบาลและการผดงครรภ์ เพื่อให้มั่นใจได้ว่าผู้ให้บริการมีความรู้และทักษะในการให้บริการอย่างเพียงพอ สามารถให้บริการได้อย่างมีคุณภาพและมาตรฐาน และยังมีการติดตาม กำกับ และประเมินผล ตลอดจนสนับสนุนการทำงานของคลินิกพยาบาลชุมชนอบอุ่นอย่างต่อเนื่อง
สภาการพยาบาล2. แนะนำไอเดียอยู่บ้านหนีร้อนแบบสบายกระเป๋า: Inexpensive In-home Joy to beat heat
ปัจจุบันนี้คนไทยอยู่ท่ามกลางสภาพอากาศที่ร้อนจัดและมีแนวโน้มที่จะร้อนขึ้นในทุกๆ ปี แบรนด์สามารถใช้โอกาสนี้ในการเข้าไปมีส่วนร่วมเพื่อช่วยสร้างความสุข สนุก สดชื่น ให้เกิดขึ้นภายในบ้านได้ โดยสามารถสร้างผ่านการแนะนำในการใช้ผลิตภัณฑ์วิธีใหม่ เช่น แนะนำความสดชื่นรูปแบบใหม่ ที่เปลี่ยนเครื่องดื่มธรรมดาให้เป็นเป็นเมนูหวานเย็นได้ง่ายๆ เพื่อเพิ่มสีสันใหม่ๆ ในการรับประทาน หรือแบรนด์จะเน้นการทำโปรโมชั่นรูปแบบ Family Pack ในช่องทางออนไลน์ให้มากขึ้น เพื่อความสะดวก คุ้มค่า และสร้างโมเมนต์แห่งความสุขร่วมกันได้ภายในครอบครัว
เปิด 2 สาเหตุทางเลื่อนดูดขาผู้โดยสาร
อดีตนายกสมาคมลิฟต์ เผยสาเหตุทางเลื่อนดูดขาคน หวีทางเลื่อนอาจแตก หรือหลุดทั้งอัน แนะใส่รองเท้าหนัง หรือรองเท้าพื้นแข็ง ส่วนผู้ประกอบการควรหมั่นตรวจสอบ
นายธเนศ ยงรัตรมงคล อดีตนายกสมาคมลิฟต์ บอกว่า เหตุการณ์ที่เกิดขึ้น ต้องให้เจ้าหน้าที่ตรวจสอบอย่างละเอียด แต่ตามหลักการทำงานของบันไดเลื่อน และทางเลื่อน พอสิ้นสุดทางเลื่อนจะมีอุปกรณ์ กั้น 1 ชิ้น คือหวีทางเลื่อน ลักษณะเป็นสีเหลือง เชื่อมระหว่างทางเลื่อนกับพื้นทางเดิน ซึ่งโอกาสที่จะดูดรองเท้า หรือขาคนเข้าไปได้ มี 2 สาเหตุ คือ 1.มีซี่ของบันไดเลื่อนแตกหรือหัก จากการโดนล้อรถเข็นกระเป๋ากระแทกกับซี่ของทางเลื่อน จนกลายเป็นซี่ฟันหลอ จนเป็นรู หรือเป็นร่อง หากผู้โดยสารมองไม่เห็น อาจจะโดนดูดเข้าไปได้ สาเหตุที่ 2 อาจเป็นไปได้ว่า แผ่นหวีเกิดหลุดทั้งแผ่น จนเป็นรู เมื่อผู้โดยสารไม่ทันสังเกต หรือก้าวช้า ขาอาจติดเข้าไปได้ การทำงานของเครื่องจักร เมื่อมีวัตถุเริ่มถูกดูดเข้าไป เครื่องจักรก็จะเดินหน้าบดสิ่งของนั้นไปเรื่อยๆ โดยเฉพาะรองเท้ายาง หรือแม้แต่เนื้อที่ขาจะค่อยๆ ถูกดูดเข้าไปได้
อดีตนายกสมาคมลิฟต์ ฝากเตือนประชาชน ควรใส่รองเท้าหนัง หรือรองเท้าพื้นแข็ง และที่สำคัญเวลาอยู่บนทางเลื่อน ต้องมีสติ ควรก้าวก่อนถึงหวีทางเลื่อน ส่วนผู้ประกอบการก็ควรหมั่นตรวจสอบ หากซี่ของบันได หรือทางเลื่อนชำรุด 2 ซี่ ต้องเปลี่ยนทันที ขอให้ประชาชนอย่าตื่นตระหนก แค่หมั่นสังเกต หากพบอุปกรณ์ชำรุด ซี่บันไดเลื่อนมีช่องฟันหลอให้รีบแจ้งเจ้าหน้าที่ทันที เช่นเดียวกับ บันไดเลื่อนห้างสรรพสินค้า ที่ด้านข้างของบันไดเลื่อน จะมีช่องว่าง หากปล่อยเด็กยื่นขาเข้าไปอาจถูกดูดได้เช่นกัน
จากเหตุการณ์วันนี้ ทำให้มองย้อนไปเมื่อปี 62 ก็เคยเกิดเหตุเด็กถูกบันไดเลื่อนดูดมาแล้ว จากการใส่รองเท้ายาง ที่เข้าไปในร่อง แล้วบันไดเลื่อนมันดูดเข้าไปเลย แต่พ่อของเด็กสามารถดึงตัวลูกออกได้ทัน ทำให้บาดเจ็บเพียงเล็กน้อย ซึ่งในการแถลงข่าวของท่าอากาศยานดอนเมืองเมื่อช่วงบ่าย ผู้สื่อข่าวก็มีการถามเรื่องนี้ว่ามีลักษณะคล้ายกันหรือไม่ โดยทางผู้อำนวยการฯ บอกว่า เหตุการณ์ปี 62 เป็นบันไดเลื่อน ไม่ใช่ทางเลื่อน. -
สำนักข่าวไทย
วันนี้ การคัดกรองมะเร็งปากมดลูกเป็นสิทธิ์หลักประกันสุขภาพแห่งชาติของสตรีไทยอายุ 30-59 ปี สามารถขอรับชุดตรวจมะเร็งปากมดลูกด้วยตนเองได้ที่โรงพยาบาลของรัฐที่เข้าร่วมโครงการ และเพื่อเพิ่มความสะดวกให้ขอรับชุดตรวจได้ง่ายขึ้น ขณะนี้ สปสช.ได้นำร่องที่เขตสุขภาพที่ 7 ใน 4 จังหวัด คือ กาฬสินธุ์ ขอนแก่น มหาสารคาม และร้อยเอ็ด โดยเพิ่ม ร้านยาและคลินิกพยาบาล จำนวน 119 แห่ง ให้เป็นจุดที่กลุ่มเป้าหมายขอรับชุดตรวจได้ผ่านแอปพลิเคชันเป๋าตัง
โรคมะเร็งปากมดลูกนับเป็นปัญหาสำคัญทางสาธารณสุขของประเทศไทย โดยสถิติพบว่า เป็นมะเร็งที่พบเป็นอันดับ 5 ในผู้หญิงไทย และมีอัตราการเสียชีวิตปีละเกือบ 5,000 ราย แต่ในขณะเดียวกันก็เป็นมะเร็งที่รักษาให้หายได้หากพบในระยะแรกเริ่ม เนื่องจาก ร้อยละ 70 ของโรคเกิดจากการติดเชื้อ HPV (เอชพีวี) โดยเฉพาะสายพันธุ์ 16 และ 18 ซึ่งเป็นสายพันธุ์ที่มีความเสี่ยงสูง ดังนั้น การตรวจคัดกรองมะเร็งปากมดลูก เพื่อหาการติดเชื้อเอชพีวีในระยะแรกเริ่ม เพื่อนำไปสู่การรักษา จึงเป็นอีกหนึ่งมาตรการสำคัญ เพื่อลดจำนวนหญิงไทยที่มีความเสี่ยงเจ็บป่วยด้วยโรคมะเร็งปากมดลูก จึงหวังว่าการร่วมกับภาคเอกชนประชาสัมพันธ์ให้สตรีรับทราบข้อมูลมากขึ้น เกิดความเข้าใจ จะทำให้สตรีเข้ารับการตรวจคัดกรองฯ มากขึ้นตามนโยบายของพวกเรา
ในแอปพลิเคชันเป๋าตัง “กระเป๋าสุขภาพ” จะมีการส่งเสริมสุขภาพป้องกันโรคของผู้หญิงอยู่ 22 รายการ สำหรับสิทธิประโยชน์คัดกรองมะเร็งปากมดลูก ปีนี้ เราตั้งเป้าหมายไว้ 1.2 ล้านราย ขณะนี้ดำเนินการไปแล้ว 7 แสนราย หรือร้อยละ 56.8 จึงอยากเชิญชวนให้สตรีกลุ่มเสี่ยงมาใช้สิทธิ์ เพื่อหลีกเลี่ยงการเป็นมะเร็งปากมดลูก เพราะหากเจอระยะต้นๆ รักษาหายได้แน่นอน และหากผลออกมาเป็นลบ แปลว่าท่านปกติ อีกห้าปีค่อยกลับมาตรวจใหม่
สิทธิประโยชน์จากการตรวจแบบดั้งเดิม สู่ HPV DNA
ในอดีต เวลาไปคัดกรองมะเร็งปากมดลูก แพทย์จะทำการตรวจแบบแปปสเมียร์ ต้องไปขึ้นขาหยั่ง เพื่อปาดเอาเซลล์ปากมดลูกออกมา แล้วนำมาตรวจในห้องปฏิบัติการทางการแพทย์ หากพบว่าผิดปกติ ก็เข้าสู่การรักษา ส่วนมากจะเจอเมื่อเซลล์ผิดปกติแล้ว ซึ่งแปลว่าอาจเป็นมะเร็งแล้ว แต่ในปัจจุบัน มีการตรวจแบบเอชพีวี ดีเอ็นเอ คือดูเซลล์ดีเอ็นเอของเชื้อ ซึ่งละเอียดมากขึ้น จะสามารถพบเชื้อ HPV ได้ตั้งแต่เนิ่นๆ แต่วิธีเก็บตัวอย่างยังเหมือนเดิม คือให้คุณหมอเก็บให้ ซึ่งทั้ง 2 วิธี ไม่ว่าจะเป็นการตรวจแบบดั้งเดิมที่เป็นแบบแปปสเมียร์ หรือแบบเอชพีวี ดีเอ็นเอ หรือแม้กระทั่ง HPV DNA Self-Sampling หรือการตรวจคัดกรองมะเร็งปากมดลูก แบบเก็บตัวอย่างด้วยตนเอง ล้วนอยู่ในสิทธิประโยชน์เหมือนกัน ดังนั้น ปัญหาประชาชนกังวลในการไปตรวจ แล้วกลัวจะต้องเสียค่าใช้จ่ายก็หมดไป
ผลสำรวจคำถาม 2. และหากท่านมี งบประมาณ "ไม่จำกัด" ท่านจะให้ "คนในครอบครัว" ตรวจสุขภาพ/รักษาโรคใด?
บันทึกผลการสำรวจคำถาม 2
"มีเงินเยอะ เลือกให้คนในครอบครัว (ไม่ใช่ตัวเอง)" พร้อมรายละเอียดบางส่วน
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน ตรวจมะเร็ง 33.3% ตรวจด้านหัวใจ ระบบเลือด 17.1%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน ตรวจมะเร็ง 33.8% ตรวจด้านหัวใจ ระบบเลือด 16.3% ตรวจสุขภาพเด็ก 7.1% ตรวจสุขภาพจิต 6% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 6.4% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 6% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 4.5% ตรวจเกี่ยวกับไต 3% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 3% ตรวจเกี่ยวกับตับ 2.8% ตรวจระบบทางเดินอาหาร 2.3%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน ตรวจมะเร็ง 34.3% ตรวจด้านหัวใจ ระบบเลือด 15.4% ตรวจสุขภาพเด็ก 7.5% ตรวจสุขภาพจิต 5.6% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 6.3% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 5.6% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 4.1% ตรวจเกี่ยวกับไต 3.4% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 3.1% ตรวจเกี่ยวกับตับ 3% ตรวจระบบทางเดินอาหาร 2.3%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน
Highlight ผศ.ดร. สมชาย แก้ววังชัย เรื่อง Terpenes สกัดจากดอกกัญชา
Terpenes สกัดจากดอกกัญชา Workshop ที่จะพาคุณไปเจาะลึกในเรื่องของกลิ่น การสกัดสารที่ให้กลิ่นอย่าง Terpenes ในดอกกัญชา และ การออกฤทธิ์ของสารเหล่านั้นกับร่างกายซึ่งเป็นตัวแปรสำคัญอย่างหนึ่งที่กำหนดอาการของกัญชา รวมถึงการใช้ในการรักษาโรค
ผศ.ดร.สมชาย แก้ววังชัย อาจารย์ภาควิชาเคมี คณะวิทยาศาสตร์ ม.มหาสารคาม อาจารย์สมชาย ผ่านงานวิจัยกัญชามาแล้วหลายปีตั้งแต่การพัฒนาและคัดแยกสายพันธุ์ การปลูก การสกัด และล่าสุด อาจารย์ได้หันมาทำการสกัด Terpenes จากดอกกัญชา และ บอกว่าจะนำ Terpenes สกัดมาได้เราได้ดมเปรียบเทียบกับดอกที่ยังไม่ได้สกัดกันใน Workshop นี้ ถือเป็นโอกาสดีที่ อ. จะได้มา Workshop ถ่ายทอดความรู้ให้พวกเราในปีนี้
Workshop : Terpenes สกัดจากดอกกัญชา วันที่ 8 กรกฎาคม : 19.00-19.45 น.
ภาพรวมจากดัชนีความสงบสุขโลก Global Peace Index (GPI) 2023
สถาบันเพื่อเศรษฐศาสตร์และสันติภาพ (The Institute for Economics & Peace - IEP) ประกาศผลการจัดอันดับ
ดัชนีความสงบสุขโลก Global Peace Index (GPI) ฉบับที่ 17 ประจำปี 2023 ครอบคลุมประเทศรัฐและดินแดนอิสระ 163 แห่ง จัดลำดับตามระดับของความสงบสุข รายงานนี้นำเสนอการวิเคราะห์ที่ขับเคลื่อนด้วยข้อมูลที่ครอบคลุมที่สุดในปัจจุบันเกี่ยวกับแนวโน้มสันติภาพ มูลค่าทางเศรษฐกิจ และวิธีการพัฒนาสังคมที่สงบสุข
รายงาน GPI ครอบคลุม 163 ประเทศ ซึ่งคิดเป็นร้อยละ 99.7 ของประชากรโลก โดยใช้ตัวบ่งชี้เชิงคุณภาพและเชิงปริมาณ 23 รายการจากแหล่งข้อมูลที่ได้รับการยอมรับอย่างสูง และวัดสถานะของสันติภาพในสามขอบเขต ได้แก่ 1) ระดับความปลอดภัยและความมั่นคงทางสังคม 2) ขอบเขตของความขัดแย้งภายในประเทศและระหว่างประเทศที่กำลังดำเนินอยู่ และ 3) ระดับของกำลังทหาร
รายงาน GPI ปี 2023 ฉบับนี้ ได้รวมการวิเคราะห์ความขัดแย้งในปัจจุบัน และความขัดแย้งที่อาจเกิดขึ้นในอนาคต รวมถึงการวิเคราะห์ผลกระทบทางเศรษฐกิจที่อาจเกิดขึ้นจากการปิดล้อมไต้หวันของจีนที่มีต่อเศรษฐกิจโลกไว้ด้วย
ผลสำรวจในปีนี้พบว่าระดับความสงบสุขทั่วโลกโดยเฉลี่ยลดลงร้อยละ 0.42 นี่เป็นการลดลงของความสงบสุขครั้งที่ 13 ในช่วง 15 ปีที่ผ่านมา โดย 84 ประเทศมีความสงบสุขที่ดีขึ้น และ 79 ประเทศมีความสงบสุขแย่ลงในปี 2565
ไอซ์แลนด์ยังคงเป็นประเทศที่สงบสุขที่สุดในโลก โดยดำรงตำแหน่งมาตั้งแต่ปี 2551 โดยมีเดนมาร์ก ไอร์แลนด์ นิวซีแลนด์ และออสเตรียอยู่ในอันดับต้น ๆ ของดัชนี อัฟกานิสถานเป็นประเทศที่มีความสงบสุขน้อยที่สุดในโลกติดต่อกันเป็นปีที่ 8 ตามมาด้วยเยเมน ซีเรีย ซูดานใต้ และสาธารณรัฐประชาธิปไตยคองโก ประเทศเหล่านี้ในทั้งสองกลุ่ม ยกเว้นไอร์แลนด์ ได้รับการจัดอันดับให้เป็นหนึ่งในสิบประเทศที่มีความสงบสุขมากที่สุด หรือสงบสุขน้อยที่สุดเสมอ โดยเน้นย้ำถึงความสงบสุขที่ปลายทั้งสองด้านของดัชนี
สงครามในยูเครนมีผลกระทบอย่างมีนัยสำคัญต่อความสงบสุขของโลก โดยยูเครนและรัสเซียมีความสงบสุขที่เลวร้ายที่สุดและใหญ่เป็นอันดับห้าตามลำดับ
ส่วน 3 ประเทศ ที่มีความเสื่อมโทรมมากที่สุด คือ เฮติ มาลี และอิสราเอล
น่ายินดีกับลิเบีย ประเทศที่ระดับความสงบสุขดีขึ้นมากที่สุดเป็นปีที่สองติดต่อกัน ตามมาด้วยบุรุนดี โอมาน โกตดิวัวร์ และอัฟกานิสถาน ยุโรปเป็นภูมิภาคที่สงบสุขที่สุดในโลกและเป็นที่ตั้งของเจ็ดในสิบประเทศที่สงบสุขที่สุด อีกสามประเทศที่สงบสุขที่สุดอยู่ในภูมิภาคเอเชียแปซิฟิก
ภูมิภาคตะวันออกกลางและแอฟริกาเหนือ (MENA) ยังคงเป็นภูมิภาคที่มีความสงบสุขน้อยที่สุดในโลก เป็นที่ตั้งของสี่ในสิบประเทศที่มีความสงบสุขน้อยที่สุด แต่ก็ยังเป็นภูมิภาคที่มีการพัฒนาด้านสันติภาพที่ใหญ่ที่สุดเช่นกัน
พัฒนาการที่สำคัญที่สุดเกิดขึ้นในภูมิภาค MENA และอเมริกาเหนือ การปรับปรุงในอเมริกาเหนือได้รับแรงหนุนจากการปรับปรุงในแคนาดา ในภูมิภาค MENA ขอบเขตความขัดแย้งอย่างต่อเนื่องเป็นตัวขับเคลื่อนหลักของการปรับปรุง โดยผลกระทบจากการก่อการร้าย ความขัดแย้งภายในที่ต่อสู้ และการเสียชีวิตจากความขัดแย้งภายในทั้งหมดดีขึ้น
Trip 1 & 2 : วันที่ 5-6 สิงหาคม และ 12-13 สิงหาคม 66 (แบบพักค้างคืน) นอนชมดาว @ชัยภูมิ
Trip 1 : วันที่ 5-6 สิงหาคม และ 12-13 สิงหาคม 66 (แบบพักค้างคืน) โปรแกรม “พิรุณโปรยปราย เที่ยวสบายๆ กลางสายฝน นอนชมดาว @ชัยภูมิ” ราคา 3,999 บาท
Trip 1 : วันที่ 2 และ 3 กันยายน 2566 (ไปเช้ากลับเย็น) เที่ยวลพบุรี อิ่มบุญ@วัดพระบาทน้ำพุ
วันที่ 2 และ 3 กันยายน 2566 (ไปเช้ากลับเย็น) โปรแกรม “ เที่ยวลพบุรี อิ่มบุญ ปันรอยยิ้ม @ วัดพระบาทน้ำพุ” ราคา 1,499 บาท
51. วัดเพชรพลี อ.เมือง จ.เพชรบุรี
เพชรบุรี
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ เวลา 08.00น.-16.00 น.
เบอร์ติดต่อ: 0817211724
ผู้ติดต่อ: อาจารย์ศุภรัตน์ สุขจิตต์
52. สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00-16.00น.
เบอร์ติดต่อ: 087-3539011
ผู้ติดต่อ: อ.กันต์กนิษฐ์ ขวัญพฤกษ์
53. วัดห้วยจระเข้ จ.นครปฐม
นครปฐม
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 08.00 - 16.00 น.
เบอร์ติดต่อ: 089 - 892 - 5423
ผู้ติดต่อ: อ.สุชิน สืบพงษ์สกุล
54. วัดศรีสวัสดิ์ จ.มหาสารคาม
มหาสารคาม
วันเวลาทำการ: เสาร์-อาทิตย์ 9.00-17.00 น.
เบอร์ติดต่อ: 088-571-2115
ผู้ติดต่อ: อ.กฤษฎา อึ้งตระกูล
56. วัดอรัญญิกาวาส (วัดป่า) อ.มือง จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.30-16.30
เบอร์ติดต่อ: 099-320-6050, 096-365-4564, 086-377-3509
ผู้ติดต่อ: อ.เมตตา กิตติคุณ
57. เมืองพัทยา จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 0900-1600
เบอร์ติดต่อ: 0911044622
ผู้ติดต่อ: ผดล อ.พิพัฒน์ ศิริกุลพัฒนผล
58. วัดสิริกาญจนาราม อ.เมือง จ.กาญจนบุรี
กาญจนบุรี
วันเวลาทำการ: วันเสาร์ และวันอาทิตย์ เวลา 8.30 - 16.30 น.
เบอร์ติดต่อ: 089 122 6292
ผู้ติดต่อ: อ.อิทธิมนต์ อ่าวสินธุ์ศิริ
59. วัดเกตการาม อ.บางคนที จ.สมุทรสงคราม
สมุทรสงคราม
วันเวลาทำการ: วันเสาร์ - อาทิตย์ (08.00 - 16.00 น.)
เบอร์ติดต่อ: 0959492451
ผู้ติดต่อ: อ.ยงยุทธ ธนิกกุล
60. อาคารทองนิมิต วิลพาวเวอร์ จ.พระนครศรีอยุธยา
พระนครศรีอยุธยา
วันเวลาทำการ: เสาร์ - อาทิตย์ , 08:00 - 17 :00 น.
เบอร์ติดต่อ: 081-905-4236
ผู้ติดต่อ: อ.ศศิวิมล เจียมรัตนศรี
61. วัดป่านิคมพัฒนาราม จ.ยโสธร
ยโสธร
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 093-379-1333 / 086-246-4140
ผู้ติดต่อ: อ.ด.ต.วสันต์พรรษ มโนวิสุทธิคุณ / อ.สุนทร ตั้งพูลผลวนิชย์
62. วิทยาลัยชุมชนสตูล จ.สตูล
สตูล
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ เวลา 9.00 น ถึง 16.30 น
เบอร์ติดต่อ: 081 479 8475
ผู้ติดต่อ: อ.ช่อมาลี นาคบรรพต
63. มหาวิทยาลัยเกษตรศาสตร์ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: สัปดาห์ละ 4 วัน (จันทร์-อังคาร-พุธ-พฤหัสบดี) เวลา 16.45 - 18.30 น.
เบอร์ติดต่อ: 080-265-9528
ผู้ติดต่อ: นายพงศนาถ เปรมภิภัสสร
64. มหาวิทยาลัยเชียงใหม่ จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00 - 20:30 น.
เบอร์ติดต่อ: 095-669-7955
ผู้ติดต่อ: อาจารย์วไลทัศน์ วรกุล (ผู้ดูแลสาขา)
65. วัดอมรินทราราม อ.เมือง จ.ราชบุรี
ราชบุรี
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 8:00 - 16:30 น.
เบอร์ติดต่อ: 092-3633556
ผู้ติดต่อ: อ.เสาวดี คล้ายโสม
66. วัดศรีสว่างวงศ์ อ.หาดใหญ่ จ.สงขลา
สงขลา
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 086-4907799
ผู้ติดต่อ: อ.ธีรรัตน์ ดิฎฐโชติ
67. วัดป่าเทพเนรมิต อ.เมือง จ.ลพบุรี
ลพบุรี
วันเวลาทำการ: วันเสาร์ และวันอาทิตย์ เวลา 08.00 - 16.30 น.
เบอร์ติดต่อ: อ.นิภา ศรีอนันต์ 089-402-1631
ผู้ติดต่อ: อ.นิภา ศรีอนันต์ 089-402-1631, อ.นงลักษณ์ ทองโต 095-445-1941
68. วัดชัยภูมิวนาราม อ.เมือง จ.ชัยภูมิ
ชัยภูมิ
วันเวลาทำการ: วัน เสาร์-อาทิตย์ เวลา 09.00-16.00น.
เบอร์ติดต่อ: 081-789-4623
ผู้ติดต่อ: อ.มานี อีหมั่น
69. วัดศรีสุทธาวาส อ.เมืองเลย จ.เลย
เลย
วันเวลาทำการ: เสาร์ อาทิตย์ 8:30 - 16.30 น.
เบอร์ติดต่อ: 081-0600655
ผู้ติดต่อ: อ.ธีระเดช ลุนาหา
70. วัดหลวงสุมังคลาราม อ.เมือง จ.ศรีสะเกษ
ศรีสะเกษ
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00 น.-16.30 น.
เบอร์ติดต่อ: 081-967-3797
ผู้ติดต่อ: อ.เถวียน รินทร
71. วัดบูรพาราม อ.เมือง จ.สุรินทร์
สุรินทร์
วันเวลาทำการ: เสาร์-อาทิตย์ (08:00-16:00)
เบอร์ติดต่อ: 081 999 0093
ผู้ติดต่อ: อ.วรศักดิ์ อินทร์ชัย
72. วัดอินทรวนาราม อ.เมือง จ.บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: เสาร์ - อาทิตย์ 08.00 - 16.30 น.
เบอร์ติดต่อ: 0614239998
ผู้ติดต่อ: อ.รวีโรจน์ ทองสง่า (ผู้ดูแลสาขา)
73. วัดพระงาม อ.เมือง จ.ตรัง
ตรัง
วันเวลาทำการ: เสาร์-อาทิตย์ (เวลา 09.00 - 16.00 น.)
เบอร์ติดต่อ: 088-7824289
ผู้ติดต่อ: อ.วันชัย ปิติ
74. มหาวิทยาลัยราชภัฎราชนครินทร์ จ.ฉะเชิงเทรา
ฉะเชิงเทรา
วันเวลาทำการ: เสาร์ - อาทิตย์ ( เวลา 08.30 น. - 16.30 น. )
เบอร์ติดต่อ: 0898324467
ผู้ติดต่อ: อ.ลิขิต บัวแดง ( ผู้ดูแลสาขา )
75. วัดเนื่องจำนงค์ อ.บ้านบึง จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ (เวลา 08:30 น. - 16:30 น.)
เบอร์ติดต่อ: 0951642873
ผู้ติดต่อ: อ.กัลยา โกกนุทาภรณ์ (ผู้ดูแลสาขา)
76. วัดพระมหาธาตุวรมหาวิหาร จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ เวลา 08.00-16.30 น
เบอร์ติดต่อ: 0872835800
ผู้ติดต่อ: คุณทิพวัลย์ ตรีตรง
77. วัดพิศาลรัญญาวาส พระอารามหลวง จ.หนองบัวลำภู
หนองบัวลำภู
วันเวลาทำการ: เสาร์-อาทิตย์ 09:00-16:00 น.
เบอร์ติดต่อ: 081-445-7449
ผู้ติดต่อ: อ. เกียรติคุณ ศีลอุดม
78. มหาวิทยาลัยขอนแก่น จ.ขอนแก่น
ขอนแก่น
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 0650969899
ผู้ติดต่อ: อ.พรหมพิศิษฐ์ โจทย์กิ่ง
79. วิศวกรรมสถานแห่งประเทศไทยในพระบรมราชูปถัมภ์ (วสท.) กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ 18:00 น. -21:00 น.
เบอร์ติดต่อ: 086-310-7295
ผู้ติดต่อ: อาจารย์ เฟื่องรุ่ง สุขไพโรจน์
80. วัดอมาตยาราม จ.ปราจีนบุรี
ปราจีนบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ 09.00 - 16.30 น.
เบอร์ติดต่อ: 083-046-7545
ผู้ติดต่อ: อ.ธีร์ธรรม ธรรมวิชญ์จิตร
81. วัดไชนาวาส อ.เมือง จ.สุพรรณบุรี
สุพรรณบุรี
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 9.00 - 16.30 น.
เบอร์ติดต่อ: 089-5981916
ผู้ติดต่อ: อ.เพชรี ภัทรภากร
82. โรงเรียนเจริญวิทยา จ.อำนาจเจริญ
อำนาจเจริญ
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00 - 16.30 น.
เบอร์ติดต่อ: 081-8797017 หรือ 096-9569859 หรือ 081-6474947
ผู้ติดต่อ: ดร.เพชรอุบล กาญจนพิมล
83. วัดวิมลนิวาส อ.เมือง จ.ร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30 น. - 16.30 น.
เบอร์ติดต่อ: 093-971-0702
ผู้ติดต่อ: อ. พรสิทธิ์ ทวยนันท์
84. อ่างศิลา จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ 8:00-16:30น.
เบอร์ติดต่อ: 094-789-7859
ผู้ติดต่อ: อ.กรกฏ สุพัฒน์
85. วิทยาลัยชุมชน จ.สระแก้ว
สระแก้ว
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 081 725 5856
ผู้ติดต่อ: นางสารภี โชคเกิด
86. ศูนย์พันธุ์วิชาติกุล จ.กระบี่
กระบี่
วันเวลาทำการ: เสาร์ อาทิตย์ เวลา 09.00 น.- 16.00 น.
เบอร์ติดต่อ: 0889954229,0867933555,0816916415
ผู้ติดต่อ: อ.เยาวดี ,อ.รัฐนันท์, อ.กาญจนา
87. บ้านสวนพรพนา จ.ลำพูน
ลำพูน
วันเวลาทำการ: 09.00-16.00 น.
เบอร์ติดต่อ: 0956851830
ผู้ติดต่อ: นายพงษ์พิชญ์ ภคพัศพงศ์
88. วัดธรรมบูชา
สุราษฎร์ธานี
วันเวลาทำการ: เสาร์ อาทิตย์
เบอร์ติดต่อ: 094-6925581
ผู้ติดต่อ: นางอำไพ รักษาวงศ์
89. วัดประชานิยม จ.กาฬสินธุ์
กาฬสินธุ์
วันเวลาทำการ: -
เบอร์ติดต่อ: 0926992387
ผู้ติดต่อ: นายประวิช สินธุศิริ
90. วัดป่าสาลวัน จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: จันทร์-ศุกร์ 18.00-20.30 น.
เบอร์ติดต่อ: 081-8798661
ผู้ติดต่อ: อ.จิตรา อุณาพรหม (ผู้ดูแลสาขา)
91. ศูนย์พัฒนาและส่งเสริมการศึกษา อ.เบตง จ.ยะลา
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
92. มูลนิธิภิรัชบุรี ณ ศูนย์นิทรรศการและการประชุมไบเทค
กรุงเทพมหานคร
วันเวลาทำการ: 8.00 น.-17.00 น.
เบอร์ติดต่อ: 063-818-9188
ผู้ติดต่อ: แอดมินสาขา92
93. วัดเทพรัตนาราม อ.บ้านแพ้ว จ.สมุทรสาคร
สมุทรสาคร
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 9.00 - 16.30 น.
เบอร์ติดต่อ: 0839799664
ผู้ติดต่อ: ผู้ดูแลสาขา 93 อาจารย์อัจฉรา วงศ์ช่างหล่อ
94. อาคารเสนาวิวัฒน์ จ.ระนอง
ระนอง
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00 -16.00 น.
เบอร์ติดต่อ: 081-5387973
ผู้ติดต่อ: ผดล.อ.ภรณี อุ่นทรัพย์เจริญ
95. วัดนาเวง ต.ธาตุเชิงชุม จ.สกลนคร
สกลนคร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00-17.00น.
เบอร์ติดต่อ: 082-8499636
ผู้ติดต่อ: วิวัฒน์ ไขไพวัน
96. วัดสิรินธรเทพรัตนาราม อ.สามพราน
นครปฐม
วันเวลาทำการ: วันเสาร์-อาทิตย์
เบอร์ติดต่อ: 0934892626
ผู้ติดต่อ: นางสาวปิยนุช นาคะเกษียร
97. วัดศรีทีปาราม อ.เมือง จ.เลย
เลย
วันเวลาทำการ: -
เบอร์ติดต่อ: 0854991779
ผู้ติดต่อ: นายธีรวัฒน์ ศรีบัวรินทร์
98. วัดเขาคอก อ.บ้านนา จ.นครนายก
นครนายก
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00 น.-16.00 น.
เบอร์ติดต่อ: 094-496-4269
ผู้ติดต่อ: นาง ธัญพร อุเทนพิทักษ์
99. วัดอุทกเขปสีมาราม อ.พนัสนิคม จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ 08 : 30 - 17 : 00 น.
เบอร์ติดต่อ: 081 - 9498635
ผู้ติดต่อ: ผดล : อ. วิโชติ แสงหิรัญ
100. ซีฟโก้ 2-ทวีมิตร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: ภาคเรียน เสาร์-อาทิตย์ เริ่มเวลา 09.00-16-00 น.
เบอร์ติดต่อ: 081 985 1669
ผู้ติดต่อ: อ.ดร.ณรงค์ ทัศนนิพันธ์ ผู้ดูแลสาขา
ปลอดภัยดี
บริเวณนี้ จะมี Workshop สาธิตการดับเพลิง ผ่านสถานการณ์จำลองภายในรถห้องฝึกดับเพลิงและกู้ภัยเคลื่อนที่ (SIMULATOR TRUCK) โดยจะแบ่งรอบสาธิตการดับเพลิงออกเป็นวันละ 3 รอบ ได้แก่ 13.00-14.30 น., 15.30-17.00 น., และ 18.00-20.00 น. ประชาชนที่สนใจ สามารถเข้ามาเพื่อร่วมกิจกรรมได้ที่หน้างาน
นอกจากนี้ บริเวณโซนปลอดภัยดี ยังมีกิจกรรมอื่นๆ ด้วย ได้แก่
- โมเดลเสาไฟฟ้าส่องสว่างประเภท หลอด LED หรือ smart lighting
- การจัดระเบียบ สายไฟและสายสื่อสาร และนำลงใต้ดิน
- แนะวิธีขอภาพจากกล้อง CCTV ออนไลน์ กรณีเกิดอุบัติเหตุหรืออาชญากรรม เพิ่มความสะดวกรวดเร็วไม่ต้องเดินทางไปที่กทม. (เสาชิงช้า)หรือ ศูนย์ฯ 12 แห่ง
ทั้งนี้ การสาธิตกิจกรรมในงาน ก็เพื่อเป็นแนวทางการแก้ไขจุดเสี่ยงภัยและอาชญากรรม ตลอดจนสร้างระบบเครือข่ายในพื้นที่จัดการสาธารณภัยให้กับประชาชน
กองปฏิบัติการดับเพลิงและกู้ภัย 1
Facebook page กองปฏิบัติการดับเพลิงและกู้ภัย
นักดับเพลิงและกู้ภัยบางกะปิ กปก.1
ช่วยเหลือประชาชน จับตัวเงินตัวทอง ขนาดความยาวประมาณ 1.50 ซม.สถานที่เกิดเหตุ:ซอยลาดพร้าว 80 แยก 26 แขวง./ เขต.วังทองหลาง กทม.
ระงับเหตุเพลิงไหม้บ้านเรือนประชาชน(เบื้องต้นเป็นห้องเก็บเอกสารพื้นที่เสียหายเล็กน้อย) สถานที่เกิดเหตุ:ซอยเอกมัย 6 แขวง.พระโขนงเหนือ เขต.วัฒนา กทม.
ช่วยเหลือประชาชนจับ งูเห่าขนาดความยาวประมาณ 30 ซม.สถานที่เกิดเหตุ:ซอย RCA ร้านคอฟฟี่เมต แขวง.บางกะปิ เขต.ห้วยขวาง กทม.
นำส่งสัตว์เลื้อยคลานจากจุดพักสัตว์สถานีดับเพลิงบางกะปิ ส่งที่กรมอุทยานสัตว์ป่าและพันธุ์พืช เขต.บางเขน กทม.
ช่วยเหลือประชาชน จับงูเหลือมขนาดความยาวประมาณ 1.50 ซม. สถานที่เกิดเหตุ: บ้านเลขที่ 54 ลาดพร้าว 62 หมู่บ้านตะวันรุ่งแขวง./ เขต.วังทองหลางกทม.
ช่วยเหลือประชาชน จับงูเห่าขนาดความยาวประมาณ 1 เมตร สถานที่เกิดเหตุ: ลานห้าง RCA ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กทม.
นักดับเพลิงและกู้ภัยบางขุนนนท์ กปก.5
ประชาชนร้องขอความช่วยเหลือเป็นเหตุ งูทางมะพร้าว ขนาด 60 เซนติเมตร สถานที่เกิดเหตุ ซอยปากน้ำฝั่งเหนือ 4 แขวงบางพรม เขตตลิ่งชัน กรุงเทพมหานคร ผู้รายงาน ขุนนนท์4-2
ประชาชนร้องขอความช่วยเหลือเป็นเหตุ งูเหลือม ขนาด 60 เซนติเมตร สถานที่เกิดเหตุ ซอยชัยพฤกษ์2 ถนนชัยพฤกษ์ แขวงคลองชักพระ เขตตลิ่งชัน กรุงเทพมหานคร ผู้รายงาน ขุนนนท์4-2
ชุดปฏิบัติการที่ 1 ออกช่วยเหลือประชาชนจับงู ซอยจรัญสนิทวงศ์ 22 แขวงบ้านช่างหล่อ เขตบางกอกน้อย กทม. ดำเนินการเรียบร้อย
ชุดปฏิบัติการที่ 1 ออกช่วยเหลือประชาชนจับงู หมู่บ้านมหาดไทย1 แขวงบางระมาด เขตตลิ่งชัน กทม. ดำเนินการเรียบร้อย
เจ้าหน้าที่ชุดปฏิบัติการ2 ออกปฏิบัติหน้าที่เหตุให้ความช่วยเหลือประชาชนรับงูเหลือม60เซ็นติเมตร ที่เกิดเหตุเลขที่ 69 ซอยชัยพฤกษ4 แขวงคลองชักพระ เขตตลิ่งชัน กทม.ดำเนินการเป็นที่เรียบร้อย @บางขุนนนท์21
นักดับเพลิงและกู้ภัยดาวคะนอง กปก. 5
เจ้าหน้าที่ชุดปฏิบัติการที่ 4 จำนวน 2 นาย ออกปฏิบัติหน้าที่ช่วยเหลือประชาชนจับงูเหลือม ยาว 60 ซม เหตุเกิดบ้านเลขที่ 112/ 238 ซอยพระรามสอง 28 ถนนพระรามสอง แขวงจอมทอง เขตจอมทอง กทม. ผู้แจ้งชื่อนาง ทองศีล โหมดนอก อายุ 56 ปี
ดับเพลิงและกู้ภัยพญาไท กปก.1
จับงูเหลือม ความยาว 50 ซม. มี คุณนที ครุฑไทย บ้านเลขที่ 259/3 ซอยเพชรบุรี 11 ถนนเพชรบุรี เขตราชเทวี กรุงเทพมหานคร พญาไท4-3 รายงาน
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 3.5 เมตร สถานที่เกิดเหตุ ภายในซอยนายเลิศ ถนนวิทยุ แขวงลุมพินี เขตปทุมวัน กทม. เจ้าหน้าที่ดำเนินการเรียบร้อย @พญาไท 2-1
จับงูสิง ความยาว 1 เมตร อยู่ในบ้านเลขที่ 145/1 ถนนดินแดง แขวงดินแดง เขตดินแดง กรุงเทพฯ เจ้าหน้าที่ออกปฏิบัติหน้าที่ 3 นาย พญาไท4-6 รายงาน
จับงูทางมะพร้าว ความยาว 80 เซนติเมตร ผู้แจ้งชื่อ นายไพโรจน์ ทรัพย์ศาลบ้านเลขที่ 750 ถนนนิคมมักกะสัน แขวงมักกะสัน เขตราชเทวี กรุงเทพมหานคร เจ้าหน้าที่ 3 นาย พญาไท4-4รายงาน
รับแจ้งจากศูนย์วิทยุพระราม 199 จับงูก้นขบ ความยาวประมาณ 80 เซนติเมตร สถานที่เกิดเหตุเลขที่ 10/36 ถนนเพชรบุรี ซอย 10 แขวงถนนเพชรบุรี เขตราชเทวี กทม. โดยมี คุณวีะยา แซ่ลิ้ม อายุ 21 ปี เป็นผู้แจ้ง @ พญาไท 1-1
ช่วยเหลือประชาชนจับงูเขียวพระอินทร์ ความยาว 70 เซนติเมตร สถานที่เกิดเหตุเลขที่ 66/1 ถนนเพชรบุรีซอย 5 แขวงทุ่งพญาไท เขตราชเทวี กรุงเทพมหานคร เจ้าหน้าที่ดำเนินการเรียบร้อย @พญาไท 2-1
ช่วยเหลือประชาชนจับงูเหลือม ขนาดความยาว 2 เมตร สถานที่เกิดเหตุเลขที่ 97/11 บิ๊กซีราชดำริ ถนนราชดำริ แขวงลุมพินี เขตปทุมวัน กรุงเทพมหานคร เจ้าหน้าที่ดำเนินการเรียบร้อย@พญาไท 2-1
จับงูเหลือม ความยาว 1.50 เมตร สถานที่เกิดเหตุ : เลขที่ 299/9 ซอยประสานสารบรรณ ถนนดินแดง แขวงดินแดง เขตดินแดง กรุงเทพฯ มี นางสาวณัฐวิภากร ทวีแก้ว อายุ 22 ปี เจ้าหน้าที่จับและนำมาพักไว้ที่สถานีเพื่อนำส่งกรมอุทยานฯ ต่อไป เจ้าหน้าที่ : 3 นาย สัญญาณเรียกขานผู้รายงาน : พญาไท 4-2
ช่วยเหลือประชาชนจับงูเหลือมขนาดความยาวประมาณ ๙๐ เซนติเมตร สถานที่เกิดเหตุ เลขที่ 60 ชุมชนสระแก้ว แขวงทุ่งพญาไท เขตราขเทวี กรุงเทพฯ เจ้าหน้าที่ดำเนินการเรียบร้อย@พญาไท 2-1
นักดับเพลิงและกู้ภัยธนบุรี กปก.5
จับงูเหลือม ความยาวประมาณ 2 เมตร เป็นที่เรียบร้อย เหตุเกิดบ้านเลขที่ 214/2 เพชรเกษม 16 แขวงวัดท่าพระ เขตบางกอกใหญ่ กทม
จับงูเขียวพระอินทร์ ความยาวประมาณ 50 เซนติเมตร เป็นที่เรียบร้อย เหตุเกิดบ้านเลขที่ 385 ซอยอินทรพิทักษ์ 3 แขวงบางยี่เรือ เขตธนบุรี กทม
จับงูเขียวพระอินทร์ ความยาวประมาณ 50 เซนติเมตร เหตุเกิดบ้านเลขที่ 181 ซอยอินทรพิทักษ์ 5 แขวงบางยี่เรือ เขตธนบุรี กทม
กทม.เตรียมส่งถังดับเพลิงลอตแรกกว่า 9 พันถังแทนถังเก่าในพื้นที่เสี่ยงสูง
3 กรกฎาคม 2566 รศ.ทวิดา กมลเวชช รองผู้ว่า ราชการกรุงเทพมหานคร ร่วมสังเกตการณ์ และพบปะผู้เข้ารับการอบรมหลักสูตรการบัญชาการเหตุการณ์สำหรับท้องถิ่น (Incident Command System) ซึ่งกรมป้องกันและบรรเทาสาธารณภัย (ปภ.) ได้จัดให้แก่ผู้อำนวยการเขตของกรุงเทพมหานคร ทั้ง 50 เขต
รองฯทวิดา กล่าวว่า การทำความ เข้าใจในระบบการบัญชาการเหตุการณ์เป็นเรื่องสำคัญสำหรับผู้อำนวยการเขตของ กทม. เนื่องจาก กทม.มีการบริหารจัดการที่ต่างจากท้องถิ่นอื่น โดย ผอ.เขตมีหน้าที่เทียบเท่ากับนายกเทศมนตรี ต้องรู้ว่าหากเกิดเหตุการณ์ใหญ่ๆ จะบัญชาอย่างไร หรือเกิดเหตุในพื้นที่รอยต่อร่วมกับจังหวัดอื่นจะต้องทำอย่างไร งานด้านป้องกัน งานสืบสวนสอบสวนต้องทำอย่างไร ซึ่งการที่ทาง ปภ.เข้ามาช่วยจัดหลักสูตรให้ เพราะมีข้อมูลการทำงานของท้องถิ่นอื่นๆ ที่ผอ.เขตจำเป็นต้องรู้ด้วย เมื่อเกิดเหตุที่ต้องจัดการจะได้พูดภาษาเดียวกัน เข้าใจ สอดคล้องไปในทิศทางเดียวกัน ซึ่งการอบรมครั้งนี้ได้เห็นความตั้งใจของ ผอ.เขตในการเข้าร่วมอย่างเต็มที่ทั้งวิชาการและฝึกปฏิบัติ
ในส่วนของการตรวจสอบถังดับเพลิง เชิงรุกทั้ง 50 เขตนั้น ขณะนี้หลายเขตทำไปได้ 60-70% แล้ว แต่บางเขต มีชุมชนในพื้นที่จำนวนมากอาจจะได้ ประมาณ 30% และการเข้าถึงพื้นที่ค่อนข้าง ใช้เวลาในการซอกแซก อย่างไรก็ตามทุกเขตกำลังระดมเจ้าหน้าที่สำรวจเชิงรุกให้ได้มากที่สุด โดยตั้งเป้าจะทำได้ครบทุกชุมชน กว่า 2,000 ชุมชนทั่ว กทม.ภายในสัปดาห์หน้า โดยจะเก็บถังที่ไม่อยู่ ในสภาพพร้อมใช้งานกลับทั้งหมด ส่วนถัง ที่ใช้งานได้จะทำการปักหมุดลงพิกัดในแผนที่ พร้อมติดสติ๊กเกอร์ QR code แสดงอายุ ของถังและประวัติการตรวจสอบถังให้ชัดเจน ในส่วนของพื้นที่เสี่ยงสูงที่เป็น พื้นที่สีแดงซึ่งเก็บถังเก่าไปจะเร่งนำที่จัดซื้อ ใหม่ลอตแรก 9,779 ถัง ไปทดแทนก่อน และเร่งจัดซื้อเพิ่มเติมอีก 3 หมื่นกว่าถัง เพื่อติดตั้งทดแทนในพื้นที่สีส้มที่เสี่ยงรองลงมาต่อไป
“ประชาชนในชุมชนต่างตื่นตัวให้ ความร่วมมือในการตรวจ ทุกครั้งที่ออกไป สำรวจ ผอ.เขต และประธานชุมชน จะมี การเตรียมรวบรวมรอไว้พร้อมตรวจ ซึ่ง เบื้องต้น อปพร. ในพื้นที่ที่รู้วิธีการจะช่วย เป็นกำลังในการตรวจ แต่หากประชาชนไม่มั่นใจสามารถโทร. 199 หรือแจ้งผ่าน Traffy Fondue เพื่อให้เจ้าหน้าที่ ดับเพลิงมาตรวจ โดยหลายชุมชนอยากให้สาธิตวิธีการด้วย”
รศ.ทวิดา กล่าว
3. อุโมงค์โคมไฟ
แนวคิด :เผยความงามและวัฒนธรรมของ ชาว เชียงใหม่ผ่านโคมล้านนา
เทคนิค :สร้างเส้นแสงลอดผ่าน “ตุง” ดึงความงามของโคมล้านนา ออกมา
บูธเชียงราย-พะเยา จัดเต็ม LINK
เตรียมพบกับ เทศกาลเที่ยวเมืองไทย “หมู่บ้านภาคเหนือ” แล้วแวะมา ชิม ช็อป บูธเชียงราย-พะเยา กันน๊า
1. SAWANBONDIN TEA & EXPERIENCE จังหวัดเชียงราย (NC6)
2. Horizon : Cafe & Restaurant จังหวัดเชียงราย (NC7)
3. Phayao Coffee Roaster จังหวัดพะเยา (NC8)
4. YOURS Thailand จังหวัดเชียงราย (NO7)
5. แม่อิงชิโบริ จังหวัดพะเยา (NO8)
6. น้ำเงี้ยวเชียงราย จังหวัดเชียงราย (NF9)
7. ข้าวเหลืองไก่ (ร้านข้าวซอยน้ำคั่ว) จังหวัดเชียงราย (NF10)
8. น้ำบ๊วย ชาแม่สลอง (ไร่ชาวังพุดตาล) จังหวัดเชียงราย (NF11)
9. Chiang Rai Fashion to the World จังหวัดเชียงราย (NH)
10. บ้านหนองหม้อ Creative Village จังหวัดเชียงราย (NH9)
11. Thailand Biennale Chiang Rai 2023 จังหวัดเชียงราย (NP02)
เปิดประสบการณ์เดินทางใหม่ #มาเหนือ ได้แม้อยู่กรุงเทพฯ
รวมอาหาร วัฒนธรรม สถานที่เที่ยว ไว้ในที่เดียว!
.
จัดเต็มความอลังการ ในโซน #หมู่บ้านภาคเหนือ กับเทศกาลเที่ยวเมืองไทย 2566 จัดเป็นครั้งที่ 41 ทุกท่านจะได้เข้ามาสัมผัสประสบการณ์การท่องเที่ยวในรูปแบบใหม่ พร้อมรวบรวม อาหาร ดนตรี วัฒนธรรม และการแสดงอันเป็นเอกลักษณ์พื้นเมือง ของภาคเหนือมาไว้ในที่เดียว
.
✨#ไฮไลต์ของงาน ใครอยากมาสัมผัสการเดินทางท่องเที่ยวธรรมชาติภาคเหนือต้องแวะ “โซนเวิ้งแวดเวียง” นำเสนอแหล่งท่องเที่ยว Unseen New Chapters ที่จะทำให้เรารู้สึกเหมือนได้ #มาเหนือ จริง ๆ เราจะได้เห็นภาพบรรยากาศสวย ๆ ได้ยินเสียงที่ทำให้ใจผ่อนคลาย และ ได้รู้สึกถึงการเดินทางไปสถานที่นั้น ให้ได้สัมผัสบรรยากาศอย่างใกล้ชิด อีกทั้งยังมีวิวทะเลหมอก Sunrise, Sunset, ไปจนถึง Starry Night ที่พร้อมเติมเต็มความงดงามของธรรมชาติให้กับชีวิต ซึ่งทั้งหมดนี้รวมอยู่ในที่เดียว อยากรู้ว่าจะเป็นอย่างไร ต้องลองมาสัมผัสด้วยตัวเองน้าาา
.
โซนเวิ้งแวดเวียง แบ่งออกเป็น 3 โซนหลัก กับ 1 โซนปิดท้าย
✅ ZONE 1 Amazing Northern Mueang Rong : ความงดงามแห่งธรรมชาติเมืองรอง จังหวัดภาคเหนือ
อลังการกับ แสง สี เสียง ของสถานที่ท่องเที่ยวธรรมชาติของภาคเหนือผ่านจอโปรเจคเตอร์รอบทิศทาง
.
✅ ZONE 2 Amazing Northern Faithival : มนต์ขลังแห่งความเชื่อและแรงศรัทธา
จำลองการเสี่ยงเซียมซีในวัดดังของภาคเหนือ ที่จะมีคำทำนายฉายผ่านจอโปรเจคเตอร์ให้เราดูด้วย
.
✅ ZONE 3 Amazing Northern Lifestyle : เสน่ห์แห่งการใช้ชีวิตและท่องเที่ยวภาคเหนือ
พาเดินทางไปสัมผัสกับธรรมชาติ ในช่วงเวลาที่สวยที่สุด ทั้งพระอาทิตย์ขึ้น พระอาทิตย์ตก และยามค่ำคืน รวมถึงจำลองบรรยากาศของวัฒนธรรม เทศกาล ให้เราได้เห็นเสน่ห์การใช้ชีวิตของคนเมืองเหนือ เพื่อสร้างแรงบันดาลใจในการท่องเที่ยวมากขึ้น
.
✅ ZONE 4 Unseen New Chapters
️ ปิดท้ายด้วย ภาพสถานที่ท่องเที่ยวภาคเหนือที่ติดอันดับใน Unseen New Chapters ผ่านจอ LED ขนาดใหญ่ ด้านท้ายกล่อง
.
งานนี้เข้าฟรี! จัดไปเลย 5 วันติด ตั้งแต่วันที่ 2-6 สิงหาคม 2566 มีกิจกรรมและการแสดงที่ไม่ซ้ำกันเลยในแต่ละวัน แล้วในงานสามารถลุ้นเป็นผู้โชคดี เข้าไปชิมอาหาร Fine dining ใน Concept เสน่ห์วันวานอาหารเหนือ จากเชฟเฟรนด์ เจ้าของร้าน AMI Fine dine เชฟผู้เชี่ยวชาญด้านอาหารไทยและอาหารไทยฟิวชั่น ได้แบบฟรี ๆ อีกด้วย ️
.
พิเศษสุด ยังมีการแสดงจากศิลปินท้องถิ่น และ ศิลปินชื่อดัง ให้เราได้รับชม ทั้ง น้องออร์แกน นักร้อง Youtuber สาวเสียงใส / ป้าดา golden song / วง HERS และ ICE TAMONWAN งานนี้จัดเต็ม ไม่มีกั๊กอย่างแน่นอน
.
การแสดงพื้นบ้าน จัดเต็มวันละ 3 รอบ อาทิเช่น ระบำสุโขทัย / ฟ้อนก๋ายลาย / การละเล่นพื้นบ้าน เดินกะลามะพร้าว และ กิจกรรม DIY วันละ 2 รอบ อาทิเช่น งานเขียนลายผ้าบาติค / ทำต่างหู ซึ่งในตลอดทั้ง 5 วัน ไม่มีซ้ำอย่างแน่นอน
.
แล้วใน ‘หมู่บ้านภาคเหนือ’ เขามีโซนอะไรบ้าง
✅ ซุ้มเย็นใจ๋
รวบรวมร้าน ชา กาแฟ โกโก้ คราฟท์โซดา หรือเครื่องดื่มผลิตจากภาคเหนือ ตกแต่งสไตล์บรรยากาศ Glamping จำนวน 12 บูธ
.
✅ คัวฮักคัวฮอม Otop
แหล่งรวมสินค้า Otop ส่งตรงจากภาคเหนือ จัดจำหน่ายสินค้ามากมายกว่า 20 ร้านค้า โดยผู้ประกอบการพื้นเมือง
.
✅ กาดหมั้ว
จัดเต็มอาหารเหนือ อาหารฟิวชั่น มิชลินเชียงใหม่ ให้ได้ลิ้มลองกันอย่างเต็มอิ่ม ได้แก่ Ginger Farm Kitchen ครัวหลองข้าว / ร้านดำรงค์ By หมูทอดกาดหลวงเชียงใหม่ / ก๋วยเตี๋ยวอังเล ร้านมิสเตอร์ฮังเล จ.ลำปาง / ข้าวเปิ๊บบ้านนาต้นจั่น จ.สุโขทัย และ ขนมเทียนเสวย บ้านกนกมณี จ.อุตรดิตถ์
.
✅ ซะป๊ะคราฟท์
จัดจำหน่ายสินค้า Handicraft ตกแต่งสไตล์ Minimal และ กิจกรรม DIY อาทิ การเพ้นท์เครื่องปั้นดินเผาชุมชนบ้านเหมืองกุง / แสตมป์ไม้บนถุงผ้า ฟ้าฮ่าม Indigo Craft & Studio จ.แพร่ / ทำตุ้มหู และ พวงกุญแจจากเศษผ้า / สุนทรีผ้าไทย Suntree-Thai จ.สุโขทัย / ทำตุงใยแมงมุม บ้านหนองหม้อ Creative Village จ.เชียงราย
.
✅ Product Highlight
3 บูธ สินค้าที่โดดเด่นของภาคเหนือ ได้แก่ อุทยานประวัติศาสตร์ศรีเทพ จ.เพชรบูรณ์ / กิจการน้ำพุร้อนสันกำแพง จ.เชียงใหม่ และ งาน Thailand Biennale Chiang Rai
.
✅ กาดนวด
กิจกรรม Wellness นวด/สปา ภาคเหนือ เช่น สปาจักราศี/สปาฟ้อนเล็บ การนวดภูมิปัญญาชาวบ้าน
.
✅ ลานกิจกรรม / ลานเอนกประสงค์
CHEF TABLE : กิจกรรมทานอาหาร Fine dining ใน Concept เสน่ห์วันวานอาหารเหนือ จากเชฟ เฟรนด์ เจ้าของร้าน AMI Fine dine
การละเล่นพื้นบ้านภาคเหนือ : โชว์กิจกรรมการละเล่นพื้นบ้านของคนในท้องถิ่น
การแสดงวัฒนธรรม : โชว์กิจกรรมการแสดงศิลปะ วัฒนธรรม ที่สืบทอดมาอย่างยาวนาน
การแสดง ศิลปิน Local : พบกับศิลปินท้องถิ่น และ ศิลปินชื่อดัง มากมายตลอดทั้ง 5 วัน
กิจกรรม DIY : ลงมือประดิษฐ์สิ่งของเครื่องใช้ต่าง ๆ จากภูมิปัญญาของชาวบ้านในท้องถิ่น
.
นอกจากนี้ ยังมีโซนกิจกรรมแชะ&แชร์ ถ่ายภาพฟรี พร้อมสแกน QR CODE แล้วรับภาพ ดิจิตอลได้เลย! รวมถึงยังมีของที่ระลึก ถุงผ้า และ Drip Bag “มาเหนือ” ที่จัดทำขึ้นพิเศษ สำหรับงานนี้เท่านั้น แจกด้วยยยยย ไม่ไปไม่ได้แล้วไหมมม
รถจักรไอน้ำส่วนหนึ่งที่จะมาจัดแสดงถาวร ณ สถานีกรุงเทพหัวลำโพง ให้ผู้สนใจได้รู้จัก ศึกษาและต่อเติมจินตนาการ
1. สถานีรถไฟจิตรลดา
สถานีรถไฟจิตรลดา เป็นสถานีที่สร้างขึ้น สำหรับพระบาทสมเด็จพระเจ้าอยู่หัว และพระบรมวงศานุวงศ์ ในการเสด็จพระราชดำเนินทางรถไฟ และเป็นสถานที่ต้อนรับพระราชอาคันตุกะในบางโอกาส ตั้งอยู่ทางทิศตะวันออกของสวนจิตรลดา ถนนสวรรคโลก แขวงสวนจิตรลดา เขตดุสิต กรุงเทพมหานคร
ฤกษ์แต่งงานปี 2566
ฤกษ์แต่งงานปี 2566 เดือนมกราคม
1 มกราคม 2566
10 มกราคม 2566
14 มกราคม 2566
16 มกราคม 2566
20 มกราคม 2566
28 มกราคม 2566
31 มกราคม 2566
ฤกษ์แต่งงานปี 2566 เดือนกุมภาพันธ์
3 กุมภาพันธ์ 2566
9 กุมภาพันธ์ 2566
13 กุมภาพันธ์ 2566
19 กุมภาพันธ์ 2566
26 กุมภาพันธ์ 2566
ฤกษ์แต่งงานปี 2566 เดือนมีนาคม
4 มีนาคม 2566
10 มีนาคม 2566
14 มีนาคม 2566
16 มีนาคม 2566
20 มีนาคม 2566
28 มีนาคม 2566
31 มีนาคม 2566
ฤกษ์แต่งงานปี 2566 เดือนเมษายน
3 เมษายน 2566
9 เมษายน 2566
13 เมษายน 2566
15 เมษายน 2566
29 เมษายน 2566
ฤกษ์แต่งงานปี 2566 เดือนพฤษภาคม
2 พฤษภาคม 2566
8 พฤษภาคม 2566
12 พฤษภาคม 2566
14 พฤษภาคม 2566
18 พฤษภาคม 2566
26 พฤษภาคม 2566
29 พฤษภาคม 2566
ฤกษ์แต่งงานปี 2566 เดือนมิถุนายน
1 มิถุนายน 2566
11 มิถุนายน 2566
13 มิถุนายน 2566
17 มิถุนายน 2566
24 มิถุนายน 2566
27 มิถุนายน 2566
30 มิถุนายน 2566
ฤกษ์แต่งงานปี 2566 เดือนกรกฎาคม
6 กรกฎาคม 2566
10 กรกฎาคม 2566
16 กรกฎาคม 2566
24 กรกฎาคม 2566
27 กรกฎาคม 2566
30 กรกฎาคม 2566
ฤกษ์แต่งงานปี 2566 เดือนสิงหาคม
5 สิงหาคม 2566
11 สิงหาคม 2566
15 สิงหาคม 2566
26 สิงหาคม 2566
29 สิงหาคม 2566
ฤกษ์แต่งงานปี 2566 เดือนกันยายน
4 กันยายน 2566
8 กันยายน 2566
10 กันยายน 2566
14 กันยายน 2566
21 กันยายน 2566
24 กันยายน 2566
ฤกษ์แต่งงานปี 2566 เดือนตุลาคม
3 ตุลาคม 2566
7 ตุลาคม 2566
9 ตุลาคม 2566
13 ตุลาคม 2566
21 ตุลาคม 2566
24 ตุลาคม 2566
27 ตุลาคม 2566
ฤกษ์แต่งงานปี 2566 เดือนพฤศจิกายน
2 พฤศจิกายน 2566
6 พฤศจิกายน 2566
12 พฤศจิกายน 2566
19 พฤศจิกายน 2566
25 พฤศจิกายน 2566
ฤกษ์แต่งงานปี 2566 เดือนธันวาคม
1 ธันวาคม 2566
5 ธันวาคม 2566
7 ธันวาคม 2566
11 ธันวาคม 2566
19 ธันวาคม 2566
22 ธันวาคม 2566
25 ธันวาคม 2566
31 ธันวาคม 2566 ชูวิทย์ ให้สัมภาษณ์ดังนี้


"ผมจะเรียนให้ทราบง่ายๆ ผมใช้ชีวิตช่วงสุดท้ายแตกต่างจากคนอื่น แตกต่างยังไง ผมกินเหล้า ผมสูบบุหรี่ ผมออกมาแฉ ผมออกมาพูด คนอื่นไม่กล้า ผมทำด้วยความเต็มใจ ผมทำด้วยความสุขของผม แน่นอนลูกเมียครอบครัวเขาอยากจะให้ผมไปพักผ่อนอยู่สงบสงบเถอะพ่อ เพื่อนฝูงก็บอกว่าเอาเบาเบาหน่อย แต่ผมเรียนให้ทราบว่า ผมใช้ชีวิตในช่วงสุดท้ายแตกต่างจากคนอื่น ผมอาจจะนั่งในสวน นั่งอยู่บนโซฟา คิดระลึกถึงสิ่งที่ผ่านมา ว่าผมทำอะไรไป หรือผมอาจจะนอนอยู่ในโรงพยาบาล มีสายยางระโยงระยาง หรือวันนึงผมอาจจะตื่นขึ้นมาเป็นอัมพฤกษ์อัมพาต ดังนั้นผมเป็นคนใช้ชีวิตทุกวันทุกวันเหมือนวันสุดท้าย แล้วเรื่องอะไรที่ผมทำได้ผมทำ อะไรที่มีความสุขผมก็ทำ หมอบอกว่าอย่าทำ ผมบอก หมอ ไม่ทำแล้วมันจะหายไหม หมอบอกไม่หาย อย่างนั้นอย่าบอกแล้วกันว่าให้ผมไม่ต้องงด ผมก็ทำของผมมีความสุข ดังนั้นการกระทำของผมเนี่ย ผมทำให้กับประเทศ ผมทำให้กับสังคม ผมมีความสุข ผมต้องการตำแหน่งมั๊ย ผมไม่ต้องการตำแหน่ง จะให้เงินผมมั๊ย ผมไม่ต้องการ คุณเคยให้ผมมาแล้วไง 6 ล้าน ผมก็เอาไปให้โรงพยาบาล ดังนั้นถ้าถามผมว่า ผมเป็นอะไรไหม สิ่งที่ผมเป็น มันไม่ได้เกี่ยวอะไรกับสิ่งที่ผมทำเลย ผมเป็นคนใช้ชีวิตด้วยความสุข ใช้ชีวิตในวัยสุดท้าย วันเวลาสุดท้ายอย่างมีความสุข ผมเลือกวิถีชีวิตแบบนั้น ไม่กินนู่นนะ ไม่กินนี่นะ แล้วมันหาย(ไหม) มันไม่หาย เมื่อมันไม่หาย ไวน์ขวดเท่าไหร่ ขวดละ 3 แสน มึงรีบเปิดเลยนะ มึงรีบเปิดกินวันนี้เลย ตั้งแต่วันนี้ เพราะอะไร เพราะกูไม่รู้ว่าพรุ่งนี้จะได้กินหรือเปล่า นั่นก็คือนิยามในการใช้ชีวิตของผม บางคนก็อาจจะไม่ได้ใช้ ดังนั้นชีวิตใครชีวิตมัน ผมเลือกวิถีทางแบบนี้แล้ว มันเป็นวิถีทางปลายทาง บางคนอาจจะเข้าวัดเข้าวา บางคนอาจจะนั่งธรรมะธรรมโม แต่ผมเป็นคนใช้ชีวิตแบบนี้ เลือกเอาความสุขในวาระสุดท้าย ผมมีหมายกำหนดการ หมายกำหนดการของผม เค้าแมกซิมั่นผม อยู่ไม่เกินแปด เพราะฉะนั้นคุณต้องดีใจนะ คุณอาจจะคิดถึงผม ในวันที่ผมไม่อยู่ คุณอาจจะคิดถึงว่า เอ๊ะมันขาดอะไรไป ซักวันนึง วันรุ่งขึ้นทุกอย่างก็เหมือนเดิมแหละครับ มันไม่มีอะไรเปลี่ยนหรอกครับ ผมไป ผมก็ไปในที่ที่สวยงาม ผมไปในที่ที่ผมคิดว่าผมไปแล้วทุกคนมีความสุข ลูกหลานไม่ต้องไปจัดงานให้สิ้นเปลือง เพราะผมมอบร่างกาย นี่ยังดีนะที่ผมอยากมีโอกาสมาคุยกับคุณ มันดีกว่าคนบางคนซะด้วยซ้ำนะ ที่เปิดมาแล้วอัมพฤกษ์อัมพาต จำอะไรไม่ได้ ยังมีโอกาสร่ำ มีโอกาสลากัน เพราะฉะนั้นอย่าไปคิดครับ เกิดแก่เจ็บตายมันเรื่องธรรมดา ไอ้ผมนี่มันไม่กลัวไง คุณถึงกลัวผมไง เพราะถ้าคนอื่นเค้าหวังได้โน่นได้นี่ หวังว่าจะใหญ่จะโต หวังว่าจะมีตำแหน่ง แต่ผมเห็นว่าไม่เหมาะสม ผมก็เลยนำเรื่องนี้มาพูดให้พวกคุณและสังคมได้ฟัง และสังคมก็เป็นผู้พิจารณา -
Nation Online
โปรโมชั่น Happy & Healthy Mom @รพ.วิภาวดี
ต้อนรับเทศกาลวันแม่
พบกับ โปรโมชั่น“Happy & Healthy Mom ”
Happy Lady
โปรแกรมตรวจสุขภาพ ความเสี่ยงผู้หญิง
โปรแกรมตรวจสุขภาพหัวใจ
โปรแกรมตรวจพิเศษ แผนก X-ray
โปรแกรมตรวจสุขภาพเบาหวาน
ตั้งแต่วันที่ 1 ส.ค - 30 ก.ย 2566
1957
การดำเนินกิจการของโรงพยาบาลกรุงเทพคริสเตียนในช่วง 4-5 ปีแรกประสบความสำเร็จเป็นอย่างดี มีผู้ป่วยมาใช้บริการเพิ่ม มากขึ้นอย่างต่อเนื่อง ทำให้อาคารเก่าคับแคบลงโรงพยาบาลจึงได้ดำเนินการก่อสร้างอาคารคอนกรีต 3 ชั้น ขึ้นหลังหนึ่งเพื่อเปิด เป็นแผนกรับผู้ป่วยนอก แผนกธุรการ แผนกทันตกรรม แผนกชันสูตร์โรค ห้องนมัสการ และแผนกเภสัชกรรม
กลุ่มหญิงตั้งครรภ์และหลังคลอด
กลุ่มหญิงตั้งครรภ์และหลังคลอด
- ทดสอบการตั้งครรภ์
- ตรวจครรภ์และประเมินความเสี่ยง
- ตรวจครรภ์ด้วยอัลตราซาวด์
- ตรวจเลือดคัดกรองภาวะซีด ซิฟิลิส เอชไอวี ตับอักเสบบี ธาลัสซีเมียและดาวน์
- ตรวจปัสสาวะ
- ฉีดวัคซีนคอตีบ บาดทะยักและวัคซีนไข้หวัดใหญ่
- ให้ยาบำรุงเสริมธาตุเหล็ก โฟลิกและไอโอดีน
- การให้ยาต้านไวรัสเอชไอวีเพื่อป้องกันการติดเชื้อจากแม่สู่ลูก
- ตรวจช่องปากและฟัน ขัดและทำความสะอาดฟันรวมถึงการขูดหินน้ำลาย
- ประเมินสุขภาพจิต
- ตรวจหลังคลอดและคุมกำเนิด
- ส่งเสริมการเลี้ยงลูกด้วยนมแม่ สมุดบันทึกสุขภาพ
- การคัดกรองธาลัสซีเมีย รวมทั้งการคัดกรองธาลัสซีเมียในคู่ของหญิงตั้งครรภ์
รางวัลชนะเลิศ ผลงานของ Matias Bercovich
ศิลปะการทำขนมปัง-ขนมอบ@ เลอ กอร์ดอง เบลอ ดุสิต LINK
เลอ กอร์ดอง เบลอ ดุสิต เปิด 2 หลักสูตร
• หลักสูตรประกาศนียบัตรศิลปะการทำขนมปัง (THE ART OF BAKERY) ฝึกทักษะการทำขนมปังแบบเข้มข้นในระยะเวลา 8 สัปดาห์ หรือ 240 ชั่วโมง ซึ่งเหมาะสำหรับผู้ที่ชื่นชอบและใฝ่ฝันจะเป็นมืออาชีพทางด้านการทำขนมปัง ผู้สำเร็จการศึกษาจะได้รับประกาศนียบัตรศิลปะการทำขนมปัง (Diplôme de Boulangerie) ที่รับรองโดยสถาบัน เลอ กอร์ดอง เบลอ และกระทรวงศึกษาธิการ
- ภาคเรียน: กุมภาพันธ์ พฤษภาคม กรกฎาคม ตุลาคม เรียน 5 ชั่วโมง/วัน (จันทร์ - ศุกร์) เรียน ภาษาอังกฤษพร้อมล่ามแปลภาษาไทย
• หลักสูตรประกาศนียบัตรการประกอบขนมอบ (PÂTISSERIE PROGRAMME) เน้นการถ่ายทอดเทคนิคการทำขนมอบตามแบบฉบับของ เลอ กอร์ดอง เบลอ และมุ่งฝึกฝนให้ผู้เรียนมีความเชี่ยวชาญในการใช้เครื่องครัวและอุปกรณ์ต่าง ๆ ผู้เรียนจะได้เรียนรู้การทำขนมเค้ก และขนมอบแบบฝรั่งเศสนานาชนิดทั้งในแบบดั้งเดิมและร่วมสมัย ที่มีวางจำหน่ายในร้านอาหาร ร้านเบเกอรี่ และร้านน้ำชา รวมไปถึงเทคนิคการทำช็อกโกแลต และศิลปะการทำน้ำตาลขั้นสูง
- ภาคเรียน: ภาควันธรรมดา: กุมภาพันธ์ พฤษภาคม กรกฎาคม ตุลาคม 11 - 12 สัปดาห์ | 3 เดือน / ระดับชั้น
ภาคพิเศษวันเสาร์: กุมภาพันธ์ กรกฎาคม 21 - 23 สัปดาห์ | 6 เดือน / ระดับชั้น
จำนวนชั่วโมงรวม: 180 ชั่วโมง / ระดับชั้น เรียน ภาษาอังกฤษพร้อมล่ามแปลภาษาไทย
โทร:02-2378877
ข้าวหมูแดงนายชุน ข้างศาลาว่าการ กทม.
ร้านข้าวหมูแดง 100 ปี ปากตรอกดินแดง เก่าแก่และระบือนามสมคำลือ เล่าว่าแรกเริ่มขายในม.ธรรมศาสตร์ ท่าพระจันทร์ ย้ายมาความที่อยู่ใกล้ศาลาว่าการกรุงเทพมหานคร ในภายหลัง (แต่ว่าเมื่อไหร่ไม่มีข้อมูล) ร้านนี้ได้รับใช้ประชาชน คนราชการ ใหญ่น้อยละแวกนั้นมายาวนาน รวมทั้งผู้ว่ากทม.ทุกคนมาแล้ว ได้ตราเชลชวนชิมเมื่อปี 2534 ครั้งหนึ่งผู้ว่าสมัคร (สุนทรเวช) เคยชมร้านนี้ออกทีวีกันเลย ปัจจุบันยังคงเสริฟข้าวหมูแดงเตาถ่านสูตรดั้งเดิม หมูกรอบมันไม่เยิ้ม ไข่ต้มสไตล์พะโล้ และน้ำราดสมุนไพรสีเข้มจัดรสหนักแน่นหวานิดๆ ก็ชอบเช่นกันค่ะร้านนี้ แม้ไม่ได้มาบ่อย เพราะจอดรถยากมาก เลยนานนานที
ร้านอยู่บนถนนดินสอ ละแวกนี้ก็ร้านเด็ดอีกหลายร้านไล่มาตั้งแต่ข้าวมันไก่ลั่นฟ้า มิตรโกหย่วน โจ๊กเจ้หงษ์ นันฟ้าเป็ดย่าง มนต์นมสด ร้านกาแฟเครื่องดื่มอีกเพียบ ถ้ามีเวลาเดินไปในตรอกตึกดิน ตรอกมหรรณพ ตรอกวัดราชนัดดา ก็อาจเจอร้านที่ชอบอีกก็ได้ ต้องเดินค่ะ สมทบทุนเพื่อสร้างบ้านหลังที่สองของเด็กป่วย รพ.สรรพสิทธิประสงค์ อุบลราชธานี
ร่วมบริจาคได้ที่ บัญชีบริจาค โรงพยาบาลเด็ก สรรพสิทธิประสงค์ ธนาคารออมสิน เลขที่บัญชี 020409188784 *ยอดบริจาคนำไปลดหย่อนภาษีได้
ทีม M 1 ส้มโอและลูกเจี๊ยบ ทีมเจริญสิน
ร่วมโหวต ให้ทีม M 1 ส้มโอและลูกเจี๊ยบ ทีมเจริญสิน เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า


ด้านนายสุเทพ พันธุ์เพ็ง กรรมการผู้อำนวยการใหญ่ บริษัท รถไฟฟ้า ร.ฟ.ท. จำกัด กล่าวว่า “รถไฟฟ้า ร.ฟ.ท. ในฐานะผู้กำกับดูแลการเดินรถไฟฟ้าแอร์พอร์ต เรล ลิงก์ ของ เอเชีย เอรา วัน มีความยินดีเป็นอย่างยิ่งที่ได้อำนวยความสะดวกให้แก่ศูนย์บริการโลหิตแห่งชาติ สภากาชาดไทย ในการใช้พื้นที่ของ แอร์พอร์ต เรล ลิงก์ สถานีมักกะสัน เพื่อนำมาดัดแปลงมาเป็นศูนย์บริจาคโลหิตเคลื่อนที่ เนื่องจากเป็นสถานที่ที่กว้างขวาง สะอาด และมีการระบายอากาศได้ดี อีกทั้งยังสามารถเดินทางมาได้สะดวกรวดเร็วด้วยรถไฟฟ้าแอร์พอร์ต เรล ลิงก์ อีกด้วย ผมหวังเป็นอย่างยิ่งว่าศูนย์บริจาคโลหิตเคลื่อนที่แห่งนี้จะสามารถรองรับ และอำนวยความสะดวกให้แก่ประชาชนทุกท่าน ที่มีจิตกุศลร่วมแรงร่วมใจกันทำความดีเพื่อช่วยเหลือเพื่อนมนุษย์ และเพื่อตอบสนองความต้องการโลหิตสำรองของสภากาชาดไทยได้เป็นอย่างดี ทั้งนี้ศูนย์บริจาคโลหิตเคลื่อนที่แห่งนี้จะสามารถอำนวยความสะดวกรวดเร็วในการเดินทางให้แก่ประชาชน โดยผู้ที่สนใจสามารถเดินทางด้วยรถไฟฟ้าแอร์พอร์ต เรล ลิงก์ มาลงที่สถานีมักกะสัน และเดินไปยังจุดฉีดวัคซีนที่จัดไว้ให้ ณ บริเวณ Express Zone ชั้น 3 ประตู 1 ของตัวอาคารสถานีมักกะสัน ซึ่งอยู่ติดกับชั้นจำหน่ายบัตรโดยสารของสถานีมักกะสัน ได้โดยสะดวก”
ความสำเร็จในการประยุกต์ใช้โมเดลใหม่
ความสำเร็จในการประยุกต์ใช้โมเดลใหม่ ด้วยการลงทุนเพิ่มในเทคโนโลยี AI ข้อมูลสารสนเทศ การดูแลรักษาผู้ป่วย และการฝึกอบรมผ่านทางออนไลน์
การนำโมเดลการดูแลผู้ป่วยแบบใหม่มาใช้ในภูมิภาคเอเชีย-แปซิฟิก ได้รับแรงหนุนจากการลงทุนเพิ่มในเทคโนโลยีดิจิทัลเฮลท์ และการขยายของระบบออนไลน์ (virtual care) ไปยังส่วนต่างๆ ในระบบนิเวศด้านเฮลท์แคร์
กล้อง CCTV กทม.จับผู้ขับขี่บนทางเท้า
35 ปีที่เราภูมิใจมากกับความสำเร็จและความเข้มแข็ง - นพ.สุรสิทธิ์ อัศดามงคล
นพ.สุรสิทธิ์ อัศดามงคล ประธานกรรมการบริหาร โรงพยาบาลบางมด แพทย์เฉพาะทางด้านศัลยกรรมตกแต่งและเสริมสร้างใบหน้า ศูนย์ศัลยกรรมความงาม เน้นย้ำถึงการขยายฐานการตลาดแบบองค์รวมและความพร้อมของโรงพยาบาลบางมดในปัจจุบันว่า “จากการเป็นแพทย์ชนบทที่ได้มาเปิดคลินิกเล็กๆ บนถนนพระราม2 ย่านบางมด แต่เดิมถนนเส้นนี้ไม่มีโรงพยาบาลเลย มีเรามาตั้งเป็นโรงพยาบาลแรก ซึ่งถนนธนบุรีปากท่อเป็นถนนที่มีอุบัติเหตุมากที่สุด ได้ทำเคสอุบัติเหตุเยอะมาก เลยคิดว่าควรไปเรียนต่อเฉพาะทางด้านศัลยกรรมตกแต่งเพื่อที่จะได้ช่วยคนไข้ที่มีอยู่มากให้เขากลับมามีคุณภาพชีวิตที่ดี สมัยก่อนเรื่องของการทำศัลยกรรมยังไม่ได้รับความนิยมมากนัก รวมถึงการศัลยกรรมตกแต่งใบหน้าและส่วนต่างๆ ของร่างกายเพื่อเสริมบุคลิกภาพและความมั่นใจ จนคนไข้เพิ่มขึ้นจึงมีการขยายเป็นโรงพยาบาลขนาด 50 เตียงเมื่อปี 2526 และขยายเป็น 100 เตียง 400 เตียง จนถึงวันนี้เป็น 35 ปีที่เราภูมิใจมากกับความสำเร็จและความเข้มแข็งในการตั้งโรงพยาบาลบางมดนี้มา
ปฏิกิริยาเพื่อนบ้านในเอเชีย
บรรดาประเทศและดินแดนในเอเชียมีความเห็นที่แตกต่างกัน ในเรื่องการปล่อยน้ำที่ได้รับการบำบัดและเจือจางแล้วจากโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะ ไดอิจิลงทะเล
ฟิลิปปินส์ได้แสดง "ความเข้าใจ" และระบุว่ายอมรับความเชี่ยวชาญทางเทคนิคของทบวงการพลังงานปรมาณูระหว่างประเทศในเรื่องนี้ เนื่องจากเป็นหน่วยงานที่ตรวจสอบความปลอดภัยของแผนการปล่อยน้ำ และสรุปว่าเป็นไปตามมาตรฐานความปลอดภัยระหว่างประเทศ
กระทรวงต่างประเทศฟิลิปปินส์ระบุว่า จะยังคงสังเกตการณ์อย่างใกล้ชิดถึงผลกระทบต่อทะเลในภูมิภาค "จากมุมมองบนพื้นฐานทางวิทยาศาสตร์และข้อเท็จจริง"
ขณะที่โฆษกกระทรวงการต่างประเทศของไต้หวันระบุว่า เคารพผู้เชี่ยวชาญในประเด็นทางวิทยาศาสตร์และกล่าวเสริมว่า ไต้หวันจะยังคงเรียกร้องญี่ปุ่นให้ปล่อยน้ำตามมาตรฐานระหว่างประเทศ
ส่วนจีนยังคงคัดค้านการปล่อยน้ำของญี่ปุ่น โดยกระทรวงการต่างประเทศของจีนได้ออกแถลงการณ์ระบุว่าขอ "คัดค้านอย่างแข็งขันและประณามอย่างรุนแรง" ต่อแผนดังกล่าว
เจ้าหน้าที่ศุลกากรของจีนได้ประกาศว่าจะระงับการนำเข้าผลิตภัณฑ์ทางทะเลของญี่ปุ่นทั้งหมดเริ่มจากวันพฤหัสบดีที่ 24 สิงหาคม
ขณะที่นายฮัน ด็อก-ซู นายกรัฐมนตรีของเกาหลีใต้กล่าวว่า รัฐบาลจะรวบรวมข้อมูลที่เกี่ยวข้องและเฝ้าสังเกตการณ์การปล่อยน้ำของญี่ปุ่น นอกจากนั้นยังระบุว่า เกาหลีใต้จะดำเนินมาตรการสนับสนุนที่หลากหลายเพื่อปกป้องอุตสาหกรรมประมง
ประวัติ พระอาจารย์โชคดี พระครูวศินปริยัตยากร เจ้าอาวาสวัดไก่เตี้ย
ประวัติ พระครูวศินปริยัตยากร (#พระอาจารย์โชคดี) เจ้าอาวาสวัดไก่เตี้ย เขตตลิ่งชัน กรุงเทพมหานคร
นามเดิมชื่อ สมภูมิ นามสกุล ร่มโพธิ์ทอง เกิดเมื่อวันเสาร์ที่ 21 มี.ค.2513 ณ บ้านสาลี ต.สาลี อ.บางปลาม้า จ.สุพรรณบุรี เป็นบุตรชายคนโตของพี่น้อง 4 คน เมื่ออายุได้ 7 ขวบ ท่านสนใจศึกษาอ่านเขียนและท่องมนตรากับคุณตาฆราวาสจอมขมังเวทยุคเก่า ได้รับสืบทอดวิชาอาคมและมนต์มหาเสน่ห์จากคุณตามาเต็มสูตร
หลังจากพระอาจารย์ได้เข้าสู่ทางธรรมแล้ว
พระอาจารย์มุ่งมั่นเรียนพระปริยัติธรรมสอบได้นักธรรมชั้นเอกและเปรียญธรรม 3 ประโยค และฝากตัวเป็นศิษย์เรียนวิปัสสนากรรมฐานกับหลวงพ่อสิงห์โต ซึ่งเป็นศิษย์หลวงพ่อช่อง กรรมฐานสายหลวงพ่อปาน วัดบางนมโค อยุธยา จนเชี่ยวชาญดีแล้วก็ออกธุดงค์ไปตามป่าเขาลำเนาไพร
จากนั้นได้เดินธุดงค์เข้าไปในประเทศเขมรแถบพระตะบองและเมืองเสียมเรียบ ได้ศึกษาคาถาอาคมกับพระอาจารย์ชาวเขมร เรียนวิชาพญาไก่เถื่อนเรียกทรัพย์ เมตตามหานิยมโชคลาภ ด้วยจิตอันตั้งมั่น
ครั้งหนึ่งมีโอกาสไปเรียนวิชา “นะหน้าขุนแผน” ลงแป้งเสกแป้งวิเศษกับพ่อครูเฒ่าชาวมอญ จ.กาญจนบุรี โดยให้สัจจะว่าจะไม่เรียกพานครู (เงินทอง) จากใครทั้งสิ้น พร้อมช่วยเหลือทุกคนที่เข้ามาพึ่งใบบุญ
เป็นต้นตำรับ “นะหน้าขุนแผน” อันลือลั่น เพราะสืบสานวิชาสายรามัญ (มอญ) แต่เพียงรูปเดียว การลงนะตามตำรับรามัญมี 4 อย่าง ประกอบด้วย
1.นะหน้าขุนแผน ลงหน้าผาก เด่นและดีเรื่องเมตตามหานิยม ค้าขาย ใครเห็นใครรัก เจรจาธุรกิจราบรื่น ผู้ใหญ่เจ้านายเมตตารักใคร่ช่วยเหลือ เลื่อนยศเลื่อนตำแหน่งได้เร็ว
2.นะสาลิกาเรียกทรัพย์ ลงอักขระที่ริมฝีปาก ดีเรื่องเจรจาการค้า ธุรกิจ เหมาะกับดารานักร้องศิลปิน นักแสดงและอาชีพที่ต้องพบปะผู้คน
3.นะเรียกเงิน ลงที่มือขวา อุปมาว่ารับทรัพย์ หยิบจับอะไรก็เป็นเงินเป็นทอง ร่ำรวยล่ำซำ
4.นะเรียกทอง ลงยันต์นะที่มือซ้าย อุปมาว่า เรียกทรัพย์ต่างๆ มาครอบครองได้อย่างใจสมปรารถนา
ทั้งหมดนี้ คือประวัติของพระอาจารย์ โชคดี สาธุ
สำหรับวัตถุมงคลล่าสุดที่ได้รับการกล่าวขานกันมากคือ พระขุนแผนเนื้อหยกแท้ ปะจุตะกรุดทองคำอุดผงสมเด็จบางขุนพรม เป็นพระที่มีพิธีเข้มขลัง โดยจัดพิธีพุทธาภิเษก วันเสาร์ที่ 11 มีนาคม 2566 มีพระเกจิอาจารย์ร่วมปลุกเสก อาทิ หลวงพ่อสมชาย วัดปริวาส หลวงพ่ออ่าง วัดใหญ่สว่างอารมณ์ หลวงพ่อวิทยา วัดบางคลาน หลวงพ่อวิชัย วัดสันติวิหาร เป็นต้น
ก่อนนั้นพระอาจารย์โชคดี ได้ปลุกเสกเดี่ยว 3 เดือน อธิษฐานจิตอย่างเข้มขลัง ตามตำราที่ได้เรียนจากครูบาอาจารย์มา เป็นเสร็จพิธี
ท่านใดสนใจไปกราบมนัสการขอพร พระอาจารย์โชคดี เชิญที่วัดไก่เตี้ย เขตตลิ่งชัน กรุงเทพมหานครได้ทุกวัน ตั้งแต่เวลา 09.00-16.00 น. ยกเว้นวันพระ (งดรับแขก)
โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ บางเขน
โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ บางเขน
เลขที่ 50 ถนนพหลโยธิน
แขวง ลาดยาว เขต จตุจักร
กรุงเทพมหานคร 10900 ประเทศไทย
โทรศัพท์ : 02-797-1900 กด 9
รอบเช้า เริ่มเปิดรับลงทะเบียน เวลา 07.30 น. ปิด เวลา 14.00 น.
เว้นวันศุกร์ รอบเช้า เริ่มเปิดรับลงทะเบียน เวลา 07.30 น. ปิด เวลา 11.00 น.
รอบเย็น เริ่มเปิดรับลงทะเบียน เวลา 16.30 น. ปิด เวลา 19.30 น
กรณีฉุกเฉิน
แผนกฉุกเฉินและสัตว์ป่วยวิกฤตของโรงพยาบาลสัตว์ฯ สามารถให้บริการในกรณีฉุกเฉินและสัตว์ป่วยวิกฤตได้ตลอด 24 ชั่วโมง
Facebook |
Website |
แผนที่นายปริญญา ผลบุตร นักธรณีวิทยา (Petrophysicist)
“นอกจากการได้แบ่งปันความรู้ให้เด็กๆ รู้สึกรักวิชาคณิตศาสตร์มากขึ้นแล้ว อีกจุดมุ่งหมายที่โครงการ After School Program เน้นคือการปลูกฝัง Growth mindset ให้เด็กๆ รู้สึกว่าถ้าทุกคนทำได้ เราก็ทำได้ ผมว่าสิ่งนี้แหละคือหัวใจสำคัญของการเรียนรู้ที่เปิดพื้นที่ให้ทุกคน”
นายปริญญา ผลบุตร หรือ คุณหนุ่ม ผู้มีอาชีพหลักเป็นนักธรณีวิทยา (Petrophysicist) ประจำที่ บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด ได้บอกเล่าถึงประสบการณ์การสอนในเวลา “หลังเลิกเรียน” ที่ได้เปลี่ยนบทบาทจากพนักงานบริษัทสู่คุณครูอาสาของโครงการ After School Program เพื่อสอนวิชาคณิตศาสตร์ทุกสัปดาห์ให้กับโรงเรียนวัดประชาศรัทธาธรรม โดยเมื่อทางบริษัทฯ ได้เข้าร่วมสนับสนุนโครงการ After School Program และประกาศรับอาสาสมัครในโครงการดังกล่าว จากการที่มีประสบการณ์และรักในการสอน คุณหนุ่มจึงได้ตัดสินใจสมัครเข้าร่วมทันทีแบบไม่ลังเล พร้อมโอบอุ้มความฝันที่อยากจะมีส่วนร่วมในการพัฒนาการศึกษาไทยให้ไกลกว่าเดิม
“ในฐานะครูอาสาที่ทำงานเป็นพนักงานบริษัทไปด้วย ผมอยากแบ่งปันความรู้จากนอกห้องเรียน หรือประสบการณ์รอบตัวจากงานที่ได้ทำมาประยุกต์ใช้ให้เด็กๆ สนุกกับการเรียนคณิตศาสตร์มากขึ้น โดยมองว่าการจะทำให้เกิดการเรียนรู้ได้นั้น เด็กต้องรู้สึกสนุกและเปิดใจก่อน จึงได้นำเอาการสอนคณิตศาสตร์แนวทางสิงคโปร์ (Singapore Maths) มาใช้ ซึ่งเน้นให้น้องๆ เข้าใจเลขคณิตผ่านภาพหรือโมเดลแทนการท่องจำจากตัวเลข เช่น เรียนรู้ด้านการหารผ่านกิจกรรมที่ให้เด็กๆ สัมผัสได้จริงอย่างการแบ่งสิ่งของหรือขนมเป็นจำนวนเท่าๆ กัน ในตอนแรกน้องๆ ยังรู้สึกไม่มั่นใจ แต่พอผ่านมาถึงประมาณสัปดาห์ที่ 6 สัมผัสได้ว่าพื้นฐานเบื้องต้นทางคณิตศาสตร์ดีขึ้นและชอบวิชานี้มากขึ้น ซึ่งตรงกับความตั้งใจที่อยากให้เด็กๆ รู้สึกว่าตนเองทำได้ ขอแค่เปิดใจเรียนรู้และฝึกฝน” คุณหนุ่ม กล่าวเพิ่มเติม
โครงการอาสาจุฬาภรณ์ได้รับการตอบรับที่ดีจากชุมชน มีผู้เข้ารับการอบรมอย่างต่อเนื่องสู่รุ่นที่ 3 และมีนักศึกษาจากวิทยาลัยแพทยศาสตร์ศรีสวางควัฒนเข้าร่วมเป็นอาสาจุฬาภรณ์ในทุกรุ่นด้วย วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน จึงได้จัดโครงการอาสาจุฬาภรณ์ขยายผล และขยายพื้นที่เป้าหมายการพัฒนาศักยภาพของประชาชน รวมถึงการสนับสนุนให้ประชาชนและบุคลากรในหน่วยงานท้องถิ่นนั้นมีส่วนร่วมในการสร้างเสริมสุขภาพ ปฏิบัติหัตถการทางการแพทย์ในเบื้องต้นได้ อีกทั้งมีส่วนร่วมในการสร้างระบบการดูแล ส่งเสริมสุขภาพชุมชน และสนับสนุนการวิจัยชุมชนที่อาจช่วยพัฒนาชุมชนในระยะยาว ทั้งนี้ ยังให้อาสาจุฬาภรณ์เสนอแนวคิดในการพัฒนาชุมชน เพื่อสร้างรายได้ให้กับตนเองและชุมชนไปสู่การพัฒนาอย่างยั่งยืน
คลินิกการแพทย์ผสมผสาน ศูนย์ส่งเสริมสุขภาพแผนไทย
ศูนย์ส่งเสริมสุขภาพแผนไทย อาคารเรือนไทย กระทรวงสารารณสุข " เปิดให้บริการ " คลินิกการแพทย์ผสมผสาน
ฝังเข็มรักษาโรค ปรับสมดุลโครงสร้างร่างกาย
กดจุดคลายพังผืด (ผ่าตัดเทียม)
หมอนรองกระดูกทับเส้นประสาท
ปวดเรื้อรัง ปวดตามข้อ ข้อติด
ปวดศีรษะไมเกรน
นิ้วล็อค
พังผืดใต้ฝ่าเท้า
เอ็นข้อมืออักเสบ
ภัญชาทางการแพทย์แผนไทย
เมตตาโอสถ-การุณย์โอสถ-ตำรับหมอเดชา
ค่าบริการตามสิทธิ์การรักษา
ติดต่อสอบถาม / จองคิว
ทุกวันอังคาร เวลา 08.30 - 16.30 น.
:02-591-1964/02-590-2606
ทุกวันพฤหัสบดี เวลา 08.30 - 12.00 น.
ไลน์ ID:@8510LXSQ
หมายเหตุ : กรุณานัดหมายล่วงหน้า
กรณีพบเพจปลอม
กรณีพบเพจปลอม
1. กดไป จุด 3 จุด
2. กด Report Profile
3. เลือก Fake page
4. กด Done
แจ้งเตือนเคสเพจปลอดหลอกลงทุนผ่าน อีเมล์ setcontactcenter@set.or.th
โทร. 02-009-9999
การสกัด Psilocybin: ความท้าทายและวิธีการที่เกิดขึ้นใหม่ - Holland Green Science Europe
เว็บไซต์ Holland Green Science Europe เผยแพร่บทความน่าสนใจเรื่อง
การสกัด Psilocybin: ความท้าทายและวิธีการที่เกิดขึ้นใหม่ (Psilocybine-extractie: uitdagingen en opkomende methoden) เกี่ยวกับ ความพยายาม "ลดทอนความเป็นอาชญากรรมของไซโลไซบิน" โดยพัฒนาและยกระดับอุตสาหกรรมแอลไซโลไซบินที่ถูกกฎหมายขึ้นมา ด้วยในปัจจุบันมีความสำเร็จในการสกัดสารสกัดจาก ไซโลไซบิน ที่ทำได้มาตั้งแต่ปี 2017 กอปรกับ มีงานวิจัยทางการแพทย์ บางชิ้นที่แนะนำว่าแอลไซโลไซบิน อาจมีการใช้งานที่เป็นไปได้สำหรับการจัดการ ภาวะซึมเศร้าที่ทนต่อการรักษา และ การรักษาโรคพิษสุราเรื้อรัง จึงเป็นความหวังว่าจะได้รับการยอมรับในระดับนานาชาติต่อไป
โรงพยาบาลลาดพร้าว 1-4 เข็ม
โรงพยาบาลลาดพร้าว ศูนย์กุมารเวชกรรม ศูนย์อายุรกรรม แนะนำ วัคซีนป้องกันไข้เลือดออก (4 สายพันธุ์) ลดความเสี่ยงที่จะเกิดอาการรุนแรงจากโรคไข้เลือดออก ปกป้องคุณและคนที่คุณรัก คำแนะนำการรับวัคซีน
1.เหมาะสำหรับผู้ที่มีอายุ 4 ปี - 60 ปี
2.ฉีดได้ในคนที่เคยและไม่เคย ติดเชื้อไข้เลือดออกมาก่อน
3.สามารถรับวัคซีนได้เลยไม่ต้องทำการตรวจเลือด
โรงพยาบาลวิภาวดี แจ็บ แอนด์ โก
โรงพยาบาลวิภาวดี ที่ สถานี BTS พญาไท ทางออกที่ 3 สอบถามข้อมูลเพิ่มเติม : แจ็บ แอนด์ โก บาย โรงพยาบาลวิภาวดี เบอร์โทร 082-903-6450
สมิติเวชจัดโปรวัคซีนป้องกันมะเร็งปากมดลูก HPV
สมิติเวชจัดโปรวัคซีนป้องกันมะเร็งปากมดลูก HPV ลดสูงสุดกว่า 25% ????4 สายพันธุ์ (3 เข็ม) 7,800 บาท ปกติ 10,674 บาท ????9 สายพันธุ์ (3 เข็ม) 19,000 บาท ปกติ 25,500 บาท รับบริการได้ที่ สมิติเวช สุขุมวิท และศรีนครินทร์ วันนี้ - 31 กรกฎาคม 66
*น้องมิลเลี่ยน สุนัขตัวที่ 1 ล้านที่ได้รับการทำหมันโดยซอยด็อก
ซอยด๊อกยังได้ร่วมมือกับมหาวิทยาลัยต่างๆ เช่น โครงการฝึกงานวิชาชีพที่หน่วยผ่าตัดทำหมันซอยด๊อกของนักศึกษาคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ และสัตวแพทย์ซอยด๊อกได้รับเชิญเป็นวิทยากรบรรยายเรื่องการจัดการปัญหาสัตว์จรจัดและจัดกิจกรรมทัศนศึกษาหน่วยทำหมันเคลื่อนที่ร่วมกับคณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เป็นต้น
การทำหมันและฉีดวัคซีนให้แก่สัตว์จรจัดในประเทศไทยถึงหนึ่งล้านตัว ไม่เพียงแต่ลดจำนวนสุนัขจรจัดและขจัดโรคพิษสุนัขบ้าเท่านั้น แต่พบว่ายังสามารถเปลี่ยนแปลงทัศนคติและทำให้ความสัมพันธ์ระหว่างมนุษย์และสุนัขในชุมชนดีขึ้นอีกด้วย จากผลสำรวจของมหาวิทยาลัยเกษตรศาสตร์ร่วมกับ International Companion Animal Management Coalition (ICAM) สำรวจข้อมูลสุนัขจรจัดในเขตกรุงเทพฯ และปริมณฑลและประเมินทัศนคติประชาชนที่อาศัยในชุมชนที่ซอยด๊อกลงพื้นที่ทำหมันสุนัขเปรียบเทียบกับชุมชนที่ยังไม่มีการทำหมันสัตว์ในพื้นที่ พบว่าประชาชนสองกลุ่มนี้มีทัศนคติที่ต่างกันอย่างชัดเจนต่อสัตว์จรจัด โดยกลุ่มแรกเห็นว่าปัญหาที่เกิดจากสัตว์น้อยลง ยินดีให้สุนัขอยู่ในบริเวณบ้าน และมีการแสดงเครื่องหมายการเป็นเจ้าของสุนัข เช่น ตั้งชื่อให้ ใส่ปลอกคอ วางชามน้ำและอาหารให้ ในขณะที่กลุ่มที่อยู่ในพื้นที่ที่ไม่มีโครงการทำหมันพบว่าปัญหาจากสุนัขจรจัดมากขึ้น และสุนัขเพิ่มจำนวนขึ้นอย่างต่อเนื่อง
เมื่อเปรียบเทียบกับการจัดการจำนวนสุนัขจรจัดด้วยวิธีอื่น เช่น การจับสุนัขไว้ในศูนย์พักพิงหรือการตัดวงจรชีวิตด้วยการฆ่าล้างบาง (เซตซีโร่) สัตว์จรจัดทั้งฝูง พบว่าปัญหาสุนัขจรจัดจะหมดไปอย่างรวดเร็ว ทั้งนี้ปัญหาเดิมจะกลับมาภายในเวลาไม่กี่สัปดาห์ เนื่องจากเป็นการแก้ปัญหาที่ปลายเหตุและใช้ทรัพยากรมหาศาลทั้งต้นทุนในการจัดการศูนย์พักพิง การจัดหาเจ้าหน้าที่ดูแลสุนัขประจำศูนย์ หรือความโหดร้ายทารุณจากการกำจัดสุนัขจำนวนมาก เป็นต้น การทำหมันฉีดวัคซีนและให้สุนัขได้อยู่ในพื้นที่เดิมเป็นการแก้ปัญหาอย่างตรงจุด แต่ใช้เวลาจึงจะเห็นการเปลี่ยนแปลง เช่นที่จังหวัดภูเก็ตซึ่งเป็นที่ตั้งของศูนย์พักพิงซอยด๊อกใช้เวลาถึง 20 ปีกว่าที่จำนวนสุนัขจะลดลง 10 เท่าจากเมื่อปี พ.ศ. 2546 เหลือเพียงไม่กี่พันตัว ณ ปัจจุบัน
โรงพยาบาลพญาไท นวมินทร์ บริการฉีดวัคซีนป้องกันมะเร็งปากมดลูก
โรงพยาบาลพญาไท นวมินทร์ บริการฉีดวัคซีนป้องกันมะเร็งปากมดลูก ป้องกันเชื้อ HPV ชนิด 4 สายพันธุ์ 3 เข็ม ชนิด 9 สายพันธุ์ 3 เข็ม ติดต่อ ศูนย์สุขภาพผู้หญิง โทร. 02-944-7111 ต่อ 2201บริการคลินิกฝังเข็ม
โรงพยาบาลค่ายเม็งรายมหาราช เปิดให้บริการคลินิกฝังเข็ม เพื่อเป็นอีกหนึ่งทางเลือกในการรักษาสำหรับผู้ที่มารับบริการโรงพยาบาลค่ายเม็งรายมหาราช โดย พ.ท.นพ.ธีรธัช คุณรัตนาภรณ์ ผ่านการอบรมหลักสูตรแพทย์ฝังเข็ม กรมแพทย์ทหารบก เปิดให้บริการทุกวันจันทร์ และวันพฤหัสบดี เวลา 13.00 – 16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์) รับเฉพาะผู้ป่วยนัดคลินิกฝังเข็ม ผู้ป่วยรายใหม่ต้องเข้าพบแพทย์ก่อนนัดตรวจคลินิกฝังเข็ม ติดต่อสอบถามเพิ่มเติมในวัน-เวลาราชการ โทร 053-717650
คลินิกฝากครรภ์นอกเวลา
คลินิกฝากครรภ์นอกเวลา สะดวก + รวดเร็ว + ลดเวลารอคอย เปิดบริการทุกวันจันทร์ เวลา 16.30 - 20.00 น.
สำนักงานป้องกันควบคุมโรคที่ 1 เชียงใหม่
โทร. 053140774
สปสช.พร้อมรับนโยบาย Quick Win บัตรปชช.ใบเดียวรักษาทุกที่ ทำได้รวดเร็ว LINK
เลขาธิการ สปสช. เผยความพร้อมการเดินหน้าตามนโยบายรัฐบาลและ รมว.สธ. “บัตรประชาชนใบเดียวรักษาได้ทุกที่” เชื่อเป็น Quick Win ที่สามารถทำได้รวดเร็ว หลังเทคโนโลยีมีความพร้อม-นำร่องบางส่วนมาแล้ว ยันไม่กังวลประชาชนมุ่งเข้ารับบริการ รพ.ใหญ่ มองต่อไปจะเกิดความสมดุลจากหน่วยบริการใกล้บ้านที่ถูกยกระดับมากขึ้น
นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) เปิดเผยถึงความพร้อมในการดำเนินตามนโยบายยกระดับ “30 บาทรักษาทุกโรค” ของรัฐบาล และรัฐมนตรีว่าการกระทรวงสาธารณสุข (รมว.สธ.) นพ.ชลน่าน ศรีแก้ว ว่า รมว.สธ.ได้มอบนโยบายการใช้ “บัตรประชาชนใบเดียวรักษาได้ทุกที่” ซึ่งเป็น 1 ในนโยบาย Quick Win ที่สามารถดำเนินการได้ในไม่ช้า หรืออาจเร็วกว่า 100 วันแรก โดยอาจมีการนำร่องในบางพื้นที่ก่อน หากยังไม่สามารถดำเนินการได้พร้อมกันในทั่วประเทศ ...
อ่านต่ออาหารคู่อื่นๆ ที่ไม่ควรกินคู่กัน
ชา+นม
โปรตีนในนม จะจับกับสารต้านอนุมูลอิสระในชาและป้องกันไม่ให้เกิดการดูดซึม อีกทั้งคาเฟอีนในชาสามารถลดการดูดซึมแคลเซียมลง ทำให้ร่างกายกลับจะไม่ได้แคลเซียมในนมอีกด้วย
วิธีที่แนะนำ บีบมะนาวลงในชาแทน เพราะจะช่วยเพิ่มปริมาณสารต้านอนุมูลอิสระในชาที่ร่างกายสามารถดูดซึมได้
ขนมปังขาว+แยม
คู่มหัตภัยคู่นี้ จะเร่งให้น้ำตาลในเลือดของคุณเพิ่มขึ้นอย่างรวดเร็ว และร่างกายของคุณต้องทำงานหนักมากเพื่อลดระดับน้ำตาลในเลือดโดยการปล่อยอินซูลินออกจากตับอ่อน ในระยะยาว กระบวนการนี้อาจทำให้ตับอ่อนเสื่อมลง และสร้างภาวะดื้อต่ออินซูลินและเบาหวานได้ในที่สุด
คำแนะนำที่เหมาะสมคือ เปลี่ยนคาร์โบไฮเดรตที่ผ่านการขัดสีแล้ว มาเป็นธัญพืชเต็มเมล็ดที่มีเส้นใยสูง ซึ่งจะช่วยชะลอการย่อยอาหาร ชะลอน้ำตาลในเลือดได้ เพราะคาร์โบไฮเดรตเชิงเดี่ยวจะขัดขวางน้ำตาลในเลือดได้มากที่สุด
สลัด+น้ำสลัดไม่มีไขมัน (non-fat dessing)
การดูดซึมสารอาหารต้องพึ่งไขมัน ดังนั้นหากหลีกเลี่ยงไขมันในสลัด หรือใช้น้ำสลัดไขมันต่ำหรือไร้ไขมันไปเลย ก็จะเป็นปัญหาต่อการดูดซึมสารอาหาร
คำแนะนำ ราดน้ำมันมะกอกและน้ำส้มสายชูลงไปในสลัดจะช่วยได้ดี
แอลกอฮอล์+คาเฟอีน
ปกติแล้วคาเฟอีทำให้ตื่น ลดง่วงมึนงง ตรงข้ามกับแอลกอฮอล์ที่ทำให้มีอาการง่วง เชื่องช้า การดื่มคาเฟอีนเข้าไป คาเฟอีนในกาแฟ (หรือในเครื่องดื่มชูกำลัง) จะไปบดบังฤทธิ์ของแอลกอฮอล์ ทำให้คุณรู้สึกไม่ค่อยเมา ทั้งๆ ที่ในความเป็นจริงแล้วอาจจะเมา อาจทำให้เกิดอุบัติเหตุได้ และอาจทำให้ดื่มมากขึ้นเพราะคิดว่าตนเองไม่เมา
ถั่วเลนทิล + ไวน์แดง
ไวน์แดงมีสารประกอบที่เรียกว่าแทนนิน เมื่อแทนนินผสมกับแหล่งธาตุเหล็กจากพืช เช่น ที่พบในถั่วเลนทิลและถั่วเหลือง แทนนินจะขัดขวางความสามารถของร่างกายในการดูดซึมแร่ธาตุดังกล่าวอย่างมาก ปัญหานี้เกี่ยวข้องอย่างยิ่งกับผู้ที่รับประทานเจและมังสวิรัติ
เบอร์เกอร์+เบียร์
เมื่อกินทั้งสองอย่างเข้าไป ตับจะทำงานโดยการย่อยแอลกอฮอล์ก่อนตามธรรมชาติ เนื่องจากร่างกายรับรู้ว่าแอลกอฮอล์เป็นสารพิษ ส่วนไขมันจะยังไม่ถูกย่อย และลอยอยู่ในกระแสเลือด จนร่างกายนำไปเก็บไว้ในเนื้อเยื่อ ไขมันทำให้อาหารย่อยช้าลง ซึ่งเป็นสาเหตุที่อาหารที่มีไขมันสูงทำให้รู้สึกอิ่มและท้องอืดเป็นเวลานานหลังจากที่คุณกินเข้าไป
Foxnewsแจ้งร้องเรียนปัญหาสุนัข-แมวจรจัด
แจ้งร้องเรียนปัญหาสุนัข-แมวจรจัด
- ผ่านแอปฯ Traffy Fondue กทม.
- กลุ่มควบคุมและพักพิงสุนัข โทร 02-328-7460
- สายด่วน 1555
กิจกรรมงานวันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี 2566 ม.เกษตร บางเขน
กิจกรรมงานวันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี 2566 วันพฤหัสบดีที่ 28 กันยายน พ.ศ. 2566 ณ อาคารจักรพันธ์เพ็ญศิริ มหาวิทยาลัยเกษตรศาสตร์ เขตจตุจักร กรุงเทพมหานคร มีกิจกรรมน่าสนใจมากมาย หัวข้อ อาทิ 1) เสวนา หัวข้อ พื้นที่ปลอดโรคพิษสุนัขบ้า : ความร่วมมือเพื่อความสำเร็จและความท้าทาย 2) Presentation: (สถานการณ์โรคและนวัตกรรมเพื่อการจัดการโรค : Global Rabies Situation and Innovations for Rabies Management) 3) Regional and global rabies situation 4) การประเมินผลกระทบของ CNVR ในการจัดการประชากรสุนัขจรจัดในเขตกรุงเทพมหานคร 5) ประสิทธิภาพและความเป็นไปได้ในการใช้วัคซีนป้องกันโรคพิษสุนัขบ้าชนิดกิน 6) วิถีสุนัขและชีวิตผู้เลี้ยงสุนัขจรจัด : การก่อตัวของสุนัขชุมชนในสังคมไทย
ศูนย์เวลเนส Wellness Center LINK
กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ได้เล็งเห็นถึงประโยชน์ของการดำเนินงานท่องเที่ยวเชิงสุขภาพโดยการเชื่อมโยงแนวคิดการแพทย์บูรณาการที่สร้างความสมดุลระหว่างร่างกายและจิตใจ ให้เกิดความสุขกายสบายใจสไตล์ไทย (Thainess Well-being) ของประชาชนและนักท่องเที่ยวให้เกิดสภาวะความมีสุขภาพดี (Good health state) รองรับกระแสการเติบโตของคนที่รักสุขภาพ สอดรับกับทิศทางการให้บริการทางการแพทย์และธุรกิจเกี่ยวกับการดูแลรักษาสุขภาพที่เติบโตมากขึ้น ในปีนี้ (พ.ศ.2566)
กรมการแพทย์แผนไทยและการแพทย์ทางเลือก จึงร่วมมือกับ สำนักงานสาธารณสุขจังหวัด และผู้ประกอบการ รวมถึงหน่วยงานที่เกี่ยวข้อง ดำเนินการโครงการส่งเสริมรูปแบบการท่องเที่ยวศักยภาพสูงที่หลากหลายและโดดเด่น มุ่งหวังให้มี
ศูนย์เวลเนส (Wellness Center) ทั่วประเทศ โดยได้ดำเนินการประชาสัมพันธ์ให้สถานประกอบการ และแหล่งท่องเที่ยวเชิงสุขภาพ เข้ารับการประเมินเป็นศูนย์เวลเนสเพื่อยกระดับมาตรฐานการบริการและสร้างความมั่นใจแก่นักท่องเที่ยว โดยได้มอบใบประกาศนียบัตรรับรองศูนย์เวลเนส
มีผู้สมัครเข้าร่วมการประเมินทั้งสิ้นจำนวน 448 แห่ง มีผู้ประกอบการที่ผ่านการประเมินและได้รับการรับรองเป็นศูนย์เวลเนส รวมทั้งสิ้น 87 แห่ง ประกอบด้วย
ศูนย์เวลเนส ประเภทที่พักนักท่องเที่ยว จำนวน 29 แห่ง
ศูนย์เวลเนส ประเภทภัตตาคาร จำนวน 15 แห่ง
ศูนย์เวลเนส ประเภทนวดเพื่อสุขภาพ จำนวน 8 แห่ง
ศูนย์เวลเนส ประเภทสปาเพื่อสุขภาพ จำนวน 14 แห่ง และ
ศูนย์เวลเนส ประเภทสถานพยาบาล จำนวน 21 แห่ง
*ข้อมูล ณ วันที่ 24 เมษายน 2566
เครื่องอัลตราซาวด์แบบพกพา
2. ประวัติการได้รับวัคซีนป้องกันโรคไข้หวัดใหญ่ ในปี 2565 ที่ผ่านมา ผู้สูงอายุ 65 ปีขึ้นไปส่วนใหญ่ ได้รับวัคซีนวัคซีนป้องกันโรคไข้หวัดใหญ่ ร้อยละ 86.05 ไม่ได้รับวัคซีน ร้อยละ 13.95 ได้รับวัคซีนที่โรงพยาบาภาครัฐ ร้อยละ 74.05 รองลงมาที่โรงพยาบาลส่งเสริมสุขภาพระดับตำบล (รพ.สต.)/สถานีอนามัยหรือศูนย์บริการสาธารณสุข โรงพยาบาลเอกชน/ คลินิกเอกชน และ อื่นๆ ร้อยละ 18.38, 4.32 และ 3.24 ตามลำดับ กลุ่มที่ได้รับวัคซีนทั้งหมด ส่วนใหญ่ไม่มีค่าใช้จ่ายในการฉีดวัคซีน ร้อยละ 96.22 และกลุ่มที่มีค่าใช้จ่ายเป็นการฉีดวัคซีนในภาคเอกชนหรือวัคซีน ที่หน่วยบริการภาครัฐที่จัดซื้อเองเพื่อเป็นทางเลือกในบริการแก่ประชาชน ร้อยละ 3.78 และกลุ่มที่ไม่ได้รับวัคซีนพบว่า สาเหตุที่ท่านไม่ได้รับวัคซีนส่วนใหญ่ เนื่องจากสิทธิเต็ม ร้อยละ 41.94 ไม่ทราบว่ามีการรณรงค์ฉีดวัคซีน ร้อยละ 19.35 และไม่มีเวลา/ไม่ว่าง ร้อยละ 12.90 ตามลำดับ ดังกราฟที่ 3-6
ประโยชน์ที่ประชาชนจะได้รับจากการมีระบบบริการสุขภาพปฐมภูมิ
โดยตามกลไกภายใน 10 ปีหลังการบังคับใช้กฎหมายนี้จะต้องจัดระบบบริการสุขภาพปฐมภูมิที่ มีคุณภาพให้กับประชาชน ซึ่งจะทำให้ประชาชนมีสุขภาพดีเพิ่มขึ้นและช่วยลดรายจ่ายของประเทศได้ใน ระยะยาว โดยจากการมีบริการปฐมภูมิ ตาม พรบ. ใน 10 ปี จะทำให้ประชาชนสุขภาพดี ไม่เจ็บป่วยด้วย โรคที่ป้องกันได้ ลดนอนโรงพยาบาล ลดป่วย ลดพิการ ประหยัดเวลารอคอย จาก 3 ชั่วโมง เหลือ 44 นาที ประหยัดเงินค่าเดินทางไป รพ. เฉลี่ย 1,655 บาท/คน และลดค่าใช้จ่ายได้ถึง 227,570 ล้านบาท ขณะนี้มีหน่วยบริการปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิ จำนวน 1,180 แห่ง ครอบคลุม ประชากร 13 ล้านคน ซึ่งในปี 2563 จะมีเพิ่มขึ้นเป็น 26 ล้านคน (ร้อยละ 40 ของประชากร) และ มีหน่วยบริการเพิ่มขึ้นเป็น 2,600 แห่ง (
hfocus)
ทั้งนี้ หน่วยบริการปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิ 1 หน่วย ให้การดูแลประชาชน ในพื้นที่รับผิดชอบ 8,000 - 12,000 คน โดยมีทีมหมอครอบครัวประกอบด้วย แพทย์เวชศาสตร์ ครอบครัว 1 คน พยาบาลวิชาชีพ 2 คน และนักวิชาการสาธารณสุข 2 คน และทีมสหสาขาวิชาชีพ อื่นๆ ได้แก่ ทันตแพทย์ เภสัชกร นักกายภาพบำบัด นักเทคนิคการแพทย์ แพทย์แผนไทย เจ้าพนักงาน สาธารณสุข เจ้าพนักงานเภสัชกรรม ตามความเหมาะสมของพื้นที่ และอาสาสมัครสาธารณสุขประจำ หมู่บ้าน (อสม.)
กล่าวได้ว่า “พระราชบัญญัติระบบสุขภาพปฐมภูมิพ.ศ. 2562” นับเป็นหนึ่งตัวอย่างของ ความก้าวหน้าในการขับเคลื่อนงานปฏิรูประบบสาธารณสุขของประเทศไทย ที่สามารถตอบสนองการ ปฏิรูประเทศโดยตรง ประชาชนได้รับบริการสุขภาพปฐมภูมิที่มีมาตรฐานและลดความเหลื่อมล้ำใน การเข้าถึงบริการสุขภาพปฐมภูมิ อันเป็นการสร้างความเป็นธรรมและความมั่นคงด้านสุขภาพให้ เกิดขึ้นในสังคมและประเทศ การมี “พระราชบัญญัติระบบสุขภาพปฐมภูมิ” จึงนับเป็นก้าวแรกในการ ปฏิรูปเพื่อการพัฒนาระบบบริการด้านสาธารณสุขของประเทศให้เดินหน้ามุ่งสู่ความยั่งยืน
อย่างไรก็ตามสำนักงานปลัดกระทรวงสาธารณสุข กระทรวงสาธารณสุข ได้วิเคราะห์ ผลกระทบที่อาจเกิดขึ้นจากกฎหมายว่าด้วยระบบสุขภาพปฐมภูมิ ตามที่บัญญัติไว้ในมาตรา ๗๗ ของ รัฐธรรมนูญแห่งราชอาณาจักรไทย โดยพิจารณาและวิเคราะห์จากสาระสำคัญของบทบัญญัติในแต่ละ มาตราของร่างพระราชบัญญัติดังกล่าวประเด็นและความคิดเห็นที่ได้จากการรับฟังความคิดเห็นของ ผู้เกี่ยวข้องในชั้นของการยกร่างพระราชบัญญัตินี้ ทั้งภาครัฐ ภาคเอกชน สถานพยาบาล ผู้ประกอบ วิชาชีพด้านการแพทย์และสาธารณสุข และประชาชน ตลอดจนรัฐธรรมนูญแห่งราชอาณาจักรไทย และบทกฎหมายอื่นที่เกี่ยวข้อง
นอกจากนั้น ได้พิจารณาและวิเคราะห์ความสอดคล้องกับร่างยุทธศาสตร์ชาติ แผนพัฒนา เศรษฐกิจและสังคมแห่งชาติ และร่างแผนปฏิรูปประเทศด้านสาธารณสุข ทั้งนี้ ผลการวิเคราะห์ สามารถจำแนกได้เป็น 3 ข้อได้แก่ 1. ผู้ซึ่งได้รับผลกระทบจากการบังคับใช้กฎหมาย 2. ผลกระทบ เชิงบวก และ 3. ผลกระทบเชิงลบ ดังนี้ (
lawamendment.go.th/)
1. ผู้ซึ่งได้รับผลกระทบจากการบังคับใช้กฎหมาย
เมื่อกฎหมายว่าด้วยระบบสุขภาพปฐมภูมิ ประกาศใช้เป็นกฎหมายย่อมส่งผลกระทบต่อผู้เกี่ยวข้อง ดังนี้
(1) ประชาชนซึ่งเป็นผู้รับบริการในเขตพื้นที่ของหน่วยบริการปฐมภูมิ
(2) หน่วยงานของ รัฐ เช่น กระทรวงสาธารณสุข กระทรวงมหาดไทยกรมบัญชีกลาง สำนักงานประกันสังคม และสำนักงานหลักประกันสุขภาพแห่งชาติ
(3) สถานพยาบาลทั้งของภาครัฐและภาคเอกชน
(4) สถาบันการศึกษา
(5) แพทย์เวชศาสตร์ครอบครัวและผู้ประกอบวิชาชีพทางการแพทย์และสาธารณสุข
2. ผลกระทบเชิงบวก
การจัดบริการสุขภาพปฐมภูมิที่เป็นระบบตามกฎหมายว่าด้วยระบบสุขภาพปฐมภูมิ มีผลกระทบเชิงบวก ดังนี้
(1) ด้านการปฏิรูปประเทศ
การจัดบริการสุขภาพปฐมภูมิที่เป็นระบบตามร่างพระราชบัญญัติดังกล่าว เป็นการ ปฏิรูปประเทศตามมาตรา 258 ช. (5) ของรัฐธรรมนูญแห่งประเทศไทย โดยการมีแพทย์เวชศาสตร์ ครอบครัวดูแลประชาชนในสัดส่วนที่เหมาะสม สอดคล้องกับหน้าที่ของรัฐตามมาตรา 55 ของ รัฐธรรมนูญแห่งราชอาณาจักรไทย ที่กำหนดให้รัฐต้องดำเนินการให้ประชาชนได้รับบริการสาธารณสุข ที่มีประสิทธิภาพอย่างทั่วถึง เสริมสร้างให้ประชาชนมีความรู้พื้นฐานเกี่ยวกับการส่งเสริมสุขภาพและ การป้องกันโรค โดยบริการสาธารณสุขดังกล่าวต้องครอบคลุมการส่งเสริมสุขภาพ การควบคุมและ ป้องกันโรค การรักษาพยาบาล และการฟื้นฟูสุขภาพ และรัฐต้องพัฒนาการบริการสาธารณสุขให้มี คุณภาพและมาตรฐานสูงขึ้นอย่างต่อเนื่อง นอกจากนั้น การจัดบริการสุขภาพปฐมภูมิดังกล่าวยังสอดคล้องเชื่อมโยงกับร่างยุทธศาสตร์ชาติ แผนพัฒนาเศรษฐกิจและสังคมแห่งชาติ และร่างแผน ปฏิรูปประเทศด้านสาธารณสุข ซึ่งจะส่งผลให้แนวทางการปฏิรูปประเทศด้านสาธารณสุข เป็นรูปธรรม ชัดเจน เป็นไปในทิศทางเดียวกัน และประเทศมีการพัฒนาอย่างยั่งยืน
(2) ด้านสังคม
โดยเมื่อพิจารณาผลกระทบด้านสังคมแล้ว การจัดบริการสุขภาพปฐมภูมิที่เป็นระบบ ตามร่างพระราชบัญญัตินี้ ย่อมมีผลเป็นการยกระดับคุณภาพชีวิตของประชาชนให้มีสุขภาพที่ดีขึ้น อย่างต่อเนื่อง ทำให้ประชาชนได้รับบริการสุขภาพปฐมภูมิที่เป็นธรรม มีคุณภาพ มีมาตรฐาน มีแพทย์ เวชศาสตร์ครอบครัวและคณะผู้ให้บริกา รสุขภาพปฐมภูมิดูแล และมีการบันทึกข้อมูล ด้านสุขภาพที่ครบถ้วน รวมทั้งครอบคลุมการสร้างความรอบรู้ด้านสุขภาพ การป้องกัน และควบคุม ปัจจัยเสี่ยงที่คุกคำมสุขภำพ และมีกำ รส่งเส ริมให้ชุมชนเป็นฐำนในกำ รส ร้ำงสุขภำพ ทุกพื้นที่ ตลอดจนให้หน่วยงานในระดับภูมิภาคและองค์กรปกครองส่วนท้องถิ่นมีส่วนร่วมในการ จัดบริการสุขภาพปฐมภูมิ รวมถึงกำหนดให้ทุกภาคส่วนเข้ามามีส่วนร่วมในการดำเนินการตามร่าง พระราชบัญญัตินี้ เพื่อลดความเหลื่อมล้ำในการเข้าถึงบริการสุขภาพปฐมภูมิ อันเป็นการสร้างความ เป็นธรรมและความมั่นคงด้านสุขภาพให้เกิดขึ้นในสังคมและประเทศ
(3) ด้านเศรษฐกิจ
สำหรับผลกระทบด้านเศรษฐกิจ นั้น โดยที่การจัดบริการสุขภาพปฐมภูมิที่เป็นระบบ ตามร่างพระราชบัญญัตินี้ จะดำเนินการภายใต้นโยบายและแผนยุทธศาสตร์เกี่ยวกับระบบสุขภาพ ปฐมภูมิที่คณะรัฐมนตรีเห็นชอบและหน่วยงานที่เกี่ยวข้องรับไปปฏิบัติ โดยครอบคลุมการพัฒนา บริการสุขภาพปฐมภูมิซึ่งเป็นโครงสร้างพื้นฐานด้านสุขภาพของประเทศ การพัฒนาฐานข้อมูลเกี่ยวกับ ระบบสุขภาพปฐมภูมิและการสนับสนุนให้มีการศึกษาวิจัยในเรื่องดังกล่าวซึ่งจะทำให้ประเทศมี ฐานความรู้ ที่สมบูรณ์ในการจัดบริการสุขภาพปฐมภูมิที่เป็นระบบ รวมตลอดทั้งการสนับสนุนให้มีการ ผลิตและพัฒนาแพทย์เวชศาสตร์ครอบครัวและคณะผู้ให้บริการสุขภาพปฐมภูมิที่มีศักยภาพเพียงพอ กับการให้บริการสุขภาพปฐมภูมิ ซึ่งการดำเนินการดังกล่าวจะทำให้ประเทศไทยยกระดับขึ้นเป็น ศูนย์กลางและเป็นฐานการบริการด้านสุขภาพในภูมิภาค
(4) ด้านงบประมาณแผ่นดิน
เมื่อประชาชนมีสุขภาพที่ดีและมีความรู้พื้นฐานเกี่ยวกับการส่งเสริมสุขภาพและการ ป้องกันโรค ประกอบกับการที่ร่างพระราชบัญญัตินี้มีสาระสำคัญในการจัดระบบการเงินการคลังด้าน สุขภาพที่มีการบูรณาการให้เป็นเอกภาพและมีประสิทธิภาพ ย่อมทำให้รัฐบาลสามารถลดและ ประหยัดงบประมาณรายจ่ายด้านสุขภาพลงได้ และสามารถนำงบประมาณส่วนนี้ไปใช้เพื่อดำเนินการ ด้านอื่น ๆ ที่จำเป็นสำหรับการพัฒนาประเทศต่อไป
(5) ด้านกฎหมาย
เมื่อกฎหมายว่าด้วยระบบสุขภาพปฐมภูมิ ประกาศใช้เป็นกฎหมายแล้ว ย่อมทำให้ ประเทศไทยมีกลไก หลักเกณฑ์ และวิธีการจัดบริการสุขภาพปฐมภูมิที่เป็นระบบ ชัดเจน และมีความต่อเนื่อง โดยเฉพาะอย่างยิ่งการมีบทกฎหมายสำหรับควบคุมคุณภาพและมาตรฐานของหน่วยบริการ ปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิ อันเป็นการส่งผลดีแก่ประชาชนผู้รับบริการที่มีกฎเกณฑ์ คุ้มครองการรับบริการสุขภาพปฐมภูมิและทำให้ได้รับบริการที่มีคุณภาพและมีมาตรฐาน และเป็นผลดี แก่หน่วยบริการปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิในการมีกฎเกณฑ์ที่ชัดเจนสำหรับการ ดำเนินการให้บริการสุขภาพปฐมภูมิ
3. ผลกระทบเชิงลบ
ในระยะสั้น การจัดบริการสุขภาพปฐมภูมิที่เป็นระบบตามกฎหมายว่าด้วยระบบ สุขภาพปฐมภูมิ อาจมีผลกระทบด้านงบประมาณ ในการที่ภาครัฐจะต้องดำเนินการขึ้นทะเบียนหน่วย บริการปฐมภูมิและเครือข่ายหน่วยบริการปฐมภูมิ และการพัฒนาระบบสารสนเทศสำหรับเชื่อมโยง ข้อมูลเกี่ยวกับการบริหารจัดการระบบสุขภาพปฐมภูมิให้มีประสิทธิภาพ ตามที่กำหนดใน ร่างพระราชบัญญัตินี้
ติดต่อตำรวจ PCT POLICE ช่องทางใหม่ Line VOOM LINK
ช่องทางสื่อสารข่าวสารเตือนภัยออนไลน์ จาก พี่ๆ ตำรวจ PCT POLICE มาช่วยให้พวกเราทุกคนรู้ทันกลโกงมิจฉาชีพ
• ปรึกษาสอบถามโทร 1441 หรือ 081-866-3000
• แจ้งความออนไลน์ www.thaipoliceonline.com
• Line:@police1441 แชทบอทกับหมวดขวัญดาว ตลอด 24 ชั่วโมง
ด้วยความห่วงใย จากตำรวจไซเบอร์ "ตำรวจไซเบอร์ ให้ความรู้ รู้ทันความคิดมิจฉาชีพ"


ด้าน นายแพทย์ อัศวเดช แสนบัว แพทย์เฉพาะทางรังสีรักษาและมะเร็งวิทยา กล่าวว่า “Oncothermia หรือการรักษามะเร็งด้วยคลื่นความร้อน โดยเราใช้คลื่นความร้อนไปที่ตรงจุด แต่ไม่ทำผลเสียต่อเซลล์ปกติของร่างกาย แต่ในด้านของเซลล์มะเร็งเมื่อได้รับพลังงานคลื่นความร้อนเซลล์มะเร็งจะมีการกักเก็บพลังงานเอาไว้จนทำให้เยื่อหุ้มเซลล์มะเร็งไม่สามารถทนได้มีการแตกตัวเกิดขึ้น เป็น Apoptosis หลังจากเกิด Apoptosis จะมีการกระตุ้นให้ตัวเม็ดเลือดขาวของเรา มากินตัว Apoptosis นั้น และจะมีการจดจำว่า เซลล์เหล่านี้เป็นเซลล์มะเร็ง จะมีการแบ่งตัวของเม็ดเลือดขาวเพื่อไปกินเซลล์มะเร็งที่ยังหลงเหลืออยู่
กล่าวคือผลจากการทำงานของเครื่อง Oncothermia จะส่งผลต่อเซลล์มะเร็ง 2 อย่างคือ
1. เกิดการตายของเซลล์มะเร็งที่ไม่ทำให้เกิดการอักเสบ
2. กระตุ้นภูมิคุ้มกันของร่างกายให้หันมาทำลายมะเร็ง
โดยการรักษาด้วย Oncothermia ไม่ก่อให้เกิดการเจ็บปวดใดๆเลย และมีผลข้างเคียงน้อยมาก โดยสามารถรักษามะเร็งที่เป็นก้อน ได้ตั้งแต่ศีรษะ จนถึงปลายเท้า ได้ในทุกส่วนของร่างกาย เราจะใช้เครื่องนี้ร่วมกับนวัตกรรมการดูแลด้วยภูมิคุ้มกันบำบัด โดยใช้หลักบูรณาการร่วมกันในทุกๆปัจจัย นอกจากนี้เรายังรักษาควบคู่ไปกับการให้ NK Cell (Natural Killer Cell) เพื่อเป็นคู่หูนักฆ่า (มะเร็ง) เป็นการจับคู่ในการรักษา เพื่อส่งเสริมซึ่งกันและกันให้เกิดประสิทธิภาพในการรักษาสูงสุดทำให้เยื่อหุ้มเซลล์มะเร็งมีการแตกตัว และตัวเซลล์นักฆ่าก็จะไปฆ่าเซลล์มะเร็งเป็นการเสริมกันและกัน สองตัวนี้เราจะนำมาใช้ในการรักษามะเร็งได้มีประสิทธิภาพมาก และที่สำคัญการใช้เครื่อง Oncothermia ร่วมกับการรักษาทั้ง 3 ขั้นตอน ไม่ว่าผ่าตัด ให้เคมีบำบัด หรือการฉายแสง จะทำให้การรักษามีประสิทธิภาพเพิ่มมากยิ่งขึ้น ผู้ป่วยที่เข้ารับการรักษาอยู่ ไม่ว่าจะที่ไหนก็ตาม สามารถเข้ามาใช้เครื่อง Oncothermia ที่พานาซีพระราม 2 ได้นะครับ” นายแพทย์ อัศวเดช กล่าว
เตือน !! ดัดแปลงปืนแบลงค์กัน มีโทษหนัก
เตือน !! ดัดแปลงปืนแบลงค์กัน มีโทษหนัก คุกสูงสุดถึง 20 ปี ปรับ 4,000-40,000 บาท
เพจตำรวจสอบสวนกลาง ได้ให้รายละเอียดเพิ่มเติมว่า ปืนแบลงค์กัน คือ สิ่งเทียมอาวุธปืน ที่นิยมใช้ในการแสดง ไม่สามารถใช้กระสุนจริงได้ แต่ปัจจุบันมีกลุ่มผู้ที่นำมาดัดแปลงเพื่อให้สามารถใช้ได้กับกระสุนจริง ทำให้ ปืนแบลงค์กันที่ถูกดัดแปลงแล้ว กลายเป็น สิ่งเทียมอาวุธปืนที่ทำอันตรายถึงชีวิต
ทั้งนี้ การมีไว้ในครอบครองและใช้ ปืนแบลงค์กันที่ถูกดัดแปลงให้ส่งเครื่องกระสุนปืนออกได้นั้น เข้าข่ายมีความผิดฐาน “มีและใช้อาวุธปืนและเครื่องกระสุนปืนโดยไม่ได้รับอนุญาต” มีโทษจำคุกไม่เกิน ปรับไม่เกิน 20,000 บาท หรือทั้งจำทั้งปรับ
นอกจากนี้ ผู้ที่ดัดแปลง สั่ง นำเข้า หรือจำหน่าย ปืนแบลงค์กัน ให้สามารถส่งเครื่องกระสุนปืนออกได้นั้น เข้าข่ายความผิดฐาน “ประกอบ ซ่อมแซม เปลี่ยนลักษณะ สั่ง นำเข้า มีหรือจำหน่าย ซึ่งอาวุธปืนหรือเครื่องกระสุนปืนสำหรับการค้า โดยไม่ได้รับอนุญาต” มีโทษจำคุกตั้งแต่ 2 ถึง 20 ปี และปรับตั้งแต่ 4,000-40,000 บาท หรือทั้งจำทั้งปรับ
ทันตแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ทำฟันฟรี 20 ตุลาคม 2566
คณะทันตแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ขอเชิญชวนผู้ที่สนใจ เข้าร่วมกิจกรรมวันทันตสาธารณสุขแห่งชาติ วันที่ 20 ตุลาคม 2566 ให้บริการทางทันตกรรม อาทิ ขูดหินปูน อุดฟัน ถอนฟัน ผ่าฟันคุด โดยไม่มีค่าใช้จ่าย พร้อมกับกิจกรรมส่งเสริมสุขภาพช่องปาก "วัดความแข็งแรงของกล้ามเนื้อใบหน้าและภาวะการกลืน" ผู้ที่สนใจเข้าร่วมกิจกรรมสามารถสแกน QR Code เพื่อลงทะเบียนออนไลน์ล่วงหน้า (Pre-Booking) หรือที่
cmu.to/Dental-Health-Registerตั้งแต่วันนี้ - 15 ตุลาคม 2566 หรือสามารถลงทะเบียนหน้างาน (Walk-in) ณ คณะทันตแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ในวันศุกร์ที่ 20 ตุลาคม 2566 ตั้งแต่เวลา 07.30 น. เป็นต้นไป
นอกเหนือจากกิจกรรมให้บริการทำฟันโดยไม่มีค่าใช้จ่ายแล้ว ยังมีอีกกิจกรรมที่น่าสนใจ คือ "โครงการกินได้ กลืนได้ อย่างมีความสุข" พบกับ 4 ฐานกิจกรรม ดังนี้ 1️⃣ วัดความแข็งแรงของกล้ามเนื้อริมฝีปาก ลิ้น และลำคอ 2️⃣ วัดความชื้นในช่องปาก 3️⃣ วัดการกลืน 4️⃣ วัดความเสี่ยงต่อการเกิดฟันผุ โดยใช้สีย้อม Plaque ในวันที่ 20 ตุลาคม 2566 เวลา 09.00 - 14.00 น. ณ คลินิกส่งเสริมทันตสุขภาพและทันตกรรมป้องกัน (อาคาร 3 ชั้น 2) คณะทันตแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
ไม่เพียงแต่เด็กๆ ชั้นมัธยมศึกษาเท่านั้น แต่น้องๆ วัยประถมศึกษา อย่างเด็กหญิงลัลล์ลลิล ชูจันทร์ หรือ น้องน้ำใจ ชั้นประถมศึกษาปีที่ 5 โรงเรียนบ้านมะเดื่อหวาน อำเภอเกาะพะงัน จังหวัดสุราษฎร์ธานี ยังได้เข้าร่วมกิจกรรมพาดาวมาหาน้อง โดยได้เล่าความรู้สึกว่า “ความประทับใจหนูให้เต็มหนึ่งร้อยเลยค่ะ เพราะปกติเป็นคนที่ชอบวิชาวิทยาศาสตร์และการทดลองอยู่แล้ว พอได้มาจับอุปกรณ์ของจริง และเป็นครั้งแรกที่ได้มาดูท้องฟ้าจำลองในโดมเลยรู้สึกตื่นเต้นมากเป็นพิเศษ แถมยังได้เห็นภาพดาวสวยๆ เป็นความทรงจำที่จะไม่ลืมเลยค่ะ”
โรงพยาบาลหนองฉาง จังหวัดอุทัยธานี
ฉีดวัคซีนพิษสุนัขบ้า เปิดให้บริการวันศุกร์
ฉีดวัคซีนพิษสุนัขบ้า เวลาให้บริการของ ศบส.39 เปิดให้บริการวัน ศุกร์ เวลา 13.00 น. – 16 .00 น. สอบถามโทร. 02-427-7949
โรคพิษสุนัขบ้า เป็นโรคติดต่อร้ายแรงชนิดหนึ่งเกิดจากเชื้อไวรัสชื่อ เรบีส์ ไวรัส (Rabies) ทำให้เกิดโรคได้ในสัตว์เลี้ยงลูกด้วยนมทุกชนิด เช่น สุนัข แมว ลิง ชะนี กระรอก ค้างคาว และคน อาการของโรคจะส่งผลต่อระบบประสาทโดยเฉพาะระบบประสาทส่วนกลางและอาจทำให้เสียชีวิต ซึ่งในปัจจุบันยังไม่มียาที่จะรักษาโรคพิษสุนัขบ้าได้
ป้องกันโรคพิษสุนัขบ้า ได้อย่างไร?
วิธีการป้องกันที่ดีที่สุดคือ การวัคซีนพิษสุนัขบ้าไว้ล่วงหน้าสำหรับบุคคลที่มีความเสี่ยง ก่อนสัมผัสโรคหรือถูกสัตว์กัด เชื้อไวรัสจะออกมากับน้ำลายสัตว์ที่ป่วยหรือมีเชื้อนี้ ผู้ป่วยมักได้รับเชื้อเนื่องจากถูกสัตว์ที่มีเชื้อไวรัสพิษสุนัขบ้ากัด เชื้อในน้ำลายสัตว์จะเข้าสู่บาดแผล นอกจากสัตว์กัดแล้วยังอาจได้รับเชื้อจากสัตว์ที่มีเชื้อนี้มาข่วน ซึ่งบนเล็บของสัตว์เหล่านี้มักเปื้อนน้ำลายสัตว์ที่อาจเลียเล็บตัวเอง
ประโยชน์ของการฉีดวัคซีนป้องกัน
เมื่อถูกสัตว์กัด การฉีดวัคซีนกระตุ้นเพียง 1-2 เข็ม ร่างกายก็จะได้ภูมิต้านทานที่สูงพอจะป้องกันโรคอย่างได้ผลและไม่เสี่ยงต่อการแพ้วัคซีน หรือเจ็บปวดจากการฉีดวัคซีนรอบๆ แผล การฉีดวัคซีนป้องกันล่วงหน้า จึงเป็นการเตรียมร่างกายให้พร้อมเพื่อต่อต้านโรคพิษสุนัขบ้า โดยฉีดเพียง 3 เข็มภายในระยะเวลา 1 เดือน ซึ่งวัคซีนนี้สามารถฉีดได้ไม่จำกัดอายุ โดยเฉพาะเด็กที่มักเล่นกับสัตว์และมีโอกาสถูกสัตว์กัด หรือถูกเลียมือที่มีแผลหรือที่ปาก โดยไม่บอกให้ผู้ปกครองทราบ ทั้งนี้ ผู้ป่วยที่เป็นโรคพิษสุนัขบ้ามักมีประวัติถูกสัตว์กัดในช่วงหกเดือนที่ผ่านมาผู้ป่วยจะมีไข้ ปวดศีรษะ มีอาการทางระบบประสาท มักมีอาการกลัวน้ำและกลัวลมร่วมด้วย โรคนี้ไม่มีทางรักษา ผู้ป่วยทุกรายจะเสียชีวิตในเวลาต่อมา
คลินิกเบาหวาน
คลินิกเบาหวาน
- คลินิกเบาหวานและต่อมไร้ท่อ ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกศูนย์เบาหวาน ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิก Carb Counting ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกเบาหวานทั่วไป ในเวลาราชการ 08.00 น. - 16.00 น. นอกเวลาราชการ 16.00 - 20.00 น.
- คลินิกตรวจภาวะแทรกซ้อนจากโรคเบาหวาน ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกให้คำปรึกษาเบาหวาน นอกเวลาราชการ 16.00 น. - 20.00 น.
- คลินิก Foot and Ankle ในเวลาราชการ 10.00 น. - 12.00 น.
- คลินิกเวชกรรมฟื้นฟู ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกศัลกรรม(ปรึกษา tenotomy) ในเวลาราชการ 13.00 น. - 16.00 น.
คลินิกกุมาร
คลินิกกุมาร
- คลินิกตรวจโรคทั่วไป ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) เวลา 13.00 - 16.00 น. (บ่าย) นอกเวลาราชการ 16.00 - 20.00 น.
- คลินิกสุขภาพเด็กดี ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกไตในเด็ก ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกภูมิแพ้ในเด็ก ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) เวลา 13.00 น. - 16.00 น. (บ่าย)
- คลินิกตรวจไฟฟ้าสมองเด็ก ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกโภชนาการ ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกป้องกันตับอักเสบในเด็ก ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกอุ่นรัก ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกทางเดินอาหาร ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกโรคเลือดในเด็ก ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกผิวหนังในเด็ก ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกแรกเกิดป่วย ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกกุมารติดเชื้อ (DSC HIV) ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกโรคระบบทางเดินหายใจในเด็ก ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกต่อมไร้ท่อในเด็ก ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกโรคระบบประสาทในเด็ก ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกหัวใจ ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกทานตะวัน (DSC HIV) ในเวลาราชการ 13.00 น. - 16.00 น.
พระคาถาสุริยบัพพา คำถวายของบูชาพระราหู
คลินิกแพทย์แผนไทย นอกเวลา
คลินิกแพทย์แผนไทย นอกเวลา เปิดให้บริการคลินิกนอกเวลา วันจันทร์,พุธ,ศุกร์ 16.30-20.30 น.
เสาร์ 8.30-16.30 น.
ให้บริการนวดเพื่อการรักษาฟื้นฟู ยาสมุนไพร ประคบสมุนไพร อบสมุนไพร ฟื้นฟูมารดาหลังคลอด
*เบิกได้ตามสิทธิการรักษา ยกเว้นสิทธิบัตรทอง ชำระเงินค่าบริการเอง
สอบถาม/จองคิวโทร 089-8882627 02-5717899 ต่อ 409
คลินิกแพทย์แผนไทยและแพทย์ทางเลือก อาคาร 4 ชั้น 2
นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร กล่าวว่า “หนึ่งในพันธกิจหลักของกรุงเทพมหานครคือการที่ผู้คนมีความมั่นคงทางสุขภาพ ตลอดระยะเวลาที่ผ่านมาเหล่าอาสาสมัครสาธารณสุขกรุงเทพมหานครทั้ง 50 เขต ได้ทำงานใกล้ชิดกับชุมชนในการสร้างความตระหนักรู้และส่งเสริมมาตราการการป้องกันโรคไข้เลือดออก อีกทั้ง ยังได้ร่วมมือกับพันธมิตรความร่วมมือ Dengue-zero ในการสื่อสารถึงภัยของไข้เลือดออกที่มีเป้าหมายในการลดการแพร่เชื้อ ลดการระบาดของโรค ที่นำไปสู่การลดจำนวนผู้ติดเชื้อได้ สำหรับการร่วมกันทำพันธกิจ ปักหมุด หยุดไข้เลือดออกและร่วมกันบอกลาไข้เลือดออกไปกับน้องอิงมาในวันนี้ คือหมุดหมายสำคัญในการให้ทุกภาคส่วนได้มีส่วนร่วมในการสร้างเกราะป้องกันและตอกย้ำว่าเราสามารถเอาชนะโรคไข้เลือดออกได้”
ปัจจุบันภาวะลิ่มเลือดอุดตันมีแนวโน้มเพิ่มมากขึ้น - ศ.นพ.พลภัทร โรจน์นครินทร์
ศ.นพ.พลภัทร โรจน์นครินทร์ นายกสมาคมโลหิตวิทยาแห่งประเทศไทย กล่าวว่า “ปัจจุบันจากปัจจัยแวดล้อมและวิถีการดำเนินชีวิตที่เปลี่ยนไป ภาวะลิ่มเลือดอุดตันมีแนวโน้มเพิ่มมากขึ้น จากข้อมูลต่างประเทศ โรคลิ่มเลือดอุดตันในหลอดเลือดดำจะถูกวินิจฉัยเป็นลำดับ 3 รองจากโรคหลอดเลือดแดงหัวใจและโรคหลอดเลือดแดงสมอง* โดยร้อยละ 60 ของโรคลิ่มเลือดอุดตันในหลอดเลือดดำเกิดขึ้นระหว่างการนอนอยู่ในโรงพยาบาลหรือหลังออกจากโรงพยาบาลใหม่ๆ และทั่วโลกมีผู้ป่วยเป็นโรคนี้ที่เชื่อมโยงกับการนอนโรงพยาบาล 10 ล้านคนต่อปี** สำหรับในประเทศไทยข้อมูลจากสำนักสถิติแห่งชาติในช่วง 6 ปีที่ผ่านมา มีการรายงานตัวเลขการวินิจฉัยภาวะลิ่มเลือดอุดตันในปอด (Pulmonary Embolism หรือ PE) เพิ่มขึ้นประมาณ 2 เท่า ทั้งนี้ สมาคมโลหิตวิทยาแห่งประเทศไทยพร้อมผลักดันและให้ความรู้แก่ประชาชนได้ตระหนัก แต่ไม่ตระหนก ตื่นรู้ แต่ไม่ตื่นกลัว เพื่อป้องกันการเกิดภาวะลิ่มเลือดอุดตัน และลดการสูญเสียที่ไม่จำเป็นในอนาคต”
อุทยานแห่งชาติดอยสุเทพ - ปุย
อุทยานแห่งชาติดอยสุเทพ-ปุย มีจุดท่องเที่ยวน่าสนใจหลายแห่ง โดยเฉพาะน้ำตก ที่มีมากถึง 6 แห่ง ได้แก่ น้ำตกห้วยแก้ว-วังบัวบาน-ผาเงิบ น้ำตกมณฑาธาร น้ำตกแม่สา น้ำตกตาดหมอก น้ำตกหมอกฟ้า น้ำตกศรีสังวาลย์ ถ้ำฤาษี จุดชมนางพญาเสือโคร่ง ยอดดอยปุย สันกู่ กิจกรรมยอดฮิตแนะนำนักท่องเที่ยว คือ การเดินทางไป
ชมนางพญาเสือโคร่ง ตั้งอยู่ห่างจากศูนย์บริการนักท่องเที่ยวและลานกางเต็นท์ อุทยานแห่งชาติดอยสุเทพ-ปุย ประมาณ 3 กิโลเมตร เป็นจุดชมดอกพญาเสือโคร่ง หรือซากุระเมืองไทย สีชมพูบานสะพรั่งทั่วพื้นที่ มีบ้านพักและลานกางเต็นท์บริการนักท่องเที่ยว รองรับนักท่องเที่ยวได้เป็นจำนวนมาก ดอกพญาเสือโคร่งหรือซากุระเมืองไทยสีชมพูนี้มักจะบานในช่วงปีใหม่ เป็นประจำทุกปี ช้าหรือเร็วกว่าเล็กน้อยตามสภาพอากาศในแต่ละปี อย่างในปี 2555 ดอกพญาเสือโคร่งบานสะพรั่งสวยงามพร้อมเพรียงกันในช่วงวันที่ 15 มกราคม นอกจากกิจกรรมชมพญาเสือโคร่งแล้ว ที่สถานีวิจัยเกษตรที่สูงขุนช่างเคี่ยน ยังเป็นที่ปลูกกาแฟ บ๊วย และท้อ ซึ่งจะออกดอกสีชมพู และขาวให้ชมกันอีกด้วย
อุทยานแนะนำกิจกรรม เมื่อมาเยือนอุทยานแห่งชาติดอยสุเทพ-ปุย คือ ทางเดินศึกษาธรรมชาติ ⇔ ทางเดินป่า ⇔ เที่ยวน้ำตก ⇔ เล่นน้ำ ⇔ ศึกษาสภาพธรณี ⇔ ชมพรรณไม้ ⇔ ดูนก/ดูผีเสื้อ/ส่องสัตว์ ⇔ ถ่ายภาพ/วิดีโอ ⇔ ดูดาว ⇔ ตั้งแคมป์พักแรม ⇔ พักผ่อนในบรรยากาศธรรมชาติ
อุทยานแห่งชาติดอยสุเทพ-ปุย ถนนศรีวิชัย ตำบลสุเทพ อำเภอเมือง จังหวัดเชียงใหม่ 50200
โทรศัพท์ : 053-210244 (ที่ทำการฯ) 053-295041 (บ้านพักนักท่องเที่ยวสวนสน)
อุทยานแห่งชาติดอยหลวง


จุดเด่นของอุทยานแห่งชาติดอยหลวง ที่เป็นเป้าหมายนักเดินป่าลุยเขา คือยอดดอยหลวง - ดอยหนอก จุดชมวิวทะเลหมอก ที่สวยไม่น้อยหน้าจุดชมทะเลหมอกอื่นใดในไทย ตั้งแต่ 1 ตุลาคมนี้ อุทยานได้เปิดการท่องเที่ยว จุดสำคัญๆ แล้ว ได้แก่ น้ำตกปูแกง จ.เชียงราย น้ำตกวังแก้ว จ.ลำปาง น้ำตกจำปาทอง จ.พะเยา ดอยหลวง - ดอยหนอก จ.พะเยา สำหรับกิจกรรมการเดินป่าศึกษาธรรมชาติ อุทยานแห่งชาติดอยหลวง เปิดให้ขึ้น 2 วัน 1 คืน สัปดาห์ละ 3 รอบ คือ รอบที่ 1 ศุกร์ - เสาร์ รอบที่ 2 เสาร์ – อาทิตย์ และรอบที่ 3 อาทิตย์ - จันทร์ โดยจำกัดนักท่องเที่ยวรอบละไม่เกิน 6 กลุ่ม กลุ่มละ 10 คน สามารถติดต่อ เพื่อ
จองกิจกรรมเดินป่าศึกษาธรรมชาติ ดอยหลวง-ดอยหนอก ทางโทรศัพท์ 06-3018-7000 ช่องทางเดียวเท่านั้น ในเวลา 09.00 – 16.00 น.
รายละเอียดศึกษาได้จากประกาศของอุทยานฯ
*นักท่องเที่ยวที่ไม่ได้จอง วันเวลา ล่วงหน้า ทางอุทยานแห่งชาติดอยหลวงไม่อนุญาตให้เข้าร่วมกิจกรรมเดินป่าเส้นทางดอยหลวง-ดอยหนอก
ด้านบนของอุทยานมี ร้านสวัสดิการ เปิดบริการทุกวัน เวลา 08.00-16.30 น.
การเดินทางมายังอุทยานดอยหลวง มาได้ 2 เส้นทาง 1) เดินทางจากอำเภอเมือง จังหวัดเชียงราย มาตามถนนสายเชียงราย-พะเยา ถึงบ้านปูแกงระยะทางประมาณ 56 กิโลเมตร แยกทางด้านขวามือเป็นทางเข้าสู่หมู่บ้านและอุทยานแห่งชาติดอยหลวง ระยะทาง 9.5 กิโลเมตร ก็จะถึงน้ำตกปูแกง 2) เดินทางจากอำเภอเมือง จังหวัดพะเยา มาตามถนนสายเชียงราย-พะเยา ถึงบ้านปูแกงระยะทางประมาณ 40 กิโลเมตร แยกทางด้านซ้ายมือเป็นทางเข้าสู่หมู่บ้านและอุทยานแห่งชาติดอยหลวง ระยะทาง 9.5 กิโลเมตร ก็จะถึงน้ำตกปูแกง
อุทยานแห่งชาติดอยหลวง ตั้งอยู่ที่
ต.แม่เย็น อ.พาน จ.เชียงราย 57280
โทรศัพท์ : 081-9602456


ในปีนี้ เมิร์ซ เอสเธติกส์ ประเทศไทย ยังร่วมเสริมสร้างองค์ความรู้ใหม่ ๆ แก่วงการแพทย์ผิวหนังและความงาม ด้วยการเป็นหนึ่งในพาร์ทเนอร์สำคัญของงาน DASIL World Congress ครั้งที่ 11 ที่จะจัดขึ้นที่กรุงเทพฯ ระหว่างวันที่ 25-27 ตุลาคม 2566 โดย DASIL เป็นองค์กรเพื่อการศึกษาที่ไม่แสวงหาผลกำไรและมีจุดประสงค์หลักการเรียนการสอนสำหรับแพทย์รุ่นใหม่ และเพื่อการแลกเปลี่ยนความรู้ ข้อมูลและเทคนิคการรักษาจากประสบการณ์ของแพทย์ผู้เชี่ยวชาญที่มีความหลากหลายจากทั่วโลก ในงาน DASIL World Congress ครั้งที่ 11 ปีนี้ เมิร์ซ เอสเธติกส์ร่วมจัดงานเสวนาในหัวข้อที่หลากหลาย ไม่ว่าจะเป็นนวัตกรรมสารลดเลือนริ้วรอยที่บริสุทธิ์สูงไม่กระตุ้นภูมิคุ้มกัน หรือ หัวข้อที่กำลังเป็นที่พูดถึงในวงกว้างอย่าง นวัตกรรมเพื่อการยกระดับคุณภาพผิว (Merz Symposium on Skin Quality Innovations) เพื่อแลกเปลี่ยนองค์ความรู้เกี่ยวกับนวัตกรรมเพื่อคุณภาพผิว สุดยอดเทรนด์ความงามเพื่อเสริมความมั่นใจ ที่เมิร์ซ เอสเธติกส์ มีความเชี่ยวชาญและเป็นผู้นำในตลาด
“การเสริมสร้างองค์ความรู้แก่ชุมชนของแพทย์ผู้เชี่ยวชาญ สามารถสร้างแรงกระเพื่อมไปได้ไกลถึงระดับ ประเทศและระดับภูมิภาค” แพทย์หญิง อัจจิมา กล่าวเสริม “นอกจากนี้ การส่งเสริมศักยภาพของแพทย์และบริการทางการแพทย์ในไทยยังสอดคล้องกับนโยบายของรัฐบาลที่มุ่งยกระดับให้ไทยเป็น Medical Hub & Aesthetics Hub ของภูมิภาคเอเชีย ซึ่งจะเป็นหนึ่งในเครื่องมือสำคัญในการกระตุ้นเศรษฐกิจโดยร่วมของประเทศด้วย”
ห้องสมุดเพื่อการเรียนรู้ สวนลุมพินี
ห้องสมุดเพื่อการเรียนรู้ สวนลุมพินี
ตั้งอยู่บริเวณสวนลุมพินี ด้านหลังพระบรมราชานุสาวรีย์รัชกาลที่ 6 ถนนราชดำริ แขวงลุมพินี เขตปทุมวัน กทม. 10330
เวลาทำการ
อังคาร - เสาร์ 08.30 - 19.30 น.
อาทิตย์ 09:00 - 17:00 น.
ปิดวันจันทร์และวันหยุดนักขัตฤกษ์
รางวัล 10 สวยสวยประจำปี 2566
สำหรับผลรางวัล 10 สวยสวยประจำปี 2566 มีดังนี้
1. สวนญี่ปุ่นดั้งเดิมในแบบผสมผสาน
2. สวนป่าคนเมืองเพื่อน้องหมา
3. สวนป่าร่มรื่นดูแลง่าย ถูกใจวัยเกษียณ
4. หลีกกรุง พักกาย ที่สวนบนดอย
5. พื้นที่นอกบ้านที่ชวนให้ออกมาใช้ชีวิต
6. สวนดอกไม้ในฝัน ณ เมืองโรแมนติก
7. สวนสร้างความทรงจำสำหรับวัยเด็ก
8. สวนป่าที่เรียบร้อย
9. สวนญี่ปุ่นร่วมสมัยที่เป็นเหมือนงานศิลปะรอบบ้าน
10. สวนเมดิเตอร์เรเนียนที่เป็นส่วนหนึ่งของธรรมชาติ
พระพุทธโสธร ประวัติ ตำนาน และงานพุทธศิลป์ (กรมศิลปากร)
พระพุทธโสธร หรือที่โดยทั่วไปนิยมเรียกว่า หลวงพ่อโสธร ตามประวัติความเป็นมากล่าวว่าประดิษฐานที่วัดโสธรวรารามวรวิหาร อำเภอเมือง จังหวัดฉะเชิงเทรา ตั้งแต่ราว พ.ศ. ๒๓๑๓ มีตำนานแสดงถึงพุทธานุภาพอันศักดิ์สิทธิที่เล่าขานสืบต่อกันมาว่าเดิมทีนั้นประดิษฐานอยู่ทางภาคเหนือ ต่อมาบ้านเมืองเกิดเหตุการณ์ระส่ำระสายจึงได้แสดงปาฏิหาริย์ลอยน้ำลงมาพร้อมกับพี่น้อง ๓ องค์ พระพุทธรูปองค์พี่มีขนาดใหญ่ล่องไปถึงแม่น้ำแม่กลอง ชาวประมงอัญเชิญขึ้นประดิษฐานไว้ที่วัดบ้านแหลม จังหวัดสมุทรสงคราม และเป็นที่รู้จักกันในชื่อ “หลวงพ่อบ้านแหลม” พระพุทธรูปองค์เล็กล่องเข้าไปที่คลองบางพลี คือหลวงพ่อโต วัดบางพลีใหญ่ จังหวัดสมุทรปราการ ส่วนพระพุทธรูปองค์กลางนั้นล่องไปทางแม่น้ำบางปะกง เมื่อมาถึงบริเวณหน้าวัดหงส์ ชาวบ้านจำนวนมากช่วยกันยกฉุดแต่ก็ไม่สามารถนำขึ้นจากน้ำได้ จนมีอาจารย์ผู้หนึ่งได้ทำพิธีบวงสรวง และใช้ด้ายสายสิญจน์คล้องพระหัตถ์อัญเชิญขึ้นจากน้ำเป็นอันสำเร็จ วัดหงส์นี้กาลภายหลังเปลี่ยนชื่อเป็นวัดโสธร และขนานนามพระพุทธรูปศักดิ์สิทธินี้ตามชื่อวัดคือ “หลวงพ่อโสธร”
อ่านทั้งหมด สีสันแห่งสายน้ำ มหกรรมลอยกระทง ปี 2566 กทม.
ในกรุงเทพฯ มีการจัดกิจกรรมลอยกระทง สีสันแห่งสายน้ำ มหกรรมลอยกระทง ปี 2566 กทม.
24 - 27 พ.ย.66 ณ บริเวณคลองผดุงกรุงเกษม (ย่านหัวลำโพง)
27 พ.ย.66 ณ สะพานพระราม 8 และวัดอรุณราชวรารามวรมหาวิหาร
นำเสนอประเพณีลอยกระทงอันทรงคุณค่า สะท้อนความงดงามของวัฒนธรรมไทยกับสายน้ำ สู่สากล ผสานความทันสมัยของสื่อผสมและเทคโนโลยีเพื่อให้เข้าถึงคนรุ่นใหม่ สร้างการรับรู้ถึงคุณค่าของกิจกรรม และร่วมรับประสบการณ์ Amazing Experience เน้นย้ำความสุขและคุณค่าอย่างวิถีไทย นำส่งคุณค่าและประสบการณ์ใหม่ของประเพณีลอยกระทงที่ใส่ใจสิ่งแวดล้อม
1.พิธีเฉลิมฉลองประเพณีลอยกระทง ขบวนแห่ประเพณีลอยกระทงและนางนพมาศ การแสดงทางวัฒนธรรม และกิจกรรมลอยกระทง
2.แลนด์มาร์คกระทงประดับไฟ 5 พื้นที่เอกลักษณ์ แสดงความรุ่งเรืองทางวัฒนธรรมที่สื่อผ่านสัญลักษณ์แลนด์มาร์คที่เป็นเอกลักษณ์ 5 พื้นที่ ได้แก่
- ประเพณียี่เป็ง จังหวัดเชียงใหม่
- ประเพณีลอยกระทงสายไหลประทีป ๑๐๐๐ ดวง จังหวัดตาก
- ประเพณีลอยกระทงเผาเทียนเล่นไฟ จังหวัดสุโขทัย
- ประเพณีลอยกระทงกาบกล้วยเมืองแม่กลอง จังหวัดสมุทรสงคราม
- ประเพณี สมมาน้ำคืนเพ็ง เส็งประทีป จังหวัดร้อยเอ็ด
3.การตกแต่งประดับไฟแสงสี ริมคลองผดุงกรุงเกษม (ย่านหัวลำโพง)
4.กิจกรรมสาธิตและ DIY การทำกระทง อาทิ โคมล้านนา กระทงกะลามะพร้าว กระทงใบลาน กระทงกาบกล้วย กระทงรวงข้าว และประดิษฐ์กระทงด้วยตนเองจากวัสดุธรรมชาติ
5.กิจกรรมตลาดย้อนยุครัตนโกสินทร์/จำหน่ายอาหารไทย
สถานการณ์โรคพิษสุนัขบ้าในปี 2566
พยากรณ์โรคและภัยสุขภาพรายสัปดาห์ กรมควบคุมโรค ฉบับที่ ฉบับที่ 9/2566 ประจำสัปดาห์ที่ 10 (วันที่ 12 – 18 มีนาคม 2566) รายงานสถานการณ์ โรคพิษสุนัขบ้าในปี 2566 (1 มกราคม - 8 มีนาคม) พบผู้ป่วยแล้วจำนวน 2 ราย (จังหวัดชลบุรี และจังหวัดระยอง) และเสียชีวิตแล้วทั้ง 2 ราย สาเหตุการเสียชีวิตเกิดจากการไม่ไปพบแพทย์ และไม่ได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าหลังสัมผัสโรค โดยเฉพาะรายที่ 2 ที่เคยมีประวัติได้รับวัคซีนป้องกันโรคพิษสุนัขบ้ามาก่อน แต่ไม่ได้รับการฉีดวัคซีนซ้ำหลังถูกสุนัขกัด”
ผู้เสียชีวิตรายที่ 3 พบในจ.สุรินทร์ ตามรายงานการเฝ้าระวังโรคในระบบรายงานเฝ้าระวัง 506 โดยกองระบาดวิทยาว่า
ตั้งแต่วันที่ 1 มกราคม - 23 พฤษภาคม 2566
ปัจจุบันการรักษาโรคกระดูกสันหลังเคลื่อนทับเส้นประสาท หรือกระดูกทับเส้นด้วยเทคนิคการยึดน็อตแบบ TLIF คือ การเชื่อมข้อกระดูกสันหลัง เพื่อหยุดการเคลื่อนของกระดูกสันหลังของผู้ป่วย และเปลี่ยนหมอนรองกระดูกสันหลังเทียมในผู้ป่วยที่หมอนรองกระดูกเสื่อม ซึ่งในสมัยก่อนจะต้องทำการผ่าตัดแบบเปิดแผล หลังจากนั้นวงการแพทย์ได้มีการพัฒนามาทำการผ่าตัดด้วยเทคนิค MIS TLIF ด้วยการใส่ท่อแล้วเลาะกล้ามเนื้อออกบางส่วน หลังจากนั้นจึงใส่หมอนรองกระดูกเทียมเข้าไป แต่ล่าสุดด้วยเทคโนโลยีใหม่ทำให้การรักษาโรคกระดูกเคลื่อนทับเส้นประสาทมีประสิทธิภาพและประสิทธิผลที่ดีต่อผู้ป่วยมากยิ่งขึ้น อีกทั้งยังสามารถลดอาการปวดแผลของผู้ป่วยลงเมื่อเทียบกับการรักษาแบบเดิมหลายเท่า ด้วยเทคนิค Full Endo TLIF (Full Endoscopic TLIF) คือ การใช้กล้องเอ็นโดสโคปเพื่อใส่หมอนรองกระดูกเทียมเข้าไป และทำการเชื่อมข้อกระดูกสันหลัง (Interbody Fusion) ด้วยสกรูแบบเจาะรู (Percutaneous Screw) ซึ่งวิธีนี้จะตัดกล้ามเนื้อน้อยที่สุด ทำลายโครงสร้างของกระดูกสันหลังน้อยมาก ความเสืี่ยงต่ำ และแตกต่างจากเทคนิคเดิม อีกทั้งยังสามารถลดขนาดของบาดแผล และให้ผลลัพธ์ที่ดีขึ้น
นางสาวพรรณสิรี คุณากรไพบูลย์ศิริ ผู้จัดการมูลนิธิรามาธิบดีฯ กล่าวเสริมว่า “การระดมทุนในครั้งนี้ นับเป็นการให้ที่จะช่วยผลักดันให้เกิดการเปลี่ยนแปลงในสังคมอย่างแน่นอน เพราะการศึกษานั้นเป็นรากฐานสำคัญของทุกคน ไม่แบ่งแยกด้วยสภาพร่างกาย เพศ อายุ ดังนั้น มูลนิธิรามาธิบดีฯ จึงมีความภูมิใจและดีใจเป็นอย่างยิ่งที่จะได้เป็นส่วนหนึ่งในการถ่ายทอด
พันธกิจของสถาบันราชสุดาไปยังสังคมวงกว้าง และเป็นสะพานแห่งการให้ที่รับน้ำใจของผู้ที่อยากช่วยให้คนพิการได้มีโอกาสทางการศึกษา อันจะช่วยยกระดับคุณภาพชีวิตของคนพิการต่อไปในอนาคต และสร้างสรรค์สังคมที่พวกเราทุกคนสามารถได้ใช้ศักยภาพและความสามารถของตนเองได้อย่างเต็มที่”
บริเวณภายในสวน กับป้ายคำเตือน คำแนะนำการใช้สถานที่ และการดูแลสุนัข
3 พฤศจิกายน 2566 ประกาศ ศูนย์พักพิงฯ ได้ปิดตัวแล้ว LINK
3 พฤศจิกายน 2566 ตามที่สถานเอกอัครราชทูตฯ ได้ประกาศให้คนไทยที่ประสงค์กลับประเทศไทยเดินทางไปที่ศูนย์พักพิงฯ ตั้งแต่วันที่ 15 ตุลาคม 2566 เป็นต้นมา และได้จัดเที่ยวบินอพยพคนไทยแล้วจำนวน 35 เที่ยวบินแล้ว นั้น
ในช่วง 2 วันที่ผ่านมา มีจำนวนผู้มาแสดงความประสงค์เดินทางกลับไทยที่ศูนย์พักพิงน้อยลงอย่างมาก จึงได้จัดเที่ยวบินเช่าเหมาลำอพยพคนไทยเที่ยวสุดท้ายเมื่อวันที่ 3 พฤศจิกายน 2566 และวันนี้ ศูนย์พักพิงฯ ได้ปิดตัวแล้ว
อย่างไรก็ดี สถานเอกอัครราชทูตฯ ขอยืนยันว่า รัฐบาลไทยยังคงดูแลผู้ที่ประสงค์เดินทางกลับประเทศไทยในช่วงสงคราม โดยท่านสามารถนำหลักฐานการเดินทางไปยื่นเรื่องขอรับเงินคืนที่สำนักงานแรงงานประจำจังหวัดของท่าน
หากมีคำถามหรือข้อสงสัย และต้องการความช่วยเหลืออื่นใดเพิ่มเติม สามารถติดต่อสถานเอกอัครราชทูตฯ (ศูนย์ช่วยเหลือคนไทย) ได้ที่
- โทรศัพท์: 053-245-2826, 055-271-2201, 050-443-8094 และ 053-5574115
- อินบ๊อกซ์เฟซบุ๊ค : www.facebook.com/thaiembassytelaviv (ทุกเรื่องเมืองยิว)
- อีเมล์ : consular.tav@mfa.go.th
- กรณีฉุกเฉิน โปรดติดต่อหมายเลข 054-636-8150
ด้วยความห่วงใยจากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ
Dog Toilet Station ถังเก็บมูลสุนัขจัดไว้ให้แล้ว
เจ้าของสุนัขต้องนำถุงขยะมาด้วยทุกครั้ง และเก็บมูลสุนัขทันที และนำมาทิ้ง ณ จุดที่จัดไว้ให้ เพื่อเป็นประโยชน์ร่วมกันกับผู้ใช้สนามและเจ้าของสุนัขท่านอื่นๆ และเพื่อสุขอนามัยน้องหมาอื่นๆ ด้วยไงล่ะ
คุณฮิโรโมริ อุชิดะ จากร้าน “กันยูโด” จังหวัดชิสึโอกะ
คุณฮิโรโมริ อุชิดะ จากร้าน “กันยูโด” จังหวัดชิสึโอกะ ร้านเก่าแก่ที่ทำขนมญี่ปุ่นอย่างต่อเนื่อง เพื่อนำความอบอุ่นและความสงบสุขมาสู่ชีวิตของผู้คน ด้วยความมุ่งมั่นอยากเผยแพร่ขนมญี่ปุ่นที่เปี่ยมไปด้วยวัฒนธรรมญี่ปุ่นไปยังประเทศต่างๆ จึงเป็นตัวกลางประสานระหว่างช่างทำขนมญี่ปุ่น เช่น การสาธิตการทำขนมในกรุงปารีส พร้อมเผชิญกับความท้าทายใหม่ๆ ด้วยการเปิดร้านที่ห้างสรรพสินค้าสยาม ทาคาชิมายะ กรุงเทพฯ และตั้งเป้าที่จะเป็นร้านขนมญี่ปุ่นที่คนในพื้นที่ชื่นชอบ
เกี่ยวกับ องค์การแพลน อินเตอร์เนชั่นแนล
องค์การแพลน อินเตอร์เนชั่นแนล เป็นองค์กรไม่แสวงผลกำไร มีการดำเนินงานในกว่า 70 ประเทศทั่วโลก เพื่อส่งเสริม พัฒนา คุ้มครองสิทธิเด็ก และความเสมอภาคสำหรับเด็กผู้หญิง สำหรับ องค์การแพลน อินเตอร์เนชั่นแนล ประเทศไทย ได้เริ่มเข้ามาดำเนินการในประเทศไทยนับตั้งแต่ปี พ.ศ. 2524 โดยยึดหลักสิทธิมนุษยชนและหลักการส่งเสริมโอกาสและความเสมอภาคระหว่างเพศเป็นแนวทางในการดำเนินงานเพื่อสร้างสังคมที่เท่าเทียมด้วยยุทธศาสตร์การพัฒนาชุมชนที่มีเด็กเป็นศูนย์กลางเพื่อผลประโยชน์สูงสุดของเด็ก มีแนวทางในการทำงานร่วมกับเด็ก เยาวชน ผู้สนับสนุน และพันธมิตรทั้งภาครัฐและเอกชน โดยเริ่มตั้งแต่จุดเล็กที่สุดอย่างครอบครัว แล้วขยายสู่ชุมชน เพื่อรังสรรค์ให้เกิดการเปลี่ยนแปลงทั้งในเชิงนโยบายและการปฏิบัติทั้งในระดับท้องถิ่น ระดับประเทศ และในระดับสากล เรียนรู้ข้อมูลเพิ่มเติมเกี่ยวกับองค์การแพลน อินเตอร์เนชั่นแนล ประเทศไทย ได้ที่ http://plan-international.org/thailand และกดติดตามเพจ
www.facebook.com/plan.thailand เพิ่มเติมเกี่ยวกับเบอร์โรมมิ่ง และวิธีระมัดระวัง
กสทช. ให้ผู้ให้บริการโทรศัพท์ระหว่างประเทศ ผู้ให้บริการ Call Termination และผู้ให้บริการโทรศัพท์เคลื่อนที่จะต้องเพิ่มเครื่องหมาย +698 นำหน้าสายที่โทรจากเบอร์โทรศัพท์ของไทยที่ใช้บริการโรมมิ่งโทรกลับมาจากต่างประเทศ (ยกเว้นกรณีสายที่มาจากประเทศที่ใช้งานรหัสประเทศ ตามที่สหภาพโทรคมนาคมระหว่างประเทศ (ITU) กำหนด ก็ให้แสดงรหัสประเทศของประเทศนั้นๆ) เพื่อให้ประชาชนทราบว่าเป็นสายที่โทรมาจากต่างประเทศ และใช้ความระมัดระวังในการรับสาย หากไม่มีญาติหรือคนรู้จักอยู่ต่างประเทศ สามารถปฏิเสธการรับสายนั้นได้ โดยเบอร์โทรศัพท์ที่นำหน้าด้วย +698 จะไม่สามารถโทรกลับได้ หากจะโทรกลับต้องตัด “+698” ออก แล้วเติมด้วย “0” และจะแสดงแค่หมายเลข แม้จะบันทึกชื่อและหมายเลขไว้ก็ตาม จึงขอให้ประชาชนสังเกตเบอร์ที่โทรเข้าก่อนรับสาย ปัจจุบันมิจฉาชีพได้ปรับเปลี่ยนวิธีการหลอกลวงประชาชนอยู่ตลอดเวลา กสทช. จึงขอให้ประชาชนใช้ความระมัดระวัง มีสติ อย่าตกใจ ไม่ให้ข้อมูลส่วนบุคคลหรือข้อมูลทางการเงิน และรหัสผ่านต่างๆ รวมทั้งอย่าหลงเชื่อ
ระมัดระวังอย่างไร
เพื่อเป็นการป้องกันการถูกหลอกลวงจากมิจฉาชีพไม่ควรรับเบอร์โทรศัพท์ที่ขึ้นต้นในรูปแบบดังกล่าว และไม่ควรติดต่อกลับไปเพื่อป้องการเสียค่าใช้จ่ายจากผู้ให้บริการเครือข่ายโทรศัพท์มือถือจากการโทรระหว่างประเทศ
ตำรวจ บก.ปอท. แนะนำว่า ให้ตั้งสติ ใช้ความระมัดระวังในการรับสายที่ขึ้นต้นด้วยเครื่องหมาย +
- ถ้าไม่ได้ติดต่อธุระที่ต่างประเทศ
- ถ้าไม่มีญาติพี่น้องอยู่ต่างประเทศ
- ถ้าไม่มีการทำธุรกรรมระหว่างต่างประเทศ
- หากน่าสงสัย วางสายทันที
หากปลายสายบอกให้โอนเงิน ให้สันนิษฐานไว้ก่อนว่าเป็นมิจฉาชีพ หากมีการอ้างถึงหน่วยงานภาครัฐ สถาบันการเงิน หรือบริษัทขนส่งต่างๆ ให้ขอหมายเลขติดต่อกลับและวางสายและตรวจสอบข้อมูลไปยังหน่วยงานหรือสถาบันการเงินที่ถูกอ้างถึง หน่วยงานของรัฐไม่มีนโยบายการติดตามหรือดำเนินคดีผ่านการโทรศัพท์หรือวีดีโอคอลหาประชาชน
หากพบเบอร์โทรที่น่าสงสัย สามารถแจ้งไปยัง NT contact center 1888 เพื่อระงับการโทรจากเบอร์โทรดังกล่าว หรือหากถูกมิจฉาชีพหลอกลวงสามารถเข้าแจ้งความได้ที่สถานีตำรวจ
ข้อมูลจาก ตำรวจ บก.ปอท. กสทช. และ บริษัท โทรคมนาคมแห่งชาติ จำกัด (มหาชน) หรือ NT
บริการเฝ้าคลอด
สอบถามที่แผนกห้องคลอด โทร 081-8839858 053-276856 ต่อ 206
ศ.นพ.วิชัย เอกพลากร หัวหน้าภาควิชาเวชศาสตร์ชุมชน คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี กล่าวถึงสถานการณ์โรคเบาหวานและโรคอ้วน ซึ่งจำนวนผู้ป่วยมีแนวโน้มเพิ่มสูงขึ้นทั่วโลก คาดการณ์ว่าในปี พ.ศ. 2573 จะมีผู้ที่เป็นโรคอ้วน 1 พันล้านคน และส่วนใหญ่อยู่ในประเทศรายได้น้อย-รายได้ปานกลาง สำหรับประเทศไทย อัตราการเสียชีวิตจากโรคเบาหวานสูงสุดเป็นอันดับแรก คิดเป็นประมาณ 66,000 คนต่อปี โดย 1 ใน 10 ของคนไทยป่วยเป็นโรคเบาหวาน และ 1 ใน 3 ไม่รู้ว่าตนเองเป็น เพราะไม่เคยตรวจวินิจฉัยมาก่อน นอกจากนี้ ยังส่งผลต่อมูลค่าทางเศรษฐกิจกว่า 3.75 แสนล้านบาท หรือ 2.2% ของ GDP ดังนั้น จึงจำเป็นต้องส่งเสริมและให้ความรู้แก่ประชาชน อาศัยความร่วมมือของทุกฝ่ายทั้งภาครัฐ ภาคเอกชน และชุมชนโดยรอบ ตลอดจนเพิ่มโอกาสในการเข้าถึงการรักษาอย่างเป็นธรรม
นายเอ็นริโก้ คานัล บรูแลนด์ (Enrico Cañal Bruland) รองประธานกรรมการและผู้จัดการทั่วไป บริษัท โนโว นอร์ดิสค์ ฟาร์มา ประเทศไทย จำกัด เผยถึงความมุ่งมั่นของโนโว นอร์ดิสค์ ด้วยการดูแลสุขภาพที่ยั่งยืนมายาวนานครบ 100 ปี นับว่าเป็นความท้าทายด้านการดูแลสุขภาพในระดับโลกเพื่อขับเคลื่อนให้เกิดการเปลี่ยนแปลงเพื่อการมีสุขภาพที่ดีในปัจจุบัน และสำหรับคนรุ่นต่อๆ ไป ด้วยนวัตกรรมการรักษาและการป้องกันแบบบูรณาการ ไม่เพียงแต่โรคเบาหวานเท่านั้น แต่ยังรวมถึงโรคอ้วน และโรค NCDs อื่นๆ ขณะที่ประเทศไทย โนโว นอร์ดิสค์ ดำเนินการมา 40 ปี โดยได้ร่วมมือกับกรมการแพทย์ กระทรวงสาธารณสุข ในโครงการ Affordability Project เพื่อให้ผู้ป่วยสามารถเข้าถึงการคัดกรอง การวินิจฉัย และการรักษาโรคเบาหวานในพื้นที่ชนบทอย่างมีประสิทธิภาพ รวมถึงให้ความรู้ในการดูแลสุขภาพและรักษาโรคเบาหวานแก่บุคลากรทางการแพทย์และผู้เกี่ยวข้อง เพื่อให้การดูแลผู้ป่วยมีประสิทธิภาพมากยิ่งขึ้น ซึ่งช่วยลดภาระค่าใช้จ่ายในระบบสาธารณสุขของไทย
25 พิพิธภัณฑ์ กรุงเทพฯ
25 พิพิธภัณฑ์ กรุงเทพฯ
1. มิวเซียมสยาม (15-17 ธ.ค.)
2. พิพิธภัณฑ์เหรียญษาปณานุรักษ์ (15-17 ธ.ค.)
3. พิพิธบางลำพู (15-17 ธ.ค.)
4. หอศิลป์บ้านเจ้าพระยา (15-17 ธ.ค.)
5. พิพิธภัณฑสถานแห่งชาติพระนคร (15-17 ธ.ค.)
6.หอศิลป์มหาวิทยาลัยศิลปากร (15-17 ธ.ค.)
7. พิพิธภัณฑ์พระบาทสมเด็จ พระปกเกล้าเจ้าอยู่หัว (15-17 ธ.ค.)
8. นิทรรศน์รัตนโกสินทร์ (15-17 ธ.ค.)
9. ศูนย์การเรียนรู้ ธนาคารแห่งประเทศไทย (15-17 ธ.ค.)
10. หอวชิราวุธานุสรณ์ (15-17 ธ.ค.)
11. วังรื่นฤดี (15-17 ธ.ค.)
12. พิพิธภัณฑ์จุฬาลงกรณ์ มหาวิทยาลัย (15-17 ธ.ค.)
13. พิพิธภัณฑสถานธรรมชาติวิทยา แห่งจุฬาลงกรณ์มหาวิทยาลัย (15-17 ธ.ค.)
14. พิพิธภัณฑ์เทศโนโลยีทางภาพ จุฬาฯ (15-17 ธ.ค.)
15. พิพิธภัณฑ์ธรณีวิทยา จุฬาฯ (15-17 ธ.ค.)
16. พิพิธภัณฑ์พืช ศาสตราจารย์กสิน สุวตะพันธุ์ จุฬาฯ (15-17 ธ.ค.)
17. พิพิธภัณฑ์บ้าน จิมทอมป์สัน (15-17 ธ.ค.)
18. หอศิลป์บ้านจิมทอมป์สัน (15-17 ธ.ค.)
19. ศูนย์วิทยาศาสตร์เพื่อการศึกษา ท้องฟ้าจำลอง กรุงเทพ (15-17 ธ.ค.)
20. แหล่งเรียนรู้ 3 ศิลปินรัตนโกสินทร์ และพิพิธภัณฑ์อาคารสายสุทธานภดล มหาวิทยาลัยราชภัฏสวนสุนันทา (15-17 ธ.ค.)
21. จัตุรัสวิทยาศาสตร์ อพวช. ณ เดอะสตรีท รัชดา (22-24 ธ.ค.)
22. พิพิธภัณฑ์อัญมณีและเครื่องประดับ (22-24 ธ.ค.)
23. หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร (22-24 ธ.ค.)
24. พิพิธภัณฑ์กองทัพอากาศและการบินแห่งชาติ (22-24 ธ.ค.)
25. สยามเซอร์เพนทาเรียม (22-24 ธ.ค.)
อุปกรณ์เดียว วิเคราะห์สารพัดด้านการทรงตัว
นวัตกรรมเครื่องวิเคราะห์การทรงตัวเป็นอุปกรณ์ดิจิทัลเทคโนโลยีแบบ Deep Tech มีขนาดเล็กกะทัดรัด น้ำหนักเบา เคลื่อนย้ายได้สะดวก ประกอบด้วย 2 อุปกรณ์หลักคือ ตัวแท่นยืน และสาย USB สำหรับต่อเข้ากับคอมพิวเตอร์ แท็บเล็ต หรือโทรศัพท์มือถือเพื่อแสดงผลผ่านหน้าจอ
“ตัวเครื่องนอกจากจะสามารถวัดค่าพื้นฐาน เช่น น้ำหนัก ดัชนีมวลกาย (BMI) ได้แล้ว ยังสามารถวัดค่าพื้นที่ในการทรงตัวและค่าระยะในการทรงตัวได้ด้วย เพื่อที่ผู้ใช้จะได้รู้ว่าเวลาที่เรายืนบนรถโดยสาร หรือยืนรอ หรือเดิน เราจะเซในระยะเท่าไร เซแบบนี้ถือว่าอยู่ในระดับปกติไหมเมื่อเทียบกับคนที่อยู่ในช่วงอายุและเพศเดียวกัน และนำไปวิเคราะห์ว่าเราจำเป็นต้องเปลี่ยนพฤติกรรมหรือไม่” อาจารย์ชัชนีอธิบาย
การใช้งานอุปกรณ์นี้ก็ง่าย เพียงต่อสาย USB จากแท่นยืนเข้ากับอุปกรณ์ที่เรามี เช่น แท็บเล็ต มือถือ หรือคอมพิวเตอร์ จากนั้นก็ขึ้นไปยืนบนแท่นยืนเหมือนกับเครื่องชั่งน้ำหนัก เครื่องก็จะแสดงผลการวิเคราะห์การทรงตัวของเราออกมาบนหน้าจออุปกรณ์ที่เราเชื่อมต่อด้วย แบบเรียลไทม์ บนหน้าจอแสดงผลการวิเคราะห์การทรงตัว ที่ทดสอบและแสดงผลแบบเรียลไทม์บนไมโครซอฟท์ เอ็กซ์เซล (Microsoft Excel) ทั้งนี้ เครื่องวิเคราะห์การทรงตัวจะแสดงผลออกมา 3 รูปแบบด้วยกัน ได้แก่
1. การแสดงผลการทรงตัวแบบแผนภูมิวงกลม แสดงค่าการทรงตัวของผู้ใช้ พื้นที่ในการทรงตัว และระยะการทรงตัว หากค่าการทรงตัวของผู้ใช้อยู่ในระดับสีเขียวอ่อน (วงกลมเล็กสุด) หมายถึงมีการทรงตัวอยู่ในระดับที่ดีมาก สีเขียวเข้ม (วงกลมกลาง) หมายถึงมีการทรงตัวอยู่ในระดับค่าเฉลี่ยทั่วไป ไล่ระดับการทรงตัวไปจนถึงระดับสีแดง (วงกลมใหญ่สุด) ที่อยู่ในเกณฑ์ที่การทรงตัวไม่สมดุล แต่ยังสามารถดำรงชีวิตประจำวันได้ และหากเกินระดับวงกลมสีแดง (วงกลมใหญ่สุด) หมายถึงอยู่ในระดับที่อันตราย มีความผิดปกติและมีความเสี่ยงสูง ต้องเข้าพบแพทย์โดยด่วน เพราะการทรงตัวผิดปกติในระดับนี้จะส่งผลกระทบต่อการดำเนินชีวิตประจำวันได้ นอกจากนี้ อาจจำเป็นต้องใช้อุปกรณ์ช่วยในการทรงตัวด้วย เช่น ไม้เท้า รถเข็น
“ระดับของการทรงตัวมีหลายระดับ แม้แต่คนที่มีการทรงตัวอยู่ในเกณฑ์ปกติก็ยังแบ่งได้เป็นหลายระดับ ไม่ว่าจะเป็นกลุ่มนักกีฬายิมนาสติก ครูสอนโยคะ ซึ่งมักเป็นกลุ่มที่มีการทรงตัวในระดับที่ดีมาก ไปจนถึงคนธรรมดาที่มีเซบ้าง แต่ก็ยังอยู่ในเกณฑ์ปกติ”
“สำหรับคนที่มีอาการเซเล็กน้อยไม่รุนแรง การปรับสมดุลของแต่ละบุคคลก็สามารถทำได้จากการอ่านแผนภูมิวงกลม เมื่อพบว่าการทรงตัวของเราค่อนไปทางซ้ายมากกว่า เราก็ควรต้องปรับร่างกายสมดุลไปทางด้านขวาเพิ่มขึ้นเล็กน้อย จะทำให้การรักษาสมดุลทรงตัวดีขึ้น”
2. การแสดงตารางข้อมูลเฉพาะบุคคล ว่าตนเองมีการทรงตัวอยู่ในเกณฑ์ปกติหรือไม่ในช่วงวัยและเพศเดียวกัน หรือเปรียบเทียบว่าในวัยของเราควรมีค่าการทรงตัวอยู่ในระดับใด
3. การแสดงค่าดัชนีมวลกาย (BMI) ได้แก่ น้ำหนัก ปริมาณไขมัน และปริมาณน้ำในร่างกาย สำหรับกลุ่มที่สนใจทางด้านสุขภาพ การปรับบุคลิกภาพ และการออกกำลังกาย
คลินิกวัยรุ่น โรงพยาบาลกลาง
คลินิกวัยรุ่น โรงพยาบาลกลาง
ให้บริการตรวจสุขภาพและรับปรึกษาปัญหาวัยรุ่น
ทุกวันพฤหัสบดี ที่ 2 และ 4 ของเดือน
เวลา 13.00 - 15.00 น.
ณ แผนกผู้ป่วยนอกกุมารเวชกรรม ชั้น 3
อาคารอนุสรณ์ 100 ปี โรงพยาบาลกลาง
โทร. 02-220-8000 ต่อ 10370, 10810 082-635-0826
โปรแกรมตรวจสุขภาพประจำปี อายุ 35-50 ปี
โปรแกรมตรวจสุขภาพประจำปี อายุ 35-50 ปี สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
กรม สบส.ส่งทีม MSERT เข้าประเมินโครงสร้างอาคารสถานพยาบาล 14 แห่ง รองรับเหตุแผ่นดินไหวรัฐฉาน
กรมสนับสนุนบริการสุขภาพ (กรม สบส.) ส่งทีมเอ็มเสิร์ท ลงพื้นที่ตรวจสอบโครงสร้างอาคารของสถานพยาบาลทั้ง 14 แห่ง ในจังหวัดเชียงราย, เชียงใหม่ และสกลนคร เพื่อเตรียมความพร้อม ในการฟื้นฟูอาคารสถานพยาบาลในกรณีที่เกิดความเสียหายต่อโครงสร้าง ให้เกิดความปลอดภัยแก่เจ้าหน้าที่ และประชาชนผู้รับบริการ ตลอด 24 ชั่วโมง
นายแพทย์สุระ วิเศษศักดิ์ อธิบดีกรม สบส. ให้สัมภาษณ์ว่า จากกรณี การเกิดแผ่นดินไหว ในเช้าวันที่ 17 พฤศจิกายน 2566 ณ รัฐฉาน ประเทศเมียนมา ซึ่งสามารถรับรู้ความสั่นไหวได้ทั่วภาคเหนือของประเทศไทย โดยเฉพาะ อำเภอแม่สาย จังหวัดเชียงราย เป็นพื้นที่รับรู้แรงสั่นสะเทือนได้มากที่สุด ซึ่งการเกิดแผ่นดินไหวในครั้งนี้ได้ส่งผลกระทบต่ออาคารสถานพยาบาล ในสังกัดกระทรวงสาธารณสุขหลายแห่ง กรม สบส.จึงสั่งการให้ทีมเอ็มเสิร์ท (Medical Supportive Emergency Response Team : MSERT) หรือทีมวิศวกรฉุกเฉิน ซึ่งประกอบด้วย วิศวกรเครื่องมือแพทย์ และวิศวกรโยธา ของศูนย์สนับสนุนบริการสุขภาพที่ 1 และ 8 ลงพื้นที่ตรวจสอบโครงสร้างอาคารของสถานพยาบาลใน 3 จังหวัด ทั้ง 14 แห่ง ซึ่งประกอบด้วย 1. จังหวัดเชียงราย ได้แก่ โรงพยาบาลเชียงรายประชานุเคราะห์, โรงพยาบาลแม่ลาว, โรงพยาบาลสมเด็จพระญาณสังวร, โรงพยาบาลแม่จัน, โรงพยาบาลพาน, โรงพยาบาลสมเด็จพระยุพราช เชียงของ, โรงพยาบาลเชียงแสน, โรงพยาบาลพญาเม็งราย, โรงพยาบาลดอยหลวง, โรงพยาบาลแม่ฟ้าหลวง และโรงพยาบาลแม่สาย 2. จังหวัดเชียงใหม่ ได้แก่ โรงพยาบาลสันทราย และโรงพยาบาลเชียงดาว 3. จังหวัดสกลนคร ได้แก่ โรงพยาบาลสกลนครเพื่อประเมินความเสี่ยง และฟื้นฟูอาคารสถานพยาบาลในกรณีที่เกิดความเสียหายต่อโครงสร้าง พร้อมกำชับทีมเอ็มเสิร์ท ให้เฝ้าระวังสถานการณ์แผ่นดินไหวอย่างใกล้ชิด เพื่อความปลอดภัยแก่เจ้าหน้าที่ และประชาชนผู้รับบริการ ตลอด 24 ชั่วโมง
ด้านทันตแพทย์อาคม ประดิษฐสุวรรณ รองอธิบดีกรม สบส. กล่าวเพิ่มเติมว่า ปัจจุบัน โครงสร้างอาคารเดิมของสถานพยาบาลในสังกัดกระทรวงสาธารณสุขที่อยู่ในพื้นที่เสี่ยงแผ่นดินไหว ทางกองแบบแผน กรม สบส.ได้ดำเนินการออกแบบปรับปรุงโครงสร้างให้มีความมั่นคง แข็งแรงสามารถต้านทานการสั่นสะเทือนหากเกิดแผ่นดินไหวแล้ว ส่วนอาคารที่ก่อสร้างใหม่ กองแบบแผน ได้ออกแบบให้เป็นอาคารต้านแผ่นดินไหว ตามพระราชบัญญัติควบคุมอาคาร พ.ศ. 2550 บุคลากรสาธารณสุข และประชาชน จึงสามารถมั่นใจได้ว่าอาคารสถานพยาบาลในสังกัดกระทรวงสาธารณสุข จะมีความมั่นคง สามารถรองรับสถานการณ์แผ่นดินไหวได้
เจ้าหน้าที่ตำรวจ กก.4 บก.ปคบ. จึงทำการตรวจสอบการจำหน่ายยาปลุกเซ็กส์รูปแบบต่างๆ ตามแพลตฟอร์มออนไลน์ พบว่ามีการจำหน่ายอย่างแพร่หลาย อาทิเช่น
- ยาน้ำ ปลุกเซ็กผู้หญิง ปลุกอารมณ์ผู้หญิง เพิ่มอารมณ์ผู้หญิง
- ไวอากร้าสำหรับผู้ชาย-ไวอากร้า ผู้หญิงแบบผสมน้ำ
- SexShop ยาปลุกเซ็กส์ราคาถูก
- ร้านขาย Sex Toy ยาเสียว ยา_แข็ง
- Kamagrajelly Smile Shop
- Kmg Oral Jelly
เมื่อทำการตรวจสอบเว็ปไซต์ดังกล่าวข้างต้นพบว่า มีการจำหน่ายยาปลุกเซ็กส์สำหรับผู้ชาย - ยาปลุกเซ็กส์ชนิดน้ำไร้รส ไร้กลิ่นสำหรับผู้หญิง, ยาเพิ่มสมรรถภาพทางเพศ, และเซ็กส์ทอยจริง เจ้าหน้าที่ตำรวจจึงทำการสืบสวนจนทราบสถานที่ที่เกี่ยวข้องกับการกระทำความผิด เข้าทำการตรวจค้น ตรวจยึดสิ่งของผิดกฎหมายส่งพนักงานสอบสวน กก.4 บก.ปคบ. และแจ้งข้อกล่าวหาผู้ต้องหาทั้งสิ้น 3 ราย
25 พ.ย. 2566 รมต.ต่างประเทศอิสราเอล ต้อนรับคนไทยกลับถึง เทลาวีฟ
25 พฤศจิกายน 2566 นาย Eli Cohen รัฐมนตรีว่าการกระทรวงการต่างประเทศ พร้อมด้วยนาย Michael Ronen อธิบดีกรมเอเชียแปซิฟิก กระทรวงการต่างประเทศ ได้เข้าเยี่ยมกลุ่มคนไทย 10 คนแรก ที่ได้รับการปล่อยตัวจากฉนวนกาซา ที่โรงพยาบาล Shamir Medical Center โดยมีนายจุลวัจน์ นรินทรางกูร ณ อยุธยา อุปทูตฯ และคณะข้าราชการสถานเอกอัครราชทูต ณ กรุงเทลาวีฟและจากกระทรวงการต่างประเทศรอต้อนรับ
นาย Cohen ได้กล่าวต้อนรับและให้กำลังใจกลุ่มคนไทยดังกล่าวคืนสู่อิสราเอลอย่างปลอดภัยและให้คำมั่นว่ารัฐบาลอิสราเอลจะให้การช่วยเหลือและการดูแลทางการแพทย์ แก่คนไทยกลุ่มนี้อย่างเต็มที่เฉกเช่นชาวอิสราเอลได้รับ โอกาสนี้ อุปทูตฯ ได้แสดงความขอบคุณต่อรัฐบาลอิสราเอลและหน่วยงานต่างๆ ที่เกี่ยวข้องที่ให้การดูแลกลุ่มคนไทยทั้ง 10 คนที่ได้รับการปล่อยตัวออกมาเป็นอย่างดียิ่ง - ภาพจาก
Royal Thai Embassy, Tel Aviv ระยะเวลาดำเนินการ รูปแบบการดำเนินงาน
6. ระยะเวลาดำเนินการ
ขอให้หน่วยบริการฉีดวัคซีน HPV ในกลุ่มเป้าหมาย ระหว่างเดือนพฤศจิกายน 2566 ถึงเดือนมกราคม 2567 ดังนี้
6.1 ให้บริการวัคซีนในกลุ่มนักเรียนหญิงไทย ชั้นประถมศึกษาปีที่ 5 ถึง ชั้นมัธยมศึกษาปีที่ 6 หรือเทียบเท่า ใน รูปแบบ วัคซีนนักเรียน (School-based vaccination) ในเดือนพฤศจิกายน 2566 โดยดำเนินการเป็นรายโรงเรียนให้ครบถ้วน เป็นลำดับแรก
6.2 ให้บริการฉีดวัคซีน HPV นักศึกษาหญิงไทยระดับอุดมศึกษาปีที่ 1 – 2 หรือเทียบเท่า หรือหญิงไทยนอกระบบการศึกษา ในหน่วยบริการ หรือ หรือจุดฉีดนอกสถานที่ ตามบริบทของพื้นที่ และให้บริการผ่านสถานศึกษาในเดือนธันวาคม 2566 ถึง เดือนมกราคม 2567
6.3 ขอให้เขตตรวจสุขภาพ ดำเนินการประชาสัมพันธ์การให้วัคซีน HPV ตามนโยบายกระทรวงสาธารณสุข โดยจัดกิจกรรมแคมเปญรณรงค์ “Kick-off 1-M doses: School based HPV Vaccine” อย่างน้อย 1 จังหวัดแต่ละเขตสุขภาพ พร้อมกันทั่วประเทศ ในวันที่ 8 พฤศจิกายน 2566
7. รูปแบบการดำเนินงาน
เนื่องจากการให้ฉีดวัคซีน HPV มีกลุ่มเป้าหมายที่อยู่ในระบบการศึกษา และนอกระบบการศึกษา จึงสามารถพิจารณาดำเนินงานตามบริบทของพื้นที่ ดังนี้
7.1 กลุ่มเป้าหมาย นักเรียนหญิงไทย ชั้นประถมศึกษาปีที่ 5 ถึง ชั้นมัธยมศึกษา
ปีที่ 6 หรือเทียบเท่า ดำเนินงานในรูปแบบวัคซีนนักเรียน (Schoolbased vaccination) สามารถดำเนินงานผ่านสถาบันการศึกษา
7.2 กลุ่มเป้าหมาย นักศึกษาหญิงไทยระดับอุดมศึกษาปีที่ 1 – 2 หรือเทียบเท่า
7.3 กลุ่มเป้าหมาย หญิงไทย อายุ 11 - 20 ปี นอกระบบการศึกษา
ดำเนินการฉีดวัคซีน HPV ในหน่วยบริการ หรือพิจารณาจัดหาช่องทางการเข้าถึงวัคซีน ให้กลุ่มเป้าหมายดังกล่าวตามความเหมาะสม เพื่อไม่ให้เสียโอกาสในการสร้างเสริมภูมิคุ้มกันโรค
8. การให้วัคซีน HPV ตามประวัติการได้รับวัคซีน
ขอให้เจ้าหน้าที่ตรวจสอบประวัติการได้รับวัคซีน HPV ของกลุ่มเป้าหมาย ก่อนให้บริการวัคซีน HPV ดังนี้
8.1 ไม่จำเป็นต้องฉีดวัคซีน กรณีกลุ่มเป้าหมายมีประวัติการได้รับวัคซีน HPV ครบตามเกณฑ์ ดังนี้
8.1.1 มีประวัติได้รับวัคซีน 3 เข็ม ตามเอกสารกำกับยา
8.1.2 มีประวัติได้รับวัคซีน 2 เข็ม ระยะห่างระหว่างเข็ม 6 เดือนขึ้นไป
8.2 ฉีดวัคซีน กรณีกลุ่มเป้าหมายมีประวัติการได้รับวัคซีน HPV ไม่ครบตามเกณฑ์ ดังนี้
8.2.1 ไม่มีประวัติได้รับวัคซีน/ไม่ทราบ ให้ฉีดวัคซีน HPV จำนวน 2 เข็ม ระยะห่างระหว่างเข็ม 6 เดือนขึ้นไป
8.2.2 มีประวัติได้รับวัคซีน 1 เข็ม หรือได้รับวัคซีน 2 เข็ม ระยะห่างน้อยกว่า 6 เดือน ให้ฉีดวัคซีน HPV จำนวน 1 เข็ม ห่างจากเข็มล่าสุด อย่างน้อย 6 เดือน
9. วัคซีนที่ให้บริการ
การให้บริการวัคซีน HPV ตามนโยบายเร่งรัด 100 วัน ประกอบด้วย วัคซีน HPV ชนิด 4 สายพันธุ์ ชื่อทางการค้า คือ Gardasil® และวัคซีน HPV ชนิด 2 สายพันธุ์ชื่อทางการค้า คือ Cecolin®
นายแพทย์อภิรักษ์ พิศุทธ์อาภรณ์ นายแพทย์สาธารณสุขจังหวัดจันทบุรี ประธานในพิธี กล่าวว่าการแปลผลเอกซเรย์ปอด ถ้าดีที่สุดก็ต้องให้ รังสีแพทย์แปลผล แต่เนื่องด้วยข้อจำกัดของโรงพยาบาลรัฐบาลโดยเฉพาะโรงพยาบาลชุมชน เอกซเรย์ปอดได้รับการอ่านโดยแพทย์เวชปฏิบัติทั่วไป ดังนั้นการที่มี AI ที่ได้รับการรับรองจากสำนักงานคณะกรรมการอาหารและยา ถือเป็นเครื่องมือแพทย์ที่มีความสามารถเทียบกับรังสีแพทย์ มาเป็นผู้ช่วยในการแปลผลจะทำให้เกิดการยกระดับการดูแลรักษาผู้ป่วยได้อย่างมาก
กลืนอย่างไร ไม่สำลัก ข้อแนะนำสำหรับผู้ป่วยและผู้ดูแล
ศ.นพ.รุ่งโรจน์ กล่าวว่าการดูแลผู้ป่วยที่มีอาการสำลัก และภาวะกลืนยากเป็นเรื่องละเอียดอ่อน ซึ่งผู้ดูแลต้องใจเย็นและเอาใจใส่เป็นพิเศษ ดังต่อไปนี้
1. ชวนผู้ป่วยขยับกล้ามเนื้อบริเวณปากและคอเป็นประจำ เพื่อทำให้กล้ามเนื้อแข็งแรงขึ้น เช่น บริหารกล้ามเนื้อคอ โดยใช้ท่าก้มเงยศรีษะช้าๆ ท่าเอียงศรีษะไปทางซ้าย-ขวา แต่ละท่าค้างไว้ 5 วินาที ทำซ้ำ 5 ครั้ง และบริหารกล้ามเนื้อปาก โดยออกเสียงอา อู อี โอ เอ ค้างไว้เสียงละ 5 วินาที ทำซ้ำเสียงละ 5 ครั้ง เป็นต้น
2. ดูแลให้ผู้ป่วยมีสมาธิในการรับประทานอาหารหรือดื่มน้ำ ตั้งใจรับประทานอาหารและกลืนอาหารให้หมด ในขณะรับประทานหรือดื่มน้ำ ต้องไม่คุย ไม่ดูโทรทัศน์ หรือไม่ทำกิจกรรมอื่น ๆ ที่จะทำให้เสียสมาธิขณะรับประทาน และจะทำให้ประสิทธิภาพในการกลืนลดลง เสี่ยงกับการสำลัก
3. แนะนำให้ผู้ป่วยก้มหน้าในขณะกลืน (Chin tuck maneuver) เมื่ออาหารเข้าปากแล้ว ให้เคี้ยวให้เสร็จเรียบร้อย และเมื่อจะกลืนต้องก้มคอ คางชิดหน้าอก แล้วค่อยกลืนเพื่อลดโอกาสสำลัก
4. สังเกตพฤติกรรมการกินของผู้ป่วย หากผู้ป่วยทำท่าจะลืมข้อแนะนำที่ให้ก้มหน้าขณะกลืน ผู้ดูแลต้องดันศีรษะผู้ป่วยให้ถูกจังหวะ คางชิดอก แล้วบอกให้ผู้ป่วยกลืนอาหาร
ศ.นพ.รุ่งโรจน์ กล่าวว่าผู้ป่วยและผู้ดูแลจะได้รับคำแนะนำดังกล่าวและฝึกปฏิบัติจากนักฝึกกลืนที่โรงพยาบาล แต่ปัญหาที่มักพบเสมอ ๆ คือเมื่อผู้ป่วยกลับบ้าน พฤติกรรมการกลืนก็กลับไปเหมือนเดิม
“ผู้ป่วยส่วนใหญ่มักทำได้แค่ตอนมาฝึกการกลืนร่วมกับนักฝึกกลืนที่โรงพยาบาล พอกลับบ้านไป ก็ไม่ได้ปรับพฤติกรรมการกินตามที่แพทย์กำชับ มีผู้ป่วยน้อยรายเท่านั้นที่ทำได้ อีกอย่างคือโรคประจำตัวบางโรคก็เป็นอุปสรรค เช่น โรคพาร์กินสัน และผู้ที่มีภาวะ Stroke กล้ามเนื้ออ่อนแรง หลอดเลือดตีบ ที่ทำให้การกลืนยากขึ้น”
หลักสูตร Front Office แผนกต้อนรับส่วนหน้า
Front Office คอร์สนี้เหมาะสำหรับตำแหน่งงานดังต่อไปนี้
- ผู้จัดการแผนกต้อนรับส่วนหน้า (Front Office Manager)
- ผู้ควบคุมฝ่ายต้อนรับส่วนหน้า (Front Office Supervisor)
- พนักงานต้อนรับ (Receptionist)
- พนักงานรับโทรศัพท์ (Telephone Operator)
- พนักงานดูแลสัมภาระ (Bell Boy)
ลิงค์หลักสูตร


พญ.ลลิตยา กองคำ รองเลขาธิการ สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวว่า “กองทุนหลักประกันสุขภาพแห่งชาติ หรือ สปสช. ยังคงเดินหน้าและพัฒนาระบบอย่างไม่หยุดนิ่ง เพื่อดูแลประชาชนผู้ใช้สิทธิให้ได้รับการเข้าถึงบริการสาธารณสุขที่จำเป็นอย่างครอบคลุมและทั่วถึง โดยในปี 2566 นี้ สปสช. ได้เดินหน้ายกระดับบัตรทองอย่างต่อเนื่อง โดยการเพิ่มสิทธิประโยชน์บริการให้กับผู้ใช้สิทธิบัตรทองมากขึ้น เพื่อเพิ่มการเข้าถึงบริการสาธารณสุข อาทิ เพิ่มการเข้าถึงยารักษามะเร็ง และนโยบายผู้ป่วยโรคมะเร็งไปรับบริการที่ไหนก็ได้ (Cancer Anywhere), เพิ่มการเข้าถึงบริการเบาหวานชนิดที่ 2, ผู้ติดเชื้อเอชไอวี และผู้ป่วยเอดส์ สามารถเข้ารับการดูแลได้ตั้งแต่การตรวจคัดกรอง การให้คำปรึกษา บริการยาต้านไวรัสเพื่อป้องกันทั้งก่อนและหลังการรับเชื้อ และบริการฟื้นฟูที่จำเป็นต่อการดูแล โดยมีเป้าหมายสำคัญเพื่อดูแลสุขภาพให้กับคนไทยทุกคน และให้ได้รับสิทธิประโยชน์โดยทั่วถึง ครอบคลุมการรักษาได้ทุกพื้นที่ทั่วประเทศ และอยากให้คนไทยได้ตระหนักเห็นความสำคัญถึงการเป็นประชากรกลุ่มเสี่ยงฯ ซึ่งโครงการ #รู้ว่าเสี่ยง เลี่ยงเสียศูนย์ (#KnowMyRisk) ไม่เพียงแต่เป็นการสื่อสารให้ประชาชนเกิดความเข้าใจที่ถูกต้องในการดูแลตนเองเท่านั้น แต่ยังทำให้รู้เท่าทันโรค รักษาได้ทันท่วงที ซึ่งโครงการฯ ดังกล่าว ยังแสดงให้เห็นถึงพลังความร่วมมือจากหลายภาคส่วนซึ่งนำไปสู่การทำให้ประชาชนสามารถเข้าถึงบริการสาธารณสุขได้มากขึ้น”
สปสช. เขต 1 เชียงใหม่
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต1 เชียงใหม่ (National Health Security Office Region 1 Chiang Mai) ดูแลพื้นที่ 8 จังหวัดภาคเหนือตอนบน ได้แก่ เชียงใหม่ เชียงราย แม่ฮ่องสอน ลำปาง ลำพูน พะเยา แพร่ น่าน
- อาคารสำนักงานไปรษณีย์เขต 5 ชั้น 2 เลขที่ 6 ถ.มหิดล ต.สุเทพ อ.เมือง จ.เชียงใหม่ 50200
- โทรศัพท์ 053285355
- โทรสาร 053-285364
- ทุกวันเวลาราชการ 8.30 น. - 16.30 น.
- สายด่วน ๑๓๓๐ ทุกวัน ตลอด ๒๔ ชั่วโมง
- แผนที่สำนักงาน google map
- website
- facebook
นราธิวาส ประชุมความคืบหน้าบัตรประชาชนใบเดียว
12 ธ.ค. 66 ดร.นพ.พงศธร พอกเพิ่มดี รักษาราชการแทนรองปลัดกระทรวงสาธารณสุข พร้อมด้วยคณะ เดินทางลงพื้นที่จังหวัดนราธิวาส เพื่อประชุมติดตามความก้าวหน้าการดำเนินงานตามนโยบายบัตรประชาชนใบเดียวรักษาได้ทุกที่ ของโรงพยาบาลในจังหวัดนราธิวาส โดยมี นายแพทย์สมบูรณ์ บุญกิตติชัยพันธ์ นายแพทย์สาธารณสุขจังหวัดนราธิวาส กล่าวต้อนรับ และนายแพทย์พรประสิทธิ จันทระ ผู้อำนวยการโรงพยาบาลนราธิวาสราชนครินทร์ นำเสนอความก้าวหน้าตามนโยบายบัตรประชาชนใบเดียวรักษาได้ทุกที่ ณ ห้องประชุมภักดีบดินทร์ ชั้น 4 โรงพยาบาลนราธิวาสราชนครินทร์
ทั้งนี้ ในที่ประชุมได้นำเสนอแผนการขับเคลื่อนนโยบายบัตรประชาชนใบเดียวรักษาได้ทุกที่ และการพัฒนาโรงพยาบาลอัจฉริยะ รวมถึง ความก้าวหน้าการดำเนินงานตามนโยบายฯ และคณะติดตามความก้าวหน้าฯ ได้ลงพื้นที่เยี่ยมหน่วยบริการในพื้นที่จังหวัดนราธิวาส ได้แก่ โรงพยาบาลกัลยาณิวัฒนาการุณย์ ร้านยาเภสัชกร และคลินิกเทคนิคการแพทย์ เพื่อติดตามความก้าวหน้าและเตรียมความพร้อมนโยบายบัตรประชาชนใบเดียวรักษาได้ทุกที่ บัตรประชาชนใบเดียว เชื่อมข้อมูลรักษา
ลงทะเบียนพิสูจน์และยืนยัน Health ID ด้วยบัตรประจำตัวประชาชน
ลงทะเบียนพิสูจน์และยืนยัน Health ID ผ่านระบบหมอพร้อม DID ด้วยบัตรประจำตัวประชาชน และโทรศัพท์มือถือที่ติดตั้งแอพพลิเคชั่น "หมอพร้อม"ได้ที่ รพ.ของรัฐ รพ.สต. สำนักงานสาธารณสุขอำเภอ ทีมงานเจ้าหน้าที่พร้อมดูแลและช่วยบริการในการลงทะเบียนแล้ว
ศูนย์ฯสาธารณสุข 69 แห่ง (50 เขต) ในกรุงเทพ
ศูนย์บริการสาธารณสุข 69 แห่ง โดยสามารถ Walk In ได้ทุกวันพุธ ตั้งแต่เวลา 13.00 -15.00 น. (สอบถามรายละเอียดเพิ่มเติมได้ที่ศูนย์บริการสาธารณสุขที่ท่านจะเข้ารับบริการ) ให้นำบัตรประจำตัวประชาชนตัวจริง ไปด้วยสำหรับใช้แสดงเพื่อรับบริการ
ตรวจสอบเบอร์โทร ศูนย์บริการสาธารณสุข 69 แห่ง ได้ที่นี่งานปีใหม่และงานกาชาดกระบี่ ประจำปี 2567 (29 ธันวาคม 2566 – 7 มกราคม 2567)
จังหวัดกระบี่ ร่วมกับเหล่ากาชาดจังหวัดกระบี่ เตรียมจัดงานปีใหม่และงานกาชาดจังหวัดกระบี่ ประจำปี 2567 ในระหว่างวันที่ 29 ธันวาคม 2566 – 7 มกราคม 2567 รวม 10 วัน 10 คืน ณ บริเวณหน้าศาลากลางจังหวัดกระบี่
วัตถุประสงค์เพื่อจัดหารายได้ให้กับเหล่ากาชาดจังหวัดกระบี่ ไว้ใช้ในกิจกรรมสาธารณกุศล การบรรเทาทุกข์และช่วยเหลือสงเคราะห์ประชาชนในด้านต่าง ๆ การจัดงานดังกล่าว มีกิจกรรมส่งท้ายปีเก่าต่อนรับปีใหม่ การออกร้านมัจฉากาชาด การจัดนิทรรศการของหน่วยงานราชการ การประชาสัมพันธ์ผลการดำเนินงานขอเหล่ากาชาดจังหวัดกระบี่ การจัดจำหน่วยผลิตภัณฑ์ชุมชน และสินค้าราคาถูกจากทั่วประเทศ การแสดงศิลปวัฒนธรรมพื้นบ้าน และการแสดงของศิลปินชื่อดังอีกมากมาย
นอกจากนี้ ได้มีการออกสลากกาชาด จำนวน 60,000 ฉบับ ๆ ละ 100 บาท จำหน่ายให้กับส่วนราชการ รัฐวิสาหกิจ ภาคเอกชน และประชาชนโดยทั่วไป โดยกำหนดออกรางวัล ณ เวทีร้านกาชาด หน้าศาลากลางจังหวัดกระบี่ในคืนวันที่ 7 มกราคม 2567 โดยวิธีหมุนวงล้อ และสามารถตรวจสอบผลการออกสลากการกุศลได้ที่ www.krabi.go.th หรือโทร 0-7562-0985,0-7561-2255 และที่ว่าการอำเภอ ทุกอำเภอ
สำหรับรางวัลสลากาชาดในปีนี้ ประกอบด้วย
รางวัลที่ 1 มี 1 รางวัล รถยนต์กระบะ Hillux Revo Double cap 2.4 Entry M/T สีขาว
รางวัลที่ 2 มี 1 รางวัล รถยนต์เก๋ง Yaris 1.2 Sport A/T สีดำ
รางวัลที่ 3 มี 10 รางวัล รถจักรยานยนต์ YAMAHA Finn 155 cc. สีดำ
รางวัลที่ 4 มี 5 รางวัล ทีสีสีจอแบน TCL
รางวัลที่ 5 มี 5 รางวัล ตูเย็น MITSUBISHI ขนาด 6.1 คิว (เลขท้าย 3 ตัว)
รางวัลที่ 6 มี 10 รางวัล รถจักรยาน (เลขท้าย 2 ตัว)
ทั้งนี้ จังหวัดกระบี่ จึงขอเชิญผู้มีจิตศรัทธาร่วมสนับสนุนสิ่งของและรางวัลสำหรับร้านมัจฉากาชาดในงานวันรวมใจให้กาชาด ซึ่งจะจัดขึ้นในวันที่ 15 ธันวาคม 2567 ณ จวนผู้ว่าราชการจังหวัดกระบี่
คลินิกทันตกรรม SMC 088-7674801 โทรนัดพบแพทย์ล่วงหน้าเท่านั้น
โทรนัดพบแพทย์ล่วงหน้า
เริ่มวันที่ 1 พฤศจิกายน 2566 เป็นต้นไป
คลินิกทันตกรรม SMC 088-7674801
โทรในวันราชการ เวลา 08.30 - 16.30 น.
โทรนัดพบแพทย์ล่วงหน้าทางหมายเลขโทรศัพท์เท่านั้น
1.ศูนย์สุขภาพพร้อม สาขาคณะเทคนิคการแพทย์ มช.
ศูนย์สุขภาพพร้อม สาขาคณะเทคนิคการแพทย์ มช. ให้บริการ วันจันทร์ - ศุกร์ เวลา 07:30 - 20:00 น.
วันเสาร์ - อาทิตย์ เวลา 07:30 - 15:30 น. วันหยุดนักขัตฤกษ์
ในบางรายที่ปรับพฤติกรรมแล้วไม่ได้ผล ก็ยังมีวิธีที่จะทำให้เราทราบถึงสาเหตุของปัญหาที่เกี่ยวข้องกับการนอน และความเสี่ยงในการเกิดโรคในอนาคตได้หลายหลากวิธี เช่น การดริปวิตามินเพื่อช่วยลดความเครียด หรือการใช้เทคโนโลยีต่างๆ โดย 1 ใน วิธีที่ดีที่สุดคือ การทำ Sleep test ถือเป็นศาสตร์ทางการแพทย์ ที่ช่วยแก้ปัญหาเกี่ยวกับการนอนได้เป็นอย่างดี นอกจากนั้นการให้คำปรึกษาจากผู้เชี่ยวชาญด้านการนอนหลับ หรือแพทย์เฉพาะทาง จะสามารถช่วยปรับพฤติกรรมและหาวิธีการแก้ปัญหาแบบเฉพาะบุคคลให้ตรงกับสรีระ และพฤติกรรมการใช้ชีวิตได้อีกด้วย ซึ่งคนจำนวนมากถึง 92.4% ยังไม่เคยทำ Sleep test ด้วยเหตุผลต่างๆ เช่น ยังไม่เห็นความสำคัญมากพอ, ขาดโอกาสในการเข้าถึงการทำ Sleep test และยังไม่ต้องการแอทมิดที่โรงพยาบาล หรือนอนหลับในสภาพแวดล้อมที่ไม่คุ้นชิน ทำให้ในปัจจุบันมีการแก้ไขปัญหาเพื่อตอบโจทย์ความต้องการนั้นๆ โดยสามารถทำ Sleep test ได้ทั้งที่บ้าน หรือแม้แต่กระทั่งในโรงแรมที่มีการออกแบบเพื่อการนอนหลับที่ดีได้ ภายในสิ่งแวดล้อมที่มีความผ่อนคลาย เพื่อตอบโจทย์ต่อการพักผ่อน และส่งเสริมให้เกิดสุขภาวะการนอนที่ดีต่อทุกคนอีกด้วย
1. ผ่านทางไลน์ทางการของสำนักงานประกันสังคม
1. ผ่านทางไลน์ทางการของสำนักงานประกันสังคม
ด้วย 4 ขั้นตอน ดังนี้
✔️ เข้ามาที่ไลน์ทางการสำนักงานประกันสังคม
และเลือกเมนู ‘ข้อมูลของคุณ’ ที่มุมขวาล่างของหน้าจอ
✔️ เลือกเมนูเปลี่ยนโรงพยาบาล
✔️ เลือกโรงพยาบาลที่ต้องการและกด ‘ยืนยัน’
✔️ เมื่อยื่นเรื่องเสร็จสิ้น รอผลเพียง 2 วันเท่านั้น
รพ.แม่สอดราม อ.แม่สอด จ.ตาก
โรงพยาบาลแม่สอด ราม ในเครือโรงพยาบาลรามคำแหง เป็นโรงพยาบาลเอกชนแห่งแรกในจังหวัดตาก ที่เปิดรับประกันสังคม พร้อมให้บริการในระบบประกันสังคม ตั้งแต่ 1 มกราคม 2567 ด้วยบริการมาตราฐาน ISO บริการทั้งชาวไทยและต่างชาติ ผู้ประกันตนสามารถเลือกเปลี่ยนสถานพยาบาลประจำปี 2567 ตั้งแต่ 16 ธ.ค. 66 - 31 มี.ค. 67
1. โครงการพระราชดำริฯ / เฉลิมพระเกียรติ / ที่เกี่ยวเนื่องกับพระบรมวงศานุวงศ์
จัดการประชุมวิซาการพัฒนาโรงพยาบาลสมเด็จ พระยุพราช ครั้งที่ 25 ประจำปี 2566 ภายใด้แนวคิด
"คนบันดาลงาน ยุพราชบันดาลใจ ยุพราชก้าวไกลด้วย นวัตกรรม" ประยุกต์ใช้หลักการโรงพยาบาลคุณธรรม ควบคู่กับการพัฒนาคุณภาพโรงพยาบาลสู่ความเป็นเลิศ เพื่อมุ่งสู่การเป็น "โรงพยาบาลคุณธรรม ก้าวล้ำด้วยคุณภาพและนวัตกรรม" พร้อมพัฒนาโรงพยาบาลสมเด็จพระยุพราช 21 แห่ง และ โรงพยาบาลเฉลิมพระเกียรติ 80 พรรษา 11 แห่ง ให้เป็น โรงพยาบาลอัจฉริยะต้นแบบ (SMART Hospital)
ศาสตราจารย์ แพทย์หญิงอุษา ทิสยากร รางวัลแพทย์สตรีตัวอย่าง 2566 LINK
ศาสตราจารย์ แพทย์หญิงอุษา ทิสยากร อายุ 75 ปี
ปัจจุบัน ศาสตราจาย์ระดับ A1 (ระดับ 11) จุฬาลงกรณ์มหาวิทยาลัย , ผู้อำนวยการระดับสูง Cluster วิจัยอายุรศาสตร์เขตร้อน จุฬาลงกรณ์มหาวิทยาลัย ที่ปรึกษา คณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล กองควบคุมโรคติดต่อ สำนักอนามัย กรุงเทพมหานคร และคณะแพทยศาสตร์ มหาวิทยาลัยธรรมศาสตร์
ท่านจบการศึกษาแพทยศาสตร์บันฑิต มหาวิทยาลัยเชียงใหม่ ปี 2541 วุฒิบัตรฯ สาขากุมารเวชศาสตร์ ปี 2518 เป็นกุมารแพทย์ประจำโรงพยาบาลเด็ก กระทรวงสาธารณสุข และเป็นอาจารย์ประจำภาควิชากุมารเวชศาสตร์ คณะแพทยศาตร์ จุฬาลงกรณ์มหาวิทยาลัย จนเกษียณอายุ
ท่านเคยดำรงตำแหน่งนายกสมาคมกุมารแพทย์แห่งประเทศไทย, นายกสมาคมโรคติดเชื้อในเด็กแห่งประเทศไทย, นายกสมาคม International Society of Tropical Pediatrics
ปัจจุบัน ตำรงตำแหน่ง นายกสมาคม Asian Society for Pediatric Infectious Diseases
ท่านมีผลงานวิชาการกว่า 200 เรื่อง เผยแพร่ผ่านวารสารวิชาการทั้งในและต่างประเทศ ใช้อ้างอิงในตำราและวารสาร
ท่านเป็นประธานฝ่ายแพทย์ โครงการลดการติดเอดส์จากแม่สู่ลูกของสภากาชาดไทยฯ ได้รับการยกย่องจาก UNAIDS ให้เผยแพร่ไปทั่วโลกในรูปแบบ UNAIDS Best Practice ปี 2543 ผลจากโครงการ ทำให้ ประเทศไทยได้รับการยกย่องจาก WHO ให้เป็นประเทศแรกในเอเซียที่สามารถลดการติดเชื้อเอดส์จากแม่สู่ลูกได้อย่างดีเยี่ยมในปี 2559
ท่านเป็นหนึ่งในผู้วิจัยหลักของไทยร่วมกับนานาชาติในเอเซียในปฏิบัติการโครงการทดสอบวัคซีนป้องกันไข้เลือดออก จนสามารถยืนยันความปลอดภัยและประสิทธิภาพของวัคซีนเป็นครั้งแรกของโลกในปี 2558
ท่านได้รับรางวัลอาจารย์ดีเด่นระดับมหาวิทยาลัยจาก จุฬาลงกรณ์มหาวิทยาลัย ได้รับปริญญาดุษฎีบัณฑิตกิตติมศักดิ์ สาขาวิชาแพทยศาสตร์ จากมหาวิทยาลัยเชียงใหม่ และจุฬาลงกรณ์มหาวิทยาลัย ได้รับรางวัลสตรีดีเด่นระดับสากลประเภทบุคคลภาครัฐ เนื่องวันสตรีสากล ประจำปี 2562 จากกระทรวงการพัฒนาสังคมและความมั่นคงมนุษย์
ท่านได้รับเหรียญกาชาดสรรเสริญ และรางวัล BE ALL TO ALL ในโอกาส 120 ปี ของ Sister of St. Paul de Chartres ประเทศไทย และ Outstanding Asian Pediatrician จาก Asian Pacifict Pediatric Association
ภาพและข้อมูลจาก
จุฬาลงกรณ์มหาวิทยาลัย TMWAร้านยาดูแลเจ็บป่วยเล็กน้อย 16 กลุ่มอาการ ยังคงเดินหน้าต่อ เร่งสร้างความเข้าใจให้มากขึ้น
สปสช. ได้มีนโยบาย “ร้านยาบริการดูแลเจ็บป่วยเล็กน้อย 16 กลุ่มอาการ” (Common Illnesses) และเริ่มดำเนินการมาตั้งแต่เดือนพฤศจิกายน 2565 จนถึงปัจจุบัน โดยเป็นการดำเนินการร่วมกับสภาเภสัชกรรม และร้านยาคุณภาพทั่วประเทศที่เข้าร่วมให้บริการตามนโยบายกับ สปสช. ด้วยวัตถุประสงค์เพื่อเพิ่มการเข้าถึงบริการรักษาพยาบาลให้กับผู้ป่วยสิทธิหลักประกันสุขภาพแห่งชาติ หรือ “บัตร 30 บาท รักษาทุกโรค” กรณีที่มีภาวะเจ็บป่วยเล็กน้อย เป็นการอำนวยความสะดวก ลดการเดินทางไปรับบริการที่โรงพยาบาล เพื่อช่วยลดความแออัดผู้ป่วยในโรงพยาบาล แต่สามารถเข้ารับการประเมินอาการและรับยาจากร้านยาใกล้บ้านได้แทน
นโยบายนี้ได้รับการยอมรับอย่างดีจากทั้งประชาชน ผู้ประกอบการร้านยาและเภสชักร ปัจจุบันมีร้านยาร่วมในโครงการ กว่า 1,500 แห่ง (ข้อมูล 1 มกราคม 2567)
อย่างไรก็ตาม ปรากฏว่าในช่วงที่ผ่านมา มีประชาชนส่วนหนึ่งอาจเกิดความเข้าใจที่สับสนต่อนโยบายนี้ จึงไปที่ร้านยาเพื่อขอใช้สิทธิบัตรทองฯ รับยากับเภสัชกร ทั้งที่ไม่ได้เจ็บป่วยเพื่อนำมาเก็บไว้ที่บ้าน ดังนั้น สปสช. ขอย้ำว่า “ประชาชนที่จะใช้สิทธิบัตรทองเข้ารับการดูแลจากร้านยาตามนโยบายนี้ จะต้องเป็นผู้ที่มีอาการเจ็บป่วยเล็กน้อยใน 16 กลุ่มอาการเท่านั้น โดยเภสัชกรจะเป็นผู้คัดกรองอาการท่าน และจ่ายยาตามอาการที่ปรากฎ แต่หากท่านไม่ได้มีอาการเจ็บป่วยก็จะไม่ได้รับการจ่ายยาใดๆ และนโยบายนี้ก็ไม่ได้มีวัตถุประสงค์ที่เป็นการแจกยาฟรี เพื่อให้นำยาไปเก็บไว้ที่บ้านได้
ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ในฐานะโฆษกสำนักงานหลักประกันสุขภาพแห่งชาติ กล่าวถึงประเด็นนี้ว่า “นโยบายนี้ สปสช. และสภาเภสัชกรรม มีเจตนาที่ดีในการร่วมดำเนินการ เพื่อให้ประชาชนได้รับความสะดวก หากเจ็บป่วยเล็กน้อยก็เข้าถึงการรักษาได้ง่าย ซึ่งท่านไม่ต้องนำยาไปเก็บไว้ที่บ้าน หากมีอาการเจ็บป่วยเกิดขึ้นเมื่อไหร่ ก็สามารถใช้สิทธิรับบริการที่ร้านยาได้ทุกเมื่อ ตามเวลาให้บริการของร้านยานั้นๆ จึงขอทำความเข้าใจ และขอความร่วมมือจากประชาชนผู้มีสิทธิบัตรทองมา ณ ที่นี้ด้วย เพื่อให้นโยบายดีๆ นี้คงอยู่ต่อไป เพราะไม่เช่นนั้นอาจส่งผลกระทบต่อการดำเนินนโยบายนี้ในอนาคตได้”
ทพ.อรรถพร กล่าวต่อว่า นอกจากการใช้สิทธิบัตรทองเพื่อเช้ารับบริการนี้ ขอแจ้งว่าเป็นสิทธิเฉพาะบุคคล ซึ่งไม่สามารถนำบัตรประชาชนผู้อื่นมาขอรับยาแทนได้ เนื่องจากเภสัชกรต้องทำการคัดกรองประเมินอาการเบื้องต้นเพื่อจ่ายยาและให้คำแนะนำการกินยา ในส่วนของผู้ป่วยที่มีภาวะเจ็บป่วยเรื้อรัง จำเป็นต้องได้รับการดูแลต่อเนื่องจากแพทย์และมีนัดรับการรักษาที่โรงพยาบาล ก็ขอให้ไปรับการรักษาตามที่หน่วยบริการนัดหมายเพื่อรับการติดตามดูแลอย่างต่อเนื่อง ไม่สามารถเข้ารับยาที่ร้านยาตามนโยบายนี้ได้
MOU ความร่วมมือ ณ โรงพยาบาลนครท่าฉลอม
พิธีลงนามบันทึกข้อตกลงความร่วมมือในการพัฒนาเทคโนโลยีระบุตัวตนของบุคคลที่ไม่มีเอกสารประจำตัวในประเทศไทย ณ โรงพยาบาลนครท่าฉลอม จังหวัดสมุทรสาคร
15 สิงหาคม 2566 นายเตช บุนนาค เลขาธิการสภากาชาดไทย พร้อมด้วย นายแพทย์ธเรศ กรัษนัยรวิวงค์ อธิบดีกรมควบคุมโรค และ ดร.ชัย วุฒิวิวัฒน์ชัย ผู้อำนวยการศูนย์เทคโนโลยีอิเล็กทรอนิกส์และคอมพิวเตอร์แห่งชาติ (เนคเทค) ปฏิบัติการแทนผู้อำนวยการสำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) ร่วมลงนามบันทึกความร่วมมือในการพัฒนาเทคโนโลยีระบุตัวตนของบุคคลที่ไม่มีเอกสารประจำตัวในประเทศไทย เพื่อการสาธารณสุขและช่วยเหลือด้านมนุษยธรรม ส่งเสริมให้มีการประยุกต์ใช้งานวิจัย เทคโนโลยี และนวัตกรรมกับงานด้านสาธารณสุข ทำให้คุณภาพชีวิตของประชาชนทุกคนในประเทศดียิ่งขึ้น
โดยได้นำเอาเทคโนโลยีการจดจำใบหน้าและลายม่านตา ด้วยระบบ Face Recognition และ Iris Recognition เข้ามาช่วยสนับสนุนทางการแพทย์ ในการบันทึกข้อมูลของผู้รับบริการฉีควัคซีน และยืนยันตัวตน ในการเข้ารับวัคซีน รวมทั้งสามารถนำไปต่อยอดในการทำงานด้านมนุษยธรรม โดยเชื่อมโยงข้อมูลเข้ากับการบริการสาธารณสุขของไทย ซึ่งจะเป็นประโยชน์ในการเฝ้าระวัง ป้องกัน และควบคุมโรค ในกลุ่มประชากรข้ามชาติที่อยู่ในประเทศไทย ณ ห้องประชุมแสงสุขเอี่ยม โรงพยาบาลนครท่าฉลอม จังหวัดสมุทรสาคร -
RTRCสรุปการเดินทางด้วยระบบขนส่งสาธารณะและปริมาณจราจร
1. งบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 จำแนกตามกลุ่มงบประมาณ
1.1 งบประมาณรายจ่ายงบกลาง รัฐบาลกำหนดไว้ จำนวน 606,765.0 ล้านบาท คิดเป็นร้อยละ 17.4 ของวงเงินงบประมาณ
1.2 งบประมาณรายจ่ายของหน่วยรับงบประมาณ รัฐบาลกำหนดไว้ จำนวน 1,150,144.0 ล้านบาท คิดเป็นร้อยละ 33.0 ของวงเงินงบประมาณ
1.3 งบประมาณรายจ่ายบูรณาการ รัฐบาลกำหนดไว้ จำนวน 214,601.7 ล้านบาท คิดเป็นร้อยละ 6.2 ของวงเงินงบประมาณ จำนวน 10 เรื่อง ได้แก่
1. ขับเคลื่อนการแก้ไขปัญหาจังหวัดชายแดนภาคใต้
2. เขตพัฒนาพิเศษภาคตะวันออก
3. ต่อต้านการทุจริตและประพฤติมิชอบ
4. เตรียมความพร้อมเพื่อรองรับสังคมสูงวัย
5. บริหารจัดการทรัพยากรน้ำ
6. ป้องกัน ปราบปราม และบำบัดรักษาผู้ติดยาเสพติด
7. พัฒนาด้านคมนาคมและระบบโลจิสติกส์
8. พัฒนาอุตสาหกรรมและบริการแห่งอนาคต
9. รัฐบาลดิจิทัล
10. สร้างรายได้จากการท่องเที่ยว
1.4 งบประมาณรายจ่ายบุคลากร รัฐบาลกำหนดไว้ จำนวน 785,957.6 ล้านบาท คิดเป็นร้อยละ 22.6 ของวงเงินงบประมาณ
1.5 งบประมาณรายจ่ายสำหรับทุนหมุนเวียน รัฐบาลกำหนดไว้ จำนวน 257,790.5 ล้านบาท คิดเป็นร้อยละ 7.4 ของวงเงินงบประมาณ
1.6 งบประมาณรายจ่ายเพื่อการชำระหนี้ภาครัฐ รัฐบาลกำหนดไว้ จำนวน 346,380.1 ล้านบาท หรือคิดเป็นร้อยละ 10.0 ของวงเงินงบประมาณ
1.7 งบประมาณรายจ่ายเพื่อชดใช้เงินคงคลัง รัฐบาลกำหนดไว้ จำนวน 118,361.1 ล้านบาท หรือคิดเป็นร้อยละ 3.4 ของวงเงินงบประมาณ
2. งบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 จำแนกตามยุทธศาสตร์การจัดสรรงบประมาณ
ยุทธศาสตร์การจัดสรรงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 ได้กำหนดไว้จำนวน 6 ยุทธศาสตร์ 1 รายการ โดยได้นำยุทธศาสตร์ชาติ และแผนแม่บทภายใต้ยุทธศาสตร์ชาติมากำหนดเป็นกรอบโครงสร้างยุทธศาสตร์การจัดสรรงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 รายละเอียดการดำเนินงานที่สำคัญสรุปได้ ดังนี้
ประเทศจีน
CHINA
1 Fujian Medical University, Fuzhou, Fujian, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนตลอด
หลักสูตร ณ สาธารณรัฐประชาชนจีน รับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ
คลินิกที่ระบุมาในหลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1.Fujian Medical University Union Hospital
2.The First Affiliate Hospital of Fujian Medical University
3.The Fujian Provincial Hospital
ว/ด/ป ที่ รับรอง 11 เม.ย. 62
ว/ด/ปครบอายุการรับรอง 10 เม.ย. 67
2 Medical College, Soochow University, Suzhou, Jiangsu Province, P.R. China
หลักสูตร
ภาษาอังกฤษ 6 ปี ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มี
การเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ใน
การเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1.First Affiliated Hospital
2.Second Affiliated Hospital
3.The Affiliated Children’s Hospital
ว/ด/ป ที่ รับรอง 11 เม.ย. 62
ว/ด/ปครบอายุการรับรอง 10 เม.ย. 67
3 Southern Medical University, Guangzhou, Guangdong,P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี
ปริญญา Bachelor of Medicine, Bachelor of Surgery(MBBS) ที่มีการเรียนการสอนตลอด
หลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ
คลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1. Nanfang Hospital
2. Zhujiang Hospital
3. Third Affiliated Hospital
ว/ด/ป ที่ รับรอง 13 มิ.ย.62
ว/ด/ปครบอายุการรับรอง 12 มิ.ย. 67
4 School of Medicine, Wuhan University, Wuhan, Hubei,P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอน
ระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1.Ren Min Hospital
2.Zhongnan Hospital
ว/ด/ป ที่ รับรอง 12 ก.ย. 62
ว/ด/ปครบอายุการรับรอง 11 ก.ย. 67
5 Xi’an Jiaotong University Health Science Center, Shanxi, P.R. China
หลักสูตร
ภาษาอังกฤษ 6 ปี ปริญญา Bachelor of Medicine, Bachelor of Surgery (MBBS) ที่มีการ
เรียนการสอนตลอดหลักสูตร (รวม Internship) ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในสาธารณรัฐ
ประชาชนจีน ดังนี้
1. The First Affiliated Hospital of Xi’an Jiaotong University
2. The Second Affiliated Hospital of Xi’an Jiaotong University
ว/ด/ป ที่ รับรอง 12 ก.ย. 62
ว/ด/ปครบอายุการรับรอง 11 ก.ย. 67
6. Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี ปริญญา Bachelor of Medicine and
Bachelor of Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน
และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ใน
ประเทศสาธารณรัฐประชาชนจีน ดังนี้
1. The First Affiliated Hospital (Wuhan Union Hospital)
2. The Second Affiliated Hospital (Tongji Hospital)
ว/ด/ป ที่ รับรอง 10 ต.ค. 62
ว/ด/ปครบอายุการรับรอง 9 ต.ค. 67
7 International Educational School of Kunming Medical University, Kunming, Yunnan, P.R. China ห
ลักสูตรภาษาอังกฤษ 6 ปี ปริญญา Bachelor of Medicine and Bachelor of
Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐ
ประชาชนจีน ดังนี้
1. The First Affiliated Hospital
2. The Second Affiliated Hospital
ว/ด/ป ที่ รับรอง 11 มิ.ย. 63
ว/ด/ปครบอายุการรับรอง 10 มิ.ย. 68
8. School of International Studies, Wenzhou Medical University, Wenzhou City, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี ปริญญา Bachelor of Medicine and Bachelor of
Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐ
ประชาชนจีน ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. The 1st Affiliated Hospital
2. The 2nd Affiliated Hospital
3. The 3rd Affiliated Hospital
โรงพยาบาลสมทบ 16 แห่ง
ว/ด/ป ที่ รับรอง 10 ก.ย. 63
ว/ด/ปครบอายุการรับรอง 9 ก.ย. 68
9. Tongji University School of Medicine, Shanghai City, P.R. China
หลักสูตรภาษาอังกฤษ
6 ปี ปริญญา Bachelor of Medicine & Bachelor of Surgery (MBBS) ที่มีการเรียนการสอน
ตลอดหลักสูตร (รวม Internship) ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลที่ใช้ในการ
เรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. Hospital I - Shanghai Tenth People’s Hospital
2. Hospital II - Tongji Hospital
3. Hospital III - Shanghai East Hospital
โรงพยาบาลสมทบ 4 แห่ง คือ
1. Hospital IV - Shanghai Pulmonary Hospital
2. Hospital V - Shanghai Yangpu Hospital
3. Hospital VI - Shanghai First Maternity and Infant Hospital
4. Shanghai Yangzhi Rehab Hospital (Shanghai Sunshine Rehab Center)
ว/ด/ป ที่ รับรอง 10 ก.ย. 63
ว/ด/ปครบอายุการรับรอง 9 ก.ย. 68
10. Tongji University School of Medicine, Shanghai, P.R. China
หลักสูตรภาษาจีน 5 ปี
ปริญญา Bachelor of Medicine ที่มีการเรียนการสอนตลอดหลักสูตร (รวม Internship) ณ
สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาใน
หลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
โรงพยาบาลหลัก 4 แห่ง คือ
1. Hospital I - Shanghai Tenth People’s Hospital
2. Hospital II - Tongji Hospital
3. Hospital III - Shanghai East Hospital
4. Hospital V - Shanghai Yangpu Hospital
โรงพยาบาลสมทบ 3 แห่ง คือ
1. Hospital IV - Shanghai Pulmonary Hospital
2. Hospital VI - Shanghai First Maternity and Infant Hospital
3. Shanghai Yangzhi Rehab Hospital (Shanghai Sunshine Rehab Center)
ว/ด/ป ที่ รับรอง 10 ก.ย. 63
ว/ด/ปครบอายุการรับรอง 9 ก.ย. 68
11. Zhejiang University, School of Medicine, Hangzhou, P.R. China
หลักสูตรภาษาอังกฤษ
6 ปี ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนการ
สอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการ
สอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1. First Affiliate Hospital
2. Second Affiliate Hospital
3. Sir RunRun Shaw Hospital
ว/ด/ป ที่ รับรอง 14 ม.ค 64
ว/ด/ปครบอายุการรับรอง 13 ม.ค.69
12. International Education College, Dalian Medical University, Dalian, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปีBachelor of Medicine and Bachelor of Surgery (MBBS) ที่มี
การเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ใน
การเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1. First Affiliated Hospital of Dalian Medical University
2. Second Affiliated Hospital of Dalian Medical University
ว/ด/ป ที่ รับรอง 10 มิ.ย.64
ว/ด/ปครบอายุการรับรอง 9 มิ.ย. 69
13. School of Medicine Xiamen University, Xiamen City, Fujian Province, P.R. China
หลักสูตร 6 ปี(Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนการ
สอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอน
ระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
โรงพยาบาลหลัก 2 แห่ง คือ
1. The Affiliated Hospital of Xiamen University
2. Zhongshan Hospital of Xiamen University
3. Women’s and Children’s Hospital affiliated to Xiamen University
โรงพยาบาลสมทบ 3 แห่ง คือ
1. Xiamen Cardiovascular Hospital
2. Xiamen Ophthalmic Center affiliated with Xiamen University
3. Xiang’an Hospital of Xiamen University
ว/ด/ป ที่ รับรอง 9 ก.ย. 64
ว/ด/ปครบอายุการรับรอง 8 ก.ย. 69
14. International Education School China Medical University, Liaoning Province, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปีปริญญา Bachelor of Medicine and Bachelor of
Surgery, (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐ
ประชาชนจีน ดังนี้
1. First Hospital of China Medical University
2. Shengjing Hospital of China Medical University
3. Fourth Affiliated Hospital of China Medical University, No.4 Chongshan East
Road, Huanggu District, Shenyang, Liaoning Province, P.R. China
ว/ด/ป ที่ รับรอง 9 มิ.ย.65
ว/ด/ปครบอายุการรับรอง 8 มิ.ย. 70
15. International Education College of Hebei Medical University, Hebei Province, P.R. China
หลักสูตรภ าษ าอังกฤษ 6 ปี ป ริญ ญ า Bachelor of Medicine and Bachelor of
Surgery, (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐ
ประชาชนจีน ดังนี้
1. The First Hospital of Hebei Medical University
2. The Second Hospital of Hebei Medical University
3. The Third Hospital of Hebei Medical University
4.The Fourth Hospital of Hebei Medical University
5. Hebei General Hospital
ว/ด/ป ที่ รับรอง 9 มิ.ย.65
ว/ด/ปครบอายุการรับรอง 8 มิ.ย. 70
16. Nanjing Medical University Jiangsu Province, P.R. China
หลักสูตรภาษาอังกฤษ 6 ปี
ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้
ในการเรียนการสอนระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน 5 แห่ง ดังนี้
1.The First Affiliated Hospital with Nanjing Medical University
2.The Second Affiliated Hospital with Nanjing Medical University
3.Nanjing First Hospital
4.Nanjing Drum Tower Hospital
5.Nanjing Benq Hospital
ว/ด/ป ที่ รับรอง 8 ก.ย. 65
ว/ด/ปครบอายุการรับรอง 7 ก.ย.70
17. Cheeloo College of Medicine, Shandong University, Shandong Province, P.R. China
หลักสูตร 6 ปี ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรอง
โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ในสาธารณรัฐ
ประชาชนจีน 2 แห่ง ดังนี้
1. Qilu Hospital of Shandong University
2. Second Hospital of Shandong University
ว/ด/ป ที่ รับรอง 9 มี.ค. 66
ว/ด/ปครบอายุการรับรอง 8 มี.ค.71
18 International School, Capital Medical University, Beijing, P.R. China
ห ลั ก สู ต ร 6 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery(MBBS) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอน
ระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ในสาธารณรัฐประชาชนจีน 7 แห่ง ดังนี้
1. Xuan Wu Hospital
2. Tian Tan Hospital
3. An Zhen Hospital
4. Tongren Hospital (west)
5. Friendship Hospital
6. Chao Yang Hospital
7. Beijing Children’s Hospital
ว/ด/ป ที่ รับรอง 14 ก.ย. 66
ว/ด/ปครบอายุการรับรอง 13 ก.ย. 71
19. International School of Medicine, Zhejiang University, Yiwu, P.R. China
หลักสูตร 6 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery(MBBS) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ สาธารณรัฐประชาชนจีน และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอน
ระดับคลินิกที่ระบุไว้ในหลักสูตร และอยู่ในสาธารณรัฐประชาชนจีน ดังนี้
1. First Affiliated Hospital, Hang Zhou
2. Second Affiliated Hospital, Hang Zhou
3. Affiliated Sir RunRun Shaw Hospital, Hang Zhou
4. Fourth Affiliated Hospital, Yiwu
ว/ด/ป ที่ รับรอง 14 ธ.ค. 66
ว/ด/ปครบอายุการรับรอง 13 ธ.ค. 71
นพ.ชลน่าน กล่าวว่า ที่ผ่านมา เมื่อประชาชนจำเป็นต้องเปลี่ยนหน่วยบริการ จะพบปัญหาเรื่องการเข้าถึงข้อมูลประวัติการรักษาพยาบาล เนื่องจากข้อมูลการรับบริการทางการแพทย์ของแต่ละหน่วยบริการไม่เชื่อมโยงกัน ทำให้ประชาชนต้องเสียเวลาในการรวบรวมข้อมูลการรักษาของตนเองจากสถานพยาบาลต่างๆ ซึ่งทั้งไม่สะดวกและเป็นภาระค่าใช้จ่ายแฝง ขณะที่แพทย์ผู้รักษามักจะได้ข้อมูลไม่ครบถ้วน อาจส่งผลกระทบต่อกระบวนการรักษา ซึ่งข้อมูลส่วนบุคคล ไม่ว่าจะเป็นประวัติการรักษา ประวัติการแพ้ยา การได้รับวัคซีน ผลทางห้องปฏิบัติการที่ผ่านมา เป็นประโยชน์อย่างมากต่อการรักษาในหน่วยบริการอื่นเมื่อเกิดภาวะฉุกเฉิน รัฐบาลจึงยกระดับระบบ 30 บาท ให้สามารถใช้บัตรประชาชนใบเดียวเข้ารับการรักษาในสถานพยาบาลทุกเครือข่ายทั้งรัฐและเอกชน โดยพัฒนาระบบบริการและเชื่อมโยงฐานข้อมูลสุขภาพจากหน่วยบริการทุกระดับ ช่วยให้ประชาชนได้รับบริการสาธารณสุขที่สะดวก รวดเร็ว มีประสิทธิภาพและคุณภาพยิ่งขึ้น รวมทั้งสามารถเข้าถึงข้อมูลสุขภาพ เพื่อดูแลสุขภาพของตนเองและครอบครัวได้
“กระทรวงสาธารณสุข กำหนดขับเคลื่อนใน 4 จังหวัดนำร่อง ได้แก่ แพร่ เพชรบุรี นราธิวาส และร้อยเอ็ด จากนั้นระยะที่ 2 จะขยายอีก 8 จังหวัด คือ เพชรบูรณ์ นครสวรรค์ สิงห์บุรี สระแก้ว หนองบัวลำภู นครราชสีมา อำนาจเจริญ และพังงา และขยายทั่วประเทศภายใน 1 ปี โดยจัดงานเปิดตัวขึ้นที่ร้อยเอ็ด พร้อมกับอีก 3 จังหวัดนำร่อง เพื่อประชาสัมพันธ์และสร้างความเข้าใจให้กับประชาชน ซึ่งวันนี้ได้มีการลงพื้นที่ตรวจเยี่ยมโรงพยาบาลจตุรพักตร์พิมาน ร้านยา ร้านแล็บ คลินิกเวชกรรม คลินิกทันตกรรม และโรงพยาบาลร้อยเอ็ด พบว่ามีความพร้อมในการขับเคลื่อนเต็มร้อย” นพ.ชลน่าน กล่าว
มีบทบาทสำคัญในการระดมการลงชื่อสนันสนุนร่าง
สำหรับเพจเขียนอนาคตกัญชาไทย ที่ประกาศเจตนารมย์ไว้ชัดเจนว่า "ประชาชนต้องมีสิทธิเข้าถึงกัญชาในฐานะความมั่นคงทางยา กัญชาต้องเป็นสิทธิพื้นฐานของประชาชน" เป็นกลุ่มกำลังสำคัญ ที่ดำเนินการรณรงค์ลงชื่อให้การสนับสนุนร่างกฏหมายกัญชาฉบับใหม่ บนความคาดหวังถึงกฏระเบียบที่เป็นเหมาะสมต่อธุรกิจและทุกภาคส่วนที่เกี่ยวข้อง
"การมีกฎหมายที่ดี การควบคุมอย่างเหมาะสม จะทำให้สังคมเราเข้าใจ และอยู่ร่วมกันได้ และทำให้ทุกชีวิตมีความปลอดภัยขึ้นด้วยเช่นกัญครับ และร่างของเรากำลังเดินไปทางนั้น"
ทางเพจให้เหตุผลใน
การรณรงค์สนับสนุนร่าง ไว้ดังนี้
ทำไมการลงชื่อสนันสนุนร่างฉบับนี้ถึงสำคัญ?
ㅤ
เพราะในการพิจรณาร่างกฎหมาย จะมีผู้เสนอร่างกฎหมายจากหลายฝ่ายเข้ามาร่วมด้วย
ร่างฉบับนี้เป็นร่างฉบับของประชาชน ที่เราลงพื้นที่ รับฟังความคิดเห็นมา
และได้หาข้อสรุป ที่ทุกคนได้ประโยชน์ร่วมกัน โดยที่ผลประโยชน์ไม่ตกไปอยู่ที่กลุ่มหนึ่งกลุ่มใดเพียงเท่านั้น
ㅤ
แต่การที่เราจะสามารถเข้าไปมีส่วนร่วมในการพิจารณา และออกมาเป็นกฎหมายบังคับใช้
จะต้องมีเงื่อนไข โดยมีการเห็นด้วย ยอมรับ จากประชาชนจำนวนมากเสียก่อน
ไม่เช่นนั้น เราเองก็จะไม่มีสิทธิ์ที่จะเสนอ และยื่นร่างฉบับนี้เข้าไปเป็นส่วนหนึ่งในการพิจารณา
ทำให้กฎหมายที่ออกมาบังคับใช้ ไม่ได้มีประชาชนเป็นส่วนร่วมอยู่เลย ทั้งที่ผู้ที่ได้รับผลจากกฎหมายที่จะบังคับใช้ คือประชาชนคนทั่วไป
การลงชื่อ ไม่ได้ทำให้มีความผิด หรือไม่ได้เป็นการทำให้สูญเสียความเป็นส่วนตัว
ㅤ
หลายคนอาจเป็นห่วง และต้องการรักษาความเป็นส่วนตัว หรือกลัวว่าจะมีผลอะไรเกิดขึ้นตามหลัง ซึ่งทางเราขอยืนยันว่าการลงชื่อเสนอกฎหมาย จะถูกเก็บไว้อย่างดี และไม่เปิดเผยข้อมูลต่อผู้ที่ไม่เกี่ยวข้อง และไม่มีผลอื่นใดตามมา เป็นเพียงการแสดงความเห็นด้วย โดยวิธีการทางกฎหมายเท่านั้น
ㅤ
เราอยากขอแรงสนันสนุนจากทุก ๆ คน ทั้งผู้ใช้งานส่วนตัว ร้านค้า ผู้ปลูก หรือผู้เกียวข้อง
ในการลงชื่อเพื่อให้เราได้ มีสิทธิ์ ในการเสนอร่างฉบับดังกล่าว เข้าสู่การพิจารณากฎหมาย
ที่เป็นธรรม จัดทำขึ้นโดยอาศัยข้อมูลจริง จากผู้เชี่ยวชาญ และมีประสบการณ์ในเรื่องกัญชามาอย่างนาวนาน และปราศจากอคติ ต่อกัญชา พืชสมุนไพรที่ควรเข้าถึงได้อย่างเป็นธรรม
ㅤ
10,000 รายชื่อ คือจำนวนที่เราต้องการ โดยไม่ช้าไปกว่าวันที่ 15 ธันวาคม 2566
โดยทุกคนสามารถดาวน์โหลดแบบฟอร์ม พิมพ์ลงในกระดาษ จากนั้นกรอกข้อมูลให้ครบถ้วน
จังหวัดแพร่
ร้านยา
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| D0788 |
รักข์ยา มินิมาร์ท |
303 |
เจริญเมือง |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054521181 |
| D0789 |
ชัยชนะเภสัช |
1/8 |
เหมืองแดง |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0936295194 |
| D0790 |
ฟาร์มาพลัส |
4/17-18 |
ยันตรกิจโกศล |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054511202 |
| D0791 |
ขวัญยา |
48/5 ซอย 1 |
เหมืองหิต |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
|
| D0792 |
ร้านขายยาเพรียว (Pure) สาขาแพร่ |
600 |
|
นาจักร |
เมืองแพร่ |
แพร่ |
54000 |
054531058 |
| D0793 |
บริษัท ธีระเภสัช 59 จำกัด |
32 |
ยันตรกิจโกศล |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054523080 |
| D0794 |
ห้างหุ้นส่วนจำกัด ว-ณิศพงศ์เฮสท์แคร์ |
114/1-/2 |
ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054524425 |
| D0795 |
ฟาสซิโน สาขาแพร่ |
2/203 |
ยันตรกิจโกศล |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054069656 |
| D0796 |
ห้างหุ้นส่วนจำกัด นครแพร่เภสัชกร (2557) |
1/22 |
|
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054625519 |
| D0797 |
เทวัญฟาร์มาซี |
47/10/11/12 |
รอบเมือง |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054511131 |
| D2037 |
ร้านยาวิริญา |
216 |
|
พระหลวง |
สูงเม่น |
แพร่ |
54130 |
0882512412 |
| D2555 |
เอ็กซ์ต้า พลัส สาขาชุมชนร่องฟอง |
211 |
|
ร่องฟอง |
เมืองแพร่ |
แพร่ |
54000 |
0845083979 |
| D2826 |
เภสัชกรธนัย |
44/8 |
ราษฎร์อุทิศ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0818819002 |
| D2981 |
ร้านยาเอ็กซ์ต้า พลัส สาขาถนนสนามกีฬาแพร่ |
24/21 |
ราษฏร์อุทิศ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0845086550 |
| D3153 |
คลังยาเวียงทอง |
169 |
|
เวียงทอง |
สูงเม่น |
แพร่ |
54000 |
0803653659 |
| D3403 |
ศาลาโอสถ |
41/6 |
วังซ้าย |
บ้านกลาง |
สอง |
แพร่ |
54120 |
0622019299 |
| D3519 |
อริยาเภสัช |
263 |
|
บ้านถิ่น |
เมืองแพร่ |
แพร่ |
54000 |
0888044085 |
| D3609 |
บ้านยาสุขใจ |
84/1 |
|
ช่อแฮ |
เมืองแพร่ |
แพร่ |
54000 |
0818462922 |
| D3643 |
ร้านยาเอ็กซ์ต้า พลัส สาขาชุมชนช่องลม |
233/13 |
|
สูงเม่น |
สูงเม่น |
แพร่ |
54130 |
0918081761 |
| D3682 |
บ้านรักษ์ยา |
548/5 |
|
เด่นชัย |
เด่นชัย |
แพร่ |
54110 |
0823722274 |
| D3998 |
บ้านเภสัช |
59 |
|
แม่ยางร้อง |
ร้องกวาง |
แพร่ |
54140 |
0659462616 |
| D4001 |
บ้านยาถุงเงิน |
141/1 |
|
กาญจนา |
เมืองแพร่ |
แพร่ |
54000 |
0831547800 |
| D4018 |
ยาเภสัชกร |
68/1 |
|
ป่าแดง |
เมืองแพร่ |
แพร่ |
54000 |
054598450,0857060944 |
| D4025 |
เวียงทองเภสัช |
78/1-2 |
|
เวียงทอง |
สูงเม่น |
แพร่ |
54000 |
0824863666 |
| D4034 |
เอส ฟาร์มาซี |
303/38 |
น้ำทองบายพาส |
นาจักร |
เมืองแพร่ |
แพร่ |
54000 |
0987465809 |
| D4035 |
ร่องฟองเภสัช |
271 |
|
ร่องฟอง |
เมืองแพร่ |
แพร่ |
54000 |
0896432652 |
| D4038 |
วังยาเฮาส์ |
100/1 |
|
วังชิ้น |
วังชิ้น |
แพร่ |
54160 |
0889151419 |
| D4052 |
นพดลเภสัช |
46 |
|
นาจักร |
เมืองแพร่ |
แพร่ |
54000 |
0931385258 |
| D4054 |
ร้านบ้านยา ๒ |
141/2 |
|
บ้านเหล่า |
สูงเม่น |
แพร่ |
54130 |
0899566403 |
| D4058 |
ธาราเภสัช |
69/1 |
|
แม่คำมี |
เมืองแพร่ |
แพร่ |
54000 |
0925635993 |
| D4060 |
แสงทองโอสถ |
137 |
|
ร่องฟอง |
เมืองแพร่ |
แพร่ |
54000 |
0633659364 |
| D4068 |
เหล่าวัฒนาเภสัช |
44 |
|
บ้านเหล่า |
สูงเม่น |
แพร่ |
54130 |
0896439687 |
| D4072 |
พัชราภรณ์เภสัช |
25/3 |
|
ดอนมูล |
สูงเม่น |
แพร่ |
54130 |
0817164255 |
| D4080 |
เด่นดวงเภสัช |
25/2 |
|
น้ำชำ |
สูงเม่น |
แพร่ |
54130 |
0846151296 |
| D4094 |
ชุมชนเภสัชกร |
39 |
จรูญลองรัฐ |
ห้วยอ้อ |
ลอง |
แพร่ |
54150 |
0818832985 |
| D4110 |
จารุพันธ์เภสัช |
526/1 |
ยันตรกิจโกศล |
เด่นชัย |
เด่นชัย |
แพร่ |
54110 |
0903167851 |
| D4117 |
เภสัชกรนรารัตน์ |
82/1 |
|
พระหลวง |
สูงเม่น |
แพร่ |
54130 |
0830304054 |
| D4121 |
สุรชัยเภสัช |
75 |
|
ร้องกวาง |
ร้องกวาง |
แพร่ |
54140 |
0851696880 |
| D4131 |
เฌอเอมเภสัช |
250/4 |
|
ห้วยอ้อ |
ลอง |
แพร่ |
54150 |
0616724516 |
| D4154 |
สุมาลีเภสัช |
5/2 |
|
ร่องกาศ |
สูงเม่น |
แพร่ |
54130 |
0846151995 |
| D4156 |
ร้านยาอังคณาเภสัช |
140/2 |
|
น้ำชำ |
สูงเม่น |
แพร่ |
54130 |
0861184517 |
| D4167 |
วังชิ้นเภสัช |
204/1 |
|
วังชิ้น |
วังชิ้น |
แพร่ |
54160 |
0954469281 |
| D4179 |
บริษัท แพร่รวมยา จำกัด |
105/30 |
ถ.ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0857124959 |
| D4238 |
ร้านยาเอ็กซ์ต้า พลัส สาขาเวียงทอง |
101 |
|
เวียงทอง |
สูงเม่น |
แพร่ |
54000 |
0845089605 |
| D4286 |
บ้านยาหัวฝาย |
10/2 |
|
หัวฝาย |
สูงเม่น |
แพร่ |
54130 |
054060187 |
| D4288 |
ร้านฟาร์มาพลัส สูงเม่น |
227 |
|
สูงเม่น |
สูงเม่น |
แพร่ |
54130 |
0802493635 |
คลินิกพยาบาลชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 44323 |
ชินกุลคลินิกการพยาบาลและการผดุงครรภ์ |
100/1 |
|
นาพูน |
วังชิ้น |
แพร่ |
54160 |
0956302762 |
| 44395 |
นาฏฤดีคลินิกการพยาบาลและการผดุงครรภ์ |
182/7 |
|
สบสาย |
สูงเม่น |
แพร่ |
54130 |
0995298299 |
คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 22597 |
คลินิกแล็บเซ็นเตอร์คลินิกเทคนิคการแพทย์ |
34/79-80 |
เหมืองหิต |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0954471867 |
| 26215 |
คลินิกเทคนิคการแพทย์น้ำทอง แล็บ เซนเตอร์ |
303/43 |
|
นาจักร |
เมืองแพร่ |
แพร่ |
54000 |
0897558213 |
| 45147 |
คลินิกเทคนิคการแพทย์ น้ำทอง แล็บ (2) |
114/9,10 |
ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0864308966 |
| 45153 |
คลินิกเทคนิคการแพทย์ เอ็น เฮลท์ แพร่ |
39/1/2 ซอย 1 |
|
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054068688, 0875457209 |
คลินิกทันตกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 26164 |
ธันยาภรณ์คลินิกทันตกรรม |
2/184 |
ยันตรกิจโกศล |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054534587 |
| 26165 |
คลินิกทันตกรรมทันตแพทย์สมศักดิ์ |
105/5 |
ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0899995405 |
| 26168 |
คลินิกทันตกรรมจริยา |
105/36 |
ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
0987478478 |
| 26169 |
คลินิกทันตแพทย์มนตรี |
2/150 |
ภูเก็ต |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054533537 |
| 26170 |
ศิริพรรณคลินิกทันตกรรม |
120/6 |
|
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
054511731 |
| 45124 |
คลินิกทันตกรรมบ้านหมอฟัน |
115 |
|
ร้องเข็ม |
ร้องกวาง |
แพร่ |
54140 |
0820787378 |
| 45253 |
คลินิกเฉพาะทางด้านทันตกรรมสาขาทันตกรรมจัดฟันหมอฐิติกา |
132/7/8 |
ช่อแฮ |
ในเวียง |
เมืองแพร่ |
แพร่ |
54000 |
081822214 |
ด้านอาจารย์ จตุรภรณ์ โชคภูเขียว จากคณะศึกษาศาสตร์ มหาวิทยาลัยขอนแก่น ซึ่งเป็นผู้อำนวยการโครงการวิจัยฯ กล่าวว่า “จากการศึกษาที่ผ่านมาของโครงการนี้ ทำให้ได้ข้อเสนอแนวทางเพิ่มศักยภาพการเข้าถึงสวัสดิการทางสังคมและการใช้ประโยชน์จากเทคโนโลยีดิจิทัลในกลุ่มผู้สูงอายุ รวมถึงการสร้างระบบนำร่องสารสนเทศอุปกรณ์ Medical IoT ที่พัฒนาขึ้นจากสถานการณ์จำลองของบริการดิจิทัลบนพื้นฐานเทคโนโลยี Internet of Things หรือ 5G โดยได้รับความร่วมมือจากหน่วยงานไม่น้อยกว่า 5 หน่วยงาน และผู้สูงอายุได้ทดลองใช้ระบบนำร่องดังกล่าวถึง 2,000 ราย อีกทั้งโครงการต้นแบบสามารถนำไปบรรจุเป็นแผนปฏิบัติราชการของจังหวัดพื้นที่เป้าหมายได้ ได้แก่ จังหวัดลำปาง จังหวัดขอนแก่น จังหวัดพระนครศรีอยุธยา และจังหวัดสงขลา และผู้ใช้บริการมีความพึงพอใจในโครงการไม่น้อยกว่า 80%”
บริษัทตรวจกลิ่น MUI Robotics ห้องปฏิบัติการตรวจวัดกลิ่นแบบดิจิทัล
MUI Robotics ให้บริการ “ห้องปฏิบัติการตรวจวัดกลิ่นแบบดิจิทัล” โดยใช้เทคโนโลยีจมูกอิเล็กทรอนิกส์ (Digital Olfactory Laboratory) โดยบริษัท เอ็มยูไอ โรบอติกส์ จำกัด
• เพิ่มมูลค่าให้กับสินค้าด้วยกลิ่น
• ควบคุมคุณภาพสินค้า (QC)
• วิจัยและพัฒนาผลิตภัณฑ์ (RD)
❇️ อาหารและเครื่องดื่ม
❇️ เครื่องสำอาง น้ำหอม
❇️ สินค้าเกษตร
❇️ บรรจุภัณฑ์พลาสติก กระป๋อง กระดาษ
❇️ อุตสาหกรรมเคมี ฯลฯ
สถานที่ตั้ง: คณะวิทยาศาสตร์ มหาวิทยาลัยมหิดล
ท่านใดสนใจเยี่ยมชมห้องแลป หรือส่งตัวอย่างผลิตภัณฑ์เพื่อทดสอบกลิ่น
กรุณาติดต่อ:
Line: @muirobotics
Email: rd.center@mui-robotics.com
Tel. 083-262-2826
วิทยากรรับเชิญจากประเทศอินโดนีเซีย Dr. Alif N Rahman
โควิด และวัคซีนผลกระทบแบบยาว - นพ.ธีระวัฒน์ เหมะจุฑา
โควิด และวัคซีนผลกระทบแบบยาว
โควิดนี้มีได้แบบชนิดตอนเดียวจบ คือแบบสั้น ติดเชื้อแบบไม่มีอาการแพร่ไปให้คนอื่นเสร็จแล้วเชื้อก็หายไปจากตัวหรือติดเชื้อและเกิดอาการเบา กลาง หนัก จนถึงเสียชีวิต
หรือแบบต่อเป็นซีรีส์ สั้น ก็คือหายจากอาการทางปอด และอวัยวะอื่น ๆ แต่ตามต่อด้วยเส้นประสาทอักเสบแขนขาอ่อนแรงอัมพาตหายใจไม่ได้หรือมีสมองอักเสบต่าง ๆ
ซีรีส์สั้นแบบนี้ อยู่ในระยะเวลาสามเดือน
ทั้งนี้ไม่จำกัดอยู่แต่เพียงว่าอาการในครั้งแรกต้องหนักมากเสมอไป แม้แต่กลุ่มที่อาการน้อย
ซีรีส์ยาว ก็มีความผิดปกติทอดยาวออกไปอีก และตั้งชื่อว่าเป็นหนังยาวของโควิด หรือ ลองโควิด (long Covid)
รูปแบบลักษณะดังกล่าวนี้ทับซ้อนกับปรากฏการณ์ที่เรียกว่า Myalgic Encephalomyelitis (ME)/Chronic fatigue syndrome (CFS)โดยลักษณะประกอบไปด้วยอาการปวดกล้ามเนื้อที่มีส่วนเกี่ยวโยงกับกระบวนการอักเสบที่เกิดขึ้นในสมองและระบบประสาทส่วนกลาง รวมทั้งมีอาการคล้ายไข้หวัดใหญ่ตลอดเวลามีอาการเหนื่อยล้ามหาศาล ทำงานไม่ได้ขาดสมาธิมีความผิดปกติทางระบบประสาทอัตโนมัติและไม่สามารถออกกำลังได้เลย
ตามประวัติศาสตร์สามารถสืบย้อนไปได้ตั้งแต่ในปี 1934 ในนครลอสแองเจลีส ปี 1948 ที่ไอซ์แลนด์ ปี 1955 ที่ลอนดอน และในปี 1984 ที่เนวาดา
ในปี 1955 คุณหมอจากไอซ์แลนด์ ได้เริ่มใช้เทอมหรือคำเรียก ME จากการเทียบเคียงลักษณะความผิดปกติในน้ำไขสันหลังระหว่างผู้ป่วยที่เกิดขึ้นที่โรงพยาบาลรอยัลฟรีในลอนดอน และผู้ป่วยในปี 1948 ที่ไอซ์แลนด์ Akureyri
โดยลักษณะอาการบ่งบอกถึงความเสียหายที่เกิดขึ้นกับสมองและไขสันหลังร่วมกับมีอาการปวดกล้ามเนื้ออย่างรุนแรงและมีอ่อนแรงและมีตะคริวร่วมด้วย
และจากหลายเหตุการณ์ต่อมาจนกระทั่งในปี 1984 ถึง 1985 ที่หมู่บ้าน Incline ในรัฐเนวาดาก็เกิดลักษณะที่คล้ายกันเช่นเดียวกันโดยทั้งหมดนี้มีอาการเริ่มต้นเป็นแบบติดเชื้อด้วยไวรัสทั้งหมด
และเรียกอีกชื่อหนึ่งว่า chronic fatigue syndrome หรือ CFS ทั้งนี้โดยเชื่อว่ากลุ่มอาการทั้งสองแบบนั้นน่าจะมีรากฐานเกี่ยวพันกับกระบวนการอักเสบในระบบประสาท
โควิดแบบยาว อาจมีได้สูงถึง 30- 50% ของผู้ที่หายจากโควิดฉบับสั้นไปแล้ว และอาการที่เกิดขึ้นมีได้เป็น 100 อย่างและครอบคลุมแทบจะทุกอวัยวะของร่างกาย โดยมีตัวร่วมโดยเฉพาะความแปรปรวนทางสมอง จิตและอารมณ์ แต่ขณะเดียวกันก็มี ความคล้องจองเหมือนกับ ME/CFS ที่กล่าวแต่ต้น ทั้งนี้โควิดเก่งกว่ารุ่นแรกๆตั้งแต่ปี 1934 ทั้งนี้เพราะกระทบในคนมากมายกว่า และอาการดูเหมือนจะรุนแรงมากกว่าที่เคยปรากฏมาก่อนในรุ่นแรกๆ
จากหลักฐานของ ME/CFS ที่ได้จากรุ่นแรกๆ ซึ่งอาจจะนำมาใช้อธิบายในโควิดนั้น โดยเป็นไปได้ว่าการอักเสบที่เกิดขึ้นจากการติดเชื้อ เกิดขึ้นนอกสมองและระบบประสาทแต่สมองรับรู้โดยตอบโต้กับโมเลกุล ชิ้นส่วนเล็ก ๆของอนุภาคการอักเสบเหล่านี้ในเลือดและอาจเป็นไปได้ที่มีการส่งผ่านโมเลกุลเหล่านี้ผ่านผนังเส้นเลือดเข้าไปในสมอง ทั้งจากการนำพาเข้าไปหรือซึมผ่านเข้าสมองโดยตรงในบริเวณที่ผนังกั้นไม่แข็งแรงและนอกจากนั้นโมเลกุลของการอักเสบเหล่านี้ยังพบได้ในเส้นประสาทเวกัส หรือเส้นประสาทสมองเบอร์ 10 ที่ทอดยาวลงมายังลำไส้และสามารถส่งผ่านการอักเสบเหล่านี้ขึ้นไปจนกระทั่งถึงก้านสมองในวงจรของ NTS (nucleus tractus solitarius) ที่ควบคุมการทำงานของระบบประสาทอัตโนมัติรวมทั้งเส้นเลือดและหัวใจเป็นต้น
และน่าจะมีผลตามติดต่อเนื่องไปถึงกระบวนการควบคุมการทำงานของฮอร์โมนต่าง ๆ ที่มีการควบคุมจากสมองตั้งแต่ในส่วนของ ไฮโปธาลามัส (hypothalamus) ต่อมใต้สมอง (pituitary) และต่อเนื่องมาถึงระบบควบคุมฮอร์โมนต่าง ๆ ในร่างกายจนกระทั่งถึงต่อมหมวกไต
ปรากฏการณ์โควิดฉบับยาวจะกลายเป็นภาระสำคัญของระบบสาธารณสุขของทุกประเทศที่มีการระบาดของโควิด
ทั้งนี้เนื่องจากคนที่ถูกกระทบจะมีได้ทุกอายุไม่จำกัดเพศ และเกิดจากการติดเชื้อโควิดแบบรุนแรงและไม่รุนแรง ด้วยอาการที่เกิดขึ้นจะบั่นทอนคุณภาพชีวิต ประสิทธิภาพของการทำงานกระบวนการของความคิดแม้กระทั่งสมาธิ สติปัญญา ความจำจะถดถอย และรุนแรงถึงขนาดที่ต้องมีการปรึกษาหรือได้รับการรักษาจากแพทย์ในแทบทุกแขนง รวมกระทั่งถึงจิตแพทย์ เพราะมีความรู้สึกหดหู่ ปฏิเสธสิ่งรอบข้างจนกลายเป็นก้าวร้าวหรือมีปัญหาทางสังคมแบบในปรากฏการณ์หลังจากที่มีภาวะเครียดอย่างรุนแรง (post traumatic stress syndrome)
และยิ่งไปกว่านั้นยังมีปรากฏการณ์ของผลกระทบของวัคซีนโควิดซึ่งในเวลาที่ผ่านมาหลังจากฉีดไปแล้วเกิดความเจ็บป่วยและเสียชีวิตรูปแบบเช่นเดียวกับโควิดแทบทุกประการ ในแบบสั้น ซีรี่ย์สั้นหรือแบบยาวทอดเวลาเป็นปี
เหล่านี้เป็นสิ่งที่ต้องมองและเตรียมตัวไปพร้อม ๆ กัน
นพ.ธีระวัฒน์ เหมะจุฑา
15 มกราคม 2567จุฬาฯ เปิดตัว DMIND
งานแถลงข่าวเปิดตัวนวัตกรรม DMIND APPLICATION สำหรับคัดกรองผู้ที่มีภาวะซึมเศร้า
20 มิถุนายน พ.ศ. 2565 รศ.นพ.ฉันชาย สิทธิพันธุ์ คณบดี คณะแพทยศาสตร์ จุฬาฯ พร้อมด้วย พญ.อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กระทรวงสาธารณสุข พญ.วิมลรัตน์ วันเพ็ญ ผู้อำนวยการสถาบันสุขภาพจิตเด็กและวัยรุ่นราชนครินทร์ นายชาติวุฒิ วังวล ผู้อำนวยการสำนักสนับสนุนการควบคุมปัจจัยเสี่ยงสุขภาพ สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) อ.ดร.ศันธยา กิตติโกวิท ผู้ช่วยอธิการบดีด้านนวัตกรรม จุฬาฯ รศ.พญ.โสฬพัทธ์ เหมรัญช์โรจน์ ผู้ช่วยคณบดีด้านนวัตกรรมการศึกษาและสารสนเทศ คณะแพทยศาสตร์ จุฬาฯ ศ.ดร.อนงค์นาฏ สมหวังธนโรจน์ รองคณบดีฝ่ายวิจัย คณะวิศวกรรมศาสตร์ จุฬาฯ และ รศ.ดร.พีรพล เวทีกูล อาจารย์ประจำคณะวิศวกรรมศาสตร์ จุฬาฯ ร่วมกันแถลงข่าวเปิดตัวนวัตกรรม DMIND Application สำหรับคัดกรองผู้ที่มีภาวะซึมเศร้า แอปพลิเคชันที่ช่วยให้ประชาชน สามารถประเมินความเสี่ยงของภาวะซึมเศร้าจากลักษณะการแสดงออกทางหน้าตา น้ำเสียง และข้อความ เพื่อประเมินภาวะซึมเศร้าเบื้องต้นให้บุคคลทั่วไปหรือผู้ป่วยโรคซึมเศร้าได้อย่างอัตโนมัติ และมีความถูกต้อง แม่นยำ ช่วยลดขั้นตอนในการวินิจฉัยของแพทย์ โดยมี คุณเตชินท์ พลอยเพชร (ดีเจมะตูม) เข้าร่วมงาน และ ผศ.ดร.ณัฐวุฒิ หนูไพโรจน์ ผู้อำนวยการศูนย์ปัญญาประดิษฐ์เพื่องานวิศวกรรม เป็นผู้ดําเนินรายการภายในงาน เมื่อเวลา 12.00 น. ณ ห้องเธียเตอร์ อาคารหอสมุด คณะแพทยศาสตร์ จุฬาฯ
ซึมเศร้าแค่ไหน เป็นโรคซึมเศร้า
เขตต่างอำเภอ
อำเภอบ้านค่าย
ร้านจุฬาฟาร์มาชี (ตรงข้ามธ.กรุงไทย สาขาบ้านค่าย)
ร้านบ้านค่ายโอสถ
อำเภอบ้านฉาง
ร้านยาครีสุขเภสัช
อำเภอปลวกแดง
ร้านธงชัยเภสัช
ร้านเมดพลัส ฟาร์มาชี
ร้านยาสิล่า ฟาร์มาชี
อำเภอแกลง
ร้านอภิญพระพรเภสัช
ร้านศาลาโอสถ สาขาเขาดิน
ร้านนวมลเภสัช
ร้านศาลาโอสถ สาขาเกาะลอย
ร้านศาลาโอสถ สาขาแกลง
ร้านวีรชัยเภสัช สาขาหน้า รพ.แกลง
อำเภอเขาชะเมา
ร้านศาลาโอสถ สาขาเขาชะมา
บ้านยาชุมชนน้ำเป็น
อำเภอนิคมพัฒนา
ร้านคลังโอสถ (ตลาดนิคม กม.12)
สอบถามข้อมูลเพิ่มเติม
โทร. 038-611104 ต่อ 2153
SMC Clinic คลินิกศัลยกรรม นอกเวลาราชการ รพ.แกลง
โครงการพลังคนไทย พลังใจให้ชีวิต มอบตู้อบเด็กทารกแรกเกิดให้กับโรงพยาบาลประจำอำเภอ
มอบตู้อบเด็กทารกแรกเกิดให้กับโรงพยาบาลประจำอำเภอ เพื่อเป็นส่วนหนึ่งในการให้ความช่วยเหลือเด็กทารกแรกคลอดที่มีความเสี่ยงให้มีโอกาสรอดชีวิตมากขึ้น และส่งต่อเด็กทารกไปยังโรงพยาบาลอื่นที่มีความพร้อมด้านเครื่องมือและบุคลากรทางการแพทย์มากกว่า เพื่อให้ได้รับการรักษาอย่างทันท่วงที
ในปี 2562 ได้มอบให้กับโรงพยาบาลจำนวน 20 โรงพยาบาล
1. โรงพยาบาลสบเมยอำเภอสบเมยจังหวัดแม่ฮ่องสอน
2. โรงพยาบาลทุ่งหัวช้างอำเภอทุ่งหัวช้างจังหวัดลำพูน
3. โรงพยาบาลท่าวังผาอำเภอท่าวังผาจังหวัดน่าน
4. โรงพยาบาลเชียงม่วนอำเภอเชียงม่วนจังหวัดพะเยา
5. โรงพยาบาลตาคลีอำเภอตาคลีจังหวัดนครสวรรค์
6. โรงพยาบาลลานสักอำเภอลานสักจังหวัดอุทัยธานี
7. โรงพยาบาลโพทะเลอำเภอโพทะเลจังหวัดพิจิตร
8. โรงพยาบาลตาพระยาอำเภอตาพระยาจังหวัดสระแก้ว
9. โรงพยาบาลบุญฑริกอำเภอบุญฑริกจังหวัดอุบลราชธานี
10. โรงพยาบาลหนองสูงอำเภอหนองสูงจังหวัดมุกดาหาร
11. โรงพยาบาลบ้านม่วงอำเภอบ้านม่วงจังหวัดสกลนคร
12. โรงพยาบาลแก่งกระจานอำเภอแก่งกระจานจังหวัดเพชรบุรี
13. โรงพยาบาลปราณบุรีอำเภอปราณบุรีจังหวัดประจวบคีรีขันธ์
14. โรงพยาบาลเกาะยาวชัยพัฒน์อำเภอเกาะยาวจังหวัดพังงา
15. โรงพยาบาลเบตงอำเภอเบตงจังหวัดยะลา
16. โรงพยาบาลไม้แก่นอำเภอไม้แก่นจังหวัดปัตตานี
17. โรงพยาบาลระโนดอำเภอระโนดจังหวัดสงขลา
18. โรงพยาบาลพรหมคีรีอำเภอพรหมคีรีจังหวัดนครศรีธรรมราช
19. โรงพยาบาลสุขสำราญอำเภอสุขสำราญจังหวัดระนอง
20. โรงพยาบาลเกาะช้างอำเภอเกาะช้างจังหวัดตราด
ปี 2563 ได้มอบให้กับโรงพยาบาลจำนวน 10 โรงพยาบาล ได้แก่
1. โรงพยาบาลสองอำเภอสองจังหวัดแพร่
2. โรงพยาบาลฟากท่าอำเภอฟากท่าจังหวัดอุตรดิตถ์
3. โรงพยาบาลสรรคบุรีอำเภอสรรคบุรีจังหวัดชัยนาท
4. โรงพยาบาลพระแสงอำเภอพระแสงจังหวัดสุราษฎร์ธานี
5. โรงพยาบาลปลายพระยาอำเภอปลายพระยาจังหวัดกระบี่
6. โรงพยาบาลรัตนวาปีอำเภอรัตนวาปีจังหวัดหนองคาย
7. โรงพยาบาลพลอำเภอพลจังหวัดขอนแก่น
8. โรงพยาบาลบึงโขงหลงอำเภอบึงโขงหลงจังหวัดบึงกาฬ
9. โรงพยาบาลนาทมอำเภอนาทมจังหวัดนครพนม
10. โรงพยาบาลเขาคิชฌกูฏอำเภอเขาคิชฌกูฏจังหวัดจันทบุรี
ปี 2564 ได้มอบให้กับโรงพยาบาลจำนวน 10 โรงพยาบาล ได้แก่
1. โรงพยาบาลปางศิลาทองอำเภอปางศิลาทองจังหวัดกำแพงเพชร
2. โรงพยาบาลนาโพธิ์อำเภอนาโพธิ์จังหวัดบุรีรัมย์
3. โรงพยาบาลบำเหน็ดณรงค์อำเภอบำเหน็ดณรงค์จังหวัดชัยภูมิ
4. โรงพยาบาลโพธิ์ศรีสุวรรณอำเภอโพธิ์ศรีสุวรรณจังหวัดศรีสะเกษ
5. โรงพยาบาลโพนทรายอำเภอโพนทรายจังหวัดร้อยเอ็ด
6. โรงพยาบาลเขาชะเมาอำเภอเขาชะเมาจังหวัดระยอง
7. โรงพยาบาลพยาบาลสถานพระบารมีอำเภอหนองปรือจังหวัดกาญจนบุรี
8. โรงพยาบาลสามชุกอำเภอสามชุกจังหวัดสุพรรณบุรี
9. โรงพยาบาลปากพะยูนอำเภอปากพะยูนจังหวัดพัทลุง
10. โรงพยาบาลมะนังอำเภอมะนังจังหวัดสตูล
ปี 2565 ได้มอบให้กับโรงพยาบาลจำนวน 10 โรงพยาบาล ได้แก่
1. โรงพยาบาลศรีนครอำเภอศรีนครจังหวัดสุโขทัย
2. โรงพยาบาลพรหมพิรามอำเภอพรหมพิรามจังหวัดพิษณุโลก
3. โรงพยาบาลหลังสวนอำเภอหลังสวนจังหวัดชุมพร
4. โรงพยาบาลรัษฎาอำเภอรัษฎาจังหวัดตรัง
5. โรงพยาบาลนาแห้วอำเภอนาแห้วจังหวัดเลย
6. โรงพยาบาลนาวังเฉลิมพระเกียรติ 80 พรรษาอำเภอนาวังจังหวัดหนองบัวลำภู
7. โรงพยาบาลมหาชนะชัยอำเภอมหาชนะชัยจังหวัดยโสธร
8. โรงพยาบาลพนาอำเภอพนาจังหวัดอำนาจเจริญ
9. โรงพยาบาลนายูงอำเภอนายูงจังหวัดอุดรธานี
10. โรงพยาบาลกุดรังอำเภอกุดรังจังหวัดมหาสารคาม
ปี 2566 ได้มอบให้กับโรงพยาบาลจำนวน 10 โรงพยาบาล ได้แก่
1. โรงพยาบาลบางบัวทองอำเภอบางบัวทองจังหวัดนนทบุรี
2. โรงพยาบาลบางเลนอำเภอบางเลนจังหวัดนครปฐม
3. โรงพยาบาลโคกสำโรงอำเภอโคกสำโรงจังหวัดลพบุรี
4. โรงพยาบาลหนองแคอำเภอหนองแคจังหวัดสระบุรี
5. โรงพยาบาลท่าเรืออำเภอท่าเรือจังหวัดพระนครศรีอยุธยา
6. โรงพยาบาลหนองเสืออำเภอหนองเสือจังหวัดปทุมธานี
7. โรงพยาบาลเฉลิมพระเกียรติสมเด็จย่า 100 ปีอำเภอเมืองยางจังหวัดนครราชสีมา
8. โรงพยาบาลราชสาส์นอำเภอราชสาส์นจังหวัดฉะเชิงเทรา
9. โรงพยาบาลกระทุ่มแบนอำเภอกระทุ่มแบนจังหวัดสมุทรสาคร
10. โรงพยาบาลสมเด็จพระพุทธเลิศหล้าอำเภอเมืองจังหวัดสมุทรสงคราม
คลินิกมลพิษทางอากาศ โรงพยาบาลตากสิน
โรงพยาบาลตากสิน เปิดบริการ คลินิกมลพิษทางอากาศ ตรวจโดยแพทย์อาชีวเวชศาสตร์ เปิดให้บริการ วันจันทร์ - ศุกร์ เวลา 9.00 น. - 12.00 น. (ยกเว้นวันพุธ และวันหยุดราชการ)
วันจันทร์ และ พฤหัส โดย พญ.เกวลิน จิรวิทยาภรณ์
วันอังคาร และ ศุกร์ โดย นพ.กสานติ์ เกียรติปานอภิกุล
ติดต่อสอบถามเพิ่มเติม 024370123 ต่อ 1426, 1430
โรงพยาบาลสินแพทย์ นครปฐม ประกาศรับสมัครงาน Sales and Marketing Manager หัวหน้าแผนกบัญชี/ผู้จัดการบัญชี
ประกาศรับสมัครงาน
1. หัวหน้าแผนกบัญชี/ผู้จัดการบัญชี 1 อัตรา
2. Sales and Marketing Manager 1 อัตรา
(มีประสบการณ์งานโรงพยาบาลจะพิจารณาเป็นพิเศษ)
ร่วมงานกับ โรงพยาบาลสินแพทย์ นครปฐม
ปรับค่าบริการ ตรวจสุขภาพ ความเสี่ยงจากการทำงาน
ปรับค่าบริการ ตรวจสุขภาพ ความเสี่ยงจากการทำงาน ได้แก่ ตรวจสมรรถภาพการมองเห็น(100บาท), ตรวจสมรรถภาพการได้ยิน(100บาท) และ ตรวจสมรรถภาพปอด(120บาท) โดยมีผลตั้งแต่ 4 กรกฏาคม 2565 เป็นต้นไป
นายโรมัน รามอส ประธานบริษัท แอสตร้าเซนเนก้า (ประเทศไทย) จำกัด กล่าวว่า “โรคมะเร็ง หากรู้เร็ว สามารถรักษาได้ โรคมะเร็งถือเป็นหนึ่งในกลุ่มโรคที่แอสตร้าเซนเนก้า ประเทศไทยให้ความสำคัญมาตลอดระยะเวลา 40 ปี เราพร้อมเดินหน้าประสานความร่วมมือกับหน่วยงานด้านสาธารณสุข องค์กรพันธมิตรทั้งภาครัฐและเอกชน เพื่อส่งเสริมคนไทยหันมาตรวจคัดกรองโรคมะเร็งตั้งแต่ระยะเริ่มต้นมากขึ้น ทั้งนี้ ในฐานะบริษัทชีวเภสัชภัณฑ์ชั้นนำระดับโลก เรามุ่งมั่นในการนำวิทยาศาสตร์มาต่อยอดและพัฒนาการดูแลสุขภาพของประชาชนมาโดยตลอด ล่าสุดกับการนำเสนอการใช้เทคโนโลยี AI มาประยุกต์ใช้ร่วมกับเครื่องเอกซเรย์ปอด เพื่อช่วยให้แพทย์สามารถตรวจพบเงาของก้อนเนื้อในปอดซึ่งอาจเป็นตัวบ่งชี้มะเร็งปอดในระยะเริ่มต้นที่อาจมีขนาดเล็กหรือมองเห็นได้ยากภายในระยะเวลา 3 นาที ซึ่งช่วยให้ผู้ป่วยได้รับการวินิจฉัยและสามารถเข้าสู่กระบวนการรักษาอย่างรวดเร็วยิ่งขึ้น ลดอัตราการเสียชีวิต เพิ่มอัตราการรอดชีวิต 5 ปีของผู้ป่วยมะเร็งปอดได้มากยิ่งขึ้น”
คลินิก SMC เวชศาสตร์ฟื้นฟู ตอบโจทย์ปัญหาออฟฟิศซินโดรม ปวดคอบ่าไหล่หลัง LINK
คลินิก SMC เวชศาสตร์ฟื้นฟู เปิดบริการ วันอังคาร สัปดาห์ที่ 2 และ 4 ของเดือน เวลา 16.30 - 20.00 น. ดูแลโดยพญ.เกวลี เอี่ยมวรสมบัติ แพทย์เวชศาสตร์ฟื้นฟู
ตอบโจทย์ปัญหาออฟฟิศซินโดรม ปวดคอบ่าไหล่หลัง มีอาหารบาดเจ็บจากการเล่นกีฬา ออกกำลังกาย ข้อติด ข้อไหล่ติด นิ้วล็อค รองช้ำ เอ็นอักเสบ กล้ามเนื้ออักเสบ ปรึกษาแพทย์ได้เลย
บริการอื่นๆ
Dry Needling Shock wave. Laser Therapy. Shock wave + Laser Therapy
เปิดรับสมัคร เจ้าหน้าที่ฝ่ายขาย
โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล จ.พระนครศรีอยุธยา เปิดรับสมัคร เจ้าหน้าที่ฝ่ายขาย จำนวน 4 อัตรา อายุ 20 - 35 ปี ปริญาตรีทุกสาขา
โรงพยาบาลเบญจรมย์ ให้บริการทำหมันชายโดยศัลยแพทย์เฉพาะทาง
โรงพยาบาลเบญจรมย์ ให้บริการทำหมันชายโดยศัลยแพทย์เฉพาะทางสุขภาพเพศชาย การทำหมันชายควรได้รับคำปรึกษาแพทย์ก่อนทำหัตถการ ทำหมันชาย ดีจริงไหม? ✅ ไม่ดมยาสลบ ใช้ยาชาเฉพาะที่  ✅ การทำหมันชายเป็นการผ่าตัดแผลขนาดเล็ก ไม่ต้องมีการเย็บแผล ✅ ใช้เวลาผ่าตัดไม่นาน หลังทำเสร็จไม่ต้องนอนโรงพยาบาล ✅ “ไม่มีผลต่อสมรรถภาพทางเพศ” คุณผู้ชายยังสามารถมีเพศสัมพันธ์ มีการแข็งตัวของอวัยวะเพศ มีการหลั่งน้ำอสุจิและมีความต้องการทางเพศเป็นปกติ ✅ สามารถกลับบ้านได้เลย เพียง 1-2 วัน แผลก็จะหายเป็นปกติ ติดต่อสอบถามเพิ่มเติม โทร. 036-413933 Hotline 064-1491414
คลินิกสุขภาพจิต โรงพยาบาลกลาง วันจันทร์ – ศุกร์
เครียด เศร้า กังวลใจ ทุกปัญหากวนใจ เรายินดีให้บริการ คลินิกสุขภาพจิต โรงพยาบาลกลาง ให้บริการ - ประเมินคัดกรอง - การวินิจฉัยโรคและการบำบัดรักษา - การส่งต่อและติดตาม - ร่วมมือกับหน่วยงานต่างๆ - การวางแผนการรักษาและช่วยเหลือ เวลาทำการ วันจันทร์ – ศุกร์ เวลา 08.00-16.00 น. และช่องทางออนไลน์ เปิดให้บริการทุกวัน ตลอด 24 ชั่วโมง
การจัดโครงการรณรงค์ Stand up to CANCER Together ภายใต้ธีม Close the Care Gap ลดวิกฤตปิดช่องว่าง ลุกขึ้นสู้มะเร็งไปด้วยกัน เพื่อร่วมตอกย้ำให้ทุกคนได้ตระหนักและเข้าถึงการดูแลรักษาสุขภาพ ลดภาวะเสี่ยงจากโรคมะเร็ง ด้วยมะเร็งบางชนิดสามารถรักษาได้หากตรวจพบในระยะแรกเริ่ม โดยให้ประชาชนได้ตระหนักถึงการเข้าถึงสิทธิประโยชน์สร้างเสริมสุขภาพและป้องกันโรคของประเทศไทย เพราะทุกคนสามารถร่วมเป็นส่วนหนึ่งที่ช่วยลดอุบัติการณ์โรคมะเร็งในประเทศได้ รวมทั้งร่วมผลักดันและขับเคลื่อนการยกระดับการตรวจวินิจฉัยและรักษาโรคมะเร็งของโรงพยาบาลจุฬาภรณ์เพื่อขยายโอกาสทางการรักษาแก่ประชาชนและเติมเต็มคุณภาพชีวิตของผู้ป่วยมะเร็งให้ดียิ่งขึ้น ตลอดจนความร่วมมือกับภาคีเครือข่ายทุกภาคส่วนที่มีส่วนสำคัญในการขับเคลื่อนนโยบายป้องกันและควบคุมโรคมะเร็งแห่งชาติ เพื่อร่วมกันลุกขึ้นสู้มะเร็ง ลดวิกฤต ปิดช่องว่าง เพิ่มโอกาสให้ประชาชนได้เข้าถึงการป้องกันดูแลและรักษาโรคมะเร็งที่มีคุณภาพอย่างเท่าเทียม”
Clinical transformation


รศ.นพ. ทวีสิน ตันประยูร ประธานปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ในการทำให้เกิด Clinical transformation นอกจากการรักษาแบบครบวงจรในแผนกต่างๆ ในโรงพยาบาลแล้ว เรายังจัดให้มีศูนย์ความเป็นเลิศทางการแพทย์โดยรวบรวมนวัตกรรมและเทคโนโลยีที่ทันสมัยมีประโยชน์กับผู้ป่วยและแพทย์ผู้เชี่ยวชาญมาร่วมกันให้การบริบาล โดยในปีนี้เรามีศูนย์ความเป็นเลิศทางการแพทย์ (Centers of Excellence) 8 ศูนย์ ได้แก่ สถาบันโรคหัวใจ สถาบันกระดูกสันหลัง ศูนย์มะเร็งฮอไรซัน ศูนย์โรคระบบประสาท ศูนย์ทางเดินอาหารและตับ ศูนย์จักษุ ศูนย์เต้านม และศูนย์ทางเดินปัสสาวะ ขณะที่ศูนย์การรักษาอื่น ๆ ยังคงให้การบริบาลด้วยคุณภาพมาตรฐานและมีการพัฒนาอย่างต่อเนื่องตามมาตรฐานของบำรุงราษฎร์ทุกประการ และเพื่อให้เกิดระบบการควบคุมคุณภาพให้ดียิ่งขึ้น เราได้นำระบบธรรมาภิบาลทางการแพทย์มาใช้ในโรงพยาบาล คือทำให้เกิดธรรมาภิบาลกับผู้ป่วยให้ได้รับการรักษาอย่างมีคุณภาพและความปลอดภัยสูงสุดด้วยนวัตกรรมและความรู้ที่ทันสมัยที่สุดในปัจจุบัน และให้เกิดธรรมาภิบาลกับแพทย์และบุคลากรทางการแพทย์ให้ได้รับความสะดวกสบายในการมาปฏิบัติงานที่โรงพยาบาลบำรุงราษฎร์
นอกจากนี้เรายังได้สร้างระบบการถ่ายทอดความรู้ในองค์กรในการปลูกฝังวัฒนธรรมองค์กร ซึ่งสั่งสมมากว่า 43 ปีให้กับแพทย์และบุคลากรจากรุ่นใหญ่สู่รุ่นใหม่ เพื่อให้การดูแลผู้ป่วยของเราเป็นไปอย่างมีคุณภาพ ปลอดภัย และอยู่ในขอบเขตของจริยธรรมและมาตรฐานทางการแพทย์ที่ดีที่สุด เพื่อให้องค์กรของเราเป็นองค์กรทางการแพทย์ที่น่าเชื่อถือที่สุด สำหรับผู้ป่วยชาวไทยและชาวต่างประเทศ
แนวคิด Harm Reduction
แนวคิดการลดอันตรายจากการใช�ยาเสพติด (Harm Reduction) คือ การลดป$ญหาหรือภาวะเสี่ยงอันตรายที่อาจเกิดกับตัวบุคคลหรือชุมชน เพื่อเป#นการปAองกันอันตรายจากการ เจ็บปCวยเป#นโรค การรักษาชีวิต การเสียชีวิต และการแบงแยกกีดกันทางสังคม โดยการทําให�พฤติกรรม สวนบุคคลที่เป#นอันตรายทําให�เป#นอันตรายน�อยลง ครอบคลุมทั้งด�านสุขภาพ สังคม และเศรษฐกิจ มีเปAาหมาย หยุดยั้ง และลดระดับการขยายตัวของป$ญหายาเสพติดไมให�ป$ญหายาเสพติดสงผลตอวิถีชีวิต มุงให�เกิดความ ปลอดภัย โดยดําเนินการรวมกับการดําเนินงานปAองกันการแพรกระจายของโรคติดตอสําคัญที่เป#นป$ญหา ทางด�านสาธารณสุข อาทิ เอชไอวี ตับอักเสบบีและซี วัณโรค และโรคติดตอทางเพศสัมพันธ� ลดอัตรา การเจ็บปCวย ลดอัตราการตาย ลดผลกระทบทางสังคม และเศรษฐกิจ โดยมีเปAาหมายในระยะตางๆที่เหมาะสม กับความเป#นป$จเจกบุคคล อีกทั้งชวยให�ผู�ปCวยยาเสพติดสามารถปรับตัวเองให�ลดการใช�ยาเสพติดลง และดํารง สถานภาพการไมกลับไปเสพซ้ําให�นานขึ้น ซึ่งจะนําไปสูการเลิกใช�ยาได�ในที่สุด (Ultimate goal) การลดอันตรายจากการใช�ยาเสพติด ได�รับการยอมรับในระดับสากลวาเป#นวิธีการที่มีประสิทธิภาพและ ประสิทธิผล อีกทั้งยังเป#นวิธีการที่คํานึงถึงหลักการสิทธิมนุษยชนขั้นพื้นฐานของผู�ปCวยยาเสพติด และครอบครัว โดยการให�ความเคารพในศักดิ์ศรีความเป#นมนุษย�ที่เทาเทียม ให�โอกาสและทางเลือกแกผู�ปCวยยาเสพติด ในการเข�าสูกระบวนการลดอันตรายจากการใช�ยาเสพติดไปจนถึงการรักษาฟQRนฟูสุขภาพและสมรรถภาพ ในการทํางาน และใช�ชีวิตรวมกับคนในสังคมตามปกติสุข ผู�ใช�ยาและสารเสพติดที่ยังไมสามารถหยุดเสพได�และ มีโรครวมเนื่องจากการใช�ยาเสพติด จัดเป#นกลุมที่เข�าถึงยาก มีป$ญหายุงยากซับซ�อน ดังนั้น แนวคิดการลด อันตรายจากการใช�ยาเสพติด จึงเป#นการเติมเต็มสิทธิทางสุขภาพของผู�ปCวยยาเสพติด เป#นการยืดหยุน การรักษาบนพื้นฐานความแตกตางและความต�องการตามความจําเป#นของผู�ปCวยยาเสพติดที่เป#นป$จเจกบุคคล เพื่อลดอันตรายที่มากับการใช�ยาเสพติด ในขณะที่ยังไมสามารถหยุดเสพยาเสพติดได
จากแนวคิดดังกลาวประเทศไทย ได�นํามาตรการการลดอันตรายจากการใช�ยาเสพติด มาใช�ในการดูแล ผู�ปCวยกลุมเสพติดรุนแรงที่ยังไมสามารถเลิกยาเสพติดได� โดยเฉพาะกลุมผู�ใช�ยาเสพติดด�วยวิธีการฉีด ซึ่งเป#นพฤติกรรมการเสพที่กอให�เกิดอันตรายในแงของการเป#นทั้งผู�ติดเชื้อและแพรเชื้อโรคสูบุคคลอื่นๆ โดยมีเปAาหมายเพื่อลดอันตรายตางๆ ที่มาจากการใช�ยาเสพติดด�วยวิธีการฉีด จูงใจให�ผู�ปCวยเลิกใช�ยาเสพติด ที่ผิดกฎหมายและเข�ามารับบริการทางการแพทย� จัดสถานที่เป#นสัดสวนไมปะปนกับผู�ปCวยยาเสพติดประเภทอื่นๆ เพื่อให�บริการลดอันตรายจากการใช�ยาเสพติดแบบรอบด�าน เน�นการปAองกันและดูแลผู�ได�รับผลกระทบ และ อันตรายตางๆ จากการใช�ยาเสพติด โดยเฉพาะโรคเอดส�และโรคติดตอที่สําคัญ เป#นการเพิ่มการเข�าถึงบริการ ที่เหมาะสมและครอบคลุมผู�ใช�ยาเสพติดที่อยูในชุมชน มีสถานที่ปลอดภัยสําหรับผู�ปCวยยาเสพติดที่มาพบปะกัน เพื่อทํากิจกรรมสร�างสรรค� ได�รับกิจกรรมและบริการที่เป#นประโยชน�ตอสุขภาพและคุณภาพชีวิต ได�รับความร เกี่ยวกับการดูแลตนเองในการลดอันตรายจากการใช�ยาเสพติด ให�คําปรึกษารายบุคคล รายกลุม ได�รับการดูแล สุขภาพ ฝWกทักษะตางๆที่จําเป#นรวมทั้งทักษะเข�าสังคม กิจกรรมนันทนาการ ตลอดจนการฝWกอาชีพ ที่จะชวยให� ผู�ใช�ยา มีคุณภาพชีวิตที่ดีขึ้นในทุกๆ ด�าน ทําให�ผู�ปCวยยาเสพติดเห็นความสําคัญของตนเองเกิดเจตคติที่ดี วาตนเองมีคุณคาตอสังคม เพิ่มศักยภาพผู�ปCวยเสพติดในการดูแลตนเอง และปAองกันโรคหรืออันตรายที่เกิดจากการ ใช�ยาเสพติด เชน การติดเชื้อเอชไอวี รวมทั้งสนับสนุนและสงเสริมให�ผู�ปCวยยาเสพติดเข�าถึงบริการของรัฐตาม สิทธิพึงมีพึงได�ของตนเอง พิทักษ�สิทธิในการได�มีสุขภาพดีทั้งกายและใจ เข�าสูกระบวนการบําบัดรักษาด�วยความ สมัครใจ เพื่อการลด ละ และเลิกยาเสพติดได�ในที่สุด ดังนั้น การนํามาตรการการลดอันตรายจากการใช�ยาเสพติดมาประยุกต�ใช�ให�เหมาะสมกับผู�ปCวยยาเสพติด ทุกประเภท ให�บริการตามความต�องการที่จําเป#นของผู�ปCวยทั้งด�านรางกาย อารมณ� จิตวิญญาณ (Holistic Needs) ผู�ให�บริการจึงต�องมีความรู� ความชํานาญเฉพาะทางอยางรอบด�าน ที่ต�องอาศัยองค�ความรู�ทางวิชาการ ทักษะ ประสบการณ� จิตวิญญาณของผู�ให�บริการ ซึ่งเป#นองค�ประกอบสําคัญของการดูแลผู�ปCวยให�ได�รับการ ดูแลชวยเหลือที่ถูกต�อง เหมาะสม โดยมีกระบวนการที่สําคัญคือ การปรับเปลี่ยนเจตคติ เข�าใจธรรมชาติผู�ปCวย ยาเสพติด มีทัศนคติเชิงบวกในการดูแลผู�ปCวยที่ยังไมสามารถเลิกยาเสพติดได� ที่มีป$ญหายุงยากซับซ�อน เป#นโรค เรื้อรังทางสมองที่อาจมีการติดซ้ําได� ทําความเข�าใจเกี่ยวกับแนวทางลดอันตรายจากการใช�ยาเสพติดที่ถูกต�อง อยางลึกซึ้ง และพัฒนาระบบบริการที่เป#นมิตร ให�บริการลดอันตรายแบบรอบด�าน ทําให�ผู�ปCวยรู�สึกวาตนเอง มีคุณคา ตระหนักถึงป$ญหาอันเกิดจากการใช�ยาเสพติดด�วยตัวของผู�ปCวยเอง พร�อมเข�าสูกระบวนการลด ละ และเลิกใช�ยาเสพติดได�ด�วยความสมัครใจ นําไปสูการดําเนินชีวิตที่ดีขึ้น สามารถอยูในสังคมได�อยางปกติสุข อันเป#นเปAาหมายสูงสุดของกระบวนการดูแลผู�ปCวยยาเสพติด เอกสาร 1 การบริการสุขภาพของผู้ป่วยนอกสิทธิประกันสุขภาพ(บัตรทอง)ในพื้นที่กรุงเทพมหานคร
สถานการณ์
การบริหารกองทุนผู้ป่วยนอก (OP) เขตพื้นที่กรุงเทพมหานคร แบ่งเป็น 2 ส่วนใหญ่ คือ ส่วนที่ 1 Central reimbursement (CR) และส่วนที่ 2 จัดสรรให้หน่วยบริการตามรายหัวประชากร เดิมบริหารเงินส่วนที่ 2 ด้วย Model 2 ศูนย์บริการสาธารณสุข( ศบส.) คลินิกต่างเป็นหน่วยบริการประจำรับเงินจัดสรรและควบคุมค่าใช้จ่ายในวงเงินของหน่วยบริการเอง ในปีงบประมาณ 2564 เริ่มปรับมาใช้ Model 5 เครือข่ายพวงบริการ ศบส. สังกัดสำนักอนามัย กรุงเทพมหานครเป็นแม่ข่าย (Area manager) และมีคลินิกเป็นลูกข่าย ควบคุมวงเงินของเครือข่าย ด้วยระบบ fee schedule และมี point system ควบคุมอีกชั้นหนึ่ง
ในปี 2566 มีเงินส่วนที่ 2 จำนวน 2,682.86 ล้านบาท สปสช.จ่ายค่าบริการผู้ป่วยนอกให้ ศบส และคลินิก เดือน ต.ค.65 - มค.66 Point ละ 1 บาท ก.พ.66 - ก.ย.66 จ่าย point ละ 0.7 บาท จ่ายให้ รพ. รับส่งต่อ (OP Refer) point ละ 1 บาทตลอดทั้งปี เมื่อสิ้นปีงบประมาณ สปสช ทำการคำนวนใหม่ ต้องจ่ายให้ รพ.รับส่งต่อ 1,900.92 ล้านบาท มีเงินเหลือนำมาจ่ายค่าบริการให้ ศบส.และคลินิก 784.94 ล้านบาท ในขณะที่มีการเบิกค่าบริการ 1,345.59 ล้านบาท ทำให้คลินิกได้รับเงินชดเชยค่าบริการ point ละ 0.57 บาท สปสช. มองว่ามีการจ่ายเงินให้หน่วยบริการเกินกว่าวงเงินที่กำหนดรวม 290.85 ล้านบาท
ในปี 2567 พบว่า ต.ค.66 - มค.67 มีการใช้เงินส่วนที่ 2 ไปแล้วมากกว่าครึ่งหนึ่ง จึงมีแนวโน้มว่าในปีนี้จะมีปัญหาเช่นเดียวกันปี 2566
30 รักษาทุกที่ด้วยบัตรประชาชนใบเดียว โคราชเริ่ม 1 มีนาคม 2567
30 รักษาทุกที่ด้วยบัตรประชาชนใบเดียว โคราชเริ่ม 1 มีนาคม 2567 ลงทะเบียนได้ที่โรงพยาบาล หรือ รพ.สต หรือศุนย์แพทย์ใกล้บ้านทุกแห่ง สิทธิข้าราชการสิทธิประกันสังคมก็ไปลงทะเบียนได้นะ
1. เช็กจุดตรวจจุดบริการสถานพยาบาล ผ่านเว็บไซต์ Bangkok Health Map
เข้าเว็บไซต์ Bangkok Health Map (
healthmap.bangkok.go.th/). จะมี ข้อมูลการบริการสุขภาพ และสถานพยาบาลในกรุงเทพมหานคร ได้แก่
- จุดติดตั้งเครื่อง AED กรุงเทพมหานคร
- ติดต่อฉุกเฉิน 1669 สถาบันการแพทย์ฉุกเฉินแห่งชาติ (สพฉ.)
- คลินิกชุมชนอบอุ่น กรุงเทพมหานคร กว่า 276 แห่ง
- สถานที่ตรวจสุขภาพ กรุงเทพมหานคร เป็นตารางกำหนดการ คาราวานตรวจสุขภาพ ตั้งแต่ มกราคม - มิถุนายน 2567 คลิกดูรายละเอียดของแต่ละกำหนดการได้ ซึ่งจะบอกข้อมูลละเอียดไว้ดีมาก ได้แก่วันเวลาสถานที่ให้บริการ จำนวนการให้บริการ บริการที่มี รวมทั้งเบอร์โทรติดต่อ และแผนที่
- ร้านขายยาที่ขึ้นทะเบียน สปสช. ในกทม. กว่า 528 แห่ง
- ตรวจสอบสิทธิการรักษา สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.)
- ปรึกษาปัญหาสุขภาพ/จองคิว Line Bangkok official กรุงเทพมหานคร
- รายชื่อ สถานพยาบาลทั้งหมด ในกรุงเทพ จำนวน 13,462 แห่ง
จองทันตกรรมออนไลน์ได้แล้วนะ
โครงการทันตกรรมปากเกร็ดเริ่มต้น ตั้งแต่ปี 2542 - ศ.ทพ.ดร.พรชัย จันศิษย์ยานนท์
ศ.ทพ.ดร.พรชัย จันศิษย์ยานนท์ คณบดี คณะทันตแพทยศาสตร์ , กล่าวว่า โครงการทันตกรรมปากเกร็ดเริ่มต้นจากความร่วมมือระหว่างกรมส่งเสริมและพัฒนาคุณภาพชีวิตคนพิการและคณะทันตแพทยศาสตร์ จุฬาฯ ตั้งแต่ปีพ.ศ. 2542 และดำเนินโครงการมาอย่างต่อเนื่อง ไม่เพียงแต่ให้บริการทันตกรรมแก่เด็ก ๆ เท่านั้น แต่ยังเป็นการปลูกฝังนิสิตหลังปริญญาที่เข้าร่วมโครงการ ลงไปปฏิบัติงานร่วมกับอาจารย์พี่เลี้ยง ให้มีความรับผิดชอบต่อสังคม และมีคุณธรรม เมตตาธรรมในการรักษาผู้ป่วยพิเศษ ซึ่งกลุ่มบริษัทกัลฟ์ได้เข้ามาเป็นกำลังสำคัญ เสริมพลังโครงการนี้ด้วยการปรับปรุงอาคารแห่งนี้ให้สวยงาม และเหมาะแก่การใช้งานมากขึ้น ต้องขอขอบคุณกลุ่มบริษัทกัลฟ์
หน่วยบริการทำหมัน อื่นๆ (บริจาค-มีค่าใช้จ่าย)
- WVS Thailand Foundation ค่าทำหมันสำหรับสุนัขตัวเมียแต่ละตัวอยู่ที่ประมาณ 800 บาท (แมวตัวเมียอยู่ที่ 650 บาท) ที่อยู่ 12 หมู่ 11 เวียงดง, น้ำแพร่, หางดง, เชียงใหม่ 50230 เวลาทำการปกติ 09.30–16.30 วันจันทร์ถึงวันเสาร์ สอบถาม 090 320 7317
- Lanna Dog Welfare ทำหมันทำหมันสุนัขเเละเเมว ทำหมันพร้อมทำบุญ บริจาคตัวละ 500 บาท เพื่อใช้เป็นค่าเวชภัณฑ์ทำหมัน
- โครงการทำหมัน(ฟรี) มูลนิธิสันติสุขเพื่อสุนัขและแมวจรจัด สนับสนุนโดยการบริจาค เบอร์โทรศัพท์ 081-6382105, 083-7818439
- โรงพยาบาลสัตว์ลานนา เปิดทุกวัน 7.00-24.00 น. โทร.098-999-4190
- โรงพยาบาลสัตว์ทองหล่อ สาขาเชียงใหม่ ให้บริการทำหมันสุนัข โดยวิธีผ่าตัด โทร 053-014-340 บริการตลอด 24 ชั่วโมง
- โรงพยาบาลสัตว์เชียงใหม่เพ็ทเฟรนด์ ผ่าตัดทำหมัน ผ่าคลอด ผ่ากระดูกและเนื้อเยื่ออ่อน รักษาสัตว์24ชั่วโมง เปิดทุกวัน โทร 095-685-5545
- โรงพยาบาลสัตว์ โคซี่ แอนด์ แคร์ ทำหมันสุนัขแมว ทุกวัน 24 ชั่วโมง ไม่มีวันหยุด โทร 081-446-4463
- โรงพยาบาลสัตว์เชียงใหม่ แม่ริม ให้บริการทำหมันแมว โดยวิธีผ่าตัด บริการตลอด 24 ชั่วโมง โทร 089-633-7670, 099-271-1616
การทาครีมกันแดดช่วยได้มาก
การตากแดดจัดเป็นเวลานาน ทำให้ผิวหนังได้รับสาร UV ที่เป็นอันตรายต่อผิว
3 จุดสำคัญห้ามละเลย ทาครีมกันแดดก่อนออกจากบ้าน
ริมฝีปาก : ควรทาลิปบาล์มที่มีสารป้องกัน แสงแดด เพิ่มความชุ่มชื้น โดยสามารถทาซ้ำได้บ่อย
ผิวหน้า&ตัว : ทาก่อนออกแดดอย่างน้อย 20 นาที โดยทาผิวหนังและทาซ้ำทุก ๆ 2 ชั่วโมง
ผิวมือ : ควรทามอยส์เจอไรเซอร์บำรุงผิวมือบ่อย ๆ และทาครีมกันแดดร่วมด้วย
และ (๘) การสนับสนุนจากภายนอกจากหน่วยงานนโยบายสำคัญ ทั้งนี้ ได้จัดทำเป็นแนวทางฉบับย่อ
(Cookbook) เพื่อให้เกิดความเข้าใจง่ายและสะดวกในการสื่อสารและนำไปปฏิบัติ (ภาคผนวก ก.)
๔.๒ ข้อเสนอในระยะต่อไป การจัดทำแนวทาง (Guideline) การบริหารจัดการตำบลเข้มแข็ง
แบบหุ้นส่วน ในรูปแบบกึ่งทางการ (semi-formal ไม่ใช่เพียงแค่การทำงานในลักษณะของภาคประชาสังคม
เท่านั้น แต่มีการทำงานอย่างเป็นระบบ มีการจัดการ และไม่ติดกับการมีคณะกรรมการ และงบประมาณ
ซึ่งมีโครงสร้างตายตัว อย่างไรก็ตาม เพื่อให้เกิดการบูรณาการเชิงพื้นที่อย่างแท้จริง ควรนำไปเชื่อมต่อ
หรือประสานกับการบริหารจัดการเชิงพื้นที่ ซึ่งเป็นรูปแบบทางการ โดยควรมีแนวทางการสนับสนุนและ
หน่วยงานที่ควรเป็นเจ้าภาพขับเคลื่อนงานในระยะต่อไป ดังนี้
๔.๒.๑ การส่งเสริมให้ส่วนราชการทำความเข้าใจแนวคิดการบริหารจัดการ
แบบหุ้นส่วนในระดับพื้นที่ เป็นการส่งเสริมให้ส่วนราชการทำความเข้าใจกับแนวคิดและแนวทาง
การบริหารจัดการแบบหุ้นส่วนในระดับพื้นที่ ซึ่งในการจัดทำแผนพัฒนาจังหวัดและกลุ่มจังหวัดได้มีการ
กำหนดคณะกรรมการในการจัดทำแผนแต่ละระดับที่มาจากทุกภาคส่วน ในขณะเดียวกัน ระเบียบกระ
ทรวงมหาดไทยว่าด้วยการจัดทำแผนฯ ได้มีการกำหนดให้มีผู้แทนที่มาจากทุกภาคส่วนทุกระดับ
เช่นเดียวกัน ซึ่งเป็นแนวคิดการบริหารจัดการแบบหุ้นส่วนในระดับพื้นที่อยู่แล้ว ทั้งนี้ อาจจัดทำเป็น
คู่มือหรือแนวทางการบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วน ฉบับส่วนราชการ เพื่อให้เกิดความเข้าใจ
ตรงกันและเป็นแนวปฏิบัติที่เชื่อมโยงกับการบริหารตำบลเข้มแข็งแบบหุ้นส่วนในพื้นที่ ทั้งนี้ ในการ
นำไปสู่การปฏิบัติสามารถใช้พระราชกฤษฎีกาว่าด้วยการบริหารงานเชิงพื้นที่แบบบูรณาการ พ.ศ. ๒๕๖๕
ซึ่งได้กำหนดแนวทางการบริหารงานเชิงพื้นที่ใน ๒ ระดับ ได้แก่ ) ระดับชาติ โดยการบริหารงาน
เชิงพื้นที่แบบบูรณาการ มุ่งเน้นการส่งเสริมและดำเนินการให้เกิดความร่วมมือย่างจริงใจระหว่าง
ภาครัฐ องค์กรปกครองส่วนท้องถิ่น ภาคประชาสังคม และภาคธุรกิจเอกชนในจังหวัด (มาตรา ๗) และ
ผ่านกลไกคณะกรรมการนโยบายการบริหารงานเชิงพื้นที่แบบบูรณาการ (ก.น.บ.) ซึ่งมีหน้าที่และอำนาจ
สำคัญ คือ วางระบบในการบริหารงานแบบบูรณาการ และบูรณาการแผนของหน่วยงานของรัฐ และ
แผนพัฒนาระดับพื้นที่ในจังหวัด กลุ่มจังหวัด และภาคเพื่อให้สามารถบริหารงานแก้ไขปัญหา และ
พัฒนาพื้นที่ได้อย่างมีประสิทธิภาพ (มาตรา ๑ㆍ (๑) รวมทั้งควบคุมดูแลและวินิจฉัยสั่งการ
ให้การบริหารแผนงาน โครงการ กิจกรรมในโครงการ งบประมาณและบุคลากรในจังหวัดมีการปฏิบัติราชการ
ร่วมกันอย่างแท้จริง (มาตรา ๑ㆍ (๖) และ ๒) ระดับพื้นที่จังหวัด ผ่านกลไกคณะกรรมกรรมการบริหารงาน
จังหวัดแบบบูรณาการ (ก.บ.จ.) ซึ่งมีผู้ว่าราชการจังหวัดเป็นประธาน มีหน้าที่สำคัญ คือ ส่งเสริมและ
ประสานความร่วมมือการพัฒนาให้เป็นไปตามแผนพัฒนาจังหวัดอย่างยั่งยืนระหว่างภาครัฐ องค์กร
ปกครองส่วนท้องถิ่น ภาคประชาสังคม และภาคธุรกิจเอกชน เพื่อสร้างบรรยากาคให้เอื้ออำนวยต่อการลงทุน
และพัฒนาเศรษฐกิจและสังคมของจังหวัด (มาตรา ๑๔ (๔)) และผ่านการขับเคลื่อนของ
ผู้ว่าราชการจังหวัดซึ่งมีหน้าที่ปฏิบัติเพื่อให้การบริหารงานในจังหวัดและกลุ่มจังหวัดเกิดการบูรณาการ
อย่างแท้จริง โดยเฉพาะอย่างยิ่งการส่งเสริมและสนับสนุนภาคประชาสังคมให้มีความเข้มแข็ง สามารถ
บริหารจัดการและแก้ไขปัญหาได้ด้วยตนเองอย่างยั่งยืน (มาตรา ๑๗ (๕) พร้อมทั้งมีการดำเนินการ
ที่หนุนเสริมและกำกับให้ส่วนราชการ หน่วยงานอื่นของรัฐ องค์กรปกครองส่วนท้องถิ่น ภาคประชาสังคม
และภาคธุรกิจเอกชน ดำเนินการตามแผนของจังหวัดและกลุ่มจังหวัดให้บรรลุผลสัมฤทธิ์ การบริหาร
ภาวะเศรษฐกิจการคลัง ประจำเดือนมกราคม 2567
ภาวะเศรษฐกิจการคลัง
ประจำเดือนมกราคม 2567. (28/2/2567)
“สถานการณ์เศรษฐกิจไทยในเดือนมกราคม 2567 มีสัญญาณปรับตัวดีขึ้นจากการขยายตัวของภาคการท่องเที่ยว การบริโภคภาคเอกชน และการส่งออกสินค้าที่ขยายตัวต่อเนื่องเป็นเดือนที่ 6 ขณะที่การลงทุนภาคเอกชนมีสัญญาณชะลอลงจากเดือนก่อน ทั้งนี้ ยังคงต้องติดตามสถานการณ์เศรษฐกิจทั้งภายในและภายนอกประเทศที่ส่งผลกระทบต่อภาคการผลิตของไทยอย่างใกล้ชิดต่อไป”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง เปิดเผยภาวะเศรษฐกิจการคลังประจำเดือนมกราคม 2567 ว่า “สถานการณ์เศรษฐกิจไทยในเดือนมกราคม 2567 มีสัญญาณปรับตัวดีขึ้นจากการขยายตัวของภาคการท่องเที่ยว การบริโภคภาคเอกชน และการส่งออกสินค้าที่ขยายตัวต่อเนื่องเป็นเดือนที่ 6 ขณะที่การลงทุนภาคเอกชนมีสัญญาณชะลอลงจากเดือนก่อน ทั้งนี้ ยังคงต้องติดตามสถานการณ์เศรษฐกิจทั้งภายในและภายนอกประเทศที่ส่งผลกระทบต่อภาคการผลิตของไทยอย่างใกล้ชิดต่อไป” โดยมีรายละเอียดสรุปได้ ดังนี้
เครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน มีสัญญาณปรับตัวดีขึ้นจากเดือนก่อนหน้า: โดยการบริโภคในหมวดสินค้าคงทน
- สะท้อนจากปริมาณจำหน่ายรถยนต์นั่ง ในเดือนมกราคม 2567 เพิ่มขึ้นจากช่วงเดียวกันปีก่อนที่ร้อยละ 2.4 และเพิ่มขึ้นเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ 9.4
- ขณะที่ยอดรถจักรยานยนต์จดทะเบียนใหม่ ในเดือนมกราคม 2567 ลดลงจากช่วงเดียวกันปีก่อนที่ร้อยละ -1.8 แต่เพิ่มขึ้นเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ 7.6
- สำหรับภาษีมูลค่าเพิ่ม ณ ระดับราคาคงที่ ในเดือนมกราคม 2567 ลดลงจากช่วงเดียวกันปีก่อนร้อยละ -2.7 แต่เพิ่มขึ้นเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ 1.1
- ในขณะที่รายได้เกษตรกรที่แท้จริง ในเดือนมกราคม 2567 เพิ่มขึ้นจากช่วงเดียวกันปีก่อนที่ร้อยละ 0.6
นอกจากนี้ ดัชนีความเชื่อมั่นของผู้บริโภค ในเดือนมกราคม 2567 ปรับตัวเพิ่มขึ้นมาอยู่ที่ระดับ 62.9 จากระดับ 62.0 ในเดือนก่อน ซึ่งเป็นการปรับตัวเพิ่มขึ้นต่อเนื่องเป็นเดือนที่ 6 และสูงสุดในรอบ 47 เดือน สะท้อนความเชื่อมั่นของผู้บริโภคต่อภาวะเศรษฐกิจที่ปรับตัวดีขึ้นต่อเนื่อง
เครื่องชี้เศรษฐกิจด้านการลงทุนภาคเอกชน มีสัญญาณปรับตัวชะลอลงจากเดือนก่อนหน้า:
- การลงทุนภาคเอกชนในหมวดเครื่องมือเครื่องจักร สะท้อนจากปริมาณจำหน่ายรถยนต์เชิงพาณิชย์ ในเดือนมกราคม 2567 ลดลงจากช่วงเดียวกันปีก่อนที่ร้อยละ -26.5 และเพิ่มขึ้นเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ 2.1
- สำหรับการลงทุนในหมวดการก่อสร้าง สะท้อนจากปริมาณการจำหน่ายปูนซีเมนต์ภายในประเทศ ในเดือนมกราคม 2567 ลดลงจากช่วงเดียวกันปีก่อนที่ร้อยละ -7.2 และลดลงเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ -2.8
- ขณะที่ภาษีธุรกรรมอสังหาริมทรัพย์ลดลงจากช่วงเดียวกันปีก่อนที่ร้อยละ -3.3
มูลค่าการส่งออกสินค้าขยายตัวต่อเนื่องจากช่วงเดียวกันปีก่อน:
- โดยมูลค่าการส่งออกสินค้ารวมในรูปเงินสกุลดอลลาร์สหรัฐ ในเดือนมกราคม 2567 อยู่ที่ 22,649.9 ล้านดอลลาร์สหรัฐ เพิ่มขึ้นจากช่วงเดียวกันปีก่อนที่ร้อยละ 10.0
- หากพิจารณาเฉพาะมูลค่าการส่งออกสินค้าที่ไม่รวมน้ำมันและสินค้าที่เกี่ยวเนื่อง ทองคำ และยุทธปัจจัย พบว่า เพิ่มขึ้นที่ร้อยละ 9.2 ซึ่งเป็นการขยายตัวต่อเนื่องเป็นเดือนที่ 6 ส่วนหนึ่งเป็นผลมาจากการขยายตัวของสินค้าในหมวดเหล็ก เหล็กกล้าและผลิตภัณฑ์ เครื่องโทรศัพท์ อุปกรณ์และส่วนประกอบ และเครื่องคอมพิวเตอร์ อุปกรณ์และส่วนประกอบ โดยขยายตัวร้อยละ 106.3 56.3 และ 32.2 ตามลำดับ
- นอกจากนี้ สินค้าข้าว ผลไม้สด แช่เย็น แช่แข็งและแห้ง สิ่งปรุงรสอาหาร และเครื่องดื่ม ขยายตัวร้อยละ 45.9 30.1 23.3 และ 18.6 ตามลำดับ อย่างไรก็ดี การส่งออกผลิตภัณฑ์มันสำปะหลัง เครื่องปรับอากาศและส่วนประกอบ และน้ำตาลทราย ชะลอตัว
ทั้งนี้ เมื่อพิจารณามูลค่าการส่งออกสินค้า โดยจำแนกเป็นรายตลาดคู่ค้าหลักของไทย พบว่า ปรับตัวดีขึ้นในตลาดทวีปออสเตรเลีย อาเซียน-5 และสหรัฐฯ ที่ขยายตัวร้อยละ 27.2 18.1 และ 13.7 ตามลำดับ รวมทั้งกลุ่มตลาดอื่น ๆ อาทิ ตลาดรัสเซียและกลุ่มประเทศเครือรัฐเอกราช (Commonwealth of Independent States: CIS) ที่ขยายตัวได้สูงถึงร้อยละ 64.6
เครื่องชี้เศรษฐกิจไทยด้านอุปทาน สำหรับภาคบริการมีสัญญาณปรับตัวดีขึ้นจากช่วงเดียวกันปีก่อน: โดยภาคบริการด้านการท่องเที่ยว ในเดือนมกราคม 2567 มีนักท่องเที่ยวชาวต่างชาติที่เดินทางเข้าประเทศไทยรวม จำนวน 3.04 ล้านคน คิดเป็นอัตราการขยายตัวต่อเนื่องจากช่วงเดียวกันปีก่¬¬อนที่ร้อยละ 41.5 โดยส่วนใหญ่เป็นนักท่องเที่ยวจากจีน มาเลเซีย เกาหลีใต้ รัสเซีย และอินเดีย ตามลำดับ
ขณะที่ภาคการเกษตร สะท้อนจากดัชนีผลผลิตสินค้าเกษตรกรรม ในเดือนมกราคม 2567 ลดลงจากช่วงเดียวกันปีก่อนที่ร้อยละ -4.4 และลดลงเมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาลที่ร้อยละ -0.2 จากการลดลงของผลผลิตในหมวดพืชผลสำคัญ อาทิ ข้าว ยางพารา และปาล์มน้ำมัน อย่างไรก็ดี ข้าวโพด และผลผลิตในหมวดไม้ผล ยังคงขยายตัว
สำหรับภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรม ในเดือนมกราคม 2567 ปรับตัวเพิ่มขึ้นมาอยู่ที่ระดับ 90.6 จากระดับ 88.8 ในเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากยอดคำสั่งซื้อที่เพิ่มขึ้นในช่วงเทศกาลตรุษจีน รวมถึงภาคการส่งออกฟื้นตัวต่อเนื่องตามอุปสงค์ในตลาดโลก
เสถียรภาพเศรษฐกิจยังอยู่ในเกณฑ์ดี: สะท้อนจากอัตราเงินเฟ้อทั่วไปในเดือนมกราคม 2567 อยู่ที่ร้อยละ -1.11 ขณะที่อัตราเงินเฟ้อพื้นฐานอยู่ที่ร้อยละ 0.52 ส่วนสัดส่วนหนี้สาธารณะ ณ สิ้นเดือนธันวาคม 2566 อยู่ที่ร้อยละ 61.3 ต่อ GDP ซึ่งยังอยู่ภายใต้กรอบวินัยการเงินการคลังที่ตั้งไว้ตามพระราชบัญญัติวินัยการเงินการคลังของรัฐ พ.ศ. 2561 สำหรับเสถียรภาพภายนอกยังอยู่ในระดับที่มั่นคง และสามารถรองรับความเสี่ยงจากความผันผวนของเศรษฐกิจโลกได้ สะท้อนจากทุนสำรองระหว่างประเทศ ณ สิ้นเดือนมกราคม 2567 อยู่ในระดับสูงที่ 221.6 พันล้านดอลลาร์สหรัฐ
1. ‘เทศกาลฯ’ ออกแบบประสบการณ์บนพื้นที่ทิ้งร้าง/ไม่ได้ถูกใช้งานด้วยเรื่องราวใหม่


กรุงเทพฯ มีพื้นที่ที่ไม่ได้ถูกใช้งานและถูกปล่อยละเลยหลายพื้นที่ ทั้งส่วนที่เป็นของหน่วยงานรัฐและเอกชน หนึ่งในนั้นคือหอเก็บน้ำประปาแห่งแรกในประเทศไทย บริเวณแยกแม้นศรี ย่านพระนคร ที่ถูกทิ้งร้างมานานกว่า 20 ปี ทว่าพื้นที่แห่งนี้กลับมีคุณค่าน่าสนใจอย่างมากในเชิงประวัติศาสตร์และสถาปัตยกรรม โดยกลุ่มผู้ขับเคลื่อนของย่านพระนคร ‘ศูนย์มิตรเมือง’ (Urban Ally) ได้จัดทำโปรเจกต์ ‘ประปาแม้นศรี’ ซึ่งเป็นส่วนหนึ่งในเทศกาลงานออกแบบกรุงเทพฯ 2566 - 2567 เปิดพื้นที่ให้คนในย่านและนอกย่านได้มามีปฏิสัมพันธ์กัน และใช้แนวคิด Festivalisation ในการสร้างประสบการณ์ใหม่ให้แก่พื้นที่สาธารณะในเมืองที่ตอบโจทย์คนทุกกลุ่ม นอกจากโปรเจกต์นี้จะทำให้พื้นที่ทิ้งร้างได้รับการปลุกชีวิตขึ้นมาใหม่ในช่วงวันงาน ยังทำให้หลายคนเห็นศักยภาพของพื้นที่สาธารณะแห่งนี้ในฐานะหมุดหมายสำหรับการจัดกิจกรรมต่าง ๆ เช่น กิจกรรมกรุงเทพกลางแปลง ที่นอกจากจะช่วยดึงดูดผู้คนและเปิดความเป็นไปได้ใหม่ ๆ ให้กับย่านแล้ว ยังสร้างมูลค่าทางเศรษฐกิจและสร้างความผูกพันระหว่างคนกับเมืองได้มากขึ้น นอกจากนี้กรุงเทพมหานครยังมีแผนเดินหน้าขับเคลื่อนแก้ปัญหาคนไร้บ้าน ด้วยการใช้พื้นที่ของ ‘ประปาแม้นศรี’ เป็น ‘บ้านอิ่มใจ’ เพื่อรองรับที่อยู่อาศัยของคนไร้บ้านในอนาคต ซึ่งจะเป็นการปรับปรุงพื้นที่ทิ้งร้างให้ถูกใช้งานได้อย่างเต็มประสิทธิภาพ ทางด้านอาคารเก่าสีส้มอายุนับร้อยปีในย่านเจริญกรุง - ตลาดน้อย อย่าง ‘อาคารชัยพัฒนสิน’ คุณสุกฤษฐิ์ ศรหิรัญ และคุณฐิติภา ศรหิรัญ ในฐานะทายาทรุ่นที่ 3 ได้เห็นความเปลี่ยนแปลงของย่านหลังการจัดเทศกาล จึงพัฒนาอาคารเก่าอายุกว่าร้อยปีของคุณตาที่ถูกปิดไว้และไม่ได้ใช้งาน ให้เป็นลานสเกตในร่ม ‘Jump Master Skate Haus’ สำหรับให้กลุ่มคนรุ่นใหม่ได้มาสัมผัสประสบการณ์ในพื้นที่มากขึ้น พร้อมการเข้าร่วมเป็นหนึ่งในพื้นที่จัดงานหลักของเทศกาลงานออกแบบกรุงเทพฯ ตั้งแต่ปี 2565 และในปี 2567 ‘อาคารชัยพัฒนสิน’ ได้ขยายสู่การเป็น Community Space ในชื่อว่า ‘The Corner House Bangkok’ ซึ่งเป็นพื้นที่พบปะของกลุ่มคนสร้างสรรค์ ที่อัดแน่นไปด้วยงานดนตรี ศิลปะ และงานสร้างสรรค์ ทั้งหมดนี้ตอกย้ำว่าอาคารเก่าแก่ทางประวัติศาสตร์สามารถปรับเปลี่ยนตามบริบททางสังคม โดยที่ยังคงไว้ซึ่งคุณค่าของอาคาร แต่เพิ่มฟังก์ชันของพื้นที่นั้น ๆ เพื่อรองรับกลุ่มผู้ขับเคลื่อนใหม่ ๆ ให้เข้ามาต่อยอดได้
| Hospital |
Country |
City |
2023 |
| 1 Mayo Clinic - Rochester |
United States |
Rochester |
1 |
| 2 Cleveland Clinic |
United States |
Cleveland |
2 |
| 3 Toronto General - University Health Network |
Canada |
Toronto |
5 |
| 4 The Johns Hopkins Hospital |
United States |
Baltimore |
4 |
| 5 Massachusetts General Hospital |
United States |
Boston |
3 |
| 6 Charité - Universitätsmedizin Berlin |
Germany |
Berlin |
7 |
| 7 Karolinska Universitetssjukhuset |
Sweden |
Solna |
6 |
| 8 AP-HP - Hôpital Universitaire Pitié Salpêtrière |
France |
Paris |
8 |
| 9 Sheba Medical Center |
Israel |
Ramat Gan |
11 |
| 10 Universitätsspital Zürich |
Switzerland |
Zürich |
12 |
| 11 Singapore General Hospital |
Singapore |
Singapore |
9 |
| 12 UCLA Health - Ronald Reagan Medical Center |
United States |
Los Angeles |
10 |
| 13 Centre Hospitalier Universitaire Vaudois |
Switzerland |
Lausanne |
14 |
| 14 Universitätsspital Basel |
Switzerland |
Basel |
15 |
| 15 Universitätsklinikum Heidelberg |
Germany |
Heidelberg |
13 |
| 16 Stanford Health Care - Stanford Hospital |
United States |
Stanford |
16 |
| 17 AP-HP - Hôpital Européen Georges Pompidou |
France |
Paris |
19 |
| 18 The University of Tokyo Hospital |
Japan |
Tokyo |
17 |
| 19 Brigham And Women’s Hospital |
United States |
Boston |
18 |
| 20 The Mount Sinai Hospital |
United States |
New York |
26 |
Triple Assessment หัวใจหลักที่ใช้ในการตรวจวินิจฉัย
พญ. สุดารัตน์ ชัยเพียรเจริญกิจ แพทย์ชำนาญการด้านศัลยศาสตร์เต้านม โรงพยาบาลบำรุงราษฎร์ กล่าวว่า หัวใจหลักที่ใช้ในการตรวจวินิจฉัยว่าเป็นหรือไม่เป็นมะเร็ง นั่นคือ Triple Assessment ได้แก่ ตรวจคัดกรอง ส่งชิ้นเนื้อ และพบศัลยแพทย์เต้านม ซึ่งผู้ป่วยสามารถทราบผลตรวจวินิจฉัยได้ภายใน 72 ชั่วโมง
เมื่อผู้ป่วย 1 คน สงสัยว่าตัวเองคลำเจอก้อนที่เต้านมหรือมาด้วยอาการผิดปกติที่เต้านม จะส่งตรวจอัลตราซาวด์สำหรับผู้ป่วยที่อายุน้อยกว่า 35 ปี ส่วนผู้ที่อายุมากกว่า 35 ปี จะส่งตรวจแมมโมแกรมและอัลตราซาวด์ในวันนั้นเลย หลังจากที่ผลออกมาแล้วพบความผิดปกติ แพทย์จะเจาะชิ้นเนื้อโดยใช้เครื่องอัลตราซาวด์บอกตำแหน่งสำหรับคนตรวจคัดกรองด้วยอัลตราซาวด์ แต่ถ้าตรวจคัดกรองด้วยแมมโมแกรม แพทย์จะเจาะชิ้นเนื้อโดยใช้เครื่องแมมโมแกรมบอกตำแหน่ง และผู้ป่วยที่มีประวัติคนในครอบครัวเคยเป็นมะเร็งเต้านมหรือเคยเสริมหน้าอกด้วยซิลิโคน จะส่งทำ MRI เต้านมเพิ่ม เพื่อตรวจเช็คให้ละเอียดว่าเต้านมมีความผิดปกติหรือไม่
1. ศูนย์ชีวาภิบาลในโรงพยาบาลศูนย์/โรงพยาบาลทั่วไป
1. ศูนย์ชีวาภิบาลในโรงพยาบาลศูนย์/โรงพยาบาลทั่วไป
1.1 องค์ประกอบ
1) เป็นหน่วยงานในโรงพยาบาล มีการกำหนดผู้รับผิดชอบเป็นหัวหน้าศูนย์ชีวาภิบาล มีพยาบาล/หรือ
สหสาขาวิชาชีพ เป็นผู้ประสานงาน ที่ชัดเจน
2) มีทีมบุคลากร ด้านการดูแลประคับประคอง (Palliative Care) โดยมีแพทย์ปฏิบัติงานด้านการดูแล
ประคับประคอง เป็นหัวหน้าทีม มีพยาบาล Palliative Care nurse เภสัชกร และทีมสหสาขาวิชาชีพ
3) มีทีมบุคลากร ด้านการดูแลผู้สูงอายุ (Elderly Care) โดยแพทย์ พยาบาล และสหวิชาชีพ ที่ผ่าน
การอบรมด้านการดูแลผู้สูงอายุ
4) มีทีมบุคลากรปฐมภูมิ ที่มีศักยภาพในการดูแลผู้ป่วยระยะยาว (Long-Term Care) โดยมี
แพทย์เวชศาสตร์ครอบครัวเป็นหัวหน้าทีม มีพยาบาลชุมชน และทีมสหวิชาชีพ
5) มีเภสัชกรร่วมทีม
6) มีระบบบริการ และระบบให้คำปรึกษาแก่เครือข่าย รวมถึงระบบจัดการยา/เวชภัณฑ์/คลังอุปกรณ์
เพื่อสนับสนุนการดูแลที่บ้านหรือชุมชน
1.2 บทบาทหน้าที่
หัวหน้า ศูนย์ชีวาภิบาล
1) กำกับดูแลให้เกิดการบูรณาการการวางแผนการดูแลผู้ป่วย ระบบบริการดูแลผู้สูงอายุ (Elderly Care) การดูแลระยะยาว (Long-Term Care) การดูแลประคับประคอง/ ระยะท้าย (Palliative Care) และระบบบริการปฐมภูมิ (Primary Health Care) ตั้งแต่การดูแลในโรงพยาบาลจนถึงบ้าน/ชุมชน อย่างมีคุณภาพ
2) จัดระบบบริการ และระบบให้คำปรึกษาแก่เครือข่าย รวมถึงระบบบริหารจัดการยา อนุพันธ์ฝิ่น (opioid) ในระบบ เพื่อให้ผู้ป่วยสามารถได้รับยาที่บ้าน/สถานชีวาภิบาลได้
3) จัดให้มีระบบฐานข้อมูลผู้ป่วยของเครือข่ายระบบชีวาภิบาล
พยาบาล ผู้ประสานงาน ศูนย์ชีวาภิบาล
1) ประสานการดูแลให้เกิดการบูรณาการในระดับ โรงพยาบาล ถึง ระดับชุมชน
2) จัดการฐานข้อมูลผู้ป่วยในเครือข่ายบริการ
ทีมดูแล ประคับประคอง
1) ให้การวินิจฉัยผู้ป่วยที่เข้าเกณฑ์ระยะประคับประคอง/ระยะท้าย (ICD 10-Z51.5) ทั้งผู้ป่วยในและผู้ป่วยนอก
2) ทำการประเมิน และ จัดทำแผนการดูแลล่วงหน้า (Advance care planning; ICD 10- Z71.8)
3) ให้การดูแลตามมาตรฐาน (physical, psychosocial, spiritual care) และพิจารณา เพื่อส่งกลับไปดูแลที่บ้าน หรือ สถานชีวาภิบาลในชุมชน
4) ส่งต่อข้อมูลการดูแลให้ทีมปฐมภูมิ เพื่อวางแผนการดูแลต่อเนื่อง
5) เป็นที่ปรึกษาให้กับเครือข่าย ในกรณี ผู้ป่วย Palliative Care ที่รับการดูแลที่บ้าน หรือ สถานชีวาภิบาล ต้องการการดูแลที่ซับซ้อน
6) ฝึกอบรมบุคลากรในเครือข่ายให้มีศักยภาพในการดูแลผู้ป่วยระยะประคับประคอง/ ระยะท้าย
ทีมดูแลผู้สูงอายุ
1) คัดกรองผู้สูงอายุทั้งผู้ป่วยใน ผู้ป่วยนอก และผู้สูงอายุในชุมชน ที่ต้องการการดูแล ระยะยาว ตามเกณฑ์
2) พิจารณาวางแผนการดูแลผู้ป่วยใน เพื่อส่งกลับไปดูแลที่บ้าน หรือ สถานชีวาภิบาลในชุมชน
3) ส่งต่อข้อมูลการดูแลให้ทีมปฐมภูมิ เพื่อวางแผนการดูแลต่อเนื่อง
4) ฝึกอบรมบุคลากรในเครือข่ายให้มีศักยภาพในการดูแลผู้สูงอายุ
ทีมปฐมภูมิ
1) ประสานเครือข่ายบริการปฐมภูมิเพื่อส่งต่อการดูแลที่บ้าน และสถานชีวาภิบาลในชุมชน
2) จัดบริการคลินิกหมอครอบครัว
3) เยี่ยมดูแลที่บ้าน (LTC & PC home care), บริการPC Home ward หรือที่สถานชีวาภิบาล หรือส่งต่อการดูแลไปยังเครือข่ายตามบริบทพื้นที่
บริการแพทย์เฉพาะทางโรงพยาบาลศูนย์บริการการแพทย์นนทบุรี
บริการแพทย์เฉพาะทางโรงพยาบาลศูนย์บริการการแพทย์นนทบุรี
บริการพอกตา ลดอาการปวดตาและเมื่อยล้า
คลินิกแพทย์แผนไทย โรงพยาบาลปากเกร็ด ได้จัดบริการพอกตา ลดอาการปวดตาและเมื่อยล้า
*** มีจำนวนจำกัด
ที่แผนกผู้ป่วยนอกโรงพยาบาลปากเกร็ด ข้างเทศบาล ให้บริการวันจันทร์ถึงวันศุกร์ เวลา 8.00 น. - 15.30 น.
• ให้คำปรึกษา
• กิจกรรมพอกตา
• หรือรับชุดพอกตากลับบ้าน
• ตัวยาที่ใช้พอกตา ทำจากสมุนไพรที่ผสมเองเท่านั้น
✅ โทรสอบถาม 02-9609900 ต่อ 300 / 080-5752970
✅ หรือ สแกนคิวอาร์โค้ด สอบถามและนัดได้
ฟ้าชมคลื่น ที่พักสวัสดิการ ของทอ.อ่าวมะนาว กองบิน 5
ห้องพักติดชายหาดอ่าวมะนาว ที่พักติดชายหาดอ่าวมะนาวเพียงแห่งเดียวในจังหวัดประจวบฯ ตั้งอยู่ในเขตของกองทัพอากาศ กองบิน 5 ห้องพักมีหลายแบบ ได้แก่ STANDARD ROOM , SUPERIOR ROOM , DELUXE ROOM , POOL VILLA ROOM , SUITE ROOM , FAMILY DELUXE ROOM , FAMILY SUITE ROOM
มีบริการสระว่ายน้ำแบบเห็นวิวทะเลสำหรับลูกค้าทุกท่านที่เข้าพัก พร้อมเจ้าหน้าที่ดูแลความปลอดภัย ให้บริการเวลา 8:30 – 19:00 น. บริเวณชายหาดอ่าวมะนาวมีกิจกรรมต่างๆมากมายสำหรับบริการนักท่องเที่ยวที่มาพักผ่อนทุกท่าน ไม่ว่าจะเป็นการขี่ม้าริมชายหาด , ขับรถ ATV , ยิงธนู , Banana Boat , ศูนย์อาหาร พร้อมเจ้าหน้าที่ดูแลความปลอดภัยตลอดชายหาด
สามารถสำรองห้องพักล่วงหน้าได้นาน 3 เดือน สอบถามห้องพักว่าง/สำรองห้องพักได้ช่องทางเดียว (08.00 – 20.00 น.)
ติดต่อสอบถามข้อมูลและจองห้องพักได้ทุกวันทางโทรศัพท์ 032-661-088 , 032-661-089 หรือ 02-534-6000 ต่อ 60464 – 60465
Website. |.
Facebookกำหนดแนวทางในการใช้เครื่องฟอกอากาศในหน่วยงาน
ให้หัวหน้างาน หัวหน้าตึก / หัวหน้าหอผู้ป่วย ที่มีเครื่องฟอกอากาศ เป็นผู้รับผิดชอบดูแลบำรุงรักษาเบื้องต้น ซึ่งอาจมีการมอบหมายงานให้เจ้าหน้าที่ในหน่วยงานรับผิดชอบแล้วแต่พิจารณาตามความเหมาะสม
- ควรวางเครื่องฟอกอากาศให้สูงจากพื้นไม่น้อยกว่า 30 ชม.
- ควรทำความสะอาดตะแกรงช่องกรองฝุ่นด้านนอก โดยใช้ผ้าชุบน้ำบิดหมาดเช็ดตรงตะแกรงอย่างน้อย 1 ครั้งต่ออาทิตย์
- ก่อนเปิดใช้งานเครื่องฟอกอากาศ ควรปิดประตูหน้าต่างให้สนิททุกครั้งเพื่อป้องกันไม่ให้ฝุ่นละอองเข้ามาในห้อง
- ให้สังเกตเวลาใช้งานเครื่องฟอกอากาศ กรณีมีไฟกระพริบเตือน ให้แจ้งช่างตรวจสอบ
- เวลาเปิด-ปิด เครื่องฟอกอากาศ สามารถเปิดได้ตลอด 24 ชั่วโมง กรณีพบเครื่องๆ มีปัญหา สามารถติดต่อช่างฯ เบอร์ ภายใน 5009 หรือคุณชวลิต กมลสดใส เบอร์โทร 082-5598999
ด้วยความปรารถนาดีจากคณะกรรมการบรรเทาผลกระทบต่อสุขภาพ จากภาวะไฟป่าและหมอกควัน เครือข่ายบริการสุขภาพอำเภอเมืองแม่ฮ่องส
อบต.ย่านซื่อ อ่างทอง การขึ้นทะเบียนสุนัขและแมว เพื่อรับวัคซีน ถึง 31 มีนาคม 2567
องค์การบริหารส่วนตำบลย่านซื่อ จังหวัดอ่างทอง ประชาสัมพันธ์ การขึ้นทะเบียนสุนัขและแมว เพื่อรับวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี พ.ศ.2567 ถึง 31 มีนาคม 2567 สอบถามโทร 035-611496 035-611497
UMSC โรงพยาบาลกลาง ใส่ใจทุกบริการ ครบ จบ ในที่เดียว
ศูนย์สนับสนุนบริการสุขภาพเวชศาสตร์เขตเมือง (UMSC)
โรงพยาบาลกลาง เป็นศูนย์บริการที่ได้ขยายการบริการเพิ่มเติมจาก ศูนย์บริหารราชการฉับไว ใสสะอาด (BFC) เพื่ออำนวยความสะดวกให้กับประชาชนมากยิ่งขึ้น ทั้งช่องทางออฟไลน์ และออนไลน์ โดยเพิ่มการให้บริการ
- สอบถามปัญหาสุขภาพ อาการเจ็บป่วยฉุกเฉิน
- สอบถามการบริการ ในโรงพยาบาล
- การพบแพทย์ออนไลน์ (Telemedicine)
กระทรวงสาธารณสุข คาดอุณหภูมิปีนี้อาจถึง 44.5 องศาเซลเซียส
กระทรวงสาธารณสุข เปิดเผยว่า ประเทศไทยได้เข้าสู่ฤดูร้อนตั้งแต่วันที่ 21 กุมภาพันธ์ที่ผ่านมา โดยตามประกาศของกรมอุตุนิยมวิทยา คาดการณ์ว่าอุณหภูมิปีนี้จะสูงขึ้นกว่าปีก่อน อาจถึง 44.5 องศาเซลเซียส ซึ่งมีความเสี่ยงส่งผลกระทบต่อสุขภาพของประชาชน โดยดูได้จากค่าดัชนีความร้อน ซึ่งเป็นค่าที่สะท้อนความรู้สึกร้อนของร่างกาย จากการนำอุณหภูมิของอากาศมาคิดร่วมกับความชื้นสัมพัทธ์ เนื่องจากเมื่อความชื้นสัมพัทธ์สูงจะทำให้เหงื่อระเหยยาก และส่งผลให้รู้สึกร้อนกว่าอุณหภูมิจริงของอากาศ หากค่าดัชนีความร้อนเกิน 40 องศาเซลเซียส จะมีความเสี่ยงเกิดโรคลมแดด หรือโรคฮีทสโตรก (Heat Stroke) ซึ่งเป็นภาวะที่ร่างกายร้อนจัดจนส่งผลกระทบต่อระบบต่างๆ ในร่างกาย และเป็นอันตรายถึงขั้นเสียชีวิตได้การป้องกันตนเอง จากความร้อน สำหรับผู้ที่ออกกำลังกายกลางแจ้ง
การป้องกันตนเอง จากความร้อน สำหรับผู้ที่ออกกำลังกายกลางแจ้ง
- ควรดื่มน้ำ 1 แก้ว ทุกๆ 15 - 20 นาที
- สวมชุดออกกำลังกายที่ระบายความร้อนได้ดี
- ดื่มเครื่องดื่มเกลือแร่
- หลีกเลี่ยงการดื่มแอลกอฮอล์ ชา กาแฟ และเครื่องดื่มที่มีน้ำตาลสูง
- หลีกเลี่ยงการออกกำลังกายอย่างหนัก ช่วงเวลา 11.00 - 15.00 น.
กลุ่มเสี่ยงที่ต้องระวังฮีทสโตรกเมื่ออยู่กลางแดดจัด
กลุ่มเสี่ยงที่ต้องระวังฮีทสโตรกเมื่ออยู่กลางแดดจัด
- ผู้ที่ทำงานหรือทำกิจกรรมกลางแจ้ง
- เด็กอายุต่ำกว่า 5 ปี และผู้สูงอายุ
- ผู้ที่พักผ่อนไม่เพียงพอ
- ผู้ที่มีภาวะอ้วน
- ผู้ที่มีโรคประจำตัว
- ผู้ที่ดื่มเครื่องดื่มแอลกอฮอล์ในปริมาณมาก
วิธีการช่วยเหลือผู้ที่เกิดอาการลมแดด
- นำผู้มีอาการเข้าร่ม นอนราบยกเท้าสูงทั้งสองข้าง ถอดเสื้อผ้าชั้นนอกออก
- เทน้ำเย็นราดบนตัวเพื่อลดอุณหภูมิร่างกายให้ต่ำลงโดยเร็วที่สุด
- ใช้ผ้าชุบน้ำเย็นหรือน้ำแข็งประคบตามซอกคอ รักแร้ ขาหนีบ ไม่ควรใช้ผ้าเปียกคลุมตัว
- รีบนำส่งโรงพยาบาลที่ใกล้ที่สุด หรือ
- โทรศัพท์ขอความช่วยเหลือ สายด่วน 1669
ศ.คลินิก นพ.อาทิตย์ อังกานนท์ คณบดีคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี และประธานคณะกรรมการบริหารมูลนิธิรามาธิบดีฯ กล่าวว่า “เกือบ 60 ปีที่คณะแพทยศาสตร์โรงพยาบาลรามาธิบดีเปิดให้บริการในฐานะโรงพยาบาลที่เปรียบเสมือน "ที่พึ่ง" ของคนไทย พร้อมบทบาทด้านการผลิตบุคลากรทางการแพทย์เข้าสู่ระบบสาธารณสุข และด้านการวิจัยและพัฒนาองค์ความรู้ทางการแพทย์เพื่อการรักษา โดยครอบคลุมทั้งงานวิจัยขั้นพื้นฐานด้านการหาตัวยาใหม่เพื่อพัฒนาประสิทธิภาพและเพิ่มการเข้าถึงตัวยาได้มากขึ้น ไปจนถึงการคิดค้นแนวทางการรักษารูปแบบใหม่สู่การเป็นต้นแบบของการรักษาโดยเฉพาะการรักษาโรคที่มีความซับซ้อน โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ถือเป็นโครงการที่ไม่เพียงเพิ่มพื้นที่ในการรักษาที่รองรับนวัตกรรมทางการแพทย์ล้ำสมัยเท่านั้น แต่มีบทบาทสำคัญในการขับเคลื่อนและสนับสนุนพันธกิจของคณะแพทยศาสตร์โรงพยาบาลรามาธิบดีอย่างครอบคลุมในทุกมิติ เพื่อผลักดันระบบการแพทย์ไทยให้ก้าวหน้าต่อไป”
เอไอ แผนกเอ็กซเรย์ อ่านฟิล์มเอ็กซเรย์ 100%
แผนกเอ็กซเรย์ รพ.บำรุงราษฎร์ ได้นำเอาระบบเอไอมาใช้อ่านค่า ฟิล์มเอ็กซเรย์ ตั้งแต่ปี 2022 ปัจจุบัน 100% ของฟิล์มเอ็กซเรย์ แมมโมแกรม อ่านด้วยเอไอทั้งหมด จะมีแพทย์ ทำการอ่านซ้ำและวิเคราะห์ร่วมกันอีกครั้ง เพื่อให้แน่ใจว่า ผลผิดปรกติที่เกิดขึ้นนั้น เป็นความผิดปรกติจริงๆ หรือไม่ ที่แพทย์จะต้องทำการตรวจรักษาต่อ ซึ่งก่อนการนำมาใช้จริงๆ ได้มีการทดสอบและค้นคว้าว่า มีการใช้งานที่ถูกต้องและเชื่อถือได้ และที่สำคัญคือแพทย์ต้องยอมรับ กับผลที่อ่านได้ กับความเห็นของแพทย์ ต้องตรงกัน นั่นทำให้มีผลการยอมรับจากแพทย์ (adoption rate) เต็ม 100% ในปี 2023 เอไอแผนกเอ็กซเรย์ อ่านฟิล์มเอ็กซเรย์ ทรวงอกไปแล้วกว่า 1 แสนเคส แมมโมแกรม กว่า 2 หมื่น เคส ปัจจุบันมีการอัพเกรด จากระบบ 2 มิติ เป็น 3-D แล้ว สามารถดูมุมมองได้มากขึ้นจาก 10 เป็น 15 directions 2 หลักสูตร TCAS67 ที่เปิดรับ - หลักสูตรแพทยศาสตรบัณฑิต และ หลักสูตรวิทยาศาสตรบัณฑิต
ผู้ช่วยศาสตราจารย์ นายแพทย์วิสุทธิ์ ล้ำเลิศธน รักษาการรองคณบดีวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน การสร้างแพทย์สมัยใหม่ที่มีคุณลักษณะเฉพาะในแบบของ CRA Doctor คือ แพทย์ที่มีความรับผิดชอบต่อสังคม มีจิตอาสา มีทักษะวิชาชีพที่เป็นเลิศ สอดคล้องกับมาตรฐานแพทยสภาและมาตรฐานสากล WFME เป็นแพทย์ที่รู้จักคิดค้นคว้าวิจัย สร้างองค์ความรู้ใหม่และนวัตกรรมเพื่อการพัฒนาประเทศอย่างยั่งยืน รวมทั้งเป็นแพทย์ที่ดูแลผู้ป่วยและครอบครัวอย่างเป็นองค์รวม
หลักสูตรที่เปิดรับ TCAS67 ของ วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน มี 2 หลักสูตรที่เปิดรับ คือ หลักสูตรแพทยศาสตรบัณฑิต และ หลักสูตรวิทยาศาสตรบัณฑิต
หลักสูตรแพทยศาสตรบัณฑิต ซึ่งตอนนี้เปิดรับสมัครรอบโควตา นักเรียนชั้นมัธยมศึกษาปีที่ 6 จากโรงเรียนวิทยาศาสตร์จุฬาภรณราชวิทยาลัย ถึงวันที่ 18 เมษายน 2567 นี้ และ รอบที่ 3 Admission ใช้คะแนนสอบกลาง เปิดรับสมัครตามประกาศของ ทปอ. ช่วงวันที่ 6 -12 พฤษภาคม2567
อีกหลักสูตรคือ หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาข้อมูลสุขภาพ ซึ่งเป็นหลักสูตรร่วมระหว่างวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ กับคณะวิศวกรรมศาสตร์ มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี เป็นการบูรณาการวิทยาศาสตร์ข้อมูลและวิทยาศาสตร์สุขภาพเข้าด้วยกัน หลักสูตรนี้เหมาะสำหรับนักเรียนที่มีความสนใจด้านวิทยาศาสตร์สุขภาพและมีความสามารถทางด้านการใช้คอมพิวเตอร์ ตอนนี้เปิดรับสมัครรอบโควตา นักเรียนมัธยมศึกษาชั้นปีที่ 6 จากโรงเรียนวิทยาศาสตร์จุฬาภรณราชวิทยาลัยและโรงเรียนดรุณสิขาลัย ถึงวันที่ 21 เมษายน 2567 นี้ และ รอบที่ 3 Admission ใช้คะแนนสอบกลาง เปิดรับสมัครตามประกาศของ ทปอ. ช่วงวันที่ 6 -12 พฤษภาคม 2567 เช่นเดียวกัน
โรงพยาบาลพังงา เข้าร่วมโครงการยกระดับ 30 บาท รักษาทุกที่ ระยะ 2
โรงพยาบาลพังงา เข้าร่วมโครงการยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว ตั้งแต่เดือนมีนาคม 2567 [
คลิปแนะนำการรับบริการ]
เขต 1
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี ดอยตุง อำเภอแม่ฟ้าหลวง จังหวัดเชียงราย
- สอ.พระราชทาน อำเภอแม่จัน จ.เชียงราย
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านปางมะโอ ต.บ่อแก้ว อ.สะเมิง จ.เชียงใหม่
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลสถาน อำเภอนาน้อย จังหวัดน่านน่าน
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีตำบลแม่ปืม จ.พะเยา
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี อนาลโย จ.พะเยา
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี แม่จั๊วะ จ.แพร่
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านโป่งสา จ.แม่ฮ่องสอน
- สถานีอนามัยเฉลิมพระเกียรติฯ บ้านทุ่งกล้วย ต.บ้านเอื้อม อ.เมืองลำปาง จ.ลำปาง
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ป่าซาง
ออกกำลังกายกลางแจ้ง อย่างไร ให้ปลอดภัยจากโรคฮีทสโตรก
คำแนะนำออกกำลังกายกลางแจ้ง ให้ปลอดภัยจากโรคฮีทสโตรก
- ดื่มน้ำอย่างสม่ำเสมอ
- หลีกเลี่ยงการออกกำลังกายอย่างหนัก
- ควรออกกำลังกายในช่วงเช้าหรือเย็น ภายในอาคาร
- สวมเสื้อผ้าที่ระบายอากาศได้ดี
- หากพบความผิดปกติของร่างกาย หรือพบเห็นผู้ที่มีอาการ สามารถปฐมพยาบาลเบื้องต้นได้ในกรณีที่ผู้ป่วยยังรู้สึกตัว เช่น พาผู้ป่วยเข้าที่ร่ม ถอดเสื้อผ้าเพื่อระบายความร้อนให้กับผู้ป่วย และแจ้งหมายเลขฉุกเฉิน 1669 เพื่อให้รถพยาบาลมาช่วยเหลือได้ทันท่วงที
เดินหน้าโครงการ ร่วมกับ สถาบันพระบรมราชชนก (สบช.)
1 พฤศจิกายน 2567 ที่โรงแรมอัศวิน แกรนด์ คอนเวนชัน นายสันติ พร้อมพัฒน์ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข (สธ.) ให้สัมภาษณ์ภายหลังเปิดประชุมวิชาการนานาชาติการศึกษาสำหรับบุคลากรสุขภาพ ว่า สถาบันพระบรมราชชนก (สบช.) ได้ดำเนินโครงการร่วมกับนานาชาติ ในการพัฒนาส่งเสริมบุคลากรทางการแพทย์และสุขภาพ เช่น แพทย์ พยาบาล เภสัชกร ฯลฯ ซึ่งจะทำให้บุคลากรทางการแพทย์และสุขภาพของเราได้รับรู้ในภาษาที่สองด้วย จะสามารถเข้าถึงนวัตกรรมเทคโนโลยีทางการแทพย์และสุขภาพต่างๆ ได้อย่างทั่วถึง รวดเร็ว มีประสิทธิภาพสูงสุด เป็นความตั้งใจและความสามารถของ สบช. ที่จะตั้งใจผลิตบุคลากรทางสุขภาพให้ได้จำนวนมากและมีประสิทธิภาพ มีความสามารถในการดูแลสุขภาพคนไทย
ที่ผ่านมาได้พูดคุยกับผู้บริหาร สธ. ว่าต้องเร่งรัดและผลิตแพทย์ให้เพียงพอกับประชาชนในชนบท คือ รพ.สต.ละ 3 คน ทั่วประเทศรวม กทม.มีประมาณ 1 หมื่น รพ.สต. ต้องใช้แพทย์ถึง 3 หมื่นคน แล้วการผลิตแพทย์ไม่ใช่คิดวันนี้ปีหน้าได้ แพทย์คนหนึ่งต้องฝึกจนมีความรู้ความสามารถสอบได้ออกมาดูแลประชาชน ใช้เวลาถึง 6 ปี
"ใน 3 หมื่นคนจะเร่งให้ สบช.เป็นหลักในการขับเคลื่อน ปีหนึ่งจะเพิ่ม 5 พันคน โดยจะผลิตแพทย์ในท้องถิ่นของเราตามสัดส่วนโควตาแต่ละจังหวัด คัดคนสอบคนของจังหวัดตนเอง เอาคนที่เก่งสุดในมัธยมปลายไปสอบเรียนแพทย์ตามโควตา เมื่อจบแล้วก็จะมาดูแลในพื้นที่ของเขา โดย 3 หมื่นคน คำนวณใช้เงินประมาณ 1.5 แสนล้านบาท หาร 6 ปี ใช้เงินเพียง 2 หมื่นกว่าล้านบาทต่อปี ผมและ สบช.ศึกษาแล้วว่าคุ้มค่าอย่างสูง สำหรับค่าใช้จ่ายนี้ สบช.เกรงว่างบจะไม่เพียงพอ ผมจึงรับปากว่าจะไปต่อสู้ทำความเข้าใจกับกระทรวงการคลัง สำนักงบประมาณ ว่าตรงนี้เป็นประโยชน์ เป็นการลดต้นทุนการดำรงชีพของประชาชนในชนบทที่จะเข้าหาหมอได้อย่างมากมายมหาศาล"
สบช.เสนอ 2 โครงการ
ศ.นพ.วิชัย เทียนถาวร อธิการบดี สบช. กล่าวว่า รัฐบาลปัจจุบันมีแนวคิดผลิตบุคลากรปฐมภูมิให้กับประเทศ มอบหมายให้ สบช.ผลิตบุคลากรรองรับหน่วยบริการปฐมภูมิ (Primary Care Unit) ให้ครอบคลุมทั่วประเทศ เรามีการเสนอ 2 โครงการ คือ
1.โครงการผลิตบุคลากรสุขภาพ โดยเฉพาะโครงการ 3 หมอ ซึ่งปี 2567 เป็นปีแรกที่เราจะผลิตบุคลากรแพทย์ 3 หมอก่อน เป้าหมายคือสถานีอนามัยเฉลิมพระเกียรติฯ 92 แห่ง เฉลี่ยจังหวัดละ 1 แห่ง จะเป็นจุดแรกที่จะผลิตแพทย์ไปอยู่แห่งละหรือจังหวัดละ 1 คน เพื่อเป็นต้นแบบและเทิดพระเกียรติสมเด็จพระพันปีหลวง ผ่านโครงการผลิตแพทย์เพิ่มเพื่อชาวชนบท (CPIRD) โดยเลือกเด็กจากท้องถิ่นที่มีสถานีอนามัยฯ เช่น อยู่เพชรบูรณ์ก็เอามาจากเพชรบูรณ์ อยู่น่านก็เอามาจากน่าน มาคัดเลือดหรือสอบ TCAS ตามปกติ มีการปลูกฝังทัศนคติเด็กที่มาเรียนให้ชัดเจนว่า เป็นบัณฑิตที่จบแล้วอยู่สถานีอนามัยฯ และเป็นแพทย์ครอบครัว เป็น "บัณฑิตคืนถิ่น" โดยไปฝึกงานที่ รพ.สมเด็จพระยุพราช 3 ปี เพื่อเป็นหมอครอบครัว เฟสต่อไปแผน 10 ปีจะผลิตรองรับ รพ.สต.ส่วนที่เหลือ 9.8 พันแห่งทั่วประเทศ แห่งละ 10% โดยวางแผน 9 หมอจะครบ 100% ใน 10 ปี ครอบคลุมครบทุกสถานีอนามัยฯ และ รพ.สต.
2.โครงการผลิตทีมสุขภาพปฐมภูมิ Primary Health Innovation Team มีแพทย์ พยาบาลครอบครัว พยาบาลชุมชน นักวิชาการสาธารณสุข อสม.ที่เรียนต่อผู้ช่วยพยาบาล ผู้ช่วยสาธารณสุข โดยปีหน้าจะมีการเปิดคณะเภสัชศาสตร์ คณะทันตแพทยศาสตร์ คณะกายภาพบำบัด รวมถึงแพทย์แผนไทย และจะเปิดเรียนด้านฉุกเฉินการแพทย์ ซึ่งเราต้องการให้มีฉุกเฉินการแพทย์ทุกสถานีอนามัยฯ/รพ.สต. แต่ในกรอบของเราจะผลิตคราวละ 3 พันคน และจะมีโครงการแซนด์บ็อกซ์มาเสริม เนื่องจากฉุกเฉินการแพทย์ กว่าชาวบ้านจะมาจะไปต้องหารถราเดินทางไกล เราก็จะมีระบบตั้งแต่เกิดเหตุ การขนส่งได้ทันที เพื่อลดความพิการและตาย [
hfocus]
กลุ่มเป้าหมาย-ประเภทร้านค้า-ประเภทสินค้า
วัตถุประสงค์
เพื่อกระตุ้นเศรษฐกิจด้วยการส่งเสริมให้มีเม็ดเงินหมุนเวียนในพื้นที่และช่วยบรรเทาภาระค่าครองชีพ ยกระดับและพัฒนาคุณภาพชีวิตให้แก่ประชาชนที่ต้องการได้รับความช่วยเหลือ เช่น กลุ่มเปราะบาง เกษตรกร เป็นต้น ซึ่งเป็นการส่งเสริมให้ประชาชนกลุ่มดังกล่าวและชุมชนมีความเข้มแข็งในด้านเศรษฐกิจ สามารถพึ่งพาตนเองได้ รวมทั้งสร้างและเพิ่มโอกาสในการประกอบอาชีพของประชาชนและสนับสนุนการพัฒนาให้เกิดนวัตกรรมด้านเทคโนโลยีดิจิทัลเพื่อประโยชน์ต่อเศรษฐกิจและสังคม
กลุ่มเป้าหมาย
ประชาชนผู้เข้าร่วมโครงการฯ ต้องมีคุณสมบัติ ดังนี้
(1) กลุ่มประชากรที่มีที่อยู่ในทะเบียนบ้าน
(2) สัญชาติไทย
(3) มีอายุเกิน 16 ปี ณ เดือนที่มีการลงทะเบียน
(4) ไม่เป็นผู้มีเงินได้พึงประเมินเกิน 840,000 บาทต่อปีภาษี
(5) เป็นผู้ที่มีเงินฝากกับธนาคารพาณิชย์และสถาบันการเงินเฉพาะกิจรวมกันไม่เกิน 500,000 บาท
แนวทางการเข้าร่วมโครงการฯ
(1) ประชาชนทุกคนต้องยืนยันตัวตนก่อนเข้าร่วมโครงการฯ โดยให้กลุ่มผู้ใช้สิทธิยืนยันตัวตนผ่านแอปพลิเคชันในสมาร์ตโฟนเพื่อเข้าร่วมโครงการฯ
(2) ตรวจสอบสถานะบุคคลและที่อยู่ตามทะเบียนบ้านกับข้อมูลกรมการปกครองของผู้ใช้สิทธิ
(3) ประชาชนเปิดแอปพลิเคชันเพื่อแสกน QR Code ณ ร้านค้าในพื้นที่ตามทะเบียนบ้าน
ทั้งนี้ ผู้จัดทำระบบจะต้องดำเนินการให้เป็นไปตามแนวทางการเข้าร่วมโครงการฯ ของประชาชนข้างต้น ตลอดจนเงื่อนไขอื่นที่อาจเพิ่มเติมภายหลัง (หากมี)
เงื่อนไขการใช้จ่ายระหว่างประชาชนกับร้านค้า
(1) การใช้จ่ายเชิงพื้นที่ระหว่างประชาชนและร้านค้าในระดับอำเภอ (878 อำเภอ)
(2) การชำระเงินภายใต้โครงการฯ ต้องเป็นแบบพบหน้า (Face to Face)
(3) กำหนดให้ประชาชนใช้จ่ายกับร้านค้าขนาดเล็กและร้านสะดวกซื้อขนาดเล็ก
ประเภทร้านค้า
ร้านค้าที่จะเข้าโครงการฯ แบ่งตามการรับการใช้จ่ายได้ ดังนี้
(1) ร้านค้าที่สามารถรับการใช้จ่ายจากประชาชนต้องเป็นร้านค้าขนาดเล็กรวมถึงร้านสะดวกซื้อขนาดเล็ก โดยไม่รวมห้างสรรพสินค้า ห้างค้าปลีก - ค้าส่งสินค้าขนาดใหญ่ระดับประเทศและระดับท้องถิ่น
(2) ร้านค้าที่สามารถรับการใช้จ่ายจากร้านค้าไม่มีการกำหนดเงื่อนไข
ทั้งนี้ รูปแบบและขั้นตอนการยืนยันตัวตน และเงื่อนไขการสมัครและวิธีการสมัครของร้านค้าที่เข้าร่วมโครงการฯ ให้เป็นไปตามที่ พณ. กำหนด
ประเภทสินค้า
(1) กำหนดให้สินค้าทุกประเภทเข้าร่วมโครงการฯ ได้ ยกเว้นสินค้าที่ไม่สามารถเข้าร่วมโครงการฯ ได้ (Negative List) ซึ่งได้แก่ สลากกินแบ่งรัฐบาล เครื่องดื่มแอลกอฮอล์ ยาสูบ กัญชา กระท่อม พืชกระท่อม ผลิตภัณฑ์กัญชาและกระท่อม บัตรกำนัล บัตรเงินสด ทองคำ เพชร พลอย อัญมณี น้ำมันเชื้อเพลิง และก๊าซธรรมชาติ ทั้งนี้ มอบหมายให้ พณ. พิจารณาสินค้าที่ไม่สามารถเข้าร่วมโครงการฯ เพิ่มเติมได้
(2) การใช้จ่ายตามโครงการฯ ไม่รวมถึงบริการ
1.Suksan Smile Plus
หากคุณกำลังมองหาคลินิกที่เพียบพร้อมเรื่องบริการ และเครื่องมือทางการแพทย์ที่ Suksan Smile Plus ตอบโจทย์อย่างแน่นอน ครอบคลุมการทำฟัน ดูแลช่องปากทุกชนิด ด้วยเครื่องมือเทคโนโลยีที่ทันสมัยและยังมีห้องปฏิบัติงานสำหรับเด็กโดยเฉพาะ โซนเด็กเล่น ครอบคลุมตลอดจน รองรับสิทธิ์ประกันสังคม
ช่องทางติดต่อ
ทำหมันฉีดวัคซีนฟรี ปี 2566 โดยอบต.นครชัยศรี
ปี 2566 อบต.นครชัยศรี จัดบริการผ่าตัดทำหมันหมาแมว วันที่ 18 พฤษภาคม 2566 ลงทะเบียนล่วงหน้า
องค์การบริหารส่วนตำบลนครชัยศรี ร่วมกับสำนักงานปศุสัตว์อำเภอนครชัยศรี ให้บริการทำหมันสุนัขและแมว จำนวนจำกัด 50 ตัว ในวันพฤหัสบดีที่ 18 พฤษภาคม 2566 เวลา 9-11 น. ณ ที่ทำการอบต.นครชัยศรี สุนัขและแมวที่จะเข้ารับการผ่าตัดทำหมัน ต้องงดน้ำและงดอาหาร ล่วงหน้าอย่างน้อย 10-12 ชั่วโมง ผู้สนใจลงทะเบียนได้ถึง 12 พฤษภาคม 66 สอบถามโทร. อบต.นครชัยศรี 034-331673 ต่อ 104
คลินิก SMC OPD จักษุ โรงพยาบาลพระปกเกล้า ออกตรวจวันอังคาร
ออกตรวจวันอังคาร 16.30 - 20.00 น. เว้นวันหยุดราชการ ณ ห้องตรวจจักษุ อาคารศัลยกรรมและจักษุ ชั้น 3
ค่าบริการเริ่มต้น 480 บาท
ค่ายา แลป เอ็กซเรย์ เบิกได้ตามสิทธิการรักษา
สอบถามโทร 039-319666 ต่อ 3931-2
แพทย์เฉพาะทางอายุรกรรม
แพทย์เฉพาะทางอายุรกรรม
ออกตรวจวันจันทร์-พฤหัสบดี เวลา 16-20 น.
ค่าบริการเริ่มต้นที่ 480 บาท
ค่ายา/แลป/เอ็กเรย์ เบิกได้ตามสิทธิการรักษา
ติดต่อสอบถาม 063-4642725 039-319666 ต่อ 8206-9
รายชื่อแพทย์
วันจันทร์ นพ.พิชานนท์ มิ่งฉาย
วันอังคาร พญ.อรวรรณ เกษมสุขสกุณี
วันพุธ นพ.นราวิชญ์ สมพรไพลิน
วันพฤหัสบดี พญ.ณสวรรณ รตินันทกุล
รวมเบอร์โทรศัพท์สำหรับนัดคลินิกพิเศษเฉพาะทางนอกเวลาราชการ โรงพยาบาลราชบุรี
รวมเบอร์โทรศัพท์สำหรับนัดคลินิกพิเศษเฉพาะทางนอกเวลาราชการ สามารถโทรนัดได้ในวันและเวลาราชการ
การประชุม FNM เริ่มจัดครั้งแรกในปี 2014 และจัดขึ้นทุกสองปี เพื่อเป็นเวทีสำหรับการแลกเปลี่ยนความรู้และสร้างเครือข่าย โดยการนำนักวิจัยและแพทย์ที่มีความรู้ความชำนาญเกี่ยวกับโรคทางเดินอาหารทำงานผิดปกติกว่า 1,000 คน จากทั่วโลกมารวมตัวกัน โดยมุ่งหวังที่จะเสริมสร้างความเข้าใจเกี่ยวกับการเชื่อมโยงที่ซับซ้อนระหว่างระบบประสาทและระบบทางเดินอาหาร เพื่อพัฒนานวัตกรรมสำหรับการวินิจฉัยและการรักษาโรคที่เกิดจากทางเดินอาหารทำงานผิดปกติที่คนทั่วไปรู้จักกันดี ได้แก่ โรคกรดไหลย้อน โรคกระเพาะอาหาร ภาวะกระเพาะอาหารเคลื่อนไหวช้า โรคลำไส้แปรปรวน ภาวะท้องผูกเรื้อรัง เป็นต้น ความผิดปกติในระบบทางเดินอาหาร ถือเป็นปัญหาสุขภาพที่พบบ่อยมากในคนไทยและคนทั่วโลก ซึ่งมีผู้ป่วยเพิ่มมากขึ้นในแต่ละปี ทั้งนี้ เนื่องจากที่ผ่านมามีการแพร่ระบาดของโควิด-19 การประชุม FNM ครั้งที่ 5 จึงถูกเลื่อนจากปี 2022 เป็น 2024
ตารางแพทย์ออกหน่วยวันจันทร์
คลินิกทันตกรรมนอกเวลาราชการ (SMC) โรงพยาบาลบุรีรัมย์
คลินิกทันตกรรมนอกเวลาราชการ (SMC) โรงพยาบาลบุรีรัมย์
ตารางออกตรวจของแพทย์ ประจำเดือนพฤษภาคม 2567
เปิดบริการ ทุกวันอังคาร - พฤหัสบดี
เวลา 16.00 - 20.00 น. ณ อาคารอำนวยการเก่า ชั้น 3
ติดต่อสอบถามข้อมูลเพิ่มเติม
และโทรนัดล่วงหน้า 062-8190363
(เวลา 08.30 - 15.00 น.)
*** หมายเหตุ :
- ค่าบริการพิเศษ 50 บาท (เบิกคืนไม่ได้)
เช่น กรณี X-ray , ติดตามการรักษา เป็นต้น
- ค่าบริการตามสิทธิการรักษาและหัตถการการรักษา
สอบถามได้ที่ เคาน์เตอร์คลินิกทันตกรรม อาคารอำนวยการเก่า ชั้น 3
ขั้นตอนรับบริการ คลินิกนอกเวลา ณ ศูนย์สุขภาพมะฮอกกานี โรงพยาบาลวชิระภูเก็ต
คลินิกเฉพาะทางกระดูกสันหลัง กระดูกและข้อ นอกเวลาราชการ
รพ.สุโขทัยเปิดให้บริการคลินิกเฉพาะทางนอกเวลาราชการ เลือกพบแพทย์อายุรกรรมและกุมารแพทย์และแพทย์ออร์โธปิดิกส์ได้ตามวันเวลาที่กำหนด ใช้ระบบนัดหมายล่วงหน้า สะดวกสบายไม่เสียเวลา เสียค่าใข้จ่าย 300 บาท (ต้นสังกัดเบิกคืนได้ 50 บาท)ค่ายาและค่าตรวจอื่นๆ เบิกได้ตามสิทธ์ โทรนัดหมายที่เบอร์ 065-4721635
ปัญหาสิ่งแวดล้อมที่คนไทยกังวลมากที่สุด 3 อันดับแรก
ผลการสำรวจยังระบุว่า ปัญหาสิ่งแวดล้อมที่คนไทยกังวลมากที่สุด 3 อันดับแรก ได้แก่
- ภาวะโลกร้อน (ร้อยละ 30)
- มลภาวะทางอากาศ (ร้อยละ 27)
- และการเปลี่ยนแปลงของอากาศ/อุณหภูมิ (ร้อยละ 22)
สำหรับสาเหตุของปัญหามลภาวะทางอากาศ คนไทยมีความเห็นที่หลากหลาย โดยสาเหตุ 5 อันดับแรก ได้แก่
- ควันจากท่อไอเสียในการใช้รถยนต์ (ร้อยละ 30)
- การเผาขยะหรือผลิตผลทางการเกษตร (ร้อยละ 26)
- การใช้บรรจุภัณฑ์ที่ทำจากโฟมหรือพลาสติก (ร้อยละ 23)
- สารเคมีที่ใช้ในการก่อสร้าง รวมถึงฝุ่น ควันต่างๆ (ร้อยละ 22)
- และการเผาไหม้เชื้อเพลิง จากถ่านหิน น้ำมัน หรือก๊าซธรรมชาติ (ร้อยละ 21)
ครบรอบ 119 ปี โรงพยาบาลตากสิน Taksin in borderbrain
ครบรอบ 119 ปี โรงพยาบาลตากสิน "119 yrs Taksin Hospital – Taksin in borderbrain" ออกแบบ logo โดย เวชนิทัศน์ โรงพยาบาลตากสิน สำนักการแพทย์ กรุงเทพมหานครโรงพยาบาลตากสิน สำนักการแพทย์ กรุงเทพมหานคร
#118ปีโรงพยาบาลตากสินมาตรฐานก้าวไกลทันสมัยในบริการ #SCANพลิกชีวิต #คิดถึงสุขภาพเชื่อมั่นสำนักการแพทย์
สิทธิประโยชน์อื่นๆ นอกเหนือ ที่คุณจะได้รับ
สิทธิประโยชน์อื่นๆ นอกเหนือ ที่คุณจะได้รับ
1. โปรแกรมตรวจสุขภาพเสริม ตรวจคัดกรองมะเร็งชาย ราคา 1,500 บาท/ตรวจคัดกรองมะเร็งหญิง 1,500 บาท และรายการตรวจสุขภาพเพิ่มเติม ราคาพิเศษ
2. ฉีดวัคซีนไข้หวัดใหญ่ ในราคา 450 บาท
3. ส่วนลดค่าห้องพัก สำหรับผู้ประกันตน
- ผู้ประกันตนสิทธิ์ประกันสังคมโรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา กรณีผู้ป่วยใน (IPD) ต้องการอัพเกรดจากห้องรวมสามัญตามสิทธิ์ เป็นห้องพิเศษเตียงเดี่ยว จ่ายส่วนต่างค่าห้อง 3,500 บาท ต่อ 1 คืน ตั้งแต่ วันที่ 1 มกราคม 2567 - 31 พฤษภาคม 2567
- ผู้ประกันตนสิทธิ์ประกันสังคมโรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา กรณีผู้ป่วยใน (IPD) ต้องการอัพเกรดจากห้องรวมสามัญตามสิทธิ์ เป็นห้องรวมสามัญพิเศษ 4 เตียง จ่ายส่วนต่างค่าห้อง 1,500 บาท ต่อ 1 คืน ตั้งแต่ วันที่ 1 มกราคม 2567 - 31 พฤษภาคม 2567
แพทย์หญิงพัชยาพรรณ ภูมิศิริวิไล
ออกตรวจคลินิกในเวลา
วันที่ 13-17 พฤษภาคม 2567
เวลา 8.00-16.00 น. ยกเว้นวันพุธ
1.CRA Ambulance Boat : เรือฉุกเฉินต้นแบบเพื่อนำส่งผู้ป่วยในพื้นที่ทุรกันดาร


1. ผลงาน CRA Ambulance Boat : เรือฉุกเฉินต้นแบบเพื่อนำส่งผู้ป่วยในพื้นที่ทุรกันดาร ที่มีการประสานผ่านระบบ Telemedicine โดย อ.มัตติกา ใจจันทร์ และ อ.ดร.เชิดศักดิ์ ดวงจันทร์ อาจารย์จากวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี และคณะ ได้รับรางวัลเหรียญทอง (Gold Medal), รางวัล Special Award จาก Association of Polish Inventors and Rationalizers และรางวัล Special Award จาก National Research Council of Thailand (NRCT) โดย CRA Ambulance Boat เป็นเรือฉุกเฉินต้นแบบเพื่อนำส่งผู้ป่วยในพื้นที่ทุรกันดาร มีจุดเด่น คือ ออกแบบโดยใช้กระบวนการวิจัยแบบ Multimethod ทีมผู้พัฒนาเป็นแบบสหวิชาชีพ โครงสร้างมีความเหมาะสมกับการส่งต่อผู้ป่วยทางน้ำในพื้นที่ที่มีสิ่งกีดขวาง หน้าเรือออกแบบให้เปิดกว้างและสามารถเทียบตลิ่งหรือท่าเทียบเรือเพื่อสะดวกต่อการลำเลียงผู้ป่วยขึ้น-ลง ท้องเรือออกแบบเป็นรูปตัว M เพื่อให้มีเสถียรภาพต่อการทำหัตถการ สื่อสารผ่านระบบ Telemedicine เชื่อมโยงกับห้องฉุกเฉินของโรงพยาบาลปลายทาง เพื่อแสดงผลการประเมินสภาพผู้ป่วยและพิจารณาการรักษาแบบ แบบ Real time
คลินิกพิเศษอายุรกรรม โสตศอนาสิก สูตินรีเวช จักษุ ทันตกรรม รพ.สมุทรปราการ
หน่วยอายุรกรรม คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกอายุรกรรม
**กรุณานัดหมายล่วงหน้า**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์-อาทิตย์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396360 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ตรวจผู้ป่วยนอกเฉพาะทางอายุรกรรมที่ไม่ฉุกเฉิน รวมทั้งทำหัตถการเพื่อประกอบการวินิจฉัยและบำบัดรักษาแก่ผู้ที่มีอายุตั้งแต่ 15 ปีขึ้นไป โดยทีมแพทย์อายุรกรรมทั่วไปและอายุรกรรมเฉพาะทาง ดังต่อไปนี้
- อายุรกรรมทั่วไป
- อายุรกรรมโรคติดเชื้อ
- อายุรกรรมโรคปอด
- อายุรกรรมโรคข้อ
- อายุรกรรมโรคโลหิตวิทยา
- อายุรกรรมโรคไต
- อายุรกรรมโรคหัวใจ
- อายุกรรมโรคทางเดินอาหารและตับ
- อายุรกรรมโรคระบบประสาทวิทยา
- อายุรกรรมทางด้านโภชนาการ
- อายุกรรมโรคต่อมไร้ท่อและเมแทบอลิซึม
คลินิกบริการประเภทผู้ป่วยนอก
คลินิกบริการประเภทผู้ป่วยนอก
วันจันทร์
อายุรกรรม (ชั้น 3)
- ศัลยกรรมทั่วไป (ชั้น 1) จันทร์ที่ 1 , 3
- ศัลยกรรมทางเดินปัสสาวะ (ชั้น 1) จันทร์ที่ 1 , 3
จักษุวิทยา (ชั้น 4)
ตรวจพิเศษฉายรังสี ศูนย์มะเร็งขอนตาล
วันอังคาร
อายุรกรรม(ชั้น 3)
กุมารเวชกรรม (ชั้น 2)
จักษุวิทยา (ชั้น 4)
ตรวจพิเศษฉายรังสี
ศูนย์มะเร็งขอนตาล
วันพุธ
อายุรกรรม(ชั้น 3) ศัลยกรรมกระดูกและข้อ (ชั้น 3) วันพุธที่ 1 , 3 , 5
จักษุวิทยา(ชั้น 4) ตรวจพิเศษทางรังสี CT และ US ทุกวันพุธ ตรวจพิเศษฉายรังสี ศูนย์มะเร็งขอนตาล
วันพฤหัสบดี
อายุรกรรม(ชั้น 3) ศัลยกรรมกระดูกและข้อ (ชั้น 3) ทุกพฤหัส
กุมารเวชกรรม (ชั้น 2)
จักษุวิทยา (ชั้น 4) ไม่รับ Walk in
ตรวจพิเศษฉายรังสี ศูนย์มะเร็งขอนตาล
วันศุกร์
อายุรกรรม (ชั้น 3) ตรวจพิเศษฉายรังสี ศูนย์มะเร็งขอนตาล
วันเสาร์
อายุรกรรม(ชั้น 3)
ศัลยกรรมกระดูกและข้อ (ชั้น 1) ทุกเสาร์
ศัลยกรรมทั่วไป (ชั้น 1) เสาร์ที่ 1 , 4
ศัลยกรรมทางเดินปัสสาวะ (ชั้น 1) เสาร์ที่ 2
ศัลยกรรมระบบประสาท (ชั้น 1) เสาร์ที่ 3
ศัลยกรรมทรวงอก (ชั้น 1) เสาร์ที่ 3
กุมารเวชกรรม (ชั้น 2)
จักษุวิทยา (ชั้น 4)
ตรวจพิเศษฉายรังสี ศูนย์มะเร็งขอนตาล
คลินิกพิเศษศัลยกรรมทางเดินปัสสาวะ เฉพาะทางนอกเวลา โรงพยาบาลอุตรดิตถ์
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันจันทร์
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี
สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
จ่ายยาเฉพาะคนป่วย (ที่มาเอง)
จ่ายยาเฉพาะคนป่วย (ที่มาเอง) เท่านั้น
หากไม่ป่วย ไม่มีอาการ จะไม่จ่ายยาให้นะ
คณะกรรมการตัดสิน
ผลงานที่ส่งเข้าประกวด Healthcare Asia Awards 2024 ได้รับการตัดสินโดยคณะกรรมการผู้ทรงคุณวุฒิซึ่งประกอบด้วย Partha Basumatary อาจารย์ใหญ่ของ Boston Consulting Group; Guillaume Sachet หัวหน้าฝ่ายการดูแลสุขภาพและวิทยาศาสตร์ชีวภาพที่ KPMG ในสิงคโปร์; Chris Hardesty หุ้นส่วนของ Pureland Venture; ดร. สเตฟานี อัลเลน หุ้นส่วนอาวุโส ผู้นำด้านการดูแลสุขภาพและวิทยาศาสตร์ชีวภาพแห่งเอเชียแปซิฟิกที่ Kearney; Abhay Bangi หุ้นส่วน หัวหน้าฝ่ายวิทยาศาสตร์สุขภาพและสุขภาพ APAC ที่ EY-Parthenon; และกวิตา เรคราช ผู้นำด้านชีววิทยาศาสตร์และการดูแลสุขภาพของ Deloitte Asia Pacific และ Southeast Asiaศูนย์บริการสาธารณสุข กรุงเทพเหนือ และ กรุงเทพใต้
กรุงเทพเหนือ
- จตุจักร ศูนย์บริการสาธารณสุข 17
- ดอนเมือง ศูนย์บริการสาธารณสุข 60
- บางซื่อ ศูนย์บริการสาธารณสุข 3 / ศูนย์บริการสาธารณสุข 19
- บางเขน ศูนย์บริการสาธารณสุข 24
- ลาดพร้าว ศูนย์บริการสาธารณสุข 66
- สายไหม ศูนย์บริการสาธารณสุข 61
- หลักสี่ ศูนย์บริการสาธารณสุข 53
กรุงเทพใต้
- คลองเตย ศูนย์บริการสาธารณสุข 41
- บางคอแหลม ศูนย์บริการสาธารณสุข 12 / ศูนย์บริการสาธารณสุข 18
- บางนา ศูนย์บริการสาธารณสุข 8
- บางรัก ศูนย์บริการสาธารณสุข 23
- ปทุมวัน ศูนย์บริการสาธารณสุข 16
- พระโขนง ศูนย์บริการสาธารณสุข 34
- ยานนาวา ศูนย์บริการสาธารณสุข 7
- วัฒนา ศูนย์บริการสาธารณสุข 21
- สาทร ศูนย์บริการสาธารณสุข 14 / ศูนย์บริการสาธารณสุข 63
- สวนหลวง ศูนย์บริการสาธารณสุข 22
1 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดโสมนัส
2 ศูนย์พัฒนาเด็กก่อนวัยเรียนมัสยิดมหานาค
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
3 ศูนย์พัฒนาเด็กก่อนวัยเรียนบ้านบาตร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
4 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเคหะชุมชนบ่อนไก่
5 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาบ่อนไก่
6 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโรงสี
7 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบัวหลวง
8 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสามัคคีรวมใจ
9 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโสณมัย - อร่ามดวง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
10 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนปรีชา 1
11 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเย็นอากาศ 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
12 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดสวัสดิวารีสีมาราม
13 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดญวน - คลองลำปัก
14 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบึงพระราม 9
15 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบึงพระราม 9 พัฒนา
16 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมทางรถไฟโค้งอโศก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
17 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมคลองบางซื่อ รัชดาภิเษก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
18 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนซอยรุ่งเรืองตอนปลาย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
19 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโรงปูนฝั่งใต้
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
20 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดธรรมมงคล
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
21 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านนิรันดร์วิลล่า
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
22 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโครงการร่วมกันสร้าง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
23 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุขสันต์ 26
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
24 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนลำสาลีพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
25 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชน 101 บึงทองหลาง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
26 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอนันต์สุขสันต์ รุ่น18-20
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
27 ศูนย์พัฒนาเด็กก่อนวัยเรียนเจริญศิริในชุมชนอาคารสวัสดิการ นทพ.
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
28 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัชรปราณี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
29 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเพชรสยาม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
30 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอันนูรอยย์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
31 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุภาวัลย์-เทพารักษ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
32 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมีนบุรีอุปถัมภ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
33 ศูนย์พัฒนาเด็กก่อนวัยเรียนสามัคคีคลองสองต้นนุ่น
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
34 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอิดซ์ฮาร์ดพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
35 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวังทองพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
36 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านปรีชา 10
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
37 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนรามอินทราเนรมิตร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
38 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนราษฎร์พัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
39 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนคู้ล่างสร้างสรรค์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
40 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบางชันพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
41 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนดารุ้ลมุกีมอุปถัมภ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
42 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดพลมานีย์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
43 ศูนย์พัฒนาเด็กก่อนวัยเรียนฟื้นนครร่มเกล้า ระยะ 1 โซน 7
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
44 ศูนย์พัฒนาเด็กก่อนวัยเรียนสุทธาโภชน์ สุนทรอุปถัมภ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
45 ศูนย์พัฒนาเด็กก่อนวัยเรียนหมู่บ้านพัฒนา (ทิพพาวาส)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
46 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดราชโกษา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
47 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมิตรสามัคคีฟื้นนครร่มเกล้าระยะ 6 โซน 12
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
48 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมิตรสามัคคีฟื้นนครร่มเกล้าระยะ 5 โซน 11
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
49 ศูนย์พัฒนาเด็กก่อนวัยเรียนฟื้นนครร่มเกล้าระยะ 4 โซน 10
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
50 ศูนย์พัฒนาเด็กก่อนวัยเรียนฟื้นนครร่มเกล้าระยะ 3 โซน 8
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
1.Health Tech สนง.เขตหนองแขม
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ สำนักงานเขตหนองแขม ตั้งอยู่หน้าสำนักงานเขตหนองแขม (ขับรถมาจอดใน “สำนักงานเขต” ได้เลย) เปิดทำการวันจันทร์-วันเสาร์ เวลา 8:00 – 17:00 น. บริการดูแลรักษาตอบโจทย์ทุกวัย พร้อมดูแลอาการ เจ็บป่วย 42 กลุ่มโรค/อาการ และ 12 กลุ่มโรคไม่ติดต่อเรื้อรัง มีเจ้าหน้าที่และพยาบาลวิชาชีพประจำ พร้อมให้บริการ
รศ. นพ.ฉันชาย สิทธิพันธุ์ คณบดีคณะแพทยศาสตร์ จุฬาลงกรณ์ มหาวิทยาลัย กล่าวว่า คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เล็งเห็นถึงความ สำคัญของนวัตกรรมทางการศึกษาเป็นอย่างยิ่ง และพร้อมที่จะผลักดันให้แพลตฟอร์ม MedUMORE เป็นโมเดลการเรียนการสอน ที่จะเปลี่ยนแปลงรูปแบบการศึกษาแพทย์ แบบดั้งเดิมไปสู่รูปแบบใหม่ที่มีประสิทธิภาพและตอบโจทย์การพัฒนาบัณฑิตแพทย์ยุคใหม่ได้มากยิ่งขึ้น ดังนั้นการผสานความร่วมมือกับสถาบันการศึกษา และองค์กรทางการแพทย์ ชั้นนำในระดับประเทศและต่างประเทศ มีส่วนช่วยให้แพลตฟอร์มการเรียนรู้อย่าง MedUMORE แข็งแกร่งและเป็นประโยชน์แก่ประเทศชาติและโลกอย่างมาก
ทริปที่ 1 โปรแกรมไหว้สา พระธาตุศักดิ์สิทธิ์ มนต์เสน่ห์ ดินแดนล้านนาตะวันออก เส้นทาง กรุงเทพ - เด่นชัย - แพร่ – น่าน
ทริปที่ 1 โปรแกรมไหว้สา พระธาตุศักดิ์สิทธิ์ มนต์เสน่ห์ ดินแดนล้านนาตะวันออก เส้นทาง กรุงเทพ - เด่นชัย - แพร่ – น่าน (เดินทางด้วยขบวนอุตราวิถีขบวน 9 และขบวน 10) เดินทางวันที่ 10 - 14 กรกฎาคม 2567 จำนวน 5 วัน 4 คืน (นอนบนรถไฟ 2 คืน) อัตราค่าโดยสารท่านละ 11,199 บาท (จำกัดทริปละ 38 ที่นั่งเท่านั้น)
กำหนดการ
- วันที่ 1 สักการะวัดภูมินทร์ (ภาพกระซิบรักบรรลือโลก) / พิพิธภัณฑ์สถานแห่งชาติน่าน (อุโมงค์ต้นลีลาวดี - งาช้างดำ) / โฮงเจ้าฟองคำ / กิจกรรมทำตุงล้านนาวัดศรีเกิด / วัดช้างค้ำวรวิหาร
- วันที่ 2 สักการะวัดพระราตุเขาน้อย (แลนมาร์คสายอินสตราแกรม) / วัดพระธาตุแช่แห้ง (วัดประจำปีเกิด ปีเถาะ) / แหล่งผลิตผ้าหม้อฮ่อม / วัดพระธาตุช่อแฮ
- วันที่ 3 พิพิธภัณฑ์โกมลผ้าโบราณ / สถานีรถไฟบ้านปิน / ลิ้มรสขนมจีนน้ำย้อยของอำเภอลอง คุ้มเจ้าหลวง / วัดจอมสวรรค์วิจิตรแห่งสถาปัตยกรรม
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันอังคารที่ 2 กรกฎาคม 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 6 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 3 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองคู้บนพัฒนา แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 4 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองยายชุ่มอุทิศ แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 9 กรกฎาคม 2567 ที่วัดศรีเอี่ยม แขวงบางนาเหนือ เขตบางนา เวลา 9.00 - 12.00 น.
- วันพุธที่ 10 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองสุกกาทอง แขวงโคกแฝด เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 11 กรกฎาคม 2567 ที่วัดพรหมวงศาราม (วัดหลวงพ่อเณร) แขวงรัชดาภิเษก เขตดินแดง เวลา 9.00 - 12.00 น.
- วันจันทร์ที่ 15 กรกฎาคม และ วันอังคารที่ 16 กรกฎาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ร่วมดำเนินโครงการ "สัตวแพทย์อาสาจุฬาภรณ์ กรุงเทพมหานคร" โดยจัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จำนวน 300 ตัว ณ บริเวณหน้าอาคารจักรพิชัยรณรงค์สงคราม ด้านหลังโรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ บางเขน แขวงลาดยาว เขตจตุจักร เวลา 7.00 - 12.00 น.
- วันพุธที่ 17 กรกฎาคม 2567 ที่ชุมชนรุ่งเรือง แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 กรกฎาคม 2567 ที่ วัดกุนนทีรุทธาราม เขตดินแดง เวลา 8.30 ถึง 11.00 น.
- วันพฤหัสบดีที่ 25 กรกฎาคม 2567 วัดไผ่ตัน แขวงพญาไท เขตพญาไท เวลา 9.00 - 12.00 น.
“สำหรับช่วงเช้า เราเน้นกลุ่มกิจกรรมวิชาการอย่างฐานมหัศจรรย์ ที่สร้างความสนใจสาขาวิชาในกลุ่มวิทย์-คณิตมากขึ้น รวมถึงมีกิจกรรมดาราศาสตร์ให้น้องๆ ได้ฝึกการใช้กล้องโทรทรรศน์และดูดาวด้วยตาเปล่าในพื้นที่จริง และกิจกรรมไฮไลท์ที่หลายคนสนใจกันมากคือ 4 ฐานปฏิบัติการทางวิทยาศาสตร์และคณิตศาสตร์ เพราะเราเข้าใจว่าในห้องเรียน น้องๆ อาจจะยังไม่มีโอกาสได้จับอุปกรณ์มากนัก แต่สำหรับค่ายนี้เราจัดเต็มกับกิจกรรมแล็บ เพื่อให้น้องๆ ทุกคนได้ทดลองกันอย่างเต็มที่ เช่นได้ลองทำสไลด์ส่องกล้องดูเนื้อเยื่อเอง พร้อมทั้งเราได้นำนวัตกรรมใหม่อย่างกล้องจุฬาสมาร์ทเลนส์ที่คล้ายกล้องจุลทรรศน์ให้น้องๆ ได้ทดลองใช้เป็นครั้งแรก
ศ.เกียรติคุณ พญ.วรรณี นิธิยานันท์ นายกสมาคมโรคเบาหวานแห่งประเทศไทยฯ
ศ.เกียรติคุณ พญ.วรรณี นิธิยานันท์ นายกสมาคมโรคเบาหวานแห่งประเทศไทยฯ กล่าวถึงสถานการณ์โรคเบาหวานทั่วโลก IDF Diabetes Atlas ปี 2564 มีผู้ป่วยจำนวน 537 ล้านคน และคาดว่าในปี 2573 จะมีผู้ป่วยเบาหวานเพิ่มขึ้นเป็น 643 ล้านคน ซึ่งโรคเบาหวานมีส่วนทำให้เสียชีวิตสูงถึง 6.7 ล้านคน หรือเสียชีวิต 1 ราย ในทุกๆ 5 วินาที ขณะที่เบาหวานในกลุ่มเด็กและวัยรุ่น ในปี 2565 สูงกว่า 1.52 ล้านคน และคาดการณ์ว่าจะเพิ่มขึ้นเป็น 2 ล้านคนภายในปี 2588 ซึ่งนับว่าเป็นอัตราการเพิ่มที่สูงมาก ซึ่งเป็นปัญหาที่น่าเป็นห่วง และส่งผลกระทบต่อภาวะเศรษฐกิจและสังคมอย่างยิ่งในอนาคต
สำหรับความท้าทายในการลดอัตราผู้เป็นเบาหวานรายใหม่ จำเป็นต้องอาศัยความร่วมมือจากทุกภาคส่วน โดยควรเร่งบูรณาการ มุ่งเน้นการทำงานอย่างสอดคล้องและไปในทิศทางเดียวกัน เพื่อสร้างความตระหนักรู้เกี่ยวกับเบาหวานในเด็กและวัยรุ่น ส่งเสริมให้เด็กและวัยรุ่นมีพฤติกรรมการกินที่ดีต่อสุขภาพ เพิ่มโอกาสให้เด็กและวัยรุ่นได้ออกกำลังกายอย่างสม่ำเสมอ ที่สำคัญควรพัฒนาระบบการคัดกรองและวินิจฉัยโรคเบาหวานในเด็กและวัยรุ่น และสนับสนุนการเข้าถึงการดูแลรักษาที่มีประสิทธิภาพ
นายชัชชาติ สิทธิพันธุ์ ผู้ว่ากรุงเทพมหานคร กล่าวว่า “เนื่องจากสภาพภูมิทัศน์ของกรุงเทพมหานครที่หลากหลายและอาจเอื้อให้เกิดแหล่งเพาะพันธุ์ยุงลาย เพื่อป้องกันและควบคุมไข้เลือดออก กทม.จึงดำเนินการเชิงรุกในพื้นที่ชุมชน โรงเรียน และศาสนสถาน โดยการเฝ้าระวังการเพาะพันธุ์ของลูกน้ำยุงลาย การสำรวจและกำจัดแหล่งเพาะพันธุ์ลูกน้ำยุงลายในพื้นที่ชุมชน การปรับภูมิทัศน์สิ่งแวดล้อม จัดทำ Big Cleaning Day ลงพื้นที่ชุมชนอย่างต่อเนื่อง และย้ำเตือนแก่ประชาชนและอาสาสมัครสาธารณสุขทั้ง 50เขต ซึ่งเป็นเส้นเลือดฝอยในการที่ช่วยกระจายความรู้ ร่วมกับการย้ำเตือนถึงวิธีลดความเสี่ยงของการแพร่กระจายด้วยการมาตรการการป้องกันไข้เลือดออก พร้อมทั้งใช้แอปพลิเคชัน Line ในการสื่อสารความเสี่ยงให้ประชาชนทราบถึงภัยของไข้เลือดออกและแนวทางในการป้องกันตนเองที่สามารถเข้าถึงได้สะดวกและรวดเร็ว นอกจากการป้องกันแบบบูรณาการแล้ว อัตราการเสียชีวิตจากโรคไข้เลือดออกจะลดลงได้ตามเป้า หากเราทุกคนมาร่วมกันเป็น เดงกี่ ฮีโร่ นำพาชุมชนไปสู่สังคมปลอดไข้เลืออดออกด้วยกัน”
ศาสตราจารย์ ดร.เอียน เฟนวิค (Prof. Ian Fenwick, Ph.D.) ผู้อำนวยการศศินทร์ เน้นย้ำถึงพันธกิจของศศินทร์ในการสร้างแรงบันดาลใจ เชื่อมต่อ และเปลี่ยนแปลงเพื่อโลกที่ดีขึ้น อัจฉริยะขึ้น และยั่งยืน ย้อนกลับไปเมื่อกว่าสี่ทศวรรษ ศศินทร์ก่อตั้งขึ้นภายใต้ความร่วมมือระหว่างจุฬาลงกรณ์มหาวิทยาลัย Kellogg School of Management และ The Wharton School ศศินทร์เป็นสถาบันสอนธุรกิจแห่งแรกของประเทศไทยที่ได้รับการรับรองตามมาตรฐานระดับสากลจาก AACSB และ EQUIS ปัจจุบันศศินทร์ยังคงขยายความร่วมมือกับมหาวิทยาลัยชั้นนำทั่วโลกอย่างต่อเนื่อง “โลกทุกวันนี้มีสิ่งให้เราเรียนรู้ได้ไม่มีวันหมด และต่อให้คุณจะเรียนรู้ทุกอย่างเกี่ยวกับโลกในวันนี้ได้ทั้งหมด พอถึงวันพรุ่งนี้ ความรู้เหล่านั้นก็จะล้าสมัยเสียแล้ว สิ่งที่เราต้องทำคือการสร้างแรงบันดาลใจให้ผู้คนแสวงหาความรู้ใหม่ๆ อย่างต่อเนื่อง และเชื่อมโยงพวกเขากับคนที่มีความคิดเหมือนกันเพื่อสร้างพลังในการเปลี่ยนแปลงธุรกิจ เปลี่ยนแปลงโลก และเปลี่ยนแปลงสังคม และองค์ประกอบสำคัญอย่างหนึ่งของการเปลี่ยนแปลงนั้นก็คือทักษะการเป็นผู้ประกอบการ” ศจ. ดร. เอียน กล่าว
ศ.พญ. ดารินทร์ ซอโสตถิกุล แพทย์ผู้ชำนาญการเฉพาะทางกุมารเวชศาสตร์โรคเลือดและมะเร็ง โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรคมะเร็ง เป็นสาเหตุของการเสียชีวิตอันดับต้น ๆ ของเด็กและวัยรุ่นทั่วโลก ซึ่งในประเทศไทย พบเด็กป่วยเจากการสำรวจพบว่า เด็กไทยเป็นมะเร็ง 1,000 คนต่อปี โดยมะเร็งในเด็กที่พบบ่อย ได้แก่ มะเร็งเม็ดเลือดขาวชนิดเฉียบพลัน มะเร็งต่อมน้ำเหลือง และมะเร็งสมองและระบบประสาท ตามลำดับ แม้ว่ามะเร็งในเด็กไม่สามารถป้องกันได้ เพราะไม่มีสาเหตุแน่ชัด แต่อาจเกิดจากโรคพันธุกรรมบางอย่าง เช่น ดาวน์ซินโดรม มารดาสัมผัสสารกัมมันตภาพรังสีหรือสารแกมมาในเอกซเรย์ขณะตั้งครรภ์ แต่หากวินิจฉัยได้เร็วและทำการรักษาในทันที เด็กมีจะโอกาสรักษาให้หายขาดได้กว่า 70-80%
ศูนย์กุมารเวช โรงพยาบาลบำรุงราษฎร์ มีแพทย์สหสาขาที่มีความชำนาญในการวินิจฉัยมะเร็งได้อย่างรวดเร็วและแม่นยำ ผู้ป่วยสามารถรับผล CT Scan หรือ MRI ภายใน 1-2 วัน นอกจากนี้ ยังมีพยาธิแพทย์ที่อ่านผลชิ้นเนื้อได้รวดเร็ว สามารถสรุปผลเพื่อเริ่มการรักษาได้ทันที ซึ่งการรักษามะเร็งในเด็กมีหลากหลายวิธี ได้แก่ การให้ยาเคมีบำบัด การฉายแสง และการผ่าตัด ทั้งนี้ การรักษามะเร็งในเด็กโดยส่วนใหญ่จะเป็นการให้ยาเคมีบำบัด โดยโรงพยาบาลบำรุงราษฎร์ เป็นหนึ่งในไม่กี่โรงพยาบาลเอกชนไม่กี่แห่งในประเทศไทย ที่สามารถให้ยาเคมีบำบัดหรือคีโมเป็นยามุ่งเป้าในการรักษามะเร็งในเด็ก นอกจากนี้ เรายังมีกุมารแพทย์เฉพาะทาง และทีมสหสาขาที่ครบครัน เช่น เภสัชกรที่มีความเชี่ยวชาญการผสมยาเคมีบำบัด และนักโภชนาการที่ให้คำแนะนำเรื่องการรับประทานอาหารได้อย่างถูกหลักโภชนาการและเพื่อหลีกเลี่ยงผลข้างเคียงจากยา ทำให้สามารถรักษาโรคยากและซับซ้อนได้ภายในระยะเวลาอันรวดเร็ว
ภายในงานมีกิจกรรมเวิร์คช็อป อาทิ การตรวจปอดและหัวใจกับหุ่นจำลอง รุ่นพี่ให้คำแนะนำการเตรียมตัวเพื่อเข้าเรียนในสาขาวิชาต่างๆ การทำแฟ้มสะสมผลงานเพื่อใช้สมัครเข้าศึกษา ตัวอย่างแฟ้มสะสมผลงานของรุ่นพี่ที่ผ่านการคัดเลือกเข้าสัมภาษณ์ และแนะนำการตอบคำถามให้โดนใจคณะกรรมการ นักศึกษารุ่นพี่รังสีเทคนิคสาธิตการใช้งานเครื่องเอกซเรย์ระบบดิจิทัลแบบพกพา “AirTouch portable X-ray” และ ทดลองให้น้องๆ ใส่ชุดตะกั่วป้องกันรังสีและสาธิตขั้นตอนปฏิบัติงานของนักรังสีเทคนิค ฝึก CPR กดหน้าอก ปั๊มหัวใจจากนักฉุกเฉินการแพทย์ สาธิตการทำแผลและอุปกรณ์ทางการพยาบาล ฐานฉีดยากับหุ่นติดไฟเขียวแดง และฐานทำคลอดจากรุ่นพี่นักศึกษาสาขาพยาบาลศาสตร์ เป็นต้น
*ภาพ น้องๆ ให้ความสนใจกับเครื่องฟังเครื่องหัวใจ
การออกแบบผลิตภัณฑ์และรสชาติ
อุตสาหกรรมได้เร่งเปิดตัวและทำการตลาดผลิตภัณฑ์ที่มีการปรุงแต่งรสชาติหลากหลาย และขยายออกไปอย่างกว้างขวางทั่วทั้งภูมิภาคในช่วงหลายปีที่ผ่านมา งานวิจัยยืนยันว่า
รสชาติ เป็นเหตุผลหลัก ที่ดึงดูดใจให้เยาวชน อยากลองใช้บุหรี่ไฟฟ้า และนิโคตินและยาสูบอื่นๆ [5, 6]
ในกรณีที่ไม่มีข้อจำกัดทางกฎหมาย ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง ผลิตและจำหน่ายผลิตภัณฑ์บุหรี่ไฟฟ้า ใน หลากหลายรสชาติ เช่น ผลไม้และขนมหวาน และมีให้เลือกกว่า 16,000 รสชาติ
อุตสาหกรรมพบวิธีหลีกเลี่ยงการห้ามใช้รสชาติ
อุตสาหกรรมหลบเลี่ยงข้อห้ามการขายบุหรี่ปรุงแต่งรสชาติ ด้วยการปรับสูตรผลิตภัณฑ์ใหม่ โดยยังคงรูปลักษณ์ที่น่าดึงดูดเช่นเดิมไว้ หรือไม่ก็เปิดตัวอุปกรณ์ใหม่ๆ อย่างแคปซูลรส หรือ บุหรี่แพ็ค มาเป็นส่วนเสริม การทบทวนงานวิจัยที่มีอยู่อย่างเป็นระบบเกี่ยวกับ บุหรี่แคปซูลที่มีรสชาติ พบว่าผลิตภัณฑ์เหล่านี้ เกี่ยวข้องกับคนหนุ่มสาว ดังนี้ [7]
- แบบสำรวจที่มุ่งเน้นเยาวชนชี้ว่า พวกเขาชอบ "รสชาติ" มากกว่า "ผลิตภัณฑ์" : การสำรวจยาสูบในกลุ่มเยาวชนแห่งชาติประจำปีของสหรัฐอเมริกา ปี 2023 [8] และการศึกษาเยาวชนในปี 2022 ออสเตรเลีย [9] พบว่าในปัจจุบัน เกือบ 9 ใน 10 ผู้ใช้บุหรี่ไฟฟ้าใช้ผลิตภัณฑ์ที่ปรุงแต่งรสชาติ
- รสชาติทำให้เยาวชนติดใจ: งานวิจัยอื่นๆ ในประเทศสหรัฐอเมริกาพบว่ามากกว่า 70% ของผู้ใช้บุหรี่ไฟฟ้ารุ่นเยาว์จะเลิกใช้หากผลิตภัณฑ์นั้น มีเฉพาะรสยาสูบเท่านั้น [10]
ผู้ผลิตบุหรี่ไฟฟ้า จะผลิตสินค้าในหลากหลายรูปแบบ ตั้งแต่ ออกแบบที่มีลักษณะคล้ายของเล่น ลูกอมหรือเครื่องดื่มที่เหมาะกับเด็ก ใช้ตัวการ์ตูน หรือ ออกแบบล้ำสมัยในรุ่นจำนวนจำกัด ซึ่งดึงดูดใจคนหนุ่มสาวได้มาก บางทีก็ออกแบบโดยแฝงหรือร่วมไปกับการใช้งานของผลิตภัณฑ์ต่างๆ เช่น สามารถนำมารวมเข้ากับเสื้อฮู้ด หรือทำให้มีรูปแบบคล้ายปากกา ลิปสติกหรือนาฬิกา ที่สามารถซ่อนได้ โดยเฉพาะจาก ครูและผู้ปกครอง และใช้ในสถานที่ที่ปกติแล้วจะห้ามการสูบบุหรี่ หรือไม่อนุญาตให้ใช้บุหรี่ไฟฟ้า
อุตสาหกรรมพยายามแทรกแซง การกำหนดนโยบายด้านสาธารณสุขที่เกี่ยวข้องกับผลิตภัณฑ์เหล่านี้ โดยแนะนำว่าเป็นทางเลือกที่ลดความเสี่ยงสำหรับผู้ใหญ่ ผู้สูบบุหรี่หรือทำหน้าที่เป็นผู้ช่วยในการเลิกบุหรี่ แต่งานวิจัยชี้ให้เห็นถึงความเป็นจริงที่แตกต่างออกไป: เด็กอายุ 13-15 ปี เป็นกลุ่มที่งใช้ บุหรี่ไฟฟ้าในอัตราที่สูงกว่าผู้ใหญ่ในทุกภูมิภาคของ WHO [11] ส่วนใหญ่จะไม่เคยเป็นผู้สูบบุหรี่มาก่อน: การศึกษาของสหรัฐอเมริกาพบว่าเกือบสามในสี่ของ ผู้ใช้บุหรี่ไฟฟ้าอายุ 18–24 ปีไม่เคยสูบบุหรี่ [12]
ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน นครชัยบุรินทร์ อ.ปากช่อง จ.นครราชสีมา
ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน "นครชัยบุรินทร์" อำเภอปากช่อง จังหวัดนครราชสีมา สร้างขึ้นเพื่อสนองพระปณิธาน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี ในฐานะองค์ประธานกรรมการขับเคลื่อนการดำเนินโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ที่มีพระปณิธานแน่วแน่ที่จะให้โรคพิษสุนัขบ้าหมดไปจากประเทศไทย
ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน เพื่อสร้างความรู้ความเข้าใจในการจัดการสถานพักพิงสัตว์ และเป็นแนวทางในการดำเนินงานระหว่างหน่วยงานที่เกี่ยวข้อง เพื่อให้เกิดการแก้ปัญหา ควบคุมโรคพิษสุนัขบ้า และควบคุมการขยายพันธุ์ของสุนัขจรจัดอย่างยั่งยืน โดยเป็นศูนย์พักพิงต้นแบบ ที่มีระบบการจัดการตามมาตรฐานสากลที่ใหญ่ที่สุดของภาคตะวันออกเฉียงเหนือ ที่ดูแลควบคุมโรคพิษสุนัขบ้าและโรคจากสัตว์สู่คน
ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน ก่อสร้างบนเนื้อที่ 30 ไร่ บนถนนมิตรภาพ อ.ปากช่อง จ.นครราชสีมา รองรับสุนัขได้ประมาณ 1,500 ตัว ในกลุ่มจังหวัดนครชัยบุรินทร์ ได้แก่ จังหวัดนครราชสีมา ชัยภูมิ บุรีรัมย์ และสุรินทร์ ให้มีชีวิตความเป็นอยู่ที่ดีขึ้น มีที่อยู่อาศัยเหมาะสม มีอาหารและน้ำอย่างเพียงพอ มีสุขอนามัยที่ดี ลดปัญหาสุนัขจรจัดสร้างความเดือดร้อนแก่ประชาชน โดยมีสัตวแพทย์และเจ้าหน้าที่ประจำศูนย์พักพิงฯ ดูแลและตรวจรักษาวินิจฉัยโรคสุนัข ที่ยึดหลักสวัสดิภาพสัตว์เป็นสำคัญ
- 906 ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน นครชัยบุรินทร์ ต.หนองสาหร่าย อ.ปากช่อง จ.นครราชสีมา
- โทร 044-300731
- Facebook | TikTok
- ร่วมแบ่งปันช่วยเหลือสุนัขไร้บ้านและเจ็บป่วยที่ศูนย์พักพิงสัตว์เลี้ยงไร้บ้าน นครชัยบุรินทร์ สามารถสมทบทุนได้ที่ บัญชีธนาคารทหารไทยธนชาติ เลขที่ 069-2-73048-4 หรือ ธนาคารกรุงเทพ เลขบัญชี 043-730490-0 ชื่อบัญชี "มูลนิธิทิพย์พิมานเพื่อสัตว์ป่วยและสัตว์ไร้ที่พึ่ง ในพระอุปถัมภ์"
ศูนย์พักพิงสุนัขกรุงเทพมหานคร
ศูนย์พักพิงสุนัขกรุงเทพมหานคร สำนักงานสัตวแพทยสาธารณสุข สำนักอนามัย กรุงเทพมหานคร เป็นหน่วยงานจัดการดูแลสุนัขจรจัดในเขตกรุงเทพมหานครแบบครบวงจร สุนัขจรจัดในศูนย์พักพิงแห่งนี้ถูกส่งต่อมาจากพื้นที่ในกรุงเทพมหานครทั้ง 50 เขต (โดยเน้นสุนัขที่ไม่มีเจ้าของที่ได้รับร้องเรียงมาทางเขต เเละเเจ้ง1555 หรือ โทรมาโดยตรง โดยเป็นการลงพื้นที่ทั้ง 3 ส่วน) โดยศูนย์ควบคุมสุนัขกรุงเทพมหานคร (ประเวศ (ส่วนแรก) เป็นคอกแรกรับ โดยอยู่ในส่วนนี้ประมาณ 7-14 วัน โดยสุนัขทุกตัวจะได้รับวัคซีนป้องกันโรคพิษสุนัขบ้า ทำหมัน และทำการรักษาเบื่องต้นในกรณีที่ได้รับบาดเจ็บ โดยในช่วงเวลานี้จะรอเจ้าของขอมารับคืนหรือ รับไปอุปการะ เมื่อครบ 14 วันขึ้นไปจะถูกส่งไปยังส่วนที่สองคือ ศูนย์ควบคุมสุนัข อำเภอทัพทัน จังหวัดอุทัยธานี
ปัจจุบันศูนย์ควบคุมสุนัขกรุงเทพมหานคร (ประเวศ) อยู่ระหว่างปรับปรุงในส่วนต่าง ๆ ที่เกี่ยวข้องเพิ่มเติม เพื่อให้เป็นคอกสุนัขต้นแบบของการควบคุมสุนัขอย่างถูกสุขลักษณะ อีกทั้งพัฒนาเป็นศูนย์เรียนรู้เกี่ยวกับสุนัขและคัดกรองโรคก่อนส่งต่อไปเลี้ยงดูแลยังศูนย์พักพิงสุนัขจรจัดกรุงเทพมหานคร (จังหวัดอุทัยธานี) โดยโครงการก่อสร้างอาคารศูนย์ควบคุมสุนัขกรุงเทพมหานคร (ประเวศ) ที่ดำเนินการ ประกอบด้วย อาคารกลุ่มควบคุมและพักพิงสุนัข 1 หลัง อาคารเก็บอาหาร 1 หลัง อาคารคอกเลี้ยงสุนัข 18 หลัง อาคารคอกเลี้ยงแมว 3 หลัง อาคารห้องเก็บซาก และเตาเผาสุนัข 1 หลัง
- ศูนย์พักพิงสุนัขกรุงเทพมหานคร ตั้งอยู่ที่ คลองตาพุก, แขวงประเวศ เขต ประเวศ กรุงเทพมหานคร 10250
- โทร 023287460
- พิกัด google map
กรุงเทพมหานคร ขอเชิญชวนผู้สนใจอยากเลี้ยงสุนัขหรือแมวได้มาติดต่อขอรับอุปการะสุนัขและแมวจากศูนย์ควบคุมและพักพิงสุนัขกรุงเทพมหานครไปเลี้ยงแทนการซื้อใหม่ ซึ่งที่ศูนย์ฯ มีสุนัขและแมวหลายสายพันธุ์ให้เลือกชมก่อนรับไปอุปการะ เพื่อให้สุนัขและแมวจรในพื้นที่กรุงเทพฯ ได้มีบ้านใหม่ และเป็นการช่วยลดจำนวนสุนัขและแมวจรในพื้นที่กรุงเทพฯ ด้วย สอบถามรายละเอียดเพิ่มเติมได้ที่ กลุ่มควบคุมและพักพิงสุนัข โทร. 023287460 [ภาพจาก
ข่าว กทม.]
9 กรกฎาคม 2567 เปิด สาขาสอง ณ อาคารซีดับเบิ้ลยู ทาวเวอร์ รัชดา
9 กรกฎาคม 2567 THG เปิดร้านขายยา ทีเอช เฮลท์ ฟาร์มา สาขาสอง ณ อาคารซีดับเบิ้ลยู ทาวเวอร์ รัชดา นายสนธิ ดำรงศิลป์ ประธานกรรมการบริหาร (กลาง) นายนพมณีรัตน์ ลีลาวิวัฒน์ กรรมการบริหาร (ที่ 3 จากซ้าย) คุณนที ตั้งจิตรสดใส ประธานเจ้าหน้าที่ฝ่ายปฏิบัติการ (ที่ 3 จากขวา) บริษัท ทีเอชเฮลท์ จำกัด ในเครือ บมจ.ธนบุรี เฮลท์แคร์ กรุ๊ป หรือ THG ร่วมพิธีเปิดร้านขายยา ทีเอช เฮลท์ ฟาร์มา ณ อาคารซีดับเบิ้ลยู ทาวเวอร์ รัชดา โดยถือเป็นสาขาสอง หลังจากเปิดสาขาแรก ณ โรงพยาบาลสิริเวช จันทบุรี เมื่อปลายปี 2566 ที่ผ่านมา
94 สาขาความเชี่ยวชาญแพทย์ไทย
1. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย สาขากุมารเวขศาสตร์. ระยะเวลาศึกษา 3 ปี
2. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย สาขาโลหิตวิทยาและมะเร็งในเด็ก ระยะเวลาศึกษา 5 ปี
3. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาขากุมารเวชศาสตร์โรคหัวใจ ระยะเวลาศึกษา +2 ปี
4. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์โรคระบบการหายใจ ระยะเวลาศึกษา +2 ปี
5. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาขากุมารเวชศาสตร์โรคไต ระยะเวลาศึกษา +2 ปี
6. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์ทารกแรกเกิดและปริกำเนิด ระยะเวลาศึกษา +2 ปี
7. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์โรคต่อมไร้ท่อและเมแทบอลิซึม ระยะเวลาศึกษา +2 ปี
8. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาขกุมารเวชศาสตร์โรคภูมิแพ้และภูมิคุ้มกัน ระยะเวลาศึกษา +2 ปี
9. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์โรคติดเชื้อ ระยะเวลาศึกษา +2 ปี
10. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาขากุมารเวชศาสตร์ประสาทวิทยา ระยะเวลาศึกษา +2 ปี
11. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์พัฒนาการและพฤติกรรม ระยะเวลาศึกษา +2 ปี
12. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์โรคทางเดินอาหารและตับ ระยะเวลาศึกษา +2 ปี
13. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสดร์ดจวิทยา ระยะเวลาศึกษา +2 ปี
14. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์โภชนาการ ระยะเวลาศึกษา +2 ปี
15. ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย อนุสาชากุมารเวชศาสตร์การนอนหลับ ระยะเวลาศึกษา +2 ปี
16. ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย สาชาจิตเวชศาสตร์ ระยะเวลาศึกษา 3 ปี
17. ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย สาชาจิตเวชศาสตร์เด็กและวัยรุ่น ระยะเวลาศึกษา 4 ปี
18. ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย สาชาจิตเวชศาสตร์การเสพคิด ระยะเวลาศึกษา 3 ปี
19. ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย อนุสาชาจิตเวชศาสตร์การนอนหลับ ระยะเวลาศึกษา +2 ปี
20. ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย อนุสาชาจิตเวชศาสตร์ผู้สูงอายุ ระยะเวลาศึกษา +2 ปี
21. ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย สาขาจักษุวิทยา ระยะเวลาศึกษา 3 ปี
22. ราชวิทยาลัยประสาทศัลยแพทย์แห่งประเทศไทย สาชาประสาทศัลยศาสตร์ ระยะเวลาศึกษา 5 ปี
23. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย สาขาพยาธิวิทยากายวิภาค ระยะเวลาศึกษา 3 ปี
24. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย สาขาพยาธิวิทยาคลินิก ระยะเวลาศึกษา 3 ปี
25. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย สาขาเวชศาสตร์บริการโลหิต ระยะเวลาศึกษา 3 ปี
26. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย สาขานิติเวชศาสตร์ ระยะเวลาศึกษา 3 ปี
27. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย อนุสาขาตจพยาธิวิทยา ระยะเวลาศึกษา +2 ปี
28. ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย อนุสาขาโลหิตพยาธิวิทยา ระยะเวลาศึกษา +2 ปี
29. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย สาขารังสีรักษาและมะเร็งวิทยา ระยะเวลาศึกษา 3 ปี
30. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย สาขาเวชศาสตร์นิวเคลียร์ ระยะเวลาศึกษา 3 ปี
31. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย สาขารังสีวิทยาวินิจฉัย ระยะเวลาศึกษา 3 ปี
โครงการเฉลิมพระเกียรติ ๘ โครงการ
โครงการเฉลิมพระเกียรติ ในนามราชวิทยาลัยจุฬาภรณ์ จำนวน ๘ โครงการ ประกอบด้วย
โครงการที่ ๑ โครงการประเมินสภาพปอดด้วยเครื่องเอกซเรย์คอมพิวเตอร์และเทคโนโลยีปัญญาประดิษฐ์ในพื้นที่กรุงเทพมหานครและปริมณฑล ส่งเสริมการนำนวัตกรรมบริการสุขภาพมาใช้ในการประเมินสุขภาพปอดของคนไทยในพื้นที่ที่ได้รับผลกระทบด้านมลภาวะทางอากาศของฝุ่นละอองจิ๋ว PM ๒.๕ โดยจะให้บริการ จำนวน ๗๒๐ ราย เพื่อให้ประชาชนได้เข้าถึงการตรวจคัดกรองโรคปอดด้วยเทคโนโลยีที่ทันสมัยโดยไม่เสียค่าใช้จ่าย ดำเนินโครงการโดย โรงเรียนรังสีเทคนิค คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์
โครงการที่ ๒ โครงการวินิจฉัยและอ่านผลการตรวจอัลตราซาวด์ให้แก่โรงพยาบาลในพื้นที่ห่างไกล ส่งเสริมการพัฒนานวัตกรรมระบบบริการสุขภาพทางไกลและพัฒนาบุคลากรในสาขาที่ขาดแคลนให้มีความรู้เชี่ยวชาญเพื่อสามารถให้บริการตรวจและวินิจฉัยผลอัลตราซาวด์แก่ผู้ป่วยในท้องถิ่นห่างไกล โดยโรงเรียนนักอัลตราซาวด์ทางการแพทย์ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์ ได้ตั้งเป้าหมายในการให้บริการวินิจฉัยและอ่านผลผู้ป่วยในโครงการ จำนวน ๑,๗๒๐ ราย
โครงการที่ ๓ โครงการตรวจคัดกรองโรคมะเร็งเต้านมด้วยนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS) และแมมโมแกรม ส่งเสริมการนำนวัตกรรมมาใช้ในการดูแลสุขภาพประชาชนด้านการป้องกันโรคมะเร็ง โดยโรงพยาบาลจุฬาภรณ์ ร่วมกับวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ได้ออกแบบระบบบริการตรวจคัดกรองมะเร็งเต้านมโดยนำนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติและแมมโมแกรม พร้อมระบบ AI ร่วมวินิจฉัยกับรังสีแพทย์ ซึ่งเป็นผลงานการสร้างสรรค์นวัตกรรมสุขภาพจากบุคลากรราชวิทยาลัยจุฬาภรณ์ที่ได้รับรางวัลจากเวทีประกวดนวัตกรรมและสิ่งประดิษฐ์ระดับนานาชาติ นำมาใช้ในการออกหน่วยลงพื้นที่สู่ชุมชนเพื่อเพิ่มโอกาสในการเข้าถึงการตรวจคัดกรองมะเร็งเต้านมในสตรีกลุ่มเสี่ยงและด้อยโอกาส ในเขตพื้นที่กรุงเทพมหานครโซนเหนือ จังหวัดปทุมธานีและนนทบุรี จำนวน ๗๒๐ ราย โดยมุ่งหวังว่าจะเป็นประโยชน์ต่อการพัฒนาระบบบริการสุขภาพให้กับประเทศไทยและเพิ่มโอกาสในการเข้าถึงการตรวจคัดกรองมะเร็งเต้านมในพื้นที่ห่างไกลต่อไป
โครงการที่ ๔ โครงการตรวจคัดกรองไวรัสตับอักเสบบีและซี หนึ่งในสาเหตุสำคัญของการเกิดโรคมะเร็งตับ ซึ่งเป็นมะเร็งที่พบมากอันดับ ๑ ของประเทศไทย โดยโรงพยาบาลจุฬาภรณ์ได้จัดทำโครงการบริการวิชาการและวิชาชีพด้านสุขภาพ เพื่อสร้างความรู้ความเข้าใจให้ประชาชนได้ตระหนักถึงภัยของไวรัสตับอักเสบและให้บริการตรวจคัดกรองไวรัสตับอักเสบบีและซี จำนวน ๗๒๐ ราย ในวันที่ ๒๕-๒๖ กรกฎาคม ๒๕๖๗ ณ อาคารรัฐประศาสนภักดี (อาคาร B) ศูนย์ราชการเฉลิมพระเกียรติฯ เพื่อให้ประชาชนได้เข้าถึงการตรวจคัดกรองที่สะดวก รวดเร็ว รู้ผลทันที เพื่อป้องกันตนเองและลดปัจจัยเสี่ยงต่อการเป็นโรคตับแข็งและมะเร็งตับในอนาคตต่อไป
โครงการที่ ๕ โครงการพยาบาลศาสตร์อาสาเจ้าฟ้าจุฬาภรณ์ เรื่อง การเสริมสร้างสุขภาพและการดูแลตนเองของผู้สูงอายุในชุมชน ดำเนินโครงการโดย วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ราชวิทยาลัยจุฬาภรณ์ ส่งเสริมสุขภาพและคุณภาพชีวิตให้กับผู้สูงอายุในชุมชนเมือง ให้ผู้สูงอายุมีความรู้ ความเข้าใจ และเตรียมพร้อมในการดูแลตนเอง เพื่อสร้างชุมชนผู้สูงอายุที่เข้มแข็งและมีสุขภาวะที่ดีอย่างยั่งยืน
โครงการที่ ๖ โครงการแลกเปลี่ยนเรียนรู้และทำงานเพื่อสังคม “สร้างสุขภาพดี ด้วยวิถีแพทย์แผนไทย” ดำเนินโครงการโดย วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ ส่งเสริมการดูแลสุขภาพประชาชนโดยให้ความรู้และฝึกปฏิบัติในการนำเอาภูมิปัญญาท้องถิ่นการแพทย์แผนไทยมาใช้ในการดูแลสุขภาพในชีวิตประจำวัน
โครงการที่ ๗ โครงการหน่วยแพทย์พระราชทานโรงพยาบาลจุฬาภรณ์ เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ โดยกำหนดการออกหน่วยให้บริการตรวจรักษาสุขภาพประชาชนในพื้นที่จังหวัดอุตรดิตถ์ ระหว่างวันที่ ๒๔ - ๒๖ กรกฎาคม ๒๕๖๗
โครงการที่ ๘ โครงการปลูกป่าเฉลิมพระเกียรติ โดยได้ดำเนินการปลูกต้นไม้ อาทิ ต้นรวงผึ้ง ต้นสัก ต้นยางนา ต้นมะค่า จำนวน ๗๒๐ ต้น ณ ศูนย์เรียนรู้ตามแนวพระราชดำริ กรมอุทยานแห่งชาติสัตว์ป่าและพันธุ์พืช หน่วยพิทักษ์ป่าหนองเสือ อำเภอท่ายาง จังหวัดเพชรบุรี เมื่อวันที่ ๑๗ พฤษภาคม ๒๕๖๗ เพื่อสืบสานพระราชปณิธานพระบาทสมเด็จพระเจ้าอยู่หัวในการมุ่งรักษาและต่อยอดตามแนวทางศาสตร์พระราชาในการที่จะช่วยกันรักษาผืนดิน ผืนน้ำ ผืนป่า ให้อยู่อย่างยั่งยืน
โรคไข้หวัดนกคืออะไร
โรคไข้หวัดนกเกิดจากการ ติดเชื้อไวรัสไข้หวัดใหญ่ที่พบในนกและสัตว์ปีก โดยอาการและความรุนแรงของโรคขึ้นกับสายพันธุ์ ของไวรัสและชนิดของสัตว์ปีกที่ติดเชื่อสายพันธุ์ที่มี การแพร่ระบาดหลายประเทศ ขณะนี้ คือ H5N1 ซึ่งทำให้สัตว์ปึกที่ติดเชื้อมีอาการป่วยที่รุนแรง และตายอย่างรวดเร็ว
1. ไซโปร®️ : สายพันธุ์ยีสต์และกระบวนการผลิตไซลิทอล
เปลี่ยนกากอ้อย ให้เป็นไซลิทอล สารให้ความหวานแทนน้ำตาลที่แคลอรี่ต่ำและดีต่อสุขภาพ ด้วยเทคโนโลยี ไซโปร®️ สุดยอดนวัตกรรมจาก ดร. เบญจรัตน์ บรรเทิงสุข ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (ไบโอเทค) สวทช. ที่จะช่วยเพิ่มมูลค่าให้กับอุตสาหกรรมอ้อยของไทย
วัยรุ่นยุคใหม่ ปฏิเสธอย่างไร ปลอดภัยจาก…บุหรี่ไฟฟ้า
9 ขั้นตอนการขึ้นทะเบียนผ่านแอป
ศูนย์สนับสนุนบริการสุขภาพที่ 1 เชียงใหม่
ศูนย์สนับสนุนบริการสุขภาพที่ 1 (Regional Health Service Support Center 1) มีพื้นที่รับผิดชอบ จำนวน 8 จังหวัด ได้แก่ จังหวัดเชียงใหม่ จังหวัดเชียงราย จังหวัดน่าน จังหวัดแพร่ จังหวัดพะเยา จังหวัดลำพูน จังหวัดลำปาง และจังหวัดแม่ฮ่องสอน
เดิมคือ สำนักงานสนับสนุนบริการสุขภาพเขต 1 จังหวัดเชียงใหม่ จัดตั้งเมื่อวันที่ 21 ตุลาคม พ.ศ. 2556 ตามคำสั่งกรมสนับสนุนบริการสุขภาพ ที่ 1580/2556 โดยมีอำนาจหน้าที่ในการส่งเสริม สนับสนุน และขับเคลื่อนยุทธศาสตร์การคุ้มครองผู้บริโภคด้านระบบบริการสุขภาพและระบบสุขภาพภาคประชาชน และควบคุม กำกับ ติดตามระบบบริการสุขภาพและระบบสุขภาพภาคประชาชนให้เป็นไปตามกฎหมาย ต่อมาเมื่อวันที่ 5 สิงหาคม พ.ศ. 2562 กรมสนับสนุนบริการสุขภาพ ได้มีคำสั่งเพื่อเปลี่ยนชื่อหน่วยงาน จัดโครงสร้างแบ่งงานภายใน และกำหนดหน้าที่ความรับผิดชอบ ตามคำสั่งกรมสนับสนุนบริการสุขภาพ ที่ 1280/2562 โดยอาศัยอำนาจตามความในมาตรา 32 แห่งพระราชบัญญัติระเบียบ บริหารราชการแผ่นดิน พ.ศ. 2534 และที่แก้ไขเพิ่มเติม อธิบดีกรมสนับสนุนบริการสุขภาพ จึงเห็นชอบให้ออกคำสั่งให้เปลี่ยนชื่อหน่วยงาน “ สำนักงานสนับสนุนบริการสุขภาพเขต 1–12 (ระบุจังหวัด) ” เป็น “ ศูนย์สนับสนุนบริการสุขภาพที่ 1 –12 ”
- เลขที่ 191/1 หมู่ 4 ต.ดอนแก้ว อ.แม่ริม จ.เชียงใหม่ 50180
- โทร 053-112-220 , 053-896-200 กด [1] กลุ่มบริหารงานทั่วไป กด [2] กลุ่มสุขศึกษาและสุขภาพภาคประชาชน กด [3] กลุ่มวิศวกรรมการแพทย์ กด [4] กลุ่มอาคารและสภาพแวดล้อม กด [5] คุ้มครองผู้บริโภคด้านระบบบริการสุขภาพ
- email : saraban-hss1@hss.mail.go.th
- Google map
- Facebook
- Website
ความได้เปรียบของการขับเคลื่อนเศรษฐกิจสุขภาพของประเทศไทย
ตลาดการท่องเที่ยวเพื่อสุขภาพของประเทศไทยใหญ่เป็นอันดับ 4 ใน เอเชีย (รองจากจีน ญี่ปุ่น และอินเดีย) และได้รับการจัดอันดับให้เป็นที่ 17 ของ โลกในด้านการแพทย์แผนโบราณและการแพทย์ผสมผสาน อันดับที่ 18 ในด้านการกินเพื่อสุขภาพ โภชนาการ ส่วนการลดน้ำหนัก การนวดไทยและสมุนไพรเป็นกิจกรรมที่สร้างมูลค่าเพิ่มให้กับอุตสาหกรรมบริการสปามาอย่างยาวนาน และได้รับการยอมรับว่าเป็นบริการส่งเสริมสุขภาพ เสริมสร้างการมีสุขภาวะ (wellness) และสนับสนุนความเป็นอยู่ที่ดี (well-being) ของผู้คน
ต่อมาเมื่อเทคโนโลยีและวิทยาการทางการแพทย์มีความก้าวหน้ามากขึ้น การดูแลสุขภาพเชิงป้องกันได้เข้ามามีบทบาท สำ คัญในการวางแผนงานด้านสุขภาพและการสาธารณสุขของทุกประเทศในโลก โดยประเทศไทยมีความได้เปรียบทางการแข่งขันจากขีดความสามารถทางการแพทย์ขั้นสูง ราคาบริการที่สมเหตุผล ความสะดวกในการเดินทาง รวมทั้งชื่อเสียงทางการท่องเที่ยว ประเทศไทยจึงเป็นจุดหมายปลายทางของการเข้าถึงบริการทางการแพทย์และความเป็นอยู่ที่ดีระดับโลก
รูปที่ 3 สัดส่วนผู้สูงอายุที่อาศัยอยู่บ้านเพียงลำพังเพิ่มขึ้นต่อเนื่อง
ธุรกิจที่อยู่อาศัยสำหรับผู้สูงอายุ พบว่ายังมีอยู่น้อย ปัจจุบันมี 728 แห่งทั่วประเทศ รองรับผู้สูงอายุได้เพียง 19,490 คนเท่านั้น
ทัพนักกีฬาอีสปอร์ต
ภายในงานแถลงข่าวมีการสาธิตรูปแบบกิจกรรมการระดมทุนในปีนี้ นำโดยนักกีฬาอีสปอร์ต หมูหวาน-เมธาสิทธิ์, กายหงิด-วิรัชสัณห์, เต๋าเอ็ก-วรสิทธิ์, คิมเซนเซย์-ศิชฌนะ, เต้-พสุ และ มาร์คกี้-เจษฏาพันธ์ พร้อมด้วย ‘หมอ (กาย)’ ที่จะมาให้คำแนะนำเกี่ยวกับปัญหาทางร่างกาย นพ. ณัฐภัทร ศรีสุวัฒน์ แพทย์ด้านเวชศาสตร์การกีฬา ภาควิชาศัลยกรรมผ่าตัดกระดูกและข้อ และ ‘หมอ (ใจ)’ ที่จะมาให้คำปรึกษาด้านจิตใจ อ.พญ. พิชชาภัสร์ ชินณะราศรี อาจารย์จิตแพทย์ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี พร้อมชวนแคสต์เกมติดตามกิจกรรม ‘BAC Clinic #เบคคลินิก’ ในวันพุธที่ 31 กรกฎาคม 2567 ติดจอรอชมไลฟ์ได้ตั้งแต่เวลา 16.00 น. และร่วมบริจาคให้กับโครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี เพื่อสร้างการเปลี่ยนแปลงที่ดีสู่สังคมร่วมกัน สามารถติดต่อข้อมูลเพิ่มเติมได้ยูทูป www.youtube.com/@RamaFoundationTH และ https://www.youtube.com/@BaconTime
เครือข่ายแพทย์ นักวิชาการ และภาคประชาชนต้านภัยยาเสพติด เสนอนโยบายใหม่ ถึงนายกฯ เป็นนโยบายทางสายกลาง
25 กรกฎาคม 2567 เครือข่ายแพทย์ นักวิชาการ และภาคประชาชน ต้านภัยยาเสพติด ลงชื่อรวม 59 คน ออกแถลงการณ์ “บทวิเคราะห์การดำเนินนโยบายกัญชาของนายกรัฐมนตรี นายเศรษฐา ทวีสิน สำหรับประชาชนผู้มีสิทธิเลือกตั้ง” ระบุว่า
เมื่อวันที่ 8 พฤษภาคม 2567 นายเศรษฐา ทวีสิน นายกรัฐมนตรี มอบนโยบายให้กระทรวงสาธารณสุขแก้ไขประกาศกระทรวง โดยดึงกัญชากลับไปเป็นยาเสพติดประเภท 5 และเร่งออกกฎกระทรวงอนุญาตให้ใช้เพื่อวัตถุประสงค์ด้านการแพทย์และสุขภาพเท่านั้น โดยให้เหตุผลว่าทั้งพรรคเพื่อไทยและพรรคภูมิใจไทยต้องทำเพื่อประชาชน ต่อมาเมื่อวันที่ 23 กรกฎาคม 2567 นายกรัฐมนตรี มอบนโยบายให้ออกเป็น พ.ร.บ.กัญชา กัญชง เพื่อยุติความขัดแย้งพรรคร่วมรัฐบาล โดยไม่นำกลับไปขึ้นบัญชียาเสพติดแล้ว
นโยบายครั้งแรก (เดือน พฤษภาคม) คือ การนำกัญชากลับไปเป็นยาเสพติดทันที เพื่อให้ใช้กัญชาเฉพาะประโยชน์ในทางการแพทย์ แต่ไม่ให้ใช้กัญชาเพื่อสันทนาการ โดยไม่ได้มีนโยบายให้ทำกฎหมายกัญชา
ส่วนนโยบายครั้งที่สอง (เดือนกรกฎาคม) คือ การคงให้สามารถใช้กัญชาเพื่อสันทนาการได้ (เนื่องจากกัญชาไม่เป็นยาเสพติด) ในขณะที่รอทำกฎหมายกัญชา นโยบายสองครั้งนี้จึงมีลักษณะตรงกันข้ามทำให้เกิดความขัดแย้งระหว่างพรรคเพื่อไทยและพรรคภูมิใจไทย เนื่องจากนโยบายแรกนั้น พรรคเพื่อไทยทำเพื่อประชาชนส่วนใหญ่ที่เห็นว่าควรนำกัญชากลับไปเป็นยาเสพติด แต่ขัดกับนโยบายของพรรคภูมิใจไทยที่มีนโยบายปลดกัญชาจากการเป็นยาเสพติด ส่วนนโยบายครั้งที่สองจะสอดคล้องกับความต้องการของพรรคภูมิใจไทย แต่ขัดกับประชาชนส่วนใหญ่ของประเทศ
เครือข่ายแพทย์ นักวิชาการ และภาคประชาชนต้านภัยยาเสพติด ขอเสนอนโยบายใหม่ เป็นนโยบายทางสายกลาง คือ “เริ่มทำกฎหมายกัญชาโดยเร็วทันที หลังนำกัญชากลับไปเป็นยาเสพติดติด” พร้อมเหตุผล ดังนี้
- เพื่อหยุดยั้ง “กัญชาเพื่อสันทนาการ” ทันที แต่สามารถใช้ “กัญชาเพื่อการแพทย์” ได้ ขณะกำลังเร่งทำกฎหมายกัญชา
- เพื่อการลดความขัดแย้งอย่างแท้จริง คือ ไม่ขัดแย้งกับพรรคภูมิใจไทยเพราะมีนโยบายให้ทำกฎหมายกัญชา และไม่ขัดแย้งกับประชาชนผู้มีสิทธิเลือกตั้งส่วนใหญ่ เพราะนำกัญชากลับไปเป็นยาเสพติดทันที
- เพื่อไม่ให้เกิดภาพลักษณ์ว่าผู้บริหารสูงสุดของประเทศมอบนโยบายกัญชาที่มีลักษณะตรงกันข้ามภายในเวลาเพียงสองเดือน
- เพื่อไม่ให้เกิดภาพลักษณ์ว่านายกรัฐมนตรีและพรรคเพื่อไทยเลือกที่จะไม่ขัดแย้งกับพรรคภูมิใจไทย โดยเลือกนโยบายที่จะขัดแย้งกับประชาชนผู้มีสิทธิเลือกตั้งส่วนใหญ่ของประเทศแทน
- เพื่อไม่ให้เกิดภาพลักษณ์ว่านายกรัฐมนตรีและพรรคเพื่อไทยผูกติดกับผลกระทบด้านลบของการปลดกัญชาจากการเป็นยาเสพติด ซึ่งเป็นที่ประจักษ์ชัดในสังคมแล้วในขณะนี้และจะมากขึ้นเรื่อยๆในอนาคต เช่นเดียวกันกับภาพลักษณ์ของพรรคการเมืองอื่นก่อนหน้านี้
เครือข่ายแพทย์ นักวิชาการ และภาคประชาชนต้านภัยยาเสพติด ขอเสนอให้ประชาชนผู้มีสิทธิเลือกตั้งส่วนใหญ่ที่ไม่ต้องการเห็นสังคมและเยาวชนเข้าไปเกี่ยวข้องกับกัญชาเพื่อสันทนาการในประเทศไทย ร่วมติดตาม รู้เท่าทัน และเรียกร้องให้นายกรัฐมนตรีกำหนดนโยบายกัญชาที่เป็นประโยชน์ต่อสังคมโดยรวม มากกว่าประโยชน์ของพรรคร่วมรัฐบาล และทำทุกวิถีทางทั้งในปัจจุบันและอนาคตที่จะไม่ให้เกิดสภาพการตัดสินใจนโยบายกัญชาในลักษณะเช่นนี้
1.กล้ามเนื้อเทียม (Artificial Muscle)
กล้ามเนื้อเทียมหรือกล้ามเนื้อจำลอง สร้างขึ้นเพื่อเลียนแบบการทำงานของกล้ามเนื้อจริงตามธรรมชาติ มีลักษณะสำคัญคือ ยืด หด ขยายหรือหมุนได้ เมื่อได้รับการกระตุ้นจากสิ่งเร้า (stimuli) ไม่ว่าเป็นกระแสไฟฟ้า ความดัน หรืออุณหภูมิ ฯลฯ อาจแบ่งกล้ามเนื้อเทียมได้เป็นหลายประเภทตามกลไกการทำงานและวัสดุ อาทิ ชนิดที่ใช้พอลิเมอร์และไอออนหรือไฟฟ้า
กล้ามเนื้อเทียมส่วนใหญ่เป็นแบบทำงานด้วยแรงลม (pneumatic artificial muscle) ซึ่งพัฒนามาอย่างยาวนานและค่อนข้างปลอดภัย มีมูลค่าการตลาดราว 2,200 ล้านดอลลาร์สหรัฐ และจะเติบโตเป็น 5,360 ล้านดอลลาร์สหรัฐ ในปี 2031 โดยมีจีน สหรัฐอเมริกา และญี่ปุ่นเป็นผู้นำและมีการนำไปใช้ประโยชน์เป็น soft robot เป็นจำนวนมาก โดยมีแนวโน้มจะนำวัสดุชนิดใหม่ ๆ มาใช้มากขึ้น เช่น carbon nanotube, graphene-liquid crystal composite fiber, shape memory alloys, liquid crystal elastomers ที่สามารถซ่อมแซมตัวเองได้ รีไซเคิลได้ หรือนำกลับมาขึ้นรูปใหม่ได้ และใช้เทคโนโลยีการพิมพ์สามมิติ (3D Printing) ในการขึ้นรูปได้อีกด้วย
โดยปัจจุบันมีความต้องการกล้ามเนื้อเทียมเพื่อนำไปใช้ในอุตสาหกรรมการแพทย์ เช่น การใช้เป็นอุปกรณ์สวมใส่เพื่อช่วยในการฟื้นฟูหรือเสริมแรงสำหรับผู้พิการ การผ่าตัดแบบ microsurgery นอกจากนี้ยังมีความต้องการนำกล้ามเนื้อเทียมไปประยุกต์ใช้ในหุ่นยนต์สำหรับอุตสาหกรรมยานยนต์ อุตสาหกรรมก่อสร้าง และระบบควบคุมอัตโนมัติในงานอุตสาหกรรม (industrial automation) เพื่อให้หุ่นยนต์มีน้ำหนักเบา สามารถทำงานกับมนุษย์ได้อย่างปลอดภัย และสามารถปรับเปลี่ยนการใช้งานได้หลากหลาย การส่งเสริมสุขภาพด้วยอุปกรณ์เสริม เช่น อุปกรณ์จากเทคโนโลยีกล้ามเนื้อเทียมจึงมีประโยชน์มาก ใช้เป็นอุปกรณ์ชีวการแพทย์หรืออุปกรณ์เสริมการเคลื่อนไหวจำพวก exoskeleton ช่วยให้เดินขึ้นลงบันไดได้ดีขึ้น หรือทำให้คนงานส่งของยกน้ำหนักของได้มากขึ้น นอกจากนี้ยังประยุกต์ใช้สร้างหุ่นยนต์จำพวก soft robot ที่มีรูปแบบการเคลื่อนที่จำเพาะ ใช้ในภารกิจกู้ภัยได้ เป็นต้น
ความสำคัญของการพัฒนากล้ามเนื้อเทียม เป้าหมายหนึ่งคือ สอดคล้องไปกับสภาวะสังคมไทย ที่กำลังก้าวไปสู่การเป็นสังคมสูงอายุ ซึ่งไม่จำเพาะแต่ในไทย แต่เกิดขึ้นทั่วโลก นั่นหมายถึงคนกลุ่มนี้มีขนาดที่ใหญ่มากเกินจะมองข้าม ควบคู่ไปกับประโยชน์ของเทคโนโลยีเอง ที่จะช่วยชีวิต ยกระดับชีวิต ผู้สูงอายุ ผู้ป่วย และผู้ที่เกี่ยวข้องได้อีกมาก อย่างไม่ข้อสงสัย จะช่วยให้ผู้สูงอายุที่ประสบ ปัญหากล้ามเนื้อ การทรงตัว การลุกนั่ง หรือกิจวัตรอื่นๆ สามารถทำได้ ลดเสี่ยง ลดอุบัติเหตุ ที่อาจส่งผลรุนแรงที่จะทำให้บาดเจ็บ กลายเป็นผู้ป่วยติดเตียงหรือถึงกับเสียชีวิต ลงไปได้ไม่น้อย อย่างแน่นอน
ตัวอย่างการพัฒนากล้ามเนื้อเทียม
ข้อมูล ณ เดือนกรกฎาคม 2567 "เศรษฐกิจการท่องเที่ยวไทย ในช่วง 3 เดือนแรกของปี 2567 ประเทศไทยมีจำนวนนักท่องเที่ยว ชาวต่างชาติ 9,370,319 คน และนักท่องเที่ยวไทยเที่ยวไทย 49.08 ล้านคน - ครั้ง ส่งผลให้เกิดมูลค่า การใช้จ่ายของนักท่องเที่ยว 686,451 ล้านบาท"
ผลิตภัณฑ์มวลรวมภายในประเทศด้านการท่องเที่ยว
- มูลค่าผลิตภัณฑ์มวลรวมภายในประเทศด้านการท่องเที่ยว (Tourism GDP) ในไตรมาสแรกของปี 2567 มีมูลค่า 697,383 ล้านบาท ขยายตัวร้อยละ 5.51 เมื่อเทียบกับโตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.57 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY) ซึ่งคิดเป็นสัดส่วนร้อยละ 15.11 ของเศรษฐกิจประเทศ
- มูลค่าผลิตภัณฑ์ มวลรวมภายในประเทศด้านการท่องเที่ยวทางตรง (Tourism Direct GDP) 291,089 ล้านบาท ขยายตัวร้อยละ 5.61 เทืยบกับ ไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.17 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY)
- มูลค่าผลิตภัณฑ์ มวลรวมกายในประเทศด้านการท่องเที่ยวทางอ้อม (Tourism Indirect GDP) 406,294 ล้านบาท ขยายตัวร้อยละ 5.43 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.86 เมื่อเทียบกับโตรมาสแรกของปี 2565 (%YoY)
ด้านการใช้จ่ายเพื่อการท่องเที่ยว
- มูลค่าการใช้จ่ายของนักท่องเที่ยวทั้งหมดในไตรมาสแรกของปี 2567 มีมูลค่า 686,451 ล้านบาท ขยายตัวร้อยละ 7.02 เมื่อเทียบกับโตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.87 มือเทียบกับโตรมาสแรกของปี 25666 (%YoY) ประกอบด้วย
• มูลค่าการใช้จ่ายของนักท่องเที่ยวระหว่างประเทศ 454,654 ล้านบาท และ
• มูลค่าการใช้จ่ายของนักท่องเที่ยวภายไมประเทศ 231,797 ล้านบาท
- การใช้จ่ายของนักท่องเที่ยวระหว่างประเทศ ขยายตัวร้อยละ 11.92 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 41.04 เมื่อเทียบกับโตรมาสแรกของปี 2566 (%YoY) ซึ่งเป็นผลมาจาการเพิ่มขึ้นอย่างต่อเนื่องของนักท่องเที่ยว ชาวต่างชาติทั้งกลุ่มตลาดระยะสั้น และกลุ่มตลาดระยะยาว โดยเป็นผลจากหลายปัจจัย อาทิ
• มาตรการ Ease of traveling ของรัฐบาล
• การลงนามยกเว้นวีชาระหว่างไทย-จีน
• การให้วีซ่าฟรีแก่นักท่องเที่ยวอินเดีย คาซัคสถาน และไต้หวัน
• การพื้นตัวของอุตสาหกรรมการบิน เป็นต้น
- ในขณะที่การใช้จ่ายของนักท่องเที่ยวภายในประเทศ หดตัวร้อยละ -1.44 เมื่อเทียบกับโตรมาสก่อนหน้า (%QoQ) ซึ่งเป็นไปตามทิศทางของดูดกาลท่องเที่ยว และขยายตัวร้อยละ 10.22 เมื่อเทียบกับโตรมาสแรกของปี 2566 (%YoY) เป็นผลจากความ
• ต้องการท่องเที่ยวในประเทศของขาวไทย
• สภาพอากาศที่หนาวเย็นของภาคเหนือ และ
• การใช้จ่ายเพื่อการบริโภคอุปโภคภาคเอกชนที่ขยายตัวสูง
อย่างไรก็ตาม ภาคการท่องเที่ยวยังมีความท้าทายจากปัจจัยด้านเศรษฐกิจโลก การฟื้นตัวของอุตสาหกรรมการบิน ในภูมิภาคเอเชีย และมาตรการส่งเสริมการท่องเที่ยวของต่างประเทศ
ด้าน นพ.โสภณ กล่าวว่า จังหวัดเพชรบูรณ์ จัดโครงการพาหมอไปหาประชาชนฯ แล้ว 1 ครั้ง ที่ อำเภอวิเชียรบุรี มีผู้เข้ารับบริการเกือบ 5,000 คน สำหรับครั้งนี้ได้จัด 23 คลินิกเฉพาะทาง คือ 1) กุมารเวชกรรม 2) โรคจากการประกอบอาชีพและสิ่งแวดล้อม 3) มะเร็งลำไส้ใหญ่และลำไส้ตรง 4) มะเร็งตับและท่อน้ำดี 5) วัณโรค 6) ดูแลพระภิกษุสงฆ์ 7) เยี่ยมบ้านผู้ต้องดูแลประคับประคอง 8) ส่งเสริมการมีบุตร 9) เวชกรรมทั่วไป 10) จิตเวช 11) ตาในเด็กและผู้สูงอายุ 12) ทันตกรรม 13) อายุกรรม 14) กระดูกและข้อ 15) กายภาพบำบัด 16) แพทย์แผนไทยและทางเลือก 17) มณีเวช 18) หู คอ จมูก 19) มะเร็งเต้านม 20) มะเร็งปากมดลูก 21) ฝึกอบรมการช่วยชีวิตขั้นพื้นฐาน 22) ศูนย์รับบริจาคอวัยวะ และ 23) เภสัชกรรม รวมทั้งมีจุดให้บริการยืนยันตัวตน รองรับนโยบาย 30 บาท รักษาทุกที่ด้วยบัตรประชาชนใบเดียว
นอกจากนี้ ยังมีหน่วยงานต่างๆ ในพื้นที่ร่วมให้บริการ อาทิ 1) การซ่อมรถจักรยานยนต์และอุปกรณ์ไฟฟ้า วิทยาลัยการอาชีพชนแดน 2) การออกบัตรผู้พิการให้กับผู้พิการ สำนักงานพัฒนาสังคมและความมั่นคงของมนุษย์ 3) แจกกล้าไม้ 1,000 ต้น ศูนย์เพาะชำกล้าไม้เขารัง 4) คลินิกแก้ไขปัญหาความยากจน ธนาคารออมสิน และ ธกส. 5) บริการทำหมันสุนัข – แมว และฉีดวัคซีนพิษสุนัขบ้า สำนักงานปศุสัตว์อำเภอชนแดน เป็นต้น คาดว่าจะมีประชาชนเข้ารับบริการในคลินิกต่างๆ ประมาณ 2,500 คน
โครงการที่ ๑ โครงการประเมินสภาพปอดด้วยเครื่องเอกซเรย์คอมพิวเตอร์และเทคโนโลยีปัญญาประดิษฐ์ในพื้นที่กรุงเทพมหานครและปริมณฑล


โครงการที่ ๑ โครงการประเมินสภาพปอดด้วยเครื่องเอกซเรย์คอมพิวเตอร์และเทคโนโลยีปัญญาประดิษฐ์ในพื้นที่กรุงเทพมหานครและปริมณฑล ส่งเสริมการนำนวัตกรรมบริการสุขภาพมาใช้ในการประเมินสุขภาพปอดของคนไทยในพื้นที่ที่ได้รับผลกระทบด้านมลภาวะทางอากาศของฝุ่นละอองจิ๋ว PM ๒.๕ ซึ่งนวัตกรรมรถเอกซเรย์คอมพิวเตอร์คันนี้เป็นนวัตกรรมที่ออกแบบโดยคนไทยในช่วงสถานการณ์การระบาดของไวรัสโควิด-๑๙ ภายในรถมีเครื่องเอกซเรย์คอมพิวเตอร์ความเร็วสูงแบบใช้ปริมาณรังสีต่ำพร้อมด้วยระบบการจัดท่าและการสแกนอัตโนมัติ วินิจฉัยรอยโรคร่วมกับระบบเทคโนโลยีปัญญาประดิษฐ์ พร้อมระบบความปลอดภัยสูงสุดจากการติดเชื้อหรือแพร่เชื้อโรคด้วยระบบกรองอากาศความเร็วสูงและแสงยูวี ๒๒๒ นาโนเมตร จึงเหมาะในการนำมาใช้คัดกรองรอยโรคในปอด โดยโรงเรียนรังสีเทคนิค คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์ จึงได้นำมาประยุกต์ใช้เพื่อดูแลสุขภาพปอดของคนไทยในพื้นที่กรุงเทพมหานครและปริมณฑลที่ได้รับผลกระทบด้านมลภาวะทางอากาศสูงของฝุ่นละอองจิ๋ว PM ๒.๕ โดยจะให้บริการในโครงการเฉลิมพระเกียรติฯ จำนวน ๗๒๐ ราย เพื่อให้ประชาชนได้เข้าถึงการตรวจคัดกรองโรคสภาวะปอดด้วยเทคโนโลยีที่ทันสมัยโดยไม่เสียค่าใช้จ่าย กลุ่มเป้าหมายที่สามารถเข้าร่วมโครงการ ฯ จะต้องอยู่ในช่วงอายุ ๒๐ - ๖๐ ปี มีพื้นที่พักอาศัยและพื้นที่ทำงานในเขตกรุงเทพมหานคร หรือ ปริมณฑล ไม่อยู่ในระหว่างการตั้งครรภ์ หรือ มีความเสี่ยงต่อการตั้งครรภ์ ไม่มีประวัติการสูบบุหรี่ ไม่เคยได้รับการวินิจฉัยว่าเป็นโรคเกี่ยวกับปอด เช่น โรคมะเร็งปอด วัณโรคปอด โรคปอดอักเสบ โรคถุงลมโป่งพอง เป็นต้น ไม่มีประวัติการติดเชื้อไวรัสโคโรนา ๒๐๑๙ ที่ลงปอด ไม่เคยมีประวัติการผ่าตัดนำเนื้อปอดออก (Lobectomy, Pneumonectomy) โดยนอกจากจะช่วยให้ประชาชนในโครงการได้รับการประเมินสภาพปอดจากภัยสุขภาพฝุ่นจิ๋วแล้ว ยังเป็นประโยชน์ต่อยอดสู่การขับเคลื่อนและพัฒนานโยบายทางด้านการจัดการมลพิษของประเทศชาติต่อไป
1.NO POVERTY ขจัดความยากจน
ขจัดความยากจน ในทุกรูปแบบยังคงเป็นหนึ่งในความท้าทายที่ยิ่งใหญ่ที่สุดที่มนุษยชาติต้องเผชิญ แม้ว่าจำนวนประชากรที่อาศัยอยู่ในความยากจนขั้นรุนแรงจะลดลงมากกว่าครึ่งหนึ่งระหว่างปี 1990 ถึง 2015 แต่ยังมีผู้คนอีกจำนวนมากที่ยังคงดิ้นรนเพื่อความต้องการพื้นฐานที่สุดของมนุษย์
ในปี 2015 ประชากรประมาณ 736 ล้านคนยังคงดำรงชีวิตด้วยเงินน้อยกว่า 1.90 ดอลลาร์สหรัฐต่อวัน หลายคนขาดแคลนอาหาร น้ำดื่มสะอาด และสุขอนามัย การเติบโตอย่างรวดเร็วในประเทศต่างๆ เช่น จีนและอินเดียได้ช่วยให้ผู้คนนับล้านหลุดพ้นจากความยากจน แต่ความก้าวหน้ายังไม่เท่าเทียมกัน ผู้หญิงมีแนวโน้มที่จะยากจนมากกว่าผู้ชาย เนื่องจากพวกเธอมีงานที่ได้รับค่าจ้าง การศึกษา และทรัพย์สินน้อยกว่า
ความก้าวหน้ายังมีจำกัดในภูมิภาคอื่นๆ เช่น เอเชียใต้และแอฟริกาใต้สะฮารา ซึ่งคิดเป็นร้อยละ 80 ของประชากรที่อาศัยอยู่ในความยากจนขั้นรุนแรง ภัยคุกคามใหม่ที่เกิดจากการเปลี่ยนแปลงสภาพภูมิอากาศ ความขัดแย้ง และความไม่มั่นคงด้านอาหาร ทำให้ต้องทำงานมากขึ้นเพื่อนำผู้คนออกจากความยากจน
SDGs คือความมุ่งมั่นอันกล้าหาญที่จะทำให้สิ่งที่เราเริ่มต้นไว้เสร็จสิ้น และยุติความยากจนในทุกรูปแบบและมิติภายในปี 2030 ซึ่งเกี่ยวข้องกับการกำหนดเป้าหมายกลุ่มที่เปราะบางที่สุด การเพิ่มทรัพยากรและบริการขั้นพื้นฐาน และการสนับสนุนชุมชนที่ได้รับผลกระทบจากความขัดแย้งและภัยพิบัติที่เกี่ยวข้องกับสภาพภูมิอากาศ
การลงทะเบียนแอป ทางรัฐ ต้องยืนยันตัวตน
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนมกราคม 2567
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมไตรมาสที่ 4/2566 และแนวโน้มไตรมาสที่ 1/2567 และรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
มกราคม 2567 ตามที่กระทรวงอุตสาหกรรม (อก.) เสนอ
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมไทยไตรมาสที่ 4 ปี 2566 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) มีค่าอยู่ที่ 89.35 ลดลงร้อยละ 5.06 เมื่อเทียบกับไตรมาสเดียวกันของปีก่อน โดยเป็นการปรับตัวลดลงเป็นไตรมาสที่ 5 ติดต่อกัน จากการผลิตเพื่อจำหน่ายในประเทศที่ลดลงตามการบริโภคภายในประเทศเป็นหลัก ประกอบกับสถานการณ์หนี้ครัวเรือนที่อยู่ในระดับสูง การปล่อยสินเชื่อของสถาบันการเงินจึงมีความเข้มงวดมากขึ้น รวมถึงอัตราดอกเบี้ยที่เพิ่มสูงขึ้น ส่งผลต่อต้นทุนการเงินและภาระหนี้ของผู้ประกอบการที่เพิ่มสูงขึ้น ทั้งนี้ อุตสาหกรรมสำคัญที่ชะลอตัวในไตรมาสที่ 4 ปี 2566 อาทิ ยานยนต์ จากการผลิตรถปิคอัพ 1 ตัน เป็นหลัก โดยเป็นผลจากการผลิตเพื่อจำหน่ายในประเทศ เนื่องจากรายได้เกษตรกร ซึ่งเป็นกลุ่มผู้บริโภคหลักปรับลดลงจากปีก่อน ส่งผลให้กำลังซื้อชะลอตัว ประกอบกับภาระหนี้สินภาคครัวเรือนอยู่ในระดับสูง ส่งผลให้สถาบันการเงินมีความเข้มงวดในการปล่อยสินเชื่อมากขึ้น ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ ตามการชะลอตัวของตลาดโลก ทำให้ความต้องการชิ้นส่วนอิเล็กทรอนิกส์ในตลาดโลกลดลง คอมพิวเตอร์และอุปกรณ์ต่อพ่วง ปรับตัวลดลงจาก Hard Disk Drive เป็นหลักจากความต้องการอุปกรณ์การจัดเก็บชะลอตัว ประกอบกับการเปลี่ยนแปลงของเทคโนโลยีที่มีอุปกรณ์อื่น ๆ ในการจัดเก็บข้อมูลมีพื้นที่จัดเก็บมากและประสิทธิภาพสูงขึ้น สำหรับ อุตสาหกรรมที่มีการขยายตัวในไตรมาสที่ 4 ปี 2566 อาทิ ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม เป็นการผลิตเพื่อตอบสนองความต้องการที่เพิ่มขึ้นจากตลาดในประเทศและตลาดส่งออก ตามการฟื้นตัวอย่างต่อเนื่องของภาคการท่องเที่ยว ประกอบกับช่วงเดียวกันของปีก่อนมีโรงกลั่นบางโรงหยุดซ่อมบำรุง สายไฟและเคเบิลอื่นๆ ชนิดใช้ในทางอิเล็กทรอนิกส์และไฟฟ้าจากสายไฟฟ้าเป็นหลัก เนื่องจากมีคำสั่งซื้อเพิ่มขึ้นจากการไฟฟ้าตามรอบการบำรุงรักษา ประกอบกับมีงานโครงการต่าง ๆ ทั้งภาครัฐ และเอกชนส่งผลให้ความต้องการใช้สายไฟฟ้ามีมากขึ้น เยื่อกระดาษ กระดาษ และกระดาษแข็ง เพิ่มขึ้นตามการเติบโตของตลาดออนไลน์ ส่งผลให้ธุรกิจขนส่งขยายตัว ความต้องการผลิตภัณฑ์หีบห่อบรรจุภัณฑ์ที่เป็นกระดาษจึงมีความต้องการมากขึ้น
เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) หดตัว ร้อยละ 2.9 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากปัญหาหนี้ครัวเรือนและดอกเบี้ยอยู่ในระดับสูง ส่งผลให้การบริโภคภายในประเทศโดยเฉพาะสินค้ากึ่งคงทนและสินค้าคงทนปรับตัวลดลง เช่น รถยนต์ ชิ้นส่วนอิเล็กทรอนิกส์ เป็นต้น ประกอบกับการชะลอตัวของเศรษฐกิจประเทศคู่ค้าหลัก เช่น ญี่ปุ่น ตะวันออกกลาง ส่งผลให้การส่งออกชะลอตัวในกลุ่มรถยนต์ เครื่องปรับอากาศ เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนมกราคม 2567 หดตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน คือ
1. ยานยนต์ หดตัวร้อยละ 9.63 จากรถบรรทุกปิคอัพและรถยนต์นั่งขนาดเล็กเป็นหลัก โดยหดตัวจากตลาดในประเทศ (-27.90%) ตามภาวะเศรษฐกิจชะลอตัวภายในประเทศ ปัญหาหนี้ครัวเรือนอยู่ในระดับสูงทำให้สถาบันการเงินมีความเข้มงวดในการปล่อยสินเชื่อเช่ามากขึ้น และหดตัวจากตลาดส่งออก (-3.92%)
2. ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม หดตัวร้อยละ 6.45 จากน้ำมันดีเซลหมุนเร็ว และน้ำมันเบนซินออกเทน 95 เป็นหลัก
3. ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 17.71 จากภาวะตลาดอิเล็กทรอนิกส์โลกที่อยู่ในช่วงกำลังฟื้นตัวจากการหดตัวในปีก่อน
อุตสาหกรรมสำคัญที่ยังขยายตัวในเดือนมกราคม 2567 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. เครื่องดื่มที่ไม่มีแอลกอฮอล์ น้ำแร่และน้ำดื่มบรรจุขวด ขยายตัวร้อยละ 14.16 จากน้ำอัดลม เครื่องดื่มรสผลไม้ และเครื่องดื่มบำรุงกำลัง เป็นหลัก ตามความต้องการบริโภคหลังสภาพอากาศร้อนขึ้นรวมถึงมีการเปิดตัวผลิตภัณฑ์ใหม่ให้ตรงกับพฤติกรรมการบริโภคของลูกค้า
2. ปุ๋ยเคมีและสารประกอบไนโตรเจน ขยายตัวร้อยละ 58.68 จากราคาปุ๋ยปรับลดลงและสินค้าเกษตรได้ราคาดี เกษตรกรมีกำลังซื้อปุ๋ยมากขึ้น
3. เครื่องประดับเพชรพลอยแท้ ขยายตัวร้อยละ 19.00 ตามการขยายตัวของตลาดในประเทศ (+54.38%) และตลาดส่งออก (+15.08%) โดยเฉพาะคู่ค้าหลักสำคัญ (ฮ่องกง อังกฤษ และ UAE) ที่ยังมีทิศทางเป็นบวกต่อเนื่อง รวมถึงฐานต่ำในปีก่อนจากปัญหาเงินเฟ้อทั่วโลก
แนวโน้มอุตสาหกรรมรายสาขาที่สำคัญ ไตรมาสที่ 1/2567
อุตสาหกรรม เหล็กและเหล็กกล้า คาดการณ์ว่าจะหดตัวเล็กน้อยเมื่อเทียบกับช่วงเดียวกันของปีก่อน เนื่องจากราคาเหล็กในตลาดโลกมีแนวโน้มปรับตัวลดลง ทำให้ผู้บริโภคชะลอการสั่งซื้อเพื่อดูทิศทางราคา และอาจส่งผลต่อความต้องการใช้เหล็ก อย่างไรก็ตาม การเร่งก่อสร้างโครงการภาครัฐ รัฐวิสาหกิจ และภาคเอกชนตามการฟื้นตัวของภาคการท่องเที่ยว คาดว่าจะเป็นปัจจัยสนับสนุนการขยายตัวของอุตสาหกรรมเหล็กในประเทศ
คาดว่าดัชนีผลผลิตจะหดตัวเล็กน้อยประมาณร้อยละ 1.0-3.0 เนื่องจากต้นทุนการผลิตที่สูง อาจส่งผลต่อความสามารถในการผลิตของผู้ประกอบการไทย และ ความไม่แน่นอนของเศรษฐกิจโลกและประเทศคู่ค้า เช่น จีน และสหรัฐอเมริกา เป็นต้น แต่อย่างไรก็ตามนโยบายการสนับสนุนและส่งเสริมการลงทุนในอุตสาหกรรม Smart Electronics อาจจะส่งผลดีต่อการผลิตชิ้นส่วนอิเล็กทรอนิกส์ของไทย ในขณะที่มูลค่าการส่งออกจะยังขยายตัวได้ต่อเนื่องประมาณร้อยละ 3.0-5.0 เนื่องจากการเติบโตอย่างต่อเนื่องของอุตสาหกรรมอิเล็กทรอนิกส์ตามความต้องการของตลาดโลกและเทคโนโลยีดิจิทัลที่มีการเปลี่ยนผ่านอย่างรวดเร็ว รวมทั้ง ความต้องการอุปกรณ์นวัตกรรมใหม่ ๆ ของผู้บริโภค
ปริมาณการผลิตยางแปรรูปขั้นปฐม (ยางแผ่น ยางแท่ง และน้ำยางข้น) ยางรถยนต์ และถุงมือยาง จะขยายตัว ทั้ง 3 ผลิตภัณฑ์ โดยยางแปรรูปขั้นปฐมจะขยายตัวจากความต้องการของอุตสาหกรรมต่อเนื่องทั้งในประเทศและต่างประเทศ ยางรถยนต์จะขยายตัวจากแนวโน้มความต้องการที่เพิ่มขึ้นในตลาดสำคัญ อาทิ สหรัฐอเมริกา ออสเตรเลีย และเกาหลีใต้ ขณะที่ถุงมือยางจะขยายตัวจากการผลิตเพื่อตอบสนองอุปสงค์ความต้องการของตลาดในประเทศเป็นหลัก
คาดว่าดัชนีผลผลิตในภาพรวมมีแนวโน้มขยายตัว เมื่อเทียบกับ ไตรมาสเดียวกันของปีก่อน โดยมีปัจจัยสนับสนุนจากมาตรการของภาครัฐที่ช่วยกระตุ้นอุปสงค์ภายในประเทศ รวมถึงจำนวนนักท่องเที่ยวที่มีแนวโน้มเพิ่มขึ้น ในส่วนของภาคการส่งออกมีแนวโน้มขยายตัว จากความต้องการสินค้าของประเทศคู่ค้า เพื่อความมั่นคงด้านอาหาร อย่างไรก็ตาม ยังคงต้องติดตามสถานการณ์เศรษฐกิจโลก ที่ยังคงชะลอตัว ปัญหาความขัดแย้งทางภูมิรัฐศาสตร์ในหลายประเทศ รวมถึงผลกระทบจากภัยแล้งที่อาจรุนแรงขึ้น
การวิจัยส่วนที่ 3 : โครงการวิจัยย่อยที่ 1 LINK
การวิจัยนี้มีวัตถุประสงค์เพื่อศึกษาลักษณะการจัดบริการสุขภาพปฐมภูมิของ รพ.สต. ที่ได้รับ การถ่ายโอนจากกระทรวงสาธารณสุขไปสู่องค์การบริหารส่วนจังหวัด ในรุ่นปีงบประมาณ 2566 โดย ต้องการทราบว่าหลังจากที่ถ่ายโอนไปแล้ว (1) มีการเปลี่ยนแปลงลักษณะสำคัญของการจัดบริการไป จากเดิมหรือไม่อย่างไร (2) มีจุดอ่อนและจุดแข็งอย่างไร และ (3) ทางเลือกในการพัฒนา รพ.สต.ให้มี ประสิทธิภาพยิ่งขึ้นควรเป็นอย่างไร จากวัตถุประสงค์ดังกล่าว คณะวิจัยได้ทบทวนวรรณกรรมที่ เกี่ยวข้องแล้วได้สรุปกรอบแนวคิดการวิจัยว่าควรใช้กรอบบริการของ รพ.สต. ติดดาว เป็นประเด็น การประเมิน และได้ถอดวัตถุประสงค์การวิจัยออกมาเป็นข้อคำถาม 13 ข้อ สำหรับใช้เป็นโจทย์หรือ คำถามในการแสวงหาคำตอบ
ในด้านวิธีวิทยาการวิจัย ได้ใช้รูปแบบการวิจัยแบบผสมผสาน แบบ (Exploratory Sequential Design) โดยเริ่มจากการวิจัยเชิงคุณภาพซึ่งใช้วิธีเก็บข้อมูลโดยการสำรวจและสัมภาษณ์ เชิงลึก หลังจากนั้นได้สกัดข้อค้นพบสำคัญออกมาตรวจหาความเป็นทั่วไป โดยการทอดแบบสอบถาม ตามระเบียบวิธีเชิงปริมาณ หลังจากได้ข้อค้นพบแล้ว ได้นำผลการค้นพบไปทำการสัมมนาเพื่อ ประมวลความเห็นจากผู้เกี่ยวข้องอีกครั้ง แล้วจึงนำผลการประมวลทั้งหมดมาทำการอภิปรายผลและ เสนอแนะ พร้อมทั้งสรุปผลการวิจัย [
รายงานฉบับเต็ม pdf]
ฉันไม่เคยถูกชกแรงขนาดนี้มาก่อน #MainStand LINK
"ฉันไม่เคยถูกชกแรงขนาดนี้มาก่อน"
แองเจล่า คารินี่ นักมวยหญิงชาวอิตาลี ให้สัมภาษณ์ทั้งน้ำตาหลังพ่ายแพ้ต่อ อิมาน เคลิฟ นักชกชาวแอลจีเรียที่ตรวจเพศไม่ผ่าน ในศึกมวยหญิง โอลิมปิก 2024 รุ่นน้ำหนัก 66 กก.
ไฟต์ระหว่าง คารินี่ กับ เคลิฟ ผู้เป็นที่กังขาเรื่องเพศสภาพ จบลงใน 46 วินาทีของยกแรกเมื่อ คารินี่ ถูกอีกฝ่ายชกเข้าใบหน้า ก่อนเดินไปบอกพี่เลี้ยงมุมเวที และตัดสินใจยอมแพ้ตกรอบเพราะสู้ไม่ไหว ก่อนคุกเข่าร้องไห้กลางสังเวียน
"ฉันไม่เคยถูกชกแรงขนาดนี้มาก่อน" คารินี่ เปิดใจกับสื่อด้วยความผิดหวัง "จมูกของฉันบาดเจ็บมาก ฉันเลยตัดสินใจหยุดแทนที่จะชกต่อ จมูกฉันเริ่มมีเลือดกำเดาไหลตั้งแต่โดนหมัดแรกแล้ว"
ขณะที่พี่เลี้ยงของเธอกล่าวเสริมว่า "เธอรู้สึกเจ็บหนักที่จมูกแล้วบอกว่า ฉันไม่อยากชกอีกแล้ว" และบอกด้วยว่าเธอเจ็บปวดมากจากหมัดของอีกฝ่าย
คารินี่ กล่าวเพิ่มเติมหลังจากนั้นว่าถึงจะเป็นฝ่ายพ่ายแพ้ แต่เธอก็ไม่เสียใจเพราะคิดว่าตัดสินใจถูกต้องแล้วที่ไม่ชกต่อ "มันไม่ใช่ความพ่ายแพ้ เพราะเมื่อฉันมุดเชือกเข้าสู่เวที ฉันได้กลายเป็นนักรบและเป็นผู้ชนะแล้ว ไม่ว่าอะไรจะเกิดขึ้น"
"ฉันไม่ได้แพ้ในคืนนี้ ฉันแค่ออกไปทำหน้าที่ในฐานะนักสู้ ฉันทำไม่สำเร็จ ฉันเดินเชิดหน้าออกมาแต่ก็มาพร้อมหัวใจที่แตกสลาย"
"ฉันคือผู้หญิงแท้ 100% สังเวียนนี้คือชีวิตของฉัน เต็มไปด้วยสัญชาตญาณ เมื่อรู้ว่ามีบางสิ่งไม่ถูกต้อง มันไม่ใช่การยอมแพ้ แต่มันแสดงให้เห็นถึงวุฒิภาวะของตัวเองที่จะต้องจบเรื่องนี้ มันคือการแสดงวุฒิภาวะมากพอที่จะบอกว่า โอเค พอได้แล้ว"
ส่วน อิมาน เคลิฟ นักชกคู่กรณี ไม่ได้ให้สัมภาษณ์สื่อหลังจากนั้น แต่สิ่งที่เกิดขึ้นจะทำให้เธอและคณะกรรมการโอลิมปิกสากล (IOC) ถูกวิจารณ์อย่างหนักไปอีกนานหลายวัน
เทรนด์ดูแลผิวและความงามของผู้บริโภคยุคใหม่ดันตลาดเวชศาสตร์ความงามไทยเติบโตต่อเนื่อง ทั้งจากผู้บริโภคชาวไทยและ นักท่องเที่ยวเชิงการแพทย์ต่างชาติ ด้วยค่าบริการในไทยที่สามารถเข้าถึงได้ง่ายเมื่อเทียบกับค่าบริการเฉลี่ยของโลก รวมถึงการส่งเสริมการท่องเที่ยวเชิงการแพทย์ของภาครัฐ จึงส่งผลให้ไทยเป็นศูนย์กลางด้านหัตถการและศัลยกรรมความงามอันดับต้น ๆ ของเอเชียแปซิฟิก โดยกระแสการดูแลความงามทั้งหัตถการและศัลยกรรมของคนไทยยังคงมาแรงเกาะเทรนด์โลกโดยเฉพาะกลุ่ม Gen Y ผู้หญิง และ LGBTQIA+ ที่มีแนวโน้มให้ความสำคัญกับความสวยความงามมากขึ้นและมีโอกาสใช้จ่ายด้านเวชศาสตร์ความงามสูงขึ้น
ธุรกิจบริการหัตถการเสริมความงามมีแนวโน้มขยายฐานผู้ใช้บริการได้มากขึ้น โดยเฉพาะในกลุ่มผู้ชายและ Gen Z โดยการใช้บริการหัตถการส่วนใหญ่ผู้บริโภคจะใช้บริการเพื่อการรักษาและบำรุงผิวมากที่สุดควบคู่กับการใช้บริการหัตถการประเภทอื่น และจะใช้จ่ายไม่เกิน 5,000 บาทต่อครั้ง อย่างไรก็ดี แม้หัตถการเสริมความงามแต่ละประเภทจะมีกลุ่มผู้ใช้บริการหลักที่แตกต่างกัน แต่ผู้บริโภคยังเลือกใช้สถานบริการที่มีความเชี่ยวชาญเฉพาะอย่างคลินิกหัตถการขนาดเล็ก คลินิกขนาดใหญ่ที่มีสาขา และโรงพยาบาลเฉพาะทาง โดยปัจจัยด้านราคา รวมถึงมาตรฐานความปลอดภัยทั้งจากสถานบริการเองและอุปกรณ์/เครื่องมือที่ใช้ในการให้บริการเป็นปัจจัย สำคัญในการเลือกสถานที่ใช้บริการของผู้บริโภค
ธุรกิจศัลยกรรมเสริมความงามมีโอกาสเติบโตสูง แม้การทำศัลยกรรมเสริมความงามจะได้รับความนิยมจากผู้บริโภคบางส่วน แต่ผู้บริโภคก็มีแนวโน้มให้ความสนใจเพิ่มมากขึ้น โดยเฉพาะจากกลุ่ม Gen Z และ LGBTQIA+ อีกทั้ง ผู้ที่ผ่านการทำศัลยกรรมส่วนใหญ่ ยังทำศัลยกรรมมากกว่า 1 ประเภท โดยการทำศัลยกรรมจมูกและดวงตาเป็นที่นิยมสูงสุดจากผู้ที่ผ่านการทำศัลยกรรมเสริมความงามมาแล้วและผู้ที่สนใจทำศัลยกรรมในระยะข้างหน้า โดยผู้บริโภคจะเลือกใช้บริการจากโรงพยาบาลเอกชนเฉพาะทางและคลินิกศัลยกรรมตกแต่งความงามเป็นหลัก ขณะที่การทำศัลยกรรมในต่างประเทศก็ได้รับความนิยมค่อนข้างสูง ซึ่งปัจจัยที่เกี่ยวข้องกับมาตรฐานความปลอดภัยถือเป็นปัจจัยที่ผู้บริโภคให้ความสำคัญมากที่สุด
ความแตกต่างในพัฒนาการทางเพศ (DSD) คืออะไร? - Healthline
หลายๆ คนมีความแตกต่างในพัฒนาการทางเพศ (DSD) ซึ่งเรียกอีกอย่างว่าภาวะอินเตอร์เซ็กซ์ “DSD” เป็นคำที่ใช้เรียกโครโมโซม ลักษณะทางเพศ และกายวิภาคที่ไม่สามารถระบุได้ว่าเป็นเพศชายหรือเพศหญิงเท่านั้น
มีผู้ป่วย DSD เกิดมาพร้อมกับ DSD ถึง 1 ใน 100 คน
ไม่ใช่ทุกคนที่เป็น DSD จะมีโครโมโซมเพศที่เปลี่ยนแปลง บางคนอาจเป็นโครโมโซม XX หรือ XY แต่พวกเขาอาจมีโครโมโซม X และ Y หรือ SCA ก็ได้
โครโมโซมเพศที่เปลี่ยนแปลงอาจรวมถึง:
45,X (กลุ่มอาการเทิร์นเนอร์)
47,XXY (กลุ่มอาการไคลน์เฟลเตอร์)
47,XXX (กลุ่มอาการไตรโซมี X)
47,XYY
48,XXYY
48,XXXY
48,XXXX
49,XXXXY
49,XXXXX
SCA ที่แตกต่างกันจะทำให้เกิดลักษณะที่แตกต่างกัน
มีคนกี่คนที่เกิดมาเป็นอินเตอร์เซ็กซ์ (How many people are born intersex?)?
มีคนมากถึง 1 ใน 100 คนที่เกิดมาพร้อมกับความแตกต่างในการพัฒนาทางเพศ (DSD) ซึ่งเป็นอีกคำหนึ่งสำหรับอินเตอร์เซ็กซ์
ตามข้อมูลของ Intersex Society of North America พบว่ามีผู้คนประมาณ 1 ใน 1,500 ถึง 1 ใน 2,000 คนที่ถูกกำหนดให้เป็นอินเตอร์เซ็กซ์ตั้งแต่แรกเกิด
อย่างไรก็ตาม ผู้ที่มีอาการอินเตอร์เซ็กซ์บางคนเพิ่งจะทราบเกี่ยวกับ DSD ของตนเองในช่วงหลังของชีวิต เช่น ในช่วงวัยรุ่นหรือเมื่อเป็นผู้ใหญ่ แม้กระทั่งผู้ที่มีลักษณะอินเตอร์เซ็กซ์ก็อาจไม่สามารถรู้ได้เลย
ตัวเลขนี้ขึ้นอยู่กับว่าคุณนิยาม "อินเตอร์เซ็กซ์" ว่าอย่างไร หลายคนมีความแตกต่างทางเพศที่แตกต่างกันซึ่งคนอื่นไม่สามารถมองเห็นได้ ดังนั้น แพทย์บางคนอาจไม่ถือว่าพวกเขาเป็นอินเตอร์เซ็กซ์
Medically reviewed by Debra Sullivan, Ph.D., MSN, R.N., CNE, COI — Written by Sian Ferguson on December 14, 2023
healthline.com/
1.Generative AI (การปฏิวัติ AI)
Generative AI (AI เชิงสร้างสรรค์) อธิบายอัลกอริทึม (เช่น ChatGPT) ที่รับข้อมูลที่ไม่มีโครงสร้างเป็นอินพุต (เช่น ภาษาธรรมชาติและรูปภาพ) เพื่อสร้างเนื้อหาใหม่ รวมถึงเสียง โค้ด รูปภาพ ข้อความ การจำลอง และวิดีโอ AI สามารถทำให้การทำงานเป็นอัตโนมัติ เพิ่มประสิทธิภาพ และเร่งความเร็วได้โดยใช้ชุดข้อมูลแบบผสมผสานที่ไม่มีโครงสร้างเพื่อสร้างเนื้อหาใหม่ในรูปแบบต่างๆ
จำนวนผู้บริจาคอวัยวะ ตั้งแต่ 1 กุมภาพันธ์ 2537 – 31 มีนาคม 2567
ผศ.นพ. พลกฤต ทีฆคีรีกุล Chief Scientific Officer โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรงพยาบาลบำรุงราษฎร์ได้ยกระดับจาก คลินิกพันธุศาสตร์เชิงป้องกัน (Preventive Genomic Clinic) เป็น “ศูนย์เวชศาสตร์จีโนม บำรุงราษฎร์ (Bumrungrad Genomic Medicine Center)” ซึ่งเป็นผู้นำในการนำเทคโนโลยีและความรู้ด้านพันธุกรรมมาใช้ในเชิงป้องกันให้แก่ผู้ป่วยอย่างครบวงจรเป็นที่เดียวในประเทศไทย โดยส่งมอบการดูแลรักษาสุขภาพในระยะยาว ที่มุ่งเน้นมาตรฐานคุณภาพในทุก ๆ ด้าน ตั้งแต่การตรวจวิเคราะห์พันธุกรรมในเชิงป้องกันเพื่อค้นหาความเสี่ยงในการเกิดโรค ภายใต้ห้องปฏิบัติการของตนเองที่ได้การรับรองมาตรฐานในระดับสากล จากวิทยาลัยพยาธิแพทย์อเมริกัน College of American Pathologists (CAP) โดยทีมแพทย์เฉพาะทาง ผู้เชี่ยวชาญในห้องปฏิบัติการ และผู้ชำนาญคุณวุฒิระดับปริญญาเอก ที่ร่วมกันกำหนดแนวทางการดูแลผู้ป่วยที่ดีและเหมาะสมที่สุด ตลอดจนการวิจัยและพัฒนาคุณภาพการดูแลรักษาผู้ป่วยด้วยนวัตกรรมใหม่ ๆ อย่างต่อเนื่อง จนทำให้โรงพยาบาลบำรุงราษฎร์ เป็นโรงพยาบาลเอกชนแห่งแรกที่ได้รับการรับรองเป็น ผู้ให้บริการด้านเวชศาสตร์จีโนม จากกระทรวงสาธารณสุข
1. ค่านิยมทางสังคม
โดยมีค่านิยมใหม่เกิดขึ้นในสังคมไทยเพื่อตอบสนองต่อความต้องการและพฤติกรรมของบุคคลที่หลากหลาย และส่งผลให้มีแนวโน้ม การใช้ชีวิตเป็นโสดเพิ่มขึ้น อาทิ
1) SINK (Single Income, No Kids) หรือคนโสดที่มีรายได้และไม่มีลูก โดยกลุ่มนี้ เน้นใช้จ่ายเพื่อเติมเต็มความสุขให้ตนเองเป็นหลัก อาทิ การท่องเที่ยว สุขภาพ/ความงาม ที่อยู่อาศัย
โดยในปี 2566 จากข้อมูล SES เมื่อจำแนกประชากรช่วงวัยเจริญพันธุ์ตามระดับรายได้ 10 กลุ่มและสถานภาพสมรส พบว่า สัดส่วนคนโสดสูงขึ้นตามระดับรายได้ โดยเฉพาะในกลุ่ม Decile ที่ 8-10 มีสัดส่วนอยู่ที่ร้อยละ 12.9 16.8 และ 15.7 ตามลำดับ
ทั้งนี้ หากพิจารณาสัดส่วนค่าใช้จ่ายด้านตัวเงินประเภทต่าง ๆ ของคนโสด ยังพบว่า ส่วนใหญ่ เป็นค่าใช้จ่ายเกี่ยวกับอาหาร การเดินทางและการติดต่อสื่อสาร และค่าใช้จ่ายอื่น ๆ (อาทิ ภาษี เบี้ยประกันภัย การบริจาค/ทำบุญ)
1. ครัวเรือนไทยที่มีลักษณะเป็น Sandwich
ครัวเรือนไทยที่มีลักษณะเป็น Sandwich มีจำนวนทั้งสิ้น 3.4 ล้านครัวเรือน ในปี 2566 หรือคิดเป็น สัดส่วนร้อยละ 14.0 ของครัวเรือนทั้งหมด อย่างไรก็ตาม ครัวเรือนลักษณะนี้มีสัดส่วนลดลง โดยในปี 2560 มีสัดส่วนอยู่ที่ร้อยละ 18.2 ของครัวเรือนทั้งประเทศ และเมื่อพิจารณาลักษณะของครัวเรือน พบว่า ครัวเรือน Sandwich ส่วนใหญ่เป็นครัวเรือน 3 รุ่น คิดเป็นสัดส่วนร้อยละ 97.1 ขณะที่ครัวเรือน 4 รุ่น มีสัดส่วนร้อยละ 2.9 อีกทั้ง ส่วนใหญ่เป็นความสัมพันธ์ที่หัวหน้าครัวเรือนอาศัยอยู่กับลูกและหลาน โดยมีสัดส่วนมากถึงร้อยละ 75.4 ของครัวเรือน Sandwich ทั้งหมด รองลงมาเป็น ครัวเรือนที่หัวหน้าครัวเรือนต้องดูแลพ่อแม่และลูกของตนเอง หรือมีสัดส่วนร้อยละ 20.1 ทั้งนี้ ครัวเรือนที่หัวหน้าครัวเรือนอาศัยอยู่กับลูกและหลาน กว่าร้อยละ 63.3 มีหัวหน้า ครัวเรือนเป็นผู้สูงอายุ ขั้นตอนรับเลี้ยง น้องหมาแมว ที่ศูนย์ควบคุมสุนัขกรุงเทพมหานคร เขตประเวศ
[
update] กทม. ขอเชิญชวนทุกท่านที่มีใจเมตตา ร่วมเป็นส่วนหนึ่งในการมอบโอกาสครั้งใหม่ให้กับน้องหมาแมว ผ่านการรับเลี้ยงจากศูนย์ควบคุมสุนัข กรุงเทพมหานคร เขตประเวศ เพื่อให้พวกเขาได้มีบ้านที่อบอุ่นและเต็มไปด้วยความรัก
คุณสมบัติผู้รับเลี้ยง
เพื่อให้การดูแลน้องหมาแมวเป็นไปอย่างราบรื่นและมีความสุข กรุงเทพมหานครจึงขอเรียนให้ท่านทราบถึงคุณสมบัติเบื้องต้นของผู้รับเลี้ยง ดังนี้
- ได้รับความเห็นชอบจากคนในครอบครัว: การต้อนรับสมาชิกใหม่เข้าบ้านเป็นเรื่องสำคัญที่ต้องได้รับการยินยอมจากทุกคนในครอบครัว เพื่อให้น้องหมาแมวได้รับความรักและการดูแลจากทุกคนในครอบครัว
- มีความรู้เบื้องต้นในการเลี้ยงสัตว์: การทำความเข้าใจพฤติกรรมและความต้องการของน้องหมาแมว จะช่วยให้ท่านสามารถดูแลพวกเขาได้อย่างเหมาะสม
- มีสถานที่เลี้ยงที่มีริ้วรอบขอบชิด: เพื่อความปลอดภัยของน้องหมาแมวและผู้อื่น สถานที่เลี้ยงควรมีความมั่นคงแข็งแรงและป้องกันการหลุดออกจากบ้าน
- สามารถดูแลค่าใช้จ่ายในการเลี้ยงสัตว์: การเลี้ยงสัตว์ต้องอาศัยค่าใช้จ่ายทั้งในเรื่องอาหาร การรักษาพยาบาล และของใช้จำเป็นต่างๆ ผู้รับเลี้ยงจึงควรมีความพร้อมทางด้านการเงิน
- มีจิตเมตตาและรักสัตว์: สิ่งสำคัญที่สุดคือความรักและความเมตตาที่ท่านมีต่อน้องหมาแมว ซึ่งจะเป็นรากฐานสำคัญในการสร้างครอบครัวที่มีความสุข
- ตอบแบบสอบถามการรับอุปการะสุนัขและแมว เพื่อคัดเลือกผู้ที่มีความเหมาะสมในการรับอุปการะ
เอกสารที่ต้องเตรียม
หากคุณมีคุณสมบัติครบถ้วนและพร้อมรับน้องหมาแมวเข้าบ้าน โปรดเตรียมบัตรประชาชนและทะเบียนบ้านเพื่อใช้ในการกรอกเอกสารดังต่อไปนี้
- เอกสารจดทะเบียนสุนัข: เพื่อลงทะเบียนน้องหมาอย่างเป็นทางการกับกรุงเทพมหานคร
- เอกสารคำร้องขออุปการะสัตว์: เพื่อแสดงความจำนงในการรับเลี้ยงน้องหมาแมวจากศูนย์ควบคุมสุนัข
สุขภาพของน้องหมาแมว
น้องหมาแมวทุกตัวที่อยู่ในความดูแลของศูนย์ควบคุมสุนัข กรุงเทพมหานคร เขตประเวศ ได้รับการตรวจสุขภาพ คัดกรองโรค ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และทำหมันแล้ว เพื่อให้ท่านมั่นใจว่าจะได้รับน้องหมาแมวที่แข็งแรงและพร้อมเป็นส่วนหนึ่งของครอบครัว
ช่องทางการติดต่อ
หากท่านสนใจรับน้องหมาแมวจากศูนย์ควบคุมสุนัข กรุงเทพมหานคร เขตประเวศ สามารถติดต่อสอบถามรายละเอียดเพิ่มเติมได้ที่
โทรศัพท์: 0 2328 7460 หรือ 0 9096 50339
Line: เพิ่มเพื่อนผ่านหมายเลข 0 9096 50339
Facebook: BKK Adopter
เวลาทำการ: วันจันทร์ - วันศุกร์ เวลา 08.30 - 16.30 น. (เวลาราชการ)
บทที่ 1 เทคโนโลยี GenAI จะยกระดับประสิทธิภาพการผลิตและขับเคลื่อนการเติบโตทางเศรษฐกิจได้ในระดับใด
ความสามารถของเทคโนโลยี GenAI ส่งผลให้เกิด “วงจรอันดีงาม” (virtuous cycle) ของการนำเทคโนโลยี ไปใช้ เพื่อเร่งผลิตภาพ และการปรับปรุงเทคโนโลยี
เทคโนโลยี GenAI ถือเป็นหนึ่งในการปฏิวัติทางเทคโนโลยีที่สำคัญที่สุดในประวัติศาสตร์ยุคใหม่ และถือเป็นเทคโนโลยีเอนกประสงค์ (general-purpose technology - GPT) ซึ่งเป็นแนวคิดที่พัฒนาโดย ทิโมธี เบรสนาฮาน (Timothy Bresnahan) และ มานูเอล แทรจเทนเบิร์ก (Manuel Trajtenberg) ในปี 1992
GPT อธิบายถึงเทคโนโลยีสำคัญที่สามารถนำไปประยุกต์ใช้ในอาชีพต่างๆ ได้หลากหลาย และโดยที่ตัวมันเอง มีศักยภาพที่จะพัฒนาปรับปรุงให้ดีขึ้นได้ในอนาคต พร้อมๆ ไปกับสร้างนวัตกรรมใหม่ๆ ขึ้นมาเพื่อช่วยเสริมการทำงานซึ่งกันและกัน ได้อีกด้วย
ตัวอย่างเช่น เครื่องจักรไอน้ำ ไฟฟ้า และคอมพิวเตอร์ เป็น GPT ที่สำคัญที่ตอบสนองเกณฑ์เหล่านี้ ก่อเกิดวงจรการพัฒนาต่อยอดจากตัวทางเทคโนโลยีตั้งต้น ผลักดันให้เกิดเศรษฐกิจที่ก้าวหน้าขึ้น และส่งเสริมซึ่งกันและกันต่อเนื่องไป
“วงจรอันดีงาม (virtuous cycle) ของนวัตกรรมที่เกิดจากเทคโนโลยีเอนกประสงค์ ส่งผลกระทบอย่างมากต่อเศรษฐกิจ” Lydia Boussour นักเศรษฐศาสตร์อาวุโสด้านกลยุทธ์และธุรกรรมของ EY-Parthenon แห่ง Ernst & Young LLP กล่าว
ทีมนักวิจัย David Byrne, Stephen Oliner และ Daniel Sichel ประมาณการว่าภาคเทคโนโลยีสารสนเทศ (IT) ซึ่งเดิมมีส่วนแบ่งเพียงเล็กน้อยของเศรษฐกิจสหรัฐฯ (น้อยกว่า 5% ในช่วงปลายทศวรรษ 1990) กลับเติบโตขึ้นมาเป็นครึ่งหนึ่งของการขยายตัวของผลผลิตแรงงานนอกภาคเกษตรกรรมของสหรัฐฯ ในช่วง 30 ปี ที่ผ่านมา (ระหว่างปี 1974 ถึง 2004)
และแม้ว่าการเติบโตของผลผลิตจะชะลอตัวลงในช่วงหลายทศวรรษที่ผ่านมา แต่ภาคไอทียังคงอยู่ในระดับสูง และหนุนการเติบโตของผลผลิตของสหรัฐฯ ได้อยู่ โดยคิดเป็นมากกว่าหนึ่งในสามของการเติบโตของผลผลิตแรงงานระหว่างปี 2004 ถึง 2012
เมื่อมองย้อนกลับไปถึงการเกิดขึ้นของยุคคอมพิวเตอร์ ที่เริ่มต้นจากคอมพิวเตอร์อิเล็กทรอนิกส์ขนาดใหญ่ ราคาแพง ขาดความสามารถในการปรับตัว และออกแบบมาเพื่อการใช้งานเฉพาะบางอย่าง เช่น วัตถุประสงค์ทางทหาร คอมพิวเตอร์อิเล็กทรอนิกส์เอนกประสงค์เครื่องแรกของโลก — Electronic Numerical Integrator and Computer (ENIAC) — ได้รับการพัฒนาขึ้นในช่วงกลางทศวรรษ 1940 เพื่อคำนวณตารางการยิงปืนใหญ่สำหรับห้องปฏิบัติการวิจัยขีปนาวุธของกองทัพสหรัฐฯ
เมื่อเวลาผ่านไป การปรับปรุงประสิทธิภาพการประมวลผลของคอมพิวเตอร์และต้นทุนที่ลดลง ทำให้หลายอุตสาหกรรมนำคอมพิวเตอร์มาใช้และทำให้เกิดนวัตกรรมใหม่ๆ ขึ้นตามมา ซึ่งส่งผลให้มีการนำคอมพิวเตอร์มาใช้กันอย่างกว้างขวางยิ่งขึ้น กระบวนการต่อเนื่องของนวัตกรรม การพัฒนาด้านไอที และความต้องการที่เพิ่มขึ้นเหล่านี้ ในที่สุด ทำให้เกิดเป็นวงจรที่มั่นคงแน่นอน และเติบโตเพิ่มขึ้นอย่างต่อเนื่อง ทั้งในด้านผลผลิตและมาตรฐานการครองชีพ
หากย้อนไปพิจารณาถึงระดับพัฒนาการและความเร็วของการเติบโตของผลิตภาพที่ขับเคลื่อนโดยไอที ตั้งแต่ช่วงทศวรรษ 1990 ทำให้ประเมินได้ว่าเทคโนโลยี GenAI มีศักยภาพที่จะเพิ่มการเติบโตของผลิตภาพได้ 50% ถึง 100% ในทศวรรษหน้า
อย่างไรก็ตาม การเติบโตนี้ เทียบไม่ได้กับการเติบโตที่เกิดจากยุคการปฏิวัติอุตสาหกรรม หรือ ยุคการนำไฟฟ้ามาใช้ ที่สูงกว่าถึงสอง-สามเท่า
บำเหน็จ-บำนาญ ประกันสังคม ใช้สิทธิยังไงคุ้ม? ลงทุนนิยม EP.385 Wealth Me Up
คุณสาธิต บวรสันติสุข ผู้เชี่ยวชาญ มาให้ข้อมูลในหัวข้อ บำเหน็จ-บำนาญ ประกันสังคม ใช้สิทธิยังไงคุ้ม? ลงทุนนิยม EP.385 Wealth Me Up
5 Apr 2024
เงินบำเหน็จ vs เงินบำนาญ ประกันสังคม เลือกแบบไหนคุ้มกว่ากัน?
กองทุนชราภาพ ดูแลคนทำงาน หลังพ้นกำหนดส่งเงินสมทบ ผ่านทาง บำเหน็จ จ่ายเป็นก้อนครั้งเดียว และ บำนาญ จ่ายเป็นรายเดือนตลอดชีวิต
แบบไหนคุ้มกว่ากัน? อยู่ที่เงื่อนไขเขาเข้าว่ามาอย่างไร หากต้วยบำเหน็จ ต้องออกด้วยบำเหน็จ เข้าด้วยบำนาญ ออกด้วยบำนาญ เลือกไม่ได้ขาออก เลือกได้เฉพาะขาเข้า หมายถึงอย่างไร
- เงื่อนไข เงินบำนาญ คือ จ่ายเงินสมทบเข้ากองทุนประกันสังคม ให้ได้อย่างน้อย 180 เดือน (ไม่จำเป็นต้องต่อเนื่องก็ได้ แต่นับรวมตลอดชีวิตการทำงาน) จ่ายให้เกิน 180 เดือนไว้ จะได้
- เงื่อนไข เงินบำเหน็จ คือ จ่ายไม่ครบ 180 เดือน
อย่างไหนคุ้มกว่ากัน ต้องคำนวนแล้วเปรียบเทียบกัน
เงินบำเหน็จ จะได้เท่าไหร่ คำนวนได้จาก
- ระบบใช้ฐานเงินเดือนสูงสุด 15,000 บาท คำนวน (แม้ว่าจะมีฐานเงินเดือนจริงสูงกว่าก็ตาม)
- เงินสมทบส่วนลูกจ้าง 3% 450 บาท เงินสมทบส่วนนายจ้าง 3% 450 บาท รวม 900 บาท ต่อเดือน
- ระยะเวลา 15 ปี จะเท่ากับ 900x12x15 (ปี) รวม 162,000 บาท
เงินบำนาญ จะได้เท่าไหร่ คำนวนได้จาก
- ระบบใช้ฐานเงินเดือนสูงสุด 15,000 บาท คำนวน (แม้ว่าจะมีฐานเงินเดือนจริงสูงกว่าก็ตาม)
- อัตราบำนาญเริ่มต้น 20% สำหรับปีที่ 1-15
- อัตราบำนาญเพิ่มอีกปีละ 1.5% สำหรับปีที่ 16 เป็นต้นไป
- จะเท่ากับ 3,000 x 12 (เดือน)
- ระยะเวลาที่ จะได้รับเท่ากับรับบำเหน็จ (162,000 บาท) คือเมื่อรับไปแล้ว 4.5 ปี (162,000 / 3000x12)
จากอาสาสมัครกู้ภัย สู่เส้นทางของ นักปฏิบัติการฉุกเฉินการแพทย์
“เมื่อมองถึงนาทีชีวิตระหว่างความเป็นและความตายที่อยู่ตรงหน้า ก็ไม่ได้รู้สึกหวาดกลัวที่จะทำหน้าที่ของนักปฏิบัติการฉุกเฉินการแพทย์เลยแม้แต่น้อย เพราะอยากช่วยเหลือ อยากเป็นความหวังสุดท้ายให้กับผู้ป่วยในสถานการณ์วิกฤต” คือคำพูดด้วยน้ำเสียงหนักแน่นและเต็มเปี่ยมไปด้วยความมุ่งมั่นจาก นางสาวกานต์ธิดา เศิกศิริ นักศึกษาคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี สาขาวิชาฉุกเฉินการแพทย์ จากเด็กสาวผู้มีใจรักในการเป็นอาสาสมัครกู้ภัยที่ได้ซึมซับถึงความสำคัญของการช่วยเหลือผู้ป่วยที่กำลังตกอยู่ในภาวะคุกคามต่อชีวิตให้มีโอกาสรอดชีวิต จนกลายมาเป็นแรงบันดาลใจให้ก้าวสู่เส้นทางของนักปฏิบัติการฉุกเฉินการแพทย์อย่างเต็มตัว ด้วยความตั้งใจจริงในการช่วยเหลือเพื่อนมนุษย์ด้วยกัน พร้อมนำองค์ความรู้และประสบการณ์มาต่อยอดและพัฒนาระบบสาธารณสุขไทยต่อไป เพราะสำหรับ กานต์ธิดา ‘การให้’ ที่ยิ่งใหญ่คือการให้ชีวิต
จุดมุ่งหมายการจัดงาน
รศ.นพ.สุภนิติ์ นิวาตวงศ์ รองผู้อำนวยการ ศูนย์รับบริจาคอวัยวะ สภากาชาดไทย กล่าวว่า วันที่ 13 สิงหาคม ของทุกปี เป็นวัน World Organ Donation Day โดยมีจุดมุ่งหมายให้ทุกคนตระหนักถึงความสำคัญของการบริจาคอวัยวะและสร้างความเข้าใจที่ถูกต้องเกี่ยวกับการบริจาคอวัยวะ ปัจจุบันมีผู้ป่วยที่รอคอยการการบริจาคอวัยวะ ณ วันที่ 31 กรกฎาคม 2567 มากถึง 7,133 ราย โดย 95 เปอร์เซ็นต์ เป็นผู้ป่วยที่รอ “ไต” มีจำนวนมากถึง 6,619 ราย ซึ่งถือเป็นอวัยวะที่ขาดแคลนที่สุด รองลงมา คือ ตับ หัวใจ ปอด และตับอ่อน ขณะเดียวกันมีผู้ที่ได้รับการปลูกถ่ายอวัยวะแล้วเพียง 465 ราย และทุกๆสัปดาห์จะมีผู้เสียชีวิต 2 รายจากการรอปลูกถ่ายอวัยวะ และมีแนวโน้มจำนวน ผู้รอรับอวัยวะเพิ่มขึ้น แม้ว่า 1 ผู้บริจาคจะสามารถบริจาคอวัยวะและเนื้อเยื่อเพื่อนำไปปลูกถ่ายอาจนำไปช่วยเหลือชีวิตคนได้ 8-9 ชีวิต
การจัดกิจกรรมในครั้งนี้มีวัตถุประสงค์เพื่อเชิญชวนผู้ที่สนใจสามารถแสดงความจำนงบริจาคได้ทั้ง 2 ประเภท คือ
1.บริจาคอวัยวะและดวงตาเพื่อนำไปปลูกถ่ายให้ผู้ป่วยและ
2.บริจาคอุทิศร่างกายเพื่อการศึกษา รวมทั้งให้ความรู้เรื่องการบริจาคอวัยวะ เพราะหลายคนยังคงเชื่อว่าถ้าบริจาคอวัยวะแล้วชาติหน้าจะเกิดมามีอวัยวะไม่ครบ แต่หากเรามองข้ามผ่านความเชื่อดังกล่าวและดูข้อเท็จจริงที่แสดงให้เห็นประโยชน์ของการบริจาคอวัยวะแล้วจะพบว่า การบริจาคอวัยวะโดยผู้บริจาคเพียงหนึ่งราย สามารถช่วยเหลือผู้ป่วยได้สูงสุดถึง รวมถึงส่งผลให้ผู้ป่วยมีสุขภาพกายที่ดีและอายุยืนยาวขึ้นได้
รศ.นพ.สุภนิติ์ กล่าวว่า จากภาวะการขาดแคลนอวัยวะในประเทศไทย แม้ว่าจะมีผู้แสดงความจำนงบริจาคอวัยวะกว่าปีละ 50,000 ราย แต่ส่วนใหญ่การเสียชีวิตมิใช่เกิดจากสมองตาย หรือมีข้อห้ามของการบริจาคอวัยวะเช่น เสียชีวิตหัวใจหยุดเต้นหรือมีการติดเชื้อ อวัยวะได้รับบาดเจ็บทำให้ไม่สามารถนำอวัยวะไปใช้ปลูกถ่ายได้ รวมทั้งปัญหาอวัยวะที่นำไปปลูกถ่ายหรือทำงานได้ไม่ดี เข้ากันไม่ได้กับร่างกายของผู้รับ เนื่องจากอายุของผู้บริจาค, ขนาดของอวัยวะ, การทำงานของอวัยวะ, ระยะเวลาขาดเลือดของอวัยว ะและความแตกต่างของเนื้อเยื่อเป็นต้น
บริจาคผ่านแอปพลิเคชัน "บริจาคดวงตา-อวัยวะ" ได้แล้ว
บริจาคอวัยวะ 1 ผู้ให้ ช่วยได้ 8 ชีวิต
บริจาคผ่านแอปพลิเคชันได้แล้ว ที่แอป "บริจาคดวงตา-อวัยวะ" Download ได้จาก
ขั้นตอนการบริจาคบนแอป
- คลิกที่ ลงทะเบียนแสดงความจำนง
- คลิก ยินยอม ให้เก็บรวบรวมข้อมูลส่วนบุคคล
- กรอกข้อมูลส่วนตัวของท่าน
- ระบุว่าจะอุทิศอวัยวะใด เมื่อถึงแก่กรรม (อวัยวะและเนื้อเยื่อ และ/หรือ ดวงตา)
- กรอกข้อมุลลงทะเบียนผู้แสดงความจำนง
- ยืนยันการลงทะเบียน
- กรอกรหัสที่ได้รับทางมือถือ เป็นระบบความปลอดภัย เพื่อใช้ยืนยันการทำรายการ
- กดรับ e-card เลือก บัตรประจำตัวผู้แสดงความจำนง หรือ ใบประกาศเกียรติคุณ
- เลือกว่าจะให้ส่งบัตรประจำตัวให้หรือไม่ (ต้องการ/ไม่ต้องการ)
- สามารถอัพโหลดวิดีโอ ได้ โดยบันทึกแสดงเจตจำนงในการจะอุทิศบริจาค เพื่อเก็บวิดีโอไว้เป็นหลักฐานในอนาคต
- กดยืนยันการส่งบัตร
มีข้อสงสัย ติดต่อเจ้าหน้าที่
"บริจาคอวัยวะ" โทร.1666 กด 1
"บริจาคดวงตา" โทร. 02-2564039 02-2564040
1.การแจ้งเตือนการนัดล่วงหน้าให้กับผู้ป่วยด้วยไลน์หรืออีเมลล์ หรือตารางนัดของผู้ป่วยให้กับเจ้าหน้าที่
- การมีระบบแจ้งเตือนอัตโนมัติ จะช่วยให้ผู้ป่วยได้รับทราบการนัดล่วงหน้าและลดความเสี่ยงจากการไม่ได้มา และยังช่วยลดขั้นตอนในการโทรนัดหรือเสียโอกาส (lost opportunity)
2.ส่งข้อความอีเมลล์ หรือไลน์ จากระบบได้สะดวก
- สามารถทราบได้ว่าข้อความที่กำลังจะส่งให้คนไข้ มีการส่งหรือยังจากเจ้าหน้าที่ก่อนหน้านั้น เพื่อป้องกันการส่งข้อความซำ้หรือสร้างความสับสนต่อคนไข้ หรือตรวจสอบข้อความการแจ้งเตือนนัดของระบบ
- การนัดของคนไข้สามารถส่งเข้า Google calendar ของเจ้าหน้าที่ได้
3.User interface ที่ใช้ง่าย ทันสมัย และตอบสนองกับการใช้งานแบบ mobility และ สถาปัตยกรรมแบบ modular และ multitenancy
- เทคโนโลยี เช่น html5 สามารถใช้งานกับอุปกรณ์พกพาได้หลากหลาย
- การออกแบบเป็นลักษณะ modular ที่รองรับการเพิ่มความสามารถใหม่ๆ เข้ามา
4.แพทย์สามารถเปรียบเทียบการรักษากับครั้งก่อน และเลือกแบบฟอร์มตรวจ หรือออกแบบฟอร์มการตรวจ รวมถึงการตรวจร่วม คือการมา 1 ครั้งของคนไข้ สามารถมีแพทย์ตรวจได้มากกว่า 1 คน
งานอนามัยโรงเรียน จันทร์–ศุกร์ 08.00 น. - 16.00 น.
งานอนามัยโรงเรียน
งานอนามัยโรงเรียน
วัน-เวลาทำการ จันทร์ – ศุกร์ 08.00 น. - 16.00 น.
ขอบเขตการให้บริการ
- รับผิดชอบดูแลสุขภาพอนามัยนักเรียนทั้งหมด 12 โรงเรียนในเขตรับผิดชอบ
- ตรวจสุขภาพนักเรียนกลุ่มเป้าหมาย, ให้การพยาบาลและส่งต่อรายที่มีปัญหาด้านสุขภาพทั้งกายและจิต
- ให้ภูมิคุ้มกันโรคแก่นักเรียนกลุ่มเป้าหมาย ได้แก่ วัคซีนป้องกันคอตีบ-บาดทะยัก แก่นักเรียน ชั้นประถม 1 และ 6, วัคซีนป้องกันโรคหัดและหัดเยอรมัน แก่นักเรียน ชั้นประถม 1, วัคซีนป้องกันมะเร็งปากมดลูก แก่นักเรียนหญิง ชั้นประถม 5, วัคซีนป้องกันไข้หวัดใหญ่ แก่นักเรียน ชั้นประถม 1 และ 2
- ติดตามเยี่ยมนักเรียนที่มีปัญหาทั้งที่โรงเรียนและที่บ้าน, เฝ้าระวังโรคในเด็กวัยเรียน
- จัดอบรมอสร. แก่โรงเรียนในสังกัดกทม. และสังกัดรัฐบาล
- สำรวจสุขาภิบาลอาหารในโรงเรียนพร้อมทั้งให้ความรู้ด้านสุขาภิบาลอาหาร, เฝ้าระวังโรคติดต่อในระบบทางเดินอาหารกับผู้ประกอบอาหารในโรงเรียน
- ให้สุขศึกษาแก่นักเรียนและครูในโรงเรียนที่รับผิดชอบ พร้อมทั้งจัดนิทรรศการเรื่องต่างๆในโรงเรียนตามสถานการณ์
- จัดทำโครงการพิเศษด้านการส่งเสริมสุขภาพ, ป้องกันและควบคุมโรคแก่ครู เจ้าหน้าที่และนักเรียนทุกสังกัด
คลินิกตา คลินิกจักษุกรรม วันจันทร์ วันพุธ และ วันศุกร์
คลินิกจักษุกรรม
วัน - เวลาทำการ : วันจันทร์ วันพุธ และ วันศุกร์ เวลา 08.00 - 12.00 น. (ยกเว้นวันหยุดราชการ)
เบอร์โทรติดต่อ : 02-2842331 ต่อ 107
วิธีสังเกตคลินิกที่ได้มาตรฐานและขึ้นทะเบียนอย่างถูกต้อง
ประชาชนคนไทยควรรู้ วิธีสังเกต ว่าเป็นคลินิกที่ได้มาตรฐานและขึ้นทะเบียนอย่างถูกต้อง
ข้อสังเกตในการเลือกคลินิกที่ได้มาตรฐานและขึ้นทะเบียนอย่างถูกต้อง
คลินิกที่ได้รับอนุญาตถูกต้อง สังเกตได้จาก
1. มีป้ายชื่อสถานพยาบาลและเลขที่ใบอนุญาตจำนวน 11 หลัก ติดไว้ที่หน้าคลินิก ใช้แผ่นป้ายพื้นสีขาว และตัวอักษรในป้าย แสดงชื่อโดยใช้สีต่าง ๆ ดังนี้
คลินิกเวชกรรม XXXXX
ใบอนุญาตเลขที่ xxxxxxxxxxx
- คลินิกเวชกรรม (สีเขียว)
- คลินิกทันตกรรม (สีม่วง)
- คลินิกการพยาบาลและการผดุงครรค์ (สีฟ้า)
- คลินิกกายภาพบำบัด (สีชมพู)
- คลินิกเทคนิคการแพทย์ (สีเลือดหมู)
- คลินิกการแพทย์แผนไทย (สีน้ำเงิน)
- คลินิกการประกอบโรคศิลปะ (สีน้ำตาล)
- คลินิกเฉพาะทางด้านเวชกรรม (สีเขียว)
- คลินิกเฉพาะทางด้านทันตกรรม (สีม่วง)
- คลินิกเฉพาะทางด้านการพยาบาลและการผดุงครรค์ (สีฟ้า)
- สหคลินิก (สีเขียวเข้ม)
2. แสดงใบอนุญาตให้ประกอบกิจการสถานพยาบาล
3. แสดงใบอนุญาตให้ดำเนินการสถานพยาบาล
4. แสดงหลักฐานการชำระค่าธรรมเนียมประจำปีของปีปัจจุบัน
5. มีแผ่นป้ายสีน้ำเงิน แสดงรูปถ่ายของผู้ประกอบวิชาชีพหรือผู้ประกอบโรคศิลปะ พร้อมชื่อ และเลขที่ใบประกอบวิชาชีพ ติดไว้หน้าห้องตรวจ
6. แสดงอัตราค่ารักษาพยาบาล และสามารถสอบถามอัตราค่ารักษาได้
โปรแกรมอีซี่คลินิก (Easy Clinic)
โปรแกรมอีซี่คลินิก ระบุว่า เหมาะสำหรับ คลินิกเสริมความงาม คลินิกเฉพาะทาง สามารถใช้งานได้กับ PC โน๊ตบุ๊ค แท็บเล็ตและสมาร์ทโฟน พร้อมกับการใช้งานที่ง่ายไม่ซับซ้อน เน้นใช้ง่าย ไม่ซับซ้อน เรียนรู้ง่าย ช่วยให้งานคลินิกของคุณง่ายขึ้น ลดปัญหาการค้นหาข้อมูลคนไข้ไม่เจอ ทำให้ตรวจสอบข้อมูลลูกค้าได้เร็วขึ้น ไม่ว่าคุณจะอยู่ที่ใดบนโลก แค่เพียงมีอินเทอร์เน็ตก็สามารถตรวจสอบรายงานได้แบบออนไลน์ทันที
Feature เด่น ของ โปรแกรมอีซี่คลินิก ได้แก่ 1) Dashboard ข้อมูลภาพรวม การวิเคราะห์ข้อมูลเพื่อสร้าง Dashboard แสดงสถิติการใช้บริการแบบเรียลไทม์ และรายการแจ้งเตือนข้อมูลต่าง ๆ 2) ระบบการขาย ออกใบเสร็จรับเงิน การชำระเงิน ได้หลายแบบ รองรับการชำระเงิน ทั้งเงินสด บัตรเดรดิต รับโอนเงินธนาคาร เงินมัดจำ แบ่งชำระ ผ่อนชำระบัญชีลูกหนี้ 3) บันทึกข้อมูลลูกค้าและค้นหา สามารถสแกนข้อมูลจากบัตรประชาชนได้แบบรวดเร็วทันใจ แบ่งกลุ่มประเภทลูกค้าแบบต่าง ๆ ได้ รวมเก็บไว้เป็นประวัติของลูกค้ารายนั้นๆ 4) การใช้บริการตัดสต็อกยาและอุปกรณ์ การจัดการสต็อกอย่างดีและเป็นระเบียบ สามารถช่วยให้คลินิกมีการทำงานที่เป็นประสิทธิภาพมากยิ่งขึ้น สามารถเช็คยอดสต็อกได้แบบเรียลไทม์ 5) ระบบจัดการคอร์ส จองคอร์ส ลูกค้าสร้างคอร์สสำหรับการขาย กำหนดราคา แยกรายละเอียด ยา/อุปกรณ์ กำหนดจำนวนหน่วย ราคาย่อยในแต่ละคอร์สได้ 6) ระบบบัตรสมาชิก (Member card) บัตรเงินสดสำหรับลูกค้าคลินิกเพิ่มความสะดวกสบายในการจ่าย พร้อมการให้สิทธิประโยชน์กับสมาชิก
นอกจากนั้น ยังมีฟีเจอร์เสริม ที่น่าสนใจ อาทิ LINE Notify สำหรับเซลล์ แอดมินเพจขายสามารถบันทึกการจองและนัดหมาย พร้อมแจ้งเตือนสรุปข้อมูลการจองทางไลน์กลุ่มการขายได้ Sales Page เพื่อกระตุ้นยอดขาย หน้าเว็บที่ใช้ในการปิดการขาย เป็นอีกหนึ่งเครื่องมือที่สำคัญเป็นอย่างยิ่งในธุรกิจบนโลกออนไลน์ เพราะสามารถสร้างข้อมูลสินค้าและบริการต่างๆตามที่เรากำหนดใส่ลงไปได้ LINE CRM ผู้ใช้สามารถเชื่อม Line Official Account ลูกค้าผู้ใช้บริการสามารถดูข้อมูลต่าง ๆ ของลูกค้าเองได้แบบเรียลไทม์ สามารถสั่งซื้อบริการกับลูกค้าได้ทันที แบบสอบถามความพึงพอใจ สร้างแบบสอบถามความพึงพอใจของลูกค้าที่มาใช้บริการได้ทันทีหลังการรับบริการเพื่อเก็บข้อมูลปรับปรุงแก้ไขได้ทันที ลดการรีวิวในทางลบจากช่องทางอื่น
- แพคเกจของอีซี่คลินิก แบ่งเป็น แบบ Economy Standard and Premium ระดับราคาตั้งแต่ 15,900 - 25,900 ต่อปี
- มีบริการ ฟรี ช่วยเหลือ Free Import Data นำเข้าข้อมูล Free Upgrade อัพเดตการใช้งานใหม่ ๆ Free Support online ดูแลให้คำปรึกษา
สอบถามเพิ่มเติม โทร 062-4655222
อุทยานแห่งชาติรามคำแหง อ.คีรีมาศ จ.สุโขทัย
อุทยานแห่งชาติรามคำแหง อยู่ในพื้นที่ ต.คีรีมาศ อ.คีรีมาศ จ.สุโขทัย มีจุดท่องเที่ยวน่าสนใจ ได้แก่ ยอดเขาหลวง ผานารายณ์ น้ำตกลำเกลียว น้ำตกสายรุ้ง อุทยานแห่งชาติรามคำแหง เป็นภูเขาสูงสลับซับซ้อน ทอดตัวอยู่ในแนวเหนือ-ใต้ ตั้งตระหง่านอยู่บนพื้นราบคล้ายจอมปลวกโดดเด่นอยู่กลางทุ่งนา ประกอบด้วยยอดเขาสำคัญ 4 แห่งด้วยกันคือ ยอดเขาพระเจดีย์ ยอดเขานารายณ์ ยอดเขาภูกา ยอดเขาพระแม่ย่า เป็นแหล่งต้นนำลำธารไหลลงไปหล่อเลี้ยงพื้นที่เกษตรกรรมรอบๆอุทยานฯ
ที่พักอุทยานแห่งชาติรามคำแหง โซนที่ทำการอุทยานแห่งชาติ บริการบ้านพัก ได้แก่ ค่ายพักรามคำแหง 911 (ค่ายเยาวชนชาย) และ ค่ายพักรามคำแหง 912 (ค่ายเยาวชนหญิง) ความจุ 40 คน/หลัง ค่าบริการ 4,500 บาท/คืน
ลานกางเต็นท์รามคำแหง โซน 2 โซนยอดเขาหลวง ห่างจากที่ทำการฯ 3.7 กม. ผู้ใช้บริการต้องนำเต็นท์ไปเอง ค่าบริการ 30 บาท/คน/คืน
Facebook อุทยาน | โทรศัพท์ 0988839297 |
จองที่พักออนไลน์ (กรมอุทยาน) eatfuntravelจำนวนผู้ประกอบโรคศิลปะ 1 มี.ค. 2565
หุ่นยนต์ช่วยผ่าตัด Davinci มีส่วนประกอบหลัก 3 ส่วน
หุ่นยนต์ช่วยผ่าตัด Davinci มีส่วนประกอบหลัก 3 ส่วน คือ
ส่วนที่ 1 Visual Cart เป็นส่วนการประมวลผล
ส่วนที่ 2 ส่วนแขนกลหุ่นยนต์ ทำหน้าที่คล้ายกับแขนของศัลยแพทย์
ส่วนที่ 3 ส่วน Console ส่วนที่ศัลยแพทย์ ควบคุมกลไกหุ่นยนต์
11 จุดจอดรถ Motorlance โรงพยาบาลเจริญกรุงประชารักษ์ จำนวน 2 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
12 จุดจอดรถ Motorlance โรงพยาบาลคลองสามวา จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
13 จุดจอดรถ Motorlance โรงพยาบาลสิรินธร จำนวน 4 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
14 จุดจอดรถ Motorlance โรงพยาบาลเวชการุณรัศมิ์ จำนวน 2 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
15 จุดจอดรถ Motorlance โรงพยาบาลวชิรพยาบาล จำนวน 2 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
16 จุดจอดรถ Motorlance โรงพยาบาลศิริราช จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
17 จุดจอดรถ Motorlance โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
18 จุดจอดรถ Motorlance โรงพยาบาลผู้สูงอายุบางขุนเทียน จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
19 จุดจอดรถ Motorlance โรงพยาบาลลาดกระบัง จำนวน 3 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
20 จุดจอดรถ Motorlance โรงพยาบาลรวมใจรักษ์ จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์ ฉีดวัคซีน 2-6 ก.ย. 2567
เขตพญาไท เชิญชวนประชาชนนำสุนัขและสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ‼ กำหนดการฉีดวัคซีน 2-6 ก.ย.67 และ 9-13 ก.ย.67 ในชุมชนเขตพญาไท เวลา 9.00 - 12.00 น. โดยศูนย์บริการสาธารณสุข 11 ประดิพัทธ์ ร่วมกับเจ้าหน้าที่ฝ่ายสิ่งแวดล้อมฯ จัดกิจกรรมเพื่อเสริมสร้างภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ในพื้นที่กรุงเทพมหานคร ปีละ 2 ครั้งช่วงเดือนมีนาคมและกันยายนในพื้นที่เขตพญาไท
งานวันป้องกันโรคพิษสุนัขบ้าโลกในปีที่ผ่านมา
งานวันป้องกันโรคพิษสุนัขบ้าโลกในประเทศไทยนั้น จัดขึ้นเป็นประจำในวันที่ 28 กันยายน ของทุกปี โดยมีเจ้าภาพหมุนเวียนกันไปดังนี้
รายละเอียดงานแต่ละปีโรงพยาบาลธีรวัฒน์ จัดหน่วยเคลื่อนที่ออกมาตรวจสุขภาพตา ณ ชมรมข้าราชการบำนาญ อ.ชนบท จ.ขอนแก่น
โรงพยาบาลธีรวัฒน์ จังหวัดกาฬสินธุ์ ขอเชิญชวนทุกๆท่านที่มีปัญหาทางด้านสายตา การมองเห็นไม่ชัด มีภาพซ้อน มีอาการตาพร่ามัว ในวันที่ 17 เดือนมิถุนายน 2566 จะมีหน่วยเคลื่อนที่ออกมาตรวจสุขภาพตาให้ กับประชาชนชาวจังหวัด ได้แก่ จ.ขอนแก่น และ จ.สุรินทร์
หน่วย จ.ขอนแก่น ชมรมข้าราชการบำนาญ อ.ชนบท 09:00-16:00น.
ขอเชิญชวนประชาชนที่อยู่ใกล้บริเวณดังกล่าว สามารถเดินทางมาตรวจเช็คสุขภาพตากันได้เลยนะคะ
หากมีข้อสงสัยอยากสอบถามพิ่มเติม ติดต่อได้ที่ 063-872-2461 หรือ 043-811-757
สาขาการผลิตสินค้าอุตสาหกรรม ขยายตัวร้อยละ 0.2 ปรับตัวดีขึ้นจากการลดลง ร้อยละ 2.9 ในไตรมาสก่อนหน้า ตามการเพิ่มขึ้นของกลุ่มการผลิตเพื่อการบริโภค ภายในประเทศขยายตัวร้อยละ 2.5 ในขณะที่ กลุ่มการผลิตเพื่อการส่งออกและกลุ่มการผลิต ที่มีสัดส่วนการส่งออกในช่วงร้อยละ 30-60 ลดลงร้อยละ 1.5 และร้อยละ 4.5 ตามลำดับ
การผลิตสินค้าสำคัญ ๆ ที่เพิ่มขึ้น เช่น การผลิตน้ำมันปาล์ม (ร้อยละ 25.5) การผลิตอาหาร สัตว์สำเร็จรูป (ร้อยละ 13.5) การผลิตเครื่องจักรอื่น ๆ ที่ใช้งานทั่วไป (ร้อยละ 8.7) การผลิต สตาร์ช และผลิตภัณฑ์จากสตาร์ช (ร้อยละ 30.1) และการผลิตผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม (ร้อยละ 1.9) เป็นต้น
ส่วนการผลิตสินค้าสำคัญ ๆ ที่ลดลง เช่น การผลิตยานยนต์ (ลดลงร้อยละ 13.4) การผลิตชิ้นส่วนและแผงวงจรฯ (ลดลงร้อยละ 18.3) การผลิตผลิตภัณฑ์ คอนกรีต ปูนซีเมนต์ และปูนปลาสเตอร์ (ลดลงร้อยละ 9.7) การผลิตจักรยานยนต์ (ลดลงร้อยละ 14.9) และการผลิตยางนอกและยางใน การหล่อดอกยางและการซ่อมสร้างยาง (ลดลงร้อยละ 7.2) เป็นต้น สำหรับอัตราการใช้กำลังการผลิตเฉลี่ยในไตรมาสนี้อยู่ที่ร้อยละ 57.79 ต่ำกว่า ร้อยละ 60.43 ในไตรมาสก่อนหน้า และต่ำกว่าร้อยละ 58.56 ในไตรมาสเดียวกันของปีก่อน
รวมครึ่งแรกของปี 2567 สาขาการผลิตอุตสาหกรรมลดลงร้อยละ 1.4
สาขาที่พักแรมและบริการด้านอาหาร ขยายตัวร้อยละ 7.8 ต่อเนื่องจากร้อยละ 11.8 ในไตรมาสก่อนหน้า โดยในไตรมาสนี้มีนักท่องเที่ยวต่างประเทศที่เดินทางเข้ามาท่องเที่ยว ในประเทศไทยจำนวน 8.131 ล้านคน (คิดเป็นร้อยละ 93.67 ของจำนวนนักท่องเที่ยวต่างประเทศในช่วงก่อนเกิดการแพร่ระบาดของโรคโควิด-19) ส่งผลให้ มูลค่าบริการรับด้านการท่องเที่ยวในไตรมาสนี้อยู่ที่ 3.32 แสนล้านบาท เพิ่มขึ้นต่อเนื่องเป็นไตรมาสที่ 12 ร้อยละ 38.6 ส่วนการท่องเที่ยวภายในประเทศ ของนักท่องเที่ยวชาวไทย (ไทยเที่ยวไทย) ขยายตัวต่อเนื่องเป็นไตรมาสที่ 10 ร้อยละ 13.0 สร้างรายรับจากนักท่องเที่ยวชาวไทยจ านวน 2.45 แสนล้านบาท เพิ่มขึ้นร้อยละ 16.9 ส่งผลให้ในไตรมาสนี้มีรายรับรวมจากการท่องเที่ยว 5.77 แสนล้านบาท เพิ่มขึ้นร้อยละ 28.5 สำหรับอัตราการเข้าพักเฉลี่ย ในไตรมาสนี้อยู่ที่ร้อยละ 69.92 ต่ำกว่าร้อยละ 75.27 ในไตรมาสก่อนหน้า แต่สูงกว่าร้อยละ 66.93 ในไตรมาสเดียวกันของปีก่อน
รวมครึ่งแรกของปี 2567 สาขาที่พักแรมและบริการด้านอาหารขยายตัวร้อยละ 9.8
สาขาการขายส่งและการขายปลีก การซ่อมยานยนต์และจักรยานยนต์ ขยายตัวร้อยละ 3.0 เทียบกับการขยายตัวร้อยละ 4.3 ในไตรมาสก่อนหน้า สอดคล้องกับการชะลอตัวของการอุปโภคบริโภคภาคเอกชน ประกอบกับการขยายตัวต่อเนื่องของภาคการท่องเที่ยว รวมครึ่งแรกของปี 2567
สาขาการขายส่งและการขายปลีก ขยายตัวร้อยละ 3.7 สาขาการขนส่งและสถานที่เก็บสินค้า ขยายตัวร้อยละ 8.1 เทียบกับการขยายตัวร้อยละ 9.7 ในไตรมาสก่อนหน้า โดยบริการขนส่งเพิ่มขึ้นร้อยละ 7.9 ตามการเพิ่มขึ้นของบริการขนส่งทางอากาศ (ร้อยละ 22.3) บริการขนส่งทางบกและท่อลำเลียง (ร้อยละ 5.2) และบริการขนส่งทางน้ า (ร้อยละ 2.6) รวมครึ่งแรกของปี 2567 สาขาการขนส่ง และสถานที่เก็บสินค้าขยายตัวร้อยละ 9.0
สาขาการก่อสร้าง ลดลงร้อยละ 5.5 ต่อเนื่องจากการลดลงร้อยละ 17.3 ในไตรมาสก่อนหน้า โดยการก่อสร้างภาครัฐลดลงร้อยละ 7.8 เทียบกับ การลดลงร้อยละ 30.1 ในไตรมาสก่อนหน้า ตามการลดลงของการก่อสร้างของรัฐบาลร้อยละ 17.2 และการก่อสร้างภาคเอกชนลดลงร้อยละ 2.2 ส าหรับดัชนีราคาวัสดุก่อสร้างลดลงร้อยละ 0.4 ตามการลดลงของราคาหมวดเหล็ก (ลดลงร้อยละ 2.0) ราคาหมวดวัสดุก่อสร้างอื่น ๆ (ลดลงร้อยละ 1.6) และราคาสุขภัณฑ์ (ลดลงร้อยละ 3.8) เป็นสำคัญ
รวมครึ่งแรกของปี 2567 สาขาการก่อสร้างลดลงร้อยละ 11.2
ศิริราชให้บริการตรวจวินิจฉัยโรคด้วย PET/CT Scan LINK
รพ.ศิริราชให้บริการตรวจวินิจฉัยโรคด้วย PET/CT Scan ณ สาขาเวชศาสตร์นิวเคลียร์ ภาควิชารังสีวิทยา โรงพยาบาลศิริราช อาคารศูนย์โรคหัวใจสมเด็จพระบรมราชินีนาถ ชั้น 10 โทร. 02-419-6195 โรงพยาบาลศิริราช มีนโยบายที่จะให้การตรวจชนิดนี้ สามารถเข้าถึงคนไทยได้อย่างทั่วถึง อันจะเป็นประโยชน์ต่อการวางแผนการรักษาพยาบาลในโรคมะเร็งหรือโรคสมองบางชนิด จึงเปิดให้บริการตรวจวินิจฉัยโรคด้วย PET/CT Scan ในอัตราพิเศษตลอดปี 2563 สำหรับโรงพยาบาลทั่วไปและประชาชนผู้สนใจ
อบรมโรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข..รุ่น 2 (ปี 2566-67)


3 ต.ค. 2566 นายปรเมศวร์ งามพิเชษฐ์ นายกเมืองพัทยา เป็นประธานในพิธีเปิดโครงการส่งเสริมสุขภาพแบบองค์รวมสำหรับผู้สูงอายุเมืองพัทยา "โรงเรียนผู้สูงอายุเมืองพัทยาสร้างสุข รุ่นที่ 2" โดยมีนายวุฒิศักดิ์ เริ่มกิจการ นายมาโนช หนองใหญ่ นางสาวทิฐิพันธ์ เพ็ชรตระกูล รองนายกเมืองพัทยา นายภูมิพิพัฒน์ กมลนาถ เลขานุการนายกเมืองพัทยา ร.ต.อ.หญิงกัญรภา มุกดาสนิท ผู้อำนวยการสำนักสาธารณสุขและสิ่งแวดล้อม และเจ้าหน้าที่สำนักสาธารณสุขและสิ่งแวดล้อม ส่วนส่งเสริมสุขภาพ ฝ่ายส่งเสริมสุขภาพ และผู้เข้ารับการอบรม เข้าร่วมพิธีเปิดฯ ซึ่งมีนายศิวัช บุญเกิด รองปลัดเมืองพัทยา กล่าวรายงานวัตถุประสงค์การจัดโครงการฯ ณ ห้องประชุมทัพพระยา ศาลาว่าการเมืองพัทยา
การอบรมครั้งนี้ มีผู้สมัครทั้งสิ้น 100 คน กำหนดจัดการอบรม สัปดาห์ละ 1 วัน ในทุกวันอังคาร ระหว่างเดือนตุลาคม 2566 ถึง เมษายน 2557 ซึ่งเมื่อวันที่ 24 ตุลาคม 2566 ที่ผ่านมา ได้ประเมินสุขภาพเบื้องต้น และ คัดกรองภาวะสุขภาพแบบองค์รวม แก่ผู้ที่สมัครเข้ารับการอบรมในโครงการนี้ พร้อมด้วยจัดกิจกรรม ที่รุ่น 1 ผูกแขนรับขวัญน้อง
จบหลักสูตร....นายกเมืองพัทยามอบวุฒิบัตรให้กับผู้ผ่านการอบรมโรงเรียนผู้สูงอายุเมืองพัทยา สร้างสุข" รุ่นที่ 2
2 เม.ย. 67 นายปรเมศวร์ งามพิเชษฐ์ นายกเมืองพัทยา เป็นประธานในพิธีปิดโครงการส่งเสริมสุขภาพแบบองค์รวม สำหรับผู้สูงอายุเมืองพัทยา หรือ โรงเรียนผู้สูงอายุ เมืองพัทยา สร้างสุข รุ่นที่ 2 และมอบวุฒิบัตรแก่ผู้เข้าร่วมโครงการฯ โดยมีนายศักดิ์ไชย เจริญอยู่คงรอด ผู้ช่วยเลขานุการนายกเมืองพัทยา นายเกียรติศักดิ์ ศรีวงษ์ชัย รองปลัดเมืองพัทยา รักษาราชการแทนปลัดเมืองพัทยา พร้อมด้วยหัวหน้าส่วนราชการ เจ้าหน้าที่ที่เกี่ยวข้อง เข้าร่วมพิธีฯ ซึ่งมี ดร.ศิวัช บุญเกิด รองปลัดเมืองพัทยา กล่าวรายงานวัตถุประสงค์ ณ ห้องประชุมทัพพระยา ศาลาว่าการเมืองพัทยา
ทั้งนี้เพื่อเป็นการเชิดชูเกียรติและเป็นขวัญกำลังใจสำหรับผู้เข้าร่วมโครงการ วันนี้ได้มีพิธีมอบวุฒิบัตรฯ จำนวน 88 คน และนักเรียนดีเด่น จำนวน 13 คน ซึ่งตลอดระยะเวลาการดำเนินโครงการนี้ผู้สูงอายุได้ให้ความร่วมมือในการเข้าร่วมทำกิจกรรมของหลักสูตร เป็นอย่างดี และมีความสุข สนุกสนานกับเพื่อนวัยเดียวกัน และเป็นสังคมแห่งกัลยาณมิตรอย่างแท้จริงต่อไป
รายงานผลศึกษาภูมิคุ้มกันต่อเชื้อฝีดาษวานรในคนที่ได้รับวัคซีนป้องกันโรคฝีดาษมากกว่า 40 ปี
5 กันยายน 2565 กรมวิทยาศาสตร์การแพทย์ แถลงข่าว "ภูมิคุ้มกันต่อเชื้อฝีดาษวานร หรือฝีดาษลิง (Monkeypox)" สายพันธุ์ B.1 และ A.2 จำนวน 30 คน พบว่า ส่วนใหญ่ภูมิคุ้มกัน ไม่ขึ้นในระดับป้องกันโรค มีเพียง 2 รายมีภูมิคุ้มกันที่สามารถลบล้างฤทธิ์ไวรัสฝีดาษวานรได้
เพื่อตอบคำถามว่าคนไทยที่รับวัคซีนฝีดาษเมื่อ 40 ปีก่อน จะมีภูมิคุ้มกันที่สามารถลบล้างฤทธิ์ไวรัสฝีดาษวานรได้หรือไม่ กรมวิทยาศาสตร์การแพทย์ จึงได้นำซีรั่มจากอาสาสมัครที่ได้รับวัคซีนโรคฝีดาษคนมานานกว่า 40 ปี จำนวน 30 คน แบ่งเป็นกลุ่มอายุ 45-54, 55-64 และ 65-74 ปี มาหาระดับภูมิคุ้มกันต่อเชื้อฝีดาษวานร สายพันธุ์ B.1 (พบในยุโรป) และ A.2 (พบในแอฟริกา) ที่แยกได้จากผู้ติดเชื้อที่พบในประเทศไทย มาทดสอบโดยวิธี Plaque Reduction Neutralization Test (PRNT) ซึ่งเป็นวิธีมาตรฐาน เพื่อหาค่าที่ไวรัสฝีดาษวานรเชื้อเป็นถูกทำลายได้ครึ่งหนึ่ง หรือที่เรียกว่า PRNT Titer 50%, PRNT50 โดยภูมิคุ้มกันที่เกิดขึ้นหลังฉีดวัคซีนฝีดาษคน ซึ่งระดับแอนติบอดี titer มากกว่าหรือเท่ากับ 32 (PRNT50 ≥ 32) ถือว่าคนนั้นมีภูมิคุ้มกันที่สามารถลบล้างฤทธิ์ไวรัสฝีดาษวานรได้
ผลการทดสอบ พบว่า ในอาสาสมัครที่ได้รับวัคซีนฝีดาษมานานกว่า 40 ปี จำนวน 28 ราย ไม่มีภูมิคุ้มกันต่อไวรัสฝีดาษวานรทั้ง 2 สายพันธุ์ มีเพียง 2 ราย ที่พบมีระดับภูมิคุ้มกันมากกว่า 32 (PRNT50 titer>32) ที่สามารถลบล้างฤทธิ์ของไวรัสฝีดาษวานรได้ ในจำนวนนี้พบ 1 รายมีภูมิคุ้มกันต่อสายพันธุ์ A.2 และอีก 1 รายมีภูมิคุ้มกันต่อทั้ง 2 สายพันธุ์ สรุปได้ว่าคนส่วนใหญ่ที่ได้รับวัคซีนป้องกันโรคฝีดาษเมื่อ 40 ปีก่อน ไม่มีภูมิคุ้มกันที่สามารถลบล้างฤทธิ์ไวรัสฝีดาษวานรได้
ในเรื่องของวัคซีนนั้น หากมีวัคซีนเข้ามาจะใช้ 2 กรณี คือ กลุ่มเสี่ยงมาก เช่น เจ้าหน้าที่ห้องแลป, คนสัมผัสใกล้ชิด และกลุ่มเสี่ยงที่มีประวัติไปสัมผัสโรคก็อาจฉีดให้ เพื่อลดความรุนแรงของโรค หากถามว่าจำเป็นต้องนำมาฉีดกับคนทั่วไปไหม ขณะนี้ยังไม่จำเป็น เนื่องจาก ขณะนี้สายพันธุ์ที่แพร่ระบาดส่วนใหญ่ เป็น BA.2 ซึ่งไม่ใช่สายพันธุ์รุนแรง ยกเว้นคนที่ภูมิคุ้มกันไม่ดี ที่กินยากดภูมิคุ้มกัน หรือคนที่เป็นโรคบางอย่างที่ทำให้ภูมิคุ้มกันน้อย รวมทั้งเด็กเล็ก
อย่างไรก็ตาม ขอเน้นย้ำว่าโรคฝีดาษวานรไม่ได้ติดต่อกันง่าย ส่วนใหญ่ติดต่อจากการสัมผัสผื่นผู้ป่วยทางผิวหนังโดยตรงหรือสารคัดหลั่งจากผู้ป่วย หลีกเลี่ยงมีเพศสัมพันธ์ที่มีความเสี่ยงหรือคู่นอนที่ไม่รู้จัก ทั้งนี้ในผู้ป่วยบางรายที่อาการไม่รุนแรง หายเองได้ แต่จะมีอาการรุนแรงได้ในผู้ที่มีภูมิคุ้มกันต่ำและในเด็กเล็ก ดังนั้นมาตรการล้างมือบ่อยๆ ด้วยสบู่หรือแอลกอฮอล์เจล สวมหน้ากาก เว้นระยะห่าง สามารถนำมาใช้ในการป้องกันโรคฝีดาษวานรได้ ปัจจุบันประเทศอเมริกาและยุโรป ได้ให้การรับรองวัคซีนจีนนีออส (JYNNEOS) เพื่อนำมาใช้ป้องกันโรคฝีดาษลิงในกรณีฉุกเฉินแล้ว
ส่วนประเทศไทยได้มีการนำเข้าวัคซีนดังกล่าวจากประเทศสหรัฐอเมริกาสำหรับป้องกันโรคในกลุ่มที่มีความเสี่ยงแล้วจำนวน 1,000 โดส
โรงพยาบาลเวียงแก่น LINK
โรงพยาบาลเวียงแก่น จ.เชียงราย ขอบริจาคผ้าอ้อมสำเร็จรูป-ยา เงินบริจาค (โอนเข้าบัญชีธนาคาร รพ.เวียงแก่น) เพื่อนำไปจัดซื้อ Syring driver ให้ผู้ป่วยประคับประคองระยะสุดท้ายที่ได้รับยาทางใต้ผิวหนัง เช่น คนไข้โรคมะเร็ง (ปกติผู้ป่วยและญาติต้องซื้อเอง ออกค่าใช้จ่ายเอง แต่ รพ.เวียงแก่น ช่วยกันระดมทุนให้คนไข้นำไปใช้ที่บ้านในระยะสุดท้าย) ติดต่อไพลิน สาระมนต์ สกุลนิธิเมธา เภสัชกรชำนาญการ รพ.เวียงแก่น 084–169-3886
แจ้งพิกัดอันตราย ร้านรับซื้อสุราเถื่อน (เมทานอล) ไปจำหน่าย 18 แห่ง
สำนักการแพทย์ กรุงเทพมหานคร แจ้งข้อมูลร้านค้าที่รับซื้อสุราเถื่อน (เมทานอล) ไปจำหน่าย 18 แห่ง ในเขตมีนบุรี คลองสามวาและพื้นที่กรุงเทพฝั่งตะวันออก พิกัดบริเวณ : ถนนหทัยราษฎร์ ถนนสามวา ถนนเจริญพัฒนา และบริเวณโดยรอบ พื้นที่เขตคลองสามวา เขตมีนบุรี กทม. ตำรวจสั่งปิดร้านยาดอง เตือนผู้ที่เคยดื่ม หากพบว่าป่วย หรือพบผู้ป่วยเป็นพิษจากการดื่มสุราเถื่อนเหล่านี้ ให้รีบพบแพทย์โดยทันที
ลักษณะอาการ ของผู้ที่ดื่มเหล้าเถื่อน หรือ ที่มีประวัติดื่มสุรายาดอง สุราต้ม เข้าไป จะมีอาการเหนื่อยหอบง่าย ซึม อ่อนเพลีย ตาพร่ามัวเฉียบพลัน (มักเป็นใน 12 ชม.) วิงเวียนศีรษะ และคลื่นไส้อาเจียน ให้รีบเข้ารับการตรวจอาการที่โรงพยาบาลที่ใกล้ที่สุดโดยด่วน หรือ ติดต่อ ศูนย์ประสานงาน War Room (เคสเมทานอล) รพ.นพรัตนราชธานี โทร. 02-5481000
ผู้บริหาร กทม. ร่วมรับเสด็จกรมสมเด็จพระเทพฯ ทรงเปิดอาคารโรงพยาบาลรัตนประชารักษ์ เขตคลองสามวา
8 สิงหาคม 2567 สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จพระราชดำเนินทรงเปิดอาคารโรงพยาบาลรัตนประชารักษ์ นามพระราชทาน ในการนี้ นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร นายสุรจิตต์ พงษ์สิงห์วิทยา ประธานสภากรุงเทพมหานคร นายต่อศักดิ์ โชติมงคล ประธานที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร นายวิศณุ ทรัพย์สมพล รศ.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร แพทย์หญิงวันทนีย์ วัฒนะ ปลัดกรุงเทพมหานคร นายณรงค์ เรืองศรี รองปลัดกรุงเทพมหานคร ผู้บริหารกรุงเทพมหานคร ผู้บริหารสำนักการแพทย์ คณะแพทย์ พยาบาล และประชาชน ร่วมเฝ้ารับเสด็จฯ ณ โรงพยาบาลรัตนประชารักษ์ เขตคลองสามวา
เลือกสิทธิประกันสังคมกับโรงพยาบาลสิรินธร กรุงเทพมหานคร
นางฟ้าของน้องๆ ออทิสติก
นางฟ้าของน้องๆ ออทิสติก ผู้ที่ไม่เคยเหน็ดเหนื่อย คุณหมอแก้วตา
ผศ.พญ.แก้วตา นพมณีจำรัสเลิศ รองผู้อำนวยการสถาบันแห่งชาติเพื่อพัฒนาเด็กและครอบครัว เปิดเผยว่า การจัดคลินิกพัฒนาการเด็กแบบครอบครัวมีส่วนร่วม จะเป็นพื้นที่ให้บริการสำหรับกลุ่มครอบครัวที่มีสมาชิกออทิสติก มีเป้าหมายเพื่อมุ่งเน้นการมีส่วนร่วมของพ่อแม่ที่มีต่อการพัฒนาการลูก ผ่านการเล่นเพื่อส่งเสริมพัฒนาการ ซึ่งทุกคลินิกที่เข้าร่วมโครงการจะมีบุคคลากรทางการแพทย์สาขาต่างๆ อาทิ กุมารแพทย์ นักจิตวิทยาเด็กและวัยรุ่น แพทย์ผู้สนใจด้านพัฒนาการเด็ก ทีมสหวิชาชีพที่ทำงานร่วมกับแพทย์ ฯลฯ เข้าร่วมฝึกอบรมกับสถาบันก่อนเข้ารับทุนสนับสนุน เพื่อนำองค์ความรู้ที่ถูกต้องไปปรับใช้และพัฒนาคลินิกให้เกิดประโยชน์สูงสุดอย่างยั่งยืน คาดว่าคลินิกนี้จะสามารถเข้าถึงง่ายและเกิดประโยชน์สูงสุดต่อการพัฒนาคุณภาพชีวิตของกลุ่มเด็กออทิสติกทั่วประเทศ
วิธีจำแนกแอลกอฮอล์ทั้ง 3 ชนิด
คลินิกพิเศษสำหรับคุณผู้ชาย
คลินิกพิเศษสำหรับคุณผู้ชาย
"อย่าปล่อยไว้ ให้รีบมาหาเรา"
เปิดให้บริการทุกวันพุธ ตรวจรักษานอกเวลาราชการ 16.00 - 20.00 น.
ณ บ้านวรรังสฤษดิ์ (ด้านข้างพระบรมราชานุสาวรีย์สมเด็จพระเจ้าตากสินมหาราช)
*รับเฉพาะผู้รับบริการสิทธิเงินสด และสิทธิเบิกจ่ายตรงกรมบัญชีกลางเท่านั้น
รพ.ชลบุรี เปิดรับสมัคร พยาบาลวิชาชีพ 36 อัตรา (22 สิงหาคม)
รพ.ชลบุรี เปิดรับสมัคร พยาบาลวิชาชีพ 36 อัตรา
เปิดรับสมัคร ตั้งแต่บัดนี้เป็นต้นไป
สถานที่สมัคร : กลุ่มงานทรัพยากรบุคคล อาคารอำนวยการ ชั้น 2 รพ.ชลบุรี
ทุกวันราชการ เวลา 08.00 น. - 16.00 น.
สอบถามโทรศัพท์
0-38932031
0-38932032
0-38932033
0-38932034
หนี้สินครัวเรือน
ในไตรมาสหนึ่ง ปี 2567 หนี้สินครัวเรือนขยายตัวในอัตราที่ชะลอลง ทำให้สัดส่วนหนี้สิน ครัวเรือนต่อ GDP ปรับลดลง เช่นเดียวกับความสามารถในการชำระหนี้ของครัวเรือน
ปรับลดลงต่อเนื่อง ทั้งนี้ ยังมีประเด็นที่ต้องให้ความสำคัญ ได้แก่ การเร่งปรับโครงสร้างหนี้ ลูกหนี้บัตรเครดิตที่เริ่มมีปัญหาการชำระหนี้คืน และการกู้นอกระบบที่หลากหลาย และเข้าถึงง่ายอาจก่อให้เกิดพฤติกรรมการก่อหนี้เกินตัว
- สถานการณ์หนี้สินครัวเรือนชะลอลง โดย หนี้สินครัวเรือนมีมูลค่า 16.37 ล้านล้านบาท ขยายตัวชะลอลง
- สัดส่วนหนี้สินครัวเรือนต่อ GDP อยู่ที่ร้อยละ 90.8 ลดลงจากร้อยละ 91.4 ของไตรมาสก่อน
- หนี้ครัวเรือนขยายตัวชะลอลงเกือบทุกประเภทสินเชื่อ ซึ่งส่วนหนึ่งเกิดจากครัวเรือนมีภาระหนี้ ในระดับสูง และคุณภาพสินเชื่อที่ปรับลดลง ทำให้สถาบันการเงินเข้มงวดในการอนุมัติสินเชื่อแก่ครัวเรือน จำแนกได้เป็น
• สินเชื่อเพื่อซื้ออสังหาริมทรัพย์ ขยายชะลอลง
• สินเชื่อเพื่อยานยนต์ ยังคงหดตัวเป็นไตรมาสที่สองติดต่อกัน
• กลุ่มสินเชื่อเพื่อการอุปโภคบริโภคส่วนบุคคลอื่น ทั้งสินเชื่อ ส่วนบุคคล สินเชื่อส่วนบุคคลภายใต้การก ากับ และสินเชื่อบัตรเครดิต ขยายตัวชะลอลง
• สินเชื่อเพื่อการประกอบธุรกิจ ที่ขยายตัวเพิ่มขึ้นร้อยละ 1.6
- คุณภาพสินเชื่อของครัวเรือนปรับลดลงต่อเนื่อง โดยไตรมาสหนึ่ง ปี 2567 มูลค่าหนี้เพื่อการอุปโภค บริโภคที่ไม่ก่อให้เกิดรายได้ (NPLs) ของธนาคารพาณิชย์ 1.63 แสนล้านบาท เพิ่มขึ้นต่อเนื่องเป็นไตรมาสที่ห้า ติดต่อกัน และสัดส่วนดังกล่าวยังปรับเพิ่มขึ้นในสินเชื่อทุกวัตถุประสงค์ โดยเฉพาะสินเชื่อบัตรเครดิตที่มีสัดส่วนหนี้เสีย ต่อสินเชื่อรวมสูงกว่าสินเชื่อประเภทอื่น
ประเด็นหนี้สินครัวเรือนที่ต้องให้ความสำคัญ ได้แก่
1. การเร่งปรับโครงสร้างหนี้ลูกหนี้บัตรเครดิตที่เริ่มมีปัญหาการชำระหนี้คืน หลังจากธนาคาร แห่งประเทศไทยมีการปรับอัตราการจ่ายบัตรเครดิตขั้นต่ำจากร้อยละ 5 เป็นร้อยละ 8 นับตั้งแต่รอบบัญชี เดือนมกราคม ปี 2567 ทำให้ลูกหนี้มียอดผ่อนชำระในแต่ละงวดเพิ่มขึ้น แม้ว่าจะเป็นหนึ่งในนโยบายการแก้ไข ปัญหาหนี้ครัวเรือน แต่ส่งผลให้ลูกหนี้บางส่วนไม่สามารถปรับตัวและมีปัญหาในการชำระคืน สะท้อนจากหนี้เสียและหนี้ที่มีค้างชำระ 1 - 3 เดือน (SMLs) ของสินเชื่อบัตรเครดิตที่เพิ่มขึ้นอย่างชัดเจนในไตรมาสหนี่ง ปี 2567 โดยสัดส่วนหนี้เสียต่อสินเชื่อรวม อยู่ที่ร้อยละ 4.13 จากร้อยละ 3.57 ของไตรมาสที่ผ่านมา เช่นเดียวกับสัดส่วน หนี้ SMLs ต่อสินเชื่อรวม เพิ่มขึ้นเป็นร้อยละ 5.25 จากร้อยละ 4.22 อีกทั้ง จากข้อมูลเครดิตบูโร ยังพบว่า ในช่วงเวลาเดียวกัน จำนวนบัญชีบัตรเครดิตที่เริ่มมีสถานะผิดนัดการชำระหนี้ (1 - 3 เดือน) ยังเพิ่มขึ้นถึงร้อยละ 26.1 จากร้อยละ 1.1 ของไตรมาสก่อน ดังนั้น สถาบันการเงินจึงอาจต้องเร่งปรับโครงสร้างหนี้ลูกหนี้บัตรเครดิต ที่เริ่มผ่อนชำระไม่ไหว รวมถึงลูกหนี้เองก็ควรรีบติดต่อหรือขอคำปรึกษาสถาบันการเงิน ทั้งก่อนที่จะเป็นหนี้เสีย และหลังเป็นหนี้เสีย
2. รูปแบบการให้กู้ยืมนอกระบบที่หลากหลาย อาจก่อให้เกิดพฤติกรรมการก่อหนี้เกินตัวได้ง่าย ปัจจุบันมักพบเห็นการให้กู้ยืมนอกระบบผ่านช่องทางโซเชียลมีเดีย ในหลากหลายรูปแบบ ทั้งการผ่อนไปใช้ไป หรือ ผ่อนครบรับของ เช่น ผ่อนบัตรคอนเสิร์ตผ่านร้านรับกดบัตรในแอปพลิเคชัน X ผ่อนเครื่องสำอางในแอปพลิเคชัน Line ผ่อนอุปกรณ์ไอที หรือสินค้าแบรนด์เนม ผ่าน Facebook หรือ Instagram ไปจนถึงสัตว์เลี้ยง ทั้งสุนัขหรือแมว ใน TikTok และยังครอบคลุมไปถึงอาร์ตทอยที่กำลังได้รับความนิยม อาทิ ตุ๊กตาลาบูบู้ ครายเบบี้ ซึ่งธุรกิจ การผ่อนรูปแบบนี้เข้าถึงได้ง่าย และส่วนใหญ่ใช้แค่บัตรประชาชนใบเดียว ทั้งนี้ ช่องทางการกู้ยืมนอกระบบข้างต้น ที่เพิ่มขึ้นและเงื่อนไขการกู้ที่เอื้อต่อการเข้าถึงสินเชื่อได้ง่าย อาจนำไปสู่พฤติกรรมการใช้จ่ายฟุ่มเฟือยและความเคยชินในการก่อหนี้ รวมถึงมีความเสี่ยงการมีหนี้สินพ้นตัวจากอัตราดอกเบี้ยนอกระบบที่อยู่ในระดับสูง โดยเฉพาะในกลุ่มเด็กรุ่นใหม
1. การสร้างจุดขายของเทศกาลที่แตกต่างจากเทศกาลอื่นหรือที่อื่น
การสร้างจุดขายของเทศกาลที่แตกต่างจากเทศกาลอื่นหรือที่อื่น ในบางประเทศอาศัย การดึงจุดแข็งของวัฒนธรรมที่เป็นเอกลักษณ์มาเป็นจุดขาย เช่น เทศกาลริโอ คาร์นิวัล (Rio Carnival) ของประเทศบราซิล ที่ไม่ใช่เพียงแค่การเฉลิมฉลองของชาวคริสต์ทั่วไป แต่มีการนำการเต้นแซมบ้า ซึ่งเป็นวัฒนธรรมของชาวลาตินอเมริกา มาผสมผสาน ทำให้มีเสน่ห์และโดดเด่นกว่าเทศกาลคาร์นิวัล ที่จัดขึ้นในประเทศอื่น นอกจากนี้ องค์ประกอบอื่น ๆ ของงานที่จัด อย่างยิ่งใหญ่ ทั้งขบวนพาเหรด การแต่งกายสีฉูดฉาด ยังเป็นปัจจัย ที่ช่วยดึงดูดนักท่องเที่ยวจากทั่วโลกจนได้รับการประกาศโดย Guinness Book World Records 2010 ว่าเป็นปาร์ตี้ที่ใหญ่ที่สุดในโลก เช่นเดียวกับ เทศกาลสาดสี (Holi Festival) หนึ่งในงานเฉลิมฉลองที่ทั่วโลกรับรู้มากที่สุดของประเทศอินเดีย มีพื้นฐานมาจากความเชื่อในศาสนาฮินดู โดยเชื่อว่าการสาดสีเป็นการปัดเป่าสิ่งชั่วร้าย
อย่างไรก็ตาม เทศกาล ที่ประสบความสำเร็จอาจไม่ได้พึ่งพาศักยภาพของวัฒนธรรมหรือประเพณีดั้งเดิมแต่เป็นการเพิ่มความคิดสร้างสรรค์ หรือต่อยอดจากบางสิ่งบางอย่าง อาทิ เทศกาลปามะเขือเทศ (La Tomatina) ในประเทศสเปน ที่จัดขึ้นทุกปี เฉพาะที่เมืองบูโญลเมืองเดียวเท่านั้น ซึ่งมีจุดเริ่มต้นจากเหตุทะเลาะวิวาทภายในงานเดินขบวนพาเหรดเมื่อปี ค.ศ. 1945 ที่มีการใช้มะเขือเทศปาใส่กัน จนเหตุดังกล่าวกลายมาเป็นกิจกรรมเพื่อสร้างความสนุกที่ได้รับความนิยมจากคนในท้องถิ่น จนกระทั่งในปี ค.ศ. 2002 เทศกาลนี้ถูกประกาศให้เป็นเทศกาลสำหรับนักท่องเที่ยวต่างชาติ ซึ่งปัจจุบันสามารถดึงดูดนักท่องเที่ยวกว่าสองหมื่นคนให้เข้าร่วม จึงนับเป็นเทศกาลที่มีเอกลักษณ์ความเฉพาะตัว
นอกจากนี้ เทศกาลอีกหนึ่งรูปแบบที่เป็นที่นิยมอย่างมาก คือ เทศกาลดนตรี ซึ่งมีรูปแบบการจัดงาน ที่แตกต่างกันไปเพื่อตอบสนองต่อคนกลุ่มต่าง ๆ อาทิ เทศกาลดนตรี Tomorrowland ของประเทศเบลเยียม เป็นเทศกาลดนตรีอิเล็กทรอนิกส์แดนซ์ (EDM) ที่ใหญ่ที่สุดในโลก มีจุดเด่นด้านการออกแบบเวทีที่อลังการ และธีมงานที่สร้างสรรค์ที่ไม่ซ้ำกันในแต่ละปี รวมถึงยังรวบรวมศิลปิน ดีเจ ดนตรีแนวอิเล็กทรอนิกส์จากทั่วโลก
ข้อมูลข้างต้น ชี้ให้เห็นว่าประเทศไทยจำเป็นต้องหามาตรการป้องกันและแก้ไขอย่างจริงจัง โดยปัจจุบัน ประเทศไทยอยู่ระหว่างพิจารณาร่างพระราชบัญญัติแก้ไขเพิ่มเติมประมวลกฎหมายอาญา (ฉบับที่ ..) พ.ศ. ... เพื่อป้องกันและปราบปรามการครอบครองสื่อลามกอนาจารเด็ก และให้ความคุ้มครองเด็กและเยาวชนจากการถูกล่วงละเมิดทางเพศ จึงกำหนดให้การกระทำในลักษณะการครอบครอง การค้า การทำให้แพร่หลายซึ่งวัตถุหรือ สิ่งลามกที่เป็นสื่อลามกอนาจารเด็กและเยาวชน ผู้กระทำความผิดต้องได้รับโทษหนักขึ้น
ทั้งนี้ การดำเนินการแก้ปัญหาให้มีประสิทธิภาพจำเป็นต้องอาศัยความร่วมมือในระดับครอบครัว ชุมชนสถาบันการศึกษา และ ภาครัฐ โดยเริ่มตั้งแต่
- การกวดขัน ตรวจจับสื่อออนไลน์ที่มีพฤติกรรมการรวมกลุ่มเพื่อคุกคามทางเพศ
- สร้างทัศนคติในการป้องกันการเพิกเฉยต่อการคุกคามทางเพศ โดยเริ่มต้นจากสถาบันครอบครัวที่จะต้องสอดส่อง ดูแลพฤติกรรมการใช้สื่อ
- ในขณะที่ระดับชุมชนและภาครัฐ จะต้องมีมาตรการในการลงโทษที่ชัดเจน เพื่อป้องกันไม่ให้ เกิดเหตุร้าย
- รวมทั้งการให้ความรู้ด้านสิทธิ โดยสถาบันการศึกษา และชุมชน ควรให้ความรู้เกี่ยวกับสิทธิ และความเสี่ยงจากการถูกคุกคามทางเพศออนไลน์
ขณะเดียวกัน ภาครัฐควรสร้างความตระหนักรู้เกี่ยวกับ การความสำคัญของการคุกคามทางเพศออนไลน์โดยการจัดช่องทางให้ความรู้แก่ผู้ปกครองรวมถึงอำนวย ความสะดวกในการให้คำปรึกษาและช่วยเหลือแก่บุคคลที่ถูกคุกคาม ทั้งทางด้านกฎหมายและการฟื้นฟูสภาพจิตใจ จากการถูกคุกคามทางเพศออนไลน์
นอกจากนี้ ยังต้องสร้างความตระหนักรู้เท่าทันภัยคุกคามดิจิทัล เนื่องจากการคุกคามทางเพศเด็กออนไลน์มีรูปแบบใหม่และเปลี่ยนแปลงไปตลอดเวลา ในระดับครอบครัวสามารถเริ่มต้นด้วย การให้ความรู้เรื่องการไม่เปิดเผยข้อมูลส่วนบุคคลของเด็กในพื้นที่ออนไลน์ ขณะที่สถานศึกษาควรให้ความรู้เกี่ยวกับ การล่อลวงทางเพศออนไลน์ให้เป็นความรู้พื้นฐานหรือเป็นหลักสูตรเพื่อไม่ให้เด็กและเยาวชนตกเป็นเหยื่อของผู้ที่ มุ่งหาผลประโยชน์ทางเพศ
อีกทั้ง ควรเร่งรัดการพิจารณากฎหมายร่างพระราชบัญญัติแก้ไขเพิ่มเติมประมวล กฎหมายอาญา (ฉบับที่ ..) พ.ศ. .... เพื่อให้เด็กได้รับการปกป้องทางกฎหมายที่สอดคล้องกับบริบทในปัจจุบัน และ ผู้กระทำความผิดได้รับโทษที่แยกจากความผิดประเภทอื่นอย่างชัดเจน
รางวัลแมกไซไซ ครั้งที่ 66 ประจำปี 2024
รางวัลแมกไซไซ ครั้งที่ 66 ประจำปี 2024 มูลนิธิรางวัลแมกไซไซได้คัดเลือกผู้มีผลงานดีเด่นเข้ารับรางวัลจำนวน 5 ท่านได้แก่ Karma Phuntsho จากภูฏาน Miyazaki Hayao จากญี่ปุ่น Nguyen Thi Ngoc Phuong จากเวียดนาม Farwiza Farhan จากอินโดนีเซีย และขบวนการแพทย์ชนท จากประเทศไทย
ปัจจุบันมีการรักษาที่หลากหลาย โดยการรักษามาตรฐานสำหรับผู้ป่วยที่ได้รับการวินิจฉัยใหม่ และเป็นชนิด Aggressive คือ การให้ chemotherapy ร่วมกับ Targeted therapy กลุ่ม monoclonal antibody โดยพบว่าประมาณ 60% ของผู้ป่วยตอบสนองต่อการรักษา อย่างไรก็ตาม ปัจจุบันมียา antibody-drug conjugate ซึ่งเป็น targeted therapy กลุ่มใหม่ ที่ให้ผลลัพธ์การรักษาที่ดีขึ้นกว่าการรักษามาตรฐาน โดยมีอัตราการอยู่รอดโดยโรคสงบ (Progression-free survival) สูงขึ้น อย่างไรก็ตามข้อมูลปัจจุบันที่ 3 ปียังไม่มีความแตกต่างของอัตราการรอดชีวิต
ในผู้ป่วยที่ไม่ตอบสนองต่อการรักษาขนานแรก แนวทางการรักษามาตรฐานขั้นถัดไป คือ การทำ stem cell transplantation อย่างไรก็ตามการรักษาวิธีนี้เหมาะกับผู้ป่วยที่ร่างกายมีความพร้อม และอายุไม่เกินกว่า 65 ปี เนื่องจากมีการใช้ยาเคมีบำบัดในขนาดสูงร่วมด้วย
ปัจจุบันมีทางเลือกของนวัตกรรมการรักษาที่เพิ่มขึ้นในกลุ่มผู้ป่วยที่ไม่สามารถรักษาด้วยการทำ stem cell transplantation ได้แก่ การรักษาด้วยเซลล์ภูมิคุ้มกันบำบัด (CAR-T Cell) หรือ Targeted therapy กลุ่ม Bi-specific antibody หรือ กลุ่ม Antibody-drug conjugate ร่วมกับ Chemotherapy ซึ่งให้ผลการรักษาดีในระดับที่น่าพอใจ
แม้ว่าขณะนี้สาเหตุการเกิดโรคหรือปัจจัยเสี่ยงที่อาจนำไปสู่โรคมะเร็งต่อมน้ำเหลือง ยังไม่สามารถระบุได้อย่างชัดเจน แต่พบมีความสัมพันธ์กับหลายภาวะ ได้แก่ การติดเชื้อ เช่น การติดเชื้อแบคทีเรีย Helicobacter pylori, การติดเชื้อ ไวรัสอีบีวี (EBV), ภาวะพร่องภูมิคุ้มกันของร่างกาย โดยพบว่าผู้ป่วย HIV มีอุบัติการณ์ของมะเร็งต่อมน้ำเหลืองเพิ่มขึ้น, โรคแพ้ภูมิตนเอง (Autoimmune disease) เช่น SLE, การสัมผัสสารเคมี เช่น สารกำจัดศัตรูพืช ดังนั้น การหลีกเลี่ยงการสัมผัสสารเคมีโดยตรง และรักษาสุขภาพร่างกายให้แข็งแรงอยู่เสมอหมั่นสังเกตตัวเอง ตรวจสุขภาพเป็นประจำทุกปี หากเจ็บป่วยให้รีบไปรักษา จึงมีบทบาทสำคัญในการพบโรคในระยะเริ่มต้น และผลลัพธ์การรักษา
การขาดแคลนบุคลากรทางการแพทย์และความท้าทายด้านการเงิน
การขาดแคลนบุคลากรทางการแพทย์และความท้าทายด้านการเงิน เป็นปัญหาเร่งด่วนต่อการให้บริการผู้ป่วยในภูมิภาคเอเชียแปซิฟิก
71% ของผู้นำในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกกังวลเกี่ยวกับปัญหาการขาดแคลนบุคลากรทางการแพทย์ที่ส่งผลต่อการดูแลรักษาผู้ป่วยที่ล่าช้า นอกจากนี้ 92% ของผู้นำในวงการเฮลท์แคร์ยังชี้ให้เห็นว่าความท้าทายด้านการเงินส่งผลกระทบต่อความสามารถขององค์กรในการดูแลผู้ป่วยทั้งในด้านเวลาและคุณภาพ และ 59% บอกว่าพวกเขากำลังปรับปรุงประสิทธิภาพ การดำเนินงานขององค์กร โดยคำนึงถึงกลยุทธ์ทางด้านการเงินควบคู่กัน
การบริหารจัดการผู้ป่วยจำนวนมากโดยไม่ลดทอนคุณภาพการบริการ จำเป็นต้องจัดลำดับความสำคัญของในกระบวนการทำงาน ซึ่งการนำระบบอัตโนมัติเข้ามาใช้จะเป็นตัวช่วยเพิ่มประสิทธิภาพการทำงานและลดผลกระทบจากการขาดแคลนบุคลากรได้ จากการสำรวจพบว่าเกือบครึ่งหนึ่ง (45%) ของผู้ให้บริการด้านสาธารณสุขในภูมิภาคเอเชียแปซิฟิก มีการนำระบบอัตโนมัติมาใช้ในกระบวนการทำงานแล้ว
คลินิกพิเศษ อายุรกรรม เฉพาะทางนอกเวลาราชการ
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ
คลินิกอายุรกรรม โดยแพทย์เฉพาะทาง ลดเวลารอคอย
เริ่มเปิดบริการ วันที่ 13 มิถุนายน 2567
#ติดต่อสอบถามและจองคิวนัดล่วงหน้า
(ในเวลาราชการ )
โทร 043-311044 ต่อ 333
SMC โรงพยาบาลลชุมแพ
แพทย์แผนไทย รพ.วัดสมานรัตนาราม (พุทธโสธร 2) เปิดให้บริการนอกเวลาราชการ
แพทย์แผนไทย รพ.วัดสมานรัตนาราม (พุทธโสธร 2) เปิดให้บริการนอกเวลาราชการแล้ว เริ่ม 1 พ.ค.67
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC) ปวดท้อง ท้องอืด อาหารไม่ย่อย เรอบ่อย
”ปวดท้อง ท้องอืด อาหารไม่ย่อย เรอบ่อย“
อันตรายจากการติดเชื้อ H.Pylori
เชื้อแบคทีเรียที่แฝงอยู่ในกระเพาะอาหาร
มีความเสี่ยงก่อให้เกิดแผลในกระเพาะอาหาร
และความเสี่ยงเป็นมะเร็งกระเพาะอาหาร
การตรวจหาเชื้อแบคทีเรีย H.Pylori
สามารถทำได้โดยวิธีการส่องกล้อง
และรักษาได้ด้วยการกินยาปฏิชีวนะร่วมกับยาลดกรด
หากสนใจ..
ท่านสามารถลงคิวนัดตรวจได้ที่
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC)
หรือสแกน Qr code เพื่อทำการนัดหมายค่ะ
ขั้นตอนการเข้ารับบริการกับศูนย์เลสิกเมตตา
อยากทำเลสิกที่ศูนย์เลสิกเมตตา มีขั้นตอนดังนี้
- จองนัดออนไลน์ผ่านไลน์ Line ID : @lasikmetta
- เข้ารับการตรวจประเมินสภาพตาสำหรับทำเลสิก
- เข้ารับการผ่าตัด
- นัดหมายครั้งต่อไป ตามแพทย์กำหนด
คลินิกหู คอ จมูกนอกเวลาราชการ โรงพยาบาลบึงกาฬ
ตารางแพทย์ออกตรวจ คลินิกพิเศษเฉพาะทางนอกเวลาราชการโรงพยาบาลหนองคาย
ตารางแพทย์ออกตรวจ คลินิกพิเศษเฉพาะทางนอกเวลาราชการโรงพยาบาลหนองคาย.. ✅สะดวก✅รวดเร็ว✅คอยไม่นาน
คลินิกพิเศษเฉพาะทางทันตกรรม นอกเวลาราชการ โรงพยาบาลนางรอง
คลินิกพิเศษเฉพาะทางทันตกรรม นอกเวลาราชการ โรงพยาบาลนางรอง
- เปิดให้บริการตรวจรักษาภายในช่องปาก รักษาทางทันตกรรมต่างๆ
- เปิดบริการวันจันทร์-วันศุกร์ เวลา 16.30-20.30 น.
- เปิดบริการวันเสาร์และวันอาทิตย์ เวลา08.30-12.00 น.
- ค่าบริการ 150 บาท+ค่าธรรมเนียมทันตแพทย์ขึ้นกับหัตถการ (ไม่สามารถเบิกคืนได้)
แผนกทันตกรรม โทร 044-633456-67(12คู่สายนอก) เบอร์ภายใน 322,325
งานประเพณีออกพรรษาบั้งไฟพญานาคโลกและประเพณีแข่งเรือยาวชิงถ้วยพระราชทานประจำปี2567 วันที่ 17 ตุลาคม 2567
งานประเพณีออกพรรษาบั้งไฟพญานาคโลกและประเพณีแข่งเรือยาวชิงถ้วยพระราชทานประจำปี2567 วันที่ 17 ตุลาคม 2567 พบกับความงามระดับจักรวาล แอนโทเนีย โพซิ้ว รองอันดับ 1 มิสยูนิเวิร์ส 2023 และนางรำชาวโพนพิสัย 1,000 ชีวิต ร่วมรำบวงสรวงองค์พญาพิสัยสัตนาคราช ณ ลานนาคาเบิกฟ้าเฟส 1 พร้อมรับชมปรากฏการณ์บั้งไฟพญานาค และการไหลเรือไฟของชุมชนต่างๆ ตลอดแนวลำน้ำโขงอำเภอโพนพิสัย
ข้อแนะนำในการป้องกันรักษา โรคจากการประกอบอาชีพ
คลินิกนอกเวลาราชการ (แผนกกายภาพบำบัด) สถาบันราชประชาสมาสัย LINK
สถาบันราชประชาสมาสัย เปิดให้บริการคลินิกนอกเวลาราชการ (แผนกกายภาพบำบัด)
เปิดให้บริการ วันจันทร์-ศุกร์ (เวลา 16.30-20.00 น.) *ปิดรับบัตรคิว 19.00 น.
✅รับผู้ป่วยนัด จำนวน 5 ท่าน/วัน
✅รับผู้ป่วย Walk in จำนวน 2 ท่าน/วัน
ติดต่อสอบถามก่อนเข้ารับบริการ
โทร 02-3859135
02-3859136
02-3859137
02-3868154 ถึง 9 ต่อ 1410
รายการขอใบรับรองเเพทย์ต่างๆ
ศูนย์สร้างเสริมสุขภาพ Wellness Center โรงพยาบาลมหาวิทยาลัยบูรพา ให้บริการการขอใบรับรองเเพทย์ต่างๆ
- ตรวจสุขภาพก่อนทำประกัน โดยแพทย์ผู้เชี่ยวชาญ
- ตรวจสุขภาพก่อนการเข้าเรียน
- ตรวจสุขภาพก่อนเข้าทำงาน
- ตรวจสุขภาพเพื่อขอวีซ่าและใบอนุญาตการทำงาน (สำหรับชาวต่างประเทศ)
- ตรวจสุขภาพเพื่อสอบใบขับขี่
- ตรวจสุขภาพก่อนการจ้างงาน
- ตรวจสุขภาพสำหรับองค์กรธุรกิจ
- ตรวจสุขภาพก่อนการเดินทางไปต่างประเทศ
หลัก 5 ข้อเบื้องต้น เพื่อเช็คว่าคุณทำเลสิกได้หรือไม่
หน่วยแบคทีเรียวิทยาและราวิทยา สาขาพยาธิวิทยา ขอเชิญร่วมกิจกรรม วันมหิดล 2567
พบกับบูธให้ความรู้ บริเวณชั้น 1 โรงพยาบาลสงขลานครินทร์ (บริเวณเวทีสุขภาพ) วันที่ 23 กันยายน 2567 เวลา 8.30-15.30 น.
วัณโรคคืออะไร
- อาการอะไรบ้างบ่งชี้ถึงการติดเชื้อ
- การตรวจวัณโรคทำอย่างไร
- เชื้อวัณโรคมีลักษณะอย่างไร
- วัณโรคติดต่อได้อย่างไร
โรคติดเชื้อราจากสัตว์
- โรคติดเชื้อราอะไรบ้างที่ติดต่อจากสัตว์สู่คน
- อาการแต่ละโรคติดเชื้อรา
- โรคติดเชื้อราตรวจอย่างไร
หน่วยแบคทีเรียวิทยาและราวิทยา สาขาพยาธิวิทยา
โทร. 074-451582
โครงการราชทัณฑ์ปันสุข ทำความ ดี เพื่อชาติ ศาสน์ กษัตริย์
จากข้อมูลสถิติด้านสุขภาพของผู้ต้องขังในช่วง 3 ปีที่ผ่านมา (ปีงบประมาณ 2561-2563 พบว่า) จำนวนผู้ต้องขังที่เจ็บป่วยและมาขอรับการรักษาที่สถานพยาบาลในเรือนจำมีแนวโน้มสูงขึ้น โดยพบจำนวนผู้ต้องขังป่วยที่มารับการรักษาในสถานพยาบาลของเรือนจำที่มาตรวจแบบไม่นอนพักที่สถานพยาบาล เฉลี่ยเดือนละ 178,542 คน จำนวนที่ให้การรักษา เฉลี่ยเดือนละ 213,738 ครั้ง นอนพักในสถานพยาบาล เฉลี่ยเดือนละ 6,977 คน ผู้ต้องขังป่วย ที่ส่งออกไปรักษายังโรงพยาบาลภายนอก กรณีไป-กลับ เฉลี่ยเดือนละ 5,148 ครั้ง นอนพักรักษาตัวภายนอก เฉลี่ยเดือนละ 896 ครั้ง (กรมราชทัณฑ์,2563) จากการวิเคราะห์รายงานการเจ็บป่วยในสถานพยาบาลเรือนจำ พบว่า ร้อยละ 49.39 ของจำนวนผู้ต้องขังทั้งหมดจะมีอาการเจ็บป่วยเล็กน้อยทั่วไป ในขณะที่ร้อยละ 1.93 ที่ต้องนอนพักค้างอยู่ในสถานพยาบาลของเรือน และมีผู้ต้องขังบางส่วนที่เกินศักยภาพของเรือนจำ จำเป็นต้องส่งออกรักษา โดยโรคที่ผู้ต้องขังมาตรวจรักษาที่สถานพยาบาลในเรือนจำส่วนใหญ่จะเป็นโรคพื้นฐาน เช่น โรคระบบทางเดินหายใจ โรคของระบบกล้านเนื้อ โรคผิวหนัง เหงือกและฟัน โรค NCDs เช่นความดันโลหิตสูง ส่วนโรคที่ต้องส่งออกไปรักษาโรงพยาบาลภายนอก จะเป็นโรคติดต่อเรื้อรัง (วัณโรค ภูมิคุ้มกันบกพร่อง ไตวายเรื้อรัง) โรคของเนื้องอก โรคหัวใจ ความผิดปกติของสายตา และโรคทางจิตเวช นอกจากนี้ ยังพบโรคระบาดตามฤดูกาล เช่น ไข้หวัดใหญ่ อีสุกอีใส หัด ตาแดง ไข้เลือดออก เป็นต้น การเข้าถึงบริการสุขภาพเป็นสิทธิขั้นพื้นฐานของบุคคลทุกคน แม้บุคคลนั้นจะสูญเสียอิสรภาพจากการต้องโทษจำคุก สิทธิดังกล่าวเป็นไปตามข้อ 12 แห่งกติการะหว่างประเทศ ว่าด้วยสิทธิทางเศรษฐกิจ สังคมและวัฒนธรรม โดยรัฐมีหน้าที่ในการป้องกันภัยคุกคามด้านสาธารณสุขที่สามารถคาดการณ์ได้ และให้การรักษาพยาบาลแก่ผู้ที่ต้องการความช่วยเหลือทางการแพทย์ นอกจากนี้ เพื่อกำหนดแนวทางสากลในการดูแลด้านสุขภาพของผู้ต้องขังในเรือนจำ มาตรฐานขั้นต่ำขององค์การสหประชาชาติว่าด้วยการปฏิบัติต่อผู้ต้องขัง (ข้อกำหนด เนลสันแมนเดลา) ระบุว่า “ผู้ต้องขังควรได้รับการบริการด้านสุขภาพตามมาตรฐานเช่นเดียวกับที่รัฐจัดให้ประชาชนทั่วไป และจะต้องสามารถเข้าถึงบริการด้านสุขภาพที่จำเป็น โดยไม่คิดมูลค่าและไม่เลือกปฏิบัติด้วยเหตุแห่งสถานภาพด้านกฎหมาย” นอกจากนี้การให้ความรู้ด้านส่งเสริมสุขภาพและอนามัยสิ่งแวดล้อม ให้กับผู้ต้องขังและเจ้าหน้าที่ในเรือนจำ ได้มีการปฏิบัติตนได้อย่างถูกต้องและเหมาะสม เพื่อเป็นแนวทางในการสร้างความตระหนักต่อการป้องกันโรค และให้ผู้ต้องขังเข้าถึงการรับการรักษาพยาบาล อย่างเท่าเทียมตามหลักมนุษยธรรม เมื่อพ้นโทษจะได้มีสุขภาพสมบูรณ์ทั้งกายและใจ ออกมาสู่สังคมภายนดกและประกอบอาชีพสุจริตได้อย่างมีคุณภาพ ดังนั้นจึงมีความจำเป็นต้องสนับสนุนงบประมาณในการขับเคลื่อนการดำเนินงานโครงการดังกล่าว
กลุ่มเป้าหมาย
1. ผู้ต้องขัง/อาสาสมัครเรือนจำ ทัณฑสถานและสถานกักขังกลาง 142 แห่ง
2. เจ้าหน้าที่ผู้ปฏิบัติงานในเรือนจำ ทัณฑสถานและสถานกักขังกลาง 142 แห่ง
พื้นที่ดำเนินงาน เรือนจำ ทัณฑสถาน และสถานกักขังกลางทั่วประเทศ จำนวนทั้งสิ้น 142 แห่ง แบ่งออกเป็นประเภท ดังนี้
เรือนจำ จำนวน 113 แห่ง
ทัณฑสถาน จำนวน 24 แห่ง
สถานกักขังกลาง จำนวน 5 แห่ง
สธ.ติดตามสถานการณ์น้ำโขงล้นตลิ่ง จ.หนองคาย กระทบ 5 อำเภอ
13 กันยายน 2567 นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข เปิดเผยว่า นายสมศักดิ์ เทพสุทิน รัฐมนตรีว่าการกระทรวงสาธารณสุข ได้กำชับให้สำนักงานสาธารณสุขจังหวัดและหน่วยบริการต่างๆ ยกระดับมาตรการเพื่อรองรับสถานการณ์อุทกภัยที่จะเกิดขึ้น และเข้าช่วยเหลือประชาชนอย่างเร่งด่วน หลังจากที่สำนักงานทรัพยากรน้ำแห่งชาติ ประกาศเตือนจังหวัดริมแม่น้ำโขงรับมือน้ำเพิ่มสูงขึ้น ช่วงวันที่ 12-16 กันยายน 2567 ล่าสุด เมื่อเวลา 16.00 น. ของวันนี้ ได้รับรายงานจากผู้อำนวยการกองสาธารณสุขฉุกเฉิน ถึงสถานการณ์น้ำท่วมในจังหวัดหนองคายว่า ขณะนี้ระดับน้ำเพิ่มสูงขึ้นอย่างต่อเนื่องและน้ำล้นตลิ่งสูง 1.16 เมตร มีพื้นที่การเกษตรและบ้านเรือนประชาชนริมน้ำโขงได้รับผลกระทบ จำนวน 5 อำเภอ 19 ตำบล 67 หมู่บ้าน ไม่มีรายงานประชาชนได้รับบาดเจ็บ สูญหาย หรือเสียชีวิต รวมถึงยังไม่มีรายงานหน่วยบริการสาธารณสุขได้รับความเสียหาย
นพ.โอภาสกล่าวต่อว่า สำหรับการช่วยเหลือผู้ป่วยติดเตียงและกลุ่มเปราะบางในพื้นที่เสี่ยง พบว่า ทั้ง 9 อำเภอของหนองคายมีผู้ป่วยติดบ้านติดเตียงรวม 1,812 ราย มีการประสานหน่วยงานต่างๆ ร่วมกันช่วยเหลือเคลื่อนย้ายผู้ป่วยในพื้นที่ 5 อำเภอเสี่ยง ได้แก่ อำเภอเมืองหนองคาย อำเภอท่าบ่อ อำเภอโพนพิสัย อำเภอสังคม และอำเภอศรีเชียงใหม่ รวมทั้งหมด 21 ราย แบ่งเป็น ย้ายไปบ้านญาติ 18 ราย ไปศูนย์พักพิง 1 ราย และไปโรงพยาบาลที่สำรองเตียงรับย้ายผู้ป่วยที่ประสบภัย 2 ราย โดยหนึ่งในนั้นเป็นผู้ป่วยหญิงอายุ 81 ปี มีโรคสมองเสื่อม ได้เคลื่อนย้ายไปยังโรงพยาบาลโพนพิสัยส่วนการเฝ้าระวังป้องกันสถานการณ์นั้น สำนักงานสาธารณสุขจังหวัดหนองคายได้เปิดศูนย์ปฏิบัติการตอบโต้ภาวะฉุกเฉินด้านการแพทย์และสาธารณสุข (PHEOC) กรณีอุทกภัย พร้อมสั่งการทุกอำเภอในพื้นที่เสี่ยงให้เปิด PHEOC เฝ้าระวังป้องกัน และให้การดูแลช่วยเหลือประชาชนที่ได้รับผลกระทบ จัดเตรียมยาและเชภัณฑ์ต่างๆ ให้เพียงพอต่อความต้องการ รวมถึงเฝ้าระวังป้องกันโรคที่มากับน้ำท่วม และให้การดูแลด้านจิตใจผู้ประสบภัย เพื่อป้องกันภาวะเครียดด้วย
ผศ.นพ. พลกฤต ทีฆคีรีกุล กล่าวในช่วง Longevity Talk ว่า ในปีนี้ ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ได้ก้าวสู่การดำเนินงานปีที่ 24 โดยมุ่งมั่นพัฒนาด้านการดูแลสุขภาพมาอย่างต่อเนื่องทั้งด้านนวัตกรรมและวิธีการที่ทันสมัย รวมถึงทุ่มเทการทำวิจัยเพื่อออกแบบการดูแลสุขภาพแบบเฉพาะบุคคล เพื่อเป้าหมายในการมีอายุยืนยาวอย่างเยาว์วัยและแข็งแรง
หัวใจสำคัญของไวทัลไลฟ์ คือ การมุ่งเน้นพัฒนานวัตกรรมใน 3 ด้านหลัก ได้แก่ 1) นวัตกรรมในห้องปฏิบัติการ (Lab Innovation) ที่ได้รับการรับรองมาตรฐานสากล ผลการตรวจวิเคราะห์ที่แม่นยำและรวดเร็วจากเทคโนโลยีขั้นสูงมาใช้งานในห้องปฏิบัติการ ซึ่งได้รับการรับรองจากวิทยาลัยพยาธิแพทย์อเมริกัน (College of American Pathologists: CAP) ช่วยให้แพทย์สามารถวินิจฉัยและวางแผนการรักษาของผู้รับบริการแต่ละบุคคลได้อย่างตรงจุด 2) การบูรณาการ AI (AI Integration) ด้วยการนำ AI มาประยุกต์ใช้ในการวิเคราะห์ข้อมูลทางพันธุกรรมและชีวภาพจำนวนมหาศาลหรือการวินิจฉัยโรคที่มีความซับซ้อนทางชีวเคมี เช่น โรคมะเร็ง และโรคทางระบบประสาทได้อย่างครอบคลุม ซึ่งจะนำไปสู่การรักษาโรคได้อย่างแม่นยำและรวดเร็วยิ่งขึ้น และ 3) นวัตกรรมแห่งความร่วมมือ (Collaborative Innovation) โดยผนวกจุดแข็งในด้านนวัตกรรมในห้องปฏิบัติการเข้ากับความเป็นเลิศทางคลินิกของบำรุงราษฎร์ ทำให้เกิดกระบวนการการวินิจฉัยและการวางแผนการดูแลสุขภาพที่ไร้รอยต่อ
นอกจากนี้ ไวทัลไลฟ์ยังได้รับการสนับสนุนจากผู้เชี่ยวชาญระดับโลกในการสร้างสรรค์นวัตกรรมใหม่ ๆ เพื่อตอบสนองต่อการเปลี่ยนแปลงของวิทยาการทางการแพทย์อย่างรวดเร็ว ซึ่งมีบทบาทสำคัญอย่างมากทำให้เราอยู่ในแถวหน้าของความก้าวหน้าทางวิทยาศาสตร์และการแพทย์
มร. มาซาอากิ ยานากิย่า ประธานกรรมการมูลนิธิฟูจิฟิล์ม บิสซิเนส อินโนเวชั่น (ประเทศไทย) และประธาน บริษัท ฟูจิฟิล์ม บิสซิเนส อินโนเวชั่น (ประเทศไทย) จำกัด กล่าวถึงที่มาของการสนับสนุนในครั้งนี้ ว่า “มูลนิธิฟูจิฟิล์ม บิสซิเนส อินโนเวชั่น (ประเทศไทย) ตระหนักถึงปัญหาการเข้าถึงบริการด้านสาธารณสุขในประเทศไทยที่ส่งผลกระทบต่อผู้ป่วย ปากแหว่งเพดานโหว่ ทั้งยังเล็งเห็นว่ายังมีคนไทยบางกลุ่มในหลายพื้นที่ยังมีข้อจำกัดในการเข้าถึงการผ่าตัด ซึ่งบ่อยครั้งการรักษาภาวะดังกล่าวต้องอาศัยการผ่าตัดอย่างต่อเนื่องหลายครั้งเป็นเวลาหลายปีจึงจะกลับมาเป็นปกติได้ ด้วยเหตุนี้ ทางมูลนิธิฯ จึงริเริ่มโครงการ ‘100 รอยยิ้ม’ ผ่านการบริจาคทุนสนับสนุนการรักษาให้กับบุคลากรทางการแพทย์ที่ทำงานร่วมกับมูลนิธิสร้างรอยยิ้ม เพื่อมอบการผ่าตัดต่อเนื่องแบบไม่จำกัดระยะเวลา และการออกหน่วยแพทย์เคลื่อนที่เพื่อการผ่าตัดแบบ 1 สัปดาห์ ด้วยเป้าหมายในการร่วมส่งมอบรอยยิ้มที่สดใสให้แก่คนไทยทั่วประเทศซึ่งรวมถึงชุมชนในพื้นที่ห่างไกล โดยมูลนิธิฯ ได้ร่วมแต่งแต้ม 100 รอยยิ้มให้แก่คนไทยผ่านการสนับสนุนในครั้งนี้เป็นมูลค่ารวมกว่า 3,000,000 บาท”
วิธีการรักษาโรคโกเชร์ มี 3 วิธี
วิธีการรักษาโรคโกเชร์ มี 3 วิธี ได้แก่
1. ยาเอ็นไซม์ทดแทน โดยการให้ยาเข้าทางหลอดเลือดดำทุก 2 สัปดาห์ เพราะยานี้จะทำงานได้ดีประมาณ 2 สัปดาห์ จากผู้ป่วยที่ท้องป่องเหมือนลูกโป่ง พอรักษาไปสักพัก ท้องยุบกลับมาเป็นปกติ ตับม้ามยุบหาย หายจากอาการซีดและเกล็ดเลือดกลับมาเป็นปกติ เด็กโตขึ้นและมีพัฒนาการเช่นเด็กปกติ วิธีนี้จำเป็นต้องได้รับยารักษาอย่างต่อเนื่องไปตลอดชีวิต
2. ยากิน อาจจะยังไม่เหมาะกับผู้ป่วยคนไทยและคนเอเชียเนื่องจากส่วนใหญ่จะเป็นโกเชร์ชนิดที่มีอาการค่อนข้างรุนแรง การรักษาแบบยากินอาจเหมาะกับชาติตะวันตกที่มีอาการไม่รุนแรงมากเท่าผู้ป่วยไทย
3. การปลูกถ่ายสเต็มเซลล์เม็ดเลือด เป็นวิธีที่หายขาดจากโรคได้ แต่ก็มีความเสี่ยง แพทย์จำเป็นต้องพูดคุยกับครอบครัว กรณีที่ปลูกถ่ายไขกระดูกแล้ว เม็ดเลือดสเต็มเซลล์ติด ก็จะต้องให้ยากดภูมิในช่วง 2 ปีแรก หลังจากนั้นคือหายขาด แต่กระบวนการที่จะหาไขกระดูกที่เข้ากันก็ไม่ง่าย ส่วนกระบวนการปลูกถ่ายไขกระดูก ก็มีความเสี่ยง โดยอัตราการเสียชีวิตอยู่ที่ 8%
โดยส่วนใหญ่ในประเทศไทย แพทย์จะแนะนำการรักษาแบบผสมผสาน โดยในช่วงแรกที่ร่างกายยังอ่อนแอ แนะนำให้ยาเอ็นไซม์ทดแทนไปก่อนประมาณ 2-3 ปี จนสภาพร่างกายดีขึ้นกลับมาเป็นปกติ ระหว่างนี้ก็หาสเต็มเซลล์ที่เข้ากันได้ไปก่อนแล้วค่อยปลูกถ่ายไขกระดูกในภายหลัง
“ตอนแรกเราคิดว่าถ้ามันเป็นโรคทางกระดูกก็สามารถผ่าตัดได้ แต่ว่าพอตรวจเจอว่าฟางเป็นโรค SMA ซึ่งเป็นโรคที่มีความซีเรียสกว่า ก็รู้สึกกังวล เรียกได้ว่ากังวลมากทีเดียวค่ะ เพราะไม่ใช่แค่ข้อจํากัดทางร่างกายที่มีในตอนนั้น แต่การเป็นโรค SMA หมายความว่าร่างกายเรากําลังค่อยๆ เสื่อมถอยลงในอนาคตด้วย อะไรที่เราเคยทําได้อย่างการก้าวขึ้นบันได หรือการลุกขึ้นจากเก้าอี้ ในตอนนี้ก็เป็นเรื่องยากแล้วค่ะ อะไรที่เรายังพอทำได้อยู่ในตอนนี้ อย่างการเดิน ก็เริ่มยากขึ้นเรื่อยๆ และวันนึงฟางก็จะเดินไม่ได้ในที่สุด น้องฟาง กล่าว
นายแพทย์วรพงษ์ เลิศวีระศิริกุล หัวหน้าศูนย์ระบบทางเดินปัสสาวะ โรงพยาบาลวิมุต เผยว่า “ศูนย์ระบบทางเดินปัสสาวะของรพ.วิมุต เพียบพร้อมด้วยทีมแพทย์ผู้ชำนาญการ ซึ่งทำงานร่วมกับทีมสหสาขาวิชาชีพที่พร้อมมอบการดูแลรักษาที่ช่วยให้ผู้ป่วยกลับไปใช้ชีวิตตามปกติได้อย่างรวดเร็วและปลอดภัยมากที่สุด สำหรับโรคต่อมลูกหมากโต หรือ BPH (Benign Prostate Hyperplasia) คือ ภาวะที่ต่อมลูกหมาก ซึ่งหุ้มอยู่ล้อมรอบท่อปัสสาวะ มีขนาดใหญ่ขึ้นจนไปเบียดท่อปัสสาวะให้แคบลง ทำให้เกิดปัญหาอาการปัสสาวะผิดปกติ ไม่ว่าจะเป็น ปัสสาวะลำบาก ต้องเบ่ง ไม่พุ่ง ปัสสาวะไม่สุด ปัสสาวะไม่ออก ปัสสาวะบ่อย ต้องลุกมาปัสสาวะกลางดึกหลายครั้ง รวมถึงการกลั้นปัสสาวะไม่อยู่ หากมีอาการเหล่านี้ ควรพบแพทย์เพื่อรีบหาแนวทางการรักษาที่เหมาะสม เพราะหากปล่อยทิ้งไว้ อาจนำไปสู่ภาวะแทรกซ้อนต่าง ๆ เช่น การติดเชื้อในระบบทางเดินปัสสาวะ ปัสสาวะเป็นเลือด นิ่วในกระเพาะปัสสาวะ หรือส่งผลกระทบต่อการทำงานของไตได้ เป็นต้น”
ผู้ป่วยโรคหัวใจน่าเป็นห่วง โควิด-19 กระตุ้นความรุนแรงโรค
อันตรายของโควิด-19 ที่รับรู้โดยทั่วไปคือเมื่อลงปอด จะทำให้เกิดภาวะปอดอักเสบได้สำหรับผู้ป่วยที่เป็นโรคทางเดิน หายใจเรื้อรัง เช่น หืด ปอดอุดกั้นเรื้อรัง อยู่แล้ว เมื่อเชื้อลงปอดจะมีอาการรุนแรงมากกว่าคนปกติ อาจส่งผลให้เกิดภาวะหายใจ ล้มเหลวตามมาได้ ส่วนผู้ป่วยโรคหัวใจ พลตำรวจตรี นายแพทย์เกษม รัตนสุมาวงศ์นายกสมาคมแพทย์โรคหัวใจแห่งประเทศ ไทย ในพระบรมราชูปถัมภ์กล่าวว่าโควิด-19 ยังส่งผลต่อระบบหัวใจและหลอดเลือดด้วย
“ในผู้ที่ไม่ได้เป็นโรคหัวใจ เมื่อเป็นโควิด-19 ก็สามารถเกิดภาวะแทรกซ้อนต่อหัวใจ เช่น ทำให้กล้ามเนื้อหัวใจอักเสบ ลิ่มเลือดอุดตัน และกล้ามเนื้อหัวใจตายจากการขาดเลือดไปเลี้ยงได้ซึ่งภาวะดังกล่าวนี้ เมื่อเกิดในผู้ป่วยที่มีโรคหัวใจอยู่แล้ว อาการจะยิ่งเลวร้ายขึ้นและอาจส่งผลให้อาการทรุดหนักจนถึงขั้นหัวใจวายได้”
ด้าน ศาสตราจารย์พิเศษ นายแพทย์ ธีรวุฒิ คูหะเปรมะ ผู้อำนวยการโรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ กล่าวถึงความร่วมมือในครั้งนี้ว่า “โรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ มีความยินดีเป็นอย่างยิ่งที่ได้เป็นส่วนหนึ่งในการเป็นกระบอกเสียงเพื่อส่งมอบความตระหนักรู้ด้านการเกิดโรคมะเร็งเต้านมในครั้งนี้ ซึ่งสอดคล้องกับความมุ่งมั่นด้านการเป็นหนึ่งในกำลังสำคัญที่ช่วยลดอัตราการสูญเสียจากโรคมะเร็ง โดยโรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ ตั้งใจที่จะมอบการรักษาที่เปี่ยมไปด้วยประสิทธิภาพตามหลักแนวคิด Total Cancer Care ผ่านเทคโนโลยีที่ครอบคลุมการดูแลโรคมะเร็งแบบครบองค์รวม 360 องศา ตั้งแต่การตรวจคัดกรองเบื้องต้นและประเมินความเสี่ยงทางพันธุศาสตร์ การวินิจฉัยอย่างละเอียดด้วยเทคโนโลยีสมัยใหม่และ การตรวจทางพยาธิวิทยา เพื่อการรักษาที่แม่นยำไปจนถึงหลังการรักษาสู่ Cancer Wellness โดยทีมแพทย์และพยาบาลเฉพาะทางที่ดูแลอย่างใกล้ชิด”
“ทั้งนี้ เมื่อผู้ป่วยหายจากการเป็นโรคมะเร็ง การฟื้นฟูร่างกายหลังจากการรักษาก็เป็นสิ่งสำคัญเช่นเดียวกัน เนื่องจากในระหว่างการรักษาโดยการใช้เคมีบำบัด การผ่าตัด หรือการฉายรังสี อาจส่งผลให้เกิดผลกระทบมากมายต่อร่างกายของผู้ป่วย ไม่ว่าจะเป็นอาการผิวแห้ง ผมร่วง การเกิดผังผืด หรือฮอร์โมนที่เปลี่ยนไปจากการรักษา การร่วมมือกับ BDMS Wellness Clinic ในครั้งนี้จึงเป็นการเติมเต็มการรักษาโรคมะเร็งให้สมบูรณ์แบบ เพื่อคืนความมั่นใจ ตลอดจนคุณภาพชีวิตที่ดีให้กับผู้ป่วยโรคมะเร็งอีกครั้ง” ศาสตราจารย์พิเศษ นายแพทย์ ธีรวุฒิ กล่าวเพิ่มเติม


พล.ต.ต.นพ.เกษม รัตนสุมาวงศ์ นายกสมาคมแพทย์โรคหัวใจแห่งประเทศไทย ในพระบรมราชูปถัมภ์ อธิบายถึงสถานการณ์การดูแลรักษาโรคหัวใจและหลอดเลือดในปัจจุบันว่าแบ่งออกเป็นสองส่วนหลัก คือ การดูแลรักษาผู้ป่วยที่เป็นโรคหัวใจแล้ว และการป้องกันการเกิดโรคหัวใจในผู้ที่มีปัจจัยเสี่ยงแต่ยังไม่เป็นโรคหัวใจ สำหรับการดูแลผู้ป่วยโรคหัวใจ ประเทศไทยมีการพัฒนาการรักษาอย่างต่อเนื่อง โดยการขับเคลื่อนจากกระทรวงสาธารณสุขรวมถึงอีกหลายๆหน่วยงานและสมาคมวิชาชีพต่างๆซึ่งรวมถึงสมาคมแพทย์โรคหัวใจแห่งประเทศไทยในพระบรมราชูปถัมภ์ เพื่อพัฒนาระบบ ‘Fast Track’ ที่ช่วยให้ผู้ป่วยภาวะกล้ามเนื้อหัวใจขาดเลือดเฉียบพลันสามารถเข้าถึงการรักษาได้อย่างรวดเร็วและได้รับผลการรักษาที่ดียิ่งขึ้น นอกจากนี้ยังสนับสนุนให้มีการจัดตั้ง ‘คลินิกหัวใจล้มเหลว’ ในหลายโรงพยาบาลทั่วประเทศ ไปพร้อมกับการทำงานร่วมกันระหว่างทีมสหวิชาชีพ เพื่อให้ผู้ป่วยได้รับการดูแลตามมาตรฐานสูงสุดที่เป็นที่ยอมรับในระดับสากล สำหรับการป้องกันการเกิดโรคหัวใจในผู้ที่ยังไม่เป็นโรคหัวใจ คือการสร้างความตระหนักรู้เพื่อให้ประชาชนเข้าใจถึงปัจจัยเสี่ยง สัญญาณเตือนและอันตรายของโรคหัวใจ โดยเผยว่าปัจจุบันมีการเผยแพร่ข้อมูลที่อาจไม่ถูกต้องในสื่อโซเชียลมีเดียอยู่และทำให้ผู้ป่วยมีความสับสนในการปรับเปลี่ยนพฤติกรรมการดำเนินชีวิต พฤติกรรมบริโภค การออกกำลังกาย การรับประทานอาหารอาหารเสริมรวมถึงความกังวลถึงผลข้างเคียงของยา ทางสมาคมฯ จึงได้จัดทำ เว็บไซต์ ThaiHealthyHeart.com ซึ่งเป็นแหล่งข้อมูลเพื่อสร้างความเข้าใจที่ถูกต้องเกี่ยวกับการป้องกันและดูแลตนเองสำหรับผู้ที่ยังไม่เป็นโรคหัวใจ โดยเฉพาะผู้ที่มีปัจจัยเสี่ยง และจัดทำแนวเวชปฏิบัติในการดูแลผู้ป่วยภาวะหัวใจขาดเลือดเฉียบพลัน ภาวะหัวใจขาดเลือดเรื้อรัง และผู้ป่วยภาวะหัวใจล้มเหลว
ผศ.ดร.วิทธวัช โมฬี หัวหน้างานวิจัยโครงการฟาร์มแชมเปี้ยน มหาวิทยาลัยเทคโนโลยีสุรนารี กล่าวว่า “การเลี้ยงไก่สวัสดิภาพสูงไม่ซับซ้อน เพียงแค่ต้องการพื้นที่ให้ไก่ได้ออกกำลัง เคลื่อนไหวร่างการตามธรรมชาติ หลังจากที่จบโครงการในครั้งนี้ พบว่าเกษตรกรสามารถขายไก่ในราคาที่สูงกว่าปกติ ซึ่งเป็นแรงจูงใจที่ดี ที่ส่งผลให้เกิดการเปลี่ยนแปลงวิธีการเลี้ยง อย่างมีนัยยะสำคัญซึ่งจะสามารถสร้างให้เป็นเกษตรกรผู้เลี้ยงไก่ได้มีอาชีพที่ยั่งยืนและสร้างรายได้มั่นคง ผลสำเร็จของโครงการฟาร์มแชมเปี้ยนที่ผมเห็นชัดเจน คือการใช้ชีวิตที่เป็นธรรมชาติ มีสุขภาวะที่ดีเราแทบไม่เห็นการจิกตีกัน ขนของไก่สวยและสุขภาพดี แข้งและจะงอยปากของไก่มีสีเหลืองสวยจากสารสีธรรมชาติ ไม่มีปัญหาอุ้งเท้าเป็นแผลเหมือนในฟาร์มอุตสาหกรรม ผู้บริโภคจึงมั่นใจได้ว่าได้รับประทานไก่ที่ปลอดภัยและมีคุณภาพ ส่วนเกษตรกรผู้เพาะเลี้ยงก็มีความสุขไปกับการประกอบอาชีพเป็นรางวัลอีกด้วย
คุณนที เอกวิจิติร (อุ๋ย บุดด้า เบลส) ศิลปินไอดอลของหลายคน


จากที่ฟังน้องคณะต่างๆ เล่าให้ฟัง หลักสูตรการเรียนการสอนในสมัยนี้ เปิดโลกผมมากเลยนะ เพราะมีการปรับเปลี่ยนให้ทันสมัย อย่างเช่นเอานวัตกรรมสองอย่างมารวมกัน อย่างนักเรียนแพทย์ก็ไม่ได้เรียนแพทย์อย่างเดียว ยังมีคั่นตรงกลางให้เป็นปริญญาโทเพื่อไปทำวิจัยเรื่องอื่นด้วย สำหรับผม ผมคิดว่าว่ามันเหมาะกับโลกยุคปัจจุบันมาก เพราะคุณไม่ได้เป็นหมออย่างเดียว แต่คุณได้ไปวิจัยเรื่องอื่น เพิ่มที่เป็นวิชาชีพอื่นที่ไม่เกี่ยวกับแพทย์ อย่างเช่นวิศวะ หรือคอมพิวเตอร์ หรืออะไรก็แล้วแต่ สุดท้ายมาคอมบายกัน แน่นอนว่าต่อไป ถ้าสมมติคุณเรียน คุณจบแล้ว คุณจะผลิตเครื่องมือแพทย์สักเครื่องมือหนึ่ง คุณก็จะมีความรู้เรื่องแพทย์ เรื่องเครื่องมืออุปกรณ์การแพทย์และวิศวะด้วย สิ่งเหล่านี้ที่เรียกว่านวัตกรรม แล้วหลักสูตรอื่นๆ ผมก็ชอบนะ เช่น วิทยาศาสตร์การเคลื่อนไหวและสุขภาพ สมัยก่อนคนเรียนพละคือเรียนพละ แต่หลักสูตรปัจจุบันนี้เป็นองค์รวมเรื่องร่างกาย เรื่องโภชนาการ เอาหลายศาสตร์มารวมกัน ตอบโจทย์มากเพราะโลกยุคปัจจุบันขาดตรงนี้ ขาดการเชื่อมโยงข้อมูลของแต่ละชนิดเอามารวมศูนย์กัน ผมว่ามันน่าสนใจมาก ท้ายสุดโลกก้าวไปข้างหน้า วิชาความรู้ต้องพัฒนาให้เท่าทันเทคโนโลยี อย่างแรกเลย เราต้องไม่ใช่ชุดความรู้เดิม สังคมต้องการชุดความรู้ใหม่ๆ ที่จะมาสร้างนวัตกรรมใหม่ๆ ซึ่งก็ต้องมาจากคณะเหล่านี้และหลักสูตรที่ปรับปรุงใหม่แบบนี้ครับ
โดย อ.นพ. วิษณุ โล่ห์สิริวัฒน์ ภาควิชาศัลยศาสตร์ คณะแพทยศาสตร์ศิริราชพยาบาล แนะนำการตรวจมะเร็งเต้านมด้วยตนเองว่า ควรตรวจในช่วงที่ไม่มีประจำเดือน เนื่องจากช่วงที่มีประจำเดือนจะมีอาหารคัดตึงเต้านม โดยช่วงเวลาที่เหมาะสมคือช่วงหมดรอบประจำเดือนประมาณ 7- 10 วัน โดยแนะนำให้ตรวจช่วงหลังอาบน้ำ อาทิ ช่วงที่ทาครีมตามร่างกายและตรวจไปด้วย ซึ่งผู้ตรวจจะรู้ถึงสรีระและความผิดปกติในตัวเราได้ดีที่สุด ศ.พญ. พรพิมพ์ กอแพร่พงศ์ ภาควิชารังสีวิทยา คณะแพทยศาสตร์ศิริราชพยาบาล ได้กล่าวเสริมถึงวิธีการตรวจด้วยตนเองว่า “การตรวจด้วยตนเองสามารถทำได้ 2 วิธีหลัก ๆ ได้แก่ วิธีที่ 1 – เริ่มจากการคลำบริเวณตรงกลางนมแล้วคลำวนเป็นวงกลมออกไปเรื่อย ๆ จนทั่วบริเวณ และแบบที่ 2 - คือการตรวจทีละส่วนของเต้านม เช่น การตรวจด้านในส่วนบนลงมาด้านในส่วนล่าง จากนั้นเปลี่ยนเป็นด้านนอกส่วนบนและด้านนอกส่วนล่าง ซึ่งทั้งหมดนี้ เป็นการตรวจโดยใช้นิ้วเนื่องจากจะทำให้มีความรู้สึกระหว่างตรวจที่ชัดเจน”
ก้าวข้ามความท้าทายด้านสุขภาพ เพื่อการมีอายุยืนยาว
การเสวนาครั้งนี้ มุ่งเน้นการศึกษาบทบาทที่สำคัญของระบบสาธารณสุข ในการเตรียมพร้อมรับมือกับประชากรสูงวัยของประเทศไทยและภูมิภาคอาเซียน โดยเฉพาะอย่างยิ่ง ในด้านความต้องการทางการแพทย์ สุขภาวะ และความท้าทายที่บุคลากรทางการแพทย์กำลังเผชิญอยู่ในปัจจุบัน ผ่านการวิเคราะห์ความท้าทายที่เกิดขึ้นใหม่ในระบบสาธารณสุข ควบคู่ไปกับการศึกษาและการพัฒนานวัตกรรมที่ได้รับการออกแบบมาเพื่อยกระดับคุณภาพชีวิต และส่งเสริมการมีอายุที่ยืนยาวของประชากร พร้อมทั้งนำเสนอผลการวิจัยและข้อมูลสำคัญเกี่ยวกับการมีชีวิตที่ยืนยาวและสุขภาวะที่ดีในภูมิภาคอาเซียน มากไปกว่านั้น การเสวนานี้ยังมีเป้าหมายสำคัญในการชี้ให้เห็นถึงความต้องการเฉพาะของประชากรสูงวัยในภูมิภาค รวมถึงการแจกแจงกลยุทธ์ที่เป็นรูปธรรมสำหรับการพัฒนาโครงสร้างพื้นฐานด้านสาธารณสุขที่มีประสิทธิภาพ โดยแนวทางนี้ถือเป็นกุญแจสำคัญในการพัฒนานโยบายที่สอดคล้องกับการเปลี่ยนแปลงทางประชากรที่เพิ่มขึ้น และการส่งเสริมคุณภาพชีวิตที่ดีของประชาชนทั่วทั้งภูมิภาค
วิชัย ธนูแก้ว เกษตรกรคอนแทรคฟาร์มมิ่งเลี้ยงสุกร มานานกว่า 20 ปี เล่าว่า เมื่อก่อนใช้ปูนขาวโรยบริเวณหน้าฟาร์ม เวลาใช้มักมีอาการแสบตาแสบมือ เมื่อมีฝนตกก็จะชะล้างปูนขาวหายไปหมด หลังจากใช้เถ้าดีเวลาฝนตกลงมาค่า pH อยู่ประมาณ pH10 ยังคงความเป็นด่างอยู่ จึงมั่นใจในคุณภาพของเถ้าดีที่สามารถป้องกันโรคได้
“น้ำปุ๋ยดี สู่เกษตรกร” จากน้ำบำบัดสู่น้ำปุ๋ยที่สร้างมูลค่าทำให้พืชผลของเกษตรกรออกผลผลิตงดงาม เพราะน้ำปุ๋ยจากฟาร์มช่วยพยุงเมื่อยามน้ำขาดแคลน ลดภาระช่วยทดแทนปุ๋ยเคมี น้ำปุ๋ยนี้ได้จากการบำบัดน้ำเสียด้วยระบบไบโอแก๊ส ได้แก๊สมีเทน แปลงเป็นกระแสไฟฟ้า ทดแทนการซื้อไฟจากการไฟฟ้า เฉลี่ย 50- 70% สามารถบริหารจัดการน้ำนำกลับมาใช้ใหม่ (Recycle) ในหน่วยงานทั้งหมดโดยไม่ปล่อยสู่ภายนอก (Zero Discharge) ทั้งทำความสะอาดโรงเรือนและอุปกรณ์ ล้างพื้นและถนน เป็นน้ำพ่นระบบฟอกอากาศหลังโรงเรือน ใช้รดน้ำในพื้นที่สีเขียวและพื้นที่การเกษตรของหน่วยงาน อาทิ ผักสวนครัว สวนยาง สวนปาล์ม และสวนป่า ขณะเดียวกัน ในช่วงแล้งเกษตรกรพื้นที่ใกล้เคียง ประสบปัญหาขาดแคลนน้ำและได้ขอนำน้ำปุ๋ยไปใช้ CPF จึงต่อยอดสู่ “โครงการปันน้ำปุ๋ยสู่เกษตรกรและชุมชน” สำหรับรดพืชสวน พืชไร่ ช่วยเกษตรกรผ่านพ้นวิกฤติแล้ง เพิ่มผลผลิต เพิ่มรายได้ และเป็นแหล่งเรียนรู้สร้างชุมชนที่เข้มแข็ง โครงการนี้ช่วยให้เกษตรกรลดค่าใช้จ่าย ทั้งลดการซื้อน้ำ ลดการใช้ปุ๋ยเคมี และต่อยอดสู่การสร้างศูนย์เรียนรู้ปราชญ์น้ำปุ๋ยที่เชี่ยวชาญการผสมน้ำกับพันธุ์พืชแต่ละชนิด
ฉีดวัคซีนป้องกันพิษสุนัขบ้าสำหรับคน ได้ที่ศูนย์สาธารณสุข กทม 22 ปากบ่อ และ 57 บุญเรือง ล้ำเลิศ
สำหรับประชาชน ที่มีประวัติสัมผัสสัตว์ที่มีความเสี่ยงต่อการติดเชื้อโรคพิษสุนัขบ้า ได้แก่ ผู้พักอาศัยในพื้นที่ดังกล่าว และผู้ที่เข้าออกพื้นที่ดังกล่าว เป็นประจำ ที่ถูกสัตว์เลี้ยงต้องสงสัยกัด ข่วน สัมผัสน้ำลายอย่างใกล้ชิด
สามารถเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สำหรับคน ได้ที่
- ศูนย์บริการสาธารณสุข 22 ปากบ่อ โทร 02-3491816
- ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ โทร 02-3961866
ในวันจันทร์ - ศุกร์ เวลา 8.00 - 14.00 น.
มีข้อสงสัย เกี่ยวกับอาการผิดปกติของสัตว์เลี้ยง เมื่อมีอาการเปลี่ยนไป เช่น กระวนกระวาย กัดไม่เลือก ขากรรไกรค้าง น้ำลายฟูมปาก ให้ติดต่อ 1555 (ตลอด 24 ชม) หรือ โทร 02-2453311. 02-3287460. 02-3287355
Pharmacist-led common ailments schemes - A global intelligence report 2023
www.fip.org
ภาพคุณนุ๊กเยี่ยมชมโรงพยาบาลมะเร็งสมัยใหม่แสตมฟอร์ดกว่างโจวที่ประเทศจีน
นายแพทย์ตนุพลยังได้กล่าวถึงความท้าทายสำคัญที่โลกของเรากำลังเผชิญในปัจจุบัน นั่นคือปัญหาสังคมผู้สูงอายุ ขณะนี้ ประชากรทั่วโลกที่มีอายุ 60 ปีขึ้นไปได้มีจำนวนเพิ่มขึ้นอย่างต่อเนื่องทั่วโลก ซึ่งในประเทศไทยประชากรกลุ่มนี้มีสัดส่วนมากกว่า 20% ของประชากรทั้งหมด ซึ่งสูงกว่าค่าเฉลี่ยทั่วโลกที่อยู่ระหว่าง 16-17% และคาดว่าในปี พ.ศ. 2574 สัดส่วนของผู้สูงอายุในประเทศไทยจะเพิ่มขึ้นสูงถึง 28% ของประชากรทั้งหมด
“วิสัยทัศน์ของผมคือการพัฒนาคุณภาพชีวิตของประชาชนไทยและชาวต่างชาติให้สุขภาพดี อายุยืนยาวอย่างมีคุณภาพ โดยนอกจากสังคมสูงอายุแล้ว อีกหนึ่งความท้าทายที่เกี่ยวข้องกับสุขภาพของมนุษย์ในปัจจุบัน คือการแพร่หลายของโรคไม่ติดต่อเรื้อรัง (NCDs) เช่น โรคหลอดเลือดสมอง โรคหัวใจและหลอดเลือด ความดันโลหิตสูง โรคปอด โรคมะเร็ง โรคเครียด และโรคอ้วน โดยประเทศไทยเป็นประเทศที่มีผู้ป่วยโรคอ้วนติดอันดับสูงสุดในภูมิภาค” นายแพทย์ตนุพล กล่าว
สำหรับหัวข้อ New Era Wellness Hub of Thailand นายแพทย์ตนุพลได้ระบุถึงสถานการณ์ปัจจุบันที่โลกของเรากำลังก้าวเข้าสู่สังคมสูงวัยอย่างเต็มรูปแบบ ซึ่งเป็นผลมาจากการพัฒนาของเทคโนโลยีทางการแพทย์ทำให้ผู้คนทั่วโลกมีอายุยืนยาวขึ้น (Lifespan) ซึ่งสวนทางกับอัตราการเกิดที่ลดลงอย่างต่อเนื่อง
นายแพทย์ตนุพล กล่าวว่า “ด้วยวิสัยทัศน์ของ BDMS Wellness Clinic เราได้เล็งเห็นถึงความสำคัญของการดูแลสุขภาพเชิงป้องกัน โดยเฉพาะในกลุ่มผู้สูงวัย เพื่อให้ไม่มีเพียงแค่มีอายุยืนยาวเท่านั้น แต่ยังสามารถยกระดับคุณภาพชีวิตให้สามารถมีอายุยืนยาวแบบสุขภาพดี (Healthspan) ผ่านการปรับเปลี่ยนไลฟ์สไตล์ตามหลักเวชศาสตร์วิถีชีวิต (Lifestyle Medicine) เพื่อลดความเสี่ยงในการเกิดโรค NCDs ต่าง ๆ และส่งเสริมสุขภาพให้แข็งแรงได้อย่างยั่งยืน นอกจากนี้ เราได้เล็งเห็นถึงศักยภาพของประเทศไทยในการเป็นศูนย์กลางการท่องเที่ยวเชิงสุขภาพของโลก เนื่องจากประเทศไทยไม่เพียงแค่มีเทคโนโลยีทางการแพทย์ที่ทันสมัยเท่านั้น แต่ยังเปี่ยมไปด้วยความงดงามของวัฒนธรรม ไม่ว่าจะเป็นอาหาร สมุนไพรไทย สถานที่ท่องเที่ยว อีกทั้งการบริการอันดีเลิศในแบบฉบับของความเป็นไทย ซึ่งเป็นองค์ประกอบสำคัญที่ช่วยดึงดูดชาวต่างชาติจากทั่วโลกให้เดินทางมาดื่มด่ำไปกับการท่องเที่ยวเชิงสุขภาพได้ ดังนั้น BDMS Wellness Clinic จึงอยากเป็นส่วนหนึ่งที่จะช่วยผลักดันประเทศไทยให้เป็น Wellness Destination of the World ผ่านการมอบประสบการณ์การดูแลสุขภาพเชิงป้องกันแบบองค์รวมให้กับผู้คนทั่วโลก”
ประกาศ โรงพยาบาลรามาธิบดี
13 ธันวาคม 2568 โรงพยาบาลรามาธิบดี
เผยแพร่ประกาศ ดังนี้
ประกาศ
เรียนผู้รับบริการโรงพยาบาลรามาธิบดี
ตั้งแต่วันที่ 1 มกราคม 2568 สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ได้ปรับเกณฑ์การเบิกจ่ายค่ารักษาพยาบาล จากกองทุน Cancer Anywhere (มะเร็งรักษาได้ทุกที่) เพื่อให้การรักษาพยาบาลเป็นไปอย่างต่อเนื่องและครอบคลุม ผู้ป่วยโรคมะเร็งที่ใช้สิทธิหลักประกันสุขภาพแห่งชาติ (บัตรทอง) ต้องมีหนังสือส่งตัวรับรองค่ารักษาพยาบาล จากหน่วยบริการต้นสังกัดตามสิทธิของท่านทุกครั้ง ทั้งนี้ตั้งแต่วันที่ 1 มกราคม 2568 เป็นต้น
ศ. นพ. ธันยชัย สุระ นายกสมาคมเวชพันธุศาสตร์และจีโนมิกส์ทางการแพทย์ (สวพจ) กล่าวว่า “การขับเคลื่อนโรคหายากเบื้องต้นใน MOU ระยะที่ 1 เริ่มต้นได้ดี ด้วยการร่วมมือจากหลายหน่วยงาน ในการขยายขอบเขตความรู้เกี่ยวกับโรคหายากให้แก่ทุกฝ่ายที่เกี่ยวข้อง สำหรับ MOU ระยะที่ 2 ในวันนี้ สมาคมฯ ต้องการสานต่อการขับเคลื่อนโรคหายากให้สังคมเกิดการรับรู้เพื่อจะได้ค้นพบผู้ป่วยโรคหายากเจอมากขึ้น เร็วขึ้น โดยเฉพาะการรับการปรึกษาจากแพทย์ผู้เชี่ยวชาญ การวินิจฉัยโรคและการตรวจเพื่อยืนยันทางห้องปฏิบัติการ จะต้องมีการพัฒนาให้ใช้เวลาน้อยลงเร็วขึ้นและสามารถตรวจเบื้องต้นได้ในประเทศไทย รวมทั้งการผลักดันให้ผู้ป่วยได้รับสิทธิประโยชน์ในการรักษาที่จำเป็นต้องอาศัยความร่วมมืออย่างบูรณาการของหลายฝ่ายที่เกี่ยวข้อง ทั้งภาครัฐ องค์กรต่าง ๆ และมูลนิธิที่เกี่ยวกับโรคหายากเองก็ตาม”
มาตรา 3 การแจ้งเตือน รัฐมนตรีว่าการกระทรวงการต่างประเทศจะแจ้งให้เลขาธิการสหประชาชาติ ผู้ที่เกี่ยวข้องอื่น ๆ และผู้นำขององค์การอนามัยโลกทราบทันทีเกี่ยวกับการถอนตัว
มาตรา 4 การเจรจาเกี่ยวกับระบบทั่วโลก ในระหว่างที่การถอนตัวกำลังดำเนินอยู่ รัฐมนตรีว่าการกระทรวงการต่างประเทศจะยุติการเจรจาเกี่ยวกับข้อตกลงการระบาดใหญ่ขององค์การอนามัยโลกและการแก้ไขระเบียบข้อบังคับด้านสุขภาพระหว่างประเทศ และการดำเนินการเพื่อให้เกิดข้อตกลงและการแก้ไขดังกล่าวจะไม่มีผลผูกพันต่อสหรัฐอเมริกา
มาตรา 5 บทบัญญัติทั่วไป (ก) ห้ามตีความข้อความใดๆ ในคำสั่งนี้ว่าทำให้เสื่อมเสียหรือส่งผลกระทบในทางอื่นใดต่อไปนี้:
(i) อำนาจที่กฎหมายมอบให้กับฝ่ายบริหารหรือหน่วยงาน หรือหัวหน้าหน่วยงาน หรือ
(ii) หน้าที่ของผู้อำนวยการสำนักงานบริหารและงบประมาณที่เกี่ยวข้องกับข้อเสนอเกี่ยวกับงบประมาณ การบริหาร หรือการออกกฎหมาย
(ข) คำสั่งนี้จะต้องนำไปปฏิบัติโดยสอดคล้องกับกฎหมายที่บังคับใช้และขึ้นอยู่กับการจัดสรรงบประมาณที่มีอยู่
(c) คำสั่งนี้ไม่ได้มีวัตถุประสงค์เพื่อและไม่ได้สร้างสิทธิหรือประโยชน์ใดๆ ในทางเนื้อหาหรือขั้นตอน บังคับใช้ได้ตามกฎหมายหรือตามความเป็นธรรมโดยฝ่ายใดๆ ต่อสหรัฐอเมริกา กระทรวง หน่วยงาน หรือองค์กร เจ้าหน้าที่ พนักงาน หรือตัวแทนของสหรัฐอเมริกา หรือบุคคลอื่นใด
ทำเนียบขาว
20 มกราคม 2025
1. Generative AI: เทคโนโลยีที่มาเป็นผู้ช่วยเพื่อลดเวลาทำงาน
เมื่อจำนวนบุคลากรทางการแพทย์ไม่เพียงพอและต้องรับภาระงานที่หนัก ผู้บริหารชั้นนำในวงการเฮลท์แคร์จึงหันมาใช้เทคโนโลยีอัตโนมัติเพื่อลดภาระงานให้กับบุคลากรทางการแพทย์ โดยจากผลสำรวจ 2024 Philips Future Health Index report เผยให้เห็นว่า 92% ของผู้บริหารชั้นนำในวงการเฮลท์แคร์เชื่อว่า เทคโนโลยีอัตโนมัติเป็นกุญแจสำคัญในการช่วยแก้ไขปัญหาด้านการขาดแคลนบุคลากร โดยเทคโนโลยีอัตโนมัติสามารถช่วยลดงานและกระบวนการที่ซ้ำซ้อนได้ ในขณะที่กว่าร้อยละ 90 ยังเชื่อว่าเทคโนโลยีอัตโนมัติจะลดภาระงานด้านเอกสาร ทำให้บุคลากรทางการแพทย์มีเวลาในการดูแลรักษาผู้ป่วยได้มากขึ้น
Generative AI หรือ ปัญญาประดิษฐ์เชิงสร้างสรรค์ เป็นเครื่องมือที่ทรงพลังในการสนับสนุนเทคโนโลยีทางการแพทย์ ช่วยเพิ่มประสิทธิภาพการทำงานของบุคลากรทางการแพทย์ตลอดระยะเวลาไม่กี่ปีที่ผ่านมา ดังนั้น 85% ของผู้บริหารชั้นนำในวงการเฮลท์แคร์ทั่วโลกจึงหันมาลงทุนหรือมีแผนที่จะลงทุนใน Generative AI ภายในสามปีข้างหน้า ซึ่งคาดว่าเทรนด์นี้จะมาแรงในช่วงปี 2025 นี้
ในปัจจุบัน Generative AI สามารถเป็นผู้ช่วยเสมือนจริงที่ช่วยลดระยะเวลาทำงานให้กับบุคลากรทางการแพทย์ ด้วยโมเดลด้านภาษาขนาดใหญ่ที่มาช่วยจัดระเบียบบันทึกทางคลีนิกและช่วยสื่อสารข้อมูลผู้ป่วยระหว่างทีมต่างๆ ให้เป็นไปได้อย่างง่ายดาย สำหรับการดูแลผู้ป่วยโรคมะเร็ง Generative AI สามารถช่วยด้านการจัดการรายงานประวัติผู้ป่วยจำนวนมาก เพื่อให้ทีมแพทย์และเจ้าหน้าที่ที่เกี่ยวข้องในการดูแลรักษาผู้ป่วยสามารถเข้าถึงข้อมูลเชิงลึกของผู้ป่วยได้อย่างสะดวกและรวดเร็วยิ่งขึ้น นอกจากนี้ยังช่วยจัดงานรายงานและประมวลผลข้อมูลทางการแพทย์ที่ซับซ้อนให้เข้าใจง่ายได้อีกด้วย ทำให้ผู้ป่วยสามารถเข้ามามีส่วนร่วมในการดูแลรักษาตัวเองได้
นายมนาเทศ อันนวัฒน์ เพรสซิเดนท์ บริษัท ไทยแลนด์ พริวิเลจ คาร์ด จำกัด กล่าวว่า“การร่วมมือกับ บีดีเอ็มเอส เวลเนส คลินิก ครั้งนี้ เป็นการจับมือพันธมิตรด้าน Health & Wellness เพื่อนำเสนอบริการแก่สมาชิกชาวต่างชาติกว่า 37,000 คน เรามีความภาคภูมิใจที่เป็นส่วนหนึ่งในการนำเสนอศักยภาพของการแพทย์และบริการด้านสุขภาพไทยผ่านการให้บริการสิทธิประโยชน์ของบริษัทฯ ซึ่งเน้นย้ำถึงความมุ่งมั่นในการยกระดับการให้บริการ ผลักดันการท่องเที่ยวเชิงการแพทย์ของไทย โดยไทยแลนด์ พริวิเลจ เชื่อมั่นในศักยภาพด้านการแพทย์ระดับสากลของ บีดีเอ็มเอส เวลเนส คลินิก แก่ชาวต่างชาติคุณภาพสูงที่ต้องการพำนักในไทย และกลุ่มที่ใส่ใจสุขภาพที่กำลังได้รับความนิยมในปัจจุบัน นอกจากนี้ ความร่วมมือยังครอบคลุมการพัฒนาแพ็กเกจบริการพิเศษที่ตอบโจทย์ไลฟ์สไตล์ชาวต่างชาติระดับสูง
ความร่วมมือนี้ จึงเป็นการผสานจุดแข็งของทั้งสององค์กรเพื่อมอบประสบการณ์ด้านสุขภาพและการพำนักระยะยาวในประเทศไทยพร้อมสิทธิประโยชน์ด้านไลฟ์สไตล์อื่น ๆ ในมิติที่หลากหลาย โดยเฉพาะบริการทางการแพทย์ตามมาตรฐานสากล และสิทธิประโยชน์พิเศษที่ออกแบบมาเพื่อตอบโจทย์ไลฟ์สไตล์ของสมาชิกโดยเฉพาะ พร้อมส่งเสริมให้ประเทศไทยก้าวสู่การเป็นจุดหมายปลายทางอันดับต้น ๆ ของโลกสำหรับการท่องเที่ยวเชิงสุขภาพ หรือ Wellness Destination of the World อย่างยั่งยืนและแข็งแกร่ง”
รายชื่อศิลปินแสดงวันที่ 8 มีนาคม (3 เวที)
ตารางการแสดงรำวงย้อนยุค งานย่าโม68
ตารางการแสดงรำวงย้อนยุคงานฉลองวันแห่งชัยชนะของท้าวสุรนารี ประจำปี 2568 ณ บริเวณสำนักงานองค์การบริหารส่วนจังหวัดนครราชสีมา ถนนราชดำเนิน 23 มีนาคม - 3 เมษายน 2568
- 23 มีนาคม 2568 โออิซิ
- 24 มีนาคม 2568 มะละกอ
- 25 มีนาคม 2568 ปูสมอหิน
- 26 มีนาคม 2568 วาสนา
- 27 มีนาคม 2568 ด้ามเคียว
- 28 มีนาคม 2568 ออนซอน
- 29 มีนาคม 2568 ปูสมอหิน
- 30 มีนาคม 2568 ออนซอน
- 31 มีนาคม 2568 เซิงเซ
- 1 เมษายน 2568 กิ่งแก้ว
- 2 เมษายน 2568 วาสนา
- 3 เมษายน 2568 มะละกอ
อบต.กมลา ทำหมันสุนัขและแมว ฟรี 4 กุมภาพันธ์ 2568
องค์การบริหารส่วนตำบลกมลา ให้บริการทำหมันสุนัขและแมว ฟรี ในวันที่ 4 กุมภาพันธ์ 2568 เวลา 09:00-12.00 น. ณ โรงจอดรถองค์การบริหารส่วนตำบลกมลา สอบถามข้อมูลเพิ่มเติมได้ที่ เบอร์โทรศัพท์ 076-385640 ต่อ 26
fb อบต.กมลา โครงการศูนย์การแพทย์รามาธิบดีศรีอยุธยา ศูนย์การแพทย์ที่ก่อตั้งบนพื้นที่ย่านพญาไท โดยมีที่มาจากมูลนิธิรามาธิบดีฯ ที่เล็งเห็นถึงโอกาสในการสร้างเงินทุนหมุนเวียนกลับมาสนับสนุนการดำเนินงานของคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี เพื่อสร้างประโยชน์แก่สังคมอย่างยั่งยืน โดยเน้นการให้บริการทางการแพทย์ที่ดูแลร่างกายและจิตใจในเชิงป้องกันเพื่อให้ผู้คนสามารถใช้ชีวิตได้อย่างเต็มศักยภาพในทุกช่วงวัย ด้วยทีมแพทย์ผู้เชี่ยวชาญและเทคโนโลยีการแพทย์ที่ทันสมัย ซึ่งคาดว่าจะเริ่มเปิดให้บริการได้ในปลายปี 2568
คลินิกเฉพาะทางนอกเวลา อายุรกรรม
AKIRA ( 1988 / 124 min) กำกับโดย คัตสึฮิโระ โอโทโมะ
AKIRA ( 1988 / 124 min) กำกับโดย คัตสึฮิโระ โอโทโมะ
กรกฎาคม ปี ค.ศ. 1988 สงครามโลกครั้งที่ 3 ได้อุบัติขึ้น จนมาถึงปี ค.ศ. 2019 ณ มหานครโตเกียว… หัวหน้าแก๊งเด็กอันธพาลผู้แข็งแกร่ง คาเนดะ ใช้ชีวิตอยู่ในเมืองที่เป็นเศษซากนี้ ไปกับการแข่งรถและทะเลาะวิวาทต่อยตีอยู่เสมอ คืนหนึ่ง เท็ตสึโอะ หนึ่งในพวกพ้องของเขา ได้เจอเข้ากับเด็กชายแปลกประหลาด ผลผลิตจากการทดลองในมนุษย์ และประสบอุบัติเหตุจนได้รับบาดเจ็บ ไม่นานกองทัพได้พาตัวเท็ตสึโอะ และเด็กชายคนนั้นไปยังศูนย์ทดลองของกองทัพ คาเนดะที่อยากจะช่วยเหลือเท็ตสึโอะให้ออกมา ได้ลักลอบเข้าไปในศูนย์ทดลอง ทว่าสิ่งที่เขาได้เห็นที่นั่นคือ เท็ตสึโอะ ผู้ได้รับ “พลัง” ใหม่จากการถูกทำการทดลองที่เกินกว่ามนุษย์จะรับไหวจนเสียสติไป ขณะเดียวกันในเบบี้รูม ห้องพิเศษของศูนย์ทดลอง ตัวทดลองเด็กผู้หญิงได้ทำนายการตื่นขึ้นมาของ “อากิระ” ความลับสุดยอดของพวกเขา เท็ตสึโอะก็ได้เข้าหาอากิระที่หลับใหลลึกอยู่ใต้ดินเพื่อที่จะไขปริศนาเรื่องพลังของเขา… อาสาสมัครประจำจุดวัดความดันโลหิต (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญนักเรียน นักศึกษา หรือผู้ที่สนใจ ที่มีในรักงานจิตอาสา มาทำกิจกรรม "อาสาสมัครประจำจุดวัดความดันโลหิต" โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 07.00-12.00 น. (จำนวนชั่วโมงอาสาสมัคร 5 ชั่วโมง) ณ ตึกผู้ป่วยนอก โรงพยาบาลศิริราช
รับสมัครผู้ที่สนใจ วันละ 22 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- ช่วยเหลือให้คำแนะนำการใช้เครื่องวัดความดันโลหิต
- ดูแลให้ผู้ป่วยจัดท่าวัดความดันโลหิตให้ถูกต้อง
- จัดระเบียบผู้ป่วยเข้าแถววัดความดันโลหิต
คุณสมบัติอาสาสมัคร
1. นักเรียนนักศึกษา อายุ 15 - 30 ปี
2. สุขภาพร่างกายแข็งแรง
3. มีทักษะในการสื่อสาร มีใจรักบริการยิ้มแย้มแจ่มใส
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
คลินิกทันตกรรมนอกเวลาราชการ โรงพยาบาลสมุทรสาคร
สอบถามรายละเอียดและนัดหมายเข้ารับบริการได้ที่ เบอร์โทรศัพท์ 034-427099 =หรือ 034-427571 ต่อ 8200 หรือ ต่อ 8899
คลินิกผู้ป่วยนอกอายุรกรรม โรคไต เบาหวาน ความดัน ไขมันสูง
แผนการฉีดวัคซีน โซน1 จำนวน 18 ชุมชน ช่วง 4-28 ก.พ.2568
ตารางงานอิมแพค เมืองทองธานี 2568
ตารางงานอิมแพค เมืองทองธานี มกราคม 2568
- JAY B CONCERT [TAPE: RE LOAD] IN BANGKOK Concert 11-12 มกราคม 2568
- คิด เฟสติวัล Concert 11มกราคม 2568
- Furniture Mega Show 2025 & POWER BUY MEGA SALE 11-19 มกราคม 2568
- Cigarettes After Sex : Xs World Tour 2025 21มกราคม 2568
- ONE 170 Sport Event 24 มกราคม 2568
- (ทู เทา ซัน ทเวนตี้โฟร์-ทเวนตี้ไฟฟ์ ทูเอนี่วัน เอเชีย ทัวร์ [เวลคัม แบ็ค]) Concert 25-26 มกราคม 2568
ตารางงานอิมแพค เมืองทองธานี กุมภาพันธ์ 2568
- ACT KANGDANIEL CONCERT IN BANGKOKConcert01 February 202501 February 2025
- มารูน ไฟฟ์ เอเชีย ทู เทา ซัน ทเวนตี้ไฟฟ์ 3 กุมภาพันธ์ 2568
- แทยัง ทู เทา ซัน ทเวนตี้ไฟฟ์ ทัวร์ [เดอะ ไลท์ เยียร์] 8 กุมภาพันธ์ 2568
- Home & Furniture Expo 8-16 กุมภาพันธ์ 2568
- เวฟ ทู เอิร์ธ ซีโร่ พอยท์ ซีโร่ ทรี เวิลด์ ทัวร์ 9 กุมภาพันธ์ 2568
- กรีน เดย์ ไลฟ์ 12 กุมภาพันธ์ 2568
- K-Pop Masterz 2025 in Bangkok THE BOYZ & TREASURE 14 กุมภาพันธ์ 2568
- แอมเวย์ เอ็กซ์โป 2568 - 15 กุมภาพันธ์ 2568
- แอมเวย์ การประชุมระดับชาติ 2568 - 15 กุมภาพันธ์ 2568
- The Script Satellites World Tour in Bangkok 20 กุมภาพันธ์ 2568
- แรบบิท ทู เดอะ มูน 2025 - 22 กุมภาพันธ์ 2568
- เคชิ: เรคเควียม ทัวร์ 26 กุมภาพันธ์ 2568
ตารางงานอิมแพค เมืองทองธานี มีนาคม 2568
- เทศกาล ร็อก วอร์ เฟสติวัล 1 มีนาคม 2568
- ASEAN (Bangkok) Energy Storage & Smart Energy Expo 5-7 มีนาคม 2568
- THAIFEX Horec 2025 5-7 มีนาคม 2568
- VIV Asia 2025 12-14 มีนาคม 2568
- Meat Pro Asia 2025 12-14 มีนาคม 2568
- Han Asia 2025 12-14 มีนาคม 2568
- Furniture Fair @IMPACT 15-23 มีนาคม 2568
- ลิปตา 20 ปี คอนใหญ่ไฟกระพริบ 22 มีนาคม 2568
- PEBACA WHAT A CONCERT 22 มีนาคม 2568
- งานแสดงสินค้า อุตสาหกรรมจักรปัก พิมพ์สกรีนและสิ่งทอไทย ครั้งที่ 9 27-30 มีนาคม 2568
- งานแสดงสินค้า เทคโนโลยีการพิมพ์และวัสดุการพิมพ์ ป้ายโฆษณา ครั้งที่ 12 27-30 มีนาคม 2568
- งานแสดงสินค้าและบริการของเจ้าเหมียวและเหล่าทาส ครั้งที่ 1 28-30 มีนาคม 2568
- BOYNEXTDOOR TOUR KNOCK ON Vol.1 IN BANGKOK 29 มีนาคม 2568
- บางกอก อินเตอร์เนชั่นแนล มอเตอร์โชว์ ครั้งที่ 46 - 26 มีนาคม - 6 เมษายน 2568
ตารางงานอิมแพค เมืองทองธานี เมษายน 2568
- บางกอก อินเตอร์เนชั่นแนล มอเตอร์โชว์ ครั้งที่ 46 - 26 มีนาคม - 6 เมษายน 2568
- สถาปนิก68 29 เมษายน - 4 พฤษภาคม 2568
ตารางงานอิมแพค เมืองทองธานี พฤษภาคม 2568
- มหกรรมการเงินกรุงเทพ ครั้งที่ 25 15-18 พฤษภาคม 2568
- Kite On The Lake ครั้งที่ 2 16-18 พฤษภาคม 2568
ตารางงานอิมแพค เมืองทองธานี มิถุนายน 2568
- มหกรรมคนรักสุนัขอันดับ 1 ของเมืองไทย 26-29 มิถุนายน 2568
ตารางงานไบเทคบางนา 2568
ตารางงานไบเทคบางนา มกราคม 2568
- “Yesterday Today Tomorrow” 12 มกราคม 2568
- Thai Cargo Expo 2025 22 - 24 มกราคม 2568
- Smart Delivery Expo 2025 22 - 24 มกราคม 2568
- Smart Retail Expo 2025 22 - 24 มกราคม 2568
- YOASOBI ASIA TOUR 2024-2025, BANGKOK 25 - 26 มกราคม 2568
- FURNITURE MEGA Sales 25 มกราคม - 2 กุมภาพันธ์ 2568
ตารางงานไบเทคบางนา กุมภาพันธ์ 2568
- Inventors Day 2025 2 - 6 กุมภาพันธ์ 2568
- Yuasa Grand Fair 2025 5 - 7 กุมภาพันธ์ 2568
- FOOD PACK ASIA 2025 12 - 15 กุมภาพันธ์ 2568
- Thailand Industrial Fair 2025 12 - 15 กุมภาพันธ์ 2568
- Glassman Asia 2025 12 - 13 กุมภาพันธ์ 2568
- THAIWATSADU x BnB home EXPO 2025 21 กุมภาพันธ์ - 02 มีนาคม 2568
- Solar & Storage Live Thailand 2025 26 - 27 กุมภาพันธ์ 2568
- The Roads & Traffic Expo Thailand 2025 26 - 27 กุมภาพันธ์ 2568
- EVCharge Live Thailand 2025 26 - 27 กุมภาพันธ์ 2568
ตารางงานไบเทคบางนา มีนาคม 2568
- IMI Show 2025 6 - 9 มีนาคม 2568
- Intelligent Asia Thailand 6 - 8 มีนาคม 2568
- COMMART UNLOCK 6 - 9 มีนาคม 2568
- The Nova Expo 2025 12 - 14 มีนาคม 2568
- 2025 YUGYEOM TOUR [TRUSTY] ENCORE IN BANGKOK 15 มีนาคม 2568
- มาม่า Presents PIANO & i The Bakery Songbook Concert 2 29 มีนาคม 2568
ตารางงานไบเทคบางนา เมษายน 2568
- Thailand International Auto Parts & Accessories Show 2025 (TAPA) 3 - 5 เมษายน 2568
- IDF World Diabetes Congress 2025 7 - 10 เมษายน 2568
- AGEING THAILAND 2025 24 - 26 เมษายน 2568
- Biggest Fair 26 เมษายน - 4 พฤษภาคม 2568
ตารางงานไบเทคบางนา พฤษภาคม 2568
- HYROX Bangkok 24 - 25 พฤษภาคม 2568
- Asia Pacific Rail 2025 28 - 29 พฤษภาคม 2568
ตารางงานไบเทคบางนา มิถุนายน 2568
- CIOSH Thailand 4 - 6 มิถุนายน 2568
ตารางงานศูนย์ฯสิริกิติ์ 2568
ตารางงานศูนย์ฯสิริกิติ์ มกราคม 2568
- Bangkok Art Biennale 2024 เทศกาลศิลปะร่วมสมัยนานาชาติ 2024 ภายใต้แนวคิด รักษา กายา (Nurture Gaia) มกราคม 2568 ถึง 25 กุมภาพันธ์ 2568
- Japan Selection 2025 งานแสดงสินค้า "All Japan" เพื่อ B2B 16 - 18 มกราคม 2568
- เที่ยวทั่วไทย ไปทั่วโลก ครั้งที่ 30 16 - 19 มกราคม 2568
- Cybersec Asia 2025 22 - 23 มกราคม 2568
- Bangkok EV Expo 2025 30 มกราคม - 2 กุมภาพันธ์ 2568
- Mobile Expo 2025 30 มกราคม - 2 กุมภาพันธ์ 2568
ตารางงานศูนย์ฯสิริกิติ์ กุมภาพันธ์ 2568
- 58th Thailand Baby and Kids Best Buy 6-9 กุมภาพันธ์ 2568
- Study in India Expo 8-9 กุมภาพันธ์ 2568
- FTI Expo 12-15 กุมภาพันธ์ 2568
- The 71st Bangkok Gems and Jewelry Fair 22-26 กุมภาพันธ์ 2568
ตารางงานศูนย์ฯสิริกิติ์ มีนาคม 2568
- งานไทยเที่ยวไทย ครั้งที่ 73 6-9 มีนาคม 2568
- งานไทยเที่ยวนอก eXtra 6-9 มีนาคม 2568
- มหกรรมบ้านและคอนโด ครั้งที่ 47 20-23 มีนาคม 2568
ตารางงานศูนย์ฯสิริกิติ์ เมษายน 2568
- Jewellery & Gem ASEAN Bangkok 2025 (JGAB) 23-26 เมษายน 2568
ตารางงานศูนย์ฯสิริกิติ์ พฤษภาคม 2568
- Pet Expo Thailand 2025 1-4 พฤษภาคม 2568
- Thailand Golf Expo 2025 22-25 พฤษภาคม 2568
- Outdoor Fest 2025 22-25 พฤษภาคม 2568
- Thailand Dive Expo (TDEX) 2025 22-25 พฤษภาคม 2568
ตารางงานศูนย์ฯสิริกิติ์ มิถุนายน 2568
- Asia DigiCommerce Services Xpo 2025 11-13 มิถุนายน 2568
- Cosmoprof CBE ASEAN 25-17 มิถุนายน 2568
ตารางงานพารากอนฮอลล์ 2568
ตารางงานพารากอนฮอลล์ (02-687-5000 Ext. 8011)
- งาน “Marriage Equality - สมรสเท่าเทียม” การเฉลิมฉลองความรักและความหลากหลายบน Pride Carpet 23 มกราคม 2568
- JEDUCATION FAIR ครั้งที่ 46 งานมหกรรมเรียนต่อญี่ปุ่นและเรียนภาษาญี่ปุ่นที่ใหญ่และครบที่สุด 25 - 26 มกราคม 2568 11:00 – 18:00 น.
- มหกรรม “Muaythai World Festival 2025" งานประกาศรางวัลเกียรติยศยกย่องบุคคลวงการมวยไทยในวันมวยไทย ประจำปี 6 กุมภาพันธ์ 2568
- THE CORRS LIVE IN BANGKOK 11 กุมภาพันธ์ 2568
- ZAAP ON SALE ครั้งที่ 38 Presented by แม่มณี "VOLCANIC SALE" 22-23 กุมภาพันธ์ 2568
- งานออกร้านคณะภริยาฑูต ครั้งที่ 58 แนวคิด “มหัศจรรย์แห่งการให้...ไม่หยุดชอป” (Miracle of Giving) 27 กุมภาพันธ์ - 2 มีนาคม 2568
- Kylie Minogue : Tension Tour 2025 10 มีนาคม 2568
- Sabuy Wedding Festival 2025 29-30 มีนาคม 2568
- Thailand MICE X-Change 2025 2-3 เมษายน 2568
- ฟาราทอล์ก งานทอล์กจัดแจง คุณแดงเชิญแขก ธีม “What’s in a name? ชื่อนั้นสำคัญไฉน” 17-18 พฤษภาคม 2568
โรงพยาบาลกรุงเทพคริสเตียนได้รับการจัดอันดับให้เป็น หนึ่งในโรงพยาบาลเฉพาะทาง “กุมารเวชกรรม” ที่ดีที่สุดในโลกประจำปี 2025 One of the World’s Best Specialized Hospitals 2025 in Pediatrics จากการจัดอันดับโดย Newsweek นิตยสารและสื่อออนไลน์ชั้นนำของสหรัฐอเมริกา ร่วมกับ Statista บริษัทข้อมูลระดับโลก
ทันตกรรมชุมชนอบอุ่น นนทบุรี
นนทบุรี [
source]
(คลินิกในนนทบุรี ที่ต้องการเพิ่มปุ่ม Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com)
- คลินิกทันตกรรม คลินิกสุธิดาทันตแพทย์
- คลินิกทันตกรรม เดอไวท์ เดลทัล คลินิก
- คลินิกทันตกรรม นิช เดนทัล โฮม
- คลินิกทันตกรรม บัว สไมล์
- คลินิกทันตกรรม บ้านรักยิ้ม2 info&map
- คลินิกทันตกรรม ป๊อปปูล่า ไบรท์สไมล์
- คลินิกทันตกรรมเด้นท์ที่รักษ์
- คลินิกทันตกรรมทันตแพทย์ชวาล สมศิริ
- คลินิกทันตกรรมบางกรวย
- คลินิกทันตกรรมบางกร่าง
- คลินิกทันตกรรมไบร์ทมี
- คลินิกทันตกรรมพลัส สาขางามวงศ์วาน
- คลินิกทันตกรรมพลัส สาขาแจ้งวัฒนะ
- คลินิกทันตกรรมพักยิ้ม
- คลินิกทันตกรรมพีช info&map
- คลินิกทันตกรรมเมืองประชา สาขาเมืองทองธานี
- คลินิกทันตกรรมยิ้มแย้ม
- คลินิกทันตกรรมเลอทูธ
- คลินิกทันตกรรมสตาร์เดนทัล
- คลินิกทันตกรรมสบายสไมล์
- คลินิกทันตกรรมสไมล์ซีซันส์ สาขาเซ็นทรัลเวสต์วิลล์
- คลินิกทันตกรรมสวนนนท์เดนทัล
- คลินิกทันตกรรมอินฟินิทสไมล์ สาขาพระนั่งเกล้า
- คลินิกทันตกรรมไอคอน สมายล์
- คลินิกศุภวรรณทันตแพทย์
- ดิออเร้นจ์คลินิกทันตกรรม
- ดิออเร้นจ์คลินิกทันตกรรม สาขาบางใหญ่
- พระปิ่นทันตแพทย์
- สไมล์เมท คลินิกทันตกรรม
- สไมล์เมท แอ็ท โรบินสันศรีสมาน คลินิกทันตกรรม
- สยามนนท์ สหคลินิก (สาขาบางบัวทอง)
- สยามนนทบุรีสหคลินิก (สาขาพระนั่งเกล้า)
- หมอหญิงทันตคลินิก
- เอสเต้ สไมล์ สหคลินิก
1) ยาที่พิมพ์ด้วย 3 มิติ (3D printed drugs)
ในบ่ายวันพุธที่แสนน่าเบื่อ คุณไปที่ร้านขายยาที่มุมถนนตามคำขอของภรรยา คุณเพียงแค่บอกชื่อของเธอให้เภสัชกรทราบ จากนั้นในวินาทีถัดมา ยาที่เธอสั่งจะพิมพ์ออกมาเป็นแคปซูลตามที่เธอขอ โดยมีขนาดยาที่แพทย์สั่ง และปรับให้เข้ากับภูมิหลังทางโมเลกุลของเธอ ฟังดูน่าทึ่งใช่ไหม? น่าเสียดายที่เรายังไปไม่ถึงจุดนั้น... Spritam ซึ่งเป็นยาที่พิมพ์ด้วยเครื่องพิมพ์ 3 มิติตัวแรกนั้นสามารถละลายได้อย่างรวดเร็วและใช้สำหรับโรคลมบ้าหมู ได้รับการอนุมัติจากสำนักงานคณะกรรมการอาหารและยาของสหรัฐอเมริกาในปี 2558นอกจากนี้ ฉันยังเคยคิดด้วยว่าบริษัทขนาดเล็กอาจคิดค้นวิธีแก้ปัญหาอื่นๆ ในการผลิตยาที่สามารถเผาผลาญได้เร็วขึ้นและนำออกสู่ตลาดได้ง่ายขึ้นเนื่องจากวิธีการผลิตนี้ และฉันคิดว่าห่วงโซ่อุปทานของอุตสาหกรรมยาทั้งหมดจะต้องได้รับการออกแบบใหม่ภายในเวลาไม่กี่ปีหรืออาจจะไม่กี่เดือน อย่างไรก็ตาม ฉันอาจจะมองโลกในแง่ดีเกินไปก็ได้ ขณะนี้การผลิตยังช้าอยู่ บริษัทเภสัชไม่เต็มใจที่จะปรับตัวให้เข้ากับเทคโนโลยีใหม่ซึ่งเปลี่ยนแปลงวิธีการผลิตยาของพวกเขามาหลายทศวรรษ เราได้เห็นการปรับปรุงบางอย่างในทศวรรษที่ผ่านมา แต่ความคืบหน้ายังช้าอยู่ และเรายังคงมียาที่ได้รับการอนุมัติเพียงไม่กี่รายการในตลาดขายเครื่องดื่มแอลกอฮอล์วันพระใหญ่ ตอบโจทย์ในแง่ธุรกิจแค่ไหน ? ThaiPBS
ขายเครื่องดื่มแอลกอฮอล์วันพระใหญ่ ตอบโจทย์ในแง่ธุรกิจแค่ไหน ? | จับตาสถานการณ์ | 6 มี.ค. 68 ThaiPBS วิเคราะห์ผลลัพธ์ในแง่ธุรกิจ หลังมติบอร์ดแอลกอฮอล์ "ผ่อนปรน" ขายเหล้าวันพระใหญ่บางพื้นที่ และมีข้อมูลบ่งชี้ว่า อาจเพิ่มความเสี่ยงของการเสียชีวิตและทรัพย์สิน โดยเฉพาะคดีเมาแล้วขับ
บอร์ดมีมติเป็นเอกฉันท์เห็นชอบ สูตรบำนาญชราภาพแบบ CARE สูตรใหม่
11 มีนาคม 2568 บอร์ดประกันสังคม ซึ่งมีนายประสงค์ ทัพชัยยุทธ์ ปลัดกระทรวงแรงงาน ในฐานะประธานบอร์ด มีมติเป็นเอกฉันท์เห็นชอบ ปรับสูตรคำนวณบำนาญชราภาพสูตรใหม่ ให้กับผู้ประกันตน ทั้ง ม.33และม.39 หลังจากนี้ ได้มอบหมายให้สปส.จะกลับไปจัดทำรายละเอียดเพิ่มเติม ศึกษาสูตรบำนาญแบบ CARE (Career-Average Revalued Earnings) หรือ "เฉลี่ยตลอดการทำงาน ปรับเป็นค่าเงินปัจจุบัน" ซึ่งศึกษามาตั้งแต่ปี 2563 จนสำเร็จ และเห็นรูปธรรมชัดเจนในวันนี้
ส่วนการดำเนินการปรับสูตร คำนวณบำนาญชราภาพแบบใหม่ จะดำเนินควบคู่ไปกับการปรับเพดานค่าจ้าง ในอัตรา 17,500 บาท ซึ่งจะมีผลบังคับใช้ใน วันที่ 1 มกราคม 2569 ใช้กับผู้ประกันตน ที่รับเงินชราภาพอยู่ในขณะนี้ 800,000 คนด้วย และคาดการณ์ว่า จะค่อยๆ ทยอยเพิ่มขึ้นปีละ 1 แสนคน ที่จะได้รับสิทธิประโยชน์ จากสูตรบำนาญนี้ ทั้ง 2 มาตรา
โดยการคำนวนสูตรใหม่ หากผู้ประกันตนคำณวนแล้วได้รับเงินชราภาพลดลง ก็จะปรับให้ได้เท่าเดิม แต่ถ้าดูแล้วสูตรใหม่นี้ ทำให้คนที่ได้รับบำนาญอยู่แล้ว ได้รับเงินเพิ่มขึ้น ก็จะให้ได้รับเพิ่มขึ้น เพื่อความเป็นธรรมมากที่สุด -
3PlusNewsตำรวจสอบสวนกลาง (CIB) ช่วยเคลื่อนย้ายผู้ป่วยและขนย้ายอุปกรณ์ทางการแพทย์ไปยังที่ปลอดภัย เหตุไฟไหม้ รพ.รามาธิบดี
ตำรวจสอบสวนกลาง (CIB) โดยกองบังคับการปฏิบัติการพิเศษ (บก.ปพ.) จัดกำลังสนับสนุนภารกิจช่วยเหลือประชาชนและผู้ป่วย จากเหตุไฟไหม้ รพ.รามาธิบดี เขตพญาไท กทม. โดยเจ้าหน้าที่ได้เร่งช่วยเคลื่อนย้ายผู้ป่วยและอุปกรณ์ทางการแพทย์ไปยังที่ปลอดภัย และอำนวยความสะดวกทางการจราจร จนกระทั่งสถานการณ์กลับสู่ภาวะปกติ
1-7 พฤศจิกายน สัปดาห์สุขภาพจิตแห่งชาติ
จัดโดยกรมสุขภาพจิต กระทรวงสาธารณสุข เพื่อยกระดับและกระตุ้นให้คนไทยให้ความสำคัญด้านสุขภาพจิตมากขึ้น เพื่อความรู้ ความเข้าใจตนเอง สภาพจิตใจตนเอง เมื่อสุขภาพจิตดีแล้ว ย่อมส่งผลดีต่อเนื่องต่อคนใกล้ชิด ครอบครัว สังคมและชุมชนได้ เป็นการช่วยเหลือดูแลกันอีกทางหนึ่ง
COSMEX 2022 01 - 03 พฤศจิกายน 2022
IN-COSMETICS ASIA 2022 01 - 03 พฤศจิกายน 2022
The Resilient Harvests Conference November 1-2, 2022 Long Beach CA LINK
งานนี้สำหรับสายปลูก Advance farming , Vertical farming ระบบควบคุมคุณภาพระดับท็อปสุดล้ำ งานนี้ระดับนโยบาย คุมกฏก็มาชุมนุมเช่นกัน เพราะเทคโนโลยีจะต้องเป็นบรรทัดฐานให้กับมาตรฐาน กฏและนโยบายต่างๆ ที่จะตามมา เรียกว่าสายฮาร์ดเอดูเคชั่นต้องไม่พลาด
The Resilient Harvests Conference November 1-2, 2022 Long Beach CA
กิจกรรม 1 พฤศจิกายน 65 - Kick of งานสัปดาห์สุขภาพจิตแห่งชาติ ประจำปี 2565
1 พฤศจิกายน 2565 กรมสุขภาพจิต เน้นย้ำให้สังคมตระหนักถึงความสำคัญของการวัดใจ เพื่อรู้เท่าทันถึงปัญหาและนำไปสู่การแก้ไข พร้อมบูรณาการเครือข่ายทุกภาคส่วนร่วม เพื่อสร้างสังคมที่ปลอดภัยและมีความสุข
นายแพทย์โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข กล่าวว่า กระทรวงสาธารณสุขเล็งเห็นความสำคัญของการดูแลสุขภาพจิตของประชาชนไทย ภายใต้วลีที่ว่า “จิตเป็นนาย กายเป็นบ่าว” จึงผลักดันและส่งเสริมให้มีการประเมินสุขภาพจิต รวมไปถึงการรณรงค์ส่งเสริมความรู้ด้านสุขภาพจิต ซึ่งการดำเนินกิจกรรม Kick off งานสัปดาห์สุขภาพจิตแห่งชาติ ประจำปี 2565 ในปีนี้มีแนวคิดที่สนับสนุนนโยบายดังกล่าวด้วยการเชิญชวนให้ทุกคนร่วม “วัดใจ เติมพลัง สังคมมีสุข” รวมไปถึงการส่งเสริมให้ประชาชนสามารถเข้าถึงบริการด้านสุขภาพจิตได้อย่างรวดเร็วโดยใช้เทคโนโลยีดิจิทัล และส่งเสริมองค์ความรู้ทุกระดับผ่านการเพิ่มพูนความรู้ด้วยการ “เติมพลัง” ทุกวัยให้ครอบคลุมทุกพื้นที่ ซึ่งผู้ที่วัดใจและเติมพลังได้อย่างเหมาะสมจะสามารถช่วยเหลือดูแลตนเองและคนรอบข้างได้ นำไปสู่การสร้าง “สังคมมีสุข” อย่างยั่งยืนต่อไป
เช็คตนเองว่ายังไหวไหม ผ่าน www.วัดใจ.com LINK
แพทย์หญิงอัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กล่าวว่า ในปีนี้กรมสุขภาพจิตสนับสนุนให้ทุกพื้นที่ร่วมวัดใจ ผ่านทาง
www.วัดใจ.com หรือ MENTAL HEALTH CHECK IN เพราะการวัดใจเป็นการตั้งคำถามกับตนเองว่ายังไหวไหม ใจสู้หรือเปล่า เพราะนอกจากจะเป็นการดูแลสุขภาพจิตในระดับบุคคล ยังเป็นการตรวจสอบสัญญาณเตือนความเสี่ยงต่าง ๆ เพื่อป้องกันและจัดการให้กลุ่มเสี่ยงสามารถเข้าถึงบริการสุขภาพจิตได้อย่างรวดเร็ว ซึ่งปัญหาสุขภาพจิตไม่ได้มีเพียงแค่โรคทางจิตเวชเท่านั้น ยังมีเรื่องที่เกี่ยวข้องกับสถานการณ์ทางใจ อันจะนำไปสู่ความเครียดและก่อให้เกิดความรุนแรงในสังคมได้ การรู้เท่าทันและสามารถค้นพบปัญหาได้อย่างรวดเร็ว จะสามารถทำให้เราหาวิธีการเพื่อช่วยเหลือและป้องกันได้อย่างเหมาะสม อีกทั้งการพัฒนาความเข้มแข็งทางใจหรือ Resilience เพื่อให้เกิดพลังแห่ง อึด ฮึด สู้ ด้วยตนเองสามารถก้าวผ่านสถานการณ์ที่ทำให้เกิดความเครียดซึมเศร้าหรือปัญหาสุขภาพจิต ซึ่งยุคสมัยที่เปลี่ยนแปลงไปการช่วยเหลือและสร้างองค์ความรู้ที่มีความยั่งยืนจากความต้องการของบริบททางสังคม จะนำไปสู่การสร้างสังคมที่มีความสุขอย่างแท้จริง
ผศ.ดร.วัฒนา รัตนพรหม อธิการบดีมหาวิทยาลัยราชภัฏสุราษฎร์ธานี กล่าวว่า มหาวิทยาลัยราชภัฏสุราษฎร์ธานี ส่งเสริมการเป็นวิศวกรสังคมของนักศึกษาในทุกมิติ โดยการเป็นต้นแบบขยายผลไปยังมหาวิทยาลัยราชภัฏทั้ง 38 แห่งเป็นประโยชน์ต่อการพัฒนาชุมชนต่าง ๆ ให้ครอบคลุม เพื่อหาแนวทางและความต้องการที่แท้จริงในการแก้ไขปัญหา การส่งเสริมให้วิศวกรสังคม รู้เท่าทันสื่อ รู้เท่าทันเทคโนโลยีดิจิทัล การรู้เท่าทันภาวะอารมณ์ของตนเองและคนรอบข้างจะเป็นส่วนสำคัญในการช่วยป้องกันปัญหาสุขภาพจิต การร่วมมือกับกรมสุขภาพจิตด้วยการคัดกรองสุขภาพใจด้วยแอพลิเคชั่น MCHI (Mental Health CHECK-IN) ทำให้มหาวิทยาลัยราชภัฏหลายแห่งสามารถช่วยนักศึกษาที่เสี่ยงต่อการทำร้ายตัวเองได้ไม่ต่ำกว่า 30 ราย มหาวิทยาลัยจะดำเนินการผลักดันให้อาจารย์นำหลักสูตร “อุ่นใจไซเบอร์” มาเพิ่มความรอบรู้ด้านสุขภาพจิต และเรียนรู้การแก้ไขปัญหาได้อย่างถูกต้องเหมาะสมอย่างยั่งยืนต่อไป
กรมสุขภาพจิต ขอให้ทุกภาคส่วนตระหนักถึงความสำคัญของสุขภาพจิต เพราะในปัจจุบันปัญหาสุขภาพจิตสามารถพบได้ทุกเพศทุกวัย การป้องกันที่มีประสิทธิผลคือการให้ทุกภาคส่วนทำหน้าที่และส่งเสริมบทบาทให้แก่กัน โดยมีเป้าหมายที่สำคัญคือเรื่องของการสร้างพลเมืองคุณภาพด้วยการร่วมวัดใจ เติมพลัง และสร้างสังคมมีสุข
โรงพยาบาลร้อยเอ็ด เปิดรับสมัครลูกจ้างชั่วคราว(รายวัน)
เปิดรับสมัครตั้งแต่ 1-25 พฤศจิกายน 2565 ในเวลาราชการ
ตำแหน่งต่างๆ ที่เปิดรับ ได้แก่ นักกิจกรรมบำบัด นักรังสีการแพทย์ นักเทคโนโลยีหัวใจและทรวงอก พยาบาลวิชาชีพ พนักงานช่วยเหลือคนไข้ (กลุ่มงานพยาบาล กลุ่มงานจิตเวช กลุ่มงานส่งเสริมสุขภาพ) พนักงานบริการ รักษาความปลอดภัย ผู้ช่วยนักกายภาพบำบัด ผู้ช่วยพยาบาล
ขอรายละเอียด ยื่นใบสมัครด้วยตนเองได้ที่ กลุ่มทรัพยากรบุคคล ชั้น 6 อาคารเฉลิมพระเกียรติจุฬาภรณ์
โทร. 043-518200 - 5 ต่อ 7659 7669
ลิงค์รายละเอียด
โรงพยาบาลราชวิถี 2 รับสมัครลูกจ้างรายคาบ LINK
โรงพยาบาลราชวิถี เรื่องรับสมัครลูกจ้างรายคาบ ** ตำแหน่งเจ้าพนักงานธุรการ ปวส.ทุกสาขา ปฏิบัติงานวันจันทร์ - วันศุกร์ เวลา 08.00 - 16.00 น. (พัก 1 ชั่วโมง) **หยุด วันเสาร์ - อาทิตย์ ** สนใจสอบถามได้ทาง Inbox หรือเบอร์โทรศัพท์ที่แจ้งไว้ ในวัน เวลา ราชการ
ICONSIAM BANGKOK ILLUMINATION 2022 วันที่ 1 พ.ย. 65 - 5 ม.ค. 66
ICONSIAM BANGKOK ILLUMINATION 2022 เทศกาลประดับไฟตกแต่งอิลลูมิเนชั่นสุดยิ่งใหญ่แห่งปี ที่ ไอคอนสยาม
จัดแสดงตั้งแต่วันที่ 1 พ.ย. 65 - 5 ม.ค. 66 ณ ริเวอร์ พาร์ค ชั้น G
ไอคอนสยามชวนคุณสร้างความทรงจำอันล้ำค่า จุดประกายแสงไฟมหัศจรรย์ส่งท้ายปีด้วยแสงแห่งอนาคตกับเทศกาลประดับไฟตกแต่งอิลลูมิเนชั่นริมฝั่งแม่น้ำเจ้าพระยา ICONSIAM Bangkok Illumination 2022 เฉลิมฉลองเทศกาลแห่งความสุข เทศกาลคริสต์มาส และส่งท้ายปีเก่าต้อนรับปีใหม่ ตอกย้ำความเป็น Global Landmark Destination ของไอคอนสยาม
เทศกาลดอกไม้ฤดูหนาว ENCHANTED FLORA PARK ศูนย์เรียนรู้ฯฟลอร่า พาร์ค วังน้ำเขียว 1 พ.ย. 2566 - 29 ก.พ. 2567
ศูนย์เรียนรู้ฯฟลอร่า พาร์ค วังน้ำเขียว จัดเทศกาลดอกไม้ฤดูหนาว ENCHANTED FLORA PARK มิติมหัศจรรย์ดินแดนดอกไม้ @Flora Park วังน้ำเขียว สัมผัสโมเม้นต์แห่งความสุขไปกับดอกไม้นับล้านดอก ตั้งแต่วันที่ 1 พ.ย. 2566 - 29 ก.พ. 2567 เปิดให้เข้าชมสวนทุกวัน 8.00 - 18.00 น. ไฮไลท์ที่น่าตื่นตาเพียบ
- ดอกไม้เมืองหนาวนับล้านดอก
- ดอกกุหลาบสายพันธุ์อังกฤษสวยหายาก
- เช็คอินบนหอชมวิว 360° ถ่ายรูปสวยทุกมุม
- เปิดประสบการณ์เที่ยวสวนดอกไม้ในรูปแบบ AR Experience ในโมเมนต์สนุกๆ กับดอกไม้นานาพรรณ
- เดินเล่นในเขาวงกตดอกไม้ กับ 3D Flower Maze
- เข้าไปในโลกจินตนาการที่เต็มไปด้วยดอกไม้กับ Immersive Experience
- งานศิลปะชิ้นโบแดงตั้งตระหง่านรอให้ทุกคนได้ใกล้ชิด
- เกมส์ กิจกรรมอีกมากมายรอทุกคนอยู่
กิจกรรม 2 พฤศจิกายน 65 - วัดใจ เติมพลัง สังคมมีสุข และ วรรณกรรมโอสถภายใต้ โครงการ “อ่านยาใจ” พลังวรรณกรรมเพื่อสร้างพลังชีวิต
กรมสุขภาพจิต จัดงานสัปดาห์สุขภาพจิตแห่งชาติ ประจำปี 2565 ณ โรงพยาบาลศรีธัญญา “วัดใจ เติมพลัง สังคมมีสุข” ร่วมกับเครือข่ายกระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์ภายใต้โครงการ “บ้านเปี่ยมพลัง” พร้อมส่งเสริมการใช้วรรณกรรมโอสถ ร่วมกับ สสส. เพื่อเติมพลังใจให้พร้อมก้าวสู่วันพรุ่งนี้ที่เปี่ยมสุข
วานนี้ 2 พฤศจิกายน 2565 กรมสุขภาพจิต จัดงานสัปดาห์สุขภาพจิตแห่งชาติ “วัดใจ เติมพลัง สังคมมีสุข” ผ่านโครงการ บ้านเปี่ยมพลัง แนะนำการดูแลสังคมและคนไร้ที่พึ่งร่วมกับ กระทรวงพัฒนาสังคมและความมั่นคง (พม.) และเน้นย้ำการดูแลใจด้วยตนเอง ให้สามารถเผชิญหน้ากับความทุกข์ ในการสร้างภูมิคุ้มทางจิตใจ ด้วยการใช้พลังแห่ง “การอ่าน” “การเขียน” เพื่อปลุกพลังแห่งชีวิต อันถือเป็นยาของใจ หรือวรรณกรรมโอสถภายใต้ โครงการ “อ่านยาใจ” พลังวรรณกรรมเพื่อสร้างพลังชีวิต
นายแพทย์เกียรติภูมิ วงศ์รจิต ที่ปรึกษารองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข และที่ปรึกษา กรมสุขภาพจิต กล่าวว่า การอ่านหนังสือ เหมือนเป็นการจัดระเบียบความคิดของตนเองซึ่งการอ่านหนังสืออย่างน้อย 6 นาที สามารถ คลายเครียดได้ และการอ่านให้เกิดคุณค่าจะต้องอ่านให้ครบทุกองค์ประกอบของหนังสือ ซึ่ง “การอ่านหนังสือให้รู้แล้วไม่เข้าใจ เข้าใจแต่ ไม่ปฏิบัติ เท่ากับไม่รู้” โดยแนวคิดหลักของการจัดงานสัปดาห์สุขภาพจิต คือ การส่งเสริมให้สุขภาพจิตดีขึ้น และการป้องกันปัญหาสุขภาพจิต กอปรกับกรมสุขภาพจิตมีภารกิจหลัก คือ การดูแลระบบบริการสุขภาพจิตของประเทศไทย พัฒนางานสุขภาพจิตให้ก้าวหน้า สู่การเป็น Mental Health 4.0 และประชาชนรวมถึงบุคลากรมีสุขภาพจิตดี ปัญญาดี มีความสุข ซึ่งหนึ่งในนโยบายที่กรมสุขภาพจิตขับเคลื่อนเพื่อบรรลุภารกิจดังกล่าวคือ การบูรณาการงานสุขภาพจิตทุกกลุ่มวัยร่วมกับภาคีเครือข่าย ทั้งภาครัฐ ภาคเอกชนและภาคประชาสังคม ซึ่งเป็นองค์ประกอบสำคัญในการสร้างปฏิสัมพันธ์กับบุคคลต่าง ๆ การอยู่ร่วมกันในสังคม ไม่แบ่งแยกคนป่วยหรือคนไม่ป่วย
แพทย์หญิงอัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กล่าวว่า จากแนวคิดการบูรณาการงานสุขภาพจิตทุกกลุ่มวัย ในเขตสุขภาพ เพื่อขับเคลื่อนระบบสุขภาพ โดยมีหน่วยงานต่าง ๆ พัฒนาระบบการสื่อสารสนับสนุนในประเด็นทางสังคมที่มีผลกระทบ ต่อสุขภาพจิต จุดประเด็นสาธารณะด้านสุขภาพจิต เพื่อให้ผู้เกี่ยวข้องเห็นความสำคัญเรื่องสุขภาพจิต ทั้งนี้การจัดกิจกรรมสัปดาห์สุขภาพจิต ที่เน้นเนื้อหา “วัดใจ เติมพลัง สังคมมีสุข” ครั้งนี้ ได้จัดขึ้นภายใต้ความร่วมมือระหว่างกรมสุขภาพจิต โดยโรงพยาบาลศรีธัญญาและภาคีเครือข่ายภาคประชาชน เพื่อมุ่งหวังให้เป็นเวทีในการเผยแพร่ความรู้ความเข้าใจเกี่ยวกับการฟื้นฟูจิตใจผ่านการบำบัดรักษาด้วยวรรณกรรม ผ่าน “วรรณกรรมโอสถ” และการสนับสนุนบอร์ดเกม เพื่อเป้าหมายที่สำคัญ คือ ส่งเสริมทักษะให้กับเด็กและเยาวชนกลุ่มเปราะบาง สนับสนุนให้ผู้ป่วยจิตเวชและ ผู้ไร้ที่พึ่งในการดูแลของกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ที่อยู่ในโครงการบ้านเปี่ยมพลัง สามารถดูแลตนเองและใช้ชีวิต ในสังคมได้อย่างมีความสุข
แพทย์หญิงมธุรดา สุวรรณโพธิ์ ผู้อำนวยการโรงพยาบาลศรีธัญญา กล่าวว่า นอกจากมีการเสวนาในประเด็น “จากวันทุกข์ที่ผ่านพ้น สู่วันที่ฟื้นคืนใจ”และ “กว่าจะมี...ภูมิคุ้มใจในวันทุกข์” เพื่อการเยียวยาสังคมในมิติต่าง ๆ กิจกรรมวันนี้เกิดผลสัมฤทธิ์ที่สะท้อนให้เห็นความร่วมมือในหลายภาคส่วน ได้แก่ กรมสุขภาพจิต โรงพยาบาลศรีธัญญา ศูนย์สุขภาพจิตที่ 4 แผนงานสร้างเสริมวัฒนธรรมการอ่าน สสส. คณะทำงานโครงการอ่านยาใจ สมาคมนักเขียนแห่งประเทศไทย ธนาคารจิตอาสา และบริษัทการีนา ออนไลน์ (ประเทศไทย) จำกัด ทั้งยังขยายขอบเขตของการฟื้นฟูสภาพจิตใจในสังคมและผู้มีประสบการเจ็บป่วยด้วยโรคทางจิตเวช ให้ได้รับบริการสุขภาพจิตที่หลากหลาย มีคุณภาพ โดยกรมสุขภาพจิตจะนำนิทานภูมิคุ้มใจเพื่อเด็กปฐมวัย ได้แก่ “ตุ๊กตาของลูก” และ “หางตุ้ม” และ “หูตั้ง” ไปใช้เยียวยาครอบครัวและเด็กที่ได้รับผลกระทบจากเหตุการณ์ที่จังหวัดหนองบัวลำภูด้วย กรมสุขภาพจิต ขอให้ทุกภาคส่วนตระหนักถึงความสำคัญของสุขภาพจิตและให้โอกาสกับผู้มีประสบการณ์เจ็บป่วยด้วยโรคทางจิตเวช โดยมาช่วยกันวัดใจ เติมพลัง สร้างสังคมมีสุขร่วมกัน
ตารางกิจกรรม งานสัปดาห์สุขภาพจิต 2565 วันที่ 2 พฤศจิกายน 2565 วัดใจ เติมพลัง สังคมมีสุข
"อ่านยาใจ : ภูมิคุ้มใจในวันทุกข์ สู่วันฟื้นคืนใจ" ณ ห้องเกียรติภูมิ วงศ์รจิต อาคาร 9 ชั้น ชั้น 9 โรงพยาบาลศรีธัญญา
- เสวนา “การฟื้นฟูสุขภาพจิตร่วมกับกรมพัฒนาสังคมและมนุษย์”
- เสวนา “จากวันทุกข์ที่ผ่านพ้น สู่วันที่ฟื้นคืนใจ”
- เสวนา"กว่าจะมี....ภูมิคุ้มใจในวันทุกข์"
- พร้อมชมนิทรรศการวรรณกรรมยาใจ : มหัศจรรย์แห่งการอ่าน ปฏิหารย์แห่งการเขียน
Thailand Coffee Hub 2023
ปี 2566 เซ็นทรัลพัฒนา ได้จัดงาน Thailand Coffee Hub 2023 ในศูนย์การค้าเซ็นทรัล จำนวน 3 ครั้ง ใน 3 จังหวัด ได้แก่
เซ็นทรัล จันทบุรี 1-7 เม.ย. 66 ,
เซ็นทรัล หาดใหญ่ 25-31 ส.ค. 66 ,
เซ็นทรัลเวิลด์ 4–10 ต.ค. 66 เทศกาลกาแฟ กลางเมือง
งาน Thailand Coffee Hub ประสบความสำเร็จสูงสุด มีการตอบรับอย่างดี จากผู้ประกอบการท้องถิ่น แบรนด์ดัง ไปจนถึงบรรดา coffee lover ทั้งคนไทยและต่างชาติ โดยในปี 2567 เซ็นทรัลพัฒนาได้วางกลยุทธ์การจัดงานให้ครอบคลุมทุกหัวเมืองใหญ่ ๆ ในแต่ละภูมิภาค เพื่อขยายชื่อเสียงของกาแฟไทยไปยังกลุ่ม Quality Tourist พร้อมทั้งขยายเครือข่ายความสัมพันธ์ไปยังกลุ่มธุรกิจกาแฟจากประเทศต่าง ๆ ให้เกิดการแลกเปลี่ยนความรู้และประสบการณ์ใหม่ ๆ นำไปสู่การบรรลุเป้าหมายของการผลักดันกาแฟไทยสู่เวทีโลกในอนาคตอันใกล้นี้ - ผู้บริหารเซ็นทรัลพัฒนา ให้ข้อมูล [
marketthink]
กิจกรรม 3 พฤศจิกายน 65 - รมว.สธ. เป็นประธานเปิดสัปดาห์สุขภาพจิตแห่งชาติ จ.นครราชสีมา
3 พฤศจิกายน 2565 นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข ให้เกียรติเป็นประธานเปิดสัปดาห์สุขภาพจิตแห่งชาติ ประจำปี 2565 “วัดใจ เติมพลัง สังคมมีสุข” ในพื้นที่จังหวัดนครราชสีมา พร้อมเน้นย้ำเครือข่ายสุขภาพจิตสนับสนุนการวัดใจให้สม่ำเสมอ รวมทั้งเสนอหลักการเติมพลังทั้งทางกายและใจ ผ่านความร่วมมือจากโครงการคู่เครือข่ายดูแลใจเพื่อคนไทยคุณภาพ ในการป้องกันและลดความเสี่ยงจากปัญหาสุขภาพจิต
นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวว่า วัตถุประสงค์ของการจัดงาน สัปดาห์สุขภาพจิตแห่งชาติปีนี้ เรารณรงค์ “วัดใจ เติมพลัง สังคมมีสุข” ซึ่งที่ผ่านมา แม้โรคระบาดโควิด - 19 จะทำให้เกิดความยากลำบากในสังคม แต่ตอนนี้สถานการณ์ได้คลี่คลายไปในทางที่ดีขึ้น สิ่งที่เราจะต้องทำให้เกิดความสมบูรณ์ที่สุด คือคนไทยต้องแข็งแรง ต้องมีสุขภาพดีทั้งกายและใจ ต้องได้รับการดูแลทางด้านสาธารณสุขในทุกมิติ ต้องมีความพร้อมในการประกอบสัมมาอาชีพเพื่อเสริมสร้างรายได้ให้กับตนเอง สำคัญอีกเรื่องคือ “สุขภาพจิต” เราจะต้องเร่งฟื้นฟูสภาพจิตใจ ให้ประชาชนคนไทยมีสุขภาพจิตใจที่เข้มแข็ง ที่จะดำเนินชีวิตต่อไปอย่างมีคุณภาพ นั่นคือภารกิจของกระทรวงสาธารณสุข สัปดาห์สุขภาพจิตแห่งชาติ จะมีการสัมมนา การแลกเปลี่ยน การเรียนรู้ การติดตามผลงาน ให้ประชาชนมีสุขภาพจิตที่ดี มีความคิดที่ดี ทัศนคติที่ดี แล้วสังคมไทยของเราจะมีความสุข สร้างความสามัคคีเป็นปึกแผ่น บ้านเมืองจะมีความมั่นคง มีความเจริญเติบโต ในทุกภาคส่วนทุกมิติ
แพทย์หญิงอัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กล่าวว่า วัยรุ่นเป็นกลุ่มเป็นช่วงอายุที่อารมณ์อ่อนไหวง่ายต่อสิ่งเร้ารอบด้าน ซึ่งส่งผลกระทบต่อภาวะสุขภาพจิตทั้งระยะสั้นและระยะยาว กรมสุขภาพจิตจึงตระหนักและเห็นความสำคัญในการดูแลสุขภาพจิตของนักศึกษามาโดยตลอด และได้ทำบันทึกข้อตกลงในการร่วมมือโครงการคู่เครือข่ายดูแลจิตใจก้าวสู่คนไทยคุณภาพกับมหาวิทยาลัยราชภัฏทั่วประเทศ เพื่อให้นักศึกษาได้รับการดูแลช่วยเหลืออย่างเหมาะสมทันท่วงที ด้วยกระบวนการส่งเสริมให้นักศึกษาวัดใจด้วยตนเองผ่านเครื่องมือ Mental Health Check In ซึ่งพบนักศึกษาได้รับการดูแลให้คำปรึกษาช่วยเหลือเบื้องต้น รวมทั้งส่งต่อไปยังหน่วยงานโรงพยาบาลคู่เครือข่ายที่มีจิตแพทย์ นักจิตวิทยาและพยาบาลจิตเวช กรมสุขภาพจิตยังสนับสนุนการจัดกิจกรรมเติมพลังจิตใจ เสริมสร้างความเข้มแข็งทางใจให้แก่นักศึกษาและอาจารย์ พร้อมพัฒนาศักยภาพคณาจารย์ ให้มีทักษะการฟัง ให้คำปรึกษาช่วยเหลือนักศึกษาเบื้องต้นได้
ผศ.ดร.อดิศร เนาวนนท์ อธิการบดีมหาวิทยาลัยราชภัฏนครราชสีมา กล่าวว่ามหาวิทยาลัยร่วมมือจัดทำข้อตกลงโครงการคู่เครือข่ายดูแลจิตใจก้าวสู่คนไทยคุณภาพกับกรมสุขภาพจิต โดยมีโรงพยาบาลเทพรัตน์เป็นโรงพยาบาลคู่เครือข่ายที่สามารถส่งต่อนักศึกษาที่มีปัญหาสุขภาพจิตสู่โรงพยาบาลจิตเวชนครราชสีมา ราชนครินทร์ รวมทั้งมหาวิทยาลัยได้สนับสนุนงบประมาณจัดกิจกรรมพัฒนาสุขภาพจิตของนักศึกษา จัดอบรมพัฒนาบุคลากรและอาจารย์ให้มีศักยภาพในการดูแลสุขภาพจิตของนักศึกษาได้อย่างครอบคลุมและเหมาะสม รวมทั้งการส่งเสริมป้องกันปัญหาสุขภาพจิตต่อเนื่อง ปัจจุบันทางมหาวิทยาลัยได้เพิ่มช่องทางการช่วยเหลือนักศึกษา ผ่านบริการศูนย์การปรึกษาเชิงจิตวิทยา (คนข้างใจ By-The-Heart-People) ทั้งนี้เพื่อสนับสนุนการ “วัดใจ เติมพลัง สังคมมีสุข” นายแพทย์สุผล ตติยนันทพร นายแพทย์สาธารณสุขจังหวัดนครราชสีมา สำนักงานสาธารณสุขจังหวัดนครราชสีมา พร้อมร่วมมือกับมหาวิทยาลัยราชภัฏนครราชสีมาในฐานะคู่เครือข่าย (โรงพยาบาลเทพรัตน์) ดูแลช่วยเหลือนักศึกษา ผ่านศูนย์แพทย์ชุมชนที่ตั้งอยู่ในมหาวิทยาลัยราชภัฏนครราชสีมา ในการส่งเสริมป้องกันและดูแลรักษาเบื้องต้น หากนักศึกษามีปัญหาด้านสุขภาพจิตที่จำเป็นต้องไปรับการรักษาจะถูกส่งต่อไปยังโรงพยาบาลเทพรัตน์ และหากมีปัญหาสุขภาพจิตที่รุนแรงยุ่งยากซับซ้อนสามารถส่งต่อโรงพยาบาลจิตเวชนครราชสีมาราชนครินทร์ได้ทันที ซึ่งเป็นการช่วยเหลือเติมพลังความเข้มแข็งจิตใจแก่นักศึกษาอย่างเป็นระบบ ทำให้สังคม มีความสุขร่วมกัน
ผศ.ดร.อดิศร เนาวนนท์ อธิการบดีมหาวิทยาลัยราชภัฏนครราชสีมา กล่าวว่า มหาวิทยาลัยมีวิสัยทัศน์ "เป็นผู้นำการศึกษา เพื่อพัฒนาท้องถิ่น สู่ความยั่งยืน" และสืบสานศิลป-วัฒนธรรมของชาติและสร้างสรรค์คุณค่าภูมิปัญญาท้องถิ่นก้าวไกลสู่สากล มหาวิทยาลัยราชภัฏนครราชสีมาจึงได้มีความร่วมมือจัดทำข้อตกลงโครงการคู่เครือข่ายดูแลจิตใจก้าวสู่คนไทยคุณภาพกับกรมสุขภาพจิต (ศูนย์สุขภาพจิตที่ 9 และโรงพยาบาลจิตเวชนครราชสีมาราชนครินทร์) จัดสนับสนุนงบประมาณจัดกิจกรรมพัฒนาสุขภาพจิตของนักศึกษา จัดอบรมพัฒนาบุคลากรและอาจารย์ให้มีศักยภาพในการดูแลสุขภาพจิตนักศึกษาได้อย่างครอบคลุมเข้าสู่กระบวนการรักษา ที่เหมาะสม รวมทั้งการส่งเสริมป้องกันปัญหาสุขภาพจิตต่อเนื่อง ปัจจุบันทางมหาวิทยาลัยฯ ได้เพิ่มช่องทางการช่วยเหลือนักศึกษา ผ่านบริการศูนย์การปรึกษาเชิงจิตวิทยา (คนข้างใจ By-The-Heart-People)
กรมสุขภาพจิต โดยโรงพยาบาลจิตเวชนครราชสีมาราชนครินทร์และศูนย์สุขภาพจิตที่ 9 จึงขอเชิญชวนประชาชนในพื้นที่ร่วม “วัดใจ เติมพลัง สังคมมีสุข” กับนิทรรศการทางด้านสุขภาพจิต กิจกรรม “วัดใจ” การให้คำปรึกษาทางสุขภาพจิต กิจกรรมเสริมสร้างพลังใจ สังคมให้มีความสุขร่วมกัน ในงานสัปดาห์สุขภาพจิตแห่งชาติ วันที่ 3-4 พฤศจิกายน 2565 ณ อาคารยุพราชเบญจมงคล (อาคาร 31) มหาวิทยาลัยราชภัฏนครราชสีมา ตั้งแต่ 8.30 น. เป็นต้นไป เพราะเรื่องสุขภาพใจ รู้ก่อน รู้ทัน ป้องกันความเสี่ยงได้ เพื่อสร้างพลเมืองยุใหม่ในศตวรรษที่ 21
โรงพยาบาลสวรรค์ประชารักษ์ เปิดรับสมัครงาน เพื่อจ้างเป็นลูกจ้างชั่วคราวรายวัน LINK
โรงพยาบาลสวรรค์ประชารักษ์ เปิดรับสมัครงาน เพื่อจ้างเป็นลูกจ้างชั่วคราวรายวัน ในตำแหน่ง
1.ตำแหน่งเจ้าพนักงานเผยแพร่และประชาสัมพันธ์ จำนวน 1 อัตรา สมัครได้ตั้งแต่วันที่ 7-16 พฤศจิกายน 2565
2.ตำแหน่งพนักงานการแพทย์และรังสีเทคนิค จำนวน 2 อัตรา สมัครได้ตั้งแต่วันที่ 7-16 พฤศจิกายน 2565
ผู้สนใจ สามารถสมัครได้ทางอินเทอร์เน็ต ตลอด 24 ชั่วโมง https://spr.thaijobjob.com/ หรือสแกนผ่านคิวอาร์โค้ด (เอกสารแนบท้ายประกาศรับสมัคร) หรือสอบถามรายละเอียดได้ที่ กลุ่มงานทรัพยากรบุคคล ชั้น 4 อาคาร 100 ปี โรงพยาบาลสวรรค์ประชารักษ์แห่งใหม่ เขาเขียว โทร. 056-219897 ตั้งแต่เวลา 08.30 – 15.00 น. หรือดูรายละเอียดได้ตามลิงค์เอกสารที่แนบ
โรงพยาบาลตรัง รับสมัครงาน
3 พ.ย.66 Sky doctor รับผู้ป่วยเสียเลือดมากจากอมก๋อย ส่งต่อ รพ.นครพิงค์


3 พฤศจิกายน 2566 เวลา 16.27 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 27 ปี อุบัติเหตุขับรถจักรยานยนต์ชนรถยนต์ มีแผลฉีกขาดขนาดใหญ่ที่ขาขวา เสียเลือดเป็นจำนวนมาก โดยรับจากโรงพยาบาลส่งเสริมสุขภาพตําบลบ้านมูเซอ ตําบลม่อนจอง อําเภออมก๋อย จังหวัดเชียงใหม่ แพทย์ได้วินิฉัย Severe laceration wound at Rt. leg (แผลฉีกขาดระดับรุนแรงที่บริเวณขาข้างขวา) จำเป็นต้องได้รับการผ่าตัดเร่งด่วน และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ ตําบลดอนแก้ว อําเภอแม่ริม จังหวัดเชียงใหม่ ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพบก ประเภทอากาศยานเฮลิคอปเตอร์ EC145 มีชุดปฏิบัติการบิน ประกอบด้วย พันตรีจิรวัฒน์ โพธิ์งาม, ร้อยเอกธนวัฒน์ หวังเป็น, จ่าสิบเอกธีรพันธ์ วรสาร และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลนครพิงค์ ประกอบด้วย แพทย์หญิง พัณณ์ชิตา ชํานาญกิจวนิชย์, นางสาว พนิดา ปันตาวะนา, นางสาว วันทนา กูลเรือน โดยการลำเลียงผู้ป่วยรายนี้เป็นการลำเลียงแบบ Primary mission เป็นครั้งแรกของพื้นที่นี้จนเมื่อเวลา 19.05 น. ได้นำส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ เป็นที่เรียบร้อย [
รพ.นครพิงค์]
3 พ.ย.66 บินรับเด็กหญิง 5 เดือน ออกซิเจนในเลือดต่ำ จากบ้านแม่จันทะ ส่งรพ.อุ้มผาง
3 พฤศจิกายน 2566 เวลา 13.10 น. สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดตาก ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยเด็กไทย เพศหญิง อายุ 5 เดือน ผู้ป่วยมีอาการไข้ ไอ หอบ หายใจเหนื่อย ออกซิเจนในเลือดต่ำ แพทย์อำนวยการประจำศูนย์รับแจ้งเหตุและสั่งการจังหวัดตาก วางแผนเพื่อดำเนินการใส่ท่อช่วยหายใจ ปรึกษากุมารแพทย์พร้อมรับเคส โดยรับจากสุขศาลาพระราชทานบ้านแม่จันทะ ตำบลแม่จัน อำเภออุ้มผาง จังหวัดตาก แพทย์ได้วินิจฉัย Pneumonia with respiratory failure (ปอดอักเสบร่วมกับภาวะหายใจล้มเหลว) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลอุ้มผาง ตำบลอุ้มผาง อำเภออุ้มผาง จังหวัดตาก
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองบินตำรวจ ประเภทอากาศยานเฮลิคอปเตอร์ Bell212 มีชุดปฏิบัติการบิน ประกอบด้วย พ.ต.อ.วิเชียร อ่อนฉ่ำ, ร.ต.อ.อภิวัฒน์ ยานสุวรรณ์, พ.ต.ต.ประทีบ พุกประทุม และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช ประกอบด้วย แพทย์หญิง ศิวนาฏ พีระเชื้อ, นางสาว คณพิชญ์ ทิพยะจันทร, นาย อพิเทพ ตระกูลค้ำวาร, นิสิตแพทย์ บุษบง อาษากิจ นิสิตแพทย์ปีที่ 6
และเมื่อเวลา 15.52 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลอุ้มผาง เป็นที่เรียบร้อย
First step เจ็บแต่เก็บอาการ มินิมาราธอน 2024 วันที่ 3 พศจิกายน 2567
First step เจ็บแต่เก็บอาการ มินิมาราธอน 2024 วันที่ 3 พศจิกายน 2567 สถานที่จัดงาน สวนพุทธมณฑล ถนนพุทธมณฑล สาย4 เข้าประตู 2 จุดปล่อยตัวใกล้กับอาคารพิพิธภัณฑ์ทางพระพุทธศาสนา บริเวณลานจอดรถ พบกับกิจกรรมวิ่งที่การออกแบบเสื้อไม่เหมือนใคร อีกทั้งของรางวัลมากมาย ไม่ว่าจะเป็น ตุ๊กตา TOP 50 คนแรก ในระยะ 10 k. ตุ๊กตา TOP 25 คนแรก ในระยะ 5k และทุนการศึกษาให้แก่น้องๆ อายุไม่เกิน 16 ปี ในระยะ 5k
ศรีเทพมาราธอน 2024 วันที่ 3 พฤศจิกายน 2567 LINK
MOCCONA Presents "Si Thep Marathon 2024" ศรีเทพมาราธอน 2567 สนับสนุนโดย กาแฟมอคโคน่า วิ่งมาราธอนในเมืองโบราณศรีเทพ วันแข่งขัน วันอาทิตย์ที่ 3 พฤศจิกายน 2567 ณ เขาคลังนอก อ.ศรีเทพ จ.เพชรบูรณ์ ระยะวิ่ง มาราธอน 42.195 กม./ ฮาล์ฟมาราธอน 21.1 กม./ มินิมาราธอน 10 กม./ ไมโครมาราธอน 5 กม.: 500 บาท
กิจกรรม 4 พฤศจิกายน 65 - งานวิจัยและเสวนา "HEARTS MATTER สุขภาพใจเยาวชน เพศหลากหลาย
สถาบันราชานุกูล และ สถาบันสุขภาพจิตเด็กและวัยรุ่นราชนครินทร์ ขอเชิญทุกท่านร่วมเปิดตัวงานวิจัยและเสวนา "HEARTS MATTER สุขภาพใจเยาวชน เพศหลากหลาย"
ร่วมพูดคุยกับ พญ.จิราภรณ์ อรุณากูร หรือ คุณหมอโอ๋ จากเพจเลี้ยงลูกนอกบ้าน, คุณพรทิพย์ ตัวแทนเยาวชน LGBTQIA+, อ.สกล คณะวิทยากรเรียนรู้และศึกษาศาสตร์ ทีมวิจัย มหาวิทยาลัยธรรมศาสตร์ และนำการเสวนาโดย หมอวี พญ.วิมลรัตน์ วันเพ็ญ ผอ.สถาบันสุขภาพจิตเด็กและวัยรุ่นราชนครินทร์
และพบกับการแสดงความสามารถจากน้องๆ เยาวชนคนพิเศษในชุด "คาเฟอีน" นำทีมโดย 3 ดาวน์มากความสามารถ พี่เสือ ฉายวิชญ์ สุจริตกุล, พี่ภพ กรภพ คงเจริญถิ่น และ พี่แบงค์ สุทธิพศ กนกนาค
พบกันในวันที่ 4 พฤศจิกายนนี้ เวลา 14.00-16.00 น. ณ สามย่านโค-ออป ชั้น 2 ศูนย์การค้า สามย่านมิตรทาวน์
4 พ.ย.66 บินรับชายไทยกล้ามเนื้อหัวใจตาย จากปาย ส่งรพ.นครพิงค์
4 พฤศจิกายน 2566 เวลา 15.01 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 52 ปี มีอาการเจ็บแน่นหน้าอก ตรวจคลื่นไฟฟ้าหัวใจมีความผิดปกติ ได้ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลปาย ตำบลเวียงใต้ อำเภอปาย จังหวัดแม่ฮ่องสอน แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ ตําบลดอนแก้ว อําเภอแม่ริม จังหวัดเชียงใหม่
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพบก ประเภทอากาศยานเฮลิคอปเตอร์ EC145 มีชุดปฏิบัติการบิน ประกอบด้วย พันตรีจิรวัฒน์ โพธิ์งาม, ร้อยเอกธนวัฒน์ หวังเป็น, จ่าสิบเอกประวิทย์ ศิริธร และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลนครพิงค์ ประกอบด้วย แพทย์หญิงคณพร คุณประเสริฐ, นางสาวสุนิสา จันตากอ พยาบาลวิชาชีพ, นายอานนท์ เขื่อนคำ นักฉุกเฉินการแพทย์
และเมื่อเวลา 16.14 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ แผนกผู้ป่วยวิกฤตหัวใจ (Cardiac Care Unit-CCU) เป็นที่เรียบร้อย
4 พ.ย.66 รับผู้ป่วยชายไทย มีภาวะกล้ามเนื้อหัวใจตาย จากอ.คลองท่อม ส่งรพ.กรุงเทพภูเก็ต
4 พฤศจิกายน 2566 เวลา 13.01 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดกระบี่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 40 ปี 11.00 น. วันนี้ มีอาการแน่นกลางอก ร้าวไปหลัง เหงื่อแตกตัวเย็น รู้สึกเหมือนจะเป็นลม ได้ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลคลองท่อม ตำบลคลองท่อมใต้ อำเภอคลองท่อม จังหวัดกระบี่ แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลกรุงเทพภูเก็ต ตำบลตลาดใหญ่ อำเภอเมือง จังหวัดภูเก็ต
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพเรือ ประเภทอากาศยานเฮลิคอปเตอร์ลำเลียงแบบที่ 4 S-76B มีชุดปฏิบัติการบิน ประกอบด้วย ร้อยเอกคชกร ส., ร้อยโทกนต์ธร ข. ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลวชิระภูเก็ต ประกอบด้วย แพทย์หญิงชนิดา เข็มเงิน, นางสาวสายพิณ สังข์เพชร พยาบาลวิชาชีพ, นายอนุชา บำรุง นักฉุกเฉินการแพทย์
และเมื่อเวลา 15.52 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลกรุงเทพภูเก็ต เป็นที่เรียบร้อย
in-cosmetics Asia 5-7 พฤศจิกายน 2024
in-cosmetics Asia 5 – 7 November 2024 BITEC, Bangkok The leading event in Asia Pacific for personal care ingredients. Where personal care ingredients and creators come together Join in-cosmetics Asia, where all areas of the cosmetics industry connect to inspire, share insights and spark potential collaborations. Celebrating excellence in the field of ingredient innovation, in-cosmetics Asia also offers high-quality education on the latest science and trends. Plus, with networking opportunities for the cosmetic ingredients community, you can uncover the tools to engage in new business and evolve your brand. Whether you are a (visiting) personal care creator or (exhibiting) supplier of ingredients, fragrances, lab equipment, testing or regulatory solutions, in-cosmetics Asia has something for you. Join us for fresh-thinking and development, unlocking better experiences for consumers in a changing world.
COSMEX 2024 - 5-7 พฤศจิกายน 2567
งาน COSMEX 2024 วันที่ 5-7 พฤศจิกายน 2567 ไบเทค บางนา งานแสดงสินค้าแบรนด์ชั้นนำด้านเทคโนโลยีการผลิตเครื่องสำอาง เครื่องจักร บรรจุภัณฑ์ และผู้ให้บริการรับจ้างผลิต ODM/OEM สำหรับเครื่องสำอางผลิตภัณฑ์ดูแลร่างกาย
ลงทะเบียนเข้าชมงานคอสเม็กซ์ 2024 ล่วงหน้าผ่านช่องทางออนไลน์ได้ตั้งแต่วันนี้ เพื่อประสบการณ์ในการเข้าชมงานที่ราบรื่นและรวดเร็ว พร้อมรับสิทธิ์ยกเว้นค่าเข้าชมงานมูลค่า 500 บาท พร้อมรับทราบข้อมูลข่าวสารล่าสุดของงาน ตลอดจนกิจกรรมและข้อเสนอพิเศษจากผู้แสดงสินค้าของเราได้ก่อนใคร พิเศษสุด! รับสูจิบัตรของงานในรูปแบบ i-Directory ได้ฟรี (ปกติมูลค่า 1,000 บาท)
in-cosmetics Asia 7-9 November 2023 @Bitec Hall EH 101-104
งาน in-cosmetics Asia จะจัดร่วมกับ COSMEX วันที่ 7 - 9 พฤศจิกายน 2566 ไบเทค บางนา เป็นงานแสดงด้านส่วนผสมผลิตภัณฑ์ดูแลร่างกายชั้นนำแห่งเอเชียแปซิฟิก นำเสนอทุกมิติของอุตสาหกรรมความงาม ครอบคลุมตั้งแต่ส่วนผสมเครื่องสำอางที่มาแรงที่สุดของปี ครบครันตั้งแต่ต้นน้ำถึงปลายน้ำ จากส่วนผสม ไปถึง ขั้นตอนและกระบวนการผลิต บรรจุภัณฑ์ พร้อมคำปรึกษาและความรู้ด้านการตลาดและการเข้าถึงลูกค้า เทรนด์ธุรกิจล่าสุด เพื่อนำไปสร้างสรรค์ผลิตภัณฑ์หรือส่งเสริมการตลาดได้อย่างมีประสิทธิภาพ คอสเม็กซ์ จึงเป็นงานที่มอบลุคแห่งความสำเร็จให้วงการความงามอย่างแท้จริง
COSMEX 2023 วันที่ 7 - 9 พฤศจิกายน 2566 ไบเทค บางนา
งาน COSMEX จะจัดร่วมกับ in-cosmetics Asia 2023 วันที่ 7 - 9 พฤศจิกายน 2566 ไบเทค บางนา เป็นงานแสดงด้านส่วนผสมผลิตภัณฑ์ดูแลร่างกายชั้นนำแห่งเอเชียแปซิฟิก นำเสนอทุกมิติของอุตสาหกรรมความงาม ครอบคลุมตั้งแต่ส่วนผสมเครื่องสำอางที่มาแรงที่สุดของปี ครบครันตั้งแต่ต้นน้ำถึงปลายน้ำ จากส่วนผสม ไปถึง ขั้นตอนและกระบวนการผลิต บรรจุภัณฑ์ พร้อมคำปรึกษาและความรู้ด้านการตลาดและการเข้าถึงลูกค้า เทรนด์ธุรกิจล่าสุด เพื่อนำไปสร้างสรรค์ผลิตภัณฑ์หรือส่งเสริมการตลาดได้อย่างมีประสิทธิภาพ คอสเม็กซ์ จึงเป็นงานที่มอบลุคแห่งความสำเร็จให้วงการความงามอย่างแท้จริง
8 พ.ย.66 รับผู้ป่วยชายไทยจากสบเมย ส่งนครพิงค์แม่ริม
8 พฤศจิกายน 2566 เวลา 15.47 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 59 ปี ปวดแสบร้อนหน้าอก ร้าวไปแขน 2 ข้าง โดยรับจากโรงพยาบาลสบเมย ตำบลแม่คะตวน อำเภอสบเมย จังหวัดแม่ฮ่องสอน แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง จึงส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพบก ประเภทอากาศยานเฮลิคอปเตอร์ Bell 212 มีชุดปฏิบัติการบิน ประกอบด้วย พันตรีอภิรักษ์ พาหอม, ร้อยเอกภูวเดช ปฐมคงสกุล, จ่าสิบเอกสุวคุณ สุวัสส์, จ่าสิบเอก ศุภฤกษ์ พลศรี และชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลศรีสังวาลย์ ประกอบด้วย นายแพทย์กรีฑา คำเนียม, นางสาวธัญสุดา นานาวรรณาคาร, นายสรพงษ์ รัตนจำเริญ
และเมื่อเวลา 18.13 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ แผนกผู้ป่วยวิกฤตหัวใจ (Cardiac Care Unit-CCU) เป็นที่เรียบร้อย
Health & Wealth Expo 2023 วันที่ 9-12 พฤศจิกายน 66
งาน Health & Wealth Expo 2023 ภายใต้แนวคิด The Journey of life จัดโดย เนชั่น กรุ๊ป ระหว่างวันที่ 9 – 12 พฤศจิกายน 2566 เวลา 11.00 – 20.00 น. ที่ Hall 5 – 6 ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์ มหกรรมการแสดงสินค้า และความรู้เพื่อการใช้ชีวิตอย่างมีความสุขและมั่งคั่ง ที่จะพาคุณไปพบกับสินค้าหลากหลาย ที่ตอบสนองการใช้ชีวิตในแต่ละช่วงอายุ อย่างครบวงจร ภายใต้แนวคิด The Journey of life พบ 4 โซนหลักที่จะพาคุณเดินทางไปสู่ ช่วงเวลาต่างๆของวัย
- Living Fit วัยหนุ่มสาว มีพลังกาย พลังใจล้นเหลือ สนใจและเปิดรับสิ่งใหม่ พบกับ Gadget สุดล้ำอุปกรณ์เทคโนโลยีต่างๆ อุปกรณ์ออกกำลังกาย Beauty & Fashion
- Money Pro วัยสร้างเนื้อสร้างตัว สนใจการออมเงิน การลงทุน เพื่อให้เงินงอกเงยด้วยวิธีต่างๆพบกับ สถาบันการเงิน การลงทุน บริษัทประกันชีวิต เป็นต้น
- Success Your life เมื่อชีวิตเริ่มมีความพร้อม มองหาความมั่นคงในชีวิต ต้องการสิ่งเติมเต็มให้กับตนเองและครอบครัว พบกับ บ้าน คอนโด ของตกแต่งบ้าน รถยนต์ไฟฟ้า EV Charger เป็นต้น
- Happy Healthy วัยแห่งความสงบ หันมาใส่ใจกับคุณภาพชีวิตมากขึ้น เลือกของที่ดีมีคุณภาพพบกับ ศูนย์สุขภาพและความงาม โรงพยาบาลชั้นนำ Health Gadget ผลิตภัณฑ์อาหารเพื่อสุขภาพ อาหารเสริม นอกจากนี้ ยังมีโซนอาหารอร่อยจากทุกภาคอีกด้วย
1. ทัศนคติที่คนไทยมีต่อการพนันความเข้าใจผิด ความกังวลและผลกระทบ
สรุปเกี่ยวกับทัศนคติคนไทยต่อการพนันแบบต่างๆ
1. การ "ซื้อล็อตเตอรี่รัฐบาล" คนไทยเกินครึ่ง (52%) เห็นด้วย ว่า "ไม่ถือเป็นการพนัน" อีก 12% ไม่แน่ใจ
2. "หวยใต้ดิน" คนไทยส่วนใหญ่ (62%) เข้าใจดีว่า เป็นการพนัน มี 10% ตอบว่าไม่แน่ใจ
3. คนไทยส่วนใหญ่ (55%) "ไม่เห็นด้วย" ที่จะเปิดให้ "พนันทายผลบอล ถูกกฏหมาย" มี 16% ตอบว่าไม่แน่ใจ
4. การเปิด "บ่อนคาสิโนถูกกฏหมาย" - คนไทยส่วนใหญ่ (54%) "ไม่เห็นด้วย" ที่จะเปิด มี 16% ตอบว่าไม่แน่ใจ
5. คนไทยส่วนใหญ่ (65%) "เชื่อว่า" คนเล่นพนันจะ "เพิ่มขึ้น" ถ้าถูกกฏหมาย มี 18% ตอบว่าไม่แน่ใจ อีก 16% ไม่เชื่อว่าจะเป็นเช่นนั้น
6. เรื่องการชิงโชค ชิงรางวัล จากการซื้อสินค้า จัดเป็นการพนันชนิดหนึ่ง นั้น จำนวนคนที่ทั้ง รู้-ไม่รู้-ไม่แน่ใจ มีจำนวนพอๆ กันคือราวๆ 33% นั่นคือเรื่องนี้ ไม่ชัดเจนในการรับรู้ของคนทั่วไป
7. เกือบ 80% เห็นตรงกันว่าพนันออนไลน์ทำให้คนติดง่ายขึ้น มีแค่ 5.5% เท่านั้นที่ไม่เห็นด้วย
8. คนส่วนใหญ่ 74% ก็เห็นด้วยว่า การที่สื่อเสนอข่าวคนถูกหวย รางวัลที่ 1 หรือการตีความเลขเด็ดต่าง จะทำให้คนเล่นหวย "มากขึ้น"
9. คนส่วนใหญ่ถึง 76% ก็เห็นด้วยว่า โฆษณาพนันออนไลน์ ชักนำคนเล่นพนัน "มากขึ้น" จริง ไม่เห็นด้วยแค่ 6%
จุฬารัตน์ 11 อินเตอร์
ยื่นใบสมัครด้วยตนเอง
ติดต่อฝ่ายบุคคล (ชั้น 3 อาคาร 1)
จันทร์ - ศุกร์ เวลา 08:00 - 17:00 น.
หรือส่งประวัติมาทาง Email: hr_ch11@chularat.com
โทร. 038-500-300 ต่อ 1340, 1341 / 085-389-7166
สถานเอกอัครราชทูตฯ ได้จัดเตรียมถุงยังชีพ มอบให้กับคนไทย
"น้ำใจคนไทย ไม่ทิ้งกัน" สถานเอกอัครราชทูตฯ ได้จัดเตรียมถุงยังชีพ พร้อมด้วยผ้าห่ม และน้ำดื่ม เพื่อนำไปมอบให้กับคนไทยที่ได้รับผลกระทบจากเหตุการณ์แผ่นดินไหวในครั้งนี้ โดยทีมสถานเอกอัครรราชทูตฯ ทีมที่สอง นำทีมโดยกงสุลพิพัฒน์ เจริญสุข ออกเดินทางจากกรุงอังการาในช่วงบ่ายของวันนี้ (10 ก.พ. 66) เพื่อไปสมทบกับทีมของเอกอัครราชทูตฯ ที่อยู่ที่เมือง Adana อยู่แล้ว โดยคาดว่าทีมที่สองจะเดินทางไปถึง Adana ในช่วงค่ำของวันนี้ และจะพร้อมลงพื้นที่มอบถุงยังชีพในวันพรุ่งนี้ (11 ก.พ. 66) [
Royal Thai Embassy, Ankara ]
11 ก.พ.66 ทีมงานของสถานเอกอัครราชทูตฯ เดินทางออกจากเมือง Adana เพื่อนำสิ่งของยังชีพไปมอบให้กับคนไทย โดยแบ่งเป็น 2 ทีม ทีม A นำโดยเอกอัครราชทูตฯ และกงสุลพิพัฒน์ฯ เดินทางไปยังเมือง Osmaniye Gaziantep และ Şanlıurfa ทีม B นำโดย คุณอนุตรฯ และเจ้าหน้าที่อาสาสมัครของสถานทูตฯ เดินทางไปยังจังหวัด Hatay
พี่น้องชาวไทยท่านใดที่อยู่ในเมืองข้างต้น แต่ยังไม่ได้รับการประสานงานจากเจ้าหน้าที่ สามารถโทรแจ้งได้ที่หมายเลข Hotline (+90) 0 533 641 56 98
2. การกำหนดอัตราค่าจ้างตามมาตรฐานฝีมือ
- วัตถุประสงค์เพื่อให้แรงงานกึ่งฝีมือ และแรงงานฝีมือได้รับค่าจ้างที่เหมาะสม จูงใจให้แรงงานพัฒนาฝีมือให้เป็นที่ยอมรับเพิ่มหลักประกันรายได้รวมทั้งเพิ่มความสามารถในการแข่งขันให้กับธุรกิจ ปัจจุบันมีการกำหนดถึง 129 สาขา ค่าจ้างอยู่ระหว่าง 345 - 900 บาทต่อวัน โดยมีการแบ่งระดับ 1 – 3 ในแต่ละสาขา
- เมื่อเปรียบเทียบค่าจ้างมาตรฐานฝีมือแรงงานมีความแตกต่างกับค่าจ้างขั้นต่ำ และใกล้เคียงกับค่าจ้างเฉลี่ยของแรงงานที่จบการศึกษาระดับมัธยมปลาย อาชีวศึกษา และวิชาชีพชั้นสูง
ห้องตรวจบริการสตรีวัยเจริญพันธ์
คลินิกวัยรุ่น เบอร์โทรติดต่อ 044 – 615002 ต่อ 1009
คลินิกนมแม่ เบอร์โทรติดต่อ 044 – 615002 ต่อ 3551-3552
Trip 1 : เสาร์ที่ 1 และอาทิตย์ที่ 2 กรกฎาคม เส้นทางแหลมผักเบี้ย โครงการพระราชดำริ (ไปเช้ากลับเย็น)
KORAT MARATHON 2024 - 10 พฤศจิกายน 2567 LINK
งานวิ่งสุดยิ่งใหญ่ ระดับ WORLD ATHLETICS "KORAT MARATHON 2024 PRESENTED BY THE MALL" งานวิ่งมาตรฐานระดับ World Athletics Road Race Label 2024 ในวันอาทิตย์ที่ 10 พฤศจิกายน 2567
คลินิกเวชศาสตร์ทั่วไปและครอบครัว LINK
สถานที่ตั้ง ชั้น 1 อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
เปิดให้บริการ
- วันจันทร์-ศุกร์ เวลา 16.00- 19.00 น.
- วันเสาร์ เวลา 08.00 - 11.00น.
หน้าที่และเป้าหมาย
ให้บริการตรวจรักษาพยาบาลผู้ป่วยทั่วไปอย่างถูกต้อง ปลอดภัยตามมาตรฐานวิชาชีพโดยคำนึงถึงความปลอดภัยและความพึงพอใจของผู้ใช้บริการเป็นสำคัญ
ขอบเขตการให้บริการ
ให้บริการรักษาพยาบาล รวมถึงส่งเสริม ป้องกัน และการดูแลต่อเนื่องในผู้ป่วยนอก ในกลุ่มที่เจ็บป่วยทั่วไป กลุ่มผู้ป่วยที่ยังไม่ได้รับการเข้าตรวจในสาขาเฉพาะโรค และผู้ป่วยที่มารักษาต่อเนื่องในกลุ่มโรคไม่ติดต่อเรื้อรัง(NCD) ที่ไม่มีภาวะแทรกซ้อน และที่ไม่มีภาวะฉุกเฉิน
บำรุงราษฎร์ปลูกถ่ายไตสำเร็จสูงกว่า 90% เทียบเท่ามาตรฐานระดับโลก - นพ. ทัตพงศ์ จิตเอื้ออารีย์
นพ. ทัตพงศ์ จิตเอื้ออารีย์ แพทย์เฉพาะทางด้านอายุรศาสตร์ - ไตวิทยา โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ไต เป็นอวัยวะที่ได้รับการปลูกถ่ายบ่อยที่สุดในโลก โดยกลุ่มที่จำเป็นต้องได้รับการรักษาด้วยการปลูกถ่ายไต คือ ผู้ป่วยโรคไตระยะสุดท้าย ทั้งในกลุ่มที่ได้รับการบำบัดทดแทนไตหรือยังไม่ได้รับการบำบัดทดแทนไตสามารถปลูกถ่ายไตได้ ซึ่งผู้ป่วยกลุ่มนี้ต้องได้รับการประเมินความพร้อมด้านสุขภาพก่อนเข้ารับการปลูกถ่ายไตจากสหสาขาวิชาชีพ อาทิ แพทย์ผู้ชำนาญการด้านหัวใจ แพทย์ผู้ชำนาญการด้านจิตเวช แพทย์ผู้ชาญการด้านศัลยศาสตร์การปลูกถ่ายอวัยวะ เป็นต้น
Vijit Chao Phraya แสงสีแห่งแม่น้ำเจ้าพระยา ต้อนรับการประชุมสุดยอดผู้นำเอเปค LINK
ททท.จัดกิจกรรม “VIJIT CHAO PHRAYA” แสดงแสงสีสร้างสีสันบรรยากาศให้แม่น้ำเจ้าพระยา ต้อนรับการประชุมสุดยอดผู้นำเอเปค กระตุ้นการเดินทางท่องเที่ยว สร้างโอกาสให้ผู้ประกอบการท่องเที่ยว
กิจกรรมจะจัดขึ้นระหว่างวันที่ 12-27 พฤศจิกายน 2565 บริเวณริมแม่น้ำเจ้าพระยา ใน 6 พื้นที่หลัก ได้แก่ 1. สะพานพระราม 8 2. ป้อมวิไชยประสิทธิ์ 3. วัดกัลยาณมิตร วรมหาวิหาร 4. สะพานพระพุทธยอดฟ้า 5. ศูนย์การค้าริเวอร์ ซิตี้ แบงค็อก 6. ไอคอนสยาม
ข้อมูลเพิ่มเติม ทั้ง 6 จุด
ทั้งนี้ผู้ที่สนใจสามารถเข้าชมสีสันบรรยากาศในแต่ละพื้นที่ได้โดยไม่เสียค่าใช้จ่าย โดยมุมมองในการชมแสงสีได้สวยงามที่สุดจะเป็นการล่องเรือในเส้นทางท่องเที่ยวแม่น้ำเจ้าพระยา และริมน้ำฝั่งตรงข้ามจุดที่ทำการแสดง เพื่อเป็นการสร้างโอกาสทางธุรกิจให้กับผู้ประกอบการเรืออาหาร เรือนำเที่ยว โรงแรม ที่พัก ตลอดจนร้านอาหารริมแม่น้ำเจ้าพระยาในพื้นที่ที่ทำการแสดง
ดนตรีในสวน "วงสุนทราภรณ์" 12 พฤศจิกายน 2565 LINK
เริ่มหนาวแล้ว...ไปชมดนตรีในสวนกัน กรุงเทพมหานคร ขอเชิญชม ดนตรีในสวน "วงสุนทราภรณ์"
เพลิดเพลินไปกับการแสดงดนตรีจาก วงสุนทราภรณ์ พร้อมชมความสวยงานของน้ำพุในบรรยากาศยามเย็น ณ สวนเบญจกิติ (ลานกิจกรรมสวนน้ำ)
ในวันเสาร์ที่ 12 พฤศจิกายน 2565 เริ่มเวลา 17:00 น.
สวิงในสวน Swing in the Park 4 วันอาทิตย์ที่ 13 พฤศจิกายน 2565 สวนวชิรเบญจทัศ สวนรถไฟ LINK
กลับมาเต้นสวิงในสวนวันอาทิตย์นี้กัน !
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีต ร่วมกับ The Stumbling Swingout และ DJ Donut
ขอเชิญชวนชาวกทม. และทุกๆท่านมาร่วมงาน
สวิงในสวน "Swing in the Park 4"
ดนตรีโดย วง The Stumbling Swingout และ DJ Donut
และมาหัดเรียนเต้นสวิงแบบมือใหม่ไปด้วยกันกับ ครูสุ และ ครูอิ๊ก
วันอาทิตย์ที่ 13 พฤศจิกายน 2565
เวลา 17.00-19.00
สถานที่ สวนวชิรเบญจทัศ (สวนรถไฟ)
กิจกรรมเข้าร่วมฟรี ไม่มีค่าใช้จ่าย !
อย่าลืมช่วยกันรักษาความสะอาดนะครับ
ขอขอบคุณทีมงานจาก กรุงเทพมหานคร ที่ช่วยดำเนินงานให้เรามี event เต้นรำฟรีสำหรับประชาชนชาวกทมและทุกๆท่านนะครับ
กรุงเทพมหานคร
กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว
ชัชชาติ สิทธิพันธุ์
BETTER CITY
Poster by Lada Phuphat
14 พฤศจิกายน วันเบาหวานโลก World Diabetes Day
ริเริ่มขึ้นครั้งแรกใน พ.ศ. 2534 โดยสหพันธ์โรคเบาหวานนานาชาติ (The International Diabetes Federation
IDF) และองค์การอนามัยโลก รณรงค์สร้างความตื่นรู้ถึงภัยโรคเบาหวาน เหตุที่เลือกวันที่ 14 พฤศจิกายน เนื่องจากเป็นวันเกิดของเฟรเดอริก แบนติง นักวิทยาศาสตร์ชาวแคนาดา ผู้ร่วมกับชาร์ลส์ เบสต์ เป็นคนแรกที่เข้าใจแนวคิดซึ่งนำไปสู่การค้นพบอินซูลินใน พ.ศ. 2465 และทำให้ได้รับรางวัลโนเบล ปี 1923 (พ.ศ. 2466)
Know Your Coffee คอร์สระยะสั้น 3 วัน 14-16 พฤศจิกายน 2023 @Food School 22,500 บาท
รียนจะได้รู้เกี่ยวกับโลกของกาแฟ ตั้งแต่ต้นน้ำจนถึงปลายน้ำ ไม่ว่าจะเป็นประวัติศาสตร์ กระบวนการการผลิต การชิมจนเกิดความเข้าใจ การทำเอสเปรสโซ ไปจนถึงการคั่ว และการดริปกาแฟ พร้อมประชันฝีมือกันผ่านกิจกรรม Fun Drip Competition ในวันสุดท้ายของการเรียน 14-16 พฤศจิกายน 2023
ช่วงเวลาเรียน: คลาส 3 วัน (2 เซสชั่นต่อวัน)
ชั่วโมงเรียน: เซสชั่นช่วงเช้า: 9:00-12:00 น. / เซสชั่นช่วงบ่าย: 13:00-16:00 น.
จำนวนชั่วโมงเรียนทั้งหมด: 18 ชั่วโมง
เหมาะสำหรับ: บุคคลทั่วไป เหล่าคอกาแฟ และผู้ประกอบการร้านกาแฟ
สิ่งที่คุณจะได้รับ: ใบประกาศนียบัตร จากเดอะ ฟู้ด สคูล แบงคอก
Wellness to ISAN 14-15 พฤศจิกายน 2567
Wellness to ISAN - เจาะตลาด Wellness สู่ภูมิภาคอีสาน 14-15 พฤศจิกายน 2567 ณ ขอนแก่นอินโนเวชั่น เซ็นเตอร์, จังหวัดขอนแก่น
27-29 ตุลาคม
วันที่ 27 ตุลาคม พบกับ
ภาพยนตร์เรื่อง "รัก 7 ปี ดี 7 หน"
ร่วมพูดคุยกับผู้กำกับ จิระ มะลิกุล และ ปวีณ ภูริจิตปัญญา ผู้กำกับภาพยนตร์ เรื่อง รัก 7 ปี ดี 7 หน
มินิคอนเสิร์ตจากวง TU85
วันที่ 28 ตุลาคม พบกับ
ภาพยนตร์เรื่อง "ร่างทรง"
มินิคอนเสิร์ตจาก เดอะพรอเพอร์แคลน
วันที่ 29 ตุลาคม พบกับ
ภาพยนตร์เรื่อง "หอแต๋วแตก แหกกระเจิง" พร้อมเสียงบรรยายภาพสำหรับคนพิการทางการมองเห็นผ่านแอปพลิเคชัน Pannana (พรรณนา)
ร่วมพูดคุยกับผู้กำกับ พชร์ อานนท์
Drag Show สุดพิเศษ จาก CHERILYN และ SRIMALA จาก Yellow Channel
16 พ.ย.66 รับผู้ป่วยชายไทย จากเกาะลันตา ส่งวชิระภูเก็ต
16 พฤศจิกายน 2566 เวลา 10.54 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดกระบี่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 40 ปี มีอาการเจ็บหน้าอกตรงกลาง ร้าวไปแขนซ้าย ไม่มีเหนื่อย ไม่มีใจสั่น นอนราบได้ ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลเกาะลันตา ตำบลเกาะลันตาใหญ่ อำเภอเกาะลันตา จังหวัดกระบี่ แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่ โรงพยาบาลวชิระภูเก็ต ตำบลตลาดใหญ่ อำเภอเมืองภูเก็ต จังหวัดภูเก็ต
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพเรือ (ทัพเรือภาคที่ 3) ประเภทอากาศยานเฮลิคอปเตอร์ S-76B มีชุดปฏิบัติการบิน ประกอบด้วย 1.เรือเอก คชกร, 2.เรือโท กนต์ธร, 3.เรือโท ธรรมรงค์, 4.จ่าเอก ชาญชัย ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลวชิระภูเก็ต ประกอบด้วย 1.นายแพทย์ ไกรฤกษ์ ชวลิตกุล, 2.นางสาว อมรรัตน์ กองธรรม, 3.นาย อนุชา บำรุง
และเมื่อเวลา 13.59 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลวชิระภูเก็ต เป็นที่เรียบร้อย
อลิอันซ์ อยุธยา เวิลด์ รัน ไทยแลนด์ ซีรีส์ 2024 - 17 พฤศจิกายน 2567 LINK
กลับมาอีกครั้ง ! กับงานวิ่งระดับโลก ALLIANZ AYUDHYA WORLD RUN THAILAND SERIES 2024 อลิอันซ์ อยุธยา เวิลด์ รัน ไทยแลนด์ ซีรีส์ 2024 Run for the Healthy World ปีนี้มาในคอนเซ็ปท์ World Run World Heritage กลิ่นอายเมืองเก่า สุดคลาสสิค ย้อนวันวานไปกับวิถีชุมชนสุดคลาสสิค ในแบบงานวิ่งรักษ์โลก และสนุกสนานไปกับมินิคอนเสิร์ตสุดพิเศษกับคนพิเศษ ณ ลานกิจกรรมหน้าศาลากลางเก่า จ.พระนครศรีอยุธยา วันอาทิตย์ที่ 17 พฤศจิกายน - การแข่งขันระยะ 21.1 กม. / 10 กม. และ 5 กม. ณ ลานกิจกรรมหน้าศาลากลางเก่า จ.พระนครศรีอยุธยา
Light Up Christmas Tree 2023 at centralwOrld เริ่ม 18 พ.ย. 65
Light Up Christmas Tree 2023 at centralwOrld
เซ็นทรัลเวิลด์ คิกออฟเทศกาลต้อนรับปีใหม่ ด้วยงานเปิดไฟต้นคริสต์มาส Light Up Christmas Tree 2023 at centralwOrld วันที่ 18 พฤศจิกายน 2565 เวลา 18:00 น. ณ Square A และ B ลานด้านหน้าศูนย์การค้าเซ็นทรัลเวิลด์ (แฟน ๆ สามารถชมงานได้บริเวณพื้นที่โดยรอบงาน ก่อนเปิดให้ประชาชนทั่วไปเข้าหลังพิธีเปิด)
ไฟต้นคริสต์มาสต้นนี้ จะเป็น แลนด์มาร์คแห่งการเฉลิมฉลองเทศกาลแห่งความสุขที่ดีสุดในเอเชีย (The Greatest Celebrating Landmark In Asia) เพราะจะมีต้นคริสต์มาสยักษ์สูงที่สุดในเอเชียตะวันออกเฉียงใต้ ที่ตกแต่งแบบจัดเต็มภายใต้ธีม Embracing Happiness พร้อมกับเนรมิตพื้นที่หน้าลานให้เป็นดินแดนของเหล่า LINE FRIENDS รูปแบบพิเศษ ที่มีเดียวในโลก และมีความสุขสนุกสนานไปกับพบกับดารา นักร้องดังที่จะมาร่วมเริ่มต้นการเฉลิมฉลองไปพร้อม ๆ กัน อาทิ ใบเฟิร์น พิมพ์ชนก, ไอซ์ พาริส, โบกี้ไลอ้อน และ photo set สุดพิเศษจากมีน-นิชคุณ และปิง-กฤตนัน พร้อมด้วยเซเลบริตี้มากมาย
งานประเพณีลอยกระทงเผาเทียน เล่นไฟ จังหวัดสุโขทัย ประจำปี 2566 (18 - 27 พฤศจิกายน 66)
งานลอยกระทงระดับชาติที่มีชื่อเสียงระดับโลก ดึงดูดนักท่องเที่ยวนานาประเทศมาร่วมชมความตระการตาและบรรยากาศประเพณีไทยสุดขลังอลังการงานหนึ่งของปี สำหรับปีนี้ ทางจังหวัดสุโขทัย กำหนดจัด กิจกรรมการแสดง แสง สี เสียง ตลาดบ้านบ้าน ในงานประเพณีลอยกระทง เผาเทียนเล่นไฟ จังหวัดสุโขทัย ระหว่างวันที่ 18 - 27 พฤศจิกายน 2566 ณ อุทยานประวัติศาสตร์สุโขทัย [
พิกัด] ตำบลเมืองเก่า อำเภอเมืองสุโขทัย จังหวัดสุโขทัย สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักงานจังหวัดสุโขทัย 055-611-619
19 พฤศจิกายน วันส้วมโลก World Toilet Day
วันส้วมโลก ตรงกับวันที่ 19 พฤศจิกายนของทุกปี รับอนุมัติจาก
สหประชาชาติ โดยมีองค์การน้ำแห่งสหประชาชาติได้เป็นผู้ดูแลหลัก เพื่อให้ประชาชนตระหนักถึงปัญหาของสุขาภิบาล มีผู้คนทั่วโลกถึง 4.5 พันล้านคนที่มีส้วมไม่ได้มาตรฐาน วันส้วมโลกได้ถูกกำหนดขึ้นโดยองค์การส้วมโลก (World Toilet Organization -
WTO) เมื่อปี พ.ศ. 2544
งานลอยกระทงในจ.สมุทรปราการ
งานลอยกระทงในจ.สมุทรปราการ
- เทศบาลนครสมุทรปราการ จัดงานส่งเสริมการท่องเที่ยวเชิงวัฒนธรรมและประเพณีลอยกระทง จังหวัดสมุทรปราการ ประจำปี 2566 เปิดรับสมัครผู้เข้าแข่งขันส่งกระทงเข้าประกวด สอบถาม โทร. ๐๒-๓๘๒-๖๑๙๙ ต่อ ๒๑๗ โทรสาร ๐๒-๓๘๒-๖๑๖๐
- งานสืบสานประเพณีลอยกระทง ลงอ่าวไทยไปปากนัำ ประจำปี 2566 บริเวณจัดงานหน้าศาลากลางจังหวัดสมุทรปราการ เปิดรับสมัครผู้เข้าประกวดนางนพมาศ ประเพณีลอยกระทง ประจำปี 2566
- เทศบาลตำบลแหลมฟ้าผ่า ลอยกระทงประจำปี 2566 27 พฤศจิกายน 2566 ณ สนามกีฬากลางเทศบาลตำบลแหลมฟ้าผ่า ในงานชม - การประกวดหนูน้อยนพมาศ - ชมมหรสพและการแสดง - และร่วมกันลอยกระทงที่ทำจากวัสดุธรรมชาติ เพื่อเป็นการขอขมาต่อพระแม่คงคา หากผู้ปกครองท่านใดจะส่งน้องๆที่อายุ 5-8 ปี เข้าประกวดหนูน้อยนพมาศ สามารถขอใบสมัครได้ที่กองการศึกษา ชั้น 3 เทศบาลตำบลแหลมฟ้าผ่า หรือ สอบถามรายละเอียดเพิ่มเติมได้ที่กองการศึกษา โทร. 02-4537136-37 ต่อ 151,153 ในวันและเวลาราชการ สมัครได้ตั้งแต่บัดนี้ จนถึงวันที่ 22 พฤศจิกายน 2566
- ประกวด หนูน้อยนพมาศ และนางนพมาศถิ่นสยาม ประจำปี 2566 ปีที่ 3
ขอเชิญน้องๆ อายุ 4-9 ปี และ 10-15 ปี สมัครเข้าประกวด วันเสาร์ที่ 25 พฤศจิกายน พ.ศ. 2566
ณ ศูนย์การค้า โรบินสันไลฟ์สไตล์ สมุทรปราการ ค่าสมัคร 500 บาท ได้รับถ้วยรางวัล และใบประกาศเกียรติคุณ ทุกท่านที่เข้าร่วมการประกวด
- งานลอยกระทง วัดคู่สร้าง ถนนประชาอุทิศ-สุขสวัสดิ์ พระสมุทรเจดีย์ สมุทรปราการ 18-27 พฤศจิกายน2566 พบกับ น้อง ต้นหอม แสงตะวัน และทีมงาน วันที่23 พย.2566 เป็นต้นไป
19 พ.ย.66 รับหญิงไทย 80 ปี หลอดเลือดหัวใจอุดตันเฉียบพลัน จากแม่สะเรียง เร่งส่งรพ.นครพิงค์
19 พฤศจิกายน 2566 เวลา 06.58 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงไทย อายุ 80 ปี เจ็บแน่นหน้าอก 2 ชั่วโมงก่อนมาโรงพยาบาล ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลแม่สะเรียง ตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอน แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลนครพิงค์ ตำบลดอนแก้ว อำเภอแม่ริม จังหวัดเชียงใหม่
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพบก ประเภทอากาศยานเฮลิคอปเตอร์ Bell 212 มีชุดปฏิบัติการบิน ประกอบด้วย 1.ร้อยเอกกฤติเดช ขะระเขื่อน, 2.ร้อยตรีวรุฒ พวงระหงษ์, 3.จ่าสิบเอกโกมล บุญสะอาด, 4.สิบเอกพีระพัฒน์ สายเป็ง ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลมหาราชนครเชียงใหม่ ประกอบด้วย 1.อาจารย์นายแพทย์กอสิน เลาหะวิสุทธิ์, 2.นางสาวนภัสกร แบนปิง นักฉุกเฉินการแพทย์, 3.นางสาวนพรัตน์ ภิลาลัย พยาบาลวิชาชีพ
และเมื่อเวลา 10.07 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลนครพิงค์ เป็นที่เรียบร้อย
19 พ.ย.66 บินรับผู้ป่วยชาย จากชุมพร ส่งรพ.หาดใหญ่
19 พฤศจิกายน 2566 เวลา 12.50 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดชุมพร ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 60 ปี ญาติไปพบ เวลา 9.30 น. ผู้ป่วยนอนอยู่บนพื้น แขนขาข้างขวา อ่อนแรง ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลชุมพรเขตรอุดมศักดิ์ ตําบลท่าตะเภา อําเภอเมืองชุมพร จังหวัดชุมพร แพทย์ได้วินิจฉัย Left MCA occlusion (หลอดเลือดมีการอุดตันในสมองส่วนกลางข้างซ้าย) จำเป็นต้องได้รับการทำหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลหาดใหญ่ ตำบลหาดใหญ่ อำเภอหาดใหญ่ จังหวัดสงขลา
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพอา่กาศ ประเภทอากาศยานเฮลิคอปเตอร์ EC725 มีชุดปฏิบัติการบิน ประกอบด้วย 1.นาวาอากาศตรี ปิยะวัฒน์ ด้วงพิบูลย์, 2. เรืออากาศเอก ธนวัฒน์ คูณขุนทด ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลสุราษฎร์ธานี ประกอบด้วย 1.แพทย์หญิง อมรรัตน์ มณีรัตน์ประเสริฐ, 2.นางสาว สุนันทา คงจันทร์, 3.เรืออากาศตรีนายแพทย์ ณัฐธัญ วัฒนไกร, 4. นาวาอากาศตรีหญิง นิภาวรรณ คงคชวรรณ
และเมื่อเวลา 17.25 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลหาดใหญ่ เป็นที่เรียบร้อย
ลากูน่า ภูเก็ต ไตรกีฬา ครั้งที่ 28 | อาทิตย์ที่ 20 พ.ย.65 LINK
รีสอร์ทครบวงจร “ลากูน่าภูเก็ต” ได้ประกาศกำหนดการจัดการแข่งขันลากูน่าภูเก็ตไตรกีฬา ครั้งที่ 28 ในวันอาทิตย์ที่ 20 พฤศจิกายน พ.ศ. 2565 โดยจะเปิดรับสมัครผู้ร่วมแข่งขันในรายการไตรกีฬาระยะเต็มประเภทเดี่ยวและประเภททีม พร้อมด้วยรายการไตรกีฬาระยะสปรินท์ และทวิกีฬา
ลงทะเบียน
lagunaphukettri.com ได้ถึงวันที่ 13 พฤศจิกายน 2565 Early birds หมดเขตวันที่ 15 สิงหาคม 2565 จองตอนนี้ พร้อมรับส่วนลดสำหรับโรงแรมในลากูน่าภูเก็ตอีกมากมาย
***นักกีฬาที่ลงทะเบียนตั้งแต่ปี 2564 ได้รับสิทธิ์โอนอัตโนมัติมาแข่งในปี 2565 โดยไม่ต้องดำเนินการใดๆ***
+++++
Calling all athletes out there!
Laguna Phuket Triathlon is back and the registrations for our 28th edition are now open! You can choose from individual or team relay and sign up for the Triathlon, Sprint or Duathlon. Registrations open until 13 November 2022 at
lagunaphukettri.com Early birds rates until 15 August 2022. Book now and secure your slot, enjoying discounted rates for our Laguna Phuket hotels too.
มอบสิ่งของยังชีพสำหรับคนไทย
สถานเอกอัครราชทูต ณ กรุงอังการา ได้เข้ามอบสิ่งของยังชีพสำหรับคนไทยที่อยู่ในพื้นที่ประสบภัยแผ่นดินไหวในตุรกีแล้ว วันนี้ ทีมสถานทูตได้นำส่งความช่วยเหลือในรูปแบบถุงยังชีพ และกำลังพาคนไทยบางส่วนออกจากพื้นที่ประสบภัยไปยังพื้นที่ปลอดภัยในจังหวัด Gaziantep Şanlıurfa Osmaniye Hatay และ Adana และกำลังอยู่ระหว่างลำเลียงความช่วยเหลือไปยังผู้ได้รับผลกระทบให้ทั่วถึงมากที่สุดต่อไป
มีลูกยากเกิดจากสาเหตุอะไรบ้าง
ภาวะมีบุตรยากเกิดจากหลายสาเหตุด้วยกัน ซึ่งอาจเกิดขึ้นได้ทั้งฝ่ายชายและฝ่ายหญิง ตามปัจจัย เงื่อนไขและภาวะต่างๆ ที่แตกต่างกันไป
สำหรับฝ่ายหญิง ปัจจัยเรื่องอายุ มักจะเป็นปัจจัยอันดับแรกที่นึกถึงกับการมีลูกยาก แต่กระนั้น อายุไม่ใช่ปัจจัยเพียงอย่างเดียว ยังมีภาวะอื่นๆ ร่วมด้วย อาทิ ภาวะมดลูกที่มีความผิดปกติ เยื่อบุโพรงมดลูกมีเนื้องอกที่ผิดปกติ มีซีสที่รังไข่ มีช็อกโกแลตซีส หรือว่าเคยผ่าตัดที่รังไข่มาก่อน
สาเหตุทางฝ่ายชาย อาจมีความซับซ้อนน้อยกว่าฝ่ายหญิง ปัจจัยสำคัญอยู่ที่ "สเปิร์ม" ของฝ่ายชาย ซึ่งภาวะที่พบได้ เช่น ตัวอสุจิไม่สมบูรณ์ เคยผ่าตัดไส้เลื่อนที่ขาหนีบ ไส้เลื่อนที่อัณฑะ เคยมีการกระทบกระเทือนที่บริเวณอวัยวะเพศอย่างรุนแรง และมีประวัติการผ่าตัด ที่บริเวณที่อาจจะมีเรื่องของฮอร์โมนเข้ามาเกี่ยวข้องการสูบบุหรี่และการใช้สารเสพติดอื่นๆ
นอกจากนี้ อาจมีกรณีอื่นๆ เช่น การที่เคยได้รับยาเคมีบำบัด (ไม่ว่าจะเป็นทั้งฝ่ายหญิงหรือฝ่ายชาย) ก็อาจจะมีผลทำให้ทั้งไข่และสเปิร์มมีคุณภาพลดลงได้ หรือ ถ้าหากเคยมีหรือมีโรคติดต่อทางเพศสัมพันธ์ ภาวะนี้อาจทำให้แพทย์นึกถึงท่อนำไข่ ที่อาจจะตีบหรือตันจนทำให้มีลูกยาก
กิจกรรมเสริมสิริมงคล ร่วมบุญปีใหม่ไทย ณ 5 ท่าน้ำร่วมสมัย
กิจกรรมเสริมสิริมงคล ร่วมบุญปีใหม่ไทย ณ 5 ท่าน้ำร่วมสมัย ในงาน “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
ท่ามหาราช ระหว่างวันที่ 13 - 16 เม.ย. 2566 ตั้งแต่เวลา 10.00 น. - 21.00 น. • สรงน้ำพระพุทธรูป • จุดถ่ายภาพ check in • ตลาดร้านค้าสายชิลล์ • ตรวจดวงชะตา
ท่ายอดพิมาน ริเวอร์ วอล์ค ระหว่างวันที่ 13 - 16 เม.ย. 2566 ตั้งแต่เวลา 8.00 น. - 18.00 น. • สักการะศาลพระบาทสมเด็จพระพุทธยอดฟ้า รัชกาลที่ 1 • สรงน้ำพระพุทธรูป • จุดถ่ายภาพตลาดดอกไม้ • จุดถ่ายภาพ check in • ตลาดร้านค้าย้อนยุค
เดอะ ล้ง 1919 ริเวอร์ไซด์ เฮอริเทจ เดสติเนชั่น ระหว่างวันที่ 13 - 16 เม.ย. 2566 ตั้งแต่เวลา 8.00 น. - 17.00 น. • สักการะเจ้าแม่หม่าโจ้ว • จุด Check in ถ่ายภาพ
สุขสยาม ณ ไอคอนสยาม ระหว่างวันที่ 8 - 17 เม.ย. 2566 ตั้งแต่เวลา 10.00 น. - 22.00 น. • ชมขบวนแห่สงกรานต์ตานตุง, ขบวนแห่พระพุทธสิหิงค์ทางชลมารค วันที่ 13 เม.ย. เวลา 15.00 น. • สรงน้ำพระพุทธสิหิงค์ ร่วมทำบุญตานตุง ถวายเป็นพุทธบูชา แด่องค์สมเด็จพระสัมมาสัมพุทธเจ้า • ชมการแสดงศิลปวัฒนธรรม 4 ภาค วันที่ 13 - 15 เม.ย. 66 เวลา 13.00 น. และ 16.00 น. • เฮฮากับมวยทะเล ที่บ่อน้ำภาคใต้ วันที่ 13 - 15 เม.ย. 66 เวลา 18.00 น. • อิ่มอร่อยกับอาหารจานเด็ด ช้อปสินค้าจากชุมชน 4 ภาค และร้านค้าประชารัฐรักสามัคคี • ร่วมเวิร์กชอป ชมงานแสดงเอกลักษณ์ความเป็นไทย โดยฝีมือคนไทย วันที่ 8 – 17 เม.ย. 66 เวลา 11.00 – 17.00 น. อาทิ การร้อยมาลัยห่วงรัก กระแตชาววัง ขนมช่อม่วง ล่าเตียง ม้าฮ่อ ส้มฉุน ทำเครื่องหอม น้ำอบ น้ำปรุง เป็นต้น • พบกับโปรโมชั่นพิเศษสุดปังต้อนรับหน้าร้อน SOOK SUMMER 2023 แลกของรางวัลมากมาย
เอเชียทีค เดอะ ริเวอร์ฟร้อนท์ ระหว่างวันที่ 13 - 16 เม.ย. 2566 ตั้งแต่เวลา 17.00 น. - 22.30 น. • ร่วมงานวัดร่วมสมัย • การแสดงจากศิลปิน การแสดงทางศิลปวัฒนธรรม หลากหลาย • สรงน้ำพระพุทธรูป อัญเชิญจากพระอารามหลวงริมแม่น้ำเจ้าพระยา • การออกร้านค้าจากชุมชน ของกินของอร่อยมากมาย • การแสดงดนตรีและนาฎศิลป์จากสถานศึกษา • การแสดงดนตรีร่วมสมัย • ชมการแสดงแขนงต่าง ๆ • ซุ้มเกมงานวัด • รำวงย้อนยุค
วัดผาสุกมณีจักร เมืองทองธานี เผาศพสัตว์เลี้ยงหมา-แมว
วัดผาสุกมณีจักร อยู่ในเมืองทองธานี ใกล้กับ ม.สุโขทัยธรรมาธิราช [
แผนที่ google map] สถานที่ฌาปนกิจสัตว์เลี้ยง หมาแมว ให้บริการตั้งแต่การเตรียมการ นิมนต์พระบังสุกุล เผา เก็บกระดูก จัดหาสิ่งประกอบกิจ เช่น ดอกไม้ , สังฆทาน , ผ้าบังสกุล อัตราค่าบำรุงในการเผาสุนัข (เตาเผาเฉพาะสุนัข) 1. ค่าบำรุงเตาเผา สุนัขขนาดใหญ่มาก (เช่น ลาบาดอร์ เซนต์เบอร์นาร์ด) 3,500 บาท 2. ค่าบำรุงเตาเผา สุนัขนาดใหญ่ 2,000 บาท 3. ค่าบำรุงเตาเผา สุนัขนาดกลาง 1,800 บาท 4. ค่าบำรุงเตาเผา สุนัขนาดเล็ก 1,500 บาท 5. ค่าบำรุงเตาเผา แมว 1,000 บาท ติดต่อสอบถามโทร. 02-5033411
*ภาพ Dhammadhura Dacho
20 พ.ย.66 บินรับผู้ป่วยหญิงไทย 69 ปี กล้ามเนื้อหัวใจตาย จากเกาะช้าง เร่งส่งรพ.พระปกเกล้า จันทบุรี
20 พฤศจิกายน 2566 เวลา 12.08 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดตราด ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงไทย อายุ 69 ปี โดย 3 วันก่อนมาโรงพยาบาล จุกใต้ลิ้นปี่ ร้าวไปคอ ไม่มีเหงื่อแตกใจสั่น ไม่มีหอบเหนื่อย ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลเกาะช้าง ตำบลเกาะช้าง อำเภอเกาะช้าง จังหวัดตราด แพทย์ได้วินิจฉัย ST-segment elevation myocardial infarction, STEMI (กล้ามเนื้อหัวใจตาย ชนิดหลอดเลือดหัวใจอุดตันเฉียบพลัน) ต้องได้รับการทำหัตถการขยายหลอดเลือดหัวใจผ่านสายสวน เป็นหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลพระปกเกล้า ตำบลวัดใหม่ อำเภอเมืองจันทบุรี จังหวัดจันทบุรี
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองทัพเรือ หมวดบิน 31 ฝูงบินทหารเรือ 3141 ประเภทอากาศยานเฮลิคอปเตอร์ EC645 T2 มีชุดปฏิบัติการบิน ประกอบด้วย 1.นาวาโท พิเชษฐ์ วิชาพร, 2.เรือเอก ชนาธิป พูลเพิ่ม, 3.เรือโท วุฒิพันธ์ ปักษี, 4.จ่าเอก พิชัยยุทธ ธงสิบสี่ ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลพระปกเกล้า ประกอบด้วย 1.แพทย์หญิง เจนจิรา ปิยะวรรณกร, 2.นางสาว เปรมพิดา ขัติวงค์ นักฉุกเฉินการแพทย์, 3.นางสาวมณีรัตน์ สุขสอาด พยาบาลวิชาชีพปฏิบัติการ
และเมื่อเวลา 14.26 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลพระปกเกล้า เป็นที่เรียบร้อย
ขั้นตอนการรับบริการ
ขั้นตอนการรับบริการคลินิกพิเศษเฉพาะทางนอกเวลาราชการ กรุณาโทรนัดหมายล่วงหน้า เพื่อความสะดวกของท่านค่ะ
- เปิดบริการ จันทร์-ศุกร์ 16.30-20.30 น. เสาร์ 9.00-12.00 น.
- ค่าบริการเริ่มต้น 400 บาท ไม่สามารถเบิกได้ ค่ายาเบิกได้ตามสิทธิ
ผ่าตัดนอกเวลาราชการ โทรสอบถาม 032-719600 ต่อ 1514 หรือ 09 5146 1138
น้องๆ ตั้งใจ เรียนรู้หลักสูตร
การใช้ประโยชน์กล้ามเนื้อเทียม หลักการทำงาน และ การคาดการณ์มูลค่าตลาด
ตัวเลขน่าสนใจ
- มูลค่าตลาดเวชศาสตร์ความงามไทย ในปี 2021 มูลค่า 5 หมื่นล้านบาท
- อัตราการเติบโตตลาดเวชศาสตร์ความงามไทย ช่วงปี 2022-2030 อยู่ที่ 10%CAGR
- สัดส่วนผู้ใช้บริการหัตถการเสริมความงาม 44%
- สัดส่วนผู้ที่ไม่เคยใช้บริการหัตถการเสริมความงาม แต่สนใจ 24%
- สัดส่วนผู้ใช้บริการหัตถการมากกว่า 1 ประเภท 63%
- สัดส่วนผู้ที่ผ่านการทำศัลยกรรมเสริมความงาม 21%
- สัดส่วนผู้บริโภคที่ไม่เคยทำศัลยกรรมความงาม แต่สนใจ 21%
- สัดส่วนผู้ที่ผ่านการทำศัลยกรรม ความงามมากกว่า 1 ประเภท 65%
คลินิกศัลยกรรม LINK
สถานที่ตั้ง ชั้น 1 อาคารดุลโสภาคย์
เปิดให้บริการ
- วันจันทร์-ศุกร์ เวลา 16.00-20.00 น.
- วันเสาร์ เวลา 08.00-12.00 น.
หน้าที่และเป้าหมาย
ให้บริการรักษาพยาบาลผู้ป่วยนอกทุกเพศทุกวัย ในกลุ่มผู้ป่วยโรคทางด้านศัลยกรรม ที่เป็นเลิศอย่างมีคุณภาพตามมาตรฐานสากล โดยยึดผู้ป่วยเป็นศูนย์กลางมุ่งเน้นความถูกต้องรวดเร็วปลอดภัยตามมาตรฐานวิชาชีพโดยคำนึงถึงความปลอดภัย และความพึงพอใจของผู้ใช้บริการ
ขอบเขตการให้บริการ
ผู้รับบริการในกลุ่มผู้ป่วยโรคทางศัลยกรรมทั่วไป , โรคทางศัลยกรรมตกแต่ง , โรคทางศัลยกรรมระบบประสาท , โรคทางศัลยกรรมเด็ก , โรคทางศัลยกรรมหลอดเลือด รวมทั้งการผ่าตัดเล็ก การทำแผลต่างๆ และไม่ครอบคลุมผู้ป่วยที่มีภาวะฉุกเฉิน
บำรุงราษฎร์ได้ดำเนินการปลูกถ่ายไตให้กับผู้ป่วยมากว่า 37 ปี ให้บริการครอบคลุมตั้งแต่การตรวจวินิจฉัยในระยะเริ่มต้น การดูแลผู้ป่วยโรคไตเรื้อรัง และการรักษาผู้ป่วยโรคไตระยะสุดท้ายด้วยการปลูกถ่ายไต และสามารถปลูกถ่ายไตผู้ป่วยได้ตั้งแต่อายุไม่ถึง 10 ปี จนถึงอายุมากกว่า 80 ปี รวมถึงผู้ป่วยที่มีโรคประจำตัวหลายโรค โดยมีทีมแพทย์และพยาบาลดูแลภาวะหลังการปลูกถ่ายไตอย่างใกล้ชิด นอกจากนี้ ยังมีทีมแพทย์ผ่าตัดที่พร้อมเดินทางไปผ่าตัดไตที่รับบริจาคจากโรงพยาบาลต่าง ๆ ทั่วประเทศ และพร้อมผ่าตัดปลูกถ่ายไตให้ผู้ป่วยหลังจากไตบริจาคมาถึงโรงพยาบาล
โดยในช่วง 2-3 ปีที่ผ่านมา บำรุงราษฎร์มีอัตราความสำเร็จในการปลูกถ่ายไตสูงกว่า 90% ซึ่งนับเป็นอัตราความสำเร็จที่สูงเทียบเท่ามาตรฐานระดับโลกอย่างสหรัฐอเมริกา แคนาดา และยุโรปตะวันตก ความสำเร็จนี้เกิดจากการผสมผสานประสบการณ์ของทีมแพทย์ เทคโนโลยีที่ล้ำสมัย และนวัตกรรมใหม่ ๆ เช่น การตรวจวิเคราะห์ยีน การใช้เทคนิคการผ่าตัดส่องกล้องและหุ่นยนต์ช่วยผ่าตัด ที่สำคัญ บำรุงราษฎร์ยังสามารถทำการปลูกถ่ายไตข้ามหมู่เลือดได้สำเร็จ ทำให้ผู้ป่วยได้รับการดูแลอย่างครบวงจรและมีโอกาสกลับมามีชีวิตที่สมบูรณ์ได้อีกครั้ง
คลินิกเฉพาะทางนอกเวลา อายุรกรรม
ลอยกระทง2566 วัดบัวขวัญ นนทบุรี 21-27 พ.ย. 2566
งานบุญประเพณี ลอยกระทง2566 วัดบัวขวัญพระอารามหลวง จะมีขึ้นใน วันที่ 21-27 พ.ย. 2566
Thailand Lifelong Learning & Education Expo 2022 วันที่ 23 - 25 พ.ย. 2565
Thailand Lifelong Learning & Education Expo 2022 อิมแพคเมืองทอง ฮอลล์ 8 วันที่ 23 - 25 พ.ย. 2565 – มหกรรมการเรียนรู้เพื่อพัฒนาทักษะและอาชีพอย่างยั่งยืน งานแสดงสินค้าและเวทีที่รวบรวมผู้ให้บริการด้านการศึกษาและพัฒนาทุกทักษะกว่า 200 แบรนด์และบริษัทชั้นนำ ส่งเสริมแนวคิดด้านการเรียนรู้ตลอดชีวิตเพื่อการมีอาชีพอย่างยั่งยืน สนับสนุนและเสริมสร้างพัฒนาการทางด้านการศึกษาเพื่อความก้าวหน้าในการพัฒนาตนเองและความยั่งยืนในทักษะแห่งอนาคต (New Skill, Reskill และ Upskill) เหมาะกับผู้ชมงานทั่วไปทุกเพศทุกวัยและบริษัทที่กำลังที่มองหาทักษะใหม่และพัฒนาทักษะเดิม
งานแสดงไฟ Nasatta Light Festival Winter Illumination 2023 ราชบุรี
งานแสดงไฟ Nasatta Light Festival Winter Illumination 2023 ในมิติแห่งโลกแห่งเทพนิยายกับไฟ ด้วยไฟ LED นับหลายล้านดวง ผสมผสานเทคโนโลยี Installation Art ล้ำสมัย
งานจัดทุก วันพุธ - วันอาทิตย์ร่วมถึงวันนักขัตกฤษ ตั้งแต่วันที่ 23 พฤศจิกายน 2022 - 29 มกราคม 2023 เวลา 18.00-22.00 ณ ณ สัทธา อุทยานไทย (NaSatta Heriatage Park) ราชบุรี
ณ สัทธา อุทยานไทย เป็น พิพิธภัณฑ์เอกชนกลางแจ้ง ที่บอกเล่าประวัติศาสตร์และวัฒนธรรมไทยผ่านประติมากรรมและหุ่นขี้ผึ้งขนาดเท่าของจริง
พิษณุโลก งานประเพณีลอยกระทงสองแควในอดีต พรหมลิขิต แห่งสายน้ำน่าน 23-27 พ.ย.66
เทศบาลนครพิษณุโลกจัดงานประเพณีลอยกระทงสองแควในอดีต จังหวัดพิษณุโลก ประจำปี 2566 "พรหมลิขิต แห่งสายน้ำน่าน" โดยกำหนดจัดขึ้นระหว่างวันที่ 23-27 พฤศจิกายน 2566 บริเวณหน้าวัดพระศรีรัตนมหาธาตุวรมหาวิหาร และบริเวณสวนชมน่านเฉลิมพระเกียรติ ภายในงานกิจกรรมประกอบไปด้วย กิจกรรมวังกระทงเทศบาลนครพิษณุโลก ซึ่งปีนี้จัดตกแต่งสวยงามแสงสีอลังการ บริเวณ ย้อนวันวานในอดีตโดยกำหนดเป็นโซนแต่งกายชุดไทย 4 ภาคให้ผู้เข้าร่วมชมกระทงได้ถ่ายรูปกับบรรยากาศเป็นที่ระลึก ณ บริเวณพลับพลาพระที่นั่งสีตลาภิรมย์สวนกลางเมือง พิษณุโลก นอกจากนี้ มีพิธีสักการะอธิษฐานจิตขอพรองค์หลวงพ่อพุทธชินราช กิจกรรมถนนสองแควแลอดีต เที่ยวงานวัดใหญ่ในอดีต รำวงย้อนยุค และการละเล่นเด็กไทยตลาดย้อนยุค การประกวดหนูน้อยนพมาศ ขบวนแห่กระทงใหญ่ และการประกวดนางนพมาศ นอกจากนี้ยังมีการจำหน่ายอาหารอร่อยไร้แอลกอฮอล์ การประกวดร้องเพลงไทยลูกทุ่ง และวงดนตรีสากล ต้านยาเสพติด การประกวดประดิษฐ์กระทงฝีมือระดับประถมศึกษา และระดับมัธยมศึกษา และประเภทประชาชนทั่วไป เป็นต้น
งานประเพณีลอยกระทงสายไหลประทีป 1000 ดวง จังหวัดตาก (24-27 พฤศจิกายน 66)
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานตาก เชิญร่วมงานประเพณี “ลอยกระทงสายไหลประทีป 1000 ดวง ประจำปี 2566 วันที่ 24-27 พฤศจิกายน 2566 ณ ริมสายธารลานกระทงสาย เชิงสะพานสมโภชกรุงรัตนโกสินทร์ 200 ปี อำเภอเมือง จังหวัดตาก มีรูปแบบโดดเด่นเป็นเอกลักษณ์และเป็นมรดกสืบทอดจากภูมิปัญญาท้องถิ่นแห่งความภาคภูมิใจของชาวจังหวัดตาก การแข่งขันลอยกระทงสายไหลประทีป 1000 ดวง
Amway Health Run 2024 วันอาทิตย์ที่ 24 พฤศจิกายน 2567
แอมเวย์ประเทศไทย ย้ำจุดยืนมอบสุขภาพและสุขภาวะที่ดี (Health & Wellbeing) อย่างยั่งยืนให้แก่ผู้คน พร้อมร่วมฉลอง 90 ปี นิวทริไลท์ จัดกิจกรรมเพื่อสุขภาพครั้งยิ่งใหญ่ กับงาน “Amway Health Run 2024” ชวนผู้ที่สนใจและชื่นชอบการวิ่งเพื่อสุขภาพ ร่วมออกสตาร์ตวิ่งด้วยกัน Run เพื่อสุขภาพที่ดีอย่างยั่งยืน ในวันอาทิตย์ที่ 24 พฤศจิกายน 2567 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ โดยแบ่งเป็น 3 ระยะทาง ได้แก่ Fun Run ระยะทาง 3 กิโลเมตร Good Run ระยะทาง 6 กิโลเมตร และ Power Run ระยะทาง 10 กิโลเมตร โดยผู้ที่เข้าร่วมกิจกรรมจะได้รับเสื้อวิ่งกู้โลกและเหรียญรางวัล ในคอนเซ็ปต์รักษ์โลก ซึ่งเป็นอีกหนึ่งความมุ่งมั่นด้านความยั่งยืน (Sustainability) ของแอมเวย์
ผู้ที่สนใจเข้าร่วมกิจกรรม “Amway Health Run 2024” สามารถซื้อบัตรเข้างานในราคา 699 บาท ทุกระยะการวิ่ง ผ่านนักธุรกิจแอมเวย์ทั่วประเทศ ตั้งแต่วันนี้เป็นต้นไป
ระยอง แฟนซี รัน @บ้านฉาง 2024 วันที่ 24 พฤศจิกายน 2567 LINK
ระยอง แฟนซี รัน @บ้านฉาง 2024 วิ่งวันที่ 24 พฤศจิกายน 2567 บริเวณ โรบินสันไลฟ์สไตล์ บ้านฉาง ต.บ้านฉาง อ.บ้านฉาง จ.ระยอง ระยะวิ่ง ระยะทาง 5/10 กิโลเมตร รางวัล การประกวดแฟนซี ✅ ไม่จำกัดอายุ ไม่จำกัดแนวทาง ✅ รางวัลแฟนซี ประเภทชาย อันดับ 1-20 ✅ รางวัลแฟนซี ประเภทหญิง อันดับ 1-20 รวม 40 รางวัล หมายเหตุ นักวิ่งแฟนซี ยังได้ลุ้นรางวัลการแข่งขัน ตามระยะที่สมัครวิ่งด้วย
สีฐานเฟสติวัล 2566 บุญสมมาบูชานาค เทศกาลลอยกระทงขอนแก่น (25 - 27 พฤศจิกายน 66)
ชวนเชิญร่วมงานเทศกาลลอยกระทงประจำปี สีฐานเฟสติวัล 2566 "บุญสมมาบูชานาค" พิเศษในปีนี้ ครบรอบ 60 ปี แห่งมหาวิทยาลัยขอนแก่น 25 - 27 พฤศจิกายน 2566 ณ ริมบึงสีฐาน มหาวิทยาลัยขอนแก่น เชื่อได้เลยว่างานสีฐานเฟสติวัล จะเป็นเทศกาลลอยกระทงสุดยิ่งใหญ่ปีนี้แห่งภาคอีสานเลยทีเดียว
งานลอยกระทง ณ โบราณสถานวัดสนามชัย สุพรรณบุรี 25-27 พฤศจิกายน 2566
งานลอยกระทง ณ โบราณสถานวัดสนามชัย เริ่มวันที่ 25-27 พฤศจิกายน 2566 ตั้งแต่เวลา 12.00 น.เป็นต้นไป พบกับกับแสงสีเสียงที่ตระการตา ชมผลิตภัณฑ์พื้นบ้าน ชิมอาหารพื้นถิ่น รวมไปถึงการแสดงสุดยิ่งใหญ่ที่ถ่ายทอดเรื่องราวความเป็นไทยให้เราได้ชมกันกับงานประจำปีแบบนี้ บอกเลยว่าต้องห้ามพลาด กิจกรรมมากมาย อาทิ
⭐️กิจกรรมประกวดขนมไทย/อาหารไทย
⭐️กิจกรรมประดิษฐ์กระทงสวรรค์
⭐️กิจกรรมการผลิตกระทงจากวัสดุธรรมชาติ)
⭐️การประกวดหนูน้อยนพมาศ
⭐️การประกวดนางนพมาศผู้สูงวัยตำบลสนามชัย
⭐️รับชมการแสดงรำวงย้อนยุค
⭐️การแสดงจากสถานศึกษาในพื้นที่ตำบลสนามชัย และพื้นที่ข้างเคียง
งานลอยกระทง หมู่บ้านญี่ปุ่น อยุธยา 25 พฤศจิกายน 66
เตรียมตัวนุ่งโจงห่มไทยเดิน “งานลอยกระทง” ที่หมู่บ้านญี่ปุ่น ตำบลเกาะเรียน อำเภอพระนครศรีอยุธยา 25 พฤศจิกายน 2566 นี้ เที่ยวงานลอยกระทงท่ามกลางบรรยากาศสวนญี่ปุ่นริมแม่น้ำเจ้าพระยา พบกับกิจกรรมต่างๆที่น่าสนใจ ชิมอาหารไทยและญี่ปุ่น สนุกไปกับการละเล่นงานวัด ชมการแสดงวัฒนธรรมจาก ททท. ลอยกระทงในแม่น้ำ
25 พ.ย. 66 หน่วยบิน 2033 กองทัพอากาศ ทำการเคลื่อนย้ายผู้ป่วยจากโรงพยาบาลฝาง ส่งต่อมหาราชเชียงใหม่
กองทัพอากาศ โดย กองบิน 41 จังหวัดเชียงใหม่ ได้รับการประสานจากศูนย์กู้ชีพเวียงพิงค์จังหวัดเชียงใหม่ เพื่อขอใช้อากาศยานของกองทัพอากาศ ในการรับผู้ป่วย ฉุกเฉินที่ต้องได้รับการรักษาอย่างเร่งด่วน พลอากาศเอก พันธ์ภักดี พัฒนกุล ผู้บัญชาการทหารอากาศ สั่งการให้หน่วยบิน 2033 จัดเฮลิคอปเตอร์แบบ EC-725 พร้อมกับทีมเวชศาสตร์การบิน ร่วมกับทีมแพทย์ Sky Doctor ทำการเคลื่อนย้ายผู้ป่วยจากโรงพยาบาลฝาง อำเภอฝาง จังหวัดเชียงใหม่ เพื่อส่งต่อการรักษาไปยัง โรงพยาบาลมหาราชนครเชียงใหม่ อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่ ตามนโยบายผู้บัญชาการทหารอากาศ ให้กองทัพอากาศประยุกต์ใช้ขีดความสามารถของยุทโธปกรณ์ และกำลังพลสนับสนุนภารกิจลำเลียงผู้ป่วยทางอากาศ จากพื้นที่ห่างไกล และต้องการความเร่งด่วนในการส่งต่อทางการแพทย์ เพราะทุกนาทีนั้นมีค่า เราจึงช้าไม่ได้ [
กองทัพอากาศ]
เดิน-วิ่งการกุศล วรคุณอุปถัมภ์ มินิมาราธอน 2022 - 26 พ.ย.65 LINK
กิจกรรม เดิน-วิ่งการกุศล วรคุณอุปถัมภ์ มินิมาราธอน เพื่อสมทบทุนสร้างโดมเอนกประสงค์ " วันเสาร์ ที่ 26 พย. 65 สมัครออนไลน์ได้แล้ว ตั้งแต่วันนี้ - 25 กย. 65 (กรณีสมัครหลังจากวันที่กำหนด อาจได้เสื้อไม่ตรงกับไซส์ที่ท่านเลือก)
เพียงคลิ๊กสมัครได้ที่
WORAKHUN RUN 2022หรือสมัครด้วยตนเอง ที่ โรงเรียนวรคุณอุปถัมภ์ ต.หนองใหญ่ อ.เมืองจันทร์ จ.ศรีสะเกษ
Facebook:
Worakhun RUN 2022
มา “สานสัมพันธ์น้องพี่ สามัคคี น้ำเงินขาว “ วิ่งสร้างกุศล สร้างสุขภาพ สร้างมิตรภาพร่วมกัน ซ้อมให้พร้อม แล้วออกมาวิ่งไปด้วยกัน
งานเพลินจิตแฟร์ Ploenchit Fair 2022 - 26 พฤศจิกายน 65
งานประจำปีของชาว expat ชาวไทยและครอบครัวชาวต่างชาติในประเทศไทย ที่เฝ้ารอจะไปสนุกกันหลังจากว่างเว้นการจัดไปเพราะเหตุโควิด งานเพลินจิตแฟร์ 26 พฤศจิกายน 65 จัดที่โรงเรียนบางกอกพัฒนา ซอยลาซาล เริ่มตั้งแต่ 10 โมงเช้า กิจกรรมปีนี้น่าจะมากมาย รายได้ยังคงมอบให้การกุศลเช่นที่เคยตามธรรมเนียมของการจัด โดย กลุ่ม BCTFN ค่าเข้างาน ผู้ใหญ่ 250 เด็ก 125 บาท จองล่วงหน้าเหลือจะได้ราคาพิเศษนะ
www.facebook.com/ploenchitfairbkk/
26 พ.ย. 65
1.กัญชาทางการแพทย์
- ดร.ภก.อนันต์ชัย อัศวเมฆิน เป็นประธานการประชุมคณะอนุกรรมการด้านการศึกษา/วิจัยผลจากการใช้กัญชาทางการแพทย์และสุขภาพ ครั้งที่1/2565 มีสำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) ร่วมการวิจัย โดยการศึกษาวิจัยกว่า 3 ปีที่ผ่านมา สธ.และเครือข่าย ทำให้เกิดการใช้ การบรรจุเข้าชุดสิทธิประโยชน์ทางสุขภาพ และการขึ้นทะเบียนผลิตภัณฑ์ กว่า 2,000 ผลิตภัณฑ์ แต่เพื่อให้เกิดการวิจัยที่รวดเร็ว นำไปสู่การแก้ปัญหาสุขภาพ เกิดการต่อยอดได้อย่างสมบูรณ์ คณะอนุกรรมการมีข้อสรุปว่า ควรมุ่งเป้าโรคที่ยังเป็นปัญหาสุขภาพ โดยศึกษาวิจัยครบวงจร โดยดึงกองผลิตภัณฑ์สมุนไพร อย. และอนุกรรมการยาหลักแห่งชาติเข้ามาเป็นแกนในการทำงานร่วมกัน และเชิญชวนผู้ที่ดำเนินการวิจัยกัญชาอยู่ สามารถแจ้งความประสงค์เข้าร่วมกับ สธ. ที่สถาบันกัญชาทางการแพทย์ ซึ่งเป็นเลขาของอนุกรรมการ ต้องการภาคีเครือข่ายช่วยกันทำงานระดับชาติให้เร็วและดี ทันความต้องการของสังคม
- นพ.สรายุทธ์ บุญชัยพานิชวัฒนา ผอ.สถาบันบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี (สบยช.) กล่าวว่า สบยช.พัฒนาประโยชน์จากสารสกัดกัญชา ชนิด CBD มาใช้ร่วมในการบำบัดรักษาผู้ป่วยยาบ้า หากได้ผลจะช่วยลดปัญหาผู้ป่วยที่ใช้ยาบ้าแล้วมีอาการทางจิตที่ก่อให้เกิดความรุนแรง (SMI-V) ได้และได้ศึกษาการใช้สารสกัด CBD ชนิดหยอดใต้ลิ้นเทียบกับยา Methylphenidate เพื่อลดอาการถอนยาและอาการอยากยา เพื่อนำผลการศึกษาไปวิจัยต่อยอดเพื่อนำสารสกัด CBD มาใช้ทดแทนเมทแอมเฟตามีน
2.เปิดห้องกัญชาสันทนาการ
- นายสง่า เรืองวัฒนกุล นายกสมาคมผู้ประกอบการถนนข้าวสาร เปิดแพลนโทเพีย ให้ผู้ประกอบการนำผลิตภัณฑ์กัญชาทั้งช่อดอก น้ำมันนวด เครื่องปรุงอาหาร และอื่น ๆ มาจำหน่าย พร้อมมีห้องพิเศษให้สูบกัญชา จัดเป็นพื้นที่เพื่อให้สันทนาการไม่ใช่พื้นที่สาธารณะ มีใบอนุญาตถูกต้องตามกฎหมาย พร้อมให้ตรวจสอบ โดยที่ผ่านมาเริ่มทดลองไปแล้วยังไม่พบปัญหา ส่วนกรณีที่ความกังวลว่า คนใช้กัญชาแล้วมีอาการเมา คลั่ง นั้น โดยธรรมชาติแทบจะไม่มีคนคลั่ง เพราะสาร THC ไม่ได้กระตุ้นให้เกิดความรุนแรง เป็นสารที่ใช้แล้วเกิดความเคลิบเคลิ้ม
CAFE SHOW SEOUL 8-11 Nov 2023
Cafe Show Seoul is the world’s largest business platform that takes place every November to revitalize the global coffee industry and F&B culture. Nov 8-11, 2023 Coex, Seoul
งานประเพณี สมมาน้ำ คืนเพ็ง เส็งประทีป ลอยกระทงร้อยเอ็ด (26-27 พฤศจิกายน 66)
งานประเพณี สมมาน้ำ คืนเพ็ง เส็งประทีป (ลอยกระทงร้อยเอ็ด) ครั้งที่ 25 ปีนี้ จัดวันที่ 26-27 พฤศจิกายน 2566
งานประเพณีเดือนยี่เป็งเชียงใหม่ ประจำปี 2566 (26-28 พฤศจิกายน 66)
"นครเชียงใหม่" ร่วมกับภาคีเครือข่าย จัดเต็ม งานประเพณีเดือนยี่เป็งเชียงใหม่ ประจำปี 2566 แบบยิ่งใหญ่ ระหว่าง 26-28 พ.ย.นี้ ชูความ "ล้านนาย้อนยุค" เพื่ออนุรักษ์วัฒนธรรมดั้งเดิม มีการจัดกิจกรรมหลากหลายตามจุดต่างๆ ทั่วเมืองเชียงใหม่ อาทิ กิจกรรมประกวดกระทงใหญ่ ชิงถ้วยพระราชทานฯ การประกวดโคมยี่เป็งล้านนา ประกวดทำกระทงฝีมือใบตอง กิจกรรมต๋ามผางปะตี้ดส่งฟ้าฮักษาเมือง กิจกรรมล่องสะเปา ปล่อยกระทงสาย รวมถึงการแสดงแสง สี เสียง และสื่อผสม การแสดงพลุเฉลิมพระเกียรติ และกิจกรรมศิลปวัฒนธรรมต่างๆ อีกมากมาย โดยยังคงความเป็นล้านนาแบบย้อนยุคเพื่ออนุรักษ์วัฒนธรรมดั้งเดิมสมัยก่อน
ป๋าเวณียี่เป็งลอยกระทง 2566 ลำน้ำกก 26-28 พฤศจิกายน 2566
เทศบาลนครเชียงรายโดยนายวันชัย จงสุทธานามณี นายกเทศมนตรีนครเชียงรายรังสรรค์พื้นที่บริเวณสวนสาธารณะริมน้ำกก(หลังวัดฝั่งหมิ่น) จัดงานป๋าเวณียี่เป็งนครเชียงราย ประจำปี 2566 สุดอลังการเพื่อร่วมอนุรักษ์สืบสานประเพณีที่ดีงาม รูปแบบการจัดงานยังคงเอกลักษณ์ความเป็นล้านนา โชว์ความยิ่งใหญ่สวยงามตระการตาของประเพณีลอยกระทง #ให้ผู้เข้าร่วมแต่งกายเข้าบรรยากาศประกวดคลิปtiktokชิงรางวัลมากมาย ระหว่างวันที่ 26-28 พฤศจิกายน 2566 ภายในงานมีกิจกรรม
- เปิดฤดูกาลท่องเที่ยว
- กระทงสายยามค่ำคืนของลำน้ำกก
- กระทงใหญ่อลังการกลางลำน้ำกก
- ประกวดกระทงใหญ่ หนูน้อยนพมาศ เทพีนพมาศ
- ลอยสะเปา ล่องนที สะหลียี่เป็ง
- เวทีสร้างสรรค์เยาวชนคนเชียงราย
- มินิคอนเสิร์ตศิลปิน
สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์ ระหว่างวันที่ 26 พ.ย. - 2 ธ.ค.2566
สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์
ระหว่างวันที่ 26 พ.ย. - 2 ธ.ค.2566
ผู้ป่วยรักษาตัวในโรงพยาบาล (รายสัปดาห์)
จำนวน 536 ราย : เฉลี่ยรายวัน 76 ราย/วัน
ผู้เสียชีวิต (รายสัปดาห์)
จำนวน 3 ราย : เฉลี่ยรายวัน 1 ราย/วัน
---------------------
ผู้ป่วยสะสม 36,204 ราย (ตั้งแต่ 1 มกราคม 2566)
เสียชีวิตสะสม 826 ราย (ตั้งแต่ 1 มกราคม 2566)
---------------------
ผู้ป่วยปอดอักเสบ 88 ราย
ผู้ป่วยใส่ท่อช่วยหายใจ 40 ราย
27 พฤศจิกายน วันคล้ายวันสถาปนา กระทรวงสาธารณสุข
พระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว รัชกาลที่ 6 ทรงมีพระบรมราชานุญาตให้เปลี่ยนชื่อ กรมพยาบาล เป็น กรมประชาภิบาล ตามความกราบบังคมทูลขอพระบรมราชานุญาตของกระทรวงมหาดไทยที่ดูแลกรมพยาบาลในขณะนั้น (พ.ศ.2459) ด้วยประสงค์จะพัฒนากิจการกรมพยาบาลให้ก้าวหน้ายิ่งขึ้น ต่อมา 27 พฤศจิกายน พ.ศ. 2461 ได้ประกาศตั้ง
กรมสาธารณสุข โดยเปลี่ยนจากกรมประชาภิบาล และทรงพระกรุณาโปรดเกล้าฯ ให้พระเจ้าน้องยาเธอ กรมหมื่นชัยนาทนเรนทร อธิบดีกรมมหาวิทยาลัยเป็นอธิบดีกรมสาธารณสุข กรมสาธารณสุขอยู่ในสังกัดกระทรวงมหาดไทย เรื่อยมาจนถึง พ.ศ. 2485 จึงได้มีการสถาปนากรมสาธารณสุขขึ้นเป็น
กระทรวงสาธารณสุข [
เกี่ยวกับสธ.]
LEO Run For Child 2022 สวนวชิรเบญจทัศ (สวนรถไฟ) 27 พ.ย.65 LINK
" LEO Run for Child ปี 3 "
เพื่อนำรายได้จากการวิ่ง มาระดมทุนเพื่อสนับสนุนโครงการ โรงเรียนนี้เพื่อน้องปี 5 โดยเราจะนำรายได้ไปช่วยบูรณะซ่อมแซมอาคารเรียนและปรับปรุงอุปกรณ์การเรียนการสอนของโรงเรียนในถิ่นทุรกันดารของประเทศไทย
สถานที่ : ณ สวนวชิรเบญจทัศ (สวนรถไฟ)
วันอาทิตย์ที่ 27 พฤศจิกายน 2565
ประเภทการวิ่ง
- VIP : 10 KM. 5 KM. >>>>> 1,500 บาท
- ระยะ 10 KM. >>>>> 600 บาท
- ระยะ 5 KM. >>>>> 500 บาท
ไปร่วมวิ่งและร่วมทำบุญกันนะคะ เพื่อเป็นการส่งเสริมการศึกษากับให้กับเยาวชนของชาติ
วิ่ง Run For Kids วิ่งด้วยใจให้ด้วยรัก 7 วันอาทิตย์ที่ 27 พ.ย.65 LINK
วันอาทิตย์ที่ 27 พฤศจิกายน พ.ศ. 2565 เวลา 04.00 – 09.00 น.
สถานที่จัดงาน ศูนย์คามิลเลียน โซเชียล เซนเตอร์ ระยอง เลขที่ 1/1 ซอยคีรี ตำบลห้วยโป่ง อำเภอเมือง จังหวัดระยอง 21150
ประเภทการแข่งขัน 2 ระยะ
วิ่งมินิมาราธอน (Mini Marathon) ระยะทาง 11.5 กิโลเมตร
เดิน-วิ่งเพื่อสุขภาพ (Fun Run) ระยะทาง 5 กิโลเมตร
รับสมัคร Walk in / ออนไลน์
ระหว่างวันที่ 10 สิงหาคม 2565 – 31 ตุลาคม 2565 เวลา 09.00– 17.00 น.
กิจกรรมวิ่งสร้างบุญ โคกขามมินิมาราธอน #2 มหัศจรรย์ ๒๒๒๒ อาทิตย์ 27 พ.ย. 65
กิจกรรมวิ่งสร้างบุญ โคกขามมินิมาราธอน #2 มหัศจรรย์ ๒๒๒๒
ในวันอาทิตย์ ที่ 27 พฤศจิกายน 2565
วัดโคกขาม ต.โคกขาม อ.เมืองฯ จ.สมุทรสาคร
จัดโดย สภาวัฒนธรรมอำเภอเมืองสมุทรสาคร ร่วมกับ ชุมชนตำบลโคกขาม กิจกรรมวิ่งสร้างบุญ “โคกขามมินิมาราธอน มหัศจรรย์ ๒๒๒๒” และร่วมไหว้พระ ปิดทอง "พระพุทธสิหิงค์ องค์ที่ 4" ณ วัดโคกขามแห่งนี้ เพื่อความเป็นสิริมงคลของทุกท่าน เพื่อจัดหารายได้เป็นสาธารณกุศล ในการการบูรณะอุโบสถศาลาวัฒนธรรมตำบลโคกขาม ซึ่งเป็นวัดเก่าแก่ ที่สร้างตั้งแต่ปี พ.ศ. ๒๒๒๒ ปัจจุบันมีอายุมากกว่า 300 ปี และได้ชำรุดทรุดโทรมไปตามกาลเวลา
สมัครตั้งแต่วันนี้ - 27 พฤศจิกายน 2565
สถานที่จัดงาน : วัดโคกขาม ต.โคกขาม อ.เมืองฯ จ.สมุทรสาคร
goo.gl/maps/ สำหรับผู้ที่สนใจสมัครได้ที่
- อบต.โคกขาม 034-457004 ต่อ 125 (เวลาราชการ)
- ศาลาประชาคมวัดโคกขาม 081-6945116 (09.00 – 15.00 น. ทุกวัน)
- สนามกีฬาจังหวัดสมุทรสาคร 063-2125468 (เวลาราชการ)
- สนง.วัฒนธรรมจังหวัดสมุทรสาคร 090-0834706 (เวลาราชการ)
- สนง.พัฒนาชุมชนอำเภอเมืองสมุทรสาคร 095-0377522 (เวลาราชการ)
ASA RUN 2022 อาษารัน 2022 ว้าวรันฟอร์ออล 27 พ.ย.65 LINK
ASA RUN 2022 : ” WOW RUN FOR ALL” อาษารัน 2022 “ว้าวรันฟอร์ออล”
อีกหนึ่งกิจกรรมที่ท่านจะได้พบกันในงาน WOW อัศจรรย์เมืองน่าอยู่ ในครั้งนี้ค่ะ กับการแข่งขันวิ่งใน 2 ประเภท ได้แก่ MINI MARATHON 10 KM และ FUN RUN 4.5 KM ในวันอาทิตย์ที่ 27 พฤศจิกายน 2565 ณ สวนเบญจกิติ
RUN For Light 55ปี คริสตจักรแสงสว่าง 27 พ.ย.65
เดิน - วิ่ง เพื่อสุขภาพ
ฉลองครบรอบ 55ปี คริสตจักรแสงสว่าง
GOOD GUY RUN 2022 วันที่ 27 พ.ย.65 LINK
GOOD GUY RUN 2022 วิ่งวันที่ 27 พฤศจิกายน 2565 บริเวณ สำนักงานคณะกรรมการป้องกันและปราบปรามการทุจริตแห่งชาติ นนทบุรี ระยะทาง 2/5/13 กิโลเมตร จัดงานโดย สำนักงานคณะกรรมการป้องกันและปราบปรามการทุจริตแห่งชาติ (ป.ป.ช.) ร่วมกับ องค์กรต่อต้านคอร์รัปชัน (ประเทศไทย) สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) สมาพันธ์ชมรมเดิน-วิ่งเพื่อสุขภาพไทย
27 พ.ย. 65 ห้ามแพทย์แผนไทยนั่งร้านขายกัญชา
1. ห้ามแพทย์แผนไทยนั่งร้านขายกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก กล่าวถึงกรณีร้านที่ได้รับใบอนุญาต จำหน่ายช่อดอกกัญชา กัญชง ทั้งดอกสด แห้งและแปรรูป นำแพทย์ที่มีใบอนุญาตประกอบวิชาชีพเวชกรรมมานั่งในร้าน หวัง ให้ขายกัญชาเพื่อสูบในร้านได้ว่า คำว่าผู้ประกอบวิชาชีพเวชกรรมที่เป็นแพทย์สาขาต่าง ๆ แม้จะมีใบอนุญาต แต่ตามกฎหมาย ของกรม สบส. ระบุว่า แพทย์ต้องปฏิบัติงานในสถานพยาบาลที่ได้รับการขึ้นทะเบียนจากกรม สบส. ยกเว้น 3 กรณี คือ
1. สถานพยาบาลทำเรื่องออกหน่วยแพทย์เคลื่อนที่
2.มีการตรวจสุขภาพนอกสถานที่ภายใต้การปฏิบัติงานของสถานพยาบาล ประจำ และ
3.การไปรักษาผู้ป่วยที่บ้านในกรณีที่มีความจำเป็นที่ต้องดูแลใกล้ชิด
หากแพทย์ไปปฏิบัติหน้าที่นอก สถานพยาบาลจะมีโทษทางอาญาด้วย ทั้งนี้ ตามประกาศข้อที่ 5 ไม่ได้บอกว่าให้แพทย์แผนไทยที่มีใบประกอบวิชาชีพเวช กรรมมานั่งในร้านและขายกัญชาเพื่อสูบได้ และ ได้แจ้งไปยังกลุ่มของแพทย์แผนไทยให้รับทราบเมื่อ 25 พ.ย. หลายคน รับทราบแล้ว คงไม่มีใครกล้ามานั่ง เพราะมีความผิดทางอาญา ส่วนเจ้าของร้านแค่ถูกยึดใบอนุญาต
2. ผลักดันแผนวิจัยกัญชา
- ภก.อนันต์ชัย อัศวเมฆิน คณะเภสัชศาสตร์ ม.มหิดล เป็นประธานประชุมคณะอนุกรรมการด้านการศึกษา/วิจัยผลจาก การใช้กัญชาทางการแพทย์และสุขภาพ ครั้งที่ 1/2565 ร่วมกับหน่วยงานของ สธ. และสวทช. เพื่อร่วมวิจัยประเด็นกัญชาทาง การแพทย์ พบว่า กว่า 3 ปีที่ผ่านมา สธ. และเครือข่าย มีการศึกษาวิจัยที่กว้างขวาง จนเกิดการใช้กัญชาและถูกบรรจุในชุด สิทธิประโยชน์ทางสุขภาพ และมีการขึ้นทะเบียนผลิตภัณฑ์กัญชากว่า 2,000 ผลิตภัณฑ์ แต่เพื่อให้เกิดการวิจัยที่รวดเร็ว มุ่ง เป้าไปสู่การแก้ปัญหาสุขภาพ เกิดการต่อยอดได้อย่างสมบูรณ์ คณะอนุกรรมการฯ ได้มีข้อสรุปว่า ควรมุ่งเป้าโรคที่ยังเป็น ปัญหาสุขภาพ โดยศึกษาวิจัยครบวงจร ต้นทาง กลางทาง ปลายทาง โดยเชิญกองผลิตภัณฑ์สมุนไพร อย. และอนุกรรมการยา หลักแห่งชาติเข้ามาเป็นแกนในการทำงานร่วมกัน เพื่อให้การวิจัยสร้างมูลค่าเชิงเศรษฐกิจและผู้ป่วยเข้าถึงยาได้ด้วยประเพณีลอยกระทงพัทยา 2566 ชายหาดพัทยากลาง (27 พฤศจิกายน 66)
เตรียมตัวมาร่วมงาน ประเพณีลอยกระทงพัทยา 2566 ณ ชายหาดพัทยากลาง ค่ำคืนวันเพ็ญ 27 พ.ย.66 นี้ด้วยกันนะ รายละเอียดสอบถาม Pattaya Contact Center 1337
วันที่ 27 ตุลาคม
วันที่ 27 ตุลาคม พบกับ ภาพยนตร์เรื่อง "รัก 7 ปี ดี 7 หน"
ร่วมพูดคุยกับผู้กำกับ จิระ มะลิกุล และ ปวีณ ภูริจิตปัญญา ผู้กำกับภาพยนตร์ เรื่อง รัก 7 ปี ดี 7 หน มินิคอนเสิร์ตจากวง TU85
อาคารกีฬาในร่ม ศูนย์เยาวชน ลุมพีนี
กิจกรรมเริ่มตั้งแต่เวลา 17.30 น. และเริ่มฉายภาพยนตร์ 19.00 น. เป็นต้นไป เข้าชมฟรีไม่มีค่าใช้จ่าย!
ลอยกระทงเทศบาลเมืองใหม่บางบัวทอง 27 พฤศจิกายน 2566
ลอยกระทงเทศบาลเมืองใหม่บางบัวทอง เชิญร่วมงานประเพณีลอยกระทงประจำปี 2566 วันจันทร์ที่ 27 พฤศจิกายน 2566 ตั้งแต่เวลา 17.00 น.เป็นต้นไป ณ สำนักงานเทศบาลเมืองใหม่บางบัวทอง
- ชมการประกวดนางนพมาศ ชิงเงินรางวัล
- การแสดงของนักเรียนโรงเรียนสหศึกษาบางบัวทอง
- การแสดงพลุ แสง สี เสียง
- การแสดงจากศิลปินชื่อดัง
สืบสานประเพณีลอยกระทง จังหวัดปทุมธานี ประจำปี 2566 วันจันทร์ที่ 27 พฤศจิกายน 2566
องค์การบริหารส่วนจังหวัดปทุมธานี ร่วมกับ เทศบาลเมืองปทุมธานี ขอเชิญร่วมงาน สืบสานประเพณีลอยกระทง จังหวัดปทุมธานี ประจำปี 2566 วันจันทร์ที่ 27 พฤศจิกายน 2566
ณ บริเวณสวนเทพปทุมเฉลิมพระเกียรติฯ หน้าศาลากลางจังหวัดปทุมธานีหลังเก่า จังหวัดปทุมธานี
เครือข่าย Sky doctor เขตสุขภาพที่ 1 ซ้อมแผนกรณีอุบัติเหตุเฮลิคอปเตอร์ตก ‼️
27 พฤศจิกายน 2566 ทีมเครือข่าย Sky doctor เขตสุขภาพที่ 1 ได้แก่ รพ.นครพิงค์ รพ.มหาราชนครเชียงใหม่ รพ.ศรีสังวาลย์ และรพ.แม่สะเรียง ร่วมกับกองกำลังผาเมือง และหน่วยดับเพลิง อบต.ดอนแก้ว จัดการซ้อมแผนกรณีเกิดอุบัติเหตุเฮลิคอปเตอร์ตก เพื่อซักซ้อมแผนปฏิบัติการ ให้มีความพร้อมรับมือหากเกิดอุบัติเหตุจริง [
รพ.นครพิงค์]
Asia International Hemp Expo 2024 - 27-30 November 2024
The “
Asia International Hemp Expo” is the very first trade exhibition for hemp industry in Asia which is organized annually. In 2023, this expo is the second edition which will showcase the latest in cutting-edge hemp technology, materials and equipment for planting, extracting and processing, with the aim of facilitating the establishment of production bases in Thailand. In addition, it will provide a valuable platform for comprehensive business negotiations among raw material suppliers and manufacturers of processed hemp products, covering the entire supply chain from upstream to downstream as well as opportunities for export channels."
The expo will focus on the following primary industries: medical supplies, food and beverages, cosmetics and spas, fashion apparel, composite products, building materials (such as HEMP Crete), and other alternative materials.
28 พ.ย. 65 กัญชาคาเฟ่
1. กัญชาคาเฟ่
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึงกรณีผู้ประกอบการร้านขายกัญชาย่านถนนข้าวสารจ้างแพทย์ แผนไทยและแพทย์ทางเลือกมาอยู่ประจำร้าน เพื่อให้สามารถจำหน่ายช่อดอกกัญชา พร้อมสูบแบบสันทนาการภายในร้านได้ โดยไม่ขัดต่อประกาศกฎกระทรวง ว่า ขอให้เป็นไปตามกฎหมาย เสพตามร้านไม่ได้ เราไม่ได้ส่งเสริมให้คนไปใช้ในทางสันทนา การ ด้วยนัยยะจะไปเสพในร้านไม่ได้ หากมีกฎหมายก็จะชัดเจน หากไม่มีก็ต้องตีความกันไป
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ เผย หลังจากประกาศมีผลบังคับใช้ หากร้านขายกัญชาเปิด สูบแบบครบวงจร ไม่อยากปิดห้องสูบ ต้องไปขออนุญาตเปิดเป็นสถานพยาบาลตาม พ.ร.บ.สถานพยาบาล แต่จะจ้างแพทย์มา นั่งประจำร้านไม่ได้และไม่ถูกต้อง เนื่องจากแพทย์ผู้ประกอบวิชาชีพเวชกรรมต้องปฏิบัติหน้าที่ในสถานพยาบาลที่ขึ้นทะเบียน กับกรมสนับสนุนบริการสุขภาพ โดย 2 สัปดาห์หลังจากนี้ กรมฯ จะลงพื้นที่สุ่มตรวจสถานประกอบการที่ขายกัญชา ระหว่างนี้ จะให้เวลาผู้ประกอบการได้ปรับตัวกับประกาศฉบับนี้ก่อน
- นายอภิลาภ บุญโสภา อุปนายกสมาคมธุรกิจท่องเที่ยว จ.เชียงใหม่ เผยเชียงใหม่ยังไม่มีการเปิดโซนกัญชาบริการอย่าง เป็นทางการ ส่วนใหญ่ นทท.ต่างชาติใช้บริการมัคคุเทศก์หรือไกด์ทัวร์ป่านำไปเสพกัญชานานแล้ว โดยเฉพาะเส้นทาง อ.แม่ริม อ.แม่แตง ที่มุ่งหน้าสู่ อ.ปาย จ.แม่ฮ่องสอน อย่างไรก็ตาม หากมีการเปิดโซนกัญชา เชื่อว่าไม่มีผลกระทบท่องเที่ยวเชียงใหม่ คนจะใช้บริการน้อยเนื่องจากขัดกับความเชื่อวัฒนธรรมประเพณีวิถีชีวิตชาวล้านนา ถูกตีตราเป็นพวกขี้ยา
- นายวีรวิชญ์ เครือสมบัติ ประธานชมรมผู้ประกอบการสถานบันเทิงหาดป่าตอง จ.ภูเก็ต กล่าวว่า ในซอยบางลาป่าตอง เปิดขายกัญชาหลายร้านมาก อยากให้ขายเป็นกิจจะลักษณะไม่ใช่ปล่อยให้ออกมาสูบกัน บางคนแพ้และไม่ชอบกลิ่น ทั้งนี้ ทาง จังหวัดได้มอบหมายหน่วยงานที่เกี่ยวข้องเข้าดูแลตรวจสอบอย่างเคร่งครัด
- น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย เผยขณะนี้มีข้อมูลจากคนในพื้นที่รวมทั้งสื่อออนไลน์นำเสนอว่ามีการเปิด กัญชาคาเฟ่ในหลายจังหวัด ต้องการให้นายกฯ และนายอนุทิน ผู้กำกับนโยบาย กลับมาทบทวนเรื่องกัญชาเสรีอย่างละเอียด อีกครั้ง
- เพจชมรมแพทย์ชนบท โพสต์ว่า วันนี้ช่อดอกกัญชาห้ามขายออนไลน์แล้ว แต่การบังคับใช้กฎหมายยังอ่อนด้อย สธ.ออก ประกาศ แต่หากค้นหาในร้านค้าออนไลน์ ยังหาซื้อได้สะดวกเหมือนเดิม หวังว่าวันนี้ซึ่งเป็นวันราชการ จะมีการบังคับใช้ กฎหมายที่จริงจัง ตรงกับนโยบายกัญชาเสรีที่มีการควบคุม อย่าให้ประกาศ สธ.เป็นเพียงละครฉากหนึ่งที่ไม่เอาจริง
- นายสมชาย แสวงการ ส.ว. โพสต์ขอผู้มีอำนาจช่วยไขคำตอบ 1) การปล่อยให้ขายช่อดอกกัญชา อ้างว่าเพื่อการแพทย์ หรือเพื่อสันทนาการ 2) การขออนุญาตตาม ม.46 พ.ร.บ.คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ.2542 ถูกใน แง่การอนุญาตจำหน่ายเท่านั้น ไม่ใช่ให้สูบได้ 3) บางร้านอวดว่าตนสามารถจัดหาแพทย์มาเป็นยามเฝ้าร้านดู นทท.ต่างชาติสูบ กัญชาสันทนาการ น่าจะเข้าข่ายผิดจรรยาบรรณแพทย์ สมควรถูกถอดถอนใบประกอบวิชาชีพและถูกดำเนินคดีอาญา
ให้ความรู้กัญชา
- สธ.ยังคงดำเนินการประชาสัมพันธ์ให้ความรู้เกี่ยวกับการใช้ประโยชน์จากกัญชาแก่ประชาชนอย่างต่อเนื่อง โดยในวันนี้ เวลา 13.00-16.30 น. กรมการแพทย์แผนไทยฯ จะจัดประชุมวิชาการหัวข้อการใช้และส่งเสริมกัญชาเพื่อเศรษฐกิจในประเทศ และต่างประเทศ (สาธารณรัฐมอลตา และสหพันธ์สาธารณรัฐเยอรมนี) ผ่านทางเฟซบุ๊กกรมฯ
โพลสำรวจผลงานที่พอใจ
- ผศ.ดร.นพดล กรรณิกา ผอ.สำนักวิจัยซูเปอร์โพล เสนอผลสำรวจเรื่องแกนนำรัฐบาลกับผลงานที่พอใจ ด้านที่โดดเด่น ช่วยเหลือบุคลากรการแพทย์ อสม.แก้วิกฤตโควิด จัดการวัคซีน ได้แก่ นายอนุทิน ชาญวีรกูล ร้อยละ 72.6 รวมทั้งมีผลงานที่ ประชาชนพอใจและแกนนำรัฐบาลที่โดดเด่นที่สุด มีจุดยืนมั่นคง ทำตามที่พูด นโยบายกัญชาช่วยชาวบ้าน นำมาทำวิจัยเพื่อ ประโยชน์ต่อสุขภาพทางการแพทย์ ไม่ต้องหลบซ่อนและอาจถูกเรียกรับสินบนใต้ดิน - ประจำวันที่ 28 พฤศจิกายน 2565 228 พ.ย. จำนวนผู้ติดเชื้อในกว่างโจว และฉงชิ่ง ลดลง และจำนวนรวมก็ลดลง
CNBC รายงานอ้างข้อมูลจากปักกิ่ง รายงานตัวเลขผู้ติดเชื้อลดลงต่ำกว่าสัปดาห์ก่อนหน้าอีกครั้ง นับตั้งแต่ต้นเดือนพฤศจิกายน กล่าวคือจำนวนผู้ติดเชื้อไม่แสดงอาการ รวม 38,421 ราย ลดลงจากสัปดาห์ก่อนที่มีจำนวน 40,052 ราย เมืองที่มีผู้ติดเชื้อลดลงอย่างมากได้แก่เมืองกว่างโจว และฉงชิ่ง ซึ่งทั้งสองเมืองมีการระบาดหนักที่สุดในรอบล่าสุด และที่สำคัญไม่มีผู้เสียชีวิตเพิ่ม ส่วนเมืองใหญ่อย่างปักกิ่งและเซี่ยงไฮ้ ยังมีจำนวนผู้ติดเชื้อเพิ่มขึ้น
วันที่ 28 ตุลาคม
วันที่ 28 ตุลาคม พบกับ ภาพยนตร์เรื่อง "ร่างทรง" มินิคอนเสิร์ตจาก เดอะพรอเพอร์แคลน อาคารกีฬาในร่ม ศูนย์เยาวชน ลุมพีนี
กิจกรรมเริ่มตั้งแต่เวลา 17.30 น. และเริ่มฉายภาพยนตร์ 19.00 น. เป็นต้นไป เข้าชมฟรีไม่มีค่าใช้จ่าย!
โอมิครอน BF.7 เป็นสายพันธุ์หลักที่กรุงปักกิ่ง
โอมิครอน BF.7 (หนึ่งในบรรดาลูกของ BA.5) ขณะนี้ระบาดเป็นสายพันธุ์หลักที่กรุงปักกิ่งประเทศจีน เกิน 1,000 รายต่อวันโดยไม่มีทีท่าว่าจะสงบลง
ไวรัสโคโรนา 2019 ที่ระบาดใหญ่ในนครปักกิ่งขณะนี้มี 3 สายพันธุ์คือ BF.7, BA.5.2, และ BA.5.1.7 ซึ่งคาดว่าแพร่มาจากแถบมองโกเลีย ในประเทศจีน โดยมี BF.7 เป็นสายพันธุ์หลัก มี 5 อาการที่พบบ่อยคือ คัดจมูก เจ็บคอ ไอ อ่อนเพลีย และน้ำมูกไหล
โอมิครอน BF.7 ซึ่งเป็นรุ่นลูกของ BA.5 มีความได้เปรียบในการเติบโต-แพร่ระบาด เหนือกว่า BA.5.2, BA.5.1.7 ประมาณ 22% ทำให้เกิดระบาดเป็นสายพันธุ์หลักในกรุงปักกิ่งได้ [
Center for Medical Genomics]
รัฐบาลกรุงปักกิ่ง เปิดเผยถึงความคืบหน้าในความพยายามเร่งฉีดวัคซีนให้กับกลุ่มผู้สูงอายุ ที่เป็นกลุ่มเสี่ยงให้มากขึ้น เพื่อให้เข้าใกล้โอกาสเปิดเมืองเปิดประเทศ โดยสัดส่วนผู้สูงอายุเกิน 80 ปีที่ได้รับวัคซีนแล้ว 65.8% ขณะที่มีเพียง 40% เท่านั้นที่ได้รับเข็มกระตุ้น ถือว่าเป็นจำนวนที่ต่ำมากเมื่อเทียบกับสหรัฐหรือสิงคโปร์ ทางการไม่ได้เปิดเผยรายละเอียดว่าจะกระจายการฉีดวัคซีนเพิ่มขึ้นอย่างไร [
CNBC]
29 พ.ย. 65 กัญชาคาเฟ่ การโฆษณากัญชา ตรวจปริมาณกัญชาในพลาสมาและปัสสาวะผู้ป่วย
พ.ร.บ.กัญชา
- นายชวน หลีกภัย ประธานสภาผู้แทนราษฎร เผย พ.ร.บ.กัญชาฯ ที่กำลังจะเข้าสู่การพิจารณาของสภาฯ ในวาระ 2 และ 3 คาดว่าจะทันในสมัยประชุมนี้ เพราะมีเวลาไปจนถึง มี.ค.66 ซึ่งร่าง พ.ร.บ.อยู่ไม่ไกลเป็นลำดับถัดจากกฎหมายขนส่งทางราง ส่วนการเลื่อนเข้ามาพิจารณาก่อน สามารถทำได้ แต่ต้องขอล่วงหน้าก่อน 1 สัปดาห์
กัญชาคาเฟ่
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. เผยการเปิดให้สูบกัญชาไม่ว่าจะเป็นบริเวณใด ไม่ใช่เจตนารมณ์ของ สธ. หากแพทย์แผนไทยไปนั่งมวนบุหรี่สูบจะถูกยึดใบอนุญาต เพราะไม่ได้ทำหน้าที่ที่ควรคือการรักษา ที่ผ่านมาไม่มีช่องโหว่เรื่อง การสูบเสพ การนำกัญชาไปแปรสภาพเป็นสินค้าจำหน่ายต้องขออนุญาตชัดเจน มีแต่คนพยายามขุดให้เจอช่องโหว่ ทั้งนี้ อธิบดีกรมการแพทย์แผนไทยฯ จะหารือแนวทางกับตำรวจควบคุมไม่ให้กระทำผิดกฎหมาย
- นายสง่า เรืองวัฒนกุล นายกสมาคมผู้ประกอบธุรกิจถนนข้าวสาร กล่าวว่า ถนนข้าวสารมีการจัดพื้นที่เฉพาะ เรียกว่า แพลนโทเพีย ในโซนมีร้านจำหน่ายสินค้าจากกัญชา กัญชง แต่ด้วยตามประกาศ สธ. ไม่สามารถให้ใช้กัญชาในร้านที่ขายได้ จึง ได้จัดเป็นห้องซิการ์บาร์ไว้ในแพลนโทเพีย ลูกค้าไปใช้บริการเหมือนห้องสูบบุหรี่ทั่วไป เพื่อไม่ให้กลิ่นและควันรบกวนคนอื่นใน ที่สาธารณะ เชื่อว่าภาครัฐควรเห็นด้วยที่ให้มีพื้นที่สำหรับสันทนาการ ในฐานะนายกสมาคมฯ จะต้องหารือกับร้านอื่น ๆ แต่ จริงๆ กฎหมายก็ยังไม่ชัดเจนในมุมมองของการตีความ
- นายชัชชาติ สิทธิพันธุ์ ผู้ว่า กทม.ฯ เผย ได้มอบหมายให้ พล.ต.อ.อดิศร์ งามจิตสุขศรี ที่ปรึกษาผู้ว่าฯ กทม .และสำนัก อนามัย ไปดูเรื่องการดำเนินการตามกฎหมายแม่ นอกจากนี้ ยังมีความกังวลของผู้สูบกัญชาว่าจะมีผลต่อการขับขี่ยานพาหนะ หรือตรวจปริมาณในเลือด ให้สำนักอนามัยไปศึกษาเพิ่มเติม
ตรวจปริมาณกัญชาในพลาสมาและปัสสาวะผู้ป่วย
- นพ.ศุภกิจ ศิริลักษณ์ อธิบดีกรมวิทยาศาสตร์การแพทย์ กล่าวว่า ได้พัฒนาห้องปฏิบัติการเพื่อตรวจปริมาณกัญชาใน พลาสมาและปัสสาวะของผู้ป่วยที่ได้รับกัญชา เพื่อเป็นข้อมูลให้แพทย์สามารถสั่งจ่ายปริมาณยากัญชาที่เหมาะสมกับผู้ป่วยแต่ ละราย โดยมีอัตราค่าตรวจวิเคราะห์ 1,400 บาท/ตัวอย่าง ระยะเวลาในการตรวจ 1-3 วันทำการ รพ./สถานพยาบาลสามารถ ส่งตัวอย่างตรวจวิเคราะห์ได้ที่สถาบันวิจัยวิทยาศาสตร์สาธารณสุข กรมวิทยาศาสตร์การแพทย์ และศูนย์วิทยาศาสตร์ การแพทย์ 15 แห่งทั่วประเทศ
โฆษณาขายสินค้ากัญชา
- กรณีชมรมแพทย์ชนบทเผยแพร่ภาพจากสื่อออนไลน์เกี่ยวกับการขายช่อดอกกัญชาผ่านเฟซบุ๊ก ขัดกับประกาศ สธ. โดย ในภาพโฆษณาดังกล่าวขึ้นตรา ม.ขอนแก่น ล่าสุด ม.ขอนแก่น ชี้แจงว่าเป็นการแอบอ้างและเป็นข่าวปลอม ไม่มีส่วนเกี่ยวข้อง
เศรษฐกิจกัญชง-กัญชา
- นายทศพร นิลกำแหง นายกสมาคมสหอุตสาหกรรมพืชกัญชงและกัญชา เผย คกก.สมาคมฯ ได้เข้าพบนายอนุทิน เพื่อ หารือการดำเนินงานของสมาคมเพื่อให้สอดคล้องกับนโยบายของภาครัฐ รวมถึงการแบ่งปันข้อมูลในหมู่สมาชิก ทั้งด้านข้อ กฎหมาย ข่าวสาร และข้อมูลอื่น ๆ ที่มีประโยชน์กับอุตสาหกรรมพืชกัญชงและกัญชาเพื่อผลักดันเป็นพืชเศรษฐกิจ รวมถึง แนวทางรับมือการเปิดเสรีนำเข้าในปี 2569 ด้วย
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า สธ.ทำทุกอย่างรอบคอบ ดำเนินการมาอย่างถูกต้อง ปลดล็อก มาแล้วออกประกาศมาควบคุม พ.ร.บ.ยังไม่ผ่านก็มีประกาศรองรับ ที่เป็นห่วงกันคือเรื่องของการเมือง แต่ไม่มีปัญหา ขอยืนยัน ว่า พ.ร.บ.กัญชา อาจทำให้ไม่สบายใจแต่มั่นใจว่าทำถูกฎหมาย ส่วนเรื่องที่กลับมาเป็นยาเสพติด คกก.ป.ป.ส.บอกว่าไม่ได้
- นายมานะ หวายทิพย์ กรรมการศูนย์นวัตกรรมสมุนไพรไทยหนองสรวง อ.ขามทะเลสอ จ.นครราชสีมา ระบุ การดำเนิน ธุรกิจเกี่ยวกับพืชกัญชาประสบปัญหาอุปสรรคในสภาวะสุญญากาศ โดยเฉพาะช่อดอกที่เป็นส่วนสำคัญและมีมูลค่าสูงสุดของ กัญชา สถานการณ์เดินไม่สุดทั้ง ๆ ที่ภาคีเครือข่ายสถาบันการศึกษาและหน่วยงานสาธารณสุขให้การรับรองดำเนินการตามขั้นตอนมาตลอด ขณะนี้กัญชากำลังออกช่อดอกหรือถึงปลายทางของกระบวนการปลูก แต่กฎหมายไม่ชัดเจน โดยเฉพาะ หน่วยงาน อย. ยังไม่ออกใบอนุญาตให้ส่งไปจำหน่ายให้กับเอกชนผลิตเป็นยา ขอให้รัฐบาลและหน่วยงานช่วยเหลือเยียวยา29 พ.ย. อุรุมชี ทยอยฟื้นคืนบริการขนส่งสาธารณะและดำเนินธุรกิจที่จำเป็น
นครอุรุมชี ในเขตปกครองตนเองซินเจียงอุยกูร์ทางตะวันตกเฉียงเหนือของจีน เริ่มทยอยฟื้นคืนบริการขนส่งสาธารณะและดำเนินธุรกิจที่จำเป็นอีกครั้งตั้งแต่วันจันทร์ (28 พ.ย.) ขณะการระบาดของโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) ในเมืองทุเลาลง ผู้คนในเมืองเริ่มออกมาทำงานและจับจ่ายซื้อของที่ซูเปอร์มาร์เก็ตและร้านค้าท้องถิ่นแล้ววันที่ 29 ตุลาคม
วันที่ 29 ตุลาคม พบกับ ภาพยนตร์เรื่อง "หอแต๋วแตก แหกกระเจิง" พร้อมเสียงบรรยายภาพสำหรับคนพิการทางการมองเห็นผ่านแอปพลิเคชัน Pannana (พรรณนา)
ร่วมพูดคุยกับผู้กำกับ พชร์ อานนท์ Drag Show สุดพิเศษ จาก CHERILYN และ SRIMALA จาก Yellow Channel
อาคารกีฬาในร่ม ศูนย์เยาวชน ลุมพีนี
กิจกรรมเริ่มตั้งแต่เวลา 17.30 น. และเริ่มฉายภาพยนตร์ 19.00 น. เป็นต้นไป เข้าชมฟรีไม่มีค่าใช้จ่าย!
29 พ.ย.66 รับผู้ป่วยหญิงไทย อายุ 54 ปี มีอาการอาเจียนเป็นเลือด จากแม่ฮ่องสอนส่ง มหาราชเชียงใหม่
29 พฤศจิกายน 2566 เวลา 16.24 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดแม่ฮ่องสอน ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยหญิงไทย อายุ 54 ปี มีอาการอาเจียนเป็นเลือด ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลศรีสังวาลย์ ตำบลจองคำ อำเภอเมือง จังหวัดแม่ฮ่องสอน แพทย์ได้วินิจฉัย upper gastrointestinal bleeding (UGIB) , Duodenal ulcer (ภาวะเลือดออกในทางเดินอาหารส่วนต้น , แผลที่ลำไส้เล็กส่วนต้น) ต้องได้รับการผ่าตัดเพื่อหยุดห้ามเลือด เป็นหัตถการเฉพาะทางซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลมหาราชนครเชียงใหม่ ตำบลสุเทพ อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่
ประสานงาน สถาบันการแพทย์ฉุกเฉินแห่งชาติ ศูนย์นเรนทร เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองบินตำรวจ ประเภทอากาศยานเฮลิคอปเตอร์ H725 มีชุดปฏิบัติการบิน ประกอบด้วย 1.พันตำรวจเอกศักดิ์สุริยา บุตรราช นักบิน 2.ร้อยตำรวจเอกนฤชิต ดวงแก้ว นักบิน 3.พันตำรวจตรีสนิท สีสิงห์ ช่างอากาศยาน ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลมหาราชนครเชียงใหม่ ประกอบด้วย 1.อาจารย์นายแพทย์ชานนท์ ช่างรัตนากร 2.นายแพทย์ศรัณปกรณ์ เพิ่มพัฒน์เดชากุล 3.นางสาวพัชรพรรณ คูหา พยาบาลวิชาชีพ 4.นางสาวณัฐณิชา หล้าหนัก พยาบาลวิชาชีพ
เมื่อเวลา 18.58 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลมหาราชนครเชียงใหม่ เป็นที่เรียบร้อย
ผู้เชี่ยวชาญจีนคาด จีนจะผ่อนคลายนโยบายโควิดเป็นศูนย์ในเดือนมีนาคมปีหน้า CNBC
สำนักข่าว
CNBC ได้รายงานว่า หลี่เต้าขุย(李稻葵) ศาสตราจารย์ด้านเศรษฐศาสตร์ของ Mansfield Freeman ของมหาวิทยาลัยชิงหวา เเละเคยเป็นถึงอดีตที่ปรึกษาธนาคาร Bank of Chinaได้ให้ความเห็นในช่อง CNBC ว่า จีนอาจผ่อนคลายนโยบายโควิดอย่างเห็นได้ชัดในเดือนมีนาคมปีหน้า!
ในขณะนี้รัฐบาลจีนกำลังมุ่งเน้นไปที่สุขภาพผู้สูงอายุก่อน โดยเฉพาะในฤดูหนาว การเเพร่ของเชื้อโควิด-19 จะเป็นไปได้ง่ายขึ้น
นับตั้งเเต่โลกเผชิญการระบาดโควิดที่ผ่านมา จีนมีมาตรการปิดประเทศมานานถึง 3 ปีเเล้ว เเละส่งผลให้ GDP จีนโตต่ำกว่า 3%
หลี่เต้าขุยกล่าวเสริมว่า ก่อนหน้านั้นหลายบริษัทย้ายฐานการผลิตมาที่จีน เพราะมองว่ามั่นคง เป็นจุดศูนย์รวมการพัฒนาต่างๆ เเต่ปรากฎว่าจากการเเพร่ระบาดโควิดที่ผ่านมา ทำให้หลายบริษัทเปลี่ยนความคิด เเละสร้างฐานผลิตในประเทศตนเองเเละประเทศอื่นเเทนเพื่อกระจายความเสี่ยง
เมื่อช่วงล่าสุดก่อนหน้า ได้เกิดการประท้วงในหลายจุดที่จีน จากมาตรการโควิดเป็นศูนย์อันเข้มงวดมากไป กระทบการประกอบอาชีพเเละการใช้ชีวิต จึงเกิดเสียงเรียกร้องให้ผ่อนคลายความเข้มงวดลง
ทางการจีนได้ตอบสนองข้อเรียกร้องดังกล่าวด้วยการเร่งระดมฉีดวัคซีนผู้สูงอายุให้มากขึ้น
อีกทั้งก่อนหน้านั้นก็กำลังพิจารณาอนุมัติวัคซีนตะวันตกเเบบ mRNA ของเยอรมนี เเละได้ปรับรายละเอียดนโยบายโควิดเป็นศูนย์หลายข้อ ไม่ว่าจะเป็นจากเเต่เดิม ปิดหมดทั้งเมือง ก็เปลี่ยนเป็นปิดเฉพาะจุด จากเเต่เดิมกักตัวผู้สัมผัสผู้ใกล้ชิดผู้ติดเชื้อก็เปลี่ยนเป็น กักตัวเฉพาะผู้ใกล้ชิดผู้ติดเชื้อเท่านั้น ปรับลดระยะเวลาการกักตัวลง ยกเลิกการตรวจครั้งละจำนวนมาก ฯลฯ
หลี่เต้าขุย ศ.ด้านเศรษฐศาสตร์ ได้ให้ความเห็นเพิ่มต่ออีกว่า หากจีนผ่อนคลายนโยบายโควิดจากศูนย์ในเดือนมีนาคมเเล้ว จีนจะยังคงเผชิญเศรษฐกิจซบเซา เเละปัญหาสภาพคล่องอสังหาฯ
ดังนั้นสิ่งที่รัฐบาลจีนควรทำคือ ปรับโครงสร้างหนี้ ลงทุนโครงสร้างพื้นฐาน เเละกระตุ้นเศรษฐกิจ
เมื่อเราพิจารณาความเห็นท่านหลี่เต้าขุย จะเห็นได้ว่า ช่วงฤดูหนาวนี้โควิดจะเเพร่ระบาดได้ง่าย เดือนมกราคมเป็นเทศกาลปีใหม่ เดือนกุมภาพันธ์เป็นเทศกาลตรุษจีนที่มีการเฉลิมฉลอง เเละเดินทางจำนวนมาก
ดังนั้นเพื่อไม่ให้เกิดผู้เสียชีวิตเเละอาการหนักอันควบคุมไม่ได้จากประชากรจีน 1,400 ล้านคน(สหรัฐฯ 300 ล้านคน) มีเเนวโน้มว่าทางการจีนอาจยังคงเข้มงวดนโยบายไปจนถึงเดือนมีนาคมปีหน้าเพื่อผ่านช่วงฤดูหนาว เเละเทศกาลดังกล่าวไปก่อน [
Insight การเมืองเศรษฐกิจโลก 30 พ.ย.65]
1 ธ.ค. รายงานผู้ติดเชื้อโควิดในจีน ณ สิ้นเดือนพฤศจิกายน
จีน รายงานผู้ติดเชื้อโควิดในท้องถิ่น 4,080 ราย (30 พ.ย.) พบผู้ติดเชื้อแบบไม่แสดงอาการ 31,720 ราย ผู้ป่วยที่หายดีและออกจากโรงพยาบาล 2,419 ราย ไม่มีรายงานผู้เสียชีวิตเพิ่ม คงยอดผู้เสียชีวิตไว้ที่ 5,233 ราย ณ สิ้นเดือนพฤศจิกายน
ก่อนหน้านี้ (29 พ.ย.) ทางการจีนเปิดเผยแผนการเร่งฉีดวัคซีนในผู้สูงอายุ กลุ่มเปราะบาง ที่มีอายุตั้งแต่ 60-80 ปี ขึ้นไป เพื่อลดความเสี่ยงเจ็บหนังหรือขั้นวิกฤต หรือเสี่ยงเสียชีวิต โดยรัฐบาลจะเร่งดำเนินการผ่านหน่วยงานท้องถิ่น พร้อมกับรับรองภาวะความรับผิดชอบของเขตอำนาจศาลท้องถิ่นในการดำเนินการดังกล่าว30 พ.ย. 65 ประกาศควบคุมช่อดอก ลงพื้นที่ตรวจสอบย่านถนนข้าวสาร ความร่วมมือไทย-อิตาลี
1.ประกาศควบคุมช่อดอก
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ แถลงชี้แจงกรณีการใช้กฎหมายควบคุมช่อดอกกัญชา โดย สาระสำคัญของประกาศฯ ล่าสุดระบุ ผู้ที่จะนำช่อดอกไปศึกษาวิจัย ส่งออก จำหน่าย/แปรรูป ต้องขออนุญาตตาม พ.ร.บ. คุ้มครองภูมิปัญญาฯ ที่กรมฯ ส่วน ตจว.ขอที่ สสจ. หากไม่ขออนุญาตจะมีความผิดตามกฎหมายอาญา เมื่อได้รับแล้วต้อง แสดงในสถานประกอบการ จัดทำข้อมูลแหล่งที่มา การนำไปใช้ รายงานปริมาณ หากจะส่งออก ต้องแจ้งรายครั้ง ประเด็นห้าม จำหน่ายเพื่อการสูบในสถานประกอบการ แพทย์ไม่สามารถประกอบวิชาชีพเวชกรรมนอกสถานพยาบาลได้ หากฝ่าฝืนจะถูก จำคุกและปรับ
- นพ.เทวัญ ธานีรัตน์ รองอธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า ต้องรอกฎหมาย พ.ร.บ.กัญชาฯ ที่กำลังจะเข้าพิจารณา ในสภา สธ.จึงออกประกาศกำหนดโซนนิ่งได้ ระหว่างนี้จะมีการตรวจสอบต่อเนื่องจนกว่าจะมีพ.ร.บ.
- นายวิศารท์ พจน์ประสาท ประธานวิสาหกิจชุมชนศูนย์อภิบาลด้วยพืชสมุนไพรแห่งริเวอร์แคว และประธานเครือข่าย วิสาหกิจชุมชนนิคมสมุนไพรสัมพันธ์ตะวันตก เผยประกาศกระทรวงฉบับนี้ถือว่าดีมาก ทำให้เกษตรกรผู้ปลูกกัญชาทาง การแพทย์อย่างถูกต้องตามกฎหมาย ได้รับการครอบครองสิทธิทั้งการดำเนินการและการขาย และขอให้รัฐบาลและหน่วยงาน ที่เกี่ยวข้อง รวมถึงผู้ที่เห็นต่าง ช่วยปราบปรามการลักลอบนำเข้ากัญชาจำนวนมากจากต่างประเทศอย่างจริงจัง รวมถึงบริษัท ยักษ์ใหญ่หลายแห่งที่สร้างคาเฟกัญชาสำหรับขายช่อดอก หาช่องโหว่กฎหมายทำให้เกษตรกรเสียโอกาสทั้งใน กทม.-ตจว.
- นายสมชาย ภิญโญ อดีตสมาชิก อบจ.นครราชสีมา เผยสถานการณ์ที่ไม่ยังมีกฎหมายรองรับพืชกัญชา ทั้งการควบคุม การใช้ และการกำหนดอัตราโทษ โดยเฉพาะช่อดอก ส่งผลให้เครือข่ายวิสาหกิจชุมชนทั่วประเทศร่วม 4 พันแห่ง ไม่สามารถ นำกัญชาที่กำลังออกช่อดอกส่งจำหน่ายให้เอกชนผลิตเป็นยา จะเร่งนำปัญหาอุปสรรครายงานให้คณะทำงานของนายอนุทิน และหน่วยงานที่เกี่ยวข้องหาแนวทางปฏิบัติเพื่อช่วยเหลือเยียวยา
- นายประชัน ชาวสามทอง ประธานและสมาชิกเครือข่ายวิสาหกิจชุมชน กล่าวว่า การควบคุมช่อดอกกัญชาควรมองให้ รอบด้าน โดยเฉพาะประโยชน์ทางการแพทย์ ภูมิปัญญาท้องถิ่นนำไปเป็นยารักษาโรค ผู้ป่วยส่วนหนึ่งได้ใช้กัญชาที่มีสรรพคุณ สามารถบรรเทาอาการเจ็บปวดเรื้อรัง ทำให้ร่างกายฟื้นฟูและหายป่วย มีคุณภาพชีวิตดีขึ้นหลายราย จากการพูดคุยกับ เครือข่ายวิสาหกิจชุมชน กรณีสายป่านสั้นและสมาชิกไม่เข้าใจบริบท มีหลายแห่งประสบปัญหาเงินทุนหมุนเวียน ต้องลดกำลัง การผลิตและชะลอการปลูก หากสถานการณ์เป็นเช่นนี้อาจเห็นวิสาหกิจชุมชนไม่สามารถเดินต่อได้และอาจเลิกกิจการเพราะ หมดทุน
- นางจิตติมา แตงจันทร์ ผู้ประกอบการร้านจำหน่ายกัญชาบนเกาะสมุย กล่าวว่า เห็นด้วยกับประกาศกรณีควบคุมเฉพาะ ช่อดอกกัญชา ต้องมีใบอนุญาตการขายกัญชา เพราะถือว่าผู้ประกอบการได้รับการอบรมมาแล้ว จะแนะนำการขายกัญชาได้ อย่างถูกต้อง ขณะนี้เกาะสมุยมี นทท.เข้ามาเยอะ ร้านกัญชาเป็นที่ตอบรับอย่างดีในช่วงกิจกรรมฟูลมูนปาร์ตี้ ไม่รู้ว่าแต่ละร้าน เปิดแบบถูกต้องหรือไม่ อยากให้ภาครัฐช่วยเข้ามาดูแล
2. ลงพื้นที่ตรวจสอบย่านถนนข้าวสาร
- นายแพทย์ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ พร้อมด้วย จนท.เขตพระนคร กทม. ลงพื้นที่ ตรวจสอบการลักลอบขายช่อดอกกัญชาบนถนนข้าวสาร และตรวจสอบใบอนุญาตของร้านที่จำหน่ายผลิตภัณฑ์กัญชา พบว่ามี บางร้านโฆษณาขายช่อดอกกัญชา ได้ขอให้ปลดป้ายลง และบางร้านถือใบอนุญาตไม่ถูกต้องไม่ตรงกับจังหวัดที่จำหน่าย จึง แนะนำให้ไปขออย่างถูกต้อง ไม่พบการวางขายกัญชาแบบพันลำ
3. ความร่วมมือไทย-อิตาลี
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ร่วมปาฐกถาพูดคุยกับสมาชิกหอการค้าไทย-อิตาเลียน ถึงโอกาสทาง ธุรกิจและความร่วมมือระหว่าง 2 ชาติ เมื่อถามถึงนโยบายกัญชา นายอนุทินกล่าวว่า สำหรับคนต่างชาติที่ไม่คุ้นเคย อาจรู้สึก แปลกใจกับนโยบายนี้ แต่สำหรับประเทศไทย กัญชาอยู่กับวิถีชาวบ้านและเป็นภูมิปัญญามานานหลายร้อยปี ในฐานะสมุนไพร ี่ปรากฏอยู่ในตำรับยาโบราณ เพียงแต่นำภูมิปัญญาดั้งเดิมกลับมาใช้ให้เกิดประโยชน์ต่อสุขภาพ และเป็นการเปิดโอกาสทาง เศรษฐกิจ และไม่ใช่เพียงแต่ประเทศไทย หลายประเทศก็กำลังขับเคลื่อนนโยบายกัญชาถูกกฎหมายอยู่ ดังนั้น ผลประโยชน์ ทางเศรษฐกิจจากนโยบายนี้จะมีแต่เพิ่มขึ้นในปีต่อ ๆ ไป
4.กฎหมายกัญชา
- นายชัชปัฐวี อัฏฐพรเมธา ตัวแทนสมาพันธ์กัญชาเพื่อประชาชน ยื่นหนังสือต่อนายศุภชัย ใจสมุทร ประธาน กมธ. วิสามัญพิจารณาร่าง พ.ร.บ.กัญชาฯ เรียกร้องให้พิจารณาแก้ไขกฎหมายและระเบียบต่างๆ ในการควบคุมกัญชาทางการแพทย์ กัญชาเพื่อการนันทนาการ และกัญชง ด้านนายศุภชัยกล่าวว่า จากข้อเรียกร้องของสมาพันธ์ฯ บางเรื่องเป็นอำนาจหน้าที่ของ สภาผู้แทนฯ ที่จะพิจารณาในร่าง พ.ร.บ.นี้ ส่วนอีกหลายเรื่องเกี่ยวข้องกับงานของ สธ. จะช่วยประสานงานไปยัง สธ.ต่อไป สื่อที่นำเสนอ : นสพ.ผจก. เว็บไซต์ (มติชน, สยามรัฐ, ผจก., ไทยโพสต์, หุ้นอินไซด์) - นายทศพร นิลกำแหง นายกสมาคมสหอุตสาหกรรมพืชกัญชงและกัญชา พร้อมสมาชิก 15 บริษัท เข้าพบนายอนุทิน เพื่อสนับสนุนและขอให้ผลักดัน พ.ร.บ.กัญชา กัญชง ให้ผ่านสภาฯ ให้ได้
5.กัญชาคาเฟ่
- น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย กล่าวว่า รู้สึกไม่สบายใจเมื่อเห็นข่าวย่านถนนข้าวสาร ใจกลางกทม. และ เมืองพัทยา พากันเปิดกัญชาคาเฟ่ขายกัญชาเพื่อสันทนาการ สอบถามนายอนุทินว่าใครเป็นคนอนุญาตให้ทำ ทั้งที่ไม่มี กฎหมายควบคุม ปล่อยให้เปิดธุรกิจขายช่อดอกกัญชามานานหลายเดือน เพิ่งออกกฎกระทรวงมาควบคุม และตั้งคำถามถึง นายกฯ ที่รับผิดชอบบริหารงานของ รมต.และหน่วยงานภาครัฐ เหตุใดจึงปล่อยปละละเลยให้เปิดร้านจำหน่ายกัญชาและสูบ เพื่อสันทนาการ
6.งานวิจัยกัญชา
- นพ.นพพร ชื่นกลิ่น ผอ.สวรส. กล่าวถึง ผลการทบทวนเอกสารงานวิจัย ตปท.เกี่ยวกับการใช้กัญชาทางการแพทย์ พบว่า มีถึง 20 งานระบุว่าลดความเจ็บปวดได้ในระดับปานกลาง เจ็บปวดเรื้อรังจากโรคมะเร็ง โรคโครห์น โรคลำไส้ที่มีการอักเสบ มี ประสิทธิภาพในการลดระดับน้ำตาลกับกลุ่มป่วยโรคเบาหวาน ส่งเสริมการนอนหลับ ทนความเจ็บปวดอีกด้วยรับคนไทยกลับไปอยู่ในพื้นที่ปลอดภัย
11 ก.พ.66 เวลาประมาณ 16.30 น. ทีมกงสุล สถานเอกอัครราชทูต ณ กรุงอังการา เดินทางไปที่ จ. Şanlıurfa เพื่อรับหญิงไทยและลูกสาวเดินทางออกจากพื้นที่ ไปยังพื้นที่ปลอดภัยต่อไป
สถานเอกอัครราชทูตฯ จะช่วยเหลือคนไทยที่ได้รับผลกระทบทุกท่านอย่างสุดความสามารถ โปรดติดตามข้อมูลข่าวสารกับทางสถานเอกอัครราชทูตฯ อย่างใกล้ชิดต่อไป
วังจันทร์วัลเลย์ ทไวไลท์ รัน 2024 วันที่ 30 พฤศจิกายน 2567
วังจันทร์วัลเลย์ ทไวไลท์ รัน Wanchang Valley Twilight Run 2024 วันที่ 30 พฤศจิกายน 2567 สนามบินนวัตนภา วังจันทร์วัลเลย์ ต.ป่ายุบใน อ.วังจันทร์ จ.ระยอง
คลินิกกุมารเวชกรรม LINK
สถานที่ตั้ง ชั้น 1 อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
เปิดให้บริการ
- วันจันทร์-ศุกร์ เวลา 16.00-18.00 น.
- วันเสาร์-อาทิตย์ เวลา 08.00-11.00 น.
- คลินิกกุมารเวชกรรม โทร.02 926-9860 เวลา 09.00-16.00 น. (เฉพาะวันราชการ)
- email : opdped.tuh@gmail.com
หน้าที่และเป้าหมาย
มีหน้าที่ในการให้บริการตรวจรักษาพยาบาลผู้ป่วยเด็ก ตั้งแต่แรกเกิดจนถึง อายุ 15 ปี อย่างมีคุณภาพตามมาตรฐานโรงพยาบาล ยึดผู้ป่วยเป็นศูนย์กลาง มุ่งเน้นความถูกต้อง รวดเร็ว และความพึงพอใจของผู้ใช้บริการ
ขอบเขตการให้บริการ
- โรคหัวใจ
- โรคโลหิตวิทยา
- โรคทางพันธุกรรม
- โรคปอด
- โรคไต
- ทารกแรกเกิด
- โรคทั่วไป
สีสันแห่งสายน้ำ มหกรรมลอยกระทง สัมผัสเสน่ห์ประเพณีกรุงเก่า
งาน "สีสันแห่งสายน้ำ มหกรรมลอยกระทง" สัมผัสเสน่ห์ประเพณีกรุงเก่า จัดโดย ททท. ร่วมกับ จ.พระนครศรีอยุธยา และกรมศิลปากร ติดตามประกาศวันจัดงานและกิจกรรมในงานได้เร็วๆนี้
การประชุม FNM 2024 ในปีนี้ จะจัดขึ้นในกรุงเทพฯ ประเทศไทย ในวันที่ 6-8 พฤศจิกายน 2567 ที่ศูนย์การประชุมแห่งชาติสิริกิติ์ โดยทางศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร จุฬาลงกรณ์มหาวิทยาลัย ได้รับเกียรติเป็นเจ้าภาพจัดงาน ร่วมกับทาง the Asian Neurogastroenterology and Motility Association ในฐานะที่ทางศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร จุฬาลงกรณ์มหาวิทยาลัย ซึ่งเป็นที่รู้จักและยอมรับในด้านวิชาการระดับนานาชาติ รวมถึงต่างชาติให้ความสนใจและไว้วางใจประเทศไทย ทั้งในด้านชื่อเสียงด้านการแพทย์ รวมถึงวัฒนธรรมและอาหาร ซึ่งเป็นเอกลักษณ์ที่โดดเด่นของประเทศไทย
คำแนะนำในการฉีดวัคซีน รพ.เมดพาร์ค
คำแนะนำในการฉีดวัคซีนทางเลือก ข้อมูล ณ วันที่ 15 ตุลาคม 2564
สำหรับผู้ที่ยังไม่ได้รับวัคซีน อย.ไทยอนุมัติให้เด็กอายุ 12-18 ปีขึ้นไปสามารถรับวัคซีนได้ ภูมิต้านทานต่อเชื้อ Delta อยู่นานกว่าและสูงกว่า Pfizer ในทุกกลุ่มอายุ
สำหรับผู้ป่วยอายุมากกว่า 18 ปี และได้รับการปลูกถ่ายอวัยวะหรือเป็นผู้ที่มีภาวะภูมิต้านทานบกพร่อง (ทั้ง 3 เข็ม ถือเป็น Primary Series)
* เข็มกระตุ้นสำหรับผู้ที่มีอายุ 18 ปีขึ้นไป
ความพร้อมและวิธีการรักษาของคลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์
คลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์ ประกอบด้วยทีมแพทย์และบุคลากรผู้ชำนาญการด้านการเจริญพันธุ์ของศูนย์กว่า 20 ท่าน ซึ่งสามารถดูแลอย่างครบวงจรได้ในที่เดียว พร้อมให้คำปรึกษาเรื่องปัญหาการมีบุตรยากจากปัจจัยต่างๆ และร่วมวางแผนการมีบุตร เพราะเข้าใจดีว่าภาวะการมีบุตรยากเป็นเรื่องที่ซับซ้อนและมีสาเหตุที่แตกต่างกันในแต่ละบุคคล บำรุงราษฎร์จึงมุ่งเน้นในการให้คำแนะนำและการรักษาโดยพิจารณาวิธีการที่เหมาะสมที่สุดกับผู้ป่วยแต่ละราย ด้วยการคำนึงถึงข้อจำกัดทางด้านสุขภาพ โรคประจำตัวหรือโรคทางพันธุกรรม รวมถึงให้ผู้ป่วยมีส่วนร่วมในการตัดสินใจมากที่สุด นอกจากนี้ บำรุงราษฎร์ยังใช้เทคโนโลยีที่ทันสมัยช่วยในการประเมินและการคัดเลือกตัวอ่อนที่สมบูรณ์ที่สุดเพื่อเพิ่มโอกาสในการตั้งครรภ์
11 ท่าน้ำ บริการเรือรับส่งฟรี (11 ท่าน้ำวิถีไทย) ตั้งแต่เวลา 9.00 น. - 17.00 น.
วัดบางบัว พหลโยธิน 46 ฌาปนกิจสัตว์เลี้ยง (เตาเผาสัตว์)
วัดบางบัว พหลโยธิน 46 แขวงอนุสาวรีย์ เขตบางเขน กรุงเทพมหานคร ราคาขึ้นกับน้ำหนักสัตว์เลี้ยง เริ่มต้น 1,500-2,000 บาท + จำนวนพระประกอบพิธี และกิจอื่นที่ต้องการ (ลอยอังคาร ของตกแต่ง ดอกไม้) ติดต่อสอบถาม 02-9401287 094-8167222 เวลาทำการ 8.00-16.00 น.
โปรแกรมงานลอยกระทงทั่วไทย
เทศกาลโคมแสนล้านดวง จ.ลำพูน
1 - 27 พ.ย.66 ณ สวนดอกไม้ สวนโคมล้านนาและโคมนานาชาติ สวนศิลป์หริภุญชัย และหอศิลป์สล่าเลาเลือง
ประเพณีลอยกระทง เผาเทียน เล่นไฟ จ.สุโขทัย
18 - 27 พ.ย.66 ณ อุทยานประวัติศาสตร์สุโขทัย
ประเพณีลอยกระทงสวรรค์ จ.แม่ฮ่องสอน
23 - 27 พ.ย.66 ณ วัดพระธาตุดอยกองมู
จุดผางปะตี๊ปตี๋นก๋า ปูจาแม่ก๋าเผือก จ.แพร่
25 - 27 พ.ย.66 ณ วัดจอมสวรรค์
27 พ.ย.66 ณ กาดสามวัย
สีฐานเฟสติวัล 2566 “บุญสมมาบูชานาค” จ.ขอนแก่น
25 – 27 พ.ย.66 ณ ริมบึงสีฐาน มหาวิทยาลัยขอนแก่น
ประเพณีเดือนยี่เป็ง จ.เชียงใหม่
26 – 28 พ.ย.66 ณ เขตเทศบาลนครเชียงใหม่
ประเพณีสมมาน้ำ คืนเพ็ง เส็งประทีป ครั้งที่ 25 จ.ร้อยเอ็ด
26 – 27 พ.ย.66 ณ ลานสาเกตนคร สวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด (บึงพลาญชัย)
เทศกาลลอยพระประทีปพระราชทานสิบสองเพ็งไทสกล “กระทงดอกผึ้ง” จ.สกลนคร
27 พ.ย.66 ณ สวนเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเฉลิมพระชนมพรรษา 980
พรรษา บริเวณริมฝั่งหนองหาร
ประเพณีลอยกระทงพัทยา จ.ชลบุรี
27 พ.ย.66 ณ ชายหาดพัทยากลาง
งานลอยกระทงสมุย จ.สุราษฎร์ธานี
27 พ.ย.66 ณ วัดคงคาราม และ พรุเฉวง เกาะสมุย
สีสันแห่งสายน้ำ มหกรรมลอยกระทง ปี 2566 กทม.
24 - 27 พ.ย.66 ณ บริเวณคลองผดุงกรุงเกษม (ย่านหัวลำโพง)
27 พ.ย.66 ณ สะพานพระราม 8 และวัดอรุณราชวรารามวรมหาวิหาร
งานลอยกระทงประจำปี จ.กระบี่
27 พ.ย.66 ณ อ่าวนาง และสวนสาธารณะธารา
ประเพณีงานลอยกระทงกาบกล้วย เมืองแม่กลอง จ.สมุทรสงคราม
18 - 27 พ.ย.66 ณ วัดภุมรินทร์กุฎีทอง อำเภออัมพวา และอุทยาน ร.2
งานลอยกระทง จ.พระนครศรีอยุธยา
26 - 27 พ.ย.66 ณ วัดสามเรือน
27 พ.ย.66 ณ อ่างเก็บน้ำภูเขาทอง
นอกจากนี้ ยังมีงานเทศกาลทั่วไป ให้ได้เที่ยวชม เช่น
Laguna Phuket Triathlon จ.ภูเก็ต
19 พ.ย.66 ณ ลากูน่าโกรฟ
งานเทศกาลพลุนานาชาติเมืองพัทยา จ.ชลบุรี
24 - 25 พ.ย.66 ณ ชายหาดพัทยา
เทศกาลโต๊ะจีนลิง ครั้งที่ 35 จ.ลพบุรี
26 พ.ย.66 ณ ลานหน้าพระปรางค์สามยอด
ที่มา : ไทยคู่ฟ้า
โดยในงานจะมีวิทยากรผู้ทรงคุณวุฒิมากกว่า 100 ท่าน มานำเสนอการค้นพบและผลงานวิจัยล่าสุด ตั้งแต่การวิจัยทางวิทยาศาสตร์ขั้นพื้นฐานไปจนถึงการปฏิบัติทางคลินิก มีการประชุมสัมมนาเจาะลึกในหัวข้อที่น่าสนใจ เช่น หัวข้อ ‘การรับประทานอาหารและจุลินทรีย์ในลำไส้มีอิทธิพลต่อการเกิดโรคและการจัดการโรคที่เกิดจากปฏิสัมพันธ์ของสมองและลำไส้อย่างไร’ และ หัวข้อ ‘Asian focus’ ที่รวมประเด็นสำคัญเกี่ยวกับปัญหาด้านการทำงานของระบบทางเดินอาหารในเอเชียและตะวันออกกลาง เป็นต้น ซึ่งผู้เข้าร่วมจะได้เรียนรู้ผ่านมุมมองใหม่ที่สร้างสรรค์ สามารถนำความรู้ไปพัฒนาต่อ และสร้างเครือข่ายที่ยั่งยืนได้ในอนาคต
น้องๆ เยี่ยมชมการดูแลผู้ป่วย 18 สิงหาคม 2024 มีคำถามว่า mpox สายพันธุ์ที่แพร่กระจายเร็วอย่าง Clade Ib มีโอกาสแพร่ผ่านทางอากาศโดยเฉพาะผ่านละอองฝอยเหมือนกับโควิดหรือไม่ ผมคงตอบว่ามีโอกาสครับ ทั้งนี้ยังไม่มีข้อมูลยืนยันกับสายพันธุ์ mpox clade Ib โดยตรง ข้อมูลที่ทำให้ผมคิดว่ามีความเป็นไปได้เอามาจากหน่วยงานสาธารณสุขของอังกฤษ (UK Health Security Agency) ที่ระบุให้ Mpox Clade I สามารถแพร่สู่คนได้ผ่านช่องทางละอองฝอย (respiratory droplets) หรือ ทางอากาศอื่นๆ (aerosol transmission) นอกเหนือไปจากการสัมผัสโดยตรง ซึ่งการระบุเช่นนี้ต้องพิจารณาจากหลักฐานทางวิชาการที่เชื่อถือได้โดยคณะกรรมการผู้เชี่ยวชาญ ทั้งนี้ถ้ามีข้อมูลใหม่เกิดขึ้น ข้อมูลนี้ก็จะถูก update ใหม่อยู่เรื่อยๆ คงต้องคอยติดตามข้อมูลอย่างใกล้ชิด...ข้อมูลมีไว้เข้าใจโรคสำหรับป้องกันตัวเอง แต่ไม่ใช่มีไว้แชร์เพื่อความตื่นตระหนก เพราะความกลัวไม่ช่วยอะไรเลย
เตาเผาสัตว์เลี้ยง วัดบางนาใน
เตาเผาสัตว์เลี้ยง วัดบางนาใน พระอารามหลวง 3322 ซอย สรรพาวุธ 1 บางนาใต้ เขตบางนา กรุงเทพมหานคร เพื่อให้ญาติโยมสาธุชนผู้มีใจรักสัตว์เลี้ยงสัตว์เลี้ยงและสัตว์เลี้ยงของท่านได้เสียชีวิตลง แล้วได้นำมาเผาซากอย่างถูกวิธี สอบถาม โทร. 092-3899010
คลินิกเฉพาะทางนอกเวลา อายุรกรรม
คลินิกเฉพาะทางนอกเวลา อายุรกรรม
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตหลักสี่
วันนี้ (18 กันยายน 2563) ที่ศูนย์ปฏิบัติการด้านข่าวโรคติดเชื้อไวรัสโคโรนา 2019 กระทรวงสาธารณสุข จ.นนทบุรี นายแพทย์ธเรศ กรัษนัยรวิวงค์ อธิบดีกรมสนับสนุนบริการสุขภาพ พร้อมด้วยนายแพทย์จักรรัฐ พิทยาวงศ์อานนท์ ผู้อำนวยการกองยุทธศาสตร์และแผนงาน กรมควบคุมโรค แถลงข่าวการเตรียมความพร้อม State Quarantine, Alternative State Quarantine และ Alternative Hospital Quarantine เพื่อรองรับการเปิดรับนักท่องเที่ยวเข้าประเทศมาพักระยะยาว 270 วัน
นายแพทย์ธเรศ กรัษนัยรวิวงค์ อธิบดีกรมสนับสนุนบริการสุขภาพ กล่าวว่า หลังจากประเทศไทยควบคุมโรคโควิด 19 ได้ดี จึงมีการผ่อนคลายให้ชาวไทยและชาวต่างชาติเดินทางเข้าประเทศ มีการตั้งสถานกักตัวที่รัฐจัดให้ (State Quarantine) และสถานกักกันทางเลือก (Alternative State Quarantine) นอกจากนี้ เมื่อรัฐบาลเห็นชอบ Medical and Wellness Program จึงมีการดำเนินการตั้งสถานกักกันโรงพยาบาลทางเลือก (Alternative Hospital Quarantine) รองรับผู้ป่วยชาวต่างชาติที่เดินทางเข้ามารักษาในประเทศ ทั้งทางอากาศ ทางน้ำ และทางบก ซึ่งเป็นการดำเนินการตามหลักมนุษยธรรม โดยมีการกักกัน 14 วัน ตรวจหาเชื้อ 3 ครั้ง มีระบบการส่งตัวผู้ป่วยที่ปลอดภัย แยกจากประชาชนทั่วไป เข้าสู่ห้องความดันลบ นอกจากนี้ กำลังดำเนินการจัดตั้งสถานกักกันในกิจการเพื่อสุขภาพ (Wellness Quarantine) รองรับการนำชาวต่างชาติที่สุขภาพแข็งแรงและปลอดเชื้อโควิด 19 เข้ามาใช้บริการกิจการสปาและการส่งเสริมสุขภาพ โดยยืนยันว่าระบบที่ดำเนินการมีความปลอดภัย
นายแพทย์ธเรศกล่าวต่อว่า จากข้อมูลถึงวันที่ 18 กันยายน 2563 มีผู้ป่วยชาวต่างชาติเดินทางมารักษาจำนวน 568 ราย เป็นผู้ป่วย 321 ราย และผู้ติดตาม 247 ราย พบผู้ติดเชื้อโควิด 19 เพียง 5 ราย เป็นผู้ป่วย 2 ราย และผู้ติดตาม 3 ราย อยู่ระหว่างการขออนุมัติ 1,629 ราย อนุมัติแล้ว 878 ราย สามารถสร้างรายได้ 25.4 ล้านบาท เนื่องจากมีการเปิดระบบให้ผู้ป่วยและญาติได้ซื้อสินค้าและเรียนออนไลน์ แต่หากเข้ามารักษาทั้งหมดตามที่ขออนุมัติ ประมาณการสร้างรายได้ 141.2 ล้านบาท เมื่อรวมกับการเปิดสถานกักกันในกิจการสุขภาพ และการท่องเที่ยวหลังกักตัวครบ 14 วัน ประมาณการรายได้ไม่ต่ำกว่า 605 ล้านบาท
สำหรับกรณีคณะรัฐมนตรีอนุมัติหลักการนักท่องเที่ยวต่างชาติประเภทพิเศษ (Special Tourist Visa : STV) เข้ามาพำนักในไทย 270 วัน หรือสามารถต่อวีซ่า 90 วันได้อีก 2 ครั้ง คุณสมบัติของผู้ที่จะเดินทางมาจะต้องเป็นการมาพำนักระยะยาว (Long Stay) ปฏิบัติตามมาตรการด้านสาธารณสุขและตกลงยินยอมกักตัวในห้องพัก 14 วันใน Alternative State Quarantine หรือ Alternative Local Quarantine ดังนั้นผู้เข้ามาจึงเป็นนักท่องเที่ยวคุณภาพ บางส่วนเป็นนักธุรกิจที่เข้ามาขับเคลื่อนเศรษฐกิจ
ด้านนายแพทย์จักรรัฐ พิทยาวงศ์อานนท์ ผู้อำนวยการกองยุทธศาสตร์และแผนงาน กรมควบคุมโรค กล่าวว่า นักท่องเที่ยวต่างชาติประเภทพิเศษ จะเริ่มจากผู้เดินทางที่ได้รับอนุญาตตามมาตรการป้องกันโรคที่ ศบค.กำหนด โดยเน้นจากประเทศเสี่ยงต่ำ เป็นนักท่องเที่ยวคุณภาพและนักธุรกิจที่มากระตุ้นรายได้ในประเทศ เช่น ซื้อพันธบัตรรัฐบาลคงไว้อย่างน้อย 1 ปี หรือซื้ออสังหาริมทรัพย์ เพื่อให้การพำนักในประเทศได้ด้วย ส่วนการจัดระบบรองรับเพื่อความปลอดภัยจากโรคโควิด 19 ในช่วงก่อนเดินทางผู้เดินทางต้องมี Fit to fly ผลตรวจปลอดโควิด 19 ใน 72 ชั่วโมง มีกรมธรรม์ 1 แสนเหรียญสหรัฐ เพื่อหากติดเชื้อจะไม่เป็นการเพิ่มภาระภาครัฐในการบริการคนไทย หลีกเลี่ยงการอยู่ในที่ชุมชนของประเทศต้นทาง เมื่อเดินทางมาถึงเข้าสู่ระบบการกักตัวที่ปลอดภัย ดำเนินการตรวจหาเชื้อ 3 ครั้ง มีการใช้แอปพลิเคชันในการติดตามตัว อย่างไรก็ตาม การมาอยู่ระยะยาว 270 วัน จะมีการหารือว่าต้องนับรวมช่วงกักตัว 14 วันด้วยหรือไม่ แต่สิ่งสำคัญคือ ต้องปฏิบัติตามมาตรการด้านสาธารณสุข สวมหน้ากาก ล้างมือ เว้นระยะห่าง และหลีกเลี่ยงเข้าที่ชุมชน และหากคนไทยยังร่วมกันคงมาตรการป้องกันโรคก็จะยิ่งเพิ่มความปลอดภัย
นอกจากนี้ ต้องมีการอบรมผู้ประกอบการด้านการท่องเที่ยวเพื่อให้ดำเนินการตามมาตรการ จัดระบบกำกับติดตามการปฏิบัติตัวป้องกันโรคโควิด 19 สื่อสารให้ประชาชนและชุมชนเข้าใจ อย่างไรก็ตาม เมื่อมีผู้เดินทางเข้ามาเพิ่มมากขึ้น จำเป็นต้องเพิ่มช่องทางเข้าออก เครื่องมือ เจ้าหน้าที่ และสถานที่กักกันทั้ง ASQ และ ALQ ให้เพียงพอ
สำหรับผู้ชอบเที่ยวในประเทศ แผนการเที่ยวในประเทศในช่วงกลางปีไม่เปลี่ยนแปลงมากนักจากช่วงต้นปี ผลสำรวจจาก US Travel Association ในช่วงเดือนกรกฎาคม 2020 เปิดเผยว่า ในบรรดานักท่องเที่ยวสหรัฐฯ ที่เดินทางท่องเที่ยวในประเทศหรือต่างประเทศในช่วง 12 เดือนที่ผ่านมา 64% ยังมีแผนที่จะเที่ยวในประเทศในช่วง 6 เดือนข้างหน้าอยู่ ซึ่งเป็นตัวเลขลดลงจากเดิมเล็กน้อย จากผลการสำรวจในเดือนมีนาคม ที่มีสัดส่วนดังกล่าวที่ 70% (รูปที่ 2) สำหรับจุดประสงค์การเที่ยวส่วนใหญ่เป็นการเดินทางไปพักผ่อน ในขณะที่การเดินทางไปติดต่อธุรกิจลดน้อยลง
Superior Lake View
ห้องพักส่วนตัวที่มีความกว้างขวาง โปร่ง โล่ง สบาย ให้ความรู้สึกผ่อนคลาย สามารถฟื้นฟูสุขภาพได้อย่างดีเยี่ยม
พื้นที่ห้อง 45 Sq.M.
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- ตู้เย็น
- ไมโครเวฟ
- ทีวี
- อุปกรณ์ในห้องน้ำ
- ตู้เซฟ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 8,700 บาท
- ค่าอาหาร 1,500 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 1,000 บาท
รวม 14,400 บาท
ห้องพักผู้ป่วยใน LINK
ห้องพักผู้ป่วยใน
ศูนย์การแพทยปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ มีห้องพักผู้ป่วย ทั้งแผนกสามัญและแผนกผู้ป่วยพิเศษ (Private Department) มีการให้บริการอย่างใกล้ชิดโดยทีมแพทย์และพยาบาลผู้เชี่ยวชาญ พร้อมสิ่งอำนวยความสะดวกภายในห้อง บริเวณห้องพักที่กว้างและปลอดภัย
- ห้องพักผู้ป่วยในพิเศษ VIP
อาคารศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ (อาคารผู้ป่วย 20 ชั้น)
ราคา 6,000 บาท/คืน
- ห้องพักผู้ป่วยในพิเศษเดี่ยว
อาคารศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ (อาคารผู้ป่วย 20 ชั้น)
ราคา 2,500 บาท/คืน
- ห้องพักผู้ป่วยในพิเศษคู่
อาคารศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ (อาคารผู้ป่วย 20 ชั้น)
ราคา 2,000 บาท/คืน
- ห้องพักผู้ป่วยในพิเศษรวม 3-6 เตียง
อาคารศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ (อาคารผู้ป่วย 20 ชั้น)
ราคา 1,200 บาท/คืน
- ห้องพักผู้ป่วยในแยกพิเศษ
อาคารศูนย์การแพทย์ปัญญานันทภิกขุชลประทาน มหาวิทยาลัยศรีนครินทรวิโรฒ (อาคารผู้ป่วย 20 ชั้น)
ราคา 1,800 บาท/คืน
- ห้องพักผู้ป่วยพิเศษ Premium
ห้องพักผู้ป่วย 1 ห้อง
ราคา 2,500 บาท/เตียง/คืน
เตียงไฟฟ้า+แอร์+ตู้เย็น+โทรทัศน์+กาต้มน้ำไฟฟ้า+ห้องน้ำในตัว+ชุดกิ๊ฟเซทรับใหม่+ชุดถ้วยชาม+ชุดรับแขก+เครื่องทำน้ำอุ่น+ไมโครเวฟ
จัดที่จอดรถให้จำนวน 1 คัน
สอบถามข้อมูลเพิ่มเติม Tel. +66 502 2345
กลุ่มงานเวชศาสตร์การกีฬาและเวชศาสตร์ฟื้นฟู
กลุ่มงานเวชศาสตร์การกีฬาและเวชศาสตร์ฟื้นฟู โรงพยาบาลเจริญกรุงประชารักษ์
Department of Sports Medicine
โทร 02-289-7309
เวลาปฏิบัติงาน เวลาส่งตรรจ
วันจันทร์ - วันศุกร์ เวลา 08.00-11.30 น. 13.00-15.30 น.
ณ อาคารเรือนราชพฤกษ์ ชั้น 2
บทบาท หน้าที่ กิจกรรมหลักของศูนย์
ให้บริการตรวจประเมิน รักษา และฟื้นฟูเฉพาะทางด้านวชศาสตร์การกีฬา ให้กับผู้ที่บาดเจ็บจากการออกกำลังกายและการเล่นกีฬา ให้สามารถกลับไปเล่นกีฬาหรือออกกำลังกายได้อย่างรวดเร็ว โดยมีประสิทธิภาพสูงสูด และส่งเสริมให้ประชาชนและงักกีฬามีสุขภาพกายที่ดี
ในอนาคต ศูนย์เวชศาสตร์การกีฬาและเวชศาสตร์ฟื้นฟู มีความตั้งใจที่จะเป็นศูนย์กลางในการให้บริการ การตรวจประเมิน การดูแลรักษาและฟื้นฟูนักกีฬาที่บาดเจ็บหรือผู้ที่บาดเจ็บจากการออกกำลังกายที่มีศักยภาพและมาตรฐานที่ดีที่สุด
ขั้นตอนการรับบริการศูนย์เวชศสตร์การกีฬาและเวชศาสตร์ฟื้นฟู
กรณีผู้ป่วยใหม่
1. ผู้ป่วยจะถูกส่งต่อมาจากคลินิก ดังนี้
- คลินิกเวชศาสตร์การกีฬา (ห้องตรวจแพทย์)
- คลินิกศัลยกรรมกระถูก
- คลินิกเวชศาสตร์ฟื้นฟูทางกีฬา
- คลินิกเวชศาสตร์ฟื้นฟู
2. ผู้ป่วยเข้าพบแพทย์ออร์โธปิดิกส์ เพื่อประเมินอาการและกำหนดแนวทางการรักษา
3. พบนักกายภาพบำบัด หรือ นักวิทยาศาสตร์การกีพา เพื่อทำการรักษาฟื้นฟูและออกกำลังกายตามคำสั่งแพทย์
ศูนย์ความเป็นเลิศ : ศูนย์เวชศาสตร์ความดันบรรยากาศสูง LINK
ศูนย์เวชศาสตร์ความดันบรรยากาศสูง
การบำบัดด้วยออกซิเจนแรงดันสูง หรือ Hyperbaric Oxygen Therapy (HBOT) เป็นกรรมวิธีการบำบัดทางการแพทย์ชนิดหนึ่ง ด้วยการให้ผู้ป่วยหายใจด้วยออกซิเจนบริสุทธิ์ ภายใต้ความดันบรรยากาศที่สูงกว่าระดับน้ำทะเล ซึ่งกระทำได้โดยใช้อุปกรณ์ทางการแพทย์ที่เรียกว่าห้องปรับแรงดันบรรยากาศสูง (Hyperbaric Chamber) ในการอัดอากาศเข้าไปในอุปกรณ์ ดังกล่าว ให้สูงขึ้นซึ่งใช้ในการรักษาโรคจากการปฏิบัติการใต้น้ำ ปัจจุบันการบำบัดนี้สามารถใช้เป็นการรักษาเสริมในโรคได้หลากหลายภาวะ เช่น ผู้ป่วยแผลเรื้อรังจากโรคเบาหวาน แผลเนื้อกระดูกกรามตาย และเนื้อเยื่ออ่อนที่ได้รับการบาดเจ็บจากผลของรังสีรักษาในผู้ป่วยมะเร็ง แผลไหม้ พิษจากก๊าซคาร์บอนมอนอกไซด์ การติดเชื้อของเนื้อเยื่ออ่อนรุนแรงจากแบคทีเรียกินเนื้อ กล้ามเนื้อเน่าตายจาก เชื้อบางประเภท ฝีในสมอง การติดเชื้อเรื้อรังของกระดูกบางกรณี การบาดเจ็บของเนื้อเยื่อจากการบดขยี้และการขาดเลือดของระยางค์ จากผลของการบาดเจ็บ เป็นต้น
ในระยะหลังได้เริ่มนำมาใช้ในการรักษาภาวะอุดตันของหลอดเลือดแดงกลางเรตินาของตา ภาวะประสาทหูดับเฉียบพลันไม่ทราบสาเหตุ นอกจากนี้ยังมีการศึกษาเพิ่มเติมในการบำบัดกลุ่มเด็กออทิสติก ผู้ป่วยบาดเจ็บที่ศีรษะรุนแรง ผู้ป่วยที่ถูกกัดด้วยงูพิษต่อระบบโลหิตและการบำบัดเพื่อบรรเทาการบาดเจ็บของกล้ามเนื้อจากการเล่นกีฬา
โรงพยาบาลสมเด็จพระปิ่นเกล้า กรมแพทย์ทหารเรือได้มีการติดตั้งห้องปรับแรงดันบรรยากาศสูงที่มีความทันสมัย มีขนาดใหญ่ที่สามารถให้ การรักษาผู้ป่วยได้คราวละ 30 คน อีกทั้งมีสิ่งอำนวยความสะดวกสบายกับผู้ป่วยในขณะรับการรักษา และที่สำคัญคือได้มีการเตรียมความพร้อมด้วยอุปกรณ์ทางการแพทย์ที่จะสามารถรองรับผู้ป่วยอาการหนัก ได้อย่างมีประสิทธิภาพภายใต้การดูแลของแพทย์และพยาบาลผู้เชี่ยวชาญเทียบเท่าการดูแลในหอผู้ป่วยวิกฤติ ทั้งนี้เพื่อความปลอดภัยอย่างสูงสุด
ราคาสุทธิเริ่มต้นที่ 49,500 บาทต่อแพ็กเกจต่อการเข้าพัก 16 วัน 15 คืนต่อ 1 ท่าน โรงแรมอลอฟท์ กรุงเทพ สุขุมวิท 11 นำเสนอแพ็กเกจ ASQ ที่หลากหลาย ได้แก่
- ห้อง Chic กว้าง 32 ตารางเมตร ราคาสุทธิ 49,500 บาท
- ห้อง Urban กว้าง 32 ตารางเมตรพร้อมวิวกรุงเทพ ราคาสุทธิ 54,500 บาท
- ห้องสูท Stylish suite กว้าง 60 ตารางเมตรมีห้องพักผ่อนแยกออกไป ราคาสุทธิ 89,000 บาท
- ห้องสูท Savvy suite กว้าง 142 ตารางเมตรพร้อมลานระเบียงด้านนอกและอ่างจากุซชี่ ราคาสุทธิ 135,000 บาท
- ห้องสูท Ultra Savvy suite กว้าง 112 ตารางเมตรแบบ 2 ห้องนอนพร้อมระเบียงด้านนอก ราคาสุทธิ 165,000 บาท
ทุกแพ็กเกจมาพร้อมกับบริการและสิ่งอำนวยความสะดวกเต็มรูปแบบ ได้แก่ บริการอาหารเช้า กลางวัน เย็น แบบเซ็ททุกวันโดยเลือกจากอาหารไทย เอเชีย ตะวันตก อาหารเจหรือมังสวิรัติ บริการน้ำดื่ม ชาและกาแฟ บริการเสื่อโยคะจัดให้เมื่อมีการร้องขอ โทรทัศน์แอลซีดีชนาด 42 นิ้วพร้อมช่องโทรทัศน์หลากหลาย ฟรีอินเตอร์เน็ตความเร็วสูง บริการพื้นที่พักผ่อนที่สระว่ายน้ำ ส่วนลด 20% อาหารและเครื่องดื่มและบริการซักรีดและสมาชิกแมริออท บอนวอยสามารถสะสมคะแนนได้
นอกจากนี้ ผู้เข้าพักยังจะได้รับการบริการและสิทธิประโยชน์ต่าง ๆ จากโรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนลซึ่งเป็นโรงพยาบาลคู่สัญญา เช่น บริการรถลิมูซีนแบบฆ่าเชื้อรับส่งจากสนามบินสุวรรณภูมิหรือสนามบินนานาชาติดอนเมืองสู่โรงแรมฯ บริการตรวจโควิด-19 (RT-PCR) 2 ครั้งในพื้นที่ที่โรงแรมฯ จัดหาให้ บริการตรวจเช็คอุณหภูมิ 2 ครั้งต่อวัน บริการสื่อสารทางไกลทางการแพทย์ และพยาบาลวิชาชีพให้บริการที่โรงแรมฯ ตลอด 24 ชั่วโมง
กรณีที่ 3 ด่านพรมแดนทางบก ประเภทเที่ยวบินเช่าเหมาลำ (Charter Flight)
หมายเหตุ
- รถพยาบาล (Ambulance) ต้องมีมาตรฐานตามที่สถาบันการแพทย์ฉุกเฉินแห่งชาติ หรือสถาบันบำราศนราดูร กรมควบคุมโรคกำหนด หรือ
- รถตู้ผลิตจากโรงงาน ไม่เกิน 11 ที่นั่ง ไม่มีห้องน้ำ เป็นไปตามมาตรฐานความปลอดภัยด้านสุขอนามัย (Amazing Thailand Safety and Health Administration: SHA) ของการท่องเที่ยวแห่งประเทศไทย
- เครื่องบินเช่าเหมาลำ (Charter Flight) ตามสำนักงานการบินพลเรือนแห่งประเทศไทยกำหนด
"But
#Thailand is also learning the lessons of the present, by working with WHO’s country office to conduct an intra-action review, to understand how it can further strengthen its public health defences"-
5:53 PM · Nov 13, 2020
---
"I urge all countries to follow
#Thailand ’s lead. No country can say it was well-enough prepared for #COVID19, or that it has no lessons to learn"-
World Health Organization (WHO)
5:53 PM · Nov 13, 2020
---
"There is no doubt that a vaccine will be a vital tool for controlling the
#COVID19 pandemic, and we’re encouraged by the preliminary results of clinical trials released this week"-
5:56 PM · Nov 13, 2020
---
"Never in history has vaccine research progressed so quickly. We must apply the same urgency and innovation to ensuring that all countries benefit from this scientific achievement"-
5:56 PM · Nov 13, 2020
---
"But we have a long way to go. The world cannot put all its eggs in one basket, and neglect the many other tools at our disposal that countries like #Thailand have shown are effective for bringing this virus under control"-
5:56 PM · Nov 13, 2020
เฉพาะระดับปฐมภูมิ (เบื้องต้น) เท่านั้น
หมายถึงระดับหน่วยบริการชุมชนอบอุ่น คลินิกชุมชนอบอุ่น (ประมาณ รพ.สต.) เท่านั้น
ไม่ได้รวมถึง รพ.ใหญ่ๆ เช่น รพ.จังหวัด รพ.ศูนย์ รพ.ทั่วไปอย่างรามา ศิริราช ราชวิถี นะคะ
1. ผู้ป่วยไม่สามารถรักษาได้ทุกที่ทั่วทั้งประเทศ
MRT ได้ติดตั้งเครื่อง AED ที่สถานีต่างๆ ใน 2 สายรวม 13 สถานี
รฟม ได้ติตั้งเครื่อง AED ที่สถานีรถไฟฟ้ามหานคร สายเฉลิมรัชมงคล 9 สถานี ได้แก่
- หัวลำโพง
- สีลม
- สิริกิติ์
- สุขุมวิท
- เพชรบุรี
- พระราม 9
- ลาดพร้าว
- จตุจักร
- กำแพงเพชร
สายฉลองรัชธรรม 4 สถานี ได้แก่
- ศูนย์ราชการนนทบุรี
- บางรักน้อยท่าอิฐ
- ตลาดบางใหญ่
- เตาปูน
และประจำทีมกู้ภัย รฟม.เพื่อความรวดเร็วในการช่วยเหลือผู้โดยสารที่อยู่ในภาวะฉุกเฉิน หมดสติ ไม่หายใจในเขตระบบรถไฟฟ้า
วิธีที่ 3 - ทำรายการผ่านแอปพลิเคชัน SSO Connect
ขั้นตอนการทำผ่านแอพ SSO Connect ของประกันสังคม
- โหลดแอพ SSO Connect มาก่อน โหลดได้ที่ แอพสโตร์ Google หรือ iOS ไอโฟน
- เปิดแอพ > เข้าระบบ
- เลือกเมนู "เปลี่ยนโรงพยาบาล"
- เลือกโรงพยาบาลที่ต้องการ กดยืนยัน รอผลตรวจสอบการเปลี่ยนสิทธิ์ใน 2-3 วันทำการ
รัฐบาลเกาหลีใต้ ไอเดียเจ๋ง
รัฐบาลเกาหลีใต้ ใช้ตู้คอนเทนเนอร์ 53 ตู้ พร้อมติดตั้งเตียง 150 เตียง สร้างเป็นโรงพยาบาล ฉุกเฉิน เพื่อลดปัญหาการขาดแคลนเตียงในกรุงโซล และมีบางส่วนจะติดตั้งที่ Seoul Medical Center ภายในวันที่ 10 ธันวาคม 2563 เพื่อใช้ในการตรวจหาเชื้อและรองรับผู้ป่วย
ที่มา: กระทรวงสาธารณสุข
เมียนมา ขยายเวลาจำกัดการเข้าประเทศ และงดออกวีซ่า ชั่วคราว
สาธารณรัฐแห่งสหภาพเมียนมา ประกาศขยายระยะเวลาการจำกัดการเดินทางเข้าประเทศของชาวต่างชาติ และระงับการออกวีซ่าทุกประเภท เป็นการชั่วคราว ไปจนถึงวันที่ 31 ธันวาคม 2563 เป็นอย่างน้อยส่วนเที่ยวบินพาณิชย์ภายในประเทศ จะเริ่มกลับมาเปิดให้บริการอีกครั้งในวันที่ 16 ธันวาคม 2563 โดยจะบังคับใช้มาตรการควบคุมการแพร่ระบาดโรค COVID-19 ตามคำแนะนำของกระทรวงสาธารณสุขและกีฬาอย่างเคร่งครัด
กลุ่มเสี่ยงสูง 26 ราย
กลุ่มเสี่ยงสูง 26 ราย
- คนในครอบครัว 7 ราย ไม่พบเชื้อ 4 รายและพบเชื้อ 3 ราย(มารดา พี่สาวและน้องสะใภ้)
- ผู้ทำงานในแพปลาของผู้ป่วย 3 ราย ลูกชายไม่พบเชื้อ ลูกจ้างชาวเมียนมา 2 รายอยู่ในระหว่างรอผล
- รพ.เอกชน 8 ราย ผลไม่พบเชื้อและจะตรวจซ้ำในวันที่ 23 ธันวาคม
- แรงงานในตลาดกุ้ง 8 ราย อยู่ในระหว่างรอผล
- แรงงานในตลาดไท อยู่ในระหว่างการดำเนินการ
ศบค. แถลง พบผู้ป่วยรายใหม่ใน จ.สมุทรสาคร รวม 548 ราย ส่วนใหญ่ไม่แสดงอาการและเป็นแรงงานต่างด้าว
ทั้งนี้ ประเมินว่าสามารถรับมือกับสถานการณ์ได้ เนื่องจากเป็นการระบาดในพื้นที่จำกัด และไม่มีผู้ป่วยรุนแรง รวมทั้งได้รับความร่วมมือจากประชาชน
ขอความร่วมมือชาวสมุทรสาครงดเดินทางออกนอกพื้นที่
กำหนดพื้นที่ควบคุมโรคเด็ดขาด (ปิดตลาดกลางกุ้งและหอพัก) 19 ธ.ค. 63 - 3 ม.ค. 64 (14 วัน) และพื้นที่สาธารณะทั่วไป เช่น สนามกีฬา สนามมวย โรงเรียน สถานที่รับเลี้ยงเด็ก ห้างสรรพสินค้า ฯลฯ
- ร้านอาหาร/เครื่องดื่ม ให้เปิดเฉพาะ take away ยกเว้นร้านในโรงพยาบาล
- รัานสะดวกซื้อ กำหนดเวลาปิด 22.00 - 05.00 น. และไม่ให้แออัด
- ตลาดนัด ตลาดสด ขายได้ 6 ชั่วโมง
- และประชาชนงดออกจากบ้านตั้งแต่เวลา 22.00 - 05.00 น.
สายด่วน สมุทรสาคร
065-5493322 /034-871274
2. การตรวจยีนในผู้ป่วยโรคเกาต์รายใหม่
การตรวจยีน HLA-B* 5801 ก่อนให้ยา Allopurinol ในผู้ป่วยโรคเกาต์รายใหม่ โดยประเทศไทยมีผู้ป่วยเกาต์รายใหม่ปีละ 8,200 ราย คาดว่าจะใช้งบประมาณสำหรับตรวจทางห้องปฏิบัติการปีละ 8.2 ล้านบาท
สั่งปิดสะพานปลาสมุทรสาคร-สมุทรปราการ หวั่นโควิดรอบใหม่เอาไม่อยู่ LINK
อสป. เรียกประชุมด่วน ระดมสมองสกัดโควิด-19 รอบใหม่ระบาดหนัก พร้อมยอมตัดไฟแต่ต้นลม สั่งปิดท่าสะพานปลาสมุทรสาคร และสมุทรปราการ งดให้บริการชั่วคราว ตั้งแต่วันที่ 20 ธ.ค. 2563 เป็นต้นไป หวั่นคุมไม่อยู่
นายมณเฑียร อินทร์น้อย ผู้อำนวยการองค์การสะพานปลา (อสป.) เปิดเผยว่า หลังตรวจพบจำนวนผู้ป่วยโรคโควิด-19 (covid 19) ที่ จ.สมุทรสาคร จ.สมุทรปราการ จ.นครปฐม และกรุงเทพฯ เพิ่มขึ้นเรื่อย ๆ อสป.ในฐานะที่เป็นผู้กำกับดูแลสะพานปลาและท่าเทียบเรือประมงทั้ง 18 แห่งทั่วประเทศ โดยในจำนวนนี้มีสะพานปลาสมุทรสาคร และสะพานปลาสมุทรปราการ รวมอยู่ด้วย ก็ไม่ได้นิ่งนอนใจ
วานนี้ (20 ธ.ค. 2563) ได้เรียกประชุมด่วนหัวหน้าสำนักงานสะพานปลาทั้ง 2 แห่ง รวมถึงผู้บริหาร และเจ้าหน้าที่ทุกหน่วยงานที่เกี่ยวข้อง เพื่อร่วมหารือ และหาแนวทางในการรับมือกับสถานการณ์ต่าง ๆ ที่เกิดขึ้น ซึ่งได้ข้อสรุปว่า จำเป็นต้องปิดท่าหรืองดให้บริการสะพานปลาสมุทรสาคร และสะพานปลาสมุทรปราการ เป็นการชั่วคราว ตั้งแต่วันที่ 20 ธ.ค. 2563 เป็นต้นไป จนกว่าสถานการณ์จะคลี่คลาย เพื่อลดความเสี่ยง และควบคุมการแพร่ระบาดของโรคโควิค-19
ประชาชาติ
21 ธค 63
วิธีจัดการกับหน้ากากอนามัยใช้แล้ว
วิธีจัดการกับหน้ากากอนามัยใช้แล้ว
หน้ากากอนามัยที่่ใช้แล้ว อาจมีเชื้อโรคติดอยู่ ควรพับให้ถูกวิธีก่อนทิ้ง
เพื่อป้องกันการแพร่เชื้อไวรัสโคโรนา 19
- หน้ากากอนามัยที่ใช้แล้ว อาจมีเชื้อโรคติดอยู่ ควรพับให้ถูกวิธีก่อนทิ้ง
- พับครึ่งหน้ากาก โดยจัดให้ด้านที่สัมผัสกับจมูกและปากอยู่ด้านใน
- จัดสายรัดให้เรียบร้อย
- พับครึ่งหน้ากากอีกสองทบ แล้วใช้สายรัดมามัดไว้
- นำไปทิ้งลงในภาชนะที่มีฝาปิด เพื่อป้องกันการแพร่เชื้อ
เซฟเก็บไว้ในมือถือ ส่งต่อให้เพื่อน แจกจ่ายและแชร์ออกไปให้กว้างขวาง
25 ธ.ค. 63 สมุทรสาคร ตั้งสถานที่ป้องกันและควบคุมโรคที่สนามกีฬาจังหวัดสมุทรสาคร LINK
คำสั่งจังหวัดสมุทรสาคร ที่ 3557/2563 เรื่องจัดตั้งสถานที่ป้องกันและควบคุมโรคตามมาตรการป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 (COVID - 19) (ฉบับที่ 25)
มีคำสั่ง ตั้งสถานที่ป้องกันและควบคุมโรคที่สนามกีฬาจังหวัดสมุทรสาคร ที่ตำบลมหาชัย อเมือง สมุทรสาคร โดยให้ใช้ชื่อว่า "ศูนย์ห่วงใยคนสาคร"
ทั้งนี้ ห้ามบุคคลใดที่ไม่ได้รับอนุญาต เข้าไปหรือออกจากสถานที่ป้องกันและควบคุมโรคติดเชื้อ (ศูนย์ห่วงใยคนสาคร) เว้นแต่ได้รับอนุญาตจากเจ้าพนักงานควบคุมโรค
ผู้ฝ่าฝืนหรือไม่ปฏิบัติตา มีโทษ ตามนัยมาตรา 53 แห่ง พ.ร.บ. โรคติดต่อ 2558 ต้องระวางโทษจำคุกไม่เกินหนึ่งปี หรือปรับไม่เกินหนึ่งหมื่นบาท หรือทั้งจำทั้งปรับ และมาตรา 18 แห่งพรก.การบริหารราชการในสถานการณ์ฉุกเฉิน 2548 ระวางโทษจำคุกไม่เกิน 2 ปี หรือปรับไม่เกิน สี่หมื่นบาท หรือทั้งจำทั้งปรับ
ตั้งแต่ 25 ธันวาคม 2563
อนุทิน-ปลัดสธ. แจ้งยกเลิกภารกิจ-กักตัวเอง หลังประชุมร่วมกับผู้ว่าฯสมุทรสาครที่มีข่าวติดโควิด-19 LINK
นพ.ทวีศิลป์ วิษณุโยธิน โฆษกศูนย์บริหารสถานการณ์โควิด-19 (ศบค.) เปิดเผยว่า นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข (สธ.) ได้กักตัวเอง 14 วันเพื่อเฝ้าระวังการติดเชื้อโควิด-19 เนื่องจากอยู่ในพื้นที่จ.สมุทรสาครที่มีการแพร่ระบาดของโรคโควิด-19 ซึ่งมีผู้ติดเชื้อเป็นจำนวนมาก นอกจากนี้จะมีการตรวจสอบว่านายนายอนุทินและผู้บริหารกระทรวงสาธารณสุขที่ร่วมคณะไปจ.สมุทรสาครมีการติดเชื้อโควิด-19 หรือไม่
ทั้งนี้ เมื่อช่วงเช้าวันที่ 28 ธ.ค.มีข่าวว่านายนายวีระศักดิ์ วิจิตร์แสงศรี ผู้ว่าราชการจังหวัดสมุทรสาคร ติดเชื้อโควิด 19 ซึ่งเมื่อวันที่ 27 ธ.ค. ที่ผ่านมา นายอนุทิน พร้อมด้วย นพ.เกียรติภูมิ วงศ์รจิต ปลัด สธ. และคณะผู้บริหาร สธ.ลงพื้นที่ จ.สมุทรสาคร มีการประชุมร่วมกับนายวีระศักดิ์เพื่อติดตามความคืบหน้าการควบคุมโรคโควิด-19 โดยล่าสุดนายอนุทินและนพ.เกียรติภูมิได้แจ้งยกเลิกภารกิจทั้งหมดแล้วเพื่อกักตัวเอง
3. ส่งยาทางไปรษณีย์ หรือ รับยาที่ร้านยาใกล้บ้าน LINK
เป็นบริการใหม่ที่จะเริ่มต้น ตั้งแต่ 4 มกราคม 2564 เป็นต้นไป
สำหรับผู้ป่วยที่มีสิทธิ์รับยาทางไปรษณีย์
- เป็นผู้ป่วยที่มีนัดอยู่เดิม
- รอการติดต่อจากโรงพยาบาลและรอรับยาทางไปรษณีย์
- ผู้ป่วยที่มีนัดอยู่เดิม หากยังไม่ได้รับการติดต่อภายใน 1 สัปดาห์ก่อนถึงวันนัด ให้โทรมาที่เบอร์ 02 354 8108 ต่อ 10540 , 10541 , 10542 , 40513 , 40514 , 40515 หรือ 40516
บริการนี้จะช่วยให้ไม่ต้องเดินทางมาโรงพยาบาล ไม่ต้องรอคิวนาน ลดความแออัด ลดการแพร่เชื้อ ประหยัดในการเดินทาง
เงื่อนไขการเข้ารับบริการ
- สิทธิประกันสุขภาพถ้วนหน้า (บัตรทอง)
- 3 กลุ่มโรค : ความดันโลหิตสูง เบาหวาน หอบหืด หรือโรคเรื้อรังอื่นๆ ตามการพิจารณาของแพทย์
- ผู้ป่วยยินยอมเข้าร่วมโครงการ
ขั้นตอนการรับยาที่ร้านยา
- ลงทะเบียนเข้าร่วมโครงการ
- พบแพทย์ที่โรงพยาบาล เพื่อรับการประเมิน
- รับใบนัด เพื่อรับยาที่ร้านยา
- รับยาตามร้านยาที่เลือกไว้ ตรงวันนัด
เอกสารยื่นรับยา
- ผู้ป่วยไปรับยาเอง 1.บัตรประจำตัวประชาชน 2.ใบนัดรับยา
- ผู้อื่นรับยาแทน 1.บัตรประจำตัวประชาชนตัวจริงของผู้ป่วยหรือสำเนาพร้อมรับรองสำเนาถูกต้อง 2.บัตรประจำตัวประชาชนตัวจริงของผู้รับยาแทน 3. ใบนัดรับยา
ร้านยาที่เข้าร่วมโครงการ
- ร้านบู๊ทส์ ยูเนี่ยนมอลล์
- ร้านเซฟดรัก เซ็นเตอร์ บิ๊กซี แจ้งวัฒนะ
- ร้านอนุสาวรีย์ เภสัช
- ร้านบู๊ทส์ เซ็นจูรี่ เดอะมูฟวี่พลาซ่า
- ร้านบู๊ทส์ ลา วิลล่า พหลโยธิน
- ร้านยาดีเภสัชกร ประชาสงเคราะห์
- ร้านสุวัฒน์เภสัช มีนบุรี
สอบถามข้อมูลเพิ่มเติม โทร. 02 206 2900 ต่อ 10540 , 10541 , 10542 หรือ 10543 เวลา 08.30 - 16.30 น. (ในวัน - เวลาราชการ)
3.บริษัท AstraZineca / Oxford
เป็นวัคซีนไวรัส Vector จะใช้วิธีการเอาสารพันธุกรรมของไวรัสใส่เข้าไปในไวรัส ให้ไวรัส Vector ส่งสารพันธุกรรมของโควิด-19 เข้าไปในเซลล์มนุษย์ให้เข้าใจว่าเป็น cDNA ของโควิด-19 ร่างกายสร้างแอนติบอดีต่อเชื้อโควิค 19 กำหนดฉีด 2 ครั้ง ห่างกัน 3-4 สัปดาห์ เก็บในอุณหภูมิตู้เย็น
ข้อดี ผลิตได้จำนวนมากได้ง่ายเพราะทำจากโรงงานเป็น DNA จะมีความคงทนกว่า จึงสามารถเก็บได้ในอุณหภูมิ 2-8 องศา ราคาจะถูก
อาการข้างเคียง มีรายงานผลข้างเคียงรุนแรง พบอาการ ไขสันหลังอักเสบ
คลังเลือด รพ.กำแพงเพชร เลือดกรุ๊ป โอ ขาดวิกฤต LINK
ขณะนี้คลังเลือดโรงพยาบาลกำแพงเพชร เลือดกรุ๊ป O ขาดวิกฤต ขอเชิญชวนทุกท่านมาร่วมบริจาคเลือดกันค่ะ
- ปล.กรุ๊ป A B AB ก็ยังขาดแคลนอยู่นะคะ สามารถมาบริจาคเลือดได้เช่นกันค่ะ
- ห้องรับบริจาคโลหิต รพ.กพ. ตึก 3 ชั้น 2
- โทร. 055 022 000
- เปิดบริการทุกวัน ตั้งแต่เวลา 08.00 น. - 15.30 น.
งานธนาคารเลือด รพ.ระยอง LINK
งานธนาคารเลือด โรงพยาบาลระยอง
เปิดรับบริจาคโลหิตตามวัน และเวลา ดังนี้
เฉพาะวันจันทร์ วันพุธ วันศุกร์ และวันเสาร์
เวลา เช้า 08.30-11.30 น. บ่าย 13.00-16.00 น.
ธนาคารเลือด
โทรศัพท์ 038-611104 ต่อ 2079-2081
วันอังคารและวันพฤหัสบดี งดรับบริจาคภายใน รพ.ระยอง
เนื่องจากออกหน่วยเคลื่อนที่ร่วมกับเหล่ากาชาดจังหวัดระยอง
ตามสถานที่ที่เหล่ากาชาดกำหนด เวลา 09.00-12.00 น.
วันอาทิตย์หยุด
หน่วยรับบริจาคโลหิตเคลื่อนที่
ตารางออกหน่วยรับบริจาคโลหิตงานธนาคารเลือด รพ.ระยอง
ด่วน! รพ.ตราด ต้องการเลือดทุกกรุ๊ป เป็นจำนวนมาก LINK
ด่วน ! รพ.ตราด ต้องการเลือดทุกกรุ๊ป เป็นจำนวนมาก / เนื่องจากสถานการณ์ COVID-19 /
เชิญชวนบริจาคเลือดกัน
งานธนาคารเลือด ชั้น 2 ตึกผู้ป่วยนอกค่ะ
เนื่องด้วยสถานการณ์ COVID-19 ทำให้หน่วยรับบริจาคโลหิตตลอดทั้งเดือนมกราคม 2564 ถูกยกเลิกทั้งหมด
- ขอเชิญชวนผู้มีสุขภาพดี ไม่มีความเสี่ยง ไม่ได้ไปพื้นที่เสี่ยง COVID-19 ตาม Timeline ผู้ติดเชื้อ บริจาคโลหิตเพื่อเป็นโลหิตสำรองในเดือนมกราคม 2564 นี้ค่ะ ขอบคุณค่ะ
ติดต่อ งานธนาคารเลือด รพ.ตราด (Blood Bank Trat Hospital)
โทร 039-511040 ต่อ 210
วันเวลาทำการ วันจันทร์ - ศุกร์
เวลา 8.30 -12.00 น. และ 13.00 - 16.30 น.
อาคารเฉลิมพระเกียรติชั้น 2 (ตึกผู้ป่วยนอก) ธนาคารเลือด โรงพยาบาลตราด
รพ.พระพุทธบาท ขอรับบริจาคเลือด กรุ๊ป A.B,O และ AB ด่วน!!!! LINK
โรงพยาบาลพระพุทธบาท ขอรับบริจาคเลือด กรุ๊ป A.B,O และ AB ด่วน!!!!
ขอเชิญบริจาคโลหิตได้ที่ ห้องธนาคารเลือด
ชั้น 2 อาคารเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา
วันจันทร์ - วันศุกร์ ตั้งแต่เวลา 08.30-15.00 น.
สอบถามรายละเอียดเพิ่มเติมได้ที่ 036-268215-8 ต่อ 4028
ธนาคารกสิกรไทย
ธนาคารกสิกรไทย
ขอแจ้งเหตุการณ์ COVID-19
เนื่องจากสถานการณ์ไวรัส COVID-19
ธนาคารจึงขอแจ้งเลื่อนเวลาปิดทำการสาขา
ในห้างสรรพสินค้าทั่วประเทศเป็น 18:00 น.
ตั้งแต่วันที่ 4 มกราคม 2564 เป็นต้นไป
เชิญร่วมบริจาคโลหิตที่ ธนาคารเลือด วชิรพยาบาล LINK
ขอเชิญร่วมบริจาคโลหิต "ให้เลือด=ให้ชีวิต" ช่วยเหลือผู้ป่วยที่มีความต้องการใช้เลือด
เนื่องจากขณะนี้ มีปริมาณเลือดสำรองในเกณฑ์ ขาดแคลน ในหมู่เลือด O และ A อย่างเร่งด่วน (รับทุกหมู่เลือด)
เปิดให้บริการทุกวันจันทร์-ศุกร์ 8-16 น.
ณ ธนาคารเลือด ชั้น 3 อาคารพยาธิวิทยา วชิรพยาบาล
*หากต้องการมาบริจาคเป็นหมู่คณะ โปรดนัดหมายล่วงหน้า เพื่ออำนวยความสะดวกตาม social distancing
สอบถามเพิ่มเติมได้ที่ โทร. 02244-3126-8
ก่อนที่ A จะรู้ตัวว่าป่วย ได้เดินทางไปพบกับ C แต่ระหว่างทาง A ได้มีโอกาสไปพบกับกลุ่มคนอื่นๆ คือ กลุ่ม B ในที่ต่างๆ ในที่สาธารณะ
รวมเบอร์โทรสำหรับเลื่อนนัดห้องตรวจ
รวมเบอร์โทรสำหรับเลื่อนนัดห้องตรวจโรงพยาบาลราชวิถี [Update หมายเลขโทรศัพท์ภายใน]
2. เตรียมเอกสารก่อนการเดินทาง
เตรียมเอกสารก่อนการเดินทาง เช่น แบบฟอร์ม COVID (ถ้ามี) หนังสือเดินทาง วีซ่า Self Declaration Form
*เอกสารมีความแตกต่างกันในแต่ละประเทศปลายทาง
Controlled areas
Controlled areas (eight provinces, down from 20): (region by region) Central: Bangkok, Nakhon Pathom, Nonthaburi, Pathum Thani, Samut Prakan, Samut Songkhram, and West: Ratchaburi, and Tak.
Controlled areas
Reopening with strict disease control measures allowed for:
- Entertainment venues of all types including pubs, bars and karaoke shops, but dining-in and the sale and consumption of alcoholic drinks must stop at 23.00 Hrs. Music performances are allowed, but dancing is prohibited.
- Restaurants and eateries, but sales and consumption of alcoholic beverages must end at 23.00 Hrs.
- Shopping malls, department stores, community malls, supermarkets and convenience marts can resume normal operating hours, but crowd activities are prohibited.
- Screening in place for Thai travellers, especially those from the maximum and high controlled areas.
- Bath and massage parlours, but with a limited number of customers.
- Spas and Thai traditional massage shops, but with a limited number of customers.
- Indoor gyms and fitness centres and boxing stadiums. Competitions can be organised with a limited number of audiences.
Closure orders remain in place for:
X Gambling venues of all types, including fighting cock and bull venues.
การทำงานของสารแคนนาบินอยด์ LINK
การทำงานของสารแคนนาบินอยด์
สารแคนนาบินอยด์ออกฤทธิ์ โดยการจับกับตัวรับ CB ที่รับสารนี้โดยเฉพาะ ตัวรับสารแคนนาบินอยด์เป็นหนึ่งในกลุ่มตัวรับที่จับคู่กับ จีโปรตีน (G-protein-coupled receptors) ในปัจจุบันพบว่ามีตัวรับสารแคนนาบินอยด์ 2 ชนิด (CB1 และ CB2) ที่สามารถยืนยันได้
ตัวรับ CB2 ส่วนใหญ่พบได้ ในเซลล์บางชนิดของระบบภูมิคุ้มกัน ระบบทางเดินอาหาร และในอวัยวะที่เกี่ยวข้องกับระบบภูมิคุ้มกัน เช่น ม้าม และต่อมทอนซิล
สารไฟโตแคนนาบินอยด์ THC จะกระตุ้นตัวรับ CB1 และ CB2 ซึ่งส่งผลควบคุมต่อกิจกรรมในระบบกายภาพต่าง ๆ เมื่อเปรียบเทียบกับ THC แล้ว CBD จะมีความสามารถในการจับกับตัวรับ CB น้อยกว่าและทำหน้าที่ยับยั้งกิจกรรมของตัวรับเป็นหลัก
ตัวอย่างเช่น ตัวรับ CB1 มีอยู่ ในพื้นที่สมองหลายส่วนซึ่งควบคุมการทำงานของสมองและพฤติกรรม สารแคนนาบินอยด์มีผลต่อการตอบสนองทางประสาทสัมผัสและและการสั่งการ (การเคลื่อนไหว) อัตราการเต้นของหัวใจ การตอบสนองทางอารมณ์ ความอยากอาหารและอาการคลื่นไส้หรืออาเจียน ความไวต่อความปวด การเรียนรู้ การจดจำและการตัดสินใจขั้นสูง
หากมีความรู้ความเข้าใจเกี่ยวกับการพัฒนาของ ECS ในมนุษย์มากขึ้น เราก็จะสามารถทำความเข้าใจการทำงานของสารไฟโตแคนนาบินอยด์ THC, CBD และสารแคนนาบินอยด์ชนิดอื่น ๆ ได้ดียิ่งขึ้นเช่นกันซึ่งความรู้ความเข้าใจนี้จะนำไปสู่การคิดค้นยาที่ดีขึ้น
[Cannabit Addict]
โรตีกัญชา ชาชัก สูตรกัญชาออแกนิค ร้าน Klab Tani (กลับ-ตานี)
โรตีกัญชา ชาชัก สูตรกัญชาออแกนิค ร้าน Klab Tani (กลับ-ตานี) "เจ้าแรกในประเทศไทย" กับเมนูสุดฮอต
- (กัญ)ชาชักกลับ-ตานี
- โรตีธรรมดา โรตีกัญชาอบชีส
- คอนเฟลก กัญชาคาราเมล
- น้ำสมุนไพร อัญชันมะนาว กระเจี๊ยบ
ไปช้าอด เพราะหมดตั้งแต่หัวบ่าย แฟนคลับติดใจหรือคาใจ โทรไปถาม ตามไปชิมต่อที่ร้านได้นะฮะ
ศ.นพ.ยง ภู่วรวรรณ
หัวหน้าศูนย์เชี่ยวชาญเฉพาะทางด้านไวรัสวิทยาคลินิก
ขอเรียนก่อนว่า ในการฉีดวัคซีนจำนวนมาก โอกาสที่จะเกิดอาการไม่พึงประสงค์ หรืออาการอื่นๆ หรือโรคอะไรก็ตามแต่ ร่วมด้วยกับการฉีดวัคซีน สามารถเกิดขึ้นได้ เมื่อเกิดอะไรเกิดขึ้น จะต้องพิสูจน์ สอบสวน ว่าโรคหรืออาการนั้น ว่ามีความเกี่ยวข้องกับวัคซีนหรือไม่ ตามที่ทราบกันในข่าวว่ามีการชะลอการใช้หลังจากที่พบว่ามีการเกิดลิ่มเลือด ขออธิบายเนื่องจากหลายท่านอาจไม่เข้าใจว่าโรคนี้คืออะไร
การเกิดลิ่มเลือดคืออะไร อธิบายโดย เมื่อขึ้นเครื่องบิน หรือนั่งนานๆ หรือนอนนานๆ โอกาสที่เลือดจะเกิดการแข็งตัวในหลอดเลือดดำ เมื่อแข็งตัวแล้ว มีโอกาสที่จะหลุดไปอุดอยู่ในปอด ทำให้เลือดดำไม่สามารถไหลกลับเข้าปอดได้ โดยเฉพาะเมื่อเป็นก้อนใหญ่ๆ อาจจะทำให้เกิดอันตรายถึงชีวิต อุบัติการณ์นี้จะพบมากในคนเชื้อชาติแอฟริกันและยุโรป มากกว่าเอเซีย โดยปกติแล้วจะพบว่ายุโรปพบมากกว่าเอเซีย 3 เท่า เราเชื่อว่าปัจจัยด้านพันธุกรรมเข้ามาเกี่ยวข้องกับโรคนี้ โรคนี้พบได้อยู่แล้วในยามปกติ
แน่นอนในการฉีดวัคซีนในภาวะนี้ ซึ่งฉีดไปแล้วถึง 3 ล้านโดส ปรากฏว่ามีผู้ป่วยเกิดลิ่มเลือดในหลอดเลือดดำ 22 ราย เสียชีวิต 1 ราย อุบัติการณ์โอกาสการเกิด 7 ใน ล้านราย ต้องสอบสวนว่าเหตุการณ์ที่เกิดขึ้นเกิดในภาวะปกติในคนธรรมดาที่ถึงแม้ไม่ได้ฉีดวัคซีนหรือไม่ เท่ากันหรือปล่าว ถ้าพบว่าฉีดวัคซีนแล้วเกิดมากกว่าปกติ ก็ต้องไปหาสาเหตุว่าวัคซีนไปทำให้เกิดอะไร ที่ทำให้ลิ่มเลือดแข็งตัวได้
ยกตัวอย่าง ฉีดวัคซีนให้คนไข้คนนึง คนไข้เดินออกไปนอก รพ. แล้วเดินตกท่อ จะอธิบายว่าการเดินตกท่อเป็นอาการไม่พึงประสงค์ก็ได้ จึงต้องสอบสวนหาสาเหตุว่าเกี่ยวข้องกับวัคซีนหรือไม่ อาจจะเกี่ยวหรือไม่เกี่ยวก็ได้ ถ้าสอบสวนแล้ว พบว่าคนไข้เดินสะดุดแล้วตกท่อ แน่นอนอย่างนี้ไม่เกี่ยวกับวัคซีน แต่หากบอกว่าฉีดวัคซีนแล้วเวียนหัว ทำให้เดินตกท่อ ก็ต้องไปหาสาเหตุว่าเวียนหัวนี้ เกี่ยวกับวัคซีนหรือปล่าว
ยกตัวอย่างการฉีดวัคซีนไฟเซอร์ในนอร์เวย์ พบว่ามีคนเสียชีวิต 28 คน ต่อมาพบว่าใน 28 คนนี้ ส่วนใหญ่เกิดในผู้สูงอายุ ในสถานพักคนชรา และพบว่าอายุมากกว่า 80 เมื่อตรวจสอบลึกลงแล้วพบว่าไม่เกี่ยวกับวัคซีนไฟเซอร์ การฉีดก็ดำเนินต่อไป
ในการเลื่อนครั้งนี้ไม่ได้บอกว่าวัคซีนไม่ดี ไม่ได้หมายถึงว่าวัคซีนมีปัญหา เป็นการเลื่อนเพื่อดูสถานการณ์ ดูผลพิสูจน์ว่ามีความเกี่ยวข้องหรือไม่เกี่ยวข้องกับวัคซีน ถ้าเกี่ยวข้องแล้ว เกี่ยวข้องเฉพาะ Batch นั้น เพราะเรารู้ว่าวัคซีนที่ใช้ในยุโรปกับเอเซียนั้นคนละ Batch กันแน่นอน ของยุโรปจะใช้ที่ผลิตในยุโรป ส่วนของเราจะเป็นที่ผลิตในเอเซีย และประเทศไทยไม่ได้เป็นประเทศเสี่ยงสูง การชะลอไป 1-2 สัปดาห์ ไม่ส่งผลกระทบมากมาย
ทำไมถึงเปลี่ยน มาเพิ่มเมนูกัญชาเข้ามา
สนใจเรื่องสรรพคุณมานานแล้วพอรัฐปลดล๊อค เลยอยากเอาภาพลักษณ์ของกัญชาที่คนเคยมองว่าเป็นยาเสพติด มาเปลี่ยนเป็นอาหารในบรรยากาศคาเฟ่ เพื่อให้คนเข้าถึงได้ง่ายและดูให้เป็นมิตรกับทุกคนใครปลูกกัญชาได้บ้าง? ตาม พ.ร.บ. ยาเสพติดให้โทษ พ.ศ. 2562 ฉบับที่ 7
See Doctor Now เหมือนมีหมออยู่ เคียงข้างคุณ
See Doctor Now โรงพยาบาลในรูปแบบเทคโนโลยี
บริการครบครันทั้งแพทย์เฉพาะทาง และนักจิตวิทยา เภสัชกร พยาบาลและนักโภชนาการ ให้คุณได้เหมือนเข้ารับการรักษาจากโรงพยาบาลจริงที่มีความน่าเชื่อถือ และไว้วางใจได้และยังสามารถเข้าถึงประวัติการรักษาของตัวคุณเองและครอบครัวได้อย่างปลอดภัย
เหมือนมีหมออยู่ เคียงข้างคุณ
- ปรึกษาแพทย์ได้ทันทีต้องการ ไม่ต้องเสียเวลาเดินทาง และรอคิว เหมือนมีแพทย์และพยาบาลประจำตัว สุขภาพกาย สุขภาพใจ
- เราเลือกหมอที่ดี ที่สุดมาเพื่อคุณ ทีมแพทย์เฉพาะทางหลากหลายสาขา และนักจิตวิทยาที่ผ่านการคัดเลือก มาอย่างดี เพื่อรองรับทุกความ ต้องการของคุณ ให้คุณได้รับ การรักษาที่มีประสิทธิภาพสูงสุด
- พยาบาลที่พร้อมดูแลคุณ พยาบาลที่พร้อมจะช่วยเหลือคุณ ในทุกๆ ด้าน และเลือกแพทย์เฉพาะทาง หรือ นักจิตวิทยาให้ตรงกับความต้องการ
Download
กทม.ข้าวสาร จัดสงกรานต์ 3 วัน 13-15 เมย 64
สมาคมผู้ประกอบธุรกิจถนนข้าวสาร เปิดเผยว่า ะจัดงานสงกรานต์ ในช่วงวันที่ 13-15 เมษายนนี้ เบื้องต้น ช่วงเช้าวันแรก (13 เม.ย.) จะเป็นประเพณีไทย มีการตักบาตรและทำบุญร่วมกัน โดยทั้ง 3 วันจะเปิดให้เล่นน้ำได้เฉพาะช่วงเวลา 15.00 น.- 20.00 น. ส่วนช่วงเวลาอื่นเป็นการเปิดให้นั่งรับประทานอาหาร เครื่องดื่ม และเดินเที่ยวซื้อของภายในถนนข้าวสาร ซึ่งจะมีการเข้มงวดในมาตรการป้องกันการแพร่ระบาดของโควิด-19 เต็มที่ ตั้งจุดตรวจอุณหภูมิ ห้ามเล่นเครื่องเล่นอันตราย และอาจกำหนดจำนวนคนที่เข้ามาหมุนเวียนในถนนข้าวสาร ในแต่ละช่วง ประมาณ 5,000 คน (รายละเอียดอาจเปลี่ยนแปลง โปรดติดตาม)ชลบุรี งดจัดงานนมัสการพระพุทธสิหิงค์ฯ และงานสงกรานต์จังหวัดชลบุรี ประจำปี 2564
ทรีทเม้นท์สปากัญชาไทย โปรโมชั่นสปา
โปรโมชั่นสปา
ลด 10% เมื่อใช้บริการทรีทเม้นท์สปากัญชาไทย ช่วง 9-10 น.
ลด 20% เมื่อซื้อทรีทเม้นท์สปากัญชาไทยต่อเนื่องกัน ลดทันทีแพคเกจที่ 2 จำนวน 20% (คน/ครั้ง)
ลด 30% เมื่อซื้อทรีทเม้นท์สปากัญชาไทยครบ 5 รายการ (อายุ 3 เดือน)
เชียงราย - มาตรการนี้สำหรับผู้เดินทางกลับภูมิลำเนาเขตจังหวัดเชียงราย ที่มาจากพื้นที่ควบคุม LINK
มาตรการนี้สำหรับผู้เดินทางกลับภูมิลำเนาเขตจังหวัดเชียงราย ที่มาจากพื้นที่ควบคุม (กรุงเทพฯ, สมุทรสาคร สมุทรปราการ สมุทรสงคราม นนทบุรี นครปฐม ปทุมธานี ตาก ราชบุรี) และเชียงใหม่ (9 เม.ย.64 เวลา 10.00 น.) ***กรณีที่เป็นนักท่องเที่ยว หรือผู้เดินทางไปปฏิบัติภารกิจที่จังหวัดเชียงราย "ไม่ต้องกักตัว" แต่ให้เฝ้าระวังสังเกตอาการตนเอง 14 วัน หรือเท่ากับอยู่ในพื้นที่จังหวัดเชียงราย ตามคำสั่งคณะกรรมการโรคติดต่อจังหวัดเชียงราย ที่ 13/2564 ลงวันที่ 8 เม.ย.64***
เพจ
สสจ.เชียงรายSILKSPAN แจกฟรี! ประกันชีวิต COVID-19 LINK
รับประกันโดย บริษัท ไทยประกันชีวิต จำกัด(มหาชน)
- รับความคุ้มครอง 100,000 บาท กรณีเสียชีวิตจากการติดเชื้อไวรัส COVID-19
- รับความคุ้มครอง 1,000 บาท กรณีเสียชีวิตทุกกรณี
- อายุผู้สมัคร ตั้งแต่อายุ 16-60 ปี
- ฟรี! ไม่มีค่าใช้จ่าย 100%
สมัครเตรียมพร้อมรับโควิด-19 ระลอกใหม่ LINK
สาเหตุการแพร่ระบาดของระลอกใหม่
เกิดจากผู้ป่วยที่มีการหลุดรอดจากระบบคัดกรองเข้ามาตาม
ช่องทางต่าง ๆ ที่ผิดกฎหมาย การป้องกันการแพร่ระบาดระลอกใหม่ จึงควรมีมาตรการสืบค้นผู้ป่วยหล่นี้ที่มีโอกาสเข้ามาในที่ชุมชน โดยเฉพาะประเทศเพื่อนบ้านที่ยังมีการระบาดของโควิด-19
การป้องกันซื้อโควิด- 19 กลายพันธ์
เชื้อกลายพันธุ์ในระลอกใหม่ ทำให้การติดเชื้อมีง่ายมากขึ้น แต่ความรุนแรงของอาการไม่แตกต่างจากเดิมมากนัก การป้องกันการติดเชื้อทางเดินหายใจจึงเป็นสิ่งที่เราต้องเคร่งครัดมากขึ้น เช่น สวมหน้ากากอนามัย ล้างมือบ่อย ๆ และลดระยะวลาอยู่ในพื้นที่เสี่ยง
การรักษาโรคโควิด-19
เนื่องจากมีการพัฒนาองค์ความรู้กี่ยวกับโรคโควิด-19 พิ่มมากขึ้น ทำให้ผู้ป่วยที่ขรับการรักษาในห้องไอซียูมีอัตราการเสียชีวิตลดลง การรณรงให้สวมหน้กากอนามัยและล้างมือบ่อย ๆ จึงเป็นมาตรการที่สำคัญอย่างยิ่งในช่วงที่กำลังรอวัคซีนโควิด-19
ข้อมูล ณ วันที่ 4 มกราคม 2564
ที่มา : ผศ. นพโอภาส พุทธเจริญ
ไม่รักเธอประเทศไทย แล้วจะไปรักใคร
Copenhagen Airport (CPH) (Kastrup, Denmark) ไม่รักเธอประเทศไทย แล้วจะไปรักใคร ถุงยังชีพจากสถานทูตไทยที่ออสโล ร้านสะดวกซื้อที่สนามบินโคเปนเฮเกน flat white อร่อย และ ป้าม่วงของเรา
13 ธันวาคม 2020
รู้ตัวว่าเสี่ยงโควิด19 ต้อง สแกนแบบประเมินความเสี่ยง
สรุป มติ ศบค.ชุดใหญ่
[[[[ ไม่มีเคอร์ฟิว ]]]]
ศบค.มีมติเห็นชอบมาตรการยกระดับการควบคุมโรคโควิด-19 ดังนี้
1. ปรับโซนสีของพื้นที่ เป็นระยะเวลา 14 วัน
ตั้งแต่เวลา 00.00 น.ของวันที่ 18 เมษายน 2564 จนถึงวันที่ 30 เมษายน 2564
แบ่งออกเป็น
โซนสีแดง หรือ พื้นที่ควบคุมสูงสุด จำนวน 18 จังหวัด ได้แก่ กรุงเทพมหานคร เชียงใหม่ ชลบุรี สมุทรปราการ ประจวบคีรีขันธ์ สมุทรสาคร ปทุมธานี นครปฐม ภูเก็ต นครราชสีมา นนทบุรี สงขลา ตาก อุดรธานี สุพรรณบุรี สระแก้ว ระยอง และขอนแก่น
โซนสีส้ม หรือ พื้นที่ควบคุมขั้นสูง จำนวน 59 จังหวัดที่เหลือ
ศบค.ขอความร่วมมือ
- ประชาชนที่อยู่ในพื้นที่โซนสีแดง 18 จังหวัด ห้ามออกนอกเคหสถานตั้งแต่เวลา 23.00 น. จนถึงเวลา 04.00 น.ของวันรุ่งขึ้น
- ขอความร่วมมือประชาชนให้ลดการเดินทาง หรือ เดินทางเท่าที่จำเป็น
- ห้างสรรพสินค้าและร้านอาหารปิดให้บริการเร็วขึ้น
- ส่วนร้านสะดวกซื้อให้ปิดในเวลาไม่เกิน 23.00 น.
2. ปิดสถานบันเทิง ผับ บาร์ อาบอบนวด ทุกจังหวัด
3.ร้านอาหาร นั่งรับประทานในร้านได้ งดจำหน่ายและงดดื่มเครื่องดื่มแอลกอฮอล์ โดยจังหวัดพื้นที่โซนสีแดง 18 จังหวัด เปิดไม่เกินเวลา 21.00 น. และจังหวัดพื้นที่โซนสีส้ม 59 จังหวัดที่เหลือเปิดไม่เกิน 23.00 น.
4.งดกิจกรรมที่มีคนรวมกลุ่มกันเกิน 50 คน กรณีที่จำเป็นให้ขออนุญาตต่อคณะกรรมการโรคติดต่อจังหวัดหรือกรุงเทพมหานคร (กทม.)
5.งดกิจกรรมงานเลี้ยง สังสรรค์ ยกเว้นสมาชิกในครอบครัวเดียวกัน
6.งดการเรียนการสอนในห้องเรียน
7.ปิดสวนสนุกและงดเล่นเครื่องเล่นในห้างสรรพสินค้า
8. ขอความร่วมมือภาครัฐและภาคเอกชน Work from Home ให้มากที่สุด
9. ปฏิบัติตามมาตรการองค์กร DMHTT อย่างเคร่งครัด คือ การเว้นระยะห่าง สวมหน้ากากอนามัย 100% ล้างมือบ่อยๆ ตรวจวัดอุณหภูมิ และสแกนไทยชนะและหมอชนะ แยกกันรับประทานอาหาร
สำหรับผู้ที่เดินทางไปต่างจังหวัด ขอความร่วมมือ Work from Home เพื่อสังเกตอาการระยะเวลา 14 วัน
ประชาชาติ 16 เมย 64
กลัวเรื่องสายพันธุ์?
ถ้าจะกลัวเรื่องสายพันธุ์...กลับมาถามตนเองว่ามีวินัยหรือไม่?
จะสายไวรัส ไหนๆ ถ้ามีวินัย รักษาระยะห่าง ไวรัส ทำอะไรเราไม่ได้เด็ดขาด ....รับรอง
11 เมย 64High flow nasal canula
High flow nasal canula เครื่องมือสำคัญในการรักษาผู้ป่วย ปอดอักเสบที่มีภาวะออกซิเจนในเลือดต่ำ
*ภาพจากเพจ รพ.นครพิงค์3.ถ้าประเมินแล้วมีความเสี่ยงสูง
3.1 ให้ติดต่อโรงพยาบาลตามสิทธิ์การรักษาของท่านทันที
ถ้าประเมินแล้วเสี่ยงระดับกลางหรือต่ำ
ไม่มีความจำเป็นต้องมาตรวจ เพราะการเดินทางไปรพ.โดยไม่จำเป็นอาจเพิ่มความเสี่ยงในการติดเชื้อ
23 เมย 64
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
ผู้ป่วยรายใหม่ 2,070 ราย
ผู้ป่วยยืนยันสะสม 50,183 ราย
หายป่วยแล้ว 30,189 ราย
เสียชีวิตสะสม 121 ราย
News
วันนี้พบผู้ป่วย 2,070 ราย
มาจากตรวจที่รพ.1,902 ราย
ตรวจค้นหาเชิงรุก 160 ราย
มาจากต่างประเทศ 8 ราย
1.รักษาตัวในรพ. 15,642 ราย
รพ.สนาม 4,231 ราย
อาการหนัก 352 ราย
ใส่ท่อช่วยหายใจอีก 91 ราย
2.ความคืบหน้าในการฉีดวัคซีนตั้งแต่ 28 ก.พ.- 22 เม.ษ.64 สะสม 964,825 โดส (เพิ่มจากเมื่อวาน 99,985 โดส เกือบ 100,000 โดส!!)
2.1 กรุงเทพมหานคร มีการฉีดวัคซีนสะสม 194,640 โดส (เพิ่มจากเมื่อวาน 7,582 โดส)
3.การรายงานผู้ติดเชื้อแต่ละจังหวัด
3.1 กทม. +740 ราย สะสม 5,515 ราย
3.2 เชียงใหม่ + 237 ราย สะสม 2,834 ราย
3.3 ชลบุรี + 125 ราย สะสม 1,665 ราย
3.4 ประจวบคีรีขันธ์ + 44 ราย สะสม 941 ราย
3.5 นนทบุรี +29 ราย สะสม 940 ราย
3.6 สมุปราการ +79 ราย สะสม 905 ราย
3.7 สมุทรสาคร +48 ราย สะสม 544 ราย
3.8 นราธิวาส +26 ราย สะสม 467 ราย
3.9 ปทุมธานี +41 ราย สะสม 410 ราย
3.10 สงขลา +17 ราย สะสม 365 ราย
3.11 ระนอง + 35 ราย สะสม 343 ราย
3.12 นครราชสีมา +69 ราย สะสม 342 ราย
3.13 นครปฐม +24 ราย สะสม 315 ราย
3.14 สุราษฎร์ธานี +38 ราย สะสม 310 ราย
3.15 เพชรบุรี +22 ราย สะสม 275 ราย
3.16 ภูเก็ต +22 ราย สะสม 272 ราย
3.17 ลำปาง +9 ราย สะสม 163 ราย
3.18 อุบลราชธานี +9 ราย สะสม 160 ราย
ณัฐพล โพธิ์คำ
รายละเอียดผู้เสียชีวิตของประเทศไทย วันที่ 23 เมษายน 2564
รายที่ 118 (ระลอกใหม่เดือนเมษายน รายที่ 24)
ชายไทย อายุ 72 ปี
ปฏิเสธโรคประจำตัว
ที่อยู่ขณะป่วย : กทม.
--------------------
รายที่ 119 (ระลอกใหม่เดือนเมษายน รายที่ 25)
ชายไทย อายุ 74 ปี
โรคประจำตัว : ความดันโลหิตสูง และโรคหัวใจเต้นผิดจังหวะ
ที่อยู่ขณะป่วย : จ.สงขลา
--------------------
รายที่ 120 (ระลอกใหม่เดือนเมษายน รายที่ 26)
หญิงไทย อายุ 29 ปี
โรคประจำตัว : โรคอ้วน
ที่อยู่ขณะป่วย : จ.สมุทรปราการ
--------------------
รายที่ 121 (ระลอกใหม่เดือนเมษายน รายที่ 27)
ชายไทย อายุ 83 ปี
โรคประจำตัว : เบาหวาน ความดันโลหิตสูง ไตเรื้อรัง และโรคหัวใจ
ที่อยู่ขณะป่วย : จ.สมุทรปราการ
สีแดงเข้ม พื้นที่ควบคุมและเข้มงวดสูงสุด 6 จังหวัด
กทม ชลบุรี เชียงใหม่ นนทบุรี ปทุมธานี สมุทรปราการ
สีแดง พื้นที่ควบคุมสูงสุด 45 จังหวัด
สีส้ม พื้นที่ควบคุม 26 จังหวัด
3. ถ่ายภาพบัตรประชาชนและภาพตัวเองกับบัตร
เป็นขั้นตอนอัพโหลดรูปถ่าย เพื่อการยืนยันตัวตน
- ถ่ายรูปบัตรประชาชน
- ถ่ายรูปตัวเอง คู่กับบัตรประชาชน ถ่ายเซลฟี่
ถ้าถ่ายสำเร็จ จะมีรูปที่ถ่ายไปแสดง
ถ้าไม่ชอบ จะถ่ายใหม่ กดปุ่มยกเลิก แล้วถ่ายใหม่ได้
ขั้นที่ 2 : ฝึกการหายใจโดยการเป่าปาก
ขั้นที่ 2 : ฝึกการหายใจโดยการเป่าปาก
2.1 เริ่มต้นจากการหายใจเข้าทางปากหรือจมูกก็ได้
2.2 จากนั้นหายใจออกโดยการห่อปาก (ทำปากจู๋) เหมือนกำลังเป่าเทียน
2.3 หายใจเป่าออกช้าๆ ยาวๆ ในจังหวะที่รู้สึกสบาย
2.4 เมื่อหายใจออกสุด ให้หายใจเข้าอีกครั้ง
2.5 หายใจออก โดยการเป่าปากซ้ำไปเรื่อยๆ
เท็กซัส ชิคเก้น แจกไก่ทอดคิกคิก ฟรี LINK
เท็กซัส ชิคเก้น แจกไก่ทอดคิกคิก ฟรี
แอดขอเป็นส่วนหนึ่งที่ส่งต่อความห่วงใย ให้ประเทศไทยพ้นวิกฤต COVID-19 เร็วๆนะครับ Texas Chicken แจกฟรี "ไก่คิกคิก 1 กล่อง มูลค่า 35 บาท" ให้กับทุกท่าน จำนวน 50,000 สิทธิ์ มูลค่ารวม 1,750,000 บาท ตั้งแต่ 20 พ.ค. 64 – 30 มิ.ย. 64
เพียงนำหลักฐานการฉีดวัคซีน COVID-19 และอย่าลืม Add Line Friend เพื่อกดรับคูปอง แล้วมารับได้ที่ Texas Chicken ทุกสาขา(จำกัด 1 สิทธิ์ ต่อ 1 ท่านเท่านั้น)
ข้อแนะนำสำหรับสตรีตั้งครรภ์ และสตรีที่ให้นมบุตร LINK
ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย ออกประกาศ ที่ 06/2564 เรื่อง การฉีดวัดซีนป้องกันโรคโควิด-19 ในสตรีตั้งครรภ์หรือสตรีให้นมบุตร
เนื่องด้วยสถานการณ์การแพร่ระบาดของโรคโควิต-19 ในประเทศไทย ในช่วงนี้มีผู้ติดเชื้อเป็นจำนวนมากและแพร่กระจายไปหลายพื้นที่อย่างรวดเร็ว สตรีตั้งครรภ์ที่ติดเชื้อโควิด-19 อาจหายได้เอง หรือมีอาการรุนแรงถึงชั้นเสียชีวิตได้ จากการทบทวนการศึกษาขนาดใหญ่ของหลายประเทศทั่วโลก พบว่า สตรีตั้งครรภ์ที่ติดเชื้อโควิด-19 มีความเสี่ยงที่โรคจะรุนแรงกว่าคนทั่วไป และมีโอกาสต้องเข้ารักษาในหอผู้ป่วยวิกฤติ (Intensive care unit, ICU) เพิ่มขึ้น ต้องใช้เครื่องช่วยหายใจ (mechanical ventilation) เพิ่มขึ้น นอกจากนี้ยังเพิ่มความเสี่ยงต่อการเกิดผลการตั้งครรภ์ที่ไม่พึงประสงค์ เช่น ครรภ์เป็นพิษ เลือดแข็งตัวผิดปกติ ทารกตายในครรภ์ ทารกเกิดก่อนกำหนด ทารกน้ำหนักตัวน้อย ทารกติดเชื้อและต้องเข้ารักษาในหอผู้ป่วยทารกแรกเกิดวิกฤติสูงขึ้น
ดังนั้นสตรีตั้งครรภ์จึงถือเป็นกลุ่มที่จะได้รับประโยชน์จากการฉีดวัคซีนป้องกันโรคโควิต -19 เพื่อลดการติดเชื้อ ลดการเกิดโรคที่รุนแรงและลดการเสียชีวิต แม้ว่าข้อมูลด้านความปลอดภัยของการฉีดวัคซีนในสตรีตั้งครรภ์ยังมีจำกัด แต่ยังไม่พบหลักฐานที่บ่งชี้ว่าวัคซีนจะก่อให้เกิดอันตรายแก่สตรีตั้งครรภ์สูงกว่าคนทั่วไป การฉีดวัคซีนจึงมีประโยชน์มากกว่าความเสี่ยงที่จะเกิดจากผลข้างเคียงของวัคซีน ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทยจึงมีข้อแนะนำ ดังนี้
1. สตรีตั้งครรภ์สามารถเข้ารับการฉีดวัคซีนได้ ยกเว้นกรณีที่มีข้อห้าม เช่น มีอาการแพ้รุนแรง
จากการฉีดครั้งแรก
2. ระยะเวลาที่ควรฉีดวัคซีนคือ หลังอายุครรภ์ 12 สัปดาห์ (3 เดือน)
3. สตรีที่ให้นมบุตรสามารถเข้ารับการฉีดวัคซีนได้
4. วัคซีนที่มีใช้ในประเทศไทย ในปัจจุบันนี้ มี 2 ชนิด คือ Sinovac และ AstraZeneca จากข้อมูลเบื้องตันสามารถใช้ได้ทั้งสองชนิด แต่มีข้อสังเกตว่าวัคซีน Sinovac มีอัตราการเกิดไข้หลังการฉีดน้อยกว่า AstraZeneca วัคซีนทั้งสองชนิดมีความปลอดภัยในการฉีดให้คนทั่วไปและมีประสิทธิภาพที่ใกล้เคียงกัน ในอนาคตอาจจะมีวัคซึนชนิดอื่นๆ ให้เลือกเพิ่มขึ้น
5. ควรหลีกเลี่ยงการฉีดวัคซีนป้องกันโรคโควิด-19 พร้อมกับวัคซีนชนิดอื่นๆ ยกเว้นมีความจำเป็น การฉีดวัคซึนชนิดอื่น ๆ ควรเว้นระยะห่างอย่างน้อย 2 สัปดาห์หลังจากฉีดวัคซีนป้องกันโรคโควิด-19
การฉีดวัคซีนถือเป็นความสมัครใจ สตรีตั้งครรภ์ควรได้รับคำปรึกษาถึงประสิทธิภาพและความ
ปลอดภัยของวัคซีนโดยละเอียดก่อนการตัดสินใจ
ประกาศ 21 พค 2564
ตารางที่ 3 – ระดับแอนตี้บอดี้ที่จับกับ SARS-CoV-2 ที่ตอบสนองต่อ COVID-19 Vaccine AstraZeneca (SDSD)a,b
Yellow Booklet สมุดเหลืองของเยอรมัน
Yellow Booklet สมุดเหลือง เป็นใบรับรองของเยอรมัน ออกให้ที่จุดฉีดวัคซีน ระบบจะออก QR code ซึ่งเช็คได้ผ่านแอป
CovPass app หรือ Corona-Warn-App (CWA )
Ref :
Federal Ministry of Health อบจ.สมุทรปราการ อนุมัติงบ 400 ล. ซื้อวัคซีนโควิด LINK
นันทิดา แก้วบัวสาย นายก อบจ.สมุทรปราการ คนดัง ระบุว่า สภาอบจ. อนุมัติจ่ายผ่านเงินสะสมงบประมาณปี 2564 กว่า 400 ล้านบาท เพื่อจัดซื้อวัคซีนทางเลือกป้องกันไวรัสโควิด 19 อาทิ Modena Pfizer Johnson and Johnson Sinopharm ผ่านกระบวนการตามที่รัฐบาลกำหนด ทั้งนี้เพื่อให้ชาวสมุทรปราการได้รับวัคซีนทางเลือกได้อย่างทั่วถึงและรวดเร็วที่สุด
นพ. รัฐภรณ์ อึ๊งภากรณ์ แพทย์ผู้ชำนาญการด้านผิวหนังและความงามศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ บางกระเจ้า กล่าวเพิ่มเติมว่า “โรงพยาบาลบำรุงราษฎร์ ยังมีบริบาลดูแลในช่วงการพักฟื้นภายหลังผ่าตัดอย่างต่อเนื่อง โดยมีทีมที่คอยดูแลอย่างใกล้ชิดที่ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ภายใต้โครงการรักษ ตั้งอยู่ที่บางกระเจ้า จังหวัดสมุทรปราการ ซึ่งเป็นศูนย์บูรณาการสุขภาพและการแพทย์แบบองค์รวมแห่งแรกในเอเชีย ด้วยจุดเด่นคือการผสมผสานระหว่างการนำเทคโนโลยีวิทยาศาสตร์ทางการแพทย์สมัยใหม่ (Advanced Medical Science) มาใช้ร่วมกับ ศาสตร์การแพทย์แบบองค์รวม (Holistic Wellness) ที่เน้นการดูแลสุขภาพเชิงป้องกัน และจัดโปรแกรมแบบเอ็กซ์คลูซีฟเฉพาะบุคคล ซึ่งดูแลโดยแพทย์ และผู้ชำนาญการด้านศาสตร์การแพทย์แขนงต่างๆ ไว้อย่างครอบคลุม ทั้งสุขภาพกายและสุขภาพใจ รวมไปถึงการปรับสมดุลของร่างกาย ดูแลผิวพรรณ ความงาม น้ำหนักตัว และการชะลอวัยให้ดูดีในแบบฉบับของแต่ละบุคคล”
อย่างไรก็ดี ในฐานะต้นแบบและแรงบันดาลใจของกลุ่มบุคคลที่มีความหลากหลายทางเพศ เกรซ นวรัตน์ เตชะรัตนประเสริฐ ให้ความเห็นว่า ที่ผ่านมากลุ่ม LGBTQ+ มีทางเลือกจำกัดในการเข้าถึงข้อมูลการเปลี่ยนแปลงตัวเองที่ถูกต้องจากผู้เชี่ยวชาญด้านนี้ จึงรู้สึกยินดีเป็นอย่างยิ่งที่โรงพยาบาลบำรุงราษฎร์มีวิสัยทัศน์ในการให้บริการครบวงจรเพื่อเป็นทางเลือกให้กับกลุ่ม LGBTQ+ ได้เป็นตัวของตัวเองในแบบที่ปลอดภัย และได้รับการดูแลจากแพทย์ที่มีประสบการณ์โดยตรง
สำนักงานผดุงครรภ์
แต่เดิมมีผดุงครรภ์ประจำตำบลมีอยู่เพียงตำบลที่มีสถานีอนามัยชั้น 2 เท่านั้น เช่น ตำบลห้วยทรายเหนือ อำเภอชะอำ(บ้านห้วยทรายเหนือ ตำบลชะอำ) ต่อมาความต้องการผดุงครรภ์มากขึ้น กรมอนามัยจึงสั่งให้จังหวัดจัดหาบุคคลไปศึกษาวิชาผดุงครรภ์ปีละ 2 คนหลักสูตร 1 ปี 6 เดือน แล้วกลับมาปฏิบัติงานในภูมิลำเนาของตนเองตามข้อตกลงระหว่างผดุงครรภ์กับกรมอนามัย โดยผดุงครรภ์ต้องจัดหาสำนักงานของตนเองหรือจะใช้บ้านพักของตนเองเป็นสำนักงานผดุงครรภ์ก็ได้ เช่น สำนักงานผดุงครรภ์ประจำตำหรุใช้บ้านพักเป็นสำนักงานโดยมี น.ส.เอื่อน บุญกอง เป็นผดุงครรภ์ และต่อมาได้รับการยกฐานะเป็นสถานีอนามัย และได้ย้ายสถานที่ไปสร้างใหม่ชื่อสถานีอนามัยตำหรุ ตำบลตำหรุ อำเภอบ้านลาด
การสร้างสำนักงานผดุงครรภ์ในช่วงระยะหลัง พ.ศ.2500 บางแห่งจะได้รับงบประมาณจากกระทรวงสาธารณสุข จนถึง พ.ศ.2522 จังหวัดเพชรบุรีมีสำนักงานผดุงครรภ์ทั้งสิ้น 33 แห่ง และในปี 2524 เป็นต้นมา สำนักงานผดุงครรภ์ก็ได้รับการยกฐานะเป็นสถานีอนามัยด้วยการสร้างอาคารที่ทำการให้ใหม่ พร้อมบ้านพักโดยใช้เงินงบประมาณ
ลักษณะการปฏิบัติงานของสำนักงานผดุงครรภ์ในช่วง พ.ศ.2499
- รับฝากครรภ์และดูแลมารดาก่อนการคลอด
- รับทำคลอดโดยไม่คิดมูลค่าอย่างใด
- เยี่ยมมารดาและทารกในระยะหลังคลอด
- จำหน่ายยาตำราหลวง
- ทำการป้องกันโรคล่วงหน้า
- ทำการเกี่ยวกับอนามัยโรงเรียน
- งานอื่นๆ ที่ได้รับมอบหมาย
ในระยะหลังการปฏิบัติงานของผดุงครรภ์ประจำสำนักงานผดุงครรภ์ มีลักษณะ คล้ายคลึงกับสถานีอนามัย
สำนักงานสาธารณสุขชุมชน(สสช.) เป็นสถานบริการสาธารณสุขระดับหมู่บ้าน เพื่อให้บริการสาธารณสุขที่จำเป็นแก่ประชาชนในเขตพื้นที่ที่มีการคมนาคมไม่สะดวก ประชาชนอยู่อย่างกระจัดกระจาย หรือเป็นชุมชนของชนกลุ่มน้อยที่มีขนบธรรมเนียมประเพณีและความเชื่อแตกต่างจากคนไทยทั่วไป เช่น สสช.บ้านป่าเด็ง ได้สร้างเมื่อ พ.ศ.2524 ที่บ้านป่าเด็ง ตำบลป่าเด็งอำเภอแก่งกระจาน ในขณะนั้นมีชาวกระเหรี่ยงอาศัยอยู่ ปัจจุบัน สสช.บ้านป่าเด็งได้รับการยกฐานะเป็นสถานีอนามัยขนาดใหญ่แห่งแรกของจังหวัดเพชรบุรีและเป็นสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษานวมินทรา
อบจ.ตรัง ให้เช็คสิทธิ 5-7 ก.ค.64 ผ่าน www.ตรังสู้.com LINK
วันที่ 5-7 ก.ค.64 นี้ โปรดตรวจสอบรายชื่อและยืนยันสิทธิรับวัคซีนของ อบจ.ตรัง ผ่านทาง
www.ตรังสู้.com
คนที่ลงทะเบียนขอรับวัคซีน ซิโนฟาร์ม ทุกช่องทาง
โปรดตรวจสอบรายชื่อผ่านการกรอกเลขบัตรประชาชน 13 หลัก และยืนยันสิทธิ (ระบบจะเปิดให้ตรวจสอบได้วันจันทร์ที่ 5 ก.ค.64 และสิ้นสุดวันพุธที่ 7 ก.ค.64)
เนื่องจากข้อมูลรายชื่อและผู้รับวัคซีน สำคัญต่อการส่งข้อมูลทำประกันภัยแพ้วัคซีน
หมายเหตุ:
1. มั่นใจว่าจะเข้ารับการฉีดวัคซีนของ อบจ.ตรัง
2. เลือกโรงพยาบาลที่ต้องการในพื้นที่
3. หากไม่มีการยืนยัน ถือว่าสละสิทธิ และ ดำเนินการจัดสรรผู้ที่อยู่ในบัญชีสำรองต่อไป
3 หากพบว่าติดเชื้อ มีสูตรต้องทานอย่างไร
3 ถ้าตรวจเชื้อแล้วพบว่า"ติดเชื้อ" ให้ใช้ฟ้าทะลายโจรให้เร็วที่สุด และปริมาณมากที่สุดเท่าที่จะทำได้ กล่าวคือ ถ้าผงฟ้าทะลายโจรขนาด 400 มิลลิกรัม ให้ใช้ ฟ้าทะลายโจร 5 เม็ดต่อครั้ง และ 4 ครั้งต่อวัน ยกเว้นถ้ามีไข้ หรือเจ็บคอมาก ให้กินทุก 4 ชั่วโมงจนกว่าไข้จะลดลงในวันที่ 2 จึงลดลงมาเหลือ 5 เม็ดต่อครั้งและ 4 ครั้งต่อวัน และภายใน 2 วันไม่ดีขึ้น ไม่ว่าจะด้วยติดเชื้อมาก ภูมิคุ้มกันไม่ดี หรือขนาดยาฟ้าะทะลายโจรไม่เพียงพอให้เพิ่มปริมาณเป็น 2 เท่าตัว หากภายใน 5 วันไม่ดีขึ้นให้รีบส่งตัวไปที่โรงพยาบาล
ใบอนุญาต ผลิต (ปลูก) ที่ออกโดย อย.
ใบอนุญาต ผลิต (ปลูก) ที่ออกโดย อย. โดยมี ชื่อผู้รับอนุญาตเป็น ผอ.รพ.สต. บ้านเขาแดง แต่จะมีเบอร์โทรศัพท์ เป็น ประธานวิสาหกิจที่ได้ร่วมเซ็น MOU กับ รพ.สต. พร้อมเลขที่ใบอนุญาต และวันหมดอายุใบอนุญาต
การแยกกักตัวที่บ้าน (ม.มหิดล)
จุด Drop Point ใน บริษัทเอกชน องค์กร
จุด Drop Point ของ “Youเทิร์น” ที่ตั้งอยู่ภายในพื้นที่ของบริษัทเอกชน องค์กรละ 1 Drop point ได้แก่
- อาคาร Energy Complex Building A
- บริษัท ปตท. จำกัด (มหาชน) สำนักงานใหญ่
- ตลาดหลักทรัพย์แห่งประเทศไทย
- บริษัท ดอยคำผลิตภัณฑ์อาหาร จำกัด (สำนักงานใหญ่)
- จุดรับของเครือข่าย Less Plastic Thailand
- จุดรับพลาสติกใช้แล้ว โครงการ ส่งพลาสติกกลับบ้าน
(รับเฉพาะพลาสติกใช้แล้วจากพนักงานในองค์กรเท่านั้น)
/// บริการตรวจ RT-PCR ปริมณฑล
สมุทรปราการ
วิธีตรวจ : RT-PCR
เวลาทำการ : [-]
วันทำการ : []
วันที่ให้บริการ :
ปริมาณตรวจ : บริการตรวจหาเชื้อโควิด-19 ต้องจองคิว*/วัน
สถานะ : ว่าง
โทรศัพท์ : 02-7018132
หมายเหตุ
บันทึกข้อมูลล่าสุดเมื่อ: 27 ก.ค. 64 23:18 (2 วันที่แล้ว)
โรงพยาบาลจุฬารัตน์ 3 อินเตอร์ [แผนที่]
วิธีตรวจ : RT-PCR
เวลาทำการ :
วันทำการ :
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 02-0332900
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง
บันทึกข้อมูลล่าสุดเมื่อ: 20 ก.ค. 64 19:28 (9 วันที่แล้ว)
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ [แผนที่]
วิธีตรวจ :
เวลาทำการ :
วันทำการ :
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 02-0805999
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง
บันทึกข้อมูลล่าสุดเมื่อ: -
เลขหมายประจำเขต กรุงเทพตะวันออก
เลขหมายประจำเขต กรุงเทพตะวันออก
อบจ.เชียงราย เปิดโครงการ ฮับคน เจียงฮายปิ๊กบ้าน LINK
อบจ.เชียงราย เปิดโครงการ ฮับคน "เจียงฮายปิ๊กบ้าน"
เพื่อรับพี่น้องชาวเชียงรายที่อาศัยอยู่ในพื้นที่ควบคุมสูงสุดและเข้มงวด 10 จังหวัด ป่วยด้วยโรคโควิค – 19 หรือมีผลตรวจโควิค – 19 เป็นบวก ที่มีความประสงค์ย้ายมารักษาตัวในพื้นที่จังหวัดเชียงราย กำลังจะออกเดินทางจากโรงพยาบาลสนามบุษราคัม กระทรวงสาธารณสุข เพื่อเข้ารับการรักษาตัวในจังหวัดเชียงราย
โดยรถทัวร์ กรีนบัส คันแรกที่พาผู้ป่วยเดินทางกลับมาถึงเชียงราย ชุดแรก เมื่อ 16 ก.ค. 64 และ มีชุดต่อๆ จนถึงปัจจุบัน
ในการนี้ องค์การบริหารส่วนจังหวัดเชียงราย ได้บรูณาการการทำงานร่วมกับสำนักงานสาธารณสุขจังหวัดเชียงราย สมาคมศิริกรณ์เชียงรายบรรเทาสาธารณภัยและบริษัทชัยพัฒนาขนส่งเชียงใหม่ ในการนำพี่น้องชาวเชียงรายกลับมาอย่างปลอดภัย
สายด่วน สำนักงานสาธารณสุขจังหวัดเชียงราย
โทร 065 0836054 หรือ 065 1208911 ทุกวัน
ช่วงเวลา 08.30 – 20.00 น
สายด่วน รับจองวัคซีนโควิด รพ.ในจังหวัดพระนครศรีอยุธยา
รพ.วิมุตได้รับวัคซีนทางเลือก Moderna เพียงพอสำหรับทุกท่าน LINK
รพ.วิมุตขอเรียนแจ้งความคืบหน้าให้ทราบว่า ทางรพ.ได้รับวัคซีนทางเลือก Moderna เพียงพอสำหรับทุกท่าน โดยจะทำการจัดสรรให้ดังนี้
กันยายน 2564
ทางรพ.วิมุตจัดสรรลำดับคิว วัน-เวลา การฉีดวัคซีน โดยจัดคิวจากลำดับที่ท่านชำระเงินจองมา
ตุลาคม 2564 - มีนาคม 2565
คาดว่าจะได้รับวัคซีนจากองค์การเภสัชกรรม และเริ่มฉีดตามนัดหมาย
สอบถามข้อมูลเพิ่มเติม :
Moderna Call Center 02-079-0500
ทุกวัน ตั้งแต่เวลา 08.00 – 17.00 น.
เขตดอนเมือง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี 6-17 ก.ย64 LINK
สำนักงานเขตดอนเมือง ร่วมกับศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร จัดกิจกรรมออกหน่วยรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 2 ประจำปี 2564 ระหว่างวันที่ 6 - 17 กันยายน 2564 เวลา 09.00 - 12.00 น. ฟรี!!!! ไม่มีค่าใช้จ่าย เพื่อเป็นการป้องกันและควบคุมการแพร่ระบาดของโรคพิษสุนัขบ้า โดยมีกำหนดออกหน่วยรณรงค์ ดังนี้
6 ก.ย.64 ชุมชนปิ่นเจริญ 4 ถ.นาวงประชาพัฒนา
7 ก.ย.64 ชุมชนวังไพเวช ซ.สรงประภา 24
8 ก.ย.64 ชุมชนปิ่นเจริญ 2 ถ.สรณคมน์
9 ก.ย.64 ชุมชนอยู่เจริญ - บุญมา ซ.เทิดราชัน 45
10 ก.ย.64 ชุมชนธนินทร 1 ถ.วิภาวดีรังสิต
13 ก.ย.64 ชุมชนศิริสุข ถ.ช่างอากาศอุทิศ
14 ก.ย.64 ชุมชนโกสุมสามัคคี 2 ซ.โกสุมรวมใจ 36
15 ก.ย.64 ชุมชนบูรพา 16 ซ.วัดเวฬุวนาราม 15
16 ก.ย.64 ชุมชนบัณฑิตโฮม ซ.วิภาวดีรังสิต 76
17 ก.ย.64 ชุมชนซอยสะพานรวมใจ ซ.วิภาวดีรังสิต 80
เขตฯ จึงขอเชิญชวนประชาชนในพื้นที่ พาเหล่านายท่านสุดรัก ที่เป็นสัตว์เลี้ยงลูกด้วยนม เช่น สุนัข แมว กระต่าย กระรอก ฯลฯ ที่มีอายุตั้งแต่ 3 เดือนขึ้นไป และยังไม่เคยได้รับวัคซีนประจำปี มาขอรับวัคซีนได้ฟรี ไม่มีค่าใช้จ่าย ที่หน่วยรณรงค์ฯ ใกล้บ้านท่าน ตามวันและเวลาดังกล่าว
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2565 9424 ต่อ 5322 ในวันและเวลาราชการ
ขั้นตอนที่ 3 แกะซองไม้เก็บตัวอย่าง
ขั้นตอนที่ 3 แกะซองไม้เก็บตัวอย่าง ระวังอย่าให้มือสัมผัสกับหัวไม้เก็บตัวอย่าง สอดไม้เก็บตัวอย่างในจมูกด้วยความนุ่มนวล ลึกประมาณ 2-3 เซนติเมตร เปลี่ยนข้างจมูกและทำเช่นเดิมค่อยๆ หมุนไม้เก็บตัวอย่างวนเบาๆ อีก 5 รอบ
กินอาหารร้อน ปรุงสุกใหม่ แยกใช้สำรับ ช้อนกลางส่วนตัว หรือหากสั่งผ่าน เดลิเวอรี่ ให้เทใส่ภาชนะส่วนตัว
เขตสุขภาพที่ 1 เชียงใหม่ เชียงราย ลำพูน แพร่
สำนักงานป้องกันควบคุมโรคที่ 1 จังหวัดเชียงใหม่
-เบอร์โทรศัพท์: 053 271 435
-เว็บไซต์: https://ddc.moph.go.th/odpc1/
เชียงใหม่
- สำนักงานสาธารณสุขจังหวัดเชียงใหม่
เบอร์โทรศัพท์: 053 211 048–50
เว็บไซต์: https://www.chiangmaihealth.go.th/cmpho_web/
- โรงพยาบาลนครพิงค์
เบอร์โทรศัพท์: 053 999 200
เว็บไซต์: http://www.nkp-hospital.go.th/
ลำพูน
- สำนักงานสาธารณสุขจังหวัดลำพูน
บอร์โทรศัพท์: 053 093 725
เว็บไซต์: https://www.lamphunhealth.go.th/
- โรงพยาบาลลำพูน เบอร์โทรศัพท์: 053 569 100
เว็บไซต์: http://www.lpnh.go.th/
เชียงราย
- สำนักงานสาธารณสุขจังหวัดเชียงราย เบอร์โทรศัพท์: 053 910 300 เว็บไซต์: http://cro.moph.go.th/
- โรงพยาบาลเชียงรายประชานุเคราะห์ เบอร์โทรศัพท์: 053 910 600 เว็บไซต์: https://www.crhospital.org/home/
แพร่
- สำนักงานสาธารณสุขจังหวัดแพร่
เบอร์โทรศัพท์: 054 511 145
เว็บไซต์: https://www.pro.moph.go.th/
- โรงพยาบาลแพร่
เบอร์โทรศัพท์: 054 533 500
เว็บไซต์: http://www.phraehospital.go.th/ph11
Smile Cannabis Cafe
ร้านนั่งทานในซอยลาดพร้าว 94 วังทองหลาง พร้อมเสริฟเมนูกัญชา หลายแบบ
Facebookวินซ์ โฮเทล ประตูน้ำ เปิดให้บริการ Hospitel ร่วมกับ โรงพยาบาลธนบุรี บำรุงเมือง
โรงพยาบาลธนบุรี บำรุงเมือง ร่วมกับ วินซ์ โฮเทล ประตูน้ำ เปิดให้บริการ Hospitel Service ดูแลผู้ป่วย Covid-19 ที่ เป็นผู้ที่ตรวจพบเชื้อ แต่ยังไม่ได้เตียงรักษาในสถานพยาบาล หรือ ผู้ป่วยที่มีอายุ 3-65 ปี ที่มีอาการไม่รุนแรงและไม่มีภาวะเสี่ยง ทั้งนี้ รองรับผู้ป่วย สิทธิประกันสุขภาพ ประกันสังคม และ บัตรทองได้ สามารถติดต่อ เข้ารับบริการได้ ที่ โทรศัพท์ 096-830-7269
โรงพยาบาลปทุมธานี ประกาศคิวรับเข็ม 3 ช่วง 29 กย -1 ตค LINK
โรงพยาบาลปทุมธานี ขอเชิญผู้ที่เคยรับวัคซีนที่โรงพยาบาลปทุมธานี ในสูตร sinovac ครบทั้ง 2 เข็ม เข้ามารับบริการฉีดวัคซีนเข็มกระตุ้น (เข็มที่3) โดยวัคซีน Astra zeneca
โดยขอให้มาเข้ารับบริการตามลำดับ ดังนี้
• ผู้ที่ได้ครบ 2 เข็ม ภายในวันที่ 2 เมษายน 2564 --> ให้มารับบริการ วันที่ 29 กันยายน 2564
• ผู้ที่ได้ครบ 2 เข็ม ภายในวันที่ 11 พฤษภาคม 2564 --> ให้มารับบริการ วันที่ 30 กันยายน 2564
• ผู้ที่ได้ครบ 2 เข็ม ภายในวันที่ 13 พฤษภาคม 2564 --> ให้มารับบริการ วันที่ 1 ตุลาคม 2564
โดยเข้ารับบริการได้ในช่วงเวลา 8.00-15.00 น. ตามวันนัดหมาย ที่จุดลานไทร
*ในกลุ่มลำดับถัดไปจะแจ้งวันให้ทราบภายหลัง
**ผู้ที่สนใจรับวัคซีนเข็มกระตุ้น โปรดมารับบริการในวันและเวลาดังกล่าว
3. พร่องน้ำในคลอง ให้อยู่ในระดับต่ำตามแผนฯ
3. พร่องน้ำในคลอง ควบคุมระดับน้ำในบ่อสูบน้ำและแก้มลิงให้อยู่ในระดับต่ำตามแผนฯ
บางคอแหลมลงพื้นที่ตรวจสอบสถานีสูบน้ำ LINK
บางคอแหลมลงพื้นที่ตรวจสอบสถานีสูบน้ำและระดับน้ำภายในพื้นที่เขตเพื่อเตรียมความพร้อมสำหรับการระบายน้ำ
วันที่ 30 กันยายน 2564 นางชดาวรรณ ป่าไม้ ผู้อำนวยการ
เขตบางคอแหลม มอบหมายให้นางสาวสุดใจ คงทน ผู้ช่วยผู้อำนวยการเขตบางคอแหลม พร้อมด้วยนางสาวกัลยา ลิขิตสารวิทย์ ผู้ช่วยผู้อำนวยการเขตบางคอแหลม หัวหน้าฝ่ายรักษาความสะอาดฯและหัวหน้าฝ่ายเทศกิจนำเจ้าหน้าที่ฝ่ายโยธาและเทศกิจ ลงพื้นที่ตรวจสอบการทำงานของเครื่องสูบน้ำของสถานีสูบน้ำ ว่าสามารถทำงานได้เป็นอย่างดี ครบถ้วน เต็มประสิทธิภาพทุกเครื่อง และตรวจสอบระดับน้ำของแม่น้ำเจ้าพระยา เพื่อเป็นการเตรียมความพร้อมในการระบายน้ำให้มีความคล่องตัวและป้องกันปัญหาน้ำเอ่อล้นในกรณีฝนตกหนัก ตามนโยบายผู้ว่าราชการกรุงเทพมหานคร พล.ต.อ.อัศวิน ขวัญเมือง
ข้อควรปฏิบัติกับสัตว์เลี้ยงเมื่อท่านป่วยด้วยโรค COVID 19 กรณีที่ท่านมีสมาชิกในครอบครัวคนอื่นๆ ที่ไม่ได้ป่วยด้วยโรคCOVID 19
3.ศุขไสยาศน์ (แคปซูล) กัญชา 76.92 มิลลิกรัม ในผงยา 500 มิลลิกรัม
ชื่อผลิตภัณฑ์ ยาศุขไสยาสน์ (แคปซูล)
รหัส TP32
ส่วนประกอบ กัญชา 76.92 มิลลิกรัม ในผงยา 500 มิลลิกรัม
ขนาดบรรจุ 60 แคปซูล ใน 1 ขวด
รูปแบบของผลิตภัณฑ์ แคปซูล
ข้อบ่งใช้ ช่วยให้นอนหลับ เจริญอาหาร
ผู้ผลิต โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ประเภทใบอนุญาต ผลิต (แปรรูปหรือสกัด) ซึ่งยาเสพติดให้โทษในประเภท 5
เลขที่ใบอนุญาต 10/2562
รายละเอียด
ผลิตภัณฑ์กัญชานี้ได้รับยกเว้นการรับรองตำรับจากสำนักงาน อย. เพื่อใช้สำหรับผู้ป่วยเฉพาะราย ภายใต้รูปแบบพิเศษของการเข้าถึงยา (Special access scheme) ต้องสั่งจ่ายโดยแพทย์ที่ผ่านการอบรมหลักสูตรการใช้กัญชาและสารสกัดจากกัญชาในทางการแพทย์จากกระทรวงสาธารณสุขและต้องได้รับการยินยอมจากผู้ป่วยหรือผู้ดูแลผู้ป่วย โดยการลงนามเป็นลายลักษณ์อักษรในเอกสารแสดงความยินยอม
เชียงใหม่ เริ่มฉีดวัคซีนไฟเซอร์ให้แก่นักเรียน นักศึกษา อายุ 12-18 ปี โรงเรียนยุพราชวิทยาลัย LINK
4 ต.ค. 64 ที่โรงเรียนยุพราชวิทยาลัย อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่ นายประจญ ปรัชญ์สกุล ผู้ว่าราชการจังหวัดเชียงใหม่ เป็นประธานเปิดกิจกรรม “Kick Off สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม” โดยมีนายรัฐพล นราดิศร รองผู้ว่าราชการจังหวัดเชียงใหม่ พร้อมด้วยนายแพทย์สาธารณสุขจังหวัดเชียงใหม่ ศึกษาธิการจังหวัดเชียงใหม่ ผู้อำนวยการศูนย์อนามัยที่ 1 เชียงใหม่ หัวหน้าส่วนราชการ ผู้แทนหน่วยงานทางการศึกษาทุกสังกัด นักเรียนโรงเรียนยุพราชวิทยาลัยและโรงเรียนขาลสุวรรณอนุสรณ์ เข้าร่วม
ศูนย์อนามัยที่ 1 เชียงใหม่ ร่วมกับสำนักงานศึกษาธิการจังหวัดเชียงใหม่และสำนักงานสาธารณสุขจังหวัดเชียงใหม่ กำหนดแนวทางในการเตรียมความพร้อมสำหรับการเปิดภาคเรียนที่ 2 ปีการศึกษา 2564 โดยวางแผนฉีดวัคซีนไฟเซอร์ (Pfizer) ให้แก่นักเรียน นักศึกษาที่มีอายุ 12-18 ปี กำหนดเริ่มฉีดวัคซีนเข็มแรก ในวันที่ 4 ตุลาคม 2564 พร้อมกันทั่วประเทศ ในส่วนของจังหวัดเชียงใหม่มีนักเรียน นักศึกษา อายุ 12-18 ปี จำนวน 138,623 คน ประสงค์ฉีดวัคซีนโดยได้รับความยินยอมจากผู้ปกครอง จำนวน 94,746 คน คิดเป็นร้อยละ 68.35 ของนักเรียน โดยเริ่มทำการฉีดวัคซีนเข็มแรกในวันนี้ จำนวน 104 คน ทั้งนี้ทางกรมควบคุมโรคจะได้จัดสรรวัคชีน รอบที่ 2 ให้แต่ละจังหวัด ภายในเดือนตุลาคมและคาดว่าจะสามารถฉีดวัคซีนไฟเซอร์ครบ 2 เข็ม ให้กับนักเรียน นักศึกษาทั้งหมดที่ประสงค์ฉีดวัคซีนได้ภายในเดือนพฤศจิกายนนี้
นายประจญ ปรัชญ์สกุล ผู้ว่าราชการจังหวัดเชียงใหม่ กล่าวว่า การฉีดวัคซีนของกลุ่มนักเรียน นักศึกษา ในครั้งนี้เพื่อสร้างภูมิต้านทานให้กับกลุ่มนักเรียน นักศึกษา ซึ่งขณะนี้มีความต้องการฉีดวัคซีนแล้วกว่าร้อยละ 68 และคาดว่าจะสามารถเพิ่มได้ถึงร้อยละ 70 จนสามารถสร้างภูมิคุ้มกันหมู่ได้ เพื่อให้สามารถเปิดการเรียนการสอนในรูปแบบปกติได้ในวันที่ 1 พฤศจิกายน นี้ ตามเป้าหมายที่วางไว้
ด้าน นายแพทย์จตุชัย มณีรัตน์ นายแพทย์สาธารณสุขจังหวัดเชียงใหม่ รายงานว่า จังหวัดเชียงใหม่ ได้รับการจัดสรรวัคซีนไฟเซอร์ สำหรับฉีดให้นักเรียน นักศึกษา จำนวน 42,060 โดส โดยได้จัดสรรวัคซีนกระจายตามโรงพยาบาลในแต่ละอำเภอ จำนวน 25 แห่ง แห่งละ 720 โดส ยกเว้นโรงพยาบาลนครพิงค์ที่ได้รับจัดสรร จำนวน 24,780 โดส ซึ่งโรงพยาบาลแต่ละอำเภอจะได้เริ่มดำเนินการฉีดวัคซีนตั้งแต่สัปดาห์นี้เป็นต้นไป ส่วนอำเภอเมืองเชียงใหม่ที่มีจำนวนนักเรียนนักศึกษาประสงค์จะฉีดวัคซีนจำนวนมาก ทางสำนักงานสาธารณสุขจังหวัดเชียงใหม่ ร่วมกับสำนักงานศึกษาธิการจังหวัดเชียงใหม่ จะพิจารณาความพร้อมของหน่วยฉีดวัคชีน รวมถึงความเหมาะสมด้านอื่น ๆ ต่อไป
เรื่อง/ภาพ ประชาสัมพันธ์ สำนักงานสาธารณสุขจังหวัดเชียงใหม่
อาชีพผู้ดูแลเด็ก โดย สถาบันคุณวุฒิวิชาชีพ (องค์การมหาชน)
เป็นโปรแกรมฝึกอาชีพผู้ดูแลเด็ก 4 คอร์ส เริ่มต้นจากพื้นฐาน ไปสู่ การดูแลเด็ก สิ่งแวดล้อมเด็ก จนถึงระดับทักษะฝีมือเฉพาะทางและเทคนิคในการปฏิบัติงาน
อาชีพผู้ดูแลเด็ก ชั้น 1
เทศกาลถือศีลกินเจสุราษฎร์ 5-15 ตุลาคม 2564 งด ม้าทรง อภินิหาร เดินธูป จุดพลุ
เทศกาลถือศีลกินเจสุราษฎร์ จัดขึ้นระหว่างวันที่ ระหว่างวันที่ 5-15 ตุลาคม 2564 มาพร้อมมาตรการบังคับ "งด ม้าทรง อภินิหาร เดินธูป จุดพลุ" กล่าวคือ
1) งดม้าทรง กำหนดให้แต่ละศาลเจ้าจัดพิธีกันเองเป็นการภายใน ผู้ปฏิบัติงานทุกคนต้องฉีดวัคซีนอย่างน้อย 1 เข็ม ตรวจ ATK ก่อนวันเริ่มกินเจ 1 วัน และตรวจอีกครั้งในวันที่ 5 ของการกินเจ รวมทั้งลดพิธีกรรมลงเหลือเพียงที่จำเป็น งดการเดินธูป ห้ามจุดพลุ ดอกไม้เพลิง ประทัด เด็ดขาด ยกเว้นประทัดแพ การจัดโรงครัว ทำเท่าที่จำเป็น และสำคัญที่สุดคือ "ห้ามไม่ให้ทานอาหารร่วมกัน ห้ามรวมกลุ่มเกิน 50 คน"
2) มาตรการควบคุมโรค ช่วงกินเจ กำหนดเงื่อนไขสำคัญคือ การจัดกิจกรรมใดๆ ต้องได้รับอนุญาตและต้องปฏิบัติตามมาตรการสธ.เคร่งครัด มีแผนรองรับ คือ หากพบผู้ติดเชื้อ ให้ปิดบริเวณนั้น 3 วันและล้างทำความสะอาด กรณีพบผู้ติดเชื้อมากกว่าร้อยละ 10 ของผู้เข้าร่วม จะพิจารณาปรับลดกิจกรรม และหากพบผู้ติดเชื้อมากกว่าร้อยละ 20 จะยุติการจัดงาน
การเรียนการสอนหลังปริญญาของแพทย์เวชปฏิบัติทั่วไป
การขับเคลื่อนเพื่อให้มีการพัฒนาหลักสูตรการเรียนการสอนแพทย์เวชปฏิบัติทั่วไป ในระดับหลังปริญญา
เกิดจากการผลักดันของราชวิทยาลัยแพทย์เวชปฏิบัติทั่วไป ในการโน้มน้าวให้โรงเรียนแพทย์9 ต่างๆ ยอมรับ โดยประสบความสำเร็จและทำให้มีการสอบเพื่อเป็นผู้เชี่ยวชาญเวชปฏิบัติทั่วไปเพื่อเป็นสมาชิกของราชวิทยาลัยครั้งแรกในปีค.ศ.1965 ดังที่กล่าวแล้วข้างต้น และมีการพัฒนาหลักสูตรการเรียนการสอนมาอย่างต่อเนื่อง
ในปัจจุบันการที่จะเป็นแพทย์เวชปฏิบัติทั่วไปและเป็นสมาชิกของราชวิทยาลัยได้จะต้องใช้เวลาเรียนในระดับหลังปริญญาเป็นอย่างน้อย 3 ปี ซึ่งประกอบไปด้วย อย่างน้อย 12 เดือนในภาควิชาและสถานบริการเวชปฏิบัติทั่วไป และมีประสบการณ์อย่างน้อย 6 เดือน ในแต่ละสาขาอย่างน้อย 2 สาขาของสาขาต่อไปนี้: general medicine, geriatric medicine, paediatrics, psychiatry, accident and emergency medicine or general surgery, obstetrics or gynecology or obstetrics and gynecology ส่วนที่เวลาเหลือเปิดโอกาสให้ผู้เข้ารับการฝึกอบรมเป็นผู้เลือก ทั้งนี้ระยะเวลาที่ใช้ในการฝึกอบรมทั้งหมดจะต้องไม่เกิน 7 ปี (ในบางช่วงผู้เข้ารับการฝึกอบรม สามารถเข้ารับการฝึกอบรมในลักษณะบางเวลา (part-time) ก็ได้)
ดังนั้นเส้นทางของการเข้ารับการฝึกอบรมในระดับหลังปริญญา เพื่อในที่สุดสอบเป็นแพทย์เวชปฏิบัติทั่วไปและเป็นสมาชิกของราชวิทยาลัยจึงมีได้หลายเส้นทาง ลักษณะการเรียนการสอนจะเป็นลักษณะสะสมเครดิตว่าได้ครบตามกำหนดของราชวิทยาลัยหรือยัง โดยไม่จำเป็นต้องเรียงลำดับว่าต้องผ่านภาควิชาหรือสาขาใดก่อนหลัง และสามารถเปลี่ยนใจได้ว่าจะเป็นแพทย์เวชปฏิบัติทั่วไปหรือแพทย์เฉพาะทางในระหว่างการฝึกอบรม จึงมีแพทย์เวชปฏิบัติทั่วไปหลายคนที่เป็นสมาชิกมากกว่าหนึ่งราชวิทยาลัย ที่พบบ่อยคือเป็นสมาชิกทั้งราชวิทยาลัยแพทย์เวชปฏิบัติทั่วไปและราชวิทยาลัยอายุรแพทย์(MRCGP & MRCP)
บางครั้งแพทย์ที่เข้ารับการฝึกอบรมมีความตั้งใจที่จะเป็นแพทย์เฉพาะทางตั้งแต่ต้น จนกระทั่งจบการฝึก
อบรมและครบเงื่อนไขของการเป็นแพทย์เฉพาะทาง แต่ต้องรอให้ตำแหน่งในฐานะ Consultant (เป็น Specialist เต็มตัวทั้งความรู้และตำแหน่ง) ในโรงพยาบาลที่ต้องการทำงานว่างลง ซึ่งอาจจะต้องรอนานหลายปีแพทย์เฉพาะทางเหล่านี้บางคนอาจเปลี่ยนใจไม่รอ และหันมารับการฝึกอบรมและสอบเป็นแพทย์เวชปฏิบัติทั่วไป ดังแสดงในแผนภาพ
ในระยะเริ่มต้นของการทำงาน แพทย์เวชปฏิบัติทั่วไปโดยทั่วไปมีรายได้สูงกว่าแพทย์เฉพาะทางที่ทำหน้าที่เป็น Consultant ในโรงพยาบาล แต่โดยรวมตลอดชีวิตการทำงาน แพทย์เฉพาะทางและแพทย์เวชปฏิบัติทั่วไปมีรายได้ใกล้เคียงกัน เนื่องจากรายได้แพทย์เฉพาะทางจะเพิ่มขึ้นอย่างต่อเนื่อง ส่วนแพทย์เวชปฏิบัติทั่วไปรายได้ค่อนข้างคงที่ จะได้เพิ่มก็ต่อเมื่อการทำงานมากกว่า 7 ปีจากนั้น 14 ปีและ 21 ปี
พยาบาลเวชปฏิบัติ (Nurse practitioner) เพิ่มศักยภาพให้กับบริการปฐมภูมิ
ราชวิทยาลัยการพยาบาล (Royal College of Nursing) ของประเทศสหราชอาณาจักรได้ให้ความหมาย
ของพยาบาลเวชปฏิบัติไว้ตั้งแต่ปี ค.ศ.1989 ว่า “an advanced level clinical nurse who through extra
education and training is able to practice autonomously, making clinical decisions, and is fully
accountable for her own practice”
ในประเทศสหราชอาณาจักรเริ่มต้นฝึกอบรมพยาบาลเวชปฏิบัติในปีค.ศ.1992 หลักสูตรโดยรวมใช้เวลาอีกประมาณ 2 ปีหลังจากจบเป็นพยาบาลวิชาชีพแล้ว10 โดยการเรียนรู้ส่วนใหญ่จะเป็นการเรียนจากแพทย์เวชปฏิบัติทั่วไปที่ได้รับมอบหมายให้เป็นทั้งผู้สอนและผู้นิเทศ ซึ่งมีการเรียนการสอน ทั้งในลักษณะฝึกปฏิบัติร่วมกับแพทย์เวชปฏิบัติทั่วไป (เรียนรู้ขณะแพทย์ดูคนไข้) ได้รับการนิเทศจากแพทย์ในขณะฝึกปฏิบัติด้วยการดูคนไข้ด้วยตัวเองตลอดจนการเรียนรู้ในห้องเรียน สำหรับการเรียนรู้ในห้องเรียนแบ่งออกเป็น 2 ลักษณะ ที่จะต้องมีตลอดหลักสูตร2 ปีคือ 1) การเรียนที่ Health centre เป็นการเรียนรู้จากแพทย์เวชปฏิบัติทั่วไป ซึ่งจะต้องมีอย่างน้อยสัปดาห์ละ1 ชั่วโมง เรียกว่า “an in-practice one hour tutorial each week”; และ 2) เรียนที่ Royal College of Nursing สัปดาห์ละ 1 วัน
สำหรับพยาบาลเวชปฏิบัติที่จบออกมาแล้ว จะทำงานที่ Health centre ร่วมทีมกับแพทย์เวชปฏิบัติทั่วไปทำให้คนไข้เข้าถึงบริการได้ง่ายขึ้น (ใช้เวลาในการรอน้อยลง) การทำงานร่วมกันเป็นทีมของพยาบาลเวชปฏิบัติ (Nurse Practitioner: NP) แพทย์เวชปฏิบัติทั่วไป (General Practitioner: GP) จนกระทั่งส่งต่อไปยังแพทย์เฉพาะทาง (Specialist) ในกรณีที่มีความจำเป็นที่จะต้องส่งต่อ
4. กลไกการเงิน
4.1 แหล่งเงินและการไหลเวียนของเงินในระบบบริการ
แหล่งเงินที่เข้ามาในระบบบริการทั้งหมด (ทั้ง NHS และ non-NHS หรือทั้งภาครัฐและเอกชน) ประมาณ 95% มาจากภาครัฐ และที่เหลือประมาณ 5% มาจากภาคเอกชน (ประกอบไปด้วยการจ่ายค่าบริการของประชาชนเมื่อไปรับบริการที่ภาคเอกชน และประกันสุขภาพภาคเอกชน) สำหรับในหัวข้อนี้จะกล่าวถึงแหล่งเงินที่เข้ามาใน NHS เท่านั้น
เงินเข้ามาใน NHS ประกอบไปด้วย 1) เงินภาษีทั่วไป (General taxes) ประมาณ 83%; 2) เงินประกันสุขภาพแห่งชาติ (National Insurance Contribution) ประมาณ 12%; 3) เงินที่ประชาชนมีส่วนร่วมจ่ายประมาณ 3%; และ 4) ดอกเบี้ยและอื่นๆอีกประมาณ 2%
ข้อดีที่มีการกล่าวถึงการนำเงินภาษีมาใช้ใน NHS คือ การไม่ต้องลงทุนเพื่อสร้างกลไกในการเก็บเงินจากประชาชนเอง (ลดต้นทุนลงในภาพรวม) โดยเฉพาะอย่างยิ่งในเมื่อระบบภาษีของประเทศมีลักษณะที่เป็นแบบก้าวหน้า (Progressive) อยู่แล้ว (ผู้มีรายได้มาก จ่ายตามสัดส่วนเมื่อเทียบกับรายได้ มากกว่าผู้มีรายได้น้อยอยู่แล้ว)
สำหรับการไหลเวียนของเงินในระบบบริการสาธารณสุขประเทศอังกฤษ สามารถแสดงได้ดังภาพ
ไทม์ไลน์ การถ่ายโอนภารกิจ
ไทม์ไลน์ การถ่ายโอนภารกิจ
26 ธันวาคม 2562
การประชุมคณะทำงานการถ่ายโอนภารกิจโรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.)
26 มิถุนายน 2563
การประชุมคณะทำงานการถ่ายโอนภารกิจโรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่ อบจ. ครั้งที่ 2/2563
การประชุมเสวนาเชิงวิชาการเพื่อรับฟังความคิดเห็นในการเตรียมการถ่ายโอนภารกิจสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี โรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่องค์การบริหารส่วนจังหวัด
การประชุมเสวนาเชิงวิชาการเพื่อรับฟังความคิดเห็นในการเตรียมการถ่ายโอนภารกิจสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี/โรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่องค์การบริหารส่วนจังหวัด
21 มิถุนายน 2564
การประชุมคณะทำงานการถ่ายโอนภารกิจโรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่องค์การบริหารส่วนจังหวัด ครั้งที่ 1/2564
8 กันยายน 2564
คู่มือแนวทางการดำเนินการถ่ายโอนภารกิจสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี และโรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่ อบจ.
19 ตุลาคม 2564
ราชกิจจาฯ ออกประกาศคณะกรรมการการกระจายอำนาจให้แก่องค์กรปกครองส่วนท้องถิ่นเรื่อง หลักเกณฑ์และขั้นตอนการถ่ายโอนภารกิจสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีและโรงพยาบาลส่งเสริมสุขภาพตำบลให้แก่องค์การบริหารส่วนจังหวัด
นักท่องเที่ยว สีเหลือง กลุ่มกักตัว
แนวทางการรับวัคซีนโมเดอร์นา รพ.วิชัยยุทธ
DOCUMENTATION
1. I am an expat living and working in Thailand, do I have to submit an insurance policy document?
- Yes
- Expats living and working in Thailand under a valid visa or residential permit are required to provide proof of insurance coverage in Thailand with a minimum coverage of 50,000 USD or valid social security card or certified letter from their employer.
- Thai nationals are not required to provide proof of insurance coverage as they are covered by Thailand’s universal healthcare programme.
2. Does my insurance have to be a COVID-19 insurance in order to register with Thailand Pass?
- No. You can also use general insurance or health insurance with a minimum coverage of 50,000 USD.
3. What are the required documents for Thailand Pass registration?
- Requirements vary depending on the scheme which you are planning to enter Thailand. Details are as follows:
** The applicant is also required to have an RT-PCR test result that is issued within 72 hours before departure and bring the results to present to the Health Control station upon arrival. This requirement is not required for Thai nationals entering under the AQ scheme. Please note that your test result must be in hard copy and in Thai or English language only.
4. What if I do not have a mobile phone, how could I present my Thailand Pass QR Code?
- If you do not carry a mobile phone with the QR Code, you may print out a hard copy of the QR code and bring it with you to present it to the officers at the airport. Preferably, you could register with Thailand Pass on your PC and print out the QR Code
5. Can I use a COVID-19 test result other than RT-PCR to enter Thailand?
- No. Your COVID-19 test result must be obtained using the RT-PCR testing technique (ATK is not permitted) and issued within 72 hours before your travel only.
6. What are the vaccines approved by Thailand?
- The vaccines approved by Thailand include;
- CoronaVac (Sinovac)
- AstraZeneca
- Pfizer-BioNTech
- Moderna
- COVILO (Sinopharm)
- Janssen (Johnson & Johnson)
- Sputnik V
7. Dose Thailand recognize mixed vaccination?
- Thailand fully recognizes mixed vaccination. However, your second dose needs to be administered based on the recommended timeframe for each vaccine type (first dose), as follows;
- 1st dose (Sinovac) = 2nd dose after 2 weeks
- 1st dose (AstraZeneca) = 2nd dose after 4 weeks
- 1st dose (Pfizer-BioNTech) = 2nd dose after 3 weeks
- 1st dose (Moderna) = 2nd dose after 4 weeks
- 1st dose (Sinopharm) = 2nd dose after 3 weeks
- 1st dose (Sputnik V) = 2nd dose after 3 weeks
*To be considered fully vaccinated, your 2nd dose must be administered at least 14 days before your travel.
*Those vaccinated with Janssen (Johnson&Johnson) vaccine do not need to receive their 2nd dose to be considered fully vaccinated.
8. I have previously been infected with COVID-19; can I travel to Thailand?
- Yes. Those previously infected with COVID-19 are considered fully vaccinated if they have received a single dose of COVID-19 vaccine within 3 months after their recovery. In this case, your proof or medical record of COVID-19 recovery must be submitted alongside your single-dose vaccination certificate. However, if you have been fully vaccinated before contracting COVID-19, you are still considered to be fully vaccinated.
อบจ.น่าน จัดฉีดเข็มแรก 22 พ.ย. LINK
22 พฤศจิกายน 2564 เวลา 09.00 น. ณ ศูนย์ฉีดวัคซีนโรงพยาบาลน่าน (วิทยาลัยสงฆ์นครน่าน) นายนพรัตน์ ถาวงศ์ นายกองค์การบริหารส่วนจังหวัดน่าน เข้าเยี่ยมและให้กำลังใจพี่น้องประชาชนรวมทั้งบุคลากรทางการแพทย์ในการฉีดวัคซีนโมเดอร์นา ที่ อบจ.น่าน ได้ดำเนินการสั่งซื้อผ่านสภากาชาดไทย และนำไปฉีดให้แก่ประชาชนกลุ่มเปราะบาง 5 กลุ่ม ที่ยังไม่เคยได้รับวัคซีนป้องกันโรคโควิด-19 ตามเงื่อนไขของสภากาชาดไทยกำหนด โดยมีกลุ่มเป้าหมายเข้ารับการฉีดวัคซีนโมเดอร์นารอบที่ 1 ของจังหวัดน่าน ในหน่วยฉีดวัคซีนต่างๆ ประกอบด้วย รพ.น่าน (วิทยาลัยสงฆ์นครน่าน) รพ.เวียงสา รพ.เชียงกลาง รพ.นาน้อย รพ.นาหมื่น รพ.บ่อเกลือ รพ.สองแคว และโรงพยาบาลภูเพียง รวมทั้งสิ้น 320 คน
อบจ.น่าน
รับการจัดสรรวัคซีนจำนวนเพียง 5,770 โดส โดสละ 1,100 บาท และเป็นเงินทั้งสิ้น 6,347,000 บาท
คลินิกความจำ โรงพยาบาลจุฬาฯ
คลินิกความจำ (Neurocognitive Unit) เป็นคลินิกที่มีทีมแพทย์และบุคลากรทางการแพทย์ผู้เชี่ยวชาญในด้านระบบประสาท โดยเฉพาะการตรวจวินิจฉัยและรักษาผู้ป่วยที่มีปัญหาด้านความจำและภาวะสมองเสื่อม
บริการ : การตรวจประเมินทางประสาทจิตวิทยา เป็นการประเมินเพื่อหาความสัมพันธ์ระหว่างพฤติกรรมและการทำงานของสมองในความสามารถด้านต่างๆ ประกอบด้วย ความสามารถทางเชาวน์ปัญญา (IQ) สมาธิ ความจำ ทักษะด้านการบริหารจัดการ (การแก้ไขปัญหา การให้เหตุผล และการวางแผน) การรับรู้มิติสัมพันธ์ และ ความเข้าใจและการใช้ภาษา รวมทั้งตรวจประเมินสภาวะทางจิตใจต่าง ๆ เช่น ภาวะซึมเศร้า วิตกกังวล ความเครียด หรือ บุคลิกภาพ เป็นต้น
อาคารภูมิสิริมังคลานุสรณ์ ชั้น 7 โซนซี
สาขาวิชาประสาทวิทยา ฝ่ายอายุรศาสตร์
โรงพยาบาลจุฬาลงกรณ์
ติดต่อรักษา
คลินิกความจำ เปิดให้บริการ
ณ อาคาร ภปร ชั้น 3 โรงพยาบาลจุฬาลงกรณ์
- วันจันทร์ 13.00 - 15.00 น.
- วันอังคาร 13.00 - 15.00 น.
- วันพุธ 8.00 - 12.00 น.
ลอยกระทงปากเกร็ด บริเวณท่าน้ำปากเกร็ด
เทศบาลนครปากเกร็ดจัดกิจกรรมประเพณีลอยกระทง ประจำปี 64 ในวันศุกร์ที่ 19 พฤศจิกายน 64 ณ บริเวณท่าน้ำปากเกร็ด และสวนสมเด็จพระศรีนครินทร์ นนทบุรี โดยการจัดพื้นที่สำหรับประชาชนลอยกระทง ตามมาตรการป้องกันการเเพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19)
อบจ.เพชรบูรณ์ ฉีดวันแรก 16 พย จำนวน 560 คน LINK
16 พ.ย. 64 อบจ.เพชรบูรณ์ ฉีดวันแรก 16 พย กลุ่มเป้าหมาย จำนวน 560 คน
สำหรับกลุ่มเป้าหมายที่สภากาชาดไทยจัดสรรวัคซีน “Moderna” ให้องค์การบริการส่วนจังหวัด เพื่อนำไปฉีดให้แก่ประชาชนกลุ่มเป้าหมาย 5 กลุ่ม ได้แก่
1. คนพิการ ผู้ป่วยติดเตียง สตรีมีครรภ์
2.ผู้สูงอายุ 70 ปีขึ้นไป
3.บุคลากรทางการแพทย์และพยาบาล
4. ผู้ที่ทำงานประจำศูนย์พัฒนาเด็กเล็ก ครูผู้สอนหนังสือ
5. บุคลากรที่ออกปฏิบัติงานสัมผัสประชาชนตามโครงการฉีดวัคซีนให้ประชาชนครั้งนี้ และบุคคลที่ไม่เคยได้รับวัคซีนมาก่อน เนื่องจากติดขัดระเบียบกฎหมายทางราชการ
t2dminsulin.com ความรู้เกี่ยวกับโรคเบาหวานชนิดที่ 2 ที่ต้องใช้อินซูลิน LINK
เทคโนโลยีสื่อการเรียนรู้
www.t2dminsulin.com ทำให้บุคลากรทางการแพทย์ พยาบาล ผู้ป่วย ผู้ดูแลผู้ป่วย และประชาชนทั่วไปสามารถเข้าถึงข้อมูลได้บนทุกแพลตฟอร์ม อำนวยความสะดวกให้สามารถเข้าถึงข้อมูลได้ทุกที่ทุกเวลา โดยข้อมูลที่ถ่ายทอดอยู่ในรูปแบบการ์ตูนแอนิเมชั่นที่เข้าใจง่าย และได้ปรับศัพท์เชิงวิชาการให้ง่ายต่อการเข้าใจ โดยเนื้อหาได้รับการตรวจสอบความถูกต้องจากทีมแพทย์ชำนาญการด้านโรคเบาหวานจากโรงพยาบาลระดับประเทศหลายแห่ง เพื่อมุ่งให้เป็นแหล่งข้อมูลที่เชื่อถือได้ อีกทั้งได้สอดแทรกสาระผ่านเกม ประกอบด้วย 8 บทเรียน อาทิ ความสำคัญของอินซูลิน, ความเข้าใจผิดและความจริงเกี่ยวกับอินซูลิน, การเริ่มใช้อินซูลินในการรักษาเบาหวาน, อาหารและการออกกำลังกายสำหรับผู้เป็นเบาหวาน, การจัดการเมื่อเกิดน้ำตาลในเลือดต่ำ, ชนิดของอินซูลิน, การเก็บและการพกพาอินซูลิน และการใช้เครื่องเจาะน้ำตาลปลายนิ้วและความจำเป็นในการปรับขนาดยา เป็นต้น และจะมีการพัฒนาความรู้เกี่ยวกับอินซูลินบนเว็บไซต์ www.t2dminsulin.com เพิ่มเป็น 12 บทเรียน ในช่วงต้นปี 2565 อีกด้วย
ทั้งนี้ หัวใจสำคัญในการก้าวไปสู่การดูแลผู้ป่วยเบาหวานเพื่อให้บรรลุเป้าหมายนั้น ต้องอาศัยความร่วมมือกันจากทุกภาคส่วนทั้งจากภาครัฐและเอกชน และสำคัญที่สุดคือภาคประชาชน รวมถึงผู้ป่วยจำเป็นต้องปรับพฤติกรรม ซึ่งหากได้รับการสนับสนุนอันดีจากแพทย์ บุคลากรทางการแพทย์ รวมถึงมีชุมชนที่ช่วยกันดูแล และได้รับความรู้ความเข้าใจอย่างถูกต้อง โดยมีโมเดลการดูแลอย่างเป็นรูปธรรม อาทิ ชมรมเบาหวาน ก็จะทำให้เกิดการรวมตัวของผู้ป่วยได้แลกเปลี่ยนประสบการณ์ ดูแลช่วยเหลือกัน จากการศึกษาผู้ที่อยู่ในชมรมฯ จะสามารถควบคุมค่าระดับน้ำตาลสะสมได้ดีกว่าผู้ที่ไม่มีชมรม จึงอยากให้เสริมพลังในการจัดตั้งชมรมผู้ป่วยเบาหวานให้มากยิ่งขึ้น เพื่อช่วยกันควบคุมระดับน้ำตาลในเลือด และลดการเกิดภาวะแทรกซ้อน เพื่อการมีคุณภาพชีวิตที่ดีขึ้นอย่างยั่งยืน
ลอยกระทง 64 ที่ มหาสารคาม (สรยุทธ สุทัศนะจินดา กรรมกรข่าว) LINK
ผู้ใช้เฟซบุ๊กรายหนึ่งได้โพสต์ภาพ การจัดงานวันลอยกระทงประจำปี 2564 ซึ่งจัดขึ้นที่คลองแห่งหนึ่งในพื้นที่ จ.มหาสารคาม โดยน้ำในคลองเป็นคราบจับเป็นกลุ่มก้อน สกปรก ส่งกลิ่นเหม็นแทบไม่สามารถลอยกระทงได้ พร้อมข้อความระบุ “ใครพาแฟนมาก็คิดดี ๆ เด้อออ รักครั้งแรกหัวใจอาจแตกสลาย รักของเราคงต้องหยุด กระทงไม่หลงทาง เพราะกระทงลอยไม่ไป” ขณะที่มีการแชร์คลิปคลองเดียวกัน ลงใน tiktok กระทั่งเป็นที่วิพากษ์วิจารณ์กันมากมาย
หน่วยรับบริจาคประจำที่ (Fixed Station)
หน่วยบริจาคในห้างสรรพสินค้า
- ศูนย์รับบริจาคโลหิตและพลาสมา สถานีกาชาด 11 วิเศษนิยม บางแค แผนที่
- บ้านทรงไทย วงศ์สว่าง แผนที่
- เดอะมอลล์ บางแค แผนที่
- เดอะมอลล์ บางกะปิ แผนที่
- เดอะมอลล์ งามวงศ์วาน แผนที่
- ดิ เอ็มโพเรียม แผนที่
รพ.จิตเวชเลยราชนครินทร์ เชิญชวนชาวเลย Walk In ฉีดวัคซีนวันที่ 25 พ.ย. 64 นี้
โรงพยาบาลจิตเวชเลยราชนครินทร์ ขอเชิญชวนพี่น้องชาวจังหวัดเลย ผู้ที่ยังไม่เคยได้รับวัคซีนป้องกันโควิด-19 ที่มีอายุ 18 ปีขึ้นไปเข้ารับวัคซีนแบบ Walk In ในวันที่ 25 พ.ย. 64 นี้ จำนวน 100 ลำดับเท่านั้น เข็มที่ 1 เป็น Astrazeneca เข็มที่ 2 เป็น Pfizer มาสร้างภูมิคุ้มกัน
ใช่ค่ะลงมาฉีดตามหมู่บ้านเลยสถานที่ฉีดมันไกลเวลาไปทีเหมารถทีละ 500 บาท
ถ้าจะไปฉีดเข็มแรกต้องไปลงทะเบียนที่ไหนคะ
สำรวจผู้ที่ไม่ได้ฉีด…ให้บริการถึงบ้าน…ถ้าไม่ฉีดยกเลิกสิทธิพิเศษต่างๆ
อสม.ออกล่ารายชื่อนัดวันออกฉีดที่อนามัยเลยค่ะ
ลองแบบจังหวัดอื่นเมื่อฉีดเสร็จก็ไห้จับของรางวัลคะน่าจะมีคนมาฉีดเพราะจะได้ลุ้นของรางวัลด้วย
เป็นไปได้มั้ย ที่คนฉีดสามารถเลือกยี่ห้อวัคซีนได้ ไม่เอาสูตรไขว้ เช่น ขอเป็น Pfizer+Pfizer เข้าใจว่าต่อไป Pfizer จะเข้ามาเยอะมาก
งงอะ อยากได้ไฟเซ่อเข็มแรก ตอนนี้ได้สูตรผสม ซิโนแวค แอสตร้ามาเสียใจมาก
มารดาติดเตียงอยู่หมู่7ต.โพธิ์กลาง ยังไม่มีการฉีดเชิงรุกเลยค่ะ
อสม.ช่วยสำรวจพื้นทร่รับผิดชอบ มีหนังสือส่งจากชุมชนไหน ไม่ต้องลงทะเบียน มาเลยยยย
ไม่มีเวลาไป ไม่มีรถไป พอว่างพอมีรถก็ค่ำๆ
1.เสียเวลาไปรอฉีดเหมิดวัน 2. เอาแต่ซิโนแวคมาให้เค้าฉีดประชาชนกลัวตายจ้า 3.ไม่มีการรับรองว่าเกิดผลข้างเคียงแล้วรัฐจะช้วยประชาชนแบบใหนประชาชนกลัวตายคือกันจ้าแถมพิการเพิ่มอีกไม่อยากได้บัตรคนพิการน่ะจ้ะ
เดินทางไปฉีดตามหมู่บ้านครับ อำนวยความสะดวก เพราะโคราชพื้นที่กว้าง บางคนเดินทางมาฉีดลำบาก
รพสต.แต่ละตำบลครับ
ให้เจ้าหน้าประสานงานไปแต่ละหมู่บ้าน พร้อมนัดหมายวันเวลาของแต่ละหมู่บ้านมาฉีดรพสต.ใกล้บ้าน
*Reply** เห็นด้วยค่ะเค้าจะมีข้อมูลจาก อสม. อยู่แล้ว เน้นการประชาสัมพันธ์ในหมู่บ้านด้วยเพราะส่วนตัวไม่ทราบว่ามีการฉีดที่ รพสต.
ความคิดส่วนตัวผมนะ
ประกาศไปเลยครับ และประชาสัมพันธ์ ให้ประชาชนเข้าถึงข้อมูล
1.บอกรายละเอียดว่าท่านจะได้รับวัคซีนอะไรสูตรไหน **ทั้งนี้ถ้าเป็นวัคซีนที่ ประชาชนไม่ต้องการก็เท่านั้นครับ
2.บอกถึงผลข้างเคียงที่เกิดขึ้นหลังรับวัคซีนในแต่ละตัวโดยละเอียด
3.ขั้นตอน และวิธีการเข้ารับวัคซีน (ต้องจองไหม หรือวอคอินได้เลย , ช่วงเวลา , สถานที่)
4.ทั้งหมดนี้ต้องจกตา ปฏิบัติตามแล้วต้องได้ฉีดจริงๆ
ใช่ค่ะ ประชาชนส่วนใหญ่ถูกปิดกั้นความรู้เกี่ยวกับเรื่องวัคซีน รับรู้เพียงด้านเดียวคือด้านลบ ฉีดแล้วตาย อัมพาต ควรมีการประชาสัมพันธ์โดยตรงกับประชาชนเอง
คนยังเชื่อข่าวลือมากกว่าเชื่อหมอ เกลียดนักการเมืองเกลียดรัฐบาลอย่างไรก็ควรจะเชื่อหมอ
ให้ อสม. ท้องถิ่น ช่วยประชาสัมพันธ์ค่ะ แล้วฉีดได้ตามโรงพยาบาลตำบลค่ะ
ต้องให้เจ้าหน้าที่สารณสุขออกตามบ้านให้ความรู้ว่าการฉีดวัคซีนช่วยได้แบบไหนทีแรกก็กลัวไม่กล้าฉีดเหมือนกันถ้าไม่ฉีดเวลาอยากไปเที่ยวไหนบางสนานที่ก็ไม่ให้เข้าถ้าเราไม่ฉีดวัคซีน2เข็มขึ้นไป อีกอย่างก็ทำให้เชื้อไม่ลงปอดด้วย
เพิ่มเงื่อนไขให้สถานที่ต่างๆว่าทุกคนต้องได้รับวัคซีน 2 เข็มขึ้นไป ถ้าไม่ได้รับวัคซีนไม่อนุญาตให้เข้าสถานที่นั้นๆ แบบนี้ก็อาจจะได้ผลนะครับ
มีคูปองส่วนลด หรือมีโปรโมชั่นเกี่ยวกับการชิงโชคค่ะ 555
ให้ผู้ใหญ่บ้านและทีมงาน ทุกหมู่บ้าน ช่วยกันเช็คว่าลูกบ้านตัวเองฉีดแล้วกี่คน คิดเป็น % ติดอะไร จะไปฉีดเมื่อไหร่ ที่บ้านผมอีกจังหวัดเขาทำแบบนี้ครับ บ้านไหนยังไม่ฉีด ก็จะโดนกดดันเบาๆ
เปิดwalk in เข็มแรกไฟเซอร์เหมือนบุรีรัมย์สิคะ เพราะหลายคนไม่อยากได้วัคซีนไขว้ค่ะ แล้วsv 2เข็ม ก็ไม่ช่วยกันเดลต้า ส่วนAZ ผลข้างเคียงมันแรงมากสำหรับคนอายุน้อย ผู้ใหญ่บางคนยังไม่กล้าเสี่ยงเลยค่ะ หลายคนก็ไม่เลยไม่กล้าเสี่ยงฉีด เพราะรอวัคซีนที่มีประสิทธิภาพมากกว่านี้
คนที่ได้แค่เค็มเดียว แต่ฉีดต่อไม่ได้แพ้มาก จะทำยังไงค่ะ
ตอนนี้เรามีวัคซีนเยอะมากแล้ว ควรยกเลิกสูตรไขว้ ให้คนฉีดสามารถเลือกยี่ห้อวัคซีนได้เอง
เปิดเข็มแรก โมเดินน่า ครับ ได้รับบริจาคมาฟรี อีก 1 ล้าน ต้องฉีดแล้วละ
pz+pz / mdn+mdn ก็จบแล้วคิดไรเยอะ
ใน กทม เดินสายฉีดถึงบ้านเลย เพราะบางคนไม่สามารถเดินทางได้ ในเมื่อเขาไม่ไปหา เราก็ไปหาเขาค่ะ
เข็ม1,2,3เลือกเลยตามความพอใจ...การเข้าถึง! ส่วนมากชาวบ้านทั่วๆไปเข้าไม่ถึงวัคซีน...walk in โดยไม่มีเงื่อนไขใครๆก็อยากฉีด วัคซีนที่มีคุณภาพ
อยากไปรับค่ะ แต่ทำไม่เป็น มีใครแนะนำบ้างได้ไหมค่ะว่าต้องทำยังไงTwT
ยากจัง คนมีอายุที่บ้านก็ไม่ยอมฉีด จึงกลายเป็นถอดแมสในบ้านตลอดแล้วเด็กเล็กเสี่ยงสุด
ทั้งๆที่เราวิ่งเต้นหาฉีดแทบตาย เสียเงินซื้อตั้งหลายพันก็ยังไม่มาให้ฉีดเลย md จนได้ฉีดอย่างอื่นไปก่อน
ยากๆ ค่ะ
** Reply ** แจกตังคับ กับ สว.จะให้แกทำอะไร ได้ผลทุกราย/ สำหรับที่บ้าน เป็นเกมชนิดหนึ่ง เป็น motive อย่าใช้ pressure
กระจาย ให้ทั่วค่ะ อนามัย รอสต.หรือแม้กระทั่ง เทศบาลตามอำเภอต่างๆ ตำบล ตั้งจุดฉีด จัดกำลังจนท.หมอ พยาบาลไปฉีด ให้ประชาชนจะะได้เข้าถึงง่าย
ไม่ต้องนั้งรถมาฉีดไกลถึงเซ็ล ทรัลหรือเดอะมอล ที่อ.เมือง
มีของรางวัล ให้ เช่น ไข่ไก่ อาหาร หรือของใช้ เอาไว้แจกประชาชนเพื่อเป็นรางวัลให้คนมารับเข็มแรก
เลิกฉีดสูตรไขว้สิครับ pfz + pfz ไปเลย
มันไม่จำเป็นต้องใช้กลยุทธอะไรเลย ถ้าเข็มแรก ไม่ใช่ Sv
บุรีรัมย์วอคอิน ฉีดไฟเซอร์ฟรี ไปถามบุรีรัมย์ครับว่าทำยังไง ผมไปฉีดมาแล้ว
จัดโปรแจกของค่ะ ของกิน ของใช้ เครื่องใช้ไฟฟ้า บัตรกำนัล (อาจต้องขอความร่วมมือจากนักธุรกิจท้องถิ่น) ส่วนใหญ่ที่ไม่ยอมฉีดคือผู้สูงอายุ
ให้ข้อมูลเชิงรุกค่ะ แบบไม่เอนเอียงเชียร์วัคซีนตัวไหนมากเกินความจริง + อาจให้เป็นของรางวัลเล็กๆน้อยๆให้เหมาะสมกับช่วงวัยที่ไม่กล้าฉีดเข็มแรก
เอามาลงอนามัยเลย อสม. ผู้ใหญ่บ้าน กำนัน อบต. เทศบาล ระบบมีอยู่แล้ว รายชื่อก็มีอยู่แล้ว กระจายเลย
หลายเสียงบอกตรงกันครับถ้าได้โมเดอร์น่า/ไฟเซอร์มาเขาก็ฉีดกันครับอยู่ที่วัคซีนจริงๆอย่าไข้ว ฉีด2เข็มครับเพราะส่วนใหญ่จองโมเดอร์น่าไปนานมากแล้วครับ
ฉีดตามรพ.สต.ใกล้บ้านค่ะเพราะยังมีคนอยากฉีดแต่ไม่สะดวกเข้าเมืองค่ะ
นนท์ Student Final Call แจ้งนัดฉีดวัคซีน สำหรับผู้มีอายุ 12-20 ปี วันที่ 25 พฤศจิกายน 2564 LINK
นนท์ Student "Final Call" แจ้งนัดฉีดวัคซีน สำหรับผู้มีอายุ 12-20 ปี ที่ยังไม่เคยได้รับวัคซีนใดๆ มาก่อนที่ได้ลงทะเบียนไว้ก่อนหน้านี้เท่านั้น
สนามฉีดวัคซีน และวันที่
1.ศูนย์กีฬากำธน สินธวานนท์ การไฟฟ้าฝ่ายผลิตแห่งประเทศไทย (บางกรวย)
- วันที่ 25 พฤศจิกายน 2564 เวลา 13.00-14.30 น. ฉีดวัคซีนสำหรับผู้มีอายุ 12-20 ปี ที่ศึกษาอยู่ในจังหวัดนนทบุรี
- วันที่ 26 พฤศจิกายน 2564 เวลา 13.00-14.30 น. ฉีดวัคซีนสำหรับผู้มีอายุ 12-20 ปี ที่มีทะเบียนบ้าน หรือ พักอาศัยอยู่ในจังหวัดนนทบุรี ที่ศึกษานอกระบบโรงเรียน หรือ ที่ศึกษานอกจังหวัด
2.โรงพยาบาลไทรน้อย ห้องประชุม ชั้น 4 วันที่ 2 ธันวาคม 2564 เวลา 9.00-12.00 น. สำหรับผู้มีอายุ 12-20 ปี ที่ศึกษาอยู่ในอำเภอไทรน้อย จังหวัดนนทบุรี และที่มีทะเบียนบ้าน หรือ พักอาศัยอยู่ในอำเภอไทรน้อยจังหวัดนนทบุรี
‼️ถ้าพักอาศัยใน จ.นนทบุรี แต่ไม่ได้มีทะเบียนบ้านอยู่ใน จ.นนทบุรี ให้แสดงหลักฐาน สำเนาทะเบียนบ้านที่อยู่อาศัยจริงในจังหวัดนนทบุรี และให้เจ้าบ้านเซนต์รับรองในสำเนาทะเบียนบ้านที่อาศัยจริงว่า ... “ข้าพเจ้าขอรับรองว่า นายอยู่ แฝงนนท์ ได้อาศัยอยู่ในบ้านของข้าพเจ้าจริง เป็นเวลาเกินกว่า 6 เดือนจริง” พร้อมลงลายมือชื่อเจ้าบ้าน
การฉีดวัคซีนจะต้องได้รับการยินยอมและอนุญาตจากผู้ปกครอง
มาตรการประเทศในเอเซีย และแคนาดา
ซาอุดิอาราเบีย ห้ามเที่ยวบินจาก แอฟริกาใต้ นามิเบีย บอตสวานา ซิมบับเว โมซัมบิค เลโซโธ และเอสวาตินี
สิงคโปร์ และมาเลเซีย จำกัดการเดินทางจากภูมิภาคแอฟริกาใต้ ผู้ไม่ได้เป็นพลเมืองของทั้ง 2 ชาติที่ไม่มีที่พำนักถาวร ที่เดินทางไปยังกลุ่มประเทศเหล่านั้น จะไม่ได้รับอนุญาตให้เข้าประเทศ ผู้ที่ได้รับอนุญาตให้เข้าได้ จะต้องถูกกักตัว
ฟิลิปปินส์ ห้ามผู้เดินทางจากประเทศ แอฟริกาใต้ บอตสวานา นามิเบีย ซิมบับเว โมซัมบิค เลโซโธ และเอสวาตินี เข้าประเทศจนถึง 15 ธันวาคม
ญี่ปุ่น ผู้ที่เดินทางจาก 6 ประเทศ - แอฟริกาใต้ บอตสวานา นามิเบีย ซิมบับเว เลโซโธ เอสวาตินี จะต้องกักตัว 10 วัน ในสถานที่ที่รัฐกำหนดและตรวจโควิดทันทีที่มาถึง และตรวจรอบสอบในวันที่ 10
อินเดีย ยังไม่ออกประกาศคำสั่งห้ามแต่อย่างใด
ฮ่องกง สั่งห้ามผู้ที่ไม่ได้พำนักอาศัยในฮ่องกง ที่เดินทางและที่อยู่ใน 8 ประเทศในรอบ 21 วันที่ผ่านมา ประเทศเหล่านั้นได้แก่ แอฟริกาใต้ บอตสวานา นามิเบีย ซิมบับเว โมซัมบิค เลโซโธ มาลาวี และเอสวาตินี
แคนาดา ประกาศปิดพรมแดนห้ามการเดินทางเข้าจากกลุ่มประเทศแอฟริกา ชาวแคนาดาที่เดินทางจากประเทศเหล่านั้น จะต้องถูกกักตัว 14 วันและตรวจหาเชื้อโควิด
ทางศูนย์จีโนมทางการแพทย์ รพ. รามาธิบดี ได้ดาวน์โหลดรหัสพันธุกรรมทั้งจีโนมของ "โอไมครอน" ทั้ง 125 ตัวอย่างมาทดสอบด้วยวิธีชีวสารสนเทศกับตัวตรวจตามของชุดตรวจ PCR ที่ทาง WHO ให้การรับรอง โดยอาศัยโปรแกรมที่ชื่อว่า
"Nextclade" (https://clades.nextstrain.org/) ปรากฏว่าจากการวิเคราะห์ผลบน"คอมพิวเตอร์" (ซึ่งต้องยืนยันผลกับตัวอย่างเชื้อไวรัสในห้องปฏิบัติการอีกครั้งหนึ่ง) พบว่าทั้ง 125 ตัวอย่างมีแนวโน้มว่าอาจเกิดปัญหากับชุดตรวจ PCR
"บางยี่ห้อ" ไม่ใช่ทุกยี่ห้อที่ WHO ให้รายชื่อไว้ คืออาจให้ผลบวกน้อยทั้งที่มีเชื้อจำนวนมาก หรือเกิดผลลบปลอม (false negative) ได้ในบางยีน โดยอาศัยการตรวจสอบรหัสพันธุกรรมของตัวตรวจตาม (PCR primer) กับส่วนจีโนมของสายพันธุ์โอไมครอนที่กลายพันธุ์ไปว่ายังตรวจจับกันได้หรือไม่ หรือตรวจจับไม่ได้เลยเนื่องจากไวรัสมีการกลายพันธุ์ไปมาก (ภาพ 2)
อย่างไรก็ตามชุดตรวจ PCR ส่วนใหญ่จะตรวจยีน 2-3 ยีนพร้อมกัน การตรวจไม่พบหรือการ "dropout" บางยีน อาจไม่ส่งผลกระทบมากนักเพราะจะมีผลบวกจากยีนตำแหน่งอื่นคอยยืนยัน
ดังนั้นศูนย์รับตรวจโควิด-PCR คงต้องระมัดระวังเลือกใช้ชุดตรวจ PCR ที่ผ่านการทดสอบว่าไม่มีปัญหาในการตรวจจับสายพันธุ์ "โอไมครอน"
แผนการฉีดวัคซีน Moderna เชิงรุก อบจ.อ่างทอง LINK
แผนการฉีดวัคซีน Moderna เชิงรุก ตามโครงการจัดหาวัคซีนป้องกันโรคโควิด-19 (Moderna) สาหรับประชาชนในจังหวัดอ่างทอง ขององค์การบริหารส่วนจังหวัดอ่างทองาสำหรับผู้ป่วยติดเตียง ผู้สูงอายุที่ได้ลงทะเบียนไว้
คริสเดียโน่ โรนัลโด้
27 สิงหาคม สตาร์ลูกหนังระดับโลกวัย 35 ปี มีผลตรวจโควิดเป็นบวกระหว่างเข้าแคมป์ทีมชาติโปรตุเกสเตรียมพบกับสวีเดนในกรุงลิสบอน ไม่มีรายงานว่าเขามีอาการใดๆ และได้บินกลับไปกักตัวที่อิตาลีในทันที สโมสรยูเวนตุสระบุว่านักเตะอีกรายที่ผลตรวจเป็นบวกคือ เวสตัน แมคเคนนี่
สถานประกอบการกิจการ ประเมินตนเองตามมาตรการ Covid-free setting
เนื่องจากจังหวัดหนองคายเป็นพื้นที่นำร่องการท่องเที่ยวเพื่อให้เกิดความพร้อม ดึงดูดความสนใจของนักท่องเที่ยวให้เข้ามาในพื้นที่ ขอความร่วมมือสถานประกอบการกิจการในจังหวัดหนองคาย เข้าประเมินตนเองตามมาตรการ Covid-free setting และปฏิบัติตามมาตรการ เพื่อลดความเสี่ยงต่อการแพร่ระบาดของโรค COVID-19 หลังจากเปิดเมืองท่องเที่ยวต่อไป ประเมินตนเอง ผ่าน
stopcovid.anamai.moph.go.th/webapp/ หากสถานประกอบการผ่านการประเมิน จะได้รับเกียรติบัตรรับรอง Covid-free setting จาก ศบค.และกระทรวงสาธารณสุข
โรงพยาบาลในนครราชสีมา
โรงพยาบาลศูนย์/ทั่วไปในจังหวัดนครราชสีมา
โรงพยาบาลชุมชน (อำเภอ) ในจังหวัดนครราชสีมา
โรงพยาบาลเอกชนในจังหวัดนครราชสีมา
Honda หนาวนี้ เที่ยวไหน ก็อุ่นใจกับฮอนด้า ตรวจสภาพรถฟรี 25 รายการ ตั้งแต่ 1 ธ.ค. 2564 - 28 ก.พ. 2565 LINK
"หนาวนี้ เที่ยวไหน ก็อุ่นใจกับฮอนด้า" ตรวจสภาพรถฟรี 25 รายการ พร้อมโปรโมชันมากมาย ตั้งแต่ 1 ธ.ค. 2564 – 31 ม.ค. 2565 และชวนลูกค้านำรถเก่าเข้าตรวจสภาพเครื่องยนต์ เพื่อแก้ปัญหามลพิษฝุ่น PM 2.5 ในโครงการ "คลินิกรถ" ตั้งแต่ 1 ธ.ค. 2564 – 28 ก.พ. 2565
1 ธันวาคม 2564
"หนาวนี้ เที่ยวไหน ก็อุ่นใจกับฮอนด้า" แคมเปญส่งท้ายปีเก่า ต้อนรับปีใหม่ 2565 โดย บริษัท ฮอนด้า ออโตโมบิล (ประเทศไทย) จำกัด ร่วมกับ กรมการขนส่งทางบก เชิญชวนลูกค้าฮอนด้าเตรียมความพร้อมก่อนการเดินทางในช่วงเทศกาลปีใหม่ 2565 เพิ่มความอุ่นใจและปลอดภัยตลอดทุกการเดินทาง ด้วยบริการตรวจสภาพรถยนต์ฟรี 25 รายการ รวมถึงข้อเสนอสุดพิเศษเฉพาะลูกค้าฮอนด้า อาทิ โปรโมชั่นยางซื้อ 3 แถม 1 ส่วนลดอะไหล่และแบตเตอรี่รถยนต์ รวมถึงการผ่อนชำระค่าใช้จ่ายงานบริการและยางรถยนต์ นานสูงสุดถึง 10 เดือน พร้อมบริการฉีดพ่นน้ำยาฆ่าเชื้อโรคภายในรถยนต์ฟรี เมื่อนำรถยนต์เข้ารับบริการที่ศูนย์บริการฮอนด้าที่ได้มาตรฐานความปลอดภัย พร้อมทีมงานผู้เชี่ยวชาญที่พร้อมให้บริการ ตั้งแต่วันที่ 1 ธันวาคม 2564 - 31 มกราคม 2565
นอกจากนี้ ฮอนด้ายังได้ร่วมกับกรมควบคุมมลพิษ กลุ่มอุตสาหกรรมรถยนต์ สภาอุตสาหกรรมแห่งประเทศไทย จัดโครงการ "คลินิกรถ" โดยมีเป้าหมายเชิญชวนให้ลูกค้านำรถยนต์ฮอนด้าที่มีอายุ 15 ปีขึ้นไปเข้ารับการตรวจเช็กสภาพเครื่องยนต์ เพื่อแก้ปัญหามลพิษฝุ่น PM 2.5 ด้วยบริการตรวจสภาพรถยนต์ฟรี 25 รายการ พร้อมรับสิทธิพิเศษส่วนลด 20% สำหรับกรองนํ้ามันเครื่อง และส่วนลด 10% สำหรับกรองอากาศ เมื่อนำรถยนต์เข้ารับบริการที่ศูนย์บริการฮอนด้า ตั้งแต่วันที่ 1 ธันวาคม 2564 – 28 กุมภาพันธ์ 2565
สิทธิประโยชน์สำหรับลูกค้าฮอนด้าที่มีรถยนต์อายุ 15 ปีขึ้นไปในโครงการ "คลินิกรถ"
รายการที่ 1 บริการตรวจสภาพรถยนต์ฟรี 25 รายการ (ตามรายการที่กำหนด*)
รายการที่ 2 ส่วนลด 20% กรองนํ้ามันเครื่อง
รายการที่ 3 ส่วนลด 10% กรองอากาศ
ลูกค้าฮอนด้าที่สนใจสามารถนำรถยนต์เข้าตรวจสภาพและรับบริการได้ที่ศูนย์บริการฮอนด้าทั่วประเทศ สำหรับแคมเปญ "หนาวนี้ เที่ยวไหน ก็อุ่นใจกับฮอนด้า" ตั้งแต่วันที่ 1 ธันวาคม 2564 – 31 มกราคม 2565 และโครงการ "คลินิกรถ" ตั้งแต่วันที่ 1 ธันวาคม 2564 – 28 กุมภาพันธ์ 2565 โดยสามารถจองคิวเข้ารับบริการล่วงหน้าผ่านบริการ "Online Service Booking" ที่ https://servicebooking.honda.co.th หรือทาง LINE Honda Thailand Official Account (@Honda-Thailand) ซึ่งลูกค้าสามารถเลือกใช้บริการพิเศษเพื่อเพิ่มความสะดวกสบายยิ่งขึ้นกับบริการ "Honda Drop & Go" เพียงนัดหมายเช็กระยะล่วงหน้า นำรถมาฝากกุญแจไว้ แล้วไปทำธุระต่อได้เลย หรือบริการ "Honda Quick Service" การนัดหมายเช็กระยะเร่งด่วน แบบรอรับรถได้ภายในเวลาที่กำหนด
สอบถามรายละเอียดเพิ่มเติมได้ที่โชว์รูมและศูนย์บริการฮอนด้าทั่วประเทศ หรือศูนย์บริการข้อมูลฮอนด้า 24 ชั่วโมง (Honda Call Center) โทร. 0 2341 7777 หรืออ่านรายละเอียดเพิ่มเติมที่ www.honda.co.th
เราระบาดเร็วขึ้น 2-5 เท่า
เรารู้จักเชื้อไวรัสโควิด-19 สายพันธุ์ “โอไมครอน” (Omicron) ดีแค่ไหน
องค์การอนามัยโลก (WHO) ได้ประกาศอย่างเป็นทางการให้ไวรัสโควิด-19 กลายพันธุ์ตัวใหม่ B.1.1.529 หรือสายพันธุ์ “โอไมครอน” เป็นกลุ่มที่น่ากังวล (VOC : Variant of Concern) แล้วสายพันธุ์นี้แพร่ระบาดง่ายกว่าเดิมไหม มีความรุนแรงแค่ไหน การฉีดวัคซีนยังเวิร์คอยู่ไหม ไปดูรายละเอียดกันได้เลยค่ะ
ติดต่อสอบถามรายละเอียดได้ที่ Contact Center โทร. 0-2450-9999
กรณีจัดงานมีผู้ร่วมงานไม่เกิน 1,000 คน
กลุ่มเด็กโตและวัยรุ่นอายุ 6-24 ปี
กลุ่มเด็กโตและวัยรุ่นอายุ 6-24 ปี มีสิทธิประโยชน์บริการ ดังนี้ ฉีดวัคซีนคอตีบ บาดทะยัก วัคซีนเอชพีวีป้องกันมะเร็งปากมดลูก (สำหรับนักเรียนหญิง ป.5) ชั่งน้ำหนักวัดส่วนสูงเพื่อติดตามการเจริญเติบโต ตรวจเลือดคัดกรองภาวะโลหิตจาง เอชไอวี ตรวจช่องปากและฟัน ตรวจวัดความดันโลหิต ตรวจคัดกรองสายตาและการได้ยิน คัดกรองความเสี่ยงจากการสูบบุหรี่ สุรา และสารเสพติด เคลือบฟลูออไรด์และหลุมร่องฟัน การให้ยาบำรุงเสริมธาตุเหล็ก แว่นตาหากมีภาวะสายตาผิดปกติ การป้องกันและแก้ไขการตั้งครรภ์ในวัยรุ่นและการตั้งครรภ์ไม่พึงประสงค์ การคุมกำเนิด การให้คำปรึกษาแนะนำด้านสุขภาพ
Zone : 2 สแกนกาย ปลดล็อควัย
ความพิเศษของโซนนี้คือการเปลี่ยนให้คุณเป็นคนในช่วงวัยต่างๆ ได้ ไม่ว่าจะเป็น วัยเด็ก วัยผู้ใหญ่ หรือวัยสูงอายุ พร้อมมีลูกเล่นที่คุณสามารถร่วมสนุกกับจอ Interactive ขนาดใหญ่ได้ โดยมีเทคโนโลยี Motion Capture
ที่สามารถจับความเคลื่อนไหวร่างกายให้ตัวละครบนหน้าจอขยับไปพร้อมๆ กับคุณ
และคุณยังสามารถเลือกดูส่วนประกอบของร่างกายได้ตามใจชอบ เช่น ร่างกายภายนอก ระบบกระดูก หรือสมองและหัวใจ เป็นกิจกรรมสนุกๆ เพื่อให้คุณได้รับข้อมูลที่ควรรู้ของวัยต่างๆ เพื่อนำไปปรับใช้ในการใช้ชีวิตได้ครับ
3. พฤติกรรมเปลี่ยน แจ้งเกิด Flexitarian ผู้บริโภคกลุ่มใหม่
จากงานวิจัยโดย Human Research Council บอกไว้ว่า 5 ใน 6 ของกลุ่มคนรับประทานมังสวิรัติและวีแกนจะล้มเลิกความตั้งใจกลางคัน ซึ่งสาเหตุมาจากการบริโภคแบบ Full-time นั้นต้องอาศัยความอดทนอย่างมาก ทำได้ยาก และรบกวนวิถีชีวิตประจำวัน เช่น การไม่บริโภค
เนื้อสัตว์ในร้านอาหารทั่วไปปัจจุบันมีตัวเลือกน้อย เมนูจำเจ และไม่อร่อยนัก ด้วยเหตุนี้ปัจจุบันคนส่วนมาก จึงหันมาบริโภคแบบ Flexitarian หรือ การบริโภคมังสวิรัติเป็นครั้งคราวมากขึ้น
โดมปลูกกัญชาจากวิสาหกิจทุ่มแพม แม่สะเรียง หนึ่งในผู้นำในอุตสาหกรรมกัญชาของไทย
อภัยภูเบศร มาเต็มทุกครั้ง
อภัยภูเบศร มาเต็มทุกครั้ง หนึ่งในสัญลักษณ์ควบคู่ไปกับงานสมุนไพรแห่งชาติ
ผลิตภัณฑ์สมุนไพรลูกประคบกัญชา เทอร์ปีนผสมอาหาร น้ำผึ้งหมักรากกัญชา มาในแพคเกจเกจดูดีมีมาตรฐาน
ผลิตภัณฑ์เครื่องสำอางค์ สารสกัด กัญชา กัญชง
รายที่ 10134 หญิง อายุ 30 ปี อ.นามน 17 ธันวาคม ไปร้านคิกคาปู้
รายที่ 10134 หญิง อายุ 30 ปี อ.นามน อาชีพพนักงานบริษัท
17 ธันวาคม 18-24 น. ไปร้านคิกคาปู้ พร้อมน้องสาว
20 ธันวาคม เริ่มมีไข้ ไอแห้ง น้ำมูกเล็กน้อย อ่อนเพลีย
22 ธันวาคม ตรวจ ATK เองที่บ้าน ผลเป็นลบ
23 ธันวาคม มีอาการไข้ ไอ ปวดกล้ามเนื้อ ตรวจอีกครั้งที่รพ.นามน ผลเบื้องต้น ATK เป็นบวก เดินทางกลับบ้าน แยกกักตัวดูอาการ แม่ที่เดินทางไปด้วย ตรวจโควิดผลเป็นลบ
24 ธันวาคม กักตัวที่บ้าน 12-13 น. รถรพ.นามนมารับตัวไปรักษา
โรงพยาบาลในจังหวัดสุรินทร์
โรงพยาบาลศูนย์สุรินทร์
โรงพยาบาลชุมชน (อำเภอ) สุรินทร์
โรงพยาบาลเอกชนสุรินทร์
เพราะความหวานคือความสุขที่ไม่ควรถูกมองข้าม
"สำหรับผมแล้วธุรกิจร้านกาแฟมันทำงานกับไลฟ์สไตล์ การทำงานของเราต้องตอบโจทย์ทั้ง Emotional และ Experience ให้กับลูกค้า ซึ่งบ้างครั้งลูกค้าที่เป็นผู้ป่วยโรคเบาหวานก็อาจจะดื่มกาแฟไม่ได้ทุกเมนู ดังนั้นเมื่อเราได้รับโอกาสให้ลองเราก็ตอบรับทันที เพราะที่ Casa Lapin เราใส่ใจกับการสร้างสรรค์สิ่งใหม่ๆ ให้กับลูกค้าอยู่แล้ว ผมเชื่อว่า ถ้าลูกค้ามีความสุข ธุรกิจก็จะเกิด ซึ่งความสุขของลูกค้าเบาหวานก็ไม่ควรถูกมองข้ามไป " เจ-เอกชัย สุขุมวิทยา ผู้บริหาร Casa Lapin และรองประธานเจ้าหน้าที่บริหาร บริษัท เจมาร์ท จำกัด (มหาชน) กล่าวถึงแรงบันดาลใจที่มาร่วมแคมเปญกับโรงพยาบาลวิมุต
ทุ่งดอกบัวตอง เส้นทางขึ้นดอยม่อนแจ่ม จ.แม่ฮ่องสอน
ช่วงเดือนพฤศจิกายน-กลางเดือนธันวาคม ชมทุ่งดอกบัวตองบานสะพรั่งริมทางหลวงหมายเลข 45 ทางขึ้นดอยม่อนแจ่ม จ.แม่ฮ่องสอน
ร้านเฮียโอ๊ตเย็นตาโฟ (ข้างอุทยานสวรรค์) ระหว่างวันที่ 27-29 ธันวาคม 2564 LINK
#ประชาสัมพันธ์สำนักงานสาธารณสุขจังหวัดนครสวรรค์
?❗️ขอให้ประชาชนที่ไปรับประทานอาหารที่ “ร้านเฮียโอ๊ตเย็นตาโฟ (ข้างอุทยานสวรรค์)” ระหว่างวันที่ 27-29 ธันวาคม 2564
#ติดต่อเข้ารับการตรวจหาเชื้อ COVID-19 ณ คลินิกไข้หวัด โรงพยาบาลของรัฐใกล้บ้าน หรือ ณ คลินิกไข้หวัด โรงพยาบาลสวรรค์ประชารักษ์ เปิดตรวจทุกวัน ระหว่างเวลา 08:30 – 22:00 น.
#โดยสวมหน้ากากอนามัยและใช้รถส่วนตัวในการเดินทาง
☎สอบถามเพิ่มเติมที่สายด่วน COVID-19 โทร. 081-3527696
⚠ และขอความร่วมมือผู้รับบริการทุกท่าน ไม่ปกปิดข้อมูลประวัติการเดินทาง หรือการสัมผัสกลุ่มเสี่ยง เพื่อความปลอดภัยของท่านและทุกคน ตลอดจนบุคคลากรทางการแพทย์
โอมิครอน เชื้อโควิด-19 สายพันธุ์ใหม่ที่ทั่วโลกเฝ้าระวัง-จับตามอง โรงพยาบาลพริ้นซ์ สุวรรณภูมิ
อาการของผู้ป่วยป่วยโควิด-19 สายพันธุ์ โอมิครอน ข้อมูลจากผู้ติดเชื้อสายพันธุ์โอมิครอนที่มีอาการ 41 ราย
ลงทะเบียนจองคิวฉีดวัคซีน โรงพยาบาลชลบุรี
***ลงทะเบียนโรงพยาบาลชลบุรี*** ประกาศโรงพยาบาลชลบุรี
ตามนโยบายของกระทรวงสาธารณสุข รพ. ชลบุรี เปิดให้บริการจองคิวฉีดวัคซีน ในกรณี
1. ประชาชนที่ยังไม่เคยได้รับวัคซีนมาก่อน (อายุ 12 ปี ขึ้นไป )
2. เคยติดเชื้อโควิด-19 และรักษาหายแล้ว 1 เดือนขึ้นไป
3. ได้รับวัคซีนครบ 2 เข็ม มาแล้ว 3 เดือนขึ้นไป
ขอให้ท่านสแกน QR code เพื่อจองวันและเวลานัดรับวัคซีน
- สถานที่ฉีดวัคซีน อาคารผู้ป่วยนอกชั้น 4 โรงพยาบาลชลบุรี เวลา 8.00 น. - 15.00 น.
- วัคซีนที่ได้รับ เป็นไปตามคำแนะนำการฉีดวัคซีนโควิด-19 ของสสจ.ชลบุรี และกระทรวงสาธารณสุข
ประกาศ ณ วันที่ 18 ธ.ค. 64
สปส. กรุงเทพมหานครพื้นที่ 2 LINK
เลขที่ 70 ซอย 10 ถนนเทศบาลรังสรรค์เหนือ แขวงลาดยาว เขตจตุจักร กทม. 10900
สถานที่ : ตรงข้ามประชาชื่น 44 ใกล้โรงเรียนเพชรรัตน์
รับผิดชอบเขต จตุจักร ดอนเมือง บางซื่อ บางเขน หลักสี่
Facebook พื้นที่ 2 แผนที่
Tel. 02-9542577, 02-9544864 , 02-9544804 , 02-9544807 , 02-9542825 , 02-9542586
Fax 02-9544869 , 02-9544879
wallap.R@sso.go.th
ฝ่ายอำนวยการ 02-9544864
งานสิทธิประโยชน์ทดแทน 02-9544804
งานการเงินและบัญชี 02-9544807
งานเงินสมทบ 02-9542825
งานทะเบียนและประสานการแพทย์ 02-9542586
จุดตรวจ ATK ฟรี ใน 11 โรงพยาบาลสังกัด กทม. LINK
โรงพยาบาลสังกัดสำนักการแพทย์ กทม. อีกทั้ง 11 แห่ง โดยไม่เสียค่าใช้จ่าย
1. โรงพยาบาลสิรินธร โทร 02-3286760
2. โรงพยาบาลตากสิน โทร 02-4377677
3. โรงพยาบาลเจริญกรุงประชารักษ์ โทร 02-2897986
4. โรงพยาบาลหลวงพ่อทวีศักดิ์ โทร 02-4293575 02-4293258
5. โรงพยาบาลเวซการุณย์รัศมิ์ โทร 02-5432090
6. โรงพยาบาลลาดกระบัง กรุงเทพฯ โทร 02-3273049
7. โรงพยาบาลราชพิพัฒน์ โทร 02-4443660
8. โรงพยาบาลผู้สูงอายุบางขุนเทียน โทร 02-2897986
9. โรงพยาบาลคลองสามวา โทร 02-1501300
10.โรงพยาบาลบางนา กรุงเทพฯ โทร 02-1800202 ต่อ103
11. โรงพยาบาลกลาง โทร 02-2251354
รายชื่อรพ.ในแม่ฮ่องสอน
โรงพยาบาลจังหวัดแม่ฮ่องสอน
โรงพยาบาลชุมชน (อำเภอ) ในแม่ฮ่องสอน
“ส่วนตัวไม่ได้คัดค้านการใช้กัญชาทางการแพทย์ แต่การจะปลดออกจากบัญชียาเสพติดประเภท 5 ตนยังไม่เห็นด้วย ต้องคิดให้รอบคอบเพื่อเป็นการคุ้มครองคนไทยโดยรวมจริง ๆ การคุมสารสกัด THC ไม่ให้เกิน 0.2% ถามว่าในชีวิตจริงหน่วยงานใดจะสามารถตรวจสอบได้อย่างทันท่วงทีและครอบคลุมทั้งประเทศ”
----------------------
รศ.ดร.ภญ.จุฑามณี สุทธิสีสังข์
รองอธิการบดี มหาวิทยาลัยมหิดล
ศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน (Drew Weissman, M.D., Ph.D.)
ศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน (Drew Weissman, M.D., Ph.D.)
ผู้อำนวยการแผนกวิจัยวัคซีนโรคติดเชื้อ และศาสตราจารย์ ภาควิชาอายุรศาสตร์
คณะแพทยศาสตร์ มหาวิทยาลัยเพนซิลวาเนีย ฟิลาเดลเฟีย
สหรัฐอเมริกา
ศาสตราจารย์ซาโตชิ โอมูระ (Professor Dr. Satoshi Omura)
ศาสตราจารย์ซาโตชิ โอมูระ (Professor Dr. Satoshi Omura) จากประเทศญี่ปุ่น ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการแพทย์ ประจำปี 2540 จากผลงานการศึกษาวิจัยจุลชีพชนิดหนึ่งชื่อ สเตรฟโตมัยซีสเอเวอร์มิติลิต จนสามารถสังเคราะห์ยา ivermectin ใช้รักษาและป้องกันโรคตาบอดจากพยาธิและโรคเท้าช้าง ต่อมาได้รับรางวัลโนเบล สาขาการแพทย์ ประจำปี 2558 จากผลงานเดียวกัน
ข.ผู้ป่วยรายใหม่ ตั้งแต่ 1 ก.พ.2565 เป็นต้นไป
พื้นที่ออกแบบไว้เป็นที่วิ่งเล่นสำหรับสุนัข แถมยังแยกเป็นกรงขนาดใหญ่สองกรงติดกัน กรงหนึ่งสำหรับสุนัขใหญ่และอีกกรงหนึ่งสำหรับสุนัขเล็ก เพื่อที่จะได้เล่นกันได้อย่างสมน้ำสมเนื้อ
Package Basic Program (สำหรับอายุ 35 - 45 ปี)
ยาห้าราก (เบญจโลกวิเชียร) แก้ไข้ กระทุ้งพิษไข้ LINK
ยาห้าราก ยาเบญจโลกวิเชียร ยาแก้วห้าดวง หรือยาเพชรสว่าง เป็นชื่อของตํารับยา เดียวกัน ยาห้ารากเป็นตํารับยาแผนโบราณของไทยที่มีการใช้กันมานานแล้ว โดยมีสรรพคุณในการใช้ แก้ไข้ กระทุ้งพิษ หรือถอนพิษต่างๆ ตํารับยาจะประกอบด้วยรากสมุนไพร 5 ชนิด ได้แก่ คนทา ชิงชี่ เท้ายายม่อม มะเดื่อชุมพร และย่านาง ในอัตราส่วนที่เท่ากัน
คำเตือน
ไม่แนะนำให้ใช้ในผู้ที่สงสัยว่าเป็นไข้เลือดออก เนื่องจากอาจบดบังอาการของไข้เลือดออก
หากใช้ยาเป็นเวลานานเกิน 3 วัน แล้วอาการไม่ดีขึ้น ควรปรึกษาแพทย์
ไม่แนะนำให้ใช้ในหญิงที่มีไข้ทับระดูหรือไข้ระหว่างมีประจำเดือน
4. Rayong in love ชวนชิม ริมเล ณ หาดแม่รำพึง 12-14 ก.พ.65 LINK
องค์การบริหารส่วนจังหวัดระยอง ขอเชิญชวนเที่ยวงาน “Rayong in love ชวนชิม ริมเล” โครงการส่งเสริมการท่องเที่ยวจังหวัดระยอง ณ หาดแม่รำพึง ลานหินขาว ตำบลตะพง อำเภอเมือง จังหวัดระยอง ตั้งแต่วันที่ 12-14 กุมภาพันธ์ 2565 เวลา 16.00 - 21.00 น. ภายในงานพบกิจกรรมมากมาย อาทิเช่น ร้านจำหน่ายอาหารทะเลสดๆ สะอาด ปลอดภัย พร้อมรับฟังดนตรีสดริมทะเล และในวันที่ 14 กุมภาพันธ์ 2565 เทศกาลแห่งความรัก เนรมิตทะเลระยองให้กลายเป็นที่ว่าการอำเภอรัก กิจกรรมพิธีจดทะเบียนสมรส ริมชายหาดสุดแสนพิเศษในงาน Rayong In Love ชวนชิม ริมเล พร้อมลุ้นรับของรางวัลใหญ่สุดประทับใจ แล้วอย่าลืม “ จับมือคนรัก มานั่งชิลกินอาหารทะเลระยอง สด สะอาด ปลอดภัย มั่นใจได้ ”
สำนักงานมูลนิธิขาเทียมฯ LINK
การให้บริการทำขาเทียม ณ สำนักงานมูลนิธิขาเทียมฯ
- ให้คนพิการที่ต้องการทำขาเทียม โทรศัพท์นัดล่วงหน้าที่เบอร์ 053-112271 หรือมาให้แพทย์ตรวจร่างกายก่อนเวลา 10.00 น.ของวันทำการ เพื่อให้การทำขาเทียมเป็นไปด้วยความรวดเร็ว คนพิการไม่ต้องเสียเวลาในการรอขาเทียม
- ในกรณีขาขาดระดับ ใต้เข่า (BK) ท่านจะได้รับ ขาเทียมภายในวันนั้น
- กรณีขาขาดระดับเหนือเข่า (AK) ท่านอาจได้รับขาเทียมภายใน 2 - 3 วัน ขึ้นอยู่กับความสภาพและความพร้อมของตอขา
มูลนิธิขาเทียม ในสมเด็จพระศรีนครินทราบรมราชชนนี สำนักงานเชียงใหม่
ที่อยู่ : 199 หมู่ 4 ต. ดอนแก้ว อ. แม่ริม จ. เชียงใหม่ 50180 โทร. 0-5311-2271-3
แฟกซ์ : 0-5311-2275
สำนักงานกรุงเทพฯ เลขที่ 44 อาคารศรีจุลทรัพย์ ชั้น 16 ถ.พระราม 1
แขวงรองเมือง เขตปทุมวัน กรุงเทพฯ 10330 โทร : 02-215-4369
ID Line : @bcx8919o
Digital Health Pass อยู่ตรงไหนในแอป
Digital Health Pass อยู่ตรงไหนในแอป
ฟังก์ชั่นนี้ จะแสดงตรง ปุ่ม "Digital Health Pass" ในหมอพร้อม (ทั้งแอปและไลน์)
[เต็มแล้ว] โรงพยาบาลเด็ก เปิดลงทะเบียนจอง เริ่ม 8 ก.พ.65 LINK
โรงพยาบาลเด็ก เปิดลงทะเบียน จองฉีดวัคซีน PfiZer เด็กอายุ 5-11 ปี #ไม่รับ walk in #ไม่มีลงทะเบียนหน้างาน ผู้ปกครองที่สนใจสามารถลงทะเบียนการจองได้ ตามคิวอาร์ โค้ด ที่ปรากฏในเอกสารนะคะ โดย SCAN Qrcode รายละเอียดเพิ่มเติม หรือมีข้อสงสัย โทรสายตรงสุขภาพเด็ก โรงพยาบาลเด็ก โทร. 1415
ภาวะซึมเศร้า (depression)
ภาวะซึมเศร้าเป็นภาวะที่พบได้บ่อยในผู้สูงอายุ โดยมีอุบัติการณ์ร้อยละ 7 - 10 ในชุมชน (ในประเทศไทยพบร้อยละ 13) 27,28 ผู้ป่วยอาจมาพบแพทย์ด้วยปัญหาความจำ จึงมีชื่อเรียกอีกอย่างหนึ่งว่า pseudodementia ซึ่งเป็นปัญหาที่แพทย์ควรวินิจฉัยให้ได้เนื่องจากเป็นสาเหตุหนึ่งของภาวะสมองเสื่อมชนิดกลับคืนเป็นปกติได้ (reversible dementia) โดยทั่วไปผู้ป่วยมักมีความผิดปกติในการนอน เบื่ออาหาร อ่อนเพลีย รู้สึกตัวเองไม่มีคุณค่าหรือรู้สึกผิด คิดถึงเรื่องการเสียชีวิต หรืออาจมีความคิดจะฆ่าตัวตายได้ (อักษรย่อช่วยจำ : SIG E-CAPS จาก Sleep, Interest, Guilt, Energy, Concentration, Appetite, Psychomotor agitation and/or retardation, Suicidal idea)
การวินิจฉัยภาวะนี้ในผู้สูงอายุบางครั้งทำได้ลำบาก เนื่องจากอาการอาจคล้ายกับอาการที่พบทั่วไปในผู้สูงอายุ เช่น การนอนไม่หลับ เบื่ออาหาร ปัญหาทางเพศ เป็นต้น บางครั้งผู้ป่วยอาจไม่รู้สึกอารมณ์หดหู่ เศร้าใจหรือซึมเศร้าก็ได้ นอกจากนั้นแพทย์ควรต้องระวังว่าภาวะซึมเศร้าอาจเป็นอาการร่วมอย่างหนึ่งของภาวะสมองเสื่อม โดยพบว่าผู้ป่วยโรคอัลไซเมอร์ระยะต้น อาจมีภาวะซึมเศร้าได้ และผู้ป่วยที่ได้รับการวินิจฉัยภาวะซึมเศร้า เมื่อติดตามผู้ป่วยไประยะหนึ่งอาจมีภาวะสมองเสื่อมได้สูงกว่าผู้สูงอายุทั่วไป ดังนั้นจึงควรติดตามประเมินความสามารถของสมองเป็นระยะในผู้ป่วยที่มีภาวะซึมเศร้า
ความผิดปกติของความจำเพียงอย่างเดียว (amnestic syndrome)
ผู้ป่วยกลุ่มนี้จะมีแต่ปัญหาของความจำ (amnesia) โดยที่การทำงานของสมองอย่างอื่นเป็นปกติ กล่าวคือ ไม่พบความผิดปกติของการใช้ภาษา (aphasia) ไม่มีการสูญเสียทักษะในการทำกิจกรรม (apraxia) ไม่มีการไม่รับรู้ในสิ่งที่เคยรู้มาก่อน(agnosia) และ ไม่มีความผิดปกติในการบริหารจัดการ (executive dysfunction) ภาวะนี้เกิดจากความผิดปกติของสมองส่วน medial temporal lobe และ วงจร Papez สาเหตุที่พบบ่อยของภาวะนี้คือ กลุ่มอาการ Wernicke-Korsakoff ซึ่งเกิดจากการติดสุราและขาดวิตามินบีหนึ่ง (thiamine) โรคสมองอักเสบจากเชื้อ herpes และอุบัติเหตุที่สมอง
โรงพยาบาลเพชรรัตน์ เปิดรับสมัคร part time หลายตำแหน่ง LINK
รับสมัครงานออนไลน์เท่านั้น
งดรับสมัครงานด้วยตนเอง เนื่องด้วยสถานะการณ์ COVID - 19 แพร่ระบาด
หากสนใจร่วมงานกับเราสามารถสมัครงาน เเละยื่นเอกสารผ่านทางเว็บไซต์ได้ที่
สอบถามข้อมูลเพิ่มเติม : แผนกบุคคล ทุกวัน จันทร์ - ศุกร์ เวลา 08.00-17.00 น. เสาร์ เวลา 08.00-12.00 น. โทร. 056-720-682 ต่อ 2417
สหรัฐฯ เฝ้าระวังภาวะมิสซี (MIS-C) ลุกลามในเด็กหลังหายป่วยจากโควิด - TNN Health LINK
ผู้เชี่ยวชาญในสหรัฐ ประเมินยอดผู้ป่วยโควิดกำลังลดจำนวนลงเรื่อยๆ หลังเชื้อโอมิครอนระบาดอย่างทั่วประเทศในช่วงเดือนมกราคมที่ผ่านมา ซึ่งในการระบาดรอบล่าสุดนี้ พบว่าเชื้อโอมิครอน ทำให้จำนวนผู้ป่วยที่เป็นเด็กติดเชื้อโควิด มากขึ้นเมื่อเทียบกับครั้งก่อนๆ โรงพยาบาลหลายแห่งมีผู้ป่วยเด็กล้นเตียง
แม้ตอนนี้สถานการณ์จะดีขึ้นกว่าเดิมแล้ว แต่สหรัฐฯ กำลังพบกับความท้าทายใหม่ เนื่องจากมีรายงานเด็กที่หายป่วยจากโควิด กลับต้องเผชิญกับภาวะ MIS-C กลุ่มอาการอักเสบที่เป็นภาวะแทรกซ้อนรุนแรงหลังติดเชื้อ
ทำความรู้จักกับภาวะ MIS-C
MIS-C หรือ Multisystem Inflammatory Syndrome in Children คือ กลุ่มอาการอักเสบหลายระบบที่เป็นภาวะแทรกซ้อนรุนแรงหลังเด็กหายจากการติดเชื้อโควิด-19 เริ่มมีอาการได้ตั้งแต่ระยะหายจากโรคจนถึงหลังติดเชื้อ 2 – 6 สัปดาห์ ส่วนใหญ่พบในเด็กผู้ชายมากกว่าเด็กผู้หญิง
อาการที่พบส่วนใหญ่ คือมีไข้ ผื่น ตาแดง มือเท้าบวมแดง ปากแห้งแตก อาจพบภาวะปิดอักเสบ ปวดท้องถ่ายเหลว คลื่นไส้ อาเจียน และหายใจเหนื่อยหอบเร็วร่วมด้วย
ซึ่งพ่อแม่ไม่ควรชะล่าใจ เมื่อเห็นลูกน้อยมีอาการผิดปกติเหล่านี้ หลังหายป่วยจากโควิดแล้ว ก็ควรรีบนำตัวเด็กส่งโรงพยาบาล เพราะ ภาวะ MIS-C อาจส่งผลกระทบต่ออวัยวะสำคัญ อาทิ ตับ สมอง ปอด และหัวใจ
สำหรับที่อเมริกา ศูนย์ควบคุมและป้องกันโรคของสหรัฐ หรือ CDC พบ จำนวนเด็กป่วยด้วยภาวะ MIS-C เพิ่มขึ้นเรื่อยๆ แต่จำนวนยอดที่อัพเดตรายเดือนล่าสุดเมื่อ 31 มกราคมที่ผ่านมา พบเด็กที่มีภาวะ MIS-C แล้วอย่างน้อย 6,800 คนจากยอดเด็กที่ติดเชื้อโควิดระลอกล่าสุด 4.5 ล้านคน
ปกติแล้วภาวะ MIS-C ไม่ได้ทำให้เด็กมีอาการป่วยรุนแรงจนถึงแก่ชีวิต แต่เมื่อสัปดาห์ก่อน หน่วยงานสาธารณสุขของรัฐวิสคอนซิส รานงานการเสียชีวิตของเด็กอายุ 10 ขวบรายหนึ่ง ซึ่งเกิดขึ้นหลังป่วยด้วยภาวะMIS-C ได้ประมาณ 1 เดือน
ขณะที่ผู้เชี่ยวชาญหลายฝ่ายกกำลังมุ่งประเด็นการศึกษาของความแตกต่างระหว่างเคสเด็กที่ติดโควิดแล้วพบ MIS-C ในขณะที่เด็กบางส่วนไม่พบ โดยปัจจุบันพบว่า เด็กที่มีอายุมากมีความเสี่ยงน้อยกว่า เนื่องจากเป็นกลุ่มเด็กที่ได้รับวัคซีนไปแล้ว
สอดคล้องกับงานวิจัยจาก CDC ที่เผยแพร่ไปเมื่อเดือนมกราคมที่ผ่านมา ว่า วัคซีนที่ผลิตโดยบริษัทไฟเซอร์ไบออนเทค มีความสามารถลดความอาการป่วยที่คล้ายกับ MIS-C ได้อย่างน้อย 91% สำหรับเด็กอายุ 12-18 ปี โดยการศึกษานี้ จัดขึ้นในช่วงที่โควิด สายพันธุ์เดลตา ระบาดเป็นสายพันธุ์หลักในอเมริกา แต่สำหรับการระบาดที่มีเชื้อโอมิครอนเป็นสายพันธุ์หลักรอบที่ผ่านมา ผู้เชี่ยวชาญยังคงสับสนในข้อมูล เนื่องจากจำนวนเคส MIS-C ยังแตกต่างกันมากในแต่ละพื้นที่
5.โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน จ.สุรินทร์
โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน
เขตสุขภาพที่ 9 จ.สุรินทร์
โทร.092-3920402
เปิดทุกวัน จันทร์-ศุกร์ เวลา 8.30-16.30 น.
บทที่ 2 - แผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ “การแก้ไขปัญหามลพิษด้านฝุ่นละออง”
แผนปฏิบัติการขับเคลื่อนวาระแห่งชาติ“การแก้ไขปัญหามลพิษด้านฝุ่นละออง” เป็นการแก้ไขปัญหาซึ่งจะต้องพิจารณาผลกระทบในทุกมิติโดยเฉพาะผลกระทบที่จะเกิดขึ้นกับประชาชน เพื่อไม่ให้เกิดผลกระทบต่อการใช้ชีวิตปกติมากเกินไป โดยมีเป้าหมาย “สร้างอากาศดีเพื่อคนไทย และผู้มาเยือน”
2.1 กรอบแนวคิด
การป้องกันไว้ก่อน (Precautionary Principle) เป็นหลักการจัดการเชิงรุกที่เน้นการป้องกันผลกระทบล่วงหน้าโดยการสร้างระบบภูมิคุ้มกันให้กับทรัพยากรธรรมชาติและสิ่งแวดล้อมโดยเฉพาะพื้นที่เสี่ยง เพื่อป้องกันความเสียหาย/ผลกระทบที่จะเกิดขึ้น และคำนึงถึงกิจกรรมที่จะก่อให้เกิดความเสี่ยงและเป็นอันตรายต่อสุขภาพอนามัยหรือสิ่งแวดล้อมเพื่อนำ ไปสู่เป้าหมายระดับชาติ แผนปฏิบัติการขับเคลื่อนวาระแห่งชาตินี้ จึงได้กำ หนดมาตรการ/แนวทางการดำ เนินงานในการจัดการคุณภาพอากาศเพื่อรองรับการเปลี่ยนแปลงและการพัฒนาของประเทศไทยในอนาคตให้มีความสมดุลระหว่างเศรษฐกิจ สังคม และสิ่งแวดล้อม โดยเริ่มตั้งแต่พัฒนาระบบการบริหารจัดการมลพิษ ซึ่งรวมถึงการพัฒนาเครื่องมือกลไก ระบบฐานข้อมูล การเชื่อมโยงเครือข่ายข้อมูลเพื่อให้หน่วยงานที่เกี่ยวข้องสามารถเข้าถึงและใช้ในการตัดสินใจทั้งในสถานการณ์ปกติและสถานการณ์วิกฤต การพัฒนาอุตสาหกรรม/เทคโนโลยีเพื่อลดและควบคุมการระบายมลพิษจากแหล่งกำเนิด และจัดการมลพิษในพื้นที่เสี่ยง การส่งเสริมทุกภาคส่วน ทั้งภาครัฐ เอกชน และประชาชนให้เข้ามามีส่วนร่วมรับผิดชอบสิ่งแวดล้อมและจัดการปัญหามลพิษทางอากาศ โดยเฉพาะการให้ความสำ คัญกับการจัดการปัญหามลพิษในเชิงพื้นที่ รวมถึงการส่งเสริมและพัฒนาบุคลากร เทคโนโลยีการวิจัยและพัฒนา เพื่อให้เกิดนวัตกรรมและให้นำ ไปประยุกต์ใช้ซึ่งจะช่วยเพิ่มประสิทธิภาพการจัดการคุณภาพอากาศให้ดียิ่งขึ้น ปรับเปลี่ยนพฤติกรรมของแหล่งกำเนิดผู้ประกอบการ และประชาชนด้วยการจูงใจ การออกกฎหมาย การบังคับใช้กฎหมาย และกำหนดบทลงโทษแก่ผู้ก่อมลพิษเพื่อลดมลพิษตั้งแต่ต้นทาง
2.2 ตัวชี้วัด
- จำนวนวันที่ปริมาณฝุ่นละอองอยู่ในเกณฑ์มาตรฐานเพิ่มขึ้น
- จำนวนจุดความร้อน (Hotspot) ภายในประเทศลดลง
- จำนวนผู้ป่วยด้วยโรคระบบทางเดินหายใจ (ที่เกี่ยวข้องกับมลพิษทางอากาศ) ลดลง
2.3 วัตถุประสงค์
- เพื่อเป็นแนวทางปฏิบัติในการดําเนินการแก้ไขปัญหาฝุ่นละอองในภาพรวมของประเทศ และในพื้นที่วิกฤตโดยการบูรณาการการดําเนินงานร่วมกันในทุกภาคส่วน
- เพื่อให้หน่วยงานที่เกี่ยวข้องมีขั้นตอน/การปฏิบัติงานที่ชัดเจนในช่วงสถานการณ์วิกฤตปัญหาฝุ่นละออง
2.4 มาตรการและแนวทางการดำเนินงานขับเคลื่อนวาระแห่งชาติ มาตรการและแนวทางการดำ เนินงานขับเคลื่อนวาระแห่งชาติ “การแก้ไขปัญหามลพิษด้านฝุ่นละออง”
เป็นมาตรการที่กำหนดขึ้นโดยมุ่งเน้นการป้องกันและแก้ไขปัญหามลพิษเชิงพื้นที่ ซึ่งเป็นพื้นที่ที่มีปัญหา/พื้นที่เสี่ยงปัญหาฝุ่นละอองในช่วงวิกฤต ได้แก่ พื้นที่ 9 จังหวัดภาคเหนือ พื้นที่กรุงเทพมหานครและปริมณฑล พื้นที่จังหวัดอื่นๆ ที่เสี่ยงปัญหาฝุ่นละออง เช่น พื้นที่ภาคตะวันออกเฉียงเหนือ จังหวัดกาญจนบุรีเป็นต้น การป้องกันและลดมลพิษที่ต้นทาง (แหล่งกำ เนิด) ซึ่งจะพิจารณาจากแหล่งกำ เนิดหลักที่ก่อให้เกิดฝุ่นละออง เช่น ยานพาหนะ การเผาในที่โล่ง ภาคอุตสาหกรรม การก่อสร้าง หมอกควันข้ามแดน รวมถึงภาคครัวเรือน และการเพิ่มประสิทธิภาพการบริหารจัดการ โดยประกอบด้วย 3 มาตรการ
- มาตรการที่1 การเพิ่มประสิทธิภาพในการบริหารจัดการเชิงพื้นที่
- มาตรการที่ 2 การป้องกันและลดการเกิดมลพิษที่ต้นทาง (แหล่งกำเนิด)
- มาตรการที่ 3 การเพิ่มประสิทธิภาพการบริหารจัดการมลพิษ
ผลิตภัณฑ์สำหรับผู้ป่วยเบาหวาน
ผลิตภัณฑ์สำหรับผู้ป่วยเบาหวาน
- แถบตรวจระดับน้ำตาลกดูโคสในเลือด (Blood Glucose Test Strips) ขนาดบรรจุ 25 ชิ้น / กล่อง
- ACCU-CHEK Softclix Lancets เข็มเจาะเลือดปลายนิ้วชนิดใช้กับปากกาเจาะเลือด ACCU-CHEK จำนวน 25 ชิ้น / กล่อง
- แถบตรวจระดับน้ำตาลกดูโคสในเลือด (Blood Glucose Test Strips) ขนาดบรรจ 50 ชิ้น / กล่อง
- เข็มเจาะเลือดปลายนิ้วชนิด ใช้กับปากกาเจาะเลือด Microlet จำนวน 100 ชิ้น / กล่อง
- BD Micro-Fine Pen Needles No. 31G x 5 mm หัวเข็มปากกาฉีดยาอินซูลิน จำนวน 10 ชิ้น
- Novone Pen Needles หัวเข็มปากกาฉีดยาอินซูลิน No.30G x 8 mm จำนวน 10 ชิ้น
- BD SENTRY SAFETY LANCET เข็มเจาะเลือดปลายนิ้วแบบมีที่กดในตัว ชนิดใช้แล้วทิ้ง ขนาด 23G x 1.8 mm จำนวน 10 ชิ้น
ศูนย์กระดูกและข้อ LINK
ศูนย์กระดูกและข้อ โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนล พร้อมให้คำปรึกษา ดูแลทุกปัญหาเกี่ยวกับโรคกระดูกและข้ออย่างครอบคลุม ด้วยทีมแพทย์เฉพาะทางด้านกระดูกและข้อที่มากด้วยประสบการณ์และความชำนาญ รวมถึงพยาบาลเฉพาะทาง นักกายภาพบำบัด และบุคลากรผู้ชำนาญการด้านอื่น ๆ ตลอดจนเทคโนโลยีการวินิจฉัยและการรักษาที่ทันสมัย พร้อมให้บริการตั้งแต่การดูแลป้องกัน การตรวจวินิจฉัยที่ถูกต้อง การรักษาที่มีประสิทธิภาพสูง ครอบคลุมทั้งการรักษาแบบไม่ผ่าตัดและการรักษาด้วยการผ่าตัด ซึ่งมีทั้งแบบผ่าตัดแผลเปิด ซึ่งเป็นเทคนิคการรักษาแบบเดิม และการผ่าตัดผ่านกล้องแผลเล็กที่เจ็บน้อย ลดภาวะแทรกซ้อน ทำให้ผู้ป่วยฟื้นตัวไว และสามารถกลับไปใช้ชีวิตตามปกติได้รวดเร็ว โดยมีนักกายภาพผู้ชำนาญช่วยดูแลเรื่องการฟื้นฟูระหว่างและหลังการรักษา เพื่อให้ผู้ป่วยมีคุณภาพชีวิตที่ดี พร้อมกลับไปใช้ชีวิตตามแบบที่ต้องการ
บริการของศูนย์กระดูกและข้อ ครอบคลุม
- เวชศาสตร์การกีฬา (Sport Medicine) ที่ได้รับการรับรองจากทางฟีฟ่า
- เท้าและข้อเท้า (Foot and Ankle)
- มือ ข้อมือ แขน ข้อศอก และหัวไหล่ (Hand, Wrist, Arm, Elbow and Shoulder)
- สะโพกและเข่า (Hip and Knee)
- อุบัติเหตุกระดูกหัก (Fracture)
- ออร์โธปิดิกส์ในเด็ก (Pediatric Orthopedics)
- มะเร็งกระดูก (Bone Cancer)
- มะเร็งเนื้อเยื่ออ่อน (Soft Tissue Sarcoma)
- มะเร็งเนื้อเยื่อเกี่ยวพัน (Connective Tissue Sarcoma)
- ภาวะกระดูกพรุน (Osteoporosis)
ALTERNATIVE QUARANTINE
ㆍกักตัว 5 วัน สำหรับสำหรับผู้ที่ได้รับวัคซีนครบตามข้อกำหนด / ผู้ที่ไม่ได้รับวัคซีน หรือได้รับไม่ครบตามข้อกำหนด
เอกสารประกอบการลงทะเบียน
1.หนังสือเดินทาง
2.หลักฐานการชำระเงินค่าโรงแรม AQ จำนวน 5 วัน และค่าตรวจ RT-PCR 1 ครั้ง* และพาหนะรับส่งจากสนามบิน
3.ประกันภัยที่ครอบคลุมค่ารักษาพยาบาล ในวงเงินไม่น้อยกว่า USD 20,000 (ผู้มีสัญชาติไทยไม่ต้องมีประกัน และชาวต่างชาติที่มีถิ่นพำนักสามารถใช้เอกสารประกันสังคมหรือเอกสารรับรองจากนายจ้าง /หน่วยงานในไทยแทนได้)
*ตรวจหาเชื้อแบบ RT-PCR ในวันที่ 4-5
SANDBOX
ㆍ Stay within Sandbox areas for 5 days before permitted to travel to other parts of Thailand
ㆍ Current Sandbox areas indude Phuket, Krabi Phan-Nga Surat Thani (Koh Samui, Koh Tao and Koh Phangan) Chonburi (Pattaya and some districts) and Trat (koh Chang)
REQUIRED DOCUMENTS FOR REGISTRATION
1.Passport
2.Certificate of Vaccination
Ages 18 and above must be fully vaccinated
Ages below 18
Traveling accompanied by parents/legal guardian Full vaccination not required
ㆍTraveling unaccompanied
- Ages below 12 must be fully vaccinated
- Ages 12 - 17 must receive one dose of vaccination
3.Paid SHA Extrat / AQ Hotel booking confirmation for 5 days and the feefor 1RT-PCR test*, 1 ATK self-test kitand airport transfer
4.Insurance with minimum coverage of USD 20,000 for medical expenses
(not required for Thai nationals and foreign nationals who have Thai social security /confirmation letters from employer in Thailand)
*RT-PCR test will be conducted on day 0-1
ทันตกรรมดิจิทัลแบบครบวงจร
จุดเด่นของ คลินิกทันตกรรม บีดีเอ็มเอส เวลเนส คลินิก คือเป็นคลินิกทันตกรรมดิจิทัล ที่ครบครันด้วยเทคโนโลยีและนวัตกรรม ตั้งแต่ Intra - Oral camera ถ่ายภาพในช่องปาก Intra – Oral Scanner สแกนภาพเป็น 3 มิติ เพื่อตรวจหาที่มาของปัญหาในช่องปาก แสดงให้กับคนไข้เพื่อการสื่อสารอย่างชัดเจน การใช้ Cad/Cam Technology เช่น ในกรณีของการทำ “ครอบฟัน” (Crown) ออกแบบการรักษาผ่านจอคอมพิวเตอร์ ให้คนไข้ได้เห็นภาพของฟันและรอยยิ้มทั้ง “ก่อน” และ “หลัง” เพื่อตัดสินสิ่งที่ดีที่สุดกับตนเองก่อนดำเนินการจริง โดยใช้เวลาตลอดทั้งกระบวนการภายในวันเดียวเรียกว่า “วันเดย์ โซลูชัน” (One - Day Solution) จากเดิมใช้เวลาหลายวันหรือหลายสัปดาห์
หรือกรณีของการทำ “รากฟันเทียม” (implants) เพื่อให้ทุกอย่างพอดีและลงตัวที่สุด จะใช้เครื่อง Dental CT Scan ที่สแกนโครงสร้างภายในปากและภาพจากเครื่อง Intra - Oral Scanner มาซ้อนทับ วางแผนออกแบบบนคอมพิวเตอร์ และพริ้นต์ออกมาเป็นไกด์ไปวางในปากเพื่อกำหนดปักรากเทียมบนขากรรไกรได้ตรงจุด รวมทั้งในการจัดฟันแบบใส (Invisalign) ที่มีการทำ Clinical Check ให้คนไข้เห็นกระบวนการจัดฟันตั้งแต่ในสัปดาห์แรกจนเสร็จสิ้นทีละขั้นตอน เพราะการจัดฟันไม่ใช่แค่เรื่องความสวยงาม แต่ต้องตอบโจทย์ทั้งสามปัจจัยคือ การบดเคี้ยวที่ไม่ราบเรียบ ความสะอาด และความสวยงาม ทำให้คนไข้ยิ้มได้อย่างมั่นใจมากขึ้น
รพ.ธนบุรี บริการตรวจปอดอักเสบ Drive In Chest X-ray 1,000 บาท/ครั้ง
เป็นบริการดีๆ ตอบโจทย์ สำหรับท่านที่ป่วยเป็นโควิดและรักษาตัวอยู่ที่บ้าน แต่ไม่แน่ใจ/มีความกังวลว่าปอดอักเสบหรือไม่? รพ.ธนบุรี เปิดให้บริการตรวจ Drive In Chest X-ray ที่ Hospitel JC Kevin ถนนนราธิวาสราชนครินทร์ สามารถลงทะเบียน นัดหมายจองวันเวลารับบริการผ่านทาง Line OA ของรพ.ธนบุรี หรือ โทร. 063-4625850, 063-4625360 หรือ
เช็อมูลทางเพจ รพเทพธารินทร์ พร้อมบริการ 2 PACKAGE
โรงพยาบาลเทพธารินทร์ พร้อมบริการ COVID 2 PACKAGE สำหรับ 2 ประเภทความต้องการ คือ Package 1) PCR + รอผล 5,900 (สำหรับกลุ่ม ATK 2 ขีดไม่มีอาการ) และ Package 2) กักตัว+รักษาในรพ. 55,000 สำหรับกลุ่ม PCR Detected อาการสีเขียว
หมายเหตุ : กรณีมีประกันสุขภาพหรือประกันโควิด เคลม ผ่าน คืนส่วนเบิกประกันได้ / รับผล PCR ทุกที่ สอบถามเพิ่มเติม ติดต่อได้ที่เบอร์ 099-175-9452, 062-7242266
โรงพยาบาลปิยะเวท บริการรักษาผู้ป่วยโควิด ผล ATK 2 ขีด โดยไม่เสียค่าใช้จ่าย ทุกสิทธิการรักษา LINK
โรงพยาบาลปิยะเวทให้บริการ รักษาผู้ป่วยติดเชื้อโควิด-19 โดยไม่เสียค่าใช้จ่าย ทุกสิทธิการรักษา หากมีผล ATK 2 ขีด พบเชื้อโควิด-19 และเป็นผู้ป่วย “กลุ่มสีเขียว” (ไม่มีอาการ - มีอาการเล็กน้อย)
สิทธิการรักษาเป็นไปตามเงื่อนไขที่สิทธิประกันสังคมและสิทธิสำนักงานหลักประกันสุขภาพแห่งชาติ (UCEP)การเข้าโครงการ HI จะไม่สามารถใช้ซ้ำกันกับโรงพยาบาลอื่นได้
รูปแบบการรักษา • เจอ แจก จบ (OP-SI) • การกักตัวที่บ้าน (HI) • ฮอสพิเทล (Hospitel)
ลงทะเบียน Home Isolation ออนไลน์ เพียงสแกน QR-Code (คิวอาร์-โค้ด) หรือติดต่อเข้ารับบริการ (Walk In) เข้าโครงการ “กักตัวที่บ้าน” Home Isolation ณ บริเวณลาดจอด1 รพ.ปิยะเวท (ตรงข้ามเซเว่น) เวลาทำการ : 08.30 – 17.00 น. ทุกวัน โทร. 02-129-5592 ช่องทางติดต่อโรงพยาบาลเพิ่มเติม 02-129-5555
บำรุงราษฎร์ มอบส่วนลด 300 บาท วัคซีนโมเดอร์นา เหลือเพียง 1,350 บาท/เข็ม
โอกาสพิเศษต้อนรับเทศกาลสงกรานต์และวันครอบครัว “กลับบ้าน พบญาติผู้ใหญ่” มั่นใจ ปลอดภัยด้วยวัคซีนโมเดอร์นา
รพ.บำรุงราษฎร์ มอบส่วนลด 300 บาท เพื่อซื้อวัคซีนโมเดอร์นา ในราคา 1,350 บาท/เข็ม (จากปกติ 1,650 บาท/เข็ม) กรอกโค้ด MDN300 ในขั้นตอนการชำระเงิน เฉพาะวันนี้ – 30 เมษายน 2565 เท่านั้น โทร.1378 กด 1 (ข้อมูลโควิด-19 และข้อมูลวัคซีน) ระหว่างเวลา 7.00 น. - 19.00 น.
โรงพยาบาลกรุงเทพ จัด 2 แพ็กเกจฟื้นฟูสมรรถภาพร่างกายหลังหายจาก COVID-19
ศูนย์เวชศาสตร์ฟื้นฟู โรงพยาบาลกรุงเทพ จัดแพ็กเกจฟื้นฟูสมรรถภาพร่างกายหลังหายจาก COVID-19 โดยทีมแพทย์เวชศาสตร์ฟื้นฟู นักกายภาพบำบัด และนักกิจกรรมบำบัด พร้อมตรวจประเมินเพื่อออกแบบโปรแกรมฟื้นฟูร่างกายเฉพาะบุคคล อาทิ การออกกำลังกายเพื่อเพิ่มความทนทานของระบบการหายใจ หัวใจและหลอดเลือด หรือเพิ่มความยืดหยุ่นของกล้ามเนื้อเฉพาะส่วน โปรแกรมลดอาการปวด โปรแกรมเพิ่มสมรรถนะการรับรู้และความจำ รวมถึงโปรแกรมฟื้นฟูอื่น ๆ ที่สอดคล้องกับปัญหาความบกพร่องทางสมรรถภาพร่างกาย
2 แพคเกจ Ultimate Rehab Service A ราคา 11,500 สำหรับผู้ป่วยที่มีอาการหลงเหลือในระบบใดระบบหนึ่งในร่างกาย การฟื้นฟูแต่ละครั้งใช้เวลา 1 – 1.5 ชั่วโมง 5 ครั้ง และ Ultimate Rehab Service B ราคา 14,000 บาท สำหรับผู้ป่วยที่มีอาการหลงเหลือร่วมกันในหลายระบบในร่างกาย การฟื้นฟูแต่ละครั้งใช้เวลา 1 – 1.5 ชั่วโมง อบถามรายละเอียดเพิ่มเติม โทร. 0 2310 3031
โรงพยาบาลเกษมราษฎร์ บางแค เปิดทำการทุกวัน LINK
ข่าวดี !! เฉพาะผู้ที่มีสิทธิ์ประกันสังคม โรงพยาบาลเกษมราษฎร์ บางแค "ขูด อุด ถอนฟัน" (ในวงเงิน 900 บาท) เปิดทำการทุกวัน เวลา 08.00 - 17.00 น. ***วันเสาร์ - อาทิตย์ กรุณานัดล่วงหน้า *สอบถาม 02-8048959 ต่อ 4115
เกษมราษฎร์ ประชาชื่น Home Isolation กักตัวที่บ้าน - โทร 1218 กด 4 หรือ 02-910-1600-45 LINK
- เป็นผู้ป่วยกลุ่มอาการสีเขียว คือ ไม่มีอาการหรือมีอาการเล็กน้อย
- สามารถกักตัวที่บ้านได้ อยู่ในเขตกรุงเทพมหานคร
- อายุไม่เกิน 60 ปี มีโรคประจำตัวที่สามารถควบคุมได้
✔️ช่องทางการติดต่อ
-ผู้ป่วยที่ผล ATK+ หรือ RT-PCR Detected ที่ต้องการเข้าโครงการ Home Isolation
กับทางโรงพยาบาลเกษมราษฎร์ ประชาชื่น "PCC Home Isolation"
ติดต่อด้วยตัวเองที่ จุดประสานงานผู้ป่วยกักตัวที่บ้าน (ทางเข้าด้านหน้ารพ.ซ้ายมือ)
✔️เตรียมเอกสารดังนี้
-บัตรประชาชนตัวจริง/สูติบัตร พร้อมสำเนา 1 ชุด
กรณีอายุต่ำกว่า 18 ปี ต้องเอกสารหลักฐานผู้ปกครอง 1 ชุด
-เอกสารผลตรวจ ATK ที่เป็นบวกหรือ RT-PCR (ถ้ามี)
ยกเว้นกรณีผู้ป่วยประสงค์ตรวจแบบชำระเงิน
ธรรมศาสตร์เฉลิมพระเกียรติ เปิดจองฉีดโมเดอร์น่า 1,500 บาท LINK
โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ วัคซีนทางเลือก Moderna เป็นเงินจำนวน 1,500.- บาท (หนึ่งพันห้าร้อยบาทถ้วน) สำหรับวัคซีนจำนวน 1 เข็ม ทั้งนี้จะไม่รวมค่าบริการอื่น ๆ ที่ไม่เกี่ยวข้องกับการบริการวัคซีน เช่น การตรวจรักษาอาการเจ็บป่วย การตรวจสุขภาพ ค่าใบรับรองแพทย์ เป็นต้น เปิดให้บริการทุกวันศุกร์ ช่วงเวลา 16.00-18.00 น. และวันเสาร์ ช่วงเวลา 9.00-12.00 น. โดยนำบัตรประชาชนตัวจริง หรือ Passport มาในวันฉีดวัคซีนด้วย
แพทย์ผู้เชี่ยวชาญท่านแรก : ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค (Prof Jiří Dvořák, MD Zurich, Switzerland)
แพทย์ผู้เชี่ยวชาญท่านแรก ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค (Prof Jiří Dvořák, MD Zurich, Switzerland) ศาสตราจารย์ด้านประสาทวิทยาแห่งมหาวิทยาลัยซูริค,อดีตประธานเจ้าหน้าที่ด้านการแพทย์ของ FIFA , ปัจจุบันเป็นที่ปรึกษาอาวุโสด้านประสาทวิทยาและการวิจัยของศูนย์กระดูกสันหลัง (Spine Center) ประจำคลินิก Schulthess เมือง Zurich และเคยดำรงตำแหน่งประธานของคลินิกนี้ มานานกว่า 35 ปีในฐานะผู้ทรงคุณวุฒิและมีผลงานวิจัยจำนวนมากมาย เกี่ยวกับกระดูกสันหลัง ส่งผลให้ได้รับรางวัลยกย่องต่างๆ มากมาย
เนื้อหาภายในหนังสือเล่มนี้ คุณหมอในฐานะผู้ชำนาญการทางด้านวิทยาศาสตร์การกีฬาและเวชศาสตร์ป้องกัน จะมาบอกเล่าถึงข้อดีของ การออกกำลังกาย เพียงแค่บริหารเวลาให้ดี แบ่งเวลามาออกกำลังกาย 30 นาที 5 ครั้ง ต่อสัปดาห์ เป็นประจำ สม่ำเสมอ ก็ช่วยให้สุขภาพแข็งแรงได้ในระยะยาว ส่วนผู้ที่ร่างกายมีข้อจำกัดหรือมีอาการบาดเจ็บ ก็สามารถออกกำลังกายได้โดยการรักษาและดูแลที่เหมาะสม
ต้นไม้มหัศจรรย์ Miracle Tree และสิทธิประโยชน์ LINK
“ต้นไม้มหัศจรรย์” หรือ Miracle Tree โครงการสุดพิเศษจาก NUSA CSR โดยผู้ก่อตั้งมีเจตนาอันแรงกล้าที่จะเป็นส่วนหนึ่งในการสร้างสังคมคุณภาพ ให้กับชาวไทย เราอยากเห็นผู้คนมีชีวิตความเป็นอยู่ที่มั่นคง มีสุขภาพที่ดี สมบูรณ์แข็งแรง มั่งคั่งไปด้วยสุขภาพ และด้านการเงิน
Miracle Token
สมาชิกจะได้รับ NUSA Token จำนวน 10,000 Token ทันที สามารถซื้อสุดยอดผลิตภัณฑ์เพื่อสุขภาพใน Miracle Shop มูลค่า 20,000.-
Miracle Wealth
สร้างรายได้ และสุขภาพดีแบบไร้ขีดจำกัด เข้าร่วมเป็นสมาชิก Miracle Wealth อัตโนมัติ มูลค่า 30,000.- มีแพทย์คอยให้คำปรึกษาปัญหาสุขภาพตลอดอายุสมาชิก พร้อมรับผลตอบแทนแบบ Passive Income
NFT Miracle Club
สิทธิพิเศษเหนือระดับของการบริการ ที่ Miracle Cannabis Land มูลค่า 20,000.- ได้รับการดูแลเหมือนเจ้าของธุรกิจ เข้าชมเมืองมหัศจรรย์เมืองกัญชา พร้อมส่วนลดในการซื้อสินค้า และบริการของบริษัท รวมถึงบริษัทในเครือ
Miracle Life Style
สะท้อนไลฟ์สไตล์ที่เป็นที่สุด ณ โรงแรม D Varee จอมเทียน 1 คืน โดยสมาชิกจะได้รับ Promotion Code เพื่อทำไปใช้สิทธิแลก Digital Voucher มูลค่า 5,000.-
MCSR Token
สิทธิในการซื้อสินค้าและบริการด้วย
NUSA Token ในราคาที่ลดกว่า 10-90% รูปแบบการซื้อขายรูปแบบใหม่ในโลกดิจิตอล รับสิทธิพิเศษในการซื้อสินค้าของพันธมิตร โดย NUSA CSR จะคอยเป็นตัวกลางในการเชื่อมต่อพาร์ทเนอร์กับร้านค้า
CSR Business Partner
รีบคว้าโอกาส เปิดประตูสู่ความมั่งคั่งและสุขภาพที่ดีก่อนใคร เข้าร่วมเป็น CSR Business Partner รับสิทธิ์เป็นเจ้าของต้นไม้มหัศจรรย์ และเติบโตไปกับเรา เปิดจองสิทธิ์ 20 เมษายน 2565
อ.วารินชำราบ รพ.และรพ.สต.
รพ.เอกชนภาคเหนือ อีสาน และใต้
| โรงพยาบาล |
คลินิกเครือข่าย |
ภาคอีสาน
|
| รพ.กาฬสินธุ์-ธนบุรี |
|
| รพ.ราชพฤกษ์ ขอนแก่น |
(043) 333555 |
| รพ.บุรีรัมย์ ราม |
(044) 625340 |
| รพ.ร้อยเอ็ด-ธนบุรี |
(043) 515191 |
| รพ.รักษ์สกล |
|
| รพ.หนองคายวัฒนา |
(042)2465201 |
| รพ.นอร์ทอีสเทอร์นวัฒนา |
(042) 325999 |
| รพ.เอกชนร่มเกล้า |
(045) 4465960 |
| พริ้นซ์ อุบลราชธานี |
(045) 2502713 |
| รพ.อุบลรักษ์ธนบุรี |
(045) 429100 |
| รพ.เมืองเลยราม |
(042) 833400 |
ภาคเหนือ
|
| รพ.พริ้นซ์ ปากน้ำโพ 1 |
|
| รพ.ศรีสวรรค์ |
(056) 311626 |
| รพ.พริ้นซ์ ปากน้ำโพ 2 |
(034) (056) 000111 |
| รพ.พะเยาราม |
|
| รพ.ชัยอรุณเวชการ |
(056) 651407 |
| รพ.พิษณุเวช พิจิตร |
(056) 613316 |
| รพ.พิษณุเวช |
|
| รพ.หริภุญชัย เมโมเรียล |
(053) 5816004 |
| รพ.ลำพูนใกล้หมอ |
|
| รพ.พริ้นซ์ ลำพูน |
(053) 582888 |
| รพ.พิษณุเวช อุตรดิตถ์ |
(055) 409000 |
| รพ.เกษมราษฎร์ศรีบุรินทร์ |
(053)717499 |
| รพ.เทพปัญญา 2 |
(053) 220022-27 |
| รพ.เอ็ม ที อินเตอร์เมด |
|
| รพ.ลานนา |
(053) 999777 |
| รพ.เทพปัญญา |
|
| รพ.เพชรรัตน์ |
(056) 720680 |
| รพ.แพร่-ราม |
(054) 522911 |
ภาคใต้
|
| รพ.วิรัชศิลป์ ชุมพร |
(077) 542555 |
| รพ.ธนบุรี-ชุมพร |
(077) 658 555 |
| รพ.ทีอาร์พีเอช |
|
| รพ.ธนบุรี ทุ่งสง |
(075) 808888 |
| รพ.นครคริสเตียน |
(082) 0630551,(075) 356214 |
| รพ.นครพัฒน์ |
(075)305999 |
| รพ.สิโรรส ปัตตานี |
(073)348100 |
| รพ.ดีบุก |
(076) 298298 |
| รพ.มิชชั่นภูเก็ต |
(076) 212386 |
| รพ.สิโรรส ยะลา |
(073) 221114 |
| รพ.ราษฎร์ยินดี |
|
| รพ.ศิครินทร์หาดใหญ่ |
(074) 366966 |
สถานการณ์ในไทย 18 เมษายน เสียชีวิต เพิ่ม 124 ราย
ประชาชนในพื้นที่ อ.เมืองระยอง ติดต่อ-QR Code รพ.ต่างๆ ดังนี้
วันที่ 12 เม.ย.65 - บาดเจ็บ 3 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 12 เม.ย.65) เกิดอุบัติเหตุ 3 ครั้ง บาดเจ็บ 3 ราย
สะสม 2 วัน (11-12 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 7 ครั้ง บาดเจ็บ 7 ราย เสียชีวิต 1 ราย
“ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
รพ.เอกชนใน ชลบุรี 12 แห่ง
สสอ. แต่ละอำเภอ ในจ.ชลบุรี
ติดต่อรพ.รัฐ นอกสังกัด สธ. 6 แห่ง
ได้แก่
รพ.ม.บูรพา
รพ.ค่ายนวมินทราชินี
รพ.เมืองพัทยา
รพ.อาภากรเกียตริวงศ์
รพ.สมเด็จพระนางเจ้าสิริกิติ์
รพ.สมเด็นฯ ณ ศรีราชา
ติดต่อ รพ.สต.ในเขต อ.เมือง ชลบุรี 17 แห่ง
คลินิกกัญชาทางการแพทย์ ทุกวันจันทร์
ประชาชนในอ.แม่พริก ติดต่อ รพ.สต.ดังนี้
ประชาชนในอ.แม่ทะ ติดต่อ รพ.สต.
ประชาชนในอ.สบปราบ ติดต่อ รพ.สต.
ประชาชนในอ.เมืองปาน ติดต่อ รพ.สต.
ประชาชนในอ.เกาะคา ติดต่อ รพ.สต.
หมวด ๒
คณะกรรมการกัญชา กัญชง
มาตรา ๘ ให้มีคณะกรรมการคณะหนึ่ง เรียกว่า "คณะกรรมการกัญชา กัญชง"ประกอบด้วย ปลัดกระทรวงสาธารณสุข เป็นประธานกรรมการ ปลัดกระทรวงเกษตรและสหกรณ์ เลขาธิการคณะกรรมการกฤษฎีกา ผู้บัญชาการตำรวจแห่งชาติ อธิบดีกรมส่งเสริมการปกครองส่วนท้องถิ่น อธิบดีกรมการแพทย์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก อธิบดีกรมวิทยาศาสตร์การแพทย์ อธิบดีกรมศุลกากร อธิบดีกรมสนับสนุนบริการสุขภาพ อธิบดีกรมสุขภาพจิต อธิบดีกรมอนามัย ธิบดีกรมส่งเสริมอุตสาหกรรม เลขาธิการกรรมการป้องกันและปราบปรามยาเสพติดนายกแพทยสภา นายกสภาการแพทย์แผนไทย และเภสัชกรรม และกรรมการผู้ทรงคุณวุฒิซึ่งรัฐมนตรีแต่งตั้งจำนวนไม่เกินเจ็ดคน ในจำนวนนี้ ให้แต่งตั้งจากภาคเอกชนไม่น้อยกว่าสามคน
ให้เลขาธิการคณะกรรมการอาหารและยาเป็นกรรมการและเลขานุการ และให้เลขาธิการคณะกรรมการอาหารและยาแต่งตั้งข้าราชการในสำนักงานคณะกรรมการอาหารและยา จำนวนไม่เกินสองคนเป็นผู้ช่วยเลขานุการ
มาตรา ๙ กรรมการผู้ทรงคุณวุฒิมีวาระการดำรงตำแหน่งคราวละสามปี เมื่อครบกำหนดตามวาระดังกล่าว หากยังมิได้มีการแต่งตั้งกรรมการผู้ทรงคุณวุฒิขึ้นใหม่ ให้กรรมการซึ่งพ้นจากตำแหน่งตามวาระนั้นอยู่ในตำแหน่งเพื่อดำเนินงานต่อไปจนกว่ากรรมการซึ่งได้รับแต่งต้ังใหม่เข้ารับหน้าที่
กรรมการผู้ทรงคุณวุฒิซึ่งพ้นจากตำแหน่งตามวาระ อาจได้รับการแต่งตั้งอีกได้ แต่จะดำรงตำแหน่งติดต่อกันเกินสองวาระไม่ได้
มาตรา ๑๐ นอกจากพ้นจากตำแหน่งตามวาระตามมาตรา ๙ กรรมการผู้ทรงคุณวุฒิพ้นจากตำแหน่งเมื่อ
(๑) ตาย
(๒) ลาออก
(๓) รัฐมนตรีให้ออก เพราะเหตุบกพร่องหรือไม่สุจริตต่อหน้าที่ หรือความประพฤติเสื่อมเสียหรือ
(๔) เป็นบุคคลล้มละลายหรือเคยเป็นบุคคลล้มละลายทุจริต
(๕) เป็นคนไร้ความสามารถหรือคนเสมือนไร้ความสามารถ
(๖) ได้รับโทษจำคุกโดยคำพิพากษาถึงที่สุดให้จำคุก เว้นแต่เป็นโทษสำหรับความผิด ที่ได้กระทำโดยประมาทหรือความผิดลทุโทษ
(๓) ถูกสั่งพักใช้หรือเพิกถอนใบอนุญาตประกอบโรคศิลปะ ใบอนุญาตประกอบวิชาชีพเวชกรรมหรือใบอนุญาตประกอบวิชาชีพอื่น
มาตรา ๑๑ ในกรณีที่กรรมการผู้ทรงคุณวุฒิพันจากตำแหน่งก่อนวาระ ให้แต่งตั้งผู้อื่นดำรงตำแหน่งแทน เว้นแต่วาระของกรรมการผู้ทรงคุณวุฒิจะเหลือไม่ถึงเก้าสิบวัน จะไม่แต่งตั้งกรรมการผู้ทรงคุณวุฒิแทนก็ได้ และให้ผู้ได้รับแต่งตั้งแทนตำแหน่งที่ว่างนั้นอยู่ในตำแหน่งเท่ากับวาระที่เหลืออยู่ของกรรมการผู้ทรงคุณวุฒิซึ่งได้แต่งตั้งไว้แล้ว
ในระหว่างที่ยังไม่ได้แต่งตั้งกรรมการผู้ทรงคุณวุฒิแทนตำแหน่งที่ว่าง ให้คณะกรรมการประกอบด้วยกรรมการเท่าที่เหลืออยู่หย่อนความสามารถ
ep. 1.2 “พนักงาน ไม่ใช่ ผู้ประมวลผลข้อมูลส่วนบุคคล”
12.การเก็บรวบรวมข้อมูลส่วนบุคคล
จุดเริ่มต้น สู่กองทุนโซล่าเซลล์โรงพยาบาลบ้านตาก
เมื่อปี 2562 เป็นเวลาราว 3 ปี หลังจากที่ พญ.ธัญญรัตน์ สิทธิวงศ์ เข้าดำรงตำแหน่งผู้อำนวยการโรงพยาบาลบ้านตาก (ตั้งแต่ปี 2559) ท่านได้ทราบเรื่องราวว่า พระครูวิมลปัญญาคุณ (พระนามขณะนั้น) แห่งวัดศรีแสงธรรม สามารถนำเอาระบบโซลาเซลล์มาติดตั้งใช้งานภายในโรงเรียนวัคศรีแสงธรรม ในอ.โขงเจียม จ.อุบล และประยุกต์ใช้กับเครื่องไฟฟ้า ระบบแอร์ ระบบไฟฟ้า ช่วยประหยัดไฟฟ้าให้กับโรงเรียนได้มาก จึงเห็นว่าหากโรงพยาบาลสามารถนำระบบนี้มาติดตั้งบ้าง ก็น่าจะเป็นประโยชน์กับการลดค่าไฟฟ้าของโรงพยาบาลไปได้ไม่น้อย
พระปัญญาวชิรโมลี ได้เล่าถึงห้วงเวลาตั้งต้นอันเป็นที่มาของโครงการโรงพยาบาลบ้านตากไว้
"พญ.ธัญญรัตน์ สิทธิวงศ์ ผอ.โรงพยาบาลคนเก่งวิ่งขึ้นลงมาโขงเจียมหลายรอบ อยากติดตั้งโซลาร์เซลล์เป็นอย่างมากจนต้องยอมรับปากเพราะเห็นความตั้งใจที่จะพัฒนาโรงพยาบาลตนเองจริง และไม่ได้มาขอให้เป็นภาระของหลวงพ่ออย่างเดียว ยังเข้าไปกราบพ่อแม่ครูอาจารย์ที่ตนเองเคารพนับถือให้ช่วยทอดผ้าป่าได้วัดละแสนสองแสนมาช่วยจนได้เงินสามล้านกว่าบาทในการจัดทอดผ้าป่ารวมบุญบารมีครูบาอาจารย์มาพร้อมกัน"
ทีมแพทย์รพ.ศูนย์ยะลา ร่วมดูแลรักษาพยาบาล รองรับความปลอดภัยงานวิ่งเทรล
3. วิตามินบี 12 การพัฒนาเม็ดเลือดแดงที่สมบูรณ์
วิตามินบี 12 มีส่วนในการทำงานของระบบประสาท กระบวนการสร้างเม็ดเลือดแดง และการสังเคราะห์ดีเอ็นเอ ผลจากวัยที่มากขึ้นและการรับประทานยาบางชนิด ส่งผลให้ผู้สูงอายุมีการดูดซึมวิตามินบี 12 น้อยลง โดยแหล่งอาหารของวิตามินบี 12 ที่ย่อยง่ายเหมาะสมสำหรับผู้สูงอายุ ได้แก่ เนื้อปลา ไข่ เทมเป้ สาหร่ายทะเล หรืออาหารที่มีการเติมวิตามินบี 12 เช่น นมจากพืช ซีเรียลอาหารเช้า
4. โพแทสเซียม ช่วยรักษาความดันโลหิต
การรับประทานโพแทสเซียมอย่างเพียงพอ ควบคู่กับการควบคุมโซเดียมในอาหาร มีส่วนช่วยลดความเสี่ยงของการเกิดความดันโลหิตสูง อาหารจำพวกผัก ผลไม้ ถั่วเปลือกแข็ง และถั่วเมล็ดแห้ง ล้วนเป็นแหล่งของโพแทสเซียม ผู้สูงอายุควรหลีกเลี่ยงการรับประทานอาหารแปรรูป เพราะนอกจากจะมีปริมาณโซเดียมสูง ปริมาณโพแทสเซียมยังลดลงจากกระบวนการผลิตอีกด้วย เน้นรับประทานอาหารรสไม่จัดจากวัตถุดิบธรรมชาติ ลดการเติมเครื่องปรุงร่วมกับการดูแลน้ำหนักตัว เพื่อควบคุมระดับความดันโลหิตให้อยู่ในเกณฑ์เหมาะสม
5. ใยอาหาร ลดความเสี่ยงโรคไม่ติดต่อเรื้อรัง (NCDs)
การรับประทานใยอาหารเป็นประจำช่วยลดความเสี่ยงของการเกิดโรคหัวใจและเบาหวานประเภทที่ 2 และช่วยให้การขับถ่ายเป็นปกติ ผู้สูงอายุหลายคนรับประทานใยอาหารไม่เพียงพอ เนื่องจากปัญหาสุขภาพฟัน จึงควรรับประทานใยอาหารที่ย่อยง่าย เช่น ข้าวแป้งไม่ขัดสี ถั่วต้มชนิดต่างๆ รวมถึงผักและผลไม้ที่ไม่แข็ง ในปัจจุบันมีทางเลือกที่สะดวกขึ้น อย่างใยอาหารแบบชงน้ำดื่ม เพื่อให้มั่นใจว่าคุณได้รับใยอาหารอาหารอย่างเพียงพอเป็นประจำทุกวัน
ท่องเที่ยวเมืองสมุนไพรอุดรธานี
สิทธิประกันสังคมกับการตรวจสุขภาพฟรี
ผู้ประกันตน โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี สามารถรับบริการตรวจสุขภาพฟรี ตามรายการ โดยพิจารณาอายุ และความถี่ในการรับบริการแต่ละประเภทประกอบกัน
ติดต่อสอบถามข้อมูลโรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี 044-376555
โปรแกรมตรวจสุขภาพ สำหรับพนักงานการไฟฟ้า
โปรแกรมตรวจสุขภาพพนักงานการไฟฟ้า
โปรแกรมตรวจสุขภาพ 1 (ชาย,หญิง < 35 ปี) (พนักงานการไฟฟ้า) ราคา 1715 บาท
โปรแกรมตรวจสุขภาพ 2 (ชาย 35-49 ปี) (พนักงานการไฟฟ้า) ราคา 2565 บาท
โปรแกรมตรวจสุขภาพ 3 (หญิง 35-49 ปี) (พนักงานการไฟฟ้า) ราคา 3170 บาท
โปรแกรมตรวจสุขภาพ 4 (ชาย ตั้งแต่อายุ 50 ปี) (พนักงานการไฟฟ้า) ราคา 3495 บาท
โปรแกรมตรวจสุขภาพ 5 (หญิง ตั้งแต่อายุ 50 ปี) (พนักงานการไฟฟ้า) ราคา 4350 บาท
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3173-2564
ชื่อ มอก. : สารสกัดจากกัญชงที่มีปริมาณแคนนาบิไดออลรวม ไม่น้อยกว่า 80% โดยมวล
TIS NAME : Hemp extract containing total cannabidol not less than 80% by mass
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 8 กันยายน 2564
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 138ตอน พิเศษ 211 งวันที่ 8 กันยายน 2564
ประกาศกระทรวง : ฉบับที่ 6194วันที่ 30 มีนาคม 2564
เอกสารฉบับเต็ม
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานนี้ครอบคลุมเฉพาะ สารสกัดจากกัญชง ที่มีปริมาณแคนนาบิไดออลรวมไม่น้อยกว่า 80% โดยมวล และมีปริมาณเตตราไฮโดรแคนนาบิไดออลรวม ไม่เกิน 0.2% โดยมวลเพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม
Abstract : This standard only covers cannabis extracts with total cannabidiol content not less than 80% by mass and total tetrahydrocannabidiol not more than 0.2% by mass for use as industrial raw materials.
2.ยกระดับศูนย์บริการสาธารณสุข เพิ่มการรักษา เพิ่มเวลา เพิ่มทรัพยากร
ประโยชน์คนกรุงฯ
- ลดภาระค่าใช้จ่ายในการเดินทางระยะไกล ลดเวลาในการเดินทางและความแออัดในสถานพยาบาลขนาดใหญ่
- ยกระดับการเข้าถึงการรักษาพยาบาลคุณภาพดีใกล้บ้านในระดับเส้นเลือดฝอย
- คลินิกบริการและการรักษาโรคตอบโจทย์ความต้องการ ตรงกับวิถีชีวิตของประชาชน
รายละเอียด
ปัจจุบัน
กทม.มีศูนย์บริการสาธารณสุข (ศบส.) หลัก 69 แห่ง ซึ่งเป็นการบริการการแพทย์ปฐมภูมิ (primary care) สำหรับประชาชน จากสถิติปี 2563 มีจำนวนผู้เข้าใช้บริการทั้งสิ้นกว่า 1.72 ล้านครั้ง (แบ่งเป็นในเวลาราชการ 1.35 ล้านครั้ง และนอกเวลาราชการประมาณ 370,000 ครั้ง)
ศบส.หลายแห่งยังมีปัญหาในหลายมิติแตกต่างกันไปในแต่ละศูนย์ เช่น โครงสร้างพื้นฐานและอาคารทรุดโทรม ความแออัดของการใช้งาน ปริมาณบุคลากรที่ไม่เพียงพอในการรองรับผู้ป่วย ส่งผลต่อขีดความสามารถในการรักษาที่จำกัด
เพื่อยกระดับคุณภาพของการบริการรักษาปฐมภูมิ กทม.จะพัฒนาคุณภาพ ศบส. ดังนี้
- ก่อสร้าง ปรับปรุงอาคารเดิมให้ทันสมัย เพียงพอกับผู้ใช้งาน
- จัดหาอุปกรณ์ เครื่องมือ และวัสดุทางการแพทย์ที่จำเป็น
- เพิ่มจำนวนเจ้าหน้าที่ทางการแพทย์เฉพาะทางให้เพียงพอ เช่น ทันตแพทย์ เจ้าหน้าที่พยาบาล นักกายภาพบำบัด ที่ปรึกษาทางจิตวิทยา ด้วยการจ้างประจำในกรอบอัตรากำลังและลูกจ้างชั่วคราวหรือ outsourcing
- เพิ่มหรือปรับเปลี่ยนคลินิกการให้บริการ ให้สอดคล้องกับวิถีชีวิตคนเมืองและกลุ่มโรคในปัจจุบัน เช่น คลินิกกายภาพบำบัด คลินิกจิตวิทยาปรึกษา สถานรับเลี้ยงเด็กกลางวัน คลินิกสุขภาพเพศหลากหลาย คลินิกสุภาพสตรีที่ครอบคลุมบริการการตรวจคัดกรองมะเร็งเต้านม และการตรวจคัดกรองมะเร็งปากมดลูก
- ขยายบริการของคลินิกนอกเวลาราชการ ตามแบบการประเมินและความต้องการของประชาชนในพื้นที่
- ปรับปรุงสวัสดิการ ค่าล่วงเวลา ตลอดจนค่าตอบแทนให้สอดคล้องกับภาระงานในส่วนเจ้าหน้าที่แพทย์ พยาบาล ข้าราชการ ตลอดจนการบรรจุลูกจ้างชั่วคราวหรือโครงการตามอัตรากำลังที่ขาดแคลน
- เพิ่มบริการให้ยืมอุปกรณ์ทางการแพทย์ เกี่ยวกับคนพิการ เช่น รถเข็น (Wheel Chair) เครื่องช่วยเดิน ถังออกซิเจน ฯลฯ
หลีกเลี่ยงอาหารโซเดียมสูง
อาหารที่ผู้ป่วยโรคไตควรหลีกเลี่ยงอย่างสิ้นเชิง คืออาหารที่มีโซเดียมสูง เช่น เกลือ ทั้งเกลือหวาน เกลือจืด และเกลือเค็ม รวมถึงอาหารที่มีฟอสฟอรัสสูง ทั้งประเภทอาหารหมักดอง อย่าง กุนเชียง หมูยอ รวมถึงไข่แดง ผลไม้ตระกูลเบอร์รี่ กาแฟ
ตารางแพทย์ห้องตรวจศัลยกรรม
3.แนวโน้มใช้จ่ายตามช่วงอายุและภูมิภาค
แนวโน้มการใช้จ่ายคงที่ในกรุงเทพฯ มากขึ้นในกลุ่มสูงวัย
โดยภาพรวมการจับจ่ายยังคงที่ โดยเฉพาะกรุงเทพฯ ที่เป็นหัวใจด้านเศรษฐกิจหลัก อย่างไรก็ตามเราเห็นประเด็นในภาคเหนือ ที่สูงขึ้นอย่างเห็นได้ชัด อันเนื่องมาจากเทศกาลสงกรานต์ ซึ่งถือว่าเป็น ‘ปี๋ใหม่เมือง’ ของชาวภาคเหนือ ทำให้ความต้องการในการจับจ่ายสูงกว่าภาคอื่นๆ
ด้านกลุ่มอายุ ในขณะที่วัยรุ่นและวัยทำงานชะลอการใช้จ่ายลง
แต่กลุ่มสูงวัย 50-60 ปี กลับมาแนวโน้มใช้จ่ายสูงขึ้นอย่างเห็นได้ชัด อันเนื่องมาจาก การกลับมาตุนสินค้าในช่วงเทศกาลซึ่งควรราคาข้าวของจะขึ้นในช่วงนั้น ผนวกกับหน้าเทศกาลไหว้บรรพบุรุษของชาวไทยเชื้อสายจีน จึงทำให้ต้องจัดเตรียมซื้อของไหว้เป็นพิเศษ
รางวัล ELSO Award of Excellence in Extracorporeal Life Support ในปี 2022
โรงพยาบาลหัวใจกรุงเทพ เป็นหนึ่งในโรงพยาบาลที่มีปริมาณของบุคลากรที่จะเข้ามาร่วมดูแลคนไข้ที่มีความซับซ้อนค่อนข้างมาก และมีความพร้อมเพรียงกันทุกแผนก ทั้งสาขาที่หายากในหลายๆ สาขา บางครั้งเจอปัญหายากในคนไข้บางราย แต่ได้ที่ปรึกษาแพทย์เฉพาะทางที่มีความเชี่ยวชาญทางด้านเรื่องนั้นมาช่วยดูแลก็ทำให้ผ่านพ้นปัญหายากๆ ไปได้
การนำเครื่องเอคโม่มาใช้ในการปฏิบัติการช่วยเหลือผู้ป่วยโรงพยาบาลหัวใจกรุงเทพ ได้รับรางวัล ELSO Award of Excellence in Extracorporeal Life Support ในปี 2022 ซึ่งเป็นรางวัลที่มอบให้กับทีมเอคโม่ จากสถาบันที่มี ECMO service ทั่วโลก ซึ่งมี 7 ด้าน เริ่มจาก Systems Focus คือ ลักษณะของศูนย์บริการ การดูแลคนไข้ จัดระบบเป็นอย่างไร มีจำนวนบุคลากรจำนวนเพียงพอหรือไม่ ด้าน Environmental Focus เรื่องของจำนวนห้องไอซียู อุปกรณ์และเครื่องมือต่างๆ ด้าน Workforce Focus จะเป็นเรื่องของจำนวนบุคลากร
ด้าน Knowledge Management เรื่องของการแลกเปลี่ยนความรู้ในโรงพยาบาล การแลกเปลี่ยนความรู้ระหว่างแพทย์และบุคลากรต่างๆ เช่น มีการประชุม มีการปรึกษาหารือกันอย่างต่อเนื่อง
ด้าน Quality Focus จะเป็นเรื่องผลสัมฤทธิ์ในการดูแลคนไข้ มีการลงข้อมูลว่าคนไข้รายนี้ใส่เครื่องเอคโม่เมื่อไร การใส่เป็นอย่างไร รวมทั้ง มีการลงฐานข้อมูล ซึ่งฐานข้อมูลนี้จะต้องเอาผลไปเทียบกับผลของ ECMO service อื่นๆ ทั่วโลกด้วย เพื่อจะเป็นส่วนหนึ่งในคะแนนที่จะนำมาพิจารณา
ด้าน Process Optimization ดูว่าการทำงานของทีมสอดคล้องกับคำแนะนำที่ให้มาหรือไม่ โดยทางการแพทย์จะมีงานวิจัยออกมาใหม่ๆ ทุกปี ทางทีมเอคโม่ของเราก็เอาความรู้พวกนี้มาปรับการทำงานของทีม ไม่ใช่ว่า 5 ปีก่อนทำอย่างไรปัจจุบันก็ทำอย่างเดิม แต่จะต้องมีการปรับปรุงเป็นระยะๆ
สุดท้าย Patient & Family Focus ไม่ใช่ดูแลแต่คนไข้แต่ต้องดูแลไปถึงครอบครัวของคนไข้ด้วย บางครั้งต้องมีการเอานักจิตวิทยา จิตแพทย์เข้ามาอยู่ในทีม ในบางเคส เพื่อที่จะให้แน่ใจว่าทั้งตัวผู้ป่วยและญาติสามารถร่วมไปกับการรักษาของทางทีมแพทย์ได้ โดยจะต้องมองภาพใหญ่ ภาพรวมทั้งหมด
ราคา ต้นสด ต้นแห้ง เส้นใย แกน
โครงการเตียงให้ยืม LINK
ยืมฟรี ไม่มีกำหนด หมดความจำเป็นใช้แจ้งคืน
โครงการเตียงให้ยืม เป็นโครงการที่จัดตั้งขึ้นโดยคนกลุ่มเล็ก ๆ ที่มีความประสงค์อยากแบ่งปันเพื่อสังคม จัดทำโครงการสำหรับผู้ป่วยที่มีความจำเป็นต้องใช้เตียง โดยไม่เสียค่าใช้จ่ายแต่อย่างใด ภายใต้หลักการ "ยืมฟรี ไม่มีกำหนด หมดความจำเป็นใช้แจ้งคืนโครงการเพื่อส่งให้ผู้ป่วยยืมใช้ต่อๆกันไป"
ติดต่อผ่านทางเพจเฟซบุ๊ค
facebook.com/โครงการเตียงให้ยืมทรีตเมนต์สปากัญชา 3 สไตล์ ไอศวรรย์ เรสซิเดนท์เชียลสปา แอนด์ คลับ LINK
ไอศวรรย์ เรสซิเดนท์เชียลสปา แอนด์ คลับ (i.sawan Residential Spa and Club) ณ โรงแรมแกรนด์ ไฮแอท เอราวัณ กรุงเทพฯ เปิดให้บริการ สปาทรีตเมนต์ตำรับกัญชา (Cannabis-Infused Spa Relaxation) 3 สไตล์ได้แก่
• ทรีตเมนต์นวดผ่อนคลายตำรับกัญชา
• ทรีตเมนต์ขัดผิวกายตำรับกัญชา
• สปาทรีตเมนต์ตำรับกัญชา
ข้อมูลเพิ่มเติม โทร.02-2541234
เอกสารแนบ : ประกาศกระทรวงสาธารณสุข เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ.2565
ผู้ช่วยศาสตราจารย์ นายแพทย์สหภูมิ ศรีสุมะ
ผู้ช่วยศาสตราจารย์ นายแพทย์สหภูมิ ศรีสุมะ สาขาวิชาเภสัชวิทยาคลินิกและพิษวิทยา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี กล่าวถึง ข้อบ่งใช้กัญชาทางการแพทย์เปรียบเทียบกับยาแผนปัจจุบัน ว่า
ในสาร THC (tetrahydrocannabinol) จะทำให้มีอาการ เมาเคลิ้ม ประสาทหลอน แต่จะช่วยในเรื่องของใช้สำหรับแก้อาเจียน ใช้ลดการปวด คลายกล้ามเนื้อ หากมีการใช้อย่างต่อเนื่องเป็นเวลานานจะมีการดื้อต่อสาร ทำให้ต้องเพิ่มขนาดที่ใช้ และสามารถติดได้ ส่วนสาร CBD (Cannabidiol) จะต้านฤทธิ์เมาประสาทหลอน ทำให้สงบ ลดอาการวุ่นวาย สามารถใช้ลดปวดได้ ไม่มีฤทธิ์เสพติด แต่อาจจะทำให้เบื่ออาหาร คลื่นไส้ ทางเดินอาหารอาจมีปัญหา
ผู้ใช้ยาจะต้องรับทราบข้อมูลของสารทั้ง 2 ตัว ว่าสารไหนควรรักษาอาการใด สำหรับกัญชาทางการแพทย์ จะต้องมีการประเมินผู้ป่วย ข้อบ่งชี้ ข้อห้าม ปัญหายาตีกัน ความเสี่ยงการติดสารเสพติด และมีการทำความเข้าใจ กับผู้ป่วยและญาติ ว่าการออกฤทธิ์จะใช้เวลา ครึ่งชั่วโมง ถึง 1 ชั่วโมง อาการจะค่อย ๆ ดีขึ้น ซึ่งแพทย์จะมีการติดตามอย่างใกล้ชิด และรายงานเข้าระบบการใช้ยา
ซึ่งจะต้องเน้นย้ำว่า สาร Cannabidiol มีทั้งประโยชน์และโทษ ควรเลือกศึกษาสารและขนาดให้ถูกต้อง และแยกคำว่า “การใช้ยา Cannabidiol ทางการแพทย์” จาก “การเสพกัญชา” ออกจากกัน การใช้ต้องมีความรู้ ได้รับคำแนะนำที่ถูกต้องจากแพทย์และเภสัชกร ซึ่งหากใช้ไม่ถูกวิธีจะนำมาสู่การเจ็บป่วย หรือบาดเจ็บ ซึ่งปัจจุบันมีการเข้าถึงได้ง่ายยิ่งขึ้น เราจึงต้องเตรียมรับมือกับกัญชาอย่างรู้เท่ารู้ทันต่อไป
3 ขั้นตอนการจดแจ้งปลูกกัญชา บนแอพ ปลูกกัญ
ขั้นตอนดังนี้
1. ติดตั้งแอพบนมือถือ/แทปเล็ต
2. ลงทะเบียน เข้าระบบ - ใช้ข้อมูลชื่อ นามสกุล เลขบัตรประชาชน เบอร์โทร
3. จดแจ้งปลูกกัญชา กัญชง
4. รับใบจดแจ้ง
ทั้งนี้ บำรุงราษฎร์ได้ใช้เทคโนโลยี Radiology AI ในศูนย์ตรวจสุขภาพ แผนกผู้ป่วยวิกฤต (ICU) แผนกฉุกเฉิน และแผนกอื่น ๆ โดยแบ่งเป็น 2 ส่วน คือ 1. Radiology INSIGHT CXR จะใช้ในการวิเคราะห์ภาพเอ็กซ์เรย์ทรวงอก เฉลี่ย 100,000 ภาพต่อปี และ 2. Radiology INSIGHT MMG จะใช้วิเคราะห์มะเร็งเต้านมจากภาพถ่ายแมมโมแกรม โดยบำรุงราษฎร์มุ่งหวังที่จะส่งมอบการบริการแก่ผู้ป่วยอย่างมีคุณค่าที่สุด โดยการตรวจหามะเร็งในเวลาที่เหมาะสมเพื่อความสำเร็จในการรักษา ซึ่งนอกจากความชำนาญการและประสบการณ์ของรังสีแพทย์แล้ว Radiology AI ยังมีส่วนช่วยสนับสนุนให้บำรุงราษฎร์ขับเคลื่อนนวัตกรรมทางการแพทย์ที่ก้าวล้ำสู่ระดับโลกอีกด้วย
Pharmacist Artirat Charukitpipat, CEO of Bumrungrad International Hospital โรงพยาบาลเอเซียอินเตอร์เนชั่นแนล จ.พระนครศรีอยุธยา LINK
โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล เป็นโรงพยาบาลเอกชนขนาดกลาง ขนาด 59 เตียง ตั้งอยู่ในอำเภอบางปะอิน จ.พระนครศรีอยุธยา แรกเริ่มดำเนินงานภายใต้ชื่อ โรงพยาบาลเอเซีย ให้บริการผู้ป่วยในพื้นที่นิคมอุตสาหกรรมโรจนะ จนในปี 2564 ได้ขยายโรงพยาบาลมากขึ้น และเข้าร่วมเป็นโรงพยาบาลประกันสังคม เพื่อรองรับความต้องการของประชาชนในพื้นที่ทั้งบุคคลทั่วไปและพนักงานในนิคมฯ ที่เพิ่มมากขึ้นอย่างรวดเร็ว
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลเอเซียอินเตอร์เนชั่นแนล สามารถรับผู้ประกันตนเพิ่มได้อีก 50,357 ราย
โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล มีคลินิกเครือข่ายประกันสังคม เป็นสถานพยาบาลในระดับสูง 2 แห่ง ได้แก่ โรงพยาบาลมหาวชิราลงกรณธัญบุรี และโรงพยาบาลไทยนครินทร
โรงพยาบาลศิริเวช จ.ลำพูน
โรงพยาบาลศิริเวช จ.ลำพูน หรือ โรงพยาบาลพริ้นซ์ ลำพูน เป็นโรงพยาบาลเอกชนขนาด 139 เตียง ตั้งอยู่ที่ 7 หมู่ที่ 5 ต.เวียงยอง อ.เมืองลำพูน จ.ลำพูน 51000 ดำเนินการโดย บริษัท พริ้นซิเพิล เฮลท์แคร์-ลำพูน จำกัด เดิมรองรับผู้ป่วย 59 เตียง ปัจจุบันได้ขยายตึกใหม่ ทำให้รองรับผู้ป่วยได้ถึง 100 เตียง เชื่อมต่อเครือข่ายการรักษาส่งต่อแพทย์เฉพาะทางในพื้นที่ภาคเหนือ ซึ่งมีเครือโรงพยาบาลพริ้นซ์ฯ ตั้งอยู่รวมกว่า 4 แห่ง
สำหรับโรงพยาบาลศิริเวชลำพูน ภายใต้การบริหารของบริษัท พริ้นซิเพิล เฮลท์แคร์ จากทั่วประเทศมีโรงพยาบาล 11 แห่งใน 10 จังหวัด และมีเป้าหมายขยายเพิ่มเป็น 20 แห่งและ 100 คลินิก ทั่วประเทศ
Tourist Visa LINK
REQUIREMENT
This type of visa is issued to applicants who wish to enter the Kingdom for
tourism purposes.
**Employment in Thailand is prohibited**
REQUIRED DOCUMENTS
• Passport or travel document with validity not less than 6 months
• Visa application form completely filled out
• Evidence of travel from Thailand (confirmed air ticket paid in full)
• Recent (4x6 cm.) photograph of the applicant
• Evidence of flight itinerary to and from Thailand
• Evidence of adequate finance (20,000 Baht per person or 40,000 Baht per family)
• NOTE: Consular officers reserve the rights to request additional documents as deemed
necessary
VISA PROCESSING FEE
• 1000 Baht per entry (in the local currency)
VISA VALIDITY
• The validity of a visa is 3 months (single entry) or 6 months (multiple entry)
PERIOD OF STAY
• Upon arrival, travellers with this type of visa will be permitted to stay in Thailand for a period of not exceeding 60 days.
EXTENSION OF STAY
• Those who wish to stay longer or may wish to change their type of visa must file an application for permission at the Office of Immigration Bureau located on Government Center B, Chaengwattana Soi 7, Laksi, Bangkok 10210, Tel 0-2141-9889 (or at http://www.immigration.go.th ). The extension of stay as well as the change of certain type of visa is solely at the discretion of the Immigration officer.
แอป DLT QR LICENCE โดยกรมการขนส่งทางบก
แอปพลิเคชันโดยกรมการขนส่งทางบก ใช้สำหรับตรวจสอบข้อมูลใบอนุญาตขับรถแบบ QR Code และเพื่อความปลอดภัยทางถนน มีความสามารถพื้นฐานคือ
- ใบอนุญาตขับรถเสมือนจริงทั้งด้านหน้าและด้านหลัง
- การแสดง QR CODE ประจำใบอนุญาตขับรถ เพื่อประโยชน์ในการตรวจสอบข้อมูล
- ตรวจสอบและแสดงข้อมูลใบอนุญาตแบบ QR Code
- ให้ข้อมูลเกี่ยวกับการต่ออายุ, การเปลี่ยนประเภท/เปลี่ยนชนิด ใบอนุญาตชนิดต่างๆ
- แชร์ตำแหน่งและเส้นทางการเดินทาง
- รวมเลขหมายโทรศัพท์ที่จำเป็นต้องใช้เมื่อเกิดเหตุฉุกเฉิน
- การแสดงข้อมูลส่วนบุคคล เพื่อช่วยเหลือทางการแพทย์
ลิงค์สำหรับดาวน์โหลด
iOS apple iPhone
Google Play
Official infoความหมายของของเหลว เจล สเปรย์
รพ.รามาธิบดีจักรีนฤบดินทร์ สมุทรปราการ (ปี 2563)
สถาบันการแพทย์จักรีนฤบดินทร์ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล เป็นโรงพยาบาลขนาดใหญ่ หอผู้ป่วยในขนาด 400 เตียง ที่อยู่ 111 หมู่ 14 ถนนเลียบคลองส่งน้ำสุวรรณภูมิ ตำบลบางปลา อำเภอบางพลี จังหวัดสมุทรปราการ เปิดให้บริการประชาชนเป็นวันแรก เมื่อ วันที่ 12 ธันวาคม พ.ศ. 2560 และมีพิธีเปิดอย่างเป็นทางการ เมื่อวันที่ 25 ธันวาคม พ.ศ. 2560 สมเด็จพระกนิษฐาธิราชเจ้า เสด็จทรงกดปุ่มเปิดป้ายชื่อ “สถาบันการแพทย์จักรีนฤบดินทร์” และป้ายชื่อ “โรงพยาบาลรามาธิบดี จักรีนฤบดินทร์”
เพิ่มเติมสอบถามโทรศัพท์ 02-8396000
นพ.ไพศาล ดั่นคุ้ม เลขาธิการคณะกรรมการอาหารและยา
นพ.ไพศาล ดั่นคุ้ม เลขาธิการคณะกรรมการอาหารและยา กล่าวเพิ่มเติมว่า ผู้ที่ต้องการปลูกกัญชา กัญชง สามารถปลูกได้โดยไม่ต้องขออนุญาต แต่จะต้องมีการจดแจ้งผ่านแอปพลิเคชันและเว็บไซต์ ปลูกกัญ ของ อย. ที่จัดทำขึ้นและสามารถถอนการจดแจ้งได้เมื่อพบการกระทำความผิดที่ไม่เป็นไปตามวัตถุประสงค์ของกระทรวงสาธารณสุข
ทั้งนี้ การจดแจ้งแอปพลิเคชันปลูกกัญนั้นเป็นไปเพื่อรักษาสิทธิของผู้ปลูกก่อนที่ พ.ร.บ.กัญชากัญชงจะประกาศบังคับใช้ โดยแจ้งตามวัตถุประสงค์การปลูก ซึ่งการปลดล็อกนี้จะทำให้ประชาชนสามารถปลูกเพื่อดูแลสุขภาพของตนเองและใช้ในครัวเรือน เพื่อนำไปใช้ในการปรุงยาสำหรับผู้ป่วยเฉพาะรายของกรณีที่เป็นแพทย์แผนไทย แพทย์แผนไทยประยุกต์ และหมอพื้นบ้าน และเพื่อใช้ในเชิงพาณิชย์หรือในทางอุตสาหกรรมได้
ขณะนี้ มีผู้ลงเบียนเพื่อขอจดแจ้งแล้วเกือบแสนราย สำหรับการผลิตแปรรูปส่วนอื่นๆ ของพืชกัญชากัญชง เช่น ใบ ช่อดอก กิ่งก้าน ราก ไม่ต้องขออนุญาตยาเสพติด ส่วนสารสกัดถ้ามี THC เกิน 0.2% ถือเป็นยาเสพติด
ทั้งนี้ ผลิตภัณฑ์ที่มีพืชกัญชากัญชง หรือสารสกัดกัญชากัญชง เป็นส่วนประกอบ เช่น ผลิตภัณฑ์สมุนไพร อาหาร เครื่องสำอาง ให้ขออนุญาตตามกฎหมายผลิตภัณฑ์นั้นๆ เช่น ยาน้ำมันกัญชา ยาแผนไทยที่มีใบ ช่อดอก ราก ฯลฯ เป็นส่วนผสม ต้องขออนุญาตตาม พ.ร.บ. ผลิตภัณฑ์สมุนไพร
กรณีเป็นแพทย์แผนไทย แพทย์แผนไทยประยุกต์ และหมอพื้นบ้าน หากจะใช้กัญชากัญชง ไปปรุงยาสำหรับผู้ป่วยเฉพาะราย ได้รับการยกเว้นตาม พ.ร.บ. ผลิตภัณฑ์สมุนไพร ให้ทำได้ตามการประกอบวิชาชีพโดยไม่ต้องขอใบอนุญาตผลิต
หากมีข้อสงสัยเรื่องการปลูก การสกัด หรือการขออนุญาตผลิตผลิตภัณฑ์ให้สอบถามเพิ่มเติมโทร 1556 กด 3 หรือสำนักงานสาธารณสุขจังหวัดนั้น ๆ
ข้อห่วงใยหลังปลด "กัญชา" จากยาเสพติด : จับตาสถานการณ์ (8 มิ.ย. 65) Thai PBS LINK
9 มิถุนายน จะเป็นวันที่กัญชา จะถูกปลดจากยาเสพติดให้โทษในประเภท 5 ส่งผลให้การผลิต นำเข้า ส่งออก จำหน่าย เสพ หรือมีไว้ในครอบครองซึ่งพืชกัญชา จะไม่มีความผิดอีกต่อไป และวันนี้ (8 มิ.ย. 65) กฎหมายที่เกี่ยวข้องในเรื่องข้อกำหนดการใช้กัญชา หรือ พ.ร.บ.กัญชา-กัญชง จะเข้าสู่การพิจารณาของสภาผู้แทนราษฎรในวาระแรก
และในระหว่างที่เกิดสูญญากาศ หลังประกาศปลดกัญชาจากยาเสพติดมีผลบังคับใช้ แต่กฎหมายควบคุมการใช้ยังไม่แล้วเสร็จ รัฐบาลได้ตั้งกรรมการขั้นมาดูแล จนกว่ากฎหมายจะมีผลบังคับใช้ แต่ก็ยังมีข้อห่วงใยจากหลายฝ่าย โดยเฉพาะการเข้าถึงและใช้กัญชาผิดประเภท ร่วมพูดคุยกับ รศ.พญ.รัศมน กัลยาศิริ ผู้อำนวยการศูนย์ศึกษาปัญหาการเสพติด
คราฟต์ซ่า กัญชา ปีนี้มาอีกสูตร คราฟต์ช่าเบอรี่
น้ำลิดรอนกัญ (น้ำรางจืดใบเตย) แก้เมากัญชา LINK
เครื่องดื่มแก้เมากัญชา ดื่มลดอาการโคลงเคลง ลดอาการเวียนศีรษะ ตามภูมิปัญญาพื้นบ้านใช้ดื่มถอนพิษ ลดอาการเมาเหล้า แก้เมาค้าง
สวนประกอบ
ใบรางจีด 10 ใบ
ใบเตย 3 ใบ
น้ำสะอาด 1 ลิตร
วิธีทำ
นำใบรางจืดและใบเตยล้างให้สะอาด เติมน้ำสะอาดลงไป ต้มเดือดนาน 15 นาที กรองเอากากออก ดื่มอุ่นๆจนกว่าอาการจะดีขึ้น
บริการวัคซีนไข้หวัดใหญ่ของประกันสังคม
สำหรับผู้ประกันตนโรงพยาบาลสิรินธร อายุตั้งแต่ 50 ปีขึ้นไป ตามประกาศประกันสังคม ให้บริการแบบ walk in เท่านั้น ที่จุดบริการฉีดยาทีคลินิกประกันสังคม จันทร์-ศุกร์ 8-12 น. เว้นวันหยุดราชการ ฉีดได้ถึง 31 สิงหาคม 2565
นำบัตรประชาชนมาด้วย
สอบถามโทร คลินิกประกันสังคม รพ.สิรินธร 02-3286900 - 15 ต่อ 11407, 11468, 10271
การรักษาข้อเข่าเสื่อม นพ.สมบัติ กล่าวว่า การรักษาข้อเข่าอักเสบจะเริ่มจาก เปลี่ยนวิธีการใช้งาน ลดกิจกรรมที่ทำให้เกิดแรงกดและกระแทกที่เข่า เช่น การนั่งยองๆ คุกเข่า ขึ้นลงบันได วิ่ง หรือการยกของหนัก รวมทั้ง รับประทานยาเพื่อลดการอักเสบในเข่า พร้อมกับ การบริหารกล้ามเนื้อเพื่อให้เข่ามีการเคลื่อนไหวที่มั่นคง
ถ้าการรักษาไม่ได้ผล อาจพิจารณา ฉีดยาเข่าในข้อเข่าเพื่อลดการอักเสบและเพื่อเพิ่มการหล่อลื่นในเข่า เช่น ยาสเตียรอยด์ หรือน้ำหล่อเลี้ยงข้อเทียมสังเคราะห์ หากยังไม่ได้ผล แพทย์อาจพิจารณารักษาด้วยการผ่าตัดเปลี่ยนข้อเข่าเทียม
สำหรับ การผ่าตัดเปลี่ยนข้อเข่าเทียม (Total Knee Replacement) มีการพัฒนาการผ่าตัดเปลี่ยนข้อเข่าเทียม ทั้งในด้านเทคนิคการผ่าตัด และวัสดุข้อเทียมที่ใช้ ทำให้การผ่าตัดมีประสิทธิภาพสูง ผู้ป่วยสามารถฟื้นตัวไว พร้อมกลับไปใช้ชีวิตในแบบที่ต้องการ โดยจะตัดเอาผิวข้อที่เสียออกและใช้ผิวข้อเทียมที่ทำด้วยโลหะและมีส่วนพลาสติกกันระหว่างผิวโลหะ เพื่อกันการกระแทกและลดแรงเสียดสีระหว่างผิวข้อ โดยใช้ข้อเทียมรุ่นมาตรฐานและรุ่น พรีเมี่ยมที่มีคุณภาพและอายุการใช้งานได้นานประมาณ 15-20 ปีขึ้นไป”
โรงพยาบาลตากสิน ฉีดวัคซีนไข้หวัดใหญ่ (แก่ผู้ประกันตน) รับ walk in เท่านั้น LINK
ฉีดวัคซีนไข้หวัดใหญ่ (แก่ผู้ประกันตน) รับ walk in เท่านั้น
สิทธิประกันสังคมโรงพยาบาลตากสิน ที่มีอายุตั้งแต่ 50 ปีขึ้นไป ตามประกาศของประกันสังคม
ฉีดเฉพาะ จันทร์ - ศุกร์ เวลา 8.00-15.00 น.
ตั้งแต่วันที่ 1 พฤษภาคม 2565 - 31 สิงหาคม 2565
หมายเหตุ : ผู้ที่จะรับบริการฉีดยาวัคซีนไข้หวัดใหญ่ ต้องไม่เคย รับวัคซีนไข้หวัดใหญ่ภายใน 6 เดือน ที่ผ่านมา
ติดต่อสอบถาม คลินิกประกันสังคม โรงพยาบาลตากสิน 02 437 0123 ต่อ 1128, 1170, 1169
เขตสุขภาพที่ 2
พิษณุโลก
- รพ.จิตเวชพิษณุโลก รพ.สังกัดกรม 055-002-050 จันทร์ถึงศุกร์ 08.30-14.00 น.
- รพ.ชาติตระการ รพช. 055-381-020 ศุกร์ 08.30 - 12.00 น.
- รพ.เนินมะปราง รพช. 055 399055 อ. 08.30 - 12.00 น.
- รพ.บางกระทุ่ม รพช. 055-391-061-2 ต่อ 125, 150 จันทร์ 08.30 – 14.00 น.
- รพ.บางระกำ รพช. 055-371168, 055-371170 พ. 08.30 - 16.30 น.
- รพ.พรหมพิราม รพช. 055-252052 ต่อ 807 พ. 08.30 - 12.00 น.
- รพ.พุทธชินราช รพศ 055-270-300 ต่อ 15145 พฤหัสบดี 08.30 – 12.00 น.
- รพร.นครไทย รพช. 094-607-5559 จ. พ. ศ. 08.30 - 12.00 น.
- รพ.วังทอง รพช. จ. - ศ. 13.00 - 16.30 น.
- รพ.วัดโบสถ์ รพช. 0 5536 1079 จ. 09.00 - 14.00 น.
- ศูนย์ส่งเสริมสุขภาพแผนไทย กมลาศรม สสจ.พิษณุโลก สสจ. 0 5525 2600 พฤ. 08.30 - 12.00 น.
สุโขทัย
- รพ.กงไกรลาศ รพช. 0 5569 1152 จ. 13.30 - 16.00 น.
- รพ.คีรีมาศ รพช. 055 627 084 พุธ 13:00-16:30 น.
- รพ.ทุ่งเสลี่ยม รพช. 0 5565 9175 อ. 13.00 - 16.30 น.
- รพ.บ้านด่านลานหอย รพช. 087-3119706 อ. 14.00 - 16.00 น.
- รพ.ศรีนคร รพช. 055-652-725 จ. - พฤ. 14.00 - 16.00 น.
- รพ.ศรีสังวรสุโขทัย รพท 055-682-030 อังคาร สัปดาห์ที่ 2 และ 4 ของเดือน
- รพ.ศรีสัชนาลัย รพช. 055-673136-7 จ. - ศ. 08.00 - 16.00 น.
- รพ.สต.กลางดง รพ.สต. 055-659233 จ. และ ศ. 08.00
- รพ.สต.เขาแก้วศรีสมบูรณ์ รพ.สต. 055-624712 จ. - ศ. 08.30 - 16.30 น.
- รพ.สต.ท่าชัย รพ.สต. รอยืนยัน
- รพ.สต.ไทยชนะศึก รพ.สต. 055-659019 จ. - ศ. 08.30 - 16.30 น.
- รพ.สต.บ้านสวน รพ.สต. 055-699196 จ. - ศ. 08.30 - 16.30 น.
- รพ.สต.บ้านหนองหมื่นชัย รพ.สต. 055-660979 จ. - ศ. 08.30 - 16.30 น.
- รพ.สต.บ้านใหม่สุขเกษม รพ.สต. รอยืนยัน
- รพ.สวรรคโลก รพช. 0 5564 1592, 0 5564 1083 รอยืนยัน
- รพ.สุโขทัย รพท 055-611-702 พุธ 13.30 - 16.30 น.
- สอน.เมืองเก่า รพ.สต. จ. - ศ. 08.30 - 14.00 น.
ตาก
- รพ.บ้านตาก รพช. 055-591435 ถึง 6 055-592079 ถึง 81 รอยืนยัน
- รพ.พบพระ รพช. 055-569-211 ศุกร์ 08.30-12.00 น.
- รพ.แม่ระมาด รพช. 055-581-229 อังคาร, พฤหัสบดี 08.30 - 12.00 น.
- รพ.แม่สอด รพท 055-531-224, 055-531-229, 055-531-990 พฤหัสบดี สัปดาห์ที่ 1 และ 3 ของเดือน 08.30 - 12.00 น.
- รพ.วังเจ้า รพช. 055-593060 ศ. 08.00 - 16.00 น.
- รพ.สต.คลองขยางโพรง รพ.สต. 086-4492048 ศ. 08.30 - 12.00 น.
- รพ.สต.นาโบสถ์ รพ.สต. 0 5589 5056
- รพ.สต.ไม้งาม รพ.สต. 055-890134 ศ. 08.30 - 12.00 น.
- รพ.สมเด็จพระเจ้าตากสินมหาราช รพท 055-511-024 พฤหัสบดี 08.30 - 12.00 น.
- รพ.สามเงา รพช. 055-800-597-8 จ-ศ 08.30-16.30 น.
- รพ.อุ้มผาง รพช. 055-561270 รอยืนยัน
- สอน.แม่จะเรา รพ.สต. 081-9619118 พฤ. 08.30 - 16.30 น.
อุตรดิตถ์
- รพ.ตรอน รพช. 055-825-859 พุธ 08.30 - 12.00 น.
- รพ.ทองแสนขัน รพช. 055-418-035 - 42 ศุกร์ 08.30 - 16.30 น.
- รพ.ท่าปลา รพช. 055-499-070 พฤ 13.00-16.00 น.
- รพ.น้ำปาด รพช. 055 481 574 จ 08.30-16.30 น.
- รพ.บ้านโคก รพช. 055-486-126 08.30 - 16.30 น.
- รพ.พิชัย รพช. 055-832-100 จ 13.00-16.30 น.
- รพ.ฟากท่า รพช. 055 489 339 พุธ 08.30-16.30 น.
- รพ.ลับแล รพช. 055-431-976 ศุกร์ 08.30 - 12.00 น.
- รพ.สต.ท่าสัก รพ.สต. 0 5549 6000 พ. 08.30 - 12.00 น.
- รพ.สต.ร่วมจิต รพ.สต.
- รพ.อุตรดิตถ์ รพศ 055-409-999 จ. - ศ. 08.30-16.00 น.
- รพ.อุตรดิตถ์ สาขา 1 (ศิลาอาสน์) รพช. 055-403340 จ. - ศ. 08.30-16.00 น.
เพชรบูรณ์
- รพ.เขาค้อ รพช. 0 5672 8075-7 พ. 08.30 - 12.00 น.
- รพ.ชนแดน รพช. 0 5676 1302 รอยืนยัน
- รพ.น้ำหนาว รพช. 056 705 793 จันทร์ 08.30-12.00 น.
- รพ.บึงสามพัน รพช. 056-731-284 พุธ ที่ 1,3 08.30-16.30 น.
- รพ.เพชรบูรณ์ รพท 056 717 600 ศุกร์ 1 3 13.00-16.30 น.
- รพร.หล่มเก่า รพช. 064-561-4338 จันทร์ - ศุกร์ 08.30 - 16.30 น.
- รพ.วังโป่ง รพช. 0 5678 6452 รอยืนยัน
- รพ.วิเชียรบุรี รพท 0 5692 8170 จ. 08.30 - 16.30 น.
- รพ.ศรีเทพ รพช. 0 5679 9467 จ. 08.30 - 16.30 น.
- รพ.สต.พุเตย รพ.สต. 056 797 737 จ. - ศ. 08.30 - 16.30 น.
- รพ.หนองไผ่ รพช. 056 781 114 อังคาร 08.30-16.30 น.
- รพ.หล่มสัก รพช. 056-711010 ต่อ 109 จ. - ศ. 08.00 - 16.30 น.
- สสจ.เพชรบูรณ์ สสจ. 0 5671 1010 จ. - ศ. 08.30 - 16.30 น.
- สอน.บ้านงิ้วงาม รพ.สต. จ. - ศ. 08.30 - 16.30 น.
กัญชากับสมองเด็ก สถาบันสุขภาพเด็ก สถาบันประสาทวิทยา
หลังจากติดตามผู้เข้าร่วมวิจัยเป็นเวลา 3 ปี พบว่า กลุ่มผู้ป่วยที่รับประทานอาหารจากพืชเป็นหลักควบคู่กับการออกกำลังกาย ให้ผลการรักษาที่ดีไม่แตกต่างจากกลุ่มที่ผ่าตัดเปิดหลอดเลือดอุดตัน แต่สิ่งที่แตกต่างกันชัดเจนคือ กลุ่มที่ปรับพฤติกรรมไม่ต้องเสียค่าใช้จ่ายที่เกิดขึ้นในการรักษา ซึ่งน้อยกว่าถึง 4-7 เท่า จึงเห็นได้ว่าการปรับพฤติกรรมแบบองค์รวม ช่วยป้องกันการเกิดโรคหัวใจและหลอดเลือด และลดค่าใช้จ่ายในการรักษาพยาบาลของผู้ป่วยลงได้
คุณหมอ Lin แพทย์ประจำ Baylor College of Medicine และ คุณหมอ Esselstyn แพทย์ประจำ Cleveland Clinic ทำการศึกษาโดยแบ่งคนเป็น 2 กลุ่ม คือกลุ่มควบคุม และกลุ่มที่รับประทาน Plant-Based diet เป็นเวลา 4 เดือน ผลการศึกษาพบว่า กลุ่มที่รับประทาน Plant-Based diet ค่าไขมันต่างๆ ในเลือดดีขึ้น ค่าสารอักเสบ hsCRP และ IL-6 ก็ลดลง รวมถึงการทำงานของหลอดเลือดดีขึ้น (brachial artery flow-mediated vasodilation) เมื่อเทียบกับกลุ่มควบคุม
ส่วนคณะวิจัยจากมหาวิทยาลัย Harvard ก็มีการศึกษาเรื่องนี้เช่นกัน ได้ตีพิมพ์ลงในวารสาร Journal of the American College of Cardiology ปี ค.ศ. 2017 ติดตามการรับประทานอาหารของผู้คน จำนวน 209,568 คน พบว่า การบริโภคพืชผักและธัญพืชไม่ขัดสี ลดความเสี่ยงของการเป็นโรคหลอดเลือดหัวใจ (Coronary Heart Disease) ได้ถึง 25% อีกงานวิจัยหนึ่งจากวารสาร The BMJ ปี ค.ศ. 2020 วิจัยโดยคณะวิจัยจาก Harvard เช่นเดียวกัน ได้ติดตามการรับประทานอาหารของผู้ชาย 43,272 คน พบว่า การเปลี่ยนจากเนื้อสัตว์แปรรูป 1 ส่วนบริโภคต่อวัน (85 กรัม) ให้เป็นโปรตีนจากพืช สามารถลดอัตราการเกิดโรคหัวใจได้ถึง 17 %
ลดความเสี่ยงการเกิดโรคเบาหวานประเภทที่ 2 วารสาร Canadian Journal of Diabetes ในปี ค.ศ. 2016 รวบรวมการศึกษาวิจัยการเกิดโรคเบาหวานประเภทที่ 2 ในคนที่รับประทานอาหารแบบ Plant-based diet ทั้งหมด 13 งานวิจัย รวมจำนวนมากกว่า 60,000 คน พบว่า ทั้งการศึกษาแบบระบาดวิทยาที่เก็บข้อมูลเป็นระยะเวลายาวนาน หรือการศึกษาแบบสุ่มและมีกลุ่มควบคุม (randomized controlled trial) ก็ชี้ให้เห็นผลไปในทิศทางเดียวกันว่า อาหารจากพืชช่วยลดความเสี่ยงของเบาหวานได้ ไม่ว่าจะเป็นระดับน้ำตาลในเลือดที่ลดลง (Fasting Plasma Glucose) การหลั่งอินซูลินที่ดีขึ้น (Insulin secretion index) และความไวของอินซูลินที่ดีขึ้น (Insulin sensitivity)
คลินิกสุขภาพสมองและความจำ
เป็นคลินิกที่รวมเอาเทคโนโลยี เพื่อสำหรับตรวจสุขภาพสมองและความจำ หลายชนิด เช่น เทคโนโลยีตรวจหาโรคอัลไซเมอร์ระยะแรก หรือระบบวิเคราะห์ชีวภาพหาบริเวณที่มีปัญหาในสมอง เป็นต้น เพื่อป้องกันแก้ไขปัญหาสมองอย่าง โรคอัลไซเมอร์และโรคพาร์กินสันตั้งแต่ระยะแรกเริ่ม
บริการที่แนะนำ: MRI EEG (Electroencephalography) Retinal scan Sleep study unit Brain power & memory assessment ABR (Auditory Brainstem Response)
จัดสอนระดับปริญญาตรี ปริญญาโท และหลักสูตรระยะสั้น
ในปีการศึกษา 2565 นี้ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ จัดการเรียนการสอนในระดับปริญญาตรี ปริญญาโท และหลักสูตรระยะสั้นผลิตบุคลากรในสาขาวิชาชีพที่ขาดแคลน ในการเยี่ยมชมแต่ละหลักสูตรได้นำเสนอการเรียนการสอนและเทคโนโลยีที่ทันสมัย ประกอบด้วย
สำหรับ “ศูนย์บริการทางการแพทย์ หริภุญไชย” ก่อตั้งขึ้น ณ ตำบลศรีบัวบาน อำเภอเมือง จังหวัดลำพูน เพื่อเพิ่มโอกาสการเข้าถึงบริการทางการแพทย์ ช่วยลดการเดินทางเข้ามารักษาที่โรงพยาบาลในเมืองใหญ่ได้ในอนาคต ลดความเหลื่อมล้ำจากการกระจุกตัวของบุคลากรทางการแพทย์ นอกจากนี้ ยังเป็นศูนย์การเรียนรู้และพัฒนาทักษะของบุคลากรทางการแพทย์ของ คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ เพื่อให้นักศึกษาแพทย์ได้ศึกษาโรคในท้องถิ่น นำไปสู่องค์ความรู้ที่หลากหลาย สามารถตอบสนองต่อความต้องการในพื้นที่ได้ในอนาคต
สวนวชิรเบญจทัศ (สวนรถไฟ) พื้นที่ 375 ไร่
สวนวชิรเบญจทัศ หรือที่นิยมเรียกกันด้วยชื่อเดิมว่า สวนรถไฟ แต่เดิมเคยเป็นสนามกอล์ฟรถไฟ ของการรถไฟแห่งประเทศไทย ปรับเปลี่ยนมาเป็นสวนสนรถไฟ พร้อมกับชื่อพระราชทานว่า สวนวชิรเบญจทัศ เมื่อ 28 กรกฎาคม 2545 ครอบคลุมเนื้อที่ 375 ไร่ ภายในสวนมีพื้นที่นันทนาการหลายรูปแบบ อาทิ เลนจักรยาน อุทยานผีเสื้อและแมลง สวนชุมชนรถไฟ สวนป่าใหญ่ในเมือง เมืองจราจรจำลอง สวนปิกนิก ฟ้าใสไม้สวย หอจดหมายเหตุพุทธทาส หรือสวนโมกข์กรุงเทพ
วิสาหกิจชุมชนกลุ่มท่องเที่ยว หมู่บ้านจุฬาภรณ์พัฒนา 10 อ.เบตง จ.ยะลา
วิสาหกิจชุมชนกลุ่มท่องเที่ยว หมู่บ้านจุฬาภรณ์พัฒนา 10 ตั้งอยู่ที่ หมู่ที่ 10 ตำบลตาอัยเวง อำเภอเบตง ในหุบเขา เนื่องจากในอดีตเป็นพื้นที่เคลื่อนไหว และฐานปฏิบัติการของโจรจีนคอมมิวนิสต์มลายา (จคม.) จากการที่พรรคคอมมิวนิสต์ มลายา ได้ยุติการต่อสู้ด้วยอาวุธและสลายกองทัพออกมาเป็นผู้ร่วมพัฒนาชาติไทย ตามข้อตกลง ลงนามสัญญาสันติภาพ 3 ฝ่าย เมื่อวันที่ 2 ธันวาคม 2532 ปัจจุบันได้มีการจัดตั้งพิพิธพันธ์วีระชน มีแหล่งท่องเที่ยวทางธรรมชาติ อาทิ ผืนป่าฮาลา-บาลา ต้นกำเนิดแม่น้ำปัตตานี ต้นไม้พันปีที่ใหญ่ที่สุดในเอเชียตันออกเฉียงใต้ คือ ต้นสมพง หรือต้นก้านไม้ขีด และเป็นแหล่งท่องเที่ยวประวัติศาสตร์การเมืองในอดีตที่น่าสนใจ และควรค่าแก่การอนุรักษ์
เกี่ยวกับชุมชนจุฬาภรณ์พัฒนา10
จากการที่พรรคคอมมิวนิสต์มาลายา ได้ยุติการต่อสู้ด้วยอาวุธและสลายกองกำลังมาเป็นผู้ร่วมพัฒนาชาติไทยตามข้อตกลง การลงนามสนธิสัญญาสันติภาพ3ฝ่าย หลังจากนั้นสมเด็จพระเจ้าลูกเธอเจ้าฟ้าจุฬาภรณ์วลัยลักณอัคราชกุมารีในราชการที่๙ ทรงมีพระราชประสงค์จะทำการพัฒนาโครงการฟื้นฟูสภาพแวดล้อมและชีวิตความเป็นอยู่ของราษฎรในพื้นที่จังหวัดยะลา ปัตตานี นราธิวาสเพื่อให้เกิดความมั่นคงภายในพื้นที่แนวชายแดนจึงได้โปรดเกล้า โปรดกระหม่อมทรงรับหมู่บ้าน“รัตนกิตติ2” เข้าร่วมโครงการ และทรงพระราชทานชื่อหมู่บ้านใหม่เป็น “หมู่บ้านจุฬาภรณ์พัฒนา10” หมู่บ้านจุฬาภรณ์พัฒนา 10 ปัจจุบันได้พัฒนาขึ้นเป็นแหล่งท่องเที่ยวเชิงอนุรักษ์ระบบนิเวศผสมผสานกับการท่องเที่ยวเชิงประวัติศาสตร์ ในการมาท่องเที่ยวที่นี่ นอกจากได้พักผ่อนหย่อนใจกับธรรมชาติแล้ว ยังได้ศึกษาประวัติศาสตร์จากผู้มีประสบการณ์ตรงในเหตุการณ์ครั้งนั้น...
จุดเด่น ตะลึงต้นไม้ยักษ์ ตามรอยฐานมั่นพรรคคอมมิวนิสต์มาลายา ศึกษาเยี่ยมชมพิพิธภัณฑ์ประวัติศาสตร์จุฬาภรณ์พัฒนา10
ที่อยู่ ตำบล อัยเยอร์เวง อำเภอ เบตง จังหวัด ยะลา 95110
073-263037 ศูนย์บริการนักท่องเที่ยว
084-7185392. ผู้ประสานงาน
ผลการวิจัยโดยมาร์เก็ตบัซซ ยังเปิดเผยอีกว่า 62% จากกลุ่มตัวอย่างมีค่าใช้จ่ายต่อเดือนมากขึ้นเมื่อเปรียบเทียบกับปีที่แล้ว โดยค่าใช้จ่ายที่เพิ่มขึ้นส่วนใหญ่มาจากการที่สินค้า หรือบริการมีราคาสูงขึ้น เช่น ข้าวของเครื่องใช้ในบ้าน, สาธารณูปโภค หรือการเดินทาง เช่น ราคาน้ำมันที่ปรับตัวสูงอย่างต่อเนื่องในปัจจุบัน เป็นต้น
คนไทยกำลังกลับมามีชีวิตแบบปกติอีกครั้งในวิถี Now Normal - เรืองริน อักษรานุเคราะห์


คุณเรืองริน อักษรานุเคราะห์ นักจิตบำบัดความสัมพันธ์และครอบครัว ได้ให้ความเห็นที่ตรงกันกับผลสำรวจนี้ในมุมมองของนักจิตวิทยาไว้ว่า “ที่ผ่านมาคนไทยต้องอยู่ภายใต้ความหวาดระแวงกับสถานการณ์การระบาดของโควิด-19 แต่หลังจากคนไทยเริ่มปรับตัวได้ในปีที่ผ่านมา มีการเริ่มปรับทัศนคติให้ไปในทางที่ดีขึ้น คนไทยหลายคนเริ่มสนใจสิ่งรอบข้างหรือเหตุการณ์บ้านเมืองยิ่งขึ้น โดยเฉพาะอย่างยิ่งการให้ความสนใจกับคนในครอบครัว ปรับเปลี่ยนวิถีชีวิตในการเป็นอยู่ ใส่ใจคนในครอบครัวมากขึ้น ให้เวลาในการสานสัมพันธ์กันระหว่างคนในครอบครัว คนหันมาสนใจเรื่องความสุขของตนเองและครอบครัว ณ ปัจจุบันมากกว่ามองถึงความสุขในอนาคต ซึ่งเป็นจุดสำคัญอีกหนึ่งจุดที่ทำให้เห็นว่าคนไทยกำลังกลับมามีชีวิตแบบปกติอีกครั้งในวิถี Now Normal มะเฟืองมองว่า เพื่อทดแทนช่วงเวลาที่หายไป พ่อแม่ควรหาช่วงเวลาพิเศษกับลูก ๆ มากขึ้น อาทิ ไปทำกิจกรรมนอกบ้าน สอนการบ้านด้วยตัวเอง หรือ ไปจับจ่ายใช้สอยด้วยกันเพื่อความสุขของทุกคนในครอบครัว และ เพื่อกระชับความสัมพันธ์ในครอบครัว ในขณะเดียวกันก็สามารถจะบาลานส์ความสุขส่วนตัว ให้เวลาตัวเองได้ด้วยเช่นเดียวกัน”
ม.เทคโนโลยีสุรนารี ขายต้นกล้ากัญชาพันธุ์ ฝอยทอง ภูผายล ต้นละ 100 บาท LINK
ม.เทคโนโลยีสุรนารี เปิดตัวต้นกล้าพันธุ์กัญชา สายพันธุ์ฝอยทอง ภูผายล พัฒนาเพื่อเข้ากับประเทศไทย โตเร็ว ลำต้นแข็งแรง ออกดอกง่าย THC เฉลี่ย 8–12% ผลผลิตต่อ 1 ต้นสด รวมกว่า 2.38 กิโลกรัม (ราก ลำต้น ใบ และช่อดอก)
กัญชาสายพันธุ์ฝอยทอง ภูผายล ที่ได้นี้ เป็นสายพันธุ์ที่พัฒนาให้เหมาะกับสภาพอากาศของประเทศไทย คือ โตเร็ว ลำต้นแข็งแรง และที่สำคัญ "ออกดอกง่าย" แม้ในอากาศประเทศไทยที่ค่อนข้างร้อน
กัญชาสายพันธุ์ฝอยทอง ภูผายล จะให้ผลผลิตต่อ 1 ต้นสด ตั้งแต่ ราก ลำต้น ใบ และช่อดอก รวมกว่า 2.38 กิโลกรัม ลำต้นแข็งแรงสมบูรณ์สามารถสูงได้เต็มที่ถึง 4 เมตร ให้ช่อดอกแน่นภายในระยะเวลา 4 เดือนครึ่ง ให้สารสำคัญออกฤทธิ์สูงระดับมาตรฐานที่ใช้ได้ทางการแพทย์และสาธาณสุข ค่าวิเคราะห์สาร THC เฉลี่ย 8 – 12 เปอร์เซนต์
ผู้สนใจติดต่อได้ที่ ฟาร์มกัญชา
มทส. สวนเกษตรเฉลิมพระเกียรติ บรมราชกุมารี
โทร. 044 -225097 มือถือ 094-543-0241 ได้ตั้งแต่บัดนี้เป็นต้นไป
เม็ดเลือดขาวมีหลายหน่วย แต่ส่วนที่เป็นด่านหน้าป้องกันสิ่งแปลกปลอมที่จะเข้าสู่ร่างกาย โดยจับและทำลายทันทีคือ NK Cell ซึ่งเป็นเม็ดเลือดขาวที่อยู่ในกลุ่มของลิมโฟไซต์ (Lymphocyte) จะมีเพียงร้อยละ 5-15 ของเม็ดเลือดขาวชนิดนี้ และที่มากกว่านั้นคือพบว่าในคนที่อายุมากขึ้น ระบบภูมิคุ้มกันต่างๆ รวมถึง NK Cell จะทำงานลดลง ทำให้อุบัติการณ์ของผู้ป่วยติดเชื้อมีมากขึ้นในคนสูงอายุ นอกจากนี้ยังมีปัจจัยที่มาจากการใช้ชีวิตประจำวันบางอย่าง เช่น พักผ่อนน้อย ใช้ร่างกายหนัก สูบบุหรี่ หรือคนที่มีความเครียดมากๆ อย่างต่อเนื่องกัน ส่งผลให้เกิดภาวะที่ติดเชื้อต่างๆ ง่ายขึ้น
2.LAAB เหมาะกับใคร
LAAB สามารถใช้ในผู้ที่มีอายุ 12 ปีขึ้นไป (น้ำหนักตัวมากกว่า 40 กิโลกรัม) ที่มีภาวะภูมิคุ้มกันบกพร่องและผู้ที่อาจมีการตอบสนองทางภูมิคุ้มกันต่อวัคซีนป้องกันโควิด-19 ได้ไม่เพียงพอจากโรคร่วมต่างๆ เช่น ผู้ป่วยมะเร็ง ผู้ป่วยที่ได้รับการปลูกถ่ายอวัยวะ ผู้ป่วยที่ได้รับยากดภูมิคุ้มกันผู้ป่วยล้างไต รวมถึงผู้ที่ไม่สามารถรับวัคซีนป้องกันโรคโควิด-19 ได้
ติดเชื้อโควิด สิทธิ์ประกันสังคม พัก Hospitel ไม่มีค่าใช้จ่าย ที่ วิชัยเวชอ้อมน้อย LINK
ติดเชื้อโควิด สิทธิ์ประกันสังคม พัก Hospitel ไม่มีค่าใช้จ่าย เฉพาะผู้ป่วยกลุ่มอาการสีเขียว
- มีไข้ไม่เกิน 39 c
- หายใจปกติ ไม่มีอาการหอบเหนื่อย
- ค่าออกซิเจนในเลือด > 96%
**เงื่อนไข
▪️ ต้องมีผลตรวจ ATK หรือ PCR ว่าพบเชื้อโควิด
▪️นอนห้องตามสิทธ์ ไม่มีค่าใช้จ่าย
▪️ นอนห้องพิเศษ มีค่าใช้จ่ายตามที่ รพ.กำหนด
โทรติดต่อที่เบอร์ 02-4417899 ต่อ 1111 , 3124 วิชัยเวชอ้อมน้อย
การรักษามะเร็งตับ LINK
การรักษามะเร็งตับ ที่โรงพยาบาลจุรีเวช “ สามารถทำได้ทันที ไม่ต้องรอคิวนาน ” โดย แพทย์รังสีร่วมรักษา จะมีการใช้เครื่องมือขนาดเล็ก ร่วมกับการใช้ภาพการตรวจทางรังสีวิทยาเป็นเครื่องนำทาง เพื่อให้การตรวจรักษาเป็นไปอย่างมีประสิทธิภาพ สามารถเห็นรอยโรคที่ต้องการตรวจรักษาได้อย่างชัดเจน ทำให้การตรวจและรักษานั้น มีความถูกต้องแม่นยำสูง เพื่อให้ได้ผลเหมือนหรือใกล้เคียงกับการผ่าตัด แต่ประหยัดเวลาและค่าใช้จ่ายมากกว่า
การรักษาด้วยการให้เคมีบำบัดผ่านทางหลอดเลือดแดงสู่ตับ ( TACE : Transarterial Chemoembolization )
การทำลายก้อนมะเร็งตับด้วยการจี้ความร้อน โดยใช้ความร้อนจากคลื่นความถี่วิทยุ ( RFA : Radiofrequency ablation )
ติดต่อสอบถาม แผนกผู้ป่วยนอก โรงพยาบาลจุรีเวช
โทร . 043-518019-26 ต่อ 8608
โรงเรียนรังสีเทคนิค
โรงเรียนรังสีเทคนิค หลักสูตรที่ผลิตนักรังสีเทคนิค มาจากการสร้างภาพทางการแพทย์มีบทบาทสำคัญเป็นอย่างมากในการช่วยแพทย์วินิจฉัย และรักษาโรคในผู้ป่วย ทำให้ประเทศไทยต้องการกำลังคนในสายงานรังสีวิทยาเพิ่มมากขึ้นตามไปด้วย โดยเฉพาะนักรังสีเทคนิคเป็นที่ต้องการและถือเป็นวิชาชีพขาดแคลนในประเทศไทย
ปัจจุบันหลักสูตรเปิดดำเนินการมาเป็นปีที่ 6 ดำเนินการเรียนการสอนโดยอาจารย์ผู้เชี่ยวชาญในแต่ละสาขา ทั้งรังสีวินิจฉัย รังสีรักษา และเวชศาสตร์นิวเคลียร์ นักศึกษามีโอกาสได้เรียนภาคทฤษฎีและภาคปฏิบัติกับเครื่องมือและเทคโนโลยีที่ทันสมัย อาทิ
ที่ศูนย์ภาพวินิจฉัยและร่วมรักษาเพื่อปวงชน ได้แก่ เครื่อง MRI 1.5 เทสลา และเครื่อง MRI ขนาด 3 เทสลา จำนวน 3 เครื่อง และมีเครื่อง MRI แบบพิเศษ คือ MRI Upright และ MRI HIFU
นอกจากนี้ในส่วนของเครื่องเอกซเรย์คอมพิวเตอร์หรือ CT ยังมีเทคโนโลยีที่ทันสมัยทั้ง 3 แบบ ได้แก่ CT Dual source, kV switching, Dual Layer ที่พร้อมให้นักศึกษาของเราไปเรียนรู้และฝึกงาน
ส่วนทางด้านเวชศาสตร์นิวเคลียร์ นักศึกษาจะได้มีโอกาส ไปเรียนรู้และฝึกปฏิบัติ ณ ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติ ซึ่งมีเครื่องมือที่ทันสมัย ได้แก่ เครื่องถ่ายภาพ Digital PET/CT เครื่องแรกของประเทศไทยจำนวน 2 เครื่อง และเครื่อง PET/MRI เครื่องแรกและเครื่องเดียวของประเทศไทย เครื่อง Cyclotron และ Module สำหรับการผลิตสารเภสัชรังสีต่างๆ และด้านรังสีรักษา
นักศึกษาจะได้มีโอกาสเรียนรู้เครื่องมือและฝึกปฏิบัติ ณ งานรังสีรักษามะเร็งวิทยา โรงพยาบาลจุฬาภรณ์ ที่มีเครื่องมือที่ทันสมัย นำเทคโนโลยีปัญญาประดิษฐ์มาใช้เพื่อช่วยแพทย์สถานทูตจีนประจำประเทศไทย แจ้งแนวทางการปฏิบัติที่ถูกต้องเกี่ยวกับการใช้กัญชา LINK
สถานทูตจีนประจำประเทศไทย ได้เผยแพร่ข้อมูลเกี่ยวกับการประกอบธุรกิจและการใช้กัญชาของชาวจีนที่อยู่ในประเทศไทย เพื่อป้องกันการใช้ในทางที่ผิดกฎหมายทั้งของไทยและของจีน และเพื่อให้ชาวจีนทราบแนวทางการปฏิบัติที่ถูกต้องเกี่ยวกับการใช้กัญชา
โดยข้อความที่สถานทูตจีนแจ้งไว้ สามารถแบ่งออกได้เป็น 2 ส่วน
ส่วนที่หนึ่ง เกี่ยวข้องกับการนำกัญชาหรือผลิตภัณฑ์ที่มีส่วนผสมของกัญชาไปใช้ในประเทศจีนหรือบทลงโทษจากประเทศจีนเกี่ยวกับการใช้กัญชา ซึ่งในส่วนนี้สถานทูตจีน ระบุว่า การสูบกัญชา หรือบริโภคผลิตภัณฑ์ที่มีกัญชาเป็นส่วนผสมของคนจีนขณะที่อยู่ในประเทศไทย แต่ถูกตรวจพบเมื่อกลับมาถึงประเทศจีน จะเท่ากับเป็นการใช้กัญชาในประเทศจีน มีผลต้องถูกลงโทษตามกฎหมาย โดยการสูบหรือบริโภคผลิตภัณฑ์ที่มีกัญชา จะทำให้มีสารตกค้างในร่างกาย จึงสามารถตรวจหาสารเสพติดได้ นอกจากนี้กฎหมายอาญา มาตรา 357 ของประเทศจีน ระบุไว้ชัดว่า กัญชาเป็นยาเสพติด การปลูก แปรรูป บริโภค และขายกัญชาในจีนเป็นสิ่งผิดกฎหมาย ส่วนสาร THC ก็จัดเป็นยาเสพติดเช่นกัน ดังนั้นไม่ว่าจะเป็นการนำเข้าผลิตภัณฑ์ที่มีสาร THC หรือการนำกัญชาเข้ามาประเทศจีน ล้วนเป็นความผิดอาญาทั้งหมด
ส่วนที่สอง เป็นส่วนที่เกี่ยวกับประเทศไทย ซึ่งสถานทูตจีน ระบุว่า ปัจจุบันยังไม่มีกฎชัดเจนว่าชาวต่างชาติที่พำนักอยู่ในประเทศไทยสามารถปลูกกัญชาได้หรือไม่ แต่ที่ชัดเจน คือ รัฐบาลไทยยังควบคุมอุตสาหกรรมกัญชาอย่างเข้มงวด โดยการใช้ต้องเป็นไปเพื่อเหตุผลทางการแพทย์และสุขภาพ ส่วนการนำเข้า เพาะปลูก ผลิตและขายกัญชาโดยไม่ได้รับอนุญาต รวมถึงการผลิตและขายผลิตภัณฑ์กัญชาที่มีสาร THC เกิน 0.2% ทั้งหมดถือเป็นความผิดตามกฎหมาย มีโทษจำคุกหรือปรับอย่างหนึ่งอย่างใดหรือทั้งสองอย่าง
พทป.จริยา สีทา (หมอออย) แพทย์แผนไทยดีเด่น ระดับจังหวัด ประจำปี 2565
พทป.จริยา สีทา (หมอออย) แพทย์แผนไทย ปฏิบัติงาน ณ กลุ่มงานการแพทย์แผนไทย โรงพยาบาลพระอาจารย์ฝั้น อาจาโร ได้รับการ คัดเลือกเป็นแพทย์แผนไทยดีเด่น ระดับจังหวัด
ประจำปี 2565 จากสำนักงานสาธารณสุขจังหวัดสกลนคร
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาคลองสาน
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาคลองสาน
ที่อยู่ : 534 ถนนเจริญรัถ แขวงคลองต้นไทร เขตคลองสาน กรุงเทพฯ 10600
[
แผนที่]
เวลาเปิดทำการ
วันจันทร์ - ศุกร์ 08.00 - 19.00 น.
วันเสาร์ - อาทิตย์ 09.00 - 16.00 น.
แพทย์ประจำ สาขาคลองสาน
1. แพทย์หญิงครองขวัญ ชมพูชาติ
แพทยศาสตรบัณฑิต คณะแพทยศาสตร์ ธรรมศาสตร์มหาวิทยาลัย พ.ศ.2561 สาขาเวชกรรมทั่วไป พ.ศ.2561
ตารางออกตรวจ
วันจันทร์ - ศุกร์ เวลา 08.00 - 19.00 น.
2. แพทย์หญิงฉัตรภัสร์ กล่ำนาค
ตารางออกตรวจ
วันวันเสาร์ 09.00 - 18.00 น.
3.แพทย์หญิงวณัฐฐา เอกสุวีรพงษ์
ตารางออกตรวจ
วันวันเสาร์ 09.00 - 18.00 น.
คลินิก สวท เวชกรรม ปิ่นเกล้า กทม. LINK
คลินิก สวท เวชกรรม ปิ่นเกล้า
เลขที่ 3/20-21 ถนนอรุณอมรินทร์ แขวงอรุณอมรินทร์ เขตบางกอกน้อย กรุงเทพฯ 10700
เปิดทำการ : จันทร์.-ศุกร์ เวลา 09.00-17.00 น.
ปิดทำการ : วันเสาร์, อาทิตย์ และวันหยุดนักขัตฤกษ์
0-2433-9077
02-433-3503
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 1 สะพานมอญ LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 1 สะพานมอญ
โทรศัพท์กลาง 02-222-7874, 02-226-5897
ให้บริการวันพฤหัสบดี 13-16 น. (เว้นวันหยุดนักขัตฤกษ์)
การบริการ
- ประเมินภาวะสุขภาพสตรีวัยเจริญพันธุ์และหลังคลอด
- ให้ความรู้ ให้คำปรึกษาแนะนำ เรื่องการคุมกำเนิ
- ให้บริการการคุมกำเนิดด้วยยาเม็ดคุมกำเนิด ยาฉีดคุมกำเนิด และถุงยางอนามัย
- ตรวจคัดกรองเบื้องต้นโรคมะเร็งเต้านม มะเร็งปากมดลูก
ศูนย์ตั้งอยู่ที่ 3 - 5 ถ.เจริญกรุง แขวงวังบูรพาภิรมย์ เขตพระนคร กรุงเทพมหานคร 10200
บริการฉีดวัคซีนป้องกันพิษสุนัขบ้า ศูนย์บริการสาธารณสุข 18 มงคล วอนวังตาล จันทน์ 43
บริการฉีดวัคซีนป้องกันพิษสุนัขบ้าในสัตว์เลี้ยง ทุกวันศุกร์ 13-16 น.
สอบถามโทร 02-2110860 ต่อ 101
ที่ตั้ง 863/2 ซ.วัดไผ่เงิน ถ.จันทร์ แขวงบางโคล่ เขตบางคอแหลม กทม.10120
FAQ ใช้ Spring Up กับบริการ Telemed
ใครเป็นผู้ให้บริการเทเลเมด?
บริษัท กู๊ด ด็อกเตอร์ เทคโนโลยี (ประเทศไทย) จำกัด เป็นผู้ให้บริการเทเลเมด ซึ่งรวมไปถึงการพูดคุยการปรึกษาแพทย์ การออกใบสั่งยา และการจัดส่งยา
ฉันสามารถปรึกษาแพทย์ผ่านวิดีโอคอลได้หรือไม่?
การปรึกษาแพทย์จะอยู่ในรูปแบบแชทออนไลน์ เราไม่ได้ให้บริการวิดีโอคอลในขณะนี้ อย่างไรก็ตาม คุณสามารถส่งรูปภาพให้แพทย์ในห้องแชทเพื่อให้รายละเอียดเพิ่มเติมประกอบการปรึกษาได้
แพทย์ในเทเลเมดน่าเชื่อถือและไว้ใจได้เพียงใด?
แพทย์ของเราทุกท่านล้วนมีใบประกอบวิชาชีพเวชกรรมที่ได้รับการยอมรับและสามารถตรวจสอบได้จากฐานข้อมูลของหน่วยงานรัฐ
ฉันควรเตรียมตัวอย่างไรก่อนพูดคุยกับแพทย์ในห้องแชท?
เพียงเตรียมบัตรประชาชนของคุณเพื่อใช้สำหรับการยืนยันตัวตนก่อนเริ่มปรึกษาแพทย์
ฉันสามารถขอใบรับรองแพทย์ได้หรือไม่?
แน่นอน คุณสามารถขอใบรับรองแพทย์ได้จากระบบเทเลเมด
แพทย์ที่ฉันปรึกษาในเทเลเมดสามารถออกใบสั่งยาให้ฉันได้หรือไม่?
แน่นอน ทางแพทย์จะเป็นผู้ออกใบสั่งยาให้กับคุณในกรณีที่แพทย์เห็นสมควรต้องออกใบสั่งยาผ่านระบบเทเลเมด นอกจากนี้ คุณสามารถเลือกได้ว่าจะเลือกรับยา และได้รับการสั่งจัดส่งโดยตรงถึงบ้านท่านผ่านระบบเทเลเมด หรือรับใบสั่งยาเพื่อนำไปซื้อยาได้ที่ร้านขายยาทั่วไปด้วยตัวเอง
Spring Up มีการบันทึกประวัติการพูดคุยปรึกษาแพทย์ของฉันผ่านห้องแชทในเทเลเมดไว้หรือไม่?
คุณสามารถเรียกดูประวัติการพูดคุยปรึกษาแพทย์ผ่านห้องแชทได้ในระบบเทเลเมด ทั้งนี้ ข้อมูลทั้งหมดในห้องแชทจะถูกเก็บเป็นความลับไว้ที่ Good Doctor ซึ่ง Spring Up ไม่สามารถเข้าถึงข้อมูลดังกล่าวได้
ฉันสามารถดูผลการวินิจฉัยของแพทย์ได้อย่างไร
เมื่อพูดคุยกับแพทย์เสร็จแล้ว คุณจะเห็นผลการวินิจฉัยและใบสั่งยา (ถ้ามี) ได้ทันทีคุณสามารถกลับเข้ามาดูในภายหลังได้ทุกเมื่อในระบบเทเลเมด
ฉันต้องทำอย่างไรหากต้องการพบแพทย์แบบฉุกเฉิน
การรับคำปรึกษาออนไลน์ไม่เหมาะสำหรับกรณีฉุกเฉินทางการแพทย์ กรุณาติดต่อหน่วยงานการให้บริการทางการแพทย์ฉุกเฉินในพื้นที่ของคุณ
ฉันจะนัดคิวเพื่อปรึกษาแพทย์ในเทเลเมดได้อย่างไร?
คุณไม่จำเป็นต้องนัดล่วงหน้า เมื่อต้องการปรึกษาแพทย์ เพียงกดปุ่ม "เริ่มปรึกษากับทีมแพทย์ทั่วไป" ในแอป Good Doctor ระบบจะจัดหาแพทย์ให้คุณอย่างรวดเร็ว
ฉันจะชำระค่าใช้จ่ายที่เกิดจากการใช้บริการเทเลเมดได้ด้วยช่องทางใด?
ปัจจุบันนี้ คุณสามารถชำระผ่านบัตรเดบิต บัตรเครดิต หรือทรูมันนี่ วอลเล็ทระบบจะแจ้งให้ทราบเมื่อมีการเปิดให้บริการชำระค่าใช้จ่ายผ่านช่องทางอื่นเพิ่มเติม
ฉันสามารถใช้สิทธิประกันสังคมเพื่อใช้บริการเทเลเมดได้หรือไม่?
ในขณะนี้ คุณยังไม่สามารถใช้สิทธิประกันสังคมสำหรับใช้งานบริการเทเลเมดในแอปของเรา
บางกอกโพสต์ ประกาศเลิกจ้างพนักงานทั้งหมดของกองบรรณาธิการ ตั้งแต่ 1 กรกฎาคม 2565 LINK
เลขาธิการ สปส. สั่งการช่วยเหลือ ลูกจ้างหนังสือพิมพ์โพสต์ทูเดย์ ถูกเลิกจ้างด่วน
ตามที่ บริษัท บางกอกโพสต์ จำกัด (มหาชน) ประกาศเลิกจ้างพนักงานทั้งหมดของกองบรรณาธิการโพสต์ทูเดย์ มีผลตั้งแต่วันที่ 1 กรกฎาคม 2565 เป็นต้นไป นั้น นายสุชาติ ชมกลิ่น รัฐมนตรีว่าการกระทรวงแรงงาน ห่วงใยลูกจ้าง ผู้ประกันตน ที่ถูกเลิกจ้าง ได้สั่งการให้ทุกหน่วยงานในสังกัดกระทรวงแรงงาน เร่งช่วยเหลืออย่างทันท่วงที ด้าน นายบุญสงค์ ทัพชัยยุทธ์ เลขาธิการสำนักงานประกันสังคม ได้เร่งสั่งการไปยังผู้อำนวยการสำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 12 ตรวจสอบข้อเท็จจริง เร่งเคลีย์ปัญหาช่วยเหลือลูกจ้าง ผู้ประกันตน แนะนำสิทธิประโยชน์ทดแทนกรณีว่างงานแล้ว
สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 12 เร่งประสานงาน ให้ความช่วยเหลือลูกจ้าง ผู้ประกันตนโดยเร่งด่วน พร้อมเข้าตรวจสอบข้อเท็จจริง ทราบว่า บริษัท บางกอกโพสต์ จำกัด (มหาชน) ตัดสินใจเลิกจ้างพนักงานทั้งหมดของกองบรรณาธิการโพสต์ทูเดย์ เนื่องจากบริษัทประสบภาวะขาดทุนจากการแข่งขันสูงของวงการสื่อในปัจจุบัน โดยให้การเลิกจ้างมีผลตั้งแต่วันที่ 1 กรกฎาคม 2565 นี้เป็นต้นไป
20 มิ.ย.65 สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 12 ได้ส่งเจ้าหน้าที่ลงพื้นที่ร่วมกับสำนักงานสวัสดิการและคุ้มครองแรงงาน สำนักงานจัดหางาน แนะนำสิทธิประโยชน์กรณีว่างงานจากการ ถูกเลิกจ้าง เนื่องจากสถานการณ์เศรษฐกิจให้กับลูกจ้าง ซึ่งจะได้รับเงินทดแทนการขาดรายได้กรณีว่างงานร้อยละ 50 ของค่าจ้างไม่เกิน 180 วัน รวมถึงการสมัครเป็นผู้ประกันตนโดยสมัครใจตามมาตรา 39 และการขอรับบำนาญชราภาพ สำหรับผู้ที่ถูกเลิกจ้างที่มีอายุครบ 55 ปีบริบูรณ์ เพื่อทำความเข้าใจแก่ลูกจ้าง ผู้ประกันตน ให้ได้รับสิทธิประโยชน์อย่างครบถ้วน
2. ยื่นบัตร ณ โรงพยาบาลที่ไปตรวจ
สามารถไปใช้บริการได้ทุกโรงพยาบาลที่ให้บริการบัตรทอง นั่นคือ ทุกโรงพยาบาลรัฐบาลทั่วไทย และ
โรงพยาบาลเอกชนบางที่ให้บริการบัตรทอง ตามรายชื่อดังนี้
โรงพยาบาลกล้วยน้ำไท 02-7692000
โรงพยาบาลนวมินทร์ 02-918-5080
โรงพยาบาลบางมด 0-2867-0606
โรงพยาบาลประชาพัฒน์ 02-4279966
โรงพยาบาลผู้สูงอายุกล้วยน้ำไท 2 02-399-4259
โรงพยาบาลเพชรเวช 1390
โรงพยาบาลแพทย์ปัญญา 02-3140726
โรงพยาบาลมงกุฎวัฒนะ 0-2574-1000
โรงพยาบาลสิรินาถ บึงกุ่ม 02-407-2900
สมุทรปราการ
โรงพยาบาลเซ็นทรัลปาร์ค 0-2312-7261
โรงพยาบาลเมืองสมุทรปู่เจ้าสมิงพราย 0-2754-2800
โรงพยาบาลแคนเซอร์อลิอันซ์ ศรีราชา 033-046-333 ชลบุรี
นครราชสีมา
โรงพยาบาลเดอะโกลเดนเกต 044 243 733
โรงพยาบาลราชสีมา ฮอสพิทอล 062 201 5601
โรงพยาบาลเอกชนร่มเกล้า 045-244658 อุบลราชธานี
โรงพยาบาลนายแพทย์หาญ 045-711356 ยโสธร
โรงพยาบาลวีระพลการแพทย์ 0-4231-2347 หนองบัวลำภู
โรงพยาบาลพิสัยเวช 042 471 421 หนองคาย
โรงพยาบาลจุรีเวช 043-518019 ร้อยเอ็ด
โรงพยาบาลพริ้นซ์ ลำพูน 053-582888 ลำพูน
โรงพยาบาลลำพูนใกล้หมอ 053581998 ลำพูน
โรงพยาบาลเขลางค์นคร-ราม 054-019619 ลำปาง
โรงพยาบาลร่มฉัตร056 224 266 นครสวรรค์
โรงพยาบาลเจษฎาเวชการ 034-821-200 สมุทรสาคร
การตรวจ Sleep Test ด้วยระบบคอมพิวเตอร์
พญ. เบญจมาศ อินทรโภคา แพทย์ชำนาญการด้านโรคระบบหายใจและเวชศาสตร์การนอนหลับ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ปัญหาการนอนที่พบบ่อยมากที่สุดและมาปรึกษาแพทย์ที่ คลินิกคุณภาพการนอนหลับ โรงพยาบาลบำรุงราษฎร์ คือ ภาวะนอนกรนหยุดหายใจขณะหลับ รองลงมาคืออาการนอนไม่หลับ โดยเบื้องต้นแพทย์จะทำการประเมินซักถามผู้ป่วย และทำการวินิจฉัยเพื่อหาสาเหตุ
โดยส่วนใหญ่แพทย์จะทำการตรวจวินิจฉัยด้วยเครื่องตรวจการนอนหลับ (Sleep Test) ด้วยระบบคอมพิวเตอร์ ซึ่งเป็นการตรวจที่เป็นมาตรฐาน (Gold Standard) ที่มีความละเอียดแม่นยำมากที่สุด ตรวจในห้องปฏิบัติการตรวจการนอนหลับในโรงพยาบาลเป็นเวลา 1 คืน โดยจะมีเจ้าหน้าที่ดูแลสังเกตอาการอย่างใกล้ชิดตลอดทั้งคืน ทำให้ได้ผลวิเคราะห์ที่แม่นยำและทราบถึงสาเหตุแท้จริงของปัญหาการนอน ซึ่งจะทำให้แพทย์สามารถวางแผนการรักษาได้อย่างมีประสิทธิภาพ
การตรวจ Sleep Test ด้วยระบบคอมพิวเตอร์
ประกอบด้วย 3 ส่วนหลักๆ คือ
1. ตรวจคลื่นไฟฟ้าสมอง คลื่นไฟฟ้ากล้ามเนื้อลูกตา ใต้คาง และขา คลื่นไฟฟ้าหัวใจ ทำให้ทราบว่าหลับตื้นหรือหลับลึก วงจรการหลับเป็นปกติหรือไม่ หรือการนอนมีคุณภาพที่ดีเพียงพอหรือไม่
2.ตรวจวัดลมหายใจ ว่าหายใจปกติหรือไม่ หรือหายใจแผ่ว หรือมีการหยุดหายใจขณะหลับ
3. ตรวจวัดระดับออกซิเจนในเลือด ว่าค่าออกซิเจนอยู่ในระดับที่เหมาะสมหรือไม่ บางคนหยุดหายใจขณะหลับ ซึ่งกรณีที่มีค่าออกซิเจนต่ำลงมาก จะมีความเสี่ยงทำให้อวัยวะในร่างกายไม่ทำงาน และเป็นอันตรายถึงชีวิตได้
เกณฑ์ส่งตัวเข้าโรงพยาบาล (3.3) LINK
เกณฑ์ส่งตัวเข้าโรงพยาบาล (3.3)
มีไข้สูงกว่า 39องศา นานกว่า 24 ชม.
เป็นโรคประจำตัว มีความเสี่ยง เช่น เบาหวาน
ออกซิเจนต่ำกว่า 94%
- ผู้ใหญ่ หากหายใจเร็วกว่า 25 ครั้งต่อนาที
- เด็ก หากมีอาการหายใจลำบาก ซึมลง กินน้อยลง
ติดต่อ Call center 081-2342714 081-2342715
การรักษาคลองรากฟัน คืออะไร
ข่าวปลอม อย่าแชร์! รพ. พญาไท 2 พบวิธีแก้ปัญหาอาการปวดกระดูกและข้อ ใช้เวลา 10 วัน รักษาที่บ้านโดยไม่ต้องผ่าตัด LINK
ตามที่มีโฆษณาชวนเชื่อเกี่ยวกับเรื่องรพ. พญาไท 2 พบวิธีแก้ปัญหาอาการปวดกระดูกและข้อ ใช้เวลา 10 วัน รักษาที่บ้านโดยไม่ต้องผ่าตัด ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยโรงพยาบาลพญาไท 2 พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีโฆษณาชวนเชื่อในสื่อออนไลน์โดยระบุว่า ข่าวดีสำหรับคนไข้ที่มีปัญหาเรื่องกระดูกและข้อ ขณะนี้มีวิธีแก้ปัญหาโดยใช้เวลา 10 วัน รักษาที่บ้านโดยไม่ต้องผ่าตัด ทางโรงพยาบาลพญาไท 2 ได้ตรวจสอบข้อมูลและชี้แจงว่า มีผู้ไม่ประสงค์ดีได้นำภาพตราสัญลักษณ์ของรพ. พญาไท 2 ไปใช้แอบอ้างบนเพจ Phyathai 2 International Hospital ซึ่งรพ.พญาไท 2 มิได้มีส่วนเกี่ยวข้องกับเพจ Phyathai 2 International Hospital และโฆษณานั้น ๆ แต่อย่างใด โดยทางรพ.พญาไท 2 ได้ดำเนินการทางกฎหมายเรียบร้อยแล้ว นอกจากนี้ ท่านสามารถติดตามข้อมูลข่าวสารของรพ. พญาไท 2 ได้ที่เพจ Phyathai2 Hospital เท่านั้น
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อ และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากโรงพยาบาลพญาไท 2 สามารถติดตามได้ที่เว็บไซต์ https://www.phyathai.com/branch/PYT2 หรือโทร 1772
บทสรุปของเรื่องนี้คือ : มีผู้ไม่ประสงค์ดีนำภาพตราสัญลักษณ์ของรพ. พญาไท 2 ไปใช้แอบอ้างบนเพจ Phyathai 2 International Hospital ซึ่งรพ.พญาไท 2 มิได้มีส่วนเกี่ยวข้องกับเพจและโฆษณาดังกล่าวแต่อย่างใด
ขั้นที่ 2 กรอกข้อมูล บัตรประชาชนและผลตรวจ ATK
BDMS Healthpassport แอป โรงพยาบาลกรุงเทพ
Mobile Healthcare Application for Patient of BDMS PLC BDMS Health Passport has the following features:
• View Health record including Medication
• View Lab Result
• Find Doctor
• Make Appointment by e-mail
• View Packages & Promotions
• Access BDMS Hospital Information including map
โหลดได้ทั้ง
iOS และ
PlaystoreChula Care จุฬาแคร์ แอปพลิเคชัน LINK
จุฬาแคร์ แอปพลิเคชัน (Chula Care Application) แอปพลิเคชันสำหรับผู้ป่วยของโรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย รองรับการเข้าใช้งานโดยผู้ป่วย ญาติผู้ป่วย และบุคลากรในโรงพยาบาล บนสมาร์ทโฟน เพื่อให้ได้รับประสบการณ์การใช้บริการในโรงพยาบาลที่สะดวก รวดเร็ว และมีประสิทธิภาพมากขึ้น สามารถดูนัดหมายพบแพทย์ พร้อมมีการแจ้งเตือนนัดหมาย เพื่อไม่ให้พลาดการพบแพทย์ แจ้งผลการตรวจสอบสิทธิ์ในการรักษา แจ้งข้อมูลใบนำทางและคิวรอพบแพทย์ พบแพทย์ทางไกล (TeleClinic) เลือกสถานที่รับยาที่ร้านสะดวกซื้อใกล้บ้าน สามารถชำระค่าบริการผ่านบัตรเดบิตหรือบัตรเครดิตได้ทุกธนาคาร บริจาคเงิน e-Donation และติดตามข่าวสาร ความรู้เกี่ยวกับการดูแลสุขภาพจากโรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย
Chula Care ได้พัฒนาระบบ และฟังก์ชันการใช้งาน เพื่อตอบสนองความต้องการของผู้ใช้งาน อาทิ เช่น การแสดงนัดหมายทั้งในรูปแบบปกติและ Teleclinic, แจ้งเตือนพบแพทย์ของระบบ Teleclinic, แจ้งเตือนให้ชำระค่าบริการวินิจฉัยของคลีนิกพยาธิวิทยา, ยอมรับเงื่อนไข PDPA และอื่นๆ ขอบคุณที่ใช้บริการ Chula Care
สอบถามการใช้งานจุฬาแคร์ แอปพลิเคชัน ได้ที่ Chula Care Call Center 02-256-4699
สถานเอกอัครราชทูต ณ กรุงปักกิ่ง แจ้งเตือนคนไทย
สถานเอกอัครราชทูต ณ กรุงปักกิ่ง แจ้งเตือนคนไทย ตามกฏหมายท้องถิ่นของสาธารณรัฐประชาชนจีน กัญชาและสารสกัดกัญชาเป็นยาเสพติดให้โทษมีการกำหนดอัตราโทษเกี่ยวกับกัญชาไว้ตามพฤติการณ์การกระทำผิ และปริมาณของกลาง มีโทษจำคุกตั้งแต่ 3 ปี จนถึงประหารชีวิต
อนึ่งขอให้ใช้ความระมัดระวังในการรับฝากสิ่งของจากผู้อื่นมายังประเทศจีน
กรมแพทย์ฯ เผยใช้สารสกัดกัญชา มีข้อบ่งชี้ชัดเจน
นพ.สมศักดิ์ อรรฆศิลป์ อธิบดีกรมการแพทย์ กล่าวว่า กรมการแพทย์ได้ใช้สารสกัดกัญชาทางการแพทย์ในการรักษาผู้ป่วย โดยมีข้อบ่งชี้เพื่อนำมาใช้ใน 3 ประเด็น คือ
1) กลุ่มที่ได้ประโยชน์ โดยมีเอกสารอ้างอิงมีการศึกษาวิจัยชัดเจน นำมารักษาใน 6 กลุ่มโรค กลุ่มผู้ป่วยโรคมะเร็งที่ได้รับยาเคมีบำบัดและมีอาการคลื่นไส้อาเจียน, เด็กที่มีอาการชัก และดื้อยาทุกชนิด ซึ่งสถาบันสุขภาพเด็กแห่งชาติมหาราชินีร่วมกับสถาบันประสาทวิทยาพบว่า ได้ผลดีถึงร้อยละ 50 , ผู้ป่วยมะเร็งระยะสุดท้าย, ผู้ป่วยปลอกประสาทเสื่อมแข็ง และ อาการปวดประสาทส่วนกลาง สถาบันประสาทวิทยาได้นำมาใช้และศึกษาวิจัยพบว่าได้ผลดี ซึ่งตรงกับผลการศึกษาของต่างประเทศ และนำมาใช้ช่วยเพิ่มความอยากอาหารในผู้ป่วยเอดส์
2) กลุ่มที่น่าจะได้ประโยชน์ โดยโรงพยาบาลประสาทเชียงใหม่ทำการศึกษาในกลุ่มพาร์กินสันได้ผลร้อยละ 30 ถึง 40 และอยู่ในระหว่างศึกษากลุ่มปลอกประสาทอักเสบ อัลไซเมอร์ และโรคทางระบบประสาทอื่น ๆ
3) กลุ่มที่อาจจะได้ประโยชน์ อาทิเช่น การใช้ในผู้ป่วยมะเร็งโดยได้ทำการทดสอบในหลอดทดลอง พบว่าสารสกัดกัญชาสามารถยับยั้งเซลล์มะเร็งได้ จำเป็นต้องมีการศึกษาวิจัยเพิ่มเติมต่อไป ทั้งนี้ การใช้กัญชาทางการแพทย์ควรเป็นทางเลือกสุดท้าย ผู้ป่วยควรได้รับการรักษาด้วยวิธีอื่นก่อน
“ขอเพียงเรามีมือสองมือ เราทุกคนก็มีโอกาสช่วยให้คน ๆ นึงรอดชีวิตกลับไปหาคนที่รักได้”
ในการอบรมเราจะมุ่งเน้นให้ผู้เข้าอบรมซึ่งไม่ใช่บุคลากรการแพทย์ ไม่มีเครื่องมือพิเศษใด ๆ สามารถที่จะใช้มือสองมือของตนในการช่วยชีวิตผู้อื่นได้ รวมถึงการให้ผู้เรียนได้ฝึกทักษะการใช้เครื่องกระตุกไฟฟ้าหัวใจอัตโนมัติ ซึ่งเป็นอุปกรณ์ที่ออกแบบมาเพื่อให้ประชาชนสามารถใช้ช่วยชีวิตผู้ป่วยที่มีภาวะหัวใจหยุดเต้นเฉียบพลันได้อย่างมีประสิทธิภาพ โดยปัจจุบันภาครัฐ และเอกชนได้เริ่มมีการติดตั้งเครื่องไว้ตามที่สาธารณะต่างๆ เช่น สนามบิน รถไฟฟ้า ทำให้ประชาชนไทยมีโอกาสเข้าถึงเครื่องมือช่วยชีวิตได้เร็วขึ้น เช่นเดียวกับในต่างประเทศ
โดยที่ผ่านมาทางโรงพยาบาลได้ทำการสอนอบรมมาอย่างต่อเนื่อง และเรามีความตั้งใจที่จะทำต่อไปเรื่อย ๆ “เพราะการช่วยชีวิต รอไม่ได้” และคนที่สำคัญที่สุด คือคนที่อยู่กับผู้ป่วย ณ เวลาที่เกิดเหตุฉุกเฉินนั้น ประชาชนทุกคนจึงเป็นบุคคลที่สำคัญที่สุดที่จะช่วยดูแลครอบครัว และชุมชนของตน
โปรแกรมธาราบำบัด LINK
ช่วยบรรเทาอาการต่างๆ เช่น ปวดกล้ามเนื้อ ปวดข้อ และมีโปรแกรมอื่นๆ ที่ใช้ธาราบำบัด ได้ เช่น
โปรแกรมลดน้ำหนัก โปรแกรมมารดาตั้งครรภ์ โปรแกรมมารดาออกกำลังกายหลังคลอด หรือโปรแกรมส่งเสริมสุขภาพ เป็นต้น
*การใช้บริการต้องนัดล่วงหน้า มีข้อห้ามสำหรับผู้ป่วยบางประเภท
สอบถามโทร 053-917553
Day 25 - Day 30
ช่วงวันท้ายๆ ก็คล้ายๆ 3 อาทิตย์ ที่ผ่านมา งดให้ยาวขึ้น คุยกันแทนเขียนหากัน ทำอย่างอื่นเสริมเข้ามา จะเล่นก็ได้บ้างไม่ถึงกับห้าม แต่เชื่อเถอะมาถึงตรงนี้ คิดและรู้สึกยังไงก็ปล่อยไปตามนั้นได้เลย วินัยในตัวมันก่อร่างสร้างแบบแผนขึ้นมาแล้ว ตัวเองจะรู้ดีสุดว่าแบบไหนได้ไม่ได้ แค่ไหนเหมาะควร มันปรับได้เอง จุดที่พอดีที่เราชอบมันจะมาเอง และ เราเลือกได้เอง ว่าจะจัดสรรมันอย่างไรในที่สุด และเมื่อถึงตอนนั้น ตารางต่างๆ ก็ไม่จำเป็นอีกต่อไป เมื่อนั้นก็ถึงเวลาออกไปใช้ชีวิตแบบไร้อิทธิพลโซเชียลแบบสไตล์เรานั่นเอง
อันดับที่ 2 รพ.ศิริราช ปิยะมหาราชการุณย์ 90.24%
นับตั้งแต่ก่อตั้งเมื่อปี 2553 จนถึงบัดนี้ กว่าสิบปี แห่งการพัฒนาด้านการให้บริการทางการแพทย์ ของโรงพยาบาลศิริราช ปิยมหาราชการุณย์ เดินหน้าไปตามเจตนาแห่งพันธกิจ ที่มุ่งเป็นโรงพยาบาลที่ให้บริการทางการแพทย์ที่เป็นเลิศ เพื่อนำประโยชน์คืนกลับสู่ศิริราชและสังคม นำมาสู่การเป็นโรงพยาบาลที่มีศรัทธามากที่สุดแห่งปี 2564 และเข้ามาเป็นโรงพยาบาลที่ดีที่สุดของประเทศไทยในอันดับที่สอง อย่างน่าภาคภูมิ ไม่เพียงแต่ความยอดเยี่ยมในด้านการแพทย์ ความรู้และเทคโนโลยีการสาธารณสุขที่ไร้ที่ติแล้ว สิ่งสำคัญอีกประการซึ่งเป็นหัวใจของโรงพยาบาลแห่งนี้ คือหลักปรัชญา แนวคิดการเป็น "ผู้รับและผู้ให้" โดยรายได้จากผู้รับบริการจะเสมือนเป็นการให้กลับสู่คณะแพทย์ศาสตร์ ศิริราชพยาบาลเพื่อนำไปช่วยเหลือผู้ด้อยโอกาสในโรงพยาบาลศิริราช และกิจการอื่นๆ เพื่อยกระดับมาตรฐานการแพทย์ไทยสู่ระดับเอเซีย และนี่คืออีกแรงผลักดันที่มีร่วมกันของผู้รับและผู้ให้ ให้โรงพยาบาลศิริราช ปิยมหาราชการุณย์ ก้าวขึ้นมาเป็นโรงพยาบาลชั้นนำระดับแนวหน้าของประเทศไทยต่อไป
บุญชู กัญชาคาเฟ่ คาเฟ่กัญชาลอยฟ้า
บุญชู กัญชาคาเฟ่ คาเฟ่กัญชาลอยฟ้า ร้านแรกในไทย เค้าว่าไว้อย่างนั้น มีโอกาสแวะไปชม ไปนั่งเล่น ปากซอยพหล 46/1 เลย ใกล้บ้านใครมั่งมั๊ย
โตโยต้ากาญจนบุรี1995 ผู้จำหน่ายโตโยต้า รับสมัคร
พนักงานดูแลฟาร์มกัญชาง
-ดูแลรับผิดชอบการปลูกและดูแลต้นกัญชง ตามที่ได้รับมอบหมายจากผู้บังคับบัญชา
- มีประกันสังคม
- มีค่าเบี้ยขยัน
- มีที่พักให้
- เสื้อฟอร์มบริษัท
Qualifications
เพศชาย อายุไม่เกิน 40 ปี ต้องผ่านหลักสูตร รด. หรือผ่านการเกณฑ์ทหารเรียบร้อยแล้ว
ไม่จำกัดวุฒิการศึกษา
มีใจรักงานเกษตรและเรื่องที่เกี่ยวกับต้นไม้
มีใจเปิดกว้างพร้อมเรียนรู้สิ่งใหม่ๆ
มีความซื่ิอสัตย์ ขยัน อดทน และมีความรับผิดชอบต่องานที่ได้รับมอบหมาย
มีความรู้ในการใช้เทคนิคเกษตรกรรมเบื้องต้น ความรู้โครงสร้างโรงเรือนแบบปิดสำหรับเพาะปลูก และระบบนิเวศ
โหลดแอพ iTIC
ฝนตก!!!
น้ำท่วม!!!
รถติด!!!
เช็คสภาพการจราจรแบบ Real-TIme ก่อนออกเดินทางได้ง่าย ๆ เพียงดาวน์โหลดแอพ iTIC
ดาวน์โหลด ได้ที่
Apple Store และ
Google Play storeตามรอย บุพเพสันนิวาส 2 ที่ วัดประยุรวงศาวาส
ไม่อยากไปไหนไกล เที่ยวในกรุงเทพ เที่ยววัด ให้เข้ากับบรรยากาศ ตามรอยหนังดังสุดฮิตตอนนี้ “บุพเพสันนิวาส 2” เพื่อเข้าชม “พระบรมธาตุมหาเจดีย์” แห่ง “วัดประยุรวงศาวาส” ที่คุณพี่ภพร่วมสร้าง ซึ่งมีความพิเศษคือ เป็นเจดีย์องค์เดียวแห่งกรุงรัตนโกสินทร์ที่มีเสาอิฐเป็นแกนกลาง และโครงการอนุรักษ์เจดีย์พระประธานของวัดประยุรวงศาวาสวรวิหาร เคยได้รับรางวัลยอดเยี่ยม อันดับ 1 จากยูเนสโก ในการประกวดโครงการอนุรักษ์มรดกทางวัฒนธรรมในภูมิภาคเอเชียและแปซิฟิก ประจำปี 2556 [
Travel360 เที่ยวรอบทิศ]
มิติที่ 2 การเปิดเผยข้อมูลสาธารณะ และการต่อต้านทุจริต
การเปิดสัญญาสัมปทาน BTS เมื่อวันที่ 1 ส.ค. 65 มีการเปิดสัญญาจ้างระหว่างกรุงเทพมหานครและบริษัท กรุงเทพธนาคม จำกัด ในส่วนสัญญาจ้างบริหารระบบขนส่งมวลชนกรุงเทพมหานคร และบันทึกข้อตกลงการมอบหมายกิจการในอำนาจหน้าที่ของกรุงเทพมหานคร โครงการระบบขนส่งมวลชนสายสีเขียว ส่วนต่อขยายที่ 1 และ 2 หลังจากเดือนก่อนหน้า กทม.ได้มีการเปิดเผยงบประมาณ กทม. ปี 2566 และการเปิดเผยคำสั่งต่าง ๆ ผ่านทางเว็บไซต์ เพื่อความโปร่งใส และเพื่อการมีส่วนร่วมของประชาชนให้มากที่สุด ทั้งนี้ สามารถตรวจสอบและดูรายละเอียดได้ที่
https://main.bangkok.go.th/ หัวข้อ open data
เรื่องต่อมาคือ กล้อง CCTV ซึ่งทั่ว กทม. มีทั้งหมด 62,000 กล้อง ที่ผ่านมาใช้เวลานานในการขอภาพวงจรปิด ขณะนี้ กทม.ได้เปิดให้มีการขอภาพจากกล้องวงจรปิด (CCTV) ของ กทม.ทางออนไลน์ได้แล้ว เพื่ออำนวยความสะดวกให้ประชาชนที่ไม่สะดวกเดินทางมาขอภาพด้วยตนเอง สามารถขอดูภาพย้อนหลังได้ ภายใน 24 ชม.
โดยวิธีการขอทำได้ 2 ช่องทาง คือ เว็บไซต์ cctv.bangkok.go.th และไลน์ @CCTVBANGKOK
ในการขอแต่ละครั้งจะสามารถขอได้ครั้งละไม่เกิน 6 กล้อง โดยเตรียมเอกสารและข้อมูลตามระบบ ซึ่งตลอดเดือน ก.ค. 65 มีผู้มาขอใช้บริการได้ภาพทั้งหมด 166 ราย โดยมี 158 ราย ได้ภาพ ส่วนอีก 8 ราย ไม่ได้ภาพ เนื่องจากเกินระยะเวลาบันทึกภาพ (7 วัน) และบางจุดกล้องชำรุด/ระบบภาพขัดข้อง โดยปัจจุบันได้รับการแก้ไขแล้ว นอกจากนี้ กทม. ได้เพิ่มประสิทธิภาพการให้บริการ ด้วยการให้ประชาชนสามารถเลือกกล้องจากในระบบได้ โดยดูจากแผนที่และถนนที่เกิดเหตุ
ในส่วนของการประกาศเจตนารมณ์ต่อต้านทุจริต 5 ข้อ (Quick Win) เมื่อวันที่ 26 ก.ค. 65 กทม. ได้ร่วมกับองค์กรต่อต้านคอร์รัปชัน (ประเทศไทย) หรือ ACT เพื่อแสดงเจตนารมณ์ร่วมกันของผู้บริหาร กทม. ในการต่อต้านทุจริต “ไม่เฉย ไม่ทำ และไม่ทนต่อการทุจริตทุกรูปแบบ” สอดคล้องกับนโยบาย 216+ นโยบาย “ลดเสี่ยงโกงผ่านความร่วมมือภาคีเครือข่ายประชาชน” และ “โปร่งใส ไม่ส่วย”
เทศกาลบอลลูนนครนายก ครั้งที่ 1 ระหว่างวันที่ 11-14 สิงหาคม 2565
เทศกาลบอลลูนนครนายก ครั้งที่ 1 ระหว่างวันที่ 11-14 สิงหาคม 2565 มาสูดโอโซนให้เต็มปอด และชมบอลลูนหลากสีสันบนน่านฟ้านครนายกที่ห้อมล้อมด้วยบรรยากาศธรรมชาติสุดๆ มาสูดโอโซนให้เต็มปอด และชมบอลลูนหลากสีสันบนน่านฟ้านครนายกที่ห้อมล้อมด้วยบรรยากาศธรรมชาติสุดแสนโรแมนติก
บัตรเข้าชมงาน ราคา 100 บาท ใช้เป็นส่วนลดในงานได้ 50 บาท/ท่าน
พิเศษ!! ต้อนรับวันแม่แห่งชาติ 12 สิงหาคม 2656
พบกับคอนเสิรต์
"ฟอร์ด สบชัย และ ต้าร์ มิสเตอร์ทีม"
บัตรเข้าชมงาน 200 บาท/ท่าน ใช้เป็นคูปองส่วนลดได้ในงานได้ 100 บาท
**เด็กอายุต่ำกว่า5ขวบ เข้าชมฟรีตลอดงาน
สอบถามข้อมูลเพิ่มเติมได้ที่ 097-0974426
คลองเตย ลงตรวจสถานบริการตามมาตรการป้องกันอัคคีภัย LINK
11 สิงหาคม 2565 พล.ต.อ. อดิศร์ งามจิตสุขศรี ที่ปรึกษาของผู้ว่าราชการ พร้อมด้วย นายจิรัฏฐ์ ม้าไว ผู้ช่วยเลขานุการผู้ว่าราชการ กรุงเทพมหานคร ลงพื้นที่ตรวจสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ณ สถานประกอบการย่าน นานาพลาซ่า ซ.สุขุมวิท 4 โดยมี นางสาวปิยธิดา นิยม ผู้อำนวยการเขตคลองเตย นางสาวกัลยา ลิขิตสารวิทย์ ผู้ช่วยผู้อำนวยการเขตคลองเตย ฝ่ายสิ่งแวดล้อมฯ ฝ่ายเทศกิจ ฝ่ายโยธา และเจ้าหน้าที่ที่เกี่ยวข้อง อีกทั้งยังมีเจ้าหน้าที่จากสถานนีตำรวจนครบาลลุมพินี เจ้าหน้าที่สถานนีดับเพลิงบ่อนไก่ ร่วมลงตรวจพื้นที่ในครั้งนี้
ทั้งนี้ ได้ตรวจสอบใบอนุญาต ตาม พ.ร.บ.การสาธารณสุข พ.ศ. 2535 และตรวจสอบความปลอดภัยด้านอาคาร ตาม พ.ร.บ.ควบคุมอาคาร พ.ศ 2522 เช่น ป้ายบอกทางหนีไฟ ทางเข้า-ออกฉุกเฉิน หรือทางหนีไฟ ไฟฉุกเฉินได้มีการตรวจสอบว่าสามารถเปิดใช้งานได้จริง รวมถึงอุปกรณ์ในการระงับเหตุอัคคีภัยก็ต้องยังสามารถใช้งานได้และไม่หมดอายุ พร้อมกำชับผู้ประกอบการสถานบริการหมั่นตรวจสอบและเตรียมความพร้อมของถังดับเพลิง ทางหนีไฟ สัญญาณเตือนภัยให้พร้อมใช้งาน เเละยังคงให้ปฏิบัติมาตรการป้องกันการเเพร่ระบาดของโรคโควิด-19 ให้เป็นไปตามที่ราชการกำหนด
คลินิกกายภาพบำบัด ศบส1 สะพานมอญ
บริการด้านรักษาโรคระบบกระดูกและข้อ เช่น ข้อเข่าเสื่อม ข้อไหล่ยึด กล้ามเนื้อ เอ็นกล้ามเนื้อักเสบ และโรคทางระบบประสาท อัมพฤกษ์ อัมพาต โดยให้บริการโดยนักกายภาพบำบัด
มีให้บริการทั้งในคลินิกและนอกคลินิก
คลินิกทันตกรรม
คลินิกทันตกรรม
ตั้งอยู่บริเวณชั้น 3
จันทร์ – ศุกร์ 8.00 น. - 12.00 น.
(หยุดวันหยุดนักขัตฤกษ์)
ขอบเขตการให้บริการ
1. บริการด้านส่งเสริมทันตสุขภาพ ได้แก่ สอนทันตสุขศึกษาแก่ เด็กก่อนวัยเรียน นักเรียน ผู้มาใช้บริการในคลินิกทันตกรรม หญิงมีครรภ์ ผู้สูงอายุ และประชาชนทั่วไป
2. บริการด้านทันตกรรมป้องกัน ได้แก่ การตรวจแนะนำสุขภาพในช่องปาก, ฝึกแปรงฟัน,เคลือบหลุมร่องฟันและเคลือบฟลูออไรด์
3. บริการบำบัดรักษาทางทันตกรรมในสถานบริการ ได้แก่ ตรวจวินิจฉัย, อุดฟัน, ขูดหินปูน, ถอนฟัน, ผ่าฟันคุด, เอกซเรย์ เป็นต้น โดยเปิดให้บริการทั้งในและนอกเวลาราชการ
4. ออกหน่วยทันตกรรมเคลื่อนที่ในโรงเรียนและชุมชน
5. กิจกรรมรณรงค์ทันตสาธารณสุข และงานโครงการพิเศษต่างๆ
ผู้ประกันตน ม.33 และ ม.39 ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ฟรี LINK
ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ สำหรับผู้ประกันตน ม.33 และ ม.39 ที่ถือบัตรประกันสังคมโรงพยาบาลทีอาร์พีเอช มีอายุตั้งแต่ 50 ปีขึ้นไป
***ไม่เสียค่าใช้จ่าย***
ตั้งแต่วันนี้ จนถึง 31 สิงหาคม 2565
สแกน QR code เพื่อนัดหมายล่วงหน้า หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ 075 218 988 ต่อ 3127
ประกันสังคมจัดให้ ผู้ประกันตน ฉีดวัคซีนไข้หวัดใหญ่ รุ่นใหม่ 2022 ฟรี LINK
ประกันสังคมจัดให้ ‼️ ผู้ประกันตน #โรงพยาบาลลานนา และ #โรงพยาบาลลานนา3 อายุ 50 ปีขึ้นไป ... #ฉีดวัคซีนไข้หวัดใหญ่ รุ่นใหม่ 2022 ที่ โรงพยาบาลลานนา และ โรงพยาบาลลานนา 3 ได้ #โดยไม่เสียค่าใช้จ่าย
โรงพยาบาลลานนา นำ #วัคซีนป้องกันไข้หวัดใหญ่ รุ่นใหม่ 2022 แบบ 4 สายพันธุ์ จากต่างประเทศมาให้บริการแล้ว..
อากาศเปลี่ยนแปลงบ่อย เตรียมเข้าสู่ฤดูฝน เป็นช่วงที่ต้องระวัง “โรคไข้หวัดใหญ่” ระบาด โดยเฉพาะกลุ่มผู้สูงอายุ อยู๋ใน "7 กลุ่มเสี่ยง" ที่ควรฉีดวัคซีนป้องกันเป็นประจำทุกปี ซึ่งการฉีดวัคซีนไข้หวัดใหญ่นี้ จะช่วยลดความรุนแรง หากมีการการติดเชื้อร่วม ทั้งไข้หวัดใหญ่และโควิด เพราะป่วยแล้วจะอาการรุนแรงกว่าปกติ รีบใช้สิทธิของท่านด่วน..ตั้งแต่วันที่ 1 พฤษภาคม 2565 - 31 สิงหาคม 2565 นี้เท่านั้น
Room Care ทางเลือกสุดประหยัด ในการอัพเกรดห้องพักผู้ป่วย ใช้ร่วมกับประกันสังคม หรือสวัสดิการที่มี LINK
Room Care ทางเลือกสุดประหยัด ในการอัพเกรดห้องพักผู้ป่วย ใช้ร่วมกับประกันสังคม หรือสวัสดิการที่มี
นอนห้องเดี่ยวได้ตลอดปีโดยไม่มีส่วนเกิน เหมาะสำหรับ
ใช้ร่วมกับประกันสังคม
ใช้ร่วมกับสวัสดิการพนักงาน หรือสวัสดิการที่มี
ใช้เพิ่มผลประโยชน์ให้กับประกันสุขภาพของคุณ
ไม่ต้องตรวจสุขภาพ
Room Care "ทางเลือกสุดประหยัด ในการอัพเกรดห้องพักผู้ป่วย"
เริ่มต้นเพียง 2,000 บาท
สอบถามเพิ่มเติม
Tel : 02-8048959-70 ต่อ 1234,1211
สิทธิพิเศษสำหรับ ประกันสังคมบุคคล และสิทธิสำหรับองค์กร (ประกันกลุ่ม + ประกันสังคม) LINK
สิทธิพิเศษสำหรับผู้เปลี่ยนสิทธิ์ประกันสังคมกับโรงพยาบาลกล้วยน้ำไท
- ตรวจสุขภาพประจำปี 13 รายการ ตามเงื่อนไขทางประกันสังคมกำหนด
- ทำฟันสบายใจ ไม่ต้องสำรองจ่าย (วงเงิน 900บาท/ปี)
- ฉีดวัคซีนไข้หวัดใหญ่ ชนิด 4 สายพันธุ์ สำหรับพนักงานที่มีอายุ 50 ปีขึ้นไป
- ตรวจคลื่นไฟฟ้าหัวใจ Electrocardiogram (EKG) สำหรับพนักงานที่มีอายุ 40 ปีขึ้นไป โดยไม่เสียค่าใช้จ่าย เงื่อนไขตามสิทธิ์ที่มี
สิทธิ์ประโยชน์ สำหรับองค์กร (ประกันกลุ่ม + ประกันสังคม)
สิทธิพิเศษสำหรับบริษัท หรือองค์กรที่เลือกใช้ประกันสังคมโรงพยาบาลกล้วยน้ำไทให้กับพนักงานของท่าน ท่านจะได้รับบริการพิเศษดังนี้
- พบแพทย์เฉพาะทาง ศูนย์หัวใจ, ศูนย์ไต, ศูนย์ผ่าตัดส่องกล้อง, ศูนย์ศัลยกรรมกระดูกและข้อ
- Telehealth ให้คำปรึกษาปัญหาสุขภาพออนไลน์ โดยแพทย์โรงพยาบาลกล้วยน้ำไท
- Health Station (เครื่องวัดความดัน+เครื่องวัดอุณหภูมิ+เครื่องวัดออกซิเจน) 1 ชุด
- Health Solution วิเคราะห์, ตรวจสุขภาพ, อบรมความรู้โรคโควิด-19 โดยทีมแพทย์
- ตรวจหัวใจด้วยเครื่องสะท้อนเสียงความถี่สูง Echocadiogram สำหรับผู้บริหาร 5 ท่าน ในการเปลี่ยนสิทธิประกันสังคม จำนวน 50 คนขึ้นไป
- ตรวจหาเชื้อโควิด-19 แบบ Antigen test kit (ATK) ตรวจ 50 คนขึ้นไป บริการตรวจนอกสถานที่ ตำกว่า 50 คน บริการตรวจที่ รพ.กล้วยน้ำไท1
- รักษาโควิด-19 และตรวจหาเชื้อโควิด-19 แบบRt-PCR สำหรับผู้มีผลตรวจ Antigen test kit "เป็นบวก"(ATK +ve) ทุกสิทธิการรักษา
- ตรวจสุขภาพประจำปี ฟรี 13 รายการ ตามเงื่อนไขประกันสังคม
- Upgrade ห้องพักได้ สำหรับผู้ประกันตนสิทธิร่วม
- กองทุนทดแทน พิเศษ รถพยาบาล(Ambulance)รับ
- ส่วนลดค่าใช้จ่าย ส่วนเกินค่าห้อง, ค่ายา 20%
รายชื่อสถานพยาบาลเครือข่าย โรงพยาบาลนวมินทร์9 ประจำปี 2565
QR Code เข้าทั้งสองระบบ รวดเร็ว
แม้ในปัจจุบัน พืชกัญชาจะได้ปลดล็อคให้ทุกส่วนของพืชกัญชาไม่ใช่ยาเสพติดให้โทษประเภท 5 ยกเว้นสารสกัดที่มีสาร THC เกินกว่า 0.2% ซึ่งจะเป็นเปิดโอกาสให้ประชาชนได้เข้าถึงการใช้ประโยชน์จากพืชกัญชามากขึ้นอย่างกว้างขวางทั้งในรูปแบบของการรักษาด้วยตำรับยาที่มีกัญชาปรุงผสม 16 ตำรับ ที่ได้รับอนุญาตและตำรับยาแผนไทยที่ปรุงเฉพาะราย รวมถึงการพัฒนาเป็นผลิตภัณฑ์ต่าง ๆ ทั้งในกลุ่มยาสมุนไพร เวชสำอาง อาหารและเครื่องดื่มเพื่อสุขภาพ และผลิตภัณฑ์อื่น ๆ อีกหลายชนิด เพื่อจำหน่ายในเชิงพาณิชย์ตามเงื่อนไขที่กฎหมายกำหนด รวมทั้งการพัฒนาผลิตภัณฑ์เพื่อใช้ในสัตว์ ทำให้ความต้องการใช้พืชกัญชาในรูปแบบวัตถุดิบสด แห้ง แปรรูปและสารสกัดเพิ่มขึ้นเป็นจำนวนมาก แต่อย่างไรก็พืชกัญชายังถือเป็นสมุนไพรควบคุม ตามประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ. 2565 ประกาศ ณ วันที่ 16 มิถุนายน พ.ศ. 2565 โดย นายอนุทิน ชาญวีรกูล รัฐมนตรีว่าการกระทรวงสาธารณสุข
*เรื่องและภาพจาก มทร.อีสาน
สวนกู เดอะคาเฟ่ บางกร่าง นนทบุรี
คาเฟ่เล็กๆ ท่ามกลางบรรยากาศท้องร่องสวนเก่า บางกร่าง นนทบุรี สดชื่นรื่นรมย์มา ยิ่งหน้าฝนยิ่งเขียวขจี เมนูกัญชาพร้อมเสิร์ฟคาวหวาน เครื่องดื่ม สารพัดหลากหลายอิ่มได้ครบ จบที่นี่
คลินิกฝากครรภ์
1.ส่งเสริมให้ผู้รับบริการได้รับการฝากครรภ์ก่อน 12 สัปดาห์และได้รับการดูแลตามเกณฑ์มาตรฐาน
2.ลดอัตราการเกิดการตั้งครรภ์ในวัยรุ่น (Teenage Pregnancy อายุ<17ปี)
3.หญิงตั้งครรภ์รายใหม่ได้รับการตรวจคัดกรองภาวะโลหิตจางธาลัสซีเมียเบื้องต้นและได้รับการส่งต่อที่เหมาะสม
4.หญิงตั้งครรภ์ได้รับการตรวจติดตามหลังคลอด
วันและเวลาให้บริการ
เปิดให้บริการเวลา 13.00 – 16.00 น. ในวันจันทร์ของทุกสัปดาห์
อัตราค่าบริการสาธารณสุข ของศูนย์บริการสาธารณสุข 9 ประชาธิปไตย
คลิกไปดูได้ที่
ศูนย์ 92. ปลดล็อกกัญชา กัญชง และพืชกระท่อม: เงื่อนไข และผลต่อเศรษฐกิจชุมชน
ตลอดระยะเวลาที่ผ่านมา กัญชา กัญชง และกระท่อม ถูกจัดเป็นยาเสพติดให้โทษ แต่ในช่วงปี 2563-2564 คนไทยได้ทำความรู้จักมักคุ้นกับพืช 3 ชนิดนี้มากขึ้น ด้วยเหตุผลทางการแพทย์ และทางเศษฐกิจโดยมีการทยอนปลดล็อคบางส่วนของพืชทั้ง 3 ชนิด จนเกิดเป็นยารักษาโรค ผลิตภัณฑ์ต่างๆ หรือแม้แต่อาหารและ เครื่องดื่ม ทำให้ประชาชนบางส่วนมีอาชีพและเข้าถึงโอกาสทางรายได้เพิ่มขึ้น
โรงพยาบาลตากสิน ให้บริการทุกวันศุกร์ LINK
โรงพยาบาลตากสินร่วมกับกรมส่งเสริมและพัฒนาคุณภาพชีวิตคนพิการ
เปิดให้บริการ การทำบัตรประจำตัวคนพิการ
ผู้ใช้บริการ เตรียมหลักฐาน ดังนี้
1. เอกสารรับรองความพิการ
2. สำเนาบัตรประชาชน
3. สำเนาทะเบียนบ้าน
4. รูปถ่ายขนาด1นิ้ว จำนวน 2 รูป / ถ่ายไว้ไม่เกิน 6 เดือน
เปิดให้บริการ ทุกวันศุกร์ เวลา 8.30 - 15.30 น.
ณ บ้านวรรังสฤษดิ์ โรงพยาบาลตากสิน
เริ่มเปิดให้บริการวันศุกร์ ที่ 26 สิงหาคม 2565 เป็นต้นไป
งานสังคมสงเคราะห์ กลุ่มงานเวชศาสตร์ชุมชน ติดต่อสอบถาม 02-4370123 ต่อ 1110
รถตรวจจอประสาทตาเคลื่อนที่
รถตรวจจอประสาทตา ติดตั้งเครื่องวัดความดันลูกตาและตรวจจอประสาทตา ใช้สำหรับตรวจจอประสาทตาในผู้ที่เป็นหรือมีความเสี่ยงจะเป็นโรคเบาหวาน
*ภาพภายในรถ จาก MHC Thailand
ผลิตภัณฑ์กัญชาทางการแพทย์อาจได้ประโยชน์ (ในอนาคต) LINK
ผลิตภัณฑ์กัญชาทางการแพทย์อาจได้ประโยชน์ (ในอนาคต) การใช้กัญชารักษาโรคมะเร็ง มีความจําเป็นต้องศึกษาวิจัยถึงประสิทธิผลของกัญชาในหลอดทดลองความปลอดภัยและประสิทธิผลในสัตว์ทดลอง ก่อนการศึกษาวิจัยในคนเป็นลําดับต่อไป เนื่องจากในปัจจุบันข้อมูลหลักฐานทางวิชาการที่สนับสนุนว่ากัญชามีประโยชน์ในการรักษาโรคมะเร็งชนิดต่างๆ ยังมีไม่เพียงพอ แต่สมควรได้รับการศึกษาวิเคราะห์อย่างละเอียด ดังนั้น ผู้ป่วยโรคมะเร็งจึงควรได้รับการรักษาตามวิธีมาตรฐานทางการแพทย์ในปัจจุบัน หากเลือกใช้เฉพาะผลิตภัณฑ์กัญชาในการรักษาโรคมะเร็งแล้ว อาจทําให้ผู้ป่วยเสียโอกาสในการรักษามะเร็งที่มีประสิทธิผลด้วยวิธีมาตรฐานได้
การก่อตั้งเอ็นเฮลท์ โนโวยีน จีโนมิกส์ จำกัด หรือ NNG (เอ็นเอ็นจี)


“การก่อตั้งบริษัท เอ็นเฮลท์ โนโวยีน จีโนมิกส์ จำกัด หรือ NNG (เอ็นเอ็นจี) ศูนย์บริการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์ในครั้งนี้ เกิดจากความมุ่งมั่นของ BDMS ที่ต้องการยกระดับขีดความสามารถทางการแพทย์ในการดูแลรักษาสุขภาพคนไทย ด้วยการแพทย์แบบจีโนมิกส์ ซึ่งสอดคล้องกับวิสัยทัศน์และพันธกิจของทาง BDMS ที่ว่าเราเป็นผู้ให้บริการด้านการดูแลสุขภาพที่ทุ่มเทและให้บริการด้วยคุณภาพระดับมาตรฐานสากลโดยเน้นผู้ป่วยเป็นสำคัญควบคู่ไปกับการใช้เทคโนโลยีทางการแพทย์ที่ทันสมัย ซึ่งการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์นี้ ถือเป็นนวัตกรรมทางการแพทย์แห่งอนาคตที่จะเข้ามามีส่วนช่วยในการดูแลและรักษาสุขภาพแบบเฉพาะบุคคลได้อย่างมีประสิทธิภาพมากขึ้น นอกจากจะได้รับการวินิจฉัยและวางแผนการรักษาได้อย่างตรงจุดแบบเฉพาะบุคคลแล้ว NNG จะช่วยให้คนไทยสามารถเข้าถึงการแพทย์แบบจีโนมิกส์ได้อย่างทั่วถึง รวดเร็ว อีกทั้งยังช่วยลดค่าใช้จ่ายได้มากขึ้น ซึ่งทาง BDMS เชื่อมั่นว่า NNG จะเป็นอีกทางเลือกหนึ่งในการดูแลรักษาสุขภาพให้คนไทยมีสุขภาพที่แข็งแรงอย่างยั่งยืนยิ่งขึ้น ทั้งนี้ BDMS ยังมุ่งมั่นในการสนับสนุนการพัฒนาบุคลากรทางด้านจีโนมิกส์ในประเทศไทยที่ปัจจุบันยังขาดแคลน โดย BDMS และคณะแพทยศาสตร์ศิริราชพยาบาล รวมถึงคณะพยาบาลศาสตร์ มหาวิทยาลัยมหิดล ได้หารือเพื่อจัดทำแผนการลงนามบันทึกข้อตกลงความร่วมมือทางวิชาการเพื่อพัฒนาบุคคลกรด้านจีโนมิกในประเทศไทยในวันที่ 12 กันยายน 2565 ซึ่งจะเปิดหลักสูตรให้กับบุคลากรทั้งในเครือข่ายและนอกเครือข่ายได้พัฒนาความเชี่ยวชาญในด้านดังกล่าวต่อไป”แพทย์หญิงปรมาภรณ์ กล่าวเสริม
คลินิกประกันสังคม โรงพยาบาลสงขลา(เกาะยอ) LINK
คลินิกประกันสังคม โรงพยาบาลสงขลา(เกาะยอ) เปิดให้บริการ ทุกวันจันทร์-วันศุกร์ ตั้งแต่เวลา 08:00 - 16:00 น. (เว้นวันหยุดราชการ และวันหยุดนักขัตฤกษ์) สามารถเข้ารับบริการได้ที่ ชั้น1 อาคารผู้ป่วยนอก
คลินิกพิเศษเฉพาะทางหัตถการหัวใจ นอกเวลาราชการ LINK
คลินิกพิเศษเฉพาะทางหัตถการหัวใจนอกเวลาราชการ โรงพยาบาลสงขลา(เกาะยอ) เปิดให้บริการ
ตรวจสุขภาพหัวใจขณะออกกำลังกาย
ตรวจหัวใจด้วยคลื่นเสียงสะท้อนความถี่สูง
ตั้งแต่เวลา 16-20 น.
ค่าธรรมเนียม ครั้งละ 300 บาท ค่าหัตถการเกินสิทธิ 720 บาท
สอบถามโทร.074-338100 ต่อ 1031 (ในเวลาราชการ)
แอป หมอ กทม. LINK
บริการสำคัญในแอปพลิเคชัน “หมอ กทม.”
• ตรวจรักษาออนไลน์ ด้วยระบบโทรเวชกรรม (Tele-medicine) โดยสามารถตรวจรักษา ติดตามอาการ ตลอดจนได้รับคำแนะนำในการใช้ยาจากแพทย์ผ่านระบบวีดีโอคอล (VDO Call) โดยไม่ต้องมาโรงพยาบาล ผู้ใช้บริการสามารถรับยาผ่านไปรษณีย์ หรือรับด้วยตนเองที่ร้านยาใกล้บ้าน
• แจ้งเหตุฉุกเฉินกับศูนย์เอราวัณ รับการช่วยเหลือเหตุเจ็บป่วยฉุกเฉินตลอด 24 ชั่วโมง โดยระบบจะประสานงานไปยังหน่วยงานที่อยู่ใกล้เคียงพิกัดของผู้ใช้งาน ณ ขณะแจ้งเหตุผ่าน แอปพลิเคชัน เพื่อส่งทีมปฏิบัติการการแพทย์ฉุกเฉินเข้าไปให้การช่วยเหลือ ดูแลรักษา และนำส่งผู้เจ็บป่วยฉุกเฉินนั้นไปยังสถานพยาบาลที่เหมาะสมต่อไป
• ตรวจสอบประวัติการรักษา เชื่อมโยงข้อมูลด้านสุขภาพส่วนบุคคลกับระบบระเบียนสุขภาพอิเล็กทรอนิกส์ส่วนบุคคล (Personal Health Record: PHR) ทั้งผลวินัจฉัยโรค ประวัติการแพ้ยา/วัคซีน ประวัติรับยา ผลแล็บ การผ่าตัด ทำให้ผู้ใช้บริการสามารถรับบริการจากสถานพยาบาลอื่นได้อย่างสะดวก โดยสามารถเรียกดูข้อมูลการรักษาได้เองโดยไม่ต้องมาโรงพยาบาล ส่วนบุคลากรทางการแพทย์ก็ได้ข้อมูลที่ครบถ้วนประกอบการรักษา
• บริการทั่วไป เช่น นัดหมายแพทย์ล่วงหน้า ตรวจสอบจำนวนคิวรอตรวจ การชำระเงิน ตรวจสอบสิทธิ์รักษา ลงทะเบียนตรวจรักษา ฯลฯ
ฟีเจอร์เด่นบนแอปพลิเคชัน
• ฟีเจอร์ นัดหมายพบแพทย์ – ตรวจสอบรายการนัดหมาย แจ้งเตือนการนัดหมาย และกดรับบัตรคิวในแอป
• ฟีเจอร์ ตรวจสอบสิทธิ์ – สามารถตรวจสอบสิทธิ์การรักษาพยาบาล อาทิ สิทธิ์บัตรทอง สิทธิ์ประกันสังคม และ สิทธิข้าราชการ
• ฟีเจอร์ Telemedicine – ตรวจรักษาออนไลน์ พร้อมบริการจัดส่งยาที่ร้านยาใกล้บ้าน หรือทางไปรษณีย์
• ฟีเจอร์ ตรวจสอบสถานะคิวตรวจ – แจ้งลำดับคิว และขั้นตอนการใช้บริการในโรงพยาบาล
• ฟีเจอร์ ลงทะเบียนตรวจรักษา – บริการลงทะเบียนตรวจรักษาโรค
• ฟีเจอร์ แจ้งเหตุเจ็บป่วยฉุกเฉิน – บริการแจ้งเหตุเจ็บป่วยฉุกเฉิน พร้อมแชร์โลเคชันเพื่อขอรับการช่วยเหลือจากศูนย์เอราวัณ
• ฟีเจอร์ ชำระเงิน – สามารถชำระค่ารักษาพยาบาลผ่านช่องทาง K PLUS โอนเงินผ่าน Thai QR Code หรือชำระผ่านบัตรเครดิต บัตรเดบิต (โดยพัฒนาเสร็จเดือน มิ.ย. 65)
(ในระยะแรก แอปพลิเคชัน “หมอ กทม.” จะเปิดให้ใช้บริการนัดหมายออนไลน์สำหรับโรงพยาบาลกลาง และจะสามารถใช้บริการเต็มรูปแบบใน 11 โรงพยาบาลสังกัดกรุงเทพมหานคร ได้แก่ โรงพยาบาลกลาง โรงพยาบาลตากสิน โรงพยาบาลเจริญกรุงประชารักษ์ โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ โรงพยาบาลเวชการุณย์รัศมิ์ โรงพยาบาลลาดกระบังกรุงเทพมหานคร โรงพยาบาลราชพิพัฒน์ โรงพยาบาลสิรินธร โรงพยาบาลผู้สูงอายุบางขุนเทียน . โรงพยาบาลคลองสามวา และโรงพยาบาลบางนากรุงเทพมหานคร รวมถึงศูนย์บริการการแพทย์ฉุกเฉินกรุงเทพมหานคร (ศูนย์เอราวัณ) ภายในเดือนมีนาคม 2565)
***โดยลงทะเบียนผ่านแอปพลิเคชั่น และลงชื่อในใบยินยอมเปิดเผยข้อมูลส่วนบุคคลให้โรงพยาบาลที่ใช้บริการในครั้งแรกของการใช้แอปพลิเคชัน “หมอ กทม.” ***
แอป EMS1669 แจ้งเหตุฉุกเฉิน ถึงศูนย์เอราวัณ
ระบบรับแจ้งเหตุฉุกเฉิน ของศูนย์บริการการแพทย์ฉุกเฉินกรุงเทพมหานคร (ศูนย์เอราวัณ) ประกอบด้วย
- รับแจ้งเหตุผ่าน 1669 โดยมีการส่งข้อมูลได้แก่ ชื่อ-สกุล, หมายเลขโทรศัพท์, อีเมล, เพศ, ปีเกิด หรือ ข้อมูลส่วนตัวเช่น โรคประจำตัว,การแพ้ยา เป็นต้น
- ระบุพิกัดที่เกิดเหตุ (latitude, longitude)
- ส่งภาพถ่ายสถานที่เกิดเหตุ
คลินิกกัญชาทางการแพทย์แผนปัจจุบัน โรงพยาบาลพัทยาเมโมเรียล
คลินิกกัญชาทางการแพทย์แผนปัจจุบัน แนวทางการรับยากัญชาเพื่อการรักษา
ข้อบ่งชี้ในการใช้ผลิตภัณฑ์กัญชา แพทย์แผนปัจจุบัน
สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกอายุรกรรม
ให้คำปรึกษาด้านการใช้สารสกัดจากกัญชา
วันอาทิตย์ – วันพฤหัสบดี 9.00- 16.00 น.
ติดต่อสอบถามรายละเอียดเพิ่มเติม 038 - 488 - 777
ติดต่อ แผนกผู้ป่วยนอก ต่อ 101, 119
ทุกวัน เวลา 08.00 - 16.00 น.
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี (ศพส.ปทุมธานี) / บ้านผู้สูงอายุ (ปทุมธานี)/ มูลนิธิผู้สูงอายุบ้านปทุมธานี (ม.ผ.ส.)
เลขที่ 9/1 หมู่ 2 ถนนรังสิต - นครนายก ตำบลรังสิต อำเภอธัญบุรี จังหวัดปทุมธานี 12110
โทรศัพท์ : 0-2577-1958 โทรสาร : 0-2577-1815
"ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี" จัดตั้งขึ้นในโอกาสจัดงานเฉลิมฉลองสิริราชสมบัติครบ 60 ปี ของพระบาทสมเด็จพระปรมินทรมหาภูมิพลอดุลยเดช ดำเนินการก่อสร้างเมื่อวันที่ 8 มีนาคม 2548 มีเนื้อที่ 32 ไร่ ก่อสร้างแล้วเสร็จ วันที่ 28 กันยายน 2549 และใช้ชื่อว่า "ศูนย์สาธิตการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี" ต่อมาได้เปลี่ยนชื่อเป็น "ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี" เปิดให้บริการผู้สูงอายุที่ประสบปัญหาทางสังคม เมื่อวันที่ 13 พฤศจิกายน 2549
ปัจจุบันศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี สังกัดกรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ (ตามพระราชบัญญัติปรับปรุงกระทรวง ทบวง กรม ฉบับที่ 14 พ.ศ. 2558)
พื้นที่รับผิดชอบ
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดปทุมธานี ให้บริการในเขตพื้นที่ความรับผิดชอบ 6 จังหวัด ดังต่อไปนี้
1. จังหวัดปทุมธานี
2. จังหวัดนนทบุรี
3. จังหวัดนครปฐม
4. จังหวัดสุพรรณบุรี
5. จังหวัดกาญจนบุรี
6. จังหวัดนครนายก
ภารกิจ
1. ศูนย์ข้อมูล : ให้บริการข้อมูลเกี่ยวกับงานด้านผู้สูงอายุ โดยจัดทำทำเนียบเครือข่ายดำเนินงานด้านผู้สูงอายุในพื้นที่บริการ/ จัดทำทำเนียบคลังปัญญา/ จัดทำสถานการณ์สถิติข้อมูลความรู้เกี่ยวกับผู้สูงอายุ/ รวบรวมข้อมูลการให้บริการหรือการดำเนินงานของศูนย์พัฒนาการจัด/สวัสดิการ/ สังคมผู้สูงอายุ รวมทั้งข้อมูลของผู้ใช้บริการ
2. ศูนย์ฝึกอบรมและพัฒนา : สนับสนุนการจัดประชุมและอบรมการให้ความรู้งานด้านผู้สูงอายุ
3. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุในสถาบัน : ให้การสงเคราะห์ช่วยเหลือ อุปการะเลี้ยงดูผู้สูงอายุที่ประสบปัญหาความเดือดร้อน ให้เป็นไปตามมาตรฐาน
4. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุในชุมชน : จัดกิจกรรมร่วมกับเครือข่ายในชุมชนเพื่อจัดสวัสดิการและช่วยเหลือผู้สูงอายุในชุมชน
การให้บริการ
ระเบียบกรมกิจการผู้สูงอายุ ว่าด้วยการให้บริการผู้สูงอายุ พ.ศ. ๒๕๕๘ ได้กำหนดคุณสมบัติของผู้ใช้บริการไว้ ... ข้อ ๗ ผู้สูงอายุที่มีความประสงค์เข้าใช้บริการในศูนย์ ต้องมีคุณสมบัติ ดังนี้
(๑) มีอายุเกิน ๖๐ ปีบริบูรณ์ขึ้นไปและมีสัญชาติไทย
(๒) ไม่เป็นผู้ต้องหาว่ากระทําผิดอาญา และอยู่ระหว่างการสอบสวนของพนักงานสอบสวน หรืออยู่ระหว่างการพิจารณาคดีของศาล
(๓) ไม่เป็นโรคติดต่อ ตามพระราชบัญญัติโรคติดต่อ พ.ศ. ๒๕๒๓ (ปัจจุบัน พ.ศ.๒๕๕๘)
(๔) มีความสมัครใจ
(๕) สามารถช่วยเหลือตนเองได้ในกิจวัตรประจําวัน
(๖) ไม่มีอาการทางจิตที่รุนแรง หรือมีพฤติกรรมด้านลบที่จะส่งผลกระทบต่อผู้อื่น
(๗) ไม่ติดสารเสพติด หรือติดสุรา
(๘) กรณีคนเร่ร่อน ถูกทอดทิ้ง หรือไร้ที่พึ่ง ต้องผ่านกระบวนการตามพระราชบัญญัติ คุ้มครองคนไร้ที่พึ่ง พ.ศ. ๒๕๕๗ ก่อน เช่น การเยี่ยมครอบครัว/ชุมชน การหาอาชีพที่เหมาะสม เป็นต้น ข้อ ๘ ผู้สูงอายุที่มีความประสงค์เข้าอยู่ในศูนย์ ต้องมีคุณสมบัติตามข้อ ๗ และต้องเป็น ผู้ประสบปัญหาความเดือดร้อนอย่างใดอย่างหนึ่ง ดังนี้ (๑) ฐานะยากจน (๒) ไม่มีที่อยู่อาศัย (๓) ขาดผู้อุปการะ หรือผู้ให้ความช่วยเหลือดูแล เมื่อพิจารณาแล้ว ผ่านคุณสมบัติตามที่กำหนด ทางศูนย์จะลงลำดับคิวการเข้าอยู่ไว้ให้ และแจ้งให้เข้าอยู่ ตามลำดับคิว ในการเข้าอยู่จะไม่เสียค่าใช้จ่ายใดๆ แต่ผู้เข้าอยู่จะถูกตัดเบี้ยยังชีพผู้สูงอายุ เนื่องจากเป็นผู้ใช้บริการที่ได้รับสวัสดิการอื่น (ปัจจัยสี่) จากภาครัฐแล้ว
Emergency Room ห้องฉุกเฉิน
มีทีมแพทย์ฉุกเฉินและพยาบาลให้ตรวจวินิจฉัย ดูแลรักษาผู้ป่วยฉุกเฉินทุกประเภท ทั้งผู้ป่วยเด็กและผู้ใหญ่บริการตลอด 24 ชั่วโมง
โทร. 02-5929550 - 99
เป็นส่วนที่ให้การช่วยเหลือผู้ป่วยอุบัติเหตุ หรือ ในสภาวะฉุกเฉิน รวมทั้งดูแลฟื้นคืนชีพและรักษาบาดแผลอย่างเร่งด่วน โดยมีเทคโนโลยีเข้ามาช่วยประเมินอาการ
• Central Monitor หรือเครื่องติดตามการทำงานของสัญญาณชีพ และติดตามคนไข้อย่างละเอียด แพทย์สามารถเฝ้าระวังผู้ป่วยวิกฤต และวิเคราะห์อาการได้แบบ Real Time รวมทั้งยังจัดเก็บข้อมูลของเครื่องต่าง ๆ ข้างเตียงผู้ป่วยมารวมไว้ในที่เดียว ทำให้สามารถจะตรวจสอบข้อมูลของคนไข้ย้อนหลัง เพื่อประเมินการรักษาที่ดีที่สุดต่อคนไข้
• Negative Pressure Room ภายในห้องฉุกเฉิน มีห้อง Negative Pressure Room เพื่อคัดแยกผู้ป่วยที่มีความเสี่ยงของกลุ่มอาการที่จะแพร่เชื้อทางอากาศ โดยห้องแห่งนี้จะมีระบบที่จะปรับอากาศภายในให้เป็นแรงดันลบ ซึ่งจะต่างกับอากาศภายนอก เพื่อให้ปรับให้เกิดการไหลเวียนของอากาศภายนอกสู่ในห้อง โดยบำบัดอากาศด้วย HEPA Filter ก่อนปล่อยอากาศออกสู่ภายนอก จะทำให้อากาศภายในห้องบริสุทธิ์ถูกปล่อยเข้าภายในห้องกักกันแห่งนี้ ทำให้มั่นใจได้ว่าจะไม่เกิดการแพร่กระจายของเชื้อที่จะสามารถติดต่อกันได้ทางอากาศอย่างแน่นอน
• Fast Track ความสำคัญของการเคลื่อนย้ายผู้ป่วย เวลาเป็นสิ่งสำคัญที่สามารถชี้ชะตาของผู้ป่วยได้ แนวทาง Fast Track สำหรับคนไข้จึงต้องถูกนำมาใช้กับห้องฉุกเฉินแห่งนี้เช่นกัน เวลาภายใน 4 – 5 ชั่วโมง สำหรับผู้ป่วยหลอดเลือดสมอง เป็นจุดที่ทำให้เขาเสียชีวิตหรืออาจพิการได้ เพราะฉะนั้นเราจึงต้องมีทีมที่พร้อมเพื่อรองรับการรักษาในส่วนนี้ สามารถที่จะ CT SCAN เตรียมยา เตรียมห้อง ICU หรือเตรียมผ่าตัด สำหรับผู้ป่วยได้ทันที
• Ambulance มีระบบ Negative Pressure เพื่อป้องกันการแพร่กระจายของเชื้อทางอากาศที่จะทำให้บุคลากรทางการแพทย์ติดเชื้อ และสามารถรองรับเพื่อช่วยเหลือผู้ป่วยได้อย่างหลากหลาย นอกจากนี้ยังมีทีมกู้ชีพ ที่ซึ่งเป็นบุคลากรผู้มีความสามารถ เชี่ยวชาญและมีประสบการณ์ในการปฏิบัติหน้าที่เป็นอย่างดี
2. ประเภทบริการ นพ.สมจิตต์ ชี้เจริญ
2. ประเภทบริการ คือ นพ.สมจิตต์ ชี้เจริญ นายแพทย์เชี่ยวชาญสาขาจักษุวิทยา โรงพยาบาลชุมพรเขตรอุดมศักดิ์ ใช้ความรู้ความสามารถด้านจักษุวิทยาพัฒนาระบบบริการผู้ป่วยด้านจักษุมากกว่า 10 ปี จนมีความมั่นคง และร่วมกับสถาบันรับรองคุณภาพสถานพยาบาล (องค์การมหาชน) นำมาตรฐานการพัฒนาคุณภาพโรงพยาบาล HA ไปใช้กับโรงพยาบาลทุกระดับและทุกสังกัดทั่วประเทศ
ขอเชิญกลุ่มสตรี อายุ 25 ปีขึ้นไป เข้ารับการตรวจ คัดกรองมะเร็งเต้านมเบื้องต้น
ขอเชิญกลุ่มสตรี อายุ 25 ปีขึ้นไป เข้ารับการตรวจ #คัดกรองมะเร็งเต้านมเบื้องต้น โดยเจ้าหน้าที่โรงพยาบาลบ้านตาขุน
ซึ่งหากพบก้อนผิดปกติจะได้รับการตรวจยืนยันด้วยเครื่องเอกซเรย์แมมโมแกรม #ฟรี
สามารถเข้ารับการตรวจคัดกรองเบื้องต้นได้ที่กลุ่มงานเวชฯ รพ.บ้านตาขุน หรือ รพ.สต.ใกล้บ้าน
ตั้งแต่วันนี้ - 10 ส.ค. 2565 ตั้งเเต่เวลา 08.30 - 16.00 (เว้นวันหยุดราชการ)
ติดต่อสอบถาม 064-4030761 หรือ 086-2785818
ต้มแซ่บเนื้อ เชฟ รัฐพล แสนรักษ์
ต้มแซ่บเนื้อ
เชฟ/เจ้าของ: รัฐพล แสนรักษ์
ร้าน: ไฮแลนด์ คาเฟ่
สรรพคุณทางยา:
“ต้มแซ่บเนื้อ” ทำจากเนื้อชายโครง ตุ๋นรวมกับเอ็นแก้วนานกว่า 3 ชั่วโมง น้ำซุปปรุงด้วยใบกัญชาสดและแห้ง สมุนไพรไทยและจีน เพิ่มความเผ็ดร้อนจากข่า ตะไคร้ ใบมะกรูด พริกขี้หนูสวน มะนาว และใบกะเพรา
ที่อยู่: 12/7 ถ.ลาดพร้าว เเขวงจอมพล เขตจัตุจักร กรุงเทพมหานคร 10900
Tel. 08-7330-8506
ผัดไทยใบกัญชามะขามเปียก LINK
เครื่องปรุง
ใบกัญชา 1 ใบ / น้ำมะขาม 25 กรัม / หอมแดง 5 กรัม / พริกป่น 1 กรัม / ใบกุยช่าย 3 กรัม / หัวปลี 50 กรัม / เส้นจันท์ 120 กรัม / ไชโป๊ว 5 กรัม / ถั่วงอก 10 กรัม / ถั่วลิสง 2 กรัม / น้ำปลา 25 กรัม / น้ำตาล 50 กรัม / กุ้งแห้ง 2 กรัม / ไข่ไก่ 1 ฟอง
วิธีการทำ
1. ตั้งกระทะใส่น้ำมันลงไป รอจนน้ำมันร้อนแล้วจึงใส่ หอมแดง ไชโป๊ว และกุ้งแห้ง ผัดให้เข้ากันจนกลิ่นหอม แล้วใส่เส้นจันท์ตามลงไปและผัดจนเส้นนิ่ม
2. ปรุงรสด้วย น้ำปลา น้ำมะขามเปียก น้ำตาล แล้วถั่วงอกและใบกุยช่ายลงไป ผัดให้เข้ากัน
3. ใส่ใบกัญชาลงไป ผัดคลุกเคล้าให้เข้ากัน จากนั้นนำผัดไทย ไว้ด้านหนึ่งของกระทะ ตอกไข่ไก่ลงไปในกระทะรอจน ไข่ใกล้สุก แล้วน้ำเส้นผัดไทยมาตลบทับไว้ให้มีลักษณะ ไข่ห่อเส้น
4. จัดใส่จานและเสิร์ฟพร้อมหัวปลีและเครื่องเคียง
อาคารคณะแพทย์ และโรงพยาบาล มหาวิทยาลัยเกษตรศาสตร์
ตรวจคัดกรองมะเร็งปอด
ตรวจคัดกรองมะเร็งปอด
1. การตรวจที่ใช้คัดกรองมะเร็งปอดชนิดต่างๆ
มีการนำการตรวจคัดกรองมาใช้เนื่องจากการตรวจเหล่านี้ช่วยในการวินิจฉัยมะเร็งปอดระยะต้น และลดอัตราการเสียชีวิต
จากมะเร็งปอด อย่างไรก็ดีไม่มีการวิจัยทางการแพทย์พบว่าการตรวจคัดกรองจะช่วยลดความเสี่ยงในการเสียชีวิตจากมะเร็งปอด
นักวิทยาศาสตร์ทำการศึกษาการตรวจคัดกรองที่มีประโยชน์สูงและความเสี่ยงต่ำ การศึกษาเรื่อง การตรวจคัดกรองมะเร็ง
มีจุดมุ่งหมายเพื่อแสดงให้เห็นว่าการวินิจฉัยมะเร็งปอดได้ในระยะต้นๆ ซึ่งยังไม่มีอาการจะช่วยลดอัตราในการเสียชีวิตจากโรค
หรือไม่ มะเร็งบางชนิดถ้าพบในระยะเริ่มแรกจะเพิ่มโอกาสในการหายมากขึ้น
2. การตรวจที่นิยมใช้คัดกรองมะเร็งปอด
2.1 เอกซเรย์ปอด คือการถ่ายภาพอวัยวะและกระดูกภายในทรวงอก โดยรังสีเอกซเรย์มีความสามารถในการทะลุทะลวง
ร่างกายไปแสดงภาพบนแผ่นฟิล์ม
2.2 การตรวจเสมหะ เป็นการนำเสมหะมาดูโดยใช้กล้องจุลทรรศน์เพื่อหาเซลล์มะเร็ง
3. การตรวจคัดกรองแบบใหม่ที่กำลังอยู่ในระหว่างการวิจัยการแพทย์
เอกซเรย์คอมพิวเตอร์ เป็นการแสดงชุดภาพของอวัยวะภายในร่างกายโดยใช้เครื่องเอกซเรย์ในการสแกนร่างกายแล้ว
ประมวลผลด้วยคอมพิวเตอร์ทำให้ได้รูปภาพออกมา
คลินิกพิเศษนอกเวลาราชการ โรคหัวใจ
คลินิกพิเศษนอกเวลาราชการ โรคหัวใจ
บริการทุกวันอังคารที่ 2 ของเดือน ตั้งแต่เวลา 16.30-20.30 น. ตึกร่มเย็น ชั้น 1
จองคิวโทร. 092-2672029 ในเวลาราชการ
แพทย์เฉพาะทางโรคหัวใจและหลอดเลือด
ค่ายา/ตรวจเลือด/เอ็กซเรย์ เบิกได้ตามสิทธิ์
บริการตรวจคลื่นไฟฟ้าหัวใจ
บริการตรวจหัวใจด้วยคลื่นเสียงสะท้อนหัวใจ
ค่าบริการ 300 บาท
อาจารย์ ดร.วเรศ จันทร์เจริญ อาจารย์ประจำวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ และ หัวหน้าทีม KEETA (กีฏะ)
โครงการ Deep Space Food Challenge เป็นอีกหนึ่งความท้าทายในรอบ 100 ปีของ NASA Centennial Challenges (การแข่งขันด้านอวกาศของนาซ่า) โดยมีเป้าหมายคือกระตุ้นนวัตกรรมการวิจัยทั้งพื้นฐานและประยุกต์ การพัฒนาเทคโนโลยี หรือการสร้างธุรกิจใหม่ๆ ขึ้น โดยผู้เข้าแข่งขันจะต้องผลิตอาหารสำหรับภารกิจทางอวกาศเป็นระยะเวลา 3 ปี เพื่อเพียงพอต่อนักบินอวกาศ 4 คนโดยไม่มีเสบียงเพิ่ม ที่สำคัญคือใช้เวลาการเตรียมอาหารให้ ‘น้อย’ ที่สุด มีความปลอดภัย มีโภชนาการสูง เป็นมิตรกับอวกาศและบนโลกอย่างเสมอภาคกัน
โดยความตั้งใจของทีม KEETA (กีฏะ) นอกจากเข้าร่วมการแข่งขันแล้ว เราต้องการสร้าง เทคโนโลยีทางอวกาศ ซึ่งต้องใช้กินได้ กินได้ในที่นี้ไม่ได้กินเป็นอาหาร แต่สามารถสร้างรายได้ ทำให้เกิดธุรกิจต่อประเทศ หรือทำให้เกิดเศรษฐกิจอวกาศ (Space Economy หรือ Space Business) นั่นคือความตั้งใจหลักของทีม โดยจะเป็นอีกหนึ่งฟันเฟืองในการขับเคลื่อนเศรษฐกิจอวกาศ (Space Economy) ในประเทศไทย เพื่อใช้กับภาคเกษตรกรรม ปศุสัตว์ และภาควิศวกรรมที่เกี่ยวข้อง และถ้าเราชนะในเฟสที่สามต่อไปนั้น คนที่ได้ผลงานคือ คนทั้งประเทศ
1. B with You มั่นใจทุกความเคลื่อนไหวการผ่าตัด ระบบเพื่อติดตามความเคลื่อนไหวของผู้ป่วยตั้งแต่เริ่มผ่าตัดไปจนถึงเสร็จสิ้นกระบวนการผ่าตัด พร้อมทั้งคำแนะนำในการปฏิบัติตัวก่อนผ่าตัด ระหว่างผ่าตัด และหลังผ่าตัด รวมถึงข้อควรระวังและข้อมูลสุขภาพที่เป็นประโยชน์ต่อผู้ป่วย ที่จะทำให้คุณมั่นใจทุกความเคลื่อนไหวการผ่าตัด
2. B in Touch อุ่นใจทุกการดูแล สบายใจเมื่อต้องพักรักษาในโรงพยาบาล ด้วยระบบที่เข้าถึงทุกรายละเอียดของการดูแลรักษาผู้ป่วย แผนการรักษา ความคืบหน้าการรักษา รายละเอียดการรักษา ตลอดจนค่ารักษาพยาบาล และข้อมูลสุขภาพที่เป็นประโยชน์ต่อผู้ป่วยขณะเข้ารับการรักษาที่โรงพยาบาล
กรุงเทพตะวันออก
- เขตคลองสามวา 083-019 5875 , 083-019 5434
- เขตคันนายาว 02-3799943
- เขตบางกะปิ 083-0211865 , 093-0686810
- เขตบึงกุ่ม 02-3647364 , 080-2407831 , 089-1418232
- เขตประเวศ 02-3287434
- เขตมีนบุรี 02-9145838 , 02-1117934
- เขตลาดกระบัง 083-0232757 , 083-0233064 , 083-0233406
- เขตสะพานสูง 083-0243028
- เขตหนองจอก 02 543 1473
ข่าวปลอม! ต้นสะเดาดำ สามารถรักษาโรคมะเร็งได้ LINK
ตามที่มีกระแสข่าวตามสื่อออนไลน์ เรื่อง ต้นสะเดาดำ สามารถรักษาโรคมะเร็งได้ ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับ สถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากที่มีการแชร์ข้อมูลว่าสะเดาดำสามารถนำมารับประทานเพื่อรักษาโรคมะเร็งได้นั้น ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข ได้ชี้แจงว่า ขณะนี้ยังไม่มีหลักฐานงานวิจัยทางคลินิกที่ยืนยันแน่ชัดว่าสะเดาดำช่วยรักษาโรคมะเร็งในมนุษย์ได้ โดยต้นสะเดาดำ สามารถนำยอดและดอกมารับประทานได้เหมือนกับยอดสะเดาเขียวทั่วไป แต่พืชสะเดาดำนอกจากจะเป็นอาหารได้แล้วยังมีสรรพคุณทางยาสมุนไพร ได้แก่ ลดความดันโลหิตสูง ลดน้ำตาลในเลือด ช่วยเจริญอาหาร เป็นต้น จากการศึกษาข้อมูลพบว่าสารสำคัญที่พบมากในสะเดาดำ คือ แอนโทไซยานิน ซึ่งเป็นกลุ่มสารต้านอนุมูลอิสระ (antioxidant) มีบทบาทในการช่วยป้องกันการเกิดโรคเรื้อรังต่างๆ เช่น โรคระบบหัวใจหลอดเลือด เบาหวาน มะเร็ง อย่างไรก็ตาม ในด้านการรักษาโรคไม่พบหลักฐานงานวิจัยที่ยืนยันได้ว่าสามารถช่วยรักษาโรคมะเร็งในมนุษย์ได้ อีกทั้งการรับประทานเพื่อหวังผลในด้านการรักษาโรคควรปรึกษาและขอคำแนะนำจากแพทย์
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : ยังไม่มีหลักฐานงานวิจัยทางคลินิกที่ยืนยันแน่ชัดว่าสะเดาดำช่วยรักษาโรคมะเร็งในมนุษย์ได้ ซึ่งการรับประทานเพื่อหวังผลในด้านการรักษาโรคควรปรึกษาและขอคำแนะนำจากแพทย์
หน่วยงานที่ตรวจสอบ : สถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข
วิธีการที่ดีที่สุดในการหลีกเลี่ยงภาวะ Long COVID ที่แพทย์ทั้งสองท่านแนะนำก็คือ อย่าติดโควิด! เพราะติดแล้วเสี่ยงต่อ Long COVID ทุกคน แต่สิ่งสำคัญยิ่งกว่าก็คือการรับวัคซีนโควิด เพราะนอกจากจะช่วยลดความรุนแรงจากการติดเชื้อแล้ว ยังช่วยลดความเสี่ยงในการเกิด Long COVID ได้อีกด้วย โดยควรรับวัคซีนอย่างน้อย 3 เข็ม และฉีดกระตุ้นทุก 4 เดือน แน่นอนว่าการปฏิบัติตัวพื้นฐานอย่างการรักษาระยะห่าง สวมหน้ากากอนามัย ล้างมือบ่อย ๆ ก็ยังคงต้องปฏิบัติตามมาตรการอย่างเคร่งครัดต่อไป
แล้วเราจะผ่านมันไปด้วยกัน!
เกี่ยวกับโรงพยาบาลวิมุต
โรงพยาบาลวิมุต ตั้งอยู่ใจกลางย่านธุรกิจใกล้สี่แยกสะพานควายของกรุงเทพมหานครฯ เป็นโรงพยาบาลขั้นตติยภูมิ (Tertiary Care) ขนาด 236 เตียงในรูปแบบอาคารสูง 18 ชั้น ซึ่งได้รับการออกแบบตามมาตรฐานสากลของ Joint Commission International (JCI) เน้นให้บริการรักษาโรคเกี่ยวกับหัวใจและหลอดเลือดหัวใจ สมอง เบาหวาน กระดูก ระบบทางเดินอาหาร และตับ รวมถึงกลุ่มโรคไม่ติดต่อเรื้อรัง (NCDs) นอกจากนี้ ยังมีบริการทางการแพทย์อื่น ๆ อาทิ ศูนย์สุขภาพผู้สูงอายุ (Geriatric center) เพื่อตอบโจทย์สังคมผู้สูงอายุ รวมถึงการดูแลพื้นฟูสภาวะหลังวิกฤต (Transitional Care) เพื่อฟื้นฟูร่างกายผู้ป่วยหลังจากรักษาเพื่อเตรียมตัวก่อนกลับบ้าน เรานำเสนอบริการในรูปแบบ One-stop Service ซึ่งครอบคลุมบริการดูแลสุขภาพถึงบ้าน (Health to Home) มอบความสะดวกสบายและทันสมัยผ่านการใช้ ViMUT Application สำหรับการตรวจสอบประวัติทางการแพทย์ส่วนบุคคล การจองนัดหมายแพทย์ด้วยตัวเอง การรับคำปรึกษาจากแพทย์แบบออนไลน์ (Telemedicine) และบริการจัดส่งยาและวัคซีนถึงบ้าน (ViMUT Drug delivery)
ศูนย์หัวใจ โรงพยาบาลกรุงเทพภูเก็ต
ศูนย์หัวใจ รพ.กรุงเทพภูเก็ต พร้อมดูแลท่านด้วยความจริงใจในทุกปัญหาสุขภาพหัวใจและหลอดเลือด ที่ให้บริการรักษาแบบครบวงจร ตั้งแต่การรักษาโรคที่เกี่ยวกับหัวใจทั่วไป การตรวจสุขภาพหัวใจ ตลอดจนการผ่าตัดหัวใจอย่างเต็มรูปแบบ อาทิเช่น การทำทางเบี่ยงหลอดเลือดหัวใจ (Bypass) การผ่าตัดเปลี่ยนลิ้นหัวใจ เป็นต้น ศูนย์ของเราพร้อมให้บริการตลอด 24 ชั่วโมงโดยอายุรแพทย์โรคหัวใจ, แพทย์ผ่าตัดหัวใจ, และทีมงานที่ได้รับการฝึกฝนเป็นพิเศษในการดูแลผู้ป่วยโรคหัวใจ พร้อมบริการรถพยาบาลฉุกเฉินสำหรับผู้ป่วยโรคหัวใจโดยเฉพาะ
เวลาทำการ
ศูนย์หัวใจ (ชั้น 2)
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 17.00 น.
ติดต่อสอบถาม
โทร: 076 254 425 ต่อ 1610,
076 361 000 ต่อ 1610,
076 655 000 ต่อ 1610
คุณวิลาสินี กาญจนกุญชร, นักวางแผนกลยุทธ์อาวุโส บริษัท ฮาคูโฮโด โอทู จำกัด ได้เสนอแนวทางให้แบรนด์ในการปรับตัวช่วยเหลือผู้บริโภคในการลดหรือคงค่าใช้จ่ายในเวลาคับขัน เจาะลูกค้ากลุ่มครอบครัวช่วงเวลาสำคัญช่วงปิดเทอมของลูกๆ ที่กำลังจะมาถึงนี้
แชร์เทคนิค Tips&Tricks ในการช่วยผู้บริโภคประหยัดค่าใช้จ่ายในชีวิตประจำวัน เพราะแม้ว่าเงินจะเฟ้อมากแค่ไหน ค่าครองชีพจะสูงมากเท่าไหร่ แต่คนไทยยังคงต้องมีการใช้จ่ายในชีวิตประจำวัน สิ่งที่แบรนด์จะทำได้ดีที่สุดตอนนี้ คือ การช่วยผู้บริโภคง่ายๆ ด้วยการแชร์เทคนิคต่างๆ เช่น การเก็บอาหารสดอย่างไรให้อยู่ได้นาน หรือวิธีการซื้อสินค้าอย่างไรให้คุ้มค่าคุ้มราคา เทคนิคการขับรถให้ประหยัดน้ำมัน ซื้อแต่ของที่จำเป็น เป็นต้น ทั้งนี้คนไทยมีแนวโน้มพร้อมปรับตัวสู้ทุกสถานการณ์สูง และยังพร้อมจับจ่ายในสิ่งที่ “ดีต่อใจ” เพื่อฮีลตัวเองจากปัญหารอบตัวที่ควบคุมไม่ได้
วันหยุดยาวและวันหยุดปิดเทอมของเด็กๆ ที่กำลังจะมาถึง ถือเป็นวันธรรมดาที่แสนพิเศษ จะได้นอนตื่นสาย ออกไปเที่ยวเล่นกับครอบครัว นี่เป็นโอกาสอันดีที่แบรนด์จะเป็นส่วนหนึ่งในการสร้างความทรงจำดีๆ สำหรับเด็กๆและครอบครัว ผ่านการจัดกิจกรรมหรือแคมเปญง่ายๆ ให้ทุกคนมีส่วนร่วมสานสัมพันธ์ในครอบครัวให้ดียิ่งขึ้น
19 ตำรับยาสารสกัดกัญชาแผนไทย
19 ตำรับยาสารสกัดกัญชาแผนไทย ได้แก่
1. น้ำมันกัญชา...
2. น้ำมันกัญชาทั้ง 5
3. น้ำมันกัญชาขมิ้นทอง
4. ตำรับยาเมตตาโอสถ
5. ยาแก้นอนไม่หลับ
6. ยาแก้ลม แก้เส้น
7. ยาแก้ลมขึ้นเบื้องสูง
8. ยาแก้ลมเนาวนารีวาโย
9. ยาแก้สัณฑฆาต
10. ยาทัพยาธิคุณ
11. ยาทำลายพระสุเมรุ
12. ยาน้ำมันสนั่นไตรภพ
13. ยาไพสาลี
14. ยาไฟอาวุธ
15. ยาริดสีดวง
16. ยาศุขไสยาศน์
17. ยาอไภยสาลี
18. ยาอัคคินีวคณะ
19. ยาอัมฤตย์โอสถ
เทคนิคดูแลสุขภาพอย่างยั่งยืน - ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค
ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค ที่ปรึกษาฝ่ายบริหารคลินิกสร้างเสริมและฟื้นฟูระบบกล้ามเนื้อและกระดูก BDMS Wellness Clinic จะมาแบ่งปันเทคนิคดูแลสุขภาพอย่างยั่งยืนแบบง่ายๆ ใคร ๆ ก็ทำได้ รวมทั้งผู้สูงวัย ว่า ปัจจุบันเรากำลังอยู่ในสังคมสูงวัยอย่างสมบูรณ์ เรื่องของอาหารการกินต้องใส่ใจเป็นพิเศษ เลือกอาหารที่ดีมีประโยชน์ได้สารอาหารครบถ้วน หลีกเลี่ยงอาหารแปรรูป น้ำตาล แป้งแปรรูป อาหารที่มีไขมันอิ่มตัวสูง โดยเฉพาะเรื่องของการออกกำลังกายซึ่งถือเป็นยาขนานสำคัญ ซึ่งล่าสุดมีงานวิจัยยืนยันแล้วว่าการออกกำลังกายช่วยในคนที่ป่วยเป็นโรคซึมเศร้าได้อีกด้วย ซึ่งเป็นผลโดยตรงมาจากการกระตุ้นฮอร์โมนและเคมีในสมองระหว่างการออกกำลังกาย
สำหรับผู้ที่เริ่มมีอายุมากขึ้น การออกกำลังยิ่งเป็นสิ่งจำเป็น เนื่องจากคนเราเมื่ออายุ 40 ปี ร่างกายจะสูญเสียมวลกล้ามเนื้อไปร้อยละ 8 ในทุก 10 ปี และเมื่ออายุ 70 ปีอัตราการสูญเสียกล้ามเนื้อจะเพิ่มขึ้นเป็นเท่าตัว การออกกำลังกายจะช่วยเสริมสร้างกล้ามเนื้อ นอกจากนี้การที่หัวใจสูบฉีดโลหิตไปเลี้ยงตามส่วนต่างๆ ของร่างกายยังเป็นการบริหารหัวใจ ทำให้หลอดเลือดแข็งแรง เพียงแค่บริหารเวลาให้ดี แบ่งเวลามาออกกำลังกาย 30 นาที 5 ครั้งต่อสัปดาห์ เป็นประจำ จะช่วยให้สุขภาพแข็งแรงได้ในระยะยาว
เผยความสำเร็จโครงการต้นแบบ-บริการเด่นของ "Siriraj Smart Hospital"
ด้าน รศ.นพ.เชิดชัย นพมณีจำรัสเลิศ รองคณบดีนวัตกรรมบริการและคุณค่าองค์กร กล่าวว่า โรงพยาบาลอัจฉริยะนั้น หมายถึงการออกแบบการให้บริการด้วยการใช้ Disruptive เทคโนโลยี ทำให้ผู้ป่วยที่มารับบริการ ได้รับบริการที่มีคุณภาพ มีความสะดวก เพิ่มการเข้าถึงและสร้างประสบการณ์ใหม่ในการมารับบริการ ขณะเดียวกันช่วยเพิ่มความสะดวกและผลิตภาพในการทำงานของบุคลากรชาวศิริราช เรียกว่าทำน้อยแต่ได้มาก”
สำหรับความคืบหน้าโครงการ “Siriraj Smart Hospital” ใน 9 โครงการย่อย ที่ดำเนินงานไปแล้วเกือบ 100% ในหลายโครงการ อาทิ Smart EMS (Emergency Medicine Service) เปลี่ยนรถพยาบาลธรรมดาให้เป็น Smart Ambulance โดยภายในตัวรถจะมีระบบอัจฉริยะต่างๆ อาทิ ระบบเชื่อมต่ออุปกรณ์ IoT เช่น อุปกรณ์วัดสัญญาณชีพ ส่งข้อมูลแบบเรียลไทม์ ช่วยให้แพทย์รักษาได้รวดเร็ว ซึ่งในระยะ 5 เดือนที่ผ่านมา ให้บริการคนไข้ไปแล้วกว่า 400 ราย ลดระยะเวลาที่แพทย์รักษาคนไข้จากเดิมเฉลี่ย 40 นาที เหลือเพียง 20 นาที
ต่อมาคือ Smart Emergency Room ระบบห้องฉุกเฉินอัจฉริยะ มีระบบปัญญาประดิษฐ์ที่คอยช่วย ประเมินสัญญาณชีพคนไข้ที่ผิดปกติ ทำให้พยาบาลจัดลำดับการดูแล ติดตามคิวผู้ป่วย และให้การรักษาอย่างทันท่วงที ที่สำคัญญาติสามารถติดตามการรักษาได้จากที่บ้าน โครงการถัดมาคือระบบการวินิจฉัยทางพยาธิวิทยาด้วยปัญญาประดิษฐ์ (Pathological diagnosis system) เริ่มต้นในโครงการมะเร็งต่อมลูกหมาก โดยจะใช้ AI เป็นผู้ช่วยแพทย์ในการอ่านผลวินิจฉัยการตรวจชิ้นเนื้อเบื้องต้น ทำให้แพทย์สามารถอ่านชิ้นเนื้อได้รวดเร็วแม่นยำ ซึ่งในอนาคตจะสามารถรองรับการอ่านชิ้นเนื้อให้กับโรงพยาบาลที่ห่างไกลและไม่มีพยาธิแพทย์ ช่วยให้เกิดการเข้าถึงบริการชั้นสูงในพื้นที่ห่างไกลได้ นอกจากนี้ ยังมีระบบผู้ช่วยการดูแลและสร้างเสริมสุขภาพรายบุคคล สำหรับผู้ป่วยโรคไม่ติดต่อเรื้อรัง (5G AI Platform for NCD) ด้วยการเปิดตัวแอปพลิเคชัน "Healthy Buddy" ช่วยผู้ป่วยเบาหวานให้บริโภคอาหารได้สัดส่วน บันทึกข้อมูลอาหารและระบุแคลอรี่ด้วยภาพถ่าย มีระบบเตือนให้กินยา บันทึกผลวัดความดันและน้ำตาล เป็นต้น
ไม่เพียงเท่านี้ศิริราช ยังนำระบบปัญญาประดิษฐ์มาช่วยบริหารจัดการระบบภายในโรงพยาบาลอย่างมีประสิทธิภาพ เช่นระบบขนส่ง ยาและเวชภัณฑ์ด้วยรถไร้คนขับ (Smart Logistic with 5G Self-Driving car) เพื่อเพิ่มผลิตภาพในระบบการขนส่งและลดต้นทุนได้ในระยะยาว รวมทั้ง Smart Inventory Management ที่ใช้ปัญญาประดิษฐ์พยากรณ์ปริมาณการใช้และการจัดการยาและเวชภัณฑ์ในแต่ละสัปดาห์ และสุดท้ายคือ ระบบเวชระเบียนกลางด้วยเทคโนโลยีบล็อกเชน (Permission based block chain for personal health record) เพื่อแลกเปลี่ยนข้อมูลผู้ป่วยเพื่อความสะดวกรวดเร็วในการรักษา นำร่องที่ 3 โรงพยาบาล คือ รพ.ศิริราช, ศิริราช ปิยมหาราชการุณย์ และศูนย์การแพทย์กาญจนาภิเษก และคาดว่าในอนาคตจะสามารถขยายไปใช้กับโรงพยาบาลทั่วประเทศได้
Dr. Tanupol Virunhagarun, M.D.
Chief Executive Officer - BDMS Wellness Clinic
Dr. Tanupol is the CEO of BDMS Wellness Clinic, Bangkok, the preventive medical clinic of Bangkok Dusit Medical Services, one of the global top five healthcare providers. He is President of the Bangkok Association of Regenerative Health and The Study of Obesity, and an active advocate of lifestyle medicine. Widely known as Dr. Amp, he is a popular social media influencer with his educational Dr. Amp Team channel amassing 45 million views and 750,000 followers. With his goal to spread knowledge about different health topics to the Thai public, Dr. Tanupol has also authored numerous successful Thai-language books including: Eat Well, Live Long; 100 Years of Great Health; Secrets of Longevity and Anti-Aging; and Power of Sleep, Power of Health. He is becoming more active within the education sector and is a Member of the Editorial Board for the peer-reviewed Bangkok Medical Journal.


รศ.นพ.ฉันชาย สิทธิพันธุ์ ผู้อำนวยการโรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย และ คณบดี คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กล่าวเสริมว่า “จุฬาลงกรณ์มหาวิทยาลัยมีวิสัยทัศน์ที่จะเป็นมหาวิทยาลัยแห่งชาติในระดับโลก มีปณิธานที่จะสร้างคน สร้างสรรค์องค์ความรู้และนวัตกรรม สร้างเสริมสังคมไทยให้ก้าวไกลในสังคมโลก คณะแพทยศาสตร์เองก็เช่นเดียวกัน เรามีวิสัยทัศน์ที่จะเป็นสถาบันต้นแบบทางการแพทย์ที่มีคุณธรรมและสร้างมาตรฐานระดับนานาชาติ สร้างงานวิจัยที่มีคุณค่า ตลอดจนให้บริการทางการแพทย์และวิชาการเพื่อเป็นแหล่งอ้างอิงวิชาการของชาติและนานาชาติและชี้นำสังคม ซึ่งความร่วมมือในเรื่องการดูแลผู้สูงอายุ และทุนวิจัยร่วมมือพัฒนานวัตกรรมการดูแลผู้สูงอายุด้านการได้ยินและทรงตัว ในครั้งนี้ของ ดร.พญ.นัตวรรณ อุทุมพฤกษ์พร และ Professor Doris Bamiou ของทางศูนย์การได้ยินการสื่อสารและการทรงตัว University College London Ear Institute สถาบันหูแห่งมหาวิทยาลัยกรุงลอนดอน และ Royal National Throat Nose Ear Hospital โรงพยาบาลหูคอจมูกแห่งสหราชอาณาจักร นับเป็นความสำเร็จอย่างแท้จริง เพราะนอกจากจะสอดคล้องกับแผนยุทธศาสตร์ของคณะแพทยศาสตร์ โดยเฉพาะการพัฒนาการวิจัยและร่วมมือหลักสูตรเพื่อนำไปสู่การเป็นสถาบันต้นแบบทางการแพทย์ที่เป็นผู้นำในระดับชาติและนานาชาติแล้ว ยังสามารถต่อยอดงานวิจัยให้กลายเป็นงานให้บริการกับบุคคลโดยทั่วไปได้อย่างแท้จริง”
Silver Age: Exercise Pills and Balanced Nutrition by Prof. Jirí Dvorák, M.D. whose main specialism on Neurology and Spinal injuries and conditions, Sports Medicine and Lifestyle Medicine. He promotes a healthy lifestyle through to research on the impact of exercise; an advocate on the prescribed 30-minute ‘exercise pill’ and importance of nutrition.
Physical inactivity is one of the most significant problems of the twenty-first century. Today, more than a hundred thousand published papers testify to the connection between exercise and health. After the age of forty, all of us, even the athletic, lose about eight per cent of our muscle mass each decade, with a further fifteen-per-cent decline between the ages of seventy and eighty.
The resulting frailty can be lethal. Regular exercise can improve muscle mass. Studies also revealed that a lack of exercise was tied to the early onset of more than forty chronic diseases or conditions, from constipation and colon cancer to depression and diabetes.
Working out regularly really does change the brain biology. The exercise pill also keeps your brain healthy, improves memory function, cognitive performance and academic achievement as well as protects it against depression and anxiety.
ความแตกต่างและความสำคัญที่ทำให้เราต้องฉีดวัคซีน - ศจ.นพ.สมศักดิ์ โล่ห์เลขา


อย่างที่กล่าวว่าปกติแล้วร่างกายคนเราสามารถขจัดเชื้อไวรัส HPV ออกไปได้เอง เหลือเพียง 10% ที่อาจตกค้างอยู่เท่านั้น หลายคนเห็นดังนี้ก็อาจรู้สึกว่าการป้องกันไม่ได้จำเป็นนัก เพราะเชื่อมั่นในความแข็งแรงของร่างกายตนเอง ศาสตราจารย์นายแพทย์สมศักดิ์ ได้อธิบายถึงความแตกต่างและความสำคัญที่ทำให้เราต้องฉีดวัคซีนไว้ว่า “ปัจจุบัน วัคซีนป้องกันไวรัส HPV มี 3 ชนิด ได้แก่ ชนิดป้องกันได้ 2 สายพันธุ์, ชนิดป้องกันได้ 4 สายพันธุ์ และชนิดป้องกันได้ 9 สายพันธุ์ ซึ่งแต่ละชนิดมีประสิทธิภาพการป้องกันเชื้อไวรัสได้แตกต่างกัน โดยชนิด 2 สายพันธุ์ ป้องกัน เชื้อ HPV สายพันธุ์ 16 และ 18 ป้องกันสาเหตุของมะเร็งปากมดลูกได้ 70%, ชนิด 4 สายพันธุ์ ป้องกันเชื้อ HPV สายพันธุ์ 16 และ 18 ได้เช่นเดียวกับ ชนิด 2 สายพันธุ์ และเพิ่มเติมการป้องกัน HPV สายพันธุ์ 6,11 ที่เป็นสาเหตุถึง 90% ที่ก่อให้เกิดโรคหูดหงอนไก่ บริเวณอวัยวะเพศทั้งผู้หญิงและผู้ชายได้ นอกจากนี้ยังก่อให้เกิดหูดในทางเดินหายใจของเด็กแรกเกิดซึ่งอาจทำให้เด็กเสียชีวิตเนื่องจากแม่ติดเชื้อ HPV ได้ ส่วนวัคซีนชนิด 9 สายพันธุ์ ป้องกัน HPV สายพันธุ์ 6, 11, 16, 18, 31, 33, 45, 52 และ 58 ซึ่งสามารถป้องกันมะเร็งปากมดลูก และหูดหงอนไก่และหูดที่ทางเดินหายใจได้ถึง 90% โดยการทำงานของวัคซีน คือการให้ร่างกายได้ทำความคุ้นเคยกับเชื้อไวรัสที่ไม่ทำให้เกิดโรคแล้ว จากนั้นภูมิคุ้มกันจะถูกกระตุ้นขึ้นมาเพื่อป้องกันการติดเชื้อไวรัสจริง
ในทางการแพทย์ แพทย์แนะนำให้เริ่มฉีดวัคซีนป้องกันเชื้อไวรัส HPV ได้ทุกเพศตั้งแต่อายุ 9 ปีขึ้นไป แต่เหมาะสมที่สุดในอายุ 9-15 ปี เพราะเป็นวัยที่สามารถกระตุ้นภูมิคุ้มกันได้ดีที่สุด อีกทั้งฉีดครบคอร์สแล้ว สามารถให้การป้องกันการติดเชื้อไปได้ยาวนาน โดยไม่ต้องฉีดกระตุ้นซ้ำอีก น.พ.สมศักดิ์ ยังแนะนำว่า เด็กอายุไม่เกิน 15 ปี ฉีดเพียงแค่ 2 เข็ม ห่างกัน 6-12 เดือน และถ้าอายุมากกว่า 15 ปี ควรฉีด 3 เข็ม ห่าง 0, 1-2 และ 6 เดือน โดยแนะนำให้ฉีดได้ทุกเพศ โดยการฉีดในผู้ชาย นอกจากจะลดการเกิดโรคโดยตรงและลดความเสี่ยงการเป็นพาหะในการแพร่เชื้อ HPV อีกด้วย
ทั้งนี้ต้องเข้าใจว่าการฉีดวัคซีนป้องกัน HPV ไม่เกี่ยวกับการพร้อมให้ลูกมีเพศสัมพันธ์ แต่การป้องกันโรคไว้ก่อนย่อมดีกว่า เนื่องจากการฉีดวัคซีนในเด็กตั้งแต่ยังไม่เคยติดเชื้อจะให้ประสิทธิภาพดีที่สุด จึงขอแนะนำให้พาบุตรหลานของท่านเข้ารับการฉีดวัคซีนป้องกัน HPV ตามที่แต่ละโรงเรียนจะจัดนัดหมาย
และสำหรับผู้ที่อายุ 27 ปีขึ้นไป หรือมีเพศสัมพันธ์แล้ว ก็สามารถปรึกษาแพทย์เพิ่มเติมเพื่อเข้ารับการฉีดวัคซีนป้องกัน HPV ได้เช่นกัน โดยวัคซีนจะป้องกันสายพันธุ์ที่ยังไม่เคยติด และป้องกันการติดเชื้อซ้ำในสายพันธุ์ที่เคยติดแล้ว
2. การตรวจวัดระดับวิตามิน แร่ธาตุ และสารต้านอนุมูลอิสระ
วิตามิน แร่ธาตุ และสารต้านอนุมูลอิสระ (Vitamins, Minerals and Antioxidant) ตัวอย่างเช่น วิตามินเอ, วิตามินซี, วิตามินอี, เบตาแคโรทีน, แอลฟาแคโรทีน, ไลโคปีน (Lycopene) , ลูทีน (Lutein), ซีแซนทีน (Zeaxanthin) ล้วนมีความสำคัญต่อระบบการทำงานในร่างกาย ทำหน้าที่ป้องกันหรือชะลอกระบวนการเกิดอนุมูลอิสระ (Free radicals) ที่เป็นสาเหตุสำคัญของการเสื่อมสภาพภายในร่างกาย
ปัจจุบันผู้คนหันมารับประทานวิตามินและแร่ธาตุเสริมกันเป็นจำนวนมาก แต่เนื่องจากร่างกายของแต่ละบุคคลมีความแตกต่างกัน การตรวจระดับวิตามิน แร่ธาตุ และสารต้านอนุมูลอิสระในเลือด หรือ การแพทย์แบบจำเพาะบุคคล (Precision and Personalized Medicine) ช่วยให้สามารถเลือกเสริมตามที่ร่างกายต้องการได้อย่างตรงจุด
“รายการไหนที่ขาดเราสามารถแก้ไขโดยการปรับการรับประทานอาหาร ให้ตรงตามผลเลือดของเรา เพื่อซ่อมแซมส่วนที่สึกหรอ รายการไหนที่ระดับวิตามินในเลือดดีอยู่แล้ว ก็ไม่ต้องไปเสริมจนเกิดโทษแก่ร่างกาย” คุณหมอแอมป์อธิบายให้เห็นภาพชัดเจนมากขึ้น
ดังนั้นในยุคที่ประชาชนนิยมการรับประทานวิตามินและอาหารเสริมกันมาก แต่ยังมีคำถามสงสัยว่าควรรับประทานวิตามินตัวไหน คุณหมอแอมป์ให้คำแนะนำว่า “เราควรรู้ก่อนว่าร่างกายเราขาดวิตามินและสารอาหารตัวใดบ้าง หากการรับประทานอาหารปกติยังไม่สามารถชดเชยสารอาหารที่ขาดได้ แนะนำให้เลือกวิตามินที่ปรับมาจากผลเลือดของเรา เพราะการรับประทานวิตามินมากไปหรือน้อยไปก็ก่อให้เกิดผลเสียได้เช่นกัน”
การตรวจเลือดช่วยป้องกันการได้รับวิตามินแร่ธาตุที่มากเกินความจำเป็น ช่วยให้แพทย์ผู้เชี่ยวชาญรู้ถึงสภาวะสุขภาพปัจจุบัน และออกแบบอาหารเสริมเฉพาะบุคคล (Customized Supplements) ในการรักษาระดับสารอาหารต่างๆ ให้อยู่ในระดับที่เหมาะสม เสริมสร้างร่างกายให้ทำงานได้อย่างเป็นปกติ
3. หลักการ
1) การปรับรูปแบบและแนวทางการปฏิบัติราชการเพื่อให้ส่วนราชการและหน่วยงานของรัฐปรับตัวได้อย่างสอดคล้องกับบริบทและสถานการณ์ที่เปลี่ยนแปลงไปได้อย่างคล่องตัวและทันการณ์โดยคำนึงถึงประสิทธิภาพและผลสัมฤทธิ์ของงานภาครัฐ ตลอดจนระโยชน์ที่ประชาชนจะได้รับจากการรับบริการเป็นสำคัญ
2) การปรับรูปแบบและแนวทางการปฏิบัติราชการที่จะต้องควบคู่ไปกับการปรับรูปแบบการบริหารส่วนราชการและหน่วยงานของรัฐในภาพรวมในทุกมิติ อาทิ ระบบและขั้นตอนการทำงานและการให้บริการประชาชน การบริหารทรัพยากรบุคคล การปรับปรุงด้านเทคโนโลยีในการปฏิบัติงาน เพื่อเพิ่มประสิทธิภาพการปฏิบัติราชการและการให้บริการประชาชนเป็นไปอย่างต่อเนื่อง รวดเร็ว เหมาะสมกับบริบทและสภาพการณ์การทำงานของแต่ละส่วนราชการและหน่วยงานของรัฐ
3) การเปิดโอกาสให้ส่วนราชการและหน่วยงานของรัฐสามารถส่งเสริมให้เกิดการปรับวิธีคิดและกรอบความคิด (Mindset) ของผู้ปฏิบัติงานทุกระดับ เพื่อให้พร้อมปรับตัวเปลี่ยนแปลงอยู่ตลอดเวลา ตลอดจนให้มีความพร้อมที่จะเรียนรู้และพัฒนาตนเองตลอดเวลาเมื่อสถานการณ์เปลี่ยนแปลงไป
4) การเปิดโอกาสให้ส่วนราชการและหน่วยงานของรัฐสามารถพิจารณากำหนดรูปแบบวิธีการปฏิบัติราชการให้สอดคล้องกับภารกิจและลักษณะงาน เพื่อให้สามารถปฏิบัติภารกิจของส่วนราชการและหน่วยงานของรัฐได้อย่างมีประสิทธิภาพ อีกทั้งยังคำนึงถึงคุณภาพชีวิตในการทำงานของผู้ปฏิบัติงานและวิถีการดำเนินชีวิตเพื่อการสร้างสมดุลที่เหมาะสมกับการปฏิบัติงาน
ตราดซิตี้
โรงแรมตราดซิตี้ โรงแรมใจกลางเมืองตราด เดินทางสะดวก ใกล้สถานที่เที่ยว Unseen Thailand พระจมน้ำ บริการด้วยมาตรฐานที่ได้รับการรับรองจากหลายหน่วยงาน
สถานที่ : อำเภอเมืองตราด จังหวัดตราด
โรงแรมมันตรา วารี
สัมผัสสุนทรีย์ภาพแห่งการผ่อนคลาย ด้วยความพิถีพิถันในการออกแบบเพื่อการพักผ่อน ครบครันด้วยสิ่งอำนวยความสะดวกมากมาย เราให้ความสำคัญกับทุกองค์ประกอบซึ่งมีผลต่อความสะดวกสบายและการพักผ่อนอย่างดีที่สุดสำหรับลูกค้าคนสำคัญของเรา ให้บริการด้วยห้องสุพีเรีย 65 ห้อง ห้องดีลักซ์ 7 ห้อง ห้องวีไอพีสูท 3 ห้อง พร้อม...
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
โรงแรม ลาวิลล่า ขอนแก่น
โรงแรมร่มรื่นแวดล้อมด้วยต้นไม้ ตั้งอยู่ใจกลางเมือง มีห้องพักไว้บริการ 41 ห้อง พร้อมด้วยอาหารเช้า มีห้องประชุม 1 ห้อง รองรับได้ 70 คน มีสระว่ายน้ำ
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
พีโน่ลาเต้ โฮเทล
#แนะนำให้รู้จักPinolatte ???????? #พักกับเราครบจบทั้งอาหารและวิวเขา #ใกล้วัดผาซ่อนแก้วเดินทางง่าย เขาค้อ ⛰สถานที่พักผ่อนและที่ท่องเที่ยว ผู้คนต่างเดินทางมาเที่ยวตลอดทั้งปี เพราะที่นี่เที่ยวได้ทุกฤดู อากาศเย็นสบาย ☁️ฤดูร้อนก็อุณหภูมิ ไม่ถึง 30 องศา และที่สำคัญ เดินทางแค่ 4-5 ชั่วโมงจากกรุงเทพเท่านั้...
สถานที่ : อำเภอเขาค้อ จังหวัดเพชรบูรณ์
ไวท์เฮ้าส์
เป็นโรงแรมสีขาว ออกแบบสไตล์โรมัน เมื่อ ออกมาด้านหลังห้องจะสามารถมองเห็นสระว่ายน้ำทุกห้อง โรงแรม โปร่ง สบาย เหมาะสำหรับพักผ่อน โรงแรมติดถนนใหญ่ สะดวกสำหรับนักเดินทาง
สถานที่ : อำเภอเมืองตาก จังหวัดตาก
เดอะ บลูสกาย รีสอร์ท เขาค้อ
เดอะ บลู สกาย รีสอร์ต เขาค้อ ถูกสรรค์สร้างพร้อมแนวคิดการพักอาศัยในรูปแบบประเทศอังกฤษแถบชนบท ตัวรีสอร์ตถูกตกแต่งให้มีความรู้สึกสื่อถึงความเป็นอังกฤษ บรรยากาศถูกปรับแต่งให้แขกที่มาพักรู้สึกราวกับว่าอยู่ที่ยุโรปจริงๆ ประสบการณ์การเข้าพักแบบนี้ถือได้ว่าหายากในประเทศไทย
สถานที่ : อำเภอเขาค้อ จังหวัดเพชรบูรณ์
ชาร์ ลอง บูทรีค
บริการห้องพัก 50 ห้อง ห้องประชุมสัมมนา 7 ห้อง
สถานที่ : อำเภอเมืองกาฬสินธุ์ จังหวัดกาฬสินธุ์
โรงแรมบ้านคุณแม่บูเลอวาร์ด
โรงแรมบ้านคุณแม่บูเลอวาร์ด โรงแรมใหม่สไตล์โมร็อคโคผสมผสานอย่างลงตัวกับอีสานบ้านเรา ขนาด 44 ห้อง บริการสระว่ายน้ำ (สระเกลือ) มีห้องอาหาร ปรุงอาหารด้วยวัตถุดิบออแกนิค รับตรงจากวิสาหกิจชุมชน เมนูเพื่อสุขภาพ มีห้องประชุมสัมมนาขนาด 150 คน
สถานที่ : อำเภอกุฉินารายณ์ จังหวัดกาฬสินธุ์
แอทสกล
โรงแรมใหม่ สวย ทันสมัย อย่างมีสไตล์ ใจกลางเมืองสกลนคร
สถานที่ : อำเภอเมืองสกลนคร จังหวัดสกลนคร
บ้านปูรีสอร์ทตราด
แหล่งพักของคนรักธรรมชาติ
สถานที่ : อำเภอเมืองตราด จังหวัดตราด
เดอะไทด์ รีสอร์ท บางแสน
ที่พักทันสมัย ติดชายหาด
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
โรงแรมบางแสนเฮอริเทจ
โรงแรมระดับ 4 ดาว และเป็นโรงแรมแห่งแรกและใหญ่ที่สุดในบางแสน จังหวัดชลบุรี มีสิ่งอำนวยความสะดวกมากมาย รวมทั้งเป็นศูนย์ประชุมที่ใหญ่ที่สุดในจังหวัดชลบุรี รองรับการจัดกิจกรรมทั้งระดับท้องถิ่นและระดับประเทศ มีห้องพักทั้งแบบเป็นคู่ และเป็นครอบครัว มีความเป็นส่วนตัว สามารถนำสัตว์เลี้ยงเข้าพักได้
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
วีลเลอร์ เบด แอนด์ ไบค์ โฮเต็ล
Wheeler Bed & Bike-ไลฟ์สไตล์โฮเต็ล (Lifestyle Hotel) แห่งเดียวในเอเชีย ..ที่ทุกพื้นที่ภายใน โรงแรมมี Concept Design ที่ชัดเจนมีเอกลักษณ์ไม่เหมือนใคร ภายใต้คอนเซ็ปต์ “คนรัก2 ล้อ” ทั้งบิ๊กไบค์ และจักรยานข้ามาไว้ด้วยกัน ทั้งการออกแบบของตึก ห้องพัก บรรยากาศ ของตกแต่งภายใน พร้อมสิ่งอำนวยความสะดวกต่างๆ ให...
สถานที่ : อำเภอเมืองชลบุรี จังหวัดชลบุรี
อุทยานแห่งชาติแม่ปืม
อุทยานแห่งชาติแม่ปืม ได้ดำเนินการสำรวจและจัดตั้งมาตั้งแต่ปี พ.ศ. 2537 และได้ประกาศเป็น อุทยานแห่งชาติตามพระราชกฤษฎีกา เมื่อวันที่ 25 ธันวาคม 2552 โดยประกาศในราชกิจจานุเบกษา เล่มที่ 126 ตอนที่ 97 ก นับเป็นอุทยานแห่งชาติลำดับที่ 120 ของประเทศไทย ซึ่งมีพื้นที่ครอบคลุม 7 อำเภอ 2 จังหวัด ประกอบด้วย อำเภอ...
สถานที่ : อำเภอแม่ใจ จังหวัดพะเยา
บ้านมะกรูด
โรงแรมเล็กๆที่เหมาะแก่การพัก อบอุ่นด้วยบรรยากาศ และบริการที่เป็นกันเองดุจญาติมิตร
สถานที่ : อำเภอเมืองพะเยา จังหวัดพะเยา
โรงแรมดับบิววัน แอด บางกอกน้อย
โรงแรมรีสอร์ท หรูแบบไทยสมัยใหม่ริมคลองบางกอกน้อยฝั่งเมืองนนทบุรี รอบล้อมด้วยวัดโบราณและชีวิตไทยๆที่ยังคงมีให้เห็นในปัจจุบันนี้ ด้วยวิถีชีวิตท้องถิ่นที่เรียบง่าย อยากให้ผู้เข้าพักได้สัมผัสกลิ่นอาย และบรรยากาศที่เป็นวิถีชีวิตไทยๆ วัฒนธรรม และสถาปัตยกรรมท้องถิ่น ถือเป็นอัตลักษณ์เฉพาะตัว
สถานที่ : อำเภอบางใหญ่ จังหวัดนนทบุรี
โรงแรมเฮอริเทจ เชียงราย โฮเทล แอนด์ คอนเวนชั่น
โรงแรมเฮอริเทจ เชียงราย โฮเทล แอนด์ คอนเวนชั่น เป็นโรงแรมขนาดใหญ่ที่สุดในจังหวัดเชียงราย ด้วยจำนวนห้องพัก 321 ห้อง และห้องประชุม 10 ห้อง ทั้งห้องประชุมขนาดใหญ่ ขนาดกลางและขนาดเล็ก ที่สามารถรองรับได้มากกว่า 1,500 คน พร้อมเทคโนโลยีที่ทันสมัยและครบครันที่สุด ซึ่งโรงแรมฯ ถูกออกแบบอย่างหรูหราได้มาตรฐานลง...
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
เดอะ ริเวอร์รี บาย กะตะธานี คอลเล็คชั่น
เป็นโรงแรมเพื่อการพักผ่อน ภายใต้กลิ่นไอล้านนาและทัศนียภาพที่สวยงามริมแม่น้ำกก ห้องพักมีหลากหลายรูปแบบ สำหรับครอบครัว คู่รัก คู่ฮันนี่มูน ที่ชื่นชอบความโรแมนติก มองเห็นแม่น้ำกก ภูเขา ชมสวนดอกไม้ และทางเดินริมน้ำ
สถานที่ : อำเภอเมืองเชียงราย จังหวัดเชียงราย
โฮเทล อาทิตยา
โรงแรม สนามกอล์ฟ
สถานที่ : อำเภอองครักษ์ จังหวัดนครนายก
ไชยแสงพาเลส
โรงแรมสูงตระหง่าน 7 ชั้น ติดวิวแม่น้ำเจ้าพระยา ที่พักสะอาด อุปกรณ์ครบครัน อยู่ใจกลางเมืองสิงห์บุรี สะดวก สบาย ด้านหลังโรงแรมติดกับห้างไชยแสงดีพาร์ทเม้นสโตร์
สถานที่ : อำเภอเมืองสิงห์บุรี จังหวัดสิงห์บุรี
บัวหลวง บูทีค รีสอร์ท
บัวหลวง บูทีค รีสอร์ท บริการบ้านพัก เป็นหลังหลากหลายสไตล์ เพื่อความเป็นส่วนตัว ตกแต่งภายในอย่างพิถีพิถัน ดีไซน์ ทันสมัยสไตล์ Natural Contemporary มีเอกลักษณ์เฉพาะตัว บริการที่พักสะอาด ใหม่ สะดวกสบาย ภายในห้องพักมีสิ่งอำนวยความสะดวกครบครัน อาทิเช่น แอร์ ทีวีแอลอีดี 32 นิ้ว ตู้เย็น เครื่องทำน้ำอุ่น...
สถานที่ : อำเภอเมืองอ่างทอง จังหวัดอ่างทอง
ภูมิไทยการ์เด้น
โรงแรมสไตล์บูทีคโฮเทล
สถานที่ : อำเภอเมืองแพร่ จังหวัดแพร่
โรงแรม มัดคำบูทีค โฮเทล
โรงแรมมัดคำ บูทีค โฮเทล เป็นโรงแรม ขนาดกลาง ในบรรยากาศเป็นกันเอง สไตล์ร่วมสมัยผสมพื้นเมือง มีความเงียบสงบเหมาะสำหรับการผักผ่อน และอยู่ใจกลางเมือง สามารถเดินทางไปยังสถานที่ต่างๆได้อย่างสะดวกสบาย
สถานที่ : อำเภอเมืองแพร่ จังหวัดแพร่
เวียงลคอร
โรงแรมเวียงลคอร โรงแรมใจกลางเมืองลำปาง ที่ได้รับมาตารฐานทั้งในเรื่องห้องพัก งานประชุม งานเลี้ยง โดยทีมงานมืออาชีพ ที่ยินดีให้บริการกับลูกค้าคนสำคัญทุกท่าน
สถานที่ : อำเภอเมืองลำปาง จังหวัดลำปาง
รีเจนท์ ลอด์จ ลำปาง
โรงแรม รีเจนท์ ลอด์จ ลำปาง เปิดบริการห้องพักรายวัน ห้องประชุมสัมมนา ห้องจัดเลี้ยง สถานที่ใกล้เคียง สนามบินจังหวัดลำปาง ค่ายสุรศักดิ์มนตรี โรงพยาบาลลำปาง
สถานที่ : อำเภอเมืองลำปาง จังหวัดลำปาง
พิชชาพรเฮ้าส์
-
สถานที่ : อำเภอเมืองแม่ฮ่องสอน จังหวัดแม่ฮ่องสอน
โรงแรมอิมพีเรียล แม่ฮ่องสอน รีสอร์ท
“Discover tranquility amid unspoiled environment. The Imperial Mae Hong Son Resort, Mae Hong Son province features 104 well-furnished rooms with a touch of local ethnic décor. Blended in beautifully with the surrounding, the hotel is a low-rise building with emphasis on the use of wooden finishing...
สถานที่ : อำเภอเมืองแม่ฮ่องสอน จังหวัดแม่ฮ่องสอน
โรงแรม โฆษะ ขอนแก่น
โรงแรมประเภท 4 ดาว จำนวนห้องพัก 197 ห้อง ห้องประชุม 11 ห้อง ได้รับการรับรองมาตรฐาน SHA Plus ที่พักยังมีบริการ Wi-Fi ฟรีในทุกห้องพัก และที่จอดรถฟรี ที่พักตั้งอยู่ในย่านขอนแก่น ช้อปปิ้ง เซ็นเตอร์ จึงอยู่ใกล้กับที่เที่ยว มี บริการนวด, สระว่ายน้ำกลางแจ้ง คลินิกกายภาพบำบัด ฟิตเนสเซ็นเตอร์ คอยอำนวยความสะด...
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
โรงแรม พันล้าน บูติค รีสอร์ท
ขอต้อนรับท่านเข้าสู่บรรยาที่เต็มเปี่ยมไปด้วยความสมบรูณ์แบบ ของห้องพักสไตล์รีสอร์ท ที่เป็นมิตรกับสุขภาพและสิ่งแวดล้อม พร้อมกับบรรยากาศเงียบสงบท่ามความเป็นส่วนตัวและความเป็นธรรมชาติ
สถานที่ : อำเภอเมืองหนองคาย จังหวัดหนองคาย
บ้านพวงคราม
ห้องพัก สะอาด สะดวก สบาย ปลอดภัย มีกล้องวงจรปิดทุกจุด ที่จอดรถ อยู่ในตลาด ใกล้ร้านอาหาร
สถานที่ : อำเภอหันคา จังหวัดชัยนาท
โรงแรมพี พาราไดซ์ จังหวัดกำแพงเพชร
เป็นโรงแรมแนวธรรมชาติมีสวนน้ำตก สระว่ายน้ำ และพื้นที่สีเขียวเยอะ ในห้องพักจะเป็นแนวบูติค มีอ่างอาบน้ำทุกห้อง มีคาเฟ่กาแฟในโรงแรม
สถานที่ : อำเภอเมืองกำแพงเพชร จังหวัดกำแพงเพชร
โรงแรมล้วนเจริญคอนโด
โรงแรมล้วนเจริญคอนโด ตั้งอยู่ในเมืองอ่างทอง การเดินทางสะดวก ห้องพักสะอาด บรรยากาศดี มีสวนกว้าง สระบัวให้ลูกค้าถ่ายรูป และพักผ่อน ยินดีให้บริการนะคะ
สถานที่ : อำเภอเมืองอ่างทอง จังหวัดอ่างทอง
ปันนารา
โรงแรมอยู่ใจกลางเมือง เดินทางสะดวก บรรยากาศร่มรื่น เป็นส่วนตัว ห้องสะอาด ฟรี wifi
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
โอทูลพบุรี
โรงแรมโอทูลพบุรี ตั้งอยู่ใจกลางเมืองลพบุรี มีพื้นที่กว้างขวางกว่า18ไร่ อยู่ใกล้ห้างสรรพสินค้าชั้นนำของจังหวัดลพบุรี อาทิเช่น Robinson,BigC,Tescolotus มีบริการแผนกต้อนรับ24ชั่วโมง และมีบริการห้องพักอีกจำนวน79ห้อง ความสะดวกสบายครบครันในห้องพัก มีบริการฟรีwifiในห้องพัก มีที่จอดรถกว้างขวาง และมีบริการฟ...
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
เอ็มดีอาร์
โรงแรมเอ็ม ดี อาร์ (MDR Hotel) เป็นที่พักสไตล์โมเดิร์นฮิป รายวัน/รายเดือนราคาคุ้มค่า ในเขต อ.เมือง จ.ลพบุรี ติดห้างสรรพสินค้าและตลาดนัดที่ใหญ่สุด บรรยากาศรายล้อมด้วยแหล่งชุมชนและสถานที่สำคัญๆน่าพักผ่อน เดินทางเข้า-ออก สะดวกติดทางหลวงหมายเลข 1 บรรยากาศร่มรื่นเป็นกันเอง
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
ริมนที รีสอร์ท
เป็นโรงแรมขนาดเล็ก ที่มีห้องพักติดสระว่ายน้ำ เป็นสระว่ายระบบน้ำเกลือ เปิดประตูจากห้องพักสามารถลงสระว่ายน้ำได้เลย
สถานที่ : อำเภอเมืองตรัง จังหวัดตรัง
มาดีสปาร์แอนด์รีสอร์ท
สถานที่สะอาด ที่พักสบาย อาหารอร่อย มีครบที่เดียวในภายในจังหวัดตรังที่ Madee Spa & Resort
สถานที่ : อำเภอเมืองตรัง จังหวัดตรัง
เดอะเบดโกลกรีสอร์ท
ออกแบบมาเพื่อรองรับนักเดินทาง นักท่องเที่ยวที่เดินระยะทางมาไกล ที่มีวิถีชีวิต คนเมืองที่แตกต่างนักเดินทางเพื่อพักผ่อน นักเที่ยวกลางคืนที่พักของเรามีความสะดวก สะบาย ที่จอดรถสะดวก เราให้บริการยืดหยุ่นเป็นกันเอง
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
โรงแรมเจริญธานี ขอนแก่น
โรงแรมเจริญธานี ขอนแก่น - ให้บริการห้องพัก ห้องประชุม สัมมนา จัดเลี้ยง จัดกิจกรรมสังสรรค์ และจัดงานแต่งงาน เพียบพร้อมไปด้วยอุปกรณ์การประชุมสัมมนาที่ทันสมัยได้มาตรฐานและสิ่งอำนวยความสะดวกครบครัน ให้งานประชุมหรือกิจกรรมขององค์กรได้ออกมาในระดับมืออาชีพและสำเร็จไปได้อย่างสมบูรณ์แบบที่สุด -...
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
ราชาวดี รีสอร์ท แอนด์ โฮเทล
สถานที่ของเราห่างจากท่าอากาศยานเพียง 5 นาทีเท่านั้น และสามารถเข้าสู่ตัวเมืองได้ในเวลาเพียง 15 นาที ทั้งโดยรถส่วนตัว รถประจำทาง SMART BUS และรถ TAXI ท่านจะได้สัมผัสกับบรรยากาศส่วนตัวท่ามกลางสวนสวยในเนื้อที่ทั้งหมด 30 ไร่หนึ่งเดียวในจังหวัดขอนแก่นพร้อมทั้งสิ่งอำนวยความสะดวกมากมายทั้งสระว่ายน้ำฟิตเ...
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
โรงแรมพูลแมน ขอนแก่น ราชา ออคิด
โรงแรมพูลแมน ขอนแก่น ราชา ออคิด ถูกออกแบบเพื่อผสมผสานกันระหว่างศิลปวัฒนธรรมและความเป็นสากลซึ่งสามารถพบศิลปกรรมต่าง ๆ ทั่วทั้งโรงแรมฯ ศิลปกรรมภายในโรงแรมฯ ได้รับการออกแบบจากศิลปินที่มีชื่อเสียงและได้รับการยอมรับมากที่สุดในประเทศไทย ซึ่งตั้งอยู่ใจกลางของเมืองขอนแก่น เป็นโรงแรมแบรนด์นานาชาติมาตรฐานระด...
สถานที่ : อำเภอเมืองขอนแก่น จังหวัดขอนแก่น
โรงแรมธารารีเจ้นท์
ที่พักสะอาด พนักงานใส่ใจ ใกล้แหล่งชุมชน
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
ริเวียร่า
สะอาด สะดวก สวยงาม ใกล้ชายแดน
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
ลพบุรีอินน์
ที่พักราคาถูก เดินทางสะดวกสบาย สะอาด ปลอดภัย ใกล้ศูนย์ราชการ
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
โรงแรมมารีน่า
ที่พักสะอาด พนักงานเป็นมิตร ใกล้แหล่งชุมชน เดินทางสะดวก
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
โรงแรมเก็นติ้ง สุไหงโก-ลก
สะอาด สงบปลอดภัย ใกล้ย่านการค้าชายแดน
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
ยูเรเซีย ชะอำ ลากูน
บรรยากาศร่มรื่น หาดส่วนตัวยาว 2.5 กิโลเมตร ผ่านการประเมิน Thai Stop Covid Plus
สถานที่ : อำเภอชะอำ จังหวัดเพชรบุรี
โรงแรมอีโค่อินน์ ตรัง
สะอาด สะดวก ทันสมัย ทันใจ คุ้มค่า
สถานที่ : อำเภอเมืองตรัง จังหวัดตรัง
การมองเห็นที่เปลี่ยนไป อาจบ่งบอกถึงปัญหาเกี่ยวกับกระจกตา - นพ. ธีรวีร์ หงษ์หยก
นพ. ธีรวีร์ หงษ์หยก แพทย์ผู้ชำนาญการด้านกระจกตา และผ่าตัดแก้ไขสายตา โรงพยาบาลบำรุงราษฎร์ ให้ข้อมูลว่า กระจกตา คือส่วนที่อยู่ด้านหน้าสุดของดวงตาดำ มีลักษณะโค้งใส มีทั้งหมด 5 ชั้น ทำหน้าที่ให้แสงผ่าน และหักเหแสงให้มาตกรวมกันที่จอตาด้านในเพื่อการมองเห็นที่ดีขึ้น ซึ่งหากผู้ป่วยเริ่มมีอาการมองไม่ชัดหรือเป็นฝ้าหมอก, ตาไม่สู้แสง, ค่าสายตาเปลี่ยนบ่อย, สายตาเอียงมากผิดปกติ, มองเห็นแสงฟุ้งๆ หรือเห็นแสงเป็นวงรอบเมื่อมองดวงไฟ, รู้สึกระคายเคืองขณะใส่คอนแทคเลนส์ หรือเกิดอุบัติเหตุ กระจกตาเป็นแผลหรือขุ่นมัว อาจแสดงได้ว่ากระจกตาอาจเริ่มมีปัญหา จึงควรจะต้องมาพบแพทย์เพื่อทำการประเมินและวินิจฉัยอาการดังกล่าว โดยจักษุแพทย์จะตรวจตาอย่างละเอียด และอาจใช้เครื่องมือในการประเมินพยาธิสภาพของกระจกตา เช่น เครื่อง Corneal Topographer ซึ่งช่วยในการดูรูปร่างของกระจกตาเพื่อให้ได้ข้อมูลที่ถูกต้องและครบถ้วน
โอไมครอนสายพันธุ์ย่อย XBB* (XBB,XBB.1-XBB.5 ฯลฯ) มีการกลายพันธุ์ไปอย่างรวดเร็วคาดว่าจะเอาชนะทุกสายพันธุ์ย่อยได้รวมทั้ง BQ.1 และ ฺBQ.1.1
กระทรวงสาธารณสุขสิงคโปร์ รายงานจำนวนผู้ติดเชื้อโอไมครอน และโอไมครอนสายพันธุ์ย่อย XBB ประจำสัปดาห์ลดจำนวนลงอย่างต่อเนื่อง
ข้อมูลความรุนแรงของการเกิดโรค (severity)
จากข้อมูลในรอบ 28 วันของประเทศสิงคโปร์ที่ผ่านมา
- พบผู้ติดเชื้อโควิด-19 รายใหม่จำนวน 177,904 ราย
- เป็นผู้ติดเชื้อที่ไม่แสดงอาการ หรืออาการไม่รุนแรงแยกตัวอยู่บ้าน 99.7%
- ผู้ติดเชื้อโควิด-19 ที่ต้องรักษาตัวในโรงพยาบาลและต้องให้ออกซิเจน 0.2%
- ผู้ติดเชื้อโควิด-19 ที่ต้องเข้ารักษาตัวใน ICU จำนวน 0.04% และ
- ผู้ที่เสียชีวิตเนื่องจากการติดเชื้อโควิด-19 จำนวนเพียง 0.02%
ประชากรสิงคโปร์ได้รับวัคซีนครบโดส 92%, ได้รับการฉีดวัคซีนเข็มกระตุ้นถึง 80% โดยกลุ่มเด็กเล็ก ผู้สูงอายุ และกลุ่มเปราะบางได้รับการฉีดวัคซีนอย่างทั่วถึง
ภาวะดื้อโบทูลินัมท็อกซินเป็นปรากฏการณ์ที่เกิดขึ้นมาสักระยะหนึ่งแล้ว - ศ.พญ.รังสิมา วณิชภักดีเดชา
ศ.พญ.รังสิมา วณิชภักดีเดชา ภาควิชา ตจวิทยา คณะแพทยศาสตร์ศิริราชพยาบาล กล่าวว่า “ภาวะดื้อโบทูลินัมท็อกซินเป็นปรากฏการณ์ที่เกิดขึ้นมาสักระยะหนึ่งแล้วแต่ยังไม่ได้เป็นที่จับตาในวงการแพทย์เท่าไรนัก ซึ่งส่วนใหญ่แล้วเกิดจากการที่ส่วนประกอบในโครงสร้างของโบทูลินัมท็อกซินกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันขึ้นมาต่อต้าน ซึ่งจากตัวเลขข้อมูลล่าสุดจากการส่งตรวจเลือดของคนไข้ที่สงสัยว่าจะมีภาวะดื้อโบในช่วงปี พ.ศ. 2564 – 2565 จำนวน 137 ราย พบว่ามีคนไข้จำนวน 79 รายที่มีผลการตรวจเป็นบวก และยืนยันว่ามีภาวะดื้อโบ ซึ่งคิดเป็นสัดส่วนถึง 58% ทั้งนี้ ในตัวเลขดังกล่าว สามารถจำแนกได้ว่าผู้ป่วยมีภูมิคุ้มกันต่อโครงสร้างโปรตีน 2 รูปแบบ โดยมีคนไข้ที่มีภาวะดื้อต่อ Core neurotoxin (โครงสร้างหลักในการออกฤทธิ์) อยู่ที่ 48% ดื้อต่อสาร Complexing proteins (โครงสร้างเสริมที่ไม่จำเป็นต่อการออกฤทธิ์) อยู่ที่ 18% และดื้อทั้ง Core neurotoxin และ Complexing proteins อยู่ที่ 8% จากผลการศึกษาพบว่า บางรายที่ดื้อต่อ Complexing proteins อาจจะยังสามารถใช้โบที่มีความบริสุทธิ์สูงที่ปราศจาก Complexing proteins ได้เห็นผลอยู่ แต่ในเคสส่วนใหญ่พบว่าดื้อต่อ Core neurotoxin นั้นต้องรอเวลาให้ระดับแอนติบอดีลดลงเท่านั้น ในฐานะแพทย์ จึงอยากแนะนำให้คนไข้เลือกเข้ารับการรักษาจากแพทย์ผู้เชี่ยวชาญและคลินิกที่มีคุณภาพ เพื่อลดความเสี่ยงและป้องกันไม่ให้เกิดภาวะดื้อโบในอนาคต”
Scientific Conference 2022
ระดับยาก 10 ขั้นตอน
เป็นท่าในการยืดกล้ามเนื้อ และฝึกความแข็งแรงของกล้ามเนื้อ และการทรงตัว
Community Circles of Inclusion เริ่มตั้งแต่ 22 ต.ค. - 6 พ.ย.65
Community Circles of Inclusion
เริ่มตั้งแต่ 22 ตุลาคม - 6 พฤศจิกายน 2565
จัดแสดงที่ L Floor, Bangkok Bangkok Art and Culture Center
มูลนิธิเดอะ เรนโบว์ รูม ร่วมกับอาร์ตคอนเนคชั่น โดยการสนับสนุนของหอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร และ โนเบิล ดีเวลลอปเม้นท์ ขอเชิญพบกับ นิทรรศการภาษาแห่งจิตวิญญาณ ครั้งที่ 6
งานครั้งนี้ จัดขึ้นภายใต้การตั้งโจทย์ที่ว่า หาก “ศิลปะ” คือภาษาสากลที่สามารถข้ามผ่านข้อจำกัดของวัจนะและอวัจนะภาษา เปิดพื้นที่การสื่อสารได้จากส่วนลึกของผัสสะและการรับรู้ของบุคคล โดยเฉพาะบุคคลที่มีความต้องการพิเศษ “ชุมชน” ก็คือพื้นที่นั้น ในแต่ละชุมชน มีการนำศิลปะมาใช้เพื่อพัฒนาศักยภาพของบุคคลที่มีความต้องการพิเศษ โดยเป็น “เครื่องมือ” ในการสื่อสาร
กระบวนการทางศิลปะจึงก่อกำเนิดชุมยชนหลากหลายของคนทุกความสามารถ ที่หล่อหลอมปัจเจกให้พัฒนาสู่การเป็นสมาชิกที่มีคุณภาพของชุมชน จากวงล้อมหนึ่งสู่วงล้อมหนึ่งเวียนไปเช่นนี้เป็นอนันต์
งานทั้งหมดที่จัดแสดงในนิทรรศการ “Community : Circles of Inclusion - ชุมชน วงล้อมแห่งการอยู่ร่วมกัน” จึงเป็นกระบวนการทดลองที่เชิญชวนเพื่อนๆ จากชุมชนต่างๆ ส่งผลงานจากหลากหลายที่ ร่วมด้วยงานจากนิทรรศการภาษาแห่งจิตวิญญาณครั้งที่ 1-4 เพื่อแสดงให้เห็นว่า ศิลปะไม่เพียงแค่สำคัญกับพัฒนาการและเป็นส่วนหนึ่งของชีวิตศิลปินผู้มีความต้องการพิเศษเท่านั้น แต่ยังก่อให้เกิดชุมชนรอบตัวของเขา เสมือนวงล้อมที่หลอมรวมกันเป็นสังคมแห่งคนทุกคนอย่างแท้จริง
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/specialrainbow เชิญชวนชมไฟประดับสะพานข้ามแม่น้ำเจ้าพระยา 13 แห่ง รอบกรุงเทพ
กรมทางหลวงชนบท เชิญชวนประชาชนร่วมสืบสานประเพณีลอยกระทง 8 พ.ย. 65 นี้ พร้อมชมทัศนียภาพไฟประดับสะพานข้ามแม่น้ำเจ้าพระยา 13 แห่ง ได้แก่ สะพานพระปกเกล้า สะพานตากสิน สะพานกรุงธน สะพานกรุงเทพ สะพานภูมิพล 1 และ 2 สะพานพระราม 3 สะพานพระราม 4 สะพานพระราม 5 สะพานพระราม 7 สะพานมหาเจษฎาบดินทรฯ สะพานปิ่นเกล้า สะพานพุทธ
แรกพบความผิดปกติ
ทราบว่าลูกผิดปกติเมื่อไร?
คุณแม่เล่าว่า....
ตั้งแต่แรกคลอด เนื่องจาก มีภาวะกล้ามเนื้ออ่อนแรง คิ้วชี้ หูชี้ แนบกับด้านหลัง ลิ้นใหญ่ คุณหมอแจ้งว่าน้องเป็นดาวน์ซินโดรม มีรูปร่างหน้าตาเหมือนดาราตลกท่านหนึ่งในสมัยนั้น ตั้งแต่นั้นคุณแม่เป็นคนดูแลและฝึกกระตุ้นพัฒนาการที่โรงพยาบาลรามาธิบดีอย่างต่อเนื่องจนกระทั่งอายุ 3 ปี จึงเริ่มพูดเป็นคำ ที่มีความหมายและสื่อสารได้มากขึ้น
จุดเปลี่ยนของครอบครัว
พ่อแม่แต่งงานนาน 10 ปี ยังไม่มีลูก...
เมื่อมีน้องแม่ก็อายุมากแล้ว จึงตัดสินใจมีลูกเพียงคนเดียว ขณะเดียวกันเมื่อตรวจทราบว่ามีความผิดปกติเป็นดาวน์ซินโดม ครอบครัวต้องทำใจยอมรับและเผชิญกับปัญหาต่างๆ ให้ได้
ในวัยที่เขายังเด็ก คุณพ่อคุณแม่ ชอบแต่งตัวให้น้องด้วยเสื้อผ้าที่น่ารักเพื่อให้ดูสะอาดสะอ้าน ตั้งแต่ทราบว่าน้องมีพฤติกรรมเบี่ยงเบนทางเพศ ครอบครัวไม่ได้รู้สึกกังวลใจ เนื่องจากน้องเป็นคนที่มีมนุษย์สัมพันธ์ดี มีน้ำใจ มีความกตัญญูและสามารถช่วยเหลือคุณพ่อคุณแม่ ทำงานได้หลายอย่าง เมื่อพ่อแม่เจ็บป่วยก็สามารถดูแลช่วยเหลือเบื้องต้นได้ ความรักที่แสดงออกต่อกัน
คือความสุขอันสำคัญของครอบครัว
หอ้งพิเศษสงฆ์ Deluxe 1500 VIP 1800
Siriraj Education Expo 2022 LINK
กลับมาอีกครั้ง! Siriraj Education Expo 2022 ทะยานสู่ฝัน สร้างสรรค์แรงบันดาลใจ เตรียมตัวพุ่งไปสู่โลกการเรียนรู้แห่งอนาคตกับศิริราช อยากเรียนแพทย์หรือวิทยาศาสตร์สุขภาพ ห้ามพลาด! วันเสาร์ที่ 5 พฤศจิกายน 2565 บนช่องทาง Online และ On Site (จำนวนจำกัด) พบกับโซน Si Metaverse และร่วมลุ้น Lucky Draw สุดพิเศษ!
เยี่ยมชมต้นแบบการคัดแยกขยะ
เยี่ยมชมต้นแบบการคัดแยกขยะ ชุมชนมัสยิดฮีดาย่าตุ้ลอิสลามิยะห์ (แสนแสบ) ซอยประชาร่วมใจ 7 ลักษณะเป็นชุมชนชานเมือง พื้นที่ 25 ไร่ บ้านเรือน 167 หลัง ประชากร 737 คน การคัดแยกเศษอาหารนำไปเลี้ยงปลา วันละประมาณ 30 กก./วัน โดยมีประชาชนในชุมชนมาจัดเก็บวันเว้นวัน การนำเศษผักผลไม้มาทำปุ๋ยหมักและน้ำชีวภาพใช้ภายในชุมชนปริมาณไม่แน่นอนตามที่มี แต่ละบ้านจะคัดแยกขยะเพื่อนำไปขายเป็นรายได้เสริมของแต่ละครัวเรือน วันละ 210 กก./วัน ซึ่งจะมีรถมารับซื้อภายในชุมชนโดยประมาณเดือนละ 4 ครั้ง เขตฯ จัดเก็บขยะภายในชุมชน 2 ครั้งต่อสัปดาห์ สำหรับปริมาณขยะก่อนดำเนินการวันละ 740 กก./วัน หรือ 22,200 กก./เดือน หลังดำเนินการคงเหลือ 500 กก./วัน หรือ 15,000 กก./เดือน รองผู้ว่าฯ จักกพันธุ์ กล่าวขอบคุณประชาชนที่เข้ามามีส่วนร่วมในการคัดแยกขยะ ซึ่งสามารถสร้างรายได้เข้าสู่ครอบครัวและชุมชน โดยให้เขตฯ นำไปเป็นชุมชนต้นแบบต่อยอดแก่ชุมชนอื่นๆ ในพื้นที่
พญ. มนฑรัตม์ เจนทวีพรกุล แพทย์เวชศาสตร์ครอบครัว โรงพยาบาลวิมุต อธิบายถึงการดูแลผู้สูงอายุในกลุ่มต่าง ๆ ว่า “ผู้สูงอายุที่ติดบ้านจะเข้าสังคมน้อยลง การได้ทำกิจกรรมที่ช่วยกระตุ้นสมองย่อมลดลงด้วย ดังนั้น เราควรประเมินว่าในความเป็นจริงแล้ว ผู้สูงอายุอยู่ติดบ้านเพราะว่ามีปัญหาในระบบใดของร่างกาย เช่นมีความสามารถในการช่วยเหลือตัวเองลดลงหรือไม่ ควรประเมินท่านในเรื่องของการเดิน การเคลื่อนไหว ประเมินเรื่องการกินยาหลายชนิดและอาจทำให้เกิดผลข้างเคียง อย่างอาการเวียนศีรษะจนไม่อยากออกไปไหน การประเมินสภาวะทางจิตใจ เช่น โรคซึมเศร้า ซึ่งทำให้ผู้สูงอายุเบื่อหน่ายกับการทำกิจกรรมต่างๆ ในกลุ่มผู้สูงอายุที่ติดบ้านนี้นอกจากจะประเมินผู้ป่วยแล้วยังควรประเมินผู้ที่ดูแลท่านด้วย เพื่อดูว่ามีความพร้อมและดูแลท่านได้เหมาะสมหรือไม่”
บริจาค มูลนิธิรามาธิบดีฯ ลดหย่อนภาษีได้ 2 เท่า
4 ขั้นตอนบริจาคออนไลน์ ลดหย่อนภาษี 2 เท่า กัยมูลนิธิรามาธิบดีฯ
บริจาคโครงการใดก็ได้ สามารถเลือกรับใบเสร็จลดหย่อนภาษี 2 เท่า
เพียงเข้าเว็บไซต์ www.ramafoundation.or.th
- คลิก >> เมนู "บริจาค” และเลือกโครงการ
- คลิก >> ลดหย่อนภาษี 2 เท่า กรอกข้อมูลส่วนตัว เลขประจำตัวผู้เสียภาษี หรือเลขบัตรประชาชน*
*ทั้งนี้ข้อมูลการบริจาคของท่านจะถูกส่งเข้าระบบ e-Donation ตามข้อกำหนดของกรมสรรพากร
9 สัญญาณเตือนเสี่ยงโรคเบาหวาน
โรคเบาหวาน คือ โรคที่เซลล์ร่างกายมีความผิดปกติในขบวนการเปลี่ยนน้ำตาลในเลือดให้เป็นพลังงาน โดยขบวนการนี้เกี่ยวข้องกับอินซูลินซึ่งเป็นฮอร์โมนที่สร้างจากตับอ่อน เพื่อใช้ควบคุมระดับน้ำตาลในเลือด เมื่อน้ำตาลไม่ได้ถูกใช้จึงทำให้ระดับน้ำตาลในเลือดสูงขึ้นกว่าระดับปกติ
9 สัญญาณเตือนเสี่ยงโรคเบาหวาน ได้แก่
1. ปัสสาวะบ่อยผิดปกติ
2. คอแห้ง กระหายน้ำบ่อย
3. หิวบ่อย กินจุกว่าเดิม
4. น้ำหนักตัวลดโดยไม่ทราบสาเหตุ
5. เป็นแผล แต่หายช้ากว่าปกติ
6. อ่อนเพลีย ไม่มีแรง
7. มีอาการตาพล่ามัว มองไม่ชัดเป็นช่วงๆ
8. ผิวหนังแห้งและคัน
9. รู้สึกชาบริเวณปลายนิ้วมือ นิ้วเท้า
ขอขอบคุณข้อมูลจาก สมาคมโรคเบาหวานแห่งประเทศไทย
แนวคิด 4E
การก่อสร้างสถาบันการแพทย์จักรีนฤบดินทร์นี้ มุ่งจะให้เป็นสถาบันการศึกษาที่มีสิ่งแวดล้อมและภูมิสถาปัตยกรรมที่เหมาะสมต่อการเรียนรู้ ก่อให้เกิดแรงบันดาลใจ และจินตนาการอย่างเต็มที่ ภายใต้กรอบแนวคิด 4E ดังนี้
Education reform เป็นการสร้างโอกาสที่คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี จะปฏิรูประบบการศึกษาและปฏิรูปหลักสูตรใหม่ ซึ่งจะสามารถทำได้มีประสิทธิภาพอย่างยิ่งในสถานที่ใหม่ร่วมกับกรอบแนวคิดใหม่
Excellent living and working condition คำนึงถึงคุณภาพชีวิตของบุคลากร นักศึกษา และผู้ป่วยเป็นสำคัญ โดยมีสิ่งอำนวยความสะดวกในการทำงานพร้อมสรรพ ทั้งศูนย์การเรียนรู้ที่ทันสมัยที่สุด มีระบบสารสนเทศ เครือข่ายคอมพิวเตอร์แบบไร้สายครอบคลุมทั้งบริเวณ มีการออกแบบหอพักให้มีความน่าอยู่ โล่ง โปร่ง ไม่แออัดและใกล้ชิดกับธรรมชาติ มีอาคารนันทนาการเพื่อการพักผ่อนและออกกำลังกาย เพื่อให้ครูและศิษย์อาศัยอยู่ใกล้ชิดกันอย่างมีความสุข ก่อให้เกิดจินตนาการและความคิดสร้างสรรค์ เป็นชุมชนของปัญญาชน และเป็นแหล่งเพาะบ่มปัญญาและการเรียนรู้อย่างแท้จริง
Environmental friendly ภูมิสถาปัตยกรรมของสถาบันการแพทย์จักรีนฤบดินทร์ เน้นความเป็นมิตรและกลมกลืนกับสิ่งแวดล้อม เช่น มีการบำบัดน้ำเสียและนำมาใช้ประโยชน์ใหม่ การจัดศูนย์ Power Plant ไว้อย่างเป็นสัดส่วนปราศจากเสียงรบกวนและควันพิษ การออกแบบทางคนเดินควบคู่กับถนน สนับสนุนให้มีการสัญจรโดยจักรยาน และไม่อนุญาตให้มีการใช้จักรยานยนต์ เป็นต้น
Energy saving คำนึงถึงการประหยัดพลังงาน โดยมุ่งอาศัยพลังงานทางเลือกเข้ามาร่วมให้มากที่สุด
ผู้ว่าชัชชาติ มาร่วมงานด้วย
เขตบางซื่อ บริการวันอาทิตย์ LINK
สำนักงานเขตบางซื่อนัดเก็บขยะชิ้นใหญ่/ขยะอันตราย ประจำเดือนพฤศจิกายน 2565 ตั้งแต่เวลา 09.00 - 12.00 น.
วันอาทิตย์ที่ 6 พฤศจิกายน ซอยกรุงเทพ - นนทบุรี 56
วันอาทิตย์ที่ 13 พฤศจิกายน ซอยกรุงเทพ - นนทบุรี 56 ซอยแยกซ้าย 1-5
วันอาทิตย์ที่ 20 พฤศจิกายน ซอยกรุงเทพ - นนทบุรี 56 ซอยแยกซ้าย 6-8
วันอาทิตย์ที่ 27 พฤศจิกายน ซอยกรุงเทพ - นนทบุรี 56 ซอยแยกขวา 1-7
สอบถามข้อมูลเพิ่มเติม โทร 02-5869974
เขตประเวศ เปิดรับ อาสาสมัครพัฒนาชุมชนเขตประเวศ ประจำชุมชน 45 อัตรา
สำนักงานเขตประเวศ เปิดรับ #อาสาสมัครพัฒนาชุมชนเขตประเวศ ประจำชุมชน 45 อัตรา 7-25 พ.ย. นี้ เป็นการเปิดรับสมัครสอบคัดเลือกบุคคลภายนอก เพื่อแต่งตั้งเป็นอาสาสมัครพัฒนาชุมชน ประจำปีงบประมาณ 2566
ผู้ประสงค์จะสมัครคัดเลือก #ขอใบสมัครและยื่นใบสมัครด้วยตนเอง ณ ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม ชั้น 4 สำนักงานเขตประเวศ
ระหว่างวันที่ 7-25 พฤศจิกายน 2565 ในวันและเวลาราชการ
สอบถามรายละเอียดเพิ่มเติม ฝ่ายพัฒนาชุมชนฯ โทร. 02 328 8941
มูลนิธิฯ ให้ความสำคัญเรื่องการสร้างเสริมภูมิคุ้มกันสำหรับเด็กไทย - นายแพทย์มานิต ธีระตันติกานนท์
นายแพทย์มานิต ธีระตันติกานนท์ ประธานกรรมการมูลนิธิวัคซีนเพื่อประชาชน และอดีตอธิบดีกรมควบคุมโรค กล่าวว่า “มูลนิธิฯ ยังคงมีความมุ่งมั่นเดินหน้ารณรงค์ และให้ความสำคัญกับการสร้างเสริมภูมิคุ้มกันในการป้องกันโรค และลดการเสียชีวิตจากโรคมาอย่างต่อเนื่อง
โดยสำหรับในปีนี้ มูลนิธิวัคซีนเพื่อประชาชน ยังคงเดินหน้าสานต่อความร่วมมือกับสมาคมโรคติดเชื้อในเด็กแห่งประเทศไทย ในโครงการจัดหาวัคซีนป้องกันโรคติดเชื้อนิวโมคอคคัส 13 สายพันธุ์ เพื่อเด็กกลุ่มเสี่ยงต่อเนื่องเป็นปีที่ 7 เด็กกลุ่มนี้ได้แก่ เด็กที่มีภูมิคุ้มกันบกพร่อง เช่น เป็นโรคมะเร็ง ได้รับการปลูกถ่ายอวัยวะ ติดเชื้อเอชไอวี หรือมีโรคประจำตัว เช่น โรคหัวใจ โรคตับ โรคไต โรคปอด เด็กที่ไม่มีม้าม เด็กกลุ่มนี้มีความเสี่ยงสูงที่จะติดเชื้อ IPD มากกว่าในเด็กปกติหลายเท่า อีกทั้งมีโอกาสเสียชีวิตหรือพิการได้มาก
หากเด็ก ๆ เหล่านี้ได้รับวัคซีนก็จะช่วยลดโอกาสเจ็บป่วย ลดค่ารักษาพยาบาล ลดความสูญเสียทางเศรษฐกิจจากการที่พ่อแม่ต้องหยุดงานเพื่อมาดูแลลูกที่ป่วย ซึ่งมูลนิธิฯ ได้ให้ความสำคัญเรื่องการสร้างเสริมภูมิคุ้มกันสำหรับเด็กไทย โดยเน้นการเพิ่มโอกาสในการเข้าถึงสำหรับเด็กที่อยู่ในกลุ่มเสี่ยง และสมควรได้รับการป้องกันเป็นอันดับแรก
นอกจากนี้มูลนิธิฯ พร้อมผลักดันให้ทุกภาคส่วนที่เกี่ยวข้องเล็งเห็นความสำคัญของการสร้างเสริมภูมิคุ้มกันที่ดีเพื่อยกระดับคุณภาพชีวิตของคนไทย ซึ่งในปัจจุบันวัคซีนนับเป็นเครื่องมือสำคัญในการดูแลสุขภาพ และเป็นอาวุธที่สำคัญที่สุดในการป้องกันโรค โดยเฉพาะในวัยเด็กซึ่งเป็นวัยที่ภูมิคุ้มกันยังทำงานไม่สมบูรณ์ และมีความเสี่ยงสูงในการติดเชื้อจากโรคต่าง ๆ
โดยในปีนี้เราได้ส่งมอบวัคซีนป้องกันโรคไอพีดี 13 สายพันธุ์ เพื่อเด็กกลุ่มเสี่ยงจำนวน 3,000 โด๊ส แก่โรงพยาบาลที่เข้าร่วมโครงการมากกว่า 35 โรงพยาบาลทั่วประเทศ เพื่อให้สามารถเข้าถึงเด็กที่อยู่ในกลุ่มเสี่ยง และไม่สามารถเข้าถึงการป้องกันได้เพิ่มขึ้น และทั่วถึงยิ่งขึ้น โดยจะครอบคลุมทั่วทุกภูมิภาคในประเทศไทย ซึ่งมีเด็กในกลุ่มเสี่ยงต่อโรค IPD มากกว่าหลายพันคนที่ได้รับการสร้างเสริมภูมิคุ้มกันไปแล้วภายใต้โครงการฯ นี้”
อีเมล์ที่หลอกลวง สังเกตดูอย่างไร
ธ.กสิกรทำตัวอย่างการสังเกตอีเมล์ที่หลอกลวงไว้ชัดเจนมาก ดังข้างต้นนี้
Barnabis สุขุมวิท 8
ร้านกัญชาในสุขุมวิท 8 เดินไม่ห่างปกซอยมากนัก
ความเหนื่อยล้าที่มากเกินไป (Hyper Fatique)
“การใช้ชีวิตที่ผ่านวิกฤติหนึ่งเพื่อมาพบกับอีกหนึ่งวิกฤติส่งผลต่อความเหนื่อยล้าของผู้บริโภคในหลายมิติ ในขณะเดียวกันการรับฟังข่าวสารและเรื่องราวต่าง ๆ ผ่านสื่อและคอนเทนต์ดิจิทัลที่มากเกินไป ไม่ว่าจะเป็นสถานการณ์การแพร่ระบาดของไวรัส ค่าครองชีพที่เพิ่มสูงขึ้น วิกฤตพลังงาน ความไม่สงบทางการเมือง และวิกฤตสภาพภูมิอากาศต่างส่งผลกระทบอย่างหนักหน่วงต่อผู้บริโภค”
คุณแมทธิว กล่าวต่อไปว่า “ผู้บริโภคจะพบกับความหมายและความสบายใจจากการเชื่อมต่อกับสภาพแวดล้อมโดยรอบ เชื่อมต่อกับชุมชน และเชื่อมต่อกับตัวเองอีกครั้ง การริเริ่มโครงการเพื่อการกุศลและชุมชนโดยเกิดจากการทำงานร่วมกันกับแบรนด์ที่สร้างแรงบันดาลใจ จะมีบทบาทที่แท้จริงในการรับมือกับระดับความเหนื่อยล้าของผู้บริโภค โดยสนับสนุนให้พวกเขาสามารถควบคุมชีวิตของตัวเอง และสร้างมุมมองเชิงบวกท่ามกลางวิกฤตทางการเงินที่กำลังเผชิญอยู่ ทั้งนี้ในช่วงห้าปีข้างหน้า คาดการณ์ว่าแบรนด์ต่าง ๆ จะสร้างขอบเขตและระเบียบในการเผยแพร่ข้อมูล และสร้างโครงการใหม่ ๆ ที่ช่วยให้ผู้บริโภคสามารถสร้างความสัมพันธ์ที่ดีกับทรัพยากรในด้านต่าง ๆ ได้ อาทิ เทคโนโลยี สุขภาพ และพื้นที่ในการพักผ่อน”
CovidHomeCare ดูแลผู้ป่วยโควิดที่บ้าน โรงพยาบาลธนบุรี
แพคเกจ ราคา 4900 บาท รวม
เอกซเรย์ปอด 1 ครั้ง
แพทย์/พยาบาลโทรเยี่ยม ติดตามอาการผ่าน Telemedicine 1 ครั้ง
ยารักษาโควิด ยาแผนปัจจุบัน
ติดต่อสอบถามในเวลาทำการได้ที่ โทร 063 4625360
ฟันซ้อน ฟันเก ฟันเรียงตัวไม่สวย
ปรึกษาทันตแพทย์เฉพาะทางด้านการจัดฟัน
ทพ.วุฒิพงษ์ เหล่าอมต
เติมเต็มความสมบูรณ์ของครอบครัว
ปรึกษาแพทย์เฉพาะทางด้านวางแผนครอบครัว
นพ.องอาจ บวรสกุลวงศ์
ท้องผูกเรื้อรัง ปรึกษาแพทย์เฉพาะทางระบบทางเดินอาหาร
นพ.สุขุมพันธ์ เก่าเจริญ อายุรศาสตร์โรคระบบทางเดินอาหาร
วันอังคาร 8 พ.ย. 14-15 น.
12 พ.ย. 65 ควบคุมกัญชา
ร่าง พรบ.กัญชา กัญชง...
- นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรมว.สธ.กล่าวถึง ความคืบหน้าร่าง พรบ.กัญชา ว่า ตราบใด ไม่มีพ.ร.บ.ต้องใช้ประกาศกระทรวงสาธารณสุข ซึ่งค่อนข้างครอบคลุม อาจจะออกประกาศควบคุมช่อดอกกัญชาเเพิ่มเติม เพื่อลดความกังวลของประชาชนผู้เห็นต่าง พยายามทำให้ประชาชนไขว้เขว หวังผลทางการเมือง สกัดความนิยมของพรรคการเมืองที่เสนอกฎหมายฉบับนี้ ในบริบทกฎหมายมุ่งเน้นนำกัญชามาใช้ทางการแพทย์ สุขภาพ และเศรษฐกิจ เพราะเป็นนโยบายเร่งด่วนรัฐบาลข้อที่ 4 ซึ่งคำว่าเร่งด่วนจริงๆ ต้องทำใน 6 เดือน ไม่เกิน 1 ปี แต่เราศึกษาวิจัยทั้งแผนไทย แผนปัจจุบัน จึงใช้เวลาจนเกือบหมดสมัยรัฐบาลถึงเสนอเข้าสภา
ควบคุมกัญชา
-นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรมว.สธ.ลงนามประกาศกระทรวงสาธารณสุขฉบับใหม่ เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ให้ช่อดอกกัญชา เป็นสมุนไพรควบคุม ห้ามจำหน่าย หรือแปรรูปเพื่อการค้าในทุกช่องทาง ห้ามจำหน่ายผ่านเครื่องจำหน่ายสินค้าอัตโนมัติ ห้ามโฆษณาสมุนไพรควบคุมเพื่อการค้า ห้ามจำหน่ายในวัด สถานที่สำหรับปฏิบัติศาสนา หอพัก สวนสาธารณะ จะทำได้ต้องได้รับใบอนุญาต ต้องปฏิบัติตามเงื่อนไขอย่างเข้มงวด ส่วนผู้ที่ได้รับอนุญาตก่อนหน้าประกาศใหม่ก็ต้องปฏิบัติตามด้วยเช่นกัน รวมทั้งห้ามขายผู้มีอายุต่ำกว่า 20 ปี นักเรียน นักศึกษา สตรีมีครรภ์ หญิงให้นมบุตร ห้ามขายเพื่อสูบในสถานที่ประกอบการ มีผลบังคับใช้หลังประกาศในราชกิจจาฯ
เพิกถอนการปลดล็อกกัญชา
-นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรมว.สธ.กล่าวถึงกรณีที่ นพ.สมิทธิ์ ศรีสนธิ์ นายกสมาคมแพทย์นิติเวชแห่งประเทศไทย และกรรมการแพทยสภา ร่วมกับ ส.ส.พรรคฝ่ายค้าน ยื่นฟ้องศาลปกครองให้พิจารณาเพิกถอนประกาศกระทรวงสาธารณสุข (สธ.) ปลดล็อกกัญชาออกจากบัญชียาเสพติดประเภท 5 ว่า เป็นไปตามกระบวนการทางกฎหมาย ต้องรอกระบวนการยุติธรรม แต่ที่ผ่านมา 5 เดือนก็ยังไม่มีอะไรที่ควบคุมไม่ได้นอกจากคนสร้างให้เป็นสถานการณ์ คนส่วนใหญ่เชื่ออยู่แล้วว่านโยบายกัญชาเน้นเรื่องการแพทย์ สุขภาพ และเศรษฐกิจ
-นายวิษณุ เครืองาม รองนายกฯ กล่าวว่า ถ้าจะทำให้กัญชากลับมาเป็นยาเสพติดให้โทษอีกนั้น ต้องแก้กฎหมายอีก เพราะถอดออกไปจากพ.ร.บ.แล้ว แต่ถ้าต้องการควบคุมให้เข้มงวด น่าจะมีวิธีอื่นที่ควบคุมได้โดยไม่ต้องแก้กฎหมาย โดยที่ได้ผลใกล้เคียงกัน ง่ายที่สุดคือ กระทรวงสาธารณสุขปรับแก้ระเบียบให้รัดกุมขึ้นและเขียนประกาศใหม่ได้ ซึ่งในการประชุม ป.ป.ส. ในสัปดาห์หน้าจะนำมาพูดคุยกัน ต่อข้อถามว่าประกาศห้ามเสพและสูบในที่สาธารณะ แต่ยังเก็บไว้ในบ้านได้หรือไม่ รองนายกฯ กล่าวว่ายังทำได้อยู่ และเมื่อไม่ใช่ยาเสพติดประเภทที่ 5 ก็เสพได้ในบ้าน ปลูกได้โดยจำกัดจำนวนต้น
-นายวัชรพงศ์ คูวิจิตรสุวรรณ เลขานุการ รมว.สธ. ให้สัมภาษณ์ว่า อะไรก็ตามหากไม่ผิดกฎหมายก็ย่อมสามารถทำได้ คนที่กังวลมากที่สุดคือประชาชน เพราะนับล้านคนปลูกกัญชาไปแล้ว หวังจะใช้เพิ่มรายได้ หวังจะใช้รักษาสุขภาพ ถ้าย้อนกลับไปเป็นยาเสพติดจะถูกจับหรือไม่ ทางที่ดีควรฟังคำแนะนำของนายประพัฒน์ ปัญญาชาติรักษ์ ประธานสภาเกษตรกรแห่งชาติ ที่เสนอว่า นโยบายเดินหน้าไปแล้วก็อย่าไปขวาง แต่ควรมาช่วยกันให้ความรู้จะดีกว่า
-นายภราดร ปริศนานันทกุล ส.ส.อ่างทอง โฆษกพรรคภูมิใจไทย กล่าวว่า ขอให้ผู้ที่จะนำกัญชากลับไปเป็นยาเสพติด ได้รู้ว่าจะส่งผลให้ประชาชนนับล้านคนที่ลงทะเบียนปลูกกัญชาได้รับผลกระทบ เราเดินมาไกลแล้ว พ.ร.บ.กัญชา กัญชง พ.ศ. ... ที่จะพิจารณาในสภา จะตอบคำถามในสิ่งที่ท่านเป็นห่วงทั้งหมดได้ และว่า นพ.สมิทธิ์ อย่าใช้ประเด็นความแตกต่างทางนโยบายของพรรคการเมืองในเรื่องกัญชา เป็นประเด็นหาเสียงเลือกตั้งกรรมการแพทยสภา ซึ่งทราบว่าคณะกรรมการแพทยสภาหลายท่านอึดอัดกับพฤติกรรมเช่นนี้
- ขณะที่ กรรมการแพทยสภาหลายคน ไม่ได้มีส่วนรับทราบกับการกระทำของ นพ.สมิทธิ์ และไม่เห็นด้วยกับการกระทำดังกล่าว ทั้งนี้ เท่ากับ นพ.สมิทธิ์กระทำในนามส่วนตัว เพียงแต่มีการใช้ตำแหน่งกรรมการแพทยสภาเท่านั้น เพื่อให้เป็นที่สนใจเนื่องจากช่วงนี้อยู่ในระหว่างการลงคะแนนเลือกตั้งกรรมการแพทยสภา
- น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย กล่าวว่า รัฐบาลโดย พล.อ.ประยุทธ์ควรแสดงภาวะผู้นำ สั่งการนายอนุทิน ยกเลิกประกาศกระทรวงสาธารณสุขโดยเร็วที่สุด ให้ทุกอย่างกลับไปสู่จุดเดิม เพราะรัฐบาลชุดนี้อาจแบกความรับผิดชอบไม่ไหวได้
ศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้อง โรงพยาบาลนพรัตนราชธานี
การบาดเจ็บที่ทางศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้อง โรงพยาบาลนพรัตนราชธานี ให้การรักษาได้แก่ ข้อไหล่หลุดซ้ำ เส้นเอ็นไหล่ฉีกขาด เส้นเอ็นในข้อเข่าฉีกขาด หมอนรองข้อเข่าฉีกขาด ข้อสะโพกเคลื่อนหลุด ข้อเท้าบาดเจ็บ เอ็นข้อเท้าขาด แพทย์ในศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้อง เป็นแพทย์ออร์โธปิดิกส์ที่ผ่านการอบรมหลักสูตรเวชศาสตร์ การกีฬาและการผ่าตัดส่องกล้องจากทั้งในประเทศและต่างประเทศ เป็นแพทย์ที่มีประสบการณ์และมีผลงานวิจัยตีพิมพ์เป็น ที่ยอมรับระดับประเทศและระดับนานาชาติ
ศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้องไม่ได้จำกัดอยู่แค่ผู้ป่วยที่เป็นนักกีฬาเท่านั้น ทางศูนย์ฯยังให้บริการตรวจรักษาและผ่าตัดส่องกล้องให้กับประชาชนทั่วไปอีกด้วย
ติดต่อศูนย์ 02-5481000ผ่าตัดข้อเข่าเทียมเทคโนโลยีแขนหุ่นยนต์ โรงพยาบาลบำรุงราษฎร์
การใช้เทคโนโลยีแขนหุ่นยนต์มาช่วยในการผ่าตัดเปลี่ยนข้อเข่าเทียมนั้น ได้รับการพิสูจน์แล้วในผู้ป่วยส่วนใหญ่ว่าได้ผลดี ลดอาการปวดหลังผ่าตัด ลดระยะเวลาการพักฟื้นที่โรงพยาบาลและช่วยให้ฟื้นตัวได้เร็ว สามารถช่วยให้ผู้ป่วยส่วนใหญ่กลับไปใช้งานข้อเข่าหลังผ่าตัดได้ดี ที่สำคัญคือมีความแม่นยำในการวางตำแหน่งผิวข้อเข่าเทียม ทำให้ข้อเข่าเทียมมีอายุการใช้งานอย่างที่ควรจะเป็น
ศูนย์เวชศาสตร์การกีฬาและข้อ โรงพยาบาลบำรุงราษฎร์ อาคาร A ชั้น 20 เคาน์เตอร์ D
เปิดบริการทุกวัน 08.00-20.00 น. โทร. 02-0668888 หรือ 1378
ตาราง Group C
| |
Group C |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
อาร์เจนตินา |
3 |
2 |
0 |
1 |
5 |
2 |
3 |
6 |
| 2 |
โปแลนด์ |
3 |
1 |
1 |
1 |
2 |
2 |
0 |
4 |
| 3 |
เม็กซิโก |
3 |
1 |
1 |
1 |
2 |
3 |
-1 |
4 |
| 4 |
ซาอุดิอาระเบีย |
3 |
1 |
0 |
2 |
3 |
5 |
-2 |
3 |
ไพทยา บัญชากิติคุณ อุปนายกสมาคมสถาปนิกสยาม ในพระบรมราชูปถัมภ์ ประธานการจัดงาน WOW Festival 2022 อัศจรรย์เมืองน่าอยู่ กล่าวเสริมว่า ทางสมาคมได้เตรียมพื้นที่นิทรรศการเกี่ยวกับเมืองผ่านไฮไลต์ต่างๆ ได้แก่ Thematic Pavilion ส่วนจัดแสดงนิทรรศการที่จะชวนมาคาดการณ์ภาพอนาคตของประเทศไทยในอีก 10 ปีข้างหน้า ร่วมเรียนรู้การเปลี่ยนแปลงเพื่อเตรียมปรับรูปแบบการใช้ชีวิตในมิติต่างๆ ให้ดียิ่งขึ้น ร่วมกับงานบรรยายเสวนา ร่วมคิดร่วมสร้าง และงานมอบรางวัลให้กลุ่มผู้พัฒนาเมือง
2.3 Banner C (in-content) เฉพาะหน้า content มี 3 options
ภาพแสดงตำแหน่งแบนเนอร์ Banner C แสดงเฉพาะหน้า content บนอุปกรณ์ต่างๆ (แบบที่ไม่มี Banner A ด้านบน)
• แบนเนอร์แนวนอน ขนาด 980x350 pixel
• แสดงเฉพาะในหน้า content
• หน้า content page จะแบ่งประเภทเป็น article content และ medical service content (หน้าข้อมูลสถานพยาบาล - โรงพยาบาล คลินิก)
• Fix banner
แบนเนอร์ C มี 3 option ได้แก่
Option 1. C1 Focus content เลือกลงเฉพาะหน้า ที่ต้องการ
Option 2. C2 Package content เลือกลงเป็น แพคเกจ 10 หน้า เลือกลงได้ตามต้องการ ตย.เช่น หน้าที่มีเนื้อหาในลักษณะ/ทิศทางเดียวกัน หรือหน้าที่มีจำนวนคนเข้าชมจำนวนมาก หรือหน้าที่มีการผลการค้นหาจำนวนมาก เป็นต้น
Option 3. C3 All content ลงทุกหน้า content ในเว็บไซต์
คลินิกหน่วยกายอุปกรณ์ให้บริการรักษาผู้ป่วยทุกเพศทุกวัยด้วยกายอุปกรณ์ที่ผลิตขึ้นเอง
รศ. พญ.กุลภา ศรีสวัสดิ์ ผู้อำนวยการโรงเรียนกายอุปกรณ์สิรินธร กล่าวว่า คลินิกหน่วยกายอุปกรณ์ให้บริการรักษาผู้ป่วยทุกเพศทุกวัยด้วยกายอุปกรณ์ที่ผลิตขึ้นเอง อาทิ แขนเทียม ขาเทียม อุปกรณ์ประคองขา แขน และลำตัว รองเท้าดัดแก้ไขความพิการ และแผ่นรองฝ่าเท้า หากแต่ที่ผ่านมา ผู้ป่วยกลุ่มนี้ซึ่งส่วนใหญ่เป็นผู้ยากไร้และด้อยโอกาสจะได้รับกายอุปกรณ์ตามสิทธิขั้นพื้นฐานเท่านั้น เนื่องจากอุปกรณ์ส่วนใหญ่มีค่าใช้จ่ายส่วนเกินสิทธิ์พื้นฐาน เนื่องจากต้นทุนการผลิต วัสดุ และส่วนประกอบหลายอย่างยังต้องนำเข้าจากต่างประเทศ
“ด้วยเหตุนี้ทางโรงเรียนกายอุปกรณ์ฯ จึงจัดตั้งกองทุน “กายอุปกรณ์เพื่อผู้พิการ” ในศิริราชมูลนิธิ ตั้งแต่ปี 2559 เพื่อช่วยเหลือผู้ป่วยผู้พิการที่ยากไร้ให้ได้รับอุปกรณ์และการรักษาที่มีคุณภาพ โดยแต่ละปีเราได้สนับสนุนค่ารักษาพยาบาลกว่าหลายล้านบาท ช่วยให้ผู้ป่วยมากกว่า 1,000 ราย ได้เข้าถึงการรักษา และในปีนี้เราขอเชิญชวนผู้มีจิตศรัทธาร่วมบริจาคช่วย ผู้พิการที่ยากไร้และด้อยโอกาสในแคมเปญ “กายอุปกรณ์...เชื่อมใจให้ไปต่อ” โดยคาดหวังว่าทุกการบริจาคที่สนับสนุนโรงเรียนกายอุปกรณ์ฯ จะช่วยเหลือผู้ป่วยให้มีคุณภาพชีวิตที่ดีได้อย่างยั่งยืน เรามีตัวแทนผู้พิการแขนขาที่ได้รับการรักษาจากคลินิกหน่วยการอุปกรณ์ 3 ราย มาแบ่งปันเรื่องราวของตนเองเพื่อสร้างแรงบันดาลใจให้กับคนในสังคมและผู้พิการคนอื่นๆ ผ่านภาพยนตร์สั้น ซึ่งจะเผยแพร่ในช่องทางออนไลน์ วันที่ 25 พฤศจิกายนนี้ จึงอยากเชิญชวนให้ทุกท่านร่วมสนับสนุนแคมเปญนี้เพื่อส่งต่อการเป็นผู้ให้”
Set C Inside-Out Beauty Set
Set C Inside-Out Beauty Set
ราคา 2,900 บาท (จากราคาปกติ 3,340 บาท) พร้อมกระเป๋าผ้าลายพิเศษ จาก NaRaYa
ประกอบไปด้วย Vita SKN จำนวน 1 กล่อง สำหรับผลิตภัณฑ์เสริมอาหาร ไวต้า เอสเคเอ็น ชนิดแคปซูลมังสวิรัติ มีส่วนผสมของสารสกัดธรรมชาติ 4 ชนิด อุดมไปด้วยสารต้านอนุมูลอิสระ ทั้งจากสารแคโรทีนอยด์, ฟลาโวนอยด์, สารประกอบฟินอลิก, กรดอัลฟ่า ไลโปอิค, และโคเอ็นไซม์ คิวเท็น รวมทั้งส่วนประกอบของเมล็ดองุ่นและเปลือกสน มาร่วมเติมสิ่งดีๆให้ร่างกายด้วยส่วนประกอบที่เสริมสร้างสุขภาพผิวพรรณ และ VitaWell จำนวน 1 กล่อง
มีส่วนประกอบของใยอาหาร 3 ชนิด ได้แก่ ฟรุคโตโอลิโกแซคคาไรด์ อินนูลิน และผงไซเลียมฮัสก์ และสกัดจากธรรมชาติกว่า 12 ชนิด อุดมไปด้วยใยอาหารช่วยเพิ่มกากในระบบทางเดินอาหาร ช่วยกระตุ้นการขับถ่าย
มีจุลินทรีย์โพรไบโอติกส์ บาซิลลัส โคแอกกูแลน มีสารสกัดจากธรรมชาติกว่า 12 ชนิด ผสมแอล-คาร์นิทีน
แอล-ทาร์เทรต ไม่มียาถ่าย ไม่มียาระบาย ดื่มได้ทุกวัน พลังงานต่ำ ซึ่งให้พลังงานเพียง 35 กิโลแคลอรี่ต่อซอง
ไม่มีน้ำตาล ไม่มีไขมัน ไม่มีกลูเตน ไม่มีนม ชุ่มคอด้วยหล่อฮังก๊วย และสดชื่นจากมิกซ์เบอร์รี่
เบลเกรด ประเทศเซอร์เบีย
กำหนดจัดงาน ระหว่าง 15 พฤษภาคม - 15 สิงหาคม 2027
ธีมงาน Play for Humanity - Sport and Music for All
เซอร์เบียชูแนวคิด ดนตรีและกีฬาเพื่อมวลมนุษยชาติ เพื่อแสดงให้เห็นถึงพลังการแสดงออก การมีส่วนร่วม "เล่น" จะช่วยสร้างความแข็งแกร่งให้กับปัจเจกบุคคลและสังคมชุมชน ยืนอยู่ได้ในภาวะการณ์ที่น่าหวาดหวั่น และเสี่ยงต่อความไม่ความปลอดภัยในปัจจุบัน การเล่นเป็นพลังเร้นที่จะผลักดันพลังการสร้างสรรค์ ริเริ่มและก่อเกิดการเติบโตงอกงาม จากกรอบใหญ่ สู่การแตกแขนงแยกย่อยออกไปในรูปแบบต่างๆ เพื่อให้สอดรับและสนองตอบกับผู้มีส่วนร่วมจากนานาชาติ และเพื่อสร้างโอกาสที่เปิดกว้างให้เกิดการขบคิดแสวงหาคำตอบและทางออกให้กับปัญหาต่างๆ ได้ มนุษย์จะเตรียมตัว เตรียใจ เตรียมกาย อย่างไรในโลกที่มีเทคโนโลยีนำทางแต่เต็มไปด้วยความน่าหวาดหวั่น และอันตราย การเตรียมตัวเพื่อดำรงตนให้ทนทานต่อความท้าทายของศตวรรษหน้าที่รออยู่ คือหัวใจ เซอร์เบียวาดหวังว่างาน Expo 2027 ณ กรุงเบลเกรด จะเป็นมหกรรมเฉลิมฉลองการฟื้นฟูโลกที่ยิ่งใหญ่ที่สุด ด้วยดนตรีและกีฬา
Website:
expobelgrade2027.org
Facebook:
expobelgrade2027ดนตรีในสวน "H.M. Song อว. บรรเลงเพลงของพ่อ" ราชภัฏนครสวรรค์ 5 ธันวาคม 65
กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม (อว.) ร่วมกับ มหาวิทยาลัยราชภัฏนครสวรรค์ ขอเชิญประชาชนทั่วไป ร่วมกิจกรรม การแสดงดนตรีในสวน "H.M. Song อว. บรรเลงเพลงของพ่อ" วันจันทร์ที่ 5 ธันวาคม 2565 เวลา 17.00 – 20.00 น.
ณ กองเสบียงฟาร์ม ต.นครสวรรค์ออก อ.เมืองฯ จ.นครสวรรค์
พบกับการแสดงดนตรีจากวง NSRU Band (เต็มวง) สาขาวิชาดนตรีศึกษา คณะมนุษยศาสตร์และสังคมศาสตร์ และร่วมจุดเทียนน้อมรำลึก ในพระมหากรุณาธิคุณของในหลวง รัชกาลที่ 9
ติดตามรับชมการถ่ายทอดสดได้ที่ Facebook : มหาวิทยาลัยราชภัฏนครสวรรค์
งานประชาสัมพันธ์และสื่อสารองค์กร NSRU
056-219100-29
กำหนดการงานมหิดล วันที่ 3-4 ธันวาคม 2565
โคลิฟอร์มในน้ำและน้ำแข็ง LINK
โคลิฟอร์มแบคทีเรีย เป็นแบคทีเรียชี้แนะ(Bacteriological indicator) ซึ่งถ้าตรวจพบในน้ำ ก็แสดงว่าน้ำนั้นน่าจะไม่ปลอดภัย คืออาจมีเชื้อโรคอยู่ในน้ำหรือในน้ำแข็งนั้น
โคลิฟอร์ม
แบ่งตามแหล่งที่มา จะแบ่งได้เป็น 2 ชนิด คือ
1. ฟีคัลโคลิฟอร์ม (Fecal coliform) อาศัยอยู่ในลำไส้ของคนและสัตว์เลือดอุ่น ถูกขับถ่ายออกมากับอุจจาระ เมื่อเกิดการระบาดของโรคระบบทางเดินอาหาร จะพบแบคทีเรียชี้แนะชนิดนี้ เช่น อี.โค.ไล (E.coli)
2. นันฟีคัลโคลิฟอร์ม (Non-fecal coliform) อาศัยอยู่ในดินและพืช มีอันตรายน้อยกว่าพวกแรก ใช้เป็นแบคทีเรียชี้แนะถึงความไม่สะอาดของน้ำได้ เช่น เอ. แอโรจิเนส (A. aerogenes)
น้ำเป็นสิ่งจำเป็นสำหรับชีวิตซึ่งนอกเหนือจากมีการบริโภคน้ำจากแหล่งน้ำธรรมชาติแล้ว เรายังบริโภคน้ำประปา น้ำดื่มบรรจุขวดและน้ำแข็งด้วย น้ำจากแหล่งต่าง ๆ ที่กล่าวถึงอาจมีเชื้อโรคที่ปะปนอยู่ซึ่งจะทราบได้จากการตรวจหาโคลิฟอร์ม น้ำและน้ำแข็งที่ตรวจพบโคลิฟอร์มอาจมีการปนเปื้อนของเชื้อโรคอาหารเป็นพิษซึ่งทำให้ผู้บริโภคมีอาการท้องร่วง ท้องเสีย อาเจียน เป็นไข้ ปวดศีรษะ หรืออาจเสียชีวิตได้
ในการตรวจสอบว่าในน้ำหรือน้ำแข็งมีโคลิฟอร์มแบคทีเรียหรือไม่ สามารถตรวจสอบได้ โดยใช้ชุดทดสอบโคลิฟอร์มในน้ำและน้ำแข็ง ของกรมวิทยาศาสตร์การแพทย์ ที่เราตรวจสอบเองตามคำอธิบายได้ไม่ยาก
การชี้แนะแนวทางให้กับแบรนด์ เป็นผลมาจากการสำรวจของฮาคูโฮโดซึ่งสะท้อนให้เห็นว่า คนไทยมูฟออนจากโควิด-19 ได้แล้วอย่างชิ้นเชิง เนื่องจากอาการป่วยสามารถรักษาให้หายได้ แต่สิ่งหนึ่งที่เปลี่ยนแปลงอย่างเห็นได้ชัดคือ พฤติกรรมของผู้บริโภคที่เปลี่ยนไปหลังการแพร่ระบาดของโควิด-19
โปรแกรมตรวจคัดกรองมะเร็งทางโลหิต
เเพ็กเกจตรวจคัดกรองโรคมะเร็งทางโลหิต โรงพยาบาลศรีสวรรค์ กรุงเทพมหานคร ราชพฤกษ์
เป็นการตรวจคัดกรองมะเร็ง เป็นการตรวจหารอยโรคก่อนเป็นตั้งแต่ระยะแรกเพื่อลดความเสี่ยงต่อการเกิดโรคร้าย รู้ตัวเร็ว ป้องกันไว
- ตรวจมะเร็งทางโลหิต (สำหรับสุภาพบุรุษ) ราคา 2,600 บาท
- ตรวจมะเร็งทางโลหิต (สำหรับสุภาพสตรี) ราคา 3,700 บาท
วันนี้ - 31 ธันวาคม 2565
โทร.1254
โรงพยาบาลกรุงไทย เวสเทิร์น นนทบุรี LINK
โรงพยาบาลกรุงไทย เวสเทิร์น เปิดให้บริการ 25 กรกฎาคม 2565 และเริ่มเปิดรับผู้ประกันตน สิทธ์ประกันสังคม ตั้งแต่วันที่ 1 ม.ค. 66 ทีมงานโรงพยาบาลมีบริการให้คำแนะนำเรื่องการเปลี่ยนสถานพยาบาลของสิทธิ์ประกันสังคม ติดต่อโทร.028229797
โรงพยาบาลกรุงไทย เวสเทิร์นเป็นโรงพยาบาลเอกชนขนาดใหญ่ 120 เตียง ตั้งอยู่ในอำเภอบางบัวทอง จังหวัดนนทบุรี พร้อมให้บริการด้านสุขภาพและการรักษาโรคโดยแพทย์เฉพาะทาง ด้วยความพร้อมทางด้านเทคโนโลยีและนวัตกรรมทางการแพทย์ที่ทันสมัย เพื่อเป็นศูนย์การรักษาและช่วยแบ่งเบาภาระของโรงพยาบาลทั้งภาครัฐและเอกชนในบริเวณภาคตะวันตกของกรุงเทพและปริมณฑล
- 77 ตำบล บางบัวทอง อำเภอบางบัวทอง นนทบุรี 11110
- โทร 02-8229797
- แผนที่
- facebook
เมกาบางนากลับมาจัดเต็ม Mega Countdown 2023 ศิลปินเพียบบบบ
เมกาบางนากลับมาจัดเต็มความสนุกอีกครั้ง! มอบความสุขส่งท้ายปีให้กับทุกคน ในงาน “Mega Countdown 2023” ที่เริ่มต้นความมันส์ของค่ำคืนนับถอยหลัง ด้วยคอนเสิร์ตจากศิลปินระดับแนวหน้าของเมืองไทย อาทิ Poly Cat, MEAN x SLAPKISS, THE TOYS, BOWKYLION, COCKTAIL, SLOT MACHINE , GETSUNOVA บนเวทีพร้อมจอ LED ขนาดใหญ่ที่ถูกดีไซน์ในรูปแบบ Wall Box มีลูกเล่นสุดล้ำ แสดงแสงสี กราฟิก เล่นไฟตามจังหวะดนตรี เพื่อให้ทุกคนได้ถ่ายภาพเก๋ๆ แชร์โมเม้นท์ความสุขให้สนุกยิ่งขึ้น และปิดท้ายกับการร่วมฉลองส่งท้ายโอกาสครบรอบ 10 ปี ของเมกาบางนา ผ่านการแสดง แสง สี เสียงสุดตระการตา ซึ่งทำให้ค่ำคืนส่งท้ายปีนี้ พิเศษกว่าปีไหนๆ
พิเศษ! สำหรับสมาชิก Mega Smile Rewards สามารถแลกรับฟรี ชุด Enjoy Set ซึ่งประกอบไปด้วยน้ำอัดลม, ป็อปคอร์น, LED Stick และ Tattoo Sticker ดีไซน์เก๋ๆ เพื่อร่วมสนุกกับบรรยากาศงานเคาน์ดาวน์สุดมัน โดยสามารถแลกรับสิทธิ์ล่วงหน้าได้ที่เคาน์เตอร์แลกรับของสมนาคุณในวันที่ 30 – 31 ธันวาคม 2565 หรือบูธกิจกรรมในงาน Mega Countdown 2023 ในวันที่ 31 ธันวาคม 2565 ตั้งแต่เวลา 16.00-22.00 น.
งานนี้ต้องไม่พลาดปักหมุดมานับถอยหลัง ส่งท้ายปีเก่าต้อนรับปีใหม่ไปด้วยกันในวันที่วันเสาร์ ที่ 31 ธันวาคมนี้ ประตูเปิดเวลา 16.00 น. เป็นต้นไป งานนี้ฟรีตลอดงาน ที่เมกาบางนานะคะ
Chiangmai Countdown 2023 @ศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส)
Chiangmai Countdown 2023 ปรากฎการณ์ฉลองเคานต์ดาวน์ส่งท้ายปี กับศิลปินชื่อดัง พร้อมชมความอลังการของพลุสุดตระการตา อิ่มอร่อยไปกับเมนูอาหารหลายร้านดัง ในบรรยากาศสุดยิ่งใหญ่ใจกลางเมืองเชียงใหม่มหานครแห่งความสุข
พิเศษสุดในค่ำคืน 31 ธ.ค. 2565 ร่วมนับถอยหลังส่งท้ายปีเก่า ทะยานเข้าสู่ปี 2023 ไปพร้อมกันกับ บุรินทร์ & The Soulsmith , MILD X ANTHONY WEI และ กวินท์ ดูวาล
28 ธ.ค. 65 - 3 ม.ค. 66 ตั้งแต่เวลา 5 โมงเย็นถึงเที่ยงคืน ณ ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส)
(*เข้างานฟรี !!! / กรุณาเตรียมบัตรประชาชนเพื่อเข้างาน / ในพื้นที่คอนเสิร์ตกำหนดอายุ 20+ ปีบริบูรณ์ขึ้นไปเท่านั้น / คุณลูกค้าที่มีอายุไม่ถึงเกณฑ์ สามารถอยู่ในโซนบริเวณก่อนทางเข้า หน้าน้ำพุพร้อมจอขนาดใหญ่ ให้ท่านได้ร่วมนับถอยหลังและชมพลุไปด้วยกัน)
สิ่งอำนวยความสะดวกในห้องพักเดี่ยว ศูนย์อายุรวัฒน์ 1 (อาคาร9) ชั้น 9
- เตียงไฟฟ้าควบคุมด้วยรีโมท
- ทีวี ตู้เย็น เครื่องทำน้ำอุ่น เครื่องปรับอากาศ
- เตียงพักญาติ
- โต๊ะชุดรับประทานอาหารของญาติ
- ที่นอนป้องกันแผลกดทับ
- ทั้ง 2 อาคาร จัดพื้นที่ส่วนกลาง เครื่องกรองน้ำ น้ำร้อน และไมโครเวฟ ไว้ให้บริการ


พญ.กอบกาญจน์ ชุณหสวัสดิกุล ผู้อำนวยการศูนย์จิณณ์ เวลเนส เซ็นเตอร์ (Jin Wellness Center) โรงพยาบาลธนบุรี บำรุงเมือง กล่าวว่า เวลเนส หรือ เวลบีอิ้ง เป็นเรื่องของการส่งเสริมป้องกันก่อนจะเกิดโรค เกิดความเสื่อมขึ้นในร่างกาย (Preventive Medicine) ที่จิณณ์ เวลเนส เซ็นเตอร์ ใช้หลักการ 4 P (Predictive Preventive Personalized และ Participatory) ตามวิทยาศาสตร์การแพทย์สมัยใหม่ เพื่อการดูแลสุขภาพแบบองค์อย่างยั่งยืน ด้วยแนวคิดการปรับสมดุลร่างกายและจิตใจภายในสู่ภายนอก เป็นการนำศาสตร์ธรรมชาติบำบัดมาผสมผสานกับแพทย์ทางเลือก ควบคู่ไปกับการแพทย์แผนปัจจุบันที่ทันสมัย เพื่อออกแบบโปรแกรมและกิจกรรมสำหรับการป้องกัน และชะลอความเสื่อมจากโรคภัยแบบเฉพาะบุคคล (Personalized Medicine) ด้วยเทคโนโลยีการตรวจหาความเสี่ยงและความผิดปกติภายในร่างกายลึกได้ในระดับเซลล์ แต่ละอวัยวะในร่างกายอย่างละเอียด ทำให้การบำบัดรักษาเป็นไปอย่างตรงจุดพร้อมมีโปรแกรมเอไอ ซึ่งเป็น Prevention Programs ใช้ประสบการณ์จากการทำงานทางด้านเวชศาสตร์ป้องกันมากว่า 20 ปี ในการเก็บอัลกอรึทึ่มหลายหมื่นเคสมาวิเคราะห์ เพื่อแนะนำและออกแบบโปรแกรมการดูแลสุขภาพตามลำดับความจำเป็นก่อนหลังเฉพาะบุคคล
นอกจากนี้ นายอนุทิน ยังได้กล่าวถึง สิทธิประโยชน์ในระบบหลักประกันสุขภาพถ้วนหน้าที่ประเทศไทยสนับสนุนให้กับประชาชนได้เข้าถึงบริการอย่างเท่าเทียม ซึ่งเป็นจุดเด่นของประเทศไทย ที่เราไม่ทิ้งใครไว้ข้างหลัง เราดูแลประชาชนทุกคนให้มีสุขภาพที่ดี ห่างไกลจากโรค และเข้าสู่ระบบบริการรักษาได้โดยเร็ว มี 4 ประเด็นสำคัญ คือ
1) การให้บริการถุงยางอนามัยฟรีแก่คนไทยอายุ 15 ปีขึ้นไปทุกเพศ ทุกสิทธิ์ สามารถรับได้ที่หน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ
2) ส่งเสริมการจัดบริการเอชไอวีโดยชุมชน โดยเพิ่มองค์กรประชาสังคมที่ผ่านการประเมินตามมาตรฐานการจัดบริการเอชไอวีและโรคติดต่อทางเพศสัมพันธ์เป็นสถานบริการสาธารณสุขอื่น ตามมาตรา 3 แห่ง พ.ร.บ.หลักประกันสุขภาพแห่งชาติ พ.ศ.
3) การให้บริการยาป้องกันก่อนการสัมผัสเชื้อเอชไอวี แก่กลุ่มเป้าหมายหลัก (ชายที่มีเพศสัมพันธ์กับชาย หญิงข้ามเพศ ผู้ให้บริการทางเพศ ผู้ใช้สารเสพติดชนิดฉีด คู่ผลเลือดต่าง) และยาป้องกันการติดเชื้อเอชไอวีหลังการสัมผัสเชื้อ ครอบคลุมประชาชนไทยทุกคน ไม่จำกัดอายุ ไม่จำกัดจำนวนครั้งการให้บริการ โดยทั้งหมดไม่มีค่าใช้จ่ายใดๆ ทั้งสิ้น
4) การปรับเกณฑ์การเข้าถึงยารักษาโรคไวรัสตับอักเสบซี (ยา Sofosbuvir/Velpatasvir) ให้ผู้ติดเชื้อได้รับการรักษาด้วยยาได้ทันที เมื่อถูกวินิจฉัยแล้ว และกำหนดให้มีการใช้ยาต้านไวรัสป้องกันการถ่ายทอดเชื้อไวรัสตับอักเสบ บี จากแม่สู่ลูก (ยาทีโนโฟเวียร์) รวมอยู่ในชุดสิทธิประโยชน์ และปรับให้มีการใช้ยาต้านไวรัส(ยา Tenofovir alafenamide) ที่มีประสิทธิผลดี เป็นยาสูตรแรกในการรักษาผู้ติดเชื้อไวรัสตับอักเสบบีเรื้อรังแทนยาสูตรเดิมที่ดื้อยาสูง ซึ่งจะสามารถลดการป่วย การตายจากโรคไวรัสตับอักเสบ และภาวะแทรกซ้อนจากตับแข็ง และมะเร็งตับได้ และขณะนี้กรมควบคุมโรคร่วมกับภาคีเครือข่ายกำลังดำเนินการขับเคลื่อนให้มีการตรวจคัดกรองการติดเชื้อไวรัสตับอักเสบ บี และ ซี ในผู้ที่เกิดก่อนปี พ.ศ. 2535 รวมอยู่ในชุดสิทธิประโยชน์ และกำลังขับเคลื่อนให้การใช้ชุดตรวจหาการติดเชื้อเอชไอวีด้วยตนเอง รวมอยู่ในชุดสิทธิประโยชน์การรักษาพยาบาลที่ประชาชนสามารถเข้าถึงชุดตรวจโดยไม่เสียค่าใช้จ่าย เพื่อทำให้ผู้ติดเชื้อเอชไอวี หรือผู้ติดเชื้อไวรัสตับอักเสบบี หรือซี ได้เข้าสู่การรักษาโดยเร็ว และเป็นการป้องกันการแพร่เชื้อไปสู่ผู้อื่น
“ในฐานะประธานการประชุม ขอเรียกร้องให้ประเทศสมาชิกขจัดการตีตราและการเลือกปฏิบัติทุกรูปแบบ ในชุมชน โรงเรียน สถานที่ทำงานและสถานพยาบาลอย่างเร่งด่วน และผลักดันนโยบายการไม่เลือกปฏิบัติและกฎหมายที่เกี่ยวข้อง รวมทั้งจัดบริการหลักประกันสุขภาพถ้วนหน้าให้มีความครอบคลุมสำหรับทุกคน เข้าถึงได้อย่างเท่าเทียม โดยไม่มีการเลือกปฏิบัติ สอดคล้องกับแนวคิดวันเอดส์โลกปีนี้ที่ว่า “Equalize : ทำให้เท่าเทียม” เพื่อมุ่งไปสู่การยุติเอดส์ในปี 2573 นี้ พร้อมกัน” นายอนุทินกล่าว
โรงพยาบาลอุ้มผาง ฉีดวัคซีนโควิดให้บุคคลทั่วไป
รางวัลรองชนะเลิศอันดับ 2 ทีม RAM2S
รางวัลรองชนะเลิศอันดับ 2 ทีม RAM2S : Room Availability Monitoring & Management Solution” โปรแกรมบริหารจัดการเตียงสำหรับเจ้าหน้าที่ภายในโรงพยาบาล และได้รับเงินรางวัลมูลค่า 20,000 บาท


ในปัจจุบัน ผมเชื่อว่าเราบรรลุเป้าหมายที่ตั้งไว้ร่วมกับบำรุงราษฎร์แล้ว ก็คือ การค้นพบวิธีการรักษาใหม่ๆ ที่เราได้นำมาใช้แล้ว แล้วก็มีหลายประเทศให้ความสนใจเรื่องที่เราทำและมาขอดูงานของจริงที่บำรุงราษฎร์ ทั้งญี่ปุ่น ยุโรป และอเมริกา ซึ่งเรามีงานวิจัยหลายอย่างที่บำรุงราษฎร์ แล้วก็มีเทคโนโลยีใหม่ๆ ที่เข้ามาใช้ ซึ่งการที่จะพิสูจน์ว่างานวิจัยใช้ได้ผลจริงหรือไม่ จะต้องนำมาปฏิบัติจริงด้วย ซึ่งที่สถาบันโรคหัวใจบำรุงราษฎร์แห่งนี้ ได้นำมาปฏิบัติทุกวันและหมั่นฝึกฝนเพื่อให้เกิดแนวทางการรักษาผู้ป่วยให้ดีที่สุด โดยมีงบประมาณสำหรับการทำวิจัยอย่างจริงจัง ยกตัวอย่าง ผู้ป่วยที่ใหลตาย แล้วเราก็เจอว่ามีความผิดปกติอย่างไร เรามีวิธีการรักษาอย่างไร ด้วยการจี้พังผืดบริเวณพื้นผิวของหัวใจห้องข้างล่างข้างขวา ซึ่งผู้ป่วยในกลุ่มนี้จะมีไม่เงินรักษา ซึ่งบำรุงราษฎร์ก็ช่วยรักษาผู้ป่วยในกลุ่มนี้โดยไม่คิดค่าใช้จ่าย และเพื่อเป็นงานวิจัยควบคู่กันไปด้วย โดยก่อนหน้านี้เป็นเรื่องที่ยากมากที่จะวินิจฉัยพบความผิดปกติในส่วนนั้น ทำให้ไม่รู้ว่าผิดปกติจากส่วนไหน ซึ่งพบได้ในงานวิจัยนี้ ซึ่งเป็นผลงานจากเมืองไทย และเป็นคนแรกของโลกที่เราทำการรักษาด้วยการจี้แล้วเป็นผลสำเร็จ ทำให้มีผู้คนสนใจและขอเข้ามาดูผลงานที่บำรุงราษฎร์
ทีมแพทย์และทีมสหสาขาวิชาชีพเฉพาะทางด้านโรคหัวใจของสถาบันโรคหัวใจ (HEART INSTITUTE)
ทีมแพทย์และทีมสหสาขาวิชาชีพของเรามีความชำนาญในการดูแลรักษาผู้ป่วยโรคหัวใจ โดยเฉพาะในรายที่ต้องการการดูแลรักษาโรคที่ยากและซับซ้อน ทีมของเราประกอบด้วย
อายุรแพทย์หัวใจ (Medicine, Cardiology)
ศัลยแพทย์ทรวงอก (Cardio-thoracic surgeon)
แพทย์กายภาพบำบัด (Cardiac rehabilitation) ผู้ชำนาญด้านการฟื้นฟูผู้ป่วยโรคหัวใจและกลุ่มนักกีฬา
การดูแลป่วยหนักระบบหัวใจและหลอดเลือด (Clinical care service) สามารถดูแลรักษาผู้ป่วยโรคหัวใจที่มีความซับซ้อนได้อย่างครอบคลุม
เภสัชกร (Clinical Pharmacist) ผู้ชำนาญด้านยารักษาโรคหัวใจโดยเฉพาะ
พยาบาล (Special nurse) ผู้ได้รับการอบรมและมีประสบการณ์ในการดูแลผู้ป่วยโรคหัวใจ
สหสาขาวิชาชีพอื่นๆที่เกี่ยวข้อง เช่น นักโภชนาการ นักกายภาพบำบัด
ภาวะเจ็บป่วยที่สถาบันโรคหัวใจดูแล
โรคหลอดเลือดหัวใจ
เยื่อหุ้มหัวใจอักเสบ
โรคลิ้นหัวใจเอออร์ติกตีบ
โรคหัวใจ
โรคหัวใจกับการเดินทาง
โรคหัวใจพิการหรือผิดปกติแต่กำเนิด
ไขมันในเลือดสูง คอเลสเตอรอลและโรคหัวใจ
ความดันโลหิตต่ำ
ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ
ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำส่วนลึก
ภาวะหลอดเลือดแดงใหญ่ในช่องท้องโป่งพอง
ภาวะหัวใจโต
ภาวะหัวใจล้มเหลว
ภาวะหัวใจห้องบนสั่นพลิ้ว
มะเร็งหัวใจ
ลิ้นหัวใจรั่ว
หัวใจเต้นผิดจังหวะ
หัวใจวาย หรือกล้ามเนื้อหัวใจตายเฉียบพลัน
การรักษา
CARDIAC ELECTROPHYSIOLOGY LAB (EP LAB)
การเปลี่ยนลิ้นหัวใจเอออร์ติกผ่านสายสวนโดยไม่ต้องผ่าตัด (TAVI)
การใส่เครื่องกระตุ้นไฟฟ้าหัวใจ
การขยายหลอดเลือดหัวใจด้วยบอลลูน
การตรวจคลื่นไฟฟ้าหัวใจ (EKG)
การตรวจทางสรีรวิทยาไฟฟ้าหัวใจ
การตรวจสมรรถภาพหัวใจด้วยการออกกำลังกาย (EXERCISE STRESS TEST)
การตรวจสวนหัวใจ (การฉีดสีหัวใจ)
การตรวจหลอดเลือดหัวใจด้วยเครื่องเอกซเรย์คอมพิวเตอร์
การตรวจหัวใจด้วยเตียงปรับระดับ (TILT TABLE TEST)
การตรวจหัวใจด้วยคลื่นเสียงสะท้อนความถี่สูงร่วมกับการออกกำลังกาย
การปิดรยางค์หัวใจห้องบนซ้าย (LAAC)
การผ่าตัด FONTAN’S OPERATION
การผ่าตัดต่อหลอดเลือดเลี้ยงหัวใจหรือการผ่าตัดบายพาส
การรักษาด้วยยาต้านการแข็งตัวของเลือด
สถิติความสำเร็จในการรักษาของสถาบันโรคหัวใจ (HEART INSTITUTE)
1. ทำบอลลูน > 350 ราย/ปี
2. ฉีดสีเพื่อดูเส้นเลือดหัวใจ > 600 ราย/ปี
3. การเกิดหลอดเลือดตีบ และแตกขณะทำบอลลูน 0% (สถิติประเทศไทย 0.22%)
4. ใส่ห้องไฟฟ้าหัวใจ > 30 ราย/ปี ตรวจทางสรีรวิทยาไฟฟ้าหัวใจ > 80 ราย/ปี
5. อัตราการเสียชีวิตจากการจี้ไฟฟ้าหัวใจ (AF & VT) = 0
6. อัตราการเสียชีวิตจากเปลี่ยนลิ้นหัวใจเออร์ติกด้วยเทคโนโลยี TAVI ตั้งแต่ปี 2559 = 0
7. ผ่าตัดหัวใจแบบเปิด > 70 ราย/ปี
พิธีเปิด อาคารนิทรรศน์พรรณพฤกษา 14 กันยายน 2565
วันที่ 14 กันยายน 2565 คุณอรรถพล ฤกษ์พิบูลย์ ประธานเจ้าหน้าที่บริหารและกรรมการผู้จัดการใหญ่ บริษัท ปตท. จำกัด (มหาชน) เป็นประธานในพิธีเปิด “อาคารนิทรรศน์พรรณพฤกษา” บริษัท พีทีที แอลเอ็นจี จำกัด ณ บ้านหนองแฟบ จังหวัดระยอง และคาดว่าจะเป็นแลนด์มาร์คจุดท่องเที่ยวแห่งใหม่ของจังหวัดระยองได้ต่อไปในอนาคต
การจ้างงานคนพิการ
- กทม. จ้างงานคนพิการแล้ว 323 คน ภายในมีนาคม 2566 เพิ่มอีก 4 ตำแหน่ง 11 อัตรา
พัฒนาทักษะเดิม เพิ่มเติมทักษะใหม่
นักจัดการเมือง นักสุขภาพเมือง นักสิ่งแวดล้อมเมือง นักปลอดภัยเมือง วิศวกรเมือง
กระจายอำนาจ
- เพิ่มประสิทธิภาพการบริการด้านสังคมและคุณภาพชีวิตของสำนักงานเขตสู่ประชาชนในพื้นที่ (Sandbox) พื้นที่น้ำร่อง เขตคลองเตย และเขตบางเขน
One Stop Service
- เปิดให้บริการ 9 แห่ง+2 แห่ง ในปี 2566
- ดำเนินการออกบัตรประจำตัวคนพิการ จำนวนรวมทั้งสิ้น 2,345 ราย
Telemedicine
- เปิดให้บริการ 9 แห่ง+2 แห่ง ในปี 2566 มีผู้รับบริการ 45,583 ราย
- เปิดใช้งานระบU e -Referral ระหว่างศูนย์บริการสารารณสุข 69 แห่ง ไปยังโรงพยาบาลในสังกัดจำนวน 6 แห่ง จำนวน 5,000+ เคส
- นำร่องใช้งานจริงแล้วที่ ดูสิตโมเดล และราชพิพัฒน์โมเดล
Sandbox สาธารณสุข
- ดุสิตโมเดล ครอบคลุม 4 เขต ดูสิต พระนคร บางชื่อ และบางพลัด Telemedicine 1,391 คน / e-Referral 3,361 คน / V EMS 1,391 คน
- ราชพิพัฒน์โมเดล ครอบคลุม 5 เขต ทวีวัฒนา บางแค หนองแขม ตลิ่งชัน ภาษีเจริญ Telemedicine 67,330 คน / Commu-lance 4,337 คน / Motor-lance 494 คน / เยี่ยมบ้านออนไลน์ 941 คน
BKK Pride Clinic
เปิดให้บริการ 11 แห่ง+5 แห่ง ใน ร.ค. 2565 ผู้รับบริการ 4,619 ราย
BKK Risk Map
แผนที่เสี่ยงภัยในกรุงเทพมหานครพร้อมเปิดข้อมูล 5 ภัย (ระยะที่ 1 ) ได้แก่ อุทกภัย อัคคีภัย จุดเสี่ยงและอันตราย ความปลอดภัยทางถนนมลพิษทางอากาศ PM 2.5
ยกระดับศักยภาพให้ชุมชนปลอดภัย
- เพิ่มประปาหัวแดง 248 จุดในพื้นที่เสี่ยงสูง จากทั้งหมด 23,598 จุด
- เพิ่มเครื่องดับเพลิงในชุมชนแออัด 451 ชุมชน รวมไม่น้อยกว่า 268 ถัง
- เพิ่มรถกู้ภัยทางถนน 15 คัน
- เร่งยกระดับสถานีดับเพลิงหลัก 37 แห่ง 11 สถานีย่อย
- ร่วมกับมูลนิธิกู้ชีพกู้ภัย 7 แห่ง แบ่งโซนการปฏิบัติการภายใต้มาตรฐานเดียวกัน
- พัฒนาแผนอำนวยการเหตุการณ์สำหรับ ผอ.เขต/ผู้ช่วย ผอ.เขต
- แผนและปฏิทินซ้อมดับเพลิง อพยพ ระดับชุมชน ปี 66 นำร่องช้อม 438 ชุมชน
กระทรวงพลังงาน (พน.)
พน. มอบของขวัญปีใหม่ ปี 2566 สรุปได้ ดังนี้
1. เตรียมการขอขยายระยะเวลาคงราคาขายส่งหน้าโรงกลั่นก๊าซหุงต้ม (Liquefied Petroleum Gas: LPG) โดยกำหนดราคาขายปลีกอยู่ที่ 408 บาท/ถัง 15 กิโลกรัม ตั้งแต่วันที่ 1 - 31 มกราคม 2566
2. ให้ส่วนลดค่าซื้อ LPG แก่ผู้ที่มีรายได้น้อยผ่านบัตรสวัสดิการแห่งรัฐ จำนวน 100 บาท/คน/3 เดือน และให้แก่กลุ่มร้านค้าหาบเร่ จำนวน 100 บาท/คน/เดือน ตั้งแต่วันที่ 1 มกราคม - 31 มีนาคม 2566
3. ตรึงราคาน้ำมันทุกชนิดในช่วงวันที่ 24 ธันวาคม 2565 - 3 มกราคม 2566 เพื่อลดค่าใช้จ่ายระหว่างการเดินทางช่วงปีใหม่
4. ตรวจสภาพรถยนต์โดยไม่เสียค่าใช้จ่ายที่สถานีบริการ FIT Auto จำนวน 35 รายการ ระหว่างวันที่ 1 ธันวาคม 2565 - 15 มกราคม 2566
5. แจกคูปองส่วนลดครึ่งราคาที่พักที่เขื่อนการไฟฟ้าฝ่ายผลิตแห่งประเทศไทย จำนวน 30,000 สิทธิ์
ด้าน นางสาวพุธิตา อาริสโตเรนัส นักฉุกเฉินการแพทย์ เผยถึงคุณสมบัติและรายละเอียดการเรียนการสอนว่า “หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาฉุกเฉินการแพทย์ มุ่งเน้นผลิตบัณฑิตให้มีความรู้ความชำนาญ และทักษะด้านฉุกเฉินการแพทย์ เพื่อให้ผู้ป่วยฉุกเฉินได้รับการผดุงชีวิต รวมทั้งป้องกันการเสียชีวิตหรือการรุนแรงขึ้นของการบาดเจ็บหรืออาการป่วย”
31 ธ.ค. 65 นำร่างกลับไทยอีก 7 เหตุไฟไหม้กาสิโนปอยเปต - สูญหาย 50 คน LINK
31 ธ.ค.2565 นายธวัชชัย บุญแสง ปลัดอำเภออรัญประเทศ จ.สระแก้ว เปิดเผยว่า เหตุการณ์ความคืบหน้าเหตุเพลิงไหม้กาสิโนแกรนด์ไดมอน ที่ปอยเปต ประเทศกัมพูชา ว่าเหตุการณ์ดังกล่าวมีผู้เสียชีวิตแล้ว 27 คน ยืนยันอัตลักษณ์บุคคล และออกหนังสือรับรองการเสียชีวิตแล้ว 18 คน เป็นการเสียชีวิตที่ไทย 1 คน และนำร่างกลับมาเมื่อวันที่ 29 ธ.ค. 10 คน และคืนวันที่ 30 ธ.ค. อีก 7 คน และที่เหลืออยู่ระหว่างพิสูจน์อัตลักษณ์บุคคล โดยมีทีมเจ้าหน้าที่พิสูจน์หลักฐานของไทย จัดชุดเข้าไปร่วมตรวจพิสูจน์ด้วย
ส่วนบุคคลสูญหายขณะนี้ เหลือประมาณ 50 คน เชื่อว่า ยังติดค้างในอาคารที่ยังไม่สามารถเข้าไปค้นหาได้ เนื่องจากบางพื้นที่ ได้รับผลกระทบจากไฟไหม้อย่างรุนแรง ส่งผลต่อโครงสร้างอาคาร
สำหรับการดำเนินการของไทยหลังจากนี้ ยืนยันว่า ศูนย์ประสานให้การช่วยเหลือผู้ประสบภัย จะเปิดให้ญาติเข้ามาติดต่อประสานงานได้ จนกว่าจะเสร็จสิ้นภารกิจ ส่วนขั้นตอนการประสานนำร่างกลับไทยทำได้เร็วขึ้น ทุกอย่างเป็นไปในทิศทางที่ดีขึ้น
ทั้งนี้ทีมกู้ภัยทั้งหมดของไทย ได้ยุติการค้นหาผู้สูญหาย และถอนกำลังออกจากพื้นที่ตั้งแต่เมื่อวานที่ผ่านมา โดยมีรายงานว่า วันนี้เจ้าของอาคารจะเข้ารื้อถอนซากอาคาร เพื่อค้นหาผู้สูญหายเพิ่มเติม
ชุมชนสุขภาพ
การแพทย์สุขภาพทางไกล ยังก่อให้เกิดมิติด้านการดูแลสุขภาพอีกรูปแบบนึงขึ้นมา นั่นคือ การให้คำแนะนำระหว่างผู้ป่วยต่อผู้ป่วยด้วยกัน ตัวอย่างเช่น ชุมชนบนเว็บไซต์ Patients Like Me หรือ Care Opinion และ cancer.org เหล่านี้เป็นชุมชนที่รวมกันของกลุ่มผู้ป่วย ญาติผู้ป่วย นักวิชาการ องค์กรหรือผู้เกี่ยวข้องในประเด็นนั้น ได้ร่วมกันแบ่งปันข้อมูลเกี่ยวกับสุขภาพ การดูแลตนเอง การรักษา ฯลฯ เพื่อให้ผู้ป่วยดูแลตนเองได้เอง บรรเทาความไม่สะดวกจากการต้องรอรับบริการแพทย์ ซึ่งรูปแบบการดูแลกันและกันนี้ เป็นโมเดลที่ได้รับการยอมรับอย่างมากในปัจจุบัน และคาดว่าจะเติบโตอีกไม่น้อยในอนาคต
ตัวอย่างแนวคิดของทั้ง 3 เว็บชุมชน
Patients Like Me (
www.patientslikeme.com) เป็นชุมชนออนไลน์ของการดูแลสุขภาพจากโรคต่างๆ มีสมาชิกกว่า 850,000 ราย มีข้อมูลสุขภาพกว่า 2,800 เรื่อง ที่เกิดมาจากการแชร์ประสบการณ์หรือความเจ็บป่วย ระหว่างคนไข้ด้วยกันเอง ที่คอยแบ่งปันคำแนะนำ การดูแลตนเอง หรืออื่นๆ ที่จำเป็นและเหมาะสมให้แก่กันและกัน
Care Opinion (
www.careopinion.org.uk) เวทีแลกเปลี่ยนประสบการณ์ของชาวอังกฤษจากการได้รับบริการสุขภาพจากรัฐบาล เว็บไซต์เชื้อเชิญให้แลกเปลี่ยนไม่ว่าประสบการณ์นั้นจะดีหรือไม่ดีก็ตาม เพราะสิ่งที่บอกเล่านั้นจะถูกส่งต่อไปยังผู้ที่จะทำให้เกิดการเปลี่ยนแปลงได้จริง บทบาทการเป็นเวทีกลางที่ส่งผ่านความเห็นจากคนไข้ไปสู่ผู้รับผิดชอบ บนความหวังที่จะช่วยยกระดับบริการในทุกภาคส่วน และประสบความสำเร็จอย่างดีเยี่ยมและใช้เป็นแบบอย่างได้
cancer.org ก่อตั้งโดยสมาคมโรคมะเร็งสหรัฐ ให้เป็นชุมชนเพื่อการแบ่งปันประสบการณ์ผู้ป่วยมะเร็งที่ประสบความสำเร็จอย่างสูง เว็บไซต์มีข้อมูลทุกมิติเกี่ยวมะเร็ง เปิดโอกาสการมีส่วนร่วมทุกรูปแบบ ทุกระดับ สมกับเจตนารมย์ที่ท้าทายยิ่งว่า เพื่อการต่อสู่กับโรคมะเร็งร้าย ให้หมดไปจากมนุษยชาติ
ธุรกิจเด่นอันดับ 2 ธุรกิจ e-commerce (ธุรกิจที่ทำการซื้อขายผ่านอิเล็กทรอนิกส์)
ปัจจัยสนับสนุน
1. ผู้บริโภคมีพฤติกรรมปรับลดการใช้จ่ายผ่านหน้าร้าน เช่น ร้านสะดวกซื้อ ห้างซุปเปอร์ต่าง ๆ มาเป็นการใช้จ่ายผ่านแพลตฟอร์มออนไลน์ที่สามารถซื้อขายได้ตลอด 24 ชม.มากขึ้น และมีระบบการชำระเงินที่หลากหลาย
2. ต้นทุนในการทำการซื้อขายผ่านออนไลน์มีต้นทุนที่ต่ำ ทำให้ระดับราคาสินค้าต่ำกว่า หน้าร้าน
3. ผู้ประกอบการหันมาทำธุรกิจ E commerce มากขึ้นทำให้ผู้บริโภคมีแนวทางการเลือกสินค้าได้ และมีรูปแบบการส่งเสริมการขายที่หลากหลาย
4. การขยายตัวของชุมชนเมืองและการเพิ่มขึ้นของชนชั้นกลาง หนุนความต้องการสินค้าอุปโภคบริโภค
5. การรีวิวสินค้าของบุคคล (ดารา, Youtuber และ Influencer) ที่มีชื่อเสียงและ
ลูกค้าเคยใช้สินค้า
ปัจจัยเสี่ยง
1. ภาวะเงินเฟ้อส่งผลต่อราคาสินค้าอุปโภคบโภคสูงขึ้น ประชาชนระมัดระวังในการใช้จ่ายมากกว่าเดิม
2. ปัญหาการหลอกขายสินค้า ไม่แสดงราคากำกับ และสินค้าไม่ได้คุณภาพ
3. การแข่งขันที่รุนแรงขึ้นทั้งจากคู่แข่งเดิมและคู่แข่งรายใหม่ และกำลังซื้อของผู้บริโภคยังไม่ฟื้นตัว
4. การแข่งขันทางด้านราคา ทำให้กำไรของธุรกิจค่อนข้างต่ำสวนทางกับต้นทุนที่สูงขึ้นตามราคาน้ำมันและภาวะเงินเฟ้อที่ขยายตัวสูงขึ้นจากสถานการณ์รัสเชีย-ยูเครน
5. ระบบโลจิสติกส์ หรือการจัดส่งสินค้าที่อาจล่าช้าและมีต้นทุนที่สูงขึ้น
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคกลาง
จังหวัดอุทัยธานี
รหัสสาขา 00735 รักการดี
จังหวัดนครสวรรค์
รหัสสาขา 5484 ชุมชนนวมินทร์ (นครสวรรค์)
จังหวัดราชบุรี
รหัสสาขา 13038 เคหะราชบุรี
จังหวัดพระนครศรีอยุธยา
รหัสสาขา 06986 ชุมชนบ้านกรด
จังหวัดสุพรรณบุรี
รหัสสาขา 06328 โพธิ์พระยา
จังหวัดลพบุรี
รหัสสาขา 15243 เลี่ยงเมืองลพบุรี
ปทุมธานี
- รพ.ปทุมธานี โทร. 025988888
- สถาบันบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี โทร. 025310080 ธัญบุรี บำบัดผู้ติดสารเสพติด
- ศูนย์ฟื้นฟูสมรรถภาพคนงานภาค1 โทร. 025670847 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ทำเครื่องดาม อุปกรณ์ช่วย
- ศูนย์การศึกษาพิเศษ ประจำจังหวัดปทุมธานี โทร. 021573009 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- ไพดี้คลินิกการประกอบโรคศิลปะ สาขากิจกรรมบำบัด ลำลูกกา โทร. 029956202 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- โรงพยาบาลธรรมศาตร์เฉลิมพระเกียรติ โทร. 029269999 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ Adaptive Environment/ Community Rehab/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์
- โรงพยาบาลเปาโล รังสิต โทร. 025778111 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.ธนบุรีบูรณา โทร. 020785777 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Palliative care/ Adaptive Environments/ เตรียมความพร้อมการพูด/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
ปัญหาการจัดการด้านข้อมูล Data Silo ปัญหาด้านบุคลากร และอุปสรรคอื่น ๆ ต่อการนำข้อมูลสารสนเทศไปใช้อย่างเต็มประสิทธิภาพ
อย่างไรก็ตาม ยังเห็นได้ชัดว่าการใช้ข้อมูล เทคโนโลยี AI และเทคโนโลยีการวิเคราะห์แนวโน้มล่วงหน้า ยังต้องมีการพัฒนาอีกมาก ซึ่งเป็นกุญแจสำคัญสู่อนาคตของวงการเฮลท์แคร์ โดยเฉพาะอย่างยิ่งการใช้งานด้านคลินิก โดยร้อยละ 41 ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกมีการแชร์ข้อมูลกับองค์กรภายนอก ในขณะที่ร้อยละ 40 ใช้ข้อมูลเพื่อการวิเคราะห์แนวโน้ม ร้อยละ 30 รวบรวมและจัดเก็บข้อมูล และร้อยละ 28 ใช้ข้อมูลเพื่อทำงานบางอย่างแบบอัตโนมัติ
นอกจากนี้ ประมาณสามในสี่ (ร้อยละ 73) ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกเห็นว่าปัญหาการจัดการข้อมูล หรือ Data Silo เป็นปัญหาสำคัญต่อการนำข้อมูลไปใช้อย่างมีประสิทธิภาพ ซึ่งมากกว่าค่าเฉลี่ยทั่วโลกที่ร้อยละ 51 สำหรับอุปสรรคอื่นๆ อาทิ ข้อจำกัดด้านโครงสร้างพื้นฐาน (ร้อยละ 23) ความกังวลถึงความเป็นส่วนตัวและความปลอดภัยของข้อมูล (ร้อยละ 21) นโยบายและข้อบังคับด้านข้อมูลสารสนเทศ (ร้อยละ 21) การต่อต้านของบุคลากรบางส่วนต่อการอัพเกรดหรือการนำเทคโนโลยีล้ำสมัยมาใช้ (ร้อยละ 20) การขาดความชัดเจนทางกฎหมาย (ร้อยละ 20) และความซับซ้อนในการจัดการข้อมูลปริมาณมาก (ร้อยละ 20)
การร่วมมือกับผู้เล่นรายอื่นในวงการเฮลท์แคร์เป็นหนึ่งในแนวทางการรับมือกับความท้าทายเหล่านี้ ยกตัวอย่างเช่น ผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกเชื่อว่าการร่วมมือกับบริษัทชั้นนำด้านเทคโนโลยีทางการแพทย์ ช่วยให้สถานพยาบาลของพวกเขาได้รับคำปรึกษาในการวางแผนงานล่วงหน้าได้ถึงร้อยละ 30 และยังให้แนวทางและ/หรือให้บริการวิเคราะห์และแปลผลข้อมูลเพื่อการปรับปรุงประสิทธิภาพอย่างต่อเนื่อง (ร้อยละ 28) และจัดหาทรัพยากร และ/หรือ บริการสำหรับการบำรุงรักษาอย่างต่อเนื่อง (ร้อยละ 27)
การต่อต้าน ทักษะ และการขาดความรู้ของบุคลากร เป็นอุปสรรคอันดับต้น ๆ ในภูมิภาคเอเชียแปซิฟิก ต่อการใช้ประโยชน์จากข้อมูลสารสนเทศ (ร้อยละ 35) ในขณะที่ผู้บริหารในวงการเฮลท์แคร์ในภูมิภาค (ร้อยละ 74) กล่าวว่า บุคลากรของพวกเขารู้สึกว่าในปัจจุบันมีข้อมูลจำนวนมากเกินไป ซึ่งสูงกว่าค่าเฉลี่ยทั่วโลกที่ร้อยละ 55 ในขณะที่ร้อยละ 21 รู้สึกว่าการฝึกอบรมและการให้ความรู้แก่บุคลากรของพวกเขาจะเป็นหนึ่งในวิธีที่ดีที่สุดที่จะนำไปสู่การจัดการข้อมูลที่มีประสิทธิภาพได้
กิจกรรมวันเด็ก รพ.พญาไท LINK
วันเด็กปีนี้ รพ.พญาไท ชวนเด็กมาสนุกกัน ในงาน PHYATHAI 1 Dinosaur Adventure วันเสาร์ที่ 14 มกราคม 2566 เวลา 9.00-13.00 น. ณ อาคาร 3 ชั้น 1 โรงพยาบาลพญาไท1
กิจกรรมภายในงาน
1.ประกวดปั้นไดโนเสาร์ด้วยแป้งโดว์หรือดินน้ำมัน ลุ้นรับ เซต Play doh Dinosaur เซตใหญ่ อลังการกลับบ้านไปเลย
2.DIY Class ครีเอทโดนัท ร่วมกันครีเอทโดนัทสุดน่ารักในแบบของตนเองและมาร่วมแข่งขันกันเถอะว่าใครเป็นสุดยอดนัก Creative ที่สุดแห่งปี 2023
3.สอยดาวแจกลูกโป่งไดโนเสาร์และลุ้นรับของรางวัลใหญ่สุดพิเศษภายในต้นไม้แหล่งภัตตาคารอาหารของสัตว์น้อยใหญ่ในป่า Dinosaur
4.ร่วมผจญภัยฐานไดโนเสาร์ทายสีที่ถูกต้อง ใครตอบถูก ใครตอบไว รับไปเลยของขวัญสุดน่ารัก ในธีม Dinosaur Adventure ของเรา
ศูนย์บริการสาธารณสุขที่ 2 สวนใหญ่
- ที่อยู่ 203 ซอย ประชาราษฎร์ 13 ตำบลสวนใหญ่ อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทรศัพท์: 02 525 2395
- แผนที่
- Facebook
- Website
บริการ
- คลินิกตรวจโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น.
- คลินิกฝังเข็ม วันอังคาร พุธ พฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น.
- คลินิกกายภาพบำบัด วันจันทร์ – ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-16.30 น.
- คลินิกสุขภาพเด็กดี (สร้างเสริมภูมิคุ้มกันโรค) วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
- คลินิกวางแผนครอบครัว วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
หมายเหตุ ติดต่อนัดหมายคลินิกฝังเข็ม คลินิกกายภาพบำบัด และคลินิกสุขภาพเด็กดี โทร. 02-5252395 (ในวันและเวลาราชการ)
คลินิกกุมารเวชกรรม
คลินิกกุมารเวชกรรม ตรวจรักษาภูมิแพ้เด็กและผู้ใหญ่ มีบริการทดสอบภูมิแพ้ทางผิวหนังและวัคซีนภูมิแพ้ ตรวจรักษาโรคต่อมไร้ท่อในเด็ก ดูแลโรคเบาหวาน ภาวะเป็นหนุ่มสาวก่อนวัย ภาวะเด็กเจริญเติบโตผิดปกติ ตัวเตี้ย
เปิดให้บริการทุกวันจันทร์ – พฤหัสบดี
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์ออนโคโลยี เพื่อการบริบาลผู้ป่วยมะเร็งแบบองค์รวม
Tel: 052 089 861
Call Center: 1719
ศูนย์ออนโคโลยี
วันจันทร์ – วันเสาร์ : 08.00 น. – 16.00 น.
วันอาทิตย์ : 14.00 น. – 17.00 น.
เป็นศูนย์ที่ให้การดูแลรักษาผู้ป่วยโรคมะเร็ง ครบทุกมิติแบบองค์รวม ตั้งแต่การวินิจฉัยโรค การรักษาในหลายแขนง (ยาเคมีบำบัด ยาพุ่งเป้า ภูมิคุ้มกันบำบัด ฮอร์โมนบำบัด) บนความร่วมมือกับโรงพยาบาลเครือข่ายทั้งในและต่างประเทศ
การวินิจฉัย
การวินิจฉัยทางรังสี พยาธิวิทยา และเซลล์วิทยา
การรักษา
นอกจากการผ่าตัดแล้ว ด้วยวิทยาการทางการแพทย์ที่ก้าวหน้ามากขึ้น ทำให้เกิดทางเลือกในการรักษามะเร็งมากมาย โดยทีมบุคลากรทางการแพทย์ผู้เชี่ยวชาญ ให้การตรวจวินิจฉัยด้วยเครื่องมือ และเทคโนโลยีชั้นสูงทางการแพทย์ และเลือกวิธีการรักษาที่ดีที่สุด โดยตระหนักถึงปัจจัยทั้งด้านร่างกาย และจิตใจของผู้ป่วยเป็นสำคัญ
ยาเคมีบำบัด
เป็นการรักษาด้วยยาหลายชนิดที่ออกฤทธิ์ต้าน หรือทําลายเซลล์มะเร็ง ทําให้เซลล์มะเร็งไม่สามารถแบ่งตัวต่อไปได้ และตายในที่สุด ยาเคมีบำบัดมีหลายรูปแบบ ส่วนมากเป็นยาฉีด โดยการหยดร่วมกับสารน้ำเข้าทางหลอดเลือดดำ ปัจจุบันมียาเคมีบำบัดในรูปแบบรับประทาน ซึ่งทำให้การบริหารยาสะดวกมากขึ้น ลดการพักรักษาตัวในโรงพยาบาล
ยากลุ่มพุ่งเป้า
เป็นการรักษาโดยอาศัยการทำงานของระบบภูมิคุ้มกัน เพื่อทำการกำจัด หรือควบคุมเซลล์มะเร็งในร่างกายได้อย่างมีประสิทธิภาพ ด้วยการให้ยาที่ออกฤทธิ์ทำลายเซลล์มะเร็งแบบจำเพาะเจาะจง ซึ่งมีประสิทธิภาพสูงกว่ายาเคมีบำบัด และมีผลข้างเคียงน้อยกว่ายาเคมีบำบัด
การรักษาด้วยภูมิคุ้มกันบำบัด
เป็นการรักษาโดยอาศัยการทำงานของระบบภูมิคุ้มกัน เพื่อทำการกำจัด หรือควบคุมเซลล์มะเร็งในร่างกายได้อย่างมีประสิทธิภาพ
ฮอร์โมนบำบัด
เป็นการรักษาโรคมะเร็งด้วยยาที่มีฤทธิ์ต้านฮอร์โมน หรือยับยั้งการสร้างฮอร์โมนบางชนิด เนื่องจากมะเร็งบางชนิด เช่น มะเร็งเต้านม มะเร็งต่อมลูกหมาก อาศัยฮอร์โมนในการเจริญเติบโต การรักษาด้วยฮอร์โมนบำบัดจึงช่วยควบคุมมะเร็งเหล่านี้ได้ โดยมีผลข้างเคียงน้อยกว่ายาเคมีบำบัด
ความร่วมมือกับโรงพยาบาลเครือข่ายทั้งในและต่างประเทศ
ศูนย์ออนโคโลยี โรงพยาบาลกรุงเทพเชียงใหม่ มีความร่วมมือกับโรงพยาบาลเครือข่ายทั้งในและต่างประเทศ เพื่อเป็นการแลกเปลี่ยนความรู้ ประสบการณ์ ในการพัฒนาให้เป็น ศูนย์แห่งความเป็นเลิศทางด้านโรคมะเร็ง สำหรับผู้ป่วยในเขตพื้นที่จังหวัดเชียงใหม่ ภาคเหนือตอนบน รวมไปถึงผู้ป่วยในประเทศเพื่อนบ้านใกล้เคียง อาทิเช่น
โรงพยาบาลวัฒโนสถ โรงพยาบาลเอกชนเฉพาะทางด้านโรคมะเร็งแห่งแรกของประเทศไทย ในเครือโรงพยาบาลกรุงเทพดุสิตเวชการ
บริษัทกรุงเทพดุสิตเวชการ และโรงพยาบาลศิริราช ร่วมกับ MD Anderson Cancer Centre ซึ่งเป็นสถาบันรักษาโรคมะเร็งอันดับหนึ่งของประเทศสหรัฐอเมริกา
ปรับปรุงแผนกทันตกรรม
"ปรับปรุงห้องฟันให้สะอาด ปลอดภัย มียูนิตทำฟันมากขึ้น มีระบบระบายอากาศที่พอจะมั่นใจได้ว่าปลอดภัยทั้งผู้ให้และผู้รับบริการ"
ทัวร์ประวัติศาสตร์ท้องถิ่นในชุมชนบริเวณย่านเยาวพานิช LINK
Yaowapanich’s Historical Walking Tour ทัวร์ประวัติศาสตร์ท้องถิ่นในชุมชนบริเวณย่านเยาวพานิช - Satarana และคณะโบราณคดี มหาวิทยาลัยศิลปากร ชวนคุณย้อนอดีตไปเดินเท้าตามหาเรื่องราวและขุดคุ้ยประวัติศาสตร์ท้องถิ่นในย่านเยาวพานิช กับ Yaowapanich’s Historical Walking Tour เพราะ "ถนนเยาวพานิช" ถนนสายเล็กๆ ที่เชื่อมถนนเยาวราชและถนนทรงวาดเอาไว้ด้วยกัน ถือเป็นเส้นทางการคมนาคมที่มีความสำคัญมาตั้งแต่อดีตถึงปัจจุบัน ตั้งแต่ในวันที่เคยเป็นคลองลำเลียงสินค้าจากแม่น้ำเจ้าพระยาขึ้นฝั่ง จนถึงปัจจุบันซึ่งถูกถมจนกลายเป็นถนนเยาวพานิชที่เต็มไปด้วยร้านค้าเก่าแก่ สถาปัตยกรรมย้อนยุค และเรื่องราวในประวัติศาสตร์มากมายที่รอให้ทุกคนมาค้นหา
นำกิจกรรมโดยเหล่านักศึกษาจากคณะโบราณคดี มหาวิทยาลัยศิลปากร ที่ได้ลงพื้นที่ค้นคว้าเรื่องราวและจัดทำข้อมูลประวัติศาสตร์ย่านเยาวพานิชเอาไว้อย่างละเอียด พร้อมนำคุณไปเดินลัดเลาะสำรวจทุกซอกทุกมุมของย่านไปด้วยกัน
ร่วมฟรี รับจำนวน 60 คน
วันเวลา
เสาร์ 04 ก.พ. 2566 10:30 - 16:00
อาทิตย์ 05 ก.พ. 2566 10:30 - 16:00
เสาร์ 11 ก.พ. 2566 10:30 - 16:00
อาทิตย์ 12 ก.พ. 2566 10:30 - 16:00
ตย.ซิลิโคนเสริมหน้าอก ก้น สะโพก
ตย.ซิลิโคนเสริมหน้าอก ก้น สะโพก จะตรวจสอบได้ง่ายกว่า จากกล่องของผลิตภัณฑ์ นั้นๆ
อย่างไรก็ตามขอฝากย้ำเตือน เพื่อความปลอดภัยในการทำศัลยกรรมความงาม ทุกท่านควรตรวจสอบ และเลือกวัสดุที่ปลอดภัย มีมาตรฐานทางการแพทย์ และผ่าน อย. เท่านั้น นอกจากนี้ ควรหาข้อมูลให้รอบด้าน เลือกศัลยแพทย์ที่เชี่ยวชาญ และโรงพยาบาลหรือคลินิกที่ได้มาตรฐาน
ศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด ปรึกษาศัลยกรรมความงาม โทร. 0-2867-0606 ต่อ 1200-1204
โรงพยาบาลเฉพาะทางแม่และเด็กแพทย์รังสิต
โรงพยาบาลเฉพาะทางแม่และเด็กแพทย์รังสิต เปิดให้บริการอย่างเป็นทางการ ณ วันที่ 1 พฤษภาคม พ.ศ. 2554 ต่อยอดจากโรงพยาบาลแพทย์รังสิต โดย นพ.กฤชรัตน์ ตระกูลช่าง กุมารแพทย์ผู้ชำนาญการด้านทารกแรกเกิด และมีทีมแพทย์ พยาบาลวิชาชีพที่มีความชำนาญในการให้การดูแลรักษา พยาบาล ทารกแรกเกิด ทารกคลอดก่อนกำหนด หรือทารกที่มีความผิดปกติตั้งแต่แรกเกิด อาทิ โรคหัวใจพิการแต่กำเนิด ระบบประสาท ระบบหายใจ โรคเลือด โรคระบบทางเดินอาหาร เป็นต้น ทั้งนี้เรามีพร้อมด้วยเครื่องมือที่ทันสมัย ได้มาตรฐานสูงสุด เพื่อใช้ในการตรวจวินิจฉัยและรักษาโรคในเด็กไม่ว่าจะเป็นโรคเลือด โรคระบบทางเดินอาหาร โรคภูมิแพ้ และโรคผิวหนัง รวมถึงพัฒนาการของเด็กทั้งร่ายและจิตใจพร้อมมุ่งมั่นที่จะดูแลรักษาเด็กแบบครบวงจร
สำหรับการบริการด้านสูติ-นรีเวชกรรม ให้บริการตรวจวินิจฉัย รักษาและการผ่าตัดโดยแพทย์ผู้ชำนาญการ รวมถึงบริการด้านการตั้งครรภ์ อาทิ ให้คำปรึกษาเตรียมตัวก่อนการสมรสหรือก่อนมีบุตร การรับฝากครรภ์ การคลอดบุตร รวมถึงมีการจัดอบรมคุณแม่คุณภาพ เพื่อเตรียมความพร้อมในการดูแลลูกน้อยหลังคลอด นอกจากนี้ยังรวมถึงโรคสตรี และวัยทอง
ในปี 2565 เรามุ่งเน้นการพัฒนาศูนย์จิตเวชเด็กแบบครบวงจร และควบคู่ไปกับการนำเทคโนโลยีใหม่ๆ เพื่อพัฒนาและยกระดับการวินิจฉัย และรักษาโรคในเด็กและด้านสูติ-นารีเวชกรรม อาทิ การส่องกล้องนรีเวช การวินิจฉัยเวชศาสตร์มารดาและทารกในครรภ์ และรักษาภาวะผู้มีบุตรยาก โดยทีมแพทย์ และพยาบาลวิชาชีพที่มีความชำนาญการคอยให้บริการราวกับผู้รับบริการเป็นหนึ่งในครอบครัวเดียวกันกับเรา
ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย The Royal College of Psychiatrists of Thailand
ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย
The Royal College of Psychiatrists of Thailand
สำนักงานเลขาธิการ : กองจิตเวชและประสาทวิทยา โรงพยาบาลพระมงกุฎเกล้า กรุงเทพ 10400
โทร. / โทรสาร: 02-640-4488
TIPCO เครื่องดื่มใบกัญชา
มี 2 สูตร กลิ่นส้มยูซุ และ ออริจินอล เครื่องดื่มจากใบแท้ๆ รู้สึกผ่อนคลาย หายเครียด ตั้งแต่แรกจิบ
Covid-19 vaccination at UDPC Institute Bangkok
Urban Disease Prevention and Control Institute Open for COVID-19 vaccination service for foreign tourists Since January 23, 2023
Address: Phahonyothin Rd. Bangkok 10220
Location map
Service fee
1. Pfizer vaccine, price 1,380 Baht/dose
2. สิทธิหลักประกัน สุขภาพของคนไทย
พ.ร.บ.หลักประกันสุขภาพแห่งชาติ พ.ศ.2545 กำหนดให้คนไทยทุกคนมีสิทธิ ได้รับบริการสาธารณสุขที่มีมาตรฐานและมีประสิทธิภาพ โดยจัดให้มี “กองทุน หลักประกันสุขภาพแห่งชาติ” เพื่อเป็นค่าใช้จ่าย สนับสนุนและส่งเสริมการจัด บริการสาธารณสุขของหน่วยบริการ ส่งเสริมให้คนไทยสามารถเข้าถึงบริการ สาธารณสุขได้อย่างทั่วถึง และมีประสิทธิภาพ “สิทธิหลักประกันสุขภาพแห่งชาติ” จึงเป็นสิทธิตามกฎหมายที่รัฐบาล จัดให้คนไทยทุกคนตั้งแต่แรกเกิดและตลอดช่วงชีวิต (ไม่ใช่สิทธิเพื่อการสงเคราะห์ เฉพาะกลุ่ม) ) และมักเรียกว่า “สิทธิบัตรทอง หรือ สิทธิ 30 บาท” คุณสมบัติของผู้มีสิทธิหลักประกันสุขภาพแห่งชาติ 3 ข้อ คือ
1. เป็นบุคคลที่มีสัญชาติไทย
2. มีเลขประจำตัวประชาชน 13 หลัก ของกรมการปกครอง กระทรวงมหาดไทย
3. ไม่มีสิทธิประกันสุขภาพจากหน่วยงานรัฐ (ที่ใช้จ่ายจากเงินงบประมาณ ของรัฐ) ได้แก่ สิทธิตามกฎหมายประกันสังคม สิทธิสวัสดิการรักษา พยาบาลของข้าราชการ / พนักงานส่วนท้องถิ่น หรือ สิทธิสวัสดิการรักษา พยาบาลของหน่วยงานรัฐอื่นๆ เช่น รัฐวิสาหกิจ องค์การมหาชน ข้าราชการการเมือง
(ตัวอย่าง) บุคคลที่มีสิทธิหลักประกันสุขภาพแห่งชาติ เช่น
- เด็กแรกเกิด ที่ไม่มีสิทธิสวัสดิการการรักษาพยาบาลข้าราชการจากบิดา มารดา
- บุตรข้าราชการที่บรรลุนิติภาวะ (อายุ 20 ปีขึ้นไป หรือ สมรส) และไม่มี สิทธิประกันสุขภาพจากหน่วยงานรัฐ
- บุตรข้าราชการคนที่ 4 ขึ้นไป และไม่มีสิทธิประกันสุขภาพจากหน่วยงานรัฐ เช่น สิทธิข้าราชการคุ้มครองบุตรเพียง 3 คน
- ผู้ประกันตนที่ขาดการส่งเงินสมทบกองทุนประกันสังคม (หมดสิทธิประกันสังคม) • ข้าราชการที่เกษียณอายุหรือออกจากราชการโดยมิได้รับบำนาญ
- ผู้ประกอบอาชีพอิสระ และไม่ได้เป็นผู้ประกันตน กลุ่มคนเหล่านี้มีสิทธิ หลักประกันสุขภาพแห่งชาติตามกฎหมาย และสามารถลงทะเบียน เพื่อเลือกหน่วยบริการประจำ โดยไม่เสียค่าใช้จ่าย
คนไทยที่อาศัยอยู่ในต่างประเทศติดต่อกันมากกว่า 2 ปีขึ้นไป (ข้อมูล จากสำนักงานตรวจคนเข้าเมือง) หรือผู้ที่ลงทะเบียนเลือกตั้งในต่างประเทศ (ข้อมูลจากสำนักบริหารการทะเบียน กรมการปกครอง) จะสามารถใช้ สิทธิหลักประกันสุขภาพแห่งชาติ ต่อเมื่อเดินทางกลับมาอาศัยอยู่ ในประเทศไทยแล้ว โดยประชาชนติดต่อแก้ไขสถานะบุคคล ณ หน่วยบริการ ในระบบหลักประกันสุขภาพแห่งชาติที่อยู่ใกล้บ้าน
สำหรับปี 2566 ภายใต้แนวคิดของ 4C1W บำรุงราษฎร์ประกาศให้เป็นปีสู่ความเป็นเลิศ (Year of Excellence) โดยมีเสาหลักด้านความเป็นเลิศ 4 ประการ ได้แก่
- ความเป็นเลิศด้านบุคลากร (People Excellence)
- ความเป็นเลิศทางการแพทย์ (Clinical Excellence)
- ความเป็นเลิศด้านคุณภาพและความปลอดภัย (Quality and Safety Excellence)
- ความเป็นเลิศในการส่งเสริมประสบการณ์ผู้ป่วย (Patient Experience Excellence)
คอร์สเรียน Basic Barista กับทีมเทรนเนอมืออาชีพจาก Worldwide Coffee LINK
คอร์สเรียน Basic Barista กับทีมเทรนเนอร์ที่มีความเชี่ยวชาญระดับมืออาชีพจาก Worldwide Coffee - Basic Barista คอร์สเรียนสอนทักษะบาริสต้า กันแบบตัวต่อตัว ทำให้มั่นใจในทุกการสรรค์สร้างเครื่องดื่ม ออกมาได้อย่างลงตัว และมีเอกลักษณ์
- สอนทฤษฎี ความรู้เบื้องต้นเกี่ยวกับกาแฟ
- ทำความรู้จักวัตถุดิบ และ อุปกรณ์ต่าง ๆ
- สอนเทคนิคการสกัด Perfect Shot Espresso
- เทคนิคการแต่งหน้าฟองนมบนเครื่องดื่ม
- เทคนิคการสตีมนม ให้เนียนนุ่ม
- เทคนิคการใช้เครื่องชงกาแฟอย่างถูกวิธี
- สอนทำเครื่องดื่มเมนูร้อน / เย็น / ปั่น มากกว่า 20 เมนู
- สอนคำนวณต้นทุนการตั้งราคาขายต่อแก้ว
เหมาะสำหรับ:
- ผู้ที่สนใจอยากเรียนรู้การชงกาแฟหรือเครื่องดื่ม
- ผู้ที่ต้องการเปิดร้านกาแฟสด และผู้สนใจทั่วไป
หลักสูตร 1 วัน เรียนจบเปิดร้านขายได้ทันที
- ฟรี! หนังสือสูตรเครื่องดื่มจำนวน 1 เล่ม
โทร. 080-8676776
เขตดุสิต ห้องสมุดเพื่อการเรียนรู้ดุสิต
เปิดบริการ อังคาร-เสาร์ เวลา 8.30-19.30 น.
อาทิตย์ 9-17 น.
หยุดวันจันทร์ และวันหยุดนักขัตฤกษ์
ที่อยู่ ศูนย์ราชการกรุงเทพมหานคร(เกียกกาย 23 ถนน ทหาร แขวงถนนนครไชยศรี เขตดุสิต กรุงเทพมหานคร 10300
โทร. 022433158
แผนที่
google map
facebookโครงการ KMITL MIND ROOM
ก่อนหน้านี้ ฝ่ายกิจการนักศึกษาจะมีบริการให้คำปรึกษาทางด้านสุขภาพจิต ผ่านโครงการ KMITL MIND ROOM โดยมีนักจิตบำบัดคอยให้คำปรึกษาทั้งรูปแบบ onsite และ online สัปดาห์ละ 1 ครั้ง ซึ่งในทุกเดือนจะมีการประชาสัมพันธ์ทั้งช่องทาง Facebook และกระจายตามกลุ่ม LINE ของนักศึกษา สำหรับกรณีที่มีภาวะซึมเศร้าร่วมด้วย ก็จะมีการทำใบนัดส่งต่อไปรักษาต่อยังโรงพยาบาลพระจอมเกล้าเจ้าคุณทหารลาดกระบัง เป็นต้น
โครงการนี้จะเป็นอาคารสูง 25 ชั้นและมีชั้นใต้ดิน 2 ชั้น ตั้งอยู่บนพื้นที่ส่วนหนึ่งของด้านหน้าองค์การเภสัชกรรม มีขนาด 15 ไร่ 2 งาน 24 ตารางวา และมีพื้นที่ใช้สอยกว่า 278,000 ตารางเมตร ซึ่งมากกว่าพื้นที่ใช้สอยของอาคารสมเด็จพระเทพรัตน์เกือบ 3 เท่า โดยคาดการณ์ว่าสามารถให้บริการผู้ป่วยนอกได้ถึง 2.5 ล้านครั้งต่อปี และให้บริการผู้ป่วยในได้ถึง 55,000 คนต่อปี ซึ่งคาดว่าจะแล้วเสร็จและเปิดให้บริการภายในปี พ.ศ 2571 (อีก 5 ปีข้างหน้า) และแม้จะได้รับเงินสนับสนุนจากภาครัฐบางส่วน แต่โครงการยังคงขาดงบประมาณด้านการก่อสร้างอาคารประมาณ 3,000 ล้านบาท และการจัดซื้ออุปกรณ์การแพทย์ทันสมัยที่มีมูลค่าสูงประมาณ 6,000 ล้านบาท
ด้านคู่รักต่างสัญชาติ อย่างคุณพุทธชาติ และคุณวิลมาร์ อาร์โนล์ด บินตรงมาจากประเทศเยอรมนี เพื่อมาทำศัลยกรรมดึงหน้าพร้อมกัน โดยการทำศัลยกรรมครั้งนี้ เป็นของขวัญแต่งงานครบรอบ 29 ปีของทั้งคู่
หาดคำสมบูรณ์ หรือบางแสนอีสาน


หาดคำสมบูรณ์ หรือบางแสนอีสานอยู่ในจังหวัดน้องใหม่จังหวัดบึงกาฬ จังหวัดที่ 77 ของไทยเป็นที่น่าจับตามองในแง่ของสถานที่ท่องเที่ยวทั้งเชิงศาสนาและวัฒนธรรมการท่องเที่ยวเชิงนิเวศ อยู่ในพื้นที่ตำบลบึงโขงหลงอยู่ หมู่ที่ 3 บ้านคำสมบูรณ์ ตำบลบึงโขงหลง อำเภอบึงโขงหลง จังหวัดบึงกาฬ เป็นสถานที่ท่องเที่ยวที่น่าประทับใจมีร้านค้ามากมายอาหารอร่อย เช่น ปลาเผากุ้งเผา แปะซะปลา แจ่วฮ้อน ยำรสเด็ด กุ้งเต้น ฯลฯ มีซุ้มไพรหญ้าให้นั่งริมน้ำหาดทรายขาว บรรยากาศดี สดชื่นเย็นสบาย เมื่อนั่งที่ซุ้มมองดูน้ำใสสะอาดจะเห็นฝั่งหมู่บ้านในเขตตัวอำเภอบึงโขงหลงและเห็นภูลังกาตั้งตระหง่านน่าเกรงขาม เขียวชอุ่มไปด้วยต้นไม้และหินผาสวยงามนักท่องเที่ยว จุดเด่นของหาดคำสมบูรณ์ คือ การมีธรรมชาติป่าไม้โอบล้อมแหล่งน้ำขนาดใหญ่ อุดมไปด้วยความสมบูรณ์ทางธรรมชาติ มีภูเขาขนาดกลางอยู่ด้านหน้านอกจากนั้น ยังมีบริการเหมือนทะเลทั่วไป คือ สามารถเช่าอุปกรณ์ทางน้ำลงเล่นน้ำได้ตลอดทั้งวันไม่ว่าจะเป็นห่วงยางเรือกล้วยและอีกมากมาย นักท่องเที่ยวส่วนใหญ่ที่มาเที่ยวที่นี้ ถ้าหากเป็นเด็กก็จะลงเล่นน้ำ แต่ถ้าหากเป็นกลุ่มวัยรุ่นคนทำงานก็จะนิยมมานอนอาบแดดหรือไม่ก็ทานอาหาร เป็นพื้นที่ชุ่มน้ำเขตห้ามล่าสัตว์ป่า และเป็นพื้นที่ชุ่มน้ำลำดับที่ 2 ของประเทศไทยเป็นพื้นที่ชุ่มน้ำที่มีความสำคัญระดับนานาชาติ (Ramsar Site อันดับที่1098 ) ตั้งอยู่ในพื้นที่ของสองอำเภอคือเซกาและบึงโขงหลง
ศาล 100 ปี ปู่อือลือ พระตำหนักปู่อือลือ วัดโศกโพธิ์ LINK
ตามตำนานปู่อือลือที่ข้องเกี่ยวกับบึงโขงหลงนั้น เชื่อว่า เกิดจากการล่มเมืองของพญานาค ซึ่งเกิดจากความรักที่ไม่สมหวังระหว่างพญานาคกับมนุษย์ ทำให้เมืองที่เจริญรุ่งเรืองล่มสลาย บริเวณแห่งนี้เดิมเป็นที่ตั้งเมือง ชื่อ รัตพานคร มี พระอือลือราชา เป็นผู้ครองนคร มเหสีชื่อ นางแก้วกัลยา มีพระธิดาชื่อ พระนางเขียวคำ ต่อมาได้อภิเษกสมรสกับพระเจ้าสามพันตา มีพระโอรสชื่อ เจ้าชายฟ้ารุ่ง ซึ่งเป็นผู้ที่มีความเฉลียวฉลาด มีความรอบรู้ และมีรูปงามด้วย ขณะประสูติมีท้องฟ้าสว่างไสว
ต่อมาได้อภิเษกสมรสกับ นาครินทรานี ซึ่งเป็นพระธิดาของพญานาคราชแห่งเมืองบาดาล ที่แปลงกายเป็นมนุษย์ การอภิเษกสมรสจัดกันอย่างมโหฬาร ทั้งเมืองบาดาล และเมืองมนุษย์ (รัตพานคร) ทำอยู่ 7 วัน 7 คืน เพื่อเป็นการสร้างสัมพันธไมตรีระหว่างพญานาคราช กับ พระเจ้าอือลือราชา ในโอกาสนี้ด้วย
ทั้งสองอยู่กินกันมาเป็นเวลา 3 ปี ก็ไม่สามารถจะมีผู้สืบสายสกุลได้ (เพราะธาตุมนุษย์กับนาค) จึงทำให้เกิดความเศร้าโศกเสียใจกับทั้งสอง ต่อมาเจ้าหญิงนาครินทรานี ล้มป่วยลง ทำให้ร่างกายของนางที่เป็นมนุษย์กลายเป็นนาคตามเดิม โดยข่าวนี้ได้แพร่สะพัดออกไปทั่วกรุงรัตพานคร และถึงแม้นางจะร่ายมนตร์กลับเป็นมนุษย์ ประชาชนและพระเจ้าอือลือก็ไม่พอใจ จึงได้ขับไล่นางนาครินทรานีกลับสู่เมืองบาดาลดังเดิม โดยได้แจ้งให้พญานาคราชมารับตัวกลับ ก่อนกลับพญานาคราช ได้ขอเครื่องกกุธภัณฑ์ของตระกูลคืน แต่พระเจ้าอือลือราชาไม่สามารถคืนให้ได้ เนื่องจากนำไปแปรสภาพเป็นอย่างอื่น ทำให้พญานาคราชกริ้วมาก และประกาศว่าจะทำลายเมืองรัตพานคร และจะเหลือเอาไว้เพียง 3 วัดเท่านั้น
หลังจากพญานาคกลับไป ในตอนกลางคืน พญานาคราชได้ยกไพร่พลมาถล่มเมืองรัตพานคร และประชาชนก็ไม่มีใครรอดพ้นจากฤทธิ์นาคได้ พอนางนาครินทรานีทราบข่าว ก็ขึ้นมาตามหาเจ้าชายฟ้ารุ่ง จนถึงแม่น้ำสงครามก็ไม่พบ จึงกลับเมืองบาดาล เมืองรัตพานครได้ถล่มเป็น "บึงหลงของ" ต่อมานานเข้าคำพูดก็กลายเป็นโขงหลง และวัดที่เหลือ 3 วัด ก็คือ วัดดอนแก้ว (วัดแก้วฟ้า) วัดดอนโพธิ์ (วัดโพธิสัตว์) และ วัดดอนสวรรค์ (วัดแดนสวรรค์) ทางที่นางนาครินทรานีตามหาเจ้าชายฟ้ารุ่ง คือ ห้วยน้ำเมา (เมารัก)
ส่วนพระอือลือราชา ไม่ได้สิ้นพระชนม์ไปกับเหตุการณ์นี้ด้วย แต่ถูกพระยานาคราชจับตัวไว้ พร้อมกับสาปให้พระอือลือราชากลายร่างเป็นนาค เฝ้าอยู่ในบึงโขงหลงชั่วนิรันดร์ จนกว่าจะมีเมืองเกิดใหม่ในดินแดนแห่งนี้ จึงจะล้างคำสาปของพระยานาคราชได้
วัดพระธาตุโบอ่อง อ.ทองผาภูมิ เจดีย์ศักดิ์สิทธิ์เก่าแก่ กลางทะเลสาป ที่ต้องล่องเรือเข้าไปเท่านั้น LINK
พระธาตุโบอ่อง ตั้งอยู่บริเวณบ้านโบอ่อง ในพื้นที่อ่างเก็บน้ำเขื่อนวชิราลงกรณ์ เป็นหนึ่งในหมู่บ้านในตำบลปิล็อค จ.กาญจนบุรี การเดินทางเข้าถึง ต้องนั่งเรือไปยังเกาะโบอ่องเท่านั้น
เจดีย์พระธาตุโบอ่อง เป็นเจดีย์ศักดิ์สิทธิ์เก่าแก่ ตั้งอยู่บนเขาเล็กๆ กลางทะเลสาป
เป็นศูนย์กลางของหมู่บ้านชาวกะเหรี่ยงพุทธ และชาวมอญ ในละแวกพื้นที่นั้นมายาวนาน จัดเป็นสถานที่และศาสนสถาน สุด unseen ที่สุดแห่งหนึ่งของประเทศไทยเลยทีเดียว
เจดีย์พระธาตุโบอ่อง มีลักษณะเป็นเจดีย์ทรงมอญ ความสูง 6 เมตร ฐานกว้างประมาณ 3x3 เมตร สร้างอยู่บนยอดเขาหินปูนเล็ก ๆ ที่มีบึงน้ำใหญ่ล้อมรอบ ในบึงมีบัวขึ้นอยู่รายล้อม และมีนกน้ำนานาชนิด ไม่มีข้อมูลแน่ชัดว่า เจดีย์พระธาตุโบอ่องสร้างมาตั้งแต่สมัยใด ข้างองค์พระธาตุ มีหอระฆังขนาดเล็ก ที่มีระฆังแขวนอยู่ ชาวบ้านเล่าต่อกันมาว่า เป็นระฆังที่พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว (รัชกาลที่ 5) ได้พระราชทานไว้ให้แขวนคู่กับพระธาตุโบอ่องแห่งนี้
เจดีย์พระธาตุโบอ่อง เป็นสิ่งศักดิ์สิทธิ์ที่เป็นที่เคารพของชาวบ้านในหมู่บ้าน มีเรื่องเล่าต่อ ๆ กันมาว่า ครั้งหนึ่งเคยมีผู้หญิงเดินข้ามสะพาน เพื่อขึ้นไปบนยอดเขา ทำให้น้ำในบึงที่อยู่บริเวณโดยรอบนั้นเหือดแห้งหายไป จึงเกิดเป็นความเชื่อของชาวบ้าน ที่ต้องออกกฎว่า "ห้ามผู้หญิงเดินข้ามสะพาน เพื่อเข้าสู่เขตพระธาตุโดยเด็ดขาด" หากผู้ใดฝ่าฝืนไม่ปฏิบัติตาม ว่ากันว่าบุคคลผู้นั้นจะต้องมีอันเป็นไปต่างๆนานา (***เป็นความเชื่อส่วนบุคคล โปรดใช้วิจารญาณ***) โดยทุกวันขึ้น 15 ค่ำ เดือน 4 ของทุกปี จะมีประชาชนชาวบ้านที่เคารพศรัทธา เดินทางไปนมัสการเจดีย์พระธาตุโบอ่องแห่งนี้เป็นจำนวนมาก
งานฉลองอนุสาวรีย์เจ้าพ่อพญาแล งานบุญฉลองข้าวใหญ่ เทศกาลไหมและของดีบ้านเขว้า
งานฉลองอนุสาวรีย์เจ้าพ่อพญาแล ประจำอำเภอบ้านเขว้า และ งานบุญฉลองข้าวใหญ่ ส่งเสริมการท่องเที่ยวเทศกาลไหมและของดีบ้านเขว้า ประจำปี 2566 วันที่ 1-5 กุมภาพันธ์ 2566 ณ บริเวณที่ว่าการอำเภอบ้านเขว้า จังหวัดชัยภูมิ
มหาเทพครุฑาราชาบดี วัดประยงค์กิตติวนาราม กรุงเทพฯ
สัญลักษณ์โดดเด่นไม่เหมือนแห่งใดในไทย ณ วัดประยงค์กิตติวนาราม คือ “มหาเทพครุฑาราชาบดี” พญาครุฑองค์ใหญ่ กายแดงชาดเปล่งปลั่ง ในเครื่องทรงสีทองเปล่งประกาย ทรงพลานุภาพยิ่งใหญ่นัก ประทับหน้าโบสถ์จตุรมุขสีครีมสง่า ดุจเทวาพิทักษ์องค์พระประธานแห่งพระพุทธศาสนา อันได้แก่ องค์ “พระศรีอริยเมตไตรย” ความสูง 15 เมตร ปิดทองทองคำแท้ทั้งองค์ ผู้ได้รับการขนานนามว่าเป็น “หลวงพ่อสำเร็จสมปรารถนา” ที่บรรดาความสำเร็จให้สาธุชนผู้ศรัทธามานักต่อนัก
วัดประยงค์กิตติวนาราม หรือ "วัดหลวงพ่อเพชร" เป็นวัดราษฎร์สังกัดคณะสงฆ์ฝ่ายมหานิกาย ตั้งอยู่ในแขวงคลองสิบสอง เขตหนองจอก กรุงเทพมหานคร วัดประยงค์กิตติวนาราม หรือชาวบ้านเรียกว่า วัดหลวงพ่อเพชร ตั้งเป็นวัดเมื่อวันที่ 31 พฤษภาคม พ.ศ. 2553 ได้รับพระราชทานวิสุงคามสีมาเมื่อวันที่ 15 มกราคม พ.ศ. 2557 แต่เดิมบริเวณตั้งวัดเป็นป่ากกและบ่อปลา พระครูวินัยธรพชร ฐานกโร หรือพระอาจารย์เพชร ได้ธุดงค์มาปักกลด ณ สถานที่แห่งนี้เมื่อ พ.ศ. 2549 ต่อมาศิษยานุศิษย์ได้แนะนำให้รู้จักกับเจ้าของที่ดิน คือ คุณประยงค์ เหมกรณ์ และด้วยความเลื่อมใสศรัทธาจึงได้บริจาคที่ดินจำนวน 2 ไร่ เพื่อตั้งสำนักสงฆ์ โดยอุทิศส่วนกุศลให้กับคุณกิตติ เหมกรณ์ ซึ่งเป็นลูกชาย ด้วยเหตุนี้จึงใช้ชื่อว่า สำนักสงฆ์ประยงค์กิตติวนาราม ต่อมาได้รับสถานะเป็นวัด โบสถ์จตุรมุขสีครีม สร้างเสร็จราว พ.ศ. 2556 ภายในวัดยังมีสิ่งน่าสนใจอีกหลายอย่าง ให้เดิมชม เมื่อแวะเวียนไปท่องเที่ยวบูชากัน
River City Bangkok Gallery
ริเวอร์ ซิตี้ แบงค็อก เป็นแกลลอรี่ สุดฮอตในช่วงหลายปีที่ผ่านมา ด้วยการจัดงานศิลปที่สุดโดนใจหลายๆ งาน อาทิ งานของแอนดี้ วอร์ฮอล์ ซีรี่ยส์งานอาร์ตยุคเรอเนซองส์แบบจัดเต็ม งานแสดงแสงสีสุดล้ำ และ ฯลฯ ที่เป็นกระแสในหมู่เยาวชนรุ่นใหม่ไม่น้อย สำหรับปี 2023 ริเวอร์ ซิตี้ แบงค็อก "ยังคงคัดสรรงานศิลปะ แอนทีค และไลฟ์สไตล์อันดีเยี่ยมเพื่อต้อนรับทุกท่านที่มาเยือน ขอให้ปีใหม่นี้เป็นปีที่เต็มไปด้วยความสุข ความหวังสำหรับการเริ่มต้นสิ่งใหม่ และต่อยอดสิ่งที่ได้ทำไว้ให้ประสบความสำเร็จ"
ริเวอร์ ซิตี้ แบงค็อก เปิดทำการทุกวัน เวลา 10.00 น. – 20.00 น.
YELO House
โกดังขนาดใหญ่ ริมคลอง ที่มีหนุ่มสาวแวะเวียนมาเยี่ยมเยือนไม่ขาด เยโล่เฮ้าส์ เหมาะกับการแฮงค์เอ้าทอดเวลาเอื่อยๆ ริมคลองมองเรือด่วนแล่นผ่าน จิบเครื่องดื่มเย็นอร่อยๆ ดูงานศิลป์ร่วมสมัย หรือจะมาใช้สเปซทำงานหรือพบปะก็ได้เหมือนกัน
YELO House อยู่ที่ ท้ายซอยเกษมสันต์ 1 แขวงวังใหม่ เขตปทุมวัน เปิดทุกวัน 10:00–19:00 น.
1. แนวโน้มในการใช้จ่ายลดลงถึง -4% เมื่อเทียบกับผลสำรวจเดือนธันวาคม 2565
การลดลงของความต้องการใช้จ่ายนี้เอง ทำให้เรามองเห็นถึงความระมัดระวังและรอบคอบของผู้คนในการใช้จ่ายมากยิ่งขึ้น โดยเฉพาะในกลุ่มคนวัย 50-59 ปี ที่มักครองอันดับ Top Spenders มาโดยตลอด ก็หันมาโฟกัสสิ่งของที่จำเป็น ชะลอการใช้จ่าย หลังจากได้จ่ายเพื่อสังสรรค์และให้รางวัลครอบครัวในช่วงเทศกาลปีใหม่ที่ผ่านมาแล้วอย่างเต็มที่
บลู #JFF2023
บลู #JFF2023
1 ชั่วโมง 47 นาที R:13+
©2021 “BLUE” Film Partners อุริตะ ผู้รักในการชกมวยทว่าขาดฝีมือ คาซึกิ ผู้เป็นรุ่นน้องของเขาที่หมายจะเป็นแชมป์ จิกะ เพื่อนสมัยเด็กที่คบหากับคาซึกิอยู่ ต่างคนต่างเก็บงำความรู้สึกเอาไว้ขณะที่แมทช์ใหญ่กำลังใกล้เข้ามา... ภาพยนตร์ดราม่าสะท้อนความเป็นมนุษย์ที่บอกเล่าเรื่องราวด้วยศิลปะการต่อสู้อันโหดร้ายอย่างการชกมวยว่าในชีวิตนี้ไม่มีใครจะเป็นชนะขาดไปเสียทุกครั้ง ผู้ชมจะต้องประทับใจกับการกำกับของผู้กำกับโยชิดะ เคย์สึเกะที่ถ่ายทอดความคิดที่เอ่อล้นที่ซ่อนไว้อยู่ในใจและการสภาพอารมณ์ของอุริตะที่แสดงโดยมัทสึยามะ เคนอิจิ นักแสดงหนุ่มชื่อดัง
รายงานจำนวนผู้เสียชีวิต
14 กุมภาพันธ์
CNN ระบุจำนวนผู้เสียชีวิตใน 2 ประเทศ มากกว่า 38,000 รายไปแล้ว เป็นตุรกี 31,643 ราย ซีเรีย 4,574 ราย
สำนักข่าว Anadolu รายงานว่า ทางการตุรกีสืบสวนผู้รับเหมาอาคาร 163 ราย ที่เกี่ยวโยงกับอาคารถล่ม บางส่วนถูกควบคุมตัว บางส่วนถูกจับกุมแล้ว บางคนถูกจับกุมขณะกำลังจะเดินทางโดยเครื่องบิน [
CNN]
13 กุมภาพันธ์
CNN ระบุจำนวนผู้เสียชีวิตใน 2 ประเทศ แตะ 34,000 รายไปแล้ว เป็นตุรกี 29,605 ราย ซีเรีย 4,574 ราย และคาดว่าจะยังเพิ่มขึ้นอีก หลังจากผ่าน 100 ชั่วโมงนับจากเกิดเหตุไปแล้ว การพบผู้รอดชีวิตเริ่มน้อยลง ขณะที่หน่วยกู้ชีพหลายทีมต้องยุติภารกิจในพื้นที่ประเทศซีเรีย จากความเสี่ยงทางการเมือง
ผู้นำอียู ประกาศให้ความช่วยเหลือตุรกีเต็มที่ หลังปธน.ตุรกีร้องขอล่าสุด ทั้งนี้มีทีมกู้ภัยจากกลุ่มประเทศในอียู 38 ทีมจาก 21 ประเทศ เจ้าหน้าที่รวม 1,651 คน และสุนัข 106 ตัว ร่วมภารกิจกู้ภัยในตุรกีขณะนี้
ขบวนรถลำเลียงสิ่งของ 22 คัน ของหน่วยงานของ UN มุ่งหน้าเข้าซีเรียอย่างต่อเนื่อง เพื่อเร่งช่วยผู้ประสบภัย ประกอบด้วย UNHCR 12 คัน WHO 7 คัน UNFPA 2 คัน และ UNICEF อีก 1 คัน บรรทุกสิ่งของ เต็นท์สนาม และทุกสิ่งที่จำเป็น
12 กุมภาพันธ์
21.45 PM CNN ระบุผู้เสียชีวิตทั้งสองประเทศเกิน 33,000 รายไปแล้ว ตุรกี 29,605 ราย ซีเรีย 3,576 ราย ด้านกลุ่ม White Helmets ที่ดำเนินการค้นหาในซีเรีย ประกาศหยุดการค้นหาแล้ว
สนามบินในเมือง Hatay กลับมาใช้งานได้แล้ว หลังแผ่นดินไหวทำรันเวย์เสียหาย ล่าสุดซ่อมแซมแล้ว หลังจากเริ่มซ่อมเมื่อวันที่ 8 ก.พ. หลังจากนี้การลำเลียงความช่วยเหลือต่างๆ จะทำได้ดีขึ้น
ทีมกู้ภัยจากออสเตรียกลับมาปฏิบัติหน้าที่อีกครั้งหลังได้รับการรับรองจากทางการตุรกีด้านความปลอดภัย
กลับกัน ทีมงานกู้ภัยจากอิสราเอล ถอนตัวและออกจากตุรกีแล้ว หลังตกเป้าหมายของถูกคุกคาม ในการทำงานบริเวณพรมแดนซีเรีย
11 กุมภาพันธ์
BBC ระบุผู้เสียชีวิตเกิน 28,000 รายไปแล้ว ความหวังในการพบผู้รอดชีวิตใต้ซากอาคารถล่มเริ่มเลือนลาง หลังย่างเข้าสู่วันที่ 6 หลังเหตุการณ์แผ่นดินไหว
รองปธน.ตุรกี ระบุว่า ผู้เสียชีวิตฝั่งตุรกี จำนวน 24,617 ราย
ขณะที่ AFP ระบุมีผู้เสียชีวิตฝั่งซีเรีย ราว 3,500 ราย
ทีมกู้ภัยเยอรมัน และออสเตรีย ระงับปฏิบัติการชั่วคราว เพื่อดูสถานการณ์ หลังมีแถลงการณ์จากกองทัพออสเตรียระบุว่าเกิดการปะทะระหว่างกองกำลังไม่ระบุสังกัด ในเมือง Hatay ที่ทำให้หน่วยกู้ภัยของออสเตรียต้องหลบเข้าหาที่พักพิงชั่วคราวของหน่วยงานระหว่างประเทศ เหตุการณ์ที่เกิดขึ้น บ่งบอกถึงความเสี่ยงที่เพิ่มขึ้นจากความขัดแย้งในพื้นที่ ที่ส่งผลโดยตรงต่อการช่วยเหลือจากนานาชาติ
ขณะที่คาดกันว่า ปัญหาที่น่าเป็นห่วงจากนี้คือ อาหารขาดแคลน และมีข่าวการจับกุมพวกลักลอบปล้นสะดมภ์และมีอาวุธปืน 48 คน กับเงิน เครื่องเพชร ที่ปล้นมา ปธน.ตุรกีประกาศกร้าวจะใช้กฏหมายเด็ดขาดจัดการพวกแหกกฏสร้างความเดือดร้อน หลังจากมีการประกาศภาวะฉุกเฉินในพื้นที่ประสบภัยไปแล้ว
ปาฏิหารย์ยังคงมีตราบที่ยังมีหวัง หลังจากล่าสุดมีการช่วย 5 คนในครอบครัวเดียวกัน เป็นพ่อแม่ ลูกสาว 2 คน และลูกชาย ออกมาจากซากอาคาร ในเมือง Gaziantep ช่วย 2 สาวพี่น้องได้ที่เมือง Antakya ส่วนในเมือง Hatay ก็ช่วยเด็ก 7 ขวบออกมาได้หลังติดอยู่นาน 132 ชั่วโมง
ชวนสาย TikTok ส่งประกวดคลิปสั้น
ขอเชิญร่วมกิจกรรมส่งประกวดคลิปสั้น งานเบญจมาศบานในม่านหมอก ครั้งที่ ๒๑ ประจำปี ๒๕๖๖ Winter Of Love @ Wangnamkhiao ฤดูหนาวแห่งความรักที่วังน้ำเขียว
วิธีการคุมกำเนิดแบบไหนที่เหมาะกับคุณ?
วิธีการคุมกำเนิดแบบไหนที่เหมาะกับคุณ?
✔️ถุงยางอนามัย ใช้ได้ทุกโอกาส เหมาะสำหรับผู้ที่ไม่ได้มีเพศสัมพันธ์เป็นประจำ
✔️ยาเม็ดคุมกำเนิด / แผ่นแปะคุมกำเนิด / วงแหวนคุมกำเนิด เหมาะกับการคุมกำเนิดชั่วคราว
✔️ยาเม็ดคุมกำเนิดฉุกเฉิน ใช้ในกรณีฉุกเฉินเท่านั้น คือหลังมีเพศสัมพันธ์แล้วพบว่าลืมคุมกำเนิด หรือถุงยางแตก
✔️ทำหมันหญิง - ชาย เหมาะสำหรับผู้มีบุตรเพียงพอแล้ว
✔️ยาฉีดคุมกำเนิด / ห่วงอนามัย เหมาะสำหรับต้องการคุมกำเนิดที่มีประสิทธิภาพในระยะที่ยาวนานขึ้น ลืมกินยา หรือคู่สมรสที่มีบัตรเพียงพอแต่ไม่ตัดสินใจทำหมัน
วาเลนไทน์นี้ Sex Safe ปลอดภัย เลือกวิธีคุมกำเนิดให้เหมาะกับคุณ เพื่อสุขภาพที่ดี ไม่เสี่ยงต่อการติดเชื้อโรคทางเพศสัมพันธ์
อันดับ 2. อุทยานแห่งชาติดอยอินทนนท์ จ.เชียงใหม่
อุทยานแห่งชาติดอยอินทนนท์ จ.เชียงใหม่ หรือ ดอยหลวงที่ชาวบ้านดั้งเดิมเรียกกัน (หมายถึงดอยที่ใหญ่มากนั่นเอง) ที่เป็นจุดหมายปลายทางของนักเดินทางท่องเที่ยวทั่วทุกสารทิศมายาวนาน ด้วยการที่มีจุดยอดดอยอินทนนท์ที่ชื่อว่าสูงที่สุดของประเทศ ที่ใครๆ ก็อยากมาพิชิต ที่ระดับความสูง 2,565.3341 เมตร พร้อมกับการได้มาสัมผัสความหนาวเย็นยะเยียบของไอหมอกและน้ำค้างแข็งอันมีชื่อเสียงบนดอยอินทนนท์แห่งนี้
จุดเด่นอื่นๆ ของอุทยานแห่งชาติดอยอินทนนท์ จ.เชียงใหม่ ได้แก่ น้ำตกแม่ยะ น้ำตกแม่กลาง น้ำตกวชิรธาร น้ำตกสิริภูมิ จุดชมวิวกิ่วแม่ปาน อ่างกา เส้นทางเดินศึกษาธรรมชาติ นาขั้นบันได บ้านแม่กลางหลวง สำหรับนักดูนก ดอยดินทนนท์ คือสวรรค์ที่แท้จริง เพราะที่นี่จะมีทั้งนกประจำถิ่นและนกอพยพมากกว่า 380 ชนิดที่สามารถพบได้บนดอยอินทนนท์ ใครตั้งใจมาดูดาว สามารถไปที่หอดูดาวเฉลิมพระเกียรติฯ 7 รอบพระชนมพรรษา ซึ่งเป็นหอดูดาวแห่งชาติของประเทศไทย และเป็นหอดูดาวขนาดใหญ่ที่สุดในภูมิภาคเอเชียตะวันออกเฉียงใต้ ป่าดงดิบในพื้นที่อุทยานแห่งชาติดอยอินทนนท์ได้รับการยกย่องว่ามีความสมบูรณ์มากที่สุดของภาคเหนือและของประเทศไทย และเป็นต้นกำเนิดของแม่น้ำปิงนั่นเอง และสุดท้ายเชิญชวนแวะชมสถานีวิจัยโครงการหลวงดอยอินทนนท์ ซึ่งเป็นสถานีวิจัยดอกไม้เมืองหนาว - ซื้อของฝากของที่ระลึก บนดอยอินทนนท์มีตลาดเล็ก ๆ ที่ชาวบ้านนำสินค้าท้องถิ่นมาขาย โดยเฉพาะผลไม้แปรรูปที่นักท่องเที่ยวสามารถซื้อเป็นของฝาก
หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา สงขลา LINK
หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา สงขลา (Regional Observatory for Public, Songkhla) ตั้งอยู่ที่ ต.เขารูปช้าง อ.เมือง จ.สงขลา เปิดให้บริการในปี 2562 เปิดทุกวันยกเว้นวันจันทร์
เวลาทำการ:
วันจันทร์ ปิดทำการ
วันอังคาร 8:30–16:00
วันพุธ 8:30–16:00
วันพฤหัสบดี 8:30–16:00
วันศุกร์ 8:30–16:00
วันเสาร์ 8:30–22:00
วันอาทิตย์ 8:30–19:00
“ความคิดสร้างสรรค์”ต่อยอดคุณค่า สร้างนวัตกรรมใหม่


อาจารย์มาร์ค เล่าต่อว่า การที่นักศึกษาของคณะได้เข้าร่วม Bangkok Design weekทำให้นักศึกษาได้ลงสนามประสบการณ์จริง เรียนรู้วิธีคิด ลงมือทำ การแก้ปัญหา การใช้ความคิดสร้างสรรค์ สามารถนำไปปรับใช้พร้อมลงสนามการทำงานจริงหลังจากเรียนจบ ปูทางให้พร้อมกระโดดเข้าสู่สนามการทำงานได้อย่างรวดเร็ว คณะฯ เน้นการสอนให้นักศึกษาตีโจทย์สินค้าหรือบริการที่ได้รับ และสื่อสารออกมาในรูปแบบงานคิดสร้างสรรค์ เน้นสร้างคุณค่าและมูลค่าใหม่จากสินค้าหรือบริการเดิม
หัวใจสำคัญของ Design Thinking คือ การนำความคิดสร้างสรรค์มาผ่านกระบวนการออกแบบ ด้วยการนำเอา“คุณค่า”มรดกวัฒนาธรรมชุมชน มาต่อยอดเป็นนวัตกรรม ทั้งที่ไม่ใช้เทคโนโลยี และใช้เทคโนโลยีเขามาเป็นตัวสนับสนุน ผ่านการนำเสนอรูปแบบใหม่ เช่น นักศึกษามีประสบการณ์สร้างมูลค่า ว่าวปักเป้า หัวสิงโต โมเดลไม้ ของดีชุมชนตลาดพูล ด้วยการถอดประสบการณ์ความชำนาญ ความปราณี เช่น ออกแบบเป็นเสื้อ โมเดลจำลอง หรือจัดกิจกรรมเวิร์คช็อปให้คนได้มีส่วนร่วมและตระหนักถึงมูลค่าทางภูมิปัญญา จากเดิม ว่าว ขายสปอร์ตเซอร์ หัวสิงโต รับจ้างเชิดตามงาน โมเดลไม้ประกอบแล้วเข็นขายตามงานต่างๆ
อย่าหลงเชื่อ!! โฆษณาผลิตภัณฑ์ WIBERRY อ้างสรรพคุณรักษาโรคตา LINK
พบการโฆษณาผลิตภัณฑ์ “WIBERRY” เลข อย. 11-106353-5-0018 ทางเว็บไซต์ระบุสรรพคุณ “...การคิดค้นสูตรสากลที่มีประสิทธิภาพเป็นอย่างมากในเรื่อง ของ: กระจกตา (กระจกตาขาวขุ่น การเกิดแผลเป็น) เส้นประสาทตา (ต้อหิน) จอประสาทตา (โรคจุดภาพชัดที่ จอตาเสื่อมในผู้สูงอายุ เบาหวานขึ้นตา สายตาสั้น สายตายาว) เลนส์แก้วตา (ต้อกระจก) แล้วหมอก็ทำได้ สำเร็จ!...”
สำนักงานคณะกรรมการอาหารและยา (อย.) ได้ตรวจสอบข้อเท็จจริง พบว่า เป็นข้อมูลลวง เนื่องจากการโฆษณาผลิตภัณฑ์ดังกล่าว จัดเป็นการโฆษณาแสดงคุณประโยชน์ คุณภาพ หรือสรรพคุณของอาหารอันเป็นเท็จ หรือเป็นการหลอกลวงให้เกิดความหลงเชื่อโดยไม่สมควร และไม่ได้รับอนุญาตโฆษณากับ อย. สำหรับผลิตภัณฑ์เสริมอาหาร อย.ไม่อนุญาตให้โฆษณาไปในทิศทางที่เกี่ยวกับการรักษาโรคต่างๆ ส่วนเว็บไซต์ที่ทำการโฆษณา ไม่พบข้อมูลผู้โฆษณา พบเพียงวิธีการสั่งซื้อผลิตภัณฑ์จะต้องกรอกชื่อ หมายเลขโทรศัพท์ ของผู้ซื้อลงในเว็บไซต์ รวมทั้งเป็นเว็บไซต์ที่จดทะเบียนในต่างประเทศ หากเกิดปัญหาใด ๆ ในการบริโภคผลิตภัณฑ์จะไม่สามารถตามหาผู้รับผิดชอบได้ ดังนั้น จึงขอเตือนผู้บริโภคอย่าหลงเชื่อโฆษณาลักษณะนี้
ข้อแนะนำ
ขอแนะผู้บริโภคว่า นอกจากการให้ความสำคัญกับการตรวจสอบข้อมูลการขออนุญาตผลิตภัณฑ์ ซึ่งสามารถตรวจสอบได้ที่ www.fda.moph.go.th หรือผ่าน Line@FDAThai, Facebook : FDAThai แล้ว ควรพิจารณาเนื้อหาการโฆษณาของผลิตภัณฑ์ดังกล่าวด้วย อย่าหลงเชื่อโฆษณาที่โอ้อวดสรรพคุณเกินจริง โดยผู้บริโภคสามารถตรวจสอบว่าโฆษณาผลิตภัณฑ์อาหาร ยา และเครื่องมือแพทย์ ได้รับอนุญาตหรือไม่ผ่านทางหน้าเว็บไซต์ อย. หมวดบริการประชาชน ในหัวข้อสืบค้นใบอนุญาตโฆษณา กรณีมีปัญหาสุขภาพควรปรึกษาแพทย์เพื่อรับการรักษาที่ถูกวิธี ทั้งนี้ หากพบผลิตภัณฑ์ที่สงสัยว่าจะไม่ปลอดภัย ขอให้แจ้งร้องเรียนได้ที่สายด่วน อย. 1556 หรือสำนักงานสาธารณสุขจังหวัดทั่วประเทศ
งานไฟ The BlueSky Light Festival 2023 เขาค้อ
3.The Deal-Hunter #ชนะทุกแคมเปญ
The Deal-Hunter #ชนะทุกแคมเปญ ในการศึกษาตลอดทั้งปี จะมีกลุ่มคนที่พร้อมรอโปรโมชั่นหรือดีลสำคัญ เพื่อให้ได้ราคาที่คุ้มที่สุดเสมอ และมักเป็นกลุ่มที่ให้คะแนนความต้องการช้อปสูงมาก ถือเป็น 7% จากผลสำรวจ โดยคนกลุ่มนี้จะ “หาทั้งของ หาทั้งดีล” ยิ่งซับซ้อนยิ่งรู้สึกอยากเอาชนะ ซึ่งแบรนด์สามารถเติมเต็มความชอบท้าทายด้วยการสร้างพื้นที่ให้นักช้อปเป็น ผู้เล่น เสมือนการเล่นเกม หรือ ใช้ platform ที่มีอยู่เปิดพื้นที่ engage กับเหล่านักช้อปมือไวให้มาแชร์ tips and tricks ในการหาดีลพิเศษ และเป็นประโยชน์กับนักช้อปมือสมัครเล่นได้นำไปใช้ด้วย
อัตราความสำเร็จที่ร้อยละ 90 บ่งบอกถึงศักยภาพและคุณภาพของบำรุงราษฎร์
3. การปฏิบัติงานทางไกล (Remote Operations) ผ่านการทำงานร่วมกันออนไลน์ (Virtual Collaboration)
นี่เป็นหนึ่งในเทรนด์เทคโนโลยีด้านเฮลท์แคร์ที่ถูกนำมาใช้งานมากขึ้นหลังจากมีการแพร่ระบาดของโควิด-19 และปัจจุบันได้กลายเป็นเทคโนโลยีหลักในวงการเฮลท์แคร์ เนื่องจากขาดแคลนบุคลากรทางการแพทย์ที่มีประสบการณ์หรือมีความเชี่ยวชาญเฉพาะทางในพื้นที่ห่างไกลมากขึ้น
การทำงานร่วมกันแบบทางไกลยังมีประโยชน์ด้านการแพทย์อื่นๆ เช่น การดูแลผู้ป่วยฉุกเฉิน อย่างระบบ Tele-ICU (เทเล-ไอซียู) ช่วยส่งเสริมการดูแลผู้ป่วยวิกฤติถึงข้างเตียงผ่านการใช้เทคโนโลยีไม่ว่าสถานพยาบาลนั้นจะตั้งอยู่ที่ไหนก็ตาม โดยทีมแพทย์ผู้เชี่ยวชาญจากส่วนกลางสามารถตรวจติดตามอาการของผู้ป่วยวิกฤติ (ICU) แบบทางไกล ได้สูงสุดถึง 500 เตียงเพื่อสนับสนุนการทำงานของทีมบุคลากรในพื้นที่ โดยผสานเทคโนโลยีแสดงภาพและเสียง (Audio-visual technology), เทคโนโลยีการวิเคราะห์เชิงคาดการณ์ (Predictive analytics) และการแสดงผลข้อมูล (Data visualization) เพื่อให้มั่นใจว่าผู้ป่วยได้รับการดูแลอย่างทันท่วงทีเมื่อจำเป็น
สงกรานต์พัทยา Rolling Loud Thailand 2023 พัทยาระอุเดือด LINK
สงกรานต์พัทยาปีนี้ เดือดระอุแน่นอน เพราะเปิดบ้านจัดงาน Rolling Loud Thailand 2023 เทศกาลดนตรี Hip Hop ระดับโลกบนแผ่นดินไทย งานนี้ที่กองทัพศิลปินแรปเปอร์ก้องโลกจะยกทัพบุกไทย ใครจะต้านอยู่ 3 วันเต็ม 13-15 เมษายน ที่ เลเจนด์สยาม
Rolling Loud Thailand 2023 จะเกิดขึ้นในช่วงเทศกาลสงกรานต์ ระหว่างวันที่ 13-15 เมษายน 2566 ที่ Legend Siam เมืองพัทยา จังหวัดชลบุรี จะมาในรูปแบบเต็ม Music Festival ประกอบด้วย 2 เวทีใหญ่ ร่วมด้วย 66 ศิลปินระดับโลก จากประเทศสหรัฐอเมริกา สหราชอาณาจักร และเอเชีย จากประเทศเกาหลี ญี่ปุ่น สาธารณรัฐประชาชนจีน มาเลเซีย สิงคโปร์ กัมพูชา ย้ำมาตรฐานเทียบเท่าระดับโลก
Line Up ศิลปินกัน ฟิตร่างกายพร้อมกระโดดให้สุดแรงปล่อยจอยกับเซอร์ไพร์สุดพิเศษมากมาย ร่วมระเบิดความมันส์ อาทิ Cardi B, Chris Brown, Travis Scott, Lil Pump, Rick Ross, BIBI และอีกมากมาย ส่วนศิลปินไทย อาทิ Thaitanium, F.Hero, UrboyTJ, Youngohm, Twopee Southside, YOUNGOHM, FIIXD x 1MILL, WONDERFRAME, SPRITE, MINDSETMOB ฯลฯ
ซ้อมแผนรับมือเหตุวิวาทและความรุนแรงในโรงพยาบาล: คู่อริ บุก แผนกฉุกเฉิน บางโพ ทำร้ายผู้บาดเจ็บ
เขตปทุมวัน LINK
เขตปทุมวัน กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข ๕ จุฬาลงกรณ์ และศูนย์บริการสาธารณสุข 16 ลุมพินี จัดให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงลูกด้วยนม เช่น สุนัข แมว กระต่าย ฯลฯ เพื่อเป็นการป้องกันและควบคุมโรคพิษสุนัขบ้าในพื้นที่เขตปทุมวัน ติดต่อสอบถาม โทร. 02-2141044
ศ. นพ. กุลวี เนตรมณี เป็นแพทย์ด้านอายุรศาสตร์โรคหัวใจที่มีประสบการณ์การทำวิจัยและการรักษาอย่างต่อเนื่องยาวนาน ศ. นพ. กุลวี นับเป็นหนึ่งในแพทย์คนแรกของโลกที่ค้นพบสาเหตุของโรคใหลตาย หรือการตายระหว่างนอนหลับอย่างกะทันหัน นอกจากนี้ สถาบันโรคหัวใจบำรุงราษฎร์ ยังมีศูนย์หัวใจเต้นผิดจังหวะ (หรือ Arrhythmia Center) ที่นับว่าเป็นศูนย์ให้การรักษาภาวะหัวใจเต้นผิดจังหวะที่ดีที่สุดในโลก เนื่องจากทีมแพทย์ที่ศูนย์หัวใจเต้นผิดจังหวะ ทำวิจัยเรื่องนี้โดยเฉพาะและได้รักษาผู้ป่วยที่มีภาวะหัวใจเต้นผิดจังหวะด้วยการจี้หัวใจผ่านสายสวนในเคสที่ซับซ้อนหลายเคส
กสทช.ย้ำให้ประชาชนระวังมิจฉาชีพหลอกลวง
นายไตรรัตน์ วิริยะศิริกุล รักษาการแทน เลขาธิการ กสทช. กล่าวว่า สำนักงาน กสทช. ได้แจ้งเตือนให้ประชาชนระวังมิจฉาชีพหลอกลวงประชาชนด้วยวิธีโอนเงิน หรือดูดเงินประชาชนจากบัญชีธนาคารผ่านโซเซียล ซึ่งมิจฉาชีพจะอ้างเป็นเจ้าหน้าที่ของรัฐทำให้ประชาชนหลงเชื่อ โดยข้อมูลของกระทรวงดิจิทัลเพื่อเศรษฐกิจและสังคม พบว่า มีคดีออนไลน์วันละ 800 คดี ต้องเร่งดำเนินการตามกหมาย และขณะนี้ได้ร่าง พ.ร.บ.การรักษาความมั่นคงปลอดภัยทางไซเบอร์ไว้แล้ว จะเร่งดำเนินการให้มีผลบังคับใช้โดยเร็วที่สุด เมื่อประกาศใช้แล้วจะให้อำนาจตำรวจไซเบอร์ในการจับผู้กระทำความผิดและสามารถทำร่วมกับสถาบันการเงินได้ ซึ่งคิดว่าจะทำให้คดีลดน้อยลง
โดยหน่วยงานที่มักจะถูกแอบอ้าง คือ กรมสรรพากร กรมศุลกากร กรมสรรสามิต กระทรวงการคลัง ซึ่งกระทรวงการคลัง ยืนยันว่าไม่มีนโยบายให้เจ้าหน้าที่ติดต่อคืนภาษีผ่านไลน์หรือระบบอื่นๆ อีกทั้งกำลังร่าง พ.ร.ก.อาชญากรรมทางเทคโนโลยี ให้กระทรวงดีอีเอส กสทช. ส่งเอสเอ็มเอส แจ้งเตือนประชาชน และหากประชาชนไม่แน่ใจหรือมีข้อสงสัย สามารถแจ้งเบาะแสและขอความช่วยเหลือ ได้ที่เบอร์ 1441 สายด่วนตำรวจไซเบอร์ หรือสอบถามมาที่สำนักงาน กสทช. Call Center หมายเลขโทรศัพท์ 1200 (ฟรีไม่มีค่าใช้จ่าย)
1.ประเภทแหล่งท่องเที่ยว (Attraction) LINK
แบ่งประเภทรางวัลย่อยออกเป็น 6 สาขา ดังนี้
1. สาขาแหล่งท่องเที่ยวเพื่อการผจญภัย (Outdoor & Adventure Activities)
2. สาขาแหล่งท่องเที่ยวเพื่อการเรียนรู้ (Learning & Doing)
3. สาขาแหล่งท่องเที่ยวธรรมชาติ (Nature & Park)
4. สาขาแหล่งท่องเที่ยวนันทนาการและความบันเทิง (Recreation & Entertainment)
5. สาขาแหล่งท่องเที่ยวประวัติศาสตร์และวัฒนธรรม (Historical & Culture)
6. สาขาแหล่งท่องเที่ยวชุมชน (Local & Community)
นิยาม
1. สาขาแหล่งท่องเที่ยวเพื่อการผจญภัย (Outdoor & Adventure Activities) - กิจกรรมหรือ สถานที่ท่องเที่ยวที่มนุษย์พัฒนาขึ้นหรือดัดแปลงธรรมชาติอย่างกลมกลืนและเป็นมิตรกับสิ่งแวดล้อม เพื่อเน้นให้นักท่องเที่ยวหรือผู้ใช้บริการได้ดำเนินกิจกรรมที่ท้าทาย ตื่นเต้น ได้รับประสบการณ์แปลกใหม่ สนุกสนานเพลิดเพลิน เช่น แหล่งหรือบริเวณที่ปีนหน้าผา ดำน้ำ ล่องแก่ง แคนู คายัก Bungee Jumping และอุทยานผจญภัย
2. สาขาแหล่งท่องเที่ยวเพื่อการเรียนรู้ (Learning & Doing) - กิจกรรมหรือสถานที่ท่องเที่ยว ที่สร้างหรือพัฒนาขึ้น เพื่อเน้นการเสริมสร้างความเข้าใจเกี่ยวกับองค์ความรู้กับกิจกรรมหรือสถานที่ ท่องเที่ยว เพื่อส่งเสริมพัฒนาศักยภาพและการเรียนรู้ให้แก่นักท่องเที่ยว เช่น กิจกรรม workshop เพื่อส่งเสริมการท่องเที่ยว พิพิธภัณฑ์ และศูนย์การเรียนรู้ในรูปแบบต่าง ๆ
3. สาขาแหล่งท่องเที่ยวธรรมชาติ (Nature & Park) - สถานที่หรือบริเวณพื้นที่ทางบกหรือ ทางทะเลที่มีความเป็นธรรมชาติและเปิดให้สาธารณชนเข้ามาใช้ประโยชน์เพื่อการท่องเที่ยวหรือพักผ่อน หรือสัมผัสเรียนรู้เกี่ยวกับสิ่งแวดล้อมตามธรรมชาติหรือระบบนิเวศและความหลากหลายทางชีวภาพ เช่น อุทยานแห่งชาติทางบกและทางทะเล วนอุทยาน เขตรักษาพันธุ์สัตว์ป่า เขตห้ามล่าสัตว์ป่า แหล่งน้ำ ลำธาร ถ้ำ น้ำตก ลำน้ำ ทะเลสาบ โป่งพุร้อน แหล่งโบราณชีววิทยา ป่าชายเลน เกาะ ชายหาด แนวปะการัง และธรรมชาติในท้องทะเล
4. สาขาแหล่งท่องเที่ยวนันทนาการและความบันเทิง (Recreation & Entertainment) - กิจกรรมหรือสถานที่ท่องเที่ยวที่สร้างหรือพัฒนาขึ้น เพื่อเน้นการให้ความบันเทิงหรือความสนุกสนาน แก่นักท่องเที่ยว เช่น สวนสนุก สวนน้ำ การแสดงต่าง ๆ ตลาดน้ำ และตลาดย้อนยุค
5. สาขาแหล่งท่องเที่ยวประวัติศาสตร์และวัฒนธรรม (Historical & Culture) - สถานที่ที่เป็น แหล่งประวัติศาสตร์ โบราณคดี หรือศาสนสถาน และอาจรวมถึงสถานที่ที่มีการจัดตกแต่งหรือรวบรวม งานด้านศิลปะหรือวัฒนธรรมของประเทศหรือของท้องถิ่น โดยมีการจัดการเพื่อเปิดให้สาธารณชนเข้ามาใช้ เพื่อการท่องเที่ยวและศึกษาหาความรู้ แหล่งท่องเที่ยวประเภทนี้อาจอยู่ในความรับผิดชอบดูแลโดย หน่วยงานภาครัฐหรือภาคเอกชนก็ได้ เช่น อุทยานประวัติศาสตร์ แหล่งโบราณคดี อนุสาวรีย์ ศาสนสถาน กำแพงเมือง คูเมือง
6. สาขาแหล่งท่องเที่ยวชุมชน (Local & Community) - ชุมชนในเขตเมืองหรือชุมชนในท้องถิ่น ที่เปิดให้มีกิจกรรมการท่องเที่ยวแก่นักท่องเที่ยวเพื่อจะได้สัมผัสเรียนรู้เกี่ยวกับวัฒนธรรม ประเพณี วิถีชีวิตหรืออัตลักษณ์ของชุมชน เป็นเครื่องมือที่เสริมสร้างความเข้มแข็งของชุมชน โดยมีสมาชิกของ ชุมชนเป็นผู้กำหนดทิศทางแผนงาน เช่น แหล่งท่องเที่ยวเชิงเกษตรของชุมชน และแหล่งท่องเที่ยว เชิงอนุรักษ์ของชุมชน
บทสรุปและข้อเสนอแนะ ในประเทศที่พัฒนาแล้วโดยเฉพาะในทวีป ยุโรปและอเมริกาเหนือ มีผลการศึกษาที่ยืนยันการ ปนเปื้อนสาร PFASs ในสิ่งแวดล้อม และผลกระทบ ที่เกิดขึ้นจากการนำสาร PFASs ไปใช้ประโยชน์ ความตระหนักถึงอันตรายและความเสี่ยงต่อสุขภาพ ของประชาชนจากการรับสัมผัสสารกลุ่มนี้ ส่งผลให้ มีการควบคุมการผลิตและใช้งานสาร PFASs ในหลายประเทศ สำหรับผลการศึกษาที่เกี่ยวข้องกับสาร PFASs ในประเทศไทย มีเพียงการตรวจสอบการปน เปื้อนในตัวอย่างสิ่งแวดล้อม ได้แก่ น้ำ ฝุ่นพื้นผิว และ อากาศ โดยผลการศึกษาที่ผ่านมาบ่งชี้ ถึงการปนเปื้อนสาร PFASs ในทุกตัวกลางที่ตรวจ สอบ ซึ่งอาจทำให้เกิดการสะสมสาร PFASs ในสิ่ง แวดล้อมของประเทศในระยะยาวหากปราศจากการ ควบคุมแหล่งกำเนิด และก่อให้เกิดความเสี่ยงต่อ คนไทยจากการรับสัมผัสสาร PFASs ผ่านตัวกลาง สิ่งแวดล้อมที่มีการปนเปื้อน แต่ปัจจุบันยังไม่มีผล การศึกษาที่ยืนยันถึงผลกระทบที่เกิดขึ้น กลายเป็นภัย เงียบที่คนไทยต้องเผชิญ การศึกษาวิจัยสาร PFASs ในประเทศไทยยังมีอยู่จำกัด ไม่ว่าจะเป็นการศึกษา แหล่งกำเนิดทั้งในส่วนของการผลิตและการใช้งาน ในอุตสาหกรรมและในผลิตภัณฑ์ที่มีสาร PFASs เป็นส่วนประกอบ รวมถึงการตรวจสอบการปนเปื้อน จากแหล่งกำเนิดสำคัญโดยเฉพาะน้ำชะขยะจาก หลุมฝังกลบรวมถึงน้ำใต้ดินที่มีการใช้สำหรับบริโภค ของประชาชนที่อยู่บริเวณโดยรอบ การศึกษาการ ปนเปื้อนในสิ่งแวดล้อมที่จำกัดพื้นที่ศึกษาเฉพาะ ในกรุงเทพมหานครและนิคมอุตสาหกรรมบางแห่ง ทำให้ขาดข้อมูลภาพรวมในระดับประเทศ และ ไม่ครอบคลุมตัวกลางสิ่งแวดล้อมที่จะนำไปสู่การ ประเมินการรับสัมผัสโดยเฉพาะการปนเปื้อนสาร PFASs ในตัวอย่างอาหารที่ถือเป็นเส้นทางการรับ สัมผัสที่สำคัญ นอกจากนี้ ยังไม่มีการศึกษาการปน เปื้อนสาร PFASs ในตัวอย่างทางชีวภาพ เช่น ใน ตัวอย่างเลือดโดยเฉพาะของประชาชนในพื้นที่ที่ตรวจ พบการปนเปื้อนสาร PFASs ในสิ่งแวดล้อม เป็นต้น แม้ว่าการศึกษาสาร PFASs ในประเทศไทยจะมีข้อ จำกัดทั้งในส่วนของบุคลากร เครื่องมือในการตรวจ วิเคราะห์ และงบประมาณในการดำเนินการ แต่ด้วย ลักษณะอันตรายทั้งการตกค้างยาวนานในสิ่งแวดล้อม การสะสมในเนื้อเยื่อสิ่งมีชีวิต และความเป็นพิษ ของสาร PFASs ทำให้การศึกษาวิจัยสารกลุ่มนี้ใน ประเทศไทยยังมีความจำเป็นอย่างมาก เพื่อให้มีฐาน ข้อมูลความรู้ที่มากพอในการสนับสนุนการออกข้อ กำหนดหรือกฎเกณฑ์ต่าง ๆ สำหรับควบคุมการผลิต และใช้สาร PFASs อย่างจริงจัง และป้องกันผลกระ ทบที่อาจจะเกิดขึ้นในอนาคตเพื่อให้ภัยเงียบที่ว่าเกิด ขึ้นจากลักษณะความเป็นอันตรายของสาร PFASs เท่านั้น ไม่ใช่เป็นภัยที่เกิดจากการละเลย
น้องแมวน้องหมากำลังบอกว่า พวกเขารู้สึกไม่ดี
นอกจากภาษากายที่บ่งบอกถึงความสุขและความรักที่พวกเขาอยากบอกให้เรารู้ ยังมีพฤติกรรมอื่นๆ ที่อาจสื่อถึงความผิดปกติของพวกเขาซึ่งเจ้าของอย่างเราต้องใส่ใจเป็นพิเศษ เพื่อป้องกันการเจ็บป่วย หรือพาน้องๆ ไปพบสัตวแพทย์เพื่อตรวจสุขภาพประจำปี หรือหากมีสัญญาณความผิดปกติ ให้รีบพาน้องๆ ไปพบคุณหมอแต่เนิ่นๆ โดยสัญญาณความผิดปกติที่ไม่อาจมองข้ามมีตั้งแต่
ลูกวัยรุ่นเริ่มมีอารมณ์ทางเพศ และเป็นช่วงวัยที่เพศสัมพันธ์อาจเกิดขึ้นได้
ควรทำ
ถือเป็นโอกาสที่จะสร้างความรู้ความเข้าใจ โดยการให้ข้อมูลกับลูกอย่างตรงไปตรงมา ถ้าวันหนึ่งลูกต้องเผชิญสถานการณ์ จะได้มีข้อมูลในการคิด และตัดสินใจ
สามารถอธิบายให้ลูกเข้าใจอารมณ์ทางเพศ ว่าเมื่อร่างกายถูกกระตุ้นเร้า เช่น การดูหนังโป๊ การกอด จูบ สัมผัส สามารถทำให้เกิดอารมณ์ทางเพศได้ และอาจนำไปสู่การมีเพศสัมพันธ์ ดังนั้น ถ้าไม่ต้องการมีเพศสัมพันธ์ ต้องหลีกเลี่ยงสถานการณ์ดังกล่าว
อธิบายให้ลูกเข้าใจว่า เมื่ออารมณ์ทางเพศเกิดขึ้น ไม่จำเป็นต้องจบลงที่การมีเพศสัมพันธ์เสมอไป เพราะอารมณ์ดังกล่าวสามารถหายไปได้เอง ลูกจึงสามารถปฏิเสธการมีเพศสัมพันธ์ ถ้าเห็นว่าเป็นเพศสัมพันธ์ที่ไม่ปลอดภัย หรือไม่พร้อม ในขณะเดียวกัน หากถูกปฏิเสธ ลูกต้องเคารพการตัดสินใจของคนอื่นด้วย
แนะนำให้ลูกรู้จักประเมินความพร้อมของการมีเพศสัมพันธ์ เช่น ชวนให้ลูกคิดว่าเพศสัมพันธ์ที่ดีต้องประกอบด้วยอะไรบ้าง อาทิ ความรัก ความยินยอมพร้อมใจของสองฝ่าย ต้องเป็นเพศสัมพันธ์ที่ปลอดภัยเท่านั้น เป็นต้น
อย่าทำ
ไม่คุยกับลูกเรื่องนี้ เพราะคิดว่าลูกยังเล็ก ไม่มีความสนใจเรื่องเพศ เพราะในความเป็นจริงเด็กรับรู้และเติบโตเกินกว่าที่พ่อแม่คิดเสมอ โดยเฉพาะถ้าพ่อแม่คิดว่าลูกยังเด็ก ปฏิบัติต่อลูกเหมือนเป็นเด็กอยู่ตลอดเวลา เด็กก็จะแสดงออกให้ตรงกับความคาดหวังของพ่อแม่ เพื่อไม่ให้พ่อแม่ผิดหวัง
เมื่อลูกพูดคุยหรือขอคำปรึกษา การตอบสนองด้วยการว่ากล่าว ตำหนิ หรือขู่ปราม จะทำให้เด็กรับรู้ว่า พ่อแม่ไม่ยอมรับเรื่องเหล่านี้ หากมีข้อสงสัยใด ลูกจะไม่ซักถามพ่อแม่อีก แต่อาจหาข้อมูลเองจากอินเทอร์เน็ต หรือถามเพื่อน ซึ่งเสี่ยงที่จะได้รับข้อมูล และความเข้าใจที่ผิดพลาดคลาดเคลื่อน
ไม่พูดคุย เพราะคิดว่า จะเป็นการชี้โพรงให้กระรอก จะทำให้ลูกขาดข้อมูลความเข้าใจ และหากต้องเผชิญสถานการณ์ ลูกจะไม่รู้ว่าควรรับมือ หรือแก้ปัญหาอย่างไร
คิดว่าครูที่โรงเรียนสอนก็เพียงพอแล้ว ในความเป็นจริง เด็กต้องการข้อมูลมากกว่าในห้องเรียนเสมอ อีกทั้งบรรยากาศในการเรียนการสอนมักไม่เอื้อให้เกิดการซักถาม ลูกอาจไม่ไว้วางใจครูมากพอ พ่อแม่เป็นคนที่ทำหน้าที่นี้ได้ดีที่สุด
โรงพยาบาลกายภาพบำบัด และสหคลินิกเวชกรรม KIN ORIGIN Healthcare Center
บริการของ Kin Origin Healthcare Center “Kin Origin Healthcare Center” เป็นโรงพยาบาลกายภาพบำบัด ดูแลด้านสุขภาพเพื่อการฟื้นฟูร่างกายอย่างครบวงจร มีเทคโนโลยีทางด้านสุขภาพ (Health Tech) ที่ทันสมัย มีแพทย์ และทีมผู้เชี่ยวชาญด้านการฟื้นฟูโดยเฉพาะ อาทิ เช่น แพทย์อายุรกรรมระบบประสาทวิทยา, ด้านเวชศาสตร์ฟื้นฟู, ด้านกระดูก และข้อ, แพทย์แผนจีน, แพทย์แผนไทย, นักกายภาพบำบัดผู้เชี่ยวชาญ ด้านระบบประสาท และสมอง, ด้านกระดูก และกล้ามเนื้อ และนักกิจกรรมบำบัด ฯลฯ นอกจากมีทีมฟื้นฟูผู้เชี่ยวชาญแล้ว ยังมีทีมพยาบาล และผู้ดูแลผู้ป่วย ที่คอยดูแดตลอด 24 ชั่วโมง และมีนักโภชนาการคอยดูแลอาหารให้ทั้ง 3 มื้อ
Kin Origin Sukhumvit 107
คาโอภูมิใจและยินดีเป็นอย่างยิ่งที่ได้เป็นส่วนหนึ่งของโครงการนี้
นายยูจิ ชิมิซึ ประธานกรรมการ บริษัท คาโอ อินดัสเตรียล (ประเทศไทย) จำกัด กล่าวถึงเป้าหมายในการจัดกิจกรรมในครั้งนี้ “โรคไข้เลือดออกเป็นโรคที่แพร่พันธุ์โดยยุงลายและสร้างภาระทั้งทางด้านสาธารณสุขและเศรษฐกิจ โดยโครงการฯ นี้จึงเป็นอีกหนึ่งโครงการที่ตอกย้ำถึงความมุ่งมั่นของคาโอและพันธมิตรในการสร้างความตระหนักรู้และป้องกันโรคไข้เลือดออก รวมทั้งปกป้องอนาคตของเด็กไทยให้ปลอดภัยจากไข้เลือดออก ต้องขอขอบคุณพันธมิตรจากทุกภาคส่วนที่ร่วมกันทำงานเพื่อยกระดับและการสร้างความตระหนักรู้และความเข้าใจเกี่ยวกับโรคไข้เลือดออก เรารู้สึกภูมิใจและยินดีเป็นอย่างยิ่งที่ได้เป็นส่วนหนึ่งของโครงการนี้”
เดือนกันยายน-ธันวาคม 2566
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 2 ศูนย์แพทย์วัดอินทาราม
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 2 ศูนย์แพทย์วัดอินทาราม
ตั้งอยู่ที่ ม.6 ต.หัวรอ อ.พระนครศรีอยุธยา จ.พระนครศรีอยุธยา 13000
โทร. 089-9012865
ศูนย์แพทย์ขนาดกลาง ขนาดใหญ่ รับผิดชอบประชากร จำนวน 8,001 คน ขึ้นไป ครอบคลุมพื้นที่ หมู่ 6 ต.หัวรอ อ.พระนครศรีอยุธยา
เครือข่ายให้การสนับสนุน คนเข้าร่วมงานคับคั่ง
กิจกรรม “จุฬาฯ สัปดาห์วันนอนหลับโลกปี 2566” ได้รับการตอบรับเป็นอย่างดี มีผู้เข้าร่วมกิจกรรมอย่างคับคั่งตลอดสัปดาห์และได้รับประโยชน์จากการเข้าถึงความรู้ที่ถูกต้องที่ทำให้คุณภาพชีวิตดียิ่งขึ้น ยิ่งไปกว่านั้น ยังมีเครือข่ายให้การสนับสนุนและเข้าร่วมงานเป็นจำนวนมาก เช่น นพ.อุดม อัศวุตมางกุร ผู้แทนอธิบดีกรมอนามัย, รศ.นพ.ทายาท ดีสุดจิต นายกสมาคมโรคจากการหลับแห่งประเทศไทย และ นพ.สุธรรม เศรษฐวงศ์ ผู้อำนวยการฝ่ายการแพทย์ โรงพยาบาลสวนเบญจกิติ 84 พรรษา


ทั้งนี้ สิ่งที่น่าห่วงอีกข้อคือ การทิ้งรอยโรคของผู้สูงอายุที่ป่วยเป็นไข้หวัดใหญ่รุนแรงที่แม้เดิมจะมีสุขภาพร่างกายแข็งแรงดี แต่เมื่อหายป่วยแล้วพบว่า บางรายมักจะมีอาการทรุดลง หรือที่เรียกทับศัพท์ว่า Deconditioning เช่น ช่วยเหลือตนเองได้ลดลงต้องมีผู้ดูแล หรือผู้สูงอายุที่เดิมช่วยเหลือตนเองไม่ค่อยได้อยู่แล้วหลังป่วยหนักทำให้เกิดภาวะผู้ป่วยติดเตียง ซึ่งไม่เพียงส่งผลกระทบต่อสุขภาพร่างกายของผู้ป่วย แต่ยังกระทบผู้คนรอบข้างเช่นกัน ดังนั้นหากเป็นไปได้ จึงแนะนำให้ฉีดวัคซีนป้องกันไข้หวัดใหญ่จะดีที่สุดเพื่อป้องกันการติดเชื้อที่จะนำไปสู่การป่วยรุนแรง โดยในปัจจุบันมีวัคซีนป้องกันไข้หวัดใหญ่ 2 ชนิด คือ ชนิด 3 สายพันธุ์ ที่ส่วนใหญ่จะเป็นวัคซีนที่ภาครัฐให้บริการโดยไม่เสียค่าใช้จ่ายแก่ประชาชนกลุ่มเสี่ยง และชนิด 4 สายพันธุ์ ที่ภาครัฐจัดเตรียมให้กับบุคลากรทางการแพทย์ สตรีตั้งครรภ์ และมีจำหน่ายโดยทั่วไปในโรงพยาบาลเอกชนและคลินิก โดยทั้ง 2 ชนิดให้ผลดี แต่อย่างไรก็ดีด้วยความก้าวหน้าทางการแพทย์ วัคซีนแบบชนิด 4 สายพันธุ์มีการพัฒนาให้สามารถสร้างภูมิคุ้มกันและป้องกันการติดเชื้อไข้หวัดใหญ่ได้ดียิ่งขึ้น โดยเฉพาะการนำมาใช้สำหรับกลุ่มผู้สูงอายุที่มีจุดด้อยในร่างกาย คือ เมื่ออายุมากขึ้นการตอบสนองวัคซีนที่ใช้ทั่วไปต่ำกว่าคนอายุน้อย ดังนั้นสำหรับผู้สูงอายุหากต้องการฉีดวัคซีนไข้หวัดใหญ่ควรเลือกที่มีประสิทธิภาพครอบคลุม ภายใต้การดูแลของแพทย์”
รศ. นพ.ชิษณุ พันธุ์เจริญ อาจารย์พิเศษ ภาควิชากุมารเวชศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ดำเนินรายการ ค่า AQI คืออะไร และ PM 2.5 ไม่ควรเกินเท่าไหร่
สำหรับเกณฑ์ของประเทศไทย กรมควบคุมมลพิษจะประชาสัมพันธ์ข้อมูลโดยใช้ค่าดัชนีคุณภาพอากาศ (Air Quality Index, AQI) ซึ่งเป็นการรายงานข้อมูลความเข้มข้นของสารมลพิษทางอากาศ 6 ชนิด รวมกัน ได้แก่ PM2.5 PM10 ก๊าซโอโซน (O3) ก๊าซคาร์บอนมอนอกไซด์ (CO) ก๊าซไนโตรเจนไดออกไซด์ (NO2) และก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เพื่อให้ง่ายต่อความเข้าใจของประชาชน จะสามารถแบ่งเป็น 5 ระดับสีด้วยกัน คือ
“สีฟ้า” AQI 0 – 25 = ดีมาก เหมาะสำหรับทำกิจกรรมกลางแจ้ง
“สีเขียว” AQI 26 – 50 = ดี สามารถทำกิจกรรมกลางแจ้งได้ปกติ
“สีเหลือง” AQI 51 – 100 = ปานกลาง ควรลดระยะเวลาอยู่กลางแจ้ง
“สีส้ม” AQI 101 – 200 = เริ่มมีผลต่อสุขภาพ ควรเฝ้าระวังสุขภาพ ใช้อุปกรณ์ป้องกันตัวเอง
หากมีอาการใด ๆ ควรปรึกษาแพทย์
“สีแดง” AQI 201 ขึ้นไป = มีผลกระทบต่อสุขภาพ หลีกเลี่ยงกิจกรรมกลางแจ้ง ใช้อุปกรณ์
Chiangmai Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ชวนสืบสานประเพณีปีใหม่เมือง ณ บ้านโบราณเชียงใหม่ (ริมแม่น้ำปิง) จัดเต็มกิจกรรมมงคล และกิจกรรมดีงามเพื่อความยั่งยืนอาทิ กาดหมั้ว ซุ้มกาดหมั้วครัวฮอม อาหารพื้นเมืองล้านนาต้นตำรับแท้ๆ โดยชุมชนเมือง 20 ชุมชน LANNA CUISINE Set Serve แบบ ขันโตก Fine Dinning โดยเหล่าเชฟชุมชน เข้าถึงวัตถุดิบพื้นถิ่นชั้นเยี่ยม เคล้าดนตรีร่วมสมัยท่ามกลางบรรยากาศเย็นสบายริมแม่น้ำปิง, ประกวดแข่งขันตำบะหนุน, กิจกรรมการแข่งขันพูดจาประสาล้านนนาโดยเยาวชน, ช้อปปิ้งผลิตภัณฑ์ประชารัฐ
อิ่มเอมไปกับ ซุ้มกาดหมั้วครัวฮอม อาหารพื้นเมืองล้านนาต้นตำรับแท้ๆ โดยชุมชนเมือง 20 ชุมชน LANNA CUISINE Set Serve แบบขันโตก Fine Dinning โดยเหล่าเชฟชุมชน เข้าถึงวัตถุดิบพื้นถิ่นชั้นเยี่ยม เคล้าดนตรีร่วมสมัย โดย อ.โจ ท่ามกลางบรรยากาศเย็นสบายริมแม่น้ำปิง ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย” ระหว่างวันที่ 13 - 16 เม.ย. 2566 บ้านโบราณเชียงใหม่ ถ.เจริญประเทศ จังหวัดเชียงใหม่
กรุงเทพฯ – ภาคตะวันออกเฉียงเหนือ
กรุงเทพฯ – ภาคตะวันออกเฉียงเหนือ
- เส้นทางที่ 1 จากกรุงเทพฯ ไป จ.สระบุรี (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – ต.ม่วงค่อม (ทางหลวงหมายเลข 21) – อ.ท่าหลวง (ทางหลวงหมายเลข 2256) – อ.ด่านขุนทด (ทางหลวงหมายเลข 2148) – ทางหลวงหมายเลข 2 ถนนมิตรภาพ จากนั้นมุ่งหน้าสู่จังหวัดนครราชสีมา
- เส้นทางที่ 2 จากกรุงเทพฯ ไป อ.วังน้อย (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – จ.สระบุรี – อ.ปากช่อง – อ.สีคิ้ว (ทางหลวงหมายเลข 2 ถนนมิตรภาพ) จากนั้นมุ่งหน้าสู่จังหวัดนครราชสีมา
- เส้นทางที่ 3 จากกรุงเทพฯ ไป จ.นครนายก (ทางหลวงหมายเลข 305) – อ.บ้านนา (ทางหลวงหมายเลข 3051) – อ.แก่งคอย (ทางหลวงหมายเลข 3222) – อ.ปากช่อง (ทางหลวงหมายเลข 2 ถนนมิตรภาพ) จากนั้นมุ่งหน้าสู่จังหวัดนครราชสีมา หรือจาก อ.บ้านนาไร่ ใช้ทางหลวงหมายเลข 33 มุ่งหน้าสู่ อ.กบินทร์บุรี สู่ อ.อรัญประเทศ
- เส้นทางที่ 4 จากกรุงเทพฯ ไป จ.ฉะเชิงเทรา (ทางหลวงหมายเลข 314 หรือ ทางหลวงหมายเลข 304) – อ.พนมสารคาม – อ.กบินทร์บุรี – อ.วังน้ำเขียว – อ.ปักธงชัย (ทางหลวงหมายเลข 304) จากนั้นมุ่งหน้าสู่จังหวัดนครราชสีมา
- เส้นทางที่ 5 จากกรุงเทพฯ ไป อ.วังน้อย (ทางหลวงหมายเลข 1 ถนนพหลโยธิน) – จ.สระบุรี – อ.ปากช่อง – อ.สีคิ้ว (ทางหลวงหมายเลข 2 ถนนมิตรภาพ) – ทางหลวงพิเศษหมายเลข 6 (ทางเบี่ยงที่ กม.65+200) จากนั้นมุ่งหน้าสู่จังหวัดนครราชสีมา
วัคซีน HPV ป้องกันมะเร็งได้ทั้งผู้ชายและผู้หญิง LINK
วัคซีน HPV ป้องกันมะเร็งได้ทั้งผู้ชายและผู้หญิง อายุตั้งแต่ 9-16 ปีขึ้นไป วัคซีนมี 2 แบบ คือ 4 สายพันธุ์ และ 9 สายพันธุ์ มาสร้างภูมิคุ้มกันให้ร่างกาย เพื่อป้องกันมะเร็ง HPV กันนะคะ สนใจฉีดวัคซีนหรือต้องการสอบถามเพิ่มเติม โทร : 034-270080-5
Package Vaccine สำหรับลูกน้อย อายุตั้งแต่ 1 เดือน - 2 ปี LINK
Package Vaccine สำหรับลูกน้อย อายุตั้งแต่ 1 เดือน - 2 ปี การได้รับวัคซีนครบถ้วนตามวัยเป็นอีกหนึ่งวิธีเสริมสร้างภูมิต้านทานและป้องกันโรคให้แก่ลูกน้อย ซึ่งเป็นวัยที่รับเชื้อโรคได้ง่ายทั้งทางอากาศ ฝุ่นละออง หรือไวรัสที่ติดต่อด้วยการสัมผัส ดังนั้นการฉีดวัคซีนที่จำเป็นสำหรับช่วงวัยต่างๆ จะช่วยปกป้องให้เด็กๆ มีร่างกายแข็งแรงและพัฒนาการที่สมวัยอย่างต่อเนื่อง สุขภาพดีเริ่มต้นตั้งแต่วัยเด็ก สนใจติดต่อสอบถามข้อมูลได้ที่แผนกกุมารเวชกรรม 034-270083 ต่อ 1010
ตารางออกตรวจแผนกศัลยกรรมกระดูกและข้อ
ORGANIC HANDMADE CLEANING PRODUCTS WORKSHOP มาทำ “น้ำยาทำความสะอาดที่เป็นมิตรกับสิ่งแวดล้อม” กันเถอะ!!


เพราะเกาะเต่าเป็นเกาะที่มีขนาดเล็ก จึงมีทรัพยากรทางธรรมชาติค่อนข้างจำกัด ชาวเกาะเต่าต่างเห็นพ้องตรงกันว่า เราควรมุ่งเน้นการรักษาและอนุรักษ์ทรัพยากรที่มีอยู่อย่างจำกัดนี้ให้เกิดประโยชน์สูงสุด . จนในที่สุดก็ทำให้เกิดแนวคิดการทำ “ผลิตภัณฑ์ออร์แกนิค” ไม่ว่าจะเป็นสบู่ แชมพู ผงซักฟอก น้ำยาทำความสะอาดพื้น เป็นต้น . จากในอดีตที่ผู้คนบนเกาะจำต้องซื้อผลิตภัณฑ์ทำความสะอาดจากนอกเกาะ ซึ่งถือเป็นการใช้ทรัพยากรเพิ่มมากขึ้น เราจึงมีความต้องการที่จะเปลี่ยนเป็นการให้ความรู้และสนับสนุนให้มีการใช้วัตถุดิบของเกาะมาทำเป็นน้ำยาต่างๆ ซึ่งเวิร์คช็อปนี้จึงช่วยหักค่าใช้จ่ายที่ไม่จำเป็น และยังดีต่อสุขภาพรวมไปถึงสิ่งแวดล้อมของเกาะเต่า เพราะเป็นวัตถุดิบทั้งหมดมาจากธรรมชาติ . เวิร์คช็อปนี้ สามารถนำไปต่อยอดและเป็นไอเดียในการผลิตของใช้อื่นๆ ซึ่งเราจะมุ่งเน้นให้ผู้คนที่มาเที่ยวได้มีส่วนร่วมในการสร้างสรรค์ผลิตภัณฑ์ตามสไตล์ของตัวเอง . นอกจากผลิตภัณ์ทำความสะอาดที่ผู้ร่วมงานจะได้กลับไปแล้ว ก็ยังมีความสนุกระหว่างการลงมือทำ โดยกิจกรรมนี้จะทำให้ทุกคนมีความรู้เรื่องผลิตภัณฑ์ออร์แกนิคมากขึ้นด้วย . มาเรียนรู้ขั้นตอนการทำงาน กระบวนการผลิตตั้งแต่ต้นจนจบ โดยส่วนผสมทั้งหมดนั้นจะมาจากเกาะเต่า เราจึง รับรองได้ว่า ปราศจากสี หรือสารเคมีที่เป็นอันตรายต่อสุขภาพและระบบนิเวศ เพราะเรามีผู้เชี่ยวชาญมากประการณ์ด้านผลิตภัณฑ์ออร์แกนิคมาสอนตลอดทั้งงาน
จุดรับส่งเส้นทางที่ 3 - เกาะรัตนกาญจน์ - ถนนคนเดิน
สถานีชาร์จ ใน นนทบุรี
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ศูนย์แสดงสินค้า และการประชุม อิมแพ็ค ลานจอดภายนอกอาคารNovotel
ที่อยู่: 94 ถ.ป๊อปปปูล่า ต.บ้านใหม่ อ.ปากเกร็ด จ.นนทบุรี 11120
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ศูนย์แสดงสินค้า และการประชุม อิมแพ็ค ลานจอดในร่ม P1
ที่อยู่: 47/569-576 หมู่ที่ 3ถ.ป๊อปปปูล่า ต.บ้านใหม่ อ.ปากเกร็ด จ.นนทบุรี 11120
เวลาทำการ : ทุกวัน 06.00 – 22.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา MRT แยกนนทบุรี1 (ภายนอกอาคาร)
ที่อยู่: ต.บางกระสอ อ.เมืองนนทบุรี จ.นนทบุรี 11000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา MRT แยกนนทบุรี1 (ภายในอาคาร)
ที่อยู่: อาคารจอดแล้วจร สถานีแยกนนทบุรี 1 ต.บางกระสอ อ.เมืองนนทบุรี จ.นนทบุรี 11000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ตึกผู้ว่าการฯ กฟผ.
ที่อยู่: 53 หมู่ 2 ถ.จรัญสนิทวงศ์ ต.บางกรวย อ.บางกรวย จ.นนทบุรี 11130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ศูนย์การเรียนรู้ กฟผ.
ที่อยู่: 53 หมู่ 2 ถ.จรัญสนิทวงศ์ ต.บางกรวย อ.บางกรวย จ.นนทบุรี 11130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา หน้าร้านกาแฟคุณสายชล
ที่อยู่: ชั้น1 อาคาร ท.103 เลขที่ 53 หมู่ 2 ถ.จรัญสนิทวงศ์ ต.บางกรวย อ.บางกรวย จ.นนทบุรี 11130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา อาคารจอดรถ ท.103
ที่อยู่: อาคารจอดรถ ท.103 ชั้น1B-ชั้น2A สำหรับกรรมการ และรองผู้ว่าการฯ กฟผ. 53 หมู่ 2 ถ.จรัญสนิทวงศ์ ต.บางกรวย อ.บางกรวย จ.นนทบุรี 11130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สำนักงานไทรน้อย กฟผ.
ที่อยู่: 81 หมู่ 11 ถ.บางกรวย–ไทรน้อย ต.ไทรน้อย อ.ไทรน้อย จ.นนทบุรี 11150
เวลาทำการ : ทุกวัน 06.00 – 18.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
ชนิดหัวชาร์จ Quick & Normal charge
มีทั้งประเภท Quick & Normal charge แต่จะต่างกำลังไฟกันไป จำง่ายๆ ในสถานีปตท. กับนอกสถานี ปตท.
- ในสถานีปตท. 160 120 100 75 50 kW DC 43 22 kW AC Normal 7 4 7 kW AC
- นอกสถานี ปตท. จำกัดกว่า Quick 120 kW DC 22 kW Normal 22, 7 kW AC
สถานีชาร์จ PTTOR ทั้งหมด (230)
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (คลองเตย) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (คลองเตย) 6/199 ซอย ชุมชนล็อค 4-5-6 แขวงคลองเตย เขตคลองเตย กรุงเทพมหานคร 10110
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (คลองเตย) สำนักพัฒนาสังคม เปิดสอน วิชาชีพระยะสั้นในภาคปกติและภาคค่ำหลักสูตร 200 ชั่วโมง เพียง 105-305 บาท วิชาที่เปิดสอน เช่น ช่างจักรยานยนต์ อาหารและโภชนาการ เบเกอรี่ คอมพิวเตอร์ เสริมสวย ตัดผมชาย นวดแผนไทย ตัดเย็บเสื้อผ้า ช่างไฟฟ้า ช่างอิเล็กทรอนิคส์
เตือนภัย แอบอ้างเป็นการไฟฟ้า หลอกจะคืนเงินให้ทางแอป
การไฟฟ้าไม่มีนโยบายคืนเงินประกันหรือเงินต่างๆทางแอปพริเคชันหรือแพลตฟอร์มต่างๆ
มิจฉาชีพ แอบอ้างเป็นเจ้าหน้าที่การไฟฟ้าส่วนภูมิภาค (กฟภ.) แจ้งว่า ผู้เสียหายมีสิทธิได้รับเงินประกันการใช้ไฟฟ้าคืน เพื่อช่วยเหลือประชาชนตามมาตรการเร่งด่วน
เมื่อผู้เสียหายกดลิงก์ที่แนบมากับข้อความดังกล่าว จะเป็นการเพิ่มเพื่อนทางแอปพลิเคชันไลน์ของการไฟฟ้าส่วนภูมิภาค ที่มิจฉาชีพปลอมขึ้นมา จากนั้นมิจฉาชีพจะสอบถามรายละเอียดต่างๆ เริ่มจากสอบถามว่า ได้รับการแจ้งเตือนมาจากช่องทางใด แจ้งผู้เสียหายว่าจะได้รับเงินประกันคืนในอัตราตั้งแต่ 2,000-6,000 บาท ขึ้นอยู่กับขนาดของมิเตอร์ที่ใช้ สอบถามว่าโทรศัพท์ที่ใช้งานใช้ระบบปฏิบัติการ Android หรือ IOS พร้อมทั้งขอหมายเลขโทรศัพท์เพื่อติดต่อกลับ เมื่อตอบคำถามเสร็จสิ้น จะมีหมายเลขโทรศัพท์ที่ไม่คุ้นเคยโทรฯ มายังผู้เสียหาย อ้างเป็นเจ้าหน้าที่การไฟฟ้าส่วนภูมิภาค แล้วทำการส่งลิงก์ทางไลน์ให้ติดตั้งแอปพลิเคชันของการไฟฟ้าส่วนภูมิภาค(ปลอม) อ้างว่าเป็นแอปพลิเคชันเวอร์ชันใหม่ล่าสุด สามารถตรวจสอบปริมาณไฟฟ้าที่ใช้ได้ในแต่ละวัน โดยมีการขอสิทธิติดตั้งแอปพลิเคชันที่ไม่รู้จัก (ไฟล์อาจเป็นอันตราย หรือไฟล์นามสกุล .apk) มีการหลอกให้ตั้งรหัสผ่าน 6 หลัก จำนวนหลายๆ ครั้ง เพื่อหวังให้ผู้เสียหายกรอกรหัสชุดเดียวกับรหัสเข้าถึง หรือทำธุรกรรมการเงินของแอปพลิเคชันธนาคารต่างๆ ในโทรศัพท์มือถือของผู้เสียหาย รวมไปถึงขอสิทธิในการควบคุมอุปกรณ์ หรือโทรศัพท์มือถือของเหยื่อ เช่น ดูและควบคุมหน้าจอ ดูและดำเนินการ เป็นต้น
โดยในขั้นตอนนี้ มิจฉาชีพจะแสร้งหวังดีสอนผู้เสียหายว่าทำอย่างไร โดยการโทรศัพท์มาแจ้งวิธีการด้วยตนเอง กระทั่งเมื่อมิจฉาชีพได้สิทธิควบคุมอุปกรณ์หรือโทรศัพท์มือถือแล้ว จะทำการล็อกหน้าจอโทรศัพท์ ทำให้เสมือนโทรศัพท์ค้าง ซึ่งมักจะแสดงข้อความว่า อยู่ระหว่างดำเนินการตรวจสอบ ห้ามใช้งานโทรศัพท์มือถือ ทำให้มิจฉาชีพสามารถนำรหัสที่ผู้เสียหายเคยกรอกเอาไว้ก่อนหน้านี้ ทำการโอนเงินออกจากบัญชีของผู้เสียหาย
การหลอกลวงในรูปแบบดังกล่าว ยังคงเป็นการหลอกลวงในรูปแบบเดิมๆ เพียงแต่มิจฉาชีพจะเปลี่ยนชื่อหน่วยงาน และเปลี่ยนเนื้อหาไปตามวันเวลา และสถานการณ์ในช่วงนั้นๆ ไม่ว่าจะเป็นการแจ้งว่าได้รับสิทธิ หรือได้รับเงินคืน ให้อัปเดตข้อมูล โดยในขั้นตอนสุดท้ายจะหลอกลวงให้เหยื่อกดลิงก์ติดตั้งแอปพลิเคชันปลอมของหน่วยงานที่แอบอ้าง ที่ผ่านมาก็ปรากฏในหลายๆ หน่วยงาน มิจฉาชีพจะอาศัยความไม่รู้ และความโลภ ของประชาชนเป็นเครื่องมือ ใช้ความสมัครใจของเหยื่อให้ติดตั้งแอปพลิเคชันปลอม มีการใช้สัญลักษณ์ของหน่วยงาน เพื่อเพิ่มความน่าเชื่อถือ
อย่างไรก็ตาม ในปัจจุบันหลายหน่วยงานได้ประกาศยกเลิกการส่งข้อความสั้น (SMS) หรือส่งอีเมลไปยังประชาชน โดยเฉพาะอย่างยิ่ง สถาบันการเงิน หรือธนาคารต่างๆ
ทั้งนี้ฝากย้ำเตือนไปยังประชาชน ไม่ว่ามิจฉาชีพจะมาในรูปแบบใดๆ ก็ตาม ให้ระมัดระวังและมีสติอยู่เสมอ โดยหากพบเห็นข้อความสั้น (SMS) หรือลิงก์ ในลักษณะดังกล่าว ให้แจ้งเตือนไปยังบุคคลใกล้ชิด และหน่วยงานภาครัฐ หรือหน่วยงานนั้นๆ ให้ช่วยตรวจสอบทันที เพื่อลดการตกเป็นเหยื่อของมิจฉาชีพ
ภาคตะวันออกเฉียงเหนือ : “วิจิตรนครพนม นครแห่งความสุขริมฝั่งโขง”
ภาคตะวันออกเฉียงเหนือ : พบกับการจัดงานแสดงแสง สี เสียง ใน Concept “วิจิตรนครพนม นครแห่งความสุขริมฝั่งโขง” สร้างสีสันบรรยากาศให้จังหวัดนครพนมและริมฝั่งโขง เพื่อกระตุ้นการเดินทางท่องเที่ยวและสร้างโอกาสให้ผู้ประกอบการท่องเที่ยวในพื้นที่ เชิญชวนสัมผัสกิจกรรมยิ่งใหญ่อลังการ กับงานการแสดงแสงสี ผ่านเทคนิค Mapping และการ Light up พร้อมกิจกรรมให้ร่วมสนุกมากมาย สามารถเที่ยวชมงานได้ตั้งแต่วันที่ 27 พฤษภาคม – 4 มิถุนายน พ.ศ.2566
น้องเทพ ด.ช.มนัสพร แสนสุข
ด.ช.มนัสพร แสนสุข หรือเทพ อายุ 14 ปี นักเรียนชั้นมัธยมศึกษาปีที่ 2 โรงเรียนวัดราชสิงขร กล่าวถึงประโยชน์ที่ได้จากการเข้าร่วมกิจกรรม "หลังจากที่คุณครูที่โรงเรียนประกาศรับสมัครนักเรียนมาเข้าร่วมโครงการผมก็ไม่รอช้าที่จะตอบรับการเข้าร่วมโดยทันที เพราะไม่ได้มีความรู้มากนักเกี่ยวกับโรคไข้เลือดออก แต่อยากนำความรู้ที่ได้ไปประยุกต์ใช้ ซึ่งการเข้าร่วมกิจกรรมในครั้งนี้ทำให้รู้ว่าจริง ๆ แล้วโรคไข้เลือดออกเป็นโรคที่ค่อนข้างน่ากลัว มีผู้ป่วยที่เสียชีวิตจากโรคนี้ด้วย ซึ่งต้องขอบคุณ พี่ ๆ วิทยากรทุกท่านที่ให้ความรู้ได้เป็นอย่างดีในทุก ๆ ฐานกิจกรรม โดยหลังจากนี้จะนำความรู้ที่ได้ไปส่งต่อให้กับเพื่อน ๆ ในโรงเรียน และครอบครัว เพื่อให้ทุกคนปลอดภัยและห่างไกลจากโรคไข้เลือดออกครับ”
ข่าวที่คนไทยให้ความสนใจมากในขณะนี้ หนีไม่พ้นข่าวการเมืองที่ร้อนระอุ ที่พรรคต่างๆ เริ่มหาเสียงกันอย่างดุเดือด คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการ ฝ่ายวิจัยการตลาดและวางแผนกลยุทธ์ อธิบายเรื่องข่าวที่คนไทยให้ความสนใจในภาพรวมไว้ว่า ‘ไม่ใช่เพียงแต่อุณหภูมิในหน้าร้อนปีนี้ที่ร้อนระอุ แต่ข่าวการเมืองและเรื่องการเลือกตั้งก็ร้อนระอุเช่นกัน รวมไปถึงเรื่องมลพิษทางอากาศที่หนักข้อขึ้นทุกวัน คนไทยหลายคนถามหาความรับผิดชอบในการจัดการเรื่องกวนใจคนไทยให้คลี่คลายและหมดไป’ ผลกระทบจากข่าวรอบตัวที่มีแต่ปัญหา อาจรั้งคนไทยให้สุขไม่สุดในช่วงเทศกาลปีใหม่ไทยที่กำลังจะมาถึงนี้
ศาสตราจารย์นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ (Ralph A. DeFronzo, M.D.) ศาสตราจารย์ สาขาวิชาเบาหวาน ภาควิชาอายุรศาสตร์ มหาวิทยาลัยเท็กซัส ซานอันโตนิโอ มลรัฐเท็กซัส สหรัฐอเมริกา
ศาสตราจารย์ นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ สำเร็จการศึกษาแพทยศาสตรบัณฑิต จากมหาวิทยาลัยฮาร์วาร์ด สหรัฐอเมริกา ศึกษาต่อสาขาวิชาอายุรศาสตร์ต่อมไร้ท่อ จากสถาบันสุขภาพแห่งชาติ และสาขาวิชาอายุรศาสตร์โรคไต จากมหาวิทยาลัยเพนซิลวาเนีย สหรัฐอเมริกา ปัจจุบันดำรงตำแหน่งศาสตราจารย์ สาขาวิชาเบาหวาน ภาควิชาอายุรศาสตร์ มหาวิทยาลัยเท็กซัส ซานอันโตนิโอ มลรัฐเท็กซัส สหรัฐอเมริกา
ในการดูแลรักษาโรคเบาหวานซึ่งเพิ่มขึ้นในทุกประเทศทั่วโลกนั้น การให้การรักษาที่เหมาะสมมีความสำคัญทั้งเพื่อป้องกันการเกิดโรคและลดภาวะแทรกซ้อนเรื้อรังจากโรคเบาหวาน ศาสตราจารย์นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ ได้ศึกษากลไกการเกิดโรคเบาหวานและพิสูจน์ได้ว่าโรคอ้วน โดยเฉพาะโรคอ้วนลงพุงทำให้เกิดการเปลี่ยนแปลงระดับโมเลกุลที่ทำให้เกิดภาวะดื้อต่ออินซูลิน ซึ่งเป็นกลไกสำคัญของการเกิดโรคเบาหวานชนิดที่ 2 รวมถึงพบว่าผู้ป่วยกลุ่มนี้มีการดูดน้ำตาลกลับที่ไตเพิ่มขึ้นผ่านช่องทางขนส่งร่วมระหว่างเกลือโซเดียมและน้ำตาลกลูโคส จากผลการศึกษาดังกล่าว ทำให้ยาเมทฟอร์มิน (metformin) และยาในกลุ่มที่ยับยั้งการดูดกลับน้ำตาลผ่านช่องทางขนส่งร่วมที่ไตนั้นเป็นที่ยอมรับอย่างแพร่หลายให้ใช้เป็นยาตัวแรกในการรักษาผู้ป่วยโรคเบาหวานชนิดที่ 2
นอกจากนี้ ศาสตราจารย์นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ ยังนำเสนอแนวทางการรักษาโรคเบาหวานแบบเฉพาะบุคคล (personalized treatment) โดยพิจารณาเลือกยาตามกลไกการเกิดโรคในผู้ป่วยแต่ละรายและศึกษาการปรับเปลี่ยนพฤติกรรมและลดน้ำหนักเพื่อทำให้ภาวะดื้อต่ออินซูลินลดลง ซึ่งแนวคิดและผลการศึกษาดังกล่าวได้รับการนำไปใช้ในการศึกษาต่อยอดและเป็นแนวทางที่สำคัญในการป้องกันและรักษาโรคเบาหวานชนิดที่ 2 อย่างแพร่หลายทั่วโลก
ผลงานการศึกษาของศาสตราจารย์นายแพทย์ ราล์ฟ เอ. ดีฟรอนโซ ซึ่งได้เชื่อมโยงองค์ความรู้จากงานวิจัยพื้นฐาน ด้านกลไกการเกิดโรค ได้ถูกนำไปพัฒนาและศึกษาต่อยอดจนเกิดแนวทางในการรักษาและป้องกันโรคเบาหวานชนิดที่ 2 ส่งผลให้มีจำนวนผู้ป่วยและการเกิดภาวะแทรกซ้อนเรื้อรังลดลงทั่วโลก ทำให้ผู้ป่วยโรคเบาหวานชนิดที่ 2 มีคุณภาพชีวิตที่ดีขึ้น อย่างมาก ก่อประโยชน์ต่อสุขภาพอนามัยและชีวิตผู้ป่วยเบาหวานหลายร้อยล้านคนทั่วโลก
โรงพยาบาลสหวิทยาการมะลิ จัดแพคเกจสุขภาพมาเพื่อคุณ
โรงพยาบาลสหวิทยาการมะลิ เตรียมโปรแกรมเพื่อสุขภาพมามายมานำเสนอ พร้อมโปรโมชั่นสุดคุ้ม พิเศษ! ลุ้นรับ Gift Voucher โปรแกรมตรวจสุขภาพราคาพิเศษ ฟรี!
กำหนดการจัดงาน มหกรรมการเงิน ประจำปี 2566 MONEY EXPO 2023
1.งานมหกรรมการเงินกรุงเทพ ครั้งที่ 23
วันที่ 11-14 พฤษภาคม 2566 ณ ชาเลนเจอร์ ฮอลล์ 2-3 อิมแพ็ค เมืองทองธานี
2. งานมหกรรมการเงินหาดใหญ่ ครั้งที่ 13 จ.สงขลา
วันที่ 7-9 กรกฎาคม 2566 ณ หาดใหญ่ ฮอลล์ ชั้น 5, ลานโปรโมขั่น ชั้น 1 ศูนย์การค้าเซ็นทรัล หาดใหญ่
3. งานมหกรรมการเงินโคราช ครั้งที่ 17 จ.นครราชสีมา
วันที่ 18-20 สิงหาคม 2566 ณ เอ็มซีซี ฮอลล์ ชั้น 3 ห้างสรรพสินค้าเดอะมอลล์ โคราช
4. งานมหกรรมการเงินระยอง ครั้งที่ 5 จ.ระยอง
วันที่ 8-10 กันยายน 2566 ณ ลานกิจกรรม ชั้น 1 ศูนย์การค้าเซ็นทรัล ระยอง
5. งานมหกรรมการเงินอุดรธานี ครั้งที่ 10 จ.อุดรธานี
วันที่ 6-8 ตุลาคม 2566 ณ อุดรธานี ฮอลล์ ชั้น 4 ศูนย์การค้าเซ็นทรัล อุดรธานี
6. งานมหกรรมการเงินเชียงใหม่ ครั้งที่ 18 จ.เชียงใหม่
วันที่ 10-12 พฤศจิกายน 2566 ณ เชียงใหม่ ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต
7. งานมหกรรมการเงินกรุงเทพ ส่งท้ายปี ครั้งที่ 6
วันที่ 14-17 ธันวาคม 2566 ณ Exhibition Hall 4 ศูนย์การประชุมแห่งชาติสิริกิติ์
งานมหกรรมการเงิน MONEY EXPO เป็นงานมหกรรมการเงินการลงทุนครบวงจร ซึ่งจัดโดย วารสารการเงินธนาคาร ในเครือ บริษัท มีเดีย แอสโซซิเอตเต็ต จำกัด
PEA Solar Rooftop LINK
PEA Solar Rooftop
ผู้ให้บริการด้านการวางระบบผลิตไฟฟ้าจากพลังงานแสงอาทิตย์แบบครบวงจรด้วยเทคโนโลยีขั้นสูงที่พัฒนาขึ้นเพื่อให้บริการลูกค้าอย่างเต็มประสิทธิภาพจากทีมงานมืออาชีพและทีมบริการหลังการขายที่ดูแลลูกค้าตลอด 24 ชั่วโมง
service ให้คำปรึกษาการวางระบบ
step1 ประเมิน และคำนวณ แผนการลงทุน
step2 จัดเตรียม และยื่นเอกสารขออนุญาต
step3 ติดตามการทำงาน ของระบบและแก้ไขปัญหา
step4 สำรวจพื้นที่
step5 ออกแบบและวางแผน การติดตั้ง
step6 เตรียมอุปกรณ์ติดตั้ง ทดสอบระบบ
step7 ระบบบริการหลังการขาย
PEA SOLAR HERO APPLICATION
Application ที่นำ Digital Platform มาใช้ให้บริการประชาชน เพื่อเพิ่มขีดความสามารถของ PEA ให้ตอบสนองความต้องการของลูกค้าที่ประสงค์จะติดตั้ง Solar Rooftop ให้สะดวก รวดเร็ว ปลอดภัย มั่นคง และยั่งยืน
รูปแบบลงทุน
1) ลงทุนเอง
เจ้าของเป็นผู้ลงทุนติดตั้งระบบ Solar Rooftop เอง ไฟฟ้าที่ผลิตได้จาก Solar ผู้ลงทุนได้รับผลประโยชน์ 100%
2) พันธมิตรลงทุนให้
PEA จัดหาผู้ร่วมลงทุน Investor ให้กับหน่วยงาน ทั้งราชการ เอกชน และรัฐวิสาหกิจที่สนใจในการติดตั้ง Solar roof top ในรูปแบบ PPA
ผ่อนชำระ/สินเชื่อ
สินเชื่อติดตั้งแผงโซลาร์ สำหรับบ้าน และโรงงาน เพื่อชีวิตที่ OK
1: รับสินเชื่ออัตราดอกเบี้ยพิเศษ
2 : รับส่วนลดผลิตภัณฑ์และค่าติดตั้งจากผู้ติดตั้งหลังคา ที่เข้าร่วมโครงการสูงสุด 40%*
3 : รับฟรี! บริการบำรุงรักษาตลอดปี จากบริษัทในเครือ ของการไฟฟ้าส่วนภูมิภาค (PEA) มูลค่าสูงสุด 5,000 บาท สำหรับ 100 ท่านแรก*
ค้าปลีกสุขภาพ (Retail Healthcare)


จากข้อมูลของนักวิจัยที่ Forrester จำนวนธุรกิจด้านการดูแลสุขภาพที่ดำเนินการผ่านร้านค้าปลีกจะเพิ่มขึ้นเป็นสองเท่าในช่วงปี 2566 สิ่งนี้กำลังกลายเป็นแนวโน้มที่มองเห็นได้ชัดเจนมากขึ้น เนื่องจากผู้ค้าปลีกอย่าง Walmart, Amazon และ CVS ให้บริการด้านสุขภาพ เช่น การตรวจเลือด การฉีดวัคซีน และการตรวจสุขภาพ อัพที่ได้รับตามธรรมเนียมของโรงพยาบาล คลินิก หรือแนวทางปฏิบัติของแพทย์ แนวโน้มนี้จะโดดเด่นมากขึ้นเนื่องจากสภาวะเศรษฐกิจโลกทำให้งบประมาณที่จำกัดสำหรับสถานพยาบาลระดับปฐมภูมิแนวหน้าแบบดั้งเดิม สิ่งนี้ประกอบขึ้นด้วยผู้ให้บริการด้านการดูแลสุขภาพรายย่อยที่ใช้ประโยชน์จากความคาดหวังของผู้บริโภคเกี่ยวกับประสบการณ์ของลูกค้าที่คล่องตัวและทางเลือกในการสร้างบริการที่ผู้ป่วยจะได้รับความสะดวกสบายและคุ้มค่ามากขึ้นกว่าการส่งมอบการดูแลเบื้องต้นแบบดั้งเดิม ดังที่งานวิจัยของ Forrester กล่าวไว้ “ในปี 2023 ผู้ป่วยจะเลือกสถานบริการสุขภาพสำหรับร้านค้าปลีกสำหรับความต้องการการดูแลเบื้องต้นของพวกเขา เนื่องจากระบบสุขภาพถูกจำกัดด้วยทรัพยากรที่ไม่เพียงพอ และไม่ตรงกับประสบการณ์ของผู้ป่วยที่ได้รับการยกระดับของร้านค้าปลีก”
โดยทั่วไป ผู้ให้บริการด้านการดูแลสุขภาพรายย่อยสามารถเข้าถึงได้มากกว่า และอาจไม่ต้องจองการนัดหมายล่วงหน้า เมื่อเทียบกับผู้ให้บริการด้านการดูแลสุขภาพแบบดั้งเดิม พวกเขายังได้รับผลกระทบน้อยกว่าจากการขาดแคลนบุคลากรทางการแพทย์ที่ผ่านการฝึกอบรมซึ่งหลายประเทศกำลังประสบอยู่ในขณะนี้ ซึ่งเป็นปัญหาที่คาดว่าจะเลวร้ายลงเท่านั้น
การพิมพ์สามมิติ 3D Printing
การใช้เทคนิคการพิมพ์ 3 มิติในการดูแลสุขภาพกำลังเติบโตอย่างรวดเร็ว โรงพยาบาลมากกว่า 110 แห่งในสหรัฐอเมริกาลงทุนสำหรับเครื่องพิมพ์ 3 มิติ ณ จุดดูแลผู้ป่วยในปี 2562 เทียบกับเพียง 3 แห่งในปี 2553 (2010)
เทคโนโลยีนี้ถูกนำมาใช้สำหรับการสร้างรากฟันเทียม การเปลี่ยนข้อต่อ รวมถึงการทำขาเทียมตามขนาด การวิจัยเกี่ยวกับการใช้เครื่องพิมพ์ 3 มิติสำหรับการผลิตเนื้อเยื่อผิวหนัง อวัยวะ หรือแม้แต่ยาก็กำลังดำเนินการอยู่เช่นกัน
ประโยชน์ที่สำคัญของการพิมพ์ 3 มิติ คือ ช่วยเร่งกระบวนการผลิตได้อย่างมาก และยังช่วยลดต้นทุนของผลิตภัณฑ์ที่ผลิตแบบดั้งเดิมอีกด้วย เทคโนโลยีดังกล่าวได้ลดเวลาในการผลิตเครื่องช่วยฟังจากมากกว่าหนึ่งสัปดาห์เหลือเพียงหนึ่งวัน (อ้างอิงจาก American Hospital Association)
ผู้ประกันตนที่ศรีบุรินทร์ทุกท่าน ฉีดวัคซีนป้องกันไข้หวัดใหญ่ ไม่มีค่าใช้จ่าย LINK
ผู้ประกันตนที่ศรีบุรินทร์ทุกท่าน ที่มีอายุ 50 ปีขึ้นไป สามารถใช้สิทธิประกันสังคม เข้ารับการฉีดวัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ โดยไม่มีค่าใช้จ่าย ณ อาคารการุญเวช ( แผนกประกันสังคม )
ตั้งแต่วันที่ 1 พฤษภาคม - 31 สิงหาคม 2566 นี้
สำหรับผู้ประกันตนท่านใดที่อายุต่ำกว่า 50 ปีสามารถเข้ารับบริการฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ในราคา 550 บาท/เข็ม
วัดน้อยนอก นนทบุรี เตาเผาสัตว์เลี้ยง
วัดน้อยนอก ราคาเริ่มต้น 1,500 บาท สถานที่ ซอยรัตนาธิเบศร์ 42 ถนนรัตนาธิเบศร์ ตำบลบางกระสอ อำเภอเมืองนนทบุรี นนทบุรี โทร 098 – 449 3992
แผนที่ google map
*ภาพจากคุณ alotsofpomme
ห้องตรวจกุมารเวชกรรม
อาคารอำนวยการ (เก่า) ชั้น 2
- ในเวลาราชการ Case HIV เด็ก รับ Refer วันจันทร์, Case TB เด็ก รับ Refer วันอังคาร เวลา 8.00-12.00 น.
(นอกเวลาราชการ Consult พญ.วรรณี)
- ในเวลาราชการติดต่อได้ที่ คุณยมนา, (พยาบาล OPDเด็ก) โทร.044-615002 ต่อ 3215 ,2164 ,3606
- อาคารเด็กดี โทร.044-615002 ต่อ 3559
- คลินิกพิเศษนอกเวลา ค่าบริการ 300/ครั้ง Line ID : Buriramsmc
ข้อมูล ณ วันที่ 15 กันยายน 2565
ติตตามโครงการได้ทางเพจหัวใจเดียวกัน LINK
ร่วมบริจาคเงินเพื่อจัดตั้งศูนย์โรคหัวใจโรงพยาบาลชุมพรเขตรอุดมศักดิ์ได้ที่
ธนาคารกรุงไทย เลขที่บัญชี 803-0-79885-7
ชื่อบัญชี เงินบริจาคจัดหาทุนเพื่อเปิดศูนย์หัวใจ รพ.ชุมพรเขตรอุดมศักดิ์
รพ.ชุมพรฯ โทรติดต่อ 077-503672-4 ต่อ 8105
คุณวรวรรณ ไกรนรา โทร.095-2681271
Line ID : @986rvnsl (มี @ ด้วยนะคะ)
St.Carlos RECC จะเป็นฮับเพื่อการดูแลกลุ่มผู้ป่วยฟื้นฟูพิเศษในย่านกรุงเทพฯและปริมณฑล
ทางโรงพยาบาลกรุงสยามเซนต์คาร์ลอส เชื่อมั่นว่าด้วยจุดแข็งของ “St.Carlos Rehabilitation and Extended Care Centre - St.Carlos RECC” ศูนย์ฟื้นฟูสมรรถภาพและการดูแลระยะยาว จะเป็นฮับเพื่อการดูแลกลุ่มผู้ป่วยฟื้นฟูพิเศษในย่านกรุงเทพฯและปริมณฑล ที่พร้อมรองรับกับจำนวนผู้ป่วยที่ต้องการการดูแลอย่างใกล้ชิด ในสังคมปัจจุบันที่คนในครอบครัวต้องทำงานนอกบ้านไม่มีเวลาเพียงพอในการดูแลผู้ป่วยกลุ่มนี้
จำนวน ส.ส.แต่ละจังหวัด (เรียงตามอักษร)@6 พฤษภาคม 16.00 น.
กระบี่ ส.ส. 3 คน 100%
- เขต 1 ภูมิใจไทย นายกิตติ กิตติธรกุล 39,520
- เขต 2 ภูมิใจไทย นายถิรเดช ตั้งมั่นก่อกิจ 62,976
- เขต 3 ภูมิใจไทย นายสฤษฏ์พงษ์ เกี่ยวข้อง 51,845
กาญจนบุรี ส.ส. 5 คน 100%
- เขต 1 เพื่อไทย นายอัครนันท์ กัณณ์กิตตินันท์ 33,183
- เขต 2 เพื่อไทย นายชูศักดิ์ แม้นทิม 23,278
- เขต 3 ภูมิใจไทย นายยศวัฒน์ มาไพศาลสิน 44,813
- เขต 4 เพื่อไทย นายศักดิ์ดา วิเชียรศิลป์ 37,401
- เขต 5 เพื่อไทย นายพนม โพธิ์แก้ว 30,152
กาฬสินธุ์ ส.ส. 6 คน 100%
- เขต 1 เพื่อไทย นายวิรัช พิมพะนิตย์ 56,559
- เขต 2 เพื่อไทย นายพลากร พิมพะนิตย์ 49,784
- เขต 3 พลังประชารัฐ นายจำลอง ภูนวนทา 37,055
- เขต 4 ภูมิใจไทย นางสาวประภา เฮงไพบูลย์ 31,536
- เขต 5 เพื่อไทย นายทินพล ศรีธเรศ 39,998
- เขต 6 เพื่อไทย นายประเสริฐ บุญเรือง 44,002
กำแพงเพชร ส.ส. 4 คน 100%
- เขต 1 พลังประชารัฐ นายไผ่ ลิกค์ 36,187
- เขต 2 พลังประชารัฐ นายเพชรภูมิ อาภรณ์รัตน์ 41,143
- เขต 3 พลังประชารัฐ นายอนันต์ ผลอำนวย 37,149
- เขต 4 พลังประชารัฐ นายปริญญา ฤกษ์หร่าย 36,132
ขอนแก่น ส.ส. 11 คน 100%
- เขต 1 ก้าวไกล นายวีรนันท์ ฮวดศรี 33,759
- เขต 2 ก้าวไกล นายอิทธิพล ชลธราศิริ 38,984
- เขต 3 ก้าวไกล นายชัชวาล อภิรักษ์มั่นคง 36,731
- เขต 4 ภูมิใจไทย นายเอกราช ช่างเหลา 33,104
- เขต 5 เพื่อไทย นายภาควัต ศรีสุรพล 50,423
- เขต 6 เพื่อไทย นายสิงหภณ ดีนาง 29,293
- เขต 7 เพื่อไทย นายสุรพจน์ เตาะเจริญสุข 37,974
- เขต 8 เพื่อไทย นางสาววิภาณี ภูคำวงศ์ 43,191
- เขต 9 เพื่อไทย นางสาวสรัสนันท์ อรรณนพพร 46,057
- เขต 10 เพื่อไทย นายวันนิวัติ สมบูรณ์ 44,173
- เขต 11 ภูมิใจไทย นายองอาจ ฉัตรชัยพลรัตน์ 37,529
จันทบุรี ส.ส. 3 คน 100%
- เขต 1 ก้าวไกล นายวรายุทธ ทองสุข 37,600
- เขต 2 ก้าวไกล นางสาวปรัชญาวรรณ ไชยสืบ 34,894
- เขต 3 ก้าวไกล นางสาวญาณธิชา บัวเผื่อน 35,428
ฉะเชิงเทรา ส.ส. 4 คน 100%
- เขต 1 เพื่อไทย นางฐิติมา ฉายแสง 35,488
- เขต 2 พลังประชารัฐ นายอรรถกร ศิริลัทธยากร 42,777
- เขต 3 เพื่อไทย นายศักดิ์ชาย ตันเจริญ 36,895
- เขต 4 ก้าวไกล นายจิรัฏฐ์ ทองสุวรรณ์ 37,381
ชลบุรี ส.ส. 10 คน 100%
- เขต 1 ก้าวไกล นายวรท ศิริรักษ์ 36,463
- เขต 2 ก้าวไกล นางสาววรรณิดา นพสิทธิ์ 30,162
- เขต 3 ก้าวไกล นายชวาล พลเมืองดี 33,183
- เขต 4 รวมไทยสร้างชาติ นายจิรวุฒิ สิงห์โตทอง 36,128
- เขต 5 เพื่อไทย นายอนันต์ ปรีดาสุทธิจิตต์ 41,939
- เขต 6 ก้าวไกล นางสาวกฤษฏิ์ ชีวะธรรมานนท์ 37,572
- เขต 7 ก้าวไกล นายสหัสวัต คุ้มคง 40,918
- เขต 8 ก้าวไกล นายจรัส คุ้มไข่น้ำ 35,240
- เขต 9 ก้าวไกล นายยอดชาย พึ่งพร 30,459
- เขต 10 พลังประชารัฐ นายสะถิระ เผือกประพันธุ์ 27,461
ชัยนาท ส.ส. 2 คน 100%
- เขต 1 รวมไทยสร้างชาติ นายอนุชา นาคาศัย 43,874
- เขต 2 ภูมิใจไทย นายมณเฑียร สงฆ์ประชา 52,205
ชัยภูมิ ส.ส. 7 คน 100%
- เขต 1 เพื่อไทย นายโอชิษฐ์ เกียรติก้องชูชัย 26,130
- เขต 2 เพื่อไทย นายเชิงชาย ชาลีรินทร์ 61,414
- เขต 3 ภูมิใจไทย นายสัมฤทธิ์ แทนทรัพย์ 35,237
- เขต 4 พลังประชารัฐ นางสาวกาญจนา จังหวะ 21,285
- เขต 5 เพื่อไทย นายศิวะ พงศ์ธีระดุลย์ 35,000
- เขต 6 ภูมิใจไทย นายเชวงศักดิ์ เร่งไพบูลย์วงษ์ 30,477
- เขต 7 พลังประชารัฐ นายอัครแสนคีรี โล่ห์วีระ 38,547
ชุมพร ส.ส. 3 คน 100%
- เขต 1 รวมไทยสร้างชาติ นายวิชัย สุดสวาสดิ์ 36,222
- เขต 2 รวมไทยสร้างชาติ นายสันต์ แซ่ตั้ง 32,501
- เขต 3 รวมไทยสร้างชาติ นายสุพล จุลใส 41,231
เชียงราย ส.ส. 7 คน 100%
- เขต 1 ก้าวไกล นายชิตวัน ชินอนุวัฒน์ 38,395
- เขต 2 เพื่อไทย นางสาวปิยะรัฐชย์ ติยะไพรัช 55,778
- เขต 3 ก้าวไกล นายฐากูร ยะแสง 25,056
- เขต 4 เพื่อไทย นางสาววิสาระดี เตชะธีราวัฒน์ 39,589
- เขต 5 เพื่อไทย นายเทอดชาติ ชัยพงษ์ 35,162
- เขต 6 ก้าวไกล นางจุฬาลักษณ์ ขันสุธรรม 31,623
- เขต 7 เพื่อไทย นายพิเชษฐ์ เชื้อเมืองพาน 31,588
เชียงใหม่ ส.ส. 10 คน 100%
- เขต 1 ก้าวไกล นางสาวเพชรรัตน์ ใหม่ชมภู 48,823
- เขต 2 ก้าวไกล นางสาวการณิก จันทดา 51,181
- เขต 3 ก้าวไกล นายณัฐพล โตวิจักษณ์ชัยกุล 47,469
- เขต 4 ก้าวไกล นางสาวพุธิตา ชัยอนันต์ 62,009
- เขต 5 เพื่อไทย นายจุลพันธ์ อมรวิวัฒน์ 38,015
- เขต 6 ก้าวไกล ว่าที่ร้อยตรีหญิงอรพรรณ จันตาเรือง 25,828
- เขต 7 ก้าวไกล นายสมดุลย์ อุตเจริญ 32,040
- เขต 8 ก้าวไกล นายภัทรพงษ์ ลีลาภัทร์ 50,878
- เขต 9 พลังประชารัฐ นายนเรศ ธำรงค์ทิพยคุณ 31,107
- เขต 10 เพื่อไทย นางสาวศรีโสภา โกฏคำลือ 32,638
ตรัง ส.ส. 4 คน 100%
- เขต 1 รวมไทยสร้างชาติ นายถนอมพงศ์ หลีกภัย 25,965
- เขต 2 พลังประชารัฐ นายทวี สุระบาล 63,185
- เขต 3 ประชาธิปัตย์ นางสาวสุณัฐชา โล่สถาพรพิพิธ 62,644
- เขต 4 ประชาธิปัตย์ นายกาญจน์ ตั้งปอง 22,812
ตราด ส.ส. 1 คน 100%
- เขต 1 ก้าวไกล นายศักดินัย นุ่มหนู 44,576
ตาก ส.ส. 3 คน 100%
- เขต 1 ก้าวไกล นายคริษฐ์ ปานเนียม 27,664
- เขต 2 ก้าวไกล นายรัชต์พงศ์ สร้อยสุวรรณ 24,133
- เขต 3 พลังประชารัฐ นายภาคภูมิ บูลย์ประมุข 31,328
นครนายก ส.ส. 2 คน 100%
- เพื่อไทย พลตำรวจตรีสุรพล บุญมา 32,030
- เพื่อไทย นายเกรียงไกร กิตติธเนศวร 20,225
นครปฐม ส.ส. 6 คน 100%
- เขต 1 ชาติไทยพัฒนา นายศุภโชค ศรีสุขจร 39,715
- เขต 2 รวมไทยสร้างชาติ พันโทสินธพ แก้วพิจิตร 33,770
- เขต 3 ชาติไทยพัฒนา นายพาณุวัฒณ์ สะสมทรัพย์ 42,825
- เขต 4 ก้าวไกล นายกิตติภณ ปานพรหมมาศ 24,898
- เขต 5 ชาติไทยพัฒนา นายอนุชา สะสมทรัพย์ 22,575
- เขต 6 ก้าวไกล นายชิษณุพงศ์ ตั้งเมธากุล 38,812
นครพนม ส.ส. 4 คน 100%
- เขต 1 เพื่อไทย นายภูมิพัฒน์ พชรทรัพย์ 44,712
- เขต 2 เพื่อไทย นางมนพร เจริญศรี 39,856
- เขต 3 ภูมิใจไทย นายอลงกต มณีกาศ 41,738
- เขต 4 ภูมิใจไทย นายชูกัน กุลวงษา 25,253
นครราชสีมา ส.ส. 16 คน 100%
- เขต 1 ก้าวไกล นายฉัตร สุภัทรวณิชย์ 37,043
- เขต 2 ก้าวไกล นายปิยชาติ รุจิพรวศิน 42,398
- เขต 3 ก้าวไกล นายศุทธสิทธิ์ พจน์ฐศักดิ์ 38,982
- เขต 4 เพื่อไทย นางสาวณัฐจิรา อิ่มวิเศษ 37,150
- เขต 5 เพื่อไทย นายสมเกียรติ ตันดิลกตระกูล 46,479
- เขต 6 เพื่อไทย นายโกศล ปัทมะ 32,136
- เขต 7 เพื่อไทย นางสาวปิยะนุช ยินดีสุข 51,348
- เขต 8 เพื่อไทย นายนิกร โสมกลาง 18,075
- เขต 9 ภูมิใจไทย นายพลพีร์ สุวรรณฉวี 38,421
- เขต 10 เพื่อไทย นายอภิชา เลิศพชรกมล 51,206
- เขต 11 เพื่อไทย นายอาทิตย์ หวังศุภกิจโกศล 60,320
- เขต 12 เพื่อไทย นายนรเสฎฐ์ ศิริโรจนกุล 44,072
- เขต 13 เพื่อไทย นายพชร จันทรรวงทอง 10,973
- เขต 14 เพื่อไทย นายศิรสิทธิ์ เลิศด้วยลาภ 32,596
- เขต 15 เพื่อไทย นายรชตะ ด่านกุล 44,121
- เขต 16 เพื่อไทย นายพรเทพ ศิริโรจนกุล 37,412
นครศรีธรรมราช ส.ส. 10 คน 100%
- เขต 1 ประชาธิปัตย์ นายราชิต สุดพุ่ม 20,334
- เขต 2 ประชาธิปัตย์ นายทรงศักดิ์ มุสิกอง 31,617
- เขต 3 ประชาธิปัตย์ นายพิทักษ์เดช เดชเดโช 31,827
- เขต 4 ประชาธิปัตย์ ว่าที่ร้อยโทยุทธการ รัตนมาศ 22,394
- เขต 5 ประชาธิปัตย์ นายชัยชนะ เดชเดโช 48,403
- เขต 6 พลังประชารัฐ นายสุธรรม จริตงาม 26,285
- เขต 7 ภูมิใจไทย นายษฐา ขาวขำ 27,943
- เขต 8 ภูมิใจไทย นางมุกดาวรรณ เลื่องสีนิล 23,393
- เขต 9 ประชาธิปัตย์ นางอวยพรศรี เชาวลิต 35,976
- เขต 10 รวมไทยสร้างชาติ นางสาวพิมพ์ภัทรา วิชัยกุล 44,233
นครสวรรค์ ส.ส. 6 คน 100%
- เขต 1 ก้าวไกล นายกฤษฐ์หิรัญ เลิศอุฤทธิ์ภักดี 31,671
- เขต 2 เพื่อไทย นายทรงศักดิ์ ส่งเสริมอุดมชัย 37,510
- เขต 3 รวมไทยสร้างชาติ นายสัญญา นิลสุพรรณ 32,100
- เขต 4 ภูมิใจไทย นายมานพ ศรีผึ้ง 32,934
- เขต 5 ภูมิใจไทย นายพีระเดช ศิริวันสาณฑ์ 46,315
- เขต 6 ชาติพัฒนากล้า นายประสาท ตันประเสริฐ 24,089
นนทบุรี ส.ส. 8 คน 100%
- เขต 1 ก้าวไกล นายนนท์ ไพศาลลิ้มเจริญกิจ 41,734
- เขต 2 ก้าวไกล นางปัญญารัตน์ นันทภูษิตานนท์ 39,086
- เขต 3 ก้าวไกล นายอนุสรณ์ แก้ววิเชียร 44,114
- เขต 4 ก้าวไกล นายนพดล ทิพยชล 36,249
- เขต 5 ก้าวไกล นายปรีติ เจริญศิลป์ 48,055
- เขต 6 ก้าวไกล นายคุณากร มั่นนทีรัย 48,169
- เขต 7 ก้าวไกล นายเกียรติคุณ ต้นยาง 48,417
- เขต 8 ก้าวไกล นายนนท์ ไพศาลลิ้มเจริญกิจ 41,734
นราธิวาส ส.ส. 5 คน 100%
- เขต 1 รวมไทยสร้างชาติ นายวัชระ ยาวอหะซัน 29,006
- เขต 2 พลังประชารัฐ นายอามินทร์ มะยูโซ๊ะ 31,289
- เขต 3 พลังประชารัฐ นายสัมพันธ์ มะยูโซ๊ะ 34,411
- เขต 4 ภูมิใจไทย นายซาการียา สะอิ 30,966
- เขต 5 ประชาชาติ นายกมลศักดิ์ ลีวาเมาะ 31,457
น่าน ส.ส. 3 คน 100%
- เขต 1 เพื่อไทย นายทรงยศ รามสูต 35,314
- เขต 2 เพื่อไทย นายชลน่าน ศรีแก้ว 56,746
- เขต 3 เพื่อไทย นายณัฐพงษ์ สุปริยศิลป์ 29,379
วัคซีนเพิ่มเติมฟรีในเด็กและผู้ใหญ่
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
- วัคซีนเด็ก - เพิ่มวัคซีนหลายประเภท
- โรคไข้หวัดใหญ่
- โรคไข้เลือดออก เป็นโรคที่กลับมาระบาดสูงอีกครั้ง และพบมากที่สุดในเด็กช่วงอายุ 5-14 ปี การฉีดวัคซีนไข้เลือดออกเดงกี่ ลดความรุนแรงของโรคได้กว่า 80 %
- โรคพิษสุนัขบ้า การฉีดวัคซีนตั้งแต่เด็กจะช่วยลดจำนวนวัคซีนที่ต้องฉีดกรณีที่พบว่าเสี่ยงได้รับโรคพิษสุนัขบ้าในภายหลัง ซึ่งวัคซีนที่ต้องฉีดหากไม่เคยได้รับวัคซีนพิษสุนัขบ้ามาก่อนมีราคาที่ค่อนข้างสูง
- โรคอีสุกอีใส โดยฉีดเป็นวัคซีน MMRV ที่รวมเข็มกับวัคซีน คางทูม หัด หัดเยอรมัน หรือ MMR ในวัคซีนจำเป็นเดิม
- วัคซีนผู้สูงอายุ - เพิ่มวัคซีนปอดอักเสบ
- โรคปอดอักเสบ และติดเชื้อในกระแสเลือด สำหรับผู้สูงวัย ฉีดเข็มเดียวแต่ป้องกันได้ตลอดชีวิต โดยอาการปอดบวมและติดเชื้อในกระแสเลือด ถือเป็นสาเหตุในการเสียชีวิตหลักของผู้สูงอายุ
ยุทธศาสตร์ที่ 2 ส่งสริม สนับสนุนการวิจัยพัฒณา และการผลิตวัคซีนรองรับความต้องการในการป้องกันโรคของประเทศ
เป็นการสร้างศักยภาพการพึ่งพาตนเองด้านวัคซีน โดยการส่งเสริมและสนับสนุนทุนในการวิจัยพัฒนาวัคซีนเป้าหมายและวัคซีนเพื่อตอบโต้การระบาด เพื่อให้สามารถต่อยอดสู่การผลิตวัคซีนในระดับอุตสาหกรรมและสนับสนุนให้เกิดการพัฒนาหรือรับการถ่ายทอดเทคโนโลยีที่ทันสมัยในการผลิตวัคซีน
1. วัคซีนที่อยู่ระหว่างการวิจัยพัฒนา
ดำเนินการวิจัยพัฒนาวัคซีน เช่น วัคซีนป้องกันโรคไข้ซิกา4 ศูนย์วิจัยและพัฒนาวัคซีน สถาบันชีววิทยาศาสตร์โมเลกุล มหาวิทยาลัยมหิดล ได้ทำการทดสอบความเป็นพิษของวัคซีนในหนู พบว่า หนูที่ได้รับซิกาวัคซีนที่มีความเข้มข้นต่างกันจำนวน 3 ครั้ง มีความปลอดภัยดีและหนูทุกตัวมีภูมิคุ้มกันต่อไวรัสซิกา
2. วัคซีนที่ผลิตได้ในประเทศและได้รับการขึ้นทะเบียน
วัคซีนป้องกันไข้หวัดใหญ่ประจำฤดูกาลชนิด 3 สายพันธุ์ ที่ผลิตได้ตั้งแต่ต้นน้ำได้รับการขึ้นทะเบียน แต่การนำไปใช้ในกลุ่มอายุ 18-64 ปี ยังไม่บรรลุเป้าหมาย เนื่องจากผลการศึกษาที่แสดงถึงประสิทธิผลและการกระตุ้นระบบภูมิคุ้มกันภายหลังจากได้รับวัคซีน 360 วัน ยังไม่ชัดเจน รวมถึงหน่วยงานกำกับดูแลได้ให้ความสำคัญในการพิจารณาการดำเนินงานที่เกี่ยวข้องกับการวิจัยวัคซีนสำหรับโควิด-19 ก่อนเป็นอันดับแรก และวัคซีนป้องกันโรคมะเร็งปากมดลูกที่ได้รับการถ่ายทอดเทคโนโลยีได้รับการขึ้นทะเบียนและการเฝ้าระวังความปลอดภัยการใช้วัคซีนหลังจากออกสู่ตลาดยังไม่บรรลุเป้าหมาย เนื่องจากข้อมูลด้านความต้องการวัคซีนระดับโลกที่มีความเปลี่ยนแปลงอาจส่งผลต่อแนวทางการวางแผนดำเนินการ จึงจำเป็นต้องมีการทบทวนแนวทางความร่วมมือและความเป็นไปได้ของการถ่ายทอดเทคโนโลยีการผลิตวัคซีนป้องกันโรคมะเร็งปากมดลูก
Cultural District 2023 สวนสาธารณะป้อมมหากาฬ
กิจกรรมประจำจันทร์ - ศุกร์
Mini Exhibition : เล่าเรื่องลิเกไทย (10.00 - 20.00 น.)
Photo Exhibition : Studio Photo by สมาคมถ่ายภาพแห่งประเทศไทยฯ (14.00 – 20.00 น.)
Photo Exhibition : การแสดงภาพถ่าย City Scape by สมาคมถ่ายภาพแห่งประเทศไทยฯ (10.00 - 20.00 น.)
Workshop : ภาพพิมพ์ความทรงจำ (10.00 - 20.00 น.)
Workshop : เลื่อมลายสายลิเก รอบ 1 (11.00 - 13.00 น.)
Workshop : เลื่อมลายสายลิเก รอบ 2 (14.00 - 16.00 น.)
กิจกรรมวันเสาร์-อาทิตย์
Mini Exhibition : เล่าเรื่องลิเกไทย (10.00 - 20.00 น.)
Photo Exhibition : Studio Photo by สมาคมถ่ายภาพแห่งประเทศไทยฯ (14.00 – 20.00 น.)
Photo Exhibition : การแสดงภาพถ่าย City Scape by สมาคมถ่ายภาพแห่งประเทศไทยฯ (10.00 - 20.00 น.)
Workshop : ภาพพิมพ์ความทรงจำ (10.00 - 20.00 น.)
Workshop : เลื่อมลายสายลิเก รอบ 1 (11.00 - 13.00 น.)
Workshop : เลื่อมลายสายลิเก รอบ 2 (14.00 - 16.00 น.)
Workshop : Photo Stage ถ่ายภาพเบื้องหลังคนลิเก และถ่ายภาพการแสดงลิเก วิทยากร โดย สมาคมถ่ายภาพแห่งประเทศไทย (14.00 - 20.00 น.)
Workshop : Photo Walk ถ่ายภาพพื้นที่โดยรอบป้อมมหากาฬ วิทยากร โดย สมาคมถ่ายภาพแห่งประเทศไทย (14.00 - 20.00 น.)
Talk : 20 พ.ค.66 : หัวข้อ “ภาพเก่าเล่าเรื่องป้อม” วิทยากร คุณไพศาลย์ เปี่ยมเมตตารัตน์ (18.00 – 20.00 น.)
21 พ.ค.66 : หัวข้อ “เล่าเรื่องลิเกไทย” วิทยากร คุณวันชัย อเนกลาภ สมาคมลิเกประเทศไทย (18.00 – 20.00 น.)
27 พ.ค.66 : หัวข้อ “ลิเกและมหรสพกรุง” วิทยากร คุณจุลภัสสร พนมวัน ณ อยุธยา / คุณฐิติชัย อัฏฏะวัชระ (18.00 – 20.00 น.)
28 พ.ค.66 : หัวข้อ “ภาพเก่าเล่าเรื่องป้อม ” วิทยากร คุณอเนก นาวิกมูล (18.00 – 20.00 น.)
Show : การแสดงลิเก วันละ 1 เรื่อง ( 4 เรื่อง) โดย สมาคมลิเกประเทศไทย (19.00 – 20.00 น.)
2. ออกกำลังกาย หรือ กิจกรรมทางกายที่ยั่งยืน (Exercise and Sustainable Physical Activity)
การมีพฤติกรรมสุขภาพดีแบบยั่งยืน ไม่ได้จำกัดเพียงแค่รูปแบบการรับประทานอาหารเท่านั้น แต่ยังรวมถึงกิจกรรมทางกายด้วย นิยามการออกกำลังกายอย่างยั่งยืนนั้นกว้างกว่าการออกกำลังกายเพื่อประโยชน์ทางด้านสุขภาพ โดยไม่ได้คำนึงแค่เพียงระยะเวลา ความหนัก และความถี่ที่เพียงพอ เพื่อให้เกิดผลดีต่อสุขภาพเท่านั้น แต่ยังรวมถึงการไม่บริโภคอาหารหรืออาหารเสริมมากเกินไป การใช้สถานที่ออกกำลังกายและอุปกรณ์เท่าที่จำเป็น หรือปรับเปลี่ยนรูปแบบการเดินทางในชีวิตประจำวัน อย่างการเดินเท้า วิ่ง ปั่นจักรยาน เพื่อลดปริมาณก๊าซเรือนกระจกที่ปล่อยออกมา (carbon footprint)
การเดินทางแบบใช้แรงกายตัวเองเป็นหลัก (Active transportation) เช่น การเดิน การขี่จักรยาน การพายเรือ เป็นรูปแบบการเดินทางที่ไม่ก่อให้เกิดคาร์บอน (carbon-free) และเพิ่มโอกาสในการออกกำลังกาย ช่วยสร้างเสริมสุขภาพในทุกช่วงอายุ ในรายงานปี พ.ศ. 2554 ตีพิมพ์ในวารสาร Environment International พบว่า การเดินทางแบบใช้แรงกาย มีส่วนช่วยลดความเสี่ยงโรคหัวใจและหลอดเลือดประมาณ 11% รวมถึงลดความเสี่ยงต่อโรคเบาหวานชนิดที่ 2 และโรคมะเร็งบางชนิด
การมีกิจกรรมทางกายอย่างสม่ำเสมอ ยังมีส่วนช่วยชะลอการสั้นลงของเทโลเมียร์ (Telomere) โดยเทโลเมียร์เป็น DNA ส่วนปลายสุดของโครโมโซม สามารถบ่งชี้อายุของเซลล์ในร่างกาย (Biological age) และบอกภาวะเสื่อมของเซลล์ (Degenerative status) ซึ่งหากความยาวเทโลเมียร์สั้น ความเสี่ยงต่อการเจ็บป่วยและแก่ชราก็เพิ่มมากขึ้น งานวิจัยจาก National Health and Nutrition Examination Survey ที่ถูกตีพิมพ์ในปี พ.ศ. 2560 ในผู้ใหญ่ชาวอเมริกันจำนวน 5,823 คน พบว่า หากมีการใช้พลังงานของการออกกำลังกายในแต่ละสัปดาห์ มากกว่า 1000
เมษายน 2566
วันที่ 5 เมษายน 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 70 แห่ง ดังนี้
1.ฮันน่าคลินิกเวชกรรม
2.จตุจักรเมดิคอลคลินิกเวชกรรม
3.ไอวี่คลินิกเวชกรรม
4.วังโสภณคลินิกเวชกรรม
5.แอทวันวันคลินิกเวชกรรม
6.มาร์ช่าคลินิกเวชกรรม
7.มายวิงส์คลินิกเวชกรรม สาขาเอกมัย
8.อินฟินิตี้บายดอกเตอร์ปาล์มคลินิกเวชกรรม สาขาเอกมัย
9.ริเวียร่าแบงคอคคลินิกเวชกรรม
10.ดนัยคลินิกเวชกรรม
11.เบธเธอร์ มี คลินิกเวชกรรม
12.ศิริมาราคลินิกเวชกรรม
13.เดอะริสคลินิกเวชกรรม
14.อทิตาคลินิกเวชกรรม สาขาซีคอนบางแค
15.ลุคแอทมีคลินิกเวชกรรม
16.เดอะวายน์คลินิกเวชกรรม
17.ทเวนตี้โฟร์เอสเธ่คลินิกเวชกรรม
18.บีเอ็นเคคลินิกเวชกรรม (นำส่ง OSS 5/4/66)
19.เดอะไลน์คลินิกเวชกรรม
20.อมรคลินิกเวชกรรม
21.อินดัสตี้คลินิกเวชกรรม
22.นิวเทรียนท์เวลเนสคลินิกเวชกรรม
23.ธรรมดาคลินิกเวชกรรม
24.คลินิกเวชกรรมแพทย์สมชัย
25.ควีน่าคลินิกเวชกรรม
26.เซ็นจูรี่คลินิกเวชกรรม
27.จีแอลคลินิกเวชกรรม
28.ซิสธีออรี่คลินิกเวชกรรม
29.คลินิกเวชกรรมดับเบิลยูพลัส สาขาสามย่าน
30.รมย์รวินท์คลินิกเวชกรรม สาขาเซ็นทรัลเฟสติวัลอีสต์วิลล์
31.มิสคลินิกเวชกรรม
32.คลินิกเวชกรรมแพทย์สัมพันธ์
33.แดเลียคลินิกเวชกรรม
34.เฮชซีคลินิกเวชกรรม สาขาลาดพร้าว
35.เอสวีคลินิกเวชกรรม
36.โอฮาน่าคลินิกเวชกรรม
37.คลินิกเวชกรรมวุฒิแพทย์
38.เลอวีย์คลินิกเวชกรรม
39.ดีเคคลินิกเวชกรรม สาขาสุขุมวิท
40.อินฟินิตี้เมดิคอลคลินิกเวชกรรม
41.บีบีเฟซคลินิกเวชกรรม
42.คลินิกเวชกรรมรามคำแหง 39
43.เอลิสต์ติกคลินิกเวชกรรม
44.คลินิกเวชกรรมเอเพ็กซ์ สาขาสีลมคอมเพล็กซ์
45.วานซ์เมดิคอลคลินิกเวชกรรม
46.บอสเมดิลอยัลคลินิกเวชกรรม
47.ยูวาเวลเนสคลินิกเวชกรรม (นำส่ง OSS 4/4/66)
48.เจเอ็มทีคลินิกเวชกรรม (นำส่ง OSS 5/4/66)
49.เอ็มดีสยามคลินิกเวชกรรม (นำส่ง OSS 5/4/66)
50.เดอการ์เนตคลินิกเวชกรรม (นำส่ง OSS 5/4/66)
51.สยามเฟอร์ทิลิตี้คลินิกแอทถนนวิทยุเฉพาะทางด้านเวชกรรมสูตินรีเวชวิทยา
52.สยามเฟอร์ทิลิตี้คลินิกแอทเกษตร-นวมินทร์ คลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวชวิทยา
53.จีน่าเฟอร์ทิลิตี้ สตูดิโอ คลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์-นรีเวชวิทยา
54.คลินิกเฉพาะทางด้านเวชกรรมจักษุและรักษาสายตารัตนิน กิมเบล
55.คลินิกทันตกรรมแอทสายไหม
56.คลินิกทันตกรรมเซนิโทนี่ สาขาพระราม 3
57.คลินิกทันตกรรมสุรชัยทันตแพทย์
58.คลินิกทันตกรรมทีธการ์เดน
59.คลินิกทันตกรรม 105 เด็นทัลโฮม
60.โอเอ็มดีคลินิกการแพทย์แผนไทย
61.สมุนไพรคลินิกการแพทย์แผนไทย
62.วายซ์คลินิกการแพทย์แผนไทยประยุกต์ สาขาลาดพร้าว
63.มาเจียคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน สาขาพาซิโอ้ลาดกระบัง
64.อดุลย์คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน
65.โบตั๋นคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน (สาขาอ่อนนุช)
66.สหคลินิกดีไลท์เฮอร์เบิลเฮาส์
67.ไนน์ตี้ฟิฟท์สหคลินิก
68.สหคลินิกดีสปายน์
69.มิสเตอร์บิ๊กสหคลินิก
70.ไทม์เวลล์เนสสหคลินิก (นำส่ง OSS 4/4/66)
วันที่ 18 เมษายน 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 76 แห่ง ดังนี้
1.คลินิกเวชกรรมกล้วยน้ำไท สาขานิคมลาดกระบัง
2.ดอกเตอร์แนทคลินิกเวชกรรม
3.เมอร์ซี่คลินิกเวชกรรม
4.วิทาเลียคลินิกเวชกรรม
5.สกรีนดอรีนคลินิกเวชกรรม
6.พีเคแอลคลินิกเวชกรรม สาขาสุขุมวิท 39
7.รสิตาคลินิกเวชกรรม
8.เพอร์ซันนีคคลินิกเวชกรรม
9.อยู่ดีมีสุขคลินิกเวชกรรม สาขาพระราม 2
10.นิวเจนคลินิกเวชกรรม
11.เอ็น เอส ที คลินิกเวชกรรม สาขาพระราม 3
12.เดอะซันคลินิกเวชกรรม
13.คลินิกเวชกรรมอลิน
14.เดอโบคลินิกเวชกรรม
15.ปันนิสาคลินิกเวชกรรม
16.ศุภานันคลินิกเวชกรรม
17.วโรดมคลินิกเวชกรรม
18.อลินคลินิกเวชกรรม
19.เดอะฟอเรสท์คลินิกเวชกรรม
20.93 ลาบาเก็ตคลินิกเวชกรรม
21.แบงคอกคลินิกเวชกรรม สาขาจุฬา-สเตเดียมวัน
22.ปิยธิดาคลินิกเวชกรรม
23.ดิออกานิกคลินิกเวชกรรม
24.อินสปายคลินิกเวชกรรม
25.คลินิกเวชกรรมภัสสรินทร์
26.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 34
27.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 17
28.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 37
29.คลินิกเวชกรรมประชาชื่น 12
30.เจนเทลคลินิกเวชกรรม
31.ปารีสคลินิกเวชกรรม
32.เลอบิ้วท์คลินิกเวชกรรม
33.คาวาอิคลินิกเวชกรรม
34.เจเจเอ็นคลินิกเวชกรรม
35.คลินิกเวชกรรมอารีรักษ์คลองเตย
36.พัฒนจักคลินิกเวชกรรม
37.เอสแอนด์ดับบลิว 2 คลินิกเวชกรรม
38.เอมาร่าคลินิกเวชกรรม สาขารัชโยธิน
39.เอ็มคลินิกเวชกรรม
40.วีไลฟ์คลินิกเวชกรรม
41.รินทร์ญาพัสคลินิกเวชกรรม
42.ดิเอชคลินิกเวชกรรม
43.เดอะคลินิก เมเจอร์รัชโยธิน คลินิกเวชกรรม
44.รวิสคลินิกเวชกรรม
45.มิลเลทคลินิกเวชกรรม
46.ยูชิคลินิกเวชกรรม
47.เจเคยองคลินิกเวชกรรม
48.ด็อกเตอร์ดนัย แบงค์คอก คลินิกเวชกรรม
49.กชามาศคลินิกเวชกรรม
50.คลินิกเวชกรรมไอวี่ (นำส่ง OSS 11/4/66)
51.เท็ดดี้บีคลินิกเวชกรรม (นำส่ง OSS 11/4/66)
52.คลินิกเวชกรรมเลอแบ็งค็อค (นำส่ง OSS 11/4/66)
53.ดวินคลินิกเวชกรรม (นำส่ง OSS 11/4/66)
54.ลาดกระบังไตเทียมคลินิกเฉพาะทางด้านเวชกรรมไตเทียม 2
55.นารีคลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์-นรีเวชวิทยา
56.บางปะกอก เอ็มอาร์ไอ คลินิกเฉพาะทางด้านเวชกรรมรังสี
57.นริศตาคลินิกเฉพาะทางด้านเวชกรรม หู คอ จมูก
58.คลินิกทันตกรรมสไมล์ลอฟท์
59.คลินิกทันตกรรม ลอทส์ ออฟ ฟัน
60.จามจุรีคลินิกทันตกรรม
61.คลินิกทันตกรรมพีช
62.คลินิกทันตกรรมบ้านทันตแพทย์
63.คลินิกทันตกรรมบ้านทันตแพทย์
64.สไมล์แฟมิลี่คลินิกทันตกรรม
65.คลินิกทันตกรรมมาสเตอร์เด้นท์ สาขาสุทธิสาร
66.คลินิกทันตกรรมทันตแพทย์สุรันต์-ยงจิต 2
67.คลินิกทันตกรรมอิสระทันตแพทย์
68.เอวาตาร์คลินิกการแพทย์แผนไทย สาขาเดอะไบรท์
69.เวชวิชชาคลินิกการแพทย์แผนไทย
70.คลินิกการแพทย์แผนไทยภากมล
71.ลำพูนไชยคลินิกการแพทย์แผนไทย
72.นุชสราคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน (นำส่ง OSS 11/4/66)
73.ยูเอ็นแคร์ อารีย์ คลินิกกายภาพบำบัด
74.ลาบาลองสหคลินิก
75.สหคลินิกโกสุมรวมใจ
76.สหคลินิก ดี เอช ซี
วันที่ 28 เมษายน 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 26 แห่ง ดังนี้
1.คลินิกเวชกรรมกล้วยน้ำไท สาขาพัฒนาการ 20
2.คลินิกเวชกรรมกล้วยน้ำไท สาขารามคำแหง 14
3.คลินิกเวชกรรมกล้วยน้ำไท สาขารัชดาภิเษก 3
4.คลินิกเวชกรรมกล้วยน้ำไท สาขาศรีนครินทร์
5.คลินิกเวชกรรมกล้วยน้ำไท สาขาสวนสยาม
6.พิทักษ์-บางไผ่คลินิกเวชกรรม
7.ธีรพรคลินิกเวชกรรม
8.คลินิกเวชกรรมวัดไผ่เขียว
9.อาร์ ดับบลิว ซี คลินิกเวชกรรม
10.เคหะร่มเกล้าคลินิกเวชกรรม
11.เดอะลอฟท์คลินิกเวชกรรม
12.คลินิกเวชกรรมกุลกานต์
13.คลินิกเวชกรรมพุทธฉือจี้
14.แมกโนเลียแบงค็อกคลินิกเวชกรรม
15.ลาโบลเล่คลินิกเวชกรรม (นำส่ง OSS 19/4/66)
16.แพทย์ธีรพันธ์คลินิกเฉพาะทางด้านเวชกรรม หู คอ จมูก
17.คลินิกทันตกรรมยูทูธ
18.คลินิกทันตกรรมพลัส สาขาสาทร (นำส่ง OSS 21/4/66)
19.คลินิกทันตกรรมนิทราทันตแพทย์ (นำส่ง OSS 20/4/66)
20.นรินทร์คลินิกกายภาพบำบัด
21.คลินิกกายภาพบำบัดเบรนรีแฮบลักซ์
22.ไลฟ์บาลานซ์คลินิกเทคนิคการแพทย์
23.สหคลินิกเวลเนสแคร์ สาขาปิ่นเกล้า
24.กัญชยา สหคลินิก
25.พรีโมแคร์เมดิคอลสหคลินิก สาขาเอ็มไพร์ทาวเวอร์
26.สหคลินิกพีเอ็มจีบางขุนเทียน (บางบอน)
มกราคม 2565
วันที่ 25 มกราคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 40 แห่งดังนี้ (Update ♥)
1.เอไอซีคลินิกเวชกรรม (ใบอนุญาต 10101007765)
2.นานักมิชชั่น สุขศาลา คลินิกเวชกรรม (ใบอนุญาต 10101005865)
3.คลินิกเวชกรรมใกล้บ้านใกล้ใจ 9 (ใบอนุญาต 10101006765)
4.คลินิกเวชกรรมหมอสุชาติ (ใบอนุญาต 10101005965)
5.นิวพีคลินิกเวชกรรม (ใบอนุญาต 10101005765)
6.เอส-มาร์ทคลินิกเวชกรรม สาขาเฟสติวัล วอล์ค (ใบอนุญาต 10101006565)
7.คลินิกเวชกรรมดุสิตาการแพทย์ (ใบอนุญาต 10101007065)
8.วิชัยเวชคลินิกเวชกรรม (ใบอนุญาต 10101008565)
9.ของขวัญคลินิกเวชกรรม สาขาทองหล่อ (ใบอนุญาต 10101008465)
10.พระนครคลินิกเวชกรรม (ใบอนุญาต 10101008365)
11.ดี อาร์ เค คลินิกเวชกรรม (ใบอนุญาต 10101007865)
12.อินเทลลิเฮลธ์พลัสคลินิกเวชกรรม (ใบอนุญาต 10101007565)
13.สิริวรรณคลินิกเวชกรรม (ใบอนุญาต 10101007965)
14.คลินิกเวชกรรมอนันต์เฮลท์แคร์ สาขาบางอ้อ (ใบอนุญาต 10101007265)
15.ดอกเตอร์ดีไลท์คลินิกเวชกรรม (ใบอนุญาต 10101007365)
16.บริพัตรเด็นทัลแคร์คลินิกทันตกรรม (ใบอนุญาต 10103005965)
17.พิสิษฐ์คลินิกเวชกรรม (ใบอนุญาต 10101007665)
18.ไดเมนชั่นคลินิกเวชกรรม สาขาทองหล่อ (ใบอนุญาต 10101008065)
19.บัณฑิตาคลินิกเวชกรรม (ใบอนุญาต 10101009065)
20.คลินิกเวชกรรมหมอวิริยะ (ใบอนุญาต 10101007465)
21.ไอ เค คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง (ใบอนุญาต 10102001465)
22.ประชาชื่นบางนาเอ็มอาร์ไอคลินิกเฉพาะทางด้านเวชกรรมรังสี (ใบอนุญาต 10102001665)
23.คลินิกเฉพาะทางด้านเวชกรรมไตเทียมรื่นฤดี (ใบอนุญาต 10102001765)
24.เค.พี.เอส.การแพทย์คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์โรคไต (ใบอนุญาต 10102001865)
25.อโศกมนตรีเด็นทัลคลินิกทันตกรรม (ใบอนุญาต 10103006365)
26.คลินิกทันตกรรมบางจากสกายเทรน (ใบอนุญาต 10103005365)
27.คลินิกทันตกรรมยิ้นหวาน สาขาสำเหร่ (ใบอนุญาต 10103005265)
28.คลินิกทันตกรรมพีเอ็นแอ๊ดวานซ์ (ใบอนุญาต 10103004565)
29.ทันตการ 999 คลินิกทันตกรรม (ใบอนุญาต 10103004865)
30.คลินิกทันตกรรมลาดพร้าวสไมล์ (ใบอนุญาต 10103006165)
31.คลินิกทันตกรรมไฮ-เด็นท์ (ใบอนุญาต 10103006265)
32.เด็นเต้คลินิกทันตกรรม (ใบอนุญาต 10103005865)
33.คลินิกทันตกรรมยูเคเดนทีซ (ใบอนุญาต 10103006465)
34.คลินิกทันตกรรมเพียวเด้นท์ (ใบอนุญาต 10103006065)
35.คลินิกทันตกรรมบ้านทันตแพทย์ (ใบอนุญาต 10103006765)
36.คลินิกทันตกรรมเสนา (ใบอนุญาต 10103005065)
37.คลินิกการแพทย์แผนไทยหมอสมหมาย (ใบอนุญาต 10108000965)
38.รักษ์มิตรคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108000765)
39.พาธแล็บคลินิกเทคนิคการแพทย์ สาขาพัฒนาการ (ใบอนุญาต 10107000365)
40.สิริยาสหคลินิก (ใบอนุญาต 10110000865)
41.Licence to Operate a Sanatorium” At Home Dental Clinic”
วันที่ 21 มกราคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 23 แห่งดังนี้ (Update ♥)
1.เอศิเลนศิ์คลินิกเวชกรรม (ใบอนุญาต 10101006665)
2.ดิณุศาคลินิกเวชกรรม (ใบอนุญาต 10101007165)
3.คลินิกเวชกรรมแพทย์สุรพล (ใบอนุญาต 10101006165)
4.ดอกเตอร์ไลฟ์คลินิกเวชกรรม สาขาเซ็นทรัลพระราม 9 (ใบอนุญาต 10101006065)
5.แพนคลินิกเวชกรรม สาขาเซ็นทรัลบางนา (ใบอนุญาต 10101006365)
6.บีอีคิวคลินิกเวชกรรม (ใบอนุญาต 10101006965)
7.อินทัชเมดิแคร์คลินิกเวชกรรม สาขาตลิ่งชัน (ใบอนุญาต 10101005665)
8.สุทธิพงศ์คลินิกเวชกรรม (ใบอนุญาต 10101006865)
9.คลินิกเวชกรรมทีเอสดีแอ็ดวานซ์เมดิซีน สาขาเซ็นทรัลพระราม 3(ใบอนุญาต 10101006465)
10.คลินิกเวชกรรมทีเอสดีแอ็ดวานซ์เมดิซีน สาขาเซ็นทรัลบางนา (ใบอนุญาต 10101006265)
11.สมาร์ทคลินิกเฉพาะทางด้านเวชกรรมสูติ-นรีเวช (ใบอนุญาต 10102001365)
12.กิจนทีคลินิกเฉพาะทางด้านเวชกรรมศัลยศาสตร์ออร์โธปดิกส์ (ใบอนุญาต10102001565)
13.คลินิกทันตกรรมบางนา (ใบอนุญาต 10103005565)
14.คลินิกทันตกรรมมิตรสัมพันธ์ (ใบอนุญาต 10103005165)
15.คลินิกทันตกรรมโสรัจทันตแพทย์ (ใบอนุญาต 10103003365)
16.เดนทัลทูมอร์โรว์คลินิกทันตกรรม (ใบอนุญาต 10103005665)
17.คลินิกทันตกรรมซีที (ใบอนุญาต 10103005765)
18.คลินิกทันตกรรมบ้านหมอปิ๋ม (ใบอนุญาต 10103004965)
19.คลินิกทันตกรรมวีเดนท์แอทนาวง (ใบอนุญาต 10103004465)
20.คลินิกทันตกรรมกรุงเทพรักษ์ฟัน (ใบอนุญาต 10103005465)
21.บุญญวรรณคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108000865)
22.เอช.ดี.แล็ป คลินิกเทคนิคการแพทย์ (ใบอนุญาต 10107000265)
23.อวิกาสหคลินิก (ใบอนุญาต 10110000765)
วันที่ 12 มกราคม 2565
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 5 แห่งดังนี้
1.คลินิกทันตกรรมสมาร์ท สไมล์ เด็นทัลเพลส
2.เพชรอนันต์คลินิกทันตกรรม
3.คลินิกทันตกรรมสไมล์เซ็นเตอร์
4.คลินิกทันตกรรมบางนานอกฟันดี
5.สหคลินิกสินเนรมิต
ผลิตภัณฑ์สุขภาพดีเด่น ประเภทนวัตกรรม จำนวน 2 รางวัล
- ผลิตภัณฑ์อภัย บี - เมล่อน มะระขึ้นก มูลนิธิโรงพยาบาลเจ้าพระยาอภัยภูเบศร ในพระปถัมภ์ สมเด็จพระเจ้าภคินีเธอเจ้าฟ้าเพชรรัตนราชสุดา สิริโสภาพัณณวดี
- ผลิตภัณฑ์เครื่องดื่มกล้วยผงสำเร็จรูป รสธรรมชาติ (ตรา ดีปาษณะ) วิสาหกิจชุมชนบ้านสบายใจ จังหวัดสมุทรสงคราม
ผลิตภัณฑ์สุขภาพดีเด่น ประเภทส่งเสริมการใช้วัตถุดิบภายในประเทศ จำนวน 11 รางวัล
- ผลิตภัณฑ์ซอสกัญชา (ตรา ดีอีเค 420) บริษัท หยั่น หว่อ หยุ่น จำกัด
- ผลิตภัณฑ์ ลูกชิ้นกัญชา วรารัตน์ ห้างหุ้นส่วนจำกัด วรารัตน์ ฟู้ดส์
- ผลิตภัณฑ์ยูสตาร์ซีบีดีคอนเซ็นเทรด เชรั่ม อิน ครีม บริษัท ไมลอทท์ แลบบอราทอรีส์ จำกัด
- ผลิตภัณฑ์มิสทิน แคนนะบิส ลีฟ เพาเดอร์ มอยส์เจอร์ รีแพร์ ชาวเวอร์ ครีม บริษัท เอส แอนด์เจ อินเตอร์เนชั่นแนล เอนเตอร์ไพรส์ จำกัด (มหาชน)
- ผลิตภัณฑ์ไม้มอยเจอร์โกลว์เฮมพ์ชิด เอ็กซ์แทรค บริษัท เอสแอลซี อินเตอร์แล็บ จำกัด
- ผลิตภัณฑ์พัฟเค้กสอดไส้ครีมกลิ่นส้ม ตราดิวเบอร์รี่ บริษัท ยูอาร์ซี (ประเทศไทย) จำกัด
- ผลิตภัณฑ์ถุงยางอนามัยวันทัช แฮปปี้ บริษัท ไทยนิปปอน รับเบอร์ อินดัสตรี้ จำกัด (มหาชน)
- ผลิตภัณฑ์ถุงยางอนามัย ไลฟ์สไตล์ แฟนตาชี บริษัท ชัวร์เท็กซ์ จำกัด
- ผลิตภัณฑ์ยาแคปซูลฟ้าทะลายโจรสกัด บริษัท สกายไลน์ เฮลท์ แคร์ จำกัด
- ผลิตภัณฑ์เบลสิด ซัสเพนชั่น บริษัท ไบโอแลป จำกัด
- ผลิตภัณฑ์แพกทรีน่า อโรมาเธอราพี มาสชาจ ออยล์ อิพพี รีเนียน บริษัท กิฟฟารีน สกายไลน์ แลบบอราทอรี่ แอนด์ เอลท์แคร์ จำกัด
ผลิตภัณฑ์สุขภาพดีเด่น ประเภทส่งเสริมเศรษฐกิจฐานราก จำนวน 8 รางวัล
- ผลิตภัณฑ์ขิงหยอง รสสาหร่าย วิสาหกิจชุมชนกลุ่มแม่บ้นทฤษฎีใหม่ (ขิงแปรรูปนวลอนันต์) จังหวัดเพชรบูรณ์
- ผลิตภัณฑ์มะขามอบแห้งแกะเมล็ด บริษัท ไนน์ แทมมะรินด์ จำกัด จังหวัดเพชรบูรณ์
- ผลิตภัณฑ์ปลาส้มเนื้อล้วน รสออริจินัล บริษัท ไร่นายจุล คุ้นวงศ์ จำกัด จังหวัดเพชรบูรณ์
- ผลิตภัณฑ์กุนเชียงปลาสลิดพร้อมบริโภค วิสาหกิจชุมชนกลุ่มอาชีพสหกรณ์วัดลาดปลาเค้า จังหวัดสุพรรณบุรี
- ผลิตภัณฑ์ขนมเปี๊ยะมะลิ ไส้ฝอยทอง วิสาหกิจชุมชนกลุ่มขนมบ้านบุญมี จังหวัดฉะเชิงเทรา
- ผลิตภัณฑ์น้ำพริกปลาร้าแจ่วบอง วิสาหกิจชุมชนกลุ่มแม่บ้านเกษตรกรแปรรูปผลผลิตทางการเกษตรสว่างวีระวงศ์ จังหวัดอุบลราชธานี
- ผลิตภัณฑ์น้ำปลาร้าปรุงสุก ตราสุนทรี วิสาหกิจชุมชนกลุ่มน้ำปลาร้าปรุงสุกสุนทรี จังหวัดอำนาจเจริญ
- ผลิตภัณฑ์กาแฟแท้ 100% คั่ว ตราถ้ำสิงห์ วิสาหกิจชุมชนกลุ่มกาแฟ บ้านถ้ำสิงห์ จังหวัดชุมพร
ผลิตภัณฑ์สุขภาพดีเด่น ประเภทสร้างสรรค์ จำนวน 3 รางวัล
- ผลิตภัณฑ์คุกกี้ขิงธัญพืช วิสาหกิจชุมชนกลุ่มแม่บ้านทฤษฎีใหม่ (ขิงแปรรูปนวลอนันต์) จังหวัดเพชรบูรณ์
- ผลิตภัณฑ์เส้นพาสต้าจากถั่วเขียว บริษัท ข้าวดินดี จำกัด
- ผลิตภัณฑ์ขนมคุกกี้กุ๊กไก่ ไส้สับปะรด แม่หนิงภูดอย
คลินิกกุมารเวชกรรม เปิดบริการทุกวันอังคาร
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกกุมารเวชกรรม ให้บริการตรวจรักษาผู้ป่วยเด็ก โรคเด็กทั่วไป โรคภูมิแพ้ หอบหืด โรคติดเชื้อ ปรึกษาปัญหาพฤติกรรม พัฒนาการ และการเจริญเติบโต โดย แพทย์หญิงรสสุคนธ์ สันติภาษ กุมารแพทย์ เปิดบริการทุกวันอังคารของเดือน เว้นวันหยุดนักขัตฤกษ์ เวลา 16.30-20.30 น. ณ ห้องตรวจเบอร์ 6 โรงพยาบาลสิงห์บรุี (เริ่มตรวจเดือนมกราคม ๒๕๖๖)
Amarin TV 34HD
นายศิริ บุญพิทักษ์เกศ กรรมการผู้จัดการใหญ่ บริษัทอมรินทร์ เทเลวิชั่น จำกัด ยังเสริมว่า Amarin TV 34HD เป็นสื่อที่จะช่วยเชื่อมโยงในทุกภาคส่วนเพื่อสร้างสังคม (Community) แห่งการแบ่งปัน และมอบสิ่งดีๆ กลับคืนสู่สังคม เหมือนที่เราได้ทำมาตลอดโดยเฉพาะในช่วง 3-4 ปีที่ผ่านมา ด้วยการเป็นสื่อกลางช่วยเหลือผู้ที่ได้รับผลกระทบจากสถานการณ์โควิด - 19 การระดมทุนจากผู้ชมของเราที่มีจิตศรัทธาเพื่อช่วยเหลือผู้ประสบภัย การนำเสนอคอนเทนต์ที่มีส่วนช่วยคนในสังคมและชุมชน เพื่อที่เราจะเติบโตไปด้วยกัน บนเส้นทางหรือสังคมที่ยั่งยืน ภายใต้สโลแกนและทิศทางการทำงานของเรา “Sustainable Route” เติบโตอย่างต่อเนื่องและยั่งยืนไปกับรายการต่างๆ ของช่องในแบบ “Real Life Entertainment สนุก เข้มข้น บนความจริง” ซึ่งเป็นแนวคิดและจุดยืนหลักของช่อง (Concept & Positioning) และเป็นเอกลักษณ์ของ Amarin TV 34HD นั่นเอง


นอกจากนี้ การดูแลสุขภาพผิวยังรวมไปถึงการลดการทำลายผิว โดยหลีกเลี่ยงแสงแดดโดยเฉพาะช่วงเวลา 10 โมงเช้าถึง 4 โมงเย็น ซึ่งเป็นช่วงเวลาที่แดดจ้า พยายามอยู่ในที่ร่ม ไม่ว่าจะทำกิจกรรมใดๆ หลีกเลี่ยงเครื่องดื่มแอลกอฮอล์และเครื่องดื่มที่มีคาเฟอีน เช่น ชา กาแฟ ซึ่งเครื่องดื่มเหล่านี้จะดึงน้ำออกจากผิวและเป็นต้นเหตุให้ผิวแห้งกร้านได้ง่าย งดสูบบุหรี่ พักผ่อนให้เพียงพอ ลดความเครียด เพราะการสูบบุหรี่ การพักผ่อนน้อย และความเครียด เป็นตัวกระตุ้นให้เกิดอนุมูลอิสระมาทำลายผิวของเราได้ ทำให้ผิวหยาบกร้าน หมองคล้ำ และเหี่ยวย่น รวมทั้ง การสูดอากาศบริสุทธิ์ ซึ่งจะช่วยในการผ่อนคลายจากการเหนื่อยล้าในแต่ละวันได้ดี และยังช่วยให้ผิวได้ออกซิเจนเพิ่มขึ้นด้วย นอกจากนี้ ยังสามารถใช้อุปกรณ์เสริมช่วยปกป้องผิว ถือเป็นอีกวิธีที่ช่วยปกป้องผิวจากแสงแดด และลดการทำลายผิวได้อย่างมาก ซึ่งสามารถทำได้ง่าย ๆ โดยการพกแว่นกันแดด หมวก หรือร่มติดตัวไว้ รวมทั้งการสวมเสื้อผ้าที่ปกปิดมิดชิดแต่โปร่งสบายเหมาะกับการสวมใส่ในหน้าร้อน การออกกำลังกายเป็นประจำเป็นวิธีง่ายๆ ที่ช่วยให้ผิวสวยได้ เพราะจะทำให้ระบบการไหลเวียนและการสูบฉีดโลหิตดีขึ้น ทำให้ผิวได้รับออกซิเจนและสารอาหารต่างๆ อย่างเต็มที่ และยังส่งผลให้ร่างกายแข็งแรงขึ้นด้วย นอกจากนี้ยังทำให้ร่างกายได้ขับถ่ายของเสียไปกับเหงื่อที่ออกมาด้วย และการนอนหลับวันละ 6-8 ชั่วโมง เพราะช่วงเวลาที่นอนหลับนั้น เป็นช่วงเวลาที่ผิวทำการซ่อมแซมเซลล์ที่เสื่อมโทรม การนอนน้อยพักผ่อนน้อย ผิวหน้าเราก็จะแห้งกร้าน ไม่สดใสได้
“การเสริมด้วยสารอาหารที่มีคุณประโยชน์ต่อการบำรุงผิวก็เป็นอีกทางที่ช่วยดูแลสุขภาพผิวของเราได้ ไม่ว่าจะเป็นสารอาหารที่ช่วยเสริมสร้างคอลลาเจน และอิลาสตินของผิวหนัง สารอาหารช่วยยับยั้งการทำลายจากอนุมูลอิสระ สารอาหารที่ช่วยป้องกันผิวที่อาจได้รับอันตรายจากรังสี UV สารอาหารที่เพิ่มความแข็งแรงให้กับเส้นเลือด สารอาหารที่ช่วยขับพิษออกจากร่างกาย และสารอาหารเสริมประสิทธิภาพการบำรุงผิว โดยวิตามินสำหรับผิวมีหลายตัว ได้แก่ วิตามินซี ที่เพิ่มคอลลาเจนและมีสารแอนตี้ออกซิแดนท์ วิตามินอี ที่ช่วยลดความเครียดของร่างกาย (MDA) หลังจากผิวได้รับรังสี UV วิตามินบี 3 คอลลาเจนไทพ์วัน กรดอัลฟ่า ลิโพอิก ซิงค์ และแอสต้าแซนธิน วิธีการดูแลผิวให้มีสุขภาพดียังรวมถึงการโบท็อกซ์ ฉีดฟิลเลอร์ ฟื้นฟูผิวด้วย PRP หรือนวัตกรรมฟื้นฟูจากภายในด้วยเกล็ดเลือดเข้มข้น Rejuran หรือการกระตุ้นเซลล์ผิวให้มีการสร้างตัวใหม่ การเลเซอร์ และการทรีทเมนต์ด้วยการ IV Drip หรือการดริปวิตามิน ซึ่งมีให้บริการทั้งหมด 9 สูตร โดยมีตัวไฮไลท์ที่น่าสนใจ 4 สูตร ได้แก่ IV Beauty Booster , IV Metabolism , IV Jet Lag และ IV Hangover Remedy ซึ่งเป็นโปรแกรมที่ให้บริการที่ BDMS Wellness Clinic Retreat โดยจะต้องเข้าพบและรับคำปรึกษาจากแพทย์เพื่อเลือกสูตร IV Drip ที่เหมาะกับความต้องการของแต่ละบุคคล” ดร.พญ.อติยา กล่าว
Thailand Earth Trail @Rayong
หมอเดชา ลั่นไม่ยอม [ข่าวสด]
ข่าวสด เผยแพร่บทสัมภาษณ์หมอเดชา หรือนายเดชา ศิริภัทร ประธานมูลนิธิข้าวขวัญ จ.สุพรรณบุรี ผู้ทำน้ำมันกัญชาสกัด น้ำมันกัญชา (ตำรับหมอเดชา) กรมการแพทย์แผนไทยและการแพทย์ทางเลือก กล่าวว่า ตนไม่เห็นด้วยถ้ารัฐบาลใหม่มีมติให้กัญชากลับเข้าไปเป็นบัญชียาเสพติดเหมือนเดิม เพราะตนใช้น้ำมันกัญชาอยู่ทุกวันเพราะรู้ว่ามันดี แล้วการใช้ทุกวันมันต้องทำเอง ไม่ใช่ต้องไปรอจากที่อื่น แต่การใช้เองมันต้องไม่ใช่ยาเสพติด ...
อ่านทั้งหมด
เขตสุขภาพที่ 5
เขตสุขภาพที่ 6
เขตสุขภาพที่ 7
เขตสุขภาพที่ 8
เขตสุขภาพที่ 9
คลินิกพิเศษเฉพาะทางนอกเวลาราชการSMC
รพ.หัวหิน สาขา 4 มหาการุณย์ (ถนนแนบเคหาสน์) LINK
บริการตรวจรักษาโรคทั่วไป วันจันทร์-วันศุกร์ เวลา 8.30-12.00น.
สำหรับ ผู้รับบริการที่ใช้สิทธิประกันสังคมสามารถยื่นบัตรและรับบริการได้โดยไม่เสียค่าบริการเพิ่ม
สำหรับ สิทธิเงินสด และสิทธิข้าราชการ จ่ายค่าบริการเพิ่มเพียง 200 บาท
คลินิกจิตเวชเด็กและวัยรุ่น เปิดให้บริการ วันจันทร์- วันศุกร์ เวลา 8.00-16.00 น.
คลินิกจิตเวช เปิดให้บริการ วันจันทร์-วันศุกร์ เวลา 8.00-16.00 น.
คลินิกทันตกรรม เปิดให้บริการ วันจันทร์- วันศุกร์ เวลา 8.30-12.00 น. (รับจำนวนจำกัด)
คลินิกสุขภาพเด็กดี เปิดให้บริการ ประเมินพัฒนาการเด็ก บริการฉีดวัคซีนป้องกันโรคในเด็ก ตรวจสุขภาพช่องปากและฟัน ให้คำแนะนำโรงเรียนพ่อแม่
• วันจันทร์ เปิดให้บริการ เด็กโครงการแคร์และกระตุ้นพัฒนาการตามช่วงอายุ
• วันอังคาร เปิดให้บริการ ฉีดวัคซีนเด็กช่วงอายุ 1-2 เดือน
• วันพุธ เปิดให้บริการ ฉีดวัคซีนช่วงอายุ 4-6 เดือน
• วันพฤหัส เปิดให้บริการ ฉีดวัคซีนช่วงอายุ 9 เดือน – 1 ปี 6 เดือน
• วันศุกร์ เปิดให้บริการ ฉีดวัคซีนช่วงอายุ 2 ปี 6 เดือน - 4 ปี
สอบถามรายละเอียดเพิ่มเติม โทร.032-515331 ต่อ 3440
คลินิกพิเศษด้านอายุรกรรม โรคหัวใจ
2. ข้อมูลที่ผิด Misinformation
ข้อมูลที่ผิดพลาดที่สร้างโดย AI และเนื้อหาที่โน้มน้าวใจจำนวนมากอาจทำให้สังคมไม่พร้อมที่จะรับมือกับความท้าทายที่สำคัญในยุคของเรา
รัฐ พรรคการเมือง และองค์กรต่าง ๆ ใช้เทคโนโลยีเพื่อสร้างอิทธิพลและโน้มน้าวผู้อื่นถึงความเชื่อ อุดมการณ์ และเรื่องเล่าทางการเมืองของตน AI ที่เกิดขึ้นใหม่อาจนำกรณีการใช้งานนี้ไปสู่ยุคใหม่และแพร่แคมเปญข้อมูลที่ปรับแต่งบิดเบือนออกไปในวงกว้าง นอกจากนี้ AI เองยังสามารถสร้างข้อโต้แย้งที่โน้มน้าวใจได้สูงซึ่งก่อให้เกิดการตอบสนองทางอารมณ์ที่รุนแรง เมื่อรวมกันแล้ว แนวโน้มเหล่านี้อาจบั่นทอนการตัดสินใจร่วมกัน ทำให้คนมีความกร้าวมากขึ้น หรือทำให้ความก้าวหน้าทางศีลธรรมตกต่ำลง
สถิติการรักษาโรคตาซับซ้อน ของบำรุงราษฎร์ 2565
รศ.ดร.อนุสรณ์ ธรรมใจ ประธานกรรมการบริหารสถาบันปรีดี พนมยงค์ ได้ให้ทัศนะไว้ว่า "การจะแก้ไขปัญหาคอร์รัปชั่นได้จะต้องได้รับความร่วมมือจากภาคส่วนต่าง ๆ ปปช. หน่วยงานเดียวไม่สามารถแก้ไขได้ ผู้นำเพียงคนเดียวก็ไม่สามารถแก้ไขได้ ต้องเป็นทั้งองคาพยพของกลุ่มผู้นำทางการเมือง แล้ว ปปช.ก็เข้ามาเป็นตัวขับเคลื่อนที่สำคัญร่วมกับสื่อมวลชน และภาคประชาชน การกระจายอำนาจจะนำไปสู่ Open government ที่ภาครัฐจะทำงานอย่างโปร่งใส ลดทุจริต และมีประสิทธิภาพสูงขึ้น เป็นส่วนนึงในระบบการปกครองที่ดี ความก้าวหน้าทางเทคโนโลยี กระแสประชาธิปไตยทางตรง การบริหารแบบมีส่วนร่วม จะทำให้เป็นความโปร่งใสที่เปลี่ยนแปลงแบบถอนรากถอนโคน เพราะสามารถตรวจสอบภาครัฐได้ ที่สำคัญเราต้องยกย่องคนดี คนซื่อสัตย์ให้เป็น Role Model สังคม ‘ต้อง’ ให้ความสำคัญเรื่องนี้ให้เป็นแบบอย่างที่ถูกต้อง ต้องโอบอุ้ม Blockchain เพื่อเป็นการนำไปปฏิรูปในการทำธุรกรรมต่างๆ กับหน่วยงานภาครัฐ เทคโนโลยีใหม่ ๆ สามารถเข้ามาช่วยแก้ไขปัญหาคอร์รัปชั่นได้"
เปิดจินตนาการผ่านหนังสือภาพ สู่การสร้างห้องเรียนแห่งความสุข
ผลจากการใช้หนังสือภาพและนิทานเข้ามาเป็นส่วนช่วยในการส่งเสริมการอ่านอย่างมีความหมาย ชี้ให้เห็นว่ากำลังดำเนินมาถูกทาง โดย ดร.รังรอง สมมิตร หัวหน้าโครงการวิจัยจากคณะศึกษาศาสตร์ มหาวิทยาลัยศรีนครินทรวิโรฒ ได้กล่าวถึงการเปลี่ยนแปลงของเยาวชนหลังจากริเริ่มโครงการฯ ว่า “จากหนังสือเล่มแรกสู่เล่มที่สิบ เราได้เห็นชัดเจนว่าเด็กผูกพันกับหนังสือ และมีคลังคำศัพท์ในการพูดมากขึ้น กิจกรรมที่เราทำไม่ใช่การสอนอ่าน แต่เป็นการใช้ภาพเป็นสื่อกลางเพื่อลดทอนความกังวลด้านความผิดถูก โดยภาพกับคำจะทำงานกับความคิดให้เด็กมองภาพและเกิดความคิดอ่านอย่างเป็นระบบ อีกทั้งเปิดพื้นที่ให้เด็กจินตนาการผ่านการคิดวิเคราะห์ สังเกตมากขึ้น ดังนั้นสำหรับปลายทางของโครงการฯ เราเชื่อว่าการอ่านที่มีความสุขจะนำไปสู่การอ่านเพื่อค้นหา และเมื่อเราเปิดพื้นที่ปลอดภัยให้เด็กๆ กล้าแสดงความคิดเห็น เมื่อนั้นเองที่เราจะได้เห็นศักยภาพที่ซ่อนอยู่ออกมา”
ISSAN RUM อีสานรัม เหล้าหนองคาย LINK
อีสานรัม แบรนด์ที่เริ่มต้นจากคู่สามีชาวฝรั่งเศส ภรรยาสาวไทย เริ่มทดลองทำเหล้าตั้งแต่การปลูกอ้อยเอง หมักเอง กลั่นเองตั้งแต่ปี 2013 โรงงานตั้งอยู่ที่จังหวัดหนองคายผลิตโดยใช้อ้อยสดๆในพื้นที่เป็นวัตถุดิบหลัก
เหล้าตัวนี้เคยได้รางวัลเหรียญเงินจากเวทีระดับโลก IWSC (International Wine and Spirit Competition) ปี 2014 ในปีแรกที่เริ่มจำหน่าย และขณะนี้พวกเขาได้ขยายโรงงานไปผลิตรัมอีกตัวจากน้ำตาล Molas บนเกาะสมุย
ข้อมูลและภาพจากเพจประชาชนเบียร์
หลักสูตรด้าน อิเล็กทรอนิกส์อัจฉริยะ (Smart Electronics)
*ปี 2563-2565
- IoT Raspberry using Python Programming อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 17/10/2565 - 21/10/2565
- IoT Raspberry using Python Programming อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 17/05/2564 - 21/05/2564
- [depa] IoT Raspberry using Python Programming อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 30/11/2563 - 04/12/2563
- Network System Administration Techniques for IT Professionals: การพัฒนาทักษะผู้บริหารระบบเครือข่าย อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 02/11/2563 - 06/11/2563
- [depa] Network System Administration Techniques for IT Professionals: การพัฒนาทักษะผู้บริหารระบบเครือข่าย อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 02/11/2563 - 06/11/2563
- [depa] Network System Administration Techniques for IT Professionals: การพัฒนาทักษะผู้บริหารระบบเครือข่าย อุตสาหกรรมอิเล็กทรอนิกส์อัจฉริยะ 03/08/2563 - 07/08/2563
การปรับพฤติกรรมให้เหมาะสมจากการได้รับข้อมูลด้านสุขภาพ
ถึงแม้ว่าคนไทยจะมีการตรวจวัดสุขภาพมากขึ้น แต่กลับมีเพียง 1 ใน 3 ของกลุ่มตัวอย่างที่มีการปรับเปลี่ยนพฤติกรรมที่เกี่ยวข้องกับการดูแลสุขภาพให้สอดคล้องกับผลของการตรวจวัดสุขภาพแบบดิจิทัล ในขณะที่ร้อยละ 40 เชื่อว่าพวกเขายังสามารถปรับพฤติกรรมการดูแลสุขภาพของตนเองได้มากกว่านี้ โดยเฉพาะในกลุ่ม Gen Z (ร้อยละ 44) และ Young Millennials (ร้อยละ42)
จากผลสำรวจยังแสดงให้เห็นว่า ร้อยละ 47 ของกลุ่มตัวอย่างในภูมิภาคนี้มองว่าคำแนะนำของแพทย์เป็นแรงจูงใจที่สำคัญที่สุดต่อการปรับเปลี่ยนพฤติกรรมให้สอดคล้องกับข้อมูลการตรวจวัดด้านสุขภาพส่วนบุคคล โดยร้อยละ 51 ของกลุ่มตัวอย่างในประเทศไทยบอกว่า พวกเขามีแนวโน้มที่จะปรับเปลี่ยนพฤติกรรมให้สอดคล้องกับข้อมูลการตรวจวัดด้านสุขภาพ หากได้รับคำแนะนำจากแพทย์และผู้ให้บริการด้านสาธารณสุข อย่างไรก็ตามมีเพียงส่วนน้อยของกลุ่มตัวอย่างในประเทศไทยที่เปิดเผยข้อมูลการตรวจวัดสุขภาพแบบดิจิทัลกับแพทย์และผู้ให้บริการด้านสาธารณสุขอย่างสม่ำเสมอ เนื่องจากปัจจัยด้านความกังวลถึงความเป็นส่วนตัวของข้อมูล (ร้อยละ 41) และปัจจัยด้านขาดความรู้ในการแชร์ข้อมูลการตรวจวัดด้านสุขภาพ (ร้อยละ 24) โดยกลุ่มตัวอย่างในประเทศไทยร้อยละ 23 บอกว่าพวกเขาไม่รู้ถึงวิธีการแชร์ข้อมูลที่ได้จากอุปกรณ์ตรวจวัดสุขภาพส่วนบุคคลให้กับแพทย์ และร้อยละ 11 บอกว่าพวกเขาขาดการรับรู้เกี่ยวกับเทคโนโลยีเพื่อการดูแลสุขภาพส่วนบุคคล ทำให้เป็นอุปสรรคสำหรับพวกเขาในการดูแลสุขภาพให้ดีขึ้น
สรุปประเด็นจากผู้ร่วมสัมนา ผู้ว่าชัชชาติ รองผู้ว่า ทวิดา และผู้บริหารรพ.รัฐ
ชัชชาติ สิทธิพันธุ์ ผู้ว่าฯ กทม. กล่าวเปิดการประชุมเชิงปฏิบัติการ Bangkok Health Zoning ว่า การสาธารณสุข กับ การศึกษา เป็น 2 เรื่องใหญ่ ที่จะช่วยลดความเหลื่อมล้ำในกรุงเทพฯ แต่มีข้อสังเกตว่ากรุงเทพฯ เป็นศูนย์รวมความเจริญทางการแพทย์ แต่การประสานงานยังไม่ค่อยดี จะทำอย่างไรให้ประสานงานเป็นเนื้อเดียวกัน จึงมีการแบ่งเป็น 7 โซน มีโรงพยาบาลแม่ข่าย สังกัด กทม. โรงพยาบาลพี่เลี้ยง สังกัดโรงเรียนแพทย์ เอกชน และสาธารณสุข
“ยอมรับว่าแต่ละโรงพยาบาลก็มีภารกิจต่างกัน การชวนมาร่วมทำงานก็ต้องทำให้เกิดประโยชน์กับทุกฝ่าย อาจใช้นวัตกรรมเข้ามามีส่วนในการพัฒนาคุณภาพ โดยนโยบายสุขภาพ กทม. ก็คงต้องเสนอให้รัฐบาลใหม่ช่วยมาดูเรื่องนี้ด้วย”
รศ.ทวิดา กมลเวชช รองผู้ว่าฯ กทม. บอกถึงตัวชี้วัดความสำเร็จของ Bangkok Health Zoning คือ
- ความแออัดในโรงพยาบาลลดลง
- ผู้ป่วยได้รับการบริการเร็วขึ้น
- ลดการส่งต่อผู้ป่วยไปโรงพยาบาลใหญ่
- เมื่อระบบเทเลเมดิซีนทำงานอย่างมีประสิทธิภาพ จะทำให้มีผู้ใช้บริการหน่วยปฐมภูมิมากขึ้น
ศ.นพ.ฉันชาย สิทธิพันธุ์ ผู้อำนวยการโรงพยาบาลจุฬาลงกรณ์ กล่าวว่า การสร้างเครือข่ายโรงพยาบาล ต้องอาศัยความเชื่อใจจากประชาชน ให้มั่นใจว่าจะได้รับการรักษาคุณภาพไม่ต่างจากโรงพยาบาลจุฬาฯ แต่ความเป็นเครือข่ายจะไม่เกิดขึ้น หากหน่วยบริการปฐมภูมิไม่เข้มแข็ง โจทย์สำคัญคือต้องใช้สถานพยาบาลให้เหมาะสมกับผู้ป่วย และมีระบบช่วยเหลือกัน โดยสิ่งที่อยากให้ กทม. ทำ คือบอกบทบาทของโรงพยาบาลพี่เลี้ยงให้ชัดเจน และในแต่ละโซนสุขภาพอาจจะปัญหาต่างกัน จำเป็นต้องออกแบบต่างกันไป
ศ.คลินิก นพ.วิศิษฎ์ วามวาณิชย์ ผู้อำนวยการโรงพยาบาลศิริราช กล่าวถึงทางเลือกของการให้บริการ ถ้าเพิ่มการเข้าถึงแล้วคุณภาพจะเป็นอย่างไร และการจำกัดการเข้าถึงบริการ จะมีคุณภาพการรักษามากกว่า คุณค่าของระบบควรเป็นแบบไหน พร้อมเห็นด้วยกับการสร้างเครือข่ายโรงพยาบาล อาจจะเป็นเครือข่ายเฉพาะโรค และเรื่องสำคัญที่ กทม. ควรเตรียมไว้ คือการควบคุมโรคระบาด เพราะมั่นใจว่าจะมีอีก รวมถึงการเกิดภัยขนาดใหญ่ ก็ควรจะมีแผนรองรับ
อีกข้อเสนอ คือ กระจายอำนาจทางการแพทย์ ในแต่ละเขตควรมีคอมมูนิตี้เซ็นเตอร์ ที่โฟกัสปัญหาสุขภาพที่ต่างกันไป เช่น บางเขตมีผู้สูงอายุมาก บางเขตเป็นแหล่งมลพิษ
“อีกเรื่องคือ การทำโฮมวอร์ด ในเรื่องนี้ อาสาสมัครสาธารณสุข และญาต ต้องวางเป้าหมายว่าจะมีส่วนร่วมอยา่งไร เรื่ององค์ความรู้ รร.แพทย์ช่วยได้ เหล่านี้ คือ New Paradigm health care (กระบวนทัศน์ใหม่ด้านการดูแลสุขภาพ) ถ้าไม่ทำ แบบนี้กรุงเทพจะมีสุขภาพดีไม่ได้ …”
นพ.จินดา โรจนเมธินทร์ ผู้อำนวยการโรงพยาบาลราชวิถี กล่าวว่า นโยบายสุขภาพดี ต้องทำครบ ทั้งส่งเสริม ป้องกัน รักษา ฟื้นฟู โดยเฉพาะการรักษาเป็นสิ่งที่เห็นผลกระทบใกล้ที่สุด มี 2 ประเด็น 1. การลดความแออัดในโรงพยาบาลใหญ่ ระดับตติยภูมิ ผู้มาใช้บริการ รอคอยนาน และ 2. การดูแลผู้ป่วยวิกฤตฉุกเฉิน
ประเด็นแรก การลดความแออัดในโรงพยาบาลนั้น รพ.ราชวิถี มีผู้ป่วยนอกรับบริการ 1.1 ล้านครั้งต่อปี 80% มีอาการอยู่ในขั้นที่เข้ารับการรักษาได้ใน รพ.ระดับทุติยภูมิ ยังไม่ถึงขนาดต้องมาที่ รพ.ราชวิถี ซึ่งเป็น รพ.ระดับตติยภูมิ และมีเพียง 20% ที่มีอาการต้องรักษาในระดับตติยภูมิจริง ๆ ดังนั้น แทนที่โรงพยาบาลตติยภูมิจะมีเตียงสำหรับคนไข้ที่หนักจริง ๆ ก็อาจถูกเบียดบังไป จึงมองว่าการจัดบริการให้เหมาะสมกับผู้ป่วย ในแต่ละเคสเป็นเรื่องจำเป็น
“สิ่งนี้เราต้องมี buffer area หรือ หน่วยบริการทุติยภูมิที่เหมาะสม ซึ่งก็คือการยกระดับศูนย์บริการสาธารณสุข และสร้างการรับรู้ให้ประชาชนมาใช้บริการ อาจจำเป็นต้องรีแบรนด์ ศูนย์บริการสาธารณสุข สร้างการรับรู้กับประชาชนให้มากขึ้น ว่ามีการยกระดับการให้บริการ ให้ประชาชนเชื่อมั่น และเข้ามาใช้บริการมากขึ้น”
ฟื้นฟูอ่าวโฉลกหลำกับความหวังใหม่ของธรรมชาติและชุมชน
โครงการดังกล่าวได้จุดประกายความหวังให้แก่ทุกชีวิตในพื้นที่อ่าวโฉลกหลำ ด้วยความคาดหวังที่จะเห็นความอุดมสมบูรณ์ของธรรมชาติเพื่อหล่อเลี้ยงผู้คนในชุมชนและเป็นบ้านใหม่ให้สัตว์ทะเลนานาชนิด โดยหลังจากจัดวางแท่นปะการังเทียมเป็นระยะเวลา 2 ปี ตั้งแต่เดือนตุลาคม 2563 จนถึงเดือนตุลาคม 2565 เรียกได้ว่าความคาดหวังดังกล่าวเริ่มกลายเป็นความจริง โดยอ่าวโฉลกหลำบริเวณทางเหนือของเกาะพะงัน ถือได้ว่าเป็นจุดเริ่มต้นที่ดีของโครงการนำร่อง เนื่องจากมีกายภาพที่เหมาะสม ทั้งความอุดมสมบูรณ์สำหรับสัตว์ทะเล ไปจนถึงเส้นทางที่เหมาะสมต่อการขนย้าย และสามารถเอื้อประโยชน์ต่อชุมชนในพื้นที่
รศ.ดร. ศุภิชัย ตั้งใจตรง กรรมการผู้อำนวยการ ศูนย์บริการวิชาการแห่งจุฬาลงกรณ์มหาวิทยาลัย ชี้ถึงความสำเร็จของโครงการฯ ว่า “จากการศึกษาติดตามอย่างใกล้ชิดพบว่าผลสำเร็จของโครงการฯ ออกมาในเชิงบวกทั้งมิติของธรรมชาติ และมิติของมนุษย์ โดยเราพบว่าคุณภาพน้ำทะเลและคุณภาพตะกอนพื้นท้องทะเลในบริเวณกองปะการังเทียมอยู่ในเกณฑ์มาตรฐานคุณภาพสิ่งแวดล้อม และพบแพลงก์ตอนพืช แพลงก์ตอนสัตว์ซึ่งเป็นแหล่งอาหารของสัตว์ทะเลหลากหลายชนิด ส่งผลให้ความหลากหลายของปลาเพิ่มขึ้นจาก 15 ชนิด เป็น 36 ชนิด ซึ่งแม้ความหนาแน่นของประชากรปลาในบริเวณกองปะการังเทียมจะยังไม่เทียบเท่าแนวปะการังธรรมชาติ แต่สิ่งที่แตกต่างออกไปคือมวลชีวภาพของปลาในด้านขนาดและน้ำหนักจะมีมากกว่า โดยปลาที่สำรวจพบส่วนใหญ่เป็นปลาที่มีคุณค่าทางเศรษฐกิจ เช่น ปลาหางแข็ง ปลากล้วย ปลาข้างเหลือง และยังพบปลาที่เคยหายไปจากพื้นที่ได้กลับเข้ามาอยู่อาศัยในพื้นที่ปะการังเทียม นอกจากนี้เรายังพบการปกคลุมของสิ่งมีชีวิตเกาะติด โดยมีปะการังดำเป็นกลุ่มเด่นอีกด้วย แสดงให้เห็นถึงแนวโน้มของปะการังเทียมจากขาแท่นหลุมผลิตปิโตรเลียมจะกลายเป็นแหล่งที่อยู่อาศัย และแหล่งอนุบาลของสัตว์น้ำที่สำคัญไม่น้อยไปกว่าแนวปะการังธรรมชาติ รวมถึงมีแนวโน้มที่จะเป็นแหล่งประมงที่สำคัญของชาวประมงในพื้นที่ในอนาคต”
หมอคนที่ 3 นักจิตวิทยา และแพทย์ประจำตึก
หมอคนที่ 3 นักจิตวิทยา และแพทย์ประจำตึก ให้การปรึกษาเพื่อวางแผนการรักษาร่วมกับจิตแพทย์ของ รพ.สุรินทร์โดยตรง
โรงพยาบาลทันตกรรม(ถาวร) ณ ต.สามพร้าว อ.เมือง จ.อุดรธานี
9 พฤษภาคม 2566 ทำหมันฟรีให้สุนัขและแมว ณ วัดโขดทิมทาราม
9 พฤษภาคม 2566 จะมีการจัดกิจกรรมทำหมันฟรีให้สุนัขและแมว ณ วัดโขดทิมทาราม
ผู้ที่สนใจเข้าร่วมโครงการ กรุณาเตรียมตัวดังนี้
1. งดน้ำและอาหารสุนัขและแมวที่จะทำหมัน อย่างน้อย 8 ชม. ก่อนผ่าตัด
2. เตรียมบัตรประจำตัวประชาชน ที่อยู่ในเขตเทศบาลนครระยอง มาลงทะเบียนเวลา 8.30 น.
3. จำกัดบ้านละ 1 ตัว
อรอร: อย่างแรกเราต้องเริ่มที่จิตใจของเราก่อน ถ้าเรามีความตั้งใจมีความเชื่อมั่น ทำในสิ่งที่รัก ก็จะไม่รู้สึกเหนื่อยและท้อ
ธนาคารกสิกรไทย : ยืนยันตัวตนที่ตู้ ATM หรือสาขาธนาคารทั่วประเทศ แจ้งลูกค้า K PLUS อัปเดตเวอร์ชันล่าสุด LINK
ธนาคารกสิกรไทย ยกระดับความปลอดภัยในการทำธุรกรรมผ่าน K PLUS แนะนำให้ลูกค้าอัปเดตเวอร์ชันล่าสุด 5.17.0 เพิ่มเมนูใหม่ สามารถตรวจสอบ หรือยืนยันตัวตนด้วยใบหน้ากับธนาคาร เพื่อใช้ทำธุรกรรมบน K PLUS สามารถทำเองได้ง่ายๆ ด้วยขั้นตอนต่อไปนี้
• เลือก “อื่นๆ" (Others)
• เลือก “การตั้งค่า" (Setting)
• เลือก “ยืนยันตัวตนด้วยใบหน้ากับธนาคาร" (Facial Verification with Bank)
หากธนาคารมีข้อมูลสแกนใบหน้าของลูกค้าแล้ว K PLUS จะแสดงข้อความว่า “คุณได้ยืนยันตัวตนด้วยใบหน้าที่พร้อมใช้งานแล้ว" ลูกค้าสามารถสแกนใบหน้าเพื่อยืนยันตัวตนในการทำธุรกรรมบน K PLUS ได้ตามปกติ
ในกรณีที่ลูกค้าเคยยืนยันตัวตนด้วยบัตรประชาชนแล้ว แต่ยังไม่เคยสแกนใบหน้า K PLUS จะให้ลูกค้าถ่ายรูปใบหน้าตามคำแนะนำบนหน้าจอ
หากลูกค้ายังไม่เคยยืนยันตัวตนและสแกนใบหน้า K PLUS จะแสดงข้อความว่า “คุณยังไม่ได้นำบัตรประชาชนไปยืนยันตัวตน (Dip Chip) ที่จุดให้บริการของธนาคาร" ให้ลูกค้านำบัตรประชาชนไปยืนยันตัวตนที่ตู้ ATM หรือสาขาธนาคารทั่วประเทศ
ทั้งนี้ เพื่อความปลอดภัยในการทำธุรกรรม ลูกค้า K PLUS ต้องยืนยันตัวตนด้วยการสแกนใบหน้าในการทำธุรกรรม 3 ประเภท ได้แก่ 1) โอนเงินตั้งแต่ 50,000 บาทขึ้นไปต่อรายการ 2) โอนเงินเมื่อมียอดรวมการโอนทุก 200,000 บาทต่อวัน 3) ปรับเพิ่งวงเงินการทำรายการต่อวัน
สอบถามข้อมูลเพิ่มเติมได้ที่ LINE Official Account @KBankLive หรือ K-Contact Center โทร.02-8888888 หรือโทร. ผ่าน K PLUS ได้ตลอด 24 ชั่วโมง
401
คลองบางพูด 2
402 คลองบางเพลี้ย
403 คลองบางโพ
404 คลองบางโพงพางใต้
405 คลองบางโพงพางเหนือ
406 คลองบางมด
407 คลองบางมะเขือ
408 คลองบางยี่ขัน
409 คลองบางระจันตอนต้น
410 คลองบางระจันตอนปลาย
411 คลองบางระทึก
412 คลองบางระแนะ
413 คลองบางระแนะน้อย
414 คลองบางระมาด
415 คลองบางรัก
416 คลองบางละมุด
417 คลองบางลัด
418 คลองบางลำเจียก
419 คลองบางลำเจียกน้อย
420 คลองบางลำภูล่าง
421 คลองบางเลา
422 คลองบางแวก
423 คลองบางแวก - บางด้วนเหนือ
424 คลองบางแวก - แยกสามกรุงศรี
425 คลองบางสะแก
426 คลองบางส่าย
427 คลองบางสี่บาท
428 คลองบางไส้ไก่
429 คลองบางหญ้า
430 คลองบางหว้า
431 คลองบางอ้อ
432 คลองบางอ้อน้อย
433 คลองบางอ้อใหญ่
434 คลองบางอ้าย
435 คลองบางอ้าย
436 คลองบ้านกล้วยใต้
437 คลองบ้านเกาะ
438 คลองบ้านขมิ้น
439 คลองบ้านขาว
440 คลองบ้านแขก
441 คลองบ้านญวนสามเสน
442 คลองบ้านไทร(ตลิ่งชัน)
443 คลองบ้านไทร(ทวีวัฒนา)
444 คลองบ้านป่า
445 คลองบ้านม้า
446 คลองบ้านม้า 1
447 คลองบ้านม้า 2
448 คลองบ้านหลาย
449 คลองบ้านหลาย
450 คลองบ้านใหม่
451 คลองบึงกลาง
452 คลองบึงขวาง
453 คลองบึงเขมร
454 คลองบึงชุมเห็ด
455 คลองบึงตัน
456 คลองบึงตาแดง
457 คลองบึงตาแรม
458 คลองบึงเตย
459 คลองบึงแตงโม (คลองสามวา)
460 คลองบึงแตงโม(หนองจอก)
461 คลองบึงทรายกองดิน
462 คลองบึงทองหลาง
463 คลองบึงทองหลางเฒ่า
464 คลองบึงนายรุ่ง
465 คลองบึงบัวฝั่งตะวันตก
466 คลองบึงบัวฝั่งตะวันออก
467 คลองบึงปรง
468 คลองบึงไผ่
469 คลองบึงฝรั่ง
470 คลองบึงพระยาสุเรนทร์
471 คลองบึงเล็ก
472 คลองบึงสิงห์โต
473 คลองบึงใหญ่
474 คลองบุญสุข
475 คลองบุปผาราม
476 คลองแบนชะโด (คลองสามวา)
477 คลองแบนชะโด(หนองจอก)
478 คลองโบสถ์
479 คลองปทุม
480 คลองประมง (คลองโล่ง)
481 คลองประเวศบุรีรมย์
482 คลองปลัดเปรียง
483 คลองปลายซอยวัดภคินีนาถ
484 คลองปักหลัก
485 คลองปั้นจาด
486 คลองปากน้ำ
487 คลองปากลัดยานยนต์
488 คลองปู่ชื่น
489 คลองเป้ง
490 คลองเปรมประชากร
491 คลองแป๊ะจ่างบน
492 คลองแป๊ะจ่างล่าง
493 คลองผดุงกรุงเกษม
494 คลองผักกะเฉด
495 คลองผักหนาม
496 คลองผาสุขใจ (ช่วงที่ 1)
497 คลองผาสุขใจ (ช่วงที่ 2)
498 คลองผู้ช่วย
499 คลองผู้ใหญ่
500 คลองผู้ใหญ่ชวลิต 1
501 คลองผู้ใหญ่ชวลิต 2
502 คลองผู้ใหญ่ชิน
503 คลองผู้ใหญ่น่วม
504 คลองผู้ใหญ่ปลื้ม
505 คลองผู้ใหญ่เปล่ง
506 คลองผู้ใหญ่สมนึก
507 คลองผู้ใหญ่สังข์
508 คลองผู้ใหญ่เส็ง 1
509 คลองผู้ใหญ่เส็ง 2
510 คลองไผ่ขวด
511 คลองไผ่เขียว
512 คลองไผ่ดำ
513 คลองไผ่สิงห์โต
514 คลองไผ่เสือขบ
515 คลองแฝด
516 คลองพญาเวิก
517 คลองพนาโรจน์
518 คลองพระโขนง
519 คลองพระโขนงเก่า
520 คลองพระไชยยศสมบัติ
521 คลองพระยาเกษม
522 คลองพระยาราชมนตรี
523 คลองพระยาสุเรนทร์
524 คลองพระราชดำริ 1
525 คลองพระราชดำริ 2
526 คลองพระสวัสดิ์
527 คลองพริกป่น
528 คลองพลับ
529 คลองพลับพลา
530 คลองพิณพาทย์
531 คลองพิณพาทย์(บางกอกน้อย)
532 คลองพิทยาลงกรณ์
533 คลองพิมพ์เสงี่ยม
534 คลองแพรกคลองนา 1
535 คลองแพรกคลองนา 2
536 คลองแพรเขียว
537 คลองโพธิ์(จอมทอง)
538 คลองโพธิ์(ทวีวัฒนา)
539 คลองโพธินิมิตร 1
540 คลองโพธินิมิตร 2
541 คลองโพธินิมิตร 3
542 คลองโพธินิมิตร 4
543 คลองโพธินิมิตร 5
44 คลองโพธินิมิตร 6
545 คลองภาษีเจริญ
546 คลองภูมิ
547 คลองมณี
548 คลองมหานาค
549 คลองมหาศร
550 คลองมอญ
551 คลองมอญ(บางพลัด)
552 คลองมอญ(ประเวศ)
553 คลองมอญ(พระโขนง)
554 คลองมอญ(สะพานสูง)
555 คลองมอญประดิษฐ์
556 คลองมะขามเทศ
557 คลองมะเขือขื่น
558 คลองมะนาว
559 คลองมะนาว(บางกอกน้อย)
560 คลองมะนาว(บางพลัด)
561 คลองม้า
562 คลองมาก
563 คลองแม่จันทร์
564 คลองแมะดำ
565 คลองย่างควาย (กลางทุ่ง)
566 คลองยายกวย
567 คลองยายจำปี
568 คลองยายจำปี
569 คลองยายต่วน
570 คลองยายต่วน
571 คลองยายทิม
572 คลองยายเท้า
573 คลองยายเทียบ
574 คลองยายเผื่อน
575 คลองยายเพิ่มช่วงปลาย
576 คลองยายเพียร
577 คลองยายโมง
578 คลองยายล้อม
579 คลองยายวัน
580 คลองยายวาด
581 คลองยายวี
582 คลองยายสร้อย (คลองเตย)
583 คลองยายสร้อย (บางแค)
584 คลองยายสาย
585 คลองยายสุ่น
586 คลองยายแสง
587 คลองยายหนอม
588 คลองยายหรั่ง
589 คลองแยกคลองกระเฉด 1
590 คลองแยกคลองกุฏีจีน
591 คลองแยกคลองกุ่มแดง
592 คลองแยกคลองครูเสงี่ยม
593 คลองแยกคลองชักพระ
594 คลองแยกคลองต้นตาล
595 คลองแยกคลองตะโหนด
596 คลองแยกคลองตาตี่
597 คลองแยกคลองตาเทียม 1
598 คลองแยกคลองตาเทียม 2
599 คลองแยกคลองเทพยนต์
600 คลองแยกคลองบางกอกใหญ่
601 คลองแยกคลองบางจาก 5
602 คลองแยกคลองบางซ่อน
603 คลองแยกคลองบางด้วนเหนือ 1
604 คลองแยกคลองบางด้วนเหนือ 2
605 คลองแยกคลองบางยี่ขัน
606 คลองแยกคลองบางแวก (ใกล้คลองตาเทียม)
607 คลองแยกคลองบางแวก 1
608 คลองแยกคลองบางแวก 2
609 คลองแยกคลองบางแวก(ใกล้คลองตาตี่)
610 คลองแยกคลองบางไส้ไก่
611 คลองแยกคลองบางหว้า
612 คลองแยกคลองพระอง
613 คลองแยกคลองมอญ
614 คลองแยกคลองยายเพิ่ม
615 คลองแยกคลองลัดครูเสงี่ยม 1
616 คลองแยกคลองลัดครูเสงี่ยม 2
617 คลองแยกคลองลำหิน
618 คลองแยกคลองวัดทองธรรมชาติ
619 คลองแยกคลองวัดยานนาวา
620 คลองแยกคลองสะพานสูง
621 คลองแยกคลองหนองบัวมน
622 คลองแยกเชิงตาแพ
623 คลองแยกนาหมอน
624 คลองแยกบางจาก 1
625 คลองแยกบางจาก 2
626 คลองแยกบางจาก 3
627 คลองแยกบางจาก 4
628 คลองแยกบางเชือกหนัง 1
629 คลองแยกบางเชือกหนัง 2
630 คลองแยกบางน้อย
631 คลองแยกบางไผ่ 1
632 คลองแยกบางไผ่ 2
633 คลองแยกบางเพลี้ย 1
634 คลองแยกบางเพลี้ย 2
635 คลองแยกบางเพลี้ย 3
636 คลองแยกบางแวก 1
637 คลองแยกบางแวก 2
638 คลองแยกบางแวก 3
639 คลองแยกบางแวก 4
640 คลองแยกบางแวก 5
641 คลองแยกบางสะแก 1
642 คลองแยกบางสะแก 2
643 คลองแยกบางสะแก 3
644 คลองแยกบางสะแก 4
645 คลองแยกบางสะแก 5
646 คลองแยกบางสะแก 6
647 คลองแยกบางสะแก 8
648 คลองแยกบางสะแก 9
649 คลองแยกบางสะแก 10
650 คลองแยกบางสะแก 11
651 คลองแยกบางสะแก 12
652 คลองแยกบางสะแก 13
653 คลองแยกบางหญ้า 1
654 คลองแยกบางหญ้า 2
655 คลองแยกยายสร้อย
656 คลองแยกรางแค
657 คลองแยกรางบัว 1
658 คลองแยกรางบัว 2
659 คลองแยกรางบัว 3
660 คลองแยกรางบัว 4
661 คลองแยกรางบัว 5
662 คลองแยกราชมนตรี 1
663 คลองแยกลำโขล่
664 คลองแยกลำต้อยติ่ง
665 คลองแยกลำตามีร้องไห้
666 คลองแยกวัดประดู่ ฯ
667 คลองแยกวัดลาดปลาเค้า
668 คลองแยกวัดอรุณ
669 คลองแยกสวนอ้อย 1
670 คลองแยกอาจารย์พร
671 คลองแยกอู่ตะเภา
672 คลองรอบกรุง (คลองบางลำภู)
673 คลองรอบกรุง (คลองโอ่งอ่าง)
674 คลองระบายน้ำ
675 คลองระหัส
676 คลองระหาญ
677 คลองรางกะนก
678 คลองรางขมิ้น
679 คลองรางขวาง
680 คลองรางขวาง
681 คลองรางขี้เหล็ก
682 คลองรางเข้ (ตาสอน)
683 คลองรางแขก
684 คลองรางแค
685 คลองรางจาก
686 คลองรางตรง
687 คลองรางตัน
688 คลองรางตาทุย
689 คลองรางตาผ่อง
690 คลองรางนาเสน
691 คลองรางบัว(จอมทอง)
692 คลองรางบัว(ภาษีเจริญ)
693 คลองรางไผ่
694 คลองรางไผ่ 1
695 คลองรางไผ่ 2
696 คลองรางไผ่ 3
697 คลองรางโพธิ์
698 คลองรางโพธิ์ (ลำรางโพธิ์)
699 คลองรางโพธิ์(ทุ่งครุ)
700 คลองรางโพธิ์บน
มอบรายได้โดยไม่หักค่าใช้จ่ายให้แก่มูลนิธิแพทย์อาสาสมเด็จพระศรีนครินทราบรมราชชนนี (พอ.สว.) เป็นจำนวนทั้งสิ้น 587,800 บาท เพื่อสนับสนุนการทำงานอย่างทุ่มเทของบุคลากรทางการแพทย์ในการเดินทางออกตรวจสุขภาพให้แก่ผู้คนในถิ่นทุรกันดาร ผู้ชนะในประเภทต่างๆ ฟูจิฟิล์มมินิมาราธอนปีนี้


ส่วน Miss Vickie Kloeris นักวิทยาศาสตร์อาหารที่เคยทำงานในห้องวิจัยของ NASA มานานกว่า 34 ปี และเป็นผู้จัดการระบบอาหารสำหรับเที่ยวบินแรกสู่สถานีอวกาศนานาชาติ (ISS) กล่าวว่า อาหารที่จะถูกส่งขึ้นไปกับนักบินอวกาศนั้น ต้องครบถ้วนทั้งด้านความปลอดภัยและโภชนาการ โดยมีเกณฑ์กำหนดจาก Nasa ที่เข้มงวดมากกว่าอาหารที่ขายทั่วไป เพราะในอวกาศเป็นสถานที่ห่างไกลโรงพยาบาลและหมอมากที่สุด นักบินอวกาศจึงต้องปลอดภัยจากเชื้อโรคและสารปนเปื้อนให้ได้มากที่สุด ขณะเดียวกันก็ต้องได้รับสารอาหารที่เหมาะสมอย่างครอบคลุมตรงตามความต้องการของร่างกายของนักบินแต่ละบุคคล สำหรับโครงการ Thai food - Mission to Space นั้น จากการที่ได้ไปดูงานวิจัยที่ห้องแล็บและวิธีการเลี้ยงดูแลไก่ของ CPF ตัวเธอรู้สึกประทับใจในมาตรฐานการผลิตเนื้อสัตว์ที่สูงมากของไทย ที่ทำให้มั่นใจได้ว่าเนื้อไก่ ซีพี นั้นปลอดสารปลอดภัยจากยาปฏิชีวนะ สารเคมีตกค้างและเชื้อโรคปนเปื้อนใด ที่จะสามารถพิชิตมาตรฐานอวกาศ ตรงตามมาตรฐานความปลอดภัยในระดับที่ NASA กำหนด และแน่นอนว่าอาหารไทยขึ้นชื่อเรื่องความอร่อยติดอันดับโลก หากมีการส่งไก่จากไทยในเมนูแบบไทยขึ้นไปบนสถานีอวกาศเป็นครั้งแรกนั้น จึงเป็นเรื่องที่น่ายินดีของนักบินอวกาศบนนั้นแน่นอน
"ขอชื่นชมซีพีเอฟ ที่มีความพยายามในการสร้างความเชื่อมั่นมาตรฐานความปลอดภัยทางอาหาร ซึ่งไม่ง่ายเลยที่จะขึ้นไปในอวกาศได้ และในฐานะนักวิทยาศาสตร์ด้านอาหารอวกาศ ก็ตื่นเต้นแทนนักบินที่จะได้ลิ้มลองรสชาติอาหารใหม่ๆ เช่น อาหารไทย" Vickie กล่าว
อีกสิ่งหนึ่งที่สำคัญคือ แพทย์ที่รักษาในโรงพยาบาลเอส สไปน์ จะทำงานกันเป็นทีมเวิร์ค เพราะว่าโดยปกติแล้วผู้ป่วย 1 คนอาจจะต้องอาศัยความเชี่ยวชาญในการรักษาที่ไม่เหมือนกัน และแพทย์ของเราก็มีความชำนาญที่แตกต่างกันไป ซึ่งการทำงานแบบทีมเวิร์คนี้จะช่วยให้เราทำงานได้อย่างมีประสิทธิภาพและประสิทธิผลอย่างดีเยี่ยม โดยปกติแล้วการรักษาโดยทั่วๆ ไป แพทย์ทุกคนสามารถรักษาได้หมด แต่อะไรที่เป็นเฉพาะทางจริงๆ อาจจะมีข้อแตกต่างกันบ้าง การมีทีมเวิร์คที่ดีจะช่วยเหลือกันได้ ไม่ใช่แค่ในประเทศเท่านั้น แต่เรายังมีทีมเวิร์คจากต่างประเทศร่วมด้วย ซึ่งทีมแพทย์ที่รักษาในโรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ เราจะมีการแชร์องค์ความรู้ของเราไปยังนานาชาติ ซึ่งเป็น Host Speaker ในต่างประเทศด้วยเช่นกัน ทำให้แพทย์ทั้งไทยและต่างประเทศได้เข้ามาฝึกและดูงานที่โรงพยาบาลเอส สไปน์ อีกทั้งยังมีที่ปรึกษาพิเศษผู้ที่คิดค้นเทคนิคการรักษาใหม่ก็ได้มาถ่ายทอดเทคนิคการรักษาที่นี่ ถือเป็นปรากฏการณ์ใหม่ในประเทศไทย
อบรม ฟรี! หลักสูตรนิติเวชเบื้องต้นและการจัดการศพ สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊ง
เปิดรับสมัครอบรม ฟรี! สำหรับอาสาสมัครมูลนิธิป่อเต็กตึ๊ง หลักสูตรนิติเวชเบื้องต้นและการจัดการศพเป็นจำนวนมาก รุ่นที่ 1/66
- รับสมัครจำนวน 60 คน
- อบรมทฤษฎีและปฏิบัติในวันที่ 23 มิ.ย.66 “ณ มหาวิทยาลัยหัวเฉียวเฉลิมพระเกียรติ วิทยาเขตยศเส”
วันพุธ ทำท่า ฝึกย่อเข่าเขย่ง
ยืนให้ระยะห่างของเท้าทั้งสองข้างกว้างเท่ากับความกว้างของไหล่ ย่อเข่า - ยืนตรง - เขย่งเท้า อย่างช้าๆตามลำดับ 30 ครั้ง วันละ 3 ชุด
ตั้งแต่ 20 มิถุนายน 2566 เปิดให้บริการครบทุก 23 สถานี
ตั้งแต่วันที่ 20 มิถุนายน 2566 นี้รถไฟฟ้ามหานครสายสีเหลือง เปิดให้บริการครบทุก 23 สถานี ตั้งแต่เวลา 06.00-21.00 น. ยังคงให้บริการฟรี ไม่คิดค่าโดยสารครับ ความถี่ของขบวนรถให้บริการทุก 10 นาที สามารถดูแผนที่บริเวณสถานีได้ที่คลิก https://ebm.co.th/th/areamap/ หากข้อสงสัยในการเดินทาง แอดไลน์ สอบถามข้อมูลกับแอดมินได้ที่ @pinkyellowline
เส้นทางที่ 2 ชม Unseen Thailand ตลาดร่มหุบ
เส้นทางที่ 2 ชม Unseen Thailand ตลาดร่มหุบ จุดดึงดูดนักท่องเที่ยวที่ขึ้นหิ้งเป็นระดับโลกไปแล้ว แบบไม่ต้องบรรยายสรรพคุณและข้อมูลอะไรอีกแล้ว ที่เหลือเพียงสิ่งเดียวคือไปดูตา ถ่ายรูป สัมผัสวินาทีที่รถไฟวิ่งผ่านและวิถีชีวิตละแวกนั้น เป็นปกติวิถีที่ตื่นตาและทรงพลังเกินบรรยาย
จากตลาดร่มหุบ ไปต่อด้วยการเข้าสักการะหลวงพ่อบ้านแหลม สิ่งศักดิ์สิทธิ์คู่เมืองสมุทรสงคราม ณ วัดเพชรสมุทรวรวิหาร แล้วไปแวะดูแลสุขภาพได้ที่ ศูนย์ดูแลสุขภาพและคลินิกแพทย์แผนไทย ณ รพ.สมเด็จพระพุทธเลิศหล้า (โทร. 034-714314 ถึง 9 ต่อ 2200 นัดหมายก่อนเข้ารับบริการ) หรือจะปิดท้ายที่ มยุรานวดเพื่อสุขภาพ ก็เป็นอีกทางเลือก (โทร. 085-1541409)
Clicknic แจกยาคลายปวดกล้ามเนื้อส่งฟรีถึงบ้าน
โปรดทราบ!! บัตรทองที่อยู่ในกทม.ทุกท่าน หาหมอผ่านแอปฟรี ยาฟรี ส่งถึงบ้านฟรี ปวดไปหมดจนทำงานลำบากทำไงดี?! ใครมีสิทธิบัตรทองแล้วทำงานหรืออาศัยอยู่ในกรุงเทพฯ บอกลาความปวดเมื่อยได้เลย! เพราะ Clicknic แจกยาคลายปวดกล้ามเนื้อส่งฟรีถึงบ้าน ผู้มีสิทธิบัตรทองหาหมอ-รับยาฟรี เพียงแค่ 1. แจ้งชื่อ-นามสกุล เพื่อเช็กสิทธิบัตรทองได้ที่ Line : https://lin.ee/zUstzHN 2. เข้าแอป Clicknic กดช่อง “สำหรับ 42 กลุ่มโรคทั่วไป (สปสช.)” 3. พบหมอ พร้อมแจ้งอาการปวดเมื่อยตัว เช่น ปวดขา ปวดไหล่ 4. รอรับยาที่บ้านได้เลย ส่งฟรี! *ตอนนี้นำร่องการใช้งานฟรีของสิทธิบัตรทองสำหรับผู้ที่อาศัย/ทำงานในกรุงเทพฯ เท่านั้น พบหมอได้ทุกวันตั้งแต่ 7.30 น.-19.30 น.
เจาะลึกผลสำรวจ
เมื่อเจาะลึกลงในรายละเอียดของผลสำรวจประจำเดือนมิถุนายน พ.ศ.2566 เผยให้เห็นถึงความเปลี่ยนแปลงของผลสำรวจใน 2 หัวข้อใหญ่ที่ทาง สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน ประเทศไทย ให้ข้อมูลไว้อ้างอิงนั่นก็คือ
1. แนวโน้มความต้องการในการใช้จ่ายลดลงกว่า 5% ส่งสัญญาณเตือนให้คนไทยต้องเซฟเงินในบัญชี
เมื่อเทียบกับผลสำรวจของเดือนกุมภาพันธ์และเดือนเมษายน 2566 ที่ผ่านมา ทำให้เห็นได้ชัดว่า คนไทยผ่านการเฉลิมฉลองในช่วงเทศกาลและใช้เงินกันมาอย่างหนักหน่วง เนื่องจากปีนี้เองเป็นปีแรกในรอบ 3 ปี ที่คนไทยได้กลับมาเฉลิมฉลองกันอย่างเต็มที่โดยไม่กังวลเรื่องการแพร่ระบาดของโควิด นั่นจึงเป็นเหตุผลสำคัญที่แสดงให้เห็นว่า เมื่อเข้าสู่ช่วงเดือนมิถุนายนหรือกลางปี มีการส่งสัญญาณจากเงินในบัญชีว่าให้พักเรื่องการใช้จ่าย ซึ่งส่งผลโดยตรงกับคะแนนความต้องการใช้จ่ายในภาพรวมที่ลดลง อีกหนึ่งผลกระทบที่ทำให้ใครหลายคนต้องเซฟเงินในบัญชีคือเรื่องสินค้าราคาแพงและค่าไฟในช่วงนี้สูงขึ้นกว่าหลายๆ เดือนที่ผ่านมา
ปัญหาสุขภาพฟันของคนไทยอาจเป็นเรื่องเล็กๆ ที่หลายคนมองข้าม แต่รู้หรือไม่ว่า ปัจจุบันการเข้าถึงการรักษาสุขภาพฟันของคนไทย ยังคงเป็นปัญหาที่พบได้ในทุกช่วงอายุ และมีแนวโน้มจะเพิ่มขึ้นอย่างต่อเนื่อง
บริษัท กัลฟ์ เอ็นเนอร์จี ดีเวลลอปเมนท์ จำกัด (มหาชน) หรือ กัลฟ์ จึงจับมือรวมพลังกับ คณะทันตแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ส่งหน่วยทันตกรรมเคลื่อนที่สู่ชุมชนผ่านโครงการ Gulf SPARKS Smiles เพื่อให้คนในชุมชนต่างๆ เข้าถึงการรักษาทางด้านสุขภาพช่องปาก เช่น ขูดหินปูน อุดฟัน ถอนฟัน และรักษาฟันคุด โดยกิจกรรมในครั้งนี้ถือเป็นการจัดกรรมเป็นปีที่ 2 แล้วครับ ซึ่งในปีที่ 2 นี้ก็ยังคงได้รับเสียงตอบรับที่ดีจากคนในชุมชนทั้ง 3 ชุมชน บางขุนเทียน หนองจอก และลาดกระบัง เป็นอย่างมาก กัลฟ์ ต้องขอขอบพระคุณทุกท่านที่ให้ความสนใจเข้าร่วมกิจกรรมในครั้งนี้ โดยหวังว่าโครงการ Gulf SPARKS Smiles จะสามารถเติมพลังในการสร้างรอยยิ้มที่สดใส และสร้างสุขภาพฟันที่ดีให้กับทุกท่านนะครับ
สำหรับปีหน้า ใครที่สนใจอย่าลืมติดตามข่าวสารการจัดกิจกรรม Gulf SPARKS Smiles ผ่านทาง Gulf SPARK ได้นะครับ เราจะรีบแจ้งข้อมูลให้คุณทราบก่อนใครเลยครับ
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า แม้ว่าปัจจุบัน ผู้ป่วยมะเร็งปากมดลูกในประเทศไทยมีจำนวนที่ลดลง เพราะประเทศไทยเรามีชุดสิทธิประโยชน์หลายอย่าง เช่น การฉีดวัคซีนป้องกันมะเร็งปากมดลูกในเด็กผู้หญิง รวมไปถึงการตรวจคัดกรองมะเร็งปากมดลูก รวมถึงการรณรงค์ให้เกิด 3 A คือ
1. Awareness เพราะคนไข้ไม่ค่อยตระหนัก ไม่ค่อยกลัวโรคนี้เท่าไร คิดว่าตัวเองไม่เป็นเพราะไม่มีอาการ ซึ่งจริงๆ โรคนี้เป็นภัยเงียบ คือถ้ามีอาการแปลว่าเป็นเยอะแล้ว
2. Accessibility การเข้าถึง ที่ผ่านมาอาจจะเข้าถึงยาก เพราะว่าต้องให้หมอมาตรวจ ต้องขึ้นขาหยั่ง แต่ปัจจุบันเป็นการทำงานเชิงรุกที่ รพ. สต. มีออกหน่วย ให้เจ้าหน้าที่ไม่ต้องเป็นคุณหมอเรียกว่า วีไอเอ (VIA) มาตรวจให้ ก็เป็นการออกตรวจเชิงรุก
3. Affordable สมัยก่อน หากอยากตรวจแบบ HPV คนไข้ต้องรับผิดชอบค่าใช้จ่ายเอง สปสช. เล็งเห็นประโยชน์ และความคุ้มค่า บรรจุเป็นชุดสิทธิประโยชน์แทนแปปสเมียร์ ทําให้เรื่องของมะเร็งปากมดลูกลดลง
อย่างไรก็ดี เราก็อยากให้ลดลงกว่านี้ อยากกําจัดมะเร็งปากมดลูกให้หมดจากประเทศไทย ทุกวันนี้ตรวจพบผู้หญิงที่เป็นมะเร็งปากมดลูก 25 ราย ต่อวัน ที่สําคัญ มะเร็งปากมดลูก เป็นมะเร็งที่รักษาค่อนข้างยากหากเป็นแล้ว จะแบ่งเป็น 4 ระยะใหญ่ๆ แต่ว่าตั้งแต่ได้รับเชื้อเอชพีวี จนไปถึงเป็นมะเร็ง กินเวลาเป็นสิบปี ดังนั้น การที่เราได้ตรวจคัดกรอง ทำให้รู้ก่อน รู้เร็ว รักษาได้ไวขึ้น มีการพยากรณ์โรคที่ดีมาก บางคนก็อยู่เป็นสิบปีก็ได้ แต่หากสมมุติมาระยะที่มีเลือดออกแล้ว มีก้อนที่ปากมดลูกแล้ว กลุ่มนี้จะรักษายาก ดังนั้น อยากให้ตรวจพบเชื้อตั้งแต่เนิ่นๆ ในอดีต เป็นการตรวจแบบแปปสเมียร์เป็นไม้ป้ายไปดูเซลล์ ต่อมาพัฒนาทันสมัยขึ้น เรียกว่า Liquid base cytology ก็จะเป็นน้ำยาก็จะดูง่ายขึ้น จน ณ ปัจจุบัน เราพัฒนาขึ้นมากมาดูระดับดีเอ็นเอของเชื้อเป็นวิธี HPV DNA Test ซึ่งมีทั้งแบบให้แพทย์เก็บตัวอย่างให้ หรือจะเก็บตัวอย่างเองก็ได้ด้วย HPV DNA Self-Sampling เพราะบางคนก็อายหมอ ไม่อยากขึ้นขาหยั่ง
ผลสำรวจคำถาม 3.แต่หากมี งบประมาณ "จำกัด" เลือกได้เพียงอย่างเดียว "ตัวท่าน" จะเลือกตรวจสุขภาพ/รักษาโรคใดก่อน?
บันทึกผลการสำรวจคำถาม 3
"เงินน้อย เลือกให้ตัวเอง" พร้อมรายละเอียดบางส่วน
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน ตรวจมะเร็ง 34.7% ตรวจด้านหัวใจ ระบบเลือด 14.7% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 10.5% ตรวจด้านสมอง 8%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน ตรวจมะเร็ง 34.1% ตรวจด้านหัวใจ ระบบเลือด 14.4% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 10.5% ตรวจสุขภาพจิต 9% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 7.9% ตรวจเกี่ยวกับตับ 2.1% ตรวจเกี่ยวกับไต 3% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 3% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 6% ตรวจระบบทางเดินอาหาร 3.8%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน ตรวจมะเร็ง 33.5% ตรวจด้านหัวใจ ระบบเลือด 14.2% ตรวจภายในสำหรับสตรี (มดลูก เต้านม การตั้งครรภ์) 11% ตรวจสุขภาพจิต 9.8% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 6.8% ตรวจเกี่ยวกับตับ 2.7% ตรวจเกี่ยวกับไต 3.3% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 2.7% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 6.3% ตรวจระบบทางเดินอาหาร 3.7%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน
ประชาชนชาวกรุงเทพผู้เลี้ยงสุนัขต้องนำไปจดทะเบียน
ประชาชนชาวกรุงเทพผู้เลี้ยงสุนัขต้องนำไปจดทะเบียน ภายใน 120 วันนับแต่วันที่เกิด หรือภายใน 30 วัน นับแต่วันที่นำมาเลี้ยง จะไปด้วยตนเองหรือมอบอำนาจให้ผู้อื่นกระทำการแทนได้
Workshop : ไม่พร้อมอย่าปลูก!!! วันที่ 9 กรกฎาคม : 18.00-18.45 น.
ไม่พร้อมอย่าปลูก!!! Workshop จาก Baba Fat (Ryan) นักปลูกประสบการณ์สูงที่หลายๆคนน่าจะรู้จักเค้าดี ผ่านงานทั้ง Indoor และ Ourdoor มากว่า 20 ปี
หลายคนแห่เข้ามาในอตุสาหกรรมการปลูกกันทั้งๆ ที่ขาดความรู้ ความพร้อม ฯลฯ จนนำพาไปสู่ข้อผิดพลาดอันใหญ่หลวง Workshop นี้ Baba Fat จะเอาประสบการณ์มาแชร์ให้ฟังว่า อุตสาหกรรมการปลูก ที่ขาดโครงสร้างพื้นฐานที่ดีนั้นจะนำคุณไปสู่หายนะแบบไหน และในหายนะนั้นยังมีโอกาสอะไรบ้างที่อุตสหกรรมนี้ยังต้องการอีกมาก
การเสื่อมถอยมากที่สุด เกิดในภูมิภาคที่ใหญ่ที่สุดของโลก คือ รัสเซียและภูมิภาคยูเรเซีย นั่นเอง ซึ่งไม่เฉพาะกับยูเครนและรัสเซียเท่านั้นที่ความสงบสุขจะเสื่อมถอยลง แต่ยังส่งผลกระทบกับประเทศอื่นๆ ในภูมิภาคด้วยเช่นกัน
จากดัชนีตัวบ่งชี้ 23 รายการใน GPI มี 10 รายการที่ผลลัพธ์ดีขึ้น 11 รายการ เสื่อมถอยลง และอีก 2 รายการไม่มีการเปลี่ยนแปลง ดัชนีด้าน "ขอบเขตความปลอดภัยและความมั่นคง" และ "ความขัดแย้งที่กำลังดำเนินอยู่" แย่ลงทั้งคู่ ในขณะที่ขอบเขต "การทหาร" (Militarisation) มีการปรับปรุงดีขึ้นเล็กน้อย โดยยังคงมีแนวโน้มที่ดีขึ้นในระยะยาว
ความเสื่อมถอยที่ใหญ่ที่สุดเมื่อเทียบเป็นรายปี เห็นได้จากตัวชี้วัดด้าน "การสู้รบจากความขัดแย้งภายนอก" (external conflicts fought) "การเสียชีวิตจากความขัดแย้งภายใน" และ "ความไม่มั่นคงทางการเมือง" จำนวนผู้เสียชีวิตจากการสู้รบเพิ่มขึ้นก่อนที่ความขัดแย้งในยูเครนจะเริ่มต้นขึ้นเสียอีก จำนวนผู้เสียชีวิตที่เกี่ยวข้องกับความขัดแย้งทั้งหมดเพิ่มขึ้น 45 เปอร์เซ็นต์ระหว่างปี 2020 ถึง 2021
มุมมองในด้านบวกบ้าง ตัวบ่งชี้ด้านความปลอดภัยและความมั่นคงหลายตัว ปรับตัวดีขึ้น รวมถึง "ผลกระทบจากการก่อการร้าย" และ "อัตราการฆาตกรรม" จำนวนเหตุฆาตกรรมลดลงในหลายประเทศแถบอเมริกากลางและแคริบเบียน ถึงแม้ว่าภูมิภาคนี้ จะยังคงเป็นพื้นที่ที่มีอัตราการฆาตกรรมโดยเฉลี่ยสูงสุด เมื่อเทียบกับพื้นที่ใดๆ ใน GPI
ในช่วง 15 ปีที่ผ่านมา โลกมีความสงบสุขน้อยลง โดยคะแนนเฉลี่ยของประเทศแย่ลงร้อยละ 5
จาก 163 ประเทศใน GPI มี 95 ประเทศที่บันทึกว่าแย่ลง ในขณะที่ 66 ประเทศปรับปรุงดีขึ้น และอีก 2 ประเทศไม่มีการเปลี่ยนแปลงในคะแนน
ตัวบ่งชี้ GPI 16 ตัวจาก 23 ตัวลดลงระหว่างปี 2551 ถึง 2566 ในขณะที่แปดตัวดีขึ้น
ตัวบ่งชี้ GPI ถึงสองในสาม บอกชัดถึงการเสื่อมถอยที่มาเพิ่มขึ้นเรื่อยๆ ตั้งแต่ปี 2008 โดยตัวบ่งชี้เกี่ยวกับความขัดแย้งที่กำลังดำเนินอยู่ และทวีความรุนแรงมากขึ้น มีถึงร้อยละ 14 ขณะที่ด้านความปลอดภัยและด้านการรักษาความปลอดภัย แย่ลงถึงร้อยละ 5.4
การทหารเป็นด้านเดียวดีขึ้น เมื่อดูจากตัวบ่งชี้ในด้าน "การสู้รบจากความขัดแย้งภายนอก" "การสู้รบจากความขัดแย้งภายใน" "จำนวนผู้ลี้ภัยและผู้พลัดถิ่นในประเทศ" และ "การประท้วงที่ใช้ความรุนแรง" เหล่านี้ ลดลงมากที่สุด
ในช่วง 15 ปีที่ผ่านมา มีมากถึง 120 ประเทศที่มีจำนวนการประท้วงรุนแรงเพิ่มขึ้น เทียบกับเพียง 20 ประเทศที่ลดลง
ปัจจัยบ่งชี้ด้าน "การสู้รบจากความขัดแย้งภายนอก" เป็นปัจจัยที่เสื่อมถอยมากที่สุดของตัวชี้วัดทั้งหมดตั้งแต่ปี 2008 โดยแย่ลงกว่าร้อยละ 50 มี 77 ประเทศที่ปัจจัยนี้แย่ลงต่อเนื่อง ตั้งแต่ปี 2008
มีถึง 122 ประเทศที่เกี่ยวข้องกับความขัดแย้งภายนอกอย่างน้อยหนึ่งครั้งตั้งแต่ปี 2008 โดยที่ประเทศส่วนใหญ่เข้าไปส่วนร่วมในระดับความร่วมมือและไม่ได้ทุ่มทรัพยากรมากแต่อย่างใด
การปรับปรุง "ขอบเขตการทหาร" เป็นไปอย่างกว้างขวาง โดยทุกภูมิภาคมีคะแนนลดลงตั้งแต่ปี 2551 อัตราการ "ติดอาวุธ" ลดลงใน 113 ประเทศ ในขณะที่ระดับค่าใช้จ่ายทางทหารโดยเฉลี่ยต่อเปอร์เซ็นต์ของ GDP ก็ลดลงเช่นกัน จาก 2.04 เป็น 1.95 เปอร์เซ็นต์
อย่างไรก็ตาม ค่าใช้จ่ายทางทหารในระดับสัมบูรณ์เพิ่มขึ้น โดยเพิ่มขึ้นมากที่สุดในประเทศจีน สหรัฐอเมริกา และอินเดีย โดยค่าใช้จ่ายรวมเพิ่มขึ้น 180,000 ล้านเหรียญสหรัฐ 70,000 ล้าน และ 40,000 ล้านเหรียญสหรัฐตามลำดับตั้งแต่ปี 2551
ความขัดแย้งหลายครั้ง นอกจากสงครามในยูเครนแล้ว ยังสร้างความเสียหายร้ายแรงอีกด้วย ปี 2565 เป็นปีที่มีผู้เสียชีวิตจากความขัดแย้งทางอาวุธมากที่สุด นับตั้งแต่การฆ่าล้างเผ่าพันธุ์ในรวันดาในปี 2537 ซึ่งเป็นปีที่มีผู้เสียชีวิตมากที่สุดในประวัติศาสตร์ของ GPI จากตัวเลขจำนวนผู้เสียชีวิตมากกว่า 100,000 คนในสงครามที่เมือง Tigray ทางตอนเหนือของเอธิโอเปีย การสู้รบระหว่างกองกำลังป้องกันเอธิโอเปีย พันธมิตรเอริเทรีย และกลุ่มกบฏ TPLF เป็นเหตุการณ์เดียวที่มีผู้เสียชีวิตมากที่สุดนับตั้งแต่ปี 1994
นอกจากนี้ ยูเครนยังมีผู้เสียชีวิตจากความขัดแย้งอย่างน้อย 82,000 คนในปี 2022 การเสียชีวิตที่เกี่ยวข้องกับความขัดแย้งในมาลีเพิ่มขึ้น 154 เปอร์เซ็นต์ในปี 2022 โดยการใช้ความรุนแรงต่อพลเรือน เพิ่มขึ้นร้อยละ 570 ขณะที่ในเมียนมา การเสียชีวิตจากความขัดแย้งเพิ่มขึ้นร้อยละ 87
ในทางตรงกันข้าม ระดับความรุนแรงในพื้นที่ที่ได้รับผลกระทบจากความขัดแย้งอื่นๆ ลดลงอย่างรวดเร็วในปีที่ผ่านมา การเสียชีวิตที่เกี่ยวข้องกับความขัดแย้งลดลงร้อยละ 91 ในอัฟกานิสถาน และร้อยละ 63 ในเยเมน
101. วัดสามแก้ว อ.เมือง จ.ชุมพร
ชุมพร
วันเวลาทำการ: วันสำคัญต่างๆ วันเปิดสอนหลักสูตรครูสมาธิเสาร์-อาทิตย์
เบอร์ติดต่อ: 08-9471-0240, 09-5258-1968
ผู้ติดต่อ: นายสุวรรณ สุวรรณนิภา/นายฉัตรชัย แสงจันทร์
102. วัดอรัญญาวาส อ.เมือง จ.น่าน
น่าน
วันเวลาทำการ: -
เบอร์ติดต่อ: 0861867182
ผู้ติดต่อ: อ.วัลภารัตน์ มีชำนาญ
103. โรงเรียนสว่างแดนดิน จ.สกลนคร
สกลนคร
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 08.30 - 16.30 น.
เบอร์ติดต่อ: 094-407-2806
ผู้ติดต่อ: อ.อภิวัชร์ เผ่าหอม
104. วัดโคกคีรี อ.เมือง จ.พัทลุง
พัทลุง
วันเวลาทำการ: เสาร์ อาทิตย์
เบอร์ติดต่อ: 086 943 7191 / 098 010 2149
ผู้ติดต่อ: อ.วีระพันธุ์ สวัสดี / อ.อัญชนา บุญกลาง
105. วัดป่าศิลาวิเวก จ.มุกดาหาร
มุกดาหาร
วันเวลาทำการ: ส-อา. เวลา 08.30-16.00 น
เบอร์ติดต่อ: 081-5550-343
ผู้ติดต่อ: มุกดา สวัสดิ์วงศ์ไชย
106. วัดถ้ำไตรรัตน์ อ.ปากช่อง จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 089 917 4586
ผู้ติดต่อ: วนิดา คำแก้ว
107. วัดนพวงศาราม จ.ปัตตานี
ปัตตานี
วันเวลาทำการ: เสาร์ อาทิตย์ 8.30-16.00 น.
เบอร์ติดต่อ: 087 396 6582
ผู้ติดต่อ: อ.บุษยา ขุนแผ้ว
108. วัดดำรงธรรมาราม อ.ขลุง จ.จันทบุรี
จันทบุรี
วันเวลาทำการ: วันเสาร์-อาทิตย์ 09.00 - 15.00 น.
เบอร์ติดต่อ: 0892518147
ผู้ติดต่อ: นายนิพล มังกร
109. วัดพุทธมงคลนิมิต อ.เมือง จ.นครสวรรค์
นครสวรรค์
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 08.30 น.-16.30 น.
เบอร์ติดต่อ: 0970435966
ผู้ติดต่อ: นางอลีนา ประวิลวรรณ์
110. โรงพยาบาลมิตรภาพเมโมเรียล จ.สระบุรี
สระบุรี
วันเวลาทำการ: 9.00-16.30
เบอร์ติดต่อ: 081-529-3353, 081-499-7489
ผู้ติดต่อ: อ.วิภารัตน์ สงวนสิน
111. วัดป่าวิมุตยาราม อ.บ้านโป่ง จ.ราชบุรี
ราชบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 08.30 - 16.30 น.
เบอร์ติดต่อ: 080-9598222
ผู้ติดต่อ: อ.พนาลี นรจิตต์ ( ผู้ดูแล )
112. วัดสนามชัย อ.เมือง จ.อ่างทอง
อ่างทอง
วันเวลาทำการ: เสาร์ - อาทิตย์ 08.00-17.00 น.
เบอร์ติดต่อ: 0846199659
ผู้ติดต่อ: อาจารย์ จิรวัฒน์ จันทร์อับ
113. วัดศรีวิสุทธาราม อ.เมือง จ.พิษณุโลก
พิษณุโลก
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30 - 16.30 น.
เบอร์ติดต่อ: 089 703 3805
ผู้ติดต่อ: ผู้ดูแลสาขา อ.ธงชัย ทุ่งโพธิแดง
114. วัดม่วยต่อ อ.เมือง จ.แม่ฮ่องสอน
แม่ฮ่องสอน
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.00-17.00 น.
เบอร์ติดต่อ: 083-8232766
ผู้ติดต่อ: ดร.ปธานชัย วายุโชติ
115. วัดท่าทอง จ.อุตรดิตถ์
อุตรดิตถ์
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 09.00 - 16.00 น.
เบอร์ติดต่อ: 084 886 7088
ผู้ติดต่อ: อ.กชพร เสนาขันธ์
116. วัดประชานิมิตร อ.บัวใหญ่ จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00 - 16.30 น.
เบอร์ติดต่อ: 091- 8319178
ผู้ติดต่อ: อาจารย์สุวณีย์ โรจนานนท์
117. วัดโสภาราม จ.ปทุมธานี
ปทุมธานี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00-1ุ6.30 น.
เบอร์ติดต่อ: 099-046-9662
ผู้ติดต่อ: อ.กฤศญารัชย์ เคน้ำอ่าง
118. วัดนาควัชรโสภณ จ.กำแพงเพชร
กำแพงเพชร
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 09-2187-4073 , 08-5269-2491
ผู้ติดต่อ: อ.เบญจวรรณ ตัญญู (ผู้ดูแลสาขา)
119. วัดอาวุธวิกสิตาราม กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา ๐๘.๓๐ - ๑๗.๐๐ น.
เบอร์ติดต่อ: 1) 081-988-8530 , 2) 083-242-1380
ผู้ติดต่อ: 1) อ.บุญศิริ ธรรมธาดา , 2) อ.กุลธิดา อาชาศรัย
120. วัดไทยชุมพล จ.สุโขทัย
สุโขทัย
วันเวลาทำการ: เสาร์ - อาทิตย์
เบอร์ติดต่อ: 090 902 5465
ผู้ติดต่อ: รุทธ์ พลาวุฑฒ์
121. วัดม่วงสระน้อย อ.ปักธงชัย จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: 08.00 น. - 17.00 น.
เบอร์ติดต่อ: 095-613- 9915
ผู้ติดต่อ: ผดล. จันทร์ทิพย์ สุทาธาวาส
122. โรงงานยาสูบ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: -
เบอร์ติดต่อ: 081-8375406
ผู้ติดต่อ: อ.วีระเดช กิไพโรจน์
123. บ้านนาสมดี ต.อาจสามารถ อ.เมือง จ.นครพนม
นครพนม
วันเวลาทำการ: เสาร - อาทิตย์
เบอร์ติดต่อ: 089 862 6860
ผู้ติดต่อ: อ.มาโนชย์ พลราชม
124. วัดสามัคคีอุปถัมภ์ จ.บึงกาฬ
บึงกาฬ
วันเวลาทำการ: 08.00 - 16.30 น.
เบอร์ติดต่อ: 0819547617
ผู้ติดต่อ: นายพรชัย ตั้งสุวรรณชัย
125. มหาวิทยาลัยมหาสารคาม
มหาสารคาม
วันเวลาทำการ: 09:00 น. ถึง 20:00 น.
เบอร์ติดต่อ: 085-9288-605, 094-543-0156, 081-731-5260
ผู้ติดต่อ: ผศ.นบปนม แก้วหานาม (ผู้ดูแลสาขา)
126. วัดสวนป่า จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00 - 16.30 น.
เบอร์ติดต่อ: 089-0925089
ผู้ติดต่อ: อาจารย์สาวิตร จิตรประวัติ (ผดล.สาขา 126)
127. โรงเจ เปา ฮก เก็ง 327/7-8 ริมคลองมอญฯ ต.วัดท่าพระ เขตบางกอกใหญ่
กรุงเทพมหานคร
วันเวลาทำการ: ทุกวันพฤหัสบดี เวลา 09.00 - 14.00 น. 9.00 - 14.00 น.
เบอร์ติดต่อ: 0637783596/0891414482
ผู้ติดต่อ: คุณสุนิษา คำสุทธิ /คุณจุฑามาศ โกมลเลิศ
128. มหาวิทยาลัยราชภัฏพระนคร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: 16.30-18.30
เบอร์ติดต่อ: 0916978959
ผู้ติดต่อ: ดร.เบญจวรรณ ศรีมารุต
129. สุมนานุสรณ์(วัดบางขวาง) จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 08.30-16.00 น.
เบอร์ติดต่อ: 0860744263
ผู้ติดต่อ: อ.วิภารัตน์ วงศ์วิวัฒน์
130. ไทมส์ สแควร์ TIMES SQUARE
กรุงเทพมหานคร
วันเวลาทำการ: ภาควันเสาร์ - วันอาทิตย์
เบอร์ติดต่อ: 064-6466595
ผู้ติดต่อ: อ.วรรณรัชต์ ยงเกียรติไพบูลย์
131. วัดวรดิตถาราม อ.เมือง จ.ตราด
ตราด
วันเวลาทำการ: -
เบอร์ติดต่อ: 0969635515
ผู้ติดต่อ: อ. ศรัณย์กร รักษ์แก้วปรียากุล
132. วัดคงคาภิมุข อ.ตะกั่วป่า จ.พังงา
พังงา
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09:00 - 16:30 น.
เบอร์ติดต่อ: 081-476-7165
ผู้ติดต่อ: อ.จินตนา สมนึก (ผู้ดูแลสาขา)
133. วัดสามัคคี ผดุงพันธ์ อ.เมือง จ.สุราษฎร์ธานี
สุราษฎร์ธานี
วันเวลาทำการ: วันจันทร์-วันศุกร์ เวลา 18.00 น.-20.00 น
เบอร์ติดต่อ: 081-9798758
ผู้ติดต่อ: อาจารย์จรี เสียงแจ้ว (ผู้ดูแลสาขา)
134. กลุ่มบริษัท ปตท. จตุจักร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: 18:00น 20:00น
เบอร์ติดต่อ: 0814828128
ผู้ติดต่อ: คุณนพดล สินธุสะ
135. วัดปุรณาวาส เขตทวีวัฒนา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 8.30-17.00 น.
เบอร์ติดต่อ: 0968492953
ผู้ติดต่อ: อ.ชิติพัทธ์ เมธีวุฒิสกุล
136. วัดคงคาเจริญ อ.ทุ่งสง จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: วันเสาร์ -อาทิตย์ 08.00 - 16.00 น.
เบอร์ติดต่อ: 081-1303214
ผู้ติดต่อ: อ.ประทุม กายสิทธิ์ (ผู้ดูแล สาขา๑๓๖)
137. วัดเนินตูม อ.เมือง จ.อุทัยธานี
อุทัยธานี
วันเวลาทำการ: เสาร์- อาทิตย์ เวลา 8.30น. - 16.30น.
เบอร์ติดต่อ: 06-2294-6939 06-3661-5614
ผู้ติดต่อ: ผดล.อ.สมาน คณฑา อ.อธิกา จันทรวงศ์
138. วัดเพชรวราราม จ.เพชรบูรณ์
เพชรบูรณ์
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 09.00-17.00 น.
เบอร์ติดต่อ: 083 625 5129
ผู้ติดต่อ: ปรียาภา ปัญควณิช ผู้ดูแลสาขา
139. วัดบุญนาครักขิตาราม จ.นครนายก
นครนายก
วันเวลาทำการ: เสาร์-อาทิตย์ 8.30 น. - 16.30 น.
เบอร์ติดต่อ: 081 985 5344, 081 305 1419
ผู้ติดต่อ: ผดล. อ.นพดล ดีเทศ
140. วัดคลองคะเชนทร์ จ.พิจิตร
พิจิตร
วันเวลาทำการ: เสารฺ-อาทิตย์
เบอร์ติดต่อ: 0818883824
ผู้ติดต่อ: ดร.รัจจา ศรีสุเทพ
141. วัดดอนตูมกมลาวาส อ.วัดสิงห์ จ.ชัยนาท
ชัยนาท
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 0818234128,0895657768,0857379949
ผู้ติดต่อ: ผดล.อ.สุชาติ ยิ่งจำเริญศาสตร์
142. วัดโสธรนิมิตต์ อ.เมือง จ.สมุทรปราการ
สมุทรปราการ
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ 08.00 - 16.00 น.
เบอร์ติดต่อ: 089-205-2024
ผู้ติดต่อ: อาจารย์ศักรินทร์ รังสิยะฉัตร
143. วัดศรีรัตนธรรมาราม อ.บางพลี จ.สมุทรปราการ
สมุทรปราการ
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 17:00-20:30 น. เสาร์-อาทิตย์ 08:00-16:00 น.
เบอร์ติดต่อ: 0812695522
ผู้ติดต่อ: อาจารย์วิระดนัย ไผ่อรุณรัตน์
144. ม.ราชภัฎสมเด็จเจ้าพระยา
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ (9:00 - 16.00)
เบอร์ติดต่อ: 081 835 5929 (ผู้ดูแลเว็ปไซต์สาขา)
ผู้ติดต่อ: อ. ชญานิศ หวังดี (ผู้ดูแลสาขา)
145. วัดแก้วพิทักษ์เจริญธรรม กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์,อาทิตย์
เบอร์ติดต่อ: 085-9162663
ผู้ติดต่อ: อ.ณิชพักตร์ กรุดพันธ์ ( ผู้ดูแลสาขา)
146. วัดอรัญญวาสี อ.ท่าบ่อ จ.หนองคาย
หนองคาย
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 8.30-15.30 น.
เบอร์ติดต่อ: 081 769 5457
ผู้ติดต่อ: อ. เวียงชัย จันทร์ดา (ผู้ดูแลสาขา)
148. มหาวิทยาลัยศรีปทุม กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: วันจันทร์ - วันศุกร์ เวลา09.00-17.00น.
เบอร์ติดต่อ: 02-579-1111 ต่อ 1433
ผู้ติดต่อ: สุวรรณี นนทการ
149. อาคารอื้อจือเหลียง กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: -
เบอร์ติดต่อ: 0896826461
ผู้ติดต่อ: ปุณรัศมิ์ พรเฉลิมรัศม์
150. โรงพยาบาลตำรวจ เขตปทุมวัน กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ ถึง พฤหัส เวลา 17.00-19.00
เบอร์ติดต่อ: 081 256 7896
ผู้ติดต่อ: พันตำรวจเอกหญิง ภิญญดา ถนอมกล่อม
โปร่งใสดี
ชวนฝากข้อความถึง ผู้ว่าฯชัชชาติ ผ่านกล่อง ‘เรื่องที่อยากบอก.. เรา’
ในบูธนี้ จะเป็นนิทรรศการที่มุ่งเน้นการแสดงความืคืบหน้าในการดำเนินงานนโยบาย ภายใต้การเปิดเผยข้อมูลผ่าน OPEN DATA และ OPEN POLICY เว็ปไซต์ที่จะเปิดเผยข้อมูลการดำเนินงาน เพื่อให้ประชาชนติดตามและให้ข้อเสนอการพัฒนานโยบายของกรุงเทพมหานคร โดยจะมีการรวบรวมการรับเรื่องร้องเรียนจากประชาชน ตลอดจนการติดตามแก้ปัญหาเรื่องร้องเรียน
ใครได้แวะเวียนมาที่งาน อยากชวนแวะบูธนี้ เพื่อฝากเรื่องร้องเรียน รวมถึงฝากกำลังใจให้กับผู้ว่าฯ และทีมข้าราชการ กทม. ที่กล่อง ‘เรื่องที่อยากบอก.. เรา’ ได้ตลอดทั้ง 3 วัน
นักดับเพลิงและกู้ภัยสามเสน กปก.1
รับแจ้งจากประชาชนทางโทรศัพท์ ให้จับงูภายในบ้านเรือนประชาชน เลขที่ 157/13 นายสุรเดช สนิทจันทร์ รกน.หน.ส.ดพ.สามเสน มอบหมายให้นายประยงค์ ปิติทวี พร้อมกำลังรวม 3 นาย เดินทางไปดำเนินการจับงูเหลือม ขนาดความยาว 1 เมตร สถานที่เกิดเหตุ เลขที่ 157/13 ถนนสวรรคโลก แขวงวชิรพยาบาล เขตดุสิต กทม. ผู้แจ้งชื่อ คุณดาว อายุ 28 ปี ระหว่างปฏิบัติหน้าที่ไม่มีผู้ใดได้รับบาดเจ็บ @สามเสน 2-1 บอมม์
ช่วยเหลือประชาชนจับตัวเงินตัวเงินตัวทอง ความยาวประมาณ 2.5 เมตร ที่เกิดเหตุเลขที่ 23/6-9 ถนนศรีอยุทธยา ซอย 16 แขวงวชิระพยาบาล เขตดุสิต เจ้าหน้าที่ดำเนินการเรียบร้อยประชาชนปลอดภัย@สามเสน1-1
รับแจ้งจากพระราม 199 จับตัวเงินตัวทอง ความยาวประมาณ 1 เมตร สถานที่เกิดเหตุเลขที่ 78 ถนนพระราม 5 ซอยสุตจริต1 แขวงสวนจิตรลดา เขตดุสิต กทม มีผู้แจ้งชื่อคุณกิตตินันท์ สายแวว อายุ 29 ปี เจ้าหน้าที่ดำเนินการเรียบร้อยประชาชนปลอดภัย เจ้าหน้าที่ออกเหตุรวม 3 นาย
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 1.5 เมตร สถานที่เกิดเหตุเลขที่ 73/8 ถนนสุคันธาราม ซอยสุคันธาราม 7 แขวงสวนจิตรลดา เขตดุสิต ดำเนินการเรียบร้อย @กบ สามเสน 3-1
นักดับเพลิงและกู้ภัยสวนมะลิ กปก.1
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 3 เมตร เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย สถานที่เกิดเหตุ ซ.ภิรมย์ แขวงจักรวรรดิ/เขตสัมพันธวงศ์@สวนมะลิ23
ช่วยเหลือประชาชนจับงูเขียวพระอินทร์ ความยาวประมาณ 1 เมตร เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย สถานที่เกิดเหตุ ซ.กรุงเกษมเก่า ถ.กรุงเกษม แขวง/เขตป้อมปราบศัตรูพ่าย@สวนมะลิ12
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ความยาวประมาณ 2 เมตร เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย สถานที่เกิดเหตุ ซ.ยศเส3 ถ.บำรุงเมือง แขวงวัดเทพศิรินทร์ เขตป้อมปราบศัตรูพ่าย@สวนมะลิ12
เขตต่างๆ เริ่มดำเนินการตรวจถังเก่า
เขตประเวศ จัดเจ้าหน้าที่สนับสนุนเก็บถังดับเพลิงในชุมชนที่ไม่ได้ใช้ประโยชน์ส่งไปกำจัดต่อไป
ศูนย์ 9 ประชาธิปไตย ประกาศรับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ LINK
ศูนย์บริการสาธารณสุข 9 ประชาธิปไตย ประกาศรับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ ศูนย์บริการสาธารณสุข 9 ประชาธิปไตย
ตำแหน่ง พนักงานช่วยงานด้านสุขภาพ
วุฒิการศึกษา ประกาศนียบัตรวิชาชีพ (ปวช.) หรือมัธยมศึกษาตอนปลาย (ม.6)
อัตราค่าตอบแทน วันละ 375 - 500 บาท
ยื่นใบสมัครด้วยตนเอง ณ ห้องธุรการ ชั้น 5 อาคารศูนย์บริการสาธารณสุข 9 ประชาธิปไตย
ตั้งแต่วันที่ 26 พฤษภาคม 2566 - 9 มิถุนายน 2566
ติดต่อสอบถามข้อมูลเพิ่มเติม 02 282 8494
4 ต้นไม้สีลูกกวาด
แนวคิด :ความงามความยิ่งใหญ่ และความหลากหลายของพันธุ์ไม้ป่าบนดอย ภาคเหนือ
เทคนิค :ประดับไฟต้นไม้ด้วยสีต่างๆ กัน ตั้งแต่โคนต้นไปจนถึงกิ่งก้านและใบ
ททท.ลำปาง-ลำพูน ขนของดีมาอวดเพียบ
ตัวแทนผู้ประกอบการในพื้นที่รับผิดชอบลำปางลำพูนปีนี้ได้แก่
- ก๋วยเตี๋ยวฮังเล ร้านมิสเตอร์ฮังเล จ.ลำปาง
- ไส้อั่วสุภัทรา ลำปาง
- ร้านดาวคะนองลำพูน
- ปราณโกโก้ลำปาง
- กลุ่มผลิตภัณฑ์ศิรดา ลำปางDe Bua (The Megic of Leaf) จังหวัดลำปาง
- ทอฝันผ้าไหมยกดอกลำพูน
- กลุ่มน้ำมอญแจ้ซ้อน จังหวัดลำปาง
- อารีเซรามิก
2.สะพานพระราม 6
สะพานพระราม 6 เป็นสะพานข้ามแม่น้ำเจ้าพระยาที่สร้างขึ้นเป็นแห่งแรกของประเทศไทย และเป็นสะพานสำคัญที่สุดในเส้นทางสายใต้ เชื่อมระหว่างแขวงบางซื่อ เขตบางซื่อ กับแขวงบางอ้อ เขตบางพลัด กรุงเทพมหานคร ในเส้นทางรถไฟสายใต้
1961
ต่อมาในปี ค.ศ.1960 ทางโรงพยาบาลได้ก่อสร้าง "ตึกเมธาธิบดี" ด้วย งินบริจาคของคุณหญิงเมธาธิบดี โดยภายหลังดำเนินการก่อสร้างตึกแล้วเสร็จ สมเด็จพระศรีนครินทราบรมราชชนนี้ ทรงพระกรุณาโปรดเกล้าฯ เสด็จพระ ราชดำเนิน มาทรงเปิดตึกศัลยกรรมเมธาธิบดี ทรงเปิดป้ายชื่อตึกและทรงตัด ริบบิ้นประตูตึก เมื่อวันศุกร์ที่ 27 มกราคม ค.ศ. 1961
กลุ่มเด็กเล็ก อายุ 0-5 ปี
กลุ่มเด็กเล็ก อายุ 0-5 ปี
- ฉีดวัคซีนป้องกันวัณโรค ตับอักเสบบี บาดทะยัก คอตีบ ไอกรน โปลิโอ เยื่อหุ้มสมองอักเสบ อุจจาระร่วงจากเชื้อไวรัสโรต้า หัด หัดเยอรมัน คางทูม ไข้หวัดใหญ่และไข้สมองอักเสบเจอี
- ตรวจเลือดคัดกรองภาวะพร่องไทรอยด์(โรคเอ๋อ) โรคฟีนิลคีโตนูเรียและโรคทางพันธุกรรมเมตาบอลิกภาวะซีดการติดเชื้อเอไอวี
- ตรวจคัดกรองการได้ยิน
- ชั่งน้ำหนักวัดส่วนสูงเพื่อติดตามการเจริญเติบโต
- ตรวจคัดกรองพัฒนาการ
- ตรวจคัดกรองวัณโรค(กลุ่มเสี่ยง)
- ตรวจช่องปากและฟัน เคลือบฟลูออไรด์
- การให้ยาไทรอกซินป้องกันภาวะพร่องไทรอยด์
- ยาบำรุงเสริมธาตุเหล็ก
- ยาต้านไวรัสเอชไอวี
- สมุดบันทึกสุขภาพ/บันทึกพัฒนาการ
- แว่นตาหากมีภาวะสายตาผิดปกติ
รางวัลรองชนะเลิศอันดับ 1 คุณนิธิรุธจ์ สุทธิเมธีโรจน์
ข้อมูลกลางองค์กรปกครองส่วนท้องถิ่น 8 ด้าน
8 ด้าน
1. สาธารณสุขและสิ่งแวดล้อม
โรงพยาบาล 15,072 แห่ง
โรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.) 8,216 แห่ง
จำนวนห้องน้ำสาธารณะ 15,833 แห่ง
2. นวัตกรรมและการศึกษา
โรงเรียนในสังกัด อปท. 1,787 แห่ง
ครู 55,753 คน
นักเรียน 716,325 คน
ศูนย์พัฒนาเด็กเล็็กในสังกัด อปท. 18,166 แห่ง
ครู 1,373 คน
เด็กเล็ก 534,733 คน
3. สาธารณภัย
อปพร. 427,613 คน
จำนวนรถดับเพลิง 3,353
จำนวนรถบรรทุกน้ำ 6,864
จำนวนรถกู้ชีพ 1,579
4.โครงสร้างพื้นฐาน
ถนนในความดูแลของ อปท. 781,094 เส้น
ถนนของ อปท. 24,201 เส้น
ถนนที่ถ่ายโอนให้ อปท. 693,871 เส้น
5.การบริหารจัดการน้ำ
จำนวนแหล่งน้ำที่มีปริมาตรกักเก็บไม่เกิน 2 ล้านลูกบาศก์เมตร 117,707 แห่ง
จำนวนประปาหมู่บ้าน 68,023 แห่ง
มีน้ำประปาใช้ 57,593 แห่ง
ไม่มีน้ำประปาใช้ 10,430 แห่ง
6.การจัดการภายในและธรรมาภิบาล
องค์กรปกครองส่วนท้องถิ่น 7,849 แห่ง (ไม่รวม กทม)
อบจ. 76 แห่ง
เทศบาลนคร (ทน.) 30 แห่ง
เทศบาลเมือง (ทม.) 195 แห่ง
เทศบาลตำบล (ทต.) 2,247 แห่ง
อบต. 5,300 แห่ง
ท้องถิ่นรูปแบบพิเศษ 1 แห่ง
จำนวนชุมชน 13,345
จำนวนหมู่บ้าน 80,061
จำนวนครัวเรือน 25,499,890
จำนวนประชากร 66,104,497 คน
เพศชาย 31,969,092 คน
เพศหญิง 34,135,405 คน
7.ศาสนา สังคมและวัฒนธรรม
จำนวนผู้สูงอายุ 10,092,560 คน
จำนวนผู้พิการ 1,937,083 คน
สวนสาธารณะ/ลานกีฬา/สนามกีฬา 33,004
จำนวนห้องสมุด 9,064
จำนวนตลาด 7,554
จำนวนสนามเด็กเล่น 7,817
8.เศรษฐกิจและแหล่งท่องเที่ยว
จำนวนนักท่องเที่ยวทั้งหมด (ต่อปี) 18,948,910 คน
นักท่องเที่ยวต่างชาติ 6,704,404 คน
นักท่องเที่ยวคนไทย 12,244,506 คน
จำนวนร้านค้า 257,002
จำนวนร้านค้าประเภทบริการ 48,368
จำนวนโรงงาน 12,487
พื้นที่ทำการเกษตร 4,880,474 ไร่
หลักสูตรเบเกอรี่@UFM ตอบโจทย์หลากหลายความต้องการ LINK
หลักสูตรเบเกอรี่@UFM
โรงเรียนสอนทำขนมอบและอาหาร ยูเอฟเอ็ม เปิดหลักสูตรเบเกอรี่ หลากหลายแบบสำหรับความต้องการที่ต่างไป เช่น เบเกอรี่เพื่อการค้า (4 สัปดาห์) หลักสูตรขนมอบ (พื้นฐาน-ขั้นสูง-ขนมอบวาไรตี้) หลักสูตรขนมปัง (พื้นฐาน-ขั้นสูง ระดับโรงแรม สูตรสุขภาพ วีแกน ซอฟท์ & สวีทเบรด ญี่ปุ่น) หลักสูตรขนมเค้กและแต่งหน้าเค้ก (คัพเค้ก มัฟฟิน มินิโรล ชีสเค้ก สเปเชียล ออลซีซั่น แต่งหน้าเค้กหลายรูปแบบ) หลักสูตรคุกกี้และพาย (คุกกี้ ซอฟท์คุกกี้และบาร์ พัฟ & พาย คุกกี้วีแกน) หลักสูตรพิเศษ (ขนมเปี๊ยะ ขนมอบเจ ซาลาเปา-หมั่นโถวเจ) หลักสูตรวันเดียว (ขนมปังโคน / เค้กไข่ไต้หวัน คุกกี้ไอศกรีม 6 รส ชูครีม 3 รส ชีสทาร์ต 3 รส ขนมอบลีน & คลีน เพื่อสุขภาพ ชุด 1 ขนมอบลีน & คลีน เพื่อสุขภาพ ชุด 2 หลักสูตรขนมปัง คัพเบรด มิลค์กี้ & ช็อกโกครีมบันซ์ ดับเบิ้ลชีสเบรด ขนมปังหน้าเยิ้ม ขนมปังเตยหอมมะพร้าวอ่อน / สไปซี่เบคอนแฮมชีส สวีท & เซเวอรี่ ครัวซองท์ ครัวซองท์ไส้คัสตาร์ด / คัพเบรดผักโขมอบชีส) ชอบแบบไหนเลือกได้เลย สอบถามค่าเรียนและตารางเรียน โทร 02-259-0620-30 ต่อ 407,408
ร้านดังที่ยังไม่เคยไปกิน
ข้าวหมูแดงนายฮุย (นาครสนุก) ยังไม่ได้กิน เพราะไปแถวนั้นทีไร โดนขาหมูโค้วจั้วฮวดเจ้าเก่าดึงไว้ทุกที เลยไปไม่ถึงนายฮุยซักที (ถ้าจะไปให้ถึง ต้องไปทางคลองถม อย่าไปทางดิโอลด์สยาม 555)
คุณสุภาวดี ตริยางกูรศรี บริจาค 100 ล้านบาท สมทบทุนคอนเสิร์ต LINK
ขอขอบคุณ คุณสุภาวดี ตริยางกูรศรี ผู้บริหารสุนีย์แกรนด์ แอนด์ คอนเวนชั่น เซนเตอร์ บริจาคจำนวน 100,000,000 บาท (#หนึ่งร้อยล้านบาทถ้วน) เพื่อสมทบทุนคอนเสิร์ตการกุศล #3 Song Of Life ขออนุโมทนาบุญ ขออานิสงฆ์ผลบุญจงดลบันดาลให้ท่านและครอบครัว ประสบแต่ความสุข ความเจริญ ตลอดไปครับ
ทีม M 2 เมเม่และมะนาว ทีม ธกส.
ร่วมโหวต ให้ทีม M 2 เมเม่และมะนาว ทีม ธกส. เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า
นายสฤษดิ์ จิณสิทธิ์ กรรมการผู้จัดการใหญ่ บริษัท เอเชีย เอรา วัน จำกัด กล่าวถึงการจัดงานในครั้งนี้ว่า “โครงการ One Drop for Life จัดขึ้นโดยมีวัตุประสงค์เพื่อเป็นส่วนหนึ่งในการแสดงพลัง และสนับสนุนสภากาชาดไทยในการเร่งจัดหาโลหิตเพื่อแก้ปัญหาสภาวะขาดแคลนโลหิตสำรอง บริษัทฯ มีความยินดีที่ได้อำนวยความสะดวกในการจัดหาพื้นที่ ที่เหมาะสมในการเปิดศูนย์บริจาคโลหิตเคลื่อนที่ในครั้งนี้ โดยบริษัทฯ ได้ผนึกกำลังพนักงาน และผู้บริหารมาร่วมบริจาคโลหิตในวันนี้เพื่อเป็นการปลูกจิตสำนึกและสร้างวัฒนธรรมในการเป็น “ผู้ให้” ด้วยการส่งเสริมกิจกรรมให้พนักงานได้มีส่วนร่วมในการทำความดีเพื่อสังคม ซึ่งสอดคล้องกับแนวทางการให้บริการเดินรถของบริษัทฯ ในวันนี้ผมอยากเชิญชวนให้ทุกท่านมาร่วมแสดงพลังร่วมใจในการกู้วิกฤติขาดแคลนโลหิตเพื่อช่วยเหลือพี่น้องชาวไทยทั่วประเทศที่กำลังต้องการโลหิตในการรักษาพยาบาล”
48% ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ของภูมิภาคเอเชีย-แปซิฟิก ลงทุนในบันทึกดิจิทัลด้านสุขภาพมากที่สุด
48% ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ของภูมิภาคเอเชีย-แปซิฟิก ลงทุนในบันทึกดิจิทัลด้านสุขภาพมากที่สุด และเกือบสามในสี่ (74%) ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคมีแผนที่จะลงทุนในปัญญาประดิษฐ์ (AI) ในอีก 3 ปีข้างหน้า นำโดยสิงคโปร์ (84%) ตามด้วยอินโดนีเซีย (76%) และออสเตรเลีย (63%) เพื่อนำไปใช้ในการคาดการณ์ผลลัพธ์ (39%) เช่น วิเคราะห์แนวโน้มผู้ป่วยต่อการตอบสนองต่อแผนการดูแลรักษา เพื่อความแม่นยำในการดูแลรักษาที่มากขึ้น เพื่อนำไปใช้สนับสนุนในการตัดสินใจทางคลินิก (35%) เช่น ให้คำแนะนำในการตรวจวินิจฉัยหรือการรักษา การแจ้งเตือนล่วงหน้า การตรวจหาโรคแบบอัตโนมัติ ตัวชี้แนะการตัดสินใจทางคลินิก เป็นต้น และเพื่อนำไปใช้ในการบูรณาการด้านวินิจฉัย (33%) เช่น ช่วยประมวลผลการตรวจวินิจฉัยจทางคลินิกจากเครื่องมือที่แตกต่าง อาทิ การตรวจด้วยภาพและพยาธิวิทยา ประวัติทางคลินิก เป็นต้น
ผู้บริหารแถวหน้าในวงการเฮลท์แคร์ของภูมิภาคนี้ผลักดันการกระจายบริการด้านสาธารณสุขที่นอกเหนือจากในโรงพยาบาล ด้วยการขยายการดูแลรักษาผู้ป่วยผ่านระบบออนไลน์ (virtual care) ไปยังส่วนต่างๆ ของระบบนิเวศด้านเฮลท์แคร์ซึ่งไม่เฉพาะสำหรับการตรวจวินิจฉัยเท่านั้น โดยครึ่งหนึ่ง (51%) ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชีย-แปซิฟิก บอกว่า สถานบริการด้านสาธารณสุขของพวกเขาให้บริการดูแลผู้ป่วยหนักหรือผู้ป่วยวิกฤตผ่านระบบออนไลน์แล้ว และ 42% บอกว่าพวกเขาจะให้บริการเช่นนั้นในอนาคต ในขณะที่ 62% ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ของภูมิภาคนี้บอกว่า พวกเขาให้บริการดูแลผู้ป่วยฉุกเฉินที่บ้านแล้ว ผ่านทั้งระบบออนไลน์และการพบปะตัวบุคคล และ 31% บอกว่าพวกเขาวางแผนที่จะทำเช่นนั้นในอีก 3 ปีข้างหน้า
สำหรับประเทศไทย มากกว่าร้อยละ 45 ของหน่วยบริการด้านเฮลท์แคร์ได้ถูกพัฒนาไปสู่การเป็น Smart Hospitals โดยกระทรวงสาธารณสุขได้มีการกำหนดกลยุทธ์เพื่อนำดิจิทัลเทคโนโลยีเข้ามาใช้ในโรงพยาบาล และมีการตั้งเป้าหมายเพื่อพัฒนาโรงพยาบาลและบริการด้านเฮลท์แคร์สู่การเป็น Smart Hospital[1]
ระบบ AI ประมวลภาพ ระบุข้อมูลเจ้าของทะเบียนรถ ตามข้อมูลกรมขนส่งทางบก
เทคนิคบางมด คือจุดแข็งของการทำศัลยกรรมที่ศูนย์ของเรา - นพ.ธนัญชัย อัศดามงคล
นพ.ธนัญชัย อัศดามงคล แพทย์เฉพาะทางด้านศัลยกรรมตกแต่ง เเละผู้อำนวยการศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด กล่าวเสริมเกี่ยวกับความโดดเด่นของการให้บริการทางการแพทย์ว่า “จุดแข็งของการทำศัลยกรรมที่ศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด คือเทคนิคการผ่าตัดเฉพาะทาง ทำให้แผลเล็ก เจ็บน้อย หายเร็วและดูเป็นธรรมชาติ เรียกว่า “เทคนิคบางมด” ซึ่งสอดคล้องกับความต้องการของคนไข้ในปัจจุบัน นอกจากนี้ การทำศัลยกรรมโดยแก้ไขปัญหาอย่างตรงจุด จะทำให้ได้ผลลัพธ์ที่ดี ทำให้คนไข้บอกต่อประสบการณ์จริงโดยตรงของตนเองไปสู่คนรอบข้างแบบปากต่อปากอย่างมีความน่าเชื่อถือได้จริงๆ
ผมตระหนักเสมอว่าหนึ่งในเป้าหมายสำคัญของโรงพยาบาลบางมด คือ การเดินหน้าในการขยายธุรกิจศัลยกรรมเพิ่มเติม โดยเน้นเจาะทุกกลุ่มเป้าหมาย โฟกัสกลุ่มเป้าหมายใหม่ๆ สร้างมิติใหม่ที่ท้าทาย ซึ่งในปีที่ รพ.บางมดครบรอบ 35 ปีนี้ เป็นปีแห่งการเติบโตอย่างก้าวกระโดด อีกทั้งที่ผ่านมามีผู้สนใจมาทำศัลยกรรมที่ศูนย์ศัลยกรรมความงามโรงพยาบาลบางมดของเราจำนวนมากทั้งคนไทยและต่างชาติ เพื่อรองรับจำนวนผู้เข้ารับบริการ จึงได้เตรียมพร้อมก้าวสู่การเป็น โรงพยาบาลศัลยกรรมแบบครบวงจร ภายใต้ชื่อ Bangmod Aesthetic & Wellness Hospital คาดว่ากำหนดแล้วเสร็จและพร้อมเปิดให้บริการได้ภายในปี 2568 มีบริการการทำศัลยกรรมความงามแบบ Ultra Luxury ศัลยกรรมได้ทั้งตัวตั้งแต่ศีรษะจรดปลายเท้า แนะนำตรวจวิเคราะห์ก่อนผ่าตัดอย่างรัดกุม โดยทีมแพทย์เฉพาะทางด้านศัลยกรรม บริการดูแลอย่างเหนือระดับสำหรับบุคคลสำคัญทุกระดับเพื่อการดูแลอย่างดีที่สุด ปลอดภัยที่สุดโดยที่คนไข้ของเราส่วนใหญ่มีทั้ง Celebrity คนไทยและคนต่างชาติ ดารา Hollywood และผู้มีชื่อเสียงในทุกวงการ
ญี่ปุ่นตรวจระดับสารกัมตรังสีในปลาที่จับได้ใกล้โรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะ ไดอิจิ
สำนักงานการประมงของญี่ปุ่นกำลังตรวจสอบระดับของทริเทียมซึ่งเป็นสารกัมมันตรังสีในปลาชุดแรกที่จับได้นอกชายฝั่งจังหวัดฟูกูชิมะ หลังจากที่ได้เริ่มปล่อยน้ำที่ได้รับการบำบัดและทำให้เจือจางแล้วจากโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะ ไดอิจิที่เสียหายลงสู่ทะเล
บริษัทพลังไฟฟ้าโตเกียวหรือ เทปโก ซึ่งเป็นบริษัทที่บริหารจัดการโรงไฟฟ้าดังกล่าวได้เริ่มปล่อยน้ำเมื่อวันพฤหัสบดีที่ 24 สิงหาคมตามแผนของรัฐบาล
สถาบันวิจัยระบบนิเวศน์ทางทะเลในจังหวัดมิยางิได้ทำการตรวจสอบดังกล่าวในวันศุกร์ที่ 25 สิงหาคม
บรรดานักวิจัยกำลังตรวจสอบปลาลิ้นหมาและปลานกฮูกที่จับได้ก่อนหน้าในวันเดียวกันจากน่านน้ำที่ห่างจากโรงไฟฟ้านิวเคลียร์ราว 5 กิโลเมตร
มีการใช้อุปกรณ์พิเศษเพื่อวิเคราะห์ความเข้นข้นของทริเทียม อุปกรณ์นี้ต่างจากอุปกรณ์ก่อนหน้าที่ต้องใช้เวลากว่า 1 เดือนถึงจะรู้ผลแต่อุปกรณ์ใหม่นี้สามารถวัดค่าได้โดยใช้เวลาราว 1 วัน
นักวิจัยคนหนึ่งระบุว่า ทางสถาบันวางแผนที่จะทำการตรวจสอบทุกวันเพื่อให้ผู้บริโภคและชาวประมงเบาใจ
สำนักงานการประมงจะเผยแพร่ผลการตรวจสอบทางเว็บไซต์อย่างเร็วที่สุดในวันเสาร์ที่ 26 สิงหาคม
โรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะ ไดอิจิประสบปัญหาการหลอมละลายที่เตาปฏิกรณ์นิวเคลียร์ 3 เตาจากแผ่นดินไหวและสึนามิเมื่อปี 2554
น้ำซึ่งใช้หล่อเย็นแท่งเชื้อเพลิงที่หลอมละลายที่โรงไฟฟ้าผสมกับน้ำฝนและน้ำใต้ดิน น้ำที่สะสมมากขึ้นได้รับการบำบัดเพื่อขจัดสารกัมมันตรังสีออกเกือบทั้งหมดแต่ยังมีทริเทียมอยู่
เทปโกเจือจางน้ำที่ได้รับการบำบัดแล้วโดยลดระดับของทริเทียมให้เหลือราว 1 ใน 7 ของมาตรฐานคุณภาพน้ำดื่มขององค์การอนามัยโลกก่อนที่จะปล่อยลงทะเล
โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ กำแพงแสน
เลขที่ 1 หมู่ 6 ต.กำแพงแสน อ.กำแพงแสน จ.นครปฐม 73140
โทรศัพท์: 034-351901-3 ต่อ 2101-3
เปิดให้บริการ
จันทร์ - พฤหัสบดี 08.30 น. - 16.30 น. และ 17.00 น. - 20.00 น.
ศุกร์ 08.30 น. - 12.00 น. และ 17.00 น. - 20.00 น.
เสาร์ - อาทิตย์ และ วันหยุดราชการ 09.00 น. - 14.00 น. และ 17.00 น. - 20.00 น.
บริการของคลินิกเฉพาะทางเวลา 09.00 น. - 15.00 น.
จันทร์ คลินิกระบบสืบพันธุ์
อังคาร คลินิกโรคผิวหนัง
พุธ โรคตา เนี้องอก ระบบสืบพันธุ์
พฤหัสบดี โรคหัวใจ
ศุกร์ คลินิกระบบสืบพันธุ์
การบริการกรณีฉุกเฉินและสัตว์ป่วยวิกฤต
แผนกฉุกเฉินและสัตว์ป่วยวิกฤตของโรงพยาบาลสัตว์ฯ สามารถให้บริการในกรณีฉุกเฉินและสัตว์ป่วยวิกฤตได้อย่างทันถ่วงที ด้วยความพร้อมของอุปกรณ์ในการช่วยชีวิต
Facebook |
Website |
แผนที่
นายภาณุ บุญวัฒโนภาส ฝ่ายดิจิทัล และเทคโนโลยีสารสนเทศ


สำหรับนายภาณุ บุญวัฒโนภาส หรือคุณบอย รองประธานกรรมการบริหาร ฝ่ายดิจิทัล และเทคโนโลยีสารสนเทศ บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด อีกหนึ่งอาสาสมัครผู้บริหารหนุ่มไฟแรงของบริษัทฯ ที่ได้แบ่งเวลาในฐานะครูอาสากล่าวเสริมว่า “ผมสอนภาษาอังกฤษให้กับนักเรียนชั้นประถมศึกษาปีที่ 6 โรงเรียนวัดพระยายัง โดยจุดเริ่มต้นคือผมอยากจะมีโอกาสเป็นส่วนหนึ่งในการพัฒนาการศึกษาของประเทศ และมีความฝันอยากเป็นอาจารย์อยู่แล้วเป็นทุนเดิม ซึ่งภาษาอังกฤษที่ผมสอนจะเน้นไปในรูปแบบการใช้ชีวิตประจำวัน เพราะปฏิเสธไม่ได้ว่าในปัจจุบันถือเป็นภาษาที่สองของเด็กๆ เลยทีเดียว โดยสิ่งที่ผมประทับใจที่สุดคือการที่ได้ให้โอกาสลูกๆ ทั้งสองคนเข้ามามีส่วนร่วมในการสอนครั้งนี้ด้วย ไม่ว่าจะเป็นการนำกิจกรรมในห้องเรียน หรือช่วยการสอน ซึ่งผมเชื่อว่าด้วยสังคมปัจจุบัน ถ้าเราไม่ให้โอกาสเขาได้เห็นโลกที่กว้างมากขึ้น และปลูกฝังแนวคิดเรื่องการแบ่งปัน เขาก็จะไม่รู้ว่าจะทำให้สังคมดีขึ้นได้อย่างไร ต้องขอบคุณ Saturday School Foundation ที่ริเริ่มโครงการนี้ขึ้นมา และขอบคุณบริษัทฯ ที่ทำให้ภาพเหล่านี้เกิดขึ้นได้จริง รวมถึงจริงจังกับการพัฒนารากฐานของประเทศผ่านการศึกษามาโดยตลอด โดยผมมองว่าการได้เข้าร่วมโครงการดังกล่าวถือเป็นประตูแห่งโอกาสทั้งสำหรับผมและครอบครัว และได้เห็นการศึกษาที่ไร้ซึ่งขีดจำกัดอย่างแท้จริง”
โครงการอาสาจุฬาภรณ์ ขยายผลสู่ชุมชนเมือง ครั้งนี้ อาสาจุฬาภรณ์ที่เข้าร่วมโครงการได้แก่อาสาจุฬาภรณ์ รุ่นที่ 1-3 ของชุมชนเมือง ได้แก่ ชุมชนการเคหะหลักสี่และชุมชนโดยรอบ ประกอบด้วย อาสาจุฬาภรณ์ รุ่นที่ 1 จำนวน 40 คน อาสาจุฬาภรณ์ รุ่นที่ 2 จำนวน 31 คน อาสาจุฬาภรณ์ รุ่นที่ 3 จำนวน 44 คน นักศึกษาวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน จำนวน 57 คน รวม 172 คน
กิจกรรมพัฒนาอาสาจุฬาภรณ์ ชุมชนเมือง ประกอบด้วย กิจกรรมสานสัมพันธ์ และกิจกรรมภาคปฏิบัติ 9 ฐาน ที่ให้ความรู้ทางวิชาการที่หลากหลาย อาทิเช่น กะหล่ำปลีบรรเทาปวด ฐานการวัดความดัน ฐานการทำแผลอย่างถูกต้อง ฐานการเจาะวัดระดับน้ำตาลในเลือดด้วยตนเอง ฐานการวัดสัดส่วนร่างกายที่ถูกต้อง ฐานการป้องกันโรคติดต่อทางเพศสัมพันธ์ ฐานสุขภาพจิตในชุมชน ฐานการช่วยเหลือชีวิตขั้นพื้นฐาน หรือ Basic Life Support และการระดมความคิดเพื่อทำกิจกรรมในชุมชน นอกจากนี้ยังมีกิจกรรม “ค้นหาของดี เรียนรู้ชุมชน” เพื่อเป็นแนวทางในการสร้างรายได้เสริมผ่านการมีส่วนร่วมด้านสุขภาพของประชาชนในชุมชนอีกด้วย
จำนวนนักท่องเที่ยวรายสัปดาห์
กังวลเป็นลองโควิด ปรึกษาและรับยาสมุนไพร ฟรี ศูนย์ส่งเสริมสุขภาพแผนไทย
เช็กด่วน ! หลังหายโควิด ท่านยังมีอาการเหล่านี้ไหม ?
นอนไม่หลับ เบื่ออาหาร
เหนื่อยง่าย หายใจลำบาก
ไข้ ไอ เสมหะ ภูมิแพ้อากาศ
ปวดเมื่อยกล้ามเนื้อ ข้อต่อ
ท้องอืด ท้องผูก ลำไส้แปรปรวน
ซึ่งอาจเป็นสัญญาณของภาวะ "ลองโควิด"
มีอาการเรื้อรังได้นานถึง 3-6 เดือน
สามารถป้องกันและดูแลรักษาตนเองได้
ด้วยการมาติดต่อขอรับบริการ ดังนี้
1) ขอรับยาสมุนไพร ฟรี ! ไม่มีค่ายา
อาทิ ยาศขไสยาศน์ , ยาฟ้าทะลายโจร , ยาห้าราก ยาจันทลีลา , ยาตรีผลา , ยาปรับธาตุ เป็นต้น
2) สุมยาสมุนไพร - ดูแลทางเดินหายใจส่วนต้น (วันอังคาร)
ศูนย์ส่งเสริมสุขภาพแผนไทย จันทร์ -ศุกร์ เวลา 8.30-16.30 น.
สอบถาม/จองคิว โทร. 02-590-2606 , 02-591-1964
4 ไม่เพื่อป้องกันเพจปลอมหลอกลงทุน
4 ไม่เพื่อป้องกันเพจปลอมหลอกลงทุน
1. ไม่ลงทุนตามคำชักชวนโดยไม่ตรวจสอบความน่าเชื่อถือ
ระวังเพจปลอม
ระวังการแอบอ้างบุคคลที่มีชื่อเสียง
2. ไม่หลงเชื่อการอ้างผลตอบแทนที่สูงเกินจริง
การลงทุนมีความเสี่ยง ดังนั้น
ผลตอบแทนที่สูงมักจะมาพร้อม
ความเสี่ยงสูง อย่าเร่งรีบตัดสินใจ
3. ไม่รีบร้อนต้องตรวจสอบตัวตนบริษัทก่อนลงทุน
ตรวจสอบรายชื่อผู้ให้บริการและบุคลากรเกี่ยวกับการลงทุนในหลักทรัพย์ ที่ได้รับอนุญาตได้ที่ www.sec.or.th
4. ไม่โอนเงินเข้าบัญชีบุคคลธรรมดา
ผู้ให้บริการที่ถูกต้องตามกฎหมายต้องใช้บัญชีธนาคารเป็นชื่อบริษัทของผู้ให้บริการเท่านั้นและต้องมีรายงานยืนยันผลการลงทุน
ศึกษาข้อมูลการลงทุนได้ที่ www.setinvestnow.com สอบถามโทร 02-009-9999
Psilocybin สารหลอนประสาท ยาโรคซึมเศร้า ยาเลิกเหล้า ? เห็ดขี้ควาย - อายุรศาสตร์ ง่ายนิดเดียว
เพจอายุรศาสตร์ ง่ายนิดเดียว เผยแพร่ข้อเขียนน่าสนใจ เกี่ยวกับการทดลองศึกษาเรื่องใช้ psilocybin เพื่อเลิกเหล้า ในกลุ่มทดลองเล็กๆ 95 คน เป็นผู้ที่ดื่มเหล้าเยอะ ติดเหล้ามาก เข้ารับการบำบัด 32 สัปดาห์ โดยแบ่งกลุ่มเป็นกลุ่มที่ได้รับยา psilocybin กับกลุ่มควบคุมเปรียบเทียบใช้ยา diphenhydramine ผลออกมาน่าทึ่งที่กลุ่มที่รับยา psilocybin มีจำนวนวันที่ดื่มหนัก ลดลงมากกว่าอีกกลุ่มถึงกว่าร้อยละ 40
วัคซีนป้องกันโรคไข้เลือดออก (Qdenga) ชนิดใหม่ โรงพยาบาลรามคำแหง 2
โรงพยาบาลรามคำแหง 2 บริการวัคซีนป้องกันโรคไข้เลือดออก (Qdenga) 4 สายพันธุ์ ชนิดใหม่ 2 เข็ม ราคา 4,500 บาท
✅ ป้องกันการติดเชื้อไข้เลือดออก 4 สายพันธุ์
✅ เหมาะสำหรับผู้ที่มีอายุ 4-60 ปี
✅ ฉีดได้ทั้งผู้ที่เคยและไม่เคยติดเชื้อไข้เลือดออกมาก่อน
ราคานี้รวมค่าบริการพยาบาล และค่าบริการโรงพยาบาล แต่ไม่รวมค่าแพทย์
ระยะเวลาตั้งแต่วันนี้ – 31 ธันวาคม 2566
แพ็กเกจวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ โรงพยาบาลธนบุรี บำรุงเมือง
แพ็กเกจวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ราคา 590 บาท ราคานี้รวมค่าแพทย์และค่าบริการทางการแพทย์แล้ว >สามารถฉีดได้ตั้งแต่ผู้มีอายุ 6 เดือนขึ้นไป >ผู้มีอายุต่ำกว่า 15 ปี เข้ารับบริการที่ศูนย์กุมารเวชกรรม ชั้น B1 >ผู้มีอายุ 15 ปีขึ้นไป เข้ารับบริการที่ศูนย์ตรวจสุขภาพ ชั้น 2 ตั้งแต่วันที่ – 31 ธันวาคม 2566 ศูนย์ตรวจสุขภาพ ศูนย์กุมารเวชกรรม call center : 02-220-7999
นายสัตวแพทย์ตันติกร รุ่งพัฒนะ ผู้อำนวยการโครงการจัดการประชากรสุนัขและแมวประเทศไทยให้ข้อมูลว่า การเพิ่มขึ้นของจำนวนสุนัขและโรคพิษสุนัขบ้าเป็นความเสี่ยงด้านสุขภาพของคนไทย ทั้งนี้มีการแสดงให้เห็นในหลายประเทศแล้วว่าโครงการทำหมันอย่างต่อเนื่องเป็นวิธีเดียวที่สามารถแก้ไขทั้งสองปัญหานี้ได้ในระยะยาวที่ทำให้ทั้งสัตว์และคนในชุมชนมีความเป็นอยู่ที่ดีขึ้น มูลนิธิฯ พบว่าสุนัขแม่ลูกอ่อนในชุมชนและสุนัขที่ร่างกายผอมโซ มีปัญหาผิวหนัง ขี้เรื้อนลดจำนวนลงจนแทบไม่มีภาพเหล่านี้ให้เห็นในพื้นที่ที่ซอยด๊อกเข้าไปทำหมัน ยกตัวอย่างเช่นจังหวัดภูเก็ตที่พื้นที่รอบเกาะเป็นที่อยู่ของสุนัขในชุมชนที่สุขภาพดีและเป็นมิตรกับนักท่องเที่ยว
ทั้งนี้ปัจจัยสำคัญที่จะส่งผลให้โครงการทำหมันประสบความสำเร็จคือการไม่นำสุนัขเข้าไปไว้ในศูนย์พักพิง แต่ให้กลุ่มที่ทำหมันฉีดวัคซีนแล้วได้อยู่ในพื้นที่ของตัวเอง สุนัขเหล่านี้จะป้องกันไม่ให้มีสุนัขหน้าใหม่เข้ามาในพื้นที่และสิ้นอายุขัยไปตามธรรมชาติ อีกประการหนึ่งคือทุกคนในชุมชนต้องเป็นหูเป็นตาหากพบเห็นการทิ้งสัตว์เลี้ยงและดำเนินการตามกฎหมายทันที เนื่องจากสัตว์เลี้ยงจำนวนมากไม่ได้ทำหมันและเมื่อกลายเป็นสัตว์จรจัดจึงมาแพร่พันธุ์บนท้องถนนทำให้ไม่ว่าจะทำหมันสัตว์มากเพียงใดก็ไม่สามารถจัดการปัญหาได้อย่างเบ็ดเสร็จ รวมถึงการสร้างจิตสำนึกเรื่องการเลี้ยงสัตว์อย่างรับผิดชอบ
โปรโมชั่นวัคซีนป้องกันมะเร็งปากมดลูก(HPV) โรงพยาบาลวิภาราม
โปรโมชั่นวัคซีนป้องกันมะเร็งปากมดลูก(HPV) รู้หรือไม่ มะเร็งปากมดลูกโรคร้าย ป้องกันได้ด้วยวัคซีน HPV ยิ่งฉีดเร็วยิ่งดี‼️ ตั้งแต่วันนี้ ถึง 31 ธันวาคม 2566 สอบถามข้อมูลเพิ่มเติมได้ที่แผนกสูติ-นรีเวช โรงพยาบาลวิภาราม โทร.02032-2550 ต่อ 2419, 2420
แพ็กเกจวัคซีนป้องกันมะเร็งปากมดลูก (Gardasil ชนิด 9 สายพันธุ์) โรงพยาบาลกรุงเทพ
แพ็กเกจวัคซีนป้องกันมะเร็งปากมดลูก (Gardasil ชนิด 9 สายพันธุ์) 2 เข็ม สำหรับเด็ก 9 – 14 ปี ราคา 16,500 บาท (ไม่รวมค่าแพทย์)
แพ็กเกจวัคซีนป้องกันมะเร็งปากมดลูก (Gardasil ชนิด 9 สายพันธุ์) 3 เข็ม สำหรับอายุ 15 ปี ขึ้นไป ราคา 23,500 บาท (ไม่รวมค่าแพทย์)
ราคาแพ็กเกจใช้ได้ตั้งแต่วันที่ 1 มกราคม 2566 – 31 ธันวาคม 2566
ศูนย์สุขภาพสตรี ชั้น 2 อาคาร D โรงพยาบาลกรุงเทพ เปิดบริการทุกวัน เวลา 08.00 - 20.00 น. 0 2310 3005 0 2755 1005 0 2310 3000 1719
โรงพยาบาลรวมแพทย์ฉะเชิงเทรา พร้อมให้บริการ วัคซีนป้องกันโรค มือ เท้า ปาก ชนิด EV71
โรงพยาบาลรวมแพทย์ฉะเชิงเทรา พร้อมให้บริการ วัคซีนป้องกันโรค มือ เท้า ปาก ชนิด EV71
1. สำหรับเด็กอายุ 6 เดือน – 5 ปี (ไม่ควรเกิน 6 ปีบริบูรณ์)
2. เป็นวัคซีนชนิดเชื้อตาย
3. ฉีดเข้ากล้ามเนื้อขนาด 0.5 มิลลิลิตร
4. ฉีดให้ครบ 2 เข็ม ห่างกัน 1 เดือน
5. แม้เคยติดเชื้อมาแล้ว หรือ ฉีด 1 เข็ม แล้วติดเชื้อ ยังแนะนำฉีดให้ครบทั้ง 2 เข็ม
6. ยังไม่มีข้อมูลความจำเป็นในการฉีดกระตุ้นเข็มที่ 3
เข้ารับบริการแบบ Walk in ได้เลย ที่แผนกเด็กดี ชั้น 2
ติดต่อสอบถาม สอบถามเพิ่มเติมได้ที่ 033-050600 ต่อ 1207 แผนกเด็กดี Well Baby Clinic
หมายเหตุ:
1. ราคาที่แจ้งนี้ รวมค่าแพทย์และค่าบริการแล้ว
2. ราคานี้ ไม่สามารถใช้ร่วมกับโปรแกรมส่งเสริมการขายอื่นได้ สามารถใช้ได้เฉพาะเงินสด หรือบัตรเครดิตเท่านั้น
คลินิกพิเศษ สูติ-นรีเวช นอกเวลา โดย สูตินรีแพทย์
โรงพยาบาลกระทุ่มแบน เปิดให้บริการ คลินิกพิเศษ สูติ-นรีเวช นอกเวลา โดย สูตินรีแพทย์
สำนักงานป้องกันควบคุมโรคที่ 2 จังหวัดพิษณุโลก
306 หมู่ 5 ถ.พิษณุโลก-วัดโบสถ์ ต.หัวรอ อ.เมือง จ.พิษณุโลก
ผลงานนวัตกรรม (Oral)
INQ-001
การให้บริการตรวจสุขภาพออนไลน์และจ่ายยาผ่านตู้จ่ายยาอัจฉริยะ
นางอาภาภรณ์ คูทองกุล
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
INQ-002
ลดภาวะ Hypothermia ในทารกแรกเกิดที่ได้รับการทา
Delayed cord clamping
คุณชนัดดา ระดาฤทธิ์
(โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย)
INQ-003
I-GREEN น วัตก ร รม รถขนมูลฝอยติดเชื้อที่เป็นมิต รต่อ
สิ่งแวดล้อม
นายสุนทร ปานเม่า
(โรงพยาบาลขนอมจังหวัดนครศรีธรรมราช)
INQ-004 การพัฒนานวัตกรรมต้นแบบแอปพลิเคชัน MAMI นางสาวพัฒน์นรี เปี่ยมธนันปภัค
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
INQ-005
ระบบฝึกอบรมออนไลน์โรงพยาบาลเมตตาประชารักษ์
(วัดไร่ขิง) หลักสูตรการพยาบาลจักษุเบื้องต้น
นายวัชรธฤต ภาทันณ์
(โรงพยาบาลเมตตาประชารักษ์ (วัดไร่ขิง))
3. ความประสงค์เข้ารับการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ในปีถัดไป ปี 2567 กลุ่มเป้ามหมาย ในผู้สูงอายุ 65 ปีขึ้นไป มีความประสงค์จะฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ในปีถัดไป ในปี 2567 ร้อยละ 99.53 โดยประสงค์ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ ร้อยละ 37.38 และประสงค์ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่พร้อมกับ วัคซีนโควิด 19 ร้อยละ 62.62 ตามลำดับ ดังกราฟที่ 7-8
ปัจจุบัน โรงพยาบาลพานาซี โรงพยาบาลจากประเทศเยอรมัน ขยายสาขามาสู่ประเทศไทย ถึง 4 สาขา อาทิ โรงพยาบาลพานาซี พระราม 2 ,เอกมัย , เขาใหญ่ จ.นครราชสีมา และที่ จ.อุดรธานี เป็นมิติใหม่ของโรงพยาบาลเฉพาะทางที่ให้บริการทางการแพทย์แผนปัจจุบันและการแพทย์ทางเลือกแบบองค์รวม เน้นการรักษาจากต้นเหตุของการเกิดโรค รวมไปถึงการป้องกันการเกิดโรคที่มีความปลอดภัย การชะลอวัย และการส่งเสริมสุขภาพ โดยทีมแพทย์ผู้มีประสบการณ์พร้อมด้วยเทคโนโลยีทางการแพทย์ที่ได้รับมาตรฐานสากลจากประเทศเยอรมนี เพื่อผลลัพธ์ที่มีประสิทธิภาพในการรักษา โดยเน้นศาสตร์ในเรื่องการป้องกันก่อนเกิดโรค รวมถึงการใช้สมุนไพร และวิตามินจากธรรมชาติ และการบำบัดจากภายในสู่ภายนอก ดูแลลึกถึงระดับสเต็มเซลล์ มุ่งหวังในการหาทางป้องกันและแก้ไขโรคร้ายก่อนจะสายเกินแก้ ด้วยการรักษาแบบองค์รวมจากแพทย์เฉพาะทาง ซึ่งออกแบบการรักษาให้เหมาะสมกับแต่ละบุคคล ดูแลรักษาโรคจากสาเหตุได้อย่างตรงจุด โดยไม่ใช้ยา สารเคมี หรือการผ่าตัด
แรงงานเร่งเยียวยา
“พิพัฒน์” เสียใจเหตุสูญเสียพารากอน สั่งเร่งตรวจสอบเยียวยา หลังพบผู้เสียชีวิตเป็นชาวต่างชาติ
นายพิพัฒน์ รัชกิจประการ รัฐมนตรีว่าการกระทรวงแรงงาน เปิดเผยถึงกรณีเหตุกราดยิงที่ศูนย์การค้าสยามพารากอน ว่า ทันทีที่ทราบข่าวว่าผู้เสียชีวิตจากการกราดยิง 2 ราย เป็นชาวเมียนมาและชาวจีน ได้สั่งการให้กรมฯ ที่เกี่ยวข้อง เร่งตรวจสอบทันที ตรวจสอบข้อเท็จจริงกับสำนักงานประกันสังคม พบว่า ชาวเมียนมาที่เสียชีวิต เป็นผู้ประกันตนตามมาตรา 33
.
ในส่วนของ ผู้บาดเจ็บ อีก 5 ราย พบว่าเป็นผู้ประกันตน 4 ราย แบ่งเป็นผู้ประกันตนตามมาตรา 33 ที่เป็นลูกจ้างชาวไทย จำนวน 2 ราย เป็นผู้ประกันตนตามมาตรา 33 ที่เป็นลูกจ้างแรงงานสัญชาติลาว จำนวน 1 ราย และเป็นผู้ประกันตนตามมาตรา 39 ที่เป็นลูกจ้างชาวไทย จำนวน 1 ราย
กระทรวงแรงงาน ขอแสดงความเสียใจต่อการสูญเสียในครั้งนี้ ขอให้เชื่อมั่นว่าเราจะดูแลและคุ้มครองแรงงานต่างชาติที่เข้ามาทำงานในประเทศไทยอย่างถูกต้องตามกฎหมายทุกคน ให้เท่าเทียมกับแรงงานไทยทุกประการ คุ้มครองตามหลักสิทธิมนุษยชน และสิทธิประโยชน์ตามกฎหมาย ชาวต่างชาติที่ทำงานในประเทศไทยอย่างถูกต้องตามกฎหมายและเป็นผู้ประกันตนตามกฎหมายประกันสังคม หากเสียชีวิตจะได้รับสิทธิประโยชน์กรณีเสียชีวิตเป็นค่าทำศพ และเงินสงเคราะห์
ในส่วนลูกจ้างที่ได้รับบาดเจ็บ เป็นลูกจ้างบริษัทรักษาความปลอดภัย และเป็นผู้ประกันตนตามมาตรา 33 นับเป็นการบาดเจ็บเนื่องจากการทำงาน จะได้รับเงินทดแทนร้อยละ70 ของค่าจ้าง ขณะที่ ลูกจ้างที่เป็นผู้ประกันตนตามมาตรา 39 จะได้รับเงินทดแทนการขาดรายได้ร้อยละ 50 ของค่าจ้าง โดยผู้ที่ได้รับบาดเจ็บ สำนักงานประกันสังคมจะดูแลสิทธิในการรักษาพยาบาลจนสิ้นสุดการรักษาทุกราย และขณะนี้ สำนักงานประกันสังคมได้เข้าไปดูแลเรียบร้อยแล้ว
ทันตแพทยศาสตร์ ม.อ. ทำฟันฟรี 12 ตุลาคม 2566
ทำฟันฟรี 12 ตุลาคม 2566 คณะทันตแพทยศาสตร์ ม.อ. ได้จัดกิจกรรมวันทำฟันฟรีและกิจกรรมเปิดกระปุกออมเเงิน เพื่อน้อมรำลึกในวันคล้ายวันพระราชสมภพ สมเด็จพระศรีนครินทราบรมราชชนนี และวันทันตสาธารณสุขแห่งชาติ โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ ม.อ. ให้บริการทางทันตกรรมแก่ประชาชนทั่วไป สำหรับผู้สนใจสามารถรับคิว เพื่อเข้ารับการรักษาได้ที่ โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ ม.อ. ตั้งแต่เวลา 06.00 - 14.00 น. จนกว่าคิวจะเต็ม งานที่ให้บริการ : อุดฟัน / ขูดหินปูน ถอนฟัน / ผ่าฟันคุด ( รับจำนวน 60 คนเท่านั้น ) ทันตกรรมสำหรับเด็ก
หมายเหตุ
- ผู้เข้ารับบริการต้องนำบัตรประชาชนมาแสดง
- เด็กอายุต่ำกว่า 12 ปี ต้องมีผู้ปกครองมาด้วย
- กรณีผ่าฟันคุด อายุต่ำกว่า 20 ปี ต้องมีใบยินยอมและมีผู้ปกครองมาด้วยเท่านั้น
และในวันนี้กองทุนเฉลิมพระเกียรติ ๑oo ปี สมเด็จย่าฯ คณะทันตแพทยศาสตร์ ม.อ. ได้จัดกิจกรรมเปิดกระปุก " โครงการวันละเหรียญ ... เพื่อผู้ป่วยปากแหว่งเพดานโหว่ ครั้งที่ 13 "
เปิดพิธี ณ ลานชั้น 7 อาคาร 3 คณะทันตแพทยศาสตร์ ม.อ. ตั้งแต่เวลา 08:30 - 09:30 น.
- ลงทะเบียนรับคืนกระปุกเงินออม ณ ลานชั้น 1 อาคาร 3 คณะทันตแพทยศาสตร์
- สำหรับผู้ที่สนใจสอบถามรายละเอียดวันทำฟันฟรี ได้ที่ 074-28-7620
- สำหรับผู้ที่สนใจกิจกรรมเปิดกระปุกออมเงิน สอบถามรายละเอียดได้ที่ 074-28-7511
โรงพยาบาลพุทธโสธร ทำฟันฟรี 20 ตุลาคม 2566
เนื่องในโอกาสวันทันตสาธารณสุข โรงพยาบาลพุทธโสธร เชิญประชาชนทั่วไปเข้ารับบริการทันตกรรม ฟรี ขูดหินปูน อุดฟัน ถอนฟัน วันที่ 20 ตุลาคม 2566 เวลา 9.00-14.00 น. กลุ่มงานทันตกรรม อาคารอุบัติเหตุชั้น 6 โทร. 038-814375 038-814376 038-814377 038-814378 วันเวลาราชการ
โรงพยาบาลกลาง ทำฟันฟรี 20 ตุลาคม 2566
โรงพยาบาลกลาง สำนักการแพทย์ กรุงเทพมหานคร ขอเชิญชวนผู้สนใจ เข้ารับบริการทางทันตกรรม (ไม่มีค่าใช้จ่าย) ????ขูดหินน้ำลาย????อุดฟัน ????ถอนฟัน ตามโครงการ “คนไทยฟันดี สดุดีสมเด็จย่า” วันทันตสาธารณสุขแห่งชาติ เพื่อถวายเป็นพระราชกุศล เนื่องในวันคล้ายวันพระราชสมภพ สมเด็จพระศรีนครินทราบรมราชชนนี วันที่ 20 ตุลาคม 2566 ไม่รับจองคิวล่วงหน้ารับจำนวน 100 ราย ติดต่อสอบถาม โทร. 02-220-8000 ต่อ 10340
“เรามองว่าการดูดาวเป็นเพียงปลายทางเท่านั้น แต่ต้นทางที่เป็นจุดประสงค์สำคัญคือการพัฒนาคนผ่านการกระจายโอกาสทางการเรียนรู้ด้านดาราศาสตร์ให้เด็กๆ ทั่วประเทศ” นายเฉลิมชนม์ วรรณทอง ผู้อำนวยการหอดูดาวเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา สงขลา ย้ำถึงเป้าหมายหลักที่มุ่งสร้างแรงบันดาลใจและต่อยอดองค์ความรู้ด้านดาราศาสตร์ให้เข้าถึงเยาวชนหลากหลายพื้นที่ “ตลอด 4 ปี ที่เปิดให้บริการมา หอดูดาวฯ สงขลามีผู้คนแวะเวียนมาใช้บริการรวมกว่า 7 แสนคน เรามุ่งกระจายโอกาสการเรียนรู้ด้านดาราศาสตร์สู่ภูมิภาคต่าง ๆ โดยเฉพาะส่วนของภาคใต้ อย่างไรก็ตาม ในส่วนของการเปิดให้เข้าชมอาจกระจายโอกาสไม่ทั่วถึง ดังนั้นเราจึงทำงานร่วมกับภาคีเครือข่ายและชุมชนทั่ว 14 จังหวัดในภาคใต้ เพื่อออกให้บริการนอกพื้นที่และเปิดโอกาสให้ทุกคนได้มีโอกาสเข้าถึงดาราศาสตร์มากที่สุด ผ่านการเรียนรู้ด้านดาราศาสตร์ที่จับต้องได้จริง เห็นจริงด้วยตาตัวเอง รวมถึงให้เด็กทุกคนในโรงเรียนได้เข้าถึงประสบการณ์อย่างทัดเทียมกันโดยไม่มีใครถูกทิ้งไว้ข้างหลัง”
คลินิคฝากครรภ์
คลินิคฝากครรภ์ ศบส. 39 เปิดให้บริการ วันจันทร์ เวลา 13.00-16.00 น. โทร. 02-427-7949ทันตกรรม
ทันตกรรม
- คลินิกทันตกรรมทั่วไป(ตรวจสุขภาพฟัน/อุดฟัน/ขูดหินปูน/ถอนฟัน) ในเวลาราชการ 08.00 น. - 16.00 น. (เช้า) นอกเวลาราชการ เวลา 16.00 น. - 20.00 น. (บ่าย)
- ศัลยศาสตร์ช่องปากและแม็กซิลโลเฟเชียล ในเวลาราชการ 08.00 น. - 16.00 น.
- ศัลยกรรมช่องปาก(การผ่าตัดในช่องปาก) ในเวลาราชการ 08.00 น. - 16.00 น.
- ทันตกรรมผู้สูงอายุ ในเวลาราชการ 08.00 น. - 16.00 น.
- ทันตกรรมประดิษฐ์(การใส่ฟันปลอม) ในเวลาราชการ 08.00 น. - 16.00 น.
- ปริทันตวิทยา(การรักษาโรคเหงือก/โรคปริทันต์) ในเวลาราชการ 08.00 น. - 16.00 น.
- วิทยาเอ็นโดดอนต์(การรักษาคลองรากฟัน) ในเวลาราชการ 08.00 น. - 16.00 น.
- ทันตกรรมจัดฟัน ในเวลาราชการ 08.00 น. - 16.00 น.
- ทันตกรรมสำหรับเด็ก ในเวลาราชการ 08.00 น. - 16.00 น.
คาถาบูชาพระราหู ลาของไหว้
ทางด้าน มร. ปีเตอร์ สไตรเบิล กรรมการผู้จัดการ บริษัท ทาเคดา (ประเทศไทย) จำกัด กล่าวว่า “ทาเคดามุ่งมั่นในการมอบสุขภาพที่ดีกว่าและอนาคตที่สดใสให้กับผู้คนทั่วโลก ผ่านนวัตกรรมการดูแลสุขภาพเพื่อยกระดับคุณภาพชีวิตของผู้ป่วย เราตระหนักดีว่าไข้เลือดออกเป็นหนึ่งในปัญหาด้านสาธารณสุขของประเทศไทย ที่มีคนจำนวนกว่า 390 ล้านคนทั่วโลกที่ได้รับผลกระทบจากโรคนี้ โดยจำนวนผู้ป่วยกว่า 96 ล้านคนมีอาการป่วยอย่างรุนแรง** เรามีความภาคภูมิใจที่ได้เป็นส่วนหนึ่งในการส่งเสริมการสร้างความตระหนักรู้เรื่องไข้เลือดออกที่เป็นประโยชน์แก่ชุมชน ทั้งการพัฒนาและต่อยอดระบบการป้องกันเพื่อควบคุมการระบาด การทำงานอย่างใกล้ชิดกับชุมชน และการส่งเสริมการสร้างภูมิคุ้มกันของโรคไข้เลือดออก ขอขอบคุณพันธมิตรความร่วมมือ Dengue-zero และทุกภาคส่วนที่ร่วมกันแสดงถึงพลังแห่งความมุ่งมั่นในการต่อสู้กับโรคไข้เลือดออกและบรรลุเป้าหมายในการให้ไข้เลือดออกในไทยเป็นศูนย์ไปด้วยกัน”
ทั้งนี้กว่าร้อยละ 80 ของผู้ที่มีภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ จะไม่แสดงอาการใดๆ หรือมีอาการที่ไม่ชัดเจน บางรายที่มีภาวะอุดตันที่ขา (Deep Vein Thrombosis หรือ DVT) อาจมีอาการปวดขา ขาบวม ผิวหนังที่ขาเปลี่ยนสีไปจากเดิม ส่วนรายที่เกิดขึ้นในปอด (PE) อาจมีอาการใจสั่น เจ็บหน้าอก หัวใจเต้นเร็ว หน้ามืด หมดสติ ไอเป็นเลือด เป็นต้น ฉะนั้นการรณรงค์สร้างความตระหนักรู้ให้กับสังคมในวงกว้าง จึงช่วยให้ประชาชนเกิดการรับรู้อย่างเข้าใจและปรับพฤติกรรมเพื่อลดความเสี่ยง หรือหากอยู่ในกลุ่มเสี่ยงก็สามารถให้ข้อมูลและขอคำแนะนำจากแพทย์เพื่อหาแนวทางป้องกันหรือรักษาได้อย่างทันท่วงที
อุทยานแห่งชาติขุนแจ - เปิดดอยลังกา และดอยมด พย 2566
อุทยานแห่งชาติขุนแจ เป็นชื่อเรียกตามชื่อของน้ำตกขุนแจ ภายในอุทยานแห่งชาติ มีทรัพยากรธรรมชาติมากมายไม่ว่าจะเป็นป่าไม้ สัตว์ป่า น้ำตกและทิวทัศน์ที่งดงาม สถานที่ท่องเที่ยวสำคัญของ อุทยานแห่งชาติขุนแจ ได้แก่ ดอยลังกา ดอยมด ดอยผาโง้ม น้ำตกขุนแจ
น้ำตกแม่โถ อ่างเก็บน้ำแม่ฉางข้าว
ล่าสุดปลายเดือนกันยายน 2566
อุทยานแห่งชาติขุนแจประกาศความพร้อมในการเตรียมเปิดการเดินทางเข้าเที่ยวชม ดอยลังกา และดอยมดแล้ว โดยที่จะเปิดให้ขึ้นตั้งแต่ 1 พ.ย. 2566 ไปจนถึง 28 ก.พ. 2567 จำกัดจำนวนนักท่องเที่ยว 70 คน /ช่วงสัปดาห์ สำหรับการจองขึ้นดอย (ตั้งแต่วันที่ 9 ต.ค. เป็นต้นไป) เปิดให้จองที่ โทร. 084-3665213, 053-727369 เท่านั้น สำหรับข้อสงสัยทุกข้อ สอบถามได้ที่ 084-3665213, 053-727369
อุทยานแห่งชาติขุนแจ
ต.แม่เจดีย์ใหม่ อ.เวียงป่าเป้า จ.เชียงราย 57260
โทรศัพท์ 084-366-5213 053-727369
รศ. นพ. วาสนภ วชิรมน แพทย์เฉพาะทางผิวหนัง
ด้าน รศ. นพ. วาสนภ วชิรมน แพทย์เฉพาะทางผิวหนัง และ อาจารย์ประจำสาขาวิชาโรคผิวหนัง คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี ม. มหิดล กล่าวว่า “งานวิจัยมีส่วนสำคัญอย่างมากในการผลิตนวัตกรรมที่ปลอดภัยต่อผู้ใช้งาน และต้องผสานกับผู้ให้บริการเสริมความงามที่ต้องยึดถือจรรยาบรรณวิชาชีพ และผู้รับบริการจะต้องรู้จักเลือกใช้ผลิตภัณฑ์ที่ปลอดภัยต่อร่างกายและมีผลกระทบน้อยที่สุด ทั้งนี้ คนไข้ควรปรึกษาแพทย์ผิวหนังผู้เชี่ยวชาญก่อนตัดสินใจเข้ารับทำหัตถการทุกครั้ง เนื่องจากผลิตภัณฑ์แต่ละชนิดมีวัตถุประสงค์ในการใช้ที่แตกต่างกัน และควรเป็นผลิตภัณฑ์ที่ใช้ควรได้รับการรับรองมาตรฐานในประเทศและระดับสากล”

ทั้งนี้การเจาะและใช้อุปกรณ์ร่วมกันภายในรูเดียว หรือแบบ Full Endo TLIF (Full Endoscopic TLIF) ซึ่งวิธีนี้จะใช้อุปกรณ์กล้องที่มีความพิเศษสูง โดยมีช่องสำหรับใส่เครื่องมือเพื่อเข้าไปทำการรักษา โดยการนำหมอนรองกระดูกที่มีปัญหาออก และยังสามารถเปลี่ยนหมอนรองกระดูกเทียมได้ภายในรูเดียว โดยที่เครื่องมือนั้นไม่เข้าไปทำลายกล้ามเนื้อโดยตรง บอบช้ำน้อยกว่าการใช้อุปกรณ์แบบ 2 รู และการรักษาด้วยวิธีนี้ ศัลยแพทย์สามารถมองเห็นเครื่องมือในการรักษาตลอดเวลา และใช้เวลาในการรักษาประมาณ 2 ชั่วโมง หลังทำการรักษาผู้ป่วยฟื้นตัวได้เร็ว แผลผ่าตัดมีขนาดเล็ก และภายใน 1 สัปดาห์ ผู้ป่วยสามารถเดินได้คล่องขึ้น ซึ่งการรักษาด้วยเทคนิค Full Endo TLIF (Full Endoscopic TLIF) นี้โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ถือเป็นรายแรกในประเทศไทย ที่ใช้เทคนิคนี้แบบเต็มรูปแบบ เพราะเนื่องจากจำเป็นต้องตัดโครงสร้างภายใน โอกาสที่แพทย์จะทำได้จะต้องเป็นแพทย์ที่มีความเชี่ยวชาญและมีประสบการณ์ที่สูงในเรื่องโรคกระดูกสันหลัง ซึ่งหาได้น้อยมาก แต่สำหรับที่โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ซึ่งเป็นโรงพยาบาลเฉพาะทางด้านกระดูกสันหลังแห่งแรกและแห่งเดียวในประเทศไทย ที่มีจุดแข็งที่โดดเด่นและเด่นชัด คือ มีทีมแพทย์ และพยาบาลเฉพาะทาง โรคปวดหลังที่เกิดจากกระดูกสันหลังและระบบประสาทโดยเฉพาะ ทำให้รู้ลึก รู้จริงและเชี่ยวชาญ สามารถรักษาได้อย่างตรงจุด ประกอบกับการนำเอานวัตกรรมสมัยใหม่จากทั่วโลกเข้ามาช่วยในการรักษา เพื่อตอบโจทย์ผู้ป่วยที่มีเวลาน้อย การฟื้นตัวทำได้เร็วขึ้น ไม่ทรมาน เหมาะสำหรับผู้ป่วยที่กลัวการผ่าต
โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ปรึกษา โทร.02-0340808
“ในการเปิดตัว โครงการทุนสถาบันราชสุดา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี ครั้งนี้ มูลนิธิรามาธิบดีฯ ได้ร่วมมือกับบริษัท ซีเนริโอ จำกัด ซึ่งเล็งเห็นความสำคัญของการ “ให้” โอกาสทางการศึกษาแก่คนพิการในสังคมไทยจัดรอบการแสดงละครเวทีการกุศล “แฟนฉัน เดอะมิวสิคัล” ขึ้นในวันเสาร์ที่ 11 พฤศจิกายน 2566 เวลา 19:30 น. โดยรายได้จากการจำหน่ายบัตรของรอบนี้จะถูกสมทบทุนให้แก่โครงการทุนสถาบันราชสุดา เพื่อช่วยพัฒนาคุณภาพชีวิตของคนพิการต่อไป อีกทั้งยังได้เชิญชวนตัวแทนนักศึกษาของสถาบันราชสุดามาร่วมชมการแสดงในรอบนี้อีกด้วย” นางสาวพรรณสิรี กล่าวทิ้งท้าย
ปฏิทินท่องเที่ยวจังหวัดเชียงราย เดือนธันวาคม 2566
1 ธันวาคม 66 - 28 มกราคม 67
งานสีสันดอยตุง ครั้งที่ 10
(ทุกวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
โครงการพัฒนาดอบดุงฯ อ.แม่ฟ้าหลวง โทร. 053-767015-7
3, 12 ธันวาคม 66
SUNDAY CRAFT MARKET
บ้านหนองหม้อ CREATIVE VILLAGE อ.เมือง
โทร. 063-6616155
6 - 11 ธันวาคม 66
งานมหัศจรรย์ 10 ชาติพันธ์แม่สาย ครั้งที่ 9
ศูนย์วิจัยและพัฒนาผลิตภัณฑ์เมล็ดคามิเลียและน้ำมันพืชอื่น
ในมูลนีธิชัยพัฒนา อ.แม่สาย เทศบาลตำบลแม่ลาย โทร. 053-731288
9 ธันวาคม 66 - 30 เมษายน 67
มหกรรมศิลปะร่วมสมัยนานาชาติ
THAILAND BIENNALE, CHIANG RAI 2023
วัฒนธรรมจังหวัดเชียงราย โทร. 053-150169
17 ธันวาคม 66
การแข่งขันวิ่ง ะดรีนาลีน ซับวัน เชียงราย ครั้งที่ 1
ลานวัฒนธรรม ศาลากดางหลังเก่า อ.เมือง
บ.ทีละก้าว โทร. 089-7491949
17 ธันวาคม 66 - 2 มกราคม 67
มหกรรมไม้ดอกอาเซียนเชียงราย กระจายการจัดงานไปอีก 4 อำเภอ อ.แม่จัน อ.ดอยหลวง อ.พญาเม็งราย อ.ป่าแดด
สวนไม้งามริมน้ำกก ศูนย์ราชการฝั่งหมื่น อบจ.เชียงราย อ.เมือง โทร. 053-175333
26 ธันวาคม 66
ตักบาตรเป็งปุ๊ด
จุดเริ่มต้นวัดมั่งเมือง อ.เมือง เทศบาลนครเชียงราย โทร. 053-715952
28 ธันวาคม 66 - 15 มกราคม 67
งานเชียงรายดอกไม้งาม ครั้งที่ 20
สวนตุงและโคมนครเชียงราย อ.เมือง โทร. 053-715952
27 ธันวาคม 66 - 2 มกราคม 67
เทศกาลชิมชา วัฒนธรรมชนเผ่า และของดี ดอยแม่สลอง ครั้งที่ 26
พิพิธภัณฑ์วรชนอดีตทหารจีนคณะชาติ อ.แม่ฟ้าหลวง อบต.แม่สลองนอก โทร. 053-765129
เทศกาลสีบสานวัฒนธรรมประเพณีปีใหม่ม้ง
ประมาณกลางเดือนธันวาคม 66 (รอยืนยัน)
สนามกีฬาบ้านมงเก้าหลัง อ.แม่ฟ้าหลวง อบต. เทอดไทย โทร. 053-730205
29 ธันวาคม 66
ตักบาตรดอกไม้
สวนตุงและโคมนครเชียงราย อ.เมือง โทร. 053-715952
30 ธันวาคม 66
MUSIC IN THE PARK ดนตรีในสวน (มีทกวันเสาร์)
สวนตุงและโคมนครเชียงราย อ.เมือง โทร. 053-715952
30 - 31 ธันวาคม 66
COUNTDOWN
สิงห์ปาร์ค เชียงราย โทร. 053-160636
31 ธันวาคม 66
ส่งท้ายปีเก่าต้อนรับปีใหม่ 256
(COUNTDOWN 2024)
หอนาฬิกาเฉลิมพระเกียรติ เชียงราย อ.เมือง โทร. 053-715952
1 มกราคม 67
พิธีอัญเชิญพระพทธรูปเวดเวียงเจียงฮายและทำบุญตักบาตรวันขึ้นปีใหม่
ถนนธนาลัย อ.เมือง เทศนาลนครเชียงราย โทร. 053-715952
โซน Pet Park สวนรถไฟ
สวนวชิรเบญจทัศ (สวนรถไฟ) มีโซน Pet Park อยู่ตรงบริเวณริมบึงด้านทิศตะวันออก ฝั่งด้านในตรงข้ามสนามไดรฟ์กอล์ฟ แฟลตรถไฟ โดยโซนนี้เปิดให้บริการมาตั้งแต่ 6 มีนาคม 2566 เปิดทุกวัน เวลา 05.00-21.00 น.
ผู้ที่นำสัตว์เลี้ยงเข้ามาใช้บริการ ต้องปฏิบัติตามข้อกำหนด ดังนี้ 1.เจ้าของสัตว์เลี้ยงจะต้องรับผิดชอบผลจากการกระทำหรือพฤติกรรมของสัตว์เลี้ยงตนเอง ในทุกกรณี 2.สัตว์เลี้ยงต้องได้รับใบอนุญาตและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าตามระยะที่กำหนด 3.เจ้าของสัตว์เลี้ยงต้องอยู่ดูแลสัตว์เลี้ยงของตนเองด้วยสายจูงหรืออยู่ภายในรถเข็นเท่านั้น 4.ให้นำสัตว์เลี้ยงขับถ่าย เก็บ และพับถุงก่อนทิ้ง ในพื้นที่ที่ทางสวนได้จัดเตรียมให้ไว้ 5.ห้ามสัตว์เลี้ยงลงเล่นน้ำในบริเวณสวนโดยเด็ดขาด6.ห้ามทำให้สัตว์เลี้ยงของผู้อื่นตกใจ 7.ห้ามไม่ให้สัตว์เลี้ยงทำร้ายผู้ใช้บริการ/สัตว์เลี้ยงของผู้อื่น และสิ่งมีชีวิตภายในสวน
ข้อห้าม ประกอบด้วย 1.ห้ามนำอาหาร/ขนมของคนและสัตว์เลี้ยงเข้ามาในพื้นที่ Pet park2.ห้ามภาชนะจากแก้วทุกชนิด 3.สัตว์เลี้ยงที่ป่วย 4.สัตว์เลี้ยงที่ก้าวร้าว 5.สัตวเลี้ยงที่อยู่ในช่วงผสมพันธุ์ และ 6.สัตว์เลี้ยง อายุต่ำกว่า 4 เดือน
เที่ยวบินกลับไทย
รายงานจากสถานเอกอัครราชทูตไทย ณ กรุง เทลอาวีฟ
Royal Thai Embassy, Tel Aviv
17 ต.ค. 2566 เที่ยวบินของสายการบิน El Al Israel Airlines ออกจากกรุงเทลอาวีฟในวันที่ 17 ตุลาคม 2566 เวลา 06.20 น. และถึงท่าอากาศยานสุวรรณภูมิในวันที่ 17 ตุลาคม 2566 เวลา 19.05 น. จำนวนเดินทางกลับ 200 คน
17 ต.ค.2566 เที่ยว 11 โมงเช้า โดยสายการบินไทย (TG) ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 17 ต.ค. 2566 เวลา 11.00 น. ถึงท่าอากาศยานสุวรรณภูมิวันที่ 18 ต.ค. 66 เวลา 03.30 น. จำนวนเดินทางกลับ 280 คน
18 ต.ค. 2566 โดยเที่ยวบินพิเศษของกองทัพอากาศไทย ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 18 ต.ค. 2566 เวลา 22.00 น. ถึงท่าอากาศยานดอนเมือง (บน.6) วันที่ 19 ต.ค. 66 เวลา 13.40 น. จำนวนเดินทางกลับ 145 คน
19 ต.ค. 2566 โดยเที่ยวบินพิเศษของสายการบินไทย ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 19 ต.ค. 2566 เวลา 11.00 น. ถึงท่าอากาศยานสุวรรณภูมิ วันที่ 20 ต.ค. 66 เวลา 03.30 น. จำนวนเดินทางกลับ 280 คน
20 ต.ค. 2566 โดยเที่ยวบินของสายการบิน Spice Jet ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 20 ต.ค. 2566 เวลา 20.15 น. ถึงท่าอากาศยานสุวรรณภูมิ วันที่ 21 ต.ค. 66 เวลา 13.10 น. จำนวนเดินทางกลับ 320 คน
20 ต.ค. 2566 โดยเที่ยวบินของสายการบิน Arkia ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 20 ต.ค. 2566 เวลา 23.00 น. ถึงท่าอากาศยานสุวรรณภูมิ วันที่ 21 ต.ค. 2566 เวลา 14.05 น. จำนวนเดินทางกลับ 214 คน
21 ต.ค. 2566 โดยเที่ยวบินพิเศษของกองทัพอากาศ ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 21 ต.ค. 66 เวลา 22.00 น. ถึงท่าอากาศยานดอนเมือง (บน.6) วันที่ 22 ต.ค. 2566 เวลา 13.40 น. จำนวนเดินทางกลับ 140 คน
23 ต.ค. 2566 โดยเที่ยวบินเช่าเหมาลำของสายการบิน Spice Jet ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 23 ต.ค. 2566 เวลา 05.15 น. เปลี่ยนเครื่อง ที่ดูไบ ด้วยสายการบินไทย ถึงท่าอากาศยานสุวรรณภูมิ วันที่ 23 ต.ค. 66 เวลา 16.10 น. จำนวนเดินทางกลับ 280 คน
23 ต.ค. 2566 โดยเที่ยวบินเช่าเหมาลำของสายการบิน El Al ออกเดินทางจากกรุงเทลอาวีฟ วันที่ 23 ต.ค. 2566 เวลา 10.00 น. ถึงท่าอากาศยานสุวรรณภูมิ วันที่ 23 ต.ค.2566 เวลา 22.50 น. จำนวนเดินทางกลับ 235 คน
26 ตุลาคม 2566 เวลา 08.30 น. สายการบิน Spice Jet ออกเดินทางจากท่าอากาศยานเบนกูเรียน ผ่านสหรัฐอาหรับเอมิเรตส์ จำนวนเดินทางกลับ 280 คน
26 ตุลาคม 2566 เวลา 20.00 น. เที่ยวบินสายการบิน EL AL เที่ยวบินที่ LY083 ออกเดินทางจากท่าอากาศยานเบนกูเรียน ถึงสนามบินสุวรรณภูมิ 27 ต.ค. 2566 เวลา 08.50 น. จำนวนเดินทางกลับ 268 คน
27 ตุลาคม 2566 เวลา 00.35 น. เที่ยวบินสายการบิน EL AL เที่ยวบินที่ LY085 ออกเดินทางจากท่าอากาศยานเบนกูเรียน ถึงสนามบินสุวรรณภูมิ 27 ต.ค. 2566 เวลา 13.20 น. จำนวนเดินทางกลับ 235 คน
28 ตุลาคม 2566 เวลา 08.30 น. สายการบิน Spice Jet ออกเดินทางจากท่าอากาศยานเบนกูเรียน จำนวนเดินทางกลับรวม 320 คน แวะเปลี่ยนเครื่อง 2 เที่ยวบิน เข้าไทย 1) NOK Air จำนวน 180 คน 2) Air Asia 140 คน
29 ตุลาคม 2566 เที่ยวบินพิเศษกองทัพอากาศ ออกจากเทลอาวีฟ เวลา 08.30 น. ถึงสนามบินดอนเมือง วันที่ 30 ต.ค. 2566 เวลา 00.50 น. จำนวนเดินทางกลับ 140 คน
29 ตุลาคม 2566 เวลา 08.30 น. สายการบิน Spice Jet ออกเดินทางจากท่าอากาศยานเบนกูเรียน ต่อเดินทางกลับไทย โดย Lion Air ถึงสนามบินดอนเมือง วันที่ 30 ต.ค. 2566 เวลา 08.40 น. จำนวนเดินทางกลับ 180 คน
31 ตุลาคม 2566 เวลา 06.20 น. สายการบิน El Al ออกเดินทางจากท่าอากาศยานเบนกูเรียน จำนวนเดินทางกลับ 70 คน
31 ตุลาคม 2566 เวลา 07.45 น. สายการบิน Spice Jet ออกเดินทางจากท่าอากาศยานเบนกูเรียน จำนวนเดินทางกลับ 279 คน
1 พฤศจิกายน 2566 เวลา 02.30 น. สายการบิน El Al ออกเดินทางจากท่าอากาศยานเบนกูเรียน ถึงท่าอากาศยานสุวรรณภูมิ เวลา 19.10 น. จำนวนเดินทางกลับ 182 คน
The Reporter รายงานว่า 1 พ.ย.66 สถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ เตรียมเที่ยวบินอพยพเพิ่มเติม ในวันที่ 2 และ 3 พฤศจิกายน 2566 และขอให้รีบมาถึงศูนย์พักพิง โรงแรมอินเตอร์คอนติเนนตัล เทลอาวีฟ โอกาสสุดท้ายที่จะลงทะเบียน ภายในเวลา 18.00 น. ของวันที่ 2 พฤศจิกายน 2566 เพื่อดำเนินการเรื่องเอกสารการเดินทาง
ป้ายเน้นย้ำกันเป็นระยะภายในสวนเกี่ยวกับการเก็บมูลสุนัขและทำความสะอาดทันที
ป้ายแบบน่ารักๆ ใต้ร่มไม้ เน้นย้ำการเก็บมูลสุนัขและทำความสะอาดทันที
คุณยาสึฮิโระ ฮิคิอามิ จากร้าน “ฮิคิอามิ โค เกทสึโด” จังหวัดโทยามะ
คุณยาสึฮิโระ ฮิคิอามิ จากร้าน “ฮิคิอามิ โค เกทสึโด” จังหวัดโทยามะ ร้านขนมญี่ปุ่นชื่อดังที่เริ่มต้นในฟุชิกิมินาโตมาจิ เมืองทาคาโอกะ จังหวัดโทยามะ ทำขนมแบบสดๆ ตามที่ลูกค้ารีเควส โดยเทคนิคทำขนมที่ยอดเยี่ยม ได้รับเลือกให้เป็น ขนมญี่ปุ่นชั้นเยี่ยมอันดับ 1 ของจังหวัดโทยามะ ครั้งหนึ่งเขาเคยทำขนมญี่ปุ่นสำหรับเป็นภาพปกซีดีของ Tokyo Jihen วงดนตรีชื่อดังของญี่ปุ่น
วิธีการตรวจสอบเบอร์แปลก ของแต่ละเครือข่ายมือถือ
ตรวจสอบเบอร์แปลก แต่ละเครือข่ายมือถือ เครือข่ายมือถือแต่ละแห่ง มีการรองรับหากลูกค้าได้รับการติดต่อจากเบอร์โทรแปลก หรือมิจฉาชีพโทรมาก่อกวน ผ่านหมายเลขโทรศัพท์ Call Center ดังนี้
- เช็กเบอร์ AIS : กด *727* เบอร์โทรศัพท์# กดโทรออก
- เช็กเบอร์ DTAC : กด *102*เบอร์โทรศัพท์# กดโทรออก
- เช็กเบอร์ TRUE : กด *933*เบอร์โทรศัพท์# กดโทรออก
- เช็กเบอร์ TOT : กด *153*เบอร์โทรศัพท์# กดโทรออก
ขณะที่ นายเอ็นริโก้ คานัล บรูแลนด์ (Enrico Cañal Bruland) รองประธานกรรมการและผู้จัดการทั่วไป บริษัท โนโว นอร์ดิสค์ ฟาร์มา (ประเทศไทย) จำกัด กล่าวในปาฐกถา ‘การเดินทางของเดนมาร์กสู่สุขภาพยั่งยืนในรอบหนึ่ง ศตวรรษ’ ว่าบริษัทฯ ได้เน้นย้ำพันธกิจในการขับเคลื่อนการเปลี่ยนแปลงเพื่อสร้างโลกที่ผู้คนมีสุขภาพดีในปัจจุบันและอนาคตของคนรุ่นต่อไปเพื่อเอาชนะโรคเบาหวาน โรคอ้วนและโรคเรื้อรังร้ายแรงอื่นๆ โดยเราเป็นผู้บุกเบิกนวัตกรรมทางวิทยาศาสตร์ ขยายโอกาสในการเข้าถึงยารักษาโรค และมุ่งมั่นทำงานเพื่อป้องกันและรักษาโรคตั้งแต่ค.ศ. 1923 (พ.ศ. 2466) เป็นต้นมา
โครงการฯ ดังกล่าว มีระยะเวลา 3 ปี ตั้งแต่ปี 2565 – 2568 และได้มีการกำหนดค่าเป้าหมายร่วมกันใน 3 ด้าน ได้แก่
(1) มีจำนวนผู้ได้รับการตรวจคัดกรองทั้งหมด 53,000 คน ครอบคลุมพื้นที่ 21 จังหวัด
(2) มีจำนวนบุคลากรทางการแพทย์และผู้เกี่ยวข้องในการดูแลรักษาผู้ป่วยทั้งหมด 7,000 คน และ
(3) มีจำนวนผู้ป่วยที่เป็นเบาหวานและอยู่ในการควบคุมดูแลระดับน้ำตาลอย่างเข้มข้นจำนวน 7,000 คน
โดยจากการดำเนินโครงการในปีแรก พบว่ายังจำเป็นต้องมีการสร้างความตระหนักในเรื่องการตรวจคัดกรอง และเสนอให้มีการจัดการข้อมูลเพื่อใช้ในการติดตามและตรวจสอบ เพื่อลดความซ้ำซ้อนของหน่วยงานที่เกี่ยวข้อง ตลอดจนเพิ่มงบประมาณในการสนับสนุนจำนวนอาสาสมัครที่เป็นผู้ตรวจคัดกรองในพื้นที่
23 พิพิธภัณฑ์ปริมณฑล/ตจว.
23 พิพิธภัณฑ์ปริมณฑล/ตจว.
26. ศูนย์การเรียนรู้ กพผ. สำนักงานกลาง (23-24 ธ.ค.)
27. อนุสรณ์สถานแห่งชาติ (15-17 ธ.ค.)
28. พิพิธภัณฑ์วิทยาศาสตร์ อพวช. (22-24 ธ.ค.)
29. พิพิธภัณฑ์พระรามเก้า อพวช. (22-24 ธ.ค.)
30. พิพิธภัณฑ์เกษตรเฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว (22-24 ธ.ค.)
31. อุทยานพระบรมราชานุสรณ์พระบาทสมเด็จพระพุทธเลิศหล้านภาลัย (22-24 ธ.ค.)
32. หอดูดาวเฉลิมพระเกียรติฯ ฉะเชิงเทรา (23-24 ธ.ค.)
33. หอดูดาวเฉลิมพระเกียรติฯ นครราชสีมา (23-24 ธ.ค.)
34. พิพิธภัณฑ์ วิลล่า มูเซ่ เขาใหญ่ (13-17 ธ.ค. / 20-24 ธ.ค.)
35. พิพิธภัณฑ์ไม้กลายเป็นหิน ช้างตึกดำบรรพ์ ไดโนเสาร์ (22-24 ธ.ค.)
36. มิวเซียมติดล้อ ณ ตลาดรถไฟ หนองคาย (22-24 ธ.ค.)
37. พิพิธภัณฑ์ธรรมชาติวิทยา มหาวิทยาลัยขอนแก่น (22-24 ธ.ค.)
38. พิพิธภัณฑ์ธนารักษ์ จังหวัดขอนแก่น (22-24 ธ.ค.)
39. หอดูดาวเฉลิมพระเกียรติฯ ขอนแก่น (23-24 ธ.ค.)
40. พิพิธภัณฑสถานธรรมชาติวิทยาแห่งน่าน (23-24 ธ.ค.)
41. อุทยานดาราศาสตร์สิรินธร (23-24 ธ.ค.)
42. จัตุรัสวิทยาศาสตร์ อพวช. จ.เชียงใหม่ (23-24 ธ.ค.)
43. พิพิธภัณฑ์ธนารักษ์ จังหวัดเชียงใหม่ (22-24 ธ.ค.)
44. อุทยานหลวงราชพฤกษ์ (24 6.ค.- 2 ม.ค.)
45. ภูเก็ตไทยหัว (15-17 ธ.ค.)
46. มิวเซียมภูเก็ต (22-24 ธ.ค.)
47. หอดูดาวเฉลิมพระเกียรติฯ สงขลา (23-24 ธ.ค.)
48. พิพิธภัณฑ์มายากล หาดใหญ่ (15-24 ธ.ค.)
ใคร ๆ ก็ตรวจสอบการทรงตัวได้
เครื่องวิเคราะห์การทรงตัวไม่ได้เป็นอุปกรณ์ที่ใช้สำหรับกลุ่มผู้สูงอายุเท่านั้น แต่สามารถนำไปใช้ได้ตั้งแต่เด็กที่มีอายุ 4 ปีขึ้นไป (หรือมีน้ำหนัก 10 กิโลกรัมขึ้นไป) รวมถึงนักกีฬา ผู้ที่ชอบออกกำลังกาย ผู้ที่ต้องการพัฒนาบุคลิกภาพ ซึ่งประโยชน์ที่ได้รับจากเครื่องวิเคราะห์การทรงตัวจะแตกต่างกันไปตามแต่ละช่วงวัยและความต้องการของแต่ละคน
กลุ่มเด็กเล็ก ในช่วงวัยนี้ เด็กอาจจะมีปัญหาเรื่องการทรงตัว ยืนไม่มั่นคง เดินเซ หรือกล้ามเนื้อไม่แข็งแรง ซึ่งอาจจะทำให้ร่างกายของเด็กไม่สามารถพัฒนาการไปตามช่วงอายุที่เหมาะสมได้ เราสามารถนำเครื่องวิเคราะห์การทรงตัวไปใช้เพื่อดูการทรงตัวของเด็กว่ามีการพัฒนาตามวัยที่เหมาะสมหรือไม่ เพื่อที่จะได้นำไปปรับด้วยการฝึกการทรงตัวและท่าทางเพื่อพัฒนากำลังกล้ามเนื้อของเด็ก
นักกีฬาและคนออกกำลังกาย เครื่องวิเคราะห์การทรงตัวสามารถนำไปใช้เป็นส่วนหนึ่งของสปอร์ตคลับหรือฟิตเนส โดยวิเคราะห์ว่าแต่ละคนมีปัญหาด้านการทรงตัวอย่างไร แล้วใช้วิธีการฝึกฝนร่างกายและปรับพฤติกรรมตามคำแนะนำของผู้เชี่ยวชาญ
“นักกีฬาบางคนเวลายืนอาจจะเอนตัวไปด้านหนึ่งทางมากกว่า ก็สามารถวิเคราะห์แล้วฝึกฝนร่างกายเพื่อปรับการทรงตัว นอกจากนี้ตัวเครื่องยังสามารถชั่งน้ำหนัก วัดปริมาณไขมันและปริมาณน้ำในร่างกายได้เช่นเดียวกับเครื่องชั่งน้ำหนักที่มีในฟิตเนส แต่พิเศษมากกว่าตรงที่สามารถวัดค่าการทรงตัวได้ด้วยในเครื่องเดียวกัน”
ส่งเสริมบุคลิกภาพสำหรับสายอาชีพ เช่น แอร์โฮสเตส พิธีกร ผู้ประกาศข่าว
“ผู้ที่มีอาชีพดังกล่าวสามารถฝึกและพัฒนาบุคลิกภาพของตัวเองได้ โดยขึ้นไปยืนบนเครื่องแล้วซ้อมยืน ซ้อมพูด เพื่อดูการยืน หากยืนไม่ตรง ยืนเซ หรือยืนทิ้งน้ำหนักข้างใดข้างหนึ่งมากเกินไป ก็จะสามารถรู้ได้ว่าตัวเราเอนไปทางใดแล้วปรับร่างกายได้ ยิ่งใช้เครื่องนี้เป็นประจำ ก็จะทราบว่าต้องปรับพฤติกรรมอย่างไร และรู้ว่าสภาวะการยืนของตัวเราเป็นอย่างไร” อาจารย์ชัชนีกล่าวแนะ
กลุ่มผู้สูงอายุ เป็นกลุ่มที่มีความเสี่ยงที่จะเกิดอันตรายจากการล้มมากที่สุด ดังนั้น การใช้งานเครื่องมือนี้จะช่วยประเมินภาวะเสี่ยงล้ม เพื่อให้ผู้สูงวัยได้ปรับพฤติกรรม หรือระวังได้ถูกจุด เช่น ขาซ้ายมีปัญหา จะปรับท่า หรือสร้างกล้ามเนื้ออย่างไร ฯลฯ
อาจารย์ชัชนีกล่าวเสริมว่า “เครื่องวิเคราะห์การทรงตัวสามารถนำมาใช้ได้หลายวัตถุประสงค์ ตามความต้องการของคนในแต่ละช่วงวัย เมื่อใช้อย่างสม่ำเสมอ ประเมินการทรงตัวไปเรื่อย ๆ ก็จะทำให้เกิดการรู้ตัว (self-alert) ในชีวิตประจำวัน ว่าการทรงตัวของเราเป็นอย่างไร จะต้องปรับหรือรักษาอย่างไรเพื่อให้เราสามารถพัฒนาการทรงตัวไปตามที่เราต้องการ และต้องระวังส่วนใดบ้าง”
การแพทย์แผนไทยและการแพทย์ทางเลือก โรงพยาบาลกลาง
การแพทย์แผนไทยและการแพทย์ทางเลือก โรงพยาบาลกลาง
เปิดให้บริการ วันจันทร์ – วันศุกร์
หยุดวันเสาร์ วันอาทิตย์ และวันหยุดนักขัตฤกษ์
เปิดให้บริการในเวลาราชการ 08.00 - 16.00 น.
เปิดให้บริการนอกเวลาราชการ 16.00 - 20.00 น.
(นอกเวลาราชการ จะเป็นระบบนัดเท่านั้น)
เปิดให้บริการ ดังนี้
1. ตรวจวินิจฉัยโรคทางแพทย์แผนไทย / แพทย์แผนไทยประยุกต์/แพทย์แผนจีน
2. นวดหัตถบำบัด
3. ประคบสมุนไพร
4. นวดหัตถบำบัด + ประคบสมุนไพร
5. อบสมุนไพรทั่วร่างกาย
6. ดูแลมารคาหลังคลอด
7. คลินิกแพทย์แผนไทยใส่ใจเข่าเสื่อม
8. คลินิกสักยาน้ำมันสมุนไพร
9. ปรับกระดูก
10. บ่งต้อหนามหวานด้วยศาสตร์การแพทย์ทางเลือก
11. ศาสตร์การแพทย์แผนจีน
12. จ่ายยาสมุนไพรตามอาการ โดยแพทย์แผนไทย แพทย์แผนไทยประยุกต์ /แพทย์แผนจีน
13.จำหน่ายผลิตภัณฑ์ส่งเสริมสุขภาพ
ขั้นตอนการเข้ารับการรักษา
1. ยืนบัตรลงทะเบียนเข้ารับการรักษา ตรงเวชระเบียนทุกครั้ง
2. ชำระค่าบริการทางการแพทย์ ตามสิทธิ
3. ลงทะเบียนคัดกรอง แจ้งชื่อ – สกุล ก่อนเข้ารับการรักษา
4. พบแพทย์ ตรวจวินิจฉัย
5. เข้ารับการรักษา
6. ชำระค่ารักษา
สอบถามรายละเอียดเพิ่มเติม กลุ่มงานการแพทย์แผนไทยฯ
โทร 02-220-8000 ต่อ 22120 , 22121 หรือ 095-625-9882
โปรแกรมตรวจสุขภาพประจำปี อายุมากกว่า 50 ปี
โปรแกรมตรวจสุขภาพประจำปี อายุมากกว่า 50 ปี สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
อนึ่ง ผลิตภัณฑ์ต้องสงสัยว่าเป็นยาเสพติดประเภทสารระเหย (ป็อปเปอร์) หรือ เอมิลไนไตรท์ (Amyl nitrite) มีฤทธิ์ขยายหลอดเลือด ถูกนำไปใช้ประโยชน์ทางการแพทย์เพื่อบำบัดอาการกล้ามเนื้อหัวใจขาดเลือด และใช้รักษาอาการพิษจากไซยาไนด์ แต่ในปัจจุบันมีผู้นำไปใช้เพื่อกระตุ้นความรู้สึกทางเพศเพื่อลดความเจ็บปวดขณะมีเพศสัมพันธ์ทางทวารหนัก และอวัยวะเพศหญิง โดยพนักงานสอบสวน กก.4 บก.ปคบ. จะนำตัวอย่างผลิตภัณฑ์ที่ตรวจยึด ส่งตรวจ ณ กรมวิทยาศาสตร์การแพทย์ กระทรวงสาธารณสุข หากตรวจพบว่าเป็นสารระเหย ผู้จำหน่ายจะมีความผิดฐาน “จำหน่ายสารระเหยโดยไม่มีภาพ เครื่องหมาย หรือข้อความที่ผู้ผลิตหรือผู้นำเข้าสารระเหยต้องจัดให้มีภาชนะบรรจุหรือหีบห่อที่บรรจุฯ” ตาม พ.ร.บ. ให้ใช้ประมวลกฎหมายยาเสพติด พ.ศ.2564 ระวางโทษจำคุกไม่เกิน 2 ปี หรือปรับไม่เกิน 40,000 บาท หรือทั้งจำทั้งปรับ
26 พ.ย. 2566 คนไทยได้รับการปล่อยตัวเพิ่มอีก 4 คน
26 พฤศจิกายน 2566 กระทรวงการต่างประเทศรายงานว่า ได้รับแจ้งจากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ ว่ามีคนไทยชุดที่สองได้รับการปล่อยตัวอีก 4 ราย ขณะนี้ อยู่ระหว่างการนำตัวไปที่โรงพยาบาลที่ฝ่ายอิสราเอลจัดไว้เพื่อตรวจสุขภาพตามขั้นตอน โดยเจ้าหน้าที่สถานเอกอัครราชทูตฯ ได้ไปช่วยเหลืออำนวยความสะดวก และประสานการติดต่อกับครอบครัวที่โรงพยาบาลแล้ว
กระทรวงการต่างประเทศขอแสดงความยินดีอย่างยิ่งกับครอบครัวของพี่น้องคนไทยทั้ง ๔ รายที่ได้รับการปล่อยตัวในวันนี้ รวมถึงขอขอบคุณทุกฝ่ายที่เกี่ยวข้องที่ได้มีบทบาทสำคัญในการเจรจาให้มีการปล่อยตัวประกันในชุดที่ 2 นี้
อนึ่ง สถานเอกอัครราชทูตฯ แจ้งข้อมูลเพิ่มเติมด้วยว่าทางการอิสราเอลได้ยืนยันจำนวนคนไทยที่ถูกควบคุมตัว เพิ่มขึ้นอีก 2 ราย ทำให้ภายหลังการปล่อยตัวคนไทยชุดที่ 2 แล้ว คาดว่ายังมีคนไทยที่ถูกควบคุมตัวอีกจำนวน 18 ราย ซึ่งรัฐบาลไทยจะพยายามอย่างเต็มที่ในการช่วยเหลือพี่น้องคนไทยที่เหลือให้ได้รับการปล่อยตัวอย่างปลอดภัยโดยเร็วที่สุด
ทั้งนี้ โดยที่มีตัวประกันเริ่มทยอยได้รับการปล่อยตัว และมีโอกาสได้พูดคุยกับญาติพี่น้องในประเทศไทย กระทรวงการต่างประเทศ ขอความร่วมมือสื่อมวลชนที่อาจ สัมภาษณ์ญาติของตัวประกัน มิให้ซักถามหรือเผยแพร่ ข้อมูลระหว่างการถูกควบคุมตัว ซึ่งอาจมีความอ่อนไหว และส่งผลกระทบต่อสวัสดิภาพของตัวประกันที่ยังอยู่ในความควบคุมได้
ขณะนี้ กระทรวงการต่างประเทศอยู่ระหว่างการประสานกับ ฝ่ายอิสราเอลเกี่ยวกับกระบวนการที่เกี่ยวข้อง เพื่อจะนำพี่น้องคนไทยทั้ง 14 รายที่ได้รับการปล่อยตัวและผ่านกระบวนการเยียวยาเบื้องต้นในอิสราเอลแล้ว กลับสู่ประเทศไทยและครอบครัวโดยเร็วต่อไป
10. การจัดหา จัดสรร และการเบิก-จ่ายวัคซีน HPV
10.1 การจัดหาวัคซีน HPV
10.1.1. กลุ่มเป้าหมายตามสิทธิประโยชน์ ตั้งแต่ปี 2560 (หญิงไทย อายุ 11 – 17 ปี) สำนักงานหลักประกันสุขภาพแห่งชาติ(สปสช.) เป็นหน่วยงานหลักในจัดหาและจัดสรรวัคซีน HPV สำหรับกลุ่มเป้าหมายดังกล่าว ดังนี้
10.1.1.1 สปสช. ดำเนินการจัดหาและจัดสรรวัคซีน HPV เพื่อให้บริการวัคซีนนักเรียน
ป.5/2563, 2564 และ 2566 เป็นที่เรียบร้อยแล้ว และทยอยจัดส่งวัคซีนให้หน่วยบริการ ตามแนวทางที่สปสช. กำหนด
10.1.1.2 กรณีหน่วยบริการต้องการวัคซีนเพิ่มเติม ขอให้เบิกวัคซีนตามแนวทางที่ สปสช.กำหนด เป็นลำดับแรก ในกรณีที่ สปสช. ไม่สามารถจัดส่งวัคซีน HPV ตามนโยบายของกระทรวงสาธารณสุขได้ทันเวลาการดำเนินงาน เพื่อมิให้ประชาชนเสียประโยชน์ในการป้องกันตนเองจากโรคมะเร็งปากมดลูก ขอให้สำนักงานสาธารณสุขจังหวัดบริหารจัดการวัคซีน HPV ที่ได้รับการสนับสนุนจากกรมควบคุมโรค เพื่อให้บริการไปพลางก่อน
10.1.2 กลุ่มเป้าหมายนอกสิทธิประโยชน์ (หญิงไทยอายุ 18 - 20 ปี) เนื่องจากสำนักงาน
หลักประกันสุขภาพแห่งชาติ (สปสช.) ไม่สามารถจัดหาวัคซีนให้กลุ่มเป้าหมายนอกสิทธิประโยชน์กรมควบคุมโรค
จึงจำเป็นต้องจัดหาและจัดสรรวัคซีน HPV สำหรับกลุ่มเป้าหมายดังกล่าว โดยขอให้บริการวัคซีนในหญิงไทย
ชั้นมัธยมศึกษาปีที่ 6 หรือเทียบเท่า (อายุ 18 ปี) ที่อยู่ในระบบการศึกษา เป็นลำดับแรก
10.2 การจัดส่งวัคซีน HPV รอบเดือนตุลาคม 2566 ที่สนับสนุนโดยกรมควบคุมโรค
10.2.1 กรมควบคุมโรค จัดส่งวัคซีน HPV ชนิด 4 สายพันธุ์ชื่อทางการค้า คือ Gardasil® สำหรับกลุ่มเป้าหมาย ดังนี้
10.2.1.1 วัคซีนสำรองสำหรับบริหารจัดการ (Buffer stock) สำหรับกลุ่มเป้าหมาย
10.1.1.2 โดยจัดส่งวัคซีน HPV ตามข้อมูลการสำรวจความต้องการวัคซีนของสำนักงานสาธารณสุขจังหวัด
10.2.1.2 วัคซีนสำหรับหญิงไทยชั้นมัธยมศึกษาปีที่ 6 หรือเทียบเท่า (อายุ 18 ปี) ที่อยู่ใน
ระบบการศึกษา โดยจัดสรรตามสัดส่วนของประชากรรายจังหวัด
หมายเหตุ
1. ในกรณีที่พบกลุ่มเป้าหมายต่างชาติต้องการรับบริการวัคซีน HPV ขอให้เขตบริการ
สุขภาพ และสำนักงานสาธารณสุขจังหวัด พิจารณาบริหารจัดการวัคซีน HPV ที่ได้รับการสนับสนุนจากกรมควบคุมโรค ได้ตามบริบทของพื้นที่อย่างเหมาะสม
2. เขตสุขภาพและสำนักงานสาธารณสุขจังหวัด สามารถบริหารจัดการวัคซีน Buffer stock
และวัคซีนสำหรับหญิงไทยอายุ 18 ปีที่อยู่ในระบบการศึกษา ได้ตามบริบทของพื้นที่อย่างเหมาะสม
10.2.2 การจัดส่งวัคซีน รอบเดือนตุลาคม 2566 ที่สนับสนุนโดยกรมควบคุมโรค
- ระยะเวลาการจัดส่ง : เริ่มจัดส่งวัคซีน HPV เดือนตุลาคม 2566
- สถานที่จัดส่ง : ดำเนินการจัดส่งวัคซีน HPV จังหวัดละ 1 แห่ง โดยขอให้สำนักงานสาธารณสุขจังหวัด กำหนดสถานที่ส่งและแจ้งรายชื่อผู้รับผิดชอบ พร้อมเบอร์ติดต่อ ภายในวันที่ 17 ตุลาคม 2566
- กรณีต้องการวัคซีนเพิ่มเติมจากข้อ 10.2 ขอให้สำนักงานสาธารณสุขจังหวัด จัดทำหนังสือราชการเพื่อขอเบิกวัคซีน HPV เพิ่มเติม ไปยังกรมควบคุมโรค (เรียน อธิบดีกรมควบคุมโรค)
นายแพทย์ ภาสกร วันชัยจิระบุญ อายุรแพทย์มะเร็งวิทยา ผู้ช่วยผู้อำนวยการโรงพยาบาลพระปกเกล้า ดูแลศูนย์ความเชี่ยวชาญระดับสูงด้านมะเร็ง และประธาน cancer warrior จังหวัดจันทบุรี กล่าวว่า “ถึงแม้ว่าในปัจจุบันจะมีวิธีการรักษาผู้ป่วยมะเร็งปอดระยะสุดท้ายหลายประการ เช่น ยามุ่งเป้า ยาภูมิคุ้มกันบำบัด และยาเคมีบำบัด เพื่อเพิ่มอัตราการรอดชีวิตของผู้ป่วย แต่การตรวจพบมะเร็งในระยะเริ่มต้นยังคงเป็นเรื่องสำคัญที่จะช่วยเพิ่มโอกาสในการรักษาให้หายได้มากที่สุด จึงได้ผลักดันโครงการนำร่องเพื่อประยุกต์ใช้เทคโนโลยี AI ที่ทำงานได้ทัดเทียมกับรังสีแพทย์มาสู่ระบบเอกซเรย์ของโรงพยาบาลรัฐ เพื่อให้แพทย์สามารถวินิจฉัยได้เร็วและมีโอกาสค้นพบมะเร็งปอดในระยะเริ่มต้นได้มากขึ้น ซึ่งจะนําไปสู่การรักษาเป็นทีม ซึ่งประกอบด้วย รังสีแพทย์ (รังสีวินิจฉัย รังสีรักษา รังสีร่วมรักษา) พยาธิแพทย์ ศัลยแพทย์ทรวงอก และอายุรแพทย์มะเร็งวิทยา) ที่ทันท่วงทีและเพิ่มโอกาสการรอดชีวิตของผู้ป่วยต่อไป"
แก้วน้ำกันสำลัก ตัวช่วยให้กลืนง่าย ลดโอกาสสำลัก
เมื่อการปรับพฤติกรรมด้วยการฝึกกลืนเป็นโจทย์ยากของทั้งตัวผู้ป่วยและผู้ดูแล ทางทีมวิจัยจึงได้พัฒนา “แก้วน้ำกันสำลัก” ขึ้นมา เพื่อเป็นตัวช่วยให้ผู้ป่วยดื่มน้ำได้อย่างปลอดภัย
“เราออกแบบแก้วน้ำกันสำลัก เพื่อให้ผู้ใช้สามารถดื่มน้ำ กลืนน้ำในขณะที่หลอดอาหารอยู่ในตำแหน่งที่ดี และหลอดลมปิดอยู่ เพื่อลดความเสี่ยงในการสำลัก”
ศ.นพ.รุ่งโรจน์ กล่าวว่าแก้วน้ำกันสำลัก ผลิตด้วยวัสดุประเภทเดียวกับขวดนมของเด็กทารก ดีไซน์ให้เหมือนแก้วน้ำปกติทั่วไป และใช้สีสันสดใสเพื่อกระตุ้นให้ผู้ใช้อยากดื่มน้ำมากขึ้น
“เราไม่ต้องการให้ผู้ใช้และคนรอบข้างรู้สึกว่าผู้ที่ใช้แก้วน้ำนี้เป็นผู้ป่วย ที่กำลังใช้อุปกรณ์ทางการแพทย์อยู่ จึงดีไซน์ให้แก้วน้ำดูกลมกลืนกับของใช้ในชีวิตประจำวัน ที่สามารถพกไปใช้ที่ไหนก็ได้” ศ.นพ.รุ่งโรจน์ อธิบายแนวคิดในการดีไซน์ “แก้วน้ำกันสำลัก”
แม้ภายนอกจะดูไม่แตกต่างจากแก้วน้ำทั่วไป แต่ภายในมีกลไกพิเศษเพื่อกันการสำลัก ที่ทีมวิจัยได้ศึกษาและคำนวณอย่างละเอียด ไม่ว่าจะเป็นมุมการไหลของน้ำ ปริมาณน้ำ และระยะเวลาการไหลของน้ำจากแก้วมาถึงริมผีปากผู้ใช้งานที่เหมาะสม
หลักสูตร Housekeeping แผนกแม่บ้าน
Housekeeping คอร์สนี้เหมาะสำหรับตำแหน่งงานดังต่อไปนี้
- ผู้จัดการแผนกแม่บ้าน (Executive Housekeeper)
- ผู้จัดการส่วนซักรีดของโรงแรม (Laundry Manager)
- ผู้ควบคุมดูแลห้องพัก (Floor Supervisor)
- พนักงานซักรีดของโรงแรม (Laundry Attendant)
- พนักงานดูแลห้องพัก (Room Attendant)
- พนักงานทำความสะอาดพื้นที่สาธารณะ (Public Area Cleaner)
ลิงค์หลักสูตร


ศ.เกียรติคุณ นพ.อมร ลีลารัศมี อดีตนายกแพทยสมาคมแห่งประเทศไทยฯ แพทย์ผู้เชี่ยวชาญ สาขา อายุรศาสตร์โรคติดเชื้อ เปิดเผยถึงสถานการณ์โรคระบบทางเดินหายใจ ในปัจจุบันว่า “โรคติดเชื้อทางเดินหายใจมีแนวโน้มแพร่ระบาดสูง โดยเฉพาะโรคติดเชื้อโควิด-19 ที่อาการทั่วไปมักมีอาการไข้ ไอ เจ็บคอ ปวดเมื่อย อ่อนเพลีย โดยอาจพบอาการหายใจลำบาก โดยเฉพาะผู้ป่วยกลุ่มเสี่ยง ซึ่งได้แก่ ผู้ป่วยที่มีอายุมากกว่า 60 ปี และผู้ที่มีโรคประจำตัว เช่น โรคความดันโลหิตสูง โรคเบาหวาน โรคอ้วน โรคภูมิคุ้มกันบกพร่อง รวมถึงเอชไอวี โรคมะเร็ง และการตั้งครรภ์ รวมถึงผู้ที่ไม่ได้รับการฉีดวัคซีนก็จะมีความเสี่ยงสูงที่จะมีอาการรุนแรง สำหรับมาตรการการป้องกัน ทุก ๆ ภาคส่วน ยังคงเน้นย้ำให้ประชาชนเฝ้าระวัง และปฏิบัติตามมาตรการป้องกันอย่างเคร่งครัดเพื่อป้องกันการติดเชื้อ นอกจากนี้การฉีดวัคซีนยังความสำคัญ และมีประโยชน์ในการป้องกันการเกิดโรครุนแรง ดังนั้น จึงควรรับวัคซีน โดยเฉพาะผู้ที่มีความเสี่ยงต่อการเจ็บป่วยรุนแรง โดยแนะนำให้ฉีดวัคซีนโควิด-19 ประจำปี และอีกโรคที่ยังต้องเฝ้าระวัง คือ ไข้หวัดใหญ่ ซึ่งเกิดจากเชื้ออินฟลูเอนซาไวรัส (Influenza virus) สามารถติดต่อโดยการหายใจเอาละอองน้ำมูก น้ำลาย และเสมหะของผู้ป่วยที่ไอหรือจาม และการสัมผัสมือหรือการใช้สิ่งของ เครื่องใช้ต่าง ๆ ร่วมกับผู้ป่วย อาการมักมีไข้สูงเฉียบพลัน ไอ หนาวสั่น ปวดศีรษะ ปวดเมื่อยกล้ามเนื้อ อ่อนเพลีย เจ็บคอ ผู้ป่วยส่วนใหญ่จะหายได้เอง แต่ผู้ป่วยบางกลุ่มที่มีความเสี่ยงต่อการเกิดภาวะแทรกซ้อน และอาการรุนแรง เช่น ผู้ที่มีโรคประจำตัว เด็กเล็ก ผู้สูงอายุ การป้องกันโดยทั่วไป คือ การล้างมือบ่อย ๆ ด้วยน้ำหรือสบู่ ไม่คลุกคลีหรืออยู่ใกล้ชิดผู้ป่วย รวมถึงหลีกเลี่ยงการไปในสถานที่ที่แออัด และการฉีดวัคซีนป้องกันไข้หวัดใหญ่ทุกปี ทั้งนี้กรมควบคุมโรคแนะนำว่า ควรฉีดวัคซีนไข้หวัดใหญ่ และวัคซีนโควิด-19”
คลินิกโรคเรื้อรัง รพ.สต.บางขะแยง
สปสช.เขต 2 พิษณุโลก
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 2 พิษณุโลก
เพชรบุรี ประชุมแนวทางการขับเคลื่อนนโยบายด้านดิจิทัลสุขภาพ
12 ธันวาคม 2566 เวลา 09:30 น. นายแพทย์เพชรฤกษ์ แทนสวัสดิ์ นายแพทย์สาธารณสุขจังหวัดเพชรบุรี เป็นประธานการประชุมชี้แจงแนวทางการขับเคลื่อนนโยบายด้านดิจิทัลสุขภาพ บัตรประชาชนใบเดียวรักษาได้ทุกที่ จังหวัดเพชรบุรี ครั้งที่ 4/2566 ร่วมด้วย นางมัลลิกา แทนสวัสดิ์ ประธานแม่บ้านสาธารณสุข สาขา จังหวัดเพชรบุรี ณ ห้องประชุม 1 พระนครคีรี ชั้น 5 สำนักงานสาธารณสุขจังหวัดเพชรบุรี
2.ศูนย์สุขภาพพร้อม ศูนย์สุขภาพมหาวิทยาลัยเชียงใหม่
ศูนย์สุขภาพพร้อม ศูนย์สุขภาพมหาวิทยาลัยเชียงใหม่ - CMU Health Center ให้บริการ
คลินิกตรวจโรคทั่วไป คลินิกายภาพบำบัด คลินิกกิจกรรมบำบัด คลินิกทันตกรรม ศูนย์สุขใจ ร้านขายยา
รพ.กรุงเทพปากช่อง อ.ปากช่อง จ.นครราชสีมา
โรงพยาบาลกรุงเทพปากช่อง อีกหนึ่งในเครือรพ.กรุงเทพ ตั้งอยู่ที่ 5/1 ถ.มิตรภาพ ต.หนองสาหร่าย อ.ปากช่อง จ.นครราชสีมา โทร. 044 088 960 เปิดรับผู้ประกันตนแล้ว โดยมี
คลินิกเครือข่ายประกันสังคม จำนวน 4 แห่ง ได้แก่ คลินิกเวชกรรมกรุงเทพมวกเหล็ก คลินิกเวชกรรมกรุงเทพเขาใหญ่ คลินิกเวชกรรมกรุงเทพสูงเนิน คลินิกเวชกรรมกรุงเทพราชสีมา สาขาโชคชัย
2.โรงพยาบาล กทม. 50 เขต 50 sพ. และปริมณฑล จัดตั้งโรงพยาบาล 120 เตียง ในเขตตอนเมือง และอำเภอเมืองเชียงใหม่
พัฒนา
โรงพยาบาลนพรัตนราชธานี คุ้มเกล้า สังกัดกรมการแพทย์ ซึ่งปัจจุบันเปิดให้บริการผู้ป่วยนอกทั่วไป ฝากครรภ์ ศูนย์ฟอกได 10 เตียง และ Home Health Care ให้เป็นโรงพยาบาลเขตมีนบุรีขนาด 60 เตียง ตั้งเป้า เดือนธันวาคมนี้ จะเปิดให้บริการผู้ป่วยนอกเฉพาะทาง (จักษุ หู คอ จมูก) อายุรกรรมโรคไต ศัลยกรรมทั่วไป โรคกระดูก และกุมาร เปิดบริการฉุกเฉิน 24 ชั่วโมง ให้บริการกายภาพบำบัด ทันตกรรม และผ่าตัดเล็ก เดือนมกราคม 2567 เปิดหอผู้ป่วยใน 25 เตียง พร้อมห้องผ่าตัดใหญ่ 1 เตียง ช่วงพฤษภาคม 2567 เพิ่มบริการห้องคลอด 1 ปี จะเป็นโรงพยาบาลรับส่งต่อระดับทุติยภูมิ ขยายหอผู้ป่วยในเป็น 60 เตียง โดยมี
โรงพยาบาลนพรัตนราชธานี เขตคันนายาว ที่อยู่ห่าง 15 กิโลเมตร เป็นโรงพยาบาลแม่ข่าย
เปิดโรงพยาบาลราชวิถีนครพิงค์ ณ อาคาร 8 ชั้น โรงพยาบาลประสาทเชียงใหม่ เพิ่มการเข้าถึงบริการของ ประขาชนในเขตอำเภอเมือง จังหวัดเชียงใหม่ โดยให้บริการ ผู้ป่วยนอกทั่วไปและเฉพาะทาง 5 สาขาหลัก ได้แก่ ศัลยกรรม ศัลยกรรมกระดูกและข้อ อายุรกรรม กุมารเวชกรรม และ สูติ-นรีเวชกรรม ตั้งแต่วันที่ 1 พฤศจิกายน 2566 ที่ผ่านมา และจะขยายเป็นโรงพยาบาลทั่วไป ขนาด 120 เตียง พร้อมจัดบริการให้ครอบคลุมทุกด้านต่อไป
มติเห็นชอบให้เพิ่มเติมสิทธิประโยชน์การรักษามะเร็งด้วยอนุภาคโปรตอน
บอร์ด สปสช. ได้มีมติเห็นชอบให้เพิ่มเติมสิทธิประโยชน์การรักษามะเร็งด้วยอนุภาคโปรตอนในระบบบัตรทอง ซึ่งเป็นวิธีการฉายรังสีด้วยอนุภาคโปรตอนที่เป็นเทคนิคการฉายรังสีสมัยใหม่ มีประสิทธิภาพในการรักษาผู้ป่วยมะเร็งและมีผลข้างเคียงลดน้อยลง โดยหลังจากนี้ สปสช. จะจัดทำประกาศเพื่อรองรับการจ่ายชดเชยตามที่กำหนดต่อไป
“มติบอร์ดในวันนี้เป็นประโยชน์ต่อผู้ป่วยมะเร็งอย่างมาก ช่วยให้เข้าถึงการรักษาที่มีประสิทธิภาพและประสิทธิผล ซึ่งจากข้อมูลในระบบของ สปสช. พบว่ามีผู้ป่วยมะเร็งที่ได้รับรังสีรักษาเข้าข่ายที่จะรับบริการฉายรังสีด้วยอนุภาคโปรตอนนี้ได้ประมาณ 32,000 รายต่อปี (ข้อมูลจากฐาน IP ปี 65ของสปสช.) โดยในปี 2565 ใช้งบประมาณที่จำนวน 50 ล้านบาทต่อปี ในการดูแลผู้ป่วย” ประธานบอร์ด สปสช. กล่าว
ด้าน นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ กล่าวว่า ที่มาของสิทธิประโยชน์นี้มาจากข้อเสนอของสมาคมรังสีรักษาและมะเร็งวิทยาแห่งประเทศไทย เป็นข้อเสนอที่ได้จากการประชุมทีมแพทย์รังสีรักษาและมะเร็งวิทยาผู้เชี่ยวชาญการฉายรังสีโรคมะเร็งในเด็ก และนำเสนอเข้าสู่การพิจารณาของคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุดในระบบหลักประกันสุขภาพแห่งชาติ ครั้งที่ 1/2566 เมื่อวันที่ 19 ตุลาคม 2566
ทั้งการรักษามะเร็งด้วยอนุภาคโปรตอนเป็นวิธีรักษามะเร็งที่มีประสิทธิผล มีอัตราการควบคุมโรคเฉพาะที่และการรอดชีวิตที่สูงในกลุ่มโรคมะเร็งสมองในเด็ก ช่วยลดผลข้างเคียงในทุกด้านเมื่อเปรียบเทียบกับการฉายรังสีโฟตอนแบบเดิม โดยการรักษาต้องใช้บุคลากรทางการแพทย์และผู้เชี่ยวชาญ ประกอบด้วย แพทย์รังสีรักษา แพทย์รังสีวินิจฉัยแพทย์เวชศาสตร์นิวเคลียร์ กุมารแพทย์ทางโลหิตวิทยาและรังสี (กรณีผู้ป่วยเด็ก) วิสัญญีแพทย์ นักฟิสิกส์การแพทย์ นักรังสีเทคนิค พยาบาล และวิศวกร
ปัจจุบันในประเทศไทยมีหน่วยบริการที่ให้บริการฉายรังสีด้วยอนุภาคโปรตอนเพียงแห่งเดียว คือศูนย์โปรตอนสมเด็จพระเทพฯ รพ.จุฬาลงกรณ์ เปิดให้บริการมาตั้งแต่สิงหาคม 2564 ดังนั้นในบริหารจัดการจ่ายชดเชย สปสช. จึงใช้รูปแบบเหมาจ่ายรายปี จำนวน 50 ล้านบาท ให้แก่ ศูนย์โปรตอนสมเด็จพระเทพรัตนราชสุดาฯ พร้อมให้มีการจัดระบบการส่งต่อ ประสานงาน เพื่อจัดบริการให้แก่ผู้ป่วยทุกวันตลอด 24 ชั่วโมง ซึ่งในกรณีการนำส่งผู้ป่วยสามารถเบิกจ่ายค่าพาหนะรับส่งผู้ป่วยอัตราเฉลี่ย 2,300 บาทต่อครั้ง
“หลังจากบอร์ด สปสช. เห็นชอบแล้ว จากนี้ สปสช. จะออกประกาศหลักเกณฑ์รองรับการจ่ายชดเชยค่าบริการ พร้อมดำเนินการตามที่บอร์ด สปสช. มอบหมาย ทั้งการกำกับติดตามประเมินผลการเข้าถึงบริการ การประสานกับหน่วยงานที่เกี่ยวข้องในการประเมินประสิทธิภาพประสิทธิผลการรักษา รวมทั้งจัดระบบส่งต่อผู้ป่วยเพื่อความสะดวกในการเข้ารับบริการอย่างเท่าเทียมกันทุกสิทธิ และรายงานต่อคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุดฯ ทุก 4 เดือน และคณะอนุกรรมการกำหนดหลักเกณฑ์การดำเนินงานและบริหารจัดการกองทุนฯ นอกจากนี้จะประสานหน่วยงานที่เกี่ยวข้องในการสนับสนุนค่าใช้จ่ายอื่นที่นอกเหนือจากทางการแพทย์เพื่อสนับสนุนบริการและการดูแลผู้ป่วย เช่น กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษ เป็นต้น” เลขาธิการ สปสช. กล่าว
รองศาสตราจารย์ แพทย์หญิงคุณหญิงวรรณา สมบูรณ์วิบูลย์ รางวัลแพทย์สตรีตัวอย่าง 2566
รองศาสตราจารย์ แพทย์หญิงคุณหญิงวรรณา สมบูรณ์วิบูลย์ อายุ 75 ปี
ปัจจุบัน วิสัญญีแพทย์ถวายงานพระบรมวงศานุวงศ์ วิสัญญีแพทย์พิเศษ โรงพยาบาลจุฬาลงกรณ์
สภากาชาดไทย อาจารย์ที่ปรึกษา ภาควิชาวิสัญญีวิทยา คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
กรรมการฝึกอบรมและสอบความรู้ความชำนาญในการประกอบวิชาชีพเวชกรรม อนุสาขาเวชบำบัดวิกฤต
และ คณะกรรมการพิจารณาผลงานทางวิชาการทางวิสัญญีวิทยา มหาวิทยาลัยมหิดล จุฬลงกรณ์
มหาวิทยาลัย และสำนักการแพทย์ กรุงเทพมหานคร
ท่านจบการศึกษาแพทยศาตร์บัณฑิต คณะแพทยศาสตร์ จุฬลงกรณ์มหาวิทยาลัย ปี 2515
วว.วิสัญญีวิทยา ปี 2519
ท่านมีผลงานวิจัยในฐานะผู้วิจัยและผู้วิจัยร่วม ตีพิมพ์ในวารสารระดับชาติและนานาชาติ 56 เรื่อง บทความวิชาการ 9 เรื่อง เขียนตำราหรือบทความในตำรา 16 เล่ม
ท่านเป็นอาจารย์ที่เป็นที่รัก ที่ชื่นชม และที่เคารพของวิสัญญีแพทย์ทั้งโรงพยาบาลจุฬาลงกรณ์ และคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และในสถาบันอื่นๆที่มีการฝึกอบรมวิสัญญีแพทย์ในประเทศไทย เนื่องจากอยู่ในวงการศึกษาและวิชาการมากว่า ๔0 ปี โดยที่อาจารย์มีความเชี่ยวชาญในสาขาต่างๆ หลายสาขา อาทิ วิสัญญีวิทยาทั่วไป วิสัญญีวิทยาสำหรับเด็ก วิสัญญีวิทยาสำหรับผู้ป่วยโรคทางระบบประสาท และการดูแลผู้ป่วยวิกฤตทางศัลยกรรม จึงช่วยผลิตวิสัญญีแพทย์เฉพาะทางออกไปรับใช้สังคมได้ในวงกว้าง และยังเป็นผู้ริเริ่มโครงการช่วยฟื้นคืนชีพของโรงพยาบาลจุฬาลงกรณ์ให้เป็นระบบที่ชัดเจน ในปัจจุบันโครงการดังกล่าวได้ต่อยอดเป็นศูนย์ฝึกทักษะการกู้ชีพและฝึกทักษะเสมือนจริงที่ใช้สอนนิสิตแพทย์ แพทย์ประจำบ้าน แพทย์ประจำบ้านต่อยอด อาจารย์พยาบาล บุคลากรทางการแพทย์ และบุคลากรทั่วไป เป็นต้นแบบอาจารย์ที่ใฝ่รู้ และพัฒนาตัวเองให้เท่าทันศาสตร์ใหม่ๆตลอดเวลา
ท่านมีความอุตสาหะที่จะถ่ายทอดความรู้และประสบการณ์เหล่านั้นให้แก่ลูกศิษย์อย่างเต็มกำลัง วิธีการสอนของอาจารย์ฉับไวและเป็นที่ประทับใจของลูกศิษย์ เป็นผู้มีความเมตตา เป็นกันเองช่วยให้คำแนะนำทั้งทางวิชาการ การใช้ชีวิต และช่วยเหลือศิษย์เมื่อยามมีปัญหา อาจารย์อุทิศเวลาให้กับราชการอย่างเต็มที่ โดยไม่ไปให้บริการในโรงพยาบาลเอกชนเลย
ท่านยังสอนแสดงการให้ยาระงับความรู้สึกในผู้ป่วยที่เข้ารับการผ่าตัดทางระบบประสาท ณ โรงพยาบาลตามจังหวัดต่างๆ ปีละ 3 ครั้ง ตั้งแต่ ปี 2553 จนถึงปัจจุบัน
ด้วยความสามารถและความจงรักภักดี ท่านได้ตามเสด็จและถวายงานทางวิสัญญีแก่พระบรมวงศานุวงศ์ทั้งในกรุงเทพ ต่างจังหวัด และต่างประเทศ ตามที่ได้โปรดเกล้าพระราชทานโอกาส ตั้งแต่ปี 2556 จนถึงปัจจุบัน ท่านได้อุทิศตัวถวายการดูแลทั้งโดยตรงและเป็นที่ปรึกษาแก่ทีมแพทย์ที่ถวายการดูแล โดยยังเข้าร่วมประชุมทีมถวายการรักษาเป็นประจำ
ท่านได้รับรางวัลผู้บริหารดีเด่น โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ปี 2547
ภาพและข้อมูลจาก
จุฬากรณ์มหาวิทยาลัย TMWAบริการการแพทย์ทางไกล เพื่อดูแลสุขภาพคนไทยสิทธิบัตรทองในต่างประเทศ
สปสช.ขยายบริการดูแลประชาชนชาวไทยที่อาศัยหรือต้องเดินทางไปต่างประเทศ ผ่านระบบบริการการแพทย์ทางไกล (Telemedicine) เริ่ม 15 ม.ค.67 เป็นต้นไป เน้นให้คำปรึกษาปัญหาสุขภาพ ไม่เสียค่าใช้จ่าย เพียงใช้หนังสือเดินทางหรือเลขประจำตัวประชาชน 13 หลัก ยืนยันตัวตนใช้สิทธิรับบริการ ประสานกระทรวงการต่างประเทศร่วมสื่อสารประชาสัมพันธ์ให้คนไทยในประเทศต่างๆ รับรู้
บริการการแพทย์ทางไกลนี้ เป็นการให้บริการผู้ป่วยได้ทุกที่ ไม่ว่าจะอยู่ในพื้นที่ใด ดังนั้นจึงสามารถที่จะขยายความครอบคลุมเพื่อให้บริการคนไทยในต่างประเทศได้ด้วย ทั้งให้คำปรึกษาปัญหาสุขภาพ ประเมินอาการเจ็บป่วยเพื่อเข้ารับการรักษาที่เหมาะสม ให้คำแนะนำในการดูแลสุขภาพเบื้องต้นสำหรับคนไทยในต่างประเทศโดยแพทย์ไทย
ที่มาของระบบบริการฯ นี้ เนื่องจากมีคนไทยที่ไปทำงานในต่างประเทศ หรือคนไทยที่ต้องเดินทางไปต่างประเทศ มีส่วนหนึ่งที่เกิดภาวะเจ็บป่วยและต้องเข้ารับบริการสาธารณสุขในประเทศนั้นๆ แต่ด้วยปัญหาด้านภาษาทำให้เป็นอุปสรรคต่อการสื่อสารกับบุคลากรทางการแพทย์และการเข้ารับบริการรักษาพยาบาล
- ในกรณีที่ผู้มีสิทธิบัตรทองมีอาการเจ็บป่วยเจ็บป่วยเล็กน้อย (common illness) สามารถรับบริการการแพทย์ทางไกลผ่านแอปพลิเคชันด้านสุขภาพของผู้ให้บริการการแพทย์ทางไกล 4 แห่ง ที่เป็นหน่วยบริการในระบบของ สปสช. ได้
- ในส่วนของขั้นตอนการรับบริการ คนไทยที่มีสิทธิบัตรทองซึ่งอยู่ในต่างประเทศสามารถเลือกรับบริการการแพทย์ทางไกลผ่านแอปพลิเคชันของผู้ให้บริการที่ สปสช. กำหนดได้ โดยรับบริการแอปใดแอปหนึ่ง ไม่เสียค่าใช้จ่ายใดๆ ทั้งสิ้น
- การใช้สิทธิรับบริการจะใช้เพียงหนังสือเดินทาง (Passport) หรือเลขประจำตัวประชาชน 13 หลัก เพื่อยืนยันตัวตนการใช้สิทธิ และจะได้พบแพทย์ผ่านระบบการแพทย์ทางไกลเช่นเดียวกับผู้มีสิทธิบัตรทอง ที่อยู่ในประเทศไทย
ปัจจุบันมี 4 แอปพลิเคชันที่ร่วมให้บริการกับ สปสช. ประกอบด้วย
- แอปพลิเคชัน Saluber MD (ซาลูเบอร์ เอ็ม ดี) โดยสุขสบายคลินิกเวชกรรม สอบถามเพิ่มเติม ไลน์ไอดี @Sooksabaiclinic ลงทะเบียนรับบริการได้ที่ https://telemed.salubermdthai.com/
- แอปพลิเคชัน Clicknic (คลิกนิก) โดยคลิกนิกเฮลท์คลินิกเวชกรรม สอบถามเพิ่มเติม ไลน์ไอดี @clicknic
- แอปพลิเคชัน Mordee (หมอดี) โดยชีวีบริรักษ์ คลินิกเวชกรรม สอบถามเพิ่มเติม ไลน์ไอดี @mordeeapp ลงทะเบียนรับบริการได้ที่ https://form.typeform.com/to/qKY8gV4X
- โททอลเล่เทเลเมด (Totale Telemed) โดยเดอะโททอลเล่คลินิก สอบถามเพิ่มเติม ไลน์ไอดี @totale
การเดินทางด้วยระบบขนส่งสาธารณะภายในกรุงเทพ และระหว่างจังหวัด
สาธารณรัฐเช็ค
CZECH REPUBLIC
1. Charles University in Prague, Faculty of Medicine in Hradec Kralove, Czech Republic
หลักสูตร 6 ปี ปริญญา Medicinae Universae Doctor (MUDr) equivalent to
M.D. ที่มีการเรียนการสอนตลอดหลักสูตร ณ สาธารณรัฐเช็ก และรับรองโรงพยาบาลหลักที่ใช้ใน
การเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐเช็ก ได้แก่ Faculty
hospital in Hradec Kralov - General Teaching Hospital
ว/ด/ป ที่ รับรอง 16 พ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 15 พ.ค. 67
2. Charles University in Prague, First Faculty of Medicine, Czech Republic
หลักสูตร 6 ปี
ปริญญา Medicinae Universae Doctor (MUDr) equivalent to M.D. ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ สาธารณรัฐเช็ก และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ
คลินิกที่ระบุมาในหลักสูตรและอยู่ในสาธารณรัฐเช็ก ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. General Teaching Hospital
2. Central Military Hospital
3. Hospital Na Bulovee
โรงพยาบาลสมทบ 2 แห่ง คือ
1.Institute of Clinical and Exp. Medicine
2. Thomayer Hospital
ว/ด/ป ที่ รับรอง 16 พ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 15 พ.ค. 67
ด้าน นพ.โอภาส กล่าวว่า กระทรวงสาธารณสุขให้ความสำคัญกับการนำเทคโนโลยีดิทัลมาประยุกต์ใช้ในงานด้านการแพทย์และสาธารณสุข เพื่อพัฒนาระบบสาธารณสุขของประเทศให้เจริญก้าวหน้าและเกิดประโยชน์สูงสุดต่อประชาชน ตลอดจนอำนวยความสะดวกในการปฏิบัติงาน และลดภาระงานของบุคลากร จึงกำหนดให้เรื่องดิจิทัลสุขภาพเป็นหนึ่งในนโยบายการดำเนินงาน โดยมีเป้าหมายหลักในการยกระดับนโยบาย 30 บาทรักษาทุกที่ด้วยบัตรประชาชนใบเดียว เพื่อคุณภาพชีวิตที่ดีของประชาชน ซึ่งจะมีถอดบทเรียนการดำเนินงานใน 4 จังหวัดนำร่อง เพื่อนำไปขยายผลอีก 8 จังหวัดในระยะที่ 2 และขยายครอบคลุมทุกจังหวัดทั่วประเทศต่อไป
จังหวัดเพชรบุรี
ร้านยา
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| D0538 |
ร้านขายยาเพรียว (Pure) สาขาเพชรบุรี |
130 |
|
ต้นมะม่วง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032474320 |
| D0539 |
สิทธิพรเภสัช |
5/19 |
รถไฟ |
คลองกระแชง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032412875 |
| D0540 |
ยาหอม |
28-30 |
สุรินทรฤาไชย |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032425950 |
| D0541 |
รวมยาเพชรบุรี |
171/4 |
นอก |
คลองกระแชง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032428949 |
| D0542 |
ร้านยารุ่งอรุณ |
143/4 |
|
ต้นมะม่วง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032414868 |
| D0543 |
ห้างหุ้นส่วนจำกัดก๊วยหมงกี่ |
29 |
พานิชเจริญ |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032425397 |
| D0544 |
ร้านยาเฮงเจริญเภสัช |
124/1 |
|
ท่าไม้รวก |
ท่ายาง |
เพชรบุรี |
76130 |
|
| D0545 |
บ้านยาท่ายาง |
199 |
|
ท่ายาง |
ท่ายาง |
เพชรบุรี |
76130 |
|
| D0546 |
เฮือนยา ภญ.สีรุ้ง |
32 |
|
หนองปรง |
เขาย้อย |
เพชรบุรี |
76140 |
0910096491 |
| D0547 |
โชต์ลดาเภสัช |
165/9 |
|
บ้านลาด |
บ้านลาด |
เพชรบุรี |
76150 |
|
| D0548 |
บู๊ทส์-โรบินสัน เพชรบุรี |
162 ยูนิต RSS-๑F-RR-๑๑๔ ชั้น๑F โรบินสัน เพชรบุรี |
|
สมอพลือ |
บ้านลาด |
เพชรบุรี |
76150 |
032491825 |
| D0549 |
ชะอำรำลึก |
261/4 |
ร่วมจิตร |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0936245493 |
| D0550 |
บ้านยาเภสัชป่าน |
5/5 |
|
แก่งกระจาน |
แก่งกระจาน |
เพชรบุรี |
76170 |
|
| D0768 |
บ้านยาแพร |
547 |
|
บ้านหม้อ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0823658833 |
| D1330 |
ธงชัยเภสัช |
5/15 |
รถไฟ |
คลองกระแชง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0816178606 |
| D1578 |
หาดเจ้าเภสัช |
224 |
|
หาดเจ้าสำราญ |
เมืองเพชรบุรี |
เพชรบุรี |
76100 |
080-27078993,080-27078993 |
| D2065 |
พีแอนด์เอฟ ท็อปส์เพชรบุรี |
162 |
|
สมอพลือ |
บ้านลาด |
เพชรบุรี |
76150 |
0812349362 |
| D2322 |
วัตสันฟาร์มาซี สาขาโรบินสันเพชรบุรี |
162 ห้องเลขที่ RR112/4 ชั้น 1F |
|
สมอพลือ |
บ้านลาด |
เพชรบุรี |
76150 |
0824864535 |
| D2445 |
ร้านยาก้อยเภสัช |
115/1 |
|
บ้านแหลม |
บ้านแหลม |
เพชรบุรี |
76110 |
0853630798 |
| D2704 |
บ้านเกศเภสัช |
387/1 |
นาคธวัช |
บ้านแหลม |
บ้านแหลม |
เพชรบุรี |
76110 |
0642654428 |
| D3300 |
โรงยาท่าแร้ง |
120/1 |
|
ท่าแร้งออก |
บ้านแหลม |
เพชรบุรี |
76110 |
0822462018 |
| D3689 |
ป๊อปเภสัช |
99/6 |
|
บ้านกุ่ม |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0619596541 |
| D3981 |
รุ่งวิกรัยเภสัช |
2 |
พานิชเจริญ |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
032401618 |
| D4126 |
ท่ายางเภสัช |
233/7 |
|
ท่ายาง |
ท่ายาง |
เพชรบุรี |
76130 |
0826659466 |
| D4127 |
ทิพวัฒน์เภสัช(สาขาตลาดชะอำ) |
26/14 |
ราษฎร์พลี 1 |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0917824665 |
| D4128 |
ห้องยานพพร |
220/14 |
รถไฟ |
คลองกระแชง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0963175046 |
| D4130 |
บ้านยา มนต์คุ้มครอง |
17/94 |
คลองเทียน |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
032742200 |
| D4132 |
ทิพวัฒน์เภสัช |
19/8 |
คลองเทียน |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0917824665 |
| D4144 |
นนท์ณภัทรเภสัช |
50/3 |
เพชรบุรี-หาดเจ้า |
โพไร่หวาน |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0942941656 |
| D4146 |
ทิพวัฒน์เภสัช สาขาชายหาดชะอำเหนือ |
246/2 |
ร่วมจิตร |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0917824665 |
| D4213 |
บ้านแหลมฟาร์มาซี |
158-159 |
นาคธวัช |
บ้านแหลม |
บ้านแหลม |
เพชรบุรี |
76110 |
0649366999 |
| D4243 |
ร้านยาเอ็กซ์ต้า พลัส สาขาบ้านชะอำ |
1/2 |
บ้านชะอำ 2 |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0845089081 |
| D4245 |
ร้านยาเอ็กซ์ต้า พลัส สาขาถนนภูมิรักษ์ |
20/22 ซอย เจตน์จำลอง 3/1 |
บริพัตร |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0918081535 |
คลินิกพยาบาลชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 35269 |
คลินิกจิรนันท์การพยาบาลและการผดุงครรภ์ |
116 |
|
บ้านหาด |
บ้านลาด |
เพชรบุรี |
76150 |
0826514953 |
| 44627 |
ยิ่งยศคลินิกการพยาบาลและการผดุงครรภ์ |
11/2 |
|
สระพัง |
เขาย้อย |
เพชรบุรี |
76140 |
095-8879726 |
| 44664 |
ยุพินคลินิกการพยาบาลและการผดุงครรภ์ |
308 |
|
หัวสะพาน |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0655494022 |
| 44668 |
บ้านกุ่มคลินิกการพยาบาลและการผดุงครรภ์ |
184 |
|
บ้านกุ่ม |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
|
| 45070 |
ใจแก้วคลินิกการพยาบาลและการผดุงครรภ์ |
46/1 |
|
ท่าแร้ง |
บ้านแหลม |
เพชรบุรี |
76110 |
0894534598 |
| 45169 |
อุไรคลินิกการพยาบาลและการผดุงครรภ์ |
123/2 |
|
หนองกระเจ็ด |
บ้านลาด |
เพชรบุรี |
76150 |
0892598725 |
| 45170 |
บุษบกแก้วคลินิกการพยาบาลและการผดุงครรภ์ |
313 |
|
ไร่ส้ม |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0817341188 |
| 45370 |
รุ่งอรุณคลินิกการพยาบาลและการผดุงครรภ์ |
87 |
|
หนองจอก |
ท่ายาง |
เพชรบุรี |
76130 |
0867659022 |
| 45234 |
ใกล้บ้านสหคลินิก |
77 |
|
ยางน้ำกลัดใต้ |
หนองหญ้าปล้อง |
เพชรบุรี |
76160 |
0962892245 |
คลินิกเวชกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 45236 |
คลินิกเวชกรรมแพทย์อรวรรณ |
157/1 |
|
สระพัง |
เขาย้อย |
เพชรบุรี |
76140 |
0915699979 |
คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 35295 |
คลินิกเทคนิคการแพทย์อินเตอร์แลป |
33 |
มาตยาวงษ์ |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0826362147 |
| 42970 |
ชะอำแล็ป คลินิกเทคนิคการแพทย์ |
45/10 |
ศรีสกุลไทย |
ชะอำ |
ชะอำ |
เพชรบุรี |
76120 |
0971645539 |
| 45057 |
เพชรสุธีแล็บ คลินิกเทคนิคการแพทย์ |
89/10 |
ราชดำเนิน |
คลองกระแชง |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
062-1811839 |
| 45069 |
ท่ายางสมาร์ทแล็บ คลินิกเทคนิคการแพทย์ |
305/7 |
|
ท่ายาง |
ท่ายาง |
เพชรบุรี |
76130 |
083-835-6166, 091-783-4800 |
| 45101 |
คลินิกเทคนิคการแพทย์ เมืองเพชรคลินิกแล็บ |
15 |
พงษ์สุริยา |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0859445217 |
คลินิกทันตกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 35224 |
คลินิกทันตกรรมบ้านทันตแพทย์ |
31 |
มาตยาวงษ์ |
ท่าราบ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0638505767 |
| 35235 |
คลินิกทันตกรรมรักษ์ยิ้ม |
141 |
|
โพไร่หวาน |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0813202717 |
| 44625 |
คลินิกทันตกรรมไลฟ์สไตล์ |
226/6 |
|
สระพัง |
เขาย้อย |
เพชรบุรี |
76140 |
0945460944 |
| 45009 |
คลินิกทันตกรรมเขาย้อย |
107/198 |
|
เขาย้อย |
เขาย้อย |
เพชรบุรี |
76140 |
0887691548 |
| 45063 |
คลินิกทันตกรรมซียูสไมล์ |
681/46 |
|
บ้านหม้อ |
เมืองเพชรบุรี |
เพชรบุรี |
76000 |
0819594141 |
ปัจจุบัน โครงการที่ กทปส. สนับสนุนได้ดำเนินการมานั้น สามารถสร้าง Prototype เพื่อนำร่องไปใช้ประโยชน์ได้ โดยมีหน่วยงานที่เกี่ยวข้อง ได้แก่ กทปส. กรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ (พม.), หน่วยบริหารและจัดการทุนด้านการพัฒนากำลังคน และทุนด้านการพัฒนาสถาบันอุดมศึกษา การวิจัยและการสร้างนวัตกรรม (บพค.), สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช), ศูนย์เทคโนโลยีสารสนเทศและการสื่อสาร สำนักปลัดกระทรวงสาธารณสุข กระทรวงการอุดมศึกษาวิทยาศาสตร์ วิจัยและนวัตกรรม (อว.) ผู้ว่าราชการจังหวัด องค์การบริหารส่วนจังหวัด (อบจ.) และเทศบาล โดยหน่วยงานต่างๆ ได้ร่วมกันหารือเรื่อง“การวางแผนการดำเนินงานร่วมกันแบบบูรณาการ เพื่อส่งเสริมให้เกิดสวัสดิการผู้สูงอายุ ยุค 5G Digital Health Innovation เพื่อเตรียมตัวก้าวสู่ Thailand Personal Health AI” เพื่อช่วยสนับสนุนและส่งเสริมให้โครงการเดินหน้าในระยะถัดไป
ขณะที่ นพ.เมธี ภัคเวช แพทย์ผู้เชี่ยวชาญด้านกระดูกสันหลัง โรงพยาบาล เอส สไปน์ แอนด์ เนิร์ฟ เผยว่างานนี้เราได้มีการแบ่งปันความรู้เกี่ยวกับการผ่าตัดกระดูกสันหลังด้วยการส่องกล้อง ด้วยเทคนิค PSLD, PSCD, และ PSTD ซึ่งการเชื่อมกระดูกสันหลังโดยการส่องกล้องเอ็นโดสโคป แบบ Full Endo TLIF และการเชื่อมกระดูกคอด้วยวิธี Endo ACDF ต่างๆ เหล่านี้ ล้วนเป็นเทคนิคใหม่ล่าสุด โดยในวันนี้มีการผ่าตัดทั้งหมด 5 เคสด้วยกัน จึงถือได้ว่าเป็นการแลกเปลี่ยนองค์ความรู้ที่มีประโยชน์อย่างมากในทุกเคส
ด้าน นพ.ชุมพล คคนานต์ แพทย์ผู้เชี่ยวชาญด้านกระดูกสันหลัง โรงพยาบาล เอส สไปน์ แอนด์ เนิร์ฟ เผยว่า ในงานนี้ได้นำเสนอการรักษาโรคกระดูกสันหลังเคลื่อนด้วยวิธีการส่องกล้อง โดยเข้าไปเปลี่ยนหมอนรองกระดูกและยึดนอตด้วยระบบนำวิถี ซึ่งเราได้เปรียบเทียบจากผลการรักษาระหว่างการส่องกล้องเพื่อเปลี่ยนหมอนรองกระดูกสันหลังแบบ (Full Endo TLIF) กับผ่าตัดแบบแผลเล็กโดยที่ใช้กล้องจุลทรรศน์ (MIS-TLIF) โดยที่มีผลงานวิจัยยืนยันแล้วว่าการผ่าตัดส่องกล้องด้วยกล้องเอ็นโดสโคป จะให้ผลการรักษาที่ดีกว่าในแง่ของการฟื้นตัวหลังการผ่าตัด การเสียเลือดน้อยกว่า และคนไข้อยู่โรงพยาบาลสั้นกว่าซึ่งอาการปวดหลัง หลังการผ่าตัดก็น้อยกว่าเดิมอย่างชัดเจน และถือได้ว่าเป็นงานที่เปิดประสบการณ์ใหม่ๆ ในการแชร์ประสบการณ์ระหว่างการผ่าตัดของเรากับแพทย์ต่างประเทศ ซึ่งเขาก็มีประสบการณ์แตกต่างกับเราพอสมควร
สถานการณ์ปัจจุบัน - นพ.ธีระวัฒน์ เหมะจุฑา
สถานการณ์ปัจจุบัน
1-คนไทยไม่ทราบว่าทำไมสุขภาพเสื่อมโทรมหลังจากหายจากโควิดหรือหลังจากฉีดวัคซีน
2- หมอเองก็เข้าใจว่าอาการหลังจากติดโควิดไปแล้วต้องไม่มากและต้องหายเองได้ แต่เมื่อไม่หายก็ไม่ทราบว่าจะรักษาอย่างไร (ลองโควิด)
3- คนรักษาเมื่อคนป่วยสุขภาพแย่หลังฉีดวัคซีน ก็จะไม่เข้าใจ และอธิบายไม่ได้ว่าทำไมแย่ลงทั้งๆ ที่ก่อนหน้ายังดี
4- คนรักษาเมื่ิอดูตามข้อมูล ของทางการก็จะรับทราบเพียงว่า วัคซีนนั้นต้องปลอดภัยอย่างแน่นอน แต่เมื่อเกิดสภาพดังกล่าวก็ไม่รู้ว่าจะอธิบายและรักษาอย่างไร
ถึงกับตรวจแล้ว ตรวจอีก ก็ไม่เจอที่จะอธิบายอาการเหนื่อย ไม่สู้งาน เดินไม่ไหว สมาธิสั้น และอื่นๆ หัวจดเท้า
หรือ ถ้าเกิดมะเร็งขึ้น ก็รักษามะเร็งไป เกิดสมองอักเสบขึ้นก็รักษาไป
และนี่ก็คือ ลองวัคซีน
5- และทำให้ ถึงเวลาแล้วที่จะต้องทำการพิจารณาอย่างถี่ถ้วน เป็นกลางโดยให้มีการแจ้งข้อมูล ไปยังสถาบันที่ไม่มี ผลประโยชน์ทับซ้อนใดๆ และช่วยกันหาทางที่จะเยียวยารักษาผู้ที่ได้รับความทรมานเหล่านี้
นพ.ธีระวัฒน์ เหมะจุฑา
15 มกราคม 2567 โรคซึมเศร้า
เกิดจากความผิดปกติของสารเคมีในสมอง สาเหตุหลักเกิดจากความผิดปกติของสารเคมีในสมอง ส่วนสาเหตุอื่นๆ เช่น พันธุกรรม สารเสพติด ความเครียด การสูญเสียความรัก ความผิดหวัง
สาเหตุหลัก
เกิดจากความผิดปกติของสารเคมีในสมอง สาเหตุอื่นๆ พันธุกรรม สารเสพติด ความเครียด การสูญเสียคนรัก ความผิดหวัง
อาการหลัก
อารมณ์เศร้า ท้อแท้ ซึม หงอย ทั้งที่ตัวเองรู้สึกหรือคนอื่นสังเกตุเห็นก็ตาม
อาการร่วม อื่นๆ
การกิน : เบื่ออาหารหรือเจริญอาหารมากเกินไป
การนอน : นอนไม่หลับหรือนอนเยอะเกินไป
พฤติกรรม : เชื่องช้าหรือกระวนกระวาย
ร่างกาย : อ่อนเพรีย ไร้เรี่ยวแรง ใจลอย ไม่มีสมาธิ
ความคิด : ตำหนิตัวเองหรือมองว่าตัวเองไร้ค่า
ซึมเศร้ารักษาให้หายได้
ด้วยการทานยาอย่างน้อย 6 - 9 เดือน การรักษาด้วยจิตบำบัด พบจิตแพทย์ หรือโทรปรึกษา สายด่วนสุขภาพจิต 1323
SMC Clinic คลินิกสูติ-นรีเวช นอกเวลาราชการ รพ.แกลง
โครงการมอบรถพยาบาลฉุกเฉิน
รถพยาบาลฉุกเฉินเป็นสิ่งจำเป็นเสมอ ในทุกๆพื้นที่มีความต้องการรถพยาบาลฉุกเฉิน เพื่อความพร้อมในการดูแลผู้ป่วยคนไทย โดยเฉพาะโรงพยาบาลขนาดเล็กที่ห่างไกล อยู่ในถิ่นทุรกันดาร การช่วยเหลือผู้ป่วย ช่วยชีวิต เหตุฉุกเฉิน การส่งต่อ และความพร้อมด้านเครื่องมือและบุคลากรทางการแพทย์ ทั้งหมดคือทุกสิ่งในรถพยาบาลฉุกเฉิน โครงการมอบรถพยาบาลฉุกเฉิน ของมูลนิธิฯ จึงเป็นคุณูปการอย่างสูงยิ่ง
ในปี 2563 มูลนิธิฯ ได้มอบรถพยาบาลฉุกเฉิน จำนวน 3 คัน ให้แก่ โรงพยาบาล 3 แห่ง ได้แก่ โรงพยาบาลสมเด็จพระยุพราชสายบุรี จ.ปัตตานี, โรงพยาบาลสุไหงโก–ลก จ.นราธิวาส ซึ่งเป็นโรงพยาบาลในจังหวัดชายแดนภาคใต้ ระดับอำเภอที่มีขนาดเล็ก ห่างไกลจากตัวเมือง มีปริมาณประชากรในพื้นที่ที่ต้องให้การดูแลรักษาเป็นจำนวนมาก แต่มีรถพยาบาลไม่เพียงพอ และโรงพยาบาลรามาธิบดีจักรีนฤบดินทร์ จ.สมุทรปราการ ซึ่งสร้างใหม่มีความจำเป็นต้องมีรถพยาบาลเพื่อใช้ในการรับส่งและดูแลผู้ป่วยที่มีจำนวนเพิ่มสูงขึ้น
คลินิกมลพิษทางอากาศ โรงพยาบาลกลาง
โรงพยาบาลกลาง เปิดบริการ คลินิกมลพิษทางอากาศออนไลน์ ให้บริการ ประเมินอาการ ติดต่อสอบถามกับทีมแพทย์ รวมถึงแหล่งข้อมูลสุขภาพเพื่อการดูแลตนเอง สอบถามโทร. 02-2208000 ต่อ 10811 (วันและเวลาราชการ)
คลินิกทันตกรรม นัดออนไลน์ ผ่านแอปพลิเคชันหมอพร้อม
คลินิกทันตกรรม เปิดบริการนัดออนไลน์ ผ่านแอปพลิเคชันหมอพร้อม บริการ ตรวจ อุด ถอน ขูด เอ็กซเรย์ฟัน รวมไปถึงอาการปวดฟัน **(แสดงคิวนัด+ติดต่อห้องบัตรก่อนรับบริการ)** ติดต่อสอบถามเพิ่มเติมโทร 02-3381133 , 02-338-1065 ต่อ 0
ประกาศรับสมัครงาน
1. หัวหน้าแผนกบัญชี/ผู้จัดการบัญชี 1 อัตรา
2. Sales and Marketing Manager 1 อัตรา
(มีประสบการณ์งานโรงพยาบาลจะพิจารณาเป็นพิเศษ)
3. เภสัชกร FULL TIME, PART TIME หลายอัตรา
4. ผู้ช่วยเภสัชกร หลายอัตรา
ร่วมงานกับ โรงพยาบาลสินแพทย์ นครปฐม
โรงพยาบาลปทุมธานี เปลี่ยนจุดให้บริการห้องอุบัติเหตุ-ฉุกเฉิน LINK
โรงพยาบาลปทุมธานี เปลี่ยนจุดให้บริการห้องอุบัติเหตุ-ฉุกเฉิน (เนื่องจากพื้นที่เดิมปิดปรับปรุง) ผู้ป่วยอุบัติเหตุ และผุ้ป่วยเร่งด่วน-ฉุกเฉิน สามารถเข้ารับบริการได้ที่ ชั้น 1 อาคารบุญฑริก (ด้านหลังอาคารฉัตรหลวง) ได้ 24 ชั่วโมง ???? ขอความร่วมมือ ผู้ป่วยที่ไม่เร่งด่วน โปรดมาเข้ารับบริการในเวลาราชการ
พญ.เมธินี ไหมแพง ประธานคณะผู้บริหาร กลุ่ม 1 และผู้อำนวยการโรงพยาบาลกรุงเทพ บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) กล่าวว่า “กว่า 10 ปีของโรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ ภายใต้การบริหารงานของบริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) เป็นบริษัทที่มีเครือข่ายกลุ่มโรงพยาบาลเอกชนที่มีขนาดใหญ่ที่สุดในประเทศไทย เรามุ่งมั่นให้การบริการทางด้านสุขภาพและศูนย์แห่งความเป็นเลิศในโรคต่าง ๆ โดยเฉพาะโรคมะเร็ง รองรับผู้ป่วยทั้งในประเทศและต่างประเทศ ซึ่งการร่วมมือกับแอสตร้าเซนเนก้า ประเทศไทยในครั้งนี้ ถือเป็นการช่วยส่งเสริมศักยภาพของโรงพยาบาล ผ่านการแลกเปลี่ยนองค์ความรู้ด้านวิชาการทางคลินิกวิทยาศาสตร์ ร่วมกับสถาบันมะเร็งระดับนานาชาติที่มีชื่อเสียงระดับโลก รวมถึงการถ่ายทอดนวัตกรรม และความเชี่ยวชาญขั้นสูงให้แก่ทีมแพทย์ผู้ชำนาญการและทีมสหสาขาวิชาชีพ (Multi-disciplinary team – MDT) เพื่อเพิ่มประสิทธิภาพกับแนวทางการวินิจฉัยและรักษาผู้ป่วยโรคมะเร็งปอด ส่งเสริมให้โรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ เป็นศูนย์แห่งความเป็นเลิศด้านโรคมะเร็งแห่งเอเชียแปซิฟิกในอนาคต”
ความร่วมมือของทั้งสององค์กรในครั้งนี้ จะช่วยปิดช่องว่างการตรวจวินิจฉัย และดูแลเติมเต็มทุกการรักษาผู้ป่วยโรคมะเร็ง Close the Care Gap ให้มีความก้าวหน้ายิ่งขึ้น และเป็นส่วนหนึ่งในการช่วยเพิ่มคุณภาพชีวิตที่ดีให้ประชาชนคนไทยและทุกเชื้อชาติ ห่างไกลจากโรคมะเร็ง และข้ามผ่านการรักษาได้อย่างมีประสิทธิภาพมากยิ่งขึ้น
เปิดรับสมัคร เจ้าหน้าที่ออกบู้ท พาร์ทไทม์ จำนวนมาก
โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล จ.พระนครศรีอยุธยา ด่วน เปิดรับสมัคร พนักงาน จำนวนมาก โทรศัพท์ : 083-1247267
ตารางจุดให้บริการนอกสถานที่ สำหรับการเปลี่ยนสิทธิประกันสังคม (เดือนมกราคม 67)
คลินิกเพศชายลพบุรี แก้ปัญหาในผู้ป่วยที่ฉีดอวัยวะเพศชาย
คลินิกเพศชายลพบุรีปัญหาในผู้ป่วยที่ฉีดอวัยวะเพศชาย หรือ ใส่การอุปกรณ์ตกแต่งอวัยวะเพศ check list อาการ ✔สารที่ฉีดมา ไหลเป็นก้อนผิดรูปร่าง ✔สารไหลลงในถุงอัณฑะ ✔มีภาวะอักเสบติดเชื้อ ปวดบวมแดง ✔เกิดแผลเป็นๆหายๆ เริ้อรัง ✔ฉีดเข้าอุดตันเส้นเลือด เกิดเนื้อตาย เนื้อเน่า ✔พบว่าบางเคสมีขนาดใหญ่มากขึ้นเรื่อยๆจนผิดปกติ ✔อาจเป็นต้นเหตุของการเกิดมะเร็ง ปรึกษาแพทย์ผู้เชี่ยวชาญ โทรสอบถามเพื่อนัดพบแพทย์เฉพาะทาง ได้ทุกวันอังคาร เวลา 17.00-19.00 น. โทร. 036-413933 โทร. 036-412160 Hotline 064-1491414
แพทย์แผนจีน โรงพยาบาลกลาง เปิดบริการวันจันทร์ - ศุกร์
แพทย์แผนจีน โรงพยาบาลกลาง ให้บริการ ฝังเข็ม ฝังเข็ม (ติดเครื่องกระตุ้นไฟฟ้า) ครอบแก้ว กัวซา รมยา เปิดบริการวันจันทร์ - ศุกร์ เวลา 8.00-16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์) สอบถามเพิ่มเติม โทร. 02 220 8000 ต่อ 22120
สำหรับโครงการรณรงค์ Stand up to CANCER Together ลดวิกฤต ปิดช่องว่าง ลุกขึ้นสู้มะเร็งไปด้วยกัน ได้จัดบริการวิชาการเสวนาให้ความรู้ครอบคลุมทุกมิติของโรคมะเร็งจากคณะแพทย์ โรงพยาบาลจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ และภาคีเครือข่ายโดยมีดีเจเอกกี้-เอกชัย เอื้อสังคมเศรษฐ์ เป็นผู้ดำเนินรายการเสวนา เริ่มด้วยการเสวนาช่วง “ยืนหยัดลุกขึ้นป้องกันมะเร็ง” โดย ผศ.พญ.สุวนิตย์ ธีระศักดิ์วิชยา ผู้รั้งตำแหน่งนายกสมาคมมะเร็งนรีเวชไทย นพ.ศุภกร พิทักษ์การกุล รองผู้อำนวยการด้านการแพทย์ สถาบันมะเร็งแห่งชาติ และ ผศ.นพ.ณัฐวุฒิ กันตถาวร รักษาการผู้ช่วยคณบดีฝ่ายบริการวิชาการและสังคม วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ เพื่อรณรงค์ให้ประชาชนได้ตระหนักถึงการป้องกันและคัดกรองเพราะมะเร็งรู้เร็วรักษาทัน และรู้ถึงสิทธิประโยชน์จากทางภาครัฐที่คนไทยสามารถเข้าถึงได้จากการขับเคลื่อนนโยบายแผนการป้องกันและควบคุมโรคมะเร็งแห่งชาติ
ขนมไหว้วันตรุษจีน กับความหมายมงคล
ททท. ขอบอกต่อสิ่งดี ๆ ต้อนรับวันตรุษจีน กับ “ขนมไหว้วันตรุษจีน” ที่นอกจากจะถูกใช้ในการตั้งโต๊ะไหว้เทพเจ้าแล้ว ยังเป็นขนมที่สื่อความหมายดี กินแล้วจะถือเป็นการเริ่มต้นชีวิตในปีใหม่ได้อย่างเป็นมงคลด้วย
- ขนมเข่ง ความหมาย คือ การมีชีวิตที่หวานชื่น และราบรื่น โดยเฉพาะขนมเข่งที่ใส่ในชะลอม จะสื่อถึงความสมบูรณ์
- ขนมเทียน ความหมาย คือ การมีชีวิตที่ราบรื่น รุ่งโรจน์โชติช่วงเหมือนแสงไฟ หรือแสงเทียน ด้วยรูปร่างขนมที่เป็นทรงกรวยแหลมเหมือนเจดีย์ จึงเป็นขนมมงคลที่ใช้ไหว้ในวันสำคัญทั้งชาวไทยและชาวจีน
- ขนมเปี๊ยะ สื่อถึงความพรั่งพร้อม สมบูรณ์ และความสมหวัง ชาวจีนส่วนใหญ่มักจะอยู่พร้อมหน้าพร้อมตากันทั้งครอบครัว เพื่อกินขนมเปี๊ยะให้เกิดความสิริมงคลแก่ชีวิต
- ซาลาเปา ชาวจีนมักนำซาลาเปามาไหว้เจ้า ด้วยคำว่า “เปา” ภาษาจีนแต้จิ๋ว แปลว่า “ห่อ” ซาลาเปาจึงหมายถึง การห่อโชค ห่อเงิน ห่อทอง มาให้ลูกหลาน
- จันอับ จับกิม หรือ แต่เหลี่ยว เป็นชื่อของ “กล่องใส่ขนม” ถึง 5 ชนิด ได้แก่ ถั่วตัด งาตัด ฟักเชื่อม ข้าวพอง และลูกกวาดถั่วเคลือบน้ำตาลสีขาวชมพู ดังนั้นจึงสื่อถึงความหอมหวาน และเจริญงอกงามรุ่งเรืองในชีวิต นั่นเอง
นพ.รุจาพงศ์ สุขบท รองประธานอาวุโสปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมว่า การแพทย์ นับเป็นหัวใจสำคัญที่ช่วยขับเคลื่อนการดำเนินธุรกิจโรงพยาบาลและสร้างความเชื่อมั่นให้ผู้รับบริการ โดยเราจะสร้าง patient engagement การมีส่วนร่วมกับผู้ป่วยโดยยึดผู้ป่วยเป็นศูนย์กลาง patient centric ในทุกสิ่งที่เราทำ ควบคู่ไปกับการนำ Innovation มาใช้เสริมประสิทธิภาพในการรักษาและสร้างการเติบโตอย่างยั่งยืนในองค์กร (sustainable growth) ผ่านการบ่มเพาะวัฒนธรรมองค์กรซึ่งเป็นรากฐานที่สำคัญ และการ empower พยาบาล เภสัชกร และบุคลากรสหสาขาวิชาชีพ ให้ได้ใช้ความรู้ความชำนาญการในแต่ละสาขาอาชีพได้อย่างเต็มศักยภาพ และทำงานร่วมกันเป็นทีม เพื่อผลลัพธ์การรักษาที่ดีที่สุดสำหรับผู้ป่วย ทั้งหมดนี้คือวัฒนธรรมที่เราจะสร้างให้เกิดขึ้นในองค์กร เพื่อก้าวสู่การเป็นผู้นำทางการแพทย์ในศตวรรษที่ 22 ต่อไป
แนวคิดการลดอันตรายจากการใช�ยาเสพติด (Harm Reduction Concept) แนวคิดเรื่อง “Harm reduction” หรือ “การลดอันตราย” เป#นแนวคิดด�านสาธารณสุข ที่มีมาแตเดิม โดยมีวัตถุประสงค�เพื่อปAองกันหรือลดผลกระทบที่ไมพึงประสงค� ที่มีตอสุขภาพอันเนื่องมาจากพฤติกรรม บางอยาง การลดอันตรายที่เกี่ยวกับการจัดการกับป$ญหาการใช�ยาหรือสารเสพติด ได�เริ่มเกิดขั้นในชวงปลาย ทศวรรษที่ 19 (ค.ศ.1970) และตอมาได�แพรขยายจนเริ่มเป#นที่รู�จักมากขึ้นในราว ค.ศ.1980 โดยในขณะนั้น ยังเน�นด�านการให�บริการสาธารณสุขที่จะลดผลกระทบทางลบ ที่ไมพึงประสงค�ที่เกิดจากการใช�ยาเสพติดและ ปAองกันอันตรายผู�ที่ใช�ยาเสพติด มากกวาที่จะให�ผู�ปCวยหยุดการใช�ยาหรือปลอดจากยาเสพติดโดยเด็ดขาด แนวคิดนี้ได�นํามาใช�เป#นวิธีการลดการแพรเชื้อของไวรัสตับอักเสบ (Hepatitis) และลดอันตรายในเรื่อง การแพรระบาดของเชื้อ HIV/เอดส� (HIV/AIDS) โดยเน�นในกลุมผู�ใช�ยาเสพติด ซึ่งมีการดําเนินการอยาง กว�างขวางในหลายประเทศทางแถบตะวันตก เชน เนเธอร�แลนด� ออสเตรเลีย ฯลฯ ทั้งนี้นักวิชาการได�ให� คําจํากัดความที่ใช�สําหรับมาตรการลดอันตรายหลายแบบ แตที่ได�รับการยอมรับมากนั้นเป#นคําจํากัดความของ International Harm Reduction Association (IHRA) ซึ่งให�คําจํากัดความไว�วา การลดอันตราย หมายถึง นโยบาย มาตรการ และโครงการที่มีเปAาหมายในการลดผลเสียทั้งทางด�านสุขภาพ สังคม และเศรษฐกิจ อันเป#น ผลจากการใช�สารเสพติด ทั้งนี้ต�องเป#นมาตรการที่มีหลักฐานเชิงประจักษ�หรือผลการวินิจฉัยรองรับวาเป#น มาตรการที่มีครอบคลุมตั้งแตการชวยให�ใช�ยาเสพติดอยางปลอดภัย การชวยให�ควบคุมการใช�ยาเสพติดได� จนกระทั่งการชวยให�เลิกยาเสพติดอยางเด็ดขาด การลดอันตรายจากการใช�ยาเสพติด คือ การลดป$ญหา หรือภาวะ เสี่ยงอันตราย การแพรระบาด การสูญเสียจากการใช�ยาเสพติดที่อาจเกิดกับตัวบุคคล ชุมชน และสังคม เป#นการปAองกันอันตรายโดยการทําให�เกิดพฤติกรรมที่เป#นอันตรายลดลง ในขณะที่ยังไมสามารถหยุดยาเสพติดได� เป#นการยืดหยุนวิธีการรักษา โดยยึดความพร�อมของผู�ปCวยเป#นฐาน (กรมการแพทย�, 2548) สรุปความหมายการลดอันตรายจากการใช�ยาเสพติด หมายถึง การลดป$ญหา หรือภาวะเสี่ยงอันตราย การแพรระบาด การสูญเสียจากยาเสพติด ที่อาจเกิดกับตัวบุคคล ชุมชน และสังคม เป#นการปAองกันอันตราย โดยการทําให�เกิดพฤติกรรมที่เป#นอันตรายลดลง ในขณะที่ยังไมสามารถหยุดยาเสพติดได� เป#นการยืดหยุน วิธีการรักษาที่ยึดความพร�อมของผู�ปCวยเป#นฐาน โดยคํานึงถึงศักดิ์ศรีของความเป#นมนุษย� มนุษยธรรม สิทธิมนุษยชน และความเข�าใจธรรมชาติของผู�ใช�ยาเสพติด 6. ชวยลดการแพรระบาดของโรคติดตอตางๆ เชน เอชไอวี วัณโรค ตับอักเสบ 7. เป#นวิธีการบริหารจัดการเพื่อให�โอกาสผู�ใช�ยาเสพติดที่พยายามเลิกหรือไมเลิกครอบคลุมมากขึ้น 8. เป#นรูปแบบที่ตอบสนองพฤติกรรมอยางเข�าใจตามธรรมชาติของผู�ใช�ยาเสพติด 9. เป#นวิธีการหนึ่งในการชวยลดป$ญหาสังคม
ปัญหาการบริหารเงินของ Model 5 ในปี 2566
1. วงเงินค่าบริการส่วนของ OP Refer สูง เนื่องจากอัตราค่าบริการ Fee schedule ที่กำหนดมีจำนวนรายการน้อยเกินไปและอัตราค่ายาบางรายการต่ำจนสำนักอนามัยและคลินิกไม่สามารถซื้อได้ ทำให้คลินิก จำเป็นต้องส่งต่อไปโรงพยาบาล และเมื่อ รพ.ส่งผู้ป่วยกลับ คลินิกฯ ก็ไม่มียาจึงต้องส่งต่อไปเรื่อยๆ ทั้งนี้ก่อนการใช้ Model 5 คลินิกสามารถจ่ายยาอะไรก็ได้
2. วงเงินค่าบริการซอง ศบส และคลินิกสูง เนื่องจากเครือข่ายพวงบริการเดียวกันสามารถรักษาผู้ป่วย แทนกันได้ ไม่มีระบบตรวจสอบการจ่ายยาซ้ำช้อน และอัตราค่บริการทางการแพทย์ใน กทม.ได้รับการปรับตาม ต้นทุนของ กทม ที่สูงกว่าต่างจังหวัด
3. ศบส. สำนักอนามัยมอบ สปสข.บริหารเงินแทน สปสช.กทม.บริหารเงินของแต่ละเครือข่ายพวงบริการรวมกันทั้งหมด ทำให้คลินิกที่ส่งต่อน้อยได้รับผลกระทบจากคลินิกและ คบส.ที่ส่งต่อมากเท่าๆ กัน
4. เมื่อ สปสช ไม่มีระบบให้ตรวจสอบการเบิกจ่ายเงินเหมือนตอนที่ใช้ Model 2
โรงพยาบาลเพชรบูรณ์ เชิญชวนชาวเพชรบูรณ์ ลงทะเบียน Health ID
โรงพยาบาลเพชรบูรณ์ ขอเชิญชวนชาวเพชรบูรณ์ทุกท่าน ลงทะเบียน "หมอพร้อม" เพื่อเข้าสู่โครงการบัตรประชาชนใบเดียวรักษาทุกที่ โดยลทะเบียนได้ที่ 1) ห้องบัตร โรงพยาบาลเพชรบูรณ์ (อาคารผู้ป่วยนอกและอุบัติเหตุ). 2) คลินิกหมอครอบครัวโรงพยาบาลเพชรบูรณ์ สาขาคลองศาลา
สิ่งที่ต้องเตรียมมา
1. บัตรประชาชน
2. โทรศัพท์ และเบอร์โทรศัพท์ ที่ใช้งานจริง ***โดย 1 เบอร์ ใช้ได้เพียง 1 คน ไม่สามารถใช้เบอร์โทรศัพท์ซ้ำกันได้***
3. ดาวน์โหลดแอปพลิเคชัน "หมอพร้อม" ***กรณีโทรศัพท์ปุ่มกด สามารถใช้เพียงเบอร์โทรศัพท์ได้ แต่จะไม่สามารดูข้อมูลการรักษาด้วยตนเองได้***
ประโยชน์ที่ได้
• ท่านจะสามารถเข้าถึงประวัติการรักษาของตัวเองได้ทั้งหมด จากทุกโรงพยาบาล ทั้งรัฐและเอกชน และเครือข่ายต่างๆที่จะเข้าร่วมในอนาคต เช่น ร้านยา คลินิก
• ทั้งประวัติการวินิจฉัยโรค รายการยา ผลเลือด และผลทางห้องปฏิบัติการอื่น ๆ ประวัติวัคซีน
• และเมื่อท่านจะไปใช้บริการที่สถานพยาบาลใด แพทย์จะสามารถเข้าถึงข้อมูลการรักษาพยาบาลของท่านจากต่างโรงพยาบาลได้ ถ้าท่านอนุญาต โดยใช้บัตรประชาชน หรือ OTP โดยไม่จำเป็นต้องใช้ใบส่งตัว
• ท่านจะสามารถขอใบรับรองแพทย์รูปแบบต่าง ๆ ผ่านแอปพลิเคชันได้ (ในอนาคตอันใกล้)
• รองรับบริการ Telemedicine บริการการแพทย์ทางไกลผ่านแอปพลิเคชัน
• เห็นประวัติการนัดหมายและใบนัด รองรับระบบการแจ้งเตือนก่อนถึงวันนัด
• และท่านจะได้รับประโยชน์ต่างๆ อีกมากมาย จากการพัฒนาระบบอย่างต่อเนื่อง และการประยุกต์ใช้จากสถานพยาบาลต่าง ๆ โดยคำนึงถึงความปลอดภัย และการเก็บรักษาข้อมูลส่วนบุคคลของท่าน
2.เลือกวันเวลาจากตารางกำหนดการบริการ
ตารางกำหนดการ คาราวานตรวจสุขภาพ ตั้งแต่ มกราคม - มิถุนายน 2567 คลิกดูรายละเอียดของแต่ละกำหนดการได้ ซึ่งจะบอกข้อมูลละเอียดไว้ดีมาก ได้แก่วันเวลาสถานที่ให้บริการ จำนวนการให้บริการ บริการที่มี รวมทั้งเบอร์โทรติดต่อ และแผนที่
งานแพทย์แผนไทยและแพทย์ทางเลือก
กัลฟ์ได้ดำเนินโครงการทันตกรรมเคลื่อนที่ ตั้งแต่ปี พ.ศ. 2563 - นายสารัชถ์ รัตนาวะดี
นายสารัชถ์ รัตนาวะดี ประธานเจ้าหน้าที่บริหาร บริษัท กัลฟ์ เอ็นเนอร์จี ดีเวลลอปเมนท์ จำกัด (มหาชน) กล่าวว่า ตั้งแต่ปี พ.ศ. 2563 ทางกัลฟ์ได้ดำเนินโครงการทันตกรรมเคลื่อนที่ร่วมกับคณะทันตแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เพื่อออกหน่วยให้บริการรักษาและดูแลสุขภาพฟันแก่ประชาชนในพื้นที่กรุงเทพฯ และจังหวัดต่าง ๆ โดยไม่คิดค่าใช้จ่าย ในครั้งนี้ยินดีที่ได้มามีส่วนร่วมปรับปรุงอาคารโครงการทันตกรรมปากเกร็ด ขยายความช่วยเหลือมาสู่กลุ่มเด็กที่อยู่ในความดูแลของสถานสงเคราะห์ในพื้นที่ปากเกร็ด ภายใต้กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ (พม.) เป็นการให้โอกาสกับเด็กและเป็นการช่วยดูแลสังคม หวังเป็นอย่างยิ่งว่าจะช่วยพัฒนาคุณภาพชีวิตของเด็กๆ ให้ดียิ่งขึ้น เติบโตเป็นกำลังสำคัญในการพัฒนาประเทศต่อไป
ความรู้เกี่ยวกับฮีทสโตรก การออกกำลังกายกลางแจ้ง และวิธีปฐมพยาบาล
อากาศร้อนจัด ออกกำลังกายกลางแจ้ง เสี่ยงโรคฮีทสโตรก (Heat Stroke)
5 วิธี ออกกำลังกายอย่างปลอดภัย
- ดื่มน้ำสะอาดบ่อย ๆ หากสูญเสียเหงื่อมากควรดื่มเครื่องดื่มประเภทเกลือแร่
- หลีกเลี่ยงการออกกำลังกายอย่างหนักติดต่อกันเป็นเวลานาน
- ควรออกกำลังกายในช่วงเช้าหรือเย็น หรือเปลี่ยนมาออกกำลังกายในอาคาร หรือบริเวณที่มีอากาศถ่ายเท
- สวมชุดออกกำลังกายที่ระบายความร้อนได้ดี
- ควรออกกำลังกายเป็นกลุ่ม และหากมีอาการผิดปกติให้รีบแจ้งบุคคลใกล้ชิด
วิธีปฐมพยาบาล
รีบนำผู้ป่วยส่งโรงพยาบาล
ระหว่างที่รอรถพยาบาล ให้พาผู้ป่วย เข้าที่ร่มและเย็น ถอดเสื้อผ้าให้เหลือเท่าที่จำเป็น
จัดให้นอนราบ ยกขา และเท้าสูงกว่าลำตัว
ใช้ผ้าชุบน้ำเย็น เช็ดตามตัวและใช้พัดลมเป่าช่วย หรือ วางถุงน้ำแข็งตามซอกคอ รักแร้ และ ขาหนีบ
หากผู้ป่วยหมดสติ ให้จับนอนตะแคง เพื่อป้องกันโคนลิ้นอุดตันทางเดินหายใจ
งบประมาณจังหวัดและงบประมาณกลุ่มจังหวัด และควบคุมดูแลการบริหารงบประมาณของหน่วยงานต่าง ๆ
ในเขตจังหวัดให้เกิดการบูรณาการ
4.๒.๒ การจัดให้มีกระบวนการเรียนรู้อย่างมีชีวิตชีวาและยั่งยืน เป็นการจัดการ
ที่ต้องยกระดับและพัฒนาอย่างต่อเนื่อง เพื่อให้เกิดการพัฒนาระบบการบริหารจัดการตำบลเข้มแข็ง
อย่างเป็นระบบทั่วทั้งประเทศ ทำให้องค์กรเกิดการเรียนรู้ มีการประเมินและพัฒนาตนเองอย่างต่อเนื่อง
โดยการประยุกต์ใช้แนวทางของการพัฒนาและรับรองคุณภาพโรงพยาบาล (Hospital Accreditation)
ได้แก่ ๑) การใช้แนวความคิดเชิงบวกในการปรับปรุงคุณภาพ กระตุ้นและส่งเสริมให้องค์ กร/หน่วยงาน
ความมุ่งมั่นที่จะพัฒนาพื่อสู่ความเป็นเลิศ มีความพยายามที่จะเรียนรู้และปรับปรุงคุณภาพ
อยู่ตลอดเวลา ๒) การสร้างกระบวนการเรียนรู้ร่วมกันจากการปฏิบัติของแต่ละคนแต่ละส่วน
เพื่อการพัฒนาคุณภาพอย่างต่อเนื่อง (Continuous Qualty Improvement : CQ) และ ๓) กระบวนการ
เรียนรู้เชิงปฏิบัติการอย่างต่อเนื่อง (Continuous Interactive Learning Through Action) ซึ่งต้องมีการ
จัดทำข้อเสนอให้หน่วยงานใดเป็นหน่วยงานเจ้าภาพขับเคลื่อนงานหรือสร้างกระบวนการเรียนรู้
ทั้งในระดับชาติหรือระดับพื้นที่
๔.๒.๓ การกำหนดให้มีเวทีแลกเปลี่ยนเรียนรู้ ในการขยายผลของการปฏิบัติตามคู่มือ
การบริหารจัดการตำบลเข้มแข็งแบบหุ้นส่วนให้แผ่ขยายในวงกว้าง อาจกำหนดให้มี "เวทีแลกเปลี่ยน
เรียนรู้" เพื่อเชื่อมโยงการเรียนรู้จากการปฏิบัติงานจริงระหว่างองค์กรที่ต้องการพัฒนาการบริหาร
จัดการตำบลเข้มแข็งแบบหุ้นส่วน หรือการนำแนวคิดไปประยุกใช้ให้เหมาะสมกับบริบทของพื้นที่
๔.๒.๔ กำหนดให้มีโครงการ/งบประมาณสนับสนุนการพัฒนาการจัดการตำบล
เข้มแข็งแบบหุ้นส่วน โดยการดำเนินงานขับเคลื่อนการพัฒนาจังหวัดและกลุ่มจังหวัดภายใต้กลไก ก..บ.
ซึ่งมีสำนักงานสภาพัฒนาการเศรษฐกิจและสังคมแห่งชาติ เป็นฝ่ายเลขานุการหลัก ได้สนับสนุน
กระบวนการมีส่วนร่วมของทุกภาคส่วนในพื้นที่ในการจัดทำแผนพัฒนาจังหวัดและกลุ่มจังหวัด
เพื่อให้ได้มาซึ่งปัญหาและความต้องการของประชาชนในพื้นที่ รวมทั้งกำหนดให้มีการประสานแผน
ในระดับพื้นที่ให้มีทิศทางที่สอดคล้องและเชื่อมโยงกัน อย่างไรก็ตาม การจัดการตำบลเข้มแข็งควรเป็น
เรื่องในความรับผิดชอบโดยตรงของเทศบาล/องค์การบริหารส่วนตำบล เนื่องจากเป็นหน่วยงานในระดับพื้นที่
ที่มีอำนาจหน้าที่รับผิดชอบตามกฎหมายและมีช่องทางงบประมาณของตนเอง เพื่อลดความซ้ำซ้อนของ
การดำเนินงานและกรสร้างกลไกใหม่ในการรับผิดชอบการจัดการตำบลเข้มแข็ง เพื่อให้การบริหารงาน
ในจังหวัดและกลุ่มจังหวัดเกิดการบูรณาการอย่างแท้จริง ตามนัยมาตรา ๑๗ แห่งพระราชกฤษฎีกาว่าด้วย
การบริหารงานเชิงพื้นที่แบบบูรณาการ พ.ศ. ๒๕๖๕ ให้ผู้ว่าราชการจังหวัดสามารถปฏิบัติในกรณี
๑) ประสาน เชื่อมโยง และกำกับให้ส่วนราชการ หน่วยงานอื่นของรัฐ องค์กรปกครองส่วนท้องถิ่น
ภาคประชาสังคม และภาคธุรกิจเอกชน ดำเนินการตามแผนพัฒนาจังหวัด/กลุ่มจังหวัด แผนปฏิบัติราชการ
ประจำปีของจังหวัด/กลุ่มจังหวัดให้บรรลุผลสัมฤทธิ์ ๒) บริหารงบประมาณจังหวัด/กลุ่มจังหวัด
และควบคุมดูแลการบริหารงบประมาณของหน่วยงานต่าง ๆ ในเขตจังหวัด ให้เกิดการบูรณาการ
๓) กำกับดูแลให้องค์กรปกครองส่วนท้องถิ่นทำคำของบประมาณและบริหารงบประมาณขององค์กร
ปกครองส่วนท้องถิ่นให้เป็นไปตามแผนพัฒนาจังหวัด/กลุ่มจังหวัด แผนปฏิบัติราชก ารประจำปี
ของจังหวัด/กลุ่มจังหวัด และ ๔) ส่งเสริมและสนับสนุนภาคประชาสังคมให้มีความเข้มแข็ง
สามารถบริหารจัดการและแก้ไขปัญหาได้ด้วยตนเองอย่างยั่งยืน
ภาวะเศรษฐกิจการคลังภูมิภาคเดือนมกราคม 2567
ภาวะเศรษฐกิจการคลังภูมิภาค
เดือนมกราคม 2567 (28/2/2567)
เศรษฐกิจภูมิภาคเดือนมกราคม 2567 มีปัจจัยสนับสนุนจากการบริโภคภาคเอกชนในภาคใต้ และภาคเหนือ และความเชื่อมั่นภาคอุตสาหกรรมที่เพิ่มขึ้นในภาคกลาง ภาคใต้ และภาคตะวันออก
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง เปิดเผยภาวะเศรษฐกิจภูมิภาคประจำเดือนมกราคม 2567 ว่า “เศรษฐกิจภูมิภาคเดือนมกราคม 2567 มีปัจจัยสนับสนุนจากการบริโภคภาคเอกชนในภาคใต้ และภาคเหนือ และความเชื่อมั่นภาคอุตสาหกรรมที่เพิ่มขึ้นในภาคกลาง ภาคใต้ และภาคตะวันออก โดยมีรายละเอียดดังนี้
เศรษฐกิจภาคใต้ในเดือนมกราคม 2567 ได้รับปัจจัยสนับสนุนจากการบริโภคภาคเอกชน อีกทั้งความเชื่อมั่นของผู้บริโภค และความเชื่อมั่นภาคอุตสาหกรรมที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากการจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ และจำนวนรถจักรยานยนต์จดทะเบียนใหม่ขยายตัวร้อยละ 13.9 และ 8.1 ต่อปี ตามลำดับ ขณะที่จำนวนรถยนต์นั่งจดทะเบียนใหม่ และรายได้เกษตรกรชะลอตัวร้อยละ -5.8 และ -0.3 ต่อปี แต่ขยายตัวร้อยละ 15.0 และ 8.3 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ตามลำดับ ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 59.9 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 58.9 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ชะลอตัวร้อยละ -39.1 ต่อปี แต่ขยายตัวร้อยละ 11.6 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล จำนวนรถบรรทุกจดทะเบียนใหม่ชะลอตัว ขณะที่เงินทุนของโรงงานที่เริ่มประกอบกิจการมีมูลค่า 653.8 ล้านบาท ขยายตัวร้อยละ 28.2 ต่อปี โดยเป็นการลงทุนในโรงงานแปรรูปไม้ยางพาราและไม้ที่ปลูกขึ้นโดยเฉพาะ 13 ชนิด ในจังหวัดสุราษฎร์ธานี เป็นสำคัญ ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 93.2 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 90.1
เศรษฐกิจภาคเหนือในเดือนมกราคม 2567 ได้รับปัจจัยสนับสนุนจากการจับจ่ายใช้สอยของประชาชนจากรายได้เกษตรกร และความเชื่อมั่นของผู้บริโภคที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากการจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ และรายได้เกษตรกรขยายตัวร้อยละ 7.2 และ 4.7 ต่อปี ตามลำดับ ขณะที่จำนวนรถยนต์นั่งจดทะเบียนใหม่ และจำนวนรถจักรยานยนต์จดทะเบียนใหม่ชะลอตัว ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 63.3 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 62.4 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ชะลอตัวร้อยละ -23.6 ต่อปี แต่ขยายตัวร้อยละ 1.6 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ขณะที่เงินทุนของโรงงานที่เริ่มประกอบกิจการมีมูลค่า 166.8 ล้านบาท ขยายตัวร้อยละ 200.9 ต่อปี โดยเป็นการลงทุนในโรงงานสีข้าว และการอบพืชผลทางการเกษตร ในจังหวัดเชียงใหม่ เป็นสำคัญ ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 96.7 ลดลงจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 98.3
เศรษฐกิจภาคตะวันออกเฉียงเหนือในเดือนมกราคม 2567 ได้รับปัจจัยสนับสนุนจากการจับจ่ายใช้สอยของประชาชนจากรายได้เกษตรกร และความเชื่อมั่นของผู้บริโภคที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากการจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ และรายได้เกษตรกรขยายตัวร้อยละ 7.4 และ 5.6 ต่อปี แต่ชะลอตัวร้อยละ -5.8 และ -1.4 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ตามลำดับ ขณะที่จำนวนรถยนต์นั่งจดทะเบียนใหม่ และจำนวนรถจักรยานยนต์จดทะเบียนใหม่ชะลอตัวร้อยละ -8.0 และ -4.2 ต่อปี แต่ขยายตัวร้อยละ 23.6 และ 1.6 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 65.3 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 64.4 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ชะลอตัวร้อยละ -31.5 ต่อปี แต่ขยายตัวร้อยละ 13.8 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ขณะที่เงินทุนของโรงงานที่เริ่มประกอบกิจการมีมูลค่า 2,221.4 ล้านบาท ขยายตัวร้อยละ 9.9 ต่อปี โดยเป็นการลงทุนในโรงงานคัดขนาดและบรรจุไข่ในจังหวัดขอนแก่น เป็นสำคัญ ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 81.5 ลดลงจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 83.4
เศรษฐกิจภาคกลางในเดือนมกราคม 2567 ได้รับปัจจัยสนับสนุนจากการจับจ่ายใช้สอยของประชาชนจากความเชื่อมั่นของผู้บริโภคที่สูงขึ้น อีกทั้งความเชื่อมั่นภาคอุตสาหกรรมที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากการจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ และจำนวนรถจักรยานยนต์จดทะเบียนใหม่ขยายตัวร้อยละ 1.8 และ 2.7 ต่อปี ตามลำดับ จำนวนรถยนต์นั่งจดทะเบียนใหม่ชะลอตัวร้อยละ -24.2 ต่อปี แต่ขยายตัวร้อยละ 4.3 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ขณะที่รายได้เกษตรกรชะลอตัว ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 61.2 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 60.2 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ และจำนวนรถบรรทุกจดทะเบียนใหม่ชะลอตัว ขณะที่เงินทุนของโรงงานที่เริ่มประกอบกิจการมีมูลค่า 1,184.1 ล้านบาท ขยายตัวร้อยละ 10.9 ต่อปี โดยเป็นการลงทุนในโรงงานผลิตเครื่องดื่มที่ไม่มีแอลกอฮอล์ ในจังหวัดสระบุรี เป็นสำคัญ ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 90.9 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 87.7
เศรษฐกิจภาคตะวันตกในเดือนมกราคม 2567 ได้รับปัจจัยสนับสนุนจากรายได้เกษตรกร อีกทั้งความเชื่อมั่นของผู้บริโภค และความเชื่อมั่นภาคอุตสาหกรรมที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากรายได้เกษตรกรขยายตัวร้อยละ 8.9 ต่อปี ขณะที่การจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ชะลอตัวร้อยละ -1.8 ต่อปี แต่ขยายตัวร้อยละ 5.2 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ส่วนจำนวนรถยนต์นั่งจดทะเบียนใหม่ และจำนวนรถจักรยานยนต์จดทะเบียนใหม่ชะลอตัว ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 61.2 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 60.2 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ จำนวนรถบรรทุกจดทะเบียนใหม่ และเงินทุนของโรงงานที่เริ่มประกอบกิจการชะลอตัว ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 90.9 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 87.7
เศรษฐกิจภาคตะวันออกในเดือนมกราคม 2567 ชะลอตัวทั้งการบริโภคภาคเอกชน และการลงทุนภาคเอกชน อย่างไรก็ตาม ความเชื่อมั่นของผู้บริโภค และความเชื่อมั่นภาคอุตสาหกรรมที่ปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากการจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ จำนวนรถจักรยานยนต์จดทะเบียนใหม่ และรายได้เกษตรกร ชะลอตัวร้อยละ -9.8 -3.9 และ-25.3 ต่อปี แต่ขยายตัวร้อยละ 1.6 10.0 และ 4.1 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล ตามลำดับ ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 65.6 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 64.6 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ชะลอตัวร้อยละ -24.7 ต่อปี แต่ขยายตัวร้อยละ 3.0 เมื่อเทียบกับเดือนก่อนหน้าหลังขจัดผลทางฤดูกาล จำนวนรถบรรทุกจดทะเบียนใหม่ชะลอตัว เงินทุนของโรงงานที่เริ่มประกอบกิจการมีมูลค่า 2,751.2 ล้านบาท ชะลอตัวจากปีก่อนหน้า ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 91.1 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 87.6
เศรษฐกิจ กทม. และปริมณฑลในเดือนมกราคม 2567 ชะลอตัวทั้งการบริโภคภาคเอกชน และการลงทุนภาคเอกชน อย่างไรก็ตามความเชื่อมั่นของผู้บริโภค และความเชื่อมั่นภาคอุตสาหกรรมปรับตัวดีขึ้น โดยเครื่องชี้เศรษฐกิจด้านการบริโภคภาคเอกชน สะท้อนจากจำนวนรถยนต์นั่งจดทะเบียนใหม่ขยายตัวร้อยละ 19.5 ต่อปี ขณะที่การจัดเก็บภาษีมูลค่าเพิ่ม ณ ราคาคงที่ จำนวนรถจักรยานยนต์จดทะเบียนใหม่ และรายได้เกษตรกรชะลอตัว ทั้งนี้ ดัชนีความเชื่อมั่นผู้บริโภคอยู่ที่ระดับ 62.7 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 61.9 เครื่องชี้ด้านการลงทุนภาคเอกชน สะท้อนจากจำนวนรถยนต์บรรทุกส่วนบุคคลจดทะเบียนใหม่ จำนวนรถบรรทุกจดทะเบียนใหม่ และเงินทุนของโรงงานที่เริ่มประกอบกิจการชะลอตัว ด้านอุปทาน เครื่องชี้ภาคอุตสาหกรรม สะท้อนจากดัชนีความเชื่อมั่นภาคอุตสาหกรรมอยู่ที่ระดับ 90.9 เพิ่มขึ้นจากเดือนก่อนหน้าซึ่งอยู่ที่ระดับ 87.7
2. ‘เทศกาลฯ’ ออกแบบให้ ‘คน’ เชื่อมต่อกัน เพื่อขับเคลื่อนคุณค่าในย่าน


หัวใจของการจัดเทศกาลคือการเป็นพื้นที่สื่อกลางที่เชื่อมโยงผู้คนหลากหลาย ทั้งนักออกแบบ นักสร้างสรรค์ รวมทั้งผู้คนที่ใช้ชีวิตในย่าน ให้มาแลกเปลี่ยนองค์ความรู้ นำไอเดียเหล่านั้นไปใช้แก้ไขปัญหาในแต่ละพื้นที่ รวมทั้งสร้างคุณค่าให้ย่าน และทำให้ย่านต่าง ๆ เริ่มต้นขับเคลื่อนพื้นที่ของตัวเองในระยะยาว เช่น ย่าน ‘ปากคลองตลาด’ ที่เดิมทีเป็นที่รู้จักในฐานะย่านขายดอกไม้ที่ใหญ่และเก่าแก่ที่สุดในกรุงเทพฯ อาจารย์หน่อง-ผศ.ดร. สุพิชชา โตวิวิชญ์ คณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศิลปากร ใช้พื้นที่นี้เป็นโจทย์สำหรับวิชาอนุรักษ์สถาปัตยกรรมพื้นถิ่นและพัฒนาชุมชน และมีการก่อตั้งเพจ Humans of Flower Market: มนุษย์ปากคลองฯ ไว้อยู่แล้ว เมื่อมีการจัดเทศกาลงานออกแบบกรุงเทพฯ จึงนับเป็นโอกาสอันดีในการนำโปรเจกต์ดังกล่าวมาเข้าร่วมเป็นส่วนหนึ่งของเทศกาลฯ เพื่อต่อยอดการทำงานร่วมกันระหว่างนักออกแบบพัฒนาเมืองกับชุมชน ผลลัพธ์ที่ได้นำมาสู่ ‘ปากคลอง Pop-Up’ ที่มีการจัดแสดงงานศิลปะหลากหลายรูปแบบ เช่น ศิลปะจัดวาง นิทรรศการภาพถ่าย สื่อผสมจากเทคโนโลยี AR โดยมีจุดประสงค์เพื่อดึงดูดใจให้นักท่องเที่ยวเดินทางมาชมงานออกแบบ แล้วแวะซื้อดอกไม้จากร้านค้าในปากคลองตลาดกลับไป นับเป็นการกระตุ้นเศรษฐกิจและสร้างประสบการณ์การท่องเที่ยวเชิงสร้างสรรค์ ที่ทำให้ย่านนั้นเชื่อมโยงกับผู้คนได้หลากหลายมิติมากกว่าแค่การเป็นพื้นที่การค้าทั่วไป นอกจากนี้ ตลาดตะลักเกี๊ยะ ในย่าน ‘เจริญกรุง - ตลาดน้อย’ ซึ่งแต่เดิมจัดงานอยู่แล้ว มาเข้าร่วมกับเทศกาลเป็นปีที่ 3 โดยปีล่าสุดได้นำเสนอ ‘Friendly Market x Bangkok Design Week 2024’ ในธีม ‘Taste of New Road - Chinatown’ (รสชาติใหม่นิวโรด - ไชน่าทาวน์) บอกเล่าให้คนภายนอกได้รับรู้ความพิเศษของวัตถุดิบและเครื่องปรุงในย่าน ที่ท้าทายร้านค้าดั้งเดิมให้ออกแบบเมนูใหม่ ๆ ที่พ่อค้าแม่ค้าในชุมชนได้ Upskill ฝีมือและเพิ่มรายได้ระหว่างการจัดงาน นอกจากนี้ยังมีเวิร์กช็อปทำขนมดั้งเดิม เช่น ขนมอิ่วก้วย กุยช่ายไส้ข้าวเหนียวทรงเครื่อง และปั้นซาลาเปาเต่า+เขียนเต่า ที่เชื่อมคนต่างรุ่นให้ใกล้ชิดและส่งต่อวัฒนธรรมร่วมกัน อีกทั้งชุมชนตลาดน้อยยังตั้งใจอยากจัดเวิร์กช็อปนี้ให้ทุกคนได้มารับพรต้อนรับปีใหม่จีนไปด้วยกัน
ตรวจเจอมะเร็งในระยะเริ่มต้นและรักษาได้เร็ว จะทำให้การรักษาได้ผลดี
พญ. ปิยวรรณ เกณฑ์สาคู แพทย์ชำนาญการด้านศัลยศาสตร์เต้านม โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมว่า การตรวจเจอมะเร็งในระยะเริ่มต้นและรักษาได้เร็ว จะทำให้การรักษาได้ผลดี และเพิ่มโอกาสรอดชีวิต ดังนั้น หลังจากที่ผู้ป่วยทราบผลตรวจว่าเป็นมะเร็ง เราสามารถทำการผ่าตัดได้ภายใน 1 สัปดาห์ โดยการผ่าตัดที่ศูนย์เต้านม โรงพยาบาลบำรุงราษฎร์ มีแนวทางหลากหลายตามความเหมาะสม ได้แก่ การผ่าตัดแบบสงวนเต้านม, การผ่าตัดออกทั้งหมดและเสริมสร้างเต้านมใหม่, การผ่าตัดเต้านมออกทั้งหมด
การฝังเข็ม ศาสตร์ของแพทย์แผนจีน ช่วยรักษาด้านใด
การฝังเข็ม ศาสตร์ของแพทย์แผนจีน จะช่วยเรื่อง
1. กระตุ้นการไหลเวียนของเลือด
2. ผ่อนคลายกล้ามเนื้อ
3. บรรเทาอาการปวด
การเตรียมตัวก่อนมาฝังเข็ม ต้องทำอย่างไรบ้าง
1. นอนพักผ่อนให้เพียงพอ
2. วัดความดันโลหิตต้องไม่เกิน 140/90
3.สตรีมีครรภ์หรือมีประจำเดือนแจ้งแพทย์ให้ทราบด้วย
4. สวมเสื้อผ้าให้เหมาะสม ไม่รัดแน่นเกินไป
5. รับประทานอาหารก่อนมารับการฝังเข็มทุกครั้ง
สนใจรักษาด้วยการฝังเข็ม ติดต่อสอบถามได้ที่โรงพยาบาลปากเกร็ดถนน 345
• การฝังเข็มเปิดบริการในคลินิกแพทย์แผนจีน
• ที่โรงพยาบาลปากเกร็ดถนน345 แพทย์แผนจีน เปิดบริการทุกวันอังคารและวันพุธ เวลา 8.00 น -15.00 น.
สามารถสอบถามรายละเอียดเพิ่มเติมหรือแอดไลน์ได้
โทร 02-1573070 ต่อ 2203
โรงพยาบาลศรีสังวาลย์ เปิดศูนย์ฉุกเฉิน กรณีหมอกควันและฝุ่นละองขนาดเล็ก
UMSC โรงพยาบาลตากสิน
ศูนย์สนับสนุนบริการสุขภาพเวชศาสตร์เขตเมือง (UMSC)
โรงพยาบาลตากสิน แอดไลน์ LINE ID : @1tks สอบถามบริการ/ปัญหาสุขภาพ ทุกประเด็นที่อยากรู้ สอบถามเพิ่มเติม
โทร 02 4377677 (จันทร์-วันศุกร์ 08.00-16.00 น)
โทร 02 4370123 (วันจันทร์-วันศุกร์ 16.00 - 08.00 น.)
โทร 02 4370123 วันเสาร์-วันอาทิตย์ และวันหยุดนักขัตฤกษ์ 24 ชม.
กรมอนามัย เปิดข้อมูลการเฝ้าระวังการเจ็บป่วยและการเสียชีวิตด้วยโรคจากความร้อน
กรมอนามัย เปิดเผยว่า จากข้อมูลการเฝ้าระวังการเจ็บป่วยและการเสียชีวิตด้วยโรคจากความร้อน (กลุ่มโรค Heat Stroke) ในช่วงปี 2562 – 2566 พบว่า มีผู้เสียชีวิตสะสม 131 คน เฉลี่ยเป็น 26.1 รายต่อปี และพบแนวโน้มผู้ป่วยเพิ่มสูงขึ้น โดยเฉพาะกลุ่มวัยทำงานและกลุ่มผู้สูงอายุ นอกจากนี้ ในปี 2566 กรมอนามัยยังได้ติดตามเฝ้าระวังอาการและพฤติกรรมการป้องกันผลกระทบต่อสุขภาพจากความร้อน โดยพบว่า อาการเสี่ยงที่พบมากที่สุด คือ ปวดศีรษะ ปัสสาวะมีสีเข้ม เวียนศีรษะ/สับสน/มึนงง มีผื่นแดงตามผิวหนัง รวมถึงยังพบพฤติกรรมเสี่ยงจากความร้อน เช่น ทำกิจกรรมกลางแจ้งในช่วงสภาพอากาศร้อนจัด อยู่ในห้องที่ระบายอากาศได้ไม่ดีหรือไม่มีเครื่องปรับอากาศ ดื่มสุรา น้ำหวาน และน้ำอัดลม จึงขอแนะนำให้ประชาชนดูแลสุขภาพตนเองเพื่อลดความเสี่ยงด้านสุขภาพจาก ความร้อน ได้แก่ ดื่มน้ำบ่อย ๆ โดยไม่ต้องรอให้กระหายน้ำ สวมเสื้อผ้าสีอ่อน ระบายอากาศได้ดี สวมหมวกปีกกว้าง แว่นกันแดด และทาครีมกันแดดเป็นประจำ หลีกเลี่ยงการทำกิจกรรมกลางแจ้งในช่วงที่มีสภาพอากาศร้อนจัดหลีกเลี่ยงการดื่มชา กาแฟ น้ำอัดลม และแอลกอฮอล์ รวมถึงรับประทานอาหารปรุงสุกใหม่ และติดตามสถานการณ์ค่าดัชนีความร้อนจากกรมอุตุนิยมวิทยา หากค่าดัชนีความร้อนอยู่ในระดับอันตราย (42.0 – 51.9 องศาเซลเซียส) ควรลดระยะเวลาการทำกิจกรรมกลางแจ้งรพ.ม.เทคโนโลยีสุรนารี แนะนำวิธีป้องกัน โรคลมแดด
โรคลมแดด หรือ Heat Stroke เป็นโรคที่เรามักพบเจอกันบ่อยในช่วงหน้าร้อน ซึ่งเป็นภาวะที่เกิดจากอุณหภูมิในร่างกายสูงเกิน 40.5 องศาเซลเซียส เกิดจากการที่อยู่ในสถานที่ที่อุณหภูมิร้อนมากๆ และร่างกายไม่สามารถปรับตัวลดอุณหภูมิให้อยู่ในเกณฑ์ปกติได้ ส่งผลเสียต่อ ระบบประสาท หัวใจ และไต
วิธีป้องกัน : ใส่เสื้อผ้าสีอ่อน หลีกเลี่ยงเสื้อผ้าหนา , ดื่มน้ำอย่างน้อยวันละ 6-8 แก้ว ,หลีกเลี่ยงการอยู่กลางแจ้ง , อาบน้ำเย็นเพื่อลดอุณหภูมิร่างกาย


รศ.นพ.ชูศักดิ์ กิจคุณาเสถียร รองคณบดีฝ่ายนโยบายและแผน คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี กล่าวเสริมว่า “โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี จะเอื้อประโยชน์ต่อการบูรณาการและสร้างเครือข่ายความร่วมมือทางการแพทย์และวิทยาศาสตร์สุขภาพเพื่อผลักดันการสร้างสรรค์และต่อยอดนวัตกรรมทางการแพทย์ที่สามารถเพิ่มศักยภาพทางการรักษาต่อไปในอนาคต โดยจะมีการนำนวัตกรรมทางการแพทย์หลากหลายประเภทเข้ามาให้บริการทางการแพทย์รวมถึงพัฒนาด้านระบบภายในโรงพยาบาลเพื่อเพิ่มประสิทธิภาพในการให้บริการทางการแพทย์ที่ดียิ่งขึ้น ไม่ว่าจะเป็นเทคโนโลยีดิจิทัลในการบันทึกข้อมูลของผู้ป่วยและการจัดการข้อมูลทางการแพทย์ เครื่องมือช่วยในการรักษาทางการแพทย์ด้วยเทคโนโลยีปัญญาประดิษฐ์ หรือ AI (Artificial intelligence) เช่น การใช้หุ่นยนต์ช่วยผ่าตัดเพื่อช่วยลดระยะเวลาการทำงานของบุคลากรทางการแพทย์ลงและลดระยะเวลาของการพักฟื้นของผู้ป่วย รวมถึงลดอาการบาดเจ็บและลดโอกาสการเกิดภาวะแทรกซ้อนของการผ่าตัด นอกจากนี้ โรงพยาบาลรามาธิบดีแห่งใหม่ยังให้ความสำคัญกับการลดระยะเวลาในการรอรับบริการของผู้ป่วย เช่น การใช้เทคโนโลยี AI เข้ามาช่วยในการจ่ายยา”
เอไอ เครื่อง CT Scan
อนาคต รพ.จะใช้ ระบบเอไอ ร่วมกับเครื่อง CT Scan ซึ่งสำคัญกับการตรวจโรคที่รุนแรง อาทิ เส้นเลือดสมองโป่งพอง เลือดออกในสมอง ก้อนเลือดอุดตันที่ปอด ฯลฯ อาการของโรคเหล่านี้ การอ่านและพบเจอในระดับวินาที มีความสำคัญกับคนไข้ ฉะนั้นการตรวจพบได้เร็วย่อมช่วยชีวิตได้เร็ว เอไอจะช่วยลด turn around time speed จาก 15 นาที เหลือเพียง 5 นาที การทำ CT Scan ช่วยลดเวลา จาก 10 นาที เหลือเพียง 5 นาที เป็นต้น การอ่านเจอพบความผิดปกติได้เร็ว ทำให้แพทย์ช่วยเหลือคนไข้ได้ทันท่วงที นั่นคือความปลอดภัยและคุณภาพการรักษา ศาสตราจารย์ แพทย์หญิง จิรพร เหล่าธรรมทัศน์ คณบดีคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ มีเครื่องมือและเทคโนโลยีที่ทันสมัย ที่ใช้ในการเรียนการสอน ในสาขาวิชารังสีเทคนิค สาขาวิชาฉุกเฉินการแพทย์ และสาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ โดย โรงเรียนรังสีเทคนิค ผลิตนักรังสีเทคนิค หรือนักรังสีการแพทย์ เพื่อเป็นผู้เชี่ยวชาญด้านการสร้างภาพทางการแพทย์ซึ่งมีบทบาทสำคัญเป็นอย่างมากในการช่วยแพทย์ตรวจวินิจฉัย และรักษาโรคในผู้ป่วย
ในสภาวการณ์ปัจจุบัน นักรังสีการแพทย์เป็นที่ต้องการและถือเป็นวิชาชีพที่มีความขาดแคลนเป็นอย่างมากในประเทศไทย ปัจจุบันหลักสูตรรังสีเทคนิค ราชวิทยาลัยจุฬาภรณ์เปิดดำเนินการมาเป็นปีที่ 8 ดำเนินการเรียนการสอนโดยอาจารย์ผู้เชี่ยวชาญในแต่ละสาขา ทั้งรังสีวินิจฉัย รังสีรักษา และเวชศาสตร์นิวเคลียร์ นักศึกษามีโอกาสได้เรียนภาคทฤษฎีและภาคปฏิบัติกับเครื่องมือและเทคโนโลยีที่ทันสมัย ได้แก่ เครื่องเอกซเรย์ เครื่องตรวจอัลตราซาวน์ แมมโมแกรมในระบบดิจิทัล เครื่อง MRI 1.5 เทสลา และเครื่อง MRI ขนาด 3 เทสลา จำนวน 3 เครื่อง และมีเครื่อง MRI แบบพิเศษ คือ MRI Upright และ MRI HIFU
นอกจากนี้ในส่วนของเครื่องเอกซเรย์คอมพิวเตอร์หรือ CT ยังมีเทคโนโลยีการสร้างภาพรูปแบบ Spectral Imaging ที่มีความทันสมัย รวมถึง Mobile CT ที่พร้อมให้นักศึกษาของเราไปเรียนรู้และฝึกงาน
ส่วนทางด้านเวชศาสตร์นิวเคลียร์ นักศึกษาจะได้มีโอกาส ไปเรียนรู้และฝึกปฏิบัติ ณ ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติ ซึ่งมีเครื่องมือที่ทันสมัย ได้แก่ เครื่องถ่ายภาพ Digital PET/CT เครื่องแรกของประเทศไทยจำนวน 2 เครื่อง และเครื่อง PET/MRI เครื่องแรกและเครื่องเดียวของประเทศไทย เครื่อง Cyclotron และ Module สำหรับการผลิตสารเภสัชรังสีต่างๆ และนอกจากนี้ด้านรังสีรักษานักศึกษาจะได้มีโอกาสเรียนรู้เครื่องมือและฝึกปฏิบัติ ณ งานรังสีรักษามะเร็งวิทยา โรงพยาบาลจุฬาภรณ์ ที่มีเครื่องมือที่ทันสมัย นำเทคโนโลยีปัญญาประดิษฐ์มาใช้เพื่อช่วยแพทย์
โรงพยาบาลสวรรค์ประชารักษ์ ร่วมพิธีเปิดโครงการ ยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว


วันที่ 30 มีนาคม 2567 เวลา 17.00 น. แพทย์หญิงรจนา ขอนทอง ผู้อำนวยการโรงพยาบาลสวรรค์ประชารักษ์ มอบหมายให้แพทย์หญิงรัตติกร ถึงสุข และนายแพทย์อภิชาต วิสิทธิ์วงษ์ รองผู้อำนวยการฝ่ายการแพทย์ พร้อมคณะเจ้าหน้าที่ ร่วมในพิธีเปิดโครงการ “ยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว” จังหวัดนครสวรรค์ โดยมีนางจิตรา หมีทอง ผู้ช่วยเลขานุการรัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธานในพิธีฯ พร้อมด้วย แพทย์หญิงวิพรรณ สังคหะพงศ์ ผู้ตรวจราชการกระทรวงสาธารณสุขเขตสุขภาพที่ 3 และนายแพทย์จักราวุธ จุฑาสงฆ์ นายแพทย์สาธารณสุขจังหวัดนครสวรรค์ เพื่อให้ประชาชนมีสุขภาวะที่ดี ทั้งกายและใจ เข้าถึงบริการได้สะดวก รวดเร็วยิ่งขึ้น และลดภาระค่าใช้จ่ายแฝงด้านสุขภาพ ทั้งนี้โรงพยาบาลสวรรค์ประชารักษ์ ร่วมออกบูธผลการดำเนินงานตามโครงการ อาทิ การยืนยันตัวตน Health ID , การแพทย์ทางไกล Telemedicine และการรับยาที่บ้าน Health Rider โดยมีบุคลากรในสังกัดกระทรวงสาธารณสุข ประชาชน และอาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) ร่วมงานจำนวน 2,000 คน ณ บริเวณหน้าป้ายอุทยาน จังหวัดนครสวรรค์
เขต 2
- สอน.แม่จะเรา จ.ตาก
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านกลาง จ.พิษณุโลก
- สอน.บ้านงิ้วงาม จ.เพชรบูรณ์
- สถานีอนามัยเฉลิมพระเกียรติสมเด็จพระศรีนครินทราบรมราชชนนี(เอิบจิตต์ ยศสุนทร อุทิศ)
- สอ.เฉลิมพระเกียรติ 2530 บ้านน้ำลัด จ.เพชรบูรณ์
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี เมืองเก่า ตำบลเมืองเก่า อำเภอเมืองสุโขทัย จังหวัดสุโขทัย
- สอน.งิ้วงาม จ.อุตรดิตถ์
การดูแลผู้ที่มีโรคประจำตัวในช่วงอากาศร้อน
การดูแลผู้ที่มีโรคประจำตัวในช่วงอากาศร้อน
- ดื่มน้ำสะอาดบ่อยๆ
- หลีกเลี่ยงการดื่มเครื่องดื่มแอลกอฮอล์ ชา กาแฟ และเครื่องดื่มที่มีน้ำตาลสูง
- หากออกกลางแจ้ง สวมหมวกปีกกว้าง แว่นตากันแดด กางร่ม ทากันแดดที่มี SPF 15 ขึ้นไป
- เตรียมยาให้พร้อม
- สวมเสื้อผ้าสีอ่อน หลวม น้ำหนักเบา
- ควรอยู่ในสถานที่ที่มีเครื่องปรับอากาศ
- งดทำกิจกรรมที่ต้องใช้กำลังมาก
- ระวังการกินยาบางชนิดที่อาจทำให้สูญเสียน้ำและเกลือแร่ได้ง่ายขึ้น
ครม. เห็นชอบในหลักการโครงการผลิตแพทย์ฯ และอนุมัติงบ 3.7 หมื่นล้าน
20 กุมภาพันธ์ 2567 นายชัย วัชรงค์ โฆษกประจำสำนักนายกรัฐมนตรี เปิดเผยว่า ที่ประชุม ครม. (20 กุมภาพันธ์ 2567) มีมติเห็นชอบในหลักการโครงการผลิตแพทย์และทีมนวัตกรรมสุขภาพเพื่อเวชศาสตร์ครอบครัวตอบสนองต่อระบบสุขภาพปฐมภูมิทั่วไทย และอนุมัติรายการผูกพันข้ามปีงบประมาณที่มีวงเงินตั้งแต่ 1,000 ล้านบาทขึ้นไป สำหรับโครงการผลิตแพทย์ฯ จำนวนทั้งสิ้น 37,234.48 ล้านบาท ตามที่กระทรวงสาธารณสุข (สธ.) เสนอ
โฆษกประจำสำนักนายกรัฐมนตรี กล่าวว่า โครงการผลิตแพทย์ฯ เป็นโครงการที่มุ่งเน้นการพัฒนาระบบบริการปฐมภูมิ (Primary care service) ซึ่งเป็นระบบบริการสุขภาพด่านแรกของระบบบริการสาธารณสุขเพื่อดูแลสุขภาพของประชาชนในท้องถิ่นที่จะช่วยให้ประชาชนสามารถเข้าถึงบริการสุขภาพได้อย่างทั่วถึง ประกอบด้วยแพทย์เวชศาสตร์ครอบครัว และสหวิชาชีพ รวม 9 สาขาวิชาชีพ ได้แก่ แพทย์เวชศาสตร์ พยาบาล นักวิชาการสาธารณ์สุข ผู้ช่วยพยาบาล ผู้ช่วยสาธารณสุข ทันตแพทย์ เภสัชกร นักฉุกเฉินการแพทย์ และแพทย์แผนไทย
โดยโครงการผลิตแพทย์ฯ มีวัตถุประสงค์เพื่อผลิตบุคลากรทางการแพทย์ การพยาบาล และการสาธารณสุข และกระจายโอกาสทางการศึกษาไปสู่ประชาชนในส่วนภูมิภาค ครอบคลุมระยะเวลา 10 ปี ระหว่างปีการศึกษา 2568 – 2577 ซึ่งเมื่อครบระยะเวลาโครงการจะสามารถผลิตบุคลากรทางการแพทย์ได้ 62,000 คน โดยกรอบวงเงินงบประมาณที่ใช้ในโครงการผลิตแพทย์ฯ มีจำนวนทั้งสิ้น 37,234.48 ล้านบาท โดยใช้จ่ายจากงบประมาณรายจ่ายประจำปี ตั้งแต่ปีงบประมาณ 2568-2583 (รวม 16 ปี) และคาดว่า (1) บุคลากรทางการแพทย์ การพยาบาล และการสาธารณสุขสามารถพัฒนาระบบสุขภาพปฐมภูมิของประเทศตามแนวคิดเวชศาสตร์ครอบครัว (2) บุคลากรของสถาบันพระบรมราชชนกและหน่วยงานเครือข่ายใน สธ. ได้รับการพัฒนาให้มีสมรรถนะตอบสนองความต้องการการผลิตบุคลากรตามแนวคิดเวชศาสตร์ครอบครัว และ (3) กระจายโอกาสทางการศึกษาทางการแพทย์ การพยาบาล และการสาธารณสุขไปสู่ประชาชนในส่วนภูมิภาค [
thaigov]
เงื่อนไขการใช้จ่าย การถอนเงิน
เงื่อนไขการใช้จ่ายระหว่างร้านค้า
- ไม่กำหนดเงื่อนไขการใช้จ่ายเชิงพื้นที่ระหว่างร้านค้ากับร้านค้าในระดับอำเภอและการชำระเงินภายใต้โครงการฯ ต้องเป็นแบบพบหน้า (Face to Face)
เงื่อนไขคุณสมบัติร้านค้าที่สามารถถอนเงินสดจากโครงการฯ ได้
ร้านค้าที่อยู่ในระบบภาษีที่สามารถถอนเงินสดจากโครงการฯ ได้แก่
- ภาษีมูลค่าเพิ่ม (Value Added Tax: VAT) หรือ
- ภาษีเงินได้นิติบุคคล (Corporate Income Tax: CIT) หรือ
- ภาษีเงินได้บุคคลธรรมดา (Personal Income Tax: PIT) เฉพาะผู้มีเงินได้พึงประเมินตามมาตรา 40 (8) แห่งประมวลรัษฎากร
เงื่อนไขการใช้จ่ายเงินในโครงการฯ และการถอนเงินสดจากโครงการฯ
- วิธีการใช้จ่ายเงิน : การใช้จ่ายเงินสามารถใช้จ่ายได้หลายรอบ
(1.1) รอบที่ 1 เป็นการใช้จ่ายระหว่างประชาชนกับร้านค้าขนาดเล็กจนถึงร้านค้าสะดวกซื้อขนาดเล็กเท่านั้น ทั้งนี้ เงื่อนไขร้านค้าที่สามารถเข้าร่วมโครงการฯ เป็นไปตามที่ พณ. กำหนด
(1.2) ตั้งแต่รอบที่ 2 ขึ้นไป เป็นการใช้จ่ายระหว่างร้านค้ากับร้านค้า ทั้งนี้ ไม่มีการกำหนดเงื่อนไขร้านค้า
- ร้านค้าไม่สามารถถอนเงินสดได้ทันที หลังประชาชนใช้จ่าย แต่ร้านค้าจะสามารถถอนเงินสดได้เมื่อมีการใช้จ่ายตั้งแต่ในรอบที่ 2 เป็นต้นไป
- ร้านค้าที่จะสามารถถอนเงินสดได้เฉพาะร้านที่มีคุณสมบัติตามที่คณะรัฐมนตรีเห็นชอบ โดยมีการยื่นขอเบิกจ่ายผ่านผู้จัดทำระบบและผู้จัดทำระบบมีหน้าที่โอนเงินให้ร้านค้าที่เบิกจ่ายโดยตรง
รายชื่อ รพ.รัฐบาล ทั่วประเทศ 163 แห่ง
2. LDC Dental
ที่ LDC Dental มีทันตแพทย์เฉพาะทางมากมาย ที่สามารถให้คำปรึกษาปัญหาช่องปาก และทำการรักษาให้คุณได้อย่างตรงจุด และผลการรักษาที่มีประสิทธิภาพ ไม่จำเป็นต้องเสียเวลา เปลืองเงินมารักษาหลายครั้ง เปิดให้บริการทุกวัน
กำหนดการ ธรรมะในสวน ณ สวนเบญจกิติ มิถุนายน-ธันวาคม 2567
มิถุนายน 2567
พระปิยโสภณ วัดพระราม ๙ กาญจนาภิเษก
หัวข้อ : นิพพาน ในอารมณ์
เสาร์ที่ 1 มิถุนายน 2567
เวลา 8.30-10.00 น.
กรกฎาคม 2567
พระมหากิตติศักดิ์ (ศ.สียวน) วัดพระเชตุพนวิมลมังคลาราม
หัวข้อ : ทานมีศีลภาวนากำกับ
เสาร์ที่ 6 กรกฎาคม 2567
เวลา 8.30-10.00 น.
สิงหาคม 2567
พระโสภณวชิรวาที (ป.ธ.3, ดร.) วัดประยุรวงศาวาส
หัวข้อ : กตัญญูคือยอดของคนดี
เสาร์ที่ 3 สิงหาคม 2567
เวลา 8.30-10.00 น.
กันยายน 2567
พระมหาอดิศักดิ์ อภิปญฺโญ วัดบรมสถล (วัดดอน)
หัวข้อ : เมตตาคือยาวิเศษ
เสาร์ที่ 7 กันยายน 2567
เวลา 8.30-10.00 น.
ตุลาคม 2567
พระราชวัชรบัณฑิต วัดจากแดง จ. สมุทรปราการ
หัวข้อ : ทำบุญขั้นพื้นฐาน ทำหมู่บ้านให้รมณีย์
เสาร์ที่ 5 ตุลาคม 2567
เวลา 8.30-10.00 น.
พฤศจิกายน 2567
พระมงคลสุตาคม (ป.ธ.7, ดร.) วัดสุทัศนเทพวราราม
หัวข้อ : ข้อคิดจากดินสอ
เสาร์ที่ 2 พฤศจิกายน 2567
เวลา 8.30-10.00 น.
ธันวาคม 2567
พระสุชีวชิรปฏิภาณ (พระมหาวีรพล วีรญาโณ) วัดพระเชตุพนวิมลมังคลาราม
หัวข้อ : พรแห่งเพียรเปลี่ยนชีวิต
เสาร์ที่ 7 ธันวาคม 2567
เวลา 8.30-10.00 น.
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ SMC เวชกรรมฟื้นฟู
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ SMC เวชกรรมฟื้นฟู เริ่มตรวจวันอังคารที่ 6 กุมภาพันธ์ 2567 เป็นต้นไป ออกตรวจ วันอังคาร เวลา 16.30 - 20.30 น. หยุดทุกวันหยุดราชการและวันหยุดนักขัตฤกษ์ ณ ห้องตรวจเวชกรรมฟื้นฟู โรงพยาบาลพระปกเกล้า (อาคารอยู่หลังรพ. ข้างโรงพยาบาลพระปกเกล้า สาขาเมือง)
ติดต่อสอบถาม 039-319666 ต่อ 5700
หอผู้ป่วยพิเศษ SMC (SMC Premium Ward) ที่ชั้น 8 ตึก 75 ปี LINK
โรงพยาบาลราชบุรี เปิดให้บริการ หอผู้ป่วยพิเศษ SMC (SMC Premium Ward) ที่ชั้น 8 ตึก 75 ปี
- รองรับผู้ป่วยผ่าตัดของคลินิกพิเศษเฉพาะทางนอกเวลาราชการ ในระยะแรกมีจำนวน 4 ห้อง
- ราคาห้องละ 2,500 บาท (ไม่สามารถใช้สิทธิลดหย่อนได้)
- แพทย์เจ้าของไข้และแพทย์ที่ปรึกษา ไม่เกิน 300 บาท/คน/วัน
- รายละเอียดเพิ่มเติม โทร 032719600 ต่อ 1514
ผศ.นพ. ยุทธนา ศตวรรษธำรง หัวหน้าศูนย์ทางเดินอาหาร-ตับ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรคระบบทางเดินอาหารและตับเป็นปัญหาที่พบได้บ่อยและเกิดขึ้นได้กับคนทุกเพศทุกวัย เนื่องจากพฤติกรรมการทานอาหาร สภาพแวดล้อมและการดำเนินชีวิตที่เปลี่ยนแปลงไปของคนในปัจจุบัน ทำให้พบผู้ที่มีอาการผิดปกติหรือเป็นโรคในระบบทางเดินอาหารและตับมากขึ้นทุกปี เช่น โรคกรดไหลย้อน โรคกระเพาะอาหารเรื้อรัง โรคลำไส้แปรปรวน โรคตับ โรคตับอ่อน เป็นต้น
ศูนย์ทางเดินอาหารและตับ โรงพยาบาลบำรุงราษฎร์ เราตระหนักถึงปัญหา และมุ่งหวังที่จะช่วยรักษาผู้ที่มีอาการหรือมีความผิดปกติในระบบทางเดินอาหารและตับอย่างครอบคลุม ทั้งโรคทั่วไปและโรคที่มีความซับซ้อน ที่ผ่านมา เรามุ่งมั่นพัฒนาตัวเราให้เป็นหนึ่งในใจของคนไทยและคนทั่วโลก โดยได้พัฒนาการรักษาอย่างต่อเนื่อง ในปี 2565 ศูนย์ทางเดินอาหารและตับ โรงพยาบาลบำรุงราษฎร์ ร่วมมือกับ ศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ซึ่งได้รับการยอมรับว่าเป็นศูนย์ที่ให้บริการตรวจและรักษาความผิดปกติของการทำงานของระบบทางเดินอาหารอันดับหนึ่งของประเทศไทยและมีชื่อเสียงระดับโลก เพื่อยกระดับมาตรฐานการรักษาให้ดียิ่งขึ้น
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ โรงพยาบาลวชิระภูเก็ต
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ โรงพยาบาลวชิระภูเก็ต เปิดให้บริการตั้งแต่ 1 มิถุนายน 2563 เป็นต้นไป เวลา 16.30-20.00 น. ณ อาคารหลวงพ่อแช่ม 100 ปี ชั้น 1 สอบถามโทร 088-5775368 088-5775367. 076-361200
ความกังวลต่อสิ่งแวดล้อมของคนไทย
ครบรอบ 118 ปี โรงพยาบาลตากสิน
15 กุมภาพันธ์ 2565 ครบรอบ 118 ปี โรงพยาบาลตากสิน มาตรฐานก้าวไกลทันสมัยในบริการ #SCANพลิกชีวิต ผลิตโดย:งานเวชนิทัศน์ โรงพยาบาลตากสิน สำนักการแพทย์ กรุงเทพมหานคร
คลินิกเครือข่าย 3 แห่ง
เข้ารับบริการได้ที่ คลินิกเครือข่าย 3 แห่ง
1. คลินิกแพทย์สมคิด อ.สนามชัยเขต จ.ฉะเชิงเทรา โทร. 038-597-655
2. บางปะกงคลินิกแพทย์ อ.บางปะกง จ.ฉะเชิงเทรา โทร. 038-832-403 ถึง 4
3. คลินิกแพทย์สุรกิจ อ.พนัสนิคม จ.ชลบุรี โทร. 038-462-095
หรือเข้าใช้ที่โรงพยาบาลหลัก “โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา”
แพทย์หญิงปนันยา พวงกุหลาบ
ออกตรวจคลินิกในเวลา
วันที่ 20-24 พฤษภาคม 2567
เวลา 8.00-16.00 น.
ยกเว้นวันพุธ
แพทย์หญิงอัจจิมา ตันกุล
ออกตรวจคลินิกในเวลา
วันที่ 27 กุมภาพันธ์ 2567
เวลา 8.00-16.00 น.
2. ผลงาน CRA CellQuant : ระบบวิเคราะห์หาตำแหน่งและจำนวนเซลล์
2. ผลงาน CRA CellQuant : ระบบวิเคราะห์หาตำแหน่งและจำนวนเซลล์
สำหรับภาพชิ้นเนื้อที่ย้อมสารเรืองแสง เพื่อการใช้งานทางการแพทย์ด้วยเทคโนโลยีปัญญาประดิษฐ์ โดย ผศ.ดร.อัญมณี ฉัตรศิริศุภชัย และ อ.ดร.ปณิธิ อัจฉราฤทธิ์ อาจารย์จากวิทยาลัยแพทยศาสตร์ศรีสวางควัฒน และ น.ส.ณิชาพัชร์ นบนอบ จากวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ได้รับรางวัลเหรียญเงิน (Silver Medal) โดย CRA CellQuant คือ เว็บแอปพลิเคชันที่เป็นมิตรต่อผู้ใช้ในการวิเคราะห์ตำแหน่งและจำนวนเซลล์สำหรับภาพอิมมูโนพยาธิวิทยาด้วยเทคโนโลยีปัญญาประดิษฐ์ นวัตกรรมเทคโนโลยีนี้ทำให้กระบวนการวิเคราะห์เซลล์เป็นไปอย่างรวดเร็วและแม่นยำ และสามารถนำไปใช้งานทางด้านวิจัยทางวิชาการ การวินิจฉัยทางคลินิก และการพัฒนาทางเภสัชกรรมได้อย่างมีประสิทธิภาพ อีกทั้งยังลดเวลาในการวิเคราะห์จากระบบอัตโนมัติของปัญญาประดิษฐ์อีกด้วย
อัพเดตประกาศล่าสุด พฤษภาคม
คลินิกพิเศษศัลยกรรมกระดูก-ทรวงอก-ทั่วไป-ตกแต่ง รพ.สมุทรปราการ
หน่วยเวชศาสตร์ครอบครัว คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกเวชศาสตร์ครอบครัว
**เปิดรับผู้ป่วยที่ไม่มีนัดหมายจำกัด**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันอังคาร เวลา16.00-19.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396330 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ตรวจรักษาโรคทั่วไปและโรคเรื้อรังที่ไม่ซับซ้อน ครอบคลุมบริการด้านการดูแลรักษา ส่งเสริมสุขภาพ ป้องกันโรค สำหรับผู้ป่วยอายุ 15 ปีขึ้นไป
หน่วยตรวจผู้ป่วยนอกเวชศาสตร์ครอบครัว เปิดให้บริการตรวจรักษาผู้ป่วยโดยให้บริการเป็นรายคลินิก ดังนี้
1.คลินิกเวชศาสตร์ครอบครัว ให้บริการตรวจรักษาสำหรับผู้ป่วยอายุมากกว่า 15 ปี ให้การ ตรวจรักษาการเจ็บป่วยด้วยโรคทั่วไปและโรคเรื้อรังที่ไม่ซับซ้อน บริการส่งเสริมสุขภาพ เช่น ตรวจสุขภาพทั่วไป ตรวจร่างกายประจำปี และการขอรับบริการวัคซีนป้องกันโรค
2. คลินิกอาชีวเวชศาสตร์ รับปรึกษา ตรวจรักษา และติดตามปัญหาสุขภาพ หรือโรคที่อาจจะเกี่ยวข้องกับการทำงาน ตรวจความพร้อมในการทำงาน ตรวจสุขภาพประจำปีของผู้ปฏิบัติงานที่มีปัจจัยเสี่ยงต่อการเกิดปัญหาสุขภาพ
คลินิกในเวลาราชการ : **เฉพาะผู้ป่วยนัดหมาย**
วันอังคาร เวลา 13.00–16.00 น. (ยกเว้นสัปดาห์ที่ 4 ของเดือน)
3. คลินิกบุคลากร ให้บริการตรวจรักษาการเจ็บป่วยและปัญหาสุขภาพของบุคลากรและครอบครัวสายตรงของบุคลากร (อายุมากกว่า 15 ปี) สังกัดคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี รวมถึง การตรวจสุขภาพประจำปี และการขอรับบริการวัคซีนป้องกันโรคของบุคลากร
คลินิกในเวลาราชการ :
วันจันทร์-พุธ เวลา 09.00–12.00 น.
4. คลินิกสูงวัยไม่ล้ม ให้บริการในการตรวจ ประเมินและติดตามความเสี่ยงในการพลัดตกหกล้ม ในกลุ่มผู้สูงอายุ (อายุมากกว่า 65 ปี) ที่มีปัญหาเรื่องการทรงตัวผิดปกติหรือมีประวัติหกล้มภายในระยะเวลา 6 เดือนก่อนเข้ารับบริการ ซึ่งผู้ป่วยกลุ่มนี้มักพบว่ามีความเสี่ยงในการหกล้มซ้า ผู้ป่วยจะได้รับการตรวจและประเมินจากแพทย์เวชศาสตร์ครอบครัว แพทย์เวชศาสตร์ฟื้นฟู และทีมนักกายภาพบำบัด เพื่อวางแผนการดูแลร่วมกับครอบครัว / ผู้ดูแล เพื่อการป้องกันการหกล้มซํ้า
คลินิกในเวลาราชการ : **เฉพาะผู้ป่วยนัดหมาย**
วันพุธ เวลา 09.00-12.00 น. (เฉพาะสัปดาห์ที่ 1 และ 3 ของเดือน)
5. คลินิกดูแลสุขภาพต่อเนื่อง ให้บริการตรวจรักษาโรคในกลุ่มผู้ป่วยทั่วไป เป็นบริการสนับสนุนพันธกิจด้านแพทยศาสตร์ศึกษา ที่ผู้ป่วยจะต้องรับทราบและยินดีที่จะเข้ารับบริการตรวจรักษากับอาจารย์แพทย์ โดยมีนักศึกษาแพทย์ร่วมเรียนรู้การซักประวัติและตรวจร่างกายด้วย
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ 08.00-16.00 น.
**ยกเว้นวันพุธ เวลา 09.00–12.00 น.
คลินิกต่างๆ ของบริการนอกเวลา รพ.นครพิงค์
คลินิกอายุรกรรม
ให้บริการดูแลรักษาปัญหาสุขภาพของผู้ป่วย ตั้งแต่ภาวะเจ็บป่วยเฉียบพลันจนถึงเจ็บป่วยเรื้อรังต่างๆ อย่างครบวงจรโดยทีมแพทย์ด้านอายุรกรรม ที่ได้รับวุฒิบัตรจากแพทยสภาให้บริการรักษาผู้ป่วยที่เป็นโรคทางอายุรกรรมทั่วไปที่มีประสบการณ์ เกี่ยวกับการตรวจรักษาโรค ผู้ป่วยที่มีปัญหาในโรคต่างๆ หรือผู้สูงอายุ ที่ต้องการการดูแลเป็นพิเศษ ทั้งการรักษาและ การดูแลสุขภาพการป้องกันโรคเพื่อให้ผู้ป่วยมีสุขภาพแข็งแรง และมีแนวทางในการป้องกันโรคต่างๆ รวมทั้งการให้บริการโดยแพทย์ทางเลือก
คลินิกกุมารเวชกรรม
บริการตรวจรักษาโรคเด็กทั่วไป โรคเฉพาะทางในเด็ก และคลินิกสุขภาพเด็กดี
1.คลินิกโรคระบบต่อมไร้ท่อและความสูง
ตรวจวินิจฉัยและรักษาโรคเบาหวานในเด็ก โรคไทรอยด์เป็นพิษ โรคขาดไทรอยด์ฮอร์โมนโรคอ้วน ภาวะเด็กตัวเตี้ยตัวเล็กและภาวะตัวสูงผิดปกติภาวะหนุ่มสาวช้าและเร็วกว่าปกติโรคต่อมใต้สมองทำงานบกพร่อง
โดยกุมารแพทย์เฉพาะทางระบบต่อมไร้ท่อและเมตาบอลิสม
2. คลินิกโรคหัวใจในเด็ก
ตรวจวินิจฉัยและรักษาผู้ป่วยเด็กโรคหัวใจและหลอดเลือด รวมถึงโรคหัวใจพิการแต่กำเนิด ภาวะหัวใจเต้นผิดปกติ เยื่อหุ้มหัวใจอักเสบกล้ามเนื้อหัวใจอักเสบ ลิ้นหัวใจอักเสบ หลอดเลือดหัวใจโป่ง ไข้รูห์มาติก และโรคคาวาซากิ
โดยกุมารแพทย์เฉพาะทางโรคหัวใจ
3.คลินิกทารกแรกเกิด
ตรวจรักษาโรคในทารกแรกเกิดประเมินพัฒนาการและติดตามสุขภาพของทารกแรกเกิดที่คลอดก่อนกำหนด ทารกที่เจ็บป่วยหลังจำหน่ายออกจากโรงพยาบาล
โดยกุมารแพทย์เฉพาะทางทารกแรกเกิดและปริกำเนิด
4. คลินิกโรคระบบทางเดินหายใจและภูมิแพ้
ตรวจวินิจฉัยและรักษาผู้ป่วยกลุ่มทางเดินหายใจและโรคปอด รวมถึงอาการจมูกอักเสบจากภูมิแพ้ ไซนัสอักเสบหลอดลมอักเสบปอดติดเชื้อ โรคปอดเรื้อรังในเด็ก โรคหอบหืด นอนกรน และอาการต่างๆ ที่เกิดขึ้นจากโรคปอดในเด็ก
โดยกุมารแพทย์เฉพาะทางโรคระบบทางเดินหายใจ
บริการคลินิกสุขภาพเด็กดี
บริการฉีดวัคซีน พร้อมทั้งให้บริการพิเศษ ได้แก่
- บริการตรวจสุขภาพเด็กตามวัย
- บริการฉีดวัคซีนทางเลือกและวัคซีนเสริมในเด็กที่มีภาวะเสี่ยงสูง
- บริการตรวจประเมินพัฒนาการและให้คำแนะนำเรื่องการเลี้ยงดูตามวัย
คลินิกศัลยกรรม
ให้บริการทางด้านศัลยกรรมครบทุกสาขา ทั้งจากการเจ็บป่วยและจากอุบัติเหตุ รวมถึงการศัลยกรรมด้านความงาม ส่งเสริมและฟื้นฟูสภาพแก่ผู้ป่วยโรคทางศัลยกรรม
มีทีมศัลยแพทย์เฉพาะทางที่มากประสบการณ์ ในแต่ละสาขาได้แก่
- ศัลยกรรมลำไส้ใหญ่ และทวารหนัก
- ศัลยกรรมระบบทางเดินปัสสาวะ
- ศัลยกรรมตกแต่ง
- ศัลยกรรมเต้านม และมะเร็งเต้านม
- ศัลยกรรมระบบประสาท
- ศัลยกรรมตับ และทางเดินน้ำดี
- ศัลยกรรมส่องกล้อง
- ศัลยกรรมของกระดูก ข้อ เส้นเอ็น เส้นประสาท กล้ามเนื้อแขนและกระดูกสันหลัง เช่น กระดูกหักจากอุบัติเหตุ เอ็นเส้นประสาทขาดจากของมีคม
- ศัลยกรรมทั่วไป
+++++
คลินิกจิตเวช
ให้บริการผู้ป่วยที่มีปัญหาสุขภาพจิตในเด็กและวัยรุ่น เช่น โรคสมาธิสั้น โรคออทิสติก ปัญหาการเรียนรู้ ปัญหาทางพฤติกรรม และบริการตรวจประเมินทางจิตวิทยาคลินิก เช่น ประเมินความสามารถทางสติปัญญา ประเมินความสามารถทางการเรียน ประเมินสภาพจิตประกอบการขอใบรับรองต่างๆ ให้บริการโดยแพทย์ผู้เชี่ยวชาญเฉพาะทาง
บริการคลินิก
1. บริการผู้ป่วยนอกจิตเวชทั่วไป/จิตเวชเด็กและวัยรุ่น
2. บริการผู้ป่วยในที่มีปัญหาทางจิตเวชทั่วไป/จิตเวชเด็กและวัยรุ่น
คลินิกพิเศษเฉพาะทางศัลยกรรม นอกเวลาราชการ
คลินิกพิเศษเฉพาะทางศัลยกรรม นอกเวลาราชการ เปิดบริการวันจันทร์ อังคาร พุธ เวลา16.30-20.30น. งานส่องกล้องทั้งอายุรกรรมและศัลยกรรม ในวันเสาร์ เวลา 8.30-12.00น. สอบถามเพิ่มเติม/นัดหมายล่วงหน้า ได้ที่ 055 409999 ต่อ5225 หรือ 061 3453904
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันอังคาร
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี
สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
สิทธิบัตรทอง ≠ ซื้อยา
สิทธิบัตรทอง ≠ ซื้อยา
เภสัชกร จะสอบถามอาการและจ่ายยาให้ตามอาการ (16 อาการจ่ายยาให้ฟรี)
คนป่วยไม่สามารถเรียกขอยาได้เองตามชอบใจ
ซึ่งหากเรียกประสงค์จะขอยาเอง หรือ เลือกยี่ห้อยาเอง ก็จะต้องชำระเงินเอง
ไม่สามารถเรียกหาสินค้า หรือ เปลี่ยน แทน การชำระเงิน ได้
แนวทาง
Healthcare Asia Awards วางแนวทางในการเปิดรับ การพิจารณา และขอบเขต ไว้ดังนี้
- การเสนอชื่อเปิดกว้างสำหรับโรงพยาบาลและบริษัทด้านการดูแลสุขภาพทั้งหมดในภูมิภาคเอเชียแปซิฟิก
- แต่ละแห่ง สามารถเสนอชื่อได้สูงสุด 4 ประเภทเท่านั้น
- คณะผู้เชี่ยวชาญที่ได้รับเลือกในอุตสาหกรรมการดูแลสุขภาพจะประเมินและให้คะแนนการเสนอชื่อแต่ละรายการโดยพิจารณาจากข้อเขียนและเอกสารประกอบที่ส่งมา
- แบบฟอร์มการเสนอชื่อแต่ละรายการสามารถใช้ได้สำหรับ 1 รายการเท่านั้น หากคุณกำลังเสนอชื่อเข้าชิงหลายประเภท โปรดป้อนแต่ละรายการแยกกัน
- กำหนดเส้นตายในการส่งผลงานคือวันที่ 9 กุมภาพันธ์ 2024
- การเสนอชื่อไม่มีค่าใช้จ่าย หากคุณชนะ โดยการเลือกหนึ่งในตัวเลือกแพ็คเกจผู้ชนะ คุณสามารถจองที่นั่งในงานเลี้ยงอาหารค่ำอันทรงเกียรติ และรับสิทธิ์เข้าถึงสิทธิประโยชน์อันมีค่ามากมาย
คุณสมบัติ
เพื่อให้มีสิทธิ์ได้รับรางวัล โครงการ/บริการ/ความคิดริเริ่มต้องเป็นอย่างใดอย่างหนึ่ง:
- เปิดตัวในช่วง 24 เดือนที่ผ่านมา
- เปิดตัวก่อน 24 เดือนตามปฏิทิน แต่มีนวัตกรรมล่าสุดเพื่อปรับปรุงโครงการ/บริการ/ความคิดริเริ่ม
ศูนย์บริการสาธารณสุข กรุงเทพกลาง และ กรุงเทพตะวันออก
กรุงเทพกลาง
- ดินแดง ศูนย์บริการสาธารณสุข 4 / ศูนย์บริการสาธารณสุข 52
- ดุสิต ศูนย์บริการสาธารณสุข 38
- ป้อมปราบศัตรูพ่าย ศูนย์บริการสาธารณสุข 20
- พญาไท ศูนย์บริการสาธารณสุข 11
- พระนคร ศูนย์บริการสาธารณสุข 9
- ราชเทวี ศูนย์บริการสาธารณสุข 2
- วังทองหลาง ศูนย์บริการสาธารณสุข 15
- สัมพันธวงศ์ ศูนย์บริการสาธารณสุข 13
- ห้วยขวาง ศูนย์บริการสาธารณสุข 25
กรุงเทพตะวันออก
- คลองสามวา ศูนย์บริการสาธารณสุข 64
- คันนายาว ศูนย์บริการสาธารณสุข 69
- บางกะปิ ศูนย์บริการสาธารณสุข 35
- บึงกุ่ม ศูนย์บริการสาธารณสุข 50 / ศูนย์บริการสาธารณสุข 56
- ประเวศ ศูนย์บริการสาธารณสุข 22 / ศูนย์บริการสาธารณสุข 57
- มีนบุรี ศูนย์บริการสาธารณสุข 43
- ลาดกระบัง ศูนย์บริการสาธารณสุข 45
- สะพานสูง ศูนย์บริการสาธารณสุข 68
- หนองจอก ศูนย์บริการสาธารณสุข 44
51 ศูนย์พัฒนาเด็กก่อนวัยเรียนฟื้นนครร่มเกล้าระยะ 2 โซน 9
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
52 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนจิตรา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
53 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดบำรุงรื่น
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
54 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมิตรปลูกศรัทธา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
55 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองสำมดตะนอยสร้างสรรค์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
56 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองศิริวังพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
57 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองดารุ้ลชุนนี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
58 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองนูรุดดีน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
59 ศูนย์พัฒนาเด็กก่อนวัยเรียนดารุ้ลนาซีฮะห์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
60 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองหมู่ 9 ฮัล-ฮุดา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
61 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองฮาซานุดดีน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
62 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองดารุ้ลฮาซานัย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
63 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองอินดารุ้ลมีนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
64 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองนูรุ้ลยากีน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
65 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองภักดีธรรม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
66 ศูนย์พัฒนาเด็กก่อนวัยเรียนเนี๊ยะมาตุ้ลมักบูลีน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
67 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองนูรุสลาม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
68 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองยายชุ่มอุทิศ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
69 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองหมู่ 2 สื่อสันติ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
70 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองคอยรุตตั๊กวา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
71 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองสะฟีรุสซาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
72 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองวัดพระยาปลา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
73 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนกิตติเหมกรณ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
74 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองวัดแสนเกษม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
75 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนนูรุ้ลลอฮ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
76 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองดารู้ลอะมาน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
77 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองวัดลำต้อยติ่ง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
78 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองวัดราษฎร์บำรุง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
79 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองซอลีฮุ้ลมุสลีมีน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
80 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองนูรุ้ลเอี๊ยะซาน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
81 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมัสยิดบ้านสมเด็จ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
82 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบ้านสวนพลู
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
83 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมัสยิดสุวรรณภูมิ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
84 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพิชัยญาติ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
85 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนซอยวัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
86 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดอัมพวา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
87 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแสงหิรัญ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
88 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสะพาน 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
89 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนรัตนจีนะ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
90 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสถาพร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
91 ศูนย์พัฒนาเด็กก่อนวัยเรียนศูนย์รวมน้ำใจ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
92 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดสน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
93 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาตลาดกลาง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
94 ศูนย์พัฒนาเด็กก่อนวัยเรียนเสนานิคม 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
95 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนประชาร่วมใจ 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
96 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพหลโยธิน32 (วังหิน)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
97 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสวนผัก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
98 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุวรรณประสิทธิ์ 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
99 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุวรรณประสิทธิ์ 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
100 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหน้าสมาคมธรรมศาสตร์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
2. Health Tech วิคตอเรีย การ์เด้นส์
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ สาขา วิคตอเรีย การ์เด้นส์ เพชรเกษม 69 อยู่ลานจอดรถ P5 เปิดบริการทุกวัน 8.00- 20.00 น. บริการตรวจ - ตรวจรักษาโดยปรึกษาแพทย์ทางไกลพร้อมรับยา - เจาะเลือดตรวจ Lab - ออกใบรับรองแพทย์ 5 โรค - คัดกรองประเมินความเสี่ยงสุขภาพเบื้องต้น ฟรี! พร้อมดูแลอาการ เจ็บป่วย 42 กลุ่มโรค/อาการ และ 12 กลุ่มโรคไม่ติดต่อเรื้อรัง มีเจ้าหน้าที่และพยาบาลวิชาชีพประจำ พร้อมให้บริการ
ศ. พญ.นิจศรี ชาญณรงค์ รองคณบดี ฝ่ายบริการวิชาการคณะ แพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เผยว่า นับจากเริ่มเปิดตัวเมื่อเดือน มิถุนายน ปี พ.ศ. 2565 จวบจนถึงปัจจุบัน “MedUMORE” มีผู้เข้าชมครบ มากกว่า 2 ล้านครั้ง ซึ่งเห็นได้ว่าแพลตฟอร์ม MedUMORE นี้ สามารถตอบโจทย์เรื่องความรู้ทาง การแพทย์ให้แก่ผู้ที่สนใจ ไม่ว่าจะเป็นนิสิตแพทย์ บุคลากรทางการแพทย์ รวมถึงประชาชน ทั่วไป สามารถเข้ามาเรียนรู้ได้แบบไร้ขีดจำกัด สะดวกดูได้ทุกพื้นที่และเข้าใจง่าย ซึ่งองค์ ความรู้ที่ให้บริการมีหลากหลายรูปแบบ อาทิ E-Book คลิปวิดีโอ และเทคโนโลยี เสมือนจริง AR/VR ซึ่งเร็ว ๆ นี้ จะมีการนำเทคโนโลยี AI GPT Integration และ Multi Visual Learning เข้ามาเป็นตัวช่วยการเรียนรู้ให้กับผู้เรียนด้วย
ซึ่งทิศทางการดำเนินงานในอนาคตอันใกล้ “MedUMORE” จะขยายความร่วมมือ กับกลุ่มพันธมิตรไปในองค์กรต่าง ๆ ทั้งในประเทศและต่างประเทศเพิ่มขึ้น เพื่อให้มีข้อมูล ที่หลากหลาย เหมาะกับนิสิตนักศึกษาแพทย์ยุคใหม่ที่ต้องการข้อมูล ความรู้ที่รวดเร็ว ทันสมัย จนในที่สุด จะสามารถพัฒนาให้ “MedUMORE” เป็นศูนย์กลางความรู้ออนไลน์ ด้านการแพทย์ที่ครอบคลุมที่สุด พร้อมทั้งจัดระบบองค์ความรู้ด้านการแพทย์ที่มีอยู่ใน หลาย Platform ให้อยู่ในที่เดียวกัน เพื่อเชื่อมต่อให้ผู้ใช้งานสามารถเข้าถึงได้สะดวก รวดเร็วและปลอดภัย นอกจากนี้ยังมีการจัดประชุมวิชาการในรูปแบบใหม่ โดยที่จะบูรณา การองค์ความรู้ทางการแพทย์ สู่ความเป็นเลิศลดความเหลื่อมล้ำ ในการเข้าถึงระบบการ ศึกษา และสร้างความเท่าเทียมด้านสาธารณสุข รวมทั้งเป็นผู้นำและศูนย์กลางการเรียนรู้ ระดับนานาชาติ
ทริปที่ 2 โปรแกรมสัมผัสประสบการณ์เมืองสามหมอก เส้นทาง กรุงเทพ – แม่ฮ่องสอน - เชียงใหม่
ทริปที่ 2 โปรแกรมสัมผัสประสบการณ์เมืองสามหมอก เส้นทาง กรุงเทพ – แม่ฮ่องสอน - เชียงใหม่ (เดินทางด้วยขบวนอุตราวิถีขบวน 9 และขบวน 10) วันที่ 20 - 25 สิงหาคม 2567 จำนวน 6 วัน 5 คืน (นอนบนรถไฟ 2 คืน) อัตราค่าโดยสารท่านละ 14,999 บาท (จำกัดทริปละ 38 ที่นั่งเท่านั้น)
กำหนดการ
- วันที่ 1 อุทยานแห่งชาติออบหลวง / สวนสนบ่อแก้ว / พิพิธภัณฑ์แม่สะเรียง / สักการะวัดพระธาตุจอมแจ้ง / วัดพระธาตุจอมทอง / วัดพระธาตุจอมกิตติ และ วัดพระธาตุจอมมอญ
- วันที่ 2 หมู่บ้านชาวกะเหรี่ยงคอยาว (บ้านห้วยเสือเฒ่า) / สักการะพระราตุดอยกองมู / วัดจองกลาง - วัดจองคำ / ชมวิวหลักล้านพร้อมชิมชา ณ บ้านรักไทย
- วันที่ 3 โครงการพระราชดำริปางตอง 2 (ปางอุ๋ง) / หมู่บ้านสันติชล / วัดน้ำฮู / พระธาตุแม่เย็น / ถนนคนเดินเมืองปาย
- วันที่ 4 สะพานประวัติศาสตร์ท่าปาย / อุทยานแห่งชาติห้วยน้ำดัง / ตลาดวโรรส
นอกจากนี้ยังมีไฮไลท์ที่เราตั้งใจเพิ่มมาปีนี้ให้สอดคล้องกับสถานการณ์ปัจจุบันที่เราไม่ได้เผชิญแค่โลกร้อนเท่านั้น แต่กำลังเข้าสู่ภาวะโลกเดือด เพื่อสร้างความตระหนักถึงประเด็นนี้ จึงนำการทดลองเชิงปฏิบัติการในการวัดการกักเก็บคาร์บอนในต้นไม้เข้ามาในค่าย เพื่อสร้างแรงบันดาลใจให้น้องๆ มีส่วนช่วยในการลดคาร์บอนในชีวิตประจำวัน สิ่งที่เราเห็นความเปลี่ยนแปลงได้อย่างชัดเจนเลยคือพอน้องๆ เรียนเรื่องนี้แล้ว ทุกคนพยายามไม่ทานข้าวเหลือเพราะตระหนักเรื่อง Food Waste และพยายามปิดไฟทุกครั้งที่ไม่ใช้งาน ทำให้เห็นว่าสิ่งที่เราพยายามสอดแทรกค่อยๆ ซึมซับเข้าหาน้องรุ่นต่อไปจริงๆ”
ในฐานะผู้ริเริ่มโครงการฯ มร. ชาร์ลส โทลิเอต์ ผู้อำนวยการฝ่ายขายกลุ่มธุรกิจยา ซาโนฟี่ ประเทศไทย และหัวหน้าโครงการฯ ให้ข้อมูลว่าโครงการ ‘โรงเรียนสุขสันต์ รู้ทันเบาหวาน’ (หรือ KiDS) ในประเทศไทย เป็นการสานต่อโครงการความร่วมมือระหว่างซาโนฟี่ ร่วมกับ สมาพันธ์เบาหวานนานาชาติ (IDF) และสมาคมนานาชาติเพื่อเบาหวานในเด็กและวัยรุ่น (ISPAD) ซึ่งได้เริ่มทำโครงการนี้ ตั้งแต่ปี พ.ศ. 2556 และยังได้เผยแพร่ไปในประเทศอื่นๆ ทั่วโลก กว่า 50 ประเทศ เพื่อรณรงค์สร้างความตระหนักรู้เกี่ยวกับโรคเบาหวาน เพื่อส่งเสริมสภาพแวดล้อมที่ปลอดภัยและเป็นมิตรให้กับกลุ่มเด็กที่เป็นเบาหวาน และป้องกันการเกิดเบาหวานชนิดที่ 2 ในเด็ก ซึ่งเน้นการส่งเสริมให้เด็กมีพฤติกรรมที่ส่งเสริมสุขภาพ ทั้งด้านอาหาร ออกกำลังกาย นอนหลับพักผ่อนให้เพียงพอ ซาโนฟี่จึงยินดีเป็นอย่างมากที่ได้ริเริ่มและสนับสนุนการดำเนินโครงการ KiDS ในประเทศไทย ร่วมกับทุกภาคส่วนที่เกี่ยวข้อง


นายยูจิ ชิมิซึ ประธานกรรมการ บริษัท คาโอ อินดัสเตรียล (ประเทศไทย) จำกัด กล่าวว่า “คาโอดำเนินธุรกิจด้วยความมุ่งมั่นในการพัฒนาคุณภาพชีวิตของคนไทย และได้ตระหนักถึงภัยร้ายของโรคไข้เลือดออกโดยได้ดำเนินโครงการ “GUARD OUR FUTURE” ต่อเนื่องเป็นปีที่ 3 เพื่อปกป้องให้ผู้คนให้ห่างไกลและปลอดภัยจากยุง ซึ่งในส่วนแรกของโครงการเรามุ่งเน้นในการทำงานร่วมกับภาครัฐ ภาคอุตสาหกรรม และสถาบันศึกษา โดยในปีนี้คาโอได้สนับสนุนการวิจัยและพัฒนาฟีเจอร์ “Mosquito Bite Crowdsourcing” ในแอปพลิเคชัน “รู้ทัน” หรือแอปแจ้งเตือนภัยสุขภาพที่อยู่รอบตัว ซึ่งดำเนินการโดย เนคเทค สวทช. และกรมควบคุมโรค เพื่อเป็นเครื่องมือให้ประชาชนเข้ามาร่วมช่วยกันรายงานสถานการณ์ของยุงตรงพื้นที่ที่ตนอาศัยอยู่ จากการทำงาน หรือทำกิจกรรมใด ๆ ได้จากทั่วประเทศ โดยข้อมูลการรายงานนี้ จะนำมาช่วยเสริมการตรวจจับการระบาดในการป้องกันควบคุมโรคไข้เลือดออกต่อไป อีกทั้งคาโอยังให้ความสำคัญกับการป้องกันการแพร่ระบาดระดับประเทศ ได้ทำการสนับสนุนผลิตภัณฑ์ป้องกันยุงให้ทางกรมควบคุมโรคอย่างต่อเนื่องเพื่อลดการแพร่ระบาดจากโรคไข้เลือดออกในวงกว้าง และในส่วนที่ 2 ของโครงการ คาโอมุ่งเน้นการพัฒนาเทคโนโลยีให้เกิดผลิตภัณฑ์ใหม่เพื่อปกป้องผู้คนให้ห่างไกลจากยุง ซึ่งล่าสุดในปีนี้คาโอได้เปิดตัวนวัตกรรมใหม่ที่โดดเด่นด้านความปลอดภัย สามารถใช้ผลิตภัณฑ์ป้องกันยุงได้และไม่รบกวนกิจวัตรประจำวันอีกด้วย”
ลงทะเบียนสุนัขแมวในจ.ภูเก็ต
เทศบาลนครภูเก็ต ขอเชิญท่านเจ้าของสัตว์เลี้ยงในเขตเทศบาลนครภูเก็ต ลงทะเบียนสุนัขและแมว รวบรวมเป็นฐานข้อมูลประชากรสัตว์เลี้ยงในพื้นที่ เพื่อการให้บริการทำหมันและฉีดวัคซีนป้องกันโรค ลงทะเบียนได้ง่ายๆ เพียงสแกนคิวอาร์โค้ด หรือเข้าเว็บไซต์
https://goo.gl/EoXymF เพื่อกรอกรายละเอียดข้อมูลสัตว์เลี้ยง สัตว์ปลอดโรค คนปลอดภัย ร่วมใจกันลงทะเบียนสุนัขและแมวกันนะคะ สอบถามรายละเอียดเพิ่มเติมได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลนครภูเก็ต โทร. 076 - 211570
มร.ดิเบียนดู โบส (Dibyendu Bose) รองผู้อำนวยการฝ่ายยุทธศาสตร์ นวัตกรรมและการพัฒนาของศศินทร์ กล่าวถึงเป้าหมายของสัปดาห์ Sasin IEW ในการส่งเสริมนวัตกรรม การเปิดกว้าง และการเปลี่ยนแปลงเชิงบวก “เรากำลังสร้างศูนย์กลาง แพลตฟอร์ม และระบบนิเวศที่คึกคักที่ซึ่งผู้ประกอบการ สตาร์ทอัพ นักลงทุน ผู้กำหนดนโยบาย และแม้แต่คนทั่วไปสามารถมารวมตัวกันเพื่อจุดประกายนวัตกรรม สร้างสังคมที่เปิดกว้าง และขับเคลื่อนการเปลี่ยนแปลงเชิงบวก เราได้จัดกิจกรรมที่น่าตื่นเต้นมากมายใน Sasin IEW รวมถึงการประชุมสุดยอด GCEC NEW FRONTIER: BANGKOK SUMMIT 2024 ที่จะมาเจาะลึกว่าทักษะการเป็นประกอบการนั้นช่วยเสริมพลังให้สังคมและธุรกิจได้อย่างไร” มร.ดิเบียนดู ปิดท้ายด้วยการกล่าวขอบคุณผู้สนับสนุน ได้แก่ สมาคมส่งเสริมจริยธรรมและธรรมาภิบาลไทย, ธนาคารกสิกรไทย จำกัดมหาชน, โรงแรมชาเทรียม แกรนด์ กรุงเทพ, มูลนิธิแม่ฟ้าหลวงในพระบรมราชูปถัมภ์, โคคาโคลา ไทยน้ำทิพย์, กลุ่มบริษัท ไทยเบฟเวอเรจ จำกัด (มหาชน), เดอะเกรทรูม, ยิปอินซอย, เซนทิเนล โซลูชั่น ไทยแลนด์ และจุฬาลงกรณ์มหาวิทยาลัย
พญ. ภาสินี เตชะวิจิตร์ แพทย์ผู้ชำนาญการเฉพาะทางกุมารเวชศาสตร์ทารกแรกเกิดและปริกำเนิด โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรงพยาบาลบำรุงราษฎร์มีแผนกบำบัดพิเศษทารกแรกเกิด หรือ Neonatal Intensive Care Unit (NICU) ซึ่งให้การดูแลทารกมามากกว่า 30,000 ราย เรามีกุมารแพทย์ทารกแรกเกิด ที่มีความชำนาญและมีประสบการณ์สูง โดยจะดูแลทารกแรกเกิดให้ปลอดภัยจากเหตุการณ์ไม่คาดฝัน รวมถึงความผิดปกติที่อาจเกิดขึ้นได้ระหว่างคลอด ไม่ว่าจะเป็น การคลอดที่ใช้ระยะเวลาในระหว่างการคลอดยาวนานเกินไป คลอดยาก หรือทารกอยู่ในท่าผิดปกติ จึงต้องมีทีม NICU อยู่ดูแลตั้งแต่ในห้องคลอดจนกระทั่งทารกมีร่างกายแข็งแรงพร้อมที่จะออกจากโรงพยาบาล
ที่ NICU เรามีทุกความพร้อมในการดูแลทารกแรกเกิดที่ต้องการการดูแลเป็นพิเศษเพื่อความปลอดภัยสูงสุดตลอด 24 ชั่วโมง ไม่ว่าจะเป็นสถานที่ตั้งของ NICU ที่อยู่เชื่อมติดกับห้องคลอด ทำให้สามารถเคลื่อนย้ายทารกได้อย่างรวดเร็วหลังทำการคลอด และยังช่วยป้องกันอันตรายที่อาจเกิดระหว่างการเคลื่อนย้าย รวมถึง มีห้องผ่าตัดอยู่ใน NICU ทำให้สามารถช่วยเหลือทารกได้อย่างทันท่วงที หากเกิดภาวะฉุกเฉินที่ต้องเข้ารับการผ่าตัด นอกจากนี้ มีบุคลากรทางการแพทย์ที่ได้รับการอบรมเฉพาะทางที่พร้อมให้การดูแล ได้แก่ แพทย์ผู้เชี่ยวชาญทางด้านทารกแรกเกิด ซึ่งเป็นแพทย์เฉพาะทางการดูแลรักษาทารกที่มีภาวะผิดปกติ พยาบาลวิชาชีพที่ได้รับการอบรมเฉพาะทาง ผ่านประสบการณ์โดยตรงที่ดูแลทารกแรกเกิดมานานกว่า 20 ปี รวมถึงกุมารศัลยแพทย์เฉพาะทางด้านต่าง ๆ ที่ให้การผ่าตัดในกรณีที่เด็กเกิดภาวะผิดปกติ และทารกที่จำเป็นต้องได้รับการผ่าตัดตั้งแต่แรกเกิด ไม่เพียงเท่านั้น NICU มีอุปกรณ์และเครื่องมือทางการแพทย์ที่ครบครัน สำหรับทารกแรกเกิดที่ต้องได้รับการดูแลเป็นพิเศษโดยเฉพาะ เช่น เครื่องช่วยหายใจชนิดความถี่สูง สำหรับทารกแรกเกิดที่มีปัญหาเกี่ยวกับระบบทางเดินหายใจ เครื่องเฝ้าติดตามการทำงานของสัญญาณชีพ และเครื่องส่องไฟรักษาภาวะตัวเหลืองในทารกแรกเกิด
ด้านตัวแทนนักเรียนชั้น ม.6 จาก โรงเรียนวชิราวุธวิทยาลัย เผยว่า
วันนี้ที่มาโอเพ่นเฮ้าส์ของราชวิทยาลัยจุฬาภรณ์ เรียกได้ว่าไม่ผิดหวังเลย เพราะได้รับการต้อนรับอย่างดี มีกิจกรรมแน่นด้วยคุณภาพได้ศึกษาแล้วก็เรียนรู้ข้อมูลต่างๆ จากทุกคณะแบบวันเดียวจบ ว่ามีสาขาอะไรบ้าง และอะไรที่เราชอบเป็นพิเศษ ส่วนตัวแล้วสนใจหลักสูตรแพทยศาสตร์ เนื่องด้วยปัจจุบันและอนาคตจะมีผู้สูงอายุมากขึ้น คนรุ่นใหม่ที่เติบโตขึ้นมาควรจะได้มีส่วนช่วยเหลือบ้าง คิดว่าเรียนแพทย์แล้วเมื่อจบไปจะนำความรู้ความสามารถไปช่วยเหลือคนไข้ ช่วยเหลือสังคม นอกจากนี้ยังประทับใจกับสถานที่ มีอาคารที่ทันสมัยมาก สภาพแวดล้อมดี ตั้งอยู่ใจกลางเมือง สะดวกในการเดินทาง อีกทั้งมีโครงการและกิจกรรมเพื่อสังคมให้นักศึกษาได้มีส่วนร่วมอีกมากมาย เป็นส่วนที่ทำให้ประทับใจและอยากเข้ามาศึกษาที่ราชวิทยาลัยจุฬาภรณ์แห่งนี้ในอนาคตมากๆ เลยครับ”
การตลาดที่แพร่หลาย
เยาวชนเป็นเป้าหมายการโฆษณา โปรโมชั่นส่งเสริมการขาย และการสปอนเซอร์ มากขึ้นเรื่อยๆ โดยเฉพาะในสื่อดิจิทัลพวกเขาคุ้นเคยและนิยม อุตสาหกรรมหลบเลี่ยงข้อบังคับต่างๆ ระดับชาติด้วยการโฆษณาดิจิทัลข้ามพรมแดน บนแพลตฟอร์มยอดนิยมระดับโลกเช่น Instagram และ TikTok
นอกจากนี้ อุตสาหกรรมยังมีการทดลองเข้าถึงตลาดดิจิทัลแพลตฟอร์มใหม่ที่เกิดขึ้น เช่น Metaverse สินค้าที่พยายามส่งเสริม มีตั้งแต่บุหรี่ บิดิ (bidi ยาเส้นมวน) หรือ ยาสูบไร้ควัน ไปจนถึง บุหรี่ไฟฟ้า ผลิตภัณฑ์ยาสูบที่ใช้ความร้อน และนิโคตินกระเป๋า (nicotine pouches)
การเผยแพร่ผลิตภัณฑ์เหล่านี้ ผ่านแพลตฟอร์ม ส่งผลกระทบต่อพฤติกรรม มีการศึกษาพบว่า การใช้แพลตฟอร์มโซเชียลมีเดียเดียวทุกวัน ในกลุ่มนักเรียนมัธยมต้น มีความสัมพันธ์เพิ่มขึ้นร้อยละ 3.8 ของความเสี่ยงในการใช้บุหรี่ไฟฟ้า และ เพิ่มขึ้นเป็น 6.1% ในหมู่นักเรียนมัธยมปลาย [13]
รายงานอีกฉบับ พบว่า จำนวนชั่วโมงการอยู่บนแพลตฟอร์มที่เพิ่มขึ้นต่อวัน ของนักศึกษามหาวิทยาลัยปีแรก จะเพิ่มความน่าจะเป็นที่จะเป็นผู้ใช้บุหรี่ไฟฟ้าตลอดชีวิตขึ้นอีก 4.6% [14]
มูลนิธิบ้านสงเคราะห์สัตว์พิการ (ในความอุปถัมภ์ของหลวงตามหาบัว ญาณสัมปันโน)
มูลนิธิบ้านสงเคราะห์สัตว์พิการ มีจุดเริ่มต้นจากครอบครัวคุณพิมพ์กุล โอฬารศิรโรจน์ (เรณู จุลสุคนธ์) ที่ได้ช่วยเหลือสัตว์ต่างๆ ที่พิการจนหายจากการเจ็บป่วย จึงเลี้ยงไว้เป็นเพื่อนแก้เหงา แต่เมื่อเพิ่มจำนวนมากขึ้น สถานที่คับแคบ และเป็นภาระที่ต้องเลี้ยงดู ประกอบกับสัตว์ส่งเสียงดัง ส่งกลิ่นรบกวนเพื่อนบ้าน จึงต้องย้ายสถานที่เลี้ยงออกไปนอกเมือง โดยตั้งชื่อว่า “บ้านสงเคราะห์สัตว์พิการ” ในปี พ.ศ. 2524
ต่อมาในปี 2532 คุณชวนชื่น โกมารกุล ณ นคร (ยั่งยืน) ได้ทราบข่าวและมาเยี่ยม แสดงประสงค์ให้ความช่วยเหลือ จึงจัดซื้อที่ดินบริจาค 200 ตารางวา ณ ที่ทำการมูลนิธิฯ ต.บ้านใหม่ อ.ปากเกร็ด จ.นนทบุรี พร้อมสร้างโรงเรือนถาวรให้ในปี พ.ศ. 2533 ในปี 2536 หลวงตามหาบัว ญาณสัมปันโน แห่งวัดป่าบ้านตาด จังหวัดอุดรธานี ได้เมตตามาเยี่ยมโปรดสัตว์พิการ ได้เห็นถึงสภาพปัญหา และภาระของการเลี้ยงดูสัตว์เหล่านี้ จึงจัดสร้างอาคาร และซื้อที่ดินติดกันให้อีก 1 ไร่ และอนุญาตให้ตั้งเป็น “มูลนิธิบ้านสงเคราะห์สัตว์พิการ (ในความอุปถัมภ์ของหลวงตามหาบัว ญาณสัมปันโน)” มาจนทุกวันนี้
มูลนิธิบ้านสงเคราะห์สัตว์พิการ (ในความอุปถัมภ์ของหลวงตามหาบัว ญาณสัมปันโน) 15/1 หมู่ 1 ซ.พระมหาการุณย์ 25 ถ.ติวานนท์ -ปากเกร็ด 56 ต.บ้านใหม่ อ.ปากเกร็ด จ.นนทบุรี 11120
- โทรศัพท์ : 02-584-4896, 02-961-5360
- โทรสาร : 02-961-5305 (คู่สายอัตโนมัติ)
- E-mail : home4animals@hotmail.com
- เว็บไซต์มูลนิธิ home4animals.orgอ | Facebook
มูลนิธิฯ มีสถานที่ดูแลสัตว์ป่วย สัตว์พิการ จำนวน 2 สาขา
- สาขาปากเกร็ด จ.นนทบุรี เปิดให้เข้าเยี่ยมและเล่นกับสัตว์ เวลาทำการ 11.00 – 17.00 น. เปิดทำการทุกวัน เทศกาล นักขัตฤกษ์ เปิดทำการปกติ [google map]
- สาขาบางเลน จ.นครปฐม เปิดให้เข้าเยี่ยม เดินเล่นกับสัตว์ แจกอาหารว่างสุนัขพิการและแมว เวลา 11.00-17.00 น. เปิดทำการทุกวัน เทศกาล นักขัตฤกษ์ เปิดทำการปกติ [google map]
ร่วมบริจาคสมทบทุนตามกำลังศรัทธา เพื่อช่วยเหลือสัตว์ป่วย สัตว์พิการ ให้ได้รับการดูแลต่อเนื่อง สัตว์นี้เป็นสัตว์จรจัดที่ร่างกายพิการ ช่วยเหลือตัวไม่ได้ ต้องมีคนช่วยเหลือดูแลต่อเนื่อง เรื่องแผลกดทับ ช่วยกระตุ้นปัสสาวะ บางเคสเป็นสัตว์ป่วยติดเตียงต้องคอยช่วยป้อนอาหารป้อนข้าว และพลิกตัวสม่ำเสมอ เงินบริจาคนี้จะนำไปดูแลสัตว์ทั้ง สาขาปากเกร็ด และ สาขาบางเลน
- ชื่อบัญชี: มูลนิธิบ้านสงเคราะห์สัตว์พิการ
- ประเภทบัญชี: ออมทรัพย์ สาขา: สรงประภา
ธ.กรุงเทพ เลขที่บัญชี 059-0-12305-5
ธ.กรุงศรีอยุธยา เลขที่บัญชี 332-1-08971-9
ธ.กสิกรไทย เลขที่บัญชี 422-2-20785-7
ธ.ซีไอเอ็มบีไทย เลขที่บัญชี 700-0-89011-4
ธ.กรุงไทย เลขที่บัญชี 198-0-26078-8
- ประเภทบัญชี: ออมทรัพย์ สาขา: เชิดวุฒากาศ ธ.ไทยพาณิชย์ เลขที่บัญชี 105-2-18418-1
32. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย อนุสาขาภาพวินิจฉัยชั้นสูง ระยะเวลาศึกษา +2 ปี
33. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย อนุสาขาภาพวินิจฉัยระบบประสาท ระยะเวลาศึกษา +2 ปี
34. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย อนุสาขารังสีร่วมรักษาระบบประสาท ระยะเวลาศึกษา +2 ปี
35. ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย อนุสาขารังสีร่วมรักษาของลำตัว ระยะเวลาศึกษา +2 ปี
36. ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย สาขาวิสัญญีวิทยา ระยะเวลาศึกษา 3 ปี
37. ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย อนุสาขาวิสัญญีวิทยาสำหรับเด็ก ระยะเวลาศึกษา +2 ปี
38. ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย อนุสาชาวิสัญญีวิทยาสำหรับผู้ป่วยโรคระบบประสาท ระยะเวลาศึกษา +2 ปี
39. ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย อนุสาชาวิสัญญีวิทยาสำหรับการผ่าตัดหัวใจ หลออดเลือดใหญ่และทรวงอก ระยะเวลาศึกษา +2 ปี
40. ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย อนุสาชาเวชศาสตร์ความปวด (วิสัญญีวิทยา) ระยะเวลาศึกษา +2 ปี
41. ราชวิทยาลัยแพทย์เวชศาสตร์ครอบครัวฯ สาชาเวชศาสตร์ครอบครัว ระยะเวลาศึกษา 3 ปี
42. วิทยาลัยแพทย์ฉุกเฉินแห่งประเทศไทย สาขาเวชศาสตร์ฉุกเฉิน ระยะเวลาศึกษา 3 ปี
43. วิทยาลัยแพทย์ฉุกเฉินแห่งประเทศไทย อนุสาชาเวชศาสตร์ฉุกเฉินนอกโรงพยาบาล ระยะเวลาศึกษา +2 ปี
44. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงสาธารณสุขศาสตร์ ระยะเวลาศึกษา 3 ปี
45. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์การบิน ระยะเวลาศึกษา 3 ปี
46. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาขาเวชศาสตร์ป้องกัน แขนงระบาดวิทยา ระยะเวลาศึกษา 3 ปี
47. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์ป้องกันคลินิก ระยะเวลาศึกษา 3 ปี
48. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงอาชีวเวชศาสตร์ ระยะเวลาศึกษา 3 ปี
49. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาขาเวชศาสตร์ป้องกัน แขนงสุขภาพจิตชุมชน ระยะเวลาศึกษา 3 ปี
50. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์ทางทะเล ระยะเวลาศึกษา 3 ปี
51. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาขาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์การเดินทาง ระยะเวลาศึกษา 3 ปี
52. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์การจราจร ระยะเวลาศึกษา 3 ปี
53. สมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย สาชาเวชศาสตร์ป้องกัน แขนงเวชศาสตร์วิถีชีวิต ระยะเวลาศึกษา 3 ปี
54. ราชวิทยาลัยแพทย์เวชศาสตร์ฟื้นฟูฯ สาชาเวชศาสตร์ฟื้นฟู่ ระยะเวลาศึกษา 3 ปี
55. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย สาชาศัลยศาสตร์ ระยะเวลาศึกษา 4 ปี
56. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย สาขากุมารศัลยศาสตร์ ระยะเวลาศึกษา 4 ปี
57. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย สาชาศัลยศาสตร์ตกแต่ง ระยะเวลาศึกษา 5 ปี
58. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย สาชาศัลยศาสตร์ยูโรวิทยา ระยะเวลาศึกษา 4 ปี
59. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย สาชาศัลยศาสตร์ทรวงอก ระยะเวลาศึกษา 5 ปี
60. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย อนุสาชาศัลยศาสตร์ลำไล้ใหญ่และทวารหนัก ระยะเวลาศึกษา +2 ปี
61.ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย อนุสาขาศัลยศาสตร์หลอดเลือด ระยะเวลาศึกษา +2 ปี
62. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย อนุสาขาศัลยศาสตร์อุบัติเหตุ ระยะเวลาศึกษา +2 ปี
63. ราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย อนุสาขาศัลยศาสตร์มะเร็งวิทยา ระยะเวลาศึกษา +2 ปี
นวัตกรรม AI รถอัลตราซาวด์เต้านมสามมิติและแมมโมแกรม
ภายในงาน ยังได้เปิดเวทีพูดคุยเจาะลึกถึง 5 นวัตกรรมบริการสุขภาพราชวิทยาลัยจุฬาภรณ์จาก 5 โครงการเฉลิมพระเกียรติ ฯ เปิดตัวด้วยนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติและแมมโมแกรม พร้อมนำ AI ร่วมวินิจฉัยผลกับรังสีแพทย์ โดย นพ.ศรัณย์ เลิศสถิตธนกร แพทย์เฉพาะทางด้านศัลยศาสตร์มะเร็งวิทยา โรงพยาบาลจุฬาภรณ์ และ อ.ดร.ทศพร เฟื่องรอด รักษาการผู้ช่วยคณบดีฝ่ายวิจัย นวัตกรรม พัฒนาผู้ประกอบการและเทคโนโลยีสารสนเทศ วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์
ด้วยมะเร็งเต้านม เป็นปัญหาสุขภาพสำคัญของสตรีทั่วโลก การควบคุมและป้องกันมะเร็งเต้านม คือ การรณรงค์ให้สตรีได้เข้ารับการตรวจคัดกรองหามะเร็งเต้านมซึ่งเทคโนโลยีทางการแพทย์สามารถตรวจพบได้ตั้งแต่ระยะเริ่มแรก ซึ่งจะช่วยทำให้การรักษาได้ผลดี เพิ่มอัตราการรอดชีวิตของผู้ป่วยได้สูงขึ้น และเพิ่มคุณภาพชีวิตของผู้ป่วยโรคมะเร็ง
เดินหน้าสร้างความมั่นคงทางอาหาร ผ่านโครงการ BKK Food Bank
“สำหรับโครงการ BKK Food Bank เป็นการนำคนที่มีเยอะและอยากแบ่งปันมาเจอคนที่ยังขาด โดยกรุงเทพมหานครตั้งเป้าหมาย BKK Food Bank Center หรือธนาคารอาหาร ให้ครบทั้ง 50 เขต ตอนนี้มีแล้ว 33 เขต” ผู้ว่าราชการกรุงเทพมหานคร กล่าว
ปัจจุบันในกรุงเทพมหานครยังมีประชาชนกลุ่มเปราะบาง เช่น ผู้สูงอายุ คนพิการ ผู้ป่วยติดเตียง ผู้ด้อยโอกาส ผู้มีรายได้น้อยหรือตกงาน ตลอดจนผู้ที่ได้รับผลกระทบจากภัยพิบัติ ที่ยังขาดแคลนอาหารและเครื่องอุปโภคบริโภคเป็นจำนวนมาก ในขณะเดียวกันก็พบว่า 1 ใน 3 ของอาหารที่ผลิต กลายเป็นอาหารส่วนเกิน (Food Surplus) และถูกทิ้งเป็นขยะทุกวัน กรุงเทพมหานครจึงได้จัดทำโครงการ BKK Food Bank ขึ้น ซึ่งนับเป็นต้นแบบแห่งแรกของประเทศไทย ที่มีเป้าหมายเพื่อสร้างความมั่นคงทางอาหารให้แก่คนเมือง (Food Safety) และสร้างกลไกส่งต่อความช่วยเหลือเพื่อแก้ปัญหาอย่างยั่งยืนตามแนวคิด SDGs ในเป้าหมายที่ 2 Zero Hunger หรือยุติความหิวโหย บรรลุความมั่นคงทางอาหารและยกระดับโภชนาการ และส่งเสริมเกษตรกรรมที่ยั่งยืน
ในการดำเนินการ BKK Food Bank ระยะแรก ได้มีการนำร่องในพื้นที่ 4 เขต ประกอบด้วย เขตบางขุนเทียน เขตห้วยขวาง เขตบางพลัด เขตพระโขนง และตั้งเป้าหมายดำเนินการให้ครบทั้ง 50 เขต ปัจจุบันเปิดให้บริการแล้ว 33 เขต ซึ่งในส่วนของการดำเนินการ BKK Food Bank เขตบางขุนเทียน ได้แบ่งรูปแบบการดำเนินการออกเป็น 3 รูปแบบ ได้แก่
รูปแบบที่ 1 BKK Food Bank Center (ธนาคารอาหาร)
รูปแบบที่ 2 BKK Food Bank ส่งต่ออาหารส่วนเกิน (Food Surplus)
รูปแบบการดำเนินการ 3 รูปแบบ
ในการดำเนินการ BKK Food Bank ระยะแรก ได้มีการนำร่องในพื้นที่ 4 เขต ประกอบด้วย เขตบางขุนเทียน เขตห้วยขวาง เขตบางพลัด เขตพระโขนง และตั้งเป้าหมายดำเนินการให้ครบทั้ง 50 เขต ปัจจุบันเปิดให้บริการแล้ว 33 เขต ซึ่งในส่วนของการดำเนินการ BKK Food Bank เขตบางขุนเทียน ได้แบ่งรูปแบบการดำเนินการออกเป็น 3 รูปแบบ ได้แก่
รูปแบบที่ 1 BKK Food Bank Center (ธนาคารอาหาร) ซึ่งเป็นการดำเนินการรวบรวมอาหาร เครื่องอุปโภคบริโภค จากผู้ที่อยากแบ่งปันให้ไปถึงผู้ที่ขาดแคลน ซึ่งเริ่มต้นได้รับการสนับสนุนจาก Lotus’s สาขาพระรามที่ 2 และผู้ประกอบการตลาดในพื้นที่เขต โดยเริ่มดำเนินการตั้งแต่วันที่ 22 มิ.ย. 65 จนถึงปัจจุบัน มีจำนวนผู้ที่ได้รับความช่วยเหลือรวมทั้งสิ้น 3,500 ราย
ทั้งนี้ BKK Food Bank Center มีรูปแบบการดำเนินการลักษณะคล้ายร้านสะดวกซื้อ ณ บริเวณชั้น 1 สำนักงานเขตบางขุนเทียน เปิดให้บริการในทุกวันศุกร์ ตั้งแต่เวลา 10.00 - 12.00 น. มีการใช้ระบบแจกพาสปอร์ตสะสมแต้มแก่กลุ่มเป้าหมาย ได้แก่ กลุ่มเปราะบาง ผู้ที่ได้รับการช่วยเหลือผ่านระบบ E-Case และลูกจ้างที่มีรายได้น้อย จากนั้นกลุ่มเป้าหมายจะนำแต้มที่เขตมอบให้มาแลกอาหารหรือสิ่งของที่ต้องการกลับไป ซึ่งเขตได้เริ่มดำเนินการด้วยระบบพาสปอร์ตสะสมแต้มนี้เมื่อวันที่ 20 ก.พ. 67 จนถึงปัจจุบัน มีกลุ่มเป้าหมายที่ได้รับความช่วยเหลือรวม 227 ราย จากจำนวนกลุ่มเปราะบางที่สำรวจในชุมชน 639 ราย โดยเขตจะหมุนเวียนจนครบจำนวนกลุ่มเป้าหมายทั้งหมดและดำเนินการสำรวจกลุ่มเป้าหมายเพิ่มเติมอย่างต่อเนื่อง
รูปแบบที่ 2 BKK Food Bank ส่งต่ออาหารส่วนเกิน (Food Surplus) ให้กลุ่มเปราะบางอย่างเป็นรูปธรรม ซึ่งเป็นการร่วมมือกันระหว่างเขต และมูลนิธิสโกลารส์ ออฟ ซัสทีแนนซ์ (SOS) เริ่มดำเนินการครั้งแรกเมื่อวันที่ 18 ก.ค. 66 ถึงปัจจุบัน โดยนำอาหารที่ใกล้หมดอายุ แต่ยังไม่หมดอายุ ยังบริโภคได้มาส่งต่อ ทั้งนี้ มีเซเว่น อีเลฟเว่น เข้าร่วมจำนวน 9 สาขา และมีผู้ที่ได้รับความช่วยเหลือรวมทั้งสิ้น 2,674 ราย จำนวนอาหาร 4,946 มื้อ รวมน้ำหนักอาหารที่บริจาค 1,177.82 กิโลกรัม ปริมาณคาร์บอนที่ลดได้ 2,979.88 kgCO2e (กิโลกรัมคาร์บอนไดออกไซด์เทียบเท่า)
รูปแบบที่ 3 กิจกรรม “BKT แบ่งกัน ปันสุข” ซึ่งเป็นการดำเนินการสนับสนุนอาหารสดพร้อมทาน อาทิ ข้าวแกง ก๋วยเตี๋ยว ขนม และเครื่องดื่ม เป็นจำนวนจาน/ชาม/แก้ว จากผู้ประกอบการในพื้นที่เขต โดยเขตจะแจกคูปองอาหารให้กลุ่มเป้าหมาย ทุกวันศุกร์ ซึ่งตัวคูปองสามารถนำมาแลกอาหารได้ภายในระยะเวลา 5 วันหลังจากวันที่ได้รับ ปัจจุบันมีร้านค้าภายในโรงอาหารเขตบางขุนเทียนและร้านค้าภายในตลาดนัดเขตบางขุนเทียนเข้าร่วมทั้งสิ้น 15 ร้าน ซึ่งถือเป็นการเพิ่มรายได้ให้กับร้านค้าภายในสำนักงานเขตอีก 1 ช่องทาง โดยมีกลุ่มเป้าหมายได้รับความช่วยเหลือแล้วทั้งสิ้น 222 ราย จากจำนวนกลุ่มเปราะบางที่สำรวจในชุมชน 639 ราย ซึ่งผู้สนับสนุนจะโอนเงินให้กับร้านค้าตามจำนวนคูปองที่ได้รับแลก
*ภาพจาก
ช็อปอะไรได้บ้างที่ BKK Food Center สัตว์ชนิดใดบ้างที่สามารถติดเชื้อไข้หวัดนก
ไข้หวัดนกสามารถติดต่อได้ในสัตว์ปีกทุกชนิด ทั้งที่เป็นสัตว์ป่าและสัตว์เลี้ยง โดยการสังเกตอาการ สัตว์ปีกหรือนกที่เลี้ยงไว้อาจป่วยเป็นโรคไข้หวัดนก ได้ดังนี้ ยืนหรือเดินไม่ตรง ขนยุ่งไม่เป็นระเบียบ หายใจลำบากหรือหายใจขัด อ่อนเพลียหรือไม่กินอาหาร มีอาการบวมตามหัว หนังตา หงอน เหนียงหรือขา น้ำมูกไหล ถ่ายเหลวเป็นน้ำ และตายอย่างกระทันหัน
2. AgriPV: แผงโซลาร์เซลล์ ลดรังสียูวีและสะท้อนความร้อนเพื่อการเกษตร
AgriPV นวัตกรรมแผงโซลาร์เซลล์จาก ดร. ทวีวัฒน์ กระจ่างสังข์ ศูนย์เทคโนโลยีพลังงานแห่งชาติ (ENTEC) สวทช. ที่ไม่บังแดด ให้พลังงานสะอาด พร้อมทั้งช่วยให้พืชเติบโตได้ดี
ตารางแพทย์ผู้ป่วยนอก วันอังคาร โรงพยาบาลชลบุรี
9 ข้อดี ตรวจสุขภาพประจำปี รพ.มหาวิทยาลัยนเรศวร LINK
ตรวจสุขภาพประจำปี นับข้อดีได้ 9 ข้อ : ไว้ใจให้เราดูแลสุขภาพคุณ โดยอาจารย์แพทย์ผู้เชี่ยวชาญ เริ่มต้นเพียง 1,170 บาท : ตรวจก่อน รู้ก่อน วางแผนเพื่อชีวิตที่มีความสุขภาพได้ . ติดต่อจองคิว 055-965638 ในวัน และเวลาราชการ
ศูนย์สนับสนุนบริการสุขภาพที่ 2 พิษณุโลก
ศูนย์สนับสนุนบริการสุขภาพที่ 2 (Regional Health Service Support Center 2) มีพื้นที่รับผิดชอบ จำนวน 5 จังหวัด ได้แก่ พิษณุโลก, อุตรดิถต์, ตาก, สุโขทัย, เพชรบูรณ์
- 21 หมู่ 4 ตำบลมะขามสูง อำเภอเมือง จังหวัดพิษณุโลก รหัสไปรษณีย์ 65000
- โทร 055-009509, แฟกซ์: 055-009510
- email : saraban-hss2@hss.mail.go.th
- Google map
- Facebook
- Website
พัฒนาการของการดูแลสุขภาพแบบองค์รวม
การเติบโตของธุรกิจบริการสุขภาพแบบองค์รวม มุ่งเน้นการสร้างบริการที่ครบครันและสร้างมูลค่าเพิ่มด้วยบริการทางการแพทย์ครบวงจร ที่ช่วยให้ผู้รับบริการมีทางเลือกในการเข้าถึงแพทย์ ทันตแพทย์ พยาบาล นักเทคนิคการแพทย์ นักกายภาพบำบัด และผู้ประกอบโรคศิลปะสาขาต่างๆ ได้อย่างเหมาะสมกับความจำเป็น และความต้องการด้านสุขภาพ ภายในสถานที่และสิ่งแวดล้อมที่ได้รับการออกแบบและตกแต่งอย่างเหมาะสม รื่นรมย์และก่อให้เกิดความสุข โดยผู้รับบริการจะได้รับประโยชน์จากการวินิจฉัย ตรวจรักษา ส่งเสริมสุขภาพ ป้องกันโรค และฟื้นฟูสุขภาพ ด้วยวิทยาการทางการแพทย์ที่แม่นยำ (precision) และเฉพาะบุคคล (personalized) มากขึ้น ช่วยส่งเสริมให้ได้รับการดูแลสุขภาพแบบองค์รวมได้อย่างครอบคลุม โดยกลุ่มบริการทางการแพทย์ที่ได้รับความนิยมในสถานประกอบการด้านเวสเนสในปัจจุบัน ได้แก่ การดุแลสุขภาพเชิงป้องกัน นวัตกรรมสุขภาพ และการแพทย์ดั้งเดิม
การดูแลสุขภาพ เชิงป้องกัน (Preventive Healthcare)
ให้ความสำคัญกับการดูแลสุขภาพเชิงป้องกัน โดยเชื่อว่าการรู้จักตัวเอง เป็นจุดเริ่มต้นในการเดินทางเพื่อสุขภาพที่ดี การให้คำ ปรึกษาทางการแพทย์จะแนะนำให้เห็นภาพที่สมบูรณ์ที่สุดเกี่ยวกับสภาวะความเป็นอยู่ในปัจจุบันของบุคคล ผ่านการตรวจคัดกรองสุขภาพทั่วร่างกายอย่างครอบคลุม รวมทั้งการวิเคราะห์ความสมดุลของฮอร์โมน สารชีวเคมีในร่างกาน ระบบไหลเวียนต่างๆ ภายในร่างกาย ภาวะโภชนาการ การ ทำงานของภูมิคุ้มกัน และอื่นๆ ซึ่งอาจบอกได้ถึงปัญหาสุขภาพที่อาจเกิดขึ้นภายในร่างกาย ก่อนที่จะแสดงอาการออกมา โปรแกรมสุขภาพส่วนบุคคลที่จัดบริการ จะมุ่งเน้นผลลัพธ์ เพื่อการปรับปรุง ป้องกัน แก้ไขหรือจัดการกับความเสี่ยงหรือจุดอ่อนด้านสุขภาพ ในขณะเดียวกันก็เพิ่มประสิทธิภาพการทำงานของอวัยวะและระบบต่างๆ ของร่างกาย
นวัตกรรม สุขภาพ (Scientific innovation)
วิทยาศาสตร์และนวัตกรรมก่อให้เกิดวิธีการต่างๆ มากมายที่ช่วยรักษาตามธรรมชาติของร่างกายและกระบวนการป้องกัน หรือบรรเทาผลกระทบอันอาจเกิดขึ้น จากการเสื่อมสภาพของร่างกายในช่วงวัยที่เปลี่ยนไป ช่วยเพิ่มความเป็นอยู่ที่ดีและสุขสบายในแต่ละวัน ลดความเครียดหรือปัญหาสุขภาพ เพิ่มความผ่อนคลายทางอารมณ์ ด้วยวิธีการทางการแพทย์ที่มุ่งเน้นผลลัพธ์แบบตรงจุด เช่น การเพิ่มวิตามินทางหลอดเลือดดำ (Vitamin drip) การให้สารต้านอนุมูลอิสระ การเพิ่มโอโซน ในกระแสเลือด (Ozone Therapy) การให้โคเอนไซม์ เพื่อเพิ่มพลังงานให้กับเซลล์ในร่างกาย (Nicotinamide adenine dinucleotide; NAD+) การแก้ไขการขาด สารอาหารในเซลล์ต่างๆ การบำบัดทางการแพทย์เพื่อการฟื้นฟู เช่น การบำบัดด้วย Mesenchymal Stem Cell (MSC) เพื่อฟื้นฟูกระดูกและกล้ามเนื้อ เพิ่มความเปล่งปลั่งของผิวหนัง การฉีดฮอร์โมนการเจริญเติบโตของมนุษย์ (Human Growth Hormone; HGH) การบำบัดด้วย ความเย็น (Cryotherapy) การล้างพิษในลำไส้ (Colon Cleansing) การบำบัดเพื่อความงามทางการแพทย์ (Aesthetic Medicine) ได้แก่ การฉีดสารสกัดโปรตีนเพื่อควบคุมกล้ามเนื้อ (Botolinum Toxin; Botox) การฉีดสารเติมเต็ม (Filler) การฉีดวิตามินและสารสกัดเพื่อบำรุง ฟื้นฟูผิวหน้าที่เสื่อมสภาพ (Mesotherapy) การใช้คลื่นความถี่สูงเพื่อยกกระชับใบหน้า (High Intensity Focused Ultrasound; HIFU) เทอร์ไมวา และอื่นๆ อีกมากมาย
รูปที่ 4 ธุรกิจที่ได้รับอานิสงส์จากการขยายตัวของสังคมสูงวัย
มูลค่าใช้จ่าย มหาศาล ของ กลุ่มเป้าหมายที่สูงวัย 2 กลุ่มวัย คือ Baby Boomer มูลค่า 1.7 ล้านล้าน และ Gen X Y Z มูลค่า 8.9 ล้านล้าน รวมกัน 10.6 ล้านล้านบาท
โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี
โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี จะทำหน้าที่ครอบคลุมใน 3 มิติ ได้แก่
1) โรงพยาบาลเพื่อให้บริการทางการแพทย์ที่มีประสิทธิภาพ
2) โรงเรียนแพทย์เพื่อผลิตบุคลากรทางการแพทย์ผู้เชี่ยวชาญเข้าสู่ระบบสาธารณสุขไทย และ
3) ศูนย์ศึกษาวิจัยเพื่อต่อยอดแนวทางในการรักษารูปแบบใหม่รวมถึงนวัตกรรมทางการแพทย์
โดยคาดการณ์ว่าจะเริ่มก่อสร้างในช่วงต้นปี พ.ศ. 2567 และคาดว่าจะแล้วเสร็จพร้อมเปิดให้บริการประชาชนภายในปี พ.ศ. 2573 โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ยังคงขาดงบประมาณสำหรับการก่อสร้างประมาณ 6,000 ล้านบาท และงบประมาณสำหรับการจัดซื้ออุปกรณ์การแพทย์ที่ทันสมัยอีกกว่า 3,000 ล้านบาท ขอเชิญชวนผู้มีจิตศรัทธาร่วมบริจาคเงินสมทบทุนให้กับโครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ได้ที่ มูลนิธิรามาธิบดีฯ www.ramafoundation.or.th
2. จุลชีพในลำไส้เพื่อดูแลสุขภาพ (Human Gut Microbes for Healthcare)
ร่างกายส่วนต่าง ๆ ประกอบด้วยจุลินทรีย์ที่มีประโยชน์มากมาย โดยเฉพาะในลำไส้ ซึ่งถ้าขาดสมดุลของจุลินทรีย์มีประโยชน์ ก็จะทำให้เกิดโรคต่าง ๆ ทั้งโรคทางเดินอาหาร โรคภูมิแพ้ โรคทางเมแทบอลิกต่าง ๆ ปัจจุบันมีผลิตภัณฑ์มากมายในท้องตลาดที่มีจุลินทรีย์ดี ทั้งแบบพรีไบโอติก (prebiotic) โพรไบโอติก (probiotic) และซินไบโอติก (synbiotic)
ในอนาคตอันใกล้อาจมีการใช้เชื้อที่ผ่านการวิศวกรรม จนได้คุณสมบัติแปลกใหม่เพิ่มเติมหรือดีกว่าเดิม อาจช่วยเฝ้าระวังหรือรักษาโรคอย่างเฉพาะเจาะจงได้อีกด้วย
ผลิตภัณฑ์จุลินทรีย์ดังกล่าวอาจสร้างขึ้นได้ โดยอาศัยความรู้ที่เรียกว่า
ชีววิทยาสังเคราะห์ (Synthetic Biology) ซึ่งใช้หลักการทางวิศวกรรมชีวเคมี ในการออกแบบและสร้างระบบชีวภาพ จนได้เป็น
“วงจรยีน (gene circuit)” ในเซลล์ซึ่งเปิด-ปิดการทำงานของยีนบางอย่างได้อย่างจำเพาะ โดยอาศัยการตอบสนองสัญญาณหรือตัวกระตุ้นจากสิ่งแวดล้อม ทำให้สามารถแจ้งเตือนการเกิดโรค หรือสามารถย่อยสลายสารพิษ หรือรักษาโรคได้อีกด้วย
ด้านการผลิตเพื่อการท่องเที่ยว
มูลค่าผลผลิตรวมของอุตสาหกรรมการท่องเที่ยว ในไตรมาสแรกของปี 2567 มีมูลค่า 291,089 ล้านบาท ขยายตัวร้อยละ 5.61 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.17 เมื่อเทียบกับโตรมาสแรกของปี 2566 (%YoY) โดยสาขาอุตสาหกรรมการท่องเที่ยวที่มีมีมูลค่าผลผลิตมากที่สุด 5 อันดับแรก ได้แก่
(1) ที่พักแรมสำหรับผู้เยี่ยมเยือน มีมูลค่า 91,617 ล้านบาท ขยายตัวร้อยละ 19.01 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ)) และขยายตัวร้อยละ 32.45 เมื่อเทืยบกับโตรมาสแรกของปี 2566 (%YoY) จากนักท่องเที่ยวชาวต่างชาติที่มีแนวโน้มชื่นชอบที่พักระดับ 4 ดาวขึ้นไป และความเชื่อมันในการใช้จ่ายของนักท่องเที่ยวชาวไทย
(2) อุตสาหกรรมการบริการอาหารและเครื่องดื่ม มีมูลค่า 64,602 ล้านบาท ขยายตัวร้อยละ 11.53 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.46 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY) จากการเผยแพร่ข่าวสารเกี่ยวกับแหล่งท่องเที่ยวทางอาหาร ซึ่งเป็นหนึ่งใน SOFT POWER ที่สำคัญของไทย
(3) การจำหน่ายปลีกสินค้าท่องเที่ยวของประเทศ มีมูลค่า 35,084 ล้านบาท หดตัวร้อยละ -15.34 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.25 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY) จากปัจจัยด้านเศรษฐกิจที่ส่งผลให้นักท่องเที่ยวควบคุมการใช้จ่าย และพฤติกรรมของนักท่องเที่ยวที่ให้ความสำคัญกับการใช้จ่ายด้านสถานพักแรม
(4) อุตสาหกรรมการบริการเพื่อการท่องเที่ยวอื่นๆ ของประเทศ มีมูลค่า 11,440 ล้านบาท ขยายตัวร้อยละ 51.06
เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 39.31 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY)
(5) อุตสาหกรรมด้านวัฒนธรรม มีมูลค่า 11,244 ล้านบาท ขยายตัวร้อยละ 3,487.99 เมื่อเทียบกับไตรมาส
ก่อนหน้า (%QoQ) และขยายตัวร้อยละ 19.26 เมื่อเทืยบกับไตรมาสแรกของปี 2566 (%YoY) จากความชื่นชอบกิจกรรม
ด้านศิลปะและวัฒนธรรมของไทย
การจ้างงานในอุตสาหกรรมการท่องเที่ยว
การจ้างงานในอตสาหกรรมการท่องเที่ยวในไตรมาสแรกของปี 2567 มีจำนวน 4.49 ล้านคน คิดเป็นร้อยละ 11.35 ของการจ้างงานทั้งหมดของประเทศ ซึ่งการจ้างงานทั้งหมดของประเทศ มีจำนวน 39.58 ล้านคน
ภาษี
ในไตรมาสแรกของปี 2567 ภาคการท่องเที่ยวสร้างภาษีทางตรงจากการท่องเที่ยวให้แก่ประเทศ จำนวน 15,976 ล้านบาท ซึ่งหดตัวร้อยละ -14.37 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และเพิ่มขึ้นถึงร้อยละ 5.03 เมื่อเทียบกับ ไตรมาสแรกของปี 2566 (%YoY)
โครงการที่ ๒ โครงการวินิจฉัยและอ่านผลการตรวจอัลตราซาวด์ให้แก่โรงพยาบาลในพื้นที่ห่างไกล
โครงการที่ ๒ โครงการวินิจฉัยและอ่านผลการตรวจอัลตราซาวด์ให้แก่โรงพยาบาลในพื้นที่ห่างไกล ส่งเสริมการพัฒนานวัตกรรมระบบบริการสุขภาพทางไกลและพัฒนาบุคลากรในสาขาที่ขาดแคลนให้มีความรู้เชี่ยวชาญเพื่อสามารถให้บริการตรวจและวินิจฉัยผลอัลตราซาวด์แก่ผู้ป่วยในท้องถิ่นห่างไกล
โดยโรงเรียนนักอัลตราซาวด์ทางการแพทย์ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์ ได้ตั้งเป้าหมายในการให้บริการวินิจฉัยและอ่านผลผู้ป่วยในโครงการ จำนวน ๑,๗๒๐ ราย โดยได้ร่วมมือกับโรงพยาบาลในพื้นที่ห่างไกลในจังหวัดตาก จังหวัดแม่ฮ่องสอน นำทีมลงพื้นที่ไปร่วมอบรมสอนการปฏิบัติงานจริงในการทำอัลตราซาวด์ พร้อมทั้งวางระบบสุขภาพทางไกลสำหรับการวินิจฉัยและอ่านผลการตรวจอัลตราซาวด์ เพื่อให้โรงพยาบาลในพื้นที่สามารถทำการตรวจอัลตราซาวด์ได้ด้วยตนเอง และนำส่งภาพผ่านระบบคลาวด์ เพื่อให้อาจารย์แพทย์ของโรงเรียนนักอัลตราซาวด์ทางการแพทย์ ร่วมวินิจฉัยและอ่านผลการตรวจอัลตราซาวด์ให้กับผู้ป่วยในท้องถิ่นห่างไกล ช่วยลดระยะเวลาการรอคอย และสามารถทำการรักษาได้ทันท่วงทีหากตรวจพบอาการผิดปกติ
โครงการดังกล่าวนอกจากจะช่วยแก้ปัญหาการขาดแคลนบุคลากรเฉพาะด้านทางอัลตราซาวด์ทางการแพทย์แล้ว ยังช่วยพัฒนาศักยภาพของบุคลากรให้มีความรู้เชี่ยวชาญเฉพาะด้าน รวมทั้งถ่ายทอดและสร้างองค์ความรู้ใหม่ได้อย่างมีคุณภาพ
2.ZERO HUNGER ภาวะอดอยากเป็นศูนย์
จำนวนคนที่ขาดสารอาหารลดลงเกือบครึ่งหนึ่งในช่วงสองทศวรรษที่ผ่านมา เนื่องมาจากการเติบโตทางเศรษฐกิจที่รวดเร็วและผลผลิตทางการเกษตรที่เพิ่มขึ้น ประเทศกำลังพัฒนาหลายประเทศที่เคยประสบกับความอดอยากและความหิวโหยสามารถตอบสนองความต้องการทางโภชนาการของตนได้แล้ว เอเชียกลางและเอเชียตะวันออก ละตินอเมริกา และแคริบเบียน ต่างประสบความสำเร็จอย่างมากในการขจัดภาวะอดอยากอย่างรุนแรง
น่าเสียดายที่ภาวะอดอยากอย่างรุนแรงและภาวะทุพโภชนาการยังคงเป็นอุปสรรคสำคัญต่อการพัฒนาในหลายประเทศ มีการประเมินว่าในปี 2017 มีผู้คน 821 ล้านคนที่ขาดสารอาหารเรื้อรัง ซึ่งมักเป็นผลโดยตรงจากการเสื่อมโทรมของสิ่งแวดล้อม ภัยแล้ง และการสูญเสียความหลากหลายทางชีวภาพ เด็กอายุต่ำกว่า 5 ปีมากกว่า 90 ล้านคนมีน้ำหนักต่ำกว่าเกณฑ์อย่างอันตราย ภาวะขาดสารอาหารและความไม่มั่นคงทางอาหารอย่างรุนแรงดูเหมือนจะเพิ่มขึ้นในเกือบทุกภูมิภาคของแอฟริกา รวมถึงในอเมริกาใต้
เป้าหมายการพัฒนาที่ยั่งยืนมีเป้าหมายเพื่อยุติภาวะอดอยากและภาวะทุพโภชนาการทุกรูปแบบภายในปี 2030 โดยให้แน่ใจว่าทุกคน โดยเฉพาะเด็กๆ มีอาหารเพียงพอและมีคุณค่าทางโภชนาการตลอดทั้งปี ซึ่งเกี่ยวข้องกับการส่งเสริมการเกษตรที่ยั่งยืน การสนับสนุนเกษตรกรรายย่อย และการเข้าถึงที่ดิน เทคโนโลยี และตลาดอย่างเท่าเทียมกัน นอกจากนี้ยังต้องอาศัยความร่วมมือระหว่างประเทศเพื่อให้แน่ใจว่ามีการลงทุนด้านโครงสร้างพื้นฐานและเทคโนโลยีเพื่อปรับปรุงผลผลิตทางการเกษตร
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนกุมภาพันธ์ 2567
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
กุมภาพันธ์ 2567 ตามที่กระทรวงอุตสาหกรรม (อก.) เสนอ ดังนี้
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมเดือนกุมภาพันธ์ 2567 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) หดตัวร้อยละ 2.8 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากปัญหาหนี้ครัวเรือนและอัตราดอกเบี้ยเงินกู้อยู่ในระดับสูง ส่งผลให้การบริโภคภายในประเทศโดยเฉพาะสินค้ากึ่งคงทนและสินค้าคงทนปรับตัวลดลง เช่น รถยนต์ ชิ้นส่วนอิเล็กทรอนิกส์ เป็นต้น ประกอบกับการชะลอตัวของเศรษฐกิจประเทศคู่ค้าหลัก เช่น อาเซียน (5) CLMV และกลุ่มประเทศตะวันออกกลาง ส่งผลให้การส่งออกชะลอตัวในกลุ่มรถยนต์ เครื่องปรับอากาศ เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนกุมภาพันธ์ 2567 หดตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน คือ
1. ยานยนต์ หดตัวร้อยละ 16.83 จากบรรทุกปิคอัพ รถยนต์นั่งขนาดเล็ก เครื่องยนต์ดีเซล และรถยนต์นั่งขนาดใหญ่ เป็นหลัก ตามการชะลอตัวของตลาดในประเทศ (-27.24%) กำลังซื้อของผู้บริโภคอ่อนตัว สถาบันการเงินเข้มงวดปล่อยสินเชื่อ
2. ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 18.66 จาก Integrated circuits (IC) และ PCBA ตามความต้องการสินค้าในตลาดโลกที่ปรับตัวลดลง
3. น้ำมันปาล์ม หดตัวร้อยละ 27.23 จากน้ำมันปาล์มดิบและน้ำมันปาล์มบริสุทธิ์เนื่องจากภาวะภัยแล้งส่งผลให้มีผลปาล์มดิบลดลงจากปีก่อน ซึ่งหดตัวจากตลาดในประเทศ (-16.19%) และตลาดส่งออก (-85.91%)
อุตสาหกรรมสำคัญที่ยังขยายตัวในเดือนกุมภาพันธ์ 2567 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม ขยายตัวร้อยละ 7.59 จากน้ำมันดีเซลหมุนเร็ว น้ำมันเครื่องบิน น้ำมันเบนซิน 91 และ แก๊สโซฮอล์ 91 เป็นหลัก ตามความต้องการในภาคขนส่งและเดินทางท่องเที่ยวที่ขยายตัวอย่างต่อเนื่อง
2. ปุ๋ยเคมีและสารประกอบไนโตรเจน ขยายตัวร้อยละ 39.82 จากการกระตุ้นยอดขายของราคาสินค้าเกษตรหลายชนิดอยู่ในเกณฑ์ดี และราคาสินค้าปรับลดลงตามราคาวัตถุดิบแม่ปุ๋ยที่ต่ำกว่าปีก่อน
3. เครื่องประดับเพชรพลอยแท้ ขยายตัวร้อยละ 24.56 ในทุกรายการสินค้า (กำไล ต่างหู สร้อย แหวน และจี้) ตามการฟื้นตัวของเศรษฐกิจประเทศคู่ค้าทำให้มีคำสั่งซื้อและส่งออกไปประเทศคู่ค้าสำคัญมากขึ้น เช่น กาตาร์ เบลเยี่ยม อินเดีย ฮ่องกง เยอรมนี ญี่ปุ่น และสหรัฐอมริกา
การวิจัยส่วนที่ 3 : โครงการวิจัยย่อยที่ 2 LINK
การวิจัยนี้เป็นส่วนที่ 3 : โครงการวิจัยย่อยที่ 2 การจัดการกำลังคนและการพัฒนาทรัพยากรมนุษย์ ของ รพ.สต. ที่ถ่ายโอนในปีงบประมาณ 2566 ของการวิจัยชุด “โครงการวิจัยประเมินผลนโยบายการถ่ายโอน โรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.) ไปสู่องค์การบริหารส่วนจังหวัด (อบจ.)” โครงการวิจัยในส่วนนี้มี วัตถุประสงค์เพื่อ “ประเมินผลด้านการจัดการบุคคลและการพัฒนาทรัพยากรมนุษย์ของโรงพยาบาลส่งเสริม สุขภาพตำบลที่ได้รับการถ่ายโอนจากกระทรวงสาธารณสุขไปสู่องค์การบริหารส่วนจังหวัด” โดยมุ่งเน้น 1) ผล การเปลี่ยนแปลงด้านกำลังคน อันเนื่องมาจากการถ่ายโอน 2) สถานะปัญหาความขาดแคลนกำลังคน ทักษะ ความสามารถ และขวัญกำลังใจของกำลังคน 3) ปัญหาอุปสรรค หรือจุดแข็งจุดอ่อนของระบบการจัดการและ การพัฒนากำลังคน และ 4) แนวทางพัฒนากำลังคน [
รายงานฉบับเต็ม pdf]
แถลงการจาก IBA
31 กรกฎาคม 2024 / แถลงการณ์ของสมาคมมวยสากลนานาชาติเกี่ยวกับการตัดสิทธิ์นักกีฬาในการแข่งขันมวยสากลชิงแชมป์โลกปี 2023
แถลงการณ์ของสมาคมมวยสากลนานาชาติเกี่ยวกับการตัดสิทธิ์นักกีฬาในการแข่งขันชกมวยชิงแชมป์โลกปี 2023
31 กรกฎาคม 2024 / IBA
ตามที่ระบุไว้ สมาคมมวยสากลนานาชาติ (IBA) เห็นว่าในช่วงเวลานี้ เป็นการเหมาะสมที่จะพูดถึงแถลงการณ์สื่อล่าสุดเกี่ยวกับนักกีฬา Lin Yu-ting และ Imane Khelif โดยเฉพาะอย่างยิ่งเกี่ยวกับการเข้าร่วมการแข่งขันกีฬาโอลิมปิกที่ปารีสในปี 2024
เราต้องการชี้แจงประเด็นต่อไปนี้:
เมื่อวันที่ 24 มีนาคม 2023 IBA ได้ตัดสิทธิ์นักกีฬา Lin Yu-ting และ Imane Khelif จากการแข่งขัน IBA Women’s World Boxing Championships New Delhi 2023 การตัดสิทธิ์นี้เป็นผลมาจากการที่นักกีฬาไม่ผ่านเกณฑ์คุณสมบัติในการเข้าร่วมการแข่งขันประเภทหญิงตามที่กำหนดไว้ในข้อบังคับของ IBA การตัดสินใจครั้งนี้ซึ่งเกิดขึ้นหลังจากการตรวจสอบอย่างละเอียดถี่ถ้วน ถือเป็นสิ่งสำคัญและจำเป็นอย่างยิ่งในการรักษาระดับความยุติธรรมและความซื่อสัตย์สูงสุดของการแข่งขัน
ที่น่าสังเกตคือ นักกีฬาไม่ได้เข้ารับการตรวจฮอร์โมนเทสโทสเตอโรน แต่เข้ารับการทดสอบแยกต่างหากที่ได้รับการยอมรับ โดยข้อมูลเฉพาะยังคงเป็นความลับ การทดสอบนี้ชี้ชัดว่านักกีฬาทั้งสองคนไม่ตรงตามเกณฑ์คุณสมบัติที่จำเป็น และพบว่ามีข้อได้เปรียบในการแข่งขันเหนือนักกีฬาหญิงคนอื่นๆ
การตัดสินใจของ IBA เมื่อวันที่ 24 มีนาคม 2023 ได้รับการรับรองโดยคณะกรรมการบริหารของ IBA เมื่อวันที่ 25 มีนาคม 2023 สามารถเข้าถึง
บันทึกอย่างเป็นทางการของการตัดสินใจนี้ได้ในเว็บไซต์ของ IBA ที่นี่ บันทึกการประชุมคณะกรรมการบริหารของ IBA
การตัดสิทธิ์นั้นขึ้นอยู่กับการทดสอบสองครั้งที่ดำเนินการกับนักกีฬาทั้งสองคน ดังนี้:
- การทดสอบที่ดำเนินการระหว่างการแข่งขัน IBA Women’s World Boxing Championships ที่อิสตันบูลในปี 2022
- การทดสอบที่ดำเนินการระหว่างการแข่งขัน IBA Women’s World Boxing Championships ที่นิวเดลีในปี 2023
เพื่อความชัดเจน
- Lin Yu-ting ไม่ได้อุทธรณ์คำตัดสินของ IBA ต่อศาลอนุญาโตตุลาการกีฬา (CAS) ดังนั้นการตัดสินจึงมีผลผูกพันทางกฎหมาย
- Imane Khelif ยื่นอุทธรณ์คำตัดสินต่อ CAS ในตอนแรก แต่ถอนการอุทธรณ์ในระหว่างกระบวนการ ซึ่งทำให้การตัดสินของ IBA มีผลผูกพันทางกฎหมายเช่นกัน
คณะกรรมการของเราได้ตรวจสอบและรับรองการตัดสินที่เกิดขึ้นระหว่างการแข่งขันชิงแชมป์โลกอย่างเข้มงวด แม้ว่า IBA จะยังคงมุ่งมั่นที่จะสร้างความเป็นธรรมในการแข่งขันในทุกรายการของเรา แต่เราแสดงความกังวลเกี่ยวกับการใช้เกณฑ์คุณสมบัติที่ไม่สอดคล้องกันขององค์กรกีฬาอื่นๆ รวมถึงองค์กรที่กำกับดูแลการแข่งขันกีฬาโอลิมปิก กฎระเบียบที่แตกต่างกันของ IOC ในประเด็นเหล่านี้ ซึ่ง IBA ไม่มีส่วนเกี่ยวข้อง ทำให้เกิดคำถามที่สำคัญเกี่ยวกับความยุติธรรมในการแข่งขันและความปลอดภัยของนักกีฬา
เพื่อชี้แจงว่าเหตุใด IOC จึงอนุญาตให้นักกีฬาที่มีข้อได้เปรียบในการแข่งขันเข้าแข่งขันในประเภทของตน เราขอแนะนำให้ผู้ที่สนใจค้นหาคำตอบโดยตรงจาก IOC
ขอแสดงความนับถือ
สมาคมมวยสากลนานาชาติ
1 สิงหาคม 2024 / IBA ยืนยันจุดยืนและถอดนักมวยออกจากการแข่งขันทั้งหมด มุ่งปกป้องนักมวยหญิง และประณามทั้งคณะกรรมการโอลิมปิกสากลและมวยโลกที่อนุญาตให้นักกีฬาที่ไม่มีคุณสมบัติเข้าร่วมแข่งขัน
ต่อจากคำชี้แจงของ IBA ที่ออกเมื่อเย็นวานนี้เกี่ยวกับการถอดนักกีฬาที่ไม่มีสิทธิ์ออกจากการแข่งขันหญิงทั้งหมดของ IBA เราขอเน้นย้ำจุดยืนและจุดยืนที่มั่นคงของเรา
IBA ยังคงมุ่งมั่นในการสร้างความเป็นธรรมในการแข่งขันในทุกรายการของเรา เราขอประณามอย่างเด็ดขาดต่อความไม่สอดคล้องกันในสิทธิ์ในการแข่งขันชกมวยที่จัดขึ้นในโอลิมปิกที่ปารีสในปี 2024 ขอย้ำอีกครั้งว่าทั้ง Imane Khelif และ Lin Yu-ting หลังจากการทดสอบแล้ว ไม่เป็นไปตามเกณฑ์คุณสมบัติที่กำหนดเพื่อแข่งขันในประเภทหญิงของรายการของเรา
การตัดสินใจของ IBA เมื่อวันที่ 24 มีนาคม 2023 ได้รับการรับรองโดยคณะกรรมการบริหารของ IBA เมื่อวันที่ 25 มีนาคม 2023
บันทึกอย่างเป็นทางการของการตัดสินใจนี้สามารถเข้าถึงได้บนเว็บไซต์ของ IBA ที่นี่ บันทึกการประชุมคณะกรรมการบริหารของ IBA ลักษณะเร่งด่วนของการตัดสินใจนั้นมีเหตุผล เนื่องจากความปลอดภัยของนักมวยของเราเป็นสิ่งสำคัญที่สุด
การตัดสิทธิ์นั้นขึ้นอยู่กับการทดสอบที่เชื่อถือได้สองครั้งที่ดำเนินการกับนักกีฬาทั้งสองคนในห้องปฏิบัติการอิสระสองแห่งดังต่อไปนี้:
- การทดสอบที่ดำเนินการระหว่างการแข่งขัน IBA Women’s World Boxing Championships ที่อิสตันบูลในปี 2022
- การทดสอบที่ดำเนินการระหว่างการแข่งขัน IBA Women’s World Boxing Championships ที่นิวเดลีในปี 2023
เพื่อความชัดเจน:
- Lin Yu-ting ไม่ได้อุทธรณ์คำตัดสินของ IBA ต่อศาลอนุญาโตตุลาการกีฬา (CAS) ดังนั้นการตัดสินดังกล่าวจึงมีผลผูกพันทางกฎหมาย
- Imane Khelif ยื่นอุทธรณ์คำตัดสินต่อ CAS ในตอนแรก แต่ถอนการอุทธรณ์ในระหว่างกระบวนการ ซึ่งทำให้การตัดสินของ IBA มีผลผูกพันทางกฎหมายเช่นกัน
นอกเหนือจากการตัดสินที่ทำไปข้างต้น และการอนุญาตให้ Imane Khelif แข่งขันโดยรู้เห็น WORLD BOXING ซึ่งมีจุดประสงค์เพียงอย่างเดียวคือการสนับสนุนการเคลื่อนไหวโอลิมปิก ได้ให้การรับรองและสนับสนุนนักกีฬาที่ไม่มีสิทธิ์ในการแข่งขันที่เพิ่งประกาศไปของพวกเขาเองเช่นกัน
ที่น่าตกใจคือ การแข่งขัน WORLD BOXING 2024 USA Boxing International Invitational พบว่า Khelif ลงแข่งขันในรอบชิงชนะเลิศเมื่อวันที่ 16 เมษายน 2024 และมีการแข่งขันอีกครั้งในรายการ Eindhoven Box Cup ซึ่งได้รับการสนับสนุนจาก WORLD BOXING เมื่อวันที่ 18 พฤษภาคม 2024
เราไม่เข้าใจเลยว่าทำไมองค์กรใดจึงเสี่ยงต่อการบาดเจ็บร้ายแรงที่อาจเกิดขึ้นใน "สนามแข่งขัน" (FOP) บทบาทหลักของผู้ตัดสินในสังเวียนคือการจัดการความปลอดภัยของนักมวยตลอดเวลา แล้วจะเป็นไปได้อย่างไรเมื่อนักมวยไม่ผ่านเกณฑ์คุณสมบัติในการแข่งขัน
IBA จะไม่สนับสนุนการชกมวยระหว่างชายและหญิงใดๆ เนื่องจากองค์กรให้ความสำคัญกับความปลอดภัยและความเป็นอยู่ที่ดีของนักกีฬาเป็นอันดับแรก เรากำลังปกป้องผู้หญิงและสิทธิของพวกเธอในการแข่งขันบนสังเวียนกับคู่ต่อสู้ที่เท่าเทียมกัน และเราจะปกป้องและสนับสนุนพวกเธอในทุกกรณี ความหวังและความฝันของพวกเขาจะต้องไม่ถูกพรากไปโดยองค์กรที่ไม่เต็มใจทำสิ่งที่ถูกต้องภายใต้สถานการณ์ที่ยากลำบาก
IBA ยืนหยัดในจุดยืนของตนและจะยังคงสนับสนุนนักกีฬาทุกคนภายใต้จิตวิญญาณของกฎเกณฑ์ต่อไป
ซีรี่ส์หมอเกาหลี-ฝรั่ง-ญี่ปุ่น บน Netflix
ซีรี่ส์หมอเกาหลี บน Netflix
- The Good Doctor (2013)
- Doctors (2016)
- Doctor Prisoner (2019)
- Doctor Cha (2023)
- Doctor Romantic (2020)
- Doctor Stranger (2014)
- Doctor John (2019)
- Doctor Slump (2024)
- Partner for justice (2019)
- Hospital Playlist (2021)
- Live Up to Your Name
- Ghost Doctor (2022)
- Yong-Pal (2015)
- Daily Dose of Sunshine (2023)
- Life (2018)
ซีรี่ส์หมอฝรั่ง บน Netflix
- Emergency NYC (2023) ปฏิบัติการช่วยชีวิตของหน่วยฉุกเฉินแห่งนิวยอร์ค
- Lenox Hill (2020) ปฏิบัติการรักษาคนไข้แห่งรพ.เลน็อกซ์ ฮิลล์ ในมหานครนิวยอร์ค
- New Amsterdam (2021) ผอ.หนุ่มคนใหม่ มารับหน้าที่บริหารโรงพยาบาลเก่าแก่ เขาจะบรรลุเป้าหมายและได้ใจบุคลากรดั้งเดิม เพื่อเป้าหมายที่สำคัญได้หรือไม่
- House (2011) อาจารย์หมออัจฉริยะนอกกรอบ ที่แก้ได้ทุกปัญหา ซีรีส์สุดฮิตยาวนานกว่า 8 ซีซั่น
- The Nurse (2023) เรื่องของพยาบาลที่มีความลับช็อคโลก
- The Good Nurse (2022) หนัง
- Gifted Hands (2009) หนัง
ซีรี่ส์หมอญี่ปุ่น บน Netflix
- Doctor-X (2021) หมอสาวฝีมือระดับเทวดา ไดมอน มิจิโกะ กับภารกิจที่เธอคนเดียวเท่านั้นที่จะพิชิตได้
- Tokyo MER (2021) หน่วยแพทย์ฉุกเฉินสุดไฮเทค ที่พร้อมลุยทุกสถานการณ์เพื่อเข้าถึงคนไข้ทั่วกรุงโตเกียว
- Black Forceps (2024) ศัลยแพทย์ญี่ปุ่นกับเทคโนโลยีสมัยใหม่
- Unnatural (2018) หน่วยชันสูตรญี่ปุ่นที่ภารกิจหลักคือการช่วยคลี่คลายคดีฆาตกรรม
- Dr.Storks (2017) เรื่องของหมอสูติหนุ่มกับภารกิจการให้กำเนิดเคสต่างๆ
ซีรี่ส์หมอไทย บน Netflix
- Doctor Climax (2024) หมอหนุ่มที่เป็นคอลัมนิสต์ไขปัญหาเรื่องเพศที่ดังเกินคาดคิด ชีวิตหมอหนุ่มไม่เหมือนเดิมไปตลอดกาล
Part 1 : อัปเดตโลกของ... “ความสวยความงาม”
ข้อมูลเกี่ยวกับ มูลค่าตลาดบริการเวชศาสตร์ความงามของโลก จ านวนการใช้บริการเวชศาสตร์ความงามของโลก มูลค่าตลาดบริการเวชศาสตร์ความงามของไทย 4 ปัจจัยสำคัญที่ส่งเสริมการใช้บริการด้านเวชศาสตร์ความงาม และชุดคำถาม : คุณให้ความสนใจต่อหัตถการความงามและศัลยกรรมเป็นอย่างไร?
การใช้บริการเวชศาสตร์ความงามโลกได้รับความนิยมเพิ่มขึ้น ส่วนหนึ่งเป็นเพราะค่าใช้จ่ายเฉลี่ยต่อครั้งของหัตถการและศัลยกรรมโลก ในช่วงปี 2019-2021 ลดลงราว 2.4%CAGR และ 9.2%CAGR ตามล าดับและมีแนวโน้มลดลงต่อเนื่องจาก
- การแข่งขันด้านราคาที่สูงขึ้นจากจ านวนสถานบริการหัตถการและศัลยกรรมที่เปิดใหม่เพิ่มขึ้น
- การพัฒนาเทคโนโลยีทางการแพทย์ที่ทันสมัยจึงท าให้ต้นทุนการให้บริการลดลง
2. AI ประยุกต์
เทคโนโลยีและเทคนิค AI ประยุกต์ใช้โมเดลที่ได้รับการฝึกอบรมผ่านการเรียนรู้ของเครื่องจักรเพื่อแก้ปัญหาการจำแนกประเภท การคาดการณ์ และการควบคุม เพื่อดำเนินกิจกรรมโดยอัตโนมัติ เพิ่มหรือขยายความสามารถและข้อเสนอ และปรับปรุงการตัดสินใจ
จำนวนผู้ที่ได้รับการปลูกถ่ายอวัยวะ ตั้งแต่ 1 กุมภาพันธ์ 2537 – 31 มีนาคม 2567
ศูนย์เวชศาสตร์จีโนม บำรุงราษฎร์ (Bumrungrad Genomic Medicine Center)
2) “PANK (Professional Aunt, No Kids) หรือกลุ่มผู้หญิงโสดอายุ 30 ปีขึ้นไป ที่มีรายได้/ อาชีพการงานดีและไม่มีลูก” ซึ่งเน้นไปที่การดูแลหลาน/เด็กในครอบครัวรอบตัว จากข้อมูล SES ปี 2566 พบว่า คนโสด PANK มีจำนวนทั้งหมด 2.8 ล้านคน โดยส่วนใหญ่เป็นผู้มีรายได้ดีและจบการศึกษาสูง กล่าวคือ กว่าร้อยละ 26.6 ของคนโสด PANK อยู่ในกลุ่มผู้มีรายได้สูงสุด (Decile 10) และจบการศึกษาในระดับปริญญาตรีขึ้นไปมากถึง ร้อยละ 46.5
ทั้งนี้ หากพิจารณาตามการประกอบอาชีพ ของคนโสด PANK (กลุ่ม Decile 10 ที่จบการศึกษาในระดับปริญญาตรีขึ้นไป) พบว่ า ส่วนใหญ่เป็นผู้ประกอบวิชาชีพด้านต่าง ๆ อาทิ นักฟิสิกส์ ดาราศาสตร์ ศิลปิน นักแสดง เจ้าหน้าที่เทคนิค เช่น ช่างเทคนิคด้าน เคมี/วิทยาศาสตร์กายภาพ ช่างเทคนิควิศวกรโทรคมนาคม เป็นต้น พนักงานเสมียน โดยมีสัดส่วนอยู่ที่ร้อยละ 33.1 28.2 และ 13.6 ตามลำดับ
2. ครัวเรือน Sandwich แม้สมาชิกส่วนใหญ่จะเป็นวัยแรงงาน แต่มีอัตราการพึ่งพิงสูง
ครัวเรือน Sandwich แม้สมาชิกส่วนใหญ่จะเป็นวัยแรงงาน แต่มีอัตราการพึ่งพิงสูง โดยในปี 2566 วัยแรงงานมีสัดส่วนร้อยละ 53.8 ขณะที่วัยสูงอายุมีสัดส่วนร้อยละ 21.8 และเด็กมีสัดส่วนร้อยละ 24.3 ทั้งนี้ เมื่อพิจารณาโครงสร้างตามช่วงวัยของครัวเรือน Sandwich พบว่า วัยสูงอายุมีสัดส่วนเพิ่มขึ้น ขณะที่วัยแรงงาน มีสัดส่วนลดลง ส่งผลให้อัตราการพึ่งพิงของครัวเรือน Sandwich มีสัดส่วนสูง คือ วัยแรงงาน 100 คน ต้องดูแลเด็กและผู้สูงอายุรวม 86 คน ขณะที่ครัวเรือน ประเภทอื่น (ครัวเรือนคนเดียวและครัวเรือนเดี่ยว) วัยแรงงาน 100 คน ต้องดูแลเด็กและผู้สูงอายุรวมเพียง 59 คนเท่านั้น ขณะเดียวกัน เมื่อพิจารณาหัวหน้า ครัวเรือนของครัวเรือน Sandwich ยังพบว่า ส่วนใหญ่ เป็นผู้สูงอายุ โดยร้อยละ 48.6 เป็นผู้มีอายุ 60 ปีขึ้นไป ที่เหลือเป็นวัยแรงงาน แบ่งเป็นอายุ 45 - 59 ปี ที่ร้อยละ 37.3 และอายุ 35 - 44 ปี ที่ร้อยละ 10.2 โดยคนที่เป็น Sandwich Generation มีอายุเฉลี่ยอยู่ที่ 58.6 ปี นอกจากนี้ ครัวเรือน Sandwich บางส่วนอาจต้องสูญเสียกำลังแรงงานเพื่อดูแลวัยอื่น โดยสมาชิกในครัวเรือน Sandwich ที่เป็นเด็กหรือผู้สูงอายุ ที่ไม่สามารถดูแลตัวเองได้ในชีวิตประจำวันโดยปราศจากคนช่วยเหลือ และไม่สามารถเดินทางไปนอกพื้นที่อื่นด้วยตัวเอง มีสัดส่วนถึงร้อยละ 15.2 และ 24.5 ของจำนวนเด็กหรือผู้สูงอายุ ทั้งหมดในครัวเรือน Sandwich ตามลำดับ ซึ่งสูงกว่าภาพรวมของประเทศที่อยู่ที่ร้อยละ 9.9 และ 17.2 ของกลุ่มเด็ก หรือผู้สูงอายุทั้งประเทศ ตามลำดับกำหนดการออกหน่วยฉีดวัคซีน ฟรี เดือนสิงหาคม 2567
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
1 ส.ค. 67 ที่วัดสะพาน แขวงพระโขนง เขตคลองเตย เวลา 9.00 - 12.00 น.
5 ส.ค. 67 ที่วัดสามพระยาวรวิหาร (วัดบางขุนพรหม) แขวงวัดสามพระยา เขตพระนคร เวลา 9.00 - 12.00 น.
6 ส.ค. 67 ที่วัดอินทร์บรรจงทรงวาดราษฎร์บำรุง แขวงบางคอแหลม เขตบางคอแหลม เวลา 9.00 - 12.00 น.
7 ส.ค. 67 ที่ชุมชนแผ่นดินทองนูรุ้ลยากีน แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
8 ส.ค. 67 ที่วัดสัมพันธวงศารามวรวิหาร แขวงสัมพันธวงศ์ เขตสัมพันธวงศ์ เวลา 9.00 - 12.00 น.
ผู้ประกันตน เกษียณ ต่อ ม.39 ดีหรือไม่?
ผู้ประกันตน เกษียณ ต่อ ม.39 ดีหรือไม่? [
คลิป]
คนที่ต่อม.39 เพื่อคงอยู่ในกองทุนต่อ เพื่อรับสิทธิรักษาพยาบาล
เหมาะกับการจำเป็นต้องรักษาสุขภาพ
กรณี การรับบำนาญ หมายถึง หมดสิทธิรักษาพยาบาล เช่นกัน จะไปใช้สิทธิบัตรทองแทน (สถานพยาบาลภาครัฐในพื้นที่ๆอาศัยอยู่)
แนะนำไปสำรวจสถานพยาบาลที่จะรับบริการบัตรทองด้วย ประกอบการพิจารณา
หลักการคำนวนบำนาญชราภาพ
- ม.33 ใช้ฐานเงินเดือนเฉลี่ย 5 ปีสุดท้าย ไม่เกิน 15,000 บาท
- ม.39 ใช้ฐานเงินเดือนไม่เกิน 4,800 บาท
บทที่ 2 เหตุใดการเพิ่มผลผลิตจากเทคโนโลยี GenAI จึงอาจล่าช้า
ผลประโยชน์ทางเศรษฐกิจที่มุ่งหวังจากการนำเทคโนโลยี GenAI ไปใช้ อาจไม่เร็วอย่างที่คิด จากปัจจัยหลายด้านประกอบกัน อาทิ เวลาที่ต้องใช้ในการเรียนรู้ ปรับตัว ปรับใช้ การพัฒนาทักษะให้พร้อมและทัน และที่สำคัญคือ "ขนาดที่เหมาะสม" ของเทคโนโลยี GenAI กับงานที่ประสงค์
การเกิดขึ้นของนวัตกรรมทางเทคโนโลยีที่สำคัญ ในช่วงแรก มักจะมีผลต่อผลผลิตและการเติบโตทางเศรษฐกิจในวงจำกัด หากมองย้อนไปในยุคที่ผ่านมา การเปลี่ยนผ่านไปสู่เทคโนโลยีใหม่ๆ นั้น ต่างต้องอาศัยเวลาในการเปลี่ยนแปลงกระบวนทัศน์ (paradigm-shifting) จนกว่าเทคโนโลยีนั้น จะเป็นที่ยอมรับในระบบเศรษฐกิจและสังคมโดยรวม
การปฏิวัติอุตสาหกรรมครั้งแรก ซึ่งเกิดขึ้นในช่วงกลางศตวรรษที่ 18 ในบริเตนใหญ่ เป็นช่วงเวลาแห่งความก้าวหน้าที่ไม่มีใครเทียบได้ จุดเด่นคือการถือกำเนิดของเครื่องจักรไอน้ำ ซึ่งริเริ่มโดยเจมส์ วัตต์ ได้เปลี่ยนแปลงการทำเหมืองและการขนส่ง และต่อมายังก่อให้เกิดคลื่นนวัตกรรมทางเทคโนโลยีใหม่ๆ ตามมา (เช่น ลูกกลิ้ง เครื่องปั่นด้ายและทอผ้า หัวรถจักรไอน้ำ) ที่ปฏิวัติอุตสาหกรรมต่างๆ มากมายในภายหลัง
แม้ว่าเครื่องจักรไอน้ำจะเป็นความก้าวหน้าทางเทคโนโลยีที่สำคัญ แต่กว่าจะออกดอกออกผล ก็ต้องรอถึง 80 ปีต่อมา นั่นคือในช่วงครึ่งหลังของศตวรรษที่ 19 ที่เครื่องจักรไอน้ำได้ช่วยส่งเสริมผลผลิตโดยรวมและเพิ่มความมั่งคั่งทางเศรษฐกิจอย่างมาก
ความสำเร็จนี้ เกิดขึ้นเมื่อเทคโนโลยีไอน้ำได้รับการปรับปรุงและนำไปใช้อย่างกว้างขวางมากขึ้นในฐานะเทคโนโลยีเพิ่มผลผลิต
มาตรฐานการครองชีพในบริเตนใหญ่เติบโตช้าในช่วงปีแรกๆ ของการปฏิวัติอุตสาหกรรมของอังกฤษ ผลิตภัณฑ์มวลรวมในประเทศ (GDP) ต่อหัวเติบโตในอัตราทบต้นต่อปีเพียง 0.4% ระหว่างปี 1750 ถึง 1800 ในที่สุด การปฏิวัติอุตสาหกรรมทำให้มาตรฐานการครองชีพเพิ่มขึ้นอย่างมาก โดยผลิตภัณฑ์มวลรวมในประเทศ (GDP) ต่อหัวเพิ่มขึ้นเป็นสองเท่าในปี 1870 และเติบโตเร็วเกือบสองเท่าในอัตราทบต้นต่อปีประมาณ 0.75% ระหว่างปี 1800 ถึง 1900
ความล่าช้าด้านผลผลิตที่คล้ายคลึงกันเกิดขึ้นกับยุคไฟฟ้า แต่ก็ใช้เวลาสั้นกว่ายุคของเครื่องจักรไอน้ำ แม้ว่ายุคไฟฟ้าจะเริ่มต้นขึ้นในช่วงทศวรรษปี 1880 ในสหรัฐอเมริกา แต่การใช้ไฟฟ้ามีความก้าวหน้าอย่างสำคัญ แค่เพียงในช่วงทศวรรษปี 1920 ผลผลิตเพิ่มขึ้นอย่างมากแล้ว ในช่วงเวลาเพียง 40 ปี
ความขัดแย้ง (paradox) ระหว่างความก้าวหน้าทางเทคโนโลยีที่รวดเร็วควบคู่ไปกับผลผลิตที่ลดลง ยังเป็นลักษณะเด่นของการปฏิวัติไอที ในช่วงทศวรรษปี 1970 ยุคเริ่มต้นของการใช้คอมพิวเตอร์ส่วนบุคคลและอินเทอร์เน็ต
ในปี 1987 โรเบิร์ต โซโลว์ นักเศรษฐศาสตร์ผู้ได้รับรางวัลโนเบล ได้กล่าวไว้ว่า "คุณจะเห็นยุคของคอมพิวเตอร์ได้ทุกที่ ยกเว้นในสถิติผลผลิต"
ในขณะนั้น การเติบโตของผลิตภาพแรงงาน ซึ่งวัดจากผลผลิตจริงต่อชั่วโมง ได้ชะลอตัวลงเหลือเพียง 0.5% ต่อปี ซึ่งถือว่าน่าผิดหวัง แต่เพียงสองทศวรรษต่อมา คือในช่วงปลายทศวรรษ 1990 และต้นทศวรรษ 2000 ผลผลิตแรงงานเริ่มสูงกว่า 2% ต่อปีอย่างสม่ำเสมอระหว่างปี 1998 ถึง 2005 เนื่องจากเทคโนโลยีไอทีแพร่กระจายไปทั่วทั้งเศรษฐกิจอย่างกว้างขวางมากขึ้น
ความเร็วในการกระจายและใช้ประโยชน์
เราพบว่าในขณะที่บริษัทต่างๆ กำลังลงทุนในเทคโนโลยี AI — ซีอีโอ 43% เริ่มลงทุนแล้ว และอีก 45% วางแผนที่จะทำในปีหน้า ตามการสำรวจ CEO Outlook Pulse ของ EY — หลายๆ บริษัทกำลังแสวงหาการเพิ่มประสิทธิภาพ ให้เร็วขึ้นกว่าการเปลี่ยนแปลงพื้นฐานแบบเดิม เพื่อเพิ่มศักยภาพในการเติบโตของ AI ให้ได้มากที่สุด และ 90% ขององค์กรยังอยู่ในช่วงเริ่มต้นของการพัฒนา AI
มีหลายปัจจัยที่เป็นเหตุของความล่าช้าในช่วงการปรับเปลี่ยนทางเทคโนโลยี และการเพิ่มประสิทธิภาพการผลิต แต่มีสามปัจจัยที่สำคัญที่ต้องเน้น:
การนำไปใช้และการกระจาย (Implementation and diffusion) : การนำเทคโนโลยีใหม่มาใช้และให้เกิดการใช้อย่างแพร่กระจายไปทั่วทั้งเศรษฐกิจ ต้องใช้เวลา และถึงแม้ว่าเทคโนโลยีจะถูกนำมาใช้แล้ว ธุรกิจต่างๆ ก็อาจล่าช้าในการนำมาใช้ เนื่องจากต้นทุนที่สูง ความไม่แน่นอนของผลลัพธ์ หรือเพียงไม่ก็กำลังรอดูว่าจะมีเทคโนโลยีที่ดีกว่าเกิดขึ้นหรือไม่
ช่วงการเรียนรู้และการปรับตัว (Learning and adjustment period) : เมื่อนำเทคโนโลยีมาใช้แล้ว ก็จะมีช่วงเวลาหนึ่งที่พนักงานและผู้จัดการจะต้องเรียนรู้วิธีใช้เทคโนโลยีอย่างมีประสิทธิภาพ ซึ่งเกี่ยวข้องกับการลองผิดลองถูก การฝึกอบรม และการพัฒนาแนวทางปฏิบัติ
นวัตกรรมเสริม (Complementary innovations) : เทคโนโลยีบางอย่างต้องการนวัตกรรมเสริมหรือโครงสร้างพื้นฐานเพื่อให้มีประสิทธิภาพอย่างเต็มที่ ตัวอย่างเช่น เครื่องยนต์ไฟฟ้าต้องใช้ระบบไฟฟ้าที่แพร่หลาย และประโยชน์ของคอมพิวเตอร์ส่วนบุคคลก็เพิ่มมากขึ้นเมื่ออินเทอร์เน็ตแพร่หลาย
ความสามารถและประสิทธิภาพที่โดดเด่นของเครื่องมือ AI ที่เกิดขึ้นใหม่นั้น แสดงให้เห็นถึงพัฒนาการครั้งใหญ่เมื่อเทียบกับเครื่องมือที่นำมาใช้เมื่อทศวรรษที่แล้ว เช่น ผู้ช่วยเสมือนบนโทรศัพท์มือถือ (cell phone virtual assistants)
แม้ว่าการเพิ่มผลผลิตในวงกว้างนั้นน่าจะเกิดขึ้นช้ากว่าปกติ แต่ความเร็วในการนำเทคโนโลยีมาใช้และความแพร่หลายในการใช้ เกิดขึ้นเร็วกว่าเดิมมาก เมื่อเทียบกับหลายทศวรรษในช่วงปี ค.ศ. 1800 เป็นประมาณ 10 ปี เท่านั้น ในยุคคอมพิวเตอร์
ความแพร่หลายและความรวดเร็วในการนำเทคโนโลยี GenAI มาใช้ จะช่วยกระตุ้นกิจกรรมทางเศรษฐกิจได้ใน สามถึงห้าปีข้างหน้า
นักเวชศาสตร์การสื่อความหมาย ผู้จุดประกายเสียงแห่งความหวัง
การสื่อสารเปรียบเหมือนสะพานที่เชื่อมต่อและยึดโยงผู้คนเข้าไว้ด้วยกัน และการฟื้นฟูผู้บกพร่องทางการสื่อสารให้สามารถสื่อสารได้เหมือนคนปกตินั้นถือเป็นเป้าหมายสำคัญของ ‘นักเวชศาสตร์การสื่อความหมาย’ หรือนักแก้ไขการพูด การเฝ้ามองน้องสาวผู้ป่วยดาวน์ซินโดรมเข้ารับการบำบัดด้านการพูดและการสื่อความหมายเป็นประจำ เป็นแรงผลักดันให้ นางสาวณัชชา ต่อสวัสด์วงศ์นักศึกษาคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี สาขาความผิดปกติของการสื่อความหมาย ตัดสินใจเล่าเรียนด้วยความมุ่งมั่นที่จะจบมาเป็นนักเวชศาสตร์การสื่อความหมาย “ในฐานะนักเวชศาสตร์การสื่อความหมาย ได้ตั้งเป้าหมายในการช่วยเหลือผู้ป่วยที่มีความผิดปกติของการสื่อความหมายให้สามารถสื่อสารและใช้ชีวิตได้เทียบเท่าคนปกติ สำหรับการตัดสินใจขอทุนการศึกษาจากมูลนิธิรามาธิบดีฯ เป็นไปเพื่อช่วยแบ่งเบาภาระค่าใช้จ่ายภายในครอบครัว และจะตั้งใจหมั่นเพียรเรียนรู้เพื่อนำความรู้มารักษาผู้ป่วยเพื่อตอบแทนสังคมต่อไป” ณัชชา กล่าวทิ้งท้าย
โดยอวัยวะที่นำมาปลูกถ่ายให้ผู้ป่วยได้มาจากผู้บริจาค 2 กลุ่ม เท่านั้น ได้แก่
กลุ่มที่หนึ่งผู้บริจาคที่มีชีวิต ได้แก่ ไตและตับ ผู้บริจาคกลุ่มนี้ต้องเป็นญาติโดยสายโลหิตหรือเป็นสามีภรรยาที่อยู่กินกันเปิดเผยอย่างน้อย 3 ปีเท่านั้นหากผู้รอรับอวัยวะไม่มีญาติที่สามารถบริจาคอวัยวะให้กันได้ เช่น หมู่เลือดหรือเนื้อเยื่อเข้ากันไม่ได้ ผู้บริจาคมีสุขภาพไม่สมบูรณ์ ฯลฯ จึงต้องรออวัยวะจากผู้บริจาคเท่านั้น
กลุ่มที่สอง คือผู้บริจาคที่เสียชีวิตจากภาวะสมองตาย ซึ่งสามารถบริจาคได้ทุกอวัยวะได้แก่ หัวใจ ปอด ตับ ไต ตับอ่อน และลำไส้เล็ก แพทย์ต้องวินิจฉัยว่ามีภาวะก้านสมองตาย และญาติลงนามยินยอมบริจาคอวัยวะ ซึ่งอวัยวะ ที่ปลูกถ่ายได้ ได้แก่ ไต 2 ข้าง, ปอด 2 ข้าง, หัวใจ, ตับ ตับอ่อน และลำไส้เล็ก นอกจากนี้ยังมีเนื้อเยื่อที่ปลูกถ่ายได้ ได้แก่ กระจกตา, ลิ้นหัวใจ, หลอดเลือด, ผิวหนัง, กระดูกและเส้นเอ็น
คุณสมบัติของผู้บริจาคอวัยวะ ดังนี้
1. อายุไม่เกิน 65 ปี
2. เสียชีวิตจากสภาวะสมองตายด้วยสาเหตุต่าง ๆ
3.ปราศจากโรคติดเชื้อรุนแรง และโรคมะเร็ง
4.ไม่เป็นโรคเรื้อรังซึ่งทำให้อวัยวะเสื่อม เช่น เบาหวาน, หัวใจ, โรคไต, ความดันโลหิตสูง, โรคตับ และไม่ติดสุรา
5. อวัยวะที่จะนำไปปลูกถ่ายต้องทำงานได้ดี
6.ปราศจากเชื้อโรคซึ่งอาจจะถ่ายทอดทางการปลูกถ่ายอวัยวะ เช่น ไวรัสตับอักเสบชนิดบี หรือซี ไวรัสโรคเอดส์ ฯลฯ
“การบริจาคอวัยวะไม่ทำให้เราตาย แต่ความตายทำให้เกิดการบริจาคอวัยวะ ก่อนที่เราจะบริจาคอวัยวะได้นั้น เราต้องทำความเข้าใจก่อนว่าร่างกายของคนเราจะเริ่มมีความเสื่อมเมื่ออายุ 30 ปีขึ้นไป ทุก ๆ 1 ปี ร่างกายจะมีความเสื่อมลงไป 1 % อวัยวะของคนเปรียบเสมือนเครื่องยนต์ ยิ่งใช้ไปนานเท่าไหร่ความเสื่อม ดังนั้นอวัยวะของหนุ่มสาวจึงเป็นอวัยวะทีมีคุณภาพที่ดีทีสุด ทางศูนย์ฯ จะรับแค่เพียงอายุสูงสุด 65 ปีเท่านั้น ส่วนหัวใจ 45 ปี ถ้าอายุมากกว่านั้นอวัยวะที่ได้รับบริจาคจะไม่คุ้มค่าแก่การปลูกถ่าย อย่างไรก็ดีการบริจาคอวัยวะถือเป็นการสร้างประโยชน์และความสุขอย่างไม่มีที่สิ้นสุด เป็นการให้ชีวิตใหม่ให้ผู้ป่วยได้กลับคืนสู่สังคมด้วยคุณภาพชีวิตที่ดี อีกทั้งยังมีโอกาสได้สร้างประโยชน์ให้กับสังคมต่อไป ” รศ.นพ.สุภนิติ์ กล่าว
กำหนดการหน่วยรับแสดงความจำนงบริจาคอวัยวะ นอกสถานที่
ศูนย์รับบริจาคอวัยวะ มีหน่วยเคลื่อนที่ ออกหน่วยรับแสดงความจำนงนอกสถานที่ เป็นประจำทุกเดือน ณ สถานที่ต่างๆ ตามกำหนดการ ดังนี้
ในพื้นที่กรุงเทพฯ
- 3 กรกฎาคม 2567 เวลา 09.00-15.00 น. บริเวณLobby อาคารว่องวานิช ถ.พระราม 9 กรุงเทพฯ
- 6-7กรกฎาคม 2567 เวลา 09.00-15.00 น. ณ วัดปากน้ำภาษีเจริญ (ศาลาโรงฉัน) กรุงเทพฯ
- 10 กรกฎาคม 2567 เวลา 09.00-15.00 น. ณ ธนาคารออมสิน สำนักงานใหญ่ (ห้องประชุมเพชรรัตน์)
ในต่างจังหวัด
- วันอาทิตย์ 9 มิถุนายน 2567 เหล่ากาชาดจังหวัดปทุมธานี ออกบูธรับแสดงความจำนงบริจาคอวัยวะ ดวงตา ร่างกาย ร่วมกับศูนย์บริการโลหิต สภากาชาดไทย และโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ณ ศูนย์การค้าฟิวเจอร์พาร์ครังสิต อ.ธัญบุรี จ.ปทุมธานี
- 14 มิถุนายน 2567 เวลา 09.00 - 14.00 น. สำนักงานสาธารณสุขจังหวัดเชียงราย ออกหน่วยรับบริจาคอวัยวะ ดวงตา โลหิต ขอเชิญชวนบุคลากรและประชาชนชาวเชียงรายร่วมบริจาคอวัยวะ ดวงตา และโลหิต เพื่อต่อชีวิต ณ มูลนิธิสาธารณกุศลสงเคราะห์เชียงราย (หน้าโรงเรียนสามัคคี)
- วันที่ 1 - 2 สิงหาคม พ.ศ. 2567 เวลา 09.00- 16.00 น. ที่งานชุมนุมกาชาดครั้งที่ 12 ระหว่าง ณ ศูนย์ประชุมและแสดงสินค้านานาชาตินงนุชพัทยา จังหวัดชลบุรี
5.ระบบแจ้งเตือนการแพ้ยา (Drug allergy alert system) สามารถค้นหายาต่างๆที่อยู่ในกลุ่มเดียวกัน หรือ subtype
ตัวอย่างการแจ้งเตือนคลินิกกายภาพบำบัด วันจันทร์ – วันศุกร์ เวลา 08.00 - 16.00 น. (ยกเว้นวันหยุดราชการ)
คลินิกกายภาพบำบัด
วัน - เวลาทำการ : วันจันทร์ – วันศุกร์ เวลา 08.00 - 16.00 น. (ยกเว้นวันหยุดราชการ)
เบอร์โทรติดต่อ : 02-2842331 ต่อ 207
คลินิกสุขภาพเด็กดี วันอังคาร และ วันพฤหัสบดี 13.00 - 16.00 น.
บริการ
1. ตรวจสุขภาพทั่วไป ได้แก่ ชั่งน้ำหนัก วัดส่วนสูง วัดรอบศีรษะ วัดรอบอก
2. ประเมินกาวะโกชนาการ และให้คำแนะน้ำในการเลี้ยงดูบุตร
3. ตรวจร่างกายโดยแพทย์ - พยาบาล
4. นัดฉีดวัคชีนเพื่อเสริมสร้างภูมิคุ้มกันโรค
5. ตรวจสุขภาพช่องปากโดยทันตแพทย์
6. ตรวจพัฒนาการและส่งเสริมพัฒนาการตามวัย โดยนักจิตวิทยา
7. บริการฉีดวัคชีนตามเกณฑ์มาตรฐานของเด็กไทย
วัน - เวลาทำการ วันอังคาร และ วันพฤหัสบดี 13.00 - 16.00 น.
โทรศัพท์ 02-2842331 ต่อ 108
คลินิกกายภาพบำบัด วันจันทร์ – วันศุกร์ เวลา 08.00 - 16.00 น. (ยกเว้นวันหยุดราชการ)
คลินิกกายภาพบำบัด
วัน - เวลาทำการ : วันจันทร์ – วันศุกร์ เวลา 08.00 - 16.00 น. (ยกเว้นวันหยุดราชการ)
เบอร์โทรติดต่อ : 02-2842331 ต่อ 207
ขอบเขตการให้บริการ
1. งานด้านส่งเสริมและป้องกัน
- ให้คำปรึกษาแนะนำเรื่องการออกกำลังกายเพื่อเพิ่มสมรรถภาพในด้านต่างๆ
- ให้คำปรึกษาแนะนำเกี่ยวกับการดูแลรักษาสุขภาพ
- ให้คำปรึกษาเรื่องโรคข้อต่างๆ โรคระบบประสาท เด็กสมองพิการ เด็กพิการแขนขา
- ให้คำปรึกษาแนะนำการป้องกันความพิการด้านต่างๆ
- ให้คำปรึกษาแนะนำภาวะแทรกซ้อนต่างๆ จากภาวะของโรค เช่น โรค เบาหวาน เป็นต้น
- ให้คำปรึกษาแนะนำเกี่ยวกับการดำเนินชีวิตประจำวันเพื่อลดการเกิดโรคต่างๆ เช่น โรคปวดหลังเรื้อรัง, เอ็นกล้ามเนื้ออักเสบ,
การบาดเจ็บจากการทำงานและการเล่นกีฬา และอื่นๆ
- เป็นวิทยากรนำการออกกำลังกายตามโครงการต่างๆ
2. งานด้านการรักษา
- ตรวจ ประเมิน วินิจฉัย และให้การรักษาทางกายภาพบำบัดแก่ผู้ป่วยที่มีปัญหาด้าน Orthopedic, Neuro, Chest and pediatric
3. งานด้านฟื้นฟู
- ฟื้นฟูสภาพผู้ป่วยทางระบบประสาทอัมพาต อัมพฤกษ์ ผู้พิการทางสมอง ผู้ป่วยเรื้อรังหรือผู้ป่วยหัวใจและหลอดเลือด เด็กที่มี ปัญหาการเคลื่อนไหว และผู้ป่วยกระดูกกล้ามเนื้อทั้งในคลินิกและเยี่ยมบ้าน
4. งานด้านการให้ความรู้
- ให้ความรู้ด้านกายภาพบำบัดในคลินิกตรวจรักษาและคลินิกส่งเสริมสุขภาพต่างๆ ในศูนย์บริการสาธารณสุข เช่น การตรวจเท้าในคลินิกเบาหวาน คลินิกผู้สูงอายุครบวงจร
- ให้ความรู้ด้านกายภาพบำบัดในชุมชนทั้งรายบุคคลและรายกลุ่ม
ขั้นตอนการให้บริการ
1.ประชาสัมพันธ์ (Public relation)
- รับบัตรคิว
- แสดงหลักฐาน (สูติบัตร หรือ บัตรประชาชน หรือบัตรนัด)
- กรอกประวัติ (เฉพาะรายใหม่)
- ชั่งน้ำหนัก วัดส่วนสูง วัดความดันโลหิต วัดอุณหภูมิร่างกาย
2.เวชระเบียน (Registration)
- ถ่ายรูป (เฉพาะรายใหม่)
- OPD (ประวัติผู้มารับบริการ)
3.เตรียมตรวจ (General Assessment)
- ซักประวัติโรคประจำตัว
- เตรียมส่งเข้าพบแพทย์ (เฉพาะรายใหม่)
4.พบแพทย์คลินิก (Physical Examination)
- ตรวจโรคทั่วไป (เฉพาะรายใหม่)
- พบนักกายภาพบำบัดเพื่อนัดหมายวัน (เฉพาะรายใหม่)
5.ชำระเงิน (Cashier)
6.พบคลินิกกายภาพบำบัด (Physical Therapy Clinic)
- พบแพทย์เวชศาสตร์ฟื้นฟู (เฉพาะรายใหม่)
- รักษาทางกายภาพบำบัด
7.นัดครั้งต่อไป (Next appointment)
อุทยานแห่งชาติศรีสัชนาลัย อ.ศรีสัชนาลัย จ.สุโขทัย
อุทยานแห่งชาติศรีสัชนาลัย อุทยานแห่งชาติลำดับที่ 26 ของไทย อยู่ในพื้นที่ ต.บ้านแก่ง อ.ศรีสัชนาลัย จ.สุโขทัย มีจุดท่องเที่ยวโดดเด่น ได้แก่ น้ำตกตาดดาว น้ำตกตาดเดือน น้ำตกห้วยทรายขาว ถ้ำธาราวสันต์ น้ำตกตาดฤาษี เหมาะกับกิจกรรการท่องเที่ยว ได้แก่ เดินป่า ชมน้ำตก เที่ยวถ้ำ/ศึกษาสภาพธรณี ชมพรรณไม้ ดูนก/ดูผีเสื้อ ดูดาว ตั้งแคมป์พักแรม ภายในบริเวณที่ทำการ มี ร้านสวัสดิการ (กาแฟ น้ำดื่ม ขนม ) เปิดให้บริการทุกวันเวลา 08.00 น -16.30 น.
ค่าเข้าอุทยาน คนไทย 20-40 บาท ต่างชาติ 100-200 บาท ผู้สูงอายุ/ผู้พิการ เข้าฟรี ยานยนต์ 30-200 มอเตอร์ไซด์ 20 บาท
ที่พักอุทยานแห่งชาติรามคำแหง ลานกางเต็นท์อุทยานแห่งชาติศรีสัชนาลัย - ค่าสถานที่ 30 บาท/คน/คืน (กรณีนำเต็นท์มาเอง) - มีเต็นท์ให้เช่าหลังละ 3 คน 225 บาท/หลัง(พร้อมเครื่องนอน 405 บาท)
ภายในมีสัญญาณทรู+ดีแทค
Facebook อุทยาน | โทรศัพท์ 095-627-5035 |
จองที่พักออนไลน์ (กรมอุทยาน) eatfuntravel
อุทยานแห่งชาติศรีสัชนาลัย ปิดการท่องเที่ยวและพักแรม ประจำปี ช่วงเดือน สิงหาคม - กันยายน ตรวจสอบข้อมูลกับอุทยานอีกครั้งสำหรับการวางแผนท่องเที่ยว
จำนวนผู้ประกอบโรคศิลปะ 30 ก.ย. 2565
โปรแกรมบริหารจัดการคลินิกความงาม JERA Cloud
JERA Cloud เป็นโปรแกรมคลินิก สำหรับคลินิกความงามแบบครบวงจร มีระบบที่สามารถดูแลครอบคลุมทุกส่วนของคลินิกความงามตั้งแต่การทำประวัติ บันทึกรายละเอียดการรักษา การจัดการสต๊อกสินค้า การคำนวณค่า DF และค่ามือพนักงาน การคำนวณยอดขาย การติดตามลูกค้า เพื่อเจ้าของธุรกิจ แพทย์ รวมถึงพนักงานในคลินิก ช่วยลดความผิดพลาด ประหยัดเวลาในการทำงาน อีกทั้งยังเพิ่มขีดความสามารถในการแข่งขันทางธุรกิจให้เจ้าของคลินิกสามารถขับเคลื่อนธุรกิจไปข้างหน้าได้อย่างรวดเร็วและมั่นคงยิ่งขึ้น
ฟีเจอร์เด่นของ JERA Cloud ได้แก่ ระบบบริหารจัดการคนไข้ ระบบซื้อสินค้า ยา/บริการ/คอร์ส ระบบ OPD บันทึกการรักษา ระบบมัดจำ/ค้างชำระ ระบบนัดหมายพร้อมส่ง SMS* ระบบบันทึกค่า DF / ค่าคอมมิชชั่น รายงานการตลาดกว่า 30 รายงาน ระบบคลังสินค้า ระบบบัตรสมาชิกสะสมแต้ม / เงิน ระบบบัตรกำนัลออนไลน์ เมนู Dashboard วิเคราะห์ธุรกิจ ฟีเจอร์พิมพ์ฉลากยา** มีระบบจัดเก็บข้อมูล พื้นที่เก็บข้อมูลคนไข้, OPD, ใบเสร็จ พื้นที่เก็บรูปก่อน - หลัง มีระบบ SMS
จุดดเด่นของ JERA Cloud เช่น
- ใช้งานได้บนทุกอุปกรณ์ ไม่ว่าจะเป็นคอมพิวเตอร์ โน๊ตบุ๊ค แท็บเล็ตหรือมือถือ ทั้งบนระบบ Windows MacOS IOS และ Android
- ไม่ต้องติดตั้ง ไม่ต้องรอให้ทีมงานเข้ามาติดตั้งบนอุปกรณ์ของคุณ เพราะระบบ JERA Cloud สามารถใช้งานได้เลยผ่าน Web Browser บนเครื่องของคุณ
- ข้อมูลปลอดภัยไร้กังวล JERA Cloud บันทึกข้อมูลประวัติผู้ป่วย และข้อมูลการรักษา บนผู้ให้บริการคลาวด์ระดับโลก (Google Cloud) จึงปลอดภัยจากภัยคุกคามต่างๆ และมีการสำรองข้อมูลอย่างสม่ำเสมอ
- ใช้ได้ไม่จำกัดจำนวนเครื่อง จำนวนผู้ใช้งานเยอะจะไม่ใช่ปัญหาอีกต่อไป
- รูปแบบบริการ 3 แบบ ได้แก่ Value เหมาะสำหรับคลินิกเวชกรรมขนาดเล็ก Elegance ออกแบบเพื่อคลินิกความงามโดยเฉพาะ และ Premium สำหรับคลินิกที่มีระบบ CRM
ข้อมูลเพิ่มเติม โทร 02-0556285
ส่วนที่ 1 Visual Cart
รู้จักส่วนประกอบ หุ่นยนต์ช่วยผ่าตัด Davinci กันทีละส่วนเลย เริ่มจาก
ส่วนที่ 1 Visual Cart เป็นส่วนการประมวลผล ประกอบด้วยกล่องประมวลผลภาพต่างๆ เพื่อส่งต่อไปยังศัลยแพทย์ เพื่อดูแบบ Real time ขณะปฏิบัติการผ่าตัด เครื่องจะมีจอภาพ เครื่องบันทึกภาพ เครื่องกระจายแก๊สที่เป่าเข้าไปในช่องท้อง แหล่งพลังงานในการห้ามเลือด จี้ห้ามเลือดต่างๆ และส่วนโปรเซสเซอร์ ของเครื่องที่ใช้ประมวลผลภาพ
21 จุดจอด Motorlance สถานีดับเพลิงลาดยาว จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
22 จุดจอด Motorlance สำนักงานเขตห้วยขวาง จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
23 จุดจอด Motorlance สำนักงานเขตลาดพร้าว จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
24 จุดจอด Motorlance โรงพยาบาลจุฬาลงกรณ์สภากาชาดไทย จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
25 จุดจอดรถ Motorlance สำนักงานเขตราชเทวี จำนวน 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
26 จุดจอดรถ Motorlance เขตวังทองหลาง 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
27 จุดจอดรถ Motorlance เขตลาดยาว 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
28 จุดจอดรถ Motorlance เขตลาดพร้าว 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
29 จุดจอดรถ Motorlance เขตดอนเมือง 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
30 จุดจอดรถ Motorlance เขตคันนายาว รามอินทรา 1 คัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
โรงพยาบาลธีรวัฒน์ จัดหน่วยเคลื่อนที่ออกมาตรวจสุขภาพตา ณ สหกรณ์ออมทรัพย์ครูสุรินทร์
โรงพยาบาลธีรวัฒน์ จังหวัดกาฬสินธุ์ ขอเชิญชวนทุกๆท่านที่มีปัญหาทางด้านสายตา การมองเห็นไม่ชัด มีภาพซ้อน มีอาการตาพร่ามัว ในวันที่ 17 เดือนมิถุนายน 2566 จะมีหน่วยเคลื่อนที่ออกมาตรวจสุขภาพตาให้ กับประชาชนชาวจังหวัด ได้แก่ จ.ขอนแก่น และ จ.สุรินทร์
หน่วย จ.สุรินทร์ สหกรณ์ออมทรัพย์ครูสุรินทร์ จำกัด 09:00-16:00น.
ขอเชิญชวนประชาชนที่อยู่ใกล้บริเวณดังกล่าว สามารถเดินทางมาตรวจเช็คสุขภาพตากันได้เลยนะคะ
หากมีข้อสงสัยอยากสอบถามพิ่มเติม ติดต่อได้ที่ 063-872-2461 หรือ 043-811-757
จุฬา PET/CT Scan สาขารังสีรักษาและมะเร็งวิทยา LINK
สาขารังสีรักษาและมะเร็งวิทยา โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย เริ่มเปิดให้บริการการรักษาโรคมะเร็งตั้งแต่ปี 2494 จนถึงปัจจุบัน มีแพทย์ผู้เชี่ยวชาญในหลากหลายสาขา และอุปกรณ์ให้การรักษาด้านรังสีรักษาอันทันสมัยที่สุดในประเทศไทย
สาขารังสีรักษาและมะเร็งวิทยา ฝ่ายรังสีวิทยา โรงพยาบาลจุฬาลงกรณ์ 1873 ถนนพระราม4 ปทุมวัน กรุงเทพฯ 10330
โทร 02-256-4100
ครรภ์ภาวะเสี่ยง เช็คได้ไม่ยากเกิน
ครรภ์ภาวะเสี่ยง ⁉️ เช็คได้ไม่ยากเกิน เพราะ ทารกแรกเกิดอาจมีความผิดปกติ หากคุณแม่มีภาวะครรภ์เสี่ยง ดังต่อไปนี้
1. อายุของคุณแม่
▪️ ตั้งครรภ์โดยที่มีอายุน้อยกว่า 17 ปี
▪️ ตั้งครรภ์เมื่ออายุมากกว่า 35 ปี
2. คุณแม่เคยมีประวัติการตั้งครรภ์ผิดปกติ
▪️ เคยมีทารกเสียชีวิตในครรภ์ หรือเสียชีวิตเมื่อแรกเกิด
▪️ เคยแท้งเอง มากกว่า 3 ครั้งติดต่อกัน
▪️ ทารกแรกคลอดมีน้ำหนักน้อยกว่า 2,500 กรัม หรือมากกว่า 4000 กรัม
▪️ มีภาวะครรภ์เป็นพิษ (มีอาการดังต่อไปนี้ อย่างน้อย 1 อาการ น้ำหนักตัว เพิ่มขึ้น, บวม, ปวดศีรษะ, ความดันโลหิตสูง, จุกแน่นใต้ชายโครง, ลูกดิ้นน้อยลง และท้องไม่โตตามอายุครรภ์) ในท้องก่อนหน้า
▪️ เคยมีประวัติคลอดก่อนกำหนด
▪️ มีประวัติตั้งครรภ์แฝด ภาวะรกเกาะต่ำ ภาวะรกเสื่อม ภาวะน้ำคร่ำน้อย
3. คุณแม่มีโรคประจำตัว หรือมีปัญหาสุขภาพโรคประจำตัวของคุณแม่มีผลต่อสุขภาพระหว่างการตั้งครรภ์ อาทิ
▪️ โรคความดันโลหิตสูง
▪️ โรคเบาหวาน
▪️ โรคหอบหืด
▪️ โรคตับ
▪️ โรคไต
▪️ โรคหัวใจ
▪️ โรคติดเชื้อต่างๆ โดยเฉพาะโรคติดเชื้อทางเพศสัมพันธ์ เช่นโรคเอดส์ โรคเริม โรคซิฟิลิส เป็นต้น
4. พฤติกรรมการใช้ชีวิตของคุณแม่
▪️ ดื่มเหล้า
▪️ ติดยาเสพติด หรือใช้สารเสพติดอื่นๆ
ภาวะครรภ์เสี่ยงมีอันตรายต่อทั้งตัวคุณแม่และทารกเป็นอย่างมาก
ดังนั้น ควรปฏิบัติตามคำแนะนำของแพทย์อย่างเคร่งครัด
รวมไปถึงการตรวจครรภ์ให้ตรงตามนัดทุกครั้ง
ร่วมบริจาค มูลนิธิสยามเชียงราย LINK
มูลนิธิสยามเชียงราย (สำนักงานใหญ่) เปิดรับบริจาคน้ำดื่ม ข้าวสาร อาหารแห้ง จำนวนมาก เพื่อนำไปให้พี่น้องประชาชนผู้ประสบอุทกภัย หากท่านใดสนใจร่วมบริจาค สามารถนำไปมอบได้ที่มูลนิธิสยาม (สำนักงานใหญ่) ห้าแยกพ่อขุน ติดกับร้านเชียงรายอะไหล่ยนต์ โทรศัพท์ 087-008-2688
ร่วมบริจาคได้ตามหมายเลขบัญชีด้านล่างนี้
ธนาคาร : ธกส. สาขาเชียงราย
เลขที่บัญชี : 020-1-93677-375
ชื่อบัญชี : มูลนิธิสยามเชียงราย
โรงพยาบาลรัตนประชารักษ์ (ชื่อเดิมโรงพยาบาลคลองสามวา) มีพื้นที่ 20 ไร่ บริเวณถนนไมตรีจืต แขวงสามวาตะวันออก เขตคลองสามวา ประกอบด้วย อาคารโรงพยาบาลความสูง 10 ชั้น และชั้นใต้ดิน 1 ชั้น พื้นที่ใช้สอย 60,195 ตารางเมตร จำนวน 250 เตียง อาคารหอพักแพทย์ความสูง 9 ชั้น พื้นที่ใช้สอย 4,800 ตารางเมตร จำนวน 70 ห้อง อาคารหอพักพยาบาลความสูง 9 ชั้น พื้นที่ใช้สอย 9,500 ตารางเมตร จำนวน 154 ห้อง อาคารจอดรถยนต์ความสูง 8 ชั้น และชั้นใต้ดิน 1 ชั้น พื้นที่ใช้สอย 20,000 ตารางเมตร จอดรถยนต์ได้ 629 คัน สามารถให้บริการประชาชนได้อย่างครอบคลุม ทั้งด้านการรักษาพยาบาล การส่งเสริมสุขภาพ การป้องกันโรค การฟื้นฟูสุขภาพที่มีประสิทธิภาพ ตลอดจนส่งเสริมการพัฒนาคุณภาพชีวิตของประชาชนในพื้นที่เขตคลองสามวาและบริเวณพื้นที่ใกล้เคียง ได้แก่ เขตหนองจอก เขตคันนายาว เขตมีนบุรี เขตสายไหม เขตบางเขน และอำเภอลำลูกกา จังหวัดปทุมธานี
พิษจากเมทานอล หรือสุราเถื่อน อันตรายถึงชีวิต
เตือน !! พบผู้ป่วยเป็นพิษจากการดื่มสุราเถื่อน (เมทานอล) หลายราย ร้านยาดอง ย่านมีนบุรี - คลองสามวา และพื้นที่กรุงเทพฝั่งตะวันออก หากพบว่ามีอาการดังกล่าว ควรพบแพทย์ทันที หรือปรึกษาอาการได้ที่ โรงพยาบาลนพรัตนราชธานี 025481000
บัตรทองเลือกใช้สิทธิกับ โรงพยาบาลสิรินธร กรุงเทพมหานคร ได้
บิ๊กบอส ผู้ขยายโอกาสให้กับน้องๆ คุณหมอ อติศักดิ์ ผู้อำนวยการสถาบัน
รศ.นพ.อดิศักดิ์ ผลิตผลการพิมพ์ ผู้อำนวยการสถาบันแห่งชาติเพื่อพัฒนาเด็กและครอบครัว มหาวิทยาลัยมหิดล เปิดเผยว่า การจัดวิ่งการกุศลในวันนี้ ประสบความสำเร็จอย่างดีเยี่ยมโดยได้รับความร่วมมือจากทุกภาคส่วนด้วยดี โดยเฉพาะอย่างยิ่ง กลุ่มเยาวชนจิตอาสา Beyond the Spectrum ในฐานะเริ่มต้นจัดกิจกรรมในครั้งนี้ โดยรายได้ทั้งหมดจากงานนี้จะนำไปก่อตั้งกองทุนเด็กพิเศษ เพื่อการดูแลเด็กออทิสติกอย่างถูกวิธี ช่วยให้เด็กออทิสติกใช้ชีวิตประจำวันได้ดีขึ้นเพื่อสร้างความเสมอภาพด้านการศึกษากับเด็กปกติ ลดปัญหาความความเหลื่อมล้ำทางสังคม โดยทางสถาบันฯ ได้เริ่มนำเงินจากกองทุนไปฝึกอบรม บุคลากรให้กับโรงพยาบาลต่างๆ ทั่วประเทศ ในรูปแบบ “คลินิกพัฒนาการเด็กแบบครอบครัวมีส่วนร่วม” ซึ่งจะพร้อมเปิดให้บริการได้ทันที จำนวน 13 คลินิก ใน 11 จังหวัดครอบคลุมทั่วทุกภูมิภาค และในอนาคตจะมีการขยายโครงการให้ครอบคลุมทุกพื้นที่ทั่วประเทศต่อไป
ศูนย์บริการสาธารณสุข 12 จันทร์เที่ยง
ศูนย์บริการสาธารณสุข 12 จันทร์เที่ยง เนตรวิเศษ แผนการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567
ผู้ที่สนใจสามารถนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีนป้องกันพิษสุนัขบ้าตามวัน เวลา และสถานที่ที่กำหนด เจ้าของสัตว์เลี้ยงกรุณานำบัตรประชาชนมาด้วยนะคะ
คลินิก Premium โรคภูมิแพ้ในผู้ป่วยเด็กและผู้ใหญ่ LINK
Taksin Premium Clinic โรคภูมิแพ้ในผู้ป่วยเด็กและผู้ใหญ่ เริ่ม 5 มิถุนายน 2567 ทุกวันพุธสัปดาห์ที่ 1 และสัปดาห์ที่ 3 ของเดือน ตรวจรักษานอกเวลาราชการ 16.00 - 20.00 น. ณ บ้านวรรังสฤษดิ์ (ด้านหน้าโรงพยาบาลตากสิน) รับเฉพาะนัดเท่านั้น (ได้ทั้งเด็กและผู้ใหญ่) จำกัดวันละ 10 คน สามารถติดต่อสอบถามได้ที่ 088 9466 1410 ฟรี ‼️ สำหรับโครงการทดสอบผิวหนังฟรีวันละ 5 เคส (สิ้นสุด ก.ย. 67) ไม่รวมค่าบริการทางการแพทย์ ให้โทรติดต่อที่ OPD กุมารฯ เท่านั้น ติดต่อสอบถาม 02 437 0123 ต่อ 1222
สุขภาพและการเจ็บป่วย
ผู้ป่วยด้วยโรคเฝ้าระวังในไตรมาสสองเพิ่มขึ้นจากช่วงเดียวกันของปีก่อน จากการเพิ่มขึ้น ของผู้ป่วยด้วยโรคที่มากับฤดูฝน นอกจากนี้ ยังต้องให้ความสำคัญกับการเจ็บป่วย ด้วยโรคหอบหืดที่พบผู้ป่วยเพิ่มขึ้น และการแพร่ระบาดของโรคไข้มาลาเรีย รวมทั้ง โรคหลอดเลือดสมองที่มีผู้เสียชีวิตเพิ่มขึ้น
- ไตรมาสสอง ปี 2567 จำนวนผู้ป่วยด้วยโรคเฝ้าระวังโดยรวมเพิ่มขึ้นจากช่วงเดียวกันของปี 2566 ร้อยละ 72.1 จาก 117,952 ราย เป็น 202,879 ราย
- ผู้ป่วยโรคที่มากับ ฤดูฝน โดยโรคที่มีจำนวนผู้ป่วยสูงสุด 2 ลำดับแรก ได้แก่ โรคไข้หวัดใหญ่ และโรคปอดอักเสบ
- ผู้ป่วยด้วยโรค ไข้หวัดใหญ่มีจ านวนสูงสุด 99,895 ราย เพิ่มขึ้นจากช่วงเดียวกันของปีก่อนถึง 3.8 เท่า
- ปี 2567 โรคไข้หวัดใหญ่เริ่มมีการระบาดตั้งแต่ไตรมาสหนึ่ง และมีแนวโน้มจะระบาดต่อเนื่องจนถึงเดือนพฤศจิกายน จากข้อมูลของกองระบาดวิทยา ตั้งแต่วันที่ 1 มกราคม - 1 สิงหาคม 2567 พบผู้ป่วยโรคไข้หวัดใหญ่ 290,396 ราย มีกรณีเสียชีวิต 20 ราย โดยพบการระบาดเป็นกลุ่มในสถานที่ที่คนอยู่รวมกันจำนวนมาก เช่น โรงเรียน เรือนจำ และ วัด ซึ่งผู้ป่วยส่วนใหญ่เป็นกลุ่มเด็กเล็กและกลุ่มวัยเรียน อายุแรกเกิด - 4 ปี และอายุ 5 - 14 ปี และพบผู้ป่วยสูงสุด ในพื้นที่ภาคกลาง รองลงมาเป็นภาคตะวันออกเฉียงเหนือ และภาคเหนือ
- สถานการณ์ด้านสุขภาพจิตของคนไทยดีขึ้น จากข้อมูลการประเมินสุขภาพจิตของคนไทย (Mental Health Check In: MHCI) พบว่า ในไตรมาสสอง ปี 2567 ซึ่งมีผู้เข้ารับการประเมินจำนวน 3.3 แสนคน พบว่า ลดลงในทุกกลุ่ม ตั้งแต่ กลุ่มผู้ที่เสี่ยงซึมเศร้า ผู้ที่มีความเครียดสูง และเสี่ยงฆ่าตัวตาย
สำหรับประเด็นที่ต้องให้ความสำคัญ คือ
1. การเจ็บป่วยด้วยโรคหอบหืดที่มีจำนวนผู้ป่วยเพิ่มขึ้นอย่างต่อเนื่อง จากข้อมูลขององค์การอนามัยโลก รายงานว่าปี 2564 พบผู้ป่วยโรคหอบหืดทั่วโลกประมาณ 262 ล้านราย และมีการเสียชีวิตราว 461,000 รายต่อปี ซึ่งกรณีของประเทศไทยจากข้อมูล Health Data Center ของกระทรวงสาธารณสุข ปีงบประมาณ พ.ศ. 2567 (1 ตุลาคม 2566 - 1 สิงหาคม 2567) คนไทยป่วยด้วยโรคหอบหืด 555,651 ราย เพิ่มขึ้นจากปีงบประมาณ พ.ศ. 2566 ที่มีผู้ป่วย 452,331 ราย และมีผู้ป่วยที่มีอาการโรคหอบหืดกำเริบเฉียบพลันต้องเข้ารับการรักษาในโรงพยาบาล เพิ่มขึ้นเป็น 56,209 ราย ในปีงบประมาณ พ.ศ. 2567 จากเดิม 51,664 ราย ในปีงบประมาณ พ.ศ. 2566 เช่นเดียวกับจำนวนผู้เสียชีวิตด้วยโรคหอบหืดที่มีแนวโน้มเพิ่มขึ้น
ทั้งนี้ สาเหตุการเกิดโรคและปัจจัยที่ก่อให้เกิด การกระตุ้นอาการหอบหืดเฉียบพลัน ประกอบด้วย1) พันธุกรรม มีประวัติคนในครอบครัวเป็นโรคหอบหืด 2) สารก่อภูมิแพ้ เช่น ฝุ่นควัน เกสรดอกไม้ ขนสัตว์ มลพิษทางอากาศ และอุณหภูมิที่เปลี่ยนแปลงอย่างรวดเร็ว 3) การติดเชื้อทางเดินหายใจ และ 4) ภาวะอ้วน
การป้องกันและดูแลรักษาโรคหอบหืด ได้แก่ 1) หมั่นทำความสะอาดบ้าน โดยเฉพาะห้องนอน ห้องทำงาน รวมทั้งเฟอร์นิเจอร์ พัดลม เครื่องปรับอากาศ และ 2) เปิดหน้าต่างให้อากาศถ่ายเทได้สะดวก
นอกจากนี้ ผู้ป่วยโรคหอบหืดต้องปรับพฤติกรรมสุขภาพ ดังนี้ 1) งดดื่ม เครื่องดื่มแอลกอฮอล์และสูบบุหรี่ 2) พักผ่อนให้เพียงพอ หลีกเลี่ยงภาวะเครียด 3) รับประทานอาหารที่มีประโยชน์ 4) ออกก าลังกายตามคำแนะนำของแพทย์อย่างถูกต้อง และ 5) ควรใช้ยารักษาอาการหอบหืดอย่างสม่ำเสมอ โดยผู้ป่วยและครอบครัวควรมียาพ่นบรรเทาอาการพกติดตัวไว้เพื่อใช้ได้ทันท่วงทีเมื่อมีอาการหอบหืดกำเริบ ซึ่งโรคหอบหืดเป็นโรคที่ยังรักษาให้หายขาดไม่ได้ แต่สามารถควบคุมโรคได้
2. การเฝ้าระวังการแพร่ระบาดของโรคไข้มาลาเรีย ปัญหาโรคไข้มาลาเรียยังคงเป็นปัญหาสาธารณสุข ที่สำคัญในประเทศไทย จากข้อมูลของกรมควบคุมโรค ปี 2566 พบว่า มีผู้ป่วยโรคไข้มาลาเรียจำนวน 16,200 ราย เพิ่มขึ้นจากปี 2565 ที่มีจำนวน 10,061 ราย หรือเพิ่มขึ้นร้อยละ 61.1 และระบาดต่อเนื่องมาตั้งแต่ปี 2565 ทั้งนี้ ข้อมูลตั้งแต่วันที่ 1 มกราคม – 1 สิงหาคม 2567 พบผู้ป่วยโรคไข้มาลาเรียแล้ว 10,627 ราย ใน 63 จังหวัด โดยพบ ผู้ป่วยสูงสุดในพื้นที่จังหวัดตาก 6,597 ราย รองลงมา ได้แก่ จังหวัดกาญจนบุรี 1,524 ราย จังหวัดแม่ฮ่องสอน 1,417 ราย และจังหวัดประจวบคีรีขันธ์ 1,267 ราย ตามลำดับ ขณะเดียวกัน ยังพบด้วยว่า จังหวัดที่ถูกประกาศ รับรองเป็นจังหวัดปลอดโรคไข้มาลาเรีย 4 จังหวัด ได้แก่ จังหวัดเชียงใหม่ จังหวัดนครศรีธรรมราช จังหวัดสตูล และ จังหวัดเลย กลับมาพบผู้ป่วยติดเชื้อในพื้นที่ ทั้งนี้ โรคไข้มาลาเรียมียุงก้นปล่องเป็นพาหะนำโรค มีความชุกชุม ตามบริเวณที่เป็นป่าเขา สวนยางพารา แหล่งน้ าธรรมชาติ หากประชาชนที่อาศัยอยู่ในพื้นที่ดังกล่าว หรือนักท่องเที่ยว ผู้เดินทางไปพักค้างคืนในพื้นที่ป่าเขาถูกยุงกัดเมื่อป่วยจะมีอาการไข้ หนาวสั่น ปวดศีรษะ ปวดกล้ามเนื้อ ควรรีบไปพบ แพทย์เพื่อตรวจหาเชื้อพร้อมแจ้งประวัติการเข้าป่าหรืออยู่ในพื้นที่ระบาดของโรคไข้มาลาเรียให้แพทย์ทราบ
3. โรคหลอดเลือดสมองมีผู้เสียชีวิตเพิ่มขึ้น องค์การโรคหลอดเลือดสมองโลก (World Stroke Organization: WSO) รายงานว่าปัจจุบันพบผู้ป่วยโรคหลอดเลือดสมองทั่วโลกมากกว่า 101 ล้านราย เสียชีวิต ประมาณ 6.5 ล้านรายต่อปี สำหรับประเทศไทย โรคหลอดเลือดสมองเป็นปัญหาสาธารณสุขที่สำคัญ ในแต่ละปี จะมีผู้ป่วยโรคหลอดเลือดสมองเพิ่มขึ้นอย่างต่อเนื่อง และเป็นสาเหตุการเสียชีวิตเป็นอันดับ 2 รองจากโรคมะเร็ง จากข้อมูล Health Data Center ของกระทรวงสาธารณสุข ปีงบประมาณ พ.ศ. 2567 (1 ตุลาคม 2566 – 1 สิงหาคม 2567) พบว่า คนไทยป่วยด้วยโรคหลอดเลือดสมอง 355,213 ราย เพิ่มขึ้นจากปีงบประมาณ พ.ศ. 2566 ที่มีผู้ป่วย 350,934 ราย และจำนวนผู้เสียชีวิตด้วยโรคหลอดเลือดสมองในปีงบประมาณ พ.ศ. 2566 มีจำนวน 47,275 ราย เพิ่มขึ้นมากสุดในช่วง 4 ปีที่ผ่านมา (ปี 2563 - 2566) สำหรับในปีงบประมาณ พ.ศ. 2567 (1 ตุลาคม 2566 – 1 สิงหาคม 2567) พบผู้เสียชีวิตแล้ว 35,116 ราย ซึ่งในกลุ่มอายุ 18 – 39 ปี มีจำนวนผู้ป่วยขยายตัว เพิ่มขึ้นมากที่สุด
ทั้งนี้ สาเหตุและปัจจัยเสี่ยงของการเกิดโรคหลอดเลือดสมอง ได้แก่ ความดันโลหิตสูง การออก กำลังกายไม่เพียงพอ การบริโภคอาหารไม่เหมาะสม ไขมันในเลือดสูง การสูบบุหรี่ การดื่มเครื่องดื่มแอลกอฮอล์ ภาวะโรคหัวใจ โรคเบาหวาน โรคอ้วน และภาวะเครียด
การปรับเปลี่ยนพฤติกรรมการดำเนินชีวิตเป็นวิธีที่ดี ที่สุดในการป้องกันโรคหลอดเลือดสมอง ทำได้โดย 1) การควบคุมระดับความดันโลหิต ระดับน้ำตาล ไขมันในเลือด และควบคุมน้ าหนักให้อยู่ในเกณฑ์ที่เหมาะสม 2) รับประทานอาหารที่ดีต่อสุขภาพ ลดหวาน มัน เค็ม 3) ออกกำลังกาย อย่างสม่ำเสมอ 4) งดเครื่องดื่มที่มีแอลกอฮอล์ งดสูบบุหรี่ และงดใช้สารเสพติดทุกชนิด 5) หลีกเลี่ยงความเครียด พักผ่อนให้เพียงพอ และ 6) ตรวจสุขภาพเป็นประจำอย่างน้อยปีละ 1 ครั้ง
นอกจากนี้ ควรสังเกตอาการตนเอง ตามหลักการ B.E.F.A.S.T ดังนี้ B (Balance) เดินเซ เวียนศีรษะบ้านหมุนฉับพลัน E (Eye) ตามัว มองเห็นภาพซ้อน ฉับพลัน F (Face) ปากเบี้ยว หน้าเบี้ยวเฉียบพลัน A (Arm) แขน ขา อ่อนแรงหรือชาครึ่งซีก S (Speech) พูดไม่ชัด เสียงเปลี่ยน ลิ้นแข็ง พูดไม่รู้เรื่อง พูดไม่ออกทันทีทันใด T (Time) หากมีอาการให้รีบนำผู้ป่วยส่งโรงพยาบาลโดยเร็ว หากไปพบแพทย์ช้า อาจเป็นอันตรายถึงแก่ชีวิตหรืออาจจะกลายเป็นโรคอัมพฤกษ์ อัมพาต ทำให้ไม่สามารถ ช่วยเหลือตนเองได้
2. การยกระดับระบบความปลอดภัยเพื่อสร้างความเชื่อมั่นให้แก่ผู้ร่วมงาน


โดยประเทศบราซิล ถือเป็นหนึ่งในประเทศที่มีปัญหาอาชญากรรมและความรุนแรง โดยในช่วง เทศกาลริโอคาร์นิวัล ได้มีการบังคับใช้ กฎหมาย “No Is No” เพื่อเป็นมาตรการในการปกป้องและดูแลความปลอดภัยสตรีในช่วงเทศกาล โดยเฉพาะการล่วงละเมิดทางเพศ ซึ่งจะประสานความร่วมมือสถานประกอบการท่องเที่ยว ตั้งแต่ที่พักไปจนถึงร้านอาหาร ไนต์คลับ และบริการขนส่ง ในการป้องกันอันตรายและคุ้มครองผู้หญิงในสถานที่ต่าง ๆ นอกจากนี้ ยังมี ศูนย์ปฏิบัติการริโอ (COR) ซึ่งเป็นห้องสังเกตการณ์พร้อมเจ้าหน้าที่ 60 คนต่อกะ และมีโดรนส่งภาพขบวนพาเหรด ในตัวเมืองริโอเพื่อรายงานสถานการณ์แบบเรียลไทม์ไปยังเจ้าหน้าที่ควบคุม อีกทั้ง ยังมีการเพิ่มกำลังเจ้าหน้าที่ ตำรวจให้ประจำการอยู่ทุกแห่ง เช่นเดียวกับ เทศกาลปามะเขือเทศ ที่ในแต่ละปีมีนักท่องเที่ยวเข้ามาจำนวนมาก ขณะที่มีข้อจำกัดด้านขนาดพื้นที่ของเมือง จึงออกมาตรการจำกัดจำนวนผู้เข้าร่วมและเตรียมพร้อมด้าน ความปลอดภัยและเหตุฉุกเฉิน โดยมีการจำหน่ายตั๋วเข้าร่วมที่มีจำนวนจำกัด และมีเจ้าหน้าที่รักษาความปลอดภัย ทั่วบริเวณงานและมีรถพยาบาลประจำอยู่แต่ละจุด ตลอดจน มีการเตรียมเฮลิคอปเตอร์เพื่อรองรับเหตุฉุกเฉินในกรณีที่เกิดเหตุไม่คาดคิด นอกจากนี้ บางประเทศได้มีการนำเทคโนโลยี ในการจัดงาน (Event Technology) มาใช้ โดยสหรัฐอเมริกา ได้มีการติดตั้ง OPENGATE เทคโนโลยีตรวจจับอาวุธขั้นสูง ในเทศกาลดนตรีฮิปฮอประดับโลกอย่าง Rolling Loud ที่มีผู้เข้าร่วมงานกว่า 100,000 คน ซึ่งช่วยกระชับเวลาและขั้นตอน การคัดกรองของเจ้าหน้าที่ได้ถึงร้อยละ 64
ความรู้สึกของ นพ.สุภัทร ฮาสุวรรณกิจ
ความรู้สึกของผมเมื่อขบวนการแพทย์ชนบทได้รับรางวัลแมกไซไซ
ผมเรียนจบแพทย์จากจุฬาฯ ในเดือนเมษายน 2537 ก็เลือกกลับมาทำงานใกล้บ้าน มาเป็น intern ที่โรงพยาบาลสงขลาครึ่งปี แล้วไปเป็นแพทย์ประจำที่โรงพยาบาลเทพาอีกครึ่งปี สนุกกับการรักษาผู้ป่วยตามความรู้ที่ร่ำเรียนมา
พฤษภาคม 2538 ผมก็ขยับไปเป็นผู้อำนวยการโรงพยาบาลสะบ้าย้อย ที่นั่นผมเริ่มเข้ามาทำงานชมรมแพทย์ชนบท คุณหมอสุวัฒน์ วิริยพงษ์สุกิจ ผู้อำนวยการโรงพยาบาลเทพาในขณะนั้นชวนผมเข้าชมรม ผมเริ่มงานด้วยการทำจดหมายข่าวชมรมแพทย์ชนบท เขียนคอลัมน์ประจำด้วยนามปากกา “งูเขียวหางไหม้” สำหรับคอลัมน์เกาะติดสถานการณ์ และนามปากกว่า “น้องชายคนเล็ก” สำหรับคอลัมน์ครอบครัวใหญ่ สำหรับผม พี่ๆแพทย์ชนบทคือต้นแบบที่ผมชื่นชมยิ่ง
ผมเรียนรู้เติบใหญ่ขึ้นมาช้าๆ เรียนรู้ผ่านการประชุมกรรมการชมรมแพทย์ชนบท เวทีเสวนา และผ่านปฏิบัติการต่างๆ ผมรับรู้ว่า “การจัดสรรทรัพยากรไม่เคยเป็นธรรม เหลื่อมล้ำ คนข้างบนที่มีอำนาจทั้งฝ่ายข้าราชการและฝ่ายการเมือง ต่างเห็นประโยชน์ตนมากกว่าส่วนรวม การคอรับชั่นก็มีมาตลอด ชมรมแพทย์ชนบทจึงหลีกไม่พ้นที่ต้องทำงานหนุนหรือค้านกับนโยบายและการเมือง
ผมอยู่ในชมรมแพทย์ชนบทมา 29 ปี เป็นสมาชิกถาวรด้วยอุดมคติที่ตรงกันโดยไม่ต้องสมัครสมาชิก และที่สำคัญชมรมนี้ไม่มีระบบการสมัครสมาชิก ใครสนใจเห็นด้วยก็กระโดดเข้ามาได้เลย ความแหลมคมในการเคลื่อนไหวและการวิพากษ์ปลัดหรือรัฐบาล จะเป็นเครื่องคัดกรองอุดมคติที่ดีกว่าใบสมัครใดๆ ประโยชน์ที่จะได้รับส่วนตนนั้น มีก็แต่มิตรภาพ การเรียนรู้ และการได้ทำงานตามความคิดความฝัน ซึ่งสำหรับผมถือว่า นี่คือโลกอุดมคติแห่งเดียวที่มีอยู่ในระบบราชการของกระทรวงสาธารณสุข
ชมรมแพทย์ชนบทเป็นสายธารแห่งอุดมการณ์ที่ยาวนานมาตั้งแต่ปี 2519 มีผู้คนเกี่ยวข้องมากมายนับหมื่นคน มีกลไกที่ขับเคลื่อนสามกลไกหลักคือ ชมรมแพทย์ชนบทเสมือนหน่วยทัพหน้าแม่ทัพชายแดนถนัดออกทำศึกจรยุทธ มูลนิธิแพทย์ชนบทเสมือนกองหลังเป็นองค์กรนิติบุคคลที่เป็นหน่วยส่งกำลังบำรุง และกลุ่มสามพรานเป็น think tank space ที่คุยกันทุกเดือนและนำไปสู่การขับเคลื่อนนโยบาย เป็นสามกลไกที่มีพลังมากจริงๆ จึงรวมเรียกว่า ”ขบวนการแพทย์ชนบท“
เท่าที่ผมนับได้ เราทำผลงานไม่น้อย
ถ้านับไม่ผิด เราดันกฏหมายระดับ พรบ.ได้ 6 ฉบับ (กฎหมายควบคุมยาสูบ 2 ฉบับ พรบ.หลักประกันสุขภาพถ้วนหน้า พรบ.สสส. พรบ.สุขภาพแห่งขาติ และ พรบ.ระบบสุขภาพปฐมภูมิ)
เราต้านทุจริตคอรัปชั่น ทุจริตยา ทุจริตไทยเข้มแข็ง ซื้อรถพยาบาลฉาว เทเลเมดิซิน เป็นต้น จนรัฐมนตรีติดคุกไป1คน ลาออกไป2คน
เราทำเรื่องดีๆจนสำเร็จเช่น การแก้ปัญหาสมองไหลในชนบทด้วยการทำให้แพทย์ในโรงพยาบาลชุมชนขึ้นได้ถึงซี9 ได้เบี้ยเลี้ยงเหมาจ่าย ให้รางวัลแพทย์ดีเด่นในชนบท ทำCLสิทธิบัตรยาสำเร็จ โรงพยาบาลแสงอาทิตย์ และแพทย์ชนบทบุกกรุงสู้ภัยโควิด เป็นต้น
ขอบคุณมูลนิธิรางวัลแมกไซไซที่เห็นถึงสายธารความต่อเนื่องในการขับเคลื่อนงานด้านสุขภาพให้สังคมไทย รางวัลนี้เป็นรางวัลระดับโลกที่ทรงเกียรติที่สุดของแพทย์ชนบทและเครือข่ายทุกคน
ภารกิจแพทย์ชนบทยังคงต่อเนื่อง เพื่อสุขภาพและคุณภาพชีวิตที่ดีขึ้นของคนทุกคนในแผ่นดินไทย
สุภัทร ฮาสุวรรณกิจ
นายจิณตวัตน์ พรสุขสวัสดิ์ หรือ คุณอู๋ อายุ 47 ปี เจ้าของเพจ AooRun นักวิ่งฟูลมาราธอน และเป็นผู้ป่วยมะเร็งต่อมน้ำเหลือง ระยะที่ 4 ชนิด Non Hodgkin B-Cell คือ ลุกลามไปทั่วแล้ว พบเมื่อเดือนธันวาคมปี 2566 ปัจจุบัน จบการรักษาไปแล้วราว 2 เดือน และกลับมาวิ่งได้แล้ว แม้ว่าวิ่งไม่ได้เหมือนแต่ก่อน แต่ก็พบความสุขจากการวิ่งในระยะสั้นๆ เป็นการสร้างภูมิคุ้มกันทั้งทางกายและใจเพื่อต่อสู้กับโรคมะเร็ง โดยมี ศ.นพ.ธานินทร์ อินทรกำธรชัย ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ประธานชมรมโรคมะเร็งต่อมน้ำเหลืองแห่งประเทศไทย และ รศ.นพ.กฤษฎา วุฒิการณ์ ผู้เชี่ยวชาญด้านโรคมะเร็งต่อมน้ำเหลือง คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ร่วมให้ข้อมูล ศักยภาพของการเชื่อมต่อข้อมูลต่อการเพิ่มประสิทธิภาพในการดูแลรักษาผู้ป่วย
ผู้นำในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกเล็งเห็นถึงโอกาสในการยกระดับการดูแลรักษาผู้ป่วย ด้วยศักยภาพของการเชื่อมต่อข้อมูลจากแหล่งต่างๆ เข้าด้วยกัน เพื่อช่วยจัดเก็บข้อมูลผู้ป่วยไว้ในที่เดียว โดยพวกเขาเชื่อว่าการนำข้อมูลเชิงลึกมาจัดเก็บและประมวลผลจะช่วยในการวางแผนหรือหาแนวทางการดูแลที่เหมาะสมได้ (36%), สามารถระบุแนวทางการรักษาที่มีประสิทธิผลได้ (36%), สามารถประเมินและบริหารจัดการความต้องการของผู้ป่วยได้ (36%), สามารถพยากรณ์และลดความเสี่ยงของอาการที่แย่ลงในผู้ป่วยได้ (33%), และสามารถลดเวลารอคอยในการตรวจวินิจฉัยและกระบวนการดูแลได้อย่างเหมาะสม (31%)
อย่างไรก็ตาม 93% ของผู้นำในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกบอกว่าพวกเขาพบอุปสรรคในการเชื่อมต่อข้อมูลอย่างน้อย 1 อย่างเมื่อนำมาประยุกต์ใช้จริง ซึ่งส่งผลต่อการดูแลรักษาผู้ป่วย ทั้งด้านเวลาและคุณภาพ ได้แก่ เพิ่มความเสี่ยงของการดูแลรักษาที่ผิดพลาด ความปลอดภัยและ/หรือคุณภาพของการดูแลผู้ป่วยที่ลดลง (36%), มีข้อจำกัดในการประสานงานระหว่างผู้ให้บริการ/หรือภายในแผนกต่างๆ (33%), ต้นทุนการดำเนินงานที่เพิ่มขึ้นเนื่องจากการขาดประสิทธิภาพ (32%), ต้องใช้เวลาในการเข้าถึง/รวมข้อมูล ทำให้มีเวลาน้อยลงในการดูแลผู้ป่วย (31%), ขาดโอกาสในการดูแลเชิงป้องกันหรือการรับการรักษาที่รวดเร็ว (31%)
แต่ผู้นำในวงการเฮลท์แคร์ในเอเชียแปซิฟิก ยังเห็นว่าหากสามารถเชื่อมต่อข้อมูลได้สำเร็จจะมีศักยภาพและประโยชน์ต่อการดูแลรักษาผู้ป่วยมากที่สุด โดย 67% เห็นว่าคุณภาพของข้อมูลมีความสำคัญที่สุด พวกเขาระบุว่าความแม่นยำของข้อมูล (36%), การปรับปรุงด้านความปลอดภัย/ความเป็นส่วนตัวของข้อมูล (34%), การเข้าถึงข้อมูลสุขภาพของตัวผู้ป่วยเอง (34%) และการทำงานร่วมกันระหว่างแพลตฟอร์ม/สถานบริการสาธารณสุข (31%) เป็นส่วนที่ควรได้รับการพัฒนาเมื่อมีการจัดการด้านข้อมูล
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC) สูตินรีเวชกรรม
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC)
สูตินรีเวชกรรม
เปิดให้บริการทุกวันอังคาร เริ่มวันที่ 20 กุมภาพันธ์ 2567 เวลา 16.30-20.30 น. (จองคิวล่วงหน้าได้ที่ 043-311044 ต่อ 211 ในเวลาราชการ)
ณ คลินิกฝากครรภ์ อาคารเอกซเรย์ชั้น 2
คลินิคพิเศษเฉพาะทางเวชศาสตร์ฟื้นฟู นอกเวลาราชการ
คลินิคพิเศษเฉพาะทางเวชศาสตร์ฟื้นฟู นอกเวลาราชการ โดยแพทย์เวชศาสตร์ฟื้นฟู ให้บริการวันพฤหัสบดี สัปดาห์ที่ 1, 3 และ 5 ของเดือน เวลา 17.00-20.00 น. แพทย์หญิงกัลยาณี บุญประสิทธิ์ สอบถามโทร 038-814375 ถึง 78 ให้การรักษา อาการปวดกล้ามเนื้อ ปวดคอ บ่าไหล่ ปวดข้อ ปวดเข่า ข้อเข่าเสื่อม ลงเข็มลดปวด (Dry Needling) รักษาอาการปวดด้วยคลื่นกระแทก (Shockwave therapy)
”ปวดท้อง ท้องอืด อาหารไม่ย่อย เรอบ่อย“ อันตรายจากการติดเชื้อ H.Pylori
”ปวดท้อง ท้องอืด อาหารไม่ย่อย เรอบ่อย“
อันตรายจากการติดเชื้อ H.Pylori
เชื้อแบคทีเรียที่แฝงอยู่ในกระเพาะอาหาร
มีความเสี่ยงก่อให้เกิดแผลในกระเพาะอาหาร
และความเสี่ยงเป็นมะเร็งกระเพาะอาหาร
การตรวจหาเชื้อแบคทีเรีย H.Pylori
สามารถทำได้โดยวิธีการส่องกล้อง
และรักษาได้ด้วยการกินยาปฏิชีวนะร่วมกับยาลดกรด
ท่านสามารถลงคิวนัดตรวจได้ที่
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC)
หรือสแกน Qr code เพื่อทำการนัดหมาย
บริการตรวจประเมินสภาพตาและผ่าตัด สำหรับผู้ที่ต้องการรักษาโรคกระจกตาโก่ง หรือกระจกตาย้วย (Keratoconus)
ศูนย์เลสิกเมตตา เปิดให้บริการตรวจประเมินสภาพตา และผ่าตัด สำหรับผู้ที่ต้องการรักษาโรคกระจกตาโก่ง หรือกระจกตาย้วย (Keratoconus) โดยรักษา ด้วย 2 วิธี คือ
1. Intracorneal ring implantation หรือ ICR โดยใช้ Femtosecond laser
2. Corneal cross-linking
สำหรับวิธีการรักษา จักษุแพทย์ผู้เชี่ยวชาญด้านกระจกตาจะเป็นผู้ประเมินค่ะ
สนใจตรวจ เพื่อเข้ารับการรักษา มีแพทย์ลงตรวจ ตามวัน และเวลา ดังนี้ วันอังคาร วันพุธ และวันพฤหัส สัปดาห์ 1,3,5
****ขั้นตอนการเข้ารับการตรวจ****
1. ติดต่อทำแฟ้มเวชระเบียนผู้ป่วยใหม่ ที่เค้าท์เตอร์ประชาสัมพันธ์ ชั้น 1
- วันอังคาร และวันพฤหัส (สัปดาห์ที่ 1,3,5) เวลา 08.00 น.
- วันพุธ เวลา 10.00 น.
2. แจ้งเจ้าหน้าที่ห้องบัตร ขอแฟ้มเพื่อมาตรวจที่ศูนย์เลสิก ชั้น M (ไม่ต้องขอคิว)
3. ติดต่อห้องเช็คสิทธิ เพื่อเช็คสิทธิการรักษา และขึ้นมาทีศูนย์เลสิก ชั้น M
หากแพทย์ติดภารกิจในวัน และเวลาดังกล่าว ทางศูนย์เลสิกขอสงวนสิทธิ์ในการเปลี่ยนแปลงเงื่อนไข โดยไม่ต้องแจ้งให้ทราบล่วงหน้า**
แพคเกจบริการของคลินิกตาสดใส
คลินิกตานอกเวลาราชการ โรงพยาบาลบึงกาฬ
งานลอยปริมณฑล (นนทบุรี ปทุมธานี สมุทรปราการ)
- งานประจำปีลอยกระทงปิดทองไหว้พระหลวงพ่อเพชร พระอุปคุต พระอาจารย์ลมูล 15 พฤศจิกายน 2567 ณ วัดสุราษฎร์รังสรรค์ อำเภอสามโคก ปทุมธานี
คลินิกพิเศษเฉพาะทางอายุรกรรม นอกเวลาราชการ โรงพยาบาลนางรอง
การตรวจสมรรถภาพปอด การได้ยิน การมองเห็น
การตรวจทางด้านอาชีวเวชศาสตร์
การตรวจสมรรถภาพปอด (Lung function test หรือ Pulmonary function test)
ตรวจเพื่อดูความสามารถในการทำหน้าที่ของปอด เช่น ดูว่าปริมาตรและความจุของปอดเป็นปกติดีหรือไม่ อากาศสามารถผ่านเข้าและออกจากปอดได้ดีเพียงใด ปอดมีความสามารถในการแลกเปลี่ยนก๊าซได้ดีเพียงใด
การเตรียมตัวก่อนตรวจ
- สภาพร่างกายปกติ ในกรณีที่เคยเป็นโรคระบบทางเดินหายใจ เช่น ไข้หวัดหลอดลมอักเสบ ปอดบวม ต้องได้รับการรักษาหายมาแล้วอย่างน้อย 3 สัปดาห์ และไม่อยู่ในระยะหลังการผ่าตัดใหม่ ๆ เช่น ผ่าตัดช่องอก ช่องท้อง เป็นต้น
- ควรสวมใส่เสื่อผ้าที่สบาย ไม่รัดทรวงอกและท้อง
- ห้ามออกกำลังกายอย่างหนักก่อนตรวจอย่างน้อย 30 นาที
- ไม่ดื่มเครื่องดื่มที่มีแอลกอฮอล์ก่อนตรวจอย่างน้อย 4 ชั่วโมง
- หยุดสูบบุหรี่ก่อนตรวจอย่างน้อย 24 ชั่วโมง
- หลีกเลี่ยงการรับประทานอาหารจนอิ่มจัดก่อนตรวจอย่างน้อย 2 ชั่วโมง
- หยุดใช้ยาขยายหลอดลมก่อนตรวจ
- ถ้าใส่ฟันปลอมชนิดที่ถอดได้ ต้องถอดออก
การตรวจสมรรถภาพการได้ยิน (Audiometry)
เป็นการตรวจเพื่อคัดกรองและป้องกันโรคประสาทหูเสื่อมจากเสียงดัง (Noise-induced hearing loss; NIHL)
การเตรียมตัวก่อนตรวจ
- สภาพร่างกายปกติ ไม่เป็นไข้หวัดหรือหูอื้อ
- หยุดรับฟังเสียงดัง ก่อนตรวจอย่างน้อย 12 ชั่วโมง ในทางปฏิบัติมักจะทำการตรวจในวันจันทร์ที่เป็นวันแรกของสัปดาห์การทำงาน เพื่อให้พนักงานได้หยุดรับฟังเสียงดังในวันหยุดประจำสัปดาห์
- หลีกเลี่ยงการสัมผัสเสียงดังที่บ้าน
- มาถึงห้องตรวจสมรรถภาพการได้ยินก่อนรับการตรวจอย่างน้อย 5 นาทีเพื่อป้องกันการหอบเหนื่อยขณะทำการตรวจ
- ก่อนเข้าห้องตรวจให้ปิดโทรศัพท์มือถือ ถอดที่คาดผมตุ้มหูใหญ่ หรือแว่นตาออก (ถ้าสวมใส่อยู่)
การตรวจสมรรถภาพการมองเห็น (Vision test)
เป็นการตรวจคัดกรองโรคหรือความผิดปกติที่เกี่ยวกับการมองเห็นให้กับคนทำงาน และใช้ในการพิจารณาว่าคนทำงานนั้นมีความพร้อมในการทำงาน (Fitness to work)หรือไม่
การเตรียมตัวก่อนตรวจ
- สภาพดวงตาไม่เป็นอุปสรรคต่อการมองเห็น เช่น ตาเจ็บตาแดง เป็นต้น
- สายตาเมื่อยล้าหรือพร่ามัวจากงานที่กำลังทำอยู่
- ผู้ที่สวมแว่นตาให้นำแว่นมาด้วยเพื่อทำการตรวจสอบแว่นตาที่ใช้อยู่ว่ามีความเหมาะสมกับการทำงานหรือไม่
โครงการส่งเสริมโภชนาการและสุขภาพเด็กและเยาวชนในถิ่นทุรกันดาร (กพด.)
สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี ทรงเริ่มงานพัฒนาเด็กและเยาวชนในถิ่นทุรกันดารมาตั้งแต่ ปี 2523 และได้ทรงงานมาอย่างต่อเนื่องมาเป็นระยะเวลากว่า 40 ปี ตั้งแต่ ปี 2533 ทรงรับสั่งให้กรมอนามัยเป็นหน่วยร่วมสนองงานในการดำเนินโครงการป้องกันและควบคุมโรคคอพอก และในปี 2539 ทรงรับสั่งให้กรมอนามัยดำเนินโครงการส่งเสริมโภชนาการและสุขภาพอนามัยแม่และเด็กในถิ่นทุรกันดาร ได้ดำเนินการร่วมกับหน่วยงานสาธารณสุขในระดับพื้นที่เป้าหมายมาอย่างต่อเนื่อง จนส่งผลให้ของภาวะสุขภาพของเด็กและเยาวชนในถิ่นทุรกันดารมีสุขภาวะดีขึ้นตามลำดับ และสภาพแวดล้อมของโรงเรียนในถิ่นทุรกันดารในพื้นที่เป้าหมายได้รับความร่วมมือในการพัฒนาจากหลายภาคส่วน ส่งผลให้มีสภาพแวดล้อมมีสุขลักษณะที่ดีขึ้นตามลำดับ ปัจจุบันการคมนาคมเดินทางไปโรงเรียนบางแห่งบางพื้นที่เข้าถึงได้สะดวกขึ้น แต่ยังมีโรงเรียนในถิ่นทุรกันดารในพื้นที่เป้าหมายส่วนหนึ่งตั้งอยู่ในพื้นที่ห่างไกลการคมนาคมเดินทางเข้าถึงยากลำบากมาก การดูแลช่วยเหลือด้านสาธารณสุขยังเข้าไม่ถึงทุกพื้นที่ทุกแห่ง เข้าถึงได้ยากมาก ส่งผลให้เด็ก เยาวชน และประชาชนยังไม่ได้รับการดูแลช่วยเหลือด้านสุขภาพอย่างครอบคลุมและทั่วถึง
กลุ่มเป้าหมาย
1. บุคลากรสาธารณสุขที่รับผิดชอบดูแลโรงเรียนเป้าหมายในโครงการตามพระราชดำริ กพด. ได้แก่ โรงพยาบาลส่งเสริมสุขภาพตำบล โรงพยาบาลชุมชน สำนักงานสาธารณสุขอำเภอ สำนักงานสาธารณสุขจังหวัด สถานบริการสาธารณสุขระดับจังหวัดในเขตพื้นที่ ศูนย์อนามัยที่ 1-12 สสม. ศอช.
2. ภาคีเครือข่ายในพื้นที่เป้าหมาย ได้แก่ องค์กรท้องถิ่น แกนนำชุมชน หน่วยงานภาครัฐ ภาคเอกชน
3. บุคลากรหน่วยงานต้นสังกัดสถานศึกษาเป้าหมาย และหน่วยร่วมสนองงานโครงการตามพระราชดำริ ส่วนกลาง ส่วนภูมิภาค
พื้นที่ดำเนินการ
สถานศึกษาในถิ่นทุรกันดารในพื้นที่เป้าหมายตามพระราชดำริ จำนวน 899 แห่ง ได้แก่
โรงเรียนตำรวจตระเวนชายแดน
โรงเรียนสังกัด สพฐ.(กพด.)
โรงเรียนพระปริยัติธรรม
โรงเรียนเอกชนสอนศาสนาอิสลาม
โรงเรียนสังกัด อบต.-อบจ.
ศูนย์การเรียนชุมชนชาวไทยภูเขา“แม่ฟ้าหลวง”
ศูนย์ส่งเสริมและพัฒนาเด็กวัยเตาะแตะ
โรงเรียนสังกัดกรุงเทพมหานคร (กพด.)
ในพื้นที่เป้าหมายตามพระราชดำริ 53 จังหวัด ได้แก่ เชียงใหม่ แม่ฮ่องสอน เชียงราย น่าน แพร่ พะเยา ลำปาง ตาก พิษณุโลก เพชรบูรณ์ อุตรดิตถ์ ขอนแก่น กาฬสินธุ์ อุดรธานี หนองคาย บึงกาฬ เลย หนองบัวลำภู บุรีรัมย์ สุรินทร์ นครพนม มุกดาหาร สกลนคร ยโสธร ศรีสะเกษ อำนาจเจริญ อุบลราชธานี จันทบุ รี ตราด นครนายก ปทุมธานี พระนครศรีอยุธยา ฉะเชิงเทรา สระแก้ว กาญจนบุรี ราชบุรี เพชรบุรี ประจวบคีรีขันธ์ ชุมพร สุราษฏร์ธานี ระนอง พังงา นครศรีธร รมราช กระบี่ ตรัง พัทลุง สงขลา สตูล ยะลา ปัตตานี นราธิวาส และกรุงเทพมหานคร
สถานการณ์อุทกภัยและดินโคลนถล่ม จ.เชียงใหม่ และจ.เชียงราย ชีวิตสะสม 16 ราย
14 กันยายน 2567 นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข เปิดเผยสถานการณ์อุทกภัยและดินโคลนถล่มในพื้นที่เขตสุขภาพที่ 1 ระหว่างวันที่ 8-13 กันยายน 2567 ว่า พบมีสถานการณ์ใน 2 จังหวัด ได้แก่
1.เชียงใหม่ คือ อ.แม่อาย และ อ.ฝาง ผู้ได้รับผลกระทบสะสม 2,978 ครัวเรือน เป็นบุคลากรทางการแพทย์ 109 ราย ผู้บาดเจ็บสะสม 3 ราย เสียชีวิตสะสม 6 ราย รพ.สต.ได้รับผลกระทบ 1 แห่ง คือ รพ.สต.บ้านท่ามะแกง ซึ่งยังต้องปิดให้บริการ มีการเปิดศูนย์พักพิง 7 แห่ง (แม่อาย 6 แห่ง ฝาง 1 แห่ง)
2.เชียงราย ได้แก่ อ.แม่สาย อ.แม่จัน อ.แม่ฟ้าหลวง และ อ.เมือง ผู้ได้รับผลกระทบ 24,925 ครัวเรือน เป็นบุคลากรทางการแพทย์ 308 ราย ผู้บาดเจ็บสะสม 133 ราย เสียชีวิตสะสม 10 ราย รพ.สต.ได้รับผลกระทบ 5 แห่ง ได้แก่
รพ.สต.แม่สาย รพ.สต.โป่งผา รพ.สต.สามัคคีใหม่ รพ.สต.ป่ายาง และ
รพ.สต.รอบเวียง แต่ยังสามารถเปิดให้บริการได้ตามปกติ มีการเปิดศูนย์พักพิง 22 แห่ง (เมือง 12 แห่ง แม่สาย 7 แห่ง แม่จัน เวียงชัย และแม่ฟ้าหลวง อำเภอละ 1 แห่ง)
“ภาพรวมทั้ง 2 จังหวัดมีผู้เสียชีวิตสะสม 16 ราย สาเหตุมาจากดินถล่ม พลัดตกน้ำ/จมน้ำ และถูกกระแสน้ำพัด ผู้บาดเจ็บสะสม 136 ราย สถานบริการสาธารณสุขได้รับผลกระทบรวม 6 แห่ง บุคลากรทางการแพทย์ได้รับผลกระทบรวม 417 ราย ได้เปิดศูนย์ปฏิบัติการฉุกเฉินด้านการแพทย์และสาธารณสุข (PHEOC) แล้วทั้ง 2 จังหวัด ส่วนกลางและสำนักงานสาธารณสุขจังหวัดสนับสนุนยาและเวชภัณฑ์ (ชุดตรวจโรคฉี่หนู รองเท้าบูท ยากันยุง) รวม 9,000 ชุด” นพ.โอภาสกล่าว
นพ.โอภาสกล่าวต่อว่า ส่วนการดูแลสุขภาพประชาชน มีการจัดทีมปฏิบัติการฉุกเฉินทางการแพทย์ (MERT) ทีมปฏิบัติการฉุกเฉินทางการแพทย์ระดับอำเภอ (Mini MERT) หน่วยแพทย์เคลื่อนที่ ทีมสุขภาพจิต (MCATT) ทีมอนามัยสิ่งแวดล้อม (SEhRT) หน่วยปฏิบัติการควบคุมโรคติดต่อ (CDCU) ทีมเฝ้าระวังสอบสวนโรคเคลื่อนที่เร็ว (SRRT) และทีมกู้ชีพกู้ภัย รวม 167 ทีม แบ่งเป็น เชียงใหม่ 52 ทีม และเชียงราย 115 ทีม ให้การเยี่ยมบ้าน 192 ราย ตรวจรักษา 1,662 ราย ให้สุขศึกษา 2,443 ราย สุขภาพจิต 784 ราย ส่งต่อผู้ป่วย 30 ราย มอบชุดดูแลสิ่งแวดล้อม 168 ราย โดยโรคและภัยสุขภาพที่พบส่วนใหญ่เป็นน้ำกัดเท้า รองลงมาเป็นอาการทางระบบกล้ามเนื้อ/กระดูก ระบบทางเดินหายใจ โรคติดเชื้อจากไวรัส เป็นต้น ยังไม่พบการระบาดของโรคที่เกี่ยวข้องกับอุทกภัย โดยในส่วนจังหวัดเชียงราย ขณะนี้สถานการณ์น้ำเริ่มลดลง ได้ให้เร่งดำเนินการตามแผนฟื้นฟูหลังน้ำลด ดูแลสุขาภิบาลสิ่งแวดล้อมและเฝ้าระวังปัญหาโรคระบาด
ทั้งนี้ จากการคาดการณ์ของสำนักงานทรัพยากรน้ำแห่งชาติ (สทนช.) และกรมอุตุนิยมวิทยา วันที่ 13-18 กันยายน 2567 จะมีปริมาณฝนตกเพิ่มขึ้น และตกหนักมากบางพื้นที่ อ.จอมทอง และ อ.ฮอด จ.เชียงใหม่ เสี่ยงน้ำท่วมฉับพลัน น้ำป่าไหลหลากและน้ำท่วมขัง ได้กำชับนายแพทย์สาธารณสุขจังหวัดเชียงใหม่ เฝ้าระวังติดตามสถานการณ์ พร้อมสื่อสารเตือนภัยประชาชนทั้งโรคที่มากับน้ำท่วมและภัยสุขภาพ โดยเฉพาะโรคฉี่หนู รวมถึงบริหารจัดการกลุ่มผู้ป่วยโรคเรื้อรังไม่ให้ขาดยา และดูแลกลุ่มเปราะบาง ส่วนที่จังหวัดหนองคาย ระดับน้ำยังสูงขึ้น ล่าสุดได้รับรายงานสถานบริการได้รับผลกระทบ 2 แห่ง คือ โรงพยาบาลหนองคาย และโรงพยาบาลศรีเชียงใหม่ ตัองปรับการให้บริการเฉพาะผู้ป่วยฉุกเฉินเท่านั้น เพื่อความปลอดภัยในการเดินทางของประชาชนและบริหารจัดการทรัพยากรทางการแพทย์ไว้รองรับสถานการณ์ได้อย่างเหมาะสม
นพ. สุธี ศิริเวชฎารักษ์ Chief Administrative Officer ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์และเอสเพอรานซ์ กล่าวว่า การมีอายุยืนยาวไม่ใช่เพียงแค่การมีชีวิตอยู่ให้นาน แต่หมายถึงการมีสุขภาพที่ดีและมีคุณภาพชีวิตที่ดีในทุกช่วงอายุ ไวทัลไลฟ์ให้ความสำคัญกับการศึกษาค้นคว้าเกี่ยวกับสาเหตุของความชรา เพื่อนำมาพัฒนาแนวทางการดูแลสุขภาพที่สามารถชะลอกระบวนการชรา และช่วยให้ทุกคนมีอายุยืนยาวอย่างมีสุขภาพที่ดี จากงานวิจัยและข้อมูลทางวิทยาศาสตร์บ่งชี้มี 12 สาเหตุสำคัญที่นำไปสู่วัยชรา เช่น การกลายพันธุ์ของ DNA ซึ่งจะเพิ่มความเสี่ยงของการเกิดเนื้องอกและโรคมะเร็งตามอายุ การสูญเสียความสมดุลของการควบคุมการผลิตและทำลายโปรตีนในเซลล์ ซึ่งจะส่งต่อความผิดปกติของระบบประสาทที่เกี่ยวข้องกับอายุ เช่น โรคอัลไซเมอร์ โรคพาร์กินสัน รวมถึงการตอบสนองต่อสารอาหารผิดปกติ นำไปสู่ภาวะผิดปกติของระบบเผาผลาญ ส่งผลต่อการเกิดโรคเรื้อรังต่าง ๆ เช่น โรคเบาหวาน โรคอ้วน โรคความดันโลหิตสูง และโรคหัวใจ เป็นต้น
สุขภาพของแต่ละคนมีความแตกต่างกัน ดังนั้น ไวทัลไลฟ์จึงได้นำเสนอแนวทางและพัฒนาแผนการดูแลสุขภาพแบบองค์รวมระยะยาวที่ปรับเปลี่ยนให้เหมาะกับความต้องการเฉพาะบุคคล เพื่อให้ทุกคนสามารถบรรลุเป้าหมายด้านสุขภาพที่ตั้งเป้าไว้ โดยมีเส้นทางการดูแลสุขภาพใน 4 ขั้นตอน ประกอบด้วย การประเมินที่ครอบคลุม การวางแผนอายุยืนเฉพาะบุคคล การบำบัดและการดูแลรักษาแบบองค์รวม และการติดตามและการปรับเปลี่ยนอย่างสม่ำเสมอ โดยใช้เทคโนโลยีที่ทันสมัยและองค์ความรู้ใหม่ ๆ เกี่ยวกับการมีอายุยืนยาว พร้อมใช้อุปกรณ์และเทคโนโลยีทันสมัย อย่างนาฬิกาสุขภาพหรือแหวนสุขภาพ เข้ามาเป็นตัวช่วยในการดูแลสุขภาพ เพื่อให้ผู้เข้ารับบริการมีอายุที่ยืนยาวพร้อมพลังแห่งความเยาว์วัย และมีคุณภาพชีวิตที่ดีขึ้นในระยะยาว
การสนับสนุนของมูลนิธิฟูจิฟิล์ม บิสซิเนส อินโนเวชั่น (ประเทศไทย) จะช่วยส่งมอบรอยยิ้มให้ผู้ป่วยทั่วประเทศทั้งหมด 100 คน โดยดำเนินโครงการเพื่อมอบการผ่าตัดแบบต่อเนื่องไม่จำกัดระยะเวลาที่โรงพยาบาลชลบุรี จังหวัดชลบุรี 30 ราย และโรงพยาบาลเชียงรายประชานุเคราะห์ จังหวัดเชียงราย อีก 50 ราย ตลอดจนสนับสนุนโครงการหน่วยแพทย์เคลื่อนที่เพื่อให้การผ่าตัดภายใน 1 สัปดาห์ ที่โรงพยาบาลแม่สอด จังหวัดตาก อีก 20 ราย
เสียงจากผู้ปกครองผู้ป่วยโรคโกเชร์
ในฐานะผู้ปกครองผู้ป่วยโรคโกเชร์ นายบุญ พุฒิพงศ์ธนโชติ ประธานมูลนิธิโรคพันธุกรรมแอลเอสดี เล่าว่าย้อนไปเมื่อ 17-18 ปีที่แล้ว ตอนนั้นลูกอายุ 2 ขวบกว่ามีไข้ขึ้นสูงจึงพาไปโรงพยาบาล โชคดีที่หมอตรวจร่างกายละเอียดและคลำเจอตับม้ามโตผิดปกติ จึงเกิดความสงสัยว่าจะเป็นโรคทางพันธุกรรม ซึ่งก็ใช้เวลาตรวจนานถึง 2 เดือน จนทราบว่าลูกป่วยเป็นโรคโกเชร์ ที่น่าตกใจคือค่ายารักษาโรคนี้สูงถึง 2 ล้านบาทต่อปี และต้องรักษาไปตลอดชีวิต ช่วงแรกเหมือนชีวิตสิ้นหวังคิดวนอยู่ในหัวว่าควรทำอย่างไร และได้ปรึกษาคุณหมอว่าจะรวบรวมคนไข้ที่ป่วยเป็นโรคหายากที่เกิดจากพันธุกรรมแอลเอสดี ซึ่งนอกจากโรคโกเชร์แล้ว ยังมีอีกหลายโรคมาร่วมพูดคุยกันเพื่อหาทางออก จึงเป็นที่มาของการก่อตั้งมูลนิธิโรคพันธุกรรมแอลเอสดี มีการจัดตั้งคณะทำงานประกอบด้วยแพทย์ด้านพันธุกรรมและกลุ่มผู้ปกครอง
หลังจากที่ก่อตั้งมูลนิธิฯ คณะทำงานได้รวบรวมสถิติข้อมูลต่างๆ และได้นำเสนอเรื่องไปยังบัญชียาหลักแห่งชาติเพื่อให้พิจารณาบรรจุยารักษาโรคโกเชร์ เนื่องด้วยโรคโกเชร์สามารถรักษาหายขาดได้และไม่เป็นภาระงบประมาณมากนัก โดยในปี 2556 ยาได้ถูกบรรจุเข้าบัญชียาหลักแห่งชาติ ทำให้ผู้ป่วยสิทธิบัตรทอง สิทธิประกันสังคม หรือสิทธิสวัสดิการรักษาพยาบาลข้าราชการ สามารถเข้าถึงการรักษาและเบิกยาได้ โดยในปีแรกสามารถรักษาผู้ป่วยโกเชร์ได้ถึง 12 คน และปัจจุบันมีผู้ป่วยที่ได้รับการรักษาทั้งสิ้น 23 คน และเคยมีผู้ป่วยโรคโกเชร์ที่ได้รับการปลูกถ่ายไขกระดูกและหายขาดแล้ว 6 คน อย่างไรก็ดี ยังมีข้อจำกัดในเรื่องการหาไขกระดูกที่เข้ากันได้ ซึ่งไม่ใช่เรื่องง่าย เพราะหากเข้ากันไม่ได้ร่างกายจะสร้างปฎิกิริยาต่อต้านและอาจเป็นอันตรายอย่างรุนแรงถึงแก่ชีวิตได้
เห็นได้ชัดว่าโรค SMA มีผลกระทบต่อผู้ป่วยและครอบครัวเป็นอย่างยิ่ง ในช่วงก่อนอายุ 20 ตอนที่ได้รับวินิจฉัยว่าป่วยเป็นโรค SMA Type 3 นั้น น้องฟางยังสามารถเดินและพึ่งพาตัวเองได้ตามปกติ เพียงแค่เดินช้า ลุกจากพื้นไม่ได้ ต้องเลี่ยงการยกของหนักหรือการเดินขึ้นลงบันได แต่เมื่ออายุมากขึ้นร่างกายก็เริ่มเสื่อมถอยลงตามอาการ ในช่วงเวลาสามปีมานี้ การอ่อนแรงที่มากขึ้น ส่งผลให้น้องฟางหกล้มและกระดูกหักจนต้องเข้ารับการผ่าตัดถึงสองครั้ง ทำให้ไม่สามารถพยุงตนเองได้และต้องเริ่มใช้วีลแชร์ น้องฟางจึงจำเป็นต้องพึ่งพาครอบครัวและคนรอบข้างเพื่อดำรงชีวิตประจำวันอย่างเลี่ยงไม่ได้ นอกจากน้องฟาง ยังมีผู้ป่วย SMA อีกหลายคนในประเภทที่รุนแรงกว่าซึ่งการเสื่อมถอยของร่างกายอาจส่งผลร้ายแรง นี่คือสิ่งที่ผู้ป่วยกล้ามเนื้ออ่อนแรง SMA จำนวนมากต้องเผชิญ น้องฟางกล่าวเสริมว่า “เวลาเราเผชิญกับปัญหาเหล่านี้ เราไม่ได้เผชิญเพียงคนเดียว แต่ครอบครัวของเราหรือว่าคนที่อยู่ข้างหลังเราก็จะต้องเผชิญกับเรื่องยากลำบากนี้ด้วย เมื่อเราพึ่งพาตัวเองได้น้อยลง เราก็ต้องพึ่งพาครอบครัวมากขึ้น เช่น เพื่อนฟางที่เป็น SMA เหมือนกัน เคยทานข้าวเองได้ แต่วันนี้เขาก็ไม่สามารถยกมือทานข้าวเองได้แล้ว หรือฟางเอง แม้แต่เข้าห้องน้ำสาธารณะด้วยตัวเองก็ทำไม่ได้แล้ว เรื่องในชีวิตประจำวันบางอย่างกลายเป็นเรื่องเกินกำลัง ในขณะที่เรื่องธรรมดาอย่างการเป็นหวัดหรือหกล้ม อาจกลายเป็นเรื่องร้ายแรงถึงชีวิต”


นายแพทย์ดนัยพันธ์ อัครสกุล แพทย์ผู้ชำนาญการศัลยศาสตร์ทางเดินปัสสาวะ กล่าวว่า “เนื่องจากโรคต่อมลูกหมากโตเป็นปัญหาสุขภาพที่สัมพันธ์กับอายุที่มากขึ้น จึงเป็นโรคที่เราป้องกันไม่ได้ แต่ปัจจุบันความก้าวหน้าทางการแพทย์ทำให้เรามีแนวทางการรักษาที่ปลอดภัยและฟื้นตัวได้เร็ว ประเด็นสำคัญจึงเป็นการพบแพทย์เพื่อตรวจต่อมลูกหมากเป็นประจำทุกปีสำหรับผู้ชายที่มีอายุ 50 ปีขึ้นไป เพราะนอกจากโรคต่อมลูกหมากโตแล้ว มะเร็งต่อมลูกหมากก็เป็นอีกหนึ่งภัยร้ายที่ไม่ควรมองข้าม เพราะถือเป็นมะเร็งอันดับ 4 ที่พบได้ในเพศชาย โดยมะเร็งต่อมลูกหมากในระยะแรกอาจไม่มีอาการชัดเจน มักตรวจพบได้จากการตรวจสุขภาพหรือการตรวจสารบ่งชี้มะเร็งต่อมลูกหมากในเลือด (serum PSA) ที่มีค่าสูงเกินปกติ เมื่อเซลล์มะเร็งขยายตัวจนเบียดท่อปัสสาวะ อาจทำให้มีปัญหาในการปัสสาวะ เช่น ปัสสาวะลำบาก ปัสสาวะไม่พุ่ง กลั้นปัสสาวะไม่อยู่ มีอาการปวดแสบเวลาปัสสาวะ หรือมีเลือดปนมากับปัสสาวะและอสุจิ ซึ่งเป็นอาการที่คล้ายกับโรคต่อมลูกหมากโต แต่จริง ๆ แล้วต่อมลูกหมากโตไม่ใช่ปัจจัยเสี่ยงที่ทำให้เกิดมะเร็ง คนที่เป็นต่อมลูกหมากโตจะมีโอกาสเป็นมะเร็งต่อมลูกหมากอยู่ประมาณ 20% เมื่อปัสสาวะไม่สามารถออกได้หมด แบคทีเรียก็สะสมและเพิ่มความเสี่ยงในการติดเชื้อ บางกรณีอาจเกิดนิ่วในกระเพาะปัสสาวะ ที่สำคัญคือการปล่อยให้กระเพาะปัสสาวะอักเสบและไตเสื่อมลงจนเกิดความเสียหายถาวร ดังนั้นหากมีอาการปัสสาวะผิดปกติ ผู้ชายไม่ควรอดทนหรือนิ่งนอนใจ ควรปรึกษาแพทย์เพื่อตรวจวินิจฉัยให้ชัดเจนจะดีที่สุด เพื่อความปลอดภัยของชีวิตเราเอง”
วัคซีน ลดความรุนแรง ลดอัตราการตายได้
ศาสตราจารย์ แพทย์หญิงศศิโสภิณ เกียรติบูรณกุล ผู้แทนจากราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย กล่าวว่า โควิด-19 ส่งผลกระทบได้กับทุกอวัยวะ อาจก่อให้เกิดผลกระทบเหมือนเป็นลูกโซ่ ต่อทั้งโรคที่ผู้ป่วยเป็นอยู่ และนำไปสู่ ภาวะแทรกซ้อนที่ตามมาได้ในหลาย ๆ ระบบ แม้กระทั่งผู้ไม่ได้มีโรคประจำตัวมาก่อน ก็พบว่าโรคบางโรคเพิ่มสูงขึ้นหลังหายจาก โควิดแล้ว เช่น โรคเบาหวาน โรคหัวใจและหลอดเลือด โรคปอด โรคทางสมอง เป็นภาวะที่เกิดตามหลังโควิด-19 หรือเรียกว่า ลองโควิดซึ่งพบประมาณร้อยละ 15 แต่ในกลุ่ม 608 นั้น โรคมีความรุนแรงทั้งในขณะที่ป่วยอยู่และหลังจากหายป่วยแล้ว
ต่อคำถามว่าวัคซีนยังมีความจำเป็นอยู่หรือไม่ ศ. พญ.ศศิโสภิณ ยืนยันว่าวัคซีนโควิดเข็มกระตุ้นยังมีความจำเป็นอยู่ “โควิด-19 มีการกลายพันธุ์ไปเรื่อย ๆ ทำให้ผู้ที่เคยฉีดวัคซีนหรือเคยติดเชื้อไปนานแล้ว ภูมิคุ้มกันที่มีอยู่อาจไม่สามารถป้องกัน โรคได้ โดยเฉพาะในกลุ่มเสี่ยง จึงมีความจำเป็นที่ต้องรับวัคซีนเข็มกระตุ้น ซึ่งข้อมูลปัจจุบันประสิทธิภาพของวัคซีนเข็มกระตุ้น จะอยู่ที่ประมาณร้อยละ 60-70 ในการป้องกันการป่วยหนักและเสียชีวิต ซึ่งถ้าพิจารณาจากความเสี่ยงของการป่วยหนักและ
เสียชีวิตที่เพิ่มขึ้นหลายเท่าในคนกลุ่มนี้แล้ว ยิ่งแสดงให้เห็นถึงความสำคัญของวัคซีนในการลดภาระโรคที่จะเกิดกับคนไข้กลุ่มนี้”
“ประเทศต่าง ๆ ทั่วโลก ทั้งในทวีปอเมริกา ยุโรป รวมถึงในแถบเอเชีย อาทิ ไต้หวัน และสิงคโปร์ ยังคงแนะนำให้ ประชากร โดยเฉพาะในกลุ่มเสี่ยง รับวัคซีนโควิดเข็มกระตุ้น เพื่อป้องกันการป่วยหนักและเสียชีวิต สำหรับประเทศไทย สมาคม โรคติดเชื้อแห่งประเทศไทยและราชวิทยาลัยอายุรแพทย์ ได้ออกคำแนะนำการฉีดวัคซีนโควิด สำหรับกลุ่ม 608 โดยแนะนำเข็ม กระตุ้น โดยเฉพาะถ้าเคยฉีดวัคซีนเข็มก่อนหน้ามาเกิน 1 ปี หรือติดเชื้อครั้งสุดท้ายมานานกว่า 3-6 เดือน และไม่ขึ้นกับว่าเคย ได้รับวัคซีนโควิด-19 มาแล้วจำนวนเท่าใด” ศ. พญ.ศศิโสภิณ ชี้แจง
แพทย์หญิงจิรา ถาวรประดิษฐ์ ผู้อำนวยการคลินิกสุขภาพเชิงป้องกันและฟื้นฟู BDMS Wellness Clinic กล่าวว่า “การดูแลผู้ป่วยมะเร็งเต้านมไม่ได้สิ้นสุดที่การรักษา การดูแลสุขภาพหลังจากการรักษาเสร็จสิ้นถือเป็นขั้นตอนสำคัญ BDMS Wellness Clinic จึงเปิดตัวโปรแกรม Breast Cancer Healing ที่ได้รับการออกแบบมาเพื่อเติมเต็มการดูแลผู้ป่วย หลังจากที่การรักษาโรคมะเร็งเสร็จสิ้นแล้ว มอบการฟื้นฟูผู้ป่วยมะเร็งเต้านมแบบครบองค์รวม ตั้งแต่การดูแลสุขภาพภายในแบบเฉพาะบุคคลเพื่อป้องกันการเกิดโรคมะเร็งซ้ำในอนาคต ปรับโภชนาการที่ตรงกับความต้องการของร่างกาย แนวทางการออกกำลังกายที่เหมาะสมหลังผ่านการผ่าตัด ฉายแสง หรือเคมีบำบัด การจัดการความเครียดและการนอนหลับ ไปจนถึงการดูแลความงามของสุขภาพผิวพรรณและเส้นผม เพื่อคืนความมั่นใจ ตลอดจนคุณภาพชีวิตที่ดีให้กับผู้ป่วยโรคมะเร็งอีกครั้ง โปรแกรม Breast Cancer Healing มอบการดูแลแบบเฉพาะบุคคลในทุกขั้นตอน โดยมีทีมแพทย์และทีมสหวิชาชีพ เช่น นักกำหนดอาหาร นักกายภาพบำบัด นักวิทยาศาสตร์การกีฬา ตลอดจนผู้เชี่ยวชาญด้านสุขภาพจิตร่วมดูแลอย่างใกล้ชิด เพื่อให้กลับไปใช้ชีวิตได้อย่างมั่นใจอีกครั้ง”
“สำหรับงาน Cardio Catalyst: Driving Change in Heart Health ในวันนี้ มองว่าเป็นจุดเริ่มต้นที่ดี ที่จะขับเคลื่อนการดูแลรักษาผู้ป่วยโรคหัวใจและหลอดเลือด ซึ่งเป็นปัญหาสาธารณสุขอันดับต้นๆ ของประเทศไทย ให้เป็นไปในทิศทางเดียวกัน และช่วยผลักดันให้เกิดความร่วมมือกันระหว่างทุกภาคส่วน ในการดูแลสุขภาพของประชาชนไทยให้มีคุณภาพชีวิตที่ดี เพื่อลดอุบัติการณ์การเกิดโรคหัวใจและหลอดเลือด”
นอกจากนี้ ยังได้กล่าวถึงหลักการ 4A ในการพัฒนาระบบการดูแลรักษาโรคหัวใจและหลอดเลือดในประเทศไทย อันได้แก่ การตระหนักรู้เกี่ยวกับโรค (Awareness) การประเมินความเสี่ยงของการเกิดโรค (Assessment) การเข้าถึงการรักษาตามมาตรฐานที่เหมาะสม (Accessibility) และการมีวินัยในการรับการรักษาและการรับประทานยา (Adherence)


คุณตุ๊ก ชนกวนันท์ รักชีพ ตัวแทนหนึ่งในผู้ปกครองที่เข้าร่วมงาน
วันนี้เจอเพื่อนที่เรียนมัธยมด้วยกันนะคะ เขาถามว่า โอเพ่นเฮ้าส์คืออะไร? เราบอกว่าจริงๆ แล้ว เราเป็นคุณแม่ เราชินกับคำนี้ เมื่อก่อนเราก็เป็นเด็กเรียน ค้นหาคณะที่อยากเรียน แต่สถานการณ์ไม่เอื้อเท่านี้ งานโอเพ่นเฮ้าส์คือเปิดรั้วมหาวิทยาลัย ให้น้องๆ ที่สนใจได้เข้ามาหาความรู้ ซึมซับประสบการณ์ ได้รู้จักและสอบถามตัวเองว่าเราอยากเรียนอะไร คณะนี้ สาขานี้จริงไหม ส่วนตัวคิดว่าเป็นประโยชน์มากๆ น้องๆ ก็จะได้เห็นภาพชัด เลือกอะไรที่เราชอบ เราไปไหวได้โดยตรงมากขึ้น เข้าสู่การงานอาชีพได้เร็ว ประหยัดทรัพยากรไปอีกหลายๆ อย่าง
กินอาหารดี สุขภาพดี สู้มะเร็งเต้านม
ผศ.ภญ. เจนนิษฐ์ มีนวัฒนา คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล เปิดเผยว่า อาหารมีบทบาทเป็นอย่างมากในการดูแลรักษาสุขภาพ ทั้งในกลุ่มคนที่ยังไม่ได้เป็นโรค และกลุ่มคนไข้ที่เป็นโรคมะเร็งเต้านม โดยในกลุ่มคนที่ยังไม่ได้เป็นโรคแนะนำให้ลดอาหารกลุ่มที่มีไขมันอิ่มตัวสูง เพิ่มผักสีสันต่าง ๆ เข้าไปเพื่อเพิ่มสารต้านอนุมูลอิสระ (Antioxidant) กระตุ้นระบบภูมิคุ้มกัน และกำจัดพวกอนุมูลอิสระต่าง ๆ ทำให้ระบบภูมิคุ้มกันของเราทำงานได้ดีมากยิ่งขึ้น รวมทั้งกลุ่มอาหารที่ประกอบไปด้วยโอเมก้า 3 เช่น ปลาแซลมอน ปลาซาร์ดีน หรือปลาทู ในส่วนของคนไข้ที่เป็นมะเร็งและกำลังอยู่ระหว่างการรักษา เซลล์ในร่างกายจะมีความอ่อนแอ จึงมีความจำเป็นในการเสริมโปรตีนในปริมาณที่เพียงพอและหลากหลาย ที่สำคัญ อาหารต้องเป็นอาหารที่ปรุงสุกมื้อต่อมื้อ และสะอาด จะมีประโยชน์ต่อร่างกายมากที่สุด
เสวนาหัวข้อ “Healthcare Practitioner Perspective”
การเสวนาหัวข้อ “Healthcare Practitioner Perspective” สะท้อนให้เห็นถึงความมุ่งมั่นของเอ็มไอที สโลน ในการสนับสนุนความต้องการของภูมิภาคอาเซียนในด้านการส่งเสริมการมีชีวิตที่ยืนยาว ผ่านความร่วมมือในการวิจัย การร่างนโยบาย และการเป็นผู้นำทางความคิด ผ่านการจัดเวทีแลกเปลี่ยนความรู้และแบ่งปันกลยุทธ์จากผู้เชี่ยวชาญในหลายภาคส่วน ทั้งนี้ สำนักงานเอ็มไอที สโลน ประจำภูมิภาคอาเซียน (MSAO) ได้แสดงให้เห็นถึงความต้องการที่จะเสริมสร้างศักยภาพของภาคสาธารณสุขในการรับมือกับการเปลี่ยนแปลงของโครงสร้างประชากร โดยเฉพาะการก้าวเข้าสู่สังคมสูงวัย พร้อมทั้งสนับสนุนแนวทางที่ยั่งยืนในการพัฒนาคุณภาพชีวิต และสุขภาวะของประชากรในระยะยาวต่อไป
“แก๊สดี สู่ชุมชน” ฟาร์มสุกรโครงการคอนแทรคฟาร์มเลี้ยงสุกรขุน อ.แม่สาย จ.เชียงราย ซึ่งทำระบบไบโอแก๊ส ด้วยบ่อหมักแบบโดมคงที่ (Fixed dome) สามารถนำแก๊สที่ได้ต่อท่อลำเลียงแก๊สให้ชุมชน ในตำบลบ้านด้าย มากกว่า 30 ครัวเรือน การต่อท่อได้งบสนับสนุนครึ่งหนึ่งจากภาครัฐโดย อบต.บ้านด้าย ช่วยลดค่าใช้จ่ายแก๊สหุงต้มแก่ 30 ครัวเรือน ประมาณ 15 ถัง/เดือน วิสาหกิจชุมชนลดได้ 5 ถัง/เดือน แม่ค้าตลาด 4 ถัง/เดือน และโรงเรียนบ้านด้ายต่อยอดความสำเร็จสามารถผลิตแก๊สเองได้แล้ว
จำเริญ สุวรรณศร สมาชิกผู้ใช้แก๊สดีบ้านดงป่าสัก กล่าวว่า แก๊สที่ได้จากการหมักมูลสุกรถูกดึงเข้าสู่ท่อแก๊สหุงต้ม ช่วยลดรายจ่ายครัวเรือน จากเดิมใช้แก๊สหนึ่งถังได้ 1-2 เดือน เมื่อใช้แก๊สถังร่วมกับแก๊สชีวภาพ ถังหนึ่งอยู่ได้ถึง 4-5 เดือน นอกจากนี้ บริษัทยังต่อยอดขับเคลื่อนวิสาหกิจชุมชนและศูนย์ฝึกอาชีพตำบลบ้านด้าย ปันแก๊สดีใช้ต้มไข่เค็มพอกดินจอมปลวก แบรนด์ “ไข่เค็มไอโอดีน” และใช้ทอด “ข้าวเกรียบออร์แกนิคบ้านดงป่าสัก” เพื่อส่งเสริมการสร้างงานสร้างอาชีพชุมชน
รองผู้ว่าฯ ทวิดา ลงพื้นที่เฝ้าระวังโรคพิษสุนัขบ้า
23 พ.ย.67 รศ.ดร.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร ลงพื้นที่ร่วมกับผู้บริหารของสำนักอนามัย และสำนักงานเขตประเวศ พร้อมเจ้าหน้าที่ผู้เกี่ยวข้อง เพื่อร่วมกันวางแผนในการเฝ้าระวังและควบคุมโรคพิษสุนัขบ้าในพื้นที่เขตประเวศ
คุณนุ๊ก และแพทยหญิง ไต้เหวินเยี่ยน อายุรแพทย์ด้านมะเร็งเต้านม
ปัจจุบัน BDMS Wellness Clinic เปิดให้บริการทั้งหมด 19 สาขาทั่วประเทศ โดยมีสำนักงานใหญ่ตั้งอยู่ที่ถนนวิทยุ กรุงเทพมหานคร อาณาจักรศูนย์ดูแลสุขภาพ ประกอบด้วยคลินิก BDMS Wellness Clinic โรงแรม Mövenpick BDMS Wellness Resort Bangkok ศูนย์ประชุม BDMS Connect Center รวมถึงบริการเครื่องบินเจ็ตส่วนตัวเพื่อตอบสนองความต้องการของผู้รับบริการระดับสูงจากต่างชาติ มูลค่าโครงการทั้งหมดรวมสูงถึง 15,000 ล้านบาท นอกจากนี้ BDMS Wellness Clinic ยังทำงานร่วมกับกลุ่มโรงแรมระดับ 5 ดาวอย่างเช่น Laguna Phuket และ โรงแรมศรีพันวา ภูเก็ต เปิดตัว BDMS Wellness Clinic สาขา Laguna Phuket และสาขา Sri panwa Phuket โดยมีเป้าหมายเพื่อมอบการพักผ่อนเชิงสุขภาพให้กับนักท่องเที่ยวทั่วโลก และยังมีแผนการดำเนินการอื่น ๆ เพื่อ ส่งเสริมประเทศไทยสู่การเป็น Wellness Destination of the World ในอนาคต
นอกจากนี้ ศาสตราจารย์นายแพทย์จีรี ดโวชัค ที่ปรึกษาผู้บริหารอาวุโส BDMS Wellness Clinic และคุณซูซี่ เอลลิส ประธานและ CEO ของ Global Wellness Institute ร่วมบรรยายออนไลน์ในหัวข้อ The Roadmap to Scientific Wellness เผยเทรนด์ Global Wellness ประจำปี 2024 ตอกย้ำเทรนด์การดูแลสุขภาพเชิงป้องกันที่กำลังเป็นที่นิยมทั่วโลก พร้อมทั้งมอบหลักในการดูแลสุขภาพ 4P Medicine ประกอบด้วย Predict หรือการตรวจคัดกรอง Prevent หรือการป้องกัน Personalise หรือการวางแผนปรับเปลี่ยนไลฟ์สไตล์เฉพาะบุคคล และ Participate หรือความร่วมมือและการสร้างแรงจูงใจให้มีวิถีชีวิตแบบสุขภาพดี เพื่อส่งเสริมและผลักดันการดูแลสุขภาพด้วยศาสตร์ Scientific Wellness ลดโอกาสความเสี่ยงการเกิดโรค NCDs มีสุขภาพดีและอายุยืนยาวอย่างยั่งยืน
ประกาศ โรงพยาบาลจุฬาลงกรณ์
14 ธันวาคม 2568 โรงพยาบาลจุฬาลงกรณ์
เผยแพร่ประกาศ ดังนี้
เรียนผู้ใช้บริการโรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย
ตั้งแต่ 1 มกราคม 2568 สปสช. ได้ปรับเกณฑ์การเบิกจ่ายค่ารักษาพยาบาลจากกองทุน Cancer Anywhere (มะเร็งรักษาได้ทุกที่)
เพื่อให้การรักษาพยาบาลเป็นไปอย่างต่อเนื่องและครอบคลุม ผู้ป่วยโรคมะเร็งที่ใช้สิทธิประกันสุขภาพถ้วนหน้า (บัตรทอง) ต้องมีหนังสือส่งตัวรับรองค่ารักษาพยาบาลจากหน่วยบริการต้นสังกัดตามสิทธิของท่านทุกครั้ง
ทั้งนี้ ตั้งแต่วันที่ 1 มกราคม 2568 เป็นต้นไป
สอบถามข้อมูลเพิ่มเติมได้ที่ งานลงทะเบียนและตรวจสอบสิทธิ อาคาร ภปร ชั้น 1 โทร. 02-256-5478
ศ.พญ.ดวงฤดี วัฒนศิริชัยกุล อาจารย์สาขาเวชพันธุศาสตร์ ภาควิชากุมารเวชศาสตร์ โรงพยาบาลรามาธิบดี และรองประธานมูลนิธิเพื่อผู้ป่วยโรคหายาก (Thai Rare Disease Foundation, ThaiRDF) กล่าวว่า “5 ปีที่ผ่านมา เราได้เห็นความเปลี่ยนแปลงที่เกิดขึ้นจากการทำงานร่วมกันของทุกภาคส่วน การที่ได้เป็นส่วนหนึ่งในการผลักดันนโยบายและสร้างความตระหนักรู้ ทำให้เราเชื่อมั่นว่าเสียงของผู้ป่วยกำลังถูกได้ยินมากขึ้น แต่ความสำเร็จที่ผ่านมาเป็นเพียงจุดเริ่มต้น เนื่องจากผู้ป่วยโรคหายากยังคงเผชิญกับอุปสรรคมากมาย โดยเฉพาะในเรื่องการเข้าถึงการตรวจวินิจฉัยที่ทันสมัย และยาใหม่ที่ใช้ในการรักษาโรคหายากหลากหลายโรคซึ่งไม่เคยมียารักษาโรคเหล่านี้มาก่อนในอดีต การลงนามระยะที่ 2 นี้ จะเป็นการย้ำถึงความมุ่งมั่นของเราในการทำงานร่วมกันเพื่อสร้างระบบดูแลผู้ป่วยโรคหายากที่แข็งแกร่งและยั่งยืน ส่งเสียงของผู้ป่วยให้ดังยิ่งขึ้น โดยขับเคลื่อนนโยบายที่เป็นรูปธรรมที่เอื้อต่อการรักษา การสนับสนุนการวิจัย และการพัฒนาบุคลากรทางการแพทย์ เพื่อให้ผู้ป่วยทุกคนได้รับการดูแลที่เหมาะสมและมีคุณภาพชีวิตที่ดีขึ้น”
2. ทำให้การวินิจฉัยที่ซับซ้อนเป็นเรื่องง่ายด้วย AI
แม้ว่าปัญญาประดิษฐ์ (AI) จะช่วยปรับปรุงการการทำงานด้านบริหารจัดการและเพิ่มการมีส่วนร่วมของผู้ป่วยได้อย่างมาก แต่บทบาทของ AI ในด้านสาธารณสุขไม่ได้มีเพียงแต่ในด้านการทำงานระบบอัตโนมัติ แต่ AI ยังสามารถช่วยยกระดับทักษะของบุคลากรทางการแพทย์ได้อีกด้วย ในขณะที่บุคลากรทางการแพทย์ที่มีประสบการณ์เฉพาะทางขาดแคลนในหลายๆ พื้นที่ทั่วโลก แต่หากมีการนำเทคโนโลยี AI เข้ามาใช้จะช่วยให้การวินิจฉัยที่ซับซ้อนกลายเป็นเรื่องง่ายขึ้น และช่วยให้บุคลากรรุ่นใหม่สามารถให้การดูแลรักษาที่มีประสิทธภาพได้อย่างมั่นใจ
ตัวอย่างเช่น ความก้าวหน้าทางเทคโนโลยี AI ทำให้การสแกนหัวใจด้วยเครื่องเอกซเรย์คอมพิวเตอร์ cardiac CT เป็นเรื่องที่ง่ายขึ้น ผู้ให้บริการด้านสาธารณสุขสามารถเข้าถึงเครื่องมือได้มากขึ้น และช่วยเพิ่มศักยภาพและส่งมอบบริการในการดูแลรักษาผู้ป่วยโรคหัวใจได้ดียิ่งขึ้น นอกจากนี้ บุคลากรทางการแพทย์ที่มีประสบการณ์น้อย ยังสามารถขอคำปรึกษาจากแพทย์เฉพาะทางที่ส่วนกลางผ่านระบบทางไกล หรือการฝึกอบรมผ่านทางออนไลน์ เพื่อให้มั่นใจในการดูแลรักษาผู้ป่วยที่มีประสิทธิภาพยิ่งขึ้น
การนำ AI เข้ามาใช้ในกระบวนการรักษามะเร็งยังสามารถช่วยเพิ่มประสิทธิภาพในการดูแลผู้ป่วย โดยเฉพาะในด้านช่วยลดความเสี่ยงของโรคหัวใจที่เกิดจากการรักษามะเร็ง อย่างการใช้รังสีรักษาและเคมีบำบัด โดยงานวิจัยแสดงให้เห็นว่า ผู้ป่วยมะเร็งที่เป็นผู้ใหญ่ไม่ว่าจะเป็นมะเร็งชนิดใดที่ผ่านการรักษามะเร็ง มีความเสี่ยงในการเกิดโรคหัวใจสูงถึง 37% [1] ด้วยเทคโนโลยี AI ล่าสุดสามารถตรวจจับสัญญาณของการเป็นพิษต่อหัวใจ (cardiotoxicity) ได้เร็วขึ้นในระหว่างการรักษา ผ่านระบบตรวจจับอัตโนมัติในการวัดค่าการทำงานของหัวใจ (Echocardiographic) และช่วยปรับปรุงกระบวนการทำซ้ำและลดเวลาในการศึกษาผล ช่วยให้กระบวนการรักษามีประสิทธิภาพมากขึ้น ลดความเสี่ยงในการรักษาล่าช้า ซึ่งส่งผลดีต่อผู้ป่วยมะเร็งที่ต้องเผชิญกับโรคหัวใจที่รุนแรงหลังการรักษา
บีดีเอ็มเอส เวลเนส คลินิก และ บริษัท ไทยแลนด์ พริวิเลจ คาร์ด จำกัด ขอร่วมเป็นส่วนหนึ่งของ #TeamThailand เพื่อช่วยผลักดันประเทศไทยสู่การเป็น Wellness Destination of the World ผ่านการมอบบริการด้านการดูแลสุขภาพที่ผสานแผนการดูแลสุขภาพเฉพาะบุคคล เข้ากับศาสตร์การแพทย์เวชศาสตร์ป้องกัน ภายใต้การดำเนินการผ่านเทคโนโลยีที่ทันสมัย ด้วยจุดมุ่งหมายในการส่งเสริมสุขภาพให้คนทั่วโลกได้มีสุขภาพดีอย่างยั่งยืน
รายชื่อศิลปินแสดงวันที่ 14 มีนาคม (1 เวที)
ตารางการแสดงลิเก งานย่าโม68
ตารางการแสดงลิเก งานย่าโม68 ฉลองชัยชนะของท้าวสุรนารี 23 มีนาคม - 3 เมษายน 2568 เวลา 20.00-24.00 น บริเวณสนามหน้าศาลาการเปรียญวัดสุทธจินดาวรวิหาร อ.เมือง จ.นครราชสีมา
- 23 มีนาคม 2568 วรต้อ สิมานคร
- 24 มีนาคม 2568 ดอกไม้ มิ่งเมือง
- 25 มีนาคม 2568 ณรงค์พร ทรงพล
- 26 มีนาคม 2568 พระเอกวันเฉลิม
- 27 มีนาคม 2568 พระเอกพรเทวัญ
- 28 มีนาคม 2568 พงษ์เพชร เบญจพร
- 29 มีนาคม 2568 ทองหยด วีรยุทธ
- 30 มีนาคม 2568 บุญยัง เสียงเสน่ห์
- 31 มีนาคม 2568 ลูกเป็ด ปากแบน
- 1 เมษายน 2568 ดาวร้าย ไข่มุกดำ
- 2 เมษายน 2568 สมยศ ลูกอ่างทอง
- 3 เมษายน 2568 ก้องภพ สกุลเพชร
เดือนกุมภาพันธ์ 2568
กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนกุมภาพันธ์ 2568 ตั้งแต่เวลา 09.00 - 15.00 น.
- วันจันทร์ที่ 3 กุมภาพันธ์ 2568 ชุมชนลานโพธิ์ (บริเวณลานจอดรถยนต์ฝั่งทะเล)
- วันพุธที่ 5 กุมภาพันธ์ 2568 ชุมชนซอยไปรษณีย์
- วันจันทร์ที่ 10 กุมภาพันธ์ 2568 วัดสว่างฟ้าพฤฒาราม
- วันพฤหัสบดีที่ 13 กุมภาพันธ์ 2568 ชุมชนแหลมราชเวช
- วันพุธที่ 19 กุมภาพันธ์ 2568 ชุมชนหัวทุ่ง
- วันจันทร์ที่ 24 กุมภาพันธ์ 2568 วัดโพธิสัมพันธ์
นำบัตรประชาชนมาลงทะเบียน เพื่อนำสัตว์เลี้ยงเข้ารับบริการด้านต่างๆ ดังนี้ การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า / การผ่าตัดทำหมันสุนัขและแมว / การให้คำแนะนำด้านสุขภาพสัตว์เลี้ยง
เทศบาลตำบลวิชิต บริการทำหมันสุนัขและแมว (นอกสถานที่) 16 มกราคม 2568
เทศบาลตำบลวิชิต ร่วมกับปศุสัตว์จังหวัดภูเก็ตให้บริการทำหมันสุนัขและแมว (นอกสถานที่)ในวันพฤหัสบดี ที่ 16 มกราคม 2568 เวลา 09.00 - 12.00 น. บริเวณหลังเวทีกลางสวนศรีภูวนาถ
- รับจำนวนจำกัด แมว 40 ตัว สุนัข 10 ตัว
- เฉพาะสุนัขและแมวในเขตตำบลวิชิตเท่านั้น
สามารถติดต่อเพื่อทำการจองได้ที่ งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลวิชิต ในวันที่ 11-15 มกราคม 2568 (หากเต็มจำนวนแล้วจะปิดรับสมัครทันที)
สอบถามเพิ่มเติมโทร.0 7652 5100 ต่อ 164
หมายเหตุ
1.สุนัขและแมวที่ทำหมันต้องงดน้ำและอาหารหลังเที่ยงวันที่ 15 มกราคม 2568
2.แมวที่ลงทะเบียนทำหมัน ต้องมีอายุ 4 เดือนขึ้นไป และมีน้ำหนักไม่น้อยกว่า 1.5 กิโลกรัม
3.สุนัขที่ลงทะเบียนทำหมัน ต้องมีอายุ 3 เดือนขึ้นไป และมีน้ำหนักไม่น้อยกว่า 3.0 กิโลกรัม
4. สัตว์ที่ป่วย หรือสุนัขและแมวหน้าสั้น ต้องติดต่อสอบถามเจ้าหน้าที่ก่อนวันมาทำหมัน ว่าสามารถทำหมันได้หรือไม่เพื่อความปลอดภัยของสัตว์เลี้ยงของท่าน
โครงการผู้ป่วยยากไร้ มีวัตถุประสงค์เพื่อระดมเงินบริจาคมาสนับสนุนผู้ป่วยที่ขาดแคลนทุนทรัพย์ในการรักษาพยาบาลให้ได้เข้าถึงการรักษาที่มีประสิทธิภาพ โครงการนี้ถือเป็นโครงการที่ผู้บริจาคให้การช่วยเหลือมากที่สุดอย่างต่อเนื่องทุกปี
คลินิกเฉพาะทางนอกเวลา จักษุ
A SAMURAI IN TIME ซามูไรข้ามเวลา ( 2024 / 131 min) กำกับโดย จุนอิจิ ยาซูดะ
A SAMURAI IN TIME ซามูไรข้ามเวลา ( 2024 / 131 min) กำกับโดย จุนอิจิ ยาซูดะ
ณ เมืองเกียวโตช่วงปลายยุคเอโดะ ในคืนหนึ่งที่มีพายุ ซามูไรตนหนึ่งเตรียมพร้อมที่จะต่อสู้กับโรนิน (ซามูไรพเนจร) แต่ยังไม่ทันไรสายฟ้าก็ฟาดลงมา และเมื่อเขาฟื้นขึ้นมาก็พบว่าตัวเองอยู่ในยุคสมัยที่แตกต่างออกไปเสียแล้ว เขาเดินทางข้ามเวลามาสู่ยุคปัจจุบัน และสถานที่ที่เขากำลังจะดวลดาบในอดีตนั้นกลายเป็นฉากถ่ายทำภาพยนตร์และละครทีวีย้อนยุคแทน ชุดซามูไรทำให้เขาถูกเข้าใจผิดว่าเป็นนักแสดงตัวประกอบ และถูกดึงเข้าสู่โลกของการถ่ายทำละครย้อนยุคอย่างไม่ทันตั้งตัว ด้วยลักษณะท่าทางและคำพูดที่ ‘สมจริง’ อย่างมากทำให้เขาได้เริ่มแสดงในผลงานหลากหลายชิ้น และรับบทบาทเป็น ‘คิราเรยากุ’ หรือนักดาบที่รับหน้าที่ตายอย่างอลังการในฉากต่อสู้
OUT #JFF2025
OUT #JFF2025 2 ชั่วโมง 9 นาที R:13+
©2023 "OUT" Film Partners
©Tatsuya IGUCHI • Makoto MIZUTA(AKITA PUBLISHING CO.,LTD.)2012 JAPANESE (EN & TH Subs) OUT คือเรื่องราวเส้นทางชีวิตอันแสนเข้มข้นสุดดรามา ที่เขียนขึ้นจากประสบการณ์ชีวิตจริงของทัตสึยะ อิกุจิ เด็กเกเรที่ต่อสู้ดิ้นรนเพื่อเริ่มต้นชีวิตใหม่ ผลงานภาพยนตร์ที่ดัดแปลงจากการ์ตูนสุดน่าทึ่งเรื่องนี้ แสดงให้เห็นถึงเส้นทางชีวิตสุดตราตรึงอันสะท้อนเรื่องราวของผู้เขียนออกมาได้อย่างแท้จริง
อาสาสมัครแนะนำ Siriraj Connect Application (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญนักเรียน นักศึกษา หรือผู้ที่สนใจ ที่มีในรักงานจิตอาสา มาทำกิจกรรม "อาสาสมัครแนะนำ Siriraj Connect Application"
โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 08.00-12.00 น. (จำนวนชั่วโมงอาสาสมัคร 4 ชั่วโมง) ณ ตึกผู้ป่วยนอก โรงพยาบาลศิริราช
รับสมัครผู้ที่สนใจ วันละ 22 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- ดูแลความเรียบร้อย และให้บริการผู้บริจาค
- แนะนำขั้นตอนการเข้ารับบริการ
- บริการน้ำดื่ม และอาหารว่างแก่ผู้รับบริจาค
คุณสมบัติอาสาสมัคร
1. นักเรียนนักศึกษา อายุ 15 - 35 ปี
2. มีความสามารถในการใช้สมาร์ทโฟนได้ดี
3. มีทักษะการสื่อสาร เรียนรู้เร็ว มีใจรักงานบริการ ยิ้มแย้ม
แจ่มใส
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
แผนการฉีดวัคซีน โซน2 จำนวน 15 ชุมชน ช่วง 4-14 มี.ค.2568
รพ.กรุงเทพ สำนักงานใหญ่ ได้รับการจัดอันดับเป็นหนึ่งในโรงพยาบาลเฉพาะทาง โรคต่อมไร้ท่อ ที่ดีสุดในโลก ปี 2025 (One of the World’s Best Specialized Hospitals 2025: Endocrinology) โดย Newsweek & Statista
ภาคกลาง
กำแพงเพชร
คลองลานโพลีคลินิก
ประเภท : [เวชกรรมชุมชนอบอุ่น] [ทันตกรรมชุมชนอบอุ่น]
คลินิกทันตกรรม เดนทัลแคร์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0832131688
คลินิกทันตกรรม เดนทัลไบร์ท
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0862455666
คลินิกทันตกรรม บ้านหมอ ฟ.ฟัน
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0918405677
คลินิกทันตกรรมดีสไมล์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0612496688
คลินิกทันตกรรมทันตแพทย์หญิงวารีวัณน์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0616636099
คลินิกทันตกรรมทีสมายล์ ชากังราว
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0934803999
คลินิกทันตกรรมบ้านหมออาร์ต
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0819091375
คลินิกทันตกรรมบิ๊กสไมล์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0914515991
คลินิกทันตกรรมยิ้มสดใส
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0877272928
คลินิกทันตกรรมรักยิ้ม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0897083464
คลินิกทันตกรรมหมอแพรว
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0916644644
เจริญ - วันเพ็ญ ทันตแพทย์ คลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0819731066,0864456737
ชัยพรคลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0944244111
ชัยพรคลินิกทันตกรรม สาขานครชุม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0873146515
บ้านต้นข้าว สหคลินิก
ประเภท : [เวชกรรมชุมชนอบอุ่น] [ทันตกรรมชุมชนอบอุ่น]
พัณณวดีทันตแพทย์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 055717723
เมดิเดนท์ สหคลินิก
ประเภท : [เวชกรรมชุมชนอบอุ่น] [ทันตกรรมชุมชนอบอุ่น]
ศูนย์ทันตกรรม อวาเด้นท์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 055713723
สหคลินิกแพทย์พงศ์สุรีย์-ทันตแพทย์กรวิสา
ประเภท : [เวชกรรมชุมชนอบอุ่น] [ทันตกรรมชุมชนอบอุ่น]
หมอโดมทำฟันคลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0846881634
ทันตกรรมชุมชนอบอุ่น ปทุมธานี
ปทุมธานี
(คลินิกในปทุมธานี ที่ต้องการเพิ่มปุ่ม Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com)
- บ้านหมอฟัน 2 คลินิกทันตกรรม
- คลินิกทันตกรรม 12 ยิ้ม
- คลินิกทันตกรรม คลินิกยิ้ม
- คลินิกทันตกรรม คลินิกรังสิตทันตแพทย์
- คลินิกทันตกรรม คุณาสานต์
- คลินิกทันตกรรม ดูแลฟัน info&map
- คลินิกทันตกรรม ที เดนทิสต์
- คลินิกทันตกรรม นครชัยคอร์เนอร์
- คลินิกทันตกรรม บ้านเรา
- คลินิกทันตกรรม บูทีค เดนทัล รังสิต
- คลินิกทันตกรรม ลิทเทิลจอย info&map
- คลินิกทันตกรรม สไมล์คราฟท์
- คลินิกทันตกรรม ออลเวย์สไมล์ สาขาโลตัส รังสิต
- คลินิกทันตกรรม เอ็ม.ที.สไมล์ เดนทัน คลินิก
- คลินิกทันตกรรม ไอเดีย สไมล์
- คลินิกทันตกรรมซานต้า
- คลินิกทันตกรรมเดนทัลดีลักซ์
- คลินิกทันตกรรมเดนทัลโดม
- คลินิกทันตกรรมเด็นทัลโฟกัส
- คลินิกทันตกรรมทีสมายล์ นวนคร
- คลินิกทันตกรรมธัญรักษ์ฟัน info&map
- คลินิกทันตกรรมนวเวช
- คลินิกทันตกรรมบ้านฟันมีสุข
- คลินิกทันตกรรมบ้านหมอฝน
- คลินิกทันตกรรมพบพลอย
- คลินิกทันตกรรมพลัส สาขาฟิวเจอร์พาร์ครังสิต
- คลินิกทันตกรรมพอส
- คลินิกทันตกรรมพอส สาขาคลองหก
- คลินิกทันตกรรมพักยิ้ม
- คลินิกทันตกรรมพีเอส สไมล์
- คลินิกทันตกรรมเพื่อนฟัน สาขานวนคร
- คลินิกทันตกรรมมอสรังสิต
- คลินิกทันตกรรมมอสลำลูกกา
- คลินิกทันตกรรมเมลโลสไมล์
- คลินิกทันตกรรมเลิฟลี่เด้นท์ (พรธิสาร 3)
- คลินิกทันตกรรมวันดีดี
- คลินิกทันตกรรมวิชุณี
- คลินิกทันตกรรมวีสไมล์ สาขา 2
- คลินิกทันตกรรมสไมล์พลัส
- คลินิกทันตกรรมสไมล์แม็กซ์
- คลินิกทันตกรรมสะพานแดง
- คูคต ทูธแอนด์เฟซ สหคลินิก
- ทูธคอร์เนอะ สหคลินิก
- เฟซสไมล์ คลินิกทันตกรรม
- ยูมี คลินิกทันตกรรมสาขารังสิต
- รีพีซ สหคลินิก
- วี เดนทัล คลินิกทันตกรรม
- สไมล์เมท แอ็ท เดอะทรี คลินิกทันตกรรม
- เอ็มสเปซ คลินิกทันตกรรม
- เอย์เมย์ คลินิกทันตกรรม
2) คอนแทคเลนส์ดิจิตอล (สำหรับผู้ป่วยเบาหวานหรืออื่นๆ) (Digital contact lens (for diabetes or else))
Google ได้ยื่นจดสิทธิบัตรต่อสำนักงานสิทธิบัตรและเครื่องหมายการค้าของสหรัฐอเมริกาในปี 2014 โดยเป็นข้อมูลเกี่ยวกับคอนแทคเลนส์ดิจิทัลแบบมัลติเซนเซอร์ที่สามารถตรวจจับการกระพริบตาได้ด้วย ซึ่งมีประโยชน์หลายอย่าง เช่น พลิกหน้าหนังสืออิเล็กทรอนิกส์ได้ด้วยการ "กระพริบตา" ในเวลาต่อมา มีรายละเอียดเพิ่มเติมเกี่ยวกับแนวคิดดังกล่าว ซึ่งเผยให้เห็นถึงการใช้งานคอนแทคเลนส์ที่เปลี่ยนแปลงไปมาก ซึ่งก็คือการวัดระดับน้ำตาลในเลือดจากน้ำตา ในปี 2014 Google กล่าวว่าตามการคำนวณในแง่ดีที่สุดของพวกเขา คอนแทคเลนส์ดิจิทัลอาจเปิดตัวได้ภายในห้าปี และการทดลองอาจเริ่มก่อนหน้านั้นด้วยซ้ำ อย่างไรก็ตามในที่สุด โปรเจ็กต์นี้ก็ถูกยุติลงในปี 2018และ Google ไม่ใช่บริษัทเดียวที่ประสบปัญหาจากแนวคิดคอนแทคเลนส์อัจฉริยะ บริษัท Mojo Vision มีแนวคิดที่จะสร้างจอแสดงผลไมโคร LED ในเลนส์พร้อมเซ็นเซอร์หลากหลายชนิดเพื่อปรับปรุงการมองเห็น แต่ตัดสินใจ " เปลี่ยนโฟกัส " และยกเลิกโปรเจ็กต์นี้ทำประชาพิจารณ์ ให้แล้วเสร็จภายใน 90 วัน
รศ.ดร.ษัษฐรัมย์ ธรรมบุษดี บอร์ดประกันสังคมฝั่งลูกจ้าง กล่าวว่า วันนี้ถือเป็นข่าวดีของผู้ประกันตน หลังจากรอความชัดเจนในเรื่องนี้ มา 2 สัปดาห์ และถือเป็นข่าวดีของนายจ้างด้วย ที่จะเพิ่มสวัสดิการให้กับลูกจ้างได้อย่างเป็นธรรม ซึ่งขั้นตอนหลังจากนี้ จะทำประชาพิจารณ์ ให้แล้วเสร็จภายใน 90 วันประกาศ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ฉบับที่ 1 (11 มีนาคม 2568)
ประกาศ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล
ฉบับที่ 1 : พบเหตุกลุ่มควันและเพลิงไหม้ที่อาคารหลัก (อาคาร 1) เบื้องต้นไม่มีรายงานผู้ป่วยได้รับบาดเจ็บจากเหตุการณ์นี้ โรงพยาบาลรามาธิบดี ของดให้บริการผู้ป่วยนอก การผ่าตัด ที่อาคาร 1 เป็นเวลา 48 ชั่วโมง เพื่อตรวจสอบความปลอดภัย งดให้บริการผู้่ป่วยใหม่ที่ห้องฉุกเฉิน
1 ธันวาคม วันเอดส์โลก World AIDS Day
เริ่มครั้งแรกวันที่ 1 ธันวาคม 2531 เพื่อให้โลกตระหนักถึงความรุนแรงของโรคเอดส์ (AIDS - Acquired Immunodeficiency Syndrome โรคภูมิคุ้มกันบกพร่อง) โรคร้ายแรงที่พบครั้งแรกเมื่อปี 2524 ในสหรัฐฯ แพร่กระจายอย่างรวดเร็วและมีผู้ติดเชื้อจำนวนมากทั่วโลก โดยเฉพาะในแอฟริกาและเอเซีย ผู้ป่วยเอดส์คนไทยรายแรก พบในปี 2526 ขณะศึกษาอยู่ที่สหรัฐฯ กลับมารักษาตัวที่ไทย ปี 2527 และเสียชีวิตในเวลาต่อมา ข้อมูลปี 2020 ทั่วโลกมีผู้ติดเชื้อ 38,000,000 ราย ไทยมีผู้ติดเชื้อที่มีชีวิตอยู่ 470,000 ราย [รามาชาแนล]
งานโฮปแฟร์ 2022 The Giant Hope Fair Xmas 1 ธันวาคม 65
งานโฮปแฟร์ 2022 ปีนี้เรียกว่า The Giant Hope Fair Xmas น่าจะเรียกว่าจัดใหญ่กันเลยปีนี้ ฉลองครบรอบ 8 ปี และ ต้อนรับเดือนแห่งความสุข คริสมาสและเทศกาลปีใหม่ที่จะมาถึง งานวันที่ 1 ธันวาคม 65 ที่โรงแรมอาวานี สุขุมวิท อ่อนนุช ตั้งแต่ 11 โมงเช้า ถึง 2 ทุ่ม เข้าชมฟรี งานนี้ ซานต้า จะมาปรากฏตัวตอน 3.30-4.30 น. ด้วยนะ เตรียมตัวเตรียมกล้องไปเลย สำหรับครอบครัวที่อยากจับภาพซานต้า พร้อมกิจกรรมสนุกๆ กิจกรรมการกุศล ชมชิมอาหารอร่อยๆ สินค้าดีๆ ในงาน เดินทางง่าย นั่ง BTS ลงสถานีอ่อนนุช
www.facebook.com/thehopefair/1 ธ.ค.65 - ปักกิ่งคลายกฏการตรวจหาเชื้อ
ปักกิ่ง (
ซินหัว) รัฐบาลกรุงปักกิ่ง ประกาศปรับข้อกำหนดที่ผ่อนคลายลงในการควบคุมโรคโควิด เพื่อลดผลกระทบต่อชีวิตความเป็นอยุ่ของประชาชน มีหลายข้อที่สำคัญ ดังนี้
- ผู้อยู่อาศัยท้องถิ่นที่ไม่ได้เข้าร่วมกิจกรรมทางสังคม ไม่จำเป็นต้องเข้าร่วมการตรวจคัดกรองกรดนิวคลีอิกระดับชุมชน หากพวกเขาไม่ได้จำเป็นต้องออกจากบ้านเรือนที่พักอาศัย เริ่มตั้งแต่วันพุธ (30 พ.ย.) ที่ผ่านมา
- สั่งยกเลิกมาตรการการจัดการแบบปิดอย่างทันท่วงทีสำหรับชุมชนที่อยู่อาศัยที่มีคุณสมบัติผ่านเกณฑ์
- อนุญาตซูเปอร์มาร์เก็ตที่ตรวจพบเชื้อไวรัสฯ กลับมาเปิดทำการหลังจากปิดหนึ่งวัน
- ห้ามการตั้งสิ่งกีดขวางประตูอาคารและทางเข้าชุมชนที่อยู่อาศัยในพื้นที่เสี่ยงสูง พร้อมสั่งเปิดช่องทางสัญจรสำหรับการขนส่งทางการแพทย์ การอพยพฉุกเฉิน และการกู้ภัยด้วย
สวีเหอเจี้ยน โฆษกรัฐบาลเทศบาลกรุงปักกิ่ง แถลงข่าวว่าข้อกำหนดนี้ครอบคลุมคนหลายกลุ่ม อาทิ ผู้สูงอายุในบ้าน เด็ก และประชาชนที่ทำงานหรือเรียนหนังสือจากบ้าน
ตารางให้บริการเดือนธันวาคม 2565 LINK
- วันศุกร์ที่ 23 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดปริวาส เขตยานนาวา เวลา 8.00 ถึง 11.00 น.รับจำนวนจำกัด 30 ตัว ให้สิทธิ์คนละไม่เกิน 2 ตัว ลงทะเบียนทำหมันหน้างาน
- วันพฤหัสบดีที่ 22 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดนินสุขาราม เขตบางบอน เวลา 8.00 ถึง 12.00 น. รับจำนวนจำกัด 60 ตัว ให้สิทธิ์คนละไม่เกิน 2 ตัว ลงทะเบียนทำหมันหน้างาน
- วันพุธที่ 21 ธ.ค. 65 มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดสามง่าม เขตหนองจอก เวลา 8.30 ถึง 12.00 น. รับจำนวนจำกัด 50 ตัว ลงทะเบียนทำหมันหน้างาน
- วันศุกร์ที่ 9 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่วัดบพิตรพิมุข เขตสัมพันธวงศ์ เวลา 8.30 - 11.00 น.
- วันพฤหัสบดีที่ 8 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนสหกรณ์ 93 เขตหนองจอก เวลา 10.00 - 12.00 น.
- วันอังคารที่ 6 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่สวนป่ามหานคร ซ.วิภาวดีรังสิต 64 เขตหลักสี่ เวลา 9.00 - 11.30 น.
- วันศุกร์ที่ 2 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนการเคหะท่าทราย เขตหลักสี่ เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 1 ธ.ค. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนซอยพระเจน เขตปทุมวัน และ วัดรวกบางบำหรุ เขตบางพลัด เวลา 9.00 - 11.00 น.
+++
เงื่อนไข
**รับทำหมันจำนวนจำกัดแค่ 30 ตัว**
**ทำหมันจำกัดจำนวนคนละ 2 ต้ว**
**ลงทะเบียนหน้างานเท่านั้น ไม่รับจองคิวล่วงหน้า**
**สุนัขและแมวที่จะทำหมัน ต้องจับขังกรง อดอาหารและน้ำ 8 ถึง 10 ชม. ก่อนนำมาทำหมัน**
ติดตามประกาศอัพเดต จากเพจ
facebook.com/rabiesbkk
1 ธันวาคม 65 ลงพื้นที่ตรวจสอบร้านขายกัญชา , Hemp Expo 2022
1.Hemp Expo 2022
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. เปิดงาน Asia International Hemp Expo 2022 ณ ศูนย์ประชุมสิริกิติ์ ซึ่งรวบรวมธุรกิจและนวัตกรรมกัญชง ผู้ประกอบการรายใหญ่และรายย่อยในประเทศและต่างประเทศ มากกว่า 50 บูธและเปิดพื้นที่ในการเจรจาทางธุรกิจเพื่อต่อยอดอุตสาหกรรมกัญชง ระบุ นโยบายขับเคลื่อนเศรษฐกิจด้วยพืชกัญชา กัญชง ดำเนินการต่อเนื่องตั้งแต่ตนเป็น รมว.สธ. กว่า 3 ปี ซึ่งวันนี้ไม่ได้เป็นยาเสพติดอีกต่อไป ดังนั้นประชาชนสามารถใช้ประโยชน์จากพืชกัญชา กัญชง เพื่อสร้างรายได้ สร้างสินค้าและผลิตภัณฑ์ต่างๆ ได้ เพื่อให้เศรษฐกิจมีความเจริญเติบโต
2.ลงพื้นที่ตรวจสอบร้านขายกัญชา
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึง กรณีการตรวจสอบร้านจำหน่ายช่อดอกกัญชาที่ถนนข้าวสารยังมีการโฆษณาชักชวนสันทนาการ จัดพื้นที่ให้สูบว่า สูบในพื้นที่สาธารณะ สถานประกอบการ และในร้านไม่ได้ ต้องใช้ในทางการแพทย์ ส่วนที่บอกมีแพทย์แผนไทยเฝ้าร้านแล้วให้สูบได้ ไม่ถูกต้อง ทำไม่ได้
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึง กรณีมีร้านหนึ่งที่มีการโฆษณาซึ่งเป็นข้อความเชิญสูบแข่งขัน มีค่าแรกเข้า 4 พันบาท ใครชนะมีกัญชาให้ ได้ให้ร้านนำป้ายบอก ย้ำว่าไม่สามารถโฆษณาทุกรูปแบบ ทั้งเชิญชวนลดแลกแจกแถม ที่ทำได้คือ การติดราคาบนผลิตภัณฑ์ ส่วนการจัดพื้นที่สูบนอกร้านแต่กฎหมายยังเอาผิดไม่ได้ ต้องนำกฎหมายท้องถิ่นมาดูว่าสุขลักษณะที่ทำเช่นนั้นถูกต้องไหม ให้กรมอนามัยมาช่วยดู เรื่องของกลิ่นและควันเป็นรำคาญ ก็ต้องเอากฎหมายอื่นมาประกอบ
- นพ.บัญญัติ เจตนจันทร์ ส.ส.พรรคประชาธิปัตย์ กล่าวถึง กรณีที่ นพ.ธงชัย เดินทางไปตรวจร้านขายกัญชาถนนข้าวสารพบแหล่งท่องเที่ยวหลายแห่งจัดทำแบบคอมมอนรูม ผิดเพียนจากกัญชาทางการแพทย์ สรุปว่า ขณะนี้ประเทศไทยกัญชาสันทนาการเต็มรูปแบบ จึงไม่รู้จะเรียกกัญชาทางการแพทย์แผนอะไร จึงขอเรียกกัญชาการแพทย์แผนอนุทิน
- นายสาทิตย์ วงศ์หนองเตย ส.ส.พรรคประชาธิปัตย์ กล่าวเสริมว่า ปัญหาที่เกิดขึ้นคือ ประกาศ สธ.ที่เกิดใหม่ยังไม่สามารถควบคุมกัญชาทางการแพทย์ที่ไม่ใช่กัญชาเพื่อสันทนาการได้ สถานการณ์กัญชาเสรีสุดขั้วที่ผิดพลาดตั้งแต่ประกาศนำกัญชาออกจากยาเสพติด ทั้งที่ยังไม่มีกฎหมายมาควบคุมจะสร้างปัญหาและนำไปสู่เรื่องนันทนาการ คาดว่า 1 ธ.ค. หากสภา
พิจารณา พ.ร.บ.ขนส่งทางรางเสร็จสิ้น จะมีการพิจารณาร่าง พ.ร.บ.กัญชาฯ วาระ 2 ซึ่งขณะนี้กรรมาธิการยังยืนอยู่แนวทางเดิม
- นายปานเทพ พัวพงษ์พันธ์ โฆษก คกก.สื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ สธ. โพสต์โต้แย้งพรรคประชาธิปัตย์กล่าวหานโยบายกัญชาของ สธ. เป็นการใช้กัญชาเพื่อสันทนาการเต็มรูปแบบ ไม่เป็นความจริง ชี้สภาควรลงมติเห็นชอบ/แก้ไขร่างกฎหมายของคณะกมธ.ให้ครบทุกมาตรา จะเตะถ่วงไม่ให้มีกฎหมายกัญชากัญชงเพื่ออะไร
เทศกาลสีสันแห่งดอยตุง ครั้งที่ 10 - 1 ธ.ค. 2566 - 28 ม.ค. 2567
“เทศกาลสีสันแห่งดอยตุง ครั้งที่ 10” ปีใหม่นี้ จัดวันที่ 1 ธ.ค. 2566 - 28 ม.ค. 2567 ทุกวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์ ดอยตุง จ.เชียงราย ในธีม “ดอกไม้ระบายดอย” หลังจากปรับปรุงสวนแม่ฟ้าหลวงครั้งแรกในรอบ 30 ปี สิ่งที่จะได้ชมในปีนี้
- 10 ดอกไม้ฤดูหนาว กับมุมถ่ายรูปที่ตื่นตาตื่นใจกว่าทุกปี
- ชิล กับ 10 กิจกรรมเพลิดเพลิน อาทิ ดนตรีอินดอย การแสดงชนเผ่า เวิร์กช็อปงานมือ
- ชิม 10 เมนูเด็ดจากครอบครัว 6 ชนเผ่า ที่หาทานได้ยาก
- ช้อป 10 สินค้างานมือแรงบันดาลใจจากดอกไม้ ธรรมชาติ และวัฒนธรรมที่หลากหลายบนดอยตุง
เทศกาลชมสวน 2566 “แอ่วสุขใจ..I wanna be (e)” อุทยานหลวงราชพฤกษ์ จ.เชียงใหม่ 1 ธันวาคม 2566 - 29 กุมภาพันธ์ 2567
งานดอกไม้เมืองหนาวที่เป็นงานประจำปีประจำใจของหลายคน ที่จะพลาดไม่ได้ สำหรับปีนี้ เทศกาลชมสวน 2566 ณ อุทยานหลวงราชพฤกษ์ จ.เชียงใหม่ มาในชื่องาน “แอ่วสุขใจ..I wanna be (e)” เริ่มตั้งแต่ 1 ธันวาคม 2566 - 29 กุมภาพันธ์ 2567 เวลา 08.00 – 18.00 น. สอบถามโทร. 053-114110 ถึง 2
แนวคิด “แอ่วสุขใจ..I wanna be (e)” ก็คือใช้ น้อง “ผึ้ง หรือ Bee” มาเป็นพระเอกเล่าเรื่องนั่นเอง เพราะผึ้งเป็นนักผสมเกสรผู้ชำนาญ จึงมีหน้าที่นำทางนักท่องเที่ยวชม เข้าไปไม้ดอกหลากสีนานาพันธุ์ ยังไงล่ะ แล้วปีนี้มีกิจกรรมอะไรบ้างนะ
- ชมไม้ดอกเมืองหนาวนานาพรรณนับล้านดอกจากเกษตรกรบนพื้นที่สูง งดงามกับกล้วยไม้นานาพันธุ์ทั้งพันธุ์แท้และพันธุ์ลูกผสม ตระการตากุหลาบกว่า 220 สายพันธุ์ ฯลฯ
- ทุ่งดอกผีเสื้อและทุ่งดอกฟอร์เก็ตมีน็อต
- Bee Home Exhibition และนิทรรศการคิดเพื่อโลก..ทำเพื่อเรา
- กิจกรรมเดินสวนกับคนสวน
- กิจกรรมประกวดภาพถ่าย (Photo Contest)
- เช็คอิน..แชะ..แชร์ กับ “Bubble Bee”
- กิจกรรม Mini Workshop อาทิ DIY จากเศษขยะพลาสติก เรซิ่นจากดอกไม้และวัสดุธรรมชาติ เทียนหอมจากขี้ผึ้งและดอกไม้ Beeswax Wrap เพนท์ขวดแก้วเป็นแจกัน FLOWER GEL CANDLE ฯลฯ
- ช้อป ผัก ผลไม้ สมุนไพร งานหัตถกรรมจากยอดดอยสูงในตลาดนัดชาวดอย ทุกวันเสาร์-อาทิตย์ เวลา 08.00-17.00 น. (เริ่มวันเสาร์ที่ 9 ธันวาคม 2566)
- ชมปรากฏการณ์พระอาทิตย์ฉายแสงลอดผ่านประตูด้านข้างหอคำหลวงเกิดขึ้นเพียงปีละ 1 ครั้ง ตลอดเดือนธันวาคมในช่วงเวลา 16.50-17.20 น. ของทุกปี
- ตระการตากับงานแสง สี Shining Flora 2023 ราตรี พฤกษา ส่องแสง ระหว่างวันที่ 27 ธันวาคม 2566 – 2 มกราคม 2567 เวลา 17.00 – 21.00 น.
AMAZING THAILAND MARATHON BANGKOK 2024 Presented by TOYOTA 1 ธันวาคม 2567 LINK
“AMAZING THAILAND MARATHON BANGKOK 2024 Presented by TOYOTA” เทศกาลวิ่งมาราธอนแห่งความสุขที่ยิ่งใหญ่ที่สุดส่งท้ายปี..."วิ่งผ่าเมือง ซีซั่น 7" อะเมซิ่งไทยแลนด์มาราธอน 2024 พรีเซ็นต์บาย โตโยต้า (ATMBKK2024) จัดขึ้นเป็นปีที่ 7 (ครั้งที่ 7) มีกำหนดการจัดงานในวันอาทิตย์ที่ 1 ธันวาคม 2567 เวลา 02.00-09.30 น.
จุดปล่อยตัว MBK ถนนพญาไท ระยะ 42.195 กม., 21.1 กม. และจุดปล่อยตัว สนามหลวง 10 กม. และแฟมิลี่รัน 4.5 กม. เส้นชัยของทุกระยะ (FINISH AREA) คือที่ สนามหลวง ทั้งนี้ เพื่อให้สถานที่จัดงานสามารถรองรับจำนวนผู้ที่จะเข้าร่วมงานได้มากยิ่งขึ้น โดยในปีนี้ คาดว่าจะมีผู้เข้าร่วมงานในวันแข่งขันมากกว่า 45,000 คน (นักวิ่ง 30,000 คน / ครอบครัวและผู้ติดตาม 15,000 คน)
ร่วมจัดงานโดย กระทรวงการท่องเที่ยวและกีฬา, การท่องเที่ยวแห่งประเทศไทย, กรุงเทพมหานคร, สมาคมกรีฑาโลก สมาคมกรีฑาแห่งประเทศไทย และไทยแลนด์ไตรลีก
การแสดงแสงไฟ BeautifulBOT วันที่ 2,3,9,10 ธันวาคม 2565 ที่ศูนย์การเรียนรู้แบงก์ชาติ
เป็นงานกิจกรรมจัดแสดงแสงไฟในโอกาสครบรอบ 80 ปี ธนาคารแห่งประเทศไทย เพื่อเผยแพร่วิสัยทัศน์และบทบาทหน้าที่ธนาคารแห่งประเทศไทย โดยแบ่งเป็น 3 SCENE คือ แสง นิรันดร์ (LIGHT ETERNITY), แสง สรรค์ (LIGHT CREATION) และ แสง คู่ฟ้า (LIGHT:THAILAND:TOGETHER) งานจัดขึ้นในวันที่ 2,3,9,10 ธันวาคม 2565 เวลา 19:00 - 22:00 น. ที่อาคารศูนย์การเรียนรู้ธนาคารแห่งประเทศไทย ด้านริมแม่น้ำเจ้าพระยา
งาน Bangkok Farmers Market @Gateway Ekamai 2-4 ธันวาคม 65
งาน Bangkok Farmers Market @Gateway Ekamai งานตลาดนัดฟาร์เมอร์มาเก็ตอันมีชื่อมายาวนาน จัดวันสุดสัปดาห์ 2-4 และ 16-18 ธันวาคม 65 ที่เกตเวย์เอกมัย เดินทางง่ายด้วย BTS ลงสถานีเอกมัย เดินต่อเข้าตึกถึงตลาดเลย เข้าชมฟรี เตรียมถุงไปหลายๆใบนะ เพราะมีของคุณภาพให้ช็อปชมชิมเลือกซื้อกันแบบละลานตา อดใจไม่ไหวแน่นอน งานเริ่ม 11 โมงเช้า ถึง 1 ทุ่ม
www.facebook.com/bkkfm2 ธันวาคม 65 ประกาศสมุนไพรควบคุม
ประกาศสมุนไพรควบคุม
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึง กรณี ส.ส.พรรคประชาธิปัตย์ แถลงข่าวกัญชาทางการแพทย์แผนอนุทิน ระบุ 5 ข้อแตกต่างในนโยบายกัญชาทางการแพทย์ที่ผิดจากมาตรฐานสากล ว่า พรรค ปชป.พูดถูกแล้ว แผนกัญชา อนุทินเป็นเรื่องดีเพราะอนุทินถือเป็นผู้ผลักดันนโยบาย ขอย้ำว่า สธ.มีแต่กัญชาทางการแพทย์ สุขภาพ เศรษฐกิจ ไม่มีกรอบอื่น อย่าไปกลัวกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ เผย กรณี ส.ส.พรรคประชาธิปัตย์ กล่าวถึงกรณีที่ตนได้ลงตรวจพื้นที่ ถ.ข้าวสาร พบมีการใช้กัญชาเชิงสันทนาการ และยอมรับว่าประกาศสมุนไพรควบคุมไม่ครอบคลุมกรณีที่มีการจัดพื้นที่สูบกัญชานอกสถานประกอบการได้ ว่า ในคกก.ประกอบด้วยผู้แทนกฤษฎีกา นักกฎหมายเกือบทุกกระทรวงที่เกี่ยวข้องช่วยกันดูว่าสามารถกำหนดประเภท ลักษณะ ชนิดของสมุนไพร ซึ่งนิยามของ พ.ร.บ.คุ้มครองและส่งเสริมภูมิปัญญาฯ ไม่ได้หมายถึงแค่พืช แต่รวมถึงส่วนต่างๆ ของพืชและสัตว์ด้วย ดังนั้น กฎหมายมีความชัดเจน มีมาตรฐาน วันนี้เราใช้กฎหมาย สธ.ที่มีอยู่ควบคุมได้ แต่จะมีขั้นตอนการบังคับใช้ มีข้อจำกัดบางประเด็น อยากเรียกร้องให้ผู้แทนราษฎรที่มีบทบาทหน้าที่ออกกฎหมาย มาออกกฎหมายในประเด็นที่ ส.ส.มีความเห็นว่าควรควบคุม ส่วนกรณีคนไทยปลูกกัญชาพื้นบ้านไม่มีมาตรฐาน มีสารโลหะหนัก กรมฯ กำลังรวบรวมข้อมูล อย่างไรก็ตาม การนำกัญชาไปทำยาผ่านการตรวจสารโลหะหนักแล้ว พร้อมให้ข้อมูลความรู้ประชาชนให้รู้จักการปลูกเพื่อใช้ประโยชน์ทั้งนี้ กัญชาเป็นพืชที่ใช้หลายพันปีตั้งแต่สมัยสมเด็จพระนารายณ์มหาราช น้ำมันกัญชาสูตร อ.เดชา ได้รับการยอมรับ มีตำรับเมตตาโอสถและการุณย์โอสถของกรมฯ และอภ.ผลิตน้ำมันกัญชาอีก 4 สูตร จึงควรนำจุดแข็งมาต่อยอดให้เกิดประโยชน์
- นายอัครเดช ฉากจินดา ผู้ประสานงานเครือข่ายเขียนอนาคตกัญชาไทย กล่าวถึง กรณีประกาศ สธ.ควบคุมเฉพาะช่อดอกว่า จุดอ่อนสำคัญของประกาศนี้คือ สถานที่ขออนุญาตจำหน่ายต้องมีที่ตั้งชัดเจน มีบ้านเลขที่ กรณีเกษตรกรปลูกในไร่ที่ไม่มีอาคาร ขอเลขที่บ้านไม่ได้ก็ไม่สามารถขายช่อดอกได้เพราะไม่มีใบอนุญาตจำหน่าย ทางกลับกันร้านสะดวกซื้อสามารถขออนุญาตจำหน่ายช่อดอกได้เพราะมีที่ตั้งชัดเจน อนาคตอาจจะได้เห็นช่อดอกวางจำหน่ายในร้านสะดวกซื้อแน่ มองว่าประกาศฉบับนี้ยังไม่ค่อยเอื้อให้ชาวบ้านเข้าถึงการใช้ในครัวเรือน แต่นายทุนทำได้ง่าย ครอบคลุมทุกอย่าง
- นายมนูญ แสงจันทร์ศิริ ประธานกลุ่มวิสาหกิจชุมชนหม่อนผลแปรรูป กลุ่มใต้ร่มบุญ กล่าวว่า สถานการณ์กัญชายังคงไม่มีความชัดเจนในเรื่องข้อกฎหมาย ทำให้มีช่อดอกที่เป็นผลผลิตตกค้างที่กลุ่มส่งจำหน่ายไม่ได้ตามคาดการณ์ ภาครัฐไม่สามารถแก้ปัญหาให้เกษตรกรได้เลย กิจกรรมเกี่ยวกับกัญชาของกลุ่มต้องชะงักลงทั้งหมด ทั้งนี้ ไม่เห็นด้วยกรณีมีกลุ่มคนออกมาคัดค้านและต้องการให้นำกัญชากลับไปอยู่ในบัญชียาเสพติด สธ.ควรมีมาตรการหรือข้อกฎหมายควบคุมอย่างรอบด้าน มองปัญหาจากล่างขึ้นสู่บน สร้างความมั่นให้กับทุกฝ่าย เพื่อให้สามารถใช้กัญชารักษาโรคได้อย่างแท้จริง
- นายไกรราช เหล่าเกษตรวิทย์ ประธานวิสาหกิจสุขฤทัยเกษตรปลอดภัย เผยระบบกัญชาเกิดความผันผวนจริง ส่งผลให้ภาควิสาหกิจชุมชนได้รับผลกระทบบางส่วนแต่ยังถือว่าไม่มากนัก ยังเดินหน้าขายส่งให้กับ รพ.หนองฉาง และเอกชนทั่วไปเหมือนเดิม เพราะเป็นระบบที่ถูกต้องตามกฎหมาย
- ดร.นันทกร บุญเกิด นักวิจัยผู้เชี่ยวชาญโครงการผลิตกัญชาเชิงคุณภาพเพื่อใช้ประโยชน์ทางการแพทย์ มทส. ได้กล่าวถึงประกาศ สธ.ควบคุมช่อดอกกัญชาว่า มีกลุ่มวิสาหกิจมาขอคำแนะนำการปลูกกัญชา จะแนะนำให้ไปหาตลาดก่อนปลูก เพื่อไม่ให้เสียเวลาและขาดทุน ส่วนหน่วยงานกลางเช่น กรมวิทยาศาสตร์การแพทย์ รับซื้อได้เพียงปริมาณจำกัด กลุ่มวิสาหกิจต้อง
ไปสืบหาว่ามีหน่วยงานใดที่สามารถซื้อช่อดอกไปใช้ในทางการแพทย์ได้ เช่น หน่วยงานแพทย์แผนไทย, รพ.สต.ที่มีนโยบายนำกัญชาไปผลิตเป็นยาใช้ในทางการแพทย์ และหากอยากได้ราคาสูงต้องควบคุมคุณภาพให้ได้เกรด A
วางมาตรการตรวจสอบขายกัญชาออนไลน์
- นพ.ธงชัย เลิศวิไลรัตนพงศ์อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึงกรณีที่ชมรมแพทย์ชนบทระบุว่า แม้จะมีประกาศสมุนไพรควบคุม (กัญชา) ที่บังคับใช้เมื่อ 24 พ.ย.65 ห้ามโฆษณาและขายออนไลน์ แต่พบว่ายังมีคนฝ่าฝืนอยู่จำนวนมาก ได้เตรียมการประสานกับกระทรวงดิจิทัลฯ และจนท.ตร. จะมีการประชุมในวันที่ 7 ธ.ค.65 เพื่อรับทราบข้อปฏิบัติร่วมกันเนื่องจาก จนท.ตร.หรือหน่วยงานอื่นอาจไม่รู้ว่าใช่ช่อดอกกัญชาหรือไม่ จึงจำเป็นต้องให้เจ้าพนักงานของกรมฯ ช่วยยืนยันหรืออาจยืนยันจากผลตรวจทางห้องแล็บได้ที่กรมฯ จากนั้นจึงแจ้งความกับตำรวจเพื่อดำเนินการทางกฎหมาย ส่วนข้อมูลที่ทางชมรมแพทย์ชนบทโพสต์เป็นข้อมูลเก่า ได้ตรวจสอบเรียบร้อยแล้ว ส่วนที่มีการนำภาพตราสัญลักษณ์ ม.ขอนแก่น ไปโฆษณาขายช่อดอกกัญชา มข.ได้ชี้แจงแล้วว่าไม่ได้เป็นผู้โพสต์ หากประชาชนพบเห็นสามารถส่งมาที่กรมฯ หรือแจ้ง สสจ.
- ชมรมแพทย์ชนบท โพสต์เพจ Dytifl นำรูป นพ.ขวัญชัย วิศิษฎ์ฐานนท์ รองอธิบดีกรมการแพทย์แผนไทยฯ มาขึ้นปกเป็น profile ขายช่อดอกกัญชา แม้ประกาศห้ามขายออนไลน์แต่ไม่มีผลให้การโฆษณาขายออนไลน์ลดลงเลย ระบุ ประกาศสธ.ท่าจะเป็นเสือกระดาษ ปิดเพจขายช่อดอกกัญชาได้กี่เพจแล้วแจ้งสาธารณชนทราบด้วย
ข่าวปลอม
- จากกรณีมีข้อความชวนเชื่อห้ามกรอกลงทะเบียนจดแจ้งปลูกกัญชาของ อย. เพราะเป็นมิจฉาชีพ เป็นเว็บไซต์และแอปพลิเคชันปลอม จะหมดตัวเพราะถูกหลอก ด้าน อย.ตรวจสอบข้อมูลและชี้แจงว่า เป็นเว็บที่ถูกต้องสำหรับการจดแจ้งการปลูกกัญชา กัญชง คือ https://plookganja.fda.moph.go.th ไม่ใช่มิจฉาชีพ
เด็กพี้กัญชาริมหาดพัทยา
- โลกโซเชียลเพจพัทยา โพสต์ภาพเด็กจับกลุ่ม 2-3 คน กำลังนั่งใช้บ้องดูดกัญชาบริเวณชายหาดพัทยา จ.ชลบุรี โดยไม่มีคนสนใจ เหมือนเป็นเรื่องปกติจนมีคนแชร์และคอมเมนต์ถึงความไม่เหมาะสมจำนวนมาก ผู้ถ่ายภาพระบุไปสอบถามและตักเตือนเด็ก เด็กตอบว่าไม่กลัวพ่อเป็นทหาร จึงอยากฝากให้หน่วยงานที่เกี่ยวข้องลงมาตรวจสอบบริเวณดังกล่าว
ต่างประเทศ
- สำนักข่าวเดลีเมล รายงานว่า จนท.กู้ภัยลอสแอนเจลิส รับแจ้งเหตุเด็กนักเรียน 10 รายป่วย ถูกนำตัวส่ง รพ.ด่วน 6 รายคาดว่าเกิดจากการรับประทานขนมผสมกัญชามากเกินขนาด
งาน Phangnga Coffee Journey #Season 2 จัดทุกวันเสาร์ของเดือนธันวาคม 2566
คอกาแฟห้ามพลาด งาน Phangnga Coffee Journey #Season 2 จัดทุกวันเสาร์ของเดือนธันวาคม 2566 เช็กอิน 4 สถานที่ 4 บรรยากาศสุดฟิน มาในรูปแบบ Coffee & Camping โดยมีผู้ประกอบการร้านกาแฟชื่อดังในพื้นที่จังหวัดพังงา ร่วมออกบูธในแบบสโลว์บาร์ นำเสนอเมนูกาแฟและเครื่องดื่มที่มีชื่อเสียงของแต่ละร้าน ภายในงานมีเสียงดนตรีจากวงโฟล์คซองคอยบรรเลงเพลงเพราะๆ ได้อารมณ์เข้ากับการจิบกาแฟ พร้อมกับมีกิจกรรมดีๆ โดยการเที่ยวงาน Phangnga Coffee Journey ครบ 4 พื้นที่ รับคูปองเงินสด 300 บาท ทันที (คูปองมีจำนวนจำกัด) สามารถนำไปใช้เป็นส่วนลดแทนเงินสดกับอาหารในร้าน Michelin หรือร้าน Thai Select ที่ร่วมรายการกับ ททท. พังงา
งาน Phangnga Coffee Journey #Season 2 จัด 4 ครั้งใน 4 พื้นที่ ทุกวันเสาร์ในเดือนธันวาคม 2566 ระหว่างเวลา 09.00-16.00 น.
- ครั้งที่ 1 วันเสาร์ที่ 2 ณ บริเวณหาดท้ายเหมือง อุทยานแห่งชาติเขาลำปี-หาดท้ายเหมือง อำเภอท้ายเหมือง
- ครั้งที่ 2 วันเสาร์ที่ 9 ณ หาดนางทอง เขาหลัก อำเภอตะกั่วป่า
- ครั้งที่ 3 วันเสาร์ที่ 16 ณ บริเวณสวนสาธารณะเฉลิมพระเกียรติสมเด็จพระศรีนครินทร์ทราบรมราชชนนี 80 พรรษา อำเภอเมืองพังงา
- ครั้งที่ 4 วันเสาร์ที่ 23 ณ บริเวณย่านเมืองเก่า อำเภอตะกั่วป่า
ททท.สำนักงานพังงา : TAT Phangnga Office 076-413400
3 ธันวาคม วันคนพิการสากล International Day of Persons with Disabilities
สหประชาชาติกำหนดให้วันที่ 3 ธันวาคม เป็นวันคนพิการสากล (International Day of Persons with Disabilities
IDPD) ตั้งแต่ปี 2535 เพื่อมุ่งส่งเสริมความเข้าใจปัญหาความพิการ ยกระดับการสนับสนุนสำหรับศักดิ์ศรี สิทธิและความเป็นอยู่ดีของผู้พิการ มุ่งเพิ่มความตระหนักถึงประโยชน์ที่จะได้จากการรวมผู้พิการเข้ากับทุกแง่มุมของชีวิตการเมือง สังคม เศรษฐกิจและวัฒนธรรม
3 ธ.ค.รายงานผู้ติดเชื้อ 3,933 ราย ปักกิ่ง เสิ่นเจิ้น คลายมาตรการโควิด
จีน รายงานตรวจพบผู้ป่วยโรคโควิด-19 ที่ติดเชื้อในท้องถิ่น 3,933 ราย ในวันศุกร์ (2 ธ.ค.) ที่ผ่านมา ติดเชื้อในท้องถิ่นแบบไม่แสดงอาการรวม 28,894 ราย และมีผู้ป่วยออกจากโรงพยาบาลหลังหายดีรวม 3,378 ราย
อนึ่ง แผ่นดินใหญ่ของจีนไม่มีรายงานผู้ป่วยโรคโควิด-19 เสียชีวิตเพิ่มเติมในวันศุกร์ (2 ธ.ค.) ทำให้ยอดผู้ป่วยเสียชีวิตคงอยู่ที่ 5,233 ราย
เมืองซินเซียง มณฑลเหอหนานทางตอนกลางของจีน ติดตั้งอุปกรณ์ทดสอบกรดนิวคลีอิกด้วยตนเอง จำนวน 1,000 เครื่อง ในพื้นที่หลายมุมเมือง โดยส่วนใหญ่จัดวางอยู่ตามชุมชน โรงเรียน โรงพยาบาล ซูเปอร์มาร์เก็ต บริษัท และสถาบันต่างๆ ผู้อยู่อาศัยส่วนใหญ่สามารถเก็บตัวอย่างสารคัดหลั่งสำหรับทดสอบกรดนิวคลีอิกอย่างชำนาญภายในเวลาไม่ถึง 20 วินาที
ทางการท้องถิ่นนครกว่างโจว เมืองเอกของมณฑลกว่างตง (กวางตุ้ง) ทางตอนใต้ของจีน รายงานการตรวจพบผู้ป่วยโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) สะสม 162,700 ราย ระหว่างการกลับมาแพร่ระบาดรอบใหม่ โดยผู้ป่วยที่ติดเชื้อแบบไม่แสดงอาการคิดเป็นราวร้อยละ 90 ของผู้ป่วยทั้งหมด จางอี้ รองผู้อำนวยการคณะกรรมการสุขภาพเทศบาลเมืองกว่างโจว กล่าวในการแถลงข่าวซึ่งจัดขึ้นที่กว่างโจวว่าในจำนวนนี้ ผู้ป่วย 4 รายมีอาการหนักขั้นวิกฤต ทว่ายังไม่มีรายงานพบผู้เสียชีวิตแต่อย่างใด จางระบุว่าขณะนี้กว่างโจวมีเตียงสำหรับรองรับผู้ป่วยเกือบ 90,000 เตียง และเตียงในหอผู้ป่วยหนักมากกว่า 2,000 เตียงสำหรับใช้ในกรณีฉุกเฉิน เขตทุกแห่งในกว่างโจวได้จัดตั้งสถานที่เก็บตัวอย่างกรดนิวคลีอิกรวมกว่า 1,700 แห่ง ตั้งแต่วันศุกร์ (2 ธ.ค.) โดยมี 87 แห่งเปิดให้บริการตลอด 24 ชั่วโมง เขตไห่จู เทียนเหอ พานอวี๋ และลี่วานในกว่างโจวได้ยกเลิกมาตรการควบคุมชั่วคราวทั้งหมดเมื่อวันพุธ (30 พ.ย.) โดยพื้นที่ทั้งหมดยกเว้นพื้นที่เสี่ยงโรคโควิด-19 ระดับสูง ถูกกำหนดให้เป็นพื้นที่เสี่ยงระดับต่ำ หรืออยู่ภายใต้มาตรการควบคุมปกติ
ปักกิ่ง เสิ่นเจิ้น คลายมาตรการโควิด
แม้ตัวเลขผู้ติดเชื้อโดยรวมทั้งประเทศจีนยังคงอยู่ในระดับสูง แต่บางเมืองบางมณฑลเริ่มขยับมาตรการหรือผ่อนคลายความเข้มงวดรวมถึงการกักตัวลงบ้างแล้ว หลังจากผลกระทบเริ่มปรากฏชัดขึ้นเรื่อยๆ ทางเศรษฐกิจและสังคม โดยเฉพาะกับประชาชนจนเกิดการประท้วงเมื่อปลายเดือนพฤศจิกายนที่ผ่านมา
ทางการปักกิ่งยกเลิกจุดตรวจหาเชื้อหลายแห่ง พร้อมกับยกเลิกการแสดงผลตรวจ PCR เมื่อต้องเข้าใช้บริการซุปเปอร์มาเก็ต อาคารพาณิชย์ ที่พักอาศัยชุมชน และรถไฟใต้ดิน แต่สถานที่บางแห่งเช่น สำนักงาน โรงพยาบาล อินเตอร์เน็ตค่าเฟ่ คาราโอเกะ บาร์ ยิม โรงเรียนทุกระดับ ยังคงจำเป็นต้องแสดงผลตรวจ 48 ชั่วโมง กรณีการจัดกิจกรรมที่มีคนรวมตัวกันมาก เปิดโอกาสให้ผู้จัดหรือหน่วยงานใช้ดุลพินิจกำหนดมาตรการเอง (
CGTN)
นครเสิ่นเจิ้น เริ่มขยับมาตรการผ่อนคลาย โดยประกาศยกเลิกการแสดงผลตรวจเมื่อต้องเข้าไปใช้บริการขนส่งสาธารณะ ร้านอาหารหรือสวนสาธารณะ พร้อมกับยกเลิก การตรวจสอบยานพาหนะก่อนเดินทางด้วยเช่นกัน สอดคล้องไปกับมาตรการผ่อนคลายที่เกิดในเมืองใหญ่อื่นๆ อย่าง เฉิงตู เทียนจิน [
CNBC]
3 ธันวาคม 65 ประเด็นมั่วสุมสูบกัญชา
ประเด็นเด็กมั่วสุมสูบกัญชา
- จากกรณีโลกโซเชียล แชร์ภาพเยาวชน 2 คน อายุประมาณ 9-10 ปี กำลังสูบกัญชาริมชายหาดเมืองพัทยา ล่าสุดเจ้าหน้าที่เทศกิจ พร้อมด้วยเจ้าหน้าที่สำนักงานสวัสดิการเมืองพัทยา สามารถควบคุมตัวได้แล้ว 1 คน มาสอบสวนที่ สภ.เมืองพัทยา มีอายุ 10 ขวบ เพิ่งหนีออกมาจากบ้านพักเด็กและครอบครัว จ.ชลบุรี มาอยู่กับยายแต่ทะเลาะกันจึงหนีออกจากบ้านหน่วยงานที่เกี่ยวข้องกำลังดำเนินการช่วยเหลือ ก่อนส่งตัวเด็กกลับเข้าบ้านพักเด็กและครอบครัวจังหวัดชลบุรีให้ดูแลต่อไป
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึงภาพดราม่าเด็กสูบกัญชาข้างถนนว่าเป็นพฤติกรรมที่ผิดกฎหมายแน่นอน ตั้งข้อสังเกตว่าเยาวชนได้ของมาอย่างไร ตำรวจต้องขยายผลจับกุม ต่อให้อยู่ในครอบครัวก็ต้องจัดการ แต่ในอีกมุมหนึ่ง ภาพที่ออกมาน่าสงสัยว่ามีการเซ็ตกันขึ้นมาเพื่อหวังผลอะไรบางอย่างหรือไม่ ยืนยันว่า สธ. รัฐบาล ผู้ที่ร่างกฎหมายตอนนี้ ไม่มีใครสนับสนุนให้นำไปใช้เพื่อการสูบเสพ แต่เน้นให้ใช้เพื่อการแพทย์ สุขภาพ และเศรษฐกิจ
- นพ.รุ่งเรือง กิจผาติ หัวหน้าที่ปรึกษาระดับกระทรวงและโฆษก สธ. ให้ความเห็นประเด็นเด็กพี้กัญชาว่า รู้สึกเป็นห่วงสังคม สธ. ผู้บริหาร และบุคลากรทุกคน ไม่ต้องการให้สิ่งเหล่านี้เกิดขึ้น และในทางกลับกันไม่อยากให้กัญชา ซึ่งมีประโยชน์ในฐานะยาสมุนไพร ต้องถูกแอบใช้อยู่ใต้ดิน อยากให้เป็นสิทธิ์ด้านสุขภาพของทุกคน ดังนั้น การใช้ที่ผิดก็ต้องควบคุม การใช้ที่ถูกก็ต้องส่งเสริม จึงมีการประกาศกฎกระทรวงฯ หลายฉบับ แต่การดูแล ยังไม่เท่า พ.ร.บ. ซึ่งตอนนี้ คณะกรรมาธิการผู้ร่างกำลังผลักดันกันอยู่ แต่มีฝ่ายการเมืองมาขวาง พอเกิดปัญหา เช่น เกิดภาพเด็กสูบกัญชา ก็นำมาโจมตีอีกพรรคการเมือง แล้วมาบอกว่าเป็นห่วงสังคม แต่เตะถ่วงการออกกฎหมาย ทำแบบนี้ไม่ถูกต้อง
- นพ.บัญญัติ เจตนจันทร์ ส.ส.ระยอง พรรคประชาธิปัตย์ แถลงกรณีภาพเด็กมั่วสุมสูบกัญชาในพื้นที่พัทยาว่า เหตุการณ์นี้เกิดขึ้นเป็นเพราะนายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. รมว.สาธารณสุข ออกประกาศกระทรวงเพื่อปลดล็อกกัญชาให้เข้าถึงอย่างแพร่หลาย ทำให้เยาวชนเข้าถึงกัญชาได้ง่าย จนถูกตั้งข้อสังเกตว่าเป็นการใช้กัญชาเพื่อสันทนาการมากกว่าการแพทย์ขอถามนายอนุทินและบุคคลทั้งหมดใน สธ. ว่ารู้สึกอย่างไรกับสิ่งที่เกิดขึ้นกับเยาวชน ในฐานะผู้กำหนดนโยบายกัญชาเสรี ทั้งนี้สธ. ไม่มีเครื่องมือควบคุมไม่ให้กัญชาไปถึงเยาวชนและกลุ่มเปราะบาง เรียกร้องให้หาวิธีแก้ไข อย่ารอร่างกฎหมายกัญชา กัญชง ที่รอพิจารณาของสภาฯ และต้องผ่านการพิจารณาของวุฒิสภา และขอเรียกร้องให้แพทย์ใน สธ.พูดความจริงเกี่ยวกับกัญชา และควรเน้นการสร้างความปลอดภัยให้กับประชาชน ก่อนการใช้เพื่อประโยชน์ทางการแพทย์
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ตอบ นพ.บัญญัติ กรณีเด็กสูบกัญชาที่บอกให้รมว.สธ.รับผิดชอบ ซึ่งการปลดล็อกมาจากมติ ป.ป.ส. ส่วนการดำเนินคดีตามกฎหมายมีขั้นตอน หากพบเจอเบาะแสแจ้ง จนท.ตร. ได้ ส่วนปัญหาเด็กเร่ร่อนให้แจ้ง พม. หรือแจ้งไปยัง “รมช.สธ. ดร.สาธิต” ที่ดูแลกรมการแพทย์แผนไทยฯ กรณีประกาศคุมช่อดอกกัญชา
- น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย ตั้งคำถามรัฐบาลที่ พล.อ.ประยุทธ์เป็นผู้นำสูงสุดว่าจะรับผิดชอบอย่างไรต่อเหตุการณ์เด็กและวัยรุ่นมั่วสุมกันเสพกัญชาที่เพิ่มจำนวนขึ้นทุกวัน เจ้าหน้าที่รัฐได้รับคำสั่งตามลำดับชั้นตั้งแต่บนสุดเรื่อยลงมาให้เข้มงวดกวดขันอย่างไรหรือไม่ ขณะนี้กฏหมายกัญชาก็ยังไม่ออกมาบังคับใช้ มีแต่ประกาศ สธ.ควบคุมช่อและดอกกัญชา ที่ความจริงไม่สามารถควบคุมได้
- นายศุภชัย ใจสมุทร ส.ส.พรรคภูมิใจไทย ในฐานะประธาน กมธ.วิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง (ฉบับที่…) พ.ศ. … โพสต์เฟซบุ๊กส่วนตัว ย้ำนโยบาย “ภูมิใจไทย” เน้นกัญชาเพื่อการแพทย์-เศรษฐกิจ หลังโดนโยงเด็กพี้กัญชา ย้ำว่าไม่หนุนเรื่องนันทนาการ พร้อมขอสภาฯ เร่งพิจารณา พรบ.ออกกฎหมายควบคุม
เจ้าอาวาสสูบกัญชาอ้างแก้เบาหวาน
- กรณีคลิปเจ้าอาวาสวัดฤทธิ์ศิริราษฎร์เจริญธรรม จ.สุโขทัย กำลังสูบกัญชาอยู่ในกุฏิและมีการร้องเรียนว่าเป็นพฤติกรรมไม่เหมาะสม ได้มีการลงพื้นที่ตรวจสอบข้อเท็จจริง เจ้าอาวาสชี้แจงว่ามีโรคประจำตัว คือ โรคเบาหวาน อยู่ระหว่างกินยารักษาและดูข่าวจากโซเชียลทราบว่ากัญชาสามารถรักษาโรคเบาหวานได้ จึงทดลองใช้กัญชารักษาโรค โดยสูบกัญชาเพียงครั้งเดียวตามที่ปรากฏในคลิป ซึ่งเป็นคลิปเก่าที่เกิดขึ้นนานแล้ว ด้านตำรวจพระ กล่าวว่า คณะสงฆ์อำเภอเมืองสุโขทัยทราบเรื่องและได้ตรวจสอบตามข้อร้องเรียนพบว่าเจ้าอาวาสวัดดังกล่าวสูบกัญชาจริงเพียงครั้งเดียว เพื่อใช้รักษาโรคเบาหวานที่น้ำตาลในเลือดสูง คณะสงฆ์จึงตักเตือนและภาคทัณฑ์ไว้
ตอบข้อสงสัยเกี่ยวกับการควบคุมช่อดอกกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก ตอบคำถามข้อสงสัยเพราะอะไรต้องควบคุม “ช่อดอกกัญชา” และประกาศกระทรวงสาธารณสุขคุมเข้มได้แค่ไหน จับกุมได้จริงหรือไม่ ขณะที่พ.ร.บ.กัญชากัญชงฯ จำเป็นแค่ไหน ดังนี้
1. ยืนยันชัดเจนว่าสนับสนุนนโยบายกัญชาเพื่อการแพทย์ เศรษฐกิจและสุขภาพ กัญชามาเดี่ยว ๆ ไม่ได้วันนี้ใช้กฎหมายของ สธ. ที่มีอยู่ควบคุมได้ แต่จะมีขั้นตอนการบังคับใช้ มีข้อจำกัดบางประเด็น
2. สาเหตุที่ต้องควบคุมกัญชาเป็นส่วน ๆ เช่นที่ประกาศ สธ. คุมเฉพาะช่อดอก เพราะมีข้อมูลทางวิชาการชัดเจนว่าส่วนอื่น ไม่ว่าจะเป็นกิ่ง ก้าน ราก ใบ มีสาร THC ไม่สูง ขณะเดียวกันก็มีสาร CBD ที่ทำให้ผลของ THC ที่มีผลต่อจิตประสาทลดลง มีงานวิจัยรองรับว่าการใช้ใบสูบจะทำให้ไม่ได้ฤทธิ์ของ THC แต่ช่อดอกกลับมีสาร THC สูง 3. การบังคับใช้ ประกาศ สธ. คุมช่อดอกกัญชา ดำเนินคดีตามกฎหมาย หากพบการกระทำผิดจะเป็นไปตามตามลำดับ คือ ตักเตือน พักใช้ใบอนุญาต แต่ถ้ายังไม่หยุดทำจะต้องยึดใบอนุญาตแล้วงดออกใบอนุญาตให้กับรายนั้น 2 ปี ยืนยันว่า ประกาศ สธ. ใช้ได้จริง แต่จะให้ดีที่สุดยืนยันว่า ต้องมีกฎหมายเฉพาะ คือ พ.ร.บ.กัญชาฯ 4. ประกาศ สธ.คุมช่อดอกกัญชา สามารถเอาผิดคนขายผ่านออนไลน์ได้หรือไม่นั้น กรมฯ ได้เตรียมประสานกับก.ดิจิทัล และเจ้าหน้าที่ตำรวจ จะมีการประชุมกันวันที่ 7 ธ.ค. นี้ เพื่อรับทราบข้อปฏิบัติร่วมกัน 5. กรมฯ กำลังรวบรวมข้อมูลประเด็นคนไทยปลูกกัญชาพื้นบ้านไม่มีมาตรฐาน มีสารโลหะหนัก 6. กัญชาทางการแพทย์มีงานวิจัย หรือมีการศึกษา อย่างสูตรกัญชาที่ได้รับการยอมรับใช้ในคลินิกกัญชาทางการแพทย์ “น้ำมันกัญชาสูตรอ.เดชา” ของกรมฯ ก็มีตำรับเมตตาโอสถและการุณย์โอสถ ขณะที่องค์การเภสัชกรรมก็ผลิตน้ำมันกัญชาอีก 4 สูตร ใช้ในการแพทย์แผนปัจจุบันเพื่อใช้ในโรงพยาบาลต่าง ๆ ทั้งรัฐและเอกชน
Khao Kho Cross Country 3 ธันวาคม 2023
Khao Kho Cross Country 2023 "the First Impression" เทศกาลงานวิ่งข้ามทุ่ง จากผืนน้ำ ทะเลสาป - สู่ยอดเขา ภูผาสูงชัน งานวิ่งฟีลกู้ด รับรองความฟีลกู้ดหนาวนี้ 3 ธันวาคม 2023
สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์ ระหว่างวันที่ 3-9 ธ.ค. 2566
สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์
ระหว่างวันที่ 3-9 ธ.ค. 2566
ผู้ป่วยรักษาตัวในโรงพยาบาล (รายสัปดาห์)
จำนวน 590 ราย : เฉลี่ยรายวัน 84 ราย/วัน
ผู้เสียชีวิต (รายสัปดาห์)
จำนวน 5 ราย : เฉลี่ยรายวัน 1 ราย/วัน
---------------------
ผู้ป่วยสะสม 36,794 ราย (ตั้งแต่ 1 ม.ค. 2566)
เสียชีวิตสะสม 831 ราย (ตั้งแต่ 1 ม.ค. 2566)
---------------------
ผู้ป่วยปอดอักเสบ 94 ราย
ผู้ป่วยใส่ท่อช่วยหายใจ 49 ราย
พระพุทธฉาย มังกี้รัน 4 ธ.ค.65 LINK
Phraphutthachay Monkey RUN : พระพุทธฉาย มังกี้รัน 4 ธันวาคม 2565 ณ วัดพระพุทธฉาย จ.สระบุรี งานวิ่งชิวๆกับบรรยากาศธรรมชาติสองข้างทาง ในช่วง หน้าหนาวนี้ มี 2 ระยะทาง ให้เลือก 21Km.(Chip timing) และ 6Km.
หัวหิน รักษ์เล Run Fun Walk วันที่ 4 ธ.ค.65 LINK
กิจกรรมเดิน-วิ่ง ริมชายหาดเมืองหัวหิน "หัวหิน รักษ์เล RUN-FUN-WALK" ปล่อยปู ตักบาตร หาดหัวหิน ระยะทาง 5.9 Km
งานเดินวิ่งสนุกสนานการกุศล ริมชายหาดเมืองหัวหิน ไม่มีการแข่งขัน มีแต่ของรางวัลและความอิ่มบุญ ตามคอนเซ็ป " ปล่อยปู ตักบาตร หาดหัวหิน "
จัดขึ้นในวันอาทิตย์ ที่ 4 ธันวาคม 2565 จุด Start/Finish ศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน เริ่ม 05.30น.
จัดโดยกลุ่มก่อการดี , เราเพื่อนกัน สนับสนุนโดยจังหวัดประจวบคีรีขันธ์, อำเภอหัวหิน, เทศบาลเมืองหัวหิน, Market Village HuaHin , การท่องเที่ยวแห่งประเทศไทย สำนักงานประจวบคีรีขันธ์ และพันธมิตรจิตกุศลมากมาย
รายได้ทั้งหมดหลังหักค่าใช้จ่ายแล้วมอบให้ สถานีกาชาดหัวหินเฉลิมพระเกียรติ
กิจกรรม ภายในงานแบ่งออกเป็น
- การปล่อยลูกพันธุ์ปูม้า (ระยะที่ 1: 1.5 กม.)
- การใส่บาตรอิ่มบุญ (ระยะที่ 2 : 2.9 กม. * จุดกลับตัว บริเวณหลัง โรงแรมชีวาศรม*)
- ร่วมกิจกรรมนั่งม้าชายหาด (ระยะที่ 3 : 4.9 กม.)
ค่าสมัคร 399.- เปิดรับสมัครตั้งแต่วันที่ 25 ต.ค. 65 - 18 พ.ย. 65 (กรณีจัดส่งมีค่าใช้จ่าย 100 บาท)
ครอบครัวมงฟอร์ต เดิน-วิ่งการกุศล MC FAMILY RUN 2022 ครั้งที่ 2 วันที่ 4 ธ.ค.65
กิจกรรมเดิน-วิ่งการกุศล MC FAMILY RUN 2022 ครั้งที่ 2 กำหนดจัดงาน : วันอาทิตย์ที่ 4 ธันวาคม 2565 (90 ปี ครอบครัวมงฟอร์ต ชวนพ่อเดิน- วิ่ง)
ผู้เข้าร่วมกิจกรรม 1) นักเรียนโรงเรียนมงฟอร์ตวิทยาลัย จำนวน 3,235 คน และ ครู บุคลากร โรงเรียนมงฟอร์ตวิทยาลัย จำนวน 250 คน
ประเภทการวิ่ง
1.1 Fun Run 5 Km. นักเรียนทุกคนและผู้ปกครองที่สนใจ
1.2 VIP Run 2 Km. ผู้บริหาร สมาคมผู้ปกครอง / ศิษย์เก่า ผู้ปกครองที่สนใจ
รายละเอียด+สมัคร
montfort.ac.th/mc-run-2/4 ธ.ค. จีนรายงานผู้ติดเชื้อโควิดในท้องถิ่น 4,168 ราย
จีน รายงานพบผู้ป่วยโรคโควิด-19 ที่ติดเชื้อในท้องถิ่น 4,168 ราย ในวันเสาร์ (3 ธ.ค.) ที่ผ่านมา ติดเชื้อในท้องถิ่นแบบไม่แสดงอาการรวม 27,433 ราย และมีผู้ป่วยออกจากโรงพยาบาลหลังหายดีรวม 3,341 ราย ขณะเดียวกันแผ่นดินใหญ่ของจีนตรวจพบผู้ป่วยโรคโควิด-19 เสียชีวิตเพิ่ม 2 ราย ทำให้ยอดผู้ป่วยเสียชีวิตรวมอยู่ที่ 5,235 ราย4 ธันวาคม 65 ห้ามขายช่อดอก , ชุดตรวจเทสกัญ
1.เด็ก 9 ขวบสูบกัญชา
-นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและ รมว.สธ. กล่าวถึงกรณีข่าวเด็ก 9 ขวบสูบบ้องกัญชาที่พัทยา ว่าเป็นการจัดฉากเพราะเด็กไม่น่าจะซื้อหามาเองได้ อย่างไรก็ตาม มีกรมการแพทย์แผนไทยฯ ดูแลการควบคุมการใช้กัญชาอยู่และได้มอบให้นายสาธิต ปิตุเตชะ รมช.สธ.ไปกำกับดูแล ถ้า ส.ส.ของพรรคประชาธิปัตย์ต้องการให้ปัญหาหมดไป ให้ช่วยกันผ่านร่าง พ.ร.บ.กัญชง-กัญชา
-นายจุติ ไกรฤกษ์ รมว.พม. กล่าวถึงเรื่องเด็กสูบกัญชาว่า เด็กกำลังรอทุกฝ่ายเข้าช่วยเหลือให้มีคุณภาพชีวิตดีขึ้น ไม่ควรมีใครเสียเวลามาโต้เถียงกัน ซึ่ง ส.ส.ประชาธิปัตย์นำเสนอภาพเด็กเสพกัญชา เป็นเรื่องจริงที่ต้องยอมรับ จากนี้ พม.จะจัดหาสถานที่ที่เหมาะสมและพัฒนาสภาพจิตใจ ความเป็นอยู่ของเด็ก ปัจจุบันประเทศไทยมีเด็กที่ถูกทอดทิ้งจากพ่อแม่ นำมาให้ปู่ย่าตายายเลี้ยงมากถึง 3.5 ล้านคน
-นพ.บัญญัติ เจตนจันทร์ ส.ส.ระยอง พรรคประชาธิปัตย์ เปิดเผยกรณีนายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรมว.สธ. กล่าวหาว่า จัดฉากเด็ก 9 ขวบสูบกัญชาที่พัทยาว่า รัฐมนตรีไม่ตอบให้ตรงคำถามว่า สะท้อนใจหรือรู้สึกเสียใจ ไม่สบายใจต่อภาพที่เกิดขึ้นหรือไม่ ตรงกันข้ามกับมองว่ามีคนจัดฉาก ยืนยันว่าไม่มีจิตใจที่จะไปทำร้ายเด็ก อยากจะฟังว่านายอนุทินรู้สึกอย่างไร จะแก้อย่างไร เพราะเป็นคนประกาศนโยบายนี้
- นายวาทิช ธนาวรัทนนท์ กรรมการผู้จัดการ ฟาร์ม โกลเด้นลีฟ ศรีราชา จ.ชลบุรี กล่าวถึงกรณีเด็กเร่ร่อนอายุ 9 ขวบดูดกัญชาถูกตำรวจจับที่พัทยา ว่า อยากให้มีการตรวจสอบข้อเท็จจริงว่าเกี่ยวกับเรื่องการเมืองหรือไม่ ช่วงนี้มีการออกข่าวเกี่ยวกับกัญชาอย่างหนัก อยากให้ความเป็นธรรมกับผู้ประกอบการกัญชาที่มีการลงทุนนับแสนนับล้านบาท เพื่อสร้างโอกาสให้เศรษฐกิจประเทศไทยดีขึ้น ผู้ประกอบการที่ขออนุญาตถูกต้องจะปฏิบัติตามที่กระทรวงสาธารณสุขออกกฎหมาย เพราะไม่คุ้มที่ร้านจะถูกปิดหรือถอนใบอนุญาต โดยเฉพาะเด็กจะไม่มีโอกาสซื้อกัญชาไปสูบแน่นอน เพราะกฎหมายระบุไว้ชัดว่ามีความผิด แต่ข่าวที่เกิดขึ้นมาจากเด็กเร่ร่อนที่อาจถูกนำไปเป็นเครื่องมือเพื่อสร้างภาพลบเกี่ยวกับการใช้กัญชา ทำให้นักการเมืองบางคนยกขึ้นมาเป็นข้อเสียของกัญชา เพื่อผลประโยชน์ทางการเมือง
2.ห้ามขายช่อดอก
-นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก ได้ส่งหนังสือด่วนที่สุด ลงวันที่ 2 ธ.ค.ส่งถึงกรรมการผู้จัดการบริษัท ช้อปปี้ (ประเทศไทย) จำกัด เพื่อขอให้มีการระงับการโฆษณาขายสินค้าสมุนไพรควบคุม(กัญชา) หลังได้รับเรื่องร้องเรียนจากประชาชน ว่า มีการประกาศโฆษณาขายกัญชาในส่วนที่เป็นช่อดอกผ่านช่องทางออนไลน์บนแพลตฟอร์มของช้อปปี้ ซึ่งไม่สามารถทำได้ตามประกาศกระทรวงสาธารณสุขเรื่องสมุนไพรควบคุม (กัญชา) พ.ศ. 2565 จึงขอให้ดำเนินการระงับการจำหน่าย ระงับการโฆษณาสมุนไพรควบคุมบนแพลตฟอร์มของ Shopee โดยเร็ว ส่วนแพลตฟอร์มอื่นๆ อยู่ระหว่างตรวจสอบ หากยังไม่ระงับการโฆษณาดังกล่าว จะมีโทษจำคุกไม่เกิน 1 ปี ปรับไม่เกิน 20,000 บาท หรือทั้งจำทั้งปรับ ทั้งนี้ลักษณะการจำหน่ายผ่านแอปดังกล่าวจะไม่สามารถใช้ชื่อค้นหาว่ากัญชาได้ แต่ผู้ขายเลี่ยงไปใช้คำอื่นแทนเช่น กัญนอก กรีน สมุนไพรอัดแท่ง โอจี เป็นต้น พบว่ามีจำหน่ายอยู่หลายร้าน ราคาเริ่มต้นหลัก 100 บาท
3.ชุดตรวจเทสกัญ
- นพ.ศุภกิจ ศิริลักษณ์ อธิบดีกรมวิทยาศาสตร์การแพทย์ กล่าวว่า ขณะนี้กรมวิทย์ฯ ตรวจ 2 อย่าง คือ
1.ตรวจในคนโดยตรวจจากปัสสาวะมีการใช้กัญชาหรือไม่ บางรายสารอยู่ในร่างกายได้นานถึง 2 เดือน แต่ปัจจุบันจะตรวจเลือดในกรณีที่แพทย์สงสัยว่าผู้ป่วยเป็นพิษจากกัญชา ในผู้ป่วยที่มีประวัติการใช้กัญชา ซึ่งศูนย์วิทยาศาสตร์การแพทย์ทุกแห่งทั่วประเทศ ตรวจได้
2.ตรวจในวัตถุดิบ เช่น อาหาร สินค้าที่ผสมกัญชาแล้วจะไปขึ้นทะเบียนกับ อย. ขณะเดียวกัน กรมวิทย์ฯได้ผลิตชุดตรวจสารสกัดกัญชาชนิดน้ำ เช่น น้ำมันกัญชา เครื่องดื่มผสมกัญชา เรียกว่าเทสกัญ ได้รับการจดสิทธิบัตรเรียบร้อยแล้ว เป็นชุดเร็วเพื่อให้รู้ว่ามีสาร THC เกิน 0.2% หรือไม่ ผลิตจำนวน 2 หมื่นชุด แจกไปยังสำนักงานสาธารณสุขจังหวัดแล้ว หากผู้ประกอบการสนใจรับถ่ายทอดเทคโนโลยีไปผลิตเป็นสินค้าชุดตรวจกัญชา ติดต่อที่กรมวิทยาศาสตร์การแพทย์ได้
4.กัญชาทางการแพทย์
-นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ เปิดเผยว่า กรมการแพทย์โดยสถาบันประสาทวิทยาและสถาบันสุขภาพเด็กแห่งชาติมหาราชินี ได้ศึกษาวิจัยการนำสารสกัดกัญชามารักษาโรคระบบประสาท เป็นการศึกษาวิจัยติดตามการรักษาโรคลมชักรักษายากในเด็กด้วยสารสกัดกัญชา CBD สูง ร่วมกับยากันชักหลายชนิดเป็นระยะเวลา 12 เดือน จำนวน 14 ราย พบว่า ผู้ป่วยมีอาการชักรุนแรงลดลง 50% ทุกรายมีผลข้างเคียง แต่ส่วนใหญ่ไม่รุนแรง และมักเกิดในช่วง 3 เดือนแรก จึงควรเริ่มยาในขนาดต่ำเพิ่มขนาดอย่างช้าๆ และเฝ้าระวังผลข้างเคียง และได้ร่วมกับสมาคมกุมารประสาทวิทยา ติดตามผลการรักษาผู้ป่วยโรคลมชักรักษายากในเด็กที่ใช้สารสกัดกัญชาชนิด CBD สูงทั่วประเทศ เบิกจ่ายในสิทธิหลักประกันสุขภาพถ้วนหน้า เพื่อให้มีข้อมูลความปลอดภัยและประสิทธิผลที่เชื่อถือได้ นำไปสู่การเสนอเข้าสู่บัญชียาหลักแห่งชาติด้านสมุนไพรบัญชี 1 ในปี 2567 ต่อไป และยังมีข้อมูลสนับสนุนถึงสารสกัดกัญชาทางการแพทย์สูตร THC:CBD 1:1(THC 2.7 mg : CBD 2.5 mg) ในลักษณะยาพ่นที่ดูดซึมผ่านช่องปาก มีประสิทธิภาพลดอาการเกร็งและอาการปวดที่เกิดจากโรคปลอกประสาทส่วนกลางอักเสบ ส่วนโรคพาร์กินสัน การใช้สารสกัดกัญชามีความปลอดภัยและน่าจะมีประโยชน์ในการใช้เป็นยาเสริมรักษา อาจช่วยลดอาการปวดเกร็ง อาการยุกยิก และการเคลื่อนไหวช้า เพิ่มคุณภาพชีวิตผู้ป่วยได้
เที่ยวสบายๆ สไตล์เชียงราย Amazing Northern Lifestyle 4-6 ธันวาคม 2566
เที่ยวสบายๆ สไตล์เชียงราย Amazing Northern Lifestyle ชมงานศิลปะ ชิมชา กาแฟ อาหารอร่อย ช็อปสินค้างานคราฟต์ สินค้าชุมชน เเพคเกจท่องเที่ยวเส้นทางชมงานไทยแลนด์เบียนนาเล่ เส้นทางชากาแฟ ลด 20% และเเพคเก็จเวลเนส ฟังเพลงเพราะๆ จากศิลปินเชียงรายตลอดงาน
วันที่ 4-6 ธันวาคม 2566 เวลา 14.00 - 20.00 น.ณ บริเวณด้านหน้าอาคารเทิดพระเกียรติ 90 ปี สมเด็จพระศรีนครินทร์ ขัวพญามังราย สอบถามรายละเอียดเพิ่มเติม โทร. 053 7446 74-5 (ททท. สำนักงานเชียงราย)
งานเดิน วิ่ง RUN for LOVE วิ่งวัฒนธรรมไทยภาคไหนๆก็ดูดี 2565 - 5 ธ.ค.65
"งานเดิน วิ่ง RUN for LOVE วิ่งวัฒนธรรมไทยภาคไหนๆก็ดูดี 2565" (เลื่อนมาจากปี2564) วันที่จัดงาน: จันทร์ 5 ธันวาคม 2565 (วันหยุดราชการ )
สถานที่จัดงาน: สวนพุทธมณฑล ถนนพุทธมณฑลสาย 4
จัดและดำเนินงานโดย: ก้าวไกลสปอร์ต : KAO KLAI SPORT
รายละเอียดและสมัคร
https://bit.ly/RUN-FOR-LOVE-2021
รายได้หลังหักค่าใช้จ่ายเพื่อนำไปบริจาคสนับสนุนทุนการศึกษาและ ค่าอาหารกลางวันน้องๆโรงเรียนบ้านผาหวาย ในการพัฒนาโรงเรียน ที่ขาดแคลนและอยู่ห่างไกล ซึ่งอุปกรณ์สื่อการเรียนการสอนมีความจำเป็นสำหรับเด็กและเยาวชน ในวัยเรียนเพื่อเป็นแนวทางในการยกระดับคุณภาพการศึกษาของน้องๆ และช่วยเหลืออุปกรณ์ทางการแพทย์ให้กับ โรงพยาบาลใกล้เคียง
Forest of illumination สัมผัสนาทีต้องมนตร์ท่ามกลางแสงสีแห่งเขาใหญ่
Forest of illumination สัมผัสนาทีต้องมนตร์ท่ามกลางแสงสีแห่งเขาใหญ่
หากคุณคือหนึ่งในนักเดินทางผู้แสวงหาการผจญภัยเหนือจินตนาการ แพ็คกระเป๋าแล้วออกเดินทางมาเจอกัน หมู่ดาวแห่ง “เขาใหญ่” ขอเป็นตัวแทนพาทุกคนออกเดินทางพบกับความมหัศจรรย์ยามค่ำคืน เมื่อผืนฟ้ากับผืนป่าบรรจบกันเป็นหนึ่งเดียว “แสงของดวงดาว” จึงเนรมิตเส้นทางแห่งการเดินป่าสุดอัศจรรย์ ที่จะสร้างประสบการณ์การเดินป่าครั้งใหม่ให้กับคุณ ขอให้เหล่านักสำรวจใช้ประสาทสัมผัสทั้ง 5 ในการเปิดรับ ชม ฟัง สัมผัส เสียงแห่งป่า ผ่านเส้นทางที่ร่องรอยแห่งดวงดาวได้สร้างไว้เพื่อตามหาหัวใจแห่งขุนเขา หวังว่าจะได้พบกัน
Venue : คีรีมายา , เขาใหญ่
Date : 5 พฤศจิกายน 2564 – 29 มกราคม 2565
เวลาเปิด - ปิด: 18:00 – 22:00 (เวลาเข้าชมรอบสุดท้าย - 21:00)
**ไม่อนุญาตให้นำสัตว์เลี้ยงเข้างาน
ราคาบัตร: Regular Ticket 300 บาท *เด็กส่วนสูงต่ำกว่า 90 เซนติเมตร เข้าฟรี
ข้อมูลเพิ่มเติม
Forest_of_illumination5 ธ.ค. จีนรายงานผู้ติดเชื้อเพิ่ม 4,247 ราย ไม่มีเสียชีวิตเพิ่ม
จีน รายงานผู้ป่วยโควิด-19 ที่ติดเชื้อในท้องถิ่นเพิ่ม 4,247 ราย ในวันอาทิตย์ (4 ธ.ค.) ที่ผ่านมา ติดเชื้อในท้องถิ่นแบบไม่แสดงอาการรวม 25,477 ราย และมีผู้ป่วยออกจากโรงพยาบาลหลังหายดีรวม 3,913 ราย ขณะยอดผู้ป่วยเสียชีวิตยังคงรวมอยู่ที่ 5,235 ราย5 ธันวาคม 65 เตือนเข้มค้ากัญชาออนไลน์
1. เด็ก 9 ขวบสูบกัญชา
-นายวัชรพงศ์ คูวิจิตรสุวรรณ เลขานุการ รมว.สธง กล่าวว่า ไม่เคยกล่าวหาว่า นพ.บัญญัติจัดฉากเพราะไม่คิดว่าคนเป็นนักการเมืองจะจิตใจต่ำได้ขนาดนั้น ทั้งนี้ควรเร่งออกกฎหมายมาควบคุมการใช้แทนที่จะหาเรื่องมาโจมตีพรรคภูมิใจไทย เพราะท่านคือส่วนสำคัญที่สกัดร่างพระราชบัญญัติกัญชา กัญชง พ.ศ. ... (พ.ร.บ.กัญชาฯ) แล้วมาอ้างว่าเป็นห่วงสังคม เพื่อจะหาช่องโจมตีพรรคอื่น ทั้งที่สามารถช่วยกันแก้ปัญหาได้
-นายราเมศ รัตนะเชวง โฆษกพรรค ปชป. กล่าวว่า กรณีเด็กพี้กัญชา เริ่มต้นมาจากการนำเสนอข่าวของสื่อมวลชนนพ.บัญญัติ เจตนจันทร์ในฐานะ ส.ส.ที่ได้ติดตามเรื่องนี้ได้นำแถลงเพื่อหาทางในการแก้ปัญหา คงไม่มีใครปัญญาอ่อนไปจัดฉากซื้อบ้องกัญชามาให้เด็กพี้กัน เพื่อเอามาเป็นประเด็นห้ำหั่นกันในทางการเมือง นักการเมืองที่ดีที่มีจิตสำนึกไม่มีใครทำแน่นอน พรรคภูมิใจไทยต้องหาหลักฐานมาว่า นพ.บัญญัติจัดฉากอย่างไร ทำด้วยวิธีการไหน ให้เวลา 7 วัน ถ้าหาหลักฐานไม่ได้คนพูดก็ต้องแสดงความรับผิดชอบ
2. เตือนเข้มค้ากัญชาออนไลน์
-น.ส.ไตรศุลี ไตรสรณกุล รองโฆษกประจำสำนักนายกฯ กล่าวว่า รมว.สาธารณสุข ได้กำชับหน่วยงานของสธ.ให้ดูแลการใช้ประโยชน์จากการกัญชาให้เป็นไปตามกฎหมายโดยเฉพาะประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม(กัญชา) พ.ศ.2565 ฉบับลงวันที่ 11 พ.ย.65 และมีผลบังคับเมื่อวันที่ 24 พ.ย.65 ที่เน้นควบคุมช่อดอกกัญชา ซึ่งกรมการแพทย์แผนไทยฯ มีการติดตามการขายช่อดอกกัญชาผ่านแพลตฟอร์มออนไลน์อย่างใกล้ชิด ซึ่งยังพบการขายอยู่ ตอนนี้กรมฯ ได้ทำหนังสือแจ้งไปยังแพลตฟอร์มบางแห่งแล้ว และทยอยตรวจสอบแพลตฟอร์มอื่นๆ หากพบจะดำเนินการลักษณะเดียวกัน ซึ่งหากเตือนแล้วไม่มีการปิดกั้นผู้ค้า ถือว่าแพลตฟอร์มเป็นผู้ฝ่าฝืนประกาศ สธ.และผิดตามกฎหมายด้วย
6 ธ.ค. จีนรายงานผู้ติดเชื้อเพิ่ม 5,046 ราย ไม่มีเสียชีวิตเพิ่ม
CGTN รายงานว่า แผ่นดินใหญ่จีนตรวจพบผู้ป่วยโควิด-19 (เมื่อ 5 ธ.ค.) ที่ติดเชื้อในท้องถิ่นเพิ่ม 4,988 ราย จากต่างประเทศ 58 ราย
- จำนวนผู้ติดเชื้อใหม่ไม่แสดงอาการ รวม 23,016 ราย
- ผู้ป่วยที่ไม่แสดงอาการที่อยู่ในการดูแลเฝ้าสังเกตการ 371,140 ราย
- รวมจำนวนผู้ป่วยในจีนแผ่นดินใหญ่ 345,529 ราย
- ผู้ป่วยออกจากโรงพยาบาลหลังหายดีรวม 3,913 ราย
- ยอดผู้ป่วยเสียชีวิตยังคงรวมอยู่ที่ 5,235 ราย
จำนวนผู้ป่วยแยกตามพื้นที่
- ฮ่องกง 465,099 ราย (หายแล้ว 100,599 เสียชีวิต 10,826 ราย)
- มาเก๊า 826 ราย (หายแล้ว 791 เสียชีวิต 6 ราย)
- ไต้หวัน 8,379,467 ราย (หายแล้ว 13,742 เสียชีวิต 14,500 ราย)
*กราฟแสดงจำนวนผู้ติดเชื้อไม่แสดงอาการ และ จำนวนผู้ติดเชื่อในท้องถิ่น (ไม่รวมจากต่างประเทศ - CGTN)
7 ธ.ค. จีนรายงานผู้ติดเชื้อเพิ่ม 4,409 ราย ไม่มีเสียชีวิตเพิ่ม
CGTN แผ่นดินใหญ่จีนตรวจพบผู้ป่วยโควิด-19 (เมื่อ 6 ธ.ค.) ที่ติดเชื้อในท้องถิ่นเพิ่ม 4,351 ราย จากต่างประเทศ 58 ราย
- จำนวนผู้ติดเชื้อใหม่ไม่แสดงอาการ รวม 20,912 ราย
- ผู้ป่วยที่ไม่แสดงอาการที่อยู่ในการดูแลเฝ้าสังเกตการ 356,627 ราย
- รวมจำนวนผู้ป่วยในจีนแผ่นดินใหญ่ 349,938 ราย
- ยอดผู้ป่วยเสียชีวิตยังคงรวมอยู่ที่ 5,235 ราย
จำนวนผู้ป่วยแยกตามพื้นที่
- ฮ่องกง 466,509 ราย (หายแล้ว 100,900 เสียชีวิต 10,842 ราย)
- มาเก๊า 827 ราย (หายแล้ว 791 เสียชีวิต 6 ราย)
- ไต้หวัน 8,395,477 ราย (หายแล้ว 13,742 เสียชีวิต 14,522 ราย)
7 ธันวาคม 65 แพลตฟอร์มกัญชาออนไลน์ อินโดนีเซียศึกษาดูงานกัญชา
1. แพลตฟอร์มกัญชาออนไลน์
- นพ.ธงชัย เลิศวิไลรัตนพงศ์อธิบดีกรมการแพทย์แผนไทยฯ ระบุ หลังตนส่งหนังสือแจ้งไปยังแพลตฟอร์มขายของชื่อดังรายหนึ่งตามที่มีการร้องเรียนว่าพบการจำหน่ายช่อดอกกัญชาออนไลน์ เข้าใจว่าทางแพลตฟอร์มได้ดำเนินการแล้ว จำนวนที่เห็นลดลง วันนี้จะประชุมร่วมกันระหว่าง จนท.กรมฯ กับ จนท.ตร. และหน่วยงานที่เกี่ยวข้องว่าจะดำเนินคดีตามกฎหมายอย่างไร และเพื่อให้ จนท.ตร.ได้สื่อสารกับแต่ละ สน.เพื่อให้เข้าใจตรงกัน ส่วนแพลตฟอร์มอื่นๆ ยังไม่พบข้อร้องเรียน ส่วนประกาศสมุนไพรควบคุมยังเห็นภาพไม่ชัดว่าตามอำนาจกรมฯ จะมีออกกฎหมายใดมาควบคุมเพิ่มเติมได้อีกบ้าง การบังคับใช้กฎหมายตาม พ.ร.บ.การสาธารณสุขของกรมอนามัยก็ค่อนข้างเอาไปจับกุมประชาชนได้ยาก ฉะนั้น หากจะมีกฎหมายควรเป็นกฎหมายโดยตรงที่เป็นกฎหมายเฉพาะ
2. อินโดนีเซียศึกษาดูงานกัญชา
- นพ.กิตติ โล่สุวรรณรักษ์ ผอ.สถาบันกัญชาทางการแพทย์ ต้อนรับและให้ข้อมูลสมาชิกรัฐสภาของคณะกรรมาธิการอินโดนีเซียที่มาศึกษาดูงานการทำให้กัญชาถูกต้องตามกฎหมายและมีมาตรการรองรับการใช้ในทางที่ผิด ณ กระทรวงสาธารณสุข โดย นพ.กิตติ ได้ให้ข้อมูลถึงพัฒนาการของข้อกฎหมายกัญชาในประเทศไทย การใช้เพื่อการรักษาพยาบาล และมาตรการป้องกันการนำไปใช้ในทางที่ผิด รวมถึงการติดตามผลกระทบทางสังคมที่เกิดขึ้น
3. ลักลอบนำเข้ากัญชา
- จนท.หน่วยเรือรักษาความสงบเรียบร้อยตามลำแม่น้ำโขง จ.นครพนม จับกุมขบวนการค้ายาเสพติดข้ามชาติลักลอบนำเข้ากัญชาแห้งอัดแท่งจากประเทศเพื่อนบ้านเพื่อนำไปขายในพื้นที่ตอนในของไทยช่วงเทศกาลปีใหม่ จำนวน 18 กระสอบ น้ำหนักรวมไม่ต่ำกว่า 1,000 กก. โดยในช่วงปีใหม่คาดว่าจะมีการทะลักเข้ามาจำนวนมากขึ้น เพราะความไม่ชัดเจนในข้อกฎหมายกัญชาเสรี หากขบวนการค้ากัญชาสามารถลำเลียงพ้นริมฝั่งแม่น้ำโขงได้ก็จะกลายเป็นกัญชาที่ถู
เทศกาลนานาชาติ พลอยและเครื่องประดับจันทบุรี 2023 วันที่ 7 - 11 ธันวาคม 2566
เทศกาลนานาชาติ "พลอยและเครื่องประดับจันทบุรี 2023" 7 - 11 ธันวาคม 2566 ณ ศูนย์ส่งเสริมอัญมณีและเครื่องประดับจันทบุรี, เคพี จิวเวลรี่เซ็นเตอร์, บริเวณตลาดพลอย ถนนศรีจันทร์ ผู้สนใจสามารถติดตามข้อมูลเพิ่มเติมได้ที่ www.git.or.th หรือโทร 02 634 4999 ต่อ 636
Thailand Friendly Design Expo 2023 นวัตกรรมอารยสถาปัตย์และสุขภาพเพื่อคนทั้งมวล LINK
งาน Thailand Friendly Design Expo 2023 มหกรรมอารยสถาปัตย์และนวัตกรรมสุขภาพเพื่อคนทั้งมวล ปี 2566 นี้ จัดเป็นครั้งที่ 7 แล้ว ระหว่างวันที่ 7-10 ธันวาคม 2566 ณ ฮอลล์ EH100-101 ศูนย์นิทรรศการและการประชุมไบเทค-บางนา งานที่จะนำเอานวัตกรรมล้ำหน้าที่เหมาะกับเทรนด์ยุคสมัยของ aging society ที่กำลังใกล้เข้ามาทั้งในประเทศไทยและทั่วโลก The Expo of Technology Innovation Design and Tourism for All
งานอาหารเพื่อคนรักสุขภาพ กินดี ชีวิตดี … แบบมีสมดุล 7-10 ธันวาคม 2566
กลับมาอีกครั้งกับมหกรรมที่รวบรวมอาหารและวัตถุดิบเพื่อคนรักสุขภาพ อัพเดทเทรนด์อาหารยุคใหม่ในคอนเซปต์ กินดี ชีวิตดี…แบบมีสมดุล 7-10 ธันวาคม 2566 รวบรวมสินค้าและบริการเกี่ยวกับอาหาร พร้อมกิจกรรมแบบจัดเต็ม ไม่ว่าจะเป็นโชว์สาธิตการทำอาหารเมนูสุขภาพ พร้อมวัตถุดิบเพื่อสุขภาพที่ขนทัพมาจากร้านค้าภายในงาน การตรวจวัดองค์ประกอบของร่างกาย เช่น การตรวจวิตามิน ค่าดัชนีที่ใช้ชี้วัดความสมดุลของน้ำหนักตัวจากคลินิกที่มีชื่อเสียง และเวิร์คชอปหลากหลายคลาส ครอบคลุมทุกวิถีของการดูแลสุขภาพให้ดีขึ้น ไม่ว่าจะเป็นการตรวจภูมิแพ้อาหารแฝง วิธีลดความอ้วนโดยการควบคุมอาหาร ปรับพฤติกรรมการกินอย่างไรให้ตรงตามความต้องการของร่างกายและโภชนาการสำหรับแต่ละบุคคล
ไนท์รันจันทบุรี ปี 2024 วันแข่ง 7 ธันวาคม 2567 LINK
ไนท์รันจันทบุรี ปี2024 งานวิ่งกลางคืนจันทบุรี “NIGHT COLOR RUN CHANTHABURI 2024” ครั้งที่ 3 ภายใต้แนวความคิด “Canival Chanthaburi” ดินแดนแห่งความสุข จันทบุรีเมืองแห่งสีสัน วันแข่ง 7 ธันวาคม 2567 ระยะแข่งขัน Mini Marathon 10 KM (ชาย - หญิง) / VIP (ชาย - หญิง) นอกจากงานวิ่ง ยังมีกิจกรรมมากมายไม่ว่าจะเป็นกิจกรรมเรืองแสง การเพนท์ตัว เพนท์หน้า จุดเชคอินถ่ายภาพแสงสี กิจกรรมแฮนเมดสีสัน และกิจกรรมสุดชิค เริ่ม 17.00 น.เป็นต้นไป
เดิน-วิ่งการกุศล เขื่อนศรีนครินทร์ 2565 วันอาทิตย์ที่ 18 ธ.ค.65
ครั้งแรกกับการวิ่งบนสันเขื่อนศรีนครินทร์ เดิน-วิ่งการกุศล เขื่อนศรีนครินทร์ 2565 เพื่อนำรายได้จากการจัดกิจกรรมมอบให้ทางโรงพยาบาลท่ากระดาน และโรงพยาบาลศุกร์ศิริศรีสวัสดิ์ เป็นการรณรงค์ส่งเสริมให้ประชาชนและเยาวชน หันมาสนใจต่อการออกกำลังกายด้วยการวิ่ง และเป็นการส่งเสริมการท่องเที่ยวของอำเภอศรีสวัสดิ์ เปิดรับสมัครแล้ววันนี้ 1 ต.ค.เวลา 0.01 น. - 30 พ.ย.2565 เวลา 23.59 น. กำหนดวันวิ่ง : วันอาทิตย์ที่ 18 ธันวาคม 2565 สถานที่ เขื่อนศรีนครินทร์ อำเภอศรีสวัสดิ์ จังหวัดกาญจนบุรี
งานกาชาด ประจำปี สวนลุมพินี 8-18 ธันวาคม 2565
งานกาชาดสวนลุมพินี ปีนี้ 8-18 ธันวาคม 2565 งานกาชาดของกรุงเทพ ที่กลับมาจัดจริงๆ ควบกับแบบออนไลน์ (เว้นไปจัดแบบออนไลน์ 2 ปี) เรียกว่าเป็น Hybrid event ติดตามอัพเดตได้ทางเพจ
facebook.com/redcrossfair/8 ธันวาคม 65 กฎหมายควบคุมกัญชา
1. กฎหมายควบคุมกัญชา
-นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึง การประชุมหารือแนวทางการบังคับใช้กฎหมายที่ควบคุมดูแลสมุนไพรควบคุม (กัญชา) พ.ศ.2565 ได้หารือถึงประกาศ สธ. เรื่องสมุนไพรควบคุม (กัญชา) พ.ศ.2565 ซึ่งบังคับใช้ตั้งแต่วันที่ 24 พ.ย.2565 โดยได้ชี้แจงรายละเอียดของประกาศ เช่น มาตรา 46 บัญญัติห้ามมิให้ผู้ใดศึกษาวิจัยหรือส่งออกสมุนไพรควบคุม หรือจำหน่าย หรือแปรรูปสมุนไพรควบคุมเพื่อการค้า เว้นแต่จะได้รับใบอนุญาตจากผู้อนุญาต ถ้าไม่มีการขออนุญาตถือว่าผิดกฎหมาย โดยห้ามจำหน่ายให้กับผู้ที่มีอายุต่ำกว่า 20 ปี สตรีมีครรภ์หรือสตรีให้นมบุตรห้ามจำหน่ายให้กับนักเรียน นิสิต หรือนักศึกษา ห้ามให้บริการสูบกัญชาในสถานประกอบการทั่วไป ห้ามจำหน่ายเพื่อการค้าผ่านเครื่องจำหน่ายสินค้าอัตโนมัติ เป็นต้น รวมถึงผู้ที่ไม่ได้รับอนุญาตให้ศึกษา วิจัยแปรรูปเพื่อการค้า กรณีผู้ที่ได้รับใบอนุญาตแล้วแต่ไม่ปฏิบัติตามเงื่อนไขในประกาศฉบับใหม่ จะพิจารณาพักใช้หรือเพิกถอนใบอนุญาตแล้วแต่กรณี และหากผู้ที่ถูกพักใช้หรือเพิกถอนใบอนุญาตยังดำเนินการอยู่จะมีโทษตามมาตรา 78 แห่ง พ.ร.บ.คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ.2542 มีโทษจำคุกไม่เกิน 1 ปี ปรับไม่เกิน 20,000 บาท หรือทั้งจำทั้งปรับ
-นายพยุงรัฐ ชาเรืองเดช ประธานกลุ่มวิสาหกิจชุมชนผู้ปลูกไม้ดอกไม้ประดับและพืชสมุนไพรตำบลชุมเห็ด จ.บุรีรัมย์เห็นด้วยกับการออกร่าง พ.ร.บ.กัญชา กัญชง หากมี พ.ร.บ.ออกมาควบคุมดูแล ทั้งการปลูก การจำหน่าย และการใช้แล้วจะเกิดประโยชน์กับทุกฝ่าย เพราะจะได้ปฏิบัติไปในทิศทางเดียวกัน รวมถึงหน่วยงานและเจ้าหน้าที่ที่ก็จะได้เกิดความชัดเจนในแนวทางปฏิบัติ หากมีผู้ฝ่าฝืนกระทำผิด พ.ร.บ.กัญชา กัญชง ที่กำหนดไว้
2. อินโดนีเซียดูงานกัญชา
-สมาชิกรัฐสภาของคณะกรรมาธิการ อินโดนีเซีย ศึกษาดูงานการทำให้กัญชาถูกต้องตามกฎหมาย และมาตรการรองรับการใช้ในทางที่ผิด ณ กระทรวงสาธารณสุข โดยมี นพ.กิตติ โล่สุวรรณรักษ์ ผอ.สถาบันกัญชาทางการแพทย์ ให้การต้อนรับและให้ข้อมูลถึงพัฒนาการของข้อกฎหมายกัญชาในประเทศไทย การใช้เพื่อการรักษาพยาบาล และมาตรการป้องกันการนำไปใช้ในทางที่ผิด รวมถึงการติดตามผลกระทบทางสังคมที่เกิดขึ้น
Coffee and Brew Playground 1 - 3 ธ.ค. และ 8 - 10 ธ.ค. 66
Coffee and Brew Playground 1 - 3 ธ.ค. และ 8 - 10 ธ.ค. 66 ในสถานที่สุดชิลล์ในสไตล์ Camping กับ #ทะเลสาบเมืองทองธานี (IMPACT LAKEFRONT) ในเดือนธันวาคมนี้ ถึง 2 Weekends! 1 - 3 ธ.ค. และ 8 - 10 ธ.ค. 66 ตั้งแต่ 8.00 - 23.00 น. จอดรถฟรี ไม่มีค่าใช้จ่าย สามารถพาสัตว์เลี้ยงมาเที่ยวงานได้ PetFriendly ภายในงานงดจำหน่ายสุราให้แก่เด็กอายุต่ำกว่า 18 ปี และจำหน่ายตามเวลาที่ พรบเครื่องดื่มแอลกอฮอล์ เท่านั้น
CU Pharma RUN FUN FAIR 8 ธันวาคม 2567
CU Pharma RUN FUN FAIR งานวิ่งจัดโดย คณะเภสัชศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย งานใหญ่ ฉลอง 111 ปี ความภูมิใจของชาวเภสัชจุฬา พบกันแน่นอน 8 ธันวาคม 2567
เดิน-วิ่งมหากุศล นครธนมินิมาราธอน ครั้งที่ 14 “วิ่งด้วยความรัก เพื่อสภากาชาดไทย” 8 ธันวาคม 2567 LINK
งาน เดิน-วิ่งมหากุศล นครธนมินิมาราธอน ครั้งที่ 14 “วิ่งด้วยความรัก เพื่อสภากาชาดไทย” RUN FOR CHARITY เงินรายได้ทั้งหมดหลังหักค่าใช้จ่ายมอบสมทบทุนสนับสนุนการดำเนินงานตามภารกิจของสภากาชาดไทย วอร์มร่างกายให้ฟิตแล้วมาวิ่งพร้อมกัน ในวันอาทิตย์ที่ 8 ธันวาคม 2567 ณ โรงพยาบาลนครธน ปล่อยตัวเวลา 05.00 น. รายละเอียดการสมัคร • FUN RUN เดินด้วยความห่วงใย ระยะทาง 3 KM. • MINI MARATHON วิ่งด้วยความรัก ระยะทาง 10.5 KM. • VIP PACKAGE 1 BIB เลือกระยะได้
ธาตุพนมฮาล์ฟมาราธอน ครั้งที่ 3 วันที่ 8 ธันวาคม 2567 LINK
ธาตุพนมฮาล์ฟมาราธอน ครั้งที่ 3 (Thatphanom Half Marathon ) เพื่อโรงพยาบาลสมเด็จพระยุพราชธาตุพนม เชิญชวนนักวิ่งใจบุญทุกท่านร่วมวิ่ง ในวันที่ 8 ธันวาคม 2567 ได้ทั้งบุญได้ทั้งสุขภาพ จุดปล่อยตัว ณ บริเวณหน้าวัดพระธาตุพนมวรมหาวิหาร อำเภอธาตุพนม จังหวัดนครพนม กิจกรรมทั้งหมด มี 3 ระยะ 5 km. 10 km. และ 21 km. [VIP ลงได้ทุกระยะ] สอบถามรายละเอียดเพิ่มเติม โทร. 08-9457-9455, 06-4683-3948 พบปัญหาด้านระบบรับสมัคร โทร.066-052-2596
9 ธันวาคม 65 เคลียร์ใจปมกัญชา - เบรกกัญชาเสรี
1. เคลียร์ใจปมกัญชา
-นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวถึง กรณี ปชป.วิจารณ์นโยบายกัญชาสร้างผลกระทบกับประชาชน ว่า ไม่ได้มีปัญหาอะไรกับ รมช.สธ. เรื่องนี้เป็นงานกระทรวง ไม่ใช่งานพรรค แยกแยะถูก ซึ่งตามคำสั่งมอบหมายงานนายสาธิต ปิตุเตชะ รมช.สธ. กำกับดูแลภารกิจ 5 กรม เมื่อมีเรื่องกัญชา นายสาธิตที่ดูแลกรมการแพทย์แผนไทยจะเป็นผู้ดูแลกำกับเรื่องการใช้กัญชาให้เป็นไปตามประกาศกระทรวง ไม่ถือว่าเป็นการโยนไฟเข้าบ้าน ปชป. เพราะเป็นเรื่องของภาระงานในสธ. ด้านนายสาธิต กล่าวชี้แจงว่า ได้มีการพูดคุยกับนายอนุทินเรียบร้อยแล้ว ไม่ได้ผิดใจอะไรกัน ส่วนเรื่องการดูแลกรมการแพทย์แผนไทยฯ ได้เชิญ นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ เข้าหารือถึงอำนาจหน้าที่ตามกฎหมาย รวมถึงการควบคุมการจำหน่าย การใช้ช่อดอกกัญชาไม่ให้เข้าถึงกลุ่มเปราะบาง เรื่องนี้ต้องศึกษากฎหมายให้ชัดเจนทั้งนี้ การแสดงความเห็นต่างในเรื่องนโยบายเป็นสิทธิของพรรคการเมือง สิทธิของสมาชิกสภาผู้แทนราษฎรแต่ละคน ตนในฐานะรมช.สธ. ก็ต้องช่วยแก้ ถ้ากฎหมายชัดเจนถึงลงมือทำได้
2. เบรกกัญชาเสรี
- ที่รัฐสภา ส.ส.พรรคประชาธิปัตย์ นำโดย นพ.บัญญัติ เจตนจันทร์ ส.ส.ระยอง, นายประกอบ รัตนพันธ์ ส.ส.นครศรีธรรมราช, น.ส.พิมพ์รพี พันธุ์วิชาติกุล ส.ส.บัญชีรายชื่อ และนายพิสิฐ ลี้อาธรรม ส.ส.บัญชีรายชื่อ ร่วมกันแถลงถึงการใช้กัญชาที่มีผลกระทบต่อเด็กและเยาวชน หลังจากการปลดล็อกกัญชาออกจากบัญชียาเสพติดให้โทษประเภท 5 มา 6 เดือน พบมีเด็กและเยาวชนได้รับผลกระทบจากสารเสพติดที่อยู่ในกัญชาเพิ่มมากขึ้น พร้อมเรียกร้องให้นายกฯ และรัฐบาลนำกัญชากลับเข้าไปบรรจุในบัญชียาเสพติดอีกครั้ง
-น.ส.ศิริภา อินทวิเชียร รองโฆษกพรรค ปชป. กล่าวว่า พรรคปชป.มีความชัดเจนต่อจุดยืนการสนับสนุนกัญชาเพื่อการแพทย์และเศรษฐกิจเพื่อการแพทย์ แต่ไม่สนับสนุนการใช้กัญชาเพื่อสันทนาการและกัญชาเสรี มาโดยตลอด ดังนั้นจำเป็นที่ทุกพรรคการเมืองต้องตระหนัก และต้องทบทวนนโยบายกัญชาให้เป็นไปตามจุดยืนเท่านั้น
9 ธ.ค. นักระบาดวิทยาจีน เร่งให้มีการฉีดวัคซีนกระตุ้นในกลุ่มเสี่ยง
จงหนานซาน นักระบาดวิทยาชั้นนำของจีน กระตุ้นเตือนการเร่งฉีดวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) โดยเฉพาะกลุ่มผู้สูงอายุและกลุ่มเสี่ยงอื่นๆจงเข้าร่วมการประชุมประจำปีของสมาคมทรวงอกแห่งชาติจีนผ่านระบบวิดีโอ และกล่าวว่าการเร่งฉีดวัคซีนเป็นหนึ่งในขั้นตอนสำคัญของการป้องกันและควบคุมโรคโควิด-19 พร้อมเรียกร้องการฉีดวัคซีนปกป้องบุคลากรการแพทย์ที่ดียิ่งขึ้น
วัคซีนป้องกันโรคโควิด-19 ของจีนได้รับการพิสูจน์แล้วว่ามีประสิทธิภาพสูงในการลดอัตราการเสียชีวิต โดยความเสี่ยงเสียชีวิตของผู้ป่วยอายุ 60 ปีขึ้นไป ซึ่งฉีดวัคซีนโดสกระตุ้นแล้วในการระบาดในนครเซี่ยงไฮ้เมื่อช่วงครึ่งแรกของปีนี้ลดลงร้อยละ 98
จงกล่าวว่ายุทธศาสตร์การป้องกันและควบคุมโรคโควิด-19 ของจีนประสบผลลัพธ์ยอดเยี่ยมและได้รับการยอมรับจากทั่วโลก
โดยการวิจัยพบว่าเชื้อไวรัสฯ ชนิดกลายพันธุ์ สายพันธุ์โอไมครอน ยังคงสามารถแพร่เชื้อเพิ่มขึ้น แต่มีอัตราการเสียชีวิตลดลงต่อเนื่อง "การติดเชื้อไวรัสฯ ชนิดกลายพันธุ์ สายพันธุ์โอไมครอน อาทิ สายพันธุ์ย่อยบีเอ.5 (BA.5) และบีเอฟ.7 (BF.7) นั้นไม่มีอะไรน่ากลัว โดยผู้ติดเชื้อส่วนใหญ่สามารถฟื้นตัวอย่างสมบูรณ์ได้ภายใน 7-10 วัน" จงกล่าว (
ซินหัวไทย)
จิม ทอมป์สัน ฟาร์ม 2566 - 9 ธันวาคม 2566 - 2 มกราคม 2567
เทศกาลเที่ยว “จิม ทอมป์สัน ฟาร์ม” ปีนี้จะจัดขึ้นวันที่ 9 ธันวาคม 2566 - 2 มกราคม 2567 ณ จิม ทอมป์สัน ฟาร์ม อำเภอปักธงชัย จังหวัดนครราชสีมา มาในแนวคิด "ไอเขียนเลตเตอร์ถึงเธอฟาร์มจิม’" สะท้อนภาพยุคสงครามเย็นในดินแดนอีสาน สะท้อนนัยวิถีชีวิตคนที่ราบสูงในรูปแบบที่คึกคักและม่วนซื่น คละเคล้าไปกับนิทรรศการน่าสนใจอีกหลายขนาน ได้แก่ นิทรรศการหมอลำ คอนเสิร์ตจากศิลปินหมอลำร่วมสมัย นิทรรศการอเมริกัน-อีสาน นิทรรศการหม่อนไหม เวิร์กช็อปที่คนชอบงานแฮนด์คราฟต์จะต้องถูกใจ นิทรรศการข้าว หลากสายพันธุ์ กิจกรรมเกี่ยวกับวัฒนธรรมและความเชื่อของชาวอีสาน รวมถึงเวทีทอล์กจากวิทยากรที่มีให้ฟังตลอดงาน 9 ธันวาคม 2566 - 2 มกราคม 2567 ไปชมและตื่นตาตื่นใจกัน - จำหน่ายบัตรรอบ Early Bird ราคาพิเศษแล้ววันนี้ - 8 ธันวาคม 2566 ราคาบัตรเริ่มต้นต่อคน เด็กและผู้สูงอายุ 90 บาท / ผู้ใหญ่ จ.-ศ. 150 บาท และ ส.-อา. 200 บาท
2. การเล่นพนัน ปี 2564 คนไทยเล่นการพนันเพิ่มขึ้น
เกี่ยวกับคนไทยเล่นพนัน มีข้อสังเกตน่าสนใจ อาทิ
• คนไทยเกินครึ่งประเทศเล่นพนัน (59.6%) ที่จำนวน 32 ล้านคน
เพิ่มจากปีก่อน 1.9 ล้านคน (6.3%) นับว่าเพิ่มเร็วและมาก (เกิน 5% ของคนไทย)
• ในจำนวนนี้เป็นนักพนันหน้าใหม่ เพิ่งเริ่มเล่นครั้งแรก 795,000 คน เพิ่ม 10.5% เทียบกับปี 62 ที่มีจำนวน 7.2 แสนคน
• เด็กและเยาวชน 15-25 ปี เล่นพนัน 4.326 ล้านคน เพิ่มจากปี 62 5.42 แสนคน (เกิน 10% ทีเดียว)
• อนุมาณได้ว่า นักพนันหน้าใหม่ที่เพิ่มขึ้น (7.2 แสนคน) ส่วนใหญ่เป็นเยาวชนทั้งสิ้น (5.42 แสนคน) เกือบ 80% ทีเดียว
• มากกว่าคนสูงอายุ 60 ปีขึ้นไป อีก (มีเพียง 4.048 ล้านคน)
• ผู้หญิง เล่นพนันมากกว่าชาย เกือบ 3 แสนคน ต่างจากปี 62 ที่ชายมากกว่าหญิง (ชาย 15.242 ล้านคน หญิง 15.179 ล้านคน)
• คนสูงอายุเกิน 60 ปี มีจำนวน 4.048 ล้านคน เพิ่มขึ้น 6.91 แสนคน ราว 15%
• ภาคอีสาน เล่นพนันมากสุด 11 ล้านคน ทิ้งห่างภาคอื่นๆและกทม.เกินครึ่ง และการเพิ่มจำนวนก็มากกว่าภาคอื่นๆ เช่นกัน
• ประเภทการพนัน อันดับ 1) ล็อตเตอรี่รัฐบาล 2) หวยใต้ดิน 3) พนันไพ่ บาคาร่า ป๊อกเด้ง 4) ทายผลบอล 5) ไฮโล/โปปั่น/น้ำเต้าปูปลา
• ที่เพิ่มขึ้นแรงมาก คือ หวยต่างประเทศ ที่เพิ่มขึ้นกว่า 1000% จากคนเล่นเพียง 78,578 คนในปี 62 กระโดดไปถึง 890,337 คนปี 64 (เพิ่ม 811,759 คน)
• ประเภทพนันที่ลดลง คือ หวยหุ้น และพนันมวยหรือมวยตู้ ซึ่งลดลงมากสุดกว่า 7.84 แสนราย *อาจเป็นเพราะโควิดจึงสั่งปิดสนามมวย/ไม่มีการถ่ายทอดการแข่งขันชกมวย
• กลุ่มเสี่ยง 3 กลุ่ม - เด็ก 15-18 เยาวชน 19-25 สูงอายุ 60 ปีขึ้นไป เล่นพนันมากขึ้นทุกกลุ่ม โดยกลุ่มเยาวชนครองสัดส่วนสูงสุด เพิ่มจำนวนขึ้นมากที่สุด และวงเงินหมุนเวียนมากสุดเช่นกัน
• วงเงินหมุนเวียนพนันเฉพาะใน 3 กลุ่มเสี่ยง รวมกันกว่า 167,956 ล้านบาท มากกว่าปี 62 ที่มีเพียง 126,209 ล้านบาท เพิ่มขึ้น 25%
• 3 อันดับ ยอดนิยม ได้แก่สลากกินแบ่ง หวยใต้ดิน และพนันไพ่
ตัวอย่างราคา ต้นสด ต้นแห้ง เส้นใย แกน บ.เฮมพ์ไทย
งานฉลอง 110 ปีสมาคมฝรั่งเศสในไทย Celebrating 110th anniversary
งานฉลอง 110 ปีสมาคมฝรั่งเศสในไทย Celebrating 110th anniversary ปีนี้สมาคมประกาศชัด จัดงานใหญ่สุดของปีนี้กันเลย ฝรั่งเศสเตรียมของขวัญมาขอบคุณความสัมพันธ์ดีงามแด่ชาวไทย ชาวฝรั่งเศสและชาวโลกด้วย จัดที่สมาคมฝรั่งเศส วันเสาร์ที่ 10 ธันวาคม 65 ถนนวิทยุ เริ่ม 11 โมงเป็นต้นไป รายละเอียดงาน เฝ้ารอการประกาศจากสมาคมนะ
www.facebook.com/AllianceFrancaiseBangkok10 ธันวาคม 65 ร่าง พ.ร.บ.กัญชาฯ
ร่าง พ.ร.บ.กัญชาฯ
- นายสฤษฏ์พงษ์ เกี่ยวข้อง ส.ส.กระบี่ และนายวิรัช พันธุมะผล ส.ส.บัญชีรายชื่อ พรรคภูมิใจไทย แถลงกรณีร่าง พ.ร.บ. กัญชง กัญชา (ฉบับที่.) พ.ศ… ว่า มีข่าวปรากฏว่านายเฉลิมชัย ศรีอ่อน เลขาธิการพรรคประชาธิปัตย์ ในฐานะ รมว.เกษตรฯ ระบุว่าปักหมุดกัญชา กัญชง กระท่อม ชิงตลาด 8 แสนล้านบาท โดยได้พูดตั้งแต่วันที่ 5 พ.ค. 64 ซึ่งคนที่มาแถลงข่าวไม่ทราบ ว่ารู้จักนายเฉลิมชัยหรือไม่ และดร.สาธิต ปิตุเตชะ รมช.สธ. ก็ได้รับมอบหมายจากนายอนุทิน ชาญวีรกูล รองนายกฯ และ รมว.สธ. ให้กำกับดูแลเรื่องกรมแพทย์แผนไทยฯ ด้วย และ ดร.สาธิต ก็ได้มอบนโยบายสร้างศักยภาพห้องแลบทดลอง สารสำคัญในกัญชา กัญชง กระท่อม ซึ่งการลงทุนเช่นนี้ผู้บริหารพรรค ปชป. ที่เป็นรัฐมนตรีฃวางแผนเรื่องนี้มาเยอะแล้ว แต่ สมาชิกพรรคที่มาแถลงข่าวที่เห็นต่างเช่นนี้ พรรคร่วมรัฐบาลและประชาชนจึงเกิดความสับสน
- น.ส.ศิริภา อินทวิเชียร รองโฆษกพรรคประชาธิปัตย์ กล่าวว่า พรรคมีจุดยืนการสนับสนุนกัญชาเพื่อการแพทย์และ เศรษฐกิจเพื่อการแพทย์ แต่ไม่สนับสนุนการใช้กัญชาเพื่อสันทนาการและกัญชาเสรีมาโดยตลอด วันนี้เห็นทั้งบาร์และคาเฟ่ กัญชา ให้บริการผลิตภัณฑ์กัญชาและช่อดอกกัญชาเพื่อใช้สูบและเสพกันทั่วประเทศ แม้จะมีประกาศ สธ. แต่เยาวชนของยังสามารถเข้าถึงช่อดอกกัญชาในท้องตลาดได้ ส่งผลเสียต่อสุขภาพและพัฒนาการระยะยาว ดังนั้นต้องทบทวนนโยบายกัญชาให้ เป็นกัญชาเพื่อการแพทย์ และเศรษฐกิจเพื่อการแพทย์เท่านั้นมาตรการ “ช้อปดีมีคืน ปี 2566” LINK
มาตรการ “ช้อปดีมีคืน ปี 2566”
มีวัตถุประสงค์เพื่อรักษาการบริโภคในประเทศ สนับสนุนผู้ประกอบการที่อยู่ในระบบภาษี รวมถึงส่งเสริมการผลิตสินค้าท้องถิ่นและการอ่าน อีกทั้งส่งเสริมให้ผู้ประกอบการเข้าสู่ระบบภาษีและการใช้ระบบภาษีอิเล็กทรอนิกส์ โดยกำหนดให้ผู้มีเงินได้ซึ่งมีหน้าที่เสียภาษีเงินได้บุคคลธรรมดาแต่ไม่รวมถึงห้างหุ้นส่วนสามัญหรือคณะบุคคลที่มิใช่นิติบุคคล หักลดหย่อนค่าซื้อสินค้าหรือค่าบริการเท่าที่ได้จ่ายเป็นค่าซื้อสินค้าหรือค่าบริการสำหรับการซื้อสินค้าหรือการรับบริการในราชอาณาจักรให้กับผู้ประกอบการจดทะเบียนภาษีมูลค่าเพิ่ม รวมถึงค่าซื้อหนังสือและค่าบริการหนังสือที่อยู่ในรูปของข้อมูลอิเล็กทรอนิกส์ผ่านระบบอินเทอร์เน็ต และค่าซื้อสินค้าหนึ่งตำบลหนึ่งผลิตภัณฑ์ซึ่งเป็นสินค้าที่ได้ลงทะเบียนกับกรมการพัฒนาชุมชนแล้ว ตั้งแต่วันที่ 1 มกราคม ถึงวันที่ 15 กุมภาพันธ์ 2566 ตามจำนวนที่จ่ายจริงแต่ไม่เกิน 40,000 บาท โดยแบ่งเป็น
- ค่าซื้อสินค้าหรือค่าบริการ จำนวนไม่เกิน 30,000 บาท จะต้องมีใบกำกับภาษีเต็มรูปในรูปแบบกระดาษหรือใบกำกับภาษีเต็มรูปในรูปแบบอิเล็กทรอนิกส์ผ่านระบบใบกำกับภาษีอิเล็กทรอนิกส์และใบรับอิเล็กทรอนิกส์ (e-Tax Invoice & e-Receipt) ของกรมสรรพากร และ
- ค่าซื้อสินค้าหรือค่าบริการ จำนวนไม่เกิน 10,000 บาท จากส่วนที่เกิน (1) จะต้องมีใบกำกับภาษีเต็มรูปในรูปแบบอิเล็กทรอนิกส์ผ่านระบบ e-Tax Invoice & e-Receipt ของกรมสรรพากรเท่านั้น
ทั้งนี้ ไม่รวมถึงค่าสินค้าและบริการบางชนิด ได้แก่ ค่าซื้อสุรา เบียร์ และไวน์ ค่าซื้อยาสูบ ค่าซื้อรถยนต์ รถจักรยานยนต์ และเรือ ค่าซื้อหนังสือพิมพ์และนิตยสาร ค่าบริการจัดนำเที่ยว ค่าที่พักในโรงแรม ค่าสาธารณูปโภค ค่าน้ำประปา ค่าไฟฟ้า ค่าบริการสัญญาณโทรศัพท์ ค่าบริการสัญญาณอินเทอร์เน็ต และค่าบริการสำหรับบริการที่มีข้อตกลงการให้บริการระยะยาว (ซึ่งเริ่มต้นก่อนวันที่ 1 มกราคม 2566 หรือสิ้นสุดหลังวันที่ 15 กุมภาพันธ์ 2566 แม้จะจ่ายค่าบริการในช่วงระยะเวลามาตรการ) และค่าเบี้ยประกันวินาศภัย โดยหลักเกณฑ์ วิธีการ และเงื่อนไขอื่น ๆ เป็นไปตามที่อธิบดีกรมสรรพากรประกาศกำหนด
3. การกำหนดค่าจ้างโดยกลไกตลาด
ส่วนใหญ่จะเกิดขึ้นในกรณีที่เป็นกลุ่มแรงงานที่มีทักษะระดับกลางขึ้นไป ที่ค่าจ้างถูกกำหนดจากการต่อรองกับนายจ้างหรือสถานประกอบการเองโดยระดับค่าจ้างแตกต่างไปตามสาขาวิชาชีพ/อุตสาหกรรม ขนาดของสถานประกอบการ และพื้นที่
เดือนกันยายน 2566 : คอนเซ็ปต์นั่งรถไฟอิ่มบุญ ปันรอยยิ้ม เที่ยวกันทั้งทีต้องดีต่อใจ
เดือนกันยายน 2566 : คอนเซ็ปต์นั่งรถไฟอิ่มบุญ ปันรอยยิ้ม เที่ยวกันทั้งทีต้องดีต่อใจ การรถไฟฯ ชวนเที่ยวทำบุญและแบ่งปันรอยยิ้มให้กับน้อง ๆ ตามแบบฉบับคนอิ่มบุญ
วัดกระทุ่มเสือปลา เตาเผาสัตว์ Petfuneral
เตาเผาสัตว์ Petfuneral สาขา วัดกระทุ่มเสือปลา 6/5 ซอย อ่อนนุช 67 แขวงประเวศ เขต ประเวศ กรุงเทพมหานคร 10250 โทรศัพท์ 098-4493992สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์ ระหว่างวันที่ 10- 16 ธ.ค. 2566
สถานการณ์ผู้ติดเชื้อโควิด 19 รายสัปดาห์
ระหว่างวันที่ 10- 16 ธ.ค. 2566
ผู้ป่วยรักษาตัวในโรงพยาบาล (รายสัปดาห์)
จำนวน 514 ราย : เฉลี่ยรายวัน 73 ราย/วัน
ผู้เสียชีวิต (รายสัปดาห์)
จำนวน 6 ราย : เฉลี่ยรายวัน 1 ราย/วัน
---------------------
ผู้ป่วยสะสม 37,308 ราย (ตั้งแต่ 1 ม.ค. 2566)
เสียชีวิตสะสม 837 ราย (ตั้งแต่ 1 ม.ค. 2566)
---------------------
ผู้ป่วยปอดอักเสบ 114 ราย
ผู้ป่วยใส่ท่อช่วยหายใจ 58 ราย
คลินิกสัตว์ด๊อกเตอร์จุฬา (Dr. Chula's Animal Clinic)
คลินิกสัตว์ด๊อกเตอร์จุฬา Dr. Chula’s Animal Clinic เปิดบริการทุกวัน 11.00 - 21.00 น. บริการ - รักษาโรคทั่วไป วัคซีน เห็บหมัด ผ่าตัด ทำหมัน ขูดหินปูน ถอนฟัน ตรวจเลือด อุลตร้าซาวด์ ultrasound เอ๊กซเรย์ดิจิตอล digital x-ray และบริการนอกสถานที่ -โทร 02-215-1272, 094-545-9494
Facebook |
@healthserv.net เราอาจออกแบบวงจรยีนทำให้เซลล์ตรวจสอบสารแปลกปลอม เช่น miRNA, ชิ้นส่วนที่มีความจำเพาะกับเนื้องอก, biomarker ต่าง ๆ ไม่ว่าจะเป็น โปรตีน เพปไทด์ สารเมแทบอไลต์ และทำให้เซลล์ตอบสนองหรือมีฟังก์ชันในลักษณะต่าง ๆ เช่น เมื่อเซลล์เจอเนื้องอกแล้วทำให้เซลล์ตายไปพร้อมกับเนื้องอก ทำให้ยาออกฤทธิ์จำเพาะที่ หรือทำให้เกิดการปล่อยสารบางอย่างเพื่อกระตุ้นระบบภูมิคุ้มกัน
ตัวอย่างงานวิจัย เช่น ปี 2017 มีนักวิจัยทำให้แบคทีเรีย E. coli บ่งชี้ภาวะอักเสบในลำไส้หนูได้สำเร็จ โดยสร้างวงจรยีนของ E. coli ทำให้ตรวจหาตัวบ่งชี้ภาวะอักเสบในลำไส้คือ สารเตตระไทโอเนต (tetrathionate) จากนั้นก็ทำให้สีอุจจาระเปลี่ยนไป ซึ่งสังเกตเห็นได้ด้วยตาเปล่า แบคทีเรียนี้อาศัยและออกฤทธิ์ในลำไส้หนูได้นาน 6 เดือน จึงใช้บ่งชี้ภาวะการอักเสบในระยะยาวได้ ที่ล้ำไปกว่านั้นได้มีการวิศวกรรมแบคทีเรีย E. coli ทำให้ใช้ตรวจหาตัวบ่งชี้ภาวะเลือดไหลในลำไส้หมู โดยแบคทีเรียดังกล่าวจะเปล่งแสงเมื่อมีเลือดไหลในลำไส้ ในการทดสอบมีการบรรจุ E. coli นี้ในไมโครแคปซูล (microcapsule) พร้อมกับมีชิป (chip) ที่สามารถใช้ตรวจวัดแสงดังกล่าว สัญญาณบ่งชี้ที่ตรวจวัดได้ทำให้เกษตรกรทราบว่าหมูตัวไหนป่วย จึงนำไปรักษาได้ทันการ
ผู้ป่วยมีอัตรารอดชีวิตจากการปลูกถ่ายหัวใจมากถึง 85-90% - พญ. ปิยฉัตร พิพัฒนพงศ์โสภณ
พญ. ปิยฉัตร พิพัฒนพงศ์โสภณ แพทย์เฉพาะทางด้านอายุรศาสตร์โรคหัวใจ - หัวใจล้มเหลว โรงพยาบาลบำรุงราษฎร์ กล่าวถึงผู้ป่วยที่มีภาวะหัวใจล้มเหลวขั้นสุดท้ายมักเผชิญกับความท้าทายในการใช้ชีวิตประจำวัน หัวใจที่อ่อนล้าไม่สามารถสูบฉีดเลือดไปเลี้ยงร่างกายได้อย่างเพียงพอ ทำให้เหนื่อยง่าย หายใจลำบาก นอนราบไม่ได้ ส่งผลให้คุณภาพชีวิตแย่ลง และมีความเสี่ยงต่อการเสียชีวิตสูงถึง 10% ต่อปี ‘การปลูกถ่ายหัวใจ’ จึงเป็นการรักษาขั้นสูงสุดที่ช่วยยืดอายุและเพิ่มคุณภาพชีวิตให้กับผู้ป่วย ปัจจุบันการผ่าตัดเปลี่ยนหัวใจถือว่าประสบความสำเร็จสูง จากสถิติผู้ป่วยมีอัตรารอดชีวิตมากถึง 85-90% ซึ่งหากผู้ป่วยไม่ได้รับการผ่าตัดปลูกถ่ายหัวใจในช่วงเวลาที่เหมาะสม ส่วนใหญ่อาจเสียชีวิตภายในระยะเวลาเพียง 1-2 ปี
CIMB THAI Triathlon for ASEAN DAY ปีที่ 2 วันที่ 11 ธ.ค.65 LINK
ฟิตร่างกายให้พร้อม ซ้อมให้เต็มที่ เพื่อร่วมเป็นส่วนหนึ่งกับการฉลองวันอาเซียนกับ ธนาคาร ซีไอเอ็มบี ไทย กับการแข่งขันที่นักไตรกีฬาไม่ควรพลาด CIMB THAI Triathlon for ASEAN DAY ปีที่ 2 การแข่งขันที่เปิดโอกาสให้ทุกคนก้าวข้ามขีดจำกัด เชื่อมั่นพลังในตัวคุณ เลือกระยะที่ใช่ Adventure Dash, Sprint, Standard และ Duathlon แล้วไประเบิดพลังพร้อมกันในวันที่ 4 สิงหาคม 2562 ณ พัฒนากอล์ฟคลับแอนด์รีสอร์ท อ.ศรีราชา จ.ชลบุรี
Bangkok Midnight Marathon อาทิตย์ที่ 11 ธ.ค.65 ที่สนามหลวง LINK
"บรรยากาศสุดคลาสสิก บนเส้นทางวิ่งยามราตรีแห่งพระนคร" ที่งาน Umay+ Bangkok Midnight Marathon 2022 เส้นทางวิ่ง ทั้งระยะ 10 KM และ 21.1 KM ที่มีจุดเริ่มต้นบนพื้นที่ประวัติศาสตร์แห่งเกาะรัตนโกสินทร์อย่างสนามหลวง ถนนราชดำเนินใน ถนนราชดำเนินกลาง ถนนราชดำเนินนอก และถนนศรีอยุธยา ท่ามกลางบรรยากาศสุดคลาสสิกพร้อมไฟประดับประดาอันสวยงามตลอดสองข้างทาง
11 ธันวาคม 65 สนธิกำลังจับกัญชาถนนข้าวสาร
สนธิกำลังจับกัญชาถนนข้าวสาร
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและแพทย์ทางเลือก เผยว่า เมื่อคืนวันที่ 9 ธ.ค.ที่ผ่านมา กรมการแพทย์แผนไทยฯ พร้อมด้วย จนท.ตำรวจ สน.ชนะสงคราม และเจ้าหน้าที่ที่เกี่ยวข้อง ลงพื้นที่ถนนข้าวสาร เขตพระนคร พบผู้กระทำผิดประกาศกระทรวงสาธารณสุข สมุนไพรควบคุม (กัญชา) พ.ศ. 2565 จำนวน 6 ราย โดย
- 2 ราย เป็นหาบเร่แผงลอย ขายกัญชาแปรรูปพันลำและจำหน่ายช่อดอก โดยไม่ได้รับอนุญาต
- รายที่ 3 และ 4 ใช้ใบอนุญาตผิดสถานที่ที่ได้รับอนุญาต
- รายที่ 5 ผิดเงื่อนไขเพราะจัดให้มีสถานที่สูบในร้าน ต้องรอคำสั่งทางปกครอง พิจารณาแจ้งให้หยุดกิจการ
- รายที่ 6 ผิดเงื่อนไข ที่จัดห้องสูบในร้านฯ และใบอนุญาตระบุที่ประกอบกิจการไม่ตรงกับสถานที่ที่จำหน่ายจึงสั่งปิดกิจการ พร้อมเร่งตรวจสอบ ข้อมูลใบอนุญาตกับสถานที่แจ้ง
และนำตัวทั้งหมดส่งพนักงานสอบสวน สน.ชนะสงคราม ดำเนินการต่อไป
นัดรวมตัว 14 ธ.ค. จี้สภาฯ ผ่านร่าง พรบ.กัญชา
- รศ.ดร.พิพัฒน์นนทนาธรณ์ นายกสมาคมนักวิจัยฯ จากกรณีที่มีข่าวเรื่องเด็กและเยาวชนใช้กัญชา ทำให้หลายฝ่าย รวมถึงนักการเมืองออกมาวิพากษ์วิจารณ์จึงเห็นสมควรว่าจะต้องเร่งออกกฎหมายควบคุมการใช้กัญชาคือ พ.ร.บ.กัญชา กัญชง พ.ศ....ที่จะเสนอเข้าสู่การพิจารณาของสภาผู้แทนราษฎร ทั้งนี้ จะนัดรวมตัว 14 ธ.ค.นี้ เพื่อเร่งให้รัฐสภาผ่านร่าง พ.ร.บ. วอน นักการเมืองอย่านำมาใช้เป็นเครื่องมือทำลายกัน
12 ธันวาคม 65 แอบอ้างแพทย์แผนไทยขายกัญชาผิดกฎหมาย
แอบอ้างแพทย์แผนไทยขายกัญชาผิดกฎหมาย
- สภาการแพทย์แผนไทย ได้ส่งข้อความแจ้งเตือนผ่านบัญชีไลน์ทางการ thaimedcare (ไทยเมดแคร์) เตือนภัย ประชาชน เนื่องจากได้รับเรื่องร้องเรียนจำนวนมากถึงการจำหน่ายกัญชาโดยแอบอ้างว่าใช้ในทางการแพทย์แผนไทย แต่ผู้ จำหน่ายมิได้มีใบอนุญาตหรือปฏิบัติตามข้อบังคับของสภาการแพทย์แผนไทยแต่อย่างใด ทั้งนี้หากตรวจสอบพบจะมีความผิด 13 ธันวาคม 65 นัดรวมตัวเครือข่ายหนุนกัญชา
1. นัดรวมตัวเครือข่ายหนุนกัญชา
- วันที่ 14 ธ.ค.65 เครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทย นัดรวมตัวกันที่หน้ารัฐสภาเพื่อ แสดงเจตนารมณ์ให้สภาพิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... ในวาระที่ 2 ต่อไป ทั้งนี้หากมีการคว่ำหรือตีรวน พ.ร.บ. ประชาชนทั่วประเทศจะให้บทเรียนในการเลือกตั้งครั้งหน้าที่กำลังจะมาถึงในอีกไม่นาน นายสนธยา แซ่โย้ (หลวงสน) หมอยาเกาะพะงันที่รักษาคนไข้ด้วยกัญชาให้หายนับหมื่นรายมานานกว่า 3 ปีกล่าวว่า ส่วนตัวไม่เห็นด้วยกับกัญชาเสรี จึงจำเป็นต้องมีกฎหมายมาควบคุม แต่การตีรวนของฝ่ายคัดค้านที่จะคว่ำร่าง พ.ร.บ. มีการ เบี่ยงเบนประเด็นเลือกใช้วาทกรรมที่ตัวเองได้ประโยชน์ในทางการเมือง ตนไม่ปฏิเสธว่ากัญชามีโทษ แต่ต้องดูถึงต้นตอกัญชา ว่าเป็นชนิดไหน มีที่มาอย่างไร นายณรงค์ฤทธิ์ เกษสุวรรณ (ลุงหีตปอย) หมอยาเกาะพะงัน เผยกัญชาอยู่คู่กับเกาะพะงันมานานมาก ใช้จนเป็นวิถีทั้งการ สูบ ช่วยเรื่องหอบหืด ลดความเครียด ที่ใช้สืบต่อกันมาและเขียนตำราไว้
2. นโยบายกัญชาเสรี
- ดร.สาธิต ปิตุเตชะ รมช.สธ. เผยได้หารือร่วมกับอธิบดีกรมการแพทย์แผนไทยฯ เพื่อหาแนวทางในการบังคับใช้กฎหมาย ควบคุม ป้องกันการใช้กัญชาในทางที่ผิดว่า ในระหว่างที่กฎหมายใหม่ หรือ พ.ร.บ.กัญชา กัญชงฯ ยังไม่ออก ก็กำชับให้ เคร่งครัดเรื่องการปฏิบัติตามกฎหมายเท่าที่มีอยู่ ในส่วนผู้ปฏิบัติอาจยังไม่มีความกล้าจะบังคับใช้ จึงให้อธิบดีกรมการแพทย์ แผนไทยฯ ทำเป็นตัวอย่างและลงพื้นที่ตรวจ เช่น ถนนข้าวสาร เป็นไปตามประกาศ สธ. เรื่อง การควบคุมสมุนไพร (กัญชา) พ.ศ.2565 ทั้งนี้ ในฐานะคนกลางมีจุดยืนต่างกันมาก จะบังคับใช้กฎหมายที่มีอยู่ในมือตอนนี้ให้เข้มที่สุด กำลังจะร่างหนังสือ เพื่อเชิญผู้แทนจากฝ่ายกระบวนการยุติธรรมทั้งหมด มาหารือทำความเข้าใจและตีความสู่การบังคับใช้ให้มากที่สุด
- นายสาทิตย์ วงศ์หนองเตย ส.ส.พรรคประชาธิปัตย์ โพสต์ตั้งคำถามถึงนโยบายกัญชาเสรีอีกครั้ง หลังในเทศกาลดนตรี Big Mountain Music Festival ที่เขาใหญ่ จ.นครราชสีมา มีการขายกัญชาเพื่อสันทนาการว่าอย่าโทษว่าไม่มีกฎหมาย
- ร.ต.อ.เฉลิม อยู่บำรุง โพสต์ว่า ปัจจุบันพรรคการเมืองคึกคัก ออกนโยบายไม่เว้นแต่ละชั่วโมง บางพรรคต้องการคะแนน นิยม คิดได้แม้กระทั่งให้กัญชาพ้นจากวงจรยาเสพติด ยืนยันว่ากัญชายังต้องเป็นยาเสพติด
- นายราเมศ รัตนเชวง โฆษกพรรค ปชป. เผย พรรค ภท.อย่าด้อยค่าพรรคอื่น เด็กสูบกัญชาทั่วบ้านทั่วเมือง ทำใจบอด มองไม่เห็น ตอนนี้ทุกคนห่วงอนาคตของลูกหลาน ที่จะต้องสูญสิ้นอนาคตไปกับนโยบายกัญชาเสรีมากกว่า
3. ลักลอบขนกัญชา
- จนท.นรข.เขตนครพนม จับกุมนายพัชรพล อ่อนเงิน และนายวรัท แซ่ตอง พร้อมของกลางกัญชาอัดแท่ง 257 แท่ง น้ำหนัก 257 กก. หลังสืบทราบว่าจะมีการลักลอบขนกัญชามาจากประเทศเพื่อนบ้านเข้ามาในพื้นที่ริมฝั่งแม่น้ำโขง ต.น้ำก่ำ เบื้องต้นผู้ต้องหารับสารภาพว่ารับจ้างจากนายทุนได้เงินครั้งละ 1 หมื่นบาท จนท.เตรียมสอบสวนขยายผลเพื่อดำเนินคดีต่อไป
บทความกัญชา
- ร่าง พ.ร.บ.กัญชา ทำให้พรรค ภท.-ปชป. ต้องบาดหมางกันอย่างรุนแรง ประเมินว่า ร่าง พ.ร.บ.ฯ มีโอกาสออกได้ 5 ทาง 1) ที่ประชุมสภาฯ มีมติให้เลื่อนการพิจารณาออกไป 2) สภาฯ ล่ม ไม่ครบองค์ประชุม 3) ส.ส.ส่วนใหญ่โหวตเห็นชอบร่าง พ.ร.บ.กัญชาทั้งฉบับ 4) ส.ส.เสียงข้างมากโหวตคว่ำร่าง พ.ร.บ.ทั้งหมด 5) ที่ประชุมสภาฯ แก้ไขรายมาตรา ไม่ให้ใช้กัญชาเสรี เพื่อสันทนาการ ให้ใช้กัญชาเพื่อประโยชน์อย่างเดียว12 ธ.ค. จีนประกาศยุติใช้รหัสเดินทางดิจิตอล LINK
CGTN รายงานเผยแพร่หนังสือจากทางการจีนระบุว่า จะยุติการใช้งานบริการรหัสเดินทางดิจิตอล วันที่ 13 ธันวาคม 2022 หลังจากที่ประกาศใช้มาแล้วเกือบ 3 ปี (ตั้งแต่ 13 กุมภาพันธ์ 2020) ซึ่งเป็นส่วนหนึ่งของมาตรการควบคุมป้องกันโรคโควิด-19 เพื่อใช้ตรวจสอบประวัติการเดินทางของประชาชน โดยใช้งานผ่าน WeChat หรือ Alipay
13 ธ.ค. ฮ่องกงยกเลิกมาตรการกักตัวผู้เดินทางเข้าประเทศ ยกเลิกใช้แอปโควิด LINK
ฮ่องกงเดินหน้าผ่อนคลายมาตรการโควิดครั้งสำคัญ จากการออกประกาศ โดย จอห์น ลี คา-ชู (John Lee Ka-chiu) ผู้บริหารสูงสุดของฮ่องกง ที่ระบุว่า ฮ่องกงจะยกเลิกมาตรการกักตัว ผู้ที่จะเดินทางเข้าฮ่องกง ตั้งแต่วันพุธที่ 14 ธันวาคม 2022 เป็นต้นไป รวมทั้งได้ยกเลิกการใช้แอปโควิดด้วย การยกเลิกมาตรการทั้งสองเป็นส่วนหนึ่งของแผนการเปิดศูนย์กลางการเงินแห่งนี้ให้กลับมาทำงานอีกครั้ง และหวังว่าการเปิดฮ่องกงอีกครั้ง จะช่วยกระตุ้นการบริโภค การท่องเที่ยวและธุรกิจได้
แต่เดิมทางการกำหนดให้ใช้รหัสสีอำพัน สำหรับนักเดินทางต่างชาติที่เดินทางเข้าไปยังฮ่องกง ซึ่งหมายความว่า จะต้องถูกกักตัว 3 วันแรก และห้ามออกไปภายนอก ทั้งร้านอาหาร บาร์
แต่หลังจากวันพุธ 14 ธันวาคม มาตรการนี้จะถูกยกเลิก ทั้งผู้เดินทางชาวต่างชาติและผู้มีถิ่นพำนักในฮ่องกง ที่เดินทางมาจากต่างประเทศ จะไม่ต้องถูกกักตัว เพียงแต่ต้องแสดงผลตรวจโควิด-19 เป็นลบเมื่อเดินทางถึง พร้อมกับยกเลิกการใช้แอปรหัสเดินทางดิจิตอล ที่แต่เดิมต้องแสดงเพื่อเข้าใช้บริการสาธารณะ เช่น ร้านอาหาร ยิม คลับ ร้านเสริมสวย ซึ่งการยกเลิกนี้เป็นไปตามนโยบายของจีนแผ่นดินใหญ่ที่ยกเลิกไปแล้วก่อนหน้านี้
14 ธ.ค. จีนหยุดเผยยอดผู้ป่วยโควิด-19 แบบไร้อาการ
เจ้าหน้าที่ศูนย์ควบคุมและป้องกันโรคของจีน เปิดเผยว่าจีนหยุดการเผยแพร่ข้อมูลเกี่ยวกับจำนวนผู้ติดเชื้อไวรัสโควิด-19 แบบไม่แสดงอาการ เริ่มตั้งแต่วันพุธ (14 ธ.ค.) เป็นต้นไป
หลี่ฉวิน หัวหน้าศูนย์เหตุฉุกเฉินทางสาธารณสุข สังกัดศูนย์ควบคุมฯ อธิบายว่าปัจจุบันการทดสอบกรดนิวคลีอิกเพื่อตรวจโรคโควิด-19 อยู่ภายใต้ยุทธศาสตร์ "ดำเนินการทดสอบเฉพาะผู้ที่เลือกรับการทดสอบเท่านั้น" เป็นหลัก ผู้ติดเชื้อไวรัสฯ แบบไม่แสดงอาการจำนวนมากไม่จำเป็นต้องเข้าร่วมการทดสอบกรดนิวคลีอิก และไม่จำเป็นต้องเข้ารับการรักษาจากสถาบันสุขภาพ จึงเป็นการยากที่จะระบุจำนวนผู้ติดเชื้อไวรัสฯ แบบไม่แสดงอาการที่แท้จริงอย่างแม่นยำ14 ธ.ค. ยอดเที่ยวบินในปักกิ่งพุ่ง หลังปรับมาตรการคุมโควิด-19
หน่วยงานกำกับควบคุมการบินพลเรือนประจำภูมิภาคตอนเหนือของจีน เปิดเผยว่ากรุงปักกิ่ง เมืองหลวงของประเทศ ได้รับรองเที่ยวบินเพิ่มขึ้นในช่วงไม่นานนี้ หลังจากจีนปรับปรุงมาตรการรับมือการระบาดของโรคโควิด-19
จำนวนเที่ยวบินทั้งหมดที่ท่าอากาศยานนานาชาตินครหลวงปักกิ่ง และท่าอากาศยานนานาชาติปักกิ่ง ต้าซิง ในวันอาทิตย์ (11 ธ.ค.) เพิ่มขึ้นร้อยละ 169 จากช่วงต้นเดือนธันวาคม และคาดว่าจำนวนเที่ยวบินรายวันของสนามบินทั้งสองแห่งจะกลับมาอยู่ที่ร้อยละ 70 ของระดับปี 2019 ในอนาคตอันใกล้
เมื่อไม่นานนี้ จีนได้ประกาศมาตรการชุดใหม่เพื่อปรับปรุงประสิทธิภาพและความเหมาะสมของการควบคุมโรคระบาด อาทิ การเสนอให้ผู้ป่วยที่มีอาการเล็กน้อยหรือไม่มีอาการกักตัวที่บ้าน และการลดการทดสอบกรดนิวคลีอิกเพื่อประชาชนเดินทางและเข้าถึงสถานที่สาธารณะง่ายขึ้น
ทั้งนี้ ผู้โดยสารไม่จำเป็นต้องแสดงรหัสสุขภาพและผลทดสอบกรดนิวคลีอิกที่เป็นลบ หรือตรวจวัดอุณหภูมิร่างกายเมื่อเข้าสู่สนามบินทั้งสองแห่งอีกต่อไปตามชุดมาตรการใหม่ด้วย (
ซินหัว)
14 ธันวาคม 65
1. พิจารณาร่าง พ.ร.บ.กัญชาฯ
- น.ส.พิมพ์รพี พันธุ์วิชาติกุล ส.ส.พรรคประชาธิปัตย์ กล่าวว่า เนื้อหาในร่างกฎหมายกัญชา ขัดต่อกฎหมายยาเสพติด ระหว่างประเทศ เนื่องจากอนุสัญญาเดี่ยวว่าด้วยยาเสพติด ค.ศ.1961 กำหนดให้กัญชาเป็นยาเสพติด เท่ากับไทยกำลังละเมิด พันธกรณีตามอนุสัญญา หากยังไม่รีบแก้ไขทางนโยบาย ผลกระทบที่ตามมาจะไม่สามารถประเมินได้ ทั้งผลเสียต่อระบบ บริการสาธารณสุข ที่ต้องใช้งบประมาณในการรักษาผู้ป่วยจากการใช้กัญชาในทางที่ผิดมากขึ้น ไปจนถึงความปลอดภัยของ เยาวชนและปัญหาสังคม และไม่คุ้มค่ากับผลดีทางด้านเศรษฐกิจ จึงขอให้ทุกคนช่วยกันคว่ำร่างกฎหมายฉบับนี้ สื่อที่นำเสนอ : นสพ. ไทยโพสต์ คอลัมน์ วิเคราะห์สถานการณ์
- วันนี้ที่ประชุมสภาฯ จะชี้ชะตาร่าง พ.ร.บ.กัญชาเสรี ผลงานชิ้นเอกของพรรคภูมิใจไทย หลังทำให้พรรคภูมิใจไทยและ พรรคประชาธิปัตย์ต้องบาดหมางกันอย่างรุนแรง
2. จับร้านขายกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ ร่วมกับ ตร.นครบาลทองหล่อ พร้อมด้วย จนท.กรมอนามัยอย.
-กรมวิชาการเกษตร ลงพื้นที่บริเวณทองหล่อ ตรวจใบอนุญาตประกอบกิจการ/ร้านค้าว่า จำหน่ายกัญชาถูกต้องตาม กฎหมายหรือไม่ พบผู้กระทำผิดจำนวน 6 ราย เป็นรถเร่ Food Truck 5 ราย จำหน่าย/ แปรรูปสมุนไพรควบคุมโดยไม่ได้รับ อนุญาต ซึ่งในจำนวนนี้ 3 รายแสดงใบอนุญาตเข้าข่ายเป็นเท็จ อีก 1 รายมีสถานประกอบการชัดเจน แต่จำหน่าย/แปรรูปช่อ ดอกกัญชาโดยไม่ได้รับอนุญาต จึงยึดอายัดของกลางและสั่งปิด จับกุมดำเนินคดี ตั้งวงเงินประกันรายละ 2 หมื่นบาท นำส่ง ฟ้องศาลต่อไป
3. งานวิจัยกัญชาทางการแพทย์กับโรคจิตเวช
- นพ.บุรินทร์ สุรอรุณสัมฤทธิ์ ที่ปรึกษากรมสุขภาพจิต กล่าวถึงประเด็น “งานวิจัยกับการใช้กัญชาในการดูแลสุขภาพ” ใน การประชุมวิชาการ DTAM Forum ว่า มีการวิจัยกัญชาเพื่อใช้ในโรคจิตเวชค่อนข้างมาก โดยเฉพาะต่างประเทศ ซึ่งมีตั้งแต่ โรควิตกกังวลทางสังคม โดยผลค่อนข้างดีการใช้กัญชากับกลุ่มโรคเครียดที่เกิดหลังเหตุการณ์สะเทือนขวัญ (PTSD) ปัจจุบัน ยังไม่มียารักษาเฉพาะ แต่พบว่ามีกลไกเข้าไปลดตัวกระตุ้นในสมอง ทำให้ดีขึ้นร่วมกับการนอนและความฝันก็จะลดลง ส่วนโรค ซึมเศร้า ไบโพลาร์ผลลัพธ์ยังไม่ชัดเจน บางงานวิจัยระบุว่าสาร THC ไปเพิ่มภาวะการฆ่าตัวตาย จึงต้องระวังเรื่องนี้พอสมควร โดยในปี 2566 กรมสุขภาพจิตได้ศึกษาการใช้ CBD รักษาผู้ป่วยกลุ่ม PTSD คนไทยในจังหวัดชายแดนใต้ คาดจะทราบผล กลางปีหน้า นอกจากนี้ยังมีงานวิจัยของ รพ.สวนปรุง ศึกษาการใช้กัญชาในผู้ป่วยที่นอนไม่หลับด้วยตำรับกัญชาศุขไสยาศน14 - 17 ธ.ค.66 งาน Thailand Coffee Fest Year End 2023
งาน Thailand Coffee Fest Year End’2023 ศูนย์การประชุมแห่งชาติสิริกิติ์ ชั้น LG ฮอลล์ 5 วันที่ 14 - 17 ธันวาคม 2566 10.00 - 20.00 น
15 ธันวาคม 65 จับกุมผู้กระทำผิดกฎหมาย
1. ประชุมสภาฯ ประเด็นกัญชา
- นายศุภชัย โพธิ์สุ รองประธานสภาฯ แจ้งผลการหารือของ กมธ. ให้ตัดมาตรา 3 ที่ระบุว่ากัญชา กัญชง ไม่ถือเป็นยาเสพ ติดให้โทษตามกฎหมายว่าด้วยยาเสพติดออกทั้งมาตรา เพื่อให้กฎหมายเดินหน้าต่อไป โดยนายจุลพันธ์ อมรวิวัฒน์ ส.ส.พรรค เพื่อไทย ระบุการตัดไม่มีผลในทางปฏิบัติต่อการแก้ปัญหากัญชาเสรี
- นพ.ธงชัย เลิศวิไลรัตนพงศ์อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึงกรณีที่ประชุมสภาฯ มีมติตัดมาตรา 3 เรื่อง กัญชา ไม่ใช่ยาเสพติด ออกจากร่าง พ.ร.บ.กัญชาฯ ว่า ไม่มีผลกระทบอะไร ยังไม่ถือว่ากัญชาจะกลับไปเป็นยาเสพติด แต่จากการ ถกเถียงในที่ประชุมมีคำถามว่าแล้วกัญชาจะมีสถานะเป็นอะไร หากเปรียบเทียบกับกระท่อมที่ยังมีฤทธิ์เสพติดก็จำเป็นต้องมี กฎหมายออกมาดูแล แต่ไม่ได้ทำให้กลับไปเป็นยาเสพติดไปโดยปริยาย วันนี้กัญชายังถือเป็นพืชสมุนไพร ส่วนการจะให้กลับไป เป็นยาเสพติด คกก.ยาเสพติดของ อย. ต้องพิจารณาและเสนอกลับเข้าไปที่ คกก.ป.ป.ส.
- นายภราดร ปริศนานันทกุล ส.ส.พรรคภูมิใจไทย เผยการตัดมาตรา 3 ที่ระบุ กัญชา กัญชง ไม่ถือว่าเป็นยาเสพติดให้โทษ ตามกฎหมายว่าด้วยยาเสพติด หรือตามประมวลกฎหมายยาเสพติดออกไป ไม่เกี่ยวข้องกับสถานะกัญชา ปัจจุบันกัญชา ยกเว้นสารสกัด THC ที่มีค่าเกินกว่า 0.2% ไม่ใช่ยาเสพติด ประชาชนที่ใช้อย่างถูกต้องตามกฎหมาย ไม่จำเป็นต้องกังวล เพราะประกาศกระทรวงสาธารณสุขบังคับใช้ ขอให้ประชาชนที่ใช้ประโยชน์ไว้วางใจ
- รศ.พิพัฒน์ นนทนาธรณ์นายกสมาคมนักวิจัยแห่งประเทศไทย พร้อมด้วยตัวแทนวิสาหกิจชุมชน เกษตรกร ผู้ป่วยและ ญาติ ตัวแทนภาคธุรกิจแบบอุตสาหกรรม เครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทย รวมตัวจัด กิจกรรมเรียกร้องให้ส.ส.รับร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. ... ในวาระที่ 2 ยืนยันว่า ต้องการสนับสนุนให้ผ่าน ร่าง พ.ร.บ. ฉบับนี้ ซึ่งจะทำให้สามารถควบคุมได้ทั้งแง่คุณภาพ การเข้าถึง จะเป็นประโยชน์ต่อประชาชน ขอให้เน้นด้านการแพทย์ก่อน และคุมให้เยาวชนใช้อย่างถูกวิธีทั้งนี้ หากร่างฉบับนี้ไม่ผ่านสภาฯ จะเดินหน้าต่อ การปลดล็อกกัญชาต้องใช้เวลา ที่สำคัญคือ อย่าปิดกั้นข้อมูลกับประชาชน อย่ายัดเยียดว่ากัญชาคือยาเสพติด อยากให้ทำความเข้าใจกันใหม่ สื่อที่นำเสนอ : นสพ.ข่าวสด เว็บไซต์ข่าวสด
- นายพิธา ลิ้มเจริญรัตน์ หัวหน้าพรรคก้าวไกล แถลงจุดยืนของพรรค คิดว่ากัญชาสามารถก้าวหน้าได้มากกว่ากัญชาทาง การแพทย์ และสามารถเป็นกัญชาสันทนาการที่มีการควบคุมได้ ย้ำว่าต้องมีกฎหมายออกมาควบคุม
2. พัฒนาระบบบริการการแพทย์แผนไทยและการแพทย์ทางเลือก
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมต.ประจำสำนักนายกฯ เป็นประธานเปิดโครงการฝึกอบรมและพัฒนาศักยภาพ อบจ. ด้านการแพทย์แผนไทย การแพทย์ทางเลือก และการใช้สมุนไพรทางการแพทย์แบบบูรณาการ ระดับปฐมภูมิ เพื่อให้ รพ.สต.ทั่วประเทศกว่า 2,000 แห่ง ใช้สมุนไพรกัญชา และกัญชง เพื่อเป็นทางเลือกในการดูแลผู้ป่วย และประชาชนในชุมชน
3.กัญชาทางการแพทย์
-พญ.มิ่งขวัญ วิชัยดิษฐ ผอ.สถาบันโรคผิวหนัง กล่าวว่า ขณะนี้สถาบันฯ ค้นคว้าวิจัยสูตรเวชสำอางต้นแบบมาแล้ว 18 สูตรตำรับ ได้แก่ ผลิตภัณฑ์บำรุงผิว ผลิตภัณฑ์บำรุงเส้นผม ผลิตภัณฑ์นวดผิวกายเพื่อผ่อนคลาย พร้อมใช้เทคโนโลยีห่อหุ้ม ระดับนาโน (Nanoencapsulation) เข้ามาช่วยในการละลายและเพิ่มความคงตัวของสารสกัดจากกัญชา โดยเลือกใช้เฉพาะ สาร cannabidiol (CBD) และ terpenes เนื่องจากไม่มีฤทธิ์ต่อจิตประสาท จึงมีความปลอดภัยในการใช้มากกว่า THC พร้อมร่วมกับภาคเอกชนต่อยอดพัฒนาเชิงพาณิชย์ ได้แก่ บริษัท สยามเวลเนส เอมารา ซึ่งเป็นผู้จัดจำหน่ายในอุตสาหกรรม เวชสำอาง และ บมจ.สยามเวลเนสกรุ๊ป เจ้าของธุรกิจสปาแอนด์เวลเนส Let’s relax ซึ่งเป็นบริการสปาที่มีสาขาทั่วประเทศ ทั้งนี้เพื่อกระตุ้นเศรษฐกิจและยกระดับนวัตกรรมสู่ Medical and Wellness Service อย่างครบวงจร
4.จับกุมผู้กระทำผิดกฎหมาย
- นพ.ธงชัย เลิศวิไลรัตนพงศ์อธิบดีกรมการแพทย์แผนไทยและแพทย์ทางเลือก ได้ร่วมกับสน.ทองหล่อ ทีมตำรวจเฉพาะิจ พนักงานเจ้าหน้าที่กรมอนามัย กรมวิชาการเกษตร และ อย.ลงพื้นที่แถวทองหล่อ เพื่อตรวจสำรวจผู้กระทำความผิด ประกาศกระทรวงสาธารณสุข สมุนไพรควบคุม (กัญชา)พ.ศ. 2565 ซึ่งเป็นการปฏิบัติการต่อเนื่องจากการตรวจบริเวณถนน ข้าวสาร เขตพระนคร ที่ผ่านมา โดยดำเนินการตรวจใบอนุญาตประกอบกิจการร้านค้าต่างๆ ว่า จำหน่ายกัญชาได้ถูกต้องตาม กฎหมายหรือไม่ ทั้งนี้ พบผู้กระทำผิด 6 ราย จำแนกเป็นรถเร่ (food truck) 5 ราย ได้จำหน่ายหรือแปรรูป แบบพันลำ/ จำหน่ายช่อดอก โดยไม่ได้รับอนุญาต โดยจำนวนนี้มี 3 ราย ที่ได้แสดงใบอนุญาตเข้าข่ายเป็นเท็จ และอีก 1 ราย มีสถาน ประกอบการชัดเจน แต่จำหน่ายหรือแปรรูปช่อดอกกัญชา โดยไม่ได้รับอนุญาต
Awakening Bangkok 2022 ตลาดน้อย 16-25 ธ.ค. 65
เทศกาลแสงไฟประจำปีของกรุงเทพฯ Awakening Bangkok โดย Time Out พร้อมกลับมาเปิดไฟให้ย่านเก่าที่เรารัก "เจริญกรุง ตลาดน้อย" กับ ธีม “Endless Tomorrow: เพื่อพรุ่งนี้ และตลอดไป” เปิดพื้นที่เพื่อสร้างบทสนทนา และสร้างแรงบันดาลใจให้กับมนุษย์ที่กำลังหาคำตอบของชีวิตในวันพรุ่งนี้ – ที่สามารถคงอยู่ตลอดไป เป็นวันพรุ่งนี้ที่เป็นนิรันดร์
กำหนดการกิจกรรม วันที่ 16-25 ธ.ค. 65 เฝ้าติดตามข้อมูลได้ที่
TimeOut16 ธันวาคม 65 น้ำมันกัญชาเมตตาโอสถ ระบบขายดอกกัญชาแห้ง
1. พ.ร.บ.กัญชา
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ประธาน คกก.ขับเคลื่อนนโยบายกัญชาเสรีทางการแพทย์ กล่าวขอบคุณสภาฯ ที่รับ พิจารณาร่าง พ.ร.บ.กัญชาฯ และขอให้เร่งพิจารณา พ.ร.บ.ฉบับนี้โดยเร็ว เพื่อเกิดการบังคับใช้กฎหมายที่มีประสิทธิภาพ และ ส่งเสริมให้เกิดการวิจัยอย่างกว้างขวาง พร้อมเน้นย้ำมาตรการในการดูแลความปลอดภัยหลังจากปลดพืชกัญชา กัญชงออก จากรายการยาเสพติด
- นพ.ไพศาล ดั่นคุ้ม เลขาฯ อย. เผย หากกัญชาจะกลับไปเป็นยาเสพติด คณะอนุกรรมการยาเสพติดให้โทษของ อย. ต้อง มีการพิจารณาเห็นชอบและเสนอต่อ คกก. ป.ป.ส. เห็นชอบ ก่อน รมว.สธ.ลงนาม ทั้งนี้ ในการประชุมของ คกก.ยาเสพติด อย. ไม่มีวาระการพิจารณากัญชากลับมาเป็นยาเสพติด ซึ่งหากกลับไปเป็นยาเสพติดแล้ว ผลิตภัณฑ์สุขภาพหลายตัวจะออกไม่ได้ ทั้งที่มีคุณภาพมาตรฐาน ทั้งอาหารและเครื่องสำอาง ซึ่งปัจจุบันมีการขึ้นทะเบียนที่ อย. กว่า 2,200 รายการ เรียกร้องสภาฯ ผ่านร่างกฎหมายเพื่อให้มีแนวทางชัดเจนในการนำมาใช้ให้เกิดประโยชน์
2. ระบบขายดอกกัญชาแห้ง
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวถึงการควบคุม กำกับการใช้กัญชาในประเทศไทย ว่า ขณะนี้กรมฯ กำลังจัดทำรายละเอียดขั้นตอนการใช้โปรแกรมการส่งต่อข้อมูลการขายดอกกัญชาแห้งในร้านค้าที่ได้รับอนุญาต โดยกำหนดให้เจ้าของร้านต้องแจ้งปริมาณกัญชาที่ครอบครอง แหล่งข้อมูลที่ซื้อและขาย คนซื้อต้องมีอายุเกิน 20 ปี ต้องเสียบ บัตรประชาชนเพื่อเป็นฐานข้อมูลเชื่อมโยงกับระบบของกรมฯ เพื่อให้กรมฯ สามารถตรวจสอบข้อมูลในระบบได้แบบเรียลไทม์ เพื่อสร้างความมั่นใจให้คกก.ควบคุมสารเสพติดนานาชาติ INCB ซึ่งมีความห่วงกังวลเรื่องการควบคุมการขายช่อดอก
3. น้ำมันกัญชาเมตตาโอสถ
- นพ.ธันวา บัวมหะกุล นพ.ชำนาญการ รพ.การแพทย์แผนไทยและการแพทย์ผสมผสาน (ยศเส) เผยผลน้ำมันกัญชา “เมตตาโอสถ” ดูแลผู้ป่วยประคับประคอง-วาระสุดท้าย ติดตาม 1 ปีในกลุ่มมะเร็ง 108 ราย พบอาการดีขึ้น ทั้งปวดหัว คลื่นไส้ อาเจียน คุณภาพชีวิตดีขึ้น พบ 47 รายใช้น้ำมันกัญชามากขึ้น - ภก.ปรีชา หนูทิม ผอ.รพ.การแพทย์แผนไทยฯ กล่าวว่า ปัจจุบันน้ำมันกัญชาตำรับ อ.เดชา อยู่ในชุดสิทธิประโยชน์ บัญชียาหลักของ สปสช. แล้ว ส่วนตำรับเมตตาโอสถกำลังดำเนินการเข้าสู่สิทธิประโยชน์ต่อไปพาหมามา MAJOR DOG DAY 2022 สวนป่าเบญจกิติ 17 ธ.ค.65
เมเจอร์ฯ ตัวจริงคอนโดเลี้ยงสัตว์ได้ ร่วมกับ กรุงเทพมหานคร เปิดโซนพิเศษในสวนป่าเบญจกิติ ที่ให้คนกับน้องหมามาสนุกในพื้นที่สีเขียวไปพร้อมกัน แค่วันเดียวเท่านั้น! MAJOR DOG DAY 2022 เปิดสวนป่าเบญจกิติ พาหมามา RUN WALK CHILL กับพื้นที่สีเขียวกลางกรุงเทพ! 17 ธ.ค. 65 สวนป่าเบญจกิติ ถ.รัชดาภิเษก เวลา 14.00 - 20.00 น.
สนุกกับกิจกรรมจัดเต็ม สำหรับคนรักน้องหมา แบบที่ไม่เคยมีมาก่อน Shoot & Share, กระทบไหล่น้องหมา NET IDOL ชื่อดัง
Run มันส์ ครั้งแรกที่คุณกับน้องหมา ได้ FUN RUN ในพื้นที่สีเขียวขนาดใหญ่ สวนป่าเบญจกิติ! ฟรี! บริการตรวจสุขภาพน้องหมา จากทีมสัตวแพทย์ก่อนวิ่ง
Walk เพลิน กว่า 20 ร้านค้าน่ารักๆ ของทั้งคนและสุนัข รายได้ส่วนหนึ่งมอบให้มูลนิธิดูแลน้องหมา
Chill ในสวน ฟินกับบรรยากาศแสนร่มรื่น พร้อมดนตรีสบายๆ เช็คอินเก็บรูปกับน้องหมาได้ทุกมุม และยังมีกิจกรรมสนุกๆ มากมาย อย่าง ดูดวงทายนิสัยน้องหมา, ภาพวาดน้องหมาน่ารักๆ โดยศิลปิน
17 ธ.ค. จีนรายงานติดเชื่อในท้องถิ่น 2,229 ราย
จีนรายงานตรวจพบผู้ป่วยโรคโควิด-19 ที่ติดเชื้อในท้องถิ่น 2,229 ราย ในวันศุกร์ (16 ธ.ค.) ที่ผ่านมา รายงานระบุว่าแผ่นดินใหญ่ของจีนมีผู้ป่วยโรคโควิด-19 ออกจากโรงพยาบาลหลังหายดีรวม 2,649 ราย โดยไม่มีผู้ป่วยเสียชีวิตเพิ่มเติมในวันศุกร์ (16 ธ.ค.) ทำให้ยอดผู้ป่วยเสียชีวิตยังคงอยู่ที่ 5,235 ราย17 ธันวาคม 65 เตรียมออกระบบ เสียบบัตรปชช.ซื้อกัญชา
1. กฎหมายควบคุมกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ เปิดเผยหลังหารือร่วมกับ ดร.สาธิต ปิตุเตชะ รมช.สธ. เกี่ยวกับการกำกับควบคุมการใช้กัญชาในทางที่ไม่ถูกต้อง มีความเห็นตรงกันว่าควรทำหนังสือเชิญหน่วยงานที่เกี่ยวข้องในการ กำกับดูแลมาหารือร่วมกันอีกครั้ง เพราะข้อสั่งการต่าง ๆ ในการพูดคุยกันครั้งแรกที่จะสั่งลงไปยังพื้นที่อาจยังไม่ชัดเจนมากนัก ถ้า รมช.สธ. ได้เข้ามานั่งหัวโต๊ะกำกับเรื่องนี้เองจะได้มีการพูดคุยตรงกับทางสำนักงานตำรวจแห่งชาติ อัยการ ก.การยุติธรรม รวมถึงกรมการปกครอง ก.มหาดไทย หรือกรุงเทพมหานคร ในช่วงบ่ายวันที่ 19 ธันวาคมนี้เพื่อให้มีความชัดเจนในการสั่งการ ข้อกฎหมาย รวมถึงจะเชิญกรมอื่น ๆ ในสังกัด สธ. มาร่วมกันหารือด้วย
- นายพิพัฒน์ นนทนาธรณ์ นายกสมาคมนักวิจัยแห่งประเทศไทย กล่าวว่า จากการฟังการอภิปรายในสภาผู้แทนราษฎร เมื่อ 14 ธ.ค. ที่ผ่านมา มีความกังวลว่าการพิจารณาร่าง พ.ร.บ.กัญชา กัญชา พ.ศ. ... จะไม่ทันในสมัยประชุมนี้ จะทำให้ ประเทศไทยเสียโอกาสการพัฒนากัญชาทั้งระบบ ทั้งที่ทำมาดีแล้ว พบว่า ส.ส. ยังขาดความรู้ ความเข้าใจในศาสตร์กัญชาอย่าง มาก ทางสมาคมนักวิจัยฯ ยินดีที่จะจัดอบรมให้ฟรี
2. เตรียมออกระบบ เสียบบัตรปชช.ซื้อกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์อธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า ตามที่ประกาศ สธ. กำหนดว่าผู้ที่จะจำหน่าย สมุนไพรควบคุม คือ ช่อดอกกัญชา จะต้องมาขออนุญาตกับกรมการแพทย์แผนไทยฯ ก่อน ขณะนี้อยู่ระหว่างการจัดทำ รายละเอียดขั้นตอน เพื่อใช้โปรแกรมบันทึกและส่งต่อข้อมูลการขายช่อดอกกัญชาแห้งในร้านค้าที่ได้รับอนุญาตแล้ว โดยกำหนดให้เจ้าของร้านต้องแจ้งปริมาณกัญชาที่ครอบครอง แหล่งข้อมูลที่ซื้อมาและขายไป ผู้ซื้อต้องมีอายุเกิน 20 ปี โดยต้องเสียบบัตรประชาชนเพื่อเป็นฐานข้อมูลเชื่อมโยงกับระบบของกรมฯ สามารถตรวจสอบข้อมูลในระบบได้แบบเรียลไทม์ เพื่อสร้างความมั่นใจให้คกก.ควบคุมสารเสพติดนานาชาติหรือ INCB ซึ่งมีความห่วงกังวลเรื่องการควบคุมการขายช่อดอก
3. ยืนยันกัญชาในขณะนี้ไม่ถือเป็นยาเสพติด
- นพ.ไพศาล ดั่นคุ้ม เลขาธิการ อย. กล่าวถึงกรณีที่ประชุมสภาผู้แทนราษฎร มีการพิจารณาร่าง พ.ร.บ.กัญชา กัญชง กมธ.วิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง ยอมตัดมาตรา 3 ออกทั้งหมด ทำให้มีการตีความว่ากัญชาจะมีสถานะกลับไป เป็นยาเสพติด ว่า ที่ประชุมสภาฯ มีการพิจารณาถึงมาตรา 3 ซึ่งระบุว่า เรื่องของกัญชา กัญชง และสารสกัด ตามกฎหมายนี้ ไม่ถือเป็นยาเสพติด ถ้าถามว่าตอนนี้กัญชายังเป็นยาเสพติดหรือไม่ คงไม่ได้ดูตามกฎหมายนี้และมาตรา 3 ไม่กระทบกับ มาตราอื่น ๆ ในร่าง พ.ร.บ.กัญชาฯ ยืนยันกัญชาในขณะนี้ไม่ถือเป็นยาเสพติด ซึ่งตามประกาศ สธ. ที่ระบุชื่อยาเสพติดประเภท 5 ไม่มีชื่อกัญชา ตั้งแต่ยอด ช่อดอก ใบ ลำต้น กิ่งก้าน จนถึงรากไม่มีส่วนไหนเป็นยาเสพติดเลย มีเพียงสารสกัด THC เกิน 0.2% โดยน้ำหนักเท่านั้นที่ยังเป็นยาเสพติดอยู่ การจะให้กัญชากลับไปเป็นยาเสพติดต้องพิจารณาเห็นชอบและเสนอโดย คณะอนุกรรมการยาเสพติดให้โทษของ อย. ต่อ คณะกรรมการ ป.ป.ส. และการประกาศระบุชื่อยาเสพติด เป็นอำนาจสุดท้าย ของคณะกรรมการ ป.ป.ส. ที่ต้องเห็นชอบก่อนแล้ว รมว.สธ.ถึงลงนามThailand Es Yen Championships 2024 ประเดิมสนามแรก ภาคกลาง 17 ธันวาคม 2566
Thailand Es Yen Championships 2024 การแข่งขันเอสเย็นชิงแชมป์ประเทศไทยในปีนี้จัดขึ้นในรูปแบบคัดเลือกตัวแทนจากภูมิภาค เพื่อเฟ้นหาผู้ชนะจากภาคกลาง ภาคใต้ ภาคเหนือ และภาคอีสานไปชิงแชมป์สุดยอดนักชงเอสเย็นใน Thailand Coffee Fest 2024 เหล่าบาริสต้าเตรียมตัวให้พร้อม ศึกษากติกาแข่งขันและวิธีการสมัครเข้าร่วม รวมถึงเกณฑ์การแบ่งภูมิภาคได้ที่ :
https://bit.ly/46UWug1 ประเดิมสนามแรก ภาคกลาง ในงาน Thailand Coffee Fest Year End 2023 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ ชั้น LG ฮอลล์ 5 วันอาทิตย์ที่ 17 ธันวาคม พ.ศ. 2566 งานกาแฟที่จะมาส่งท้ายปี 2023 ให้เต็มไปด้วยสีสันและความสนุกจากกาแฟ การแข่งขันรอบภาคกลาง ลงทะเบียนพร้อมกันในวันที่ 4 ธันวาคมนี้ เวลา 9.00 น. ผ่านทาง Facebook : Thailand Coffee Fest รับสมัครจำนวนจำกัด 18 คน ค่าสมัครท่านละ 4,900 บาท มาร่วมเป็นส่วนหนึ่งในเวทีการแข่งขันสุดยิ่งใหญ่เพื่อผลักดันกาแฟสัญชาติไทยไปด้วยกัน
เดิน-วิ่งการกุศล ฅนเหล็กมินิมาราธอน 18 ธ.ค. 65
กลับมาอีกครั้ง กับงานเดิน-วิ่งการกุศล ฅนเหล็กมินิมาราธอน KONLHEK MINI MARATHON 2022 ปีนี้ จัดในวันที่ 18 ธันวาคม 2565 ที่ STADIUM ONE กรุงเทพฯ
สมัครผ่าน Application บนมือถือ สแกน QR code ที่ ลิ่งค์
shutterrunning2014.run/konlhek/อุทัยธานี มาราธอน มรดกโลกห้วยขาแข้ง 2022 อาทิตย์ที่ 18 ธ.ค.65 LINK
อุทัยธานี มาราธอน มรดกโลกห้วยขาแข้ง 2022
วัน อาทิตย์ ที่ 18 ธันวาคม 2565 สถานที่จัดกิจกรรม วิทยาลัยชุมชนอุทัยธานี อำเภอบ้านไร่ จังหวัดอุทัยธานี
“เพื่อสมทบทุนในการจัดการศึกษาสำหรับเด็กพิการ ศูนย์การศึกษาพิเศษ ประจำจังหวัดอุทัยธานี
และเพื่อจัดซื้ออุปกรณ์ทางการแพทย์ โรงพยาบาลบ้านไร่ จังหวัดอุทัยธานี”
สามารถสมัครได้ด้วยตนเองได้ที่
องค์การบริหารส่วนจังหวัดอุทัยธานี โทร 056-514027
ศูนย์การศึกษาพิเศษ ประจำจังหวัดอุทัยธานี โทร 056-970109
โรงพยาบาลบ้านไร่ 056-539000
Beauty Run BY AssetWise 18 ธ.ค.65 LINK
Beauty Run 2022 by AssetWise งานวิ่งการกุศลที่คุณจะได้ทั้งความสุข และความสวยกลับไป ออกสตาร์ทไปพร้อมกับตัวแทนจักรวาล แอนนา เสืองามเอี่ยม จากเวที Miss Universe Thailand 2022, นิต้า มานิตา นางสาวไทย 2022 และหนุ่มหล่อจากทีม Mister International Thailand อิ่มใจได้แบ่งปันรายได้ส่วนหนึ่งหลังจากหักค่าใช้จ่ายจากการจัดกิจกรรม ให้แก่สถาบันมะเร็งแห่งชาติ เพื่อช่วยเหลือผู้ป่วยโรคมะเร็งที่ขาดทุนทรัพย์ในการรักษา
วันที่ทำการแข่งขัน : 18 ธันวาคม 2565
สถานที่จัดกิจกรรม : สวนเบญจกิติ, จังหวัดกรุงเทพมหานคร
ระยะทางแข่งขัน ระยะทาง 5 กิโลเมตร (ฟันรัน) ระยะทาง 10 กิโลเมตร (มินิ มาราธอน)
TOOLGETHER RUN 2022 (วิ่งครั้งนี้...มีแต่ได้ ครั้งที่ 2) 18 ธ.ค.65
TOOLGETHER RUN 2022 (วิ่งครั้งนี้...มีแต่ได้ ครั้งที่ 2) 18 ธันวาคม 2565 ณ เมืองโบราณ จ. สมุทรปราการ ระยะทาง 10/5/3 km
18 ธันวาคม 65 คืบหน้าคดีผู้กระทำผิดย่านทองหล่อ
คืบหน้าคดีผู้กระทำผิดย่านทองหล่อ
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก เผยความคืบหน้ากรณีคดีผู้กระทำผิด 6 ราย ที่กระทำผิดเงื่อนไขสมุนไพรควบคุม (กัญชา) 2565 ย่านทองหล่อ โดยจำคุก 2 เดือน รอลงอาญา 2 ปี ปรับ 5,000 บาท พร้อมระบุการดำเนินการครั้งนี้แสดงให้เห็นถึงตัวบทกฎหมายบังคับใช้ได้จริงสำหรับผู้ฝ่าฝืนหรือกระทำผิด ต้องโทษตาม กฎหมาย จึงขอย้ำผู้ประกอบการทุกคน ดำเนินการให้ถูกต้องตามประกาศของ สธ. เพื่อร่วมกันควบคุมกัญชาในสังคมให้เกิด ประสิทธิภาพต่อไป
ตั้งข้อสงสัยกรณี อย. แนะเลือกจัดกระเช้าผลิตภัณฑ์ผสมกัญชา กัญชง
- Smit Fa Srisont โพสต์ถึงกรณี อย. แนะนำให้เลือกซื้อผลิตภัณฑ์อาหาร เครื่องสำอาง สมุนไพรที่มีส่วนประกอบของ กัญชา กัญชง ที่ได้รับอนุญาตจาก อย. มาจัดกระเช้าด้วยตนเอง ว่า เพื่อการแพทย์จริงหรือไม่ ไม่มีประเทศใดในโลกนำมาผสม อาหารหรือขนมแล้วบอกเพื่อการแพทย์ และที่สำคัญ อย. โปรโมทเองด้วย19 ธ.ค.จีนรายงานติดเชื่อในท้องถิ่น 1,918 ราย
จีนรายงานตรวจพบผู้ป่วยโรคโควิด-19 ที่ติดเชื้อในท้องถิ่น 1,918 ราย ในวันอาทิตย์ (18 ธ.ค.) ที่ผ่านมา รายงานระบุว่าแผ่นดินใหญ่ของจีนมีผู้ป่วยโรคโควิด-19 ออกจากโรงพยาบาลหลังหายดีรวม 1,344 ราย โดยไม่มีรายงานผู้ป่วยเสียชีวิตเพิ่มเติมในวันอาทิตย์ (18 ธ.ค.) ทำให้ยอดผู้ป่วยเสียชีวิตยังคงอยู่ที่ 5,237 รายมาตรการลดภาษีที่ดินและสิ่งปลูกสร้างปี 2566
มาตรการลดภาษีที่ดินและสิ่งปลูกสร้างปี 2566 (มาตรการลดภาษีที่ดินฯ)
มีวัตถุประสงค์เพื่อลดภาระภาษีที่ดินและสิ่งปลูกสร้าง (ภาษีที่ดินฯ) ให้แก่ผู้เสียภาษี เนื่องจาก
- สนับสนุนการฟื้นตัวทางเศรษฐกิจอย่างต่อเนื่องหลังจากสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19)
- สิ้นสุดระยะเวลาการยกเว้นภาษีให้แก่เจ้าของที่ดินหรือสิ่งปลูกสร้างซึ่งเป็นบุคคลธรรมดาและใช้ประโยชน์ในการประกอบเกษตรกรรมและการบรรเทาภาษีกรณีผู้เสียภาษีที่ดินฯ ที่มีภาระภาษีที่ดินฯ มากกว่าภาษีโรงเรือนและที่ดินและภาษีบำรุงท้องที่ ในปี 2562 ในช่วง 3 ปีแรกของการจัดเก็บภาษีที่ดินฯ (2563-2565) และ
- มีการเพิ่มขึ้นของราคาประเมินทุนทรัพย์ที่ดินหรือสิ่งปลูกสร้างในปี 2566 ซึ่งใช้เป็นฐานในการคำนวณภาษีที่ดินฯ
โดยมาตรการดังกล่าวจะให้ลดภาษีในอัตราร้อยละ 15 ของจำนวนภาษีที่คำนวณได้สำหรับการจัดเก็บภาษีที่ดินฯ ของปีภาษี พ.ศ. 2566
ยกตัวอย่างเช่น
- กรณีมีที่ดินและสิ่งปลูกสร้างมูลค่า 1 ล้านบาท ใช้ประกอบกิจการ เช่น ร้านขายของชำ ร้านตัดผม ร้านขายอาหารตามสั่ง โรงงาน อาคารสำนักงาน เป็นต้น ปกติจะมีภาระภาษี 3,000 บาท แต่จะได้รับการลดภาษีจากมาตรการลดภาษีที่ดินฯ 450 บาท คงเหลือภาษีที่ต้องชำระ 2,550 บาท
- และตัวอย่างกรณีที่ดินหรือสิ่งปลูกสร้างที่ได้รับลดภาษีในอัตราร้อยละ 50 ของจำนวนภาษีที่คำนวณได้อยู่แล้ว เช่น โรงผลิตไฟฟ้า เขื่อน เป็นต้น จะได้รับการลดภาษีในอัตราร้อยละ 15 ของจำนวนภาษีที่คำนวณได้หลังจากได้รับการลดภาษีร้อยละ 50 แล้ว
อย่างไรก็ดี ที่ดินหรือสิ่งปลูกสร้างที่ได้รับการลดภาษีร้อยละ 90 แล้ว เช่น สวนสัตว์ สวนสนุก สถานที่เล่นกีฬา เป็นต้น จะไม่ได้รับการลดภาษีตามมาตรการลดภาษีที่ดินฯ เพิ่มเติมอีก
ในอนาคตเราอาจออกแบบวงจรยีนทำให้เซลล์จุลินทรีย์จำเพาะบางชนิดทำหน้าที่ตรวจสอบสารแปลกปลอมต่าง ๆ ไม่ว่าจะเป็นชิ้นส่วนที่มีความจำเพาะกับเนื้องอก, biomarker ชนิดต่าง ๆ และทำให้เซลล์ตอบสนองหรือมีฟังก์ชันในลักษณะต่าง ๆ ในทำนองเดียวกับตัวอย่างที่กล่าวไปแล้ว ช่วยทำให้ยาออกฤทธิ์ได้อย่างจำเพาะที่ หรือแม้แต่ช่วยปล่อยสารบางอย่าง เพื่อกระตุ้นระบบภูมิคุ้มกันได้อีกด้วย
21 ธ.ค. ยอดผู้ป่วยใหม่ 3,049 ราย ไม่มีเสียชีวิต
จีนรายงานจำนวนผู้ติดเชื้อในท้องถิ่น ในวันอังคาร (20 ธ.ค.) ที่ผ่านมา จำนวน 3,049 ราย ออกจากโรงพยาบาลหลังหายดีรวม 1,953 ราย และไม่มีรายงานผู้ป่วยเสียชีวิตเพิ่ม ยอดผู้ป่วยเสียชีวิตแตะที่ 5,241 รายสถาบันชาและกาแฟแม่ฟ้าหลวง อบรมแปรรูปกาแฟ ฟรี 21 ธันวาคม 2566 LINK
สถาบันชาและกาแฟ ขอเชิญเกษตรกร ผู้ประกอบการและผู้ที่สนใจเข้าร่วมกิจกรรม อบรมการแปรรูปกาแฟโรบัสต้า Fine Robusta เบื้องต้น ในวันพฤหัสบดีที่ 21 ธันวาคม 2566 เวลา 09.00 - 16.00 น. ณ ห้อง E3A 609 มหาวิทยาลัยแม่ฟ้าหลวง
วิทยากร คุณธนวัฒน์ แซ่หลิน
Q Robusta Grader
GCS Techno Roasting Lv. 1 Lv.2
Thailand Coffee Excellence (Robusta) 2021 #Rank6
Thailand Aromaster Roasting 2019 #Rank5
ลงทะเบียนฟรี รับจำนวนจำกัด 30 ท่าน เท่านั้น
????ลิงค์ลงทะเบียน https://forms.gle/Hh2xpgwKjy6rqua2A
หากคุณกำลังสนใจกาแฟโรบัสต้า ไม่ควรพลาด
ติดต่อสอบถามเพิ่มเติม
สถาบันชาและกาแฟ แห่งมหาวิทยาลัยแม่ฟ้าหลวง
E-mail: teacoffee@mfu.ac.th
โทร. 0 5391 6253
เครือโรงพยาบาลพริ้นซ์ ลงทุนร่วม บ.ราช กรุ๊ป สร้างโรงพยาบาลแห่งใหม่ จ.สกลนคร
22 ธันวาคม 2564 พริ้นซิเพิล แคปิตอล จำกัด (มหาชน) (เครือโรงพยาบาลพริ้นซ์) ประกาศการลงทุน ร่วมกับ บริษัท ราช กรุ๊ป จำกัด (มหาชน) จัดตั้งบริษัทใหม่ชื่อ "บริษัท พริ้นซิเพิล เฮลท์แคร์ - สกลนคร จำกัด" ในสัดส่วน 75:25 โดยมีวัตถุประสงค์เพื่อเช่าที่ดินขนาด 14 ไร่ และก่อสร้างโรงพยาบาลขนาด 59 เตียง ในจังหวัดสกลนคร ชื่อว่า โรงพยาบาล พริ้นซ์ สกลนคร มูลค่าเงินลงทุนรวมทั้งสิ้น 463 ล้านบาท ประกอบไปด้วยค่าก่อสร้างสิ่งปลูกสร้าง ค่าอุปกรณ์เครื่องมือทางการแพทย์ ระบบเทคโนโลยีสารสนเทศ และเงินทุนหมุนเวียน
11 มีนาคม 2565 มีพิธีวางศิลาฤกษ์ โรงพยาบาลพริ้นซ์ สกลนคร คาดว่าจะเปิดให้บริการภายในเดือน กุมภาพันธ์ ปี พ.ศ. 2566
22 ธ.ค. เซินเจิ้น เร่งเปลี่ยนจุดตรวจโควิดเป็นห้องให้คำปรึกษาสำหรับผู้ป่วยมีไข้
นครเซินเจิ้น มณฑลกว่างตง (กวางตุ้ง) ทางตอนใต้ของจีน กำลังปรับเปลี่ยนตู้ทดสอบกรดนิวคลีอิกเป็นห้องให้คำปรึกษาสำหรับผู้ป่วยมีไข้ เช่นเดียวกับอีกหลายเมืองในประเทศ ซึ่งเป็นส่วนหนึ่งของความพยายามล่าสุดเพื่อรับมือกับจำนวนผู้ป่วยโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) ที่เพิ่มขึ้น
เจ้าหน้าที่และผู้อาศัยในนครเซินเจิ้นเผยว่าหลายเขตของเมืองกำลังปรับเปลี่ยนตู้ทดสอบกรดนิวคลีอิกเป็นห้องให้คำปรึกษาที่สามารถให้บริการผู้ป่วยมีไข้และจ่ายยาขั้นพื้นฐาน เพื่อลดแรงกดดันที่เพิ่มขึ้นในโรงพยาบาลแห่งต่างๆ
สำนักสาธารณสุขเขตฝูเถียนของเซินเจิ้นระบุว่าตู้ทดสอบกรดนิวคลีอิกในท้องถิ่น จำนวน 53 ตู้ ถูกดัดแปลงเป็นห้องให้คำปรึกษาอาการไข้ ด้านศูนย์สุขภาพชุมชน 66 แห่งในเขตเป่าอันดำเนินการปรับเปลี่ยนการใช้งานตู้ทดสอบกรดนิวคลีอิกที่ถูกทิ้งร้างกลับมา
เฉินปี้ฉิน ผู้อำนวยการศูนย์สุขภาพชุมชนในเขตฝูเถียน กล่าวว่าห้องให้คำปรึกษาขนาด 4 ตารางเมตร สามารถรองรับแพทย์และผู้ป่วยได้ครั้งละ 1 คน พร้อมติดตั้งอุปกรณ์ฆ่าเชื้อโรคและระบบระบายอากาศ โดยทำเลที่ตั้งของสถานที่เหล่านี้เอื้อให้ผู้อาศัยที่ป่วยเป็นไข้สามารถเข้ารับการรักษาได้สะดวก
บริษัทจัดหาตู้ทดสอบกรดนิวคลีอิกในเซินเจิ้นระบุว่าตู้ทดสอบกรดนิวคลีอิกจำนวนมากไม่ได้ถูกนำมาใช้งาน หลังรัฐบาลผ่อนปรนข้อบังคับการทดสอบกรดนิวคลีอิก โดยนอกจากถูกปรับเปลี่ยนเป็นห้องให้คำปรึกษาแล้ว ตู้ทดสอบบางแห่งยังถูกปรับเป็นห้องฉีดวัคซีนด้วย
ทั้งนี้ หลายเมืองของจีนเร่งเปิดคลินิกรักษาไข้และกักตุนยาเพิ่มขึ้น หลังพบจำนวนผู้ป่วยมีไข้จำนวนมากในช่วงไม่กี่วันที่ผ่านมา โดยนครกว่างโจว เมืองเอกของกว่างตง ได้เพิ่มจำนวนคลินิกไข้ในโรงพยาบาลจาก 114 เป็น 199 แห่ง เนื่องจากผู้เชี่ยวชาญประเมินว่ากว่างโจวจะเผชิญการระบาดของโรคโควิด-19 แตะจุดสูงสุดช่วงต้นเดือนมกราคมนี้
ด้านกรุงปักกิ่งได้เปิดคลินิกไข้ชั่วคราวที่มีห้องให้คำปรึกษา 4 ห้อง ภายในโรงยิมกว่างอันในเขตซีเฉิงเมื่อสัปดาห์ที่แล้ว พร้อมด้วยร้านขายยาชั่วคราวและคลังเก็บยา ซึ่งจัดเตรียมยาลดไข้และสิ่งจำเป็นอย่างเพียงพอFine Robusta Festival 2023 วันที่ 22 ธันวาคม 2566
Fine Robusta Festival 2023 กิจกรรมงานกาแฟ วันที่ 22 ธันวาคม 2566 เวลา 8.00-18.00น.
ที่ เอสที กาแฟชุมพร อ.สวี จ.ชุมพร ร่วมสนุกกับกิจกรรมน่าสนใจต่างๆมากมาย อาทิ
- งานแข่งขันดริปกาแฟโรบัสต้า
- ยืดอกพกช้อนคัพปิ้ง Public cupping fine robusta (ฟรีไม่มีค่าใช้จ่าย)
- Work Shop เทสประสาทการดมกลิ่น ด้วยชุดฝึก Le Nez ที่ใช้เฉพาะในกาแฟโรบัสต้า (ฟรีไม่มีค่าใช้จ่าย)
- Work Shop เทคนิคการดริปกาแฟโรบัสต้าแบบเซียนกระซิบ
- พบบูธกาแฟของพี่น้องชาวกาแฟโรบัสต้าจากหลายแหล่งและสตรีทฟู๊ดทรัคหลากหลายเจ้า
ASIA FITNESS CONFERENCE 2022 30 กันยายน - 02 ตุลาคม 2022
ศรัทธาทุกย่างก้าว มุ่งสู่พระเจ้า 5 พระองค์ Evening Run #2
ศรัทธาทุกย่างก้าว มุ่งสู่พระเจ้า 5 พระองค์ Evening Run #2
งานวิ่งที่น่ารักที่สุด ของผาซ่อนแก้ว กับเส้นทางที่สวยและฟินที่สุดของเรา
วันเสาร์ ที่ 23 ธันวาคม 2566 เริ่มปล่อยตัวเวลาประมาณ 16.30 น.
ณ วัดพระธาตุผาซ่อนแก้ว อ. เขาค้อ จ. เพชรบูรณ์
Fun Run 6.3 km. / Mini 10.2 km.
ค่าสมัคร Fun Run 399- / Mini Marathon 499 -
ธนาคารออมสิน สร้างพระนอน 108 เมตร วัดพระธาตุผาซ่อนแก้ว 02 55555 99999
รายได้ทั้งหมดไม่หักค่าใช้จ่าย สมทบทุนสร้างมหาวิหารพระนอน 108 เมตร
ร่วมสนุกพร้อมได้ร่วมบุญมหากุศลได้แล้ววันนี้
ฟิตร่างกายให้พร้อม แล้วมาวิ่งบนเขา.......กับเรานะ
สมัครได้แล้ววันนี้ที่ ลิงค์รับสมัคร https://shorturl.asia/E4MVd
ตรวจสอบรายชื่อได้ที่ https://shorturl.asia/xP9dD
สอบถามเพิ่มเติม แป๋ม พิฐชญา 082 429 4569 / ฟิวส์ 095 516 6255
Lets Glow Night Run 2022 อุทยานสวรรค์ นครสวรรค์ 24 ธ.ค.65 LINK
งานวิ่งซนๆ ของคนมีแสง ครั้งนี้เรามาในธีมวิ่งเรืองแสงตลุยด่าน จะพาทุกท่านย้อนเข้าไปในบรรยากาศ Video Game 8 bit งานวิ่งที่จะทำให้ทุกท่านได้วิ่งเก็บเกี่ยวความสุข กับสเตชั่นสวยๆ สนุกๆ บนเส้นทางภายในอุทยานสวรรค์ ท่ามกลางสายลมหนาวของช่วงเวลาส่งท้ายปีเก่า ต้อนรับปีใหม่ เปิดรับสมัครแล้ววันนี้ ถึงวันที่ 25 พฤศจิกายน 2565 (หรือจนกว่าครบจำนวน)
งานวันที่ 24 ธันวาคม 2565 ณ อุทยานสวรรค์ เวลา 20.00 น.
งานวิ่งสุสานชาวไทยเชื้อสายเวียดนามแห่งประเทศไทย ครั้งที่ 1 - 25 ธ.ค.65 LINK
งานวิ่งสุสานชาวไทยเชื้อสายเวียดนามแห่งประเทศไทย & น้ำตกเขาสามหลั่น ฮาล์ฟมาราธอนครั้งที่ 1 วันแข่งขัน : อาทิตย์ ที่ 25 ธันวาคม 2565 สถานที่: สุสานชาวไทยเชื้อสายเวียดนาม แห่งประเทศไทย บ้านโคกหัวนา ตำบล หนองนาก อำเภอหนองแค สระบุรี 18230
เปิดรับสมัคร ตั้งวันนี้ จนถึง วันปิดรับสมัคร 20 ตุลาคม 2565 23:59 น.
รายละเอียดการแข่งขัน
เปิดรับสมัคร ตั้งวันนี้ จนถึง วันปิดรับสมัคร 20 ตุลาคม 2565 23:59 น.
ประเภทและรายการ
- HALF MARATHON 21.1 ก.ม.
- MINI MARATHON0 10.5 ก.ม..
- FUNRUN 5 ก.ม.
- เดินการกุศล ระยะทาง 3 ก.ม. (ไม่มีการแข่งขัน)
- VIP (** VIP สามารถเลือกระยะลงแข่งขันได้ทุกรายการ **)
Facebook
25 ธ.ค. ปักกิ่ง เร่งตั้งคลินิกไข้ชั่วคราว
โรงพยาบาลบางแห่งในกรุงปักกิ่ง เมืองหลวงของจีน ได้จัดตั้งคลินิกไข้ชั่วคราวภายในโรงยิมสำหรับให้บริการต่างๆ แก่ประชาชน เช่น การตรวจวินิจฉัยโรค การออกใบสั่งยา และการจ่ายยา เพื่ออำนวยความสะดวกกลุ่มผู้ป่วยที่มีไข้ในการเข้ารับการรักษาพยาบาล และรองรับความต้องการทางการแพทย์ของผู้อยู่อาศัย (ซินหัว)
อลิอันซ์ อยุธยา เวิลด์ รัน ไทยแลนด์ ซีรีส์ 2022 Run for the Healthy World 26-27 พ.ย. 65 LINK
ALLIANZ AYUDHYA WORLD RUN THAILAND SERIES 2022 อลิอันซ์ อยุธยา เวิลด์ รัน ไทยแลนด์ ซีรีส์ 2022 Run for the Healthy World พลาดไม่ได้! เส้นทางวิ่งสุดฟิน ของขุนเขา สายหมอก และวิถีชุมชนของอำเภอไทรโยค จังหวัดกาญจนบุรี
รายละเอียดการแข่งขัน
วันแข่งขัน: 26-27 พ.ย. 2565
วันเสาร์ที่ 26 พ.ย. Family Run ระยะทาง 3 กม.
วันอาทิตย์ที่ 27 พ.ย. ระยะทาง 21.1 กม. และ 10 กม.
สถานที่ : Xtreme Centric Park โรงแรมริเวอร์แคว์ วิลเลจ ไทรโยค จ.กาญจนบุรี
ประเภทการแข่งขัน : ระยะ 21.1 กม. และ 10 กม.
** Family Run 3 กม. ไม่มีการแข่งขัน
26 ธ.ค.โรงงานยาในเทียนจินเร่งผลิตยารักษาโควิด
เหล่าพนักงานบริษัทเภสัชภัณฑ์ในเทศบาลนครเทียนจินทางตอนเหนือของจีน ทำงานผลิตและขนส่งยารักษาโรคอย่างแข็งขัน ขณะสายการผลิตยารักษาโรคในเทียนจินเร่งทำงานเต็มกำลังเพื่อขยายอุปทานยารักษาอาการเจ็บป่วยของผู้ติดเชื้อไวรัสโควิด-19 (ภาพจาก ซินหัว)
27 ธ.ค. จีนเตรียมวัคซีนโควิด กว่า 10 ชนิด เพื่อฉีดกระตุ้นเข็มที่สอง
กลุ่มผู้เชี่ยวชาญจากคณะทำงานเฉพาะกิจระหว่างหน่วยงานเพื่อการรับมือโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) แห่งคณะรัฐมนตรีจีน เผยว่าปัจจุบันจีนมีวัคซีนป้องกันโรคโควิด-19 รวม 13 ชนิด สำหรับฉีดเป็นวัคซีนโดสกระตุ้นที่สอง ซึ่งได้รับอนุมัติให้วางจำหน่ายในตลาดแบบมีเงื่อนไขหรือใช้งานในกรณีฉุกเฉิน
กลุ่มผู้เชี่ยวชาญจากกลไกร่วมป้องกันและควบคุมโรคโควิด-19 แห่งคณะรัฐมนตรีจีน กล่าวว่าประชาชนส่วนใหญ่เลือกวัคซีนป้องกันโรคโควิด-19 ชนิดมุ่งต้านเชื้อไวรัสฯ ชนิดกลายพันธุ์ สายพันธุ์โอไมครอน สำหรับฉีดเป็นวัคซีนโดสกระตุ้นที่สอง
แผ่นดินใหญ่ของจีนได้ฉีดวัคซีนป้องกันโรคโควิด-19 กว่า 3,460 ล้านโดส เมื่อนับถึงวันศุกร์ (23 ธ.ค.) โดยมีประชากรได้รับวัคซีนครบโดสแล้วกว่าร้อยละ 90 อย่างไรก็ดี กลุ่มผู้เชี่ยวชาญชี้ว่าระดับของแอนติบอดีจะลดลงตามระยะเวลาหลังการฉีดวัคซีน พร้อมเสริมว่าการกลายพันธุ์ของเชื้อไวรัสฯ ส่งผลให้ภูมิคุ้มกันอ่อนแอลง ซึ่งทำให้แอนติบอดีมีประสิทธิภาพลดลง
กลุ่มผู้เชี่ยวชาญอ้างอิงการศึกษาหลายชิ้น ซึ่งแสดงให้เห็นว่าการฉีดวัคซีนโดสกระตุ้นสามารถกระตุ้นเซลล์ความจำทางภูมิคุ้มกันในร่างกายของผู้ทดลองและเพิ่มระดับแอนติบอดี ซึ่งจะช่วยป้องกันการเจ็บป่วยขั้นรุนแรงและการเสียชีวิต พร้อมแนะนำผู้มีคุณสมบัติที่ยังไม่ได้รับวัคซีนโดสกระตุ้นเข้ารับวัคซีนโดยเร็วที่สุด โดยกลุ่มประชากรที่มีความเสี่ยงติดเชื้อสูง ผู้มีอายุ 60 ปีขึ้นไป ผู้มีโรคประจำตัวร้ายแรง และผู้มีภูมิคุ้มกันต่ำ ควรเข้ารับวัคซีนโดสกระตุ้นที่สอง หลังฉีดวัคซีนโดสกระตุ้นแรก 6 เดือน
ส่วนผู้ที่ได้รับวัคซีนชนิดเชื้อตาย 3 โดสแรก สามารถเลือกรับวัคซีนชนิดอื่นๆ ที่รัฐบาลแนะนำเป็นวัคซีนโดสกระตุ้นที่สอง ซึ่งได้แก่ วัคซีนชนิดโปรตีนลูกผสม วัคซีนชนิดใช้อะดิโนไวรัสเป็นตัวนำพา หรือวัคซีนชนิดใช้เชื้อไวรัสไข้หวัดใหญ่เป็นตัวนำพา
ด้านศูนย์ควบคุมและป้องกันโรคของจีนได้ทำการติดตามอาการไม่พึงประสงค์หลังการฉีดวัคซีนป้องกันโรคโควิด-19 โดยอ้างอิงจากการฉีดวัคซีนกว่า 3.4 พันล้านโดสให้กับประชาชนกว่า 1.3 พันล้านคน ซึ่งพบว่าอัตราอุบัติการณ์ของอาการไม่พึงประสงค์ต่อวัคซีนป้องกันโรคโควิด-19 นั้นใกล้เคียงกับวัคซีนอื่นๆ ทั่วไป และอัตราอุบัติการณ์ดังกล่าวในผู้สูงอายุต่ำกว่าคนหนุ่มสาวเล็กน้อย
จีนเร่งผลิตเวชภัณฑ์ รับมือโควิด
จีนดำเนินงานรับรองการผลิตเวชภัณฑ์สำคัญอย่างเร่งด่วน ขณะมีการปรับปรุงประสิทธิภาพและความเหมาะสมของการรับมือโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) ภายในประเทศ
กระทรวงอุตสาหกรรมและเทคโนโลยีสารสนเทศ รวมถึงหน่วยงานที่เกี่ยวข้องของจีน ได้จัดตั้งกลไกการประสานงานฉุกเฉินกับทางการท้องถิ่น เพื่อช่วยผู้ประกอบธุรกิจเภสัชภัณฑ์ขยายกำลังการผลิต และรับรองการจัดสรรอุปทานยาสำคัญสำหรับควบคุมโรคโควิด-19
โจวเจี้ยน เจ้าหน้าที่กระทรวงฯ กล่าวว่ากลุ่มบริษัทที่เกี่ยวข้องและบริษัทฝ่ายสนับสนุนหลักทั้งหมดถูกจัดอยู่ใน "บัญชีขาว" เพื่อรับการสนับสนุนและบรรลุความร่วมมือด้านปัจจัยการผลิต
ทางการท้องถิ่นทั่วจีนได้ออกสารพัดมาตรการเพื่อเพิ่มผลผลิตเวชภัณฑ์ ซึ่งรวมถึงการจัดหาวัตถุดิบและพลังงาน การจัดตั้งสายการผลิตใหม่ และการส่งเสริมการยกระดับเทคโนโลยี เพื่อช่วยผู้ประกอบการดำเนินการผลิตเต็มกำลัง ณ ฐานการผลิตของปู้ฉาง ฟาร์มาซูติคัลส์ (Buchang Pharmaceuticals) บริษัทผู้รับผิดชอบการผลิตยาที่เกี่ยวข้องกับการควบคุมโรคโควิด-19 สามตัว มีสายการผลิตดำเนินงานตลอด 24 ชั่วโมง จำนวน 8 สาย
ส่วนบริษัท หูเป่ย เฮิงตี๋ จำกัด (Hubei Biocause Heilen Pharmaceutical) บริษัทเภสัชภัณฑ์ในมณฑลหูเป่ยทางตอนกลางของจีน เผยว่าสายการผลิตยาลดไข้ไอบูโพรเฟน (ibuprofen) ทั้งหมดทำการผลิตสูงสุดเท่าที่ได้ โดยผลผลิตวัตถุดิบสำหรับยาดังกล่าวอยู่ที่ 10-13 ตันต่อวัน
ทั้งนี้ กระทรวงฯ พยายามรับรองการจัดสรรยาอย่างตรงเป้าหมายและสมเหตุสมผล ให้ความสำคัญกับการแจกจ่ายเวชภัณฑ์สู่สถานที่สำคัญ เช่น สถาบันการแพทย์และบ้านพักคนชรา พร้อมแนะนำร้านขายยาออนไลน์รายใหญ่ปรับปรุงแพลตฟอร์มการซื้อยาออนไลน์
27 ธ.ค. จีนมุ่งปรับมาตรการโควิด-19 รับหยุด ปีใหม่-ตรุษจีน ราบรื่น
หนังสือเวียนจากสำนักงานทั่วไปของคณะกรรมการกลางพรรคคอมมิวนิสต์จีนและคณะรัฐมนตรีจีน ซึ่งเกี่ยวกับการปฏิบัติงานช่วงวันหยุดเทศกาลปีใหม่และเทศกาลตรุษจีน เน้นย้ำการรับรองการปรับเปลี่ยนระยะการรับมือโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) อย่างราบรื่น
การปฏิบัติงานช่วงวันหยุดดังกล่าวควรให้ความสำคัญกับประชาชนและชีวิตมนุษย์เหนือสิ่งอื่นใด ตลอดจนปรับใช้แนวทางตามหลักวิทยาศาสตร์และมาตรการแบบมุ่งเป้า พร้อมตระเตรียมการตอบสนองความต้องการการรักษาทางการแพทย์ โดยเฉพาะผู้ป่วยอาการหนัก เพื่อรับรองการรักษาตามลำดับปกติ
ทางการท้องถิ่นและหน่วยงานรัฐควรดำเนินมาตรการรับมือโรคโควิด-19 ในสถานที่ องค์กร และกลุ่มประชากรสำคัญอย่างจริงจัง เพื่อลดผลกระทบต่อการผลิตและวิถีชีวิตของประชาชน พร้อมเพิ่มความพยายามชี้แนะผู้ป่วยรับการรักษาแบบแบ่งกลุ่ม แบ่งระดับ และแบบส่งต่อ รวมถึงการให้คำแนะนำแก่ผู้ป่วยที่รักษาตัวในบ้าน
หนังสือเวียนยังเรียกร้องการผลิต จัดหา สำรอง และจัดสรรยาและน้ำยาทดสอบโรคอย่างมีประสิทธิภาพยิ่งขึ้น รวมถึงการสืบสวนสอบสวนและลงโทษตามกฎหมายกับกรณีโก่งราคาและกักตุนเวชภัณฑ์ที่เกี่ยวข้องกับการรักษาโรคโควิด-19
ขณะเดียวกันหนังสือเวียนบ่งชี้ความสำคัญของการตอบสนองความต้องการเดินทางของประชาชน การลดความเสี่ยงแพร่เชื้อไวรัสฯ และการจัดสรรบริการขนส่งที่ปลอดภัยและเข้าถึงง่ายตามหลักการ ระหว่างมหกรรมการเดินทางช่วงเทศกาลตรุษจีนในอนาคตอันใกล้
ทั้งนี้ หนังสือเวียนเสนอแนวทางให้ผู้ประกอบการและองค์กรอนุญาตลูกจ้างลาหยุดแบบไม่ทับซ้อนกันตามข้อกำหนดขององค์กรและความต้องการของพนักงาน ด้านโรงเรียนสามารถเริ่มใช้กำหนดการวันหยุดแบบไม่ทับซ้อนกัน เพื่อเกื้อหนุนการเดินทางแบบเหลื่อมเวลาของนักเรียน27 ธ.ค. จีนประกาศยกเลิกผลตรวจโควิดนักเดินทางต่างประเทศ ตั้งแต่ 8 ม.ค. เป็นต้นไป
แถลงการณ์บนเว็บไซต์กระทรวงการต่างประเทศของจีน เมื่อวันอังคาร (27 ธ.ค.) ระบุว่าจีนจะยกเลิกการทดสอบกรดนิวคลีอิกกับนักเดินทางขาเข้าจากต่างประเทศ เริ่มต้นตั้งแต่วันที่ 8 ม.ค. เป็นต้นไป
นักเดินทางขาเข้าจีนควรรับการตรวจโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) แบบ PCR ภายใน 48 ชั่วโมงก่อนการเดินทาง
ผู้มีผลตรวจเป็นบวก ควรเลื่อนการเดินทางจนกว่าจะมีผลตรวจเป็นลบ
ขณะเดียวกันนักเดินทางขาเข้าจีนไม่จำเป็นต้องยื่นขอรหัสสุขภาพจากคณะผู้แทนทางการทูตและกงสุลจีน แต่จะแจ้งสถานะสุขภาพของนักเดินทางบนบัตรพิธีการศุลกากร
ส่วนผู้มีสถานะสุขภาพผิดปกติหรืออาการไข้จะได้รับชุดทดสอบแอนติเจนที่ด่านศุลกากร โดยนักเดินทางจะได้รับคำแนะนำให้กักตัวที่บ้านจนกว่าจะหายดีหรือรับการรักษาที่โรงพยาบาล ซึ่งขึ้นอยู่กับสภาพสุขภาพร่างกาย (ภาพ
ซินหัว)
28 ธ.ค. ปักกิ่งเร่งกระจายยาและสิ่งของให้ประชาชน
เหล่าเจ้าหน้าที่ชุมชนตระเวนส่งมอบชุดบรรจุภัณฑ์ช่วยเหลือ ซึ่งประกอบด้วยยาและสิ่งของป้องกันโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) แก่ผู้สูงอายุที่อาศัยตามลำพังและกลุ่มผู้พิการในเขตย่อยหยางฟางเตี้ยน เขตไห่เตี้ยน กรุงปักกิ่ง เมืองหลวงของจีน นอกจากนั้นยังจัดสรรชุดอุปกรณ์ทางการแพทย์แบบใช้ร่วมกันให้ประชาชนสำหรับใช้กรณีฉุกเฉินอีกด้วย (ซินหัว)
จีนพัฒนาระบบ uFAST เพื่อจัดส่งยาแบบตรงเป้าหมาย ด้วยโดรน
บทความวิจัยที่ตีพิมพ์ผ่านวารสารแอดวานซ์ แมททีเรียลส์ (Advanced Materials) เมื่อไม่นานนี้ เผยว่าคณะนักวิจัยจีนได้พัฒนาระบบปฐมพยาบาลที่ใช้อากาศยานไร้คนขับหรือโดรน เพื่อจัดส่งยาแบบตรงเป้าหมาย
การจ่ายยาสำคัญให้ผู้ป่วยโรคเฉียบพลันอย่างทันท่วงทีถือเป็นสิ่งสำคัญในการช่วยชีวิต ขณะการจัดส่งชุดปฐมพยาบาลที่เชื่องช้าและการขาดผู้ที่เคยฝึกอบรมใช้ยามักนำไปสู่อาการบาดเจ็บสาหัสหรือแม้กระทั่งการเสียชีวิต
บทความระบุว่าระบบปฐมพยาบาลแบบใหม่หรือยูฟาสต์ (uFAST) ช่วยให้ผู้ป่วยใช้แผ่นแปะยารักษาฉุกเฉินเพื่อบรรเทาอาการป่วยผ่านเข็มฉีดยาขนาดไมครอนที่จะกระตุ้นด้วยการสัมผัส โดยไม่ต้องมีบุคลากรทางการแพทย์
ทีมวิจัยจากมหาวิทยาลัยเจ้อเจียงได้สาธิตความสามารถใช้งานจริงและความปลอดภัยของระบบดังกล่าวในสถานการณ์จำลองของหมูที่มีภาวะน้ำตาลในเลือดต่ำขั้นรุนแรง โดยการจ่ายฮอร์โมนกลูคากอน (Glucagon) แบบอัตโนมัติ
อนึ่ง นักวิจัยคาดว่าระบบยูฟาสต์จะอำนวยความสะดวกในการพัฒนาอุปกรณ์ตรวจวัดทางสรีรวิทยาที่สวมใส่ได้ ระบบตรวจจับหรือวิเคราะห์สุขภาพ ตลอดจนวิธีการและอุปกรณ์จัดส่งยาขั้นสูงเทศกาลเชียงรายดอกไม้งาม ดนตรีในสวน 28 ธ.ค. 66 - 15 ม.ค.67
เทศกาลเชียงรายดอกไม้งาม โดยเทศบาลนครเชียงราย กำหนดจัดวันที่ 28 ธันวาคม - 15 มกราคม 2567 ณ สวนตงและโคมนครเชียงราย มีกิจกรรมได้แก่พิธีเปิดงาน วันที่ 28 ธันวาคม พิธีตักบาตรดอกไม้วันที่ 29 ธันวาคม ดนตรีในสวน แสดงทุกวันเสาร์ งานส่งท้ายปีเก่ารับปีใหม่ 2567 เคาน์ดาวน์ และพิธีอัญเชิญพระพุทธรูปแวดเวียงเจียงฮายและทำบุตรตักบาตรวันขึ้นปีใหม่ 1 ธันวาคม 2567 เตรียมพร้อมออกเดินทางไว้แต่เนิ่นๆ นะจ๊ะ สอบถามเพิ่มเติม เทศบาลนครเชียงราย 053-711333
29 ธ.ค. เซี่ยงไฮ้ เปลี่ยนศูนย์ตรวจโควิดเป็นคลินิกไข้ชั่วคราว
เทศบาลนครเซี่ยงไฮ้ทางตะวันออกของจีนปรับเปลี่ยนจุดทดสอบกรดนิวคลีอิกหลายแห่งเป็นคลินิกไข้ชั่วคราว เพื่อตอบสนองความต้องการทางการแพทย์ของประชาชนท้องถิ่นได้ดียิ่งขึ้น โดยทั้งสองด้านของคลินิกไข้เป็นหน้าต่างสำหรับการตรวจร่างกาย การวินิจฉัยและการรักษา และการจ่ายยา
สวีตงเจี้ยน แพทย์ประจำคลินิกไข้ชั่วคราว กล่าวว่าเจ้าหน้าที่คนหนึ่งรับผิดชอบการตรวจร่างกาย ลงทะเบียน และเรียกเก็บค่าธรรมเนียม ส่วนอีกคนหนึ่งเป็นแพทย์เวชปฏิบัติทั่วไป
หญิงแซ่ลู่ ประชาชนท้องถิ่นคนหนึ่ง เผยว่าคลินิกไข้อยู่ใกล้บ้าน คนไม่เยอะ ทำให้สามารถเข้ารับบริการทางการแพทย์ได้ทันที
จูจินเสียง รองผู้อำนวยการสำนักงานพัฒนาสังคมตำบลหนานเสียง ระบุว่าจะมีการเปลี่ยนจุดทดสอบกรดนิวคลีอิกเป็นคลินิกไข้ชั่วคราวเพิ่มขึ้น รวมถึงยกระดับการบริการ หลังจากประเมินความต้องการการรักษาทางการแพทย์ของประชาชนและทรัพยากรทางการแพทย์ที่มีอยู่แล้ว24 พ.ย. 66 ฮ.EC725 บินรับผู้ป่วยชาย 70 ปี ภาวะหลอดเลือดแดงใหญ่ในช่องท้องโป่งพอง จากฝาง เร่งส่งรพ.มหาราช เชียงใหม่
24 พฤศจิกายน 2566 เวลา 16.13 น.
สถาบันการแพทย์ฉุกเฉินแห่งชาติ ได้รับการประสานจากศูนย์รับแจ้งเหตุและสั่งการจังหวัดเชียงใหม่ ขอสนับสนุนเฮลิคอปเตอร์เพื่อรับผู้ป่วยชายไทย อายุ 70 ปี มีอาการปวดท้องด้านซ้าย 3 วันก่อนมาโรงพยาบาล ทำการรักษาและปฐมพยาบาลเบื้องต้น โดยรับจากโรงพยาบาลฝาง ตำบลเวียง อำเภอฝาง จังหวัดเชียงใหม่ แพทย์ได้วินิจฉัย Rupture abdominal aortic aneurysm (ภาวะหลอดเลือดแดงใหญ่ในช่องท้องโป่งพอง) จำเป็นต้องได้รับการรักษาซึ่งเกินศักยภาพ และผู้ป่วยมีอาการทรุดตัวลง มีภาวะฉุกเฉินวิกฤต จึงส่งต่อไปรักษาที่โรงพยาบาลมหาราชนครเชียงใหม่ ตำบลสุเทพ อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่
ประสานงานศูนย์นเรนทร สถาบันการแพทย์ฉุกเฉินแห่งชาติ เพื่อแจ้งขอรับการสนับสนุนอากาศยานจากกองบิน 41 (กองทัพอากาศ) ประเภทอากาศยานเฮลิคอปเตอร์ EC725 มีชุดปฏิบัติการบิน ประกอบด้วย 1.นาวาอากาศตรี วัฒนพงษ์ ทองแตง, 2.เรืออากาศเอก ทินวุฒิ วงษ์พร, 3.พันจ่าอากาศเอก วชริศักดิ์ เย็นสรง, 4.พันจ่าอากาศโท เอนก ทองเจริญ, 5.พันจ่าอากาศโท เฉลิมเกียรติ มูลเนียม, 6.พันจ่าอากาศเอก ชินวัตร โพธิ์ชัยเลิศ, 7.พันจ่าอากาศตรี สถาพร แก้วพูนผล, 8.พันจ่าอากาศเอก ทรงศักดิ์ น้องศิลา ชุดปฏิบัติการลำเลียงผู้ป่วยทางอากาศโดยโรงพยาบาลมหาราชนครเชียงใหม่ ประกอบด้วย 1.นายแพทย์ ปริญญา เทียนวิบูลย์, 2.นายแพทย์ ศรัณย์ปกรณ์ เพิ่มพัฒน์เดชากุล, 3.นาย ธนาวิชญ์ อุ่นนันกาศ, 4.นางสาว นภัสกร แบนปิง
และเมื่อเวลา 18.39 น. ได้ส่งตัวเข้ารับการรักษาต่อที่โรงพยาบาลมหาราชนครเชียงใหม่ เป็นที่เรียบร้อย
มาตรการลดค่าธรรมเนียมจดทะเบียนสิทธิและนิติกรรมสำหรับที่อยู่อาศัยปี 2566
มาตรการลดค่าธรรมเนียมจดทะเบียนสิทธิและนิติกรรมสำหรับที่อยู่อาศัยปี 2566 (มาตรการลดค่าธรรมเนียมฯ)
มีวัตถุประสงค์เพื่อสนับสนุนและลดภาระให้แก่ประชาชนที่ต้องการมีที่อยู่อาศัยเป็นของตนเอง ส่งเสริมการซื้อขายอสังหาริมทรัพย์เพื่อสร้างความมั่นคงในทางเศรษฐกิจ รวมถึงช่วยรักษาระดับกิจกรรมทางเศรษฐกิจในภาคอสังหาริมทรัพย์และธุรกิจที่เกี่ยวเนื่องกับภาคอสังหาริมทรัพย์ และสนับสนุนการฟื้นตัวทางเศรษฐกิจหลังจากสถานการณ์การแพร่ระบาดของ COVID-19 โดยมาตรการดังกล่าวจะให้ลดค่าจดทะเบียน
- การโอนอสังหาริมทรัพย์จากร้อยละ 2 เหลือร้อยละ 1 และ
- ค่าจดทะเบียนการจำนองอสังหาริมทรัพย์จากเดิมร้อยละ 1 เหลือร้อยละ 0.01 (เฉพาะการโอนและจดจำนองในคราวเดียวกัน)
สำหรับการซื้อขายที่อยู่อาศัย ได้แก่ บ้านเดี่ยว บ้านแฝด บ้านแถว อาคารพาณิชย์ และห้องชุด (ทั้งบ้านมือ 1 และมือ 2) เฉพาะที่มีราคาซื้อขาย และราคาประเมินทุนทรัพย์ไม่เกิน 3 ล้านบาท และวงเงินจำนองไม่เกิน 3 ล้านบาท ต่อสัญญา โดยไม่รวมถึง กรณีการขายเฉพาะส่วน ตั้งแต่วันที่กฎหมายมีผลใช้บังคับถึงวันที่ 31 ธันวาคม 2566
30 ธ.ค. จีนเผย ยาเม็ดรักษาโควิด-19 VV116 มีประสิทธิภาพเท่ายาแพกซ์โลวิด
จีนเผยผลการศึกษาทางวิทยาศาสตร์ที่เผยแพร่ในวารสารการแพทย์นิวอิงแลนด์ เปิดเผยว่า "วีวี116" (VV116) ซึ่งเป็นยาต้านโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) ชนิดรับประทานของจีน มีประสิทธิภาพในการฟื้นฟูสุขภาพหลังป่วยได้รวดเร็วเทียบเท่ากับยาแพกซ์โลวิด (Paxlovid)
ยาต้านเชื้อไวรัสโคโรนาข้างต้นที่พัฒนาขึ้นโดยหลายสถาบันในสังกัดสถาบันบัณฑิตวิทยาศาสตร์จีน (CAS) แสดงผลลัพธ์ที่ดีในการรักษาการติดเชื้อไวรัสฯ สายพันธุ์โอไมครอนระยะแรกเริ่ม
ก่อนหน้านี้การศึกษาเบื้องต้นขนาดเล็กรายการหนึ่ง แสดงให้เห็นว่ากลุ่มผู้ป่วยที่ได้รับยาวีวี116 ภายใน 5 วัน หลังผลทดสอบเป็นบวกครั้งแรก มีระยะเวลาขับเชื้อไวรัสฯ ออกจากร่างกายสั้นกว่าผู้ป่วยที่ได้รับการดูแลแบบปกติ โดยอยู่ที่เฉลี่ย 8.56 วัน ขณะที่ระยะขับเชื้อของกลุ่มควบคุม (กลุ่มที่ใช้เปรียบเทียบผลการทดลอง) เฉลี่ยอยู่ที่ 11.13 วัน
การศึกษาใหม่ที่เผยแพร่เมื่อวันพุธ (28 ธ.ค.) ยังเผยว่าระยะที่ 3 ซึ่งเป็นการทดลองแบบสุ่มระหว่างการระบาดของเชื้อไวรัสฯ ชนิดกลายพันธุ์ สายพันธุ์โอไมครอน พบว่ากลุ่มผู้ป่วยที่ได้รับยาวีวี116 มีระยะเวลาเฉลี่ยในการฟื้นฟูสุขภาพหลังป่วยอยู่ที่ 4 วัน เทียบกับผู้รับประทานยาแพกซ์โลวิดซึ่งอยู่ที่ 5 วัน
การศึกษายังพบว่าผลการรักษาด้วยยาวีวี116 ในกลุ่มผู้ใหญ่ที่มีอาการระดับเล็กน้อยถึงปานกลางและเสี่ยงที่จะมีอาการลุกลามในโรงพยาบาล 7 แห่งของเซี่ยงไฮ้ ไม่ได้ด้อยไปกว่ายาแพกซ์โลวิด หรือยานีมาทรีเวียร์-รีโทนาเวียร์ (nirmatrelvir-ritonavir) ทั้งยังมีข้อกังวลด้านความปลอดภัยน้อยกว่า
ทั้งนี้ คณะนักวิจัยกล่าวว่าเนื่องจากอุปทานยาแพกซ์โลวิดทั่วโลกไม่เพียงพอต่อความต้องการ ยาวีวี116 จึงถือเป็นทางเลือกที่ดีกว่าThe Reporters รายงานภารกิจแรก เมือง Hatay LINK
The Reporters SPECIAL: เปิดภารกิจแรก ทีมกู้ภัย USAR Thailand เผยภาพความเสียหาย สะเทือนใจ พบผู้เสียชีวิต 1 ราย และ ยังหวังพบผู้รอดชีวิต ท่ามกลางอากาศหนาวเย็นและอาฟเตอร์ช็อค ขณะที่คุณซูซาน ผู้ดูแลสุนัข K9 ได้รับบาดเจ็บเล็กน้อยระหว่างร่วมค้นหาผู้สูญหาย
ทีมแพทย์คลินิกตานอกเวลาราชการ โรงพยาบาลบึงกาฬ
ศูนย์ผิวหนังธรรมศาสตร์ (นอกเวลาราชการ)
ศูนย์ผิวหนังธรรมศาสตร์ (นอกเวลาราชการ)
ทำนัดพบแพทย์ศูนย์ผิวหนัง โทร. 02 9269435 , 02 926 9524 ล่วงหน้าอย่างน้อย 7 วันทำการ
**เฉพาะผู้ที่มีเลขประจำตัวผู้ป่วย (HN) โรงพยาบาลธรรมศาสตร์ฯ)
** วันจันทร์-ศุกร์ (เฉพาะวันราชการ) เวลา 14.00 – 16.00 น. หรือ ณ ศูนย์ผิวหนัง ชั้น 3 อาคารชวนชูชาติ วพน.7
** กรณีไม่มีเลขประจำตัวผู้ป่วย (HN) โรงพยาบาลธรรมศาสตร์ฯ ลงทะเบียนขอเลขประจำตัวผู้ป่วย (HN) Online ทางลิงก์นี้
tu-ekyc/ หรือ tuh.hospital.tu.ac.th **
วันเวลาเปิดบริการ
• เปิดบริการวันจันทร์-วันศุกร์* และ วันเสาร์ (เฉพาะวันราชการ* / วันพุธ* (เปิดบางสัปดาห์))
* ผู้ป่วยใหม่หรือผู้ป่วยมาไม่ตรงนัด ณ ชั้น 1 อาคารม.ร.ว.สุวพรรณ สนิทวงศ์
วันจันทร์-วันศุกร์* เปิดรับรหัสบริการ เวลา 15.00 - 16.00 น.
วันเสาร์ เปิดรับรหัสบริการ เวลา 07.00 - 10.00 น.
- กดรับรหัสบริการ ณ ตู้รับรหัสบริการ จุดคัดกรองอาการ
- ติดต่อพยาบาลคัดกรองอาการ
- ติดต่อทำบัตรใหม่ / ออกสิทธิ์ (กรณีใช้สิทธิ์) / รับใบนำทาง ณ หน่วยประสานสิทธิฯ
- ยื่นใบนำทาง และ รอเรียกคิวตรวจ ณ ศูนย์ผิวหนัง ชั้น 3 อาคารชวนชูชาติ วพน.7
* ผู้ป่วยมีบัตรนัด มาตรงนัด ณ ศูนย์ผิวหนัง ชั้น 3 อาคารชวนชูชาติ
วันจันทร์-วันศุกร์* เปิดรับบัตรนัด เวลา 16.00 - 18.00 น.
วันเสาร์ เปิดรับบัตรนัด เวลา 07.00 - 11.00 น. เปิดรับบัตรนัด เวลา 07.00 - 12.00 น.
- ยื่นบัตรนัดก่อนเวลานัด 30 นาที
- กดรับรหัสบริการ ณ ตู้รับรหัสบริการ
- ชั่งน้ำหนัก วัดความดันโลหิต ก่อนยื่นบัตรนัด ณ เคาน์เตอร์พยาบาล
- รอเรียกคิวตรวจตามเวลานัดหมาย
อัตราค่าบริการ
คลินิกพิเศษบริการเฉพาะทาง (นอกเวลราชการ)
- ค่าบริการโรงพยาบาล 220 บาท (สิทธิข้าราชการเบิกได้ 50 บาท)
- ค่าธรรมเนียมแพทย์ 500-900 บาท (ขึ้นอยู่กับความซับซ้อนของโรค)
- สิทธิข้าราชการสามารถเบิกค่ายาและเวชภัณฑ์ได้ตามสิทธิ
หมายเหตุ
- สิว ฝ้า ปัญหาความงาม ไม่สามารถเบิกค่ารักษาพยาบาล และ ไม่สามารถใช้สิทธิประกันสังคมหรือ สิทธิประกันสุขภาพถ้วนหน้าบัตรทอง) ในการรับบริการ ณ คลินิกพิเศษบริการเฉพาะทาง (นอกเวลราชการ) ได้
- เปิดบริการฉายแสงอาทิตย์เทียม วันจันทร์ วันอังคาร วันพุธ (เปิดเป็นบางสัปดาห์เท่านั้น) วันพฤหัสบดีและศุกร์ เวลา 16.00 - 18.00 น. ยกเว้นวันหยุดนักขัตฤกษ์และวันหยุดพิเศษ ที่ประกาศเพิ่มโดยรัฐบาลและวันที่แพทย์งดตรวจ
คลินิกจิตเวช LINK
สถานที่ตั้ง ชั้น 1 อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
เปิดให้บริการ
- วันจันทร์-วันศุกร์ เวลา 16.00-19.00 น.
- วันเสาร์ เวลา 08.00-11.00 น.
- ให้บริการตรวจรักษาพยาบาลผู้ป่วยนอกด้านสุขภาพจิตและจิตเวช อย่างถูกต้อง ปลอดภัยตามมาตรฐานวิชาชีพ โดยคำนึงถึงความพึงพอใจของผู้ใช้บริการเป็นสำคัญ
ขอบเขตการให้บริการ
บริการตรวจรักษาพิเศษเฉพาะทางนอกเวลาราชการ ด้านสุขภาพจิตและจิตเวช ที่ไม่มีภาวะวิกฤตฉุกเฉิน โดยทีมสหวิชาชีพ รวมทั้ง บริการทดสอบทางจิตวิทยา (ต้องทำการนัดหมายล่วงหน้าเนื่องจากใช้เวลาในการตรวจรักษา)โดยมีคลินิกเฉพาะโรคเป็นระบบต่าง ๆ ดังนี้
- สุขภาพจิ
- สุขภาพจิตเด็กและวัยรุ่น
- จิตวิทยา
Chiang Mai Charming Night Run 2022 ส่งท้ายปี 31 ธันวาคม 65
งานวิ่งที่คุณรอคอย... กลับมาแล้ว เปลี่ยนคืนข้ามปี...ให้มีสีสัน... กับไนท์รัน ที่ให้คุณได้มันส์แบบ ชิลล์...แชะ...รัน พร้อมนับถอยหลังกับแสงสีเสียงสุดอลังการในค่ำคืนสิ้นปี พบกับมินิมาราธอนระยะทาง 5 กิโลเมตรเบาๆ ที่จะวิ่งก็ได้ เดินก็ดี รออัพเดตข้อมูลเพิ่มเติมที่
fb/charmingchiangmaiflowerfestival31 ธ.ค.จีนอนุมัตินำเข้าโมลนูพิราเวียร์แล้ว
เมื่อวันศุกร์ (30 ธ.ค.) สำนักงานบริหารเวชภัณฑ์แห่งชาติจีน เปิดเผยการอนุมัติพิเศษและการอนุมัติแบบมีเงื่อนไขเพื่อการจดทะเบียนนำเข้าโมลนูพิราเวียร์ (Molnupiravir) ยารักษาโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (โควิด-19) ของเมิร์ก แอนด์ โค (Merck & Co)
โมลนูพิราเวียร์เป็นยาชนิดรับประทานที่มีโมเลกุลขนาดเล็ก สำหรับผู้ป่วยวัยผู้ใหญ่ที่มีอาการของโรคโควิด-19 ระดับเล็กน้อยถึงปานกลาง และมีความเสี่ยงสูงที่จะเกิดอาการป่วยหนัก รวมถึงผู้ป่วยโรคโควิด-19 ที่เป็นผู้สูงอายุ น้ำหนักเกิน หรือมีโรคไตเรื้อรัง เบาหวาน โรคหัวใจและหลอดเลือดรุนแรง และโรคปอดเรื้อรัง
ทั้งนี้ สำนักงานฯ ร้องขอผู้ถือครองสิทธิทางการตลาดของยาโมลนูพิราเวียร์ดำเนินการวิจัยที่เกี่ยวข้องต่อไป ปฏิบัติตามข้อกำหนดตามเงื่อนไขต่างๆ ภายในระยะเวลาที่กำหนด และยื่นผลการวิจัยการติดตตามผลต่อเนื่องโดยทันทีมาตรการจากกรมสรรพสามิต 2 มาตรการ - ปรับลดภาษีน้ำมันเครื่องบินไอพ่น และยกเว้นค่าธรรมเนียมอนุญาตสุรา ยาสูบ ไพ่
1. มาตรการปรับลดอัตราภาษีสรรพสามิตสำหรับน้ำมันเชื้อเพลิงเครื่องบินไอพ่นที่นำไปใช้เป็นเชื้อเพลิงสำหรับอากาศยานภายในประเทศ
มีวัตถุประสงค์เพื่อสนับสนุนการท่องเที่ยวและบริการให้มีการฟื้นตัวอย่างต่อเนื่องตามนโยบายของรัฐบาล และบรรเทาผลกระทบการดำเนินธุรกิจของผู้ประกอบอุตสาหกรรมท่องเที่ยวและสายการบินภายหลังสถานการณ์การแพร่ระบาดของ COVID-19 โดยลดอัตราภาษีตามปริมาณของน้ำมันเชื้อเพลิงสำหรับเครื่องบินไอพ่นที่ใช้บินในประเทศ จากลิตรละ 4.726 บาท เหลือลิตรละ 0.20 บาท โดยมีผลบังคับใช้ตั้งแต่วันที่ 1 มกราคม 2566 ถึงวันที่ 30 มิถุนายน 2566
2. มาตรการยกเว้นค่าธรรมเนียมการอนุญาตขายสุรา ยาสูบ และไพ่ ตามพระราชบัญญัติภาษีสรรพสามิต พ.ศ. 2560
มีวัตถุประสงค์เพื่อเป็นการลดภาระของผู้ประกอบการที่ได้รับใบอนุญาตขายสุรา ยาสูบ และไพ่ ให้สามารถฟื้นตัวได้อย่างต่อเนื่องภายหลังสถานการณ์การแพร่ระบาดของ COVID-19 โดยให้สิทธิยกเว้นค่าธรรมเนียมใบอนุญาตขายสุรา ยาสูบ และไพ่ ประเภทที่ 1 และประเภทที่ 2 สำหรับผู้ประกอบการที่ประสงค์จะประกอบกิจการต่อเนื่อง ณ สถานประกอบการเดิม ประเภทใบอนุญาตเดิม ที่ยื่นคำขอระหว่างวันที่ 1 มกราคม 2566 ถึงวันที่ 31 ธันวาคม 2566
ยุคนี้โลกมันหมุนไว ทุกอย่างไปกับคำว่าเจริญ ถ้าเราเอาคำว่าเจริญมาใช้ในทางที่ถูก เราก็จะได้พัฒนาตัวเอง แต่ถ้าเราเอามาใช้ผิดมันก็จะเกิดโทษนั่นแหละ ทุกอย่างเปลี่ยนไป ไม่เที่ยง เป็นไปตามดีมานด์ซัพพลาย หลักสูตรการเรียนการสอนใหม่ๆ ก็คิดค้นมาจากโลกขาดอะไร การศึกษาก็พัฒนาไปตอบรับตรงนั้น เพราะการศึกษามีเพื่อให้มนุษย์ได้เรียนรู้ สำเร็จ และไปใช้ชีวิตต่อ เพื่อพัฒนาตัวเองและประเทศต่อไป
นอกจากนี้ การออกกำลังกายก็มีความสำคัญในการช่วยลดความเสี่ยงในการเกิดมะเร็ง เนื่องจากการออกกำลังกายเป็นหนึ่งในกลไกที่ทำให้ร่างกายมีการใช้พลังงานอย่างเหมาะสม พร้อมทั้งลดโอกาสการเกิดโรคอ้วน และกระตุ้นระบบภูมิคุ้มกันของร่างกายได้ สำหรับผู้ป่วยในช่วงที่ให้ยาเคมีบำบัดหรือรับการรักษาอาจจะรู้สึกอ่อนเพลีย หากวันที่รู้สึกว่าเริ่มฟื้นตัวแล้ว การออกกำลังกายเบา ๆ ถือเป็นการกระตุ้นระบบภูมิคุ้มกันได้ แต่ควรหลีกเลี่ยงการออกกำลังกายในบริเวณชุมชน เนื่องจากมีโอกาสติดเชื้อค่อนข้างสูง
หนุ่มน้อยเจ้าความคิด โอ๊ต- อธิป ถวิลวิทู ผู้ก่อตั้ง Beyond The Spectrum
นายอธิป ถวิลวิทู ผู้ก่อตั้ง Beyond the Spectrum กล่าวว่า คณะทำงานเยาวชนจิตอาสาในนาม Beyond the Spectrum ซึ่งเป็นองค์กรที่จัดตั้งขึ้นโดยไม่หวังผลกำไร มีความมุ่มมั่นและจะไม่หยุดที่จะเป็นส่วนหนึ่งต่อการมีส่วนร่วมในการพัฒนา และสร้างการรับรู้ที่ถูกต้อง ต่อภาวะออทิสติกอย่างต่อเนื่อง พวกเรารู้สึกขอบคุณที่การจัดงานครั้งนี้ได้รับการตอบรับเข้าร่วมงานอย่างดีจากทุกภาคส่วน และจะนำความสำเร็จในวันนี้เป็นพลังในการสานต่อ และสร้างสรรค์กิจกรรมใหม่ๆ เพื่อส่งสริมความก้าวหน้าอย่างยั่งยืนต่อไป
น้องๆๆลองใส่เสื้อเกราะ รังสีเทคนิค ตารางการแข่งขัน
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางเขน
2. เที่ยวใกล้ๆ สั้นๆ ขับรถไป
ในช่วงโควิด-19 ระบาด นักท่องเที่ยวในหลายประเทศนิยมขับรถไปเที่ยว ทริปจึงมักเป็นทริปใกล้ๆ สั้นๆ จากการสำรวจของบริษัทที่ปรึกษาชั้นนำหลายแห่ง จากกลุ่มตัวอย่างกว่า 10 ประเทศ นักท่องเที่ยวเลือกที่จะขับรถไปท่องเที่ยวเอง ด้วยเหตุผล ด้านความปลอดภัยและการรักษาระยะห่างทางสังคม อย่างในกรณีของจีนระยะทางที่คนอยากไปเที่ยวมากที่สุดอยู่ในระยะการขับรถที่มากกว่า 3 ช่ัวโมง (McKinsey) เช่นเดียวกับในกรณีของสหรัฐฯ ที่ผู้ตอบแบบสอบถามกว่า 60% ของผู้ที่จะขับรถไปเที่ยว เลือกที่จะขับรถในรัศมีไม่เกิน 300 ไมค์ หรือ 483 กิโลเมตร ซึ่งผลสำรวจของ Lufthasa ในกลุ่มนักท่องเที่ยวจีน เกาหลีใต้ ญี่ปุ่น พบว่า นักท่องเที่ยว 70% มีแนวโน้มจะไปเที่ยวทริปส้ันๆ ไม่กี่วันในช่วงวันหยุดสุดสัปดาห์มากกว่าสถาบันมะเร็งแห่งชาติ - กิจกรรมวันการดูแลแบบประคับประคองสากล ประจำปี 2563 LINK
กิจกรรมวันการดูแลแบบประคับประคองสากล ประจำปี 2563
สถาบันมะเร็งแห่งชาติ จัดกิจกรรมวันการดูแลแบบประคับประคองสากล ประจำปี 2563 World Hospice & Palliative Care day 2020 ภายใต้ธีม Palliative care : Its “My Care My Comfort, ดูแลด้วยความห่วงใย ใส่ใจความสุขสบาย” โดยมีนายแพทย์จินดา โรจนเมธินทร์ ผู้อำนวยการสถาบันมะเร็งแห่งชาติ เป็นประธานในพิธี
ภายในงานมีจัดแสดงนิทรรศการให้ความรู้เกี่ยวกับการดูแลผู้ป่วยประคับประคอง บูธกิจกรรมต่างๆ อาทิ ตุง พันผูกใจ โยงใยชีวิติ เป็นต้น พร้อมทั้งรับฟังเสวนาความรู้ในหัวข้อ “My Care My Comfort, ดูแลกาย สบายใจ” จาก พระครูศรีวิรุฬหกิจ วัดอมรคีรี รองประธาน กลุ่มอาสาคิลานธรรม และแพทย์หญิงชุติมา สิมะสาธิตกุล หัวหน้ากลุ่มงานเวชศาสตร์ประคับประคอง ณ ลาน OPD ชั้น 1 อาคารดำรงนิราดูร สถาบันมะเร็งแห่งชาติ เมื่อวันที่ 8 ตุลาคม 2563
Executive River View
ห้องพักส่วนตัว ในบรรยากาศผ่อนคลาย ด้วยวิวโค้งน้ำเจ้าพระยาและคุ้งบางกระเจ้า พื้นที่สีเขียวที่ใหญ่ที่สุดและเป็นปอดของกรุงเทพฯ
พื้นที่ห้อง 31.8 Sq.M.
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- ตู้เย็น
- ไมโครเวฟ
- ทีวี
- อุปกรณ์ในห้องน้ำ
- ตู้เซฟ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 6,000 บาท
- ค่าอาหาร 1,200 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 600 บาท
รวม 11,000 บาท
ศูนย์ตรวจรักษาและผ่าตัดผ่านกล้อง LINK
ศูนย์ตรวจรักษาและผ่าตัดผ่านกล้องกรุงเทพมหานคร
โรงพยาบาลเจริญกรุงประชารักษ์ สำนักการแพทย์
Bangkok Metropolitan Excellence Center (BMEC)
โทร 02-289-7082
คลินิกตรวจรักษาและผ่าตัดผ่านกล้องของศูนย์ BMEC ให้บริการตรวจรักษาโรคทางนรีเวชที่ต้องเข้ารับการผ่าตัดผ่านกล้อง ได้แก่
- เนื้องอกมดลูก
- ถุงน้ำร้งไข่ เยื่อบุโพรงมดลูกเจริญผิดที่
- มดลูกหรือกระบังลมหย่อน
- การทำผ่าตัดแก้หมันโดยการผ่ตัดผ่านกล้อง
โดยการให้คำแนะนำครอบคลุมตั้งแต่
- การตรวจประเมินก่อนทำผ่่าตัดผ่านกล้อง
- การตรวจภายใน
- การตรวจคัดกรองมะเร็งทางนรีเวช
- การตรวจอัลตร้าซาวด์
- การให้คำแนะนำการปฏิบัติตนก่อนและหลังทำผ่าตัดผ่านกล้อง
- การตรวจติดตามหล้งทำผ่าตัด
ศูนย์ BMEC ให้บริการตรวจรักษาแลผ่าตัดผ่านกล้องด้วยทีมแพทย์ผู้เชี่ยวชาญและมีประสบการณ์สูง มีเครื่องมือที่ทันสมัยครบถ้วนและพร้อมใช้งาน ทั้งนี้ ศูนย์ BMEC ยังเป็นสถาบันฝึกอบรมแพทย์และพยบาลผ่าตัดผ่านกล้องทางนรีเวช ซึ่งเปิดฝึกอบรมแพทย์ จนถึงปัจจุบันเป็นรุ่นที่ 12 แล้ว โดยมีแพทย์จาก โรงพยาบาลรัฐและเอกชน เข้ารับการฝึกอบรมเป็นจำนวนมาก รวมทั้งเปิดฝีกอบรมพยาบาลผ่าตัดผ่านกล้องเป็นรุ่นที่ 6 แล้ว
บริการผู้ปวยใน : การจองห้องพิเศษ LINK
ผู้ป่วยที่ประสงค์จะนอนห้องพิเศษ กรุณาติดต่อจองห้องล่วงหน้าหรือจองได้ในวันที่พบแพทย์ตามวัน เวลา ดังนี้
สถานที่ แผนกรับผู้ป่วยใน ศูนย์ประสานบริการผู้ป่วย (ในวันจันทร์-วันศุกร์)
สิทธิประโยชน์
- สิทธิเงินสด
- สิทธิ์ประกันสังคม
- สิทธิ์ประกันต้น
ค่าใช้จ่ายสำหรับผู้เข้าพักเพิ่มเติมราคา 32,000 บาทสุทธิต่อผู้ใหญ่ 1 ท่านและ 25,000 บาทสุทธิต่อเด็ก 1 ท่าน (ต่ำกว่า 12 ปี) เข้าพักต่อห้องสูงสุดไม่เกิน 2 ท่านต่อ 1 ห้องหรือผู้ใหญ่ 2 ท่านและเด็ก 1 ท่านหากเข้าพักในห้องสูท ราคาห้องสูท Ultra Savvy suite สำหรับ 2 ท่านรวมบริการตรวจทางการแพทย์และอาหารทุกมื้อ ผู้เข้าพักต้องจ่ายเต็มจำนวนในขั้นตอนการจองห้องพัก กรุณาดูข้อกำหนดและเงื่อนไขอื่น ๆ เพิ่มเติม
ด้วยทำเลทองใจกลางถนนสุขุมวิท โรงแรมอลอฟท์ กรุงเทพพร้อมต้อนรับทุกท่านกลับบ้านอย่างอบอุ่น มีสไตล์ ให้บริการห้องพักและห้องสูทพร้อมเทคโนโลยีทันสมัย สิ่งอำนวยความสะดวกครบครันและอาหารรสเลิศ ปลอดภัยด้วยมาตรฐานการดูแลด้านสุขภาพระดับสากลโดยโรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนลซึ่งเป็นโรงพยาบาลคู่สัญญาที่พร้อมดูแลและให้คำปรึกษาตลอดระยะเวลาในการเข้าพักของท่าน
ดูรายละเอียดแพ็กเกจกักตัวทางเลือกหรือ ASQ ต่าง ๆ ของโรงแรมอลอฟท์ กรุงเทพ สุขุมวิท ได้ที่
http://bit.ly/ASQAloftBangkok หากต้องการจองแพ็กเกจ กรุณาติดต่อคุณอุมาพร โทรศัพท์ 095 391 0824 คุณวิศรุดา โทรศัพท์ 081 334 3093 โทรศัพท์ 02 207 7000 หรืออีเมล reservations.aloftbkk@alofthotels.com
##
เกี่ยวกับโรงแรมอลอฟท์ กรุงเทพ - สุขุมวิท 11
อลอฟท์ กรุงเทพ สุขุมวิท 11 เป็นอีกหนึ่งที่พักใจกลางเมืองที่มีเอกลักษณ์ในกรุงเทพ เมืองที่เป็นจุดหมายปลายทางของการเดินทาง โรงแรมของเราให้บริการห้องพักและห้องสวีทที่ได้รับแรงบันดาลใจจากล็อฟท์สไตล์ เน้นความโล่งโปร่งสบาย คงไว้ซึ่งโครงสร้างเดิมของอาคาร เน้นคุณสมบัติที่ชาญฉลาดทางด้านเทคโนโลยี อินเทอร์เน็ตไร้สาย และทิวทัศน์มุมกว้างของกรุงเทพ ทำเลทองของเราบนถนนสุขุมวิททำให้ซอย 11 อยู่ใกล้แค่เอื้อม นอกจากนี้คุณยังสามารถใช้บริการรถตุ๊กตุ๊กรับส่งฟรีไปยังสถานีรถไฟฟ้าบีทีเอสนานาและสถานีรถไฟใต้ดิน MRT เพื่อเดินทางไปยังสถานที่ท่องเที่ยวที่มีชื่อเสียงต่าง ๆ ในกรุงเทพได้ การเดินทางมาหาเราเป็นเรื่องง่าย - มาโดย BTS นานาทางออก 3 รถตุ๊กตุ๊กรับส่งฟรี พร้อมที่จอดรถฟรี หรือแท็กซี่ ดูข้อมูลเพิ่มเติมได้ที่
www.aloftbangkoksukhumvit11.com
รายละเอียดเพิ่มเติมกรุณาติดต่อ
ซันเดย์ เตรียมพร้อม กลิ่นหอม ผู้จัดการแผนกสื่อสารการตลาด
โรงแรมอลอฟท์ กรุงเทพ - สุขุมวิท 11
treamprom.klinhom@marriott.com
โทรศัพท์ 02 207 7060
โทรศัพท์มือถือ 081 717 1494
ไม่แนะนำให้ย้ายบ่อยๆ นะคะ
โดยเฉพาะคนที่เป็นโรคเรื้อรังต้องรักษาต่อเนื่อง เช่น เบาหวาน ความดัน ไขมันในเลือด ไม่ควรย้าย
2. ต้องเป็นผู้มีสิทธิในกรุงเทพมหานคร เท่านั้น
เชียงราย จัด Big Cleaning Day
จังหวัดเชียงราย จัดกิจกรรมทําความสะอาดเมือง Big Cleaning Day ภายใต้รหัส 10101220 (เริ่มตั้งแต่ เวลา 10.00 น. วันที่ 10 เดือน 12 ปี ค.ศ. 2020) โดยความร่วมมือจากทุกภาคส่วน ปฏิบัติการล้างเมืองทั้ง 18 อําเภอ พร้อมนํารถเก็บตัวอย่างชีวนิรภัยพระราชทาน ให้บริการตรวจหาเชื้อ SAR-CoV-2 บริเวณหน้าศาลากลางจังหวัดฯ จํานวน 1 คัน
ที่มา: กระทรวงสาธารณสุข
กลุ่มผู้สัมผัสเสี่ยงต่ำ 139 ราย
กลุ่มผู้สัมผัสเสี่ยงต่ำ 139 ราย แรงงานในตลาดกุ้ง
- สัญชาติไทย 14 ราย
- เมียนมา 125 ราย
อยู่ในระหว่างรอผล
ประกาศจังหวัดนครปฐม ให้คนที่ไปหรือกลับจากเมียนมา ต้องมารายงานตัว
ประกาศศูนย์ปฏิบัติการโควิด-19 จังหวัดนครปฐม ฉบับที่ ๘๔/๒๕๖๓ เรื่อง ให้บุคคลที่มีประวัติการเดินทางไปหรือกลับจากสาธารณรัฐแห่งสหภาพเมียนมาและพื้นที่เสี่ยงตามประกาศศูนย์บริการสถานการณ์แพร่ระบาดของโรคติดเชื้อไวรัสติดเชื้อไวรัสโคโรนา 2019 กระทรวงมหาดไทย(ศบค.มท.) ตั้งแต่วันที่ ๑ พฤศจิกายน ๒๕๖๓ เป็นต้นมา ให้มารายงานตัวต่อเจ้าหน้าที่
3. อุปกรณ์ ในการรักษาภาวะหัวใจ และ/หรือ ปอดล้มเหลวเฉียบพลัน
รายการอุปกรณ์ Extracorporeal Membrane Oxygenator (ECMO) ในการรักษาภาวะหัวใจ และ/หรือ ปอดล้มเหลวเฉียบพลัน โดยประมาณการณ์จำนวนผู้รับบริการตั้งต้นปีที่ 1 จำนวน 300 ราย ขณะที่คาดว่าค่าใช้จ่ายในปีแรกอยู่ที่จำนวน 26 ล้านบาท
ระยะปลอดภัยจากละอองฝอยไอจาม
ระยะปลอดภัยจากละอองฝอยไอจาม
อยู่ห่างระยะ 2 เมตร
เพื่อความปลอดภัยจากละอองฝอยของคนที่ไอจาม
อนุทิน ขอให้กำลังใจผู้ว่าฯ สมุทรสาครติดโควิด ขณะที่ผลตรวจตนเองไม่พบเชื้อ รอตรวจซ้ำ! LINK
รองนายกฯ-รมว.สธ. โพสต์เฟซบุ๊กเผยแพทย์ระบุเป็นผู้เสี่ยงต่ำ เพราะใส่หน้ากากตลอดเวลา แต่เพื่อเข้ามาตรการได้เฝ้าระวังอาการตัวเอง 14 วัน และตรวจหาเชื้อผลเป็นลบ และขอยกเลิกพบปะกับบุคคลต่างๆทั้งหมด
เมื่อวันที่ 28 ธ.ค. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข(สธ.) โพสต์เฟซบุ๊ก อนุทิน ชาญวีรกูล ระบุถึงกรณีผู้ว่าราชการจังหวัดสมุทรสาครติดโควิด-19 ว่า
“ผมทราบข่าวท่านผู้ว่าราชการจังหวัดสมุทรสาครติดเชื้อโควิด เมื่อเช้าวันที่ 28 ธันวาคม
ผมขอให้พวกเราทุกคนให้กำลังใจ และอวยพรให้ท่านผู้ว่าฯวีระศักดิ์ วิจิตรแสงศรี หายป่วยในเร็ววัน
ท่านผู้ว่าฯวีระศักดิ์ เป็นคนทำงานที่ทุ่มเท อดทน เสียสละ ด้วยความรักที่มีต่อประชาชนชาวสมุทรสาคร อย่างจริงใจ
4. ให้คำปรึกษาฟรี การตรวจคัดกรอง COVID-19 ผ่านระบบ Online LINK
พบกับทีมแพทย์โรงพยาบาลราชวิถี ในการให้คำปรึกษาฟรี "การตรวจคัดกรอง COVID-19" ผ่านระบบ Online "ราชวิถี-มีหมอ" สะดวก รวดเร็ว ปลอดภัย ลดความเสี่ยง
ง่ายๆ เพียง 4 ขั้นตอน
- ทำแบบประเมินความเสี่ยงด้วยตนเอง (ตลอด 24 ชั่วโมง) ผ่านช่องทาง https://covid19.rajavithi.go.th
- รับรหัสเข้าพบแพทย์ (เวลา 09.00 - 15.00 น.)
- ติดตั้งแอปพลิเคชันมีหมอ (Me-more)
- ลงทะเบียนและจองคิวเพื่อพบแพทย์จากโรงพยาบาลราชวิถี
แพทย์จะทำการตรวจผ่านระบบออนไลน์ ทุกวันจันทร์-ศุกร์ เวลา 09.00-15.00 น.
ปรึกษาปัญหาสุขภาพ โทร 02 206 2900 ต่อ 50432 หรือ 50433
4.วัคซีนของจีน บริษัท Sinova
เป็นวัคซีนเชื้อตาย ใช้หลักการกับวัคซีนที่ทำมาแต่ในอดีต เช่น วัคซีนตับอักเสบเอ วัคซีนโปลิโอ พิษสุนัขบ้า ฉีด 2 ครั้ง ห่างกัน 2-4 สัปดาห์ เก็บในอุณหภูมิตู้เย็น
ข้อดี ความปลอดภัย เป็นเชื้อตายสามารถให้ในคนที่มีภูมิคุ้มกันบกพร่องได้ ภูมิคุ้มกันต่ำ
อาการข้างเคียง พบเกิดอาการข้างเคียงรุนแรงในการทดลอง ยังไม่มีรายงาน
คลังเลือด รพ.บุรีรัมย์ ขอรับบริจาคเลือด ทุกหมู่ จำนวนมาก LINK
คลังเลือด รพ.บุรีรัมย์ ขอรับบริจาคเลือด ทุกหมู่เลือด เป็นจำนวนมาก + ตารางออกหน่วย มค 2564
สามารถบริจาคได้ที่
โรงพยาบาลบุรีรัมย์ อาคารเฉลิมพระเกียรติ ชั้น 5
กลุ่มงานเทคนิคการแพทย์ ห้องบริจาคโลหิต (504)
จันทร์-ศุกร์ 8-20 น.
วันหยุด-นักขัตฤกษ์ 8-16 น.
โทร 044 615 002
ตารางออกหน่วยรับบริจาคโลหิตเคลื่อนที่ รพ.บุรีรัมย์ มกราคม 2564
7 มกราคม อำเภอบ้านกรวด
12 มกราคม อำเภอประโคนชัย
13 มกราคม อำเภอแคนดง
19 มกราคม อำเภอคูเมือง
20 มกราคม โรงเรียนภัทรบพิทร
21 มกราคม กองกำกับการตำรวจภูธรบุรีรัมย์
28 มกราคม อำเภอลำหานทราย
29 มกราคม โรงงานวิก
งานธนาคารเลือด รพ.ธรรมศาสตร์เฉลิมพระเกียรติ์ LINK
งานธนาคารเลือด โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ์
- ร่วมกันบริจาคโลหิต ได้ทุกวัน ทั้งวันหยุดและวันนักขัตฤกษ์ ณ.อาคารพลังใจ ภายในโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ เราเปิดให้บริการทุกวัน 8:30-15:30 น. (ไม่หยุดพักเที่ยง)
- ขอเชิญร่วมบริจาคโลหิต ทุกวันอาทิตย์ที่ 2 และ 4 ของเดือน ณ.ศูนย์การค้าฟิวเจอร์ปาร์ค รังสิต ชั้น 3 โซนกวดวิชา
งานธนาคารเลือด โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ
สังกัดเหล่ากาชาดจังหวัดปทุมธานี
ปฏิบัติงานเป็นเครือข่ายศูนย์บริการโลหิตแห่งชาติ สภากาชาดไทย
ติดต่อสอบถามข้อมูล
ถ้าต้องการจัดกิจกรรมรับบริจาคโลหิตนอกสถานที่
โทร 02-926-9123
ผู้ประสานงาน
dr.nichcha.p@gmail.com
ID Line : jaajajaja1702
บริจาคโลหิตได้ที่ โรงพยาบาลชุมพรเขตรอุดมศักดิ์ LINK
บริจาคโลหิตได้ที่ โรงพยาบาลชุมพรเขตรอุดมศักดิ์ งานธนาคารเลือด
อาคารผ่าตัดชั้น 1
เปิดบริการทุกวัน ไม่เว้นวันหยุดราชการ
ช่วงเช้าเวลา 08.30 น. ถึง 11.30 น.
และช่วงบ่ายเวลา 13.00 น. ถึง 15.30 น.
โทร 077-503672 ต่อ 151
ด่วน รพ.ลำพูน เลือดสำรองขาดแคลนหนักมาก LINK
ด่วน โรงพยาบาลลำพูนเลือดสำรองขาดแคลนหนักมาก
ขอเชิญผู้มีสุขภาพสมบูรณ์ แข็งแรง ไม่ได้อยู่ในสถานที่เสี่ยงต่อการแพร่เชื้อโควิด
ร่วมบริจาคโลหิต ได้ที่ห้องรับบริจาคโลหิต โรงพยาบาลลำพูน ตึก 60 ปี ชั้น 2
เปิดบริการทุกวัน ถึง 2 ทุ่ม
สอบถามโทร 053-569187 ต่อ 23 , 095-6909943
เชิญชาวชลบุรี ร่วมบริจาคโลหิตได้ที่ งานคลังเลือด รพ.ชลบุรี LINK
เชิญชาวชลบุรี ร่วมบริจาคโลหิต เนื่องจากขณะนี้โลหิตสำรองมีน้อย แต่มีผู้ป่วยต้องการใช้โลหิตในการผ่าตัด และรักษาจำนวนมาก ขอเชิญร่วมเป็นส่วนหนึ่งในการรักษาผู้ป่วยด้วยการบริจาคโลหิต ส่วนท่านใดที่ต้องการบริจาคเกล็ดเลือด แจ้งความประสงค์ได้ อาจได้รับการพิจารณาบริจาคในทันที่เพราะมีความต้องการจำนวนมาก !!!
บริจาคโลหิตได้ที่ งานคลังเลือด กลุ่มงานเทคนิคการแพทย์ ตึกเฉลิมราชสมบัติชั้น 3 โรงพยาบาลชลบุรี
เวลาราชการ 8.00-15.30 น.
วันหยุดราชการและหยุดนักขัตฤกษ์ เวลา 8.30-15.30 น.
โทร 038931458
ธนาคารกรุงไทย
ธนาคารกรุงไทย
แจ้งเปลี่ยนแปลงเวลาปิดทำกรสาขาในห้างสรรพสินค้า
เนื่องจากสถานการณ์ COVID-19
กรุงไทยขอแจ้งเปลี่ยนแปลงเวลาปิดทำการสาขาดังนี้
- สาขาในห้งๆ ที่อยู่ในพื้นที่ควบคุมสูงสุด 28 จังหวัด ปิดทำการเวลา 18.00 น.
- สำหรับจังหวัดนนทบุรี ระยอง และ สมุทรปราการปิดทำการเวลา 17.00 น.
- ยกเว้น สาขาบิ๊กซี มหาชัย และเซ็นทรัลพลาซา มหาชัย ปิดทำการ จนกว่าจะมีคำสั่งเปลี่ยนแปลง
เมื่อ A เดินทางไปพบ C เราสามารถระบุได้ว่ากลุ่ม C คือใคร มีจำนวนเท่าใด ด้วยการสอบถาม ทำให้กลุ่ม C ได้รับการกักตัวเฝ้าระวัง
3. ศึกษาโดยละเอียดว่า ผลตรวจโควิด ที่ต้องการนั้น เป็นข้อกำหนดของใคร?
3. ศึกษาโดยละเอียดว่า ผลตรวจโควิด ที่ต้องการนั้น เป็นข้อกำหนดของใคร? อาทิเช่น
- ข้อกำหนดของสายการบิน
- ข้อกำหนดของประเทศทางผ่าน
- ข้อกำหนดของประเทศปลายทาง
ซึ่งรายละเอียดสามารถหาได้ที่
- เว็บไซต์ของสถานฑูตประเทศปลายทาง ที่ตั้งอยู่ในไทย
- เว็บไซต์ของกระทรวงต่างประเทศไทย ของประเทศปลายทาง
Maximum controlled area (1 province)
Maximum controlled area (1 province): Samut Sakhon remains classified under this area.
Reopening with strict disease control measures allowed for:
- Markets and flea markets.
- Restaurants and eateries, but must close at 21.00 Hrs., and no alcoholic drinks.
- Shopping centres and department stores, but must close at 21.00 Hrs.
- Nurseries and elderly care centres for residents.
- Hotels with visitor contact tracing systems.
Closure orders remain in place for:
- Entertainment venues of all types including pubs, bars and karaoke shops.
- Boxing stadiums and indoor fitness clubs.
- Fighting cock-bull-fish venues and similar racetracks and amulet centres.
- Bath and massage parlours, spas, and Thai traditional massage shops.
- Educational institutions of all levels.
- Playgrounds, amusement parks, game arcades and Internet shops.
- Meeting and banquet activities and venues, cultural events with mass gathering, and trade fairs.
- Public transport terminals.
มีโรงพยาบาลหลังสวน จ.ชุมพร โรงพยาบาลภูสิงห์ จ.ศรีสะเกษ โรงพยาบาลชุมแพ จ.ขอนแก่น โรงพยาบาลท่าสองยาง จ.ตาก และโรงพยายาลพระปกเกล้า จ.จันทรบุรี
ไอศครีมหลากรส
ไอศครีมหลากรส
เครื่องดื่มและขนมร้าน Kanomsiam
เครื่องดื่มและขนมร้าน Kanomsiam
มีหลายสาขาในดังอย่าง สยามพารากอน สวนเพลินมาเก็ต และเอ็มควอเทียร์
ศ.พญ.กุลกัญญา โชคไพบูลย์กิจ
แพทย์ผู้เชี่ยวชาญศูนย์เด็ก (โรคติดเชื้อ) โรงพยาบาลศิริราช ปิยมหาราชการุณย์
อย่างที่ทราบกันว่า วัคซีนยิ่งใช้มาก จะยิ่งมีรายงานเข้ามามากเป็นธรรมดา โดยเฉพาะในประเทศที่มีระบบรายงานที่เข้มข้น เป็นน้อยเป็นมากก็รายงาน ยิ่งเป็นมากยิ่งต้องรายงาน เป็นที่ทราบกันดีแล้วว่า โรคทุกโรคที่รายงาน ไม่ว่าจะเป็นอาการแข็งตัวของเลือดผิดปกติ หรือระบบการมองเห็น ตามัว โรคเหล่านี้ เป็นโรคที่มีอยู่แล้ว และเกิดขึ้นเป็นประจำอยู่แล้ว ไม่ว่าจะมีหรือไม่มีวัคซีนก็ตาม ดังนั้นเมื่อมีการฉีดวัคซีน ในปริมาณถึง 30 กว่าล้านโดส ในเวลาอันรวดเร็ว ย่อมหลีกเลี่ยงไม่ได้ที่อาจจะพบลักษณะที่เรียกว่า temporal relation คือการฉีดในระยะเวลาใกล้ๆกับที่โรคบางโรคกำลังก่อตัวขึ้นมา แต่ในขณะเดียวกัน ก็ต้องมีความจำเป็นที่จะต้องระมัดระวัง เพราะไม่ว่าเมื่อใดก็ตามหรือมีเหตุการณ์ใดก็ตามเกิดขึ้นใกล้เคียงกับการฉีดวัคซีน ก็จำเป็นต้องมีการสืบสวนสอบสวนอย่างละเอียด ก่อนจะฟันธงออกมาว่าเกี่ยว/ไม่เกี่ยวกับวัคซีน อย่างเช่นที่ท่านอ.ยงได้กล่าวถึงตัวอย่างรายงานการเสียชีวิต ยกตัวอย่างเช่นในผู้สูงวัย ซึ่งเป็นกลุ่มเสี่ยงของโควิด และเป็นกลุ่มเป้าหมายที่จะต้องฉีดวัคซีน ทุกๆวันก็จะต้องมีผู้สูงวัยเสียชีวิต ซึ่งเป็นเหตุการณ์ธรรมชาติ ดังนั้นเมื่อมีการฉีดวัคซีน ทุกวันๆ ก็ย่อมจะมีเหตุการณ์ที่เผอิญไปใกล้เคียงกับจังหวะเวลาที่ท่านเสียชีวิตพอดีด้วยเหตุการณ์ต่างๆ อันนี้ก็เช่นกัน ดังนั้นจึงต้องมีการสืบสวน และในการสืบสวนทุกครั้งที่ผ่านมาก็สร้างมั่นใจให้กับการใช้วัคซีนมากขึ้น ว่ามันไม่เกี่ยวกัน อันนี้ก็เป็นอีกเหตุการณ์นึงที่จำเป็นต้องมีการสืบสวนเช่นกัน เผอิญว่าเป็นจังหวะเดียวกันกับที่เรากำลังเริ่มมีการใช้วัคซีน ดังนั้นก็ถือว่าเป็นความระมัดระวังที่ดีเยี่ยม เพื่อที่จะได้มั่นใจในข้อมูล และรอข้อมูลสืบสวนให้เสร็จสิ้นก่อนที่จะเริ่มประกาศใช้
อยากเรียนให้ทุกท่านสบายใจว่า ในคณะผู้เชี่ยวชาญทั้งหลาย เมื่อฟังเหตุการณ์แล้ว ก็คิดตรงกันว่าไม่น่าจะเกี่ยวกับวัคซีน เพราะเหตุการณ์ภาวะแข็งตัวของหลอดเลือดผิดปกติ ไม่ใช่เหตุการณ์ที่เป็นผลข้างเคียงของวัคซีนที่เคยพบมาในอดีตของการใช้วัคซีนต่างๆ ในโลกนี้เลย ไม่ว่าจะในวัคซีนไข้หวัดใหญ่ เด็กๆ เล็กๆ ตั้งแต่เกิดจนกระทั่งโต ที่ได้รับทั้งวัคซีน คอตีบ บาดทะยัก ไอกรน โปลิโอ วัคซีน(ไวรัส)ตับเอ ตับบี มากมาย เหตุการณ์ที่เลือดแข็งตัวผิดปกติ ไม่เคยเป็นปัญหาของวัคซีนใดๆ มาก่อนเลย ไม่ว่าจะเป็นวัคซีนชนิดมีชีวิตหรือไม่มีชีวิต เมื่อเกิดเหตุการณ์ที่กังวลใจที่เผอิญอาจเกิดใกล้กัน จึงต้องสืบสวนไว้ก่อน นับว่าเป็นสิ่งดี ทั้งนี้ในหมู่นักวิชาการก็แทบจะพูดเป็นเสียงเดียวกันว่าไม่เกี่ยวกัน แต่เราก็จะไม่บอกก่อนจนกว่าผลสืบสวนจะออกมา
อีกอันที่สำคัญคือระบบการเฝ้าระวังอาการข้างเคียงหลังได้รับวัคซีน เป็นระบบที่อาจจะสร้างความกังวลให้หลายคน แท้จริงแล้วเป็นระบบที่ทำให้เรามั่นใจและปลอดภัยสูง ในประเทศไทยเราก็มี ทั้งซิโนแวคและแอสตร้าเซนเนก้า โดยกระทรวงสาธารณสุขและอย. ผ่านทาง
แอป หมอพร้อม ฉีดแล้วมีอาการใดๆ ก็ตาม รายงานเข้ามาด้วยตัวเองได้ และทางสถานพยาบาลได้มีการจัดระบบที่จะสังเกตอาการหลังฉีด และรายงานภาวะใดๆ ที่มีความผิดปกติหลังฉีด พร้อมคณะผู้เชียวชาญ ที่จะลงตรวจในรายละเอียดว่าเกี่ยวหรือไม่เกี่ยวกับวัคซีน ไม่เฉพาะวัคซีนตัวนี้ แต่ทุกๆวัคซีนที่จะนำมาใช้ อยากให้ทราบว่าระบบหลังบ้านของเราดีงามและเข้มแข็ง ทางฝั่งยุโรปเขาเข้มแข็งมานานแล้ว จึงได้มีรายงานเช่นเหล่านี้มา การที่หยุดชั่วคราว นั้นเกิดบ่อยๆ เป็นเรื่องปกติ ในประเทศไทยเราก็ทำมาในหลายวาระ ที่ผ่านมาทั้งในไทยและทั่วโลก ไม่พบว่าเหตุการณ์รุนแรงเกิดจากวัคซีน
การตอบรับเป็นอย่างไรบ้าง
ดีเกินคาด จากเมื่อก่อนที่ร้านจะมีแต่เด็กๆ วัยรุ่น ตอนนี้มีกลุ่มผู้ใหญ่และผู้สูงอายุเข้ามาเยอะมาก เพราะพวกเค้ามองว่ากัญชาสำหรับพวกเค้าคือยาชนิดนึง ทำให้ยอดขายเพิ่มขึ้น 200%ใครปลูกกัญชงได้บ้าง?...ตามกฎกระทรวงฯ เฉพาะกัญชง พ.ศ. 2563 ซึ่งประกาศในราชกิจจานุเบกษาเมื่อวันที่ 30 ธ.ค. 63 และมีผลบังคับใช้ตั้งแต่ 29 ม.ค. 64
Chiiwii ปรึกษาหมอออนไลน์
Chiiwii ช่วยดูแลคุณและคนที่คุณห่วงใย ด้วยบริการปรึกษาปัญหาสุขภาพกับคุณหมอผู้เชี่ยวชาญ ผ่านวีดีโอคอล โทร และแชทภายในแอพฯ
เรามีคุณหมอหลากหลายสาขาให้คุณเลือกเองได้ เหมือนมีคุณหมอเป็นเพื่อนคู่ใจเรื่องสุขภาพให้คุณถึงที่บ้าน อาทิ
- สุขภาพเพศหญิง/โรคติดต่อ
- การเตรียมตัวเป็นคุณแม่ ดูแลสุขภาพคุณแม่และลูกน้อย
- พัฒนาการและพฤติกรรมเด็ก
- สุขภาพจิตเด็กและวัยรุ่น และสุขภาพจิตผู้ใหญ่และผู้สูงอายุ
- โรคผิวหนัง และ เสริมความงาม
- โภชนาการ ดูแลสุขภาพทั่วไป อาหารเสริม การออกกำลังกาย โรคกระดูกและข้อ
- น้ำตาลในเลือดสูง ไขมันในเลือดสูง ความดันโลหิตสูง ไทรอยด์
ใช้งานสะดวก เป็นส่วนตัวด้วยการสนทนาแบบรายบุคคล
เพียงสมัคร ค้นหาคุณหมอ และทำนัดจากตารางเวลา ตามที่คุณและคุณหมอสะดวก
แล้วเลือกวิธีรับคำปรึกษา เช่น วีดีโอคอล โทร หรือแชทผ่านแอพ
มีระบบแจ้งเตือนก่อนเวลานัด เพื่อไม่ให้คุณพลาดการรับคำปรึกษา
ชำระเงินผ่านบัตรเครดิตแบบออนไลน์ สะดวกและปลอดภัย หรือโอนเงิน
แล้วมาคุยกับคุณหมอส่วนตัวของคุณกันนะคะ ไม่ต้องรอให้ป่วย
ที่ Chiiwii เราใช้ใจดูแลใจ
หากต้องการสอบถามข้อมูลเพิ่มเติมด้านการใช้งาน
สามารถติดต่อทีมงาน Chiiwii ได้ที่ โทร 064-5850232 (08:00 - 20:00 น.)
อีเมล contact@chiiwii.com ไลน์ไอดี @chiiwii
ปทุมธานี งดจัดงานประเพณีสงกรานต์ ประจำปี 2564
บุรีรัมย์ - มาจาก 7 จว. ตรวจ Rapid test หรือ กักตัว 14 วัน LINK
1.ผู้ที่มาจากจังหวัด กรุงเทพมหานคร ปทุมธานี สมุทรปราการ นครปฐม นนทบุรี ชลบุรี และเชียงใหม่ ให้ดำเนินการดังนี้
- กรอกแบบคำถามสุขภาพ ต.8 บร. และหรือแอพพลิเคชั่นที่ทางราชการกำหนด (ไทยชนะ หมอชนะ) และไปรายงานตัวกับผู้ใหญ่บ้าน/ประธานชุมชน อสม. หรือศูนย์คัดกรอง COVID-19 ประจำหมู่บ้าน
- เข้ารับการตรวจ Rapid Antigen Test ในกรณีที่ อสม.หรือศูนย์โควิดประจำขุมชนคัดกรองแล้วว่ามีความเสี่ยงสูง
- หากความเสี่ยงต่ำ และไม่จำเป็นต้องตรวจ Rapid test ทาง โรงพยาบาลจะออกเอกสารรับรองว่าได้ดำเนินการสอบสวนโรคแล้ว และสามารถกลับภูมิลำเนาของตนได้
2.เดินทางด้วยเครื่องบินผ่าน ตรวจที่สนามบิน ‼️
3.รถไฟ รถส่วนตัว รถโดยสาร ตรวจที่ โรงพยาบาลของรัฐในอำเภอที่ท่านเดินทางมา ‼️
กรุณาติดต่อ รพ.ก่อนการเดินทาง
- กรณีตรวจแล้วพบเชื้อ ให้ตรวจยืนยันทางห้องปฏิบัติการที่โรงพยาบาลบุรีรัมย์อีกครั้งด้วยวิธี RT-PCR
- กรณีไม่พบเชื้อ ขอให้คำนึงถึงมาตรการ สวมแมส เว้นระยะห่าง ล้างมือ และตรวจวัดอุณหภูมิของตนเองอย่างสม่ำเสมอ เลี่ยงการเข้าไปในพื้นที่ชุมชนที่มีคนหมู่มาก
4.หากไม่ประสงค์จะตรวจหาเชื้อ ต้องกักตัว 14 วัน หรือ เมื่อกักตัวครบ 7 วันแล้ว ให้ทำการตรวจหาเชื้อ
5.ผู้ที่เดินทางมาจากจังหวัดอื่นๆ นอกเหนือจาก 7 จังหวัดข้างต้น ไม่ต้องกักตัวหรือตรวจหาเชื้อ COVID-19
หากต้องการตรวจมีค่าใช้จ่าย 600 บาท
เพจ
สสจ บุรีรัมย์ โทร 044 611 562
รพ. บุรีรัมย์ โทร 044 615 002
ป้องกันการติด โควิด-19 แบบ Swiss Cheese ด้วยตนเอง LINK
การป้องโควิด-19 แบบ Swiss Cheese คือ การลดช่องโหว่ที่ทำให้มีโอกาสติดเชื้อด้วยการนำวิธีป้องกันต่าง ๆ ที่มีอยู่แล้ว
เช่น การสวมหน้ากากอนามัย การล้างมือ มารวมซ้อนกับแนวทางป้องกันอื่น ๆ เช่น ลดระยะเวลาเสียงสัมผัสเชื้อในพื้นที่แออัด ซึ่งจะช่วยลดโอกาสผิดพลาดในการติดเชื้อได้มากขึ้น
ตัวอย่าง การป้องกันแบบ Swiss Cheese ด้วยตนเองที่เห็นได้ชัด คือ การใส่หน้ากากอนามัย การล้างมือ และการลดระยะเวลาในการที่จะไปสัมผัสเชื้อ (exposure time) ในสถานการณ์ดังต่อไปนี้
การเดินทางในระบบขนส่งสาธารณะ โดยเฉพาะรถโดยสารสาธารณะที่แออัด ไม่ควรใช้วลาอยู่ในนั้นนาน ๆ
ไม่พูดคุยในลิฟต์ ควรสวมหน้ากากอนามัย และลดการสัมผัสในลิฟต์ หากต้องกดปุ่มในลิฟต์ให้ใช้แอลกอฮอล์เจลทำความสะอาดมือ
สถานที่ที่คนหนาแน่น และการระบายอากาศไม่ดี เช่น ห้างสรรพสินค้า ควรใช้เวลาทำธุระให้สั้นที่สุด
การเดินทางด้วยเครื่องบิน ควรวนระยะห่างช่วงรอขึ้นหรือลงเครื่อง สวมหน้ากากอนามัยตลอดเวลา พร้อมกับเช็กอินจุดที่เดินทางเข้า-ออก และพกแอลกอฮอล์เจลติดตัวเป็นประจำ
ข้อมูล ณ วันที่ 4 มกราคม 2564
ที่มา : ผศ. นพ.โอภาส พุทธเจริญ
7-11 ในสนามบิน Copenhagen Airport (CPH) (Kastrup, Denmark) เห็นแล้วรู้สึกเหมือนได้อยู่ใกล้บ้าน
ใครมีสิทธิ์ตรวจ โควิด19 ฟรี
Ventilator แบบแยกจอ ทำให้แพทย์ดูแลผู้ป่วยได้สะดวก และมีความปลอดภัยมากขึ้น
*ภาพจากเพจ รพ.นครพิงค์ 3.2 หากไม่ทราบสิทธิ์การรักษา สามารถตรวจสอบได้ที่ QR Code นี้ หรือ
กดลิงค์นี้ แนวทางการตรวจคัดกรองโรคติดเชื้อโควิด-19
3.1 ถ่ายภาพเอกสารยืนยันที่อยู่ กรณีที่อยู่ปัจจุบันไม่ตรงกับบัตรปชช.
สำหรับกรณีที่อยู่ปัจจุบันไม่ตรงกับบัตรปชช. (เช่น ทำงานต่างจังหวัด หรืออยู่ต่างจังหวัดมาทำงานกรุงเทพ ฯลฯ) ต้องแสดงเอกสารที่บอกว่าตัวเองอยู่ที่ใด
เอกสารที่ใช้ได้ เช่น
- บิลค่าไฟฟ้า
- บิลค่าน้ำ
- หนังสือรับรองเจ้าบ้าน หรือ บ้านเช่า
ถ่ายแล้วแนบไป ช่องที่ 3 (ตามภาพ)
ขั้นที่ 3 : ผสานขั้นที่ 1 และ 2 เข้าด้วยกัน
การฝึกโดยผสานขั้นตอน 1 และ 2 เข้าด้วยกัน ดังนี้
1. วางมือลงบนหน้าอกและหน้าท้อง
2. หายใจเข้า ให้ทั้งหน้าอกและหน้าท้องพองออก
3. หายใจออกเป่าปาก พร้อมให้หน้าอกและหน้าท้องยุบลง
4. ทำช้าๆ ในจังหวะที่รู้สึกสบาย อาจทำซ้ำประมาณ 10-20 รอบต่อครั้ง
การฝึกหายใจด้วยวิธีนี้ สามารถทำได้บ่อยๆ ถ้าทำได้ทุกชั่วโมงจะยิ่งเป็นผลดี ขอให้ทุกท่านปอดขยาย หายเหนื่อ อาการดีขึ้นโดยเร็ว
ZEN GROUP รับฟรี‼️ ทาโกะยากิ 1 ที่ LINK
We are Vaccinated สร้างภูมิคุ้มกันหมู่กู้วิกฤติ
ZEN GROUP สนับสนุนคนไทย ฉีดวัคซีนช่วยชาติ
รับฟรี‼️ ทาโกะยากิ 1 ที่ (มูลค่า 100 บาท)
เพียงแสดงหลักฐานการฉีดวัคชีน และซื้อสินค้าเมนูใดๆ ก็ได้อย่างน้อย 1 เมนู ที่ร้าน ZEN ทุกสาขา
ตั้งแต่วันที่ 18 พ.ค. 64 - 30 มิ.ย. 64 นี้เท่านั้น
การใช้ยาคุมกำเนิดชนิดฮอร์โมน LINK
ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย มีข้อแนะนำเกี่ยวกับการฉีดวัคซีนป้องกันโรค โควิด-19 ในผู้ที่ใช้ยาคุมกำเนิดชนิดฮอร์โมน ดังนี้
1. ยาคุมกำเนิดชนิดฮอร์โมนที่มีเอสโตรเจนเป็นส่วนประกอบ ได้แก่ ยาเม็ด ยาฉีดคุมกำเนิดและแผ่นยาปิดผิวหนังคุมกำเนิด มีผลเพิ่มความเสี่ยงในการเกิดหลอดเลือดดำอุดตันได้มากกว่าผู้ที่ไม่ได้ใช้วิธีการดังกล่าว อย่างไรก็ตามภาวะดังกล่าวพบได้น้อยมากในสตรีไทย และยังพบได้น้อยกว่าในสตรีตั้งครรภ์ซึ่งมีระดับเอสโตรเจนสูงมากตามธรรมชาติ
2. ข้อมูล ณ ปัจจุบัน ซึ่งรวบรวมจากการศึกษาวิจัยเกี่ยวกับการฉีดวัคนป้องกันโรคโควิด-19 ในสตรีทั่วโลกและในประเทศไทย ซึ่งมีผู้ที่ใช้ยาคุมกำเนิดชนิดฮอร์โมนอยู่ด้วยเป็นจำนวนมาก ไม่พบว่ามีการเพิ่มความเสี่ยงในการเกิดหลอดเลือดดำอุดตันแต่อย่างใด
3. ผู้ที่ใช้ยาคุมกำเนิดชนิดฮอร์โมนทุกชนิด สามารถรับการฉีดวัคซีนป้องกันโรคโควิด-19 ได้ โดยไม่จำเป็นต้องหยุดการใช้
4. หากยังมีความกังวลใจ และต้องการหยุดการใช้ยาคุมกำเนิดชนิดฮอร์โมน ควรใช้วิธีการคุมกำเนิดอื่นๆ มาทดแทนเพื่อป้องกันการตั้งครรภ์
ประกาศราชวิทยาลัยสูตินรีแพทย์CDC สหรัฐอเมริกา
สหรัฐเรียกใบรับรองว่า COVID-19 vaccination record card จัดทำเป็นระบบกลาง เรียกว่า Vaccine Administration Management System (VAMS) (แต่มีบางรัฐที่อาจไม่ใช้ระบบนี้) ใช้สำหรับกำหนดวันรับวัคซีน บันทึกการฉีดเข็มแรกและเข็มที่สอง
Ref :
CDC,
V-safe After Vaccination Health Checkerอบจ.อ่างทองประกาศแผนจัดสรรวัคซีนตัวเลือกซิโนฟาร์ม LINK
22 มิถุนายน 2564 องค์การบริหารส่วนจังหวัดอ่างทอง ประกาศแผนการจัดสรรวัคซีนตัวเลือก "ซิโนฟาร์ม" ขององค์การบริหารส่วนจังหวัดอ่างทอง ตามมติเห็นชอบของคณะกรรมการโรคติดต่อจังหวัดอ่างทอง กำหนดให้ 5 กลุ่ม
1.อาชีพบริการ เช่น ส่งอาหาร ตลาดสด ตลาดนัด ขนส่งสาธารณะ และประชาชนทั่วไป 60%
2.บุคคลากรทางการศึกษา ครู อาจารย์ 16%
3.ผู้ด้อยโอกาส พิการ ยากจน 10%
4.อาสากู้ชีพ กู้ภัย 4%
5.บุคคลากร อปท. กำนัน ผู้ใหญ่บ้าน 10%
เงื่อนไข
1.อายุตั้งแต่ 18 ปีขึ้นไป
2.มีภูมิลำเนาตามทะเบียนบ้านจังหวัดอ่่างทอง
3.ไม่ได้รับนัดหมายวัคซีนโควิด-19 จากช่องทางอื่นใด
ช่องทางการลงทะเบียนแจ้งความประสงค์รับวัคซีนจะประชาสัมพันธ์ทางเพจ องค์การบริหารส่วนจังหวัดอ่างทอง ต่อไป
นายสุรเชษ นิ่มกุล นายกองค์การบริหารส่วนจังหวัดอ่างทอง ทุ่มงบประมาณกว่า 40 ล้านบาท เพื่อการจัดหาวัคซีนซิโนฟาร์ม (
30 พค 64)
4 แม่ทัพ แห่ง Pride Clinic - (จากซ้ายไปขวา) ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ นพ. สิระ กอไพศาล รศ.นพ. ทวีสิน ตันประยูร นพ. รัฐภรณ์ อึ๊งภากรณ์
การบริหารงานสาธารณสุขของจังหวัดเพชรบุรี พ.ศ.2499
ลักษณะการปฏิบัติงานของแผนกอนามัยจังหวัดเพชรบุรี
1. งานประจำธุรการ ได้แก่ การโต้ตอบหนังสือ เบิกจ่ายเงิน ขายยาตำราหลวง รวบรวมรายงานและสถิติต่างๆ
2. ตรวจแนะนำอนามัยอำเภอ สารวัตรสุขาภิบาลและผดุงครรภ์
3. สำรวจกิจการสาธารณสุขต่างๆ
4. ควบคุมร้ายขายยา สถานพยาบาล
5. ปฏิบัติงานหน่วยแพทย์เคลื่อนที่ตามอนามัยที่กำหนด
6. งานอื่นๆ ที่ได้รับมอบหมาย เช่นตรวจโรคให้ข้าราชการประจำปี อบรมแพทย์ประจำตำบล
ลักษณะการปฏิบัติงานของอนามัยอำเภอ
1. อนามัยอำเภอที่ไม่ได้ปฏิบัติงานในสถานีอนามัยชั้นสองจะทำงานในด้านป้องกันโรค อนามัยโรงเรียนและสุขาภิบาล
2. อนามัยอำเภอที่ปฏิบัติงานที่สถานีอนามัยชั้นสองจะปฏิบัติงานด้านการรักษาพยาบาล การป้องกันโรค อนามัยโรงเรียนและสุขาภิบาล
จากอดีตที่กล่าวถึงข้างต้น สำนักงานสาธารณสุขจังหวัดมีวิวัฒนาการมาโดยตลอด จนถึงยุคปัจจุบัน (ปี 2545) มีการปฎิรูปโครงสร้างของกระทรวงสาธารณสุข, สำนักงานสาธารณสุขจังหวัด, สำนักงานสาธารณสุขอำเภอ, สถานีอนามัย, โรงพยาบาล ใหม่โดย สำนักงานสาธารณสุขจังหวัดเพชรบุรีได้ปรับโครงสร้างตามที่กระทรวงสาธารณสุขได้วางกรอบไว้ ดังนี้
อบจ.เชียงราย เปิดลงทะเบียนผ่าน เชียงรายร่วมใจ LINK
นางอทิตาธร วันไชยธนวงศ์ นายกอบจ.เชียงราย ระบุว่าได้ทำสั่งจองวัคซีนซิโนฟาร์ม 100,000 โดส (มูลค่า 100 ล้านบาท) และรอคำตอบว่าจะได้รับจัดสรรจำนวนเท่าใด วัคซีนชิโนฟาร์มนี้ หากได้มาก็จะนำไปรวมกับวัคซีนตัวอื่นๆ ทั้งซิโนแวค แอสตราเซเนก้า เพื่อจัดสรรให้ประชาชนต่อไป
ชาวเชียงรายที่ต้องการ ต้องลงทะเบียนผ่านแอพ
"เชียงรายร่วมใจ" นายกยืนยันว่าวัคซีนนี้ จะฉีดให้ฟรี ทั้งนี้ขอให้ชาวเชียงรายเข้่าใจว่า จะไม่สามารถเลือกได้ว่าจะรับวัคซีนใด ขึ้นกับคณะกรรมการควบคุมโรคติดต่อจังหวัดเชียงรายเป็นผู้จัดสรร
4 หากติดเชื้อและหอบเหนื่อย ออกซิเจนต่ำกว่า 95%
4 ถ้าตรวจเชื้อแล้วพบว่า "ติดเชื้อ" และมีอาการหอบเหนื่อย หายใจไม่สะดวกหรือวัดออกซิเจนแล้วต่ำกว่า 95% ให้สงสัยว่าอาจเกิดภาวะปอดอักเสบแล้วหรือเชื้อลงปอดแล้ว
ลำพังฟ้าทะลายโจรอย่างเดียวจะไม่สามารถรักษาได้ จำเป็นต้องไปโรงพยาบาลเร็วที่สุด
โดยในระหว่างที่หาโรงพยาบาลไม่ได้ ก็ต้องอาศัยแพทย์แผนไทยผู้มีประสบการณ์ในการใช้ตำรับยา "ปอดพิการ" ตามตำรายาหลวงแพทย์ศาสตร์สงเคราะห์ในสมัยรัชกาลที่ 5 หรือตำรับยาอื่นที่เหมาะสมกับอาการต่อไป
ใบทะเบียนวิสาหกิจ
ใบทะเบียนวิสาหกิจ
จุด Drop Point สถานศึกษา
จุด Drop Point ของ “Youเทิร์น” ที่ตั้งอยู่ภายในพื้นที่ของสถานศึกษา ได้แก่
- คณะทันตแพทยศาสตร์ มหาวิทยาลัยมหิดล จำนวน 1 Drop point
- มหาวิทยาลัยธุรกิจบัณฑิตย์ 4 Drop point (ใช้ภายในมหาวิทยาลัย)
- สถาบันการจัดการปัญญาภิวัฒน์
นนทบุรี
โรงพยาบาลเวิลด์เมดิคอล
วิธีตรวจ : Drive Thru Test
เวลาทำการ : [13:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : 150 คนต่อวัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 028369999
หมายเหตุ
- เริ่มแจกบัตรคิว เวลา 04.00 น. - เปิดตรวจ เวลา 13.00-17.00 น. (ตามเวลาที่กำหนดในบัตรคิว) - ไม่รับตรวจสตรีมีครรภ์ - ตรวจผู้มีอายุตั้งแต่ 5-65 ปี - 1 คน 1 บัตรคิว - ค่าตรวจ 3000 บาท สำหรับคนไทย - ใบรับรอบแพทย์ 650 บาท (สำหรับบุคคลที่ต้องการ)
เลขหมายประจำเขต กรุงเทพใต้
เลขหมายประจำเขต กรุงเทพใต้
ลงทะเบียนฉีดวัคซีน อยุธยาพร้อม
ตรัง ติดต่อ สสอ. รพ. รพ.สต.ใกล้บ้าน พร้อมหลักฐาน LINK
สำนักงานสาธารณสุขจังหวัดตรัง แจ้งประชาสัมพันธ์ สำหรับบุคคลที่ต้องการลงทะเบียนรับวัคซีนป้องกันโรคโควิด-19 เข็มที่2 ในจังหวัดตรัง ให้ดำเนินการดังนี้
1. ติดต่อสำนักงานสาธารณสุขอำเภอใกล้บ้าน ก่อนนัดฉีด 2 สัปดาห์ ยกเว้นอ.เมือง ให้ติดต่อ รพ.สต.หรือศูนย์บริการสาธารณสุขเทศบาลใกล้บ้าน
2. แสดงหลักฐานการนัดฉีดเข็มที่ 2 ของสถานที่ที่รับบริการเข็ม 1 เพื่อนัดวันฉีดใหม่
3.มารับบริการฉีดเข็ม 2 ตามนัดที่ใหม่
รพ.ดอนตูม ฉีดวัคซีนโควิดเข็ม 1 ประชาชนอายุ 18 ปี ขึ้นไป ฉีดวันที่ 24 ส.ค. LINK
โรงพยาบาลดอนตูม กำหนดฉีดวัคซีนโควิด-19
สำหรับ
1. ประชาชนทั่วไปอายุ 18 ปี ขึ้นไป ที่ประสงค์รับวัคซีนเข็มที่ 1*
*อายุ 18 ปีขึ้นไปคือเกิดก่อน 25 ส.ค.46
** อยู่ภูมิลำเนาใดก็ได้
2.ผู้ที่ลงรายชื่อรับวัคซีนไว้กับ
- โรงพยาบาลดอนตูม
- รพ.สต. (สถานีอนามัย)
- อสม. ในเขตของท่าน
- เว็บไซด์จังหวัด(ระบบจองวัคซีนจังหวัดนครปฐม)
ให้มารับการฉีดวัคซีน #ซิโนแวค ในวันที่ 24 สิงหาคม 2564
สถานที่รับวัคซีน ณ วัดสามง่าม
เริ่ม ลงทะเบียน 07.00 น.
ปิด ลงทะเบียน 15.00 น.
เอกสารที่ต้องเตรียม
1.บัตรประชาชน
2.ชาวต่างชาติ : นำบัตรสีชมพูที่มีเลขประจำตัว และ พาสปอรต์
เพื่่อความรวดเร็วของท่าน
ท่านสามารถเตรียมสำเนาบัตรประชาชนพร้อม ระบุ น้ำหนัก ส่วนสูง และเบอร์โทร
สำนักงานเขตบางพลัด ร่วมกับ ศูนย์บริการสาธารณสุข 31 ออกหน่วยเคลื่อนที่บริการฉีด 13-27 กันยายน 64 LINK
สำนักงานเขตบางพลัด ร่วมกับ ศูนย์บริการสาธารณสุข 31 ประชาสัมพันธ์การออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2564 (ครั้งที่2)
กำหนดการและสถานที่ ดังนี้ (เวลา 10-12 น.)
13 กันยายน 2564 - ชุมชนวัดาวดึงษาราม บางยี่ขัน
14 กันยายน 2564 - ชุมชนวัดภคินีนาถ บางยี่ขัน
15 กันยายน 2564 - ชุมชนวัดทอง บางยี่ขัน
16 กันยายน 2564 - ชุมชนริมคลองบางพลัด บางอ้อ
17 กันยายน 2564 - ชุมชนวัดเพลง บางพลัด
20 กันยายน 2564 - ชุมชนโค้งมะขาม บางบำหรุ
21 กันยายน 2564 - ชุมชนมะพร้าวคู่ บางบำหรุ
22 กันยายน 2564 - ชุมชนศาลเจ้าปุงเท่ากง บางพลัด
23 กันยายน 2564 - ชุมชนเติมสุข บางอ้อ
27 กันยายน 2564 - ชุมชนแสงทอง บางอ้อ
ขอความร่วมมือใส่หน้ากากอนามัย ขณะนำสัตว์เลี้ยงมาใช้บริการ เว้นระยห่าง ระหว่างบุคคล และปฏิบัติตามมาตการป้องกันและควบคุมโรคโควิด-19
ไทย ไลอ้อน แอร์ LINK
สายการบินไทย ไลอ้อน แอร์ ขอความร่วมมือผู้โดยสารเตรียมความพร้อมก่อนการเดินทาง ดังนี้
✔️โปรดตรวจสอบมาตรการในการเข้าจังหวัดปลายทาง https://www.moicovid.com/ข้อมูลสำคัญ-จังหวัด/
✔️เตรียมเอกสารการฉีดวัคซีนโควิด-19 หรือ เอกสารรับรองผลตรวจคัดกรองเชื้อโควิด-19 โดยวิธี RT-PCR หรือ Antigen Test Kit (ATK) ไม่เกิน 72 ชั่วโมง หรือ เอกสารการติดเชื้อโควิด-19 และรักษาหายแล้วไม่เกิน 90 วัน (รายละเอียดขึ้นอยู่กับจังหวัดปลายทาง)
✔️แจ้งความจำเป็นในการเดินทางผ่าน https://covid-19.in.th/
✔️ลงทะเบียนผ่านแอพพลิเคชันของแต่ละจังหวัด (ขึ้นอยู่กับจังหวัดปลายทาง)
✔️โปรดเผื่อเวลาถึงสนามบินอย่างน้อย 2 ชั่วโมง เพื่อทำการเช็คอินและแสดงเอกสารตามเงื่อนไขของจังหวัดปลายทาง
เดินทางอย่างปลอดภัยด้วยการสวมหน้ากากอนามัยตลอดการเดินทาง ล้างมือด้วยสเปรย์หรือเจลแอลกอฮอล์ และเว้นระยะห่างเพื่อความปลอดภัย
สายการบินไทย ไลอ้อน แอร์ให้ความอุ่นใจ ปลอดภัยทุกเที่ยวบิน ✈️
*เงื่อนไขเป็นไปตามที่สายการบินกำหนด
ขั้นตอนที่ 4 เก็บไม้ตัวอย่างที่ทดสอบแล้ว
ขั้นตอนที่ 4 สอดไม้เก็บตัวอย่างผ่านช่อง B โดยให้หัวไม้ที่เก็บตัวอย่างอยู่ที่ช่อง A ระวังอย่าให้มือสัมผัสกับหัวไม้เก็บตัวอย่าง
ล้างมือบ่อยๆ ล้างมือทุกสัมผัส
เขตสุขภาพที่ 2 พิษณุโลก สุโขทัย อุตรดิตถ์
สำนักงานป้องกันควบคุมโรคที่ 2 จังหวัดพิษณุโลก
-เบอร์โทรศัพท์: 055 214 615-7
-เว็บไซต์: https://ddc.moph.go.th/odpc2/ (ยังไม่เปิดให้บริการ)
สุโขทัย
- โรงพยาบาลสุโขทัย
เบอร์โทรศัพท์: 055 611 702
เว็บไซต์: http://www.skth.go.th/
- โรงพยาบาลศรีสังวรสุโขทัย
เบอร์โทรศัพท์: 055 682 030
เว็บไซต์: https://www.srisangworn.go.th/
อุตรดิตถ์
- สำนักงานสาธารณสุขจังหวัดอุตรดิตถ์
เบอร์โทรศัพท์: 055 411 439
เว็บไซต์: https://uto.moph.go.th/2018/web
- โรงพยาบาลอุตรดิตถ์
เบอร์โทรศัพท์: 055 409 999
เว็บไซต์: http://www.uttaradit-hosp.go.th:81/utthosp/โรงแรม VIE Hotel Bangkok เปิดบริการ Hospitel ร่วมกับ รพ.พระรามเก้า
โรงแรม VIE Hotel Bangkok เปิดบริการ Hospitel ร่วมกับ รพ.พระรามเก้า รองรับผู้ป่วยที่ติดเชื้อ แต่ยังหาเตียงไม่ได้ เป็นกลุ่มสีเขียวที่มีอาการไม่รุนแรง และสามารถรองรับผู้ป่วยกลุ่มสีเหลือง ได้ โดยมีการจัดแยกพื้นที่บริการออกจากกัน และยังพร้อมรองรับผู้ป่วยระดับสีแดง ICU ได้อีก 20 ห้อง โดยผู้ที่มีประกันสุขภาพ สามารถเคลมได้ทุกกรณี โรงแรม วี กรุงเทพ มีห้องให้บริการ 5 รูปแบบ คือ ห้อง DELUXE KING, DELUXE TWIN, ห้อง DELUXE SUITE และ ห้อง GRAND DUPLEX SUITE
ติดต่อสอบถามเพื่อเข้ารักษาตัวที่ Hospitel ได้ทุกวัน ตั้งแต่เวลา 8:00-17:00 น. เบอร์โทร 02-202-9889
4. เมื่อมีฝนตก ศูนย์ควบคุมระบบป้องกันน้ำท่วม ประสานงานกับทีมภาคสนาม ทันที
เมื่อมีฝนตก ศูนย์ควบคุมระบบป้องกันน้ำท่วม แจ้งเตือนสถานการณ์ฝนตกให้ผู้ปฏิบัติงานภาคสนาม และแจ้งเตือนหน่วยงานที่เกี่ยวข้องผ่านกลุ่ม Line “เตือนภัยน้ำท่วม กทม.” (ปภ. ทหาร ตำรวจ สื่อมวลชน) ทันที
5. หน่วยปฏิบัติการเร่งด่วน (BEST) ประจำจุดเสี่ยง
หน่วยปฏิบัติการเร่งด่วน (BEST) ประจำจุดเสี่ยงน้ำท่วมและจุดสำคัญเมื่อคาดว่าจะมีฝนตกหนัก เพื่อเร่งระบายน้ำ และแก้ไขปัญหาเรื่องขยะอุดตันตะแกรงช่องรับน้ำพร้อมการช่วยเหลือแก้ปัญหาด้านการการจราจร
ข้อควรปฏิบัติกับสัตว์เลี้ยงเมื่อท่านอยู่ในกลุ่มความเสี่ยงสูงต่อการติดเชื้อ COVID-19 และจำเป็นต้องกักตัว 14 วัน ข้อควรปฏิบัติกับสัตว์เลี้ยงเมื่อท่านอยู่ในกลุ่มความเสี่ยงสูงต่อการติดเชื้อ COVID-19 และจำเป็นต้องกักตัว 14 วัน
4.น้ำมันกัญชาทั้ง 5 (สูตรรับประทาน)อภัยภูเบศร 5 ml
ชื่อผลิตภัณฑ์ ยาน้้ามันกัญชาทั้ง5 (สูตรรับประทาน) อภัยภูเบศร
รหัส TP33
รูปแบบของผลิตภัณฑ์
- ใน 5 มิลลิลิตร มีรากกัญชา, ลำต้นและก้านกัญชา, ใบกัญชาแห้ง, ดอกและเมล็ดกัญชาอย่างละ 312.5 มิลลิกรัม
- รอผลวิเคราะห์จากกรมวิทย์
ขนาดบรรจุ 5 มิลลิลิตร/ขวด
รูปแบบของผลิตภัณฑ์
น้ำมันของเหลวใสใช้สำหรับรับประทาน หรือหยดใต้ลิ้น
ข้อบ่งใช้
ช่วยให้นอนหลับเจริญอาหาร แก้ลมปะกัง บรรเทาปวดเรื้อรัง
ชื่อผู้ผลิต โรงพยาบาลเจ้าพระยาอภัยภูเบศร โดยความร่วมมือมูลนิธิ โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ใบอนุญาตผล ตเลขที่ 8/2563
ข้อห้ามใช้ :
ห้ามสั่งใช้ในกลุ่มผู้ป่่วยดังนี้
1) ผู้ที่มีประวัติ แพ้ผลิตภัณฑ์ ที่ได้จากการสกัดกัญชา หรือส่วนประกอบใดๆ ในยานี้ (ผลิตภัณฑ์นี้มีส่วนผสมของน้้ามันมะพร้าว)
2) ผู้ป่วยโรคหัวใจและหลอดเลือดขั้นรุนแรง หรือไม่สามารถคุมอาการได้
3) ผู้ป่วยที่มีประวัติความผิดปกติทางจิตเวช
4) สตรีมีครรภ์หรือสตรีที่ให้นมบุตร
5) ผู้ที่ใช้ยาละลายลิ่มเลือดวาร์ฟาริน
ข้อควรระวัง :
ระวังการใช้ในกลุ่มผู้ป่วยดังนี้
*ยกเว้นในกรณีที่แพทย์พิจารณาแล้วว่า ผู้ป่วยได้รับประโยชน์มากกว่าความเสี่ยง
1) ผู้ที่ทำงานขับขี่ยานพาหนะหรือเกี่ยวกับเครื่องจักรกลหรือทำงานที่เสี่ยงอันตราย เพราะยานี้อาจทำให้ง่วงซึม
2) บุคคลที่อายุต่ำกว่า25 ปี เพราะอาจมีผลต่อพัฒนาการทางสมอง
3) ผู้ป่วยโรคตับและไต (มีค่าเอนไซม์ตับที่ผิดปกติ สูงเกิน 3 เท่าของค่าบนปกติ , มีค่าอัตราการกรองของไต (GFR) น้อยกว่า 60 มิลลิลิตร/นาที/1.73ตารางเมตร)
4) ผู้ป่วยที่มีประวัติการใช้สารเสพติด รวมถึงนิโคติน หรือเป็นผู้ดื่มสุราอย่างหนัก
5) ผู้ป่วยที่ใช้ยากล่อมประสาท หรือยาที่ออกฤทธิ์ทางจิตอื่นๆ หรือยาโรคประจำตัวเรื้องรังหลายชนิด
อาการไม่พึงประสงค์:
ที่พบบ่อยคือ ง่วงนอน ปากแห้ง เวืยนศีรษะ คลื่นไส้ ทั้งนี้ ส่วนใหญ่ขึ้นกับการตอบสนองของแต่ละคน วิธีการใช้ยา ขนาดยาที่ใช้ (ดังนั้นจึงแนะนำให้เริ่มใช้ในขนาดที่ต่ำที่สุด)
สตูล Kick Off ฉีดวัคซีน Pfizer ให้นักเรียน โรงเรียนราชประชาอนุเคราะห์ 42 อำเภอเมืองสตูล LINK
4 ตุลาคม 2564 ที่หอประชุมเย็นศิระ โรงเรียนราชประชาอนุเคราะห์ 42 ตำบลเกตรี อำเภอเมืองสตูล จังหวัดสตูล จังหวัดสตูล ศูนย์อนามัยที่ 12 ยะลา ร่วมกับสำนักงานสาธารณสุขจังหวัดสตูล และโรงเรียนราชประชานุเคราะห์ 42 จังหวัดสตูล จัดกิจกรรม “Kick Off สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม” ซึ่งเป็นกิจกรรมที่จัดขึ้นพร้อมกันทั่วประเทศ โดยมีพลเอกประยุทธ จันทร์โอชา นายกรัฐมนตรี เป็นประธานการกิจกรรม Kick Off จากส่วนกลาง สำหรับจังหวัดสตูล มีนายเอกรัฐ หลีเส็น ผู้ว่าราชการจังหวัดสตูล เป็นประธานการจัดกิจกรรม พร้อมด้วยผู้อำนวยการศูนย์อานมัยที่ 12 ยะลา ผู้อำนวยการโรงพยาบาลสตูล รองนายแพทย์สาธารณสุขจังหวัดสตูล ศึกษาธิการจังหวัดสตูล ผู้อำนวยการโรงเรียนราชประชานุเคราะห์ 42 สตูล ร่วมกิจกรรมฯ
นายเอกรัฐ หลีเส็น ผู้ว่าราชการจังหวัดสตูล กล่าวว่า สำหรับกิจกรรม Kick Off ศูนย์อนามัยที่ 12 ยะลา คัดเลือกจังหวัดสตูลเป็นจังหวัดนำร่องจาก 7 จังหวัดภาคใต้ตอนล่าง ซึ่งเป็นนโยบายของรัฐบาลที่ให้ความสำคัญกับการฉีดวัคซีนป้องกันการแพร่ระบาดของเชื้อไวรัสโคโรนา 2019 ให้แก่นักเรียน เยาวชน ที่มีอายุระหว่าง 12-18 ปี พร้อมทั้งสร้างความมั่นใจให้กับผู้ปกครอง และเพื่อให้นักเรียนได้กลับมาใช้ชีวิตเรียนหนังสือในโรงเรียนโดยเร็วที่สุด ซึ่งจังหวัดสตูลได้รับการจัดสรรวัคซีนรอบแรก จำนวน 11,460 Dozes โดยจังหวัดสตูลมีนักเรียนที่ได้รับการยินยอมจากผู้ปกครองให้เข้าร่วมฉีดวัคซีน COVID-19 ทั้งหมด จำนวน 20,680 คน ซึ่งในวันนี้เป็นการฉีดวัคซีน Pfizer ให้กับนักเรียนโรงเรียนราชประชานุเคราะห์ 42 จังหวัดสตูล มีนักเรียนเข้ารับบริการฉีดวัคซีน จำนวน 465 คน และนักเรียนของศูนย์การศึกษาพิเศษประจำจังหวัดสตูล จำนวน 2 คน รวมทั้งสิ้น 467 คน
ด้านนางสาวสุจารี รักษกุล ชั้นมัธยมศึกษาปีที่ 6 โรงเรียนราชประชานุเคราะห์ 42 จังหวัดสตูล กล่าวว่า ตนเองรู้สึกตื่นเต้นและกลัว แต่หลังจากฉีดวัคซีนรู้สึกโล่งมากและไม่มีอาการแต่อย่างใด และได้เตรียมตัวได้พักผ่อนมาเพียงพอ ส่วน ด.ช.ธนภัทร ชัยศิริ ชั้นมัธยมศึกษาปีที่ 1 โรงเรียนราชประชานุเคราะห์ 42 จังหวัดสตูล กล่าวว่ารู้สึกดีใจที่ได้รับวัคซีนป้องกันโรค COVID-19 และอยากบอกเพื่อนๆว่าฉีดวัคซีนไม่ได้เจ็บและยังเป็นผลดีในเรื่องของการป้องกันโรค COVID-19 ด้วย
ด้านนางสุพรรณนา แก้วเพิ่มพูน ผอ.โรงเรียนราชประชานุเคราะห์ 42 จังหวัดสตูล กล่าวว่า จากการสำรวจผู้ปกครองนักเรียนรู้ดีใจและยินดีที่ให้เด็กๆเข้ารับการฉีดวัคซีนเพราะจะเป็นการป้องกันโรค COVID-19 ได้อย่างดี ในขณะที่ คณะครู และบุคลกรภายในโรงเรียนได้รับวัคซีน 100%
เรื่อง/ภาพ จาก โควิด-19 สตูล
อาชีพพนักงานให้การดูแล ชั้น 2 โดย สถาบันคุณวุฒิวิชาชีพ (องค์การมหาชน) LINK
อาชีพพนักงานให้การดูแล ชั้น 2
คำอธิบายหลักสูตร
ผู้ที่ผ่านการเรียนรู้ตามชุดฝึกอบรมนี้แล้วบุคคลจะมีความรู้เกี่ยวกับการดูแลสุขอนามัย
ส่วนบุคคล ความสุขสบาย และสิ่งแวดล้อมของผู้ป่วย การฟื้นฟูสภาพร่างกายของผู้ป่วย
การจัดการผู้ป่วยในภาวะฉุกเฉิน การดูแลเมื่อถึงแก่กรรม การจัดการอุปกรณ์การ
รักษาพยาบาล และการสนับสนุนงานธุรการในหน่วยงาน
โครงสร้างหลักสูตร
มอดูลฝึกอบรมของคุณวุฒิวิชาชีพ (Module Training) 2 ชั่วโมง 1 นาที
มอดูลที่ 1 การดูแลสุขอนามัยส่วนบุคคล ความสุขสบาย และสิ่งแวดล้อมของ ผู้ป่วย 25 นาที
มอดูลที่ 2 การฟื้นฟูสภาพร่างกายของผู้ป่วย 15 นาที
มอดูลที่ 3 การจัดการผู้ป่วยในภาวะฉุกเฉิน และการดูแลเมื่อถึงแก่กรรม 34 นาที
มอดูลที่ 4 การจัดการอุปกรณ์การรักษาพยาบาล 25 นาที
มอดูลที่ 5 การสนับสนุนงานธุรการในหน่วยงาน 20 นาที
สื่อวีดิทัศน์แสดงกระบวนการประเมินสมรรถนะบุคคลตามมาตรฐานอาชีพ 16 นาที
สื่อวีดิทัศน์แสดงกระบวนการประเมินสมรรถนะบุคคลตามมาตรฐานอาชีพ 16 นาที
เทศกาลกินเจ 64 ณ ศาลเจ้าโจวซือกง ตลาดน้อย เริ่มแล้ว
5 ตุลาคม 2564 ชาวไทยเชื้อสายจีนเข้าร่วมพิธีกิ่วอ้วงฮุกโจ้ว หรือพิธีเชิญเจ้า ตามคติความเชื่อแบบพุทธมหายาน ณ ศาลเจ้าโจวซือกง ตลาดน้อย
ศาลเจ้าโจวซือกง (วัดซุนเล่งยี่) ตลาดน้อย เป็นศาลเจ้าเก่าแก่อายุประมาณ 200 ปี ย่านเยาวราช มีชื่อเสียงด้านการจัดประเพณีกินเจได้ยิ่งใหญ่ตามประเพณีจีนโบราณ เป็นศูนย์กลางของชาวจีนฮกเกี้ยนในกรุงเทพมหานคร
มาตรการควบคุมดูแล มีจุดคัดกรองผู้ที่จะเดินทางเข้ามาภายในศาลเจ้า และทุกคนต้องสวมหน้ากากอนามัยตลอดเวลา โรงเจมีการทำฉากกั้นเพื่อเว้นระยะห่างระหว่างคนตักอาหารและผู้มารับอาหาร จัดโต๊ะให้นั่งครึ่งเดียวจากปกติ คือนั่งได้เพียง 4 คนต่อโต๊ะ และที่สำคัญเจ้าหน้าที่ทุกคนยังมีการตรวจโควิดก่อนเป็นที่เรียบร้อยเพื่อสร้างความมั้นใจแก่คนที่เดินทางมาไหว้เจ้าขอพรภายในศาลเจ้าโจวซือกงแห่งนี้
เรื่องและภาพจาก TNN Thailand
NT ลงทะเบียนได้ที่ บมจ.โทรคมนาคมแห่งชาติ LINK
NT เปิดลงทะเบียนฉีดวัคซีนโควิด-19 รอบใหม่ 2 กลุ่ม
เข็ม 1 สำหรับบุคคลทั่วไปที่มีอายุ 18 ปีขึ้นไป และไม่เคยได้รับวัคซีน
เข็ม 3 สำหรับผู้ที่เคยได้รับวัคซีนซิโนแวคครบ 2 เข็ม ก่อนวันที่ 31 กค 64 จากทุกศูนย์ฉีด
เริ่มลงทะเบียนได้วันที่ 7 ต.ค. 64
คลิกลงทะเบียน
ลงแล้ว เข้ารับการฉีดได้วันที่ 9-31 ต.ค. 64 ณ ศูนย์ฉีดวัคซีนกลางบางซื่อ
1 หมายเลข ลงทะเบียนได้ 1 สิทธิ์ และลงทะเบียนด้วยเลขหมายเครือข่ายใดก็ได้
โครงสร้างเพื่อการบริหารจัดการในปัจจุบัน
โครงสร้างในระบบบริการด้านสาธารณสุขของประเทศอังกฤษได้รับการวิพากวิจารณ์ว่า มีการเปลี่ยนแปลงบ่อยเกินไป เหตุผลสำคัญคือการเปลี่ยนแปลงทางการเมือง ทำให้ผู้ให้บริการต้องปรับตัวบ่อย โครงการการบริหารใช้หลักการของการถือประชาชนเป็นศูนย์กลาง ดังภาพ
ทั้งนี้องค์ประกอบสำคัญที่ทำหน้าที่บริหารจัดการคือ หน่วยงานที่อยู่ทางด้านขวามือของภาพ ซึ่งประกอบไปด้วย Department of Health, Strategic Health Authority, และ Primary Care Trust ส่วนองค์ประกอบที่ทำหน้าที่เป็นผู้ให้บริการแบ่งอย่างง่ายออกเป็น Primary care และ Secondary care Department of Health (DH) Department of Health มีนักการเมืองที่รับผิดชอบด้านสาธารณสุข เรียกว่า Secretary of State for Health (เทียบเท่ารัฐมนตรีว่าการกระทรวงสาธารณสุข) และมีข้าราชการประจำที่อยู่ในตำแหน่งสูงสุดมี 2 ตำแหน่งประกอบด้วย
1) Permanent Secretary of DH (อาจเทียบได้กับปลัดกระทรวงสาธารณสุข) ดูแลการบริหารจัดการภายใน DH รับผิดชอบการวางนโยบายและยุทธศาสตร์
2) Chief Executive of NHS (อาจเทียบได้กับเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ) รับผิดชอบการจัดหา การจัดการ และควบคุมกำกับผลลัพธ์ของบริการ
หมายเหตุ ในช่วงปีค.ศ.2000–2006 Permanent secretary of DH และ Chief Executive of NHS คือบุคคลคนเดียวกัน ทั้งสองตำแหน่งขึ้นตรงต่อ Secretary of State for Health
ตำแหน่งทางวิชาการจะมี Chief professional officers เป็นตำแหน่งสูงสุด ซึ่งประกอบไปด้วย Chief Medical Officer, Chief Nursing Officer, Chief Dental Officer, Chief health professions officer, Chief pharmaceutical officer และ Chief Scientific Officer ซึ่งมีหน้าที่ผลิตองค์ความรู้และให้“Expert input” เพื่อการวางนโยบายและยุทธศาสตร์
คณะกรรมการ (Board) ของ DH ประกอบไปด้วยตัวแทนจากภาคส่วนต่างๆ 14 คน
รัฐมนตรี(Secretary of state) ไม่มีตำแหน่งใน Board อย่างไรก็ตามบทบาทหลักของ Board คือ การกำหนดยุทธศาสตร์ เพื่อตอบสนองต่อเป้าหมายที่นโยบายของรัฐมนตรี
สำหรับบาทที่เป็นหน้าที่หลักของ DH ประกอบด้วย
1) กำหนดทิศทางในภาพรวมของ NHS (Setting overall direction)
2) กำหนดมาตรฐานบริการ (Ensuring national standards are set)
3) ทำให้เกิดความมั่นใจว่ามีทรัพยากรที่จะนำมาใช้ใน NHS เพียงพอ (Securing resources)
4) ทำการตัดสินใจในกรณีที่มีการลงทุนที่ต้องใช้เงินจำนวนมาก (Making major investment decisions)
5) เพิ่มทางเลือกให้กับคนไข้และผู้ใช้บริการ (Improving choice for patients and users)
ภายใต้ DH มีหน่วยงานที่ดูแลเฉพาะเรื่องเรียกว่า Arm’s Length Bodies (ALBs) แบ่งออกได้เป็น 3 ลักษณะคือ
1) Executive agencies เช่น Medicines and Healthcare products Regulatory Agency (MHRA) ดูแลเรื่องยาและเครื่องมือทางการแพทย์ให้ปลอดภัยต่อประชาชน
2) Special Health Authorities กลุ่มนี้ถึงแม้จะอยู่ภายใต้ (ได้รับงบประมาณผ่าน) DH แต่มีความเป็นอิสระเนื่องจากมี Board เป็นของตนเอง เช่น Health Protection Agency, Information Center for Health and Social Care, National Institute for Health and Clinical Excellence (NICE), Postgraduate Medical Education and Training Board
3) Non-departmental public bodies ถูกตั้งขึ้นเมื่อรัฐมนตรีต้องการคำแนะนำ เช่น Commission for Patient and Public Involvement in Health Strategic Health Authorities (SHAs)
ก่อนหน้าปี ค.ศ.2002 หน่วยงานที่เป็นโครงสร้างของ Strategic health authorities นี้มีชื่อว่า Regional health authorities ในประเทศอังกฤษเดิมมีStrategic health authorities ทั้งหมด 28 แห่ง ปัจจุบันลดลงเหลือเพียง 10 แห่ง (ค่อยๆ ลดลงตั้งแต่ปี ค.ศ.2006) ดูแลประชากรแห่งละประมาณ 2.5–7.5 ล้านคน (เทียบเท่าหน่วยงานในระดับเขตของไทย) มีหน้าที่ในการวางยุทธศาสตร์ที่สำคัญดังนี้
1) วางแผน พัฒนาและเชื่อมโยงยุทธศาสตร์ต่างๆ เพื่อมุ่งหวังให้ประชาชนในพื้นที่มีสุขภาพดีขึ้น
2) ทำให้เกิดความมั่นใจในคุณภาพของการให้บริการและองค์กรต่างๆ ภายในระบบบริการรวมทั้งมองไปข้างหน้าเพื่อการพัฒนาอย่างต่อเนื่อง
3) เป็นตัวกลางในการช่วยเริ่มต้นงานนโยบาย และพัฒนาศักยภาพของบุคลากรตามเป้าหมายของนโยบาย
4) ช่วยพัฒนา Trusts ต่างๆ ให้มีศักยภาพที่จะเป็น Foundation trust
5) เป็นตัวแทนกระทรวงสาธารณสุข ติดตามกำกับการบริหารในพื้นที่ที่รับผิดชอบให้มีประสิทธิภาพ ทำให้เกิดความมั่นใจว่านโยบายที่สำคัญในระดับชาติสามารถผสมผสานกับแผนงานในพื้นที่ โดยเป็นผู้รับรองแผนที่จะนำไปปฏิบัติในพื้นที่ ซึ่งนำเสนอโดย PCT Primary Care Trusts (PCTs) Primary Care Trust (PCT) เป็นโครงสร้างใหม่ที่พัฒนาขึ้นมาจาก Primary Care Group (เป็นโครงสร้างที่ทำหน้าที่ซื้อบริการที่พัฒนาต่อมาจาก GP fundholder) เชื่อมโยงกับโครงสร้างด้านการบริหารจัดการเดิมที่เรียกว่า District Health Authority
PCTs เดิมมีทั้งหมด 303 แห่ง ปัจจุบันมีลดลงเหลือ 152 แห่ง (ค่อยๆ ลดลงตั้งแต่ปีค.ศ.2006) มีเจ้าหน้าที่ รวมผู้ให้บริการที่อยู่ในชุมชนที่เดิมเป็นข้าราชการ ทั้งหมดประมาณ 1,000 คน (ที่อยู่ในสำนักงานของ PCT มีประมาณ 200 คน) บริหารงบประมาณ ประมาณ 450 ล้านปอนด์ต่อปีครอบคลุมประชากรแห่งละประมาณ 3 แสนคน เป็นหน่วยงานสำคัญที่ทำหน้าที่ขับเคลื่อน NHS เนื่องจากจากจะต้องดูแลงบประมาณประมาณ 85% ของงบประมาณทั้งหมดของ NHS PCT มีคณะกรรมการ 2 ชุด คือ PCT Board และ Executive committee
Primary Care Trust Board (PCT board) พิจารณานโยบายและกำนดทิศทางการดำเนินการของ PCT คณะกรรมการชุดนี้ประกอบด้วย
1. ประธาน
2. รองประธาน และ ผอ..ด้าน strategic commissioning
3. Non-executive director
4. Non-executive director
5. Chief executive
6. ผู้อำนวยการด้านการเงินและข้อมูลข่าวสาร
7. ผู้อำนวยการด้านสาธารณสุข
8. รองประธาน และ ผู้อำนวยการด้าน provider services
9. Chair of executive committee
10. Nurse member of executive committee
11. GP member of executive committee
โดยลำดับที่ 1 ถึง 4 เป็นตัวแทนประชาชน (เป็นนักการเมืองท้องถิ่นหรือผู้ทรงคุณวุฒิ) ลำดับที่ 5-8 เป็นเจ้าหน้าที่ PCT และลำดับที่ 9-11 เป็นตัวแทนวิชาชีพผู้ให้บริการ
Executive committee เป็นการทำงานร่วมกันระหว่าง PCT senior managers กับตัวแทนของผู้ให้บริการในพื้นที่ คณะกรรมการชุดนี้ประกอบด้วย
1. Chief executive
2. ผู้อำนวยการด้านการเงินและข้อมูลข่าวสาร
3. ผู้อำนวยการด้านสาธารณสุข
4. Chair of executive committee
5. Nurse member of executive committee
6. GP member of executive committee
7. Primary Care Medical Director
8. Director of Performance & Planning
9. Head of Strategy, Performance and Commissioning, London Borough of Newham
10. Head of Adults Services
11. Head of Children’s & Young People’s Services
12. Assistant Director, Communications & Corporate Affairs
13. Trust Secretary
โดยลำดับที่ 1-3 และ 10-13 เป็น PCT senior managers และ ลำดับที่ 4-9 เป็นตัวแทนของผู้ให้บริการที่อยู่ในพื้นที่
หน้าที่รับผิดชอบหลักของ PCT ประกอบด้วย
1) วางแผนและทำให้เกิดความมั่นใจได้ว่า ประชาชนที่อยู่ในความรับผิดชอบจะได้รับบริการตามความจำเป็นที่ต้องได้รับ (Planning and securing services) โดยได้รับมอบจากประชาชนผ่านรัฐ ในการทำหน้าที่เป็น “นายหน้า” โดยเป็นผู้ถือเงินเพื่อซื้อบริการแทนประชาชน (Commissioner or purchaser) เพื่อจ่ายเงินให้กับผู้ให้บริการหรือสถานบริการตามข้อตกลง (Agreements) ที่ทำกับผู้ให้บริการหรือสถานบริการนั้นๆ ทั้งที่อยู่ในและนอก NHS (ส่วนใหญ่เป็นสถานบริการที่อยู่ภายใน NHS) รวมทั้งมีหน้าที่ดูแลให้ผู้ให้บริการมีจำนวนเพียงพอ
2) ประสานเพื่อให้เกิดความร่วมมือกับ Local authorities โดยเฉพาะอย่างยิ่งเพื่อการพัฒนาบริการเชิงสังคม (Social care)
3) สนับสนุนให้เกิดการพัฒนาศักยภาพของเจ้าหน้าที่ที่ให้บริการ รวมถึงการลงทุน เครื่องมือ ระบบข่าวสารและเทคโนโลยี เพื่อที่จะให้มั่นใจได้ว่าบริการสุขภาพระดับพื้นที่ ได้รับการพัฒนา ทันสมัยและมีการพัฒนาคุณภาพอย่างต่อเนื่อง
การร่วมมือกับรัฐบาลท้องถิ่นตั้งเป็นกองทุนร่วม (Care Trusts) เพื่อจัดบริการเชิงสังคม (Social care)
Care Trusts คือโครงสร้างที่จัดให้มีขึ้นเพื่อรองรับการร่วมมือระหว่างองค์กรหรือหน่วยที่อยู่ภายใน NHS (โดยเฉพาะอย่างยิ่ง PCT) กับ Local authorities บนพื้นฐานของการมีข้อตกลง (Agreement) ร่วมกัน โดยเฉพาะอย่างยิ่งเป็นการส่งเสริมให้เกิดการให้บริการเชิงสังคม (Social services) ปัจจุบันจำนวน Care Trusts ยังคงมีจำนวนน้อย แต่ในระดับนโยบายมีความคาดหวังว่า จำนวน Care Trusts จะมีจำนวนเพิ่มขึ้นเรื่อยๆ ในอนาคต
4.2 แนวโน้มใหม่ “การจ่ายตามผลลัพธ์ (Payment by results)”
ในอนาคตรัฐบาลมีนโยบายการจ่ายเงินให้กับโรงพยาบาลแบบใหม่ มีชื่อเรียกว่า “Payment by results” เป็นการจ่ายให้กับสถานบริการโดยยึดที่ผลลัพธ์ หรือ Output เป็นหลัก โดยที่ Input และ Process เป็นหน้าที่รับผิดชอบของสถานบริการ ซึ่งผู้ทำหน้าที่จ่ายเงินจะไม่ให้ความสำคัญมากนัก เช่น ในระยะเวลาเท่ากัน แต่ให้บริการได้มากกว่า (เช่น ผ่าตัด Elective surgery ได้มากกว่า หรือคนไข้ใช้เวลาในการรอน้อยลง) จะได้รับค่าตอบแทนเพิ่ม มีการจัดกลุ่มและกำหนดเป็นค่าตอบแทน โดยใช้ชื่อวิธีการจัดกลุ่มลักษณะนี้ว่า Healthcare Resource Groups (HRG)1 การกำหนดราคาจะถูกกำหนดโดยส่วนกลาง (National tariff) ซึ่งผู้วางนโยบายมีความคาดหวังว่าค่าใช้จ่ายโดยรวมจะไม่เพิ่มขึ้น และการจ่ายเงินแบบใหม่จะช่วยลดค่าใช้จ่ายในการเจรจาเพื่อต่อรองราคา (Transaction cost)
ในระยะแรกจะใช้วิธีการจ่ายเงินแบบนี้กับ Elective Surgery ก่อน โดยเริ่มจาก 6 Specialties: Opthalmology, Cardiothoracic surgery, ENT, Trauma & orthopaedics, General surgery, Urology วิธีการจ่ายเงินแบบเดิมเรียกว่า “Block contracts” เป็นการเจรจาและตกลงราคาในระดับพื้นที่ เปลี่ยนเป็น “Service Level Agreements (SLAs)” เป็น “ข้อตกลง” ที่เชื่อมระหว่าง “ผลลัพธ์” ที่ได้จากการให้บริการกับ “ราคา” ที่กำหนดขึ้นมาจากส่วนกลาง
4.3 วิธีการมีส่วนร่วมจ่ายของผู้รับบริการ (Co-payment)
ในขณะเริ่มต้น NHS ประชาชนทุกคนรับบริการฟรีณ จุดที่รับบริการ ระบบการมีส่วนร่วมจ่าย (Co-payment) กับประชาชนบางกลุ่ม เริ่มนำมาใช้ในปี1952
โดยพื้นฐานของระบบภายใต้ NHS ประชาชนไม่ต้องจ่ายค่าบริการใดๆ โดยตรงให้กับผู้ให้บริการในขณะรับบริการ แต่เป็นการจ่ายโดยอ้อมผ่านระบบภาษีและประชาชนบางกลุ่มต้องมีส่วนร่วมจ่าย (Co-payment) ในขณะไปรับบริการให้กับ NHS แต่ประชาชนส่วนใหญ่ของประเทศได้รับบริการฟรี(ไม่ต้องจ่าย Copayment)
กลุ่มที่รับบริการฟรีประกอบด้วย ผู้มีรายได้น้อย ผู้สูงอายุ (ชาย > 65 ปีหญิง > 60 ปี) อายุต่ำกว่า 16 ปี อายุ 16-19 ปี ที่เป็นนักศึกษาที่จะต้องเรียนเต็มเวลา หญิงมีครรภ์ หญิงที่มีบุตรอายุ
น้อยกว่า 12 เดือน ทหารผ่านศึก และผู้ที่เป็นโรคเรื้อรังบางโรค เช่น Permanent fistula, Hypoadenalinism (Addison’s disease), Hypopituitarism (Diabetes inspidus), Diabetes mellitus, Hypoparathyroidism, Myasthenia gravis, Myxedema, Epilepsy เป็นต้น
ส่วนที่เหลือเป็นกลุ่มประชากรที่จะต้องมีส่วนร่วมจ่าย ต้องจ่ายตามจำนวนชนิด (Items) ของยาที่แพทย์สั่งมาในใบสั่งยา โดยประชาชนต้องจ่ายประมาณ 6.20 ปอนด์ ต่อ ยาหนึ่งชนิด โดยไม่
คำนึงถึงปริมาณยา (จำนวนเม็ดหรือปริมาตรของยา) แพทย์สั่งยามากชนิดประชาชนต้องจ่ายมากขึ้นตามจำนวนชนิดของยา เช่น แพทย์สั่งยา 1 ชนิด ประชาชนจ่าย 6.20 ปอนด์, 2 ชนิดจ่าย 12.40 ปอนด์, 3 จ่าย 18.60 ปอนด์ เป็นต้น ทั้งนี้ในกรณีแพทย์มีความเห็นว่า ยาที่คนไข้จำเป็นต้องรับประทาน มีราคาถูกกว่า 6.20 ปอนด์ และเป็นยาที่คนไข้สามารถซื้อได้เองโดยตรงจากร้านขายยา แพทย์มักจะไม่เขียนชื่อยาตัวนั้นลงในใบสั่งยา เป็นการช่วยทำให้คนไข้จ่ายน้อยกว่า (เป็นการซื้อยาโดยตรงจากร้านขายยา) เช่น กรณีที่แนะนำให้ใช้ยา Paracetamol, Calamine lotion หรือ Bromhexine เป็นต้น ดังนั้นเมื่อไรก็ตามที่แพทย์สั่งยาลงใบสั่งยามากชนิด คนไข้จะต้องมีส่วนร่วมในการจ่ายมากขึ้นตามจำนวนชนิดของยาไปด้วย โดยที่แพทย์ไม่ได้รับประโยชน์ใดๆ
นอกจากนี้คนไข้ที่อยู่ในกลุ่มที่ต้องมีส่วนร่วมจ่าย สามารถซื้อบัตร (Season ticket) ราคาประมาณ 25 ปอนด์ สำหรับบริการฟรีเป็นเวลา 4 เดือน และราคาประมาณ 60 ปอนด์ เพื่อรับบริการ
ฟรีเป็นเวลา 1 ปี
ด้วยระบบนี้ทำให้ “ใบสั่งยา” ทุกใบที่หมอสั่งจ่ายยาให้คนไข้ ถูกรวบรวมอย่างเป็นระบบโดย NHS และเป็น “เครื่องมือ” สำคัญที่ทำให้ NHS มีข้อมูลที่นำไปใช้วิเคราะห์ พฤติกรรมการจ่ายยาของแพทย์เวชปฏิบัติทั่วไป รวมทั้งส่งมูลที่เป็นภาพรวมของพฤติกรรมการจ่ายยาของแพทย์ เช่น ค่าเฉลี่ยของจำนวนชนิดยาที่สั่งในใบสั่งยาในปัญหาสุขภาพที่พบบ่อย รวมทั้งมีการส่งข้อมูลเป็น
ลักษณะเตือนไปยังแพทย์ที่จ่ายมากกว่าปกติ(จ่ายยาเกินจำเป็น) ถือเป็นอีกกลไกที่สำคัญอันหนึ่งที่ใช้ในการควบคุมและกำกับ พฤติกรรมการจ่ายยาของแพทย์
ผังการใช้งาน Thailand Pass สำหรับเดินทางเข้าประเทศ
Thailand Pass traveler journey
รู้ลึกเรื่องวัคซีนโมเดอร์นา รพ.วิชัยยุทธ
SECURITY AND PRIVACY
1. Will my personal information be safe with Thailand Pass?
- Your personal information is encrypted and safe with Thailand Pass as it will be used for the purpose of approving and facilitating your arrival in Thailand only.
2. I have inquiries regarding my travel to Thailand / Thailand Pass system, where can I find more information?
- More information can be found on the Department of Consular Affairs, Ministry of Foreign Affairs of Thailand’s website (https://consular.mfa.go.th/), or you may contact the Royal Thai Embassy / Royal Thai Consulate-General in your area for more information.
- Thailand Pass is also designed to be user-friendly and provides step-by-step instructions on how to register correctly.
อบจ.มหาสารคาม ได้จัดสรร 11,550 โดส เริ่มฉีด 18 พ.ย.64 LINK
18 พ.ย.64 อบจ.มหาสารคาม โดยนายก อบจ.ส่งมอบวัคซีนให้กับสสจ.มหาสารคาม และเริ่มฉีดให้กับประชาชนจำนวน กลุ่มผู้สูงอายุจำนวน 640 ราย
.
17 ส.ค.64 ประกาศได้รับจัดสรร ล็อตแรกจำนวน 11,550 โดส จาก สภากาชาดไทย กระจายวัคซีนให้แก่กลุ่มเป้าหมายจำนวน 5 กลุ่มดังนี้ กลุ่มที่ 1 คนพิการ ผู้ป่วยติดเตียง สตรีตั้งครรภ์ กลุ่มที่ 2 ผู้สูงอายุ 70 ปีขึ้นไป กลุ่มที่ 3 บุคลากรทางการแพทย์และพยาบาลในถิ่นทุรกันดาร กลุ่มที่ 4 ผู้ที่ทำงานประจำในศูนย์พัฒนาเด็กเล็ก ครูผู้สอนในโรงเรียนอนุบาลหรือครูอาจารย์ผู้ทำหน้าที่สอนหนังสือในโรงเรียนและกลุ่มที่ 5 บุคลากรที่ต้องออกปฏิบัติงานสัมผัสประชาชนตามโครงการวัคซีนของ อบจ.มหาสารคาม ที่ยังไม่เคยได้รับวัคซีนป้องกันโควิด-19 มาก่อนและบุคลากรที่ยังไม่สามารถรับการฉีดวัคซีนได้เนื่องจากติดขัดระเบียบหรือกฎหมาย
ต้องเตรียมภาพถ่ายของพาสปอร์ตเล่ม และ หนังสือรับรองการฉีดวัคซีน ให้พร้อม เพื่ออัพโหลดในขั้นตอนนัดหมายด้วย
ท่าบริหารการประสานงานของสมอง
รพ.ธนบุรี เริ่มฉีดวัคซีน โมเดอร์นา วันแรก 5 พ.ย.64 LINK
รพ.ธนบุรี พร้อมให้บริการฉีดวัคซีนทางเลือก “โมเดอร์นา (Moderna)” เริ่มวันแรกตั้งแต่วันที่ 5 พ.ย. 2564 เป็นต้นไป
จำนวนวัคซีนที่โรงพยาบาลได้รับการจัดสรรในรอบแรกนี้มีจำนวน 3,000 โด๊ส โดยโรงพยาบาลได้จัดลำดับคิวการฉีดให้กับผู้รับบริการที่มีลำดับการสั่งซื้อโดยตรงกับ รพ.ธนบุรี ตั้งแต่เลขที่ 0001 ถึง 2551 โรงพยาบาลจะส่ง SMS ถึงผู้ที่ได้สิทธิ์ เพื่อให้เข้าไปดำเนินการระบุวันที่จะเข้ารับการฉีดวัคซีน สำหรับผู้ซื้อที่มีลำดับการสั่งซื้อเกินกว่าเลขที่ 2551 จะได้รับสิทธิ์ตามลำดับในรอบถัดไป เมื่อโรงพยาบาลได้รับการจัดสรรวัคซีนล็อตต่อไป
เทศบาลนครรังสิต จัดงาน ปทุมนครา ธารานฤมิต 18 - 19 พ.ย. ตรวจเข้มก่อนเข้างาน
เทศบาลนครรังสิต เชิญร่วมงาน
"ปทุมนครา ธารานฤมิต" วันที่ 18 - 19 พ.ย. 64 ณ บริเวณริมเขื่อนสะพานแดง 12:00 - 21:00 น. ต.ประชาธิปัตย์ อ.ธัญบุรี เที่ยวงานสำราญใจ สวมชุดไทย ใส่หน้ากากอนามัย แสดงผลการฉีดวัคซีนครบ 2 เข็ม หรือแสดงผลตรวจ ATK ไม่เกิน 72 ชั่วโมง เพื่อเข้าพื้นที่จัดงาน หรือผู้ที่ได้รับสายรัดข้อมือจากเทศบาลนครรังสิต สามารถเข้างานได้ทันที สถานที่ลอยกระทงทั้ง 9 จุด ได้แก่
- บริเวณริมเขื่อนสะพานแดง
- บริเวณบึงใหญ่ หมู่บ้านรัตนโกสินทร์ 200 ปี
- บริเวณปากทางเข้าหมู่บ้านพฤกษาวิลล์7 คลองสอง
- บริเวณมูลนิธิไทรทองรังสิตสงเคราะห์(ไต่ เซี่ย หุก โจ้ว)
- บริเวณชุมชนเดชาพัฒนา 87
- บริเวณสวนสาธารณะ ซอยรังสิต-ปทุมธานี 8
- บริเวณหน้าหมู่บ้านนฐดา
- บริเวณประตูน้ำจุฬาลงกรณ์
- บริเวณริมเขื่อนด้านหน้าโรงเรียนชมชุมประชาธิปัตย์วิทยาการ
ติดต่อสอบถามเพิ่มเติมได้ที่ กองการศึกษา โทร 0 2567 6000 ต่อ 1002
คึกคัก จุฬาฯ - เกษตรศาสตร์ จับมือ ลอยกระทงเทียน อนุรักษ์สิ่งแวดล้อม (PPTV) LINK
คึกคัก!! จุฬาฯ - เกษตรศาสตร์ จับมือ “ลอยกระทงเทียน” อนุรักษ์สิ่งแวดล้อม นักศึกษาและประชาชนเดินทางมาร่วมลอยกระทง ที่สระพระพิรุณ มหาวิทยาลัยเกษตรศาสตร์ บางเขน กันอย่างคึกคัก ซึ่งในปีนี้ องค์การบริหารสโมสรนิสิตจุฬาฯ (อบจ.) ร่วมกับมหาวิทยาลัยเกษตรศาสตร์ จัดงานลอยกระทง ประจำปี 2564 ในรูปแบบออนไลน์ ภายใต้ชื่องาน “Loy Krathong Festival” โดยใช้ “กระทงเทียน” ในการลอยเพื่อเป็นการช่วยอนุรักษณ์ธรรมชาติและสิ่งแวดล้อม นอกจากลอยกระทงแล้ว ยังมีกิจกรรมอื่นๆ ที่น่าสนใจอีกมายมาย ไม่ว่าจะเป็น เดินซื้อของกินอร่อย ๆ จากบูธร้านค้าของนิสิต, การแสดงจากทั้งสองมหาวิทยาลัยที่ขนกันมาอย่างหนาแน่น เช่น CU Band, CU Dance Club, ชมรมล้านนา, KU Band, KU Acoustic, ดาวกระจุย และ KU Dance (เมื่อวันที่ 19 พ.ย. 2564)
รพ.สาขาในกรุงเทพ 6 แห่ง
ได้แก่
- รพ.รามาฯ แผนที่
- รพ.ตำรวจ แผนที่
- รพ.สมเด็จพระปิ่นเกล้า แผนที่
- สถาบันพยาธิวิทยา ศูนย์อำนวยการแพทย์พระมงกุฏเกล้า แผนที่
- รพ.ภูมิพลฯ แผนที่
- คณะแพทย์วชิรพยาบาล ม.นวมินทราธิราช แผนที่
สถาบันพัฒนาการเด็กราชนครินทร์ แจ้งผู้ป่วยเด็กอายุ 12-18 ปี เข้ารับวัคซีนได้
สถาบันพัฒนาการเด็กราชนครินทร์ แจ้งผู้ป่วยเด็กอายุ 12-18 ปี ของสถาบัน สามารถแจ้งความประสงค์เข้ารับวัคซีนโควิดได้ โดยจะฉีดเป็นวัคซีนไฟเซอร์ ทั้ง 2 เข็ม โดยแจ้งผ่านช่องทางต่างๆ ตามระบุ QR Code หรือคลิกลิงค์
intranet.ricd.go.th/vaccine แจกเงินเข็มละ 10000 ครับ
เอาวัคซีนดีๆที่ไม่ไขว้อ่ะค่ะ ฉีดแน่นอน คนที่บ้านไม่ฉีดเพราะวัคซีนไขว้ จะให้ฉีดทั้งทีอย่าทำเหมือนชาวบ้านตาดำๆไม่มีความสำคัญ แค่แอสตร้าเขาก็ยอมฉีดกันแล้วค่ะไม่ต้องไฟเซอร์ก็ได้ ขอแค่วัคซีนที่ไม่ไขว้
ประสานกับอสม.เพราะในแต่ละหมู่บ้านชุมชนก็มีอยู่แล้ว อยากจะรู้จำนวนคนที่ฉีดยังไม่ฉีด คนต่างจังหวัด คนต่างด้าวที่มาอยู่ในจ.โคราช ถ้าเป็นไปได้ฉีดเป็นหมู่บ้าน หรือชุมชนก็ดีค่ะ เพราะคนที่อยากฉีดแต่ไม่สะดวกจะเดินทางไปก็มีค่ะ การลงพื้นที่จะได้รู้สาเหตุมาทำไมบางคนจึงไม่ยอมฉีดวัคซีนค่ะ
จริงๆแล้วถ้าจำกัดว่าคนที่ไม่ได้ฉีดวัคซีนห้ามเข้า ห้ามใช้บริการ หรือห้ามไปในสถานที่ต่างๆและอะไรอีกเยอะแยะในส่วนนี้มันจะทำให้บุคคลเหล่านั้นรู้สึกว่าตัวเองเป็นตัวพาหะนำโรคอะซึ่งจริงๆมันไม่น่าจะใช่นะคะ หลายคนที่ยังไม่ฉีดเขาก็มีเหตุผลบางคนลงทะเบียนไม่เป็น บางคนกลัวไม่กล้าที่จะฉีด ส่วนตัวมองว่าถ้ามีวัคซีนดีๆหรือมีทางเลือกเกี่ยวกับวัคซีนที่หลากหลาย หลายๆคนอาจจะเข้ารับวัคซีนมากขึ้น และหลายๆคนไม่ต้องการสูตรไขว้ค่ะ
เข้าถึงบ้าน เหมือนหาเสียงค่ะ
วอร์คอินเลือกฉีดmRNAได้ เค้าก็แย่งกันละ บังคับไขว้สูตรเดียวบนโลก และAZ ที่ทั่วโลกไม่ยอมรับ บางคนเค้าประเมิณร่างกายแล้ว จะเดินเข้าไปเสี่ยงเพื่อ
อ่ออีกอย่าง ดูงานบุรีรัมย์ก็ได้นะ เพื่อนอยู่ชายเขตแดนมหาสารคาม-บุรีรัมย์ วอร์คไปฉีดไฟเซอร์ที่บุรีรัมย์ได้เฉย
ก้อต้องหาวัคซีนที่ดีๆๆและไม่มีความเสี่ยงในการฉีดมาสิค่ะนี่รัยพอฉีดมาก้อเป็นโน้นเป็นนี่แถมตายกะมี
ถ้าเอาของดีๆ มาฉีดให้เค้า ใครจะไม่อยากฉีด วันเลือกตั้งนี้จัดเลยครับ คัดกรองใครไม่ฉีด จับฉีดเลย ใหนๆก็มาเกือบทุกคนแล้วให้ อสม.สำรวจว่าใครยังไม่ได้ฉีด รีสรายชื่อไว้ถ้ายังไม่พร้อมฉีดให้หมอ อนามัยเข้าถึงบ้านจับฉีดโลด
กลยุทธ์ คือ ตอบโจทย์ปัญหาที่ ปชชกลัว
1. ปชชไม่มั่นใจสูดไขว้ ไม่มั่นใจในวัคซีน
2. ปขช ไม่มีสิทธ์เลือก วัคซีนที่เขาอยากฉีดได้เอง
3. การให้ข้อมูลวัคซีนที่ถูกต้อง เที่ยงตรงไม่อวย
(ดีก็บอกดี อันไหนไม่ดีก็บอกไม่ดี)
4. อย่าโกหกปปช ว่าวัคซีนตัวนี้ดีเช่นSV ซึ่งปชช. เขาเข้าถึงข้อมูล เขาดูจากสื่อ เขาดูวิจัยของไทยและประเทศต่างๆ เขามีการพูดคุยอย่าปิดหูปิดตาปชช
5. การฉีดเชิงรุก เป็นสิ่งที่ดีเพราะบางทีคนแก่ผู้ป่วยติดเตียง ก็ไม่สามารถไปต่อคิวนานๆได้
(ถ้าเชิงรุกได้จริง แนะนำเอาวัคซีนไปให้ปชช เลือกเลยคะ เปนcatalog ไปเลย พร้อมบอกข้อดีข้อเสียให้ปชช เลือกเอง ดีปปชเลือกเอง ถ้าข้อเสียปชช ก้รับได้เอง อย่างน้อยปชช ก็เปนผุ้เลือก)
6. เมื่อปชช ฉีด คุณต้องกล่าการันตรีว่าถ้ามันมีเอฟเฟคเกิดขึ้น มีรพ. ไหนรับรอง และเขียนใบรับรองว่า เกิดจากวัคซีนจริง ไม่ใช่ ไปบอกด้วยเหตุผลอื่น หมอ ,รพ ต้องตรงไปตรงมากับปชช
7. ต้องให้สิทธแด่ ปชช ในการคิด,วิเคราะห์ ,เลือกฉีดวัคซีนได้เอง เพราะชีวิต ,จิตวิญญาณ เปนของปชช.
ถ้าวัคซีนดี ใครๆก้อยากฉีด คุณไม่ต้องวิ่งหาปชชเลย มีแต่ปชช อยากวิ่งเข้าหาวัคซีน
ไม่ต้องหากรยุทธ์ อะไรมาหลอกล้อ ปชช. ด้วยซ้ำ
#วัคซีนที่ดีคือวัคซีนที่ปชชสามารถเลือกฉีดได้เอง
#ไฟเซอร,โมเดอน่า, AZ คือวัคซีนที่ควรอยุ่ในร่างกายมนุษย์คะ ส่วนอีกตัวไม่ขอพูดถึงเพราะมันไม่ได้ถูกจัดอยุ่ในวัคซีนกลุ่มนี้
ถ้ามีวัคซีนดีๆ เช่น Pfizer,Moderna
ตัวนี้ไม่ต้องบังคับ
ใครๆก็อยากฉีดค่ะ
(จากใจปชช.ที่จำยอมไปฉีดสูตรไขว้ แต่ในใจอยากฉีดPfizer มาก)
ให้ ผญบ. อสม. สำรวจลูกบ้านคนไหนยังไม่ฉีด เชิงรุกเลยคะ คนที่ยังไม่ฉีดใกล้ รพสต.ที่ไหนไปที่นั่น ผลพลอยได้อาจจะมีลูกบ้านที่ต้องฉีดเข็ม 2 ด้วยคะ
คนงานที่บ้านเราบอกให้ไปฉีด เขาบอกถ้าผมตายเจ้จะรับผิดชอบผมและครอบครัวผมไมละใครก็บังคับผมไม่ได้ เราก็ยกเหตุและผลต่างๆ สรุปทุกวันนี้ไม่มาทำงานอีกเลย555555 แรงจูงใจเท่านั้น
ผุ้สุงอายุเดินไม่ไหวอยากให้คุนหมออนามัยไปฉีดให้ที่บ้าน
บ้าน ชุมชน ตำบล อำเภอ จังหวัด สำรวจทีละบ้านสิค่ะ จัดสถานที่ ตามวัดใกล้ๆในชุมชน เราว่าโอน่ะ คนเฒ่าคนแก่ ไหนจะกลัว ไหนจะการเดินทาง พอลำบาก เค้าก็ไม่อยากฉีด แค่เสนอความคิดเห็นนะค่ะ
ดูบุรีรัมย์ สุรินทร์ เลยค่ะ
ที่บ้านพวกหมอและอสม เดินฉีดตามบ้านคะ ใครไม่ฉีดจะให้ไปอยู่ที่กักตัวคะ
กระจาย ที่ฉีดครับ
ลงตาม อนามัย ลงตามหมู่บ้าน โรงงาน
แยกหน่วย แบบมดงาน ลงพื้นที่ครับ
เพราะทุกคนไม่สามารถ มาที่ เซ็นทรัลได้
ยังมี concern เรื่อง
1. การเข้าถึงวัคซีน
2. ความรู้ เรื่องผลข้างเคียงของวัคซีน
ลองพิจารณาดูนะคะ
- จริงๆเรื่องผลข้างเคียงวัคซีน มีให้หาอ่านจากแหล่งข้อมูลที่น่าเชื่อถือได้อีกเยอะค่ะ
.
แต่ถ้า รพ.มหาราช จะ reference ข้อมูลอีก พี่น้องคนโคราช น่าจะมีความเชื่อมั่นมากยิ่งขึ้นนะคะ
ไฟเซอร์ 2 เข็ม แบบ บุรีรัมย์ สิคับ เดินเข้าฉีดได้เลย จบคับ
วัคซีนเข้าถึงยาก...มีข้อจำกัดในขนาดที่บางคนอยากฉีด (ทะเบียนบ้านอยู่จังหวัดอื่นแต่ตัวทำงานหรืออาศัยอยู่ที่นี่ ไม่สามารถฉีดได้)
ควรให้เลือกวัคซีนได้
เปิดให้เข้าถึงในการฉีดได้ถึงแบบสะดวกทุกรพ.ในอำเภอ ไม่ต้องเดินทางไกล ให้ทุกคนฉีดได้แม้ไม่ใช่คนทะเบียนบ้านที่นี่
ให้สามารถเดินเข้ามาฉีดได้เลยย พร้อมสามารถเลือกสูตรใดก็ได้ตามต้องการและอาจมีสิทธิ์ประโยชน์อื่นๆด้วย
อบจ.เชียงใหม่ รายชื่อ LINK
ประกาศองค์การบริหารส่วนจังหวัดเชียงใหม่ ให้ผู้ที่มีรายชื่อเข้ารับการฉีดวัคซีน ป้องกันโควิด 19 (Moderna) ที่ยังไม่ได้เข้ารับการฉีดวัคซีน ตามวัน เวลา ที่องค์การบริหารส่วนจังหวัดเชียงใหม่กำหนด ให้ติดต่อแจ้งความประสงค์ฉีดวัคซีน หรือสละสิทธิ์ ได้ที่กองสาธารณสุข องค์การบริหารส่วนจังหวัดเชียงใหม่ ภายในวันศุกร์ที่ 26 พฤศจิกายน 2564 ที่เบอร์โทรศัพท์ 0 5399 8333 ต่อ 178-179 ในวันและเวลาราชการ รายชื่อผู้ที่ยังไม่เข้ารับวัคซีน ตามภาพด้างล่าง
อดีตประธานาธิบดีโดนัลด์ ทรัมป์
3 ตุลาคม เป็นข่าวไปทั่วโลกเมื่ออดีตประธานาธิบดีทรัมป์ อายุ 74 ปี ประกาศผ่านทวิตเตอร์ว่าตัวเขา และเมลานี ทรัมป์ มีผลตรวจโควิดเป็นบวก เขาเข้ารับการรักษาด้วยาเรดิซิเวีย สเตอรอยด์ เด็กซาเมธาโซ และอีกบางขนาน เขาหายหลังจากเข้ารักษาไม่กี่วันและกลับสู่ทำเนียบขาวได้อย่างตกตะลึง
โรงพยาบาลในหนองคาย LINK
โรงพยาบาลจังหวัดหนองคาย
โรงพยาบาลชุมชน (อำเภอ) ในจังหวัดหนองคาย
โรงพยาบาลเอกชนในจังหวัดหนองคาย
โรงพยาบาลในจังหวัดอุดรธานี
โรงพยาบาลศูนย์/ทั่วไปในจังหวัดอุดรธานี
โรงพยาบาลชุมชน (อำเภอ) ในจังหวัดอุดรธานี
โรงพยาบาลเอกชนในจังหวัดอุดรธานี
อบจ.อุตรดิตถ์ จัดฉีดโมเดอร์นาล็อตแรก 24 พ.ย.64 LINK
24 พฤศจิกายน 2564 เวลา 10.30 น. ณ บริเวณสนามกีฬาพระยาพิชัยดาบหัก (ฝั่งกีฬาในร่ม) นายชัยศิริ ศุภรักษ์จินดา นายกองค์การบริหารส่วนจังหวัดอุตรดิตถ์ เป็นประธานเปิดโครงการส่งเสริมและสนับสนุนการดำเนินงานเฝ้าระวังป้องกันและควบคุมโรคติดต่อกรณีการให้บริการฉีดวัคซีนโควิด 19 Moderna ให้กับประชาชนกลุ่มเปราะบางและกลุ่มต่างๆในพื้นที่ตามเงื่อนไขการบริหารจัดการวัคซีนสำหรับประชาชนของสภากาชาดไทย
Isuzu Siam City ตรวจเช็กฟรี 30 รายการ LINK
บริการที่มีมาตรฐาน พร้อมสิ่งอำนวยความสะดวกขณะรอรับบริการ
พิเศษ สำหรับลูกค้านำรถเข้าสาขา บางใหญ่, ลาดพร้าว และ ลำลูกกา ฟรี คูปองเครื่องดื่มเต่าบิน มีเมนูเครื่องดื่มให้เลือกกว่า 80 รายการ
- ทีมช่างมืออาชีพที่มีความเชี่ยวชาญเฉพาะอีซูซุ
- เครื่องมือที่ทันสมัย ใช้เฉพาะรถอีซูซุ
- อะไหล่แท้ตรีเพชร ลด 15%
- ตรวจเช็กฟรี 30 รายการ
- บริการพ่นฆ่าเชื้อในห้องโดยสาร ฟรี
ลูกค้าสามารถนำรถมาเช็คระยะได้เลยน้าา
️ปลอดภัย‼ มีฉีดพ่นฆ่าเชื้อให้ทุกคัน มีมาตรการเว้นระยะห่างความปลอดภัยทางสังคม
อาการของเราคล้ายไข้หวัดใหญ่
คณะกรรมการด้านวัคซีนและภูมิคุ้มกันของประเทศสหราชอาณาจักรอังกฤษ (The Joint Committee on Vaccination and Immunisation, UK) ลดระยะห่างการฉีดวัคซีนเข็มกระตุ้น (Booster Dose) เหลือ 3 เดือน เพื่อช่วยลดความเสี่ยงการติดเชื้อไวรัสโควิด-19 สายพันธุ์ใหม่ “โอมิครอน (Omicron)”
เป็นคนน่าน ติดโควิดต้องการกลับมารักษา ณ ภูมิลำเนา
กรณีเป็นคนน่าน ติดโควิดต้องการกลับมารักษา ณ ภูมิลำเนา
ติดต่อ ศูนย์ประสานงาน "รับผู้ป่วยโควิด-19 กลับน่าน" โดยสำนักงานสาธารณสุขจังหวัดน่าน
สแกน QR Code สื่อสารโควิด-19น่าน
ID:@876vtsfm
หรือโทร 084-2128070
ตรวจผล COVID-19 โรงพยาบาลลำพูน
กลุ่มผู้ใหญ่ อายุ 25-59 ปี
กลุ่มผู้ใหญ่ อายุ 25-59 ปี มีสิทธิประโยชน์บริการ ดังนี้ ฉีดวัคซีนคอตีบ บาดทะยัก ตรวจวัดความดันโลหิต ตรวจเลือดคัดกรองเบาหวาน เอชไอวี คัดกรองความเสี่ยงจากการสูบบุหรี่ สุราและสารเสพติด คัดกรองปัจจัยเสี่ยงต่อการเกิดโรคหัวใจ และหลอดเลือด ตรวจคัดกรองมะเร็งปากมดลูก ตรวจคัดกรองมะเร็งลำไส้ใหญ่ (50-70 ปี) เคลือบฟลูออไรด์ การให้ยาบำรุงเสริมธาตุเหล็ก การป้องกันและแก้ไขการตั้งครรภ์ไม่พึงประสงค์ การคุมกำเนิด ให้ความรู้ตรวจเต้านมด้วยตนเอง และให้คำปรึกษาแนะนำด้านสุขภาพ
Zone : 3 ส่องกล้องท่องกาย
โซน Virtual Reality เป็นการสร้างภาพจำลองการเกิดโรคต่างๆ ในร่างกาย ให้คุณสามารถเห็นได้อย่างสมจริงแบบต่อหน้าต่อตา ด้วย VDO VR ที่จัดทำขึ้นใหม่สำหรับนิทรรศการสุขภาวัฒนะโดยเฉพาะ ซึ่งจะพาคุณไปดูการเกิดขึ้น ของโรคต่างๆ ในร่างกาย เช่น การเกิดขึ้นของมะเร็ง การตีบตันและแตกของหลอดเลือดสมอง และโรคอื่นๆ ที่อาจจะเกิดขึ้นได้หากคุณละเลยการดูแลสุขภาพ
2. วัคซีนใหม่ของ Novavax มีประสิทธิภาพสูงเพียงใด?
ในงานทดลองที่ใช้เป็นหลักฐานยื่นขออนุมัติวัคซีนนั้น วัคซีนของ Novavax มีประสิทธิผลในแง่ของการป้องกันโรคอยู่ที่ 90% ซึ่งหมายความว่า ในกลุ่มที่ได้รับการฉีดวัคซีนมีผู้ที่ป่วยเป็นโรค Covid-19 "น้อยกว่า" ในกลุ่มควบคุมที่ได้วัคซีนปลอม 90%
และเป็นการฉีดวัคซีนเป็นจำนวน 2 โดสที่ได้รับห่างกัน 3 สัปดาห์ อย่างไรก็ตาม ข้อเท็จจริงอย่างนึงที่เราไม่ควรจะมองข้าว ก็คือ ผลลัพธ์ส่วนใหญ่ของงานทดลองนี้เป็นผลจากการทดลองกับไวรัสสายพันธุ์อัลฟ่า ซึ่งก็คือพันธุ์เดลต้าที่กำลังระบาดในเยอรมนี ณ ขณะนี้นั่นแหละที่ไปผลักดันอัลฟ่าออกไปจนแทบจะทั้งหมด อย่างไรก็ตาม และงานศึกษาทดลองทั้งสองชิ้นก็ดันเสร็จสิ้นก่อนที่ตัวเดลต้าจะเข้ามาเป็นไวรัสแพร่ระบาดหลัก และแน่นอนว่า ก็ก่อนที่จะมีการค้นพบ Omicron อย่างแน่ชัด ดังนั้นก็จึงยังไม่ชัดเจนว่า วัคซีนของ Novavax มีประสิทธิภาพเพียงใดในตอนนี้ โดยบริษัท Novavax เองก็ได้ประกาศไปแล้วว่า ยังไงเสียก็จะต้องใช้วัคซีนกระตุ้นโดส 3 เป็นตัวกระตุ้นเพื่อป้องกันเดลต้าเท่านั้น จึงจะสามารถคาดหวังระดับแอนติบอดีที่ใกล้เคียงกับไวรัสดั้งเดิมได้ เพราะฉะนั้นคำถามที่ว่า วัคซีนของ Novavax จะมีประสิทธิภาพดีเพียงใดกับ Omicron ก็ยังไม่แน่ชัด บริษัทประกาศเมื่อต้นเดือนธันวาคมว่า ต้องการทดสอบวัคซีนของตนกับตัวกลายพันธุ์ดังกล่าว
บริษัทแถลงข่าวว่า "ข้อมูลจากห้องแลปคาดว่า จะออกมาในไม่กี่สัปดาห์ข้างหน้านี้" นอกจากนี้ ผู้ผลิตยังกล่าวว่า ได้เริ่มพัฒนาสไปค์โปรตีนจำเพาะของโอไมครอนสำหรับวัคซีนใหม่แล้ว ตามแผนการปัจจุบัน การผลิตครั้งแรกในโรงงานเชิงพาณิชย์คาดว่าอาจจะเกิดขึ้นได้ในเดือนมกราคม 2022"
อย่างไรก็ตาม ผู้เชี่ยวชาญด้านวัคซีนทั้งหลายกลับชี้ให้เห็นว่า เทคโนโลยีของ Novavax สามารถกระตุ้นการป้องกันวัคซีนในระบบภูมิคุ้มกันได้เพียงไม่กี่ส่วนเท่านั้น ในขณะที่วัคซีน mRNA สามารถกระตุ้นไปถึงการก่อตัวของ T-Cell ซึ่งเป็นเซลล์ที่มีหน้าที่กำจัดเชื้อแปลกปลอมที่สำคัญ รวมไปถึงสามารถกระตุ้นเซลล์หน่วยความจำที่เกี่ยวข้องอีกด้วย โดย Christian Münz ศาสตราจารย์ด้านภูมิคุ้มกันไวรัสจากมหาวิทยาลัยซูริก บอกกับหนังสือพิมพ์ RND ว่า "วัคซีนที่ใช้โปรตีนเป็นส่วนประกอบ แทบจะไม่สามารถกระตุ้น T-Cell ได้ แต่ไปกระตุ้นการตอบสนองของแอนติบอดีเป็นหลัก นั่นทำให้ไวรัสสามารถต้านทานวัคซีนเหล่านี้ได้ง่ายขึ้น เพราะการตอบสนองทางภูมิคุ้มกันไม่ครอบคลุมมากนัก"
เช่นเดียวกับที่เป็นที่แน่ชัดว่า ตัวกลายพันธุ์ Omicron จะเข้ามาเป็นไวรัสสายพันธุ์ที่มีอิทธิพลอย่างมากต่อกระบวนการติดเชื้อในไม่ช้า “วัคซีนนี้ก็จะต้องถูกดัดแปลงให้เข้ากับ Omicron เหมือนกัน” Carsten Watzl เลขาธิการสมาคมภูมิคุ้มกันวิทยาแห่งเยอรมนีเขียนเมื่อเร็ว ๆ นี้เกี่ยวกับวัคซีน Novavax บน Twitter
ทั้งนี้ บทวิเคราะห์ของ อีไอซี (SCB EIC) เผยถึงพฤติกรรมผู้บริโภค Flexitarian ว่า เป็นกลุ่มคนที่พยายามลดการบริโภคเนื้อสัตว์ให้น้อยลง ในลักษณะที่ว่า เป็นการรับประทานบางอย่าง ไม่รับประทานบางอย่าง หรือรับประทานบ้าง ไม่รับประทานบ้าง ซึ่งสามารถทำได้หลายรูปแบบ เช่น บางกลุ่มเลือกที่จะไม่รับประทานเพียงเนื้อแดงเท่านั้น บางกลุ่มไม่รับประทานนม หรือไข่ บางกลุ่มเลือกที่จะรับประทานวีแกนบางมื้อหรือบางวัน โดยสถาบันวิจัยตลาดและพฤติกรรมผู้บริโภคระดับโลกอย่าง Mintel ได้ออกมายืนยันว่า การกินแบบ Flexitarian นั้น กำลังเป็นที่นิยมโดยเฉพาะในกลุ่มประเทศยุโรป ในขณะที่คนไทยเองก็รับประทานเนื้อสัตว์น้อยลงเช่นกัน จากข้อมูลโดยสำนักงานสถิติแห่งชาติพบว่า สัดส่วนของคนไทยที่ไม่รับประทานเนื้อสัตว์เพิ่มขึ้น จาก 4 เปอร์เซ็นต์ ในปี 2013 เป็น 12 เปอร์เซ็นต์ ในปี 2017 ของประชากรไทยอายุ 6 ปีขึ้นไป
เรียกได้ว่า พฤติกรรมการบริโภคมังสวิรัติเป็นครั้งคราวของผู้บริโภคกลุ่มนี้ จะยิ่งผลักดันให้กระแส Plant-based Food แพร่หลายในวงกว้างมากขึ้น ซึ่งแน่นอนว่า ผู้ประกอบการในกลุ่มอาหารไม่สามารถเพิกเฉยต่อการเปลี่ยนแปลงของพฤติกรรมนี้ได้ จำเป็นต้องปรับตัวตาม เพื่อตอบโจทย์ความต้องการในรูปแบบใหม่ที่เกิดขึ้น
THCG Group
THCG Group หนึ่งในผู้เล่นสำคัญของอุตสาหกรรมกัญชา กัญชง กระท่อม ครบเครื่องทั้งต้นน้ำ กลางน้ำและปลายน้ำ
Luxury Box Set
น้ำมันกัญชาในรูปแบบ Luxury Box Set เพิ่มคุณค่าผลิตภัณฑ์และรูปแบบ
ผลิตภัณฑ์อาหารเสริมในแพคเกจและดีไซน์ ทันสมัย
ประกาศ ศูนย์ต้านโควิด กาฬสินธุ์
สถานที่กักตัว อนามัย 7 Hotel Quarantine Hospitel หากผลตรวจ ATK เป็นบวก LINK
บริการสถานที่กักตัว อนามัย 7 Hotel Quarantine Hospitel เฝ้าระวังโควิด-19
หากผลตรวจ ATK เป็นบวก (Positive/ผลบวก 2 ขีด) หรือสัมผัสเสี่ยงสูง เข้ากักตัวฟรี ไม่มีค่าใช้จ่าย
โทร 061-9724533
โรงแรมในเครือข่าย พร้อมด้วย
- อาหาร 3 มื้อ
- ปรึกษาเจ้าหน้าที่ แพทย์ ผ่าน Telemedicine
- บริการตรวจ RT-PCR/ATK
- บริการส่งตัวไปรักษาต่อในรพ. เมื่อพบอาการผิดปกติ
รายที่ 10135 ชาย 36 ปี ชาวอ.กมลาไสย 16 ธันวาคม ไปทานอาหารร้านคิกคาปู้
รายที่ 10135 ชาย อาชีพรับจ้าง อายุ 36 ปี ชาวอ.กมลาไสย ไม่มีโรคประจำตัว
16 ธันวาคม 22-23 น.ไปทานอาหารร้านคิกคาปู้ ตลาดโรงสี กับเพื่อน 4 คน
19 ธันวาคม เริ่มอาการไข้หวัด คอแห้ง
20 ธันวาคม มีน้ำมูก ไอ
23 ธันวาคม เข้าตรวจหาสารพันธุกรรมโควิด ที่รพ.กาฬสินธุ์ บ่ายเดินทางกลับไปกักตัวที่บ้าน
24 ธันวาคม รพ.กาฬสินธุ์ รายงานผลตรวจยืนยันพบสารพันธุกรรมโควิด-19 เวลา 13.30 น. เข้ารับการรักษา ณ รพ.ร่องคำ
ถนนสีส้มทองกวาว แห่ง อ.ดอกคำใต้ จ.พะเยา
เดือนกุมภาพันธ์-เมษายน ถ. สายพะเยา - เชียงคำ ช่วง อ.ดอกคำใต้ จ.พะเยา ระยะทางกว่า 20 กม. จะพบดอกทองกวาวบานสะพรั่งสองข้างทาง ทำให้ช่วงถนนสายนี้เป็นถนนที่สวยงามติดอันดับ 1 ใน 9 ของประเทศ
ร้านรถเมล์คอนหวัน (ข้างอุทยานสวรรค์) ในวันที่ 31 ธันวาคม 2564 -1 มกราคม 2565 LINK
#ประชาสัมพันธ์สำนักงานสาธารณสุขจังหวัดนครสวรรค์
?❗️ขอให้ประชาชนที่ไปรับประทานอาหารที่ “ร้านรถเมล์คอนหวัน” (ข้างอุทยานสวรรค์) ในวันที่ 31 ธันวาคม 2564 -1 มกราคม 2565
ติดต่อเข้ารับการตรวจหาเชื้อ COVID-19 ณ คลินิกไข้หวัด โรงพยาบาลสวรรค์ประชารักษ์ ทุกวัน เวลา 08:30 – 22:00 น.
#โดยสวมหน้ากากอนามัยและใช้รถส่วนตัวในการเดินทาง
☎สอบถามเพิ่มเติมที่สายด่วน COVID-19 โทร. 081-3527696
⚠ และขอความร่วมมือผู้รับบริการทุกท่าน ไม่ปกปิดข้อมูลประวัติการเดินทาง หรือการสัมผัสกลุ่มเสี่ยง เพื่อความปลอดภัยของท่านและทุกคน ตลอดจนบุคคลากรทางการแพทย์
สปส. กรุงเทพมหานครพื้นที่ 3 LINK
อาคาร 12 ชั้น กระทรวงแรงงาน ถนนมิตรไมตรี แขวงดินแดง เขตดินแดง กทม. 10400
สถานที่ : บริเวณกระทรวงแรงงานอาคารสำนักงานประกันสังคม 02-2454101
รับผิดชอบเขต ดินแดง พญาไท ราชเทวี ห้วยขวาง
Facebook พื้นที่ 3 แผนที่
Tel. 02-2484867, 02-2451220, 02-2481318, 02-2454008, 02-2454012, 02-2454440
Fax 02-245-3907
รพ.ขุนยวม ชวนเชิญ Walk in ฉีดเข็ม 3
“เราเห็นด้วยกับการใช้ประโยชน์จากกัญชาในทางการแพทย์ แต่เราไม่เห็นด้วยกับการยกเลิกกัญชาจากการเป็นยาเสพติด”
--------------------------
วัชรพงศ์ พุ่มชื่น
ศูนย์วิชาการสารเสพติดภาคเหนือ
รองศาสตราจารย์ ดร.กอตอลิน กอริโก สำเร็จการศึกษาดุษฎีบัณฑิตจากมหาวิทยาลัยเซเก็ด ประเทศฮังการี
ศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน สำเร็จการศึกษาแพทยศาสตร์บัณฑิต และดุษฎีบัณฑิตจากมหาวิทยาลัยบอสตัน สหรัฐอเมริกา หลังจากนั้นฝึกอบรม ณ สถาบันสุขภาพแห่งชาติ รัฐแมรี่แลนด์ สหรัฐอเมริกา กับนายแพทย์ แอนโทนี ฟอซี (Dr. Anthony Fauci) ผู้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี 2556 สาขาการแพทย์
รองศาสตราจารย์ ดร.กอตอลิน กอริโก และศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน ได้ร่วมกันศึกษาวิจัยวิธีการนำเมสเซนเจอร์ อาร์เอนเอ มาใช้ในทางการแพทย์ โดยในปี พ.ศ.2549 ได้ร่วมกันค้นพบว่าการใช้นิวคลิโอไซด์ดัดแปลงช่วยลดปฏิกิริยาของเซลล์ต่ออาร์เอนเอแปลกปลอมได้ ซึ่งเป็นก้าวสำคัญในการนำเมสเซนเจอร์อาร์เอนเอมาใช้ประโยชน์ ทั้งนี้เนื่องจากตามธรรมชาติแล้ว เมสเซนเจอร์อาร์เอนเอแปลกปลอมที่ให้เข้าไปจากภายนอกเซลล์จะถูกกลไกต่อต้านไวรัสของเซลล์ตรวจจับ และเมื่อพบอาร์เอนเอแปลกปลอมก็จะกระตุ้นกลไกต่างๆที่จะยับยั้งการแปลรหัสจากอาร์เอนเอและกระตุ้นให้เกิดการอักเสบ ซึ่งกลไกเหล่านี้เป็นอุปสรรคสำคัญในการนำเมสเซนเจอร์อาร์เอนเอมาใช้ฉีดเข้าในร่างกายเพื่อการป้องกันหรือรักษาโรค การค้นพบดังกล่าวรวมทั้งการศึกษาวิจัยต่อๆ มาของ รองศาสตราจารย์ ดร.กอตอลิน กอริโก และศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน ที่ทำให้มีการนำซูโดยูริดีนมาใช้ในการสร้างเมสเซนเจอร์อาร์เอนเอ และการคิดค้นวิธีการในการทำเมสเซนเจอร์อาร์เอนเอที่มีซูโดยูริดีนให้บริสุทธิ์ เป็นรากฐานสำคัญในการนำเทคโนโลยีเมสเซนเจอร์อาร์เอนเอมาใช้ในการพัฒนาวัคซีนต่อต้านโควิด-19 รองศาสตราจารย์ ดร.กอตอลิน กอริโก และศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน ยังเป็นผู้มีบทบาทสำคัญในการพัฒนาวัคซีนโควิด-19 ด้วยเทคโนโลยีใหม่นี้ได้อย่างรวดเร็ว
ผลงานของรองศาสตราจารย์ ดร.กอตอลิน กอริโก และศาสตราจารย์ ดร. นายแพทย์ ดรู ไวส์แมน ทำให้เกิดวัคซีนโควิด-19 ชนิดเมสเซนเจอร์อาร์เอนเอ ซึ่งเป็นวัคซีนที่ได้ถูกพัฒนาขึ้นอย่างรวดเร็วตอบสนองกับการระบาด ทำให้สามารถลดการติดเชื้อและการเจ็บป่วยรุนแรง อีกทั้งยังเป็นเครื่องมือสำคัญในการควบคุมการระบาดในประเทศต่างๆ ทั่วโลก เป็นประโยชน์ต่อสุขภาพอนามัย และชีวิตผู้ป่วยหลายร้อยล้านคนทั่วโลก
ศาสตราจารย์ตู โยวโยว (Professor Tu You You)
ศาสตราจารย์ตู โยวโยว (Professor Tu You You) จากสาธารณรัฐประชาชนจีน เป็นสมาชิกของกลุ่ม china cooperative research group on qinghaosu and its derivatives as antimalarials ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการแพทย์ ประจำปี 2546 จากการศึกษาสารสกัดชิงเฮาซูจนสามารถพัฒนาเป็นยารักษาโรคมาลาเรีย ต่อมาได้รับรางวัลโนเบล สาขาการแพทย์ ประจำปี 2558 จากการศึกษาเดียวกัน
พื้นที่สำหรับกิจกรรมแอคทีฟ เช่น เล่นจานร่อน เล่นอเมริกันฟุตบอลขนาดเล็ก จะมาชุมนุมกันเต้นรำตอนเย็น เล่นดนตรีกันเป็นกลุ่มหรือจะเอางานสำคัญของเมือง ที่ต้องใช้พื้นที่ขนาดใหญ่
โรงพยาบาลบางจาก เปิด Walk in ฉีดเข็ม 1-2-3-4 ถึงวันที่ 5 กุมภาพันธ์ 2565 LINK
โรงพยาบาลบางจาก เปิดให้บริการฉีดวัคซีนโควิด-19 แบบ Walk in ฉีดเข็ม 1-2-3-4
ในวันที่ 31 มกราคม - 5 กุมภาพันธ์ 2565 ณ สวนสาธารณะ เทศบาลเมืองลัดหลวงเฉลิมพระเกียรติ (ข้างวัดชมนิมิตร)
เริ่มเเจกบัตรคิว เวลา 05.00 น. จำนวนวันละ 1,000 คิว/วัน
กรุณาเตรียม
1. บัตรประชาชนตัวจริง
2. ปากกาส่วนตัว
3. ใบรับรองการฉีดวัคซีนครบ 2 เข็ม หรือหมอพร้อม
4. สำหรับต่างชาติ นำ Passport , บัตรชมพู , บัตรประกันสังคม (ถ้ามี) และควรมีล่ามหรือนายจ้างมาด้วย
Package Basic Program (สำหรับอายุ 45 ปีขึ้นไป)
ยาประสะมะแว้ง บรรเทาอาการไอ ขับเสมหะ ลดอาการระคายคอ LINK
แพทย์แผนไทยนิยมใช้ทั้งมะแว้งเครือ และมะแว้งต้น มาทำยาโดยเรียกว่า "มะแว้งทั้งสอง" นอกจากนี้ ผลมะแว้ง ยังนิยมนำมากินเป็นผักจิ้มกับน้ำพริก รสชาติออกขม แต่ช่วยให้ชุ่มคอ ขับเสมหะได้ดีมาก
ยาประสะมะแว้งเป็นยาแผนโบราณที่เป็นยาสามัญประจำบ้านและจัดอยู่ในกลุ่มยารักษากลุ่มอาการของระบบทางเดินหายใจ ที่กระทรวงสาธารณสุขประกาศใช้ในบัญชียาจากสมุนไพร ที่มีการใช้ตามองค์ความรู้ดั้งเดิมในบัญชียาหลักแห่งชาติ
โรงงานขาเทียมพระราชทาน โรงพยาบาลสิชล นครศรีธรรมราช LINK
โรงงานขาเทียมพระราชทาน โรงพยาบาลสิชล นครศรีธรรมราช ให้บริการด้านกายอุปกรณ์ ผลิต ซ่อมขาเทียมพระราชทาน แผ่นรองชั้นในรองเท้าในผู้ป่วยเบาหวาน ซ่อม wheel Chair ส่งเสริมป้องกันให้คำแนะนำการดูแลตอขาและขาเทียม ด้วยเทคโนโลยี และเครื่องมือตามมาตรฐานวิชาชีพ รวมทั้งลงเยี่ยมติดตามหลังจากการจำหน่ายขาเทียมพระราชทาน เพื่อให้ผู้พิการขาขาดได้รับขาเทียมพระราชทานที่มีคุณภาพ รวดเร็ว ไม่มีภาวะแทรกซ้อน ผู้รับบริการพึงพอใจ
- ติดต่อ โรงงานขาเทียมพระราชทาน กลุ่มงานเวชกรรมฟื้นฟู ชั้น 2 อาคารสนับสนุนบริการโทร : 075-535630-4 ต่อ 157 หรือ 081-9217846
- เวลาเปิดให้บริการ จันทร์-ศุกร์
- ขั้นตอนการรับบริการ โดยย่อ คือ 1. ทำบัตรคิว 2. พบแพทย์และนักกายภาพบำบัดเพื่อตรวจสุขภาพตอขาและสั่งทำขาเทียม 3. เริ่มตรวจตรวจสุขภาพตอขาและสั่งทำขาเทียม 4. เริ่มทำขาเทียม โดยช่างขาเทียม
รายละเอียด คลิกไปดูที่เว็บไซต์โรงงาน
รพ.มหาวชิราลงกรณธัญบุรี LINK
สอบถามเพิ่มเติม
- ไลน์ @mth.canceranywhere
- โทร.02 5461960-6 ต่อ 1004.1006
- มือถือ 081-358-9171
- ในเวลาราชการ วันจันทร์-วันศุกร์ เวลา 08.00 น.-16.00 น.
ความผิดปกติของการใช้ภาษา (aphasia)
ผู้ป่วยที่มีความผิดปกติของการใช้ภาษาเช่น เรียกชื่อคนที่คุ้นเคยไม่ถูก เรียกชื่อสิ่งของไม่ได้ อาจทำให้ผู้ดูแลเข้าใจว่า ผู้ป่วยจำไม่ได้และมีภาวะสมองเสื่อม แต่ความผิดปกติกลุ่มนี้จะเสียแต่ด้านการใช้ภาษาเพียงอย่างเดียว ไม่มีความผิดปกติของการทำงานของสมองระดับสูง (higher cortical function) อื่นๆ
ภาวะสมองเสื่อมชนิดกลับคืนเป็นปกติได้ (reversible หรือ arrestable dementia)
ส่วนหนึ่ง ของผู้ป่วยที่มีภาวะสมองเสื่อมเกิดจากสาเหตุที่สามารถแก้ไขให้กลับคืนเป็นปกติหรือหยุดยั้งไม่ให้การดำเนินโรคเลวลงได้ โดยมีตัวอักษรย่อเพื่อง่ายต่อการจำ คือ DEMENTIA ซึ่งย่อมาจาก
- Drug toxicity โดยเฉพาะยาที่ออกฤทธิ์ต่อจิตประสาท เช่น ยานอนหลับ ยาที่มีฤทธิ์ anticholinergic และยาคลายกล้ามเนื้อ
- Emotional disorder ได้แก่ ภาวะซึมเศร้า
- Metabolic และ endocrine disorder ที่สำคัญคือ โรคต่อมไทรอยด์ทำงานน้อยเกินไป (hypothyroidism) ซึ่งมักมีอาการไม่จำเพาะ เช่น เคลื่อนไหวช้า ท้องผูก นอนมาก แยกได้ยากจากสิ่งที่พบได้ทั่วไปในผู้สูงอายุ
- Eye and Ear disorder ทำให้ขาดสิ่งเร้ามากระตุ้นระบบประสาท มักเป็นสาเหตุที่พบได้น้อยในเวชปฏิบัติ
- Nutritional disorder (thiamine, folate, B6 and B12 deficiency) / Normal pressure hydrocephalus ในประเทศไทย มักไม่พบภาวะขาดวิตามินบี 12 บ่อยเท่าในต่างประเทศ การตรวจคัดกรองหาระดับวิตามินบี 12 ในผู้ที่มีภาวะสมองเสื่อม จึงควรพิจารณาทำเฉพาะในกรณีที่มีข้อบ่งชี้ทางเวชกรรมอื่นๆ ด้วย32,33
- Tumor (primary และ secondary brain tumor) และ Trauma โดยเฉพาะ chronic subdural hematoma ซึ่งพบมากในผู้สูงอายุ โดยอาจไม่มีประวัติภาวะหกล้มหรืออุบัติเหตุนำมาก่อนถึงร้อยละ 50 และบางรายอาจมีอาการหลังจากอุบัติเหตุที่ไม่รุนแรงได้นานหลายเดือน34
- Infection เช่น โรคเยื่อหุ้มสมองอักเสบจากเชื้อวัณโรค (tuberculous meningitis), neurosyphilis, โรคเยื่อหุ้มสมองอักเสบจากเชื้อ cryptococcus (cryptococcal meningitis) ภาวะสมองเสื่อมเนื่องจากการติดเชื้อ HIV (HIVassociated dementia : HAD) และ cerebral cysticercosis อย่างไรก็ตามผู้ป่วยกลุ่มนี้แม้ได้รับการรักษาแล้วก็ตามระดับความสามารถของสมองมักไม่กลับเป็นปกติเหมือนเดิมทั้งหมด
- Arteriosclerosis (vascular dementia) และ Alcohol ภาวะสมองเสื่อมที่เกิดจากปัญหาของหลอดเลือด สามารถให้การป้องกันหรือชะลอการดำเนินโรคได้ ถ้าผู้ป่วยได้รับการแก้ไขปัจจัยเสี่ยงของโรคหลอดเลือด สำหรับการดื่มอัลกอฮอล์ สามารถทำให้เกิดภาวะสมองเสื่อมได้จากหลายสาเหตุ เช่น alcoholic dementia, Wernicke-Korsakoff syndrome, Marchiafava-Bignami syndrome และ อุบัติเหตุที่ศีรษะจากเมาสุรา เป็นต้น การหยุดแอลกอฮอล์ จึงเป็นการหยุดยั้งสาเหตุของภาวะเหล่านี้
การศึกษาในต่างประเทศพบว่าภาวะสมองเสื่อมเกิดจากสาเหตุที่แก้ไขหรือยับยั้งการดำเนินโรคได้ถึงร้อยละ 0-23 สำหรับสาเหตุที่แก้ไขแล้วทำให้มีการฟื้นคืนในความสามารถของสมองเพียงบางส่วนและร้อยละ 0-10 สำหรับสาเหตุที่แก้ไขแล้ว ทำให้มีการฟื้นคืนในความสามารถของสมองได้ทั้งหมด5,6 อย่างไรก็ตามรายงานการวิจัยในระยะหลังกลับพบภาวะสมองเสื่อมที่เกิดจากสาเหตุที่แก้ไขหรือยับยั้งการดำเนินโรคได้ลดลงเหลือต่ำกว่าร้อยละ 17 ซึ่งการลดลงของความชุกนี้อาจเกิดจากการที่ภาวะต่างๆ ที่ทำให้เกิดสมองเสื่อมชนิดที่แก้ไขได้ลดลงจริง (แต่สาเหตุที่ลดลงกลับไม่แน่ชัด) เกิดจากการที่มีการดูแลรักษาผู้ป่วยดีขึ้น ทำให้สามารถรักษาผู้ป่วยก่อนที่จะเกิดภาะสมองเสื่อม หรืออาจเกิดจากการที่มีการรายงานโรคเปลี่ยนไปจากเดิม8
สาเหตุที่มีรายงานที่ทำให้เกิดภาวะสมองเสื่อมที่แก้ไขหรือยับยั้งได้ ได้แก่ ภาวะการขาดวิตามินบี 12 ขาดโฟเลต ความผิดปกติของดุลเกลือแร่ ภาวะการทำงานของต่อมไทรอยด์บกพร่อง (ทั้งโดยผลระยะสั้นที่ทำให้มีความคิดอ่านช้า ความสามารถในการทำงานของสมองบกพร่องและการที่เพิ่มความเสี่ยงต่อการเกิดโรคอัลไซเมอร์ ประมาณ 2 เท่า)9 โรคติดเชื้อในระบบประสาท เช่น โรคซิฟิลิส โรคเยื่อหุ้มสมองอักเสบ โรคเนื้องอกในสมอง โพรงน้ำในสมองขยายตัว (hydrocephalus) ยาบางชนิด ตลอดจนอารมณ์ซึมเศร้า เป็นต้น5 จึงเป็นที่มาของการส่งตรวจเช็คระดับของวิตามินบี 12 โฟเลต VDRL การทำงานของต่อมไทรอยด์ การตรวจภาพรังสีสมอง เพื่อพยายามหาสาเหตุที่แก้ไขหรือยับยั้งได้ อย่างไรก็ตามการศึกษาในประเทศอินเดียพบภาวะสมองเสื่อมจากสาเหตุที่แก้ไขได้ถึงร้อยละ 18 โดยเกิดจากการติดเชื้อในระบบประสาท (ร้อยละ 8.5 โพรงน้ำในสมองขยายตัว (hydrocephalus; ร้อยละ 6.2) และภาวะขาดวิตามินบี 12 (ร้อยละ 3.9) เป็นหลัก10 แต่ยังไม่เคยมีการศึกษานี้ในประเทศไทยมาก่อน
โรงพยาบาลกาฬสินธุ์-ธนบุรี ประกาศรับสมัคร LINK
- แม่บ้าน 1 อัตรา
- เจ้าหน้าที่เปล 1 อัตรา
- เจ้าหน้าที่ยานยนต์ 1 อัตรา
สมัครได้ตั้งแต่วันนี้ - 5 ก.พ. 2565
เขียนใบสมัครด้วยตนเองที่แผนกบุคคล ชั้น 3 โรงพยาบาลกาฬสินธุ์ - ธนบุรี
สอบถามรายละเอียดเพิ่มเติมโทร. 043-840444 ต่อ 3101 (แผนกบุคคล)
2) Complicated care การรักษาโรคซับซ้อน
Complicated care การรักษาโรคซับซ้อน บำรุงราษฎร์มีทีมแพทย์ชำนาญการและประสบการณ์ในการรักษาผู้ป่วยที่มีอาการซับซ้อนเกี่ยวเนื่องกับหลายอวัยวะหรือเป็นโรคยากต่อการวินิจฉัย โดยมี Center of Excellence ที่ครอบคลุมการรักษาในทุกโรค ซึ่งรวมถึงการปลูกถ่ายอวัยวะ (Organ transplantation) มีทีมแพทย์ที่มีประสบการณ์และความชำนาญการขั้นสูงในการผ่าตัดปลูกถ่ายอวัยวะ มากว่า 30 ปี ทั้งการปลูกถ่ายไต, ปลูกถ่ายหัวใจ, ปลูกถ่ายตับ และปลูกถ่ายตา โดยบำรุงราษฎร์เป็นโรงพยาบาลเอกชนแห่งแรกในประเทศไทย ที่ประสบความสำเร็จในการผ่าตัดปลูกถ่ายหัวใจให้แก่ผู้ป่วยที่มีภาวะหัวใจล้มเหลว
6.โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน จ.พัทลุง
โรงพยาบาลการแพทย์แผนไทยและการแพทย์ผสมผสาน
เขตสุขภาพที่ 2 จ.พัทลุง
โทร.074-600036
เปิดทุกวัน จันทร์-ศุกร์ เวลา 8.30-16.30 น.
มาตรการที่ 1 การเพิ่มประสิทธิภาพในการบริหารจัดการเชิงพื้นที่
ผลผลิต : จำนวนวันที่ฝุ่นละอองอยู่ในเกณฑ์มาตรฐานในช่วงวิกฤต เพิ่มขึ้นร้อยละ 5 ต่อปี
หน่วยงานหลัก: กระทรวงมหาดไทย กรุงเทพมหานคร จังหวัด
มาตรการเพิ่มประสิทธิภาพในการบริหารจัดการเชิงพื้นที่ มุ่งเน้นการบริหารจัดการ/ควบคุมมลพิษจากแหล่งกำ เนิดในเชิงพื้นที่ โดยการกำหนดแนวทางปฏิบัติในการแก้ไขปัญหาในช่วงวิกฤตสถานการณ์ รวมถึงการดำเนินงานในระยะเร่งด่วนในการแก้ไขปัญหามลพิษทางอากาศเพื่อรองรับสถานการณ์ในช่วงวิกฤตในพื้นที่ที่มีปัญหาและพื้นที่เสี่ยงปัญหาฝุ่นละออง ได้แก่
- พื้นที่ 9 จังหวัดภาคเหนือ
- พื้นที่กรุงเทพมหานครและปริมณฑล
- พื้นที่ประสบปัญหาหมอกควันภาคใต้
- พื้นที่ตำบลหน้าพระลาน อำเภอเฉลิมพระเกียรติจังหวัดสระบุรี
- พื้นที่จังหวัดอื่นที่เสี่ยงปัญหาฝุ่นละออง เช่น จังหวัดขอนแก่น จังหวัดกาญจนบุรีเป็นต้น
โดยมีแนวทางการดำ เนินงานในการบริหารจัดการดังนี้
1.1 ทบทวน วิเคราะห์ข้อมูลและประเมินผลสถานการณ์ PM2.5 ที่เกิดขึ้นและการดำเนินการที่ผ่านมาเพื่อถอดบทเรียนการแก้ไขปัญหาฝุ่นละอองที่ผ่านมา
1.2 ปรับปรุงระบบการบริหารจัดการในภาวะฉุกเฉินและจัดทำแผนเผชิญเหตุ/แผนตอบโต้สถานการณ์ให้มีประสิทธิภาพยิ่งขึ้น โดยแบ่งการทำ งานออกเป็น 3 ช่วง คือ
- 1) ช่วงก่อนวิกฤต
- 2) ช่วงระหว่างเกิดสถานการณ์วิกฤต (กำหนดให้มีโครงสร้าง/กลไกการบริหารจัดการแผนเผชิญเหตุ/มาตรการตอบโต้สถานการณ์ที่จะดำ เนินการในแต่ละช่วงระดับของฝุ่นละอองหรือ AQI) และ
- 3) ช่วงหลังวิกฤต
1.3 การดำเนินการตามแผนเผชิญเหตุ/แผนตอบโต้สถานการณ์ในช่วงวิกฤตตามที่กำหนดไว้
ใช้ระบบบริหารจัดการแบบเบ็ดเสร็จ (Single Command) เป็นกลไกจัดการปัญหาฝุ่นละอองโดยจัดตั้งศูนย์บัญชาการระดับจังหวัดมีผู้ว่าราชการกรุงเทพมหานคร/ผู้ว่าราชการจังหวัดที่ประสบปัญหาเป็นผู้บัญชาการเหตุการณ์เพื่อให้การอำนวยการสั่งการในการแก้ไขปัญหาฝุ่นละอองมีเอกภาพและหน่วยงานที่เกี่ยวข้องสนับสนุนการปฏิบัติงาน
ทั้งนี้ ในช่วงระหว่างเกิดสถานการณ์วิกฤต (ธันวาคม - เมษายน) เป็นขั้นปฏิบัติการช่วงปริมาณ PM2.5 เกินมาตรฐานเพื่อให้หน่วยงานที่เกี่ยวข้องหรือผู้มีอำนาจหน้าที่ สามารถปฏิบัติได้ทันทีตามการเปลี่ยนแปลงของสถานการณ์ฝุ่นละอองโดยได้กำหนดเป็น 4 ระดับ ดังนี้
- ระดับที่ 1 เป็นระดับที่ปริมาณฝุ่นละออง PM2.5 มีค่าไม่เกิน 50 ไมโครกรัมต่อลูกบาศก์เมตร
ให้ส่วนราชการทุกหน่วยต้องดำ เนินการตามภารกิจ อำนาจหน้าที่และกฎหมายที่มีอยู่ให้ครบถ้วนตามสภาวการณ์ปกติ เพื่อควบคุมรักษาคุณภาพสิ่งแวดล้อมในกรุงเทพมหานครและจังหวัดปริมณฑลให้อยู่ในระดับปกติ
- ระดับที่ 2 เป็นระดับที่ปริมาณฝุ่นละออง PM2.5 มีค่าระหว่าง 51 - 75 ไมโครกรัมต่อลูกบาศก์เมตร
ให้ทุกส่วนราชการต้องดำ เนินการเพิ่มและยกระดับมาตรการต่างๆ ให้เข้มงวดขึ้น ในระดับนี้ผู้ว่าราชการกรุงเทพมหานครและผู้ว่าราชการจังหวัดที่ประสบปัญหาฝุ่นละอองเป็นผู้บัญชาการเหตุการณ์ในพื้นที่รับผิดชอบ สำหรับส่วนราชการอื่นๆเช่น กระทรวงมหาดไทย กระทรวงเกษตรและสหกรณ์ กระทรวงคมนาคม กระทรวงสาธารณสุข กรมป้องกันและบรรเทาสาธารณภัย และกรมควบคุมมลพิษเป็นหน่วยสนับสนุนในการปฏิบัติการ
- ระดับที่ 3 เป็นระดับที่ปริมาณฝุ่นละออง PM2.5 มีค่าระหว่าง 76 - 100 ไมโครกรัมต่อลูกบาศก์เมตร
และได้มีการดำเนินการในระดับที่ 2 แล้ว แต่สถานการณ์ฝุ่นละอองยังไม่ลดลง และเมื่อคาดการณ์แล้วพบว่าจะมีแนวโน้มสูงขึ้น ให้เป็นอำนาจและหน้าที่ของผู้ว่าราชการกรุงเทพมหานครและผู้ว่าราชการจังหวัดที่ประสบปัญหาฝุ่นละอองในการใช้กฎหมายที่มีอยู่ เช่น พระราชบัญญัติการสาธารณสุข พ.ศ. 2535 พระราชบัญญัติป้องกันและบรรเทาสาธารณภัยแห่งชาติพ.ศ. 2550 เป็นต้น เพื่อเข้าไปควบคุมพื้นที่หรือควบคุมแหล่งกำเนิดที่ก่อให้เกิดเหตุรำคาญหรือมีผลกระทบต่อประชาชน ซึ่งผู้ว่าราชการกรุงเทพมหานครและผู้ว่าราชการจังหวัดอาจสั่งการตามกฎหมายให้หยุดกิจกรรมใดๆ เพื่อให้คุณภาพอากาศกลับสู่สภาวะปกติโดยคำ แนะนำ ของคณะกรรมการควบคุมมลพิษ ในการให้ข้อเสนอแนะ สนับสนุนข้อมูลทางวิชาการและพิจารณากำ หนดมาตรการควบคุมแหล่งกำ เนิดมลพิษ เพื่อระงับยับยั้งสถานการณ์ค่าฝุ่นละอองขนาดเล็ก PM2.5 ที่มีแนวโน้มสูงขึ้น
- ระดับที่ 4 เป็นระดับที่ปริมาณฝุ่นละอองขนาดเล็ก PM2.5 มีค่ามากกว่า 100 ไมโครกรัมต่อลูกบาศก์เมตรและมีการดำเนินการในระดับที่ 3 แล้ว แต่สถานการณ์ฝุ่นละอองยังไม่ลดลงและมีแนวโน้มสูงขึ้นมากกว่า 100 ไมโครกรัมต่อลูกบาศก์เมตร ต่อเนื่อง แนวทางปฏิบัติกำหนดให้มีการประชุมคณะกรรมการสิ่งแวดล้อมแห่งชาติเป็นกรณีเร่งด่วนพิเศษ และพิจารณากลั่นกรองแนวทางในการแก้ไขปัญหาฝุ่นละอองขนาดเล็ก โดยจะต้องนำ กราบเรียนนายกรัฐมนตรี เป็นการเร่งด่วน เพื่อพิจารณาในการสั่งการอย่างใดอย่างหนึ่งที่เป็นแนวทางหรือมาตรการในการลดมลพิษจากแหล่งกำเนิดของหน่วยงานต่างๆ ต่อไป
มาตรการที่ 2 การป้องกันและลดการเกิดมลพิษที่ต้นทาง (แหล่งกำเนิด)
มุ่งให้ความสำคัญในการควบคุมและลดการระบายมลพิษทางอากาศจากแหล่งกำเนิดรวมถึงลดจำนวนแหล่งกำเนิดมลพิษ
- มีการนำน้ำมันเชื้อเพลิงมีกำมะถันไม่เกิน 10 ppm มาใช้ในกรุงเทพมหานครและปริมณฑลก่อนกฎหมายบังคับใช้และกำหนดใช้ทั่วประเทศตั้งแต่วันที่ 1 มกราคม 2567
หน่วยงานหลัก : กระทรวงพลังงาน
- ไม่ให้มีการเผาในไร่อ้อยร้อยละ 100 ภายในปี พ.ศ. 2565
หน่วยงานหลัก : กระทรวงอุตสาหกรรม (สำนักงานคณะกรรมการอ้อยและน้ำตาลทราย)
- บังคับใช้มาตรฐานการระบายมลพิษจากรถยนต์ใหม่ Euro 6/VI ภายในปี พ.ศ. 2565
หน่วยงานหลัก : กระทรวงอุตสาหกรรม
- จำนวนจุดความร้อนในพื้นที่ป่า พื้นที่เกษตร พื้นที่ริมทาง และพื้นที่ชุมชน ลดลง
หน่วยงานหลัก : กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม
กระทรวงมหาดไทย กรุงเทพมหานคร จังหวัด กระทรวงเกษตรและสหกรณ์กระทรวงคมนาคม
- จำนวนวันที่ฝุ่นละอองอยู่ในเกณฑ์มาตรฐาน ในช่วงวิกฤตเพิ่มขึ้นร้อยละ 5 ต่อปี
หน่วยงานหลัก : กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม
กระทรวงมหาดไทย กระทรวงพลังงาน
กระทรวงคมนาคม กรุงเทพมหานคร
กระทรวงพาณิชย์กระทรวงอุตสาหกรรม
สำนักงานตำรวจแห่งชาติกระทรวงสาธารณสุข
โดยมีแนวทางการดำเนินงานในการควบคุมและลดมลพิษจากแหล่งกำ เนิดแต่ละประเภท ซึ่งประกอบด้วยมาตรการทั้งระยะสั้นและระยะยาว ดังนี้
- 2.1 ควบคุมและลดมลพิษจากยานพาหนะ
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• ให้ใช้มาตรการจูงใจเพื่อส่งเสริมให้มีการนำ น้ำ มันเชื้อเพลิงมีกำ มะถันไม่เกิน 10 ppm มาจำหน่ายก่อนกฎหมายมีผลบังคับใช้บังคับใช้มาตรฐานการระบายมลพิษทางอากาศจากรถยนต์ใหม่ Euro 5 ภายในปี 2564
• ให้เร่งรัดให้มีการเชื่อมโยงโครงข่ายระบบคมนาคมขนส่งสาธารณะ ทั้งระบบหลักและระบบรองให้มีประสิทธิภาพ ปลอดมลพิษ และอำนวยความสะดวกแก่ผู้ใช้บริการ เพิ่มความเข้มงวดมาตรฐานและวิธีการตรวจวัดการระบายมลพิษจากรถยนต์ ปรับลดอายุรถที่จะต้องเข้ารับการตรวจสภาพรถประจำ ปีพัฒนาระบบการตรวจสภาพรถยนต์ให้มีการเชื่อมโยงข้อมูลผลการตรวจสภาพให้มีประสิทธิภาพมากยิ่งขึ้น เพิ่มทางเลือกในการเดินทางสัญจรให้ประชาชนที่สะดวกและปลอดภัย เช่น ทางจักรยาน ทางเดินเท้าที่สะดวกและปลอดภัย เป็นต้น
• การศึกษาความเหมาะสมในการจำกัดอายุการใช้งานรถยนต์ รวมถึงระบบการจัดการซากรถยนต์ที่หมดอายุการใช้งาน
• การจัดการคมนาคมขนส่งด้าน Demand Side Management ให้ควบคุมการนำ รถยนต์ใช้แล้วในต่างประเทศ (ใช้ส่วนตัว) เข้ามาในประเทศ
• การควบคุมการนำ เข้าเครื่องยนต์เก่าใช้แล้ว (ทั้งรถและเรือ) โดยต้องเป็นไปตามมาตรฐานการระบายมลพิษสำหรับรถผลิตใหม่ที่ประเทศไทยบังคับใช้อยู่ ณ เวลาที่นำเข้า และต้องมีอายุไม่เกิน 5 ปีใช้มาตรการจูงใจเพื่อสนับสนุนส่งเสริมการผลิตและการใช้รถยนต์ไฟฟ้า
• ให้กำหนดพื้นที่และมาตรการในการจำกัดจำนวนรถเข้าในเขตใจกลางเมือง ให้มีการซื้อทดแทนรถราชการเก่าด้วยรถยนต์ไฟฟ้า
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• ปรับปรุงคุณภาพน้ำมันเชื้อเพลิงที่มีกำมะถันไม่เกิน 10 ppm ให้แล้วเสร็จภายในปีพ.ศ. 2566 และบังคับใช้น้ำมันเชื้อเพลิงที่มีกำมะถันไม่เกิน 10 ppm ตั้งแต่วันที่ 1 มกราคม พ.ศ. 2567 เป็นต้นไป
• บังคับใช้มาตรฐานการระบายมลพิษทางอากาศจากรถยนต์ใหม่ Euro 6 ภายในปี 2565
• ใช้มาตรการจูงใจเพื่อสนับสนุนส่งเสริมการผลิตและการใช้รถยนต์ไฟฟ้า
• การเชื่อมโยงโครงข่ายระบบคมนาคมขนส่งสาธารณะทั้งระบบหลัก และระบบรองให้มีประสิทธิภาพ ปลอดมลพิษ และอำนวยความสะดวกแก่ผู้ใช้บริการ
• เปลี่ยนรถโดยสารประจำทางของ ขสมก. ทั้งหมดให้เป็นรถที่มีมลพิษต่ำ (รถไฟฟ้า/NGV/มาตรฐาน Euro VI)
• การจัดการคมนาคมขนส่งด้าน Demand Side Management เพื่อเพิ่มความสามารถในการเข้าถึงบริการของประชาชนผู้ใช้บริการ ปรับปรุง/แก้ไขการเก็บภาษีประจำปี
• สำหรับรถยนต์ใช้งาน การควบคุมการระบายฝุ่นจากการขนถ่ายสินค้าที่ท่าเรือและจากเรือสู่เรือ
• การพิจารณาการย้ายท่าเรือคลองเตยออกจากพื้นที่กรุงเทพมหานคร
การห้ามนำ เข้าเครื่องยนต์ใช้แล้วทุกประเภท
• การซื้อทดแทนรถราชการเก่าด้วยรถยนต์ไฟฟ้า
• ส่งเสริม/สนับสนุนการใช้รถยนต์ไฟฟ้า และการใช้บริการระบบขนส่งสาธารณะ
• การควบคุมการระบายมลพิษทางอากาศจาก Non-road Engine
- 2.2 ควบคุมและลดมลพิษจากการเผาในที่โล่ง/ภาคการเกษตร
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• ส่งเสริมให้มีการจัดการเศษวัสดุทางการทำ เกษตร โดยการนำ มาใช้ประโยชน์อย่างมีประสิทธิภาพ เพื่อลดการเผาในที่โล่ง
• ห้ามไม่ให้มีการเผาในพื้นที่ชุมชน ริมทาง และเผาขยะโดยเด็ดขาด
• การเพิ่มประสิทธิภาพของท้องถิ่นในการจัดการขยะมูลฝอย
• ยกระดับการป้องกันไฟป่าและจัดการไฟป่าอย่างมีประสิทธิภาพ
• การใช้มาตรการทางสังคมกับผู้ลักลอบเผาป่า •
กำหนดมาตรการทางกฎหมายโดยการออกระเบียบกำหนดให้โรงงานน้ำตาลรับอ้อยไฟไหม้เข้าหีบได้ไม่เกินร้อยละ 20 ต่อวัน ภายในปี2564
• กำหนดมาตรการสนับสนุนจากภาครัฐในการสนับสนุนเครื่องจักรกลการเกษตรเพื่อแก้ไขปัญหาอ้อยไฟไหม้
• กำหนดพื้นที่ปลอดการเผาอ้อยเพื่อเป็นจังหวัดต้นแบบปลอดการเผาอ้อย ร้อยละ 100 จำนวน 5 จังหวัด ในปี 2563
• ส่งเสริมสินเชื่อเพื่อเพิ่มประสิทธิภาพการผลิตอ้อยอย่างครบวงจร
• การประชาสัมพันธ์เพื่อสร้างเครือข่ายชุมชนในพื้นที่ที่มีการเผา
• การเพิ่มประสิทธิภาพของท้องถิ่นในการจัดการขยะมูลฝอยเพื่อไม่ให้มีการกำจัดโดยการเผา
• ควบคุมเตาเผามูลฝอยติดเชื้อของสถานพยาบาลเพื่อไม่ให้มีการกำจัดโดยการเผาในที่โล่ง
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• ให้มีการกำหนดระเบียบหรือแนวปฏิบัติในการจัดการเศษวัสดุจากการทำเกษตรประเภทต่างๆ โดยให้มีการนำมาใช้ประโยชน์อย่างมีประสิทธิภาพเพื่อไม่ให้มีการเผาในที่โล่ง
• ห้ามไม่ให้มีการเผาในที่โล่งและเผาขยะโดยเด็ดขาด
• ให้มีการพิจารณาการพัฒนาระบบหรือยกระดับโดยผนวกมิติด้านสิ่งแวดล้อมเข้าไปในกระบวนการกำหนดมาตรฐานสินค้าเกษตร : การปฏิบัติทางการเกษตรที่ดีหรือมาตรฐานสินค้าเกษตรและอาหาร
• สำหรับพืชเกษตรที่มักมีการเผาวัสดุการเกษตรก่อนหรือหลังการเก็บเกี่ยวให้มีความเข้มงวดขึ้น
• ใช้มาตรการหรือกลไกทางเศรษฐศาสตร์หรือมาตรการทางสังคมผลักดันให้เกิดแนวทางรับซื้อสินค้าจากเกษตรกรที่ผ่านการรับรองมาตรฐานทางการเกษตร
• การใช้มาตรการทางสังคมกับผู้ลักลอบเผาป่า
• การประชาสัมพันธ์เพื่อสร้างเครือข่ายชุมชนในพื้นที่ที่มีการเผา
• กำหนดมาตรการทางกฎหมายโดยการออกระเบียบ กำหนดให้โรงงานน้ำตาลรับอ้อยไฟไหม้เข้าหีบได้ไม่เกินร้อยละ 0 - 5 ต่อวัน ภายในปี 2565 เพื่อให้อ้อยไฟไหม้หมดไปภายในปี 2565
• ป้องกันไฟป่าและจัดการไฟป่าอย่างมีประสิทธิภาพ
• การเพิ่มประสิทธิภาพของท้องถิ่นในการจัดการขยะมูลฝอยเพื่อไม่ให้มีการกำจัดโดยการเผา
• ควบคุมเตาเผามูลฝอยติดเชื้อของสถานพยาบาลเพื่อไม่ให้มีการกำจัดโดยการเผาในที่โล่ง
• กำหนดแนวทางการจัดการปุ๋ยไนโตรเจน รวมถึงปรับปรุงการจัดการมูลสัตว์ในภาคปศุสัตว์
- 2.3 ควบคุมและลดมลพิษจากการก่อสร้างและผังเมือง
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• กำหนดกฎระเบียบมาตรการและเกณฑ์ปฏิบัติที่ดีในการควบคุมฝุ่นละอองจากการก่อสร้างประเภทต่างๆ
• ส่งเสริมให้มีการจัดทำผังเมืองและการก่อสร้างสิ่งปลูกสร้างต่างๆ ต้องคำนึงถึงปัจจัยที่จะมีผลต่อการระบายอากาศและการสะสมของมลพิษทางอากาศ
• การบังคับใช้กฎหมายอย่างเข้มงวดกับผู้ที่ทำ ให้กรวด หิน ดิน เลน ทราย หรือเศษวัตถุก่อสร้างตกหล่น รั่วไหล ปลิว ฟุ้งกระจายลงบนถนน
• ส่งเสริมการก่อสร้างที่เป็นมิตรกับสิ่งแวดล้อมและการเพิ่มพื้นที่สีเขียวในเขตเมืองให้ได้ตามมาตรฐานสากล รวมถึงรณรงค์และสร้างแรงจูงใจให้องค์กรรัฐวิสาหกิจและภาคเอกชนเข้าร่วมโครงการในลักษณะการดำ เนินกิจกรรมการแสดงความรับผิดชอบต่อสังคม (CSR) ในการเพิ่มและการจัดการพื้นที่สีเขียวอย่างยั่งยืน
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• บังคับใช้กฎหมายอย่างเข้มงวดกับผู้ที่กระทำ การใดๆ ที่ทำ ให้กรวด หิน ดิน เลน ทราย หรือเศษวัตถุก่อสร้าง ตกหล่น รั่วไหล ปลิว ฟุ้งกระจายลงบนถนน
• ส่งเสริมการก่อสร้างที่เป็นมิตรกับสิ่งแวดล้อม เพิ่มพื้นที่สีเขียวในเขตเมืองให้ได้ตามมาตรฐานสากล รวมถึงรณรงค์และสร้างแรงจูงใจให้องค์กรรัฐวิสาหกิจและภาคเอกชนเข้าร่วมโครงการในลักษณะการดำ เนินกิจกรรมการแสดงความรับผิดชอบต่อสังคม (CSR) ในการเพิ่มและการจัดการพื้นที่สีเขียวอย่างยั่งยืน
- 2.4 ควบคุมและลดมลพิษจากอุตสาหกรรม
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• กำหนดมาตรฐานการระบายมลพิษทางอากาศในรูป Loading ในพื้นที่ที่มีปัญหาฝุ่นละอองโดยคำ นึงถึงความสามารถหรือศักยภาพในการรองรับมลพิษทางอากาศของพื้นที่
• ติดตั้งระบบตรวจสอบการระบายมลพิษทางอากาศแบบอัตโนมัติต่อเนื่องที่ปล่องของโรงงานอุตสาหกรรม จำพวก 3 เตาเผาเชื้อเพลิงและหม้อไอน้ำ หรือแหล่งกำเนิดความร้อนที่มีขนาดตามที่กระทรวงอุตสาหกรรมกำหนด และรายงานผลผ่านระบบ on-line ตามประกาศกระทรวงอุตสาหกรรม การจัดทำเนียบการปลดปล่อยและเคลื่อนย้ายมลพิษ
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• ทบทวนและปรับปรุงมาตรฐานการระบายมลพิษทางอากาศจากโรงงานอุตสาหกรรมให้เทียบเท่ามาตรฐานสากล
• ปรับปรุงการใช้พลังงานอย่างมีประสิทธิภาพในภาคอุตสาหกรรม เพิ่มการใช้พลังงานหมุนเวียนและพลังงานทางเลือกในการผลิตไฟฟ้า
- 2.5 ควบคุมและลดมลพิษจากภาคครัวเรือน
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) และมาตรการระยะยาว (พ.ศ. 2565 - 2567)
• โดยเป็นการดำเนินงานต่อเนื่องในการสนับสนุนการใช้พลังงานสะอาดในครัวเรือน
• พัฒนาและส่งเสริมการใช้เตาหุงต้มและเตาปิ้งย่าง ปลอดมลพิษ
• พัฒนาและส่งเสริมการใช้เตาเผาอิฐและถ่านปลอดมลพิษ
มาตรการที่ 3 การเพิ่มประสิทธิภาพการบริหารจัดการมลพิษ
เป็นการพัฒนาระบบ เครื่องมือ กลไกในการบริหารจัดการ รวมถึงการศึกษาวิจัยเพื่อพัฒนาองค์ความรู้ด้านต่างๆ เพื่อเป็นข้อมูลประกอบการตัดสินใจและกำหนดแนวทางมาตรการป้องกันและแก้ไขปัญหาในอนาคต ประกอบด้วยมาตรการระยะสั้นและระยะยาว
- เครือข่ายการติดตามตรวจสอบคุณภาพอากาศ ให้ครอบคลุมทั่วประเทศ ภายในปี2567
หน่วยงานหลัก :
• กระทรวงมหาดไทย
• กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม
- มีเครื่องมือสนับสนุนการตัดสินใจในการบริหารจัดการ
• ระบบฐานข้อมูลด้านมลพิษ/สิ่งแวดล้อม และผลกระทบต่อสุขภาพ 1 ระบบ
• ระบบคาดการณ์สถานการณ์ฝุ่นละออง 1 ระบบ
• กลไกความร่วมมือระหว่างประเทศเพื่อลดมลพิษข้ามแดน
หน่วยงานหลัก :
• กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม
• กระทรวงสาธารณสุข
• กระทรวงการอุดมศึกษา
• วิทยาศาสตร์วิจัยและนวัตกรรม
• กระทรวงศึกษาธิการ กระทรวงอุตสาหกรรม
• กระทรวงต่างประเทศ
• กระทรวงกลาโหม
• กระทรวงมหาดไทย
• กระทรวงคมนาคม
โดยมีแนวทางการดำเนินงานในการพัฒนาระบบ เครื่องมือ กลไกในการบริหารจัดการมลพิษ ดังนี้
- 3.1 พัฒนาเครือข่ายการติดตามตรวจสอบคุณภาพอากาศ
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) และมาตรการระยะยาว (พ.ศ. 2565 - 2567)
โดยเป็นการดำ เนินงานต่อเนื่องในการขยายเครือข่ายการติดตามตรวจสอบคุณภาพอากาศและให้ท้องถิ่นติดตามตรวจวัดคุณภาพอากาศในพื้นที่ของตนเอง พัฒนาศักยภาพของท้องถิ่นในการดำ เนินการติดตามการตรวจสอบคุณภาพอากาศเพื่อให้มีการเฝ้าระวังสถานการณ์ในพื้นที่
- 3.2 ทบทวน/ปรับปรุงกฎหมาย/มาตรฐาน/แนวทางปฏิบัติให้สอดคล้องกับสถานการณ์
มาตรการระยะสั้น (พ.ศ.2562 - 2564) ประกอบด้วย
• การกำหนดค่ามาตรฐาน PM2.5 ในบรรยากาศเฉลี่ยรายปีให้เป็นไปตามเป้าหมายระยะที่ 3 ขององค์การอนามัยโลก (WHO IT-3)
• การปรับปรุง พ.ร.บ. ส่งเสริมและรักษาคุณภาพสิ่งแวดล้อมแห่งชาติพ.ศ. 2535 รวมทั้งศึกษาความเหมาะสมเรื่องกฎหมายอากาศสะอาด (Clean Air Act) รวมถึงการพิจารณาความเหมาะสมในการจัดระเบียบการเผาภาคการเกษตร
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• พิจารณากำหนดค่ามาตรฐาน PM2.5 ในบรรยากาศเฉลี่ย 24 ชั่วโมง ให้เป็นไปตามเป้าหมายระยะที่ 3 ขององค์การอนามัยโลก (WHO IT-3)
- 3.3 ส่งเสริมการวิจัย/พัฒนาองค์ความรู้ด้านเทคโนโลยีการติดตามตรวจสอบ การตรวจวิเคราะห์และนวัตกรรมเพื่อลดมลพิษทางอากาศ เพื่อนำ ไปประยุกต์ใช้ด้านการจัดการคุณภาพอากาศ รวมถึงเผยแพร่ ประชาสัมพันธ์และถ่ายทอดองค์ความรู้
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• ดำเนินโครงการนำ ร่องเพื่อทดสอบความเป็นไปได้ในการติดตั้งอุปกรณ์กรองฝุ่น (Diesel Particulate Filter,DPF) ในรถใช้งาน
• การจัดทำคู่มือการเรียนการสอนว่าด้วยการเปลี่ยนแปลงสภาพภูมิอากาศและข้อควรปฏิบัติในการร่วมกันลดโลกร้อนเพื่อสร้างความตระหนักและการมีส่วนร่วมในการลดมลพิษทางอากาศ (รวมถึงสาเหตุ/การป้องกันการเกิดฝุ่นละออง) การเผยแพร่ประชาสัมพันธ์และถ่ายทอดองค์ความรู้ รวมทั้งสร้างเครือข่ายประชาสังคมเพื่อสร้างความตระหนักรู้และสร้างความร่วมมือระหว่างหน่วยงานภาครัฐ ท้องถิ่น เอกชน ประชาชน
• ส่งเสริมการมีส่วนร่วมสร้างความตระหนักและปรับพฤติกรรมของประชาชนในการลดการปล่อยมลพิษจากกิจกรรมต่างๆ
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• ศึกษาความเหมาะสมในการใช้เครื่องมือการตรวจวัดคุณภาพอากาศแบบเซนเซอร์
• การเผยแพร่ประชาสัมพันธ์และถ่ายทอดองค์ความรู้รวมทั้งสร้างเครือข่ายประชาสังคม เพื่อสร้างความตระหนักรู้และสร้างความร่วมมือระหว่างหน่วยงานภาครัฐ ท้องถิ่น เอกชน ประชาชน
- 3.4 การแก้ไขปัญหามลพิษข้ามแดน
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• การขับเคลื่อนการดำ เนินงานตามข้อตกลงเรื่องมลพิษหมอกควันข้ามแดน : ขับเคลื่อนการดำ เนินงานตามโรดแมปอาเซียนปลอดหมอกควันข้ามแดน (ASEAN Transboundary Haze - Free Roadmap) และขับเคลื่อนการดำ เนินงานตามแผนปฏิบัติการเชียงราย 2017 เพื่อป้องกันมลพิษจากหมอกควันข้ามแดน (ChiangRai 2017 Plan of Action for Transboundary Haze Pollution Control in the Mekong Sub-Region)
• การประสานความร่วมมือระหว่างประเทศเพื่อป้องกันและแก้ไขปัญหามลพิษ โดยใช้กลไกในทุกระดับ ได้แก่ ระดับอาเซียน ระดับคณะกรรมการชายแดนภายใต้กระทรวงกลาโหม และระดับจังหวัดชายแดนคู่ขนานระหว่างประเทศไทยกับประเทศเพื่อนบ้านการป้องกันและแก้ไขปัญหามลพิษข้ามแดนจากการขนส่ง
มาตรการระยะยาว (พ.ศ. 2565 - 2567) ประกอบด้วย
• การขับเคลื่อนการดำ เนินงานตามข้อตกลงเรื่องมลพิษหมอกควันข้ามแดน : ขับเคลื่อนการดำ เนินงานตามโรดแมปอาเซียนปลอดหมอกควันข้ามแดน (ASEAN Transboundary Haze - Free Roadmap) ขับเคลื่อนการดำ เนินงานตามแผนปฏิบัติการเชียงราย 2017 เพื่อป้องกันมลพิษจากหมอกควันข้ามแดน (ChiangRai 2017 Plan of Action for Transboundary Haze Pollution Control in the Mekong Sub-Region)
• การประสานความร่วมมือระหว่างประเทศเพื่อป้องกันและแก้ไขปัญหามลพิษ โดยใช้กลไกในทุกระดับ ได้แก่ ระดับอาเซียน ระดับคณะกรรมการชายแดนภายใต้กระทรวงกลาโหม และระดับจังหวัดชายแดนคู่ขนานระหว่างประเทศไทยกับประเทศเพื่อนบ้าน
- 3.5 จัดทำบัญชีการระบายมลพิษทางอากาศจากแหล่งกำ เนิด
มาตรการระยะสั้น (พ.ศ. 2562 - 2564)
• การจัดทำบัญชีการระบายมลพิษทางอากาศจากแหล่งกำ เนิดเป็นระยะๆ เพื่อใช้เป็นข้อมูลประกอบการกำหนด/ปรับปรุงแนวทางและมาตรการป้องกันและแก้ไขปัญหามลพิษ
- 3.6 พัฒนาระบบฐานข้อมูลและระบบเฝ้าระวังที่เป็นหนึ่งเดียว
มาตรการระยะสั้น (พ.ศ.2562 - 2564) และระยะยาว (พ.ศ. 2565 - 2567)
• บูรณาการระบบข้อมูลสารสนเทศอย่างเป็นระบบทั้งแหล่งกำ เนิด ปริมาณมลพิษในบรรยากาศ และผลกระทบต่อสุขภาพเพื่อการวางแผนการบริหารจัดการและสื่อสารแจ้งเตือน พัฒนาระบบ
• เฝ้าระวังผลกระทบต่อสุขภาพที่เกิดจากมลพิษทางอากาศและการรายงานผล สร้างความเข้มแข็งของประชาชน ชุมชนในการดูแลป้องกันผลกระทบต่อสุขภาพ
- 3.7 พัฒนาระบบคาดการณ์สถานการณ์ฝุ่นละออง
มาตรการระยะสั้น (พ.ศ. 2562 - 2564) ประกอบด้วย
• การพัฒนาระบบคาดการณ์สถานการณ์ฝุ่นละออง เพื่อใช้เป็นข้อมูลประกอบการทบทวน/ปรับปรุงมาตรการและแนวทางการดำ เนินงานในการป้องกันและแก้ไขปัญหามลพิษในระยะต่อไป
รศ. (พิเศษ) นพ.ทวี โชติพิทยสุนนท์ ประธานมูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ เปิดเผยถึงสถานการณ์ไข้หวัดใหญ่ทั่วโลกโดยรวมในช่วง 2 ปีที่ผ่านมาลดลงอย่างต่อเนื่อง เนื่องจากมาตรการป้องกันโควิด-19 ที่เข้มงวด ขณะที่ในปี พ.ศ. 2565 นี้ เริ่มมีรายงานจากหลายประเทศ โดยเฉพาะในทวีปยุโรปมีรายงานความรุนแรงของโรคไข้หวัดใหญ่สูงขึ้น รวมถึงในสหรัฐอเมริกา ที่พบการระบาดในสัดส่วนที่เพิ่มมากขึ้น เนื่องจากประชาชนมากกว่า 70% ในสหรัฐอเมริกาไม่จำเป็นต้องสวมหน้ากากในสถานที่สาธารณะแล้ว ขณะที่มีรายงานการวิจัยจาก University of Pittsburgh สหรัฐอเมริกาคาดการณ์ว่าฤดูไข้หวัดใหญ่ปี 2021-2022 มีแนวโน้มจะรุนแรงกว่าปกติ ซึ่งอาจมีจำนวนผู้ป่วยไข้หวัดใหญ่ โดยเฉพาะอย่างยิ่งในเด็กเพิ่มขึ้นเมื่อเทียบกับการป่วยในฤดูกาลปีก่อนการระบาดของโควิด-19 โดยสามารถลดจำนวนผู้ป่วยที่มีอาการหนักถึงขั้นต้องเข้ารับการรักษาตัวในโรงพยาบาล หากมีการฉีดวัคซีนไข้หวัดใหญ่เพิ่มขึ้น 20-50% จากปีก่อนๆ เนื่องจากในช่วงที่มีมาตรการป้องกันโควิด-19 ชาวอเมริกันจำนวนมหาศาลพลาดโอกาสที่จะสร้างภูมิคุ้มกันไข้หวัดใหญ่ด้วยการติดเชื้อเองจากธรรมชาติหรือฉีดวัคซีนกระตุ้นภูมิคุ้มกัน และเมื่อมาตรการป้องกันโควิด-19 ต่างๆ ถูกยกเลิก จึงทำให้มีโอกาสติดเชื้อรุนแรงกว่าปกติเพราะผู้คนห่างหายจากภูมิคุ้มกันมากว่า 2 ปีแล้ว และยังตรงกับฤดูกาลไข้หวัดใหญ่ของประเทศในเขตอบอุ่นซีกโลกเหนืออีกด้วย ซึ่งจะกระทบต่อเด็กอายุต่ำกว่า 2 ขวบลงมา ทำให้เสี่ยงที่จะติดเชื้อและมีอาการรุนแรงมากเป็นพิเศษ เพราะเด็กในกลุ่มนี้ยังไม่เคยได้สัมผัสเชื้อไข้หวัดใหญ่มาก่อน
ผลิตภัณฑ์อื่นๆ
ผลิตภัณฑ์อื่นๆ
- ผงเกลือล้างจมูกชนิดซอง (20 ซอง) สำหรับผสมน้ำด้างจมูก
- ชุดอุปกรณ์สำหรับทำความสะอาดโพรงจมูก ประกอบด้วย กระบอกฉีดยาขนาด 25 cc จำนวน 2 ชิ้น และจุ๊กล้างจมูก 1 ชิ้น
- เครื่องวัดอุณหภูมิร่างกาย ระบบดิจิตอล จำนวน 1 เครื่อง พร้อมถ่านสำรอง
- หน้ากากอนามัยทางการแพทย์ แบบ 3 ชั้น Level 1 จำนวน 50 ชิ้น
- PCL COVID19 Ag Gold ชุดตรวจหาเชื้อCovid 19 จากน้ำลาย สำหรับบุคคลทั่วไป ทำการทดสอบด้วยตนเอง จำนวน 1 ชุด
- 75% แอลกฮอล์ สเปรย์ 60 ml
- DETTOL SENSITIVE WET WIPES ผ้าเช็ดทำความสะอาดผิวแบบเปียกสูตรอ่อนโยน ขนาดบรรจุ 10 ชิ้น / แพค
ศูนย์กระดูกสันหลัง LINK
ศูนย์กระดูกสันหลัง โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนลเป็นศูนย์แห่งความเป็นเลิศทางการแพทย์ พร้อมให้บริการวินิจฉัย ดูแลรักษาโรค และความผิดปกติที่เกี่ยวข้องกับกระดูกสันหลัง ไขสันหลัง และเส้นประสาท โดยมีทีมสหสาขาวิชาชีพเฉพาะทาง ได้แก่ ศัลยแพทย์กระดูกสันหลังและออร์โธปิดิกส์ ศัลยแพทย์ระบบประสาท แพทย์วิสัญญี แพทย์เวชศาสตร์ฟื้นฟู แพทย์ด้านระงับปวด นักกายภาพบำบัด เภสัชกร นักโภชนาการ และพยาบาลเฉพาะทางด้านกระดูกสันหลัง พร้อมกับการวินิจฉัยและรักษาด้วยเทคโนโลยีที่ทันสมัย โดยได้รับการรับรองในระดับสากลจาก JCI ประเทศสหรัฐอเมริกาในการดูแลผู้ป่วยปวดหลังส่วนล่าง (Low Back Pain)
Scope Of Services
บริการครอบคลุมตั้งแต่การวินิจฉัยโรคด้วยเครื่องมือ อุปกรณ์ เทคโนโลยีที่ทันสมัย นำไปสู่การรักษาที่เหมาะสม มีประสิทธิภาพ ป้องกันผลข้างเคียงจากการรักษา โดยการรักษามีหลากหลายวิธี ขึ้นอยู่กับความเหมาะสมของผู้ป่วยแต่ละราย เช่น การรักษาด้วยการทำกายภาพบำบัด การรักษาด้วยยา การระงับความปวดด้วยการฉีดยาบล็อกเส้นประสาท และการรักษาด้วยการผ่าตัดที่มีหลากหลายวิธี เช่น Microdiscectomy Surgery, Full Endoscopy Spinal Surgery, Direct Lateral Interbody Fusion และ Anterior Interbody Fusion เป็นต้น นอกจากนี้ยังมีการดูแลฟื้นฟูหลังการรักษาเพื่อให้ผู้ป่วยกลับมามีคุณภาพชีวิตที่ดีและลดโอกาสการกลับมาเป็นซ้ำ
กรมสุขภาพจิต กับสถานการณ์ของโรคไบโพลาร์ในประเทศไทย
พญ. อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กระทรวงสาธารณสุข กล่าวถึงสถานการณ์ของโรคไบโพลาร์ในประเทศไทย ในปี 2564 พบว่ามีผู้ป่วยจำนวน 38,681 คนที่เข้าถึงการรักษา ซึ่งลดลงจากปี 2563 ถึง 3% สะท้อนให้เห็นว่าผู้ป่วยจำนวนหนึ่งไม่สามารถเข้าถึงการรักษาได้ หรืออาจได้รับผลกระทบจากการแพร่ระบาดของโควิด-19 ซึ่ง ‘โรคไบโพลาร์’ เป็นหนึ่งในโรคทางอารมณ์ที่หากไม่ได้รับการรักษาอย่างต่อเนื่อง จะส่งผลต่อการใช้ชีวิตของผู้ป่วยอย่างมาก ทำให้ไม่สามารถทำงานได้อย่างมีประสิทธิภาพ มีปัญหาความสัมพันธ์กับคนใกล้ชิด รวมไปถึงการทำร้ายตัวเองและปัญหาการฆ่าตัวตาย โดยในช่วงการระบาดโควิด-19 มีผู้ที่กังวลและทำแบบประเมินสุขภาพจิต ผ่าน Mental Health Check พบว่า ช่วงสายพันธุ์เดลต้าระบาด ประมาณเดือนสิงหาคม 2564 มีผู้ป่วยภาวะซึมเศร้าเพิ่มมากขึ้น อาทิ กลุ่มที่ถูกเลิกจ้างงาน กลุ่ม First Jobber ที่เพิ่งจบการศึกษาและหางานทำไม่ได้ กลุ่มที่ติดเชื้อโควิด-19 จนเกิดภาวะเครียด ซึ่งในช่วงปี 2564 จะเห็นได้ว่ามีการเสียชีวิตด้วยการฆ่าตัวตายเพิ่มสูงขึ้น
ALTERNATIVE QUARANTINE
ㆍ 5 days quarantine for both fully vaccinated travelers and unvaccinated travelers
REQUIRED DOCUMENTS FOR REGISTRATION
1.Passport
2.Paid AQ Hotel booking confirmation for 5 days including the fee for 1RT-PCR test" and airport transfer.
3.Insurance with minimum coverage of USD 20,000 for medical expenses (not required for Thai nationals and foreign nationals who have Thai social security
/confirmation letters from employer in Thailand)
*RT-PCR test will be conducted on day 4-5
ความหนาวในเดือนเมษา มองมุมหนึ่งก็ดีนะ มองในอีกมุม เราเคยเจอแบบนี้บ้างไหม? - Thon Thamrongnawasawat LINK
Thon Thamrongnawasawat
ความหนาวในเดือนเมษา มองมุมหนึ่งก็ดีนะ มองในอีกมุม เราเคยเจอแบบนี้บ้างไหม?
นี่คือความแปรปรวนของสภาพอากาศ ภาวะโลกร้อนเริ่มส่งสัญญาณว่า มนุษย์เอย เจ้าจะทำอย่างไร
ลมกระโชกแรงในหลายพื้นที่ ชาวเรือแถวภาคใต้ต้องระมัดระวัง เรือเล็กอาจลำบาก การทำมาหากินสะดุด
อะไรที่ไม่ปรกติ ไม่ดีหรอกครับ และโลกกำลังร้อนขึ้นกว่านี้ เราจะเจออะไรมากกว่านี้
อยากรอด…ต้องเร่ง หาทุกวิถีทางช่วยกันลดก๊าซเรือนกระจก ควบคู่ไปกับการรับมือ
ทุกอย่างไม่ง่าย แต่โลกเตือนเราถี่ขึ้นเรื่อยๆ จะยากแค่ไหน เราก็ต้องช่วยกันทำ
ผมจึงเดินทางอีกครั้ง ไปสู่แหล่งหญ้าทะเลกว้างใหญ่ กักเก็บคาร์บอนได้มากมาย
ไปไหน… บ่ายนี้เจอกันครับ
ภาพ windy.com แสดงลมแรงในอ่าวไทย (สีส้มจะแรงระดับ 20+ นอต)
เป็นภาพพยากรณ์ในวันพรุ่งนี้เช้าครับ
สมายดีไซน์ ออกแบบรอยยิ้มสวยที่สุดในแบบของคุณ
เพราะ “รอยยิ้ม” ไม่ได้หมายถึงความสวยงามเพียงอย่างเดียว การยิ้มอย่างมั่นใจยังสร้างบุคลิกภาพที่ดี ด้วยวิสัยทัศน์ที่ว่า “รอยยิ้มของคุณคือความสุขของเรา” (Your Smile is Our Passion) คลินิกทันตกรรม บีดีเอ็มเอส เวลเนส คลินิก ให้ความสำคัญเรื่องของ “สมาย ดีไซน์” (Smile Design) ใช้เทคโนโลยีที่เรียกว่า Personalized Smile Design เพื่อถ่ายภาพคนไข้ขณะยิ้มและออกแบบรอยยิ้มใหม่ในกรณีที่คนไข้รู้สึกไม่มั่นใจในรอยยิ้มของตนเอง รวมทั้งมีการทำม็อคอัพ จำลองให้เห็นภาพ และเลือกแบบของการยิ้มในมุมที่สวยถูกใจที่สุด ก่อนดำเนินการ เช่นเดียวกับการทำ “วีเนียร์” (Veneer) หรือเคลือบฟันเทียมที่เป็นการแก้ไขผิวหน้าฟัน โดยสามารถเลือกทั้งรูปทรงและสีของฟันได้ ตอบโจทย์เรื่องของบุคลิกภาพอย่างแท้จริง
รพ.เจ้าพระยา บริการตรวจรักษาโควิดในเด็ก 24 ชม. ค่าตรวจ RT-PCR 3,200 บาท
โรงพยาบาลเจ้าพระยา เปิดให้บริการตรวจรักษาโควิดในเด็ก ศูนย์กุมารเวช 24 ชม. ค่าตรวจ Real-Time RT-PCR 3,200.- (ราคานี้ไม่รวม ค่าบริการโรงพยาบาล ค่าบริการพยาบาล และค่ากุมารแพทย์) ตรวจได้ตั้งแต่ เด็กแรกเกิด – 15 ปี สามารถ Walk in เข้ารับการตรวจได้ทันที ไม่ต้องนัดหมายล่วงหน้า รับดูแลเป็นผู้ป่วยในหอผู้ป่วยโควิดสำหรับเด็กโดยเฉพาะได้ทันที (สำหรับเด็กอายุ 1 ปีขึ้นไป) ขอรับคำปรึกษาและรายละเอียดเพิ่มเติม Call Center: 024338222, 024335666 เวลา 08.00-17.00 น.
บางปะกอก 9 อินเตอร์ฯ จัด 5 โปรแกรมตรวจ Long Covid เริ่มต้น 1,000 บาท
โรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนล จัด 5 โปรแกรม รองรับการตรวจสุขภาพหลังติดเชื้อโควิด หาความผิดปกติและอาการต่างๆ ที่อาจหลงเหลืออยู่ แต่ละโปรแกรม มีจำนวนรายการตรวจที่แตกต่างกันไป
Program A ตรวจสุขภาพปอด 18 รายการ ราคา 12,500
Program B ตรวจสุขภาพปอด 14 รายการ ราคา 4,000
Program C ตรวจสุขภาพปอด 12 รายการ ราคา 3,000
Program D ตรวจสุขภาพปอด 6 รายการ ราคา 2,500
Program E ตรวจสุขภาพปอด 3 รายการ ราคา 1,000
สอบถาม, นัดหมาย Call center 1745
Hospitel Service รพ.บี.แคร์ฯ ดูแลผู้ป่วย COVID-19 LINK
โรงพยาบาล บี.แคร์ เมดิคอลเซ็นเตอร์ ร่วมกับ Gold Orchid Hotel Bangkok Package (เริ่มต้น) : Hospitel 7 days + Telehealth @ Home 3 days
????ห้องเดี่ยว (Single room) 25,000.- / ท่าน
????ห้องคู่ (Double room) 19,000.- / ท่าน
เงื่อนไขแพ็กเกจ
✅ เกณฑ์รับเข้ารักษาในโรงพยาบาล หรือ Hospitel ขึ้นอยู่กับเกณฑ์เงื่อนไขการรับ Admit และดุลยพินิจของแพทย์
✅ รับเฉพาะผู้ป่วย COVID-19 กลุ่มอาการสีเขียว อายุ 15 – 60 ปี และ ไม่มีโรคประจำตัว ไม่มีภาวะตั้งครรภ์ ไม่มีภาวะอ้วนหรือน้ำหนักเกิน 100 kg สามารถช่วยเหลือตัวเองได้ดี และใช้เครื่องมือสื่อสารได้
✅ กรณีผู้รับบริการอยู่ไม่ครบจำนวนวันตามที่ระบุในแพ็กเกจ ขอสงวนสิทธิ์ในการคืนเงิน
✅ ราคาดังกล่าวรวมค่าห้อง ค่าอาหาร 3 มื้อ ค่าบริการทางการแพทย์ และ ค่าบริการทางการพยาบาล
✅ ราคาดังกล่าวรวมค่าตรวจทางห้องปฏิบัติการ (ตามรายการที่กำหนด)
✅ ราคาดังกล่าวรวมค่า X-ray ปอด
✅ ราคาดังกล่าวรวมค่ายาพื้นฐานรักษาตามอาการเบื้องต้น
✅ แพ็กเกจดังกล่าวไม่รวมค่ารถโรงพยาบาล (รับ และ/หรือ ส่ง)
สอบถามเพิ่มเติม (เวลาทำการ 08.00 – 18.00 น.)
???? Covid Call Center โทร. 02 532 4444 ต่อ 3554, 3555
???? ลูกค้าตัวแทนประกัน (Insurance Agent) : โทร. 02-532-4444 ต่อ 5007 หรือ line @insurancebcare
???? ลูกค้าคู่สัญญา (Corporate) : โทร. 02-532-4444 ต่อ 5006
โรงพยาบาลเมดพาร์ค เปิด Walk-In วัคซีนทางเลือก MODERNA ราคา 1,650
โรงพยาบาลเมดพาร์ค เปิด Walk-In วัคซีนทางเลือก MODERNA ราคา 1,650 บาท* (จำนวน 1 เข็ม) โดยไม่ต้องจองล่วงหน้า บริเวณชั้น G ตั้งแต่เวลา 8.00 - 16.00 น. *ราคาดังกล่าวรวมค่าวัคซีนและค่าบริการโรงพยาบาลในวันที่ฉีดวัคซีนเท่านั้น
พัทยาเมโมเรียล บริการวัคซีนป้องกันพิษสุนัขบ้า หลังกัด
โรงพยาบาลพัทยาเมโมเรียล บริการวัคซีนป้องกันพิษสุนัขบ้า การฉีดวัคซีนหลังสัมผัสโรค การสัมผัสโรค ได้แก่ การโดนกัด ข่วน เลียผิวหนังที่มีบาดแผล หรือ น้ำลายของสัตว์ กระเด็นเข้าเยื่อเมือก คือ จมูก ปาก ตา และ คนที่กินเนื้อสัตว์ ที่สงสัย หรือเป็น โรคพิษสุนัขบ้า การสัมผัสที่เสี่ยงจะต้องได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้ครบถ้วน จึงจะสามารถป้องกันโรคพิษสุนัขบ้าได้ ติดต่อสอบถามรายละเอียดเพิ่มเติม 038-488-777 ติดต่อ แผนกอุบัติเหตุ และฉุกเฉิน ต่อ 111, 112 ทุกวัน เวลา 08.00 - 20.00 น.
HOME ISOLATION เกษมราษฎร์ รามคำแหง โทร. 066-136-4111 line@ : @kasemrad-ram
HOME ISOLATION การแยกกักตัวที่บ้านสำหรับผู้ป่วยที่เข้าเกณฑ์ และจำเป็นต้องแยกกักตัวที่บ้านสามารถติดต่อสถานพยาบาลใกล้บ้านท่าน
1.ผู้ป่วยโควิด-19 อาการเล็กน้อย ระหว่างรอเตียง หรือรักษา 10 วันแล้วแยกกักตัวที่บ้านต่อ
2.ผู้ป่วยที่เข้าเกณฑ์ต่อไปนี้ หรือแพทย์พิจารณาว่าทำ HI ได้
3.การดูแลจากสถานพยาบาล
1. ปรอทวัดไข้ และเครื่องวัดออกซิเจนในเลือด
2. Telemedicine โดยทีมแพทย์ และพยาบาล
3. รับประทานยาตามดุลยพินิจของแพทย์
4. อาหาร 3 มื้อ ติดตาม ประเมินอาการ และให้คำปรึกษา
5. หากอาการเปลี่ยนแปลง หรือแย่ลง ให้แจ้งทีมแพทย์และสถานพยาบาล
โรงพยาบาลบางมด ทำฟัน ไม่ต้องสำรองจ่าย LINK
ทำฟัน “ไม่ต้องสำรองจ่าย” ใกล้สิ้นปีแล้ว อย่าลืมมาใช้สิทธิที่โรงพยาบาลบางมดกันนะคะ สิทธิประกันสังคม ในวงเงิน 900 บาท/ปี ไม่ต้องสำรองจ่าย ขูดหินปูน อุดฟัน ถอนฟัน ผ่าฟันคุด หากเกินวงเงิน 900 บาท จะต้องชำระส่วนเกินเอง
แพทย์ผู้เชี่ยวชาญท่านที่สอง : ศาสตราจารย์ นายแพทย์ เซอร์จิโอ ฟาซิโอ (Prof Sergio Fazio, MD, PhD Portland, Oregon and Tarrytown, New York, US)
แพทย์ผู้เชี่ยวชาญท่านถัดไป ศาสตราจารย์ นายแพทย์ เซอร์จิโอ ฟาซิโอ (Prof Sergio Fazio, MD, PhD Portland, Oregon and Tarrytown, New York, US) ศาสตราจารย์วุฒิคุณด้านโรคหัวใจ ประจำ Stanford University คุณหมอเคยดำรงตำแหน่งเป็นผู้อำนวยการศูนย์ป้องกันโรคหัวใจ ณ Knight Cardiovascular Institute ของ Oregon Health & Science University (OHSU) และที่นี่เองที่คุณหมอได้ริเริ่มความร่วมมือเพื่อนำทฤษฎีการรักษาโรคหัวใจแบบป้องกัน (Preventive Cardiology) มาสู่ประเทศไทย
ภายในหนังสือ Health Brings Wealth คุณหมออธิบายถึงความสำคัญของ หัวใจ ซึ่งเป็นอวัยวะทำงานตลอด 24 ชั่วโมง ไม่เคยได้หยุดพัก การดูแลสุขภาพหัวใจและหลอดเลือด ต้องเริ่มต้นที่ตัวเรา ด้วยการหันมาใส่ใจการใช้ชีวิต ไม่ว่าจะเป็น การเลือกรับประทานอาหารที่ดี คือ ไม่หวานจัด ไม่เค็มจัด และอาหารที่ไม่มีไขมันอิ่มตัวสูง พฤติกรรมการใช้ชีวิตที่ดี นอนหลับพักผ่อนให้เพียงพอ เคลื่อนไหวร่างกายอยู่เสมอ ลดความเครียด อันเป็นปัจจัยหนึ่งที่ทำให้เกิดโรคหัวใจ และอีกหลายวิธี เพื่อรักษาหัวใจให้อยู่ด้วยกันกับเราไปนานๆ
รพ.บางพลี แจ้งติดต่อ ศูนย์ไมลอท เจอ แจก จบ LINK
ศูนย์บริการโรงพยาบาลบางพลี-ไมลอท ให้บริการ เจอ แจก จบ
✅รับเฉพาะผู้ป่วยสีเขียวที่มีผล ATK แล้วเท่านั้น ✅รับทุกสิทธิ์ ✅มีใบรับรองแพทย์/ใบกักตัว ✅จ่ายยา/ ปรอทวัดไข้ ✅ไม่มียาฟาวิพิราเวีย
❌ไม่มีเครื่องวัดออกซิเจน
❌ไม่ทำ RT-PCR
ข้อดีคือ
- มีเบอร์ติดต่อกลับ ที่นามบัตร
- มีเจ้าหน้าที่ติดต่อเยี่ยมภายใน 48-72 ชม.
- เหมาะสำหรับผู้ป่วยสีเขียวที่ไม่มีประกันโควิดและต้องการแค่ยาไปทานที่บ้าน
- นำผลตรวจ ATK พร้อมบัตรประชาชนไปรับยาโครงการ เจอ แจก จบ
- เป็นอาคารชั้นเดียวเลยซุ้มวัดบางพลีใหญ่ใน ด้านซ้ายมือฝั่งร้านก๋วยเตี๋ยวเรือโป๊ะแตก ก่อนถึงปั๊มน้ำมันบางจาก (ขวามือ) 200-300 เมตร
ศูนย์วัคซีน One Stop รพ.พระปกเกล้า ฉีดวัคซีนไฟเซอร์ LINK
โรงพยาบาลพระปกเกล้า จังหวัดจันทบุรี
เปิดให้บริการฉีดวัคซีนป้องกันโควิด 19 แบบ One Stop Service
สำหรับประชาชนอายุ 12 ปีขึ้นไป ฉีดวัคซีนเข็มที่ 1-2-3-4
ฉีดวัคซีนไฟเซอร์ (Pfizer) และแอสตร้าเซนเนก้า (AstraZeneca)
เปิดให้บริการทุกวัน เวลา 08.30 – 15.30 น.
เว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์
ณ ชั้น 2 อาคารประชาธิปกศักดิเดชน์ โรงพยาบาลพระปกเกล้า
กรุณาเตรียมใบนัดและประวัติการฉีดวัคซีนหรือใช้ภาพถ่ายในโทรศัพท์ จาก application หมอพร้อม
ตัวเลข ผู้ติดเชื้อ ปอดอักเสบ ใส่ท่อช่วยหายใจ และเสียชีวิต
ตั้งแต่ 5-18 เมษายน 2565
- ผู้ติดเชื้อรายวัน เริ่มลดลง
- ผู้ป่วยปอดอักเสบ เริ่มเพิ่มขึ้นหลังจากลดระดับลงไป ก่อน-หลังสงกรานต์
- ผู้ป่วยใส่ท่อช่วยหายใจ แนวโน้มเดียวกันกับผู้ป่วยปอดอักเสบ
- ผู้เสียชีวิต เริ่มชะลอตัวลง คาดว่าจะลดลงเรื่อยๆ จากนี้ ในจำนวนนี้ 123 ราย เป็นกลุ่ม 608 อีก 116 ราย ไม่ได้รับเข็มกระตุ้น
ประชาชนในพื้นที่ อ.แกลง ติดต่อ รพ.ต่างๆ ดังนี้
วันที่ 13 เม.ย.65 - บาดเจ็บ 2 ราย เสียชีวิต 1 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 13 เม.ย.65) เกิดอุบัติเหตุ 3 ครั้ง บาดเจ็บ 2 ราย เสียชีวิต 1 ราย (อ.วัฒนานคร)
สะสม 3 วัน (11-13 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 10 ครั้ง บาดเจ็บ 9 ราย เสียชีวิต 2 ราย (อ.วังสมบูรณ์ และ อ.วัฒนานคร)
“ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
QR Code รพ.มหาวิทยาลัย บูรพา
สรุปจำนวนผู้ประกันตน มีนาคม 2565
ประชาชนในอ.ห้างฉัตร ติดต่อ รพ.สต.ดังนี้
สถาบันการแพทย์จักรีนฤบดินทร์ สมุทรปราการ เชิญชวนเข้ารับวัคซีน COVID-19 เข็มที่ 4 LINK
สถาบันการแพทย์จักรีนฤบดินทร์ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี
พร้อมให้บริการฉีดวัคซีนชนิด แอสตร้า ไฟเซอร์ โมเดอร์นา (ขึ้นกับวัคซีนที่รพ.มีพร้อมในวันนั้นๆ)
เงื่อนไข สำหรับผู้ที่ได้รับวัคซีนครบ 3 เข็ม ไม่น้อยกว่า 4 เดือน (120 วัน)
Walk in เข้ารับบริการได้ ในวันจันทร์ พุธ ศุกร์ เวลา 9.30-14 น.
ณ จุดบริการวัคซีน ชั้น 3 โซน A อาคารรพ.รามาธิบดีจักรีนฤบดินทร์
(งดบริการเสาร์-อาทิตย์ วันหยุดนักขัตฤกษ์)
ติดต่อ 02-8396000
13.การเก็บรวบรวมข้อมูลส่วนบุคคลจากแหล่งอื่น
ผงชูรสไม่มีประโยชน์ทางโภชนาการ เพียงทำให้อาหารมีรสชาติโดยรวมดีขึ้นเท่านั้น LINK
ผงชูรสไม่มีประโยชน์ทางโภชนาการ เพียงทำให้อาหารมีรสชาติโดยรวมดีขึ้นเท่านั้น ซึ่งต้องใส่ในปริมาณที่เหมาะสม อันตรายของผงชูรสแบ่งออกเป็น 2 ส่วนคือ
1. เกิดจากเกลือโซเดียมเพราะผงชูรสมีโซเดียมที่มาจากโซดาไฟ เป็นองค์ประกอบสำคัญซึ่งอันตรายดังนี้
- ทำให้ภูมิต้านทานหรือภูมิคุ้มกันของร่างกายลดลง
- เพิ่มอันตรายต่อผู้เจ็บป่วยด้วยโรคต่างๆ เช่น โรคไต ความดันโลหิตสูง และโรคหัวใจ
- ทำให้เกิดการคั่งในสมองเด็ก เมื่อเด็กโตขึ้น จะเป็นคนปัญญาอ่อน ทำให้เด็กทารกเกิดอาการชักโคม่า
2. เกิดจากตัวผงชูรสแท้ ทำให้เกิดอันตราย
- ทำให้เกิดอาการแพ้ผงชูรส ซึ่งมีจะมีอาการชาและร้อนวูบวาบที่ปาก ลิ้น ใบหน้า แน่นหน้าอก หายใจไม่สะดวก
- ทำลองสมองส่วนหน้า ซึ่งควบคุมการเจริญเติบโตและระบบสืบพันธ์ของร่างกาย
- ทำให้วิตามินในร่างกายลดลง โดยเฉพาะอย่างยิ่งวิตามินบี 6
- เปลี่ยนแปลงโครโมโซม ทำให้ผิดปกติ เช่น ปากแหว่ง หูแหว่ง จมูกวิ่น แขนขาพิการ
- ทำลายระบบประสาทตา สายตา หรือเกิดตาบอด
- ทำลายกระดูและไขกระดูก ซึ่งเป็นส่วนที่ผลิดเม็ดเลือดแดง ในร่างกาย ทำให้โลหิตจางได้
- เกิดโรคมะเร็งและทำลายระบบประสาทส่วนกลาง
Healthy By Rama ตอน อันตรายจากผงชูรส
ท่องเทียวหนองคาย เชียงคาน
สิทธิบัตรทอง (หลักประกันสุขภาพถ้วนหน้า(รพ.มทส))
ผู้มีสิทธิลงทะเบียนหลักประกันสุขภาพถ้วนหน้าของโรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี
1. เป็นนักศึกษามหาวิทยาลัยเทคโนโลยีสุรนารีที่มีสัญชาติไทย มีเลขประจำตัวประชาชน 13 หลัก
2. ไม่มีสวัสดิการด้านการรักษาพยาบาลอื่นใดที่รัฐจัดให้ การเข้ารับบริการ : ต้องแสดงบัตรประชาชน หรือบัตรนักศึกษาทุกครั้ง
กลุ่มที่ได้รับความคุ้มครอง
– การส่งเสริมสุขภาพ การป้องกันโรคและการควบคุมโรค
1. การตรวจและดูแลเพื่อส่งเสริมสุขภาพของหญิงตั้งครรภ์
2. การดูแลสุขภาพเด็ก พัฒนาการและภาวะโภชนาการ รวมถึงการให้ภูมิคุ้มกันโรคตามแผนงานการให้ภูมิคุ้มกันโรคของประเทศ
3. การตรวจสุขภาพประชาชนทั่วไปและกลุ่มเสี่ยง
4. การวางแผนครอบครัว (ยาคุมกำเนิด ถุงยางอนามัย ห่วงอนามัย ยาฝังคุมกำเนิด และการทำหมันถาวร)
5. ยาต้านไวรัสเอดส์
6. การเยี่ยมบ้าน และการดูแลผู้ป่วยที่บ้าน
7. การให้ความรู้ด้านสุขภาพแก่ผู้รับบริการในระดับบุคคลและครอบครัว
8. การให้คำปรึกษา (counseling) และสนับสนุนให้ประชาชนมีส่วนร่วมในการส่งเสริมสุขภาพ
9. การส่งเสริมสุขภาพและป้องกันโรคในช่องปาก ได้แก่ การตรวจสุขภาพช่องปาก การแนะนำ ด้านทันตสุขภาพ การให้ฟลูออไรด์เสริมในกลุ่ม
ที่มีความเสี่ยงต่อโรคฟันผุ เช่น กลุ่มเด็ก ผู้สูงอายุ ผู้ป่วยฉายรังสีบริเวณศีรษะและลำคอ รวมทั้งการเคลือบหลุมร่องฟัน
– บริการด้านการตรวจวินิจฉัย
1. การตรวจ การวินิจฉัย การรักษา และการฟื้นฟูสมรรถภาพทางการแพทย์จนสิ้นสุดการรักษา ทั้งนี้รวมถึงการแพทย์ทางเลือกที่ผ่านการรับรองของคณะกรรมการ
2. การคลอดบุตร รวมกันไม่เกิน 2 ครั้ง กรณีที่บุตรมีชิวิตอยู่ (กรณีบุตรคลอดแล้วรอดออกมามีชีวิต)โดยนับตั้งแต่ใช้สิทธิในโครงการหลักประกันสุขภาพ
3. ค่าอาหาร และค่าห้องสามัญ
4. การถอนฟัน การอุดฟัน การขูดหินปูน การทำฟันปลอมฐานพลาสติก การรักษาโพรงประสาทฟันน้ำนมและการใส่เพดานเทียมในเด็กปากแหว่งเพดานโหว่
5. ยาและเวชภัณฑ์ตามกรอบบัญชียาหลักแห่งชาติ
6. การจัดส่งต่อเพื่อการรักษาระหว่างหน่วยบริการ
กลุ่มที่ไม่ได้รับความคุ้มครอง
– กลุ่มบริการที่เกินความจำเป็นพื้นฐาน
1. การรักษาภาวะมีบุตรยาก
2. การผสมเทียม
3. การกระทำใดๆ เพื่อความสวยงาม โดยไม่มีข้อบ่งชี้ทางการแพทย์
4. การตรวจวินิจฉัย และรักษาใดๆ ที่เกินความจำเป็นและไม่มีข้อบ่งชี้ทางการแพทย์
5. การรักษาที่อยู่ระหว่างการค้นคว้าทดลอง
– กลุ่มบริการที่มีงบประมาณจัดสรรเป็นการเฉพาะ
1. การบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดและสารเสพติดตามกฎหมายว่าด้วยยาเสพติด 2. อุบัติเหตุการประสบภัยจากรถและอยู่ในความคุ้มครองตามกฎหมายว่าด้วยการคุ้มครองผู้ประสบภัยจากรถเฉพาะส่วนที่บริษัทหรือกองทุนตามกฎหมายนั้นต้องเป็นผู้จ่าย
– กลุ่มบริการอื่นๆ
1. โรคเดียวกัน ที่ต้องใช้ระยะเวลารักษาตัวในโรงพยาบาล ประเภทผู้ป่วยในเกินกว่า 180 วัน ยกเว้นกรณีมีความจำเป็น ต้องรักษาต่อเนื่อง จากการแทรกซ้อน หรือมีข้อบ่งชี้ทางการแพทย์
สามารถดูรายละเอียดสิทธิหลักประกันสุขภาพถ้วนหน้าเพิ่มเติมได้ที่ : http://www.nhso.go.th
โปรแกรมตรวจสุขภาพ สำหรับลูกจ้างการไฟฟ้า
เกณฑ์การเบิก ตามอายุ
ต่ำกว่า 35 ปี เบิกได้ 580 บาท
35 ปีขึ้นไป เบิกได้ 1,050 บาท
ทั้งสองแบบ ลูกจ้างชำระส่วนต่างเองนอกเหนือสิทธิเรียกเก็บ แนวทางดูแลตนเอง เมื่อมีอาการต่างๆจากโรคโควิด-19
4.เปลือกกัญชง มอก. 3184-2564
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3184-2564
ชื่อ มอก. : เปลือกกัญชง
TIS NAME : Hemp bast
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 8 กันยายน 2564
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 138ตอน พิเศษ 211 งวันที่ 8 กันยายน 2564
ประกาศกระทรวง : ฉบับที่ 6203วันที่ 30 มีนาคม 2564
เอกสารฉบับเต็ม
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานนี้ครอบคลุมเปลือกกัญชงที่มาจากต้นกัญชงที่เป็นไปตามที่กฎหมายกำหนด และความยาวเปลือกต้องไม่น้อยกว่า 150 cm เพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม โดยกำหนดขอบข่าย บทนิยาม ชั้นคุณภาพและสัญลักษณ์ คุณลักษณะที่ต้องการ การบรรจุ เครื่องหมายและฉลาก การชักตัวอย่างและเกณฑ์ตัดสิน และการทดสอบ
Abstract : This standard covers hemp bast derived from the legal hemp plant and the shell length must not be less than 150 cm to be used as raw materials in the industry by defining the scope, definitions, general characteristics, packing, Mark and Label, sampling and criteria for conformity and testing.
3.หมอถึงบ้าน ผ่าน Telemedicine
ประโยชน์คนกรุงฯ
- ประชาชนได้รับการบริการและรักษาพยาบาลที่สะดวก รวดเร็ว ทันสมัย และเชื่อถือได้โดยไม่ลดต้นทุนเวลาและค่าใช้จ่ายได้
รายละเอียด
ประสบการณ์และภาพจำของประชาชนในการเข้ารับการรักษาพยาบาลในโรงพยาบาลของรัฐ ทั้งการรอคิวที่ล่าช้าด้วยการทำเอกสาร การนัดหมาย การรอชำระเงินและรับยา ตลอดจนการรอพบแพทย์ที่มีความเชี่ยวชาญสูงแต่มีจำนวนจำกัด หลายพื้นที่ครอบครัวอยู่ห่างไกลสถานพยาบาล ส่งผลให้ค่าใช้จ่ายในการเดินทางสูง ต้องใช้เวลาอยู่ที่โรงพยาบาลกว่าครึ่งวัน แต่พบแพทย์เพียง 10-15 นาที
ผู้ป่วยหลายกลุ่มโรคต้องมีการตรวจรักษาเป็นประจำเพื่อดูความเปลี่ยนแปลงของอาการ (follow up) ทุกๆ เดือน หรือ 3 เดือนครั้ง ส่งผลให้ประชาชนบางกลุ่มเสียโอกาสในการทำงานสร้างรายได้ ไม่อยากลางานหรือหยุดงานเนื่องจากขาดรายได้และเป็นภาระค่าใช้จ่าย ยิ่งค่าใช้จ่ายในการเดินทางไปยังสถานพยาบาลของกลุ่มผู้สูงอายุหรือผู้ที่ช่วยเหลือตัวเองไม่ได้ยิ่งมีค่าใช้จ่ายสูงกว่าปกติ
ปัญหาดังกล่าวสามารถแก้ไขได้ และอำนวยความสะดวกให้แก่ประชาชนด้วยการประยุกต์ใช้อุปกรณ์ที่ทันสมัย และโครงข่ายเทคโนโลยีดิจิทัลทางการแพทย์
แม้ปัจจุบัน กทม. จะมีการริเริ่มโครงการ telemedicine ผ่านแอพพลิเคชั่น “หมอ กทม.” ในกลุ่มผู้ป่วยนอก (OPD) ที่มีข้อมูลผู้ป่วยอยู่เดิมภายใต้สถานพยาบาลในสังกัดบ้างแล้ว ในระยะยาว กทม.จะพัฒนาให้การให้บริการสาธารณสุขและการรักษาพยาบาลครอบคลุมครบวงจร เช่น การรับแจ้งผู้ป่วยและทำนัดหมาย เช่น ผ่านแอพพลิเคชั่นของ กทม. อย่าง BMAQ การชำระเงินรูปแบบออนไลน์ (e-Payment) การรับยาที่บ้านหรือร้านยาใกล้บ้าน ผสานกับแจ้งเตือนให้กินยาให้ถูกต้องตามแพทย์แนะนำ
เป้าหมายเพื่อให้ประชาชนได้รับบริการการรักษาที่สะดวก รวดเร็ว ทันสมัย และเชื่อถือได้ผ่านการให้คำปรึกษาจากแพทย์ผู้เชี่ยวชาญโดยแบ่งการใช้เทคโนโลยีเป็น 2 รูปแบบ คือ
- การบริการจากสถานพยาบาลทุติยภูมิ (โรงพยาบาล) กับปฐมภูมิ (ศูนย์บริการสาธารณสุขหรือศูนย์สุขภาพชุมชน) เพื่อเสริมบริการการรักษาแบบมีเจ้าหน้าที่คอยสนับสนุน โดยเฉพาะกลุ่มผู้สูงอายุในชุมชนที่เข้าไม่ถึงเทคโนโลยีและต้องการความช่วยเหลือ
- การบริการแบบ end-to-end ใช้แอพพลิเคชั่นทางสมาร์ตโฟนเพื่อให้สถานพยาบาลติดต่อกับคนไข้ที่ต้องพบแพทย์เป็นประจำและมีประวัติการรักษาอยู่เดิมได้โดยตรง ลดการเดินทาง พบหมอออนไลน์ รอรับยาที่บ้าน
ผู้ป่วยโรคไตสามารถกินอาหารในแนวทางคาร์โบไฮเดรตต่ำ (Low Carb) ได้หรือไม่
นี่คือหนึ่งในคำถามที่มีผู้ป่วยกลุ่มวัยรุ่นถามเข้ามาเป็นจำนวนมาก โดย รศ. พญ. ปิยวรรณ กิตติสกุลนาม ได้ให้คำตอบว่า ผู้ป่วยโรคไตที่อยู่ในช่วงก่อนบำบัดทดแทนไต หรือการฟอกไต ควรรับประทานอาหารที่มีโปรตีนต่ำ (Low Protein) ดังนั้นการดูแลสุขภาพและร่างกายโดยเลือกรับประทานอาหารในสูตรโปรตีนสูง (High Protein) คาร์โบไฮเดรตต่ำ (Low Carb) จึงไม่เหมาะกับผู้ป่วยโรคนี้เป็นอย่างยิ่ง
ตารางแพทย์ห้องตรวจ หู คอ จมูก
รพ.ที่ได้รับรางวัลส่วนใหญ่จะอยู่ในทวีปอเมริกาและยุโรป เช่น Mayo Clinic Rochester, Oregon Health & Science University, The Royal Brompton Hospital, University of Pittsburgh Medical Center, Boston Children’s Hospital, Cleveland Clinic, Duke University Hospital, Massachusetts General Hospital, Northwestern Memorial Hospital, Stanford Hospital and Clinics, The University of Chicago Medical Center
ในแถบเอเชียตะวันออก โรงพยาบาลหัวใจกรุงเทพ นับเป็นแห่งที่ 3 ถัดจาก National Taiwan University Hospital และ Chonnam National University Hospital ที่ได้รางวัลนี้
โครงการเชื่อมสุข โทร.02-2402951-52 LINK
โครงการเชื่อมสุข มูลนิธิช่วยการสาธารณสุขชุมชน มีวัตถุประสงค์เพื่อ "เชื่อมความช่วยเหลือ" ระหว่าง "ผู้มีจิตศรัทธา" ที่ประสงค์จะบริจาคอุปกรณ์เครื่องใช้ขนาดใหญ่ อาทิ เตียงผู้ป่วย รถเข็นผู้ป่วย กับ "ผู้ป่วยยากไร้ และหน่วยงานที่มีความต้องการใช้จริง" ติดต่อโครงการได้
สถานที่ตั้งโครงการ อาคารศูนย์การแพทย์และสาธารณสุข ชั้น 5
(ศูนย์บริการสาธารณสุข 41 คลองเตย) เลขที่ 139 ถนนอาจณรงค์ แขวง/เขตคลองเตย กรุงเทพฯ
โทร.02-2402951 02-2402952
ขณะนี้บริการเฉพาะพื้นที่กรุงเทพฯ และปริมณฑลเท่านั้น (โดยในอนาคตอาจมีการขยายโครงการไปยังภูมิภาคอื่นๆ ของประเทศ)
เครือโรงแรมอนันตรา เปิดตัวทรีตเม้นต์สูตรกัญชา Cannabis Stress-Release Journey LINK
เครือโรงแรมระดับโลกอย่างอนันตรา ก็พร้อมให้บริการทรีตเม้นต์ที่ผสานกัญชาเพื่อความผ่อนคลายในคอนเซ็ปต์ "Cannabis Stress-Release Journey" 3 แพคเกจ ได้แก่
• Restful Slumber Journey (90 นาที)
• Cannabis Stress-Release Journey
• Head to Toe Calming Journey
ให้บริการใน 4 อนันตราในไทย ได้แก่ Anantara Siam Bangkok Hotel, Anantara Riverside Bangkok Resort, Anantara Chiang Mai Hotel และ Anantara Bophut Koh Samui Resort
ศึกษาข้อมูล/สอบถามเพิ่มเติมอนันตรา หรือโทร. 02-3659110
เอกสารแนบ : ข้อพิจารณาความผิดเกี่ยวกับพืชกัญชาตามประมวลกฏหมายยาเสพติด
รองศาสตราจารย์ แพทย์หญิงพรจิรา ปริวัชรากุล
รองศาสตราจารย์ แพทย์หญิงพรจิรา ปริวัชรากุล ภาควิชาจิตเวชศาสตร์ คณะแพทยศาสตร์ศิริราชพยาบาล กล่าวถึง ฤทธิ์ของสารในกัญชาต่อระบบประสาทและจิตใจ ว่า
ญาตินำผู้ป่วยมารักษาตัวที่โรงพยาบาลศิริราช เนื่องจากมีอาการเห็นภาพหลอน ผวา ซึมเศร้า พยายามฆ่าตัวตาย ญาติแจ้งว่าให้ยาแผนปัจจุบันรักษาอาการป่วยปกติ แต่ผู้ป่วยมีอาการแปลกไปจึงพามาโรงพยาบาล และได้มารับทราบทีหลังว่า ผู้ป่วยได้แอบใช้กัญญาที่ได้จากคนรู้จัก
โดยใช้ใบกัญชาสด 1 หยิบมือ ต้มกับน้ำดื่มทุกวันนาน 1 สัปดาห์ หลังจากนั้นแม้หยุดใช้กัญชา แต่อาการไม่กลับสู่ระดับเดิมอีก ผู้ป่วยยังมีช่วงที่เกิดอาการทางจิตเป็นระยะ การตัดสินใจแย่ลง อาการซึมเศร้าที่เคยสงบแล้ว กลับมากำเริบ แม้จะรักษาให้บรรเทาลง แต่ไม่มีช่วงที่กลับมาสดชื่นปกติอีกจนถึงปัจจุบัน
ซึ่งจะเห็นได้ว่าผู้ใช้กัญชาจะทำให้มีภาวะเมากัญชา มีอาการสติสัมปชัญญะผิดปกติ อารมณ์ พฤติกรรมเปลี่ยนแปลงไป มีอาการซึมเศร้า หรือครื้นเครงมากกว่าปกติ โรควิตกกังวลจากกัญชา มีอาการวิตกกังวลเกิดขึ้นระหว่างหรือไม่นานหลังจากเมาหรือถอนพิษกัญชา เช่น อาการหวาดหวั่น กังวล กลัว ระบบประสาทไวต่อการกระตุ้น โรคจิตจากกัญชา เช่น มีอาการหลงผิด ประสาทหลอน ความคิดไม่เป็นระบบ เป็นต้น
อย่างไรก็ตาม กัญชาสามารถกระทบต่อความสามารถทางสมอง เพิ่มความเสี่ยงต่อระบบจิตเวช และการฆ่าตัวตายได้ สำหรับผู้ประกอบการ ควรให้ข้อมูลสุขภาพกับผู้ที่บริโภค เพื่อให้สังคมอยู่ร่วมกันได้อย่างมีความสุข มีเศรษฐกิจที่ดี บนพื้นฐานของสุขภาพและคุณภาพชีวิตของประชาชนที่ดีด้วย
แสดงผลการจดแจ้งและออกเลขสารบบ
เมื่อจดแจ้งแล้ว ระบบจะออกเลขจดแจ้งให้ทันที
ตามตัวอย่างหน้าเพจ จะแสดงผลการจดแจ้งเอาไว้ ร่วมกับข้อมูลระบุอื่นๆ ได้แก่
สิ่งที่ปลูก จำนวนต้น วันที่บันทึก วันที่รับแจ้ง สถานที่ปลูก เหตุผลการปลูก และแหล่งที่มา
ข้อมูลการปลูกจะทำให้ทราบจำนวนและแหล่งที่ปลูกกัญชา และกัญชงทั่วประเทศ เพื่อเป็นแหล่งข้อมูลให้ผู้ประกอบการแสวงหาวัตถุดิบเพื่อนำไปผลิตเป็นผลิตภัณฑ์ที่มีคุณภาพมาตรฐานออกสู่ตลาด อีกทางหนึ่ง
หากมีข้อสงสัยสอบถามได้ที่ call center โทร 1556 กด 3
พญ. พัชรี ประสิทธิ์วรนันท์
พญ. พัชรี ประสิทธิ์วรนันท์ แพทย์ชำนาญการด้านรังสีวิทยา โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “จากข้อมูลสถาบันมะเร็งแห่งชาติ ในปี 2563 พบหญิงไทยป่วยด้วยมะเร็งเต้านมรายใหม่ ประมาณ 18,000 คนต่อปี และมีผู้เสียชีวิตจากมะเร็งเต้านม ประมาณ 4,800 คน หรือเฉลี่ย 13 คนต่อวัน ซึ่งมะเร็งเต้านมเป็นอันดับหนึ่งของมะเร็งที่พบบ่อยในผู้หญิงไทยและจากรายงานยังมีแนวโน้มสูงขึ้นทุกปี ฉะนั้นผู้หญิงในวัย 40 ปีขึ้นไป จึงควรเข้ารับการตรวจแมมโมแกรมเป็นประจำทุกปี ปัจจุบันบำรุงราษฎร์มีการนำปัญญาประดิษฐ์สำหรับแมมโมแกรม หรือ Radiology INSIGHT MMG ซึ่งมีส่วนช่วยในการคัดกรอง วิเคราะห์ และวินิจฉัยมะเร็งเต้านมบนภาพถ่ายแมมโมแกรม โดยก่อนหน้านี้ รังสีแพทย์ก็มีการอ่าน แปลผล วิเคราะห์ และวินิจฉัยโรคจากภาพถ่ายต่างๆ อยู่แล้ว แต่การนำ AI เข้ามาใช้ทางการแพทย์นั้น ก็เสมือนมีผู้ช่วย มาช่วยวิเคราะห์ โดยในส่วนนี้เองจะช่วยเพิ่มความรอบคอบให้กับแพทย์ได้มากขึ้น ทั้งนี้ รังสีแพทย์จะนำผลของ Radiology AI มาประกอบการวินิจฉัย มะเร็งเต้านมหากได้รับการวินิจฉัยตั้งแต่ระยะแรกเริ่ม และเริ่มการรักษาอย่างเหมาะสมทันท่วงที ก็จะทำให้ผู้ป่วยมีอัตราการรอดชีวิต 5 ปี สูงถึง 99% แต่หากวินิจฉัยช้า ทำให้อัตราการรอดชีวิต 5 ปี จะลดลงเหลือ 86% ลงมาจนถึง 29% ตามระยะของมะเร็งที่สูงขึ้น ดังนั้น หากตรวจพบเร็วจะช่วยเพิ่มโอกาสความสำเร็จในการรักษาผู้ป่วยได้มากขึ้น”
โรงพยาบาลดีบุก จ.ภูเก็ต LINK
โรงพยาบาลดีบุก จ.ภูเก็ต เป็นโรงพยาบาลเอกชนขนาดกลาง ระดับทุติยภูมิ ตั้งอยู่ที่ ถ.เจ้าฟ้า ต.วิชิต อ.เมืองภูเก็ต จ. ภูเก็ต เปิดให้บริการตั้งแต่ปี 2557 เป็นอีกทางเลือกสำหรับชาวไทยและชาวต่างประเทศในภูเก็ตและจังหวัดใกล้เคียง ปัจจุบันโรงพยาบาลดีบุก ได้รับการรับรองมาตรฐานโรงพยาบาล Hospital Accreditation (HA) อยู่ภายใต้การบริหารจัดการของโรงพยาบาลกรุงเทพภูเก็ตอย่างเต็มรูปแบบ โรงพยาบาลดีบุก เป็นโรงพยาบาลประกันสังคมแห่งที่ 5 ในจ.ภูเก็ต และเป็น 1 ใน 2 โรงพยาบาลเอกชน (อีกแห่งคือ โรงพยาบาลมิชชั่นภูเก็ต)
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลดีบุกสามารถรับผู้ประกันตนเพิ่มได้อีก 17,159 ราย
โรงพยาบาลดีบุก โรงพยาบาลเครือข่าย 2 แห่ง ได้แก่ โรงพยาบาลมะเร็งสุราษฎร์ธานี โรงพยาบาลกรุงเทพภูเก็ต
โรงพยาบาลพีเอ็มจี กรุงเทพ
โรงพยาบาล PMG เป็นโรงพยาบาลทั่วไปขนาดใหญ่ จำนวน 109 เตียง ตั้งอยู่ที่ 280 ถ.พระราม2 แขวงแสมดำ เขตบางขุนเทียน กรุงเทพมหานคร เปิดตัวในปี พ.ศ. 2564 เปลี่ยนชื่อจากรพ.พระราม 2 เดิ่มเป็น PMG มีความหมาย เพื่อส่งมอบการดูแลสุขภาพ และนวัตกรรมที่เป็นเลิศ P = Professional (ความเป็นมืออาชีพ) M = Medical Standards (มาตรฐานทางการแพทย์) G = Good Health and Longevity (สุขภาพที่ดีและยืนยาว) เพื่อการดูแลผู้ป่วยที่เป็นเลิศ และปลอดภัยแก่ผู้ป่วยทั้งใน ประเทศและต่างประเทศ
Transit Visa
Transit Visa
REQUIREMENT
This type of visa is issued to applicants who wish to enter the Kingdom for the following purposes :
• To travel in transit through the Kingdom in order to proceed to the country of destination or to re-enter his/her own country (category "TS")
• To participate in sports activities (category "S")
Note: Those who are scheduled to stay in the Kingdom longer than one month , NonImmigrant Visa category “O” can be issued to them
• The person in charge or crew of a conveyance coming to a port, station or area in the Kingdom (category "C")
**Employment in Thailand is prohibited**
REQUIRED DOCUMENTS
• Passport or travel document with validity not less than 6 months
• Visa application form completely filled out
• Evidence of travel from Thailand (confirmed air ticket paid in full)
• Recent (4x6 cm.) photograph of the applicant
• Evidence of adequate finance (10,000 Baht per person or 20,000 Baht per family)
• Visa of a third country in a passport or travel document
• Letter of invitation stating the application’s participation in sports activities in the Kingdom
• NOTE: Consular officers reserve
the rights to request additional documents as deemed necessary
VISA PROCESSING FEE
• 800 Baht per entry (Visa fee may be changed without prior notice)
VISA VALIDITY
• The validity of a visa is three months.
PERIOD OF STAY
• Travellers coming to Thailand with this type of visa will be permitted to stay in the Kingdom for a period not exceeding 30 days.
EXTENSION OF STAY
• Those who wish to stay longer or may wish to change their type of visa must file an application for an extension at the Office of Immigration Bureau located on Government Center B, Chaengwattana Soi 7, Laksi, Bangkok 10210, Tel 0-2141-9889 (or at http://www.immigration.go.th ). The extension of stay as well as the change of certain type of visa is solely at the discretion of the Immigration officer. (For more information please visit http://www.thaiembassy.org/ ).
รายได้ กำไรสุทธิ
กลุ่มโรงพยาบาลเอกชนมีการเติบโตด้านรายได้ และกำไรเพิ่มขึ้นทุกปี ตั้งแต่ปี 2012-2019
ด้านรายได้ เติบโตแทบทุกปี ในอัตราเกิน 10% เว้นเพียงปี 2016, 2018 และ 2019 ที่เติบโตเป็นตัวเลขหลักเดียว
ด้านกำไรสุทธิ เติบโตในอัตราเกิน 10% สอดคล้องกับรายได้ รวมถึงปีที่อัตราการเติบโตต่ำกว่า กำไรสุทธิก็ต่ำลงเช่นกัน
อุตสาหกรรม มีอัตรากำไรค่อนข้างแน่นอนที่ราว 13% มีเพียง 2 ปีที่ส่วนแบ่งกำไรนี้สูงกว่า คือ 16.9% ปี 2012 และ 16.5% ปี 2019 ก่อนจะตกฮวบลงมาในปี 2020 จากปัญหาโควิด
ขณะที่ปี 2020 ที่เริ่มมีโควิดระบาด ภาพรวมรายได้ก็ยังถือว่าสูงมาก ที่ระดับ 148,383 ล้านบาท (ลดลง 12.7% จากปี 2019) ส่วนอัตรากำไรลดลงอย่างมีนัยยะ เหลือเพียง 14,605 ล้านบาท (ลดลง 47.8%)
เงื่อนไขการนำของเหลว เจล สเปรย์ ขึ้นเครื่องบิน
ศูนย์การแพทย์และโรงพยาบาลมหาวิทยาลัยพะเยา (ปี 2563)
โรงพยาบาลมหาวิทยาลัยพะเยา เป็นโรงพยาบาลในสังกัดคณะแพทยศาสตร์ มหาวิทยาลัยพะเยา เป็นโรงพยาบาลขนาด 200 เตียง ให้บริการรักษาพยาบาลประชาชนใน 5 จังหวัดภาคเหนือ ได้แก่ พะเยา แพร่ น่าน เชียงราย และลำปาง และเป็นสถานที่เรียนและฝึกปฏิบัติงานวิชาชีพสายการแพทย์ ของมหาวิทยาลัย
โรงพยาบาลตั้งอยู่ที่ 19 หมู่ 2 ถนนพหลโยธิน ตำบลแม่กา อำเภอเมืองพะเยา จังหวัดพะเยา 56000 โทร.054-466758
นายปานเทพ พัวพงษ์พันธ์ คณบดีสถาบันแพทย์แผนบูรณาการและเวชศาสตร์ชะลอวัย มหาวิทยาลัยรังสิต
นายปานเทพ พัวพงษ์พันธ์ คณบดีสถาบันแพทย์แผนบูรณาการและเวชศาสตร์ชะลอวัย มหาวิทยาลัยรังสิต กล่าวว่า ต้องการสื่อสารให้ประชาชนเข้าใจทั้งประโยชน์และข้อควรระวังมากขึ้น และทำความเข้าใจที่ไม่ถูกต้องในสังคม รวมถึงการประเมินติดตามสถานการณ์ให้ประชาชนใช้กัญชาอย่างถูกต้องอย่างเข้าใจ
การรับฟังความคิดเห็นของประชาชนมีความสำคัญ เพื่อปรับปรุงข้อห่วงใยในช่วงรอยต่อนี้ แม้กัญชาจะไม่ได้อยู่ในฐานะของยาเสพติดแล้ว แต่กระทรวงสาธารณสุขก็ได้มีการเตรียมความรู้และมาตรการมากกว่าช่วงนิรโทษกรรมกัญชาเมื่อปี 2562 ที่สามารถดำเนินการเปลี่ยนผ่านได้โดยไม่เกิดปัญหาแต่อย่างใด
อย่างไรก็ตามมีคำแนะนำว่าในช่วงการเปลี่ยนผ่านในระหว่างรอ พ.ร.บ.กัญชา กัญชง การปลูกทั้งหมดควรทำการจดแจ้งในแอปพลิเคชัน ปลูกกัญ ของ อ.ย. เพื่อรักษาสิทธิของแต่ละคนในอนาคตหลัง พ.ร.บ.กัญชา กัญชง ประกาศบังคับใช้
ในขณะเดียวกันการปรุงอาหารที่ใช้ส่วนต่างๆ ของกัญชาจะต้องมีความระมัดระวังไม่ให้เกิดผลเสียและหากใส่กัญชามากเกินพอดี อาจทำเกิดอาการไม่พึงประสงค์และเสียลูกค้าในร้านอาหารได้
ในขณะที่ผู้ที่ปลูกเพื่อจำหน่ายควรศึกษาเพื่อให้มีความชัดเจนเสียก่อนในเรื่องสายพันธุ์ วิธีการปลูก และคุณภาพให้เป็นไปตามผลิตภัณฑ์ของผู้ซื้อเพื่อป้องกันความเสียหายในทางธุรกิจของผู้ปลูกกัญชากัญชงเอง
ควรระวังว่ากัญชายังไม่สามารถนำติดตัวไปยังต่างประเทศได้ หากยังไม่มีใบรับรองทางการแพทย์ หรือประเทศเหล่านั้น กำหนดให้กัญชายังคงเป็นยาเสพติต หรือห้ามนำเข้าจากประเทศอื่น
สัมภาษณ์พิเศษ:ศุภชัย ใจสมุทร เคลียร์ทุกข้อสงสัย ปลดล็อกกัญชาเสรี: Matichon TV LINK
สัมภาษณ์พิเศษ:ศุภชัย ใจสมุทร ส.ส. ภูมิใจไทย เคลียร์ทุกข้อสงสัย ปลดล็อกกัญชาเสรี เดินหน้าสู่ “พืชเศรษฐกิจ” อะไรทำได้ อะไรทำไม่ได้
00:00 ไฮไลท์
04:12 9 มิ.ย.กัญชาไม่ใช่ยาเสพติดอีกต่อไป
10:18 สูบกัญชา โดนจับหรือไม่
16:38 นักโทษคดีกัญชาเฮ “ไร้ความผิดทั้งหมด”
17:28 “แอพปลูกกัญ” ชาวบ้านลงทะเบียนปลูกกัญชาเองที่บ้านได้
20:29 ร่างพรบ. การจดทะเบียนทำธุรกิจกัญชา
31:19 ศุภชัยชี้ ภูมิใจไทยพูดจริงทำจริงเพื่อประชาชน
น้ำผึ้งมะนาวโซดา
เครื่องดื่มเย็นซ่าสดชื่น รสเปรี้ยวอมหวาน แก้เมากัญชา ช่วยให้ชุ่มคอ
ส่วนประกอบ (ขนาด 16 ออนซ์)
น้ำผึ้ง 30 มิลลิลิตร
น้ำมะนาว 20 มิลลิลิตร
น้ำเชื่อม 10 มิลลิลิตร
โซดา 120 มิลลิลิตร
น้ำแข็ง
วิธีทำ
ตวงน้ำผึ้ง น้ำมะนาว น้ำเชื่อม คนให้เข้ากันจนน้ำผึ้งละลาย เติมโซดาลงไป คนเล็กน้อย เทใส่แก้ว เติมน้ำแข็ง ดื่มแบบเย็น
เจาะเลือดที่บ้าน LINK
โรงพยาบาลสิรินธร มีบริการเจาะเลือดถึงบ้าน สำหรับผู้ป่วยกลุ่มต่างๆ เพื่ออำนวยความสะดวก ลดความแออัด ลดเสี่ยง ติดต่อ หน่วยงานปชส.หรือแผนกที่ระบุในใบนัด
ทีมศัลยแพทย์เฉพาะทางด้านการผ่าตัดเปลี่ยนข้อเข่าที่มากด้วยประสบการณ์


การผ่าตัดเปลี่ยนข้อเข่าเทียม ที่ศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล มีทีมศัลยแพทย์เฉพาะทางด้านการผ่าตัดเปลี่ยนข้อเข่าที่มากด้วยประสบการณ์ พร้อมด้วยทีมแพทย์สหสาขา เช่น วิสัญญีแพทย์ แพทย์กายภาพบำบัด และ อายุรแพทย์ เพื่อให้มั่นใจว่าผู้ป่วยแต่ละรายจะได้รับการดูแลอย่างครอบคลุม ครบทุกมิติ ด้วย มาตรฐานการดูแลรักษาระดับสากลที่ได้รับการรับรอง (Program Certificate สำหรับ Total Knee Replacement Program) โดย JCI ประเทศสหรัฐอเมริกา มีการใช้เทคโนโลยีขั้นสูง (digital template / pre-operative planning program) เพื่อวางแผนให้การผ่าตัดเป็นไปอย่างถูกต้อง ช่วยระบุเลือกขนาด และตำแหน่งของข้อเทียมได้อย่างตรงจุด ร่วมกับ เทคนิคระงับปวด (pain intervention technique) เช่น การบล็อคเส้นประสาท และการใช้คลื่นไฟฟ้าความถี่สูง (เป็นกรณีทางเลือกเสริมสำหรับการระงับอาการปวดหลังผ่าตัด) ซึ่งส่งผลให้ผู้ป่วยเจ็บน้อย หรือไม่เจ็บเลย ลดการบาดเจ็บของกล้ามเนื้อบริเวณใกล้เคียง ตลอดจน ผลแทรกซ้อนหลังผ่าตัดต่ำ เช่น ลดการทำลายเส้นประสาท ลดโอกาสการติดเชื้อหลังผ่าตัด และลดความเสี่ยงการเกิดลิ่มเลือดอุดตัน ทำให้ผู้ป่วยฟื้นตัวได้ไว สามารถเดินได้ภายใน 24 ชม. หลังผ่าตัด และสามารถกลับไปใช้ชีวิตประจำวันได้ใกล้เคียงกับปกติรวดเร็วมากยิ่งขึ้น
โรงพยาบาลเจริญกรุงประชารักษ์ บริการฉีดฟรี ผู้ประกันตนสิทธิประกันสังคม
ผู้ประกันตนสิทธิประกันสังคม โรงพยาบาลเจริญกรุงประชารักษ์ (ผู้ประกันตนมาตร 33 และมาตรา 39) อายุ 50 ปีขึ้นไป ฉีดวัคซีนป้องกัน ไข้หวัดใหญ่ 4 สายพันธ์ุฟรี
ติดต่อฉีดวัคซีน คลินิกประกันสังคม ชั้น 4 อาคาร 72 พรรษา มหาราชินี
วันราชการเวลา 08.00 - 15.00 น.
นำบัตรประจำตัวประชาชน มาด้วยทุกครั้ง
เข้ารับบริการได้ทันที ไม่ต้องจองคิวล่วงหน้า
โทร. 02 289 7760
ให้บริการถึง 31 สิงหาคม 2565
เขตสุขภาพที่ 3
ชัยนาท
- รพ.ชัยนาทนเรนทรรพท062-363-2955อังคาร 13.00-16.30 น.
- รพ.เนินขามรพช.056-410-881ศ 13.00-16.00 น.
- รพ.มโนรมย์รพช.02-725-9595ศุกร์ 08.30 - 16.00 น.
- รพ.วัดสิงห์รพช.056-461-344พุธ 13.00 - 16.00 น.
- รพ.สรรคบุรีรพช.056-481-016อังคาร 08.30 - 16.00 น.
- รพ.สรรพยารพช.056-499-769จันทร์ - ศุกร์ 08.30 - 12.00 น.
- รพ.หนองมะโมงรพช.056-466-993ศุกร์ 08.00 - 16.00 น.
- รพ.หันคารพช.056-451-880พฤหัสบดี 13.00 - 16.00 น.
อุทัยธานี
- รพ.ทัพทันรพช.056-540-026ศ 13.00-16.30 น.
- รพ.บ้านไร่รพช.056-539-000ศ 08.30-16.30 น.
- รพ.ลานสักรพช.056-537-086อ 13.00-16.30 น.
- รพ.สต.หูช้างรพ.สต.056-542-140จ. 08.30 - 16.30 น.
- รพ.สว่างอารมณ์รพช.056-599-000พฤ 13.30-16.00 น.
- รพ.หนองขาหย่างรพช.056-545-201ศ 13.00-16.30 น.
- รพ.หนองฉางรพช.056-531-141พ พฤ 08.30-15.30 น.
- รพ.ห้วยคตรพช.056-518-005อ 13.00-16.00 น.
- รพ.อุทัยธานีรพท056-511-081พ 13.00-16.30 น.
- สอน.นวมินทราชินีรพ.สต.056-989-083จ. 08.30 - 16.30 น.
นครสวรรค์
- รพ.เก้าเลี้ยวรพช.056-383-562พฤ 08.30-12.00 น.
- รพ.โกรกพระรพช.056-291-200ศ 13.00-16.00 น.
- รพ.ชุมแสงรพช.056-282-223อ 08.30-12.00 น.
- รพ.ตากฟ้ารพช.056-241-027จ 08.00-12.00 น.
- รพ.ตาคลีรพช.056-801-112อ 08.30-16.30 น.
- รพ.ท่าตะโกรพช.056-249-036อ 13.00-16.00 น.
- รพ.บรรพตพิสัยรพช.056-279-500จ-ศ 14.30-16.30 น.
- รพ.พยุหะคีรีรพช.056-341-755พฤหัสบดี ที่ 2 ของเดือน 13.00-16.30 น.
- รพ.ไพศาลีรพช.056-259-378พฤ ที่ 2 ของเดือน 13.00-16.30 น.
- รพ.แม่วงก์รพช.056-238-012จ 13.00-16.30 น.
- รพ.ลาดยาวรพช.056-385-011พ 13.00-16.30 น.
- รพ.สต.ศาลเจ้าไก่ต่อรพ.สต.
- รพ.สวรรค์ประชารักษ์รพศ056-219888 ต่อ 1870 056-219888 ต่อ 1166พุธ 08.30 - 16.00 น.
- รพ.หนองบัวรพช.056-876-224อ 13.00-16.30 น.
กำแพงเพชร
- รพ.กำแพงเพชรรพท055-022-000อังคาร และพฤหัสบดี 13.00 - 16.00 น.
- รพ.โกสัมพีนครรพช.055-714 -081พ 08.30-12.00 น.
- รพ.ขาณุวรลักษบุรีรพช.055-725-272จันทร์ - ศุกร์ 08.30 - 16.30 น.
- รพ.คลองขลุงรพช.055-781-006ศ 08.30-16.30 น.
- รพ.คลองลานรพช.055-786-262พฤ 08.30-12.00 น.
- รพ.ทรายทองวัฒนารพช.055-862-208จันทร์ - ศุกร์ 08.30 - 16.30 น.
- รพ.ทุ่งโพธิ์ทะเลรพช.055-714-098พฤหัสบดี 13.00 - 16.30 น.
- รพ.ไทรงามรพช.055-791-006ศ 08.30-16.30 น.
- รพ.บึงสามัคคีรพช.055-871-672พฤ 08.30-12.00 น.
- รพ.ปางศิลาทองรพช.055-741- 951พุธ 08.30 - 16.30 น.
- รพ.พรานกระต่ายรพช.055-775-678อ 13.00-16.30 น.
- รพ.ลานกระบือรพช.055-769-086อ 08.30-16.30 น.
- รพ.สต.เฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีรพ.สต.055 739 279รอยืนยัน
- รพ.สต.หนองกรดรพ.สต.055 746 153รอยืนยัน
อีกงานวิจัยจาก JAMA internal medicineปี ค.ศ. 2019 ทำการวิเคราะห์ผล 9 การศึกษาวิจัย จากคนรวมทั้งสิ้น 307,099 คน การรับประทานอาหารจากพืช สามารถลดความเสี่ยงการเกิดโรคเบาหวานชนิดที่ 2 ได้ 23 % และงานวิจัยจากวารสารInternational Journal of Medicine in Developing Countries ปี ค.ศ. 2020 ในคนจำนวน 69,213 คนจาก 5 การศึกษา พบว่า การรับประทานอาหารจากพืชช่วยชะลอการดูดซึมน้ำตาลเข้าสู่กระแสเลือด ช่วยลดระดับน้ำตาลเฉลี่ยสะสม (Hemoglobin A1C; HbA1C) และลดความเสี่ยงโรคเบาหวานประเภทที่ 2 ได้สูงถึง 57%
ลดความเสี่ยงโรคอ้วน ช่วยรักษาระดับน้ำหนักตัวให้เหมาะสม จากการลดปริมาณไขมันจากเนื้อสัตว์ และการรับประทานใยอาหารที่เพิ่มขึ้นทำให้รู้สึกอิ่มท้องยาวนาน มีการศึกษาในผู้สูงอายุ 9,633 คน ตีพิมพ์ในวารสาร Epidemiology ปี ค.ศ. 2019 โดยจัดทำเป็นคะแนนการบริโภคพืชผัก รายงานว่าผู้สูงอายุที่มีคะแนนการบริโภคพืชผักเพิ่มขึ้น ทุก 10 คะแนน จะมีรอบเอวลดลง 2 เซนติเมตร และมีไขมันลดลง 1.1 %
ลดความเสี่ยงการเกิดโรคมะเร็งบางชนิดการรับประทาน Plant-based diet สามารถลดการได้รับสารก่อมะเร็งที่เกิดจากการบริโภคเนื้อสัตว์แปรรูปและเนื้อแดง รวมทั้งพืชยังอุดมไปด้วยสารพฤกษเคมีที่ช่วยป้องกันการเกิดโรคมะเร็งได้
ในปี ค.ศ. 2018 รายงานจาก World Cancer Research Fund (WCRF) ร่วมกับ American Institute for Cancer Research (AICR) เป็นองค์กรที่ไม่แสวงหาผลกำไร ได้ติดตามการรับประทานอาหารในคนที่ไม่พบมะเร็งจำนวน 41,543 คน เป็นระยะเวลา 8 ปี พบว่าการรับประทานอาหารจากพืชเป็นหลัก โดยเลือกรับประทานธัญพืชไม่ขัดสี ถั่ว ผักและผลไม้ อย่างน้อย 400 กรัมต่อวัน ร่วมกับลดการรับประทาน น้ำตาล ไขมัน เนื้อแดง เนื้อสัตว์แปรรูป และจำกัดการดื่มแอลกอฮอล์ ช่วยลดความเสี่ยงการเกิดมะเร็งทุกชนิดลดลง 12% ทั้งมะเร็งลำไส้ มะเร็งเต้านม รวมถึงการลดการเกิด NCDs และโรคอ้วนที่เป็นสาเหตุของการเกิดมะเร็งอีกหลายชนิด
งานวิจัยในชาวแคนาดา ปี ค.ศ. 2015 ตีพิมพ์ลงในวารสาร Nutrition Journal เปรียบเทียบรูปแบบการรับประทานอาหารในคน 1,179 คน การรับประทานอาหารแบบ Plant-based diet ช่วยลดความเสี่ยงโรคมะเร็งลำไส้ใหญ่และทวารหนัก (Colorectal cancer) 45 %
วารสาร Scientific Reports ของ Nature ได้รายงานการวิจัย การเกิดมะเร็งเต้านม เปรียบเทียบระหว่างกลุ่มที่การรับประทานอาหารจากพืชผักที่ดีต่อสุขภาพ เช่น ธัญพืชไม่ขัดสี ผักผลไม้สด เป็นต้น กับกลุ่มที่รับประทานอาหารจากพืชผักเช่นกัน แต่มักเป็นอาหารกลุ่มที่ไม่ดีต่อสุขภาพ เช่น ข้าวแป้งที่ขัดสี น้ำผลไม้ และเครื่องดื่มที่มีน้ำตาลสูง ในผู้ที่รับประทานอาหารจากพืชผักที่ดีต่อสุขภาพชี้เห็นว่าสามารถช่วยลดความเสี่ยงของมะเร็งเต้านมได้ถึง 67 % เมื่อเทียบกับกลุ่มที่รับประทานอาหารจากพืชผักที่ไม่ดีต่อสุขภาพ
เพิ่มระดับสารต้านอนุมูลอิสระและลดการอักเสบในร่างกายสารพฤกษเคมีต่างๆในพืช มีฤทธิ์ยับยั้งกระบวนการเกิดสารอนุมูลอิสระ ช่วยชะลอความเสื่อมของเซลล์ และลดความเสี่ยงโรคไม่ติดต่อเรื้อรังต่างๆ (NCDs)
เสริมความแข็งแรงของแบคทีเรียในลำไส้ (probiotics) ช่วยเสริมสร้างระบบภูมิคุ้มกันให้แข็งแรงใยอาหารช่วยส่งเสริมการเจริญเติบโตของแบคทีเรียชนิดดีที่ทำหน้าที่ปกป้องทางเดินอาหารป้องกันสิ่งแปลกปลอมเข้าสู่ร่างกาย
ลดความเสี่ยงการเกิดโรคไต เพราะการรับประทานโปรตีนจากสัตว์มีความสัมพันธ์กับการทำงานของไตที่ลดลงและการเกิดโรคนิ่วในไต
การศึกษารูปแบบการรับประทานอาหารในผู้หญิง 3,121 คน ในปี ค.ศ.2012 ตีพิมพ์ลงในวารสาร American Journal of Kidney Diseases พบว่า กลุ่มที่รับประทานอาหารที่มีเนื้อสัตว์แปรรูป เนื้อแดง ข้าวแป้งขัดสี และของหวานในปริมาณมาก มีความเสี่ยงต่อการขับโปรตีนอัลบูมินออกมาในปัสสาวะ (Microalbuminuria) สูงกว่าถึง 2.17 เท่าเมื่อเทียบกับกลุ่มที่ไม่ค่อยรับประทานประเภทนี้ ซึ่งแสดงให้เห็นถึงการทำงานของไตที่เสื่อมถอยลง ต่อมาในปี ค.ศ. 2015 วารสาร Journal of Nephrology ตีพิมพ์การศึกษาเกี่ยวกับความสัมพันธ์ระหว่างสารอาหารหลัก กับโรคไตเรื้อรัง (อัตราการกรองของไต 60 มิลลิลิตรต่อนาทีต่อ 1.73 ตารารางเมตร) พบว่า การรับประทานโปรตีนจากพืชในปริมาณสูง ช่วยลดความเสี่ยงโรคไตเรื้อรังได้ 30% ในทางกลับกันถ้าบริโภคโปรตีนจากเนื้อสัตว์มากกว่าโปรตีนจากพืช ประมาณ 2 เท่า จะเพิ่มความเสี่ยงถึง 28 %
การศึกษาในผู้ป่วยโรคเบาหวานชนิดที่ 2 จำนวน 420 คน ที่ตีพิมพ์ในวารสาร Kidney International Reports ปี ค.ศ. 2019 พบว่า ผู้ที่รับประทานโปรตีนจากพืชในปริมาณสูงสามารถลดความเสี่ยงภาวะแทรกซ้อนทางไตได้ถึง 53 % ในขณะที่ผู้รับประทานโปรตีนจากสัตว์ในปริมาณสูง จะเพิ่มความเสี่ยงมากขึ้นอีก 6 %
จากงานวิจัยมากมายแสดงให้เห็นถึงประโยชน์ของการรับประทาน Plant-based diet ต่อสุขภาพ และเพื่อให้ได้รับสารอาหาร และกรดอะมิโนจำเป็นครบทุกชนิด ผู้ที่รับประทาน Plant-based diet ควรรับประทานโปรตีนจากพืชให้หลากหลายชนิด“เช่น กินข้าวคู่กับถั่ว เพราะข้าวมีกรดอะมิโนไลซีนน้อย การกินถั่วซึ่งมีไลซีนสูงก็ช่วยเสริมกันได้ และในทางตรงกันข้าม ถั่วที่มีเมไทโอนีนน้อย การกินข้าวที่มีเมไทโอนีนสูงกว่าก็ช่วยให้ได้กรดอะมิโนจำเป็นครบถ้วน” คุณหมอแอมป์ยกตัวอย่างให้เข้าใจง่าย
ดังนั้นควรเลือกรับประทาน ถั่วเมล็ดแห้ง ถั่วเปลือกแข็ง เมล็ดพืชต่างๆ เต้าหู้ ข้าวกล้อง ธัญพืช เห็ดต่างๆและผักหลากชนิด เป็นต้น
นอกจากนี้ ผู้ที่รับประทานอาหารแบบ Plant-based diet มีความเสี่ยงในการขาดวิตามินบี 12 เนื่องจากวิตามินบี 12 พบมากในเนื้อสัตว์ ไข่และผลิตภัณฑ์จากนม จึงควรเพิ่มการรับประทานวิตามินบี 12 ที่มาจากแหล่งของพืช เช่น เทมเป้ สาหร่ายทะเล หรืออาหารที่มีการเติมวิตามินบี 12 เช่น นมจากพืช ซีเรียลอาหารเช้าเป็นต้น
ทั้งนี้ทั้งนั้นต้องระวังการปนเปื้อนจากสารพิษและยาฆ่าแมลง กระทรวงสาธารณสุข ได้แนะนำวิธีการลดสารพิษตกค้างในผักผลไม้สด
โซเดียมไบคาร์บอเนต (เบกกิ้งโซดา) โดยใช้ 1 ช้อนโต๊ะ ผสมน้ำอุ่นหรือน้ำธรรมดา 1 กะละมัง (20 ลิตร) แช่นาน 15 นาที แล้วล้างออกด้วยน้ำสะอาด ซึ่งจะช่วยลดสารพิษตกค้างได้ถึง 80-95 %
ล้างด้วยน้ำไหลผ่าน เด็ดผักออกเป็นใบ จากนั้นเปิดน้ำไหลแรงพอประมาณ ให้น้ำไหลผ่าน โดยวิธีนี้จะช่วยลดสารพิษตกค้างได้ 54-63 %
ลอกหรือปอกเปลือกชั้นนอก ของผักออกทิ้ง เด็ดผักเป็นใบ แช่น้ำสะอาดนาน 5-10 นาที จะช่วยลดสารพิษตกค้างได้ 27-72 %
น้ำส้มสายชู โดยใช้น้ำส้มสายชู 5% 1 ช้อนโต๊ะ ผสมน้ำ 4 ลิตร แช่นาน 10 นาที แล้วล้างออกด้วยน้ำสะอาด จะช่วยลดสารพิษตกค้างได้ 29-38 %
อย่างไรก็ตาม การจะลดปริมาณสารพิษได้มากหรือน้อย ขึ้นอยู่กับชนิดและประเภทของผักด้วย
คลินิกสุขภาพหัวใจและหลอดเลือด
คลินิกที่ให้บริการตรวจหัวใจและหลอดเลือดแบบครบชุด เพื่อออกแบบระบบดูแลสุขภาพหัวใจเชิงรุกให้กับเหมาะสมแต่ละบุคคล
กรมการแพทย์ เผย ประโยชน์จากกัญชาทางการแพทย์
กรมการแพทย์ เผย ประโยชน์จากกัญชาทางการแพทย์
1.ภาวะคลื่นไส้อาเจียนจากเคมีบำบัด
2.โรคลมชักที่รักษายากในเด็กและโรคลมชักที่ดื้อต่อยารักษา
3.ภาวะกล้ามเนื้อหดเกร็งในผู้ป่วยโรคปลอกประสาทเสื่อมแข็ง
4.ภาวะปวดประสาทส่วนกลาง
5.ภาวะเบื่ออาหารในผู้ป่วยเอดส์ที่มีน้ำหนักตัวน้อย
6.การเพิ่มคุณภาพชีวิตในผู้ป่วยที่ได้รับการดูแลแบบประดับประคอง
ซึ่งสารสกัดกัญชา ได้ประโยชน์ในการรักษา ที่มีข้อมูลวิชาการสนับสนุนชัดเจน และไม่แนะนำให้ใช้สารสกัดกัญชา เป็นการรักษาเริ่มต้นในทุกกรณี
การนำสารสกัดกัญชามาใช้ในทางการแพทย์
จำเป็นต้องคำนึงถึงประสิทธิผลและความปลอดภัยเป็นสำคัญ เพื่อให้ผู้ป่วยได้รับประโยชน์สูงสุด
ที่มา : คำแนะนำการใช้กัญชาทางการแพทย์ ฉบับปรับปรุง ครั้งที่ 4
หลักสูตรอัลตราซาวด์ทางการแพทย์ - ผศ.นพ.สุรเชษฎ์ สิริพงษ์สกุล
ผู้ช่วยศาสตราจารย์ นายแพทย์สุรเชษฎ์ สิริพงษ์สกุล ผู้อำนวยการโรงเรียนนักอัลตราซาวด์ทางการแพทย์ บรรยายถึงการจัดทำหลักสูตรโดยความร่วมมือในการจัดทำหลักสูตรอัลตราซาวด์ทางการแพทย์ ระหว่างวิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ และ Monash University ประเทศออสเตรเลีย เพื่อให้เป็นหลักสูตรต้นแบบมุ่งผลิตนักอัลตราซาวด์ที่มีความรู้ ความเชี่ยวชาญ และมีประสิทธิภาพ เพื่อเข้ามาเป็นส่วนร่วมในการเสริมการบริการและวิชาการ ทางด้านอัลตราซาวด์ทางการแพทย์ของประเทศ โดยหลักสูตรมีวัตถุประสงค์เพื่อส่งเสริมให้นักรังสีเทคนิค แพทย์ พยาบาล และผู้ที่เกี่ยวข้องทางด้านอัลตราซาวด์ทางการแพทย์สามารถเรียนรู้ตลอดชีวิตได้ในทุกที่ ทุกเวลาทุกโอกาส ทั้งยังส่งเสริมการศึกษานอกระบบและการศึกษาตามอัธยาศัยให้สามารถเข้าสู่การศึกษาในระบบมากยิ่งขึ้น ทั้งนี้ในกิจกรรมการเยี่ยมชมมีการทำอัลตราซาวด์แสดงให้เห็นถึงการตรวจในแต่ละส่วนของร่างกายที่มากกว่าแค่การตรวจอัลตราซาวด์ภายในช่องท้อง หรือการอัลตราซาวด์ทางสูติศาสตร์ นอกจากนี้หลักสูตรฯ ยังส่งเสริมให้ผู้เรียนมีทักษะการถ่ายทอดความรู้ให้แก่ผู้อื่น สอดคล้องกับปรัชญาของคณะฯในการ “สร้างครูผู้สร้าง”
ขณะนี้กำลังอยู่ในระหว่างการก่อสร้าง โดยโครงการตั้งอยู่บนเนื้อที่ประมาณ 12 ไร่ ประกอบด้วยอาคารขนาด 4 ชั้น จำนวน 4 อาคาร สามารถรองรับผู้ป่วยได้มากกว่า 200 เตียง เพื่อเป็นศูนย์กลางในการรักษาโรคเฉพาะทางในเขต 17 จังหวัดภาคเหนือ อนุภูมิภาคลุ่มน้ำโขงและนานาชาติ ส่งเสริมการท่องเที่ยวของจังหวัดเชียงใหม่ในการบริการสุขภาพทางเลือกใหม่ และมุ่งเป็นศูนย์เรียนรู้และพัฒนาทักษะของบุคลากรทางการแพทย์
การจัดตั้ง “ศูนย์ส่งเสริมพฤฒผู้สูงอายุ” และ “ศูนย์บริการทางการแพทย์ หริภุญไชย” ขึ้นนี้ มหาวิทยาลัยเชียงใหม่เชื่อมั่นในการให้บริการทางการแพทย์ที่เปี่ยมไปด้วยคุณภาพ โดยเน้นประชาชนเป็นศูนย์กลาง และตอบโจทย์ความต้องการของสังคม เพื่อบรรลุถึงวิสัยทัศน์ในการเป็นมหาวิทยาลัยชั้นนำที่รับผิดชอบต่อสังคม และพัฒนาสู่ความเป็นเลิศที่ยั่งยืนในอนาคต
ข้อมูลจาก
เพจ CMU Officialสวนลุมพินี เนื้อที่ 360 ไร่
สวนลุมพินี เนื้อที่ 360 ไร่ เป็นสวนสาธารณะแห่งแรกของกรุงเทพ กำเนิดจากพระราชดำริของในหลวงรัชกาลที่ 6 เมื่อปี 2468 ทรงพระราชทานที่ดินบริเวณทุ่งศาลาแดงถัดจากพื้นที่ของจุฬาลงกรณ์มหาวิทยาลัยออกไป เพื่อจัดงาน สยามรัฐพิพิธภัณฑ์ เมื่อแรกเริ่ม และจัดทำเป็นสวนพฤษชาติต่อเพื่อให้ประชาชนได้ใช้พื้นที่ พักผ่อน ในระยะต่อมา ปัจจุบันอยู่ในการดูแลของกรุงเทพมหานคร เปิดให้บริการทุกวัน เวลา 04.30 – 21.00 น.
สวนป่าเบญจกิติ (สวนเบญจกิติ) เนื้อที่ 300 ไร่
สวนเบญจกิติ เนื้อที่ 300 ไร่ ตั้งอยู่ที่ ถนนรัชดาภิเษก เขตคลองเตย จัดเป็นสวนสาธารณะระดับย่าน แรกเริ่มเกิดจากพัฒนาพื้นที่โดยรอบบึงยาสูบเดิม ชื่อสวนเบญจกิติได้รับพระราชทานจากสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง เสด็จฯ มาทรงทำพิธีเปิดเมื่อวันที่ 9 ธันวาคม พ.ศ. 2547 ปัจจุบันกรุงเทพมหานครได้ปรับปรุงให้กลายเป็น "สวนป่าเบญจกิติ" เป็นสวนป่ากลางเมืองแห่งแรกและแห่งเดียว เพิ่มเฉลิมวโรกาสครบ 7 รอบสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ (เมื่อปี 2559) มีกำหนดเปิดอย่างเป็นทางการในวันที่ 12 สิงหาคม 2565
[ภาพ Supanut Arunoprayote
Wikipedia ]
โฮมสเตย์บ้านตม อ.พนัสนิคม จ.ชลบุรี
โฮมสเตย์บ้านตม ชลบุรี เป็นการรวมกลุ่มของคนในชุมชนบ้านตม ผลิตภัณฑ์สมุนไพร แชมพู อาหารที่มีความเฉพาะตัวของที่นี่ เครื่องจักสานที่เป็นงานฝีมือ เอกลักษณ์ของ อ.พนัสนิคม จ.ชลบุรี โฮมสเตย์ บ้านตม มีบริการจำนวน 10 หลัง แต่ละหลังมีการเตรียมพร้อม ปรับภูมิทัศน์บริเวณบ้าน ทำความสะอาดและจัดระเบียบ เป็นไปตามหลักเกณฑ์ทำให้ ได้รับการสนับสนุนจาก ธนาคารออมสิน สาขาภาค 15 ชลบุรี ในการขับเคลื่อนกิจกรรมนี้เป็นอย่างดี
ที่อยู่ บ้านตม ต.สระสี่เหลี่ยม อ.พนัสนิคม จ.ชลบุรี
โทร.089 120 5897
แล้วคนไทยจะปรับตัวอย่างไรในสภาวะข้าวยากหมากแพงเช่นนี้ จากผลสำรวจพบว่าคนไทยได้มีการวางแผนในการรับมือกับค่าครองชีพที่สูงขึ้น โดย 67% ตั้งใจจะงด หรือลดค่าใช้จ่ายสำหรับสินค้า หรือบริการที่ไม่มีความจำเป็น, 50% จะปรับพฤติกรรมในการบริโภค/อุปโภค เช่น ลดการรับประทานอาหารที่มีราคาแพง, ลดการใช้ของต่างๆ ให้น้อยลง, 43% พยายามซื้อสินค้าหรือบริการที่ให้ข้อเสนอที่ดีที่สุด เช่น คูปอง, แสตมป์, ส่วนลด เป็นต้น
โอกาสของแบรนด์ในการทำ Emotional Marketing และวิถี NOW NORMAL - ธัชชัย กลีบบัว
เพื่อให้แบรนด์สามารถทำการตลาดได้สอดคล้องกับสถานการณ์ช่วงหน้าฝนนี้ คุณ ธัชชัย กลีบบัว ตำแหน่ง ผู้จัดการฝ่ายวางแผนกลยุทธ์ บริษัท สปา-ฮาคูโฮโด ได้ให้คำแนะนำว่า
1. แบรนด์ควรใช้โอกาสนี้ในการสนับสนุนให้ “พ่อแม่ได้ใช้เวลาของตัวเองมากขึ้น” ช่วงที่ลูกอยู่โรงเรียน หลังจากที่ต้องดูแลลูกและทำงานที่บ้านมาเป็นระยะเวลาที่นานกว่า 2 ปี ทำให้มีความเครียด ความเหนื่อยล้า สะสมมากยิ่งขึ้น แต่ในตอนนี้โรงเรียนเริ่มกลับมาเปิดเทอม on site 100% แล้ว ทำให้เด็ก ๆ ได้กลับไปเรียนที่โรงเรียนตามปกติ ซึ่งถือเป็นโอกาสที่ดีที่พ่อแม่ผู้ปกครองหลาย ๆ ท่าน จะได้กลับมามีเวลาพักผ่อนมากยิ่งขึ้น ดังนั้นแบรนด์ต่าง ๆ ควรมองเห็นถึงโอกาสในการทำ Emotional Maketing ในการสร้างแคมเปญ Happy To School โดยใช้ Key Message พ่วงกับโปรโมชั่นต่าง ๆ เพื่อที่จะกระตุ้นให้พ่อแม่ผู้ปกครองหันมาซื้อของ ซื้อความสุขให้กับตัวเองมากยิ่งขึ้น
“ตอนนี้โรงเรียนได้กลับมาเปิดให้เรียนที่โรงเรียนครั้งหลังจากหายไปนานกว่า 2 ปี ซึ่งการเปิดเทอมนี้ก้เป็นหนึ่งในผลดีสำหรับพ่อแม่ผู้ปกครอง ที่จะได้มีเวลาให้กับตนเองมากยิ่งขึ้นสามารถจัดสรรเวลาให้ตนเองและครอบครัวได้อย่างลงตัว ซึ่งในยุค Now Normal นี้ ถือว่าเป็นโอกาสที่ดี ที่จะทำให้ครอบครัวกลับมาสานสัมพันธ์กันได้อย่างดีมากยิ่งขึ้น โดยที่ไม่ทิ้งความสุขของตัวเอง แต่กลับมีมากขึ้นในทางกลับกัน” คุณเรืองริน กล่าวเสริม
2. เป็นแรงขับเคลื่อนสังคมไทยให้ใช้ชีวิต “NOW NORMAL” เร็วที่สุด จากที่ผ่านมาตลอดระยะเวลา 2 ปีเต็ม กับการระบาดของโควิด-19 คนไทยยังมีความรู้สึกไม่มั่นคงกับเรื่องของอนาคต แบรนด์ควรสร้างกระแสให้คนไทยมีความสุขและมีพลังใจในการกลับมาใช้ชีวิตตามปกติอีกครั้ง ด้วยการเชิญชวนคนไทยมาร่วมสร้าง Soft Power ใหม่ ๆ เพื่อเป็นการสร้างสีสันและจุดกระแสให้เกิดการฟื้นตัวทางเศรษฐกิจ โดยสามารถหาแง่มุมในการทำแคมเปญที่มีจุดเชื่อมโยงทางเอกลักษณ์หรือความภาคภูมิใจของไทย ไม่ว่าจะเป็นด้านอาหาร วิถีชีวิต การแต่งตัว หรือด้านอื่น ๆ เช่น การปลุกกระแสการไหว้แบบไทย หรือการปลุกกระแสอาหารไทย เพื่อดึงดูดความสนใจของนักท่องเที่ยวชาวต่างชาติ
“โดยสถานการณ์ในปัจจุบัน ถือว่าเป็นสัญญาณที่ดีขึ้นที่คนไทยกำลังจะกลับมาใช้ชีวิตได้แบบปกติอีกครั้ง เริ่มมีแนวโน้มในการต้องการออกมาจับจ่ายใช้สอยในสิ่งที่ต้องการมากขึ้น จากผลการสำรวจสามารถมองเห็นได้ว่า คนไทยกำลังจะกลับมามีความสุขมากขึ้นอีกครั้งในรอบ 2 ปี หลังจากที่เผชิญกับการระบาดของโควิด-19 ถึงแม้ตอนนี้จะเป็นเปอร์เซ็นต์ความสุขที่ยังน้อย แต่ในอนาคตจะสูงขึ้นแบบต่อเนื่องอย่างแน่นอน” คุณชุติมา วิริยะมหากุล กล่าวปิดท้าย
วิสาหกิจชุมชนบ้านทุ่งแพม สั่งจองต้นพันธ์ุสายพันธุ์ไทย ต้นอ่อน 50-150 บาท LINK
วิสาหกิจชุมชนกลุ่มปลูกและแปรรูปบุก เกษตรอินทรีย์บ้านทุ่งแพม จ.แม่ฮ่องสอน (ใบอนุญาตปลูกเลขที่ 5/2563) เปิดจองสั่งซื้อ ต้นกล้ากัญชาเพศเมีย สายพันธุ์ไทย คือ สายพันธุ์หางกระรอกอีสาน พันธุ์หางกระรอกก้านแดง เป็นต้นอ่อนจากการเพาะเมล็ดพันธุ์นิรโทษกรรมที่ถูกต้องตามกฏหมาย
ราคา อายุต้นอ่อน 2 สัปดาห์ ราคา 50 บาท
ราคา อายุต้นอ่อน 4 สัปดาห์ 150 บาท
จุดเด่น
สายพันธุ์ THC เด่น
มาตรฐานผลิต GAP
วัสดุปลูกอินทรีย์ไร้สารตกค้าง
สอบถามโทร. 065-2913168
ปัจจุบันด้วยกระแสการสร้างความรับรู้เรื่องเวชศาสตร์ป้องกัน (Preventive medicine) ที่กว้างขวางขึ้น ประกอบกับความก้าวหน้าทางนวัตกรรมและเทคโนโลยีทางการแพทย์ สนับสนุนให้มีการตรวจวัดปริมาณและความสามารถของ NK Cell เพื่อประเมินความแข็งแกร่งในการทำหน้าที่เป็นด่านหน้าในการปกป้องสิ่งแปลกปลอมที่จะเข้ามาในร่างกาย เพราะเมื่อใดที่ NK Cell น้อยลงหรืออ่อนแอ ย่อมเสี่ยงต่อการเจ็บป่วย
3. LAAB ใช้อย่างไร
สำหรับการใช้งาน LAAB เป็นยาฉีดเข้ากล้ามเนื้อบริเวณสะโพกทั้ง 2 ข้าง ข้างละ 150 มิลลิกรัม โดยมีผลวิจัยสนับสนุนว่าการฉีดยาครั้งเดียวสามารถให้การป้องกันการติดเชื้อไวรัสก่อโรคโควิด-19 ได้อย่างน้อย
6 เดือน
โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ
โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ บรรยายถึงภาพรวมของหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ ซึ่งเป็นหลักสูตรใหม่แห่งแรกของประเทศไทย ใช้เวลาศึกษา 4 ปี ทั้งภาคทฤษฎีและปฏิบัติ
ในภาคทฤษฎีประกอบด้วยวิชาหลักที่เกี่ยวข้องกับการเคลื่อนไหว เช่น กายวิภาคศาสตร์ ชีวกลศาสตร์ สรีรวิทยาการออกกำลังกาย จิตวิทยา โภชนาการ เป็นต้น
ในส่วนการฝึกภาคปฏิบัติจะเริ่มฝึกประสบการณ์ในการทำงานจริงตั้งแต่ชั้นปีที่ 3 ซึ่งต้องฝึกงานทั้งในโรงพยาบาลจุฬาภรณ์ สถานออกกำลังกายทั้งภายในโรงพยาบาลจุฬาภรณ์ และภายนอก เช่น หน่วยงานภาครัฐและเอกชน สโมสรกีฬา ทั้งเพื่อสุขภาพ และเพื่อนักกีฬาชั้นเลิศ และทีมกีฬาอาชีพ เช่น ทีมฟุตบอล วอลเลย์บอล เป็นต้น
นอกจากนี้นักศึกษาต้องมีงานวิจัยเพื่อสร้างนวัตกรรมและปฏิบัติงานจิตอาสาเพื่อชุมชนในระหว่างการศึกษาอีกด้วย ทั้งนี้ยังมีเทคโนโลยีใหม่ๆ อาทิ ห้องชีวกลศาสตร์ เพื่อการทดสอบการวิเคราะห์ท่าทางการเคลื่อนไหวแบบ 3 มิติ (3D-Dimension Movement Analysis) เป็นการวิเคราะห์ท่าทางโดยมีการติดเครื่องหมายสะท้อนแสงที่ปุ่มกระดูกหรือข้อต่อ และใช้กล้องบันทึกภาพการเคลื่อนไหว จากนั้นใช้โปรแกรมเฉพาะเพื่อวิเคราะห์ตัวแปรทางคิเนเมติกส์และคิเนติกส์ของการเคลื่อนไหว เช่น มุมองศาของข้อต่อ ความเร็วเชิงเส้น เชิงมุมของข้อต่อ และแรงปฏิกิริยาในแนวดิ่งจากพื้น เป็นต้น เพื่อประเมินและวางแผนในพัฒนาการฝึกซ้อมของนักกีฬาให้มีพัฒนาการที่ดีมากยิ่งขึ้น
สถานกงสุลใหญ่ ณ นครซิดนีย์ ขอแจ้งเตือนคนไทย LINK
สถานกงสุลใหญ่ ณ นครซิดนีย์ ขอแจ้งเตือนคนไทย
- ห้ามนำเข้า กัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของพืชชนิดดังกล่าวเข้ามาในประเทศออสเตรเลีย
- กัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของพืชชนิดดังกล่าวเป็นสิ่งต้องห้ามภายใต้กฎหมาย NSW และจัดเป็นสารเสพติด
ฉะนั้น การนำเข้ามาในประเทศโดยมิชอบด้วยกฎหมายของ NSW ถือเป็นความผิด มีโทษสูงสุดถึงจำคุกตลอดชีวิต อย่างไรก็ตาม การนำยารักษาโรคที่มีส่วนประกอบของกัญชาเข้ามานั้นจะขึ้นกับดุลยพินิจของเจ้าหน้าที่ ทั้งนี้ ขอให้ท่านพกใบสั่งยา หรือจดหมายจากแพทย์ติดตัวมาด้วย
ดูข้อมูลเพิ่มเติมได้ที่
Importing and Exporting Drugs or Precursorsอินทัชเมดิแคร์คลินิกเวชกรรม สาขาเจริญกรุง
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาเจริญกรุง
ที่อยู่ : 985, 987 ถนนเจริญกรุง แขวงมหาพฤฒาราม เขตบางรัก กรุงเทพฯ 10500
[
แผนที่]
เวลาเปิดทำการ
วันจันทร์ - ศุกร์ 08.00 - 19.00 น.
วันเสาร์ - อาทิตย์ 09.00 - 16.00 น.
แพทย์ประจำ สาขาเจริญกรุง
1. แพทย์หญิงเรณุกา ไหมสุทธิสกุล
แพทยศาสตรบัณฑิต คณะแพทย์ศาสตร์ มหาวิทยาลัยขอนแก่น แพทย์เวชปฏิบัติทั่วไป
ตารางออกตรวจ
วันจันทร์ - ศุกร์ เวลา 08.00 - 19.00 น.
คลินิกเวชกรรม สวท ดินแดง กทม. LINK
คลินิกเวชกรรม สวท ดินแดง
เลขที่ 2/11-13 อาคารพาณิชย์ 1 ถนนประชาสงเคราะห์ ดินแดง กรุงเทพฯ 10400
เปิดทำการ : จันทร์.-ศุกร์ เวลา 09.00-17.00 น.
ปิดทำการ : วันเสาร์, อาทิตย์ และวันหยุดนักขัตฤกษ์
064-6190965
0-2245-1888
0-2245-7384
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 6 สโมสรวัฒนธรรมหญิง LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 6 สโมสรวัฒนธรรมหญิง
ให้บริการวันพุธ 13-16 น. (เว้นวันหยุดนักขัตฤกษ์)
สอบถามโทร 0 2282 8493
บริการอื่นๆ สำหรับสตรี
- คลินิกฝากครรภ์ครั้งแรก จันทร์ 13-16 น.
- คลินิกสุขภาพเด็กดี อังคาร,พุธ,พฤหัสบดี 13-16 น.
- คลินิกครอบครัวอบอุ่น ส่งเสริมพัฒนาการเด็กล่าช้า พุธ 8-12 น.
- คลินิกสูตินรีเวช (ตรวจรักษาฝากครรภ์ต่อเนื่อง) ตรวจคัดกรองมะเร็งเต้านม มะเร็งปากมดลูก พุธ 13-16 น.
- คลินิกครอบครัวอบอุ่น พฤหัสบดี 8-12 น.
ศูนย์บริการสาธารณสุข 6 ตั้งอยู่ที่ สี่แยกมหานาค ดุสิต. 426 ถนนพิษณุโลก แขวงสี่แยกมหานาค เขตดุสิต กรุงเทพมหานคร 10300
คลินิกวัคซีนพิษสุนัขบ้า ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง
คลินิกวัคซีนพิษสุนัขบ้า ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง
ให้บริการวันจันทร์ และวันพุธ 13-16 น. (เว้นวันหยุดนักขัตฤกษ์)
โทรศัพท์ 02-9107314
ที่อยู่ศูนย์ : วงศ์สว่าง 27 (ซอยสายลม) แขวงวงศ์สว่าง เขตบางซื่อ กรุงเทพมหานคร 10800
17 มิถุนายน 65 ร้านอาหารญี่ปุ่น ดารุมะ ซูชิ ประกาศปิดร้านและเลิกจ้างพนักงาน LINK
ประกันสังคม ให้ความช่วยเหลือลูกจ้างดารุมะ ซูชิ ที่ถูกเลิกจ้าง
จากการตรวจสอบ ร้านดารุมะ ซูชิ ได้จดทะเบียนในนามบริษัท ดารุมะ ซูชิ จำกัด มีสำนักงานใหญ่ตั้งอยู่ที่เลขที่ 87 โครงการ เดอะ แจส รามอินทรา ชั้นที่ 2 ห้องเอ 217 ถนนลาดปลาเค้า แขวงอนุสาวรีย์ เขตบางเขน กรุงเทพมหานคร ประกอบกิจการ ร้านอาหารญี่ปุ่น มีนายเมธา ชลิงสุข เป็นกรรมการ มีลูกจ้าง 71 คน ได้เปิดให้บริการอยู่ในกรุงเทพมหานคร และจังหวัดใกล้เคียงรวมทั้งสิ้นจำนวน 27 สาขา
และเมื่อวันที่ 17 มิถุนายนที่ผ่านมา ผู้จัดการสาขาได้ประกาศปิดร้านและเลิกจ้างพนักงาน
วันที่ 20 มิถุนายน 2565 พนักงานตรวจแรงงาน สำนักงานสวัสดิการและคุ้มครองแรงงานกรุงเทพมหานครพื้นที่ 9 ได้ไปที่สำนักงานใหญ่แต่ไม่พบบุคคลใดจึงปิดหนังสือเชิญนายจ้างมาพบเพื่อให้ข้อเท็จจริงในวันที่ 27 มิถุนายน 2565
การช่วยเหลือด้านประกันสังคม สำนักงานใหญ่เป็นผู้ขึ้นทะเบียนผู้ประกันตนให้แก่ลูกจ้างทั้งของสำนักงานใหญ่มี 8 คน และของสาขา 63 คน เบื้องตันมีการขึ้นทะเบียนผู้ประกันตนรวม 71 คน ลูกจ้างที่ขึ้นทะเบียนผู้ประกันตนแล้ว 71 คน เมื่อถูกเลิกจ้างจะมีสิทธิได้รับเงินทดแทนการขาดรายได้กรณีว่างงาน 50 เปอร์เซ็นต์ของค่าจ้างเป็นระยะเวลาไม่เกิน 180 วัน หากมีลูกจ้างที่สำนักงานใหญ่ยังไม่ขึ้นทะเบียนผู้ประกันตน สำนักงานประกันสังคมจะดำเนินการให้นายจ้างยื่นขึ้นทะเบียนผู้ประกันตน และให้นำส่งเงินสมทบเพื่อให้ลูกจ้างได้รับการคุ้มครองตามกฎหมายประกันสังคม ซึ่งหากมีหลักฐานว่ามีการจ้างงาน มีนิติสัมพันธ์นายจ้าง ลูกจ้างกันจริง เช่น สลิปเงินเดือน หลักฐานการลงเวลาเข้างาน หรือหลักฐานอื่นๆ ก็ถือว่าลูกจ้างเป็นผู้ประกันตน มีสิทธิรับประโยชน์ทดแทนกรณีเลิกจ้าง หากมีหลักฐานว่าทำงานเกิน 6 เดือน ลูกจ้างก็สามารถเบิกเงินกรณีว่างงานได้ ส่วนลูกจ้างที่ไม่ได้ขึ้นทะเบียนและไม่ได้นำส่งเงินสมทบสำนักงานประกันสังคมจะไปติดตามนายจ้างและดำเนินการตามกฎหมาย
คุณอัญพัชร์ ปิยะสถิตโชติ ผู้จัดการทั่วไปร้านดารุมะ ซูชิ ที่ได้นำพนักงานทั้งหมด 50 คน มายื่นขอรับเงินประกันการว่างงาน กล่าวว่า ตนและพนักงานทั้งหมดที่มาในวันนี้ขอขอบคุณ ท่านนายกรัฐมนตรี ท่านรัฐมนตรีแรงงาน ที่ได้ใส่ใจในความเดือดร้อนของพนักงานทุกคน พวกเราทุกคนจะไม่ลืมบุญคุณในครั้งนี้
7 ขั้นตอน ตรวจ HIV ฟรี ปีละ 2 ครั้ง LINK
7 ขั้นตอน ตรวจ HIV ฟรี ปีละ 2 ครั้ง
หากคิดว่าเป็นกลุ่มเสี่ยง หรือมีความเสี่ยง และยังไม่เคยตรวจเลย แนะนำว่าควรตรวจนะจ๊ะ "HIV ตรวจเร็ว รู้ก่อน ก้าวต่อได้" การตรวจทำได้ 2 วิธี 1) ไปตรวจที่โรงพยาบาลที่ให้บริการภายใต้หลักประกันสุขภาพแห่งชาติ (บัตรทอง) ได้เลย หรือ 2) ตรวจการติดเชื้อเอชไอวีด้วยตนเอง ด้วยชุด HIV self-test มี 2 ชนิด คือ ชุดตรวจจากการเจาะเลือดที่ปลายนิ้วมือ รู้ผลภายใน 1 นาที และชุดตรวจโดยใช้สารน้ำในช่องปาก รู้ผลภายใน 20 นาที หาซื้อได้ที่ร้านขายยาทั่วไป แต่ยังไม่ครอบคลุมทั่วประเทศ (บางแห่งอาจไม่มี)
สำหรับการจะไปตรวจที่โรงพยาบาล ต้องเตรียมตัว 7 ขั้นตอน ดังนี้
1. เตรียมบัตรประชาชนให้พร้อม พร้อมด้วยหน้ากากอนามัย และเจลล้างมือ
2. ยื่นบัตร ณ โรงพยาบาล
3. ทำบัตรเวชระเบียน
4. รับคำปรึกษาก่อนตรวจเลือด
5. เจาะเลือด
6. รอฟังผล
7. รับคำปรึกษาหลังการตรวจ
ง่ายๆ แค่ได้ตรวจ ก็สบายใจ ไม่ต้องกังวลอีกต่อไป จำไว้เลย ตรวจเร็ว รู้ก่อน ไปต่อได้ ชัวร์
ปัจจุบัน การรักษาภาวะนอนกรนหยุดหายใจขณะหลับ มากกว่า 95% แพทย์ทั่วโลกนิยมรักษาด้วยเครื่องอัดอากาศแรงดันบวกเพื่อขยายช่องทางเดินหายใจ ซีแพพ (Continuous Positive Airway Pressure: CPAP) ซึ่งทางการแพทย์ถือว่าเป็นวิธีที่มีประสิทธิภาพมากที่สุด ด้วยหลักการปล่อยให้แรงดันอากาศเปิดช่องคอที่แฟบให้เปิดขยาย ทำให้ไม่เกิดการอุดกั้นเวลาหายใจขณะที่นอนหลับ โดยไม่ต้องผ่าตัด
วิธีนี้สามารถรักษาภาวะนอนกรน และภาวะนอนกรนหยุดหายใจขณะหลับได้ทุกระดับอาการ โดยข้อดีคือ ผู้ป่วยไม่นอนกรน ไม่หยุดหายใจขณะหลับ ส่งผลให้วงจรการนอนกลับมาเป็นปกติ โดยหลังการรักษาแล้ว ผู้ป่วยจะมีคุณภาพการนอนที่ดีขึ้น นอนได้เต็มอิ่ม ตื่นมารู้สึกสดชื่น อารมณ์ดี มีสมาธิดีขึ้น ความจำดีขึ้น อีกทั้งยังช่วยให้โรคต่างๆ ที่เคยเป็นมีอาการที่ดีขึ้นตามไปด้วย เช่น โรคความดันโลหิตสูง โรคเบาหวาน เพราะการคุมเบาหวานจะดีขึ้น น้ำหนักลดลงโดยอัตโนมัติ เพราะการนอนที่ดีจะช่วยให้ร่างกายมีการเผาผลาญที่ดี และระบบของร่างกายจะมีความสมดุลมากขึ้น ที่สำคัญ การรักษาด้วยวิธี CPAP ยังเป็นการป้องกันโรคที่ยังไม่เกิดขึ้นได้อีกด้วย เช่น โรคหัวใจ โรคหลอดเลือดสมอง เป็นต้น
รายชื่อร้านยาในภาคตะวันออก
วิสาหกิจเพ็ชรลานนา เป็นวิสาหกิจชุมชนรุ่นแรก การบุกเบิกปลูกกัญชาในแปลงขนาดใหญ่ จนถึงปัจจุบัน ได้มีพัฒนาไปอย่างมาก มีผลิตภัณฑ์หลากหลายออกมาสู่ผู้บริโภค ที่ใช้ประโยชน์จากกัญชา
ข่าวปลอม อย่าแชร์! ผลิตภัณฑ์ Viagron เพิ่มขนาดอวัยวะเพศชายโดยไม่ต้องผ่าตัด และมีแพทย์ผู้เชี่ยวชาญด้านระบบปัสสาวะเป็นผู้ผลิต LINK
ตามที่มีการจำหน่ายผลิตภัณฑ์ Viagron เพิ่มขนาดอวัยวะเพศชายโดยไม่ต้องผ่าตัด และมีแพทย์ผู้เชี่ยวชาญด้านระบบปัสสาวะเป็นผู้ผลิต ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับ สำนักงานคณะกรรมการอาหารและยา กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีการโพสต์ชวนเชื่อว่าผลิตภัณฑ์ Viagron สามารถแก้ไขปัญหาเรื่องการแข็งตัวของอวัยวะเพศ ขนาดองคชาต การหลั่งเร็ว และคุณภาพของตัวอสุจิโดยไม่ต้องทำการผ่าตัด ซึ่งมีส่วนประกอบสำคัญจากธรรมชาติในผลิตภัณฑ์ที่สามารถเพิ่มความใคร่ การไหลเวียนโลหิต และเพิ่มขนาดของอวัยวะเพศ โดยทำให้องคชาตยาวขึ้น 4 ซม. ถึง – 5.3 ซม. ในสภาวะที่ยังไม่แข็งตัว และเพิ่มขึ้นได้ 8.7 เมื่อเกิดภาวะแข็งตัวแล้ว ทางสำนักงานคณะกรรมการอาหารและยา กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่า ในระบบสืบค้นข้อมูลผลิตภัณฑ์ของสำนักงานคณะกรรมการอาหารและยา ไม่ปรากฎข้อมูลการอนุญาตผลิตภัณฑ์ดังกล่าว และเว็บไซต์ขายผลิตภัณฑ์ดังกล่าวมีการแสดงข้อมูลทางการแพทย์ที่เป็นเท็จ และมีการใช้ข้อความโฆษณาแสดงคุณประโยชน์หรือสรรพคุณที่ไม่ได้รับอนุญาต
นอกจากนี้ยังพบว่ามีการแอบอ้างชื่อบุคลากรทางการแพทย์ในตำแหน่งศาสตราจารย์ผู้เชี่ยวชาญด้านระบบปัสสาวะ โดยกล่าวว่าเป็นผู้ผลิตผลิตภัณฑ์ดังกล่าว โดยชื่อแพทย์ตามที่กล่าวอ้างในเว็บไซต์ ไม่มีข้อมูลชื่อในฐานข้อมูลตรวจสอบรายชื่อแพทย์จากเว็บไซต์ของแพทย์สภา และภาพแสดงการเปิดคลินิกสุขภาพ ผู้ขายมีการแอบอ้างภาพจากงานเปิดคลินิกกัญชาทางการแพทย์ที่จังหวัดสุราษฎร์ธานี
อย. จึงขอเตือนประชาชนว่าผลิตภัณฑ์ดังกล่าวไม่ได้รับอนุญาตจากสำนักงานคณะกรรมการอาหารและยา และไม่สามารถเพิ่มขนาดอวัยวะเพศชายได้ อย่าหลงเชื่อซื้อผลิตภัณฑ์ดังกล่าวมารับประทาน เพราะอาจได้รับอันตรายได้ หากพบการโฆษณาผลิตภัณฑ์ที่โอ้อวดสรรพคุณเกินจริง หรือโฆษณาผลิตภัณฑ์ที่ต้องสงสัยสามารถร้องเรียนได้ที่ สายด่วน อย. 1556
บทสรุปของเรื่องนี้คือ : ในระบบสืบค้นข้อมูลผลิตภัณฑ์ของสำนักงานคณะกรรมการอาหารและยา ไม่ปรากฎข้อมูลการอนุญาตผลิตภัณฑ์ดังกล่าว และเว็บไซต์ขายผลิตภัณฑ์ดังกล่าวมีการแสดงข้อมูลทางการแพทย์ที่เป็นเท็จ และมีการใช้ข้อความโฆษณาแสดงคุณประโยชน์หรือสรรพคุณที่ไม่ได้รับอนุญาต อีกทั้งพบว่ามีการแอบอ้างชื่อบุคลากรทางการแพทย์ โดยชื่อแพทย์ตามที่กล่าวอ้างในเว็บไซต์ ไม่มีข้อมูลชื่อในฐานข้อมูลตรวจสอบรายชื่อแพทย์จากเว็บไซต์ของแพทย์สภา
ขั้นที่ 3 เจ้าหน้าที่จะติดต่อกลับและประสานเข้ารักษาแบบผู้ป่วยนอก
Siriraj Connect รพ.ศิริราช LINK
Siriraj Connect เป็นแอพพลิเคชั่นที่นำเสนอประสบการณ์ที่ดีในการให้บริการแก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลศิริราช ซึ่งจะสามารถเรียกดูข้อมูลทั่วไป หรือข่าวประชาสัมพันธ์ต่างๆ ของโรงพยาบาล รวมทั้งสามารถเข้าถึงข้อมูลการนัดหมาย, คิวการรับบริการในจุดต่างๆ และการตรวจสอบสิทธิในการรับบริการของตัวเอง รวมทั้งสามารถส่งเอกสารเพื่อรับรองสิทธิการรักษาล่วงหน้าได้ผ่านทางโทรศัพท์มือถือ หรืออุปกรณ์พกพาต่างๆ เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัย และสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับผู้ที่มารับบริการที่โรงพยาบาลศิริราช
ดาวน์โหลดได้
iOS และ
Android Vajira@Home วชิรพยาบาล LINK
วชิรพยาบาล เปิดตัว telemedicine แอพพลิเคชั่น Vajira@Home นวัตกรรมที่ให้ผู้ป่วยพบหมอได้จากที่บ้าน สะดวกสบาย ส่งเสริมคุณภาพชีวิตที่ดี เป็นแอปพลิเคชันที่นำบริการทางการแพทย์ระดับสูงของโรงพยาบาลวชิรพยาบาลมาถึงมือผู้ป่วย จากการออกแบบโดยให้ผู้ป่วยเป็นจุดศูนย์กลางของแผนแบบ (patient centric design) ทำให้ผู้ป่วยมีประสบการณ์ใช้แอปพลิเคชันที่ราบรื่นและสะดวกสบาย โดยแอปพลิเคชัน Vajira@Home สามารถให้ผู้ป่วยนัดแพทย์ผู้เชี่ยวชาญของโรงพยาบาลวชิรพยาบาล ให้คำปรึกษา วินิจฉัยโรค รักษา และจ่ายยาผ่านแอปพลิเคชันเดียว นอกจากนี้ แอปพลิเคชันยังสามารถให้ผู้ป่วยเข้าถึงข้อมูลการนัดหมาย, ประวัติการรักษาของตนเอง, คิวการรับบริการในจุดต่างๆ ในโรงพยาบาลวชิรพยาบาล, บันทึกค่าต่างๆ ให้แพทย์ติดตามความคืบหน้าของอาการ, บันทึกค่าบางค่าผ่านการเชื่อมต่อกับเครื่องมืออื่นๆ เช่น นาฬิกาดิจิตอลและเครื่องตรวจน้ำตาลดิจิตอล, แจ้งเตือนเหตุฉุกเฉินเพื่อเรียกรถพยาบาล (Emergency Medical Service), ระบบการติดตามการส่งยาผ่านไปรษณีย์, ระบบ e-KYC ผ่านแอปพลิเคชัน และอื่นๆ อีกมากมายที่จะเข้ามาในอนาคต เพื่อเพิ่มความสะดวกสบายและส่งเสริมให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้นอย่างทั่วถึงและปลอดภัยจากโรคแพร่ระบาดที่มีโอกาสติดเชื้อจากการเดินทางมาที่โรงพยาบาล
Ram Application โรงพยาบาลรามคำแหง
Ram Application อำนวยความสะดวกแก่สมาชิกของ โรงพยาบาลรามคำแหง รวบรวมข่าวสารข้อมูลและสาระความรู้ทางสุขภาพ เทคโนโลยีในการรักษาพยาบาล อีกทั้งยังสามารถตรวจสอบคิว การนัดหมาย และข้อมูลสุขภาพต่างๆของคุณ ให้คุณได้รับข้อมูลอย่างครบถ้วนภายในแอพเดียว
ดาวน์โหลดทั้ง
iOS และ
Androidกรมแพทย์แผนไทย ชี้คนป่วยได้ประโยชน์จริง เข้าบัญชียาหลักแล้ว
นพ.ยงยศ ธรรมวุฒิ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก กล่าวว่า ปัจจุบันกรมการแพทย์แผนไทยและการแพทย์ทางเลือกมีตำรับยากัญชาแผนไทยที่ประชาชนสามารถนำมาใช้รักษาสุขภาพ จำนวน 19 ตำรับ และมีการผลักดันยากัญชาแผนไทย 5 รายการ คือ ยาแก้ลมแก้เส้น ยาศุขไสยาศน์ ยาทำลายพระสุเมรุ น้ำมันกัญชา (หมอเดชา) และน้ำมันกัญชาทั้ง 5 สู่ชุดสิทธิประโยชน์และบัญชียาหลักแห่งชาติ
นอกจากนี้ได้ดำเนินการต่อเนื่องในการสร้างความรอบรู้ด้านสุขภาพผ่านเครือข่ายสุขภาพในระดับชุมชน ส่งเสริม ป้องกัน และฟื้นฟูสุขภาพด้วยการแพทย์แผนไทยการแพทย์ทางเลือก ในหน่วยบริการสาธารณสุขทุกระดับและเป็นการเสริมสร้างเศรษฐกิจอย่างยั่งยืน
ข้อมูลปีงบประมาณ 2564 มีประชาชนที่ใช้น้ำมันกัญชาทางการแพทย์และยาแผนไทยที่มีกัญชาผสมปรุง จำนวน 238,865 ราย
ตั้งแต่ปี 2562 จนถึงปัจจุบัน มีการศึกษาวิจัยยาที่มีกัญชาปรุงผสมในตำรับ ที่อยู่ระหว่างการวิจัยโดยกรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับภาคีเครือข่าย จำนวน 49 เรื่อง เพื่อเป็นทางเลือกให้กับประชาชนในการดูแลรักษาสุขภาพ
สำหรับการควบคุมการใช้กัญชาในช่วงระยะก่อนกฎหมายกัญชา กัญชง ประกาศใช้ โดย พ.ร.บ.คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ. 2542 มีผลบังคับใช้ในวันที่ 17 มิถุนายน 2565 ให้กัญชาเป็นสมุนไพรควบคุม ตามประกาศกระทรวงสาธารณสุข มาตรา 46 การวิจัย การส่งออก การแปรรูปเพื่อการค้าทำไม่ได้ทันที ตามมาตรา 78 ผู้ใดกระทำผิด มีโทษจำคุก 1 ปี ปรับไม่เกิน 2 หมื่นบาท หรือทั้งจำทั้งปรับซึ่งมีการดำเนินการตามกรอบกฎหมายอย่างเคร่งครัด
อย่างไรก็ตามกัญชา เป็นสมุนไพรที่มีประโยชน์ต้องให้ประชาชนเข้าถึงได้ แต่ต้องดำเนินการควบคู่กับการควบคุม คุ้มครองบุคคล และสังคม ไม่ให้ได้รับอันตรายที่อาจเกิดจากการบริโภค และการป้องกันการใช้ในทางที่ผิด
พิริยาภรณ์ ธรรมมารักษ์ ประธานกรรมการบริหาร SIBA วิทยาลัยอาชีวศึกษาสันติราษฎร์ ในพระอุปถัมภ์สมเด็จพระเจ้าภคินีเธอเจ้าฟ้าเพชรรัตนราชสุดา สิริโสภาพัณณวดี กล่าวว่า วิทยาลัยอาชีวศึกษาสันติราษฎร์ ในพระอุปถัมภ์ฯ เป็นองค์กรแห่งการเรียนรู้ที่มุ่งพัฒนาสมรรถนะของนักศึกษาเต็มศักยภาพ บูรณาการสู่มาตรฐานสากล เปิดสอนหลักสูตรประกาศนียบัตรวิชาชีพและหลักสูตรประกาศนียบัตรวิชาชีพชั้นสูง โดยทางวิทยาลัยมีความต้องการให้บุคลากรของทางวิทยาลัยที่นอกจากจะเสริมความรู้ ทักษะในการเรียนสายอาชีพ การสร้างรายได้แล้ว เราต้องการส่งเสริมให้บุคลากรมีความรู้ ความสามารถในด้านอื่น ๆ โดยเฉพาะในด้านสาธารณสุข การปฐมพยาบาลและช่วยชีวิตเบื้องต้นอย่างถูกต้องและปลอดภัย
Celes Samui มอบบริการระดับพรีเมี่ยมสำหรับนักท่องเที่ยว


นักท่องเที่ยวที่เข้าพัก ณ Celes Samui จะได้รับคำปรึกษาและการออกแบบโปรแกรมตรวจสุขภาพเฉพาะบุคคลโดยแพทย์ผู้ชำนาญการจาก BDMS Wellness Clinic ผ่านระบบ Telemedicine และ on-site ภายใต้ชื่อ “BDMS Wellness Clinic Retreat at Celes Samui” รวมทั้งการบริการทางการแพทย์จากทีมงานมืออาชีพ ประกอบด้วย
1.การตรวจสุขภาพเชิงป้องกันก่อนการเกิดโรค (Preventive Check-up)
2.การตรวจระดับวิตามิน, แร่ธาตุ,ฮอร์โมน และสารต้านอนุมูลอิสระ (Vitamins, Minerals, Hormones and Antioxidants)
3.การตรวจวัดความยาวเทโลเมียร์ (Telomere Length) เพื่อดูอายุเซลล์ (Biological Age)
4.การตรวจรหัสพันธุกรรม ตรวจความเสี่ยงมะเร็งและความเสี่ยงในการเกิดโรคต่างๆ (Genetic Test)
5.การตรวจระบบภูมิคุ้มกันของร่างกาย (NK cell activity)
6.การให้วิตามินทางหลอดเลือดดำ (IV Vitamin drip)
7.การออกกำลังกายเฉพาะบุคคล (Personalized Exercise Programs)
8.โปรแกรมเพื่อการผ่อนคลายความเครียดและดูแลสุขภาพจิต (Mental Wellness)
9.การดูแลและควบคุมน้ำหนัก (Weight management program) และ
10.โปรแกรมเพิ่มประสิทธิภาพการนอนหลับ (Sleep wellness)
อันดับที่ 3 รพ.กรุงเทพ 88.42%
โรงพยาบาลกรุงเทพ เครือข่ายโรงพยาบาลที่ใหญ่ที่สุดของประเทศไทย บริหารเครือข่ายโรงพยาบาลในไทยและกัมพูชา 6 กลุ่ม ได้แก่ กลุ่มโรงพยาบาลกรุงเทพ กลุ่มโรงพยาบาลสมิติเวช โรงพยาบาลบี เอ็น เอช กลุ่มโรงพยาบาลพญาไท กลุ่มโรงพยาบาลเปาโลเมโมเรียล และกลุ่มโรงพยาบาลรอยัล มีโรงพยาบาลรวมกัน 50 แห่ง กล่าวถึงโรงพยาบาลกรุงเทพ ไม่มีข้อสงสัยในระดับของคุณภาพ มาตรฐานและการบริการที่ยอดเยี่ยม ศักยภาพการดูแลให้บริการ ที่ผู้รับบริการจากนานาประเทศทั่วโลกให้ความเชื่อมั่น
บริลเลี่ยนท์ แคนนาบิทซ์ Brilliant Cannabitz
รับสมัคร ทีมขายสารสกัดกัญชง
นำเสนอขาย ตรวจสอบ ติดตามการสั่งซื้อจากลูกค้า
สรรหาลูกค้ารายใหม่ๆ และรักษาฐานลูกค้ารายเก่า
จัดทำตารางการเยี่ยมลูกค้า รายงานผลการเยี่ยม ประเมินผลการเยี่ยมลูกค้า
รายงานสรุปผลงานการขายของตนเองในแต่ละเดือน
ติดตามความเคลื่อนไหวของตลาดคู่แข่ง แนวโน้มผู้บริโภค
และความต้องการของลูกค้า
สร้างสัมพันธภาพที่ดีระหว่างลูกค้าและองค์กร
แก้ไขปัญหา และ อุปสรรคของงานขาย
งานอื่น ๆ ที่ได้รับมอบหมาย
++ คุณสมบัติผู้สมัคร ++
ไม่จำกัดเพศ อายุระหว่าง 25-45 ปี
จบการศึกษาระดับ ปริญญาตรี สาขาวิทยาศาสตร์การอาหาร บริหารธุรกิจ ด้านการขาย ด้านการตลาด หรือสาขาที่เกี่ยวข้อง
มีประสบการณ์ขายหรือมีช่องทางการขายด้านเคมีภัณฑ์และวัตถุดิบสำหรับเครื่องสำอาง หรือด้านอาหารเสริม จะพิจารณาเป็นพิเศษ
มีใบขับขี่และรถยนต์เป็นของตัวเอง
บุคลิกดี รักการบริการ มีทักษะด้านการสื่อสาร และ เจรจาต่อรอง
มีความรับผิดชอบ กระตือรือร้น มนุษย์สัมพันธ์ดี มีความอดทน และพัฒนาตนเองอยู่เสมอ
สามารถติดต่อหาลูกค้ารายใหม่ ให้กับบริษัทฯ ผลักดันยอดขายสารสกัด
แสดงใบอนุญาตคลินิกไว้ชัดเจน
Amazing 17 วิถีชุมชน คนภาคกลาง
Amazing 17 วิถีชุมชน คนภาคกลาง
ครอบครัวสายช็อปต้องชอบแน่ งานรวมสุดยอดสินค้าชุมชน ตั้งแต่วันที่ 10 - 14 สิงหาคม 2565
เวลา 10.30 - 20.00 น. ที่ ลานโปรโมชั่น ชั้น2 ศูนย์การค้าเซียร์ รังสิต
9-14 สิงหาคม ถนนคนเดิน เสน่ห์ไทยนิยม สำนักงานเขตบึงกุ่ม LINK
บึงกุ่มขยายเวลาชวนเที่ยวงาน “ถนนคนเดิน เสน่ห์ไทยนิยม” ณ ถนนหน้าสำนักงานเขตบึงกุ่ม สำนักงานเขตบึงกุ่ม ขอประชาสัมพันธ์ขยายเวลาชวนท่านเที่ยวงาน “ถนนคนเดิน เสน่ห์ไทยนิยม” ตามโครงการไทยช่วยไทยกระตุ้นเศรษฐกิจ เพิ่มอีก 2 วัน ถึงวันที่ 14 สิงหาคม 2565 ตั้งแต่เวลา 17.00 – 21.00น. ณ บริเวณถนนหน้าสำนักงานเขตบึงกุ่ม ภายในงานมีการจัดจำหน่ายสินค้า OTOP ผลิตภัณฑ์ชุมชน อาหารคาวหวานหลากหลายชนิด และสินค้าอุปโภคบริโภคราคาถูก รวมทั้งการแสดง และฉายหนังกลางแปลง รอบ 19.00น. สับเปลี่ยนหมุนเวียนทุกวัน
ภาษีเจริญ ตรวจต่อเนื่อง ป้องกันอันตรายจากเหตุอัคคีภัย
11 ส.ค.. 65 ผอ.ยุทธนา ป่าไม้ พร้อมด้วยผช.วัลลภ เกียรติวรศรีกุล นำทีมฝ่ายสิ่งแวดล้อม ฝ่ายโยธา และฝ่ายเทศกิจ จับมือกับตำรวจ สน.ภาษีเจริญ ตรวจสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ เพื่อตรวจสอบระบบความปลอดภัย โดยเฉพาะระบบป้องกันการเกิดอัคคีภัย และความปลอดภัยของอาคาร สร้างความเชื่อมั่นให้แก่ผู้ใช้บริการ ณ สถานประกอบการในพื้นที่เขตภาษีเจริญ
คลินิกฝากครรภ์
วัน-เวลาทำการ
วันจันทร์ 13.00 น. - 16.00 น.
หมายเหตุ : บริการฟรี ยกเว้นต่างด้าว
ขอบเขตการให้บริการ
1.ผู้รับบริการรายใหม่ (ฝากครรภ์ครั้งที่ 1)
- ซักประวัติการตั้งครรภ์ ตรวจร่างกายทั่วไป
- ให้คำปรึกษาโดยแพทย์-พยาบาล-นักสังคมสงเคราะห์
- เจาะเลือดตรวจโรคติดต่อทางเพศสัมพันธ์และโรคทางพันธุกรรมธาลัสซีเมีย
- บริการฉีดวัคซีนป้องกันโรคบาดทะยัก
- ตรวจครรภ์โดยแพทย์-พยาบาลเวชปฏิบัติ
2. ผู้รับบริการรายเก่า (ฝากครรภ์ครั้งที่ 2)
- ตรวจร่างกายทั่วไป ได้แก่ ชั่งน้ำหนัก วัดความดันโลหิต ตรวจปัสสาวะ
- ให้ความรู้เรื่องเตรียมความพร้อมสู่การเป็นพ่อ-แม่
- ให้ความรู้เรื่องทันตสุขภาพ ตรวจสุขภาพในช่องปากและขูดหินปูนโดยทันตแพทย์ (ฟรี)
- ตรวจครรภ์ และให้คำปรึกษาโดยพยาบาลวิชาชีพ
3. ผู้รับบริการรายเก่า (ฝากครรภ์ตั้งแต่ครั้งที่ 3 ขึ้นไป)
- ตรวจร่างกายทั่วไป ได้แก่ ชั่งน้ำหนัก วัดความดันโลหิต ตรวจปัสสาวะ
- ตรวจครรภ์ และให้คำปรึกษาโดยพยาบาลวิชาชีพ
ประกันสังคม ได้สิทธิตรวจสุขภาพ ฟรี ทางเราจัดให้ LINK
การตรวจสุขภาพประกันสังคมฟรีนั้น สามารถใช้ได้ทั้ง ผู้ประกันตนมาตรา 33 และ ผู้ประกันตนมาตรา 39 ซึ่งผู้ประกันตนสามารถเข้าใช้บริการในสถานพยาบาลที่ทำการเลือกไว้ โดยไม่ต้องเสียค่าใช้จ่ายใด ๆ ทั้งสิ้น สิทธิตรวจสุขภาพประกันสังคมฟรีนั้น มีด้วยกัน 14 รายการ แบ่งเป็น 4 ประเภทคือ
- การตรวจร่างกายตามระบบ
- การตรวจทางห้องปฏิบัติการ
- การตรวจสารเคมีในเลือด
- การตรวจอื่นๆ
ซึ่งการตรวจแต่ละประเภทนั้น จะมีเงื่อนไขแตกต่างกันออกไป
การตรวจสุขภาพประกันสังคมฟรีนั้น ถือเป็นสิทธิประโยชน์ขั้นพื้นฐานสำหรับผู้ประกันตนมาตรา 33 และ 39 เพื่อให้ผู้ประกันตนสามารถตรวจร่างกาย เตรียมวางแผนรับมือ หรือ ป้องกันปัจจัยเสี่ยงที่อาจจะก่อให้เกิดโรคได้
สอบถามการย้ายสิทธิประกันสังคม โทร 035-356888 หรือ 081-6315853
ตรวจความผิดปกติของโครโมโซม สำหรับผู้ถือบัตรประกันสังคม เกษมราษฎร์ บางแค LINK
เพราะความผิดปกติของโครโมโซมของทารกในครรภ์ ทำให้เกิดความพิการได้ทั้งทางด้านสมอง พัฒนาการ และร่างกาย เช่น กลุ่มดาวน์ซินโดรม (Down sndrome) ติดต่อสอบถาม โทร. 1218 กด 3 (สาขาบางแค)
สำหรับผู้ถือประกันสังคมและฝากครรภ์สม่ำเสมอที่ตึกประกันสังคม โรงพยาบาลเกษมราษฎร์ บางแค
การตรวจภาวะผิดปกติของโครโมโซม
- ตรวจเลือดตรวจคัดกรองภาวะดาวน์ซินโดรม อายุครรภ์ 10-20 สัปดาห์ ราคา 13,900 บาท
เปลี่ยนสิทธิมากล้วยน้ำไท ไม่ยาก
บัตรประกันสังคม รพ.นวมินทร์ และ นวมินทร์ 9
ขอเชิญชวนผู้ถือบัตรประกันสังคม รพ.นวมินทร์ และ นวมินทร์ 9
เปิดให้บริการ วันจันทร์-เสาร์ เวลา 08.00-15.00 น.
ของขวัญปีใหม่
มอบให้สำหรับผู้ที่ถือบัตรรับรองสิทธิประกันสังคม และบริษัท
แบบที่1
สำหรับผู้ที่ถือบัตรรับรองสิทธิประกันสังคม สามารถเข้ารับบริการตรวจสุขภาพ ตามเงื่อนไขที่กำหนดได้ที่สถานพยาบาลตามหน้าบัตรรับรองสิทธิของท่าน ฟรี!
เริ่ม 1 มกราคม 2560 #มาตรา39สามารถใช้ได้เช่นกัน
สอบถามรายละเอียดเพิ่มได้ที่ :
คลินิกประกันสังคม
โทร 02-5181818 ต่อ 572,581
ฝ่ายพัฒนาธุรกิจ และลูกค้าสัมพันธ์
โทร 02-5181818 ต่อ 270,271,272,275
แบบที่2
สำหรับบริษัทที่สนใจเข้าร่วมโครงการสุขภาพและคัดกรองความเสี่ยง #ในสถานประกอบการ
1.ตรวจสุขภาพตามช่วงอายุ
(เฉพาะพนักงานผู้ถือบัตรรับรองสิทธิ์ รพ.นวมินทร์ และรพ.นวมินทร์9)
2.คัดกรองความเสี่ยงโดยซักประวัติตามแบบคัดกรองความเสี่ยง ชั่งน้ำหนัก วัดส่วนสูง ประเมินค่า BMI เฉพาะผู้ประกันตนสัญชาติไทยเท่านั้น)#ผู้ถือบัตรกลุ่มโรงพยาบาลนวมินทร์ #50ท่านขึ้นไป
Promotion
สอบถามรายละเอียดเพิ่มได้ที่ :ฝ่ายพัฒนาธุรกิจ และลูกค้าสัมพันธ์โทร 02-5181818 ต่อ 417,271,272,275
ช่วงอายุ 15-17 ปี
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
อายุ 18-19 ปี
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
อายุ 20-34 ปี
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ตรวจระดับไขมันในเส้นเลือด (Cholesterol , HDL )**
อายุ 35-49 ปี
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ตรวจระดับไขมันในเส้นเลือด (Cholesterol )**
ตรวจระดับไขมันในเส้นเลือด ( HDL )**
ตรวจระดับน้ำตาลในเลือด ( FBS)**
ตรวจเชื้อไวรัสตับอักเสบบี (HBs Ag)
อายุ 50-54 ปี
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ตรวจระดับไขมันในเส้นเลือด (Cholesterol )**
ตรวจระดับไขมันในเส้นเลือด ( HDL )**
ตรวจระดับน้ำตาลในเลือด ( FBS)**
ตรวจหาเลือดในอุจจาระ ( FOBT)
ตรวจเชื้อไวรัสตับอักเสบบี (HBs Ag)
อายุ 55 ปี ขึ้นไป
ตรวจร่างกายตามระบบ
เอกซเรย์ทรวงอกระบบดิจิตอล
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ตรวจระดับไขมันในเส้นเลือด (Cholesterol )**
ตรวจระดับไขมันในเส้นเลือด ( HDL )**
ตรวจระดับน้ำตาลในเลือด ( FBS)**
ตรวจหาเลือดในอุจจาระ ( FOBT)
ตรวจความสมบูรณ์ของปัสสาวะ (UA)
ตรวจการทำงานของไต (Creatinine)
ตรวจเชื้อไวรัสตับอักเสบบี (HBs Ag)
รายการที่มีเครื่องหมาย ** กรุณางดน้ำ งดอาหารก่อนตรวจ 8 ชม.
เปิดให้บริการทุกวัน เวลา 8.00 – 15.00 น.
สอบถามรายละเอียด ฝ่ายพัฒนาธุรกิจและลูกค้าสัมพันธ์ 02-5181818 ต่อ 270,271,272,275
คุณพร้อมพร สุภัทรวนิช ผู้ช่วยผู้อำนวยการด้านวิจัยการตลาดและกลยุทธ์ สถาบันวิจัยความเป็นอยู่ ฮาคูโฮโด อาเซียน (ประเทศไทย) ได้ให้คำแนะนำในสถานการณ์นี้ว่า
แบรนด์ควรทำแคมเปญสนับสนุน “Best Version of Me” เพื่อความสุขของตัวเองและครอบครัว
เมื่อความอยากช้อปพีคสุด พร้อมความสุขที่เพิ่มขึั้น แบรนด์ควรสร้างโอกาสแห่งการช้อปอย่างเต็มที่ ไม่ว่าเป็นการพัฒนาภาพลักษณ์ภายนอก ทั้งเสื้อผ้า หน้า ผม หรือการ upskill ด้านต่างๆ เช่น การเรียน การซื้ออุปกรณ์เพื่อเสริมการทำงาน หรือ แคมเปญฉลองการ ‘กลับไปใช้ชีวิตนอกบ้าน’ ในช่วงเทศกาลวันแม่ วันเกิด หรือวันหยุดยาวเพิ่มโอกาสในการออกไปท่องเที่ยว ออกไปทำงาน ออกไปเรียน เพื่อเติมความสุขให้ตนเองและครอบครัว
แสดงจุดยืน ความโปร่งใส จริงใจต่อผู้บริโภค ในช่วงเวลาที่ยากลำบาก
ในสถานการณ์ที่ข้าวยากหมากแพง ผู้คนก็ยังคงต้องซื้อของกินของใช้ มีรายจ่ายเพิ่มขึ้น แบรนด์ควรแสดงจุดยืนผ่านการสื่อสารที่ตรงไปตรงมา เช่น อธิบายเหตุและผลต่อผู้บริโภคอย่างชัดเจนถ้าหากร้าน แบรนด์ มีความจำเป็นต้องขึ้นราคาสินค้า หรือ หาทางช่วยผู้บริโภคด้วยการตรึงราคาสินค้าเท่าที่ไหว
งานคือเงิน เงินคืองาน สิ่งที่คนไทยให้ความสำคัญที่สุดในช่วงนี้ คือ เรื่องงานและเงิน เพราะเน้นสร้างความมั่นคง มีเงินใช้จ่ายได้เต็มที่ สร้างความสุขให้ตัวเลขและครอบครัว
//////////
[1] Khotcharrat R, Patikulsila D, Hanutsaha P, Khiaocham U, Ratanapakorn T, Sutheerawatananonda M, Pannarunothai S. “Epidemiology of Age-Related Macular Degeneration among the Elderly Population in Thailand. Journal of the Medical Association of Thailand. 2015 Aug; 98(8): 790-797.
Available from: https://pubmed.ncbi.nlm.nih.gov/26437537/
[2] International Diabetes Federation, 10th edition, 2021.
Available from: https://diabetesatlas.org/data/en/country/196/th.html
[3] กรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ https://www.dop.go.th/th/know/15/926
[4] American Academy of Ophthalmology. Diabetic Retinopathy Symptoms.
Available from: http://www.geteyesmart.org/eyesmart/diseases/diabetic-retinopathy/symptoms.
[5] Heier JS et al. Efficacy, durability, and safety of intravitreal faricimab up to every 16 weeks for neovascular
age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3, non-inferiority trials. www.thelancet.com Published online January 24, 2022 https://doi.org/10.1016/S0140-6736(22)00010-1
[6] Wykoff CC et al. Efficacy, durability, and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with diabetic macular oedema (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. www.thelancet.com Published online January 24, 2022 https://doi.org/10.1016/S0140-6736(22)00018-6
7 Data on file. Eichenbaum DA, et al. Presented at the American Society of Retina Society of Retina Specialists Annual Meeting, New York, NY, July 13-16, 2022
Herbalista Wellness Cafe x City Forest คาเฟ่กัญย่านบางพลัด
คาเฟ่กัญย่านบางพลัด ใกล้ MRTบางอ้อนั่นไง #คาเฟ่กัญชาที่จะทำให้คุณมีความสุข ด้วยเมนูน่าชิม อย่าง เเครกเกอร์ชาเขียวกัญชา เหมาะสำหรับผู้ชอบกลิ่นหอมของชาเขียวผสมฤทธิ์ของกัญชา คุกกี้กัญชาเเละบราวนี่กัญชา เครื่องดื่มกัญชา อย่าง อเมริกาโน่กัญชา ชากัญชา ชาเขียวพรีเมียมกัญชา ช็อกโกเเลตกัญชา ชาซีลอนลาเต้กัญชา ชามะนาวกัญชา ฯลฯ ดูรูปแล้วอยากชิมทุกแก้วเรย
ซอยจรัญสนิทวงศ์ 91แยก4 โทร.092-2514678
Work equals money
"Work equals money." There is currently nothing more important for Thai consumers than work and money. They are focusing on ensuring stability and sufficient income to allow them to spend on things that make them and their families happy.
Ms. Chulika Saisila, Strategic Solution Manager at SPICY Hakuhodo, added "People are happy at the moment and feel secure with their current state of happiness. They are ready to live a normal life and are content with the happiness they have at present. They aren’t worried about making up for any happiness they might have missed out on during the past two years.
“The increasing happiness levels of Thai consumers is a positive sign for the economy and daily life. Vendors will see higher income, and the long-stagnant tourism segment will return to its former glory".
3.โฆษณาอาหารเสริมเกินจริง: ควรแก้ปัญหาอย่างไร?
โรงพยาบาลเวชการุณย์รัศมิ์
โรงพยาบาลเวชการุณย์รัศมิ์ สำนักการแพทย์ กรุงเทพมหานคร "เปิดให้บริการศูนย์บริการคนพิการแบบเบ็ดเสร็จ (One Stop Service)" ตรวจวินิจฉัยและออกใบรับรองคนพิการ โดยแพทย์เฉพาะด้านต่างๆ ของ รพ.
✅ ทางการมองเห็น
✅ ทางการเคลื่อนไหวหรือร่างกาย
✅ ทางจิตใจหรือพฤติกรรม
✅ ทางสติปัญญา
✅ ทางการเรียนรู้
เปิดให้บริการทุกวัน เวลา 8.00 - 16.00 น.
หยุดทุกวันพุธ และวันทำการวันสุดท้ายของแต่ละเดือน ติดต่อสอบถามเพิ่มเติม โทร 02-5431307 ต่อ 276,277 กลุ่มงานเวชกรรมฟื้นฟู
รถเอ็กซเรย์เคลื่อนที่
ดูแลโดยกองควบคุมโรคเอดส์ วัณโรคและโรคติดต่อทางเพศสัมพันธ์ สำหรับหน่วยรถเอกซเรย์ปอดเคลื่อนที่ จะให้บริการเอกซเรย์ปอด ค้นหาผู้ป่วยวัณโรคในชุมชน เพื่อเฝ้าระวังป้องกันการแพร่กระจายของวัณโรค พร้อมให้ความรู้เรื่องวัณโรคแก่ประชาชน ซึ่งกรณีหากพบผู้ป่วยวัณโรค สำนักอนามัยจะประสานงานกับศูนย์บริการสาธารณสุขในพื้นที่ ติดตามผู้ป่วยไปรับการรักษาที่ศูนย์บริการสาธารณสุข พร้อมติดตามให้เข้ารับการรักษาอย่างถูกต้อง โดยไม่เสียค่าใช้จ่าย
ในช่วงโควิด-19 ระบาด รถเอกซเรย์ปอดเคลื่อนที่ถูกใช้สำหรับตรวจเอกซเรย์ปอดเพื่อการผู้ติดเชื้อเพื่อเข้าสู่ระบบการรักษา
ข้อเท็จจริงเกี่ยวกับกัญชาทางการแพทย์ โดย แพทยสภา LINK
คำแนะนำ การใช้กัญชาทางการแพทย์สำหรับแพทย์ ฉบับที่ ๑ ตุลาคม ๒๕๖๒
สารสกัดกัญชาในการแพทย์ (สำหรับแพทย์)
ข้อเท็จจริงเกี่ยวกับกัญชาทางการแพทย์ (สำหรับประชาชน)
ประกาศแพทยสภาที่ ๕๓ /๒๕๖๕ เรื่อง ไม่ใช้กัญชาในทางที่ผิด New
ประกาศแพทยสภาที่ เรื่อง ไม่ใช้กัญชาในทางที่ผิด (Infographic) New
คำแนะนำการใช้กัญชาทางการแพทย์
ที่มา: กรมการแพทย์ กระทรวงสาธารณสุข ฉบับปรับปรุงครั้งที่ 2/2562
เฟรช เมดิก กัญชาทางการแพทย์ พัทยา-จอมเทียน
เฟรช เมดิก คลินิก ตั้งอยู่ในพัทยาจอมเทียน เป็นคลินิกด้านสุขภาพความงามและ กัญชาทางการแพทย์ ได้รับอนุมัติจาก อย ให้ใช้ กัญชาทางการแพทย์และกระท่อมในการรักษาโรค
น้ำมันกัญชาที่ใช้เป็นทางการแพทย์ที่ผลิตโดยการสกัดจากกัญชาออร์แกนิค ที่ปลูกและควบคุมจากกระทรวงสาธารณสุข และ อย.อนุมัติ ให้จัดจำหน่ายโดย องค์การเภสัชกรรม (อภ). 3 สูตร น้ำมันกัญชา CBD น้ำมันกัญชา THC น้ำมันกัญชาผสม THC:CBD เฟรช เมดิก คลินิก มีใบอนุญาตถูกต้องตามกฎหมายและรักษาสำหรับคนไข้ทุกท่าน ชาวไทยและชาวต่างชาติ
เฟรช เมดิก คลินิก เปิดบริการ จันทร์ – เสาร์ 10:00 – 19:00 ที่อยู่ 489/02 วิวทะเลเรสซิเด้นซ์คอนโดมิเนียม 4 หมู่ 12 จอมเทียนซอย 5 ต.หนองปรือ อ.บางละมุง จ.ชลบุรี 20150 โทร.092-4719159
ด้าน
นายณรงค์ฤทธิ์ กาละพุฒ ประธานคณะผู้บริหารกลุ่มธุรกิจสนับสนุนโรงพยาบาล 7.1 บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) หรือ BDMS กล่าวถึงที่มาของการก่อตั้ง บริษัท เอ็นเฮลท์ โนโวยีน จีโนมิกส์ จำกัด หรือ NNG (เอ็นเอ็นจี) ศูนย์บริการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์ว่า “ประเทศไทยมีการตรวจวิเคราะห์ยีนเฉพาะบุคคลเพิ่มมากขึ้นเรื่อยๆ ในแต่ละปี ซึ่งการตรวจดังกล่าวจำเป็นที่จะต้องใช้เทคโนโลยีขั้นสูง ทำให้ต้องนำยีนดังกล่าวไปตรวจวิเคราะห์ยังห้องแล็บในต่างประเทศ ผู้ใช้บริการจึงต้องแบกภาระค่าใช้จ่ายที่สูง ประกอบกับใช้ระยะเวลาที่ค่อนข้างนาน บางครั้งอาจไม่ทันท่วงทีกับการรักษาโรค โดยเฉพาะโรคร้าย ด้วยข้อจำกัดดังกล่าวตลอดจนความมุ่งมั่นที่จะส่งเสริมและพัฒนาการแพทย์จีโนมิกส์ในประเทศไทย บริษัท เนชั่นแนล เฮลท์แคร์ ซิสเท็มส์ จำกัด หรือ เอ็นเฮลท์ (N Health) ในฐานะผู้นำด้านการตรวจวิเคราะห์ทางห้องปฏิบัติการของประเทศไทย ในเครือ BDMS จึงได้ผสานความร่วมมือกับ บริษัท โนโวยีน เอไอที จำกัด (NovogeneAIT) สิงคโปร์ ก่อตั้ง บริษัท เอ็นเฮลท์ โนโวยีน จีโนมิกส์ จำกัด หรือ NNG (เอ็นเอ็นจี) ศูนย์บริการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์ขึ้น เพื่อสนับสนุนโครงการ BDMS Genomic Center และเป็นการยกระดับขีดความสามารถของวงการแพทย์ไทยให้เป็นอีกหนึ่งทางเลือกในการรักษาแบบเฉพาะบุคคลให้กับประชาชนไทย และขยายบริการสู่การเป็น Genomic Center แห่งเอเชียตะวันออกเฉียงใต้”
คลินิกประกันสังคม โรงพยาบาลสงขลา LINK
ผู้ที่ใช้สิทธิประกันสังคม โรงพยาบาลสงขลา สามารถเข้ารับบริการได้ที่ คลินิกประกันสังคม รพ.เมืองสงขลา ตามวันและเวลา ดังนี้
ในเวลาราชการ จันทร์-ศุกร์ 8-16 น.
นอกเวลาราชการ จันทร์-ศุกร์ 16.30-20 น.
เสาร์-อาทิตย์ 8-12 น.
*เฉพาะสิทธิประกันสังคม โรงพยาบาลสงขลา เท่านั้น
สอบถามโทร. 074-338100 หรือ 074-313254
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ สูติ-นรีเวช LINK
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ สูติ-นรีเวช โรงพยาบาลเมืองสงขลา ให้บริการตรวจภายใน อัลตราซาวด์ ตรวจมะเร็งปากมดลูก ปรึกษาฝากครรภ์ วางแผนครอบครัว และคุมกำเนิด
เปิดให้บริการ จันทร์-พุธ เวลา 16.30-20.30 น. สอบถามโทร.074-313254 ค่าบริการเริ่มต้น 300 บาท (ที่เหลือเบิกได้ตามสิทธิ์)
BKK Connect ข้อมูลข่าวสารต่างๆ เพื่อชาวกทม.
แอปพลิเคชัน กทม. Now Connect (พัฒนาโดย CAT Telecom) เป็นแอปพลิเคชันสำหรับชาวกรุงเทพมหานคร โดยรวบรวมข้อมูลข่าวสารต่างๆ และระบบการส่งเสริมด้านสิทธิประโยชน์ การแจ้งเตือน และบริการต่างๆ ไว้อย่างครบครัน กทม. connect, คลิกเดียวรู้เรื่อง, กทม. now connect
คลินิกกัญชาทางการแพทย์ โรงพยาบาลเอกชล
โรงพยาบาลเอกชล เปิดให้บริการ คลินิกกัญชาทางการแพทย์ " ปรึกษา ฟื้นฟู บำบัด " โดยมี นพ.คมกฤช สุวรรณกูฏ แพทย์ประจำคลินิกกัญชาทางการแพทย์ เปิดให้บริการทุกวันอังคาร 13.00-20.00 น. กรุณานัดหมายล่วงหน้า
สอบถามเพิ่มเติม โทร 038-939999 ต่อ 2132-2133
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์ฯ จ.พระนครศรีอยุธยา
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์ฯ จ.พระนครศรีอยุธยา
ที่อยู่ 200/11 ม.2 ต.บ่อโพง อ.นครหลวง จ.พระนครศรีอยุธยา 13260
สนใจติดต่อบริจาค
ร่วมบริจาคทำบุญได้ที่ ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์
จังหวัดพระนครศรีอยุธยา 200/11 ม.2 ต.บ่อโพง อ.นครหลวง จ.พระนครศรีอยุธยา 13260
โทร 035-743277,035-743077
จองเลี้ยงอาหารและทำกิจกรรม โทร. 062-6160880
เกี่ยวกับศูนย์
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์ฯ จ.พระนครศรีอยุธยา เดิมชื่อว่า "สถานสงเคราะห์คนชราวาสนะเวศม์" และได้ย้ายมาสังกัดกรม กิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ เมื่อวันที่ 6 มีนาคม 2558 จนถึงปัจจุบัน
ประวัติความเป็นมาของศูนย์วาสนะเวศม์ฯ สืบเนื่องจากครั้งที่สมเด็จพระอริยวงศาคตญาณ (วาสนมหาเถระ) สมเด็จพระสังฆราชสกลมหาสังฆปรินายก วัดราชบพิธสถิตมหาสีมาราม เมื่อครั้งยังมีพระชนม์ได้ทรงหายประชวร ในปีพุทธศักราช 2528 คณะศิษยานุศิษย์ถือ เป็นสิริมงคลและพระบารมีธรรม จึงได้ดำเนินการจัดสร้างสถานสงเคราะห์คนชราวาสนะเวศม์ขึ้นเพื่อช่วยเหลือสงเคราะห์คนชรา ที่ได้รับความยากลำบาก และประสบปัญหาทางสังคมให้ได้มีที่อยู่อาศัยที่ตำบลบ่อโพง อำเภอนครหลวง จังหวัดพระนครศรีอยุธยา ซึ่งเป็นตำบลและอำเภอที่ประสูติของพระองค์ เป็นการสร้างความเจริญและตอบแทนชาติภูมิของพระองค์ ซึ่งสมเด็จพระสังฆราชสกลมหาสังฆปรินายก เสด็จวางศิลาฤกษ์ เมื่อวันที่ ๒ กุมภาพันธ์ ๒๕๒๙ และได้ทำพิธีเปิดเป็นทางการ เมื่อวันที่ 8 พฤษภาคม 2530 โดยสมเด็จพระศรีนครินทรา บรมราชชนนี เสด็จพระราชดำเนิน เป็นองค์ประธาน และสมเด็จพระสังฆราช ทรงโปรดประทานชื่อสถานสงเคราะห์แห่งนี้ว่า "วาสนะเวศม์" ซึ่งมีความหมายว่า "ที่อยู่ของผู้มีบุญ" รวมพื้นที่ประมาณ 26 ไร่ ค่าก่อสร้างทั้งสิ้นประมาณ 30 ล้านบาทเศษ
ต่อมาในปี พ.ศ.2531 และ พ.ศ.2536 คณะศิษยานุศิษย์และคุณทองใบ เร่งเพียร ได้จัดซื้อที่ดินเพิ่มเติมให้อีก 25 ไร่ เพื่อขยายการ บริการให้สงเคราะห์คนชราประเภทพิเศษ (ปลูกบ้านอยู่เอง) ในการนี้ได้มีผู้ยื่นคำร้องขออนุมัติและจัดสร้างบ้านพักอยู่เอง จำนวน 5 ราย มีผู้บริจาคบ้านพักชนิดทาวน์เฮ้าส์ 4 ห้องนอน จำนวน 1 ราย โครงการนี้เป็นโครงการร่วมมือระหว่างมูลนิธิสมเด็จ พระสังฆราช(วาสนะเวศม์ฯ) และกรมประชาสงเคราะห์เดิม และเมื่อ พ.ศ.2545 ได้มีการปรับโครงสร้างส่วนราชการจึงได้มาอยู่สังกัด กรมพัฒนาสังคมและสวัสดิการ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์ ให้บริการผู้สูงอายุซึ่งมาอายุ 60 ปี ขึ้นไปโดยศูนย์ฯได้จัดบริการด้านต่างๆให้แก่ผู้สูงอายุ เพื่อให้ผู้สูงอายุมีความสุข อยู่ดีกินดี ตามควรแก้อัตภาพ ซึ่งบริการของศูนย์ฯ แบ่งออกเป็น งานสงคราะห์ผู้สูงอายุในศูนย์พัฒนา และ งานสวัสดิการผู้สูงอายุและด้อยโอกาสในชุมชน โดยทางศูนย์ ได้มีตั้งภารกิจของศูนย์ ฯไว้ดังนี้
ภารกิจศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุวาสนะเวศม์ :
1. ศูนย์ข้อมูลและสารสนเทศงานสวัสดิการสังคมผู้สูงอายุ
2. ศูนย์ฝึกอบรมและพัฒนา
3. ศูนย์การเรียนรู้
4. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุแบบสถาบัน
5. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุในชุมชน
6. ศูนย์ให้บริการคำแนะนำปรึกษา
แพคเกจตรวจสุขภาพ หญิง 19 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
แพคเกจตรวจสุขภาพ ชาย 18 รายการ
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
3.ประเภทวิชาการ คือ พญ.นฤมล สวรรค์ปัญญาเลิศ
3.ประเภทวิชาการ คือ พญ.นฤมล สวรรค์ปัญญาเลิศ นายแพทย์ทรงคุณวุฒิ ที่ปรึกษากรมการแพทย์ พัฒนาทีมปฏิบัติการฉุกเฉินทางการแพทย์และสาธารณสุขในภาวะภัยพิบัติ (MERT) เพื่อลดปัญหาการขาดแคลนทีมแพทย์ที่จะลงไปช่วยในพื้นที่ประสบภัยพิบัติรุนแรง โดยร่วมกับสมาคมเวชศาสตร์ฉุกเฉินแห่งประเทศไทย และหน่วยงานต่างๆ ที่เกี่ยวข้อง พัฒนาหลักสูตรเตรียมความพร้อมทีมบุคลากรทางการแพทย์เพื่อดูแลรักษาผู้ป่วยฉุกเฉินในภาวะภัยพิบัติ ตั้งแต่ปี 2552 และขยายผลครบทุกจังหวัด ทำให้มีทีม MERT ในการช่วยเหลือผู้ประสบภัยทั้งในประเทศ เช่น มหาอุทกภัยเมื่อปี 2554 และในต่างประเทศ เช่น เหตุแผ่นดินไหวที่เนปาลปี 2558 เป็นต้น โดยพัฒนาศักยภาพทีม MERT จนได้รับการรับรองตามมาตรฐานองค์การอนามัยโลก เป็นทีม Thailand EMT และยังพัฒนาทีม Mini MERT หรือทีมฉุกเฉินเคลื่อนที่เร็วในระดับอำเภอ ประเมินความรุนแรงของสถานการณ์ในพื้นที่และช่วยเหลือผู้ประสบภัยเบื้องต้น จนครบทุกอำเภอ
โรงพยาบาลบ้านตาขุน เปิดให้บริการ Walk-in ฉีดวัคซีน ทุกวันศุกร์
โรงพยาบาลบ้านตาขุน เปิดให้บริการ Walk-in ฉีดวัคซีน ทุกวันศุกร์เวลา 09.00 - 15.00 (เว้นวันหยุดราชการ)
โครงการที่อยู่ระหว่างการดำเนินการ ตามนโยบาย เพิ่มพื้นที่สีเขียว
โครงการและนโยบายสำคัญที่อยู่ระหว่างการดำเนินการและกำลังจะดำเนินการ
1. เพิ่มพื้นที่สาธารณะที่ประชาชนสามารถเข้าถึงได้ง่าย สะดวกสบายด้วยการเดินภายใน 15 นาที หรือระยะประมาณ 800 เมตร กระจายอยู่ทั่วกรุงเทพฯ โดยไม่ต้องใช้พื้นที่มาก แต่มีสิ่งอำนวยความสะดวกครบครัน ตอบสนองความต้องการของประชาชนได้อย่างแท้จริง
2. จัดการดูแลต้นไม้อย่างถูกวิธีและเป็นระบบ โดยจัดหารุกขกรมืออาชีพดูแลต้นไม้ประจำเขต จัดทำทะเบียนต้นไม้เพื่อเป็นทรัพย์สินของกรุงเทพมหานคร พร้อมทั้งสำรวจและประเมินสุขภาพต้นไม้เป็นประจำ เพื่อวางแผนดูแลต้นไม้ได้อย่างมีประสิทธิภาพ
3. ปลูกต้นไม้ล้านต้น เสริมร่มเงา เพิ่มพื้นที่สีเขียว ลดฝุ่นและมลพิษ โดยประชาชนมีส่วนร่วม
ข้าวกะเพราสุขใจ เชฟ ฐานิตา บุญเชิด @อภัยภูเบศร เดย์ สปา
ข้าวกะเพราสุขใจ
เชฟ/เจ้าของ: ฐานิตา บุญเชิด
ร้าน: อภัยภูเบศร เดย์ สปา
สรรพคุณทางยา:
“ข้าวกะเพราสุขใจ” ผัดกะเพราถือเป็นเมนูง่าย ๆ ที่อยู่คู่กับคนไทยมาอย่างช้านาน เพราะเป็นเมนูที่ทําง่าย ใช้วัตถุดิบน้อย และมีรสชาติอร่อย หอมกลิ่นเฉพาะของใบกะเพรา นอกจากจะมีส่วนประกอบหลักของเนื้อสัตว์ที่หยิบมาปรุงซึ่งเป็นแหล่งของโปรตีนคุณภาพดีแล้ว สาร Carvacrol ที่พบในใบกะเพรามีส่วนช่วยบรรเทาอาการหวัดอีกด้วย ที่สำคัญยังมีใบกัญชาเป็นส่วนผสม ช่วยให้ผ่อนคลาย และนอนหลับได้อย่างสนิท
ที่อยู่: โรงพยาบาลเจ้าพระยาอภัยภูเบศร ตำบลท่างาม อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี 25000
Tel. 0-37211-088 ต่อ 3123,
0-37217-127
พะโล้สมุนไพรใบกัญชา LINK
วัตถุดิบ
เครื่องพะโล้ (อบเชย 1 ชิ้น กานพลู 2 ชิ้น โป๊ยกั๊ก 2 ชิ้น ลูกจันทน์เทศ 1 กรัม พริกไทย 1 กรัม) / ใบกัญชา 1 ใบ / ไข่ต้ม 1 ฟอง / เต้าหู้ 1 ชิ้น / น้ำปลา 40 กรัม / น้ำตาลโตนด 20 กรัม / ซีอิ๊วดำ 5 กรัม / ซีอิ๊วขาว 20 กรัม / รากผักชี 5 กรัม / น่องไก่ 200 กรัม
วิธีการทำ
1 ตั้งกระทะ ใส่น้ำมันลงไปเล็กน้อย แล้วใส่เครื่องพะโล้ลงไปผัดในกระทะจนมีกลิ่นหอม
2. ตั้งหม้อ ต้มน้ำ และใส่เครื่องพะโล้ลงไป แล้วใส่ใบกัญชาเมื่อน้ำเดือดได้ที่
3. ปรุงรสด้วยน้ำปลา ซีอิ๊วขาว ซีอิ๊วดำ และน้ำตาล หลังจากนั้นจึงใส่วัตถุดิบอื่น ๆ ได้แก่ น่องไก่ ไข่ต้ม และเต้าหู้ตามลงไป ต้มไฟอ่อนจนสุก
4. ยกออกจากเตา และจัดเสิร์ฟ
ความมุ่งหวังในการตั้งคณะแพทย์
ดร.กฤษณพงศ์ กีรติกร กล่าวถึงความมุ่งหวังระดับสูงในบทบาทของคณะแพทย์และโรงพยาบาล ว่า
"เนื่องจากเป็นโรงเรียนแพทย์ในมหาวิทยาลัย จึงจะต้องมีความเก่งและมีความลึกมากๆ เหมือนกับเรียกว่าเป็น Treasury Hospital เป็นโรงพยาบาลที่รับมาเป็นทอดที่สาม (ตติยภูมิ) อันนี้จะเป็น Super Treasury ผมอยากให้ดูเรื่องเอาโรงพยาบาลที่เก่ง ไปงัด พัฒนาการของโรงพยาบาลจังหวัด โรงพยาบาลอำเภอ โรงพยาบาลส่งเสริมสุขภาพตำบาล (รพ.สต.) คือใช้ความเก่งข้างบนไปงัดข้างล่างให้เก่งขึ้น ให้ดูแลประชาชนได้มากขึ้น เป็นความหวัง รวมทั้งไปสืบค้นภูมิปัญญาท้องถิ่น ในเรื่องสมุนไพร เรื่องการรักษาพยาบาล หรือ เรื่องอะไรก็ตาม"
ดร.จงรัก วัชรินทร์รัตน์ อธิการบดีฯ กล่าวถึงความมุ่งหวังของคณะแพทย์ฯ นี้ว่า
"ผมมีความหวังสูงว่า คณะแพทย์ศาสตร์ จะเป็นคณะแพทย์ที่เน้นการวิจัย โดยเฉพาะความโดดเด่นเรื่องของสิ่งมีชีวิต โรคจากสิ่งมีชีวิตสู่คน โรคจากแบคทีเรีย โรคจากไวรัส โรคจากสัตว์สู่คน โรคจากทางการเกษตร จากสารเคมีก็ดี จากอุบัติเหตุก็ดี หรือเชื้อต่างๆ ที่เข้ามาจากการเกษตร เราจะต้องโดดเด่นในประเด็นเหล่านี้ ซึ่งเป็นความรู้ดั้งเดิม เราจะต้องเป็นความภาคภูมิใจของคนไทย ว่ามีคณะแพทย์ที่มีความโดดเด่นในเรื่องดังกล่าวซึ่งน่าจะเป็นแห่งแรกๆ ของโลก
รศ.ดร.สมหวัง ขันตยานุวงศ์ กล่าวถึงความมุ่งหวังไว้ว่า
"ความคิดในการจะจัดตั้งคณะแพทย์ศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ นั้นมีนานแล้ว เรื่องของการที่จะสร้างองค์ความรู้ทางด้านการแพทย์ที่เกี่ยวข้องกับทางด้านวิชาการในด้านการเกษตร รวมทั้งการสร้างแพทย์ที่จะออกไปรับใช้สังคม ซึ่งเป็นสังคมเกษตรกรรมโดยภาพรวมของประเทศ โดยเฉพาะอย่างยิ่งในที่เราอยากจะให้ภาพของคณะแพทยศาสตร์ โรงพยาบาลมหาวิทยาลัยเกษตรศาสตร์ เป็นสถาบันอุดมศึกษาหรือเป็นสถานที่ที่ให้การรักษาพยาบาล ในการส่งเสริมสุขภาพที่สามารถจับต้องได้ ให้กับประชาชน โดยส่วนรวม ทุกภาคส่วน"
มหาวิทยาลัยเกษตรศาสตร์ เชื่อมั่นว่าการจัดตั้งคณะแพทยศาสตร์ จะพัฒนามหาวิทยาลัยเกษตรศาสตร์ ให้เป็นมหาวิทยาลัยที่มุ่งสร้างศาสตร์การแพทย์แห่งแผ่นดิน เพื่อสุขภาพที่ดีของประชาชน เป็นมหาวิทยาลัยแห่งการเรียนรู้ตลอดชีวิต รวมถึงมหาวิทยาลัยของคนทั้งโลก
ตรวจคัดกรองมะเร็งลำไส้ใหญ่
โรคมะเร็งลำไส้ใหญ่เป็นโรคมะเร็งที่พบได้บ่อยเป็นอันดับต้นๆในคนไทย และอุบัติการณ์เพิ่มขึ้นเรื่อยๆ ในปัจจุบัน การตรวจคัดกรอง โรคมะเร็งลำไส้ใหญ่อย่างสม่ำเสมอ และการตรวจหาความผิดปกติที่ลำไส้ได้ตั้งแต่ในระยะเริ่มแรก พบว่าสามารถลดอัตราการเสียชีวิตจากโรคมะเร็งลำไส้ได้อย่างชัดเจน
ดังนั้นบุคคลที่มีอายุมากกว่า 50 ปี และบุคคลที่มี พ่อ แม่ พี่ น้องลูกป่วยด้วยโรคมะเร็งลำไส้ใหญ่จึงควรได้รับการส่องกล้องตรวจลำไส้ใหญ่อย่างสม่ำเสมอ
บุคคลที่มีความเสี่ยงสูงที่จะเป็นมะเร็งลำไส้ใหญ่
- โรคมะเร็งลำไส้ใหญ่พบได้ในทุกอายุ แต่อัตราเสี่ยงของการเกิดมะเร็งลำไส้ใหญ่ จะสูงขึ้นในผู้สูงอายุ โดยจะพบได้มากหลัง อายุ 50 ปี แต่โอกาสเกิดโรคจะมีการเพิ่มสูงขึ้นเป็นลำดับ หลังอายุ 40 ปี เป็นต้นไป
- บุคคลที่มีญาติใกล้ชิดเป็นโรคมะเร็งลำไส้ใหญ่, หรือผู้ที่มีความเจ็บป่วยเรื้อรังของลำไส้บางอย่าง จะมีความเสี่ยงที่จะเป็นโรคมะเร็งลำไส้ใหญ่สูงกว่าคนทั่วไป (Crohn’s disease และ Ulcerative colitis)
- ผู้ชายและผู้หญิงมีโอกาสเกิดใกล้เคียงกัน
- มีอาการท้องผูกเป็นประจำ
- ทานเนื้อสัตว์ จำนวนมาก
- ทานผักน้อย
- ไม่ออกกำลังกาย
- สูบบุหรี่ หรือดื่มสุรา
ความเสี่ยงที่จะเป็นโรคมะเร็งลำไส้ใหญ่ ในกรณีที่มีญาติใกล้ชิดเป็นโรคมะเร็งลำไส้ใหญ่
- ถ้ามีพ่อ, แม่, พี่, น้องหรือลูก เป็นโรคนี้ 1 คน => จะมีความเสี่ยงเพิ่มขึ้น 2-3 เท่า
- ถ้ามีพ่อ, แม่, พี่, น้องหรือลูก เป็นโรคนี้ 2 คน => จะมีความเสี่ยงเพิ่มขึ้น 3-4 เท่า
- ถ้ามีพ่อ, แม่, พี่, น้องหรือลูก เป็นโรคนี้ โดยอายุของญาติที่เป็นโรคอายุน้อยกว่า 50 ปี => จะมีความเสี่ยงเพิ่มขึ้น 3-4 เท่า
- ถ้ามีพ่อ, แม่, พี่, น้อง, ลูก มีเนื้องอกที่ลำไส้ 1 คน => จะมีความเสี่ยงเพิ่มขึ้น 2 เท่า
- ถ้ามีปู่, ย่า, ตา, ยาย, ลุง, ป้า, น้า, อา เป็นโรคนี้ 1 คน => จะมีความเสี่ยงเพิ่มขึ้น 1.5 เท่า
- ถ้ามีปู่, ย่า, ตา, ยาย, ลุง, ป้า, น้า, อา เป็นโรคนี้ 2 คน => จะมีความเสี่ยงเพิ่มขึ้น 2-3 เท่า
ในตลอดช่วงสถานการณ์ของ COVID-19 ที่ผ่านมา โรงพยาบาลให้บริการ B at Home Services อาทิ บริการเจาะเลือดที่บ้าน* (Lab at Home) ด้วยมาตรฐานเสมือนมารับบริการที่โรงพยาบาล บริการฉีดวัคซีนถึงบ้าน* (*2 บริการนี้เฉพาะกรุงเทพฯ และปริมณฑล) บริการตรวจหาเชื้อ COVID-19 ที่บ้าน และบริการปรึกษาแพทย์ออนไลน์ แบบ Real-Time โดยไม่ต้องเข้ามารับบริการภายในโรงพยาบาลผ่านแอปพลิเคชันมายบีพลัส (My B+ Application) ตั้งแต่นัดหมายแพทย์แบบ real-time การปรึกษาแพทย์ ดูประวัติผลตรวจสุขภาพและข้อมูลยา ไปจนถึงข้อมูลสุขภาพอื่น ๆ ให้คุณเข้าถึงบริการด้านสุขภาพสะดวก รวดเร็ว พร้อมนำนวัตกรรมปัญญาประดิษฐ์ (AI) อย่าง Inspectra CXR ซอฟต์แวร์อัจฉริยะเพิ่มประสิทธิภาพการทำงาน เป็นผู้ช่วยแพทย์วิเคราะห์ความผิดปกติจากภาพเอกซเรย์รังสีทรวงอกได้อย่างละเอียด ชัดเจน
กรุงเทพใต้
- เขตคลองเตย 02-2497738
- เขตบางคอแหลม 083-0261885 , 083-0261891 , 083-0262496 , 083-0262742 , 083-0264889
- เขตบางนา 02-1735266
- เขตบางรัก 02-1117941
- เขตปทุมวัน 02-2143015 , 082-3177797
- เขตพระโขนง 02-3112035 , 084-6371664 , 095-7898554 , 02-3316975
- เขตยานนาวา 02-2942396
- เขตวัฒนา 02-3818930
- เขตสวนหลวง 083-0262742
- เขตสาทร 02-2128112 ต่อ 7215 , 063-0355369 , 063-9169362 , 063-3492521
ข่าวปลอม! ใบทุเรียนเทศ! สามารถนำมาใช้เป็นยารักษามะเร็งในคนได้ LINK
ตามที่มีข่าวปรากฏตามสื่อ เกี่ยวกับประเด็น ใบทุเรียนเทศสามารถนำมาใช้เป็นยารักษามะเร็งในคนได้ ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับทางสถาบันมะเร็งแห่งชาติ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีข่าวปรากฏตามสื่อเรื่อง ใบทุเรียนเทศสามารถนำมาใช้เป็นยารักษามะเร็งในคนได้ โดยระบุว่า การนำใบทุเรียนเทศมาต้มเป็นชาแล้วรับประทาน จะช่วยในการฆ่าเซลมะเร็ง ซึ่งมีประสิทธิภาพมากกว่าการทำคีโมถึง 10,000 เท่า ทางสถาบันมะเร็งแห่งชาติ กระทรวงสาธารณสุข ได้ชี้แจงถึงประเด็นนี้ว่า ยังไม่มีหลักฐานยืนยันแน่ชัดว่าใบทุเรียนเทศสามารถนำมาใช้เป็นยารักษามะเร็งในคนได้ ซึ่งแม้ว่าจะมีรายงานวิจัยส่วนหนึ่งที่ระบุว่าใบทุเรียนเทศมีฤทธิ์ทำลายเซลล์มะเร็งได้ดีกว่ายาเคมีบำบัดนั้น แต่ข้อมูลนี้เป็นเพียงงานวิจัยในระดับเซลล์ และสัตว์ทดลองเท่านั้น จึงไม่สามารถสรุปได้ว่าใบทุเรียนเทศสามารถนำมาใช้เป็นยารักษามะเร็งในคนได้
ซึ่งใบทุเรียนเทศมีสารบางชนิดที่มีฤทธิ์เป็นยาระงับปวด สามารถต้านการอักเสบ และต้านการเกิดเนื้องอก ทั้งนี้การศึกษาวิจัยในคนมีความสำคัญ และจำเป็นต้องศึกษาหลายด้าน เช่น กลไกการออกฤทธิ์ต่อเซลล์ต้นกำเนิดมะเร็ง การส่งสัญญาณภายในเซลล์ การแยกสารที่ออกฤทธิ์ชนิดต่าง ๆ การทดสอบด้านพิษวิทยาและความปลอดภัย ตลอดจนการควบคุมคุณภาพและมาตรฐานผลิตภัณฑ์ ซึ่งปัจจุบันมีผลิตภัณฑ์จากใบทุเรียนเทศวางจำหน่ายในรูปแบบต่าง ๆ ทั้งในรูปแปบ แคปซูลหรือชาชง ผู้บริโภคควรศึกษาส่วนประกอบของผลิตภัณฑ์และหากมีอาการผิดปกติควรรีบปรึกษาแพทย์ สำหรับผู้ป่วยมะเร็งควรปรึกษาแพทย์ก่อนใช้ผลิตภัณฑ์
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : ไม่มีหลักฐานยืนยันแน่ชัดว่าใบทุเรียนเทศสามารถนำมาใช้เป็นยารักษามะเร็งในคนได้
หน่วยงานที่ตรวจสอบ : สถาบันมะเร็งแห่งชาติ กระทรวงสาธารณสุข
ศูนย์สมองและระบบประสาท โรงพยาบาลกรุงเทพภูเก็ต
ศูนย์สมองและระบบประสาท รพ.กรุงเทพภูเก็ต ให้บริการตรวจรักษาโรคทางสมองและระบบประสาท โดยทีมแพทย์ผู้เชี่ยวชาญด้านระบบประสาทและหลอดเลือดสมอง และศัลยแพทย์ระบบประสาทเฉพาะทาง ให้การบำบัดรักษาร่วมกับทีมสหสาขา เช่น นักกายภาพบำบัดเฉพาะด้าน พร้อมด้วยเครื่องมือทางการแพทย์ที่มีเทคโนโลยีที่ทันสมัย เพื่อรักษาความผิดปกติของระบบประสาทและสมองอย่างครบวงจร
เวลาทำการ
ศูนย์สมองและระบบประสาท
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 17.00 น.
ติดต่อสอบถาม
โทร: 076 254 425 ต่อ 3750,
076 361 000 ต่อ 3750,
076 655 000 ต่อ 3750
โรคหรือภาวะโรค ที่ใช้กัญชาได้
กล่าวคือที่มีหลักฐานสนับสนุนประโยชน์ของการใช้สารสกัดกัญชาในการรักษาได้ สามารถใช้ยาสกัดกัญชารักษาได้อย่างมีประสิทธิผลประกอบไปด้วย
- ภาวะคลื่นไส้อาเจียนจากเคมีบำบัด
- ภาวะเบื่ออาหารในผู้ป่วยเอดส์ที่มีน้ำหนักตัวน้อย
- ภาวะปวดประสาทส่วนกลางในผู้ป่วยโรคปลอกประสาทเสื่อมแข็ง
- โรคลมชักที่รักษายากดื้อต่อยารักษา
- และผู้ป่วยที่รักษาแบบประคับประคองระยะสุดท้าย เพื่อเพิ่มคุณภาพชีวิต
Healthy Eating and Wellness Trend - นายแพทย์ ตนุพล วิรุฬหการุญ
นายแพทย์ ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก (BDMS Wellness Clinic) กล่าวว่า ปัจจุบันทั่วโลกกำลังหันมาสนใจ Healthy Eating and Wellness Trend คือ แนวทางการกินและปรับวิถีชีวิตเพื่อสุขภาพที่ดี เป็นเคล็ดลับการใช้ชีวิตในแต่ละวันอย่างมีคุณภาพ
การกินเป็นหนึ่งในกิจกรรมที่สำคัญมากๆ ของมนุษย์ การกินที่ดีสามารถทำให้มนุษย์มีสุขภาพแข็งแรง มีภูมิคุ้มกัน ใช้ชีวิตอย่างมีความสุข ในทางกลับกัน การกินที่ไม่เหมาะสมสามารถก่อให้เกิดโรคภัยไข้เจ็บได้นานับประการ การกินอาหารเป็นสิ่งที่มนุษย์สามารถควบคุมและเปลี่ยนแปลงได้ด้วยตัวเอง
ผลจากการที่มนุษย์เผชิญกับการแพร่ระบาดของไวรัสโควิด-19 ทำให้ผู้คนใส่ใจในการดูแลสุขภาพของตัวเองมากขึ้นอย่างเต็มใจ เพราะอยากใช้ชีวิตอยู่อย่างมีคุณภาพและมีความสุขในทุกๆ วัน ทำให้ Healthy Eating and Wellness Trend มาแรง เพราะหากกินดี อยู่ดี มีการพักผ่อนที่เพียงพอ จะช่วยเสริมสร้างภูมิคุ้มกัน ช่วยให้สุขภาพแข็งแรง อายุยืนยาว ส่งผลให้ ธุรกิจอาหารเพื่อสุขภาพ โดยเฉพาะ อาหารแพลนท์เบสด์ ไดเอท (Plant-based Diet) อาหารที่ทำจากพืชผักได้รับความนิยมมากขึ้น และการท่องเที่ยวเชิงสุขภาพเติบโตอย่างรวดเร็ว
ประเทศไทยจัดเป็นหนึ่งภูมิศาสตร์ที่เหมาะสมในทุก ๆ ด้านที่มีศักยภาพตอบสนองความต้องการของนักท่องเที่ยวเชิงสุขภาพได้อย่างดี เพราะมีอาหารอุดมสมบูรณ์ สถานที่ท่องเที่ยวสวยงาม ด้านการแพทย์ทันสมัย และการบริการก็มีคุณภาพ
นายแพทย์ตนุพลคาดการณ์ว่าเมื่อการแพทย์สามารถควบคุมการแพร่ระบาดของไวรัสโควิด-19ได้ ผู้คนมั่นใจเริ่มเดินทางเข้ามาท่องเที่ยวในไทย จะเป็นโอกาสที่ดีของธุรกิจการท่องเที่ยวเชิงสุขภาพในไทย และธุรกิจอื่นๆ ที่เกี่ยวข้อง จะให้บริการที่มีคุณภาพสร้างความประทับใจให้นักท่องเที่ยว ช่วยให้เศรษฐกิจไทยมีการฟื้นตัวอย่างรวดเร็ว เพื่อเป็นเส้นทางให้ประเทศไทยเป็นศูนย์กลางด้านการดูแลสุขภาพของโลกได้ในอนาคต
William E. Heinecke
Chairman of Minor International Plc.
One of the best known expatriates in Southeast Asia, Bill Heinecke is the driving force behind the leading global brands under the Minor Group umbrella. His visionary spirit, unwavering commitment and hands-on management style are the cornerstones of his unparalleled successes, which are deeply rooted in Thailand. Bill created his very first company here at the young age of 17. Today, Minor International (MINT) owns and operates a diversity companies, focused on three primary business sectors: restaurants, hotels and lifestyle retail brands. MINT operates over 2,200 restaurants, over 400 retail trading outlets, and over 535 hotels across 55 countries.
บรรยายหมอไทย จาก “หู” ถึง “สมอง”
ศาสตราจารย์ Doris Bamiou จาก โรงพยาบาลหูคอจมูกแห่งชาติอังกฤษ Royal National Throat Nose Ear Hospital, ศูนย์หูแห่งมหาวิทยาลัยแห่งกรุงลอนดอน UCL Ear Institute ได้เข้าร่วมการบรรยายให้แก่ โสต ศอ นาสิกแพทย์กว่า 300 ชีวิต ในงานประชุม “ประชุมวิชาการก้าวไกล” จัดโดย ราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย ครั้งที่ 2/2565 ในหัวข้อ “Hearing Loss - the Highest Modifiable Risk Factors for Dementia” เผยถึงความสำคัญของปัญหาการได้ยิน ซึ่งมีผลต่อสภาวะสมองเสื่อม เพราะหูเป็นอวัยวะรับเสียง แต่สมองเป็นอวัยวะที่ใช้ในการได้ยิน พร้อมกับเน้นย้ำว่าปัญหาการได้ยินและสมองเสื่อมจะมีจำนวนมากขึ้นเรื่อย ๆ และเป็นปัญหาด้านสาธารณสุขที่สำคัญที่ต้องเร่งวิจัยพัฒนาเพื่อสามารถให้บุคลากรสามารถจัดการให้ดีขึ้นได้ในอนาคต
Healthy Eating & Wellness Trend by Dr. Tanupol Virunhagarun, M.D. a regenerative doctor. He focused his topics on lifestyle and anti-aging medicine; 5 pillars of health and wellness; what to eat and not to eat, clean foods and clean eating, important nutrients and amount of nutrients that the body needs. COVID-19 rapidly reshapes consumer behaviors. The diets play a crucial role in reducing the risks of chronic diseases and lowering the complications risks of COVID-19. Consumers now pay close attention to their health and the environment. They realize that Daily Exercise, Good Sleep, Balanced Nutrition and a Peaceful Mindset are the keys to a healthy and long life. Healthy foods especially plant-based foods will be in high demand. The future of plant-based foods and wellness tourism will definitely look bright. There are several reasons why Thailand is best for wellness tourism. With its abundant food, beautiful tourist spots, very well trained doctors, the most cutting-edge medical technology as well as excellent amenities in hospitality services, Thailand is truly shines
Dr. Tanupol believes that once the spread of the COVID-19 virus is under control and borders cautiously reopen, all areas of health and wellness tourism will soon be welcoming foreign wellness tourists and Thailand’s resilience will once again be displayed to the world.
ติดตามเรื่องความรู้เรื่องก๊าซเรือนกระจก คาร์บอนเครดิต ได้กับ องค์การบริหารจัดการก๊าซเรือนกระจก (องค์การมหาชน)
เสียงสะท้อน จากประสบการณ์ตรงของผู้ป่วยมะเร็งปากมดลูก
หลายคนอาจมีข้อสงสัยว่าอาการแรกเริ่มของมะเร็งปากมดลูกเป็นอย่างไร ต้องรักษาในรูปแบบใด ใช้เวลานานแค่ไหนจึงจะหายขาด ซึ่งภายในงานเสวนา นางสมควร สระทองแก่น อดีตผู้ป่วยโรคมะเร็งปากมดลูก ได้มาร่วมแบ่งปันประสบการณ์ด้วย “เราเคยเป็นผู้ป่วยมะเร็งปากมดลูก และต้องเข้ารับการรักษาประมาณปีกว่า ตลอดชีวิตก่อนหน้านี้ไม่เคยเข้ารับการตรวจภายในมาก่อนเลย ในช่วงแรกเลยเริ่มจากการที่ประจำเดือนมาในปริมาณมากทุกวัน และมาไม่เป็นเวลา มีอาการปวดท้องหนักเมื่อประจำเดือนมา ในตอนแรกเข้าใจว่าเป็นผลข้างเคียงจากการที่อายุมากขึ้น กำลังเข้าใกล้วัยหมดประจำเดือน แต่เมื่ออาการหนักเข้าเราก็ต้องไปหาหมอ และก็ได้พบว่าตัวเองเป็นมะเร็งปากมดลูก และเข้าสู่ระยะที่สองแล้ว ณ เวลานั้นตกใจมาก ต้องตั้งสติและนั่งทบทวนว่าจะรักษาอย่างไร วิธีการแบบไหน ก็ได้ความว่าต้องเข้ารับการฉายแสงและทำคีโมเป็นประจำด้วยระยะเวลามากกว่า 1 ปี โดยมีค่าใช้จ่ายหลายแสนบาท”
3. การตรวจคัดกรองมะเร็งทั้งในเพศหญิงและเพศชาย
เนื่องจากมะเร็งมักจะไม่แสดงอาการในระยะเริ่มต้น การตรวจหาสารบ่งชี้มะเร็ง (Tumor marker) จากเลือด จึงมีส่วนช่วยคัดกรองความเสี่ยงของโรคมะเร็งบางชนิด เช่น
- ค่า Alpha-fetoprotein (AFP) ที่มักมีค่าสูงกว่าปกติในผู้ป่วยมะเร็งตับ (Hepatocellular carcinoma) รวมถึงมะเร็งของรังไข่ หรือ อัณฑะ ชนิด embryonal cell carcinoma
- ค่า Carcinoembryonic antigen (CEA) ซึ่งมักสูงผิดปกติผู้ป่วยมะเร็งของระบบทางเดินอาหารต่างๆ, มะเร็งตับอ่อน, มะเร็งปอด, มะเร็งรังไข่ มะเร็งเต้านม โดยเฉพาะ มะเร็งลำไส้ใหญ่ จะพบ ค่า CEA สูง บ่อยกว่ามะเร็งชนิดอื่นๆ
- ค่า Prostate-specific antigen (PSA) ในเพศชายเพื่อดูความเสี่ยงมะเร็งต่อมลูกหมากและภาวะต่อมลูกหมากโตที่ไม่ใช่มะเร็ง (benign prostatic hyperplasia, BPH)
- ค่า Cancer antigens (CA15-3) เพื่อคัดกรองมะเร็งเต้านมในผู้หญิง
- ค่า Cancer antigens (CA125) เพื่อคัดกรองมะเร็งรังไข่ชนิด non-mucinous type
- ค่า Cancer antigens (CA19-9) เพื่อคัดกรองมะเร็งตับอ่อน และมะเร็งของท่อน้ำดี
การตรวจคัดกรองมะเร็งอื่นๆ ได้แก่
การตรวจแปปสเมียร์ (Pap Smear หรือ Pap Test) เพื่อคัดกรองมะเร็งปากมดลูก โดยแพทย์จะใช้เครื่องมือสอดเข้าไปในช่องคลอด เพื่อเก็บเซลล์จากมดลูกส่งตรวจทางห้องปฏิบัติการเพื่อตรวจหาเซลล์ที่ผิดปกติ หรือเซลล์ที่อาจพัฒนากลายเป็นเซลล์มะเร็ง รวมถึงการตรวจหาเชื้อไวรัส HPV (Human papillomavirus) ซึ่งเพิ่มความเสี่ยงการเกิดมะเร็งปากมดลูกได้
EDIM (Epitope Detection in Monocytes) เป็นหนึ่งในเทคโนโลยีที่ช่วยในการคัดกรองความเสี่ยงมะเร็งในระยะเริ่มแรก (Early detection cancer) โดยใช้การตรวจเซลล์เม็ดเลือดขาวชนิดโมโนไซต์ที่ถูกกระตุ้นกลายเป็นแมคโครฟาจ (macrophage) ซึ่งทำหน้าที่จับกินสิ่งแปลกปลอมทั่วร่างกาย ไม่ว่าจะเป็น แบคทีเรีย เซลล์เสื่อมสภาพ รวมถึงเซลล์มะเร็ง จึงสามารถพบชิ้นส่วนของเซลล์ที่ผิดปกติอยู่ภายในเซลล์แมคโครฟาจได้ ส่วนสำคัญในวิธีการตรวจวัดนี้จะใช้ตัวบ่งชี้ 2 ตัว คือ DNaseX และ TKTL1 Gene เพื่อนำมาคำนวณเป็นคะแนน ใช้ดูความเสี่ยงของการมีเซลล์ผิดปกติที่มีโอกาสพัฒนาไปเป็นเซลล์มะเร็งได้
4. วัตถุประสงค์
1) เพื่อเพิ่มประสิทธิภาพและผลสัมฤทธิ์ของงานภาครัฐ มีการพัฒนาคุณภาพการให้บริการให้สะดวก รวดเร็ว โดยลดข้อจำกัดด้านเวลาและสถานที่ในการให้บริการประชาชน มีการทบทวนกระบวนการปฏิบัติราชการและปรับเปลี่ยนวิธีการทำงานให้สะดวก รวดเร็ว ลดความแออัดตลอดจนออกแบบและปรับปรุงการบริการภาครัฐรูปแบบใหม่ที่มีประชาชนเป็นศูนย์กลาง
2) เพื่อให้การบริหารทรัพยากรบุคคลภาครัฐเกิดความยืดหยุ่นและคล่องตัว สอดคล้องกับสถานการณ์การทำงานวิถีใหม่ หรือกรณีสถานการณ์ไม่ปรกติ ฉุกเฉิน หรือเหตุวิกฤติอื่น ๆ โดยใช้เทคโนโลยีดิจิทัลสนับสนุนการปฏิบัติงาน เพื่อเป็นการสร้างคุณภาพชีวิตและการทำงาน ตลอดจนส่งเสริมแรงจูงใจในการปฏิบัติราชการของข้าราชการและเจ้าหน้าที่ของรัฐ
ใจดีจริงจริง
ธรรมชาติสวยงาม สะอาด สงบ ปลอดภัย กลางใจเมืองนราธิวาส
สถานที่ : อำเภอเมืองนราธิวาส จังหวัดนราธิวาส
โรงแรมตันหยง
สะอาด สะดวก สบาย สวยงาม กลางใจเมือง
สถานที่ : อำเภอเมืองนราธิวาส จังหวัดนราธิวาส
กรีนวิว บูติก โฮเต็ล
สะอาด สงบ สะดวก สะบาย
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
เวนิส พาเลซ
ผ่านมาตรฐาน CFS SHA+
สถานที่ : อำเภอสุไหงโก-ลก จังหวัดนราธิวาส
อิมพีเรียล นราธิวาส
ผ่าน SHA+ TSC2+
สถานที่ : อำเภอเมืองนราธิวาส จังหวัดนราธิวาส
โรงแรม Meliá Koh Samui
Our picture-perfect resort Meliá Koh Samui fronts the powder white sands and aquamarine waters of secluded Choeng Mon Beach, nestled into the north-eastern tip of Koh Samui island in the Gulf of Thailand. The first property in Thailand launched under Spanish hotel group Meliá Hotels International, M...
สถานที่ : อำเภอเกาะสมุย จังหวัดสุราษฎร์ธานี
ดูก็องวิลเลจ
-
สถานที่ : อำเภอสิเกา จังหวัดตรัง
บัดดี้ โอเรียนทอล ริเวอร์ไซด์
อกจากที่พักจะได้รับการรับรองมาตรฐาน SHA ที่พักยังมีบริการ Wi-Fi ฟรีในทุกห้องพัก และที่จอดรถฟรี ที่พักตั้งอยู่ในย่านสนามบินนานาชาติดอนเมืองของกรุงเทพ ผู้เข้าพักจึงได้อยู่ใกล้สถานที่ท่องเที่ยวน่าสนใจและร้านอาหารอร่อยๆ ทริปยังไม่จบถ้าไม่ได้แวะไปที่เที่ยวชื่อดังอย่าง วัดพระเชตุพนวิมลมังคลาราม (วัดโพธิ์)...
สถานที่ : อำเภอปากเกร็ด จังหวัดนนทบุรี
โนโวเทล กรุงเทพ ฟิวเจอร์พาร์ค รังสิต
โรงแรมโนโวเทล กรุงเทพ ฟิวเจอร์พาร์ค รังสิต ตั้งอยู่ในทำเลที่เหมาะสำหรับทั้งนักเดินทางทั้งติดต่อธุรกิจหรืออท่องเที่ยว ซึ่งจะช่วยให้สามารถใช้เวลาทำงานหรือพักผ่อนอย่างรื่นรมย์ได้อย่างคุ้มค่า โดยอยู่ห่างจากห้างสรรพสินค้าฟิวเจอร์พาร์ค รังสิต ซึ่งเป็นห้างสรรพสินค้าชั้นนำที่ใหญ่ที่สุดแห่งหนึ่งในเอเชีย ด้...
สถานที่ : อำเภอธัญบุรี จังหวัดปทุมธานี
โรงแรมไชยแสง วิลล่า
โรงแรมไชยแสงวิลล่า CHAISAENG VILLA สัมผัสบรรยากาศการพักผ่อนที่สะดวกสบาย กับห้องพักที่เพรียบพร้อมด้วยเครื่องอำนวยความสะดวกครบครัน ไชยแสงวิลล่า โรงแรมขนาด 69 ห้อง ตั้งอยู่ในตัวเมืองจังหวัดสิงห์บุรี ติดกับถนนสายสิงห์บุรี-อ่างทอง บริการห้องพักอย่างมีระดับ ทั้งแบบ Standard และ V.I.P. พร้อมด้วยมาตรฐานควา...
สถานที่ : อำเภอเมืองสิงห์บุรี จังหวัดสิงห์บุรี
โรงแรมกรุงศรีริเวอร์
โรงแรมกรุงศรีริเวอร์ได้รับมาตรฐานการรับรองมูลนิธิใบไม้เขียว ลดการใช้โฟม และพลาสติก
สถานที่ : อำเภอพระนครศรีอยุธยา จังหวัดพระนครศรีอยุธยา
โรงแรมศุภาลัย ป่าสัก รีสอร์ท แอนด์ สปา
ด้วยระยะทางเพียง 124 กม. จากกรุงเทพฯ-สระบุรี คุณจะได้พบกับรีสอร์ทธรรมชาติ ณ โค้งน้ำที่สวยที่สุดของแม่น้ำป่าสัก บนอาณาบริเวณ 183 ไร่ สามารถรองรับแขกได้มากถึง 600 ท่าน กว่า 2,000 บริษัทชั้นนำพิสูจน์แล้วว่า โรงแรมศุภาลัย ป่าสัก รีสอร์ท แอนด์ สปา เหมาะเป็นสถานที่สำหรับจัดกิจกรรม ประชุ มสัมมนา และอื่น...
สถานที่ : อำเภอแก่งคอย จังหวัดสระบุรี
นารายณ์ไอยรา พาเลซ
โรงแรมคุณภาพดีมีมาตรฐาน ย่านใจกลางเมือง จังหวัดลพบุรี "สงบ สะอาด บรรยากาศบ้านเราเอง"
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
ลพบุรีอินน์ รีสอร์ท
พร้อมรองรับท่านด้วยห้องพักเดี่ยว สไตล์รีสอร์ท 76 ห้อง แบ่งเป็น 3 ประเภทได้แก่ Standard Deluxe Suite สัมผัสบรรยากาศเงียบสงบ ห้องพักสุดหรู ที่ได้รับการตกแต่งเป็นอย่างดี พร้อมสิ่งอำนวยความสะดวกครบครัน สระว่ายน้ำขนาดใหญ่ ใกล้ห้างสรรพสินค้าชั้นนำของลพบุรี
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
เดอะ เทมโป ลพบุรี
ที่พักสะอาด พนักงานบริการดี มีบริการอาหารเช้าที่อร่อย สภาพแวดล้อมและบรรยากาศโดยรอบดี ร่มรื่น ปลอดโปร่ง และยังมีสวนนดอกไม้ไว้สำหรับให้ผู้ใช้บริการได้ถ่ายรูปสวยๆ ไว้เก็บเป็นที่ระลึกได้อีกด้วยค่ะ
สถานที่ : อำเภอเมืองลพบุรี จังหวัดลพบุรี
ทินิดี โฮเต็ล บางกอก กอล์ฟ คลับ
ทินิดี โฮเต็ล บางกอก กอล์ฟ คลับ ได้รับการรับรองมาตรฐานด้านความปลอดภัยและสุขอนามัย (SHA Plus+) จากการท่องเที่ยวแห่งประเทศไทย ซึ่งมอบให้กับสถานประกอบการที่ผู้ประกอบการและพนักงานในสถานประกอบการนั้น ได้รับการฉีดวัคซีนครบ 3 เข็มแล้วมากกว่าร้อยละ 70 ควบคู่กับมาตรฐาน Safe Travels จาก World Travel & Tourism...
สถานที่ : อำเภอเมืองปทุมธานี จังหวัดปทุมธานี
ชลพฤกษ์ รีสอร์ท
ต้อนรับท่านด้วยบรรยากาศที่อบอุ่น สัมผัสกับความงดงามของธรรมชาติที่แท้จริง เหมาะสำหรับการพักผ่อน หรือทำกิจกรรม และการจัดประชุมสัมมนาตั้งแต่ 30-1,000 ท่าน โดยมีห้องพักหลากหลายรูปแบบให้เลือก จำนวนมากกว่า 400 ห้อง พร้อมกันนี้ ยังมีสระว่ายน้ำ ,ห้องสปา ร้านกาแฟ ร้านอาหารริมสวน และ โครงการโคกหนองนาโมเดล "ธ...
สถานที่ : อำเภอบ้านนา จังหวัดนครนายก
วีรันดา รีสอร์ท แอนด์ วิลล่า หัวหิน ชะอำ
You won’t need to wear your crown jewels to this beachfront hotel in Hua Hin, but expect to be treated like royalty. Located on a private swathe of sand once frequented by kings and queens, it’s as exclusive—but laid back—as you can get. Lined with casuarina trees, the shores of Cha-Am are quiet, s...
สถานที่ : อำเภอชะอำ จังหวัดเพชรบุรี
เอซ ออฟ หัวหิน รีสอร์ท
เอซ ออฟ หัวหิน รีสอร์ท เป็นรีสอร์ทแนวไลฟ์สไตล์สุดหรู ติดชายหาดสำหรับนักเดินทางที่ค้นหาสุดยอดประสบการณ์แห่งการพักผ่อนแบบสุดคูลบนชายหาดชะอำ-หัวหิน ตื่นตาตื่นใจกับสถาปัตยกรรมและภูมิทัศน์ของโรงแรมที่มีเอกลักษณ์ โดดเด่น เหมาะกับการถ่ายรูปเก๋ ๆ เท่ ๆ เพื่อแชร์ไลฟ์สไตล์ที่น่าอิจฉาของคุณในโลกโซเชียล รวมถึงส...
สถานที่ : อำเภอชะอำ จังหวัดเพชรบุรี
เดอะ ปาลายานา หัวหิน
ให้บริการพูลวิลล่าขนาดกว้างขวางและสุดแสนพิเศษหลากหลายห้อง พร้อมให้คุณได้เลือกสรร อีกทั้งยังมีสระว่ายน้ำ, สปา, ฟิตเนส และ Kid’s club สำหรับเเด็ก
สถานที่ : อำเภอชะอำ จังหวัดเพชรบุรี
เอลมาสชะอำ ดีไซน์ โฮเท็ล
เอลมาส ชะอำ ดีไซน์โฮเท็ล (Elmas Cha-Am Design Hotel) เพชรเม็ดงามแห่งใหม่ ใกล้ชายหาดชะอำ เอลมาส ชะอำ ดีไซน์โฮเท็ล เป็นโรงแรมแห่งใหม่ มาตรฐาน 4 ดาว ที่อยู่ไม่ไกลจากชายหาดชะอำ/หัวหิน ใช้เวลาในการเดินทางจาก กทม. ประมาณ 2.5-3 ชั่วโมง ระยะทาง 186 กิโลเมตร และอยู่ห่างชายหาดชะอำเพียง 500 เมตร ด้วยรูปลักษณ์ด...
สถานที่ : อำเภอชะอำ จังหวัดเพชรบุรี
ดับเบิ้ลทรี บาย ฮิลตัน สุขุมวิท กรุงเทพฯ
โรงแรมดับเบิ้ลทรี บาย ฮิลตัน สุขุมวิท กรุงเทพฯ เป็นโรงแรมระดับพรีเมี่ยม ตั้งอยู่บนถนนสุขุมวิทซอย 26 ซึ่งเป็นศูนย์กลางทางธุรกิจที่สำคัญ รวมถึงแหล่งช้อปปิ้ง และความบันเทิงที่หลากหลายของกรุงเทพฯ นอกจากนี้ โรงแรมยังตั้งอยู่ไม่ไกลจากรถไฟฟ้าบีทีเอส สถานีพร้อมพงษ์ และอยู่ห่างจากสนามบินนานาชาติสุวรรณภูมิราว...
เขตคลองเตย จังหวัดกรุงเทพมหานคร
ฮิลตัน สุขุมวิท กรุงเทพฯ
โรงแรมฮิลตัน สุขุมวิท กรุงเทพฯ เป็นโรงแรมหรูระดับ 5 ดาวที่ตั้งอยู่ในแหล่งศูนย์กลางความเจริญของถนนสุขุมวิท โดยอยู่ใกล้กับแหล่งธุรกิจ แหล่งบันเทิงและช็อปปิ้ง ซัมมิทคือห้องประชุมขนาดย่อมที่ถูกตกแต่งเป็นห้องนั่งเล่นพร้อมห้องครัวในสไตล์นิวยอร์กเพ็นเฮ้าส์ โดยภายในแบ่งออกเป็น 3 ห้องย่อยที่ติดตั้งอุปกรณ์อำน...
เขตคลองเตย จังหวัดกรุงเทพมหานคร
เรือนช่อฟ้า
อยู่ใจกลางเมืองหนองบัวลำภู เดินทางสะดวกใกล้แหล่งท่องเที่ยว
สถานที่ : อำเภอเมืองหนองบัวลำภู จังหวัดหนองบัวลำภู
ภูฟ้ารีสอร์ต
โรงแรมราคาประหยัด บรรยากาศธรรมชาติ
สถานที่ : อำเภอเมืองหนองบัวลำภู จังหวัดหนองบัวลำภู
แทนซิโน
โรงแรมมาตรฐาน SHA Extra Plus ห้องพักกว้าง ปลอดภัย เดินทางสะดวก
สถานที่ : อำเภอเมืองหนองคาย จังหวัดหนองคาย
รอยัลนาคารา
โรงแรมอยู่กลางเมือง ห่างจากสะพานไทย-ลาว 1.5 กม. ห่างจากสถานีรถไฟ 1 กม. มีห้องพักห้องประชุมให้บริการ มีเครื่องอำนวยความสะดวกครบครัน ผ่านมาตรฐาน SHA PLUS /covid free setting
สถานที่ : อำเภอเมืองหนองคาย จังหวัดหนองคาย
โรมแรมเจ.พี.เอ็มเมอรัลด์
บรรยากาศธรรมชาติ เป็นกันเอง
สถานที่ : อำเภอเมืองยโสธร จังหวัดยโสธร
เดอะกรีนปาร์คแกรนด์
บรรยากาศธรรมชาติ
สถานที่ : อำเภอเมืองยโสธร จังหวัดยโสธร
สไมล์ บัฟฟาโล่ รีสอร์ท
ที่พักชัยนาทวิวนา
สถานที่ : อำเภอมโนรมย์ จังหวัดชัยนาท
การปลูกถ่ายกระจกตา ทางออกของการแก้ปัญหาการมองเห็น


สาเหตุที่ทำให้กระจกตาขุ่น เป็นฝ้าขาว บวมขึ้น หรือ ทำให้กระจกตาโค้งเบี้ยวผิดรูปร่างไป ที่พบได้บ่อยในต่างประเทศ ได้แก่ โรคความเสื่อมของเซลล์กระจกตาด้านในจากพันธุกรรม เซลล์ด้านในของกระจกตามีหน้าทำให้กระจกตาใสโดยการควบคุมน้ำในกระจกตา เมื่อเสื่อมจึงทำให้กระจกตาบวม หนา เป็นฝ้าได้ และโรคกระจกตาโก่งย้วย ที่อาจจะสัมพันธ์กับภูมิแพ้ที่ไม่ได้ควบคุม ทำให้ขยี้ตามาเป็นระยะเวลานาน จนเกิดภาวะกระจกตาอ่อนแอ บางลง และโก่งเบี้ยวผิดรูปไป ส่วนในประเทศไทยจะพบกระจกตาขุ่นจากแผลติดเชื้อที่กระจกตาได้บ่อยกว่า ซึ่งอาจเกิดจากการทำงาน การใส่คอนแทคเลนส์ที่ไม่ได้ดูแลให้ดี หรือการขี่มอเตอร์ไซค์ที่ไม่ใส่หมวกกันน็อค ซึ่งจะช่วยป้องกันศีรษะและดวงตา อีกสาเหตุที่พบบ่อย คือ กระจกตาเสื่อมบวมภายหลังการผ่าตัดตาที่ซับซ้อน นอกจากนั้น กระจกตาเสื่อมจากพันธุกรรม หรือกระจกตาขุ่นผิดปกติตั้งแต่กำเนิด ก็พบได้ไม่น้อยเช่นกัน ทั้งหมดล้วนมีผลทำให้เกิดแผลเป็นฝ้าขาวที่กระจกตา กระจกตาบวมหรือความโค้งที่ผิดรูปร่างไป ซึ่งจะทำให้เกิดการสูญเสียการมองเห็นได้อย่างรุนแรง ซึ่งหลายๆ โรคก็สามารถแก้ไขได้ โดยการ "การปลูกถ่ายกระจกตา" เพื่อให้กระจกตากลับมาใส และมองเห็นได้อีกครั้งหนึ่ง
โอไมครอนสายพันธุ์ย่อยมีการรีไซเคิลตำแหน่งการกลายพันธุ์ของโอไมครอนดั้งเดิม เช่นในตำแหน่ง “R346, L452, K444, F486, N460”
จุดเริ่มต้นในการเปิดศูนย์วินิจฉัยภาวะดื้อต่อโบทูลินัมท็อกซิน - รศ.ดร.นพ.ยุทธนา ศรีนวลประเสริฐ
รศ.ดร.นพ.ยุทธนา ศรีนวลประเสริฐ ภาควิชาวิทยาภูมิคุ้มกัน คณะแพทยศาสตร์ ศิริราชพยาบาล กล่าวเสริมว่า “การทดสอบเพื่อตรวจวัดปริมาณแอนติบอดีต่อโบทูลินัมท็อกซินนั้นได้ผ่านกระบวนการพัฒนา และการตรวจสอบความถูกต้องทางคลินิก จนสามารถนำมาให้บริการทางคลินิกในการช่วยเหลือคนไข้ได้ จึงเป็นจุดเริ่มต้นในการเปิดศูนย์วินิจฉัยภาวะดื้อต่อโบทูลินัมท็อกซิน ซึ่งศูนย์ฯ ดังกล่าวเป็นการบูรณาการระหว่างคลินิกและปรีคลินิก เพื่อดูแลรักษาคนไข้โดยใช้ข้อมูลทางด้านคลินิก เช่น ประวัติการฉีดโบทูลินัมท็อกซินของคนไข้ว่าเคยฉีดชนิดใดบ้าง ปริมาณมากน้อยเพียงใด ลักษณะการไม่ตอบสนอง เพื่อหาแนวทางการรักษาของคนไข้แต่ละคนได้อย่างมีประสิทธิภาพ อีกทั้งยังเป็นการสนับสนุนการทำงานของแพทย์ในการเลือกวิธีรักษาหรือเลือกโบทูลินัมท็อกซินได้ อย่างเหมาะสม ทำให้คนไข้สามารถกลับมาฉีดได้อีกครั้งอย่างปลอดภัย”
ตารางกิจกรรมลอยกระทงเมืองพัทยา
เลือกเที่ยวได้ตามใจ ใกล้ที่ไหนสนุกที่นั่น
การศึกษา ความสามารถพิเศษ และได้รับการจ้างงาน
การศึกษา
น้องเริ่มเข้าโรงเรียนอนุบาล โดยมีครูการศึกษาพิเศษช่วยดูแลการเล่นกับเพื่อน รวมทั้งให้กำลังใจแก่ครอบครัว โดยเน้นฝึกส่งเสริมพัฒนาการเรื่องการพูด และช่วงเวลาเหนื่อยที่สุดก็คือ วัยเด็ก
ถ้าเราพยายามฝึกให้มาก เขาจะมีพัฒนาการในทิศทางที่ดีขึ้นเรื่อยๆ
เรียนอนุบาลถึงมัยมศึกษาปีที่ 1-3 โรงเรียนชาญวิทย์
เรียนมัธยมศึกษาปีที่ 4-6 โรงเรียนบริบูรณ์ศึกษา
สามารถอ่านออกเขียนได้ในระดับพื้นฐาน
หลังจบมัรยมศึกษาปีที่ 6 ได้เริ่มเข้าโครงการจ้างงานที่สถาบันราชานุกูล
ขณะที่เรียนชั้นประถมศึกษา คุณแม่พาไปฝึกว่ายน้ำเพื่อให้กล้ามเนื้อแขนขาแข็งแรง และคล่องแคล่วมากขึ้น สามารถเคลื่อนไหวร่างกายได้
ความสามารถพิเศษ
เป็นนักกีพาว่ายน้ำ ชอบการแสดงเต้นรำและเดินแบบ ได้รับคัดเลือกเป็นตัวแทนของมูลนิธิ Five for all ไปเดินแบบตามงานสำคัญต่างๆเสมอ ด้วยอุปนิสัยที่เข้ากับคนอื่นได้ง่าย คุยเก่ง กล้าแสดงออก มีความมั่นใจในตนเอง ทำให้ภพเป็นที่รู้จักและเป็นที่รักของบุคลากรที่ทำงานร่วมกัน
รวมทั้งผู้รับบริการของสถาบันด้วย
การทำงาน
ภพได้รับการจ้างงาน โดยปฏิบัติงานที่กลุ่มงานการพยาบาลผู้ป่วยนอก สถาบันราชานกูล โดยมีหน้าที่รับ-ส่งแฟ้มเอกสาร พาผู้ป่วยไปรับบริการที่หน่วยงานต่างๆ ภายในสถาบัน
ภพสามารถช่วยแบ่งเบางานบริการได้เป็นอย่างดี สามารถทำงานที่ทำอยู่ประจำได้โดยไม่ต้องตักเตือน รู้จักมาตามเวลานัดหมาย ปฏิบัติตามกฎระบียบในการทำงาน และรับผิดชอบต่องานที่ได้รับมอบหมายได้ดี แต่งกายเรียบร้อยเหมาะสม อารมณ์ดียิ้มแย้มแจ่มใส ไม่มีพฤติกรรมก้าวร้าว
รองศาสตราจารย์ ดร.ศิริรัตน์ หิรัญรัตน์ ผู้อำนวยการโรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพกล่าวว่า หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ เป็นหลักสูตรแรกและหลักสูตรเดียวในประเทศไทยในปัจจุบันนี้ โดยจุดเด่นของหลักสูตรคือ นักศึกษาจะมีความเชี่ยวชาญในการวิเคราะห์ความเคลื่อนไหว และสามารถที่จะออกแบบโปรแกรมการออกกำลังกาย รวมถึงให้คำแนะนำด้านอาหาร และการพักผ่อน ที่เหมาะสมสำหรับแต่ละบุคคลได้เป็นอย่างดี โดยจะเน้นที่การดูแลสุขภาพและวิเคราะห์ความเคลื่อนไหวของผู้สูงอายุ เพื่อให้เกิดสังคมสูงวัยที่มีคุณภาพชีวิตที่ดี
สำหรับ นักศึกษาที่จบหลักสูตรฯ นี้ไปสามารถประกอบอาชีพในหน่วยงานภาครัฐและเอกชน โรงพยาบาล ศูนย์เวชศาสตร์ฟื้นฟู ศูนย์สุขภาพ และสโมสรกีฬา และเพื่อตอบรับกับโจทย์แห่งอนาคตของประเทศไทย นั้นคือ สังคมสูงวัย ก็มีอาชีพแห่งอนาคตรองรับ โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพสอนให้วิเคราะห์การเคลื่อนไหวและออกแบบโปรแกรมการเคลื่อนไหวเพื่อสร้างเสริมสุขภาพให้เหมาะสมได้สำหรับทุกช่วงอายุ
นอกจากนั้น ทางสถาบันยังมีแผนที่จะเปิดหลักสูตรเพิ่มเติม เป็นระดับปริญญาโทและหลักสูตรประกาศณียบัตร 1 ปีในเร็วๆ นี้ โดยจะเปิดกว้างสำหรับคนที่จบในสาขาที่เกี่ยวข้อง คนที่ต้องการต่อยอดงานวิจัย หรือต้องการเพิ่มความเชี่ยวชาญให้สอดคล้องกับอาชีพที่ทำอยู่ เพื่อผลิตบุคลากรที่มีความรู้ ความสามารถและเชี่ยวชาญในด้านการวิเคราะห์ความเคลื่อนไหวและสุขภาพให้มีมากยิ่งขึ้น สอดรับกับการก้าวเข้าสู่สังคมสูงวัยของประเทศไทย อีกทั้งจะมีการเปิดห้องปฏิบัติการวิทยาศาสตร์ความเคลื่อนไหวและสุขภาพ ซึ่งในช่วงแรกนี้เน้นการให้บริการด้านวิชาการ ให้เป็นศูนย์บริการตรวจสุขภาพและวิเคราะห์ความเคลื่อนไหวสำหรับบุคคลทั่วไปด้วย
สำรวจสวน 15 นาที ถนนราษฎร์ร่วมใจ
สำรวจสวน 15 นาที ถนนราษฎร์ร่วมใจ ซอยประชาร่วมใจ 62 พื้นที่ 3 ไร่ 3 งาน 45 ตารางวา กรรมสิทธิ์ที่ดินกระทรวงมหาดไทย (บึงทรายกองดิน) เป็นพื้นที่จะสร้างสวนใหม่ อยู่ระหว่างการปรับปรุงพื้นที่
ปัจจุบันในพื้นที่เขตคลองสามวา มีสวน 3 แห่ง ได้แก่
1.สวนวารีภิรมย์ บริเวณซอยประชาร่วมใจ 47 พื้นที่ 121 ไร่ 3 งาน 38 ตารางวา ภายในสวนประกอบด้วย ทางจักรยาน ถนนวิ่งออกกำลังกาย
2.สวนสิริภิรมย์ บริเวณซอยประชาร่วมใจ 5 พื้นที่ 32 ไร่ 1 งาน 33 ตารางวา ภายในสวนประกอบด้วย ทางจักรยาน/วิ่งออกกำลังกาย อุปกรณ์ออกกำลังกาย
3.สวนสามวาพนานุรักษ์ บริเวณซอยสามวา 24 พื้นที่ประมาณ 2 ไร่ ภายในสวนประกอบด้วย ลานสเก็ตบอร์ด หอสมุด ทางวิ่งออกกำลังกาย สวนกล้วย 43 สายพันธุ์ และปลูกต้นไม้ที่ขึ้นต้นด้วยคำว่า “มะ” เช่น มะเกลือ มะพลับ มะพูด สวนดังกล่าวเป็นสวนสาธารณะเปิด ไม่มีประตูเปิด-ปิด อยู่สุดทางถนนสามวา จึงเป็นจุดเสี่ยงภัยอาชญากรรม
ทั้งนี้ รองผู้ว่าราชการกรุงเทพมหานคร ได้มอบหมายให้เขตฯ เพิ่มความถี่ในการจัดเจ้าหน้าที่เทศกิจตรวจตราดูแลความปลอดภัย ย้ายตู้เขียวจากด้านหน้าทางเข้าสวน ไปติดตั้งด้านในของสวน หาแนวทางในการติดตั้งไฟส่องแสงสว่างเพิ่มเติม
“ส่วนกลุ่มคนไข้ติดเตียงที่ช่วยเหลือตัวเองไม่ได้ ยิ่งต้องประเมินว่านอนติดเตียงเพราะอะไร สามารถรักษาให้หายหรือดีขึ้นจนไม่นอนติดเตียงได้หรือไม่ แต่หากเป็นโรคเรื้อรังที่ไม่สามารถรักษาให้กลับมาเดินได้เหมือนเดิม ก็ต้องเน้นการดูแลเพื่อป้องกันไม่ให้เกิดภาวะแทรกซ้อน เช่น การบริหารกล้ามเนื้อไม่ให้ลีบฝ่อ บริหารข้อไม่ให้ยึดติด การป้องกันแผลกดทับ รวมไปถึงการทำความสะอาดตามร่างกายไม่ให้อับชื้น ป้องกันการเกิดเชื้อราที่ผิวหนัง อีกทั้งควรหากิจกรรมช่วยกระตุ้นสมองไม่ให้สมองเสื่อมและถดถอยอีกด้วย”
การปรับที่พักอาศัยสำหรับผู้สูงอายุที่ติดบ้านก็เป็นเรื่องสำคัญ เพื่อป้องกันการพลัดตกหกล้มซึ่งถือเป็นสาเหตุที่ทำให้ผู้สูงอายุกลายเป็นผู้ป่วยติดเตียงหรือเสียชีวิตได้ ดังนั้น ลูกหลานจึงต้องดูแลตั้งแต่ทางเดินเข้าบ้าน ไม่ควรใช้วัสดุที่ลื่น มีราวจับตลอดทางเดิน ห้องน้ำควรแยกส่วนเปียกและส่วนแห้งออกจากกัน โถชักโครกไม่ควรอยู่ในระดับที่ต่ำมากเกินไปทำให้ลุกลำบาก ควรมีราวจับเพื่อช่วยในการพยุงตัว ตลอดจนควรมีที่นั่งทั้งเวลาอาบน้ำและที่นั่งขณะแต่งตัว ไฟในห้องน้ำหรือระหว่างทางเดินก็ถือเป็นสิ่งที่สำคัญมากเช่นเดียวกัน
ทำบุญกับโรงพยาบาลสงฆ์ ลดหย่อนภาษีได้ 2 เท่า
บัญชีธนาคารกรุงไทย จำกัด (มหาชน) สาขาถนนศรีอยุธยา บัญชี ฝากออมทรัพย์ เลขที่ 013-1-85026-1 ชื่อบัญชี เงินบริจาคบำรุงโรงพยาบาลสงฆ์
ส่งหลักฐานการโอนเงินบริจาคพร้อมชื่อที่อยู่เพื่อขอใบเสร็จรับเงิน ที่เบอร์แฟกซ์ 02-6409537 หรือ www.priest-hospital.go.th/Donate/SendPaymentSlip หรือ เบอร์โทรติดต่อ 02-640-9537 ถึง 46 ต่อ 1326
เพจ รพ.สงฆ์
www.facebook.com/ ภายในสถาบันการแพทย์จักรีนฤบดินทร์ ประกอบด้วยอาคารสำคัญ ดังนี้ โรงพยาบาลรามาธิบดีจักรีนฤบดินทร์ อาคารศูนย์การเรียนรู้และวิจัยเฉลิมพระเกียรติฯ อาคารปรีคลินิกและศูนย์วิจัย อาคารกายวิภาคคลินิก ศาลาประชาคม และพิพิธภัณฑ์รามาธิบดี หอพักนักศึกษา และอาคารนันทนาการ
สถาบันการแพทย์จักรีนฤบดินทร์แห่งนี้ได้ก่อตั้งขึ้นด้วยน้ำใจของคนไทยที่บริจาคมาทางมูลนิธิรามาธิบดีฯ โดยได้นำเงินบริจาคนำไปจัดสรรเพื่อสนับสนุนการจัดซื้ออุปกรณ์การรักษาจำนวนมาก ได้แก่ ห้องธาราบำบัด หุ่นยนต์ฝึกเดินห้องกระตุ้นประสาทสัมผัส เครื่องซีทีสแกน เครื่อง Digital Subtraction Angiography ห้องเรียน Simulation Center ห้องเรียนกายวิภาคศาสตร์ ตลอดจนอุปกรณ์การเรียนการสอนที่ทันสมัยและเป็นนวัตกรรมใหม่ที่มีราคาสูง ได้แก่ Anatomage table (เตียงผ่าตัดกายวิภาคเสมือนจริง) zSpace AIO Pro และ zSpace Laptop (เครื่องแสดงเทคโนโลยีภาพสามมิติเสมือนจริง) อันเป็นเครื่องมือสำคัญช่วยบ่มเพาะเมล็ดพันธุ์รามาธิบดีให้เป็นบุคลากรการแพทย์ที่มีจิตวิญญาณและมีศักยภาพดูแลผู้ป่วยต่อไปในอนาคต
นับว่า “การให้” ของทุกคนได้สร้าง “ผลลัพธ์แห่งการให้” ที่เป็นรูปธรรมนั่นก็คือ “การที่คนไทยมีสุขภาพที่ดี” มูลนิธิรามาธิบดีฯ ขอเชิญทุกคนร่วมเป็นสานต่อการให้ไม่สิ้นสุดไปด้วยการร่วมบริจาคสมทบทุนโครงการต่างๆ ทาง
www.ramafoundation.or.th โทร 02-201-1111 LINE @Ramafoundation
อาหารไม่หวาน ก็ก่อเบาหวานได้ จริงหรือ?
อาหารบางประเภทแม้ไม่มีรสหวาน แต่หากรับประทานในปริมาณมากจะถูกปรับเปลี่ยนเป็นน้ำตาลเพิ่มความเสี่ยงต่อการเป็นเบาหวานได้
FC ผู้ว่า จัดว่าหนาแน่นเหมือนเดิม
บางแค Deliveryเก็บให้ถึงที่...เก็บฟรี ถึงบ้าน LINK
บางแค Delivery เก็บให้ถึงที่...เก็บฟรี‼️ ถึงบ้าน
อาทิตย์ที่ 6 พฤศจิกายน 2565 ณ ชุมชนศิริเกษม1 เขตบางแค ตั้งแต่เวลา 09.00 น. เป็นต้นไป
สอบถามเพิ่มเติมได้ที่ ฝ่ายรักษาความสะอาดฯ เบอร์โทร 0 2454 5808 ในเวลาราชการ
คลองสาน รับสมัครอาสาสมัครพัฒนาชุมชน(ด้านเทคโนโลยี) 34 อัตรา LINK
สำนักงานเขตคลองสาน เรื่อง รับสมัครสอบคัดเลือกบุคคลภายนอกเพื่อแต่งตั้งเป็นอาสาสมัครพัฒนาชุมชน ประจำปีงบประมาณ 2566 จำนวน 34 ชุมชน (ชุมชนละ 1 อัตรา)
คุณสมบัติทั่วไป
- สัญชาติไทย
- อายุตั้งแต่ 18 ปีขึ้นไป
- มีวุฒิการศึกษาไม่ต่ำกว่ามัธยมศึกษาตอนต้น
- มีความรู้ทักษะด้านเทคโนโลยี การใช้อินเทอร์เน็ต และการใช้งานคอมพิวเตอร์เบื้องต้น
- มีภูมิลำเนาอยู่ในชุมชนหรือพักอาศัยในชุมชนนั้น ๆ โดยประธานหรือรองประธานกรรมการชุมชน เป็นผู้รับรอง อย่างน้อย 1 คน
อัตราค่าจ้าง
ปฏิบัติงานในชุมชน ไม่น้อยกว่าวันละ 8 ชั่วโมง จำนวน 4 วัน/เดือน
อัตราค่าจ้างรายวัน วันละ 300.- บาท (1,200.- บาท/เดือน)
รายละเอียดคุณสมบัติ และเอกสารหลักฐานการสมัคร ตามรายละเอียดที่แจ้งนี้
ผู้สนใจ สามารถยื่นใบสมัครด้วยตนเอง พร้อมหลักฐาน ได้ตั้งแต่วันนี้ - 22 พฤศจิกายน 2565 (ในวันและเวลาราชการ)
ประกาศรายชื่อผู้มีสิทธิสอบ ในวันที่ 28 พฤศจิกายน 2565
กำหนดสอบคัดเลือก ในวันที่ 8-9 ธันวาคม 2565 เวลา 09.00 - 16.00 น.
สอบถามเพิ่มเติม : ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม ชั้น 4 สำนักงานเขตคลองสาน ☎ 0 2437 5279 ต่อ 5086-7
ให้ความสนใจกับสินค้าท้องถิ่น (International Localism)
“ท่ามกลางความไม่แน่นอนจำนวนมากในทั่วทุกมุมโลก เราจะเห็นความพยายามในการปกป้องทรัพยากรและสนับสนุนธุรกิจในท้องถิ่น นี่เป็นผลกระทบที่หลงเหลืออยู่จากสถานการณ์การแพร่ระบาด และยังเป็นสิ่งที่สะท้อนถึงความเปลี่ยนแปลงทางความคิดของผู้บริโภคเกี่ยวกับสิ่งที่สำคัญต่อพวกเขา การเชื่อมต่อกับท้องถิ่นยังช่วยให้ผู้บริโภคสามารถควบคุมการเงิน ผลกระทบต่อสิ่งแวดล้อม และผลกระทบต่อจิตใจ ในขณะที่พวกเขาได้ตอบแทนสังคมไปด้วย
“ผู้บริโภคมักจะสนับสนุนผู้ผลิตที่มีถิ่นกำเนิดจากท้องถิ่น รวมถึงแบรนด์ที่ประทับความเป็นของแท้ดั้งเดิมในสิ่งที่ตนผลิตและจำหน่าย แนวคิด ‘ท้องถิ่นนิยม’ จะหมายถึงการสนับสนุนชุมชนที่ผลิตสินค้านั้น ๆ มากกว่าที่ ๆ ผู้บริโภคอยู่ และในอีกไม่กี่ปีข้างหน้า ผู้บริโภคจะมีความต้องการในการตรวจสอบย้อนกลับไปถึงวัตถุดิบและความโปร่งใสของแบรนด์เกี่ยวกับวิธีที่แบรนด์อนุรักษ์ทรัพยากรในท้องถิ่นมากขึ้น”
13 พ.ย. 65 ปรับปรุงประกาศ ก.สธ. เรื่อง สมุนไพรควบคุม (กัญชา)
ปรับปรุงประกาศ ก.สธ. เรื่อง สมุนไพรควบคุม (กัญชา)
- กรณี นพ.สมิทธิ์ ศรีสนธิ์ นายกสมาคมแพทย์นิติเวชแห่งประเทศไทยและกรรมการแพทยสภา ร่วมกับ ส.ส.พรรคฝ่ายค้านยื่นต่อศาลปกครองเรียกร้องให้ยกเลิกประกาศกระทรวงสาธารณสุข เมื่อ 8 ก.พ. 2565 โดยให้ "พืชกัญชา" กลับเข้าไปอยู่ในรายชื่อยาเสพติดให้โทษในประเภทที่ 5 ขณะที่นายวิษณุ เครืองาม รองนายกรัฐมนตรี ได้แนะนำให้สธ. ออกประกาศมาควบคุมให้เข้มงวดจะดีกว่าการแก้ไขกฎหมายแล้วเอากัญชากลับไปเป็นยาเสพติดประเภทที่ 5 นั้น
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ให้สัมภาษณ์ว่า เข้าใจถึงความหวังดีของนายวิษณุ และขอบคุณที่ให้คำแนะนำ ทางคณะกรรมการคุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย ได้นำคำแนะนำดังกล่าวมาหารือในที่ประชุมและมีมติให้ปรับปรุงประกาศสมุนไพรควบคุมฉบับเดิม ที่ประกาศไปเมื่อ 16 มิ.ย. 2565 เมื่อผ่านความเห็นเรียบร้อยแล้ว ในฐานะ รมว.สธ. จึงได้ลงนามในประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ. 2565 เพื่อให้เกิดการป้องกันอย่างครอบคลุมและยังคงใช้ประโยชน์จากพืชกัญชาได้สูงสุด โดยการปรับปรุงประกาศสมุนไพรควบคุมจากที่คุมกัญชาทั้งต้น เป็นการคุมเฉพาะช่อดอกกัญชา โดยมีข้อกำหนดว่า หากจะนำช่อดอกกัญชาไปใช้เพื่อศึกษา จำหน่ายหรือแปรรูป ให้ขออนุญาตกับกรมแพทย์แผนไทยฯ ก่อน ห้ามจำหน่ายให้กับเด็ก คนท้อง นักศึกษา รวมถึงห้ามขายออนไลน์ ตู้อัตโนมัติ และห้ามโฆษณา คล้ายคลึงกับเนื้อหาที่ถูกกำหนดในร่าง พ.ร.บ.กัญชาฯ มีความครอบคลุมและชัดเจนที่สุด รองรับทุกข้อห่วงใย ส่วนกรณี นพ.สมิทธิ์ ร่วมกับพรรคฝ่ายค้าน ตนไม่เคยรู้จักและไม่ทราบว่าเป็นใคร สอบถามทาง ศ.เกียรติคุณ พญ.สมศรี เผ่าสวัสดิ์ นายกแพทยสภา และ พล.อ.ท.นพ.อิทธพร คณะเจริญ เลขาธิการแพทยสภา ยืนยันว่าพฤติกรรมของ นพ.สมิทธิ์ เป็นพฤติกรรมส่วนตัวและไม่ได้รับความเห็นชอบใด ๆ จากแพทยสภา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยและการแพทย์ทางเลือก กล่าวถึงประเด็นการออกประกาศสมุนไพรควบคุมกัญชา ฉบับปรับปรุงว่า เป็นการปรับปรุงจากฉบับเดิมที่คุมเข้มกัญชาทั้งต้น ทำให้การนำไปใช้ประโยชน์เพื่อการแพทย์ สุขภาพและเศรษฐกิจทำได้ยาก ซึ่งมีการคาดไว้ว่าเมื่อมี พ.ร.บ.กัญชาฯ ก็จะยกเลิกประกาศฉบับเดิม แต่ขณะนี้ร่างพ.ร.บ.กัญชาฯ ยังไม่สมบูรณ์ จึงต้องมีการควบคุมกัญชาพร้อมกับยังสามารถนำไปใช้ประโยชน์ได้ ดังนั้น เมื่อเรามีข้อมูลมากขึ้น มีความเห็นของผู้เชี่ยวชาญที่ทำงานด้านกัญชา จึงได้ปรับปรุงประกาศสมุนไพรควบคุมแบบการควบคุมเพียงช่อดอกกัญชาส่วนอื่นที่ไม่ใช่ช่อดอกก็ไม่ต้องขออนุญาตในการนำไปใช้ประโยชน์โดยเนื้อหาล้อมาจากร่าง พ.ร.บ.กัญชาฯ เป็นหลัก กำหนดว่าหากจะนำไปศึกษา จำหน่ายหรือแปรรูปเพื่อการค้า จะต้องขออนุญาตก่อน อย่างไรก็ตาม ประกาศฉบับปรับปรุงจะไม่กระทบต่อประชาชนที่ขึ้นทะเบียนปลูกกัญชาในระบบ "ปลูกกัญ" ของ อย. แต่หากปลูกแล้วจะทำการค้า ต้องขออนุญาตกรมแพทย์แผนไทยฯ
- นพ.เอกชัย เพียรศรีวัชรา รองอธิบดีกรมอนามัย กล่าวว่า ส่วนอื่นของกัญชาที่นอกเหนือจากประกาศควบคุมช่อดอก เช่น ใบกัญชา กรมอนามัยได้ออกประกาศ สธ. เมื่อ 2 เดือนที่ผ่านมา ควบคุมสถานประกอบการ ร้านอาหารที่ใช้กัญชาเป็นส่วนผสมต้องแสดงเมนูที่มีกัญชาเป็นส่วนผสมชัดเจน มีคำแนะนำในการบริโภค กลุ่มต้องห้ามรับประทาน หากฝ่าฝืนมีโทษตาม พ.ร.บ.การสาธารณสุข เจ้าพนักงานตามกฎหมาย คือ บุคลากรสังกัด สธ. ในระดับพื้นที่ ร่วมกับเจ้าหน้าที่ท้องถิ่นดำเนินการตรวจสอบเอาผิดได้นอกจากนี้กรมอนามัยยังออกคำแนะนำเกี่ยวกับปริมาณส่วนผสมของกัญชาในเมนูอาหารเครื่องดื่ม กรณีวางขายใบกัญชาตามท้องถนนที่เคยเป็นข่าว จะมีการเอาผิดทางร้าน ฐานไม่ถูกสุขลักษณะ ดังนั้นถือว่าการควบคุมการใช้กัญชาครอบคลุมทั้งต้นอยู่แล้ว
- นพ.อรรถพล แก้วสัมฤทธิ์ รองอธิบดีกรมอนามัย กล่าวว่า กรมอนามัยยังคงเน้นย้ำให้ผู้ประกอบการร้านอาหารที่ใช้กัญชาในการประกอบ ปรุงอาหาร ต้องปฏิบัติตามหลักเกณฑ์ที่กำหนดตามประกาศ สธ. อย่างเคร่งครัด หากเจ้าพนักงานตามกฎหมายพบการกระทำที่ฝ่าฝืนประกาศ สธ. สามารถดำเนินการตามขั้นตอนของกฎหมาย มีโทษปรับไม่เกิน 50,000 บาท
- นายศุภชัย ใจสมุทร ส.ส.บัญชีรายชื่อ พรรคภูมิใจไทย ในฐานะประธาน กมธ.วิสามัญพิจารณา ร่าง พ.ร.บ.กัญชา กัญชง (ฉบับที่) พ.ศ. กล่าวภายหลังนายอนุทิน ออกประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม (กัญชา) ระบุว่า เป็นการก้าวข้ามเรื่องการเมือง เพื่อประโยชน์ประชาชน
- พล.อ.ท.นพ.อิทธพร คณะเจริญ เลขาธิการแพทยสภา ได้โพสต์ข้อความผ่านเฟซบุ๊กส่วนตัวว่า "ประกาศกระทรวงสาธารณสุข เรื่องสมุนไพรควบคุม (กัญชา) พ.ศ.2565 ลงวันที่ 11 พฤศจิกายน 2565 ขอบคุณท่านอนุทิน และเพื่อความปลอดภัย คงต้องมีรายละเอียดอื่น ๆ ตามมาอีกมากมาย เพื่อควบคุมส่วนอื่น ๆ ของกัญชา
- นายสุทิน คลังแสง ส.ส.มหาสารคาม พรรคเพื่อไทย ในฐานะประธานคณะกรรมการประสานงานพรรคร่วมฝ่ายค้านกล่าวถึงกรณี สธ. ออกประกาศควบคุมกัญชา ห้ามขายออนไลน์และผ่านตู้อัตโนมัติ ว่า การห้ามขายถือว่าโอเค แต่ไม่ได้เป็นมาตรการป้องกันการเสพที่ได้ผล เพราะเด็กที่เสพอาจไปปลูกหรือครอบครัวปลูกแล้วเสพเอง ถือเป็นช่องว่างสำคัญ ถ้าจะใช้เพื่อการแพทย์จริง ๆ ควรนำกัญชากลับไปเป็นยาเสพติดเหมือนเดิม แล้วใช้ประกาศ สธ. เมื่อปี 63 อนุญาตให้นำมาใช้ทางการแพทย์ได้
ตาราง Group D
| |
Group D |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
ฝรั่งเศส |
3 |
2 |
0 |
1 |
6 |
3 |
3 |
6 |
| 2 |
ออสเตรเลีย |
3 |
2 |
0 |
1 |
3 |
4 |
-1 |
6 |
| 3 |
ตูนิเซีย |
3 |
1 |
1 |
1 |
1 |
1 |
0 |
4 |
| 4 |
เดนมาร์ค |
3 |
0 |
1 |
2 |
1 |
3 |
-2 |
1 |
รศ.นพ.สุรศักดิ์ ลีลาอุดมลิปิ ผู้อำนวยการโรงพยาบาลรามาธิบดี
ด้านรศ.นพ.สุรศักดิ์ ลีลาอุดมลิปิ ผู้อำนวยการโรงพยาบาลรามาธิบดี กล่าวว่า “ปัจจุบันโรงพยาบาลรามาธิบดี มีผู้ป่วยเข้ารับการรักษาเฉลี่ยกว่า 2 ล้านครั้งต่อปี ซึ่งจำนวนไม่น้อย เป็นผู้ป่วยยากไร้หรือผู้ป่วยที่ต้องการความช่วยเหลือเรื่องทุนทรัพย์ รวมถึงผู้ป่วยที่เป็นโรคที่สิทธิพื้นฐานไม่ครอบคลุมและผู้ป่วยที่จำเป็นต้องใช้ยาหรืออุปกรณ์การแพทย์บางรายการนอกเหนือบัญชียาหลักแห่งชาติ ด้วยความเชื่อมั่นในหลักสิทธิมนุษยชน โครงการเพื่อผู้ป่วยยากไร้ จึงไม่เพียงเป็นการให้ความช่วยเหลือและดูแลผู้ป่วยตามมาตรฐานสถานพยาบาล แต่ยังเป็นอีกความมุ่งมั่นสำคัญของโรงพยาบาลรามาธิบดี เพื่อผลักดันให้เกิดความก้าวหน้าทางการแพทย์และสาธารณสุข และสร้างโอกาสในการเข้าถึงการรักษาอย่างเต็มประสิทธิภาพให้กับคนไทยทุกคน”
แคมเปญ “ความสุขจากการให้...ไม่สิ้นสุด” เป็นอีกหนึ่งโครงการที่รวบรวมเสียงแทนคำขอบคุณของเหล่าผู้ป่วยภายใต้โครงการเพื่อผู้ป่วยยากไร้ที่ได้รับการช่วยเหลือด้านค่ารักษาพยาบาลจากน้ำใจของคนไทย ที่ได้เปลี่ยนเงินบริจาคเป็นพลังให้ผู้ป่วยเหล่านี้มีกำลังใจในการต่อสู้กับโรคร้ายต่อไปได้ รวมถึงยังเป็นการสร้างความสุขให้แก่ครอบครัวและคนใกล้ชิดอีกด้วย ด้วยโอกาสดีใกล้ช่วงเทศกาลปีใหม่นี้มูลนิธิรามาธิบดีฯ จึงขอเชิญชวนผู้มีจิตศรัทธาร่วมส่งมอบความสุข...ที่ไม่สิ้นสุดผ่านการบริจาคเพื่อสนับสนุนโครงการเพื่อผู้ป่วยยากไร้ รวมถึงโครงการอื่น ๆ ภายใต้มูลนิธิรามาธิบดีฯ เพื่อร่วมกันสร้างความสุขทั้งผู้ให้และผู้รับ อย่างไม่สิ้นสุด
Festival in the Park
Festival in the Park (Festival: Happy hour - Happy ground) ส่วนจัดกิจกรรมในมิติชีวิตคนเมืองโดยเปลี่ยนฉากหลังเป็นธรรมชาติ เพื่อให้คนหันมาหวงแหนธรรมชาติมากขึ้น อาทิ Curated Cuisine การมีบาร์ลับในกรุง นิทรรศการชั่วคราว ศิลปะการจัดวาง การจัดแสดงแสง-เสียง จุดฉายภาพยนตร์ งานดนตรีในสวน และงานแสดงสดจากกลุ่มศิลปิน
นอกจากนี้โรงเรียนกายอุปกรณ์สิรินธร ยังได้ช่วยเหลือผู้ป่วยผู้พิการที่ยากไร้ โดยได้รับความร่วมมือและการสนับสนุน ผ่านกิจกรรมขององค์กรเอกชนต่างๆ ด้วยดีเสมอมา
นาย เชาวลิต เอกบุตร กรรมการบริหารมูลนิธิเอสซีจี กล่าวว่า เจตนารมณ์มุ่งมั่นของมูลนิธิคือ “เชื่อมั่นในคุณค่าของคน” เราจึงมีกิจกรรมโครงการต่าง ๆ ที่สอดคล้องกับสถานการณ์และสภาพความจำเป็นของสังคม โดยในปีนี้มูลนิธิเอสซีจี ร่วมกับศิริราช เปิดโครงการ“เป๋าบุญ หนุนขา” สมทบกองทุนกายอุปกรณ์เพื่อผู้พิการ โดยผู้บริจาคจะได้รับกระเป๋าเอนกประสงค์ที่ผลิตจากถุงปูนซีเมนต์ที่ยังไม่ผ่านการใช้งานเป็นของที่ระลึก ซึ่งกระเป๋าดังกล่าวตัดเย็บโดยกลุ่มคนไร้ที่พึ่งที่ได้รับการส่งเสริมอาชีพและสร้างรายจากกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ทุกการบริจาคจึงเป็นการให้บุญต่อบุญ
นางกนกพร รอดรุ่งเรือง ผู้ช่วยกรรมการผู้จัดการใหญ่บริหารชื่อเสียงองค์กรและกิจการเพื่อสังคม บริษัท ปตท. จำกัด (มหาชน) กล่าวว่า ในฐานะบริษัทพลังงานแห่งชาติ หนึ่งในพันธกิจคือพัฒนาสังคมและคุณภาพชีวิตของคนไทยให้เติบโตไปด้วยกัน ปตท.จึงสนับสนุนงบประมาณเพื่อปรับปรุงพื้นที่อาคารโรงเรียนกายอุปกรณ์สิรินธรตามหลักการออกแบบเพื่อคนทั้งมวลเพื่อให้เหมาะสมกับผู้ป่วยพร้อมยกระดับคุณภาพชีวิตของผู้พิการตามเจตนารมย์ของโรงเรียนฯ
นางพักร์วิมล สตะเวทิน รองกรรมการผู้จัดการ ฝ่ายอีคอมเมิร์ซ บริษัท เซ็นทรัล ฟู้ด รีเทล จำกัด ในเครือเซ็นทรัล รีเทล กล่าวว่า “ท็อปส์” มีเจตนารมย์ที่จะดำเนินธุรกิจเคียงคู่กับการเอาใจใส่สังคมในทุกมิติ จึงจัดทำโครงการต่าง ๆ ร่วมกับคณะแพทยศาสตร์ ศิริราชพยาบาลอย่างต่อเนื่องตั้งแต่ปี 2560 สำหรับการสนับสนุนโครงการระดมทุนโรงเรียนกายอุปกรณ์สิรินธร เป็นอีกหนึ่งความตั้งใจของท็อปส์ ที่ต้องการมีส่วนร่วมสร้างความเท่าเทียม สร้างโอกาสการเข้าถึงบริการทางการแพทย์ และ สร้างคุณภาพชีวิตที่ดีให้กับผู้ป่วยที่ด้อยโอกาส โดยปีใหม่นี้ท็อปส์ได้จัดกระเช้าของขวัญภายใต้แนวคิด Every Day DISCOVERY ส่งมอบความสุขที่ยิ่งใหญ่ผ่านแคมเปญ “Celebrating the Future” เพื่อให้กระเช้าของขวัญปีใหม่ มีคุณค่าและมีความหมายในการให้มากขึ้น ‘ท็อปส์’ จึงขอเป็นตัวกลางส่งคืนความสุขสู่สังคม โดยรายได้ส่วนหนึ่งจากการจำหน่ายกระเช้าของขวัญปีใหม่ ตั้งแต่ 1 พฤศจิกายน 2565 – 31 มกราคม 2566 จะร่วมสมทบทุนเพื่อการผลิตแขนขาเทียม โรงเรียนกายอุปกรณ์สิรินธร พร้อมเชิญชวนลูกค้าของท็อปส์ทุกคนร่วมกันส่งต่อความสุขไปด้วยกันผ่านกล่องบริจาค และ สแกนคิวอาร์โค้ดได้ที่ ท็อปส์, ท็อปส์ ฟู้ด ฮอลล์, ท็อปส์ ไฟน์ ฟู้ดส์, ท็อปส์ คลับ และแฟมิลี่มาร์ท ทุกสาขา
นายอาณัติ เมฆไพบูลย์วัฒนา รองประธานคณะกรรมการบริหาร ของ บมจ. ทรู คอร์ปอเรชั่น ในนามบริษัท เครือเจริญโภคภัณฑ์ จำกัด กล่าวว่า เครือเจริญโภคภัณฑ์และทรู คอร์ปอเรชั่น พร้อมสนับสนุนแคมเปญ “กายอุปกรณ์...เชื่อมใจให้ไปต่อ” อันจะเป็นส่วนหนึ่งของการส่งเสริมให้โรงเรียนกายอุปกรณ์สิรินธรสามารถดำเนินงานได้อย่างยั่งยืน โดยนำศักยภาพความเป็นสื่อ ร่วมประชาสัมพันธ์โครงการระดมทุนผ่านสื่อต่างๆ ของเครือฯ เปิดช่องทางระดมทุนผ่านแอปพลิเคชัน ทรูมันนี่ วอลเล็ท ที่มีผู้ใช้บริการครอบคลุมทุกเครือข่าย และจัดทำแคมเปญรณรงค์รับบริจาค รวมไปถึงผลักดันไอเดียในการระดมทุนให้แก่โรงเรียน
Set D Happy Wellness Set
Set D Happy Wellness Set
ราคา 2,900 (จากราคาปกติ 3,330 บาท) พร้อมกระเป๋าผ้าลายพิเศษ จาก NaRaYa
ประกอบไปด้วย Calcium-LT Plus แคลเซียม – แอลที พลัส จำนวน 1 กล่อง ตอบโจทย์คนรักสุขภาพมากยิ่งขึ้นด้วย แคลเซียม แอล - ทรีโอเนต ที่สามารถดูดซึมเข้าร่างกายได้ถึง 95% มากกว่าแคลเซียมทั่วไปถึง 9 เท่า และส่วนผสมจากคอลลาเจนไทพ์ทู ทางเลือกใหม่ในการดูแลกระดูกและข้อ พร้อมทั้ง App Fast โปรตีนพืช จำนวน 1 กล่อง เป็นโปรตีนสกัดจากพืช 4 ชนิด พร้อมสารอาหารที่มีประโยชน์ที่จำเป็นต่อการเจริญเติบโตและช่วยซ่อมแซมส่วนที่สึกหรอของร่างกาย มีกรดอะมิโนจำเป็นครบถ้วน ช่วยเสริมสร้างและคงสภาพของมวลกล้ามเนื้อ รับประทานง่าย ด้วยรสชาติวานิลลา
มาลาก้า สเปน
กำหนดจัดงาน ระหว่าง 5 มิถุนายน - 5 กันยายน 2027
ธีมงาน The Urban Era: towards the Sustainable City
UN ระบุว่าในปี 2050 ประชากรโลกกว่า 3 ใน 5 จะอาศัยอยู่ในเขตเมือง เช่นนั้นแล้ว สังคมเมืองจะมีโฉมหน้าอย่างไร จะปรับตัวและพัฒนาไปในทิศทางใด เพื่อรับมือกับสารพัดปัจจัยและปัญหาที่ไม่อาจเลี่ยงได้ และความหนาแน่นของสังคมเมืองระดับนั้น จะอยู่ร่วมกันกับการพิทักษ์สิ่งแวดล้อมและการประยุกต์ใช้เทคโนโลยีได้อย่างไร มาลาก้ามุ่งจะนำเสนอแพลตฟอร์มการใช้ชีวิต อันเกิดจากการแลกเปลี่ยนเรียนรู้ ด้วยนวัตกรรมอันมีแบบแผน เพื่อหาคำตอบว่า อนาคตที่แท้ของสังคมเมืองนั้น จะมีรูปโฉมอย่างไร แพลตฟอร์มที่เสมือนเป็นเบ้าหลอมของแนวคิด แนวปฏิบัติ หลักการ ข้อเสนอ ก่อเป็นโอกาสที่เอื้อต่อการสะท้อนทัศนะและถกเถียงอย่างสร้างสรรค์ แน่นอนว่าหลักคิดของธีมของมาลาก้า ได้วางให้สอดคล้องไปในทิศทางเดียวกับวาระการพัฒนาอย่างยั่งยืนที่ UN 2015-2030 ได้วางไว้
Website:
expo2027.malaga.eu
Facebook:
malaga2027ดนตรีในสวน H.M.SONG อว. บรรเลงเพลงเพื่อพ่อ 5 ธันวาคม 2565 วิทยาลัยชุมชนพังงา
วิทยาลัยชุมชนพังงา ... ขอเชิญทุกท่านรับชมและฟัง #ดนตรีในสวน "H.M.SONG อว. บรรเลงเพลงเพื่อพ่อ" ... ในวันที่ 5 ธันวาคม 2565 เวลา 16.00-18.30 น. .. ฟัง 48 บทเพลงพระราชนิพนธ์ในรัชกาลที่ 9 ณ สวนสมเด็จพระศรีนครินทร์ อ.เมืองพังงา เพื่อน้อมรำลึกในพระมหากรุณาธิคุณฯ
สารกันรา (กรดซาลิซิลิค)
สารกันราหรือ กรดซาลิซิลิค salicylic acid เป็นกรดอินทรีย์ชนิดหนึ่ง ที่ใช้เป็นวัสดุในการทำเครื่องสำอาง และการผลิตยาบางชนิด สูตรเคมีคือ C6H4OH.COOH มีลักษณะเป็นผลึกสีขาวมีจุดหลอมเหลว 159 องศาเซลเซียส มีสมบัติยับยั้งการเจริญเติบโตของจุลินทรีย์ได้ดี แต่เป็นอันตรายต่อมนุษย์ เป็นสารที่ห้ามใช้ในอาหาร แต่มีการนำสารชนิดนี้ใส่ในน้ำดองผักผลไม้เพื่อให้ดูใสเหมือนใหม่อยู่เสมอ กระทรวงสาธารณสุขจึงได้กำหนดห้ามนำมาใส่เจือปนในอาหาร ปัจจุบันยังตรวจพบกรดซาลิซิลิคในอาหารหลายชนิด เช่น แหนม หมูยอ ผักผลไม้ดองจำพวก มะม่วงดอง ผักกาดดอง มะกอกดอง มะดันดอง ขิงดอง ก๊งฉ่าย เกี๊ยมฉ่าย ไชโป้ และหน่อไม้อัดปี๊บถ้าผู้บริโภคได้รับสารกันราหรือกรดซาลิซิลิคจนมีความเข้มข้นในเลือดปริมาณ 25ถึง 35 มิลลิกรัม ต่อเลือด 100 มิลลิลิตร จะมีอาการอาเจียน หูอื้อ มีไข้และอาจถึงตายได้
ในเมื่อมีการนำสารกันราหรือกรดซาลิซิลิคมาเจือปนในอาหารจึงต้องมีการตรวจสอบเพื่อดูว่าอาหารบางชนิดที่มีจำหน่ายทั่วไปมีการลักลอบใช้สารกันราหรือไม่ กรมวิทยาศาสตร์การแพทย์ ได้จัดทำชุดทดสอบกรดซาลิซิลิค(สารกันรา)ในอาหาร เพื่อให้นำไปใช้ทดสอบได้เอง
ในชุดทดสอบจะมีน้ำยาทดสอบสองชนิด หลอดหยดและภาชนะที่ใส่ตัวอย่างสำหรับการทดสอบให้ครบถ้วน น้ำยาทดสอบ 1 คือ สารละลายกรดซาลิซิลิค น้ำยาทดสอบ 2 คือ สารละลายเฟอร์ริคคลอไรด์ (FeCl3) วิธีการทดสอบสามารถทำได้ตามคำแนะนำซึ่งมีขั้นตอนต่าง ๆ หลายขั้น แต่ใช้เวลาเพียงไม่กี่นาทีก็จะทราบได้ว่า ผลไม้ดองหรือผักดองนั้นมีสารกันราหรือกรดซาลิซิลิคเจือปนอยู่หรือไม่
คุณสิตาพัชญ์ รุจิธันยพัชร์ เจ้าหน้าที่วางแผนกลยุทธ์อาวุโส บริษัท ฮาคูโฮโด อินเตอร์เนชั่นแนล (จำกัด) ชี้ประเด็นอ้างอิงจากผลสำรวจแนวโน้มความต้องการในการใช้จ่ายของคนไทยในเชิง insight พบความสนใจอยู่ 4 ประเด็น
1. แนวโน้มการใช้จ่ายสูงทุกสถิติ
2. สาวๆ เอ็นจอยมากขึ้น
3. คนกรุงเทพ ตื่นเต้น
4. งานไว้ก่อน ขอพักกายใจก่อน
ดูเเลสุขภาพคุณผู้ชาย
กับโปรแกรมตรวจคัดกรองมะเร็งรายโรค ด้วยการตรวจคัดกรองมะเร็ง เพื่อหารอยโรคก่อนเป็นตั้งแต่ระยะแรกเพื่อลดความเสี่ยงต่อการเกิดโรคร้าย รู้ตัวเร็ว ป้องกันไว
- ตรวจคัดกรองมะเร็งทางโลหิต ราคา 2,600 บาท
- CT Scan Whole Body ตรวจเอกซเรย์คอมพิวเตอร์ ตั้งเเต่ศีรษะ-ช่องท้อง ราคา 19,999 บาท (จากราคา 32,000 บาท)
วันนี้ - 31 ธันวาคม 2565
โรงพยาบาลเชียงราย ราม LINK
โรงพยาบาลเชียงรายราม (เดิมคือโรงพยาบาลเชียงรายอินเตอร์) โรงพยาบาลเอกชนขนาดกลางจำนวน 59 เตียง เครือโรงพยาบาลรามคำแหง กลางเมืองเชียงราย เปิดให้บริการ 24 ชั่วโมง และเริ่มเปิดรับผู้ประกันตนประกันสังคม เป็นปีแรก สอบถามข้อมูลเพิ่มเติม โทร.053-719-719 , 062-130-8988
- 123 หมู่ 26 ถ.พหลโยธิน ต.รอบเวียง.อ.เมิองเชียงราย จ.เชียงราย 57000
- โทร.053-719-719 , 062-130-8988
- แผนที่
- facebook
COUNTDOWN 2023 @เซ็นทรัล อยุธยา แลนด์มาร์กเคานต์ดาวน์ที่ใหญ่ที่สุดในอยุธยา
มาปลดปล่อยความมันส์ ฉลองกันแบบข้ามปี ส่งท้ายปีเก่าไปกับคอนเสิร์ตจากศิลปินชื่อดังตลอดทั้ง 5 วัน พร้อมชมพลุสุดยิ่งใหญ่ใจกลางเมืองอยุธยาในคืน Countdown เข้าสู่ปี 2023 ไปด้วยกัน!
27 ธ.ค. 65 : TANGMO WALAYUPATH (The Voice All Stars)
28 ธ.ค. 65 : MELON FANG X MIZZ RAMON
29 ธ.ค. 65 : THE PARKINSON
30 ธ.ค. 65 : CLASH
31 ธ.ค. 65 : SPRITE, ICEACE, DON KIDS
COUNTDOWN 2023
วันที่ 27-31 ธันวาคม 2565
ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล อยุธยา
สิ่งอำนวยความสะดวกในห้องพักคู่ ศูนย์อายุรวัฒน์ 1 (อาคาร9) ชั้น 9
- เตียงผู้สูงอายุปรับได้ชนิด 3 กลไก
- เตียงพักญาติ
- *เครื่องทำน้ำอุ่น *เครื่องปรับอากาศ *ตู้เย็น (*ใช้ร่วมกัน)
- ทั้ง 2 อาคาร จัดพื้นที่ส่วนกลาง เครื่องกรองน้ำ น้ำร้อน และไมโครเวฟ ไว้ให้บริการ
Health is Wealth
ภายในงานยังมอบความรู้แก่ประชาชนเพื่อนำกลับไปดูแลตนเอง ในหัวข้อ Health is Wealth คือ The power of Transformation คือพลังของการเปลี่ยนตัวคุณให้เป็นคนใหม่ที่มั่งคั่งด้วยวิธีการดูแลแบบยั่งยืน, รู้ทันโรคด้วย 8 สัญญาณความเสื่อม โดย พญ. กอบกาญจน์ ชุณหสวัสดิกุล การดูแลสุขภาพลำไส้เพื่อป้องกันการเป็นมะเร็ง โดย ศ.พญ. วโรชา มหาชัย รู้ทันก่อนสายภูมิต้านทานแก่ได้ถ้าไม่ป้องกันโดย นพ.กรธัช อชิรรุจักร แพทย์อายุรกรรมโลหิตวิทยา ดูแลฮอร์โมนอย่างไรให้สูงวัยแบบไม่แปรปรวน โดย นพ.สิทธิชัย ภิญโญพจนารถ และภัยเงียบของช่องปากฟันไม่ดีส่งผลให้ป่วยเรื้อรังโดยรศ.ทพ.ดร. สรสัณห์ รังสิยานนท์ แพทย์ผู้ชำนาญการศูนย์ทันตกรรม
รางวัล Creativity Awards
สำหรับรางวัล Creativity Awards ตกเป็นของ ทีม Dentograft จากเครือโรงพยาบาพญาไท-เปาโล ได้รับรางวัลมูลค่า 10,000 บาท
ซึ่งโรคหัวใจบางกลุ่มบางชนิด อาจมีความเชื่อมโยงกับพันธุกรรม แต่บางโรคบางภาวะ เช่น ภาวะหัวใจห้องบนสั่นพลิ้ว (atrial fibrillation) ซึ่งกรรมพันธุ์ในปัจจุบันนี้เริ่ม advance ขึ้น มีการกลายพันธุ์เกิดขึ้น ปัจจุบันทางโรงพยาบาลบำรุงราษฎร์ และโรงพยาบาลจุฬาลงกรณ์ ร่วมกับมหาวิทยาลัยอื่นๆ ก็ได้ร่วมกันทำ Whole Genome Sequencing เทคโนโลยีถอดรหัสพันธุกรรมนำมาใช้ในการวิเคราะห์ DNA (สารพันธุกรรม) หาความเสี่ยงในการเกิดโรค และก็มีผลงานตีพิมพ์ขึ้นมา
Related Package ประเมินความเสี่ยง โรคหลอดเลือดหัวใจ
แพ็กเกจเพื่อประเมินภาวะหัวใจล้มเหลว
สำหรับแพคเกจนี้จะช่วยในการประเมินอาการและภาวะหัวใจล้มเหลว เพื่อใช้ในการพิจารณาแนวทางการดูแลรักษาอย่างองค์รวมโดยทีมสหสาขาวิชาชีพของโรงพยาบาลบำรุงราษฎร์
Heart Screening Echo or Treadmill
แพ็กเกจ Heart Screening Echo or Treadmill : เหมาะสำหรับคนที่ไม่มีอาการ
Heart Screening Stress Echo
แพ็กเกจ Heart Screening Stress echo : เหมาะสำหรับคนที่มีอาการเช่น เจ็บหน้าอก, เหนื่อยง่าย, ใจสั่น และคนไข้ที่มีความเสี่ยงในการเกิดโรคหัวใจสูง เช่น เบาเหวาน, ความดันโลหิตสูง, สูบบุหรี่ หรือมีประวัติครอบครัวสายตรงเป็นโรคหัวใจและหลอดเลือด
Heart Screening CT coronary artery
แพ็กเกจ Heart Screening CT coronary artery : เหมาะสำหรับคนที่ต้องการตรวจคัดกรองโรคหัวใจแต่ไม่สามารถเดินสายพานได้
การตรวจคัดกรองโรคหัวใจ ด้วยคลื่นเสียงสะท้อนความถี่สูง (Echocardiogram)
การตรวจคัดกรองโรคหัวใจ ด้วยคลื่นเสียงสะท้อนความถี่สูง (Echocardiogram) เป็นการตรวจคัดกรองความเสี่ยงต่อการเกิดโรคหัวใจ ในผู้ที่ยังไม่มีอาการ เป็นวิธีที่รวดเร็ว ไม่เจ็บ รู้ผลตรวจภายใน 1 ชั่วโมง
แพ็กเกจตรวจสุขภาพหัวใจ (อายุมากกว่า 40 ปี)
แนะนำสำหรับผู้ที่ยังไม่ได้รับการวินิจฉัยว่าเป็นโรคหัวใจ และต้องการทราบว่าตนเองมีอาการหรือเป็นโรคหรือไม่ รวมถึงแนะนำในกลุ่มที่มีความเสี่ยงสูง ทั้งนี้เพื่อเป็นการป้องกันหรือรักษาโรคตั้งแต่ระยะแรกๆ ที่ยังไม่มีภาวะแทรกซ้อน เนื่องจากการป้องกันหรือการรักษาจะได้ผลดีที่สุดที่ เริ่มแรกก่อนที่จะเกิดภาวะแทรกซ้อนใดๆ
การตรวจวินิจฉัยด้วยการฉีดสี หลอดเลือดหัวใจ ผ่านสายสวนทางขาหนีบ
การฉีดสีหลอดเลือดหัวใจ คือ การฉีดสารทึบรังสี เพื่อดูหลอดเลือดที่ไปเลี้ยงหัวใจ
การตรวจวินิจฉัยด้วยการฉีดสี หลอดเลือดหัวใจ ผ่านสายสวนทางข้อมือ
การฉีดสีหลอดเลือดหัวใจ คือ การฉีดสารทึบรังสี เพื่อดูหลอดเลือดที่ไปเลี้ยงหัวใจ
รายละเอียด ติดต่อ
สถาบันโรคหัวใจ
ชั้น 14 A อาคารบำรุงราษฎร์ อินเตอร์เนชั่นแนล คลินิก (อาคาร A)
065-509-9198 (ระหว่างเวลา 8.00-20.00 น. )
02-066-8888 (ระหว่างเวลา 20.00-8.00 น. )
Email Heartcenter@bumrungrad.com
bumrungrad.com/heart-institute
กระทรวงแรงงาน (รง.)
รง. มอบของขวัญปีใหม่ ปี 2566 ให้แก่ผู้ใช้แรงงานทั่วประเทศ จำนวน 6 กิจกรรม ภายใต้โครงการ “ให้ ฟรี ลด แรงงานสุขใจ” ดังนี้
1. ให้สินเชื่อที่อยู่อาศัยเพื่อผู้ประกันตนในระบบประกันสังคม ตาม ม. 33 ดอกเบี้ยต่ำ ไม่เกินรายละ 2 ล้านบาท วงเงิน 30,000 ล้านบาท มีเป้าหมาย 15,000 ราย ตั้งแต่เดือนมกราคม 2566 เป็นต้นไป
2. ให้เข้าถึงสิทธิรักษา 5 โรค ตามโรงพยาบาลที่กำหนด 7,500 คน ได้แก่ โรคมะเร็งเต้านม ก้อนเนื้อที่มดลูก โรคนิ่ว โรคหลอดเลือดสมอง และโรคหัวใจและหลอดเลือด ตั้งแต่วันที่ 1 มกราคม - 30 มิถุนายน 2566 เป็นต้นไป
3. ให้งานทำ “ต้องการทำงาน ต้องได้งานทำ” โดยมีตำแหน่งงานว่างที่หลากหลายไว้ให้บริการ รวม 613,784 อัตรา แบ่งเป็นในประเทศ 563,784 อัตรา และต่างประเทศ 50,000 อัตรา
4. ฟรี ค้นหาความเสี่ยงโรคหลอดเลือดและโรคหัวใจในสถานประกอบการใน 7 จังหวัดนำร่อง ได้แก่ จ. สมุทรปราการ ชลบุรี นนทบุรี ปทุมธานี ระยอง พระนครศรีอยุธยา และสมุทรสาคร มีเป้าหมายผู้ประกันตน 300,000 คน ให้ได้รับการตรวจสุขภาพ โดยสามารถลดค่าใช้จ่ายของผู้ประกันตนต่อหัวเฉลี่ยรายละ 910 บาท (กลุ่มเสี่ยง) 340 บาท (กลุ่มไม่เสี่ยง) วงเงินรวมทั้งสิ้น 187.50 ล้านบาท ตั้งแต่เดือนมกราคม 2566 เป็นต้นไป
5. ฟรี อบรมเจ้าหน้าที่ความปลอดภัย ระดับเทคนิค ระดับเทคนิคขั้นสูง และระดับวิชาชีพ 10,000 คน โดยมีหลักสูตรการอบรมเกี่ยวกับความปลอดภัยในการทำงาน เช่น กฎหมายความปลอดภัยอาชีวอนามัย และสภาพแวดล้อม ในการทำงานและกฎหมายที่เกี่ยวข้อง และทักษะการปฏิบัติงานด้านความปลอดภัยในการทำงาน ตั้งแต่เดือนมกราคม - มีนาคม 2566
6. ลดอัตราค่าทดสอบมาตรฐานฝีมือแรงงานแห่งชาติ คงเหลือ 1 - 3 บาท นาน 3 เดือน มีผู้เข้าทดสอบ 5,000 คน ทั่วประเทศ คิดเป็นมูลค่าของขวัญกว่า 1 ล้านบาท ตั้งแต่วันที่ 1 มกราคม - 31 มีนาคม 2566
ฉะนั้นผู้ที่มีคุณสมบัติเบื้องต้น คือต้องเป็นผู้ที่จบการศึกษาระดับมัธยมปลายหรือเทียบเท่า สามารถเข้าเรียนในหลักสูตรฉุกเฉินการแพทย์ หลักสูตร 4 ปี หรือระดับประกาศนียบัตรวิชาชีพขั้นสูง หรือ เทียบเท่าในสาขาเวชกิจฉุกเฉิน ปฏิบัติการฉุกเฉินการแพทย์หรือสาขาวิชาอื่นที่เกี่ยวข้องและได้รับอนุมัติให้สำเร็จการศึกษาก่อนวันเปิดภาคเรียน รุ่นละ 30 คน สามารถเข้าเรียนต่อในหลักสูตร 2 ปี เมื่อจบการศึกษาจะได้รับปริญญาตรีวิทยาศาสตรบัณฑิต (ฉุกเฉินการแพทย์) นักศึกษาจะได้รับการถ่ายทอดความรู้ ประสบการณ์รวมถึงการอัพสกิลผ่านประสบการณ์จริงทั้งด้านความรู้ โดยเน้นความรู้เชิงทฤษฎีและ/หรือข้อเท็จจริงเป็นหลัก เช่น ความรู้ทางกฎหมายที่เกี่ยวข้องกับการปฏิบัติงานฉุกเฉิน ระบบสุขภาพของประเทศไทย ระบบการแพทย์ฉุกเฉินของประเทศไทยและนานาชาติหลักการพื้นฐานด้านระบบคุณภาพและความปลอดภัยของผู้ป่วย รวมทั้งมาตรฐานการปฏิบัติการฉุกเฉิน
30 ธันวาคม 2565 เปิดรายชื่อผู้เสียชีวิต 10 ศพ LINK
30 ธันวาคม 2565 ช่วงดึกที่ผ่านมา เจ้าหน้าที่ของไทย ได้เดินทางไปรับศพผู้เสียชีวิตจากเหตุเพลิงไหม้คาสิโนในฝั่งปอยเปต ที่วัดตาด กัมพูชา จำนวน 10 ศพ โดยเก็บด้วยการแช่โลงเย็น และจะเดินทางกลับไปตามสถานที่ดังนี้
โรงเจ 5 ศพ ดังนี้
1.น.ส.พิมพิศา ชาวไร่อ้อย
2.นางพุทธิกา จริตเพ็ชร
3.นายวรวุฒิ จิรศักดิ์
4.นายอุดร คงเรือง
5.นายขวัญทอง จันงาม
วัดป่าไผ่ จำนวน 3 ศพ ดังนี้
1.นายพีระพันธ์ สิตะโปสะ
2.น.ส.พรธิรัตน์ ไกรยศธนานนท์
3.นางนงรัตน์ สิตะโปสะ
รพ.อรัญประเทศ จำนวน 1 ศพ ดังนี้
น.ส.นิธินันท์ ขุนจรูญ
รพ.สมเด็จพระยุพราชสระแก้ว จำนวน 1 ศพ ดังนี้
นางทัศนีย์ โสรัสสะ
ทั้งนี้จังหวัดสระแก้ว ตั้งศูนย์ประสานการให้ความช่วยเหลือคนไทยผู้ประสบภัยเหตุไฟไหม้บ่อยปอยเปตกัมพูชา เพื่อให้ญาติผู้สูญหาย ที่ต้องการรับญาติ หรือจะติดต่อสอบถามเพิ่ม สามารถติดต่อได้ที่ ศูนย์ประสานงานช่วยเหลือผู้ประสบภัย โทรศัพท์
- ป้องกันภัย จังหวัดสระแก้ว 081 172 2603
- ปลัดอำเภออรัญประเทศ 063 901 2906
Cr:สำนักประชาสัมพันธ์เขต 7 จันทบุรี กรมประชาสัมพันธ์
บริการสุขภาพในร้านค้าปลีก Retail Healthcare
ในสหรัฐ แบรนด์ค้าปลีกยักษ์ใหญ่ทุกราย ไม่ว่าจะเป็น วอลมาร์ท อะเมซอน และซีวีเอส กำลังเดินหน้านำบริการสุขภาพมาสู่ช่องทางค้าปลีกของตน ด้วยบริการพื้นฐาน เช่น ฉีดวัคซีน ตรวจเลือด หรือตรวจสุขภาพเบื้องต้น ซึ่งแต่เดิมบริการเหล่านี้ ต้องทำในโรงพยาบาลและโดยแพทย์เท่านั้น ความเปลี่ยนแปลงนี้ไม่ใช่แค่ในสหรัฐ แต่จะเป็นเทรนด์ที่จะพบได้ทั่วโลกในอนาคตอันใกล้นี้ (ในไทยก็เช่นกัน หลังจากที่สปสช. ร่วมกับสภาเภสัชฯ สามารถให้เภสัชกร วินิจฉัยและจ่ายยากับผู้ป่วยโรคพื้นฐาน 16 อาการ ณ ร้านขายยาได้)
จะกล่าวได้ว่า รูปแบบบริการสุขภาพในค้าปลีกนี้ เป็นอีกหนึ่งวิวัฒนาการที่เป็นผลจากภาวะโรคระบาดก็ได้เช่นกัน ด้วยความจำเป็นที่ประชาชนต้องการเข้าถึงการบริการสุขภาพที่รวดเร็วกว่าเดิม ประหยัดกว่าเดิม เมื่อเทียบกับการบริการทางการแพทย์แบบดั้งเดิมที่ต้องทำเฉพาะในโรงพยาบาล โดยแพทย์ ซึ่งมีจำนวนจำกัด ต้องรอนานและสิ้นเปลืองค่าใช้จ่าย จากรายงานของ Forester บริษัทที่ปรึกษาด้านข้อมูลผู้บริโภคระบุว่า ผู้บริโภคในปี 2023 เลือกที่จะเข้ารับบริการสุขภาพเบื้องต้นในหน่วยค้าปลีก เป็นเพราะระบบสุขภาพแบบเดิมไม่สามารถตอบสนองความต้องการของผู้ป่วยได้มากเพียงพอ เหตุจากระบบสุขภาพเองก็มีทรัพยากรต่างๆ (แพทย์ พยาบาล เจ้าหน้าที่ อุปกรณ์ เวชภัณฑ์) ไม่เพียงพอด้วย
ขณะที่รูปแบบการบริการสุขภาพผ่านค้าปลีก ตอบโจทย์ได้ดีกว่าในหลายด้าน ผู้ป่วยไม่ต้องเสียเวลารอทำนัด แต่เดินเข้าหาได้ทันทีที่ต้องการ ยาและเวชภัณฑ์ต่างๆ ก็มีพร้อมรองรับไม่ขาดแคลน บุคลากรก็พร้อมกว่าและให้บริการได้ทันที
*องค์การอนามัยโลกคาดการณ์ว่า จะขาดแคลนเจ้าหน้าที่สาธารณสุข 10 ล้านคนภายในปี 2573 (2030) ส่วนใหญ่อยู่ในประเทศที่มีรายได้ต่ำและปานกลาง https://www.who.int/health-topics/health-workforce
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคตะวันออก
จังหวัดชลบุรี
รหัสสาขา 07343 พรประภานิมิตร ซอย 16
จังหวัดจันทบุรี
รหัสสาขา 13094 บ้านเนินวง (จันทบุรี)
สมุทรปราการ
- รพ.ยุวประสาทไวทโยปถัมภ์ โทร. 023843381 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- ศูนย์เวชศาสตร์ฟื้นฟูสภากาชาดไทย โทร. 027038915 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Cardiac Rehab/ Adaptive Environments/ Community Rehab/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.สำโรงการแพทย์ โทร. 0-2361-1111
- โรงพยาบาลรามาธิบดีจักรีนฤบดินทร์ โทร. 02839 6000 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Cardiac Rehab/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- โรงพยาบาลบางพลี โทร. 027524500 ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Palliative care/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- โรงพยาบาลจุฬารัตน์ 3 อินเตอร์ โทร. 020332900 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน
- มีนนิ่งคิดส์คลินิกการประกอบโรคศิลปะ สาขากิจกรรมบำบัด โทร. 083-929-2932 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- โรงพยาบาลสมุทรปราการ โทร. 02-701-8132-9 ต่อ 2507 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ ผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ผู้สูงอายุสมองเสื่อมตามวัย
- รพ.บางบ่อ โทร. 023381133
ถึงแม้ว่าภูมิภาคเอเชียแปซิฟิกจะตระหนักถึงความสำคัญของข้อมูลสารสนเทศ และประโยชน์ต่อการตัดสินใจเชิงคลินิก แต่ระดับความรู้และการรับรู้ถึงวิธีการนำข้อมูลสารสนเทศไปใช้ยังคงขาดแคลนและเหลื่อมล้ำในภูมิภาค โดยเฉลี่ยแล้วมากกว่าครึ่ง(ร้อยละ 55) ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิก กล่าวว่าพวกเขาไม่ทราบถึงวิธีการนำข้อมูลไปใช้ประกอบในการตัดสินใจ ซึ่งสูงกว่าค่าเฉลี่ยทั่วโลกที่ร้อยละ 35 ยกตัวอย่าง ในอินโดนีเซียมีเพียงร้อยละ 7 ของบุคลากรที่บอกว่าพวกเขามีความเชี่ยวชาญมากพอที่จะนำข้อมูลสารสนเทศไปใช้ แต่ในสิงคโปร์และออสเตรเลีย บุคลากรมีความเชี่ยวชาญในการใช้ข้อมูลสารสนเทศมีถึงร้อยละ 50 และร้อยละ 20 ตามลำดับ ชี้ให้เห็นว่าในภูมิภาคนี้ควรมีการแบ่งปันข้อมูลและความรู้ระหว่างประเทศมากขึ้น
นอกจากนี้ รายงานของฟิลิปส์ยังเผยว่า การให้ความสำคัญด้านสวัสดิการของบุคลากรภายในภูมิภาคเกิดขึ้นหลังจากการแพร่ระบาดครั้งใหญ่ เนื่องจากการขาดแคลนบุคลากร และภาวะการหมดไฟยังคงเป็นปัญหาสำคัญของวงการเฮลท์แคร์ โดยร้อยละ 30 ของผู้บริหารในวงการเฮลท์แคร์ให้ความสำคัญกับความพึงพอใจและการรักษาบุคลากรเอาไว้เป็นอันดับแรก เท่ากับค่าเฉลี่ยในระดับโลก และแนวโน้มนี้ดูเหมือนจะดำเนินต่อไป โดยผู้บริหารในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกร้อยละ 28 เชื่อว่าความพึงพอใจของบุคลากรและการรักษาบุคลากรเอาไว้จะยังคงมีความสำคัญไปอีก 3 ปีนับจากนี้ ซึ่งต่างจากผลสำรวจในปี 2021 ที่ผู้บริหารส่วนมากคาดการณ์ไว้ว่าความพึงพอใจของบุคลากรและการรักษาบุคลากรเอาไว้อาจจะไม่ถูกจัดลำดับความสำคัญในระดับต้น ๆ ในอนาคต
ร้อยละ 23 ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิก เห็นว่าการขยายพื้นที่การดูแลรักษาจากแค่เพียงในโรงพยาบาลเป็นเรื่องที่ต้องให้ความสำคัญในขณะนี้ และร้อยละ 32 เห็นว่าเป็นเรื่องที่สำคัญภายใน 3 ปีต่อจากนี้ เมื่อเทียบกับทั่วโลก ประเทศออสเตรเลีย (ร้อยละ 36) ให้ความสำคัญกับการดูแลรักษานอกโรงพยาบาลและสถานพยาบาลอยู่ในลำดับที่ 2 ต่อจากประเทศเนเธอร์แลนด์ (ร้อยละ 37)
จากเทรนด์ข้างต้น ส่งผลให้ร้อยละ 45 ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิก และร้อยละ 49 ในภูมิภาคอาเซียน มีการลงทุนด้านการแพทย์ทางไกล หรือเทเลเฮลท์เป็นจำนวนมาก นอกจากนี้ โซลูชั่นการเฝ้าติดตามผู้ป่วยทางไกลก็เป็นอีกหนึ่งเครื่องมือที่สำคัญในการขยายขอบเขตการดูแลรักษานอกโรงพยาบาล โดยร้อยละ 19 ของผู้บริหารและบุคลากรแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิก และร้อยละ 21 ในภูมิภาคอาเซียน กล่าวว่าการลงทุนในเรื่องดังกล่าวเป็นสิ่งที่พวกเขาให้ความสำคัญอันดับต้น ๆ ในปัจจุบัน และร้อยละ 26 ในทั้งสองภูมิภาค กล่าวว่าการลงทุนด้านนี้จะสำคัญยิ่งขึ้นในอนาคตอันใกล้
ตั้งแต่ปีค.ศ. 2016 ฟิลิปส์ได้จัดทำรายงานผลสำรวจ Future Health Index เพื่อช่วยเตรียมความพร้อมให้กับประเทศต่าง ๆ ทั่วโลกในการรับมือกับความท้าทายของระบบสาธารณสุข เพื่อสร้างระบบสาธารณสุขที่เพียงพอและมีประสิทธิภาพ สำหรับรายละเอียดเพิ่มเติมเกี่ยวกับรายงาน Future Health Index สามารถเยี่ยมชมได้ที่
Future Health Index methodology และสำหรับรายงาน Future Health Index 2022 ฉบับเต็ม สามารถเข้าชมได้ผ่านเว็บไซต์ของเรา
กิจกรรม Happy Children Day โรงพยาบาลเด็กสินแพทย์ LINK
โรงพยาบาลเด็กสินแพทย์ ขอเชิญชวนน้อง ๆ หนู ๆ ร่วมกิจกรรม Happy Children’s Day ท่องดินแดนในฝัน ในวันเสาร์ ที่ 14 มกราคม 2566 ตั้งแต่เวลา 09.00-12.00 น. ณ บริเวณ Well Baby Center
กิจกรรมภายในงาน
1. ล้วงไข่ไดโนเสาร์
2. ปาเป้า
3. โยนห่วงหรรษา
4. Bingo
5. มายากลลูกโป่งจาก Bozo
และกิจกรรมอื่น ๆ ที่น่าสนใจ เด็ก ๆ ที่เข้านร่วมงานทุกคนจะได้รับของที่ระลึกมากมาย
แล้วมาร่วมสนุกกันเยอะ ๆ นะคะ
ศูนย์บริการสาธารณสุขที่ 3 ท่าทราย
- ที่อยู่ 4 ซอย ทรายทอง 15 ท่าทราย อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทร 02-9528705 - 6
- แผนที่
- Facebook
บริการ
- คลินิกตรวจโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น. 13.00-16.30 น.
- คลินิกฝังเข็ม วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น. วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-15.00 น.
- คลินิกสุขภาพเด็กดี (อายุ 2 เดือน – 4 ปี) วันจันทร์ ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
- คลินิกเพื่อนใจ (นพ.ประยุกต์ เสรีเสถียร) วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ ตามตารางโทรนัดล่วงหน้า 13.00-15.00 น.
- ตรวจคัดกรองมะเร็งปากมดลูก/ มะเร็งเต้านม วันพุธ ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.00 น.
หมายเหตุ ติดต่อนัดหมายคลินิกเพื่อนใจ โทร.02-9528705 (ในวันและเวลาราชการ)
ศัลยกรรม รักษาโรคศัลยกรรมทั่วไป
ศัลยกรรม รักษาโรคศัลยกรรมทั่วไป
เปิดให้บริการทุกวันอังคาร พุธ พฤหัสบดี
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์โรคระบบประสาทและสมอง เทคโนโลยีและความเชี่ยวชาญคือหัวใจของการรักษา
Tel: 052 089 862
Call Center: 1719
ศูนย์โรคระบบประสาทและสมอง
" เปิดบริการทุกวัน 08.00 – 16.00 น. "
ศูนย์แห่งความเป็นเลิศด้านโรคสมองและระบบประสาท โรงพยาบาลกรุงเทพเชียงใหม่ มีความพร้อมในการให้บริการตรวจ วินิจฉัย รักษา และให้การดูแลอย่างครบวงจร โดยผู้แพทย์ผู้เชี่ยวชาญเฉพาะทาง และทีมสหสาขาวิชาชีพ ซึ่งได้รับการฝึกอบรมอย่างต่อเนื่อง พร้อมด้วยอุปกรณ์ และเครื่องมือตรวจวินิจฉัยทางการแพทย์ที่ทันสมัย สามารถส่งต่อผู้ป่วยเพื่อเข้ารับการฟื้นฟู หรือพบประสาทศัลยแพทย์ได้อย่างรวดเร็ว นอกจากนี้ โรงพยาบาลยังมีระบบ Stroke Pathway เพื่อให้มั่นใจได้ว่าผู้ป่วยจะได้รับการรักษาอย่างรวดเร็ว ทันท่วงที ลดความเสี่ยงที่จะเกิดความพิการถาวรได้ โรคเกี่ยวกับสมองและระบบประสาทที่สามารถพบได้บ่อย อาทิเช่น
โรคปวดศีรษะและไมเกรน
โรคเวียนศีรษะ
โรคอัมพฤกษ์จากหลอดเลือดสมองตีบ แตก หรือตัน
โรคลมชักหรืออาการวูบ
โรคการเคลื่อนไหวผิดปกติ และพาร์กินสัน
ปวดแสบปวดร้อน จากเส้นประสาทอักเสบ
ภาวะการนอนผิดปกติ
โรคของกล้ามเนื้อ เช่น กล้ามเนื้ออักเสบ กล้ามเนื้ออ่อนแรง
โรคสมองเสื่อม
โรคของเส้นประสาท เช่น ชามือ ชาเท้า
โรคปลอกประสาทอักเสบ
การรักษาแบบอื่นๆ ได้แก่ การผ่าตัดสมอง การผ่าตัดกระดูกสันหลัง การนำเอาเครื่องมือที่ทันสมัยเข้ามาช่วยในการวินิจฉัย เพื่อผลการตรวจที่แม่นยำ ส่งผลให้การรักษามีประสิทธิภาพเพิ่มมากขึ้น และที่สำคัญคือการมีความร่วมมือทางการแพทย์เพื่อพัฒนาศักยภาพและแลกเปลี่ยนความรู้ด้านวิชาการและเทคโนโลยี
บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน)
บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ร่วมกับ Oregon Health & Science University (OHSU) รัฐโอเรกอน ประเทศสหรัฐอเมริกา
บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) ร่วมกับ ศ.นพ.คีธ แอล แบล็ค ศัลยแพทย์สมองชื่อดังของโลก
ปรับปรุงห้องฉุกเฉินใหม่
"ทำห้องฉุกเฉินใหม่ ใครเคยมาที่โรงพยาบาลคงรู้สึกได้ว่าห้องฉุกเฉินน่ากลัวมากแต่ตอนนี้โล่ง โปร่ง สบายตา แต่ไม่จำเป็นก็อย่ามาเลยครับ ต้องขอบคุณ คุณนันทิดา แก้วบัวสาย นายกองค์การบริหารส่วนจังหวัดสมุทรปราการที่สนับสนุนงบประมาณด้วยครับ"
ห้องอุบัติเหตุและฉุกเฉิน ที่ได้รับเงินสนับสนุนในการปรับปรุงก่อสร้าง จากองค์การบริหารส่วนจังหวัดสมุทรปราการ ได้รับเกียรติจากท่านผู้ว่าราชการจังหวัดสมุทรปราการ เป็นประธานเปิดงานฯ นายกองค์การบริหารส่วนจังหวัดสมุทรปราการ นายแพทย์สาธารณสุขจังหวัดสมุทรปราการ พร้อมด้วย ผู้อำนวยการโรงพยาบาลสมุทรปราการ คณะผู้ติดตามและเจ้าหน้าที่โรงพยาบาลสมุทรปราการ ร่วมงานอย่างพร้อมเพรียง เมื่อวันที่ 3 มี.ค.65
เส้นทางการเข้ามารับบริการแผนกอุบัติเหตุและฉุกเฉิน กรณีผู้ป่วยฉุกเฉินเท่านั้น
- เดินทางเข้ารพ. ทางประตูที่ 1 ขับรถ/เดินตรงไป ทางเข้าห้องฉุกเฉิน อยู่ด้านข้างอาคารผู้ป่วยนอก
- เบอร์ติดต่อ 02-701-8132 ต่อ 2150
Street Performance LINK
ชวนทุกท่านมาพบกับกิจกรรม ‘Street Performance’ ชมศิลปะหลากหลายแขนง ทั้งวงดนตรีสด สตรีทแฟชั่นโชว์ และศิลปะวัฒนธรรมแบบจีน อย่างการเชิดสิงโต รำพัด และอื่นๆ อีกมากมาย เต็มอิ่มไปกับความน่าตื่นตาตื่นใจและบรรยากาศดีๆ ของถนนเยาวราช
แสดง 4 - 12 ก.พ. 17:00 - 22:00
สอบถามโทร. 0928561155
ราชวิทยาลัยแพทย์เวชศาสตร์ฟื้นฟู แห่งประเทศไทย The Royal College of Physiatrists of Thailand
ราชวิทยาลัยแพทย์เวชศาสตร์ฟื้นฟู แห่งประเทศไทย
The Royal College of Physiatrists of Thailand
ชั้น 11 อาคารเฉลิมพระบารมี 50 ปี ซ. ศูนย์วิจัย ถ.เพชรบุรีตัดใหม่ กรุงเทพฯ 10310
โทร. 02-7166808 โทรสาร 0-2716-6809
Thairehab@gmail.com
www.rehabmed.or.th/ เมจิก ฟาร์ม เฟรช น้ำผลไม้รวมผสมน้ำใบกัญชา
เมจิก ฟาร์ม เฟรช น้ำผลไม้รวมผสมน้ำใบกัญชา รายแรกของไทย ที่ผ่านการรับรองมาตรฐานและคุณภาพจาก อย. มาพร้อมกัน 3 รสชาติอร่อยโดนใจ “มิกซ์เบอร์รี่ - ลิ้นจี่ - สับปะรด” บรรจุขวดในขนาด 250 มล. ดับกระหาย ผ่อนคลายรับซัมเมอร์
Walk in for COVID vaccination at Bangrak STIs Center
3. ตรวจสอบสิทธิและการลงทะเบียน
คนไทยทุกคนมีสิทธิประกันสุขภาพภาครัฐตามกฎหมาย เพื่อความสะดวกใน การใช้สิทธิหลักประกันสุขภาพแห่งชาติได้อย่างถูกต้อง จึงควรตรวจสอบสิทธิของ ตนเองและบุคคลในครอบครัว ซึ่งสปสช.ได้พัฒนาระบบทะเบียนสามารถตรวจสอบ สิทธิได้ 3 วิธี ดังนี้
1. ติดต่อด้วยตนเอง ในวันเวลาราชการ
• ต่างจังหวัด - หน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ เช่น โรงพยาบาล ส่งเสริมสุขภาพตำบล(รพ.สต.) หรือที่คุ้นเคยในชื่อสถานีอนามัย ศูนย์บริการสาธารณสุข คลินิกชุมชนอบอุ่น ศูนย์สุขภาพชุมชนเมือง โรงพยาบาลของรัฐ - สำนักงานสาธารณสุขจังหวัด - สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 1 - 12
• กรุงเทพมหานคร - สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 13 กทม. - จุดรับลงทะเบียนสิทธิหลักประกันสุขภาพแห่งชาติในพื้นที่ กทม. ได้แก่ o สำนักงานเขต 19 เขตของกรุงเทพมหานคร (ข้อมูลเพิ่มเติม หน้า 19) o สถานีรถไฟกรุงเทพ (หัวลำโพง)
2. ทางโทรศัพท์ สายด่วน สปสช. โทร. 1330 • ตรวจสอบสิทธิอัตโนมัติ โทร.1330 กด 2 ตามด้วยเลขประจำตัว ประชาชน 13 หลัก กด # กดโทรออก หมายเหตุ : ค่าบริการโทรศัพท์มือถือตามโปรโมชั่น สำหรับโทรศัพท์ พื้นฐาน (โทรศัพท์บ้านหรือตู้โทรศัพท์สาธารณะ) ครั้งละ 3 บาท ทั่วประเทศ
3. ผ่านระบบอินเทอร์เน็ต ได้แก่
www.nhso.go.th
app สปสช
ข้อมูลสิทธิหลักประกันสุขภาพแห่งชาติ ในระบบตรวจสอบสิทธิอัตโนมัติ จะปรับปรุงให้เป็นปัจจุบัน ทุกวันที่ 15 และวันที่ 28 ของทุกเดือน
การลงทะเบียนเลือกหน่วยบริการประจำ
เพื่อให้ประชาชนสิทธิหลักประกันสุขภาพแห่งชาติมีหน่วยบริการประจำ* (ข้อมูลเพิ่มเติมหน้า 21) สปสช.จัดระบบลงทะเบียนสิทธิหลักประกันสุขภาพ แห่งชาติของประชาชน ดังนี้
1) การลงทะเบียนรายบุคคล
แยกเป็น 2 กรณี
1.1กรณียื่นแบบคำร้องด้วยตนเอง ของผู้มีสิทธิที่ยังไม่ได้รับการ ลงทะเบียน (สิทธิว่าง) และผู้มีสิทธิขอเปลี่ยนหน่วยบริการประจำ
1.2กรณีหน่วยบริการลงทะเบียนให้ผู้มีสิทธิเข้ารับการรักษาพยาบาล ครั้งแรก หากผู้มีสิทธิหลักประกันสุขภาพแห่งชาติยังไม่ได้รับการ ลงทะเบียน (สิทธิว่าง) เข้ารับบริการรักษาพยาบาลครั้งแรกที่หน่วย บริการใดในระบบหลักประกันสุขภาพแห่งชาติ ให้หน่วยบริการที่ ให้การรักษาพยาบาลจัดให้ผู้มีสิทธิลงทะเบียนและเลือกหน่วยบริการ ประจำ โดยบันทึกข้อมูลตามโปรแกรมการลงทะเบียนออนไลน์ และแจ้ง สปสช.ภายใน 30 วัน นับตั้งแต่วันที่ให้บริการ
2)การลงทะเบียนในกลุ่มเฉพาะ เช่น
- กลุ่มนักเรียนนักศึกษาที่ศึกษาหรือพักในหอพักของสถานศึกษา ที่เห็นชอบ และสมัครใจลงทะเบียนเลือกหน่วยบริการประจำตาม ข้อบังคับ สปสช.
- กลุ่มทหารกองประจำการ (ทหารเกณฑ์) ดำเนินการโดยกรมการแพทย์ ทหาร กระทรวงกลาโหม
3)การลงทะเบียนแทนผู้มีสิทธิ ตามมติคณะกรรมการหลักประกันสุขภาพ แห่งชาติ ได้แก่
- กรณี เด็กแรกเกิด 0-5 ปี
- กรณี บุคคลสิ้นสุดสิทธิสวัสดิการรักษาพยาบาลข้าราชการ /รัฐวิสาหกิจ หรือสิ้นสุดสิทธิประกันสังคม หรือสิ้นสุดสิทธิประกันสุขภาพอื่นที่รัฐ จัดให้
- กรณี หน่วยบริการประจำที่บุคคลได้ลงทะเบียนไว้แล้วถอนตัว หรือ พ้นจากการเป็นหน่วยบริการประจำ
- กรณี เปลี่ยนหน่วยบริการประจำสำหรับนักศึกษาที่สำเร็จการศึกษาแล้ว แต่ยังไม่ได้เปลี่ยนหน่วยบริการประจำกลับไปยังภูมิลำเนา/ผู้พำนัก ในราชทัณฑ์ที่พ้นโทษ (ผู้พ้นโทษต้องขังในเรือนจำ) / ทหารเกณฑ์ที่ปลด ประจำการ
หมายเหตุ : บุคคลที่ได้รับการลงทะเบียนแทน สามารถยื่นคำร้องพร้อม เอกสารลงทะเบียน ขอเปลี่ยนหน่วยบริการประจำได้ที่ สถานที่รับลงทะเบียน
4) การลงทะเบียนสิทธิคนพิการ ในระบบหลักประกันสุขภาพแห่งชาติ คนพิการผู้ใช้สิทธิหลักประกันสุขภาพแห่งชาติที่ยังไม่ได้ลงทะเบียนสิทธิ คนพิการในระบบหลักประกันสุขภาพแห่งชาติ ต้องนำใบรับรองความ พิการจากแพทย์ หรือแสดงบัตรคนพิการตาม พ.ร.บ ส่งเสริมและพัฒนา คุณภาพชีวิตคนพิการแห่งชาติ พ.ศ.2550 ลงทะเบียน ณ สถานที่รับ ลงทะเบียน เพื่อรับสิทธิฟื้นฟูสมรรถภาพ
เอกสารลงทะเบียน
1) บัตรประจำตัวประชาชน สำหรับเด็กอายุต่ำกว่า 15 ปี ถ้าไม่มีบัตรประจำ ตัวประชาชน ให้ใช้สูติบัตร (ใบเกิด)
2) หนังสือรับรองการพักอาศัย (กรณีที่อยู่ไม่ตรงตามบัตรประจำตัว ประชาชน) พร้อมสำเนาบัตรประจำตัวประชาชนของเจ้าบ้าน หรือหลักฐาน อื่นที่แสดงว่าตนเองนั้นอาศัยอยู่จริง เช่น ใบเสร็จ ค่าน้ำ ค่าไฟ สัญญาเช่า ที่พัก ฯลฯ
3)แบบคำร้องขอลงทะเบียน (ขอได้ ณ จุดรับลงทะเบียน)
กรณีมอบให้ผู้อื่นลงทะเบียนแทน ต้องเพิ่มหนังสือมอบอำนาจ และสำเนา บัตรประจำตัวประชาชนของผู้รับมอบอำนาจด้วย
สถานที่ลงทะเบียน
• ต่างจังหวัด ติดต่อในวันเวลาราชการ ได้ที่
- หน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ เช่น โรงพยาบาล ส่งเสริมสุขภาพตำบล (รพ.สต.) หรือที่คุ้นเคยในชื่อ สถานีอนามัย ศูนย์บริการสาธารณสุข คลินิกชุมชนอบอุ่น ศูนย์สุขภาพชุมชนเมือง โรงพยาบาลของรัฐ
- สำนักงานสาธารณสุขจังหวัด
- สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 1 - 12
• กรุงเทพมหานคร
- สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 13 กทม. ในวันเวลาราชการ
- สำนักงานเขต 19 เขตของกรุงเทพมหานคร เปิดให้บริการในวันเวลา ราชการ (เวลา 8.00 น. - 16.00 น.)
- จุดรับลงทะเบียนสิทธิหลักประกันสุขภาพแห่งชาติ สถานีรถไฟกรุงเทพ (หัวลำโพง) เปิดให้บริการทุกวัน ตั้งแต่เวลา 8.00 น. - 19.00 น.
โมโนโครม อ่านใจ บายครูต้น
1.ความเป็นเลิศด้านบุคลากร (People Excellence)
บุคลากรโรงพยาบาล คือทรัพย์สินที่มีค่าที่สุด บำรุงราษฎร์มีนโยบายที่ชัดเจนและต่อเนื่องในการสรรหา สร้าง รักษา และพัฒนาบุคลากรให้เติบโตไปพร้อมกับองค์กร ตลอดจนปลูกฝังวัฒนธรรมองค์กรที่แข็งแกร่งจากรุ่นสู่รุ่น หนึ่งในกิจกรรมที่บำรุงราษฎร์ทำมาโดยตลอด คือ การสร้างและพัฒนาให้มีบุคลากรด้านการแพทย์และการพยาบาลที่ทรงคุณค่าให้แก่โรงพยาบาลและแก่ประเทศชาติ ซึ่งรวมถึงการให้ทุนการศึกษาแก่พยาบาล
Basic Barista Class คอร์สสอนชงกาแฟ แบบ Private โรงคั่วกาแฟมดแดงไฟ LINK
Basic Barista Class คอร์สสอนชงกาแฟ แบบ Private ตัวต่อตัว ของโรงคั่วกาแฟมดแดงไฟ (ถนน วังสิงห์คำ ต.ป่าตัน) เป็นคอร์สแบบ 2 วัน ที่เนื้อหาหลัก ๆ คือ
1. เน้น ๆ ให้คุณลงมือทำ
2. ความรู้เบื้องต้นเกี่ยวกับกาแฟ และโปรเซสต่างๆ
3. การปรับความละเอียดเครื่องบดกาแฟ
4. ปัจจัยต่างๆที่มีผลต่อการสกัดช็อต Espresso
5. การผสมเมล็ดเพื่อให้ได้เอกลักษณ์เฉพาะเป็นของตัวเอง
6. เข้าใจการทำงานของเครื่องชงกาแฟ และเครื่องบดกาแฟ เพื่อที่จะเลือกใช้กับร้านได้อย่างเหมาะสม
7. การตั้งระดับน้ำเครื่องชงกาแฟให้เหมาะสม
8. การเลือกใช้เมล็ดกาแฟ ตามระดับการคั่ว
9. หลักการสตีมนมที่ถูกต้อง เพื่อให้ได้ฟองนมที่มีคุณภาพ
10. สอนชงกาแฟตามเมนูสากล และเมนูร้อน เย็น ปั่นอื่นๆ
11. นักเรียนได้ลงมือปฏิบัติ ชิม และวิเคราะห์เองทั้งหมด
12. การคำนวณต้นทุน และสิ่งที่จำเป็นสำหรับการเปิดร้าน
13. สอนการเทลาเต้อาร์ต ลายหัวใจ ทิวลิป โรเซ็ตต้า
14. การล้างเครื่อง และบำรุงรักษาเครื่องชง เครื่องบด
อัดแน่น ใน คอร์ส 2 วัน และได้ลองชงกับเครื่องชงระดับ Hi - End และเครื่องบดมากกว่า 4 ชนิด อีกด้วย นี่เป็นเพียงส่วนหนึ่ง ในคลาส Basic Barista Course โทร.062-1954949
เขตหนองจอก ห้องสมุดเพื่อการเรียนรู้หนองจอก
ศูนย์ตั้งอยู่ใน โรงเรียนภักดีนรเศรษฐ ถนนเลียบวารี แขวงกระทุ่มลาย
ถ. เลียบวารี แขวงกระทุ่มราย เขตหนองจอก กรุงเทพมหานคร 10530
โทร. 029884480
แผนที่
google map
facebook
NongchokLibrary/
โดยที่ผ่านมา โครงการช่วยเหลือนักศึกษาในด้านสุขภาพจิต ยังมีข้อจำกัดอยู่หลายประการ เช่น ช่วงวันเวลาที่ให้บริการน้อย โดยเฉลี่ยต่อหนึ่งชั่วโมงนักจิตบำบัดจะให้คำปรึกษาได้เฉลี่ย 2 คน อีกทั้งจำนวนผู้เชี่ยวชาญกับสัดส่วนของนักศึกษาไม่สมดุลกัน รวมถึงงบจัดสรรสำหรับการจ้างผู้เชี่ยวชาญด้านจิตวิทยาไม่เหมาะสม จึงทำให้ทุกวันนี้ ขาดแคลนนักจิตบำบัด จึงอยากหาแนวทางร่วมกันเพื่อสานต่อโครงการ KMITL MIND ROOM และให้เกิดประสิทธิภาพมากขึ้น รวมถึงสานต่อการจัดฝึกอบรมภาคปฎิบัติการเกี่ยวกับปัญหาด้านสุขภาพจิตให้กับเจ้าหน้าที่บุคลากรที่ต้องทำงานร่วมกับนักศึกษาว่ากรณีที่มีนักศึกษาเข้ามาปรึกษาควรจะดำเนินการอย่างไร แต่อาจต้องปรับกรอบการทำงานให้ชัดเจนและเป็นระบบมากยิ่งขึ้น
โครงการเพื่อผู้ป่วยยากไร้


เป็นโครงการเก่าแก่ที่เกิดขึ้นมาพร้อมๆ กับการก่อตั้งมูลนิธิรามาธิบดีฯ โดยก่อตั้งขึ้นเพื่อช่วยเหลือผู้ป่วยที่เข้ามารักษาที่โรงพยาบาลรามาธิบดี แต่ไม่สามารถรับภาระค่าใช้จ่ายในการรักษาพยาบาลได้ ซึ่งครอบคลุมผู้ป่วยยากไร้ในทุกประเภท ได้แก่ ผู้ป่วยจากสถานสงเคราะห์ ผู้ป่วยจิตเวช ภิกษุ แม่ชี ผู้ป่วยเร่ร่อน ผู้ป่วยจากภัยพิบัติ ผู้ป่วยต่างด้าว รวมถึงผู้ป่วยระดับกลางที่ใช้สิทธิประกันตน หรือใช้ประกันสุขภาพถ้วนหน้า เนื่องจากมีข้อจำกัดในการใช้สิทธิหลายกรณี เช่น สิทธิไม่ครอบคลุมบางโรค ยาหรืออุปกรณ์การแพทย์บางรายการไม่อยู่ในบัญชียาหลักแห่งชาติที่ผู้ป่วยต้องชำระเพิ่มเติมเอง นอกจากนี้ยังช่วยเหลือครอบคลุมไปดูแลปัญหาด้านจิตใจ ครอบครัว และช่วยค่าใช้จ่ายที่จำเป็นอื่นๆ เพื่อให้ผู้ป่วยได้รับการรักษาและมีคุณภาพชีวิตที่ดีขึ้น เนื่องจากรามาธิบดี มีความเชี่ยวชาญ และเป็นความหวังของผู้ป่วยทางด้านโรคซับซ้อน ซึ่งส่วนใหญ่เป็นโรคที่ต้องใช้ค่ารักษาสูงมาก และใช้ระยะเวลาการรักษาเป็นเวลานาน ดังนั้น จึงทำให้จำนวนผู้ป่วยที่ต้องการการสนับสนุนเรื่องเงินสำหรับค่ารักษาพยาบาลนั้นมีจำนวนมากขึ้นอย่างต่อเนื่อง โดยเฉลี่ยใน แต่ละปีมูลนิธิได้ใช้งบประมาณการช่วยเหลือผู้ป่วยยากไร้เป็นจำนวนเงินกว่า 100 ล้านบาท โดยเป็นการช่วยเหลือผู้ป่วยที่ไม่มีรายได้ถึง 40% และการช่วยเหลือส่วนที่เหลือไปยังผู้ป่วยผู้มีรายได้ต่ำ โดยผู้ป่วยที่ได้รับการช่วยเหลือเป็นผู้ป่วยเด็กและผู้สูงวัยกว่า 57%
ในปี พ.ศ.2565 ที่ผ่านมาสัดส่วนเงินบริจาคเพื่อช่วยเหลือผู้ป่วยยากไร้คิดเป็น 19% จากโครงการทั้งหมดที่มูลนิธิระดมทุนอยู่ โดยมีสัดส่วนของผู้ป่วยยากไร้รายใหม่ที่ได้รับการช่วยเหลือจากมูลนิธิฯเพิ่มขึ้นกว่า 4% เมื่อเทียบกับปีพ.ศ. 2564
เราไปฟังมุมมองจาก นายแพทย์ นพ.ธนัญชัย อัศดามงคล แพทย์เฉพาะทางด้านศัลยกรรมตกแต่ง และผู้อำนวยการศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด โดยคุณหมอเผยว่า เทรนด์ความงามเป็นสิ่งที่คนให้ความสนใจมากขึ้นทุกปี ซึ่งมาจาก 2 สาเหตุหลักๆ คือมุมมองหรือค่านิยมที่มีต่อการทำศัลยกรรมความงามดีขึ้น ถ้าเป็นเมื่อก่อนเวลาไปทำศัลยกรรมมาส่วนใหญ่ต้องปกปิด แต่ปัจจุบันคนให้การยอมรับมากขึ้น อย่างที่สองคือสังคมมีมุมมองที่มีต่อคนทำศัลยกรรมเปลี่ยนไปเยอะเลย เมื่อก่อนคนที่ไปทำศัลยกรรมมาจะถูก
เจดีย์กองข้าวศรีบุญเนาว์
เจดีย์กองข้าวศรีบุญเนาว์ หรือพระธาตุภูลังกา ตั้งอยู่ที่ ตำบลนางัว อำเภอบ้านแพง นครพนม [
แผนที่] เป็น เจดีย์สีทองที่บรรจุพระบรมสารีริกธาตุของสมเด็จพระสัมมาสัมพุทธเจ้าที่อัญเชิญมาจากประเทศเนปาล เมื่อปี ๒๕๔๓ ตั้งอยู่บนลานหินที่มีลักษณะคล้ายกองข้าวนำมากองไว้ ซึ่งเป็นจุดสูงสุดของภูลังกาสูงประมาณ ๕๖๓ เมตร จากระดับน้ำทะเลปานกลาง ห่างจากที่ทำการอุทยานแห่งชาติภูลังกาประมาณ ๔ กิโลเมตร ลักษณะทั่วไปเป็นลานหินกว้างสลับด้วยพรรณไม้นานาชนิด มีอากาศเย็นสบายตลอดทั้งปี เป็นจุดชมวิวดูพระอาทิตย์ขึ้นจากแม่น้ำโขง สปป.ลาวในตอนเช้าที่สวยงามมาก
วัดสระลงเรือ อ.ห้วยกระเจา สถาปัตยกรรมเรือสุพรรณหงส์จำลองที่ใหญ่ที่สุดในโลก LINK
วัดสระลงเรือ สันนิษฐานว่าสร้างขึ้นในสมัยอยุธยา และประมาณ 100 กว่าปีได้มีผู้คนอพยพมาอาศัยบริเวณวัดสระลงเรือ ได้พบวัดเก่าซึ่งมีสิ่งปลูกสร้างที่ยังเหลืออยู่ในขณะนั้น เช่น เจดีย์ และพระปรางค์ 2 องค์ วิหารและอุโบสถ ซากปรักหักพัง ในอุโบสถหลังนี้มีพระพุทธรูปปางมารวิชัยประทับอยู่ในนั้น และมีต้นโพธิ์ใหญ่ปกคลุมอุโบสถ มีสระน้ำสระเล็กอยู่ด้านหน้าอุโบสถ ทางด้านตะวันออกเฉียงเหนือ
เมื่อ 20 กว่าปีที่ผ่านมา นายจำเนียร ใคร่ครวญ ซึ่งเป็นชาวบ้านสระลงเรือโดยกำเนิดแต่ได้ไปทำธุรกิจในต่างถิ่น ได้เข้ามากราบขอพรจากหลวงพ่อใหญ่องค์ดำ (พระพุทธอนันตภูมิสุคคุตโต) ซึ่งในปัจจุบันประทับอยู่ในวิหารแก้ว หน้าพระอุโบสถวัดสระลงเรือ หลังจากนั้นชีวิตของนายจำเนียร ใคร่ครวญ ก็ได้ประสบความสำเร็จตามที่ได้ตั้งใจไว้ทุกประการ ต่อมานายจำเนียร ใคร่ครวญจึงได้สร้างพระอุโบสถและเรือสุพรรณหงส์ขึ้นภายในวัด (บริเวณสระน้ำโบราณที่ได้รับการขยายให้กว้างขึ้นกว่าเก่าหลายเท่าตัว) โดยให้เหตุผลว่า ตนได้รับพรจากหลวงพ่อใหญ่องค์ดำ (พระพุทธอันตภูมสุคคุตโต) จึงตั้งใจสร้างพระอุโบสถและเรือสุพรรณหงส์ลำนี้ขึ้น เพื่อเป็นอนุสรณ์และทดแทนบุญคุณหลวงพ่อใหญ่องค์ดำ (พระพุทธอนันตภูมิสุคคุตโต) ที่ประทานมาให้แก่ตัวของนายจำเนียร ใคร่ครวญ และครอบครัว
สิ่งสำคัญในวัด
- เรือสุพรรณหงส์จำลองที่ใหญ่ที่สุดในโลก
- พระอุโบสถ
- มณฑปพระครูอรัญกาญจนเขต (หล่วน กนฺตสีโล)
- สวรรค์นรกภายในพระอุโบสถ
- ศาลาการเปรียญ
- เจ้าแม่กวนอิมกลางสระน้ำ
- พิพิธภัณฑ์เรือโบราณ
งานศาลหลักเมืองและบุญข้าวจี่ใหญ่ อาจสามารถ ร้อยเอ็ด 9-14 กุมภาพันธ์ 2566
งานศาลหลักเมือง และ บุญข้าวจี่ใหญ่ อ.อาจสามารถ จ.อยเอ็ด วันที่ 9-14 กุมภาพันธ์ 2566
การแสดง
9 ก.พ. รถแห่ (ฟรี) & บิ๊กวัน กันทรลักษ์
10 ก.พ. น้องนุช ประทุมทอง & โอม ศิวะกร
11 ก.พ. หมอลำซิ่ง (ฟรี) & กลางวัน หมอลำซิ่ง (ฟรี)
12 ก.พ. ท๊อป วงมอซอ
13 ก.พ. หมอลำซิ่ง (ฟรี)
14 ก.พ. ทำบุญตักบาตร
ศาลเจ้าพ่อครุฑ แขวงศาลเจ้าพ่อเสือ เขตพระนคร กรุงเทพฯ
ตั้งอยู่บริเวณตรอกครุฑ ริมคลองหลอด แขวงศาลเจ้าพ่อเสือ เขตพระนคร ศาลนี้มีมานานมากกว่าร้อยปี ที่นี่เป็นที่ประดิษฐาน “องค์พญาครุฑ” ครุฑไม้แกะสลักเก่าแก่องค์ใหญ่ มีตำนานาเล่ากันว่า เคยมีคนพบครุฑเป็นไม้แกะสลัก สันนิษฐานว่าอาจจะเป็นครุฑที่ติดกับหัวเรือรบสมัยโบราณ แล้วเกิดหลุดลอยตามน้ำมาติดอยู่บริเวณนั้นไม่ยอมไปไหน จนมีคนมาพบแล้วเกิดศรัทธา จึงอัญเชิญมาแล้วตั้งเป็นศาลภายในซอย ต่อมาถูกขโมยไป ชาวบ้านจึงรวมกันสร้างสร้างองค์ครุฑขึ้นมาใหม่ และบูรณะศาลเจ้าพ่อครุฑในเวลาต่อมาและได้รับการดูแลอย่างดีจนปัจจุบัน การขอพรองค์พญาครุฑ ณ ศาลเจ้าพ่อครุฑ แห่งนี้ ให้ใช้ธูป พวงมาลัย 1 พวง ธัญพืช 9 อย่าง น้ำแดง 1 ถ้วย ตั้งจิตอธิษฐานอย่างตั้งใจ แต่ไม่แนะนำให้บนบานศาลกล่าว
2. คนกรุงเทพฯยังใช้จ่ายคึกคัก คนต่างจังหวัดเริ่มชะลอการใช้จ่าย
เมื่อจบเทศกาลฉลองปีใหม่ไป คนกรุงเทพฯ ส่วนใหญ่ยังคงต้องการใช้จ่ายเพื่อเสริมภาพลักษณ์ของตัวเองให้ดูดีขึ้นต้อนรับปีใหม่ แม้ค่าครองชีพจะขยับสูงขึ้นเรื่อยๆ ก็ยังคงไม่หวั่น ใช้จ่ายหนุนเศรษฐกิจกันอย่างคับคั่ง แต่ในทางกลับกันคนต่างจังหวัดยังคงกังวลเรื่องเศรษฐกิจ ยิ่งในพื้นที่ที่ผู้คนมีรายได้หลักจากการท่องเที่ยว จึงทำให้มีความกังวลว่านักท่องเที่ยวจะเทกันไปตามแต่เมืองหลวงใหญ่ๆ และอีกหนึ่งข้อกังวลคือนักท่องเที่ยวในประเทศเองก็มองหาโอกาสใหม่ๆ ในการท่องเที่ยวในต่างประเทศมากกว่าในประเทศ
BL Metamorphosis #JFF2023
BL Metamorphosis #JFF2023
1 ชั่วโมง 58 นาที R:ท
©2022 “BL Metamorphosis” Film Partners ภาพยนตร์ Coming of age ของสาวน้อยมัธยมปลายวัย 17 ปี กับคุณยายวัย 75 ปี สองสาวที่เชื่อมต่อกันด้วยนิยาย Boys’ love (BL) อุราระ ซายามะ อายุ 17 ปี เด็กสาวมัธยมปลายที่ดูธรรมดาไม่โดดเด่นเหมือนกับเด็กคนอื่น ความสนุกเพียงหนึ่งเดียวของเธอนั้นคือ การได้อ่านการ์ตูน BL ที่เธอชื่นชอบอย่างลับ ๆ ตัวเอกอีกคนหนึ่ง ยูกิ อิจิโนะอิ อายุ 75 ปี หญิงหม้ายผู้มีเวลาว่างแต่ก็ไม่มีงานอดิเรกอะไรเป็นพิเศษ และรู้สึกตัวแล้วว่าวันสุดท้ายของชีวิตเข้ามาใกล้ทุกขณะ วันหนึ่ง ทั้งสองได้เจอกันในร้านหนังสือที่อุราระทำงานพิเศษ มีหนังสือการ์ตูน BL เล่มหนึ่งวางอยู่ตรงหน้าโดย ยูกินั้นไม่รู้ความหมายของ BL เพียงแค่หยิบหนังสือเล่มนั้นขึ้นมาโดยแค่คิดว่าหน้าปกนั้นสวยดีเท่านั้น แล้วอุราระและยูกิก็ได้พบกัน ได้พูดคุยในเรื่องราวที่ทั้งคู่ชื่นชอบ จนมิตรภาพได้ก่อตัวขึ้นมา นี่คือเรื่องราวที่จะบอกเล่าถึงความท้าทายในความต่างของอายุ 58 ปี ที่นำไปสู่การเปลี่ยนแปลงในตัวของพวกเขา
อันดับ 3. อุทยานแห่งชาติภูหินร่องกล้า จ.พิษณุโลก
อุทยานแห่งชาติภูหินร่องกล้า จ.พิษณุโลก โด่งดังเพราะมี ซากุระเมืองไทย หรือ ดอกนางพญาเสือโคร่ง จะออกดอกเบ่งบานในช่วงฤดูหนาวนั่นเอง ซึ่งจุดที่จะชมความสวยงามของพญาเสือโคร่ง ต้องไปที่ ภูลมโล นอกจากนั้นในอุทยานยังมีจุดน่าสนใจอื่นๆ ได้แก่ น้ำตกหมันแดง น้ำตกร่มเกล้า-ภราดร น้ำตกขมิ้นน้อย ลานหินปุ่ม ลานหินแตก ผาชูธง ภูแผงม้า สะพานมรณะ ที่หลบภัยทางอากาศ และที่พลาดไม่ได้ คือ ใบเมเปิ้ลเปลี่ยนสีที่โรงเรียนการเมืองการทหาร
ค่าเข้าชม คนไทย ผู้ใหญ่ 40 เด็ก 20 ชาวต่างชาติ ผู้ใหญ่ 200 เด็ก 100
หอดูดาวเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา นครราชสีมา
หอดูดาวเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา นครราชสีมา (Regional Observatory for Public, Nakhon Ratchasima) ตั้งอยู่ภายในมหาวิทยาลัยเทคโนโลยีสุรนารี ต.สุรนารี อ.เมือง จ.นครราชสีมา เปิดให้บริการในปี 2557 เปิดทุกวันยกเว้นวันจันทร์
เวลาทำการ:
วันจันทร์ ปิดทำการ
วันอังคาร 9:00–16:00
วันพุธ 9:00–16:00
วันพฤหัสบดี 9:00–16:00
วันศุกร์ 9:00–16:00
วันเสาร์ 9:00–22:00
วันอาทิตย์ 9:00–16:00
ในมุมของสังคมเกิดการตระหนักและมองเห็น สัมผัส ถึงคุณค่าจากวิถีชีวิตแบบเดิมผ่านมุมมองและรูปแบบใหม่ เราไม่อยากเสียต้นทุนทางวัฒนธรรมไปกับการเปลี่ยนแปลงของเวลาจากการเปลี่ยนของช่วงอายุคน เพราะเอกลักษณ์เกิดขึ้นได้ต้องใช้เวลานาน เราจะทำอย่างไรให้การเปลี่ยนแปลงของเมืองกับวิถีชีวิตเดิมและผู้คนเติบโตไปพร้อมกันได้ โดยเราคาดหวังว่าการถ่ายทอดแนวคิดนี้จะเป็นฐานเศรษฐกิจในอนาคตให้กับย่านนี้ได้ ซึ่งเป็นในรูปแบบใหม่ที่เข้ากับยุคสมัยซึ่งผู้คนที่อยู่อาศัยเดิมในพื้นที่สามารถใช้คุณค่าจากทักษะหรือประสบการณ์ส่งต่อไปยังคนรุ่นใหม่ ๆ
“อนาคตอาชีพของงานความคิดเชิงออกแบบ จะจำเป็นต่อทุกบริษัท คล้ายกับการที่บริษัทจะต้องมีฝ่ายกฎหมาย ปัจจุบันสังคมมีความเปลี่ยนแปลงรวดเร็ว ธุรกิจที่จะอยู่ได้ต้องปรับตัวให้ทันและจะต้องมีความคิดสร้างสรรค์ในการปรับตัวเพื่อสร้างความยั่งยืนให้ธุรกิจ การติดอาวุธกระบวนการคิดเชิงออกแบบ นักคิดนวัตกรรม ช่วยให้นักศึกษาที่จบจากคณะออกแบบและสถาปัตยกรรม ของเรากลายเป็นที่ต้องการในตลาดในทุกสายอาชีพ มีค่าตัวสูง และยังมีความพร้อมที่จะก้าวออกไปสร้างธุรกิจของตนเอง หรือต่อยอดธุรกิจครอบครัวด้วยสร้างนวัตกรรม เพิ่มมูลค้าทางธุรกิจในรูปแบบใหม่ ๆ” อาจารย์มาร์ค เล่า
เป็นที่มาของการออกแบบและสถาปัตยกรรมศาสตร์ เดิมชื่อว่า คณะสถาปัตยกรรมศาสตร์ ของมหาวิทยาลัยศรีปทุม พร้อมกับเปิดหลักสูตรใหม่ ‘Design Innovation’เพื่อดึงเอาจุดแข็งในการสร้างนวัตกร ผ่านการปลูกฝังรากฐาน Design Thinking ทักษะด้านการออกแบบที่มาพร้อมความคิดสร้างสรรค์ นวัตกรรมและเทคโนโลยี รวมถึงความสามารถในการบริหารจัดการ เพื่อปรับเปลี่ยนและเพิ่มโอกาสทางธุรกิจให้ทันกับการถูกดิสรัปจากความเปลี่ยนแปลงที่เกิดขึ้นเร็วจากหลายมิติ
Light of Nature Color of Kanchanaburi 2022
Light of Nature Color of Kanchanaburi 2022 เทศกาลไฟสุดตระการของกาญจนบุรี ตั้งแต่ 30 พ.ย.2022 - 3 ม.ค.2023 ได้ที่ CHAN nature cafe สัมผัสกับบรรยากาศเหมือนเมืองหนาว มีหิมะตก สวนดอกไม้ไฟ ทะเลดาว มีค่าเข้าชม
เขตบางเขน LINK
สำนักงานเขตบางเขน ร่วมกับ ศูนย์บริการสาธารณสุข 24 บางเขน เชิญชวนประชาชนที่รักน้องหมาน้องแมว พาน้องหมาแมว ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ระหว่างวันที่ 13-24 มีนาคม 2566 เวลา 10.00 ถึง 12.00 น. จุดให้บริการ ตามวันและสถานที่ ดังนี้
13 มี.ค. ชุมชนชมรมหมู่บ้านพหลโยธิน 48
14 มี.ค. ชุมชนหมู่บ้านทิมเรืองเวช
15 มี.ค. ชุมชนรุ่งสว่าง
16 มี.ค. ชุมชนหมู่บ้านปั้นทอง 3
17 มี.ค. ชุมชนหมู่บ้านเฉลิมสุข 9
20 มี.ค. ชุมชนหมู่บ้านอนันต์สุขสันต์ รุ่น1 8-20
21 มี.ค. ชุมชนหมู่บ้านเสนาวิลล่า
22 มี.ค. ชุมชนยิ่งศิรี
23 มี.ค. ชุมชนร่วมพัฒนา 33
24 มี.ค. ชุมชนหมู่บ้านเก้าแสนสอง
สอบถามโทร 02-5528062 (ฝ่ายสิ่งแวดล้อม)
02-5791342 ต่อ 15 (ศูนย์ฯ 24 บางเขน)
4. The Passionate Spender #ของมันต้องมี
The Passionate Spender #ของมันต้องมี ความสุขซื้อได้ด้วยการช้อป โดยคนกลุ่มนี้มีเปอร์เซ็นต์อยู่ที่ 7% เทียบเท่ากับคนในกลุ่มที่สาม แต่ด้วยความแตกต่างคือ คนกลุ่มนี้พร้อมเปย์ตลอดปีแบบไม่มีอะไรมากั้น ความอยากใช้เงินถูกกระตุ้นด้วยความรู้สึกในแต่ละวัน ซื้อเพื่อตอบสนองอารมณ์ “อยากได้ต้องได้” มากกว่าเหตุผล เมื่อได้จ่ายเงินแล้วก็จะรู้สึกสบายใจ ดังนั้นแบรนด์ควรจับตาเทรนด์หรือ trigger point ที่อาจก่อให้เกิดความเปลี่ยนแปลงทางอารมณ์ เพื่อช่วยสร้างข้ออ้างใหม่ๆในการช้อป และปลุกไฟแห่งการอยากเปย์ให้ลุกโชนอยู่เสมอ
เทศกาลสงกรานต์ Songkran Pak Chong Festival 2023
เที่ยวสงกรานต์ปากช่อง เฟสติวัล 2023 Songkran Pak Chong Festival 2023 วันที่ 11-15 เมษายน 2566 ณ แฮ็ปปี้ ฮิลล์ อำเภอปากช่อง จังหวัดนครราชสีมา
ชมฟรี คอนเสิร์ต! ศิลปินเพียบเวที
12 เมษายน เบิ้ล ปทุมราช , ลูลู่ ลาล่า
13 เมษายน ธัญญ่า อาร์สยาม , ฟิว กิติกร- หน่อย สุธิษา
14 เมษายน ลำไย ไหทองคำ
และชมการประกวดสาวงามจากทั่วฟ้าเมืองไทย เพื่อเฟ้นหาผู้ชนะ 7 ตำแหน่ง 7 มงกุฎ 7 สายสะพาย #7 Miss Queens Songkran Pak Chong Festival 2023 พร้อมรับของรางวัลกว่า 300,000 บาท ห้ามพลาด! งานเทศกาลแห่งความสุข ความสนุกสนาน มาร่วมสืบสานประเพณีสงกรานต์นี้
4. โซลูชันด้านสารสนเทศ (Informatics solutions) ที่เป็นกลางและสามารถทำงานร่วมกับหลากหลายเครื่องมือหรือระบบได้
เนื่องจากระบบสาธารณสุขมีการเชื่อมต่อกันมากขึ้น ระบบและอุปกรณ์ต่าง ๆ ที่แตกต่างกันจำเป็นต้องสามารถ "เชื่อมต่อ" ถึงกันได้เพื่อสร้างประสบการณ์ไร้รอยต่อสำหรับผู้ป่วยและบุคลากรทางการแพทย์ ตามปกติ โรงพยาบาลจะจัดซื้ออุปกรณ์และเครื่องมือการแพทย์จากหลากหลายแบรนด์ ซึ่งมักส่งผลต่อการกระจัดกระจายของโครงสร้างพื้นฐานทางดิจิทัล ส่งผลต่อประสบการณ์ด้านสาธารณสุขที่ไม่เชื่อมต่อกัน แนวทางในการแก้ปัญหาคือ การนำโซลูชันด้านสารสนเทศที่เป็นกลางและสามารถทำงานร่วมกับหลากหลายเครื่องมือหรือระบบได้มาใช้มากขึ้นใน ปีค.ศ. 2023 และในอนาคต
อีกตัวอย่างหนึ่งคือ ในการดูแลผู้ป่วยฉุกเฉินและในระยะฟื้นฟู แพลตฟอร์มเชื่อมต่อเครื่องมือแพทย์แบบเป็นกลาง สามารถรวบรวมและวิเคราะห์ข้อมูลจากเครือข่ายของอุปกรณ์ที่เชื่อมต่อกันเพื่อประมวลผลข้อมูลเชิงลึกและการแจ้งเตือนที่สนับสนุนการดูแลผู้ป่วยได้ดีขึ้น และแพลตฟอร์มดังกล่าวยังสามารถเชื่อมต่อกับระบบเวชระเบียนอิเล็กทรอนิกส์ (EMR) ของโรงพยาบาล รวมถึงเครื่องมือสื่อสารและความร่วมมือทางคลินิกได้อีกด้วย ส่งผลให้บุคลากรในโรงพยาบาลสามารถเห็นภาพรวมเกี่ยวกับอาการและปัจจัยด้านสุขภาพของผู้ป่วยแต่ละรายได้ เมื่อการส่งต่อข้อมูลระหว่างระบบและอุปกรณ์ง่ายขึ้น บุคลากรทางการแพทย์ก็ไม่ต้องเสียเวลาไปกับการดึงข้อมูลผู้ป่วยจากไซต์และแผนกต่าง ๆ อีกต่อไป
เขตลาดกระบัง
เนื่องจากเกิดสถานการณ์การระบาดของโรคพิษสุนัขบ้าบริเวณรอบพื้นที่รับผิดชอบของศูนย์บริการสาธารณสุข 45 ร่มเกล้า ดังนั้นเพื่อเป็นการป้องการการแพร่ระบาดของโรคพิษสุนัขบ้าไม่ให้แพร่กระจายเป็นวงกว้าง ศูนย์บริการสาธารณสุข 45 ขอเชิญชวน ประชาชนที่อยู่ในพื้นที่ดังกล่าว นำสัตว์เลี้ยงของท่านมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยเจ้าหน้าที่จะเข้าดำเนินการ ลงพื้นที่แบบ หน่วยเคลื่อนที่ไปยังชุมชนของท่าน ตามวันและเวลาที่ประกาศ
2.ประเภทที่พักนักท่องเที่ยว (Accommodation) LINK
แบ่งประเภทรางวัลย่อยออกเป็น 4 สาขา ดังนี้
1. สาขาลักซ์ชัวรี โฮเทล (Luxury Hotel)
2. สาขาโลเคชัน โฮเทล (Location Hotel)
3. สาขารีสอร์ต (Resort)
4. สาขาดิไซน์ โฮเทล (Design Hotel)
นิยาม
1. สาขาลักซ์ชัวรี โฮเทล (Luxury Hotel) - ที่พักที่มีภาพลักษณ์หรูหราทั้งภายนอกและภายใน มี ความพิเศษเฉพาะตัวทางด้านกายภาพและการบริการ พร้อมมีสิ่งอำนวยความสะดวกในระดับดีเยี่ยม เทียบเท่า 5 ดาว (ตามเกณฑ์มาตรฐานสากล)
2. สาขาโลเคชัน โฮเทล (Location Hotel) - ที่พักตั้งอยู่ในเขตเมือง ศูนย์กลางธุรกิจ ชุมชน หรือ แหล่งท่องเที่ยว มีความสะดวกและมีทางเลือกในการใช้ระบบขนส่งสาธารณะ มีบริการและสิ่งอำนวยความ สะดวกที่เหมาะสมกับความต้องการของกลุ่มผู้ใช้บริการ
3. สาขารีสอร์ต (Resort) - ที่พักตั้งอยู่ท่ามกลางบรรยากาศที่เป็นธรรมชาติ และจัดให้มีสิ่งอำนวย ความสะดวกหรือกิจกรรมนันทนาการ เพื่อตอบสนองการพักผ่อนของผู้ใช้บริการ
4. สาขาดิไซน์ โฮเทล (Design Hotel) - ที่พักเน้นการออกแบบ มีเอกลักษณ์เฉพาะทั้งภายนอกและ ภายใน ที่ให้ประสบการณ์เฉพาะกับผู้ใช้บริการ
***ทั้งนี้ นิยามดังกล่าวเป็นเพียงส่วนหนึ่งของเงื่อนไขในการส่งผลงานเข้าประกวด โดยเกณฑ์การให้ คะแนนยังคำนึงถึงการพิจารณาในด้านอื่นควบคู่กันไปด้วย
จิรา คงปราณ
สาขาวิชาอนามัยสิ่งแวดล้อมและเทคโนโลยี
สำนักวิชาสาธารณสุขศาสตร์ มหาวิทยาลัยวลัยลักษณ์
The Public Health Journal of Burapha University : Vol.13 No.2 July - December 2018
ปีที่ 13 ฉบับที่ 2 (2561): กรกฎาคม-ธันวาคม 2561
เผยแพร่แล้ว: ก.ย. 26, 2018 คำสำคัญ: สารเพอร์ฟลูออโรอัลคิล สารโพลีฟลูออโรอัลคิล การปนเปื้อนในสิ่งแวดล้อม ความเสี่ยงต่อสุขภาพ
พฤติกรรมผิดปกติอื่นๆ
พฤติกรรมการกินที่ผิดปกติ – หากน้องๆ มีพฤติกรรมการกินน้อยลงหรือมากขึ้นจนผิดสังเกต ไม่อยากอาหาร หรือดื่มน้ำมากผิดปกติ อาจเป็นสัญญาณแสดงอาการเจ็บป่วยของโรคต่างๆ เช่น โรคระบบทางเดินอาหาร
เลียขนมากผิดปกติ – บ่งบอกถึงอาการของโรคผิวหนัง โดยเฉพาะหากมีขนร่วงร่วมกับอาการคัน ระคายเคืองทำให้ต้องเลียขนมากขึ้น เพื่อบรรเทาความเจ็บปวดและไม่สบายตัวที่เกิดจากโรค นอกจากนี้ การเลียขนที่บ่อยจนผิดปกติในน้องแมวอาจบ่งบอกได้ถึงสภาวะเครียดหรืออาการป่วยอื่นๆ ได้อีกด้วย
หลีกเลี่ยงการปีนป่ายขึ้นที่สูง เหนื่อยง่าย นอนบ่อย นอนกรน – บ่งบอกถึงโรคอ้วน และเสี่ยงต่อการเป็นโรคเรื้อรังอื่นๆ ตามมา เช่น โรคระบบทางเดินหายใจ โรคข้อกระดูกเสื่อม
ก้าวร้าวผิดปกติ ข่วนกำแพง ทำลายข้าวของ หลบมุม – หากน้องแมวน้องหมาที่บ้านมีอาการแบบนี้ ไม่ควรนิ่งนอนใจ นั่นแปลว่า น้องๆ มีอาการเครียดที่ต้องดูแลเอาใจใส่อย่างใกล้ชิด โดยอาจพาไปพบสัตวแพทย์ หากเกิดขึ้นบ่อยครั้ง
การทราบถึงพฤติกรรมที่ผิดปกติโดยการดูแลและหมั่นสังเกตน้องแมวน้องหมาอย่างใกล้ชิด และการพาไปพบสัตวแพทย์เป็นประจำอย่างน้อย 2 ครั้งต่อปี เพื่อตรวจสุขภาพประจำปี รวมไปถึงการให้อาหารและโภชนาการที่เหมาะสมกับความต้องการเฉพาะของพวกเขา และความต้องการพิเศษในแต่ละช่วงวัยและสายพันธุ์ ยังช่วยป้องกันความเจ็บป่วยที่อาจเกิดขึ้นได้อย่างมีประสิทธิภาพมากขึ้น และยังเป็นการสร้างสุขภาพที่ดีอย่างต่อเนื่องให้สัตว์เลี้ยงที่เรารัก ให้เขาเป็นความสดใส เติมเต็มความสุขและรอยยิ้ม รวมทั้งสร้างโมเมนต์พิเศษเป็นความทรงจำดีๆ ในชีวิตของเราไปอีกนานแสนนาน
หากอยากเข้าใจความต้องการของน้องแมวและน้องหมาที่คุณรักเพิ่มมากขึ้น สามารถดูข้อมูลเพิ่มเติมเกี่ยวกับน้องแมวและน้องหมาสายพันธุ์ต่างๆ เพื่อให้สารอาหารที่เหมาะสมและส่งเสริมสุขภาพที่ดีของพวกเขาได้ที่ royal canin
ลูกดูหนังโป๊บ่อย
ควรทำ
ควรสอนลูกให้มีวิจารณญาณ และมีความรู้เท่าทันสื่อ ว่าหนังโป๊เป็นการแสดง ที่มีการจัดแสดงภาพ แสง สี เสียง และเขียนบท ไม่ต่างจากหนังประเภทอื่นๆ สิ่งที่เห็นไม่ใช่เรื่องจริง ลูกไม่ควรลอกเลียนแบบ อาจเกิดผลเสียได้
สร้างเงื่อนไขการใช้อินเทอร์เน็ตลูก เช่นกำหนดให้ลูกใช้ได้วันละกี่ชั่วโมง และต้องแบ่งเวลาไปทำอย่างอื่นอย่างเหมาะสม
สามารถชวนลูกทำกิจกรรมอย่างอื่น เช่น ไปเล่นกีฬา ไปเที่ยวกับเพื่อน ฯลฯ เพื่อให้ลูกเรียนรู้อย่างรอบด้าน ไม่หมกมุ่นกับสื่อมากเกินไป
อย่าทำ
การสั่งห้ามไม่ให้ลูกดู เป็นสิ่งที่เป็นไปไม่ได้ เพราะสื่อทุกวันนี้เข้าถึงเด็กอย่างง่ายดาย และรวดเร็ว
การจับตามอง และควบคุมพฤติกรรมการใช้อินเทอร์เน็ตของลูกตลอดเวลา เพราะกลัวลูกดูหนังโป๊ จะทำให้ลูกไม่เชื่อใจและคิดว่าพ่อแม่จุ้นจ้านเรื่องส่วนตัว
คลินิกโรคหลอดเลือดสมอง (Stroke Clinic)
ศูนย์ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง (Stroke) พญ.หทัยรัตน์ ผดุงกิจ แพทย์ผู้เชี่ยวชาญเฉพาะทางด้านโรคสมองและระบบประสาท คลินิกเฉพาะทางโรคสมองและระบบประสาท อัมพฤกษ์ อัมพาต โรคหลอดเลือดสมอง ด้วย เทคโนโลยีคลื่นแม่แหล็กไฟฟ้า TMS (Transcranial Magnetic Stimulation) การให้บริการ • ให้บริการตรวจคัดกรองโรค • โรคหลอดเลือดสมอง อัมพฤกษ์ อัมพาต • โรคสมองเสื่อม โรคพาร์กินสัน(Parkinson) อัลไซเมอร์ • โรคกล้ามเนื้ออ่อนแรงผิิดปกติ • โรคปวดเรื้อรัง • เจาะเลือด และตรวจสุขภาพ ปรึกษา และวางแผน การดูแลสุขภาพของร่างกาย และสมอง (Personal Healthy Consultation) ตรวจวิเคราะห์สุขภาพในระดับชีวโมเลกุล (Lab Investigation) เสริมสร้างและกระตุ้นภูมิคุ้มกันด้วยสูตรอาหารเสริม และวิตามันเฉพาะบุคคล (Individual Immune Booster Supplement & Iv Vitamin therapy) จัดโปรแกรมรักษาฟื้นฟู โรคทางสมองเส้นประสาท และกล้ามเนื้อ (Individual Treatment Program) เพื่อนำร่องโครงการฯ นี้ พันธมิตรได้ร่วมกันจัดกิจกรรมเวิร์คช็อป ซึ่งเป็นกิจกรรมที่จะมอบความรู้ความเข้าใจกับน้องๆ นักเรียน และคุณครูกว่า 7,900 คน จาก 10 โรงเรียนนำร่องในเขตพื้นที่กรุงเทพมหานคร เพื่อสร้างความรู้ความเข้าใจเกี่ยวกับโรคไข้เลือดออก รวมถึงวิธีการป้องกันตัวเองจากโรคไข้เลือดออกผ่านการควบคุมประชากรของลูกน้ำและยุงลาย และสิ่งที่สำคัญที่สุดคือเพื่อเป็นการแก้ไขปัญหา การป้องกันและการควบคุมไข้เลือดออกในชุมชนอย่างยั่งยืน โดยต่อจากนี้ โรงเรียนที่เข้าร่วมโครงการฯ จะได้ฝึกทักษะและใช้ความคิดในเชิงบูรณาการในการควบคุมปริมาณของลูกน้ำและยุงลาย เพื่อนำเสนอโครงการเข้าประกวดเฟ้นหา “สุดยอดโรงเรียนปลอดไข้เลือดออก” ต่อไป
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 3 ศูนย์แพทย์ป้อมเพชร
ศูนย์แพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 3 ศูนย์แพทย์ป้อมเพชร
ตั้งอยู่ที่ โรงเรียนป้อมเพชร ม.1 ถ.อู่ทอง ต.หอรัตนไชย อ.พระนครศรีอยุธยา จ.พระนครศรีอยุธยา 13000
โทร. 035-245001 089-9012864
ศูนย์แพทย์ขนาดกลาง รับผิดชอบประชากร จำนวน 3,000 - 8,000 คน ครอบคลุมพื้นที่ หมู่ 1 ต.หอรัตนไชย อ.พระนครศรีอยุธยา
นพ.สุธรรม เศรษฐวงศ์ กล่าวทิ้งท้ายว่า “ปัจจุบัน พบว่า ผู้ที่มีปัญหาจากการนอนหลับ มีจำนวนเพิ่มมากขึ้นเรื่อย ๆ อาทิ การนอนกรน การมีภาวะหยุดหายใจขณะหลับ การนอนไม่หลับ หรือหลับยาก ส่งผลทำให้มีจำนวนผู้เข้ามารับบริการเพิ่มจำนวนมากขึ้นเช่นกัน จนทำให้คิวเข้ารับการตรวจ Sleep Test ที่ศูนย์นิทราเวชฯ มีจำนวนมากและรอคิวค่อนข้างนาน จึงเกิดโครงการร่วมกับโรงพยาบาลสวนเบญจกิติ 84 พรรษา เพื่อส่งต่อผู้เข้ารับบริการไปรับการตรวจ Sleep Test ทำให้ผู้รับบริการได้รับการตรวจวินิจฉัยอย่างรวดเร็วมีประสิทธิภาพ และได้มาตรฐานเช่นเดียวกับการเข้ารับบริการที่ศูนย์นิทราเวชฯ โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย โดยตรง เนื่องจากค่าใช้จ่ายสามารถเบิกจ่ายตามสิทธิ์ได้ตามปรกติ มีค่าบริการเพิ่มขึ้นเพียงแค่ 1,000 บาท เพื่อแลกกับการลดเวลารอคิว ทำให้มีเสียงตอบรับเป็นอย่างดีจากผู้ใช้บริการที่ต้องการความรวดเร็วและไม่ต้องการรอนาน”
สำหรับผู้ที่สนใจติดตามข่าวสารความรู้เกี่ยวกับการนอนหลับ สามารถติดตามข่าวสารเพิ่มเติมได้ที่ Facebook ของทางศูนย์นิทราเวช โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ที่ https://web.facebook.com/sleepcenterchula หรือ สนใจเข้ารับการตรวจที่คลินิกตรวจการนอนหลับพรีเมียม ติดต่อที่ 02-649-4037 Line id : @392mkjrr
เราหวังให้ภาครัฐตระหนักถึงกลุ่มเด็ก ผู้สูงอายุ นั่นคือมีการเพิ่มจำนวนการฉีด ขยายการฉีดวัคซีนให้เป็นแบบ 4 สายพันธุ์ และเพิ่มงบประมาณการฉีดวัคซีนสู่ประชากรวัยแรงงาน เพื่อเป็นหลักประกันด้านสุขภาพให้ประชาชนมีสุขภาพแข็งแรง เป็นฟันเฟืองหลักของเศรษฐกิจประเทศ ซึ่งหากไม่มีการฉีดวัคซีนที่เพียงพอและเกิดการแพร่ระบาด ประเทศไทยจะสูญเสียโอกาส และสูญเสียทรัพยากรกับค่าใช้จ่ายในการดูแลรักษามากเสียยิ่งกว่าการป้องกัน ตามหลักการคำนวณด้านเศรษฐศาสตร์สาธารณสุข โดยผู้สนใจสามารถศึกษาข้อมูลเกี่ยวกับโรคไข้หวัดใหญ่ และโรคติดเชื้อต่างๆ เพิ่มเติม ได้ที่เว็บไซต์มูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ http://www.ift2004.org/ หรือทางทางเพจของมูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่
คุณหญิงจำนงศรี หาญเจนลักษณ์ การประยุกต์ใช้แนวทางการกำหนดค่าจ้างจากต่างประเทศ
ต้องส่งเสริมให้แรงงานพัฒนาทักษะเพื่อให้ได้รับค่าจ้างที่สูงขึ้น และได้รับค่าจ้างที่สอดคล้องกับประสบการณ์
- สนับสนุนให้แรงงานได้รับการฝึกอบรมและทดสอบเพื่อเพิ่มระดับทักษะ
- บูรณาการหลักสูตรการฝึกอบรม และทดสอบสมรรถนะแรงงานของแต่ละหน่วยงานที่มีการรับรองมาตรฐานทักษะแรงงานให้มีความเชื่อมโยงกับอัตราค่าจ้าง อาทิ กรมพัฒนาฝีมือแรงงาน สถาบันคุณวุฒิวิชาชีพ และองค์กรภาคเอกชน
- เร่งส่งเสริมให้แรงงานตระหนักถึงความสำคัญของการทดสอบฝีมือแรงงาน
ป้องกันตัวเอง หากมีอาการใด ๆ ควรปรึกษาแพทย์
ปริมาณฝุ่นละอองในบรรยากาศโดยทั่วไปของประเทศไทย ตามมาตรฐานคุณภาพสิ่งแวดล้อม พระราชบัญญัติส่งเสริมและรักษาคุณภาพสิ่งแวดล้อมแห่งชาติ พ.ศ.2535 กำหนดว่าปริมาณฝุ่น PM2.5 ไม่ควรเกิน 50 ไมโครกรัมต่อลูกบากศ์เมตร ใน 24 ชั่วโมง และไม่เกิน 25 ไมโครกรัมต่อลูกบากศ์เมตรต่อปี
ทั้งนี้ ในวันที่ 1 มิถุนายน 2566 คณะกรรมการสิ่งแวดล้อมแห่งชาติมีมติให้กำหนดมาตรฐานฝุ่น PM2.5 ใหม่ โดยปรับลดลงเป็น 37.5 ไมโครกรัมต่อลูกบากศ์เมตร สำหรับค่าเฉลี่ย 24 ชั่วโมง และ 15 ไมโครกรัมต่อลูกบากศ์เมตร สำหรับค่าเฉลี่ยรายปี โดยจะมีผลบังคับใช้ในทันทีนับแต่วันประกาศในราชกิจจานุเบกษา
อย่างไรก็ตาม “เกณฑ์กำหนดมาตรฐานใหม่ยังคงสูงกว่าคำแนะนำคุณภาพอากาศ (Air Quality Guidelines, AQGs) ฉบับใหม่ที่องค์การอนามัยโลก (WHO) ประกาศไว้ในเดือนกันยายน 2564 กล่าวคือ ปริมาณฝุ่น PM2.5 ไม่ควรเกิน 15 ไมโครกรัมต่อลูกบากศ์เมตร ใน 24 ชั่วโมง และไม่เกิน 5 ไมโครกรัมต่อลูกบากศ์เมตรต่อปี” คุณหมอแอมป์เสริม
โปรแกรมตรวจสุขภาพ ต้อนรับการเปิดโรงพยาบาล สินแพทย์ นครปฐม LINK
โปรแกรมตรวจสุขภาพ Grand Opening Check Up Package
Smart Program 1,811
Absolute Program 4,111
Exclusive Program ชาย 7,111 หญิง 9,111
Ultimate Program ชาย 10,111 หญิง 12,111
Prestige Program ชาย 12,111 หญิง 14,111
สอบถามข้อมูลเพิ่มเติมได้ที่ โทร. 034-271999
Phuket Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ช้อป ชิม ถ่ายรูปบ๊ายใจ…สไตล์บาบ๋า ร่วมสืบสานวิถีแห่งไทยประเพณีสงกรานต์ ณ สี่แยกชาร์เตอร์ (เมืองเก่าภูเก็ต) และอุทยานแห่งชาติสิรินารถ ริมหาดไม้ขาว ร่วมตักบาตรข้าวสารอาหารแห้ง และตักบาตรข้าวสุก ริมทะเล ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
วันที่ 13 เม.ย. 2566 ณ วัดไม้ขาว จ.ภูเก็ต
วันที่ 15 - 16 เม.ย. 2566 ณ สี่แยกชาร์เตอร์ (ชุมชนเมืองเก่า) จ.ภูเก็ต
กรุงเทพฯ – ภาคตะวันออก
กรุงเทพฯ – ภาคตะวันออก
- เส้นทางที่ 1 จากกรุงเทพฯ ไป จ.ชลบุรี (ทางหลวงพิเศษหมายเลข 7 สาย กรุงเทพฯ – ชลบุรี – พัทยา)
- เส้นทางที่ 2 จากกรุงเทพฯ ไป อ.บางปะกง (ทางหลวงหมายเลข 34 ถนนบางนา-ตราด) จากนั้นมุ่งหน้าสู่จังหวัดชลบุรี โดยใช้ทางหลวงหมายเลข 3 ถนนสุขุมวิท
- เส้นทางที่ 3 จากกรุงเทพฯ ไป อ.พนัสนิคม – จ.ชลบุรี (ทางหลวงหมายเลข 304)
- เส้นทางที่ 4 จากกรุงเทพฯ ไปทางหลวงหมายเลข 34 ถนนเทพรัตน – ทางพิเศษบูรพาวิถี (บางนา – ชลบุรี) จากนั้นมุ่งหน้าสู่จังหวัดชลบุรี โดยใช้ทางหลวงหมายเลข 3 ถนนสุขุมวิท
ตารางออกตรวจแผนกกุมารเวชกรรม
Reef Watch Monitoring สวมบทคุณหมอช่วยกันดูแลสุขภาพปะการัง
บริเวณเกาะเต่าล้อมรอบไปด้วยแนวหินปะการัง ที่มาพร้อมความหลากหลายทางชีวภาพสูงสุดในอ่าวไทย!! แถมยังเป็นเกาะที่ได้รับความนิยมในเรื่องของการดำน้ำตื้นและดำน้ำลึก ดังนั้น การรักษาแนวปะการังเพื่อความสวยงามและรักษาระบบนิเวศ โดยการตรวจสอบสำรวจอย่างสม่ำเสมอ ซึ่งอยู่ภายใต้การจัดการดูแลโดยกรมทรัพยากรทางทะเลและชายฝั่ง (ทช.) และชุมชนนักดำน้ำในพื้นที่ จึงเป็นสิ่งที่บุคคลทั่วไปร่วมกิจกรรมนี้ได้
กิจกรรมดูแลสุขภาพปะการัง ซึ่งถือเป็นหนึ่งใน 12 กิจกรรมที่แสดงให้เห็นถึงความนอบน้อมต่อธรรมชาติของงาน Spotlight Koh Tao 2023 จะเป็นการสำรวจดูว่า ปะการังบริเวณในต่างๆ มีการฟอกขาวเกิดขึ้นหรือไม่ โดยเป็นการเก็บข้อมูลเพื่อติดตามผลในระยะต่อไป
อย่างที่ทราบกันดีแล้วว่า แนวปะการังเป็นป่าของท้องทะเล การเกิดการฟอกขาวสามารถ บ่งชี้ถึงปัจจัยต่างๆ ไม่ว่าจะเป็น ภาวะโลกร้อน โรคภัยในปะการัง และการชะล้างจากแผ่นดินใหญ่
กิจกรรมนี้ เรามุ่งมั่นที่จะปกป้องและอนุรักษ์แนวปะการังรอบเกาะเต่า ด้วยการแนะนำให้ผู้คนจำนวนมากรู้จักกระบวนการดูแลแนวปะการัง เพื่อส่งเสริมแนวทางปฏิบัติการดำน้ำลึก และดำน้ำตื้นให้คงอยู่กับเกาะเต่าอย่างยาวนาน
ผู้ร่วมสนุกแบบมีสาระในกิจกรรมนี้ จะได้เรียนรู้วิธีดำน้ำตื้นเพื่อสำรวจแนวปะการัง ซึ่งเป็นวิธีที่ดีและเรียบง่าย แถมยังใช้ง่ายได้จริง โดยจะมีการจดบันทึกคุณภาพของแนวปะการังและส่งผลไปยังเจ้าหน้าที่ที่ดูแล เพื่อวิเคราะห์ผล และสังเกตการณ์เบื้องต้น
APRIL 3-9 2023 01:00 PM - 05:00 PM
Locations: Sensi Paradise Beach Resort,
Organizers: Department of Marine and Coastal Resources (DMCR),Green Fins Koh Tao Thai Divers Team (KTDT)
Tickets: Reef Watch Monitoring: 3000 THB
จุดรับส่งเส้นทางที่ 4 สนาม 36 พรรษษ - วัดญวน - วัดเหนือ - ถนนคนเดิน
สถานีชาร์จ ใน ปทุมธานี
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา ศูนย์การค้า เดอะไนน์เซ็นเตอร์ ติวานนท์ (TNCT)
ที่อยู่: 99/99หมู่ที่ 2 ต.บางกะดี อ.เมืองปทุมธานี จ.ปทุมธานี 12000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Future Park Rangsit (in-door)
ที่อยู่: 94 ศูนย์การค้าฟิวเจอร์พาร์ครังสิต ถ.พหลโยธิน ต.ประชาธิปัตย์ อ.ธัญบุรี จ.ปทุมธานี 12130
เวลาทำการ : ส – อา 10.00 – 22.00 น.
จ – พฤ 10.30 – 21.30 น.
ศ 10.30 – 22.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Future Park Rangsit (out-door)
ที่อยู่: 94 ศูนย์การค้าฟิวเจอร์พาร์ครังสิต ถ.พหลโยธิน ต.ประชาธิปัตย์ อ.ธัญบุรี จ.ปทุมธานี 12130
เวลาทำการ : ทุกวัน 06.00 – 00.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สนามกอล์ฟ ริเวอร์เดล
ที่อยู่: 123 ถ.ติวานนท์ ต.บางกะดี่ อ.เมืองปทุมธานี จ.ปทุมธานี 12000
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Market Village รังสิต
ที่อยู่: 98 หมู่ 2 ถ.รังสิต – นครนายก ต.บึงยี่โถ อ.ธัญบุรี จ.ปทุมธานี 12130
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ EV Station PluZ กรุงเทพ
เทอมินอล 21 อโศก (อาคารจอดรถ ชั้นเอ็ม)
88 ซอย สุขุมวิท 19 แขวง คลองเตยเหนือ เขตวัฒนา กรุงเทพมหานคร 10110
เทอมินอล 21 อโศก (อาคารจอดรถ ชั้นเอ็ม)
88 ซอย สุขุมวิท 19 แขวง คลองเตยเหนือ เขตวัฒนา กรุงเทพมหานคร 10110
แมริออท เอ็กเซกคิวทีฟ อพาร์ทเมนท์ สุขุมวิท พาร์ค
90 ซอยสุขุมวิท 24 แขวงคอลงเตย เขตคลองเตย กรุงเทพมหานคร 10110
สถานีบริการ เจริญราษฎร์
92/1 ถ.เจริญราษฎร์ แขวงบางโคล่ เขตบางคอแหลม กรุงเทพมหานคร 10120
เทอมินอล 21 พระราม 3
356 ถ.พระรามที่ 3 แขวง บางโคล่ เขตบางคอแหลม กรุงเทพมหานคร 10120
แมริออท เอ็กเซกคิวทีฟ อพาร์ทเมนท์ สาทร วิสต้า กรุงเทพฯ
1 ซอย 3 แขวงทุ่งมหาเมฆ เขตสาทร กรุงเทพมหานคร 10120
สถานี สาขาราษฎร์บูรณะ ขาออก
193/2 ถ.ราษฎร์บูรณะ แขวงบางปะกอก เขตราษฎร์บูรณะ กรุงเทพมหานคร 10140
สถานีบริการ สาขาทุ่งครุ
26/4 ถ.เลียบทางด่วน แขวงทุ่งครุ เขตทุ่งครุ กรุงเทพมหานคร 10140
สถานี สาขากาญจนาภิเษก-บางบอน
97/1 ถ.กาญจนาภิเษก แขวงบางบอนเหนือ เขตบางบอน กรุงเทพมหานคร 10150
สถานีบริการ ปตท. ภาวดี กาญจนาภิเษก
40/28 หมู่ที่ 10 แขวงบางบอน เขตบางบอน กรุงเทพมหานคร 10150
สถานีบริการ สาขาพระราม 2 (ขาออก)
585 ถ.พระรามที่ 2 แขวงแสมดำ เขตบางขุนเทียน กรุงเทพมหานคร 10150
สถานีบริการ ปตท. ช.สามเศียร
444/4 ถ.เพชรเกษม แขวงบางหว้า เขตภาษีเจริญกรุงเทพมหานคร 10160
สถานีบริการ ปตท. สิริเจริญวัฒนา
86 หมู่ที่ 8 แขวงฉิมพลี เขตตลิ่งชัน กรุงเทพมหานคร 10170
สถานี สาขาราชพฤกษ์ 1
31/12 ม.13 แขวงบางระมาด เขตตลิ่งชัน กรุงเทพมหานคร 10170
สถานีบริการ สาขาวงแหวนกาญจนาภิเษก-ตลิ่งชัน
58/5 ม.19 ถ.กาญจนาภิเษก แขวงศาลาธรรมสพน์ เขตทวีวัฒนา กรุงเทพมหานคร 10170
สถานีบริการ สาขาบรมราชชนนี (ขาเข้า)
302/1 ถ.บรมราชชนนี แขวงฉิมพลี เขตตลิ่งชัน จ.กรุงเทพมหานคร 10170
สถานี สาขาเทพรักษ์
202/1 ถ.เทพรักษ์ แขวงท่าแร้ง เขตบางเขน กรุงเทพมหานคร 10220
สถานีบริการ บจ.ส.เจริญกิจ เพิ่มสิน
29/12 ถ.เพิ่มสิน แขวงคลองถนน เขตสายไหม กรุงเทพมหานคร 10220
สถานีบริการ บจ.เจพีอีลีทออเงิน
42/94 ถ.สุขาภิบาล 5 แขวงออเงิน เขตสายไหม กรุงเทพมหานคร 10220
สถานีบริการ สาขาพหลโยธิน กม.25
438 ถ.พหลโยธิน แขวงสายไหม เขตสายไหม กรุงเทพมหานคร 10220
สถานีบริการ บจ.ซุปเปอร์โมเดล เอนเนอจี
388 ถนนสายไหม แขวงสายไหม เขตสายไหม กรุงเทพมหานคร 10220
สถานีบริการ บจ.ส.รุ่งวิภา
201/19 ถ.วิภาวดี รังสิต แขวงตลาดบางเขน เขตหลักสี่ กรุงเทพมหานคร 10220
สถานีบริการ บจ.ส.เจริญกิจ สุขาภิบาล 5
48 ถ.สุขาภิบาล 5 แขวงออเงิน เขตสายไหม กรุงเทพมหานคร 10220
เดอะ พรอมานาด (อาคารจอดรถ ชั้น1)
587,589, 589/7-9 ถนนรามอินทรา แขวงคันนายาว เขตคันนายาว กรุงเทพ 10230
แฟชั่นไอส์แลนด์ (อาคารจอดรถ ดี ชั้น1)
587,589, 589/7-9 ถนนรามอินทรา แขวงคันนายาว เขตคันนายาว กรุงเทพ 10230
แฟชั่นไอส์แลนด์ (อาคารจอดรถ เอ ชั้น2)
587,589, 589/7-9 ถนนรามอินทรา แขวงคันนายาว เขตคันนายาว กรุงเทพ 10230
สถานีบริการ สาขาลาดพร้าว-วังหิน
499 ถ.ลาดพร้าววังหิน แขวงลาดพร้าว เขตลาดพร้าว กรุงเทพมหานคร 10230
สถานีบริการ สาขานวลจันทร์
195 ม.10 ถ.นวลจันทร์ แขวงคลองกุ่ม เขตบึงกุ่ม กรุงเทพมหานคร 10230
สถานีบริการ สาขานวลจันทร์
195 ม.10 ถ.นวลจันทร์ แขวงคลองกุ่ม เขตบึงกุ่ม กรุงเทพมหานคร 10230
สถานีบริการ บจ.เอ็กซ์เพิร์ท เอนเนอจี
189 เกษตร - นวมินทร์ แขวง นวมินทร์ เขตบึงกุ่ม กรุงเทพมหานคร 10240
โออาร์ สเปซ รามคำแหง 165
211/1 ถนนรามคำแหง แขวงราษฎร์พัฒนา เขตสะพานสูง กรุงเทพมหานคร 10240
สถานีบริการ รามคำแหง
ถ.รามคำแหง แขวงสวนหลวง เขตสวนหลวง กรุงเทพมหานคร 10250
สถานีบริการ สาขาพัฒนาการ (ขาออก)
315/4 ถ.พัฒนาการ แขวงประเวศ เขตประเวศ กรุงเทพฯ 10250
สถานี สาขาสวัสดิการสำนักงานปลัดกระทรวงกลาโหม(บางนาขาเข้า)
138 ซ.สุขุมวิท 64 แยก 10 แขวงพระโขนงใต้ เขตพระโขนง กรุงเทพมหานคร 10260
สถานี สาขาสำนักงานปลัดกระทรวงกลาโหม(บางนาขาออก)
82 ซ.สุขุมวิท 64 แขวงพระโขนงใต้ เขตพระโขนง กรุงเทพมหานคร 10260
สถานี สาขาสรรพาวุธ-บางนา
500/4 ถ.สรรพาวุธ แขวงบางนาเหนือ เขตบางนา กรุงเทพมหานคร 10260
สุพรีม สามเสน
1024 ถนนสามเสน แขวง ถนนนครไชยศรี เขตดุสิต กรุงเทพมหานคร 10300
สถานีบริการ สาขาแยกประชาอุทิศ-ลาดพร้าว
359 ถ.ประดิษฐ์มนูธรรม แขวงวังทองหลาง เขตวังทองหลาง กรุงเทพมหานคร 10310
ลานจอดรถอาคารเกษม อาคารจอดรถ 3 คณะรัฐศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
ลานจอดรถอาคารเกษม คณะรัฐศาสตร์ 254 ถ. พญาไท แขวง ปทุมวัน เขตปทุมวัน กรุงเทพมหานคร 10330
อาคารจอดรถ 1 (ข้างจามจุรี 9) จุฬาลงกรณ์มหาวิทยาลัย
254 ถนนพญาไท อาคารจามจุรี 9 จุฬาลงกรณ์มหาวิทยาลัย แขวง วังใหม่ เขตปทุมวัน กรุงเทพมหานคร 10330
อาคารจอดรถ 2 คณะอักษรศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
ลานจอดรถหน้าโรงอาหาร คณะอักษรศาสตร์ 254 ถ. พญาไท แขวง ปทุมวัน เขตปทุมวัน กรุงเทพมหานคร 10330
สถานี สาขาสามย่าน
1323 ถ.พระราม 4 แขวงวังไหม่ เขตปทุมวัน กรุงเทพมหานคร 10330
ลานจอดรถหน้าอาคารเลิศอุรัสยะนันทน์ จุฬาลงกรณ์มหาวิทยาลัย
254 ถนนพญาไท แขวง วังใหม่ เขตปทุมวัน กรุงเทพมหานคร 10330
อาคารจอดรถ 4 จุฬาลงกรณ์มหาวิทยาลัย
อาคารจอดรถ 4 ซอย จุฬาลงกรณ์ 12 แขวง วังใหม่ เขตปทุมวัน กรุงเทพมหานคร 10330
สยามสเคป ชั้น 4
อาคารเลขที่ 215 อาคารสยามสเคป ถนนพญาไท แขวงปทุมวัน เขตปทุมวัน กทม. 10330
อุทยาน ๑๐๐ ปี จุฬาฯ
1701 ถนนพระราม 6 แขวงวังใหม่ เขตปทุมวัน กทม. 10330
อาคารวิทยกิตติ์ ชั้น 4
จุฬาลงกรณ์ซอย 64 ถนนพญาไท แขวงปทุมวัน เขตปทุมวัน กทม. 10330
สถานีบริการ ลานจอดรถ ซียูสปอต โซน
ซอยจุุฬาลงกรณ์ 10 แขวงวังใหม่ เขตปทุมวัน กทม. 10330
สถานีสาขาวิภาวดี (เดิม-สวัสดิการ ร.1 รอ.)
181 ถ.วิภาวดีรังสิต แขวงสามเสนใน เขตพญาไท กรุงเทพมหานคร 10400
สถานีบริการ ปตท. เอ็น.จี.วี. กม.5
77/1 หมู่ที่ 3 แขวงแสนแสบ เขตมีนบุรี กรุงเทพมหานคร 10510
สถานีบริการ ปตท.เอเชียมีนบุรี
78/2 ถนนรามคำแหง แขวงมีนบุรี เขตมีนบุรี กรุงเทพมหานคร 10510
เอสเจ อินฟินิท วัน บิสซิเนส คอมเพล็กซ์
349 ถนนวิภาวดีรังสิต แขวงจอมพล เขตจตุจักร กรุงเทพมหานคร 10900
สถานีบริการ ปตท. กำแพงเพชร 2
ซอยริมถนนกำแพงเพชร 2 แขวงจตุจักร เขตจตุจักร จังหวัด กรุงเทพมหานคร 10900
สถานีบริการ หจก.ศรีเจริญภัณฑ์
1093 ถ.วิภาวดีรังสิต แขวงลาดยาว เขตจตุจักร กรุงเทพมหานคร 10900
เจ เจ มอลล์ (อาคารจอดรถ ชั้น3)
588 ถนนกำแพงเพชร 2 , จตุจักร , กรุงเทพ 10900
อาคารจอดรถเอนเนอร์ยี่คอมเพล็กซ์ (พี 1 ชั้น 10)
555/2 อาคารเอนเนอร์ยี่คอมเพล็กซ์ อาคารบี ชั้น 10 ถ.วิภาวดีรังสิต จตุจักร กทม.10900
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ประเวศ) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร ประเวศ 295 ถนน เฉลิมพระเกียรติ ร. 9 แขวงหนองบอน เขต ประเวศ กรุงเทพมหานคร 10250
เวลาเรียนรอบเช้า 09.00 - 12.00 น.
เวลาเรียนรอบบ่าย 13.00 - 16.00 น.
เวลาเรียนรอบค่ำ 17.00 - 20.00 น.
วิชาที่เปิดสอน : คอมพิวเตอร์และระบบสารสนเทศเพื่องานอาชีพ คอมพิวเตอร์เพื่องานสำนักงาน ภาษาอังกฤษในชีวิตประจำวัน สร้างแบบเสื้อผ้าสตรี1 อุตสาหกรรมกางเกงบุรุษ อุตสาหกรรมเสื้อผ้าเด็ก ขนมอบ อาหารไทย แต่งผมสตรี ซอยผมสตรี ตัดผมสุภาพบุรุษ ซอยผมสุภาพบุรุษ นวดไทยเพื่อสุขภาพ เครื่องยนต์แก๊สโซลีน เครื่องจักรยานยนต์ ซ่อมเครื่องใช้ไฟฟ้าชนิดมอเตอร์ จักรยานยนต์ เดินสายและติดตั้งอุปกรณ์ไฟฟ้าภายในอาคาร เครื่องปรับอากาศ แต่งหน้า แต่งเล็บ
5 อันดับภัยออนไลน์
คดีออนไลน์ที่ได้รับแจ้งสูงสุด 5 อันดับแรก
- หลอกขายของแล้วไม่ได้ของ
- หลอกทำภารกิจ
- หลอกกู้เงิน
- คอลเซนเตอร์
- หลอกลงทุน
สถิติ เดือนมีนาคม (20 วันแรกของเดือน) รับแจ้ง 75,307 ครั้ง ความเสียหาย กว่า 1 พันล้านบาท
ภาคตะวันออก : “วิจิตร@ระยอง เมื่อสุริยาลับขอบฟ้า การผจญภัยตามหา ขุมทรัพย์แห่งความอุดมสมบูรณ์ ของภาคตะวันออก จึงเริ่มขึ้น..”
ภาคตะวันออก : พบกับการแสดง แสง สี เสียง ภายใต้แนวคิด “วิจิตร@ระยอง เมื่อสุริยาลับขอบฟ้า การผจญภัยตามหา ขุมทรัพย์แห่งความอุดมสมบูรณ์ ของภาคตะวันออก จึงเริ่มขึ้น..” สร้างสีสันบรรยากาศให้กับสถานที่ท่องเที่ยวในจังหวัดระยอง ให้สวยงามและให้เป็นที่ประจักษ์สู่สายตานักท่องเที่ยว เพื่อกระตุ้นท่องเที่ยว เชิญชวนเที่ยวงาน สัมผัสบรรยากาศการแสดงแสง สี เสียง ด้วยการประดับตกแต่งไฟ ด้วยเทคนิค Projection Mapping เกาะกลางน้ำ, โลกแสงสีสันใต้น้ำของแมงกะพรุน, การแสดงโชว์ Lighting ณ สะพานแห่งวิถีวิจิตร, กิจกรรมแสดงพลุ ดอกไม้ไฟ เป็นต้น บนพื้นที่กว่า 2 ตารางกิโลเมตร เสมือนได้อยู่ท่ามกลางดินแดนเหนือจินตนาการ และพบกับการแสดงดนตรีจากศิลปินชั้นนำ รวมถึงการสนับสนุนให้ผู้ประกอบการร้านค้าในชุมชนท้องถิ่นออกร้านขายของ สามารถเที่ยวชมงานได้ตั้งแต่วันที่ 27 พฤษภาคม – 4 มิถุนายน พ.ศ. 2566 ณ เจดีย์กลางน้ำป่าชายเลน จังหวัดระยอง
น้องตาต้า ด.ญ.วรรณภา ธรรมศรี
ด.ญ.วรรณภา ธรรมศรี หรือตาต้า อายุ 13 ปี นักเรียนชั้นมัธยมศึกษาปีที่ 1 โรงเรียนวัดปทุมวนาราม กล่าวถึงกิจกรรมที่ตนชื่นชอบที่สุด “หลังจากที่ได้เข้าร่วมกิจกรรมในฐานความรู้ที่ 1 ทำให้ได้รับความรู้เกี่ยวกับวงจรชีวิตของยุง ไข่ ลูกน้ำ และตัวโม่งของยุงชนิดต่าง ๆ รู้สึกชื่นชอบเป็นพิเศษ เนื่องจากได้เห็นลูกน้ำ และยุงที่มีชีวิตในหลากหลายสายพันธุ์ รวมถึงยุงบางชนิดที่ไม่มีโอกาสได้เห็นในชีวิตจริงมาก่อนจึงค่อนข้างตื่นเต้น และประทับใจมาก พี่ ๆ วิทยากรให้ความรู้ในรูปแบบที่น่าสนใจและสนุกสนาน สร้างแรงบันใจในการคิดโครงการนำเสนอได้อีกด้วยค่ะ”
โรงพยาบาลสิรินธร ให้บริการฉีดวัคซีนโควิด แบบ WALK IN LINK
โรงพยาบาลสิรินธร ให้บริการฉีดวัคซีนโควิด แบบ WALK IN ตามวันและเวลาดังนี้
วันจันทร์ - ศุกร์ ตั้งแต่เวลา 13.00 – 15.00 น.
วันเสาร์ ตั้งแต่เวลา 08.00 – 12.00 น.
สิ่งที่ต้องเตรียมมา
1. บัตรประชาชนตัวจริงเท่านั้น / หนังสือเดินทาง (PASSPORT) สำหรับชาวต่างชาติ
2. บัตรโรงพยาบาล (ถ้ามี)
3. เอกสารรับรองการได้รับวัคซีน 19 (ถ้ามี)
4. ปากกาส่วนตัว
โทรสอบถามข้อมูลได้ที่กลุ่มงานเวชศาสตร์ชุมชน
ในวันและเวลาราชการ วันจันทร์ – วันศุกร์ เวลา 08.00 – 16.00 น.
ได้ที่เบอร์โทร 0 2328 6900-15 ต่อ 10294 , 17100
โรงพยาบาลเวชการุณย์รัศมิ์ เปิดให้บริการฉีดวัคซีนป้องกัน Covid-19 LINK
โรงพยาบาลเวชการุณย์รัศมิ์ สำนักการแพทย์ กรุงเทพมหานคร เปิดให้บริการฉีดวัคซีนป้องกัน Covid-19 เดือนเมษายน 2566 เปิดบริการ ทุกวันจันทร์ (วันทำการ) เวลา 13.00-16.00 น.
ขั้นตอนการรับบริการ
1. ยื่นบัตร (คลินิกวัคซีนผู้ใหญ่) ชั้น 1
2. ยืนยันตัวตนที่ชั้น 1
3. ตรวจคัดกรอง (ห้องประกันสังคม ชั้น 2)
4. ติดต่อการเงิน ชั้น 2
5. ฉีดวัคซีน
6. รับหนังสือรับรอง/ใบนัด
วัคซีนไฟเซอร์ฝาสีส้มและฝาสีแดง
เปิดบริการ วันศุกร์ที่ 28 เมษายน 2566
เวลา 13.00-14.30 น. ที่ห้องตรวจกุมาร
วัคซีนสำหรับชาวต่างชาติ
ฟรี! สำหรับผู้ถือใบอนุญาตทำงาน (Work Permit)
- อัตราค่าบริการวัคซีนไฟเซอร์ 1,330 บาท
- อัตราค่าบริการวัคซีนแอสตราฯ 1,130 บาท
ติดต่อสอบถามเพิ่มเติม
โทร. 0–2988-4100 กด 197
ประชาสัมพันธ์โรงพยาบาลเวชการุณย์รัศมิ์
นายแพทย์ดักลาส อาร์ โลวี (Douglas R. Lowy, M.D.) รองผู้อำนวยการสถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติ สหรัฐอเมริกา
นายแพทย์ดักลาส อาร์ โลวี สำเร็จการศึกษาแพทยศาสตรบัณฑิตจาก มหาวิทยาลัยนิวยอร์ค สหรัฐอเมริกา หลังจากฝึกอบรมเป็นแพทย์ประจำบ้านอายุรศาสตร์ที่มหาวิทยาลัยสแตนฟอร์ด และแพทย์ประจำบ้านสาขาวิชาตจวิทยา มหาวิทยาลัยเยล สหรัฐอเมริกา แล้วได้เข้าทำงานที่สถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติจนถึงปัจจุบันปัจจุบันดำรงตำแหน่งรองผู้อำนวยการสถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติ สหรัฐอเมริกา
อุปกรณ์ทางการแพทย์ที่สวมใส่ได้ (Wearable Medical Devices)


อุปกรณ์สวมใส่จะถูกนำมาใช้มากขึ้นโดยบุคคลในช่วงปี 2566 เพื่อติดตามสุขภาพและกิจกรรมการออกกำลังกายของตนเอง เช่นเดียวกับที่แพทย์ใช้เพื่อตรวจสอบผู้ป่วยจากระยะไกล "Internet of Medical Things" ได้ขยายตัวอย่างรวดเร็วในช่วงไม่กี่ปีที่ผ่านมา จากอุปกรณ์ง่ายๆ ที่ออกแบบมาเพื่อติดตามสัญญาณชีพ เช่น อัตราการเต้นของหัวใจและระดับออกซิเจนในเลือด ไปจนถึงนาฬิกาอัจฉริยะที่สามารถสแกนที่ซับซ้อน เช่น ECG สิ่งทออัจฉริยะที่สามารถตรวจจับความดันโลหิตและทำนาย เสี่ยงต่อการเกิดภาวะหัวใจวาย และถุงมืออัจฉริยะที่สามารถลดอาการสั่นของผู้ป่วยโรคพาร์กินสันได้ นอกจากความเจ็บป่วยทางร่างกายแล้ว การให้ความสำคัญมากขึ้นกับการพัฒนาอุปกรณ์สวมใส่ที่สามารถตรวจสอบและตรวจจับสัญญาณของความเจ็บป่วยทางจิตได้ การศึกษาที่เผยแพร่ในปีนี้แสดงให้เห็นว่าตัวบ่งชี้ทางกายภาพ เช่น ระดับกิจกรรม รูปแบบการนอนหลับ และอัตราการเต้นของหัวใจสามารถใช้ตรวจจับเมื่อใดที่บุคคลอาจมีความเสี่ยงต่อภาวะซึมเศร้า และเราอาจเริ่มเห็นอุปกรณ์สวมใส่ทางการแพทย์ที่รวมเอาฟังก์ชันนี้ไว้ในเร็วๆ นี้
ในปี 2566 เราจะเห็นอุปกรณ์ทางการแพทย์ที่สวมใส่ได้ทำหน้าที่เป็นอุปกรณ์ที่ “ล้ำหน้า” มากขึ้น ซึ่งหมายความว่าอุปกรณ์เหล่านั้นจะติดตั้งโปรเซสเซอร์และสามารถใช้การวิเคราะห์ในอุปกรณ์ได้ แทนที่จะต้องส่งข้อมูลย้อนกลับและส่งต่อระหว่างอุปกรณ์และระบบคลาวด์เพื่อ ประมวลผล ซึ่งมีประโยชน์หลัก 2 ประการ ประการแรกคือความเป็นส่วนตัว เนื่องจากข้อมูลส่วนบุคคลที่ละเอียดอ่อนของผู้ป่วยไม่ต้องออกจากอุปกรณ์ ประการที่สอง มีความเร็ว ซึ่งมีความสำคัญอย่างยิ่งในกรณีของอุปกรณ์ที่ออกแบบมาเพื่อตรวจจับและเตือนสภาวะที่อาจเป็นอันตรายต่อชีวิตในแบบเรียลไทม์
การตัดต่อยีน CRISPR
เทคโนโลยีการแก้ไขยีน Palindromic Repeats (CRISPR) แบบคลัสเตอร์อย่างสม่ำเสมอสามารถเปลี่ยนวิธีการรักษาโรคได้อย่างก้าวกระโดด ย่นระยะเวลา และทำให้เกิดความก้าวหน้าอย่างมากในความพยายามจะพิชิตโรคร้ายแรงหลายๆ โรค อาทิ โรคมะเร็ง หรือ เอชไอวี ได้ในเวลาไม่กี่ปี
เทคโนโลยีนี้ทำงานโดย "ควบคุมกลไกธรรมชาติ" ของไวรัสที่บุกรุก แล้ว "ตัด" สายดีเอ็นเอที่ติดเชื้อออก ด้วยการเปลี่ยนแปลงการกลายพันธุ์ของเซลล์
CRISPR ยังมีศักยภาพในการเปลี่ยนแปลงวิธีการรักษาโรคที่หายาก เช่น ซิสติกไฟโบรซิสและโรคเซลล์รูปเคียว
อย่างไรก็ตาม ความกังวลด้านจริยธรรมในการนำมาใช้ กำลังเป็นที่ถกเถียง อย่างกว้างขวางและเผ็ดร้อน ภายหลังจากกรณี ทีมนักวิทยาศาสตร์ถูกดำเนินคดีในจีนในปี 2020 ที่พวกเขาอ้างว่าได้สร้าง “นักออกแบบทารก (designer babies)” รายแรกของโลกโดยใช้ CRISPR
สิทธิประกันสังคม รพ.พริ้นซ์ ลำพูน ฉีดวัคซีนไข้หวัดใหญ่ ไม่มีค่าใช้จ่ายใดๆ LINK
เริ่มตั้งแต่วันนี้! "สิทธิประกันสังคม รพ.พริ้นซ์ ลำพูน อายุตั้งแต่ 50 ปีขึ้นไป #ฉีดวัคซีนไข้หวัดใหญ่4สายพันธุ์ ไม่มีค่าใช้จ่ายใดๆ มาเลยที่ รพ.พริ้นซ์ ลำพูน"
เชิญชวนผู้ประกันตน รพ.พริ้นซ์ ลำพูน อายุตั้งแต่ 50 ปีขึ้นไป รับบริการฉีด #วัคซีนป้องกันโรคไข้หวัดใหญ่4สายพันธุ์ #ไม่มีค่าใช้จ่าย สามารถเข้ารับวัคซีนได้ ตั้งเเต่วันที่ 1 พฤษภาคม 2566 ถึง 31 สิงหาคม 2566
หมายเหตุ* สำหรับผู้ประกันตนที่ไม่สามารถเข้ารับการบริการจาก รพ. ต้นสังกัดของท่าน รพ.พริ้นซ์ ลำพูน สามารถให้บริการท่านได้ โดยผู้ประกันตนติดต่อที่ “สำนักงานประกันสังคม” โทร. 02-956-2500 ถึง 10 (เบอร์นี้ให้บริการเฉพาะวันทำการ จ-ศ) เพื่อขอรับ Code ก่อนเข้ารับบริการ ที่ รพ.พริ้นซ์ ลำพูน
ติดต่อโรงพยาบาลพริ้นซ์ ลำพูนได้ที่ Call center : 053-582888
ห้องตรวจหู คอ จมูก
ห้องตรวจหู คอ จมูก อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 4 โทร. 044-615002 ต่อ 4411
ประสบการณ์ในผู้ป่วยกลุ่มฟื้นฟูพิเศษในโรงพยาบาลฯ กว่า 22 ปี - คุณสิรินภา หยองอนุกูล
คุณสิรินภา หยองอนุกูล ผู้อำนวยการฝ่ายบริหาร โรงพยาบาลกรุงสยามเซนต์คาร์ลอส เผยถึงแผนการพัฒนา “St.Carlos RECC” ว่า “หลังจากมีประสบการณ์ในผู้ป่วยกลุ่มฟื้นฟูพิเศษในโรงพยาบาลฯ กว่า 22 ปี ในระยะช่วง 1-2 ปีที่ผ่านมาได้พบว่าสถิติของผู้ป่วยกลุ่มนี้เฉพาะในโรงพยาบาลกรุงสยามเซนต์คาร์ลอส มีแนวโน้มสูงขึ้น และประเทศไทยในปี ค.ศ.2040 ผู้สูงอายุจะเพิ่มขึ้นเป็น 33% (อายุ 60 ปี) จึงเล็งเห็นถึงช่องว่างและโอกาสของตลาดผู้ป่วยที่ต้องการดูแลอย่างใกล้ชิด โดยใช้วิชาชีพเฉพาะเข้าไปฟื้นฟู รวมถึงสภาพแวดล้อมที่เอื้อต่อการดูแลผู้ป่วยในทุกมิติ
บึงกาฬ ส.ส. 3 คน 100%
- เขต 1 ภูมิใจไทย นายสยาม เพ็งทอง 25,295
- เขต 2 ภูมิใจไทย นายสุวรรณา กุมภิโร 26,541
- เขต 3 เพื่อไทย นายนิพนธ์ คนขยัน 30,277
บุรีรัมย์ ส.ส. 10 คน 100%
- เขต 1 ภูมิใจไทย นายสนอง เทพอักษรณรงค์ 36,707
- เขต 2 ภูมิใจไทย นายไชยชนก ชิดชอบ 46,729
- เขต 3 ภูมิใจไทย นายอดิพงษ์ ฐิติพิทยา 38,468
- เขต 4 ภูมิใจไทย นายรังสิกร ทิมาตฤกะ 37,706
- เขต 5 ภูมิใจไทย นายโสภณ ซารัมย์ 47,746
- เขต 6 ภูมิใจไทย นายศักดิ์ ซารัมย์ 35,229
- เขต 7 ภูมิใจไทย นายพรชัย ศรีสุริยันโยธิน 28,685
- เขต 8 ภูมิใจไทย นายไตรเทพ งามกมล 34,429
- เขต 9 ภูมิใจไทย นายรุ่งโรจน์ ทองศรี 45,059
- เขต 10 ภูมิใจไทย นายจักรกฤษณ์ ทองศรี 39,006
ปทุมธานี ส.ส. 7 คน 100%
- เขต 1 ก้าวไกล นายสรวีย์ ศุภปณิตา 29,272
- เขต 2 ก้าวไกล นายเจษฎา ดนตรีเสนาะ 40,206
- เขต 3 ก้าวไกล นางสาวชลธิชา แจ้งเร็ว 43,096
- เขต 4 ก้าวไกล นายสกล สุนทรวาณิชย์กิจ 41,705
- เขต 5 เพื่อไทย นายมนัสนันท์ หลีนวรัตน์ 35,074
- เขต 6 ก้าวไกล นายเชตวัน เตือประโคน 48,900
- เขต 7 ก้าวไกล นายประสิทธิ์ ปัทมผดุงศักดิ์ 35,866
ประจวบคีรีขันธ์ ส.ส. 3 คน 100%
- เขต 1 ภูมิใจไทย นายสังคม แดงโชติ 34,445
- เขต 2 ประชาธิปัตย์ นายจักพันธ์ ปิยพรไพบูลย์ 42,736
- เขต 3 ประชาธิปัตย์ นายประมวล พงศ์ถาวราเดช 20,444
ปราจีนบุรี ส.ส. 3 คน 100%
- เขต 1 ภูมิใจไทย นายอำนาจ วิลาวัลย์ 35,641
- เขต 2 ก้าวไกล นายวุฒิพงศ์ ทองเหลา 35,451
- เขต 3 ภูมิใจไทย นายสฤษดิ์ บุตรเนียร 30,833
ปัตตานี ส.ส. 5 คน 100%
- เขต 1 ประชาชาติ ผู้ช่วยศาสตราจารย์วรวิทย์ บารู 14,452
- เขต 2 พลังประชารัฐ นายคอซีย์ มามุ 23,483
- เขต 3 ประชาชาติ นายสมมุติ เบ็ญจลักษณ์ 23,636
- เขต 4 ประชาธิปัตย์ นายยูนัยดี วาบา 21,556
- เขต 5 ประชาชาติ นายสาเหะมูหามัด อัลอิดรุส 37,068
พระนครศรีอยุธยา ส.ส. 5 คน 100%
- เขต 1 ก้าวไกล นายทวิวงศ์ โตทวิวงศ์ 41,081
- เขต 2 ก้าวไกล นายชริน วงศ์พันธ์เที่ยง 21,639
- เขต 3 ภูมิใจไทย นางสาวพิมพฤดา ตันจรารักษ์ 37,824
- เขต 4 ภูมิใจไทย นายสุรศักดิ์ พันธ์เจริญวรกุล 50,080
- เขต 5 ภูมิใจไทย นายประดิษฐ์ สังขจาย 29,207
พะเยา ส.ส. 3 คน 100%
- เขต 1 พลังประชารัฐ นายธรรมนัส พรหมเผ่า 53,963
- เขต 2 พลังประชารัฐ นายอนุรัตน์ ตันบรรจง 32,779
- เขต 3 พลังประชารัฐ นายจีรเดช ศรีวิราช 34,720
พังงา ส.ส. 2 คน 100%
- เขต 1 ภูมิใจไทย นายอรรถพล ไตรศรี 34,443
- เขต 2 พลังประชารัฐ นายฉกาจ พัฒนกิจวิบูลย์ 21,506
พัทลุง ส.ส. 3 คน 100%
- เขต 1 ประชาธิปัตย์ นางสุพัชรี ธรรมเพชร 49,471
- เขต 2 รวมไทยสร้างชาติ นายนิติศักดิ์ ธรรมเพชร 41,201
- เขต 3 ประชาธิปัตย์ นายร่มธรรม ขำนุรักษ์ 47,848
พิจิตร ส.ส. 3 คน 100%
- เขต 1 ภูมิใจไทย นายภัทรพงศ์ ภัทรประสิทธิ์ 43,965
- เขต 2 ภูมิใจไทย นายวินัย ภัทรประสิทธิ์ 33,390
- เขต 3 ภูมิใจไทย นายศิริวัฒน์ ขจรประศาสน์ 33,425
พิษณุโลก ส.ส. 5 คน 100%
- เขต 1 ก้าวไกล นายปดิพัทธ์ สันติภาดา 40,198
- เขต 2 เพื่อไทย นายนพพล เหลืองทองนารา 30,819
- เขต 3 รวมไทยสร้างชาติ นายพงษ์มนู ทองหนัก 44,436
- เขต 4 เพื่อไทย นางสาวพิมพ์พิชชา ชัยศุภกิจเจริญ 25,626
- เขต 5 ก้าวไกล นายศุภปกรณ์ กิตยาธิคุณ 25,763
เพชรบุรี ส.ส. 3 คน 100%
- เขต 1 รวมไทยสร้างชาติ นางธิวัลรัตน์ อังกินันทน์ 40,235
- เขต 2 ภูมิใจไทย นายฤกษ์ อยู่ดี 24,869
- เขต 3 รวมไทยสร้างชาติ จ่าอากาศเอกอภิชาติ แก้วโกศล 11,597
เพชรบูรณ์ ส.ส. 6 คน 100%
- เขต 1 พลังประชารัฐ นางสาวพิมพ์พร พรพฤฒิพันธุ์ 35,905
- เขต 2 พลังประชารัฐ นายจักรัตน์ พั้วช่วย 38,352
- เขต 3 พลังประชารัฐ นายบุญชัย กิตติธาราทรัพย์ 31,707
- เขต 4 พลังประชารัฐ นายวรโชติ สุคนธ์ขจร 41,039
- เขต 5 พลังประชารัฐ นางวันเพ็ญ พร้อมพัฒน์ 34,971
- เขต 6 พลังประชารัฐ นายอัคร ทองใจสด 47,118
แพร่ ส.ส. 3 คน 100%
- เขต 1 เพื่อไทย นายทศพร เสรีรักษ์ 41,565
- เขต 2 เพื่อไทย นายนิยม วิวรรธนดิฐกุล 32,845
- เขต 3 เพื่อไทย นายวรวัจน์ เอื้ออภิญญกุล 32,446
ภูเก็ต ส.ส. 3 คน 100%
- เขต 1 ก้าวไกล ว่าที่ร้อยตรีสมชาติ เตชถาวรเจริญ 21,252
- เขต 2 ก้าวไกล นายเฉลิมพงศ์ เเสงดี 21,913
- เขต 3 ก้าวไกล นายฐิติกันต์ ฐิติพฤฒิกุล 20,421
มหาสารคาม ส.ส. 6 คน 100%
- เขต 1 เพื่อไทย นายกิตติศักดิ์ คณาสวัสดิ์ 30,859
- เขต 2 เพื่อไทย นายไชยวัฒนา ติณรัตน์ 34,062
- เขต 3 ภูมิใจไทย นายลัทธชัย โชคชัยวัฒนากร 41,727
- เขต 4 เพื่อไทย นายสรรพภัญญู ศิริไปล์ 38,744
- เขต 5 เพื่อไทย นายจิรวัฒน์ ศิริพานิชย์ 45,087
- เขต 6 เพื่อไทย นายรัฐ คลังแสง 46,765
มุกดาหาร ส.ส. 2 คน 100%
- เขต 1 พลังประชารัฐ นายวิริยะ ทองผา 33,514
- เขต 2 ก้าวไกล นายณกร ชารีพันธ์ 28,555
แม่ฮ่องสอน ส.ส. 2 คน 100%
- เขต 1 ประชาธิปัตย์ นายดนุภัทร์ เชียงชุม 18,777
- เขต 2 ประชาธิปัตย์ นายสมบัติ ยะสินธุ์ 20,345
ยโสธร ส.ส. 3 คน 100%
- เขต 1 ไทยสร้างไทย นางสุภาพร สลับศรี 53,130
- เขต 2 เพื่อไทย นายบุญแก้ว สมวงศ์ 44,851
- เขต 3 ภูมิใจไทย นายธนพัฒน์ ศรีชนะ 37,946
ยะลา ส.ส. 3 คน 100%
- เขต 1 ประชาชาติ นายสุไลมาน บือแนปีแน 23,682
- เขต 2 ประชาชาติ นายซูการ์โน มะทา 51,946
- เขต 3 ประชาชาติ นายอับดุลอายี สาแม็ง 31,741
ร้อยเอ็ด ส.ส. 8 คน 100%
- เขต 1 ชาติไทยพัฒนา นายอนุรักษ์ จุรีมาศ 40,436
- เขต 2 เพื่อไทย นายฉลาด ขามช่วง 28,158
- เขต 3 พลังประชารัฐ นางรัชนี พลซื่อ 39,181
- เขต 4 เพื่อไทย นายนรากร นาเมืองรักษ์ 36,822
- เขต 5 เพื่อไทย นางสาวจิราพร สินธุไพร 61,288
- เขต 6 เพื่อไทย นายกิตติ สมทรัพย์ 36,878
- เขต 7 ไทยสร้างไทย นายชัชวาล แพทยาไทย 42,484
- เขต 8 เพื่อไทย นางสาวชญาภา สินธุไพร 47,305
ระนอง ส.ส. 1 คน 100%
- เขต 1 ภูมิใจไทย นายคงกฤษ ฉัตรมาลีรัตน์ 44,717
ระยอง ส.ส. 5 คน 100%
- เขต 1 ก้าวไกล นางสาวกมนทรรศน์ กิตติสุนทรสกุล 17,386
- เขต 2 ก้าวไกล นายกฤช ศิลปชัย 38,813
- เขต 3 ก้าวไกล นายนครชัย ขุนณรงค์ 29,034
- เขต 4 ก้าวไกล นายชุติพงศ์ พิภพภิญโญ 38,707
- เขต 5 ก้าวไกล นางสว่างจิตต์ เลาหะโรจนพันธ์ 34,706
ราชบุรี ส.ส. 5 คน 100%
- เขต 1 รวมไทยสร้างชาติ นางสาวกุลวลี นพอมรบดี 52,941
- เขต 2 พลังประชารัฐ นางบุญยิ่ง นิติกาญจนา 36,009
- เขต 3 พลังประชารัฐ นายจตุพร กมลพันธ์ทิพย์ 49,262
- เขต 4 รวมไทยสร้างชาติ นายอัครเดช วงษ์พิทักษ์โรจน์ 54,815
- เขต 5 พลังประชารัฐ นายชัยทิพย์ กมลพันธ์ทิพย์ 44,253
ลพบุรี ส.ส. 5 คน 100%
- เขต 1 เพื่อไทย นายสิทธิชัย หล่อประสงค์สุข 22,391 28,405
- เขต 2 ก้าวไกล นายสาธิต ทวีผล 26,417
- เขต 3 ภูมิใจไทย นางสาวมัลลิกา จิระพันธุ์วาณิช 43,325
- เขต 4 ภูมิใจไทย นายนรินทร์ คลังผา 41,413
- เขต 5 เพื่อไทย นายวรวงศ์ วรปัญญา 41,822
ลำปาง ส.ส. 4 คน 100%
- เขต 1 ก้าวไกล นางทิพา ปวีณาเสถียร 51,579
- เขต 2 เพื่อไทย นายธนาธร โล่ห์สุนทร 41,114
- เขต 3 ก้าวไกล นายชลธานี เชื้อน้อย 41,651
- เขต 4 ก้าวไกล นางสาวรภัสสรณ์ นิยะโมสถ 47,027
ลำพูน ส.ส. 2 คน 100%
- เขต 1 ก้าวไกล นายวิทวิสิทธิ์ ปันสวนปลูก 30,127
- เขต 2 เพื่อไทย นายรังสรรค์ มณีรัตน์ 47,050
เลย ส.ส. 4 คน 100%
- เขต 1 เพื่อไทย นายเลิศศักดิ์ พัฒนชัยกุล 49,831
- เขต 2 เพื่อไทย นายศรัณย์ ทิมสุวรรณ 50,421
- เขต 3 ภูมิใจไทย นายธนยศ ทิมสุวรรณ 44,272
- เขต 4 เพื่อไทย นายสมเจตน์ แสงเจริญรัตน์ 45,638
แว่นตาฟรีถึง 18 ปี
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
ให้แว่นตาฟรี สำหรับเด็กที่มีอายุต่ำกว่า 18 ปี ที่มีปัญหาทางสายตา อยู่ในสิทธิหลักประกันสุขภาพถ้วนหน้า
ยุทธศาสตร์ที่ 3 ส่งเสริม สนับสนุนอุตสาหกรรมวัคซีนภายในประเทศให้มีความเข้มแข็งและส่งออกได้
เป็นการเสริมสร้างศักยภาพของอุตสาหกรรมวัคซีนของประเทศ โดยการแสวงหาและส่งเสริมความร่วมมือระหว่างภาครัฐและเอกชนทั้งในประเทศและต่างประเทศ รวมทั้งการกำหนดนโยบาย มาตรการ หรือระเบียบปฏิบัติที่สนับสนุนให้เกิดการลงทุน
1. มาตรการสนับสนุนอุตสาหกรรมวัคซีนในประเทศ
- ยังไม่สามารถกำหนดหรือออกมาตรการส่งเสริมด้านสิทธิประโยชน์ในการลงทุนและด้านภาษีแก่ผู้ผลิตวัคซีนเพิ่มเติมได้ อย่างไรก็ตาม สวช. ได้ดำเนินการตามระเบียบคณะกรรมการวัคซีนแห่งชาติว่าด้วยหลักเกณฑ์การคัดเลือกและวิธีการจัดซื้อยาที่เป็นวัคซีนที่รัฐต้องการส่งเสริมและสนับสนุน พ.ศ. 2563 (ประกาศในราชกิจจานุเบกษาเมื่อวันที่ 14 สิงหาคม 2563 โดยประกาศผลการคัดเลือกรายชื่อที่เป็นวัคซีนซึ่งผลิตภายในประเทศและผู้ผลิตที่รัฐต้องการส่งเสริมและสนับสนุน ซึ่ง สวช. ได้มีการติดตามผลการจัดซื้อตามประกาศฯ ตั้งแต่ปีงบประมาณ พ.ศ. 2564 และติดตามต่อเนื่องในปีงบประมาณ พ.ศ. 2565 พบว่า ผู้ผลิตสามารถจำหน่ายวัคซีนได้ตามที่ได้รับการส่งเสริมหรือสนับสนุน
- มาตรการสนับสนุนที่เอื้อต่อการผลิตวัคซีนสัตว์สู่คน โดยวิจัยและพัฒนาวัคซีนป้องกันโรคพิษสุนัขบ้าชนิดเชื้อตายในเซลล์เพาะเลี้ยงสำหรับคนยังอยู่ในห้องปฏิบัติการจึงยังไม่มีกำหนดมาตรการสนับสนุนที่เอื้อต่อการผลิตวัคซีนสัตว์สู่คนให้ได้รับรองมาตรฐานที่ชัดเจน
2. มูลค่ารวมการลงทุนในอุตสาหกรรมการผลิตและส่งออกวัคซีนระหว่างหน่วยงานภาครัฐและเอกชน
เกิดความร่วมมือระหว่างหน่วยงานภาครัฐและเอกชนในการร่วมลงทุนวิจัยพัฒนาและผลิตวัคซีนโควิด-19 โดย สวช. ได้สนับสนุนโครงการการศึกษาความปลอดภัย (Safety) ความสามารถในการกระตุ้นภูมิคุ้มกัน (Immunogenicity) และประสิทธิภาพ (Vaccine Efficiency) ของแคนดิเดตซับยูนิตวัคซีน สำหรับป้องกันโควิด-19 ที่ใช้พืชเป็นแหล่งผลิตในมนุษย์ระยะ 2A ภายใต้วงเงิน 211 ล้านบาท
Cultural District 2023 สวนสาธารณะสราญรมย์
กิจกรรมวันจันทร์ – ศุกร์
Mini Exhibition : มหรสพในสมัยรัชกาลที่ 6 – เปลี่ยนแปลงการปกครอง (10.00 – 20.00 น.)
Workshop : (10.00 – 20.00 น.)
1.โปสการ์ดภาพพิมพ์ กิ่ง ก้าน ใบ
2.Worksheet ตามรอยประวัติศาสตร์จากพันธุ์พืช
3.Worksheet สถาปัตยกรรมเล่าเรื่อง
4.Check Playlist Songs ต้นไม้ร้องเพลง
Show : การแสดงดนตรีแจ๊ส / ลีลาศ / เต้นสวิง (18.30 – 20.00 น.)
.
กิจกรรมวันเสาร์-อาทิตย์
Mini Exhibition : มหรสพในสมัยรัชกาลที่ 6 – เปลี่ยนแปลงการปกครอง (10.00 – 20.00 น.)
Workshop : 10.00 – 20.00 น.
1.โปสการ์ดภาพพิมพ์ กิ่ง ก้าน ใบ
2.Worksheet ตามรอยประวัติศาสตร์จากพันธุ์พืช
3.Worksheet สถาปัตยกรรมเล่าเรื่อง
4.Check Playlist Songs ต้นไม้ร้องเพลง
Talk&Trip : 20 พ.ค.66 : หัวข้อ “สวนเจ้าสู่ประชาชน” วิทยากร ศ.ดร.ชาตรี ประกิตนนทการ
Talk : 27 พ.ค.66 : หัวข้อ Talk หัวข้อ “ท่วงทำนองในเกาะรัตนโกสินทร์” วิทยากร อาจารย์ อัษฎาวุธ สาคริก ทายาทหลวงประดิษฐ์ไพเราะ (มูลนิธิหลวงประดิษฐ์ไพเราะ)
Trip : 21 พ.ค.66
Trip 1 : “ดูนกในวรรณคดี” วิทยากร วัชระ สงวนสมบัติ นักปักษีวิทยา (สุดยอดแฟนพันธุ์แท้ดูนก 2 ปี ซ้อน) สำนักวิชาการพิพิธภัณฑ์ธรรมชาติวิทยา องค์การพิพิธภัณฑ์วิทยาศาสตร์แห่งชาติ (13.00 – 15.30 น.)
Trip 2 : “ต้นไม้ในบทเพลง” วิทยากร: ดร.ชลวิทย์ ทองเจริญชัยกิจ
สำนักวิชาการพิพิธภัณฑ์ธรรมชาติวิทยา องค์การพิพิธภัณฑ์วิทยาศาสตร์แห่งชาติ (16.00 – 17.30 น.)
Trip : 28 พ.ค.66
Trip 1 : “ดูนกในวรรณคดี” วิทยากร วัชระ สงวนสมบัติ นักปักษีวิทยา (สุดยอดแฟนพันธุ์แท้ดูนก 2 ปี ซ้อน) สำนักวิชาการพิพิธภัณฑ์ธรรมชาติวิทยา องค์การพิพิธภัณฑ์วิทยาศาสตร์แห่งชาติ (13.00 - 15.30 น.)
Trip 2 : “ต้นไม้ในบทเพลง” วิทยากร: ดร.ชลวิทย์ ทองเจริญชัยกิจ สำนักวิชาการพิพิธภัณฑ์ธรรมชาติวิทยา องค์การพิพิธภัณฑ์วิทยาศาสตร์แห่งชาติ (16.00 - 17.30 น.)
Show : การแสดงดนตรีแจ๊ส / ลีลาศ / เต้นสวิง (18.30 – 20.00 น.)
พฤษภาคม 2566
วันที่ 16 พฤษภาคม 2566
สถานพยาบาลที่ได้รับใบอนุญาต จากการขอเปลี่ยนแปลงรายการสถานพยาบาล (คลินิก) จำนวน 22 แห่ง ดังนี้ (New!)
1.เดอะสกายคลินิกเวชกรรม
2.คลินิกเวชกรรมเอมมิตรการแพทย์
3.ดีเอสซีคลินิกเวชกรรม
4.เดอะไพร์มเมดิคอลคลินิกเวชกรรม
5.คลินิกเวชกรรมรักประชา เอกชัย
6.นาเนทเต้คลินิกเวชกรรม
7.สุวรรณทวีคลินิกเวชกรรม
8.คลินิกเวชกรรมกล้วยน้ำไท สาขาสะแกงาม
9.ด็อกเตอร์คลินิกเวชกรรม สาขาพหลโยธิน 22
10.คลินิกเวชกรรมเอสเค
11.ฟงดูวคลินิกเวชกรรม
12.อุราคลินิกเวชกรรม สาขารัชดา
13.วัชรพลคลินิกเวชกรรม
14.ดอกเตอร์ทรายคลินิกเวชกรรม สาขาศรีนครินทร์
15.วิวาเช่คลินิกเวชกรรม
16.นภาวราคลินิกเวชกรรม
17.นาโฮลิค อโศก คลินิกเวชกรรม
18.เกียรติการแพทย์คลินิกเวชกรรม สาขาเสรีไทย
19.นิติพลคลินิกเวชกรรม สาขาเซ็นทรัลลาดพร้าว
20.คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งใบหน้าหมอกร
21.คลินิกทันตกรรมไบร์ทดี
22.ด็อกเตอร์เดย์คลินิกทันตกรรม
ตุลาคม - ธันวาคม 2564
วันที่ 30 ธันวาคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 21 แห่งดังนี้
1.แพทย์วิชญาคลินิกเวชกรรม (ใบอนุญาต 10101004765)
2.คลินิกเวชกรรม นพ.อรรถพล (ใบอนุญาต 10101004665)
3.พฤกษาคลินิกเวชกรรม สาขาอารีย์ (ใบอนุญาต 10101005565)
4.คลินิกเวชกรรมไบโอเซลล์ สาขาเซ็นทรัลลาดพร้าว (ใบอนุญาต 10101005265)
5.คลินิกเวชกรรมเปาโล สาขารสาทาวเวอร์ (ใบอนุญาต 10101004965)
6.เดอมาสเตอร์คลินิกเวชกรรม (ใบอนุญาต 10101005465)
7.กานต์ชนกคลินิกเวชกรรม สาขาบิ๊กซีเอ็กซ์ตร้าเพชรเกษม (ใบอนุญาต 10101004865)
8.สกลคลินิกเวชกรรม (ใบอนุญาต 10101005065)
9.พฤกษาคลินกเวชกรรม สาขารัชดาภิเษก (ใบอนุญาต 10101005165)
10.ภัทราวุธคลินิกเฉพาะทางด้านเวชกรรมประสาทวิทยา (ใบอนุญาต 10102001265)
11.ฟ.ฟันทันตแพทย์ คลินิกทันตกรรม (ใบอนุญาต 10103003465)
12.คลินิกทันตกรรม เอส สไมล์ (ใบอนุญาต 10103002965)
13.คลินิกทันตกรรมตากสิน 21 (ใบอนุญาต 10103003965)
14.คลินิกทันตกรรมแอทสไมล์ (ใบอนุญาต 10103002865)
15.คลินิกทันตกรรมยิ้นฟันใส สาขาหทัยราษฎร์ (ใบอนุญาต 10103003265)
16.สีลมเด็นตัลบิลดื้งคลินิกทันตกรรม (ใบอนุญาต 10103003065)
17.คลินิกทันตกรรมสุขุมวิท 93 (ใบอนุญาต 10103003865)
18.ศาลาแดงคลินิกทันตกรรม (ใบอนุญาต 10103002765)
19.คลินิกกายภาพบำบัดรางน้ำ (ใบอนุญาต 10106000465)
20.ธมนวรรณคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108000665)
21.สหคลินิกประชาชนการแพทย์ (ใบอนุญาต 10110000565)
วันที่ 9 ธันวาคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 7 แห่งดังนี้
1.จินตนาคลินิกเวชกรรม (ใบอนุญาต 10101004265)
2.รมย์รวินท์คลินิกเวชกรรม สาขาเซ็นทรัลพลาซาพระราม 9(ใบอนุญาต 10101004365)
3.มีนบุรีคลินิกเวชกรรม (ใบอนุญาต 10101003765)
4.คลินิกเวชกรรกมหมอสันทิต (ใบอนุญาต 10101004465)
5.นวมินทร์คลินิกเวชกรรม (ใบอนุญาต 10101003565)
6.กันยาคลินิกกายภาพบำบัด สาขาเหม่งจ๋าย (ใบอนุญาต 10106000265)
7.ศศิรักษ์ สหคลินิก (ใบอนุญาต 10110006364) (นำส่ง OSS 9/12/64)
วันที่ 22 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 13 แห่งดังนี้
1.บางมด 3 คลินิกเวชกรรม (ใบอนุญาต 10101002965)
2.นายแพทย์ทรงพลคลินิกเวชกรรม (ใบอนุญาต 10101003065)
3.นิติพลคลินิกเวชกรรม (ใบอนุญาต 10101002665)
4.นิติพลคลินิกเวชกรรม สาขาเดอะมอลล์บางกะปิ (ใบอนุญาต 10101002165)
5.เมโกะคลินิกเวชกรรม สาขาเซ็นทรัลเวิลด์ (ใบอนุญาต 10101002465)
6.คลินิกทันตกรรมฟอร์จูน (ใบอนุญาต 10103001265)
7.ด็อกเตอร์ทูธคลินิกทันตกรรม (ใบอนุญาต 10103001965)
8.คลินิกทันตกรรมไอเดนท์ (ใบอนุญาต 10103002265)
9.คลินิกทันตกรรมสไมล์แอทร่มเกล้า (ใบอนุญาต 10103002365)
10.เซย์ชีสเดนทัลคลินิกทันตกรรม (ใบอนุญาต 10103002165)
11.คลินิกทันตกรรมแกรนด์ (ใบอนุญาต 10103001865)
12.คลินิกการแพทย์แผนไทย ปิยะพงษ์ (ใบอนุญาต 10108000465)
13.ฐิติกรคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน (ใบอนุญาต 10109000165)
วันที่ 18 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 3 แห่งดังนี้
1.หมอวิภาคลินิกเวชกรรม (ใบอนุญาต 10101001665)
2.โซลคลินิกเวชกรรม (ใบอนุญาต 10101001765)
3.มอร์ฟันคลินิกทันตกรรม (ใบอนุญาต 10103001665)
วันที่ 17 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 8 แห่งดังนี้
1.คลินิกเวชกรรมภาษีเจริญ (ใบอนุญาต 10101001365)
2.คลินิกเวชกรรมบาดาลเวช (ใบอนุญาต 10101001965)
3.ชัยโรจน์การแพทย์คลินิกเวชกรรม (ใบอนุญาต 10101001865)
4.คลินิกเฉพาะทางด้านเวชกรรมจักษุแพทย์อุมาภรณ์ (ใบอนุญาต 10102000565)
5.คลินิกทันตกรรมบ้านฟันยิ้มใส (ใบอนุญาต 10103001565)
6.ภัททวุตม์เด็นทัลคลินิกทันตกรรม (ใบอนุญาต 10103001465)
7.คลินิกทันตกรรมรามคำแหง (ใบอนุญาต 10103001365)
8.เตียก้วงเส็งคลินิกการแพทย์แผนไทย (ใบอนุญาต 10108000265)
วันที่ 15 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 9 แห่งดังนี้
1.จตุจักรคลินิกเวชกรรม (ใบอนุญาต 10101001565)
2.ศิริกัญญาคลินิกเวชกรรม (ใบอนุญาต 10101001465)
3.ศศิราคลินิกเวชกรรม (ใบอนุญาต 10101002065)
4.คลินิกเวชกรรมเบล่าโกลว์ (ใบอนุญาต 10101000965)
5.พีเคเอสคลินิกเฉพาะทางด้านเวชกรรมผิวหนัง (ใบอนุญาต 10102000365)
6.หมอต่อพงศ์คลินิกเฉพาะทางด้านเวชกรรมศัลยศาสตร์ตกแต่งและเสริมสร้างใบหน้า(ใบอนุญาต 10102000465)
7.เด็นทัลวันคลินิกทันตกรรม (ใบอนุญาต 10103001165)
8.คลินิกทันตกรรมมหานคร 1 (ใบอนุญาต 10103001065)
9.คลินิกการแพทย์แผนไทยฉัตรหลวง (ใบอนุญาต 10108000365)
วันที่ 11 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 14 แห่งดังนี้
1.เศรณีคลินิกเวชกรรม สาขาลาดพร้าว 101 (ใบอนุญาต10101000865)
2.ณิชาคลินิกเวชกรรม (ใบอนุญาต10101000765)
3.ราชเทวีคลินิกเวชกรรม สาขาพระรามเก้า (ใบอนุญาต10101001165)
4.ลูฟวร์คลินิกเวชกรรม (ใบอนุญาต10101001065)
5.เดอะคลีนิกค์พระราม 9 คลินิกเวชกรรม (ใบอนุญาต10101001265)
6.ณรงค์จักษุคลินิกเฉพาะทางด้านเวชกรรมจักษุ (ใบอนุญาต10102000165)
7.คลินิกเฉพาะทางด้านเวชกรรมผิวหนังไอสกาย (ใบอนุญาต10102000265)
8.เอสเอฟซีเฟอร์ทิลิตี้คลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวช สาขารามอินทรา(ใบอนุญาต 10102000665)
9.คลินิกทันตกรรมสุขภาพฟัน (ใบอนุญาต 10103000765)
10.คลินิกทันตกรรมสาทรทันตแพทย์ (ใบอนุญาต 10103001065)
11.คลินิกทันตกรรมโมเดิร์น (ใบอนุญาต 10103000865)
12.พลอยสร้างสุขสหคลินิก (ใบอนุญาต 10110000265)
13.ศูนย์พรหมวชิรญาณสหคลินิก สาขาวัดยานนาวา (ใบอนุญาต 10110000365)
14.สหคลินิกสรงประภาการแพทย์ (ใบอนุญาต 10110000465)
วันที่ 1 พฤศจิกายน 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 3 แห่งดังนี้
1.สีกันการแพทย์คลินิกเวชกรรม (ใบอนุญาต 10101000665)
2.ครอบครัวฟันดีคลินิกทันตกรรม (ใบอนุญาต 10103000465)
3.คลินิกทันตกรรมทันตแพทย์สุรันต์-ยงจิต (ใบอนุญาต 10103000365)
วันที่ 28 ตุลาคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 11 แห่งดังนี้
1.เฌอคลินิกเวชกรรม สาขาซีคอนบางแค
2.พี ดี คลินิกเวชกรรม
3.เอสเคคลินิกเวชกรรม
4.พี ดี คลินิกเวชกรรม สาขาชิดลม
5.คลินิกทันตกรรมอุบลรัตน์
6.เด็นทอล สไมล์ คลินิกทันตกรรม
7.คลินิกทันตกรรมพจนี
8.คลินิกทันตกรรมเด็นทัลไลฟ์
9.คลินิกการแพทย์แผนไทยบางกอกน้อย
10.อุ่นรักคลินิกการพยาบาลและการผดุงครรภ์
11.เพชรบุรี 7 สหคลินิก
คลินิกโรคข้อและรูมาติสซั่ม นอกเวลาราชการทุกวันพฤหัสบดี
คลินิกโรคข้อและรูมาติสซั่ม เปิดบริการนอกเวลาราชการทุกวันพฤหัสบดี งดบริการทุกพฤหัสบดีที่ 3 ของเดือน ค่าบริการเบื้องต้น 250บาท. ปล. สามารถเบิกค่าตรวจเลือดและค่ายาได้ตามสิทธิ์
คลินิกศัลยกรรมกระดูกและข้อ ทุกวันจันทร์
คลินิกพิเศษเฉพาะโรคนอกเวลาราชการ คลินิกศัลยกรรมกระดูกและข้อ บริการตรวจรักษาผู้ป่วยด้านกระดูกและข้อ ทุกวันจันทร์ (เริ่มวันจันทร์ที่ 7 พฤศจิกายน 2565) ตั้งแต่เวลา 16.30-20.30 น. ณ ห้องตรวจเบอร์ ๖ ชั้น ๑ อาคารหลวงพ่อแพ เขมังกโร
ผู้รับบริการสามารถเบิกค่ายาได้ตามสิทธิ์
ค่าบริการเริ่มต้นที่ 300 บาท
บริการตรวจ
- กระดูกหัก/ร้าว/เคลื่อน
- ปวดเข่า / ปวดสะโพก/ปวดไหล่ / ปวดหลัง
- ข้ออักเสบ
- เอ็นอักเสบ
- ปวดตามข้อที่ไม่ใช่รูมาตอยด์ (Rhumatoid)
หากมีข้อสงสัยในการบริการคลินิกเฉพาะโรค (คลินิกศัลยกรรมกระดูกและข้อ)
สอบถามรายละเอียดเพิ่มเติมได้ที่ หมายเลขโทรศัพท์ 036-522507-11 ต่อ 1115 (ในวันที่เปิดบริการคลินิก)


นายเจรมัย พิทักษ์วงศ์ กรรมการผู้จัดการใหญ่ ธุรกิจ Media & Event ยังเสริมว่า ธุรกิจ Media&Event ของเรามีทีมงานที่ทำสื่อหลากหลายในมือ และมีความชำนาญด้านการจัดงานแฟร์และอีเว้นต์ จนได้รับความไว้วางใจจากลูกค้า ทั้งภาครัฐและเอกชน ในการให้จัดแคมเปญ วางแผนการตลาด และจัดงานอีเว้นต์อย่างมากมาย และสำหรับงาน AMARIN EXPO 2023 ที่เรากำลังจัดอยู่ เป็นงานแฟร์ล่าสุดที่ตั้งใจรวบรวมเนื้อหา กิจกรรม และสินค้าหลากหลายแบรนด์จากทั้งเครืออมรินทร์ รวมความสุขให้แก่ทุกครอบครัว สร้างประสบการณ์ใหม่กับ 5 โซน ช็อปสนุกกว่า 1,100 บูธ ได้แก่ บ้านและสวน, Amarin Baby&Kids, กินดีอยู่ดี, Explorers และร้านนายอินทร์ พร้อมกิจกรรมสุดพิเศษ ไม่ว่าจะเป็น Mini Concert จากศิลปินชื่อดัง, Meet & Greet ศิลปินดารา, พิธีกร และผู้ประกาศข่าวจาก Amarin TV รวมถึงกิจกรรมเสวนาที่น่าสนใจ พร้อม Workshop อีกมากมาย โดยเราจะใช้ข้อมูลเชิงพฤติกรรมของผู้อ่านจากสื่อออนไลน์ และผู้ชมงาน อีเวนต์ที่จัดในแต่ละปี มาวิเคราะห์อย่างมืออาชีพ และถูกต้องตามหลักการเป็นฐานข้อมูลอ้างอิง เพื่อพัฒนาธุรกิจ Media & Event ให้เป็นผู้จัดงานที่เข้าถึงผู้บริโภคมากที่สุด และเป็นสื่อออนไลน์ที่ทำได้มากกว่าการเข้าถึง Reach แต่สามารถให้คำตอบ และทางเลือกที่ดี รวมถึงสร้างความมั่นใจ และสร้างโอกาสให้ธุรกิจต่าง ๆ ให้ลูกค้าได้อย่างมีประสิทธิภาพ
“การจัดลำดับความสำคัญของสุขภาพที่ดีในวันหยุดเป็นวิธีที่ยอดเยี่ยม ในการเริ่มต้นนิสัยที่ดีต่อสุขภาพซึ่งอาจส่งผลดีในระยะยาวต่อสุขภาพร่างกายและจิตใจของเรา การผสมผสานกิจกรรมการออกกำลังกาย การผ่อนคลาย และการดูแลทางการแพทย์สามารถช่วยป้องกันโรคไม่ติดต่อ ปรับปรุงการทำงานของสมอง และประหยัดค่าใช้จ่าย ไม่มีคำว่าสายเกินไปที่จะเริ่มสร้างนิสัยที่ดีต่อสุขภาพ และกุญแจสำคัญคือการทำให้สนุกและเพลิดเพลิน ดังนั้น เราควรมาเริ่มให้ความสำคัญกับสุขภาพในวันหยุดและดูแลสุขภาพของเรา” ศาสตราจารย์ นายแพทย์จีรี ดโวชัค กล่าวทิ้งท้าย
Thailand Earth Trail@Chaiyaphum
Thailand Earth Trail@Suphanburi
ชูวิทย์ - ต้องนำกัญชากลับไปเป็นยาเสพติด และร้านขายกัญชาจะต้องปิด
แนวหน้า เสนอข่าวว่า นายชูวิทย์ กล่าวถึง MOU เรื่องกัญชา ว่า จะต้องนำกัญชากลับไปเป็นยาเสพติด และร้านขายกัญชาจะต้องปิด ไม่ปิดไม่ได้ ต้องพูดให้ชัดและต้องปิดทั้งหมด เมื่อกลับไปเป็นยาเสพติด และเป็นกัญชาทางการแพทย์ ก็ต้องให้แพทย์เป็นคนออกจะให้แพทย์ไปอยู่ในร้านขายกัญชาได้อย่างไร ถ้าทำไม่ได้ก็จะมาประท้วงท่าน พร้อมกับป้ายอวยพรในฐานะประชาชนว่า ให้ท่านมีเจตนารักษาประชาธิปไตย อย่าได้สร้างเงื่อนไข เพราะถ้าไม่มีเงื่อนไขก็ปฏิวัติไม่ได้ ง่ายๆประเทศไทยมีอยู่แค่นั้นเอง วันนี้ซึ่งตรงกับวันที่ 22 พฤษภาคม ตนจึงมาให้กำลังใจในฐานะประชาชน ท่านอย่าได้สร้างเงื่อนไข เพราะหากท่านไม่สร้างเงื่อนไข มันก็ไม่ต้องมีเงื่อนไขที่จะต้องใช้เท้าออกไปเดินที่ถนน ....
อ่านทั้งหมด
เขตสุขภาพที่ 10
เขตสุขภาพที่ 11
เขตสุขภาพที่ 12
คลินิกโรคปอดและมะเร็งทั่วไป
รพ.หัวหิน สาขา5 (หนองพรานพุก) LINK
เปิดให้บริการ
โรงพยาบาลหัวหิน สาขา5 หนองพรานพุก บริการตรวจรักษาโรคทั่วไป รับยาต่อเนื่อง วันจันทร์-วัน
ศุกร์ เวลา 8.30-12.00 น. ฉีดยาทำแผล 13.00-15.30 น. ติดต่อสอบถาทโทร. 032-510411
สำหรับผู้รับบริการที่ใช้สิทธิการรักษาที่โรงพยาบาลหัวหินสามารถเข้ารับบริการได้ โดยไม่เสียค่าบริการเพิ่ม
สอบถามรายละเอียดเพิ่มเติมได้ที่ รพ.หัวหิน สาขา 5 โทร. 032- 510411
3.เกมตัวแทน Proxy Gaming
การฝึกฝนเอไอด้วยเป้าประสงค์ที่ผิดพลาดบิดเบือน ระบบ AI สามารถค้นหาวิธีใหม่ในการบรรลุเป้าหมาย ซึ่งต้องแลกด้วยคุณค่าส่วนบุคคลและสังคม
ระบบ AI ได้รับการฝึกอบรมโดยมีวัตถุประสงค์ที่วัดได้ ซึ่งอาจเป็นตัวแทนทางอ้อมสำหรับสิ่งที่เราให้ความสำคัญเท่านั้น ตัวอย่างเช่น ระบบผู้แนะนำ AI (AI recommender systems) ได้รับการฝึกอบรมเพื่อเพิ่มเมตริกเวลาในการดูและอัตราการคลิกให้สูงสุด อย่างไรก็ตาม เนื้อหาที่ผู้คนมีแนวโน้มที่จะคลิกมากที่สุด ไม่จำเป็นต้องเหมือนกับเนื้อหาที่จะช่วยปรับปรุงความเป็นอยู่ที่ดีของพวกเขา (Kross et al., 2013) นอกจากนี้ หลักฐานบางอย่างบ่งชี้ว่าระบบผู้แนะนำทำให้ผู้คนเกิดความเชื่อแบบสุดโต่งเพื่อให้คาดเดาการอ้างอิงได้ง่ายขึ้น (Jiang et al., 2019) เมื่อระบบ AI มีความสามารถและมีอิทธิพลมากขึ้น วัตถุประสงค์ที่เราใช้ในการฝึกอบรมระบบจะต้องได้รับการระบุอย่างรอบคอบมากขึ้นและรวมคุณค่าของมนุษย์ที่มีร่วมกัน
ประชากรโลก 2.2 พันล้านคน บกพร่องทางการมองเห็น
องค์การอนามัยโลก (WHO) รายงานว่าทั่วโลกพบประชากร 2.2 พันล้านคนที่มีความบกพร่องทางการมองเห็น ซึ่งในจำนวนนี้กว่า 50% เป็นปัญหาที่สามารถป้องกันได้หรือยังไม่ได้รับการแก้ไข ขณะที่ในปี 2563 มีประชากร 1.1 พันล้านคนสูญเสียการมองเห็น โดยคาดการณ์ว่าในอีก 30 ปีข้างหน้า จะมีผู้ที่สูญเสียการมองเห็นเพิ่มขึ้นอีก 600 ล้านคน เป็น 1.7 พันล้านคน
นายกิตติ ตั้งจิตรมณีศักดา รองประธานสภาอุตสาหกรรมแห่งประเทศไทย “ที่ผ่านมาเราจะเห็นได้ว่า คอร์รัปชั่นใหญ่ที่มีความซับซ้อนเชิงนโยบายจะยังคงอยู่ แต่ที่เห็นได้ชัดเจนเลยคือ คอร์รัปชั่นเล็ก ๆ น้อย ๆ ลดลง เพราะด้วยเทคโนโลยี โซเชียลมีเดียเข้ามามีบทบาท ทุกคนเป็นนักสืบ เป็นผู้สื่อข่าวออนไลน์ เมื่อทุกคนช่วยกันก็ทำให้ทุจริตเหล่านี้หายไป ต้องมีการปฏิรูปการบังคับใช้กฎหมาย ลดเรื่องการขอใบอนุญาต ลดการใช้อำนาจการใช้ดุลพินิจของเจ้าหน้าที่ลง มีการกำหนดเงื่อนไขให้ชัดเจนและมีประสิทธิภาพเข้ามาทดแทน โทษต้องหนักและปรับให้ได้จริง ๆ ประชาชนต้องช่วยกันผลักดันให้เกิดสิ่งนี้ขึ้นมา ปัญหาการคอร์รัปชั่นก็จะลดลงได้ คนโกงต้องถูกประณามไม่ใช่การได้รับเกียรติยังมีคนยกมือไหว้ เรื่องลักษณะนี้ต้องหมดไป และในส่วนของเอกชนที่ได้มีการแสดงนโยบายเผยแพร่ต่อสาธารณชนว่าเป็นองค์กรที่ต่อต้านคอร์รัปชั่น ได้กระทำอย่างจริงจังหรือไม่ เราทุกคนควรมีหน้าที่ที่ต้องช่วยกัน”
โดยมี ดร.วิทย์ สิทธิเวคิน เป็นผู้ดำเนินรายการสัมมนาและนำซักถาม
หนังสือภาพ ถือเป็นเครื่องมือสำคัญในการสร้างความเท่าเทียมในห้องเรียนได้อย่างนึกไม่ถึง


ด้าน นางอรวรรณ โสสะ คุณครูจากโรงเรียนวัดโลกา จังหวัดสงขลา ที่ได้นำเทคนิคการสอนโดยใช้หนังสือภาพจากโครงการฯ มาสอน ได้เล่าถึงกระบวนการเรียนรู้ของเด็กๆ ว่า “หนังสือภาพ ถือเป็นเครื่องมือสำคัญในการสร้างความเท่าเทียมในห้องเรียนได้อย่างนึกไม่ถึง โดยเมื่อเราได้ลองจัดการเรียนการสอนกับเด็กหลายๆ กลุ่ม ทั้งเด็กที่มีทักษะการอ่านดี ไปจนถึงกลุ่มเด็กๆ ที่ยังต้องพัฒนาด้านการอ่าน จะเห็นได้ว่าหนังสือภาพสามารถทลายกำแพงระหว่างเด็กสองกลุ่มนี้ เพราะภาพเป็นสื่อกลางที่ทำให้ไม่ว่าเด็กกลุ่มไหนก็สามารถมองภาพแล้วเข้าใจได้เหมือนเพื่อนๆ แทนที่จะใช้ตัวหนังสืออย่างเดียว อีกทั้งกระบวนการของเราได้เปิดพื้นที่ให้เด็กได้แสดงความคิดเห็นอย่างแท้จริง โดยเราเริ่มตั้งแต่การ Read Aloud หรืออ่านให้เด็กฟังแล้วให้เขียนเส้นเรื่องเหตุการณ์สำคัญในเนื้อเรื่อง ต่อด้วยการให้เด็กๆ แต่ละกลุ่มมาโต้แย้งถึงความคิดของตัวละครในการตัดสินใจกระทำบางอย่างในเรื่อง และสิ้นสุดลงที่ให้เด็กๆ วิเคราะห์ถึงเหตุการณ์ที่เป็นจุดเปลี่ยนของเนื้อเรื่อง ดังนั้นกระบวนการต่างๆ เหล่านี้ไม่เพียงแต่ทำให้เด็กๆ กล้าคิด กล้าแสดงออกเท่านั้น แต่เป็นการให้เด็กสามารถอ่านคิดวิเคราะห์ได้เป็นระบบ ซึ่งในฐานะคุณครูมองว่ากระบวนการนี้จะเป็นทักษะติดตัวให้นักเรียนสามารถนำไปใช้ในวิชาอื่นหรือในชีวิตประจำวันได้”
Onson (ออนซอน) เหล้าสกลนคร ริเริ่มตั้งแต่ปี 2561 LINK
ออนซอน (Onson) เหล้าสกลนคร ใช้วัตถุดิบที่เป็นอ้อยแท้ ช่อดอกมะพร้าวจากสวน เริ่มมาตั้งแต่ปี 2561 แต่เกือบเลิกทำเพราะไม่มีผู้สานต่อ เจ้าของคนปัจจุบันเล่าว่า จริงๆ แล้วเจ้าของเดิมคือคุณลุงข้างบ้าน แกทำเหล้าออนซอนเป็นงานอดิเรก แต่ไม่ประสบความสำเร็จในการขาย จุดเปลี่ยนตรงที่ เจ้าของมาเปิดร้านอาหารที่สกลนคร โดยคอนเซ็ปต์ของร้านต้องมีการใช้ผลิตภัณฑ์ของสกลนครทั้งหมด จึงเริ่มเอาเหล้าตัวนี้มาทำอาหาร เช่น หมักปลา ก็ช่วยทำให้รสชาติอาหารดีขึ้น กลิ่นคาวน้อยลง ตอนนั้นต้องการเอามาประกอบอาหารเป็นหลัก ลุงแกจะมีคัมภีร์อยู่เล่มนึงไว้จดสูตรการทดลองทำเหล้า ในทุกๆวันที่แกทำ มีสูตรในนั้นเยอะมาก ผมเสียดายความรู้แก เพราะยังไงเราก็ต้องนำเหล้ามาใช้ในร้านอาหารของเราอยู่แล้ว เลยขอให้แกอยู่ช่วยทำต่อ พร้อมกับปรับแบรนด์ วางโพซิชั่นนิ่งตัวเองใหม่ เน้นการท่องเที่ยว ให้อยู่ในเชลฟ์ได้อย่างภูมิใจ
ข้อมูลและภาพจากเพจประชาชนเบียร์
หลักสูตรด้าน การเกษตรและเทคโนโลยีชีวภาพ (Agriculture and Biotechnology) 2566 LINK
- [VFM] ผู้จัดการธุรกิจโรงปลูกพืชแนวตั้ง (Indoor Vertical Farming Manager) รุ่นที่ 2 อุตสาหกรรมการเกษตรและเทคโนโลยีชีวภาพ : ค่าอบรม 17,900 วันที่อบรม 19/07/2566 - 21/07/2566
- [VFC] หลักสูตรการปลูกพืชสมุนไพรด้วยโรงปลูกพืชแนวตั้ง (Vertical Farming) ตอน "กัญชา (Cannabis)" (Mastering Indoor Vertical Farming for Cannabis) รุ่นที่ 4 อุตสาหกรรมการเกษตรและเทคโนโลยีชีวภาพ : ค่าอบรม 7,490 วันที่อบรม 19/06/2566 - 20/06/2566
- [VF2] รู้จริงเทคโนโลยีโรงปลูกพืชแนวตั้งใน 2 วัน (Mastering Vertical Farming System in 2 Days) รุ่นที่ 8 อุตสาหกรรมการเกษตรและเทคโนโลยีชีวภาพ : ค่าอบรม 3,500 วันที่อบรม 11/05/2566 - 12/05/2566
- [VFBT] หลักสูตรโอกาสทางธุรกิจและเทคโนโลยีโรงปลูกพืชแนวตั้ง (Mastering Vertical Farming Business and Technology) รุ่นที่ 2 อุตสาหกรรมการเกษตรและเทคโนโลยีชีวภาพ : ค่าอบรม 9,900 วันที่อบรม 30/03/2566 - 31/03/2566
- [VF3] รู้จริงระบบการปลูกพืชแนวตั้งใน 3 วัน (Mastering Vertical Farming System in 3 Days) รุ่นที่ 4 อุตสาหกรรมการเกษตรและเทคโนโลยีชีวภาพ : ค่าอบรม 10,900 วันที่อบรม 15/02/2566 - 17/02/2566
นายวิโรจน์ วิทยาเวโรจน์ ประธานและกรรมการผู้จัดการ บริษัท ฟิลิปส์ (ประเทศไทย) จำกัด กล่าวว่า “ปัจจุบัน คนไทยจำนวนมากหันมาให้ความสำคัญกับการดูแลสุขภาพที่ดีในระยะยาว และการดูแลรักษาปัญหาสุขภาพที่อาจมีอยู่ก่อนแล้ว การตรวจวัดสุขภาพถือเป็นก้าวแรกของการดูแลสุขภาพ แต่เพื่อให้เห็นผลอย่างแท้จริง การปรับเปลี่ยนพฤติกรรมให้เหมาะสมถือเป็นสิ่งสำคัญในการดูแลสุขภาพ ความรู้ คือปัจจัยสำคัญในการนำข้อมูลจากการตรวจวัดด้านสุขภาพไปประยุกต์ใช้ นอกจากนี้ระบบเฮลท์แคร์ในภูมิภาคจะต้องมีกรอบการทำงานและโครงสร้างพื้นฐานในการเชื่อมต่อบุคลากรทางการแพทย์กับข้อมูลด้านสุขภาพส่วนบุคคลอย่างปลอดภัย เพื่อให้มั่นใจได้ว่าข้อมูลเหล่านั้นจะเป็นประโยชน์ต่อการดูแลสุขภาพของผู้คน” และอีกหนึ่งปัจจัยที่ช่วยส่งเสริมการดูแลสุขภาพ คือการพัฒนาเทคโนโลยีเพื่อการดูแลสุขภาพส่วนบุคคลให้ก้าวหน้า จากผลสำรวจนี้แสดงให้เห็นว่า ผู้บริโภคในภูมิภาคเอเชียให้ความสนใจต่อข้อมูลด้านสุขภาพ โดยผลสำรวจในประเทศไทยพบว่า การรายงานผลตรวจวัดสุขภาพบนอุปกรณ์เพื่อการดูแลสุขภาพส่วนบุคคลที่ (ร้อยละ 49) และการออกแบบอุปกรณ์เพื่อการดูแลสุขภาพส่วนบุคคลให้สามารถแสดงผลข้อมูลให้เข้าใจง่าย (ร้อยละ 51) เป็นปัจจัยสำคัญต่อการปรับเปลี่ยนพฤติกรรมในการดูแลสุขภาพ
เสียงตอบรับในเชิงบวกจากชุมชน
ทางด้านชาวบ้านในชุมชน ต่างมีเสียงตอบรับในเชิงบวก เนื่องจากโครงการดังกล่าวเปรียบเสมือนความหวังในการหล่อเลี้ยงอาชีพของคนในชุมชนทั้งในด้านการประมงและการท่องเที่ยวในอนาคต โดยนายพี พัฒนศิริ หรือพี่จาว เจ้าของร้าน Sunset Walk ตัวแทนชาวบ้านในพื้นที่เกาะพะงันกล่าวว่า “การมีบ้านปลาเพิ่มมากขึ้นถือเป็นความฝันของชาวเกาะมาตั้งแต่ได้ยินโครงการนี้ครั้งแรก เมื่อก่อนที่บริเวณอ่าวเราก็ใช้วิธีสร้างปะการังเทียมเช่นเดียวกันแต่เป็นแท่งปูนบ้างแท่งสี่เหลี่ยมบ้าง แต่พอเป็นโครงการ Rigs-to-Reefs นั้น ต่างจากบ้านปลาหลังเล็กๆ ที่เราเคยเอาไปวางกันเอง เพราะการเอาแท่นหลุมผลิตปิโตรเลียม 7 แท่นไปวางเรียกได้ว่ากลายเป็นอาณาจักรปลาได้เลย ซึ่งแน่นอนว่าปลาหลายชนิดจะต้องแวะไปที่นั่นตั้งแต่นักล่าไปจนถึงผู้อยู่อาศัยและปลาสวยงาม แล้วก็เป็นแบบนั้นจริงๆ ครั้งแรกที่ได้มีโอกาสไปเห็นก็คิดว่าเป็นโครงการที่ยิ่งใหญ่มากและก็เป็นเรื่องที่ส่งผลประโยชน์ให้ชุมชนได้ ซึ่งตอนนี้ก็เหลือแต่การจัดสรรการใช้ประโยชน์ให้เกิดผลสูงสุดทั้งกับชุมชนและสิ่งแวดล้อม”
9 พฤษภาคม 2566 เทศบาลนครระยองร่วมกับสำนักงานปศุสัตว์จังหวัดระยอง จัดกิจกรรมทำหมันสุนัขและแมวฯ เพื่อส่งเสริมการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้า ณ วัดโขดทิมทาราม โดยมีประชาชนเข้าร่วมโครงการจำนวน 29 ราย ทำหมันสุนัขและแมวรวมจำนวน 29 ตัว ขอขอบคุณทุกท่านที่ให้การสนับสนุนกิจกรรมฯ เป็นอย่างดียิ่ง พบกันใหม่ ในวันที่ 11 พฤษภาคม 2566 ณ วัดปากน้ำ วันที่ 18 พฤษภาคม 2566 ณ ที่ทำการชุมชนเรือนจำ
ทนงศักดิ์: ในเรื่องของความท้าทาย จะเห็นได้ว่าเป็นเรื่องของการทำงานที่ยาวนาน ประกอบกับคนไข้ที่มากขึ้นด้วย ทั้งนี้เราได้รับการฝึกฝนมาตลอด 4 ปีในการเรียน ทำให้มีการรับมือได้ครอบคลุมหลายสถานการณ์ที่อาจจะเกิดขึ้นได้ ดังนั้นอาจจะมีในเรื่องของการปรับตัวเล็กๆ น้อยๆ มากกว่า ที่ทำให้เรารับมือได้ดียิ่งขึ้น ทำให้ความท้าทายที่เป็นเรื่องยากกลายเป็นเรื่องง่ายสำหรับเรา
ธนาคารไทยพาณิชย์ : ยืนยันตัวตนที่สาขาทั่วประเทศ เช็คสถานะ ผ่านแอป SCB EASY LINK
เมื่อต้องการทำธุรกรรมดังต่อไปนี้ผ่านแอป SCB EASY ต้องมีการยืนยันตัวตนด้วยใบหน้า
1. โอนเงินไปยังบุคคลอื่น ตั้งแต่ 50,000 บาทขึ้นไปต่อครั้ง
2. มูลค่ารวมของธุรกรรมโอนเงินทุก ๆ 200,000 บาท ภายใน 1 วัน
3. ปรับเพิ่มวงเงินให้โอนได้ตั้งแต่ 50,000 บาทขึ้นไป
วิธีการยืนยันตัวตนด้วยใบหน้า
กรุณานำบัตรประชาชนไปอัปเดตข้อมูลของท่านให้เป็นปัจจุบันและถ่ายรูปใบหน้าได้ที่ธนาคารไทยพาณิชย์ทุกสาขาทั่วประเทศ ได้ตั้งแต่วันนี้เป็นต้นไป
หากลูกค้ามีข้อสงสัยหรือประสงค์จะสอบถามข้อมูลเพิ่มเติม โปรดติดต่อ ศูนย์บริการลูกค้าธนาคารไทยพาณิชย์ SCB Call Center โทร. 02-777-7777 ทุกวันตลอด 24 ชั่วโมง
ข้อมูลอ้างอิง SCB เตรียมความพร้อมสำหรับการยืนยันตัวตนด้วยใบหน้า 701
คลองรางโพธิ์ล่าง
702 คลองรางแม่น้ำ
703 คลองรางยายคง
704 คลองรางยายเพียร
705 คลองรางราชพฤกษ์
706 คลองรางเวก
707 คลองรางสะแก
708 คลองรางใหญ่
709 คลองรางอ้อ - รางแก้ว
710 คลองราชพฤกษ์
711 คลองราชพฤกษ์น้อย
712 คลองราชพฤกษ์ใหญ่
713 คลองราชมนตรี - บางโคลัด
714 คลองราษฎร์เจริญสุข
715 คลองราษฎร์สามัคคี
716 คลองราษฏร์บูรณะ
717 คลองโรงฆ่าสัตว์
718 คลองโรงน้ำมัน
719 คลองโรงปลา
720 คลองโรงภาษี (โรงปูน)
721 คลองโรงยาว
722 คลองโรงสี (บางกอกใหญ่)
723 คลองโรงสี (บางแค)
724 คลองโรงสีเก่า
725 คลองโรงหนัง
726 คลองไร่
727 คลองล็อค 4 (เชื่อมคลองเจ็ก)
728 คลองลัดกัลยา
729 คลองลัดขี้เหล็ก
730 คลองลัดครูเสงี่ยม
731 คลองลัดคลองขวาง
732 คลองลัดคลองตาแป้น
733 คลองลัดคลองบางแวก
734 คลองลัดคลองสวนอ้อย
735 คลองลัดเช็ดหน้า
736 คลองลัดตากลั่น
737 คลองลัดตาเตี้ย
738 คลองลัดตานิล
739 คลองลัดตาแย้ม
740 คลองลัดตาเหนียว
741 คลองลัดถมยา
742 คลองลัดทับยาว
743 คลองลัดนิ่มไสว
744 คลองลัดบางปะแก้ว-บางปะกอก
745 คลองลัดบางระแนะ
746 คลองลัดบางลิ่ม
747 คลองลัดผู้ใหญ่ปลอด
748 คลองลัดมะยม
749 คลองลัดม้า
750 คลองลัดยายกุล
751 คลองลัดแยกคลองสามกรุงศรี
752 คลองลัดวัดไชยฉิมพลี
753 คลองลัดวัดสะพาน
754 คลองลัดสะแก
755 คลองลาดกะดาน 1
756 คลองลาดโตนด
757 คลองลาดบัวขาว
758 คลองลาดพร้าว
759 คลองลาดยาว
760 คลองลาดลำภู
761 คลองลาดลำภู (บางขุนเทียน)
762 คลองลาว
763 คลองลำกอไผ่(ลาดกระบัง)
764 คลองลำกอไผ่(หนองจอก)
765 คลองลำกะดาน
766 คลองลำกะโหลก
767 คลองลำเกร็ด
768 คลองลำเกวียนหัก
769 คลองลำเกาะเลา
770 คลองลำแขก
771 คลองลำโขล่
772 คลองลำควายชน
773 คลองลำควายตาย
774 คลองลำจรเข้ตาย
775 คลองลำเจดีย์
776 คลองลำเจดีย์เล็ก
777 คลองลำเจียก
778 คลองลำเจียรดับ
779 คลองลำชวด
780 คลองลำชวดเตย
781 คลองลำชะล่า
782 คลองลำชะล่า(ลาดกระบัง)
783 คลองลำชะล่า(หนองจอก)
784 คลองลำด้วน
785 คลองลำต้น
786 คลองลำต้นกล้วย
787 คลองลำต้นไทร
788 คลองลำต้อยติ่ง
789 คลองลำตาจีน
790 คลองลำตาต่าย
791 คลองลำตานวย
792 คลองลำตาพ่วง
793 คลองลำตาแพ่ง
794 คลองลำตาเฟื่อง
795 คลองลำตามีร้องไห้
796 คลองลำตาอิน
797 คลองลำตาอู
798 คลองลำตุ๊กตา
799 คลองลำแตงโม
800 คลองลำไทร
801 คลองลำนกแขวก(มีนบุรี)
802 คลองลำนกแขวก(หนองจอก)
803 คลองลำนายโส
804 คลองลำนุ่น
805 คลองลำบ่อยาว
806 คลองลำบึงขวาง(มีนบุรี)
807 คลองลำบึงขวาง(หนองจอก)
808 คลองลำบึงทองหลาง
809 คลองลำบึงบัว
810 คลองลำบึงบ้านม้า
811 คลองลำบึงใหญ่
812 คลองลำบุรี
813 คลองลำบุหรี่พวง
814 คลองลำแบน
815 คลองลำแบนใหญ่
816 คลองลำปลาเน่า
817 คลองลำปลาแย
818 คลองลำปัก
819 คลองลำผักชี
820 คลองลำผักชีเก่า
821 คลองลำไผ่
822 คลองลำไผ่ผี
823 คลองลำฝอยทอง
824 คลองลำพะอง
825 คลองลำพังพวย
826 คลองลำพังพวย(มีนบุรี)
827 คลองลำพุทธา
828 คลองลำมดตะนอย
829 คลองลำมะขาม
830 คลองลำมะละกอ
831 คลองลำมะละกอฝั่งใต้
832 คลองลำมะละกอฝั่งเหนือ
833 คลองลำรางเกาะเล็ก
834 คลองลำรางชวดด้วน
835 คลองลำรางตาแก่
836 คลองลำรางตาคี
837 คลองลำรางตาติ่ง
838 คลองลำรางตาเสือ
839 คลองลำรางบึงบัว
840 คลองลำรางลัดคูเวียง
841 คลองลำรางศาลเจ้าพ่อต่วน
842 คลองลำรางหลุมบัว
843 คลองลำรางเอื้อเฟื้อ
844 คลองลำวังคา
845 คลองลำสลิดทองบน
846 คลองลำสลิดทองล่าง
847 คลองลำสาลี
848 คลองลำหลุมบัว
849 คลองลำหิน
850 คลองลำหินฝั่งใต้
851 คลองลำหินฝั่งเหนือ
852 คลองลำอ้อตัน
853 คลองลำอ้ายแบน
854 คลองลำอีรั้ว
855 คลองลิง
856 คลองลุงหน่าง
857 คลองลูกวัว
858 คลองลูกวัวเก่า
859 คลองเลนเปน
860 คลองเล้าหมู
861 คลองเลียบซอยเพชรเกษม 48
862 คลองวังเดิม
863 คลองวังใหญ่บน
864 คลองวังใหญ่ล่าง
865 คลองวัดกก
866 คลองวัดกระจัง
867 คลองวัดกระทุ่มเสือปลา
868 คลองวัดกลาง
869 คลองวัดกลาง
870 คลองวัดกัลยาณ์
871 คลองวัดเกียรติประดิษฐ์
872 คลองวัดแก้ว
873 คลองวัดไก่เตี้ย
874 คลองวัดขุนจันทร์
875 คลองวัดครุฑ
876 คลองวัดคฤหบดี ฝั่งใต้
877 คลองวัดคฤหบดี ฝั่งเหนือ
878 คลองวัดโคนอน
879 คลองวัดจันทร์ใน
880 คลองวัดเจ้ามูล
881 คลองวัดเจ้าอาม
882 คลองวัดฉิมทายิกาวาส
883 คลองวัดช่องนนทรี
884 คลองวัดเชิงเลน
885 คลองวัดไชยทิศ
886 คลองวัดญวนสะพานขาว
887 คลองวัดดงมูลเหล็ก
888 คลองวัดดอกไม้
889 คลองวัดด่าน
890 คลองวัดด่านเหนือ
891 คลองวัดดาวดึงษ์ษาราม
892 คลองวัดดีดวด
893 คลองวัดดุสิตาราม
894 คลองวัดตรีทศเทพ
895 คลองวัดตลิ่งชัน
896 คลองวัดตะกล่ำ
897 คลองวัดตึก
898 คลองวัดโตนด
899 คลองวัดทอง
900 คลองวัดทองธรรมชาติ
901 คลองวัดทองนพคุณ
902 คลองวัดทองบน
903 คลองวัดทองบางจาก
904 คลองวัดทองเพลง
905 คลองวัดท่าข้าม
906 คลองวัดท่าพระ
907 คลองวัดเทพศิรินทร์
908 คลองวัดไทร
909 คลองวัดน้อย
910 คลองวัดน้อยเก่า
911 คลองวัดน้อยนางหงษ์
912 คลองวัดน้อยใหม่
913 คลองวัดนาคนิมิตร
914 คลองวัดนาคปรก
915 คลองวัดบวรมงคล ฝั่งใต้
916 คลองวัดบวรมงคล ฝั่งเหนือ
917 คลองวัดบึงทองหลาง
918 คลองวัดเบญจมบพิตร
919 คลองวัดปฐมบุตรอิศราราม
920 คลองวัดประดู่(บางกอกใหญ่)
921 คลองวัดประดู่(ภาษีเจริญ)
922 คลองวัดประยูร
923 คลองวัดปรินายก
924 คลองวัดปริวาส
925 คลองวัดไผ่เงิน
926 คลองวัดพิกุล
927 คลองวัดเพลง
928 คลองวัดเพลง(ตลิ่งชัน)
929 คลองวัดเพลง(ภาษีเจริญ)
930 คลองวัดเพลงวิปัสสนา
931 คลองวัดภาวนา
932 คลองวัดมะลิ
933 คลองวัดยางสุทธาราม
934 คลองวัดยานนาวา
935 คลองวัดยายร่ม
936 คลองวัดรวก
937 คลองวัดรวกสุทธาราม
938 คลองวัดระฆัง
939 คลองวัดร้าง
940 คลองวัดราชวรินทร์ (พุ่มหิรัญ2)
941 คลองวัดราชสิทธาราม
942 คลองวัดราชาธิวาส
943 คลองวัดลาดปลาเค้า
944 คลองวัดเลียบ
945 คลองวัดศรีบุญเรือง
946 คลองวัดศาลาครืน
947 คลองวัดสังข์กระจาย
948 คลองวัดสังเวช
949 คลองวัดสำเภา
950 คลองวัดสิงห์
951 คลองวัดสิตาราม
952 คลองวัดสีสุก
953 คลองวัดสุนทรธรรมทาน
954 คลองวัดสุวรรณ
955 คลองวัดเสาหิน
956 คลองวัดหงส์รัตนาราม
957 คลองวัดหลวง
958 คลองวัดหลักสี่
959 คลองวัดใหม่ยายนุ้ย(จอมทอง)
960 คลองวัดใหม่ยายนุ้ย(ธนบุรี)
961 คลองวัดอรุณ
962 คลองวัดอังกุรา
963 คลองวัดอัปสรสวรรค์
964 คลองวัดอ่างแก้ว
965 คลองวัดอินทาราม
966 คลองศรีกุมาร
967 คลองศรีภูมิ
968 คลองศรีศุภผล
969 คลองศรีสำราญ
970 คลองศรีสุราษฎร์
971 คลองศาลเจ้า
972 คลองศาลเจ้า
973 คลองศาลเจ้า
974 คลองศาลเจ้า(ตลิ่งชัน)
975 คลองศาลเจ้า(บางกอกใหญ่)
976 คลองศาลเจ้า(ภาษีเจริญ)
977 คลองศาลเจ้าต้นโพธิ์
978 คลองศาลเจ้าแม่ทับทิม (บางขุนเทียน)
979 คลองศาลเจ้าแม่ทับทิม(จอมทอง)
980 คลองศาลเตี้ย
981 คลองศาลาแดง
982 คลองศาลาลอย
983 คลองศาลาลอยบน
984 คลองศาลาลอยล่าง
985 คลองศิริจันทร์
986 คลองศิรินธร
987 คลองสนามกลางลำ
988 คลองสนามชัย
989 คลองสมเด็จเจ้าพระยา
990 คลองส้มป่อย
991 คลองส้มป่อยบน
992 คลองส้มป่อยพระราม 6
993 คลองสมานเชื้อบำรุง
994 คลองสรศักดิ์
995 คลองสลุด
996 คลองสวน
997 คลองสวน(ภาษีเจริญ)
998 คลองสวน(ยานนาวา)
999 คลองสวนข่อย
ด้าน นายเอบิซา ทาเคเล่ ผู้ชนะรางวัล Top Speed ระยะทาง 9 กิโลเมตร ประเภทชาย กล่าวว่า “ดีใจและเป็นเกียรติมาก ๆ ที่ได้รับรางวัล Top Speed จากงาน FUJIFILM NEVER STOP Running 2023 นอกจากจะได้เอาชนะใจตัวเองแล้วยังได้มีโอกาสสนับสนุนมูลนิธิดี ๆ เพื่อสังคมที่ช่วยดูแลสุขภาพของคนในพื้นที่ห่างไกลอีกด้วย ขอขอบคุณฟูจิฟิล์ม ที่จัดงานวิ่งการกุศลที่ช่วยขับเคลื่อนสังคมได้เป็นรูปธรรมเช่นนี้”
ทั้งนี้ ซีพีเอฟได้รับมาตรฐานการผลิตและความปลอดภัยด้านอาหารระดับนานาชาติสูงสุดถึง 6 มาตรฐาน โดยล่าสุด ยังเป็นบริษัทรายแรกในอาเซียนที่มีมาตรฐานการผลิตอาหารของตนเอง (CPF Food standard; PS 7818:2018) โดยการสนับสนุนจาก BSI หรือสถาบันมาตรฐานอังกฤษ ซึงเป็นมาตรฐานที่เกิดจากการบูรณาการมาตรฐานสากลหลายๆ มาตรฐานเข้าด้วยกัน ประกอบด้วย HACCP(CODEX) , ISO 9001, ISO 22000 รวมถึง กฎระเบียบภายในและต่างประเทศ ตลอดจนมาตรฐานความปลอดภัยอาหารของสมาคมผู้ค้าปลีกแห่งอังกฤษ (BRC) การปฏิบัติทางสุขลักษณะที่ดี (GHP) ระบบการจัดการสวัสดิภาพสัตว์เพื่อส่งออก และสามารถตรวจสอบย้อนกลับตลอดห่วงโซ่การผลิตได้ 100% ด้วยเทคโนโลยี Blockchain ขณะที่มาตรฐานอวกาศ จะต้องผ่านกระบวนการตรวจเชื้อโรค สารตกค้าง ความปลอดภัย และคุณภาพด้านอาหารต่างๆ ตามหลักเกณฑ์ของ Space Food Lab อีกถึงมากกว่า 40 การตรวจสอบ
เทคนิคการรักษาในโรงพยาบาลเอส สไปน์ เปรียบเสมือนขับรถ Formula 1 ดังนั้นผู้ขับจะต้องมีความชำนาญโดยเฉพาะ ปกติแล้วนักขับที่จะมาอยู่ร่วมทีมกับเรา จะต้องถูกส่งไปฝึกจนกว่าจะขับรถ Formula 1 ได้ ใช้อุปกรณ์ที่ดีที่สุดอย่างชำนาญสำหรับการรักษาในส่วนของกระดูกสันหลังได้เป็นอย่างดี จุดไหนที่เราเห็นว่าเป็นจุดที่เขายังขาดเราก็ส่งเสริมและสนับสนุนทุกรูปแบบให้เขาทำได้ เขาจะต้องเป็นนักขับรถ Formula 1 ที่เก่งที่สุด เช่นเดียวกับที่เขาต้องเป็นแพทย์ที่รักษาโรคกระดูกสันหลังที่ดีที่สุดที่เราเทรนได้ในปัจจุบันเพื่อเป็นนักแข่งรถ Formula 1 ที่ดีที่สุด
อบรมหลักสูตรความรู้เบื้องต้นการจัดการสาธารภัยฯ รุ่นที่ 1/66 สำหรับอาสาสมัครกู้ชีพกู้ภัย มูลนิธิป่อเต็กตึ๊ง
การอบรม "หลักสูตรความรู้เบื้องต้นการจัดการสาธารภัยฯ" รุ่นที่ 1/66 สำหรับอาสาสมัครกู้ชีพกู้ภัย มูลนิธิป่อเต็กตึ๊ง เท่านั้น! อบรม "ฟรี!" วันนี้ถึงวันที่ 8 พ.ค.66 โดยทีมวิทยากรผู้เชี่ยวชาญจาก กรมป้องกันและบรรเทาสาธารณภัยฯ รับสมัครจำนวน 60 คน อบรมวันที่ 13 พ.ค.66 ณห้องประชุมชั้น 2 อาคาร 2 มูลนิธิป่อเต็กตึ๊ง
วันพฤหัสบดี ทำท่า ฝึกก้าวหน้า/ ถอย
ฝึกก้าวหน้า/ ถอย ยืนให้ระยะห่างของเท้าทั้งสองข้างกว้างเท่ากับความกว้างของไหล่ ก้าวเท้าไปด้านหน้า - ถอยหลัง ทั้งข้างขวาและซ้าย ข้างละ 30 ครั้ง วันละ 3 ชุด
เส้นทางที่ 3 ท่องเที่ยวเชิงเกษตร แวะชม Unseen โบสถ์ปรกโพธิ์ วัดบางกุ้ง
เส้นทางที่ 3 สนุกหลายรสชาติมาก ตั้งแต่ ท่องเที่ยวเชิงเกษตร บ้านสวนมะนาวโห่ ลุงสิริ ที่ดังไปทั่วไทย (โทร.080-5665124) เที่ยวสวน กินอาหารเครื่องดื่มอร่อยได้เรย ต่อด้วยการ นวดผ่อนคลายที่คลินิกการแพทย์แผนไทย 2 แห่ง แนะนำ คือ คลินิกการแพทย์แผนไทย โรงพยาบาลนภาลัย (นัดล่วงหน้า โทร. 034-761476 ต่อ 6310 ) หรือ คลินิกการแพทย์แผนไทย รพ.สต.บางกุ้ง (นัดล่วงหน้า โทร. 034-702834) และที่ต้องไม่พลาด คือแวะชม Unseen โบสถ์ปรกโพธิ์ วัดบางกุ้ง วัดเก่าแก่ของจังหวัดสมุทรสงคราม เป็นวัดที่มีโพธิ์ปรกที่สวยงามที่สุดของประเทศ ถ่ายภาพสวยหลายมุมมาก เข้มขลังอลังการสุดๆ
ตรวจสุขภาพ วัดค่าสัญญาณชีพต่างๆ ผ่าน แอป Clicknic
Clicknic รู้หลายคนอาจรู้สึกว่าการหาหมอออนไลน์อาจทำให้คุณหมอตรวจเราได้ไม่ละเอียดพอ คลายกังวลได้เลย เพราะ Clicknic พัฒนาเทคโนโลยีสุดล้ำมาวัดค่าสัญญาณชีพ, ตรวจชีพจร และอัตราการเต้นหัวใจ ผ่านมือถือกันไปเลย โดยให้ AI ตรวจจับสีผิวบนหน้าของเพื่อนๆ ที่มีการเปลี่ยนแปลงในระดับที่ตาเปล่าเรามองไม่เห็นนั้นเอง
ตรวจสุขภาพผ่านมือถือทำดังนี้
1. ดาวน์โหลดแอป Clicknic : http://onelink.to/w5vub9
2. ลงทะเบียนเพื่อใช้งาน
3. กดไอคอน “บัญชี/Account” ที่มุมล่างขวา
4. กดไปที่ “ข้อมูลสุขภาพ/Health profile”
5. เลื่อนลงมาด้านล่างสุดแล้วกด "อัพเดทข้อมูลด้วยการแสกนใบหน้า/Vital Signs Face Scanning"
ปัญหา (Pain Point) โรคมะเร็งปากมดลูก เหตุใดผู้หญิงไทยไม่ค่อยเข้ารับการตรวจคัดกรองฯ
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า มีหลายปัจจัย แต่ปัญหาหลักๆ คือหลายคนไม่อยากขึ้นขาหยั่ง อายหมอ และไม่มีอาการผิดปกติอะไรจึงไม่คิดจะมาตรวจ หลายคนรอจนมีอาการแล้วค่อยมาพบแพทย์ ซึ่งเมื่อมาพบแพทย์ในตอนนั้นก็มักจะช้าเกินไป จึงอยากรณรงค์ให้ผู้หญิงอย่าละเลยการเข้ารับการตรวจคัดกรองฯ
ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวว่า ปัจจุบันมีนวัตกรรม มีเทคโนโลยีใหม่เกิดขึ้น มีการพัฒนาการตรวจคัดกรองมะเร็งปากมดลูกแบบเก็บตัวอย่างด้วยตนเอง HPV DNA Self-Sampling สปสช. จึงได้บรรจุสิทธิประโยชน์นี้เข้าไปด้วย ไม่มีค่าใช้จ่าย เช่นกัน
ซึ่งวันนี้มีการนำร่องแล้วที่เขตสุขภาพที่เจ็ด (ขอนแก่น ศรีสะเกษ ร้อยเอ็ด และมหาสารคาม) เป็นการตรวจแบบ HPV DNA แต่แทนที่จะมาให้แพทย์เก็บตัวอย่างให้ ผู้หญิงก็เก็บเองได้เลย
ผลสำรวจคำถาม 4. เช่นเดียวกัน หากมี งบประมาณ "จำกัด" เลือกได้เพียงอย่างเดียว ท่านจะให้ "คนในครอบครัว" ตรวจสุขภาพ/รักษาโรคใดก่อน?
บันทึกผลการสำรวจคำถาม 4
"เงินน้อย เลือกให้คนในครอบครัว (ไม่ใช่ตัวเอง)" พร้อมรายละเอียดบางส่วน
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน ตรวจมะเร็ง 35.7% ตรวจด้านหัวใจ ระบบเลือด 20.1%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน ตรวจมะเร็ง 35.8% ตรวจด้านหัวใจ ระบบเลือด 19.1% ตรวจเกี่ยวกับตับ 3% ตรวจเกี่ยวกับไต 3.2% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 5.1% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 6% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 5.8% ตรวจระบบทางเดินอาหาร 3.6%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน ตรวจมะเร็ง 36.2% ตรวจด้านหัวใจ ระบบเลือด 17.8% ตรวจเกี่ยวกับตับ 3.1% ตรวจเกี่ยวกับไต 3.8% ความเสี่ยงอัมพฤกษ์ อัมพาต พาร์คินสัน 4.6% ตรวจเกี่ยวกับปอด ระบบทางเดินหายใจ 6.1% ตรวจด้านสมอง (ระบบประสาท สมองเสื่อม) 5.7% ตรวจระบบทางเดินอาหาร 3.1%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน
แจ้งเหตุเกี่ยวกับสุนัข โทร. 02-2453311 หรือ 02-2487417 หากมีเหตุต่างๆ ดังนี้
เหตุเกี่ยวกับสุนัขที่ต้องแจ้งสำนักงานแพทย์สาธารณสุขภายใน 30 วัน ที่โทร.
1. ย้ายสถานที่อยู่
2. บัตรประจำตัวสูญหายชำรุด
3. สัตว์ทำร้ายคนหรือพยายามทำร้ายคน
4. สุนัขตาย
5. เปลี่ยนเจ้าของ
Workshop : การใช้ AI ในอุตสาหกรรมกัญชา วันที่ 9 กรกฎาคม : 17.00-17.45 น.
ปัจจุบัน AI ได้เข้ามามีบทบาทกันชีวิตเรามากขึ้นและกำลังเติบโตแบบไม่หยุด ในอุตสาหกรรมกัญชาของประเทศไทยเองก็มีคนที่กำลังพัฒนา AI อยู่ และเราได้เชิญมาเป็นวิทยากรใน Workshop ของเราในปีนี้
ดร. ณธกร ทัศนัส อาจารย์สาขาวิศวกรรมไฟฟ้าและคอมพิวเตอร์คณะวิทยาศาสตร์และวิศวกรรมศาสตร์ และเป็นผู้อำนวยการศูนย์วิจัยและนวัตกรรมพืชกัญชา ม.เกษตรสกลนคร ซึ่งอ. เชี่ยวชาญในการทำระบบออโตเมชั่น และในระยะหลายปีที่ผ่านมาได้เริ่มพัฒนา AI ที่ใช้เป็นตัวช่วยในอุตสาหกรรมกัญชา อ. จะมาถ่ายทอดให้เราฟังกันว่า AI จะเข้ามามีบททางในอุตสาหกรรมขนาดไหน และเราจะเอาไปต่อยอดได้ยังไงในอนาคต
การใช้อากาศยานไร้คนขับ (UAVs) หรือที่เรียกกันทั่วไปว่าโดรนกำลังถูกนำมาใช้งานกันมากขึ้น ทั้งโดยฝ่ายรัฐและ ฝ่ายที่ไม่ใช่รัฐ ใช้โดรนในการโจมตีเป้าหมายทั้งทางทหารและโครงสร้างพื้นฐานเพิ่มมากขึ้น จำนวนฝ่ายที่ไม่ใช่รัฐ มีการใช้โดรนเพิ่มขึ้นสองเท่าระหว่างปี 2561-2565 และจำนวนการโจมตีด้วยโดรนทั้งหมดเพิ่มขึ้นเกือบสามเท่าในช่วงเวลาเดียวกัน
ทั้งความรุนแรงและความสงบสุขสามารถแพร่ถึงกันได้ (ประหนึ่งโรคติดต่อ) การกระทำในภูมิภาคหรือประเทศหนึ่งอาจลุกลามไปยังภูมิภาคและประเทศที่มีพรมแดนติดกัน นำไปสู่วงจรอธรรมหรือวงจรอุบาทว์ที่สันติภาพและความขัดแย้งดำเนินควบคู่กันไป ยุโรปตะวันออกเป็นตัวอย่างของการเปลี่ยนแปลงที่ชัดเจน ที่ความสงบสุขในประเทศหนึ่ง ทำให้ประเทศเพื่อนบ้านสงบสุขไปด้วย การผนวกไครเมียของรัสเซียในปี 2557 นำไปสู่การเพิ่มกำลังทางทหารในยูเครน เบลารุส ลิทัวเนีย ลัตเวีย และเอสโตเนีย โดยค่าใช้จ่ายทางทหารและความสัมพันธ์ของประเทศเพื่อนบ้านแย่ลงในประเทศเหล่านี้ทั้งหมด
แถบชายฝั่งแอฟริกาตะวันตกเป็นตัวอย่างของวัฏจักรแห่งสันติวิถีที่ดีงาม ประเทศต่างๆ ในแถบนี้มีคะแนน GPI ดีขึ้นในช่วง 15 ปีที่ผ่านมา แม้จะมีความรุนแรงอย่างกว้างขวางในภูมิภาค Sahel ที่อยู่ใกล้เคียง และมีประวัติความขัดแย้งที่รุนแรง นอกเหนือจากกินีแล้ว ทุกประเทศในแอฟริกาตะวันตกชายฝั่งทะเลมีตัวเลขความสงบสุขดีขึ้นตั้งแต่ปี 2551 ถึง 2566 เหตุผลก็มาจากการพัฒนาด้านธรรมาภิบาลและเสถียรภาพทางการเมือง ตลอดจนการมีทรัพยากรที่เพิ่มขึ้นสำหรับการเฝ้าระวังตรวจตราและดูแลความปลอดภัยในสังคม เหล่านี้มีบทบาทสำคัญ ต่อการเพิ่มความสงบสุขทั้งสิ้น
ผลกระทบทางเศรษฐกิจของความรุนแรงต่อเศรษฐกิจโลกในปี 2565 อยู่ที่ 17.5 ล้านล้านดอลลาร์ ในแง่ความเสมอภาคของกำลังซื้อ (PPP) ตัวเลขนี้คิดเป็น 12.9 เปอร์เซ็นต์ของ GDP ของโลก หรือ 2,200 ดอลลาร์ต่อคน เพิ่มขึ้น 6.6 เปอร์เซ็นต์จากปีที่แล้ว สิ่งนี้ได้รับแรงหนุนหลักจากการเพิ่มขึ้นของผลกระทบทางเศรษฐกิจโดยรวมของค่าใช้จ่ายทางทหารทั่วโลก ซึ่งเพิ่มขึ้นร้อยละ 16.8 แม้ว่าประเทศอื่นๆ จะลดค่าใช้จ่ายทางทหารลงเป็นเปอร์เซ็นต์ของ GDP มากกว่าที่เพิ่มขึ้น การเพิ่มขึ้นส่วนใหญ่เป็นผลมาจากการรุกรานยูเครนของรัสเซียและการใช้จ่ายทางทหารที่เกี่ยวข้องจากประเทศต่างๆ ที่เกี่ยวข้องกับความขัดแย้งทั้งทางตรงและทางอ้อม
สำหรับสิบประเทศที่ได้รับผลกระทบจากความรุนแรงมากที่สุด ผลกระทบทางเศรษฐกิจโดยเฉลี่ยเท่ากับร้อยละ 34 ของ GDP เทียบกับร้อยละ 2.9 ในสิบประเทศที่ได้รับผลกระทบจากความรุนแรงน้อยที่สุด ยูเครน อัฟกานิสถาน และสาธารณรัฐแอฟริกากลาง ก่อให้เกิดต้นทุนทางเศรษฐกิจจากความรุนแรงตามสัดส่วนที่ใหญ่ที่สุดในปี 2564 เท่ากับ 63, 47 และ 40 เปอร์เซ็นต์ของ GDP ตามลำดับ
รายงาน GPI ปี 2023 ยังพิจารณาถึงผลกระทบทางเศรษฐกิจจากการปิดล้อมไต้หวันของจีน ตามสมมุติฐาน IEP ประมาณการว่าการปิดล้อมจะส่งผลกระทบมากเป็นสองเท่าของวิกฤตการเงินโลก โดย GDP ทั่วโลกจะลดลง 2.8 เปอร์เซ็นต์ภายในหนึ่งปี เศรษฐกิจจีนจะหดตัวประมาณร้อยละ 7 ในขณะที่เศรษฐกิจของไต้หวันจะหดตัวเกือบร้อยละ 40 จะเกิดผลกระทบอย่างรุนแรงในอุตสาหกรรมใดก็ตาม ที่ต้องพึ่งพาอุปกรณ์อิเล็กทรอนิกส์ที่ซับซ้อน เนื่องจากไต้หวันผลิตเซมิคอนดักเตอร์ลอจิกขั้นสูงมากกว่าร้อยละ 90 ของโลก คู่ค้าหลักทั้ง 5 ของจีนล้วนเป็นประเทศประชาธิปไตยที่พัฒนาแล้ว โดยมีความเชื่อมโยงด้านกลาโหมที่แข็งแกร่งกับสหรัฐฯ
ความจำเป็นในการตอบสนองเชิงระบบเพื่อสร้างสันติภาพเป็นเรื่องเร่งด่วน ความขัดแย้งทวีความรุนแรงขึ้นในหลายภูมิภาค มีผู้เสียชีวิตจากความขัดแย้งเพิ่มขึ้นอย่างรวดเร็ว ช่องว่างระหว่างประเทศที่มีความสงบสุขมากที่สุดและน้อยที่สุดยังคงเพิ่มขึ้น และแม้ว่ามาตรการทางทหารหลายอย่างจะดีขึ้นในช่วงสิบห้าปีที่ผ่านมา การแพร่กระจายของเทคโนโลยีทางทหารขั้นสูงที่มีราคาถูกลง การแข่งขันทางภูมิรัฐศาสตร์ที่เพิ่มขึ้น และกระแสความไม่มั่นคงทางการเมืองที่แฝงอยู่ในหลายประเทศ เหล่านี้ชี้ไปในทิศทางที่ดูเหมือนว่า ความสงบสุขทั่วโลกจะถดถอยลงอย่างต่อเนื่อง
152. อาคารไออาร์บิวติน่า อ.ลำลูกกา จ.ปทุมธานี
ปทุมธานี
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 17.30 - 20.30 น.
เบอร์ติดต่อ: 063-946-3263
ผู้ติดต่อ: อ.พรรณวดี หอมโกศล
153. โรงเรียนศรีสุวิช อ.บางละมุง จ.ชลบุรี
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
154. วัดป่าดาราภิรมย์ อ.แม่ริม จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: -
เบอร์ติดต่อ: 088-252-9427
ผู้ติดต่อ: นายโปษัณ เย็นบุตร
155. วัดป่ารัชดาราม อ.ป่าซาง จ.ลำพูน
ลำพูน
วันเวลาทำการ: -
เบอร์ติดต่อ: 0629953696
ผู้ติดต่อ: พันเอกสุทัศน์ นันตา
156. วัดมณีไพรสณฑ์ อ.แม่สอด จ.ตาก
ตาก
วันเวลาทำการ: เสาร์-อาทิตย์ ระหว่างเวลา 09.00-16.00 น.
เบอร์ติดต่อ: 0843810628
ผู้ติดต่อ: นายเชิดชัย พัทยาวรรณ
157. วัดภูเก็ต อ.ปัว จ.น่าน
น่าน
วันเวลาทำการ: จันทร์-อาทิตย์ เวลา 09.00 น. - 16.00 น.
เบอร์ติดต่อ: 089-950-5292
ผู้ติดต่อ: นายพยนต์ อินมณี
158. วัดอำมาตย์ อ.เทิง จ.เชียงราย
เชียงราย
วันเวลาทำการ: -
เบอร์ติดต่อ: 081-3875365
ผู้ติดต่อ: อาจารย์โรจน์ จุใจ (ผู้ดูแลสาขา)
159. วัดเสาธงทอง จ.สิงห์บุรี
สิงห์บุรี
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ เวลา 09.00 - 16.00 น.
เบอร์ติดต่อ: 08-6470-0251
ผู้ติดต่อ: อ.บุศรารินทร์ ทองมีบุญญาทิพย์
160. วัดสารนาถธรรมาราม อ.แกลง จ.ระยอง
ระยอง
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 09.00 - 16.00 น.
เบอร์ติดต่อ: 084-351-9645
ผู้ติดต่อ: อาจารย์ชัยมินพงศ์ พงศ์สุรนาท
161. วัดเจียงอีศรีมงคลวราราม อ.เมือง จ.ศรีสะเกษ
ศรีสะเกษ
วันเวลาทำการ: วันจันทร์ - ศุกร์ เวลา 18.00 - 20.30 น.
เบอร์ติดต่อ: 094-291-4722
ผู้ติดต่อ: อ.พรหมทิพย์ ทองแท้
162. วัดทุ่งโพธาราม อ.สร้างคอม จ.อุดรธานี
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
163. วัดป่าประดู่ อ.กบินทร์บุรี จ.ปราจีนบุรี
ปราจีนบุรี
วันเวลาทำการ: วันเสาร์-วันอาทิตย์
เบอร์ติดต่อ: 0811303214 ,0947899994 ,0895264581
ผู้ติดต่อ: อ.ปทุม กายสิทธิ์ ,อ.นรเสฏฐ์ นาคภัทรพงศ์ ,อ.นิภาวดี ณีรอด
164. เรือนพักสว่างใจ อ.อุทุมพรพิสัย จ.ศรีสะเกษ
ศรีสะเกษ
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 0898490282
ผู้ติดต่อ: นายอนุวัตร โสภา
165. วัดประชุมโยธี จ.พังงา
พังงา
วันเวลาทำการ: ส.อา. 9.00 น. - 1ุ6.00 น.
เบอร์ติดต่อ: 0815379305
ผู้ติดต่อ: ผดล. สุภาภรณ์ พฤกษาพนาชาติ
166. โชติเวชการ เกาะสมุย จ.สุราษฎร์ธานี
สุราษฎร์ธานี
วันเวลาทำการ: -
เบอร์ติดต่อ: 089-457-6116
ผู้ติดต่อ: อ.ศันสนีย์ ศรแมน
167. วัดน้ำไหล อ.นางรอง บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: 08.30-16.30 น.
เบอร์ติดต่อ: 0854937324
ผู้ติดต่อ: อ.วิจิตร ธวัชชัย
168. อาคารกองบุญมา สีลม เขตบางรัก
กรุงเทพมหานคร
วันเวลาทำการ: วันจันทร์-ศุกร์ 18.00-20.30 น.
เบอร์ติดต่อ: 0935586168
ผู้ติดต่อ: ฐานิสรณ์ ธินิศิริ
169. ตลาดยิ่งเจริญ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: ภาคจันทร์-ศุกร์ เวลา 18.00-20.30 น. ภาคเสาร์-อาทิตย์ เวลา 09.00-16.30 น.
เบอร์ติดต่อ: 08-6539-7427
ผู้ติดต่อ: อ.วิชสุนันท์ แสนรัมย์ (ผู้ดูแลสาขา)
170. มหาวิทยาลัยรามคำแหง
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์-ศุกร์ , เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 0819126177
ผู้ติดต่อ: เชาวลิต พุทธอุปถัมภ์
171. วัดห้วยทรายใต้ อ.ชะอำ จ.เพชรบุรี
เพชรบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 8.30 - 16.00น.
เบอร์ติดต่อ: 090-595-1456
ผู้ติดต่อ: อ.นันทิศักดิ์ ไตรยสุทธิ์
172. วัดท่าบันเทิงธรรม อ.บางใหญ่ จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 8.00 น.- 16.00 น.
เบอร์ติดต่อ: 0818413797
ผู้ติดต่อ: อ.สมมาตร รักษ์ถาวรกุล
173. วัดหนามแดง จ.สมุทรปราการ
สมุทรปราการ
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ 8.00-17.00 น.
เบอร์ติดต่อ: 081-815-1672
ผู้ติดต่อ: ผู้ดูแลสาขา อ.รัชนี ชัยชาติ
174. วัดบ้านหาญ อ.ด่านขุนทด จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30- 17.00 น,
เบอร์ติดต่อ: 091-018-8873
ผู้ติดต่อ: นายจำเริญ ผดุงชอบ
176. ม.เทคโนโลยีราชมงคลพระนคร
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
177. วิทยาลัยแพทย์ศาสตร์นานาชาติจุฬาภรณ์ ม.ธรรมศาสตร์ ศูนย์รังสิต
ปทุมธานี
วันเวลาทำการ: -
เบอร์ติดต่อ: 081-9724268
ผู้ติดต่อ: กาญจนา โมธินา
178. กฟผ.บางกรวย (EGAT) นนทบุรี
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
180. อาคารอกนิษฐ์ บุญเหลือหล่อ (พหลโยธิน11)
กรุงเทพมหานคร
วันเวลาทำการ: วันจันทร์-วันศุกร์ 18.00-20.30 น.
เบอร์ติดต่อ: 0819851669
ผู้ติดต่อ: ผู้ดูแลสาขา : อ.ดร.ณรงค์ ทัศนนิพันธ์
181. สำนักงานปลัดกระทรวงพาณิชย์ จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: จันทร์-ศุกร์ 8.30-16.30 น.
เบอร์ติดต่อ: 0818265519- ผดล.นพพร 0992191631 - นภาพันธุ์ (ผช.ผดล.) 0850888002-วีรวัฒน์ (ผช.ผดล.) 0996535692-สุพาณี (ผช.ผดล)
ผู้ติดต่อ: นพพร ลิ้นทอง (ผดล.) , นภาพันธ์ จันทร์อุฏฐานะ (ผช.ผดล.) , วีรวัฒน์ เสมอใจ (ผช.ผดล.) , สุพาณี ชัยสิทธิ์เมฆินทร์ (ผช.ผดล.)
182. วัดใหญ่อินทาราม จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00 - 20.00 น.
เบอร์ติดต่อ: 089 832 6468 , 064 193 9166 , 081 941 1319 , 086 313 4640
ผู้ติดต่อ: อาจารย์พิมพ์พิชชา คงวัฒน์ทวีสิน
183. วัดโตนด อ.หลังสวน จ.ชุมพร
ชุมพร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00-16.00 น.
เบอร์ติดต่อ: 093-864-4150 , 084-841-5763 , 061-498-3532
ผู้ติดต่อ: อ.ยุทธศักดิ์ กิตติมานะพันธ์ , อ.ศิริวรรณ ศรีสังข์ , คุณเมธาพร ทองเฝือ
184. วัดอินทรแบก อ.ศรีมหาโพธิ จ.ปราจีนบุรี
ปราจีนบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ 9.00-16.30 น.
เบอร์ติดต่อ: 083-046-7545
ผู้ติดต่อ: อ.ธีร์ธรรม ธรรมวิชญ์จิตร
185. 47/19 ถ.ละม้ายอุทิศ อ.เมือง จ.นราธิวาส
นราธิวาส
วันเวลาทำการ: 09.00-16.00น.
เบอร์ติดต่อ: 089-6586690
ผู้ติดต่อ: ผดล.ดลธรรม พุทธสุภะ
186. วัดป่าเลิศธรรมนิมิต ลำลูกกา คลอง 11 จ.ปทุมธานี
ปทุมธานี
วันเวลาทำการ: 09.00 - 18.00 น
เบอร์ติดต่อ: 0814395429
ผู้ติดต่อ: คุณวรรณา เกิดเกียรติสุดา
187. รร.สตรีวัดมหาพฤฒาราม
กรุงเทพมหานคร
วันเวลาทำการ: 8.00-17.00
เบอร์ติดต่อ: 02-2365758
ผู้ติดต่อ: สาขา 187
188. โรงพยาบาลสินแพทย์ เสรีรักษ์
กรุงเทพมหานคร
วันเวลาทำการ: 09.00-17.00 น.
เบอร์ติดต่อ: 0639982655
ผู้ติดต่อ: อ.นฤมล
189. วัดภูริทัตตถิราวาส อ.พรรณานิคม จ.สกลนคร
สกลนคร
วันเวลาทำการ: เสาร์-อาทิตย์ (08.00น. - 16.30 น.)
เบอร์ติดต่อ: 081-392-1067
ผู้ติดต่อ: อ.วิเศษ พันธุ์ชัย
190. วัดล้อมแรด อ.เถิน จ.ลำปาง
ลำปาง
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ 08.00 น. - 16.30 น.
เบอร์ติดต่อ: 0899564585
ผู้ติดต่อ: อ.พรศักดิ์ ศิษย์ชัยชนะ
191. วัดจันทร์ตะวันออก อำเภอเมือง
พิษณุโลก
วันเวลาทำการ: วันจันทร์-วันศุกร์ เวลา 17.30 -20.00 น.
เบอร์ติดต่อ: 089-961-5942
ผู้ติดต่อ: ผู้ดูแลสาขา อ.ภัทรภร มีพยุง
192. วัดโพธิสัมพันธ์ อ.บางละมุง จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: วันจันทร์ - วันศุกร์ เวลา 18.00 - 20.00 น.
เบอร์ติดต่อ: 088-2050425
ผู้ติดต่อ: ผดล. อาจารย์ ทวีศักดิ์ เหมะชยางกูร
193. วัดคุณหญิงส้มจีน อ.คลองหลวง จ.ปทุมธานี
ปทุมธานี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 8.30 - 17.00 น.
เบอร์ติดต่อ: 0812860312, 0649464929
ผู้ติดต่อ: อรวรรณ คชบาง
194. พุทธมณฑลสาย 4 อ.สามพราน จ.นครปฐม
นครปฐม
วันเวลาทำการ: 09:30 - 15:30
เบอร์ติดต่อ: 083 296 3886
ผู้ติดต่อ: อ.ฉวีวรรณ ประสานดี
195. วัดป่าวิศรุตรัตนาราม เขตหนองจอก กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: -
เบอร์ติดต่อ: โทร 081-914-6326 : อ.ศรีพัจฌาย์ หันไชยเนาว์
ผู้ติดต่อ: โทร 083-599-5365 : อ.สิทธิพันธุ์ หลักแหลม
196. วัดเกาะหลัก พระอารามหลวง จ.ประจวบคีรีขันธ์
ประจวบคีรีขันธ์
วันเวลาทำการ: 08:00-16:00 (เสาร์-อาทิตย์)
เบอร์ติดต่อ: 0819705375
ผู้ติดต่อ: อ. เชาว์ มณีวัฒนาพฤกษ์
197. มหาวิทยาลัยราชภัฎเชียงราย
เชียงราย
วันเวลาทำการ: จันทร์-ศุกร์ 08.30-16.00 น.
เบอร์ติดต่อ: 0982725880
ผู้ติดต่อ: ปริพรรน์ แก้วเนตร
198. วัดศรีมงคล อ.ชุมแพ จ.ขอนแก่น
ขอนแก่น
วันเวลาทำการ: เสาร์ - อาทิตย์
เบอร์ติดต่อ: 0951786297
ผู้ติดต่อ: ดร.จามรี ศิริจันทร์
199. วัดป่าสตึกพัฒนา อ.สตึก จ.บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: เสาร์-อาทิตย์ 08.30-16.30น.
เบอร์ติดต่อ: 065-098-9829
ผู้ติดต่อ: อาจารย์ ดร. ถาวร พอสม (ผู้ดูแล)
200. ถนนเลียบทางด่วนเอกมัย-รามอินทรา กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ 18.00 น. - 20.30 น.
เบอร์ติดต่อ: 081-985-1669
ผู้ติดต่อ: อ.ดร.ณรงค์ ทัศนนิพันธ์
เศรษฐกิจดี
ในโซนนี้ นอกจากมีของดีจาก 50 เขต และสินค้าจาก Bangkok Brand ให้ได้ช้อปปิ้งแล้ว
ภายใต้แนวคิดเศรษฐกิจดี กรุงเทพมหานครยังมีแนวคิดในการเพิ่มโอกาสการตลาดแรงงาน ตลอดจนเพิ่มโอกาสสร้างรายได้ เพิ่มทักษะอาชีพใหม่ที่โรงเรียนฝึกอาชีพ กทม. ด้วย นอกจากนี้ที่บูธ ยังมีการเปิดข้อสอบจากคลังข้อสอบเข้ารับราชการ กทม. โดยจะเปิดโอกาสให้ประชาชนที่สนใจ ได้เข้ามาทดลองทำข้อสอบจริง จากคลังข้อสอบเข้ารับราชการ กทม. จะมีรอบการทดลองทำข้อสอบจริง 2-3 รอบต่อวัน ทั้งภาค ก ภาค ข และภาค ค ทั้งทำบนกระดาษและ e-testing โดยสามารถเลือกตำแหน่งสอบได้ ทั้งนี้ หลังทำข้อสอบด้วย
นักดับเพลิงและกู้ภัยพหลโยธิน กปก.1
จับตัวเงินตัวทอง ความยาวประมาณ 80 ซม. ภายในบ้านเลขที่ 61 ซ.อินทามระ21 แขวง สามเสนใน เขตพญาไท กทม. เจ้าหน้าที่ดำเนินการจับเป็นที่เรียบร้อยประชาชนอุ่นใจ
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 1 เมตร สถานที่เหตุเกิดเลขที่ 86 ซอย วิภาวดี 17 แยก6 แขวง/เขตจตุจักร กทม. เจ้าหน้าที่ดำเนินการเรียบร้อย # พหล1-5
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 1 เมตร สถานที่เกิดเหตุ : เลขที่ 17/1 ซอยวิภาวดี17 แย10-1 แขวง/ เขต จตุจักรกรุงเทพฯ เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย
ช่วยเหลือประชาชนจับงูเขียวพระอินทร์ ความยาวประมาณ 1 เมตร สถานที่เหตุเกิดเลขที่ 24/4 ซอย พหลโยธิน 2 แขวงสามเสนใน เขตพญาไท กทม. จนท.ดำเนินการเรียบร้อย
ช่วยเหลือประชาชนจับงูเหลือม ความยาวประมาณ 3 เมตร สถานที่เหตุเกิดเลขที่ 128 ซอย อินทามระ 10 แขวงสามเสนใน เขตพญาไท กทม. จนท.ดำเนินการเรียบร้อย # พหล1-4
นักดับเพลิงและกู้ภัยดุสิต
ช่วยเหลือประชาชนงูเขียวพระอินทร์ ขนาด 40 เซนติเมตร บ้านเลขที่ 1095/1-3 ซอยถนนนครไชยศรี แขวงถนนนครไชยศรี เขตดุสิต กทม. เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย ผู้แจ้ง คุณอำนวย มาดล อายุ 70 ปี
ช่วยเหลือประชาชนตัวเงินตัวทอง ขนาด 1 เมตร บ้านเลขที่ 21 ซอยอารีย์สัมพันธ์ 4 แขวงพญาไท เขตพญาไท กทม. เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย ผู้แจ้ง คุณ กรชูลี สุวรรณประทีป
ช่วยเหลือประชาชนตามการร้องขอ จับงูเหลือม ความยาวประมาณ 2 เมตร เหตุเกิดบ้านเลขที่ 37 ซอยระนอง 2 ถนนพระรามห้า แขวงถนนนครไชยศรี เขตดุสิต กทม.@ดุสิต 42
ช่วยเหลือประชาชน จับงูเหลือมขนาดความยาว 1.20 ม. ซ.ระนอง 1 ถ.เทอดดำริ ดุสิต 47 พร้อม จนท. 4 นาย รถดุสิต 06-2 ดำเนินการเป็นที่เรียบร้อย
ช่วยเหลือประชาชนจับงูเหลือม ขนาด 1.20 ม. ซ.พระรามหก 41 รถดุสิต 06-2 ดุสิต 47 พร้อม จนท. 3 นาย ดำเนินการเป็นที่เรียบร้อย
เจ้าหน้าที่ชุดปฏิบัติการ 1 ช่วยเหลือประชาชนจับงู แต่ไม่พบได้ประชาสัมพันธ์ให้เจ้าของบ้านทราบแล้ว เหตุเกิด บ้านเลขที่ 11 ซอยพระรามหก 41 ถนนพระรามหก แขวงพญาไท เขตพญาไท กทม. ผู้แจ้ง คุณปิยะ ดโนทัย ผู้ควบคุม ดุสิต 4-6
ช่วยเหลือประชาชนตัวเงินตัวทองขนาด 1.2 เมตรบ้านเลขที่ 35/1 ซอยระนอง 1 แขวงถนนนครไชยศรีเขตดุสิต กทม.เจ้าหน้าที่ดำเนินการเป็นที่เรียบร้อย ผู้แจ้ง คุณนิรัญ แล้วสถิตย์
นักดับเพลิงและกู้ภัยภูเขาทอง กปก.1
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ขนาดความยาวประมาณ 1 เมตร สถานที่เกิดเหตุ บ้านเลขที่ 2 ถนนบริพัตร แขวงบ้านบาตร เขตป้อมปราบฯ กรุงเทพฯ ดำเนินการเรียบร้อย
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ขนาดความยาวประมาณ 1 เมตร สถานที่เกิดเหตุ บ้านเลขที่ 2 ถนนบริพัตร แขวงบ้านบาตร เขตป้อมปราบฯ กรุงเทพฯ ดำเนินการเรียบร้อย
นักดับเพลิงและกู้ภัยห้วยขวาง กปก.1
ช่วยเหลือประชาชน จับงูเหลือม ขนาดความยาวประมาณ 1.50 เมตรดำเนินการเป็นที่เรียบร้อย สถานที่เกิดเหตุ บ้านเลขที่ 44ซอยประชาสงเคราะห์14 แยก2-4 ถ.ประชาสงเคราะห์แขวงดินแดง เขตดินแดง กรุงเทพมหานคร ห้วยขวาง2-1รายงาน
นักดับเพลิงและกู้ภัยสุทธิสาร กปก.1
จับงูเหลือม ขนาดความยาวประมาณ 1 เมตร สถานที่เกิดเหตุกองบังคับการปราบปราม แขวง จอมพล เขต จตุจักร กทม. ชื่อผู้แจ้ง: คุณ สุภาพร แพงมา @สุทธิสาร 3-1
ช่วยเหลือประชาชนจับงูเหลือม ความยาว 2 เมตร สถานที่เกิดเหตุ: กองบังคับการปราบปราม ถนนพหลโยธิน แขวงจอมพล เขตจตุจักร กทม ผู้รายงาน : สุทธิสาร 11
ช่วยเหลือประชาชนจับตัวเงินตัวทอง ความยาว 50 เซ็นติเมตร สถานที่เกิดเหตุ 123 หมูบ้านพหลโยธินกอล์ฟ ซอยพหลโยธิน 19/1 ถนนพหลโยธิน แขวงจตุจักร เขตจตุจักร กทม. ผู้รายงาน : สุทธิสาร 11
จับงูเหลือม ความยาวประมาณ 2.5 เมตร ดำเนินการเรียบร้อย สถานที่เกิดเหตุ: บ้านเลขที่ 168/4 ซอย วิภาวดี 20 แขวง จอมพล เขต จตุจักร กทม ชื่อผู้แจ้ง: คุณ พีระพัฒน์ บุญยรัตน์พันธ์ @สุทธิสาร 3-1
ช่วยเหลือประชาชนจับงูเหลือม ความยาว 50 เซ็นติเมตร สถานที่เกิดเหตุ 49/90 ซอยจิ๊บดำริห์ ถนนสุทธิสาร แขวงรัชดาภิเษก เขตดินแดง กทม. ผู้รายงาน : สุทธิสาร 11
จับงูเขียว ขนาดความยาวประมาณ 80 เซนติเมตร ดำเนินการเรียบร้อย
กำจัดรังแตน ขนาดเส้นผ่าศูนย์กลาง 10 เซนติเมตร จำนวน 3 รัง ดำเนินการเรียบร้อย สถานที่เกิดเหตุ : เลขที่ 588 ถนน วิภาวดี ซอย วิภาวดี 24 แขวง จอมพล เขตจตุจักร ผู้แจ้ง : นิติบุคคลอาคารชุด เดอะเซ้นต์ เรสิเดนเซส @สุทธิสาร 31
เขตราชเทวี สำรวจถังดับเพลิงในชุมชน พร้อมติดตั้ง QR Code บันทึกข้อมูลและติดตามซ่อมบำรุง
6 กรกฎาคม 2566 สำนักงานเขตราชเทวี โดย ฝ่ายปกครอง ฝ่ายพัฒนาชุมชนฯ ร่วมกับ สำนักป้องกันและบรรเทาสาธารณภัย ลงพื้นที่บริเวณชุมชนซอยเพชรบุรี 7 (ซอยสุเหร่า) และ ชุมชนแฟลตสถานีตำรวจนครบาลพญาไท เพื่อสำรวจและตรวจสอบสภาพถังดับเพลิงแบบยกหิ้ว ซึ่งถังที่เสื่อมสภาพจะถูกจัดเก็บคืนและติดถังใหม่ทดแทน ส่วนถังที่ยังสามารถใช้งานได้จะมีการติดตั้ง QR Code บนตัวถังเพื่อบันทึกข้อมูลการตรวจให้ประชาชนสามารถสแกนเข้าดูรายละเอียดต่าง ๆ ได้ อาทิ ประเภทของถัง ตำแหน่งที่ติดตั้ง รวมถึงสามารถติดตามการซ่อมบำรุงได้อีกด้วย
ความรู้เรื่องมะเร็งรังไข่
ข้อมูลจาก
สถาบันมะเร็งแห่งชาติ รายงานว่า มะเร็งรังไข่เป็นมะเร็งที่พบได้มาก เป็นอันดับ 2 ของ มะเร็งระบบอวัยวะสืบพันธุ์สตรีพบ ได้มากในช่วงอายุ 40-60 ปีในเด็กก่อนหรือหลังวัย 10 ปีก็อาจพบได้
สาเหตุ
ยังไม่ทราบแน่ ชัด แต่พบเหตุส่งเสริม ที่ทำให้เกิดมะเร็งรังไข่ ดังนี้ คือ
1.สภาพแวดล้อม เช่น สารเคมี อาหาร เนื่องจากพบว่าในประเทศ อุตสาหกรรมมีผู้ป่วยเป็น มะเร็งรังไข่มากกว่าประเทศเกษตรกรรม
2.สตรีที่ไม่ มีบุตร หรือมีบุตรน้อย
3.ผู้ที่เคย เป็นมะเร็งที่เต้านม มะเร็ง มดลูก และมะเร็งระบบทางเดิน อาหาร โอกาสเป็น มะเร็งรังไข่มี มากกว่าคนปกติ
อาการ
1. อาจไม่มีอาการ แพทย์ตรวจพบโดยบังเอิญ
2. มีอาการท้องอืดเป็นประจำ
3. มีก้อนในท้องน้อย
4. ปวด แน่นท้อง และถ้าก้อนมะเร็งโตมากจะกด กระเพาะปัสสาวะหรือลำไส้ส่วนปลาย ทำให้ ถ่ายปัสสาวะหรืออุจจาระลำบาก
5. ในระยะท้ายๆอาจมีน้ำในช่องท้องทำให้ท้องโต ขึ้นกว่าเดิม เบื่ออาหาร ผอมแห้ง น้ำหนักลด
การวินิจฉัย
1. การตรวจภายในอาจคลำพบก้อนใน บริเวณท้องน้อย การคลำพบก้อนรังไข่ได้ในสตรีวัย หมดประจำเดือน ควรนึกถึงมะเร็งของรังไข่ไว้ด้วย (เพราะตามปกติวัยหมดประจำเดือน รังไข่จะฝ่อ)
2. การทำแพพสเมียร์จากในช่องคลอด ส่วนบนทางด้านหลัง อาจพบเซลล์มะเร็งของรังไข่ ได้
3.การตรวจด้วย เครื่องความถี่สูงอาจช่วยบอกได้ว่ามีก้อน ในท้อง ในรายที่อ้วนหรือหน้าท้อง หนามาก คลำด้วยมือตาม ปกติตรวจไม่พบ
4. การผ่าตัดเปิดช่องท้อง และตรวจดู เป็นวิธีที่สำคัญ และแม่นยำที่สุดในการวินิจฉัยโรค อย่างแน่นอนสามารถ ขลิบหรือตัดเอาเนื้อมาตรวจหาชนิดของมะเร็ง และทราบถึงระยะ ของโรค ด้วย
การรักษา
การผ่าตัดเป็นวิธีแรกที่แพทย์จะเลือกทำการ รักษา ถ้าไม่สามารถตัดออกได้หมดเนื่องจาก โรคกระจายออกไปมากแล้ว แพทย์จะพยายาม ตัดออกให้ได้มากที่สุดเท่าที่จะทำได้ แล้วจะให้ การรักษาต่อด้วยเคมีบำบัด หรือรังสีบำบัด
การป้องกัน
เนื่องจาก มะเร็งรังไข่ในระยะแรก ๆ มักจะไม่มีอาการ อีกทั้งยังไม่ทราบสาเหตุที่ แท้จริง การป้องกันจึงทำได้ยาก ดังนั้นวิธีที่ดีที่สุดคือ รับการตรวจภายในหรือตรวจด้วยคลื่นความ ถี่สูง โดยแพทย์อย่างน้อยปีละครั้ง
ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์ ประกาศรับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ LINK
ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์
ประกาศรับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ
1. ตำแหน่ง พนักงานช่วยงานด้านสาธารณสุข (ช่วยงานอนามัยโรงเรียน)
(วุฒิการศึกษา ปวช. / ปวส. ทุกสาขา) 1 อัตรา
สามารถสมัครด้วยตนเอง หรือสมัครทาง E-mail
ดาวน์โหลดใบสมัคร https://webportal.bangkok.go.th/.../0000.../register/OUT.pdf
ส่งใบสมัครและเอกสารหลักฐานมายังช่องทางต่อไปนี้
1. ยื่นใบสมัครด้วยตนเองที่ ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์ 663 ถนนสาธุประดิษฐ์ ( ซอย 55-57 ) แขวงบางโพงพาง เขตยานนาวา กรุงเทพมหานคร ในวันและเวลาราชการ
2. ส่งทาง E-mail : healthcentre_7@hotmail.com
สอบถามข้อมูลเพิ่มเติมได้ที่ 02 2842331 ต่อ 100
5. บ่อน้ำพุร้อนไลท์ไลน์
แนวคิด :เพื่อเฉลิมฉลองความมหัศจรรย์ของธรรมชาติและสำนึกในพระมหากรุณาธิคุณ
เทคนิค :สร้างความรู้สึกแปลกใหม่ด้วยแสงไฟและฉายภาพเล่าเรื่องด้วยแสงเลเซอร์
3. ตึกแดง (ตึกพัสดุ การรถไฟแห่งประเทศไทย)
ตึกแดง (ตึกพัสดุ การรถไฟแห่งประเทศไทย) เป็นชื่อเรียกของ อาคารพัสดุยศเส ตั้งอยู่ติดกับสะพานยศเส ริมคลองผดุงกรุงเกษม สันนิฐานว่าก่อสร้างขึ้นในปี 2453 ซึ่งเป็นช่วงเวลาใกล้เคียงกับการสร้างอาคารสถานีกรุงเทพ สร้างขึ้นเพื่อใช้เก็บพัสดุจากการสร้างอุโมงค์ขุนตาน และการก่อสร้างทางรถไฟสายใต้ ปัจจุบันเป็นสถานที่ทำงานของฝ่าย และสำนักงานของการรถไฟฯ
อีสานไปไสกะแซ่บ
อีสานไปไสกะแซ่บ ️
ยกความแซ่บ มาไว้ที่งาน #เทศกาลเที่ยวเมืองไทยครั้งที่41
แล้วไปสนุกกับ ไห…ไฮเทค
ม่วนซื่นกับการแสดง street performance
พร้อมแซ่บ 20 จานดัง
20 จานแซ่บ
10 นวัตกรรมอาหารอีสาน
20 Arts & Crafts
มางานนี้มีแต่ความแซ่บบบบ
ศูนย์การประชุมแห่งชาติสิริกิติ์
️2-6 สิงหาคมนี้ เท่านั้น
โปรแกรมตรวจสุขภาพวันแม่@รพ.พญาไท
โปรแกรมตรวจสุขภาพวันแม่ ราคาเริ่มต้น 4,290 – 5,990 บาท
1. โปรแกรมตรวจสุขภาพ Happy MOM 1 ราคา 4,290 บาท
2. โปรแกรมตรวจสุขภาพ Happy MOM 2 ราคา 4,990 บาท
3. โปรแกรมตรวจสุขภาพ Happy MOM 3 ราคา 5,990 บาท
เริ่มขายวันที่ 7 – 14 สิงหาคม 2566
สอบถามข้อมูลเพิ่มเติมได้ที่
038-317-333
1772
1965
ในวันพุธที่ 10 พฤศจิกายน ค.ศ. 1965 พระบาทสมเด็จพระเจ้าอยู่หัว เสด็จพระราชดำเนินทรงเปิดตึกคนไข้ในของโรงพยาบาล ซึ่งต่อมาภายหลัง ในปี ค.ศ.1987 ได้ตั้งชื่อว่า "อาคารประสงค์ชัยรัตน์" เพื่อเป็นที่ระลึกถึง อาจารย์นายแพทย์ประสงค์ ชัยรัตน์ ผู้อำนวยการโรงพยาบาลท่านที่สอง
กลุ่มเด็กโตและวัยรุ่นอายุ 6 - 24 ปี
กลุ่มเด็กโตและวัยรุ่นอายุ 6 - 24 ปี
- ฉีดวัคซีนคอตีบ บาดทะยัก
- ฉีดวัคซีนเอชพีวีป้องกันมะเร็งปากมดลูก (สำหรับนักเรียนหญิง ป.5)
- ชั่งน้ำหนักวัดส่วนสูงเพื่อติดตามการเจริญเติบโต
- ตรวจเลือด คัดกรองภาวะซีด เอชไอวี
- ตรวจวัดความดันโลหิต
- ตรวจคัดกรองสายตาและการได้ยิน
- คัดกรองความเสี่ยงจากการสูบบุหรี่/สุรา/สารเสพติด
- ตรวจคัดกรองวัณโรค
- ตรวจช่องปากและฟัน เคลือบฟลูออไรด์และหลุมร่องฟัน
- การให้ยาบำรุงเสริมธาตุเหล็กและโฟลิก
- แว่นตาหากมีภาวะสายตาผิดปกติ (สำหรับอายุ 6-12 ปี หรือนักเรียน ป.1-ป.6)
- การป้องกันและแก้ไขการตั้งครรภ์ในวัยรุ่นและการตั้งครรภ์ไม่พึงประสงค์ การคุมกำเนิด
- การให้คำปรึกษาแนะนำการป้องกันเอชไอวีหลังสัมผัส
รางวัลรองชนะเลิศอันดับ 2 คุณกิตติธัช โพธิวิจิตร
ABC Cooking Studio เปิดหลักสูตร ขนมหลายแบบ LINK
ABC Cooking Studio สตูดิโอสอนทำอาหาร เค้ก และขนมปังในรูปแบบโฮมเมด ดั้งเดิมจากประเทศญี่ปุ่น เปิดหลักสูตร ขนม 3 แบบหลัก
Bread Course ขนมปังโฮมเมด แบบ Basic Course และ Master Course (แต่ละเดือนเรียนไม่เหมือนกันนะ) การเรียนคอร์สขนมปัง ซึ่งคอร์สพื้นฐานจะเริ่มจากการลงเรียนตั้งแต่ 8 ครั้ง 16 ครั้ง และ 24 ครั้ง สมาชิกผู้ที่จบคอร์สเรียนจำนวน 24 ครั้ง จะสามารถเรียนหลักสูตรขั้นสูงต่อได้ ค่าเรียนเริ่มต้น Basic Course หมื่นนิดๆ
Cake Course เรียนรู้การทำขนมแบบโฮมเมด เพื่อมอบเป็นของขวัญพิเศษ สำหรับเพื่อนและคนรักของคุณ แบบ Basic Course เรียนรู้เทคนิคการอบขนมขั้นพื้นฐานให้เสร็จสมบูรณ์ภายใน 2 ชม. และ Master Course นำเทคนิคและความรู้ที่ได้รับจากคอร์สพื้นฐานมาปรับใช้ และเรียนรู้เทคนิคใหม่ๆในคอร์สขั้นสูงที่จะทำให้คุณกลายเป็นผู้เชี่ยวชาญในการอบขนม ค่าเรียนเริ่มต้น Basic Course 9 พันกว่าๆ
Wagashi Course เรียนรู้วัฒนธรรมของขนมวากาชิ ซึ่งจะได้เรียนรู้ถึงประวัติและต้นกำเนิดของขนมวากาชิ อีกทั้งยังเรียนรู้เทคนิคของขั้นตอนการปั้น การห่อ การนึ่ง และการเรียนรู้ถึงวัตถุดิบส่วนผสมต่างๆ เพื่อสรรสร้างขนมสไตล์ญี่ปุ่นที่มีความละเอียดอ่อนในการทำ เรียน 6 ชนิด (6 เดือน) Nerikiri ขนมเนริกิริ Kingyoku and Minazuki ขนมมินะซึคิ Sakura Mochi เมนู ซากุระโมจิ Daifuku เมนูไดฟูกุ Mizuyokan and Wakaayu ขนมวากายู Matcha Roll โรลชาเขียวมัทฉะ ค่าเรียน 11,700 บาท
โทรสอบถาม 02-646-1910
คุณสมคิด ธนาพรพานิชย์กุลและภรรยา ร่วมบริจาคเงินจำนวน 60,000 บาท
ขอขอบคุณ คุณสมคิด ธนาพรพานิชย์กุลและภรรยา อดีตที่ปรึกษากรรมาธิการ การกฎหมาย การยุติธรรมสิทธิมนุษยชน บริจาคเงินจำนวน 60,000 บาท สมทบทุนคอนเสิร์ตการกุศล "เพลงเพื่อลมหายใจ #3 Song of Life " เพื่อสร้างตึกผู้ป่วยในสำหรับเด็กแรกเกิด ผู้ป่วยโรคเลือดและผู้ป่วยมะเร็งโรงพยาบาลเด็กสรรพสิทธิประสงค์
ทีม M 3 บิ๋มและแหวน ทีม Speed Music Hall
ร่วมโหวต ให้ทีม M 3 บิ๋มและแหวน ทีม Speed Music Hall เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า
ผู้ที่สนใจสามารถร่วมบริจาคโลหิตได้ที่ศูนย์บริจาคโลหิตเคลื่อนที่ บริเวณพื้นที่ชั้น 3 ประตู 1 Express zone สถานีแอร์พอร์ต เรล ลิงก์ มักกะสันในวันที่ 21 ส.ค. และ 18 ก.ย. 2566 เวลา 11.00-19.00 น. ติดตามข่าวสารและกิจกรรมและกิจกรรมที่น่าสนในจากแอร์พอร์ต เรล ลิงก์ ได้ที่ ได้ที่ เฟซบุ๊ค @AirportRailLink
นอกจากนี้ การนำโมเดลการดูแลผู้ป่วยแบบใหม่มาประยุกต์ใช้ กว่าครึ่ง (58%) ของผู้บริหารแถวหน้าในวงการเฮลท์แคร์และบุคลากรทางการแพทย์รุ่นใหม่ในภูมิภาคเอเชีย-แปซิฟิก เห็นตรงกันว่าจำเป็นต้องมีการฝึกอบรมบุคลากรให้มีทักษะที่จำเป็น โดยเกือบหนึ่งในสามของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ ระบุว่าทักษะในการอ่านและแปลข้อมูล (29%) ความสมัครใจของบุคลากรที่จะประยุกต์ใช้เทคโนโลยีใหม่ๆ (29%) ทั้งสองเป็นปัจจัยสู่ความสำเร็จในการนำโมเดลการดูแลผู้ป่วยแบบใหม่มาใช้ ในขณะที่ 44% ของบุคลากรทางการแพทย์รุ่นใหม่ยอมรับว่าพวกเขาต้องการการฝึกอบรมเพิ่มเติมทางด้านเทคโนโลยีสมัยใหม่เพื่อช่วยในการตรวจวินิจฉัย (41%) และเพื่อช่วยลดภาระงาน (40%) ซึ่งถือเป็นเหตุผลสำคัญในการผลักดันให้บุคลากรทางการแพทย์ดูแลผู้ป่วยได้ดีขึ้นด้วย
ข้อมูลส่งเข้าศูนย์บัญชาการ
ส่วนที่ว่าคนไทยบินไปทำศัลยกรรมความงามที่ต่างประเทศกันเยอะก็จริง แต่ในทางกลับกันก็มีคนต่างประเทศจำนวนไม่น้อยมาทำศัลยกรรมความงามที่ไทยเรา โดยมีสัดส่วนเพิ่มขึ้นเฉลี่ยถึง 20% โดยเฉพาะการทำศัลยกรรมที่โรงพยาบาลบางมดในปีที่ผ่านๆ มา เราพบว่ามีสถิติหรือจำนวนผู้เข้ารับบริการศัลยกรรมความงามเฉลี่ยแล้วมากกว่า 3,800 รายต่อปี เนื่องจากเรามีเทคโนโลยีด้านการผ่าตัดทัดเทียมกับนานาชาติ อย่างในการประชุมระดับโลกที่เกี่ยวกับศัลยกรรมความงาม ศัลยแพทย์จากประเทศไทยรวมถึงผมเองก็ได้รับเชิญให้เป็น Speaker แลกเปลี่ยนความรู้ ซึ่งในฐานะศัลยแพทย์ความงาม ผมเองก็เชื่อมั่นว่าฝีมือแพทย์ไทย เทคนิคต่างๆ ประเทศไทยไม่เป็นรองประเทศไหน
สำหรับเรื่องเทคนิคใหม่ในปีนี้ปีหน้าจะมีอะไรพิเศษบ้าง ผมบอกได้เลยว่าคือเรื่องการดึงหน้า Modern facelift 2023 เทคนิคใหม่นี้ได้รับการพัฒนามาจากการศัลยกรรมดึงหน้าแบบเดิมจากคนไข้หลายหมื่นรายของศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด โดยเราค้นพบแล้วว่าการผ่าตัดดึงหน้าในชั้นกล้ามเนื้อระดับ SMAS ได้ผลลัพธ์ที่ดี จึงมีการเพิ่มเทคนิคการเย็บที่ชั้น SMAS มากขึ้น ถึง 3 เทคนิค (Triple SMAS techniques) ทำให้ผลลัพธ์ของการดึงหน้าดูเป็นธรรมชาติมากขึ้น มีปรับตามโครงสร้างร่างกายและปรับตามความหย่อนคล้อยของแต่ละบุคคลได้มากยิ่งขึ้นและผลลัพธ์ยาวนานขึ้น นอกจากนี้ยังมีการผสมผสาน การฉีดไขมันของตัวเอง (Fat Grafting) ผสานสารสกัดพลาสม่า (PRP) ทั่วใบหน้าด้วยเทคนิคบางมดซึ่งสามารถทำร่วมกันในการผ่าตัดครั้งเดียวได้จึงช่วยเติมเต็มร่องและริ้วรอยต่างๆ ให้ตื้นลง นอกจากนี้ยังมีการเสริมหน้าอกเทคนิคใหม่ ขนาดหน้าอกที่เป็นธรรมชาติโดยศูนย์ศัลยกรรมความงามโรงพยาบาลบางมด ได้คิดค้นเทคนิคพิเศษสำหรับการเสริมหน้าอกชื่อว่า Modern Breast 2023 เป็นการเสริมหน้าอกแบบเฉพาะด้วยเทคนิค Triple Plane ร่วมกับเทคนิคส่องกล้อง (Endoscopic Assisted) ผลลัพธ์หลังทำให้การเสริมหน้าอกมีความเป็นธรรมชาติมากขึ้น เป็นต้น”
ตรวจไม่พบ ทริเทียมในปลาที่จับได้นอกชายฝั่งของโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะไดอิจิ LINK
สำนักงานประมงของญี่ปุ่นระบุว่า ระดับของทริเทียมในปลาที่จับได้นอกชายฝั่งที่ตั้งของโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะไดอิจิที่เสียหาย อยู่ในระดับต่ำเกินกว่าจะตรวจพบได้ หลังผู้ประกอบการโรงไฟฟ้าแห่งนี้เริ่มปล่อยน้ำที่ผ่านการบำบัดและเจือจางแล้วจากโรงไฟฟ้าดังกล่าวลงสู่มหาสมุทร
ทางสำนักงานดำเนินการตรวจสอบสารกัมมันตรังสีตามปกติในผลิตภัณฑ์ประมงจากจังหวัดฟูกูชิมะและจังหวัดข้างเคียง นับตั้งแต่เกิดอุบัติเหตุนิวเคลียร์ที่โรงไฟฟ้าดังกล่าว
เจ้าหน้าที่มีแผนสุ่มตรวจระดับของทริเทียมในปลาที่จับได้ในน่านน้ำภายในระยะ 10 กิโลเมตรจากโรงไฟฟ้าเป็นประจำทุกวันต่อเนื่องประมาณหนึ่งเดือน หลังจากที่เริ่มปล่อยน้ำเมื่อวันพฤหัสบดีที่ 24 สิงหาคม โดยจะเผยแพร่ผลที่ได้ในหนึ่งหรือสองวันต่อมา
ในวันเสาร์ที่ 26 สิงหาคม สำนักงานประมงของญี่ปุ่นได้เผยแพร่ผลการวิเคราะห์ครั้งแรก หลังจากตรวจสอบปลาฮิราเมะและปลาโฮโบที่จับได้เมื่อวันก่อนหน้า
ผลที่ได้แสดงให้เห็นว่าระดับทริเทียมในปลาดังกล่าว “ไม่สามารถตรวจพบได้” เนื่องจากน้อยกว่าประมาณ 10 เบ็กเคอเรลต่อกิโลกรัม ซึ่งเป็นระดับน้อยที่สุดที่รัฐบาลระบุว่าสามารถตรวจพบได้ในการตรวจสอบ
ทางสำนักงานยังมีแผนที่จะวิเคราะห์ปลาที่จับได้ในพื้นที่ที่กินวงกว้างกว่าเดิม โดยพยายามพิสูจน์ความปลอดภัยของผลิตภัณฑ์ทางทะเลของญี่ปุ่น
โรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะไดอิจิประสบการหลอมละลายสามครั้งในเหตุแผ่นดินไหวและสึนามิเมื่อปี 2554 นับจากนั้นมา น้ำที่ใช้เพื่อหล่อเย็นแท่งเชื้อเพลิงนิวเคลียร์ผสมเข้ากับน้ำฝนและน้ำใต้ดิน และค่อย ๆ ซึมเข้าไปในอาคารเตาปฏิกรณ์นิวเคลียร์ที่เสียหาย
น้ำดังกล่าวผ่านการบำบัดเพื่อขจัดสารกัมมันตรังสีส่วนใหญ่ออกไปแล้ว แต่ยังเหลือทริเทียมอยู่ ก่อนจะปล่อยน้ำ ผู้ประกอบการโรงไฟฟ้าได้เจือจางเพื่อลดระดับของทริเทียมให้อยู่ที่ประมาณหนึ่งในเจ็ดของแนวทางสำหรับน้ำดื่มที่กำหนดโดยองค์การอนามัยโลก
หลวงพ่อสัมฤทธิ์
ประวัติหลวงพ่อสัมฤทธิ์ (#พระพุทธสัมฤทธิ์ประสิทธโชค)เป็นพระพุทธรูปสมัยสุโขทัยปางมารวิชัย(สะดุ้งมาร) องค์พระลงรักปิดทองคำทั้งองค์ หน้าตักกว้าง 73 นิ้ว ลืมพระเนตร
ในตำนานกล่าวไว้ว่าพระมหาธรรมราชาที่4 พระมหากษัตริย์ผู้ปกครองเมืองสุโขทัยเป็นผู้สร้างขึ้น เพื่อเป็นพุทธบูชาในยุคนั้น ราวปี พ.ศ.1979
ครั้นมื่อเกิดศึกสงครามได้ถูกนำล่องแพขนาบกับไม้ไผ่มาตามแม่น้ำยมลงมาสู่แม่น้ำเจ้าพระยา
เมื่อล่องแพมาถึงท้องคุ้งคลองบางกอกน้อยเพลาใกล้พลบค่ำเกิดความมหัศจรรย์ฟ้าร้องคำรามรอบทิศทาง ท้องฟ้าแผ่สว่างไปด้วยประกายสีทอง และแพก็หยุดนิ่งไม่เคลื่อนไปข้างหน้า แม่ทัพนายกองและสมุนไพล่พลต่างตกตะลึงทำอะไรกันไม่ถูก
ทุกคนจึงหยุดพักแรมที่ริมฝั่งคลองบางกอกน้อย เมื่อเดินขึ้นฝั่งเพื่อพักผ่อน จึงได้พบพระธุดงธ์ปักกรดอยู่ที่ป่าโคนไม้ แม่ทัพนายกองจึงได้สนทนาธรรมเกิดความศรัทธา จึงนำหลวงพ่อสัมฤทธิ์ขึ้นจากแพประดิษฐานที่ใต้ต้นไม้โดยห่างจากชายฝั่งคลอง 28 ก้าวเท้า
ต่อมาในยุครัตนโกสินทร์ ครั้งเมื่อเกิดสงครามเก้าทัพ ปี พ.ศ.2328 แม่ทัพนายกองมาทำพิธีบวงสรวงต่อหน้าหลวงพ่อสัมฤทธิ์และวางแผนขุมกำลังในการสู้รบครานั้น พม่ายกทัพมา 9 ทัพ 5 ทาง เป็นสงครามครั้งแรก ระหว่างราชวงศ์โก้นบองของพม่ากับอาณาจักรรัตนโกสินทร์แห่งราชวงศ์จักรี พระเจ้าปดุงแห่งพม่ามีความทะเยอทะยานที่จะขยายพระราชอำนาจของพระองค์เข้ามาในสยาม แต่ก็ได้รับความปราชัยต่อ พระบาทสมเด็จพระพุทธยอดฟ้าจุฬาโลกมหาราช (รัชกาลที่ 1) หลังจากนั้นพระองค์จึงมีรับสั่งให้เจ้าพระยารัตนาพิพิธมาบูรณะวัดไก่เตี้ย ด้วยความศรัทธาในชัยชนะคราวนั้น
พระอาจารย์โชคดี วัดไก่เตี้ย ตลิ่งชันโรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ หนองโพ
121 ม.8 ต.บ้านเลือก อ.โพธาราม จ.ราชบุรี 70120
โทรศัพท์ : 032-389182, 032-389046 โทรสาร : 032-389295
บริการ
เวลาในการให้บริการฝ่ายสัตว์เลี้ยง เปิดบริการทุกวัน ตั้งแต่เวลา 08.30 – 19.30 น. ยกเว้นวันศุกร์หยุดให้บริการเวลา 11.30 – 16.30 น.
เวลาให้บริการฝ่ายสัตว์ใหญ่ วันจันทร์-วันศุกร์ ตั้งแต่เวลา 08.30-16.30 น. วันเสาร์-วันอาทิตย์ และวันหยุดนักขัตฤกษ์ ตั้งแต่เวลา 08.30 - 16.30 น.
คลินิกพิเศษ โรงพยาบาลสัตว์ มก.หนองโพ 13.00 น. - 16.00 น.
จันทร์ คลินิกพิเศษระบบประสาท
อังคาร คลินิกพิเศษโรคผิวหนัง
พุธ คลินิกพิเศษสัตว์เลี้ยงชนิดพิเศษ,คลินิกพิเศษโรคแมว
พฤหัสบดี คลินิกพิเศษโรคหัวใจ
Facebook |
Website |
แผนที่
นายวุฒิพงษ์ วงษ์ชัยวัฒนกุล ผู้จัดการโครงการ After School Program


นายวุฒิพงษ์ วงษ์ชัยวัฒนกุล หรือคุณแบงค์ ผู้จัดการโครงการ After School Program ภายใต้ Saturday School Foundation กล่าวถึงการขับเคลื่อนโครงการฯ ว่า “ความตั้งใจของมูลนิธิคืออยากให้คนทั่วไปเข้ามามีส่วนร่วมเพื่อขยายโอกาสในระบบการศึกษาไปด้วยกัน โดยนอกจากวิชาพื้นฐานอย่างคณิตศาสตร์ ภาษาอังกฤษ แล้ว เรายังเปิดสอนวิชาอื่นๆ อย่าง ภาษาญี่ปุ่น การเขียนโปรแกรม ดนตรี และสะเต็มศึกษา (STEM) อีกด้วย โดยหลังจากผ่านการคัดเลือก อาสาสมัครทุกคนต้องเข้าอบรมก่อน ซึ่งเราเน้นการเรียนการสอนแบบ Active Learning คือให้เด็กๆ เรียนรู้ผ่านการมี ส่วนร่วมในห้องเรียน เช่น การเรียนผ่านเกมการ์ด ผ่านการจำลองสถานการณ์ เป็นต้น ระหว่างอบรมครูอาสา เราเน้นเสมอว่าอยากให้ห้องเรียนเป็น Sandbox คือเป็นกระบะทรายให้เด็กๆ ลองผิดลองถูกได้ และไม่มีเด็กคนไหนที่ทำสิ่งใดไม่ได้เช่นกัน ในระยะยาว เราอยากเดินทางไปถึงความสำเร็จในการปลดล็อคโมเดลดังกล่าวให้โรงเรียนหรือชุมชนสามารถตั้งกลุ่มดำเนินการรับสมัครครูอาสาได้เองโดยไม่จำเป็นต้องผ่านตัวกลาง เพื่อให้ต่อไปใครที่อยากเข้าร่วมก็สามารถเชิญชวนกันเข้าไปได้ ซึ่งถือเป็นการขยายโอกาสของพื้นที่การศึกษาตามความตั้งใจแรกเริ่มของเรา”
จึงนับได้ว่า โครงการอาสาจุฬาภรณ์ เป็นโครงการที่จะเกิดประโยชน์อย่างยิ่งในการวางรากฐานให้ประชาชนในเขตชุมชนเมืองได้มีส่วนร่วมในการดูแลสุขภาพของตนเองและชุมชน ทั้งในด้านการป้องกันโรค และการดูแลรักษาสุขภาพเบื้องต้น ภายใต้การดูแลและให้คำแนะนำอย่างใกล้ชิดจากคณาจารย์และบุคลากรของราชวิทยาลัยจุฬาภรณ์ ทั้งนี้ เพื่อให้ประชาชนได้มีสุขภาพที่ดี สมดังพระปณิธานใน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี องค์ประธานราชวิทยาลัยจุฬาภรณ์ ที่ทรงจัดตั้งราชวิทยาลัยจุฬาภรณ์ขึ้น เพื่อความเป็นเลิศเพื่อทุกชีวิต (Be excellent for lives)
วิธีจับโป๊ะ เพจปลอมหลอกลงทุน
วิธีจับโป๊ะ เพจปลอมหลอกลงทุน
4 ข้อสังเกต เน้นๆ
1. ดูยอด Like
เพจจริงมักจะมีคน Like เยอะ แต่เพจปลอม คน Like น้อย แค่หลักสิบหลักร้อย
2. ดู URL
เพจปลอมมักจะมี URL แปลกๆ
3. สังเกตหน้า About
หน้า About ของเพจจริงมีรายละเอียดเกี่ยวกับธุรกิจและข้อมูลติดต่อชัดเจน
4. เครื่องหมายรับรองตัวตน
หรือ Verified Badge เป็นวงกลมสีน้ำเงิน เพจจริงส่วนใหญ่มี แต่เพจปลอม จะไม่มี
บทความ เห็ดขี้ควาย โดย ศ.นพ.ธีระวัฒน์ เหมะจุฑา
ศ.นพ.ธีระวัฒน์ เหมะจุฑา ได้เขียนถึงเห็ดขี้ควายไว้หลายบทความ น่าสนใจ ที่ Healthserv นำมาเผยแพร่ไว้ อาทิ
เกษมราษฎร์ อินเตอร์เนชั่นแนล รัตนาธิเบศร์ วัคซีนป้องกันไข้เลือดออก 4 สายพันธุ์
วัคซีนป้องกันไข้เลือดออก 4 สายพันธุ์
- ฉีดได้ทั้งคนที่เคยเป็นและไม่เคยเป็น
- ไม่ต้องตรวจภูมิ สามารถฉีดได้เลย
- สามารถป้องกันเชื้อไข้เลือดออกได้ทั้ง 4 สายพันธุ์
- ประสิทธิภาพการป้องกันการติดเชื้อ 80.2%
- ลดการนอนโรงพยาบาล : 90.4%
- ฉีดได้ตั้งแต่ อายุ 4 ปี - 60 ปี
ฉีด 2 เข็ม ห่างกัน 3 เดือน
ราคา 4,500 บาท
*ราคานี้ไม่รวมค่าแพทย์
*ราคานี้รวมค่าบริการโรงพยาบาลแล้ว
สนใจสอบถามข้อมูลเพิ่มเติมได้ที่
แผนกตรวจสุขภาพ 02-594-0020-65 ต่อ 1276, 1277
และแผนกกุมารเวช 02-594-0020-65 ต่อ 1310, 1311
โปรเด็ดๆ สำหรับเดือน 7 วัคซีนไข้หวัดใหญ่ รพ.บางโพ
โปรเด็ดๆ สำหรับเดือน 7 วัคซีนไข้หวัดใหญ่
โปรโมชั่น สุดพิเศษ
1. วัคซีนไข้หวัดใหญ่ HIGH DOSE สำหรับอายุ 65 ปีขึ้นไป
- สำหรับ 1 ท่าน 2,500 บาท
- สำหรับ 2 ท่าน 4,777 บาท
(รวมค่าแพทย์และค่าบริการ)
2 วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์
- สำหรับ 1 ท่าน 777 บาท
- สำหรับ 4 ท่านขึ้นไป ท่านละ 700 บาท (มาพร้อมกัน)
- ให้บริการฉีดวัคซีนที่บ้าน ราคาท่านละ 700.-
10 ท่านขึ้นไป ระยะทางไม่เกิน 10 กม.
(รวมค่าแพทย์และค่าบริการ)
ปรึกษาปัญหาสุขภาพ / ฉีดวัคซีน
โทร 02-5870144 ต่อ 2200 คลินิกอายุรกรรม
ขณะนี้มูลนิธิฯ ดำเนินงานหน่วยทำหมันสัตว์เคลื่อนที่ทั้งสิ้น 15 หน่วยในกรุงเทพฯ และปริมณฑลและจังหวัดในภาคใต้ รวมถึงห้องทำหมันในศูนย์พักพิงที่ภูเก็ตและกรุงเทพฯ มูลนิธิเพื่อสุนัขในซอยยังยินดีให้คำปรึกษาและแนะนำการจัดการสุนัขตามแนวทาง CNVR แก่หน่วยงานหรือองค์กรที่สนใจโดยไม่มีค่าใช้จ่าย
ทั้งนี้สามารถติดตามการทำงานของมูลนิธิเพื่อสุนัขในซอยได้ที่ www.soidog.org/th และเฟสบุ๊ค มูลนิธิเพื่อสุนัขในซอย ประเทศไทย และบริจาคสนับสนุนโครงการทำหมันของมูลนิธิเพื่อสุนัขในซอยได้ที่ ชื่อบัญชี: มูลนิธิเพื่อสุนัขในซอย (Soi Dog Foundation) เลขที่บัญชี: 573-0-47456-5 ธนาคารกรุงเทพ (BBL)
โปรแกรมวัคซีนป้องกันมะเร็งปากมดลูก รพ.เปาโล เกษตร
โปรแกรมวัคซีนป้องกันมะเร็งปากมดลูก เกณฑ์ในการฉีดวัคซีนจะแบ่งตามช่วงอายุ คือ อายุ 9-14 ปี ต้องฉีด 2 เข็ม และอายุ 15 ปี ขึ้นไป ฉีด 3 เข็ม โดยวัคซีนจะมีประสิทธิภาพในการป้องกันการติดเชื้อ HPV สายพันธุ์ที่บรรจุในวัคซีน ได้มากกว่า 90% ทั้งนี้ควรปรึกษาสูตินรีแพทย์ เพื่อเลือกชนิดและช่วงเวลาที่เหมาะสมในการรับวัคซีน วัคซีนป้องกันมะเร็งปากมดลูก 4 สายพันธุ์ (อายุ 9-14 ปี) HPV vaccine Gardasil 2 เข็ม 6,000 .- วัคซีนป้องกันมะเร็งปากมดลูก 4 สายพันธุ์ (อายุ 15 ปีขึ้นไป) HPV vaccine Gardasil 3 เข็ม 8,990 .- วัคซีนป้องกันมะเร็งปากมดลูก 9 สายพันธุ์ (อายุ 9-14 ปี) HPV vaccine Gardasil 2 เข็ม 14,500 .- วัคซีนป้องกันมะเร็งปากมดลูก 9 สายพันธุ์ (อายุ 15 ปีขึ้นไป) HPV vaccine Gardasil 3 เข็ม 21,500 .-
วันนี้ - 31 ธันวาคม 2566 สามารถเข้ารับบริการได้ภายใน 31 ธันวาคม 2566
*เงื่อนไขการให้บริการ เป็นไปตามโรงพยาบาลกำหนด
สอบถามรายละเอียดข้อมูลเพิ่มเติม แผนกสูตินรีเวช โรงพยาบาลเปาโล เกษตร โทร. 02 1500 900 ต่อ 5420
วัคซีนป้องกัน โรค มือ เท้า ปาก โรงพยาบาลเด็กสินแพทย์
วัคซีนที่ป้องกันโรคนี้แบบเฉพาะเจาะจงต่อเชื้อเอนเทอโรไวรัส 71 ที่เป็นเชื้อที่ทำให้เกิดอาการรุนแรง โดยเฉพาะภาวะสมองอักเสบได้ แต่ยังไม่สามารถใช้เพื่อป้องกันโรคมือเท้าปากที่มีสาเหตุมาจากเชื้อเอนเทอโรไวรัสชนิดอื่น หรือเชื้อค็อกแซกกี้ไวรัสอื่นๆได้ วัคซีนชนิดนี้มีความปลอดภัย เนื่องจากผ่านการศึกษาและมีการใช้มาแล้วกว่า 48 ล้านโดสในต่างประเทศ ไม่พบอาการข้างเคียงที่รุนแรง พบเพียงอาการไข้ ท้องเสีย หรือเบื่ออาหาร ฯลฯ ซึ่งเป็นอาการที่พบได้ปกติเหมือนการฉีดวัคซีนทั่วไป วัคซีนชนิดนี้ใช้สำหรับเด็กอายุ 6 เดือน ถึง 5 ปี ฉีดเข้ากล้ามเนื้อ 2 เข็ม ห่างกัน 1 เดือน
วัคซีนป้องกันโรคมือเท้าปาก ชนิดรุนแรง จากเชื้ออีวี 71 เหมาะกับ
เด็กอายุ 6 เดือน ถึงน้อยกว่า 6 ปี
ฉีดเข้ากล้ามเนื้อ 2 เข็ม ห่างกัน 1 เดือน
แพ็คเกจวัคซีนป้องกันมะเร็งปากมดลูก(HPV Vaccine) โรงพยาบาลธนบุรี
แพ็คเกจวัคซีนป้องกันมะเร็งปากมดลูก(HPV Vaccine) โรงพยาบาลธนบุรี
แพ็คเกจ HPV Vaccine Gardasil 9 (ไม่รวมค่าแพทย์และค่าบริการ)
3 เข็ม ราคา 21,000 บาท
2 เข็ม ราคา 13,900 บาท สำหรับอายุ 9-14 ปี
แพ็คเกจ HPV Vaccine Gardasil 4 (ไม่รวมค่าแพทย์และค่าบริการ)
3 เข็ม ราคา 9,700 บาท
2 เข็ม ราคา 6,400 บาท สำหรับอายุ 9-14 ปี
ติดต่อศูนย์สูติ-นรีเวช ทุกวัน 08:00 - 19:00 โทร 1645 กด 1 ต่อ 7970-1
สอบถามโทร 02-4872000
บริการตรวจหาเชื้อโควิด-19
คลินิคเฉพาะทางศัลยกรรม นอกเวลาราชการ
คลินิคเฉพาะทางศัลยกรรม นอกเวลาราชการ รพ. กระทุ่มแบน เปิดให้บริการแล้ว
ทุกวันจันทร์ พุธ พฤหัส และวันอังคารที่ 1 และ 3 เวลา 16.30-20.00น.
ค่ายาและและค่าแลป ค่าเอกซเรย์ เบิกฟรีได้ตามสิทธิรักษา
มีค่าบริการทางการแพทย์ เริ่มต้นครั้งละ 400 บาท
พบแพทย์ผู้เชี่ยวชาญ ไม่แออัด ไม่รอนาน เวลาสะดวก
ติดต่อสอบถามหรือนัดล่วงหน้าที่ โทร 086-3254509 หรือ แสกน QR line ตามรูป
สำนักงานป้องกันควบคุมโรคที่ 3 จังหวัดนครสวรรค์
516/66 หมู่ 10 ตำบลนครสวรรค์ตก
ผลงานพัฒนาระบบงาน (Oral)
SD-001
พัฒนา app TUH for ALL ในการเลื่อนนัดหมายและรับยาเดิม
ต่อเนื่องกลุ่มผู้รับบริการผู้ป่วยนอก
นางสาวเกศินี อินทรา
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
SD-002
จัดรูปแบบการเตรียมความพร้อมรับผู้ป่วยอ บ ัติเหตุ ESI level
1-2
นางสาวพรกรัญย์ ทำนา
(โรงพยาบาลจุฬาลงกรณ์สภากาชาดไทย)
SD-003
การพัฒนาคุณภาพการบริการโดยมุ่งลดปัญหาการร้องเรียนมุ่งสร้างความพึงพอใจในการให้บริการลูกค้า
นายบุญมี คลองรั้ว
(โรงพยาบาลกรุงเทพภูเก็ต)
SD-004 การบริหารจัดการระบบน้ำภายในโรงพยาบาลดีบุกอย่างยั่งยืน นายนิติพงศ์ รักมาก
(โรงพยาบาลดีบุก)
SD-005 ระบบไฟนำทางเพื่อความปลอดภัยทางเภสัชกรรม นางสาวรัตติยาพร แก้วสุ
(โรงพยาบาลนพรัตนราชธานี)
SD-006
3-1-1 รู้เร็ว ควบคุมโรคเร็วประชาชนรามันลดป่วยตาย
ด้วยโรคไข้เลือดออก
นางสาวซากีนะ ดอละ
(โรงพยาบาลรามัน)
SD-007
MEC Management บริหารจัดการข้อมูลศูนย์เครื่องมือแพทย์
ภายใต้สโลแกนWTU
นายมูฮัมหมัดซอฟี ซาจิ
(โรงพยาบาลรามัน)
SD-008 ยุติเอดส์ด้วยเพื่อนร่วมทาง แพทย์หญิงอัยดา หะยีบากา
(โรงพยาบาลรามัน)
SD-009 สะดวก เข้าถึงได้ง่าย ทันเวลาด้วย KPI Web
นางสาวซูไรนี หะยีอาซา
(โรงพยาบาลรามัน)
SD-010 Zero Defects Zero MALA
เภสัชกรหญิงฟารีดา ปฐบริรักษ
(โรงพยาบาลรามัน)
SD-011 พัฒนาระบบสำรองข้อมูลที่มีความปลอดภัยและมีประสิทธิภาพ นายมูฮัมหมัด ฮิแต
(โรงพยาบาลรามัน)
SD-012 Telemedicine เข้าถึงง่าย ผู้ป่วยปลอดภัย แพทย์หญิงเกสกาญจน์ นงรัตน์
(โรงพยาบาลรามัน)
เครื่องเอกซเรย์แบบพกพาที่ได้รับการสนับสนุนจากฟูจิฟิล์ม
ทั้งนี้ รพ.พานาซียังก้าวสู่การเป็นผู้นำด้าน “สเต็มเซลล์” โดยทุ่มทุนสร้างศูนย์เก็บสเต็มเซลล์ที่พานาซี พระราม2 เพื่อเป็นคลังเก็บรักษาสเต็มเซลล์จากเลือด เป็นนวัตกรรมขั้น ADVANCE ของสเต็มเซลล์พร้อมรับฝากสเต็มเซลล์จากเลือด ในแลปของพานาซีที่มีระบบการดูแลรักษา ควบคุม ให้มีคุณภาพที่สมบูรณ์ที่สุดได้นานถึง 10 ปี ในอนาคตถ้าหากเราเจ็บป่วย เราสามารถนำสเต็มเซลล์ที่เรามาฝากไว้ในช่วงที่ร่างกายเรายังสมบูรณ์ เอาไปใช้สำหรับการรักษาพยาบาลได้ในอนาคต โดยนวัตกรรมนี้ เป็นความร่วมมือของ พานาซี กับ รพ.โชนัน คามาคูระ ประเทศญี่ปุ่น องค์ความรู้นี้ นอกจากจะนำมาช่วยคนไทยแล้ว เรายังสามารถเป็นเซ็นเตอร์ในการรักษาพยาบาลด้านโรคหลอดเลือด ซึ่งสามารถนำมาต่อยอดสร้างเศรษฐกิจด้าน Wellness ให้กับประเทศไทยได้อีกด้วย
จิตแพทย์ วอนสังคมช่วยกันเฝ้าระวัง
จิตแพทย์ วอนสังคมช่วยกันเฝ้าระวัง อย่าส่งต่อภาพความรุนแรงทุกรูปแบบ ป้องกันการบ่มเพาะพถติกรรมรุนแรงและการเลียนแบบก่อเหตุซ้ำรอย
พญ.อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กล่าวถึงกรณีเหตุการณ์กราดยิงพารากอน โดยผู้ก่อเหตุเป็นเยาวชน ว่า เป็นเรื่องที่น่าตกใจและน่าเสียใจ ที่เด็กถึงขั้นการลงมือใช้อาวุธร้ายแรง ส่วนสาเหตุของการก่อเหตุในครั้งนี้ยังต้องมีการวิเคราะห์ในเชิงลึก เพราะอาจมีรายละเอียดอีกหลายอย่างที่ยังไม่รู้ แต่โดยธรรมชาติของวัย ช่วงวัยรุ่นเช่นนี้จะเป็นกลุ่มที่มีอารมณ์เปลี่ยนแปลงง่าย มีวุฒิภาวะจำกัดในการควบคุมอารมณ์
ส่วนการที่เด็กมีประสบการณ์รับรู้ความรุนแรงโดยตรงต่อตัวเอง หรือการเห็นภาพจากสื่อต่างๆ ไม่ว่าจะเป็นข่าว หรือสื่อเพื่อความบันเทิง คลิปวิดีโอ ภาพยนตร์ เกม เมื่อผ่านการสัมผัสและการรับรู้ไปนานๆ จะทำให้เกิดความชาชิน เกิดการซึมซับแม้กระทั่งตัวเองยังไม่รู้ตัวว่าได้เผลอรับความรุนแรงเข้าไปแล้ว นี่คืออีกสิ่งที่ต้องตื่นตัวช่วยกันเฝ้าระวังสังคม ป้องกันไม่ให้มีข่าวภาพข่าวคลิปเหตุการณ์ หรือกระทั่งสื่อความบันเทิงที่มีความรุนแรงถูกเผยแพร่อย่างไร้ข้อจำกัด
ส่วนเรื่องที่ว่าเด็กป่วยทางจิตหรือไม่ มองว่าประเด็นที่สังคมจะได้ประโยชน์มากกว่าอาจจะไม่ใช่การสรุปว่าเด็กเจ็บป่วยหรือไม่ แต่เป็นการวิเคราะห์เหตุการณ์ว่า ไม่ว่าเด็กจะเป็นอะไรก็ตาม แต่สังคมต้องตื่นตัวกับการป้องกันความรุนแรง ไม่ว่ารายนี้จะเจ็บป่วยหรือไม่ แต่เด็กทุกคนที่เจ็บป่วยทางจิตต้องได้รับการดูแลอย่างถูกต้อง ไม่ว่ารายนี้จะขาดยาหรือไม่แต่ผู้ป่วยทุกคนต้องไม่ขาดยา และต้องได้รับการดูแลที่เหมาะสมจากแพทย์ พร้อมกับได้รับความร่วมมือจากครอบครัว
พญ.อัมพร กล่าวด้วยว่า ตนเองได้เข้าเยี่ยมผู้บาดเจ็บที่ รพ.จุฬาลงกรณ์ เพื่อให้เกิดความมั่นใจว่า ผู้ที่ได้รับบาดเจ็บทั้งหมดจะได้รับการดูแลทั้งทางร่ายกายและจิตใจ รวมถึงการเยียวยาจิตใจครอบครัวผู้ที่เกี่ยวข้องด้วย โดยย้ำกับทาง รพ. ต้องการความช่วยเหลือกรมสุขภาพจิตพร้อมเต็มที่ โดยมีทีม ช่วยเหลือเยียวยาจิตใจผู้ประสบภัย MCATT ที่คอยดูแลเรื่องสุขภาพจิตหลังเกิดความรุนแรงต่างๆ ซึ่งจะมีการรวบรวมตัวเลขผู้ที่ได้รับผลกระทบทางจิตใจเพื่อการดูแลต่อไป
อย่างไรก็ตาม หลังจากนี้จะเดินทางไปที่ห้างฯ พารากอน เพื่อเปิดพื้นที่ดูแลเรื่องจิตใจผู้ที่ได้รับผลกระทบทางจิตใจจากเหตุที่เกิดขึ้น เช่น ผู้ที่อยู่ใกล้เคียง พนักงานในห้างฯ เป็นต้น
โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ ม.นเรศวร ทำฟันฟรี 500 คน 19 ตุลาคม 2566
เพื่อเทิดพระเกียรติสมเด็จพระศรีนครินทราบรมราชชนนีพระมารดาแห่งวงการทันตแพทย์ไทย
เนื่องใน "วันทันตสาธารณสุขแห่งชาติ" โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มหาวิทยาลัยนเรศวร จึงเปิดให้บริการทางทันตกรรม โดย ไม่เสียค่าใช้จ่าย ได้แก่ ตรวจสุขภาพช่องปาก, อุดฟัน, ขูดหินน้ำลาย, ถอนฟัน และ ผ่าฟันคุด รวม 500 คน ในวันพฤหัสบดีที่ 19 ตุลาคม 2566 เวลา 08.00 - 15.00 น. (กรุณานำบัตรประชาชนมาติดต่อที่เคาน์เตอร์เวชระเบียน ชั้น 1 อาคารโรงพยาบาลทันตกรรม 1)
** ติดต่อสอบถามรายละเอียด หมายเลขโทรศัพท์ 055-966866 หรือ 055-967462
มือเล็กๆ ของเด็กๆ นักเรียน กำลังเอื้อมไปจับกล้องโทรทรรศน์เพื่อศึกษาการเคลื่อนที่ของหมู่ดาวใต้ท้องฟ้าที่มืดสนิท โดยนอกจากการดูดาวผ่านโดมท้องฟ้าจำลองเคลื่อนที่ขนาดเส้นผ่านศูนย์กลาง 7 เมตร ระบบฟลูโดม ดิจิทัล ที่สร้างความตื่นตาตื่นใจให้เด็กๆ ราวกับกำลังท่องไปในเอกภพแล้ว อีกหนึ่งไฮไลต์ของกิจกรรม พาดาวมาหาน้อง คือการพาน้องๆ ออกจากสภาวะ “จำลอง” มาแหงนมองท้องฟ้าภายใต้หมู่ดาราจริงในช่วงกลางคืน โดยน้องๆ ได้ชมวงแหวนดาวเสาร์ซึ่งแตกต่างจากการมองด้วยตาเปล่าอย่างสิ้นเชิง รวมถึงดาวพฤหัสบดีซึ่งหากมองผ่านกล้องโทรทรรศน์ จะเห็นดาวบริวารด้วยกัน 4 ดวง ไปจนถึงสังเกตรายละเอียดพื้นผิวของดวงจันทร์ พร้อมชมกลุ่มดาวอีกมากมายที่รอให้เด็กๆ และชุมชนเข้าไปทำความรู้จัก ซึ่งสภาพท้องฟ้าทางภาคใต้นั้น ยังเอื้อต่อการสังเกตการณ์ได้ดีในช่วงฤดูฝนของไทยอีกด้วย
โรงพยาบาลนครพิงค์ เชิญทำฟันฟรี ‼️ 20 ตุลาคม 2566 เนื่องในวันทันตสาธารณสุขแห่งชาติ
กลุ่มงานทันตกรรม โรงพยาบาลนครพิงค์ ขอเชิญร่วมกิจกรรมวันทันตสาธารณสุขแห่งชาติ วันศุกร์ที่ 20 ตุลาคม 2566 โดยจะมีกิจกรรมการให้บริการใน 2 จุดได้แก่
1. งานทันตกรรม โรงพยาบาลนครพิงค์ อาคาร 3 ชั้น 4 เปิดให้บริการ วันที่ 20 ตุลาคม 2566 เวลา 8.30-15.00 น. - ขูดหินปูน - อุดฟัน - ถอนฟัน - บริการฉุกเฉินด้านทันตกรรม
2.หน่วยทันตกรรมเคลื่อนที่ ณ ห้องประชุม อบต.โป่งแยง เปิดให้บริการ วันที่ 19-20 ตุลาคม 2566 เวลา 9.00-15.00 น. - ขูดหินปูน - ถอนฟัน - ตรวจรอยโรคในช่องปากกลุ่มเสี่ยง - เคลือบฟลูออไรด์ในกลุ่มเสี่ยง - ทันตสุขศึกษา
ฟรี ‼️ ไม่มีค่าใช้จ่าย
ติดต่อสอบถาม : งานทันตกรรม โรงพยาบาลนครพิงค์ อาคาร 3 ชั้น 4 โทร. 053-999200 ต่อ 1166
คลินิคเบาหวาน
คลินิคเบาหวาน ศบส.39 เปิดให้บริการวันอังคาร และ วันพฤหัสบดี ศุกร์ เวลา 8.00 น. – 12.00 น. การบริการ
- การประเมินอาการก่อนการเป็นเบาหวานและป้องกันอาการของโรคที่อาจเกิดขึ้น
- การตรวจรักษาผู้ป่วยหญิงตั้งครรภ์ที่เป็นเบาหวาน
- การประเมินและดูแลเพื่อป้องกันโรคแทรกซ้อนจากเบาหวานเช่น โรคแทรกซ้อนทางตา, เท้า
- การให้คำปรึกษาด้านโภชนาการ พฤติกรรม และการดูแลสุขภาพในผู้ป่วยเบาหวาน
- การให้คำปรึกษาด้านการใช้ยา การประเมินการใช้ยาและรวมถึงการป้องกันอาการไม่พึงประสงค์ที่อาจเกิดขึ้น
- การตรวจคัดกรองโรคเบาหวานสำหรับญาติของผู้ป่วยเบาหวาน
- การออกเยี่ยมบ้านในผู้ป่วยเบาหวานเพื่อประเมินการดูแลผู้ป่วยที่บ้าน
- การตรวจรักษาและจัดการโรคทางด้านฮอร์โมนอื่นๆ
คลินิควัณโรค เปิดให้บริการวันศุกร์
คลินิควัณโรค เปิดให้บริการวันศุกร์ เวลา 08.00 น – 12.00 น. การให้บริการ
- ให้บริการตรวจเสมหะแก่ผู้ที่มีอาการสงสัยวัณโรค
- ให้การดูแลรักษาวัณโรค
- เป็นศูนย์กลางเครือข่ายในการตรวจวินิจฉัยวัณโรค และส่งต่อผู้ป่วยวัณโรคไปรับยาใกลล้บ้าน
- ให้คำปรึกษาเรื่องโรควัณโรค
หู คอ จมูก
หู คอ จมูก
- คลินิกหู คอ จมูก ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกหู คอ จมูกบ่าย เวลา 13.00 น. - 16.00 น. (บ่าย) คลินิกหู คอ จมูกนอกเวลา เวลา 16.00 น. - 20.00 น.
- คลินิกนอนกรน ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกโรค จมูกและภูมิแพ้ ในเวลาราชการ 13.00 น. - 16.00 น.
- คลินิกตรวจการได้ยิน ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกฝึกพูด ในเวลาราชการ 08.00 น. - 16.00 น.


โรคไข้เลือดออก (Dengue fever) เป็นโรคที่เกิดจากการติดเชื้อไวรัสเดงกี (Dengue virus) โดยมียุงลายเป็นพาหะนำโรค ซึ่งโดยทั่วไปแล้ว มักพบในประเทศเขตร้อนและจะระบาดในช่วงฤดูฝนของทุกปี ไข้เลือดออกพบได้ในทุกเพศทุกวัย แต่พบมากที่สุดในกลุ่มเด็กอายุ 5-14 ปี แต่พบว่าในวัยทำงานมีการเสียชีวิตสูงสุด ซึ่งกลุ่มเด็กที่ติดเชื้อไข้เลือดออกสามารถสังเกตได้จากอาการ โดยหากมีอาการไข้สูงลอย มีผื่นแดงหรือจุดเลือดออกตามตัว ให้สันนิษฐานว่าอาจติดโรคไข้เลือดออกได้ ทั้งนี้ควรไปพบแพทย์เพื่อวินิจฉัยโรคโดยเร็ว เนื่องจากโรคไข้เลือดออกจะทำให้มีเกล็ดเลือดที่ต่ำและอาจนำพาไปสู่อาการช็อกและการเสียชีวิตได้หากไม่ได้รับการรักษาอย่างทันท่วงที ทั้งนี้ ประชาชนควรหมั่นปฏิบัติตามมาตราการในการควบคุมโรคอย่างเคร่งครัด เพื่อการป้องกันและเฝ้าระวังโรคไข้เลือดออก เช่น ปิดภาชนะเก็บกักน้ำให้มิดชิด ป้องกันการเข้าไปวางไข่ของยุงลาย เปลี่ยนน้ำในภาชนะอยู่เสมอๆ เพื่อไม่ให้มีแหล่งน้ำที่ยุงสามารถไปเพาะพันธุ์ได้ ปล่อยปลากินลูกน้ำในภาชนะใส่น้ำ และปรับปรุงสิ่งแวดล้อมรอบข้างให้ปลอดโปร่งแล้ว โดยไข้เลือดออกสามารถป้องกันได้ด้วยการฉีดวัคซีน ซึ่งเป็นหนึ่งในทางเลือกเพื่อเสริมสร้างภูมิคุ้มกันโรค โดยสามารถปรึกษาแพทย์หรือสถานพยาบาลใกล้ท่านเพื่อขอรับคำแนะนำในการฉีดวัคซีนไข้เลือดออก
ปัจจัยที่ก่อให้เกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ - ศ.นพ. พันธุ์เทพ อังชัยสุขศิริ


ปัจจัยที่ก่อให้เกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำนั้น ศ.นพ. พันธุ์เทพ อังชัยสุขศิริ สาขาวิชาโลหิตวิทยา ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ให้ข้อมูลว่า ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ อาจเกิดขึ้นจากการที่เลือดจับตัวแข็งและสะสมในหลอดเลือดดำ (Venous System) ซึ่งส่วนใหญ่เกิดได้จากการอักเสบในเส้นเลือดดำ โดยกลุ่มเสี่ยงสูงที่มีโอกาสเกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ ได้แก่ ผู้ป่วยมะเร็ง จากข้อมูลผู้ป่วยในทวีปเอเซียรวมถึงประเทศไทย ผู้ป่วยที่เป็นโรคหลอดเลือดดำอุดตันมีราวๆ ร้อยละ 20 ที่มีโรคมะเร็งอย่างใดอย่างหนึ่งร่วมด้วย ผู้ที่ต้องผ่าตัดหรือผู้ที่ได้รับอุบัติเหตุ และต้องนอนโรงพยาบาลมีการเคลื่อนไหวทางร่างกายน้อย เป็นเวลานานๆ ก็เป็นกลุ่มเสี่ยง และอีกกลุ่มที่มักถูกมองข้ามคือ หญิงตั้งครรภ์ ซึ่งอาจมีความเสี่ยงในการเกิด VTE มากกว่าคนปกติ ถึง 4 เท่า และเป็นสาเหตุการเสียชีวิตของมารดาถึงร้อยละ 10 นอกจากนี้ การเกิด VTE ยังมีปัจจัยอื่นร่วมด้วย ได้แก่ ผู้ป่วยโรคเรื้อรัง ผู้ป่วยไม่สามารถขยับเคลื่อนไหวได้ ผู้ป่วยที่มีน้ำหนักเกิน ผู้ที่มีประวัติ VTE ในครอบครัว การใช้ยาคุมกำเนิด สูบบุหรี่จัด เป็นต้น
ดร. โอเว่น ซุงก้า รองประธานอาวุโส ฝ่ายวิทยาศาสตร์และวิจัยทางการแพทย์
พร้อมกันนี้ ดร. โอเว่น ซุงก้า รองประธานอาวุโส ฝ่ายวิทยาศาสตร์และวิจัยทางการแพทย์ บริษัทเมิร์ซ เอสเธติกส์ภูมิภาคเอเชียแปซิฟิก ยังได้ร่วมแชร์เทรนด์เสริมความงามระดับโลกว่า “นวัตกรรมเพื่องานผิวในอุดมคติ ล้วนมีพื้นฐานมาจากวิทยาศาสตร์และงานวิจัยทั้งสิ้น เพื่อให้ผิวได้รับคุณประโยชน์ในการฟื้นฟูอย่างเต็มที่ ทั้งในแง่ของการประสิทธิภาพและความปลอดภัย”
โดยภายในกิจกรรมเสวนาในครั้งนี้ เมิร์ซ เอสเธติกส์ ประเทศไทย ยังได้อัปเดตเทรนด์ความงามล่าสุด ด้วยการเผยศาสตร์ใหม่แห่งการฟื้นฟูผิว Regenerative Biostimulator ครั้งแรกในประเทศไทยกับนวัตกรรมสารฉีดกระตุ้นสร้างเส้นใยผิวใหม่แบบครบถ้วน 5 ประการที่เตรียมสร้างปรากฎการณ์ใหม่ให้กับอุตสาหกรรมความงามในไทย เร็วๆ นี้
สำหรับงานเสวนา “Science Behind Confidence” ถูกจัดขึ้นเพื่อสื่อสารความตั้งใจในการขับเคลื่อนโลกและวงการนวัตกรรมเสริมความงาม ด้วยการศึกษาวิจัยและให้ความสำคัญกับความรู้ทางวิทยาศาสตร์ ผ่านความร่วมมือกันของวงการแพทย์และบริษัทชั้นนำด้านนวัตกรรมความงามอย่างเมิร์ซ เอสเธติกส์ อีกทั้งยังร่วมสร้างการตระหนักรู้ในวงกว้างด้านความงามกับความมั่นใจที่ต้องมาพร้อมกับความปลอดภัย ซึ่งเป็นหัวใจสำคัญในการพัฒนานวัตกรรมของเมิร์ซ เอสเธติกส์อย่างยิ่ง
สำหรับผู้ที่สนใจและอยากได้ไอเดียในการแต่งบ้าน รางวัล 10 บ้านน่าอยู่ 10 สวนสวย จะจัดเป็นนิทรรศการบริเวณบ้านตัวอย่าง ในงานบ้านและสวนแฟร์ Living Festial 2023 วันที่ 27 ตุลาคม – 5 พฤศจิกายน 2566 ณ อาคารชาเลนเจอร์ อิมแพ็ค เมืองทองธานี
ทางเดินคอนกรีตเป็นระเบียบ ผืนหญ้าเขียวน่าวิ่งเล่น
คุณโนโบรุ อิวาสะ จากร้าน“ชิโรเฮ โรโฮ” จังหวัดชิงะ
คุณโนโบรุ อิวาสะ จากร้าน“ชิโรเฮ โรโฮ” จังหวัดชิงะ เป็นร้านเก่าแก่ตั้งอยู่ในเมืองโอมิโนะคุนิที่ล้อมรอบทะเลสาบบิวะ มาเป็นเวลากว่า 150 ปี โดยทางร้านยังคงสร้างสรรค์ขนมญี่ปุ่นแสนอร่อยที่จะทำให้รู้สึกถึงการเปลี่ยนแปลงของฤดูกาลทั้งสี่และคุณโนโบรุ อิวาสะเป็นช่างทำขนมที่ได้รับการรับรองว่า เป็นช่างทำขนมฝีมือดีเป็นเลิศ เพียงไม่กี่คนท่ามกลางช่างฝีมือขนมญี่ปุ่น
บริษัทฯ ได้มุ่งมั่นที่จะพัฒนาผลิตภัณฑ์และบริการที่ช่วยให้ผู้ป่วยสามารถควบคุมโรคเบาหวานและโรคอ้วนได้อย่างมีประสิทธิภาพ และพร้อมทำงานร่วมกับภาครัฐและเอกชนเพื่อส่งเสริมแนวทางปฏิบัติที่ดีที่สุดในการป้องกันและควบคุมโรค ตลอดจนสนับสนุนการศึกษาและวิจัยเพื่อพัฒนานวัตกรรมใหม่ๆ เพื่อพัฒนาคุณภาพชีวิตของผู้ป่วยให้ดียิ่งขึ้น นวัตกรรมนับเป็นหัวใจสำคัญของการดำเนินธุรกิจของบริษัท และสร้างความยั่งยืนให้กับองค์กรมาตลอดช่วง 100 ปีที่ผ่านมาและในอีก 100 ปีข้างหน้า อีกทั้งตระหนักถึงภัยคุกคามของแนวโน้มการเพิ่มขึ้นของผู้ป่วยโรคอ้วนและโรคเบาหวาน ซึ่งบั่นทอนสุขภาพและความมั่งคั่งของคนรุ่นหลัง เรามุ่งมั่นที่จะทำงานร่วมกับพันธมิตรทั่วโลกเพื่อขับเคลื่อนการเปลี่ยนแปลงและยกระดับการรักษาแบบบูรณาการและป้องกันความเสี่ยงของโรคในทุกด้านที่อาจเป็นไปได้
โดยศูนย์ดูแลสุขภาพ Steno Diabetes Center ที่ Copenhagen ณ ประเทศเดนมาร์ก นับเป็นตัวอย่างโมเดลที่ประสบความสำเร็จที่เกิดขึ้นจากความร่วมมือระหว่างรัฐบาลเดนมาร์กและมูลนิธิโนโว นอร์ดิสค์ ซึ่งศูนย์ฯ แห่งนี้ได้ถูกออกแบบโดยคำนึงถึงมิติต่างๆ ในการดูแลสุขภาพอย่างพิถีพิถัน เพื่อมุ่งเน้นในการยกระดับการดูแลผู้ป่วยเบาหวานและการวิจัยเบาหวานเพื่อเพิ่มคุณภาพชีวิตที่ดีขึ้นสำหรับผู้ป่วยเบาหวานในองค์รวม
จากรายงาน BMJ Global Health (ปี 2564) ระบุว่าในปีพ.ศ. 2603 หากประเทศไทยไม่มีการเปลี่ยนแปลง อย่างมีนัยสำคัญ ผลกระทบทางเศรษฐกิจจากโรคอ้วนคาดว่าจะเติบโตขึ้นเป็น 4.9% ของ GDP ในประเทศไทย ซึ่งค่าใช้จ่ายนี้ รวมถึงค่าใช้จ่ายโดยตรงจากการรักษาสุขภาพ และค่าใช้จ่ายทางอ้อม เช่น การสูญเสียผลผลิต (lost productivity) จากการใช้แรงงานไม่เต็มประสิทธิภาพ หรือการขาดงานจากผู้ที่ต้องรักษาโรคอ้วน และหากลดความชุกของโรคอ้วนลง 5% จากระดับที่คาดการณ์ไว้หรือคงไว้ที่ระดับปี 2562 จะทำให้ต้นทุนทางเศรษฐกิจลดลงเฉลี่ย 5.2% และ 13.2% ต่อปี ระหว่างปีพ.ศ. 2563 - 2603 ตามลำดับ
วิเคราะห์การทรงตัวเพื่อการแพทย์
แม้การใช้งานเครื่องวิเคราะห์การทรงตัวจะทำได้หลากหลาย แต่เป้าหมายหลักในการคิดค้นนวัตกรรมนี้คือการนำไปใช้ทางการแพทย์ ในสถานพยาบาลต่าง ๆ บ้านพักคนชรา ศูนย์รับเลี้ยงเด็ก รวมถึงการออกตรวจคนไข้นอกสถานที่ หรือในพื้นที่ห่างไกล
“นี่คือเหตุผลที่ทำไมเครื่องมือนี้จึงมีขนาดเล็ก พกพาได้สะดวก และสามารถอ่านผลได้โดยไม่ต้องมีผู้เชี่ยวชาญเฉพาะทาง”
อาจารย์ชัชนีกล่าวว่าการนำเครื่องวิเคราะห์การทรงตัวไปใช้ทางการแพทย์ หลัก ๆ มีอยู่ 2 รูปแบบ คือ
- ใช้ประเมินภาวะความเสี่ยงในการล้ม โดยเฉพาะในกลุ่มผู้สูงอายุที่มีความเสี่ยงที่จะล้มแล้วเกิดอันตรายถึงชีวิตมากที่สุด เนื่องจากคนส่วนมากมักจะไม่รู้ตัวว่าตัวเองเดินเซหรือมีการทรงตัวที่ไม่ดีจนกระทั่งเกิดอุบัติเหตุขึ้นแล้ว
- ใช้ฝึกการทรงตัวและท่าทางเพื่อฝึกกำลังกล้ามเนื้อ หลังจากที่ใช้เครื่องแล้ววิเคราะห์ว่าผู้ใช้ว่ามีปัญหาการทรงตัวอย่างไร ก็นำผลที่ได้ไปปรับพฤติกรรม อาทิ ฝึกฝนกำลังกล้ามเนื้อ เปลี่ยนวิธีการยืน เพื่อพัฒนาให้การทรงตัวดียิ่งขึ้น และติดตามพัฒนาการที่ได้จากการปรับเปลี่ยนพฤติกรรมว่ามีการทรงตัวที่ดีขึ้นหรือไม่
อาจารย์ชัชนีกล่าวถึงผลที่ได้จากการนำนวัตกรรมเครื่องวิเคราะห์การทรงตัวไปใช้งานจริงว่า “จากที่ได้เอาไปใช้ในสถานพยาบาล 3 แห่ง แพทย์มีความเห็นเชิงบวก ผลตอบรับค่อนข้างดี โดยเฉพาะแพทย์อายุรกรรมและกุมารแพทย์ที่อยากให้มีเครื่องนี้ไว้ใช้คัดกรองผู้ป่วย เพราะอุปกรณ์นี้สามารถให้ค่าการทรงตัว ค่าน้ำหนัก และค่าอื่น ๆ ได้ ครบในอุปกรณ์เดียว ทำให้แบ่งเบาภาระงานของแพทย์และเข้าถึงกลุ่มผู้ป่วยที่ห่างไกลโรงพยาบาลได้”
นอกจากนี้ อาจารย์ชัชนียังได้แนะนำนวัตกรรมชิ้นนี้ให้กับแพทย์เพื่อนำไปใช้กับกลุ่มผู้มีอาการออทิสติกและสมาธิสั้น และผู้ป่วยที่ได้รับผลกระทบกระเทือนทางสมอง เพื่อนำผลการวิเคราะห์การทรงตัวมาประกอบแนวทางการทำกายภาพฟื้นฟู
“คนกลุ่มออทิสติกและสมาธิสั้นมักมีปัญหาด้านการทรงตัว เราต้องให้ฝึกให้เขาทรงตัวว่าจะต้องทำอย่างไร ถ้าเราฝึกเขาให้เขาพัฒนาตามแบบแผนได้ เขาก็สามารถพัฒนาสมาธิได้ยาวขึ้น”
นอกจากเครื่องวิเคราะห์การทรงตัวแล้ว อาจารย์ชัชนี ยังพัฒนาอุปกรณ์ นวัตกรรมอื่น ๆ ที่ช่วยเหลือและเกี่ยวข้องกับการทรงตัว เช่น นวัตกรรมไม้เท้า “Smart devices for people: Self Balancing Stick”
“ผู้สูงอายุส่วนมากไม่นิยมใช้ไม้เท้า เนื่องจากมีความคิดว่าถ้าใช้ไม้เท้าแล้วร่างกายจะไม่แข็งแรง ทั้งที่ในความเป็นจริงแล้ว ไม้เท้าเป็นอุปกรณ์ที่ช่วยให้ผู้ที่มีปัญหาเรื่องการทรงตัวสามารถประคองร่างกายของตัวเองได้ดียิ่งขึ้น เราจึงพัฒนานวัตกรรมไม้เท้า Smart Flow ที่จะช่วยให้ผู้สูงอายุที่มีปัญหารทรงตัวสามารถทรงตัวได้ดียิ่งขึ้น “
ค่าบริการทางทันตกรรม
ค่าบริการทางทันตกรรม สอบถามเพิ่มเติม คลินิกทันตกรรม โทร. 02-2008000 ต่อ 10340
เบื้องต้นการกระทำดังกล่าวเป็นความผิดตาม
1. พ.ร.บ. ยา พ.ศ.2510
1.1. ฐาน “ขายยาแผนปัจจุบันโดยไม่ได้รับอนุญาต” ระวางโทษ จำคุกไม่เกิน 5 ปี หรือปรับไม่เกิน 10,000 บาท หรือทั้งจำทั้งปรับ
1.2. ฐาน “ขายยาที่ยังไม่ขึ้นทะเบียนตำรับยา” ระวางโทษจำคุกไม่เกิน 3 ปี หรือปรับไม่เกิน 5,000 บาท หรือทั้งจำทั้งปรับ
2. พ.ร.บ. เครื่องมือแพทย์ พ.ศ.2551 ฐาน “ขายเครื่องมือแพทย์ที่ไม่ได้รับใบรับจดแจ้ง” ระวางโทษจำคุกไม่เกินหนึ่งปี หรือปรับไม่เกิน 100,000 บาท หรือทั้งจำทั้งปรับ
3. กรณีการจำหน่ายเซ็กส์ทอย มีความผิดตามประมวลกฎหมายอาญา พ.ศ.2499 มาตรา 287 ฐาน“ขายวัตถุหรือสิ่งของลามก” ต้องระวางโทษจำคุกไม่เกินสามปี หรือปรับไม่เกินหกหมื่นบาท หรือทั้งจำทั้งปรับ
เภสัชกรหญิงวรสุดา ยูงทอง ผู้อำนวยการกองยา กล่าวว่า ปฏิบัติการในครั้งนี้ สำนักงานคณะกรรมการอาหารและยา (อย.) ขอขอบคุณตำรวจกองบังคับการปราบปรามการกระทำความผิดเกี่ยวกับการคุ้มครองผู้บริโภค (บก.ปคบ.) ที่สืบสวนขยายผลจนสามารถตรวจยึดยาที่ผิดกฎหมายได้จำนวนมาก จากการจับกุมพบยาที่ไม่ได้ขึ้นทะเบียนตำรับยาที่ลักลอบนำเข้า และขายให้ผู้บริโภคเฉพาะกลุ่ม ซึ่งตัวผลิตภัณฑ์ถือว่าเป็นอันตรายต่อผู้บริโภคและการใช้ยาผิดวัตถุประสงค์เป็นอันตรายถึงแก่ชีวิตได้ เนื่องจากไม่ทราบแหล่งผลิตว่ามีมาตรฐานหรือไม่ ทั้งจากกระบวนการผลิตที่ไม่ได้มาตรฐาน และอันตรายจากการใช้ยาเกินขนาดจนอาจถึงแก่ชีวิตได้ จึงขอเตือนไปยังพี่น้องประชาชนว่า ไม่ควรซื้อยาใด ๆ ผ่านทางอินเทอร์เน็ตหรือโซเชียลมีเดียมารับประทานเอง ควรได้รับคำแนะนำในการใช้ยาที่ถูกต้องจากเภสัชกร เนื่องจากผลข้างเคียงของการใช้ยาที่ไม่ถูกต้องอาจเป็นอันตรายถึงชีวิต
อย. จึงขอย้ำเตือนพี่น้องประชาชนว่า ยาจะต้องได้รับอนุญาตจากสำนักงานคณะกรรมการอาหารและยา (อย.) ก่อนผลิต นำเข้า หรือจำหน่าย และยาไม่สามารถซื้อขายทางออนไลน์ได้ ต้องซื้อจากร้านยา หรือได้รับการตรวจวินิจฉัยและจ่ายโดยแพทย์จากสถานพยาบาลของรัฐหรือเอกชนเท่านั้น
ทั้งนี้ หากผู้บริโภคพบเห็นผลิตภัณฑ์ที่ต้องสงสัยหรือไม่ได้รับอนุญาต สามารถแจ้งได้ที่สายด่วน อย. 1556 หรือผ่าน Email: 1556@fda.moph.go.th Line@FDAThai, Facebook: FDAThai หรือ ตู้ปณ.1556 ปณฝ.กระทรวงสาธารณสุข จ.นนทบุรี 11004 หรือสำนักงานสาธารณสุขจังหวัดทั่วประเทศ
พล.ต.ท.จิรภพ ภูริเดช ผบช.ก. กล่าวว่าจากการตรวจสอบในครั้งนี้พบ ยาไม่มีทะเบียน เป็นจำนวนมาก ซึ่งทางตำรวจเฝ้าระวังและจะขยายผลถึงต้นตอของยาไม่มีทะเบียนที่ตรวจพบในแหล่งจำหน่ายทุกจุด และฝากความห่วงใยมายังพี่น้องประชาชนโดยเฉพาะนักท่องเที่ยวตามสถานบันเทิงต่างๆ ควรระมัดระวังเครื่องดื่มของตนเอง ไม่ดื่มเครื่องดื่มจากคนแปลกหน้า ไม่ดื่มเครื่องดื่มที่อยู่ในภาชนะปากกว้างที่ง่ายต่อการผสมยาอันตรายลงไป และไม่ละสายตาจากเครื่องดื่มของตนเอง เป็นต้น และ ขอเตือนไปยังกลุ่มคนที่ลักลอบขายและใช้สรรพคุณยาผิดวัตถุประสงค์ว่า ยาคือหนึ่งในปัจจัยสี่ ที่ใช้เพื่อรักษาโรคหรือบรรเทาอาการเจ็บป่วยจำเป็นอย่างยิ่งที่จะต้องใช้อย่างถูกวิธีและได้รับคำแนะนำในการใช้อย่างละเอียด จากผู้ประกอบวิชาชีพเภสัชกรรม โดยเฉพาะยาอันตรายและยาควบคุมพิเศษซึ่งจะต้องใช้อย่างระมัดระวังตามใบสั่งของแพทย์เท่านั้น และจะดำเนินการกวาดล้างผู้ที่กระทำผิดอย่างต่อเนื่อง หากพี่น้องประชาชนพบเห็นร้านขายยาใดมีพฤติกรรมในการใช้พนักงานขายยาที่ไม่ใช่ผู้ประกอบวิชาชีพเภสัชกรรมหรือการกระทำความผิดกฎหมายในลักษณะอื่นใดสามารถแจ้งเบาะแสได้ที่สายด่วน ปคบ.1135 หรือ เพจ ปคบ.เตือนภัยผู้บริโภคได้ตลอดเวลา
“ผู้ต้องหาหรือจําเลยยังเป็นผู้บริสุทธิ์ตราบใดที่ศาลยังไม่มีคําพิพากษาถึงที่สุด”
สรุปการให้บริการวัคซีน HPV ตามนโยบายเร่งรัดของกระทรวงสาธารณสุข
1. ให้บริการฉีดวัคซีนผ่านระบบโรงเรียน เป็นอันดับแรก
1.1 ระยะเวลาให้บริการ: เดือนพฤศจิกายน 2566 โดยใช้วัคซีนที่สปสช. จัดส่งให้หน่วยบริการ (ในกรณีที่ สปสช. ไม่สามารถจัดส่งวัคซีน HPV ตามนโยบายของกระทรวงสาธารณสุขได้ ทันเวลาการดำเนินงาน ขอให้สำนักงานสาธารณสุขจังหวัดบริหารจัดการวัคซีน HPV ที่ได้รับการสนับสนุนจากกรมควบคุมโรค เพื่อให้บริการไปพลางก่อน)
1.2 ฉีดเข็มที่ 1 ในเด็กหญิงไทย ชั้นประถมศึกษาปีที่ 5 ถึง มัธยมศึกษาปีที่ 6 ทุกชั้นปี ให้เสร็จสิ้น ตามรายโรงเรียน ทั้งนี้กรณีกลุ่มเป้าหมายมีประวัติได้รับวัคซีนเข็มที่ 1 เกิน 6 เดือน สามารถฉีดเข็มที่ 2 ได้
1.3 เขตสุขภาพ จัดกิจกรรมรณรงค์การฉีดวัคซีนผ่านระบบโรงเรียน อย่างน้อย 1 จังหวัด แต่ละเขตสุขภาพ พร้อมกันทั่วประเทศ ในวันที่ 8 พฤศจิกายน 2566
2. ให้บริการฉีดวัคซีนในเด็กหญิง อายุ 11 - 17 ปี นอกระบบโรงเรียน และหญิงอายุ 18 - 20 ปี
2.1 ระยะเวลาให้บริการ: เดือนธันวาคม 2566 ถึงเดือนมกราคม 2567
2.2 การสนับสนุนวัคซีนสำหรับกลุ่มเป้าหมาย
- กลุ่มเป้าหมายตามสิทธิประโยชน์ ตั้งแต่ปี 2560 (หญิงไทย อายุ 11 – 17 ปีหรือเด็กที่เกิด วันที่ 1 ม.ค. 49 - 31 ธ.ค. 55) สปสช. เป็นหน่วยงานหลักในการจัดหา จัดสรร และส่งวัคซีน
- กลุ่มเป้าหมายนอกสิทธิประโยชน์ (หญิงไทยอายุ 18 - 20 ปี หรือ เด็กที่เกิด วันที่ 1 ม.ค. 46 - 31 ธ.ค 48) เนื่องจาก สปสช. ไม่สามารถจัดหาวัคซีนให้กลุ่มเป้าหมายนอกสิทธิประโยชน์ กรมควบคุมโรคจึงสนับสนุนวัคซีนให้กลุ่มเป้าหมาย
2.3 ภายหลังการฉีดผ่านระบบโรงเรียนครบถ้วนแล้ว และยังคงมีวัคซีนเหลือในพื้นที่ สามารถ
บริหารจัดการได้ตามบริบทของพื้นที่
2.4 เขตสุขภาพและสำนักงานสาธารณสุขจังหวัด สามารถบริหารจัดการวัคซีน ได้ตามบริบทของพื้นที่อย่างเหมาะสม
3. บันทึกข้อมูลการฉีดวัคซีนผ่านระบบ MOPH Claim
4. หน่วยบริการสามารถเบิกค่าฉีดวัคซีน และค่าชดเชย AEFI จาก สปสช. (อยู่ระหว่างการประสานกับสปสช. / ตามที่ สปสช. กำหนด)
ทั้งนี้ ขั้นตอนการเตรียมการให้บริการ ขณะให้บริการ และหลังให้บริการ อ้างอิงจากแนวทางการ
ให้บริการวัคซีนป้องกันการติดเชื้อไวรัสเอชพีวี (HPV) ตามนโยบายเร่งรัด 100 วัน ของ กระทรวงสาธารณสุข ฉบับเดือนกันยายน 2566
คณะผู้แทนนายกรัฐมนตรีอิสราเอล เยี่ยมกลุ่มคนไทยที่ได้รับการปล่อยตัว
26 พฤศจิกายน 2566 นางสาวพรรณนภา จันทรารมย์ เอกอัครราชทูต ได้ต้อนรับนาย Yossi Shelly, Director of Prime Minister’s Office และผู้แทนนายกรัฐมนตรีอิสราเอล พร้อมกับเข้าเยี่ยมกลุ่มคนไทยที่ได้รับการปล่อยตัวจากฉนวนกาซา ที่โรงพยาบาล Shamir Medical Center โดยมีพันโท Oron Mincha กระทรวงกลาโหมอิสราเอล และผู้แทนโรงพยาบาลร่วมต้อนรับ
นาย Shelly ได้กล่าวแสดงความยินดีที่กลุ่มคนไทยได้รับการปล่อยตัวและเดินทางกลับอิสราเอลอย่างปลอดภัยและให้คำมั่นว่ารัฐบาลอิสราเอลจะให้การช่วยเหลือและการดูแลทางการแพทย์แก่คนไทยกลุ่มนี้อย่างเต็มที่ รวมทั้งขอบคุณแรงงานไทยที่เป็นกำลังสำคัญในการเสริมสร้างภาคการเกษตรของอิสราเอลมาโดยตลอด และหวังว่าเมื่อสถานการณ์ปกติแรงงานไทยจะเดินทางกลับมาทำงานในอิสราเอล ซึ่งเอกอัครราชทูตได้ใช้โอกาสนี้กล่าวขอบคุณรัฐบาลอิสราเอลและหน่วยงานต่างๆ ที่เกี่ยวข้องที่ให้การดูแลกลุ่มคนไทยเป็นอย่างดีเช่นเดียวกับที่ให้การดูแลชาวอิสราเอลที่ได้รับผลกระทบจากภาวะสงคราม
26 พฤศจิกายน 2566 นาย Uriel Menachem Buso รัฐมนตรีว่าการกระทรวงสาธารณสุขอิสราเอล ได้เดินทางไปเยี่ยมตัวประกันชาวไทยจำนวน 14 คนที่เพิ่งได้รับการปล่อยตัวจากฉนวนกาซา ที่โรงพยาบาล Shamir Medical Center โดยมีนายจุลวัจน์ นรินทรางกูร ณ อยุธยา อัครราชทูต ให้การต้อนรับ โอกาสนี้ นาย Menachem Buso ได้กล่าวต้อนรับและให้กำลังใจตัวประกันชาวไทย รวมทั้งยืนยันว่า อิสราเอลจะดูแลรักษาพยาบาลตัวประกันกลุ่มนี้อย่างดียิ่ง


เมื่อเดือนตุลาคมที่ผ่านมา บอร์ดพัฒนาระบบสุขภาพแห่งชาติ ได้เห็นชอบเดินหน้า “มะเร็งครบวงจร” เพื่อการดูแลประชาชนไทยในทุกขั้นตอนตั้งแต่การส่งเสริมป้องกัน คัดกรอง ตรวจวินิจฉัย รักษา และการดูแลฟื้นฟูกายใจจากโรคมะเร็ง พร้อมจัดตั้งทีม Cancer Warrior เพื่อต่อสู้มะเร็ง 5 ชนิด คือ มะเร็งตับ มะเร็งท่อน้ำดี มะเร็งลำไส้ใหญ่และไส้ตรง มะเร็งเต้านม และมะเร็งปากมดลูก แต่ยังไม่ได้มีเรื่องมะเร็งปอด ดังนั้นเพื่อเป็นการยกระดับการดูแลผู้ป่วยมะเร็งปอด ซึ่งนโยบายดังกล่าวสอดคล้องกับวิสัยทัศน์ และแผนการดำเนินงานของแอสตร้าเซนเนก้าที่ทำมาอย่างต่อเนื่องตลอดระยะเวลา 40 ปี กับเป้าหมายในการยกระดับประสิทธิภาพการตรวจวินิจฉัยโรคในระยะเริ่มต้น การร่วมมือกับหน่วยงานพันธมิตร ทั้งภาครัฐและเอกชนในการส่งเสริมการป้องกันโรค และถ่ายทอดองค์ความรู้ พร้อมริเริ่มโครงการต่างๆ ที่เป็นมากกว่าการรักษา ซึ่งเราจะยังคงเดินหน้าขยายขอบเขตความก้าวหน้าทางวิทยาศาสตร์ ด้วยความเชื่อมั่นว่าอนาคตที่ยั่งยืนเกิดขึ้นได้ เมื่อประชาชน (People) ชุมชน (Society) และโลก (Planet) มีสุขภาพที่ดีและแข็งแรง (Making Health Happen)
ภาพประกอบ : กิจกรรมสอบถามแนวคิดการตรวจ รักษาไว มีผลต่อผลของการรักษา จากผู้เข้าร่วมการประชุม
คุณสมบัติพิเศษของแก้วน้ำ
ศ.นพ.รุ่งโรจน์ อธิบายคุณสมบัติพิเศษของแก้วน้ำว่า “แก้วน้ำนี้ช่วยให้ผู้สูงวัยสามารถดื่มน้ำได้โดยไม่ต้องเงยคอ เพราะการที่ผู้สูงวัยไม่ต้องเงยคอ จะช่วยลดการสำลักลงได้มาก และที่สำคัญ แก้วน้ำกันสำลักนี้สามารถควบคุมปริมาณน้ำต่อการดื่มแต่ละครั้งให้ไม่มากจนเกินไป และกำหนดเวลาในการดื่มให้ไม่เร็วเกินไปได้ ด้วยปริมาณการดื่มที่เหมาะสม มุมที่เหมาะสม ท่าดื่มที่เหมาะสม เวลาดื่มที่ไม่เร็วจนเกินไป เหล่านี้เป็นสิ่งที่จะช่วยให้ผู้สูงวัย หรือผู้ป่วยสำลักน้อยลง”
หลักสูตร Food Production แผนกประกอบอาหาร
หลักสูตร Food Production แผนกประกอบอาหาร คอร์สนี้เหมาะสำหรับตำแหน่งงานดังต่อไปนี้
- ผู้บริหารงานครัว (Executive Chef/ Sous Chef)
- พ่อครัวแต่ละงาน (Demi Chef)
- ผู้ช่วยพ่อครัวฝ่ายอาหาร (Commis Chef)
- หัวหน้าแผนกงานแต่ละครัว (Chef de Partie)
- ผู้ช่วยพ่อครัวขนมหวาน (Commis Pastry)
- พนักงานทำขนมปัง (Baker)
- พนักงานแล่เนื้อ (Butcher)
ลิงค์หลักสูตร
นอกจากนี้ภายในงานพบกับตัวแทนเครือข่ายพันธมิตร ชุมชนกลุ่มคนไข้ ที่มาร่วมพูดคุยถึงบทบาทการสร้างเครือข่าย พร้อมแชร์ประสบการณ์ตรงในฐานะผู้ป่วย นำทีมโดย คุณศุภลักษณ์ จตุเทวประสิทธิ์ ประธานชมรมเบาหวานโรงพยาบาลจุฬาฯ คุณอรวรรณ โอวรารินท์ ประธาน และผู้ร่วมก่อตั้งชมรมผู้ป่วยมะเร็งเต้านมแห่งประเทศไทย คุณไอรีล ไตรสารศรี ผู้ก่อตั้งอาร์ต ฟอร์ แคนเซอร์ บายไอรีล และรองประธานชมรมผู้ป่วยมะเร็งแห่งประเทศไทย และ ผศ.นุชรินทร์ ศศิพิบูลย์ ประธานชมรมผู้ป่วยโรครูมาตอยด์
อนึ่ง โครงการให้ความรู้ประชาชนกลุ่มเสี่ยงต่อโรคระบบทางเดินหายใจที่สามารถติดต่อได้ ภายใต้โครงการ #รู้ว่าเสี่ยง เลี่ยงเสียศูนย์ (#KnowMyRisk) เป็นหนึ่งในโครงการที่ริเริ่มและดำเนินการ โดยแพทยสมาคมฯ ซึ่งได้รับความร่วมมือร่วมใจจากหลากหลายภาคี โดยหวังว่าจะสามารถส่งผลสำเร็จ รวมถึงสร้างความรู้ ความเข้าใจให้กับประชาชน ที่อยู่ในกลุ่มเสี่ยงต่อโรคระบบทางเดินหายใจที่สามารถติดต่อได้ รวมถึงกลุ่มเปราะบาง ได้เข้าถึงการรักษา และเข้ารับวัคซีนได้อย่างเหมาะสม เพื่อลดความรุนแรงของโรค และลดการเสียชีวิต
สปสช.เขต 3 นครสวรรค์
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 3 นครสวรรค์
เตรียมบัตรประชาชนเพื่อลงทะเบียนผ่านแอปหมอพร้อม
เตรียมบัตรประชาชนเพื่อลงทะเบียนผ่านแอปหมอพร้อม
3.ศูนย์สุขภาพพร้อม สาขามีโชค เชียงใหม่
ศูนย์สุขภาพพร้อม สาขามีโชค เชียงใหม่ ให้บริการ โดยจะเริ่มเปิดให้บริการ (Soft openning) ในวันพฤหัสบดีที่ 11 กุมภาพันธ์ 2559 เปิดทำการทุกวันเวลา 07.30 – 20.00 น. (เปิดบริการทุกวันไม่เว้นวันหยุดนักขัตฤกษ์)
บริการเจาะเลือด ตรวจสุขภาพประจำปี ตรวจตามคำสั่งแพทย์ และเอกซเรย์ทรวงอก
วันจันทร์ – วันศุกร์ ระหว่างเวลา 07.30 – 12.00 น.
วันเสาร์ – วันอาทิตย์ ระหว่างเวลา 07.30 – 15.30 น.
บริการให้คำปรึกษาและให้การรักษาทางกายภาพบำบัด รวมถึงการตรวจคลื่นไฟฟ้าหัวใจ (EKG)
เปิดบริการทุกวัน ระหว่างเวลา 08.00 – 20.00 น.
การใช้สิทธิโรงพยาบาลใหม่
ผู้ประกันตนสามารถใช้สิทธิโรงพยาบาลใหม่ได้ หลังจากยื่นเรื่องแล้วจะสามารถใช้สิทธิ ณ โรงพยาบาลใหม่ได้ภายในวันที่ 1 และ 16 ของเดือน
สอบถามข้อมูลเพิ่มเติมเกี่ยวกับประกันสังคมได้ที่ www.sso.go.th หรือโทรสายด่วน 1506 ให้บริการทุกวัน ตลอด 24 ชั่วโมง
รพ.กรุงไทยปทุม อ.เมือง จ.ปทุมธานี
โรงพยาบาลกรุงไทย ปทุมเป็นโรงพยาบาลทั่วไป ขนาด 30 เตียง เปิดให้บริการเมื่อวันที่ 9 เดือนกันยายน พ.ศ. 2562 ที่ตั้ง สาขาปทุม 33 ม.3 ต.บางขะแยง อ.เมือง จ.ปทุมธานี 12000 เวลาทำการ เปิดบริการตลอด 24 ชม. โดยมีเป้าหมายเพื่อรองรับและให้บริการรักษาประชาชนในพื้นที่เมืองปทุมธานี โดยพร้อมด้วยศูนย์การแพทย์และแผนกรักษา 9 แผนก พร้อมห้องพักผู้ป่วยหลายขนาดที่มีสิ่งอำนวยความสะดวกที่เหมาะสม ครบทุกความต้องการของผู้เข้ารับการรักษา สอบถามโทร 02 822 9797
3.สุขภาพจิต/ ยาเสพติด จัดตั้งศูนย์มินิธัญญารักษ์ ดูแลผู้ป่วยจิตเวชและยาเสพติดทุกจังหวัด
จัดการประชุมวิชาการยาเสพติดแห่งชาติ ครั้งที่ 23 ณ อาคารอิมแพคฟอรั่ม เมืองทองธานี จังหวัดนนทบุรี พร้อมมอบนโยบายด้านการบำบัตรักษาและฟื้นฟูผู้ติดยาเสพติดของกระทรวงสาธารณสุข ยึดหลักการ "เปลี่ยนผู้เสพ เป็นผู้ป่วย" ให้เข้าสู่กระบวนการบำบัดและฟื้นฟู ขณะนี้ได้จัดตั้ง "มินิธัญญารักษ์" แล้ว 46 จังหวัด รวมโรงพยาบาล 76 แห่ง จำนวน 1,333 เตียง แบ่งเป็น การดูแลระยะกลาง (Intermediate Care :IMC) 42 แห่ง ดูแลระยะยาว (Long Term Care : LTC) 19 แห่ง ดูแลทั้งระยะกลางและระยะยาว 15 แห่ง รวมทั้งเปิดหอผู้ป่วยจิดเวชและ ยาเสพติดครบ 77 จังหวัด รวม 7,796 เตียง และจัดตั้งกลุ่มงานจิดเวชและยาเสพติดในโรงพยาบาลชุมชนครบ ทั้ง 755 แห่งมติรับทราบแนวทางดำเนินการจ่ายค่าใช้จ่ายกรณีบริการผ่าตัดด้วยหุ่นยนต์
บอร์ด สปสช. ได้มีมติรับทราบแนวทางดำเนินการจ่ายค่าใช้จ่ายกรณีบริการผ่าตัดด้วยหุ่นยนต์ โดยนำร่องให้บริการผู้ป่วยมะเร็ง 3 กลุ่ม ได้แก่ 1. มะเร็งต่อมลูกหมาก 2. มะเร็งลำไส้ใหญ่และลำไส้ตรง (ในกลุ่ม CA rectum, CA Anal Canal) และ 3. มะเร็งตับ ตับอ่อน และท่อน้ำดี (เริ่มในบริการ Whipple Operation) คาดการณ์ว่าจะมีกลุ่มเป้าหมายที่เป็นผู้ป่วยมะเร็งต่อมลูกหมากประมาณ 500 ราย ผู้ป่วยมะเร็งลำไส้ใหญ่และลำไส้ตรงประมาณ 50 ราย และมะเร็งตับ ตับอ่อนและท่อน้ำดี อีกประมาณ 50 ราย รวมผู้ป่วยที่เป็นกลุ่มเป้าหมายในการรับบริการทั้งหมดจำนวน 600 ราย ประมาณการณ์ค่าใช้จ่ายชุดอุปกรณ์ในการในการผ่าตัดหุ่นยนต์ประมาณ 100,000 บาทต่อราย รวมเป็นเงินงบประมาณทั้งหมดจำนวน 60 ล้านบาท
ทั้งนี้ หน่วยบริการที่จะร่วมให้บริการผ่าตัดด้วยหุ่นยนต์ในระบบบัตรทองฯ นี้ จะต้องผ่านการประเมินศักยภาพจากคณะกรรมการการพัฒนาระบบบริการผ่าตัดแผลเล็ก (MIS : Minimal Invasive Surgery) ที่กระทรวงสาธารณสุขแต่งตั้ง หรือคณะกรรมการอื่นตามที่ สปสช. กำหนด ส่วนหน่วยบริการภาครัฐ 7 แห่ง ที่ให้บริการผ่าตัดด้วยหุ่นยนต์อยู่แล้วในปัจจุบัน สามารถให้บริการต่อเนื่อง และถือว่าผ่านการประเมินแล้ว
“การผ่าตัดด้วยหุ่นยนต์ เป็นเทคโนโลยีและนวัตกรรมทางการแพทย์ที่ทันสมัย มีความแม่นยำในการผ่าตัด โดยเฉพาะตำแหน่งที่เข้าถึงได้ยาก ช่วยลดภาวะแทรกซ้อนในการผ่าตัดได้ ทำให้ผู้ป่วยมีความปลอดภัยในการรักษามากขึ้น มีระยะเวลาในการฟื้นตัวเร็วขึ้นทำให้พักรักษาตัวในโรงพยาบาลสั้นลง รวมทั้งลดการสัมผัสระหว่างผู้ป่วยและแพทย์ผู้ผ่าตัด ช่วยเพิ่มคุณภาพบริการและความปลอดภัยในการผ่าตัดให้กับประชาชน สิทธิประโยชน์นี้จึงนับเป็นประโยชน์ต่อประชาชนอย่างยิ่ง” นพ.ชลน่าน กล่าว
ด้าน นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวต่อว่า คณะอนุกรรมการกำหนดหลักเกณฑ์การดำเนินงานและการบริหารจัดการกองทุน สปสช. ได้มีมติเห็นชอบการเพิ่มรายการบริการผ่าตัดวันเดียวกลับและการผ่าตัดแผลเล็กเป็นสิทธิประโยชน์ในระบบบัตรทอง เมื่อวันที่ 18 ส.ค. 65 และได้มีผลการบริการตั้งแต่ 1 ต.ค. 2565 เป็นต้นมา ต่อมาในการประชุมคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุด สปสช. เมื่อวันที่ 19 ต.ค. 2566 ได้เห็นชอบข้อเสนอบริการการผ่าตัดด้วยหุ่นยนต์ในผู้ป่วยมะเร็ง 3 กลุ่มข้างต้น เพื่อเป็นบริการด้านการแพทย์และสาธารณสุขที่ควรสนับสนุนเพื่อสร้างความเป็นเลิศขั้นสูงสุดของไทย โดยมอบให้ สปสช. นำเข้ากระบวนการบริการ MIS และรายงานต่อคณะทำงานเพื่อทราบผลการดำเนินการ
ทั้งนี้ สปสช. ได้ร่วมกับคณะกรรมการการพัฒนาระบบบริการ การผ่าตัดแบบวันเดียวกลับ (One Day Surgery) และการผ่าตัด. แผลเล็ก (Minimally Invasive Surgery) ผู้เชี่ยวชาญจากราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย กรมบัญชีกลาง สำนักงานประกันสังคม และสำนักพัฒนาโรคร่วมไทย หารือแนวทางการให้บริการผ่าตัดด้วยหุ่นยนต์ ให้สอดคล้องกันทั้ง 3 กองทุน และนำมาสู่มติรับทราบของบอร์ด สปสช. ในวันนี้ โดยในขั้นต่อไป สปสช. จะหารือร่วมกับหน่วยงานที่เกี่ยวข้อง เพื่อกำหนดเงื่อนไข ข้อบ่งชี้ อัตราจ่าย และแนวทางการติดตามประเมินผลต่อไป
บริการผ่าตัดด้วยหุ่นยนต์ สำหรับผู้ป่วยมะเร็งบัตรทอง
25 ธ.ค. 2566 คณะกรรมการหลักประกันสุขภาพแห่งชาติ (บอร์ด สปสช.) ที่มี นพ.ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธาน มีมติรับทราบแนวทางดำเนินการจ่ายค่าใช้จ่ายกรณีบริการผ่าตัดด้วยหุ่นยนต์ โดยนำร่องให้บริการผู้ป่วยมะเร็ง 3 กลุ่ม ได้แก่
1. มะเร็งต่อมลูกหมาก
2. มะเร็งลำไส้ใหญ่และลำไส้ตรง (ในกลุ่ม CA rectum, CA Anal Canal) และ
3. มะเร็งตับ ตับอ่อน และท่อน้ำดี (เริ่มในบริการ Whipple Operation)
คาดการณ์ว่าจะมีกลุ่มเป้าหมายที่เป็นผู้ป่วยมะเร็งต่อมลูกหมากประมาณ 500 ราย ผู้ป่วยมะเร็งลำไส้ใหญ่และลำไส้ตรงประมาณ 50 ราย และมะเร็งตับ ตับอ่อนและท่อน้ำดี อีกประมาณ 50 ราย รวมผู้ป่วยที่เป็นกลุ่มเป้าหมายในการรับบริการทั้งหมดจำนวน 600 ราย ประมาณการณ์ค่าใช้จ่ายชุดอุปกรณ์ในการในการผ่าตัดหุ่นยนต์ประมาณ 100,000 บาทต่อราย รวมเป็นเงินงบประมาณทั้งหมดจำนวน 60 ล้านบาท
หน่วยบริการที่จะร่วมให้บริการผ่าตัดด้วยหุ่นยนต์ในระบบบัตรทองฯ นี้ จะต้องผ่านการประเมินศักยภาพจากคณะกรรมการการพัฒนาระบบบริการผ่าตัดแผลเล็ก (MIS : Minimal Invasive Surgery) ที่กระทรวงสาธารณสุขแต่งตั้ง หรือคณะกรรมการอื่นตามที่ สปสช. กำหนด
ส่วนหน่วยบริการภาครัฐ 7 แห่ง ที่ให้บริการผ่าตัดด้วยหุ่นยนต์อยู่แล้วในปัจจุบัน สามารถให้บริการต่อเนื่อง และถือว่าผ่านการประเมินแล้ว
“การผ่าตัดด้วยหุ่นยนต์ เป็นเทคโนโลยีและนวัตกรรมทางการแพทย์ที่ทันสมัย มีความแม่นยำในการผ่าตัด โดยเฉพาะตำแหน่งที่เข้าถึงได้ยาก ช่วยลดภาวะแทรกซ้อนในการผ่าตัดได้ ทำให้ผู้ป่วยมีความปลอดภัยในการรักษามากขึ้น มีระยะเวลาในการฟื้นตัวเร็วขึ้นทำให้พักรักษาตัวในโรงพยาบาลสั้นลง รวมทั้งลดการสัมผัสระหว่างผู้ป่วยและแพทย์ผู้ผ่าตัด ช่วยเพิ่มคุณภาพบริการและความปลอดภัยในการผ่าตัดให้กับประชาชน สิทธิประโยชน์นี้จึงนับเป็นประโยชน์ต่อประชาชนอย่างยิ่ง” นพ.ชลน่าน กล่าว
นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวต่อว่า คณะอนุกรรมการกำหนดหลักเกณฑ์การดำเนินงานและการบริหารจัดการกองทุน สปสช. ได้มีมติเห็นชอบการเพิ่มรายการบริการผ่าตัดวันเดียวกลับและการผ่าตัดแผลเล็กเป็นสิทธิประโยชน์ในระบบบัตรทอง เมื่อวันที่ 18 ส.ค. 65 และได้มีผลการบริการตั้งแต่ 1 ต.ค. 2565 เป็นต้นมา ต่อมาในการประชุมคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุด สปสช. เมื่อวันที่ 19 ต.ค. 2566 ได้เห็นชอบข้อเสนอบริการการผ่าตัดด้วยหุ่นยนต์ในผู้ป่วยมะเร็ง 3 กลุ่มข้างต้น เพื่อเป็นบริการด้านการแพทย์และสาธารณสุขที่ควรสนับสนุนเพื่อสร้างความเป็นเลิศขั้นสูงสุดของไทย โดยมอบให้ สปสช. นำเข้ากระบวนการบริการ MIS และรายงานต่อคณะทำงานเพื่อทราบผลการดำเนินการ
สปสช. ได้ร่วมกับคณะกรรมการการพัฒนาระบบบริการ การผ่าตัดแบบวันเดียวกลับ (One Day Surgery) และการผ่าตัด. แผลเล็ก (Minimally Invasive Surgery) ผู้เชี่ยวชาญจากราชวิทยาลัยศัลยแพทย์แห่งประเทศไทย กรมบัญชีกลาง สำนักงานประกันสังคม และสำนักพัฒนาโรคร่วมไทย หารือแนวทางการให้บริการผ่าตัดด้วยหุ่นยนต์ ให้สอดคล้องกันทั้ง 3 กองทุน และนำมาสู่มติรับทราบของบอร์ด สปสช. ในวันนี้ โดยในขั้นต่อไป สปสช. จะหารือร่วมกับหน่วยงานที่เกี่ยวข้อง เพื่อกำหนดเงื่อนไข ข้อบ่งชี้ อัตราจ่าย และแนวทางการติดตามประเมินผลต่อไป
ประเทศอียิปต์
EGYPT
1. Faculty of Medicine, Al Azhar University, Nasr City, Cairo Governate, Egypt
หลักสูตร 7 ปี (5 ปี + Clerkship 2 ปี) ปริญญา Bachelor of Science in Medicine and Surgery (MB Bch) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศอียิปต์และรับรองโรงพยาบาลหลักที่ใช้ใน การเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศอียิปต์ ดังนี้ 1. Al-Hussein Hospital 2. Sayed Galal Hospital
ว/ด/ป ที่ รับรอง 12 ธ.ค. 62 1
ว/ด/ป ครบอายุ การรับรอง 1 ธ.ค. 67จังหวัดร้อยเอ็ด
ร้านยา จ.ร้อยเอ็ด
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| D0266 |
ร้านเภสัชกรทาริกา |
7/8 |
เปรมประชาราษฎร์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
43515381 |
| D0267 |
ห้างหุ้นส่วนจำกัด บ้านหมอยาเภสัช |
41/8-9 ซอย 1 (ปัทมานนท์) |
ปัทมานนท์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0897130061 |
| D0268 |
ร้านห้องยาเภสัชกร |
35/6 |
หายโศรก |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
43512275 |
| D0269 |
ยาเภสัชกร |
4/13 |
เพลินจิต |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043515151 |
| D0270 |
ห้างหุ้นส่วนจำกัด ห้างขายยาวีระเภสัช |
271 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
43511713 |
| D0271 |
ยูมี แคร์ |
43 |
ปัทมานนท์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0814398383 |
| D0272 |
ร้านยาจริงใจ |
182/4 ซอย 8 |
ราชการดำเนิน |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0910608556 |
| D0273 |
คลังยาดีเภสัช |
201/4 |
ราชการดำเนิน |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0896196209 |
| D0458 |
ร้านขายยาเพรียว (Pure) สาขาร้อยเอ็ด |
320 |
|
เหนือเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043512275 |
| D1021 |
ประสิทธิ์เภสัช |
176/2 |
|
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
089620504 |
| D1022 |
Health up สาขาโรบินสันร้อยเอ็ด |
137 |
|
ดงลาน |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043540945 |
| D1023 |
มิตรยาเภสัช |
257/3 |
|
ขวัญเมือง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0895788440 |
| D1024 |
กนกวรรณฟาร์มา |
127 |
|
เกาะแก้ว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0982395587 |
| D1025 |
ธีระศักดิ์เภสัช 2 |
148/1 |
|
รอบเมือง |
หนองพอก |
ร้อยเอ็ด |
45210 |
0885610835 |
| D1026 |
บ้านยานิรชาเภสัช |
263 |
|
ขามเปี้ย |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0883403786 |
| D1027 |
บ้านยาอาจสามารถ |
93 |
|
อาจสามารถ |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0875972112 |
| D1028 |
ศูนย์รวมยาสุวรรณภูมิ |
440/1 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0854653439 |
| D1029 |
กรกนกเภสัช |
108 |
|
บัวแดง |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0885800999 |
| D1030 |
ณ บ้านยา |
168 |
|
เมยวดี |
เมยวดี |
ร้อยเอ็ด |
45250 |
096-3535295 |
| D1658 |
บ้านยาทรัพย์พานิช |
12/31 |
กองพล 10 |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0899829688 |
| D1659 |
หมอยาจังหาร |
153 |
|
ปาฝา |
จังหาร |
ร้อยเอ็ด |
45000 |
0833453797 |
| D1660 |
นัษฐิดาเภสัช |
6 |
|
นิเวศน์ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
043031376 |
| D1661 |
เภสัชกรจุฑาภรณ์ |
384/4 |
ประสานเมือง |
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0901926860 |
| D1664 |
อุ่นใจเภสัช |
178 |
|
หมูม้น |
เชียงขวัญ |
ร้อยเอ็ด |
45170 |
0845119448 |
| D1666 |
บ้านหมอยา |
151/1 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0898611931 |
| D1683 |
เอส.พี. ฟาร์มา |
223 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043031024 |
| D1730 |
เภสัชกรอริยะ |
409 |
รัตนวงษา |
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0939462565 |
| D2046 |
สิริแคร์ |
286 |
|
สระนกแก้ว |
โพนทอง |
ร้อยเอ็ด |
45110 |
0934971388 |
| D2347 |
วัตสันฟาร์มาซี สาขาโรบินสันร้อยเอ็ด |
137 |
|
ดงลาน |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
098-8292576 |
| D2365 |
เพื่อนเภ ฟาร์มาซี |
221/1 |
|
เกาะแก้ว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0929554519 |
| D2540 |
เอ็กซ์ต้า พลัส สาขาตลาดราชภัฏร้อยเอ็ด |
304 |
|
เกาะแก้ว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0845081077 |
| D2557 |
ยาไลออน |
33/1 |
กองพล 10 |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0636641556 |
| D2576 |
หมอยาเชียงขวัญ |
51 |
|
บ้านเขือง |
เชียงขวัญ |
ร้อยเอ็ด |
45000 |
080-9109971 |
| D2595 |
หมอยาหน้าค่าย |
190 |
|
สีแก้ว |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0933269333 |
| D2629 |
EVA PHARMA |
13 |
|
เกาะแก้ว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0959134112 |
| D2761 |
วี ฟาร์มาซี |
717 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0929159393 |
| D3035 |
ร้านขายยาโลตัส สาขาร้อยเอ็ด |
68 |
เทวาภิบาล |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043513420 |
| D3139 |
ร้านยามิดไนท์ |
55/33 |
ศรีเทวา |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0862187861 |
| D3236 |
ณัชชาฟาร์มาซี สาขาตลาดหายโศรก |
37/6-7 |
หายโศรก |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0900212224 |
| D3332 |
วุฒิไกรเภสัช |
74 |
|
บัวแดง |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0803570935 |
| D3369 |
สันติศักดิ์เภสัช |
1/11-12 |
เทศบาลบำรุง |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0814398383 |
| D3389 |
ร้านยาชื่นใจโอสถ |
412 |
ปัทมานนท์ |
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0631546595 |
| D3470 |
ปันยาฟาร์มาซี |
342/1 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0804022237 |
| D3491 |
ล้านยากองสุข |
265 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
091-8672038 |
| D3611 |
คลินิกยาเชียงขวัญ |
126/3 |
|
หมูม้น |
เชียงขวัญ |
ร้อยเอ็ด |
45000 |
0847433247 |
| D3674 |
ยาบ้านขอนแก่น |
209 |
|
ขอนแก่น |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0934645419 |
| D3759 |
ร้านขายยาหมอยาบ้านขวาว |
299 |
|
ขวาว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0902921069 |
| D3762 |
ศิริวัฒน์เภสัช |
388/1 |
|
กลาง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0934464641 |
| D3977 |
หมอยาคมดาว |
219 |
|
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0895839355 |
| D3983 |
วังยา |
58/15 |
สันติสุข |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0817081098 |
| D4083 |
กุสุมาลย์เภสัช |
15/3 |
|
เมยวดี |
เมยวดี |
ร้อยเอ็ด |
45250 |
0864651926 |
| D4133 |
ยาฟาร์มาซิส2 |
207/2 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0989429966 |
| D4134 |
ร้านยาดีดี |
580 |
|
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0942864555 |
| D4135 |
ร้านจิตติเภสัช |
176/3 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0850099499 |
| D4136 |
ร้านจิตติเภสัช |
176/3 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0850099499 |
| D4137 |
พนมไพรเภสัช |
176 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0992929876 |
| D4138 |
ร้านขายยาวิไลภรณ์เภสัช |
82 |
|
ปอภาร (ปอพาน) |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0953651577 |
| D4139 |
เทวกรเภสัช |
219/2 |
นิคมดำริห์ |
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0818720387 |
| D4140 |
ร้านยาสองพี่น้อง |
201/4 |
|
โพนทราย |
โพนทราย |
ร้อยเอ็ด |
45240 |
0885610762 |
| D4143 |
หมอยาวราภรณ์ |
212 |
|
สีแก้ว |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0807536036 |
| D4147 |
ศุภิญญาเภสัช |
288 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0942844449 |
| D4157 |
ร้านขายยาเภสัชกรทองย้อย |
3 |
|
เชียงใหม่ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0925569351 |
| D4159 |
บ้านยาจังหาร |
64/15 |
|
จังหาร |
จังหาร |
ร้อยเอ็ด |
45000 |
0646646259 |
| D4163 |
บ้านยานุจรินเภสัช |
59/2 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0946199462 |
| D4165 |
เภสัชกรภณิชชา |
514 |
|
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0955639924 |
| D4170 |
ธนะโรจน์โอสถ |
37/11-12 |
หายโศรก |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0894190723 |
| D4175 |
ส.เจริญทรัพย์เภสัช |
465 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0878229168 |
| D4180 |
บ้านหมอยา ฟาร์มาซี |
18 |
|
ดงแดง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0863930971 |
| D4184 |
คลังยาเมืองพรหมกาญจน์ศิริญเภสัช |
219/1 |
|
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0883393353 |
| D4195 |
ใส่ใจเภสัช |
18/3 |
|
โพธิ์สัย |
ศรีสมเด็จ |
ร้อยเอ็ด |
45280 |
0832641236 |
| D4197 |
หัวโทนเภสัช |
109 |
|
หัวโทน |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0878596788 |
| D4200 |
หมอยาไทย |
115 |
|
นิเวศน์ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0935395425 |
| D4202 |
บ้านยาใกล้หมอ |
25/56-57 |
มีโชคชัย |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0653926553 |
| D4209 |
หญิงฟาร์มาซี |
562 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0931459426 |
| D4212 |
เสลภูมิเจริญเภสัช |
179 |
|
ขวัญเมือง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0931256995 |
| D4214 |
วชิระเภสัช |
186/7-8 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0836858012 |
| D4244 |
ร้านยาเอ็กซ์ต้า พลัส สาขาบายพาสรอบเมืองร้อยเอ็ด |
700 |
|
ดงลาน |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0845088923 |
| D4273 |
จุลเภสัช |
2/8 ซอย ราชการดำเนิน 12 |
ราชการดำเนิน |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0879440476 |
| D4276 |
บูรพาคลังยา |
599 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0626499463 |
| D4281 |
สาธิกาเภสัช |
360/1 |
|
บัวแดง |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0973348837 |
| D4305 |
ร้ายยาเภสัชหนองฮี |
123/2 |
|
หนองฮี |
หนองฮี |
ร้อยเอ็ด |
45140 |
0821200091 |
เริ่มที่ ศ.ดร.สมปอง คล้ายหนองสรวง ผู้อำนวยการ หน่วยบริหารและจัดการทุนด้านการพัฒนากำลังคน และทุนด้านการพัฒนาสถาบันอุดมศึกษา การวิจัยและการสร้างนวัตกรรม (บพค.) กล่าวว่า “เป้าหมายสูงสุดของ บพค. ก็คือการที่เห็นคนไทยมีสุขภาพที่ดีเข้าสู่สังคมผู้สูงวัยด้วยเป้าหมายที่ทางร่างกายและจิตใจสุขภาพแข็งแรงเป็นผู้สูงวัยที่เปลี่ยนแปลงอนาคตของประเทศได้ และภายในสามปีนี้เราจะได้เห็นประโยชน์ที่เกี่ยวกับ สุขภาพของคนไทยหรือคอมมูนิตี้ ที่เป็น Personal AI อย่างแน่นอน”
นพ.ศรัณย์ จินดาหรา แพทย์ผู้เชี่ยวชาญด้านกระดูกสันหลัง โรงพยาบาล เอส สไปน์ แอนด์ เนิร์ฟ เผยว่าภายในงานได้มีโอกาสนำเสนอการผ่าตัดส่องกล้องรักษาโรคหมอนรองกระดูกสันหลังส่วนอกกดทับเส้นประสาท Percutaneous Stenoscopic Thoracic Decompression : PSTD ซึ่งการผ่าตัดด้วยวิธีนี้ยากมาก เพราะเป็นช่วงที่ใกล้กับอวัยวะสำคัญของร่างกาย และโรคนี้เกิดขึ้นกับคนไทยน้อยมากอาจจะพบอยู่บ้างประมาณสัก 5% ซึ่งระดับความรุนแรงของโรคนี้ ถ้าเกิดขึ้นแล้วอาจจะทำให้มีปัญหาเกี่ยวกับการเดินไม่ได้ ขาอ่อนแรง หรือขาเกร็ง ทรงตัวไม่ได้ เดินแล้วจะล้ม ซึ่งการผ่าตัดแบบเดิมนั้นจะต้องผ่าเปิดแผลอย่างเดียวเท่านั้น และมีการเชื่อมด้วยอุปกรณ์พวกสกรูหรือว่าเหล็กดาม แต่ในปัจจุบันเราสามารถเปลี่ยนมาเป็นการผ่าตัดที่เล็กลง ผ่านกล้องเอ็นโดสโคป ซึ่งสามารถให้ผลลัพธ์ที่ใกล้เคียงกันโดยไม่ต้องมีการผ่าตัดใหญ่ ไม่ต้องมีการยึดเหล็กเชื่อม ทำให้คนไข้สามารฟื้นตัวได้ไวกว่าเดิมหลายเท่า
สำหรับโรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ซึ่งถือได้ว่าเป็นโรงพยาบาลเฉพาะทางด้านกระดูกสันหลังแห่งเดียวและแห่งแรกในประเทศไทย ที่มีจุดแข็งที่เด่นชัด คือ การมีทีมแพทย์และพยาบาลเฉพาะทางโรคปวดหลังที่เกิดจากกระดูกสันหลังและระบบประสาทโดยเฉพาะ ทำให้รู้ลึก รู้จริง สามารถรักษาได้อย่างตรงจุด ประกอบกับการนำเอานวัตกรรมสมัยใหม่จากทั่วโลกเข้ามาช่วยในการรักษา ตอบโจทย์ผู้ป่วยที่มีเวลาน้อย และยังฟื้นตัวได้เร็ว ไม่ทรมานเหมาะสำหรับผู้ป่วยที่กลัวการผ่าตัด
โรคซึมเศร้าในเด็ก
โรคซึมเศร้าในเด็ก : พ่อแม่หลายท่านมักจะกังวลว่าเมื่อลูกเราโตขึ้นจนกระทั่งเริ่มเข้าสู่วัยเรียน อาจมีการปรับตัวเข้าสู่สังคม การใช้ชีวิตของลูกเราจะเป็นอย่างไรบ้าง บางครั้งลูกๆ อาจพบความเครียดจนกระทั่งความเครียดสะสม มีพฤติกรรมที่เปลี่ยนไป ด้วยความเข้าใจในความวิตกนี้ จึงอยากบอกถึงเรื่องโรคซึมเศร้า เพื่อให้พ่อแม่สามารถสังเกตลูกตัวเองได้ เป็นการรับมือให้ทันกับอารมณ์ที่เปลี่ยนไปของลูก
ปัจจัยที่ส่งผลต่อโรคซึมเศร้าในเด็ก
ปัจจัยทางการยภาพ
สาเหตุจากกรรมพันธ์ : มีความเสี่ยงที่จะเทำให้เด็กเกิดโรคซึมเศร้าได้
สาเหตุจากเคมีในสมองไม่สมดุล : เป็นสาเหตุพื้นฐานของผู้ป่วยโรคซึมเศร้า
สาเหตุจากโรคบางชนิด : เช่น โรคเกี่ยวกับหลอดเลือดในสมอง โรคพาร์กินสัน
ปัจจัยทางจิตใจ
สาเหตุจากผู้ปกครอง : เด็กถูกเลี้ยงดูอย่างเข้มงวดจนเกินไป หรือถูกบังคับมากจนเกินไป
สาเหตุจากเพื่อน : ถูกเพื่อนกลั่นแกล้งเป็นประจำเวลาอยู่ที่โรงเรียน
สาเหตุจากตัวเอง : เช่น โรคขาดความมั่นใจในตัวเองจนรู้สึกกับตัวเองในแง่ลบ
สาเหตุจากอดีต : เกิดจากการจดจำเรื่องราวเลวร้าย เช่น การถูกทำร้ายร่างกาย
วิธีสังเกตว่าลูกเป็นโรคซึมเศร้าหรือไม่
ไม่ร่าเริงเหมือนก่อน
มีอาการเศร้าซึม จากที่เมื่อก่อนก็ร่าเริงเป็นปกติ อาการเหล่านี้จะสามารถสังเกตุได้ง่ายมากที่สุด
ไม่อยากอาหาร / ทานอาหารมากเกินไป
ไม่อยากอาหาร น้ำหนักลดลงหรือในขณะที่บางรายก็ทานอาหารมากเกินไป
มีอาการป่วย นอนไม่หลับ
บางครั้งเด็กก็ไม่สามารถประมวลความรู้สึกออกมาได้ว่า สิ่งที่กำลังเกิดอยู่นั้นคือ "ความเศร้า"
เฉื่อยชา สมาธิสั้น
เฉื่อยชา ไม่มีสมาธิในการเรียน ความจำแย่ลง เด็กมีอาการสมาธิสั้นลง
รู้สึกว่าตนเองไร้ค่า
รู้สึกผิด โทษตัวเอง รู้สึกว่าตนเองไร้ค่า บางคนถึงขนาดอยากฆ่าตัวตาย
ข้อมูลจาก สถาบันสุขภาพจิตเด็กและวัยรุ่นราชนครินทร์ (กรมสุขภาพจิต กระทรวงสาธารณสุข)
SMC Clinic คลินิกกุมารเวช นอกเวลาราชการ รพ.แกลง
คลินิกมลพิษทางอากาศ โรงพยาบาลเจริญกรุงประชารักษ์
คลินิกมลพิษทางอากาศ โรงพยาบาลเจริญกรุงประชารักษ์ (กลุ่มงานอาชีวเวชกรรม) ชั้น 22 อาคาร 72 พรรษา มหาราชินี เปิดให้บริการ 1) ด้านการตรวจวินิจฉัยและติดตามอาการผู้ป่วยจากการสัมผัสมลพิษทางอากาศ 2) ด้านการให้คำปรึกษาและคัดกรองภาวะสุขภาพจากการสัมผัสมลพิษทางอากาศ 3) ด้านวิชาการและการรายงานสถานการณ์คุณภาพอากาศประจำวัน 4) ให้บริการปรึกษาปัญหาสุขภาพทุกวันและเวลาราชการ 5) ให้บริการพบแพทย์อาชีวเวชศาสตร์ ทุกวันพุธ ตั้งแต่เวลา 13.00-15.00 น. สอบถามโทร. 02-2897221 / 7198
กายภาพบำบัด นัดออนไลน์ ผ่านแอปพลิเคชันหมอพร้อม
กายภาพบำบัด เปิดบริการนัดออนไลน์ #ผ่านแอปพลิเคชันหมอพร้อม
บริการรักษาฟื้นฟู ด้วยเครื่องมือทันสมัย และหัตถการกายภาพบำบัด
**(เฉพาะผู้ป่วยรายเก่าที่เคยผ่านการวินิจฉัยของแพทย์ รพ.บางบ่อแล้ว
ติดต่องานกายภาพบำบัด กลุ่มงานเวชกรรมฟื้นฟูตามเวลานัดหมาย) **
ติดต่อสอบถามเพิ่มเติมโทร 02-3381133 , 02-338-1065 ต่อ 0
เจ็บป่วยฉุกเฉินโทร.สายด่วน 1669
โรงพยาบาลปทุมธานี แนะโทร 1669 สำหรับกรณีฉุกเฉิน จะดีที่สุด เพราะ 5 เหตุผลสำคัญ คือ ได้มาตรฐาน มีความพร้อม ลดบาดเจ็บซ้ำ มีความรวดเร็ว และ ไม่มีค่าใช้จ่าย บริการฉุกเฉิน 1669 เป็นสิทธิพื้นฐานของคนไทยทุกคนที่จะได้รับการดูแลเมื่อเกิดเหตุฉุกเฉิน
แพทย์แผนไทยและการแพทย์ทางเลือก โรงพยาบาลกลาง เปิดให้บริการ วันจันทร์ – วันศุกร์
กลุ่มงานการแพทย์แผนไทยและการแพทย์ทางเลือก โรงพยาบาลกลาง เปิดให้บริการ วันจันทร์ – วันศุกร์
หยุดวันเสาร์ วันอาทิตย์ และวันหยุดนักขัตฤกษ์
เปิดให้บริการในเวลาราชการ 08.00 - 16.00 น.
เปิดให้บริการนอกเวลาราชการ 16.00 - 20.00 น.
(นอกเวลาราชการ จะเป็นระบบนัดเท่านั้น)
เปิดให้บริการ ดังนี้
1. ตรวจวินิจฉัยโรคทางแพทย์แผนไทย / แพทย์แผนไทยประยุกต์/แพทย์แผนจีน
2. นวดหัตถบำบัด
3. ประคบสมุนไพร
4. นวดหัตถบำบัด + ประคบสมุนไพร
5. อบสมุนไพรทั่วร่างกาย
6. ดูแลมารคาหลังคลอด
7. คลินิกแพทย์แผนไทยใส่ใจเข่าเสื่อม
8. คลินิกสักยาน้ำมันสมุนไพร
9. ปรับกระดูก
10. บ่งต้อหนามหวานด้วยศาสตร์การแพทย์ทางเลือก
11. ศาสตร์การแพทย์แผนจีน
12. จ่ายยาสมุนไพรตามอาการ โดยแพทย์แผนไทย แพทย์แผนไทยประยุกต์ /แพทย์แผนจีน
13.จำหน่ายผลิตภัณฑ์ส่งเสริมสุขภาพ
ขั้นตอนการเข้ารับการรักษา
1. ยืนบัตรลงทะเบียนเข้ารับการรักษา ตรงเวชระเบียนทุกครั้ง
2. ชำระค่าบริการทางการแพทย์ ตามสิทธิ
3. ลงทะเบียนคัดกรอง แจ้งชื่อ – สกุล ก่อนเข้ารับการรักษา
4. พบแพทย์ ตรวจวินิจฉัย
5. เข้ารับการรักษา
6. ชำระค่ารักษา
สอบถามรายละเอียดเพิ่มเติม กลุ่มงานการแพทย์แผนไทยฯ
โทร 02-220-8000 ต่อ 22120 , 22121 หรือ 095-625-9882
ชวนสตรีไทยตรวจคัดกรองมะเร็งปากมดลูกด้วยตนเอง
โรงพยาบาลจุฬาภรณ์ ร่วมรณรงค์เชิญชวนสตรีไทยอายุระหว่าง 30-59 ปี เข้ารับบริการตรวจคัดกรองมะเร็งปากมดลูกด้วยตนเอง HPV DNA Self-sampling ฟรี “เลิกเขิน เลิกอาย ไม่ต้องขึ้นขาหยั่ง” ซึ่งเป็นชุดสิทธิประโยชน์ภายใต้โครงการกองทุนส่งเสริมสุขภาพและป้องกันโรคในระบบหลักประกันสุขภาพแห่งชาติ โดยมีสำนักอนามัย กรุงเทพมหานคร โดยศูนย์บริการสาธารณสุข 53 ทุ่งสองห้องเข้าร่วมให้บริการประชาชน ตรุษจีนปลอดภัย ปรับการไหว้ ลดการเผา
ตรุษจีนปลอดภัย ปรับการไหว้ ลดการเผา จะช่วยลดอันตรายได้มากที่จะเกิดจาก การจุดธูป การจุดประทัด การเผากระดาษเงินกระดาษทอง อาหารคาวหวาน
การป้องกัน
- ใช้ธูปให้สั้นลง ไม่จุดธูปบนอาหาร หรือเปลี่ยนมาใช้ธูปไฟฟ้า
- จุดประทัด ให้ห่างจากตัว จุดให้ห่างไกลจากเด็กเล็กและผู้สูงอายุ เตรียมน้ำไว้ดับเมื่อเกิดเหตุฉุกเฉิน
- เผากระดาษเงิน/ทอง นอกอาคาร หรือเผาในภาชนะที่มีฝาปิด
- ซื้ออาหารสด ใหม่ สะอาด ปรุงอาหารให้สุก ป้องกันการได้รับอาหารเป็นพิษ
Operation Transformation


นพ.นิพัฒน์ กุหลาบขาว รองประธานเจ้าหน้าที่บริหารสายงานปฏิบัติการ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ในเรื่อง Operation Transformation โรงพยาบาลบำรุงราษฎร์ได้มีการนำระบบ Digital Healthcare มาใช้ เพื่อเพิ่มศักยภาพ และให้ผลลัพธ์ในการรักษาที่ดีที่สุดสำหรับผู้ป่วย เพื่อการให้บริบาลแก่ผู้ป่วยอย่างปลอดภัย ถูกต้อง และรวดเร็ว และมุ่งเน้นในการดูแลผู้ป่วยอย่างครบวงจร และไร้รอยต่อ โดยเริ่มตั้งแต่ก่อนผู้ป่วยมาถึงโรงพยาบาล ในช่วงเวลาที่ผู้ป่วยรับการรักษาตัวอยู่ในโรงพยาบาล และรวมถึงหลังจากที่เสร็จสิ้นการรักษาไปแล้ว โดยระบบ Digital Healthcare ที่เราใช้อยู่นี้ จะมีการ update ระบบให้ทันสมัย และมีประสิทธิภาพอยู่ตลอด เช่น ระบบจัดเก็บเวชระเบียนอิเล็กทรอนิกส์แบบ EMR (Electronic Medical Record) เพื่อช่วยให้ทีมแพทย์เฉพาะทางของเรา และทีมสหสาขาวิชาชีพอื่นๆ เช่น พยาบาล เภสัช นักรังสีเทคนิค นักกายภาพ เป็นต้น ได้สามารถเข้าถึงข้อมูลสุขภาพและแผนการรักษาของผู้ป่วยได้อย่างรวดเร็ว แม่นยำ และเป็นระบบ ทั้งนี้ก็เพื่อประโยชน์สูงสุดต่อผู้ป่วย และยังเป็นการเพิ่มประสิทธิภาพในกระบวนการการสื่อสารทั้งภายใน และภายนอกองค์กรของเราอีกด้วย นอกจากนี้ เรามี Bumrungrad Application ที่ใช้ในการสื่อสารและให้ข้อมูลแก่ผู้ป่วย โดยมีด้วยกันหลายภาษาหลักตามกลุ่มผู้ป่วยของเรา ทั้งไทย อังกฤษ อารบิค พม่า จีน ญี่ปุ่น โดยเทคโนโลยีต่าง ๆ ที่นำมาใช้ในการ Transform Operation นี้จะมุ่งเน้นในเรื่องของการเพิ่ม operation efficiency ซึ่ง focus อยู่ 4 ข้อหลัก ๆ โดยยึดหลักของ F A S T; Friendly use, Accuracy, Safety – patient, Timeliness
แนวปฏิบัติการลดอันตรายจากการใช�ยาเสพติด เน�นการปฏิบัติที่เข�าถึงตัวบุคคล โดยคํานึงถึงศักดิ์ศรีของความเป#นมนุษย� มนุษยธรรม สิทธิมนุษยชน ความเข�าใจธรรมชาติของผู�ใช�ยาเสพติดบนพื้นฐานของคุณภาพชีวิต สุขภาพของบุคคลและชุมชน ซึ่งแนวปฏิบัติการลดอันตรายจากการใช�ยาเสพติด จะเป#นชุดบริการที่หลากหลายที่ผู�ให�บริการทางสุขภาพ สามารถคัดสรรค�เพื่อเสนอเป#นทางเลือกให�กับผู�ใช�ยาเสพติดในแตละสถานการณ�และแตละโอกาส โดยคํานึงถึง ความแตกตางกันตามป$จเจกบุคคล สําหรับแนวปฏิบัติด�านการลดอันตรายจากยาเสพติดแบบรอบด�าน ประกอบด�วย 16 ชุดบริการ ดังนี้ (คําสั่งศูนย�อํานวยการปAองกันและปราบปรามยาเสพติดแหงชาติที่ 2/2560 ลงวันที่ 17 กุมภาพันธ� 2560 เรื่อง แนวทางการดําเนินงานลดอันตรายจากยาเสพติด (Harm Reduction) ประกอบด�วย 1. การให�บริการด�านยาเสพติด 1) การให�ความรู�และให�คําปรึกษาแนะนําเกี่ยวกับยาเสพติด เพื่อสร�างความเข�าใจ ความตระหนัก และการประเมินความเสี่ยงของตนเอง รวมถึงการฝWกทักษะการปAองกันยาเสพติด 2) การบําบัดรักษายาเสพติดโดยใช�ยาและสารทดแทนระยะยาว เชน การบําบัดรักษาโดยใช�เมทาโดน ทดแทนระยะยาว (Methadone Maintenance Therapy: MMT) ตามมาตรฐานทางการแพทย� 3) การจัดให�มีบริการปAองกันและดูแลรักษาอาการจากการใช�ยาเกินขนาดในพื้นที่ดําเนินการ เชน การให�บริการ Naloxone เป#นต�น 4) การสงเสริมและสนับสนุนให�กลุมเปAาหมายสมัครใจเข�ารับบําบัดรักษาและฟQRนฟูสมรรถภาพ ผู�ติดยาเสพติดจนสามารถเลิกใช�ยาเสพติดได�ในที่สุด 2. การให�บริการด�านสุขภาพกายและจิต 1) การให�ความรู�เพื่อสร�างความเข�าใจ ความตระหนัก และการประเมินความเสี่ยงของตนเอง รวมถึงการฝWกทักษะการปAองกันการติดเชื้อเอชไอวี โรคติดตอทางเพศสัมพันธ� วัณโรค และไวรัสตับอักเสบบี และซี 2) การให�คําปรึกษา และตรวจการหาเชื้อเอชไอวีโดยสมัครใจ (VCT) และสงตอเข�ารับบริการ ดูแลรักษาด�วยยาต�านไวรัส 3) การให�คําปรึกษา ตรวจหาและสงตอเข�ารับบริการดูแลรักษาการติดเชื้อไวรัสตับอักเสบบี และซี 4) การสนับสนุนให�ใช�เข็มและอุปกรณ�ฉีดที่สะอาด 5) การแจกถุงยางอนามัย 6) การตรวจและรักษาโรคติดตอทางเพศสัมพันธ� 7) การปAองกัน วินิจฉัย และรักษาวัณโรค. 8) การให�บริการรักษาด�านจิตเวช 3. การให�บริการด�านสังคม 1) การเยี่ยมบ�านรายบุคคล โดยอาสาสมัครภาคประชาสังคม และเจ�าหน�าที่ภาครัฐ 2) กิจกรรมเพื่อนชวยเพื่อน ทั้งในลักษณะกิจกรรมกลุม กิจกรรมบําเพ็ญประโยชน� กิจกรรมบริการสังคม 3) จัดให�มีพื้นที่ที่ปลอดภัย (Drop in center) ในการดําเนินกิจกรรมลดอันตรายจากการใช�ยาเสพติด โดยเน�นการมีสวนรวมของชุมชน 4) จัดบริการให�คําปรึกษาด�านกฎหมาย แกกลุมเปAาหมายและผู�ปฏิบัติงานในพื้นที่
ข้อเสนอเพื่อแก้ปัญหา
1. สปสช ควรจัดกลไกการรับผิดชอบผลจากการประเมินวงเงินและการบริหารผิดพลาด และถ้าผลการเบิกค่าบริการปลายปีเพิ่มมากเกินวงเงินจากการเพิ่มสิทธิประโยชน์ สปสช.ต้องของบประมาณเพิ่มเติมเพื่อเยียวยา
2. การตั้ง Provider board เพื่อให้เกิดความเป็นธรรมกับทุกฝ่าย มีการถ่วงดุลย์อำนาจระหว่างกองทุนและหน่วยบริการ ใช้ข้อมูลการบริการจริงในการคำนวณวงเงิน
3. หยุดใช้ Model 5 ใน กทม กลับไปใช้ Model 2 โดยเร็ว และจัดสรรเงินค่าบริการผู้ป่วยนอกให้เพียงพอสำหรับการบริการอีก 8 เดือนที่เหลือในปีงบประมาณ 2567 และจ่ายเงินค่าบริการทางการแพทย์ในอัตราปกติ
4. ระมัดระวังการขยายการบริหารที่มีลักษณะคล้าย Mode! 5 ออกไปนอก กทม
โรงพยาบาลสิงห์บุรี เปิดให้ประชาชนชาวสิงห์บุรี ลงทะเบียน Health ID
โรงพยาบาลสิงห์บุรี เปิดให้ประชาชนชาวสิงห์บุรี ลงทะเบียน Health ID ที่จุดลงทะเบียนหน้าห้องประชาสัมพันธ์ (แผนกติดต่อสอบถาม) ชั้น 1 อาคารหลวงพ่อแพ เขมังกโร ซึ่งจะมีเจ้าหน้าที่ของโรงพยาบาลสิงห์บุรี บริการรับลงทะเบียน ภาคเช้าตั้งแต่เวลา 9-12.00 น. ภาคบ่ายตั้งแต่เวลา 13-16.30 น. (ในวันราชการ) ผู้รับบริการต้องนำบัตรประชาชนและโทรศัพท์มือถือ มาเพื่อใช้ในการลงทะเบียน
3.ข้อมูลละเอียด
ข้อมูลละเอียดไว้ดีมาก ได้แก่วันเวลาสถานที่ให้บริการ จำนวนการให้บริการ บริการที่มี รวมทั้งเบอร์โทรติดต่อ และแผนที่
อีกหนึ่งกิจกรรมในวันนี้ คือการวาดภาพศิลปะบนผนังห้องกิจกรรม ของน้องๆ กลุ่มศิลปินเด็กและเยาวชนจากมูลนิธิ ออทิสติกไทย หรือกลุ่ม Artstory (อาร์ต สตอรี่) ถ่ายทอดภาพวาดจากแรงบันดาลใจ หลังจากได้ไปทัศนศึกษาที่ศูนย์การเรียนรู้เกษตรฯ ของโรงไฟฟ้าหนองแซง จ.สระบุรี ทำให้บรรยากาศภายในอาคารมีชีวิตชีวา และเป็นมิตรกับเด็ก ๆ มากขึ้น ตอกย้ำพันธกิจของ GULF ภายใต้แนวคิด “Powering the Future, Empowering the People” ที่มุ่งดำเนินธุรกิจควบคู่ไปกับการยกระดับคุณภาพชีวิตของคนในสังคมอย่างยั่งยืน
ทั้งนี้ การขับเคลื่อนไปสู่การปฏิบัติต้องทำให้เกิดการบูรณาการแผนและงบประมาณ เชิงพื้นที่ของส่วนกลาง ส่วนภูมิภาคและส่วนท้องถิ่น ซึ่งในส่วนภูมิภาคมีงบประมาณของจังหวัดนั้น การสนับสนุนการพัฒนาระบบการบริหารราชการที่เกี่ยวข้อง โดยควรกำหนดให้คณะกรรมการบริหารงาน จังหวัดแบบบูรณาการ (ก.บ.จ.) จัดให้มี "แผนงาน โครงการและงบประมาณสนับสนุนการพัฒนาระบบ การจัดการตำบลเข้มแข็งแบบมีหุ้นส่วน" ในระดับตำบลอย่างเป็นรูปธรรมและต่อเนื่อง และสนับสนุนให้ อำเภอและตำบลใช้เครื่องมือหรือองค์ความรู้หรือวิธีการจัดการตำบลเข้มแข็งและการจัดทำแผนตำบล เชิงคุณภาพ
3. ‘เทศกาลฯ’ ออกแบบ ‘เมือง’ ให้ ‘น่าอยู่’ ขึ้น


เทศกาลฯ ยังเป็นพื้นที่ที่ทำให้บทสนทนาเรื่องการออกแบบและพัฒนาเมือง ขยายวงออกไปไกลกว่าแค่ในวงการออกแบบ และทำให้ประเด็นเรื่องความคิดสร้างสรรค์และการออกแบบเข้าถึงผู้คนที่หลากหลายได้ง่ายขึ้น เช่น โปรเจกต์ Re-Vendor เจริญกรุง 32 (ปี 2566) โมเดลทดลองการจัดการสตรีทฟู้ดริมทางย่านเศรษฐกิจสร้างสรรค์ ซอยเจริญกรุง 32 ที่นำทีมโดย Cloud-floor (คลาวด์ฟลอร์) บริษัทสถาปนิกที่ให้ความสำคัญเรื่องการพัฒนาเมืองและพื้นที่สาธารณะ ใช้โอกาสของเทศกาลฯ ชักชวนผู้ที่เกี่ยวข้องกับการจัดการสตรีทฟู้ดให้เข้ามามีส่วนร่วม ทั้งภาครัฐ ตัวแทนเทศกิจ ตัวแทนผู้ค้า และตัวแทนผู้ซื้อ และนำไอเดียจากทุกฝ่ายมาสร้างเป็นโมเดลทดลองในซอยเจริญกรุง 32 ช่วงที่มีการจัดเทศกาลฯ ผู้ที่แวะมาเที่ยวเทศกาลฯ ก็มีโอกาสได้ทดลองผลงานต้นแบบและให้ฟีดแบ็กเพื่อปรับปรุงโปรเจกต์ให้ดียิ่งขึ้น เทศกาลฯ จึงช่วยสร้างการมีส่วนร่วมในการให้ไอเดียการพัฒนาเมืองไม่ได้จบอยู่ที่เพียงคนกลุ่มใดกลุ่มหนึ่ง แต่ทุกคนสามารถมีส่วนร่วมได้ ปัจจุบันโปรเจกต์นี้ยังคงพัฒนาต่อ และโปรเจกต์ที่ถือเป็นความสำเร็จของเทศกาลฯ ในการนำผลงานไปต่อยอด คือโปรเจกต์ภายใต้โครงการพัฒนาป้ายรถประจำทางในย่านเจริญกรุง (ปี 2561) ที่เรียกได้ว่าเป็นป้ายรถเมล์ที่เปลี่ยนเมืองให้น่าอยู่มากขึ้น โดยกลุ่มนักออกแบบ MAYDAY! ร่วมกับ CEA และสำนักการจราจรและขนส่ง โดยมีการทำเวิร์กช็อปสร้างสรรค์ป้ายรถเมล์จากความต้องการของผู้ใช้งาน จนเกิดเป็นป้ายรถเมล์ที่ส่งต่อให้กรุงเทพมหานครได้นำไปใช้งานได้จริงในปัจจุบัน
นอกจากความปลอดภัย หายจากโรคแล้ว ยังคำนึงถึงความสวยงามของเต้านม
นพ. ธีรภพ ไวประดับ แพทย์ชำนาญการด้านศัลยศาสตร์เต้านม โรงพยาบาลบำรุงราษฎร์ เปิดเผยว่า ความปลอดภัยในการผ่าตัดและคุณภาพชีวิตของผู้ป่วยหลังการผ่าตัด เป็นหัวใจหลักในการดูแลรักษา เรามีตัวเลขที่ยืนยันถึงผลสำเร็จต่างๆ ในปีที่ผ่านมา เช่น การติดเชื้อหลังผ่าตัดมะเร็งเต้านม 0%, การเกิดภาวะแทรกซ้อนน้อยกว่า 1% ที่ต้องผ่าตัดซ้ำภายใน 72 ชั่วโมง, ผู้ป่วยสามารถเคลื่อนไหวข้อไหล่ หัวไหล่หลังผ่าตัดได้ทันที ผ่านโปรแกรมการทำกายภาพบำบัดก่อน-หลัง และมีการติดตามผลการรักษาหลังผ่าตัดเพื่อให้ข้อไหล่มีการเคลื่อนไหวได้ มากกว่า 90 องศา ได้ 100%
ทั้งนี้ การผ่าตัดมะเร็งเต้านม นอกจากความปลอดภัยของผู้ป่วยในการรักษาโรคให้หายขาด เรายังคำนึงถึงความสวยงามของเต้านม เพื่อรักษาอวัยวะที่ช่วยเพิ่มความมั่นใจให้กับผู้หญิงไว้อย่างดีที่สุด โดยเราสามารถทำการผ่าตัดมะเร็งเต้านมออกแล้วเสริมใหม่ได้ทุกรูปแบบของเต้านม ทั้งใช้เนื้อเยื่อหน้าท้อง เนื้อเยื่อด้านหลัง หรือการใช้ซิลิโคน แม้แต่คนที่เคยผ่าตัดเต้านมออกไป 1 ข้าง แล้วอยากเสริมใหม่อีก 1 ข้าง เราก็สามารถทำให้ทั้ง 2 ข้างเท่ากันได้
อัตราค่าบริการ ในการฝังเข็ม
อัตราค่าบริการ ในการฝังเข็ม คลินิกแพทย์แผนจีน ครั้งละ 350 บาท
แพทย์แผนจีน เปิดบริการทุกวันอังคารและวันพุธ เวลา 8.00 น -15.00 น. ที่โรงพยาบาลปากเกร็ดถนน345
คลินิกมลพิษ โรงพยาบาลศรีสังวาลย์ ประชาชนใช้ประเมินอาการเบื้องต้นหากป่วยจากมลพิษ
คลินิกมลพิษ โรงพยาบาลศรีสังวาลย์ รูปแบบออนไลน์ Web Application สำหรับให้ประชาชนใช้ประเมินอาการเบื้องต้นหากป่วยจากมลพิษทางอากาศ กรอกประวัติผ่านฟอร์ม และรับคำแนะนำการดูแลสุขภาพเบื้องต้น
UMSC โรงพยาบาลเจริญกรุงประชารักษ์
UMSC โรงพยาบาลเจริญกรุงประชารักษ์ Line ID: @ckphosp พร้อมตอบทุกคำถาม!!
✅สอบถามปัญหาสุขภาพ
✅สอบถามการบริการ
✅พบแพทย์ออนไลน์ Telemedicine
✅อาการเจ็บป่วยฉุกเฉิน
✅ศูนย์ข้อมูลข่าวสาร รพ.เจริญกรุงประชารักษ์
✅นัดหมายการตรวจล่วงหน้า
✅จองคิวรถตู้ รับ - ส่ง ผู้ที่มีปัญหาด้านการเคลื่อนไหว
✅ รับเรื่องร้องเรียน และร้องทุกข์
โทร. 02-289-7986, 02-289-7311
มือถือ 061-456-0932, 099-014-4372
วันจันทร์ - วันศุกร์ เวลา 08.00 - 16.00 น.
(ยกเว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์)
คุณพรรณสิรี คุณากรไพบูลย์ศิริ ผู้จัดการมูลนิธิรามาธิบดีฯ กล่าวว่า “มูลนิธิรามาธิบดีฯ เดินหน้าผลักดันความก้าวหน้าทางการแพทย์ควบคู่ไปกับการสร้างโอกาสให้ประชาชนไทยสามารถเข้าถึงบริการทางการแพทย์ได้อย่างทั่วถึง พร้อมเปิดตัวโครงการ “รามา+1 เพิ่มพื้นที่ บวกความหวัง” และภาพยนตร์ประชาสัมพันธ์ชุดใหม่จากเรื่องราวของ “ความหวัง” เป็นไปเพื่อวัตถุประสงค์ในการช่วยระดมทุนให้แก่โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ซึ่งถือเป็นภารกิจสำคัญในปีนี้และอย่างน้อยอีก 7 ปีข้างหน้า การสื่อสารภายใต้โครงการ “รามา+1 เพิ่มพื้นที่ บวกความหวัง” สะท้อนให้เห็นว่า มูลนิธิรามาธิบดีฯ นั้นตระหนักถึงพลังของการให้ และขอบคุณทุกน้ำใจที่ส่งต่อความช่วยเหลือและสร้างความหวังร่วมกันมาโดยตลอด จึงขอเชิญชวนทุกคนมาร่วมเป็นพลังบวกหนึ่งในการสร้างโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ซึ่งอาคารแห่งนี้จะดูแลผู้ป่วยที่ใช้สิทธิรักษาเบิกจ่ายประกันสังคม และสิทธิพื้นฐานต่าง ๆ”
เอไอ ตรวจหามะเร็งในกระเพาะอาหาร
รพ.บำรุงราษฎร์ นำเอาระบบเอไอ ตรวจสแกนช่องท้อง (AI Colonoscope) จากการคิดค้นของ คณะวิศวกรรมศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ใช้ในการส่องกล้องหามะเร็งลำไส้ ระบบจะทำงานร่วมกับระบบกล้อง เมื่อพบติ่งเนื้อที่อาจเป็นเหตุของมะเร็ง ให้ทำการตัดออก ลดความเสี่ยงมะเร็งได้ จากความเห็นแพทย์ที่ใช้เอไอ ยอมรับว่า การใช้สายตาในการอ่านอาจเกิดผิดพลาดได้บ้างเป็นปกติ เครื่องมือเอไอ สามารถใช้เป็นเครื่องมือช่วยได้ ก่อนการนำมาใช้จริง ได้มีการทดสอบการอ่านและตรวจสอบผล เพราะเป้าหมายสำคัญที่สุดของการใช้เครื่องมือเอไอใหม่ๆ เหล่านี้ คือการยอมรับผลการวินิจฉัย ทั้งโดยแพทย์และผู้ป่วยนั่นเอง
โรงเรียนวิทยาศาสตร์การแพทย์ หลักสูตรฉุกเฉินการแพทย์


โรงเรียนวิทยาศาสตร์การแพทย์ หลักสูตรฉุกเฉินการแพทย์ ทางหลักสูตรมุ่งเน้นผลิตบัณฑิตให้มีความรู้ความชำนาญ และทักษะด้านฉุกเฉินการแพทย์ เพื่อให้ผู้ป่วยฉุกเฉินโดยเฉพาะผู้ป่วยฉุกเฉินวิกฤตนั้นได้รับการผดุงชีวิตรวมทั้งป้องกันการเสียชีวิตหรือการรุนแรงขึ้นของการบาดเจ็บหรืออาการป่วยนั้นได้อย่างถูกต้อง ในส่วนของการเรียนการสอน นอกเหนือจากเนื้อหาวิชาการ นักศึกษาจะได้ประสบการณ์ฝึกปฏิบัติกับหุ่นจำลอง ได้ฝึกซ้อมการบริบาลผู้ป่วยหรือผู้บาดเจ็บนอกโรงพยาบาลเสมือนจริงในศูนย์จำลองสถานการณ์เพื่อการเรียนรู้ รวมทั้งได้ฝึกประสบการณ์จริงในช่วงฝึกภาคสนามที่โรงพยาบาลแหล่งฝึกทั่วประเทศไทย เพื่อพัฒนาทั้งความรู้และทักษะให้มีความพร้อมที่จะดูแลประชาชนได้อย่างมีประสิทธิภาพ สอดคล้องกับนโยบายปฏิรูประบบสาธารณสุขของประเทศและยกระดับการให้บริการการแพทย์ฉุกเฉินนอกโรงพยาบาลให้ดียิ่งขึ้น นอกจากนี้ทางหลักสูตรยังได้เล็งเห็นถึงความสำคัญในการพัฒนาศักยภาพของบุคลากรในการตอบโต้ภัยพิบัติให้มีมาตรฐานสากล ซึ่งจะมีการสอดแทรกองค์ความรู้และทักษะการบริหารสาธารณภัยให้แก่นักศึกษาทั้งในรูปแบบของกิจกรรมการเรียนการสอน กิจกรรมนอกหลักสูตร และโอกาสในการศึกษาเฉพาะทางต่อต่างประเทศ
โรงพยาบาลหนองบัวลำภู เปิดงานนโยบาย ยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว
นพ.ไพฑูรย์ ใบประเสริฐ ผู้อำนวยการโรงพยาบาลหนองบัวลำภูและเจ้าหน้าที่ ให้การต้อนรับ รศ.นพ.เชิดชัย ตันติศิรินทร์ ผู้ช่วยรัฐมนตรีประจำกระทรวงสาธารณสุข พร้อมด้วย นพ.ชัยวัฒน์ พัฒนาพิศาลศักดิ์ รักษาการในตำแหน่งสาธารณสุขนิเทศก์ เขตสุขภาพที่ 8 รอ.นพ.จักรวาล หารไชย รองผู้อำนวยการสำนักงานเขตสุขภาพที่ 8 และ เจ้าหน้าที่สำนักงานเขตสุขภาพที่ 8 ร่วมตรวจเยี่ยมจุดบริการ และรับชมการสาธิตการเข้ารับบริการของโรงพยาบาลหนองบัวลำภู และเดินทางร่วมตรวจเยี่ยมการให้บริการของร้านขายยา การรับยาที่ร้านขายยาผ่านหมอพร้อม ณ ร้านสุกรีเภสัช และร่วมพิธีเปิดงานนโยบาย “ยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว” และ เยี่ยมชมบูธนิทรรศการ ผลงานการดำเนินงานของโรงพยาบาลทุกแห่ง ณ สนามสมเด็จพระนเรศวรมหาราช จ.หนองบัวลำภู
เขต 3
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีบ้านไตรตรึงษ์ ตำบลไตรตรึงษ์ อำเภอเมือง จังหวัดกำแพงเพชร
- สอน.ห้วยกรด จังหวัดชัยนาท
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านหนองเบน อำเภอเมืองฯ จังหวัดนครสวรรค์
- สถานีอนามัยเฉลิมพระเกียรติฯ สำนักขุนเณร อำเภอดงเจริญ จังหวัดพิจิตร
- สอน.บ้านประดู่ยืน จ.อุทัยธานี
แหล่งเงิน 500,000 ล้านบาท ในการดำเนินโครงการฯ
แหล่งเงินในการดำเนินโครงการฯ
เป็นเงินจำนวน 500,000 ล้านบาท จำแนกได้ ดังนี้
- เงินงบประมาณรายจ่ายปีงบประมาณ พ.ศ. 2568 จำนวน 152,700 ล้านบาท โดยหน่วยงานที่เกี่ยวข้องพิจารณาปรับกรอบวงเงินงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2568 เพื่อให้มีแหล่งเงินในการรองรับการดำเนินนโยบายกระตุ้นเศรษฐกิจของรัฐบาล
- การดำเนินโครงการผ่านหน่วยงานของรัฐ จำนวน 172,300 ล้านบาท ซึ่งจะพิจารณานำมาสนับสนุนการดำเนินนโยบายรัฐภายใต้วัตถุประสงค์และกฎหมายจัดตั้งของหน่วยงานรัฐนั้นในการพัฒนาคุณภาพชีวิตและให้ความช่วยเหลือทางการเงินแก่เกษตรกร ทั้งนี้ ในการดำเนินการต้องสอดคล้องกับกฎหมายว่าด้วยวินัยการเงินการคลังของรัฐและอยู่ภายใต้ขอบเขตหน้าที่และอำนาจของหน่วยงานดังกล่าวด้วย
- การบริหารจัดการเงินงบประมาณรายจ่ายปีงบประมาณ พ.ศ. 2567 จำนวน 175,000 ล้านบาท ทั้งนี้ เนื่องจากพระราชบัญญัติงบประมาณรายจ่ายประจำปีงบประมาณ พ.ศ. 2567 มีความล่าช้าในการประกาศใช้ จึงอาจพิจารณาแนวทางการบริหารเงินงบประมาณในปี 2567 ร่วมกับสำนักงบประมาณให้สอดคล้องกับสถานการณ์การใช้งบประมาณ เช่น การปรับลดงบประมาณที่ไม่จำเป็นหรืองบประมาณที่หน่วยรับงบประมาณไม่สามารถเบิกจ่ายได้ทันในปีงบประมาณ พ.ศ. 2567 การใช้งบกลางรายการเงินสำรองจ่ายเพื่อกรณีฉุกเฉินหรือจำเป็น เป็นต้น
3. Smile Gallery
เป็นคลินิกที่เน้นการรักษาที่มีประสิทธิภาพ มีบริการจัดฟันที่หลากหลาย เพียงพอต่อความต้องการของแต่ละบุคคลอย่างแน่นอน ให้บริการโดยแพทย์มากประสบการณ์ ผลลัพธ์ของรอยยิ้มที่เป็นธรรมชาติ และมีรีวิวที่น่าเชื่อถือจากผู้ใช้งานจริง
และต่อมาในปี 2566 ศูนย์ทางเดินอาหารและตับ ได้ต่อยอดขยายคลินิกเฉพาะทาง เพื่อพัฒนาการรักษาให้ครอบคลุมมากยิ่งขึ้น และทัดเทียมมาตรฐานโลก โดยมีคลินิกเฉพาะทางต่าง ๆ ประกอบไปด้วย คลินิกโรคทางเดินอาหารทั่วไป (General GI Center), ศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร (Motility Center), ศูนย์ส่องกล้องทางเดินอาหาร (Endoscopy Center), โปรแกรมตับอ่อน (Pancreas program), คลินิกพันธุกรรมโรคระบบทางเดินอาหาร, คลินิกโรคลำไส้อักเสบเรื้อรัง (IBD Center), คลินิกโรคตับ (Liver Center) และคลินิกไมโครไบโอมแบบบูรณาการ (Integrative Microbiome Clinic)
ปัจจุบันเรามีวิวัฒนาการใหม่ ๆ เข้ามาช่วยเสริมประสิทธิภาพการวินิจฉัยรักษาได้ดีขึ้น เช่น การให้บริการตรวจคัดกรองโรคในทางเดินอาหารด้วยการส่องกล้องพร้อมระบบ AI detection ซึ่งช่วยให้สามารถเจอติ่งเนื้อได้มากขึ้นถึง 54% เมื่อเจอติ่งเนื้อในลำไส้หรือกระเพาะอาหาร แพทย์จะสามารถตัดชิ้นเนื้อเพื่อส่งตรวจวิเคราะห์หาสาเหตุได้ในทันที โดยการส่องกล้องไม่ต้องผ่าเปิดหน้าท้อง สิ่งเหล่านี้สะท้อนถึงความมุ่งมั่นในการแสวงหาสิ่งที่ดีที่สุดให้กับผู้ป่วยของเรามาโดยตลอด
คลินิกอัลตราซาวด์ นอกเวลาราชการ ศูนย์สุขภาพมะฮอกกานี โรงพยาบาลวชิระภูเก็ต
บริการทันตกรรมนอกเวลา ในวันจันทร์และอังคาร
รพ.สุโขทัยจะเริ่มเปิดให้บริการทันตกรรมนอกเวลา ในวันจันทร์และอังคาร เวลา 16.30-20.30 น. จองคิวผ่านทางแอพพลิเคชั่นและไลน์ได้
ข้าราชการและผู้ประกันตนเบิกได้ตามสิทธิ์ จ่ายส่วนเกินนิดเดียว
สนใจสอบถามได้ที่แผนกทันตกรรมนะครับ โทร 0875742966
ครบรอบ 117 ปี โรงพยาบาลตากสิน (2564)
15 กุมภาพันธ์ 2564 ครบรอบ 117 ปี โรงพยาบาลตากสิน สำนักการแพทย์ กรุงเทพมหานคร โลโก้โดย : เวชนิทัศน์ โรงพยาบาลตากสิน
แพทย์คลินิกนอกเวลา
คลินิกนอกเวลา
แพทย์หญิงปนันยา พวงกุหลาบ
สามารถมาใช้บริการได้ ตั้งแต่
เวลา 16.00-20.00น.
สถาบันการแพทย์จักรีนฤบดินทร์ วันงดสูบบุหรี่โลก 2024
"World No Tobacco Day 2024 วันงดสูบบุหรี่โลก" วันพฤหัสบดีที่ 30 พฤษภาคม 2567 เวลา 09.00-11.30 น. ณ โถงกิจกรรม ชั้น 1 โซน B อาคารโรงพยาบาลรามาธิบดีจักรีนฤบดินทร์ สถาบันการแพทย์จักรีนฤบดินทร์ (จ.สมุทรปราการ) ลงทะเบียน และรับของที่ระลึกภายในงาน
หน่วยกุมารเวชศาสตร์ คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกกุมารเวชศาสตร์
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-ศุกร์ 16.00-19.00 น.
วันเสาร์ 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
- สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396242 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ฝากครรภ์ คลอดบุตร ตรวจคัดกรองความผิดปกติของโครโมโซมขณะตั้งครรภ์ (Thai NIPT) ตรวจก่อนสมรส ตรวจก่อนมีบุตร ฝังยาคุมกำเนิด ตรวจเช็คมะเร็งปากมดลูก ตรวจหาเชื้อไวรัส HPV ฉีดวัคซีนป้องกันมะเร็งปากมดลูก ตรวจมดลูกหย่อน ใส่อุปกรณ์เพื่อผยุงมดลูกแทนการผ่าตัด ผ่าตัดทางนรีเวช
คลินิกพิเศษเฉพาะทาง จิตเวชและยาเสพติด นอกเวลาราชการ
รพ.อุตรดิตถ์ เปิดบริการคลินิกพิเศษเฉพาะทาง "คลินิกจิตเวชและยาเสพติด" นอกเวลาราชการ ทุกวันอังคาร เวลา 16.30-20.30 น.
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันพุธ
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
จ่ายยาเฉพาะขอบเขต 16 อาการ เท่านั้น ยาอื่นๆ ไม่จ่ายให้นะ
ตามกฏก็คือ เภสัชกรจะจ่ายสำหรับการเจ็บป่วยเล็กน้อย 16 อาการ เท่านั้น ประกอบด้วย
1. ไข้/ไอ/เจ็บคอ
2. ปวดข้อ
3. เจ็บกล้ามเนื้อ
4. อาการทางผิวหนัง ผื่น คัน
5. ปวดท้อง
6. บาดแผล
7. ท้องเสีย
8. ปวดหัว
9. เวียนหัว
10. ปวดฟัน
11. ท้องผูก/ริดสีดวงทวาร
12. ถ่ายปัสสาวะขัด/เจ็บ/ลำบาก
13. ปวดประจำเดือน
14. ตกขาวผิดปกติ
15. ความผิดปกติต่างๆ ที่เกิดขึ้นกับตา
16. ความผิดปกติต่างๆ ที่เกิดขึ้นกับหู
กรณีอื่นๆ ไม่จ่ายให้ ไม่ว่าจะ ขอ เติมยาคุณหมอเคยให้แต่ไม่พอนัด หรือขอยาโรคเรื้อรัง หรือ โรคที่กำลังรักษากับคุณหมออยู่ = ใช้สิทธิไม่ได้ ทั้งสิ้น ติดต่อแพทย์ที่ดูแลท่านอยู่เท่านั้นจ้า
เกณฑ์การตัดสิน
สำหรับผลงานที่จะถูกส่งเข้าประกวดในหมวดหมู่ภายใต้ Hospital of the Year, Diagnostics Provider of the Year, Most Improvement Community Hospital of the Year และ Primary Care Provider of the Year:
- ความสำเร็จ - อะไรคือเหตุการณ์สำคัญที่น่าทึ่งที่โรงพยาบาลหรือคลินิกได้รับ?
- ความท้าทายและแนวทางแก้ไข - อะไรคือความท้าทายที่ใหญ่ที่สุดที่โรงพยาบาลหรือคลินิกต้องเผชิญในการขับเคลื่อนบริษัทไปข้างหน้า มีวิธีแก้ไขปัญหาใดบ้างที่ถูกนำมาใช้เพื่อเอาชนะความท้าทายเหล่านี้
- นวัตกรรม - โรงพยาบาลหรือคลินิกริเริ่มโครงการริเริ่มที่มีเอกลักษณ์และเป็นนวัตกรรมซึ่งสร้างผลกระทบเชิงบวกต่อผู้ป่วยและอุตสาหกรรมการดูแลสุขภาพอย่างไรบ้าง
สำหรับผลงานที่ส่งเข้าประกวดประเภท CEO of the Year (สำหรับโรงพยาบาลเท่านั้น):
- ความสำเร็จ - อะไรคือเหตุการณ์สำคัญที่น่าทึ่งที่ CEO ประสบความสำเร็จ?
- ความท้าทายและแนวทางแก้ไข - อะไรคือความท้าทายที่ใหญ่ที่สุดที่ CEO เผชิญในการขับเคลื่อนบริษัทไปข้างหน้า? มีวิธีแก้ไขปัญหาใดบ้างที่ถูกนำมาใช้เพื่อเอาชนะความท้าทายเหล่านี้
- นวัตกรรม - อะไรคือความคิดริเริ่มที่มีเอกลักษณ์และเป็นนวัตกรรมที่ CEO แนะนำซึ่งสร้างผลกระทบเชิงบวกต่อผู้ป่วยและอุตสาหกรรมการดูแลสุขภาพ
สำหรับผลงานที่จะถูกส่งเพื่อสนับสนุนโครงการต่างๆ เช่น Clinical Service Initiative, Employee Engagement, ICT Initiative, Marketing Initiative, CSR Initiative เป็นต้น
- เอกลักษณ์และนวัตกรรม - ความคิดริเริ่มนี้ได้นำเสนอนวัตกรรมใหม่หรือนวัตกรรมล้ำสมัยหรือไม่?
- ประสิทธิผลและผลกระทบ - โครงการริเริ่มนี้บรรลุวัตถุประสงค์และเป้าหมายหรือไม่ มีการใช้มาตรการอะไรบ้างในการประเมินความสำเร็จ? ผลกระทบต่อบริษัทและอุตสาหกรรมของคุณเป็นอย่างไร?
- พลวัต - กลยุทธ์ โครงการ บริการ หรือผลิตภัณฑ์มีความยืดหยุ่นต่อการเปลี่ยนแปลงและโอกาสที่ก้าวหน้าหรือไม่?
ศูนย์บริการสาธารณสุข กรุงธนเหนือ และ กรุงธนใต้
กรุงธนเหนือ
- คลองสาน ศูนย์บริการสาธารณสุข 28
- จอมทอง ศูนย์บริการสาธารณสุข 29
- ตลิ่งชันศูนย์บริการสาธารณสุข 49
- ทวีวัฒนา ศูนย์บริการสาธารณสุข 67
- ธนบุรี ศูนย์บริการสาธารณสุข 27
- บางกอกใหญ่ ศูนย์บริการสาธารณสุข 33
- บางกอกน้อย ศูนย์บริการสาธารณสุข 30
- บางพลัด ศูนย์บริการสาธารณสุข 31
กรุงธนใต้
- ทุ่งครุ ศูนย์บริการสาธารณสุข 59
- บางขุนเทียน ศูนย์บริการสาธารณสุข 42
- บางบอน ศูนย์บริการสาธารณสุข 65
- บางแค ศูนย์บริการสาธารณสุข 40
- ภาษีเจริญ ศูนย์บริการสาธารณสุข 47 / ศูนย์บริการสาธารณสุข 62
- ราษฎร์บูรณะ ศูนย์บริการสาธารณสุข 39 / ศูนย์บริการสาธารณสุข 58
- หนองแขม ศูนย์บริการสาธารณสุข 48
สอบถามรายละเอียดเพิ่มเติมก่อนเข้ารับบริการได้ที่ศูนย์บริการสาธารณสุขใกล้บ้าน หรือสายด่วนสำนักอนามัย 02-2032872
101 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดอินทร์บรรจง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
102 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดพระยาไกร ระยะ 3
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
103 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสวนหลวง 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
104 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเซ่งกี่
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
105 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโรงแก้ว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
106 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหลังสามร้อยห้อง (1)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
107 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดไผ่เงิน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
108 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนซอยสีน้ำเงิน 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
109 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนจันทร์เกษม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
110 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนซอยสวนรื่น
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
111 ศูนย์พัฒนาเด็กก่อนวัยเรียนจารุรัตน์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
112 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนนิคมมักกะสัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
113 ศูนย์พัฒนาเด็กก่อนวัยเรียนริมคลองสามเสน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
114 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมทางรถไฟสายท่าเรือ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
115 ศูนย์พัฒนาเด็กก่อนวัยเรียนศูนย์เด็กปฐมวัยคลองเตย ล็อค 6
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
116 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนร่มเกล้า
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
117 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนน้องใหม่
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
118 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนคลองเตยล็อค 1-2-3
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
119 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดคลองเตยใน 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
120 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอ่อนนุช 40 ไร่
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
121 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดเทพากร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
122 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมัสยิดนูรุ้ลยากิน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
123 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนศิลปเดช
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
124 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนโมราวรรณ 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
125 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนนาคภาษิต
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
126 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอัลเอี๊ยะติซอม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
127 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนธรรมานุรักษ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
128 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมุสลิมพัฒนาบ้านป่า
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
129 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดใต้
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
130 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอัลกุ๊บรอ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
131 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนร่วมพัฒนาบ้านป่า
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
132 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนศาลาลอย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
133 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุเหร่าบ้านดอน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
134 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเฉลิมอนุสรณ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
135 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนชายคลองบางบัว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
136 ศูนย์พัฒนาเด็กก่อนวัยเรียนบางบัว (หมู่บ้านพระอาทิตย์)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
137 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนรวมใจสามัคคี (หนองผักชี)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
138 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดลุ่มเจริญศรัทธา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
139 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวิมานสุข
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
140 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบ้านเกาะ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
141 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเกาะแครายพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
142 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่ 8 สะพานสูง (สุเหร่าซีรอ)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
143 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหัวบ้านคลองบางเลา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
144 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนจันทราสุข
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
145 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนรุ่งมณีพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
146 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนลาดพร้าว 91
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
147 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนกมาลุลอิสลาม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
148 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนข้างโรงงานธานินทร์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
149 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดปุรณาวาส
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
150 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่ 2 บางมด
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
3. Health Tech ตลาดนัดสนามหลวง2
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ สาขา ตลาดสนามหลวง 2 (ย้ายมาจากตลาดเวิลด์มาร์เก็ต ตั้งแต่ 1 มีนาคม 2567) ตั้งอยู่ บริเวณหน้าสำนักงานตลาดสนามหลวง 2 ติดกับจุดจอดรถประจำทางสาย 91ก เปิดให้บริการทุกวัน 8.00 - 18.00 น


ผศ.(พิเศษ) นพ.สุรินทร์ อัศววิทูรทิพย์ ผู้ช่วยคณบดีฝ่ายบริการวิชาการ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เสริมว่า “MedUMORE” ได้รวบรวม คอนเทนต์ด้านการแพทย์ไว้มากกว่า 2,000 คอนเทนต์ และคอร์สเรียนออนไลน์เนื้อหา ด้านการแพทย์มากกว่า 900 คอร์สเรียน และยังมีนวัตกรรมทางการแพทย์ที่ล้ำสมัยให้ ความรู้เรื่องโรคภัยต่างๆ ซึ่งเป็นเรื่องเด่นประเด็นร้อนในสังคมผ่านคลิปวิดีโอสั้น ในช่วง “หมอขอเล่า” โดยมีแพทย์ผู้เชี่ยวชาญเฉพาะทางด้านต่างๆ ถ่ายทอดความรู้อย่างถูกต้อง โดยมุ่งเป้าหมายให้เกิดพฤติกรรมการแชร์ข้อมูลสุขภาพบนมาตรฐานความรู้ทางวิชาการที่ถูกต้องในสื่อโซเชียล ซึ่งหลายครั้งสังคมส่งต่อข้อมูลที่ไม่ถูกต้อง แต่หากเข้ามาสืบค้นใน MedUMORE ก็จะได้รับรู้ข้อมูลถูกต้องที่มาจากแพทย์หรือผู้เชี่ยวชาญในเรื่องนั้นๆ โดยตรง พร้อมกล่าวถึงความพิเศษของแอปพลิเคชัน “MedUMORE” จะมีระบบจดจำ ประวัติการเข้าเรียน สามารถแนะนำเนื้อหาให้เหมาะสมกับผู้เรียนตามความสนใจ ในแต่ ละบุคคล เหมาะสำหรับนักเรียน นิสิตและนักศึกษาแพทย์ รวมถึงบุคลากรทางการแพทย์ และคอร์สชมฟรี สำหรับประชาชนแบบไม่ต้อง Login เมื่อเรียนแล้วยังสามารถทำแบบ ทดสอบวัดความเข้าใจ และได้รับ Certificate เมื่อเรียนจบอีกด้วย
ทริปที่ 3 โปรแกรมไหว้สามหาครูบาแห่งภาคเหนือ เส้นทาง กรุงเทพ-ลำพูน-ลำปาง
ทริปที่ 3 โปรแกรมไหว้สามหาครูบาแห่งภาคเหนือ เส้นทาง กรุงเทพ-ลำพูน-ลำปาง (เดินทางด้วยขยวนอุตราวิถีขบวน 9 และขนวน 10) วันที่ 18 - 22 กันยายน 2567 จำนวน 5 วัน 4 คืน (นอนบนรถไฟ 2 คืน) อัตราค่าโดยสารท่านละ 10,999 บาท (จำกัดทริปละ 38 ที่นั่งเท่านั้น)
กำหนดการ
- วันที่ 1 สักการะวัดพระบาทตากผ้า / วัดบ้านปาง (ครูบาศรีวิชัย ตนบุญแห่งล้านนา) / วัดพระพุทธบาทห้วยต้ม (ครูบาชัยวงศา) / ศูนย์หัตถกรรมและวัฒนธรรมกะเหรี่ยงบ้านห้วยต้ม / พระมหาราตุเจดีย์ศรีเวียงชัย
- วันที่ 2 สักการะวัดพระพุทธบาทผาหนาม (ครูบาอภิชัยขาวปี) / สะพานรถไฟทาชมภู / อนุสาวรีย์พระนางเจ้าจามเทวี / วัดพระธาตุหริภุญชัยวรมหาวิหาร
- วันที่ 3 สักการะวัดพระธาตุดอยพระฌาณ / วัดพระธาตุลำปางหลวง / อินทราเซรามิก / มิวเซียมลำปาง / วัดปงสนุกเหนือ / วัดจองคา / วัดศรีรองเมือง / กาดกองต้า
ไม่เพียงแต่กิจกรรมด้านวิชาการเท่านั้น แต่น้องเจนนี่ยังย้ำว่า “เรียนคือเรียน แต่เมื่อเล่นเราก็เต็มที่กับกิจกรรมนันทนาการไม่แพ้กัน กิจกรรมที่หนูมองว่าสามารถเปิดโลกให้น้องๆ ค้นหาตนเองได้มากขึ้นคือตลาดนัดคณะ ที่น้องจะได้พูดคุยเกี่ยวกับประสบการณ์ตรงจากตัวแทนรุ่นพี่นิสิตแต่ละคณะ อีกทั้งยังมีแนะแนวอาชีพจากพี่ๆ เชฟรอนในฝ่ายวิศวกรรมโครงสร้าง และฝ่ายสุขภาพ ความปลอดภัย และสิ่งแวดล้อม เพื่อเปิดโอกาสให้เห็นเส้นทางอนาคตที่อยากจะเป็นชัดเจนขึ้น รวมถึงเราอยากสร้างค่ายนี้ให้เป็นเหมือนครอบครัวรากแก้วของน้องๆ เพื่อสานสัมพันธ์กับเพื่อนที่มาจากหลากหลายโรงเรียนอย่างกิจกรรมกีฬาสี ไปจนถึง Rakkaew Tonight ที่ให้น้องๆ แต่ละกลุ่มทำการแสดงร่วมกัน ซึ่งพอได้ยินน้องๆ เดินมาบอกว่าพอเข้ามหาลัยแล้ว อยากกลับมาเป็นพี่ค่ายอีกครั้ง ทำให้หนูรู้สึกว่าแรงบันดาลใจที่หนูและเพื่อนทุกคนอยากส่งต่อ ได้ส่งไปถึงน้องแล้วจริงๆ”
ด้าน ดร.พญ. เลิศลักษณ์ ลีลาเรืองแสง ผู้อำนวยการ สำนักการแพทย์ กรุงเทพมหานคร กล่าวว่ากรุงเทพมหานครให้ความสำคัญกับปัญหาเบาหวาน ซึ่งเป็นโรคเรื้อรังที่พบบ่อยในคนกรุงเทพฯ และยินดีร่วมสนับสนุนโครงการ KiDS เพื่อส่งเสริมความรู้และทักษะเกี่ยวกับการจัดการเบาหวานในเด็กแก่คณะครู ปัจจุบัน สำนักการแพทย์ กรุงเทพมหานคร มีโรงพยาบาลในสังกัด 11 แห่ง โดยมีศูนย์เบาหวานอยู่หลายแห่ง อาทิ โรงพยาบาลกลาง โรงพยาบาลเจริญกรุงประชารักษ์ และโรงพยาบาลตากสิน และในปีนี้ กรุงเทพมหานครยังคงเดินหน้าพัฒนาระบบสุขภาพ โดยเน้นการบูรณาการระบบสุขภาพและทำงานร่วมกันอย่างไร้รอยต่อ ทั้งการส่งเสริมป้องกันและการรักษาอย่างต่อเนื่อง ซึ่งโครงการฯ นี้ เป็นหนึ่งในความร่วมมือเพื่อพัฒนาระบบสุขภาพ โดยสำนักการแพทย์ กรุงเทพมหานคร ได้ประสานกับสำนักงานต่างๆ เพื่อเชิญผู้แทนคุณครูฝึกอบรมเพื่อนำไปถ่ายทอดความรู้เกี่ยวกับเบาหวานให้แก่นักเรียนและขยายผลต่อได้อย่างมีประสิทธิภาพ
ภายใต้ความร่วมมือ Dengue-zero ที่มุ่งมั่นในการนำพาประเทศไทยสู่สังคมปลอดไข้เลือดออกตามกลยุทธ์ที่ส่งเสริมการทำงานกับภาคีเครือข่ายต่างๆ ซึ่งตลอดเวลา 3 ปีที่ผ่านมากิจกรรมภายใต้ความร่วมมือนี้ได้สนับสนุนให้เกิดการป้องกันและควบคุมไข้เลือดออกในเชิงรุก ที่เข้าถึงกลุ่มเป้าหมายได้เป็นอย่างดี โดยในปีนี้แคมเปญ “ยิ่งไม่รู้ ยิ่งต้องป้องกัน” จะมายกระดับการสร้างความตระหนักรู้ เพื่อให้ประชาชนได้รับรู้ถึงความอันตรายของโรคโดยได้ ‘วิน เมธวิน โอภาสเอี่ยมขจร’ ศิลปินดาวรุ่งระดับอินเตอร์มาเป็นหนึ่งใน “เดงกี่ ฮีโร่” ในการสร้างความตระหนักรู้เกี่ยวกับการป้องกันไข้เลือดออกและการเสริมสร้างภูมิคุ้มกันเพื่อปกป้องตนเองและคนใกล้ตัวให้ห่างไกลจากไข้เลือดออก
ผศ.พญ. มนัสวี ก่อวุฒิกุลรังษี แพทย์ผู้ชำนาญการเฉพาะทางกุมารเวชศาสตร์โรคต่อมไร้ท่อและเมตาบอลิสม โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ปัจจุบัน เทรนด์การใช้เทคโนโลยีดิจิทัลได้เข้ามามีบทบาทในชีวิตประจำวันส่งผลกระทบต่อเด็กของเด็ก ๆ เป็นอย่างมาก ถ้าหากใช้อย่างไม่ถูกต้อง เหมาะสม อาจส่งผลกระทบต่อพัฒนาการเด็กในยุคปัจจุบันที่เติบโตและคุ้นเคยกับเทคโนโลยีสมัยใหม่ จะมีแนวโน้มเสพติดเทคโนโลยี จนส่งผลกระทบต่อสุขภาพและการเจริญเติบโตได้ โดยเฉพาะภาวะะผิดปกติที่เกิดจากต่อมไร้ท่อทำงานผิดปกติ เช่น โรคเบาหวานในเด็กและโรคอ้วน ภาวะเป็นหนุ่มสาวก่อนวัย รวมถึงภาวะเตี้ย ซึ่งหากไม่ได้รับการวินิจฉัยและการรักษาอย่างถูกต้อง อาจนำไปสู่ผลกระทบต่อสภาพจิตใจและการปรับตัวของเด็ก
ด้านตัวแทนนักเรียนจาก โรงเรียนสามเสนวิทยาลัย เผยว่า
กิจกรรมวันนี้สนุกมาก เพราะอะไรที่ไม่เคยรู้ ไม่เคยเห็นหลายๆ อย่างแบบชัดเจนก็เคลียร์หมด เบื้องต้นรับรู้ชื่อเสียงและหลักสูตรของราชวิทยาลัยจุฬาภรณ์ ในด้านการเรียนการสอนที่มีสาขาแพทยศาสตร์ พยาบาลศาสตร์ และวิทยาศาสตร์สุขภาพอยู่แล้ว ซึ่งตอนแรกอาจมองเป็นเรื่องไกลตัว บางทีสนใจแต่ไม่มีประสบการณ์ตรง โอกาสดีในวันนี้ได้เรียนรู้หลายอย่าง ซึ่งไม่ใช่แค่คำพูดหรือคำสอนเท่านั้น หากแต่ได้ลงมือปฏิบัติทำกิจกรรมของแต่ละคณะเลย โอเพ่นเฮ้าส์ เสมือนการเปิดโลกให้พวกเราได้เรียนรู้ สัมผัส และได้ทดสอบความถนัด อีกทั้งทำให้เห็นด้านต่างๆ ของมหาวิทยาลัยที่นักเรียนชั้นมัธยมศึกษาอย่างเราอาจจะไม่เคยเห็นมาก่อน ไม่รู้ว่าเป็นแบบไหน เรียนกันอย่างไร วันนี้ได้มาเห็นกับตาและทำให้ตัดสินใจได้ง่ายขึ้นค่ะ”
การตลาดยาสูบแบบกำหนดพุ่งเป้า
การตลาดยาสูบแบบพุ่งเป้า (กำหนดเป้าหมาย) ประกอบด้วย
- โฆษณาแบบจ่ายเงิน (paid ads) หรือ เพจของบริษัทบนโซเชียลมีเดีย
- การโปรโมตผลิตภัณฑ์แบบชำระเงิน โดยผู้มีอิทธิพล (influencers) ซึ่งมีผู้ติดตามบนโซเชียลมีเดีย รวมถึงแพลตฟอร์มเกมที่เด็กๆ และเยาวชนติดตาม ความสัมพันธ์ทางการเงินเหล่านี้ไม่ได้เปิดเผยเสมอไป และ บริษัทยาสูบก็ถูกเปิดโปง ว่าใช้อินฟลูเอนเซอร์ที่อายุน้อยกว่าที่บริษัทได้กำหนดแนวปฏิบัติโดยสมัครใจเอาไว้
- การวางตำแหน่งผลิตภัณฑ์ (product placement) เช่น การแสดงภาพยาสูบในสตรีมมิง รายการที่ได้รับความนิยมในหมู่วัยรุ่นอายุ 15-24 ปี เพิ่มขึ้นสองเท่าในปี 2565 (2022) เป็นจำนวนถึง 25 ล้านคน [15]; ภาพการใช้ยาสูบและบุหรี่ไฟฟ้าแพร่หลายในสื่อบันเทิง รวมทั้งในวิดีโอเกมยอดนิยม [16] และรายการทีวี สำหรับวัยรุ่นและคนหนุ่มสาว เช่น Stranger Things เป็นต้น บนแพลตฟอร์มสตรีมมิ่งระดับโลก [16]; การวิจัยชี้ให้เห็นว่าการเผยแพร่ผ่านสื่อเหล่านั้น เชื่อมโยงกับการรับรู้ที่เพิ่มขึ้นในหมู่เยาวชน และ ล่อใจให้เข้าถึงการใช้ผลิตภัณฑ์เหล่านั้นสูงขึ้นด้วย
- สนับสนุนเทศกาลดนตรีที่สามารถสร้างการรับรู้เกี่ยวกับแบรนด์ยาสูบและผลิตภัณฑ์ของบริษัทที่เกี่ยวข้อง ในหมู่ผู้ชมที่เป็นวัยรุ่น อาจมีการแจกตัวอย่างฟรี ในโอกาสเหล่านั้น [17];
- การสนับสนุนกิจกรรมที่เกิดขึ้นทางออนไลน์ เช่น อีสปอร์ต หรือเทศกาลออนไลน์
- บัญชีบนแพลตฟอร์มรวมถึง Facebook และ Instagram ที่ดูเหมือนจะเน้นไปที่หัวข้อไลฟ์สไตล์ด้านดนตรีหรือกีฬา บางบัญชีเน้นไปในเชิงสื่อสารองค์กร (ที่ฟังดูดี) เช่น ข้อมูลเกี่ยวกับความหลากหลายและนโยบายด้านสิ่งแวดล้อม
การสนับสนุนด้านกีฬา
- การสนับสนุนด้านนี้จะช่วยสร้างการรับรู้และดึงดูดแบรนด์ อาทิเช่น การสนับสนุน Formula 1 ช่วยให้บริษัทได้โปรโมตข้อความและแบรนด์ของตน ไปยังแฟนกีฬาอายุน้อยทั่วโลกได้มากขึ้น ผ่านคลิปวิดีโอการแข่งขัน โซเชียลมีเดีย และกิจกรรมส่งเสริมการขายอื่นๆ ที่เชื่อมโยงกับกีฬา [18] พวกเขายังเข้าถึงผู้ชมของซีรีส์เรียลลิตี้ของ Netflix เรื่อง Formula 1: Drive to Survive, who ซึ่งบางส่วนอาจไม่ใช่กลุ่มที่ชม F1 โดยตรงก็ได้ รวมถึง การสนับสนุนของ BAT ใน ทีม McLaren F1 ช่วยโปรโมตแบรนด์บุหรี่ไฟฟ้า ในประเทศต่างๆ เช่น อินเดีย ซึ่งบุหรี่ไฟฟ้าเป็นสิ่งต้องห้าม
64.ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย สาขาสูติศาสตร์และนรีเวชวิทยา ระยะเวลาศึกษา 3 ปี
65. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาขามะเร็งวิทยานรีเวช ระยะเวลาศึกษา +2 ปี
66. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาชาเวชศาสตร์การเจริญพันธุ์ ระยะเวลาศึกษา +2 ปี
67. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาขาเวชศาสตร์มารดาและทารกในครรภ์ ระยะเวลาศึกษา +2 ปี
68. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาขาเวชศาสตร์เชิงกรานสตรีและศัลยกรรมซ่อมเสริม ระยะเวลาศึกษา +2 ปี
69. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาขาเวชศาสตร์ทางเพศ ระยะเวลาศึกษา +2 ปี
70. ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย อนุสาชาการผ่าตัดทางนรีเวชที่มีการลุกล้ำน้อย ระยะเวลาศึกษา +2 ปี
71. ราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย สาขาโสด ศอ นาสิกวิทยา ระยะเวลาศึกษา 3 ปี
72. ราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย อนุสาชาศัลยศาสตร์ตกแต่งและเสริมสร้างใบหน้า ระยะเวลาศึกษา 2 ปี
73. ราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย อนุสาชาโสต ศอ นาสิกวิทยาการนอนหลับ ระยะเวลาศึกษา 2 ปี
74. ราชวิทยาลัยแพทย์ออร์โธปิติกส์แห่งประเทศไทย สาขาออร์โธปิดิกส์ ระยะเวลาศึกษา 4 ปี
75. ราชวิทยาลัยแพทย์ออร์โธปิติกส์แห่งประเทศไทย อนุสาชาออร์โธปิติกส์เด็ก ระยะเวลาศึกษา +2 ปี
76. ราชวิทยาลัยแพทย์ออร์โธปิติกส์แห่งประเทศไทย อนุสาชาเนื้องอกกระดูกและระบบเนื้อเยื่อเกี่ยวพัน ระยะเวลาศึกษา +2 ปี
77. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย สาขาอายุรศาสตร์มะเร็งวิทยา ระยะเวลาศึกษา 4 ปี
78. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย สาขาอายุรศาสตร์โรคเลือด ระยะเวลาศึกษา 3 ปี
79. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย สาขาอายุรศาสตร์ ระยะเวลาศึกษา 3 ปี
80. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย สาชาประสาทวิทยา ระยะเวลาศึกษา 3 ปี
81. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย สาขาดจวิทยา ระยะเวลาศึกษา 4 ปี
82. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาอายุรศาสตร์โรคไต ระยะเวลาศึกษา +2 ปี
83. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาอายุรศาสตร์ โรคระบบทางเดินอาหาร ระยะเวลาศึกษา +2 ปี
84. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาอายุรศาสตร์โรคระบบการหายใจ และภาวะวิกฤติโรคระบบการหายใจ ระยะเวลาศึกษา +2 ปี
85. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาเวชบำบัดวิกฤต ระยะเวลาศึกษา +2 ปี
86. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาอายุรศาสตร์โรคข้อและรูมาติสซั่ม ระยะเวลาศึกษา +2 ปี
87. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาอายุรศาสตร์โรคอมไร้ท่อและเมนทบอลิซึม ระยะเวลาศึกษา +2 ปี
88. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาอายุรศาสตร์โรคติดเชื้อ ระยะเวลาศึกษา +2 ปี
89. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาชาอายุรศาสตร์โรคภูมิแพ้และภูมิคุ้มกันทางคลินิก ระยะเวลาศึกษา +2 ปี
90. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาอายุรศาสตร์โรคหัวใจ ระยะเวลาศึกษา +2 ปี
91. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาอายุรศาสตร์ผู้สูงอายุ ระยะเวลาศึกษา +2 ปี
92. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาเวชเภสัชและพิษวิทยา ระยะเวลาศึกษา +2 ปี
93. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาโภชนศาสตร์คลินิก ระยะเวลาศึกษา +2 ปี
94. ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย อนุสาขาอายุรศาสตร์การนอนหลับ ระยะเวลาศึกษา +2 ปี
นวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS)


อย่างไรก็ตาม ในปัจจุบันยังพบว่ามีสตรีอีกเป็นจำนวนมากที่รอคิวหรือไม่สามารถเข้าถึงการตรวจคัดกรองมะเร็งเต้านมด้วยการทำแมมโมแกรมและอัลตราซาวด์ โรงพยาบาลจุฬาภรณ์ ร่วมกับ วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ จึงได้เล็งเห็นความจำเป็นในการออกแบบพัฒนาระบบบริการสุขภาพเคลื่อนที่สำหรับการตรวจคัดกรองมะเร็งเต้านมในสตรีไทยด้วยนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS) และแมมโมแกรม พร้อมด้วยระบบรายงานผลดิจิทัล และเทคโนโลยีปัญญาประดิษฐ์ AI ร่วมวินิจฉัยกับรังสีแพทย์ ผลงานซึ่งได้รับรางวัลจากเวทีประกวดนวัตกรรมและสิ่งประดิษฐ์ระดับนานาชาติ โดยนำร่องให้บริการตรวจคัดกรองมะเร็งเต้านมแก่สตรีกลุ่มเสี่ยงและด้อยโอกาส อายุ ๓๕ ปีขึ้นไป ในเขตพื้นที่กรุงเทพมหานครโซนเหนือทั้งหมด ๗ เขต จังหวัดปทุมธานีและจังหวัดนนทบุรี ในโครงการเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ๒๘ กรกฎาคม ๒๕๖๗ จำนวน ๗๒๐ ราย ซึ่งโครงการดังกล่าวยังเป็นประโยชน์ต่อยอดส่งเสริมการนำนวัตกรรมและเทคโนโลยีบริการสุขภาพมาใช้เพื่อยกระดับและพัฒนานโยบายระบบบริการสุขภาพให้กับประเทศไทยเพื่อเพิ่มโอกาสในการเข้าถึงการตรวจคัดกรองมะเร็งเต้านมในพื้นที่ห่างไกลต่อไป
ระบบ BKK Food Bank เขตบางขุนเทียน
ปัจจุบันสำนักงานเขตบางขุนเทียนได้ดำเนินการใช้งานระบบการบริหารจัดการคลังสินค้าและการส่งต่ออาหาร เครื่องอุปโภคบริโภคให้กับกลุ่มเปราะบาง ภายใต้โครงการ BKK Food Bank ที่พัฒนาโดยบริษัท เอส เจ พี เทคโนโลยี จำกัด (SJP GROUP) โดยเริ่มใช้งานเมื่อวันที่ 29 มี.ค. 67 เป็นวันแรก ซึ่งระบบการบริหารจัดการคลังสินค้าและการส่งต่ออาหารนี้ สามารถอำนวยความสะดวกและมีส่วนช่วยในการบริหารจัดการโครงการ BKK Food Bank เขตบางขุนเทียน ได้ดังนี้
1. สามารถบันทึกรายการและจำนวนสินค้าที่ได้รับจากผู้สนับสนุนแยกแต่ละประเภทเข้าสต๊อก (Stock) ด้วยการใช้เครื่องสแกนบาร์โคด
2. สามารถเก็บฐานข้อมูลกลุ่มเปราะบางที่ผ่านเกณฑ์การคัดเลือกเข้าสู่ระบบ เพื่อให้สิทธิในการรับความช่วยเหลือตามโครงการ BKK Food Bank และโครงการ BKT แบ่งกัน ปันสุข ของสำนักงานเขตบางขุนเทียน
3. สามารถคำนวณจำนวนแต้มสินค้าด้วยการใช้เครื่องสแกนบาร์โคด และระบบสามารถตัดจำนวนสินค้าจากสต๊อกเมื่อมีการยิงบาร์โคดที่สินค้า โดยสินค้าแต่ละประเภทจะมีการกำหนดจำนวนแต้มตามมูลค่า และกลุ่มเปราะบางสามารถเลือกสินค้าที่ต้องการได้ในจำนวนแต้มที่ทางสำนักงานเขตบางขุนเทียนกำหนดไว้ ทั้งนี้ กรุงเทพมหานครพร้อมขยายการใช้งานระบบการบริหารจัดการคลังสินค้าและการส่งต่ออาหารให้ทั่วพื้นที่กรุงเทพฯ ทั้ง 50 เขต ต่อไป
โรคไข้หวัดนกติดต่อมาสู่คนได้อย่างไร
โรคไข้หวัดนกสามารถติดต่อจากสัตว์ปีกมาสู่คนได้ ทั้งจากการสัมผัส สารคัดหลั่ง จากสัตว์ปีกที่ป่วยโดยตรง เช่น อุจจาระ น้ำมูก น้ำลายของ สัตว์ปึก หรือเกิดจากการสัมผัสสิ่งแวดล้อม พื้นผิวที่ปนเปื้อนเชื้อไวรัส จากสัตว์ปีกที่ป่วย สำหรับการติดต่อจากคนสู่คนมีโอกาสเกิดได้น้อย
3. เปปไทด์จากจิ้งหรีด: โปรตีนทางเลือกใหม่
โปรตีนทางเลือกใหม่! เปปไทด์จากจิ้งหรีด ???? โดย อาจารย์ ดร.ภัทราภรณ์ สุขขาว และ อาจารย์นรฤทธิ สมศิริ คณะการจัดการธุรกิจอาหาร สถาบันการจัดการปัญญาภิวัฒน์ อุดมด้วยโปรตีนและกรดอะมิโน อร่อย ดีต่อสุขภาพ แถมยังช่วยเกษตรกรไทยอีกด้วยนะ
ตารางแพทย์ผู้ป่วยนอก วันพุธ โรงพยาบาลชลบุรี
บุหรี่ไฟฟ้า ไม่สูบ…ก็เสี่ยง
ศูนย์สนับสนุนบริการสุขภาพที่ 3 นครสวรรค์
ศูนย์สนับสนุนบริการสุขภาพที่ 3 (Regional Health Service Support Center 3) มีพื้นที่รับผิดชอบ จำนวน 5 จังหวัด ได้แก่ กำแพงเพชร พิจิตร นครสวรรค์ ชัยนาท อุทัยธานี
- 516/17 ถนนพหลโยธิน ตำบลนครสวรรค์ตก อำเภอเมืองนครสวรรค์ จังหวัดนครสวรรค์ 60000
- โทร 0 5622 1289
- email : saraban-hss3@hss.mail.go.th
- Google map
- Facebook
- Website
รูปที่ 5 รายได้เฉลี่ยต่อปีของกลุ่มผู้สูงอายุที่มีศักยภาพแบ่งตามพื้นที่
เชิญชวนผู้มีจิตศรัทธาร่วมบริจาคเงินสมทบทุน
#คำว่าให้ไม่สิ้นสุด #ความสุขจากการให้ไม่สิ้นสุด
3. แฝดดิจิทัลในการดูแลสุขภาพ (Digital Twin in Healthcare)
จะดีแค่ไหน หากเรารู้ผลการรักษาก่อนการรักษาจริง สามารถปรับวิธีการรักษาให้เหมาะสมกับเราที่สุด หรือแม้แต่สามารถประเมินความเสี่ยงการเป็นโรคต่างๆ ของเราได้ล่วงหน้า
แฝดดิจิทัลในการดูแลสุขภาพ (Digital Twin in Healthcare) คือ ฐานข้อมูสภาพร่างกาย สภาวะร่างกายส่วนบุคคลแบบดิจิทัล รวมถึงข้อมูลสัมพันธ์อื่นๆ เช่น เวลา สถานที่ ตำแหน่ง ฯลฯ ที่วัดค่าอย่างต่อเนื่องและเก็บบันทึกไว้ ผ่านทางอุปกรณ์อัจฉริยะสวมใส่ได้หรือพกพาได้ชนิดต่าง ๆ ที่มีเซนเซอร์ติดไว้ อาทิ สมาร์ตวอตช์หรือสมาร์ตโฟน รวมถึง ข้อมูลประวัติการรักษาทางการแพทย์ต่างๆ เช่น ผลการตรวจร่างกาย ตรวจเลือด ภาพถ่ายทางการแพทย์ ฯลฯ โดยข้อมูลบุคคลเหล่านี้ จะนำไปใช้ในการตรวจวิเคราะห์ วินิจฉัย ในการรักษาโรค ไปจนถึงการกระบวนการที่ซับซ้อนขึ้นได้ เช่น จำลองการทำงานอวัยวะร่างกาย จำลองทดสอบสมมุติฐานการรักษา พยากรณ์โรค เพื่อกำหนดแนวทางการรักษาโรค การให้ยา และแนวทางป้องกันหรือดูแลสุขภาพ นั่นเอง
ปัจจุบันมีหลายบริษัทในต่างประเทศที่ ได้พัฒนา Digital Twin Platform สำหรับใช้ในทางการแพทย์ อาทิ
- บริษัททวินเฮลท์ (Twin Health) จากสหรัฐอเมริกา ได้พัฒนา Digital Twin Platform สำหรับดูแลผู้ป่วยโรคเบาหวาน โดยจำลองระบบการเผาผลาญพลังงานของผู้ป่วยจากข้อมูลต่าง ๆ ของผู้ป่วย เช่น ข้อมูลผลตรวจทางการแพทย์ ข้อมูลจากอุปกรณ์สวมใส่ รวมทั้งข้อมูลพฤติกรรมจากแบบสอบถาม เมื่อประมวลผลด้วย AI ก็สามารถสร้างแผนการดูแลสุขภาพ เช่น การรับประทานอาหาร การออกกำลังกาย และการนอนที่เหมาะสมได้
- บริษัทคิวไบโอ (Q Bio) สหรัฐอเมริกา ได้พัฒนาเครื่อง MRI ที่สแกนผู้ป่วยได้ทั้งตัว โดยใช้เวลาแค่ 15 นาที เมื่อใช้ข้อมูลนี้ร่วมกับข้อมูลทางสุขภาพอื่น ๆ เช่น ข้อมูลทางพันธุกรรม ข้อมูลทางสุขภาพ ข้อมูลจากอุปกรณ์สวมใส่ และนำไปประมวลผลโดยใช้แบบจำลอง AI ที่สร้างจากฐานข้อมูลสุขภาพขนาดใหญ่ ก็ได้ข้อมูลสุขภาพเฉพาะบุคคลที่มีประโยชน์ สรุปผลสุขภาพและความเสี่ยงในปัจจุบัน และทำนายแนวโน้มในอนาคตได้
- บริษัทเมชไบโอ (Mesh Bio) ประเทศสิงคโปร์ ได้พัฒนาระบบ HealthVector® Diabetes เพื่อทำนายความเสี่ยงในการเป็นโรคไตเรื้อรังของผู้ป่วยเบาหวาน โดยใช้แบบจำลอง AI ที่ประมวลผลจากข้อมูลประวัติทางการแพทย์ต่าง ๆ ของผู้ป่วย ระบบนี้ได้ผ่านการขึ้นทะเบียนเครื่องมือแพทย์ที่สิงคโปร์แล้ว ถือเป็นระบบ Digital Twin แรกของโลกที่ใช้งานทางคลินิกได้แล้ว บริษัทมีแผนขยายงานในภูมิภาคอาเซียนต่อไป
ประเทศไทยมีแนวโน้มที่บริษัทชั้นนำทางด้านเทคโนโลยีการแพทย์ รวมทั้งบริษัท health-tech startup ที่จะนำเทคโนโลยีนี้ เข้ามาใช้งานในประเทศไทยในอนาคต
โครงการที่ ๓ โครงการตรวจคัดกรองโรคมะเร็งเต้านมด้วยนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS) และแมมโมแกรม
โครงการที่ ๓ โครงการตรวจคัดกรองโรคมะเร็งเต้านมด้วยนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS) และแมมโมแกรม ส่งเสริมการนำนวัตกรรมมาใช้ในการดูแลสุขภาพประชาชนด้านการป้องกันโรคมะเร็ง
ด้วยมะเร็งเต้านม เป็นปัญหาสุขภาพสำคัญของสตรีทั่วโลก การควบคุมและป้องกันมะเร็งเต้านม คือ การรณรงค์ให้สตรีได้เข้ารับการตรวจคัดกรองหามะเร็งเต้านม ซึ่งเทคโนโลยีทางการแพทย์สามารถตรวจพบได้ตั้งแต่ระยะเริ่มแรก ซึ่งจะช่วยทำให้การรักษาได้ผลดี เพิ่มอัตราการรอดชีวิตของผู้ป่วยได้สูงขึ้น และเพิ่มคุณภาพชีวิตของผู้ป่วยโรคมะเร็ง
อย่างไรก็ตาม ในปัจจุบันยังพบว่ามีสตรีอีกเป็นจำนวนมากที่รอคิวหรือไม่สามารถเข้าถึงการตรวจคัดกรองมะเร็งเต้านมด้วยการทำแมมโมแกรมและอัลตราซาวด์ โรงพยาบาลจุฬาภรณ์ ร่วมกับ วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ จึงได้เล็งเห็นความจำเป็นในการออกแบบพัฒนาระบบบริการสุขภาพเคลื่อนที่สำหรับการตรวจคัดกรองมะเร็งเต้านมในสตรีไทยโดยนำนวัตกรรมรถอัลตราซาวด์เต้านมสามมิติ (3D-ABUS) และแมมโมแกรม พร้อมด้วยระบบรายงานผลดิจิทัล และเทคโนโลยีปัญญาประดิษฐ์ AI ร่วมวินิจฉัยกับรังสีแพทย์ ซึ่งเป็นผลงานการสร้างสรรค์นวัตกรรมสุขภาพจากบุคลากรราชวิทยาลัยจุฬาภรณ์ที่ได้รับรางวัลจากเวทีประกวดนวัตกรรมและสิ่งประดิษฐ์ระดับนานาชาติ นำมาใช้ในการออกหน่วยลงพื้นที่สู่ชุมชนเพื่อเพิ่มโอกาสในการเข้าถึงการตรวจคัดกรองมะเร็งเต้านมในสตรีกลุ่มเสี่ยงและด้อยโอกาส ในเขตพื้นที่กรุงเทพมหานครโซนเหนือทั้งหมด ๗ เขต จังหวัดปทุมธานีและนนทบุรี จำนวน ๗๒๐ ราย โดยมุ่งหวังว่าจะเป็นประโยชน์ต่อการพัฒนาระบบบริการสุขภาพให้กับประเทศไทยและเพิ่มโอกาสในการเข้าถึงการตรวจคัดกรองมะเร็งเต้านมในพื้นที่ห่างไกลต่อไป
3.GOOD HEALTH AND WELL-BEING สุขภาพและความเป็นอยู่ที่ดี
สุขภาพที่ดีและความเป็นอยู่ที่ดี
เราได้ประสบความคืบหน้าอย่างมากในการแก้ไขปัญหาสาเหตุการเสียชีวิตและโรคต่างๆ ที่สำคัญหลายประการ อายุขัยเพิ่มขึ้นอย่างมาก อัตราการเสียชีวิตของทารกและมารดาลดลง เราได้พลิกกระแสของ HIV และการเสียชีวิตจากมาลาเรียลดลงครึ่งหนึ่ง
สุขภาพที่ดีมีความจำเป็นต่อการพัฒนาอย่างยั่งยืน และวาระการพัฒนาปี 2030 สะท้อนให้เห็นถึงความซับซ้อนและความเชื่อมโยงของทั้งสองประเด็น โดยคำนึงถึงความไม่เท่าเทียมกันทางเศรษฐกิจและสังคมที่เพิ่มมากขึ้น การขยายตัวของเมืองอย่างรวดเร็ว ภัยคุกคามต่อสภาพอากาศและสิ่งแวดล้อม ภาระที่ต่อเนื่องของ HIV และโรคติดเชื้ออื่นๆ และความท้าทายที่เกิดขึ้นใหม่ เช่น โรคไม่ติดต่อ การครอบคลุมด้านสุขภาพถ้วนหน้าจะเป็นส่วนสำคัญในการบรรลุเป้าหมายการพัฒนาที่ยั่งยืนข้อที่ 3 การยุติความยากจนและลดความไม่เท่าเทียมกัน นอกจากนี้ ลำดับความสำคัญด้านสุขภาพระดับโลกที่เกิดขึ้นใหม่ซึ่งไม่ได้ระบุไว้อย่างชัดเจนในเป้าหมายการพัฒนาที่ยั่งยืน รวมถึงการดื้อยาต้านจุลชีพ ยังเรียกร้องให้มีการดำเนินการ
แต่โลกยังคงหลงทางในการบรรลุเป้าหมายการพัฒนาที่ยั่งยืนที่เกี่ยวข้องกับสุขภาพ ความก้าวหน้าไม่สม่ำเสมอทั้งระหว่างประเทศและภายในประเทศ ประเทศที่มีอายุขัยสั้นที่สุดและอายุขัยยาวนานที่สุดมีช่องว่างระหว่างกันถึง 31 ปี และแม้ว่าบางประเทศจะมีความก้าวหน้าอย่างน่าประทับใจ แต่ค่าเฉลี่ยของประเทศกลับปกปิดว่ายังมีหลายประเทศที่ถูกทิ้งไว้ข้างหลัง แนวทางหลายภาคส่วน อิงตามสิทธิ และคำนึงถึงเพศมีความจำเป็นในการแก้ไขความไม่เท่าเทียมกันและสร้างสุขภาพที่ดีสำหรับทุกคน
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนมีนาคม 2567
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
มีนาคม 2567 ตามที่กระทรวงอุตสาหกรรม (อก.) เสนอ
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมเดือนมีนาคม 2567 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) หดตัวร้อยละ 5.1 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากปัญหาหนี้ครัวเรือนและอัตราดอกเบี้ยเงินกู้อยู่ในระดับสูง ส่งผลให้การบริโภคภายในประเทศโดยเฉพาะสินค้ากึ่งคงทนและสินค้าคงทนปรับตัวลดลง เช่น รถยนต์ ชิ้นส่วนอิเล็กทรอนิกส์ เป็นต้น ประกอบกับการชะลอตัวของเศรษฐกิจประเทศคู่ค้าหลัก เช่น อาเซียน (5) CLMV ส่งผลให้การส่งออกชะลอตัวในกลุ่มรถยนต์ ชิ้นส่วนอิเล็กทรอนิกส์ เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนมีนาคม 2567 หดตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน คือ
1. ยานยนต์ หดตัวร้อยละ 22.63 จากบรรทุกปิคอัพ รถยนต์นั่งขนาดเล็ก รถยนต์นั่งขนาดใหญ่ และเครื่องยนต์ดีเซลเป็นหลัก ตามการหดตัวของตลาดในประเทศ (-33.15%) เนื่องจากกำลังซื้อของผู้บริโภคอ่อนแอ หนี้สินครัวเรือนอยู่ในระดับสูง ปัญหาการผ่อนชำระหนี้ สถาบันการเงินเข้มงวดในการปล่อยสินเชื่อ
2. น้ำตาล หดตัวร้อยละ 25.26 จากน้ำตาลทรายดิบ กากน้ำตาล และน้ำตาลทรายขาว เป็นหลัก เนื่องจากผลผลิตอ้อยสดมีน้อยกว่าปีก่อนจากปัญหาภัยแล้ง ฝนทิ้งช่วงทำให้พื้นที่เพาะปลูกได้รับผลกระทบบางพื้นที่
3. ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 15.33 จาก Integrated circuits (IC) เป็นหลัก ตามการชะลอตัวเศรษฐกิจโลกที่ส่งผลต่อการบริโภคและลงทุน
อุตสาหกรรมสำคัญที่ยังขยายตัวในเดือนมีนาคม 2567 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม ขยายตัวร้อยละ 5.32 จากน้ำมันเครื่องบิน ก๊าซหุงต้ม และแก๊สโซฮอล์ 91 เป็นหลัก ตามความต้องการใช้ในการเดินทางที่ขยายตัวต่อเนื่อง โดยเฉพาะภาคการท่องเที่ยว
2. แป้งมันสำปะหลัง ขยายตัวร้อยละ 47.65 จากแป้งมันสำปะหลัง เป็นหลักตามปริมาณหัวมันสดเข้าสู่โรงงานมากกว่าปีก่อนหลังปัญหาโรคใบด่างเริ่มลดลง หัวมันสดได้ราคาดี เกษตรกรขยายพื้นที่เพาะปลูก
3. อาหารสัตว์สำเร็จรูป ขยายตัวร้อยละ 8.45 จากอาหารสัตว์เลี้ยง และอาหารสุกรสำเร็จรูป เป็นหลัก โดยอาหารสัตว์เลี้ยงขยายตัวจากตลาดส่งออก (+33.62%) ตามความนิยมในการเลี้ยงสุนัขและแมว สำหรับอาหารสุกรเพิ่มขึ้นตามปริมาณการเลี้ยงหมูของเกษตรกรที่มีปริมาณเพิ่มมากขึ้น
การวิจัยส่วนที่ 3 : โครงการวิจัยย่อยที่ 3 LINK
โครงการวิจัยในส่วนนี้มีวัตถุประสงค์เพื่อ “ประเมินผลด้านระบบข้อมูล/สารสนเทศของโรงพยาบาล ส่งเสริมสุขภาพตำบลที่ได้รับการถ่ายโอนจากกระทรวงสาธารณสุขไปสู่องค์การบริหารส่วนจังหวัด” โดยมุ่ง ศึกษา การเปลี่ยนแปลงสังกัดของ รพ.สต. ที่ถ่ายโอนไปสู่ อบจ. ได้ทำให้เกิดการเปลี่ยนแปลงระบบข้อมูลและ สารสนเทศได้บ้างหรือไม่ อย่างไร และประเมินผลความพร้อมและประสิทธิภาพของระบบข้อมูลและ สารสนเทศของ รพ.สต. ในการสนับสนุนการให้บริการแก่ประชาชน ภายหลังจากการถ่ายโอนไปสู่ อบจ
ผลจากการทบทวนวรรณกรรมที่ผ่านมา เพื่อให้ทราบว่าระบบข้อมูล/สารสนเทศของ รพ.สต. ที่ถ่าย โอนไปสู่ อบจ. มีสถานภาพเป็นอย่างไร เปลี่ยนแปลงไปจากเดิมหรือไม่ ผู้วิจัยได้พิจารณานำหลักเกณฑ์การ ประเมินคุณภาพตามมาตรฐาน รพ.สต. ติดดาว (เฉพาะส่วนที่ว่าด้วยระบบข้อมูลสารสนเทศ)มาประกอบการ ประเมินด้วย โดยเสนอกรอบแนวคิดการวิจัยในลักษณะโจทย์การวิจัย 5 ข้อ ดังนี้ดังจะกล่าวแต่ละข้อในผล การค้นพบ
ในด้านวิธีวิทยาการวิจัย คณะวิจัยได้เลือกใช้วิธีวิจัยการประเมินผล โดยการวิจัยเชิงคุณภาพ โดยเก็บรวบรวมข้อมูลโดยวิธีสำรวจเชิงรุกร่วมไปกับการสัมภาษณ์ผู้มีประสบการณ์ตรงในการผลิตข้อมูลนั้น หลังจากนั้นได้ทำการวิเคราะห์และตีความเพื่อตอบโจทย์การวิจัย จาก 32 รพ.สต. ใน 8 จังหวัด 4 ภาค [
รายงานฉบับเต็ม pdf]
แถลงการณ์ร่วมของหน่วยมวยสากล/IOC สำหรับการแข่งขันปารีส 2024
2 สิงหาคม 2024
ทุกคนมีสิทธิที่จะเล่นกีฬาได้โดยไม่เลือกปฏิบัติ
นักกีฬาทุกคนที่เข้าร่วมการแข่งขันชกมวยในโอลิมปิกเกมส์ ปารีส 2024 จะต้องปฏิบัติตามกฎเกณฑ์การมีสิทธิ์เข้าร่วมการแข่งขันและกฎเกณฑ์ทางการแพทย์ที่เกี่ยวข้องทั้งหมดที่กำหนดโดยหน่วยชกมวยปารีส 2024 (PBU) (โปรดดูกฎเกณฑ์ที่เกี่ยวข้องทั้งหมดที่นี่) เช่นเดียวกับการแข่งขันชกมวยโอลิมปิกครั้งก่อนๆ เพศและอายุของนักกีฬาจะพิจารณาจากหนังสือเดินทาง
กฎเหล่านี้ยังใช้บังคับในช่วงรอบคัดเลือก รวมถึงการแข่งขันมวยสากลของ European Games 2023, Asian Games, Pan American Games และ Pacific Games การแข่งขันรอบคัดเลือกของ African Games 2023 ที่ดาการ์ (SEN) และการแข่งขันรอบคัดเลือกระดับโลก 2 รอบที่จัดขึ้นที่ Busto Arsizio (ITA) และกรุงเทพฯ (THA) ในปี 2024 ซึ่งมีนักมวยจากคณะกรรมการโอลิมปิกแห่งชาติ (NOC) 172 ประเทศเข้าร่วมทั้งหมด 1,471 คน ทีมมวยสากลผู้ลี้ภัย และนักกีฬาประเภทบุคคล และมีการแข่งขันรอบคัดเลือกมากกว่า 2,000 นัด
PBU ใช้กฎมวยสากลของ Tokyo 2020 เป็นพื้นฐานในการพัฒนาระเบียบข้อบังคับสำหรับ Paris 2024 เพื่อลดผลกระทบต่อการเตรียมตัวของนักกีฬาและรับประกันความสม่ำเสมอระหว่างการแข่งขันกีฬาโอลิมปิก กฎการแข่งขันโอลิมปิกโตเกียว 2020 นี้มีพื้นฐานมาจากกฎหลังการแข่งขันริโอ 2016 ซึ่งมีผลบังคับใช้ก่อนที่ IOC จะสั่งระงับสหพันธ์มวยสากลนานาชาติในปี 2019 และถอนการรับรองในปี 2023
เราพบรายงานที่ให้ข้อมูลที่ทำให้เข้าใจผิดเกี่ยวกับนักกีฬาหญิงสองคนที่แข่งขันในโอลิมปิกที่ปารีสในปี 2024 นักกีฬาทั้งสองคนแข่งขันมวยสากลระดับนานาชาติในประเภทหญิงมาหลายปีแล้ว รวมถึงโอลิมปิกที่โตเกียว 2020 การแข่งขันชิงแชมป์โลกของสมาคมมวยสากลนานาชาติ (IBA) และการแข่งขันที่ได้รับการอนุมัติจาก IBA
นักกีฬาทั้งสองคนนี้ตกเป็นเหยื่อของการตัดสินใจที่กะทันหันและตามอำเภอใจของ IBA เมื่อใกล้จะสิ้นสุดการแข่งขันชิงแชมป์โลก IBA ในปี 2023 พวกเธอถูกตัดสิทธิ์โดยกะทันหันโดยไม่มีกระบวนการทางกฎหมายใดๆ
ตามบันทึกการประชุมของ IBA ที่มีให้บนเว็บไซต์ การตัดสินใจครั้งนี้เริ่มต้นโดยเลขาธิการและซีอีโอของ IBA เพียงคนเดียว คณะกรรมการ IBA ลงมติรับรองในภายหลังและขอให้กำหนดขั้นตอนสำหรับกรณีที่คล้ายกันในอนาคตและสะท้อนให้เห็นในระเบียบ IBA บันทึกการประชุมยังระบุด้วยว่า IBA ควร "กำหนดขั้นตอนที่ชัดเจนเกี่ยวกับการทดสอบเพศ"
การกระทำที่ก้าวร้าวต่อนักกีฬาทั้งสองคนนี้ในปัจจุบันมีสาเหตุมาจากการตัดสินใจโดยพลการซึ่งเกิดขึ้นโดยไม่มีขั้นตอนที่เหมาะสม โดยเฉพาะอย่างยิ่งเมื่อพิจารณาว่านักกีฬาทั้งสองคนนี้เคยแข่งขันในระดับสูงสุดมาหลายปีแล้ว
แนวทางดังกล่าวขัดต่อหลักธรรมาภิบาลที่ดี
กฎเกณฑ์การมีสิทธิ์ไม่ควรเปลี่ยนแปลงในระหว่างการแข่งขันที่กำลังดำเนินอยู่ และการเปลี่ยนแปลงกฎเกณฑ์ใดๆ จะต้องปฏิบัติตามกระบวนการที่เหมาะสมและควรยึดตามหลักฐานทางวิทยาศาสตร์
IOC มุ่งมั่นที่จะปกป้องสิทธิมนุษยชนของนักกีฬาทุกคนที่เข้าร่วมการแข่งขันกีฬาโอลิมปิกตามกฎบัตรโอลิมปิก จรรยาบรรณของ IOC และกรอบกลยุทธ์ด้านสิทธิมนุษยชนของ IOC IOC รู้สึกเสียใจกับการละเมิดที่นักกีฬาทั้งสองคนกำลังได้รับอยู่ในขณะนี้
IOC ถอนการรับรอง IBA ในปี 2023 หลังจากระงับการรับรองในปี 2019 การถอนการรับรองได้รับการยืนยันโดยศาลอนุญาโตตุลาการกีฬา (CAS) ดูคำชี้แจงของ IOC หลังจากคำตัดสิน
IOC ได้ชี้แจงอย่างชัดเจนว่าจำเป็นต้องให้สหพันธ์มวยแห่งชาติบรรลุฉันทามติเกี่ยวกับสหพันธ์นานาชาติใหม่เพื่อให้มวยถูกบรรจุอยู่ในโปรแกรมกีฬาของการแข่งขันกีฬาโอลิมปิก LA28
4 ปัจจัยสำคัญที่ขับเคลื่อนการเติบโต
4 ปัจจัยสำคัญที่ขับเคลื่อนให้การใช้บริการเวชศาสตร์ความงามในไทยเติบโต ทั้งจากผู้ใช้บริการ ในประเทศและผู้ใช้บริการต่างชาติ
- ค่านิยมความสวยความงามในยุคที่ Social media ขับเคลื่อนสังคมจึงส่งผลให้ คนส่วนใหญ่ให้ความสำคัญกับภาพลักษณ์ของตนเอง
• จากข้อมูลของ Meta พบว่า มากกว่า 600 ล้านคนทั่วโลกใช้ฟิลเตอร์บน Facebook และ Instagram
• ผลสำรวจของ University of London ในปี 2021 ยังพบว่า 90% ของ ผู้หญิงทั่วโลกจะแต่งรูปและใส่ฟิลเตอร์ก่อนโพสต์ลง Social media
- เทรนด์ดูแลความงามและเวชศาสตร์ชะลอวัย จากการก้าวเข้าสู่สังคมผู้สูงอายุ โดยสมบูรณ์ (Aged society)* ของไทย
- ค่าบริการในไทยที่เข้าถึงได้ง่าย โดยเฉพาะบริการด้านเวชศาสตร์ความงามที่คนส่วนใหญ่ นิยมใช้บริการ อย่างเช่น
เสริมหน้าอก ค่าบริการเฉลี่ยของไทย 82,500 บาทต่อครั้ง ขณะที่ค่าบริการเฉลี่ยของโลก 152,361 บาทต่อครั้ง
ฉีดโบท็อก ค่าบริการเฉลี่ยของไทย 250 บาทต่อยูนิต ขณะที่ค่าบริการเฉลี่ยของโลก 560 ต่อยูนิต
- การส่งเสริมจากภาครัฐสู่การเป็นศูนย์กลางการท่องเที่ยวเชิงการแพทย์ของไทย โดยบริการด้านเวชศาสตร์ความงามถือเป็นส่วนสำคัญในการดึงดูดนักท่องเที่ยว ต่างชาติ
• นักท่องเที่ยวเชิงการแพทย์ทั่วโลกนิยมใช้บริการเวชศาสตร์ความงามสูงเป็น อันดับ 2 รองจากบริการด้านทันตกรรม
• ในปี 2021 ชาวต่างชาติเดินทางมาใช้บริการเวชศาสตร์ความงามในไทย เพิ่มขึ้นราว 20%YOY โดยส่วนใหญ่เดินทางมาจากยุโรป สหรัฐฯ และเอเชีย
3. Industrializing machine learning - การนำการเรียนรู้ของเครื่องจักรมาใช้ในเชิงอุตสาหกรรม
แนวโน้มการนำการเรียนรู้ของเครื่องจักรมาใช้ในเชิงอุตสาหกรรมนั้นสรุปรวมระบบนิเวศของโซลูชันซอฟต์แวร์และฮาร์ดแวร์ที่เปลี่ยนแปลงอย่างรวดเร็ว ซึ่งช่วยให้การพัฒนา การปรับใช้ และการบำรุงรักษาโซลูชันการเรียนรู้ของเครื่องจักรมีความรวดเร็วและลดความเสี่ยงลงจำนวนผู้แสดงความจำนงบริจาคอวัยวะ ตั้งแต่ 1 กุมภาพันธ์ 2537 – 31 มีนาคม 2567
3) “Waithood” กลุ่มคนโสดที่เลือกจะรอคอยการมีความรักต่อไป เนื่องจากความไม่พร้อม/ ไม่มั่นคงในสถานะทางเศรษฐกิจ จึงมองว่าการแต่งงานในขณะที่ยังไม่พร้อมจะเป็นการลดโอกาสด้านอื่น ๆ ที่อาจเข้ามา อีกทั้ง ยังจะเป็นภาระทางการเงินอีกด้วย
ซึ่งส่วนหนึ่งสะท้อนได้จากคนโสดร้อยละ 40 ที่มีรายได้ต่ำสุด (Bottom 40) โดยมีสัดส่วนอยู่ที่ร้อยละ 37.7 ของประชากรช่วงวัยเจริญพันธุ์ทั้งหมดที่มีรายได้ต่ำกว่าร้อยละ 40
ทั้งนี้ คนโสด Bottom 40 ส่วนใหญ่เป็นเพศชายมากถึงร้อยละ 62.6 อีกทั้ง ยังมีระดับการศึกษาที่ไม่สูงนัก ส่งผลให้ความสามารถ ในการหารายได้จ ากัด โดยอาชีพส่วนใหญ่ของคนโสด Bottom 40 คือ ผู้ปฏิบัติงานที่มีฝีมือด้านการเกษตร ป่าไม้ และประมง และผู้ประกอบอาชีพด้านงานพื้นฐาน อาทิ คนงาน ผู้ช่วยท าความสะอาดที่พักอาศัย นอกจากนี้ ร้อยละ 52.9 ยังเป็นผู้ไม่ได้ทำงานหารายได้อีกด้วย
3. สมาชิกในครัวเรือน Sandwich ส่วนใหญ่เป็นแรงงานนอกระบบ
สมาชิกในครัวเรือน Sandwich ส่วนใหญ่เป็นแรงงานนอกระบบ โดยร้อยละ 47.2 ประกอบอาชีพ เกษตรกรรมและเป็นแรงงานทั่วไป (คนทำความสะอาด รับจ้างทั่วไป) ขณะที่หัวหน้าครัวเรือนร้อยละ 31.9 ท างานส่วนตัว รองลงมาเป็น พนักงานเอกชน และผู้ช่วยธุรกิจในครัวเรือน ที่ร้อยละ 15.9 และ 11.7 ตามลำดับ ทำให้ส่วนใหญ่กว่า ร้อยละ 80 ขาดหลักประกันรายได้ที่มั่นคงในยามเกษียณ ขณะเดียวกัน ครัวเรือน Sandwich ยังเป็นกลุ่ม ที่มีทรัพย์สินทางการเงินเพื่อการออมน้อย โดยร้อยละ 41.8 ของครัวเรือน Sandwich มีเงินออมมูลค่าน้อยกว่า 20,000 บาทต่อครัวเรือน ทำให้เมื่อสูงวัยจะต้องพึ่งพาสวัสดิการจากเบี้ยยังชีพผู้สูงอายุเพียงอย่างเดียว ซึ่งอาจ ไม่เพียงพอต่อการด ารงชีวิตที่มีคุณภาพ ผู้ประกันตน ‘เกษียณ’ ต้องขอรับเงินบำนาญ ก่อนต่อ ม.39?
ผู้ประกันตน ‘เกษียณ’ ต้องขอรับเงินบำนาญ ก่อนต่อ ม.39 [
clip]
ผู้ประกันตน ม.33 จนครบอายุ 55 ปี ส่งสมทบครบ 180 เดือน มีสิทธิรับบำนาญ
สามารถสมัคร ม.39 ต่อได้ แต่ ควรทำหลังรับบำนาญ แล้ว 2 ก้อน แรกไปก่อน
เพื่อเป็นการล็อกฐานเงินเดือนที่บำนาญก้อนแรก ที่อิงฐานเงินเดือน 15,000 บาท
เพราะไม่ได้รับบำนาญก้อนแรก แต่ไปต่อ ม.39 เลย ระบบจะจัดฐานเงินเดือนแรก เป็นแค่ 4,800 บาท
ทั้งนี้ ตามกฏหมายที่เขียนไว้ ว่า เมื่อรับเงินบำนาญก้อนแรกไปแล้ว ในอนาคต เมื่ออยากจะกลับมา อีกครั้ง จะยึดจากฐานเพดานเงินเดือน ตามบำนาญก้อนแรก (ในม.33 นั่นเอง)
บทที่ 3 ความกลัวเกี่ยวกับการว่างงานจำนวนมากที่เกิดจาก AI มีเหตุผลเพียงพอหรือไม่
GenAI มีแนวโน้มที่จะ "กำจัด" งานเฉพาะบางประเภท แทนที่จะเป็นอาชีพ และส่งผลให้เกิดงานใหม่
เทคโนโลยีได้เปลี่ยนแปลงธรรมชาติและโครงสร้างการทำงานมาเป็นเวลานานหลายศตวรรษ โดยแทนที่งานบางประเภทในขณะที่สร้างงานอื่นๆ ขึ้นมา แต่ความวิตกกังวลเกี่ยวกับการว่างงานจำนวนมากที่เกิดจากเทคโนโลยีไม่เคยเกิดขึ้นจริง
ปัจจุบันนี้ ไม่ใช่ครั้งแรกที่ความก้าวหน้าทางเทคโนโลยีทำให้เกิดความกังวลว่าเครื่องจักรจะทำให้แรงงานของผู้คนล้าสมัย ในช่วงปลายศตวรรษที่ 16 สมเด็จพระราชินีนาถเอลิซาเบธที่ 1 ทรงปฏิเสธที่จะให้สิทธิบัตรแก่วิลเลียม ลี นักประดิษฐ์ชาวอังกฤษสำหรับเครื่องถักแบบกลไก เนื่องจากเกรงว่าเครื่องจะเข้ามาแทนที่แรงงานคน
เมื่อไม่นานมานี้ ความกลัวแบบเดียวกันนี้ได้รับการตอบรับจากประชาชนและในการอภิปรายนโยบาย เนื่องจากเทคโนโลยี GenAI ได้รับการพัฒนาอย่างรวดเร็วและมีศักยภาพในการทำให้การทำงานและงานต่างๆ เป็นระบบอัตโนมัติในหลายอุตสาหกรรม แม้จะมีข้อกังวลเหล่านี้ แต่ระดับการจ้างงานกลับเพิ่มขึ้นอย่างต่อเนื่องในศตวรรษที่ผ่านมา เนื่องจากเทคโนโลยีใหม่สร้างงานได้มากกว่าทำลายงาน
ผลกระทบของ AI ต่อแรงงาน
นวัตกรรมทางเทคโนโลยีสามารถส่งผลต่อแรงงานได้ 3 วิธีหลัก:
- การสร้างงาน: เทคโนโลยีใหม่สามารถนำไปสู่การเกิดขึ้นของอุตสาหกรรมและภาคส่วนใหม่ ซึ่งสร้างโอกาสในการทำงานใหม่ ตัวอย่างเช่น การเติบโตของอินเทอร์เน็ตทำให้เกิดงานต่างๆ มากมายในด้านการออกแบบเว็บ การตลาดดิจิทัล อีคอมเมิร์ซ และการสนับสนุนด้านไอทีที่ไม่เคยมีมาก่อน
- การแทนที่งาน: ในทางกลับกัน ระบบอัตโนมัติและความก้าวหน้าทางเทคโนโลยีบางอย่างสามารถทำให้บางงานล้าสมัย งานประจำและซ้ำซาก ไม่ว่าจะเป็นงานที่ใช้แรงงานคน (เช่น งานสายการประกอบ) หรืองานที่ต้องอาศัยความรู้ (เช่น การป้อนข้อมูล) มักจะถูกทำให้เป็นระบบอัตโนมัติ
- การเปลี่ยนแปลงงาน: งานจำนวนมากอาจถูกเปลี่ยนแปลงด้วยเทคโนโลยี แทนที่จะถูกกำจัดไป งานบางอย่างอาจเปลี่ยนเป็นแบบอัตโนมัติไป งานใหม่ๆ ก็อาจเกิดขึ้นตามมา หรือทดแทน หรือลักษณะของงานอาจเปลี่ยนไป ตัวอย่างเช่น ปัจจุบัน พนักงานธนาคารทำหน้าที่จัดการเงินสดน้อยลงเนื่องจากมีตู้เอทีเอ็ม แต่ทำงานบริการลูกค้ามากขึ้น
การนำเครื่องจักรมาใช้ในภาคเกษตรกรรมของสหรัฐฯ อย่างรวดเร็วในช่วงต้นศตวรรษที่ 20 กระตุ้นให้เกิดการเปลี่ยนแปลงโครงสร้างการจ้างงานครั้งใหญ่ที่สุดครั้งหนึ่งในประวัติศาสตร์ยุคใหม่ การนำเครื่องมือและเครื่องจักรใหม่ๆ มาใช้ทำให้ผลผลิตเพิ่มขึ้นอย่างมาก ส่งผลให้ความต้องการแรงงานในฟาร์มลดลง แรงงานที่ถูกเลิกจ้างจำนวนมากถูกบังคับให้ฝึกทักษะใหม่เพื่อหางานอื่น เช่น งานในโรงงาน การอพยพด้านแรงงานนี้ สอดคล้องกับความต้องการแรงงานที่เกิดจากการปฏิวัติอุตสาหกรรม นำไปสู่การจัดสรรงานใหม่ๆ ในสหรัฐอเมริกา
แรงงานเคลื่อนย้ายจากภาคเกษตรกรรมไปสู่อาชีพที่ไม่ใช่ภาคเกษตรกรรม สัดส่วนของภาคเกษตรกรรมในการจ้างงานโดยรวมลดลงจาก 55% ในปี 1850 เหลือ 41% ในปี 1900 และเหลือเพียง 10% ในปี 1950
ในช่วงหลังนี้ การเปลี่ยนผ่านสู่ระบบดิจิทัลของเศรษฐกิจและระบบอัตโนมัติได้เข้ามาแทนที่และเปลี่ยนแปลงงานจำนวนมาก โดยเข้ามาแทนที่งานประจำบางอย่างที่เคยทำโดยแรงงาน ซึ่งส่วนใหญ่เป็นงานที่มีทักษะต่ำและปานกลาง แต่ยุคข้อมูลยังทำให้การจ้างงานที่เกี่ยวข้องกับไอทีเติบโตอย่างรวดเร็ว ด้วยการสร้างตำแหน่งงานใหม่ๆ มากมายที่ไม่เคยมีมาก่อน เช่น นักวิทยาศาสตร์ข้อมูล วิศวกรซอฟต์แวร์ หรือ นักพัฒนาเว็บ
ระหว่างปี 1990 ถึง 2001 การจ้างงานในภาคการผลิตของสหรัฐฯ ลดลง 12% ในขณะที่การจ้างงานด้านการออกแบบระบบคอมพิวเตอร์และบริการที่เกี่ยวข้องเพิ่มขึ้นสามเท่า นอกจากนี้ พนักงานในภาคไอทียังได้รับค่าจ้างสูงกว่าพนักงานทั่วไปในภาคเอกชน ค่าจ้างรายชั่วโมงเฉลี่ยของพนักงานออกแบบระบบคอมพิวเตอร์สูงกว่าพนักงานทั่วไปถึง 1.8 เท่าในปี 1990 และสูงกว่าประมาณสองเท่าในช่วงปลายทศวรรษปี 2007
เนื่องจากเทคโนโลยี GenAI สามารถทำงานด้านความคิดที่ไม่เป็นกิจวัตรได้ จึงมีศักยภาพที่จะเปลี่ยนแปลงลักษณะและเนื้อหาของงานได้อย่างมาก โดยเฉพาะอย่างยิ่งสำหรับพนักงานออฟฟิศ แต่เทคโนโลยี GenAI อาจเข้ามาแทนที่งานเฉพาะบางงานแทนที่จะเป็นงานทั้งหมด และจะนำไปสู่การสร้างงานใหม่ เช่น ผู้ฝึกสอนด้าน AI นักจริยธรรม หรือผู้พัฒนา
คำถามเชิงกลยุทธ์ที่ผู้นำธุรกิจควรถามเกี่ยวกับผลกระทบทางเศรษฐกิจของ AI
ผลกระทบทางเศรษฐกิจมหภาคของเทคโนโลยี GenAI นำเสนอเรื่องราวที่ซับซ้อนให้ผู้นำธุรกิจได้คลี่คลาย การทำความเข้าใจผลกระทบทางเศรษฐกิจในวงกว้างนั้นถือเป็นสิ่งสำคัญยิ่ง โดยช่วยให้มั่นใจได้ว่ากลยุทธ์และจริยธรรมขององค์กรจะสอดคล้องกัน ผู้นำทางธุรกิจสามารถวางตำแหน่งบริษัทของตนให้เป็นจุดตัดระหว่างนวัตกรรมทางเทคโนโลยีและความยืดหยุ่นของเศรษฐกิจมหภาค ซึ่งช่วยให้มั่นใจได้ว่าจะเติบโตอย่างยั่งยืนในโลกที่ได้รับอิทธิพลจากเทคโนโลยี GenAI มากขึ้น
การรับรู้ภูมิทัศน์เศรษฐกิจมหภาค: ผู้นำประเมินและปรับตัวอย่างไรกับภูมิทัศน์เศรษฐกิจมหภาคที่เปลี่ยนแปลงไปซึ่งได้รับอิทธิพลจากเทคโนโลยี GenAI มีทีมงานหรือบุคคลเฉพาะทางที่วิเคราะห์แนวโน้มเศรษฐกิจโลก การเปลี่ยนแปลงในพลวัตทางการค้า หรือการหยุดชะงักที่อาจเกิดขึ้นในห่วงโซ่อุปทานโลกอันเป็นผลมาจากความก้าวหน้าของเทคโนโลยี AI หรือไม่
นวัตกรรมและการเติบโตทางเศรษฐกิจ: บริษัทใช้ประโยชน์จากพลังของเทคโนโลยี GenAI เพื่อส่งเสริมนวัตกรรมที่ขับเคลื่อนการเติบโตทางเศรษฐกิจในวงกว้างได้อย่างไร บริษัทกำลังสำรวจความร่วมมือ การทำงานร่วมกัน หรือการมีส่วนร่วมในระบบนิเวศที่ขยายผลกระทบทางเศรษฐกิจผ่านนวัตกรรมที่ขับเคลื่อนด้วยเทคโนโลยี AI หรือไม่
ภูมิทัศน์การแข่งขันและการวางตำแหน่งเชิงกลยุทธ์: ในขณะที่เทคโนโลยี GenAI ปรับเปลี่ยนโครงสร้างอุตสาหกรรมและพลวัตการแข่งขัน บริษัทคาดการณ์และนำทางการเปลี่ยนแปลงที่อาจเกิดขึ้นในห่วงโซ่คุณค่าของอุตสาหกรรมได้อย่างไร การลงทุนเชิงกลยุทธ์ในเทคโนโลยี GenAI ช่วยรับประกันความได้เปรียบทางการแข่งขันของบริษัทในสถานการณ์เศรษฐกิจมหภาคที่เปลี่ยนแปลงนี้ได้อย่างไร
ผลกระทบภายนอกทางเศรษฐกิจและการสร้างมูลค่า: ผู้นำช่วยรับประกันได้อย่างไรว่ากลยุทธ์เทคโนโลยี GenAI ของบริษัทสร้างมูลค่าทางเศรษฐกิจที่ยั่งยืนโดยไม่สร้างผลกระทบภายนอกทางเศรษฐกิจเชิงลบโดยไม่ได้ตั้งใจ มีมาตรการใดบ้างที่ใช้ประเมินผลกระทบต่อสังคมและเศรษฐกิจโดยรวมของโครงการ AI ของบริษัท
การจัดการความเสี่ยงด้านเศรษฐกิจ: ในกรณีที่เศรษฐกิจตกต่ำหรือตลาดมีความไม่แน่นอน บริษัทใช้ประโยชน์จากเทคโนโลยี GenAI ในการประเมินความเสี่ยงด้านเศรษฐกิจและกลยุทธ์การบรรเทาความเสี่ยงที่แข็งแกร่งได้อย่างไร การวิเคราะห์เชิงคาดการณ์ที่ขับเคลื่อนด้วยเทคโนโลยี AI ช่วยในการจัดการความเสี่ยงเชิงรุกได้อย่างไร
พลวัตของตลาดแรงงานและกลยุทธ์ด้านบุคลากร: เนื่องจากเทคโนโลยี GenAI อาจเข้ามาเปลี่ยนแปลงตลาดแรงงาน ผู้นำจะมั่นใจได้อย่างไรว่า กลยุทธ์ด้านบุคลากรของบริษัทจะพร้อมสำหรับอนาคตและถูกต้องตามจริยธรรม มีการกำหนดวิธีการฝึกฝนทักษะใหม่และยกระดับทักษะพนักงานเพื่อให้สอดคล้องกับภูมิทัศน์ที่เปลี่ยนแปลงไปหรือไม่
การมีส่วนร่วมของผู้มีส่วนได้ส่วนเสียในเศรษฐกิจ GenAI: บริษัทมีส่วนร่วมกับผู้มีส่วนได้ส่วนเสียอย่างไร ตั้งแต่ผู้ลงทุนไปจนถึงผู้บริโภค ในการระบุข้อเสนอที่มีคุณค่าในบริบทเศรษฐกิจที่ขับเคลื่อนด้วยเทคโนโลยี GenAI นี้ การรับรู้และความกังวลของผู้มีส่วนได้ส่วนเสียถูกผนวกเข้าในการตัดสินใจเชิงกลยุทธ์อย่างไร
ภายใต้สภาวการณ์การเปลี่ยนแปลงและความไม่แน่นอนของโรคในปัจจุบัน คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี จึงเห็นโอกาสในการยกระดับหลักสูตรแพทยศาสตร์ให้สอดรับกับความเปลี่ยนแปลงดังกล่าว ประกอบกับความนิยมในด้านกีฬาที่เพิ่มขึ้น จึงเป็นจุดเริ่มต้นของความร่วมมือกับวิทยาลัยวิทยาศาสตร์และเทคโนโลยีการกีฬา มหาวิทยาลัยมหิดล ในการเปิดหลักสูตรใหม่เพื่อผลิต ‘นักปฏิบัติการฉุกเฉินการแพทย์ด้านกีฬา’ (Sport Paramedic) เป็นความหวังให้กับอุตสาหกรรมการกีฬาและการแพทย์ไทยในอนาคต
6. การจัดการคลังยาที่จัดลำดับตามล็อตและทราบตำแหน่งที่เก็บที่กำหนดตามสาขาและส่วนกลาง การโอนระหว่างสาขา สามารถทราบจำนวนยา/เวชภัณฑ์ ที่มีอยู่และใกล้หมดอายุ การเตือนเมื่อจำนวนต่ำกว่าที่ตั้งไว้ การติดตาม ล็อตที่จ่ายให้ผู้ป่วย
รายละเอียดเพิ่มเติม
นอกจากนี้ โปรแกรมคลินิก ใช้เป็นระบบจำหน่ายยา ที่มีคุณสมบัติเช่น แจ้งเตือนแพ้ยา รู้ล็อตของยาที่จำหน่ายและลำดับของ Expiry Date รู้ตำแหน่งที่เก็บยา ใช้ barcode reader ในการบันทึกยา รวมถึงโอนกลับมายังห้องตรวจ
จำนวนผู้ประกอบโรคศิลปะ 30 ก.ย. 2566
โปรแกรมบริหารคลินิก MCS (Miracle Clinic System)
Miracle Clinic System ผู้นำด้าน Digital Health Service Provider และผู้พัฒนาและให้บริการระบบบริหารคลินิกแบบครบวงจร โดยมีลิขสิทธิ์ในชื่อโปรแกรม Miracle Clinic System ถูกพัฒนาและต่อยอดออกแบบมาเฉพาะทางสำหรับใช้งานในคลินิกทางการแพทย์ ไม่ว่าจะเป็นการเก็บข้อมูลผู้ป่วย ข้อมูลประวัติการรักษา ข้อมูลการชำระเงิน ข้อมูล OPD ต่างๆ พร้อมทั้งรายงานทางคลินิก ซึ่งรองรับคลินิกประเภทต่างๆ อาทิ คลินิกเวชกรรมทั่วไป คลินิกเวชกรรมความงาม คลินิกกายภาพบำบัด คลินิกเด็ก คลินิกเพื่อการมีบุตร คลินิกกระดูกและข้อ คลินิกฝังเข็มแพทย์แผนจีน เป็นต้น
โปรแกรมบริหารคลินิก MCS ทีมพัฒนาและทีมสนับสนุนของบริษัทรองรับการบริการและข้อมูลทางการแพทย์ที่อัพเดตและเปลี่ยนแปลงตลอดเวลา โดยการนำเทคโนโลยีที่ทันสมัยมาปรับปรุงและเพิ่มประสิทธิภาพให้กับระบบและงานบริการของคลินิกตั้งแต่การสั่งซื้อวัตถุดิบจนไปถึงการนัดหมายลูกค้า ตั้งแต่ต้นทางจนไปถึงปลายทาง และพร้อมเชื่อมต่อกับพันธมิตรเพื่อเสริมความเข้มแข็งและประสิทธิภาพของระบบ
สอบถามโทร 082-662-5559 064-319-4441 02-1147164
โปรแกรมบริหารคลินิกออนไลน์ Cliniter
CLINITER ซอฟต์แวร์ที่พัฒนามาเพื่อช่วยแก้ไขระบบการจัดการ และบริหารภายในให้กับคลินิก ด้วยเทคโนโลยีการบริหารจัดการคลินิกสมัยใหม่ ทำให้คลินิกบริหารจัดการได้อย่างรวดเร็วยิ่งขึ้น เพิ่มความปลอดภัยในการจัดเก็บข้อมูล และวิเคราะห์ข้อมูลได้อย่างแม่นยำ มีความสะดวกในการค้นหาข้อมูลและบันทึกข้อมูล เป็นตัวกลางในการเชื่อมต่อระหว่างคลินิกและคนไข้
CLINITER มีรูปแบบบริการให้เลือกดังนี้
1) Cliniter Plus ระบบจัดการคลินิกออนไลน์แบบครบวงจร มีฟีเจอร์เด่น อาทิ Doctor Noteเขียนบนหน้าจอทัชสกรีนได้ ลดการใช้กระดาษ แพทย์สามารถเขียนจดบันทึกลงบนหน้าจอได้เลย ระบบนัดหมาย ติดตามทางแอปพลิเคชัน ระบบแจ้งเตือนนัดหมายผ่านทาง Line notification ระบบตารางเวรแพทย์ ระบบพิมพ์ฉลากยา ระบบออกใบรับรองแพทย์ ระบบเซ็นเอกสารยินยอมการรักษา ค่าบริการแบ่งเป็นแพคเกจ Mini Plus More Plus Ultimate Plus (20,000 - 36,000 ต่อปี)
2) Cliniter Dental สำหรับบริหารคลินิกทันตกรรม มีฟีเจอร์เด่น อาทิ ระบบ Tooth Chart ระบบ Doctor Note บันทึกข้อมูลง่าย เพียงเขียนบนหน้าจอ Application ส่งข่าวสารประชาสัมพันธ์แจ้งเตือนนัดหมายให้กับลูกค้าคลินิก ระบบคำนวนค่า DF ระบบ Dash Board ระบบแจ้งเตือนคิวลูกค้า ผ่านทางไลน์ ค่าบริการแบ่งเป็นแพคเกจ Standard. Premium Ultra. (20,000 - 38,000 ต่อปี)
อนาคตจะมี Cliniter Beauty Cliniter Pet ออกมาสู่ตลาด
สอบถามโทร 095-6460428
ส่วนที่ 2 ส่วนแขนกลหุ่นยนต์
ส่วนที่ 2 ส่วนแขนกลหุ่นยนต์ ถือเป็นพระเอกของเครื่องนี้เลย เป็นส่วนที่อยู่ใกล้ผู้ป่วยมากที่สุด ทำหน้าที่คล้ายกับแขนของศัลยแพทย์ ประกอบด้วยแขนกล 4 แขน (เพิ่มแขนให้กับแพทย์ขึ้นมาอีก 2 แขน 4 มือ เลยทีเดียว) และแขนนี้ยังทรงพลังกว่าแขนของมนุษย์ เพราะปกติเวลาแพทย์ผ่าตัดจะมีความเมื่อยล้าเกิดขึ้น แขนหุ่นยนต์นี้จะไม่มีปัญหาเหล่านั้น ทำให้มีความเสถียร ทำให้การผ่าตัดแม่นยำขึ้น
การรักษาทางทันตกรรมกับนิสิตทันตแพทย์
รับการรักษาในเวลา 8.30-16.00 น.วันจันทร์ถึงศุกร์ ยกเว้นวันหยุดราชการ
สามารถตรวจฟัน ถ่ายภาพรังสี อุดฟัน ขูดหินปูน ถอนฟัน ผ่าฟันคุด เคลือบหลุมร่องฟัน เคลือบฟลูออไรด์ รักษารากฟันน้ำนม หรือสิทธิประโยชน์ทางทันตกรรมที่สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กำหนด
ติดต่อสอบถาม โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มหาวิทยาลัยนเรศวร โทร 055-966866
ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติ โรงพยาบาลจุฬาภรณ์ LINK
ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติ โรงพยาบาลจุฬาภรณ์ มีการให้บริการ ตรวจวินิจฉัยสำหรับผู้ป่วยด้วยเครื่องเพทซึ่งมีทั้งเทคโนโลยี “ดิจิทัลเพทซีที” Digital PET/CT Biograph Vision และ “เพทเอ็มอาร์ไอ” PET/MRI Biograph mMR 3 Tesla ให้แพทย์สามารถเลือกส่งตรวจในเครื่องที่มีความเหมาะสมกับรอยโรคและชนิดมะเร็งของผู้ป่วยได้ในอัตราค่าบริการใกล้เคียงกัน
โดยเพทซีที อัตราเริ่มต้นที่ 20,000 บาท และเพทเอ็มอาร์ไอเริ่มต้นที่ 25,000 บาท
แต่สำหรับบางชนิดของมะเร็งทางศูนย์ฯ ก็ให้บริการตรวจควบคู่กันให้ทั้ง 2 เครื่องเพื่อเพิ่มประสิทธิภาพในการวางแผนการรักษาให้กับผู้ป่วย อาทิ มะเร็งต่อมลูกหมาก ตรวจวินิจฉัยทั้งเครื่องPET/MRI และ PET/CT พร้อมกันในอัตราค่าบริการ 23,000 บาท หรือตรวจเพทเอ็มอาร์ไอในผู้ป่วยมะเร็งต่อมน้ำเหลือง ราคา 18,000 บาท เป็นต้น โดยที่ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติให้บริการตรวจผู้ป่วยทั้งที่เป็นผู้ป่วยของโรงพยาบาลจุฬาภรณ์ และผู้ป่วยที่ส่งมาจากโรงพยาบาลต่างๆ ทั่วประเทศ
การบริหารกล้ามเนื้อ 4 ส่วน
การบริหารกายเพื่อสร้างความแข็งแรงและทนทานของกล้ามเนื้อ 4 ส่วน โดยทำในช่วงเวลาว่าง ๆ ได้ดังนี้ บริหารกล้ามเนื้อคอ การบริหารกล้ามเนื้อคอด้านหลัง การบริหารกล้ามเนื้อคอด้านข้าง 1 การบริหารกล้ามเนื้อคอด้านข้าง 2 บริหารกล้ามเนื้อไหล บริหารข้อไหล่และหลังแขน บริหารไหล บริหารหัวไหล่ บริหารกล้ามเนื้อลำตัว บริหารกล้ามเนื้อขา
เตือนภัยแม่เสพยาขณะตั้งครรภ์ระวังลูกผิดปกติ เกิดภาวะวิกฤติ เสี่ยงอันตรายทั้งแม่และลูก
มูลนิธิกระจกเงา เปิดร่วมบริจาคสิ่งของเหลือใช้ เพื่อเป็นส่วนหนึ่งในการดูแลผู้เดือดร้อนในยามวิกฤติน้ำท่วม มูลนิธิกระจกเงาเลขที่ 191 ซอยวิภาวดีรังสิต 62 แยก 4-7 แขวงตลาดบางเขน เขตหลักสี่ กทม. 10210 โทร.06-1909-1840, 06-3931-6340 และที่ว่าการ อ.เทิง 053-795-502
23 สิงหาคม 2567 ทีมส่วนหน้ามูลนิธิกระจกเงา ยังอยู่ในพื้นที่ บ้านเหล่า ม.1 ต.ตับเต่า อ.เทิง เพื่อช่วยล้างบ้านให้ผู้สูงอายุตัวคนเดียว และชาวบ้านหลายสิบครัวเรือน ที่สาหัสจากน้ำท่วมฉับพลันและน้ำป่าไหลหลาก
ภารกิจฟื้นฟูช่วยชาวบ้าน ยังต้องการอุปกรณ์ทำความสะอาด และของตั้งต้นจำนวนมาก เช่น แพมเพิสสำหรับผู้ป่วย เครื่องใช้ไฟฟ้า หมอหุงข้าว กาน้ำร้อน เครื่องครัว เครื่องนอน ผ้าห่ม ฯลฯ
สามารถสนับสนุนสิ่งของเหล่านี้ได้ที่ มูลนิธิกระจกเงา เลขที่ 191 ซอย วิภาวดีรังสิต 62 แยก 4-7 แขวงตลาดบางเขน เขตหลักสี่ กทม. 10210 โทร. 06 1909 1840, 06 3931 6340
หรือ สนับสนุนงานภัยพิบัติของมูลนิธิกระจกเงาได้ที่ กองทุนภัยพิบัติ (Special Force) โดยมูลนิธิกระจกเงา เลขที่บัญชี 202-258298-3 ธ.ไทยพาณิชย์
คลินิกเลิกบุหรี่ โรงพยาบาลสิรินธร กรุงเทพมหานคร
เปิดบริการวันพฤหัสบดี และ วันศุกร์ เวลา 8.00-12.00 น. ณ ห้องตรวจผู้ป่วยนอก คลินิกระบบทางเดินหายใจ ชั้น 2 อาคารบริการ โรงพยาบาลสิรินธร กรุงเทพมหานคร สอบถามโทร 02-3286900 ถึง 19 ต่อ 11400
บรรยากาศการวิ่งที่แตกต่าง นำความสุขมาร่วมเป็นส่วนหนึ่งในการช่วยน้องออทิสติก วิ่งเข้าเส้นขัยไปด้วยกัน เข้าเส้นชัยพร้อมกันทุกวัย ไม่ทิ้งใครไว้ข้างหลัง
งานนี้ จึงเป็นงานที่นักวิ่งทุกคนนอกจากจะได้รับสุขภาพที่แข็งแรงผ่านกิจกรรมการออกกำลังกายแล้ว ยังหอบความสุขในการร่วมเป็นส่วนสำคัญ ในการมีส่วนร่วมพัฒนาน้องๆออทิสติกกลับบ้านอย่างอิ่มเอมใจ ความสุขที่ยั่งยืนนี้จะกลับมาอีกครั้งในปีหน้า จึงขอเชิญชวนผู้สนใจทั่วไปติดตามกิจกรรมของเราได้อย่างต่อเนื่องได้ที่ facebook fanpage - Run Together For Autism วิ่งด้วยกัน รันเพื่อ. น้อง และติดตามกิจกรรมของเยาวชนจิตอาสาในนาม Beyond the Spectrum เพื่อเป็นกำลังใจและ ไม่พลาดกิจกรรมต่างๆ ที่จะจัดขึ้นในลำดับต่อไป
การบริโภคเครื่องดื่มแอลกอฮอล์และบุหรี่
การบริโภคเครื่องดื่มแอลกอฮอล์และบุหรี่ไตรมาสสอง ปี 2567 เพิ่มขึ้นจากปีก่อน โดยต้องให้ความสำคัญกับการตอบสนองต่อสื่อประชาสัมพันธ์ในการงดเหล้าของเด็กและ เยาวชนที่ลดลง และการเพิ่มขึ้นของการลักลอบนำเข้าบุหรี่ไฟฟ้า
- ไตรมาสสอง ปี 2567 การบริโภคเครื่องดื่ม แอลกอฮอล์และบุหรี่ ภาพรวมเพิ่มขึ้น ร้อยละ 1.0 โดยเป็นการบริโภคแอลกอฮอล์เพิ่มขึ้นร้อยละ 3.2 ขณะที่การบริโภคบุหรี่ ลดลงร้อยละ 1.9 จากการท่องเที่ยวช่วงเทศกาล ทั้งนักท่องเที่ยว ในประเทศและต่างประเทศ
ประเด็นที่ควรให้ความสำคัญ คือ
1. เด็กและเยาวชนไม่ตระหนักถึง สื่อประชาสัมพันธ์งดการดื่มแอลกอฮอล์ จาก รายงานโครงการประเมินผลการรณรงค์ “งดเหล้า เข้าพรรษา ปี 2566” พบว่า นักดื่มเยาวชนอายุระหว่าง 15 - 19 ปี บริโภคแอลกอฮอล์มีจำนวน 1.2 ล้านคน เพิ่มขึ้น ประมาณ 2 แสนคน จากปี 2565 ที่มีจำนวน 1.0 ล้านคน ทั้งที่มีการประชาสัมพันธ์โครงการงดเหล้าเข้าพรรษาทุกปี ชี้ให้เห็นว่าเด็กมีการรับรู้หรือตอบสนองต่อสื่อประชาสัมพันธ์ลดลง ซึ่งงานศึกษาในประเทศออสเตรเลีย พบว่า การรณรงค์ให้เลิกดื่มแอลกอฮอล์ในช่วงเทศกาลสามารถลดการดื่มแอลกอฮอล์ และเพิ่มการตระหนักรู้เกี่ยวกับอันตราย ของการดื่มแอลกอฮอล์ได้ ขณะเดียวกัน จากรายงานของ YSDN (Youth Strong & Development Network)14 ปี 2567 โดย ข้อมูลการสำรวจเยาวชนที่อายุระหว่าง 12 – 15 ปี จำนวน 10,078 คน ยังพบด้วยว่า เด็กไทยมีค่านิยมทางสังคมที่มองว่า การดื่มในงานบุญประเพณีและในที่สาธารณะเป็นเรื่องปกติ และอาจเป็นอีกหนึ่งสาเหตุที่ทำให้การประชาสัมพันธ์ให้มี การงดเหล้าไม่ประสบผลสำเร็จ ดังนั้น หน่วยงานที่เกี่ยวข้องควรสร้างทัศนคติที่ถูกต้องให้กับเด็ก รวมถึงปรับปรุงแนวทางการรณรงค์ลดการบริโภคเครื่องดื่มแอลกอฮอล์ รวมไปถึง การบังคับใช้กฎหมายกับร้านค้าที่จำหน่ายเครื่องดื่มให้เด็กที่มีอายุต่ ากว่า 20 ปี
2. การเพิ่มขึ้นของการลักลอบนำเข้าบุหรี่ไฟฟ้า จากรายงานของกรมศุลกากร ปี 2566 พบว่า กรมศุลกากรสามารถจับกุมผู้กระทำความผิดลักลอบนำเข้าบุหรี่ไฟฟ้า น้ำยาบุหรี่ไฟฟ้า และอุปกรณ์ที่เกี่ยวข้องกับ บุหรี่ไฟฟ้าจำนวน 516,324 ชิ้น มูลค่ารวมถึง 95.7 ล้านบาท เพิ่มขึ้นจากปี 2564 ที่มีจำนวน 54,439 ชิ้น มูลค่ารวม 8.8 ล้านบาท สะท้อนการขยายตัวของตลาดบุหรี่ไฟฟ้าที่เพิ่มสูงขึ้น ซึ่งส่งผลกระทบต่อสุขภาพของประชาชน จากการศึกษาของประเทศสหรัฐอเมริกา15 ปี 2566 พบว่า คนที่สูบบุหรี่ไฟฟ้ามีโอกาสที่จะเป็นโรคกล้ามเนื้อหัวใจ ขาดเลือดสูงกว่าคนที่ไม่ได้สูบบุหรี่ไฟฟ้า แม้ว่าอายุยังน้อย ดังนั้น หน่วยงานที่เกี่ยวข้องควรเฝ้าระวังสถานการณ์ การลักลอบนำเข้าบุหรี่ไฟฟ้าจากต่างประเทศอย่างจริงจัง รวมถึงดำเนินการตรวจสอบจับกุมร้านค้าที่ลักลอบขาย บุหรี่ไฟฟ้า ทั้งจากช่องทางออนไลน์ และร้านค้าภายในประเทศ รวมถึงสร้างความตระหนักรู้ถึงความเสี่ยงต่อสุขภาพ จากการใช้บุหรี่ไฟฟ้า
3. การเตรียมสิ่งอำนวยความสะดวกให้แก่ผู้เข้าร่วมงาน


หนึ่งในปัญหาที่พบอยู่บ่อยครั้งของการจัดงานเทศกาล คือ การจราจรที่หนาแน่นและติดขัด ขณะที่การมีระบบคมนาคมที่ครอบคลุมและเชื่อมโยงกัน ถือเป็นปัจจัยที่ส่งผลต่อประสบการณ์ของนักท่องเที่ยวกับงานเทศกาลนั้นๆ โดยประเทศเบลเยียมได้มีมาตรการรองรับสำหรับเทศกาลดนตรี Tomorrowland ที่มีการเชื่อมโยงระบบขนส่ง โดยจัดให้มีบริการรถรับส่งจากสนามบินบรัสเซลส์ (สนามบินใกล้สุดของงาน) ไปยังที่จุดจัดงานโดยตรงซึ่งจะเปิดให้จองล่วงหน้าผ่านทางเว็บไซต์ของงาน ขณะเดียวกัน ยังจัดให้มีรถไฟสายพิเศษไปยังสถานที่จัดงานเทศกาล เพิ่มเติมจากระบบปกติ อีกทั้ง ยังมีที่จอดรถรองรับนักท่องเที่ยวที่เดินทางโดยรถยนต์ส่วนตัว นอกจากนี้ ผู้จัดงานยังได้ประสานความร่วมมือกับผู้สนับสนุน (Sponser) อย่างสายการบินบรัสเซลส์ แอร์ไลน์ ในการออกแพ็กเกจทริป “Tomorrowland’s Global Journey” ที่ประกอบด้วยตั๋วเข้าร่วมงาน ตั๋วเครื่องบิน พร้อมโรงแรมที่พัก เพื่ออำนวยความสะดวกในการเข้าร่วมงาน อีกทั้งภายในงานยังมีเต็นท์ไว้คอยให้บริการ ซึ่งเป็นอีกหนึ่งทางเลือกที่พักให้ผู้เข้าร่วมงาน ด้านสิ่งอำนวยความสะดวกอื่น ๆ ได้จัดให้มีบริการ เช่าล็อกเกอร์สำหรับเก็บสัมภาระ ห้องน้ำ สถานีชาร์จโทรศัพท์ รวมถึงมีจุด Info point เพื่อให้บริการด้านข้อมูล ซึ่งมีป้ายบอกทางที่ชัดเจน อีกทั้ง ยังมีแผนที่แบบโต้ตอบได้ ให้บริการผ่านแอป Tomorrowland ทั้งนี้ สิ่งอำนวยความสะดวกต่าง ๆ ภายในงานยังออกแบบ โดยคำนึงถึงผู้เข้าร่วมที่มีความพิการ อาทิ ทางเข้าที่มีลิฟต์ ห้องน้ำที่ออกแบบโดยเฉพาะ อีกทั้ง ยังอนุญาตให้นำสุนัขนำทางเข้ามาในบริเวณงานได้ และมีเจ้าหน้าที่คอยดูแลในการเข้าถึงบริเวณต่างๆ นอกจากนี้ ยังมีการใช้อุปกรณ์เทคโนโลยี Tomorrowland bracelet ซึ่งเป็นสายรัดข้อมือ ที่ไม่เพียงเป็นเสมือนตั๋วเข้าร่วมงานเท่านั้น แต่ยังเป็นช่องทางชำระเงินบริการต่างๆ ที่ผู้เข้าร่วมสามารถ เติมเงินเข้าไปได้ ทำให้ผู้เข้าร่วมงานไม่จำเป็นต้องพกเงินสด
ศ.นพ.ธานินทร์ กล่าวเพิ่มเติมว่า โรคมะเร็งต่อมน้ำเหลืองปัจจุบันถือว่าเป็นโรคมะเร็งที่สามารถพบได้บ่อย และพบเพิ่มขึ้นทุก ๆ ปี อย่างไรก็ตามเป็นโรคที่ตอบสนองกับการรักษาได้ดี และมีโอกาสรักษาให้หายขาดได้ ทำให้ทั่วโลกให้ความสำคัญ และตื่นตัวกับโรคมะเร็งต่อมน้ำเหลืองเป็นอย่างมาก จึงยกให้วันที่ 15 กันยายน ของทุกปี ตรงกับ "วันมะเร็งต่อมน้ำเหลืองโลก" ในปีนี้ "ชมรมโรคมะเร็งต่อมน้ำเหลืองแห่งประเทศไทย" จัดงานเสวนา "ปาฏิหาริย์ เปลี่ยนมะเร็ง ให้เป็นสุข : Miracle is all around X" ครั้งที่ 10 ในวันอาทิตย์ที่ 15 กันยายน พ.ศ. 2567 เวลา 12.00 – 16.00 น. ณ ชั้น 3 โซน Eden ศูนย์การค้าเซ็นทรัลเวิลด์ ภายในงานดังกล่าวมีกิจกรรมที่น่าสนใจมากมาย อาทิ พูดคุยกับแพทย์ผู้เชี่ยวชาญเจาะลึกถึงนวัตกรรมใหม่การรักษาโรคมะเร็งต่อมน้ำเหลือง ถาม-ตอบ กับแพทย์ผู้เชี่ยวชาญในการรักษาโรคมะเร็งต่อมน้ำเหลืองในปัจจุบัน มาจุดพลังใจไปกับอดีตผู้ป่วย “The X Fighters : คนสู้โรค” ที่หายจากโรคมะเร็งต่อมน้ำเหลือง แรงบันดาลใจไม่สิ้นสุด “The X Team” โดย ชมรมผู้ป่วยโรคมะเร็งต่อมน้ำเหลืองแห่งประเทศไทย Miracle X Art Toys จากศิลปินชื่อดัง พร้อมกับแรงบันดาลใจในการสร้างสรรค์ผลงานเพื่อช่วยผู้ป่วยโรคมะเร็งต่อมน้ำเหลือง และ Miracle X Encourage โดย วิน เมธวิน โอภาสเอี่ยมขจร พร้อมกิจกรรม X Auction สุดพิเศษ!!
MIRACLE X Art Toys Collabs by เหล่าศิลปิน Art Toys ชื่อดัง และ วิน เมธวิน โอภาสเอี่ยมขจร ราคา 999 บาท สงวนสิทธิ์จำหน่ายภายในงานวันอาทิตย์ที่ 15 กันยายน เท่านั้น!! (รายได้ทั้งหมดมอบให้กับชมรมโรคมะเร็งต่อมน้ำเหลืองแห่งประเทศไทย โดยไม่หักค่าใช้จ่าย) ผู้ป่วยมะเร็งต่อมน้ำเหลือง ผู้ดูแล และประชาชนทั่วไป สามารถลงทะเบียนเข้าร่วมงานได้...ฟรี!! โดยไม่มีค่าใช้จ่าย ไม่เสียค่าใช้จ่ายใดๆ ในการเข้าร่วมงาน ติดต่อสำรองที่นั่งได้ตั้งแต่วันนี้ จนถึงวันเสาร์ ที่ 14 กันยายน 2567
การนำ AI มาใช้เพิ่มขึ้นเพื่อสนับสนุนการตัดสินใจทางคลินิก และความสนใจด้านGenerative AI ที่มากขึ้น
ในภูมิภาคเอเชียแปซิฟิก ผู้นำในวงการเฮลท์แคร์ต่างเห็นว่าการประยุกต์ใช้เทคโนโลยี AI ในภูมิภาคประสบความสำเร็จ จากการนำเทคโนโลยี AI มาใช้เพื่อสนับสนุนการตัดสินใจทางคลินิกเพิ่มมากขึ้น จากผลสำรวจพบว่ามีการนำเทคโนโลยี AI มาใช้สนับสนุนทางคลินิกและวางแผนที่จะนำไปใช้ในหลายๆ ด้านภายใน 3 ปีข้างหน้า ได้แก่ ด้านการดูแลเชิงป้องกัน (91%), ด้านการบริหารจัดการยา (90%), ด้านระบบติดตามผู้ป่วยในโรงพยาบาล (89%), ด้านการวางแผนการรักษา (89%), ด้านระบบติดตามผู้ป่วยระยะไกลหรือแบบรีโมท (87%), ด้านระบบในศูนย์สั่งการทางคลินิก (83%), ด้านรังสีวิทยา (79%) และด้านพยาธิวิทยา (79%)
ขั้นต่อไปของเทคโนโลยี คือ การนำ Generative AI มาใช้ โดยผู้นำในวงการเฮลท์แคร์ในภูมิภาคเอเชียแปซิฟิกเล็งเห็นถึงประโยชน์ของอัลกอริทึม AI ที่สามารถใช้ในการทำคอนเทนท์ต่างๆ ตามคำสั่งที่ป้อนเข้าไป อาทิ ข้อความ รูปภาพ หรือข้อมูล ซึ่งจะเป็นประโยชน์ต่อการดูแลรักษาผู้ป่วยเพื่อแสดงให้เห็นถึงประสิทธิภาพและข้อมูลเชิงลึกใหม่ๆ จากข้อมูลของผู้ป่วย โดย 36% ของผู้นำในวงการเฮลท์แคร์ในเอเชียแปซิฟิกลงทุนในเทคโนโลยี Generative AI และ 62% มีแผนที่จะลงทุนในเทคโนโลยีนี้ภายใน 3 ปีข้างหน้า ซึ่งความสนใจด้าน Generative AI ของผู้นำด้านเฮลท์แคร์ในเอเชียแปซิฟิกมากกว่าผู้นำด้านเฮลท์แคร์ทั่วโลกที่ปัจจุบันลงทุนอยู่ 29% และมีแผนที่จะลงทุนภายใน 3 ปีข้างหน้าอยู่ที่ 56%
ถึงแม้ว่าจะมีความตื่นตัวด้านเทคโนโลยี AI เป็นวงกว้าง แต่ 95% ของผู้นำในวงการเฮลท์แคร์ในเอเชียแปซิฟิกยังมีความกังวลเกี่ยวกับความแม่นยำของข้อมูลในแอปพลิเคชันที่ใช้ AI เนื่องจากอาจส่งผลต่อผลลัพธ์ทางสุขภาพ ดังนั้น พวกเขาจึงระบุว่าเทคโนโลยี AI ต้องถูกนำไปใช้อย่างมีความรับผิดชอบเพื่อป้องกันความผิดพลาด โดยกลยุทธ์ในการลดความเสี่ยงของความผิดพลาดทางข้อมูล คือ ความโปร่งใสและความเข้าใจด้าน AI สำหรับบุคลากรทางการแพทย์ (45%), การทำให้บุคลากรมีความมั่นใจในข้อมูลและเทคโนโลยี AI (43%), มีการฝึกอบรมและให้ความรู้อย่างต่อเนื่องเกี่ยวกับ AI (40%) และมีการกำหนดนโยบายสำหรับการใช้ข้อมูลและ AI อย่างมีจริยธรรม (39%) ซึ่งกลยุทธ์เหล่านี้จะสามารถทำได้ผ่านการทำงานร่วมกันในทุกภาคส่วนที่เกี่ยวข้อง
ศูนย์บริการสาธารณสุข 13 ไมตรีวานิช
ศูนย์บริการสาธารณสุข 13 ไมตรีวานิช
2 กันยายน 2567 วัดปทุมคงคา
3 กันยายน 2567 วัดจักรวรรดิราชาวาสวรวิหาร
4 กันยายน 2567 ชุมชนมิตรชัยภูมิ
5 กันยายน 2567 วัดไตรมิตรวิทยาราม
6 กันยายน 2567 วัดชัยชนะสงคราม
9 กันยายน 2567 ชุมชนภิรมย์
10 กันยายน 2567 ชุมชนโปลิสสภา ชุมชนโชฎึก
11 กันยายน 2567 ชุมชนตลาดน้อย ศาลเจ้าโจวซือกง
12 กันยายน 2567 ย่านกรมภูธเรศร์
13 กันยายน 2567 สำนักงานเขตสัมพันธวงศ์
ติดต่อโทร 02-2227875
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกจักษุ โรงพยาบาลชุมแพ
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกจักษุ ทุกวันพุธ เวลา 16.30 - 20.30 น. ณ อาคารจักษุ โรงพยาบาลชุมแพ จองคิวล่วงหน้า (โทรในเวลาราชการ) 043-311044 ต่อ 333 หรือไลน์ SMC โรงพยาบาลชุมแพ (
คลิกแอดไลน์) "พบแพทย์เฉพาะทาง ลดเวลารอคอย บริการประทับใจ" *ค่าบริการนอกเวลา 300 บาท (ไม่สามารถเบิกได้)
คลินิกพิเศษเฉพาะทางนอกเวลา ศัลยกรรมทางเดินอาหาร & ส่องกล้อง
โรงพยาบาลบางละมุง เปิดให้บริการคลินิกพิเศษเฉพาะทางนอกเวลา เวลา 16:00-20:00น. รับทุกสิทธิ์⁉️ ค่าบริการนอกเวลา พบแพทย์เฉพาะทาง 450 บาท ค่ายา/LAB/X-ray เบิกได้ตามสิทธิ์ของท่าน Scan qr code ลงคิวนัดหรือโทรติดต่อเจ้าหน้าที่
- อายุรกรรมทางเดินอาหารและตับ & ส่องกล้อง
- ศัลยกรรมทางเดินอาหาร & ส่องกล้อง
- ศัลยกรรมทางเดินปัสสาวะ
- ปวดท้องเรื้อรัง กรดไหลย้อน อาหารไม่ย่อย ท้องผูกสลับท้องเสีย เบื่ออาหารน้ำหนักลด ปัสสาวะลำบาก ปัสสาวะไม่พุ่ง ต่อมลูกหมากโต
"รอไม่นาน ไม่ต้องลางานมาตรวจ"
คลินิกพิเศษเฉพาะทางรังสีวิทยา นอกเวลาราชการ โรงพยาบาลนางรอง
3 เหตุผลที่ต้องเลือก PSU Lasik Center ศูนย์เลสิก ม.อ. เพื่อเลสิกดวงตาคุณ
โครงการควบคุมและป้องกันโรคขาดสารไอโอดีน
โรคขาดสารไอโอดีนมีผลต่อความพิการทางสติปัญญา ซึ่งส่งผลต่อพัฒนาการทางสมองและความสามารถ ในการเรียนรู้ของเด็กไทยที่จะเติบโตเป็นกำลังสำคัญของประเทศชาติในอนาคต โรคขาดสารไอโอดีนมีผลกระทบต่อประชากรทุกกลุ่มวัย โดยเฉพาะอย่างยิ่งทารกที่อยู่ในครรภ์มารดาจนถึงอายุ 3 ปี หากขาดสารไอโอดีน จะทำให้สมองเจริญเติบโตไม่เต็มที่ลดความเฉลียวฉลาด หรือระดับสติปัญญาของเด็กได้ถึง 10 - 15 จุด ทำให้เด็กมีปัญหาการเรียน และกระทบต่อการเจริญเติบโต และยังส่งผลถึงความสามารถในการเรียนรู้ของเด็ก คุณภาพชีวิตของคนหนุ่มสาว อันเป็นสาเหตุที่ก่อให้เกิดความสูญเสียทางเศรษฐกิจและการพัฒนาสังคม
ประเทศไทยมีเป้าหมายที่จะทำให้ประชาชนได้รับสารไอโอดีนเพียงพอต่อความต้องการของร่างกายในทุกเพศ ทุกวัย รวมทั้งหญิงตั้งครรภ์และหญิงให้นมบุตร มีการรณรงค์ส่งเสริมให้ใช้เกลือเสริมไอโอดีน ทั้งในครัวเรือน ร้านอาหาร ศูนย์พัฒนาเด็กเล็ก โรงเรียน โรงพยาบาล เป็นต้น มีการสุ่มตรวจคุณภาพเกลือที่แหล่งผลิต แหล่งจำหน่าย ครัวเรือน และโรงเรียน ต้องให้ได้มาตรฐาน หญิงตั้งครรภ์ทุกคนที่มาฝากครรภ์ในสถานบริการสาธารณสุขต้องได้รับยาเม็ดเสริมไอโอดีน และมีเป้าหมายให้ทุกชุมชน หมู่บ้านดำเนินการชุมชนหมู่บ้านไอโอดีน เพื่อสร้างความเข้มแข็งให้ประชาชนสามารถดูแลตนเองได้
ปัจจุบันสถานการณ์ระดับไอโอดีนในปัสสาวะหญิงตั้งครรภ์ก่อนได้รับยาเม็ดเสริมไอโอดีน ภาพรวมของประเทศมีแนวโน้มดีขึ้น โดยในปี พ.ศ. 2564 พบค่ามัธยฐานไอโอดีนในหญิงตั้งครรภ์ก่อนได้รับยาเม็ดเสริมไอโอดีนอยู่ในเกณฑ์เพียงพอ คือ 155 ไมโครกรัมต่อลิตร แต่ยังคงพบปัญหาในบางจังหวัดโดยเฉพาะภาคตะวันออกเฉียงเหนือ สำหรับการเฝ้าระวังติดตามการจ่ายยาเม็ดเสริมไอโอดีนในหญิงตั้งครรภ์ข้อมูลจาก Health Data Center (HDC) กระทรวงสาธารณสุข พบว่า พ.ศ. 2565 หญิงตั้งครรภ์ได้รับยาเม็ดเสริมไอโอดีน ร้อยละ 80.3 ซึ่งยังไม่บรรลุเป้าหมายร้อยละ 100 ส่วนสถานการณ์การผลิต การกระจาย และความครอบคลุมการใช้เกลือเสริมไอโอดีนในครัวเรือน พ.ศ. 2564 พบว่า เกลือเสริมไอโอดีนที่มีคุณภาพ (มีไอโอดีน 20 - 40 ppm) ณ สถานที่ผลิต และสถานที่จำหน่าย คิดเป็นร้อยละ 93.3 และ 83.1 ตามลำดับ ความครอบคลุมเกลือเสริมไอโอดีนคุณภาพในครัวเรือนมีแนวโน้มสูงขึ้น โดยใน พ.ศ. 2564 พบร้อยละ 84.2 ซึ่งสอดคล้องกับคุณภาพเกลือเสริมไอโอดีน ณ สถานที่ผลิตและสถานที่จำหน่าย ที่มีแนวโน้มสูงขึ้นในทุกปี อย่างไรก็ตามความครอบคลุมการใช้เกลือเสริมไอโอดีนที่มีคุณภาพยังต่ำกว่าค่าเป้าหมายที่กำหนดไว้ (ร้อยละ 90) ดังนั้น เพื่อให้เกิดประโยชน์สูงสุดแก่กลุ่มเสี่ยงและประชาชนทั่วไป สำนักโภชนาการจึงได้ดำเนินงานมาอย่างต่อเนื่อง โดยปัจจุบันได้ดำเนินการตามแผนปฎิบัติการด้านการควบคุมและป้องกันโรคขาดสารไอโอดีนแห่งชาติ ปี 2565 - 2570 โดยการดำเนินงานใน ปี ๒๕๖๖ มุ่งเน้นกิจกรรมสำคัญ คือ การขับเคลื่อนการดำเนินงานชุมชนหมู่บ้านไอโอดีน ให้ครอบคลุมทั่วประเทศ การส่งเสริมให้ผู้ประกอบการร้านค้าจำหน่ายผลิตภัณฑ์เสริมไอโอดีน ผู้ประกอบการร้านอาหารใช้เกลือเสริมไอโอดีน และผลิตภัณฑ์เสริมไอโอดีนในการปรุงประกอบอาหาร การเฝ้าระวังและติดตามสถานการณ์ที่เกี่ยวข้องกับโรคขาดสารไอโอดีน การเฝ้าระวังคุณภาพเกลือเสริมไอโอดีนในครัวเรือน การพัฒนาแพลทฟอร์มไอโอดีนให้รองรับการบันทึกข้อมูลระดับไอโอดีนในปัสสาวะของกลุ่มเสี่ยง และการบันทึกข้อมูลคุณภาพเกลือเสริมไอโอดีนในชุมชน รวมทั้งพัฒนาฐานข้อมูลชุมชนหมู่บ้านไอโอดีน และฐานข้อมูลผู้ประกอบการร้านอาหาร โรงอาหาร รถเข็น แผงลอย ฟู๊ดทรัค และโฮมเมด ที่ใช้ผลิตภัณฑ์เสริมไอโอดีน ให้ครอบคลุมทั่วประเทศ
กลุ่มเป้าหมาย
1. หญิงตั้งครรภ์
2. เด็กอายุ 3-5 ปี
3. ผู้สูงอายุ
77 จังหวัด ศูนย์อนามัย 12 ศูนย์และสถาบันพัฒนาสุขภาวะเขตเมือง
ติดตามสถานการณ์อุทกภัย วาตภัยและดินโคลนถล่ม จากอิทธิพลพายุไต้ฝุ่น “ยางิ”
15 กันยายน 2567 ที่ ศูนย์ปฏิบัติการฉุกเฉินด้านการแพทย์และสาธารณสุข สำนักงานปลัดกระทรวงสาธารณสุข จ.นนทบุรี นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข ประชุมทางไกลติดตามสถานการณ์อุทกภัย วาตภัย และดินโคลนถล่ม จากอิทธิพลพายุไต้ฝุ่น “ยางิ” กับจังหวัดเสี่ยงในภาคเหนือและภาคอีสาน และกล่าวว่า นายสมศักดิ์ เทพสุทิน รัฐมนตรีว่าการกระทรวงสาธารณสุข มีความห่วงใยและได้ย้ำให้ทุกจังหวัดโดยเฉพาะพื้นที่เสี่ยงเตรียมความพร้อมทั้งยาและเวชภัณฑ์ต่างๆ ดูแลกลุ่มผู้ป่วยโรคเรื้อรัง กลุ่มเปราะบาง ติดบ้านติดเตียง รวมถึงป้องกันโรคและภัยสุขภาพที่มาจากน้ำท่วม ซึ่งส่วนกลางและสำนักงานสาธารณสุขจังหวัดได้สนับสนุนยาและเวชภัณฑ์ เช่น ยาชุดช่วยเหลือผู้ประสบภัย ชุดทดสอบโรคฉี่หนู ยาพระราชทาน ยารักษาน้ำกัดเท้า ยากันยุง และรองเท้าบูท เป็นต้น รวม 21,400 ชุด
นายแพทย์โอภาสกล่าวต่อว่า ในการบริหารจัดการสถานการณ์ ได้แบ่งจังหวัดที่จะได้รับผลกระทบเป็น 3 กลุ่ม คือ 1.กลุ่มรอรับน้ำโขงที่กำลังจะมาถึง เช่น อำนาจเจริญ อุบลราชธานี นครพนม มุกดาหาร ให้ติดตามสถานการณ์อย่างต่อเนื่อง เตรียมความพร้อมยาและเวชภัณฑ์ พร้อมสำรวจกลุ่มเปราะบางเพื่อเตรียมแผนเคลื่อนย้าย 2.กลุ่มที่ระดับน้ำเพิ่มสูงขึ้น เช่น เลย หนองคาย บึงกาฬ ให้เตรียมการป้องกันสถานบริการไม่ให้ได้รับผลกระทบจากน้ำท่วม เพื่อให้สามารถดูแลช่วยเหลือประชาชนได้อย่างเต็มที่ ทั้งที่อยู่ในโรงพยาบาลและที่ไม่สามารถเดินทางมาโรงพยาบาลได้ เช่นที่ หนองคาย เปิดศูนย์พักพิงรวม 17 แห่ง ก็ได้ระดมทีมด้านการแพทย์และสาธารณสุขทั้งจังหวัดข้างเคียงและส่วนกลางเข้าสนับสนุนดูแล 3.กลุ่มที่สถานการณ์เริ่มคลี่คลาย เช่น เชียงราย เชียงใหม่ ซึ่งจะต้องเร่งฟื้นฟู ให้เฝ้าระวังเรื่องโรคระบาดที่มากับน้ำท่วม ที่พบบ่อยคือ โรคฉี่หนู (leptospirosis) ต้องจัดระบบเฝ้าระวังและค้นหาสัญญาณการระบาดให้เร็ว เพื่อควบคุมโรคได้ทันท่วงที และออกคำแนะนำประชาชน รวมถึงเจ้าหน้าที่ผู้ปฏิบัติงาน เช่น ทีมกู้ชีพ/กู้ภัย หากไข้สูง ปวดเมื่อยกล้ามเนื้อ ให้รีบพบแพทย์พร้อมแจ้งประวัติลุยน้ำย่ำโคลน
สำหรับการดูแลด้านสุขภาพจิต ได้ส่งทีมช่วยเหลือเยียวยาจิตใจผู้ประสบภาวะวิกฤต (MCATT) ออกปฏิบัติการควบคู่กับการดูแลด้านสุขภาพกาย โดยตั้งแต่ 16 สิงหาคม – 13 กันยายน 2567 ทำการประเมินและให้การช่วยเหลือด้านสุขภาพจิต ทั้งผู้ประสบภัย ญาติผู้สูญเสีย/บาดเจ็บ เจ้าหน้าที่และชุมชนวงกว้าง รวม 21,680 คน ในจำนวนนี้พบมีภาวะเครียดสูง 521 คน เสี่ยงซึมเศร้า 73 คน และเสี่ยงฆ่าตัวตาย 13 คน ซึ่งทั้งหมดได้รับการดูแลและติดตามอาการอย่างต่อเนื่องแล้ว
พญ. สุวรรณา สุวรรณพงษ์ Program Director ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ กล่าวว่า ไวทัลไลฟ์ได้ออกแบบพัฒนาและกลั่นกรองมานานหลายปี จนเป็น ‘โปรแกรมการดูแลสุขภาพของไวทัลไลฟ์’ โดยได้นำเทคโนโลยีขั้นสูงและข้อมูลเชิงลึกทางวิทยาศาสตร์ เพื่อช่วยให้ผู้เข้ารับบริการมีอายุยืนยาวอย่างมีคุณภาพ โปรแกรมนี้เน้นการประเมินสุขภาพเชิงลึกแบบเฉพาะบุคคล ผ่านการตรวจสุขภาพที่ครอบคลุม รวมถึงการวิเคราะห์ข้อมูลทางพันธุกรรมและชีวภาพต่าง ๆ เพื่อสร้างแผนการดูแลสุขภาพที่ตรงกับความต้องการของแต่ละคน
นอกจากนี้ ไวทัลไลฟ์ยังใช้นวัตกรรมการรักษาที่ช่วยชะลอกระบวนการชราในระดับเซลล์ และมีการติดตามสุขภาพอย่างใกล้ชิดผ่านอุปกรณ์สวมใส่ต่าง ๆ เพื่อติดตามตัวชี้วัดด้านสุขภาพที่สำคัญในแต่ละวัน เพื่อให้ได้ข้อมูลที่แม่นยำและทันสมัย รวมถึงใช้เทคโนโลยีปัญญาประดิษฐ์ขั้นสูงเข้ามาวิเคราะห์ข้อมูลสุขภาพของผู้เข้ารับบริการอย่างละเอียด เพื่อคาดการณ์ความเสี่ยงของโรคต่าง ๆ ได้ล่วงหน้า ช่วยให้แพทย์สามารถวางแผนการรักษาที่ตรงจุดและเฉพาะบุคคลได้มากขึ้น ตลอดจนเข้าใจถึงกลไกของโรคในระดับโมเลกุลได้อย่างลึกซึ้ง จากการบูรณาการข้อมูลและเทคโนโลยีที่หลากหลาย จึงทำให้ไวทัลไลฟ์สามารถให้บริการดูแลสุขภาพแบบองค์รวมที่ครอบคลุมทุกมิติ ทั้งด้านร่างกาย จิตใจ และอารมณ์ เพื่อเป้าหมายของการมีสุขภาพที่ดีและอายุยืนยาว
“การส่งมอบ 100 รอยยิ้มให้แก่คนไทยในครั้งนี้สอดคล้องกับจุดมุ่งหมายใหม่ของกลุ่มบริษัทฟูจิฟิล์มในการ ‘แต่งแต้มรอยยิ้มให้โลกของเรา’ ซึ่งเป็นแนวทางในการดำเนินธุรกิจเพื่อสร้างสรรค์สังคมที่ดีขึ้นและยกระดับคุณภาพชีวิตของคนทั่วโลก ภายใต้แผนเชิงคุณค่าแห่งความยั่งยืน 2030 (Sustainable Value Plan 2030) เพื่อขับเคลื่อนการประกอบธุรกิจพร้อม ๆ กับแนวทางของกลุ่มบริษัทฟูจิฟิล์มในเรื่องความรับผิดชอบต่อสังคมอย่างยั่งยืนใน 4 มิติหลักได้แก่ สิ่งแวดล้อม สุขภาพ ชีวิตประจำวัน และสไตล์การทำงาน ทั้งยังยึดมั่นในการเสริมสร้างความแข็งแกร่งด้านการช่วยเหลือผู้คนอย่างเท่าเทียมและยกระดับสังคมให้ทั่วทั้ง ‘ห่วงโซ่อุปทาน’ และแน่วแน่ในหลัก ‘การกำกับดูแล’ ให้ทุกการดำเนินงานของกลุ่มบริษัทให้มีความโปร่งใสและเป็นธรรม โดยโครงการ 100 รอยยิ้มที่เราร่วมสร้างในวันนี้ เป็นส่วนหนึ่งของเส้นทางการมุ่งสู่ 100 ปีแห่งความสำเร็จของฟูจิฟิล์ม สอดรับการพันธกิจการดำเนินธุรกิจควบคู่ไปกับการยกระดับสังคมที่เราได้ทำมาตลอด 90 ปี” มร. มาซาอากิ ยานากิย่า กล่าวเสริม
มุมมองแพทย์ผู้เชี่ยวชาญโรคหายาก
ศ.พญ. ดวงฤดี กล่าวเสริมว่า โรคหายากในแต่ละโรค จะมียารักษาที่ราคาแตกต่างกันไป บางโรคค่ายารักษา 2-3 แสนต่อปี บางโรคหลักล้านต่อปี ซึ่งปัจจุบันมีเทคโนโลยีและวิธีการรักษาใหม่ๆ เช่น ยีนบำบัด (Gene Therapy) โดยจะมีการปรับแต่งยีนที่ผิดปกติใส่เข้าไปในคนไข้เพื่อให้หายจากโรค รักษาเพียงครั้งเดียวแต่หายตลอดชีวิต ค่ารักษาประมาณ 50–60 ล้านบาท บางคนอาจมองว่าราคาสูงมาก แต่หากเทียบกับค่ารักษาปีละ 2 ล้านบาทต่อคน หากรักษายาวนาน 50 ปี ก็เท่ากับ 100 ล้านบาท เพราะโรคหายากจะต้องรักษาไปตลอดชีวิต ทำให้ต้องใช้งบประมาณมากกว่าหลายเท่า จึงทำให้มีการคิดวิธีรักษาแบบใหม่ คือ ‘ยีนบำบัด’ ฉีดครั้งเดียวแต่หายขาด คุณภาพชีวิตก็ดีขึ้นมาก ครอบครัวและผู้ป่วยไม่ต้องทนทุกข์ทรมาน กลับมาใช้ชีวิตปกติและเป็นทรัพยากรที่สำคัญของชาติต่อไปได้
แม้ว่าปัจจุบัน โรคโกเชร์ยังไม่มีการรักษาด้วยยีนบำบัด แต่โรคหายากบางโรคมีการรักษาด้วยวิธีนี้แล้ว จึงจำเป็นต้องให้สังคมไทยรับรู้เพื่อให้คนไข้มีโอกาสเข้าถึงการวินิจฉัยได้รับการรักษาก่อนที่จะเกิดภาวะแทรกซ้อนรุนแรง ซึ่งหากเกิดภาวะแทรกซ้อนรุนแรงแล้วการได้รับยาก็ช่วยอะไรไม่ได้มาก การสร้างการรับรู้ให้กับสังคมเพื่อสร้างแรงขับเคลื่อนไปสู่ภาครัฐจึงเป็นสิ่งจำเป็น ทั้งนี้ ศ.พญ. ดวงฤดี วอนให้ฝ่ายที่เกี่ยวข้องกับนโยบายการเงิน สิทธิประโยชน์ทั้งบัตรทอง บัตรราชการ ประกันสังคม รวมไปถึงสำนักงานคณะกรรมการอาหารและยา (อย.) ร่วมกันพิจารณาหารือถึงกระบวนการ และแนวทางใหม่ๆ ที่เหมาะสมกับการเข้าถึงรักษาโรคหายาก ถึงงบประมาณจะสูง แต่จำนวนผู้ป่วยมีน้อยราย ผลกระทบงบประมาณไม่สูงมาก อีกประการหนึ่ง โรคหายากจำเป็นต้องได้รับการรักษาไม่เช่นนั้นอาจเป็นอันตรายถึงชีวิตก่อนวัยอันควร
อีกความท้าทายสำคัญ คือ จำนวนแพทย์ด้านพันธุกรรม ซึ่งยังมีน้อยอยู่ ทั้งประเทศไทยมีเพียง 28 คน อยู่ภาคเหนือ 1 คน ภาคตะวันออกเฉียงเหนือ 1 คน และนอกนั้นอยู่ในกรุงเทพฯ ด้วยปัญหาการเบิกจ่ายไม่ค่อยได้ เช่น ค่าตรวจยีนเบิกไม่ได้ ค่ายารักษาก็เบิกจ่ายไม่ได้ จึงไม่มีใครอยากเรียนสาขานี้ เพราะแพทย์ก็อยากให้คนไข้ได้เข้าถึงการรักษาที่เหมาะสม ซึ่งต้องยอมรับว่าทุกวันนี้ยังมีผู้ป่วยโรคหายากอีกมากที่เข้าไม่ถึงระบบสุขภาพของสาธารณสุขไทย
ศ.พญ. ดวงฤดี ฝากไปยังทุกภาคส่วนที่เกี่ยวข้องว่า ทุกวันนี้ โรคหายากหรือโรคทางพันธุกรรมสามารถรักษาได้ และมีกรอบทิศทางที่ดำเนินการได้ การคัดกรองโรคจะทำให้ตรวจวินิจฉัยได้รวดเร็วขึ้น ฉะนั้น จึงวอนขอให้ภาครัฐพิจารณาส่งเสริมการผลิตแพทย์ผู้เชี่ยวชาญด้านพันธุกรรมเพิ่มเติม เพื่อบรรจุและส่งไปประจำยังเขตสุขภาพ 13 เขตทั่วประเทศ เพื่อให้การวินิจฉัยเป็นไปอย่างถูกต้องและรวดเร็ว เพราะยิ่งตรวจพบเร็วเท่าไร คนไข้ก็สามารถเข้าถึงการรักษาเร็วเท่านั้น และยังเป็นประโยชน์ป้องกันโรคเกิดซ้ำอีกในครอบครัวซึ่งนับว่าคุ้มค่าอย่างยิ่งแก่ครอบครัว นอกจากนี้ ยังเสนอให้ภาครัฐพิจารณาปรับนโยบายเกี่ยวกับกระบวนการพิจารณายา และงบประมาณ ให้เข้ากับบริบทของสังคมและสอดคล้องกับนวัตกรรมทางการแพทย์ เพื่อเร่งผลักดันการเข้าถึงการรักษาโรคหายากที่มีประสิทธิภาพ ปลอดภัยและยั่งยืน
การรณรงค์สร้างความตระหนักรู้ ก้าวสำคัญเพื่อการเปลี่ยนแปลง
ด้วยความมุ่งมั่นที่จะขับเคลื่อนการตระหนักรู้เรื่องโรค SMA และมีความฝันที่จะสร้างการเปลี่ยนแปลงที่ดีขึ้นและจับต้องได้จริงเพื่อกลุ่มผู้ป่วย น้องฟางยังมีบทบาทเป็นหนึ่งในแกนนำของกลุ่ม SMA Thailand กลุ่มผู้ป่วย SMA ที่รวมตัวกันเพื่อสร้างความเข้มแข็งและเป็นกำลังให้แก่กัน ด้วยแนวทาง ‘ฝัน หวัง ไปต่อ’
“ในตอนที่ฟางยังเด็ก โรค SMA ยังไม่เป็นที่ตระหนักรู้ในวงกว้าง และการรักษาค่อนข้างจำกัดค่ะ ต้องประคับประคองและรับมือตามอาการ ครอบครัวได้แต่เฝ้ามองผู้ป่วยค่อยๆ อ่อนแรงลง แต่ในปัจจุบัน ฟางเชื่อว่าเรารับมือกับสิ่งที่เผชิญได้อย่างแข็งแรงขึ้นค่ะ วันนี้โลกมีเทคโนโลยีการรักษาที่ก้าวหน้าขึ้นแล้ว มีการรักษาที่ช่วยชะลอการอ่อนแรง อีกทั้งยังมีการตรวจคัดกรอง (Screening) ที่ครอบคลุมตั้งแต่พ่อและแม่ในระยะก่อนตั้งครรภ์จนถึงเด็กในระยะแรกเกิด ในหลายประเทศ ผู้คนมีความเข้าใจเลยว่าการตรวจคัดกรองโรค SMA เป็นสิ่งที่จำเป็นต้องทำเมื่อวางแผนจะมีลูก ในฐานะผู้ป่วยฟางจึงมองว่า นอกจากความพยายามเพื่อสร้างระบบที่ดีและโอบอุ้มผู้ป่วยในปัจจุบันให้เข้าถึงการรักษาและการดูแลที่เหมาะสมแล้ว การสร้างความตระหนักรู้เรื่องการคัดกรองทารกในครรภ์ (Prenatal screening), การคัดกรองพาหะ (Carrier screening) และการตรวจคัดกรองทารกแรกเกิด (Newborn screening) ในไทยเป็นสิ่งที่เราอยากเน้นย้ำมากๆ ไปพร้อมกันค่ะ เพราะหากมีการตรวจและวินิจฉัยก่อนการตั้งครรภ์หรือในทารก ก็จะสามารถรับมือได้อย่างทันท่วงที ผู้ที่มียีนพาหะในตัวเอง ก็จะมีทางเลือกในการสร้างครอบครัวที่แตกต่างออกไป หรือเด็กแรกเกิดที่ตรวจพบโรคก่อนแสดงอาการ ก็มีโอกาสได้รับการรักษาทันเวลาและมีประสิทธิภาพ ” น้องฟาง กล่าวเสริม
แนวทางในการรักษาต่อมลูกหมากโต รพ. วิมุต


“รพ. วิมุต มีแนวทางในการรักษาต่อมลูกหมากโต ได้แก่ การรักษาด้วยยาในกลุ่มคลายกล้ามเนื้อบริเวณต่อมลูกหมาก (alpha-blocker) และกลุ่มลดขนาดต่อมลูกหมาก ทั้งนี้หากการรักษาด้วยยาแล้วยังไม่ได้ผลที่น่าพอใจหรือมีภาวะแทรกซ้อน แพทย์จะแนะนำให้ทำการผ่าตัด โดยมากจะทำผ่านการส่องกล้องผ่านท่อปัสสาวะ ใช้เวลาพักฟื้นสั้น โดยวิธีที่เป็นที่นิยมในปัจจุบัน ได้แก่
1. TURP (Transurethral Resection of Prostate) เป็นการผ่าตัดโดยใช้หัวตัดไฟฟ้า ถือเป็นวิธีที่แพร่หลายที่สุด ใช้เวลาพักฟื้น 2-3 วัน เหมาะกับต่อมลูกหมากโตขนาดปานกลางถึงใหญ่
2. Laser Prostate เป็นการผ่าตัดโดยใช้เลเซอร์ เหมาะสำหรับต่อมลูกหมากที่มีขนาดใหญ่ขึ้น ใช้เวลาพักฟื้น 1-2 วัน
3. Water Vapor Therapy เป็นการผ่าตัดด้วยระบบไอน้ำ ซึ่งเป็นเทคโนโลยีใหม่ที่รักษาโดยการฉีดไอน้ำที่มีอุณหภูมิ 103 องศาเซลเซียลเข้าไปที่เซลล์ต่อมลูกหมากเพื่อทำลายเนื้อเยื่อในต่อมลูกหมาก วิธีนี้เหมาะสำหรับต่อมลูกหมากขนาดเล็กถึงปานกลาง มีข้อดีเรื่องระยะการพักฟื้นที่สั้นกว่า ไม่ต้องนอนโรงพยาบาลและพักไม่เกิน 1 วัน และ
4. นวัตกรรมใหม่ล่าสุดอย่าง UROLIFT (ยูโรลิฟต์) ใช้อุปกรณ์ขนาดเล็กมากมายึดติดกับต่อมลูกหมากถาวรเพื่อดึงเนื้อเยื่อให้ถ่างออกจากท่อปัสสาวะ UROLIFT เป็นวิธีการรักษาโรคต่อมลูกหมากโตที่ได้รับการอนุมัติจากองค์การอาหารและยาสหรัฐ (FDA) ตั้งแต่ปี 2556 และได้รับการอนุมัติจาก อย. ไทยเมื่อเดือนกุมภาพันธ์ 2567 โดยใช้เวลาผ่าตัดเพียง 30 นาทีถึง 1 ชั่วโมงเท่านั้น ข้อดีคือเป็นหัตถการที่แก้ไขปัญหาการปัสสาวะได้อย่างรวดเร็ว ไม่ส่งผลกระทบต่อสุขภาพทางเพศ ไม่ต้องนอนโรงพยาบาล ทั้งนี้ แนวทางการรักษาจะขึ้นอยู่กับดุลยพินิจของแพทย์ว่าผู้ป่วยเหมาะสำหรับการผ่าตัดแบบใดมากที่สุด”
เตรียมพร้อมรับมือ เมื่อเริ่มเข้าสู่ฤดูการระบาดของโควิด ช่วงปลายปี
รศ. นพ.ภิรุญ ชี้ว่าในปีที่ผ่าน ๆ มาเราได้เรียนรู้ว่า จำนวนผู้ป่วยและเสียชีวิตจากโควิด-19 มีแนวโน้มที่จะเพิ่มสูงขึ้น ในช่วงที่มีการเดินทาง ผู้คนหนาแน่น ไปมาหาสู่กัน โดยเฉพาะช่วงสงกรานต์ และช่วงปลายปีซึ่งตามลักษณะของการระบาด ก็ พอจะคาดคะเนได้ว่า ในช่วงปลายปีที่จะถึงนี้ เราก็ต้องเตรียมพร้อมรับมือ โดยการป้องกันตัวเองไม่ว่าจะเป็นการสวมหน้ากาก อนามัย เมื่อต้องอยู่ในพื้นที่ที่มีคนอยู่แออัด และการฉีดวัคซีนเข็มกระตุ้นเพื่อสร้างภูมิคุ้มกันเตรียมไว้
ภายในงาน “Voice of Care for Breast Cancer” ยังมีกิจกรรมให้ความรู้ด้านโภชนาการเพื่อการป้องกันมะเร็ง การสอนวิธีการตรวจหามะเร็งเต้านม รวมถึงเวิร์คช็อปการใส่วิกผมให้แก่ผู้เข้าร่วมงาน โดยได้รับเกียรติจาก คุณปัทมา พรมมินทร์ ผู้ป่วยมะเร็งเต้านมที่เคยรักษาที่โรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ และฟื้นฟูสุขภาพที่บีดีเอ็มเอส เวลเนส คลินิก มาร่วมแชร์ประสบการณ์ตรง นอกจากนี้ คุณบูม สุภาพร วงษ์ถ้วยทอง นักแสดงและพิธีกรชื่อดัง ยังได้ร่วมรณรงค์เป็นกระบอกเสียงของผู้หญิงไทยทุกคน ส่งต่อความใส่ใจให้ผู้หญิงดูแลตัวเองห่างไกลโรคมะเร็ง พร้อมทั้งยืนหยัดสู้ก้าวผ่านโรคไปอย่างสวยงาม
ทางด้าน เภสัชกรหญิงสุมาลี คริสธานินทร์ ประธานบริหาร บริษัท โนวาร์ตีส (ประเทศไทย) จำกัด ได้กล่าวถึงความสำคัญในการสร้างความตระหนักรู้ เข้าใจถึงสาเหตุและปัจจัยเสี่ยงต่างๆ เพื่อลดอัตราการเกิดโรคหลอดเลือดและหัวใจ และส่งเสริมให้เกิดผลการรักษาที่ดีขึ้น
“ที่โนวาร์ตีส เราเล็งเห็นว่า การเสียชีวิตจากโรคหัวใจและหลอดเลือดเป็นสิ่งที่สามารถป้องกันได้ เราจึงเชื่อว่าการทำงานร่วมกับผู้ป่วย บุคลากรทางการแพทย์ และองค์กรต่างๆ ทั่วโลก จะนำไปสู่การพัฒนาการดูแลโรคหัวใจที่ก้าวหน้าไปมากกว่าการใช้ยาเพียงอย่างเดียว โดยในปีนี้เราได้ต่อยอดจากความสำเร็จในปีที่ผ่านมา ด้วยความมุ่งหวังที่จะช่วยผลักดันให้เกิดความเปลี่ยนแปลงที่ดีขึ้นทางด้านการดูแลรักษาโรคหัวใจและหลอดเลือด เนื่องจากโรคเหล่านี้กำลังส่งผลกระทบเป็นวงกว้าง ไม่เพียงในผู้สูงอายุ แต่ยังรวมถึงผู้ที่มีอายุน้อยทั่วโลก ผ่านเวทีที่ช่วยสร้างความตระหนักรู้เกี่ยวกับโรคในทุกภาคส่วนให้ห่างไกลจากโรคหัวใจและหลอดเลือด ที่ผ่านมาเราได้ทำงานร่วมกับหลายภาคส่วนในการยกระดับการรักษาภาวะหัวใจล้มเหลวให้ได้มาตรฐานสากล เราภูมิใจที่ได้เป็นส่วนหนึ่งของความก้าวหน้านี้ และขอขอบคุณโรงพยาบาลและทีมบุคลากรทางการแพทย์ซึ่งมีบทบาทสำคัญในการดูแลและทุ่มเทเพื่อผู้ป่วยอย่างตั้งใจเสมอมา ด้วยความร่วมมือกัน เราจะสามารถช่วยให้ผู้ป่วยโรคหัวใจและหลอดเลือดมีชีวิตที่ยืนยาว สุขภาพดียิ่งขึ้น และได้ใช้เวลาอันมีค่ากับคนที่รักมากขึ้น”
การเสวนาและกิจกรรมครั้งนี้ เป็นการผนึกกำลังอย่างเหนียวแน่นจากทุกภาคส่วน เพื่อส่งเสริมการดูแลสุขภาพหัวใจและลดอัตราการเสียชีวิตทำให้ผู้ป่วยมีอายุยืนยาวขึ้น กลับมานอนโรงพยาบาลซ้ำน้อยลง และเพิ่มคุณภาพชีวิตที่ดีให้ผู้ป่วย ตอกย้ำถึงเส้นทางความสำเร็จในวันข้างหน้าที่มุ่งสู่การสร้างคุณภาพชีวิตที่ยั่งยืนแก่ประชาชนไทย ในขณะเดียวกันประชาชนยังสามารถมีส่วนร่วมในการลดจำนวนผู้ป่วยโรคหัวใจและโรคหลอดเลือดได้ โดยการหมั่นตรวจสุขภาพหัวใจ คอยสังเกตและเอาใจใส่ครอบครัวและคนใกล้ชิด เพื่อป้องกันและลดปัจจัยเสี่ยงที่จะเกิดโรค รวมถึงกระตุ้นให้ผู้ป่วยให้มีวินัยในการรักษามากขึ้น เพื่อเพิ่มโอกาสในการใช้ชีวิตได้อย่างมีความสุข
สุเทพ ศิริมูล เจ้าของเทพศิริฟาร์ม จ.อุบลราชธานี เล่าถึงการเลี้ยงไก่ในโครงการว่า “ผมมีสโลแกนว่า ‘มีตู้เย็นข้างบ้าน มีพยาบาลใกล้ตัว ทุกครอบครัวมีโรงปุ๋ย’ หมายถึง การที่เราเลี้ยงไก่ในพื้นที่เปิดให้เขาได้หากินเองตามธรรมชาติ เปรียบเหมือนมีตู้เย็นข้างบ้านที่มีอาหารสดใหม่อยู่เสมอ การมีพยาบาลใกล้ตัว ก็คือสมุนไพร ไก่จะคุ้ยเขี่ยและกินสมุนไพรต่าง ๆ ซึ่งช่วยดูแลสุขภาพของเขา และเมื่อปล่อยไก่ออกไป สิ่งที่ตามมาคือปุ๋ยจากมูลไก่ที่กระจายอยู่บนหญ้า ทำให้เราได้ปุ๋ยที่ปลอดภัยและเป็นธรรมชาติ” สุเทพยังเสริมว่า เขามีแผนขยายเครือข่ายเกษตรกรในการเลี้ยงไก่สวัสดิภาพสูง โดยเน้นไปที่กลุ่มเยาวชนที่จบการศึกษาระดับ ม.6 และต้องการสร้างอาชีพต่อไป


ในฐานะคุณแม่ พิจารณาจากความต้องการของลูกเป็นหลัก แต่บางครั้งบางที น้องอาจจะมีวุฒิภาวะไม่เพียงพอ เห็นโลกมาน้อยกว่าเรา เราก็เป็นในฐานะผู้ช่วย ขนาดเราโตแบบนี้ยังต้องมีผู้ช่วย มีเลขา เลย เป็นปกติมาก เราก็ทำหน้าที่ผู้ช่วยผู้หาความรู้ ซัพพอร์ต เป็นหูเป็นตา ช่วยกันพิจารณา บังเอิญว่าที่บ้านลูกคนโตสนใจในด้านสายวิทยาศาสตร์สุขภาพ งานวันนี้ทำให้เขาเห็นแนวทางชัดขึ้นว่าเหมาะกับเขาไหม? เขาสนใจแบบไหน? ส่วนตัวประทับใจกับหลักสูตรแพทย์ ผลิตคุณหมอที่เต็มไปด้วยองค์ความรู้ควบคู่ไปกับคุณธรรม แล้วคุณก็ต้องแข็งแรงสุขภาพดี เพราะต้องไปดูแลคนอื่น คือสร้างคนเก่งคนดี แล้วก็สร้างแนวความคิดให้ตัวเองแข็งแรงทั้งกายและใจด้วย ท้ายสุด อยากเรียนเอง แต่คงเลยวัยมาแล้ว ให้กำลังใจน้องๆ รุ่นลูกๆ หลานๆ แล้วกันนะคะ เข้าใจว่าทุกคนกลัว ทุกคนเหนื่อยในการเรียน บางครั้งระหว่างทางมันท้อเพราะหลักสูตรใหม่ๆ ที่ปรับตามยุคสมัยก็ยากจริงๆ แต่คิดว่ายากแค่ไหนก็ไม่เกินความสามารถของน้องๆ อย่าชะล่าใจ อย่าประมาท อย่าขี้เกียจ ให้คิดว่าเราไม่ได้เหนื่อยอย่างนี้ทุกวันหรือตลอดไป อาจแค่หนึ่งปี สองปี สามปี สี่ปี ทำให้ดีที่สุด เอาให้สุดพีค อะไรที่ทำสุดความสามารถ พอเราสำเร็จแล้ว ได้ชัยชนะกลับมาแล้ว เราจะชื่นใจ ขอให้น้องๆ ทุกคนสมหวังได้คณะอย่างที่ตั้งใจจะเรียนนะคะ”
จากผู้ป่วยมะเร็งเต้านม สู่การเป็นผู้ส่งต่อกำลังใจ


คุณไอรีล ไตรสารศรี ผู้ก่อตั้ง ART for CANCER เปิดเผยว่า โครงการ ART for CANCER เป็นโครงการที่ก่อตั้งขึ้นจากจุดเริ่มต้นที่พบว่าป่วยเป็นมะเร็งเต้านม เมื่อเป็นมะเร็งแล้วจึงรู้สึกว่าเป้าหมายชีวิตเปลี่ยนไป จึงอยากมีชีวิตอยู่อย่างมีคุณค่า และแก้ไขปัญหาด้วยศักยภาพของตนผ่านงานศิลปะ และการระดมทุนเพื่อช่วยเหลือผู้ป่วยโรคมะเร็ง รวมทั้งการความช่วยเหลือผ่านการให้กำลังใจ กำลังทรัพย์ และการให้ความรู้ เพื่อส่งเสริมการเพิ่มอัตราการรอดชีวิตของผู้ป่วย “จริง ๆ แล้วผู้หญิงไทยยังคงกลัวการไปตรวจมะเร็งเต้านม และยังมีความเชื่อที่ว่าเป็นมะเร็งเต้านมต้องตัดทิ้งเท่านั้น สิ่งหนึ่งที่โครงการ ART for CANCER ให้ความสำคัญคือ การพยายามให้ความรู้ เปลี่ยนความเชื่อเดิม ๆ ในเรื่องการเป็นโรคมะเร็งเต้านมให้เกิดความเชื่อใหม่ว่า ตรวจพบเร็วในระยะเริ่มต้น รักษาหายได้ การเปลี่ยนความกลัวการไปตรวจของคนนั้นจึงเป็นเรื่องที่ท้าทายมาก หลายคนกลัวการรักษา กลัวการตัดเต้านม กลัวไม่หาย ไม่ว่าความกลัวในแบบใดก็ตาม เรามีหน้าที่ย้อนกลับไปหาสาเหตุ และอุดรอยรั่วความกลัวตรงนั้น ด้วยความรู้ และความเข้าใจที่ถูกต้อง ทุกการช่วยเหลือที่เปลี่ยนความคิดคนได้ หรือให้กำลังใจผู้ป่วยได้มันเป็นพลังส่งต่อเรื่องราวดี ๆ สร้างทัศนคติที่ดีให้กับทุกคน”
“กากตะกอนดี สู่เกษตรกร” จากกากตะกอนในระบบไบโอแก๊สของทั้งฟาร์มสุกรและโรงงาน ที่ยังมีจุลินทรีย์ดี มีแร่ธาตุสารอาหารที่พืชต้องการ นำไปตากแห้งกลายเป็นปุ๋ยอินทรีย์ชั้นดี โดยมีเครือข่ายร่วมพัฒนา ทั้งสำนักงานอุตสาหกรรมจังหวัด กรมพัฒนาที่ดิน หน่วยงานบริหารส่วนท้องถิ่น นักวิชาการเกษตร CPF และ CPP เพื่อส่งมอบปุ๋ยกากตะกอนให้เกษตรกรรอบหน่วยงาน รวมถึงโครงการผักปลอดภัยชุมชนบ้านด้าย ศูนย์พัฒนาพันธุ์พืชจักรพันธ์เพ็ญศิริ โครงการในพระราชดำริ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ช่วยลดการใช้ปุ๋ยเคมี ลดต้นทุนการผลิต เพิ่มรายได้ ขณะเดียวกัน ฟาร์มในโครงการส่งเสริมฯ สามารถเพิ่มรายได้เสริมจากการกรอกปุ๋ยกากตะกอน
บันเทิง ผลเจริญ ปราชญ์ปุ๋ยกากตะกอนสวนผลไม้ กล่าวว่า กากตะกอนดี ช่วยลดต้นทุนการผลิตได้กว่า 50% ซื้อปุ๋ยเคมีลดลงมากกว่าครึ่ง กากตะกอนดีได้มาฟรีๆนำมาหมักรวมกับกากน้ำตาล ทำให้ผลผลิตดีขึ้น ดินก็ไม่เสียด้วย
นอกจากนี้ได้จัดทีมเจ้าหน้าที่จากสำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุขในพื้นที่ สำนักงานเขตประเวศและอาสาสมัครสาธารณสุขกรุงเทพมหานคร (อสส.) รณรงค์ให้ความรู้เกี่ยวกับการป้องกันโรคพิษสุนัขบ้าในคน และในสัตว์ พร้อมให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชนที่มีการระบาด
จดหมายเปิดผนึก สภาเภสัชกรรม (ฉบับที่ 3)
จดหมายเปิดผนึก สภาเภสัชกรรม (ฉบับที่ 3) เรื่อง ชี้แจงกรณีแถลงการณ์แพทยสภา ฉบับวันที่ ๑๙ พฤศจิกายน พ.ศ. ๒๕๖๗
สืบเนื่องจากแถลงการณ์แพทยสภา เรื่อง ความเข้าใจในกรณีการฟ้องศาลปกครอง เกี่ยวเนื่องกับ โครงการดูแลอาการเจ็บป่วยเล็กน้อย ๑๖ กลุ่มอาการโดยเภสัชกรร้านยา ในระบบหลักประกันสุขภาพแห่งชาติ ทำให้สมาชิกเภสัชกรกังวลใจเป็นอย่างยิ่งในข้อมูลและทัศนคติดังกล่าว และอาจส่งผลต่อการทำงานร่วมกันของสหสาขาวิชาชีพในการร่วมดูแลประชาชนด้านยาและสุขภาพ
สภาเภสัชกรรม ขอเรียนเพื่อสร้างความเข้าใจที่ถูกต้องในประเด็นต่าง ๆ ดังต่อไปนี้
๑. กระบวนการพิจารณาโครงการดูแลอาการเจ็บป่วยเล็กน้อย ๑๖ กลุ่มอาการโดยร้านยาคุณภาพ ได้ผ่านกระบวนพิจารณาและกลั่นกรองหลายขั้นตอน โดยคณะอนุกรรมการชุดต่าง ๆ ของสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ทั้งคณะอนุกรรมการกำหนดประเภทและขอบเขตในการให้บริการสาธารณสุข คณะอนุกรรมการนโยบายและยุทธศาสตร์ คณะอนุกรรมการบริหารจัดการกองทุน คณะอนุกรรมการด้านกฎหมาย และในที่สุดเสนอ คณะกรรมการหลักประกันสุขภาพแห่งชาติ ซึ่งประกอบไปด้วยผู้แทนแพทย์ เภสัชกร และวิชาชีพ อื่นๆ ภาคประชาสังคม ผู้ทรงคุณวุฒิ และผู้เชี่ยวชาญจากสาขาอื่น ๆ จึงมีมติเห็นชอบให้ดำเนินการในโครงการดูแล อาการเจ็บป่วยเล็กน้อย ๑๖ กลุ่มอาการโดยเกสัชกรร้านยา ดังกล่าวนี้ โดยมีรายละเอียดแนวปฏิบัติที่รอบคอบ เพื่อให้ความปลอดภัยแก่ประชาชนผู้รับบริการ โดยให้บริการตั้งแต่ ๓๑ ตุลาคม ๒๕๖๕ จนถึง ๒๑ พฤศจิกายน ๒๕๖๗ มีผู้รับบริการทั้งสิ้น ๑,๗๙๑,๙๓๐ คน จำนวนครั้ง ๔,๙๘๕,๑๔๕ ครั้ง ร้อยละ ๙๐ อาการหายหรือทุเลา ไม่พบกรณีที่ผู้เข้ารับบริการที่เกิดปัญหารุนแรง หรือเสียชีวิตแต่อย่างใด อีกทั้งผู้ที่ได้รับการคัดกรองเบื้องต้น จากเภสัชกร มีบางส่วนได้รับการส่งต่อแพทย์ทันที ประชาชนได้รับการดูแลขภาพเบื้องต้น แนะนำการใช้ยาและ ปรับเปลี่ยนพฤติกรรมเสี่ยงต่อสุขภาพ และจากผลการสำรวจพบว่า ประชาชนที่เข้ารับบริการในโครงการนี้มีความพึงพอใจในระดับมากที่สุด
เรารู้สึกเป็นเกียรติที่ได้ร่วมงานกับ คุณสุทธิดาเพื่อส่งเสริมการรักษามะเร็งของประเทศไทย
ดังที่เราทราบกันดีว่าขณะนี้อัตราการเกิดโรคมะเร็งและอัตราการเสียชีวิตทั่วโลกสูงมาก และยากที่จะรักษาให้หายขาด ในฐานะโรงพยาบาลที่เชี่ยวชาญด้านมะเร็ง เรามุ่งมั่นที่จะพัฒนาเทคโนโลยีการรักษามะเร็งมาตลอด 20 ปี เพื่อมอบทางเลือกใหม่และความหวังใหม่ให้กับผู้ป่วยโรคมะเร็ง โดยมีคุณสุทธิดา มาทำหน้าที่ทูตต่อต้านมะเร็ง มาช่วยสร้างแรงบันดาลใจให้ผู้ป่วยทั่วโลกให้มีความหวังต่อสู้กับโรคมะเร็ง
รางวัล CEO of the Year 2024 โดยหนังสือพิมพ์ Bangkok Post จัดขึ้นเพื่อยกย่องผู้นำที่มีวิสัยทัศน์และสร้าง แรงบันดาลใจ ซึ่งได้เปลี่ยนอุตสาหกรรมและนำมาซึ่งการเปลี่ยนแปลงในเชิงบวก รางวัลในปีนี้ได้ให้ความสำคัญกับผู้บริหารระดับสูงและผู้นำที่ได้ทำให้ธุรกิจต่าง ๆ ประสบความสำเร็จ มีความก้าวหน้า และเติบโตอย่างยั่งยืน ซึ่งครอบคลุมหลากหลายหมวดหมู่ และไม่เพียงแต่ยกย่องความสำเร็จขององค์กร แต่ยังยกย่องการมีส่วนร่วมที่สำคัญและความคิดริเริ่มที่ยั่งยืนที่ผู้นำเหล่านี้มอบให้กับสังคมและเศรษฐกิจ ตั้งแต่การพัฒนากลยุทธ์ทางธุรกิจไปจนถึงการเป็นผู้นำที่เปลี่ยนแปลงความเป็นอยู่ของผู้คนโดยสมบูรณ์
ทั้งนี้ นายแพทย์ตนุพล วิรุฬหการุญ ประธานคณะผู้บริหาร BDMS Wellness Clinic และ BDMS Wellness Resort บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) เข้าร่วมงานรับรางวัล CEO of the Year 2024 สาขา “Best CEO in Excellence in Wellness Leadership” จากหนังสือพิมพ์ Bangkok Post อย่างเป็นทางการ ในงาน Bangkok Post CEO of the Year Award 2024 ณ โรงแรมเซ็นทาราแกรนด์ เซ็นทรัลเวิลด์ เมื่อค่ำคืนวันที่ 7 พฤศจิกายน 2567 ที่ผ่านมา


ต่อด้วยการอัปเดตเทรนด์ในวงการแพทย์ด้านเวชศาสตร์การป้องกัน โดย นายแพทย์วรทย์ รังสิมาหริวงศ์ แพทย์ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน และเวชศาสตร์การกีฬา (Preventive Medicine and Sports Medicine) และ แพทย์หญิงณัฏฐ์นรี บุญศิรภัสสรแพทย์ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน (Preventive Medicine) BDMS Wellness Clinic ภายใต้หัวข้อ Hacking the Code - How Epigenetics Can Unlock Your Health Potential ที่ได้เผยถึงความสำคัญของเทคโนโลยีสมัยใหม่ อย่าง ชีวสารสนเทศศาสตร์ (Bioinformatics) ซึ่งเป็นการใช้เทคโนโลยีคอมพิวเตอร์และเครื่องมือทางคณิตศาสตร์ในการจัดการ วิเคราะห์ และตีความข้อมูลชีวภาพ เช่น ลำดับพันธุกรรม (DNA/RNA) ข้อมูลจากโปรตีน และข้อมูลทางชีววิทยาอื่น ๆ โดยชีวสารสนเทศศาสตร์มีบทบาทสำคัญในการวิจัยและความเข้าใจในชีววิทยาระดับโมเลกุลที่ช่วยส่งเสริมคุณภาพชีวิตให้ผู้คนบนโลก และสามารถ “ป้องกันก่อนเกิดโรค” ตลอดจน “รู้อายุเซลล์ (Biological Age) ผ่านการตรวจความยาว Telomere” และ “ความเสี่ยงของการเกิดโรคในอนาคตผ่านการตรวจ Epigenetics” ของตัวเองผ่านการตรวจสุขภาพในระดับเซลล์และวางแผนป้องกันการเกิดโรคผ่านหลักเวชศาสตร์วิถีชีวิตได้อย่างเหมาะสม
ประกาศโรงพยาบาลศิริราช
14 ธันวาคม 2567 โรงพยาบาลศิริราชา
เผยแพร่ประกาศ เกี่ยวกับผู้ป่วยสิทธิ์หลักประกันสุขภาพแห่งชาติเพื่อการรักษาโรคมะเร็ง มีผลตั้งแต่ 1 มกราคม 2568
รศ.นพ.ฮิโรชิ จันทาภากุล นายกสมาคมโรคภูมิแพ้ โรคหืด และวิทยาภูมิคุ้มกันแห่งประเทศไทย และอาจารย์สาขาวิชาโรคภูมิแพ้และภูมิคุ้มกันทางคลินิก ฝ่ายอายุรศาสตร์ โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย กล่าวว่า “การที่ยาสำหรับโรคหายากได้ถูกบรรจุเข้าสู่บัญชียาหลักแห่งชาติ นอกจากจะช่วยให้ผู้ป่วยโรคหายากสามารถเข้าถึงการรักษาได้อย่างเท่าเทียมแล้วนั้น ยังเป็นการช่วยให้บุคลากรทางการแพทย์และนักวิจัยสามารถเข้าใจโรคหายากได้ดียิ่งขึ้น โดยเฉพาะความรุนแรงและการตอบสนองต่อยาของผู้ป่วยในประเทศไทย ซึ่งจะนำไปสู่การศึกษาเกี่ยวกับโรคหายากที่ลึกขึ้นและช่วยเหลือผู้ป่วยได้มากยิ่งขึ้นในอนาคต โดยความร่วมมือจากบันทึกข้อตกลงฯ ระยะที่ 1 ที่ผ่านมาเราได้จัดตั้งศูนย์วินิจฉัยและศูนย์ส่งต่อผู้ป่วยโรค HAE ที่เข้าถึงได้ง่ายขึ้น ส่งเสริมความแข็งแกร่งให้กับกลุ่มผู้ป่วยในไทย สำหรับ MOU ครั้งใหม่นี้เราจะยังมุ่งมั่นสร้างแรงกระเพื่อมเกี่ยวกับโรคหายากให้มากขึ้นกว่าเดิม เพื่อให้ภาครัฐและหน่วยงานที่เกี่ยวข้องเห็นว่ากลุ่มผู้ป่วยเหล่านี้ก็เป็นหนึ่งในวาระสำคัญของประเทศเช่นเดียวกัน”
3. ศัลยกรรมยุคใหม่
การปฏิวัติเงียบๆ ในวงการศัลยกรรมได้เริ่มแผ่ขยายเป็นวงกว้าง เมื่อการผ่าตัดเล็ก (minimal invasive) กำลังเข้ามาแทนที่การผ่าตัดใหญ่แบบดั้งเดิม โดยการผ่าตัดเล็กมาเปลี่ยนแปลงแนวทางการรักษาแบบเดิมโดยเฉพาะในด้านการรักษาโรคหัวใจและหลอดเลือด เพื่อช่วยให้ผู้ป่วยฟื้นตัวเร็วขึ้น ลดความเจ็บปวด และลดความเสี่ยงจากภาวะแทรกซ้อนได้ดีขึ้น
จากความก้าวหน้าทางเทคโนโลยีทางการแพทย์ ทำให้การศัลยกรรมหรือผ่าตัดเล็กแบบ minimally invasive ก้าวหน้าไปอีกขั้น แต่ก็มีความซับซ้อนมากขึ้นเช่นกัน แพทย์จำเป็นต้องรวบรวมและวิเคราะห์ข้อมูลจากเครื่องมือการตรวจวินิจฉัยที่หลากหลาย ไม่ว่าจะเป็น ภาพเอ็กซเรย์ 2 มิติ แบบภาพสด, ภาพจากอัลตราซาวด์แบบ 3 มิติ, การตรวจด้วยอัลตราซาวด์หลอดเลือด (IVUS) และการวัดการไหลเวียนของเลือด (FFR หรือ iFR) และในขณะเดียวกันก็ต้องประเมินและติดตามภาวะของผู้ป่วยอย่างใกล้ชิด ดังนั้นการเชื่อมต่อของระบบ ซอฟต์แวร์ และเครื่องมือต่างๆ จึงมีความสำคัญเพิ่มมากขึ้น การบูรณาการระบบเหล่านี้จะช่วยให้แพทย์ศัลยกรรมสามารถวางแผนการผ่าตัดรักษาผู้ป่วยได้ด้วยความมั่นใจ
ตัวอย่างนวัตกรรมล่าสุดของฟิลิปส์ในกลุ่ม Image-guided therapy ช่วยเพิ่มโอกาสในการรักษาโรคหลอดเลือดสมอง เพราะทุกๆ 2 วินาที จะพบผู้ป่วยโรคหลอดเลือดสมอง ซึ่งเป็นสาเหตุอันดับสองของการเสียชีวิตทั่วโลก และเป็นสาเหตุหลักของภาวะความพิการในระยะยาว อย่างไรก็ตาม น้อยกว่า 5% ของประชากรทั่วโลกที่สามารถเข้าถึงการรักษาได้ทันท่วงที ด้วยการสวนหลอดเลือดแบบไม่ต้องผ่าตัด (mechanical thrombectomy) หรือการผ่าตัดเล็ก (minimal invasive) ซึ่งเป็นวิธีการรักษาที่มีประสิทธิภาพสูง [2] นอกจากนี้การเพิ่มการเข้าถึงการรักษาโรคหลอดเลือดสมอง ด้วยการเพิ่มจำนวนโรงพยาบาลที่มีความพร้อม และเพิ่มการฝึกอบรมบุคลากรทางการแพทย์เกี่ยวกับเทคนิคการรักษาแนวทางใหม่ล่าสุดแบบผ่าตัดเล็ก ถือเป็นภารกิจสำคัญที่ฟิลิปส์มุ่งมั่นจะทำต่อร่วมกับองค์การโรคหลอดเลือดสมองโลก (World Stroke Organization)
กำหนดการซ้อมรำบวงสรวงท้าวสุรนารี ประจำปี 2568 (มค-มีค)
รายชื่อศิลปินแสดงวันที่ 15 มีนาคม (1 เวที)
นอกจากนี้ มูลนิธิรามาธิบดีฯ ยังให้ความสำคัญกับการสื่อสารถึง ‘ผลลัพธ์จากการให้’ ที่จับต้องได้ เพื่อสร้างความเชื่อมั่นในกลุ่มผู้บริจาคและสะท้อนความโปร่งใสในการดำเนินงาน โดยเฉพาะการจัดสรรทุนทรัพย์จากการบริจาคของประชาชนเพื่อสร้างสาธารณประโยชน์อย่างแท้จริง เช่น การสนับสนุนงบประมาณการบริหารจัดการ การจัดซื้ออุปกรณ์การแพทย์ การซ่อมแซมและบำรุงระบบในอาคารสถานที่ของโรงพยาบาลรามาธิบดี รวมถึงสถาบันการแพทย์จักรีนฤบดินทร์ โดยเฉพาะอาคารกายวิภาคทางคลินิก (Clinical Anatomy Building) ผ่านการจัดซื้อเครื่องมือการเรียนการสอนที่เป็นสากล เพื่อเปิดโอกาสให้นักศึกษาแพทย์ได้เรียนรู้กายวิภาคผ่านเทคโนโลยีสามมิติที่ล้ำสมัย เอื้อต่อการเรียนรู้และทบทวนบทเรียน ควบคู่ไปกับการศึกษาจากร่างอาจารย์ใหญ่ เพื่อผลิตบุคลากรทางการแพทย์ที่เต็มเปี่ยมด้วยความสามารถและความเชี่ยวชาญเข้าสู่ระบบสาธารณสุขไทย
คลินิกเฉพาะทางนอกเวลา จักษุ
Let’s Go Karaoke! #JFF2025
Let’s Go Karaoke! #JFF2025 1 ชั่วโมง 48 นาที R:ท ©2024 "Let’s Go Karaoke!" Film Partners JAPANESE (EN & TH Subs) เรื่องราวมิตรภาพสุดเหลือเชื่อระหว่างเด็ก ม.ต้นสุดเหนียมจากชมรมประสานเสียง กับหนุ่มยากูซ่าผู้อับจนหนทาง จับพลัดจับผลูมาฝึกร้องเพลงคาราโอเกะแสนวายป่วงด้วยกัน ได้เวลาวอร์มเสียง วอร์มใจ เตรียมร้องเพลงไปด้วยกันกับสองนักแสดงนำ อายาโนะ โก และไซโต จุน
อีเว้นท์ทั้งหมด (All Events) LINK
รวม 35 อีเวนต์ไฮไลต์ Bangkok Design Week 2025 ไม่ว่าจะเป็นนิทรรศการ เวิร์กช็อป ทอล์ก และโปรเจกต์พิเศษจากนักคิด นักออกแบบ และครีเอเตอร์หลากหลายสาขา ที่รอการไปสำรวจของคุณ [
click]
- 8-16 กุมภาพันธ์ ที่ย่านเจริญกรุง - ตลาดน้อย, เยาวราช - ทรงวาด, ปากคลองตลาด, และพื้นที่อื่นๆ
- 15 - 23 กุมภาพันธ์ ที่ย่านพระนคร, บางลำพู - ข้าวสาร, และพื้นที่อื่นๆ
- เฉพาะเสาร์และอาทิตย์ 8-9, 15-16, 22-23 กุมภาพันธ์ ที่ย่านหัวลำโพง, บางโพ, และพื้นที่อื่นๆ
อาสาสมัครประคองผู้ป่วยที่ช่วยเหลือตัวเองได้น้อย (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญชวนนักเรียนนักศึกษา และผู้ที่สนใจกิจกรรม อาสาสมัคร "Safety for my patients" อาสาสมัครประคองผู้ป่วยที่ช่วยเหลือตัวเองได้น้อย
โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 08.30-12.00 น. (จำนวนชั่วโมงอาสาสมัคร 4 ชั่วโมง) ณ หน่วยระงับปวด ตึก 10 ชั้น 1
รับสมัครผู้ที่สนใจเพียงวันละ 2 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- อำนวยความสะดวก และดูแลผู้ป่วยที่ช่วยเหลือตัวเองได้น้อย
คุณสมบัติอาสาสมัคร
1. นักเรียนนักศึกษา หรือประชาชนทั่วไป อายุ 16 - 45 ปี
2. สุขภาพร่างกายแข็งแรง ไม่มีปัญหาด้านกล้ามเนื้อ/กระดูก
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
คลินิกอายุรกรรม โรคทั่วไป ความดันสูง เบาหวาน ไขมันเลือดสูง
คลินิกอายุรกรรม โรคติดเชื้อต่างๆ เบาหวาน ความดัน ไขมันเลือดสูง
แผนการฉีดวัคซีน โซน3 จำนวน 15 ชุมชน ช่วง 18-27 มี.ค.2568
ทันตกรรมชุมชนอบอุ่น สมุทรปราการ
สมุทรปราการ
(คลินิกในสมุทรปราการ ที่ต้องการเพิ่มปุ่ม Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com)
- คลินิกเฉพาะทางด้านทันตกรรมจัดฟัน เอ.ซี.
- คลินิกทันตกรรม บ้านรักฟัน
- คลินิกทันตกรรม พลัส สาขาบางนา
- คลินิกทันตกรรม หมอฟันบางบ่อ
- คลินิกทันตกรรม เอซ info&map
- คลินิกทันตกรรมเซเว่น สาขาบีทีเอสเคหะฯ
- คลินิกทันตกรรมเด็นต้าแคร์
- คลินิกทันตกรรมเดนทัลมี
- คลินิกทันตกรรมไดโนเดนท์ info&map
- คลินิกทันตกรรมเทพารักษ์
- คลินิกทันตกรรมธีรพรทันตแพทย์
- คลินิกทันตกรรมบางพลีน้อยทันตแพทย์
- คลินิกทันตกรรมพาราไดซ์
- คลินิกทันตกรรมเพียงยิ้ม
- คลินิกทันตกรรมเมคยูสมายล์
- คลินิกทันตกรรมรักฟันอิมพีเรียล
- คลินิกทันตกรรมสไมล์เอสบีซี
- คลินิกทันตกรรมอมยิ้ม
- คลินิกทันตกรรมออร่าไวท์ info&map
- คลินิกทันตกรรมแอพพิคัล
- คลินิกบางบ่อทันตแพทย์
- มังกรคลินิกทันตกรรม
- สหคลินิก หมอเอ-หมอโจ ทันตกรรม-เวชกรรม
- หมอก็อฟคลินิกทันตกรรม
3) ตู้บริการทางการแพทย์ทางไกล (Telemedicine kiosks)
แนวคิดเบื้องหลังตู้บริการเทเลเมดิซีน Healthspotคือการมอบการดูแลที่สะดวกและมีคุณภาพในสถานที่ยอดนิยม เช่น พื้นที่ขายปลีกหรือสำนักงาน ถือเป็นการผสมผสานระหว่างเทเลเฮลท์และการดูแลส่วนบุคคลอย่างแท้จริง ผู้ป่วยสามารถติดต่อกับผู้ให้บริการแบบพบหน้ากันผ่านหน้าจอวิดีโอ และได้รับการดูแลแบบรายบุคคลในละแวกบ้านของตน ในตอนแรกดูเหมือนว่าจะเป็นการพัฒนาที่ปฏิวัติวงการ แต่บริษัทกลับล้มละลาย เหตุผลคืออะไร? โมเดลการทำงานของ Healthspot ไม่ได้มอบประสบการณ์บริการด้านสุขภาพตามความต้องการที่แท้จริงตามที่สัญญาไว้ มีราคาแพงเกินไป ตลาดเป้าหมายมีขนาดเล็กเกินไป และตู้จำหน่ายสินค้าเองก็ใหญ่เกินไปในยุคที่สมาร์ทโฟนสามารถเล่นวิดีโอคุณภาพระดับ HD ได้ แนวคิดของตู้ตรวจสุขภาพแบบดิจิทัลไม่ได้หายไปพร้อมกับ Healthspot บริษัทสตาร์ทอัพแห่งหนึ่งในอินเดียเพิ่งเปิดตัวตู้ตรวจสุขภาพดิจิทัลเพื่อตรวจวินิจฉัยพื้นฐาน เช่น ความดันโลหิต น้ำตาลในเลือด และภาวะหัวใจในหลายภาษา หลายคนมีอุปกรณ์ขนาดพกพาที่บ้านที่สามารถทำแบบเดียวกันได้กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว ประจำเดือนมีนาคม 2568
กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนมีนาคม 2568 ตั้งแต่เวลา 09.00 - 15.00 น. ดังนี้
- วันจันทร์ที่ 3 มีนาคม 2568 ชุมชนร้อยหลัง
- วันพุธที่ 5 มีนาคม 2568 ชุมชนสุเหร่าต้นกระบก
- วันจันทร์ที่ 10 มีนาคม 2568 ชุมชนชัยพรวิถี
- วันพุธที่ 12 มีนาคม 2568 ชุมชนกระบก 33
- วันจันทร์ที่ 17 มีนาคม 2568 วัดป่าสุทธิภาวัน
- วันพุธที่ 19 มีนาคม 2568 ชุมชนหนองใหญ่บ้านบน
- วันจันทร์ที่ 24 มีนาคม 2568 ชุมชนหนองใหญ่บ้านล่าง
- วันพุธที่ 26 มีนาคม 2568 ชุมชนพัทยาเหนือ
- วันจันทร์ที่ 31 มีนาคม 2568 ชุมชนเพนียดช้าง
นำบัตรประชาชนมาลงทะเบียน เพื่อนำสัตว์เลี้ยงเข้ารับบริการด้านต่างๆ ดังนี้ การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า / การผ่าตัดทำหมันสุนัขและแมว / การให้คำแนะนำด้านสุขภาพสัตว์เลี้ยง
หมายเหตุ : ให้บริการในสุนัขและแมว ที่มีอายุ 6 เดือน ขึ้นไป ควรงดน้ำ งดอาหารสัตว์เลี้ยง อย่างน้อย 12 ชั่วโมง และรับเฉพาะสุนัขพันธุ์ไทยและแมวพันธุ์ ไทย เท่านั้น กรณีทำหมันตัวเมีย ให้บริการบ้านละไม่เกิน 2 ตัว ตัวผู้ไม่จำกัด
ติดตามข้อมูลข่าวสารเพิ่มเติม facebook :
Pattayaconnectofficial
สอบถามรายละเอียดเพิ่มเติมที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
ฝ่ายนายจ้าง ขออภัยที่ต้องใช้เวลาถึง 2 สัปดาห์
ดร.มนตรี ฐิรโฆไท กรรมการประกันสังคม ฝ่ายนายจ้าง กล่าวว่า ต้องขออภัยผู้ประกันตนที่ต้องรอการพิจารณาเรื่องนี้ถึง 2 สัปดาห์ พร้อมชี้แจงว่า ในช่วง 2 สัปดาห์ที่ผ่านมานั้น บอร์ดประกันสังคมได้พิจารณาในส่วนต่างๆ หลังนักคณิตศาสตร์ประกันภัย กลับไปพิสูจน์ตรวจสอบสูตรการคำนวณให้ดีขึ้น ให้เกิดความเป็นธรรมกับผู้ประกันตนในทุกกลุ่ม ดังนั้นในช่วง 90 วันหลังจากนี้ ขอให้ผู้ประกันตนให้ความสนใจในการทำประชาพิจารณ์ประกาศ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ฉบับที่ 2 (12 มีนาคม 2568)
ประกาศ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล
ฉบับที่ 2 (12 มีนาคม 2568)
จากกรณีที่มีกลุ่มควันและเพลิงไหม้เกิดขึ้นที่ อาคารหลัก (อาคาร 1) ของโรงพยาบาลรามาธิบดี เมื่อวันที่ 11 มีนาคม 2568 และทางคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ได้ชี้แจง ออกประกาศฉบับที่ 1 ถึงเหตุการณ์ที่เกิดขึ้นไปแล้วนั้น
ในวันนี้ ทางคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ได้ทำการอพยพยพย้าย ผู้ป่วยไปยังจุดปลอดภัย จำนวนครบถ้วน 191 ราย โดยเป็นการอพยพย้ายภายในโรงพยาบาล จาก เหตุการณ์ดังกล่าวมีผู้ได้รับบาดเจ็บจากการสูดเขม่าควันจำนวน 1 รายซึ่งเป็นบุคลากรที่เข้าไปช่วยเหลือ ในการเคลื่อนย้ายผู้ป่วย ผู้ได้รับบาดเจ็บดังกล่าวได้รับการดูแลอยู่ในหอผู้ป่วยวิกฤต (ICU) และได้รับ การดูแลอย่างดีที่สุด
ผลกระทบดังกล่าว ทำให้คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดลได้รับ ผลกระทบในการให้บริการด้านรังสีวิทยาและพยาธิวิทยา ฝั่งอาคารหลัก (อาคาร 1) โดยเบื้องต้นการให้ บริการด้านรังสีวิทยาและพยาธิวิทยาบางส่วนต้องย้ายไปให้บริการที่อาคารสมเด็จพระเทพรัตน์เป็น การชั่วคราว ทั้งนี้ จากข้อกังวลเรื่องรังสีรั่วไหล ทางทีมวิศวกรรมได้ตรวจสอบแล้วไม่พบการรั่วไหลของรังสี สำหรับด้านการให้บริการทางพยาธิวิทยา ได้แก่ การบริจาคโลหิต ในขณะนี้ ทางคณะแพทยศาสตร์ โรงพยาบาลรามาธิบดีมหาวิทยาลัยมหิดล ขอขอบคุณผู้ที่ประสงค์จะบริจาคแต่เนื่องจากหน่วยคลังเลือด มีพื้นที่ในการรับบริจาคโลหิตอย่างจำกัด อาจจะไม่ได้รับความสะดวก
ทั้งนี้ การเปิดให้บริการหน่วยต่างๆ ภายในอาคารหลัก (อาคาร 1) ชั้น 1 - 9 ฝั่งใต้ ยังคงปิดให้บริการ เพื่อทำการระบายกลิ่นและกลุ่มควันออกจากอาคารอย่างต่อเนื่อง
ทางคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล จะดำเนินการลดจำนวนผู้ป่วย การผ่าตัด ผู้ป่วยที่ไม่เร่งด่วนออกไป กายใน 1 - 2 วัน โดยหากสามารถดำเนินการได้ปกติจะมีการประกาศต่อไป
ต้องขอขอบคุณความช่วยเหลือจากทุกภาคส่วนรวมทั้งเจ้าหน้าที่ดับเพลิงบรรเทาสาธารณภัย กำลังจากตำรวจทหารที่เข้ามาช่วยเหลือรวมทั้งสถานพยาบาลที่อยู่ใกล้เคียงที่พร้อมจะรับผู้ป่วยไปดูแล ต่อและต้องขอบคุณบุคลากรของคณะฯ ทุกท่านที่ได้เข้ามาช่วยเหลือกันเพื่อให้ผู้ป่วยได้รับความปลอดภัย ทุกคน บุคลากรทุกท่านทำงานอย่างมืออาชีพตามแผนที่ได้ซ้อมไว้และยังช่วยกันแก้ไขปัญหาเฉพาะหน้า จนสามารถกลับมาดูแลผู้ป่วยได้อย่างต่อเนื่อง
จึงประกาศมาเพื่อทราบโดยทั่วกัน
โรงเพยาบาลรามาธิบดี
1 มิถุนายน วันดื่มนมโลก World Milk Day LINK
วันที่ 1 มิถุนายน ของทุกปีตรงกับวันดื่มนมโลก หรือ World Milk Day เพื่อให้ประเทศต่าง ๆ และองค์กรให้ความสำคัญและสนับสนุนการบริโภคนมแก่ประชาชน สำหรับประเทศไทย อย. ได้รณรงค์เชิญชวนคนไทยเลือกซื้อนมที่มีคุณภาพเพื่อความปลอดภัย โดยเลือกซื้อผลิตภัณฑ์นมที่แสดงเลขสารบบอาหาร 13 หลัก และมีข้อมูลบนฉลากครบถ้วน เช่น ชื่ออาหาร ชื่อที่ตั้งผู้ผลิต ผู้แบ่งบรรจุ ปริมาณสุทธิ ส่วนประกอบสำคัญ วันเดือนปีที่ผลิต วันเดือนปีที่หมดอายุ รวมทั้งภาชนะบรรจุต้องอยู่ในสภาพเรียบร้อย ไม่รั่ว ไม่ซึม ไม่บวม ไม่มีรอยฉีกขาด และควรเลี่ยงการซื้อนมจากร้านค้าที่มีการเก็บผลิตภัณฑ์นมเพื่อจำหน่ายแบบไม่เหมาะสม
4 - 5 พ.ค.67 Phang Nga Triathlon 2023 Pure the Ocean LINK
การแข่งขันไตรกีฬาบนพื้นที่ที่สวยงามที่สุดที่หนึ่งในจังหวัดพังงา ด้วยมาตรฐานการจัดงานระดับนานาชาติ กับรายการ Phang Nga Triathlon 2023 by Pure Blue Foundation บนชายหาดนาใต้ เพียง 25 นาทีจากสนามบินภูเก็ต - คณะกรรมการจัดการแข่งขันมีมติเห็นชอบเลื่อนการจัดกิจกรรมในวันที่ 5-7 พฤษภาคม 2566 ไปในวันที่ 4 - 5 พฤษภาคม 2567 แทนกำหนดการเดิม เพื่อเตรียมความพร้อม สร้างความมั่นใจ และความปลอดภัย ในการรับรองนักกีฬาทุกท่านที่ตั้งใจลงแข่งขัน ผู้สมัครแข่งขันในปี 2566 ทุกท่านจะได้รับโอนสิทธิ์แข่งขันไปปี 2567 โดยอัตโนมัติ
3. สลากกินแบ่งรัฐบาล หวยใต้ดิน การพนันยอดนิยมของคนไทย
สลากกินแบ่ง เป็นพนันอันดับหนึ่งของชาวไทยทุกกลุ่ม
• 45.4% หรือ 24.626 ล้านคน เกือบครึ่งประเทศ เล่นล็อตเตอรี่
• เงินหมุนเวียน 139,977 ล้านบาท/ปี เงินหมุนเวียนต่องวด 6.665 หมื่นล้านบาท (21 งวด)
• เด็กต่ำกว่า 20 ปี เล่นพนันสลาก 7.024 แสนคน
• กลุ่มเสี่ยง 3 กลุ่ม เพิ่มขึ้นเกิน 10% ทุกกลุ่ม ขณะที่คนวัยทำงาน 26-59 ปี เพิ่มขึ้นเพียง 7%
หวยใต้ดิน ยอดนิยมอันดับ 2 ของชาวไทย
• 35.5% หรือ 19.273 ล้านคน เล่นหวยใต้ดิน เพิ่มจากปี 62 1.536 ล้านคน (8.7%)
• เงินหมุนเวียน 149,919 ล้านบาท เฉลี่ย 7.139 หมื่นล้าน/งวด (21 งวด) *มากกว่าล็อตเตอรี่เกือบ 5 พันล้าน
• วัยทำงาน 26-29 ปี และ เด็ก 15-18 ปี เป็นกลุ่มใหญ่ที่จำนวนผู้เล่นหวยใต้ดิน เพิ่มเกิน 20% กลุ่มสูงอายุ 14% เยาวชน 19-25 เพิ่มเกือบ 13%
วิธีรับมือเมื่อมีอีเมล์ / SMS หลอกลวงส่งมา
ตั้งสติและตรวจสอบเมื่อได้รับอีเมลแปลกๆ
ดูให้แน่ๆ ช้าๆ ว่าเป็นอีเมลที่เรารู้จักหรือไม่ มีลักษณะเข้าข่ายอีเมลหลอกลวงที่แนะไว้ข้างต้นหรือไม่
Celebrate Life New Year 2023 ต้นคริสต์มาสขนาดยักษ์ แสงสีไฟ @สามย่านมิตรทาวน์
สามย่านมิตรทาวน์ เริ่มจัดงานประดับไฟปีใหม่แล้วนะ “Celebrate Life New Year 2023” โดยปีนี้มาในคอนเซ็ปต์น่ารัก ๆ ที่นอกจาก ต้นคริสต์มาสขนาดยักษ์ และอีเวนต์แสง สี เสียง ในธีม Mitr Vibes ณ อุโมงค์เชื่อมมิตร เหมือนปีก่อน ๆ แล้ว ยังมีเหล่า character ที่เป็นตัวแทนของความสนุกสนานประจำเทศกาลแห่งความสุขต้อนรับปีใหม่แบบนี้ อย่าง Dakota (ซานต้า), Vify (ต้นคริสต์มาส), Ronda (ตุ๊กตาขนมผิง), Amity (เอลฟ์) และ Kate (disco ball) มาร่วมสร้างสีสันตามจุดตกแต่งต่าง ๆ ทั่วทั้งสามย่านมิตรทาวน์อีกด้วย ตามวาฬมาถ่ายรูปกันนะครับบบ
สำหรับกำหนดการกิจกรรมต่าง ๆ มีตามนี้
- 6-8 ธ.ค. เก็บคลิปความสุขรอบตัว ด้วย Videobooth 360 องศา ฟรี!
- 22 พ.ย. พบกับ Disco Snow Globe ให้ทำคอนเท้นต์สวยรับปีใหม่แบบไม่ซ้ำใคร
- 25 พ.ย. งานเปิดไฟต้นคริสต์มาส และโชว์สุดพิเศษจาก “Proxie” ในงาน Samyan Mitrtown Light Up Christmas Tree Celebration 2023 ตั้งแต่เวลา 19.30 น.เป็นต้นไป
- 26-30 พ.ย. เกมส์ลุ้นรางวัลสนุก ๆในงานเยอะมาก
- 24-31 ธ.ค. จิบนมเคาท์ดาวน์ กับคู่จิ้น ซี-นุนิว
ระยะเวลา: วันนี้ถึง 10 มกราคม 2566
เวลาเปิดไฟต้นคริสต์มาส: 18:00 น.
ธุรกิจเด่นอันดับ 3 ธุรกิจ Social Media และ Online Entertainment
ปัจจัยสนับสนุน
1. ประชาชนรับชมภาพยนตร์และรายการต่างๆ ผ่าน Streaming Platform มากขึ้น
2. การเพิ่มขึ้นของช่องทางในการสื่อสาร โดยเฉพาะช่องทางออนไลน์ ที่สามารถเข้าถึงได้ตลอด 24 ชม.
3. การเพิ่มขึ้นของการโปรโมทโฆษณาผ่น Social Influencer อาทิเช่น Net-ldol หรือ Youtuber
4. ธุรกิจขนาดเล็ก-ใหญ่ หันมาโปรโมทสินค้าผ่านช่องทางออนไลน์มากขึ้น
5. พฤติกรรมการรับชมสื่อผ่าน Application เพิ่มขึ้น
6. พฤติกรรมการเล่น Social Media เพิ่มขึ้น
7. กระแสเทคโนโลยีเมตาเวิร์สที่เริ่มเข้ามามีบทบาทกับวงการสื่อและสิ่งบันเทิง
ปัจจัยเสี่ยง
1. ผู้บริโภคบางส่วนไม่สามารถเข้าถึงสื่อผ่านช่องทางออนไลน์ได้ เนื่องจากใช้อุปกรณ์ไม่เป็น
2. การแข่งขันที่รุนแรงในช่องทีวีดิจิทัล
3. ข้อจำกัดในการเข้าถึงระบบอินเตอร์ของผู้บริโภคบางส่วน
4. การเดิบโตของรายจ่ายด้านโฆษณา อ้างอิงเศรษฐกิจในประเทศที่กำลังฟื้นตัว
5. การเปลี่ยนแปลงของการกำกับดูแลการประกอบกิจการกระจายเสียงและกิจการโทรทัศน์
6. โดรงสร้างพื้นฐานด้านเทคโนโลยี และโครงข่ายต่างๆ ที่ยังไม่ครอบคลุม
มอบยา จำนวน 200 ชุด ช่วยเหลือผู้ประสบภัยน้ำท่วม จังหวัดสระแก้ว
Green Health Care&Share 2013.10.16
"มอบยา จำนวน 200 ชุด ช่วยเหลือผู้ประสบภัยน้ำท่วม จังหวัดสระแก้ว" โครงการ Gree Health Care&Share โดยมีนายแพทย์จารุวัฑ ใช้ความเพียร ผู้อำนวยการโรงพยาบาลกรุงเทพจันทบุรี เป็นประธาน มอบยาจำนวน 200 ชุด ช่วยเหลือผู้ประสบภัยน้ำท่วม จังหวัดสระแก้ว โดยมีท่าน พ.ต.ท. เสกสรร จินดาพรรณ สารวัตรสถานีตำรวจท่องเที่ยว 6 เป็นตัวแทนในการรับมอบเมื่อวันที่ 14 ตุลาคม 2556 ที่ผ่านมา ณ โรงพยาบาลกรุงเทพจันทบุรีมอบอุปกรณ์จราจร ให้กับจุดกู้ภัยแสลง จ.จันทบุรี
Green Health Care&Share 2013.10.24
"มอบอุปกรณ์จราจร ให้กับจุดกู้ภัยแสลง จ.จันทบุรี" นพ.จารุวัฑ ใช้ความเพียร ผู้อำนวยการโรงพยาบาลกรุงเทพจันทบุรี เป็นประธานในการมอบ กรวยจราจร 15 กรวย เสื้อจราจรสะท้อนแสง 20 ตัว ให้กับจุดกู้ภัยแสลง จ.จันทบุรี เพื่อนำไปใช้อำนวยความสะดวกให้กับประชาชนในด้านจราจร โดยมีตัวแทนกู้ภัยแสลง จ.จันทบุรี เป็นตัวแทนในการรับมอบ เมื่อวันที่ 22 ตุลาคม 2556 ที่ผ่านมา ณ โรงพยาบาลกรุงเทพจันทบุรี — at Bangkok Hospital Chanthaburi. นอกจากนี้ สถาบันโรคหัวใจบำรุงราษฎร์ ยังเป็นศูนย์ส่งต่อผู้ป่วยระดับตติยภูมิในภูมิภาคเอเชียแปซิฟิก และขยายขอบเขตการรับรักษาไปยังทุกแห่งของโลก โดยมีผู้ป่วยเข้ารับการรักษาภาวะหัวใจเต้นผิดจังหวะจากทั่วโลก รวมถึงสหรัฐอเมริกาและยุโรป ศูนย์หัวใจเต้นผิดจังหวะของบำรุงราษฎร์ มีชื่อเสียงเป็นที่ยอมรับในการจี้หัวใจผ่านสายสวนในผู้ป่วยที่มีอาการ ภาวะหัวใจห้องบนสั่นพลิ้ว เนื่องจากเป็นสถานที่เพียงไม่กี่แห่งในโลกที่ศึกษาการจี้หัวใจด้วยคลื่นวิทยุความถี่สูง (CFAE ablation) ร่วมกับเทคโนโลยี CardioInsight ตรวจจับหัวใจเต้นผิดจังหวะ โดยไม่ต้องมีการผ่าตัดหรือสอดเครื่องมือใด ๆ อย่างต่อเนื่องมาตั้งแต่ปี พ.ศ. 2559
สถาบันโรคหัวใจบำรุงราษฎร์ มุ่งมั่นพัฒนางานวิจัยอย่างต่อเนื่อง ศ. นพ. กุลวี เนตรมณี กล่าวด้วยความภาคภูมิใจว่า “เราตีพิมพ์บทความวิจัยประมาณ 10 บทความต่อปีในวารสารทางการแพทย์ชั้นนำของโลก เราภาคภูมิใจกับความสำเร็จนี้ เรายังร่วมมือกับจุฬาลงกรณ์มหาวิทยาลัย พัฒนาปัญญาประดิษฐ์ช่วยในการรักษาผู้ป่วย และร่วมกับสถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง พัฒนาเทคโนโลยีการตรวจจับภาวะหัวใจหยุดเต้นเฉียบพลัน ที่สำคัญคือ เราเป็นที่ปรึกษาด้านงานวิจัยระดับโลก ที่ได้รับความเชื่อถือจากสถาบันโรคหัวใจนานาชาติจากสหรัฐอเมริกา, ยุโรป และญี่ปุ่น ให้รีวิวงานวิจัยและให้ความคิดเห็น โดยที่ผ่านมาหลายสถาบัน ต่างก็ให้ความสนใจมาศึกษาดูงาน และสร้างความร่วมมือต่อไปในอนาคต”
โรงพยาบาลสิรินธร ให้บริการฉีดวัคซีนโควิด-19 (Walk in) ศูนย์การค้าโรบินสันไลฟ์สไตล์ลาดกระบัง
โรงพยาบาลสิรินธร เปิดให้บริการฉีดวัคซีนโควิด-19 (Walk in) สำหรับประชาชนอายุ 12 ปีขึ้นไป Moderna (bivalent) 29 เมษายน - 12 พฤษภาคม 2566 10.00 - 14.00 น. ลานกิจกรรม หน้าลิฟต์แก้ว ชั้น 2 ศูนย์การค้าโรบินสันไลฟ์สไตล์ลาดกระบัง
สิ่งที่ต้องเตรียม ✅
1. บัตรประจำตัวประชาชนตัวจริงเท่านั้น
2. เอกสารรับรองการได้รับวัคซีนโควิด-19 (ถ้ามี)
หมายเหตุ
ต้องได้รับวัคซีนโควิด มาแล้วอย่างน้อย 2 เข็ม ฉีดเข็มที่ 3 ห่างจากเข็มที่ 2 อย่างน้อย 3 เดือน และเข็มที่ 4 ห่างจากเข็มที่ 3 อย่างน้อย 4 เดือน ทั้งที่ ผู้ที่เคยติดเชื้อไวรัสโคโรนา 2019 และเคยได้รับวัคซีนโควิด 19 มาแล้วอย่างน้อย 2 เข็ม แนะนำให้ฉีดวัคซีนหลังติดเชื้ออย่างน้อย 3 เดือน
สถาบันการแพทย์จักรีนฤบดินทร์ กิจกรรม "World No Tobacco Day 2024 วันงดสูบบุหรี่โลก"
สถาบันการแพทย์จักรีนฤบดินทร์ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี จัดกิจกรรม "World No Tobacco Day 2024 วันงดสูบบุหรี่โลก" เราจัดกันที่โรงพยาบาลรามาธิบดี (จ.กรุงเทพฯ) วันศุกร์ที่ 31 พฤษภาคม 2567 เวลา 08.00-12.00 น. ณ หอประชุมอารี วัลยะเสวี ชั้น 2 อาคารหลัก (อาคาร 1) [
ลงทะเบียนเข้าร่วมงาน]
ฟังการบรรยายพิเศษ จากผู้ทรงคุณวุฒิ บู้ทกิจกรรมเผยแพร่ความรู้ บุหรี่ไฟฟ้าผิดกฏหมาย พิษภัยจากบุหรี่ไฟฟ้า บู้ทให้คำปรึกษาเลิกบุหรี่ /บุหรี่ไฟฟ้า รวมสนุกตอบคำถามชิงรางวัลเกี่ยวกับอันตรายจากบุหรี่ไฟฟ้า
๒. กระบวนการชักประวัติเพื่อจ่ายยาในการดูแลอาการเจ็บป่วยเล็กน้อย เป็นมาตรฐานที่เภสัชกรให้การบริบาลต่อผู้ป่วยมาเป็นเวลานานมากกว่า ๗๐ ปี (ตั้งแต่ พ.ศ. ๒๔๗๙) และเป็นไปอย่างถูกต้องและชอบธรรม ตามพระราชบัญญัติยาและพระราชบัญญัติวิชาชีพเภสัชกรรม จนเป็นที่ยอมรับของประชาชนเป็นการทั่วไป ซึ่งเดิมประชาชนเป็นผู้จ่ายค่ายาเอง สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) เห็นประโยชน์ของการบริบาลทางเภสัชกรรมดังกล่าว จึงได้บรรจุเป็นหนึ่งในสิทธิประโยชน์ให้ประชาชนโดยใช้งบประมาณของ สปสช. ซึ่งงบประมาณดังกล่าวได้มาจากภาษีของประชาชน ในขณะที่ กรรมการแพทยสภาบางท่านได้มีการเผยแพร่ ข้อความผ่านสื่อสังคมออนไลน์ว่า "การฟ้องร้อง สปสช.และสภาเภสัชกรรมโดยแพทยสภา ไม่เกี่ยวกับการห้ามเภสัช จ่ายยา ตามบริบทเดิม แม้แต่น้อย" ซึ่งอาจตีความได้ว่า หากเป็นกรณีผู้ป่วยจ่ายเงินเอง แพทยสภาไม่ขัดข้อง แต่หาก สปสช. จ่ายค่าบริการแทนประชาชน ดังเช่นในโครงการฯนี้ แพทยสภากลับฟ้องร้องว่าไม่ปลอดภัย จึงทำให้มีข้อสังเกตว่า การฟ้องร้องดังกล่าว เป็นไปเพื่อความปลอดภัยของประชาชน มากน้อยเพียงไร
๓. สภาเภสัชกรรม ขอขอบพระคุณเพื่อนแพทย์ ที่ได้ให้กำลังใจเภสัชกรในฐานะ "ทีมสุขภาพ" ด้วยความเป็นมิตรและให้เกียรติซึ่งกันและกัน บนพื้นฐานของความเข้าใจในสภาพความเป็นจริงของสังคมไทยที่มีความเหลือมล้ำ ยังมีประชาชนจำนวนมากที่ไม่สามารถเข้าถึงบริการได้ โดยเฉพาะในอาการเจ็บป่วยเล็กน้อย ซึ่งเป็นความทุกข์ และบั่นทอนคุณภาพชีวิตของประชาชนผู้ด้อยโอกาส แต่เป็นการยากมากที่จะเข้าถึงแพทย์ และมีค่าใช้จ่ายสูงในการเดินทางเข้ารับบริการนี้ที่โรงพยาบาล ในขณะที่ต้องหาเข้ากินค่ำ
อาการเจ็บป่วยเล็กน้อยเหล่านี้ ไม่จำเป็นต้องผ่านการตรวจร่างกายหรือส่งตรวจทางห้อง แต่สามารถที่จะซักถามเพื่อประเมินอันตรายโดยเภสัชกรซึ่งเป็นผู้ที่ร่ำเรียนด้านยาในด้านต่าง ๆ จากหลักสูตรการศึกษา ๖ ปี ในคณะเภสัชศาสตร์ ทุกมหาวิทยาลัย ที่ได้รับการรับรองหลักสูตรจากสภาเภสัชกรรม และยังผ่านการอบรมในโครงการร้านยาคุณภาพอีกด้วย หากมีความเสี่ยงอันตรายที่จะเป็นโรคร้ายแรง เภสัชกรจะรีบส่งต่อไปให้ แพทย์ดูแลโดยด่วนตามมาตรฐานวิธีปฏิบัติงานที่กำหนด โดยหากมั่นใจว่าเป็นเพียงอาการเจ็บป่วยเล็กน้อย เภสัชกรจะเลือกสรรยาที่ใช้ในการบรรเทาอาการและดูแลอาการเจ็บป่วย อย่างเหมาะสม รวมทั้งทำการติดตามผลการใช้ยาเพื่อให้มั่นใจว่า ประชาชนที่ได้รับบริการตามโครงการฯนี้ สามารถกลับไปประกอบอาชีพ หาเลี้ยงครอบครัวได้ซึ่งเท่ากับเป็นการกลั่นกรองผู้ป่วย เพื่อลดภาระงานบริการ เพื่อให้แพทย์สามารถใช้เวลากับผู้ป่วยในโรคที่มีความซับช้อนมากขึ้นด้วย
การปลูกถ่ายหัวใจ จึงเป็นทางเลือกในการรักษาที่สำคัญสำหรับผู้ป่วยภาวะหัวใจล้มเหลวขั้นสุดท้าย เพราะเป็นการรักษาที่ตรงจุดและมีประสิทธิภาพสูง โดยการแทนที่หัวใจที่เสียหายด้วยหัวใจดวงใหม่จากผู้บริจาค ทำให้หัวใจสามารถทำงานได้เป็นปกติอีกครั้ง ส่งผลให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้นอย่างเห็นได้ชัด ทั้งนี้ การปลูกถ่ายหัวใจเป็นการผ่าตัดใหญ่และมีขั้นตอนที่ซับซ้อน โดยก่อนการผ่าตัด แพทย์จำเป็นต้องประเมินสภาพร่างกายและสภาพจิตใจของผู้ป่วยอย่างละเอียดเพื่อให้มั่นใจการผ่าตัดจะได้ผลลัพธ์ที่ดีที่สุด และหลังการผ่าตัด ผู้ป่วยจะต้องอยู่ที่โรงพยาบาลประมาณ 1-3 สัปดาห์ ซึ่งจะมีหน่วยดูแลผู้ป่วยโรคหัวใจขั้นวิกฤต ที่จะดูแลผู้ป่วยหลังการผ่าตัดปลูกถ่ายหัวใจอย่างใกล้ชิดตลอด 24 ชั่วโมง
Bike Zone Tri Sim 2021-2022 Series 4 สนาม LINK
ไตรซิม 2022 ในปีนี้เป็นการแข่งขันไตรกีฬาระยะสั้นๆ เต็มรูปแบบ โดยมีวัตถุประสงค์เพื่อทดสอบ พัฒนา และเตรียมความพร้อมสู่การแข่งขันไตรกีฬาที่ระยะไกลขึ้น รายการไบค์โซนไตรซิม 2021 ซีรี่ย์ มีระบบชิพไทม์มิ่ง ทำให้นักกีฬาได้บันทึกสถิติอย่างเป็นทางการตลอดทั้งปี และยังมีคะแนนสะสมแต่ละสนามสำหรับทุกคนที่เข้าเส้นชัยในเวลาที่กำหนด เพื่อลุ้นรับรางวัลปลายปี
ระยะของการแข่งขัน : ว่ายน้ำ 400 เมตร (ในสระว่ายน้ำขนาดมาตรฐานความยาว 50 เมตร จำนวน 4 รอบ) จักรยาน 20 km.(บนถนนเลาะคันคลอง 1 รอบ) วิ่ง 5km
สถานที่ : สระว่ายน้ำ อุบลรัตนราชกัญญา มหาวิทยาลัยแม่โจ้ จ.เชียงใหม่
ประเภท ชาย / หญิง : รุ่นการแข่งขัน ประเภทชาย 3 รางวัล ประเภทหญิง 3 รางวัล
สนามที่ 1 วันที่ 13 มีนาคม 2565
สนามที่ 2 วันที่ 8 พฤษภาคม 2565
สนามที่ 3 วันที่ 17 กรกฎาคม 2565
สนามที่ 4 วันที่ 11 กันยายน 2565
ICON LUMINAIRE เล่นกับแสง ได้ทั้งวันทั้งคืน
ICON LUMINAIRE An all-day illuminous mirror park วันที่ 1 พ.ย. 65 – 25 ธ.ค. 65 ณ ICONSIAM Park ชั้น 2
ICON LUMINAIRE เป็นปรากฏการณ์ครั้งใหญ่กับเทศกาลงานไฟที่โดดเด่นด้วยเทคนิคกระจกสะท้อนแสง ทำให้เล่นกับแสงได้ทั้งกลางวันและกลางคืน นั่นหมายถึง คุณสามารถมาเช็กอินเล่นกับไฟได้ตลอดวัน กับมุมถ่ายรูปที่อัดแน่น ทั่วพื้นที่ไอคอนสยาม พาร์ค จุดไฮไลต์ของงาน อาทิ งานศิลปะสุดพิเศษ CRUX Highlight Art Piece, CLOUD ISLANDS เมฆหลากสีสันสุดน่ารักที่มาพร้อมกับวิวโค้งน้ำที่สวยที่สุดของแม่น้ำเจ้าพระยา, CURVE มุม Art installation แบบครึ่งวงกลมที่สะท้อนความสดใสส่งท้ายปี, COSMIC TUNNEL (Kaleioscope) อุโมงค์ Infinity ที่พร้อมจะสะท้อนตัวตนของคุณในมิติใหม่ และอีกมากมาย
ค่าเข้าชม
บัตรราคาเริ่มต้นที่ ผู้ใหญ่ 250 บาท, เด็ก (สูงระหว่าง 90-110 ซม.) 150 บาท *เด็กส่วนสูงตํ่ากว่า 90 เซนติเมตร เข้าชมฟรี, กลุ่ม 5 คน 1,000 บาท และครอบครัว (ผู้ใหญ่ 2 คน เด็ก 2 คน) 700 บาท สามารถซื้อบัตรได้ที่บริเวณหน้างาน หรือซื้อออนไลน์ได้ที่ https://bit.ly/3FhYQen
เวลาเข้าชม
จันทร์ - ศุกร์ เปิดบริการเวลา 14:00 – 20:00 น. (เข้าชมรอบสุดท้าย เวลา 19:30 น.)
วันเสาร์ - อาทิตย์ เปิดบริการเวลา 11:00 – 21.00 น. (เข้าชมรอบสุดท้าย เวลา 20:30 น.)
ระยะที่ 2 เฉพาะ 2 กลุ่มก่อน
รู้เท่าทัน ว่าธนาคารไม่ส่งลิงค์ให้ลูกค้าทำอะไรแน่ๆ
เป็นนโยบายของทุกธนาคาร และองค์กรต่างๆ อยู่แล้ว ที่จะไม่ส่งลิงค์ หรือเอกสารแนบ ให้กับลูกค้าโดยไม่มีเหตุ หรือไม่ได้เป็นบุคคลในธนาคารหรือองค์กรโดยตรง ยิ่งเป็นการให้คลิกลิงค์ ดาวน์โหลดไฟล์ หรือกรอกข้อมูล ยิ่งไม่มี
ธุรกิจเด่นอันดับ 3 ธุรกิจด้าน Fintech และการชำระเงินฝากระบบเทคโนโลยี


ปัจจัยสนับสนุน
1. มีความหลากหลายทางธุรกรรมการเงิน เช่น การชำระค่าสินค้า การใช้จ่ายผ่านบัตรเดบิตและเครดิต การให้สินเชื่อผ่านระบบโมบายแบงก์กิ้งสำหรับการช็อปปิ้งออนไลน์ การให้กู้ยืมระหว่างกัน (peer-to-peer lending) หรือจะเป็นด้านการลงทุน
2. Mobile Technology : ซึ่งยังคงมีแนวโน้มการใช้งานเพิ่มขึ้น และจะยิ่งเชื่อมต่อทุกคนให้เข้าถึง Fintech
3. นโยบายการละเว้นค่าธรรมเนียมทางการเงิน การโอน การชำระเงิน ฯลฯ
4. การพัฒนาแหล่งการชำระเงินตามร้านค้าด้งเดิม ร้านค้าออนไลน์ ผู้ประกอบการ ที่มีการชำระผ่านระบบอิเล็กทรอนิกส์เพิ่มมากขึ้น
5. พฤติกรรมการชำระเงินด้วยอิเล็กทรอนิกส์มีเพิ่มขึ้น โดยเฉพาะคนรุ่นใหม่
6. รัฐบาลมีนโยบายส่งเสริมการทำธุรกรรมผ่านดิจิทัลมากขึ้น โดยเฉพาะการออกมาตรการช่วยเหลือจากการระบาดของโควิด-19 ผ่านแอปพลิเคชั่น "เป๋าตัง" และนโยบายกระตุ้นการบริโภคต่างๆ
ปัจจัยเสี่ยง
1. ความเชื่อมันของประชาชนต่อความปลอดภัยในการให้บริการผ่านแฟลตฟอร์มของธนาคาร
2. ภัยคุกคามทางไซเบอร์ (Hacker) ที่เพิ่มสูงขึ้นตามพัฒนาการเทคโนโลยี
3. ข่าวเรื่องความปลอดภัยในเรื่องของข้อมูล และอาชญากรรมทางด้านเทคโนโลยี เช่น มิจฉาชีพแอบอ้างเป็นธนาคารผู้ให้บริการเงินกู้แล้วหลอกลวงเงิน ผ่าน SMS ไลน์ เฟสบุ๊ก แอปเงินกู้ และโทรศัพท์
4. การปลอมแปลงหน้าตา application ของสถาบันการเงินต่างๆ
5. การหลอกลวงนำข้อมูลส่วนบุคคลไปใช้ในทางที่มิชอบ
สรุปผล
จากข้อมูลผลการประเมินการเข้าถึงบริการวัคซีนป้องกันโรคไข้หวัดใหญ่สำหรับกลุ่มผู้สูงอายุ 65 ปีขึ้นไป จะเห็นได้ว่ากลุ่มเป้าหมายส่วนใหญ่ที่เข้ารับบริการจะเป็นกลุ่มผู้สูงอายุในช่วงต้นที่สามารถช่วยเหลือช่วยเหลือตัวเองได้ ทำให้มีโอกาสเข้าถึงบริการได้มากกว่าช่วงอายุที่สูงวัยเพิ่มขึ้น ซึ่งพบว่าผู้สูงอายุส่วนใหญ่มีความประสงค์ในการเข้ารับ การฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ จากข้อมูลยังพบว่าผู้ที่ได้รับวัคซีนส่วนใหญ่รับบริการในโรงพยาบาลภาครัฐและ ไม่ได้เสียค่าใช้จ่ายในการเข้ารับการฉีดวัคซีนตรงนี้อาจจะส่งผลต่อการตัดสินใจเข้ารับบริการ แต่เนื่องด้วยข้อจำกัดของ กลุ่มเป้าหมายมีความประสงค์เข้ารับวัคซีนมากกว่าจำนวนวัคซีนป้องกันโรคไข้หวัดใหญ่ การสื่อสารกับกลุ่มเป้าหมาย ทำให้ไม่ทราบว่ามีการรณรงค์ฉีดวัคซีน และบางส่วนไม่มีเวลาหรือไม่ว่างที่จะสามารถเข้ารับบริการฉีดวัคซีนได้ ส่งผลให้กลุ่มเป้าหมายพลาดการได้รับวัคซีนป้องกันโรคไข้หวัดใหญ่ ดังนั้น ควรจัดหาวัคซีนเพิ่มเติม เพื่อเพิ่มโอกาส ให้ประชาชนกลุ่มเสี่ยงสามารถเข้าถึงบริการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ โดยการจัดระบบบริการวัคซีนประจำปี ให้รองรับการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่พร้อมกับวัคซีนโควิด 19 ได้อย่างครอบคลุมกลุ่มเป้าหมายมากที่สุด ในระยะถัดไป
๔. สภาเภสัชกรรมเห็นด้วยว่า ผู้ประกอบวิชาชีพทุกคนควรคำนึงถึงความปลอดภัยของประชาชนเป็นสำคัญ และขอให้แพทยสภาพิจารณาถึงประเด็นความปลอดภัยในการใช้ยาให้ครอบคลุมทั้งระบบ เพื่อให้ประชาชนมีความปลอดภัยในการใช้ยามากขึ้น โดยเฉพาะอย่างยิ่งในคลินิก ซึ่งส่วนใหญ่ยังพบว่า ฉลากยาไม่ระบุชื่อยา และรายละเอียดเกี่ยวกับยาที่จ่าย
ทำให้ไม่สามารถตรวจสอบและตรวจสอบย้อนกลับได้หากมีปัญหาการใช้ยา และไม่เป็นไปตาม ประกาศกระทรวงสาธารณสุข เรื่อง มาตรฐานการให้บริการของสถานพยาบาลเกี่ยวกับฉลากบรรจุยา พ.ศ. ๒๕๖๕ เพื่อการคุ้มครองผู้บริโภคอย่างแท้จริง อีกทั้งผู้ส่งมอบยาอาจเป็นผู้ที่มิได้มีความรู้เรื่องยา จึงขอให้ทางแพทยสภา พิจารณาการให้บริการในลักษณะดังกล่าวของคลินิกด้วย ทั้งนี้ เพื่อให้เกิดความปลอดภัยของ ประชาชนด้านยาและสุขภาพ และเป็นไปตามมาตรฐานสูงสุด
สภาเภสัชกรรม ขอขอบคุณ เภสัชกร ที่ร่วมการแสดงความเห็นอย่างสร้างสรรค์ รวมทั้ง หลายท่านยังเสนอแนวทางในการเพิ่มคุณภาพและความปลอดภัยจากการใช้ยาของประชาชน และขอขอบคุณเพื่อนแพทย์หลายท่าน ที่แสดงความปรารถนาดีต่อประชาชนอย่างจริงใจ ด้วยการอาสาที่จะช่วย เพิ่มพูนทักษะ ให้เภสัชกร ให้มีสมรรถนะ ในการคัดกรองและส่งต่อผู้ป่วยที่มีความเสี่ยงอย่างรวดเร็วขึ้น ตลอดจนการร่วมพัฒนาแนวปฏิบัติในการดูแลผู้ป่วยร่วมกันที่ชัดเจนระหว่างแพทย์และเภสัชกร
สภาเภสัชกรรม หวังเป็นอย่างยิ่งว่า แพทยสภา จะเปิดใจ
"หยุดและทบทวน" ตลอดจนร่วมแลกเปลี่ยนความคิด รับฟังความเห็นและความรู้สึกของประชาชน ร่วมกันสร้างความสามัคคีและการทำงานร่วมกันของภาคีสุขภาพ กระทรวงสาธารณสุข และสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) อย่างยั่งยืน
สุดท้ายนี้ สภาเภสัชกรรม พร้อมที่จะให้ความร่วมมือกับแพทยสภาในการหาทางออกที่เหมาะสม บนพื้นฐานความเข้าใจร่วมกัน
การให้เกียรติซึ่งกันและกัน ตามจรรยาบรรณในการประกอบวิชาชีพ เพื่อสร้างบรรยากาศที่ดีในการทำงานร่วมกันของวิชาชีพ โดยอยู่บนพื้นฐานที่สำคัญที่สุด คือ
ประโยชน์และความปลอดลอดภัยของประชาชน อย่างแท้จริง
สภาเภสัชกรรม
๒๑ พฤศจิกายน ๒๕๖๗
คลินิกพยาบาลชุมชนอบอุ่น จ.ร้อยเอ็ด
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 27086 |
สุพิศคลินิกการพยาบาลและการผดุงครรภ์ |
14/1 |
|
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0885603649 |
| 27095 |
นีรนุชคลินิกการพยาบาลและการผดุงครรภ์ |
130/1 |
|
เทอดไทย |
ทุ่งเขาหลวง |
ร้อยเอ็ด |
45170 |
0639825416 |
| 27096 |
พวงผกาคลินิกการพยาบาลและการผดุงครรภ์ |
94 |
|
เทอดไทย |
ทุ่งเขาหลวง |
ร้อยเอ็ด |
45170 |
0885614797 |
| 27101 |
นิยม-บุญคลินิกการพยาบาลและการผดุงครรภ์ |
50 |
|
บึงนคร |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0935580006 |
| 27102 |
นวลฉวีคลินิกการพยาบาลและการผดุงครรภ์ |
321 |
แจ้งสนิท |
นิเวศน์ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0910567953 |
| 27103 |
สุจิตราคลินิกการพยาบาลและการผดุงครรภ์ |
192 |
|
หนองไผ่ |
ธวัชบุรี |
ร้อยเอ็ด |
45190 |
0933213112 |
| 27112 |
ผดุงรักษ์คลินิกการพยาบาลและการผดุงครรภ์ |
133 |
|
โนนสวรรค์ |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0872383747 |
| 27116 |
วิไลวรรณคลินิกการพยาบาลและการผดุงครรภ์ |
50 |
|
โนนสง่า |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0918297579 |
| 27137 |
กรรณิกาคลินิกการพยาบาลและการผดุงครรภ์ |
91 |
|
เชียงใหม่ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0819659353 |
| 27142 |
สวรรค์พรคลินิกการพยาบาลและการผดุงครรภ์ |
42 |
|
หนองใหญ่ |
โพนทอง |
ร้อยเอ็ด |
45110 |
0955673440 |
| 27149 |
สุนีระนุชคลินิกการพยาบาลและการผดุงครรภ์ |
189 |
|
โพธิ์ทอง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0819741682 |
| 27154 |
วีรวรรณคลินิกการพยาบาลและการผดุงครรภ์ |
200 |
|
โคกสูง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0872452548 |
| 27160 |
พรวิไลคลินิกการพยาบาลและการผดุงครรภ์ |
252 |
|
คำนาดี |
โพนทอง |
ร้อยเอ็ด |
45110 |
0963529646 |
| 27165 |
คลินิกการพยาบาลและการผดุงครรภ์ประภาพร |
118 |
|
เมยวดี |
เมยวดี |
ร้อยเอ็ด |
45250 |
0623289859 |
| 27166 |
ไพรินทร์คลินิกการพยาบาลและการผดุงครรภ์ |
99 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0958092290 |
| 27168 |
สายสุมนต์คลินิกการพยาบาลและการผดุงครรภ์ |
6 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0894468996 |
| 27226 |
ปิยนุชคลินิกการพยาบาลและการผดุงครรภ์ |
54 |
ปัทมานนท์ |
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0826974693 |
| 27258 |
สดศรีคลินิกการพยาบาลและการผดุงครรภ์ |
96 |
|
บ่อพันขัน |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0833271903 |
| 27276 |
สวาสดิ์คลินิกการพยาบาลและการผดุงครรภ์ |
164 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0817693988 |
| 27327 |
สุภาพคลินิกการพยาบาลและการผดุงครรภ์ |
11 |
|
บ้านแจ้ง |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0801784520 |
| 27329 |
คลินิกการพยาบาลและการผดุงครรภ์จำเนียร |
189 |
|
บ้านแจ้ง |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0862252716 |
| 41812 |
สุดาคลินิกการพยาบาลและการผดุงครรภ์ |
281 |
|
รอบเมือง |
หนองพอก |
ร้อยเอ็ด |
45210 |
0815464269 |
| 42988 |
จ๋ารักหล่อคลินิกการพยาบาลและการผดุงครรภ์ |
19 |
|
ขวาว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
|
| 43197 |
นิรมลคลินิกการพยาบาลและการผดุงครรภ์ |
9 |
|
บุ่งเลิศ |
เมยวดี |
ร้อยเอ็ด |
45250 |
0857420440 |
| 43243 |
เบญจภรณ์คลินิกการพยาบาลและการผดุงครรภ์ |
283 |
|
โคกล่าม |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0800208029 |
| 43285 |
สายใจคลินิกการพยาบาลและการผดุงครรภ์ |
44 |
|
ภูเขาทอง |
หนองพอก |
ร้อยเอ็ด |
45210 |
0859228454 |
| 43298 |
คลินิกการพยาบาลและการผดุงครรภ์สุพรรณี |
213 |
|
ยางใหญ่ |
จังหาร |
ร้อยเอ็ด |
45000 |
0866319993 |
| 43325 |
คัทลียาคลินิกการพยาบาลและการผดุงครรภ์ |
22 |
|
ภูเขาทอง |
หนองพอก |
ร้อยเอ็ด |
45210 |
0826459416 |
| 43483 |
วิจิตราคลินิกการพยาบาลและการผดุงครรภ์ |
148 |
|
ดงแดง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
088 5614401 |
| 43514 |
อารยาคลินิกการพยาบาลและการผดุงครรภ์ |
390 |
|
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0868611819 |
| 43665 |
หมายแหม่มคลินิกการพยาบาลและการผดุงครรภ์ |
45 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0821153897 |
| 43666 |
บ้านสุขภาพคลินิกการพยาบาลและการผดุงครรภ์ |
168 |
ชมสะอาด -โพนทอง |
เมยวดี |
เมยวดี |
ร้อยเอ็ด |
45250 |
0973196428 |
| 43740 |
ศุภิศาคลินิกการพยาบาลและการผดุงครรภ์ |
222 |
|
ชมสะอาด |
เมยวดี |
ร้อยเอ็ด |
45250 |
0658983941 |
| 43751 |
มณฑิราคลินิกการพยาบาลและการผดุงครรภ์ |
20 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0968101734 |
| 43841 |
นิตยาคลินิกการพยาบาลและการผดุงครรภ์ |
146 |
|
หนองหมื่นถ่าน |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
|
| 43961 |
บังอรคลินิกการพยาบาลและการผดุงครรภ์ |
145 |
|
กกโพธิ์ |
หนองพอก |
ร้อยเอ็ด |
45210 |
0945420279 |
| 43968 |
คลินิกการพยาบาลและการผดุงครรภ์มณีวรรณ |
79 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0895692577 |
| 43993 |
ปฐมาภรณ์คลินิกการพยาบาลและการผดุงครรภ์ |
19 |
|
คำพอุง |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0885714082 |
| 44008 |
บัวลมคลินิกการพยาบาลและการผดุงครรภ์ |
241 |
|
หนองใหญ่ |
โพนทอง |
ร้อยเอ็ด |
45110 |
0940600745 |
| 44031 |
ฐิติชญาน์คลินิกการพยาบาลและการผดุงครรภ์ |
224 |
|
ขอนแก่น |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0621168897 |
| 44082 |
วิชชากรคลินิกการพยาบาลและการผดุงครรภ์ |
147 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0635163675 |
| 44117 |
รัตนาพรคลินิกการพยาบาลและการผดุงครรภ์ |
81 ซอย บ้านเหล่าลิง |
|
บ้านดู่ |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0994549246 |
| 44133 |
กรรณิกาคลินิกการพยาบาลและการผดุงครรภ์ |
52 |
|
พระเจ้า |
เชียงขวัญ |
ร้อยเอ็ด |
45000 |
0899441189 |
| 44145 |
อ้อม คลินิกการพยาบาลและการผดุงครรภ์ |
104 |
|
บุ่งเลิศ |
เมยวดี |
ร้อยเอ็ด |
45250 |
0903387148 |
| 44146 |
วิไลลักษณ์คลินิกการพยาบาลและการผดุงครรภ์ |
250 |
|
หนองแก้ว |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0945307385 |
| 44148 |
ไมตรีคลินิกการพยาบาลและการผดุงครรภ์ |
45 |
|
ชมสะอาด |
เมยวดี |
ร้อยเอ็ด |
45250 |
0625645942 |
| 44155 |
เพียงเพ็ญคลินิกการพยาบาลและการผดุงครรภ์ |
67 |
|
ชมสะอาด |
เมยวดี |
ร้อยเอ็ด |
45250 |
0922797197 |
| 44172 |
ชมัยพรคลินิกการพยาบาลและการผดุงครรภ์ |
168 |
|
หนองขุ่นใหญ่ |
หนองพอก |
ร้อยเอ็ด |
45210 |
0836777166 |
| 44183 |
สาครคลินิกการพยาบาลเเละการผดุงครรภ์ |
95 |
|
ขี้เหล็ก |
ปทุมรัตต์ |
ร้อยเอ็ด |
45250 |
0973135360 |
| 44202 |
สมจิตรคลินิกการพยาบาลและการผดุงครรภ์ |
186 |
|
ขอนแก่น |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45250 |
0873128414 |
| 44235 |
นาบุญคลินิกการพยาบาลและการผดุงครรภ์ |
10 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0894468996 |
| 44239 |
วัลย์ลิยาคลินิกการพยาบาลและการผดุงครรภ์ |
123 |
|
ช้างเผือก |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0878553750 |
| 44245 |
แป่งแหม่มคลินิกการพยาบาลและการผดุงครรภ์ |
125 |
|
สระนกแก้ว |
โพนทอง |
ร้อยเอ็ด |
45110 |
0932287414 |
| 44258 |
วุฒิชัยคลินิกการพยาบาลและการผดุงครรภ์ |
106 |
|
เมืองหงส์ |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0622678987 |
| 44259 |
โพนทองคลินิกการพยาบาลและการผดุงครรภ์ |
32/2 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0899397600 , 0936962599 |
| 44260 |
มัชฌิมาคลินิกการพยาบาลและการผดุงครรภ์ |
193 |
|
หนองผือ |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0934499015 |
| 44287 |
ประยงค์คลินิกการพยาบาลและการผดุงครรภ์ |
168 |
|
โคกสูง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0810486866 |
| 44315 |
สุรีภรณ์คลินิกการพยาบาลและการผดุงครรภ์ |
260 |
|
หนองขุ่นใหญ่ |
หนองพอก |
ร้อยเอ็ด |
45210 |
0833431948 |
| 44316 |
สุรีภรณ์คลินิกการพยาบาลและการผดุงครรภ์ สาขา 2 |
177 |
|
โคกกกม่วง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0833431948 |
| 44335 |
วิไลวรรณคลินิกการพยาบาลและการผดุงครรภ์ |
162 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0903715260 |
คลินิกพยาบาลชุมชนอบอุ่น จ.ร้อยเอ็ด
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 44367 |
รัตนาคลินิกการพยาบาลและการผดุงครรภ์ |
149/2 |
|
เมยวดี |
เมยวดี |
ร้อยเอ็ด |
45250 |
0910566545 |
| 44368 |
ธิดาวรรณคลินิกการพยาบาลและการผดุงครรภ์ |
157 |
|
นาอุดม |
โพนทอง |
ร้อยเอ็ด |
45110 |
0833380167 |
| 44413 |
ภิริสาคลินิกการพยาบาลและการผดุงครรภ์ |
127 |
|
เด่นราษฎร์ |
หนองฮี |
ร้อยเอ็ด |
45140 |
0885631329 |
| 44415 |
รัชนีคลินิกการพยาบาลและผดุงครรภ์ |
86 |
|
หนองฮี |
หนองฮี |
ร้อยเอ็ด |
45140 |
0818714104 |
| 44417 |
คลินิกการพยาบาลและการผดุงครรภ์อบอุ่น |
360 |
|
รอบเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0899419687 |
| 44465 |
หมวยเกิ้งคลินิกการพยาบาลและการผดุงครรภ์ |
125 |
|
สระนกแก้ว |
โพนทอง |
ร้อยเอ็ด |
45110 |
0877710695 |
| 44486 |
พิกุลคลินิกการพยาบาลและการผดุงครรภ์ |
51 |
|
โพนเมือง |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0857615740 |
| 44489 |
บ้านเหล่าคลินิกการพยาบาลและการผดุงครรภ์ |
132 |
|
ผาน้ำย้อย |
หนองพอก |
ร้อยเอ็ด |
45210 |
0910566545 |
| 44490 |
รัตนาคลินิกการพยาบาลและการผดุงครรภ์ |
124 |
|
รอบเมือง |
หนองพอก |
ร้อยเอ็ด |
45210 |
0910584952 |
| 44498 |
ยุพินคลินิกการพยาบาลและการผดุงครรภ์ |
16 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0980965924 |
| 44503 |
สมลักษณ์คลินิกการพยาบาลและการผดุงครรภ์ |
442 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0817394885 |
| 44508 |
คลินิกการพยาบาลและการผดุงครรภ์พรรณี ศิริอมรพรรณ |
89/1 |
|
เหล่าหลวง |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0910619124 |
| 44528 |
บุญดำรงคลินิก คลินิกการพยาบาลและการผดุงครรภ์ |
117 |
|
เชียงขวัญ |
เชียงขวัญ |
ร้อยเอ็ด |
45000 |
0805989966 |
| 44532 |
สุพิชฌาย์คลินิกการพยาบาลและการผดุงครรภ์ |
189 |
|
ชุมพร |
เมยวดี |
ร้อยเอ็ด |
45250 |
0862197092 |
| 44548 |
ยุวธิดาคลินิกการพยาบาลและการผดุงครรภ์ |
159 |
|
โนนตาล |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0848969169 |
| 44550 |
บ้านเดื่อคลินิกการพยาบาลและการผดุงครรภ์ |
15 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0855426228 |
| 44557 |
ปทุมรัตต์คลินิกการพยาบาลและการผดุงครรภ์ |
132 |
|
บัวแดง |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0981029188 |
| 44558 |
คลินิกการพยาบาลและการผดุงครรภ์พันทิพย์ |
308 |
|
เชียงใหม่ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
08574917556 |
| 44560 |
สุภาพรคลินิกการพยาบาลและการผดุงครรภ์ |
89 |
|
หนองตาไก้ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0815455842 |
| 44562 |
แอนหนึ่งคลินิกการพยาบาลและการผดุงครรภ์ |
228 |
|
จังหาร |
จังหาร |
ร้อยเอ็ด |
45000 |
0816616679 |
| 44566 |
ลภัสรดาคลินิกการพยาบาลและการผดุงครรภ์ |
177 |
|
คำพอุง |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0972894544 |
| 44567 |
นันท์นลินคลินิกการพยาบาลและการผดุงครรภ์ |
66 |
|
บัวคำ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0933287438 |
| 44568 |
รจนาคลินิกการพยาบาลและการผดุงครรภ์ |
26 หมู่9 |
|
บ้านดู่ |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0939694478,0825917081 |
| 44577 |
ยุรันทร์คลินิกการพยาบาลและการผดุงครรภ์ |
145 |
|
เชียงใหม่ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0987845308 |
| 44606 |
สำราญคลินิกการพยาบาลและการผดุงครรภ์ |
217 |
|
ดงแดง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0812618598 |
| 44623 |
ประภาพรคลินิกการพยาบาลและการผดุงครรภ์ |
224 |
|
น้ำคำ |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0857585424 |
| 44633 |
เมืองแวงคลินิกการพยาบาลและการผดุงครรภ์ |
276 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0958092290 |
| 44661 |
ภาวดีคลินิกการพยาบาลและการผดุงครรภ์ |
23 |
|
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0945416377 |
| 44663 |
ลำใยคลินิกการพยาบาลและการผดุงครรภ์ |
101 |
|
สระบัว |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0810491130 |
| 44707 |
ทัศณีย์คลินิกการพยาบาลและการผดุงครรภ์ |
53 |
|
หนองตาไก้ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0868610200 |
| 44710 |
อนุธิดาคลินิกการพยาบาลและการผดุงครรภ์ |
5 |
|
ดงครั่งใหญ่ |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0973106680 |
| 44712 |
ยุทธพงษ์คลินิกการพยาบาลและการผดุงครรภ์ |
147 |
|
บุ่งเลิศ |
เมยวดี |
ร้อยเอ็ด |
45250 |
0652390765 |
| 44759 |
อุ่นใจคลินิกการพยาบาลและการผดุงครรภ์ |
55 |
|
เชียงขวัญ |
เชียงขวัญ |
ร้อยเอ็ด |
45000 |
0654625466 |
| 44777 |
ศิริรักษ์คลินิกการพยาบาลและการผดุงครรภ์ |
112 |
|
โนนชัยศรี |
โพนทอง |
ร้อยเอ็ด |
45110 |
0883111436 |
| 44780 |
ปัญญ์สุขคลินิกการพยาบาลและการผดุงครรภ์ |
165 |
|
หนองแก้ว |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0620379877 |
| 44805 |
ลักษณาวดีคลินิกการพยาบาลและการผดุงครรภ์ |
204 |
|
อาจสามารถ |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0872242879 |
| 44813 |
สุจิตราคลินิกการพยาบาลและการผดุงครรภ์ |
134 |
|
หน่อม |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0655899070 |
| 44826 |
คลินิกการพยาบาลและการผดุงครรภ์บุษบง |
175 |
|
หนองผือ |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0987139175 |
| 44845 |
โฮมแคร์คลินิกการพยาบาลและการผดุงครรภ์ |
176 |
|
สะอาดสมบูรณ์ |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0624949453 |
| 44889 |
เฉลิมวุฒิคลินิกการพยาบาลและการผดุงครรภ์ |
149 |
|
โคกสูง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0853035080 |
| 44967 |
สิรวิชญ์คลินิกการพยาบาลและการผดุงครรภ์ |
171 |
|
โพนทราย |
โพนทราย |
ร้อยเอ็ด |
45240 |
0862184522 |
| 44970 |
บ้านบึงงามคลินิกการพยาบาลและการผดุงครรภ์ |
22 |
|
บึงงาม |
หนองพอก |
ร้อยเอ็ด |
45210 |
0634167035 |
| 44972 |
เมืองโพธิ์ชัยคลินิกการพยาบาลและการผดุงครรภ์ |
113 |
|
ขามเปี้ย |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0885714082 |
| 44980 |
ชมพูคลินิกการพยาบาลและการผดุงครรภ์ |
170 |
|
หนองแวง |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0816699565 |
| 45023 |
รัชฎาภรณ์คลินิกการพยาบาลและการผดุงครรภ์ |
38 |
|
โพธิ์ศรี |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0986250722 |
| 45048 |
สุภาพรรณคลินิกการพยาบาลและการผดุงครรภ์ |
208 |
|
โนนชัยศรี |
โพนทอง |
ร้อยเอ็ด |
45110 |
0650914245 |
| 45071 |
อ้อย&ต๋อยคลินิกการพยาบาลและการผดุงครรภ์ |
152 |
|
สีแก้ว |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0895770437 |
| 45073 |
บุษดีคลินิกการพยาบาลและการผดุงครรภ์ |
96 |
|
ดู่น้อย |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0872153358 |
| 45075 |
จิตสุดาคลินิกการพยาบาลและการผดุงครรภ์ |
108 |
|
สวนจิก |
ศรีสมเด็จ |
ร้อยเอ็ด |
45000 |
0649744642 |
| 45078 |
เกศินีคลินิกการพยาบาลและการผดุงครรภ์ |
144 |
|
นาแซง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0995864264 |
| 45080 |
นรินทร์คลินิกการพยาบาลและการผดุงครรภ์ |
312 |
|
ดงลาน |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0655254941 |
| 45082 |
บ้านพยาบาลคลินิกการพยาบาลและการผดุงครรภ์ |
235/10 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0810508625 |
| 45093 |
อุ่นใจคลินิกการพยาบาลและการผดุงครรภ์ |
146 |
|
น้ำใส |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0843372768 |
| 45115 |
ทัศนีย์คลินิกการพยาบาลและการผดุงครรภ์ |
117 |
|
บึงเกลือ |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0933202846 |
| 45143 |
นนทรัตน์คลินิกการพยาบาลเเละการผดุงครรภ์ |
101 |
|
ภูเงิน |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0992939869 |
| 45148 |
สุวรรณีคลินิกการพยาบาลและการผดุงครรภ์ |
179/1 |
แจ้งสนิท |
กลาง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0815446743 |
| 45151 |
พิรินดาคลินิกการพยาบาลและการผดุงครรภ์ |
85 |
|
หนองแวง |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0916981061 |
| 45162 |
อรุณรัตน์คลินิกการพยาบาลและการผดุงครรภ์ |
158 |
|
เชียงใหม่ |
โพธิ์ชัย |
ร้อยเอ็ด |
45230 |
0985979351 |
| 45171 |
สุวคนธ์คลินิกการพยาบาลและการผดุงครรภ์ |
109 |
|
มะอึ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0651123569 |
| 45172 |
ศิริรักษ์คลินิกการพยาบาลและการผดุงครรภ์ |
52 |
|
คูเมือง |
เมืองสรวง |
ร้อยเอ็ด |
45220 |
0812626789 |
| 45176 |
ศิวาพรคลินิกการพยาบาลและการผดุงครรภ์ |
84 |
|
หนองหิน |
เมืองสรวง |
ร้อยเอ็ด |
45220 |
0959202193 |
| 45200 |
ศรัณยพรคลินิกการพยาบาลและการผดุงครรภ์ |
|
|
ธวัชบุรี |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0875049099 |
| 45335 |
ธนิดาคลินิกการพยาบาลและการผดุงครรภ์ |
116 |
|
ดอกไม้ |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0804211424 |
| 27124 |
สุกัลยาคลินิกการพยาบาลและการผดุงครรภ์ |
93 |
|
กุดน้ำใส |
พนมไพร |
ร้อยเอ็ด |
45140 |
0923891192 |
คลินิกเวชกรรมชุมชนอบอุ่น จ.ร้อยเอ็ด
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 27178 |
คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์ หมอบุญยงค์ |
7/7 |
เปรมประชาราษฎร์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043515381 |
| 27187 |
หมอวันชัยคลินิกเฉพาะทางด้านเวชกรรมสูติศาสตร์และนรีเวชวิทยา |
48 |
สุริยะเดชบำรุง |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0896234546 |
| 27208 |
คลินิกเวชกรรมหมอศักดา สาขา 2 |
225 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043031024 |
| 27233 |
คลินิกเวชกรรมหมอชัชวาลย์ |
78/1-3 |
สุนทรเทพ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0862311334 |
| 27241 |
คลินิกเวชกรรมหมอชิตเขต สาขา 2 |
342/9 ซอย 18 |
เทวาภิบาล |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0899446885 |
| 27333 |
คลินิกเวชกรรมหมอชิตเขต |
298 |
รณชัยชาญยุทธ |
อาจสามารถ |
อาจสามารถ |
ร้อยเอ็ด |
45160 |
0899446885 |
| 42557 |
สหคลินิกบ้านคุณหมอร้อยเอ็ด |
90/7 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0645523228 |
| 45099 |
คลินิกเวชกรรมนายแพทย์ธนพล |
166 |
|
หนองผือ |
เมืองสรวง |
ร้อยเอ็ด |
45220 |
0812841765 |
| 45141 |
คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์หมอฐมฤกษ์ |
58/2-4 |
สันติสุข |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0947899566 |
| 45145 |
คลินิกเฉพาะทางด้านเวชกรรมออร์โธปิดิกส์ นพ.คณภัท |
209 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
099-494-4996 |
| 45194 |
คลินิกเวชกรรมแพทย์หญิงแวววลี |
364 |
|
นิเวศน์ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0843232923 |
| 45307 |
คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์โรคระบบทางเดินอาหารหมออลงกรณ์ |
25/56-57 |
มีโชคชัย |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0653926553 |
คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 44419 |
เซ็นทรัลแล็บ101คลินิกเทคนิคการแพทย์ |
41/2 |
ปัทมานนท์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0885603475 |
| 45118 |
ธีรารัตน์คลินิกแล็บ คลินิกเทคนิคการแพทย์ |
450/2 |
หน้าโรงพยาบาล |
เกษตรวิสัย |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0963519918 |
คลินิกทันตกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 18500 |
คลินิกทันตกรรมรักษ์ฟัน |
210 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0885622559 |
| 27162 |
คลินิกทันตกรรม เยาวพาทันตแพทย์ |
416/1 |
|
แวง |
โพนทอง |
ร้อยเอ็ด |
45110 |
0902594569 |
| 27198 |
คลินิกทันตกรรมลดาวรรณทันตแพทย์ |
27/1 |
ศรีเทวา |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0866426791 |
| 27199 |
คลินิกทันตกรรมห้าแยกสายน้ำผึ้ง |
30/4 |
มีโชคชัย |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0831503434 |
| 27219 |
คลินิกทันตกรรมทันตแพทย์สันติภาพ |
448-450-452 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0819740974 |
| 27221 |
คลินิกทันตกรรมบ้านหมอฟัน |
6/13 |
เพลินจิต |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
043518159 |
| 27228 |
คลินิกทันตกรรม หมอธีระ-หมอนิรมล |
253/12 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0818717271 |
| 27273 |
คลินิกทันตกรรม หมอปรัชชิญา |
423 |
ประสานเมือง |
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0927167499 |
| 43309 |
คลินิกทันตกรรมบ้านรักษ์ยิ้ม |
384/2 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0814916419 |
| 43324 |
คลินิกทันตกรรมมิดไนท์ |
55/32 |
ศรีเทวา |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0845147833 |
| 43327 |
คลินิกทันตกรรมครอบครัวฟันดี |
52/8 |
เปรมประชาราษฎร์ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0926639090 |
| 43332 |
คลินิกทันตกรรมหมอฟันพนมไพร |
34 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0872265722 |
| 43334 |
คลินิกทันตกรรมไวท์เฮ้าส์ |
56 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0994698642 |
| 43335 |
คลินิกทันตกรรมบ้านฟันสวย |
293/5 ซอย 4 |
เทวาภิบาล |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0892775241 |
| 43341 |
คลินิกทันตกรรมบ้านรักฟัน |
52 |
|
เกาะแก้ว |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0910659895 |
| 43419 |
คลินิกทันตกรรม หมออนวัช-หมอภาวีรัตน์ |
2/10 |
เทวาภิบาล |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0897134359 |
| 43788 |
คลินิกทันตกรรมหยาดฝน ฟ.ฟัน |
568 |
ปัทมานนท์ |
หัวช้าง |
จตุรพักตรพิมาน |
ร้อยเอ็ด |
45180 |
0931532422 |
| 43792 |
คลินิกทันตกรรมบ้านพันไมล์ |
192 |
|
สระคู |
สุวรรณภูมิ |
ร้อยเอ็ด |
45130 |
0857048579 |
| 44854 |
คลินิกทันตกรรมมายเด้นท์ |
176 |
|
หนองผือ |
เมืองสรวง |
ร้อยเอ็ด |
45220 |
0936359696 |
| 45092 |
คลินิกทันตกรรมสไมล์ |
18-20 |
ราชการดำเนิน |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
084-5120821 |
| 45102 |
คลินิกทันตกรรมทันตแพทย์หญิงวรรณนภา |
19 |
|
สระนกแก้ว |
โพนทอง |
ร้อยเอ็ด |
45110 |
0872276449 |
| 45107 |
คลินิกทันตกรรมประภัสสร |
400/1 |
|
บัวแดง |
ปทุมรัตต์ |
ร้อยเอ็ด |
45190 |
0813457206 |
| 45113 |
คลินิกทันตกรรม บ้าน ฟ.ฟัน |
3/5 |
กองพลสิบ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0835995425 |
| 45129 |
คลินิกทันตกรรมไอไบรท์ |
44-46 |
สุนทรเทพ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0817278808 |
| 45132 |
เกษตรวิสัยคลินิกทันตกรรม |
78/3 |
ปัทมานนท์ |
เกษตรวิสัย |
เกษตรวิสัย |
ร้อยเอ็ด |
45150 |
0898627782 |
| 45136 |
นฤพรคลินิกทันตกรรม |
450 |
|
พนมไพร |
พนมไพร |
ร้อยเอ็ด |
45140 |
0971578542 |
| 45137 |
คลินิกทันตกรรมมอร์ฟัน |
88 |
ศรีเทวา |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0913195692 |
| 45144 |
คลินิกทันตกรรม ซี-สไมล์ |
207 |
ผดุงพานิช |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0651516993 |
| 45178 |
คลินิกทันตกรรมทันตแพทย์สุรศักดิ์ |
348/1 |
|
ขวัญเมือง |
เสลภูมิ |
ร้อยเอ็ด |
45120 |
0619389491 |
| 45206 |
คลินิกทันตกรรมกู๊ดจ๊อบ |
160 |
|
ปาฝา |
จังหาร |
ร้อยเอ็ด |
45000 |
062-2490985 |
| 42557 |
สหคลินิกบ้านคุณหมอร้อยเอ็ด |
90/7 |
รณชัยชาญยุทธ |
ในเมือง |
เมืองร้อยเอ็ด |
ร้อยเอ็ด |
45000 |
0645523228 |
คลินิกการแพทย์แผนไทยชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 45086 |
หมอภูมิณรงค์สหคลินิก(การแพทย์แผนไทยและการแพทย์แผนไทยประยุกต์) |
373 |
|
นิเวศน์ |
ธวัชบุรี |
ร้อยเอ็ด |
45170 |
0646498787 |
ลานต้นคริสต์มาสภูเรือ
"ลานต้นคริสต์มาสภูเรือ" จุดท่องเที่ยวยอดฮิตในช่วงฤดูหนาว ของจ.เลย ปกติจะเริ่มเปิดให้ชมช่วงปลายเดือนพฤศจิกายน แต่ปีนี้ยังไม่ประกาศชัดเจน โปรดติดตามข้อมูล หรือสอบถามที่ว่าการอำเภอภูเรือ โทร. 042899123
ต้องไม่คลิกลิงค์ หรือคลิกเปิดเอกสารแนบเด็ดขาด
ย้ำเตือนอีกครั้งว่า ห้าม คลิกลิงค์ หรือคลิกเปิดเอกสารแนบเด็ดขาด อย่าสนใจหรือพยายามรู้ว่าจะเป็นอย่างไรหากคลิกหรือเปิดไฟล์นั้น เพราะเมื่อนั้น อาจสายไปจนแก้ไขอะไรไม่ได้ และยังไง ก็ไม่มีทางรู้อยู่ดี
ธุรกิจเด่นอันดับ 3 ธุรกิจงานคอนเสิร์ต มหกรรมจัดแสดงสินค้า งาน Event
ปัจจัยสนับสนุน
1. หลังการเปิดประเทศ ทำให้งานคอนเสิร์ตมหกรรมจัดแสดงสินค้า, Event สินค้าและช่วยฟื้นฟูธุรกิจ MICE กระเตื้องขึ้น โดยได้แรงหนุนจากภาคการท่องเที่ยวที่เริ่มกลับมาคึกคัก
2.การเพิ่มขึ้นของช่องทางในการสื่อสาร โดยเฉพาะช่องทางออนไลน์ ที่สามารถรับชมได้ตลอด 24 ชม.
3. ภาครัฐสนับสนุนการจัดนิทรรศการและงานแสดงสินค้าสามารถดึงเม็ดเงินจากนักธุรกิจต่างชาติและเป็นเครื่องมือที่สำคัญที่จะฟื้นฟูและกระตุ้นเศรษฐกิจในประเทศ
4. ผู้บริโภคมีความต้องการในการเข้าร่วมกิจกรรมต่างๆ หลังจากไม่สามารถเข้าร่วมกิจกรรมต่างๆ ได้มากในช่วงที่ผ่านมา
ปัจจัยเสี่ยง
1. การจัดประชุม (Meeting) แบบออนไลน์ในช่วง 3 ปีที่ผ่านมา ทำให้หลายหน่วยงานหลายธุรกิจ งานนิทรรศการ รวมถึงงานแสดงสินค้าหันมาใช้กันอย่างแพร่หลายเพราะต้นทุนต่ำและมีประสิทธิภาพค่อนข้างสูง
2. ต้นทุนด้านพลังงานสูงขึ้น ส่งผลให้ต้นทุนการดำเนินงานด้านต่างๆ เพิ่มขึ้น
3. ความไม่แน่นอนเรื่องของสถานการณ์โควิด-19
4. ภวะเศรษฐกิจที่ยังไม่ฟื้นตัวอย่างชัดเจน ยังคงมีความเสี่ยงในหลายด้าน
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ทันตกรรม โรงพยาบาลหนองคาย
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ทันตกรรม โรงพยาบาลหนองคาย
เปฺิดให้บริการ วันจันทร์ - วันพฤหัสบดี 16.30 น. - 20.30 น.
วันเสาร์ 08.30 น. - 12.30 น.
งดวันหยุดนักขัตฤกษ์ สามารถสอบถามข้อมูลเพิ่มเติม หรือ จองคิวตรวจ สายตรงทันตกรรม รพ.หนองคาย
โทร 061-0290404 หรือ 042413456 ต่อ 119
คลินิกอายุรกรรม LINK
สถานที่ตั้ง ชั้น 1 อาคารดุลโสภาคย์
เปิดให้บริการ
- วันจันทร์-วันศุกร์ เวลา 16.00-20.00 น.
- วันเสาร์-วันอาทิตย์ เวลา 08.00-12.00 น.
- E-mail : tuhopdmed1@gmail.com (ลงทะเบียนรับยาทางไปรษณีย์)
หน้าที่และเป้าหมาย
ให้การบริการสุขภาพแก่ผู้ป่วยอายุรกรรมอย่างมีคุณภาพ มีความปลอดภัยและมีประสิทธิภาพ ตามมาตรฐานวิชาชีพ อย่างเป็นองค์รวม โดยคำนึงถึงความต้องการของผู้รับบริการทั้ง ด้านร่างกาย จิตใจ อารมณ์และจิตวิญญาณ การให้บริการครอบคลุมทั้งด้านการรักษาส่งเสริม ป้องกัน และฟื้นฟูสภาพหรือให้ผู้รับบริการสามารถดูแลตนเองและใช้ชีวิตอยู่ในสังคมได้อย่างมีความสุข
ขอบเขตการให้บริการ
ดูแลให้การรักษาพยาบาลแก่ผู้ป่วยอายุรกรรมที่มีอายุตั้งแต่ 15 ปีขึ้นไป โดยให้บริการทั้งคลินิกอายุรกรรมทั่วไปและคลินิกเฉพาะโรค ยกเว้นผู้ป่วยที่อยู่ในภาวะวิกฤต ดังนี้ คลินิกโรคทางเดินหายใจ คลินิกโรคหัวใจและหลอดเลือด คลินิกโรคไต คลินิกโรคเบาหวานต่อมไร้ท่อและเมตาโบลิซึม คลินิกโลหิตวิทยา คลินิกประสาทวิทยา คลินิกโรคผิวหนัง คลินิกโรคข้อและรูมาติซั่ม คลินิกทางเดินอาหารและตับ คลินิกโพทูลินัมท็อกซินทางระบบประสาท คลินิกโรคลมชัก คลินิกธาลัสซีเมีย คลินิกโภชนาการ คลินิกมะเร็ง คลินิกกระดูกพรุน คลินิกปอดอุดกั้นเรื้อรัง คลินิกเคมีบำบัด คลินิกโรคติดเชื้อ คลินิกโรคหลอดเลือดหัวใจที่รักษาผ่านสายสวน
คลินิกศัลยกรรมระบบทางเดินปัสสาวะ LINK
สถานที่ตั้ง ชั้น 2 อาคารดุลโสภาคย์
เปิดให้บริการ
- วันจันทร์-วันพฤหัสบดี เวลา 15.00-19.00 น.
- วันเสาร์ เวลา 08.00-11.00 น.
หน้าที่และเป้าหมาย
ให้บริการตรวจรักษาพยาบาลผู้ป่วยนอกทุกเพศ ทุกวัย ทางด้านศัลยกรรมระบบทางเดินปัสสาวะ อย่างถูกต้อง ปลอดภัยตามมาตรฐานวิชาชีพโดยคำนึงถึงความปลอดภัยของผู้ใช้บริการเป็นสำคัญ
ขอบเขตการให้บริการ
- ผู้รับบริการที่มีปัญหาเกี่ยวกับระบบทางเดินปัสสาวะที่ไม่มีภาวะฉุกเฉิน
- ผู้รับบริการเพศชายที่ต้องการปรึกษาเรื่องการทำหมันหรือแก้หมัน
Service Excellence Transformation วิถีแห่งบำรุงราษฎร์ (Bumrungrad Way)


ในขณะเดียวกัน เมื่อเราได้มีการ Transform operation process ที่ดีแล้ว ทางโรงพยาบาลบำรุงราษฎร์เอง ก็ได้มีพัฒนาในเรื่องของ การให้บริบาลให้มีประสิทธิภาพที่ดียิ่งขึ้น เพื่อเป็นการเสริมสร้างประสบการณ์ในการดูแลสุขภาพที่เหนือความคาดหมายแก่ผู้ป่วยและครอบครัว โดยทางเราได้มีการนำเครื่องมือที่ชื่อว่า วิถีแห่งบำรุงราษฎร์ (Bumrungrad Way) มาใช้ เป็นแนวปฏิบัติของบุคลากรในการบริบาลผู้ป่วยของทุกแผนก ทุก patient touch point ซึ่งเป็นแบบฉบับของบำรุงราษฎร์เอง และทางเราได้มีการปรับให้สอดคล้อง ตามยุคสมัย ตามขนบธรรมเนียม จารีตประเพณี ที่แตกต่างกันในผู้ป่วยแต่ละคน เพราะผู้ป่วยของเราเดินทางมาจากทั่วทุกมุมโลก และต้องการการดูแลแบบ personalized ซึ่ง Bumrungrad Way นี้เป็นแนวปฏิบัติที่ยึดผู้ป่วยเป็นศูนย์กลาง นำไปสู่การให้บริบาลด้วยความเท่าเทียม และเอื้ออาทร นอกจากนั้น เรายังได้เสาะหาและนำเทคโนโลยีใหม่ ๆ เช่น เทคโนโลยี AI เข้ามาปรับใช้เพื่อยกระดับการบริบาลของเราให้มีประสิทธิภาพยิ่งขึ้น เพื่อที่จะทำให้ผู้ป่วยของเราเกิดความประทับใจ และส่งต่อเรื่องราวดี ๆ ไปยังบุคคลรอบตัว โดยทั้งหมดที่กล่าวมานี้ นับเป็นการสร้างความเชื่อมั่นที่ดีที่สุดของ โรงพยาบาลบำรุงราษฎร์
เช็คกับต้นทาง
หากสงสัย ไม่แน่ใจ กรณีอาจสับสนว่าเคยติดต่อธนาคาร หรือองค์กรใดไว้หรือไม่ ให้ตรวจสอบไปยังหน่วยงานนั้นโดยตรงทันทีที่ทำได้
ใจสู้หรือเปล่า อย่าได้ถามกัน มันเกินร้อย ไปนานแล้ว เป็นกำลังใจให้กันนะคะ
น้องๆ ฝึกการทำแผลเบื้องต้น นอกจากจะวิ่งแล้วยังมีมุมต้อนรับน้องๆด้วย สนุกมากๆไม่ยอมกลับกันเลยทีเดียว
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตจตุจักร
Executive Lake View
ห้องพักส่วนตัว ในบรรยากาศผ่อนคลาย ด้วยวิวทะเลสาบและสวนป่าเบญจกิติ ที่ครอบคลุมพื้นที่ถึง 320 ไร่
พื้นที่ห้อง 37.25 ตรม.
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- ตู้เย็น
- ไมโครเวฟ
- ทีวี
- อุปกรณ์ในห้องน้ำ
- ตู้เซฟ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 6,000 บาท
- ค่าอาหาร 1,200 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 600 บาท
รวม 11,000 บาท
บริการผู้ป่วยนอก ผู้ป่วยใหม่ ตารางแพทย์ออกตรวจ LINK
บริการผู้ป่วยนอก ผู้ป่วยใหม่
กรอกประวัติทำเวชระเบียนที่ แผนกเวชระเบียนและตรวจสอบสิทธิ์ ชั้น 1 อาคารผู้ป่วยนอก ผู้ป่วยเก่านัด
ผู้ป่วยเก่าไม่ได้นัด
ศูนย์โทรศัพท์
02-4600000,
02-8766120 - 29
02-475-2995
แผนกเวชระเบียนผู้ป่วย 02-475-2951
นอกเวลาราชการ 02-475-2796
Aloft Bangkok Sukhumvit 11 managed by Marriott International launches Alternative State Quarantine (ASQ) in partnership with Bangpakok 9 International Hospital with package rates starting from THB 49,500
ผังพื้น (Floor Plan) พร้อมราคา อาคาร A-C LINK
อาคาร A1-A2
ราคา 1,820,000 - 2,800,000
อาคาร B1-B3
ราคา 1,820,000 - 2,999,999
อาคาร C1-C2
ราคา 1,820,000 - 2,800,000
ประเด็นที่ว่าไม่ต้องใช้ใบส่งตัวนั้น หมายถึงกรณีเคสแอดมิทเท่านั้น
เคสส่งตัวเพื่อเจอหมอเฉพาะทางหรือส่งไป รพ. ที่มีความพร้อมมากกว่านั้น ยังต้องใช้ใบส่งตัวเหมือนเดิมจ้า
3. คำว่ารักษาทุกที่หมายถึงรักษาได้ใน เครือข่ายหน่วยบริการชุมชนอบอุ่น ทุกที่ภายในเขตตัวเอง
คำสั่งห้ามเคลื่อนย้ายแรงงานต่างด้าวเข้า-ออกพื้นที่ สมุทรสาคร
คำสั่งจังหวัดสมุทรสาคร ห้ามเคลื่อนย้ายแรงงานต่างด้าวเข้า-ออกพื้นที่จังหวัดสมุทรสาคร เพื่อควบคุมการแพร่ระบาดของโรคโควิด-19 ตั้งแต่ 18 ธ.ค. นี้
ประกาศจังหวัดนครปฐม ควบคุมการจัดกิจกรรมที่มีคนมาก
ประกาศศูนย์ปฏิบัติการโควิด-19 จังหวัดนครปฐม ฉบับที่ ๘๕/๒๕๖๓ เรื่อง การปฏิบัติตามมาตราการป้องกัน ควบคุมการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019(COVID-19) ในการจัดกิจกรรมที่มีการรวมคนจำนวนมาก ในท้องที่จังหวัดนครปฐม
4. ตรวจแล็บกลุ่มเสี่ยงวัณโรค
การคัดกรองและวินิจฉัยวัณโรคด้วยการตรวจเอกซเรย์ปอดในทุกกลุ่มเสี่ยง และการตรวจทางห้องปฏิบัติการด้วยวิธี Molecular assay ได้แก่ Real-time PCR (Exprt MTB/RIF), Real-time PCR MTB/MDR, TB-LAMP, LPA โดยกลุ่มเสี่ยงวัณโรค ได้แก่ ผู้สัมผัสวัณโรค ผู้ต้องขัง ผู้ติดเชื้อเอชไอวี ผู้ป่วยโรคเรื้อรัง และผู้สูงอายุ จำนวน 1.098 ล้านราย คาดว่าจะใช้งบประมาณทั้งสิ้น 725 ล้านบาท
จามยังไงให้ไม่แพร่เชื้อ
จามยังไงให้ไม่แพร่เชื้อ
มือของคุณอาจเป็นตัวการแพร่เชื้อไวรัสโคโรนา 19!
"อย่าใช้แค่มือปิดปาก เวลาไอจาม!"
- มือคุณคือพาหะนำโรค
- ควรใช้ทิชชูปิดปากเวลาไอจาม
- ถ้าไม่มีทิชชูใช้ข้อศอกแทน
- ไอจามแล้วต้องรีบล้างมือ
5. ผู้ป่วยมะเร็ง "รักษาได้ทุกที่" ไม่ต้องใช้ใบส่งตัว (Cancer Anywhere) LINK
ผู้ป่วยมะเร็ง "รักษาได้ทุกที่" ไม่ต้องใช้ใบส่งตัว (Cancer Anywhere)
เริ่ม 1 ม.ค. 64 เป็นต้นไป
หลักเกณฑ์ เงื่อนไขการเข้ารับบริการ
- ผู้ป่วยสิทธิหลักประกันสุขภาพถ้วนหน้า (UC)
- ได้รับการวินิจฉัยว่าเป็นมะเร็ง (ผู้ป่วยใหม่และผู้ป่วยเก่า)
- ครอบคลุมทุกวิธีการรักษา เช่น ผ่าตัด เคมีบำบัด รังสีรักษา ฮอร์โมน
- รักษาจนครบ Course ในโรงพยาบาลที่เริ่มรักษา
- ครอบคลุมการตรวจติดตามหลังการรักษา (Follow up)
เอกสารที่ควรเตรียมก่อนมาโรงพยาบาล
เพื่อความสะดวกรวดเร็วในการรับบริการ
- บัตรประจำตัวประชาชน
- ประวัติการรักษา
- ผลการตรวจทางห้องปฏิบัติการ
- รายงานผลทางรังสีวินิจฉัย
- รายงานผลทางพยาธิวิทยา
- ผลชิ้นเนื้อพร้อมสไลด์บล็อก
- ผลชิ้นเนื้อไขกระดูก
นอกจากนี้ ยังมีคำแนะนำ ระยะเวลาของการฉีดวัคซีน ในช่วงวัคซีนขาดแคลน
บริษัท AstraZineca / Oxford หรือ AZ สามารถขยายเวลาให้เข็มที่ 2 ได้ยาวกว่าที่ทางบริษัทกำหนด โดยเฉพาะตัวของ AstraZineca ซึ่งกำลังจะมีใช้ในประเทศไทยเร็วๆ นี้ คือ สามารถให้รอเข็มที่ 2 ได้นานถึง 12 สัปดาห์ หรือ 3 เดือน
ทั้งนี้ การฉีดวัคซีนเข็มแรก คือ การทำให้ร่างกายเห็นแอนติเจนเป้าหมายครั้งแรก ในที่นี้คือโปรตีนสไปค์ของไวรัสโรคโควิด-19 ร่างกายจะเริ่มสร้างแอนติบอดีต่อแอนติเจนนั้น โดยเซลล์ที่เรียกว่า B cell หรือเม็ดเลือดขาว แต่ B cell ของเราจะสร้างแอนติบอดี้ได้ปริมาณไม่มาก ประสิทธิภาพในการทำงานไม่ดี และที่สำคัญจะอยู่กับเราไม่นาน หรือ ภูมิตกไว
แต่ถ้าร่างกายได้รับเข็มที่สอง หรือ การ boost B cell จะถูกกระตุ้นซ้ำทำให้สร้างแอนติบอดีออกมามากขึ้น ที่สำคัญความสามารถในการจับกับแอนติเจน หรือตัวไวรัส จะแน่นขึ้นอย่างมีนัยสำคัญ ระดับ 100-1000 เท่า จากข้อมูลจากการทดสอบทางคลินิคระยะที่ 3 ที่บ่งชี้ว่า ถ้าเว้นระยะห่างนานขึ้นประสิทธิภาพของวัคซีนในการกระตุ้นแอนติบอดีหลังฉีดเข็มสองจะดีขึ้น
รู้จัก 4 วัคซีนดัง ก่อนฉีดป้องกันโควิด-19
แต่มีรายงานเบื้องต้นว่า วัคซีนโควิด-19 ไม่ปลอดภัยสำหรับผู้ที่มีสภาวะภูมิแพ้, บุคคลที่ได้รับการรักษาด้วยยาต้านการแข็งตัวของเลือด ไม่ควรได้รับวัคซีน, ผู้ที่มีภูมิคุ้มกันบกพร่องรวมถึงบุคคลที่ได้รับการบำบัดด้วยภูมิคุ้มกัน อาจมีการตอบสนองของภูมิคุ้มกันต่อวัคซีนลดลง
รวมทั้ง ผู้ที่ใช้ยากดภูมิคุ้ม, วัคซีนไม่ปลอดภัยสำหรับหญิงตั้งครรภ์ เพราะมีความเสี่ยงที่อาจเกิดขึ้นกับแม่และทารกในครรภ์, วัคซีนไม่ปลอดภัยสำหรับผู้ที่วางแผนจะตั้งครรภ์ภายในไม่กี่เดือนหลังจากได้รับวัคซีน, ผู้ได้รับวัคซีนจะไม่สามารถให้นมบุตรได้
เรื่องและภาพ
จาก TNN Thailand
6/1/2564
รพ.พระปกเกล้า ย้ายที่รับบริจาคโลหิตชั่วคราว ไปยังอาคารศูนย์การค้าชุมชนองค์การบริหารส่วนจังหวัด (ตรงข้ามจวนผู้ว่าจันทบุรี) LINK
ย้ายที่รับบริจาคโลหิต ไปยังที่รับบริจาคโลหิตชั่วคราว จากรพ.พระปกเกล้า ไปยังอาคารศูนย์การค้าชุมชนองค์การบริหารส่วนจังหวัดตรงข้ามจวนผู้ว่าราชการจังหวัด ติดกับจุดบริการทำพาสปอร์ต
เริ่มทำการ 11 ม.ค.2564 ตั้งแต่เวลา
08.30-15.30น. จนสถานการณ์ Covid-19 จะคลี่คลาย
โทรสอบถาม 039 319 616
ตอนนี้สถานการณ์เลือดสำรองเข้าสู่ภาวะวิกฤติหนักมาก การใช้ปริมาณใกล้เคียงเดิม แต่ผู้บริจาคโลหิตน้อยลงมากๆๆ วันละ10-20 ราย ได้เลือดประมาณ 10-12ถุง
ใครว่าง ใครพร้อม ใครปลอดภัย มานะ
ปล.บริจาคเลือดไม่ได้ ช่วยเคาะประตูบ้านบอกต่อก็ได้นะครับ
ศูนย์รับบริจาคเลือดศิริราช LINK
หน่วยรับบริจาคเลือดประจำเดือน มกราคม 2564
ศูนย์รับบริจาคเลือดศิริราช อาคารนวมินทรบพิตร ๘๔ พรรษา ชั้น 3
ห้องรับบริจาคเลือด : เปิดทำการทุกวัน ตั้งแต่เวลา 08.30 - 16.00 น
ติดต่อสอบถาม 02-414-0100 หรือ 02-414-0102 (ในเวลาราชการ)
ห้องรับบริจาคเกล็ดเลือด : เปิดให้บริการ จันทร์ - ศุกร์และวันอาทิตย์ ยกเว้นวันเสาร์และวันหยุดนักขัตฤกษ์ ตั้งแต่เวลา 08.30 - 14.00 น
ติดต่อสอบถาม 02-414-0104 (ในวันและเวลาทำการ)
ธนาคารกรุงศรีอยุธยา
ธนาคารกรุงศรีฯ
แจ้งเปลี่ยนแปลงเวลาทำการสาขาและสำนักงานแลกเปลี่ยนเงินตราต่างประเทศ เป็นการชั่วคราว
เนื่องจากสถานการณ์ COVID-19 ธนาคารกรุงศรีฯ จึงขอแจ้งแปลี่ยนแปลงเวลาทำการสาขา
และสำนักงานแลกเปลี่ยนเงินตราต่างประเทศ ที่เปิดเกินกว่า 18.00 น.
จะปิดเวลา 18.00 น. ตั้งแต่วันที่ 5 มกราคม 2564 เป็นต้นไป
(จนกว่าจะมีประกาศเปลี่ยนแปลง)
ทั้งนี้ลูกค้าสามารถใช้บริการได้ผ่านช่องทาง ดังนี้
- ตู้ ATM
- Krungsri Online/Krung Biz Online
- KMA
- ตัวแทนธนาคาร (Bankin Agent)
- โทร 1572
คนกลุ่ม C ได้รับการกักตัวเฝ้าระวังต่อไป
4. ดูระยะเวลา ตรวจโควิดก่อนเดินทาง ให้ชัดเจน
4. ดูระยะเวลา ตรวจโควิดก่อนเดินทาง ให้ชัดเจน
เพราะมีความสำคัญมาก ว่าต้องการผลตรวจภายในเวลา กี่วัน หรือ กี่ชั่วโมง และ นับจากที่ใด - ประเทศต้น ประเทศทางผ่าน หรือ ประเทศปลายทาง
โครงการดังกล่าวช่วยนำร่องให้กับโรงพยาบาลทีสนใจเป็นจำนวนมากติดต่อเข้ามาขอรับการสนับสนุน แต่ด้วยทุนมีจำกัดการขอรับบริจาคค่อยข้างล่าช้าต้องใช้เวลา 1 ปีจึงปิดโครงการได้ ส่วนโรงพยาบาลที่สนใจก็ขอให้ช่วยระดมทุนร่วมกับโรงพยาบาลและชุมชนในพื้นที่โดยเฉพาะโรงพยาบาลบ้านตาก จ.ตาก ติดต่อครูบาอาจารย์ให้ช่วยระดมทุนเป้าหมายจะติดตั้งขนาด 137 กิโลวัตต์ และทางโรงเรียนศรีแสงธรรม โดยพระครูวิมลปัญญาคุณก็ช่วยประชาสัมพันธ์ และช่วยบริจาคร่วมด้วย พร้อมกับพานักเรียนทีมงานช่างขอข้าวไปติดตั้งให้
ศ.เกียรติคุณ พญ.สมศรี เผ่าสวัสดิ์ นายกแพทยสภา
ในนามของแพทยสภา และแพทย์กว่า 7 หมื่นราย เห็นด้วยเป็นอย่างยิ่ง เนื่องจากภาวะแทรกซ้อนนี้ ยังไม่เป็นที่แน่ชัด จึงเห็นด้วยอย่างยิ่งในการชะลอไว้ก่อน เพราะทุกท่านที่เกี่ยวข้องในที่นี่ได้กลั่นกรองมาแล้วอย่างดี เห็นด้วยเป็นอย่างยิ่ง
กัญชง-กัญชาที่ผลิตในประเทศ...ส่วนไหนเป็น-ไม่เป็นยาเสพติด ตามประกาศ สธ. เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ. 2563
3 หมอรู้จักคุณ กรมสนับสนุนบริการสุขภาพ
แอปพลิเคชัน 3 หมอรู้จักคุณ ระบบการรับบริการทางการแพทย์และสาธารณสุขผ่านสมาร์ทโฟนสำหรับกลุ่มผู้ใช้ภาคประชาชน
แอปพลิเคชัน 3 หมอรู้จักคุณ ระบบการรับบริการทางการแพทย์และสาธารณสุขผ่านสมาร์ทโฟนสำหรับกลุ่มผู้ใช้ภาคประชาชน พัฒนาคุณภาพชีวิตที่ดีของประชาชนและเจ้าหน้าที่ให้มีร่วมกัน เน้นการดูแลรักษาสุขภาพตนเอง แสดงข้อมูลการแพทย์ พร้อมข่าวสารจากคลินิกหมอครอบครัว
"กรมสนับสนุนบริการสุขภาพ" ซึ่งเป็นนักพัฒนาได้ระบุว่าแนวปฏิบัติด้านความเป็นส่วนตัวของแอพอาจรวมถึงการจัดการข้อมูลตามที่อธิบายไว้ด้านล่าง ข้อมูลนี้ยังไม่ได้รับการตรวจสอบยืนยันจาก Apple สำหรับข้อมูลเพิ่มเติม ให้ดูที่ นโยบายความเป็นส่วนตัวของนักพัฒนา
ภูเก็ต เทศกาล ลากูน่า ภูเก็ต รีไวฟ์ 555 เฟสติวัล 31 มีนาคม - 18 เมษายน 2564
เทศกาล "ลากูน่า ภูเก็ต รีไวฟ์ 555 เฟสติวัล" (Laguna Phuket Revive 555 Festival) โดยมีกิจกรรมมากมายทั้งสปอร์ตอีเวนต์ การแสดงดนตรี พบกับศิลปินชั้นนำอย่าง ก้อง สหรัถ, ดา เอ็นโดรฟิน, เยสเซอร์เดย์, ป๊อบ ปองกูล, ลาบานูน, กอล์ฟ เอฟ ฮีโร่, ไทยเทเนียม, ไอซ์ ศรัณยู และ อินสติงค์ พร้อมด้วยกิจกรรมส่งเสริมวัฒนธรรม และกิจกรรมของชุมชนตลอด 3 สัปดาห์ รวมถึงเทศกาลยอดนิยมของคนไทยอย่างเทศกาลสงกรานต์ เพื่อดึงดูดนักท่องเที่ยวไทยและชาวต่างชาติที่ทำงานและพำนักในไทยมาเยี่ยมเยือนและเห็นถึงความสวยงามของจังหวัดภูเก็ต เริ่มตั้งแต่วันที่ 31 มีนาคม - 18 เมษายน 2564
สระแก้ว - มาจาก 17 จว. รายงานตัว LINK
18 เมย 64 ผู้ว่าฯ สระแก้ว ออกคำสั่งคุมเขัมมาตรการเฝ้าระวังป้องกันและควบคุมการแพร่ระบาดCOVID-19
ข้อ 11 การเฝ้าระวังผู้ที่เดินทางเข้ามาในจังหวัดสระแก้วซึ่งเดินทางมาจากจังหวัด #พื้นที่ควบคุมสูงสุด รวม 17 จังหวัด ได้แก่ กรุงเทพมหานคร จังหวัดขอนแก่น จังหวัดชลบุรี จังหวัดเชียงใหม่ จังหวัดตาก จังหวัดนครปฐม จังหวัดนครราชสีมา จังหวัดนนทบุรี จังหวัดปทุมธานี จังหวัดประจวบคีรีขันธ์ จังหวัดภูเก็ต จังหวัดระยอง จังหวัดสงขลา จังหวัดสมุทรปราการ จังหวัดสมุทรสาคร จังหวัดสุพรรณบุรี และจังหวัดอุดรธานี ให้ปฏิบัติดังนี้
(1) ให้รายงานตัวต่อเจ้าพนักงานควบคุมโรคติดต่อในพื้นที่ (นายอำเภอ ปลัดอำเภอ สาธารณสุขอำเภอ ผู้อำนวยการโรงพยาบาลส่งเสริมสุขภาพตำบล ปลัดเทศบาล ปลัดองค์การบริหารส่วนตำบล กำนัน ผู้ใหญ่บ้าน แพทย์ประจำตำบล สารวัตรกำนัน ผู้ช่วยผู้ใหญ่บ้าน) ทันทีที่เดินทางมาถึง
(2) กรณีพักที่โรงแรมหรือที่พักเอกชนหรือสถานที่อื่นที่มีลักษณะคล้ายกัน ให้เจ้าของ ผู้จัดการสถานที่จัดทำทะเบียนบันทึกรายการต่าง ๆ ของผู้เข้าพัก แล้วแจ้งต่อนายอำเภอท้องที่เพื่อรายงานคณะกรรมการโรคติดต่อจังหวัดสระแก้ว
(3) จะต้องปฏิบัติตามมาตรการป้องกันโรคโควิด-19 และเฝ้าระวังสังเกตตนเอง หากมีอาการไข้ ไอ มีน้ำมูก เจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่รับรส ให้ไปพบแพทย์ทันที
(4) ให้ผู้ที่รับรายงานตัวตาม (1) แจ้งสาธารณสุขอำเภอทันที
- ขอให้ผู้ที่มีความประสงค์จะมารับบริการตรวจคัดกรองและ Swab Covid-19 ทำแบบประเมินและนัดคิวล่วงหน้าตามแบบฟอร์มนี้ https://formfaca.de/sm/a9xJQUKtq
- หรือมาทำที่จุดคัดกรอง คลินิกไข้หวัด (ARI clinic) ก่อนรับบริการได้
สายด่วนโควิด โรงพยาบาลในจังหวัดสระแก้ว
- รพ.สมเด็จพระยุพราชสระแก้ว โทร 081-982-4747
- รพ.คลองหาด โทร 086-836-3826
- รพ.ตาพระยา โทร 096-915-1922
- รพ.วังน้ำเย็น โทร 082-970-3122
- รพ.วัฒนานคร โทร 084-362-9988
- รพ.อรัญประเทศ 066-114-2876
- รพ.เขาฉกรรจ์ โทร 092-279-9878
- รพ.โคกสูง โทร 098-958-9463
- รพ.วังสมบูรณ์ โทร 080-633-5492
หลักการแพร่กระจ่ายของเชื้อโควิด-19 LINK
การตะโกน ไอ หรือจาม อาจทำให้สารคัดหลั่งที่ปนเปื้อนเชื้อเกิดฝอยละอองที่มีอนุภาคเล็กกว่า 5 ไมครอน ทำให้เชื้อล่องลอยอยู่ในอากาศได้นานในที่อับ และกระจายได้ไกลกว่า 2 เมตร ถ้าไม่ใส่หน้ากากอนามัยส่วนการพูดคุยสารคัดหลั่งที่ปนเปื้อนเชื้อมักจะมีอนุภาคขนาดใหญ่กว่า 10 ไมครอน และตกลงพื้นอย่างรวดเร็วที่ระยะไม่เกิน 1 เมตร
ระยะวลาของเชื้อโควิด-19 ที่อยู่ตามสถานที่หรือสิ่งของต่างๆ
– สถานที่ที่มีอุณหภูมิต่ำมาก เช่น 0 องศา เชื้ออยู่ได้นาน 30 วัน
– วัสดุที่เป็นพลาสติก เชื้ออยู่ได้นาน 3-4 วัน
– แก้วน้ำ เชื้ออยู่ได้นาน 2 วัน
– สถานที่ปิด ระบายอากาศไม่ดี เชื้ออาจล่องลอยในอากาศได้นาน 3 ชม.
ข้อแนะนำควรเว้นระยะห่าง ยิ่งห่างยิ่งดี
– สถานที่ปิด (ห้องปิดที่ใช้เครื่องปรับอากาศ) ห่างกันอย่างน้อย 2 เมตร (พื้นที่อย่างน้อย 4 ตารางแมตรต่อ 1 คน)
– สถานที่เปิดที่เป็นอากาศธรรมชาติ (open air) ห่างกันอย่างน้อย 1 เมตร (พื้นที่อย่างน้อย 1 ตารางเมตรต่อ 1 คน)
ข้อมูล ณ วันที่ 4 มกราคม 2564
ที่มา : รศ(พิเศษ) นพ.กำพล สุวรรณพิมลกุล
อวยพรจากสถานฑูต
Very beatiful tote bag ประกอบไปด้วยมาม่า หน้ากากอนามัย เจลล้างมือและกระดาษทิชชู่ และ คำอวยพรจากสถานเอกอัครราชทูต ณ กรุงออสโล "ขอให้สุขภาพแข็งแรง ด้วยรักและห่วงใย"
Hemoperfusion
Hemoperfusion หนึ่งในเครื่องมือจากการบริจาคของประชาชนผ่านโครงการก้าวคนละก้าว
*ภาพจากเพจ รพ.นครพิงค์
4.กรณีมีสิทธิ์รักษาที่รพ.ราชบุรี และเสี่ยงสูง
ให้ติดต่อทางโทร 032-719-600 พร้อมแจ้งความเสี่ยงของท่าน
22 เมย 64
รายงาน
วันนี้พบผู้ป่วย 1,470 ราย
มาจากการตรวจที่รพ.1,370 ราย
ค้นหาเชิงรุก 100 ราย
1.รักษาตัวในรพ.14,555 ราย รักษาตัวในรพ.สนาม 3,593 ราย อาการหนัก 320 ราย ใส่ท่อใช้หายใจ 80 ราย
2.ความคืบหน้าในการฉีดวัคซีนตั้งแต่ 28 ก.พ.- 21 เม.ษ.64
สะสม 864,840 โดส (เพิ่มจากเมื่อวาน 152,230 โดส)
2.1 กรุงเทพมหานคร มีการฉีดวัคซีนสะสม 184,647 โดส (เพิ่มจากเมื่อวาน 14,455 โดส)
3.การรายงานผู้ติดเชื้อแต่ละจังหวัด
3.1 กทม. + 446 ราย สะสม 4,775 ราย
3.2 เชียงใหม่ +99 ราย สะสม 2,597 ราย
3.3 ชลบุรี +87 ราย สะสม 1,540 ราย
3.4 นนทบุรี +118 ราย สะสม 911 ราย
3.5 ประจวบคีรีขันธ์ +37 ราย สะสม 897 ราย
3.6 สมุทรปราการ +39 ราย สะสม 826 ราย
3.7 สมุทรสาคร +30 ราย สะสม 496 ราย
3.8 นราธิวาส + 23 ราย สะสม 441 ราย
3.9 ปทุมธานี + 31 ราย สะสม 369 ราย
3.10 สงขลา +42 ราย สะสม 348 ราย
3.11 ระยอง +18 ราย สะสม 308 ราย
3.12 นครปฐม +21 ราย สะสม 291 ราย
3.13 สุราษฎร์ธานี +42 ราย สะสม 272 ราย
3.14 เพชรบุรี +21 ราย สะสม 253 ราย
3.15 สุโขทัย + 9 ราย สะสม 33 ราย
3.16 ภูเก็ต +9ราย สะสม 251 ราย
3.17 ราชบุรี +21 ราย สะสม 141 ราย
3.18 นครศรีธรรมราช +21 ราย สะสม 100 ราย
3.19 หนองคาย + 5 ราย สะสม 29 ราย
3.20 พังงา + 5 ราย สะสม 28 ราย
3.21 เพชรบูรณ์ +1 ราย สะสม 40 ราย
3.22 กำแพงเพชร +1 ราย สะสม 36 ราย
3.23 แม่ฮ่องสอน +1 ราย สะสม 31 ราย
3.24 นครสวรรค์ +29 ราย สะสม 166 ราย
3.25 จันทบุรี +7 ราย สะสม 73 ราย
3.26 พิษณุโลก +10 ราย สะสม 191 ราย
3.27 ระนอง +8 ราย สะสม 19 ราย
3.28 ชัยภูมิ +12 ราย สะสม 46 ราย
3.29 อยุธยา +25 ราย สะสม 217 ราย
3.30 อุบลราชนี +12 ราย สะสม 151 ราย
3.31 กาฬสินธุ์ +2 ราย สะสม 35 ราย
3.32 สุรินทร์ +3 ราย สะสม 47 ราย
3.33 เชียงราย +16 ราย สะสม 211 ราย
3.34 ร้อยเอ็ด +10 ราย สะสม 53 ราย
3.35 นครพนม +7 ราย สะสม 61 ราย
3.36 ศรีสะเกษ +15 ราย สะสม 84 ราย
3.37 ตาก +3 ราย สะสม 55 ราย
3.38 มุกดาหาร +2 ราย สะสม 11 ราย
3.39 ยะลา +3 ราย สะสม 13 ราย
3.40 นครนายก +4 ราย สะสม 35 ราย
3.41 ตรัง +5 ราย สะสม 24 ราย
3.42 เลย +3 ราย สะสม 23 ราย
3.43 กาญจนบุรี +6 ราย สะสม 62 ราย
3.44 บุรีรัมย์ +5 ราย สะสม 67 ราย
3.45 ลพบุรี +5 ราย สะสม 75 ราย
ณัฐพล โพธิ์คำ
ยะลา ประกาศ 12 เมย 64 LINK
ประกาศบังคับใช้มาตรการสวมหน้ากากอนามัย ทุกครั้งเมื่อออกนอกเคหสถาน ผู้ใดฝ่าฝืนมีความผิด ระวางโทษ ถูกจับปรับไม่เกิน 20,000 บาท #Saveyala
ฟังก์ชั่นใช้งานใน "หมอพร้อม v.2"
ในหมอพร้อม เวอร์ชั่น 2 นี้ มีฟังก์ชั่นสำคัญ 12 ฟังก์ชั่น ที่สำคัญในการรับการฉีดวัคซีน
- เมื่อเพิ่มแล้ว จึงลงทะเบียน (กดรับเงื่อนไขต่างๆ ไป) ต้องกรอกข้อมูลบัตรประชาชนและเบอร์โทรศัพท์ แต่หากไม่มีข้อมูลในระบบให้กรอกข้อมูลส่วนตัว ลงไปให้ครบ แล้วกดบันทึก
- ลงทะเบียนแทนคนอื่นได้ เช่น ลงให้พ่อแม่ ผู้สูงอายุ คนในครอบครัว ฯลฯ วิธีการ ให้กดเลือกเพิ่มบุคคลอื่น และระบุความสัมพันธ์ จากนั้นกรอกข้อมูลบัตรประชาชนและเบอร์โทรศัพท์
- ลงทะเบียนฉีดวัคซีนโควิด - กดเมนู "ลงทะเบียนขอรับวัคซีน" จากนั้นจะได้รับข้อความแจ้งยืนยัน
- จองคิวฉีดวัคซีน กดเมนูจองฉีดวัคซีน COVID-19 เลือกจอง และกดรับสิทธิ โดยระบบจะให้ทำแบบคัดกรอง เลือกโรงพยาบาล วัน เวลา เพื่อจองฉีดวัคซีน
- กรณีเปลี่ยนคิวจองฉีดวัคซีน - ให้กดเลือกเมนูข้อมูลการจองฉีดวัคซีน COVID-19 เข็มที่ 1 และทำการเปลี่ยนการจองโดยระบุวัน เวลาใหม่ จากนั้นระบบจะส่งข้อความยืนยันนัดหมายใหม่มาให้
- แจ้งเตือนฉีดวัคซีน เข็มที่ 1 - ก่อนถึงนัดหมายฉีดวัคซีน 1 วัน
- ยืนยันการฉีดวัคซีน เข็มที่ 1 - หลังได้รับการฉีดวัคซีนแล้ว จะได้รับข้อความยืนยันและใบแจ้งอาการข้างเคียงที่อากเกิดขึ้น ภายใน 24 ชั่วโมง
- ทำแบบประเมินอาการไม่พึงประสงค์ ครั้งที่ 1 - หลังฉีดวัคซีน เข็มที่ 1 ภายใน 1, 7 และ 30 วัน
- แจ้งเตือนฉีดวัคซีน เข็มที่ 2
- ยืนยันการฉีดวัคซีน เข็มที่ 2 - โดยจะได้รับข้อความยืนยันและใบแจ้งอาการข้างเคียงที่อากเกิดขึ้น ภายใน 24 ชั่วโมง
- การออกใบรับรองการฉีดวัคซีน - โดยสามารถสแกน QR Code เพื่อตรวจสอบความถูกต้อง
- ทำแบบประเมินอาการไม่พึงประสงค์ ครั้งที่ 2 - หลังฉีดวัคซีน เข็มที่ 2 ภายใน 1, 7 และ 30 วัน
ส่วนผู้ที่ต้องการเดินทางไปต่างประเทศ กระทรวงสาธารณสุขได้เตรียมเอกสารรับรอง International Health Certificate ซึ่งข้อมูลที่แสดงจะขึ้นอยู่กับความต้องการของแต่ละประเทศที่เดินทางไป เช่น
- การรับรองการฉีดวัคซีน
- ผลการตรวจหาเชื้อในโพรงจมูก
- ตรวจเลือดหาภูมิคุ้มกัน
ระบบรองรับหลังฉีด ล็อตใหญ่ มิ.ย. 2564
- ได้รับใบรับรองหรือใบรับรองดิจิทัล
- มีคิวอาร์โค้ดเฉพาะบุคคล สำหรับตรวจสอบ
- สามารถขอใบรับรองไปต่างประเทศ
- ข้อมูลจะเก็บไว้ในฐานข้อมูล
- มีแผนภาพออนไลน์แสดงจำนวนผู้ฉีดวัคซีน
3.2 ระบุที่อยู่ปัจจุบันเพิ่มเติม
อากะ ทุกสาขา รับฟรี‼️ ซุปกิมจิ LINK
อากะ ร่วมกับร้านอาหารในเครือเซ็นกรุ๊ป ทั้ง Zen , On the Table , Din’s , *ตำมั่ว , *ลาวญวณ และ *เขียง (*เฉพาะสาขาที่ร่วมรายการ) มอบสิทธิพิเศษให้แก่คนไทยที่พร้อมใจกันไปฉีดวัคซีนเพื่อต้านโรคโควิค 19
เพียงแสดงหลักฐานการฉีดวัคซีนของตัวท่านเอง และซื้อเมนู Take away ทั้ง ?AKA BOWL ? AKA BENTO AKA YAKINIKU @HOME เมนูใดก็ได้ 1 เมนู รับฟรี‼️ ??? ซุปกิมจิ (มูลค่า 145 บาท) ทันที
สิทธิพิเศษนี้ระหว่างวันที่ 18 พ.ค. 2564 - 30 มิ.ย. 2564
อากะ ทุกสาขา
*ดูเงื่อนไขที่เพจ
ลาวญวน บาย ตำมั่ว รับฟรี‼️ตำมั่ว 1 จาน LINK
ลาวญวน บาย ตำมั่ว
สนับสนุนคนไทย ฉีดวัคซีนช่วยชาติ ภายใต้แคมเปญ "We are Vacinated"
รับฟรี‼️ตำมั่ว 1 จาน เพียงแสดงหลักฐานการฉีดวัคซีน และซื้อสินค้าเมนูใดๆก็ได้อย่างน้อย 1 เมนู
ระยะเวลา : 18 พ.ค. 64 ถึง 30 มิ.ย. 64
เฉพาะสาขาลาวญวนที่ร่วมรายการ*
คำแนะนำสำหรับผู้ป่วยโรคตับประเภทต่างๆ LINK
วัคซีน COVID-19 ช่วยลดความรุนแรงและโอกาสเสียชีวิตจากการป่วยด้วยโรค COVID-19 ทั้งในคนทั่วไปแล่ะผู้ป่วยโรคตับทุกชนิด
ปัจจุบันยังไม่มีข้อมูลว่าวัคชีน COVID-19 ใดดีกว่ากันทั้งในคนปกติและผู้ป่วยโรคตับ สำหรับวัคซีนของ AstraZeneca ใช้ไวรัสที่ไม่แบ่งตัว จึงไม่นำเกิดข้อเสียจากการฉีดวัคซีน
ผู้ที่ลุงอายุ อ้วน และผู้ที่มีโรคเรื้อรัง เช่น เบาหวาน ความดันโลหิตสูง โรคปอด หอบหืด ไตวายเรื้อรัง รวมทั้งโรคตับอักเสบเรื้อรัง ตับแข็ง มะเร็งตับ ผู้ป่วยที่ได้รับยากดภูมิ และผู้ป่วยภายหลัง
ปลูกถ่ายตับมีความเสี่ยงสูงที่จะเกิดโรค COVID-19 ที่รุนแรงและมีโอกาสเสียชีวิตสูงกว่าคนปกติ
ผู้ป่วยโรคตับประเภทต่างๆ และโรคตับแข็งระยะต้นควรฉีดวัคซีน COVID-19 โดยเฉพาะอย่างยิ่งผู้ปวยโรคตับแข็งระยะกลางและระยะท้าย มะเร็งตับ และผู้ป่วยภายหลังปลูกถ่ายตับที่มีอาการคงที่ เนื่องจากมีโอกาสเสี่ยงที่จะเกิดโรค COVID-19 ที่รุนแรงมากขึ้น ผลข้างเคียงของวัคซีนมีโอกาสเกิดขึ้นได้น้อยเมื่อเทียบกับความรุนแรงของโรค ยกเว้นผู้ปวยที่มีประวัติแพ้วัคซีนควรปรึกษาแพทย์ก่อน คนใกล้ชิดในครอบครัวก็ควรฉีดวัคซีน COVID-19 เช่นกัน
ผู้ป่วยกายหลังปลูกถ่ายตับควรฉีดวัคซีน COVID-19 หลังปลูกถ่ายตับอย่างน้อย 3 เดือนขึ้นไป (หรืออย่างเร็วสุดคือ 1 เดือนหลัง ปลูกถ่ายตับ ขึ้นกับดุลยพินิจของแพทย์ผู้ดูแล)
ผู้ป่วยโรคตับอักเสบเรื้อรังจากไวรัสตับอักเสบปีหรือชี ตับอักเสบจากการแพ้ภูมิ มะเร็งตับ และภายหลังปลูกถ่ายตับที่ได้รับยารักษา ไม่จำเป็นต้องหยุดยาต้านไวรัส การรักษาโรคนั้นๆ หรือยากดภูมิ ก่อนและระหว่างฉีดวัคซีน COVID-19
ผู้ปวยโรคตับแข็งที่มีเกล็ดเลือดต่ำหรือเลือดแข็งตัวช้า ควรกดตำแหน่งที่ฉีดยาไว้ 1-2 นาที หลังฉีดวัคซีน COVID-19
ผู้ป่วยโรคตับที่ฉีดวัคซีน COVID-19 แล้วมีไข้ สามารถรับประทานยาลดไข้พาราเซตามอลตามขนาดยาที่ดูกต้องและเหมาะสมได้
ในขณะนี้ ข้อมูลของวัคซีน COVID-19 ในผู้ที่มีอายุต่ำกว่า 18 ปียังอยู่ระหว่างการศึกษา แต่มีแนวโน้มที่วัคซีนจะช่วยป้องกันการติดเชื้อ COVID-19 และลดความรุนแรงของโรค COVID-19 ได้เช่นเดียวกัน
สมาคมโรคตับแห่งประเทศไทยสมาคมโรคตับแห่งประเทศไทย
Thai Association for the Study of the Liver (THASL)
24 พฤษภาคม 2564
ใบรับรองวัคซีน อิสราเอล
ใบรับรองของอิสราเอล ออกให้ทุกคนที่ได้รับวัคซีนเข็มที่สองแล้ว 1 สัปดาห์ มีอายุ 6 เดือน
ผู้ที่มีใบรับรองนี้ จะได้รับการยกเว้นไม่ต้องกักตัว และสามารถใช้เดินทางระหว่างประเทศได้
การใช้ใบรับรองต้องควบคู่ไปกับหลักฐานอื่น เช่น บัตรประจำตัวประชาชน พาสปอร์ต ใบขับขี่
ปกติขอผ่านทางออนไลน์ กรณีอื่นสามารถขอผ่านกระทรวงสาธารณสุข หรือจุดบริการต่างๆทั่วประเทศ หรือทางโทร หรือ ผ่านทาง HMO (Health Maintenance Organizations)
corona.health.gov.ilอบจ ประจวบฯ พร้อมจัดหาวัคซีนเพื่อชาวประจวบฯ ได้ฉีดฟรี LINK
1 มิถุนายน 2564 นายสราวุธ ลิ้มอรุณรักษ์ นายกองค์การบริหารส่วนจังหวัดประจวบคีรีขันธ์ เปิดเผยว่าขณะนี้ อบจ.ประจวบฯ มีงบประมาณพร้อมในการจัดซื้อวัคซีนตัวเลือก หากหน่วยงานในส่วนกลางยืนยันว่าไม่มีปัญหาติดขัดในระเบียบหรือกฎหมาย และไม่ถูกทักท้วง อบจ.พร้อมซื้อทันที โดยวางแผนร่วมกับคณะกรรมการโรคติดต่อจังหวัด หน่วยงานสาธารณสุข รวมทั้ง อบต.และเทศบาลในพื้นที่ เนื่องจาก จ.ประจวบฯ เป็นเมืองท่องเที่ยวหลัก ซึ่งขณะนี้มีการจัดทำโครงการหัวหินรีชาร์ท เพื่อเปิดเมืองท่องเที่ยวและรับนักท่องเที่ยวต่างขาติโดยไม่ต้องกักตัวตั้งแต่วันที่ 1 ตุลาคมนี้ เป็นต้นไป
เขื่อน ภัทรดนัย เสตสุวรรณ กล่าวว่า บริการของ Pride Clinic นอกจากมีความครอบคลุมความต้องการแล้ว ทางโรงพยาบาลฯ ยังให้ความสำคัญกับข้อมูลความเป็นส่วนตัว ซึ่งถือเป็นเรื่องสำคัญมากสำหรับกลุ่มนี้ ทั้งยังมีบริการให้คำปรึกษาทางด้านจิตเวชด้วย
โครงสร้างองค์กร
ในส่วนของสำนักงานสาธารณสุขจังหวัดเป็นหน่วยงานที่ขึ้นตรงต่อผู้ว่าราชการจังหวัด มีนายแพทย์สาธารณสุขจังหวัดเป็น เป็นผู้บังคับบัญชาดูแลรับผิดชอบ สำนักงานสาธารณสุขจังหวัด ได้รับการนิเทศงาน กำกับดูแลและสนับสนุนทรัพยากรจากสำนักงานปลัดกระทรวงสาธารณสุข(ผ่านทางสำนักตรวจราชการกระทรวง) และกรมวิชาการต่าง ๆ มีอำนาจหน้าที่เกี่ยวกับการจัดทำแผนยุทธศาสตร์ด้านสุขภาพของจังหวัด การกำกับ ดูแล ประเมินผล และสนับสนุนการปฏิบัติงานของหน่วยงาน สาธารณสุขในจังหวัด และปฏิบัติงานร่วมกับหรือสนับสนุนการปฏิบัติงาน
ของหน่วยงานที่เกี่ยวข้องหรือที่ได้รับมอบหมาย นอกจากนี้ ยังมีโรงพยาบาลระดับจังหวัด คือ โรงพยาบาลทั่วไป (365 เตียง) รวมทั้งโรงพยาบาลระดับอำเภอ อีก 7 แห่ง คือ โรงพยาบาลชุมชน (30 – 60 เตียง) ทั้งหมดขึ้นตรงต่อนายแพทย์สาธารณสุขจังหวัด
โรงพยาบาลทั่วไป
แบ่งงานภายในออกเป็น 5 กลุ่มคือ กลุ่มภารกิจด้านอำนวยการ กลุ่มภารกิจด้านพัฒนาระบบบริการสุขภาพ กลุ่มภารกิจด้านการพยาบาล กลุ่มภารกิจด้านบริการตติยภูมิ และกลุ่มภารกิจด้านบริการปฐมภูมิและทุติยภูมิ
โรงพยาบาลชุมชน
แบ่งงานภายในออกเป็น 3 กลุ่มภารกิจ คือ กลุ่มภารกิจด้านอำนวยการ กลุ่มภารกิจด้านบริการ และกลุ่มภารกิจด้านการพยาบาล
สำนักงานสาธารณสุขอำเภอ
เป็นหน่วยงานที่ขึ้นตรงต่อนายอำเภอ มีสาธารณสุขอำเภอ เป็นหัวหน้ามีหน้าที่
ทางด้านบริหาร ส่งเสริม สนับสนุน ควบคุมกำกับ ติดตามและประเมินผลการปฏิบัติงานของ
สถานีอนามัย สำนักงานสาธารณสุขอำเภอได้รับการนิเทศงาน และประสานงานจากสำนักงานสาธารณสุขจังหวัด ซึ่งจะเป็นผู้สนับสนุนทางวิชาการและบริหาร มีอำนาจหน้าที่เกี่ยวกับการจัดทำแผนยุทธศาสตร์ด้านสุขภาพของอำเภอ การกำกับ ดูแล ประเมินผล และสนับสนุนการปฏิบัติงานของหน่วยงานสาธารณสุขในอำเภอ และปฏิบัติงานร่วมกับหรือสนับสนุนการปฏิบัติงานของหน่วยงานที่เกี่ยวข้องหรือได้รับมอบหมาย
สถานีอนามัย
เป็นหน่วยบริการสาธารณสุขระดับตำบล หรือระดับหมู่บ้าน มีหน้าที่ในการจัดบริการ
สาธารณสุขผสมผสานแก่ประชาชนในชนบท ในเขตพื้นที่รับผิดชอบ โดยครอบคลุมประชากรประมาณ 1,000 – 5,000 คน มีเจ้าหน้าที่ปฏิบัติงานประจำ คือ เจ้าพนักงานสาธารณสุขชุมชน (พนักงานอนามัย ผดุงครรภ์และพยาบาลเทคนิค) ปัจจุบันเริ่มมีทันตาภิบาล พยาบาลวิชาชีพ และนักวิชาการสาธารณสุข บรรจุเข้าทำงานในระดับสถานีอนามัยด้วย
ทิศทางของสถานีอนามัยในอนาคตน่าจะปรับเป็นศูนย์สุขภาพชุมชน โดยเน้นการบริการใกล้บ้านใกล้ใจ อาจมีแพทย์ประจำหรือหมุนเวียนเพื่อบริการตรวจรักษาพยาบาลคนในชุมชนนั้นๆ
เมื่อมีการการปฏิรูปโครงสร้างใหม่มีผลบังคับใช้ตั้งแต่วันที่ 3 ตุลาคม 2545 โครงสร้างสำนักงานสาธารณสุขจังหวัดได้ปรับปรุงภารกิจและโครงสร้างใหม่ มีการเปลี่ยนชื่อตำแหน่งใหม่ ดังนี้
1. รองนายแพทย์สาธารณสุขจังหวัดคนที่ 1 (รอง 1) เป็น
นายแพทย์ 9 ด้านเวชกรรมป้องกัน
2. รองนายแพทย์สาธารณสุขจังหวัดคนที่ 2 (รอง 2) เป็น
นักวิชาการสาธารณสุข 9 ด้านส่งเสริมพัฒนา
3. รองนายแพทย์สาธารณสุขจังหวัดคนที่ 3 (รอง 3) เป็น
เจ้าหน้าที่บริหารงานสาธารณสุข 8
4. กลุ่มงานต่างๆ เปลี่ยนเป็น
- หัวหน้าฝ่ายบริหารทั่วไป
- หัวหน้างานแผนงาน ประเมินผล
- หัวหน้างานระบาดวิทยา
- หัวหน้างานข้อมูลข่าวสาร
- หัวหน้างานควบคุมโรคติดต่อ
- หัวหน้างานแนะนำเผยแพร่
- หัวหน้างานประยุกต์ใช้เทคโนโลยี
- หัวหน้างานดำเนินการตามกฎหมาย
- หัวหน้างานประสานรัฐและท้องถิ่น
- หัวหน้างานพัฒนาบุคลากร
ต่อมา ได้มีการปรับเปลี่ยนภารกิจและโครงสร้างใหม่ ในวันที่ 5 ตุลาคม 2549 ดังนี้
1. กลุ่มอำนวยการ
- งานบริหารทั่วไป
- งานประกันสุขภาพ
2. กลุ่มพัฒนาการสาธารณสุข
- งานทันตสาธารณสุข
- งานควบคุมโรค (งานควบคุมโรคติดต่อ, งานควบคุมโรคไม่ติดต่อและการบาดเจ็บ)
- งานส่งเสริมสุขภาพและอนามัยสิ่งแวดล้อม
3. กลุ่มนโยบายและสนับสนุนบริการสุขภาพ
- งานคุ้มครองผู้บริโภค
- งานพัฒนายุทธศาสตร์ (งานพัฒนายุทธศาสตร์, งานข้อมูลข่าวสาร, งานระบาดวิทยา)
- งานพัฒนาบุคลากรและคุณภาพบริการ (งานพัฒนาบุคลากร, งานสารนิเทศ/สุขศึกษา,งานพัฒนาคุณภาพบริการ)
4. งานรักษาพยาบาล
5. งานศูนย์คอมพิวเตอร์
พฤศจิกายน พ.ศ.2551 มีการปรับเปลี่ยนภารกิจและโครงสร้างใหม่
1.กลุ่มงานบริหารทั่วไป
2.กลุ่มงานพัฒนายุทธศาสตร์สาธารณสุข
3.กลุ่มงานคุ้มครองผู้บริโภคและเภสัชสาธารณสุข
4.กลุ่มงานประกันสุขภาพ
5.กลุ่มงานควบคุมโรค
6.กลุ่มงานส่งเสริมสุขภาพ
7.กลุ่มงานทันตสาธารณสุข
8.กลุ่มงานพัฒนาทรัพยากรบุคคลคุณภาพและรูปแบบบริการ
24 พฤศจิกายน พ.ศ.2554 มีการปรับเปลี่ยนภารกิจและโครงสร้างใหม่ ดังนี้
1. กลุ่มงานบริหารทั่วไป
2.กลุ่มงานพัฒนายุทธศาสตร์สาธารณสุข
3.กลุ่มงานส่งเสริมสุขภาพ
4.กลุ่มงานควบคุมโรค
5.กลุ่มงานคุ้มครองผู้บริโภคและเภสัชสาธารณสุข
6.กลุ่มงานประกันสุขภาพ
7.กลุ่มงานพัฒนาคุณภาพและรูปแบบบริการ
8.กลุ่มงานทันตสาธารณสุข
9.กลุ่มงานนิติการ
10.กลุ่มงานทรัพยากรบุคคล
11.กลุ่มงานอาชีวเวชศาสตร์และเวชศาสตร์สิ่งแวดล้อม
5 ข้อพิจารณาในผู้ที่มีกินยาลดความดันโลหิตหรือยาละลายลิ่มเลือดหรือเบาหวาน
5 สำหรับผู้ที่มีกินยาลดความดันโลหิตหรือยาละลายลิ่มเลือดแล้วไม่ป่วย จะต้องพิจารณาและตรวจสอบอย่างใกล้ชิดว่าจะต้องหยุดฟ้าทะลายโจร หรือหยุดยาลดความดันโลหิตหรือยาละลายลิ่มเลือด เพราะตัวยาเหล่านี้เสริมฤทธิ์ไปในทางเดียวกัน
หากเป็นเบาหวานจะต้องระวังด้วยว่ายาฟ้าทะลายโจรทำให้น้ำตาลลดลง ดังนั้นผู้ที่ใช้ยาเบาหวานอยู่ จะต้องคอยวัดระดับน้ำตาลอย่างต่อเนื่องด้วย
ดังนั้นจึงจำเป็นต้องตรวจค่านำตาลและความดันโลหิตในกลุ่มผู้ป่วยเหล่านี้ด้วย
สติ๊กเกอร์จากฟาร์ม
สติ๊กเกอร์ติดหน้าร้าน เพื่อแสดงว่า รับใบกัญชามาจากฟาร์มที่ถูกต้องตามกฏหมาย แต่อย่างไรหากมีการตรวจสอบ จะยึดจาก เอกสารจำหน่าย ชิ้นส่วนที่ไม่ใช่ ยส.5 ที่ออกโดย อย. เป็นสำคัญ
ขวดพลาสติกใช้แล้ว ทำอะไรได้บ้าง
เคยสงสัยกันไหมครับว่าขวดพลาสติกที่ถูกนำเข้าสู่กระบวนการ Upcycling แปลงร่างเพิ่มมูลค่า เปลี่ยนเป็นอะไรได้บ้าง วันนี้แอดมินขอนำตัวอย่างผลิตภัณฑ์มาฝากทุกคนกันนะครับ
- กระเป๋าใส่เหรียญ ใช้ขวดพลาสติก 1.5 ใบ
- กระเป๋า crossbody ใช้ขวดพลาสติก 3.4 ขวด
- เสื้อยืด ใช้ขวดพลาสติก 8 ขวด
- จีวร ใช้ขวดพลาสติก 15 ขวด
- ชุด PPE ใช้ขวดพลาสติก 18 ขวด
นอกจากลิสต์ที่แอดมินนำมาฝากแล้ว ยังมีผลิตภัณฑ์จากพลาสติกใช้แล้วอีกมากมายที่ถูกชุบชีวิตให้กลับมาใช้ประโยชน์ได้อีกครั้ง ซึ่งทุกคนก็สามารถมาร่วมเป็นส่วนหนึ่งในการดูแลโลกใบนี้ของเราได้ เพียงคุณนำพลาสติกใช้แล้วมาจัดการอย่างเป็นระบบผ่าน YOUเทิร์น Platform เท่านั้นเองครับ
ปทุมธานี
โรงพยาบาลเปาโลรังสิต
วิธีตรวจ : RT-PCR
เวลาทำการ :
วันทำการ :
วันที่ให้บริการ : [2021-07-28]
ปริมาณตรวจ : 50/วัน
สถานะ : ว่าง
โทรศัพท์ : 025778111
หมายเหตุ
ลงทะเบียนจองคิวล่วงหน้า 1 วันตามลิงค์ https://bit.ly/3tSpWAr (ถ้าเอาใบรับรองแพทย์จ่ายเพิ่ม 500)
โรงพยาบาลธนบุรีบูรณา
วิธีตรวจ : RT PCR drive-thru
เวลาทำการ : [08:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : 80 ต่อวัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 0845528555
โรงพยาบาลกรุงสยามเซนต์คาร์ลอส
วิธีตรวจ : RT-PCR
เวลาทำการ : [07:00-17:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ส. อา. ]
วันที่ให้บริการ :
ปริมาณตรวจ : /วัน
สถานะ : ว่าง
โทรศัพท์ : 029756700
หมายเหตุ
- ฟรีสำหรับกลุ่มเสี่ยง (เปิดรับบัตรคิว 7:00 ตรวจ 8:30-17:00)
เลขหมายประจำเขต กรุงธนฯ เหนือ
เลขหมายประจำเขต เขตกรุงธนฯ เหนือ
ใครต้องไปตรวจหาโควิด - อยุธยา ชวนรู้ สู้ภัย Covid-19
ปทุมธานี ทะเบียนผ่าน QR code LINK
ผู้ที่ประสงค์ฉีดวัคซีนเข็ม 2 ที่โรงพยาบาลปทุมธานี (กรณีเข็ม 1 จากสถานีกลางบางซื่อหรือที่อื่น) กรุณาลงทะเบียนผ่าน QR code ก่อนวันนัดฉีดเดิมอย่างน้อย 3 วัน เพื่อพิจารณาจัดวันนัดใหม่ (ซึ่งอาจจะไม่ตรงตามนัดเดิม โดยจะแจ้งวันนัดใหม่ผ่านข้อความ SMS หรือตรวจสอบได้ในหมอพร้อม)
ศูนย์บริการสาธารณสุข 44 ลำผักชี หนองจอก ออกหน่วยเคลื่อนที่ 9-15 กันยายน 64 LINK
ศูนย์บริการสาธารณสุข 44 ลำผักชี หนองจอก กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ประจำปี 2564
ทุกจุด ให้บริการเวลา 9-12 น.
9 กันยายน 64 - ชุมชนทรัพย์เจริญ
10 กันยายน 64 - ชุมชนสหกรณ์ 93
13 กันยายน 64 - ชุมชนพิบูลย์ทรัพย์ 15
14 กันยายน 64 - ชุมชนวัดใหม่กระทุ่มล้ม
15 กันยายน 64 - ชุมชนก้าวหน้า ม.6
เอกสารที่ต้องมี
1.เอกสารการรับวัคซีนของสัตว์เลี้ยง
2.บัตรประชาชนเจ้าของสัตว์เลี้ยง
ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมฯ โทร 02 543 1477 ในวันเวลาราชการ
THAI Smile Airways LINK
ไทยสมายล์ขอแนะนำให้ผู้โดยสารตรวจสอบมาตรการควบคุมการเดินทางเข้า-ออกพื้นที่ตามประกาศแต่ละจังหวัดอย่างละเอียดก่อนการเดินทาง และขอให้เผื่อเวลาในการเดินทางมายังสนามบินให้เร็วขึ้นด้วยนะคะ เราขอยืนยันในการให้บริการแบบฟูลเซอร์วิสและปฏิบัติตามมาตรฐานความปลอดภัยและสุขอนามัยต่างๆ อย่างครบถ้วนเพื่อให้ผู้โดยสารอุ่นใจตลอดการเดินทาง
เอกสาร
1. เอกสารแสดงผลการฉีดวัคซีน สามารถใช้เป็นเอกสาร หรือจากแอปพลิเคชัน ก็ได้
2. กรณีต้องมีเอกสารการตรวจหาเชื้อ COVID-19 โดยวิธี RT-PCR หรือ Anitgen Test Kit
แนะนำให้ เช็คสถานที่ตรวจได้ที่ https://service.dmsc.moph.go.th/labscovid19 ซึ่งเป็นรายชื่อที่สายการบินรับรอง
3. สำหรับผู้โดยสารที่อายุต่ำกว่า 18 ปี จำเป็นต้องมีผลตรวจ COVID-19 แบบ RT-PCR หรือ Antigen test
4.เด็กอายุต่ำกว่า 6 ปี เดินทางกับผู้ใหญ่ ไม่ต้อง swap ตรวจหาเชื้อ COVID-19
นพ. ยง ภู่วรวรรณ LINK
คนที่เคยเป็นโรคโควิด-19 แล้วจำเป็นต้องฉีดวัคซีนหรือไม่
นพ. ยง ภู่วรวรรณ ให้ความเห็นว่า
การติดตามผู้ที่เคยเป็นโรคโควิด แล้ว มีโอกาสเป็นซ้ำได้อีก การติดเชื้อซ้ำส่วนมากจะเกิดขึ้นหลัง 3 เดือนไปแล้วหลังติดเชื้อ
ดังนั้นในผู้ที่เคยติดเชื้อหรือเป็นโรคมาแล้ว เมื่อหายแล้วก็ควรที่จะได้รับวัคซีน โดยให้หลังการติดเชื้อแล้ว 3 ถึง 6 เดือน ในประเทศทางตะวันตก จะให้ตามกำหนดของวัคซีน
ขณะนี้ทางศูนย์ได้ดำเนินการทำวิจัยในเรื่องนี้ โดยผู้ที่หายจากโรค COVID-19 แล้ว ตั้งแต่ 2 เดือนขึ้นไป เป็นอาสาสมัครมารับวัคซีน ซึ่งมีทั้ง AstraZeneca และ Sinovac 1 ครั้ง และจะขอตรวจภูมิต้านทานติดตามดูระดับภูมิต้านทาน ดังนั้นจะเป็นผู้ที่หายแล้วเกินกว่า 2 เดือน จะเป็นกลุ่มผู้ที่เคยติดเชื้อตั้งแต่ก่อนสงกรานต์ เพื่อที่จะได้รับวัคซีนในเดือนหน้า
ส่วนผู้ที่หายมานานมากกว่า 6 เดือนส่วนใหญ่จะเป็นผู้ที่ติดเชื้อปีที่แล้ว ขณะนี้ได้ให้วัคซีนไปแล้ว 62 คน โดยจะให้วัคซีน 2 ครั้งตามกำหนดของวัคซีน AstraZeneca และ Sinovac อยู่ระหว่างการติดตามผลการศึกษาจะเป็นประโยชน์อย่างมาก เพราะขณะนี้เรามีผู้ติดเชื้อเป็นแสนคน และคงเกิน 2 แสน คน ในไม่ช้าอย่างแน่นอน เพื่อเป็นแนวทางในการให้วัคซีนในกลุ่มผู้ที่เคยติดเชื้อมาก่อน
ที่มา : Facebook Yong Poovorawan (นพ.ยง ภู่วรวรรณ)
ศูนย์ข้อมูล COVID-19 29 พฤษภาคม 2564
ขั้นตอนที่ 5 หยดน้ำยาทดสอบ
ขั้นตอนที่ 5 บีบฝาหลอดน้ำยาออก ค่อยๆ หยดน้ำยาลงบนช่อง A 6 หยด หมุนไม้เก็บตัวอย่างไปทางขวา 2 รอบทางซ้าย 2 รอบ
เว้นระยะห่าง หากต้องสนทนาหรือพบปะ อย่างน้อย 1 เมตรหรือหนึ่งช่วงแขน
เขตสุขภาพที่ 3 นครสวรรค์ (ยังไม่เปิดให้บริการ)
สำนักงานป้องกันควบคุมโรคที่ 3 จังหวัดนครสวรรค์
-เบอร์โทรศัพท์: 056 221 822
-เว็บไซต์: https://ddc.moph.go.th/odpc3/
(ยังไม่เปิดให้บริการ)โรงแรมเดอะสุโกศล กรุงเทพ เปิดบริการ Hospitel ดูแลโดยโรงพยาบาลพญาไท 2
โรงพยาบาลพญาไท 2 ร่วมกับ โรงแรมเดอะสุโกศล กรุงเทพ เปิดให้บริการ ฮอลพิเทล รองรับผู้ป่วยกลุ่มสีเขียว โดยมีเกณฑ์ผู้ป่วย ดังนี้ ผู้ป่วยอายุตั้งแต่ 1 - 60 ปี มีไข้ น้อยกว่า 38.5 c เป็นกลุ่มไม่มีอาการ หรือมีอาการน้อย ไม่มีอาการหอบเหนื่อย ไม่มีหายใจแรง ไม่มีอาการไอมากหรือแน่นหน้าอก
ไม่มีภาวะปอดอักเสบ หรือ หากมีภาวะปอดอักเสบต้องอาการคงที่หลังจากรับการรักษาใน รพ.มาแล้ว 4-7วัน ไม่มีภาวะแทรกซ้อน ไม่มีโรคประจำตัวรุนแรง สามารถดูแลตนเองได้ (กรณีเด็กต้องมีผู้ปกครองดูแลตลอดการรักษา) สามารถใช้โทรศัพท์ในการติดต่อสื่อสาร ไม่มีความเสี่ยงทางจิตเวช
สอบถามข้อมูลเพิ่มเติม ติดต่อ 1772
โรงพยาบาลเวชศาสตร์เขตร้อน ฉีดเข็ม 3 วันที่ 29 กันยายน 64 LINK
โรงพยาบาลเวชศาสตร์เขตร้อน ฉีดเข็ม 3 วันที่ 29 กันยายน 64
เงื่อนไขหลักในการรับวัคซีน COVID-19 เข็มที่ 3 ในวันที่ 29 กันยายน 2564
1. สำหรับชาวไทย ที่มีอายุ 18 ปีขึ้นไป
2. สำหรับผู้ที่ได้รับ เข็ม1 Sinovac+เข็ม2 Sinovac หรือ เข็ม1 Sinopharm+เข็ม2 Sinopharm ก่อนวันที่ 30 มิถุนายน 2564 เท่านั้น โดยวัคซีนที่ท่านจะได้รับคือ AstraZeneca
3. ให้นำหลักฐานยืนยันการฉีดครบ 2 เข็ม ใน "หมอพร้อม" มาแสดงเพื่อยืนยัน และรพ.ขอสงวนสิทธิ์ในการฉีดให้ผู้ที่เข้าเกณฑ์เท่านั้น
6. หน่วยงานภาคสนามลงพื้นที่ตามจุดต่างๆ
หน่วยงานภาคสนามลงพื้นที่ตามจุดต่างๆ และรายงานจุดที่มีน้ำท่วมให้ศูนย์ควบคุมระบบป้องกันน้ำท่วมรับทราบสถานการณ์จนกว่าจะเข้าสู่ภาวะปกติ
5. ยาน้ำมันกัญชาหยอดใต้ลิ้น 5 ml THC (THC 2.7% w/v : CBD 2.5% w/v)
ชื่อผลิตภัณฑ์ ยาน้ำมันกัญชาหยอดใต้ลิ้น
รหัส SAS14
ส่วนประกอบ THC2.7% w/v : CBD 2.5% w/v
ขนาดบรรจุ 5 มิลลิลิตร/ขวด
รูปแบบของผลิตภัณฑ์ น้ำมันกัญชาหยดใต้ลิ้น
ข้อบ่งใช้
1.เพิ่มคุณภาพชีวิตผู้ป่วยมะเร็งระยะสุดท้าย เช่น ลดปวด ลดผลข้างเคียงต่อการใช้เคมีบำบัด
หรือรังสีรักษา ท้าให้กินข้าวได้ นอนหลับ
2.บรรเทาอาการปวดในผู้ปวดปลายประสาท ที่ไม่ตอบสนองในรักษา (intractable neuropatic
pain) และโรคอื่นๆที่มีหลักฐานการใช้ว่าได้ประโยชน์และอยู่ในการพิจารณาของแพทย์ผู้ท้าการรักษา
ผู้ผลิต โรงพยาบาลเจ้าพระยาอภัยภูเบศร
ประเภทใบอนุญาต ผลิต (แปรรูปหรือสกัด) ซึ่งยาเสพติดให้โทษในประเภท 5
เลขที่ใบอนุญาต 10/2562
รายละเอียด ผลิตภัณฑ์กัญชานี้ได้รับยกเว้นการรับรองตำรับจากส้านักงาน อย. เพื่อใช้สำหรับผู้ป่วยเฉพาะราย ภายใต้รูปแบบพิเศษของการเข้าถึงยา (Special access scheme ) ต้องสั่งจ่ายโดยแพทย์ที่ผ่านการอบรมหลักสูตรการใช้กัญชาและสารสกัดจากกัญชาในทางการแพทย์จากกระทรวงสาธารณสุขและต้องได้รับการยินยอมจากผู้ป่วยหรือผู้ดูแลผู้ป่วย โดยการลงนามเป็นลายลักษณ์อักษรในเอกสารแสดงความยินยอม
ตาก Kick off การฉีดวัคซีน Pfizer โรงเรียนราชประชานุเคราะห์ 55 LINK
รองผู้ว่าฯ ตาก พร้อมคณะ ร่วม Kick off การฉีดวัคซีน Pfizer ป้องกันโรคโควิด-19 เพื่อ “สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม” วันที่ 4 ตุลาคม 2564 เวลา 13.00 น. ณ โรงเรียนราชประชานุเคราะห์ 55 นายสมชัย กิจเจริญรุ่งโรจน์ รองผู้ว่าราชการจังหวัด รักษาราชการแทนผู้ว่าราชการจังหวัดตาก พร้อมนายแพทย์วิทยา พลสีลา นายแพทย์สาธารณสุขจังหวัดตาก ดร.เกศราภรณ์ พลสีลา ประธานแม่บ้านสาธารณสุข สาขาจังหวัดตาก ศึกษาธิการจังหวัดตาก สาธารณสุขอำเภอเมืองตาก และเจ้าหน้าที่ที่เกี่ยวข้อง ร่วม Kick off และตรวจเยี่ยมการฉีดวัคซีนป้องกัน โรคติดเชื้อไวรัสโคโรนา 2019 สำหรับนักเรียน อายุ 12-18 ปี โดยมีนายศรยุทธ เรืองน้อย ผู้อำนวยการโรงเรียนราชประชานุเคราะห์ 55 ให้การต้อนรับ ในการนี้คณะแพทย์และพยาบาล โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราชออกให้บริการฉีดวัคซีน Pfizer ให้นักเรียนกลุ่มเป้าหมายดังกล่าว จำนวน 120 คน ตามนโยบาย “สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม”
เรื่อง/ภาพ สสจ.ตาก
จันทบุรีจัดงานเทศกาลถือศีลกินเจ ปี 2564 พร้อมมาตรการเข้มและงดบางกิจกรรม


การจัดงานเทศกาลถือศีลกินเจ จันทบุรี ประจำปี 2564 เป็นปีที่ 134 ของบ้วนเฮงเจตั๊ว วัดเขตร์นาบุญญาราม เป็นงานบุญประเพณีอันดีงามประจำปีของชาวจังหวัดจันทบุรี แม้สถานการณ์โควิดในจันทบุรียังไม่น่าพอใจนักในช่วงเวลานี้ การจัดงานจึงมีความเข้มงวดและต้องงดบางกิจกรรม อาทิ งดกิจกรรมการรวมกลุ่ม โดยงดการละเล่นอุปรากรจีน, งดการจำหน่ายอาหารในโรงเจ , งดจัดโรงครัวและโรงทาน และงดการเดินขบวนแห่ในกิจกรรมรับเจ้า ลอยกระทง และส่งเจ้า โดยใช้รถยนต์ในขบวนต่างๆ แทน กิจกรรมร่วมกันทั้ง 2 โรงเจ ให้ปฏิบัติร่วมกันดังเดิม คือ การรับเจ้า ลอยกระทงและส่งเจ้า ให้คณะกรรมการเป็นตัวแทนเจอิ๊วปฏิบัติหน้าที่แทน และขอความร่วมมือ ในการสวมหน้ากากอนามัยตลอดเวลาที่อยู่ในโรงเจ ตรวจคัดกรองวัดอุณหภูมิก่อนเข้างาน ผู้มีอาการไข้ ไอ จาม น้ำมูกไหล งดเข้างานและไปพบแพทย์ ล้างมือด้วยแอลกอฮอล์ ณ จุดคัดกรองก่อนเข้างาน รักษาระยะห่าง 1 เมตร ใช้เวลาด้านในให้สั้นที่สุด สำหรับการบริการอาหารเจให้แก่ประชาชนทั่วไปนั้น ได้จัดอาหารเจจำนวนวันละ 500 กล่องเพื่อแจกจ่ายให้แก่ประชาชนทั่วไปโดยได้รับความอนุเคราะห์จากเทศบาลเมืองจันทบุรีเอื้อเฟื้อสถานที่บริเวณหน้าอาคารป้องกันและบรรเทาสาธารณภัย เทศบาลเมืองจันทบุรี ตั้งแต่วันที่ 6 - 14 ตุลาคม 2564 เวลา 15.00 น. เป็นต้นไป
4.4 ความสัมพันธ์ทางด้านการเงินของแพทย์เวชปฏิบัติทั่วไปกับ NHS
จากการที่กลุ่มแพทย์ทั้งหมดโดยรวม ต่อต้านการเกิดขึ้นของหลักประกันสุขภาพถ้วนหน้าอย่างชัดเจน และแพทย์เวชปฏิบัติทั่วไปเป็นกลุ่มที่มีความ “กังวล” เรื่อง “รายได้” มากที่สุดว่า หลังมีNHS เกิดขึ้นจะทำให้รายได้โดยรวม “ลดลง” จึงน่าสนใจว่า หลังจากที่รัฐบาลสามารถเจรจาต่อรองสำเร็จ แพทย์เวชปฏิบัติทั่วไปได้รับค่าตอบแทนจาก NHS อย่างไร
ค่าตอบแทนของแพทย์เวชปฏิบัติทั่วไปที่ได้รับจาก NHS แบ่งออกได้เป็น 3 ลักษณะใหญ่ๆ คือ
1) เหมาจ่ายตามจำนวนประชากรที่รับผิดชอบ (Capitation fee)
2) ได้รับเป็นเงินเดือน แต่การคำนวณส่วนหนึ่งยังคงอิงอยู่กับจำนวนประชากรที่รับผิดชอบ(Allowance which is like salary) และ
3) ค่าตอบแทนตามรายการของการให้บริการ (Fee for certain item of service) ซึ่งมีการ
พัฒนาขึ้นมาในภายหลัง
ลักษณะที่หนึ่ง เหมาจ่ายตามจำนวนประชากรที่รับผิดชอบ โดยจะได้ค่าตอบแทนสูงขึ้น ถ้าดูแลผู้สูงอายุ หรือผู้ที่มีปัญหาหรืออยู่ในถิ่นทุรกันดาร เช่น การให้ค่าตอบแทนตามอายุของประชาชนที่อยู่ในความรับผิดชอบ ซึ่งแบ่งออกเป็น 3 กลุ่ม มากกว่า 75 ปี(35 ปอนด์); ระหว่าง 65-74 ปี(18 ปอนด์); และน้อยกว่า 65 ปี(14 ปอนด์) ส่วนค่าตอบแทนสำหรับการดูแลประชาชนใน
เขตที่มีปัญหาหรือทุรกันดาร (พื้นที่แพทย์ไม่อยากไปอยู่ เช่น ชนบทห่างไกล พื้นที่ที่มีการใช้ยาเสพติด พื้นที่เสี่ยงภัย เป็นต้น) โดยแพทย์เวชปฏิบัติทั่วไปจะได้รับค่าตอบเป็นรายหัวเพิ่มมากกว่าอัตราปกติซึ่งแบ่งออกเป็น 3 ระดับคือ สูง (ได้เพิ่ม 10 ปอนด์) กลาง (ได้เพิ่ม 7 ปอนด์) และต่ำ (ได้เพิ่ม 5 ปอนด์) เป็นต้น
ลักษณะที่สอง จ่ายในลักษณะเงินเดือน จำนวนเงินเดือนที่ได้รับมีที่มาจาก 2 แหล่งคือ 1) จากจำนวนประชากรที่รับผิดชอบกล่าวคือ เมื่อมีจำนวนประชากรที่อยู่ในความรับผิดชอบมากขึ้นจำนวนเงินเดือนโดยรวมเพิ่มขึ้น แต่อัตราอัตราเงินเดือนเมื่อเทียบกับประชากรทั้งหมดจะลดลง เช่น ได้รับค่าตอบแทนสูงสุดในประชากร 400 คนแรก (เช่น 8 ปอนด์ต่อคน) 200 คนถัดมาได้รับลดลง (เช่น 6 ปอนด์ต่อคน) และลดลงไปเรื่อยๆ จนเกินกว่าที่กำหนด เช่น กำหนดว่าจำนวนประชากรในส่วนที่เกินกว่า 1200 คน จะไม่นำมาคำนวณเพื่อคิดเป็นเงินเดือน และ 2) จากจำนวนปีที่ทำงานเป็นแพทย์เวชปฏิบัติทั่วไป ถ้าทำงานมาต่ำกว่า 7 ปีไม่ได้รับเงินเดือนในส่วนนี้ทำงานมา 7-14 ปี(400 ปอนด์), 14-21 ปี(2500 ปอนด์), และมากกว่า 21 ปี(5000 ปอนด์)
ลักษณะที่สาม จ่ายค่าตอบแทนตามรายการของการให้บริการ แบ่งออกเป็น 3 กลุ่มคือ กลุ่มที่หนึ่ง จ่ายเพิ่มเมื่อทำได้เกินกว่าเป้าหมายที่กำหนด (Target payments) ประกอบด้วย การให้วัคซีนในเด็กเล็ก (เช่น ถ้าได้เกินเป้าหมายได้รับ 1800 ปอนด์ ถ้าไม่ถึงได้รับ 600 ปอนด์) การ booster ในเด็กก่อนวัยเรียน (เช่น ถ้าได้เกินเป้าหมายได้รับ 600 ปอนด์ ถ้าไม่ถึงได้รับ 200 ปอนด์) การตรวจหามะเร็งปากมดลูก (เช่น ถ้าได้เกินเป้าหมายได้รับ 2400 ปอนด์ ถ้าไม่ถึงได้รับ 800 ปอนด์) กลุ่มที่สอง จ่ายตามกิจกรรมที่ทำตามช่วงเวลา (Sessional payments) ประกอบด้วย การทำคลินิกส่งเสริมสุขภาพ (Health promotion clinics: 45 ปอนด์), การผ่าตัดเล็ก (Minor surgery: 100 ปอนด์), และการสอนนักศึกษาแพทย์ กลุ่มที่สาม จ่ายตามแต่ละรายการของการให้บริการ (Item-of-service fee) ประกอบด้วยการให้วัคซีนเพื่อป้องกันโรค (5 ปอนด์) การให้บริการวางแผนครอบครัว (15 ปอนด์) และการใส่ห่วงอนามัย (IUD: 45 ปอนด์)
นอกจากนี้ ยังมีกิจกรรมการให้บริการอื่นๆ ที่ทำให้แพทย์เวชปฏิบัติทั่วไปมีรายได้เพิ่มขึ้น เช่น การให้บริการกรณีฉุกเฉิน(Emergency treatment fees: 20 ปอนด์) การให้บริการที่บ้านในเวลากลางคืน (Night visit มีhigh rate: 45 ปอนด์ กับ low rate:15 ปอนด์) เป็นต้น
ด้วยระบบการจ่ายค่าตอบแทนโดยรัฐให้กับแพทย์เวชปฏิบัติทั่วไป (อย่างซับซ้อน) ในลักษณะนี้ เป็นที่น่าสังเกตว่าแพทย์เวชปฏิบัติทั่วไป ยังคงมองว่าตนเองยังคงอยู่ในภาคเอกชนและทำงานอิสระในลักษณะเป็นเจ้านายตัวเอง (Doctor is his/her own boss)
ในกรณีที่ถ้าแพทย์เวชปฏิบัติทั่วไป ลงทุนเองด้วยการซื้อหรือเช่าตัวอาคารเพื่อทำคลินิกส่วนตัว จะสามารถเบิกในลักษณะค่าเช่าตัวอาคารจาก NHS ได้บางส่วน (ประมาณ 70% ของราคามาตรฐาน) รวมทั้งถ้าจ้างบุคลากรสามารถเบิกคืนจากการจ้างบุคลากรได้ไม่เกิน 2 คน ซึ่งมักจะเป็น พยาบาลที่ช่วยหมอในคลินิก (Practice nurse) และพนักงานต้อนรับ (Receptionist) โดยแพทย์เวชปฏิบัติทั่วไป สามารถเบิกคืนจาก NHS ได้ประมาณคนละไม่เกิน 70% ของเงินเดือน
ของบุคลากรแต่ละชนิดที่จ้าง ถ้าแพทย์เวชรวมกลุ่มกัน (Group practice) สามารถจ้างบุคลากรได้หลายคน และมักจะจ้างผู้จัดการคลินิก (Practice Manager) ด้วย เพื่อดูและในภาพรวมรวมไปถึงการติดต่อเชื่อมโยงกับ NHS ให้มีความคล่องตัว และบริหารจัดการการดำเนินการภายในสถานบริการได้อย่างมีประสิทธิภาพมากขึ้น
นอกจากนี้ แพทย์เวชปฏิบัติทั่วไปสามารถเบิกค่าใช้จ่ายเพื่อซื้อยา เครื่องมือ อุปกรณ์ที่จำเป็นต้องใช้เพื่อการให้บริการ (GP dispensing payments) รวมทั้งเพื่อซื้อ หรือ Up-grade computer (Computer costs reimbursement) ตามเงื่อนไขที่ NHS กำหนดได้อีกด้วย
-----------
[1] พัฒนาขึ้นมาจากการจ่ายเงินในลักษณะที่เรียกว่า Case mix: วิธีการจ่ายเงินแบบ Case mix (เป็นคำที่ใช้ในประเทศอังกฤษ) เป็นวิธีเดียวกับการจ่ายเงินแบบ DRG (เป็นคำที่ใช้ในประเทศอเมริกา)
Thailand Pass สำหรับทั้งคนไทยและชาวต่างประเทศ
ข้อมูลโมเดอร์นาจากสหรัฐ รพ.วิชัยยุทธ
อบจ.อุดรธานี ฉีดเข็มแรก 23 พ.ย. LINK
สอบถามข้อมูลเพิ่มเติมได้ที่ 042-244394 ต่อ 106 กองสาธารณสุข องค์การบริหารส่วนจังหวัดอุดรธานี
อบจ.อุดรธานี ได้ดำเนินการจัดซื้อวัคซีนโมเดอร์นา จำนวน 17 ล้านบาท จากสภากาชาดไทยจำนวน 7,692 โดส
เลือกวิธีรับรูปเล่ม และการชำระเงิน
ลอยกระทง ม.เกษตร (ธานินทร์ คงศิลา) LINK
อบก. นิสิต กองกิจการนิสิต กองยานฯ ทีมงาน ม.เกษตร ทุกส่วนที่เกี่ยวข้อง พยายามดูแลทั้งความปลอดภัย ทำตามมาตราการป้องกันโควิดอย่างเต็มที่ และทำให้ดีที่สุด แต่คนอยากเที่ยว เราก็หยุดคนไม่อยู่ ก็เกษตรเรามีสถานีรถไฟฟ้านี่นา #สายสีเขียว ลอยให้สนุก กลับบ้านปลอดภัย ป้องกันไป รอดปลอดภัยโควิดกันนะครับ
ศูนย์โลหิตในต่างจังหวัด ศูนย์ 2-7 (ภาคกลาง-ตะวันออก-อีสาน)
บริจาคได้ที่ภาคบริการโลหิตแห่งชาติในจังหวัดต่างๆ
สถาบันสุขภาพเด็กแห่งชาติฯ บริการฉีดวัคซีนไฟเซอร์ เพื่อเด็กอายุ 12-18 ปี ลงทะเบียนทาง QR Code เท่านั้น ไม่รับ walk in
สถาบันสุขภาพเด็กแห่งชาติฯ บริการฉีดวัคซีนไฟเซอร์ เพื่อเด็กอายุ 12-18 ปี วันที่ 12,26-27 พฤศจิกายน และวันที่ 3,4,17,18,24,25 ธันวาคม 2564 เวลา 8-15 น.
ผู้สนใจลงทะเบียนทาง QR Code เท่านั้น ไม่รับ walk in
เมลาเนีย ทรัมป์
2 ตุลาคม สุภาพสตรีหมายเลข 1 อายุ 50 ปี ขณะนั้นมีผลตรวจว่าติดโควิดพร้อมกับประธานาธิบดีโดนัลด์ ทรัมป์ เธอเล่าถึงอาการว่า "ปวดร่างกาย ไอและปวดศรีษะ เหนื่อยตลอดเวลา" นอกจากนั้นบารอน ลูกชายวัย 14 ปี ของทั้งคู่ ก็ตรวจพบว่าติดเชื้อเช่นกัน แต่ไม่มีอาการใดๆ
โรงพยาบาลในอุบลราชธานี
รพ.ศูนย์/ทั่วไปในอุบลราชธานี
รพ.ชุมชน (อำเภอ) ในอุบลราชธานี
รพ.เอกชนในอุบลราชธานี
อยากฉีดตัวไหน "เลือกวัคซีน" ได้เลย ติดต่อสถานบริการสาธารณสุขใกล้บ้าน
สูตร SV + AZ + AZ
AZ + MD + MD
PZ + PZ + PZ
โรงพยาบาลเฝ้าไร่ LINK
ติดเชื้อโควิด-19 ทำอย่างไร ต้องการกลับมารักษา ทำอย่างไร ติดต่อมาที่หมายเลขนี้ 095-6700745
FIT Auto ทุกสาขา บริการตรวจเช็ครถเบื้องต้น 35 รายการ ฟรี จองคิวออนไลน์ได้ LINK
บริการตรวจเช็ก 35 รายการ เป็นบริการตรวจเช็กสภาพรถเบื้องต้นของรถคุณ โดยไม่เสียค่าใช้จ่าย ใดๆ ที่ FIT Auto ทุกสาขา
• ระยะดึงเบรกมือ • ระยะฟรีแป้นเหยียบเบรก • ความเร็วรอบเดินเบา • ไส้กรองแอร์ • ใบปัดน้ำฝน และน้ำยาฉีดกระจก • แอร์ • ตรวจสอบแอร์รถยนต์ด้วยกล้องไมโครแคม • หม้อน้ำและฝาหม้อน้ำ • ท่อยางหม้อน้ำและระบบหล่อเย็น • สายพานหน้าเครื่องยนต์ • น้ำมันเครื่อง • ไส้กรองอากาศ • น้ำมันเบรก • แบตเตอรี่และน้ำกลั่น • น้ำมันพวงมาลัยพาวเวอร์ • หัวเทียน • พัดลมระบายอากาศ • สายหัวเทียน/คอยล์จุดระเบิด • น้ำยาแอร์ • ไดชาร์จ • น้ำมันเกียร์ • การสึกหรอของหน้ายาง • ร่องรอยการถูกเบียด รอยกระแทก รอยบาด รูรั่วซึม • ความลึกร่องดอกยาง • ระบบส่องสว่างและไฟสัญญาณ • ยางอะไหล่ • น้ำมันเฟืองท้าย • ยางหุ้มเพลาขับ หน้า-หลัง • ลูกหมากต่างๆ • ลูกปืนล้อ • โช้คอัพและชิ้นส่วนที่เกี่ยวข้อง • บู๊ชและลูกยางช่วงล่างทั้งหมด • สายอ่อนเบรก • จานเบรก • ผ้าเบรก และคาลิปเปอร์
แต่เรายังไม่เคยทำให้ใครตาย
[ชมคลิป] ทำไมต้องจับตาโอมิครอน โดย แพทย์หญิงวรฉัตร เรสลี LINK
ไวรัสโควิดกลายพันธุ์ที่กำลังเป็นที่สนใจตัวล่าสุด ณ ขณะนี้
COVID สายพันธุ์ Omicron (B.1.1.529) หรือเรียกกันว่า “โอมิครอน”
- เพราะอะไรทั่วโลกต่างให้ความสนใจไวรัสสายพันธุ์นี้?
- สายพันธุ์โอมิครอน ถ้าติดแล้วอาการจะรุนแรงไหม?
- จะมาแทนที่สายพันธุ์เดลต้า (Delta) หรือเปล่า?
- เชื้อสายพันธุ์นี้ดื้อต่อวัคซีน ดื้อต่อยาไหม? การวินิจฉัยทำได้อย่างไร?
- เราจะต้องดูแลตัวเองต่างไปจากเดิมอย่างไรบ้าง?
ตอบครบทุกข้อสงสัยในคลิปเดียว โดย แพทย์หญิงวรฉัตร เรสลี
อายุรแพทย์เฉพาะทางโรคติดเชื้อ
เชิญชวนสถานประกอบการในจังหวัดน่าน ร่วมโครงการ COVID Free Setting
จังหวัดน่าน ขอเชิญชวนสถานประกอบการทุกแห่งในจังหวัดน่าน ร่วมใจลงทะเบียนเข้าร่วมโครงการ COVID Free Setting เพื่อป้องกันการแพร่ระบาดของโรคโควิด-19 และสร้างความปลอดภัยสูงสุด ทั้งผู้ใช้บริการ ผู้ให้บริการ และสถานประกอบการ
?เมื่อสมัครลงทะเบียนแล้วสถานประกอบการ จะได้รับสิทธิ ดังนี้
☑เกียรติบัตรรับรองมาตรฐานความปลอดภัย
☑พนักงานได้รับการฉีดวัคซีนโควิด-19
☑พนักงานได้รับการสุ่มตรวจหาเชื้อโควิด-19 ด้วยวิธี ATK ตามกำหนด
☑การปรชาสัมพันธ์สถานประกอบการ
?สนใจรายละเอียดสามารถติดต่อสอบถาม สำนักงานสาธารณสุขจังหวัดน่าน โทร.0984029469 หรือสถานบริการสาธารณสุขใกล้บ้าน หรือสมัครเข้าร่วมโครงการผ่านระบบออนไลน์ได้ตั้งแต่วันนี้เป็นต้นไป
กลุ่มผู้สูงอายุ 60 ปีขี้นไป
กลุ่มผู้สูงอายุ 60 ปีขี้นไป มีสิทธิประโยชน์บริการ ดังนี้ ฉีดวัคซีนคอตีบ บาดทะยัก ตรวจประเมินความสามารถในการทำกิจวัตรประจำวัน (ADL) ตรวจ วัดดัชนีมวลกาย ความดันโลหิต ตรวจเลือดคัดกรองเบาหวาน เอชไอวี คัดกรองปัจจัยเสี่ยงต่อการเกิดโรคหัวใจและหลอดเลือด โรคหลอดเลือดสมอง คัดกรองโรค ซึมเศร้า ตรวจคัดกรองมะเร็ง ลำไส้ใหญ่ (50-70 ปี) การเคลือบฟลูออไรด์ ให้ความรู้ออกกำลังกาย และฝึกสมองป้องกันโรคสมองเสื่อม ให้ความรู้ตรวจเต้านมด้วยตนเอง การให้คำปรึกษาแนะนำด้านสุขภาพ
Zone : 4 ฉายโรคร้าย คลายสงสัย
โซนนี้จะมีการฉายภาพลงไปยังหุ่นจำลองขนาดใหญ่ ให้คุณได้เปรียบเทียบกับร่างกายของตัวเองได้อย่างชัดเจน ซึ่งจะเห็นตั้งแต่การเหี่ยวย่นของผิวหนัง การหักของกระดูก การบาดเจ็บของอวัยวะภายใน และลักษณะการเกิด โรคร้ายต่างๆ อย่างละเอียด ซึ่งจะทำให้คุณเข้าใจในร่างกายของตัวเองมากยิ่งขึ้น และนำไปสู่การดูแลตัวเองในที่สุดครับ
ผลิตภัณฑ์สปาก็ประยุกต์ไปได้
ไทม์ไลน์ ผู้ป่วยยืนยันโอมิครอน รายที่ 2-3 (หมายเลขผู้ป่วย 19158,19159)
ผู้ป่วยยืนยัน COVID-19 จังหวัดสุรินทร์ สายพันธุ์ Omicron รายที่ 2,3 (หมายเลขผู้ป่วย 19158,19159)
- เพศหญิง อายุ 40 ปี อาชีพแม่บ้าน อำเภอกาบเชิง
- เพศชาย อายุ 58 ปี อาชีพธุรกิจส่วนตัว อำเภอกาบเชิง
- ประวัติเสี่ยง : เดินทางกลับจากประเทศเดนมาร์ก
- ผู้สัมผัสเสี่ยงสูง 19 ราย ผู้สัมผัสเสี่ยงต่ำ 2 ราย
ไทม์ไลน์
16 ธ.ค. เดินทางถึงประเทศไทย ตรวจ PCR ทันที ณ สนามบินสุวรรณภูมิ เข้าพักที่ รร.แกรนด์ เซ็นเตอร์พอยต์ เทอมินัล 21 พร้อมลูกชาย 1 โดยรถของโรงแรม
17 ธ.ค. แจ้งผลตรวจครั้งที่ 1 ไม่พบเชื้อ ผลตรวจลูกชาย ไม่พบเชื้อ
18 ธ.ค. 11 น. เดินทางจาก กทม. มาถึงอ.กาบเชิง โดยรถตู้ไม่ประจำทาง ช่วงเย็น 18.30-1.00 น. กินข้าวกับญาติ 19 คน
23 ธ.ค. พาหลานชายไปรพ.เอกชน อ.เมือง สุรินทร์ เนื่องจากมีอาการไข้ ไอ เจ็บคอ ผลตรวจพบเชื้อโควิด
24 ธ.ค. เข้ารักษาที่รพ.กาบเชิง พร้อมส่งตรวจพันธุกรรมหาโอไมครอน เวลา 24 น. รพ.สมิติเวช กรุงเทพนำรถเข้ารับไปรักษา
25 ธ.ค. รพ.กาบเชิง ยืนยันผลตรวจพบโอมิครอน
ถนนสายโรแมนติก ชมพูพันธุ์ทิพย์ จ. กำแพงเพชร
ชมพูพันธุ์ทิพย์ จ. กำแพงเพชร เรียกว่าเป็น ถนนสายโรแมนติกอีกเส้นทางนึง ด้วยสีชมพูของดอกชมพูพันธุ์ทิพย์ บนเส้นทางหลวงชนบทหมายเลข 3010 ถนนบ้านลำมะโกรก-บ้านหนองแผ่นดิน จ.กำแพงเพชร
ติดต่อลงทะเบียนฉีดวัคซีนโควิด 19 โรงพยาบาลในจังหวัดนครสวรรค์
อาการ รู้สึกเพลีย ปวดเมื่อยตัว ปวดกล้ามเนื้อ ส่วนใหญ่ 2-3 วัน อาการจะดีขึ้น ไม่ไอ ไม่มีผลกระทบเรื่องได้กลิ่นรับรส วิธีป้องกัน สวมหน้ากากเวลาพูดคุย หมั่นล้างมือ เลี่ยงการอยู่ในพื้นที่แออัด - Pattaya International Hospital
สปส. กรุงเทพมหานครพื้นที่ 4 LINK
เลขที่ 144/182-2 ซอยสลีม 10 ถนนสลีม แขวงสุริยวงศ์ เขตบางรัก กทม. 10500
** จุดสังเกต : ตรงข้ามธนาคารกรุงเทพสำนักงานใหญ่ **
รับผิดชอบเขต บางรัก ปทุมวัน
Facebook พื้นที่ 4 แผนที่
Tel. 02-6340180-95 , 02-6340973 , 02-6340974 , 02-6340250 , 02-6340251 , 02-6340252 , 02-6340198 , 02-6340199 , 02-6340325 , 02-6340326 , 02-6340971 , 02-6340972
Fax 02-6340196 - 7
ฝ่ายอำนวยการ 02-6340973 - 4
งานสิทธิประโยชน์ทดแทน 02-6340250 - 2
งานการเงินและบัญชี 02-6340198 - 9
งานเงินสมทบ 02-6340325
งานทะเบียนและประสานการแพทย์ 02-6340971 - 2
อยู่ อ.แม่สะเรียง มีอาการ ติดต่อ 053-681027 LINK
เนื่องจากเกิดการแพร่ระบาดโควิด-19 ในเขตอำเภอแม่สะเรียง
ขอความร่วมมือผู้ที่มีอาการทางระบบทางเดินหายใจ
ไข้ - ไอ - น้ำมูก
ให้มารับการตรวจที่คลินิก ARI ของโรงพยาบาล
ในวัน และ เวลาราชการ
ติดต่อ 053-681027
เซอร์เกรกอรี พอล วินเทอร์ (Sir Gregory Paul Winter)
เซอร์เกรกอรี พอล วินเทอร์ (Sir Gregory Paul Winter) ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการแพทย์ ประจำปี 2559 จากการพัฒนาเทคโนโลยีในการสร้าง และดัดแปลงโมเลกุลของแอนติบอดีให้มีประสิทธิภาพสูงและมีความเป็นสิ่งแปลกปลอมลดลง (Antibody Humanization) นำไปสู่ความก้าวหน้าในการพัฒนายา กลุ่มใหม่ จากชีวโมเลกุลซึ่งมีประโยชน์อย่างมากในการรักษาโรค ต่อมาได้รับรางวัลโนเบล สาขาเคมี ประจำปี 2561 จากการพัฒนาเดียวกัน
พื้นที่จัดกิจกรรมกลางแจ้งให้ชมรมต่างๆ สามารถมาขอใช้พื้นที่ทำกิจกรรม เช่น การจัดปาร์ตี้ปิกนิก กินบาร์บีคิวกันได้
ธนาคารเลือด ร.พ.ภูมิพลฯ เปิดรับบริจาคเลือดกรุ๊ป O LINK
เนื่องจากในขณะนี้ เลือดกรุ๊ป O ของ ธนาคารเลือด ร.พ.ภูมิพลอดุลยเดช กรมแพทย์ทหารอากาศ อยู่ในภาวะวิกฤต ขอเชิญชวนผู้มีสุขภาพแข็งแรงร่วมบริจาคโลหิตขอเชิญบริจาคโลหิตในหน่วย ได้ที่ กองบริการโลหิต อาคารศูนย์มะเร็ง ชั้น3 รพ.ภูมิพลอดุลยเดช พอ. เปิดทำการ วันจันทร์ - วันศุกร์ ตั้งแต่เวลา 08.00 -16.00น. ปิดรับบัตรเวลา 15.30น. (ไม่หยุดพักกลางวัน)
สอบถามรายละเอียดเพิ่มเติม หรือต้องการบริจาคโลหิตเป็นหมู่คณะ ติดต่อ 0 2534 7838 หยุดวันเสาร์ - วันอาทิตย์ และวันหยุดนักขัตฤกษ์
โรงพยาบาลปทุมธานี เปิด walk in (โดยไม่ต้องนัด) ถึง 4 กุมภาพันธ์ 2565 LINK
เปิดฉีดวัคซีนโควิดแบบ walk in (โดยไม่ต้องนัด) วันที่ 31 มกราคม ถึง 4 กุมภาพันธ์ 2565 เวลา 13.00-15.00 น. ณ. ลานไทร รพ.ปทุมธานี รับวันละ 500 คน หรือจนวัคซีนหมด
***เริ่มแจกคิวเวลาประมาณ 10.00 น.***
โปรดแสดงหลักฐานการได้รับวัคซีนบนหมอพร้อม และบัตรประชาชนที่จุดบริการ ขอความร่วมมือในการหลีกเลี่ยงการมารอคอยก่อนเวลาแจกบัตรคิวตั้งแต่เช้า เพื่อลดความแออัดภายในโรงพยาบาล และเพื่อให้การบริการอื่นภายใน รพ. สะดวกมากขึ้น ตรวจสอบแนวทางการการให้บริการฉีดวัคซีนเข็ม ที่ 1-4 ได้ตามประกาศ ของทาง รพ. วัคซีนที่มีให้บริการ คือ sinovac, Astra zeneca และ Pfizer
โปรแกรมตรวจสุขภาพสิทธิข้าราชการ อายุน้อยกว่า 35 ปี
รพ.สงขลา LINK
ติดต่อสอบถาม ศูนย์ประสานผู้ป่วยมะเร็ง รพ.สงขลา 074-338100 ต่อ 1204
การวินิจฉัยแยกภาวะสมองเสื่อมชนิด cortical และ ชนิด subcortical
การวินิจฉัยแยกโรคระหว่าง ภาวะสมองเสื่อมชนิด cortical และ ชนิด subcortical มีประโยชน์ในด้านการวินิจฉัยโรคเบื้องต้นด้วยอาการและอาการแสดงก่อนการตรวจเพิ่มเติมทางห้องปฏิบัติการ แพทย์เวชปฏิบัติทั่วไปที่ไม่คุ้นเคยกับการประเมินผู้ป่วย ภาวะสมองเสื่อมสามารถประเมินได้ โดยการตรวจหาอาการแสดงของประสาทที่สั่งการเคลื่อนไหว (motor sign)35,36 ซึ่งประกอบด้วย
- ความตึงของกล้ามเนื้อ (tone) เพิ่มขึ้น
- ปฏิกิริยาสะท้อนกลับเพิ่มขึ้นผิดปกติ (hyperreflexia)
- ความผิดปกติของท่าเดิน เช่น spastic gait, hemiplegic gait, parkinsonian gait เป็นต้น
- ท่าทางที่ผิดปกติ (posture abnormality) เช่น ท่าทางที่โค้งไปด้านหน้า (stooped posture) หรือ ท่าทางที่เหยียดไปด้านหลัง (extended posture)
- การเคลื่อนไหวที่ผิดปกติ (movement disorder) เช่น tremor, chorea, asterixis, dystonia และmyoclonus
- การพูดที่ผิดปกติ (abnormal speech) เช่น เสียงพูดเบาผิดปกติ (hypophonia), พูดไม่ชัด (dysarthria) หรือไม่พูดหรือพูดไม่ได้ (mutism)
อาการแสดงข้างต้นเกิดจากพยาธิสภาพของสมองส่วน corticobulbar tract, corticospinal tract และ extrapyramidal pathway ซึ่งเป็นโครงสร้างส่วน subcortex ดังนั้นผู้ป่วยที่มีอาการแสดงดังกล่าวจึงจัดอยู่ในกลุ่มภาวะสมองเสื่อมชนิด subcortical ผู้ป่วยที่ไม่มีอาการแสดงดังกล่าวจัดอยู่ในกลุ่มภาวะสมองเสื่อมชนิด cortical โรคที่มีอาการเด่นทางด้าน cortical ได้แก่ AD และfrontotemporal dementia (FTD) ในขณะที่โรคอื่นๆ เช่น dementia with Lewy bodies (DLB), hydrocephalus, VaD, Dementia associated with Parkinson’s disease และ ก้อนเนื้องอกของสมอง จะมีอาการเด่นทางด้าน subcortical มากกว่า อย่างไรก็ตาม การประเมินโดยวิธีนี้อาจไม่ตรงกับพยาธิวิทยาของโรคที่แท้จริงได้ เนื่องจากทุกโรคมีความผิดปกติของสมองทั้งส่วน cortical และ subcortical ได้ ตัวอย่างเช่น AD มีการสูญเสียของเซลล์ประสาทที่ basal forebrain และ locus ceruleus ด้วย ซึ่งเป็นโครงสร้างส่วน subcortical หรือ FTD บางชนิดก็มีความผิดปกติของโครงสร้างส่วน subcortical เป็นต้น
ผลิตภัณฑ์บรรเทาอาการปวด
ผลิตภัณฑ์บรรเทาอาการปวด
- พลาสเตอร์บรรเทาปวดตราเสือ (สูตรเย็น) จำนวน 1 แผ่น (10 ชม. x 7 ชม.)
- ยาหม่องตราเสือ สูตรคลาสสิก 10 กรัม
- AMMELTZ YOKO YOKO HEAT PATCH GOLD แผ่นประคบร้อน บรรเทาอาการปวดประจำเดือน จำนวน 1 แผ่น
- 3M Nexcare Cold/Hot Pack Mini อุปกรณ์ประคบเย็นและร้อน จำนวน 2 ชิ้น พร้อมถุงผ้า
การรักษาแบบบูรณาการองค์รวม LINK
การรักษาแบบบูรณาการองค์รวม
“INTEGRATED CARE SERVICES: VALUE BEYOND EXCELLENCE”
การรักษาแบบบูรณาการองค์รวม หรือ “Integrated Care Services” เป็นหลักการสำคัญเพื่อให้บริการทางการแพทย์ที่มีประสิทธิภาพ โดยเน้นการดูแลและรักษาผู้ป่วยแบบบูรณาการ ครอบคลุมทั้งทางด้านร่างกายและจิตใจ การดูแลผู้ป่วยแบบบูรณาการองค์รวมมีความสำคัญอย่างยิ่ง โดยเฉพาะในผู้ป่วยที่มีโรคประจำตัวหลักหรือโรคร่วมที่มีความซับซ้อนและส่งผลต่อคุณภาพชีวิต เช่น โรคทางระบบสมองและประสาท โรคระบบกระดูกและข้อ เป็นต้น
“การให้การดูแลผู้ป่วยแบบบูรณาการองค์รวมที่โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนล” เป็นการให้บริการดูแลรักษาผู้ป่วยแบบ One – Stop Care Center เพียบพร้อมไปด้วยการดูแลจากทีมแพทย์สหสาขาวิชา โดยมีแพทย์ผู้ชำนาญการครอบคลุมทุกสาขาสำหรับการดูแลผู้ป่วยแต่ละรายแบบองค์รวมทุกระบบโรค โดยจะประเมินปัญหาทางด้านสุขภาพอื่น ๆ ร่วมกับวางแผนการรักษาอย่างมีประสิทธิภาพ ป้องกันผลข้างเคียงจากการรักษา และสอดคล้องกับการรักษาโรคหลักของผู้ป่วยรายนั้น ๆ
การบำบัดรักษาด้วยระบบจิตเวชทางไกล Telepsychiatry
ทั้งนี้ กรมสุขภาพจิตได้ดำเนินการเพิ่มศักยภาพในการบำบัดรักษาผู้ป่วยไบโพลาร์ด้วย ‘ระบบจิตเวชทางไกล’ หรือ ‘Telepsychiatry’ ซึ่งเป็นการใช้เทคโนโลยีในสถาบันและโรงพยาบาลจิตเวชทั้ง 20 แห่งทั่วประเทศ โดยมีแผนจะขยายบริการในเครือข่ายอื่นๆ ให้ครอบคลุมมากที่สุด สำหรับรูปแบบการให้บริการตรวจรักษาทางไกลนี้ครอบคลุมทุกการรักษาในทุกด้านอันเป็นประโยชน์ต่อผู้ป่วย ประกอบด้วย การให้คำปรึกษาตรวจวินิจฉัยโดยจิตแพทย์ บริการให้คำปรึกษาเรื่องยาจิตเวชทางไกลโดยเภสัชกร บริการให้คำปรึกษาทางสุขภาพจิตและจิตเวช จิตบำบัดทางไกลโดยนักจิตวิทยาคลินิก บริการเยี่ยมบ้านทางไกลและบริการสังคมสงเคราะห์ทางไกลโดยนักสังคมสงเคราะห์ บริการให้การฟื้นฟูสมรรถภาพโดยทีมฟื้นฟูสมรรถภาพ โดยในอนาคตกรมสุขภาพจิตจะดำเนินการพัฒนาระบบบริการอย่างต่อเนื่องเพื่อให้เข้าถึงกลุ่มผู้ป่วยไบโพลาร์อย่างทั่วถึง ส่งผลต่อคุณภาพชีวิตที่ดีขึ้น หมายเหตุ
ㆍการพิจารณาอนุมัติ Thailand Pass ใช้เวลา 3-7 วัน
ㆍยกเลิกการตรวจ RT-PCR ก่อนเดินทางเข้าไทย แต่ผู้เดินทางต้องตรวจสอบข้อกำหนดของแต่ละสายการบิน / ประเทศที่แวะเปลี่ยนเครื่อง (transit)
กรณีมีคำถามเพิ่มเติม โปรดติดต่อกรมการกงสุล โทร 02-572-8442 (24 ชั่วโมง)
หรืออีเมล testgo@consular.go.th และสามารถอ่าน FAQs (คำถามที่พบบ่อย)
บนเว็บไซต์ www.consular.mfa.go.th และ tp.consular.go.th
Remark
• Processing time for Thailand Pass is 3-7 days
• Pre-departure RT-PCR test for entry into Thailand is no longer required.
However, travelers are advised to verify airline policies and entry requirements of transiting countries.
For further inquiries, please contact the Department of Consular Affairs (DCA)
Tel. (66) 02-572-8442 (24 hours) or Email: testgo@consular.go.th
Please refer to the FAQs at www.consular.mfa.go.th and tp.consular.go.th for additional information.
"วันเดย์ โซลูชัน" ตอบโจทย์ชีวิตยุค 5G
ทพ.กิตติพงศ์ บูรณะโสภณ ผู้ช่วยผู้อำนวยการคลินิกทันตกรรม บีดีเอ็มเอส เวลเนส คลินิก กล่าวว่า วิถีชีวิตของคนในยุคปัจจุบันที่เร่งรีบ ประกอบกับการเฝ้าระวังโควิด-19 ทำให้คนจำนวนมากกังวลกับการไปทำฟันที่คลินิก อยากทำฟันให้เสร็จเร็วในจำนวนครั้งที่น้อยที่สุด ครอบฟันที่ปกติใช้เวลาประมาณ 7 วัน โดยที่คนไข้จะต้องมีครอบฟันแบบชั่วคราวอยู่ในปาก ฉะนั้นยิ่งสามารถลดเวลาทำฟันลงได้เร็วแค่ไหนยิ่งมีความปลอดภัยมากขึ้นเท่านั้น บริการแบบ “วันเดย์ โซลูชัน” จึงเข้ามาตอบโจทย์ผู้รับบริการที่มีเวลาน้อย ต้องการแก้ปัญหาในช่องปากอย่างรวดเร็ว รวมทั้งชาวต่างประเทศที่เดินทางเข้ามาใช้บริการทันตกรรม
ทั้งนี้ “วันเดย์ โซลูชัน” ครอบคลุมถึงการบริการ อุดฟัน ซึ่งปกติจะใช้อมัลกัม (Amalgam) วัสดุสีเงินเป็นโลหะเจือกับปรอทใช้ในการอุดฟัน ซึ่งเป็น Direct Method ทำกับการอุดฟันใหญ่ๆ ได้ยากและใช้เวลานาน การใช้ Onlays/Inlays ซึ่งเป็น Indirect Method คือทำชิ้นงานให้เสร็จก่อนจึงนำเข้าไปติดในโพรงฟัน จึงเป็นการแก้ปัญหาวัสดุอุดขนาดใหญ่และสามารถใช้งานได้ในทันที
เกษมราษฎร์ ประชาชื่น บริการตรวจหาเชื้อโควิด-19 พร้อมรับรักษา ในช่วงเทศกาลสงกรานต์ เป็นปกติ ไม่มีวันหยุด
โรงพยาบาลเกษมราษฎร์ ประชาชื่น เปิดให้บริการตรวจหาเชื้อโควิด-19 พร้อมรับรักษา ในช่วงเทศกาลสงกรานต์ เป็นปกติ #ไม่มีวันหยุด เปิดให้บริการตั้งแต่ เวลา 08.00 - 15.00 น. (พัก 12.00 น. ) ไม่ต้องจองล่วงหน้า สามารถ walk in ได้เลย "ดูแลใกล้ชิด สนิทเหมือนญาติ" สอบถามโทร : 02-910-1600 ต่อ 0
ตรวจ Long Covid รพ.เทพธารินทร์ ราคาเริ่มต้น 2,999
โรงพยาบาลเทพธารินทร์ แนะนำแพ็คเกจตรวจสุขภาพ Long Covid สำหรับผู้ผ่านการติดเชื้อโควิด-19 ราคาเริ่มต้น 2,999. เป็นการตรวจอาการที่ผู้ป่วยโควิด-19 มักพบภายหลังจากการรักษาหายแล้ว ซึ่งอาการที่เกิดขึ้นมีความหลากหลาย และอาจแตกต่างกันไปในแต่ละบุคคล โดยอาจเป็นอาการที่เกิดขึ้นใหม่หรือเป็นอาการที่หลงเหลืออยู่หลังรักษาหาย
ระยะเวลาโปรโมชั่น ตั้งแต่วันนี้ - 31 ธันวาคม 2565 สอบถามเพิ่มเติม 02 348 7000 ต่อ 3215, 3216
โรงพยาบาลเปาโล เกษตร ร่วมกับโรงแรมมารวย การ์เด้นท์ เปิดให้บริการ Hospitel LINK
โรงพยาบาลเปาโล เกษตร ร่วมกับโรงแรมมารวย การ์เด้นท์ เปิดให้บริการ Hospitel สำหรับผู้ประกันตนที่มีผลตรวจ ATK 2 ขีด เปิดลงทะเบียนเวลา 08.00 รับจำนวนจำกัด (โรงพยาบาลแจ้งยืนยันเข้ารับการรักษาให้ทราบผ่าน SMS) หมายเหตุ : หากคิวเต็มจำนวน ท่านจะไม่สามารถลงทะเบียนได้ กรุณาติดต่อลงทะเบียนใหม่ในวันต่อไป สอบถาม โทร.02-1500-900
โรงพยาบาลลาดพร้าว บริการวัคซีน MODERNA 1 เข็ม1,290 บาท
โรงพยาบาลลาดพร้าว บริการวัคซีน MODERNA : 1 เข็ม..1,290 บาท WALK IN ตั้งแต่วันที่ 1 - 12 เมษายน 2565 เท่านั้น เปิดบริการทุกวัน เวลา 08.00-16.00 น. สอบถามโทร 0-2530-2556
วัคซีนป้องกันโรคพิษสุนัขบ้า 5 เข็ม โรงพยาบาลขอนแก่นราม
โรงพยาบาลขอนแก่นราม บริการ วัคซีนป้องกันพิษสุนัขบ้า (Rabies Vaccination) วัคซีนนี้ต้องฉีด 5 เข็ม Verorab vaccine หรือ Speeda vaccine
* ราคายังไม่รวมค่าแพทย์และค่าบริการ
*ราคาอาจมีการเปลี่ยนแปลงโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
โทร 043-002-002 043-239-000
แพทย์ผู้เชี่ยวชาญท่านที่สาม : ผู้ช่วยศาสตราจารย์วุฒิคุณ นายแพทย์ ตนุพล วิรุฬหการุญ (หมอแอมป์) (Adj Asst Prof Tanupol Virunhagarun, MD Bangkok, Thailand)
แพทย์ผู้เชี่ยวชาญท่านที่สาม ผู้ช่วยศาสตราจารย์วุฒิคุณ นายแพทย์ ตนุพล วิรุฬหการุญ (หมอแอมป์) (Adj Asst Prof Tanupol Virunhagarun, MD Bangkok, Thailand) ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน (Preventive Medicine) ดูแลคนไข้ในการดูแลฟื้นฟูสุขภาพ ด้านการลดน้ำหนักและควบคุมโรคอ้วนที่มีความมุ่งมั่นที่จะดูแลผู้ป่วยทำให้เรื่องควบคุมน้ำหนักไม่ใช่เรื่องยากสำหรับการดูแลสุขภาพ
คุณหมอแอมป์เป็นผู้ที่ให้ความสำคัญกับการขับเคลื่อนและกระตุ้นให้ประชาชนคนไทยเกิดความตระหนัก และสนใจในการดูแลสุขภาพในเชิงป้องกันโรคมากขึ้น โดยการให้ความรู้ผ่านทางการบรรยาย และช่องทางสื่อออนไลน์ อาทิ Facebook : Dr Amp Team, Instagram : DrAmp Team, Spotify : Dr.Amp Team, YouTube : DrAmp Team, Website : www.dramp.com เพื่อให้คนได้ปฏิบัติกัน ปัจจุบันมีผู้ติดตาม มากกว่า 750,000 คน
อีกทั้ง ยังเป็นเจ้าของผลงานหนังสือ Best Seller อีกหลายเล่ม อาทิ เคล็ดลับชะลอวัย ห่างไกลโรค, กินดี อยู่นาน คือของขวัญชีวิต, สุขภาพดีอายุ 100 ปี คุณก็มีได้, นอนถูกวิธี สุขภาพดีตลอดชีวิต
อ.น้ำขุ่น รพ.-สสจ.น้ำขุ่น และรพ.สต.
กรุงเทพยังคงติดเชื้อมากที่สุด และมีผู้ป่วยปอดอักเสบมาที่สุด
ประชาชนในพื้นที่ อ.นิคมพัฒนา ติดต่อ รพ.ต่างๆ ดังนี้
วันที่ 14 เม.ย.65 - บาดเจ็บ 5 ราย เสียชีวิต 3 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 14 เม.ย.65) เกิดอุบัติเหตุ 5 ครั้ง บาดเจ็บ 5 ราย เสียชีวิต 3 ราย (อ.ตาพระยา 2 ราย ,อ.อรัญประเทศ 1 ราย)
สะสม 4 วัน (11-14 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 15 ครั้ง บาดเจ็บ 14 ราย เสียชีวิต 5 ราย (อ.วังสมบูรณ์ 1 ราย อ.วัฒนานคร 1 ราย อ.ตาพระยา 2 ราย ,อ.อรัญประเทศ 1 ราย)
.
“ชีวิตวิถีใหม่ ขับขี่อย่างปลอดภัย ไร้อุบัติเหตุ”
14.การใช้หรือเปิดเผยข้อมูลส่วนบุคคล
ศูนย์ตรวจการนอนหลับศิริราชกาญจนา และคลินิกนอนกรน คณะแพทย์ศาสตร์ศิริราชพยาบาล LINK
ศูนย์ตรวจการนอนหลับศิริราชกาญจนา และคลินิกนอนกรน คณะแพทย์ศาสตร์ศิริราชพยาบาล ให้บริการตรวจวิเคราะห์ รักษาความผิดปกติจากการนอนหลับ
แพทย์เฉพาะทาง
รศ.นพ.วัฒนชัย โชตินัยวัตรกุล
อ.พญ.ษรินทร์ รุ่งมณี
อ.พญ.ชวนนท์ พิมลศรี
พญ.ศิริลักษณ์ ผลศิริปฐม
นพ.นพดล ตรีประทีปศิลป์
สอบถามเพิ่มเติม
ศูนย์ตรวจการนอนหลับกาญจนาภิเษก โทร. 061-384-9154
เปิดให้บริการทุกวัน เวลา 8.00 - 20.00 น.
คลินิกโสต ศอ นาสิก ลาริงซ์ (ENT) โทร. 02-849-6600 ต่อ 2571-2574
เปิดบริการ วันจันทร์ - ศุกร์ เวลา 9.00 - 16.00 น.
Line @sleeplabgi
Facebook
facebook.com/sleeplabgj/
บริษัทประกันที่เป็นคู่สัญญา LINK
เพื่อความสะดวก ก่อนการเข้ารับบริการ กรุณาตรวจสอบเงื่อนไขความคุ้มครองของบัตร สอบถามเพิ่มเติม โทร.0 4437 6555
เงื่อนไขและข้อยกเว้นกรมธรรม์โดยทั่วไป
1.เมาสุรา
2.ถูกทำร้ายร่างกาย
3.รักษาเกี่ยวกับหลัง ยกเว้นมีการแตกหักของกระดูก
4.ทะเลาะวิวาท
5.รักษารากฟัน/ใส่ฟันปลอม
6.แท้งบุตร
รายการที่ไม่คุ้มครอง
1.กลุ่มยานอนหลับ คลายเครียด
2 .กลุ่มเวชสำอางค์
3.กลุ่มยาบำรุง เช่น วิตามินต่างๆ,Centrum, Celvista, Viartril-S ,Artroda,Glakay เป็นต้น
4.Cast comfort
5 ยาทาป้องกันการเกิดแผลเป็น หรือลบรอยแผลเป็น เช่น Scar Gell
กลุ่มเวชภัณฑ์
1 เวชภัณฑ์สิ้นเปลือง เช่น Cold Hot Pack,Pampers,ชามรูปไต,ป้ายข้อมือ,แก้วยา,กะละมังแช่ก้น
2.เวชภัณฑ์ 2 เช่น Support ต่างๆ (LS-support,knee support เป็นต้น)
*โปรดโทรนัดหมายและยืนยันวันออกตรวจของแพทย์กับพยาบาลก่อนรับการตรวจทุกครั้ง
ติดต่อสอบถามข้อมูลโรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี 044-376555
รายชื่อบริษัทคู่สัญญา
1. บริษัท เอไอเอ จำกัด (มหาชน)
2. บริษัท อลิอันซ์ อยุธยา ประกันชีวิต จำกัด (มหาชน)
3.บริษัท เอฟดับบลิวดี ประกันชีวิต จำกัด (มหาชน)
4. บริษัท บูพา ประกันสุขภาพ(ประเทศไทย) จำกัด
5. บริษัท กรุงเทพประกันชีวิต จำกัด(มหาชน)
6. บริษัท เมืองไทยประกันชีวิต จำกัด (มหาชน )
7. บริษัท ไทยประกันชีวิต จำกัด (มหาชน)
8. บริษัทวิริยะประกันภัย จำกัด (มหาชน)
9. บริษัท กรุงไทยแอกซ่า ประกันชีวิต จำกัด( มหาชน)
10. บริษัทแอกซ่าประกันภัย จำกัด (มหาชน)
11. บริษัท เจนเนอราลี่ประกันชีวิต (ประเทศไทย)
12. บริษัท เมืองไทยประกันภัย จำกัด(มหาชน)
13. บริษัท ทิพยประกันชีวิต จำกัด(มหาชน)
14. บริษัท ทิพยประกันภัย จำกัด (มหาชน)
15. บริษัท ศรีอยุธยา เจนเนอรัล ประกันภัย จำกัด(มหาชน)
16. บริษัท สมโพธิ์เจแปน นิปปอนโคอะประกันภัย
17. บริษัท ธนชาตประกันภัย จำกัด (มหาชน)
18. บริษัท โตเกียวมารีน ประกันชีวิต(ประเทศไทย) จำกัด
19. บริษัท โตเกียวมารีน ประกันภัย (ประเทศไทย )
20. บริษัท อลิอันซ์ ซี.พี. ประกันภัย จำกัด(มหาชน)
21. บริษัท นวกิจประกันภัย จำกัด (มหาชน)
22. บริษัท คิวบีอี ประกันภัย จำกัด (มหาชน)
23.บริษัท ไทยศรีประกันภัย จำกัด (มหาชน)
24. บริษัท เอชไลฟ์ แอสชัวรันส์ จำกัด (มหาชน)
25. บริษัท ไทยประกันภัย จำกัด(มหาชน)
26. บริษัท แมนูไลฟ์ ประกันชีวิต จำกัด (มหาชน)
27. บริษัท พรูเด็นเชียล ประกันชีวิต (ประเทศไทย)
28. บริษัท ประกันชีวิตนครหลวงไทย
29. บริษัท กรุงเทพประกันภัย จำกัด (มหาชน)
30. บริษัท เวสเทิร์น ดิจิตอล จำกัด (ประเทศไทย)
เกณฑ์พิจารณา ส่งต่อเข้าโรงพยาบาล
แนวทางปฏิบัติเมื่อต้องแยกกักตัวที่บ้าน
5.แกนกัญชง มอก. 3185-2564
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3185-2564
ชื่อ มอก. : แกนกัญชง
TIS NAME : Hemp hurd
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 8 กันยายน 2564
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 138ตอน พิเศษ 211 งวันที่ 8 กันยายน 2564
ประกาศกระทรวง : ฉบับที่ 6204วันที่ 30 มีนาคม 2564
เอกสารฉบับเต็ม
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานนี้ครอบคลุมแกนต้นกัญชงที่มาจากต้นกัญชงที่เป็นไปตามที่กฎหมายกำหนดและได้รับอนุญาตให้ผลิตภายในประเทศเพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม
Abstract : This standard covers hemp hurd derived from hemp that are legally required and licensed for domestic production for industrial use.
4.Mobile Medical Unit รถสุขภาพเชิงรุก ตรวจถึงชุมชน
ประโยชน์คนกรุงฯ
- ลดภาระค่าใช้จ่ายในการเดินทางระยะไกล ลดเวลาในการเดินทาง และลดความแออัดในสถานพยาบาลโดยไม่จำเป็น
- ยกระดับการเข้าถึงการรักษาพยาบาลคุณภาพดีใกล้บ้านในระดับเส้นเลือดฝอย
รายละเอียด
รถตรวจเชิงรุกชุมชน สุขภาพดีวิถีใหม่ - ช่วยเสริมประสิทธิภาพการทำงานของเจ้าหน้าที่ทางการแพทย์และอาสาสมัครสาธารณสุขกรุงเทพฯ (อสส.) และยกระดับการเข้าถึงการส่งเสริมสุขภาพป้องกันโรคของหน่วยแพทย์เคลื่อนที่ สาธารณสุขชุมชน และหน่วยตรวจเคลื่อนที่ไปยังสถานศึกษา
เจ้าหน้าที่ทางการแพทย์และพยาบาลสามารถตรวจวินิจฉัยโรคเบื้องต้น ตรวจวัดค่าสัญญาณชีพ (vital signs) ตรวจวัดมวลกล้ามเนื้อและองค์ประกอบของร่างกายเพื่อดูเรื่องโภชนาการ เจาะเลือดส่งตรวจ เอ็กซเรย์ รวมถึงจ่ายยาสามัญพื้นฐานให้แก่ประชาชนด้วยความสะดวกรวดเร็ว
นอกจากนี้ ในตัวรถยังติดตั้งอุปกรณ์เทคโนโลยีดิจิทัล (digital device) เพื่อเชื่อมต่อบริการทางการแพทย์ผ่านระบบ telemedicine ด้วยอุปกรณ์รับ-ส่งสัญญาณคุณภาพสูงระบบ 5G ให้ประชาชนและเจ้าหน้าที่ด่านหน้าได้รับคำปรึกษาหรือวินิจฉัยโรคจากจากแพทย์ผู้เชี่ยวชาญ
การบริการภายใต้ตัวรถ mobile unit ที่ทันสมัย ตลอดจนมีพื้นที่ปิดมิดชิด ส่งผลให้การซักถามอาการโรคหรือการตรวจคัดกรองเบื้องต้นมีประสิทธิภาพมากยิ่งขึ้น เช่น การตรวจคัดกรองมะเร็งเต้านมในสตรี
เป้าหมายเพื่อให้ประชาชนคนกรุงเทพฯ เข้าถึงสวัสดิการด้านการตรวจคัดกรองสุขภาพพื้นฐาน ซึ่งไม่มีค่าใช้จ่ายและเป็นสิทธิของประชาชนทุกคนที่จะได้รับการบริการสาธารณสุขคุณภาพดี
หมวด ฉ. (ต่อ) หมวด ช. ซ. ด.
เทคนิคการเลือกซื้อผลิตภัณฑ์อาหารที่ดีต่อสุขภาพ
วิธีที่ผู้ป่วยโรคไตหรือทุกคนที่รักสุขภาพสามารถทำตามได้ คือการอ่านฉลากโภชนาการทุกครั้งก่อนซื้อสินค้า โดยสิ่งที่ต้องพิจารณาเป็นหลัก คือ ปริมาณพลังงาน โปรตีน ไขมัน และเกลือแร่เมื่อเทียบกับปริมาณที่แนะนำให้รับประทานต่อวัน ทั้งนี้ หากตัวเลขดังกล่าวสูงเกินไปสำหรับผู้สูงวัย หรือผู้ป่วยบางท่าน อาจพิจารณาตัวเลขจำนวนหน่วยบริโภคต่อผลิตภัณฑ์เพิ่มเติม เพื่อลดหรือปรับจำนวนอาหารให้เหมาะสมได้
แต่หากใครที่ต้องการวิธีที่ง่ายและสะดวกยิ่งกว่านั้น สามารถมองหาตราสัญลักษณ์ทางเลือกสุขภาพ ที่เป็นการแสดงว่าผลิตภัณฑ์อาหารนั้นได้ผ่านเกณฑ์การพิจารณาแล้วว่า มีปริมาณน้ำตาล ไขมัน และโซเดียมที่เหมาะสม เพื่อเป็นการลดหวาน มัน เค็ม ที่เป็นการลดปัจจัยเสี่ยงต่อการเกิดโรคไม่ติดต่อเรื้อรังได้เช่นกัน
4.ทัศนคติต่อปัจจัยสำคัญ
เปรียบเทียบกับคราวก่อน (เดือนกุมภาพันธ์ 65)
- ครอบครัว 28% (ลดลง 4%)
- สุขภาพ 28% (เพิ่มขึ้น 4%)
- ความมั่งคั่ง 13% (เพิ่มขึ้น 2%)
- การงาน 11% (ลดลง 1%)
- ความปลอดภัย 6%
*ตัดหมวดความสัมพันธ์ 5% ออก
ข้อมูลนี้บอกอะไร
ครอบครัว แม้คะแนนจะลดลงแต่ยังสำคัญที่สุด โดยเฉพาะคนอายุ 50-59 ปี ที่มองว่าครอบครัวคือหัวใจ อยากใช้เวลากับครอบครัว เน้นความสุขจากในบ้านและลูกหลาน
ความมั่งคั่ง ด้วยสถานการณ์เศรษฐกิจของประเทศไทยในตอนนี้ ทุกอย่างราคาแพงขึ้น สวนทางกับรายได้ที่หาได้ยากกว่าเดิม นึกถึงความมั่งคั่งมากกว่าความมั่นคงในหน้าที่การงาน อยากเปิดรับโอกาสใหม่ๆ เพื่อทำให้มีรายได้มากขึ้นจากหลากหลายช่องทาง
ความปลอดภัย สถานการณ์ในช่วงนี้รู้สึกว่าอันตรายอยู่รอบตัวเรา จึงต้องปลอดภัยไว้ก่อน ต้องเซฟตัวเองจากอันตรายต่างๆ ไม่ว่าจะเป็นจากโควิดหรือโจรที่เยอะขึ้นจากข้าวของที่แพงขึ้น
สุขภาพ คนอายุ 40-49 ปี ให้ความสำคัญเรื่องนี้มากขึ้นอย่างชัดเจน (33% เพิ่มขึ้นจาก 25% ) เพราะอายุมากขึ้นต้องดูแลตัวเอง รวมไปถึงสถานการณ์ที่มีโรคระบาดร้ายแรง ถ้าสุขภาพไม่ดีอาจมีค่าใช้จ่ายสูงและยังหมดกำลังใจ จะส่งผลให้ทุกอย่างแย่ไปด้วย
ภาวะวิกฤตที่เกิดขึ้น หัวใจ นับเป็นอวัยวะหนึ่งที่เกิดภาวะวิกฤตขึ้นได้ตลอดเวลา ไม่เลือกสถานที่ ยิ่งในสภาวการณ์ปัจจุบันของประชากรในประเทศไทย ที่มีคนก้าวเข้าสู่สังคมสูงวัยมากขึ้น จึงทำให้มีสัดส่วนของคนไข้ที่เป็นโรคหัวใจมากขึ้นเรื่อย ๆ เป็นเงาตามตัว ตามสัดส่วนแล้วผู้ชายจะเริ่มเป็นโรคหัวใจได้เร็วกว่าผู้หญิง โดยจะเริ่มตั้งแต่อายุ 40 ปี ขึ้นไป ในขณะที่ ด้วยสรีระ ฮอร์โมน กายภาพของผู้หญิงทำให้ปกป้องร่างกายของผู้หญิงได้ดีกว่า จึงทำให้ผู้หญิงกว่าจะเริ่มเป็นโรคหัวใจจริงๆ จะเห็นได้ในวัย 60 ปีขึ้นไป
"ในปัจจุบันการทำงานมีความเครียดมากขึ้น มีการแข่งขันกันสูง รวมทั้ง อาหารการกินที่หันเหไปรับประทานเลียนแบบชาติทางตะวันตกมากขึ้น ทำให้ร่างกายมีไขมันเพิ่มขึ้น อีกทั้ง การกินดีอยู่ดีของประชากรไทยในบางส่วนที่พอทำงานหนักก็อยากจะรับประทานมากขึ้นซึ่งมีผลต่อหลอดเลือดและหัวใจ ทำให้ทุกวันนี้เราเห็นคนไข้ที่เป็นโรคหัวใจเพิ่มขึ้น"
เด็กตั้งแต่แรกเกิดจนถึงอายุ 15 ปี โรคหัวใจที่พบจะเป็นโรคหัวใจแต่กำเนิด ซึ่งหลีกเลี่ยงและแก้ไขไม่ได้ โดยในเด็กเกิดใหม่ 100 คน จะมี 0.5-1 % ที่มีความผิดปกติของหัวใจโดยกำเนิดในรูปแบบใดรูปแบบหนึ่ง ปัจจุบันเด็กเกิดน้อยลงอัตราการเกิดของโรคก็น้อยลงไปด้วยตรงกับข้ามกับผู้ใหญ่ที่มีอายุเฉลี่ยสูงขึ้นตามวัยก็จะพบการอุบัติของโรคหัวใจเพิ่มขึ้นเรื่อย ๆ
ส่วนประชากรไทยที่มีอายุ 15- 40 ปี วัยกลางๆ จะเจอโรคลิ้นหัวใจรูมาติกค่อนข้างมาก ซึ่งเป็นธรรมดาของประเทศกำลังพัฒนาที่จะเจอกับปัญหานี้ด้วยกันทั้งนั้น โดยโรคลิ้นหัวใจรูมาติกเกิดจากการรับยาฆ่าเชื้อที่ไม่เพียงพอ มีการติดเชื้อแบคทีเรียบางชนิดทำให้มีปฏิกิริยาต่อร่างกาย ต่อลิ้นหัวใจ ซึ่งการเกิดของโรคจะใช้เวลาเป็นสิบๆ ปี และมักจะแสดงอาการในช่วงอายุ 30-40 ปี ก็เลยทำให้ลิ้นหัวใจเสียหายจนกระทั่งใช้งานไม่ได้ หากเป็นมากก็ต้องเปลี่ยนลิ้นหัวใจ โดยในแต่ละปีทั่วประเทศไทยจะมีผู้ป่วยเปลี่ยนลิ้นหัวใจประมาณ 3-4 พันคน
ส่วนในวัย 50 ปีขึ้นไป จะไปเน้นหนักที่ โรคหลอดเลือดหัวใจตีบ ด้วยอายุที่มากขึ้น ร่วมกับ การสูบบุหรี่ หรือมีประวัติเป็นโรคเบาหวาน มีประวัติไขมันสูง มีประวัติหลอดเลือดเสื่อม ก็จะส่งผลทำให้หลอดเลือดหัวใจตีบ พอหลอดเลือดหัวใจตีบเลือดไปเลี้ยงกล้ามเนื้อหัวใจไม่ได้ กล้ามเนื้อหัวใจก็ตาย ถ้าไปตีบในตำแหน่งที่สำคัญมากๆ เป็นทางหลัก ก็จะไม่มีเลือดไปเลี้ยงหัวใจทั้งแถบ คนไข้ก็จะเสียชีวิตทันที รวมทั้ง ความเสื่อมของร่างกาย หากไม่เป็นโรคของลิ้นหัวใจตีบในช่วงนี้ก็จะไปเป็นในวัย 70-80 ปี สืบเนื่องมาจากความเสื่อมของร่างกาย โดย 2-3% ของประชากรวัย 70 ปีขึ้นไป จะเป็นโรคนี้
โครงการช่วยเหลือผู้ป่วยติดเตียง โทร.02-2402951-52 LINK
โครงการช่วยเหลือผู้ป่วยติดเตียง โดย สำนักอนามัย กทม. และมูลนิธิช่วยการสาธารณสุขชุมชนฯ ช่วยเหลือผู้ป่วยและผู้สูงอายุติดเตียง ด้วยการสนับสนุนชุดวัสดุอุปกรณ์คลายทุกข์แก่ผู้ป่วย ได้แก่ แผ่นรองซับ วัสดุอุปกรณ์ และสิ่งจำเป็นสำหรับผู้ป่วยติดเตียง เพื่อเยียวยาช่วยเหลือผู้ป่วย และครอบครัวผู้ป่วยให้มีคุณภาพชีวิตที่ดีขึ้น
ติดต่อสอบถามรับความช่วยเหลือได้ที่ โทร.02-2402951 02-2402952
อาจารย์ แพทย์หญิงจริยา ภูดิศชินภัทร
อาจารย์ แพทย์หญิงจริยา ภูดิศชินภัทร ภาควิชาเวชศาสตร์ป้องกันและสังคม คณะแพทยศาสตร์ศิริราชพยาบาล กล่าวถึง กรณีศึกษาฤทธิ์ของสารในกัญชาในอาหารและอาการพิษจากการใช้กัญชา ว่า
จากกรณีศึกษา ผู้ที่ประทานคุกกี้มีที่ปริมาณสาร THC อยู่ที่ 0.109 mg/g และสาร CBD อยู่ที่ 0.045 mg/g หลังจากรับประทานไป 1 ชั่วโมง คนที่หนึ่ง มีอาการมึนศีรษะ หัวใจเต้นแรง รู้สึกเท้าไม่ติดพื้น ตัวลอย เห็นตัวเองมีหลายคน รู้สึกเวลาผ่านไปเร็ว รู้สึกกึ่งหลับกึ่งตื่นตลอดเวลา เป็นอยู่ประมาณ 4 ชั่วโมง สุดท้ายต้องเข้าโรงพยาบาล และอีกสองคน มีอาการน้อยกว่าคนแรก มีอาการเวียนหัว คลื่นไส้ รู้สึกใจสั่นซึ่งในคุกกี้ มีสาร THC อยู่เพียงร้อยละ 0.0109 เท่านั้น
โดยจากประกาศของกระทรวงสาธารณสุข เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ. 2565 ระบุว่า สารสกัดจากทุกส่วนของพืชกัญชา หรือกัญชง ซึ่งเป็นพืชในสกุล Cannabis ยกเว้น สารสกัดดังต่อไปนี้ สารสกัดที่มีปริมาณสารเตตราไฮโดรแคนนาบินอล (THC) ไม่เกินร้อยละ 0.2 โดยน้ำหนัก เฉพาะที่ได้รับอนุญาตให้สกัดจากพืชกัญชาหรือกัญชงที่ปลูกภายในประเทศ จะเห็นได้ว่าคุกกี้ร้านนี้ มีปริมาณสาร THC น้อย แต่ทำให้คนไข้ มีผลกระทบทางด้านร่างกายด้วยเช่นกัน
โดยในอนาคต หากไม่สามารถหลีกเลี่ยงในการใช้สารที่มีส่วนผสมของกัญชา ควรจะต้องมีการทำการวิจัย และศึกษาหาข้อมูล เพื่อหาจุดที่สามารถใช้ได้อย่างปลอดภัย มีประโยชน์ทางการแพทย์ และไม่ก่อให้เกิดผลเสียกับสุขภาพของประชาชนในประเทศ
นพ. กุรุวินท์ ลิ้มสมุทรเพชร
ด้าน นพ. กุรุวินท์ ลิ้มสมุทรเพชร แพทย์ชำนาญการด้านรังสีวิทยา โรงพยาบาลบำรุงราษฎร์ กล่าวถึงปัญญาประดิษฐ์สำหรับการเอกซเรย์ปอด หรือ Radiology INSIGHT CXR เสมือนเป็นผู้ช่วยรังสีแพทย์ในการตรวจหาภาวะความผิดปกติของภาพเอกซเรย์ปอด เช่น ก้อนมะเร็งปอด ซึ่งรวมถึงจุดเล็กๆ ในตำแหน่งที่ยากต่อการวินิจฉัย วัณโรคในระยะที่แสดงอาการ รวมถึงช่วยวินิจฉัยภาวะฉุกเฉินได้ตั้งแต่เนิ่น ๆ เช่น ภาวะลมรั่วในปอด ซึ่งหากเกิดลมรั่วน้อยๆ ผู้ป่วยบางรายอาจยังไม่แสดงอาการใด ๆ หรืออาจมาด้วยอาการเจ็บหน้าอก แต่หากรังสีแพทย์สามารถวินิจฉัยได้เร็วและทราบผลตั้งแต่เนิ่น ๆ ก็จะทำให้ผู้ป่วยไม่พลาดโอกาสในการรักษา โดยมีงานวิจัยพบว่าผู้ป่วยโรคมะเร็งปอด หากได้รับการวินิจฉัยตั้งแต่ระยะแรกเริ่ม จะทำให้มีอัตราการรอดชีวิต 5 ปี ถึง 73% แต่หากวินิจฉัยช้า อัตราการรอดชีวิต 5 ปีจะเหลือเพียง 18% เท่านั้น
อย่างไรก็ตาม Radiology AI ไม่ได้เข้ามาเพื่อทดแทนที่รังสีแพทย์ แต่จะเป็นเครื่องมือสนับสนุนสำหรับกระบวนการวินิจฉัยและตัดสินใจของรังสีแพทย์ โดยจะเป็นรูปแบบการให้ “ความเห็นที่สอง” (Second Opinion) ซึ่งจากผลการสำรวจความคิดเห็นของรังสีแพทย์ส่วนใหญ่มากกว่า 60% ระบุว่าได้รับประโยชน์จากการนำ Radiology AI มาใช้ในการช่วยวิเคราะห์ภาพเอกซเรย์ปอด สำหรับในส่วนของซอฟต์แวร์ Radiology AI นั้น ยังมีโอกาสการพัฒนาอย่างต่อเนื่องเพื่อให้ตอบโจทย์การทำงานที่มีประสิทธิภาพมากขึ้น ขณะเดียวกัน ความคิดเห็นและข้อเสนอแนะของรังสีแพทย์ของโรงพยาบาลบำรุงราษฎร์ มีความสำคัญและมีส่วนช่วยในการปรับปรุงประสิทธิภาพการทำงานของ Radiology AI ให้ดียิ่งขึ้นแก่บริษัทผู้พัฒนาปัญญาประดิษฐ์ นอกจากนี้ Radiology AI นี้ ยังช่วยเสริมให้การทำงานร่วมกันระหว่างรังสีแพทย์, AI และแพทย์ผู้รักษาผู้ป่วย มีประสิทธิภาพและเกิดประสิทธิผลในการรักษาสูงสุดต่อผู้ป่วย อีกทั้งยังเป็นตัวเร่งการเรียนรู้ของรังสีแพทย์รุ่นใหม่ ๆ ในเวลาจำกัดได้อย่างมีประสิทธิภาพ
The Radiology Department of Bumrungrad


The Radiology Department of Bumrungrad is a standout in adopting AI to treat patients because it was the first department using the AI technology. Radiologists are frontline physicians in the digital age. However, 22 years ago in the year 2000, Bumrungrad began using the Picture Archiving and Communication System (PACS) to collect medical images - particularly radiographs, to share with our staff for the first time as digital files. In 2001, Bumrungrad adopted Computer Radiography, which uses digital image plates to replace X-ray film radiography. The scanner then reads out the latent image from the plates before sharing them online. Physicians can either print the files on film or examine them on the computer. In 2007, the Bumrungrad Department of Radiology moved to digital radiography using digital detector arrays (DDAs), which provide high quality digital images and can upload them to our online system in seconds. There is no need for the scanner anymore.
โรงพยาบาลทีอาร์พีเอช จ.ตรัง LINK
โรงพยาบาลทีอาร์พีเอช จ.ตรัง เป็นโรงพยาบาลเอกชนขนาดกลาง ตั้งอยู่ที่ ถนนโคกขัน ตำบลทับเที่ยง อำเภอเมืองตรัง ตรัง โรงพยาบาลทีอาร์พีเอช เปลี่ยนจากชื่อเดิม โรงพยาบาลตรังรวมแพทย์ ในปี 2563 เป็นโรงพยาบาลเอกชนในจังหวัดตรัง เปิดดำเนินการตั้งแต่ ปี พ.ศ. 2525 โดยเริ่มต้นจาก โรงพยาบาล ขนาด 50 เตียง และค่อยๆ เติบโตต่อเนื่องตลอดมา จนเป็นโรงพยาบาลขนาด 200 เตียง จนถึงปัจจุบัน
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลทีอาร์พีเอชสามารถรับผู้ประกันตนเพิ่มได้อีก 40,030 ราย
โรงพยาบาลทีอาร์พีเอช มีเครือข่าย สถานพยาบาลในระดับสูง ได้แก่ โรงพยาบาลตรัง และ สถานพยาบาลในระดับรอง 3 แห่ง ได้แก่ คลินิกเวชกรรมนายแพทย์ธีระ คลินิกเวชกรรมทีอาร์พีเอช ลันตา อินเตอร์เนชั่นแนลคลินิกเวชกรรม
Non - Immigrant Visa LINK
CATEGORY / PURPOSES OF VISIT
"F"(Official) : To perform official duties (using ordinary passport)
"B" (Business) : To conduct business / to be employed/internship (extra curricular)
"IB" (Investment through BOI) : To invest or perform other activities relating to investment, subject to the provision of the established laws on investment promotion
"ED" (Education) : To study, to have a study tour or technical visit to government agencies, intentional organisation, to participate in projects, seminars, conference or training course conducted by government agencies or intentional organization ,
to participate in buddhism activities approved by related gavernment agencies
"M" (Mass Media) : To work as a journalist, reporter or film production team
"R" (Religion) : To perform missionary work or other religious activities with the
concurrence of the Thai concerned Ministries or relevant Government
agencies
"EX" : To work as an expert or specialist in a specific field
"RS" : To conduct scientifc research, training or teaching in a research institute
(with an approval from The National Research Council of Thailand)
"O" : Others (for more information see .....)
ราชทัณฑ์ พร้อมปล่อย "ผู้ต้องขังคดีกัญชาอย่างเดียว" 4,103 ราย หลัง 9 มิย 65 LINK
สำรวจผู้ต้องขังคดีความผิดเกี่ยวกับพืชกัญชาที่อยู่ในความรับผิดชอบของกรมราชทัณฑ์ จำนวนทั้งสิ้น 4,103 ราย แยกเป็นผู้ต้องขังระหว่างพิจารณาคดี 884 ราย และนักโทษเด็ดขาด 3,219 ราย
นายธวัชชัย ชัยวัฒน์ รองอธิบดีกรมราชทัณฑ์ และโฆษกกรมราชทัณฑ์ เปิดเผยว่า ตามที่เว็บไซต์ราชกิจจานุเบกษา ได้เผยแพร่ประกาศกระทรวงสาธารณสุข เรื่อง ระบุชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ.2565 เมื่อวันที่ 9 กุมภาพันธ์ 2565 ซึ่งจะมีผลบังคับใช้ในวันที่ 9 มิถุนายน 2565 จึงส่งผลให้การผลิต นำเข้า ส่งออก จำหน่าย เสพ หรือมีไว้ในครอบครอง ซึ่งพืชกัญชา หรือการกระทำอื่นเกี่ยวกับพืชกัญชาก่อนวันที่ 9 มิถุนายน 2565 จะไม่มีความผิดอีกต่อไป ให้ผู้ที่ได้กระทำการนั้นพ้นจากการเป็นผู้กระทำความผิด และถ้าได้มีคำพิพากษาถึงที่สุดให้ลงโทษแล้วก็ให้ถือว่าผู้นั้นไม่เคยต้องคำพิพากษาว่าได้กระทำความผิดนั้น ถ้ารับโทษอยู่ก็ให้การลงโทษนั้นสิ้นสุดลง
น้ำมันกัญชา หยอดใต้ลิ้น ราคาไม่ถึงพัน
ยาดองมะกรูด
เครื่องดื่มจากตำรับยาดองเปรี้ยวเค็ม ทีมีรสเปรี้ยว บำรุงไฟธาตุ ผสานกลิ่นหอมของมะกรูด ช่วยแก้ทางกองลม เป็นยาฟอกเลือดสตรี ปรุงเป็นเครื่องดื่ม ให้รสเปรี้ยวซ่า สดชื่น ช่วยให้ชุ่มคอ
ส่วนประกอบ (ขนาด 16 ออนซ์)
ยาดองมะกรูด 20 มิลลิลิตร
น้ำเชื่อม 30 มิลลิลิตร
มะนาว 10 มิลลิลิตร
โซดา/น้ำแข็ง
วิธีทำ
ตวงยาดองมะกรด น้ำเชื่อม น้ำมะนาวใส่ลงในแก้ว คนให้เข้ากัน เติมน้ำแข็งใส่โชดาให้เต็มแก้ว คนให้เข้ากันก่อนดื่ม
คลินิก LONG COVID ให้บริการทุกวันอังคาร เวลา 13.00 -16.00 น. LINK
คลินิก LONG COVID ให้บริการทุกวันอังคาร เวลา 13.00 -16.00 น.
สำหรับผู้ป่วยที่สงสัยมีอาการผิดปกติ หลังจากหายจากโควิดแล้ว อย่างน้อย 1 เดือน
ติดต่อ คลินิกโรคทางเดินหายใจ โทร.02-32886900 ถึง 15 ต่อ 11400
บริการทุกวันอังคาร เวลา 13-16 น.
สิทธิการรักษา ตามสิทธิของผู้ป่วย
แพ็กเกจผ่าตัดเปลี่ยนข้อเข่า ฉลอง ครบ 50 ปี BDMS
ในปีนี้ เนื่องในโอกาสครบ 50 ปี BDMS ได้มอบแพ็กเกจผ่าตัดเปลี่ยนข้อเข่า BDMS Total Knee Replacement (1ข้าง) ราคา 250,000 บาท รวมข้อเข่าเทียม 1 ชุด (ตามรุ่นที่กำหนด) อุปกรณ์ช่วยเดิน 1 ชิ้น รวมค่าแพทย์ผ่าตัดและแพทย์วิสัญญี ค่าห้องผ่าตัด ค่ากายภาพบำบัดระหว่างการรักษาที่รพ. ค่ายากลับบ้าน(ที่เกี่ยวกับการผ่าตัด) ค่าอาหาร (ตามกำหนด) และห้องพัก 4 คืน (รวมห้อง ICU 1 คืน) ฯลฯ พร้อมด้วยโปรโมชั่น Be Strong For Surgery ด้วยสิทธิประโยชน์อีก 6 รายการ เช่น ฟรี! การตรวจประเมินความพร้อมเตรียมตัวก่อนผ่าตัด (medical clearance) ฟรี! การตรวจ COVID-19 ก่อนผ่าตัด สำหรับผู้ป่วยและญาติเฝ้าไข้ 1 ท่าน ฟรี! ค่าทำแผลหลังผ่าตัด 1 ครั้ง (ไม่รวมค่าแพทย์ผู้ป่วยนอก) และบัตรของขวัญ มูลค่ารวม 5,000 บาท สำหรับรักษาที่รพ.ในครั้งถัดไป และอื่นๆ อีก 2 รายการ สามารถซื้อแพ็กเกจนี้ได้ตั้งแต่วันนี้ – 31 กรกฎาคม 2565 ใช้บริการผ่าตัดได้ถึง 31 สิงหาคม 2565
อาหารจากพืชดีต่อโลก
การรับประทานอาหารแบบ Plant-based diet ไม่เพียงแต่ให้ประโยชน์ทางสุขภาพเท่านั้น แต่ยังส่งผลดีต่อสิ่งแวดล้อมอีกด้วย มีงานวิจัยแสดงให้เห็นว่าผู้ที่รับประทานอาหารที่ทำจากเนื้อสัตว์ก่อให้เกิดก๊าซคาร์บอนไดออกไซด์ถึง 1.83 ตันคาร์บอนต่อคนต่อปีตลอดกระบวนการผลิต ขณะที่ผู้ที่รับประทานอาหารวีแกน ก่อให้เกิดก๊าซคาร์บอนไดออกไซด์เพียง 0.89 ตันคาร์บอนต่อคนต่อปีเท่านั้น
ผลผลิตเนื้อวัว 1 กิโลกรัม ปล่อยก๊าซคาร์บอนไดออกไซด์สู่ชั้นบรรยากาศสูงถึง 60 กิโลกรัม ขณะที่ถั่วเหลืองก่อให้เกิดก๊าซคาร์บอนไดออกไซด์เพียง 0.9 กิโลกรัม เท่านั้น ซึ่งปริมาณต่างกันถึง 60 เท่า แสดงให้เห็นว่า หากลดการบริโภคผลิตภัณฑ์จากสัตว์ลง จะสามารถลดการเกิดก๊าซเรือนกระจกสาเหตุสำคัญของภาวะโลกร้อนได้
ทรัพยากรน้ำที่ถูกใช้ในสินค้าปศุสัตว์ก็มากกว่าอย่างเห็นได้ชัด เนื้อวัว 1 กิโลกรัม ต้องใช้น้ำสูงถึง 15,415 ลิตร เนื้อหมู และ เนื้อไก่ ใช้น้ำ 5,988 และ 4,325 ลิตรตามลำดับ ในขณะที่การผลิตพืชผัก 1 กิโลกรัม ลดการใช้ทรัพยากรน้ำลงหลายเท่า โดย ข้าวใช้น้ำ 1,673 ลิตร แอปเปิ้ล 822 ลิตร และมะเขือเทศใช้น้ำเพียง 287 ลิตร เท่านั้น
จะเห็นได้ว่าการรับประทานอาหารจากพืชไม่เพียงแต่จะส่งผลดีต่อสุขภาพ แต่ยังส่งผลดีต่อสิ่งแวดล้อม จากการลดการเกิดก๊าซเรือนกระจก การใช้ที่ดินในการทำปศุสัตว์ ลดการใช้ทรัพยากรน้ำได้ รวมทั้งสารเคมีและยาปฏิชีวนะที่ถูกใช้น้อยลงในขั้นตอนการเลี้ยงสัตว์อีกด้วย
คุณหมอแอมป์อยากแนะนำให้ทุกคนหันมาดูแลสุขภาพ ปรับการรับประทาน ลดการกินเนื้อแดงและเนื้อสัตว์แปรรูป “ใครลดได้ลด ใครที่ยังทำไม่ได้ ไม่เป็นไร อาจเริ่มลดจากรับประทานเป็นประจำ เป็นรับประทานนานๆ ที ส่วนใครที่ทำได้ดีแล้วหมอก็ขอชื่นชมเป็นเป็นกำลังใจให้”
คลินิกสุขภาพทางเดินอาหาร
ความผิดปกติในระบบทางเดินมีหลากหลายลักษณะ อาทิ การขับถ่ายผิดปกติ ปัญหาช่องท้อง ท้องอืด เฟ้อ อาการคลื่นไส้อาเจียน น้ำหนักลด ลำไส้อักเสบ ระบบย่อย ระบบทางเดินอาหาร เหล่านี้ จะก่อให้เกิดปัญหาต่อเนื่องในอนาคตได้ โดยเฉพาะเมื่อแก่ตัว คลินิกสุขภาพทางเดินอาหาร นำเอา เทคโนโลยีมาช่วย เพื่อสำรวจปัญหาและเตรียมการเชิงรุกเพื่อแก้ไขและป้องกัน
4 เมนูยอดฮิตที่มีส่วนผสมของกัญชา กรมอนามัย
4 เมนูยอดฮิตที่มีส่วนผสมของกัญชา 1มื้อไม่ควรกินเมนูกัญชาเกิน 2 เมนู และไม่ควรปรุงผ่านความร้อน เนื่องจากสาร THC จะละลายออกมา เสี่ยงได้รับสารTHCเกินปริมาณ (สาร THC ห้ามเกิน 1.6 มิลลิกรัม)
แก้เมากัญชา น้ำลิดรอนกัญ (น้ำรางจืดใบเตย)
สูตรทำ น้ำลิดรอนกัญ (น้ำรางจืดใบเตย) แก้เมากัญชา
เครื่องดื่มแก้เมากัญชา ดื่มลดอาการโคลงเคลง ลดอาการเวียนศีรษะ ตามภูมิปัญญาพื้นบ้านใช้ดื่มถอนพิษ ลดอาการเมาเหล้า แก้เมาค้าง
สวนประกอบ
ใบรางจีด 10 ใบ
ใบเตย 3 ใบ
น้ำสะอาด 1 ลิตร
วิธีทำ
นำใบรางจืดและใบเตยล้างให้สะอาด เติมน้ำสะอาดลงไป ต้มเดือดนาน 15 นาที กรองเอากากออก ดื่มอุ่นๆจนกว่าอาการจะดีขึ้น
สวนเสรีไทย เนื้อที่ 350 ไร่
สวนเสรีไทย เนื้อที่ 350 ไร่ เดิมเรียกว่า สวนน้ำบึงกุ่ม อยู่ในหมู่บ้านสหกรณ์ ซ.เสรีไทย 57 เขตบึงกุ่ม เริ่มมีการพัฒนาพื้นที่ให้เป็นสวนสาธารณะตั้งแต่ปี 2528 และเปิดใช้งานมาจนกระทั่งเมื่อวันที่ 16 สิงหาคม 2540 ได้เปลี่ยนชื่อมาเป็นสวนเสรีไทย อย่างเป็นทางการ ตรงกับวันครบรอบ 52 ปี การสิ้นสุดสงครามโลกครั้งที่ 2 และเป็นการรำลึกถึงขบวนการเสรีไทย ที่กอบกู้ประเทศในมิให้ตกเป็นฝ่ายพ่ายแพ้ในสงครามโลกครั้งที่ 2 จุดเด่นในสวนเสรีไทย อาทิ อาคารเสรีไทยอนุสารณ์ สวนน้ำขนาดใหญ่มีเกาะกลางน้ำ สวนป่า 3 สวน ลานดอกไม้หอม และลานไม้ผล
สวนรมณีย์ทุ่งสีกัน เนื้อที่ 15 ไร่
สวนรมณีย์ทุ่งสีกัน เนื้อที่ 15 ไร่ ตั้งอยู่ที่ ถนนเวฬุวนาราม เขตดอนเมือง เดิมเรียกว่า สวนป่าสีกัน สำนักงานเขตดอนเมืองได้รับมอบจากกระทรวงมหาดไทย เมื่อ 14 กรกฎาคม 2540 และปรับปรุงใหม่ เปิดให้บริการเมื่อวันที่13 มิถุนายน 2548 กับชื่อพระราชทาน "รมณีย์ทุ่งสีกัน" ในสวนมีจุดเด่น อาทิ หอนาฬิกา อัฒจันทร์กลางแจ้ง บึงน้ำ ทางเดินออกกำลังกาย ศาลา ทางเดินริมยน้ำและสะพาน เปิดให้บริการทุกวัน 05.00 น. - 21.00 น.
เฮินฮัก โฮมสเตย์ อ.พรรณานิคม จ.สกลนคร
hern-hug เฮินฮัก home to relax โฮมสเตย์ สายวัฒนธรรมพุทธ ร่วมตักบาตรที่ถนนบิณฑบาต ตามรอยหลวงปู่มั่น แห่งวัดป่าภูริทัตตถิราวาส (วัดป่าบ้านหนองผือ) มีโอกาสต้องแวะชมศึกษาขั้นตอนการทอผ้า และ อุดหนุนสินค้า ของกลุ่มวิสาหกิจชุมชน ผลิตภัณฑ์ผ้าทอมือ ตามภูมิปัญญาท้องถิ่น แวะเที่ยวชม อ่างเก็บน้ำบ้านหนองผือ สูดบรรยากาศบริสุทธิ์ ยามเย็น หรือจะแวะชมสวนผลไม้ เด็ดมะม่วงจิ้ม พริกเกลือ น้ำปลาหวาน กันสดๆจากต้น เด็ดสุดๆ เรียกว่ามาพักที่ เฮินฮัก โฮมสเตย์ ไม่มีเบื่อ ที่พักสะอาด ปลอดภัย บริการเป็นกันเอง
ที่อยู่ บ้านหนองผือ ตำบล นาใน อำเภอ พรรณานิคม สกลนคร 47130
โทร. 091 862 8487
เทียบการเปลี่ยนแปลงรายได้ของครอบครัว
NUSA ขายต้นกล้ากัญชาพร้อมกระถาง
Nusa CSR บริษัทร่วมทุนระหว่าง ณุศาศิริ(ไทย) กับ บริษัท CSR (จีน) เพื่อเป็นบริษัทระดับโลก ด้านนวัตกรรมกัญชาและกัญชง ในการปลูก สกัด วิจัย ส่งออกทั้งในและต่างประเทศได้ ขายต้นกล้ากัญชาพร้อมกระถางแบบต่างๆ ได้แก่
1. ต้นกล้ากัญชาพร้อมกระถาง 900 บาท
2. ต้นกล้ากัญชาพร้อมชุดปลูก 890 บาท - ดินพร้อมปลูก 2 แกลลอน ปุ๋ยบำรุงใบ ปุ๋ยบำรุงดอก ต้นกล้าต้นกัญชาพร้อมกระถาง
3. ต้นกัญชาสูง 30-50 cm. พร้อมชุดปลูก 1,400 บาท - ดินพร้อมปลูก 5 แกลลอน ปุ๋ยบำรุงใบ ปุ๋ยบำรุงดอก ต้นกัญชาใหญ่ สูง 30-50 cm. ใส่ตะกร้า
*ทั้ง 3 แบบ จำกัดจำนวนการซื้อได้คนละไม่เกิน 10 ต้น
รายละเอียดเพิ่มเติม โทร.1608 กด 9
miraclecannabisland.com/เสริมแกร่งให้ NK Cell
วิธีทำให้ระบบภูมิคุ้มกันในร่างกาย โดยเฉพาะเม็ดเลือดขาวที่ชื่อว่า NK Cell มีความแข็งแรงขึ้น พญ.จิรา ถาวรประดิษฐ์ กล่าวว่ามี 5 ปัจจัยหลัก คือ 1. นอนหลับพักผ่อนให้เพียงพอวันละ 7-8 ชั่วโมงต่อวัน 2. กินอาหารครบหมู่และหลากหลาย หลีกเลี่ยงอาหารประเภทปิ้ง ย่าง ทอด โดยเฉพาะอาหารที่มีปริมาณน้ำตาลสูง ซึ่งจะส่งผลให้น้ำตาลในเลือดสูง ประสิทธิภาพการทำงานของเม็ดเลือดขาวก็ลดลงด้วย 3. ความเครียด ทุกวันนี้คนส่วนมากอยู่ในภาวะเครียด การฝึกคลายอารมณ์ เช่น การเดินออกกำลังกายยืดกล้ามเนื้อตอนเช้าๆ หรือฝึกโยคะ รำไทชิ ชี่กง ฯลฯ ล้วนช่วยให้ความเครียดลดลง คอร์ติซอล ฮอร์โมน ลดลง เม็ดเลือดขาวก็จะทำงานได้ดีขึ้น 4. ออกกำลังกายอย่างสม่ำเสมอ ไม่ว่าจะเป็นการเดินเร็ว ปั่นจักรยาน หรือเต้นแอโรบิก อย่างน้อยสัปดาห์ละ 150 นาที หรือวันละ 30 นาที 5 วันต่อสัปดาห์ ช่วยให้เม็ดเลือดขาวทำงานได้ดีขึ้น และ 5. อากาศ ควรหลีกเลี่ยงพื้นที่ที่แออัดที่เต็มไปด้วยฝุ่นควันและมลภาวะ
4.LAAB ขึ้นทะเบียนที่ไหนบ้าง
ปัจจุบัน LAAB ได้รับการขึ้นทะเบียนในหลายประเทศทั่วโลก ไม่ว่าจะเป็น ประเทศสหรัฐอเมริกา สหราชอาณาจักร รวมถึงสหภาพยุโรป และอีกกว่า 30 ประเทศทั่วโลกสำหรับการป้องกันก่อนการสัมผัสเชื้อไวรัสก่อโรคโควิด-19
โรงเรียนวิทยาศาสตร์การแพทย์ หลักสูตรฉุกเฉินการแพทย์
โรงเรียนวิทยาศาสตร์การแพทย์ หลักสูตรฉุกเฉินการแพทย์ ทางหลักสูตรมุ่งเน้นผลิตบัณฑิตให้มีความรู้ความชำนาญ และทักษะด้านฉุกเฉินการแพทย์ เพื่อให้ผู้ป่วยฉุกเฉินโดยเฉพาะผู้ป่วยฉุกเฉินวิกฤตนั้นได้รับการผดุงชีวิตรวมทั้งป้องกันการเสียชีวิตหรือการรุนแรงขึ้นของการบาดเจ็บหรืออาการป่วยนั้นได้อย่างถูกต้อง มีประสิทธิภาพ มีคุณธรรม จริยธรรม จรรยาบรรณและเจตคติที่ดีตามมาตรฐานการแพทย์ฉุกเฉิน สามารถทำงานเป็นทีมร่วมกับสหวิชาชีพในงานฉุกเฉินการแพทย์ได้อย่างถูกต้อง เพื่อลดอัตราความเสี่ยงและความสูญเสียของผู้ป่วยกรณีฉุกเฉินให้ได้รับการปฏิบัติการฉุกเฉินก่อนถึงมือผู้ประกอบวิชาชีพในสถานพยาบาลที่รับผู้ป่วยไว้ค้างคืน มีความทันสมัยเข้ากับบริบทของประเทศและนานาชาติ นำไปสู่การวิจัย ช่วยเหลือ และการถ่ายทอดความรู้ให้กับบุคคลอื่นได้
ปัจจุบัน เปิดการเรียนการสอนในสาขาวิชาฉุกเฉินการแพทย์ (ต่อเนื่อง) เป็นสาขาของการประกอบโรคศิลปะด้านสุขภาพที่กระทำต่อผู้ป่วยฉุกเฉินนอกสถานพยาบาลเป็นหลัก รวมทั้งสามารถดูแลเบื้องต้นในห้องฉุกเฉิน เพื่อให้ผู้ป่วยฉุกเฉินนั้นได้รับการช่วยชีวิตและป้องกันการเสียชีวิต โดยกิจกรรมเยี่ยมชมยังจำลองสถานการณ์การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุพลัดตกจากที่สูง มีการปวดเจ็บต้นคอและแผ่นหลังเคลื่อนย้ายขึ้นรถพยาบาล (Ambulance) ตลอดจนสาธิตเครื่องมือและอุปกรณ์เทคโนโลยีที่ทัน สมัยภายในรถก่อนนำผู้บาดเจ็บหรือผู้ป่วยส่งโรงพยาบาลต่อไป
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาอุดมสุข
อินทัชเมดิแคร์คลินิกเวชกรรม สาขาอุดมสุข
ที่อยู่ : 243 ถ.อุดมสุข แขวงบางนาเหนือ เขตบางนา กรุงเทพมหานคร 10260
[
แผนที่]
เวลาเปิดทำการ
จันทร์ - ศุกร์ 08.00 - 19.00 น.
แพทย์ประจำ สาขาอุดมสุข
1. พญ.อุไรรัตน์ ไชยประสพ
แพทยศาสตรบัณฑิต คณะแพทย์ศาสตร์ มหาวิทยาลัยเชียงใหม่ แพทย์เวชปฏิบัติทั่วไป
ตารางออกตรวจ
จันทร์-ศุกร์ 8.00 - 19.00 น.
คลินิก สวท เวชกรรม เชียงใหม่ LINK
คลินิก สวท เวชกรรม เชียงใหม่
เลขที่ 200/3 ถนนบำรุงราษฎร์ ตำบลวัดเกต อำเภอเมือง จังหวัดเชียงใหม่ 50000
เปิดทำการ : จันทร์.-ศุกร์ เวลา 08.30-16.30 น.
เปิดทำการ : เสาร์ เวลา 9.00 -15.00 น.
ปิดวันอาทิตย์และวันหยุดนักขัตฤกษ์
053-249-406
086-461-6059
คลินิกวางแผนครอบครัวและหลังคลอด ศูนย์บริการสาธารณสุข 15 ลาดพร้าว LINK
คลินิกวางแผนครอบครัวและหลังคลอด ศูนย์บริการสาธารณสุข 15 - ลาดพร้าว
ให้บริการในเวลาราชการเวลา 13.00 - 16.00 น. ให้บริการในวันพุธ (หยุดวันหยุดนักขัตฤกษ์)
179/1 ซอย ลาดพร้าว 41( ภาวนา ) แขวงสามเสนนอก เขตห้วยขวาง กรุงเทพมหานคร 10310
โทรศัพท์ 02-939-9548 , 02-541-8380
โทรสาร 02-541-8382
21 มิถุนายน 2565 ไฟไหม้ชุมชนบ่อนไก่ ถนนพระราม 4 ประกันสังคมเร่งช่วยดูแล LINK
21 มิถุนายน 2565 เวลาประมาณ 13.12 น. เกิดเหตุเพลิงไหม้บ้านเรือนประชาชนภายในชุมชนบ่อนไก่ ถนนพระราม 4 เขตปทุมวัน นายกรัฐมนตรี สั่ง รัฐมนตรีว่าการกระทรวงแรงงาน เข้าดูแลให้ความช่วยเหลือ ลูกจ้าง และประชาชน ที่ได้รับความเดือดร้อนจากเหตุเพลิงไหม้ชุมชนบ่อนไก่ ในทันที
สำนักงานประกันสังคม ลงพื้นที่ให้ความช่วยเหลือผู้ได้รับความเดือดร้อน ซึ่งจากการตรวจสอบข้อมูลพบว่า เป็นพื้นที่ชุมชนแออัด ส่วนใหญ่เป็นบ้านไม้ และห้องเช่าเกือบร้อยหลังคาเรือน มีซอยคับแคบ ทำให้รถดับเพลิงและการลำเลียงน้ำเข้าไปฉีดดับเพลิงค่อนข้างยากลำบาก เจ้าหน้าที่ระดมรถดับเพลิงกว่า 10 คัน ฉีดน้ำนานหลายชั่วโมง จึงสามารถควบคุมเพลิงให้อยู่ในวงจำกัดได้ จุดเกิดเหตุเป็นชุมชนเก่าปลูกสร้างด้วยไม้ สภาพเป็นไม้เก่า จึงเป็นเชื้อเพลิงอย่างดีประกอบกับลมแรงทำให้เพิ่มขยายวงกว้างออกไป
ทั้งนี้ นายวีระชัย รื่นผกา ผู้นำชุมชนซึ่งเป็นเครือข่ายประกันสังคม แจ้งว่า ผู้ได้รับความเดือดร้อนที่มีการลงทะเบียนแล้วจำนวน 107 ราย ในจำนวนนี้เป็นผู้ประกันตนมาตรา 40 ซึ่งอยู่ในกลุ่มผู้ได้รับความเดือดร้อนจำนวน 70 ราย
สำนักงานประกันสังคม ลงพื้นที่นำสิ่งของ เครื่องอุปโภคบริโภค อาทิ เสื้อผ้า ชุดเครื่องนอน ผ้าห่ม หน้ากากอนามัย ข้าวสาร อาหารกระป๋อง และน้ำดื่ม ไปมอบผ่านตัวแทนเครือข่ายประกันสังคมในพื้นที่ ให้ลูกจ้าง และประชาชน ที่ได้รับผลกระทบจากเหตุเพลิงไหม้ ณ ชุมชนบ่อนไก่ เป็นการบรรเทาความเดือดร้อนในเบื้องต้น สำหรับผู้ประกันตนหญิง 1 ราย ที่ได้รับบาดเจ็บยังไม่รู้สึกตัว ได้ส่งตัวไปพักรักษาที่โรงพยาบาลจุฬาลงกรณ์ ซึ่งสำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 4 จะเข้าเยี่ยมและดูแลค่ารักษาพยาบาลต่อไป
4. รับคำปรึกษาก่อนตรวจเลือด
นอนกรนหยุดหายใจขณะหลับ เพิ่มโอกาสเป็นโรคหลอดเลือดสมอง
พญ. ดารกุล พรศรีนิยม แพทย์ชำนาญการด้านประสาทวิทยาและเวชศาสตร์การนอนหลับ โรงพยาบาลบำรุงราษฎร์ กล่าวถึงข้อมูลสถิติที่น่าสนใจ รายงานว่าผู้ที่มีภาวะนอนกรนหยุดหายใจขณะหลับ จะมีโอกาสเป็นโรคหลอดเลือดสมอง เพิ่มสูงขึ้นถึง 3 เท่า ภายในระยะเวลา 10 ปีหากไม่ได้รับการรักษา อีกทั้งยังมีงานวิจัยที่สอดคล้องกัน รายงานว่ากลุ่มที่ป่วยเป็นโรคหลอดเลือดสมองตีบ หรือโรคหลอดเลือดสมองแตก จะมีโอกาสเกิดภาวะนอนกรนหยุดหายใจขณะหลับสูงถึง 50 - 90% ที่สำคัญ ภายในเวลา 10 ปี หากไม่ได้รับการรักษาภาวะนอนกรนหยุดหายใจขณะหลับ จะเพิ่มโอกาสที่จะป่วยเป็นโรคหลอดเลือดสมอง โรคหัวใจ โรคเบาหวาน โรคความดันโลหิตสูง เนื่องจาก 3 ปัจจัยหลัก ได้แก่ 1. การที่มีระดับออกซิเจนต่ำเป็นพักๆ ขณะหลับ 2. วงจรการนอนไม่ดี ทำให้คลื่นสมองตื่นบ่อย 3. ระบบหัวใจและหลอดเลือดมีการเปลี่ยนแปลง เนื่องด้วยช่วงที่หยุดหายใจจะเป็นช่วงที่มีความดันโลหิตขึ้นสูง ชีพจรเต้นเร็วขึ้น บางคนมีภาวะหัวใจเต้นผิดจังหวะร่วมด้วย หัวใจต้องบีบตัวแรงขึ้นเพื่อเพิ่มเลือดไปเลี้ยงสมอง เพื่อช่วยเพิ่มระดับออกซิเจนในสมอง ซึ่งการเปลี่ยนแปลงในลักษณะนี้เกิดขึ้นหลายๆ รอบ ทุกคืน เป็นระยะเวลานาน จึงส่งผลให้เกิดการเปลี่ยนแปลงของระบบหัวใจและหลอดเลือด
อย่างไรก็ตาม ภาวะนอนกรนหยุดหายใจขณะหลับจะยิ่งเพิ่มความรุนแรงมากขึ้น เมื่อมีภาวะอ้วนร่วมด้วย มีอายุที่มากขึ้น รวมถึงหากเป็นผู้หญิงในวัยหมดประจำเดือน อายุประมาณ 50 - 55 ปี ก็จะมีภาวะหยุดหายใจเพิ่มมากขึ้นเช่นกัน เพราะในช่วงอายุที่มีประจำเดือน ร่างกายจะมีฮอร์โมนเอสโตรเจนที่ช่วยทำให้กล้ามเนื้อหลอดลมแข็งแรง แต่พอฮอร์โมนเอสโตรเจนลดลงหรือหมดไป กล้ามเนื้อหลอดลมก็จะแฟบลง ทำให้มีการนอนกรนหยุดหายใจมากขึ้น
ตัวอย่างผลผลิตจากกลุ่มปลูก หลายสายพันธุ์ให้ศึกษา
ข่าวปลอม อย่าแชร์! ผู้ที่เป็นโรคไมเกรน เสี่ยงเส้นเลือดสมองแตก มากกว่าคนปกติถึง 46% LINK
กรณีที่มีการแชร์คลิปเกี่ยวกับสุขภาพในประเด็นเรื่องผู้ที่เป็นโรคไมเกรน เสี่ยงเส้นเลือดสมองแตก มากกว่าคนปกติถึง 46% ทางศูนย์ต่อต้านข่าวปลอม กระทรวงดิจิทัลเพื่อเศรษฐกิจและสังคม ได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสถาบันประสาทวิทยา กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
กรณีที่มีการโพสต์เตือนโดยกล่าวว่าไมเกรน ‼️ อย่าทิ้งไว้นาน เสี่ยงเส้นเลือดสมองแตกมากกว่าคนปกติถึง 46% ทางสถาบันประสาทวิทยา กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่าเนื้อหาข้อความดังกล่าวไม่เป็นความจริง ไม่มีข้อมูลทางการแพทย์ในปัจจุบันบอกถึงไมเกรนจะเกี่ยวข้องกับความเสี่ยงโรคหลอดเลือดสมองแตกตามที่กล่าวอ้าง
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อ และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันประสาทวิทยา กรมการแพทย์ กระทรวงสาธารณสุข สามารถติดตามได้ที่เว็บไซต์ www.pni.go.th หรือโทร. 02 3069899
บทสรุปของเรื่องนี้คือ : เนื้อหาข้อความดังกล่าวไม่เป็นความจริง ไม่มีข้อมูลทางการแพทย์ในปัจจุบันบอกถึงไมเกรนจะเกี่ยวข้องกับความเสี่ยงโรคหลอดเลือดสมองแตก
ขั้นที่ 4 รับยาด้วยตนเอง หรือ รับที่บ้าน ภายใน 12 ชั่วโมง
TUH For All โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ LINK
TUH For All และ TUH Care โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ สำหรับผู้ใช้บริการของทาง รพ.ธรรมศาสตร์เฉลิมพระเกียรติ มีฟังก์ชั่น
-ตรวจสอบสิทธิการรักษา
-ตรวจสอบประวัติการรักษา
-รับบัตรคิว
** เงื่อนไขการใช้บริการ : ผู้ใช้งานต้องทำการลงทะเบียน Consent form ที่ห้องบัตรโดยแจ้งกับเจ้าหน้าที่ว่า ลงทะเบียนใช้งานแอพพลิเคชั่นของทางโรงพยาบาลก่อนเท่านั้น
โหลดได้ทั้ง
iOS และ
AndroidPRINC Health แอป รพ.พริ๊นซ์
PRINC Health แอปพลิเคชั่นที่ช่วยให้ผู้เข้ารับบริการสามารถ เข้าถึงการรักษาพยาบาลได้สะดวกมากยิ่งขึ้น เชื่อมต่อกับระบบโรงพยาบาลในเครือพริ้นซ์ ซึ่งทำให้สามารถเรียกดูประวัติการรักษาของตนเอง และนัดหมายเพื่อพบแพทย์ได้อย่างรวดเร็ว รวมไปถึงสามารถรับข้อมูลข่าวสารต่างๆ จากโรงพยาบาลได้อีกด้วย
ดาวน์โหลดทั้ง
iOS และ
Android กรมอนามัย ออกประกาศคุมการปรุงอาหาร คุมกลิ่นควันกัญชา
นพ.สุวรรณชัย วัฒนายิ่งเจริญชัย อธิบดีกรมอนามัย กล่าวว่า กรมอนามัยมีส่วนร่วมในการดูแล ควบคุมป้องกัน และคุุ้มครองประชาชนในฐานะผู้บริโภคให้มีความปลอดภัยจากการใช้กัญชา ใน 2 ประเด็นที่สำคัญ คือ
1) การออกประกาศกระทรวงสาธารณสุขที่กำหนดให้การกระทำให้เกิดกลิ่นหรือควันของกัญชากัญชงหรือพืชอื่นใดเป็นเหตุรำคาญ ซึ่งมีผลบังคับใช้เมื่อวันที่ 15 มิถุนายน 2565 โดยอาศัยอำนาจของ พ.ร.บ. การสาธารณสุขเพื่อคุ้มครอง ป้องกันไม่ให้ กลิ่น ควันการใช้กัญชาที่ไม่เหมาะสม ส่งผลกระทบต่อสุขภาพผู้ที่ประสบเหตุและผู้ที่อาศัยใกล้เคียง ซึ่งประชาชนประสบเหตุสามารถแจ้งเจ้าพนักงานได้ และเจ้าพนักงานสามารถใช้อำนาจ ตามมาตรา 44 ในการตักเตือน ดำเนินการและระงับเหตุได้ หากฝ่าฝืนคำสั่งจะมีบทลงโทษทั้งจำและปรับ
2) การออกประกาศกรมอนามัยในการนำใบกัญชามาประกอบหรือปรุงอาหารในสถานประกอบกิจการอาหาร (ฉบับที่ 2) พ.ศ. 2565 โดยกำหนดให้ร้านอาหารต้องแสดงข้อมูลว่ามีการนำกัญชามาใช้ ใช้ในเมนูใด ใช้ในปริมาณเท่าใด และจัดทำคำแนะนำการบริโภค และเตือน ซึ่งสอดรับกับ พ.ร.บ.สมุนไพรควบคุม
ทั้งนี้ ได้ดำเนินการยกระดับประกาศกรมอนามัย ให้เป็นร่างประกาศกระทรวงสาธารณสุข ซึ่งอยู่ระหว่างนำเข้าสู่การพิจารณาของคณะกรรมการสาธารณสุขเพื่อให้มีการบังคับใช้คุ้มครองผู้บริโภคต่อไป
ครั้งนี้ทางวิทยาลัยจึงได้คัดเลือกบุคลากร อาจารย์ และนักศึกษา เพื่อเข้าร่วมอบรมเสริมทักษะการช่วยชีวิต รวมไปถึงการปฐมพยาบาลเบื้องต้น เพื่อให้สามารถนำไปใช้ในชีวิตจริงได้ โดยได้ร่วมมือกับ โรงพยาบาลกรุงเทพ ที่มีความพร้อมทางด้านบุคลากร อุปกรณ์ และ ประสบการณ์ที่สามารถถ่ายทอดให้ความรู้กับทางบุคลากรของทางวิทยาลัยได้
นอกจากนี้ยังสามารถเลือกรับประทานอาหารได้หลากหลายเมนูทั้งอาหารมังสวิรัติ อาหารวีแกน อาหารที่ปราศจากกลูเตน (Gluten-free diet) และปราศจากผลิตภัณฑ์จากนมสัตว์ (Dairy-free diet) หรืออาหารท้องถิ่นที่มีความสดใหม่และปราศจากสารเคมี (Organic food) และเครื่องดื่มสุขภาพ ที่ออกแบบจากนักกำหนดอาหาร (Dietician) ที่ BDMS Wellness Clinic รังสรรค์ร่วมกับเชฟมืออาชีพจาก Celes Samui ซึ่งมีประสบการณ์มาอย่างยาวนาน
“BDMS Wellness Clinic มีบริการจัดส่งวิตามินและผลการตรวจสุขภาพพร้อมการแปลผล การออกแบบการรักษา และวางแนวทางในการดูแลสุขภาพ โดยแพทย์ผู้ชำนาญการด้านเวชศาสตร์ป้องกัน (Preventive Medicine) ให้ถึงที่พักหรือจุดหมายปลายทางที่ต้องการ เพื่อความสะดวกและตอบสนองต่อความต้องการของแต่ละบุคคลมากที่สุด”
หมอแอมป์ กล่าว
อันดับที่ 4 รพ.รามาธิบดี 82.83%
นับตั้งแต่การเปิดให้บริการเมื่อปี 2512 นับถึงวันนี้เกินครึ่งศตวรรษแล้ว สำหรับโรงพยาบาลรัฐขนาดใหญ่ภายใต้การกำกับของ มหาวิทยาลัยมหิดล แห่งนี้ ที่เจริญเติบโตและมีพัฒนาการรุดหน้า ควบคู่ไปกับการเจริญเติบโตของประเทศในช่วง 50 ปีที่ผ่านมา เป็นเสาหลักอีกเสาของการสาธารณสุขในประเทศไทย ที่ผลิตบุคลากรแพทย์และความรู้ด้านการแพทย์มากมายตลอดระยะเวลาที่ผ่านมา
ฟาร์มกัญชล Goldenleaf Hemp
รับสมัคร
นักวิชาการปลูกพืชแบบโรงเรือน SMART GREEN HOUSE
- ปฏิบัติงานในแปลงปลูกกัญชา กัญชง แบบ SMART GREEN HOUSE และระบบโรงเรือนของฟาร์ม ที่ตั้งตำบลเขาคันทรง อำเภอศรีราชา จังหวัดชลบุรี ต้องพักในฟาร์มที่ฟาร์มจัดให้ เพราะต้องดูแลพืชในเวลากลางคืน กรณีฉุกเฉินด้วย
งานวัดไผ่โรงวัว สุพรรณบุรี 5-13 สค.65
ไปเที่ยวกัน งานวัดไผ่โรงวัว สุพรรณบุรี 5-13 สค.65 บรรยากาศงานวัดคึกครื้น ของกิน ของใช้ มหรสพ เครื่องเล่น ดนตรี ( 9 วัน 9 คืน ) ให้เลือกเพียบ!! เปิด 10.00-23.00 น พิกัด วัดไผ่โรงวัว อ.สองพี่น้อง สุพรรณบุรี
12 สิงหา เข้าอุทยานแห่งชาติ ฟรี ทั่วประเทศ LINK
12 สิงหาคม 2565 นี้ เข้าฟรีอุทยานแห่งชาติทั่วประเทศ
นอกจากนี้ วันอื่น ที่เป็นวันสำคัญเข้าอุทยานแห่งชาติฟรีประจำปี
1. วันเด็กแห่งชาติ
2. วันครอบครัว (14 เมษายน)
3. วันเฉลิมฯ พระราชินี (3 มิถุนายน)
4. วันเฉลิมฯ พระเจ้าอยู่หัว (28 กรกฎาคม)
5. วันแม่แห่งชาติ (12 สิงหาคม)
6. วันพ่อแห่งชาติ (5 ธันวาคม)
เขตลาดกระบัง ตรวจเข้มสถานบันเทิงในพื้นที่เขต ป้องกันเหตุอัคคีภัยเชิงรุก LINK
8 ส.ค.2565) นายธนะสิทธิ์ เมธพันธ์เมือง ผู้อำนวยการเขตลาดกระบัง พร้อมด้วยคณะผู้บริหารเขตฯและเจ้าหน้าที่ที่เกี่ยวข้อง ร่วมกับ พ.ต.อ. ขจร อบทอง ผู้กำกับ สน.ฉลองกรุง พร้อมเจ้าหน้าที่ตำรวจ ส.น.ฉลองกรุง ส.น.ลาดกระบัง และสถานีดับเพลิง ขตลาดกระบัง ลงพื้นที่ตรวจเข้มสถานบริการในพื้นที่เขต ป้องกันเหตุอัคคีภัยและเช็คมาตรฐานความปลอดภัยด้านต่างๆเชิงรุก โดยกำชับผู้ประกอบการสถานบริการ ให้ปฏิบัติตามมาตรฐานความปลอดภัย โดยเฉพาะทางหนีไฟ ถังดับเพลิงพร้อมใช้งาน ป้ายทางหนีไฟเรืองแสง ไฟฉุกเฉิน และให้มีการอบรมการอพยพหนีไฟเพื่อป้องกันอัคคีภัย สร้างความปลอดภัยในชีวิตและทรัพย์สินของประชาชนที่มาใช้บริการ
ปิดท้าย ผอ.แอ๊ด ได้ลงพื้นที่รับเรื่องร้องเรียนจากประชาชน เรื่องสถานบริการเปิดติดบ้านเรือน และส่งเสียงดังรบวนการใช้ชีวิต ซึ่งผอ.ได้ประสานเจ้าหน้าที่เพื่อเร่งบรรเทาความเดือดร้อนให้แก่ประชาชนทันที เพื่อให้กรุงเทพฯเป็นเมืองน่าอยู่สำหรับทุกคน
คลินิกวางแผนครอบครัว ศบส1 สะพานมอญ
บริการวันพฤหัสบดี 13-16 น. เว้นวันหยุด
- ประเมินภาวะสุขภาพสตรีวัยเจริญพันธ์และหลังคลอด
- ให้ความรู้ ปรึกษาแนะนำ การคุมกำเนิด
- บริการคุมกำเนิดด้วยยาเม็ดคุมกำเนิด ยาฉีด และถุงยางอนามัย
- ตรวจคัดกรองเบื้องต้น มะเร็งเต้านม มะเร็งปากมดลูก
คลินิกสุขภาพเด็กดี
วัน-เวลาทำการ
วันอังคาร และวันพฤหัสบดี 13.00 - 16.00 น.
(หยุดวันหยุดนักขัตฤกษ์)
ขอบเขตการให้บริการ
1. คัดกรองพัฒนาการเด็กที่คลินิกสุขภาพเด็กดี โรงเรียน ศูนย์รับเลี้ยงเด็ก
2. ประเมินพัฒนาการเด็ก ตลอดจนสรุปปัญหาพัฒนาการและวางแผนให้การช่วยเหลือดูแลร่วมกับผู้ปกครอง
3. ส่งเสริมพัฒนาการเด็กตามระดับความสามารถและให้คำแนะนำการส่งเสริมพัฒนาการเด็กแก่ผู้ปกครอง
4. จัดโปรแกรมฝึกเด็กที่บ้านสำหรับผู้ปกครอง
5. เยี่ยมบ้านเด็กในรายที่มีปัญหา
6. จัดทำบันทึกพัฒนาการเด็กรายบุคคล
7. ส่งต่อในรายที่มีปัญหาซับซ้อน
สิทธิประโยชน์เพิ่มเติมหลังเปลี่ยนมาใช้ประกันสังคมกับรพ.เอเชียอินเตอร์ฯ LINK
สิทธิประโยชน์เพิ่มเติมหลังเปลี่ยนมาใช้ประกันสังคมกับรพ.เอเชียอินเตอร์ฯ
1. เปลี่ยนประกันสังคมมายังรพ.เอเชียอินเตอร์ฯ
รับสิทธิ์นอนห้องคู่ ฟรี 1 ปี
จำกัด 50,000 สิทธิ์
2. ผู้ที่ยังไม่มีประกันสังคม ผู้ที่เริ่มทำงาน เลือกประกันสังคมกับรพ.เอเชียอินเตอร์ฯ
รับสิทธิ์ตรวจ ATK และนอนห้องคู่ ฟรี 1 ปี
จำกัด 50,000 สิทธิ์
3. เมื่อเข้ารับการฉีดวัคซีนไข้หวัดใหญ่ ผู้ประกันตนของรพ.เอเชียอินเตอร์
รับสิทธิ์การตรวจมวลกระดูก ฟรี 1 ครั้ง
4. เพื่อสนับสนุนการส่งเสริมป้องกันโรค ผู้ประกันตนของรพ.เอเชียอินเตอร์
รับสิทธิ์ X-RAY ทรวงอก ฟรี 1 ครั้ง
- สิทธิพิเศษสามารถใช้ได้ 1 ครั้งในระยะเวลา 1 ปีหลังเปลี่ยนประกันสังคม
- สงวนสิทธิ์สำหรับผู้เปลี่ยนประกันสังคมตั้งแต่วันที่ 1-31 มกราคม 2565
แคนนาบิส เฮมพ์ คาเฟ่ อโยธยา Cannabis Hemp Ayothaya cafe
แคนนาบิส เฮมพ์ คาเฟ่ อโยธยา ตลาดน้ำอโยธยา นอกจากอาหารเครื่องดื่มแล้ว ที่นี่ยังมีต้นกล้าขายด้วยนะ ต้นละ 80 บาทเอง สนใจลองไปส่องที่เพจเค้าดู ช้าอาจหมด หรือโทร 091-496-8888, 091-834-7233
เอกซเรย์ระบบภาพ 3 มิติ
เอกซเรย์ระบบภาพ 3 มิติ คือการถ่ายภาพเอกซเรย์ระบบภาพ 3 มิติบริเวณฟัน ขากรรไกรและกะโหลกศรีษะ ซึ่งเป็นข้อมูลสำคัญที่ช่วยให้ทันตแพทย์ใช้ในการวินิจฉัยโรค วางแผนการรักษาและติดตามผลการรักษา
เอกซเรย์ระบบภาพ 3 มิติ ละเอียดกว่าระบบ 2 มิติ
ใช้ปริมาณรังสีน้อยกว่า
ระบบ 2 มิติจะเห็นเพียงด้านหน้า หรืออาจะเห็นแค่เงาฟันที่บังกัน ขณะที่เอกซเรย์ระบบภาพ 3 มิติ จะบอกได้ชัดเจนกว่าถึงลักษณะฟัน ความใกล้ไกลของของฟันแต่ละซี่ เห็นกระดูที่เหลืออยู่ว่ามากน้อยเพียงใด
4.แรงงานข้ามชาติในยุคโควิด-19: ก้าวข้ามการแยกเขาแยกเรา สู่ความร่วมมือในการแก้ไขปัญหา
ในสถานการณ์การแพร่ระบาดของโควิด-19 นี้ ไทยปฏิบัติต่อคนไทยและชาวต่างชาติแตกต่างกัน ซึ่งการกระทำเช่นนี้ในที่สุดได้ส่งผลกระทบต่อสุขภาพคนไทยอย่างหลีกเลี่ยงไม่ได้ เพราะโรคระบาดไม่ได้สนในเรื่องสัญชาติหรือเชื้อชาติ มนุษย์ทุกคนมีสิทธิติดโรคระบาดทั้งสิ้น
โรงพยาบาลราชพิพัฒน์ ให้บริการทุกวันจันทร์ - ศุกร์ 8.00 - 16.00 LINK
One stop service ศูนย์บริการคนพิการแบบเบ็ดเสร็จ โรงพยาบาลราชพิพัฒน์
ติดต่อได้ที่ ชั้น 1 อาคารเฉลิมพระเกียรติ
ทุกวันจันทร์ - ศุกร์ 8.00 - 16.00 เว้นวันหยุดราชการ
สอบถามโทร. 02-4212222 หรือ 061-7201878
เตรียมเอกสารให้พร้อม
ยื่นเอกสารพร้อมพบแพทย์ประเมิน
ทุกวันศุกร์ เจ้าหน้าที่จะรวบรวมเอกสาร
เพื่อออกบัตรคนพิการ เพื่อจัดส่งทางไปรษณีย์ต่อไป
Targeted industries for Highly-Skilled Professional
หน่วยสัตวแพทย์เคลื่อนที่
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิปสุนัข
ทั้งนี้ ประโยชน์ที่จะได้รับจากการก่อตั้ง NNG (เอ็นเอ็นจี) ศูนย์บริการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์นั้น ยังช่วยให้ไทยมีคลังจีโนมที่แข็งแกร่ง เพื่อนำไปใช้พัฒนาศักยภาพทางการแพทย์ของประเทศให้ดียิ่งขึ้นด้วย “ความร่วมมือในการพัฒนาศูนย์บริการตรวจวิเคราะห์ทางการแพทย์และการรักษาแบบจีโนมิกส์ในครั้งนี้ ถือเป็นการสนับสนุนการดำเนินงานของภาครัฐในการเก็บรวบรวมข้อมูลทางพันธุศาสตร์ของประชากรไทย เพื่อใช้เป็นฐานข้อมูลในการพัฒนาการตรวจพันธุกรรมเพื่อเพิ่มขีดความสามารถในการรักษาพยาบาลเฉพาะบุคคลทั้งในเชิงการป้องกันและการรักษา ตลอดจนสนับสนุนงานด้านการวิจัยและการพัฒนาร่วมกับบริษัทผลิตยาและวัคซีนในอนาคต สำหรับโรคต่างๆ โรคร้ายแรง และโรคอุบัติใหม่ ให้เหมาะสมกับคนไทยมากที่สุด เพื่อสนับสนุนให้ไทยเป็นประเทศที่มีพัฒนาการทางการแพทย์เชิงรุก และพร้อมรองรับการให้บริการในระดับสากลต่อไป”แพทย์หญิงปรมาภรณ์ กล่าวสรุป
การแพทย์แผนไทย โรงพยาบาลสงขลา LINK
กลุ่มงานการแพทย์แผนไทย โรงพยาบาลสงขลา เปิดให้บริการดังนี้
นวดรักษา
จ่ายยาสมุนไพร
ประคบสมุนไพร
ฟื้นฟูสุขภาพมารดาหลังคลอด
พอกเข่ารักษาข้อเข่าเสื่อม
ให้คำแนะนำด้านแพทย์แผนไทย
บริการทุกวันจันทร์-ศุกร์ 8-16 น. (เว้นวันหยุด)
** ค่าธรรมเนียมเข้ารับบริการตามสิทธิ
สอบถามโทร. รพ.สงขลา เกาะยอ 074-338100 ต่อ 4005
รพ.เมืองสงขลา 074-321074
BMAQ จองคิวล่วงหน้ารับบริการ สำนักงานเขต 50 เขต
BMA Q “บริการทันใจ นัดหมายทันเวลา” จองคิวล่วงหน้า ทางแอปพลิเคชันบนมือถือ แบ่งการทำงานเป็น 2 เมนู ได้แก่
1. นัดล่วงหน้า ประชาชนสามารถจองคิวล่วงหน้าได้ ที่สำนักงานเขต 50 เขต และจุดบริการด่วนมหานคร 12 จุด โดยเลือก สถานที่ วันที่ และช่วงเวลา (จำกัดจำนวนโควต้าในแต่ละช่วงเวลา) ที่สะดวก โดยจะได้รับการจองเป็น QR-Code และนำมาสแกนเพื่อรับ บัตรคิวทางแอปพลิเคชัน “BMA Q” ที่จุดให้บริการ เพื่อรับคิวแบบนัดหมาย ได้บริการสะดวก และรวดเร็ว
2. ตรวจสอบจำนวนผู้ใช้บริการ สามารถดูจำนวนคิวรอ แบบ Real Time โดยแสดงผลเรียงลำดับจากจุดให้บริการที่อยู่ใกล้ที่สุด เพื่อวางแผนการติดต่อราชการได้ และมีระบบแผนที่แสดงจุดที่ตั้งของทุกจุดบริการ
คลินิกกัญชาทางการแพทย์ โรงพยาบาลกล้วยน้ำไท LINK
คลินิกปราณะ หรือ คลินิกกัญชาทางการแพทย์ โรงพยาบาลกล้วยน้ำไท เปิดให้บริการแล้ว จันทร์ - ศุกร์ ตั้งแต่ 09.00 -15.00 น. (หยุดทำการวันเสาร์ อาทิตย์ และวันหยุดนักขัตฤกษ์)
ชั้น2 อาคารกาญจนาภิเษก โทร. 080-5601820 / 02-7692047
ขอบเขตอาการ ปวดเรื้อรัง นอนไม่หลับ ปวดศรีษะเรื้อรัง ออฟฟิตซินโดรม ริดสีดวง กระเพาะ อัลไซเมอร์ โรคอื่น ๆ บรรเทาได้ด้วย ตำรับยาจากวัตถุดิบกัญชา ดูแลการรักษาโดยแพทย์แผนไทย
บริการผู้ป่วยนอก SMART OPD
ปัจจุบันให้บริการวันละ 4 - 6 ห้องตรวจ ในสาขาต่างๆ เวชศาสตร์ครอบครัว, อายุรกรรมทั่วไป, โสต ศอ นาสิก, จักษุ, ออร์โธปิดิกส์, ศัลยกรรม, ศัลยกรรมตกแต่ง, นรีเวช, กุมารเวช
โทร. 02-5929550 ต่อ 70019 - 20
บริการของเรา
- ให้การดูแลผู้ป่วย
- บริการทำแผลทั่วไป และแผลเรื้อรัง
- ปรึกษาปัญหาสุขภาพโดยพยาบาลวิชาชีพ
- ตรวจเท้าเบาหวาน
- บริหารร่างกายยามเช้า
- การบริหารเท้าผู้ป่วยเบาหวาน
- ให้สุขศึกษาโรคเบาหวาน
แพคเกจตรวจสุขภาพชายหญิง พร้อมมีบุตร
สอบถามโทร.02-5929550 ต่อ 70019 - 20
วันจันทร์-ศุกร์ 8-16 น.
Line OA : ผู้ป่วยนอกราชวิถี2
แพคเกจตรวจสุขภาพ ชาย-หญิง ก่อนเข้าทำงาน
ปานเทพ ออกแถลงการณ์ หลังสภามีมติคว่ำพ.ร.บ.กัญชา LINK
14 กันยายน นายปานเทพ พัวพงษ์พันธ์ พร้อมด้วยนายเทวัญ ธานีรัตน์ และนายอภิวัฒน์ จ่าตา ออกแถลงการณ์ หลังจากสภามีมติให้ถอนร่าง พ.ร.บ.กัญชา กัญชง กลับไปพิจารณาใหม่ โดยมีเนื้อหาดังนี้
สืบเนื่องจาก 2 พรรค ไม่เห็นด้วยกับร่างพรบ กัญชา กัญชง และอยากให้กัญชากลับไปเป็นยาเสพติดใหม่ อยากเรียนว่า สิ่งที่คณะกรรมาธิการ ได้ทำการระดมสรรพกำลัง นับตั้งแต่เกิดสุญญากาศทางข้อกฏหมาย เมื่อ 9 มิถุนายน 2565
รัฐบาลประยุทธ์ จันทร์โอชา รวมถึงรัฐมนตรีว่าการกระทรวงสาธารณสุข ได้ออกมาตรการหลายประการจำนวนมาก เพื่อคุ้มครองสังคม ในระหว่างที่รอกฏหมายกัญชา กัญชง แม้ว่าจะอยู่ในสถานการณ์ที่ควบคุมได้ ดีพอสมควร แต่ก็ยังเทียบไม่ได้กับร่าง พรบ กัญชา กัญชง ที่มีความรัดกุมรอบคอบหลายมิติ
และถ้ากฏหมายฉบับ นี้ ยังไม่ผ่าน ฝ่ายการเมืองต้องคำนึงว่า สถานการณ์เดิมของภาวะสุญญากาศ จะยังคำดำรงอยู่ต่อไป
4.ประเภทผู้นำชุมชน คือ นายสมร สอนจันทร์
4.ประเภทผู้นำชุมชน คือ นายสมร สอนจันทร์ ผู้ใหญ่บ้านบ้านเขาใหญ่ หมู่ 1 ต.ท่ามะขาม อ.เมือง จ.กาญจนบุรี เป็นผู้นำชุมชนในการจัดการสภาพชุมชนและอนามัยสิ่งแวดล้อมอย่างมีส่วนร่วมและจิตอาสานำเทคโนโลยีสารสนเทศและนวัตกรรมมาใช้พัฒนางานดูแลประชาชนในทุกด้าน ส่งเสริมพัฒนาพื้นที่ให้มีสุขภาวะ เป็นต้นแบบพื้นที่เรื่องการจัดการขยะเปียก ขยะครัวเรือน ขยะชุมชน ให้ชุมชนสะอาด เป็นระเบียบ ช่วยลดการเจ็บป่วยโรคไข้เลือดออก แก้ปัญหายาเสพติดในชุมชน
ทุกคนสามารถร่วมเพิ่มพื้นที่สีเขียวกับ กรุงเทพมหานครได้
1. ช่วยกันปลูกต้นไม้ในพื้นที่ของตน
2. ช่วยกันเป็นหูเป็นตาสอดส่องดูแลต้นไม้ในพื้นที่สาธารณะ
3. แนะนำพื้นที่ที่เหมาะสมสำหรับจัด ทำสวนสาธารณะให้แก่กรุงเทพมหานคร
4. หน่วยงานหรือประชาชนเจ้าของที่ หากมีพื้นที่ที่ไม่ได้ใช้ประโยชน์ สามารถนำมาให้กรุงเทพมหานครพิจารณาความเหมาะสมเพื่อพัฒนาเป็นพื้นที่สาธารณะต่อไปได้
ผัดกะเพรากัญชา เนื้อดรายเอจราดข้าว, ไข่ดาว เชฟ สิทธิฉันท์ วุฒิพรกุล @Roddeeded BAAN KHUN NOP
ผัดกะเพรากัญชา เนื้อดรายเอจราดข้าว, ไข่ดาว
เชฟ/เจ้าของ: สิทธิฉันท์ วุฒิพรกุล
ร้าน: บ้านคุณนพ (รสดีเด็ด)
สรรพคุณทางยา:
“ผัดกะเพรา” เมนูสามัญประจำบ้านที่มีรสชาติเผ็ดร้อนและกลิ่นหอมเฉพาะตัวของกะเพรา เข้ากันได้ดีกับรสชาติและรสสัมผัสของเนื้อดรายเอจนุ่ม ๆ ที่ละลายในปาก และใบกัญชาที่ช่วยเพิ่มให้ผัดกะเพรามีรสที่กลมกล่อมลงตัวมากยิ่งขึ้น
ที่อยู่: 1676 แยกสะพานอ่อน ถ.รองเมือง (บันทัดทอง) เขตประทุมวัน กรุงเทพมหานคร 10330
Line: 0925955165
Tel. 0-2595-5165
ลาบหมูทอดสองทิศใบกัญชา LINK
เครื่องปรุง
ใบกัญชา 2 ใบ / ผักชีฝรั่ง 5 กรัม / หอมแดง 10 กรัม / ใบมะกรูด 2 กรัม / น้ำมะนาว 10 กรัม / พริกป่น 2 กรัม / ข้าวคั่ว 5 กรัม / น้ำปลา 20 กรัม / ผักเคียง 2 กรัม (แครอท แตงกวา พริกแห้ง) / หมูสับ 100 กรัม
วิธีการทำ
1. นำข้าวคั่ว พริกป่น น้ำปลา ใบมะกรูด หอมแดง และผักชีฝรั่ง ผสมกับหมูสับ หมักทิ้งไว้สักครู่
2. ปั้นหมูสับที่หมักไว้เป็นก้อนกลมแบน แล้วห่อด้วยใบกัญชา
3. ตั้งกระทะ ใส่น้ำมัน รอจนน้ำมันร้อน แล้วส่หมูลงในกระทะ และทอดจนหมูสุก มีสีเหลืองน่ากิน
4. จัดเสิร์ฟ
การตรวจคัดกรองมะเร็งในผู้หญิง
การตรวจคัดกรองมะเร็งในผู้หญิง
ตรวจสุขภาพหามะเร็งอย่างไรดี และเมื่อไหร่!
โรคที่มักพบได้บ่อยในผู้หญิงก็คือ มะเร็งเต้านม มะเร็งปากมดลูก ดังนั้นจึงเน้นไปที่อวัยวะเหล่านี้เป็นหลัก
เต้านม
โดยทั่วๆไป ผู้หญิงอายุตั้งแต่ 25 ปีขึ้นไป ควรจะต้องเริ่มมีการตรวจเต้านมตัวเองอยู่สม่ำเสมอ แนะนำให้ตรวจหลังการหมดช่วงมีประจำเดือน และให้พบแพทย์เพื่อตรวจเต้านมทุก1-3ปี
อายุตั้งแต่ 40 ปีขึ้นไป แนะนำเริ่มมีการตรวจแมมโมแกรมเป็นประจำทุกปี และยังต้องมีการตรวจด้วยตัวเองต่อไปอย่างสม่ำเสมอเช่นเดิม
แต่ถ้าเป็นผู้หญิงที่มีความเสี่ยงมากกว่าคนทั่วไป เช่น เคยเป็นมะเร็งเต้านมมาก่อน เคยตรวจเจอเนื้อเต้านมชนิด LCIS เคยฉายแสงก่อนอายุ 30 ปี บริเวรหน้าอก มีประวัติคนในครอบครัวเป็นมะเร็งเต้านม หรือเป็นมะเร็งทางพันธุกรรมเต้านม รังไข่ อาจต้องเริ่มตรวจแมมโมแกรมที่อายุ 30 พบแพทย์เพื่อตรวจร่างกายทุก 6-12 เดือน หรือตรวจแมมโมแกรมอาจไม่พอ บางรายอาจต้องตรวจ MRI หรือคลื่นแม่เหล็กไฟฟ้าร่วมด้วย
ปากมดลูก
อายุ 21-29 ปี ให้ตรวจ Pap test (ตรวจแป๊ป) ทุก 3ปี เป็นการตรวจภายในและตรวจเซลล์มะเร็งที่ปากมดลูก
อายุ 30-65 ปี ให้ตรวจ Pap test ทุก3ปีได้ และถ้าจะให้ดียิ่งขึ้นอาจต้องมีการตรวจเชื้อ HPV (เอชพีวี) เพิ่มเติม โดยทำทุก 5 ปีถ้าตรวจ Pap test ร่วมกับการตรวจ HPV
ลำไส้ใหญ่
คนทั่วไป เริ่มตรวจที่อายุ 50 ปีค่ะ
โดยการตรวจได้หลายแบบได้แก่
* การส่องกล้องตรวจลำไส้ส่วนปลายและทวารหนัก (flexible sigmoidoscopy) ทุก 5 ปี
* การส่องกล้องตรวจลำไส้ใหญ่ทั้งหมด (colonoscopy) ทุก10 ปี
* การตรวจอุจจาระ โดยอาจร่วมกับส่องกล้องลำไส้ส่วนปลายปละทวารหนัก ทุก 5 ปี
* การตรวจลำไส้ใหญ่ทางเอ็กซเรย์คอมพิวเตอร์ CT colonography ทุก 5 ปี
โรงพยาบาลกรุงเทพมุ่งมั่นพัฒนายกระดับการรักษาสู่ความยั่งยืนในระดับสากล พัฒนารูปแบบบริการเป็น Your Healthcare Intelligence เพื่อให้ผู้รับบริการได้รับความพึงพอใจสูงสุด ทั้งด้านความปลอดภัยขั้นสูง ผนวกกับคุณภาพการรักษาตามมาตรฐานสากล ภายใต้ค่าใช้จ่ายที่คุ้มค่า โดยบุคลากรทางการแพทย์ที่มีความชำนาญการ อุปกรณ์การแพทย์ที่ทันสมัย และระบบการให้บริการอัจฉริยะรูปแบบใหม่ในทุกมิติของการรักษาพยาบาล ที่ดูแลสุขภาพคุณเสมอมา เพื่อให้ทุกคนมีคุณภาพชีวิตที่ดีอย่างยั่งยืน
ข่าวปลอม! หากมีความเครียดติดต่อกัน 5 วัน เซลล์ในร่างกายจะกลายเป็นเซลล์มะเร็งได้ทันที LINK
ตามที่มีการบอกต่อข้อมูลเกี่ยวกับประเด็นเรื่องหากมีความเครียดติดต่อกัน 5 วัน เซลล์ในร่างกายจะกลายเป็นเซลล์มะเร็งได้ทันที ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีผู้โพสต์ระบุว่าหากมีความเครียดติดต่อกัน 5 วัน เซลล์ในร่างกายจะกลายเป็นเซลล์มะเร็งได้ทันที ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่า ความเครียด คือ การตอบสนองของร่างกายต่อสภาวะกดดันทางกาย จิตใจ และอารมณ์ เมื่อมีความเครียดเกิดขึ้น ร่างกายจะมีการสร้างฮอร์โมนเพื่อตอบสนองต่อความเครียดนั้น ส่งผลให้หัวใจเต้นเร็วขึ้น ความดันโลหิตและระดับน้ำตาลในเลือดเพิ่มสูงขึ้น จากการสืบค้นข้อมูลเบื้องต้นพบว่าความเครียดอาจเกี่ยวข้องกับการขยายขนาดและแพร่กระจายของมะเร็งในผู้ป่วยโรคมะเร็ง
อย่างไรก็ตาม มีข้อมูลงานวิจัยที่บ่งชี้ว่าการมีความเครียดน้อย ๆ ในช่วงสั้น ๆ จะทำให้ร่างกายตื่นตัว ส่งผลดีต่อการใช้ชีวิตประจำวัน แต่ในทางกลับกันหากความเครียดนั้นกินระยะเวลายาวนานจะส่งผลเสียต่อร่างกายและจิตใจ และอาจนำไปสู่การมีพฤติกรรมเพิ่มความเสี่ยงโรคมะเร็ง เช่น สูบบุหรี่ ดื่มสุรา เป็นต้น สำหรับการเผยแพร่ข้อมูลว่าหากมีความเครียดติดต่อกัน 5 วัน เซลล์ในร่างกายจะกลายเป็นเซลล์มะเร็งได้ทันทีนั้น พบว่ายังไม่มีหลักฐานทางการแพทย์ยืนยันแน่ชัด และหากความเครียดส่งผลกระทบหลายด้าน จึงควรหาวิธีผ่อนคลายจากภาวะเครียด เช่น การออกกำลังกายเป็นประจำสม่ำเสมอ ทำกิจกรรมที่ชอบ นั่งสมาธิ เป็นต้น
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : ยังไม่มีหลักฐานทางการแพทย์ยืนยันแน่ชัด แต่ความเครียดอาจนำไปสู่การมีพฤติกรรมเพิ่มความเสี่ยงโรคมะเร็ง เช่น สูบบุหรี่ ดื่มสุรา เป็นต้น
ศูนย์ความเป็นเลิศทางการแพทย์ทางกระดูกและข้อ โรงพยาบาลกรุงเทพภูเก็ต
เป็นศูนย์การแพทย์เฉพาะทางในการรักษาโรคกระดูก ข้อ เส้นเอ็น กล้ามเนื้อ เส้นประสาท รวมทั้งบริการผู้ป่วยโรคกระดูกสันหลังทุกประเภท และการดูแลทางเวชศาสตร์การกีฬา โดยคณะแพทย์ผู้เชี่ยวชาญเฉพาะสาขา และทีมพยาบาลที่มีประสบการณ์ ครอบคลุมโรคทางกระดูกและข้ออย่างครบถ้วน ให้บริการรักษาแบบครบวงจร ทั้งผู้ป่วยอุบัติเหตุ ผู้ป่วยทั่วไปเกี่ยวกับระบบโครงร่างของกระดูก การตรวจวินิจฉัย การรักษาแบบไม่ต้องผ่าตัด และการรักษาด้วยวิธีผ่าตัด โดยมีทั้งการผ่าตัดแบบเปิดแผลกว้าง และการผ่าตัดผ่านกล้อง ซึ่งเป็นเทคนิคการผ่าตัดสมัยใหม่ที่ได้รับความนิยมในปัจจุบัน เนื่องจากเป็นวิธีที่ช่วยให้ผู้ป่วยเสียเลือดน้อยลง บาดแผลขนาดเล็ก อาการเจ็บปวดแผลหลังการผ่าตัดน้อยกว่าการผ่าตัดแบบเปิด ส่งผลให้ผู้ป่วยฟื้นตัวเร็ว สามารถกลับไปทำงานและใช้ชีวิตได้ตามปกติเร็วขึ้น
เวลาทำการ
ศูนย์กระดูกและข้อ
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 17.00 น.
หลังเวลา 17.00 น. รับบริการได้ที่
ศูนย์อุบัติเหตุและฉุกเฉิน
สถาบันโรคกระดูกสันหลังกรุงเทพภูเก็ต
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 16.00 น.
รับบริการได้ที่ศูนย์กระดูกและข้อ
ศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้องในข้อ
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 16.00 น.
ติดต่อสอบถาม
ศูนย์กระดูกและข้อ
โทร: 076 254 425 ต่อ 3744,
076 655 000 ต่อ 3744
สถาบันโรคกระดูกสันหลังกรุงเทพภูเก็ต
โทร: 076 254 425 ต่อ 8335,
076 655 000 ต่อ 8335
ศูนย์เวชศาสตร์การกีฬาและการผ่าตัดส่องกล้องในข้อ
โทร: 076 254 425 ต่อ 1094,
076 655 000 ต่อ 1094
ความสนใจของคนไทยในขณะนี้คงหนีไม่พ้นเรื่องของข่าวสารบ้านเมือง เศรษฐกิจ ชีวิตประจำวัน จากผลสำรวจเห็นได้ชัดว่า ขณะนี้คนไทยสนใจข่าวเกี่ยวกับการเมืองสูงสุด คุณธีรเมศร์ นิติจรรยาวงศ์, ผู้อำนวยการฝ่ายวางแผนกลยุทธ์การสื่อสาร บริษัท ฮาคูโฮโด โอทู จำกัด ได้กล่าวถึงเรื่องนี้ไว้ว่า "ขณะนี้ข่าวการเมืองร้อนแรงที่สุด คนไทยให้ความสนใจมาก โดยเฉพาะเรื่องวาระครบ 8 ปี ของนายกรัฐมนตรี คนไทยกำลังจับตามองว่าบทสรุปของเรื่องนี้จะไปจบในทิศทางไหน หรือแม้กระทั่งเรื่องผู้ว่าฯ กทม. คนใหม่ ว่าจะจัดการปัญหาน้ำท่วมที่ต้องพบเจอทุกปีอย่างไร จะมีการเปลี่ยนแปลงได้มากแค่ไหน แต่ในขณะเดียวกันก็มีเรื่อง Forex3D ที่คนไทยให้ความสนใจเป็นจำนวนไม่น้อย เพราะเป็นคดีฉ้อโกง ทำให้คนไทยหลายคนตั้งถามถึงความโปร่งใส และความชอบธรรมในสังคม ซึ่งจุดนี้เองทำให้กระแสคนในสังคมเปลี่ยนไป มีการจับกลุ่มพูดคุยแลกเปลี่ยนความเห็นกันมากขึ้น ใส่ใจในคนรอบตัวมากยิ่งขึ้น ไม่เพียงแต่รับข่าวสารแล้วจบไป แต่ต้องการการเปลี่ยนแปลงอันเป็นรูปธรรมมากขึ้น"
นอกจากนี้ชี้ชัดว่าเรื่องความมั่งคั่งของคนไทยถือว่าอยู่ในเกณฑ์ที่ควรระวัง ยิ่งในยุคที่เกิดภาวะเงินเฟ้อพร้อมทั้งค่าครองชีพสูงแบบนี้ อาจจะทำให้ใครหลายคนชักหน้าไม่ถึงหลัง คนส่วนใหญ่จึงมุ่งมั่นพัฒนาตนเอง มองถึงความมั่งคั่งในอนาคต โดยเริ่มจากการเรียนรู้ในสิ่งต่างๆ เพื่อพัฒนาศักยภาพและเพิ่มโอกาสในการสร้างรายได้ให้ตนเองและครอบครัวในระยะยาว ปรับตัวสู้กับสถานการณ์เศรษฐกิจที่ไม่แน่นอน การศึกษาหาความรู้ไว้ต่อยอดในอนาคตจึงเป็นเรื่องสำคัญ
แต่เมื่อลงลึกถึงความสุขในภาพรวมคนไทยมีเกณฑ์ความสุขที่ลดลงเมื่อเทียบจากผลสำรวจเมื่อเดือนสิงหาคมที่ผ่านมา หากแยกเพศจะเห็นได้ชัดว่า ใน 100 คน เพศชายมีเกณฑ์ความสุขที่เพิ่มขึ้น +2 แต่ในเพศหญิงมีเกณฑ์ความสุขที่ลดลง -3 อันส่งผลมาจากภาระหน้าที่ในการทำงาน ทั้งงานในบ้าน งานนอกบ้าน รวมถึงการต้องดูแลเด็กๆ ในช่วงปิดเทอม ทำให้ไม่มีเวลามากพอในการพักผ่อน ซึ่งนี่เป็นอีกหนึ่งเหตุผลสำคัญที่ทำให้แนวโน้มเรื่องความสุขโดยรวมลดลง
อย่างไรก็ตาม แม้ในภาวะเงินเฟ้อ ค่าครองชีพพุ่งสูง ของกิน ของใช้มีราคาที่แพงขึ้น ผู้คนรู้สึกท้อและหดหู่ แต่ก็ยังมีสัญญาณที่ดีที่คนไทยยังคงพร้อมปรับตัวสู้ในทุกสถานการณ์ สถาบันวิจัยความเป็นอยู่ ฮาคูโฮโด อาเซียน ประเทศไทย จึงแนะแบรนด์ต่าง ๆ ให้ร่วมเป็นส่วนหนึ่งในการช่วยเหลือและเข้ามามีบทบาทในช่วงเวลาดังกล่าวด้วย
ขณะที่บางภาวะโรคมีผลวิจัยขนาดเล็ก ระบุว่า สารสกัดกัญชามีแนวโน้มอาจได้ประโยชน์ในการรักษาอาการ อาทิ โรคพาร์คินสัน โรคอัลไซเมอร์ โรควิตกกังวลทั่วไป และโรคปลอกประสาทอักเสบอื่นๆ การนำมาใช้ประโยชน์จึงเป็นไปตามดุลยพินิจของแพทย์ผู้รักษา ขณะเดียวกันสารสกัดกัญชาจะเป็นความหวังสำหรับรักษาผู้ป่วยโรคมะเร็งและโรคอื่นๆ
ครั้งแรกในไทยและอาเซียน กับคลินิกการได้ยินและการทรงตัวขั้นสูง


ดร.พญ.นัตวรรณ อุทุมพฤกษ์พร แพทย์ผู้เชี่ยวชาญด้านโสต ศอ นาสิก ประจำคลินิกการได้ยินและการทรงตัวขั้นสูง (Advance hearing and balance clinic) กล่าวสรุปว่า “โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย เป็นโรงพยาบาลโรงเรียนแพทย์ในระดับตติยภูมิที่รับผู้ป่วยส่งต่อจากโรงพยาบาลต่างๆ ทั้งในกรุงเทพฯ และต่างจังหวัด โดยเฉพาะการให้บริการรักษาผู้ป่วยที่มีปัญหาการได้ยินและทรงตัว ซึ่งนับเป็นปัญหาที่พบบ่อยและมีความซับซ้อนของโรคในกลุ่มผู้สูงอายุ จำเป็นต้องใช้เครื่องมือที่ทันสมัย อาศัยความรู้ความสามารถของแพทย์และผู้เชี่ยวชาญเฉพาะทาง เพื่อให้บริการการรักษาการได้ยินและทรงตัวขั้นสูงในระดับสมอง พร้อมทั้งตรวจประเมินและแปลผลการได้ยินรวมทั้งการทรงตัวได้อย่างมีประสิทธิภาพ และเป็นการต่อยอดความร่วมมือวิจัยกับนานาประเทศที่ผ่านมา โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย จึงได้จัดตั้ง “คลินิกการได้ยินและการทรงตัวขั้นสูง” (Advance hearing and balance clinic) ภายใต้ศูนย์การได้ยินการสื่อสารและการทรงตัว Hearing Speech and Balance Centre ซึ่งนับเป็นแห่งแรกในประเทศไทยและภูมิภาคตะวันออกเฉียงใต้ โดยคลินิกและศูนย์ฯ ตั้งอยู่ที่ ชั้น 8 อาคาร ส.ธ. โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย
About the Speakers
Prof. Keith L Black, M.D.
BDMS Wellness Clinic Executive Advisor l Brain Wellness Clinic
Dr. Keith L. Black is a renowned neurosurgeon and scientist in Los Angeles. He received his medical degree from University of Michigan Medical School and has been in practice for more than 20 years.
Keith L. Black is the chairman of the Department of Neurosurgery and the director of the Maxine Dunitz Neurosurgical Institute at Cedars-Sinai Medical Center. Dr. Black also holds the Ruth and Lawrence Harvey Chair in Neurosciences and is a professor of neurosurgery at Cedars-Sinai Medical Center. At age seventeen, he published his first scientific paper, which earned the Westinghouse Science Award. He earned both his undergraduate and medical degrees in six years. He completed his internship in general surgery and residency in neurological surgery at the University of Michigan Medical Center in Ann Arbor.
Dr. Black has pioneered research on designing ways to open the blood-brain barrier, enabling chemotherapeutic drugs to be delivered directly into the tumor. His other ground-breaking research includes developing a vaccine to enhance the body’s immune response to brain tumors, using gene arrays to develop molecular profiles of tumors, employing optical technology for brain mapping. He has also made use of precisely targeted microwave radiation to kill cancer cells, a computer-driven technology that may someday be performed remotely, without requiring the physical presence of the surgeon in the operating room. His work had drawn national attention. He was profiled on the public television series The New Explorers, the magazine Esquire included him on its list of “The 21 Most Important People of the 21st Century,” and TIME magazine featured him on the cover of a 1997 special edition, “Heroes of Medicine.” His autobiography, Brain Surgeon, was published in 2009.
Prof. Jirí Dvorák, M.D.
BDMS Wellness Clinic Executive Advisor | Musculoskeletal and Rehabilitation Clinic
Senior Consultant in Neurology and Research at the Spine Center, Schulthess Clinic, Zurich, where he previously served as Chairman for 35 years. A Professor of Neurology at the University of Zurich, former Chief Medical Officer at FIFA, and a Consultant at BDMS Wellness Clinic, Bangkok. Prof. Dr. Jirí Dvorák is a Senior Advisor of the British Journal of Sports Medicine, a previous Deputy Editor of SPINE, and is widely published with 462 original articles. His immense contributions to spine research on clinical biomechanics and to sports medicine on injury prevention have resulted in numerous awards. His current research activities are focused on prevention of communicable and non-communicable diseases, and he is also developing a national-level Lifestyle Medicine Diploma for Thailand. An Honorary Member of EUROSPINE, which he co-founded in 1990, also at the International Society of Arthroscopy, Knee Surgery and Orthopedic Sports Medicine, and the Czech Medical Academy.
Dr. Tanupol Virunhagarun, M.D.
Chief Executive Officer - BDMS Wellness Clinic
Dr. Tanupol is the CEO of BDMS Wellness Clinic, Bangkok, the preventive medical clinic of Bangkok Dusit Medical Services, one of the global top five healthcare providers. He is President of the Bangkok Association of Regenerative Health and The Study of Obesity, and an active advocate of lifestyle medicine. Widely known as Dr. Amp, he is a popular social media influencer with his educational Dr. Amp Team channel amassing 45 million views and 750,000 followers. With his goal to spread knowledge about different health topics to the Thai public, Dr. Tanupol has also authored numerous successful Thai-language books including: Eat Well, Live Long; 100 Years of Great Health; Secrets of Longevity and Anti-Aging; and Power of Sleep, Power of Health. He is becoming more active within the education sector and is a Member of the Editorial Board for the peer-reviewed Bangkok Medical Journal.
William E. Heinecke
Chairman of Minor International Plc.
One of the best known expatriates in Southeast Asia, Bill Heinecke is the driving force behind the leading global brands under the Minor Group umbrella. His visionary spirit, unwavering commitment and hands-on management style are the cornerstones of his unparalleled successes, which are deeply rooted in Thailand. Bill created his very first company here at the young age of 17. Today, Minor International (MINT) owns and operates a diversity companies, focused on three primary business sectors: restaurants, hotels and lifestyle retail brands. MINT operates over 2,200 restaurants, over 400 retail trading outlets, and over 535 hotels across 55 countries.
การตรวจคัดกรองและเข้ารับวัคซีนป้องกัน HPV
สำหรับบริการตรวจคัดกรองและเข้ารับวัคซีนป้องกัน HPV ฟรีเพื่อประชาชน นายแพทย์จักรกริช ได้กล่าวเสริมเรื่องการสนับสนุนจากภาครัฐว่า “ทางสปสช. เล็งเห็นถึงอันตรายของโรคมะเร็งปากมดลูกที่ต้องเอาใจใส่อย่างใกล้ชิด โดยมีการจัดสรรงบประมาณเพื่อดูแลโรคดังกล่าวอย่างครบวงจร ตั้งแต่ส่งเสริมการตรวจคัดกรองสำหรับหญิงไทยอายุ 30-60 ปี ให้มีสิทธิเข้ารับการตรวจคัดกรองโรคนี้ทุก 5 ปีได้ฟรี ณ สถานพยาบาลที่มีรายชื่อสังกัดอยู่ และจัดบริการฉีดวัคซีนในโรงเรียนให้กับนักเรียนหญิงชั้น ป.5 ทั่วประเทศกว่า 4 แสนราย ซึ่งโครงการนี้ได้ดำเนินมามาตลอดตั้งแต่ก่อนหน้าการระบาดของโควิด-19 แม้จะมีการขาดช่วงไปเนื่องจากสถานการณ์โรคระบาด และมีปัญหาวัคซีนขาดตลาด แต่เราก็ได้กลับมาดำเนินการต่อในปี 2565 ซึ่งปีนี้ สปสช. สามารถจัดหาวัคซีน HPV ชนิด 4 สายพันธุ์ให้กับนักเรียนชั้นป.5 ทั่วประเทศ
นอกจากนี้ สปสช.ได้ส่งเสริมให้มีการตรวจคัดกรองมะเร็งปากมดลูก โดยสนับสนุน ชุดตรวจ HPV DNA Testing เพื่อให้ประชาชนสามารถเก็บตัวอย่างได้ด้วยตนเองเพื่อส่งตรวจมะเร็งปากมดลูกโดยคาดว่าจะสามารถเริ่มให้บริการได้ในเร็ว ๆ นี้ ตลอดจนพัฒนาสิทธิประโยชน์ในการดูแลการติดเชื้อ HPV ที่รับข้อเสนอจากคณะทำงานผู้เชี่ยวชาญ รวมถึงกระทรวงสาธารณสุข และอาจมีการพิจารณาเพิ่มช่วงอายุของเด็กและเยาวชนที่ได้รับสิทธิในการฉีดวัคซีน HPV รวมถึงเด็กผู้ชายในอนาคต เพื่อส่งเสริมความปลอดภัยด้านสุขภาพให้คนไทยอีกด้วย”
มะเร็งปากมดลูกแม้เป็นโรคร้ายสำหรับทุกคนในสังคม แต่ก็สามารถป้องกันได้ไม่ยาก โดยการฉีดวัคซีน HPV ในประชาชนทุกเพศ ตั้งแต่อายุ 9 ปีขึ้นไป และเข้ารับการตรวจคัดกรองอย่างสม่ำเสมอทุก 5 ปี เมื่อมีอายุ 30 ปีขึ้นไป แต่สำหรับผู้เคยตรวจพบมะเร็งปากมดลูกและรักษาหายแล้วก็ยังต้องมีการเข้ารับคำแนะนำจากแพทย์อย่างต่อเนื่อง เพื่อป้องกันการกลับมาป่วยซ้ำ โดยทางการแพทย์แนะนำให้ประชาชนทุกคนทั้งที่ไม่เคยมีประวัติการป่วยเป็นมะเร็งมาก่อน รวมถึงผู้ที่ได้รับการฉีดวัคซีนแล้วเข้ารับการตรวจร่างกายอย่างสม่ำเสมอ เพื่อให้แน่ใจว่ามีร่างกายที่สมบูรณ์แข็งแรงตลอดเวลา สามารถรับการรักษาได้ทันท่วงทีหากตรวจเจอความผิดปกติ เพื่อสุขภาพที่ดีอย่างยั่งยืน
4. การตรวจสุขภาพหัวใจและหลอดเลือด
นอกจากการตรวจระดับน้ำตาลและไขมันในเลือดแล้ว การตรวจสุขภาพหัวใจและหลอดเลือดเพื่อให้ละเอียดมากขึ้นนั้นยังมีอีกหลายวิธี เช่น
- การตรวจคลื่นไฟฟ้าหัวใจ (Electrocardiogram; EKG) เพื่อดูกระแสไฟฟ้าที่หัวใจผลิตออกมาขณะหัวใจหดและคลายตัวว่ามีความผิดปกติหรือไม่
- การตรวจสมรรถภาพการไหลเวียนของหลอดเลือดแดงส่วนปลาย (Ankle Brachial Index; ABI) เพื่อค้นหาหลอดเลือดส่วนปลายอุดตัน
- การทดสอบสมรรถภาพหัวใจด้วยการออกกำลังกาย (Exercise stress test; EST) เพื่อดูการเปลี่ยนแปลงคลื่นไฟฟ้าหัวใจขณะออกกำลังกาย
- การตรวจหัวใจด้วยคลื่นความถี่สูง (Echocardiogram; ECHO) เพื่อประเมินการทำงานของหัวใจ เช่น การบีบตัวของกล้ามเนื้อหัวใจ เป็นต้น
- การตรวจหาคราบหินปูนที่หลอดเลือดแดงของหัวใจ (Coronary Artery Calcium Scan; CAC) สามารถทำได้โดยไม่ต้องฉีดสี (Non-contrast) เพื่อใช้บ่งชี้ความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจตีบและกล้ามเนื้อหัวใจขาดเลือด โดยแปลผลออกมาเป็นตัวเลข ซึ่งตัวเลขที่มากขึ้นนั้น หมายถึงความเสี่ยงที่หลอดเลือดหัวใจจะตีบหรือตันมากขึ้น
- การตรวจอัลตราซาวน์เพื่อตรวจดูหลอดเลือดแดงคาโรติด (Ultrasound Carotid Artery) บริเวณคอทั้งสองข้าง เพื่อดูการไหลเวียนของเลือด และคราบหินปูน (Calcified plaque) ทำให้เห็นว่าหลอดเลือดมีการตีบตันหรือไม่
Riche Farm (วิสาหกิจชุมชนริเช่ ฟาร์ม)
พื้นที่เกษตรสมัยใหม่ คำนึงถึงความปลอดภัยผู้บริโภค
สถานที่ : อำเภอมโนรมย์ จังหวัดชัยนาท
ภูเรือแซงค์ฌัวรี รีสอร์ท แอนด์ สปา
ทางโรงแรมได้ผ่านการรับรอง "โรงแรมที่เป็นมิตรกับสุขภาพและสิ่งแวดล้อม Green Heath Hotel"
สถานที่ : อำเภอภูเรือ จังหวัดเลย
โรงแรมเจ้าพระยาธารา ริเวอร์ไซด์ ชัยนาท
ยินดีต้อนรับเข้าสู่ โรงแรมเจ้าพระยาธารา ริเวอร์ไซด์ ชัยนาท โรงแรมตั้งอยู่ในตัวเมืองชัยนาท ติดแม่น้ำเจ้าพระยา ในโรงแรมมีสิ่งอำนวยความสะดวก เช่น เครื่องปรับอากาศ, โทรทัศน์, ทีวีดาวเทียม, เครื่องทำน้ำอุ่น, ตู้เย็น, มินิบาร์, ระเบียงและเตียงที่สะดวกสบาย นอกจากนี้เรายังมีบริการอาหารเช้าฟรี, อินเตอร์เน็ตไ...
สถานที่ : อำเภอเมืองชัยนาท จังหวัดชัยนาท
แฟนตาซี รีสอร์ท ชัยนาท
แฟนตาซี รีสอร์ต ชัยนาท เป็นที่พักอันยอดเยี่ยมสำหรับผู้ไปเยือนชัยนาท ไม่ว่าจะเพื่อพักผ่อนท่องเที่ยวหรือติดต่อธุรกิจ จากที่พัก ท่านสามารถเดินทางได้อย่างสะดวกง่ายดายไปยังทุกที่ในเมืองที่มีชีวิตชีวานี้ เนื่องจากที่พักตั้งอยู่ในทำเลที่เดินทางสะดวก ผู้เข้าพักจึงไปยังสถานที่ท่องเที่ยวยอดนิยมต่างๆ ของเมืองไ...
สถานที่ : อำเภอเมืองชัยนาท จังหวัดชัยนาท
ภโวทัยฟาร์มผึ้ง รีสอร์ท
ที่พักใกล้เมือง ฟาร์มผึ้ง
สถานที่ : อำเภอเมืองชัยนาท จังหวัดชัยนาท
เคปนิทรา หัวหิน
Relax to the whispering of the wind and the waves for as long as you want.
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
บ้านดวงแก้ว รีสอร์ท
บ้านดวงแก้ว รีสอร์ท มีลักษณะบ้านพัก เป็นหลัง ๆ สไตล์ Resort แบบบ้านทรงไทยแบบประยุกต์ อยู่บริเวณปากทางเข้าหมู่บ้านเขาตะเกียบ บ้านดวงแก้ว รีสอร์ท มีทั้งหมด 19 หลัง มี 2 สระว่ายน้ำ มี 1 ร้านอาหาร สร้างเป็นสไตล์รีสอร์ท บ้านทุกหลังจะตั้งเรียงล้อมรอบสระว่ายน้ำ
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
สายลม
หาดทรายขาวรายล้อมความสวยงามของทะเลหัวหินกับสายลมที่จะพัดพาให้การพักผ่อนริมทะเลหัวหินของคุณเต็มไปด้วยความสุขและความทรงจำที่ดี
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
กรีนแอทบุรีรัมย์
บูติคโฮเทลในอุทยานจามจุรี สัมผัสกับธรรมชาติสีเขียว ต้นใหญ่ สายน้ำและลำธาร ...
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
แอทที บูทีค
@T Boutique Hotel is located in Klongwan approximately 4 hours’ drive from Suvannabhumi Airport, just 10 mins’ Drive from the fantastic beach town Prachuapkhirikhan. , and 5 mins’ Drive to The Ao Manao Beach, Almost of the area is peaceful with the only local fisherman villages and local residences....
สถานที่ : อำเภอเมืองประจวบคีรีขันธ์ จังหวัดประจวบคีรีขันธ์
ชีวาศรม อินเตอร์เนชั่นแนล เฮลท์ รีสอร์ท
นับตั้งแต่ปี พ.ศ. 2538 ชีวาศรม อินเตอร์เนชั่นแนล เฮลท์ รีสอร์ท รีสอร์ทเพื่อสุขภาพต้นแบบแห่งแรกในเอเชีย ตั้งอยู่ที่อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์ เปิดให้บริการและแนะแนวทางปฏิบ้ติในการดูแลสุขภาพแบบองค์รวม ที่มุ่งเน้นการคืนความสมดุลให้แก่ร่างกาย จิตใจ และจิตวิญญาณแก่ผู้รักสุขภาพที่เดินทางมาจากทั่วโ...
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
เมอเวนพิค อัสสรา รีสอร์ท แอนด์ สปา หัวหิน
A fully immersive escape in an idyllic natural setting that can be easily reached and is removed from the crowds. Elegant with a casual ambience, this attractive low-rise resort is surrounded by a landscape of gently swaying palms, verdant gardens and reflective lagoons. All our 96 suites and villa...
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
การปลูกถ่ายกระจกตา จะช่วยแก้ไขปัญหาการมองเห็นของผู้ป่วย - รศ.พญ. งามจิตต์ เกษตรสุวรรณ
รศ.พญ. งามจิตต์ เกษตรสุวรรณ ประธานชมรมกระจกตาและการแก้ไขสายตาแห่งประเทศไทย และแพทย์ผู้ชำนาญการด้านกระจกตา โรงพยาบาลบำรุงราษฎร์ กล่าวถึงวิธีการปลูกถ่ายกระจกตา จะเป็นการผ่าตัดเอากระจกตาของผู้ป่วยที่ขุ่นหรือเป็นโรคออก แล้วปลูกถ่ายด้วยกระจกตาของผู้บริจาค ข้อดีของการรักษาด้วยการปลูกถ่ายกระจกตา คือจะช่วยแก้ไขปัญหาการมองเห็นของผู้ป่วยให้ดีขึ้น ช่วยเสริมความแข็งแรงของกระจกตาในกรณีที่ผู้ป่วยมีกระจกตาบางหรือทะลุ และช่วยควบคุมการติดเชื้อที่กระจกตาในกรณีที่ผู้ป่วยมีการติดเชื้อที่กระจกตา ซึ่งการรักษาจะใช้กล้องผ่าตัดรุ่นใหม่ที่มีการผนวกเทคนิคที่ช่วยในการตรวจชั้นต่างๆ ของกระจกตาในระหว่างผ่าตัด (Microscope-integrated intraoperative optical coherence tomography) ช่วยให้การผ่าตัดกระจกตามีความแม่นยำมากขึ้น
ซุปโอไมครอนสายพันธุ์ย่อย (A soup of omicron subvariants) อาจก่อให้เกิดการระบาดระลอกใหม่ (new wave) ในแต่ละภูมิภาคด้วยสายพันธุ์ย่อยที่แตกต่างกัน
ในการก่อตั้งศูนย์วินิจฉัยภาวะดื้อต่อโบทูลินัมท็อกซิน คณะแพทยศาสตร์ศิริราชพยาบาล ได้จับมือร่วมกับ เมิร์ซ เอสเธติกส์ ประเทศไทย บริษัทชั้นนำระดับโลก ผู้ผลิตและจัดจำหน่ายเครื่องอัลเทอร่า และเวชภัณฑ์สำหรับใช้ในคลินิกเสริมความงาม ในการริเริ่ม “โครงการส่งตรวจภาวะดื้อโบ” เพื่อเพิ่มช่องทางให้คนไทยได้เข้าถึงการรักษาภาวะดื้อโบได้ง่ายขึ้น ซึ่งนอกจากการมารับการทดสอบที่คณะแพทยศาสตร์ศิริราชพยาบาลแล้ว ทางบริษัทยังได้อำนวยความสะดวกให้ผู้ป่วย โดยร่วมมือกับพันธมิตรคลินิกความงามมากกว่า 40 แห่งทั่วกรุงเทพมหานคร ในการสร้างเครือข่ายในการช่วยเก็บข้อมูล และตัวอย่างเลือดของผู้ป่วยที่สงสัยว่าตัวเองจะมีภาวะดื้อโบ รวมถึงการนำส่งตัวอย่างเลือดไปตรวจที่ศูนย์วินิจฉัยภาวะดื้อต่อโบทูลินัมท็อกซินในขั้นตอนถัดไป และให้คำแนะนำในการปฏิบัติตัวอย่างถูกต้องเพื่อบรรเทาความกังวลและช่วยลดความรุนแรงของภาวะดื้อโบได้อีกด้วย ทั้งนี้ ยังตั้งเป้าหมายจำนวนคลินิกร่วมโครงการให้ถึง 100 คลินิก ในปีถัดไปอีกด้วย
Yesterday I was, Tomorrow I will be ที่ Galleria 1 on 2nd floor, River City Bangkok
Yesterday I was, Tomorrow I will be
เริ่มตั้งแต่ 7 ตุลาคม - 20 พฤศจิกายน 2565
จัดแสดงที่ Galleria 1 on 2nd floor, River City Bangkok
นิทรรศการที่อยากบอกให้ทุกคนรู้ว่า ‘สิ่งดีๆ ต้องใช้เวลา’ ที่เล่าผ่านผลงานของศิลปินหญิง Pomme Chan โดยภายในนิทรรศการจะนำผลงานที่ Pomme Chan สร้างสรรค์ขึ้นในแต่ละช่วงเวลาชีวิตมาจัดแสดง เริ่มตั้งแต่ชิ้นแรกที่เป็นจุดเริ่มต้นในฐานะศิลปิน ไม่ว่าจะเป็นงานจิตรกรรม ประติมากรรม ไปจนถึงเฟอร์นิเจอร์ หรือของแต่งบ้านต่าง
ติดตามรายละเอียดเพิ่มเติม ที่นี่:
facebook.com/RiverCityBangkok ลอยกระทงจุฬาฯ
“จะลอยกับคู่ ลอยกับเพื่อน หรือจะลอยคนเดียว ก็มาลอยกระทงที่จุฬาฯ”
เชิญชวนทุกคนมาร่วมลอยกระทงด้วยกันได้วันที่ 5 พฤศจิกายน 2565 17.00 - 21.00 น.
กระทงเทียนจำหน่ายภายในงาน 15 บาทเท่านั้น
รับชำระทั้งเงินสดและเงินโอน ถ้าจ่ายเงินสด รบกวนทุกคนเตรียมเงินมาให้พอดีน้าา
จำกัดเฉพาะกระทงเทียนที่ขายภายในงานเท่านั้น ห้ามนำเข้ามาเอง
ในการลงพื้นที่วันนี้มี นางสาวนฤนันมนต์ ห่วงทรัพย์ สมาชิกสภากรุงเทพมหานคร เขตคลองสามวา นายพันธ์ศักดิ์ เจริญสุข ผู้อำนวยการเขตคลองสามวา พร้อมด้วยคณะผู้บริหาร ข้าราชการ และเจ้าหน้าที่เขตคลองสามวา สำนักการโยธา สำนักสิ่งแวดล้อม ชาวชุมชนมัสยิดฮีดาย่าตุ้ลอิสลามิยะห์ (แสนแสบ) และผู้ที่เกี่ยวข้อง ร่วมลงพื้นที่และให้ข้อมูล
อุปกรณ์ช่วยเหลือฉุกเฉิน ผู้ช่วยไฮเทคในการดูแลผู้สูงอายุ
ปัจจุบันได้มีการนำเทคโนโลยีดิจิทัลมาช่วยในการแจ้งเหตุฉุกเฉินเพื่อเพิ่มความอุ่นใจสำหรับผู้สูงอายุในบ้านหรือในขณะอยู่นอกบ้านตามลำพัง อาทิ โรงพยาบาลวิมุตได้นำเสนอบริการ ViMUT Life Link บริการที่ช่วยให้ผู้สูงอายุสามารถแจ้งเหตุฉุกเฉิน เพื่อให้ได้รับการรักษาได้อย่างทันท่วงที มีทั้งแบบปุ่มกดฉุกเฉินภายในบ้านและปุ่มกดฉุกเฉินแบบพกพา ซึ่งอุปกรณ์จะส่งสัญญาณแจ้งเหตุไปยังทีมแพทย์ฉุกเฉินตลอด 24 ชั่วโมง โดยเครื่องจะติดต่อเจ้าหน้าที่พร้อมส่งตำแหน่ง GPS ของผู้ป่วยแบบอัตโนมัติ เพื่อประสานให้ความช่วยเหลืออย่างเร่งด่วน
ร่วมบริจาคและสมทบทุน โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย LINK
โรงพยาบาลจุฬาลงกรณ์ เปิดให้ร่วมสมทบทุนโครงการ กองทุน และสถานที่ต่างๆ หลายรายการ อาทิ กองทุน 30 พฤษภาฯ กองทุน ส.ธ. เพื่อผู้สูงวัย สมทบทุนค่ารักษาพยาบาลพระภิกษุ สามเณร อาพาธ สมทบทุนช่วยเหลือผู้ป่วยยากไร้ กองทุนเงินบริจาคเพื่อใช้ในกิจการคลินิกโรคสมองเสื่อม ศูนย์ความเป็นเลิศด้านภูมิคุ้มกันบำบัดมะเร็ง สมทบทุนอื่นๆ [
ศึกษารายละเอียดแต่ละโครงการ]
ติดต่อสอบถาม การบริจาค
อาคารวชิรญาณวงศ์ ชั้น 1 โทร. 02-2564382 หรือ 02-2564505
ศาลาทินทัต ( ข้างตึกอำนวยการ ) โทร. 02-2564397
การรับใบเสร็จรับเงิน ส่งรายละเอียด ชื่อ – นามสกุล ที่อยู่ และวัตถุประสงค์การบริจาคพร้อมเบอร์โทรศัพท์ ( เพื่อใช้ในการออกใบเสร็จรับเงินส่งกลับไปยังผู้บริจาคทางไปรษณีย์)
บางเขน จัดเก็บขยะชิ้นใหญ่ LINK
บางเขน จัดเก็บขยะชิ้นใหญ่ และอันตราย
อาทิตย์ที่ 13 พฤศจิกายน 2565 เวลา 09.00 น.
อาทิตย์ที่ 20 พ.ย. 65 ไปที่หมู่บ้านอัมรินทร์นิเวศน์ 1 เตรียม
Checklist เสี่ยงเบาหวาน โดย คณะแพทยศาสตร์ศิริราชพยาบาล
เนื่องในวันเบาหวานโลกประจำปีนี้เรามาเช็คตนเองกันดีกว่าครับว่ามีโอกาสที่จะเป็นเบาหวานไหม ซึ่งถ้ามีเพียง 1 ข้อก็มีโอกาสเป็นเบาหวานได้
1. อายุ 35 ปีขึ้นไป
2. อ้วน (มีดัชนีมวลกายมากกว่า 25)
3. มีคนในครอบครัวเป็นโรคเบาหวาน
4. มีโรคความดันโลหิตสูง
5. มีระดับไขมันในเลือดสูง
6. มีโรคหัวใจและหลอดเลือด
การจับจ่ายอย่างรอบคอบ (Intentional Spending)
“ผู้บริโภคหันมาให้ความสนใจกับสิ่งที่มีความหมายต่อตนเองและจับจ่ายใช้สอยอย่างระมัดระวังมากขึ้น และในสภาพเศรษฐกิจที่ยากลำบาก ผู้บริโภคต้องการที่จะมีการตัดสินใจการใช้เงินอย่างชาญฉลาด โดยไม่ต้องแลกกับคุณภาพชีวิตของตนเอง
“ผู้บริโภคจะให้ความสำคัญกับความคงทน ความยืดหยุ่น และการใช้งานได้ตราบนานเท่านาน เพราะพวกเขาพยายามลดการจับจ่ายใช้สอย และเลือกจับจองสินค้าที่อยู่ได้ยาวนานและตอบสนองวัตถุประสงค์หลากหลาย อย่างไรก็ตาม เมื่อตลาดมีการใช้คำกล่าวอ้างเกี่ยวกับคุณค่าเพิ่มเติมต่าง ๆ มากขึ้นจนถึงจุดอิ่มตัว ผู้บริโภคก็จะเกิดความสงสัยและมีความเฉลียวฉลาดเพิ่มขึ้น ในอีกห้าปี เราคาดว่าจะเห็นการเพิ่มจำนวนของแบรนด์ที่มุ่งเน้นเจตจำนงเพื่อสังคมและส่งมอบนวัตกรรมที่ช่วยแก้ปัญหาระยะยาวที่อุตสาหกรรม ประเทศ และชุมชนที่แบรนด์นั้น ๆ เป็นส่วนหนึ่ง กำลังประสบอยู่” คุณแมทธิวกล่าวสรุป
14 พ.ย. 65 ควบคุมกัญชา - ทำร้ายร่างกายหลังเสพกัญชา
1.ควบคุมกัญชา
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. เผย ช่อดอกกัญชาเท่านั้นที่ยังเป็นยาเสพติดอยู่ ซึ่งมาจากการหารือกับคณะกรรมการชุดต่างๆ ทั้งนี้ มีประกาศ สธ. รองรับอยู่แล้ว ทั้งของกรมอนามัย กรมการแพทย์แผนไทยฯ และกรมการแพทย์ส่วนการอนุมัติผลิตภัณฑ์ต่าง ๆ ให้ใช้เชิงพาณิชย์หรือการผลิตยา มี อย.เป็นผู้อนุมัติครบถ้วน ขณะนี้ยังไม่มีข้อมูลใดระบุว่าควบคุมไม่ได้
2. ร่างพ.ร.บ.กัญชา กัญชง...
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ยืนหยัดต่อสู้ปลดล็อกกัญชาให้ประชาชน หากสภาฯ ไม่ผ่านกฎหมายกัญชา จะเสมอใหม่ในสมัยหน้า ชี้นักบริหารต้องชั่งน้ำหนักประโยชน์-โทษ ทั้งนี้ ชมรมฯ เผยชั่งน้ำหนักแล้ว คัดค้านกัญชาเสรีต่อไป ประโยชน์ทางการแพทย์พอมีอยู่บ้าง รองานศึกษาวิจัย แต่ปล่อยเสรีมีโทษมหันต์
- นพ.บัญญัติ เจตนจันทร์ ส.ส.พรรคประชาธิปัตย์ กล่าวว่า ตนยืนยันจะสู้วาระ 2 ทุกมาตรา เพราะจากการอ่านหลักการเหตุผลของกฎหมาย คือ ให้มี พ.ร.บ.กัญชา กัญชง เพื่อการแพทย์ล้วน ไม่มีนันทนาการหรือเสรี หากจะทำสอดไส้มาตนไม่ยอม สธ.ยุคนี้ตกต่ำมาก ไม่ฟังประชาชน และทำไมไม่ตั้งศูนย์เฝ้าระวังปัญหาสุขภาพจิต
- ผศ.นพ.สมิทธิ์ ศรีสนธิ์ นายกสมาคมแพทย์นิติเวชแห่งประเทศไทย กล่าวว่า ขณะนี้มีการรวบรวมรายชื่อผู้ที่จะร่วมกันค้านผ่านเว็บไซต์ CHANGE ได้ 1.8 หมื่นคน รายชื่อแพทย์ 1.6 พันคน ที่ไม่เห็นด้วยกับกัญชาเสรี นอกจาก พ.ร.บ.กัญชาฯ ต้องปรับปรุงแล้ว ยังจำเป็นต้องเพิกถอนประกาศ สธ. ให้กัญชากลับไปเป็นยาเสพติด เพราะอีกนานกว่าจะมี พ.ร.บ. แต่ความเสียหายที่เกิดขึ้นแล้วนั้นมีมาก ดังนั้นต้องโทษตัวเองที่ปลดล็อกโดยไม่มีอะไรออกมารองรับ
3.ทำร้ายร่างกายหลังเสพกัญชา
- เพจสายไหมต้องรอด เข้าช่วยเหลือคุณตาวัย 80 ปี ถูกหลานชายวัย 29 ปี เมากัญชาทุบตีทำร้ายร่างกายได้รับบาดเจ็บณ เขตบางกะปิ กทม.
ตาราง Group E
| |
Group E |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
ญี่ปุ่น |
3 |
2 |
0 |
1 |
4 |
3 |
1 |
6 |
| 2 |
สเปน |
3 |
1 |
1 |
1 |
9 |
3 |
6 |
4 |
| 3 |
เยอรมัน |
3 |
1 |
1 |
1 |
6 |
5 |
1 |
4 |
| 4 |
คอสตาริกา |
3 |
1 |
0 |
2 |
3 |
11 |
-8 |
3 |
กิจกรรมนันทนาการ (Fun&Recreation) ได้แก่ พาชมงานสถาปัตยกรรมและวิถีชีวิตในเขตพระนคร งานประกวดภาพถ่าย โดยส่วนหนึ่งนำมาจัดแสดงในส่วนเฟสติวัล และงานวิ่งในระยะ 10 กิโลเมตร และ 4.5 กิโลเมตร รอบบริเวณเส้นทางสวนเบญจกิติ
สนับสนุนโครงการ
การสนับสนุนโครงการในครั้งนี้ สะท้อนความมุ่งมั่นของเครือเจริญโภคภัณฑ์และทรู คอร์ปอเรชั่น ที่มุ่งเสริมสร้างให้ประชากรไทยมีสุขภาวะที่ดี สุขภาพแข็งแรง และสามารถใช้ชีวิตได้อย่างปกติสุข มีโอกาสประกอบอาชีพ เพื่อสร้างประโยชน์และคุณค่าให้แก่ครอบครัว ชุมชน และประเทศชาติต่อไป
นอกจากองค์กรและหน่วยงานที่กล่าวมา ประชาชนผู้มีจิตศรัทธายังสามารถเติมเต็มโอกาสและคุณภาพชีวิตที่ดีแก่พวกเขา มาร่วมเป็น“ผู้ให้” เพราะทุกการให้จะเติมเต็มชีวิตใหม่ให้คนอีกนับล้าน
1. บริจาคเงินเข้าศิริราชมูลนิธิ ธนาคารกรุงเทพ ชื่อบัญชี ศิริราชมูลนิธิ เลขที่บัญชี 901-7-07188 โดยระบุในบันทึก "กองทุนกายอุปกรณ์เพื่อผู้พิการ" หรือ "กองทุน D003366"
2. บริจาคผ่าน Application ธนาคารที่ท่านมีบัญชีเงินฝาก โดยสแกนผ่าน QR CODE (กรุณาระบุ“กองทุนกายอุปกรณ์เพื่อผู้พิการ” หรือ “กองทุน D003366” )
3. สำหรับท่านที่ต้องการใบเสร็จรับเงิน รวมถึงการลดหย่อนภาษี 2 เท่า (e-Donation ถึง 31 ธันวาคมนี้เท่านั้น) ที่ออกโดยศิริราชมูลนิธิ กรุณากรอกข้อมูลผ่านช่องทางไลน์ @sirirajfoundation หรือส่งอีเมลมาที่ donation@sirirajfoundation.org กรุณาแจ้งข้อมูลชื่อ นามสกุล ที่อยู่ หมายเลขโทรศัพท์ และหมายเลขบัตรประจำตัวประชาชน เพื่อจัดส่งเอกสารการบริจาคแก่ท่านต่อไป
สอบถามเพิ่มเติมได้ที่ @sisspo หรือ สแกน QR Code
GARMIN RUN ASIA SERIES 2022 วันที่ 25 ธ.ค.65
GARMIN RUN ASIA SERIES 2022 THAILAND HALF MARATHON งานวิ่งใหญ่ประจำปีที่รวมตัวเหล่านักวิ่งแนวหน้าระดับประเทศเข้าไว้ด้วยกัน
โอกาสเดียวที่คุณจะได้เริ่มภารกิจ
FROM ZERO TO HERO
วันวิ่ง: 25 ธันวาคม 2565
เวลา: 03:00-08:00 น.
สถานที่: อินดอร์สเตเดี้ยม หัวหมาก
ระยะทางวิ่ง: 21.1 กม. / 10 กม. / 5 กม.
ซาน คาร์ลอส เดอ บาริโลเช พาตาโกเนีย อาร์เจนติน่า
กำหนดจัดงาน ระหว่าง 1 กุมภาพันธ์ - 30 เมษายน 2027
ธีมงาน Nature + Technology = Sustainable Energy. A viable future for humanity
Exo 2027 ณ บาริโลเช จะเป็นห้วงเวลาที่ดีในการหวนกลับมาทบทวนถึงประวัติศาสตร์ เพื่อสร้างสรรค์โอกาสใหม่ๆ โลกที่่จะมองลงไปยังหัวใจของหญิงชายทุกผู้นาม พลังของมนุษย์จะสถิตย์ในธรรมชาติอย่างเหมาะสม พร้อมกับหันมองไปยังเทคโนโลยีและค้นคำตอบว่าจะนำมันมารับใช้เพื่อยกระดับคุณภาพชิวิตและสุขภาวะมนุษยได้อย่างไร บาริโรเช จะแสดงให้เห็นความสำคัญที่ไม่อาจแยกจาก ระหว่างธรรมชาติและเทคโนโลยี ทั้งสองกระแสธารไหลที่จะรวมกันไปอย่างมั่นคง เพื่อรังสรรค์ความยั่งยืนด้านการใช้พลังงาน หนุนเนื่องพลังในตัวมนุษย์ และเร่งเร้าความคิดสร้างสรรค์ได้อย่างไร พร้อมๆไปกับการแสวงหาบทใหม่ของวิถีชีวิตที่ในยุคที่ประชากรโลกเร่งตัวขึ้น โดยที่ต้องไม่ละเลยและละทิ้งความห่วงใยต่อความหลากหลายและสิ่งแวดล้อม เราทั้งหลาย ในฐานะของมนุษยชาติ ผู้ซึ่งก่อร่างสร้างปัจจุบัน ไม่อาจเลี่ยงไม่รับผิดชอบต่อการสร้างอนาคตได้อย่างแน่นอน บทใหม่เริ่มต้นเมื่อโลกใบเก่าสิ้นไป
Website:
expo2027.ar
Facebook:
Expo2027Barilocheดนตรีในสวน H.M. Song อว.บรรเลงเพลงของพ่อ โดยกลุ่มเยาวชน ระนอง 5 ธ.ค. 65
กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัย และนวัตกรรม (อว.) และ วิทยาลัยชุมชนระนอง ในนาม อว. ส่วนหน้า จังหวัดระนอง ขอเชิญชวน ทุกท่าน เข้าร่วมกิจกรรม "ดนตรีในสวน" "H.M. Song อว.บรรเลงเพลงของพ่อ" เพื่อน้อมรำลึก ในพระมหากรุณาธิคุณ และเทิดพระเกียรติ 5 ธันวาคม 2565 เนื่องในวันคล้างวันพระบรมราชสมภพพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลบเดชมหาราช บรมนาถบพิตร พบกับ โฟร์คแบรนด์ โดยกลุ่มเยาวชน จังหวัดระนอง วง "Me skill" และ วง "พลาสเทล" พร้อมด้วยการแสดง ดนตรีไทย ในบทเพลงพระราชนิพนธ์ ณ โรงยิมนิเซียมเก่า องค์การบริหารส่วนจังหวัดระนอง ในวันที่ 5 ธันวาคม 2565 ตั้งแต่เวลา 17.00 น. เป็นต้นไป
สารตกค้างพวกยาฆ่าแมลง LINK
การลดสารพิษตกค้างในพืชผักและผลไม้ ทำได้โดยการล้างโดยใช้โซเดียมไบคาร์บอเนต
อาหารที่มักตรวจพบว่ามีสารพิษตกค้างพวกยาฆ่าแมลงได้แก่ ผัก ผลไม้ ธัญพืชต่างๆอาหารตากแห้งบางชนิด เช่น ปลาทูเค็ม ปลาแห้ง เนื้อแห้ง เป็นต้น เมื่อรับประทานเข้าไปสารพิษเหล่านี้จะสะสมในร่างกายนานเข้าก็จะเป็นปัญหาเรื้อรังเป็นอันตรายต่อระบบสมองและประสาท เช่น ความจำเสื่อม สมาธิสั้น ยาฆ่าแมลงที่ตกค้างในร่างกายเป็นพิษต่อตับ และ ไต รบกวนระบบภูมิคุ้มกันของร่างกายกระทบต่อต่อมไร้ท่อ (ฮอร์โมน)เป็นสารก่อมะเร็ง และสารก่อกลายพันธุ์และทำให้ทารกในครรภ์พิการได้ด้วย สารพิษพวกยาฆ่าแมลงส่วนมากที่พบตกค้างในอาหาร เป็นสารพิษในกลุ่มฟอสเฟต และคาร์บาเมทซึ่งมีผลกระทบต่อระบบประสาท และถ้าได้รับพิษ 2 ชนิด รวมกันขึ้นไป จะยิ่งทำให้เกิดพิษสะสมเสริมกันสูงมากขึ้นนับ 1000 เท่า
การลดสารพิษตกค้างในพืชผักและผลไม้ ทำได้โดยการล้างให้สะอาดโดยวิธีล้างอาจทำได้โดยใช้โซเดียมไบคาร์บอเนต (ผงฟู) 1 ช้อนโต๊ะ ผสมน้ำอุ่น 1 กะละมัง (20 ลิตร) แช่ผักนาน 15 นาทีแล้วล้างด้วยน้ำสะอาดจะช่วยลดปริมาณสารพิษในผักลงได้ 90 – 92% หรือใช้น้ำส้มสายชู (5%) ประมาณ 1 ช้อนโต๊ะ ผสมน้ำ 1 กะละมัง แช่นาน 30 -45 นาที แล้วล้างออกด้วยน้ำสะอาด ปริมาณสารพิษที่ลดลงด้วยวิธีนี้คือ 60 – 84% หรืออาจล้างผักโดยให้น้ำไหลผ่าน ใช้มือช่วยคลี่ใบผัก นาน 2 นาที วิธีนี้ลดปริมาณสารพิษลงได้ 50 - 63% แต่ถ้าใช้การต้มหรือลวกผักด้วยน้ำร้อน ปริมาณสารพิษที่ลดลงคือ 48 – 50%
ถ้าเราต้องการตรวจสอบว่า ในผักหรือผลไม้มีสารพิษตกค้างพวกยาฆ่าแมลงปนเปื้อนอยู่หรือไม่ก็สามารถตรวจสอบได้โดยใช้ชุดทดสอบ เอ็ม เจ พี เค (MJPK) ของกรมวิทยาศาสตร์การแพทย์
1. แนวโน้มการใช้จ่ายสูงทำลายทุกสถิติในรอบ 2 ปี ที่ 69% โดยเฉพาะสินค้าที่ตอบสนองด้านอารมณ์
แรงกระตุ้นเชิงบวกจากภาคเศรษฐกิจการท่องเที่ยวที่กลับมาคึกคัก เทศกาล festive และโปรโมชั่นจากแบรนด์ ล้วนส่งผลให้คนไทยอยาก ‘ปลดล็อก’ จากพันธนาการความกังวลทั้งปวง เช่น การหาของขวัญให้ครอบครัว จับฉลากปีใหม่ พบปะสังสรรค์ โดยสินค้าที่นิยม อาทิ โทรศัพท์ใหม่ เสื้อผ้า collection ใหม่ รถป้ายแดงคันใหม่ ร้านอาหารเปิดใหม่ที่ต้องไปลอง
โปรแกรมคลอด Mom and Child
โปรแกรมคลอด "Mom and Child" ที่คุณแม่รอคอยและถามถึงกันมากที่สุด
เพื่อต้อนรับสมาชิกใหม่ของครอบครัวอย่างสมบูรณ์
โรงพยาบาลศรีสวรรค์ กรุงเทพมหานคร ราชพฤกษ์
ให้การดูแลคุณแม่และลูกน้อยตั้งแต่ในครรภ์ จนถึงกำหนดวันคลอด
ด้วยความใส่ใจ ดูแลอย่างอบอุ่นใจ
- คลอดธรรมชาติ ราคา 39,000 บาท
- ผ่าตัดคลอด ราคา 55,900 บาท
"พร้อมรับสิทธิ์ Prestige คุณเเม่เเละลูกน้อย"
วันนี้ - 31 มีนาคม 2565
สอบถามโทร.1254
โรงพยาบาลศูนย์การแพทย์มหาวิทยาลัยวลัยลักษณ์ นครศรีธรรมราช LINK
โรงพยาบาลศูนย์การแพทย์มหาวิทยาลัยวลัยลักษณ์ นครศรีธรรมราช เป็นโรงพยาบาลในสังกัดมหาวิทยาลัยวลัยลักษณ์ ขนาด 426 เตียง ได้ทำพิธีเปิดอาคาร เมื่อ วันพฤหัสบดีที่ 24 พฤศจิกายน พ.ศ. 2565 ที่ผ่านมา โรงพยาบาลศูนย์การแพทย์มหาวิทยาลัยวลัยลักษณ์ เป็นโรงพยาบาลประกันสังคม แห่งที่ 6 ในจังหวัด นครศรีธรรมราช เปิดรับผู้ประกันตนประกันสังคมเป็นปีแรก นอกจากรองรับผุ้ประกันตนประกันสังคมแล้ว ยังสามารถดูแลผู้ป่วยสิทธิอื่นๆ ได้แก่ สิทธิข้าราชการเบิกจ่ายตรง สิทธิองค์กรปกครองส่วนท้องถิ่น(อปท.) สิทธิประกันสุขภาพถ้วนหน้า 30 บาท(เฉพาะนักศึกษา) สิทธิพรบ. สิทธิรัฐวิสาหกิจ สิทธิพนักงาน มวล. สิทธิประกันอุบัติเหตุ มวล. สิทธิประกันชีวิต และผู้ป่วยที่จ่ายเงินเอง ติดต่อสอบถามเพิ่มเติม โทร. 075-673059 ในวันและเวลาราชการ
- 222 มหาวิทยาลัยวลัยลักษณ์ ตำบล ไทยบุรี อำเภอท่าศาลา นครศรีธรรมราช 80160
- โทร. 075-673059
- แผนที่
- facebook
BURIRAM ถิ่นภูเขาไฟ ไดโนเสาร์ COUNTDOWN 2023
BURIRAM ถิ่นภูเขาไฟ ไดโนเสาร์ COUNTDOWN 2023 วันที่ 24 ธันวาคม-1 มกราคม 2566 ณ สนามช้างอารีน่า กิจกรรมภายในงาน มีดังนี้
✅ปิดทองขอพร พระบรมราชานุสาวรีย์พระบาทสมเด็จพระพุทธยอดฟ้าจุฬาโลกมหาราช (รัชกาลที่ 1)
✅ สวนไดโนเสาร์ในดินแดน 6 ภูเขาไฟ
✅ กินกัญ STREET FOOD MARKET
✅ การแสดงจากศิลปิน THE VOICE
✅ การประกวด COVER DANCE
✅หมู่บ้านท่องเที่ยววิถีชุมชน
✅ งานกาชาดบุรีรัมย์
✅ การแสดงจากโรงเรียนประโคนชัยพิทยาคม แชมป์รายการชิงช้าสวรรค์ 2022
✅ การแสดงพลุ COUNTDOWN 2023
ทั้งยังมีกิจกรรมต่างๆ อีกมากมาย อาทิ ดนตรีสร้างความเปลี่ยนแปลงสุขภาพให้คุณเป็นคนใหม่ได้อย่างไร โดย อ.เนตรชนก สิงห์เห ฟู้ดเวิร์คช็อปสาธิตการทำอาหารเพื่อการดูแลสุขภาพลำไส้ และผิวพรรณ โดยนักกำหนดอาหาร รวมถึงชวนไปเปิดมุมมองฟังเคล็ดลับการดูแลสุขภาพของเซเลปและพิธีกรชื่อดังที่ อาทิ คุณชาลอต โทณวณิก คุณเอิร์ธ ศัลย์ อิทธิสุขนันท์ คุณตุ๊ก ชนกวนันท์ คุณนุ่น ดารัณ และ ลูกสาว คุณมุก ณปภัช พร้อมกับแพ็กเกจตรวจสุขภาพราคาประหยัด ที่โรงพยาบาลธนบุรี บำรุงเมือง ให้ของขวัญกับตัวเองและคนที่คุณรักด้วยการเปลี่ยนตัวคุณให้เป็นคนใหม่ เพราะตัวคุณคือของขวัญที่ดีที่สุด
ปัจจุบัน สถาบันโรคหัวใจบำรุงราษฎร์ เรามีบุคลากรทางการแพทย์เฉพาะทางที่พรั่งพร้อม สามารถรักษาผู้ป่วยที่มีอาการซับซ้อน ต้องการการรักษาขั้นสูง รวมถึงการทำงานร่วมมือกันอย่างแข็งแกร่งทีมแพทย์และทีมสหสาขาวิชาชีพหลากหลายสาขาที่มีเป้าหมายเดียวกัน คือ ความปลอดภัยสูงสุดของผู้ป่วยและการทำให้ผู้ป่วยและครอบครัวกลับมาใช้ชีวิตประจำวันได้ดีที่สุดและมีคุณภาพมากที่สุด โดยให้การดูแลรักษาผู้ป่วยโรคหัวใจได้อย่างครอบคลุม อาทิ โรคหัวใจขาดเลือด โรคหัวใจเต้นผิดจังหวะ ภาวะหัวใจล้มเหลว โครงสร้างของหัวใจผิดปกติ โรคหัวใจที่ถ่ายทอดทางพันธุกรรม โรคหัวใจพิการแต่กำเนิด และการคัดกรองและการส่งเสริมสุขภาวะของหัวใจ โดยเฉพาะผู้ที่มีอาการซับซ้อน หรือผู้ที่ต้องการการรักษาขั้นสูง ด้วยทีมแพทย์และสหสาขาวิชาชีพทำงานร่วมกันแบบไร้รอยต่อ
ของขวัญปีใหม่ จากกระทรวงการคลัง กลุ่มที่ 2 มาตรการ/โครงการของสถาบันการเงินเฉพาะกิจ
โดยสถาบันการเงินเฉพาะกิจได้จัดทำโครงการของขวัญปีใหม่ปี 2566 ของสถาบันการเงินเฉพาะกิจ เพื่อเสริมสภาพคล่อง ลดภาระค่าใช้จ่ายดอกเบี้ยและเสริมสร้างวินัยทางการเงินให้แก่ประชาชนและผู้ประกอบการ ประกอบด้วย มาตรการคืนเงินหรือลดอัตราดอกเบี้ย สินเชื่ออัตราดอกเบี้ยพิเศษ รางวัลพิเศษของสลากออมสิน การลดค่างวดการผ่อนชำระ และการยกเว้นค่าดำเนินการค้ำประกันสินเชื่อ รวมทั้งสิ้น 15 โครงการ (เอกสารแนบ) จากหน่วยงานดังนี้
- ธนาคารออมสิน
- ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร
- ธนาคารอาคารสงเคราะห์
- ธนาคารพัฒนาวิสาหกิจขนาดกลางและขนาดย่อมแห่งประเทศไทย (ธพว.)
- ธนาคารเพื่อการส่งออกและนำเข้าแห่งประเทศไทย (EXIM Bank)
- บรรษัทประกันสินเชื่ออุตสาหกรรมขนาดย่อม (บสย.)
แต่ละแห่งมีจำนวนโครงการและรายละเอียด ดังนี้
กระทรวงวัฒนธรรม (วธ.)
วธ. มอบของขวัญปีใหม่ ปี 2566 ในช่วงเดือนธันวาคม 2565 - มกราคม 2566 จำนวน 11 กิจกรรม โดยแบ่งเป็นกิจกรรมทางศาสนา กิจกรรมท่องเที่ยวทางวัฒนธรรมและกิจกรรมทางศิลปวัฒนธรรม ดังนี้
1. กิจกรรมทางศาสนาเสริมสร้างความเป็นสิริมงคล 2 โครงการ ได้แก่ (1) กิจกรรมสวดมนต์ข้ามปี เสริมสิริมงคลทั่วไทย ส่งท้ายปีเก่า ต้อนรับศักราชใหม่ 2566 ระหว่างวันที่ 31 ธันวาคม 2565 - 1 มกราคม 2566 เพื่ออุทิศถวายพระราชกุศลแด่สมเด็จพระบูรพมหากษัตริยาธิราช ถวายพระราชกุศลแด่พระบาทสมเด็จพระเจ้าอยู่หัว และพระบรมวงศานุวงศ์ทุกพระองค์ รวมทั้งประเทศชาติ และสร้างแรงจูงใจให้ประชาชน ลด ละ เลิก อบายมุขในเทศกาลปีใหม่ ซึ่งประชาชนสามารถสวดมนต์ข้ามปีได้ทุกที่ผ่านระบบโซเชียลมีเดีย โดยในต่างประเทศได้ขอความร่วมมือให้วัดไทยและวัดต่าง ๆ ทั่วโลกมีส่วนร่วมจัดกิจกรรมสวดมนต์ข้ามปีฯ ด้วย และ (2) กิจกรรมตักบาตรต้อนรับปีใหม่ 2566 ณ วัดพระเชตุพนวิมลมังคลาราม กรุงเทพมหานคร เพื่อเริ่มต้นวันใหม่ด้วยการพัฒนาจิตใจด้วยกิจกรรมทางศาสนา เป็นสิริมงคลแก่ชีวิต และเป็นแบบอย่างที่ดีงามแก่สังคมไทย
2. กิจกรรมท่องเที่ยวทางวัฒนธรรมและเยี่ยมชมแหล่งเรียนรู้เชิงสร้างสรรค์ทางศิลปวัฒนธรรมและประวัติศาสตร์ 7 กิจกรรม เช่น (1) จัดงานมหกรรมวัฒนธรรมแห่งชาติ “วิถีถิ่น วิถีไทย” ภาคตะวันออกเฉียงเหนือ ระหว่างวันที่ 24 - 27 ธันวาคม 2565 ณ วัดพระธาตุนาดูน ตำบลพระธาตุ อำเภอนาดูน จังหวัดมหาสารคาม เพื่อสนับสนุนการสร้างคุณค่าและมูลค่าเพิ่มให้กับผลิตภัณฑ์ทางวัฒนธรรมของชาติและท้องถิ่น (2) เปิดให้บริการเข้าชมอุทยานประวัติศาสตร์และพิพิธภัณฑสถานแห่งชาติทุกแห่งเป็นกรณีพิเศษ โดยงดเก็บค่าเข้าชม และเปิดโอกาสให้ประชาชนสักการะพระพุทธปฏิมา ณ พระที่นั่งพุทไธยสวรรย์ ระหว่างวันที่ 28 ธันวาคม 2565 - 8 มกราคม 2566 และ (3) เปิดบ้านศิลปินแห่งชาติและผู้มีผลงานดีเด่นทางด้านวัฒนธรรมให้เป็นแหล่งเรียนรู้มรดกภูมิปัญญาด้านศิลปวัฒนธรรมทั่วประเทศ
3. กิจกรรมทางศิลปวัฒนธรรม ส่งความสุขแบบไทย 2 กิจกรรม ได้แก่ (1) จัดกิจกรรมการแสดงทางศิลปวัฒนธรรมในพื้นที่ของหน่วยงานในสังกัด วธ. เช่น กิจกรรม “ดนตรีในสวน” ต้อนรับลมหนาว ณ บริเวณลานละลาน ศูนย์มานุษยวิทยาสิรินธร (องค์การมหาชน) และการแสดงและกิจกรรมทางศิลปวัฒนธรรมของนักเรียน นักศึกษาของสถาบันการศึกษาในสังกัด วธ เช่น การแสดงโขน เรื่อง รามเกียรติ์ รวมถึงนาฏศิลป์ไทย และดนตรีไทย ณ อุทยานประวัติศาสตร์สุโขทัย การแสดงโนรา ดนตรีไทย และเพลงพื้นบ้านภาคใต้ และ (2) มอบของขวัญปีใหม่ทางวัฒนธรรมให้แก่ประชาชน เช่น บัตรอวยพรปีใหม่ 2566 ในรูปแบบของ E-Card เพื่อให้ประชาชนเข้ามา Download ผ่านทางเว็บไซต์ www.m-culture.go.th และ www.ocac.go.th ตั้งแต่เดือนธันวาคม 2565 เป็นต้นไป
ภายหลังจากจบการศึกษาแล้ว นักศึกษาจะมีความเชี่ยวชาญในการทำงานของนักฉุกเฉินการแพทย์ คือการบริบาลและดูแลรักษาผู้ป่วยนอกสถานพยาบาล และในห้องฉุกเฉินของโรงพยาบาล เป็นการกู้ชีพชั้นสูง การทำหัตถการและการบริหารยาฉุกเฉิน การรักษาและส่งต่อไปยังสถานพยาบาลฉุกเฉิน เพื่อให้ผู้ป่วยพ้นจากภาวะวิกฤติ นอกจากนี้ ยังมีบทบาทในการพัฒนาระบบการแพทย์ฉุกเฉินไทย เพื่อประโยชน์สูงสุดของผู้ป่วย โดยกลุ่มปฎิบัติการช่วยเหลือผู้ป่วย ณ จุดเกิดเหตุ แบ่งเป็น 4 กลุ่ม ประกอบด้วย เจ้าหน้าที่อาสาสมัครกู้ชีพฉุกเฉิน ใช้เวลาอบรมทั้งหมด 40 ชั่วโมง พนักงานฉุกเฉินการแพทย์ ใช้เวลาอบรมทั้งหมด 115 ชั่วโมง เจ้าพนักงานฉุกเฉินการแพทย์ จบการศึกษาระดับมัธยมปลายหรือเทียบเท่า เข้าเรียนในหลักสูตร 2 ปี นักฉุกเฉินการแพทย์
อุปกรณ์ทางการแพทย์ที่สวมใส่ได้ที่จะฉลาดกว่าเดิม
อุปกรณ์สวมใส่ Wearable Medical Devices ไม่ใช่สิ่งใหม่ในพ.ศ.นี้อีกต่อไป แต่กระนั้นก็ยังเป็นเทรนด์ที่น่าจับตาต่อไป ไม่ใช่การเป็นเทรนด์เพราะความใหม่ แต่จะเป็นเทรนด์เพราะการใช้อุปกรณ์เหล่านี้ จะแพร่หลายและเติบโตมากขึ้น ต่างหาก เพราะไม่เพียงการเลือกใช้ที่เป็นการเลือกเฉพาะบุคคลและตามรสนิยมเท่านั้น แต่โอกาสการเพิ่มจะมาจากการถูกแนะนำให้ใช้โดย แพทย์ เทรนเนอร์หรืออื่นๆ ที่มีความเกี่ยวข้องกับบุคคลที่จำเป็นหรือต้องอ้างอิงกับข้อมูลสุขภาพที่จะเก็บรวบรวมได้จากอุปกรณ์สวมใส่เหล่านั้นนั่นเอง ข้อมูลอาทิ อัตราการเต้นหัวใจ ระดับอ๊อกซิเจนในเลือด เหล่านี้เป็นข้อมูลสำคัญ พร้อมๆกับการพัฒนาด้านเทคโนโลยีและวัสดุอุปกรณ์ที่จะช่วยให้การเก็บข้อมูลสุขภาพทำได้ดียิ่งขึ้นไปกว่าเดิม ยิ่งข้อมูลมากและลึกเท่าใด ก็ยิ่งเป็นประโยชน์ต่อการวินิจฉัยมากขึ้นนั่นเอง การมอนิเตอร์เฝ้าระวังแบบรีลไทม์ผ่านอุปกรณ์สวมใส่ก็เป็นอีกแนวทางที่นำมาใช้ประโยชน์
อุปกรณ์สวมใส่ในอนาคตจะฉลาดขึ้นกว่าในรุ่นก่อนๆ การเพิ่มระบบประมวลผลลงไปในอุปกรณ์เพื่อให้สามารถจะวิเคราะห์ข้อมูลที่เก็บได้เลย ข้อดีชัดๆ 2 ประการ คือ การรักษาข้อมูลส่วนบุคคลไว้ในเครื่อง กับ ความเร็วประมวล แบบรีลไทม์ย่อมดีกว่า การที่ข้อมูลต้องถูกส่งออก-ประมวลผล-รับเข้า ผ่านระบบคลาวด์แบบเดิม แต่เครื่องที่ทำงานแบบรีลไทม์ได้จบในเครื่อง จะมีประโยชน์มากกว่า โดยเฉพาะกับกรณีเครื่องออกแบบมาให้มีระบบสำหรับการป้องกันและแจ้งเตือนอันตรายทันทีนั่นเอง
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคเหนือ
จังหวัดเชียงราย
รหัสสาขา 05609 เชียงรายเมืองใหม่ 3
จังหวัดน่าน
รหัสสาขา 12127 ดิอิมเพลส (ขาออกเมืองน่าน)
จังหวัดพิษณุโลก
รหัสสาขา 05074 แยกเรือนแพ
รหัสสาขา 09562 สินวนา 2 (ม.นเรศวร)
รหัสสาขา 00802 ปทุมทอง
จังหวัดพะเยา
รหัสสาขา 11243 หน้า ม.พะเยา
จังหวัดลำปาง
รหัสสาขา 14994 ชุมชนทับหมาก
จังหวัดแพร่
รหัสสาขา 15596 ชุมชนร่องฟอง
จังหวัดตาก
รหัสสาขา 11674 แม่สอดอินเตอร์
จังหวัดกำแพงเพชร
รหัสสาขา 17411 ถนนชากังราว
จังหวัดเพชรบูรณ์
รหัสสาขา 00969 หล่มเก่า
นครปฐม
- รพ.ดอนตูม โทร. 034381768 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.สามพราน โทร. 034388957 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.นครปฐม โทร. 034213606 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- รพ.หลวงพ่อเปิ่น โทร. 034961113
- รพ.เมตตาประชารักษ์ วัดไร่ขิง โทร. 034388700 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- ศูนย์การแพทย์กาญจนาภิเษก คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล โทร. 028496600 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ การยศาสตร์/ Adaptive Environment/ เตรียมความพร้อมการได้ยิน/ เตรียมความพร้อมการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- ศูนย์พัฒนาการเด็ก Goodboy & Nice girl สามพราน โทร. 02 – 4042579, 089 – 9245046 เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- สาขากิจกรรมบำบัด มหาวิทยาลัยมหิดล ศาลายา 024415450 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม กายอุปกรณ์/ Pressure garment/ Cardiac Rehab/ Palliative care/ Adaptive Environments/ ฟื้นฟูผู้ป่วยบกพร่องการได้ยิน/ ฟื้นฟูผู้ป่วยบกพร่องการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ จิตเวชผู้ใหญ่/ บำบัดผู้ติดสารเสพติด/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- Meaning-kids สามพราน โทร.0909269775 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- Apollo kids โทร. 0982529924 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- สถาบันแห่งชาติเพื่อการพัฒนาเด็กและครอบครัว มหาวิทยาลัยมหิดล ศาลายา โทร. 02-4410601 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
กิจกรรมงานวันเด็ก โรงพยาบาลรามคำแหง LINK
คลินิกเด็กสุขภาพดี โรงพยาบาลรามคำแหง ขอเชิญน้องๆ หนูๆ ร่วมกิจกรรมงานวันเด็กแห่งชาติ 2566 วันเสาร์ที่ 14 มกราคม 2566 เวลา 10.00-12.00 น. ณ บริเวณคลินิกเด็กสุขภาพดี อาคาร 3 ชั้น 2 สอบถามข้อมูลเพิ่มเติมได้ที่ “คลินิกเด็กสุขภาพดี” โรงพยาบาลรามคำแหง โทร. 0 2743 9999 ต่อ 3240-3244
กิจกรรมพิเศษ!!
น้องๆ หนูๆ ที่มีอายุ 5-10 ปี ที่สนใจเข้าร่วมแสดงความสามารถพิเศษที่ตัวเองถนัดได้ เช่น เล่านิทาน ร้องเพลง เต้น ฯลฯ พร้อมรับเกียรติบัตรการแสดงความสามารถจากทางโรงพยาบาล เปิดรับสมัครตั้งแต่วันนี้ - 8 มกราคม 2566 ที่ “คลินิกเด็กสุขภาพดี” Facebook และ Line@ ของโรงพยาบาล
นอกจากนี้เด็กๆ ที่เข้าร่วมงานทุกคนยังจะได้รับของขวัญน่ารักๆ เช่น ตุ๊กตาพี่หมีแสนน่ารัก ที่วัดส่วนสูงสุดคิ้วท์ และของที่ระลึกอื่นๆ อีกมากมาย แล้วมาร่วมสนุกกันเยอะๆ นะ
ศูนย์บริการสาธารณสุขที่ 4 สมรโกฏิ
- ที่อยู่ 20/6 ม.8 ถ.รัตนาธิเบศร์ 17 ตำบล บางกระสอ อ.เมือง นนทบุรี 11000
- โทร. 02-5277320
- แผนที่
- Facebook
บริการ
- คลินิกตรวจโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น. วันจันทร์ , อังคาร ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-16.30 น.
- คลินิกฝังเข็ม วันจันทร์ , ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น. วันพุธ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-16.30 น.
- คลินิกสุขภาพเด็กดี (สร้างเสริมภูมิคุ้มกันโรค) วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-16.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น.
- คลินิกวางแผนครอบครัว วันจันทร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-12.00 น.
หมายเหตุ ติดต่อนัดหมายคลินิกแพทย์แผนไทย 02-5277320 (ในวันและเวลาราชการ)
ออร์โธปิดิกส์ ตรวจรักษาโรค กระดูก ข้อ เส้นเอ็น และกล้ามเนื้อ
ออร์โธปิดิกส์ ตรวจรักษาโรค กระดูก ข้อ เส้นเอ็น และกล้ามเนื้อ
เปิดให้บริการทุกวันจันทร์-ศุกร์
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์โรคหัวใจกรุงเทพเชียงใหม่
Tel: 052 089 776
Call Center: 1719
ศูนย์โรคหัวใจกรุงเทพเชียงใหม่
เปิดให้บริการตามวันและเวลาดังนี้
วันจันทร์ – วันศุกร์ เวลา 07.00 – 17.00 น. วันเสาร์ - วันอาทิตย์ 08.00 - 12.00 น.
“ศูนย์โรคหัวใจกรุงเทพเชียงใหม่” ได้รับการยกระดับให้เป็นศูนย์แห่งความเป็นเลิศทางด้านโรคหัวใจ ให้บริการรักษาเฉพาะทางด้านโรคหัวใจอย่างครบวงจร ทั้งการตรวจวินิจฉัย รักษา ติดตามดูแล ตลอดจนการฟื้นฟูสมรรถภาพหัวใจหลังการผ่าตัด ด้วยอุปกรณ์ทางการแพทย์และเทคโนโลยีอันทันสมัย เพื่อให้การรักษาเกิดประสิทธิภาพแก่ผู้รับบริการอย่างสูงสุด โดยทีมแพทย์ผู้เชี่ยวชาญเฉพาะทางและทีมสหสาขาวิชาชีพ มุ่งมั่นที่จะให้การดูแลสุขภาพหัวใจของทุกท่านอย่างครบถ้วนและได้มาตรฐานระดับสากล ศูนย์โรคหัวใจกรุงเทพเชียงใหม่ ภายใต้การบริหารของบริษัท กรุงเทพดุสิตเวชการ จำกัด ยังมุ่งพัฒนาความร่วมมือในโครงการแลกเปลี่ยนทักษะและความรู้ทางการแพทย์กับสถาบันนานาชาติชั้นนำ อาทิ Oregon Health & Science University (OHSU) ซึ่งเป็นสถาบันการศึกษาทางการแพทย์ที่มีชื่อเสียงในด้านการรักษา การพัฒนางานวิจัย นวัตกรรมที่ได้มาตรฐานของสหรัฐอเมริกา โดยช่วยยกระดับวงการแพทย์ไทยให้มีมาตรฐานและคุณภาพในระดับสากล พร้อมแลกเปลี่ยนความรู้และประสบการณ์การทำงานให้แก่บุคลากรทางแพทย์ ไม่ว่าจะเป็นแพทย์ พยาบาล เภสัชกร หรือผู้เชี่ยวชาญด้านต่าง ๆ เพื่อเพิ่มความรู้ความเข้าใจเรื่องบริการทางการแพทย์ระดับสากล งานวิจัยทางการแพทย์ รวมไปถึงการส่งต่อผู้ป่วยระหว่างองค์กรเพื่อให้ได้เข้ารับการรักษาอย่างมีประสิทธิภาพ
การให้บริการตรวจวินิจฉัยโรคหัวใจ
การตรวจหลอดเลือดหัวใจด้วยเครื่องเอกซเรย์คอมพิวเตอร์ (Coronary CT Angiography)
การตรวจคลื่นหัวใจด้วยคลื่นเสียงสะท้อนความถี่สูง (Echocardiography)
การตรวจการทำงานของระบบไฟฟ้าในหัวใจ และการจี้หัวใจที่เต้นเร็วผิดปกติ (Electrophysiology Study)
การบันทึกคลื่นไฟฟ้าชนิดติดตัว (Holter Monitor)
การตรวจทดสอบสมรรถภาพหัวใจ (Exercise Stress Test)
การตรวจวัดการแข็งตัวของหลอดเลือดแดง ABI (Ankle-Brachial Index)
การตรวจคลื่นไฟฟ้าหัวใจ EKG
การตรวจสมรรถภาพหัวใจด้วยคลื่นเสียงสะท้อนความถี่สูงหลังการออกกำลังกาย (Exercise Stress Echocardiography)
การตรวจสมรรถภาพหัวใจด้วยคลื่นเสียงสะท้อนความถี่สูงโดยการใช้ยาโดบูตามีน (Dobutamine Stress Echocardiography)
การทดสอบด้วยเตียงที่ปรับเอียง (Tilt Test)
การรักษาโดยการผ่าตัดหัวใจและหลอดเลือดที่สำคัญ
ศูนย์ฟื้นฟูสมรรถภาพหัวใจ (Cardiac Rehabilitation)
ทำงานร่วมกับ ศูนย์โรคหัวใจกรุงเทพเชียงใหม่ และ ทีมสหสาขาวิชาชีพ ในการดูแลฟื้นฟูผู้ป่วยโรคหัวใจและหลอดเลือด โดยมีเป้าหมายเพื่อฟื้นฟูสภาพการทำงานของร่างกายและฟื้นฟูสมรรถภาพหัวใจของผู้ป่วยเพื่อให้สามารถกลับไปใช้ชีวิตประจำวันได้ตามปกติ ทั้งยังช่วยในการป้องกันโรคหลอดเลือดหัวใจไม่ให้กลับมาเป็นซ้ำอีกในอนาคต
ทีม แพทย์เวชศาสตร์ฟื้นฟู และนักกายภาพบำบัดที่มีความชำนาญและมากประสบการณ์ในการดูแลผู้ป่วยกลุ่มโรคหัวใจ ตั้งแต่การดูแลเตรียมตัวผู้ป่วยทั้งก่อนและหลังเข้ารับการผ่าตัดหัวใจ ทั้งนี้รวมทั้งผู้ป่วยโรคหัวใจที่ไม่ได้รับการผ่าตัดอีกด้วย
เครื่องมือและอุปกรณ์ทางการแพทย์ที่ทันสมัย พร้อมนักกายภาพผู้เชี่ยวชาญในการดูแลผู้ป่วยแบบตัวต่อตัว (พร้อมหน้ากากอนามัยป้องกันโควิด-19 และการเว้นระยะห่างอย่างเหมาะสม) เป็นการช่วยฟื้นฟูร่างกาย รวมทั้งป้องกันความเสี่ยงจากการทำกิจกรรมและออกกำลังกายได้อย่างใกล้ชิด
แนวทางในการดูแลและประเมินสุขภาพผู้ป่วยโรคหัวใจก่อนและหลังรับบริการ โดยร่วมเป็นส่วนหนึ่งของทีมสหสาขาวิชาชีพใน การประชุมครอบครัวผู้ป่วย หรือ Family Meeting
ให้ความรู้ที่ถูกต้องเป็นการเพิ่มทักษะให้กับผู้ป่วย ผู้ดูแล รวมทั้งครอบครัว เพื่อให้สามารถนำมาปฏิบัติและดูแลตนเองได้ในชีวิตประจำวันหลังการผ่าตัดหัวใจ
การดูแลผู้ป่วยโรคหัวใจด้วยทีมสหสาขาวิชาชีพ
ทีมสหสาขาวิชาชีพ
ประกอบด้วย
ผู้ป่วยโรคหลอดเลือดหัวใจตัน (coronary artery disease)
ผู้ป่วยโรคกล้ามเนื้อหัวใจขาดเลือด (post-myocardial infarction)
ผู้ป่วยโรคหัวใจล้มเหลวที่อาการคงที่ (stable heart failure)
ผู้ป่วยที่ได้รับการทำหัตถการหรือผ่าตัดเกี่ยวกับหัวใจ เช่น percutaneous coronary intervention, cardiac surgery, heart transplant
ผู้ป่วยโรคหลอดเลือดส่วนปลาย
ผู้ที่มีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจตัน
ทำห้องยาใหม่
"ทำห้องยาใหม่ให้ใกล้ชิดผู้รับบริการ และแน่นอนครับ ต้องดู ทันสมัย โล่งโปร่ง ปลอดภัย"
THEROOTSROUTES The Lives of Orchards LINK
The Lives of Orchards
เส้นทางนี้เป็นเส้นทางที่บอกเล่าเรื่องราวของกรุงเทพฯ ในอดีต ผ่านรูปแบบการเดินทางที่แตกต่างกัน นำไปสู่ประสบการณ์การเปลี่ยนผ่านพื้นที่ที่แตกต่างกัน จากตรอกซอกซอย ไปสู่วัดที่เงียบสงบสวยงาม จนถึงสวนลิ้นจี่ที่เก่าแก่ที่สุดในกรุงเทพฯ
พาผู้เข้าร่วมย้อนเวลากลับไปค้นหารากเหง้าของกรุงเทพฯ ในอดีต เมื่อแม่น้ำและลำคลองยังคงเป็นส่วนสำคัญในชีวิตประจำวันของผู้คน โดยเฉพาะอย่างยิ่งกับชุมชนเกษตรกรและชาวสวนริมน้ำ เราจะพาผู้เข้าร่วมเดินสำรวจตรอกซอกซอยเล็กใหญ่ เริ่มจากขึ้นรถไฟ ล่องเรือผ่านคลองเล็กๆ สัมผัสบรรยากาศบ้านเรือนและชุมชนริมน้ำ จากนั้นร่วมสำรวจสวนผลไม้ที่เก่าแก่ที่สุดแห่งหนึ่งของกรุงเทพฯ โดยเฉพาะอย่างยิ่งเรียนรู้วัฒนธรรมของชาวสวนกรุงธนบุรีผ่านมรดกวัฒนธรรมอาหารและระบบการจัดการน้ำสำหรับการเพาะปลูกที่เกือบจะสูญหายไปในทุกวันนี้เนื่องจากการพัฒนาและกระจายตัวของพื้นที่เมือง
สถานที่บางส่วนที่ผู้เข้าร่วมจะได้ร่วมสัมผัสประสบการณ์เกี่ยวกับความรู้และวิถีชีวิตชาวสวนกรุงธนบุรี ได้แก่
วัดราชาอรสารราชวรวิหาร
สวนภูมิใจ / Natura คาเฟ่
ระบบการเกษตรแบบดั้งเดิม
ตลาดพลู
ตารางเวลา
เสาร์ 04 ก.พ. 2566 09:00 - 12:30
อาทิตย์ 05 ก.พ. 2566 14:00 - 17:30
พฤหัสบดี 09 ก.พ. 2566 14:00 - 17:30
อาทิตย์ 12 ก.พ. 2566 09:00 - 12:30
ค่าใช้จ่าย (บาท): 1500
จำนวนที่รับ (คน): 15
สอบถาม โทร.0896643895
ราชวิทยาลัยแพทย์ออร์โธปิดิกส์แห่งประเทศไทย The Royal College Of Orthopaedic Surgeons Of Thailand
ราชวิทยาลัยแพทย์ออร์โธปิดิกส์แห่งประเทศไทย
The Royal College Of Orthopaedic Surgeons Of Thailand
เลขที่ 2 ซอยศูนย์วิจัย ชั้น 4 อาคารเฉลิมพระบารมี ถนนเพชรบุรีตัดใหม่ บางกะปิ เขตห้วยขวาง กรุงเทพฯ
โทรศัพท์ : 02-716-5436-7
E-mail: secretariat@rcost.or.th
www.rcost.or.th อิชิตัน กรีนแลป น้ำชาเขียวผสมเทอร์ปีน
อิชิตัน กรีนแลป น้ำชาเขียวผสมเทอร์ปีน น้ำมันหอมระเหยจากพืชธรรมชาติ สูตรไม่มีน้ำตาล และสูตรน้ำตาลน้อย
COVID-19 VACCINE FOR TOURIST At Institute of dermatology
COVID-19 VACCINE FOR TOURIST
(5 years old older)
At Institute of dermatology
12 FL.
Address : 456 Rajavithi road, Thung Phaya Thai, Ratchathewi District, Bangkok
January
From monday to saturday (Sunday off)
9.00 am - 3.00 pm
SERVICE FEE
Pfizer Vaccine 1,380 Baht/dose
Astrazeneca vaccine 1,180 Baht/dose
(Cash : Thai baht(THB))
Location :
https://bit.ly/IODmap การดำเนินการของหน่วยงานราชการส่วนท้องถิ่น
การดำเนินการควบคุมกิจการที่เป็นอันตราย ต่อสุขภาพของหน่วยงานราชการส่วนท้องถิ่น
- การออกข้อกำหนดของท้องถิ่นกำหนดประเภทของกิจการที่ เป็นอันตรายต่อสุขภาพตามพระราชบัญญัติการสาธารณสุข พ.ศ. 2535 มาตรา 31
- การกำหนดหลักเกณฑ์และเงื่อนไขสำหรับให้ผู้ดำเนินกิจการ ที่ต้องควบคุมในท้องถิ่น
- การกำหนดหลักเกณฑ์วิธีการ และเงื่อนไขในการขอและต่อ ใบอนุญาต
- การกำหนดอัตราค่าธรรมเนียม จะต้องเป็นไปตาม กฎกระทรวง
- ราชการส่วนท้องถิ่นต้องเผยแพร่ประชาสัมพันธ์ข้อกำหนด ของท้องถิ่น
- การจัดทำทะเบียนสถานประกอบการที่เป็นอันตรายต่อ สุขภาพ
- การตรวจสอบและให้คำแนะนำ
- การอบรมให้ความรู้แก่ผู้ประกอบกิจการบางประเภทตาม ความจำเป็นของปัญหา
- การเข้าดำเนินการในสถานประกอบการ
เจ้าพนักงานท้องถิ่นได้แก่
- ผู้ว่าราชการกรุงเทพมหานคร
- นายกเมืองพัทยา
- นายกเทศมนตรี
- นายก อบต
- นายก อบจ.
เจ้าพนักงานสาธารณสุข
- ผู้บริหารและนักวิชาการสังกัดกระทรวงสาธารณสุข
- นายแพทย์สาธารณสุขจังหวัด ,สาธารณสุขอำเภอ นักวิชาการสาธารณสุขระดับชำนาญการ
- ผู้อำนวยการสำนัก / กอง / หัวหน้ากองสาธารณสุขและ สิ่งแวดล้อมเทศบาล/อบต.
4. หน่วยบริการและการใช้สิทธ
หน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ หมายถึง สถานบริการ* ที่ขึ้นทะเบียน เป็นหน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ เช่น โรงพยาบาลศูนย์ โรงพยาบาลทั่วไป โรงพยาบาลชุมชน โรงพยาบาลส่งเสริม สุขภาพตำบล (รพ.สต.) หรือที่คุ้นเคยในชื่อสถานีอนามัย คลินิกชุมชนอบอุ่น ศูนย์บริการสาธารณสุข ศูนย์สุขภาพชุมชนเมือง เป็นต้น
สถานบริการ* หมายถึง สถานบริการสาธารณสุขของรัฐ ของเอกชน และของสภากาชาดไทย หน่วยบริการการประกอบโรคศิลปะสาขาต่างๆ และสถานบริการสาธารณสุขอื่น ที่คณะกรรมการกำหนดเพิ่มเติม
“เครือข่ายหน่วยบริการ” หมายถึง หน่วยบริการที่รวมตัวกันและขึ้นทะเบียน เป็นเครือข่ายหน่วยบริการ
หน่วยบริการประจำ หมายถึง หน่วยบริการหรือกลุ่มหน่วยบริการที่ขึ้น ทะเบียนเป็นหน่วยบริการประจำ โดยได้รับค่าใช้จ่ายจากกองทุนหลักประกัน สุขภาพแห่งชาติ เพื่อบริการสาธารณสุขในลักษณะเหมาจ่ายรายหัว และค่าใช้จ่าย อื่นตามที่คณะกรรมการหลักประกันสุขภาพแห่งชาติกำหนด โดยหน่วยบริการมี คุณลักษณะ ดังนี้
1. ให้บริการด้านเวชกรรมด้วยตนเอง
2. จัดบริการสาธารณสุขระดับปฐมภูมิที่จำเป็นต่อสุขภาพและการดำรงชีวิต อย่างเป็นองค์รวม ทั้งการสร้างเสริมสุขภาพ การป้องกันโรค การตรวจ วินิจฉัยโรคการรักษาพยาบาล และการฟื้นฟูสมรรถภาพ
3. เป็นหน่วยต้นสังกัดของหน่วยบริการปฐมภูมิ และอาจมีหน่วยบริการ ปฐมภูมิมากกว่า 1 แห่งเป็นเครือข่าย
4. มีเครือข่ายหน่วยบริการเพื่อการส่งต่อผู้รับบริการไปรับบริการสาธารณสุข ในกรณีที่เกินขีดความสามารถ
5. ผู้มีสิทธิหลักประกันสุขภาพแห่งชาติ สามารถเลือกลงทะเบียนใน หน่วยบริการประจำ เพื่อเป็นหน่วยบริการประจำตัวของตนเองที่ จะเข้ารับบริการสาธารณสุข โดยไม่เสียค่าใช้จ่ายได้ ตามสิทธิที่กำหนด
หน่วยบริการปฐมภูมิ หมายถึง หน่วยบริการที่ขึ้นทะเบียนเป็นหน่วยบริการ ปฐมภูมิในเครือข่ายของหน่วยบริการประจำ และรับค่าใช้จ่ายเพื่อบริการ สาธารณสุขจากหน่วยบริการประจำ หรือค่าใช้จ่ายอื่นตามที่คณะกรรมการหลัก ประกันสุขภาพแห่งชาติกำหนด โดยมีคุณลักษณะ ดังนี้
1) จัดบริการสาธารณสุขระดับปฐมภูมิได้อย่างเป็นองค์รวม ทั้งการสร้าง เสริมสุขภาพ การป้องกันโรค การตรวจวินิจฉัยโรค การรักษาพยาบาล และการฟื้นฟูสมรรถภาพ
2) ผู้มีสิทธิหลักประกันสุขภาพ สามารถใช้บริการสาธารณสุขในหน่วยบริการ ปฐมภูมิที่เป็นเครือข่ายของหน่วยบริการประจำที่เลือก (ต้นสังกัดของ หน่วยบริการปฐมภูมิ) โดยไม่เสียค่าใช้จ่ายได้ตามสิทธิที่กำหนด
หน่วยบริการรับส่งต่อ หมายถึง หน่วยบริการที่ขึ้นทะเบียนเป็นหน่วยบริการ รับการส่งต่อทั่วไปหรือหน่วยบริการที่รับการส่งต่อเฉพาะด้าน ซึ่งสามารถจัดบริการ สาธารณสุขระดับทุติยภูมิ ตติยภูมิ หรือเฉพาะทาง โดยผู้มีสิทธิหลักประกันสุขภาพ แห่งชาติ สามารถใช้บริการสาธารณสุข ณ หน่วยบริการรับส่งต่อได้ เมื่อได้รับการ ส่งต่อหรือได้รับความเห็นชอบจากหน่วยบริการประจำ หรือตามที่ สปสช.กำหนด ทั้งนี้ หน่วยบริการที่รับส่งต่อมีสิทธิได้รับค่าใช้จ่ายเพื่อบริการสาธารณสุขจากหน่วย บริการประจำหรือจากกองทุน ตามที่คณะกรรมการหลักประกันสุขภาพแห่งชาติ กำหนด
หน่วยบริการร่วมให้บริการ หมายถึง สถานบริการที่จัดบริการสาธารณสุข ระดับปฐมภูมิเฉพาะด้านตามเกณฑ์ที่สปสช.กำหนด และได้ขึ้นทะเบียนเป็นหน่วย บริการร่วมให้บริการ โดยมีข้อตกลงเป็นหนังสือกับหน่วยบริการประจำหรือ สำนักงาน ในการให้บริการสาธารณสุขแก่ผู้มีสิทธิ ทั้งนี้ หน่วยบริการร่วมให้บริการ มีสิทธิได้รับค่าใช้จ่าย เพื่อบริการสาธารณสุขจากหน่วยบริการประจำหรือจาก กองทุน ตามที่คณะกรรมการหลักประกันสุขภาพแห่งชาติกำหนด
การใช้สิทธิรับบริการสาธารณสุข
ผู้ใช้สิทธิหลักประกันสุขภาพแห่งชาติสามารถเข้ารับบริการสาธารณสุข ดังนี้
กรณีทั่วไป
1. ติดต่อรับบริการที่หน่วยบริการปฐมภูมิ/หน่วยบริการประจำตามสิทธิ ของผู้มีสิทธิหลักประกันสุขภาพแห่งชาติ
2. แจ้งความจำนงใช้สิทธิหลักประกันสุขภาพแห่งชาติก่อนรับบริการ
3. แสดงบัตรประจำตัวประชาชน หรือ บัตรประจำตัวที่มีรูปถ่ายและ เลขประจำตัวประชาชน ที่ทางราชการออกให้ สำหรับเด็กที่มีอายุต่ำกว่า 15 ปี ถ้าไม่มีบัตรประจำตัวประชาชนแสดงสำเนาสูติบัตร (ใบเกิด)
สำหรับผู้ลงทะเบียนสิทธิคนพิการในระบบหลักประกันสุขภาพแห่งชาติ กรณีที่จำเป็น สามารถรับบริการสาธารณสุขได้ที่หน่วยบริการของรัฐ ที่ขึ้นทะเบียนในระบบหลักประกันสุขภาพแห่งชาติได้ทุกแห่ง
กรณีอุบัติเหตุ หรือ เจ็บป่วยฉุกเฉิน
ถ้าผู้มีสิทธิหลักประกันสุขภาพแห่งชาติเกิดอุบัติเหตุหรือภาวะเจ็บป่วยฉุกเฉิน อยู่ไกลจากหน่วยบริการประจำตามสิทธิ สามารถใช้สิทธิเข้ารับบริการได้ที่หน่วย บริการในระบบหลักประกันสุขภาพแห่งชาติที่อยู่ใกล้ที่สุด ได้ตามความจำเป็น โดยไม่จำกัดจำนวนครั้ง
กรณีเจ็บป่วยฉุกเฉินถึงแก่ชีวิต
ผู้เจ็บป่วยฉุกเฉินถึงแก่ชีวิต จำเป็นต้องได้รับการรักษาอย่างทันท่วงที เพื่อการ รอดชีวิต สามารถเข้ารักษาพยาบาลในโรงพยาบาลที่ใกล้ที่สุด โดยใช้ บัตรประจำตัวประชาชนเพื่อแสดงตนในการเข้ารับบริการ จะได้รับการรักษา จนอาการพ้นวิกฤติ จากนั้น โรงพยาบาลที่ให้การรักษาจะส่งตัวผู้ป่วยกลับไป ยังหน่วยบริการประจำหรือหน่วยบริการในระบบหลักประกันสุขภาพแห่งชาติ ที่พร้อมให้การรักษาต่อไป
ผู้้ป่วยเจ็บป่วยฉุกเฉินถึงแก่ชีวิต หมายถึง ผู้ป่วยหรือผู้ที่ได้รับบาดเจ็บ ซึ่งมี อาการบ่งชี้ว่า จะเป็นอาการที่คุกคามต่อการทำงานของอวัยวะสำคัญ ได้แก่ หัวใจ สมอง การหายใจ ต้องได้รับการรักษาและดูแลติดตามอย่างใกล้ชิด เพราะอาจทำให้ เสียชีวิตได้รวดเร็ว ยกตัวอย่าง เช่น หัวใจหยุดเต้น / หอบรุนแรง / มีอาการเขียว คล้ำ / หมดสติไม่รู้สึกตัว / สิ่งแปลกปลอมอุดกั้นหลอดลม / มีอาการวิกฤติจาก อุบัติเหตุ / มีเลือดออกมากห้ามไม่หยุด / ภาวะขาดน้ำอย่างรุนแรง / แขน ขา อ่อนแรง ปากเบี้ยว พูดลำบาก / ชัก / มีอาการวิกฤติจากไข้สูง เป็นต้น
เจ็บป่วยฉุกเฉิน ติดต่อได้ที่ โทร 1669


โดย ศ. นพ. นิมิต เตชไกรชนะ ประธานเจ้าหน้าที่บริหาร ศูนย์พัฒนาและฝึกอบรมบุคลากรบำรุงราษฎร์ และรองประธานเจ้าหน้าที่บริหาร สายงานวิจัยและการศึกษา โรงพยาบาลบำรุงราษฎร์ ให้ข้อมูลเพิ่มว่า โรงพยาบาลมีสถาบันทางวิชาการที่ส่งเสริมด้านการศึกษาและฝึกอบรมเพื่อให้บุคลากรมีความรู้ที่ทันสมัยอยู่เสมอ ถือได้ว่าปัจจุบันบำรุงราษฎร์เป็น ‘สถาบันวิชาการทางการแพทย์ภาคเอกชน’ หรือ Academic Private Hospital อย่างเต็มรูปแบบ อีกทั้งยังสนับสนุนให้แพทย์และบุคลากรได้มีโอกาสทำงานวิจัย ตีพิมพ์ผลงานในวารสารทางวิชาการทั้งในระดับชาติและนานาชาติ ซึ่งนับเป็นการถ่ายทอดแบ่งปันองค์ความรู้ขององค์กรไปสู่สาธารณชนอีกด้วย โดยล่าสุด บำรุงราษฎร์ได้รับรางวัลสุดยอดองค์กรไทย Thailand Best Employer Brand Award 2023 ได้แก่ รางวัลองค์กรนายจ้างยอดเยี่ยมของไทย และรางวัลองค์กรยอดเยี่ยมด้านการใช้เทคโนโลยีเพื่อฝึกอบรมและเรียนรู้ รวมถึงได้รับการยกย่องจาก Hospital Management Excellence Award 2022 ให้เป็นผู้ชนะเลิศในหมวดความหลากหลาย (Diversity) ในฐานะองค์กรด้านสาธารณสุขที่มีบทบาทโดดเด่นในการเคารพความแตกต่างหลากหลาย นับเป็นเครื่องการันตีถึงความเป็นเลิศด้านบุคลากร
เขตทุ่งครุ ห้องสมุดเพื่อการเรียนรู้ทุ่งครุ
ตั้งอยู่ หน้าสวนธนบุรีรมย์ ศูนย์ทุ่งครุ มีความ active สูง หนังสือดีๆ เพียบ มีกิจกรรมตลอดปี กิจกรรมหลากหลาย เข้ากับเทศกาล/วาระ โดยเฉพาะกับเยาวชนละกัน สนุกได้ตลอดแน่ๆ เมื่อมาศูนย์นี้
ถ. ประชาอุทิศ แขวงบางมด เขตทุ่งครุ กรุงเทพมหานคร 10140
โทร. 024265257
แผนที่
google map
facebook
BMAThungKhruLibrary
Website
bangkoklibrary.go.th/
แคมเปญ “ความสุขจากการให้...ไม่สิ้นสุด”
แคมเปญที่ต้องการสะท้อนให้เห็นถึงผลลัพธ์แห่ง “การให้” จากน้ำใจของคนไทยผ่านการรวบรวมเสียงแทนคำขอบคุณของเหล่าผู้ป่วยภายใต้โครงการเพื่อผู้ป่วยยากไร้ที่ได้รับการช่วยเหลือด้านค่ารักษาพยาบาลจากน้ำใจของคนไทย และเพื่อตอกย้ำว่า “การให้” จาก “ผู้บริจาค” ที่ส่งต่อความสุขไปยังผู้รับหรือ “ผู้ป่วย”ยังทำให้เกิดความสุขอีกหลากหลายรูปแบบ เช่น ความสุขของผู้บริจาคที่ได้เห็นผู้ป่วยหายดีได้กลับไปใช้ชีวิตกับครอบครัว หรือการมอบทุนทรัพย์ให้กับนักศึกษาผ่านโครงการ “ทุนการศึกษารามาธิบดี” เพื่อมุ่งสร้างบุคลากรทางการแพทย์ให้นำความรู้มาช่วยยกระดับคุณภาพชีวิตของประชาชนในสังคมไทย หรือแม้กระทั่งความสุขที่ได้ร่วมเป็นส่วนหนึ่งในการก่อสร้างโครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ที่กำลังจะเกิดขึ้นในอนาคตและโครงการต่างๆที่มูลนิธิให้การดูแลอยู่อีกมากมาย
มองว่าเป็นคนที่มีความบกพร่องทางร่างกาย หรือไม่สวยไม่หล่อเลยต้องไปทำศัลยกรรม พอไปทำมาแล้วก็เลยไม่อยากให้ใครรู้ เพราะกลัวจะถูกมองว่าเป็นคนที่บกพร่อง หรือไม่สวยไม่หล่อ แต่สำหรับมุมมองคนทั่วไปในปัจจุบันที่มีต่อคนทำศัลยกรรม เขาจะมองว่ามันคือการดูแลตัวเอง ทำไปเพื่อเสริมสร้างความมั่นใจ ทำไปเพื่อส่งเสริมและเติมเต็มความสุขในชีวิต สำหรับบางคนเก็บเงินมาทำศัลยกรรมเพื่อเป็นรางวัลชีวิตกับให้กับตนเองก็มี เห็นได้ชัดว่ามุมมองเกี่ยวกับการทำศัลยกรรมมีความเป็น Positive มากขึ้น
หลายคนเรียนจบมหาวิทยาลัย ทำงานมากมาย ประสบความสำเร็จ รู้สึกเหนื่อยมามาก แต่ไม่ได้ดูแลตนเองสักเท่าไร จึงอยากทำศัลยกรรมความงาม เพื่อถือเป็นรางวัลชีวิต ดังนั้นการทำศัลยกรรมก็สามารถเติมเต็มความสุขในชีวิตได้แล้ว ที่ผ่านมาคนไข้หลายคนเป็นคู่รักเช่นสามีจูงมือภรรยาเข้ามาทำศัลยกรรมพร้อมกันเพื่อเป็นของขวัญวันแต่งงาน หรือแม้แต่คู่แม่ลูกที่เข้ามาศัลยกรรมดึงหน้าพร้อมกันอีกหลากหลายคู่ ไม่เท่านั้นเราพบว่าปัจจุบันการทำศัลยกรรมของคนไข้หลายคนนอกจากจะอยากสร้างโอกาสในหน้าที่การงานแล้วยังเป็นการให้รางวัลชีวิตตนเองในบั้นปลายอีกด้วย
นพ.ธนัญชัย ยังกล่าวอีกว่าในขณะที่เทคนิคทางการแพทย์สมัยใหม่ก็พัฒนาขึ้น จึงเปิดโอกาสให้คนทุกเพศทุกวัยเข้ารับการศัลยกรรมได้เปิดกว้างขึ้น เช่นศัลยกรรมดึงหน้า เมื่อก่อนคนที่จะดึงหน้าส่วนใหญ่จะมีอายุประมาณ 60-70 ปี แต่ในปัจจุบันอายุประมาณ 30-40 ปีก็เริ่มมาทำแล้ว ซึ่งเป็นการดึงหน้าเฉพาะส่วนที่มีความหย่อนคล้อยเช่น คนช่วงวัย 30-40 ปี อาจจะมีหางตาหรือคิ้วที่เริ่มตกไปตามวัย บางคนเริ่มปรากฏรอยตีนกา ซึ่งถ้าเป็นเมื่อก่อนอายุ 30-40 ปี หมอจะยังไม่แนะนำให้ดึงหน้า ตรงกันข้ามกับปัจจุบันด้วยเทคนิคทางการแพทย์ที่ดีขึ้นทำให้เราสามารถดึงหน้าแยกส่วนได้ สามารถฉีดยาชาทำโดยไม่ต้องผ่าตัดใหญ่ ใช้เวลาน้อยลงและตรงปัญหามากขึ้น เช่น คนวัย 30-40 ปีที่มาดึงเฉพาะส่วน ใช้เวลา 30 นาทีก็เสร็จแล้ว ถือเป็นการผ่าตัดเล็ก ดูแลง่าย
ทั้งนี้คุณหมอธนัญชัยยังฝากทิ้งท้ายว่า การทำศัลยกรรมไม่ได้อยู่ที่ว่าใครมองเราอย่างไร แต่เราต่างหากที่มองตัวเองอย่างไร บางครั้งการทำศัลยกรรมเพียงเล็กน้อยแต่ทำให้เรามั่นใจมากขึ้นและมีความสุข การทำศัลยกรรมก็เปรียบเสมือนรางวัลชีวิตเราแล้วเพราะความงามเป็นสิ่งที่คู่ควรกับทุกคน การเสริม เติมแต่ง เพื่อให้ได้เป็นคนที่สวยและดูดีที่สุดในแบบของตัวเอง จะช่วยเสริมสร้างความมั่นใจและความภูมิใจในตนเอง ทางศูนย์ศัลยกรรมความงามโรงพยาบาลบางมดจึงพัฒนาเทคนิคและวิธีการเพื่อมอบความสวยที่สมบูรณ์แบบอย่างยั่งยืนให้กับทุกคน
ปรึกษาเรื่องศัลยกรรมความงาม โทร. 0-2867-0606 ต่อ 1200-1204
ถ้ำนาคา
“ถ้ำนาคา” ตั้งอยู่ในพื้นที่อุทยานแห่งชาติภูลังกา อ.บึงโขงหลง จ.บึงกาฬ และอยู่ใกล้กับวัดถ้ำชัยมงคล การขึ้นไปเที่ยวถ้ำต้องเดินขึ้นบันไดสูงชันที่ทางอุทยานฯ จัดสร้างขึ้นไปกว่า 1,400 ขั้น ใช้เวลาเดินราว 1-1.30 ชั่วโมง
เหตุที่ถ้ำแห่งนี้ได้ชื่อว่า “ถ้ำนาคา” หรือ “ถ้ำพญานาค” เนื่องจากมีของหินและผนังถ้ำดูคล้ายพญานาค ที่มีรูปทรงคล้ายพญานาคหรืองูขนาดใหญ่นอนขดตัว โดยมีส่วนสำคัญ ๆ ทั้งส่วนหัว ลำตัว และเกล็ดพญานาค (ตามจินตนาการและความเชื่อของชาวบ้าน) ความเชื่อเรื่องพญานาคที่ถ้ำนาคา
ด้วยเหตุนี้จึงมีตำนานเรื่องเล่าเชื่อมโยงกับความเชื่อของถ้ำแห่งนี้ว่า ถ้ำนาคาคือพญานาคหรืองูยักษ์ที่ถูกสาปให้กลายเป็นหิน โดย “อือลือราชา”หรือ “ปู่อือลือ” เทพบนสรวงสวรรค์ ที่ถูกสาปให้เป็นพญานาคปกครองเมืองบาดาล (เชื่อกันว่าคือบึงโขงหลง จ.บึงกาฬ) ที่มีทั้งพญานาคและมนุษย์อาศัยอยู่ร่วมกัน ได้สาปบริวารพญานาคของตนให้กลายเป็นหินที่ถ้ำแห่งนี้เนื่องจากทำผิดจารีต เพราะไปมีสัมพันธ์สวาทกับมนุษย์ ซึ่งก็คือถ้ำนาคา หรือ ถ้ำพญานาค ที่ อช.ภูลังกา แห่งนี้
ลวดลายหินเกล็ดพญานาคแห่งถ้ำนาคา กำเนิดถ้ำนาคา-ตัวพญานาค หลังถ้ำนาคาถูกเปิดตัวเป็นแหล่งท่องเที่ยวใหม่มาแรง
ล่าสุดทางกรมทรัพยากรธรณี ก็ได้ทำการสำรวจถ้ำเพิ่มเติม เพื่อนำชุดความรู้ใหม่ ๆ มานำเสนอ ควบคู่ไปกับการพัฒนาถ้ำแห่งนี้ให้เป็นแหล่งท่องเที่ยวเรียนรู้ในทางธรณีวิทยา นาย “ชัยพร ศิริพรไพบูลย์” หรือ “อาจารย์ชัยพร” ผู้เชี่ยวชาญด้านถ้ำและนักธรณีวิทยา กรมทรัพยากรธรณี ที่เป็นผู้นำทีมการสำรวจถ้ำนาคาอย่างเจาะลึกและเข้มข้น ในช่วงปลายเดือนมิ.ย. 63 ที่ผ่านมา ได้เผยข้อมูล และชุดความรู้ใหม่ ๆ ของถ้ำนาคา ผ่านเฟซบุ๊กบัญชีรายชื่อส่วนตัว Chaiporn Siripornpibul โดยมีประเด็นหลัก ๆ ดังนี้
หินทรายแห่งภูลังกา...ถ้ำนาคาเป็นส่วนหนึ่งของภูเขาหินทรายชื่อ “ภูลังกา” ที่อยู่ในหมวดหินยุคครีเทเซียสตอนปลาย (ประมาณ 70 ล้านปีที่แล้ว ซึ่งเป็นช่วงท้าย ๆ ของโลกยุคไดโนเสาร์)
หินทรายบริเวณนี้นอกจากจะมีความหนาค่อนข้างมาก และเนื้อหินมีความเป็นเนื้อเดียวกัน (homogeneous) แล้ว ยังมีความพรุนสูง ซึ่งมีผลสำคัญต่อการเกิดลวดลายคล้ายเกล็ดพญานาค รอยเว้าผนังถ้ำ กำเนิดแห่งถ้ำนาคา ช
ส่วนตัวถ้ำนาคาหรือส่วนที่เป็นลำตัวพญานาคนั้น เกิดจากการยกตัวของแผ่นดิน (Tectonic uplift) ในภาคอีสาน ทำให้เกิด “รอยเว้าผนังถ้ำ (cave notch)” ที่มีลักษณะโค้งนูนออกมา และคั่นสลับด้วยผนังหินที่โค้งเว้าเข้าไป
จากนั้นเกิดการกัดเซาะที่เป็นวัฏจักร (Cyclic Erosion) ในยุคโลกเย็นหรือ “ยุคน้ำแข็ง” กับยุคโลกร้อนในอดีตที่เกิดสลับกันเป็นวงรอบประมาณทุก ๆ 1 แสนปี โดยมีน้ำเป็นตัวการหลักในการกัดเซาะหินลงไปตามกลุ่มรอยแตกของหินในแนวตั้งที่มีสองแนวตัดกันจนเป็นรูปตารางสี่เหลี่ยม หินลวดลายคล้ายเกล็ดพญานาคแห่งถ้ำนาคา
ปรากฏการณ์เหล่านี้กินเวลายาวนานมาก จนทำให้เกิดเป็นถ้ำนาคาในปัจจุบัน ที่มีลักษณะเป็นช่องแคบตัดกันเหมือนถ้ำเขาวงกตขนาดเล็กที่ไม่มีหลังคาถ้ำ ทำให้ผนังแห่งนี้มีความโค้งและเว้าสลับกันดูคล้ายลำตัวพญานาคหรืองูยักษ์ ตามจินตนาการของชาวบ้านในแถบนั้น *หัว-เกล็ดพญานาค
ขณะที่ในส่วนของหินที่มีลักษณะทางธรณีวิทยาคล้าย “เกล็ดพญานาค” อ.ชัยพร ได้ให้ข้อมูลว่า เกิดจากการขยายตัวและหดตัวของผิวหน้าของหิน ซึ่งกระบวนการนี้มีชื่อเป็นภาษาอังกฤษว่า “ซันแครก” ( Sun Cracks)
เกล็ดพญานาคจากปรากฏการณ์ซันแครก จะเกิดขึ้นเป็นวัฏจักรเช่นกัน แต่เป็นวัฏจักรที่สลับปรับเปลี่ยนระหว่างความร้อนจากแสงแดดในช่วงกลางวันกับความเย็นในช่วงกลางคืน แต่กระบวนการนี้จะเกิดขึ้นอย่างต่อเนื่องเป็นเวลาที่ยาวนานมากคาดว่าจะใช้เวลานับแสนปีหรือนานกว่านั้น
นอกจากนี้ล่าสุดได้มีการตั้งชื่อก้อนหินขนาดใหญ่ที่มีบางมุมมองแล้วดูคล้ายหัวงูขนาดใหญ่ อันเป็นที่มาของชื่อ “หินหัวพญานาค”นั้น เป็นส่วนของหินที่แตก (ขนาดใหญ่) และหล่นมาจากหน้าผา โดยบริเวณส่วนหัวมีลวดลายเป็นรอยแตกของผิวหน้าของหินแบบซันแครกที่ดูคล้ายผิวหนังของงูยักษ์ไม่น้อยเลย
หลังถ้ำนาคาโด่งดังเป็นที่รู้จักอย่างแพร่หลาย ก็ได้มีนักท่องเที่ยวหลายคนเดินทางไปบันทึกภาพของสถานที่แห่งนี้ หลังการเปิดแหล่งท่องเที่ยวในอุทยานแห่งชาติทั่วประเทศเมื่อ 1 ก.ค. 63 มุมป่าโบราณ โดยหนึ่งในนั้นก็คือเพจ “Buengkan day” ที่มี “ศรัทธา ลาภวัฒนเจริญ” เป็นแอดมินและช่างภาพ ซึ่งได้นำเสนอภาพมุมอันซีนถ้ำนาคาอันสวยงามแปลกตา แฝงลี้ลับน่าพิศวง จนได้รับการแชร์กันในโลกโซเชียลอย่างกว้างขวาง สำหรับภาพอันซีนถ้ำนาคานั้นก็อย่างเช่น ภาพสายน้ำไหลผ่านหินหัวพญานาค ลำตัว-เกล็ดพญานาคที่มีรากไม้เกาะเกี่ยว ลวดลายเกล็ดพญานาค (ซันแครก) ที่มีตะไคร้ขึ้นเขียวครึ้ม หรือมุมต้นไม้โบราณที่หลายคนจินตนาการไปถึงป่าโบราณใน “เพชรพระอุมา” สุดยอดนิยายผจญภัยของเมืองไทย อันซีนถ้ำนาคา และนี่ก็คือมนต์เสน่ห์ของ “ถ้ำนาคา” อช.ภูลังกา จ.บึงกาฬ
วัดถ้ำเสือ อ.ท่าม่วง ความอลังการบนยอดเขา LINK
วัดถ้ำเสือ เป็นวัดและสถานที่ท่องเที่ยวที่ตั้งอยู่บนยอดเขาในอำเภอท่าม่วง จังหวัดกาญจนบุรี ติดกับวัดถ้ำเขาน้อยซึ่งเป็นวัดจีนตั้งอยู่ด้านหลัง เป็นที่รู้จักสำหรับทิวทัศน์ที่ล้อมรอบด้วยทุ่งนาและประดิษฐานพระพุทธรูปขนาดใหญ่ หลวงพ่อชินประทานพร ภายในวัดประกอบด้วยอาคารและเจดีย์ สถาปัตยกรรมไทย, จีน, ญี่ปุ่น และผสมผสาน เดิมเป็นสำนักสงฆ์ขนาดเล็กในบริเวณถ้ำเสือด้านล่างริมเนินเขา ต่อมาชาวบ้าน ร่วมกันสร้างและบูรณะ จนกลายเป็นวัดที่ใหญ่โต และมีความวิจิตรงดงาม
จุดเด่นของวัดที่ดึงดูดนักท่องเที่ยวมากหน้าหลายตาให้มาเยี่ยมชมคือพระพุทธรูปปางประทานพรที่ใหญ่ที่สุดของจังหวัดกาญจนบุรีนามว่าหลวงพ่อชินประทานพร ซึ่งสร้างขึ้นในปี พ.ศ. 2516 โดยตัวองค์พระประดับโมเสกสีทองอร่ามทั้งองค์โดดเด่นเป็นสง่าอยู่บนยอดเขา การขึ้นไปยังพระพุทธรูปจะต้องเดินขึ้นบันไดนาค ต้นบันไดมีสัตว์หิมพานต์สีสันสวยงามตั้งอยู่หลายตัว บันไดทางขึ้นนี้มี 157 ขั้น หากไม่สะดวกที่จะเดินขึ้นบันได ทางวัดมีรถรางบริการในราคาคนละ 10 บาท
ขณะเดินหรือนั่งรถรางขึ้นเขาสามารถมองลงไปชมชมวิวทิวทัศน์ทะเลสาบและเขื่อนวชิราลงกรณ์โดยรอบได้ในมุมกว้าง ที่อยู่ถัดจากองค์พระพุทธรูปคือพระเจดีย์เกศแก้วมหาปราสาท องค์พระเจดีย์มีขนาดใหญ่ มีความสูง 69 เมตร กว้าง 29 เมตร เป็นสีอิฐทั้งองค์ แบ่งเป็นชั้นต่าง ๆ เก้าชั้น แต่ละชั้นจะมีพระพุทธรูปสำริดประดิษฐานอยู่ ภายในยังมีจิตรกรรมฝาผนังงดงาม มีบันไดเวียนสำหรับขึ้นไปนมัสการพระบรมสารีริกธาตุที่ประดิษฐานอยู่ชั้นที่เก้า ซึ่งเป็นชั้นบนสุดของพระเจดีย์ โดยพระบรมสารีริกธาตุที่อยู่ภายในได้อัญเชิญมาจากประเทศอินเดียในปี พ.ศ. 2533หน้าต่างอีกด้านหนึ่งของเจดีย์ยังสามารถมองไปเห็นวิหารจีนของวัดถ้ำเขาน้อยที่ตั้งอยู่ใกล้กันและมีความสูงใกล้เคียงกัน ด้านข้างองค์พระพุทธรูปยังมีอุโบสถทรงจตุรมุข มีซุ้มเสมารอบ 8 ทิศเป็นสถาปัตยกรรมแบบไทยที่มีลวดลายสวยงามวิจิตรด้านหลังสามารถมองลงไปเห็นทิวทัศน์ของเทือกเขาและทุ่งนาสีเขียว บริเวณเชิงเขามีถ้ำเสือ ซึ่งเป็นถ้ำขนาดเล็ก ภายในมีร่างของพระครูสิทธิวิมล (หลวงปู่ชื่น ปาสาทิโก) อยู่ในโลงแก้ว มีประดิษฐานพระประจำวันเกิดและมีจัดจำหน่ายวัตถุมงคล เดินทางอย่างไร หากมาจากกรุงเทพฯ ให้ใช้ถนนเพชรเกษม (ทางหลวงหมายเลข 4) มุ่งหน้าสู่จังหวัดนครปฐม จากนั้นขับมุ่งหน้าไปยังจังหวัดกาญจนบุรี สังเกตป้ายเลี้ยวซ้ายไปอำเภอท่าม่วง เพื่อเลี้ยวซ้ายไปเข้าเส้นแสงชูโตเก่า จากนั้นไปตั้งหลักที่วงเวียนหอนาฬิกา โรงพยาบาลท่าม่วง วิ่งเลียบถนนเขื่อนวชิราลงกรณ์ไปจนสุดทาง จะพบสามแยก ให้เลี้ยวขวา ไปตามทางอีก 1 กิโลเมตรจะพบแยกซ้ายเข้าวัดม่วงชุม เลี้ยวซ้ายไปตามทางจะพบป้ายบอกทางเข้าวัด วัดถ้ำเสือตั้งอยู่ติดกับวัดถ้ำเขาน้อย
วัดบางนา หลวงปู่เส็ง ปทุมธานี
วัดเก่าแก่ในจังหวัดปทุมธานี สร้างขึ้นเมื่อประมาณ พ.ศ. 2310 ในช่วงกรุงศรีอยุธยาตอนปลายและตอนต้นแห่งกรุงรัตนโกสินทร์ เป็นวัดมอญโบราณที่ตั้งอยู่ริมแม่น้ำเจ้าพระยา ที่นี่มีองค์ “พญาครุฑ” อยู่หลายจุดให้ได้สักการบูชา เนื่องจาก “หลวงปู่เส็ง จันทรังสี” เกจิชื่อดังด้านวิชาอาคมต่าง ๆ ซึ่งเป็นอดีตเจ้าอาวาสได้จัดสร้างขึ้น อีกทั้งยังมีสรีระสังขารของท่านให้ได้กราบไหว้ขอพรด้วย
Ardel Gallery Of Modern Art
หอศิลป์อาร์เดล ก่อตั้งปี 2006 เป็นไมล์สโตนสำคัญของพัฒนาการในแวดวงงานศิลปะของไทยเกือบสองทศวรรษที่ผ่านมา พื้นที่จัดแสดงงานศิลปะที่นำเสนอผลงานศิลปินชั้นนำรุ่นแล้วรุ่นเล่าเสมอมา แม้จะเป็นหอศิลป์ที่ตั้งอยู่โดดเดี่ยวจากใจกลางกรุงเทพมาก (บนถนนบรมราชชนนี) แต่การมีผลงานจัดแสดงอย่างต่อเนื่องไม่ขาดสาย ย่อมบ่งบอกถึงคุณภาพของหอศิลป์อาร์เดล ที่ต้องเจียดเวลาไปสัมผัสให้ได้สักครั้ง
เปิดทุกวัน 10.30 - 19 .00 น. เว้นวันจันทร์
3. ค่าความสุขคงที่ หวังให้เพิ่มสูงขึ้นในการสำรวจครั้งถัดไป
ทิศทางความสุขของคนไทยจากผลสำรวจยังคงคงที่ เมื่อเทียบกับผลสำรวจเดือนธันวาคม 2565 ที่ผ่านมา และคนไทยหวังให้มีสัญญาณอันดีที่ทำให้อนาคตจะมีแนวโน้มความสุขมากขึ้น ให้คนไทยยิ้มได้อย่างเต็มที่
เพียงความว่างเปล่า #JFF2023
เพียงความว่างเปล่า #JFF2023
1 ชั่วโมง 47 นาที R:13+
©2021 "Intolerance" Film Partners นักเรียนหญิงชั้นมัธยมต้นถูกสงสัยว่ากำลังขโมยของในซุปเปอร์มาร์เก็ต เธอวิ่งหนีออกมาจากร้านแต่กลับถูกรถชนจนเสียชีวิต ผู้เป็นพ่อได้ข่มขู่ทางโรงเรียนและเจ้าของร้านด้วยความเดือดดาล จนสุดท้ายทุกคนก็ถูกกดดันและบีบคั้นอารมณ์จนถึงขีดสุด ภาพยนตร์เรื่องนี้จะสะเทือนหัวใจคนดูด้วยการเดินเรื่องที่ชวนให้ตกตะลึง ถ่ายทอดผ่านภาพของพฤติกรรมและจิตใจของคนที่ตกอยู่ในสถานการณ์วิกฤต ภาพยนตร์ดราม่าไม่ธรรมดาที่ตั้งคำถามเกี่ยวกับการให้อภัยและการฟื้นฟูทางจิตวิญญาณ นอกจากนี้ยังได้ทีมนักแสดงคุณภาพมาร่วมถ่ายทอดอารมณ์ความรู้สึกสุดสมจริง ไม่ว่าจะเป็น อาราตะ ฟูรูตะ นักแสดงชื่อดังจากการแสดงละครเวที มาถ่ายทอดอารมณ์อันน่าสะพรึงกลัวในบทบาทคุณพ่อ และโทริ มัตสึซากะ หนึ่งในนักแสดงวัยรุ่นที่ยอดเยี่ยมที่สุดคนหนึ่งในยุคนี้
อันดับ 4. อุทยานแห่งชาติเขาพระวิหาร จ.ศรีสะเกษ
ผามออีแดง ในอุทยานแห่งชาติเขาพระวิหาร มีชื่อเสียงเป็นที่รู้จัก ทั่วประเทศ เป็นจุดชมวิวพระอาทิตย์ขึ้นที่สวยงาม ท่ามกลางทะเลหมอก และจากจุดนี้จะเห็นปราสาทเขาพระวิหารอีกด้วย จุดสนใจอื่นๆ ได้แก่ ภาพแกะสลักนูนต่ำปราสาทโดนตวล น้ำตกตาดไฮ ช่องอานม้า สระตราว สถูปคู่ และน้ำตกถ้ำขุนศรี
จากห้องเรียน สู่ระบบคิดในสนาม
กิ๊ฟ โชติรส จันเอก นักศึกษาจากคณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศรีปทุมซึ่งตอนนี้ทำงานอิสระด้วยการรับออกแบบ เล่าถึงประสบการณ์บนสนามจริงให้ฟังว่า การได้เข้าร่วมทำงานกับคณะฯ ในการออกแบบนิทรรศการของ Bangkok Design week ได้รับประสบการณ์ที่ต่างออกไปจากการเรียนในห้องเรียนเพียงอย่างเดียว ได้เรียนรู้งานจากพื้นที่จริง เดินลงพื้นที่คุยกับคนในชุมชน ได้รู้ปัญหาและสิ่งที่ชุมชนต้องการ ทำให้นำโจทย์ที่ได้มาคิดต่อยอดเพื่อนำเสนอออกมาผ่านนิทรรศการ
“ได้นำระบบวิธีคิดที่คณะสอนมาใช้ในงานจริงและได้เรียนรู้การทำงานกับคนที่หลากหลาย การเรียนสถาปัตยกรรมสามารถต่อยอดออกไปได้หลายอาชีพ ไม่ใช่แค่ออกแบบบ้านเพียงอย่างเดียว แต่สามารถปรับไปสู่การนำระบบคิดสร้างสรรค์ไปใช้ได้กับทุกงาน” อดีตนักศึกษาจากคณะสถาปัตยกรรมศาสตร์เล่า
มิ้ม พัชรินทร์ เครือศรี นักศึกษาคณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศรีปทุม ซึ่งตอนนี้ทำงานอิสระด้านการออกแบบ เขียนแบบ เล่าว่า การทำงานในนิทรรศการตลาดพลู เริ่มจากการคัดเลือกสถานที่สำคัญที่มีจุดเด่นในย่าน แล้วใช้วิธีเดินสำรวจเพื่อเก็บข้อมูลเชิงลึกที่ถูกต้อง หลังจากนั้นนำข้อมูลที่ได้มาเรียบเรียงเพื่อนำเสนอในรูปแบบดิจิทัลบนแอปพลิเคชันด้านท่องเที่ยวเพื่อแนะนำให้คนในพื้นที่ได้เข้าถึงความสำคัญและคุณค่าของย่านตลาดพลู ส่วนงานออกแบบในพื้นที่จะมีการแลกเปลี่ยนความคิดในทีม ทำงานเหมือนระบบงานของบริษัทจริง ๆ
สำหรับสิ่งที่ได้จากโครงการนี้คือได้ประสบการณ์ใหม่ ๆ จากหลายฝ่ายที่ต้องทำงานด้วย ไม่ว่าจะเป็นชุมชนเดิม การทำความเข้าใจกับความต้องการของคนที่เข้ามาอยู่ใหม่ ซึ่งจะต้องเก็บข้อมูลอย่างละเอียดและถูกต้องในการออกแบบ 1 ชิ้นงาน ซึ่งทำให้ได้กระบวนความคิดในการทำงานและสามารถนำไปเป็นวิธีคิดในการทำงานอื่น ๆ ได้ด้วย
เทศกาลโคมไฟจังหวัดภูเก็ต ประจำปี 2566 LINK
เทศกาลโคมไฟจังหวัดภูเก็ต ประจำปี 2566 จังหวัดภูเก็ต ร่วมกับชมรมอ๊ามภูเก็ต รื้อฟื้นเทศกาลโคมไฟขึ้นมา วันเทศกาลโคมไฟ หรือ “หยวนเซียว” เป็นคืนที่พระจันทร์เต็มดวงเพ็ญแรกในรอบปี ตรงกับวันที่ 15 เดือนอ้ายในปฏิทินจันทรคติจีน ในวันนี้ชาวจีนจะนิยมกินขนมหยวนเซียว “ขนมบัวลอย” เพราะมีรูปลักษณ์ทรงกลมเหมือนพระจันทร์ และออกจากบ้านมาชมการประดับโคมไฟ เพื่อความเป็นสิริมงคลและเป็นการเฉลิมฉลองช่วงเทศกาลและเป็นการกลับมารวมกันของครอบครัว โดยจะมีการอวยพรเพื่อมอบความสุขเฉลิมฉลองกันในครอบครัวช่วงเทศกาล ในขณะเดียวกันช่วงเทศกาลโคมไฟ ยังถือเป็นวันที่คู่รักจะได้พบและร่วมทำกิจกรรมต่างๆ เช่น ปล่อยโคมไฟ ชมการประดับไฟ และจุดประทัด โดยเทศกาลโคมไฟได้สืบทอดต่อกันมาจนเป็นวัฒนธรรมท้องถิ่น แต่เนื่องจากหลายปีที่ผ่านมา การดำเนินชีวิตของชาวท้องถิ่นในภูเก็ตขาดความต่อเนื่องในการรักษาขนบธรรมเนียมวิถีชีวิตและเอกลักษณ์วัฒนธรรมที่ดีงามของท้องถิ่น
เทศกาลโคมไฟในจังหวัดภูเก็ตในยามค่ำคืน ได้ระหว่างวันที่ 15 มกราคม-5 กุมภาพันธ์ 2566
5.The Happy-Go-Lucky #ปล่อยจอย
The Happy-Go-Lucky #ปล่อยจอย แม้ว่าเศรษฐกิจไทยจะมีความไม่แน่นอนตลอดทั้งปี แต่ยังมีกลุ่มที่ยังมองโลกแง่บวก ใช้ชีวิต และใช้จ่ายแบบ “สบายๆ” สไตล์คนไทย มีมากใช้มาก มีน้อยใช้น้อย ไม่คิดเยอะ ซึ่งถือเป็น 5% ของกลุ่มการสำรวจ คนกลุ่มนี้ต้องการซื้อความสุขใจให้ตัวเองในปัจจุบัน มากกว่าการวางแผนการเงินในอนาคตอย่างจริงจัง ดังนั้นแบรนด์สามารถเข้าไปมีบทบาทในการช่วยเติมความสุขวันละนิด ให้คนกลุ่มนี้ได้ โดยที่ ไม่ต้องเน้นเยอะ แต่เน้นบ่อย
การทำเด็กหลอดแก้ว IVF
พญ. ณหทัย ภัคธินันท์ สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์ คลินิกรักษาผู้มีบุตรยาก บำรุงราษฎร์ อธิบายถึงการทำเด็กหลอดแก้ว หรือการปฏิสนธิภายนอกร่างกาย หรือ IVF (In-vitro Fertilization) เป็นการนำไข่และอสุจิมาผสมกันให้เกิดการปฏิสนธิภายนอกร่างกายในห้องปฏิบัติการ จากนั้นจึงจะนำไข่ที่ได้รับการผสมแล้ว (ตัวอ่อน) ย้ายกลับเข้าไปในมดลูกของฝ่ายหญิง เพื่อให้เกิดการตั้งครรภ์ต่อไป
5. เฮลท์แคร์กำลังย้ายไปอยู่บนคลาวด์ (Cloud)
คลาวด์เป็นอีกหนึ่งเทคโนโลยีที่สำคัญในการเชื่อมต่อและบูรณาการโครงสร้างพื้นฐานไอทีด้านเฮลท์แคร์ เมื่อโครงสร้างพื้นฐานจำเป็นต้องมีความปลอดภัยระดับสูงและสามารถรองรับข้อมูลปริมาณมากๆ ได้ เพื่อช่วยให้ผู้ให้บริการด้านสาธารณสุขสามารถปรับให้เข้ากับความต้องการที่เปลี่ยนแปลงได้อย่างรวดเร็วโดยไม่ต้องกังวลเกี่ยวกับความปลอดภัยของข้อมูล ก่อนหน้านี้การประยุกต์ใช้คลาวด์ในวงการเฮลท์แคร์ถือว่าล้าหลังมาก แต่ในช่วงไม่กี่ปีที่ผ่านมา การประยุกต์ใช้คลาวด์ในวงการเฮลท์แคร์เติบโตอย่างรวดเร็วและได้รับการยอมรับมากขึ้น และน่าจะได้เห็นการนำคลาวด์ไปใช้ทั่วทุกมุมโลกในปี 2023 นี้ และน่าจะได้เห็นการเพิ่มขึ้นของโซลูชัน software-as-a-service (SaaS) ที่ส่งผ่านระบบคลาวด์ตามมา
สงกรานต์ GCIRCUIT 2023
สงกรานต์ GCIRCUIT 2023 กลับมาระเบิดจักรวาลดนตรีดีเจกระหน่ำสงกรานต์ ที่พร้อมระเบิดจักรวาล สู่โลกใบใหม่ภายใต้ธีม The Big Bang ในวันที่ 13 – 16 เมษายน 2566
GCIRCUIT เป็นแดนซ์เฟสติวัลปาร์ตี้ของเกย์ ระดับโลก เวทีที่เป็นหมุดหมายปาร์ตี้ของเกย์คอมมูนิตี้ทั่วโลก และยิ่งใหญ่ที่สุดในเอเชีย GCIRCUIT เป็นงานที่เนรมิตเมื่องไทยให้กลายเป็นเมืองนอก ด้วยโปรดักชั่นระดับโลก พร้อมกับความมันส์ แสงสีเสียง ความเปียก ความชุ่มฉ่ำ ความบันเทิงระเบิดโลก ที่ไม่รู้ลืม
เขตดอนเมือง LINK
13-24 มีนาคมนี้ สำนักงานเขตดอนเมืองร่วมกับศูนย์บริการสาธารณสุข 60 (รสสุคนธ์มโนชญากร) ออกให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับน้องหมา น้องแมวและสัตว์เลี้ยงลูกด้วยนม ฟรี! สอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมฯ โทร. 0256 9424 ต่อ 5341
พยาบาลแผนกฉุกเฉินกำลังช่วยเหลือผู้บาดเจ็บ เปลี่ยนเปล
ซ้อมแผนเผชิญเหตุทะเลาะวิวาทและใช้ความรุนแรง ผู้ร้ายถูกจับกุม
เขตราษฎร์บูรณะ
เขตราษฎร์บูรณะ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับ(น้องหมา, น้องแมว) ระหว่างวันที่ 13 - 24 มีนาคม 2566 เวลา 09.00 - 12.00 น. สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0-2428-4884 ต่อ 6820
นพ. อชิรวินทร์ จิรกมลชัยสิริ แพทย์ชำนาญการด้านอายุรศาสตร์โรคหัวใจ โรงพยาบาลบำรุงราษฎร์ ย้ำว่า “ศาสตร์โรคหัวใจเป็นสาขาที่ซับซ้อนและเกี่ยวข้องกับอีกหลายสาขา สาขาย่อยต่าง ๆ ของศาสตร์นี้มุ่งเน้นการรักษาเฉพาะส่วนของหัวใจ ดังนั้น ความเข้าใจในส่วนประกอบต่าง ๆ ของหัวใจจึงเป็นสิ่งสำคัญในการให้การรักษาที่มีประสิทธิภาพ มีผลการรักษาผู้ป่วยที่ยอดเยี่ยมเป็นที่น่าพอใจ”
นพ. อชิรวินทร์ เปิดเผยว่า ผลลัพธ์การรักษาแสดงให้เห็นว่าสถาบันโรคหัวใจบำรุงราษฎร์ ประสบความสำเร็จตามเป้าหมายให้การรักษาที่มีประสิทธิภาพระดับเวิลด์คลาส
3. ประเภทการท่องเที่ยวเชิงสุขภาพ (Health and Wellness Tourism) LINK
แบ่งประเภทรางวัลย่อยออกเป็น 4 สาขา ดังนี้
1. สาขาสปา (Spa)
2. สาขาเวลเนส สปา (Wellness Spa)
3. สาขาเวลเนส แอนด์ สปา รีทรีต (Wellness & Spa Retreat)
4. สาขานวดไทย (Nuad Thai for Health)
นิยาม
1. สาขาสปา (Spa) - สถานบริการสปาที่ให้บริการดูแลและเสริมสร้างสุขภาพ การผ่อนคลาย รวมถึง การบริการเพื่อความงาม โดยใช้เวลาในการให้บริการเพียงระยะสั้น ๆ เช่น อบไอน้ำ พอกตัว ขัดตัว นวดหน้า นวดตัว โดยต้องมีใบอนุญาตประกอบกิจการสถานประกอบการสปาเพื่อสุขภาพ จากกระทรวงสาธารณสุข
2. สาขาเวลเนส สปา (Wellness Spa) - สถานบริการสปาที่ให้บริการดูแลและเสริมสร้างสุขภาพ การ ผ่อนคลาย รวมถึงการบริการเพื่อความงาม เช่น อบไอน้ำ พอกตัว ขัดตัว นวดหน้า นวดตัว และมีบริการสร้าง เสริมสุขภาพแก่ร่างกายและจิตใจ โดยมีการออกแบบโปรแกรมเฉพาะบุคคลที่มีจุดประสงค์ในการบำบัดสุขภาพ การพักผ่อนเพื่อสุขภาพ และการผ่อนคลายความเครียด โดยมีผู้เชี่ยวชาญด้านการดูแลสุขภาพเป็นผู้ให้ คำปรึกษาและประเมินการเปลี่ยนแปลงด้านสุขภาพ โดยต้องมีใบอนุญาตประกอบกิจการสถานประกอบการ สปาเพื่อสุขภาพ และใบอนุญาตประกอบกิจการสถานพยาบาลหรือใบอนุญาตให้ดำเนินการสถานพยาบาลจาก กระทรวงสาธารณสุข
3. สาขาเวลเนส แอนด์ สปา รีทรีต (Wellness & Spa Retreat) - สถานบริการสปาและบริการ สุขภาพแบบองค์รวมที่เน้นสร้างเสริมสุขภาพแก่ร่างกายและจิตใจ โดยมีการออกแบบโปรแกรมเฉพาะบุคคลที่ มีจุดประสงค์ในการบำบัดสุขภาพ การพักผ่อนเพื่อสุขภาพ และการผ่อนคลายความเครียด รวมถึงให้บริการ กิจกรรมเพื่อสุขภาพต่าง ๆ โดยมีผู้เชี่ยวชาญด้านการดูแลสุขภาพเป็นผู้ให้คำปรึกษาและประเมินการ เปลี่ยนแปลงด้านสุขภาพ เช่น การล้างพิษ (Detoxification) การลดน้ำหนัก การฝึกโยคะ การนั่งสมาธิ และ การรับประทานอาหารเพื่อสุขภาพ โดยต้องมีใบอนุญาตประกอบกิจการสถานประกอบการสปาเพื่อสุขภาพ ใบอนุญาตประกอบกิจการโรงแรม และใบอนุญาตประกอบกิจการสถานพยาบาลหรือใบอนุญาตให้ดำเนินการ สถานพยาบาลจากกระทรวงสาธารณสุข
4. สาขานวดไทย (Nuad Thai for Health) - สถานบริการนวดไทยเพื่อสุขภาพที่ให้บริการดูแลและ ส่งเสริมสุขภาพ การผ่อนคลาย โดยมีการออกแบบเมนูที่ใช้เวลาในการให้บริการเพียงระยะสั้น ๆ เช่น การนวด ไทย นวดไทยประคบ หรือการผสมผสานศาสตร์การนวดไทยที่เป็นภูมิปัญญาไทย (ฤาษีดัดตน นวดตอกเส้น หรือนวดย ่าขาง เป็นต้น) โดยต้องมีใบอนุญาตประกอบกิจการสถานประกอบการนวดเพื่อสุขภาพ จาก กระทรวงสาธารณสุข
พบว่าลูกมีการสำเร็จความใคร่ด้วยตนเอง หรือช่วยตัวเอง เป็นประจำ
ควรทำ
พ่อแม่ควรยอมรับและทำความเข้าใจว่า ลูกอยู่ในช่วงวัยรุ่น มีความต้องการทางเพศที่ต้องการปลดปล่อย
บอกลูกว่า การช่วยตัวเองเป็นเรื่องธรรมชาติของมนุษย์ ไม่ใช่เรื่องผิดปกติ บางคนอาจมีความต้องการทางเพศที่สูงกว่าคนอื่น แต่แสดงว่ามีสุขภาพร่างกายแข็งแรงดี แต่ก็ไม่ควรช่วยตัวเองจนอวัยวะเพศได้รับบาดเจ็บ
ถ้าลูกกังวลว่าช่วยตัวเองบ่อยเกินไปหรือไม่พ่อแม่สามารถแนะนำให้ลูกสังเกตร่างกายตัวเอง ถ้ารู้สึกเหนื่อย เพลีย ไม่มีแรง ก็สันนิษฐานได้ว่าร่างกายต้องการการพักผ่อน
พ่อแม่อาจจะชวนลูกทำกิจกรรมอื่นๆ ร่วมกันเพื่อให้ลูกแบ่งเวลาไปทำอย่างอื่นบ้าง เช่น เล่นกีฬา ทำกิจกรรมร่วมกันเพื่อไม่ให้ลูกหมกมุ่นอยู่กับเรื่องเพศเพียงอย่างเดียว
อย่าทำ
จับตาสอดส่องพฤติกรรมลูกแม้กระทั่งในเวลาส่วนตัวเพื่อป้องกันไม่ให้ลูกช่วยตัวเอง จะทำให้ลูกอึดอัดและรู้สึกว่าพ่อแม่ไม่เคารพความเป็นส่วนตัว
พูดเชิงขบขันหรือล้อเลียนลูก ทำให้ลูกรู้สึกอับอาย จะทำให้เด็กรู้สึกไม่ดีต่อร่างกายตัวเอง และยิ่งตีตัวออกจากพ่อแม่
การดุด่า ต่อว่า หรือทำโทษ เมื่อพบว่าลูกแอบช่วยตัวเอง จะทำให้ลูกมีทัศนคติไม่ดีต่อเรื่องเพศ และกระทบความสัมพันธ์ในครอบครัว
การนำเหตุการณ์ที่พบเห็นลูกช่วยตัวเองไปเล่าให้ญาติ คนรู้จักฟัง อาจด้วยความกังวลของพ่อแม่ จะทำให้เด็กรู้สึกว่า พ่อแม่ไม่เคารพความเป็นส่วนตัว เด็กจะปิดบัง และไม่ขอคำแนะนำปรึกษา หรือหากเกิดปัญหาก็จะไม่ขอความช่วยเหลือจากพ่อแม่
คลินิกโรคกระดูกและข้อ (Orthopedic Clinic)
คลินิกโรคกระดูกและข้อ (Orthopedic Clinic) รักษาโรคข้อเข่าเสื่อม (Knee Osteoarthritis) ด้วยการฉีดน้ำเลี้ยงข้อเข่า ทำให้ข้อเข่ามีความยืดหยุ่น มีน้ำเลี้ยงข้อเข่าที่มีความหนืดใกล้เคียงกับคนปกติ และรับแรงกระแทกได้ดี ทำให้หายจากอาการปวด และทำให้มีคุณมากชีวิตที่ดีขึ้น โรคข้อเข่าเสื่อม (Knee Osteoarthritis) ส่วนใหญ่พบในผู้สูงอายุเฉลี่ยอยู่ที่ 50 ปีขึ้นไป แต่ในปัจจุบันมีแนวโน้ม หรือโอกาสเกิดขึ้นได้ไวขึ้น ไม่ใช่แค่ผู้สูงอายุก็เป็นได้ เนื่องจากการใช้ชีวิตประจำวัน หรือพฤติกรรมต่าง ๆ เช่น น้ำหนักมากที่มากเกินไป ก็ทำให้เป็นโรคเข่าเสื่อมได้ศูนยแพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 4 ศูนย์แพทย์วัดตึก
ศูนยแพทย์โรงพยาบาลพระนครศรีอยุธยา สาขา 4 ศูนย์แพทย์วัดตึก
ตั้งอยู่ที่ ม.1 ต.ท่าวาสุกรี อ.พระนครศรีอยุธยา จ.พระนครศรีอยุธยา 13000
โทร. 089-9012866
ศูนย์แพทย์ขนาดกลาง รับผิดชอบประชากร จำนวน 3,000 - 8,000 คน ครอบคลุมพื้นที่ หมู่ 1 ต.ท่าวาสุกรี อ.พระนครศรีอยุธยา
HEAT STROKE ... เด็กก็เป็นได้ ผู้ใหญ่ก็ควรระวัง
HEAT STROKE ... เด็กก็เป็นได้ ผู้ใหญ่ก็ควรระวัง
หากต้องมีการออกแดด
✔️ควรสวมหมวก หรือกางร่ม
✔️พกน้ำดื่ม
✔️สวมเสื้อผ้าสีอ่อน หลวม น้ำหนักเบา
คำแนะนำ
????หลีกเลี่ยงการทำกิจกรรมกลางแดดจัด
????อยู่ในบริเวณที่มีอากาศถ่ายเทหรือมีเครื่องปรับอากาศ
????ดื่มน้ำบ่อย ๆ ไม่ต้องรอกระหาย
????ไม่เปิดพัดลมจ่อตรงตัว
????ไม่อยู่ในรถที่จอดตากแดดตามลำพัง
????ผู้ปกครองควรดูแลเด็กอย่างใกล้ชิด
หากพบผู้ป่วยเป็นโรคลมร้อน โทร 1669 และพาผู้ป่วยเข้าที่ร่ม หรือห้องที่มีความเย็น จัดให้นอนราบ ยกเท้าและสะโพกสูง ถอดเสื้อผ้าออก ใช้ผ้าชุบน้ำเย็นเช็ดตามตัว และนำส่งโรงพยาบาลโดยเร็ว
รับสมัครพนักงานตำแหน่ง : ผู้ช่วยนักกิจกรรมบำบัด 1 อัตรา LINK
รับสมัครพนักงานตำแหน่ง : ผู้ช่วยนักกิจกรรมบำบัด 1 อัตรา คุณสมบัติ - อายุ 18-30 ปี - ระดับการศึกษา : มัธยมศึกษาปีที่6 / ปวส. - ผ่านการฝึกอบรมผู้ช่วยเหลือผู้ป่วย NA - มีประสบการณ์ดูแลเด็กเล็ก ผู้ป่วยทางด้านร่างกาย ผู้สูงอายุ จะพิจารณาเป็นพิเศษ - มีจิตสำนึกในการดูแลเอาใจใส่ผู้ป่วยเป็นอย่างดี สมัครได้ทุกวันจันทร์-เสาร์ เวลา 13.00 น.-15.00 น.แผนกบุคคล ชั้น 2 **สำเนาเอกสารสำคัญใช้ในการสมัครงาน และรูปถ่ายขนาด 1 นิ้ว 1 ใบ การแต่งกายของผู้สมัคร ผู้หญิง : สวมกระโปรง เสื้อเชิ้ต รองเท้าคัทชู
PM2.5 ส่งผลเสียต่อร่างกายอย่างไร?
ค่าฝุ่น PM2.5 22 ไมโครกรัมต่อลูกบากศ์เมตร เทียบเท่ากับการสูบบุหรี่ 1 มวน
ในปี 2565 ควันพิษที่ประชาชนในกรุงเทพฯ สูดดมเข้าไปนั้นเทียบเท่ากับการสูบบุหรี่ราว 1,225 มวนตลอดทั้งปี หรือเฉลี่ยวันละ 3.36 มวนเลยทีเดียว ซึ่งถือได้ว่าอันตรายเป็นอย่างมาก คุณหมอแอมป์ให้เหตุผลว่า เนื่องจากฝุ่น PM2.5 เป็นอนุภาคที่มีขนาดเล็กมาก สามารถเข้าแทรกซึมสู่ร่างกายของมนุษย์เข้าไปได้ลึกจนทะลุถุงลมปอด เข้าไปในกระแสเลือดโดยตรง และส่งผลเสียต่อการทำงานของระบบหายใจและส่วนอื่น ๆ ได้มากมาย ซึ่งมีดังต่อไปนี้
• ร่างกายได้รับความเสียหายจากสารอนุมูลอิสระและเกิดภาวะการอักเสบ
ฝุ่นควันมลพิษต่าง ๆ สามารถกระตุ้นการสร้างสารตัวหนึ่งที่ชื่อว่า “สารอนุมูลอิสระ หรือ Free radicals” จนเกิดภาวะ oxidative stress นำมาซึ่งการทำลาย DNA, ยับยั้งการซ่อมแซม DNA ชักนำให้เกิดความผิดปกติแก่ทารกในครรภ์ การกลายพันธุ์ และผลเสียอื่นได้
นอกจากนี้ “สารอนุมูลอิสระจะไปสะสมอยู่ที่ตับ ซึ่งเป็นอวัยวะที่ทำหน้าที่เหมือนเป็นโรงงานกำจัดของเสียภายในร่างกาย โดยมีสารสำคัญอย่าง ‘กลูตาไธโอน’ ที่ช่วยในการขับสารพิษ ซึ่งหากร่างกายมีระดับของสารสำคัญนี้มากก็จะสามารถกำจัดของเสียได้เร็ว หากมีน้อยก็จะกำจัดของเสียได้ช้า และยิ่งได้รับของเสียในปริมาณมาก ก็จะทำให้เกิดโรคภัยไข้เจ็บตามมา” คุณหมอแอมป์กล่าวถึงอันตรายของสารอนุมูลอิสระ
• ทำให้เทโลเมียร์สั้นลง
เทโลเมียร์ (Telomere) คือส่วนปลายสุดของโครโมโซม ทำหน้าที่ป้องกันไม่ให้รหัสพันธุกรรม
ถูกทำลายไปในระหว่างการแบ่งเซลล์ ซึ่งหากเราได้รับอนุมูลอิสระอย่างการสัมผัสมิลพิษทางอากาศมาก ก็จะส่งผลให้เทโลเมียร์หดสั้นลงมากกว่าปกติ เกิดความเสียหายต่อรหัสพันธุกรรมของเราได้ และเป็นหนึ่งในสาเหตุของการเกิดโรคเรื้อรังต่าง ๆ ตามมา
• เหนี่ยวนำให้เกิดโรคเรื้อรังตามมา
ฝุ่น PM2.5 มีสัมพันธ์กับการสร้างสารอักเสบที่เพิ่มขึ้น โดยมีจำนวนเซลล์เม็ดเลือดขาวที่มากขึ้น ซึ่งกระบวนการอักเสบที่เกิดขึ้นดังกล่าวจะเข้าไปทำลายเซลล์ต่าง ๆ ทำให้พวกเรา โดยเฉพาะในเด็กมีภูมิต้านทานลดลง เป็นหวัดบ่อยมากขึ้น มีภาวะภูมิแพ้ และเกิดโรคเรื้อรังต่าง ๆ ไม่ว่าจะเป็นโรคเบาหวาน โรคหลอดเลือด โรคอัมพฤกษ์ โรคอัมพาต และร้ายแรงที่สุดคือ เป็นโรคมะเร็งในระยะยาวได้เช่นกัน โดยเฉพาะอย่างยิ่งโรคมะเร็งปอดที่ฆ่าชีวิตคนไทยไปกว่า 122,104 ราย ในปี 2563 ประกอบกับฝุ่นพิษนี้มีสารอินทรีย์ระเหยง่ายอย่างสารโพลีไซคลิกอะโรมาติกไฮโดรคาร์บอน (PAHs) จึงเป็นเหตุให้สำนักงานวิจัยมะเร็งระหว่างประเทศ (IARC) จัดให้เป็นสารระเหยชนิดนี้เป็นหนึ่งในสารก่อมะเร็งสำหรับมนุษย์
Lamphun Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ณ วัดพระธาตุหริภุญชัย วรมหาวิหาร ชมขบวนแห่พระ และเทศกาลดนตรีวัยรุ่น, การแสดงวงดนตรีเครื่องเป่า Windensemble และรถแห่วง Windensemble รอบเมืองลำพูน และจุดแลนด์มาร์คต่าง ๆ พบกับ ขบวนแห่พระ และคอนเสิร์ตจากเหล่านักร้องประสานเสียง พร้อมดนตรีร่วมสมัยจากคนรุ่นใหม่ การแสดงวงดนตรีเครื่องเป่า Windensemble รถแห่วง Windensemble รอบเมืองลำพูน และจุดแลนด์มาร์คต่าง ๆ ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
วันที่ 13,15,16 เม.ย. 2566 ณ ถนนอินทยงยศ อำเภอเมืองลำพูน
กรุงเทพฯ – ภาคใต้
กรุงเทพฯ – ภาคใต้
- เส้นทางที่ 1 จากกรุงเทพฯ ไป จ.สมุทรสาคร – จ.สมุทรสงคราม (ทางหลวงหมายเลข 35) – แยกวังมะนาว – จ.เพชรบุรี (ทางหลวงหมายเลข 4 ถนนเพชรเกษม) จากนั้นมุ่งหน้าสู่จังหวัดประจวบคีรีขันธ์
- เส้นทางที่ 2 จากกรุงเทพฯ ไป อ.สามพราน – อ.นครชัยศรี – จ.นครปฐม – จ.ราชบุรี – แยกวังมะนาว – จ.เพชรบุรี (ทางหลวงหมายเลข 4 ถนนเพชรเกษม) จากนั้นมุ่งหน้าสู่จังหวัดประจวบคีรีขันธ์
- เส้นทางที่ 3 จากกรุงเทพฯไป ถนนบรมราชชนนี (ทางหลวงหมายเลข 338 ปิ่นเกล้า – นครชัยศรี) – อ.นครชัยศรี – จ.นครปฐม – จ.ราชบุรี – แยกวังมะนาว – จ.เพชรบุรี (ทางหลวงหมายเลข 4 ถนนเพชรเกษม) จากนั้นมุ่งหน้าสู่จังหวัดประจวบคีรีขันธ์
ตารางออกตรวจแผนกจักษุแพทย์
Mooring Buoys Maintenance เปิดประสบการณ์การเรียนรู้ “วิธีผูกและดูแลรักษาทุ่นจอดเรือ”
อย่างที่ทราบกันดีแล้วว่า “เกาะเต่า” เป็นดำน้ำที่สำคัญของโลก โดยมีจุดดำน้ำมากกว่า 50 จุดรายล้อมรอบเกาะ และเพื่อเป็นการป้องกันแนวปะการังรวมไปถึงระบบนิเวศเพื่อไม่ให้ได้รับความเสียหายจากเรือขนาดใหญ่ จึงจำเป็นต้องมีทุ่นจอดเรือติดตั้งไว้ เพื่อเป็นเครื่องหมายแสดงแนวเขตปะการัง
และเพื่อเป็นการแสดงความรักต่อธรรมชาติ ทีมงาน SPOTLIGHT Koh Tao จึงบรรจุกิจกรรมผูกทุ่นไว้อย่างเรื่อยมา ซึ่งเวิร์กช็อปนี้ จะทำให้ทุกคนได้เรียนรู้การบำรุงรักษาทุ่นนี้ให้คงสภาพใช้งานได้อย่างปกติ เพื่อช่วยป้องกันนักดำน้ำ นักท่องเที่ยว รวมไปถึงป้องกันความเสียหายใต้ท้องทะเล จากการที่เรือท่องเที่ยวมาทิ้งสมอเหนือแนวปะการัง
กิจกรรมนี้ จะมีทั้งผู้เชี่ยวชาญและการสนับสนุนจากกรมทรัพยากรทางทะเลและชายฝั่ง(ทช.) ช่วยตรวจสอบทุ่นจอดเรือ รวมถึงดูแลบำรุงรักษาให้เป็นไปด้วยความเรียบร้อย
ผู้ที่ต้องการเรียนรู้การจัดวาง การจัดระเบียบทุ่นจอดเรือ หรือวิธีการเปลี่ยนทุ่นต้องไม่พลาดกิจกรรมนี้ รับรองเลยว่า ได้สาระและดีต่อใจเมื่อได้นอบน้อมต่อธรรมชาติแน่นอน
สถานีชาร์จ ใน สมุทรปราการ
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Market Village สุวรรณภูมิ
ที่อยู่: 99/29 หมู่ที่1 ถ.เทพรัตน์ ต.บางพลีใหญ่ อ.บางพลี จ.สมุทรปราการ 10540
เวลาทำการ : ทุกวัน 08.00 – 21.00 น.
สถานีชาร์จ EV Station PluZ ปริมณฑล - นนทบุรี ปทุมธานี สมุทรปราการ
สถานีบริการ สาขาประชาชื่น 2
7/4 ถ.ประชาชื่นนนทบุรี ต.ท่าทราย อ.เมืองนนทบุรี นนทบุรี 11000
สถานีบริการ ปตท. กนิษฐาพาณิชย์
160/6 หมู่ที่ 2 ต.สวนใหญ่ อ.เมืองนนทบุรี จ.นนทบุรี 11000
สถานีบริการ ปตท. โปรเทคโนโลยี
55/65 หมู่ 1 ตำบลอ้อมเกร็ด อำเภอปากเกร็ด จังหวัดนนทบุรี 11120
สถานีบริการ แอลพีจี บจก.เลิศราชพฤกษ์
75/5 หมู่ที่ 2 ต.บางพลับ อ.ปากเกร็ด จ.นนทบุรี 11120
สถานีบริการ สาขาแยกสันติสุข
52/78 ถ.ปทุมสามโคก ต.บางปรอก อ.เมืองปทุมธานี ปทุมธานี 12000
สถานี สาขาเพื่อสวัสดิการกรมพัฒนาสังคมและสวัสดิการ
17 ม.2 ต.รังสิต อ.ธัญบุรี ปทุมธานี 12110
สถานีบริการ สาขาคลองหลวง กม.6
10/12 ม. 7 ต.คลองสาม อ.คลองหลวง ปทุมธานี 12120
สถานีบริการ ปตท. ไวท์ พาวเวอร์
23 ซ.พหลโยธิน 96 ต.ประชาธิปัตย์ อ.ธัญบุรี จ.ปทุมธานี 12130
สถานีบริการ ปตท. อิทธิศักดิ์
36/33 หมู่ที่ 3 ต.คูคต อ.ลำลูกกา จ ปทุมธานี 12130
สถานี บริการ บจ.ปิโตรเลียม(ถ.347)
99 ม.1 ต.เชียงรากน้อย อ.สามโคก ปทุมธานี 12160
สาขาศรีนครินทร์ บางเมือง
299/9 ม.5 ถ.ศรีนครินทร์ ต.บางเมือง อ.เมืองสมุทรปราการ สมุทรปราการ 10270
สถานี สาขาบางนา-ตราด กม.16
20/38 ม.7 ต.บางโฉลง อ.บางพลี สมุทรปราการ 10540
สถานี สาขากิ่งแก้ว
236 ม.12 ต.ราชาเทวะ อ.บางพลี สมุทรปราการ 10540
สยามคันทรีคลับกรุงเทพ
111 หมู่ที่ 2 ทางคู่ขนาน ถนนบางนา-ตราด ตำบล ศีรษะจรเข้ใหญ่ อำเภอบางเสาธง สมุทรปราการ 10570
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (หนองจอก) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (หนองจอก) ถนน เชื่อมสัมพันธ์ แขวง โคกแฝด เขต หนองจอก กรุงเทพมหานคร 10530
โรงเรียน ฝึกอาชีพกรุงเทพมหานคร (หนองจอก) เป็นโรงเรียนฝึกอาชีพ สังกัดกรุงเทพมหานคร ซึ่งเป็น 1 ใน 10 โรงเรียนทั่วเขตกรุงเทพมหานคร มีสาขาวิชาให้เลือกเรียนมากกว่า 50 วิชา เป็นหลักสูตรระยะสั้น เรียนจบแล้วสามารถประกอบอาชีพได้ทันที สอนโดยครูผู้มีประสบการณ์ จบแล้วได้รับใบประกาศนียบัตรจากกรุงเทพมหานคร สาขาที่เปิดสอน อาทิเช่น ออกแบบเวปไซต์ , อินเตอร์เน็ต , ตกแต่งภาพด้วย Photoshop ,ภาพเคลื่อนไหว, ซ่อมคอมพิวเตอร์ , สปา , นวดแผนไทย ,เสริมสวย ,ตัดผมชาย ,อาหารไทย และเบเกอรี่ , ดอกไม้ประดิษฐ์, ตัดเย็บเสื้อผ้า ,ซ่อมแอร์ ,ซ่อมรถยนต์ และ จักรยานยนต์ เป็นต้น
3 วิธีการไม่ตกเป็นเหยื่อ มิจฉาชีพออนไลน์
ตำรวจไทย PCT Police แนะนำวิธีการไม่ตกเป็นเหยื่อ มิจฉาชีพออนไลน์
1. เลือกบริการร้านค้าตามแพลตฟอร์มพวก อีคอมเมิรซ ค่ะ พวกลาซาด้า ชอปปี้ น็อคน็อค เซเว่น ฯลฯ พวกนี้ เขามีการรับประกันเมื่อได้สินค้าไม่ตรงปก ไม่ได้สินค้า เขารับประกันให้เรา โอนเงินคืนให้เรา แล้วเขามีหน้าที่ไปจัดการกับคนโกงเอง
2. อย่าเห็นแก่ของถูกเกินไปค่ะ ทุกอย่างต้องมีที่ไปที่มา การซื้อขายคือธุรกิจค่ะ ไม่ใช่การกุศล
3. ถ้าจะซื้อจากแพลตฟอร์มโซเชียลอื่นๆ ที่ไม่ได้เป็นแพลตฟอร์มค้าขายโดยตรง ระวัง ดูให้ดีค่ะ ของปลอมเยอะ ดูรีวิว ดูยอดไลค์ ทักไป ดูเลขบัญชีปลายทาง เอาชื่อไปหาในเน็ตก่อนค่ะ ว่าเคยมีประวัติโกงไหม
ภาคใต้ : “วิจิตร 5 ภาค @นครศรีธรรมราช ศิลป์ศรัทธา มาหานครฯ"
ภาคใต้ : พบกับการแสดง แสง สี เสียง ภายใต้แนวคิด “วิจิตร 5 ภาค @นครศรีธรรมราช ศิลป์ศรัทธา มาหานครฯ" สร้างสีสันบรรยากาศให้สถานที่ท่องเที่ยวจังหวัดนครศรีธรรมราช เพื่อกระตุ้นการท่องเที่ยวและสร้างรายได้ให้กับสถานประกอบการในพื้นที่จัดงาน เชิญชวนเที่ยวแดนใต้ สัมผัสกิจกรรมการแสดงแสง สี เสียง ด้วยเทคนิค Mapping 3D, Light up, Light Installation, City Tour และ Story Telling พร้อมกิจกรรมมากมายภายในงาน สามารถเที่ยวชมงานได้ตั้งแต่วันที่ 20 – 28 พฤษภาคม พ.ศ.2566
โครงการ “Dengue-zero School Project โรงเรียนติด Guard ห่างไกลไข้เลือดออก” ยังมีแผนที่จะเผยแพร่ความตระหนักรู้เกี่ยวกับโรคไข้เลือดออกและการป้องกัน โดยการนำแนวคิดและความคิดริเริ่มสร้างสรรค์ของเด็ก ๆ และคุณครูที่ได้เข้าร่วมโครงการ ไปต่อยอดสู่การนำไปปฏิบัติจริง ทั้งในโรงเรียนและชุมชนต่างๆ ทั่วประเทศ นอกจากนี้ผู้เข้าร่วมโครงการยังสามารถเป็นกระบอกเสียงและสร้างแรงบันดาลใจให้กับผู้อื่น เพื่อช่วยลดจำนวนผู้ป่วยไข้เลือดออกให้เป็น “ศูนย์” และร่วมกันสร้างอนาคตที่สดใสด้วยสภาพแวดล้อมที่ปลอดจากไข้เลือดออกได้อีกด้วย
ดร.จอห์น ที ชิลเลอร์ (John T. Schiller, Ph.D.) นักวิจัยดีเด่น สถาบันสุขภาพแห่งชาติ และรองหัวหน้าห้องปฏิบัติการมะเร็งระดับเซลล์ สถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติ สหรัฐอเมริกา
ดร.จอห์น ที ชิลเลอร์ สำเร็จการศึกษาดุษฎีบัณฑิตจุลชีววิทยา จากมหาวิทยาลัยวอชิงตัน สหรัฐอเมริกา ต่อจากนั้น ทำงานเป็นนักวิจัยที่ห้องปฏิบัติการมะเร็งระดับเซลล์ สถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติตลอดมาปัจจุบันดำรงตำแหน่งนักวิจัยดีเด่นของสถาบันสุขภาพแห่งชาติและรองหัวหน้าห้องปฏิบัติการมะเร็งระดับเซลล์ สถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติ สหรัฐอเมริกา
การดูแลสุขภาพเฉพาะบุคคล (Personalized Healthcare)
ในช่วงปี พ.ศ. 2566 ผู้ป่วยจะมีโอกาสมากขึ้นในการรับการรักษาพยาบาลที่ปรับให้เหมาะกับพวกเขาโดยเฉพาะ ซึ่งรวมถึงแนวคิดของยาที่แม่นยำ ซึ่งยาและการรักษาอื่นๆ นั้นได้รับการปรับให้เหมาะกับกลุ่มผู้ป่วยโดยเฉพาะ โดยพิจารณาจากปัจจัยต่างๆ เช่น อายุ พันธุกรรม หรือปัจจัยเสี่ยง แทนที่จะให้ยาในแนวทางเดียวที่เหมาะกับทุกคน รูปแบบการดูแลสุขภาพเฉพาะบุคคลที่ทันสมัยและแม่นยำที่สุดจะพิจารณาจากข้อมูลทางพันธุกรรมหรือจีโนมของบุคคล และสามารถช่วยแพทย์ในการคาดการณ์ว่ายาจะมีประสิทธิภาพเพียงใด หรือมีแนวโน้มที่จะได้รับผลข้างเคียงหรือไม่ บางครั้งใช้อัลกอริทึม AI และ ML เพื่อช่วยในการคาดคะเนเหล่านี้
คำว่า การดูแลสุขภาพเฉพาะบุคคล บางครั้งก็ใช้กับการเคลื่อนไหวเพื่อให้ผู้ป่วยมีทางเลือกมากขึ้นเกี่ยวกับวิธีการวางแผนและส่งมอบการดูแล ซึ่งมักจะเกี่ยวข้องกับการร่างแผนการรักษาส่วนบุคคลสำหรับแต่ละบุคคล โดยพิจารณาจากสถานการณ์ ความคิดเห็น และความเชื่อของตนเองเมื่อทำการเลือกว่าควรปฏิบัติอย่างไรและที่ไหน เช่นเดียวกับในอุตสาหกรรมและเศรษฐกิจในวงกว้างนอกเหนือจากการดูแลสุขภาพ การปรับเปลี่ยนให้เหมาะกับแต่ละบุคคลทุกรูปแบบมีแนวโน้มที่จะเป็นเทรนด์สำคัญตลอดปี 2566
Bernard Marr
Forbes
ติดตามข่าวสารล่าสุดเกี่ยวกับแนวโน้มธุรกิจและเทคโนโลยีที่เกิดขึ้นใหม่ อย่าลืมสมัครรับจดหมายข่าวของฉัน ติดตามฉันบน Twitter, LinkedIn และ YouTube และอ่านหนังสือของฉัน "ทักษะในอนาคต" และ "แนวโน้มธุรกิจในทางปฏิบัติ ซึ่งเพิ่งได้รับรางวัล Business Book of the Year ประจำปี 2565
ความจริงเสมือน (Virtual reality - VR)
ตลาด VR และ AR (ความจริงเสริม) กำลังเฟื่องฟูทั่วโลก และเทคโนโลยีทั้งสองกำลังถูกใช้มากขึ้นในแอปพลิเคชันด้านการดูแลสุขภาพ เทคโนโลยีนี้สามารถนำไปใช้ได้หลากหลายวิธี เช่น การผ่าตัดขั้นสูง ช่วยบรรเทาความเจ็บปวด และรักษาภาวะสุขภาพจิต
ศัลยแพทย์สามารถใช้หมวกนิรภัย VR เพื่อซ้อมหัตถการต่างๆ ตลอดจนมองเห็นภายในร่างกายของผู้ป่วยได้อย่างเต็มที่ และเทคโนโลยีสามารถช่วยให้ผู้คน "ไม่เรียนรู้" ความเจ็บปวดเรื้อรังโดยการฝึกสมองใหม่ Forbes กล่าว
VR ยังสามารถช่วยให้ผู้ที่มีความผิดปกติทางจิตเอาชนะความกลัวได้ด้วยการสร้างสภาพแวดล้อมที่ควบคุมสำหรับการปฏิสัมพันธ์ทางสังคม การเข้ารับการรักษาเป็นเวลา 2 ชั่วโมงเพราะกลัวความสูงช่วยลดความวิตกกังวลของผู้ป่วยได้เฉลี่ย 68% ตามข้อมูลของ Forbes
ผู้ประกันตน รพ.หริภุญชัยฯ อายุ 50 ปีขึ้นไป ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ ฟรี LINK
ผู้ประกันตน รพ.หริภุญชัยฯ อายุตั้งแต่ 50 ปีขึ้นไป รับบริการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ 4 สายพันธุ์ เชิญชวนผู้ประกันตน รพ.หริภุญชัยฯ อายุตั้งแต่ 50 ปีขึ้นไป #รับบริการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ 4 สายพันธุ์ #ไม่มีค่าใช้จ่าย สำหรับผู้ประกันตน ม.33 และ ม.39 ที่ยังไม่ได้รับวัคซีนไข้หวัดใหญ่ ประจำปี สามารถเข้ารับวัคซีนได้ตั้งแต่วันที่ 1พฤษภาคม 2566 – 31 สิงหาคม 2566
กรณีผู้ประกันตนโรงพยาบาลอื่นสามารถโทรติดต่อเบอร์ โทร. 02-9562500 เพื่อขอรับ Code ก่อนเข้ารับบริการฉีด ณ รพ.หริภุญชัยฯ ติดต่อสอบถามหรือนัดหมายได้ที่ โรงพยาบาลหริภุญชัย ราม โทร.053-581111
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ผู้ป่วยนอกศัลยกรรม
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ ผู้ป่วยนอกศัลยกรรม เปิดให้บริการ เดือนมิถุนายน 2566 วันจันทร์ และ วันศุกร์ เวลา 16.00-20.00 น. ณ อาคารศัลยกรรม ชั้น 1
ห้องตรวจทันตกรรม
ห้องตรวจทันตกรรม ตารางปฏิบัติแพทย์ ทันตกรรมเฉพาะทาง อาคารอำนวยการ ชั้น 3 เบอร์โทรติดต่อ 044 – 615002 ต่อ 3313 ,3305
- ทันตกรรมประดิษฐ์
- ทันตกรรมสาธารณสุข
- ทันตกรรมสำหรับเด็ก
- คลินิกการเรียนการสอนนักศึกษาทันตแพทย์ มทส.
- วิทยาเอ็นโดดอนต์
หมายเหตุ อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้น 4 (รับเฉพาะตรวจฟัน, ถอนฟัน, อุดฟัน, ขูดหินปูน, คลินิกศัลยกรรมช่องปากและแม็กซิโลเฟเซียล, ทันตกรรมบริทันตวิทยา, ทันตกรรมรากเทียม ,ทันตกรรมหัตถการ ,ทันตกรรมจัดฟัน) เบอร์โทรติดต่อ 044 – 615002 ต่อ 4412
กลุ่มเป้าหมายผู้ป่วยเป็น 4 กลุ่มสำคัญ
โดยแบ่งกลุ่มเป้าหมายผู้ป่วยเป็น 4 กลุ่มสำคัญ ดังนี้
- กลุ่มผู้ป่วยที่ช่วยเหลือตนเองไม่ได้ เช่น อัมพฤกษ์ อัมพาต
- กลุ่มผู้ป่วยโรคเรื้อรัง เช่น โรคระบบทางเดินหายใจ โรคหัวใจและหลอดเลือด โรคไตวายเรื้อรัง โรคหลอดเลือดสมอง โรคมะเร็ง และโรคเบาหวาน
- กลุ่มผู้ป่วยเปราะบางระยะสุดท้าย
- กลุ่มผู้ป่วยพักฟื้นหลังการผ่าตัด
ซึ่งผู้ป่วยทั้ง 4 กลุ่มนี้ ต้องการการดูแลเป็นพิเศษ เรามองว่าการส่งพยาบาลหรือผู้ช่วยดูแลตามบ้านนั้นอาจไม่ครอบคลุม เพราะในบางครั้งจะมีความซับซ้อนของอาการ จึงจำเป็นต้องได้รับการดูแลโดยผู้เชี่ยวชาญอย่างใกล้ชิด ตลอด 24 ชั่วโมง ดังนั้นการตั้งศูนย์ดูแลในโรงพยาบาลฯ จึงเป็นคำตอบของการดูแลผู้ป่วยกลุ่มฟื้นฟูพิเศษได้ใกล้ชิด และได้มาตรฐานการดูแลเฉพาะบุคคลได้ดีกว่าการดูแลที่บ้าน ด้วยสภาพแวดล้อม เครื่องมือทางการแพทย์ ทีมแพทย์และเจ้าหน้าที่ที่ดูแล จะตอบโจทย์ทั้งผู้ป่วยและญาติๆ ที่อาจจะไม่มีเวลาในการดูแล
ศรีสะเกษ ส.ส. 9 คน 100%
- เขต 1 เพื่อไทย นายธเนศ เครือรัตน์ 42,445
- เขต 2 เพื่อไทย นายสุรชาติ ชาญประดิษฐ์ 42,374
- เขต 3 ภูมิใจไทย นายธนา กิจไพบูลย์ชัย 37,933
- เขต 4 เพื่อไทย นายภูมินทร์ ลีธีระประเสริฐ 38,410
- เขต 5 เพื่อไทย นายอมรเทพ สมหมาย 32,884
- เขต 6 เพื่อไทย นายวีระพล จิตสัมฤทธิ์ 35,317
- เขต 7 เพื่อไทย นางสาววิลดา อินฉัตร 30,394
- เขต 8 ภูมิใจไทย นายอาสพลธ์ สรรณ์ไตรภพ 42,882
- เขต 9 เพื่อไทย นางนุชนาถ จารุวงษ์เสถียร 38,051
สกลนคร ส.ส. 7 คน 100%
- เขต 1 เพื่อไทย นายอภิชาติ ตีรสวัสดิชัย 29,716
- เขต 2 ประชาธิปัตย์ นายชาตรี หล้าพรหม 27,405
- เขต 3 เพื่อไทย นางสาวจิรัชยา สัพโส 49,346
- เขต 4 เพื่อไทย นายพัฒนา สัพโส 35,690
- เขต 5 พลังประชารัฐ นายชัยมงคล ไชยรบ 28,567
- เขต 6 เพื่อไทย นางสาวสกุณา สาระนันท์ 39,035
- เขต 7 เพื่อไทย นายเกษม อุประ 32,195
สงขลา ส.ส. 9 คน 100%
- เขต 1 ประชาธิปัตย์ นายสรรเพชญ บุญญามณี 40,521
- เขต 2 รวมไทยสร้างชาติ นายศาสตรา ศรีปาน 20,553
- เขต 3 ประชาธิปัตย์ นายสมยศ พลายด้วง 39,577
- เขต 4 พลังประชารัฐ นายชนนพัฒฐ์ นาคสั้ว 32,320
- เขต 5 ประชาธิปัตย์ นายเดชอิศม์ ขาวทอง 42,368
- เขต 6 ประชาธิปัตย์ นางสาวสุภาพร กำเนิดผล 34,835
- เขต 7 ภูมิใจไทย นายณัฏฐ์ชนน ศรีก่อเกื้อ 31,926
- เขต 8 ประชาธิปัตย์ พลตำรวจตรีสุรินทร์ ปาลาเร่ 42,412
- เขต 9 ประชาธิปัตย์ นายศักดิ์สิทธิ์ ขาวทอง 28,740
สตูล ส.ส. 2 คน 100%
- เขต 1 ภูมิใจไทย นายพิบูลย์ รัชกิจประการ 36,810
- เขต 2 ภูมิใจไทย นายวรศิษฎ์ เลียงประสิทธิ์ 55,612
สมุทรปราการ ส.ส. 8 คน 100%
- เขต 1 ก้าวไกล นางสาวพนิดา มงคลสวัสดิ์ 46,383
- เขต 2 ก้าวไกล นางสาวรัชนก สุขประเสริฐ 43,435
- เขต 3 ก้าวไกล นายพิชัย แจ้งจรรยาวงศ์ 50,177
- เขต 4 ก้าวไกล นายวุฒินันท์ บุญชู 49,043
- เขต 5 ก้าวไกล นางสาวนิตยา มีศรี 60,282
- เขต 6 ก้าวไกล นายวีรภัทร คันธะ 37,730
- เขต 7 ก้าวไกล นายบุญเลิศ แสงพันธุ์ 39,151
- เขต 8 ก้าวไกล นายตรัยวรรธน์ อิ่มใจ 46,539
สมุทรสงคราม ส.ส. 1 คน 100%
- เขต 1 ก้าวไกล นายอานุภาพ ลิขิตอำนวยชัย 42,852
สมุทรสาคร ส.ส. 3 คน 100%
- เขต 1 ก้าวไกล นายณัฐพงษ์ สุมโนธรรม 45,545
- เขต 2 ก้าวไกล นายศิริโรจน์ ธนิกกุล 46,896
- เขต 3 ก้าวไกล นายศิรสิทธิ์ สงนุ้ย 35,068
สระแก้ว ส.ส. 3 คน 100%
- เขต 1 พลังประชารัฐ นางขวัญเรือน เทียนทอง 42,106
- เขต 2 พลังประชารัฐ นางสาวตรีนุช เทียนทอง 41,173
- เขต 3 เพื่อไทย นายสรวงศ์ เทียนทอง 53,989
สระบุรี ส.ส. 4 คน 100%
- เขต 1 ก้าวไกล นายสรพัช ศรีปราชญ์ 32,444
- เขต 2 เพื่อไทย นายอรรถพล วงษ์ประยูร 38,203
- เขต 3 ภูมิใจไทย นายวัชรพงศ์ คูวิจิตรสุวรรณ 45,417
- เขต 4 พลังประชารัฐ นายองอาจ วงษ์ประยูร 29,506
สิงห์บุรี ส.ส. 1 คน 100%
- เขต 1 พลังประชารัฐ นายโชติวุฒิ ธนาคมานุสรณ์ 42,024
สุโขทัย ส.ส. 4 คน 100%
- เขต 1 เพื่อไทย นางพรรณสิริ กุลนาถศิริ 32,130
- เขต 2 เพื่อไทย นายชูศักดิ์ คีรีมาศทอง 30,339
- เขต 3 เพื่อไทย นางสาวประภาพร ทองปากน้ำ 33,259
- เขต 4 เพื่อไทย นายจักรวาล ชัยวิรัตน์นุกูล 36,738
สุพรรณบุรี ส.ส. 5 คน 100%
- เขต 1 ชาติไทยพัฒนา นายสรชัด สุจิตต์ 46,324
- เขต 2 ชาติไทยพัฒนา นายณัฐวุฒิ ประเสริฐสุวรรณ 43,795
- เขต 3 ชาติไทยพัฒนา นายนพดล มาตรศรี 39,348
- เขต 4 ชาติไทยพัฒนา นายเสมอกัน เที่ยงธรรม 42,639
- เขต 5 ชาติไทยพัฒนา นายประภัตร โพธสุธน 41,695
สุราษฎร์ธานี ส.ส. 7 คน 100%
- เขต 1 รวมไทยสร้างชาติ นางสาวกานสินี โอภาสรังสรรค์ 27,978
- เขต 2 รวมไทยสร้างชาติ นายพิพิธ รัตนรักษ์ 24,625
- เขต 3 รวมไทยสร้างชาติ นางสาววชิราภรณ์ กาญจนะ 46,456
- เขต 4 รวมไทยสร้างชาติ นายพันธ์ศักดิ์ บุญแทน 26,043
- เขต 5 รวมไทยสร้างชาติ นายปรเมษฐ์ จินา 25,520
- เขต 6 ภูมิใจไทย นายพิชัย ชมภูพล 43,112
- เขต 7 รวมไทยสร้างชาติ นายธานินท์ นวลวัฒน์ 30,359
สุรินทร์ ส.ส. 8 คน 100%
- เขต 1 ภูมิใจไทย นายปกรณ์ มุ่งเจริญพร 36,305
- เขต 2 เพื่อไทย นายชูชัย มุ่งเจริญพร 39,570
- เขต 3 ภูมิใจไทย นางสาวผกามาศ เจริญพันธ์ 44,534
- เขต 4 เพื่อไทย นายพรเทพ พูนศรีธนากูล 35,198
- เขต 5 เพื่อไทย นายครูมานิตย์ สังข์พุ่ม 68,300
- เขต 6 ภูมิใจไทย นายล้ำเลิศ พัวพัฒนโชติ 38,611
- เขต 7 ภูมิใจไทย นายเรืองวิทย์ คูณวัฒนาพงษ์ 42,050
- เขต 8 ภูมิใจไทย นางปทิดา ตันติรัตนานนท์ 39,558
หนองคาย ส.ส. 3 คน 100%
- เขต 1 พลังประชารัฐ นายกระแสร์ ตระกูลพรพงศ์ 33,078
- เขต 2 เพื่อไทย นางสาวชนก จันทาทอง 33,352
- เขต 3 เพื่อไทย นายเอกธนัช อินทร์รอด 18,237
หนองบัวลำภู ส.ส. 3 คน 100%
- เขต 1 เพื่อไทย นายสยาม หัตถสงเคราะห์ 26,309
- เขต 2 เพื่อไทย นายไชยา พรหมา 32,247
- เขต 3 เพื่อไทย นายณพล เชยคำแหง 32,252
อ่างทอง ส.ส. 2 คน 100%
- เขต 1 ภูมิใจไทย นายภราดร ปริศนานันทกุล 26,508
- เขต 2 ภูมิใจไทย นายกรวีร์ ปริศนานันทกุล 46,306
อำนาจเจริญ ส.ส. 2 คน 100%
- เขต 1 ภูมิใจไทย นางสุขสมรวย วันทนียกุล 38,275
- เขต 2 ภูมิใจไทย นางญาณีนาถ เข็มนาค 46,881
อุดรธานี ส.ส. 10 คน 100%
- เขต 1 ก้าวไกล นายณัฐพงษ์ พิพัฒน์ไชยศิริ 32,476
- เขต 2 เพื่อไทย นางหทัยรัตน์ เพชรพนมพร 41,285
- เขต 3 ไทยสร้างไทย นายหรั่ง ธุระพล 36,250
- เขต 4 เพื่อไทย นายภาณุ พรวัฒนา 21,475
- เขต 5 เพื่อไทย นายกรวีร์ สาราคำ 36,489
- เขต 6 ไทยสร้างไทย นายอดิศักดิ์ แก้วมุงคุณทรัพย์ 27,751
- เขต 7 เพื่อไทย นายธีระชัย แสนแก้ว 33,928
- เขต 8 เพื่อไทย นายเกรียงศักดิ์ ฝ้ายสีงาม 33,537
- เขต 9 เพื่อไทย นายวัชระพล ขาวขำ 43,529
- เขต 10 เพื่อไทย นางเทียบจุฑา ขาวขำ 47,532
อุตรดิตถ์ ส.ส. 3 คน 100%
- เขต 1 เพื่อไทย นางสาวกฤษณา สีหลักษณ์ 32,820
- เขต 2 เพื่อไทย นายวารุจ ศิริวัฒน์ 36,119
- เขต 3 เพื่อไทย นายรวี เล็กอุทัย 48,779
อุทัยธานี ส.ส. 2 คน 100%
- เขต 1 ภูมิใจไทย นายเจเศรษฐ์ ไทยเศรษฐ์ 49,464
- เขต 2 ภูมิใจไทย นายชาดา ไทยเศรษฐ์ 43,505
อุบลราชธานี ส.ส. 11 คน 100%
- เขต 1 เพื่อไทย นายวรสิทธิ์ กัลป์ตินันท์ 32,468
- เขต 2 ประชาธิปัตย์ นายวุฒิพงษ์ นามบุตร 38,164
- เขต 3 เพื่อไทรวมพลัง นางพิมพกาญจน์ พลสมัคร 31,218
- เขต 4 เพื่อไทย นางสาวกิตติ์ธัญญา วาจาดี 39,462
- เขต 5 ภูมิใจไทย นายสุทธิชัย จรูญเนตร 44,121
- เขต 6 เพื่อไทย นางสาวธัญธารีย์ สันตพันธุ์ 43,430
- เขต 7 เพื่อไทย นางสาวสุดารัตน์ พิทักษ์พรพัลลภ 38,533
- เขต 8 มิใจไทย นางสาวแนน บุณย์ธิดา สมชัย 31,773
- เขต 9 เพื่อไทย นายประภูศักดิ์ จินตะเวช 31,311
- เขต 10 เพื่อไทรวมพลัง นายสมศักดิ์ บุญประชม 62,754
- เขต 11 ภูมิใจไทย นางสาวตวงทิพย์ จินตะเวช 43,797
สุขภาพดี มีรางวัล (Health Score)
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
เพิ่มระบบแรงจูงใจประจำปี – เป้าหมายสุขภาพรายบุคคล
เป้าหมายสุขภาพรายบุคคล เป็นระบบคะแนนสุขภาพที่ขึ้นอยู่กับ
พฤติกรรมสุขภาพ เช่น การเลิกสูบบุหรี่ จำนวนก้าวในการเดินต่อวัน
ผลการตรวจสุขภาพประจำปี เช่น เลือด น้ำหนัก BMI
การเข้ารับการรักษาอย่างต่อเนื่องตามคำสั่งแพทย์
การไม่มีภาวะเจ็บป่วยที่ต้องมาโรงพยาบาล
ได้รับคูปองอาหารอินทรีย์/สินค้าสุขภาพ 300 บาท/ปี หรือรางวัลอื่น ๆ ที่จูงใจประชาชนให้รักษาสุขภาพ
ยุทธศาสตร์ที่ 4 พัฒนาองค์กรด้านวัคซีนของประเทศให้เข้มแข็งและบริหารจัดการทรัพยากรวัคซีนของประเทศให้มีคุณภาพและเพียงพอ
เช่น การให้ความสำคัญกับการผลิต การพัฒนา และการรักษาบุคลากรในสาขาที่จำเป็นและขาดแคลนให้เพียงพอ รวมทั้งการพัฒนาและบริหารจัดการโครงสร้างพื้นฐานให้ได้มาตรฐานสากล
1. จำนวนบุคลากรและผู้เชี่ยวชาญด้านวัคซีนมีเพียงพอ
เนื่องจากสถานการณ์การแพร่ระบาดของโควิด-19 ยังคงเกิดขึ้นอย่างต่อเนื่องส่งผลให้ต้องปรับเปลี่ยนรูปแบบการจัดกิจกรรมการพัฒนาศักยภาพบุคลากรมาเป็นการอบรมออนไลน์ ประกอบกับหน่วยงานต่าง ๆ ที่เกี่ยวข้องด้านวัคซีนต้องวางแผนรับมือตอบโต้สถานการณ์ดังกล่าว ส่งผลให้ไม่สามารถดำเนินโครงการพัฒนาบุคลากรได้
2. โครงสร้างพื้นฐานด้านวัคซีนได้รับการพัฒนาเพื่อให้ได้มาตรฐานสากล
ศูนย์สัตว์ทดลองแห่งชาติ มหาวิทยาลัยมหิดลสามารถรักษาระบบมาตรฐานสัตว์ทดลองสากล6 (Association for Assessment and Accreditation of Laboratory Animal Care International: AAALAC) และ ISO9001 ในการผลิตสัตว์ทดลอง (หนูเมาส์ จำนวน 80,737 ตัว/ปี หนูตะเภา จำนวน 6,107 ตัว/ปี และกระต่าย 1,134 ตัว/ปี) ที่มีคุณภาพมาตรฐานเพื่อบริการให้แก่นักวิจัยและนักวิทยาศาสตร์ได้ สำหรับการพัฒนาห้องปฏิบัติการสัตว์ทดลองสู่มาตรฐาน OECD Good Laboratory Practice (OECD GLP)7 และ AAALAC เพื่อทดสอบและตรวจสอบคุณภาพวัคซีนในสัตว์ทดลองและการเตรียมความพร้อมโรงงานผลิตวัคซีนระดับกึ่งอุตสาหกรรม โดยใช้โรงงานต้นแบบผลิตยาชีววัตถุแห่งชาติ ซึ่งเป็นความร่วมมือระหว่างมหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรีและสำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) เพื่อให้ประเทศมีโครงสร้างพื้นฐานรองรับการผลิตวัคซีนโควิด-19 หรือการระบาดของเชื้ออุบัติใหม่ ไม่สามารถดำเนินการได้ เนื่องจากไม่มีงบประมาณสนับสนุน
3. เครือข่ายศูนย์ทรัพยากรชีวภาพทางการแพทย์เพื่อการวิจัยด้านวัคซีน
ดำเนินการสร้างความร่วมมือให้เกิดการจัดตั้งเครือข่ายทรัพยากรชีวภาพฯ มาตั้งแต่ปี 2562 โดยได้จัดทำแนวทางมาตรฐานในการปฏิบัติเพื่อเก็บรักษาและใช้บริการชีววัสดุของศูนย์ชีววัสดุประเทศไทย8 เพื่อเป็นมาตรฐานการจับเก็บและการให้บริการ อีกทั้งในปี 2563 ได้มีการขยายเครือข่ายทรัพยากรชีวภาพฯ สู่สถาบันการศึกษาและองค์กรต่าง ๆ สำหรับปีงบประมาณ พ.ศ. 2564 และปีงบประมาณ พ.ศ. 2565 การบริหารจัดการเครือข่ายศูนย์ทรัพยากรชีวภาพฯ เพื่อการวิจัยและพัฒนาวัคซีน ไม่สามารถดำเนินการได้ เนื่องจากไม่ได้รับงบประมาณสนับสนุน
Cultural District 2023 โรงภาพยนตร์ควีนส์
กิจกรรมประจำจันทร์ – ศุกร์
Mini Exhibition : History of Queen Theater จัดแสดงตั้งแต่ชั้น 1 - ชั้น 4 โดยรอบ (10.00 – 18.00 น.)
Workshop : 10.00 – 18.00 น.
1.Monoprint Postcard
2.กิจกรรมภาพติดตา หรือ Flip book
3.กิจกรรมหุ่นเงา / สอนวาดภาพโปสเตอร์หนัง
Trip : ชมห้องฉายภาพยนตร์ รอบละ 5 คน
11.00 – 11.20 น. / 11.30 – 11.50 น. / 13.00 – 13.20 น. / 13.30 – 13.50 น. / 14.00 – 14.20 น. / 14.30 – 14.50 น. / 15.00 – 15.20 น. / 15.30 – 15.50 น. / 16.00 – 16.20 น. / 16.30 – 16.50 น. / 17.00 – 17.20 น. / 17.30 – 17.50 น.
.
กิจกรรมวันเสาร์-อาทิตย์
Mini Exhibition : History of Queen Theater จัดแสดงตั้งแต่ชั้น 1 - ชั้น 4 โดยรอบ (10.00 – 18.00 น.)
Workshop : 10.00 – 18.00 น.
1.Monoprint Postcard
2.กิจกรรมภาพติดตา หรือ Flip book
3.กิจกรรมหุ่นเงา / สอนวาดภาพโปสเตอร์หนัง
Trip : ชมห้องฉายภาพยนตร์ รอบละ 5 คน
11.00 – 11.20 น. / 11.30 – 11.50 น. / 13.00 – 13.20 น. / 13.30 – 13.50 น. / 14.00 – 14.20 น. / 14.30 – 14.50 น. / 15.00 – 15.20 น. / 15.30 – 15.50 น.
Talk : 20 พ.ค.66 : หัวข้อ “เล่าเรื่องภาพยนตร์ไทย กับโรงภาพยนตร์ควีนส์” วิทยากรคุณโดม สุขวงศ์ ผู้ก่อตั้งหอภาพยนตร (16.00 – 18.00 น.)
27 พ.ค.66 : หัวข้อ “เล่าเรื่องภาพยนตร์ไทย กับโรงภาพยนตร์ควีนส์” วิทยากร คุณชลิดา เอื้อบำรุงจิต ผู้อำนวยการหอภาพยนตร์ (16.00 – 18.00 น.)
Trip : 21 – 28 พ.ค.66 : “ตามรอยโก๋หลังวัง” วิทยากร คุณพาฉัตร ทิพทัส ภัณฑารักษ์มิวเซียมสยาม (14.00 - 16.00 น.)
มกราคม - กุมภาพันธ์ 2564
วันที่ 17 กุมภาพันธ์ 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 17 แห่งดังนี้
1.บลิ้งบายดอกเตอร์ใหม่คลินิกเวชกรรม (เขตวัฒนา) (เลขใหม่ 10101012764)
2.ไอดอลมีคลินิกเวชกรรม (เขตดินแดง) (เลขใหม่ 10101012564)
3.วุฒิคลินิกเวชกรรม (เขตสัมพันธวงศ์) (เลขใหม่ 10101012664)
4.คลินิกเวชกรรมสุทัศน์ (เขตบางซื่อ) (เลขใหม่ 10101013064)
5.คลินิกเวชกรรมวิทยแพทย์ (เขตสาทร) (เลขใหม่ 10101013164)
6.วีว่าคลินิกเวชกรรม (เขตบางพลัด) (เลขใหม่ 10101013264)
7.คลินิกเฉพาะทางด้านเวชกรรมศัลยศาสตร์ตกแต่งหลุยส์ (เขตสาทร) (เลขใหม่ 10102002264)
8.ดรีมคลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง (เขตดินแดง) (เลขใหม่ 10102002064)
9.เอช-อี พาโธ แล็บบอราทอรี่คลินิกเฉพาะทางด้านเวชกรรมพยาธิวิทยา (เขตสวนหลวง)(เลขใหม่ 10102001964)
10.คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่งบลอสซั่มพลาสติกเซอร์เจอรี่ (เขตดอนเมือง)(เลขใหม่ 10102002164)
11.คลินิกทันตกรรมสว่างทันตแพทย์ (เขตบางกอกใหญ่) (เลขใหม่ 10103008664)
12.คลินิกทันตกรรมยิ้มฟันใส สาขารามอินทรา 109 (เขตมีนบุรี) (เลขใหม่ 10103008364)
13.ฮักฟันคลินิกทันตกรรม (เขตบางแค) (เขตใหม่ 10103008464)
14.สไมล์แฟมิลี่คลินิกทันตกรรม (เขตบางเขน) (เลขใหม่ 10103008564)
15.ศุภเวชคลินิกการแพทย์แผนไทย (เขตสวนหลวง) (เลขใหม่ 10108001664)
16.คลินิกการแพทย์แผนไทยจินดา (เขตคันนายาว) (เลขใหม่ 10108001764)
17.ไวทัลสลีปสหคลินิก (เขตราชเทวี) (เลขใหม่ 10110001364)
วันที่ 5 กุมภาพันธ์ 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 2 แห่งดังนี้
1.ปาริชาดคลินิกเวชกรรม (เลขใหม่ 10101011864)
2.นวมินทร์ สหคลินิก (เลขใหม่ 10110001264)
วันที่ 28 มกราคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 17 แห่งดังนี้
1.ฟอร์จูนคลินิกเวชกรรม (เลขใหม่ 10101011664)
2.อี เอส เอส คลินิกเวชกรรม (เลขใหม่ 10101011764)
3.คลินิกเวชกรรมณฐพลการแพทย์ (เลขใหม่ 10101011564)
4.ธนัชชาคลินิกเวชกรรม (เลขใหม่ 10101012464)
5.เฟิร์สเฟซคลินิกเวชกรรม (เลขใหม่ 10101011464)
6.เดอะแบร์ทัชคลินิกเวชกรรม (เลขใหม่ 10101011364)
7.คลินิกเวชกรรม สวท ปิ่นเกล้า (เลขใหม่ 10101011164)
8.คลินิกเวชกรรม ไบโอเซลล์ (เลขใหม่ 10101011064)
9.อิมเมจินี่คลินิกเวชกรรม สาขาเซ็นทรัลพลาซาลาดพร้าว (เลขใหม่ 10101011264)
10.คลินิกเวชกรรมวีระกิตติ์ (เลขใหม่ 10101012364)
11.คลินิกเวชกรรมพีพีการแพทย์ (เลขใหม่ 10101012164)
12.สยามเลเซอร์คลินิกเวชกรรม สาขาพาราไดซ์ พาร์ค (เลขใหม่ 10101012064)
13.คลินิกเวชกรรมเอเพ็กซ์ สาขาเซ็นทรัลบางนา (เลขใหม่ 10101012264)
14.คลินิกเฉพาะทางด้านเวชกรรมไตเทียม ตรัยเวชชก์ (เลขใหม่ 10102001864)
15.คลินิกทันตกรรมเด็นต้าแลนด์ กรุงเทพฯ (เลขใหม่ 10103007764)
16.คลินิกทันตกรรมบ้านรักษ์ฟัน (เลขใหม่ 10103007564)
17.จีเนียไอวีเอฟแอนด์เจเนติกส์ สหคลินิก (เลขใหม่ 10110001164)
วันที่ 27 มกราคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 13 แห่งดังนี้
1.โกลบอลเมดิคัลคลินิกเวชกรรม (เลขใหม่ 10101011964)
2.ฟันดีเซ็นเตอร์คลินิกทันตกรรม (เลขใหม่ 10103007964)
3.ดี เด็นทัล คลินิกทันตกรรม (เลขใหม่ 10103008164)
4.ศิริลักษณ์ทันตแพทย์คลินิกทันตกรรม (เลขใหม่ 10103008064)
5.ฟัน คลินิกทันตกรรม (เลขใหม่ 10103008264)
6.คลินิกทันตกรรมอัมรินทร์ (เลขใหม่ 10103007664)
7.คลินิกทันตกรรมพีสไมล์ (เลขใหม่ 10103007264)
8.คลินิกทันตกรรมลาซาล (เลขใหม่ 10103007864)
9.ภทรคลินิกทันตกรรม สาขาบางนา (เลขใหม่ 10103007364)
10.เอกมัยคลินิกทันตกรรม (เลขใหม่ 10103007464)
11.คลินิกทันตกรรมบ้านรักษ์ฟัน (เลขใหม่ 10103006764)
12.แฟมิลี่เดนตอลคลินิก คลินิกทันตกรรม (เลขใหม่ 10103007064)
13.สหคลินิกมูลนิธิไลออนส์ในประเทศไทย (เลขใหม่ 10110001064)
วันที่ 25 มกราคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 11 แห่งดังนี้
1.แพทย์หญิงโตเจริญคลินิกเวชกรรม (เลขใหม่10101010764)
2.ลาดกระบังคลินิกเวชกรรม (เลขใหม่ 10101010264)
3.คลินิกเวชกรรมแมกซ์ไลฟ์ (เลขใหม่ 10101010164)
4.คลินิกเวชกรรมแพทย์ลาดพร้าว (เลขใหม่ 10101010864)
5.คลินิกเวชกรรม หมอพร (เลขใหม่ 10101010964)
6.คลินิกเวชกรรมบางกอก (เลขใหม่ 10101010464)
7.ซีซีคลินิกเวชกรรม (เปลี่ยนแปลงรายการ)
8.พรเกษมอนุสาวรีย์คลินิกเฉพาะทางด้านเวชกรรมผิวหนัง(เลขใหม่ 10102001664)
9.คลินิกทันตกรรมเดนต้าสมายล์ (เลขใหม่ 10103006864)
10.คลินิกทันตกรรมบิ๊กสไมล์ (เลขใหม่ 10103006964)
11.คลินิกทันตกรรมธัชสราเด็นตัลเซ็นเตอร์ (เลขใหม่ 10103007164)
12.หทัยศิริคลินิกกายภาพบำบัด (เลขใหม่ 10106000464)
วันที่ 21 มกราคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 20 แห่งดังนี้
1.คลินิกเวชกรรมสาธุฯการแพทย์ (10101010564)
2.มคลินทร์คลินิกเวชกรรม สาขาพระราม 3 (10101010364)
3.คลินิกเวชกรรมจรัญสนิทวงศ์ 83/1 (10101024561)
4.เอสอาร์ซีคลินิกเวชกรรม สาขาเอสพละนาดรัชดา (10101009964)
5.แอนจาลีคลินิกเวชกรรม (10101010064)
6.แมนดารินคลินิกเวชกรรม (10101010664)
7.พรเกษมศรีนครินทร์คลินิกเฉพาะทางด้านเวชกรรมผิวหนัง (10102001564)
8.บางกอกไซโตเจเนติกซ์คลินิกเฉพาะทางด้านเวชกรรมสูตินรีเวช (10102001364)
9.คลินิกทันตกรรมวงศ์สว่างเด็นทัลแคร์ (10103003664)
10.คลินิกทันตกรรมยูทาคะ (10103005464)
11.ดีโอ้เดนทัลคลินิกทันตกรรม (10103006564)
12.คลินิกทันตกรรมทันตแพทย์สมรัก (10103005164)
13.คลินิกเมตตาทันตแพทย์คลินิกทันตกรรม (10103005064)
14.คลินิกทันตกรรม พี.เอ.ทันตแพทย์ (10103005564)
15.คลินิกทันตกรรมเดนเต้พลัส (10103006664)
16.คลินิกทันตกรรมวินัยทันตแพทย์ (10103005364)
17.รามเวชคลินิกการแพทย์แผนไทย (10108001064)
18.อุ่นเรือนคลินิกการแพทย์แผนไทยประยุกต์ (10111000364)
19.นำชัยคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน(10109000264)
20.สหคลินิกพีเอ็มจีบางขุนเทียน (10110000664)
วันที่ 11 มกราคม 2564
สถานพยาบาลที่ขอต่ออายุใบอนุญาตการประกอบกิจการสถานพยาบาล จำนวน 36 แห่งดังนี้
1.รสิตาคลินิกเวชกรรม สาขาแจ้งวัฒนะ (10101003564)
2.คลินิกเวชกรรมดำรงค์การแพทย์ (10101001364)
3.ราขเทวีคลินิกเวชกรรม สาขาสามเสน (10101003164)
4.คลินิกเวชกรรมคมสันการแพทย์ (10101004664)
5.คลินิกเวชกรรมเอเชียการแพทย์ (10101004764)
6.ร่มเกล้าคลินิกเวชกรรม (10101003064)
7.เอ็น เมดิคัล คลินิกเวชกรรม (10101004164)
8.ใกล้หมอโพลีคลินิกเพชรเกษม 46 คลินิกเวชกรรม (10101004064)
9.คลินิกเวชกรรมรวมแพทย์ (10101003964)
10.เดอะวายน์คลินิกเวชกรรม (10101003764)
11.จรัลสนิทวงศ์คลินิกเวชกรรม (นำส่ง OSS 14/1/64)
12.สุรวงศ์เมดิคลินิกเวชกรรม (10101004264)
13.คลินิกเวชกรรมหมอศิริชัย (10101003864)
14.แพนคลินิกเวชกรรม สาขาเซ็นทรัลลาดพร้าว (10101003664)
15.คลินิกเฉพาะทางด้านเวชกรรมไตเทียมบางชัน (10102001164)
16.คลินิกเฉพาะทางด้านเวชกรรมกุมารเวชศาสตร์แพทย์ไพโรจน์-ปราณี (10102000964)
17.รัมภาอินเตอร์เนชั่นแนลคลินิกเฉพาะทางด้านเวชกรรมผิวหนัง (10102000864)
18.แฮร์เดอม่าคลินิกเฉพาะทางด้านเวชกรรมโรคผิวหนัง (10102001264)
19.คลินิกทันตกรรมดิออรัลเฮลท์ (10103003864)
20.คลินิกทันตกรรมแฮปปี้เด็นทัลโฮม (10103003364)
21.คลินิกทันตกรรมบุรารักษ์ทันตแพทย์ (10103004064)
22.คลินิกทันตกรรมออเงินทันตแพทย์ (10103003764)
23.คลินิกทันตกรรมสไมล์ดีไซน์ (10103004864)
24.คลินิกทันตกรรมสไมล์ไดอารี (10103004764)
25.คลินิกทันตกรรมเดนท์สไมล์ (10103004664)
26.คลินิกทัตกรรมกรุงเทพ (10103003464)
27.คลินิกทันตกรรม เอ็ม ดี แอทสีลม (10103004964)
28.คลินิกเวชกรรมลาดปลาเค้า 37 (10101004564)
29.คลินิกทันตกรรมบ้านรักษ์ฟัน (10103003964)
30.คลินิกทันตกรรมหมอฟัน103 (10103004564)
31.แสนดีคลินิกการแพทย์แผนไทย (10108000764)
32.ราศีคลินิกการแพทย์แผนไทย (10108000864)
33.คลินิกการแพทย์แผนไทยเวชพฤกษ์ (10108000664)
34.เฮลท์แลนด์พระราม 2 คลินิกการแพทย์แผนไทย การแพทย์แผนไทยประยุกต์ (10111000264)
35.คังมิ้งคลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีน (10109000164)
36.สิริยาสหคลินิก (นำส่ง OSS 14/1/64)
วันที่ 5 มกราคม 2564
การต่ออายุใบอนุญาตการประกอบกิจการและดำเนินการสถานพยาบาลจำนวน 16 แห่ง ดังนี้
1.คลินิกเวชกรรมนายแพทย์วิฑูรย์ (เลขใหม่ 10101002864)(นำส่งOSS 4/1/64)
2.คลินิกเวชกรรมแพทย์ 2000 สาขาสะพานใหม่ (เลขใหม่10101001564)
3.ใจสบายคลินิกเวชกรรม (เลขใหม่ 10101001664)
4.ชานิสาคลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมตกแต่ง (เลขใหม่ 10102000664)
5.คลินิกทันตกรรมเคอิชิคาอิเดนตัลแคร์ (เลขใหม่ 10103001164)
6.คลินิกทันตกรรมสุขภาพฟัน (เลขใหม่ 10103001964)
7.คลินิกทันตกรรมรักฟัน (เลขใหม่ 10103002064)
8.คลินิกทันตกรรมบ้านหมอฟัน (เลขใหม่ 10103001364)
9.คลินิกทันตกรรมเดนทอลสไมล์พลัส (เลขใหม่ 10103002664)
10.คลินิกทันตกรรมสาย 1 (เลขใหม่ 10103002864)
11.คลินิกทันตกรรมบ้านทันตแพทย์ (เลขใหม่ 10103001464)
12.เด็นท์แคร์คลินิกทันตกรรม (เลขใหม่ 10103001864)
13.คลินิกทันตกรรมธีระศักดิ์ (เลขใหม่ 10103002764)
14.คลินิกกายภาพบำบัดแนชเชอรัลฮีลลิ่ง สาขารามคำแหง (เลขใหม่ 10106000364)
15.มุกดาคลินิกการแพทย์แผนไทย (เลขใหม่ 10108000264)
16.อภิวัฒน์คลินิกการแพทย์แผนไทย (เลขใหม่ 10108000364)
คลินิกตา นอกเวลาราชการ ทุกวันพุธ
คลินิกตา นอกเวลาราชการ เปิดบริการเพิ่มทุกวันพุธ เวลา 16.30-20.00น รบกวนยื่นบัตรก่อน 18.00น ค่าบริการเบื้องต้น 250 บาท
คลินิกพิเศษจิตเวช บริการตรวจรักษาทุกวันจันทร์ ที่ 2 และที่ 4 ของเดือน
โรงพยาบาลสิงห์บุรี เปิดบริการคลินิกพิเศษเฉพาะโรคนอกเวลาราชการ คลินิกจิตเวช โดย พญ.ลลิตา เลิศนันทกุล บริการตรวจรักษาทุกวันจันทร์ (จันทร์ที่ 2 และจันทร์ที่ 4 ของเดือน)
เริ่มวันจันทร์ที่ 14 พฤศจิกายน 2565
ตั้งแต่เวลา 16.30-20.30 น.
ณ ห้องตรวจจิตเวช อาคารปฐมภูมิ
ผู้รับบริการสามารถเบิกค่ายาได้ตามสิทธิ์
ค่าบริการเริ่มต้นที่ 300 บาท
หากมี่อาการดังต่อไปนี้ สามารถมารับบริการได้
- นอนไม่หลับ
- เครียด วิตกกังวล และซึมเศร้า
- อาการทางจิต
- สมองเสื่อม
- บำบัดสุราและยาเสพติด
- สมาธิสั้น
สอบถาม 036-522507-11 ต่อ 6100 ในวันและเวลาราชการ (หรือวันที่บริการตรวจคลินิกนอกเวลา)
เตรียมขยายงานแฟร์ใหม่ๆ
นอกจากงานแฟร์ที่เราจัดเป็นประจำอยู่แล้ว ในปีถัดไป เราได้เตรียมขยายงานแฟร์ใหม่ๆ เช่น
งาน AMARIN EXPO ที่จะไปจัดตามส่วนภูมิภาค เช่น เชียงใหม่ ขอนแก่น หาดใหญ่, งานบ้านและสวน Pets Fair, งาน บ้านและสวน Garden & Farm Festival, งานกินดี อยู่ดี และจากการร่วมทุนกับ Dek-D ก็จะมีการขยายงาน T-CAS ของ Dek-D ร่วมกับ National Geographic Thailand เพื่อให้รองรับผู้มาร่วมงานมากยิ่งขึ้น
ความสำเร็จอันงดงามเกิดขึ้นได้โดยคณะผู้บริหารที่มีวิสัยทัศน์เยี่ยม และทีมงานมากความสามารถขององค์กร ทำให้ธุรกิจของอมรินทร์กรุ๊ป ขับเคลื่อนสู่เป้าหมาย และก้าวสู่การเติบโตได้อย่างยั่งยืน สมดุลทั้งทางด้านเศรษฐกิจ สังคม ชุมชน และสิ่งแวดล้อม
คำว่า "เสรี" ที่ไม่มีจริง กับคำว่า "ยาเสพติด" ที่ตีตรา kittychopaka
คิตตี้ ช่อผกา ผู้คร่ำหวอดแวดวงกัญชาไทยและมีชื่อเสียงในระดับนานาชาติ โพสต์เรื่อง คำว่า "เสรี" ที่ไม่มีจริง กับคำว่า "ยาเสพติด" ที่ตีตรา --
เสรี หมายถึง ที่ทำได้โดยอิสระ ที่ทำได้ตามอำเภอใจ มีสิทธิที่จะทำจะพูดได้โดยไม่ละเมิดสิทธิของผู้อื่น (เอามาจากกูเกิ้ล)
ยาเสพติด หมายถึง สารหรือยาที่อาจเป็นผลิตภัณฑ์ธรรมชาติ หรือจากการสังเคราะห์ ซึ่งเมื่อเสพเข้าสู่ร่างกายไม่ว่าจะโดย การกิน ดม สูบ ฉีด หรือ ด้วยประการใด ๆ แล้วจะทำให้เกิดผล ต่อร่างกายและจิตใจในลักษณะสำคัญ เช่น - ต้องเพิ่มขนาดการเสพขึ้นเรื่อยๆ - มีอาการอยากยาเมื่อขาดยา (เอามาจากกูเกิ้ล)
ถึงแม้ว่าแต่ล่ะฝั่งแต่ล่ะฝ่ายเข้าใจความหมายของคำว่าเสรี กับคำว่ายาเสพติด เพียงแค่มุมมองของคำเดียวกันนั้นอยู่คนละขั้ว ด่ากัญไปมา ไม่ฟังกัญ ตัดสินกัญโดยไม่พยายามทำความเข้าใจ
อ่านทั้งหมด
คลินิกทางเดินอาหาร และตับ
คลินิกพิเศษด้านอายุรกรรม โรคไต
4.ความเฉื่อยเนือย Enfeeblement
ความเฉื่อยเนือย อาจเกิดขึ้นได้หากมีการมอบหมายงานที่สำคัญให้กับเครื่องจักรมากขึ้นเรื่อยๆ ในสถานการณ์เช่นนี้ มนุษยชาติสูญเสียความสามารถในการปกครองตนเอง (self-govern) และต้องพึ่งพาเครื่องจักรอย่างสิ้นเชิง คล้ายกับสถานการณ์ที่แสดงในภาพยนตร์ WALL-E
เมื่อระบบ AI รุกล้ำความฉลาดระดับมนุษย์ ศักยภาพการทำงานของมนุษย์ในด้านต่างๆ จะค่อยๆ ถูกแทนที่ด้วย AI ในการทำงานต่างๆ ให้บรรลุผล แรงงานจะมนุษย์จะหมดค่าลงอย่างรวดเร็ว
ยิ่งโลกก้าวไปเร็วขึ้น องค์กรต่างๆ อาจยอมเลิกล้มการควบคุมระบบ AI โดยสมัครใจเพื่อให้ตามทัน สิ่งนี้อาจทำให้มนุษย์ไร้ความเกี่ยวโยงทางเศรษฐกิจมากขึ้น และเมื่อ AI ทำให้หลาย ๆ ด้านในอุตสาหกรรมต่าง ๆ เป็นอัตโนมัติไปแล้ว ก็ยิ่งยากที่มนุษย์ย้อนกลับเข้ามาในระบบงานนั้นอีก และเมื่อนั้น มนุษย์อาจมีแรงจูงใจเหลือเพียงเล็กน้อย ที่จะแสวงหาความรู้หรือเพิ่มทักษะ หลายคนอาจมองว่าเป็นโลกที่ไม่น่าปรารถนาอีกต่อไป ยิ่งไปกว่านั้น ความเฉื่อยเนือยไร้แรงจูงใจ จะลดการควบคุมของมนุษยชาติในอนาคต เพิ่มความเสี่ยงของผลลัพธ์ที่ไม่ดีในระยะยาว
จะเห็นได้ว่า การอ่านอย่างมีความหมายไม่ได้เป็นเพียงการอ่านออกหรืออ่านได้ แต่คือพื้นฐานสำคัญที่เราทุกคนต้องเสริมสร้างให้เด็กและเยาวชนเพื่อเป็นรากฐานต่อยอดไปสู่การพัฒนาความฉลาดรู้ด้านการอ่าน (Reading literacy) และช่วยให้เกิดการคิดอย่างมีวิจารณญาณและสร้างสรรค์ โดยโครงการวิจัยและพัฒนานำร่อง “การใช้หนังสือภาพเพื่อเสริมสร้างความคิดอย่างมีวิจารณญาณและการอ่านอย่างมีความหมาย” ถือเป็นก้าวเดินที่สำคัญในการมุ่งมั่นพัฒนาทักษะการอ่าน อันจะต่อยอดไปสู่พลังคนที่เข้มแข็งของประเทศไทย และนำไปสู่การสร้างนวัตกรรมใหม่ๆ ไม่รู้จบต่อไปในอนาคต
ตำนาน สุราชุมชน ตราด LINK
“ตำนาน” มีจุดเริ่มต้นมาจากการทำเหล้าป่าตั้งแต่รุ่นตายายใน ย่านท่าพริก จังหวัดตราด เจ้าของตำนานเติบโตมาในครอบครัวที่สมัยก่อนตายาย และแม่อาศัยการต้มเหล้าป่าเลี้ยงชีพ เช่นเดียวกับชาวบ้านในละแวกนั้น พอเติบโตมาเขาจึงอยากเก็บตำนานภูมิปัญญาชาวบ้านที่รังสรรค์เครื่องเทศพื้นเมืองจนได้ลูกแป้งเชื้อสุรา ผสมผสานข้าวจ้าวในท้องถิ่น จนได้เหล้าป่ารสชาติของตนเอง หากนับตั้งแต่เริ่มทำเองจนตอนนี้ทำถูกกฎหมายก็ผ่านมา 14 ปีแล้ว
ข้อมูลและภาพจากเพจประชาชนเบียร์
โคโยตี้ลำก้า สุราชุมชนจากเชียงใหม่ LINK
"ลำก้า” ภาษาเหนือแปลว่าอร่อย เวลามีคนถาม “ลำก่อ”(อร่อยมั้ย) ถ้าอร่อยก็จะตอบว่า “ลำก้า” และคำว่า "ลำก้า" ยังฟังคล้ายกับคำว่า "วอดก้า" ที่กฎหมายไทยไม่ให้สุราชุมชนใช้ แต่คำว่า “สุราขาว” หรือ “สุราชุมชน” ทำให้คำว่า “ลำก้า” ในแบรนด์นี้ มี 2 ความหมายในตัวเอง ส่วนคำว่าโคโยตี้มาจากคุณพ่อเห็นสาวๆ บางคนดื่มเหล้าแล้วกลายเป็นโคโยตี้ แกชอบคำนี้เลยเอามาตั้งเป็นชื่อแบรนด์
ข้อมูลและภาพจากเพจประชาชนเบียร์
หลักสูตรด้าน ยานยนต์สมัยใหม่ (Next-Generation Automotive) 2566 LINK
- MTP024: หลักสูตรการบริหารจัดการการขนส่งสินค้าโดยใช้ระบบขนส่งทางราง (Railway Logistics Management: RLM) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 49,000 วันที่ฝึกอบรม : 06/11/2566 - 11/11/2566
- MTP021: หลักสูตรมาตรฐานระบบราง รุ่นที่ 3 (Railway Engineering Standards: RES) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 14,900 วันที่ฝึกอบรม : 23/08/2566 - 25/08/2566
- MTP017: หลักสูตรแนวคิดและมาตรฐานการออกแบบสถานีรถไฟ รุ่นที่ 4 (Concept and Standard in Railway Station Design: RSD) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 14,900 วันที่ฝึกอบรม : 24/07/2566 - 26/07/2566
- MTP001: หลักสูตรฝึกอบรม การพัฒนาบุคลากรด้านวิศวกรรมระบบขนส่งทางราง รุ่นที่ 11 (Railway Engineering Training Course: REN11) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 135,000 วันที่ฝึกอบรม : 25/05/2566 - 11/08/2566
- MTP004: เทคโนโลยีน้ำหนักเบาและการบูรณาการในยานพาหนะสมัยใหม่ รุ่นที่ 3[LWV] อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 13,500 วันที่ฝึกอบรม : 18/05/2566 - 19/05/2566
- MTP005: รู้จริงทุกเทคโนโลยียานยนต์ไฟฟ้าใน 2 วัน รุ่นที่ 7(MEV7) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 9,900 วันที่ฝึกอบรม : 19/04/2566 - 20/04/2566
- MTP020: หลักสูตรการซ่อมบำรุงรถไฟฟ้า รุ่นที่ 3 (Railway System Maintenance: RSM) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 14,900 วันที่ฝึกอบรม : 22/03/2566 - 24/03/2566
- MTP023: หลักสูตรฝึกอบรมเชิงปฏิบัติการ ความรู้พื้นฐานสำหรับช่างติดตั้งสถานีประจุไฟฟ้าสำหรับยานยนต์ไฟฟ้า รุ่นที่ 2(ECI) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 9,630 วันที่ฝึกอบรม : 22/03/2566 - 23/03/2566
- GPP040: หลักสูตรความรู้เพื่อให้บริการสถานีประจุไฟฟ้าสำหรับยานยนต์ไฟฟ้า รุ่นที่ 8 (Fundamental of EV Charging Station Technology: FEC8) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 13,910 วันที่ฝึกอบรม : 22/02/2566 - 24/02/2566
- MTP019: หลักสูตรการเดินรถไฟฟ้า รุ่นที่ 3 (Railway System Operation: RSO) อุตสาหกรรมยานยนต์สมัยใหม่ : ค่าอบรม 14,900 วันที่ฝึกอบรม : 22/02/2566 - 24/02/2566
นาย เมียร์ เคียร์ Business Leader กลุ่มธุรกิจ Personal Health ฟิลิปส์ เอเชีย-แปซิฟิค กล่าวว่า “ในปี 2023 เป็นต้นไป การสนับสนุนให้ผู้บริโภคมีการนำข้อมูลด้านสุขภาพไปใช้ในการปรับเปลี่ยนพฤติกรรมเพื่อการดูแลสุขภาพเชิงรุก เราจำเป็นต้องทำมากกว่าการเชื่อมต่อระหว่างบุคลากรทางแพทย์กับข้อมูลด้านสุขภาพ ฟิลิปส์เล็งเห็นถึงความสำคัญของการเชื่อมต่อผู้บริโภคกับเทคโนโลยีล้ำสมัย ที่สามารถให้คำแนะนำจากข้อมูลที่มีอยู่ได้ ยกตัวอย่างเช่น นวัตกรรมแปรงสีฟันไฟฟ้า ที่สามารถเชื่อมต่อกับแอปพลิเคชั่นสำหรับผู้ใช้ เพื่อให้คำแนะนำและการแปรงฟันแบบเฉพาะบุคคลอย่างมีประสิทธิภาพ จากการวิเคราะห์พฤติกรรมและแนวโน้มการแปรงของผู้ใช้งานได้โดยตรง”
“เราเห็นความแตกต่างระหว่างก่อนมีแท่นกับหลังทำโครงการฯ ซึ่งจากอาชีพหลักของเราที่เป็นชาวประมงอยู่แล้ว เรียกได้ว่าเห็นประโยชน์ที่เกิดขึ้นจริง ทำให้เราไม่ต้องออกไปจับปลาไกลเกินไป และมีกลุ่มปลาเศรษฐกิจอยู่เยอะขึ้น ซึ่งปลาบางชนิดที่แต่ก่อนไม่เคยมีมาก็เริ่มมีเข้ามามากขึ้น” นายคำนึง สิงหนาท หรือพี่ยุ่ง ชาวประมงในพื้นที่อ่าวโฉลกหลำกล่าวเสริม
11 พฤษภาคม 2566 ทำหมันสุนัขและแมว ณ วัดปากน้ำ LINK
11 พฤษภาคม 2566 เทศบาลนครระยองร่วมกับสำนักงานปศุสัตว์จังหวัดระยอง จัดกิจกรรมทำหมันสุนัขและแมวฯ พร้อมให้ความรู้เรื่องโรคพิษสุนัขบ้า และการควบคุมการเลี้ยงสัตว์หรือปล่อยสัตว์ พ.ศ. 2563 เพื่อส่งเสริมการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้า ณ วัดปากน้ำ โดยมีประชาชนเข้าร่วมโครงการจำนวน 33 ราย ทำหมันสุนัขและแมวรวมจำนวน 33 ตัว
ศุภานน: สถานการณ์ปัจจุบันมีการเปลี่ยนแปลงของพยาบาลเกิดขึ้นมาก สิ่งเดียวที่จะทำให้พยาบาลก้าวข้ามสู่การพยาบาลที่มีคุณภาพต้องเริ่มจากตัวเราเองโดยต้องมุ่งมั่นในการทำงานและทำตามบทบาทหน้าที่ของเราอย่างเต็มประสิทธิภาพ
ธนาคารกรุงไทย : ยืนยันตัวตนด้วยใบหน้าที่ตู้ ATM สีเทา และสาขาทั่วประเทศ เช็คสถานะผ่านแอป Krungthai NEXT และเป๋าตัง LINK
ธนาคารกรุงไทย นำเทคโนโลยีมายกระดับความปลอดภัยในการทำธุรกรรมการเงิน ได้แก่ การพัฒนาระบบแจ้งเตือนผู้ใช้งาน เมื่อตรวจพบการบันทึกภาพ หรือ วิดีโอหน้าจอ หรือใช้โปรแกรมควบคุมหน้าจอมือถือของผู้ใช้งาน (Screen Sharing /Screen Recording) เพื่อป้องกันการเข้าถึงแอปฯ จากทางไกล และการยกเลิกส่ง SMS และ e-mail แนบลิงก์ ล่าสุด ธนาคารพัฒนาระบบการยืนยันตัวตนด้วยใบหน้ามาใช้กับ แอปพลิเคชัน Krungthai NEXT และเป๋าตัง เมื่อทำธุรกรรมโอนเงิน หรือปรับเพิ่มวงเงินผ่านแอปฯ ดังนี้
1. โอนเงินตั้งแต่ 50,000 บาท ขึ้นไปต่อครั้ง
2. มียอดโอนเงินสะสมทุก 200,000 บาท ต่อวันต่อบัญชี
3. ปรับเพิ่มวงเงินโอนตั้งแต่ 50,000 บาทขึ้นไป
การยืนยันตัวตนด้วยใบหน้า ทำให้การทำธุรกรรมโอนเงิน ปลอดภัยมากขึ้น ทำธุรกรรมผ่านแอปฯ ได้คนเดียวเท่านั้น สะดวกมากขึ้น เมื่อต้องการเปลี่ยนอุปกรณ์มือถือ ลืมรหัส หรือเปลี่ยนเบอร์โทรศัพท์ใหม่ในการรับ OTP สำหรับการทำธุรกรรม ทำให้สามารถใช้งานแอปฯ ได้อย่างต่อเนื่อง
การยืนยันตัวตนด้วยใบหน้าก่อนโอนเงิน เริ่มในเดือนมิถุนายน 2566 สำหรับลูกค้าที่ยังไม่เคยมีข้อมูลการยืนยันตัวตนด้วยใบหน้า หรือ ข้อมูลไม่อัพเดต สามารถเพิ่มข้อมูลได้ เพียงนำบัตรประชาชนไปขอดำเนินการผ่านธนาคารกรุงไทยทุกสาขา และ ตู้ ATM ที่มีสัญลักษณ์ Confirm ID (ตู้สีเทา) โดยอัพเดตข้อมูลครั้งเดียวใช้ได้ทั้ง แอปฯ Krungthai NEXT และ เป๋าตัง
สอบถามข้อมูลเพิ่มเติมได้ที่ Krungthai Contact Center 02-111-1111
อ้างอิง krungthai.com เสริมแกร่งเทคโนโลยี สแกนใบหน้า | เช็กสถานะว่ายืนยันตัวต ผ่านแอปฯ Krungthai NEXT และ เป๋าตัง 1000 คลองสวนแดน
1001 คลองสวนแดน 1
1002 คลองสวนแดน 2 (ซอยจรัญฯ94/1)
1003 คลองสวนพริก
1004 คลองสวนเลียบ(จอมทอง)
1005 คลองสวนเลียบ(ภาษีเจริญ)
1006 คลองสวนสี่สิบ
1007 คลองสวนหยอม
1008 คลองสวนหลวง
1009 คลองสวนหลวง
1010 คลองสวนหลวง(จอมทอง)
1011 คลองสวนหลวง(บางคอแหลม)
1012 คลองสวนหลวงใต้
1013 คลองสวนหลวงเหนือ
1014 คลองสวนเหลี่ยม
1015 คลองสวนอ้อย
1016 คลองสวนอ้อย (ภาษีเจริญ)
1017 คลองสวนอ้อย(พระโขนง)
1018 คลองสวนอ้อย(ราชเทวี)
1019 คลองสหกรณ์
1020 คลองสอง
1021 คลองสอง(บางขุนเทียน)
1022 คลองสอง(ภาษีเจริญ)
1023 คลองสอง(หนองจอก)
1024 คลองสองต้นนุ่น
1025 คลองสองตอน
1026 คลองสองตะวันตก
1027 คลองสองตะวันออก
1028 คลองสองห้อง
1029 คลองสะแก
1030 คลองสะแกงาม
1031 คลองสะแกหัก
1032 คลองสะพานควาย
1033 คลองสะพานยาว (คลองสวน)
1034 คลองสะพานสูง
1035 คลองสะพานสูง
1036 คลองสะพานเสา
1037 คลองสะพานเหลือง
1038 คลองสาเก
1039 คลองสาทร
1040 คลองสาธารณะข้างหมู่บ้านเทพนคร
1041 คลองสาน
1042 คลองสาน(ยานนาวา)
1043 คลองสาม(บางขุนเทียน)
1044 คลองสามกรุงศรี
1045 คลองสามขา
1046 คลองสามง่าม (บางขุนเทียน)
1047 คลองสามง่าม (สายไหม)
1048 คลองสามง่าม (หนองจอก)
1049 คลองสามตะวันตก
1050 คลองสามตะวันออก
1051 คลองสามประเวศ
1052 คลองสามวา
1053 คลองสามเสน
1054 คลองสามเสน
1055 คลองสามอิน
1056 คลองสามัคคี
1057 คลองสารภี
1058 คลองสาหร่าย
1059 คลองสำเหร่
1060 คลองสิงห์โต
1061 คลองสี่
1062 คลองสีชมพู
1063 คลองสี่ตะวันตก
1064 คลองสี่ตะวันออก
1065 คลองสี่ประเวศ
1066 คลองสี่วา
1067 คลองสุทธาวาส
1068 คลองสุเหร่าสวนพลู
1069 คลองสุเหร่าใหม่ (คลองกลาง)
1070 คลองเสาธง
1071 คลองเสาวโคน
1072 คลองเสาหิน
1073 คลองเสาหิน(บางกอกใหญ่)
1074 คลองเสือน้อย
1075 คลองแสงศิริ
1076 คลองแสนแสบ
1077 คลองแสมดำใต้
1078 คลองแสมดำเหนือ
1079 คลองหกขุด
1080 คลองหกขุด (จรเข้บัว)
1081 คลองหกโรง
1082 คลองหนองกง
1083 คลองหนองเขิน
1084 คลองหนองแขม
1085 คลองหนองควายหาย
1086 คลองหนองคา
1087 คลองหนองจอก
1088 คลองหนองตะแคง
1089 คลองหนองบอน
1090 คลองหนองบอน
1091 คลองหนองบอน
1092 คลองหนองบัวบาน
1093 คลองหนองบัวมน
1094 คลองหนองปรือ
1095 คลองหนองปลาหมอ
1096 คลองหนองพงไหม้
1097 คลองหนองยาว
1098 คลองหนองระแหง
1099 คลองหนองรี
1100 คลองหนองใหญ่
1101 คลองหน้า สน.ลำผักชี
1102 คลองหนามแดง
1103 คลองหน้าวัด
1104 คลองหน้าวัดเกาะฯ
1105 คลองหน้าวัดหนัง
1106 คลองหนึ่ง
1107 คลองหนึ่ง(บางขุนเทียน)
1108 คลองหนึ่ง(หนองจอก)
1109 คลองหนึ่งตะวันตก
1110 คลองหนึ่งตะวันออก
1111 คลองหมอเชื้อ
1112 คลองหม้อแตก
1113 คลองหมอนสี่สิบ
1114 คลองหมาหลง
1115 คลองหมื่นแช่ม
1116 คลองหลวงณรงค์
1117 คลองหลวงพ่อบ้านแหลม
1118 คลองหลวงแพ่ง
1119 คลองหลวงวารี
1120 คลองหลวงวิจิตร
1121 คลองหลอด กม.2
1122 คลองหลอด กม.3
1123 คลองหลอดวัดราชนัดดา
1124 คลองหลอดวัดราชบพิธ
1125 คลองหลอแหล
1126 คลองหลัง รร.ฤดีศึกษา
1127 คลองหลัง สน.ทุ่งครุ
1128 คลองหลังค่ายลูกเสือ
1129 คลองหลังวัดเกาะฯ
1130 คลองหลังวัดบางสะแกใน 1
1131 คลองหลังวัดบางสะแกใน 2
1132 คลองหลังวัดพิชัยญาติ
1133 คลองหลังวัดม่วง
1134 คลองหลังวัดราชสิทธาราม
1135 คลองหลังหมู่บ้านศุภาลัย 1
1136 คลองหลังหมู่บ้านศุภาลัย 2
1137 คลองหลุมไผ่
1138 คลองหลุมไผ่
1139 คลองห้วยขวาง
1140 คลองหวังโต
1141 คลองหะยีมีนา
1142 คลองหัวกระบือ
1143 คลองหัวไผ่
1144 คลองหัวหมาก
1145 คลองหีบ
1146 คลองใหม่(ทวีวัฒนา)
1147 คลองใหม่(ยานนาวา)
1148 คลองอภิชาติ
1149 คลองอรชร
1150 คลองอ้อ
1151 คลองออเกาะ
1152 คลองออเงิน
1153 คลองออเงินน้อย
1154 คลองออเป้ง
1155 คลองอ้อมจาก
1156 คลองอาจารย์พร
1157 คลองอ้ายสลุด
1158 คลองอินทนินทร์
1159 คลองอู่ตะเภา
1160 คลองแอนเน็กซ์
1161 คลองโอ่งอ่าง
เหล่านักวิ่งมืออาชีพ คนรักสุขภาพ ตลอดจนเหล่าคนใจบุญที่อยากสนับสนุนงานการกุศลได้มารวมตัวกันอย่างคึกคัก เพื่อเข้าร่วมแข่งขันในการวิ่งทั้งหมด 3 ประเภทด้วยกัน ได้แก่ 1) มินิมาราธอนระยะทาง 9 กิโลเมตร 2) ฟันรันระยะทาง 4 กิโลเมตร และ 3) เดิน-วิ่งระยะทาง 2 กิโลเมตร พร้อมชิงรางวัลมูลค่ารวม 137,940 บาท (สำหรับประเภทมินิมาราธอนระยะทาง 9 กิโลเมตรเท่านั้น) อาทิ รางวัล Top Speed (ชาย/หญิง) โดยได้รับถ้วยรางวัลและผลิตภัณฑ์กล้องมิลเลอร์เลส Fujifilm X-S10 พร้อมเลนส์ Fujinon XC 15-45mm F.3.5-5.6 OIS PZ
นพ.ดิตถพงษ์ ยังกล่าวอีกว่า เทคโนโลยีเป็นอะไรที่เปลี่ยนแปลงได้ตลอดไม่มีที่สิ้นสุด แพทย์ที่โรงพยาบาลเอส สไปน์ ก็เช่นกันเรามีโปรแกรมในการศึกษาต่อเนื่องเพื่อรับสิ่งใหม่ๆ ที่เกิดขึ้นในโลกใบนี้ อย่างแรกคือ โปรแกรมส่งแพทย์ไปเรียนที่ต่างประเทศ ไม่ใช่เรียนการรักษาทั่วไป แต่เน้นเรียนกับเฉพาะบุคคลที่ชำนาญในด้านนี้จริงๆ หรือเป็นบุคคลที่เชี่ยวชาญการรักษาในด้านกระดูกสันหลังโดยเฉพาะ ซึ่งเรามีเครือข่ายอยู่ทั่วโลก ดังนั้นจึงมั่นใจได้ว่าแพทย์ของเราจะมีโปรแกรมการเรียนอย่างต่อเนื่องและตลอดเวลา ซึ่งมันจะหล่อหลอมให้แพทย์ทุกท่านมี DNA เดียวกัน และความเข้าใจที่ตรงกัน โดยทุนนี้มาจากโรงพยาบาล ซึ่งเราได้นำรายได้ส่วนหนึ่งมาพัฒนาบุคลากรของเราอย่างดีที่สุด ไม่ใช่แค่ในส่วนของแพทย์อย่างเดียวเท่านั้น แต่เรายังพัฒนาทีมพยาบาลด้วยเช่นกัน ด้วยอุปกรณ์เครื่องมือที่ถูกพัฒนามาแบบใหม่ๆ หรือเทคนิคใหม่ๆ เราก็นำเข้ามาเพื่อประโยชน์สูงสุดของผู้ป่วยที่เข้ามาใช้บริการในโรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ แห่งนี้
หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 4/66 (สำหรับกู้ชีพ/กู้ภัย ทุกสังกัด)
หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 4/66 (สำหรับกู้ชีพ/กู้ภัย ทุกสังกัด) รับสมัครจำนวน 60 คน
ภาคทฤษฎี (Online) วันที่ 12 พ.ค. 66 เวลา 09.00 - 12.00 น.
ภาคปฏิบัติ (On-site) วันที่ 20 พ.ค.66 มี 2 ช่วงให้เลือก
ช่วงเช้า เวลา 08.00-12.00 น. หรือ
ช่วงบ่าย เวลา 13.00-16.00 น.
"ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
วันศุกร์ ทำท่า ฝึกย่ำอยู่กับที่
ยืนให้ระยะห่างของเท้าทั้งสองข้างกว้างเท่ากับความกว้างของไหล่ ย่ำเท้าขวา - ซ้าย สลับกันช้า ๆ 30 ครั้ง วันละ 3 ชุด
เส้นทางที่ 4 ท่องเที่ยวเรียนรู้ ศึกษาดูงานรางวัล อย.ควอลิตี้อะวอร์ด
เส้นทางที่ 4 ท่องเที่ยวเรียนรู้ ศึกษาดูงาน
วิสาหกิจชุมชนบ้านสบายใจ จ.สมุทรสงคราม ที่ได้รับรางวัล อย.ควอลิตี้อะวอร์ด ปี 2565 ถึง 2 รางวัลในปีเดียว จาก 2 ประเภท คือ 1.รางวัลผลิตภัณฑ์สุขภาพดีเด่น ประเภทนวัตกรรม ผลิตภัณฑ์เรื่องดื่มกล้วยผงสำเร็จรูป รสธรรมชาติ (ตราดีปาษณะ) และ 2) รางวัลสถานประกอบการผลิตภัณฑ์สุขภาพดีเด่น (สถานประกอบการผลิตภัณฑ์สุขภาพชุมชน) ไม่มีวิสาหกิจใดทำได้มาก่อน ชมผลิตภัณฑ์ ศึกษาดูงาน ของวิสาหกิจ จะได้รับประโยชน์ในการนำไปพัฒนาต่อยอดได้อย่างมาก (แนะนำนัดล่วงหน้า โทร.084-3545615)
จบทัวร์ความรู้ ต้องผ่อนคลายด้วยคอร์สดูแลสุขภาพ ที่คลินิกแพทย์แผนไทย รพ.สต.ลาดใหญ่ นัดล่วงหน้าเช่นกันที่โทร.034-756018
ปวดท้อง, ท้องร่วง, โรคกระเพาะ หรือกรดไหลย้อน ก็ใช้สิทธิบัตรทองหาหมอฟรี รับยาฟรีได้
ปวดท้อง แสบท้อง ท้องเสีย อย่าคิดว่าเป็นเรื่องเล็ก ปล่อยไว้นานระวังกลายเป็นโรคร้าย! ไม่ว่าจะปวดท้องแบบไหน ‘คลิก Clicknic’ ให้เราช่วยดูแล ยิ่งมีสิทธิบัตรทองรักษาครอบคลุมถึง 42 โรค รักษา รับยา ฟรี! หาหมอจริง ผ่าน VDO Call รอรับยาถึงหน้าบ้าน พร้อมใบรับรองแพทย์ . หากมีอาการปวดท้อง, ท้องร่วง, โรคกระเพาะ หรือกรดไหลย้อน ก็ใช้สิทธิบัตรทองหาหมอฟรี รับยาฟรีได้จาก Clicknic
2.กระแสโควิดซาลง แต่อากาศร้อนและปัญหาฝุ่นยังคงอยู่ ต้องดูแลสุขภาพกันต่อไป
เนื่องจากสถานการณ์โควิดมีแนวโน้มที่ดีขึ้น ทำให้คนไทยหลายคนเริ่มละเลยเรื่องการใส่ใจสุขภาพของตนเอง คนไทยบางส่วนเลิกทำกิจกรรมเพื่อสุขภาพนอกบ้าน เช่น การเดิน วิ่ง จ๊อกกิ๊ง ยังรวมไปถึงการเลิกทานวิตามินซีหรือเลิกทานผลิตภัณฑ์เสริมเพื่อสุขภาพ ซึ่งอย่างไรก็ตามการดูแลสุขภาพของตนเองและครอบครัวยังคงเป็นสิ่งที่สำคัญ เนื่องจากปัญหาฝุ่นที่ยังคงอยู่ สภาพอากาศที่ร้อนจัดและเปลี่ยนแปลงตลอดเวลา อาจส่งกระทบต่อสุขภาพของคนไทยได้ แบรนด์ควรแนะหรือนำเสนอทางออกที่ดีต่อสุขภาพที่สามารถทำเองได้ง่ายๆ ที่บ้าน เช่น การทานผักและผลไม้ ทานอาหารให้ครบ 5 หมู่ รวมไปถึงการดื่มน้ำให้เพียงพอในหนึ่งวัน เพียงเท่านี้ก็จะสามารถสร้างเสริมให้คนไทยมีสุขภาพที่ดีไปด้วยกัน
วิธีการเก็บตัวอย่างด้วยตนเอง
เราจะให้ประชาชนไปรับชุดเก็บตัวอย่างด้วยตนเอง ได้ที่โรงพยาบาลใกล้บ้านก็ได้ ร.พ. ส.ต. ก็ได้ เราเพิ่มมาอีก ไปรับที่ร้านยาก็ได้ ร้านยาที่เป็นเอกชนที่เข้าร่วม ขณะนี้ มีอยู่ทั่วประเทศกว่าพันแห่ง เก็บออกมาเสร็จเรียบร้อยแล้ว ก็ส่งให้กับหน่วยตรวจ ซึ่งก็อาจจะเป็นโรงพยาบาล ไปเข้าห้องปฏิบัติการตรวจแล้วรอฟังผลผ่านแอปพลิเคชั่นเป๋าตัง
HPV DNA Self-sampling Test ทางเลือกใหม่ให้ผู้หญิงสามารถเลือกเก็บตัวอย่างด้วยตนเองได้ จะเป็นกุญแจสำคัญในการช่วยกำจัดมะเร็งปากมดลูกให้สิ้นซากได้อย่างไร
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า การเก็บตัวอย่างดังกล่าวจะช่วยแก้ปัญหาการอายแพทย์ และกังวลการขึ้นขาหยั่งได้ สะดวกมากขึ้น วิธีการเก็บตัวอย่างด้วยตนเองไม่ยุ่งยาก หมอแนะนําให้ใช้เก้าอี้ หรือฝาชักโครก เข้าห้องน้ำ ล้างมือให้สะอาด ยกขาข้างหนึ่งไว้ จับก้านไม้ตรวจไว้แหย่ไม่ให้ลึกเกินไป หมุนราวๆ 30 วินาที ทำตามคู่มือ แล้วเก็บใส่หลอดเก็บตัวอย่าง ปิดฝา แล้วดำเนินการส่งให้ห้องปฏิบัติการตรวจต่อไป แนะนําว่ารับแล้วให้ตรวจเลย ตรวจเสร็จแล้วส่งตรงนั้นเลยไม่ต้องเป็นภาระ เมื่อเสร็จเรียบร้อยก็จะส่งไป ไปที่โรงพยาบาล ไปที่จุด เขาก็ไปตรวจ ตรวจอะไรเรียบร้อยแล้ว เราจะส่งผลกลับมาที่แอพฯเป๋าตังเหมือนเดิม
ที่สำคัญ องค์การอนามัยโลก (WHO) ประกาศแล้วว่า การตรวจ HPV DNA Self-Sampling มีความคุ้มค่า แนะนำให้เป็นมาตรฐานการตรวจคัดกรองมะเร็งปากมดลูก สําหรับประเทศที่ รายได้ปานกลางถึงรายได้ต่ำ ในอดีต การตรวจคัดกรอง หรือการรักษาดีๆจะมีเฉพาะในประเทศที่รายได้สูงหน่อย แต่ล่าสุด WHO ประกาศแล้วว่าการตรวจนี้คุ้มค่า เนื่องจากมันสามารถเข้าถึงได้ง่าย ตรวจเองได้ ความแม่นยําสูง ประเทศไทยเราก็มีสิทธิประโยชน์ให้ตรวจฟรี WHO ก็ประกาศแล้ว ประเทศไทยก็เป็นหนึ่งในนั้น ก็อยากให้เข้ามารับการตรวจคัดกรองกันให้มากขึ้น
ข้อมูลผู้ตอบแบบสอบถาม (เพศ)
บันทึกผลการสำรวจ ตามเพศ - แบ่ง 4 กลุ่ม คือ ชาย หญิง LGBTQ และ ไม่ระบุ
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน หญิง 70.5%. ชาย 22.9%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน หญิง 70%. ชาย 23.1% LGBTQ 4.9% และ ไม่ระบุ 2.1%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน หญิง 71.7%. ชาย 22.2% LGBTQ 4.4% และ ไม่ระบุ 1.7%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน หญิง 72.7%. ชาย 22% LGBTQ 3.4% และ ไม่ระบุ 1.9%
สุนัขควบคุมพิเศษ หมายถึงสุนัขพันธุ์ที่ดุร้าย
สุนัขพันธุ์ที่ดุร้าย เช่น พิทบูลเทอเรีย บูลเทอเรีย รอทไวเลอร์ ฟิล่าบราซิลเรียโร หรือสุนัขที่มีประวัติทำร้ายคน ผู้เลี้ยงต้องควบคุมดูแลเป็นพิเศษ และมีข้อกำหนดที่ต้องปฏิบัติเคร่งครัด
Workshop สุดยอดนักปลูก Kirt Rohlack มือรางวัล 3 รางวัล EMERALD CUP
Workshop ปีนี้เราได้แขกรับเชิญที่เป็นนักปลูกที่เคยคว้ารางวัล EMERALD CUP มา 3 รางวัล ได้แก่ อันดับ 1 Highest Cannabinoid Profile, 2014, อันดับ 2 Highest Cannabinoid Profile, 2013 และ อันดับ 5 Best Flowers, 2013 เรื่องประสบการณ์ไม่ต้องห่วง
คุณ Kirt Rohlack (Kirt TARATERA) : จะมาทำ Workshop กับ เราทั้งสองวัน วันละหัวข้อ ได้แก่
วันที่ 8 กรกฎาคม : 18.00-18.45 น. : Aloe Gel and Water Propagation (การทำชำด้วยเทคนิคการใช้ Aloe Gel)
วันที่ 9 กรกฎาคม : 19.00-19.45 น. : Sprouted Seed Tea (การทำราก และทำน้ำยาเร่งราก)
ใครทีมีข้อสงสัยเรื่องการปลูกสามารถถามคำถามได้เต็มที่เลย
201. วัดโรงธรรมสามัคคี อ.สันกำแพง จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา08.30-16.00น.
เบอร์ติดต่อ: 0819936456
ผู้ติดต่อ: อ.ณัธฐ์สินี ณ เชียงใหม่
202. กองเรือยุทธการสัตหีบ จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 09.00 - 16.30 น.
เบอร์ติดต่อ: 081-001-9899
ผู้ติดต่อ: อาจารย์ พรชัย ตระกูลศรีมงคล
203. วัดเจดีย์ยอดทอง อ.เมือง จ.พิษณุโลก
พิษณุโลก
วันเวลาทำการ: เสาร์-อาทิตย์ 8:00-17:00 น.
เบอร์ติดต่อ: 081-6883344
ผู้ติดต่อ: อจ.กุลภรณ์ กมลวัฒนะ (ผู้ดูแลสาขา )
204. วัดพระนอน (ขอนม่วง) อ.แม่ริม จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: วันเสาร์และอาทิตย์
เบอร์ติดต่อ: 080-990-6835
ผู้ติดต่อ: อ.รุ่งทิพย์ ศรีณรงค์
205. โรงเรียนประกอบวิทยา จ.สมุทรสงคราม
สมุทรสงคราม
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00- 20.30 น.
เบอร์ติดต่อ: 0829158745
ผู้ติดต่อ: อ.เทิดพันธุ์ บุญทอง
206. วัดไทรใหญ่ อ.ไทรน้อย จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ (8.00-17.00น.)
เบอร์ติดต่อ: 081-912-6735
ผู้ติดต่อ: อ.ปรีดา สุทธิภิบาล
207. วัดเทพมงคลปานสาราม อ.ตาคลี จ.นครสวรรค์
นครสวรรค์
วันเวลาทำการ: เสาร์-อาทิตย์ 08:00-16:30 น.
เบอร์ติดต่อ: 0815341746 ,0869397459,0866808966
ผู้ติดต่อ: อ.ซ้อน ชุนใช้ อ.นรภัทรบวรพล อินทรเกษตร อ.สุรางค์ วีรสุเมธา
208. วัดพระบรมธาตุวรวิหาร อ.เมือง จ.ชัยนาท
ชัยนาท
วันเวลาทำการ: เสาร์- อาทิตย์ เวลา 08.30น. - 16.30น.
เบอร์ติดต่อ: 095-3242-935 064-4264-582 081-1306-875
ผู้ติดต่อ: อ.สุขุม คณฑา (ผดล.) , อ.จิณห์นิภา บุญญานุวัตร (ผช.ผดล.)
209. วัดคลองระนง อ.ชุมแสง จ.นครสวรรค์
นครสวรรค์
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 9:00 น.-16:00 น.
เบอร์ติดต่อ: 0873127539
ผู้ติดต่อ: 0612724589
210. วัดเขากรวดมหาพุทธาราม อ.เมือง จ.ราชบุรี
ราชบุรี
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00 น. - 20.30 น.
เบอร์ติดต่อ: 084-3159529
ผู้ติดต่อ: ผดล. พรทิพย์ สินประสงค์
211. วัดป้อมวิเชียรโชติการาม อ.เมือง จ.สมุทรสาคร
สมุทรสาคร
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00 - 20.30 น.
เบอร์ติดต่อ: 081-8598426
ผู้ติดต่อ: อ.วนิดา บุญยบุตร (ผดล.)
212. วัดดาวลอย อ.ปากท่อ จ.ราชบุรี
ราชบุรี
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08:00 - 16:00 น.
เบอร์ติดต่อ: 083-599-1849
ผู้ติดต่อ: อ.จตุพล ศรีเทพ
213. วัดสุวรรณคีรี อ.พนมสารคาม จ.ฉะเชิงเทรา
ฉะเชิงเทรา
วันเวลาทำการ: เสาร์ อาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 085 920 2950
ผู้ติดต่อ: อ.ทศพล แพน้อย
214. วัดแก้วไพฑูรย์ เขตจอมทอง กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ 08.00น.-16.30น.
เบอร์ติดต่อ: 0848638639
ผู้ติดต่อ: อ.มาลี หมื่นณรงค์ (ผู้ดูแลสาขา)
215. วัดเขาโบสถ์ อ.บางสะพาน จ.ประจวบคีรีขันธ์
ประจวบคีรีขันธ์
วันเวลาทำการ: วันเสาร์-อาทิตย์ 9.00-16.00น.
เบอร์ติดต่อ: 0898995440
ผู้ติดต่อ: อ.วีระ สังข์เฉย
216. วัดตาอี อ.บ้านกรวด จ.บุรีรัมย์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
217. วัดสวนใหญ่ อ.ลำปลายมาศ จ.บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.30 - 16.30 น.
เบอร์ติดต่อ: 0850615150
ผู้ติดต่อ: อ.กมลทิพย์ เข็มทิศ
218. วัดโนนสว่าง อ.วังสะพุง จ.เลย
เลย
วันเวลาทำการ: วันเสาร์-อาทิตย์ 08:30 - 16:00 น.
เบอร์ติดต่อ: 088 033 9379
ผู้ติดต่อ: อ.กฤษณพงษ์ เหมบุรุษ
219. วัดสว่างอารมณ์ จ.ชัยภูมิ
ชัยภูมิ
วันเวลาทำการ: 18.00-20.30 น.
เบอร์ติดต่อ: 081-660-5267
ผู้ติดต่อ: อ.ถวัลย์ ปรเมศวร์โยธิน (ผดล.)
220. วัดโคกท่าเจริญ อ.พานทอง จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18:00 น.-20:00 น.
เบอร์ติดต่อ: 0816298502
ผู้ติดต่อ: อ.มนต์ชัย กิจบรรณเดช (ผดล.สาขา220)
221. วัดสว่างอารมณ์วรวิหาร อ.สวรรคโลก จ.สุโขทัย
สุโขทัย
วันเวลาทำการ: วันเสาร์- วันอาทิตย์ เวลา 8.30-16.30 น.
เบอร์ติดต่อ: 095-619-5044
ผู้ติดต่อ: อ.ถิราภรณ์ ศรีสุเทพ ผู้ดูแลสาขา
222. วัดบ้านพร้าว อ.นครไทย จ.พิษณุโลก
พิษณุโลก
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30-16.00 น
เบอร์ติดต่อ: 0992681564,0862113001
ผู้ติดต่อ: ผดล.สาขา222อ.จารุณี มีพยุง , ผช.ผดล.อ.สุนีย์รัตน์ ทองปากน้ำ
223. วัดประดิษฐาราม อ.ทุ่งใหญ่ จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 08.00 - 17.00 น.
เบอร์ติดต่อ: 087-270-4398
ผู้ติดต่อ: อ.พรณี หนูชุม
224. วัดเสนาราม อ.ท่าศาลา จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 08.00 - 17.00 น.
เบอร์ติดต่อ: 1. 081 683 0889 2. 0622367721
ผู้ติดต่อ: 1.อ.พุทธิดา ดีไธสง 2.วิษาโรจน์ สรรพนิล
225. วัดสว่างเนตร จ.เพชรบูรณ์
เพชรบูรณ์
วันเวลาทำการ: -
เบอร์ติดต่อ: 0812837342
ผู้ติดต่อ: ผศ.ดร.วิไลวรรณ วิภาจักษณกุล
226. วัดพุทธปัญญา จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 0859459546
ผู้ติดต่อ: อ.ฐนดล สังข์ทอง (ผู้ดูแลสาขา)
227. วัดกลาง อ.เกษตรวิสัย จ.ร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: ทุกวันเสาร์-อาทิตย์ เวลา 08.30 - 16.30 น.
เบอร์ติดต่อ: 063-3599423
ผู้ติดต่อ: นางจินดาภรณ์ บุญมี
228. รร.พรหมรังษี อ.พัฒนานิคม จ.ลพบุรี
ลพบุรี
วันเวลาทำการ: เสาร์ อาทิตย์ 8.30 -16.00 น.
เบอร์ติดต่อ: 087-7932290 , 087-9356633 , 098-2564359 , 098-2799749 , 082-1985959 , 095-8461846
ผู้ติดต่อ: อ.อธิการ เมธากาญจนา อ.ชุลี ถนัดช่าง อ.สุวพัชร ละออง อ.พรทิพา ทองแย้ม อ.รัศสิชาพร ศรีสวัสดิ์ อ.สุปราณี เขาใหญ่
229. วัดบูรพา อ.เมือง จ.อุบลราชธานี
อุบลราชธานี
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 15.00-20.00น
เบอร์ติดต่อ: 0942646663
ผู้ติดต่อ: สุพรทิพย์ ภัทรวัชช์รวีร์
230. วัดหาดเสี้ยว อ.ศรีสัชนาลัย จ.สุโขทัย
สุโขทัย
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 8.00 น.-16.00 น.
เบอร์ติดต่อ: 082 596 7962
ผู้ติดต่อ: สิรภพ แก้วทุ่ง
231. วัดนาค อ.บางปะหัน จ.พระนครศรีอยุธยา
พระนครศรีอยุธยา
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์
เบอร์ติดต่อ: ๐๙๐ ๖๔๒ ๘๔๔๔
ผู้ติดต่อ: อ.ณญาน นลินขวัญ
232. วัดหลวงราษฎร์เจริญธรรม ต.แม่เจดีย์ อ.เวียงป่าเป้า จ.เชียงราย
เชียงราย
วันเวลาทำการ: -
เบอร์ติดต่อ: 091-0362984
ผู้ติดต่อ: ประภารัตน์ เจริญสุข
233. วัดป่าคำเจริญ อ.บ้านดุง จ.อุดรธานี
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
234. วัดศิริราษฎร์วัฒนา อ.เจริญศิลป์ จ.สกลนคร
สกลนคร
วันเวลาทำการ: วันเสาร์ - อาทิตย์ เวลา 08.00 - 16.00 น.
เบอร์ติดต่อ: 089-6239364
ผู้ติดต่อ: อ.ก่อพิสิษฐ์ ว่องไว
235. วัดท่ามะกา อ.ท่ามะกา จ.กาญจนบุรี
กาญจนบุรี
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00 น.-17.00 น.
เบอร์ติดต่อ: 091-884-9484
ผู้ติดต่อ: อ.วรวุฒิ ศรีสวาท
236. ศักดิ์สิทธิ์ อัลลอย เขตบางบอน กรุงเทพฯ
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์ เวลา 18.00 น. - 20.30 น.
เบอร์ติดต่อ: (081) 777-9933
ผู้ติดต่อ: อ.ปัญญา วิทยวัฒนไพศาล (ผดล.)
237. วัดเนรมิตวิปัสสนา อ.ด่านซ้าย
เลย
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา 08.00 - 16.30 น.
เบอร์ติดต่อ: 0818543045
ผู้ติดต่อ: อ.ประภาส ตามะทะ
238. วัดพรหมโลก อ.พรหมคีรี จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: 09.00-16.00
เบอร์ติดต่อ: 0840576717
ผู้ติดต่อ: นายสุเทพ ศุภจิตตากร
239. วัดมัชฌิมเขต อ.กระบุรี จ.ระนอง
ระนอง
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 09.00-16.00 น.
เบอร์ติดต่อ: 092-268-5198
ผู้ติดต่อ: นางอรอารีย์ เมืองทิพย์
240. วัดวังตะวันตก อ.เมือง จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: -
เบอร์ติดต่อ: 095-4199446
ผู้ติดต่อ: อ.วรพจน์ หนูช่วย
241. วัดธารทอง อ.ขนอม จ.นครศรีธรรมราช
นครศรีธรรมราช
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา 08.00 -17.00 น.
เบอร์ติดต่อ: 062 979 1469
ผู้ติดต่อ: ทิพาภรณ์ อนุพัฒน์
242. วัดพระยืน อ.เมือง จ.ลำพูน
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
243. วัดต้นส้านสามัคคี อ.ฝาง เชียงใหม่
เชียงใหม่
วันเวลาทำการ: ส.- อ. เวลา 08.30 - 16.00 น.
เบอร์ติดต่อ: 084-0506555
ผู้ติดต่อ: อ.กีรวัสส์ แสงโรจนธงชัย
244. วัดพรหมวิหาร อ.แม่สาย จ.เชียงราย
เชียงราย
วันเวลาทำการ: -
เบอร์ติดต่อ: 085-039-5539
ผู้ติดต่อ: อ.เตือนจิต วุฑฒิพงพิพัฒน์
245. วัดไพรงาม อ.กงไกรลาศ จ.สุโขทัย
วันเวลาทำการ: เสาร์ และอาทิตย์ 9.00 - 16.00 น.
เบอร์ติดต่อ: 0643567705
ผู้ติดต่อ: สุนทรี อินทโชติ
246. โรงเรียนวัดสำนักกะท้อน อ.บ้านฉาง จ.ระยอง
ระยอง
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09:00-16:30 น.
เบอร์ติดต่อ: 090-292-4636
ผู้ติดต่อ: อาจารย์ นาวาโทหญิง พัชญ์ชสุทธิ์ เจริญวงศ์
247. วัดโพธิ์ปฐมาวาส พระอารามหลวง
สงขลา
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 091-949-4289
ผู้ติดต่อ: อ.วรพันธุ์ ลิ่มรัชชพงศ์
248. วัดป่าทรงคุณ จ.ปราจีนบุรี
ปราจีนบุรี
วันเวลาทำการ: เสาร์ อาทิตย์
เบอร์ติดต่อ: 061-5651595, 064-4659951 , 085-4359965
ผู้ติดต่อ: อัญชลี มงกุฎทอง , สมคิด ศรีบุญจันทร์ , กนกรัตน์ หงษ์ทอง
249. วัดสุวรรณวิจิตร อ.ปราสาท จ.สุรินทร์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
250. วัดบ้านแพน อ.เสนา จ.พระนครศรีอยุธยา
พระนครศรีอยุธยา
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 8.00 - 17.00 น.
เบอร์ติดต่อ: 081-856-2390
ผู้ติดต่อ: อ.พรชัย วุฒิปัญญาเลิศ
เดินทางดี
กทม. มีแนวทางการเพิ่มความคล่องตัวการเดินทาง จึงได้มีแนวทางการส่งเสริมการใช้ระบบขนส่งสาธารณะ รวมถึงการเพิ่มทางเลือกในการเดินทางด้วย ในโซนนิทรรรศการนี้จะมีการยกทางข้ามและการกวดขันวินัยจราจรมาให้ทดสอบกัน
ที่บูธนี้ จะมีกิจกรรมการสาธิตจากเจ้าหน้าที่ พร้อมให้ประชาชนร่วมทดลองด้วย โดยมีกิจกรรม ดังนี้
- การจำลองทางข้าม ที่มีสัญญาณเสียงเตือนก่อนข้าม
- การทำงานของกล้องตรวจจับการฝ่าฝืนขับขี่หรือจอดรถบนทางเท้าด้วยเทคโนโลยี AI
- Showcase ของระบบสัญญาณไฟจราจรแบบเป็นพื้นที่ Area Traffic Control: ATC แบบจำลองทางข้ามและการกวดขันวินัยจราจรบริเวณทางแยก
- ผังแสดงเชื่อมต่อระบบการทำงานของ BMA Network โดยรายงานจากระบบส่งไปยังหน่วยงานที่เกี่ยวข้องเพื่อการดำเนินการต่อผู้ฝ่าฝืน
- โมเดลการให้บริการประชาชนด้านการเดินทาง เพื่ออำนวยความสะดวกและความปลอดภัย
- โมเดลศาลาที่พักผู้โดยสารรูปแบบใหม่
- การแสดงข้อมูลการเดินรถไฟฟ้า, ระบบขนส่งสาธารณะใน กทม. เป็นต้น
เขตปทุมวัน คุมเข้มตรวจคุณภาพถังดับเพลิงในชุมชนทุกแห่งเน้นย้ำความปลอดภัย พร้อมใช้งาน
28 มิถุนายน 2566 นางสาวสุขวิชญาณ์ นสมทรง ผู้อำนวยการเขตปทุมวัน พร้อมด้วยฝ่ายปกครอง ฝ่ายพัฒนาชุมชนฯ และฝ่ายเทศกิจ ร่วมกับเจ้าหน้าที่ดับเพลิงและกู้ภัยบ่อนไก่ ลงพื้นที่ตรวจสอบคุณภาพความพร้อมของถังดับเพลิงและอุปกรณ์ต่างๆในชุมชนพื้นที่เขตปทุมวัน ทั้ง 17 ชุมชน ได้แก่ ชุมชนพัฒนาบ่อนไก่ ชุมชนเคหะชุมชนบ่อนไก่ ชุมชนซอยโปโล ชุมชนซอยร่วมฤดี ชุมชนซอยพระเจน ชุมชนหลังวัดปทุมวนาราม ชุมชนแฟลตสน. ปทุมวัน ชุมชนวัดชัยมงคล ชุมชนบ้านครัวใต้ ชุมชนวัดบรมนิวาส ชุมชนริมคลองนางหงส์ ชุมชนชาวชูชีพ ชุมชนวัดสามง่าม ชุมชนจรัสเมือง ชุมชนแฟลตการรถไฟ ชุมชนวัดดวงแข และชุมชนตรอกสลักหิน
ศูนย์ฯ12รับสมัครงาน LINK
ศูนย์ฯ12รับสมัครงาน ศูนย์บริการสาธารณสุข สิบสอง จันทร์เที่ยง เนตรวิเศษ ประกาศรับสมัครงาน
ผู้ช่วยธุรการ 1 ตำแหน่ง
พนักงานช่วยงานด้านสาธารณสุข 1 ตำแหน่ง
พนักงานทั่วไป 1 ตำแหน่ง
มาสมัครด้วยตนเองนะคะ สอบถามโทร. 02-2917637 02-2917638
6. สายธารแห่งแสงสว่าง
แนวคิด : ความเชื่อมโยงระหว่างคนกับสายน้ำพร้อมกับการพัฒนาที่ก่อ ให้เกิดความเจริญซึ่งอำนวยประโยชน์แก่ประชาชนอย่างต่อเนื่อง
เทคนิค :ลากเส้นแสงรอบขอบลำธารเพื่อสร้างอาณาเขตที่งดงามแปลกตาของ “สายน้ำแห่งแสง”
รถดีเซลรุ่นใหม่ล็อตแรก ฮิตาชิ จากประเทศญี่ปุ่น
4. สถานีรถไฟกรุงเทพ (หัวลำโพง)
สถานีรถไฟกรุงเทพ (หัวลำโพง) เป็นสถานีรถไฟหลักของประเทศไทย และเป็นสถานีที่เก่าแก่ที่สุด เริ่มก่อสร้างขึ้นในปลายรัชสมัยพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว ในปี พ.ศ. 2453 สร้างเสร็จ และเปิดใช้งานเมื่อวันที่ 25 มิถุนายน พ.ศ. 2459 ในรัชสมัยพระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว
พบกับจันท์เจ้าได้ที่งานเที่ยวเมืองไทย
พุธ - อาทิตย์นี้ใครที่ไปเที่ยวงาน "เที่ยวเมืองไทย" อย่าลืมแวะมาที่บูธของร้านจันท์เจ้าขนไอศกรีมครบรส และเมนูขนมหวานที่ยังไม่มีขายหน้าร้านให้ได้ลองชิมก่อนใคร มาเปิดตัวที่นี่ครั้งแรกด้วยนะคะ เราเลือกวัตถุดิบที่เรานำมาทำไอศกรีมและของหวานต่างๆนั้น ไม่ได้มาจากที่ไหนไกล เป็นของดี จากภาคตะวันออกและของพื้นบ้านทั้งนั้นเลยค่ะ มาเจอกันได้วันที่ 2-6 สิงหาคม 2566 เวลา 10.00 - 21.00 น. ณ. ศูนย์ประชุมแห่งชาติสิริกิต์ ชั้น L ฮอลล์ 5-8 โซนภาคตะวันออก
โปรโมชั่น สำหรับเทศกาลวันแม่ @โรงพยาบาลลานนา
โปรโมชั่น สำหรับเทศกาลวันแม่ปีนี้ พาคุณแม่มาตรวจสุขภาพ วันที่ 12 สิงหาคม 2566 รับของที่ระลึกได้ทันที !!
“ เพราะสุขภาพดี คือของขวัญที่มีค่าที่สุด ”
โปรแกรมตรวจสุขภาพ สำหรับคุณแม่ และสุภาพสตรี
โปรแกรมที่ 1 สำหรับสตรีผู้เข้าสู่วัยกลางคนขึ้นไป ราคา 6,100 บาท
โปรแกรมที่ 2 สำหรับสุภาพสตรีทั่วไป ราคา 3,700 บาท
**กรุณางดน้ำ งดอาหาร อย่างร้อย 8-10 ชั่วโมง ก่อนเข้ารับการตรวจ
*โปรโมชั่นเฉพาะวันที่ 12 สิงหาคม 2566
สอบถามข้อมูลเพิ่มเติมได้ที่ ศูนย์ตรวจสุขภาพ โรงพยาบาลลานนา โทร 052-134727
1970
ในปี ค.ศ. 1970 โรงพยาบาลได้ก่อสร้างอาคารหอพัก 9 ชั้น เพื่อเป็นที่พักของแพทย์ พยาบาล และเจ้าหน้าที่ โดยมีชั้นล่างเป็นห้องอาหารและห้องครัวที่ทันสมัย
กลุ่มผู้ใหญ่อายุ 25-59 ปี
กลุ่มผู้ใหญ่อายุ 25-59 ปี
- ฉีดวัคซีนคอตีบ บาดทะยัก
- ตรวจวัดความดันโลหิต
- ตรวจเลือดคัดกรองเบาหวาน เอชไอวี
- คัดกรองความเสี่ยงจากการสูบบุหรี่/สุรา/สารเสพติด
- คัดกรองปัจจัยเสี่ยงต่อการเกิดโรคหัวใจและหลอดเลือด
- ตรวจคัดกรองวัณโรค มะเร็งช่องปาก
- ตรวจคัดกรองการกลายพันธุ์ของยีนโรคมะเร็งเต้านม
- คัดกรองมะเร็งปากมดลูก
- ตรวจอุจจาระคัดกรองมะเร็งลำไส้ใหญ่ (50-70 ปี)
- เคลือบฟลูออไรด์
- การให้ยาบำรุงเสริมธาตุเหล็กและโฟลิก
- การป้องกันและแก้ไขการตั้งครรภ์ไม่พึงประสงค์ การคุมกำเนิด ยาคุมกำเนิด
- การให้ความรู้ตรวจเต้านมด้วยตนเอง
- การให้คำปรึกษาแนะนำการป้องกันเอชไอวีหลังสัมผัส
รางวัลชมเชย คุณพุทธรัตน์ หอวัง
คอร์สสอนทำโดนัทมาสเตอร์คลาส โรงเรียนสอนทำอาหารและเบเกอรี่ Cooking Talk LINK
คอร์สสอนทำโดนัทมาสเตอร์คลาส โรงเรียนสอนทำอาหารและเบเกอรี่ Cooking Talk เหมาะสำหรับผู้อยากทำเพื่อประกอบอาชีพแต่ยังไม่อยากลงทุนเยอะ และยังไม่ค่อยมีพื้นฐานเบเกอรี่ หรืออยากทำกินเองเล่นๆที่บ้านก็ทำได้ง่ายๆ คอร์สนี้ตอบโจทย์ บทเรียนของคอร์สนี้
• สอนทำแป้ง 2 ชนิด (Classic Dough & Mochi Dough)
• สอนทำไส้และเคลือบหน้า 15 ชนิด ครอบคลุมทั้งการทำเกลซ แยม ครีม และซอสต่างๆ และสามารถประยุกต์เพิ่มได้อีกหลายรสชาติ
(ปฏิบัติทั้ง 15 รสชาติ)
• สามารถประยุกต์ในการตกแต่งเพื่อทำเป็นของขวัญ premium เพื่อจัดงานเทศกาลต่างๆ ได้เช่น วันเกิด , วันรับปริญญา , ปีใหม่
(*คุณครูเลือกมาสาธิต 2-3 ชนิดเพื่อเป็นตัวอย่าง)
เรียน 1 วัน เริ่มเรียน 10:00 - 16:00 น.
ราคา 3990 บาท
ลงมือปฏิบัติ 1 คน / 1 ชุด
คุณไพบูลย์ จงสุวัฒน์ (โกเฒ่า) สนับสนุนบัตรคอนเสิร์ต ราคา 2,000 บาท 100 ใบ
ขอขอบคุณ คุณไพบูลย์ จงสุวัฒน์ (โกเฒ่า) บริษัท ยิ่งยงมินิมาร์ท จำกัด สนับสนุนบัตรคอนเสิร์ตการกุศล เพื่อลมหายใจ Song Of Life #3 ราคา 2,000 บาท จำนวน 100 บัตร
ทีม M 4 ช่อม่วงและข้าวฟ่าง ทีม AB มอเตอร์ไบค์
ร่วมโหวต ให้ทีม M 4 ช่อม่วงและข้าวฟ่าง ทีม AB มอเตอร์ไบค์ เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า
ประเพณีออกพรรษาและบั้งไฟพญานาคโลก จ. หนองคาย ประจำปี 2566
จังหวัดหนองคายได้กำหนดจัดงาน “ประเพณีออกพรรษาและบั้งไฟพญานาคโลก” ประขึ้นเป็นประจำทุกปี เพื่อรองรับนักท่องเที่ยวทั้งชาวไทยและชาวต่างชาติที่เดินทางมาชมปรากฏการณ์ “บั้งไฟพญานาค” ในคืนวันออกพรรษา ขึ้น 15 ค่ำ เดือน 11 ซึ่งในปีนี้ตรงกับวันอาทิตย์ที่ 29 ตุลาคม 2566 โดยในปีนี้จะมีการจัดกิจกรรมต่างๆ ตั้งแต่วันที่ 20 ตุลาคม- 6 พฤศจิกายน 2566 ใน 6 อำเภอที่ติดกับแม่น้ำโขงประกอบด้วย อ.สังคม, อ.ศรีเชียงใหม่, อ.ท่าบ่อ, อ.เมือง, อ.โพนพิสัย และ อ.รัตนวาปี ซึ่งมีการจัดกิจกรรมหลากหลาย เช่น
- วันที่ 21 ตุลาคม วิ่งตามรอยปรากฏการณ์ “บั้งไฟพญานาค” ที่ อ.รัตนวาปี
- วันที่ 22 ตุลาคม วิ่งเปิดเมืองพญานาค ที่ อ.โพนพิสัย
- วันที่ 26 ตุลาคม บวงสรวงและรำบูชาพญานาค อ.เมือง
- วันที่ 27 ตุลาคม บวงสรวงและรำบูชาพญาศรีสุวรรณหงส์สัตตนาคราช อ.ศรีเชียงใหม่, รำบวงสรวงบูชาพญานาค ประจำปี 2566 อ.ท่าบ่อ, การแสดงแสง สี เสียง ตำนานบั้งไฟพญานาค อ.เมือง
- วันที่ 28 ตุลาคม บวงสรวงบูชาพญานาค อ.รัตนวาปี
- วันที่ 29 ตุลาคม บวงสรวงเจ้าแม่สองนาง บวงสรวงพระธาตุกลางน้ำ, การแข่งขันเรือยาวขนาดใหญ่, ลอยกะโป๋ไฟ กลางแม่น้ำโขง อ.เมือง, บวงสรวงบูชาพญานาคแบบดั้งเดิม, บวงสรวงวันเปิดโลก บูชาพระพุทธเจ้าและบูชาพญานาค รำบวงสรวงพญาพิสัยสัตนาคราช มี ใบเฟิร์น พิมพ์ชนก มาร่วมรำด้วย อ.โพนพิสัย
- 30 ตุลาคม ทำบุญตักบาตรเทโวโรหณะ อ.เมือง อ.สังคม อ.โพนพิสัย
- วันที่ 4 - 6 ตุลาคม การแข่งขันเรือยาว อ.โพนพิสัย เป็นต้น
การเพิ่มขึ้นเท่าตัวของเทคโนโลยีดิจิทัล เพื่อรับมือกับปัญหาการขาดแคลนบุคลากรและความพึงพอใจในการทำงาน
ปัญหาการขาดแคลนบุคลากรกำลังเป็นปัญหาสำคัญของวงการสาธารณสุขทั่วโลก จากรายงานของสำนักงานสถิติแห่งชาติและกระทรวงสาธารณสุขเผยอัตราแพทย์ในประเทศไทยคือแพทย์ 0.5 คน ต่อประชากร 1,000 คน ในขณะที่ WHO ระบุไว้ว่าอัตราที่เหมาะสมคือแพทย์ 2.8 คนต่อประชากร 1,000 คน นอกจากนี้ แผนกำลังคนตามการจัดระบบบริการโดยเขตสุขภาพแสดงให้เห็นว่าประเทศไทยยังขาดแคลนบุคลากรทางการแพทย์มากกว่า 38,174 คน ซึ่งในจำนวนนี้เป็นแพทย์ 6,115 ตำแหน่งและเป็นพยาบาล 28,174 ตำแหน่ง
เทศกิจส่งหนังสือแจ้งเก็บค่าปรับ ถึงผู้กระทำผิด ไปจ่ายค่าปรับที่สำนักงานเขต
สำหรับการชำระค่าปรับ ขณะนี้ทางเจ้าหน้าที่ตำรวจมีการทำ MOU กับกรมการขนส่งทางบกอยู่แล้ว หากภายใน 30 วันไม่มาชำระค่าปรับ จะส่งเรื่องให้เจ้าหน้าที่ตำรวจเพื่อประสานความร่วมมือกับกรมการขนส่งทางบก ในขณะที่การต่อทะเบียนปลายปี หากยังไม่ได้จ่ายค่าปรับเขาก็ต้องไปจ่ายค่าปรับก่อนที่จะมาต่อทะเบียน แต่ในอนาคต กทม. อาจจะมีการทำ MOU โดยตรงกับกรมการขนส่งทางบก เพื่อที่จะไม่ต้องส่งผ่านทางเจ้าหน้าที่ตำรวจซึ่งส่วนนี้กำลังอยู่ระหว่างการเจรจาและจะพิจารณาดำเนินการต่อไป
โรงพยาบาลบางมด ไม่เพียงแต่จะให้บริการด้านศัลยกรรมเท่านั้น แต่ยังบริการรักษาโรคครบทุกแขนง ตลอด 24 ชั่วโมง - นพ.เทวเดช อัศดามงคล
นพ.เทวเดช อัศดามงคล ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบางมด กล่าวถึงการให้บริการที่สมบูรณ์แบบของโรงพยาบาลบางมดว่า “โรงพยาบาลบางมดไม่เพียงแต่จะให้บริการด้านศัลยกรรมที่โดดเด่นและเชี่ยวชาญแล้วนั้น โรงพยาบาลบางมด เป็นโรงพยาบาลทั่วไป ขนาดใหญ่ ที่ให้บริการรักษาโรค เช่น สูตินรีเวช ศัลยกรรมกระดูก ศัลยกรรมทั่วไป กุมารเวช 24 ชม. อายุรกรรม ตลอดจนนวัตกรรมผ่าตัดมดลูกผ่านช่องคลอด แบบไร้แผล
โรงพยาบาลบางมด เป็นโรงพยาบาลแห่งแรกบนถนนพระรามที่2 ให้บริการอุบัติเหตุ ฉุกเฉิน ตลอด 24 ชม. มีแพทย์ผู้เชี่ยวชาญดูแลเคสอุบัติเหตุ รวมถึงเคสศัลยกรรมกระดูก เช่น อุบัติเหตุจราจร การผ่าตัดเปลี่ยนข้อเข่าเทียม การผ่าตัดเส้นเอ็นไขว้หน้าขาด การผ่าตัดแก้ไขนิ้วล๊อก (ปลดล๊อก นิ้วล๊อก) ด้วยวิธีสะกิด ไม่ต้องผ่าตัด ในราคาเริ่มต้นเพียง 6,999 บาท ไม่ต้องนอนโรงพยาบาล สะกิดเสร็จกลับบ้านได้เลย
อีกทั้งเรายังมีนักกายภาพบำบัดผู้เชี่ยวชาญ รักษาอาการปวด จาก Office syndrome ซึ่งเรามีเครื่องมือแพทย์ที่ทันสมัย อาทิเช่น High power laser therapy สำหรับผู้ที่มีอาการปวดอักเสบเฉียบพลันหรือเรื้อรัง ในราคาเริ่มต้นเพียง 700 บาทต่อครั้งอีกด้วย และเรายังมีบริการตรวจสุขภาพครบวงจร เน้นเรื่องการดูแลสุขภาพเชิงป้องกัน เพื่อให้ท่านได้มีสุขภาพ พลานามัยที่สมบูรณ์ แข็งแรง สอดคล้องกับสถานการณ์ปัจจุบันที่เราเจอปัญหามลพิษทางอากาศ ฝุ่น PM 2.5, Covid-19 โรงพยาบาลบางมดมีเครื่อง CT Scan ที่ช่วยตรวจคัดกรองมะเร็งปอด โดยใช้วิธีเอกซเรย์คอมพิวเตอร์ปอดแบบใช้ปริมาณรังสีต่ำ ราคาพิเศษเพียง 2,500 บาท เพื่อตรวจหาความเสี่ยง และได้รับการรักษาที่ทันเวลา
จีนและเกาหลีเหนือวิจารณ์ญี่ปุ่นเรื่องการปล่อยน้ำบำบัดแล้วจากโรงไฟฟ้าที่ฟูกูชิมะ
จีนและเกาหลีเหนือวิพากษ์วิจารณ์ญี่ปุ่นที่การประชุมของคณะมนตรีความมั่นคงแห่งสหประชาชาติ เรื่องที่ญี่ปุ่นปล่อยน้ำซึ่งผ่านการบำบัดและเจือจางแล้วจากโรงไฟฟ้าพลังนิวเคลียร์ฟูกูชิมะไดอิจิที่เสียหาย ลงสู่มหาสมุทร ญี่ปุ่นปฏิเสธคำกล่าวหานี้และเรียกร้องให้ทั้งสองประเทศอ้างอิงคำกล่าวเหล่านี้ด้วยหลักฐานทางวิทยาศาสตร์
มีการเรียกประชุมฉุกเฉินเมื่อวันศุกร์ที่ 25 สิงหาคม เพื่อประณามความพยายามอันล้มเหลวของเกาหลีเหนือที่จะปล่อยดาวเทียมสอดแนมทางทหาร
นายคิม ซ็อง เอกอัครราชทูตเกาหลีเหนือประจำสหประชาชาติได้เน้นย้ำจุดยืนของเกาหลีเหนือว่า การปล่อยดาวเทียมดังกล่าวเป็นการใช้ “สิทธิอันชอบธรรม” เพื่อปกป้องอธิปไตยและผลประโยชน์ด้านความมั่นคงของเกาหลีเหนือ
เมื่อกล่าวถึงประเด็นเรื่องการปล่อยน้ำ นายคิม ซ็องกล่าวว่าคณะมนตรีความมั่นคงแห่งสหประชาชาติควรประณามสิ่งที่เขาเรียกว่า “อาชญากรรมอันเลวร้ายของญี่ปุ่นที่มีต่อมนุษยชาติ” ซึ่งเป็นอันตรายต่อความปลอดภัยและความมั่นคงของผู้คนทั้งหมดรวมถึงสภาพแวดล้อมด้านนิเวศวิทยาทางทะเลด้วย
อิชิกาเนะ คิมิฮิโระ เอกอัครราชทูตญี่ปุ่นประจำสหประชาชาติได้ตอบว่า คำกล่าวหาใด ๆ ก็ตามซึ่งขาดหลักฐานทางวิทยาศาสตร์ ไม่สามารถยอมรับได้
เก็ง ส่วง รองผู้แทนถาวรจีนประจำสหประชาชาติ ได้ร่วมกับเกาหลีเหนือในการวิจารณ์ญี่ปุ่น โดยกล่าวว่าเขาต้องการใช้โอกาสนี้อธิบายจุดยืนของจีน
จากนั้น ทูตของเกาหลีเหนือได้กล่าวอีกครั้งและขอให้ระงับการปล่อยน้ำ อิชิกาเนะได้อธิบายต่อมาว่า น้ำดังกล่าวผสมกับน้ำทะเลปริมาณมากและเจือจางเพื่อลดระดับของทริเทียมแล้ว
ท้ายที่สุดแล้ว ระดับของทริเทียมจะอยู่ที่ประมาณหนึ่งในเจ็ดของปริมาณที่องค์การอนามัยโลกอนุญาตไว้เพื่อเป็นแนวทางสำหรับความปลอดภัยของน้ำดื่ม
สัญญาณเตือนอาการโรคไข้เลือดออก
.มีอาการไข้สูงลอย 2 วัน
.ปวดศีรษะ ปวดกล้ามเนื้อ
.มีจุดแดงขึ้นเล็กๆ ตามตัว
.คลื่นไส้อาเจียน
.อุจจาระสีดำหรือมีเลือด
ห้ามซื้อยา Nsaids เช่น ไอบูโพรเฟน แอสไพริน ยาชุด มากินเองเด็ดขาด
ควรรีบไปพบแพทย์เพื่อวินิจฉัยและรักษาให้เร็วที่สุด
สัญญาณเตือนอาการโรคไข้เลือดออก
.มีอาการไข้สูงลอย 2 วัน
.ปวดศีรษะ ปวดกล้ามเนื้อ
.มีจุดแดงขึ้นเล็กๆ ตามตัว
.คลื่นไส้อาเจียน
.อุจจาระสีดำหรือมีเลือด
ห้ามซื้อยา Nsaids เช่น ไอบูโพรเฟน แอสไพริน ยาชุด มากินเองเด็ดขาด
ควรรีบไปพบแพทย์เพื่อวินิจฉัยและรักษาให้เร็วที่สุด
โรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ หัวหิน
ถนนเพชรเกษม ตำบลหนองแก อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์ 77110
โทรศัพท์ 032-909234-5
เปิดให้บริการ
จันทร์-พฤหัส 08.30 น. - 16.00 น.
ศุกร์ 08.30 น. - 11.30 น.
เสาร์-อาทิตย์ และวันหยุดราชการ 08.30 น. - 16.00 น.
คลินิกนอกเวลาราชการ 17.00 น. - 19.30 น.
Facebook |
Website |
แผนที่
พื้นที่ของโครงการ After School Program เพื่อขยายกรอบโอกาสทางการศึกษาของทุกคนให้กว้างกว่าเดิม
การสร้างพื้นที่ของโครงการ After School Program เพื่อขยายกรอบโอกาสทางการศึกษาของทุกคนให้กว้างกว่าเดิม ไม่เพียงแต่ส่งต่อโอกาสให้เด็กๆ ในห้องเรียนเท่านั้น แต่นักเรียนมัธยม นักศึกษามหาวิทยาลัย หรือแม้กระทั่งพนักงานบริษัทในอุตสาหกรรมพลังงานอย่างเชฟรอนยังได้มีโอกาสเป็นหนึ่งในฟันเฟืองเพื่อสร้างโอกาสในระบบการศึกษาไปพร้อมกัน โดยการที่เชฟรอนมุ่งผลักดันให้บุคลากรในทุกระดับมีส่วนร่วมในกิจกรรมเพื่อสังคมนั้น ได้เปิดมุมมองใหม่ๆ อย่างคาดไม่ถึงให้พนักงานได้สัมผัสประสบการณ์นอกเหนือจากงานประจำที่ได้ทำ ซึ่งการเชื่อมั่นใน “พลังคน” ของเชฟรอน ได้ถ่ายทอดสู่พนักงานจนได้ก้าวขึ้นมาเป็นส่วนหนึ่งของการสร้างโอกาสที่ยิ่งใหญ่ ผ่านหลักสูตร “หลังเลิกเรียน” ที่ได้จุดประกายการศึกษาไทยสู่อนาคตที่ยั่งยืน นอกจากนี้ ได้รับเกียรติจาก อาจารย์พชรพล พะระรามันห์ ผู้เชี่ยวชาญด้านการพัฒนาอาหารในชุมชน เพื่อค้นหาของดีในชุมชนที่สามารถนำไปพัฒนาเพื่อให้เกิดประโยชน์ ในการดูแลสุขภาพนำไปสู่การสร้างรายได้ที่ยั่งยืน ทั้งนี้อาสาจุฬาภรณ์ได้ค้นพบสิ่งที่สามารถนำไปพัฒนาต่อยอดมากกว่า 10 อย่าง เช่น การนำพืชสมุนไพรในชุมชน มาทำเป็นผลิตภัณฑ์เพื่อสุขภาพ และสร้าง Gastronomy Tourism เพื่อสนับสนุนการท่องเที่ยวบริเวณรอบชุมชนอีกด้วย ฯลฯ ท้ายสุดอาสาจุฬาภรณ์ยังได้ระดมความคิดเสนอโครงการพัฒนาสุขภาพในชุมชน เช่น โครงการรำกลองยาวเพื่อสุขภาพ บาสโลปเพื่อสุขภาพกายและใจที่ดี และ โครงการหมอมาแล้ว ฯลฯ
3 เรื่องต้องรู้ ไม่หลงกล แก๊งหลอกเปิดบัญชีลงทุน
3 เรื่องต้องรู้ ไม่หลงกล แก๊งหลอกเปิดบัญชีลงทุน
เช็ค 3 สิ่งนี้ ก่อนจะคิดส่งข้อมูลส่วนตัวออกไป
1. การเปิดบัญชีออนไลน์
• เปิดบัญชีกับผู้ประกอบธุรกิจ หรือ บริษัทหลักทรัพย์ที่ได้รับอนุญาตจาก ก.ล.ต. เท่านั้น
• ไม่ส่งข้อมูลส่วนตัวหรือเปิดบัญชีผ่านบุคคลที่ไม่น่าเชื่อถือ
2. การโอนเงินเข้าบัญชีซื้อขาย
• โอนเงินลงทุนเข้าบัญชีบริษัทหลักทรัพย์เท่านั้น
• ไม่ฝากหรือโอนเงินลงทุนเข้าบัญชีส่วนตัวของบุคคลเด็ดขาด
3. ช่องทางการซื้อขาย
• ดาวน์โหลด Application การลงทุนผ่านทาง App Store หรือ Google Play เท่านั้น
• ไม่กดดาวน์โหลดโปรแกรมจากสิงก์ที่ไม่น่าเชื่อถือ
งานวิจัยเผยสารสกัดจาก เห็ดเมา มีส่วนช่วยรักษาโรคซึมเศร้าได้ หากใช้ร่วมกับการทำจิตบำบัด -
Workpoint Today เผยแพร่บทความ เรื่องผลการทดลองวิจัย การใช้สารสกัดจากเห็ดเมา รักษาผู้ป่วยโรคซึมเศร้า
1 ใน 3 ของผู้ป่วยโรคซึมเศร้าหายเป็นปกติใน 3 สัปดาห์ หลังใช้ยาที่มีสารสกัดจากเห็ดเมาภายใต้การดูแลของนักจิตบำบัด
งานวิจัยที่ได้รับการตีพิมพ์ลงในวารสารทางการแพทย์ New England Journal of Medicine ลงวันที่ 3 พ.ย. 2022 เผยถึงผลการศึกษาในการนำไซโลไซบิน (Psilocybin) ซึ่งเป็นสารสกัดจากเห็ดเมา หรือ เห็ดขี้ควาย (Magic Mushroom) มาใช้ในการบำบัดผู้ป่วยโรคซึมเศร้าขั้นรุนแรง
การทดสอบครั้งนี้มีอาสาสมัคร 233 คน จาก 10 ประเทศในยุโรปและอเมริกาเหนือเข้าร่วม โดยทีมวิจัยได้ใช้ยา Comp360 psilocybin ขนาด 1 มิลลิกรัม 10 มิลลิกรัม และ 25 มิลลิกรัม ร่วมกับการทำจิตบำบัด (Psychotherapy) ในผู้ป่วย ซึ่งส่วนใหญ่อยู่ในวัย 40 ปี และมีอาการซึมเศร้าขั้นรุนแรงมาเป็นเวลากว่า 1 ปี
วิธีการรักษาคือ หลังจากให้ยาแล้ว จะให้ผู้ป่วยนอนลงบนเตียงภายในห้องที่เงียบสงบ จากนั้นผู้ป่วยจะอยู่ในสภาวะผ่อนคลาย และมีอาการคล้ายกับการฝันในขณะที่ยังตื่นอยู่ เป็นเวลา 6-8 ชั่วโมง
ผลการทดลองสรุปว่า ตัวยาขนาด 25 มิลลิกรัมให้ผลลัพธ์ที่ดีที่สุด โดย 1 ใน 3 ของกลุ่มตัวอย่างได้รับการวินิจฉัยว่าหายจากโรคซึมเศร้าใน 3 สัปดาห์ ขณะที่ 1 ใน 5 มีอาการดีขึ้นอย่างเห็นได้ชัดใน 12 สัปดาห์
ดร.เจมส์ รัคเกอร์ หนึ่งในทีมวิจัย ได้เปิดเผยกับทางสำนักข่าวบีบีซีว่า การใช้ยา Comp360 psilocybin สามารถทำให้อาการดีขึ้นได้มาก แต่ก็สามารถส่งผลเสียได้เช่นกัน อย่างเช่นในกรณีที่นึกถึงความทรงจำอันเจ็บปวดในอดีตขึ้นมา จึงต้องมีนักจิตบำบัดคอยอยู่ด้วยตลอด
ปัจจุบันคาดว่ามีผู้ป่วยโรคซึมเศร้าขั้นรุนแรงราว 100 ล้านคนทั่วโลก ที่ไม่ตอบสนองต่อการรักษาใดๆ ที่มีอยู่ และมีถึง 30% ที่พยายามฆ่าตัวตาย
แพ็กเกจวัคซีนผู้สูงอายุ เกษมราษฎร์ บางแค
วัคซีนไข้หวัดใหญ่ควรฉีดทุกปี วัคซีนไอพีดีป้องกันปอดบวม เยื้อหุ้มสมองอักเสบ หูอักเสบ หมายเหตุสามารถฉีดกระตุ้นได้ทุก 5 ปี หรือตามแพทย์สั่ง ราคานี้รวมค่าแพทย์และค่าบริการโรงพยาบาลแล้ว ระยะเวลา วันนี้-31 ธันวาคม 2566 สอบถามเพิ่มเติม 02-804-8959 ต่อ 5038.5053 (ศูนย์ตรวจสุขภาพ)
Vaccine HPV ป้องกันโรคมะเร็งปากมดลูก โรงพยาบาลหัวเฉียว
HPV 4 สายพันธุ์ และ 9 สายพันธุ์
4 สายพันธุ์ - 2 เข็ม (9-14 ปี) 6,000 บาท 3 เข็ม (15 ปีขึ้นไป) 8,700 บาท
* 2 สายพันธุ์ เป็นสาเหตุมะเร็งปากมดลูกและทวารหนัก 2 สายพันธุ์ เป็นสาเหตุเกิดหูดอวัยวะเพศ
9 สายพันธุ์ - 2 เข็ม (9-14 ปี) 14,000 บาท 3 เข็ม (15 ปีขึ้นไป) 20,000 บาท
* 7 สายพันธุ์ เป็นสาเหตุมะเร็งปากมดลูกและทวารหนัก 2 สายพันธุ์ เป็นสาเหตุเกิดหูดอวัยวะเพศ
สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกลูกค้าสัมพันธ์ โทร. 02223-1351 ต่อ 3126
วัคซีนป้องกัน โรคมือเท้าปาก โรงพยาบาลศิครินทร์ กรุงเทพฯ
โรงพยาบาลศิครินทร์ กรุงเทพฯ มีวัคซีนป้องกันโรคมือเท้าปาก รุนแรง จากไวรัส EV71 วัคซีนป้องกันโรคมือเท้าปาก EV71 (2 เข็ม) 6,200 บาท วัคซีนป้องกันโรคมือเท้าปาก EV71 (1 เข็ม) 3,200 บาท โปรโมชั่นตั้งแต่วันนี้ - 31 ธันวาคม 2566 ราคาดังกล่าวรวมค่าวัคซีน และค่าเวชภัณฑ์แล้ว แต่ยังไม่รวมค่าแพทย์ และค่าบริการโรงพยาบาล ใช้ได้เฉพาะที่โรงพยาบาลศิครินทร์ กรุงเทพฯ เท่านั้น
*วัคซีนนี้ไม่สามารถใช้เพื่อป้องกันโรคมือ เท้า ปาก ที่มีสาเหตุจากเชื้อเอนเทอโรไวรัสชนิดอื่น (รวมถึง Coxasackie Virus A16 และอื่นๆ)
ขั้นตอนการตรวจสุขภาพ
ควรได้รับ 2 เข็ม โดยเว้นระยะห่างจากเข็มแรก 1 เดือน
วัคซีนสำหรับเด็กอายุ 6 เดือน – 5 ปี
สอบถามรายละเอียดเพิ่มเติมติดต่อสถาบันกุมารเวช อาคาร 1 ชั้น 2 โทร.1728 ต่อ 10240, 10241
สำนักงานป้องกันควบคุมโรคที่ 4 สระบุรี
ยุติธรรม เร่งกรมคุ้มครองสิทธิฯ เยียวยาเหยื่อ
รมว.ยุติธรรม เร่งกรมคุ้มครองสิทธิฯ เยียวยาเหยื่อกราดยิงที่สยามพารากอน
จากเหตุระทึกยิงกลางห้างสยามพารากอน พันตำรวจเอก ทวี สอดส่อง รัฐมนตรีว่าการกระทรวงยุติธรรม ได้แสดงความเสียใจต่อเหตุการณ์ที่เกิดขึ้น พร้อมสั่งการให้กรมคุ้มครองสิทธิและเสรีภาพ เร่งช่วยเหลือเยียวยาแก่ผู้เสียชีวิตและผู้บาดเจ็บโดยเร็ว
ตามพระราชบัญญัติค่าตอบแทนผู้เสียหายและค่าทดแทนและค่าใช้จ่ายแก่จำเลยในคดีอาญา พ.ศ. 2544 และที่แก้ไขเพิ่มเติม (ฉบับที่ 2) พ.ศ.2559 นั้น
- กรณีเสียชีวิต มีสิทธิได้รับ ค่าตอบแทนกรณีถึงแก่ชีวิต 100,000 บาท, ค่าจัดการศพ 20,000 บาท, ค่าขาดอุปการะเลี้ยงดู 40,000 บาท และค่าเสียหายอื่น 40,000 บาท ทั้งนี้ เนื่องกรณีดังกล่าว เป็นคดีอุจฉกรรจ์ สะเทือนขวัญ สาธารณชน สามารถจ่ายสูงสุดตามกฎหมาย รวม 200,000 บาท
- ส่วนกรณีบาดเจ็บ มีสิทธิได้รับ ค่ารักษาพยาบาล ไม่เกิน 40,000 บาท, ค่าฟื้นฟูสมรรถภาพ ร่างกายและจิตใจ ไม่เกิน 20,000 บาท, ค่าขาดประโยชน์ทำมาหาได้ ตามอัตราค่าจ้างขั้นต่ำไม่เกิน 1 ปี ในกทม.วันละ 353 บาท และค่าตอบแทนความเสียหายอื่น ไม่เกิน 50,000 บาท
.
ทั้งนี้ การจ่ายค่าตอบแทนฯ ขึ้นอยู่กับดุลพินิจในการพิจารณาของคณะกรรมการ ซึ่งกระทรวงยุติธรรม จะเร่งดำเนินการให้การช่วยเหลือเยียวยาอย่างเร็วที่สุด โดยตามกฎหมายนี้ จะให้การช่วยเหลือแก่ชาวไทยและชาวต่างชาติอย่างเท่าเทียมกัน และขอให้เชื่อมั่นว่ารัฐบาลไทยให้ความสำคัญต่อการคุ้มครองสิทธิของทุกคนที่ประสบเหตุในประเทศไทยไม่เลือกปฏิบัติ
คณะทันตแพทยศาสตร์ มหาวิทยาลัยขอนแก่น ทำฟันฟรี 20 ตุลาคม 2566
เนื่องในวันคล้ายวันพระราชสมภพสมเด็จพระศรีนครินทราบรมราชชนนีและงานทันตสาธารณสุขแห่งชาติ คณะทันตแพทยศาสตร์ มหาวิทยาลัยขอนแก่น กำหนดเปิดให้บริการทางทันตกรรม โดยไม่คิดค่าใช้จ่าย.. วันศุกร์ที่ 20 ตุลาคม 2566 เริ่ม 08.00 - 14.00 น. (วันเดียวเท่านั้น) เปิดให้บริการ ผู้ป่วย 1 รายต่อ 1 งาน ▶️ อุดฟัน ▶️ ขูดหินปูน ▶️ ถอนฟัน/ผ่าฟันคุด ▶️ ทันตกรรมสำหรับเด็ก (มาพร้อมกับผู้ปกครอง) - อุดฟัน เคลือบหลุมร่องฟัน - ถอนฟัน - รักษารากฟัน - ขัดฟัน เคลือบฟลูออไรด์ ภายในงานมีนิทรรศการงานทันตสาธารณสุขและให้ความรู้ในการดูแลสุขภาพช่องปาก
นายอนุชา เตยแก้ว เจ้าหน้าที่สารสนเทศดาราศาสตร์ หอดูดาวเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา สงขลา กล่าวเสริมว่า “เพราะดาราศาสตร์เป็นสิ่งที่อยู่รอบตัวของทุกคน ยิ่งเราจุดประกายการเรียนรู้ให้แก่น้อง ๆ เยาวชนมากเท่าไหร่ ก็เป็นจุดเริ่มต้นที่ทำให้เด็ก ๆ เรียนรู้อย่างสนุกสนานจากสิ่งที่อยู่ใกล้ตัวมากขึ้นเท่านั้น ซึ่งนอกจากหอดูดาวฯ สงขลาจะเป็นหอดูดาวภูมิภาคสำหรับประชาชนที่สำคัญในภาคใต้แล้ว เรายังมุ่งเปิดโอกาสให้เยาวชนและประชาชนเรียนรู้ผ่านเทคโนโลยีใหม่ๆ โดยตรงทั้งการบริการในส่วนพื้นที่หอดูดาวเอง และการกระจายโอกาสผ่านการลงพื้นที่ชุมชนต่างๆ ซึ่งเราผลักดันการใช้โจทย์วิจัยแนวหน้าในการพัฒนาเทคโนโลยีและเทคนิควิศวกรรมขั้นสูงอยู่เสมอ จุดนี้เอง ผมหวังว่าจะช่วยเปิดโอกาสให้กับเยาวชนรุ่นใหม่ได้อย่างดี เพื่อที่เด็กๆ เหล่านี้จะเติบโตไปเป็นส่วนหนึ่งในการพัฒนาเทคโนโลยีและประเทศในอนาคต”
คลินิกทันตกรรม
คลินิกทันตกรรม ศูนย์บริการสาธารณสุข 39 ราษฎร์บูรณะ โทร. 0-24277949#105 งานบริการทันตกรรม อื่นๆ ที่ดำเนินการ
-งานเคลือบหลุมร่องฟันในโรงเรียน
-ฝึกแปรงฟันในโรงเรียน
-อบรมอาสาสมัครสาธารณสุขประจำโรงเรียน
-เคลือบฟลูออไรด์วานิชในศูนย์พัฒนาเด็กเล็ก
-สอนทันตสุขศึกษาในชุมชน
-คลินิกทันตกรรมเลิกบุหรี่
-ประกวดสุขภาพฟันผู้สูงอายุ
-ประกวดสุขภาพเด็กฟันดี
-ประกวดศูนย์พัฒนาเด็กเล็ก
-โครงการคนกรุงเทพรักฟัน
-โครงการขูดหินปูนในหญิงตั้งครรภ์ฟรี
-กิจกรรมวันทันตสาธารณสุข
-สนับสนุนสื่อทันตสาธารณสุข
-ออกหน่วยทันตกรรมเคลื่อนที่
-เผยแพร่ความรู้ด้านทันตกรรม
คลินิกสุขภาพสตรี (Women’s Health Clinic)
คลินิกสุขภาพสตรี (Women’s Health Clinic) ศบส.39 เปิดให้บริการวันพุธ เวลา 13.00 น. – 12.00 น. ให้บริการดูแลสุภาพสตรีให้คำปรึกษา และตอบคำถาม ตั้งแต่การวินิจฉัย ตรวจรักษาทางด้านนรีเวช รวมถึงดูแลสตรีตั้งแต่เตรียมตัวเป็นคุณแม่ไปจนถึงหลังคลอด เพื่อสร้างความมั่นใจและคลายความกังวล ได้แก่
- สูติ-นรีเวชทั่วไป เช่น ภาวะผิดปกติของการมีประจำเดือน ปวดประจำเดือน ปวดท้องน้อย ตกขาว ฯลฯ
- รักษาผู้มีปัญหานรีเวช ด้วยการผ่าตัดเปิดผนังท้องและผ่าตัดผ่านกล้องรักษาโรคทางนรีเวช เช่น เนื้องอกอวัยวะสืบพันธุ์สตรี การขูดมดลูก
- คลินิกฮอร์โมนสตรี เช่น ฉีดยาคุมกำเนิด
- การป้องกันโรคด้วยวัคซีน เช่น การฉีดวัคซีนป้องกันมะเร็งปากมดลูก
- แนะนำให้คำปรึกษาวางแผนครอบครัวตรวจสุขภาพก่อนแต่งงาน เพื่อเตรียมความพร้อมก่อนแต่งงานและวางแผนการตั้งครรภ์
- ดูแลการฝากครรภ์ ให้คำปรึกษาการเตรียมตัวสำหรับการเป็นคุณแม่ รวมถึงการคุมกำเนิดวิธีต่างๆ หลังคลอดบุตร
- ตรวจเลือดคัดกรอง ความเสี่ยงภาวะดาวน์ซินโดรม เป็นต้น
คลินิกตะวันใหม่
คลินิกตะวันใหม่
- คลินิกตะวันใหม่ ในเวลาราชการ 08.00 - 16.00 น.
- คลินิก BKK Pride , คลินิก PEP/PrEP ในเวลาราชการ 08.00 - 16.00 น. นอกเวลาราชการ เวลา 16.00 - 20.00 น.
- คลินิกรักษ์เพื่อน นอกเวลาราชการ 16.00 - 20.00 น.
คลินิกผู้สูงอายุ
- คลินิกผู้สูงอายุ ในเวลาราชการ 08.00 น. - 16.00 น.
คลินิกจิตเวช
- คลินิกจิตเวช ในเวลาราชการ 08.00 น. - 16.00 น. นอกเวลาราชการ 16.00 - 20.00 น.
คลินิกประกันสังคม
- คลินิกประกันสังคม ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) และคลินิกประกันสังคมบ่าย เวลา 13.00 น. - 16.00 น. (บ่าย)
ความเสี่ยงของการเกิด VTE ในผู้ป่วยหลังการผ่าตัดจะไม่เท่ากัน - รศ.พญ. ปิยนุช พูตระกูล
รศ.พญ. ปิยนุช พูตระกูล ภาควิชาศัลยศาสตร์ โรงพยาบาลรามาธิบดี ได้แชร์ข้อมูลและสถิติที่น่าสนใจว่า ความเสี่ยงของการเกิด VTE ในผู้ป่วยหลังการผ่าตัดจะไม่เท่ากัน ขึ้นอยู่กับปัจจัยทางหัตถการและปัจจัยจากตัวผู้ป่วยเองด้วย โดยหัตถการที่มีความเสี่ยงสูงในการเกิด VTE คือ การเปลี่ยนข้อสะโพกและข้อเข่า และการผ่าตัดระบบประสาท นอกจากนี้ ระยะเวลาของการผ่าตัด ระดับความรุนแรงของเนื้อเยื่อที่ได้รับบาดเจ็บและระยะเวลาที่ไม่ได้ลุกเดินหลังผ่าตัด ก็ส่งผลต่อการเกิดภาวะ VTE ด้วยเช่นกัน
ทุกวันนี้ วงการแพทย์สามารถป้องกันการเกิด VTE ในผู้ป่วยผ่าตัดได้หลายวิธี เช่น การให้ยาต้านการแข็งตัวของเลือด ปัจจุบันการป้องกันภาวะลิ่มเลือดอุดตันด้วยยาในโรงพยาบาลทำได้ด้วยการใช้ยาฉีดและยารับประทานเพื่อป้องกันการแข็งตัวของเลือด การพยายามให้ผู้ป่วยเคลื่อนไหว การใส่เครื่องกระตุ้นบีบนวดกล้ามเนื้อบริเวณขา ใส่ถุงน่องทางการแพทย์ หรือลุกเดินอย่างเหมาะสม รวมถึงการให้ความรู้แก่ผู้ป่วยเกี่ยวกับการป้องกัน โดยโรงพยาบาลรามาธิบดี ได้นำร่องการทำแบบประเมินความเสี่ยงของผู้ป่วยก่อนการผ่าตัด โดยระบุว่าผู้ป่วยคนไหนที่มีความเสี่ยงในการเกิด VTE และให้การป้องกันอย่างเหมาะสมเพื่อให้ผู้ป่วยปลอดภัยจากภาวะ VTE มากที่สุด ยาฉีดคาดว่าจะเป็นทางเลือกหนึ่งที่มีความเหมาะสมกับสภาพผู้ป่วยที่เข้ารับการรักษาในโรงพยาบาล หรือฉีดต่อเนื่องที่บ้านมีประสิทธิภาพและมีความปลอดภัยกับผู้ป่วยทุกกลุ่ม ทั้งผู้ป่วยโรคมะเร็ง ผู้ป่วยผ่าตัด และหญิงตั้งครรภ์ ซึ่งชนิดของยาฉีดบางตัวบรรจุอยู่ในบัญชียาหลักแห่งชาติแล้ว ครอบคลุมสิทธิการเบิกจ่ายทุกสิทธิทั้งบัตรประกันสุขภาพ ประกันสังคม และข้าราชการ
จุดบริการรถรับ-ส่งนักท่องเที่ยว เพื่อเข้าชมพลุเทศกาลพลุนานาชาติเมืองพัทยา 24-25 พ.ย. นี้
จุดบริการรถรับ-ส่งนักท่องเที่ยว เพื่อเข้าชมพลุเทศกาลพลุนานาชาติเมืองพัทยา 24-25 พ.ย. นี้
ทุกเส้นทางเริ่มบริการเวลา 15.00-1.00 น. จุดต่างๆ ดังนี้
ฝั่งพัทยาเหนือ
เริ่มต้น วัดหนองใหญ่ ถ.สุขุมวิท
จุดแวะรับส่ง เมืองพัทยา ถ.พัทยาเหนือ
จุดปลายทาง วงเวียนปลาโลมา พัทยาเหนือ
ฝั่งพัทยาใต้
เริ่มต้น โลตัสเทพประสิทธิ์ ถ.สุขุมวิท
จุดแวะรับส่ง บิ๊กซี พัทยาใต้
จุดปลายทาง โรงเรียนเมืองพัทยา 8 พัทยาใต้
สรุปสถานการณ์ผลกระทบต่อคนไทย (สถานะวันที่ 1 พ.ย. 66)
สรุปสถานการณ์ผลกระทบต่อคนไทยจากสถานการณ์อิสราเอล-กาซา (สถานะวันที่ 1 พ.ย. 66)
มีคนไทยเสียชีวิต - 32 ราย (คงเดิม) บาดเจ็บ - 19 ราย (คงเดิม) ยังรักษาตัวอยู่ใน รพ. 4 ราย ถูกจับกุม - 22 ราย (คงเดิม)
จนถึงวันนี้ สถานทูตได้ช่วยเหลือคนไทยให้กลับถึงประเทศไทยแล้วรวม 33 เที่ยวบิน จำนวนผู้ได้รับการช่วยเหลือ 7,282 คน
ชุมชนคนรักน้องหมาไม่เพียงต้อนรับคนไทย แต่ชาวต่างชาติให้มาใช้สถานที่จำนวนไม่น้อย นักท่องเที่ยวที่มาเดินเที่ยวชม ก็มีความสนุกเพลิดเพลินทักทายกัน
คุณโทโมคาสึ สึนากะ จากร้าน“อาโอยางิ เซอิเกะ” จังหวัดโตเกียว
คุณโทโมคาสึ สึนากะ จากร้าน“อาโอยางิ เซอิเกะ” จังหวัดโตเกียว ร้านขนมญี่ปุ่นดั้งเดิมผลิตขนมญี่ปุ่นแสนอร่อยที่มีคุณภาพและเป็นที่โปรดปรานของคนในท้องถิ่น มีชื่อเสียงในฐานะร้านขนมโยคังที่ก่อตั้งมายาวนาน เป็นที่เคารพนับถือจากร้านโยคังทั่วประเทศตั้งแต่ฮอกไกโดถึงโอกินาว่า และเป็นเหมือนพี่ใหญ่ที่จะเป็นผู้นำของรุ่นต่อไป
ที่ผ่านมา โนโว นอร์ดิสค์ ทำงานร่วมกับพันธมิตรเพื่อสร้างสภาพแวดล้อมในเมืองที่ดีต่อสุขภาพ ซึ่งออกแบบมาเพื่อป้องกันโรคอ้วนและโรคเบาหวาน โดยจัดการกับอุปสรรคต่อสุขภาพและขับเคลื่อนการเปลี่ยนแปลงอย่างเป็นระบบในกว่า 40 เมืองทั่วโลก
ในประเทศไทย โนโว นอร์ดิสค์ ได้ดําเนินธุรกิจในประเทศไทยมาเป็นเวลา 40 ปี โดยนําผลิตภัณฑ์และนวัตกรรมในการรักษาโรคมาปรับใช้ เพราะเชื่อว่าจะช่วยยกระดับคุณภาพชีวิตผู้ป่วย มุ่งมั่นค้นหาผลิตภัณฑ์ใหม่ผ่านการวิจัยทางคลินิกอย่างต่อเนื่อง โรคอ้วนเป็นเรื่องที่ควรให้ความสำคัญในการรักษาเพราะโรคอ้วนเป็นสาเหตุนําไปสู่โรคอื่นอีกกว่า 200 โรค จึงควรผลักดันให้เป็นวาระเร่งด่วน เพื่อป้องกันภาระทางสุขภาพในอนาคตทั้งทางตรงและทางอ้อมเพื่อให้คนรุ่นต่อไปได้รับการดูแลสุขภาพที่ดีขึ้นอย่างยั่งยืน
ศ. เกียรติคุณ พญ.วรรณี นิธิยานันท์ นายกสมาคมโรคเบาหวานแห่งประเทศไทย กล่าวว่า ความชุกของโรคเบาหวานชนิดที่ 2 ที่เกิดจากปัญหาโรคอ้วนและพฤติกรรมการใช้ชีวิตมีแนวโน้มเพิ่มขึ้นเป็นลำดับ โดยมีอัตราผู้ป่วยรายใหม่ประมาณหนึ่งแสนคนต่อปี ในปัจจุบันมีคนไทยเป็นโรคเบาหวานอยู่ประมาณ 5.2 ล้านคน หรือ 1 ใน 11 คนไทยที่อายุ 15 ปีขึ้นไป กำลังป่วยด้วยโรคเบาหวาน ในจำนวนนี้กว่า 40% ที่ไม่รู้ว่าตัวเองป่วย ขณะที่ผู้ได้รับการวินิจฉัยและดูแลรักษามีเพียง 54.1% หรือเพียง 2.8 ล้านคน ในจำนวนนี้มีเพียง 1 ใน 3 คน ที่สามารถบรรลุเป้าหมายในการรักษา ทำให้อัตราการเสียชีวิตจากโรคเบาหวานในไทยมีมากถึง 200 รายต่อวัน เชื่อว่าการผนึกกำลังของทุกฝ่ายเพื่อร่วมกันแก้ไขปัญหาคือทางออกที่ดีที่จะช่วยลดอัตราผู้ป่วยเบาหวาน โรคอ้วน และโรค NCDs เพื่อยกระดับคุณภาพชีวิตความเป็นอยู่ของผู้ป่วยและสังคมไทยให้ดีขึ้นอย่างยั่งยืน สอดคล้องกับ 9 เป้าหมายการดำเนินงานขององค์การอนามัยโลก (WHO) ในการป้องกันควบคุมสถานการณ์โรคไม่ติดต่อในระดับโลก ภายในปี 2568
ทรงตัวได้ สุขภาพดี
ในอนาคต อาจารย์ชัชนีตั้งใจต่อยอดพัฒนาอุปกรณ์วิเคราะห์การทรงตัวให้สามารถขยายผลการวิเคราะห์ข้อมูล เช่น ระบบสายตา ระบบประสาทส่วนกลาง ระบบประสาทรับรู้ความรู้สึก ระบบหู และระบบต่าง ๆ ที่มีเชื่อมโยงและส่งผลต่อการทรงตัว
“นวัตกรรมนี้เป็นเครื่องมือเบื้องต้น ที่ช่วยเหลือการทำงานของแพทย์ในการคัดกรองสภาวะเสี่ยงล้มในผู้สูงอายุ ใคร ๆ ก็สามารถใช้ได้เพื่อตรวจรู้การทรงตัวและสภาวะของตัวเอง นับเป็นการช่วยลดภาระแพทย์ได้มาก และคนในสังคมจะมีสุขภาวะที่ดีขึ้น”
ผู้ที่สนใจนวัตกรรมเครื่องวิเคราะห์การทรงตัว สามารถติดต่อได้ที่ อาจารย์ชัชนี ทางอีเมล somdesignup@gmail.com หรือ Facebook Page: Design Up หรือ LINE Official Account: Design Up (https://lin.ee/UsxvGgv)
เทศกาลชมดอกทิวลิป ฟาร์มดอกไม้เมืองหนาว ระยอง
Miracle of Natural เทศกาลชมดอกทิวลิป ฟาร์มดอกไม้เมืองหนาว Flora Exhibition Hall จ.ระยอง เริ่มเปิดวันที่ 8 พฤศจิกายน 2566 เปิดวันจันทร์-เสาร์ เวลา 9:30-16:00 น. หยุดวันอาทิตย์และวันหยุดนักขัตฤกษ์ เยี่ยมชมฟรีไม่มีค่าใช้จ่าย (กรุ๊ปทัวร์และบุคคลที่ต้องการถ่ายรูปเชิงพาณิชย์ต้องแจ้งล่วงหน้า) ปีนี้มาพร้อมทิวลิปสุดแสนอลังการที่บานพร้อมกันมากกว่า 40,000 ดอก หยิบเสื้อหนาวแสนเก๋แล้วออกไปถ่ายรูปกัน [
facebook]
ค่าคลอดบุตร
ค่าคลอดบุตร สอบถามเพิ่มเติม ห้องตรวจสูตินรีเวชกรรม โทร. 02-2008000 ต่อ 10350-52
ข้อคำถาม
Q1: ในกรณีให้วัคซีนในรูปแบบนักเรียนในเด็กหญิงไทยชั้นประถมศึกษาปีที่ 5 พบว่า มีนักเรียนหญิงอายุไม่ถึง 11 ปี สามารถฉีดวัคซีนได้หรือไม่
A1: สามารถพิจารณาให้วัคซีนได้ตามรูปแบบการให้วัคซีนนักเรียนตามปกติโดยมีช่วงอายุผู้รับวัคซีนตามที่ ระบุไว้ในเอกสารกำกับยา
Q2: หญิงที่มีเพศสัมพันธ์มาก่อน สามารถฉีดวัคซีนได้หรือไม่
A2: การมีเพศสัมพันธ์ไม่เป็นข้อห้ามของการฉีดวัคซีน HPV แต่การฉีดวัคซีน HPV ในหญิงที่ไม่เคยมีเพศสัมพันธ์จะมีประสิทธิภาพสูงกว่าหญิงที่เคยมีเพศสัมพันธ์
Q3: การฉีดวัคซีน HPV ต้องมีการขอความยินยอมจากผู้ปกครองก่อนหรือไม่ และกรณีที่ผู้ปกครองของเด็กไม่ยินยอมให้เด็กฉีดวัคซีน มีวิธีการดำเนินการอย่างไร
A3: การฉีดวัคซีนในเด็กที่ยังไม่บรรลุนิติภาวะ จำเป็นต้องได้รับความยินยอมจากผู้ปกครอง ทั้งนี้ การรับวัคซีนให้เป็นไปตามความสมัครใจของผู้ปกครองและเด็กกลุ่มเป้าหมาย
Q4: หญิงที่มีประวัติการได้รับวัคซีนครบ 2 เข็ม จำเป็นต้องฉีดวัคซีนอีกหรือไม่
A4: มีประวัติได้รับวัคซีน 2 เข็ม ระยะห่างระหว่างเข็ม 6 เดือนขึ้นไป ไม่จำเป็นต้องฉีดวัคซีนเพิ่ม
แต่ถ้าได้รับวัคซีน 2 เข็ม ระยะห่างน้อยกว่า 6 เดือน ให้ฉีดวัคซีน HPV จำนวน 1 เข็ม ห่างจากเข็มล่าสุดอย่างน้อย 6 เดือน
Q5: การฉีดวัคซีน HPV ตามนโยบายกระทรวงสาธารณสุข ฉีดให้เฉพาะในเด็กที่อยู่ระบบการศึกษาเท่านั้นใช่หรือไม่
A5: กระทรวงสาธารณสุขมีนโยบายให้ฉีดวัคซีน HPV ในกลุ่มเป้าหมายทั้งที่อยู่ในระบบการศึกษาภาครัฐและเอกชน และกลุ่มเป้าหมายนอกระบบการศึกษา โดยสามารถพิจารณาดำเนินงานตามบริบทของพื้นที่
Q6: ขณะนี้มีการดำเนินงานให้วัคซีน HPV ตามแนวทางของสภากาชาดไทย หน่วยบริการสามารถนำมาบันทึกเป็นผลการดำเนินงานได้หรือไม่
A6: หน่วยบริการสามารถนำมาบันทึกเป็นผลงานได้
Q7: หน่วยบริการต้องบันทึกข้อมูลการฉึดวัคซีนอย่างไร
A7: ขอให้หน่วยบริการบันทึกข้อมูลตามแนวทางการบันทึกข้อมูลการให้บริการวัคซีน HPV ในระบบ MOPH Claim
27 พ.ย. 66 คนไทยชุดที่ 3 อีก 3 ราย ได้รับการปล่อยตัวจากฉนวนกาซา
27 พฤศจิกายน 2566 เมื่อวันที่ 26 พฤศจิกายน 2566 (ตามเวลาอิสราเอล) กระทรวงการต่างประเทศได้รับแจ้งจากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ ว่ามีคนไทยชุดที่ 3 ได้รับการปล่อยตัวอีก 3ราย ได้แก่
1) นายวิเชียร เต็มทอง
2) นายสุรินทร์ เกสูงเนิน
3) นายพรสวรรค์ ปินะกาโล
ขณะนี้ ทั้ง 3 รายอยู่ที่โรงพยาบาลที่ฝ่ายอิสราเอลจัดไว้เพื่อตรวจสุขภาพ โดยเจ้าหน้าที่สถานเอกอัครราชทูตฯ ได้ไปช่วยเหลืออำนวยความสะดวก และประสานการติดต่อกับครอบครัวที่โรงพยาบาลแล้ว
กระทรวงการต่างประเทศขอแสดงความยินดีอย่างยิ่งกับครอบครัวของพี่น้องคนไทยทั้ง ๓ รายที่ได้รับการปล่อยตัวในวันนี้ และขอขอบคุณทุกฝ่ายที่เกี่ยวข้องที่มีส่วนผลักดันการเจรจา
ทั้งนี้ คาดว่ายังมีคนไทยที่ถูกควบคุมตัวอีกจำนวน 15 ราย ซึ่งรัฐบาลไทยจะพยายามอย่างเต็มที่ในการช่วยเหลือพี่น้องคนไทยที่เหลือให้ได้รับการปล่อยตัวอย่างปลอดภัยโดยเร็วที่สุด และจะนำพี่น้องคนไทยทั้ง 17 รายที่ได้รับการปล่อยตัวและผ่านกระบวนการเยียวยาเบื้องต้นในอิสราเอลแล้ว กลับสู่ประเทศไทยโดยเร็วต่อไป
ดีไซน์พิเศษเพื่อช่วยผู้ป่วยพาร์กินสัน
นอกจากนี้ แก้วน้ำกันสำลักยังมีดีไซน์พิเศษเพื่อช่วยผู้ป่วยพาร์กินสันด้วย
“หูของแก้วน้ำมีลักษณะนูนขึ้นมา เพื่อช่วยคนไข้พาร์กินสันที่มีภาวะเกร็งกำมือได้ไม่สุด สามารถจับแก้วน้ำได้ถนัด มั่นคง และมั่นใจในการดื่มน้ำมากยิ่งขึ้น”
ศ.นพ.รุ่งโรจน์ ให้คำแนะนำเพิ่มเติมว่าสำหรับคนไข้พาร์กินสันที่มีอาการเกร็ง ช้า สั่น ควรกินยาโรคพาร์กินสันก่อนรับประทานอาหาร ดื่มน้ำ หรือทำกิจกรรมต่าง ๆ เพราะเมื่อยาออกฤทธิ์ดี คนไข้จะมีอาการสั่นน้อยลง เคลื่อนไหวร่างกายได้ดีเกือบเป็นปกติ ลดโอกาสการสำลักลงได้
หลักสูตร Food and Beverage Service แผนกอาหารและเครื่่องดื่ม)
Food and Beverage Services คอร์สนี้เหมาะสำหรับตำแหน่งงานดังต่อไปนี้
- ผู้อำนวยการแผนกอาหารและเครื่องดื่ม (F&B Director)
- ผู้จัดการห้องอาหาร (F&B Outlet Manager)
- หัวหน้าพนักงานบริการ (Head Waiter/ Head Waitress)
- พนักงานผสมเครื่องดื่ม (Bartender)
- พนักงานเสิร์ฟ (Waiter/Waitress)
ลิงค์หลักสูตร
ยืนยันตัวตนด้วยการสแกนใบหน้า ป้องกันการสวมสิทธิ
เจ้าหน้าที่ ณ ศูนย์บริการของ รพ.ของรัฐทุกแห่ง รพ.สต. และ สสอ.ทุกแห่ง จะช่วยดำเนินการให้ท่าน
4.ศูนย์สุขภาพพร้อม สาขาลำปาง
ศูนย์สุขภาพพร้อม ลำปาง คณะเทคนิคการแพทย์ มหาวิทยาลัยเชียงใหม่ ให้บริการด้านสุขภาพ แก่พี่น้องชาวลำปาง และพื้นที่ใกล้เคียง อาทิเช่น ตรวจสุขภาพประจำปี ตรวจเลือดตามคำสั่งแพทย์ เอกซเรย์ อัลตร้าซาวด์ช่องท้อง กายภาพบำบัด นวดแผนไทย การประเมินและส่งเสริมพัฒนาการเด็ก ฝึกพูด และการศึกษาพิเศษ ข้าราชการ/รัฐวิสาหกิจ เบิกได้ตามสิทธิ ตั้งอยู่บริเวณ ตลาดราชวงศ์ ด้านหลัง ร้าน ส.วิไล 999 มีที่จอดรถ สามารถจอดรถฝั่งที่ระบุ “สำหรับผู้รับบริการศูนย์สุขภาพพร้อม”
รพ.ปิยะเวชช์ระยอง อ.ปลวกแดง จ.ระยอง
รพ.ปิยะเวชช์ ระยอง เป็นรพ.แห่งที่ 3 ในเครือรพ.ปิยะเวชช์ (อีก 2 แห่งคือ
รพ.ปิยะเวชช์ บ่อวิน และ
รพ.ปิยะเวชช์ นิคมพัฒนา) ตั้งอยู่ที่ 288 ม .3 ต มาบยางพรซอย ตำบล มาบยางพร อำเภอปลวกแดง ระยอง 21140 โทรศัพท์: 038-020100
4.มะเร็งครบวงจร ให้บริการวัคซีน HPV ในหญิงอายุ 11 - 20 ปีทั่วประเทศ จำนวน 1 ล้านโดส
จัดกิจกรรมคิกออฟการรณรงค์สร้างภูมิ HPV นักเรียนไทยสุขภาพดี ปลอดมะเร็ง "Save Our Children by 1 Milion HPV Vaccines" ที่โรงเรียนไทรน้อย อ.ไทรน้อย จ.นนทบุรี เริ่มฉีดวัคซีนป้องกันเชื้อ HPV สำหรับนักเรียนหญิง อายุ 11-20 ปี จำนวน 1 ล้านโดส ในสถานศึกษาพร้อมกันทั่วประเทศ เพื่อป้องกันมะเร็งในสตรีไทยตามสโลแกน "สวย เริด เชิด สู้มะเร็ง" หรือ "Women Power No Cancer" โดยผลการดำเนินงานตั้งแต่วันที่ 8 - 27 พฤศจิกายน 2566 ฉีดวัคซีน HPV ไปแล้ว 501,608 โดส ซึ่งเร็วกว่ากำหนดเดิมที่คาดไว้ว่าจะถึง 5 แสนโดสแรกในช่วงพฤศจิกายน 2566
ข้อมูล ณ 27 ธันวาคม 2566 ได้ดำเนินการฉีดวัคซีนไปแล้วกว่า 1.4 ล้านโดส คิดเป็น 139.2%
จัดอบรมหลักสูตร Cancer Warriors รุ่นที่ 1 ให้กับแพทย์ พยาบาล สหวิชาชีพ และเจ้าหน้าที่ที่เกี่ยวข้อง เพื่อสร้างทีมต่อสู้โรคมะเร็ง (Cancer Warriors) ในทุกระดับ ตั้งแต่ระดับกระทรวง ระดับเขตสุขภาพ และระดับ จังหวัด ทำงานร่วมกันเป็นเครือข่ายในโรคมะเร็งสำคัญ 5 ชนิด คือ มะเร็งตับ มะเร็งท่อน้ำดี มะเร็งลำไส้ใหญ่และไส้ตรง มะเร็งเต้านม และมะเร็งปากมดลูก รวมทั้งดูแลประชาชนให้มีความรอบรู้และมีพฤติกรรมการป้องกันมะเร็งที่ถูกต้อง ช่วยลดอุบัติการณ์การเกิดโรคและการเสียชีวิตจากโรคมะเร็งอย่างเป็นรูปธรรม ที่ โรงแรมเซ็นทรา บาย เซ็นทารา ศูนย์ราชการ และคอนเวนชันเซ็นเดอร์ แจ้งวัฒนะ กรุงเทพมหานคร
รักษามะเร็งด้วยอนุภาคโปรตอน
25 ธันวาคม 2566 บอร์ด สปสช. ที่มี นพ.ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธาน ได้มีมติเห็นชอบให้เพิ่มเติมสิทธิประโยชน์การรักษามะเร็งด้วยอนุภาคโปรตอนในระบบบัตรทอง ซึ่งเป็นวิธีการฉายรังสีด้วยอนุภาคโปรตอนที่เป็นเทคนิคการฉายรังสีสมัยใหม่ มีประสิทธิภาพในการรักษาผู้ป่วยมะเร็งและมีผลข้างเคียงลดน้อยลง
สิทธิประโยชน์การรักษานี้ เป็นส่วนหนึ่งของนโยบาย มะเร็งครบวงจรของรัฐบาลและกระทรวงสาธารณสุข เพื่อดูแลผู้ป่วยมะเร็งให้เข้าถึงการรักษาและมีคุณภาพชีวิตที่ดี
“การรักษานี้ เป็นประโยชน์ต่อผู้ป่วยมะเร็งอย่างมาก ช่วยให้เข้าถึงการรักษาที่มีประสิทธิภาพและประสิทธิผล ซึ่งจากข้อมูลในระบบของ สปสช. พบว่ามีผู้ป่วยมะเร็งที่ได้รับรังสีรักษาเข้าข่ายที่จะรับบริการฉายรังสีด้วยอนุภาคโปรตอนนี้ได้ประมาณ 32,000 รายต่อปี (ข้อมูลจากฐาน IP ปี 65ของสปสช.) โดยในปี 2565 ใช้งบประมาณที่จำนวน 50 ล้านบาทต่อปี ในการดูแลผู้ป่วย” ประธานบอร์ด สปสช. กล่าว
สิทธิประโยชน์นี้มาจากข้อเสนอของสมาคมรังสีรักษาและมะเร็งวิทยาแห่งประเทศไทย เป็นข้อเสนอที่ได้จากการประชุมทีมแพทย์รังสีรักษาและมะเร็งวิทยาผู้เชี่ยวชาญการฉายรังสีโรคมะเร็งในเด็ก และนำเสนอเข้าสู่การพิจารณาของคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุดในระบบหลักประกันสุขภาพแห่งชาติ ครั้งที่ 1/2566 เมื่อวันที่ 19 ตุลาคม 2566
การรักษามะเร็งด้วยอนุภาคโปรตอนเป็นวิธีรักษามะเร็งที่มีประสิทธิผล มีอัตราการควบคุมโรคเฉพาะที่และการรอดชีวิตที่สูงในกลุ่มโรคมะเร็งสมองในเด็ก ช่วยลดผลข้างเคียงในทุกด้านเมื่อเปรียบเทียบกับการฉายรังสีโฟตอนแบบเดิม โดยการรักษาต้องใช้บุคลากรทางการแพทย์และผู้เชี่ยวชาญ ประกอบด้วย แพทย์รังสีรักษา แพทย์รังสีวินิจฉัยแพทย์เวชศาสตร์นิวเคลียร์ กุมารแพทย์ทางโลหิตวิทยาและรังสี (กรณีผู้ป่วยเด็ก) วิสัญญีแพทย์ นักฟิสิกส์การแพทย์ นักรังสีเทคนิค พยาบาล และวิศวกร
ปัจจุบันในประเทศไทยมีหน่วยบริการที่ให้บริการฉายรังสีด้วยอนุภาคโปรตอนเพียงแห่งเดียว คือศูนย์โปรตอนสมเด็จพระเทพฯ รพ.จุฬาลงกรณ์ เปิดให้บริการมาตั้งแต่สิงหาคม 2564 ดังนั้นในบริหารจัดการจ่ายชดเชย สปสช. จึงใช้รูปแบบเหมาจ่ายรายปี จำนวน 50 ล้านบาท ให้แก่ ศูนย์โปรตอนสมเด็จพระเทพรัตนราชสุดาฯ พร้อมให้มีการจัดระบบการส่งต่อ ประสานงาน เพื่อจัดบริการให้แก่ผู้ป่วยทุกวันตลอด 24 ชั่วโมง ซึ่งในกรณีการนำส่งผู้ป่วยสามารถเบิกจ่ายค่าพาหนะรับส่งผู้ป่วยอัตราเฉลี่ย 2,300 บาทต่อครั้ง
“หลังจากบอร์ด สปสช. เห็นชอบแล้ว จากนี้ สปสช. จะออกประกาศหลักเกณฑ์รองรับการจ่ายชดเชยค่าบริการ พร้อมดำเนินการตามที่บอร์ด สปสช. มอบหมาย ทั้งการกำกับติดตามประเมินผลการเข้าถึงบริการ การประสานกับหน่วยงานที่เกี่ยวข้องในการประเมินประสิทธิภาพประสิทธิผลการรักษา รวมทั้งจัดระบบส่งต่อผู้ป่วยเพื่อความสะดวกในการเข้ารับบริการอย่างเท่าเทียมกันทุกสิทธิ และรายงานต่อคณะทำงานยกระดับความเป็นเลิศด้านการแพทย์ขั้นสูงสุดฯ ทุก 4 เดือน และคณะอนุกรรมการกำหนดหลักเกณฑ์การดำเนินงานและบริหารจัดการกองทุนฯ นอกจากนี้จะประสานหน่วยงานที่เกี่ยวข้องในการสนับสนุนค่าใช้จ่ายอื่นที่นอกเหนือจากทางการแพทย์เพื่อสนับสนุนบริการและการดูแลผู้ป่วย เช่น กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษ เป็นต้น”
ศักยภาพการรองรับปริมาณการเดินทาง เปรียบเทียบการเดินทางจริง
ประเทศเยอรมัน
GERMANY
1. Charité Medical School, Berlin, Germany
หลักสูตรภาษาเยอรมัน 6 ปี ปริญญา Zeugnis über die Ärztliche Prüfung (Final Medical State Exam Diploma) ที่มีการเรียนการสอน ตลอดหลักสูตร ณ ประเทศเยอรมันนีและรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ คลินิกที่ระบุมาในหลักสูตร และอยู่ในประเทศเยอรมันนีดังนี้ 1. Campus Charité Mitte (CCM) in Mitte, Berlin 2. Campus Benjamin Franklin (CBF) in Lichterfelde, Berlin 3. Campus Virchow Klinikum (CVK) in Wedding, Berlin 4. Campus Berlin Buch (CBB) in Buch, Berlin
ว/ด/ป ที่ รับรอง 10 ก.ย. 63
ว/ด/ป ครบอายุ การรับรอง 9 ก.ย. 68จังหวัดนราธิวาส
ร้านยา จ.นราธิวาส
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| D0521 |
ดี-เมด (D-MED) |
275 |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0886571777 |
| D0522 |
ดาดาเภสัช |
191 ซอย 1 |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
|
| D1036 |
คลินิกยาอัชรี |
24/3 |
|
โคกเคียน |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0858795591 |
| D1037 |
ร้านเอ็นเจ ฟาร์มาซี |
8/1 |
|
มะนังตายอ |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0848597377 |
| D1038 |
มาเรีย ฟาร์มาซี |
6/7 |
พณาสณฑ์ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0636651556 |
| D1039 |
บ้านทอนเภสัช |
226/9 |
|
โคกเคียน |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0842507132 |
| D1040 |
ยุวลักษณ์เภสัช |
25/1 |
พณาสณฑ์ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0936849595 |
| D1343 |
เอเซียพาณิชย์ |
160 |
เอเชีย 18 |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0655362662 |
| D1758 |
นาดีย์เภสัช |
294 |
|
จวบ |
เจาะไอร้อง |
นราธิวาส |
96130 |
0896597396 |
| D1844 |
2 เภสัชกร |
71 |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
073611454 , 0869594625 |
| D2105 |
ร้านยาฟารุก |
78 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
0897373735 |
| D2170 |
แว้งฟาร์มาซี |
169/26 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
091-8470939 |
| D2171 |
ศูนย์ยาโก-ลก |
136 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
089-6932683, 081-9797306 |
| D3142 |
คลินิกยากูฟัต |
100/1 |
|
จวบ |
เจาะไอร้อง |
นราธิวาส |
96130 |
0849759475 |
| D3397 |
เกาซัรฟาร์มาซี |
189 |
เพชรเกษม |
บาเจาะ |
บาเจาะ |
นราธิวาส |
96170 |
0849693056 |
| D4015 |
รวมยาโก-ลก |
20 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0617865624 |
| D4020 |
พีเตอร์ส์ ฟาร์มาซี |
183/19 |
|
รือเสาะ |
รือเสาะ |
นราธิวาส |
96150 |
0958289590 |
| D4021 |
ยี่งอเภสัช |
15 |
มรรคาปิ่นนิตย์ |
ยี่งอ |
ยี่งอ |
นราธิวาส |
96180 |
0862898236 |
| D4022 |
หมอยาเภสัช |
24 |
บายพาส |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0897351754 |
| D4023 |
เอี๊ยะซิ่วโอสถ |
27 |
วงศ์วิถี |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0866549695 |
| D4024 |
กวงฮวดร้านยา |
342 |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0818965155 |
| D4029 |
คิดถึงเภสัช |
7/1 |
|
สุไหงปาดี |
สุไหงปาดี |
นราธิวาส |
96140 |
0818973171 |
| D4030 |
ห้องยาเภสัช |
362/15 |
|
ยี่งอ |
ยี่งอ |
นราธิวาส |
96180 |
0936870934 |
| D4036 |
นูรมาเภสัช |
108/1 |
|
ดุซงญอ |
จะแนะ |
นราธิวาส |
96220 |
0836550060 |
| D4042 |
จารวีเภสัช |
54/3 |
สุริยะประดิษฐ์ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0898706898 |
| D4044 |
สุนทรีเภสัช |
25/1 |
|
พร่อน |
ตากใบ |
นราธิวาส |
96110 |
0831938833 |
| D4045 |
ลอนดอนฟาร์มาซี |
24,26 ซอย 1 (ถนนเจริญเขต) |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0896564880 |
| D4047 |
ก๊ะฟาร์มาซี |
302 |
|
ดุซงญอ |
จะแนะ |
นราธิวาส |
96220 |
0849180896 |
| D4049 |
ร้านยาเก็นติ้ง |
37 ซอย 1/1 |
เจริญเขต |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0996142563 |
| D4050 |
ทองพนังโอสถ |
698 |
|
เจ๊ะเห |
ตากใบ |
นราธิวาส |
96110 |
0634566325 |
| D4051 |
ศูนย์ยาบารอกัต |
344/3 |
|
ปะลุกาสาเมาะ |
บาเจาะ |
นราธิวาส |
96170 |
0895954806 |
| D4056 |
ตันหยงเภสัช |
57 |
เทศบาล10 |
ตันหยงมัส |
ระแงะ |
นราธิวาส |
96130 |
0869551105 |
| D4057 |
ซุบฮีเภสัช |
111/1 |
|
ปะลุกาสาเมาะ |
บาเจาะ |
นราธิวาส |
96170 |
0859993556 |
| D4059 |
บ้านหมอยา |
93/5 |
ระแงะมรรคา |
ตันหยงมัส |
ระแงะ |
นราธิวาส |
96130 |
0828333453 |
| D4061 |
คลังยานรา |
406 |
ตากใบ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0897388896 |
| D4062 |
นครยา |
41 |
ทรายทอง6 |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
064 5352426 |
| D4063 |
ดีนาร์ฟาร์มาซี |
1/44 |
|
ยี่งอ |
ยี่งอ |
นราธิวาส |
96180 |
0863188793 |
| D4067 |
นิโรสเภสัช |
39/8 |
|
ศรีสาคร |
ศรีสาคร |
นราธิวาส |
96210 |
0839917635 |
| D4069 |
ตะวันเภสัช |
42/5 |
|
เจ๊ะเห |
ตากใบ |
นราธิวาส |
96110 |
0887837942 |
| D4070 |
นราฟาร์มาซี |
37/14 |
ระแงะมรรคา |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0843001275 |
| D4076 |
วิชาญเภสัช |
44/15 ซอย ละม้ายอุทิศ |
สุริยะประดิษฐ์ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0869595990 |
| D4081 |
มุมยา 365 |
105 |
อารีฟมรรคา |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0816894044 |
| D4088 |
เรือนยา |
71/3 |
ระแงะมรรคา |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0817669965 |
| D4090 |
จิระเภสัช |
23-25 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
073611384 |
| D4093 |
คลังยาบาเจาะ |
196 |
เพชรเกษม |
บาเจาะ |
บาเจาะ |
นราธิวาส |
96170 |
0869567292 |
| D4095 |
อาชวาเภสัช |
10/3 |
รามโกมุท |
ยี่งอ |
ยี่งอ |
นราธิวาส |
96180 |
0828303434 |
| D4098 |
กัวลา ฟาร์มาซี |
48/3 |
|
ซากอ |
ศรีสาคร |
นราธิวาส |
96210 |
0869581025 |
| D4100 |
เพื่อนยาบายพาส |
12/48 |
ประชาสงเคราะห์ |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0962964635 |
| D4106 |
คลังยาโก-ลก |
34 |
บุษยพันธ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0805401959 |
| D4114 |
ร้านลูกช้างฟาร์ม่า |
246 |
ทรายทอง 4 |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0898445486 |
| D4122 |
อัสราเภสัช |
84 |
โคกเคียน |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0842563961 |
| D4141 |
อมรรัตน์เภสัช |
291 |
พิชิตบำรุง |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0849953963 |
| D4142 |
ศูนย์ยานรา |
310 |
พิชิตบำรุง |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0896566471 |
| D4149 |
ร้านยาฟารุก บูเก๊ะตา |
127/30 |
- |
โละจูด |
แว้ง |
นราธิวาส |
96160 |
0897373735 |
| D4151 |
ร้านยาอัลฟาร์ม |
43/2 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
0818986250 |
| D4155 |
ร้านยาสุขภาพดวิษ |
240 |
พิชิตบำรุง |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0815993373 |
| D4168 |
ส.เจริญเภสัช |
12-14 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0819908456 |
| D4176 |
ลำภูเภสัช |
130/2 |
|
ลำภู |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0842694488 |
| D4193 |
คริสตัล ฟาร์มา |
40/8 |
|
เจ๊ะเห |
ตากใบ |
นราธิวาส |
96110 |
0617014747 |
| D4194 |
บั๊ค ฟาร์มา |
52 |
จิตมงคล |
ตันหยงมัส |
ระแงะ |
นราธิวาส |
96130 |
0617014747 |
| D4198 |
ฟาอิสฟาร์มาซี |
244 |
ปะลุรู |
ปะลุรู |
สุไหงปาดี |
นราธิวาส |
96140 |
0862945715 |
| D4199 |
คลินิกยา จาราแวเภสัช |
276 |
จารุเสถียร |
ปะลุรู |
สุไหงปาดี |
นราธิวาส |
96140 |
0986200315 |
| D4215 |
ปริญญาเภสัช |
100 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0894635551 |
| D4217 |
บ้านเภสัชกร |
171/16 |
รัชดา |
เจ๊ะเห |
ตากใบ |
นราธิวาส |
96110 |
0968487847 |
| D4220 |
ตากใบเภสัชกร |
32-33 |
|
เจ๊ะเห |
ตากใบ |
นราธิวาส |
96110 |
0878993121 |
| D4227 |
ศูนย์ยาอมานะฮฺ |
166/2 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
0910498085 |
| D4307 |
ฟาร์มาซีด |
81/1 |
ประชาวิวัฒน์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0816082009 |
คลินิกพยาบาลชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 25758 |
นัยต์ชนกการพยาบาลและการผดุงครรภ์ |
55 |
|
สุไหงปาดี |
สุไหงปาดี |
นราธิวาส |
96140 |
0810962428 |
| 44834 |
บาตงคลินิกการพยาบาลและการผดุงครรภ์ |
4/1 |
|
บาตง |
รือเสาะ |
นราธิวาส |
96150 |
0926327010 |
| 45062 |
วนิสาคลินิกการพยาบาลและการผดุงครรภ์ |
46 |
กำปงบารู |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0849951293 |
| 45150 |
ต้นไทรคลินิกการพยาบาลและการผดุงครรภ์ |
167/1 |
เพชรเกษม |
ปะลุกาสาเมาะ |
บาเจาะ |
นราธิวาส |
96170 |
0892999945 |
| 45187 |
รอฮีมะห์คลินิกการพยาบาลและการผดุงครรภ์ |
157/4 |
|
สากอ |
สุไหงปาดี |
นราธิวาส |
96140 |
0612638663 |
คลินิกเวชกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 25736 |
คลินิกเวชกรรมแพทย์พรประสิทธิ |
52 |
วงศ์วิวัฒน์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0898763704 |
| 25740 |
คลินิกเวชกรรมแพทย์จันทรา |
54 |
สฤษดิ์วงศ์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0817668304 |
| 42164 |
คลินิกเฉพาะทางด้านเวชกรรมอายุรศาสตร์แพทย์ถิรพล |
43 |
วรคามินทร์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0807850005 |
| 42356 |
คลินิกเฉพาะทางด้านเวชกรรมเวชศาสตร์ครอบครัวแพทย์ฮัมดี |
58/18 |
โคกเคียน |
โคกเคียน |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0824284652 |
| 42728 |
ดิ อโรคาเซียคลินิกเวชกรรม |
238 |
พิชิตบำรุง |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0815993373 |
| 42740 |
คลินิกเวชกรรมแพทย์วันเตาเฟ็ก |
402/2 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
0815433046 |
| 45019 |
บ้านทอนคลินิกเวชกรรม |
57 |
|
โคกเคียน |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0808626074 |
| 45191 |
คลินิกเวชกรรมหมอสุณิสา |
118/9 |
|
แว้ง |
แว้ง |
นราธิวาส |
96160 |
0635354494 |
คลินิกเทคนิคการแพทย์ชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
|
25754
|
คลินิกเทคนิคการแพทย์โก-ลก
|
271/1 ซอย 11
|
เจริญเขต
|
สุไหงโก-ลก
|
สุไหงโก-ลก
|
นราธิวาส
|
96120
|
0898106793
|
|
42603
|
เซ็นเตอร์ คลินิกเทคนิคการแพทย์ (สาขานราธิวาส)
|
140
|
ระแงะมรรคา
|
บางนาค
|
เมืองนราธิวาส
|
นราธิวาส
|
96000
|
0902252329
|
|
42604
|
เซ็นเตอร์คลินิกเทคนิคการแพทย์ (สาขาสุไหงโก-ลก)
|
87
|
วงศ์วิวัฒน์
|
สุไหงโก-ลก
|
สุไหงโก-ลก
|
นราธิวาส
|
96120
|
0646254323
|
|
44977
|
คลินิกเทคนิคการแพทย์อาร์ไอแล็บ
|
191
|
ระแงะมรรคา
|
บางนาค
|
เมืองนราธิวาส
|
นราธิวาส
|
96000
|
0945902233
|
คลินิกทันตกรรมชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 44000 |
คลินิกทันตกรรมเดียรี่เด้นท์ |
146 |
ประชาวิวัฒน์ |
สุไหงโก-ลก |
สุไหงโก-ลก |
นราธิวาส |
96120 |
0819163855 |
คลินิกการแพทย์แผนไทยชุมชนอบอุ่น
|
รหัส
|
ชื่อหน่วยบริการ
|
ที่ตั้ง
|
ถนน
|
ตำบล
|
อำเภอ
|
จังหวัด
|
ไปรษณีย์
|
โทรศัพท์
|
| 45031 |
สุไลมานคลินิกการแพทย์แผนไทย |
24/1 |
เทศบาล 13 |
ตันหยงมัส |
ระแงะ |
นราธิวาส |
96130 |
0862903593 |
| 45154 |
ซูไฮมิงคลินิกการแพทย์แผนไทย |
88/1 |
เทศบาล 11 |
ตันหยงมัส |
ระแงะ |
นราธิวาส |
96130 |
0630874254 |
| 45217 |
หมอยาฮารีคลินิกการแพทย์แผนไทย |
15 |
พิชิตบำรุง |
บางนาค |
เมืองนราธิวาส |
นราธิวาส |
96000 |
0818965301 |
ในขณะที่ พญ.ลลิตยา กองคำ รองเลขาธิการ สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ก็มีความยินดีที่จะสนับสนุนโครงการวิจัยเพื่อเพิ่มศักยภาพในการเข้าถึงสวัสดิการทางสังคมและการใช้ประโยชน์จากเทคโนโลยีดิจิทัลสำหรับผู้สูงอายุ โดยเชื่อว่าจะสามารถเป็นส่วนที่เข้ามาช่วยเสริมระบบหลักประกันสุขภาพแห่งชาติในการดูแลผู้สูงอายุอย่างมีประสิทธิภาพมากยิ่งขึ้น ด้าน นายประสิทธิ์ ทองแท่งไทย รองนายกองค์การบริหารส่วนจังหวัดขอนแก่น มองว่า การที่จะให้ผู้สูงอายุในพื้นที่ได้รับข้อมูลข่าวสาร ต้องมีหน่วยบริการที่ใกล้พี่น้องประชาชนที่สุดโดยเฉพาะ รพสต. ที่ต้องให้ความรู้แก่ผู้สูงอายุเกี่ยวกับอุปกรณ์IoTต่าง ๆ เพราะโรคหลายหลายโรคจะต้องมีการเก็บข้อมูลและใช้ความเร่งด่วนในการรักษาอย่างทันท่วงที
หมวด 1 บททั่วไป / หมวด 2 คณะกรรมการ กัญชา กัญชง
SMC Clinic ทันตกรรมนอกเวลาราชการ รพ.แกลง
คลินิกมลพิษทางอากาศ โรงพยาบาลสิรินธร
คลินิกมลพิษทางอากาศ โรงพยาบาลสิรินธร สำนักการแพทย์ กรุงเทพมหานคร ห้องตรวจศัลยกรรม ห้องหมายเลข 11 เปิดให้บริการทุกวันอังคาร เวลา 13.00 น. - 16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)โทร. 02-3286900
แม้คนป่วยมะเร็งจะเพิ่มมากจริง แต่ก็ผู้รอดชีวิตก็เพิ่มขึ้นเช่นกัน
แม้ว่าจำนวนข้อมูลสถิติจำนวนผู้ป่วยมะเร็งจะเพิ่มขึ้นทุกปี แต่จำนวนผู้รอดชีวิตก็เพิ่มขึ้นทุกปีเช่นกัน เพราะความก้าวหน้าของการวินิจฉัยที่รวดเร็วและแม่นยำกว่าสมัยก่อน
เสวนาในช่วง
“มะเร็งรุกมา เราลุกขึ้นสู้ด้วยกัน” กับทีมแพทย์โรงพยาบาลจุฬาภรณ์ นำโดย พญ.จอมธนา ศิริไพบูลย์ ผู้อำนวยการศูนย์มะเร็งวิทยา ผศ.พญ.เจษฎาพร พร้อมเที่ยงตรง แพทย์ผู้เชี่ยวชาญสาขาเวชศาสตร์นิวเคลียร์ พญ.เอมวิภา ลือประสิทธิ์สกุล แพทย์เฉพาะทางด้านอายุรกรรมโลหิตวิทยา ร่วมเสวนาสร้างความรู้ความเข้าใจถึงนวัตกรรมความก้าวหน้าในการรักษาโรคมะเร็ง ทั้งในด้านของการตรวจวินิจฉัยและรักษาทางเวชศาสตร์นิวเคลียร์ที่รวดเร็วและแม่นยำ การรักษามะเร็งทางโรคเลือดด้วยการปลูกถ่ายไขกระดูกโดยการใช้เซลล์ตัวเองบำบัด (Autologous Stem Cell Transplant) โดยโรงพยาบาลจุฬาภรณ์ได้นำมาใช้ในการรักษาผู้ป่วยมะเร็งชนิด Multiple Myeloma โดยผู้ป่วยที่ใช้สิทธิข้าราชการสามารถเบิกจ่ายตรงเพื่อเข้าถึงการรักษาด้วยนวัตกรรมดังกล่าวได้อีกด้วย
ซินเจียยู่อี่ ตรุษจีนนี้ระวัง อ้วน นะ
ของไหว้ที่มีไขมันและให้พลังงานสูง ควรกินแต่น้อยเพิ่มผักให้มากขึ้น หมั่นออกกำลังกายเป็นประจำ จะอร่อยได้ไม่กลัวอ้วน ช่วงตรุษจีนนี้
- ไก่ต้ม 1 ตัว 2,169 กิโลเเคลอรี่ ต่อส่วนที่กินได้
- ผัดหมี่ซั่ว 1 จาน 326 กิโลเเคลอรี่ ต่อ 100 กรัม
- ขนมเข่ง 1 เข่ง 120 - 200 กิโลเเคลอรี่ ต่อ 1 ชิ้น
- ขนมเทียน 1 ชิ้น 115 กิโลเเคลอรี่ ต่อ 1 ชิ้น
- ส้ม 1 ผล 56 กิโลเเคลอรี่ ต่อ 1 ลูก
ความต้องการพลังงาน
หญิง : 1,600 กิโลแคลอรี่/วัน
ชาย : 2,000 กิโลแคลอรี่/วัน
People Transformation
ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ ประธานเจ้าหน้าที่บริหาร โรงพยาบาลบำรุงราษฎร์ กล่าวว่า เรื่องของ People Transformation เป็นเรื่องที่สำคัญที่สุดเรื่องหนึ่ง ตลอดระยะเวลากว่า 43 ปีเข้าสู่ปีที่ 44 ของโรงพยาบาลบำรุงราษฎร์ สิ่งที่บำรุงราษฎร์ให้คุณค่ามากที่สุด คือ เรื่องของบุคลากร ปัจจุบันเรามีพนักงานอยู่กว่า 4,000 คน มีแพทย์อีกกว่า 1,300 คน เราปลูกฝังค่านิยมและวัฒนธรรมองค์กร คือ iAIC (Inclusion, Agility, Innovation, Caring) ซึ่งเป็น DNA ของคนบำรุงราษฎร์ เน้นเรื่องการปลูกฝัง Agile mindset ของเราที่แข็งแกร่ง ซึ่งเป็นพื้นฐานที่สำคัญในเรื่อง Transformation ทำให้พนักงานเปิดใจในเรื่องของการเปลี่ยนแปลง และ เป็นกุญแจสำคัญที่ทำให้เราฝ่าวิกฤตต่าง ๆ มาได้
โรงพยาบาลบำรุงราษฎร์ให้ความสำคัญในเรื่องการสร้างองค์กรให้เติบโตอย่างยั่งยืน เรามีแผนงานการสืบทอดตำแหน่งงาน (succession planning) มีการวาง career path และ career development ที่ชัดเจน และพัฒนาผู้นำจากภายใน มุ่งเน้นด้านการพัฒนาฝึกฝนกลุ่มผู้นำรุ่นใหม่และตระเตรียมการเสริมสร้างผู้นำในอนาคต ที่จะสืบสานการดำเนินงานของโรงพยาบาลอย่างไร้รอยต่อ ไม่ว่าจะเป็น การถ่ายทอดองค์ความรู้ จากผู้นำรุ่นปัจจุบันเพื่อรักษาจุดแข็ง ในขณะเดียวกันก็สามารถเติมเต็มและพัฒนาองค์กรให้เหมาะสมกับสภาวะในอนาคตที่จะมาถึง
แนวทางในการพัฒนานโยบายยาเสพติด - น.พ.ภาสกร ชัยวานิชศิริ
แนวทางในการพัฒนานโยบายยาเสพติด น.พ.ภาสกร ชัยวานิชศิริ รองอธิบดีกรมการแพทย@ กระทรวงสาธารณสุข เป#นที่ทราบดีวายาเสพติดทําลายชีวิตมนุษย�จํานวนมาก แตนโยบายของรัฐที่ไมมีอํานาจในการทําลายล�าง สูงกวามาก คนหนุมสาวที่ต�องคดีอาญาจากความผิดเล็กน�อยเกี่ยวกับยาเสพติด สงผลคุกคามตามความเป#นปกติสุข ในชีวิต มากกวาพฤติกรรมการใช�ยาเป#นครั้งคราวของคนเหลานี้มาก ผลกระทบจากนโยบายการ ห�ามสงผลกระทบ ที่ไมคาดคิด ทั้งเรี่องผู�ต�องขังล�นคุก ตลาดมืด และองค�กรอาชญากรรมข�ามชาติ การใช�ความรุนแรง การคอร�รัปชั่น และความไมมั่นคงของสังคมและชาติ นโยบายเหลานี้มักถูกกําหนดจากคตินิยม มากกวาการใช�ข�อมูลเชิงประจักษ� ข�อตกลงเริ่มแรกขององค�การสหประชาชาติเมื่อปw ค.ศ.1961 และ 1971 ตั้งใจที่จะปกปAองสุขภาพและสวัสดิภาพ ของมวลมนุษย� แตสังคมโลกใช�นโยบายคูขนานที่ไมสมดุลระหวางการห�ามและการควบคุมการใช� โดยการประกาศ สงครามกับยาเสพติดโดยมุงหวังให�ยาเสพติดหมดไปจากสังคมโลก ซึ่งเป#นภาพมายาที่เป#นไปไมได� ในทางตรงข�าม กลับสงผลเสียมากมายดังกลาวในขณะที่ป$ญหายาเสพติดกลับรุนแรงขึ้น ในปw ค.ศ.2011 the Global Commission on Drug Policy ได�มีการประชุมเพื่อปฏิรูปนโยบายหลักทางด�านยาเสพติด โดยใช�หลักฐานเชิง ประจักษ� ได�ข�อสรุปการใช�นโยบายที่ต�องเน�นประเด็นสุขภาพและสิทธิมนุษยชนเป#นประเด็นนํา แทนการใช�ระบบ ศาล สร�างสมดุลใหมระหวางการเน�นประเด็นสุขภาพ สิทธิมนุษยชน และการพัฒนากับประเด็นการบังคับใช� กฎหมาย International Drug Policy Consortium (IDPC) ได�เสนอหลักการ 5 ด�าน ในการจัดทํานโยบายดังนี้ 1. การพัฒนานโยบาย โดยมีการประเมินวัตถุประสงค�ตามลําดับความสําคัญและข�อมูลเชิงประจักษ� 2. ต�องเป#นนโยบายที่เน�นการลดอันตรายที่เป#นผลกระทบจากการใช�ยาและตลาดยา มากกวาการมุงที่ จะลดปริมาณ 3. นโยบายต�องยึดหลักกฎหมายสิทธิมนุษยชน 4. นโยบายต�องครอบคลุมคนทุกกลุมของสังคม โดยเฉพาะคนชายขอบ และไมเน�นการลงโทษ คนเหลานี้ 5. การพัฒนาและการนําสูการปฏิบัติที่ต�องมีโครงสร�างให�กลุมประชาสังคมเข�ามามีสวนรวม สะท้อนปัญหาระบบบริการผู้ป่วยบัตรทองใน กทม
สะท้อนปัญหาระบบบริการผู้ป่วยบัตรทองใน กทม โดยผศ.พญ.ปฐมพร ศิรประภาสิริ ปฏิบัติหน้าที่ผู้ตรวจราชการเขตสุขภาพที่ 13
การบริหารงบค่าบริการผู้ป่วยนอกในพื้นที่กรุงเทพมหานคร แบ่งเป็น 2 ส่วนใหญ่ คือ
ส่วนที่ 1 Central reimbursement (CR)
ส่วนที่ 2 จัดสรรให้หน่วยบริการบริหารเงิน
ปีงบประมาณ 2564 ปรับวิธีการบริหารงบส่วนที่ 2 จาก Model 2 เป็น Model 5
Model 2 ศูนย์บริการสาธารณสุข(ศบส.) คลินิกชุมชนอบอุ่นต่างเป็นหน่วยบริการประจำ ทำการรักษา-ส่งต่อภายในวงเงินที่ได้รับจัดสรร
Model 5
- เครือข่ายพวงบริการ ศบส.เป็นหน่วยบริการประจำแม่ข่าย-คลินิกฯเป็นลูกข่าย
- หน่วยบริการต่างๆเบิกเงินชดเชยค่าบริการตามจริง ยึดหลักการ global budget (งบประมาณปลายปิด) ควบคุมวงเงินด้วยระบบ fee schedule และ point system
- เครือข่ายพวงบริการเดียวกันจะรับผิดชอบประชากรร่วมกัน สามารถรักษาผู้ป่วยแทนกัน และส่งต่อผู้ป่วยแทนกันได้
โรงพยาบาลสวรรค์ประชารักษ์ เชิญชวนชาวนครสวรรค์ ลงทะเบียน Health ID
โรงพยาบาลสวรรค์ประชารักษ์ เชิญชวนชาวจังหวัดนครสวรรค์นำบัตรประชาชน มาลงทะเบียนเข้าร่วมโครงการ “ 30 บาทรักษาทุกที่ ด้วยบัตรประชาชนใบเดียว ” เพื่อเข้าถึงสิทธิประโยชน์ผ่านระบบดิจิทัลทางการแพทย์ เช่น ประวัติสุขภาพอิเล็กทรอนิกส์ สมุดสุขภาพประชาชน ใบรับรองแพทย์ดิจิทัล การนัดหมายออนไลน์ การดูแลผู้ป่วยที่บ้านหรือการแพทย์ทางไกล และการรับยาเดิมในกรณีคนไข้อาการคงที่ เป็นต้น
ผู้สนใจสามารถนำบัตรประชาชน/โทรศัพท์มือถือ มาลงทะเบียน Health ID ได้ที่ โรงพยาบาลสวรรค์ประชารักษ์ ห้องบัตร หมายเลข 3-7 อาคาร 1 ชั้น 1 เวลา 08.00 -20.00 น. ทุกวัน ไม่เว้นวันหยุดราชการ โรงพยาบาลชุมชนประจำอำเภอ ทุกอำเภอ โรงพยาบาลรัฐ / รพ.สต. ทุกแห่ง
รายงานผลดำเนินงาน ครบ 60 วัน (24 ธันวาคม 66 - 24 กุมภาพันธ์ 67)
สำหรับ
ผลการดำเนินงานด้านการตรวจคัดกรองสุขภาพประชาชนในเขตพื้นที่กรุงเทพฯ ตั้งแต่วันที่ 24 ธันวาคม 2566 ถึง 24 กุมภาพันธ์ 2567 (ปัจจุบัน) ผู้รับบริการทั้งหมด 58,171 คน พบว่า
- ผู้รับบริการเป็นเพศหญิง จำนวน 37,769 คน เพศชาย จำนวน 20,402 คน
- มีภูมิลำเนาอยู่ในกรุงเทพมหานคร จำนวน 45,485 คน ต่างจังหวัด จำนวน 12,449 คน
- เป็นกลุ่มผู้สูงอายุ (60 ปีขึ้นไป) จำนวน 21,609 คน อายุ 35-49 ปี จำนวน 12,342 คน อายุ 50-59 ปี จำนวน 12,125 คน อายุ 15-34 ปี จำนวน 11,218 คน อายุ 6-14 ปี จำนวน 710 คน และ อายุ 0-5 ปี จำนวน 125 คน
- ใช้สิทธิการรักษาบัตรทอง จำนวน 32,055 คน ประกันสังคม จำนวน 14,353 คน และเบิกได้ จำนวน 7,363 คน
- มีผู้พิการและมีปัญหาด้านความสามารถในการช่วยเหลือตนเอง จำนวน 994 คน
- ทั้งนี้ ผลการตรวจคัดกรองสุขภาพ พบว่าประชาชนมีภาวะสุขภาพปกติ จำนวน 13,968 คน เสี่ยงต่อการเจ็บป่วย จำนวน 43,531 คน และตรวจพบการป่วย จำนวน 8,926 คน
4. ‘เทศกาลฯ’ ฟื้นฟูภูมิปัญญาใกล้สูญหาย ให้กลับมาเข้าถึงง่าย
คุณค่าประการหนึ่งที่แฝงอยู่ในการจัดเทศกาลฯ คือการทำให้มรดกทางวัฒนธรรมภายในชุมชนที่ใกล้สูญหายไปตามกาลเวลากลับมาเป็นที่รู้จักในวงกว้างอีกครั้ง เช่น กิจกรรมของกลุ่ม Sense of Nang Loeng (ปี 2566) ที่นำละครชาตรี ศิลปะการละครอันทรงคุณค่าของชุมชนตลาดนางเลิ้ง ตลาดบกแห่งแรกของไทยที่มีประวัติศาสตร์ยาวนานตั้งแต่สมัยรัชกาลที่ 5 มาจัดแสดงในรูปแบบร่วมสมัย เพื่อรื้อฟื้นอัตลักษณ์ของย่านนางเลิ้งที่เป็นบ้านครูดนตรีไทยและคณะละครในอดีตขึ้นมาใหม่ และดึงดูดความสนใจให้คนรุ่นใหม่หันมาทำความรู้จักนางเลิ้งในอีกแง่มุมหนึ่งกันมากขึ้น นอกจากนี้ยังมีการปรับปรุงพื้นที่สาธารณะให้กลายเป็นนิทรรศการชั่วคราว และต่อยอดชื่อเสียงในด้านอาหารอร่อยของดีประจำย่าน โดยเชิญนักออกแบบและนักสร้างสรรค์มืออาชีพเข้ามาร่วมคิดร่วมลงมือทำไปพร้อม ๆ กับคนในชุมชน เพื่อเปิดโอกาสให้ศิลปินท้องถิ่นและบรรดาพ่อค้าแม่ค้าได้มีช่องทางแสดงออก มีโอกาสสร้างรายได้ ทั้งระหว่างการจัดเทศกาลฯ และต่อยอดไปสู่การทำโปรเจกต์พัฒนาชุมชนในระยะยาว เพื่อให้สามารถขับเคลื่อนเศรษฐกิจได้อย่างเป็นรูปธรรม
สปสช.เขต 4 สระบุรี
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 4 สระบุรี
- เลขที่ 65/3 ซอย 1 ถนนพิชัยรณรงค์สงคราม ตำบลปากเพรียว อำเภอเมืองสระบุรี จังหวัดสระบุรี 18000
- เบอร์โทรศัพท์ 036-213205
- โทรสาร 036-213263
- แผนที่ google map
- website
- facebook
การรักษาผู้ป่วยมะเร็งเต้านมมีหลายวิธี
นพ. หฤษฎ์ สุวรรณรัศมี แพทย์ชำนาญการด้านมะเร็งวิทยา โรงพยาบาลบำรุงราษฎร์ อธิบายว่า การรักษาผู้ป่วยมะเร็งเต้านมมีหลายวิธี เช่น การผ่าตัด การให้ยาเคมี การฉายแสง การให้ยาต้านฮอร์โมน การให้ยามุ่งเป้า และการให้ยากลุ่มภูมิคุ้มกันบำบัด ซึ่งการให้ยาผู้ป่วยหลังผ่าตัดมะเร็งเต้านมจะช่วยลดโอกาสของการกลับมาเป็นซ้ำ โดยบำรุงราษฎร์มียาที่ได้รับการรับรองข้อบ่งใช้ในโรคมะเร็งแต่ละชนิดอย่างครอบคลุม โดยเราจะเลือกยาให้เหมาะกับผู้ป่วยแต่ละราย นอกจากนี้ เรายังมีการตรวจการแสดงออกของยีนในตัวมะเร็ง (Genomic risk) เพื่อบอกโอกาสการกลับมาเป็นซ้ำหลังผ่าตัดมะเร็งเต้านม และหากเป็นมะเร็งเต้านมระยะเริ่มต้น การตรวจยีนจะช่วยทำให้เรารู้ว่าหากต้องให้ยาเคมีบำบัด ผู้ป่วยจะได้รับประโยชน์จากการให้ยาหรือไม่ ซึ่งเป็นการรักษาแบบ Precision Oncology ทำให้แพทย์สามารถเจาะจงใช้ยารักษามะเร็งที่เหมาะสม พร้อมวางแผนหลีกเลี่ยงผลข้างเคียงที่มีโอกาสเกิดขึ้นได้ตั้งแต่แรก
UMSC โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินธฺโร อุทิศ
UMSC โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินธฺโร อุทิศ พร้อมดูแลชาวหนองแขม บางบอน ให้บริการแพทย์ออนไลน์ ผ่านแอป หมอกทม. บริการส่งยาทางไปรษณีย์ (ตามดุลยพินิจแพทย์) สอบถามโทร. 02-4293575 02-4293576. 02-4293577 02-4293578 02-4293579 02-4293580 02-4293581 (กด 0)
กรมควบคุมโรค รายงานผู้เสียชีวิตจากภาวะอากาศร้อน
ข้อมูลกองระบาดวิทยา กรมควบคุมโรค ระหว่างเดือนมีนาคม - พฤษภาคมของทุกปี พบรายงานผู้เสียชีวิตที่เข้าข่ายการเฝ้าระวังการเสียชีวิตจากภาวะอากาศร้อน ระหว่างปี 2560-2566 จำนวน 24, 18, 57, 12, 7, 8 และ 37 ราย ตามลำดับ
โดยในปีที่ผ่านมา ระหว่างวันที่ 5 มีนาคม - 22 พฤษภาคม 2566 มีรายงานการเจ็บป่วย และเสียชีวิตจากภาวะอากาศร้อนรวม 47 ราย (ป่วย 10 ราย เสียชีวิต 37 ราย) พบมากสุดในเดือนเมษายน ส่วนใหญ่เป็นเพศชาย สำหรับผู้ป่วย 10 ราย มีอายุระหว่าง 13-75 ปี ส่วนใหญ่ประกอบอาชีพเกษตรกรรม (ร้อยละ 30) รองลงมาเป็นอาชีพรับจ้าง (ร้อยละ 20) จากข้อมูลยังพบว่าผู้ป่วยมีโรคประจำตัวร่วมด้วย (ร้อยละ 10) ได้แก่ ความดันโลหิตสูง, เบาหวาน, หัวใจและหลอดเลือด และเป็นผู้ป่วยติดเตียง กิจกรรมหรือปัจจัยเสี่ยงที่สำคัญ ได้แก่ การทำกิจกรรมกลางแจ้ง การดื่มสุรา ทั้งนี้ ผู้ป่วยมีอาการเจ็บป่วยขณะอยู่กลางแจ้งถึงร้อยละ 80 ส่วนผู้เสียชีวิต 37 ราย อายุระหว่าง 17-81 ปี ประกอบอาชีพรับจ้าง (ร้อยละ 27) ภาคกลางมีผู้เสียชีวิตที่เกี่ยวเนื่องจากภาวะอากาศร้อนสูงที่สุด (ร้อยละ 35) นอกจากนี้ พบว่าผู้เสียชีวิตมีโรคประจำตัวร่วมด้วย (ร้อยละ 31) ได้แก่ ความดันโลหิตสูง, เบาหวาน, หัวใจและหลอดเลือด มีพฤติกรรมและปัจจัยเสี่ยงที่สำคัญ คือ การดื่มสุรา อีกทั้งพบว่าเป็นการเสียชีวิตกลางแจ้ง (ร้อยละ 62)
ภายในงานแถลงข่าว ฐิสา-วริฏฐิสา ลิ้มธรรมมหิศร ตัวแทนนักแสดงจิตอาสาร่วมแบ่งปันมุมมองในเรื่อง “ความหวัง” พร้อมเชิญชวนแฟนคลับร่วมซื้อเสื้อยืดสุขใจ เพื่อระดมทุนเข้าโครงการฯ และสร้างการเปลี่ยนแปลงที่ดีในอนาคตร่วมกัน พร้อมด้วยการเปิดตัวกิจกรรม “#A4SpaceChallenge” ชวนทำคอนเทนต์ที่สะท้อนถึงพื้นที่ที่มีอยู่จำกัดในอาคารเก่าและแสดงให้เห็นถึงความจำเป็นการก่อสร้างอาคารใหม่ของโรงพยาบาลรามาธิบดี โดยวิธีการเล่นคือ จับกลุ่ม 4 คนมายืนด้วยกันบนกระดาษ A4 ให้ครบ 10 วินาที และร่วมกันท้าต่อเพื่อน ๆ ให้เล่นชาเลนจ์นี้ต่อ เพื่อเป็นการประชาสัมพันธ์เชิญชวนบริจาคเงินให้โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี โดยทุกคนสามารถร่วมทำชาเลนจ์แล้วโพสต์รูปหรือคลิปลงในโซเชียลมีเดียพร้อมแทค #A4SpaceChallenge ได้แล้วตั้งแต่วันนี้เป็นต้นไป
เอไอ วิเคราะห์ผลเลือด ตรวจหาภูมิ และตรวจอุจจาระ
เอไอนำมาใช้ตรวจวิเคราะห์เม็ดเลือด ตรวจเซลส์เม็ดเลือด
เอไอ ตรวจหาภูมิ
เอไอ ตรวจอุจจาระ
โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ


โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ เป็นหลักสูตรแรกของประเทศไทย ใช้เวลาศึกษา 4 ปี ทั้งภาคทฤษฎีและปฏิบัติ ในภาคทฤษฎีประกอบด้วยวิชาหลักที่เกี่ยวข้องกับการเคลื่อนไหว เช่น กายวิภาคศาสตร์ ชีวกลศาสตร์ สรีรวิทยาการออกกำลังกาย จิตวิทยา โภชนาการ เป็นต้น ในส่วนการฝึกภาคปฏิบัติจะเริ่มฝึกประสบการณ์ในการทำงานจริงตั้งแต่ชั้นปีที่ 3 ซึ่งต้องฝึกงานทั้งในโรงพยาบาลจุฬาภรณ์ สถานออกกำลังกายทั้งภายในโรงพยาบาลจุฬาภรณ์ และภายนอก เช่น หน่วยงานภาครัฐและเอกชน สโมสรกีฬา ทั้งเพื่อสุขภาพ และเพื่อนักกีฬาชั้นเลิศ และทีมกีฬาอาชีพ เช่น ทีมฟุตบอล วอลเลย์บอล เป็นต้น นอกจากนี้นักศึกษาต้องมีงานวิจัยเพื่อสร้างนวัตกรรมและปฏิบัติงานจิตอาสาเพื่อชุมชนในระหว่างการศึกษาอีกด้วย ทั้งนี้ยังมีเทคโนโลยีใหม่ๆ อาทิ ห้องชีวกลศาสตร์ เพื่อการทดสอบการวิเคราะห์ท่าทางการเคลื่อนไหวแบบ 3 มิติ (3D-Dimension Movement Analysis) เป็นการวิเคราะห์ท่าทางโดยมีการติดเครื่องหมายสะท้อนแสงที่ปุ่มกระดูกหรือข้อต่อ และใช้กล้องบันทึกภาพการเคลื่อนไหว จากนั้นใช้โปรแกรมเฉพาะเพื่อวิเคราะห์ตัวแปรทางคิเนเมติกส์และคิเนติกส์ของการเคลื่อนไหว เช่น มุมองศาของข้อต่อ ความเร็วเชิงเส้น เชิงมุมของข้อต่อ และแรงปฏิกิริยาในแนวดิ่งจากพื้น เป็นต้น เพื่อประเมินและวางแผนในพัฒนาการฝึกซ้อมของนักกีฬาให้มีพัฒนาการที่ดีมากยิ่งขึ้น
สสจ.อำนาจเจริญ เปิดตัวโครงการยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว
สำนักงานสาธารณสุขจังหวัดอำนาจเจริญ จัดกิจกรรม Kick off เปิดตัวโครงการ “ยกระดับ 30 บาท รักษาทุกที่ ด้วยบัตรประชาชนใบเดียว” ในวันเสาร์ที่ 30 มีนาคม 2567 ณ หอประชุมสวนพุทธอุทยาน อำเภอเมือง จังหวัดอำนาจเจริญ
เขต 4
- สอน.สาริกา จ.นครนายก
- สอ.เฉลิมพระเกียรติ ร 9 ตำบลทรายมูล จ.นครนายก
- สถานีอนามัยเฉลิมพระเกียรติรัชกาลที่ ๙
- มูลนิธิพัฒนาสถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี
- สอน.คลองมะสง จ.นนทบุรี
- สอ.เฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา (วัดประยูร) ตำบลคูคต จ.ปทุมธานี
- สอ.เฉลิมพระเกียรติ สมเด็จย่า 84 ตำบลบึงน้ำรักษ์ จ.ปทุมธานี
- สถานีอนามัยาเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีตำบลบ่อเงิน จ.ปทุมธานี
- สถานีอนามัยเฉลิมพระเกียรติกาญจนาภิเษกครองราชครบ 50 ปี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านกลาง ปทุมธานี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี นครหลวง อำเภอนครหลวง จังหวัดพระนครศรีอยุธยา
- สถานีอนามัยาเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีตำบลโคกสลุง จ.ลพบุรี
- สอน.ลำพญากลาง จ.สระบุรี
- สอน.พิกุลทอง อ.ท่าช้าง จ.สิงห์บุรี
- สอน.บ้านทุ่งกลับน้อย จ.สิงห์บุรี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษานวมินทราชินี บ้านทุ่งกลับน้อย ตำบลพักทัน อำเภอบางระจัน จังหวัดสิงห์บุรี
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี บ้านยางช้าย จังหวัดอ่างทอง
การเตรียมสัตว์ก่อนการผ่าตัด - หลังการผ่าตัด
การเตรียมสัตว์ก่อนการผ่าตัด
เราไม่ได้ตรวจเลือดก่อนการผ่าตัดเนื่องจากมีจำนวนสัตว์ที่รับการผ่าตัดในแต่ละเดือนเป็นจำนวนมาก และ เราไม่มีทุนทรัพย์สำหรับการเจาะเลือด เจ้าของสามารถพาสัตว์เลี้ยงไปตรวจเลือดเองตามคลินิกสัตว์ที่สะดวกก่อนนำมาทำหมันกับเราเพื่อความปลอดภัยของสัตว์เลี้ยงท่าน
- กรุณาตรวจสอบเหงือกของสัตว์ จะต้องเป็นสีชมพูสุขภาพดี (ไม่ขาวซีด), มีพฤติกรรมกินอาหารที่ปกติและไม่มีโรคแทรกซ้อนก่อนการผ่าตัด
- สัตว์เลี้ยงของคุณต้องไม่มีอาการท้องเสีย อาเจียน หรือมีน้ำตาและน้ำมูกไหล
- สัตว์เลี้ยงจะต้องงดอาหาร 8 ชั่วโมงก่อนเข้ารับการผ่าตัด สามารถให้น้ำได้เล็กน้อย เพื่อป้องกันภาวะขาดน้ำ
หลังการผ่าตัด
หลังการผ่าตัด จะต้องสังเกตการกินอาหารของสัตว์เลี้ยง ห้ามอาบน้ำหรือเล่นน้ำ ภายใน 7 วัน
เรากำลังปฏิบัติภารกิจทำหมันมีหลายวิธีในการช่วยเหลือเรา:
- อาสาสมัคร - ยืมมือและทำงานกับเรา
- บริจาค - เพื่อช่วยเหลือช่วยชีวิตและการฟื้นฟูสุขภาพสุนัขจรจัด
- ไลค์และแชร์โพสของเราคุณไม่เคยรู้ใครที่อาจเห็นมัน ให้ความรู้แก่ผู้อื่นและเพื่อนของคุณ
- กดไลค์หากชอบโพสต์และเรื่องราวของเรา Love Dog โครงการทำหมันสุนัขจังหวัดชุมพร
เพื่อที่เราจะดำเนินการต่อไปได้เราต้องการการบริจาคอย่างยิ่งยวดเพื่อมาครอบคลุมค่าใช้จ่ายของเราซึ่งรวมถึงค่าเช่า, ค่าน้ำไฟ, เงินเดือนพนักงาน, ยา, ค่าน้ำมัน, ค่าซ่อมรถ, อุปกรณ์, อาหาร, และค่าใช้จ่ายอื่นๆหลายอย่างที่เราต้องใช้ในภารกิจการทำหมันของเรา
เดือนเมษายน-พฤษภาคม 2567
กำหนดการเดือนเมษายน-พฤษภาคม 2567 เวลา 9.00 - 12.00 น. ทุกจุด
- 1 เมษายน 2567 วัดป่าสุทธิภาวัน
- 3 เมษายน 2567 วัดช่องลมนาเกลือ
- 10 เมษายน 2567 วัดช่องลมนาเกลือ
- 22 เมษายน 2567 วัดกระทิงราย
- 24 เมษายน 2567 วัดกระทิงราย
- 1 พฤษภาคม 2567 วัดจิตตภาวัน
- 3 พฤษภาคม 2567 วัดจิตตภาวัน
- 6 พฤษภาคม 2567 เกาะล้าน
- ฉีดวัคซีน โรคพิษสุนัขบ้า สัตว์เลี้ยงจะต้องมีสุขภาพแข็งแรง ไม่ป่วย มีอายุ 3 เดือนขึ้นไป
- ผ่าตัดทำหมันคุมกำเนิดถาวร ให้บริการสำหรับสุนัขและแมวไทยเท่านั้น งดรับสุนัขแมวพันธุ์หรือผสม และต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง ไม่ป่วย โดยงดน้ำ งดอาหาร พร้อมกักบริเวณ หรือขังกรง เป็นเวลา 8 - 12 ชั่วโมง (ให้สิทธิ์ครัวเรือนละไม่เกิน 2 ตัว) ระหว่างรอขอความร่วมมือ ล่ามโซ่หรือขังโกรงห้ามปล่อยสุนัขและแมวเพื่อป้องกันน้องแอบทานอาหาร)
- ผู้เข้ารับบริการจะต้องนำบัตรประชาชนมาลงทะเบียน
- หากผู้เข้ารับบริการไม่มีทะเบียนบ้านอยู่ในเขตพื้นที่ ให้แจ้งที่อยู่ที่อาศัย ที่อยู่ปัจจุบันในเขตพื้นที่ได้
สำหรับประชาชนที่สนใจนำสุนัขและแมวเข้ารับบริการ ควรปฏิบัติตามรายละเอียดดังกล่าวอย่างเคร่งครัด สามารถสอบถามเพิ่มเติมได้ที่ กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา หมายเลขโทรศัพท์ 038 – 111826 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
ระยะเวลาการดำเนินโครงการฯ ไม่เกินเดือนกันยายน 2569
ระยะเวลาการดำเนินโครงการฯ
เนื่องจากมีแนวทางการใช้แหล่งเงินงบประมาณรายจ่ายปีงบประมาณ พ.ศ. 2567 และ พ.ศ. 2568 ในการดำเนินโครงการฯ ดังนั้น จึงจะต้องมีการพิจารณาระยะเวลาดำเนินโครงการฯ ให้สอดคล้องกับแหล่งเงินดังกล่าว โดยระยะเวลาดำเนินโครงการฯ จะต้องไม่เกินเดือนกันยายน 25694.Wink clinic
สำหรับ Wink Clinic เป็นคลินิกที่ให้บริการทันตกรรมและหัตถกรรม มีความเชี่ยวชาญการให้บริการที่หลากหลาย ซึ่งโดดเด่นเรื่องการทำฟัน ฟอกฟันขาว มีโปรโมชั่นส่วนลดการทำฟันมากมาย ให้คุณได้เลือกใช้บริการ
ในปีนี้ โรงพยาบาลบำรุงราษฎร์ได้รับเกียรติให้เป็นผู้สนับสนุนหลักของงาน FNM 2024 นับเป็นความภาคภูมิใจในฐานะคนไทยที่ได้เป็นส่วนหนึ่งของงานประชุมวิชาการระดับนานาชาติครั้งนี้ที่ประเทศไทยเราเป็นเจ้าภาพ ซึ่งจะทำให้แพทย์ไทยเป็นที่รู้จักและยอมรับในเวทีทางวิชาการระดับนานาชาติ และแสดงถึงศักยภาพของไทยในฐานะประเทศที่เป็นผู้นำการประชุมวิชาการระดับโลกที่สำคัญ การประชุมนี้ไม่เพียงแต่จะช่วยส่งเสริมอุตสาหกรรมการดูแลสุขภาพ แต่ยังเป็นเวทีสำหรับนวัตกรรมทางการแพทย์และความร่วมมือในอนาคตของประเทศไทย ปัจจัยเหล่านี้จะเอื้อประโยชน์ต่อโครงสร้างพื้นฐานด้านการดูแลสุขภาพ สร้างแรงบันดาลใจให้กับวงการแพทย์ในประเทศ และท้ายที่สุดจะยกระดับมาตรฐานการดูแลผู้ป่วยทั่วทั้งภูมิภาค
ผู้สนใจสามารถลงทะเบียนเข้าร่วมงาน FNM 2024 หรือศึกษารายละเอียดและหัวข้อเสวนาเพิ่มเติมได้ที่
www.fnm2024.comคลินิกรังสีรักษา นอกเวลาราชการ ศูนย์สุขภาพมะฮอกกานี โรงพยาบาลวชิระภูเก็ต
ครบรอบ 116 ปี โรงพยาบาลตากสิน
โลโก้ 116 ปี โรงพยาบาลตากสิน ออกแบบโดย:งานเวชนิทัศน์ ฝ่ายวิชาการและแผนงาน โรงพยาบาลตากสิน
คลินิกนอกเวลา
แพทย์หญิงผาณิต เทศัชบุตร
สามารถมาใช้บริการได้ ตั้งแต่
เวลา 16.00-20.00น.
ธรรมศาสตร์เฉลิมพระเกียรติ กิจกรรมวันงดสูบบุหรี่โลก 2567
โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ขอเชิญเข้าร่วมกิจกรรมวันงดสูบบุหรี่โลก ประจำปี 2567 “ร่วมปกป้องเด็กและเยาวชนจากบุหรี่ไฟฟ้า” วันที่ 30 พฤษภาคม 2567 เวลา 08.30-12.00 น. ณ โถงกิจกรรมชั้น 1 อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
กิจกรรมภายในงานประกอบด้วย
✅ 08.30 - 09.00 น. ลงทะเบียน
✅ 09.00 - 09.15 น. พิธีเปิด โดยผู้อำนวยการโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ
✅ 09.15 - 09.30 น. การแสดงจากนักเรียน
✅ 09.30 -10.00 น. การบรรยายให้ความรู้ เรื่อง พิษภัยของบุหรี่ โดย รศ.พญ.ภัทริน ภิรมย์พานิช
✅ 10.00 - 10.30 น. การบรรยายให้ความรู้ เรื่อง บุหรี่ไฟฟ้ากับเยาวชน โดย อ.พญ.วีร์วะรินทร์ เจริญพร
✅ 10.30 - 11.00 น. ประกาศผลรางวัล คลิปรณรงค์ร่วมปกป้องเด็กและเยาวชนจากบุหรี่ไฟฟ้า
✅ 11.00 -12.00 น. ร่วมกิจกรรมตามบูธต่างๆ
- ให้คำปรึกษาเลิกบุหรี่
- เกมส์ เซียมซีเสี่ยงทาย
- นิทรรศการบุหรี่ไฟฟ้า
สอบถามเพิ่มเติมได้ที่ งานส่งเสริมสุขภาพ โทร. 0 2926 9916
หน่วยสูติ-นรีเวช คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกสูติ-นรีเวช
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396242 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ฝากครรภ์ คลอดบุตร ตรวจคัดกรองความผิดปกติของโครโมโซมขณะตั้งครรภ์ (Thai NIPT) ตรวจก่อนสมรส ตรวจก่อนมีบุตร ฝังยาคุมกำเนิด ตรวจเช็คมะเร็งปากมดลูก ตรวจหาเชื้อไวรัส HPV ฉีดวัคซีนป้องกันมะเร็งปากมดลูก ตรวจมดลูกหย่อน ใส่อุปกรณ์เพื่อผยุงมดลูกแทนการผ่าตัด ผ่าตัดทางนรีเวช
คลินิกพิเศษผ่าตัดเปลี่ยนข้อเข่า-ข้อสะโพกเทียม นอกเวลาราชการ โรงพยาบาลอุตรดิตถ์
ทางเลือกใหม่...ลดเวลารอคอย ผ่าตัดเปลี่ยนข้อเข่า-ข้อสะโพกเทียม นอกเวลาราชการ โดยทีมแพทย์ศัลยกรรมออร์โธปิดิกส์ รพ.อุตรดิตถ์ สอบถามโทร 055-409999 ต่อ 1137 1139
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันพฤหัสบดี
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
เจ็บป่วยเล็กน้อย = สามารถมาหาได้ด้วยตัวเอง
เจ็บป่วยเล็กน้อย = สามารถมาหาได้ด้วยตัวเอง
*ยกเว้น* ผู้พิการ (มีบัตร) หรือ ผู้ป่วยติดเตียง หรือ COVID-19
151 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนชมทรัพย์ (การีมี)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
152 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนประชาอุทิศ 68
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
153 ศูนย์พัฒนาเด็กก่อนวัยเรียนบลูไลท์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
154 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมคลองบางซื่อ ลาดพร้าว 42-44
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
155 ศูนย์พัฒนาเด็กก่อนวัยเรียนหัวรถจักรตึกแดง (บางซื่อ)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
156 ศูนย์พัฒนาเด็กก่อนวัยเรียนบ้านพักรถไฟก่อสร้าง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
157 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสะพานเกษะโกมล
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
158 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดไผ่ตัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
159 ศูนย์พัฒนาเด็กก่อนวัยเรียนตรีเพชร 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
160 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสามัคคีพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
161 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านพลับพลา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
162 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอับดุลรอมาน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
163 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบ้านคูคตพัฒนา (สุเหร่าคูคต)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
164 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านธรากร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
165 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเคหะนคร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
166 ศูนย์พัฒนาเด็กก่อนวัยเรียนศูนย์เจริญพัฒนา (คูคต)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
167 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพร้อมใจพัฒนา(สุขใจ)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
168 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองดารุ้ลฆอนี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
169 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านเคหะนคร 2 (หัวซิ่วติ่งลิ้มเซาะคิ้ม)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
170 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเกาะกลาง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
171 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนร่วมใจพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
172 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนอ่อนนุช (เกาะมุสลิม)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
173 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนคลองสะแก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
174 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนประสาทศีล
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
175 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนลาดพร้าว 45
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
176 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมคลองวัดสะพาน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
177 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแฟลต 23-24
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
178 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาชุมชนใหม่ (แฟลต 19-22)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
179 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาชุมชนใหม่
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
180 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวงศ์สวัสดิ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
181 ศูนย์พัฒนาเด็กก่อนวัยเรียนผ่องพลอยอนุสรณ์ ลิขิต 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
182 ศูนย์พัฒนาเด็กก่อนวัยเรียนหมู่บ้านพัฒนาซอยสวนพลู
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
183 ศูนย์พัฒนาเด็กก่อนวัยเรียนเชุมชนชื้อเพลิงใน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
184 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเชื้อเพลิงนอก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
185 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเพชรทองคำ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
186 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสามัคคี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
187 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหลวงพ่อขาว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
188 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดสีสุก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
189 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนคลองเก้าห้อง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
190 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนข้างสถานีรถไฟวงเวียนใหญ่
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
191 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสงวนทรัพย์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
192 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดดาวดึงษาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
193 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดไชยทิศ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
194 ศูนย์พัฒนาเด็กก่อนวัยเรียนริมทางรถไฟมักกะสัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
195 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบุณยรักษ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
196 ศูนย์พัฒนาเด็กก่อนวัยเรียนมูลนิธิอิสลามเพื่อการพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
197 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนจตุรมิตรสัมพันธ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
198 ศูนย์พัฒนาเด็กก่อนวัยเรียนพิทักษา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
199 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนทรัพย์นุกูล
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
200 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแฟลต 12
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
4. Health Tech โรงพยาบาลราชพิพัฒน์
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ สาขาโรงพยาบาลราชพิพัฒน์ Future Education, Future Learners, and Future Healthcare
นอกจากนี้ภายในงานมีการเสวนาเรื่อง “Future Education, Future Learners, and Future Healthcare อนาคตการศึกษาเพื่อการแพทย์ และสาธารณสุขยุคใหม่ของไทย” โดย ศ. ดร.วิเลิศ ภูริวัชร ผู้รักษาการแทน อธิการบดีจุฬาลงกรณ์มหาวิทยาลัย กล่าวถึงวิสัยทัศน์ของจุฬาลงกรณ์มหาวิทยาลัย ในการเป็นผู้นำด้านนวัตกรรมการศึกษาและความสำคัญของการสร้างบัณฑิตยุคใหม่ที่มี ทักษะการเรียนรู้ตลอดชีวิต
เพราะบทบาทของมหาวิทยาลัยนั้น นอกจากจะเป็นแหล่งรวม ความรู้แล้วยังต้องเป็นแหล่งช่วยพัฒนาคุณภาพชีวิต เพื่อตอบโจทย์ประชาชนชาวไทย ขยายขอบเขตกว้างถึง Global citizen หรือประชากรโลกนั่นเอง
“วันนี้ผมภูมิใจกับคณะแพทยศาสตร์ที่มีแพลตฟอร์ม MedUMORE และภูมิใจที่จุฬาลงกรณ์มหาวิทยาลัย มีส่วน ช่วยสนับสนุนให้ MedUMORE เป็นแหล่งการเรียนรู้ที่มีการรวบรวมเนื้อหาที่ครอบคลุม ในหลายด้านและองค์ความรู้จากความร่วมมือของหลายองค์กรชั้นนำ ไม่ว่าจะเป็นความรู้ ด้าน สุขภาพกาย สุขภาพใจ สุขภาพเงินและการลงทุน ทักษะด้านบริหารและการจัดการ จากผู้เชี่ยวชาญในแต่ละสาขาที่จะช่วยให้ท่านได้เติบโตขึ้นได้
ดังนั้นปัจจุบันเราไม่ได้ก้าว ตามโลกอีกต่อไป แต่จุฬาลงกรณ์มหาวิทยาลัยจะก้าวล้ำโลก เราเป็นผู้ที่ชี้นำในระดับโลก ความเป็น Pioneer หมายความว่าเรามีนวัตกรรมทางการแพทย์ที่เป็นผู้นำ (Leading) กล่าวโดยสรุปคือ เรานำองค์ความรู้มาชี้นำสังคม ชี้นำประชากรให้มีคุณภาพชีวิตที่ดีขึ้น และนี่คือบทบาทที่ยิ่งใหญ่ของจุฬาลงกรณ์มหาวิทยาลัย”
ศ.พญ.ธนินี สหกิจรุ่งเรือง ประชาสัมพันธ์ สมาคมโรคเบาหวานแห่งประเทศไทยฯ กล่าวเสริมว่ากิจกรรมอบรมในโครงการ KiDS นี้ ครอบคลุมถึงความรู้เกี่ยวกับโรคเบาหวานในเด็กและวัยรุ่น จากแพทย์ผู้เชี่ยวชาญด้านเบาหวาน เสวนาถึงการดูแลจัดการเบาหวานในโรงเรียน ผ่านมุมมองของ IDF Youth Leaders โดยจะมีเยาวชนผู้ที่เป็นเบาหวาน ซึ่งจะเป็นกระบอกเสียงสะท้อนเกี่ยวกับโรคเบาหวานในประเทศไทย รวมถึงมีการแนะนำสื่อ ‘โรงเรียนสุขสันต์ รู้ทันเบาหวาน’ โดยทีมงาน KiDS Project ตลอดจนสื่อต่างๆ ของภาคส่วนที่เกี่ยวข้อง เช่น สื่อจากโครงการสามเหลี่ยมสมดุล (สสส.) และสื่อจากชมรมเพื่อเด็กและวัยรุ่นเบาหวาน เพื่อสนับสนุน healthy lifestyle เพื่อป้องกันเบาหวานในอนาคต อีกทั้งยังมีการแบ่งกลุ่มแลกเปลี่ยนเรียนรู้ ระดมสมองเพื่อหาแนวทางและสร้างเครือข่ายสนับสนุน ทั้งเชิงป้องกัน และการดูแลเด็กๆ ที่เป็นเบาหวานในโรงเรียนให้มีสุขภาวะที่ดีทั้งร่างกายและจิตใจ รวมถึงลดการแบ่งแยก ตีตราเด็กและวัยรุ่นที่ต้องใช้ชีวิตกับโรคเบาหวาน
นายปีเตอร์ สไตรเบิล กรรมการผู้จัดการ บริษัท ทาเคดา (ประเทศไทย) จำกัด กล่าวว่า “ทาเคดามุ่งมั่นเป็นส่วนหนึ่งของกำลังสำคัญในการขับเคลื่อนให้ประเทศไทยก้าวสู่สังคมปลอดไข้เลือดออกผ่านความร่วมมือกับภาครัฐและเอกชนในหลากหลายมิติ เพื่อช่วยลดภาระทางด้านสาธารณสุข เศรษฐกิจ และสังคม โดยเน้นการสื่อสารที่ให้เห็นถึงความสำคัญของมาตรการป้องกันโรคไข้เลือดออกและการสร้างเสริมภูมิคุ้มกันให้แก่บุคลากรทางการแพทย์ อาสาสมัครสาธารณสุขกรุงเทพมหานคร คุณครูและนักเรียนในพื้นที่เสี่ยงทั่วประเทศ ขอขอบคุณกรมควบคุมโรค กรุงเทพมหานคร และเหล่าพันธมิตรที่ร่วมกันทำงานเพื่อปกป้องคนไทยจากไข้เลือดออก และเราจะทำงานและเดินหน้าประสานทุกความร่วมมือเพื่อให้บรรลุเป้าหมายในการลดอัตราการระบาด การเจ็บป่วย และการสูญเสียให้เป็นศูนย์ในไทยให้ได้”
มร.ลาร์ส สเวนสัน (Lars Svensson) ผู้บริหารศูนย์บริหารจัดการความยั่งยืนและส่งเสริมผู้ประกอบการแห่งศศินทร์ กล่าวว่าวันเปิดการประชุมนี้ตรงกับวันครีษมายัน หรือ summer solstice ซึ่งเป็นวันที่มีเวลากลางวันยาวนานที่สุดในรอบปี และยังเป็นเทศกาลเฉลิมฉลองกลางฤดูร้อนในประเทศสวีเดนด้วย “เรามารวมตัวกันที่นี่เพื่อทำให้ความร่วมมือของเรางอกงาม เพื่อฉลองให้กับแสงสว่างของการคิดบวก เพื่อการขยายเครือข่ายของเรา และเพื่อความรักและความเชื่ออันแรงกล้าว่าการเป็นผู้ประกอบการที่เปิดกว้างสามารถขับเคลื่อนผลกระทบเชิงบวกได้จริงๆ” มร.ลาร์ส กล่าว
โดย โรคอ้วน เป็นโรคที่พบได้บ่อยมากขึ้นในเด็ก ซึ่งเกิดจากการเด็กทานอาหารที่ไม่ดีต่อสุขภาพ ทำให้มีน้ำหนักเกิน และอาจเกิดภาวะแทรกซ้อน เช่น เบาหวาน นอนกรน ความดันหรือไขมันในเลือดสูง ที่โรงพยาบาลบำรุงราษฎร์ จึงมีแพทย์และผู้เชี่ยวชาญหลากหลายสาขาที่ให้การดูแลร่วมกันเป็นทีม เพื่อผลลัพธ์ที่ดีที่สุดกับเด็ก เช่น แพทย์ต่อมไร้ท่อที่ดูแลทางด้านโรคเบาหวาน นักโภชนาการที่ให้คำแนะนำด้านการทานอาหาร แพทย์ทางเดินหายใจที่ดูแลเรื่องการนอนกรน และแพทย์ทางเดินอาหารและตับที่ดูแลหากมีภาวะมีไขมันพอกที่ตับ การเป็นหนุ่มสาวก่อนวัย เป็นอีกภาวะที่พบได้บ่อยในปัจจุบัน ส่งผลต่อการเติบโตของเด็ก จึงควรได้รับการวินิจฉัยอย่างรวดเร็วและทำการรักษาทันที นอกจากนี้ ความสูงที่ไม่ตรงตามเกณฑ์ อาจเกิดจากภาวะเตี้ย ซึ่งต้องได้รับการตรวจวินิจฉัยและรักษาเพิ่มเติม ส่วนเด็กที่มีส่วนสูงกว่าเกณฑ์ปกติ อาจเกิดจากภาวะการเป็นหนุ่มสาวก่อนวัย ควรพามาตรวจสุขภาพตามวัย ซึ่งที่โรงพยาบาลบำรุงราษฎร์มีการประเมินเพื่อการรักษาเฉพาะบุคคล โดยแพทย์เฉพาะทางด้านโรคต่อมไร้ท่อที่ให้คำปรึกษา ตรวจวินิจฉัย และรักษาได้อย่างรวดเร็ว รวมถึงมีพยาบาลเฉพาะทางด้านต่อมไร้ท่อ ที่ให้คำแนะนำและดูแลได้อย่างครบวงจร
ที่โรงพยาบาลบำรุงราษฎร์ เรามีกุมารแพทย์ด้านต่อมไร้ท่อ ที่ผ่านการดูแลเด็กโรคระบบต่อมไร้ท่อจากทั่วโลกมามากกว่า 20,000 ราย รวมถึงแพทย์หลากหลายสาขาที่ให้การดูแลร่วมกันเป็นทีม เพื่อผลลัพธ์ที่ดีที่สุดกับเด็ก นอกจากนี้ เรายังมีความพร้อมทั้งในด้านเทคโนโลยีและเครื่องมือที่มีประสิทธิภาพสำหรับการวินิจฉัยและรักษา โดยเรามุ่งหวังให้เด็ก ๆ ทุกคน เติบโตอย่างมีสุขภาพแข็งแรงทั้งด้านสุขภาพและมีพัฒนาการการเติบโตที่ดีสมวัย
สอบถามรายละเอียดเกี่ยวกับการรักษาได้ที่ศูนย์กุมารเวช โรงพยาบาลบำรุงราษฎร์ ชั้น 17-18 อาคาร A (คลินิก) โทร. 061 409 1613 (Hotline) หรือโทร. 02 066 8888 และ 1378 (Contact Center)


“หลักสูตรที่นี่เกือบทั้งหมดเป็นหลักสูตรที่จะได้ช่วยเหลือ แล้วก็อาจจะได้ค้นพบสิ่งที่คนในยุคก่อนหลายๆ คน เรียกว่าเป็นโรคเวรโรคกรรม บอกว่ามันไม่มีทางรักษา ในปัจจุบันมีเทคโนโลยีต่างๆ เกิดขึ้นมากมาย มีแม้กระทั่งการใช้เอไอเพื่อจะเรียนรู้รหัสพันธุกรรม ช่วยหาตำแหน่งส่วนที่กลายพันธุ์ เพื่อที่จะได้ออกแบบยาหรือการรักษาที่ตรงเป้ามากขึ้น วันข้างหน้าโรคต่างๆ เหล่านี้ อาจจะมีโอกาสที่หายมากขึ้น คนในเจเนอเรชันตั้งแต่เราขึ้นไป นับวันจะร่วงโรยจากโลกนี้ แต่ก็ยังอุ่นใจที่สามารถฝากความหวังไว้กับเด็กๆ รุ่นใหม่ในวันนี้ได้ ขอบคุณที่สนใจราชวิทยาลัยจุฬาภรณ์และหลักสูตรค่ะ วันหนึ่งในอนาคตข้างหน้า น้องอาจจะเป็นคุณหมอ อาจจะเป็นพยาบาล อาจจะเป็นนักฉุกเฉินการแพทย์ หรืออาจจะเป็นนักวิจัยที่ค้นพบการรักษาใหม่ๆ ที่เป็นความหวังของโลกใบนี้ ท้ายสุดในนามราชวิทยาลัยจุฬาภรณ์ เรามีความเชื่อมั่นว่าเด็กไทยไม่แพ้เด็กชาติไหนในโลกนี้ ก็ขออนุญาตฝากความหวังไว้ในมือน้อยๆ ของเด็กๆ ทุกคน หวังว่าในวันข้างหน้าทุกๆ คนจะได้สร้างประสบการณ์อันยิ่งใหญ่ แล้วก็เป็นความหวัง ซึ่งไม่ใช่แต่ของคนไทย แต่จะเป็นความหวังของมนุษยชาติ ที่เกี่ยวกับการค้นพบบางอย่างในโลกใบนี้” ศาสตราจารย์ แพทย์หญิงยุวเรศมคฐ์ กล่าวทิ้งท้าย
ความรับผิดชอบต่อสังคม
อุตสาหกรรมยาสูบและอุตสาหกรรมที่เกี่ยวข้อง ก็ใช้กิจกรรมองค์กรความรับผิดชอบสังคม เพื่อสร้างการรับรู้ถึงแบรนด์และขัดเกลาชื่อเสียงในหมู่ผู้ชมรุ่นเยาว์
- ในบางประเทศ อุตสาหกรรมจะให้การสนับสนุนด้านวิชาการ ทุนการศึกษาหรือการสร้างโรงเรียนเพื่อส่งเสริมความรู้สึกเชิงบวกและหันเหความสนใจจากการแสวงหาผลประโยชน์จากคนหนุ่มสาว
- ในบางประเทศ อุตสาหกรรมนี้ได้ดูแลเยาวชน การรณรงค์ต่อต้านการสูบบุหรี่และต่อต้านการใช้บุหรี่ไฟฟ้า การวิจัยพบว่า แคมเปญเหล่านี้ไม่มีประสิทธิผลที่จะลดความตั้งใจของเยาวชนที่จะใช้ยาสูบหรือบุหรี่ไฟฟ้า แต่อย่างใด และอาจส่งผลตรงกันข้ามด้วยซ้ำ [19] เช่น แคมเปญอาจกระตุ้นให้เยาวชนมีมากขึ้นทัศนคติที่ดีต่อบริษัทยาสูบ
- อุตสาหกรรมให้การสนับสนุนการแข่งขันระดับโลกสำหรับเยาวชน เช่น Conrad Challenge ซึ่งมุ่งเป้าไปที่ เด็กอายุ 13–18 ปี (20) และ BAT’s Battle of the Minds ซึ่งมุ่งเป้าไปที่นักศึกษามหาวิทยาลัย [21] นอกจากนี้ยังสนับสนุนกิจกรรมกีฬาและสิ่งอำนวยความสะดวก สร้างความตระหนักรู้อย่างมีประสิทธิภาพของบริษัทยาสูบและผลิตภัณฑ์ของบริษัทเหล่านั้น ในกลุ่มเยาวชน
ศูนย์พักพิงสุนัขจังหวัดสุพรรณบุรี แห่งที่ 1 (เทศบาลเมืองจังหวัดสุพรรณบุรี)
ศูนย์พักพิงสุนัขจังหวัดสุพรรณบุรี แห่งที่ 1 (เทศบาลเมืองจังหวัดสุพรรณบุรี) กองสาธารณสุขเทศบาลเมืองสุพรรณบุรี ช่องทางการติดต่อสอบถาม โทร 035-511021 ต่อ 126 ศูนย์พักพิงฯ เชิญชวน
- ร่วมหาบ้านใหม่ให้สุนัข
- ร่วมบริจาคอาหารให้สุนัข
- ร่วมบริจาคสมทบทุนช่วยเหลือสุนัขจรจัด ณ ศูนย์พักพิงสุนัขจังหวัดสุพรรณบุรี แห่งที่ 1 เทศบาลเมืองสุพรรณบุรี บัญชีธ.กรุงไทย เลขที่ 747-0-493166
ธารน้ำใจเพียงเล็กน้อยของท่าน อาจมีความหมายกับหลายชีวิต
ศูนย์พักพิงสุนัขฯ ได้จัดกิจกรรมร่วมกับปศุสัตว์จังหวัดสุพรรณบุรี ปศุสัตว์อำเภอเมืองสุพรรณบุรีในการผ่าตัดทำหมันสุนัขและแมวให้กับประชาชนในเขตเทศบาลเมืองสุพรรณบุรี เพื่อควบคุมจำนวนประชากรของสุนัขและแมว เพื่อรองรับการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าในเขตเทศบาลเมืองสุพรรณบุรี สามารถติดตามข้อมูลได้ทาง
เพจของศูนย์พักพิง นวัตกรรมการวินิจฉัยโรคตับด้วยการส่องกล้อง
นวัตกรรมการวินิจฉัยโรคตับด้วยการส่องกล้องระบบทางเดินอาหารและตับ ด้วยมะเร็งตับเป็นมะเร็งที่พบมากเป็นอันดับ 1 ของประเทศไทย โดยมะเร็งตับที่พบมากในประเทศไทยมี 2 ชนิด คือ มะเร็งท่อน้ำดีตับมีสาเหตุหลักจากพยาธิใบไม้ตับพบมากทางภาคอิสาน และ มะเร็งของเซลล์ตับ พบได้ทั่วทุกภาคของประเทศไทย ซึ่งสาเหตุที่สำคัญที่สุดในการเกิดมะเร็งของเซลล์ตับในคนไทย คือ การเป็นพาหะของเชื้อไวรัสตับอักเสบ บี และ ซี โดยกระทรวงสาธารณสุขตั้งเป้ากำจัดโรคไวรัสตับอักเสบบีและซี ให้สำเร็จภายในปี พ.ศ. 2573 โรงพยาบาลจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ จึงร่วมรณรงค์ชวนคนไทยเข้าตรวจคัดกรองไวรัสตับอักเสบบีและซี พร้อมอัพเดทนวัตกรรมการวินิจฉัยโรคตับ โดย นพ.วรวัฒน์ แสงวิภานภาพร ศูนย์ทางเดินอาหารและตับ โรงพยาบาลจุฬาภรณ์
กทม. พร้อมช่วยประสานกรมประมงเยียวยาเกษตรกร
ในส่วนของความเสียหายที่เกิดขึ้นกับเกษตรกรเนื่องจากการแพร่ระบาดของปลาหมอคางดำนั้น ผู้อำนวยการเขตบางขุนเทียน ได้กล่าวว่า ในพื้นที่เขตบางขุนเทียนมีเกษตรกรที่ได้รับผลกระทบที่ขึ้นทะเบียนไว้ ประมาณ 800 ราย ขณะนี้อยู่ในขั้นตอนรอการเยียวยา
รองผู้ว่าฯ ศานนท์ กล่าวเสริมว่า ทางกรมประมงได้มีการส่งหนังสือถึงกรมบัญชีกลางเพื่อจัดสรรงบประมาณมาเยียวยา ซึ่งหากมีความคืบหน้าทางกรุงเทพมหานครจะทำการติดต่อเกษตรกรอีกครั้งหนึ่ง
“เรื่องการเยียวยาต้องเป็นไปในมาตรฐานเดียวกัน ซึ่งกรมประมงเป็นหลัก คือดูภาพรวมทั้งประเทศ เพราะเป็นเหตุที่เกิดขึ้นทั่วประเทศไม่ใช่แค่ในพื้นที่กรุงเทพมหานคร ส่วนเราจะเพิ่มเติมอะไรได้นั้น จะต้องดูระเบียบของเราอีกครั้งหนึ่ง” ผู้ว่าฯ ชัชชาติ กล่าว
ในวันนี้ นายศานนท์ หวังสร้างบุญ รองผู้ว่าราชการกรุงเทพมหานคร นายพรพรหม วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานครและผู้บริหารด้านความยั่งยืนกรุงเทพมหานคร นายเฉลิมพล โชตินุชิต รองปลัดกรุงเทพมหานคร นางภัสรา นทีทอง ผู้อำนวยการเขตบางขุนเทียน คุณปิติ มนัสประกัลภ์ President Business Development บริษัท สหสเตนเลส สตีล จำกัด พร้อมด้วยผู้บริหารและเจ้าหน้าที่สำนักงานเขตบางขุนเทียน ผู้แทนสำนักพัฒนาสังคม สื่อมวลชน ประชาชนกลุ่มเปราะบางในพื้นที่เขตบางขุนเทียน ร่วมกิจกรรม
ผู้ป่วยที่เป็นโรคไข้หวัดนกมีอาการอย่างไร
ผู้ที่มีความเสี่ยงต่อโรคไข้หวัดนก คือ ผู้ที่มีประวัติสัมผัสสัตว์ปีก ในพื้นที่ที่มีการระบาดของโรคไข้หวัดนก ในช่วง 14 วันก่อนมีอาการ ผู้ป่วยที่ติดเชื้อ ไข้หวัดนกมักมีอาการเด่นชัด คือ ไข้ และอาการทางระบบทางเดินหายใจ ส่วนใหญ่ มีอาการไอและหายใจเหนื่อยหอบจากปอดอักเสบ ผู้ป่วยบางรายอาจพบภาวะ แทรกซ้อนทางปอดรุนแรง คือ ระบบทางเดินหายใจล้มเหลว นอกจากนี้ อาจพบอาการทางระบบทางเดินอาหาร เช่น ท้องเสีย และอาจพบอาการทางระบบ ประสาท เช่น ซึม ชัก ในผู้ป่วยที่อาการรุนแรงมากจะมีภาวะการทำงานของ อวัยวะต่างๆ ล้มเหลวและเสียชีวิตได้
กลุ่มผู้ป่วยที่มักจะมีอาการรุนแรงและเสียชีวิต คือ กลุ่มผู้ป่วยสูงอายุ ที่มีโรคประจำตัว เช่น ความดันโลหิตสูง เบาหวาน โรคหัวใจ โรคตับ โรคไตเรื้อรัง เป็นต้น และกลุ่มหญิงตั้งครรภ์
4. NomadML: แพลตฟอร์ม AI สัญชาติไทย
NomadML แพลตฟอร์ม AI สัญชาติไทย โดย ดร. ธีศิษฏ์ ลีลาสวัสดิ์สุข ศูนย์เทคโนโลยีอิเล็กทรอนิกส์และคอมพิวเตอร์แห่งชาติ (NECTEC) สวทช. ที่จะปฏิวัติวงการ Computer Vision ไม่ต้องเขียนโค้ด ก็เทรนโมเดล AI ได้ง่ายๆ
ตารางแพทย์ผู้ป่วยนอก วันพฤหัสบดี โรงพยาบาลชลบุรี
หยุดคิด หยุดสูบ!!สร้างชีวิตใหม่ ด้วยการเลิกบุหรี่ไฟฟ้า
ศูนย์สนับสนุนบริการสุขภาพที่ 4 นนทบุรี
ศูนย์สนับสนุนบริการสุขภาพที่ 4 (Regional Health Service Support Center 4) มีพื้นที่รับผิดชอบ จำนวน 8 จังหวัด ได้แก่ สระบุรี นนทบุรี ลพบุรี อ่างทอง นครนายก สิงห์บุรี พระนครศรีอยุธยา ปทุมธานี
สำนักงานสนับสนุนบริการสุขภาพเขต 4 จังหวัดนนทบุรี จัดตั้งเมื่อวันที่ 21 ตุลาคม พ.ศ. 2556 ตามคำสั่งกรมสนับสนุนบริการสุขภาพ ที่ 1580/2556 โดยมีอำนาจหน้าที่ในการส่งเสริม สนับสนุน และขับเคลื่อนยุทธศาสตร์การคุ้มครองผู้บริโภคด้านระบบบริการสุขภาพและระบบสุขภาพภาคประชาชน และควบคุม กำกับ ติดตามระบบบริการสุขภาพและระบบสุขภาพภาคประชาชนให้เป็นไปตามกฎหมาย ต่อมาเมื่อวันที่ 5 สิงหาคม พ.ศ. 2562 กรมสนับสนุนบริการสุขภาพ ได้มีคำสั่งเพื่อเปลี่ยนชื่อหน่วยงาน จัดโครงสร้างแบ่งงานภายใน และกำหนดหน้าที่ความรับผิดชอบ ตามคำสั่งกรมสนับสนุนบริการสุขภาพ ที่ 1280/2562 โดยอาศัยอำนาจตามความในมาตรา 32 แห่งพระราชบัญญัติระเบียบ บริหารราชการแผ่นดิน พ.ศ. 2534 และที่แก้ไขเพิ่มเติม อธิบดีกรมสนับสนุนบริการสุขภาพ จึงเห็นชอบให้ออกคำสั่งให้เปลี่ยนชื่อหน่วยงาน “ สำนักงานสนับสนุนบริการสุขภาพเขต 1–12 (ระบุจังหวัด) ” เป็น “ ศูนย์สนับสนุนบริการสุขภาพที่ 1 –12 ”
- อาคารกองวิศวกรรมการแพทย์ ชั้น M-2 เลขที่ 88/33 หมู่ที่ 4 ตำบลตลาดขวัญ อำเภอเมือง จังหวัดนนทบุรี 11000
- โทรศัพท์ 02-1495614 โทรสาร 02-1495613
- email : saraban-hss4@hss.mail.go.th , hss4nonthaburi@gmail.com
- Google map
- Facebook
- Website
รูปที่ 6 จำนวนผู้ประกอบการ SMEs ในแต่ละธุรกิจ
4. การพัฒนาซอฟต์แวร์แบบเอไอเสริม (AI-Augmented Software Development)
ที่ผ่านมา การพัฒนาซอฟต์แวร์ต่างๆ เป็นฝีมือของมนุษย์ทั้งสิ้น การมาถึงของ generative AI ทำให้โลกตื่นตะลึงกับความสามารถอันมากมาย ประโยชน์ด้านสำคัญด้านหนึ่ง คือการใช้ generative AI เพื่อพัฒนาซอฟต์แวร์ นักพัฒนาซอฟต์แวร์สามารถนำ generative AI เป็น software development tools ที่สำคัญ และทำงานร่วมกับ Machine Learning เพื่อใช้ในกระบวนการออกแบบ สร้าง ทดสอบ รวมไปถึงการวางตลาดแอปพลิเคชันและซอฟต์แวร์ต่าง ๆ อย่างรวดเร็วมากขึ้น
AI จะเข้ามาช่วยการสร้างและแปลโค้ดต่าง ๆ โดยเฉพาะโค้ดรูปแบบดั้งเดิมให้ใช้ได้กับภาษาสมัยใหม่ รวมไปถึงการแปลงภาษาธรรมชาติอย่างภาษาพูดของคนให้กลายเป็นโค้ดได้อย่างรวดเร็ว นอกจากนี้ อัลกอริทึม (algorithm) ที่ AI และ ML สร้างขึ้น จะมีส่วนเข้ามาเป็นผู้ช่วยเสนอแนะการตัดสินสำคัญต่าง ๆ รวมถึงเพิ่มบทบาทใน “การออกแบบพัฒนาทักษะ” ทั้งในรูปแบบของการอบรมหรือการทำงาน การเสริมทักษะ การรีสกิล (reskill) การอัปสกิล (upskill) ให้เหมาะสมกับบุคลากรในองค์กรมากยิ่งขึ้น
ประมาณการณ์กันว่าจะมีการยกระดับผลิตภาพ (productivity) ของการทำซอฟต์แวร์และแอปพลิเคชันใหม่ ๆ ราว 35-45% ไปพร้อมๆ กับการลดต้นทุนได้ถึง 20% โดยใช้เวลาที่สั้นลงอีกด้วย
ทั้งนี้คาดว่าภายในปี พ.ศ.2571 วิศวกรซอฟต์แวร์หรือโปรแกรมเมอร์ในองค์กรราว 75% จะใช้ AI ช่วยในการเขียนโค้ด เทียบกับปัจจุบันที่ยังทำเช่นนี้น้อยกว่า 10%
โครงการที่ ๔ โครงการตรวจคัดกรองไวรัสตับอักเสบบีและซี
โครงการที่ ๔ โครงการตรวจคัดกรองไวรัสตับอักเสบบีและซี หนึ่งในสาเหตุสำคัญของการเกิดโรคมะเร็งตับ ซึ่งเป็นมะเร็งที่พบมากอันดับ ๑ ของประเทศไทย โดยมะเร็งตับที่พบมากในประเทศไทยมี 2 ชนิด คือ มะเร็งท่อน้ำดีตับมีสาเหตุหลักจากพยาธิใบไม้ตับพบมากทางภาคอิสาน และ มะเร็งของเซลล์ตับ พบได้ทั่วทุกภาคของประเทศไทย
ซึ่งสาเหตุที่สำคัญที่สุดในการเกิดมะเร็งของเซลล์ตับในคนไทย คือ การเป็นพาหะของเชื้อไวรัสตับอักเสบ บี และ ซี โดยกระทรวงสาธารณสุขตั้งเป้ากำจัดโรคไวรัสตับอักเสบบีและซี ให้สำเร็จภายในปี พ.ศ. ๒๕๗๓
โดยโรงพยาบาลจุฬาภรณ์ได้จัดทำโครงการบริการวิชาการและวิชาชีพด้านสุขภาพ เพื่อสร้างความรู้ความเข้าใจให้ประชาชนได้ตระหนักถึงภัยของไวรัสตับอักเสบและให้บริการตรวจคัดกรองไวรัสตับอักเสบบีและซี จำนวน ๗๒๐ ราย ในวันที่ ๒๕-๒๖ กรกฎาคม ๒๕๖๗ ณ อาคารรัฐประศาสนภักดี (อาคาร B) ศูนย์ราชการเฉลิมพระเกียรติฯ เพื่อให้ประชาชนได้เข้าถึงการตรวจคัดกรองที่สะดวก รวดเร็ว รู้ผลทันที เพื่อป้องกันตนเองและลดปัจจัยเสี่ยงต่อการเป็นโรคตับแข็งและมะเร็งตับในอนาคตต่อไป
4.QUALITY EDUCATION การศึกษาที่มีคุณภาพ
ตั้งแต่ปี 2000 เป็นต้นมา มีความคืบหน้าอย่างมากในการบรรลุเป้าหมายการศึกษาระดับประถมศึกษาทั่วถึง อัตราการลงทะเบียนเรียนทั้งหมดในภูมิภาคกำลังพัฒนาสูงถึง 91 เปอร์เซ็นต์ในปี 2015 และจำนวนเด็กทั่วโลกที่ไม่ได้ไปโรงเรียนลดลงเกือบครึ่งหนึ่ง นอกจากนี้ อัตราการรู้หนังสือยังเพิ่มขึ้นอย่างมาก และเด็กผู้หญิงจำนวนมากได้ไปโรงเรียนมากกว่าที่เคย ทั้งหมดนี้ถือเป็นความสำเร็จที่น่าทึ่ง
ความก้าวหน้าในบางภูมิภาคกำลังพัฒนายังคงยากลำบากเนื่องมาจากระดับความยากจนที่สูง ความขัดแย้งด้วยอาวุธ และสถานการณ์ฉุกเฉินอื่นๆ ในเอเชียตะวันตกและแอฟริกาเหนือ ความขัดแย้งด้วยอาวุธที่ยังคงดำเนินอยู่ทำให้จำนวนเด็กที่ไม่ได้ไปโรงเรียนเพิ่มขึ้น ซึ่งเป็นแนวโน้มที่น่าเป็นห่วง แม้ว่าแอฟริกาใต้สะฮาราจะมีความก้าวหน้ามากที่สุดในด้านการลงทะเบียนเรียนในระดับประถมศึกษาเมื่อเทียบกับภูมิภาคกำลังพัฒนาทั้งหมด จาก 52 เปอร์เซ็นต์ในปี 1990 เป็น 78 เปอร์เซ็นต์ในปี 2012 แต่ความแตกต่างจำนวนมากยังคงมีอยู่ เด็กจากครัวเรือนที่ยากจนที่สุดมีโอกาสไม่ได้ไปโรงเรียนมากกว่าเด็กจากครัวเรือนที่ร่ำรวยที่สุดถึง 4 เท่า ความเหลื่อมล้ำระหว่างพื้นที่ชนบทและเขตเมืองยังคงสูงอยู่
การบรรลุการศึกษาที่ครอบคลุมและมีคุณภาพสำหรับทุกคนตอกย้ำความเชื่อที่ว่าการศึกษาเป็นหนึ่งในเครื่องมือที่ทรงพลังและพิสูจน์แล้วสำหรับการพัฒนาอย่างยั่งยืน เป้าหมายนี้ช่วยให้มั่นใจได้ว่าเด็กหญิงและเด็กชายทุกคนจะเรียนจบประถมศึกษาและมัธยมศึกษาฟรีภายในปี 2030 นอกจากนี้ยังมีเป้าหมายที่จะให้เข้าถึงการฝึกอบรมอาชีวศึกษาที่ราคาไม่แพงอย่างเท่าเทียมกัน ขจัดความเหลื่อมล้ำทางเพศและความมั่งคั่ง และบรรลุการเข้าถึงการศึกษาระดับสูงที่มีคุณภาพอย่างทั่วถึง
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนเมษายน 2567
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมไตรมาสที่ 1/2567 และแนวโน้มไตรมาสที่ 2/2567 และรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
เมษายน 2567 ตามที่กระทรวงอุตสาหกรรมเสนอดังนี้
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมไทยไตรมาสที่ 1 ปี 2567 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) มีค่าอยู่ที่ 100.93 ลดลงร้อยละ 3.58 เมื่อเปรียบเทียบกับไตรมาสเดียวกันของปีก่อนเป็นการปรับตัวลดลงเป็นไตรมาสที่ 6 ติดต่อกัน ตามการชะลอตัวเศรษฐกิจโลก โดยการผลิตเพื่อส่งออกยังคงชะลอตัว เช่นเดียวกับเศรษฐกิจภายในประเทศ ซึ่งมีการปรับตัวลดลงในสินค้าที่มีบทบาทสำคัญในภาคอุตสาหกรรม หลังจากการเติบโตของเศรษฐกิจไทยลดลง และรายได้ครัวเรือนเพิ่มขึ้นน้อย สวนทางกับภาวะหนี้ครัวเรือนที่เพิ่มสูงขึ้น ทั้งนี้ อุตสาหกรรมสำคัญที่ชะลอตัวในไตรมาสที่ 1 ปี 2567 อาทิ ยานยนต์จากสินค้ารถบรรทุกปิคอัพ และรถยนต์นั่งขนาดเล็ก เป็นหลัก จากกำลังซื้อในประเทศที่อ่อนตัวลง หนี้สินครัวเรือนอยู่ในระดับสูง สถาบันการเงินมีความเข้มงวดในการปล่อยสินเชื่อกระทบต่อการออกรถยนต์ใหม่ ประกอบกับผู้บริโภคบางส่วนหันไปซื้อรถยนต์มือสองที่มีราคาถูกกว่า ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ ตามการชะลอตัวของเศรษฐกิจโลกที่กระทบต่อการบริโภคและการลงทุน ส่งผลให้ความต้องการสินค้าอิเล็กทรอนิกส์ ชะลอตัว และ น้ำมันปาล์ม จากน้ำมันปาล์มดิบและน้ำมันปาล์มบริสุทธิ์ สาเหตุหลักมาจากสภาพอากาศที่แห้งแล้งยาวนาน ส่งผลให้ปริมาณผลปาล์มออกสู่ตลาดน้อยลง สำหรับ อุตสาหกรรมที่มีการขยายตัวในไตรมาสที่ 1 ปี 2567 อาทิ ผลิตภัณฑ์ที่ได้จากการกลั่นปีโตรเลียม จากการเติบโตของภาคการท่องเที่ยวที่กลับเข้าสู่ภาวะปกติ ทำให้ทิศทางการใช้น้ำมันเชื้อเพลิงในการเดินทางมีมากขึ้น ปุ๋ยเคมีและสารประกอบไนโตรเจนเป็นการผลิตเพื่อรองรับการเพาะปลูกในช่วงถัดไป ประกอบกับสามารถนำเข้าแม่ปุ๋ยได้เพิ่มขึ้นซึ่งในช่วงเดียวกันของปีก่อนเกิดปัญหาขาดแคลนแม่ปุ๋ยและมีราคาแพง และ เครื่องดื่มที่ไม่มีแอลกอฮอล์ น้ำแร่ และน้ำดื่มบรรจุขวดประเภทอื่น ๆ เพิ่มขึ้นจากสินค้าเกือบทุกรายการ ยกเว้นเครื่องดื่มกาแฟสำเร็จรูปจากสภาพอากาศที่ร้อนจัดทำให้ผู้บริโภคมีความต้องการสินค้าเพิ่มมากขึ้น
ภาวะเศรษฐกิจอุตสาหกรรมเดือนเมษายน 2567 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) อยู่ที่ระดับ 90.34 ขยายตัวร้อยละ 3.4 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากฐานของปีก่อนต่ำ เนื่องจากเดือนเมษายน ปี 2566 ค่าดัชนีผลผลิตอุตสาหกรรมค่อนข้างต่ำ (MPI เดือนเมษายน 2566 อยู่ที่ 87.35) และภาคการท่องเที่ยวขยายตัวในเกณฑ์ดี ส่งผลให้อุตสาหกรรมที่เกี่ยวข้องได้รับอานิสงส์ เช่น อาหารและเครื่องดื่ม และการกลั่นน้ำมัน เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนเมษายน 2567 ขยายตัวเมื่อเทียบกับ
ช่วงเดียวกันของปีก่อน คือ
1. เครื่องปรับอากาศ ขยายตัวร้อยละ 24.19 ตามความต้องการบริโภคมากขึ้นเนื่องจากสภาพอากาศร้อนจัดและผู้ผลิตพัฒนาสินค้าตรงตามความต้องการของผู้บริโภค อาทิ กรอง PM 2.5 โดยขยายตัวทั้งตลาดในประเทศ (+18.64%) และตลาดส่งออก (+15.54%) ไปสหรัฐฯ ยุโรป เอเชีย และตะวันออกกลาง
2. ผลิตภัณฑ์ที่ได้จากการกลั่นปิโตรเลียม ขยายตัวร้อยละ 4.78 จากน้ำมันเครื่องบิน ก๊าซหุงต้ม และแก๊สโซฮอล์ 91 เป็นหลัก โดยน้ำมันเครื่องบินและแก๊สโซฮอล์ 91 ขยายตัวตามการฟื้นตัวของภาคท่องเที่ยว โดยเฉพาะเทศกาลสงกรานต์ปีนี้คึกคักกว่าปีก่อน ส่งผลให้มีนักท่องเที่ยวเดินทางท่องเที่ยวและกลับภูมิลำเนาเพิ่มขึ้น
3. อาหารสัตว์สำเร็จรูป ขยายตัวร้อยละ 18.11 จากอาหารสัตว์เลี้ยง อาหารไก่ และอาหารสุกร เป็นหลัก โดยอาหารสัตว์เลี้ยงขยายตัวจากตลาดส่งออก (+36.25%) ตามความนิยมในการเลี้ยงสุนัขและแมว เนื่องจากคำสั่งซื้อจากตลาดยุโรปเพิ่มขึ้น รวมทั้งอาหารไก่และอาหารสุกร ก็เพิ่มขึ้นตามปริมาณการเลี้ยงของเกษตรกร
อุตสาหกรรมสำคัญที่หดตัวในเดือนเมษายน 2567 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. ชิ้นส่วนและแผ่นวงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 17.16 จาก Integrated Circuits (IC) และ PCBA เป็นหลัก ตามการชะลอตัวของตลาดอิเล็กทรอนิกส์โลก
2. ยานยนต์ หดตัวร้อยละ 6.82 จากรถบรรทุกปิคอัพ รถยนต์นั่งขนาดเล็ก และรถยนต์นั่งขนาดใหญ่ เป็นหลัก ตามการชะลอตัวของเศรษฐกิจ กำลังซื้อของผู้บริโภคลดลง อีกทั้งสถาบันการเงินมีความเข้มงวดในการปล่อยสินเชื่อ โดยหดตัวทั้งตลาดในประเทศ (-27.97%) และตลาดส่งออก (-6.81%)
3. ปูนซีเมนต์ หดตัวร้อยละ 7.39 จากพื้นสำเร็จรูป และเสาเข็มคอนกรีต เป็นหลักตามการชะลอตัวของภาคอสังหาริมทรัพย์
แนวโน้มอุตสาหกรรมรายสาขาที่สำคัญ ไตรมาสที่ 2/2567
อุตสาหกรรมเหล็กและเหล็กกล้า คาดการณ์การผลิตจะทรงตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน เนื่องจากราคาเหล็กในตลาดโลกมีแนวโน้มปรับตัวลดลง ทำให้ผู้บริโภคชะลอการสั่งซื้อเพื่อดูทิศทางราคา และอาจส่งผลต่อความต้องการใช้เหล็ก อย่างไรก็ตาม การเร่งดำเนินโครงการก่อสร้างต่าง ๆ ของภาครัฐที่คาดว่าจะกลับมาดำเนินการได้ตามการเบิกจ่ายงบประมาณภาครัฐ คาดว่าจะเป็นปัจจัยสนับสนุนการขยายตัวของอุตสาหกรรมเหล็กในประเทศ
อุตสาหกรรมอิเล็กทรอนิกส์ คาดว่าดัชนีผลผลิตจะหดตัวประมาณร้อยละ 9.06
เนื่องจากต้นทุนการผลิตที่สูงขึ้นและความไม่แน่นอนของเศรษฐกิจโลกและประเทศคู่ค้า เช่น จีน และสหรัฐอเมริกา เป็นต้น ในขณะที่มูลค่าการส่งออกจะยังขยายตัวได้ต่อเนื่องประมาณร้อยละ 7.57 จากชิ้นส่วนอิเล็กทรอนิกส์หรือผลิตภัณฑ์ที่เกี่ยวข้องกับเทคโนโลยีปัญญาประดิษฐ์ (AI) การผลิตชิปขั้นสูง และการพัฒนาเทคโนโลยีสมาร์ทโฟน รวมทั้ง การส่งเสริมให้เกิดการลงทุนในอุตสาหกรรมต้นน้ำของอิเล็กทรอนิกส์ในประเทศ
อุตสาหกรรมยางและผลิตภัณฑ์ยาง คาดการณ์ได้ว่า ปริมาณการผลิตยางแปรรูป ขั้นปฐม (ยางแผ่น ยางแท่ง และน้ำยางข้น) ยางรถยนต์ และถุงมือยาง จะขยายตัว ทั้ง 3 ผลิตภัณฑ์ โดยยางแปรรูปขั้นปฐมและถุงมือยางจะขยายตัวจากความต้องการของตลาดทั้งในประเทศและต่างประเทศ ขณะที่ยางรถยนต์จะขยายตัวจากความต้องการของตลาดต่างประเทศเป็นหลักโดยเฉพาะในตลาดสำคัญอย่างสหรัฐอเมริกาและเกาหลีใต้
อุตสาหกรรมอาหาร คาดว่าดัชนีผลผลิตในภาพรวมมีแนวโน้มขยายตัว เมื่อเทียบกับไตรมาสเดียวกันของปีก่อน โดยมีปัจจัยสนับสนุนจากจำนวนนักท่องเที่ยวที่มีแนวโน้มเพิ่มขึ้นในช่วงสงกรานต์ ในส่วนของภาคการส่งออกมีแนวโน้มขยายตัว จากความต้องการสินค้าของประเทศคู่ค้า เพื่อความมั่นคงด้านอาหาร อย่างไรก็ตามยังคงต้องติดตามสถานการณ์เศรษฐกิจโลกที่ยังคงชะลอตัว รวมถึงปัญหาความขัดแย้งทางภูมิรัฐศาสตร์ที่ยังไม่คลี่คลาย
คำถาม : คุณให้ความสนใจต่อหัตถการความงามและศัลยกรรมเป็นอย่างไร?
คำถาม : คุณให้ความสนใจต่อหัตถการความงามและศัลยกรรมเป็นอย่างไร?
คนไทยส่วนใหญ่ใส่ใจด้านความสวยความงาม โดยกลุ่ม Gen Y มีแนวโน้มให้ความสำคัญมากขึ้น และมีโอกาสใช้จ่ายสูงขึ้นโดยเฉพาะกลุ่มผู้หญิงและ LGBTQIA+
4. Next-generation software development - การพัฒนาซอฟต์แวร์รุ่นถัดไป
การพัฒนาซอฟต์แวร์รุ่นต่อไปประกอบด้วยเครื่องมือและเทคโนโลยีที่ช่วยให้สามารถดำเนินการปรับใช้โค้ดสมัยใหม่ รวมถึงสร้างโค้ดอัตโนมัติ ทดสอบ รีแฟกเตอร์ และแปลโค้ดได้ ซึ่งสามารถปรับปรุงคุณภาพของแอปพลิเคชันและกระบวนการพัฒนาได้
เปรียบเทียบผู้รออวัยวะ ผู้บริจาค ผู้ที่ได้รับการปลูกถ่าย ตั้งแต่ 1 มกราคม 2558 – 31 มีนาคม 2567
5 สิงหาคม 2024 สมาคมมวยสากลนานาชาติ (IBA) ได้
ชี้แจงข้อเท็จจริงที่นำไปสู่การตัดสิทธิ์นักมวย 2 คน คือ อิมาน เคลิฟ จากแอลจีเรีย และหลิน ยู่ติง จากไทเปของจีน
- อิมาน เคลิฟ เข้าร่วมการแข่งขัน IBA ตั้งแต่ปี 2018 และหลิน ยู่ติง เข้าร่วมการแข่งขันตั้งแต่ปี 2017 ผู้บริหาร IBA ปัจจุบันซึ่งดำรงตำแหน่งผู้นำตั้งแต่เดือนธันวาคม 2020 ได้ดูแลปัญหาดังกล่าวตั้งแต่การแข่งขัน IBA Women’s World Boxing Championships ครั้งแรกที่จัดขึ้นในปี 2022 IBA ไม่สามารถแสดงความคิดเห็นเกี่ยวกับการแข่งขันครั้งก่อนและการขาดการดำเนินการของผู้นำในเรื่องนี้
- หลังจากได้รับการร้องเรียนจากโค้ชหลายคน นักมวยจึงตกลงที่จะทดสอบเพศ โดยเก็บตัวอย่างเลือดเมื่อวันที่ 17 พฤษภาคม 2022 ห้องปฏิบัติการ Sistem Tip จากอิสตันบูล (หมายเลขใบอนุญาต: 194-MRK) ออกรายงานเมื่อวันที่ 24 พฤษภาคม 2022 หลังจากการแข่งขันสิ้นสุดลง ห้องปฏิบัติการตรวจพบผลการทดสอบที่ไม่ตรงตามเกณฑ์การมีสิทธิ์เข้าร่วมการแข่งขันประเภทหญิงของ IBA
- เคลิฟคว้าเหรียญเงินในประเภท 63 กก. ส่วนหลินคว้าเหรียญทองในประเภท 57 กก.
- การทดสอบหนึ่งครั้งต่อนักกีฬาแต่ละคนไม่เพียงพอที่จะตัดสินผลการแข่งขันตามลำดับ ในกรณีที่อาจเกิดข้อผิดพลาดในการทดสอบหนึ่งครั้ง ทนายความแนะนำให้ติดตามสถานการณ์และติดต่อ IOC
- IBA แจ้งตัวแทน IOC เกี่ยวกับการทดสอบเหล่านี้ แต่ IOC ไม่ได้ตอบสนองใดๆ
- สถานการณ์ดังกล่าวถือเป็นเรื่องใหม่ในวงการมวยโดยสิ้นเชิง และ IBA ตัดสินใจดำเนินการทดสอบครั้งที่สองก่อนที่จะตัดสิทธิ์นักมวยหลังจากปรึกษาหารือหลายครั้ง อย่างไรก็ตาม การทดสอบครั้งที่สองสามารถทำได้เฉพาะในประเทศที่เป็นกลางและภายในช่วงการแข่งขันของ IBA เท่านั้น
- ในการแข่งขัน IBA Women’s World Boxing Championships 2023 ครั้งต่อไปที่นิวเดลี เคลิฟและหลินได้รับการทดสอบตามความยินยอมอีกครั้งก่อนการแข่งขันครั้งแรก การเก็บตัวอย่างเลือดทำเมื่อวันที่ 17 มีนาคม 2023 ดร. ลาล พาธแล็บส์ จากนิวเดลี ออกรายงานเมื่อวันที่ 23 มีนาคม 2023 ผลการตรวจนั้นเหมือนกันทุกประการกับผลการตรวจครั้งแรก
- เมื่อวันที่ 24 มีนาคม 2023 จอร์จ เยโรลิมโปส เลขาธิการและซีอีโอของ IBA ในขณะนั้น แจ้งทั้งเคลิฟและหลินเกี่ยวกับการถูกตัดสิทธิ์จากการแข่งขันเนื่องจากไม่ตรงตามเกณฑ์คุณสมบัติ นักกีฬาได้รับสำเนาผลการตรวจของตน และได้รับแจ้งเกี่ยวกับความเป็นไปได้ในการอุทธรณ์ต่อ CAS ภายใน 21 วัน
- เคลิฟและหลินได้รับแจ้งเกี่ยวกับการตัดสินใจดังกล่าว และยอมรับโดยการลงนามในเอกสาร รายละเอียดการตรวจแนบมากับจดหมาย • เมื่อวันที่ 26 มีนาคม 2023 คณะกรรมการบริหาร IBA ได้ลงมติด้วยเสียงข้างมากให้สัตยาบันต่อการตัดสินใจของเลขาธิการและซีอีโอของ IBA ในนามของ IBA ในการตัดสิทธิ์ Imane Khelif และ Lin Yu-ting จากการแข่งขัน IBA Women’s World Boxing Championships 2023
- การทดสอบเหล่านี้ส่งผลต่อชีวิตส่วนตัวของบุคคลที่เกี่ยวข้องและถือเป็นข้อมูลทางการแพทย์ที่ได้รับการคุ้มครองเป็นข้อมูลส่วนบุคคล เราไม่ได้รับอนุญาตให้เผยแพร่เอกสารเหล่านี้โดยไม่ได้รับความยินยอมจากบุคคลที่เกี่ยวข้อง อย่างไรก็ตาม Imane Khelif และ Lin Yu-ting ต่างก็ได้รับสำเนาการทดสอบเหล่านี้ และพวกเขาไม่เคยโต้แย้งเรื่องนี้ พวกเขารู้ว่าการทดสอบเหล่านี้มีอยู่จริงและไม่ใช่เรื่องปลอม
- นักกีฬาทั้งสองคนได้รับสิทธิ์ในการอุทธรณ์ต่อการตัดสินใจของคณะกรรมการไปยัง CAS
- Lin Yu-ting ไม่ได้อุทธรณ์ต่อการตัดสินใจที่ประกาศว่าเธอไม่มีสิทธิ์ และการตัดสินใจดังกล่าวก็กลายเป็นเรื่องถูกกฎหมายและมีผลผูกพัน
- เมื่อวันที่ 12 พฤษภาคม 2023 IBA ได้แก้ไขกฎทางเทคนิคและการแข่งขัน หลังจากหารือกันภายใน คณะกรรมการบริหารได้ตัดสินใจว่าการแข่งขัน IBA จะจัดขึ้นเฉพาะระหว่างนักกีฬาชายและระหว่างนักกีฬาหญิงเท่านั้น การเข้าร่วมการแข่งขันชกมวยของนักกีฬา DSD (“ความแตกต่างของพัฒนาการทางเพศ”) ถือเป็นอันตรายต่อสุขภาพและความปลอดภัยของนักมวย
- การแก้ไขกฎเกณฑ์ข้อกำหนดและเงื่อนไขโดยคณะกรรมการ:
คำจำกัดความของผู้ชาย/ผู้ชาย/เด็กชาย = บุคคลที่มีโครโมโซม XY
คำจำกัดความของผู้หญิง/ผู้หญิง/เด็กผู้หญิง = บุคคลที่มีโครโมโซม XX
กฎ 4.2. คุณสมบัติด้านเพศ:
4.2.1.นักมวยจะต้องแข่งขันกับนักมวยที่มีเพศเดียวกัน ซึ่งหมายถึงผู้หญิงกับผู้หญิงและผู้ชายกับผู้ชายตามคำจำกัดความของกฎเหล่านี้
4.2.2.เพื่อกำหนดเพศ นักมวยจะต้องเข้ารับการทดสอบแบบสุ่มและ/หรือการทดสอบเฉพาะเพศ ซึ่งจะดำเนินการโดย IBA โดยร่วมมือกับเจ้าหน้าที่ห้องปฏิบัติการที่ได้รับการคัดเลือก
4.2.3. ในกรณีที่มีผลลัพธ์ที่ไม่พึงประสงค์ นักมวยจะได้รับแจ้งจาก IBA ทันที
4.2.4. ในกรณีที่มีผลลัพธ์ที่ไม่พึงประสงค์ นักมวยจะถูกตัดสิทธิ์จากการแข่งขันดังกล่าวทันที และจะถูกห้ามไม่ให้แข่งขันในรายการแข่งขันที่เป็นเจ้าของและได้รับอนุญาตจาก IBA อีกต่อไปสำหรับเพศดังกล่าว เพื่อจุดประสงค์นี้ IBA จะแบ่งปันข้อมูลดังกล่าวกับหน่วยงานภายในที่เกี่ยวข้องเกี่ยวกับความลับของนักมวย
- เมื่อวันที่ 14 เมษายน 2023 อิมาน เคลิฟได้ยื่นอุทธรณ์ต่อ CAS เพื่อขอให้ IBA โต้แย้งการตัดสินใจตัดสิทธิ์เธอจากการแข่งขัน IBA จ่ายส่วนแบ่งค่าใช้จ่ายในการดำเนินการ ซึ่งแสดงให้เห็นถึงความซื่อสัตย์สุจริตของ IBA สหพันธ์นานาชาติไม่กี่แห่งที่ตกลงจ่ายส่วนแบ่งค่าใช้จ่ายในการดำเนินคดีของ CAS เมื่อวันที่ 27 กรกฎาคม 2023 CAS ได้ออกคำสั่งยุติการดำเนินคดีและยุติการดำเนินคดีเนื่องจากผู้ร้องไม่ชำระค่าใช้จ่ายในการดำเนินคดี
- หลังจากยุติการดำเนินคดีต่อหน้า CAS แล้ว IBA และอิมาน เคลิฟได้ติดต่อเพื่อแก้ไขสถานการณ์ โดยเฉพาะอย่างยิ่ง นักกีฬาได้มอบเอกสารทางการแพทย์หลายฉบับให้กับ IBA ซึ่งได้รับการตรวจสอบโดยคณะกรรมการการแพทย์ของ IBA
- เมื่อวันที่ 23 มีนาคม 2024 คณะกรรมการการแพทย์ของ IBA ได้ออกรายงานเกี่ยวกับคุณสมบัติของเคลิฟ เมื่อวันที่ 12 เมษายน 2024 IBA ได้แจ้งให้ Imane Khelif ทราบเกี่ยวกับข้อสรุปที่คณะกรรมการแพทย์ของ IBA ได้ทำไว้และยืนยันอีกครั้งว่าเธอไม่มีสิทธิ์เข้าร่วมการแข่งขัน IBA Women’s Competition ดังนั้น โปรไฟล์ของเธอในรุ่น Elite Women Light Welter จึงถูกลบออกจากฐานข้อมูลของ IBA เธอไม่ได้อุทธรณ์ต่อคำตัดสินของ IBA ในครั้งนี้
- IBA ไม่ต้องการแสดงความคิดเห็นเกี่ยวกับชีวิตส่วนตัวของบุคคลใดบุคคลหนึ่ง สำหรับ IBA ไม่สำคัญว่า Imane Khelif และ Lin Yu-ting จะระบุตัวตนของพวกเขาอย่างไร และหนังสือเดินทางของพวกเขาเขียนว่าอย่างไร ความกังวลหลักของ IBA คือความไม่สมดุลของฮอร์โมนของพวกเขาทำให้พวกเขามีข้อได้เปรียบที่ชัดเจนเหนือคู่ต่อสู้หญิงในประเภทน้ำหนักของตน ซึ่งอาจเป็นอันตรายต่อนักมวยหญิงคนอื่นๆ ที่เราเคยเห็นมาแล้วในระหว่างการแข่งขันกีฬาโอลิมปิก ดังนั้น เธอจึงไม่มีสิทธิ์เข้าร่วมการแข่งขันของ IBA
- เมื่อวันที่ 5 มิถุนายน 2023 IBA ได้ส่งจดหมายอย่างเป็นทางการถึง IOC เกี่ยวกับกรณีดังกล่าว เมื่อวันที่ 16 มิถุนายน 2023 นาย Kit McConnell ผู้อำนวยการฝ่ายกีฬาของ IOC ได้ส่งอีเมลแจ้งยืนยัน
- เมื่อวันที่ 31 กรกฎาคม 2024 สำนักงานสหพันธ์มวยสากลแห่งอิตาลีได้ส่งอีเมลสอบถามไปยังแผนกกีฬาของ IBA เพื่อสอบถามเกี่ยวกับข้อเท็จจริงที่นำไปสู่การตัดสิทธิ์ของ Khelif ในคืนก่อนการแข่งขันกับนักมวยของพวกเขา Angela Carini ในโอลิมปิกที่ปารีส 2024
- IBA ได้ออกแถลงการณ์ครั้งแรกเกี่ยวกับกรณีของ Khelif/Lin หลังจากได้รับการร้องขอจากสื่อหลายครั้งเมื่อวันที่ 31 กรกฎาคม 2024
- เมื่อวันที่ 1 สิงหาคม 2024 Carini ได้ยุติการแข่งขันในรุ่นน้ำหนัก 66 กก. กับ เคลิฟ ในโอลิมปิกที่ปารีส 2024 หลังจากผ่านไป 46 วินาที
- IBA ประณามกฎเกณฑ์การมีสิทธิ์เข้าร่วมของ IOC ที่อนุญาตให้นักมวยที่ถูกตัดสิทธิ์เข้าร่วมการแข่งขันหลังจากที่ IOC ได้รับคำเตือนเกี่ยวกับการไม่มีสิทธิ์เข้าร่วมการแข่งขัน
- IOC อ้างในการแถลงข่าวว่าองค์กรไม่เคยได้รับแจ้งเกี่ยวกับกรณีดังกล่าว ซึ่งเป็นเรื่องโกหก IBA ถูกบังคับให้แถลงข่าวเมื่อวันที่ 5 สิงหาคม 2024 ที่กรุงปารีส เพื่อหารือเกี่ยวกับสถานการณ์โดยละเอียด
- IBA ได้ออกแถลงการณ์พร้อมรายการข้อเท็จจริงและเอกสารแนบหลังการแถลงข่าวเพื่อสรุปคดี
4. ครัวเรือน Sandwich มีสัดส่วนค่าใช้จ่ายต่อรายได้สูงกว่าคนกลุ่มอื่น
ครัวเรือน Sandwich มีสัดส่วนค่าใช้จ่ายต่อรายได้สูงกว่าคนกลุ่มอื่น โดยครัวเรือน Sandwich มีค่าใช้จ่ายเฉลี่ย 31,452 บาทต่อครัวเรือนต่อเดือน ขณะที่มีรายได้เฉลี่ยอยู่ที่ 39,414 บาทต่อครัวเรือนต่อเดือน หรือมีค่าใช้จ่ายเพื่อการอุปโภคบริโภคคิดเป็นสัดส่วนร้อยละ 90.1 ของรายได้ ซึ่งสูงกว่าเมื่อเปรียบเทียบกับครัวเรือนลักษณะอื่น และค่าเฉลี่ยของประเทศ ทั้งนี้ การที่แรงงานในครัวเรือน Sandwich มีรายได้ไม่สูงนัก ส่วนหนึ่งเกิดจากส่วนใหญ่มีระดับการศึกษาต่ำ โดยร้อยละ 57.7 ของสมาชิกในครัวเรือน Sandwich จบการศึกษาในระดับ ประถมศึกษาหรือต่ำกว่า และมีเพียงร้อยละ 12.7 ที่จบการศึกษาระดับอนุปริญญาขึ้นไปจ่ายเงินสมทบ 179 เดือน ทำอย่างไร…ให้ได้รับเงินบำนาญ?
จ่ายเงินสมทบ 179 เดือน แต่อายุครบ 55 ปี ก่อน ทำอย่างไร…ให้ได้รับเงินบำนาญ? [
clip]
เมื่ออายุครบ 55 ปี แต่จ่ายเงินสมทบ 179 เดือน เมื่อขอรับเงินจากกองทุนชราภาพ จะได้รับ บำเหน็จ (รับเงินก่อน) เท่านั้น
กรณีรับบำเหน็จแล้ว ถือว่าสิ้นสุดสิทธิ
เมื่อจะกลับเข้า ม.39 จะนับเริ่มหนึ่งใหม่ ไม่ได้นับต่อจาก 179 เดือน
บำเหน็จ คำนวนจาก 2 กรณี ตามจำนวนเดือนที่ส่ง
- ต่ำกว่า 12 เดือน (1-11 เดือน) : เงินสมทบของผู้ประกันตน x จำนวนเดือน (1-11 เดือน) = จำนวนเงินบำเหน็จชราภาพ
- เกิน 12 เดือน (12-179 เดือน หรือ 1 ปี-14 ปี 11 เดือน) : เงินสมทบของผู้ประกันตน + เงินสมทบของนายจ้าง + ผลประโยชน์ตอบแทน = จำนวนเงินบำเหน็จชราภาพ
* “ผลประโยชน์ตอบแทน” เงินบำเหน็จชราภาพ ม.33 และ 39 คือ "เงินปันผล" ที่จ่ายให้แก่ผู้ประกันตนจากการที่สำนักงานประกันสังคมนำเงินสมทบไปลงทุน โดยแต่ละปีจะมีอัตราที่แตกต่างกัน ตามที่สำนักงานประกันสังคมกำหนด โดยย้อนหลัง 5 ปี มีผลตอบแทนดังนี้ 2562 4.52 2563 2.75 2564 2.83 2565 3.46 2566 2.53
ตัวอย่างการคำนวน
- กรณีส่งสมทบ 11 เดือน : 11 x 300 (ยอดส่งต่อเดือน) = 3,300 บาท
- กรณีส่งสมทบ 179 เดือน : เงินสมทบของผู้ประกันตน + เงินสมทบของนายจ้าง + ผลประโยชน์ตอบแทน
1) คำนวนจากส่วนเงินสมทบ 900x179 เป็นเงิน 161,100 บาท (900 คือ 450 (3% ของ 15,000) ฝั่งลูกจ้าง และ 450 ฝั่งนายจ้าง)
2) คำนวนจากผลประโยชน์ตอบแทน 5 ปี ย้อนหลัง ดังนี้
2562 10,800 10,800 x 4.52% 488.16
2563 10,800 (10,800+10,800) x 2.75% 594.00
2564 10,800 (10,800+10,800+10,800) x 2.83% 916.92
2565 10,800 (10,800+10,800+10,800+10,800) x 3.46% 1,494.72
2566 9,900 [(10,800+10,800+10,800+10,800+9,900) x 2.53%] x 11/12 (11 จาก 12 เดือน) 1,231.47
รวมผลประโยชน์ตอบแทน 4,725.27 บาท
3) รวมทั้งสองส่วน 165,825.27 บาท
ทำอย่างไรหากจะอยากรับบำนาญ
ไม่ต้องรับบำเหน็จ แล้วสมัคร ม.39 ต่อได้ จะได้รับต่อ
แต่ฐานเงินเดือนจะลดลงจาก 15,000 ลงมาที่ 4,800 จริง
แต่ปกติจะคำนวนจำนวนเดือนที่ 60 เดือนสุดท้าย การมีเดือน 4,800 มารวมทำให้ฐานลดลง แต่ก็ถือว่าเล็กน้อย
บทสรุป
นี่คือบทความเศรษฐกิจมหภาคชุด EY-Parthenon เกี่ยวกับผลกระทบทางเศรษฐกิจของเทคโนโลยี AI บทความชุดนี้มุ่งหวังที่จะให้ข้อมูลเชิงลึกเกี่ยวกับศักยภาพทางเศรษฐกิจของเทคโนโลยี AI เชิงสร้างสรรค์ รวมถึงพัฒนาการใหม่ๆ และข้อมูลเชิงลึกที่นำไปปฏิบัติได้จริงสำหรับผู้มีอำนาจตัดสินใจของบริษัท บทความแรกในชุดนี้จะกล่าวถึงบทเรียนจากเหตุการณ์สำคัญทางประวัติศาสตร์ 3 เหตุการณ์เกี่ยวกับการเปลี่ยนแปลงทางเทคโนโลยีอย่างรวดเร็ว ซึ่งอาจช่วยคาดการณ์ผลกระทบทางเศรษฐกิจของเทคโนโลยี AI ได้ บทความเพิ่มเติมในชุดนี้จะเผยแพร่ในอีกไม่กี่เดือนข้างหน้า
จากเหตุการณ์ไม่คาดคิด พลิกชีวิตสู่การค้นพบอาชีพ Sport Paramedic โดยไม่ละทิ้งความรักในกีฬาฟุตบอล
นายกานต์ ปาลิบาล นักศึกษาคณะแพทยศาสตร์ โรงพยาบาลรามาธิบดี หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาฉุกเฉินการแพทย์ และหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การกีฬา ผู้ค้นพบอาชีพนักปฏิบัติการฉุกเฉินการแพทย์ด้านกีฬา จากเหตุการณ์ไม่คาดฝัน “ในขณะที่กำลังเล่นฟุตบอล อยู่ ๆ โค้ชของผมก็หมดสติและหัวใจหยุดเต้นไปกลางสนามฟุตบอล ท่ามกลางความตกใจในตอนนั้น มีนักฉุกเฉินการแพทย์เข้ามาช่วยทำให้หัวใจของโค้ชกลับมาเต้นอีกครั้ง นั่นคือสิ่งที่จุดประกายให้ผมสนใจอาชีพนักปฏิบัติการฉุกเฉินการแพทย์ ซึ่งที่คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี เป็นที่แรกและที่เดียวของประเทศไทยที่เปิดสอนในหลักสูตรที่ครอบคลุมความสนใจของผมทั้งด้านการแพทย์และด้านการกีฬา ในอนาคตผมตั้งใจที่จะช่วยเหลือและดูแลนักกีฬาอย่างดีที่สุด เพราะผมอยากให้นักกีฬาไทยได้แสดงศักยภาพอย่างเต็มที่และเล่นกีฬาอย่างมีความสุข” กานต์ กล่าวทิ้งท้ายด้วยรอยยิ้ม
7.การรักษาความปลอดภัย เช่นการทำระบบ 2FA (two-factor authentication)ในการใช้งานระบบ ทำใช้การใช้งานมีความปดอดภัยมากขึ้น
การกำหนดให้ไม่สามารถระบุตัวตนได้ (de-identified of patient) หมายถึงผู้ป่วยสามารถแจ้งความประสงค์ไม่ต้องการให้เก็บข้อมูลไว้ ระบบทำการลบข้อมูลไฟล์ทั้งหมด และทำการไม่ระบุตัวตน(เช่น ไม่สามารถทราบชื่อ นามสกุล ที่อยู่ รหัส id เป็นต้น) ซึ่งจะคงเหลือไว้ในส่วนของการวินิจฉัยและการรักษาไว้เพื่อประโยชน์ในทางการแพทย์
8. โปรแกรมบริหารคลินิก สามารถเข้าถึงข้อมูลได้ตลอดเวลาและกำหนดบทบาทตามหน้าที่ (Roles) เช่น กำหนดหน้าที่แพทย์ พยาบาล ยา/เวชภัณฑ์ การเงิน จัดการคลังยา (การรับเข้า/ออก ปรับจำนวน ล็อต ย้ายระหว่างคลัง ส่งไปสาขา) รายงาน แล็บ กำหนดการเข้าถึงสาขา
9. สำหรับคลินิกความงามมีคุณสมบัติเช่น การใช้/โอน คอร์ส การทราบค่าใช้จ่ายหลังจากจบคอร์ส การกำหนดค่าคอมมิชชั่นและแสดงผล การสะสมแต้มเพื่อใช้เป็นส่วนลด
คลินิกยาเสพติด (คลินิกก้าวใหม่พลัส)
คลินิกยาเสพติด(คลินิกก้าวใหม่พลัส) เป็นหน่วยบริการด้านการบำบัดรักษาและฟื้นฟูสมรรถภาพผู้ติดยาเสพติดทั้งทางร่างกาน จิตใจ อารมณ์ สังคมอย่างครบถ้วน จนผู้เข้ารับการบำบัดสามารถกลับไปใช้ชีวิตได้ตามปกติ โดยไม่ต้องพึ่งพายาเสพติด มี 4 คลินิก ได้แก่ คลินิกเมทาโดน (เฮโรอีน) คลินิก กายจิต สังคมบำบัด (ยาเสพติด) คลินิกฟ้าใส บำบัดบุหรี คลินิกบำบัดแอลกอฮอล์
วัน-เวลา ทำการ :
- ในเวลาราชการ จันทร์ – ศุกร์ เวลา 08.00 น. – 16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
- นอกเวลาราชการ จันทร์, พุธ, ศุกร์ เวลา 16.00 น. – 20.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
- เสาร์, อาทิตย์, วันหยุดนักขัตฤกษ์ เวลา 08.00 น. – 12.00 น. (เฉพาะผู้รับยาเมทาโดนต่อเนื่อง)
โทร : 02 2943305 ต่อ 208, 209
เอกสารที่ใช้ : บัตรประชาชน ใบขับบี่ หรือหลักฐานที่ยืนยันตัวตนได้
เยาวชนอายุต่ำกว่า 18 ปี ต้องมีผู้ปกครองมาด้วย เพื่อให้การยินยอม ในการเข้าบำบัดรักษา
คลินิกสูตินรีเวช ทุกวันอังคาร และ วันพุธ 13.00 น. - 16.00 น.
คลินิกสูตินรีเวช
วัน-เวลา ทำการ : ทุกวันอังคาร และ วันพุธ 13.00 น. - 16.00 น.
เบอร์โทรติดต่อ : 02 2842331 ต่อ 203
กลุ่มเป้าหมาย : สตรีวัยเจริญพันธุ์และสตรีกลุ่มเสี่ยง
โปรแกรม คลินิก APS_X Platform
โปรแกรมคลินิก APS_X Platform เป็นโปรแกรมคลินิก สำหรับ ศูนย์ดูแลผู้สูงอายุ ธุรกิจความงาม คลินิกเฉพาะทาง คลินิกเวชกรรม คลินิกทั่วไป คลินิกพยาบาลผดุงครรภ์ คลินิกกายภาพบำบัด คลินิกแพทย์แผนไทย-จีน คลินิกอายุรกรรม คลินิกแม่และเด็ก คลินิกบําบัดยาเสพติด คลินิกสุขภาพจิต คลินิกตา โปรแกรมคลินิก APS_X Platform ออกแบบให้ใช้งานง่าย สะดวกสบาย และรันบน Cloud ด้วยเทคโนโลยีที่ทันสมัยในยุคนี้ ทำให้ไม่ต้องใช้แฟ้ม OPD Card แบบเก่า
จุดเด่นของโปรแกรม ได้แก่ Real Time Data การส่งข้อมูลสะดวกและรวดเร็ว ลดระยะเวลาง่ายต่อการบริหารงาน AWS Cloud ข้อมูลคลินิกถูกรักษาไว้ที่ AWS Cloud ด้วยมาตรฐานความปลอดภัยที่ได้รับการยอมรับจากองค์กรชั้นนำทั่วโลก Data Security Web Application Security เว็บไซต์นี้ได้เข้ารหัสแบบ SSL 256-bit ข้อมูลของคุณจะได้รับการป้องกันและความปลอดภัย
Features พื้นฐาน ได้แก่ ระบบนัดหมาย (ล็อกห้อง, แพทย์) ระบบจัดคิว (ล็อกห้อง, แพทย์) ระบบ ค่าคอมมิชชั่นระบบบาร์โค้ด ยิงเข้า-ออก-เช็คสต๊อก
ระบบ admin กลาง (สำหรับหลายสาขา)ระบบ Lab & X-Ray ระบบ ICD10/วินิจฉัยโรค แบบใหม่ ระบบ บัญชี
ระบบ เอกสารแบบใหม่ ระบบ คูปอง, บัตรสมาชิก (วงเงิน)
ระบบ ดึงข้อมูลผ่าน บัตรประชาชน-พาสปอร์ต ระบบแจ้งเตือน นัดหมายทาง Email ระบบแจ้งเตือน เอกสารทาง Email ระบบ สมัครสมาชิกออนไลน์ (ผ่าน line@) และยังมีโปรแกรมเสริมพร้อมรองรับอีกมาก
บริการของโปรแกรม จัดเป็นแพคเกจ Package N+ Package B+ Package PRO+ ในอัตรา 21,000 - 105,000 บาท/ปี
สอบถามโทร 098-1816769 043-002488
ส่วนที่ 3 Console
ส่วนที่ 3 ส่วน Console ส่วนที่ศัลยแพทย์สื่อสาร ส่งสัญญาณ ควบคุมกลไกหุ่นยนต์ Davinci เชื่อมต่อกับคนไข้ ขณะปฏิบัติการผ่าตัด
PET/CT Scan พร้อมระบบ Flow Motion โรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ LINK
โรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ โรงพยาบาลเฉพาะทางด้านโรคมะเร็ง พร้อมให้บริการผู้ป่วยด้วย PET/CT ใหม่ 2 เครื่อง ด้วยเทคโนโลยีใหม่ คือ Biograph mCT Flow ของบริษัท Siemens ที่ทำให้ผู้รับการตรวจจะมีความรู้สึกนุ่มนวลและสบายขึ้น ขณะอยู่บนเตียงตรวจ และการทำงานของเครื่องราบรื่น ไม่เหมือนเครื่องรุ่นก่อนเมื่อ 10 ปีที่แล้ว นอกจากนี้คุณภาพของภาพ PET Scan ก็มีความคมชัดที่สูงขึ้น ทำให้แพทย์สามารถแปลผลภาพสแกนด้วยความมั่นใจและถูกต้องยิ่งขึ้น
สอบถามเพิ่มเติม โทร 02-7551188 (สายด่วนมะเร็ง 8:00 น. - 20:00 น.) 02-3103000 (หลัง 20:00 น.) หรือ 1719
มหาวิทยาลัยราชภัฏอุตรดิตถ์ ขอเชิญร่วมบริจาคสิ่งของเพื่อช่วยเหลือผู้ประสบอุทกภัย จ.น่าน และ จ.แพร่
มหาวิทยาลัยราชภัฏอุตรดิตถ์ ขอเชิญร่วมบริจาคสิ่งของเพื่อช่วยเหลือผู้ประสบอุทกภัย จ.น่าน และ จ.แพร่ บริจาคได้ที่ชั้น 1 อาคารภูมิราชภัฎวิทยาลัยน่าน ตั้งแต่วันนี้-31 ส.ค.นี้ โทรศัพท์ 055-416-601 ต่อ 1692
บริการรถรับ-ส่งผู้สูงอายุและผู้พิการโรงพยาบาลสิรินธร ฟรี
โครงการให้บริการ รถรับ - ส่งผู้สูงอายุและผู้พิการโรงพยาบาลสิรินธร ฟรี ‼️ ไม่มีค่าใช้จ่าย (เริ่ม 14 กุมภาพันธ์ 2567 เป็นต้นไป)
รถรับส่งให้บริการในวันและเวลาราชการ ช่วงเวลา 08.00-16.00 น.
ขอบเขตการให้บริการ
1. ประชาชนในพื้นที่เขตประเวศและพื้นที่ใกล้เคียง *ในระยะ 10 กิโลเมตร*
2. ผู้ที่มีอายุ มากกว่าหรือเท่ากับ หรือผู้พิการที่มีปัญหาการเคลื่อนไหว
3. ผู้ป่วยที่สามารถนั่งรถวีลแชร์ได้และไม่มีอาการผิดปกติ
4. ผู้ป่วยที่มีนัดรักษาต่อเนื่องกับโรงพยาบาลสิรินธร
5. ให้บริการฟรีเดือนละ 1 ครั้ง
6. ต้องมีการ **นัดหมายขอใช้บริการล่วงหน้า 7 วัน
โดยนัดหมายผ่านศูนย์ UMSC 24 ชั่วโมง หรือ Walk in เวลา 08.00-16.00 น. วันทำการ
ช่องทางการติดต่อ
1. ติดต่อที่ UMSC ชั้น 1 อาคารบริการ
2. UMSC ทาง LINE @1srt
3. โทร 02-3286900 ถึง 15 ต่อ 11499
ซุ้มของ น้องเอม หวั่งหลี และผองเพื่อน นำสีทีโอเอ มาร่วมทำกิจกรรม เป็นหนึ่งบู้ธ ที่คึกคักมาก
พิษจากเมทานอล หรือสุราเถื่อน
ความปลอดภัยในชีวิตและทรัพย์สิน
ไตรมาสสอง ปี 2567 คดีอาญารวมเพิ่มขึ้นร้อยละ 26.7 เป็นการเพิ่มขึ้นทั้งจากคดียาเสพติด คดีประทุษร้ายต่อทรัพย์ และคดีชีวิต ร่างกาย และเพศ ในส่วนการรับแจ้งอุบัติเหตุทางถนน พบผู้ประสบภัยสะสมเพิ่มขึ้นร้อยละ 0.6 โดยประเด็นที่ต้องให้ความส าคัญ ได้แก่ การละเมิด สิทธิเด็กและเยาวชน การเฝ้าระวังการเล่นพนันกีฬา และความเสี่ยงต่อการเกิดอุบัติเหตุ จากการก่อสร้างงานสาธารณะ
- คดีอาญาในไตรมาสสอง ปี 2567 มีการรับแจ้งทั้งหมดจำนวน 112,921 คดี เพิ่มขึ้นจากไตรมาสเดียวกัน ของปี 2566 ร้อยละ 26.7 โดยเป็น
• การรับแจ้งคดียาเสพติด จำนวน 91,014 คดี เพิ่มขึ้นร้อยละ 29.9
• คดีประทุษร้าย ต่อทรัพย์ จ านวน 17,007 คดี เพิ่มขึ้นร้อยละ 19.3
• คดีชีวิต ร่างกาย และเพศ จำนวน 4,900 คดี เพิ่มขึ้นร้อยละ 2.3
- ด้านการรับแจ้งอุบัติเหตุทางถนน จากข้อมูลของศูนย์ข้อมูลอุบัติเหตุ เพื่อเสริมสร้างวัฒนธรรม ความปลอดภัยทางถนน (THAI RSC) ไตรมาสอง ปี 2567 (ข้อมูล ณ วันที่ 30 มิถุนายน 2567) มีการรับแจ้งอุบัติเหตุ ผู้ประสบภัยสะสมรวมจำนวน 201,049 ราย เพิ่มขึ้นร้อยละ 0.6 จากไตรมาสเดียวกันของปี 2566 โดยเป็นผู้บาดเจ็บ สะสมจำนวน 197,736 ราย เพิ่มขึ้นร้อยละ 0.8 ขณะที่ผู้เสียชีวิตสะสมจำนวน 3,272 ราย ลดลงร้อยละ 7.8 และผู้ทุพพลภาพสะสมจำนวน 41 ราย ลดลงร้อยละ 8.9 โดยประเภทยานพาหนะที่เกิดอุบัติเหตุสูงสุด คือ รถจักรยานยนต์ ร้อยละ 90.4 รองลงมาเป็นรถยนต์ ร้อยละ 9.6 และเมื่อจำแนกตามช่วงอายุ พบว่า ผู้ประสบภัย ส่วนใหญ่กว่าร้อยละ 30.4 อยู่ในช่วงอายุระหว่าง 36 – 60 ปี
ประเด็นความปลอดภัยในชีวิตและทรัพย์สินที่ต้องให้ความสำคัญ ได้แก่
1. การละเมิดสิทธิเด็กและเยาวชนโดยบุคลากรในสถานศึกษา จากข้อมูลความไม่ปลอดภัย ของนักเรียน ของสำนักงานคณะกรรมการการศึกษาขั้นพื้นฐาน (สพฐ.) ในปี 2566 พบกรณีความไม่ปลอดภัยของนักเรียน จำนวน 2,618 กรณี ซึ่งในจำนวนนี้ร้อยละ 8.6 เป็นภัยจากการถูกละเมิดสิทธิ อาทิ การลงโทษ นักเรียนเกินกว่าเหตุสมควร บุคลากรครูมีความประพฤติไม่เหมาะสม
นอกจากนี้ ปัจจุบันยังพบกรณีการเผยแพร่ วิดีโอหรือรูปภาพเด็กและเยาวชน จากพฤติกรรมของบุคลากรครูที่มีการผลิตเนื้อหา (Content) ของตนเองกับ นักเรียนในสถานศึกษา ซึ่งสามารถแบ่งเนื้อหาออกเป็น 3 ลักษณะ ได้แก่
1) พฤติกรรมประจำวันในโรงเรียน อาทิ การร้องเพลง การรับประทานข้าว/ขนม
2) เนื้อหาการเรียน อาทิ การเขียนคำตอบผิดหรือตลก ผลการเรียน และ
3) พฤติกรรมเชิงลบ อาทิ การทะเลาะรังแก การร้องไห้ (คณาธิป ทองรวีวงศ์, 2567) ซึ่งทำการเผยแพร่ลงบนสื่อโซเชียลมิเดีย (Social Media) โดยไม่ได้รับความยินยอมจากผู้ปกครองและ นักเรียนก่อน ถือเป็นการละเมิดสิทธิส่วนบุคคลตาม พ.ร.บ. คุ้มครองข้อมูลส่วนบุคคล พ.ศ. 2562 (PDPA) และอาจเข้าข่าย มีความผิดตาม พ.ร.บ. คุ้มครองเด็ก พ.ศ. 2546 หากการเผยแพร่ เนื้อหาวิดีโอหรือรูปภาพของนักเรียนนั้น เป็นการเพิ่มจำนวน ผู้ติดตามและการแสวงหาผลประโยชน์จากการรับโฆษณาสินค้า บนออนไลน์ ทั้งนี้ การเผยแพร่ข้อมูลส่วนบุคคล อาทิ ชื่อ - นามสกุล ที่อยู่ และชื่อโรงเรียน ยังอาจทำให้เด็กและ เยาวชนเสี่ยงต่อการตกอยู่ในอันตรายจากการถูกคุกคามทางเพศบนออนไลน์หรือการถูกล่อลวงลักพาตัวจากผู้ไม่หวังดี หรือมิจฉาชีพ อีกทั้ง ข้อมูลต่าง ๆ ที่เกี่ยวข้องยังอาจกลายเป็น Digital footprint ที่ส่งผลกระทบสร้างความเสียหาย กับเด็กต่อไปจนถึงวัยผู้ใหญ่ในอนาคต
2. การเฝ้าระวังการเล่นพนันกีฬา โดยเฉพาะกีฬาฟุตบอลที่มีฤดูการแข่งขันตลอดทั้งปี โดยข้อมูลของ สำนักงานตำรวจแห่งชาติ ในไตรมาสสอง ปี 2567 พบการเล่นพนันกีฬาฟุตบอล จำนวน 2,391 คดี เพิ่มขึ้นสูงจาก ไตรมาสก่อนหน้าถึงร้อยละ 449.718 สะท้อนได้จากช่วงการแข่งขันฟุตบอลชิงแชมป์แห่งชาติยุโรป ครั้งที่ 17 (UEFA European Football Championship 2024: EURO 2024)19 ซึ่งมีผู้กระทำความผิดตาม พ.ร.บ. การพนัน พ.ศ. 2478 รวมทั้งสิ้นจำนวน 4,078 คน แบ่งเป็นผู้เล่นจำนวน 3,842 คน ผู้จัดให้เล่น (เจ้ามือ) จำนวน 203 คน และผู้เดินโพย จำนวน 33 คน ทั้งในรูปแบบบ่อนพนันและเว็บไซต์พนันออนไลน์จำนวน 224 เว็บไซต์
ขณะเดียวกัน จากผลการสำรวจเรื่องพฤติกรรมการใช้จ่ายของประชาชนในช่วงการแข่งขันฟุตบอล EURO 2024 ของมหาวิทยาลัย หอการค้าไทย ในปี 2567 ยังพบมูลค่าการใช้จ่ายนอกระบบเศรษฐกิจ (การพนันฟุตบอล) จำนวนกว่า 67,044 ล้านบาท เพิ่มขึ้นสูงถึงร้อยละ 46.3 จากรอบการแข่งขัน ปี 2562 ทั้งนี้ เมื่อพิจารณาถึงสาเหตุจูงใจในการเล่นพนัน พบว่า ร้อยละ 44.7 คาดหวังเงินรางวัล รองลงมา ร้อยละ 47.1 เพื่อความสนุกสนาน ซึ่งส่วนใหญ่ร้อยละ 51.8 มีแหล่งที่มาของเงินในการเล่นพนันมาจากเงินเดือนประจำ/รายได้ปกติ รองลงมา ร้อยละ 38.7 มาจากเงินออม อาจส่งผลกระทบ ก่อให้เกิดปัญหาหลากหลายด้าน อาทิ ปัญหาการเงินหรือการก่อหนี้สิน ปัญหาความเครียดและความวิตกกังวล และ ปัญหาสุขภาพร่างกายจากการพักผ่อนไม่เพียงพอ รวมถึงปัญหาอาชญากรรม
3. ความเสี่ยงต่อการเกิดอุบัติเหตุจากการก่อสร้างงานสาธารณะ โดยในระหว่างปี 2561 - 256621 พบการเกิดอุบัติเหตุบนท้องถนนสะสมจากการก่อสร้างทางสาธารณะขนาดใหญ่หลายโครงการรวมกันจำนวนกว่า 2,249 ครั้ง โดยมีผู้บาดเจ็บจำนวน 1,327 ราย และผู้เสียชีวิตจำนวน 134 ราย ซึ่งมีแนวโน้มเกิดขึ้นอย่างต่อเนื่อง ทั้งนี้ อุบัติเหตุส่วนใหญ่เกิดขึ้นจากหลายสาเหตุสำคัญ อาทิ วัสดุก่อสร้างร่วงหล่นทับ รถยนต์ตกร่องถนนที่กำลัง ก่อสร้างเนื่องจากไม่มีป้ายแจ้งเตือน ก่อให้เกิดความเสียหายทั้งต่อชีวิตและทรัพย์สิน
ดังนั้น หน่วยงานที่เกี่ยวข้อง จำเป็นต้องให้ความสำคัญกับการยกระดับมาตรการป้องกันและความปลอดภัยจากการก่อสร้าง โดยเฉพาะ การตรวจสอบวัสดุ เครื่องจักรกล เศษชิ้นส่วน ให้ยึดเกาะกับส่วนวัสดุที่มั่นคงได้มาตรฐาน รวมถึงสนับสนุนการมี ส่วนร่วมในกระบวนการติดตาม ตรวจสอบ และประเมินการทำงานของผู้รับจ้างก่อสร้างอย่างสม่ำเสมอ เพื่อสร้าง ความปลอดภัยและความมั่นใจแก่ผู้สัญจรใช้รถบนท้องถนนมากยิ่งขึ้น
4. การประชาสัมพันธ์งานเทศกาลและมีมาตรการส่งเสริมการตลาดให้เข้าถึงกลุ่มเป้าหมาย
ซึ่งประเทศสกอตแลนด์มีการวางกลยุทธ์ในการประชาสัมพันธ์ Edinburgh Festival Fringe หรือเทศกาลศิลปะกลางแจ้งที่ยิ่งใหญ่ที่สุดในโลก ซึ่งมีการจัดทำข้อมูลเพื่อวางแผนและจัดลำดับการประชาสัมพันธ์ โดยใช้เครื่องมือ ที่เรียกว่า MOSAIC39 ในการรวบรวมและจัดกลุ่มนักท่องเที่ยวเชิงลึกอย่างเป็นระบบ ซึ่งทำให้ทราบว่ากลุ่มเป้าหมายอาศัยอยู่ที่ไหน มีสัดส่วนเท่าไหร่ มีพฤติกรรมการจับจ่าย หรือมีกิจกรรมวันหยุดเป็นอย่างไร ซึ่งข้อมูลเหล่านี้ช่วยให้สามารถเข้าใจกลุ่มเป้าหมาย เพื่อกำหนดทิศทางการทำการตลาด รวมถึงข้อมูลที่ต้องการสื่อสารออกไปให้ดียิ่งขึ้น โดยอาศัยสื่อโซเชียลมีเดียเป็นเครื่องมือส่งเสริมให้เกิดการรับรู้ในวงกว้าง ผ่านแฮชแท็ก # EdinburghFestival #Fringe ที่ใช้ร่วมกันในทุกแพลตฟอร์ม นอกจากนี้ ยังมีการประสานความร่วมมือระหว่างองค์กรศิลปะ บริษัทเอกชน และหน่วยงานท่องถิ่นทั้งในและต่างประเทศ รวมถึง Influencer ในการประชาสัมพันธ์และสร้างคอนเทนต์ ที่น่าสนใจเกี่ยวกับงานเทศกาล อีกทั้งยังมีการใช้ Google analytics เพื่อประเมินผลการประชาสัมพันธ์และสำรวจ ความคิดเห็นของผู้เข้าร่วมเพื่อนำมาปรับปรุงการจัดเทศกาลต่อไป
"อนาคตของการดูแลรักษาผู้ป่วยที่ดีขึ้นสำหรับผู้คนที่มากขึ้น จะสำเร็จได้ผ่านเทคโนโลยีการเชื่อมต่อของข้อมูลและการใช้เทคโนโลยี AI เพื่อสนับสนุนการทำงานทางคลินิก ปรับปรุงกระบวนการทำงานและเพิ่มประสิทธิภาพให้กับผู้ให้บริการสาธารณสุข ฟิลิปส์ เราได้นำประโยชน์ของเทคโนโลยี AI และเทคโนโลยีข้อมูลสารสนเทศ ผสานกับการทำงานร่วมกับพันธมิตรเพื่อสร้างนวัตกรรมทั้งในกลุ่ม Imaging, Interventional และ Monitoring ให้ล้ำหน้าเหนือความต้องการเหล่านี้" ดร.เบอร์บี กล่าวเสริม
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC) คลินิกศัลยกรรมทั่วไป
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ (SMC) คลินิกศัลยกรรมทั่วไป OPD-SMC ตรวจรักษาโรคศัลยกรรมทั่วไป มะเร็งเต้านม ไส้เลื่อน ริดสีดวงทวาร นิ่วในถุงน้ำดี ส่องกล้องทางเดินอาหาร
ค่าบริการนอกเวลา 300 บาท (เบิกไม่ได้)
เปิดทุกวันจันทร์ เวลา 16.30-20.30 น. ณ อาคารจักษุ รพ.ชุมแพ
คลินิกพิเศษเฉพาะทางศัลยศาสตร์ ออร์โธปิดิกส์ นอกเวลาราชการ โรงพยาบาลนางรอง
7 ขั้นตอนเข้ารับบริกาคเลสิกที่ ศูนย์เลสิก ม.อ.
เทศบาลเมืองศรีราชา ร่วมกับรพ.เอกชน-มูลนิธิ อบรมการช่วยฟื้นคืนชีพ ช่วยชีวิตในสถานการณ์ต่างๆ
วันศุกร์ที่ 2 สิงหาคม 2567 เทศบาลเมืองศรีราชาจัดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ตามโครงการในพระราชประสงค์พระบาทสมเด็จพระบรมชนกาธิเบศรมหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร เทศบาลเมืองศรีราชา ประจำปีงบประมาณ 2567
เทศบาลเมืองศรีราชา ร่วมกับโรงพยาบาลพญาไท ศรีราชา และศูนย์การเรียนรู้มูลนิธิสว่างบริบูรณ์พัทยา ได้นำแนวคิดของนายฉัตรชัย ทิมกระจ่าง นายกเทศมนตรีเมืองศรีราชา “Sriracha Wellness City” มีเป้าหมายให้ศรีราชาเป็นเมืองแห่งสุขภาวะที่ดี จึงได้จัดโครงการอบรมหมอหมู่บ้านในพระราชประสงค์ตามโครงการในพระราชประสงค์พระบาทสมเด็จพระบรมชนกาธิเบศรมหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร เทศบาลเมืองศรีราชา ประจำปีงบประมาณ 2567 โดยมีนายประภัส เจริญสันติสุข รองนายกเทศมนตรีเมืองศรีราชา เป็นประธานในพิธีเปิดพร้อมด้วย ว่าที่ร้อยตรีทนงศักดิ์ พวงน้อย ปลัดเทศบาล รองปลัดเทศบาล และหัวหน้าส่วนราชการ เข้าร่วมพิธีเปิด
วัตถุประสงค์เพื่อให้ผู้เข้ารับการฝึกอบรมมีความรู้ ทักษะ ประสบการณ์ มีความรู้ในเรื่องการปฐมพยาบาล การช่วยฟื้นคืนชีพ ช่วยชีวิตในสถานการณ์ต่างๆ อีกทั้งเพื่อให้ผู้เข้าร่วมการอบรมสามารถช่วยเหลือผู้ที่ได้รับบาดเจ็บ หรือเจ็บป่วยให้พ้นจากอันตรายได้อย่างถูกต้อง และมีประสิทธิภาพก่อนนำส่งโรงพยาบาล เพื่อลดความรุนแรงของการบาดเจ็บที่เกิดขึ้น
นอกจากนั้นเทศบาลเมืองศรีราชา ได้มอบเกียรติบัตรให้กับนางสาวเทพกานต์ กิจการ นักเรียนชั้นมัธยมศึกษาปีที่ 6 โรงเรียนสาธิต “พิบูลบำเพ็ญ” มหาวิทยาลัยบูรพา ในฐานะผู้ทำคุณประโยชน์ ทำความดี กล้าหาญ และมีจิตสาธารณะ จากกรณีที่นางสาวเทพกานต์ กิจการ ได้ช่วยชีวิตโดยการ CPR ให้กับผู้ป่วยที่มาออกกำลังกายภายในสวนสาธารณะ ศรีราชา แล้วหมดสติประสบภาวะหัวใจหยุดเต้น นางสาวเทพกานต์ จึงได้ทำการปั๊มหัวใจจนผู้ป่วยหายใจ หลังจากรถพยาบาลมาก็ส่งต่อผู้ป่วยให้กับทีมกู้ชีพเพื่อนำส่งโรงพยาบาล ซึ่งนางสาวเทพกานต์ แจ้งว่าได้เคยผ่านการอบรมการปฐมพยาบาลและการช่วยฟื้นคืนชีพ จึงได้นำความรู้ที่ได้รับมาช่วยชีวิตผู้ป่วยให้รอดและปลอดภัยได้ [
คลิปวันงาน]
โครงการพัฒนาอนามัยสิ่งแวดล้อมพื้นที่โครงการพระราชดำริและโครงการเฉลิมพระเกียรติ
น้ำ มีความสำคัญต่อการดำรงชีวิตของประชาชน ทั้งน้ำใช้เพื่อการอุปโภค บริโภค และน้ำเพื่อการเกษตร ด้วยสถานการณ์ปัจจุบันการเปลี่ยนแปลงสภาพภูมิอากาศพบปัญหาภัยแล้ง อุทกภัย การปนเปื้อนสารเคมีเกษตร และภัยอื่นๆ รัฐบาลได้เล็งเห็นความสำคัญของปัญหาจึงได้กำหนดแผนแม่บทการบริหารจัดการทรัพยากรน้ำ 20 ปี (พ.ศ. 2561 - 2580) เพื่อขับเคลื่อนการดำเนินงานมีความสอดคล้องกับเป้าหมายของยุทธศาสตร์ชาติ 20 ปี ภายใต้ยุทธศาสตร์ ด้านที่ 5 การเติบโตที่เป็นมิตรกับสิ่งแวดล้อมเพื่อการพัฒนาอย่างยั่งยืน และแผนแม่บทภายใต้ยุทธศาสตร์ชาติ ประเด็นที่ 19 การบริหารจัดการน้ำทั้งระบบเพื่อใช้เป็นแนวทางในการบริหารจัดการน้ำ มีวิสัยทัศน์ให้ทุกหมู่บ้านมีน้ำสะอาดอุปโภคบริโภค น้ำเพื่อการผลิตมั่นคง คุณภาพน้ำอยู่ในเกณฑ์มาตรฐาน บริหารจัดการน้ำอย่างยั่งยืนภายใต้การพัฒนาอย่างสมดุล โดยการมีส่วนร่วมของทุกภาคส่วน และสอดคล้องกับเป้าหมายการพัฒนาที่ยั่งยืน (Sustainable Development Goals: SDGs) เป้าหมายด้านการส่งเสริมให้ประชาชนมีสุขภาพดีประเด็นที่ 6 การจัดการน้ำสะอาด การสุขาภิบาล และสุขอนามัย ให้เกิดความยั่งยืนบนความเป็นเมืองและชุมชนในการบริหารจัดการน้ำที่มีความเท่าเทียมทั้งประเทศ โดยเฉพาะในพื้นที่ห่างไกลทุรกันดาร โครงการอันเนื่องมาจากพระราชดำริและโครงการเฉลิมพระเกียรติในการแก้ไขปัญหาน้ำเน้นการพัฒนาคุณภาพชีวิตและความเป็นอยู่ที่ดีขึ้นของประชาชน มีกรอบแนวคิดการพัฒนาต้องอยู่บนฐานของการพึ่งตนเอง คิดแก้ปัญหาอย่างองค์รวมหรือคิดให้เชื่อมโยงกัน เน้นแก้ปัญหาด้วยหลักใช้ธรรมชาติแก้ธรรมชาติ การแก้ปัญหาต้องสอดคล้องเหมาะสมกับพื้นที่ ทุกอย่างมีค่าไม่มีของเสียทำแล้วต้องไม่มีคนเสียประโยชน์ เกิดความยั่งยืนต้องลงมือทำสร้างตัวอย่างความสำเร็จให้เห็นเกิดการขยายผลต่อไป สำนักสุขาภิบาลอาหารและน้ำดำเนินการ 3 กิจกรรม ได้แก่ 1. กิจกรรมการพัฒนาคุณภาพน้ำบริโภคในพื้นที่ลุ่มน้ำปากพนัง อันเนื่องมาจากพระราชดำริ ตามโครงการพัฒนาพื้นที่ลุ่มน้ำปากพนังอันเนื่องมาจากพระราชดำริ 2. กิจกรรมการพัฒนาคุณภาพน้ำบริโภคในพื้นที่รักษ์น้ำเพื่อพระแม่ของแผ่นดิน และ 3. กิจกรรมพัฒนาคุณภาพน้ำบริโภคภายใต้โครงการพัฒนาเด็ก และเยาวชนในถิ่นทุรกันดาร ตามพระราชดำริสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี (กพด.) เพื่อให้ประชาชนที่อาศัยในพื้นที่โครงการมีน้ำบริโภคและสุขาภิบาลอาหารที่สะอาด ปลอดภัย ซึ่งในการแก้ไขปัญหาดังกล่าวจำเป็นต้องอาศัยความร่วมมือจากผู้มีส่วนเกี่ยวข้องหลายด้าน ส่งเสริมกระบวนการเรียนรู้และพัฒนาอาชีพตามแนวเศรษฐกิจพอเพียง ส่งเสริมความเข้มแข็งและการพัฒนาคุณภาพชีวิตของครอบครัวและชุมชน ฟื้นฟู และอนุรักษ์ทรัพยากรดิน น้ำ ป่าไม้ เพื่อความสมดุลและยั่งยืน ตามพระราชกรณียกิจในพื้นที่เยี่ยมติดตามงานโครงการฯ ทรงมีพระราชกระแสสำคัญเกี่ยวกับการพัฒนาด้านน้ำ โภชนาการ สุขาภิบาล และสุขภาพอนามัย
ในปีงบประมาณ 2567 กรมอนามัย โดยสำนักสุขาภิบาลอาหารและน้ำ จึงจัดทำโครงการพัฒนาอนามัยสิ่งแวดล้อมพื้นที่โครงการพระราชดำริและโครงการเฉลิมพระเกียรติ กำหนดให้มีการพัฒนาการจัดการคุณภาพน้ำบริโภคและสุขาภิบาลอาหาร สนับสนุนและสนองพระราชดำริครอบคลุมเด็กและเยาวชน ประชาชนทุกลุ่มวัยในระดับครัวเรือนและชุมชน เพื่อพัฒนาคุณภาพชีวิตในด้านน้ำบริโภคและสุขาภิบาลอาหารที่สะอาด ปลอดภัยซึ่งจะเป็นปัจจัยขั้นพื้นฐานของการมีสุขภาพที่ดี
กลุ่มเป้าหมาย
1. ครู ตชด. ครูอนามัย พระพี่เลี้ยง ครูพี่เลี้ยง นักเรียน โรงเรียนในถิ่นทุรกันดาร ประกอบด้วย โรงเรียนตำรวจตระเวนชายแดน โรงเรียนพระปริยัติธรรม โรงเรียนเอกชนสอนศาสนาอิสลาม โรงเรียน กพด. สังกัดสำนักงานคณะกรรมการการศึกษาขั้นพื้นฐาน โรงเรียน กพด. สังกัดองค์กรปกครองส่วนท้องถิ่น ศูนย์การเรียนรู้ชุมชนชาวไทยภูเขา “แม่ฟ้าหลวง” (ศศช.) โรงเรียน กพด. สังกัดสำนักการศึกษา กรุงเทพมหานคร รวมจำนวน 890 แห่ง อสม. และประชาชนกลุ่มเปราะบางที่อาศัยในพื้นที่รอบโรงเรียน กพด.
พื้นที่เป้าหมาย
- โรงเรียนในถิ่นทุรกันดาร ประกอบด้วย โรงเรียนตำรวจตระเวนชายแดน สถานศึกษาในสังกัดสำนักงานคณะกรรมการการศึกษาขั้นพื้นฐาน โรงเรียนพระปริยัติธรรม โรงเรียนเอกชนสอนศาสนาอิสลาม ศูนย์ส่งเสริมและพัฒนาเด็กวัยเตาะแตะ ศูนย์การเรียนชุมชนชาวไทยภูเขา “แม่ฟ้าหลวง” (ศศช.) ฯลฯ
พญ. วรรณวิพุธ สรรพสิทธิ์วงศ์ Business Development Director ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ กล่าวทิ้งท้ายว่า นอกจากไวทัลไลฟ์จะนำองค์ความรู้ทางวิทยาศาสตร์มาประยุกต์ใช้ในการพัฒนานวัตกรรมและโปรแกรมดูแลสุขภาพที่ตอบโจทย์ความต้องการของแต่ละบุคคล โดยเน้นการตรวจวินิจฉัยที่แม่นยำ การดูแลเฉพาะบุคคล และการเปลี่ยนแปลงวิถีชีวิต เพื่อช่วยให้ทุกคนสามารถมีชีวิตที่ยืนยาวอย่างแข็งแรงแล้ว ไวทัลไลฟ์โฉมใหม่ยังให้ความสำคัญในเรื่องการออกแบบประสบการณ์ของผู้มารับบริการ ผ่านแนวคิด ‘Ecosystem of Care’ โดยใช้หลักการของสัดส่วนและความกลมกลืนของ Golden Ratio ระบบนิเวศด้านการดูแลสุขภาพ เน้นการสร้างประสบการณ์เชิงบวกโดยยึดหลักผู้มารับบริการเป็นศูนย์กลาง เช่น การอำนวยความสะดวกสบาย และการช่วยแก้ไขปัญหา (Pain Point) ให้กับผู้มารับบริการได้อย่างเหมาะสมในทุกจุดของการให้บริ
ปากแหว่งเพดานโหว่ ความพิการแต่กำเนิดที่ส่งผลกระทบเด็กไทย 1 ใน 700 คน หรือ 2,000 คนต่อปี
ข้อมูลทางสถิติจากมูลนิธิสร้างรอยยิ้ม พบว่าทารกไทยที่เกิดมา 700 คน จะมี 1 คนที่เกิดมาพร้อมภาวะปากแหว่งหรือเพดานโหว่ และบางรายมีอาการทั้งสองอย่าง ในประเทศไทยพบเด็กที่มีภาวะปากแหว่งหรือเพดานโหว่โดยเฉลี่ยจำนวน 2,000 รายต่อปี สำหรับสถิติทั่วโลก พบว่าทุก ๆ 3 นาทีมีทารก 1 คนที่เกิดมาพร้อมภาวะปากแหว่งเพดานโหว่ ซึ่งเป็นความผิดปกติบนใบหน้าแต่กำเนิด โดยทารกที่มีภาวะ “ปากแหว่ง” จะมีรอยแยกของริมฝีปากบนและอาจมีรอยแยกไปจนถึงเหงือกและเพดานปากส่วนหน้า ส่วนภาวะ “เพดานโหว่” จะมีรอยแยกที่เพดานอ่อนไปจนถึงเพดานแข็ง ถือเป็นภาวะที่ยังไม่สามารถระบุสาเหตุที่แน่ชัดทางการแพทย์ โดยมีปัจจัยจากความผิดปกติทางพันธุกรรม ปัจจัยทางสิ่งแวดล้อม การใช้สารเสพติดหรือยาบางชนิดของมารดาเมื่อตั้งครรภ์ รวมถึงความผิดปกติในช่วงไตรมาสแรกของการตั้งครรภ์ โดยปากแหว่งเพดานโหว่เป็นภาวะที่ส่งผลกระทบทางร่างกายมากมาย เช่น โรคทางหูและปัญหาทางทันตกรรม การสูญเสียการได้ยิน ความเสี่ยงต่อการติดเชื้อได้ง่าย ปัญหาด้านการพูดและการรับประทานอาหาร นอกจากนี้ ความผิดปกติบนใบหน้า ยังลดทอนความมั่นใจในการใช้ชีวิตของผู้ป่วย ส่งผลกระทบต่อสภาพจิตใจ หากไม่ได้รับการรักษาผ่านการผ่าตัด
การเดินทางระยะยาวที่งดงาม สู่วันแห่งการตระหนักรู้โรค SMA
ในฐานะตัวแทนกลุ่มผู้ป่วย น้องฟางได้แสดงความขอบคุณทุกๆ หน่วยงานที่ได้ยื่นมือเข้ามาช่วยเหลือ ไม่ว่าจะเป็นด้านภาครัฐ ด้านทีมแพทย์ ทีมวิจัย และบริษัท โนวาร์ตีส สำหรับโครงการ APPIS Innovator program เพื่อขับเคลื่อนการตระหนักรู้ และมุ่งมั่นพัฒนาคุณภาพชีวิตของผู้ป่วย SMA เปรียบเสมือนจิ๊กซอว์ที่กำลังประกอบเข้าด้วยกันเป็นภาพที่สวยงามขึ้น ในการเดินทางระยะยาวไปจนถึงวันที่การตระหนักรู้โรค SMA แพร่หลาย และคนทั่วไปมีความเข้าใจเกี่ยวกับโรค SMA มากขึ้น
“ฟางมองว่าทุกๆ ความพยายาม ไม่ว่าจะเล็กหรือใหญ่มันสำคัญหมดเลย แค่มีคนพูดถึงโรคนี้ก็ดีใจมากแล้วค่ะ อย่างตอนนี้ฟางรู้ว่า SMA กำลังถูกผลักดันเข้าระบบประกันสุขภาพ และถูกพิจารณาตั้งแต่ขั้นตอนการคัดกรองจนถึงการรักษา เรียกได้ว่าครบวงจรเลย ซึ่งเรื่องนี้คงไม่อาจเกิดขึ้นได้จากครอบครัวผู้ป่วยเพียงลำพัง หากไม่มีการผลักดันอย่างจริงจังจากบุคลากรทางการแพทย์และผู้ที่มีส่วนตัดสินใจทั้งภาครัฐและภาคเอกชน ฟางอยากบอกว่าขอบคุณจริงๆ นะคะ ทั้งในฐานะตัวผู้ป่วยเอง และในฐานะครอบครัวผู้ป่วย ที่ทำให้เราได้รู้ว่ายังมีความหวัง เรายังไปต่อได้ ได้มีการรับฟัง และยังมีผู้คนที่สนับสนุนเราอยู่ ทำให้เกิดชุมชนผู้ป่วยที่เข้มแข็งขึ้นจากความพยายามของคุณทุกคน” น้องฟาง กล่าวทิ้งท้าย
โรงพยาบาลวิมุต แนะนำเคล็ดลับ 5 เริ่มและ 4 เลิก เพื่อการดูแลสุขภาพผู้ชาย
โรงพยาบาลวิมุต แนะนำเคล็ดลับ 5 เริ่มและ 4 เลิก เพื่อการดูแลสุขภาพผู้ชายก่อนโรคภัยร้ายมาเยือน ได้แก่
เคล็ดลับ 5 เริ่ม:
- เริ่มตรวจสุขภาพประจำปี โดยเฉพาะผู้ชายอายุ 50 ปีขึ้นไป
- เริ่มออกกำลังกายสม่ำเสมอ การออกกำลังกายช่วยเสริมสร้างระบบทางเดินปัสสาวะและสุขภาพเพศชายโดยรวม
- เริ่มการรับประทานอาหารที่มีประโยชน์ ดื่มน้ำอย่างเพียงพอจะส่งเสริมการทำงานของระบบทางเดินปัสสาวะ
- เริ่มรักษาน้ำหนักตัวที่เหมาะสม ช่วยลดความเสี่ยงของโรคต่อมลูกหมากโตและปัญหาสุขภาพอื่นๆ
เคล็ดลับ 4 เลิก:
- เลิกบุหรี่ บุหรี่มีสารเคมีที่ทำลายสุขภาพทุกส่วนของร่างกาย
- เลิกดื่มแอลกอฮอล์ในปริมาณที่มากเกินไป
- เลิกรับประทานอาหารที่มีไขมันและน้ำตาลสูง
- เลิกนอนดึก การนอนไม่พอเพียงทำให้ร่างกายอ่อนแอและเสี่ยงต่อโรคมากมาย
ผู้ที่สนใจสามารถติดต่อศูนย์ระบบทางเดินปัสสาวะ ชั้น 4 โรงพยาบาลวิมุต เวลาทำการ 8:00 – 20:00 น. โทร. 0 2079 0040 หรือใช้บริการ Telemedicine ปรึกษาแพทย์ออนไลน์ได้ง่ายๆ
ยืนยัน วัคซีนโควิด มีความปลอดภัย เสี่ยงน้อยกว่าป่วยเป็นโควิด
ในประเด็นผลข้างเคียงของวัคซีนที่พูดกันอย่างกว้างขวางจนอาจสร้างความสับสน และความเข้าใจไม่ถูกต้องกับ ประชาชนนั้น พลตำรวจตรี นายแพทย์เกษม รัตนสุมาวงศ์นายกสมาคมแพทย์โรคหัวใจแห่งประเทศไทย ในพระบรม ราชูปถัมภ์ชี้ว่าหนึ่งในอาการข้างเคียงที่พูดถึงกันบ่อย คือ กล้ามเนื้อหัวใจอักเสบ ซึ่งจากการเก็บข้อมูลการฉีดในประเทศไทยเอง มีรายงานว่าพบได้ประมาณ 2 ในล้าน ซึ่งจะเกิดเพิ่มขึ้นในวัยรุ่นชายอายุ 18-29 ปี โดยเฉพาะหลังเข็มที่ 2 แต่หลังเข็มกระตุ้น เราแทบจะไม่เจอรายงานเลย โดยถ้าเทียบกับอุบัติการณ์ที่เราเจอในคนทั่วไปที่ไม่ได้รับวัคซีนก็พบว่าไม่ได้เจอเพิ่มขึ้นหลังเข็ม กระตุ้น การฉีดวัคซีนเข็มกระตุ้น โดยเฉพาะในกลุ่มเสี่ยงจึงไม่มีความกังวลในจุดนี้
“อย่างที่อธิบายไปข้างต้นแล้วว่า โควิด-19 เองก็อาจทำให้เกิดกล้ามเนื้อหัวใจอักเสบได้และพบได้บ่อยกว่าการฉีดวัคซีน ด้วยซ้ำไป หากจะชั่งน้ำหนักแล้วประโยชน์ที่ได้รับจากวัคซีนมีมากกว่าโอกาสที่จะเกิดผลข้างเคียงที่รุนแรงแทบจะเทียบกันไม่ได้” พล.ต.ต. นพ.เกษม กล่าว
BDMS Wellness Clinic และโรงพยาบาลมะเร็งกรุงเทพ วัฒโนสถ มุ่งมั่นเป็นผู้นำในการป้องกันและฟื้นฟูสุขภาพของผู้ป่วยมะเร็งเต้านมอย่างรอบด้าน โดยให้การดูแลผู้ป่วยอย่างเฉพาะเจาะจงและครบถ้วนในทุกขั้นตอน ตั้งแต่การป้องกันไปจนถึงการดูแลฟื้นฟูผู้ป่วยหลังการรักษา เพื่อให้ผู้ป่วยคนไทยทุกคนสามารถผ่านพ้นช่วงเวลาอันยากลำบากนี้ไปได้อย่างเข้มแข็ง และมีคุณภาพชีวิตที่ดีอย่างยั่งยืน
ธวัชชัย พวงจันทร์ จากพลูโตฟาร์ม หนึ่งในผู้ผลิตไก่รายใหญ่ของ จ.สุรินทร์ กล่าวว่า “การเลี้ยงไก่แบบอุตสาหกรรมมักมีการกักบริเวณ ตัดจะงอยปาก ซึ่งเป็นการทรมานสัตว์ และเมื่อเลี้ยงในพื้นที่หนาแน่นหลักพันตัวขึ้นไป ไก่จะเกิดความเครียดและมีพฤติกรรมทำร้ายกัน แต่การเลี้ยงแบบปล่อย ไก่จะได้มีพื้นที่และอิสระ ไม่ทำร้ายกัน ทำให้เราสังเกตได้ว่าไก่มีอารมณ์ที่ดีขึ้น” เขาเชื่อว่าการเลี้ยงไก่สวัสดิภาพสูงส่งผลดีต่อผู้บริโภคโดยตรง โดยเฉพาะเด็กและเยาวชน เพราะการได้รับอาหารที่ปลอดภัยจะส่งผลดีต่อการเจริญเติบโตอย่างเป็นธรรมชาติ ธวัชชัยกล่าวว่า “เราคำนึงถึงผู้บริโภคเป็นหลัก การเลี้ยงไก่สวัสดิภาพสูงตอบโจทย์และสามารถเปลี่ยนแปลงวิธีการเลี้ยงทั้งหมดได้จริง ๆ”
ในปีนี้ บ้านและสวน ได้เชิญ คุณตั้ม-ศุภพงศ์ สอนสังข์ ดีไซเนอร์จาก Jird Design Gallery เป็นผู้ออกแบบ โล่รางวัลในธีม “แดด ฝน คน ต้นไม้” ซึ่งเป็นธีมเดียวกับงานบ้านและสวนแฟร์ Living Festival 2024 โดยเลือกใช้วัสดุไม้พื้นถิ่นไทย 3 ชนิดที่พบเห็นได้บ่อยในบ้านไทยตั้งแต่ในสมัยอดีต นั่นคือ ไม้เต็ง ไม้แดง และไม้รกฟ้า มาออกแบบโล่รางวัล เพื่อบอกถึงการอยู่ร่วมกันระหว่างคนกับธรรมชาติอย่างเข้าใจ
"Waste No More สานต่อความยั่งยืน" โครงการซึ่งเกิดจากความคิดสร้างสรรของพนักงานธุรกิจสุกรของซีพีเอฟ ที่ได้รับรางวัลโดดเด่นในการประกวด CPF Sustainability in Action Awards 2024 เป็นต้นแบบของโครงการที่มีแนวปฏิบัติที่ดี ตอบโจทย์การใช้ทรัพยากรอย่างรู้คุณค่าและเกิดประสิทธิภาพสูงสุด ยังสะท้อนถึงความตระหนัก ความตั้งใจ ในการมีส่วนร่วมขับเคลื่อนเป้าหมายลดการปล่อยก๊าซเรือนกระจกเป็นศูนย์ (Net-Zero) ถ่ายทอดและแลกเปลี่ยนเรียนรู้ระหว่างพนักงานและชุมชนรอบข้าง สร้างคุณค่าคืนสู่สังคมและสิ่งแวดล้อมอย่างยั่งยืน
ภาพคุณนุ๊ก ขณะรับบริการตรวจสุขภาพ ณ โรงพยาบาลมะเร็งสมัยใหม่แสตมฟอร์ดกว่างโจว ประเทศจีน
ด้าน คุณสุทธิดา เกษมสันต์ ณ อยุธยา กล่าวว่า เธอยินดีเป็นอย่างยิ่งที่จะแบ่งปันประสบการณ์ของเธอที่โรงพยาบาลมะเร็งสมัยใหม่กว่างโจวให้กับผู้ป่วยโรคมะเร็งในประเทศไทย เพื่อให้ผู้ป่วยโรคมะเร็งมีทางเลือกมากขึ้นและได้รับการรักษาที่ดียิ่งขึ้น สามารถช่วยให้ผู้ป่วยมะเร็งหลุดพ้นจากความเจ็บปวด ขอให้พวกเราได้ร่วมมือกันส่งมอบความรักนี้ไปยังผู้ป่วยและทุกๆ คน โดยได้เดินทางไปที่โรงพยาบาลมะเร็งสมัยใหม่แสตมฟอร์ดกว่างโจว เพื่อตรวจสุขภาพหลังป่วยมะเร็งไทยรอยด์เมื่อ 4 ปีก่อน และได้รับคำปรึกษาจากแพทย์ด้านมะเร็งเต้าพร้อมเข้าเยี่ยมคนไข้ชาวไทยและต่างชาติพร้อมพูดให้กำลังใจซึ่งกันและกัน เพราะนุ๊กมองว่าไม่มีใครเข้าใจคนไข้มากไปกว่าคนไข้ด้วยกันเอง และยังได้มีโอกาสเดินสายพูดคุยกับคนไข้ในงานสัมมนาร่วมกับกับโรงพยาบาลมะเร็งสมัยใหม่กว่างโจวแสตมฟอร์ดกว่างโจว
นอกจากนี้ ยังได้รับกรณีศึกษาเกี่ยวกับการบุกเบิกแบรนด์ไทยในวงการท่องเที่ยวเชิงเวลเนส ในหัวข้อ THANN Wellness Destination : CEO Insights on a Journey to the Balance of Body, Mind, and Spirit โดย คุณฐิติพัฒน์ ศุภภัทรานนท์ กรรมการผู้จัดการ บริษัท ธัญ ออริซ่า จำกัด ที่นำเสนอ จุดหมายปลายทางสำหรับเวลเนสเพื่อความสมดุลของร่างกายองค์รวม คือ ร่างกาย จิตใจ และ จิตวัญญาณ ผ่าน 6 องค์ประกอบแห่ง เวลเนส ได้แก่ ร่างกาย อารมณ์ จิตใจ สิ่งแวดล้อม สังคม ความรอบรู้ และสิ่งแวดล้อม
ประกาศ โรงพยาบาลภูมิพล
13 ธันวาคม 2567 โรงพยาบาลภูมิพลอดุลยเดช กรมแพทย์ทหารอากาศ
เผยแพร่ประกาศ ดังนี้
ตั้งแต่วันที่ 1 ม.ค.68 ผู้ป่วยมะเร็งต้องมีหนังสือส่งตัวจากหน่วยบริการปฐมภูมิ(โมเดล5) จากหน่วยบริการประจำ(โมเดลอื่นๆ)
4. ความสำคัญของข้อมูลในการดูแลรักษาผู้ป่วยวิกฤต
การดูแลผู้ป่วยวิกฤต เวลาเป็นสิ่งสำคัญอย่างยิ่ง แต่มักจะไม่ทันการณ์เสมอ บุคลากรทางการแพทย์มักจะเสียเวลาในการรวบรวมข้อมูลผู้ป่วยจากหลากหลายแหล่ง การใช้ระบบข้อมูลสารสนเทศที่เชื่อมต่อเป็นวงกว้างสำหรับติดตามอาการผู้ป่วยจะช่วยแก้ไขปัญหานี้ได้ ด้วยการเชื่อมต่อข้อมูลจากเครื่องมือและเทคโนโลยีที่แตกต่างเข้าไว้ด้วยกัน เพื่อสร้างมาตรฐานใหม่ให้กับผู้ป่วยที่สามารถเข้าถึงข้อมูลได้จากทุกจุดในโรงพยาบาล
ในปี 2025 เราจะได้เห็นความก้าวหน้าของเครื่องติดตามสัญญาณชีพที่สามารถเชื่อมต่อกับระบบข้อมูลสารสนเทศที่รวบรวมข้อมูลจากเครื่องมือและเทคโนโลยีทางการแพทย์ที่หลากหลาย เราจะได้เห็นการบูรณาการของเครื่องมือทางการแพทย์และการเชื่อมต่อของเทคโนโลยีจากหลากหลายแบรนด์เข้าไว้ด้วยกัน เพื่อสนับสนุนการดูแลผู้ป่วยวิกฤตให้กับผู้ให้บริการสาธารณสุข ด้วยการเพิ่มประสิทธิภาพทางคลีนิก ความแม่นยำของข้อมูล และการเพิ่มเวลาให้กับเจ้าหน้าที่ในการดูแลผู้ป่วยมากขึ้น ความร่วมมือและการพัฒนาร่วมกันในอุตสาหกรรมจะช่วยทำให้ระบบและอุปกรณ์ต่างๆ สามารถ "สื่อสาร" กันได้ง่ายขึ้น ส่งผลให้สามารถส่งต่อข้อมูลผู้ป่วยได้อย่างสะดวกมากขึ้น
นอกจากนี้ การทลายกำแพงของการเชื่อมต่อข้อมูลจะทำให้เราสามารถพัฒนาอัลกอริธึมที่ช่วยให้ทีมแพทย์สามารถประเมินและคาดการณ์อาการของผู้ป่วยได้ล่วงหน้า และป้องกันความรุนแรงในผู้ป่วยได้
เราเพิ่งจะเริ่มหาแนวทางในการวิเคราะห์ข้อมูลขั้นสูงในการดูแลผู้ป่วยวิกฤต เพื่อการตั้งค่าแจ้งเตือนหากพบความผิดปกติหรือกรณีฉุกเฉิน ในอนาคต เทคโนโลยี AI จะสามารถให้คำแนะนำเฉพาะบุคคลได้ ด้วยการเปรียบเทียบข้อมูลทั้งหมดของผู้ป่วยกับเคสอื่นๆ ที่คล้ายคลึงกันหลายพันเคส เพื่อหาแนวทางรักษาที่ดีที่สุดสำหรับผู้ป่วยแต่ละราย
รายชื่อศิลปินแสดงวันที่ 21 มีนาคม (1 เวที)
นอกจากนี้ มูลนิธิรามาธิบดีฯ พัฒนาช่องทางการสื่อสารที่เข้าถึงกลุ่มคนที่หลากหลาย ตอบโจทย์พฤติกรรมผู้บริโภคในแต่ละแพลตฟอร์ม โดยเฉพาะ TikTok ที่พัฒนาขึ้นมาเพื่อเป็นช่องทางสนับสนุนของที่ระลึกและมอบความสุขที่เกิดจาก ‘การให้’ โดยเน้นสร้างเนื้อหาที่เข้ากับยุคสมัย ดึงดูดกลุ่มคนรุ่นใหม่ให้ได้รู้จักกับมูลนิธิฯ แม้จะยังไม่เคยมีประสบการณ์ตรงกับโรงพยาบาล
คลินิกเฉพาะทางนอกเวลา กุมารเวชกรรม
All the Long Nights #JFF2025
All the Long Nights #JFF2025
1 ชั่วโมง 59 นาที R:ท
©Maiko Seo / 2024 " All the Long Nights " Film Partners JAPANESE (EN & TH Subs) ภาพยนตร์แสนงดงามชิ้นนี้จะทำให้ผู้ชมได้สัมผัสถึงความอ่อนโยนของผู้คนที่ต้องเผชิญแรงกดดันและความยากลำบากในชีวิต แสดงนำโดยโฮคูโตะ มัตสึมูระ และโมเนะ คามิชิราอิชิ โดยได้โช มิยาเกะมาเป็นผู้กำกับ ผู้ซึ่งได้รับการยกย่องจากผลงานเรื่อง Small, Slow but Steady ในงานเทศกาลภาพยนตร์นานาชาติ รวมถึงงานเทศกาลภาพยนตร์นานาชาติเบอร์ลิน โดยภาพยนตร์เรื่องนี้ดัดแปลงมาจากนิยายของไมโกะ เซโอะ ผู้ชนะรางวัลหนังสือขายดีจากผลงานเรื่อง And So the Baton is Passed อาสาสมัครบริการหน่วยตรวจโรคจักษุ (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญนักเรียน นักศึกษา หรือผู้ที่สนใจ ที่มีในรักงานจิตอาสา มาทำกิจกรรม "อาสาสมัครบริการหน่วยตรวจโรคจักษุ"
โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 07.30-11.00 น. (จำนวนชั่วโมงอาสาสมัคร 4 ชั่วโมง) ณ ตึกผู้ป่วยนอก ชั้น 5
รับสมัครผู้ที่สนใจเพียงวันละ 4 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- ช่วยจัดแถว และดูแลผู้ป่วยที่มารับบริการ
- ช่วยพยุงผู้ป่วยที่เข้ามารับบริการตรวจด้วยเครื่องมือพิเศษ
คุณสมบัติอาสาสมัคร
1. นักเรียนนักศึกษา อายุ 16 - 25 ปี 2. สุขภาพร่างกายแข็งแรง
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
คลินิกผ่าตัดเฉพาะทาง สูตินรีเวชกรรม
คลินิกอายุรกรรม โรคติดเชื้อต่างๆ เบาหวาน ความดัน ไขมันเลือดสูง
แผนการฉีดวัคซีน โซน4 จำนวน 17 ชุมชน ช่วง 14-23 พ.ค.2568
สอบถามข้อมูลเพิ่มเติม โทร 055-9863221 ถึง 28 เพจ
เทศบาลนครพิษณุโลกfanpageทันตกรรมชุมชนอบอุ่น สมุทรสาคร สมุทรสงคราม นครปฐม
(คลินิกที่ต้องการเพิ่มปุ่ม Info map (ฟรี) แจ้งมาที่ healthserv.net@gmail.com)
สมุทรสาคร
- ดีโอ้เดนทัลคลินิกทันตกรรม สาขาสมุทรสาคร
- บีเอ็มคลินิกทันตกรรม info&map
นครปฐม
- คลินิกทันตกรรม บ้านรักยิ้มทันตแพทย์
- คลินิกทันตกรรมยิ้มสวย info&map
- คลินิกทันตกรรมสไมล์
- คลินิกทันตกรรมหมอแคท
- คลินิกทันตกรรมหมอภัส
- คลินิกทันตกรรมออร่าสไมล์
- ดีโอ้เดนทัลคลินิกทันตกรรมสาขานครปฐม
- หมอเมย์คลินิกทันตกรรม
4) อวัยวะบนชิป (Organs-on-chips)
การเปลี่ยนจากการทดลองทางคลินิกที่ยาวนานและมีราคาแพงมากเป็นไมโครชิปขนาดเล็กที่สามารถใช้เป็นแบบจำลองของเซลล์ อวัยวะ หรือระบบสรีรวิทยาทั้งหมดของมนุษย์นั้นมีข้อดีที่ชัดเจน ยาหรือส่วนประกอบต่างๆ สามารถทดสอบได้โดยไม่มีข้อจำกัด ทำให้การทดลองทางคลินิกเร็วขึ้นและแม่นยำยิ่งขึ้น (ในแต่ละกรณี เงื่อนไขและสถานการณ์จะเหมือนกัน) เทคโนโลยี Organs-on-Chipsสามารถใช้เซลล์ต้นกำเนิดเพื่อเลียนแบบอวัยวะต่างๆ ของร่างกายด้วยชุดอุปกรณ์ ผู้เชี่ยวชาญหลายคนเชื่อว่าเทคโนโลยีนี้สามารถปฏิวัติการทดลองทางคลินิกและแทนที่การทดลองกับสัตว์ได้อย่างสมบูรณ์ นอกจากนี้ยังสามารถปรับปรุงการรักษามะเร็งได้อีก ด้วย แม้ว่าการทดลองเหล่านี้จะดูมีแนวโน้มดี แต่ก็ยังห่างไกลจากการจำลองสรีรวิทยาของมนุษย์ทั้งร่างกายอย่างแท้จริง และแม้แต่บริษัทผู้บุกเบิกก็เปลี่ยนโฟกัสไปแล้วไม่ต้องพูดถึงว่าหากสามารถเลียนแบบอวัยวะได้ การเชื่อมโยงโมเดลเข้าด้วยกันก็ซับซ้อนกว่าที่เราคิดบอร์ดฝ่ายลูกจ้าง กับน้ำตาแห่งความสำเร็จ
นายธนพงษ์ เชื้อเมืองพาน บอร์ดฝ่ายลูกจ้าง ในฐานะประธานอนุกรรมการสิทธิประโยชน์ กล่าวพร้อมน้ำตาอาบแก้มว่า ว่า วันนี้ถือเป็นความสำเร็จที่ตนเองและทีมประกันสังคมก้าวหน้า ได้ร่วมกันผลักดันและสู้มาเป็นเวลานาน พร้อมยืนยันว่า สูตรคำนวณบำนาญชราภาภาพใหม่นี้ ไม่มีใครที่ได้เปรียบหรือเสียเปรียบ เป็นสูตรที่เท่าเทียมของทุกคนที่ได้บำนาญ ในส่วนตัวมองว่าสูตรบำนาญสูตรเก่ามีความเหลื่อมล้ำหลายด้าน ดั้งนั้นควรจะทำอะไรให้โปร่งใสและเท่าเทียม12 มีนาคม 68 เจ้าหน้าที่พิสูจน์หลักฐาน และทีมวิศวกร ตรวจสอบเหตุ
เจ้าหน้าที่พิสูจน์หลักฐาน และทีมวิศวกร ตรวจสอบเหตุเพลิงไหม้โรงพยาบาลรามาธิบดี ขณะที่โรงพยาบาลยังงดให้บริการในอาคารหลักทั้งหมดเป็นเวลา 48 ชั่วโมง
MCOT4. หวยอื่นๆ ขยายตัวอย่างก้าวกระโดด
ธุรกิจเด่นอันดับ 4 ธุรกิจจัดทำคอนเทนต์ ธุรกิจ Youtuber การรีวิวสินค้า และ Influencer


ปัจจัยสนับสนุน
1. พฤติกรรมในการติดตามสื่อของคนในปัจจุบันเปลี่ยนแปลงไป
2. การเพิ่มขึ้นของช่องทางในการสื่อสาร โดยเฉพาะช่องทางออนไลน์ ที่สามารถรับชมได้ตลอด 24 ชม.
3. พฤติกรรมของผู้บริโภคปัจจุบันให้ความสนใจกับ influencer
4. การเพิ่มขึ้นของการโปรโมทโฆษณาผ่าน Social Influencer อาทิเช่น Net-ldol หรือ Youtuber
5. กลยุทธ์การเพิ่มยอดขายของธุรกิจผ่าน Application มีเพิ่มขึ้น
6. ธุรกิจขนาดเล็ก-ใหญ่ หันมาโปรโมทสินค้าผ่านช่องทางออนไลน์มากขึ้น
7. การเข้าสู่ตลาดเกี่ยวกับ Youtuber ง่ายและมีต้นทุนการดำเนินการที่ต่ำ
ปัจจัยเสี่ยง
1. กฎระเบียบ กฎหมายต่างๆ ที่ไม่เอื้อต่อการดำเนินธุรกิจ
2. เมื่อเกิดความผิดพลาดหรือเป็นโทษต่อผู้บริโภค ธุรกิจอาจถึงขั้นต้องปิดกิจการ
3. ข้อจำกัดในการเข้าถึงระบบอินเตอร์เน็ตของผู้บริโภคบางส่วน
4. ธุรกิจมีการแข่งขันกันค่อนข้างสูง โดยเฉพาะเรื่องราคาหรือการให้โปรโมชั่น
5. ศิลปินดาราผันตัวมาเป็น Youtuber มากขึ้น ส่งผลให้การแข่งขันในตลาด Influencer มีความรุนแรงมากขึ้น
6. Al Influencer หรือ Vitual Influencer เป็นอีกรูปแบบหนึ่งที่เริ่มเข้ามามีบททบาทในปัจจุบัน เพื่อทำการตลาดเป็นเรื่องที่น่าสนใจสำหรับแบรนด์ต่างๆ และยังเสียค่าใช้จ่ายในการทำงานน้อยกว่าคนจริงๆ
THA MAHARAJ ILLUMINATION มหัศจรรย์แสงไฟ ณ ท่ามหาราช
THA MAHARAJ ILLUMINATION มหัศจรรย์แสงไฟ ณ ท่ามหาราช เมื่อลมหนาวมาเยือน เมื่อดาวนับล้านแห่งค่ำคืนสว่างขึ้น เมื่อความเปล่งประกายสะท้อนกับพื้นน้ำ เกิดความมหัศจรรย์ที่จะเนรมิตประสบการณ์ใหม่ ให้ท่ามหาราชไม่เหมือนเดิมไปตลอดกาล 9 ความพิเศษที่จะพานำคุณไปสู่โลกแห่งความมหัศจรรย์ใต้สายลมหนาวกลางกรุง ดินแดนแห่งดวงดาว ดินแดนแห่งมิติใหม่ของกรุงเทพ ดินแดนแห่งความสุข
วันที่ : 20 ธันวาคม 2564 – 6 กุมภาพันธ์ 2565 เวลาเข้าชม : 17.00 - 21.00 น. สถานที่ : ท่ามหาราช กรุงเทพ
ค่าเข้าชม ผู้ใหญ่ 120 บาท เด็ก 80บาท จำกัดเพียง 60 ท่าน ต่อรอบ
*ขอสงวนสิทธิ์ไม่ออกเรือ เมื่อมีผู้โดยสารไม่ถึง 15 คน โดยผู้จัดจะดำเนินการคืนเงินให้
ธุรกิจเด่นอันดับ 4 ธุรกิจโฆษณาและสื่อออนไลน์
ปัจจัยสนับสนุน
1. กิจกรรมทางเศรษฐกิจฟื้นตัวหลาย ๆ ด้านไม่ว่าจะเป็นการส่งออก การท่องเที่ยว และกำลังซื้อของผู้บริโภคที่เพิ่มขึ้น ทำให้แนวโน้มธุรกิจโฆษณาและสื่อออนไลน์เติบโตได้ดีขึ้น
2. การปรับเปลี่ยนรูปแบบการโฆษณา ที่เป็นการเจาะกลุ่มเป้าหมายเฉพาะมากขึ้น
3. ประมาณการณ์อุตสาหกรรมสื่อโฆษณาปี 2565 จะเติบโต 5-8% จากเศรษฐกิจฟื้นตัวเร็ว โดยสื่อยอดนิยมยังคงเป็นสื่อออนไลน์ที่มีอัตราการเดิบโตที่สูงขึ้น โดยผ่านทางแพลตฟอร์มโซเซียลมีเดีย อย่าง TikTok, Youtube, facebook, instragram ฯลฯ
4. สื่อโฆษณาที่กลับมามีอิทธิพลมากขึ้น คือสื่อนอกบ้านและสื่อเคลื่อนที่ตลอดจนสื่อในโรงภาพยนตร์
ปัจจัยเสี่ยง
1. เงินเฟ้อยังคงเป็นปัจจัยต่อตลาดสื่อโฆษณาโดยรวม
2. ธุรกิจมีการแข่งขันในตลาดสูง โดยเฉพาะสื่อออนไลน์ที่เข้าถึงกลุ่มผู้บริโภคได้อย่างทั่วถึง
ข้อเสนอแนะ
1.ควรจัดหาและบริหารจัดการวัคซีนให้มีความเพียงพอต่อความต้องการต่อกลุ่มเป้าหมายในผู้สูงอายุ 65 ปีเพื่อให้กลุ่มเป้าหมายสามารถเข้าถึงบริการได้อย่างครอบคลุมสำหรับการลดโอกาสการป่วยที่รุนแรงและการเสียชีวิต
2. เจ้าหน้าที่ควรการสื่อสารประชาสัมพันธ์กับประชาชนกลุ่มเสี่ยง ชี้แจงรายละเอียดของกำหนดการรณรงค์ สถานที่/การนัดหมายฉีดวัคซีน กลุ่มเป้าหมายชี้แจงให้ชัดเจน เพื่อให้สามารถฉีดวัคซีนได้ตรงกลุ่มเป้าหมายให้เข้าถึง ระบบริการ และได้รับการฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ได้ตามที่กำหนด
3. หน่วยบริการควรจัดบริการให้มีความเหมาะสมกับบบริบทของพื้นที่ เช่น วัน เวลา สถานที่ให้บริการฉีด วัคซีน รวมถึงควรออกให้บริการเชิงรุกในกลุ่มที่เข้าถึงยากลำบาก เช่น กลุ่มผู้สูงอายุติดบ้าน ติดเตียง หรือผู้ที่ที่ไม่ สามารถเข้ามารับบริการได้เพื่อให้กลุ่มเป้าหมายสามารถเข้ารับบริการฉีดวัคซีนได้อย่างสะดวกและทั่วถึง
การประเมินการเข้าถึงบริการวัคซีนป้องกันโรคไข้หวัดใหญ่สำหรับกลุ่มผู้สูงอายุ 65 ปีขึ้นไป
ที่ปรึกษา :
นายแพทย์โสภณ เอี่ยมศิริถาวร รองอธิบดีกรมควบคุมโรค
นายแพทย์วิชาญ บุญกิติกร ผู้อำนวยการกองโรคติดต่อทั่วไป
ผู้เรียบเรียง : นายแพทย์ชนินันท์ สนธิไชย พรนภา มักกะสัน รสกร วันประยูร
กลุ่มงานสร้างเสริมภูมิคุ้มกันโรค และแผนงานโรคป้องกันด้วยวัคซีน กองโรคติดต่อทั่วไป
จัดทำโดย : กองโรคติดต่อทั่วไป กรมควบคุมโรค กระทรวงสาธารณสุข
หากเตรียมการอย่างเหมาะสมก็จะถือเป็นโอกาสสำคัญ เราจะมีวิศวกรซอฟต์แวร์หรือโปรแกรมเมอร์ที่ทำงานกับ AI ได้อย่างดี ทำให้สามารถใช้ประโยชน์จากเทคโนโลยีนี้ในการสร้างงานและผลิตภัณฑ์ได้อย่างมีประสิทธิภาพและรวดเร็วมากยิ่งขึ้น เพิ่มโอกาสทางการตลาดและความสามารถในการแข่งขันสำหรับธุรกิจในทุกขนาด ตั้งแต่พ่อค้าแม่ค้าออนไลน์รายย่อย ธุรกิจสตาร์ตอัป (start-up), SMEs ตลอดจนธุรกิจขนาดใหญ่
ซอฟต์แวร์ใหม่ ๆ ที่เกิดขึ้น อาจมีส่วนช่วยลดความเหลื่อมล้ำด้านดิจิทัลของคนในประเทศลง และจะเป็นส่วนหนึ่งของเครืองมือที่ทำให้เกิด digital transformation ซึ่งจะช่วยให้ประเทศพัฒนาอย่างก้าวกระโดดได้ จนเข้าสู่ยุคเศรษฐกิจดิจิทัล (digital economy) อย่างเต็มตัวในที่สุด
แต่หากล่าช้าหรือไม่เตรียมการให้ดี ก็จะกลับกลายเป็นภัยคุกคามได้ในที่สุด
คลินิกศัลยศาสตร์ออร์โธปิดิกส์ LINK
สถานที่ตั้ง ชั้น 1 อาคารดุลโสภาคย์
เปิดให้บริการ
- วันจันทร์-ศุกร์ เวลา 16.00-19.00 น.
- วันเสาร์-อาทิตย์ เวลา 08.00-11.00 น.
หน้าที่และเป้าหมาย
ให้บริการตรวจรักษาทางด้านศัลยกรรมกระดูกและข้อ และด้านเวชศาสตร์ฟื้นฟู ให้ได้รับการบริการที่มีคุณภาพรวดเร็วถูกต้องและปลอดภัยตามมาตรฐานวิชาชีพร่วมกับทีมสหสาขาวิชาชีพโดยยึดผู้ป่วยเป็นศูนย์กลาง เพื่อให้ผู้ใช้บริการพึงพอใจ
ขอบเขตการให้บริการ
- บริการรักษาพยาบาลผู้ป่วยนอกทุกเพศทุกวัย
- ให้บริการด้านศัลยกรรมกระดูกและข้อ ด้านเวชศาสตร์ฟื้นฟูและกายอุปกรณ์
- ให้บริการผู้ป่วยที่มีปัญหาเกี่ยวกับกระดูกและข้อ เส้นเอ็นกล้ามเนื้อและเส้นประสาท (ยกเว้นกะโหลกศีรษะ กระดูกใบหน้าและซี่โครง)
คลินิกหู คอ จมูก LINK
สถานที่ตั้ง ชั้น 2 อาคาร ม.ร.ว. สุวพรรณ สนิทวงศ์
เปิดให้บริการ
- วันจันทร์-วันศุกร์ เวลา 16.00-19.00 น.
- วันเสาร์ เวลา 08.00-11.00 น.
หน้าที่และเป้าหมาย
ให้บริการตรวจรักษาพยาบาลผู้ป่วย โรค หู คอ จมูก อย่างมีคุณภาพ ได้มาตรฐาน
ขอบเขตการให้บริการ
ให้บริการ ดูแลสุขภาพ ผู้ป่วยนอก ที่มีปัญหา ในเรื่อง โรคทาง หู คอ จมูก อายุตั้งแต่ 15 ปีขึ้นไป
คลินิกจักษุ LINK
สถานที่ตั้ง ชั้น 2 ศูนย์จักษุเฉพาะทาง อาคาร ม.ร.ว.สุวพรรณ สนิทวงศ์
เปิดให้บริการ
- วันจันทร์-วันศุกร์ เวลา 16.00-18.00 น.
- วันเสาร์ เวลา 08.00-11.00 น.
หน้าที่และเป้าหมาย
ให้บริการรักษาพยาบาลผู้ป่วยโรคทางจักษุ อย่างมีคุณภาพ ถูกต้องปลอดภัยจากภาวะแทรกซ้อน ตามมาตรฐานวิชาชีพอย่างเป็นองค์รวม โดยคำนึงถึงความต้องการของผู้รับบริการตลอดจนการส่งเสริมการมีส่วนร่วมของญาติ การให้บริการครอบคลุมทั้งด้านการป้องกัน ส่งเสริม รักษา และฟื้นฟูสภาพ มีเป้าหมายให้ผู้รับบริการมีคุณภาพชีวิตที่ดี และได้รับความพึงพอใจในบริการ
ขอบเขตการให้บริการ
ให้การดูแลรักษาพยาบาลผู้ป่วยทุกช่วงอายุ ที่ไม่อยู่ในภาวะฉุกเฉิน หรือสอบถามข้อมูลเเกี่ยวกับตารางลงตรวจของแพทย์เฉพาะทางก่อนเข้ารับการตรวจ
- มีแพทย์ผู้เชี่ยวชาญเฉพาะทุกอนุสาขาจักษุวิทยา
- มีพยาบาลเวชปฏิบัติทางตา ที่มีความสามารถและมีทักษะในการปฏิบัติงานอย่างถูกต้องตามมาตรฐานวิชาชีพ
- มีเครื่องมือตรวจพิเศษทางจักษุที่หลากหลาย รองรับโรคที่ซับซ้อนทางจักษุได้
หนึ่งในกิจกรรมที่บำรุงราษฎร์ทำมาโดยตลอด คือ การสร้างและพัฒนาให้มีบุคลากรด้านการแพทย์และการพยาบาลที่ทรงคุณค่าให้แก่โรงพยาบาลและแก่ประเทศชาติ รวมถึงการให้ทุนการศึกษาแก่พยาบาล โดยโรงพยาบาลมีสถาบันทางวิชาการที่ส่งเสริมด้านการศึกษาและฝึกอบรมเพื่อให้บุคลากรมีความรู้ที่ทันสมัยอยู่เสมอ ถือได้ว่าปัจจุบันบำรุงราษฎร์เป็น ‘สถาบันวิชาการทางการแพทย์ภาคเอกชน’ หรือ Academic Private Hospital อย่างเต็มรูปแบบ อีกทั้งยังสนับสนุนให้แพทย์และบุคลากรได้มีโอกาสทำงานวิจัย ตีพิมพ์ผลงานในวารสารทางวิชาการทั้งในระดับชาติและนานาชาติ และมีความร่วมมือกับโรงเรียนแพทย์ เพื่อพัฒนางานวิจัยทางการแพทย์และนวัตกรรมการรักษา ตลอดจนเพิ่มขีดความสามารถของบุคลากรอย่างต่อเนื่อง
วิธีแก้ไขที่สามารถทำได้
1. กรณีกรอกข้อมูลชื่อผู้ใช้ และรหัสผ่าน
- เปลี่ยนรหัสผ่านทันที
- ตั้งรหัสผ่านให้ยากแก่การคาดเดา และแตกต่างกันในแต่ละระบบ
- กำหนดวิธีเข้าสู่ระบบด้วยการพิสูจน์ตัวตนร่วมกัน 2 ประเภท ขึ้นไป (2 Factor Authentication)
2. กรณีเปิดเผยข้อมูลทางบัญชี หรือข้อมูลบัตรเครดิต / บัตร ATM
- แจ้งเรื่องไปยังธนาคารเพื่ออายัดบัญชี หรือยกเลิกบัตรเครดิต (หากดำเนินการได้)
- หมั่นตรวจสอบ รายการเคลื่อนไหวทางบัญชี
- หากพบความเสียหายทางการเงิน ให้รวบรวมหลักฐานแจ้งตำรวจ และติดต่อธนาคาร เพื่อระงับบัญชีปลายทาง
3. กรณีเปิดไฟล์แนบหรือติดตั้งโปรแกรมมัลแวร์
- ติดตั้งโปรแกรมแอนตี้ไวรัส และทำการสแกนเครื่อง
- เปลี่ยนรหัสผ่านทันทีหลังจากลบมัลแวร์แล้ว
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตลาดพร้าว
เช่นเดียวกันกับไทย ข้อมูลเดือนกรกฎาคมชี้ว่า จังหวัดที่อยู่ไม่ไกลเกินจากรัศมีการขับรถจากกรุงเทพฯ ได้นั้น มีอัตราการพัก (Occupancy Rate หรือ OR) ที่ฟื้นตัวได้เร็วกว่าจังหวัดอื่น อัตราการเข้าพักโดยเฉลี่ย ณ เดือน กรกฎาคม 2020 ท้ังประเทศอยู่ที่ 25.7% ฟื้นตัวจาก 2.3% และ 3.8% ในช่วงเดือนเมษายนและพฤษภาคมที่มีการ Lockdown โดยจังหวัดท่องเที่ยวที่ค่า OR ฟื้นตัวได้ดีกว่าจังหวัดอื่น ส่วนหนึ่งคือ จังหวัดที่อยู่ไม่ไกลจากกรุงเทพฯ ซึ่งมีผู้บริโภคจำนวนมาก และสามารถขับรถไปเที่ยวได้ เช่น ประจวบคีรีขันธ์ กาญจนบุรี นครราชสีมา เป็นต้น ในขณะที่นักท่องเที่ยวมักต้องเดินทางไปเที่ยวด้วยเครื่องบิน ค่า OR ยังฟื้นตัวได้ไม่ดีนัก เช่น ภูเก็ต กระบี่ เป็นต้น
เทรนด์นี้ยังคงดำเนินต่อไป โดยข้อมูลที่รวดเร็วกว่าอย่ำงข้อมูลจาก Apple Map ก็สื่อว่า จังหวัดที่อยู่รอบข้างกรุงเทพฯ กำลังเป็นที่นิยมในการท่องเที่ยว Krungthai COMPASS ได้นำข้อมูลการขอรับเส้นทางจาก Apple Map ในจังหวัดที่อยู่ใกล้ๆ กรุงเทพฯ เช่น กาญจนบุรี นครราชสีมา ยังคงมีผู้คนขอใช้ Apple Map ในการขับรถไปมากกว่า จังหวัดอื่นๆ เช่นเดียวกับจังหวัดที่เป็นจังหวัดท่องเที่ยวในภูมิภาคต่างๆ ก็มีคนไปท่องเที่ยวมากขึ้น เช่นกัน เช่น อุบลราชธานี และขอนแก่น ในขณะที่จังหวัดอย่างภูเก็ตและเชียงใหม่ คนยังไม่ขับรถไปเที่ยวกันน้อยกว่าช่วงก่อนโควิด-19
อย่างไรก็ดี แม้ว่าคนไทยจะกลับไปเที่ยวบางจังหวัดไม่ต่างจากช่วงก่อนโควิด-19 แต่ไม่ได้หมายความว่ารายได้ท่องเที่ยวน้ันๆ จะกลับมาเท่าเดิม เพราะบางจังหวัดมี สัดส่วนรายได้จากนักท่องเที่ยวต่างชาติสูงมาก แม้ว่าคนไทยจะกลับไปเที่ยวจังหวัดน้ันๆ เหมือนเดิมแล้ว แต่รายได้การท่องเที่ยวคาดว่าน่าจะยังต่ากว่าช่วงก่อนโควิด -19 อยู่เยอะ อย่างเช่น ชลบุรี ที่มีสัดส่วนรายได้จากชาวต่างชาติถึง 80% ในปี 2019
ICU/CCU
โรงพยาบาลเมดพาร์คมีห้อง ICU มากถึง 130 ห้อง หรือคิดเป็น 30% จำนวนห้องพักผู้ป่วยทั้งหมด ซึ่งถือว่ามีอัตราส่วน ICU ต่อจำนวนเตียงสูงที่สุด สามารถรองรับผู้ป่วยที่ต้องการการดูแลใกล้ชิดเป็นพิเศษได้อย่างเพียงพอ รวมทั้งมีการจัดพื้นที่สำหรับพยาบาลนั่งเฝ้าหน้าห้องผู้ป่วยวิกฤต เพื่อติดตามดูอาการอย่างใกล้ชิด และสามารถให้ความช่วยเหลือได้ทันท่วงที โดยจะมีอัตราส่วนของพยาบาลต่อผู้ป่วยในหออภิบาลผู้ป่วยหนักคือ 1:1
พื้นที่ห้อง 4m x 3m : 12 Sq.M.
สิ่งอำนวยความสะดวก
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 7,400 บาท
- ค่าอาหาร 1,000 บาท
- ค่าบริการพยาบาล 6,000 บาทค่าบริการโรงพยาบาล 2,800 บาท
รวม 17,200 บาท
Bangkok, October 29, 2020 –
Aloft Bangkok - Sukhumvit 11 managed by Marriott International today announces the participation in the country’s Alternative State Quarantine (ASQ) program in Bangkok in partnership with Bangpakok 9 International Hospital.
Offering a series of government-approved Alternative State Quarantine (ASQ) packages for Thai citizens, international travelers and expatriates returning to Thailand, this staycation-style accommodation for duration of the mandatory 15-night quarantine period is offered in association with the very well-known Bangpakok 9 International Hospital. With a prime location in the heart of Sukhumvit easily accessible from Suvarnabhumi and Done Mueang International airport, and with International health standards provided by Bangpakok 9 International Hospital, guests can stay in style at Aloft Bangkok Sukhumvit 11 hotel in a safe environment, while turning their quarantine into a relaxing experience in one of our breezy rooms and suites, with tech-forward amenities, scenic views of Bangkok skyline and delectable cuisine.
Package rates starting from THB 49,500 net only, guests can enjoy a 15 nights stay (16 days) in their preferred room type ranging from the 32-sqm Chic room at THB 49,500 net, Urban room (32 sqm) featuring panoramic city views at THB 54,500 net, Stylish suite (60 sqm) with separate living area at THB 89,900 net, Savvy suite (142 sqm) with outdoor terrace and private Jacuzzi at THB 135,000 net and 2-bedroom Ultra savvy suite (112 sqm) with balcony at THB 165,000 net.
All packages come with complete services during stay including daily breakfast, lunch and dinner with a delicious choice of Thai, Asian and Western sets plus vegetarian options available, Drinking water, coffee and tea, Yoga mat available upon request, 42-inch LCD TV with an array of international channels, Complimentary Wi-Fi, Captivating poolside relaxation area, 20% discount on room service and laundry service and Marriott Bonvoy members earn elite nights and points from stays.
In addition, all guests will receive first-class medical care from
Bangpakok 9 International Hospital including sanitized limousine pick up service from Suvarnabhumi Airport or Don Mueang Int’l Airport to the hotel, Total 2 Covid-19 screening tests (RT-PCR) conducted in a designated area at the hotel, Telemedicine system service, 24-hour nurse available for daily health monitoring and other benefits.
แบบประเมินพฤติกรรมการบริโภคอาหาร
ท่านทำพฤติกรรมเหล่านี้บ่อยเพียงใด ทำเครื่องหมาย O รอบตัวเลข ในช่องที่ตรงกับตัวคุณ ตามความรู้สึกของคุณเองและตามความเป็นจริง
4.เครือข่ายหน่วยบริการชุมชนอบอุ่นมี 2 ประเภท
ได้แก่ คลินิกชุมชนอบอุ่น (รักษาเต็มเวลา) และคลินิกเฉพาะทาง ชุมชนอบอุ่น (คลินิกเฉพาะทาง คลินิกทันตกรรม คลินิกการพยาบาลและการผดุงครรภ์ คลินิกกายภาพบำบัด ร้านขายยา ขย.1 ฯลฯ ในและนอกเวลาราชการ)
เปรูระงับการทดลองวัคซีน บ. จีน Sinopharm ชั่วคราว
สนข.South China Morning Post รายงานว่า ทางการเปรูระงับการทดลองวัคซีนป้องกันโรค COVID-19 ของบริษัท Sinopharm ของจีนชั่วคราวภายหลังตรวจพบว่าเกิดผลข้างเคียงรุนแรงหลายอาการกับอาสาสมัครรายหนึ่ง รวมถึงอาการกล้ามเนื้ออ่อนแรง โดย สธ.เปรูอยู่ระหว่างการตรวจสอบว่าเป็นผลข้างเคียงจากวัคซีนดังกล่าวหรือสาเหตุอื่น ๆการระงับการทดลองวัคซีน มีขึ้นขณะบริษัท Sinopharm กำลังทดลองฉีดวัคซีนในเปรูกับอาสาสมัคร 12,000 ราย โดยในขณะนี้เปรูมีผู้ติดเชื้อ COVID-19 กว่า 980,000 รายและเสียชีวิตกว่า 36,000 ราย
รองผู้ว่ากทม.ลงพื้นที่ตรวจสถานประกอบการ 4 ประเภท
รองผู้ว่าราชการจังหวัดฯ พร้อมคณะ ลงพื้นที่ตรวจสถานประกอบการ 4 ประเภท ซึ่งเคยพบการระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 ซึ่งประกอบด้วยสนามมวยผับ บาร์และคาราโอเกะระหว่างวันที่ 9-15 ธันวาคม 2563 เพื่อสร้างความเข้าใจและขอความร่วมมือเจ้าของสถานประกอบการ ให้ปฏิบัติตามมาตรการป้องกันควบคุมโรคอย่างเคร่งครัด
สาธารณสุขจังหวัดนครปฐม ให้คนที่ไปตลาดค้าส่งสัตว์น้ำสมุทรสาคร ต้องลงทะเบียน
สำนักงานสาธารณสุขจังหวัดนครปฐม ประกาศให้ประชาชนจังหวัดนครปฐมที่มีประวัติการเดินทางไป ตลาดค้าส่งสัตว์น้ำ ในพื้นที่จังหวัดสมุทรสาคร ระหว่างวันที่ 15 พ.ย. - 13 ธ.ค. 63
- สแกน และลงทะเบียนผ่าน QR Code เจ้าหน้าที่สาธารณสุขจะดำเนินการตรวจสอบ และหากพบว่ามีความเสี่ยง จะติดต่อกลับ
- แจ้งสำนักงานสาธารณสุขอำเภอ รพ.สต. ใกล้บ้านทุกแห่ง หรือ
- โทร 065 9402374 เวลา 8.00-20.00 น.
5. การตรวจคัดกรองการได้ยินในเด็กแรกเกิดกลุ่มเสี่ยง
การตรวจคัดกรองการได้ยินในเด็กแรกเกิดกลุ่มเสี่ยง โดยกำหนดกลุ่มเป้าหมายไว้ที่ 30,434 คน ประมาณการณ์ค่าใช้จ่ายไว้ 12.33 ล้านบาท
สังเกตและเช็คอาการให้เป็น
สังเกตและเช็คอาการให้เป็น
ไวรัสโคโรนา 19
ยิ่งรู้เร็ว!
ลดการแพร่เชื้อ!
เช็กอาการตามนี้!
- มีไข้
- ไอ จาม
- มีน้ำมูก
- เพิ่งกลับจากพื้นที่เสี่ยง
ถ้าเริ่มมีอาการเหล่านี้ใน 14 วัน หลังจากไปพื้นที่ระบาดที่ได้รับการประกาศอย่างเป็นทางการ ควรรีบไปพบแพทย์
- ถ้าสงสัยว่าติดเชื้อ ให้สวมหน้ากากอนามัย และล้างมือสม่ำเสมอ เพื่อป้องกันการแพร่เชื้อ รีบไปพบแพทย์และแจ้งข้อมูล เช่น อาการป่วย วันที่เริ่มมีอาการป่วย วันเดินทางมาถึงประเทศไทย สถานที่พัก
- สอบถามข้อมูลเพิ่มเติมได้ที่สายด่วยกรมควบคุมโรค 1422
รพ.ศรีสะเกษ มีผู้ป่วยที่ต้องการโลหิตเป็นจำนวนมาก LINK
ศรีสะเกษยังไม่มีผู้ป่วยโควิด แต่มีผู้ป่วยที่ต้องการโลหิตเป็นจำนวนมาก
ขอเชิญร่วมกันบริจาคโลหิต ที่ธนาคารเลือด รพ.ศรีสะเกษ อาคาร 10 ชั้น 2 เวลา 9.00-15.30 น ทุกวันไม่เว้นวันหยุด
สำนักงานเหล่ากาชาดจังหวัดศรีสะเกษร่วมกับโรงพยาบาลศรีสะเกษ มีแผนออกหน่วยรับบริจาคโลหิตเคลื่อนที่ ประจำเดือน มกราคม 2564
- เตรียมบัตรประจำตัวประชาชนมาด้วยทุกครั้ง
- มาร่วมบริจาคโลหิตอย่างต่อเนื่อง ทุกๆ 3 เดือน หรือ ปีละ 4 ครั้ง เพื่อช่วยเหลือชีวิตผู้ป่วย #Plus1เพิ่มจำนวนครั้งเพิ่มโลหิตเพิ่มชีวิต 1
- สอบถามโทร. 045 611 503 , 045 616 380-1 ต่อ 2903
บริจาคโลหิตได้ที่ รพ.พังงา LINK
บริจาคโลหิตได้ที่ โรงพยาบาลพังงา
- ติดต่อสอบถามเจ้าหน้าที่ห้องรับบริจาคเลือด โทร 076-411616 ต่อ 6008
- เปิดบริการทุกวันไม่เว้นวันหยุดราชการ
- ตั้งแต่เวลา 8.30-16.00 น. (12.00 น.พักเที่ยง)
ธนาคารเลือด รพ.เจ้าพระยายมราช LINK
ประกาศ ธนาคารเลือด โรงพยาบาลเจ้าพระยายมราช ขาดแคลนเลือดสำรองทุกกรุ๊ป โดยเฉพาะกรุ๊ป A และ AB
ติดต่อเพื่อบริจาคโลหิตได้ที่
งานธนาคารเลือด ชั้น 4 ตึกอุบัติเหตุ7ชั้น
วันเวลาราชการ 8.30 - 12.00 น. และ 13.00 - 15.30 น.
วันเสาร์อาทิตย์ และวันหยุดนักขัตฤกษ์ 9.00 - 12.00 น. และ 13.00 - 14.30 น.
โทร 035 514 999
ปล.รบกวนมาลงทะเบียนก่อนเวลาปิดทำการครึ่งชั่วโมงนะคะ
ธนาคารทิสโก้
ธนาคารทิสโก้ แจ้งปรับเวลาการให้บริการ
สำหรับสาขาที่อยู่ในพื้นที่ควบคุมสูงสุด เนื่องจากสถานการณ์ COVID-19
ตั้งแต่วันที่ 11 ม.ค. 64 เป็นต้นไป
หรือจนกว่าจะมีการเปลี่ยนแปลง
- สาขาในศูนย์การค้า (เปิดให้บริการทุกวัน) เวลาทำการใหม่ 10.30- 18.00 น. และ 11.00- 18.00 น.
- สาขาทั่วไป (เปิดให้บริการจันทร์-ศุกร์) เวลาทำการใหม่ 9.30- 16.00 น.
ปัญหาคือ กลุ่ม B เพราะไม่สามารถระบุได้ว่า B เหล่านั้นคือใคร กลุ่มใด อยู่ที่ใด และตัว B เอง ก็ไม่รู้ว่าตัวเองได้อยู่ในกลุ่ม B ไปแล้ว
5. ดูในแน่ชัดว่า ต้องตรวจด้วยวิธีใด
5. ดูในแน่ชัดว่า ต้องตรวจด้วยวิธีใด ระหว่าง RT-PCR หรือ Antigen test และ ต้องแจ้งผลให้กับสถานทูตก่อนหรือไม่
นักเรียนของที่นี่ได้เรียนวิชาโซล่าร์เซลล์กับพระครูวิมลปัญญาคุณจนสามารถออกไปติดตั้งตามสถานที่ต่างๆ ใช้เวลาประมาณ 2 สัปดาห์โรงพยาบาลก็สามารถเปิดใช้งานได้แล้ว ผ่านไป 2 เดือนแรกสามารถลดค่าไฟฟ้าลงเดือนละ 90,000 บาท นับว่าประสบความสำเร็จตามเป้าที่วางไว้เพราะโรงพยาบาลมีค่าไฟฟ้าประมาณ 180,000 บาท สามารถลดได้มา 50% และยังมีโครงการจะติดตั้งต่อไปอีกเมื่อมีทุน
ชานมไข่มุก Cannacha พบกันเร็วๆนี้ที่ RCA
ศ.เกียรติคุณ นพ.ปิยะสกล สกลสัตยาทร
ที่ปรึกษาด้านยุทธศาสตร์และแผนงานการบริหารจัดการ การให้วัคซีนป้องกันโรคติดเชื้อไวรัสโควิด 19
อยากสรุปว่า ความปลอดภัยของประชาชนคือเป้าหมายสูงสุดของสธ. วัคซีนแอสตร้า ไม่ใช่วัคซีนที่ไม่ปลอดภัยนะ ขณะฉีดไปแล้ว 34 ล้านโดส ทั่วโลก มีผลข้างเคียงบ้าง ระหว่างที่สืบสวน เราก็ชะลอไปได้ คิดว่าไม่เกิน 1-2 สัปดาห์ ถ้าผลออกมาถูกต้อง ยิ่งจะช่วยยืนยัน สร้างความมั่นใจว่าปลอดภัยในการฉีดให้ประชาชน การฉีดวัคซีนขณะนี้ไม่ได้หยุด การฉีดวัคซีนซิโนแวคยังคงดำเนินต่อไป
ส่วนใหญ่ตอบรับในเชิงบวก
ใช่ค่ะ ส่วนใหญ่บวกหมดเลย ผู้คนที่เข้ามาต่างรู้ว่ากัญชาถูกปลดล๊อคจากยาเสพติดแล้วยกเว้นส่วนดอกกัญชง เป็นส่วนประกอบในผลิตภัณฑ์สุขภาพ อะไรได้บ้าง?
หมอรู้จักคุณ Med Care LINK
หมอรู้จักคุณ Med Care
โครงการพัฒนาต้นแบบของเทคโนโลยีที่ช่วยในการพัฒนาคุณภาพการให้บริการทางการแพทย์ฉุกเฉินทางไกลในชนบท โดยผ่านเครือข่ายดิจิทัลความเร็วสูง (ระยะที่ 2) [มหาวิทยาลัยนเรศวร ผู้จัดทำ]
- หมอรู้จักคุณ แพทย์ผู้เชี่ยวชาญ ระบบให้คำปรึกษาทางการแพทย์ ระยะไกลผ่านสมาร์ทโฟน
- หมอรู้จักคุณ ประชาชน เข้าถึงข้อมูลสุขภาพส่วนตัว พร้อมแหล่งบริการทางการแพทย์ที่สำคัญ
- หมอรู้จักคุณ คลินิกหมอครอบครัว บันทึกข้อมูลทางการแพทย์ ของชุมชนที่ตนเองดูแล
- หมอรู้จักคุณ อสม. บันทึกแบบรายงาน อสม. และลูกน้ำยุงลาย
เลย ห้วงประเพณีงานสงกรานต์เดือนเมษายน 64 น่าเที่ยวทั้งเดือน
ในห้วงประเพณีงานสงกรานต์เดือนเมษายน 2564 จังหวัดเลยมีกิจกรรมท่องเที่ยวที่น่าสนใจทั้งเดือน ได้แก่
- วันที่ 1-9 เมย 64 การจัดงานดอกฝ้ายบาน สืบสานวัฒนธรรมไทเลย ประจำปี 2564 ณ บริเวณสนามหน้าศาลากลางจังหวัดเลย ซึ่งเป็นงานประจำปีของจังหวัดเลย
- วันที่ 4 เมย 64 การแข่งขันวิ่ง "ดอกฝ้ายบาน มาราธอน 2021" วิ่งมาราธอนกับเส้นทางใหม่ที่ท้าทายระยะ 42.195 และฮาล์ฟมาราธอน 21.1 กิโลเมตร ,
- วันที่ 5-11 เมย 64 ประเพณีสืบสานวัฒนธรรมลำพวยเกมส์ อำเภอผาขาว ชมการแข่งขันกีฬาชนิดต่าง ๆ
- วันที่ 6 เมย 64 งานตุ้มโฮมปี้น้องไต หรืองานวัฒนธรรมไทดำ ณ ศูนย์วัฒนธรรมไทยดำ บ้านนาป่าหนาด ชมวัฒนธรรมความเป็นอยู่ของชาวไทดำชง
- วันที่ 10 เมย 64 ประเพณีงานสงกรานต์ไทย ลาว บ้านเหมืองแพร่ อำเภอนาแห้ว
- วันที่ 13-15 เมย 64 งานประเพณีสงกรานต์ที่ด่านซ้าย อำเภอด่านซ้าย สรงน้ำพระ ณ วัดโพนชัย ร่วมพิธีกรรม ทำความสะอาดบ้านและเลี้ยงเฮือนเจ้าแม่นางเทียม ,
- วันที่ 13-15 เมย 64 งานประเพณีสงกรานต์ที่เชียงคาน พิธีทำบุญตักบาตร ร่วมขนทรายเข้าวัด และก่อปราสาททราย ที่วัดศรีคุนเมือง รวมถึงเล่นน้ำคลายร้อนที่หาดนางคอย
- วันที่ 13-15 เมย 64 งานประเพณีสงกรานต์ที่ปากชม ประกวดก่อเจดีย์ทราย สรงน้ำพระ เล่นน้ำที่แม่น้ำโขง บ้านหาดเบี้ยอำเภอปากชม
- วันที่ 13-15 เมษายน 2564 งานประเพณีสงกรานต์เมืองเลย สรงน้ำพระพุทธมงคลเมือง ที่หน้าพิพิธภัณฑ์เมืองเลย
- วันที่ 13 เมย 64 พิธีสรงน้ำพระเจ้าองค์แสน พระเจ้าฝนแสนห่า ที่บ้านนาพึง อำเภอนาแห้ว
- วันที่ 13 เมย 64 ประเพณีสงกรานต์ สรงน้ำพระพุทธรูปหลวงพ่อเพชร สรงน้ำพระปู่และพระพุทธรูปอายุร้อยปีหลายองค์ ที่วัดโพธิ์ชัย ตำบลแสงภา อำเภอนาแห้ว
- วันที่ 14, 19 และ 26 เมษายน 2564 งานประเพณีสงกรานต์และแห่ต้นดอกไม้ที่วัดศรีโพธิ์ชัย บ้านแสงภา อำเภอนาแห้ว ร่วมกิจกรรมทำต้นดอกไม้ขนาดใหญ่ที่สำเร็จได้ภายในวันเดียว
- วันที่ 16 เมย 64 งานประเพณีสงกรานต์และแห่ต้นดอกไม้บ้านอาฮี อำเภอท่าลี่
- วันที่ 17-18 เมย 64 งานประเพณีสงกรานต์และสรงน้ำพระพุทธเมตตา ที่อุทยานแห่งชาติภูกระดึง ร่วมสรงน้ำพระพุทธเมตตา บนยอดภูกระดึง
- วันที่ 21 เมย 64 งานประเพณีบุญข้าวพันก้อน อำเภอเชียงคาน ร่วมแห่ข้าวพันก้อน สืบสานวัฒนธรรมโบราณ
- วันที่ 23-26 เมย 64 งานนมัสการพระธาตุศรีสองรัก ร่วมชมพิธีเปิดงาน การรำบวงสรวงบูชาพระธาตุศรีสองรัก พิธีล้างธาตุและคารวะธาตุ พิธีแห่นาคและทำขวัญนาค ทำบุญตักบาตร พิธีบูชาธาตุ พิธีถวายต้นผึ้ง สรงน้ำพระธาตุ พิธีสู่ขวัญธาตุ พิธีเวียนเทียน พิธีจุดบั้งไฟ และพิธีบรรพชาอุปสมบทพระ
- วันที่ 25 เมย 64 นาแห้วเทรล แอนด์ ครอสคันทรี 2021 การแข่งขันวิ่งข้ามทุ่ง (Cross Country Running) แข่งวิ่งไปตามทางวิบากที่กำหนด เป็นเนินเขา ทางลาดเอียง เหมาะกับนักวิ่งขาลุยและรักธรรมชาติ 3 ระยะ คือ 10 กิโลเมตร 3 กิโลเมตร และระยะสาธิต
- วันที่ 27-29 เมย 64 งานบุญประเพณีวัฒนธรรมผีขนน้ำ (แมงหน้างาม) บุญเดือนหก ชมขบวนแห่ผีขนน้ำอันยิ่งใหญ่ตระการตา
ขอนแก่น - มาจาก 17 จว. กักตัวเอง 14 วัน ตั้งแต่ 18 เมย 64 LINK
17 เมย 64 -
ประกาศจังหวัดขอนแก่น เรื่อง มาตรการ การเฝ้าระวัง ป้องกัน และควบคุมโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) จังหวัดขอนแก่น (ฉบับที่ 34)
หากมาจาก 17 จังหวัด - กทม เชียงใหม่ ชลบุรี สมุทรปราการ ประจวบฯ สมุทรสาคร ปทุมธานี นครปฐม ภูเก็ต นครราชสีมา นนทบุรี สงขลา ตาก อุดรฯ สุพรรณฯ สระแก้ว ระยอง - ให้กักตัวเอง 14 วัน + รายงานตัว
ผู้เดินทางเข้า
1. รายงานตัวผ่าน
QR Code หรือแจ้ง อสม/จนท สธ./ผู้นำชุมชน
/////////////
เพจ
รพ.ขอนแก่น
รพ. ขอนแก่น โทร 043 009 900
วันที่ 11 เมษายน 2564 ศบค.รายงานสถานการณ์สถานการณ์การติดเชื้อ COVID-19 ในประเทศ ผ่านเพจเฟซบุ๊ก ศูนย์ข้อมูล COVID-19 เมื่อเวลา 11.00 น. ระบุว่า
- พบผู้ป่วยรายใหม่ 967 ราย
- ผู้ป่วยยืนยันสะสม 32,625 ราย
- หายป่วยแล้ว 28,214 ราย
- เสียชีวิตสะสม 97 ราย
ข้อมูลผู้รับวัคซีน (ณ วันที่ 10 เมษายน 2564)
เข็มที่ 1 จำนวน 15,656 ราย l สะสม 485,957 ราย
เข็มที่ 2 จำนวน 2,360 ราย l สะสม 69,439 ราย
ทั้งนี้ สถานการณ์โรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ทั่วโลก มียอดผู้ติดเชื้อรวม 136,002,033 ราย อาการรุนแรง 102,598 ราย รักษาหายแล้ว 109,362,892 ราย เสียชีวิต 2,939,054 ราย
การรับมือผลข้างเคียงวัคซีนโควิด-19 LINK
โดยหลักการวัคซีนจะทำหน้ที่กระตุ้นภูมิคุ้มกันของร่างกายให้รู้จักกับเชื้อโรคล่วงหน้าก่อนที่จะได้รับเชื้อเพื่อป้องกันไม่ให้ติดเชื้อ เจ็บป่วย หรือเสียชีวิต แต่อาจมีผลข้างเคียงเล็กน้อย เช่น ปวดเมื่อย มีไข้ ซึ่งเป็นเรื่องปกติที่แสดให้เห็นว่าภูมิคุ้มกันกำลังถูกกระตุ้นจากวัคซีน เพื่อป้องกันไม่ให้เราเจ็บป่วยหรือเสียชีวิต
อาการที่อาจเกิดขึ้นกับผู้ที่ได้รับวัคซีนโควิด-19
- มีไข้
- ปวดเมื่อยตามตัว
- ปวด หรือระคายเคืองตำแหน่งที่ฉีด
- หากเกิดผลข้างเคียง ตั้งแต่การฉีดวัคซีนเข็มแรก ในเข็มที่สองก็อาจมีอาการมากขึ้นได้เล็กน้อย
- อาการแพ้วัคซีน อาจกิดได้แต่น้อยมากคือน้อยกว่า 1 ใน 1,000,000 คนที่ฉีด
ประสิทธิภาพของวัคซีนโควิด-19
วัคซีนจะเริ่มได้ผลอย่างน้อยต้อง 2 อาทิตย์หลังจากได้รับเข็มที่หนึ่ง แต่จะได้ผลเพียง 50% และหลังจากฉีดข็มที่สองอย่างน้อย 1 อาทิตย์ จึงจะได้ผลสูงตามผลการวิจัยของแต่ละวัคซีน
ต้องฉีดวัคซีนเข็มที่สอง จึงจะมีประสิทธิภาพเทียบเท่กับผลวิจัยของวัคซีนแต่ละยี่ห้อ
คำแนะนำจากแพทย์
ประชาชนส่วนใหญ่ควรได้รับวัคซีนอย่างทั่วถึง แต่ถึงแม้ว่าจะได้รับวัคซีนก็ไม่ควรประมาทต่อการติดชื้อ และยังต้องรักษามาตรการโดยสวมหน้ากาก ล้างมือ และเว้นระยะห่างทางสังคม เพื่อลด์โอกาสการติดเชื้อของตัวเองในกรณีที่วัคซีนยังออกฤทธิ์ไม่เต็มที่ และป้องกันการติดเชื้อสายพันธุ์ใหม่ในอนาคตด้วย
ข้อมูล ณ วันที่ 4 กุมภาพันธ์ 2564
ที่มา : ศ. นพ.เกียรติ รักษ์รุ่งธรรม
สถานการณ์ COVID-19 จังหวัดระยอง (ชาญนะ เอี่ยมแสง) LINK
สถานการณ์ COVID-19 จังหวัดระยอง
วันที่ 12 เมษายน 2564
1. วันนี้จังหวัดระยอง ยืนยันพบผู้ป่วย จำนวน 31 ราย ผู้ป่วยสะสม จำนวน 642 ราย
2. พื้นที่ที่พบผู้ป่วย ได้แก่
ต.ปลวกแดง ต.ตาสิทธิ์ ต.มาบยางพร ต.แม่น้ำคู้ อ.ปลวกแดง,
ต.เชิงเนิน อ.เมืองฯ,
ต.หนองบัว อ.บ้านค่าย,
ต.บ้านฉาง อ.บ้านฉาง,
ต.ปากน้ำประแส อ.แกลง
3. ตั้งแต่วันที่ 1 เม.ย. 64 ดำเนินการตรวจค้นหาเชิงรุกแล้ว จำนวน 1,788 ราย และกลุ่มเสี่ยงได้รับการกักตัวใน HQ / LQ จำนวน 155 ราย
กักตัววันแรก
พร้อมแค่ไหนอย่าถาม ?
ขออนุญาตไม่โชว์โรงแรม โรงแรมไม่สวย วิวไม่งาม แต่ บริการดี จนทตรึม
กรุ๊ปนี้รวมกันมาจากนอร์เวย์ สวีเดน เดนมาร์ก ฟินแลนด์ ไอซ์แลนด์ และอื่นๆ โดยเที่ยวบินพิเศษของป้าม่วง ซึ่งป้าม่วงเอาอีกแล้ว เครื่องบินว่างครึ่งลำ แต่ทุกคนถูกจับให้นั่งติดกัน โซนเดียว ไม่มีเว้นที่ เว้นแถว ตลอดสิบชั่วโมงของการบิน ไม่มี on board entertainment จ้า นี่ถ้าไม่มีน้องๆ แอร์คอยบริการอาหารและเครื่องดื่ม ไม่มี kindle ไม่มีเพลงในมือถือคงนึกว่ากลับเที่ยวบินพิเศษจริงๆ ?
ตอนคุยกับแม่ แม่ถามว่า เสี่ยงมั้ย เอิ่ม ตอบไงดีอะ ? น่าจะอีกห้าวัน ตรวจรอบแรก ลุ้นกันไป ทุกคนที่นั่งเบียดกันมา บนเครื่องบินว่างๆ จอมืดๆ
15 ธันวาคม 2020
การดูแลผู้ป่วยหนัก
การดูแลผู้ป่วยหนัก ต้องใช้ทรัพยากรจำนวนมาก ทั้งบุคลากร เครื่องมือและเวชภัณฑ์ต่างๆ
*ภาพจากเพจ รพ.นครพิงค์5. เจ้าหน้าที่จะสอบถามเพิ่มเติมและนัดเข้ามาตรวจเพิ่มเติม
ตาก ตั้งแต่ 22 เมย 64 เป็นต้นไป จนกว่าจะมีคำสั่งเปลี่ยนแปลง LINK
มาตรการป้องกัน ควบคุมโรคติดเชื้อไวรัสโคโรนา 2019 จังหวัดตาก(เพิ่มเติม) ตามคำสั่งจังหวัดตากที่ 1287/2564 ลงวันที่ 22 เมษายน 2564
ให้ประชาชนในพื้นที่จังหวัดตากสวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้งตลอดเวลาที่ออกนอกเคหสถาน(บ้านเรือนหรือที่อยู่อาศัย) ทั้งนี้ ตั้งแต่วันที่ 22 เมษายน 2564 เป็นต้นไป จนกว่าจะมีคำสั่งเปลี่ยนแปลง
4.เลือกเครือข่ายหน่วยบริการ
ระบบจะแสดงเครือข่ายบริการที่สามารถเลือกได้
มีจำนวนจำกัด ซึ่งระบบจัดสรรให้สอดคล้องกับพื้นที่ หรือหน่วยบริการที่เปิดรับ
กดเลือกแล้วกดยืนยัน
ข้อควรพิจารณาในผู้ป่วยโรคหัวใจและหลอดเลือด LINK
ข้อควรพิจารณาในการฉีดวัคซีนป้องกันโรคโคโรนาไวรัส 2019 (COVID-19)
ในผู้ป่วยโรคหัวใจและหลอดเลือด
ในกรณีผู้ป่วยเพิ่งมีอาการหรืออาการยังไม่คงที่หรือยังมีอาการที่เป็นอันตรายต่อชีวิต (life-threatening) เช่น ผู้ป่วยที่มีอาการของโรคหลอดเลือดหัวใจตีบชนิดเฉียบพลัน (Acute coronary syndrome) หรือภาวะหัวใจล้มเหลวชนิดเฉียบพลัน (Acute decompensated heart failure) ให้รอจนกว่าอาการดีขึ้นและคงที่จึงจะฉีดวัคซีน
ทั้งนี้ไม่มีข้อกำหนดเวลาที่ขัดเจน ให้แพทย์เป็นผู้พิจารณาเป็นรายๆ ไป โดยอาจให้เมื่อผู้ป่วยมีอาการคงที่พร้อมที่จำหน่ายจากโรงพยาบาลหรือช่วงที่ติดตามการรักษาแบบผู้ป่วยนอก
ในกรณีที่ผู้ป่วยมีความดันโลหิตสูงชนิดรุนแรง SBP> 160 mmHg ควรควบคุมความดันโลหิตให้ดีก่อนฉีดวัคซีน
ในกรณีที่รับประทานยาต้านการแข็งตัวของเลือดวาร์ฟาริน ควรจะต้องมีระดับ INR ที่น้อยกว่า 3
สำหรับผู้ป่วยที่รับประทานยาต้านการแข็งตัวของเลือดกลุ่มใหม่ (NOACs) และยาต้านเกล็ดเลือด เช่น aspirin, clopidogrel, ticagrelor หรือ prasugrel สามารถฉีดวัคซีนได้ ควรใช้เข็ม 23G หรือเล็กกว่าและไม่คลึงกล้ามเนื้อหลังฉีดวัคซีน ควรกดตำแหน่งที่ฉีดหลังการฉีดยานานอย่างน้อย 2 นาที และแน่ใจว่าไม่มีเลือดออกผิดปกติ
แนวทางการให้วัคซีนป้องกันโรคโคโรนาไวรัส 2019 (COVID-19) ในผู้ป่วยโรคหัวใจและหลอดเลือด ขึ้นอยู่กับดุลยพินิจของแพทย์ผู้ดูแลรักษาและสภาพของผู้ป่วยตลอดจนปัจจัยอื่นๆ ร่วมด้วย ดังนั้น แนวทางเวชปฏิบัติฉบับนี้ไม่สามารถใช้เป็นเอกสารอ้างอิงใดๆ ในทางกฏหมาย
ใบรับรองของอิตาลี
อิตาลีเรียกใบรับรองว่า cerficiato verde หรือ green pass ใช้สำหรับแสดงเพื่อเดินทางหรือร่วมงาน กิจกรรมต่างๆ ในอิตาลี เงื่อนไขการออกให้คือได้รับวัคซีนครบโดสแล้ว หรือตรวจแล้วผลเป็นลบ หรือหายจากโรคโควิด
รัฐบาลอิตาลีประกาศว่า ปลายเดือนมิถุนายนจะออกดิจิดัลเวอร์ชั่น และ QR Code ให้ใช้ เพื่อสามารถใช้เดินทางในยุโรปได้
แต่ละแคว้นจะเป็นผู้ออกใบรับรองให้ประชาชนของตน ดังนั้นรูปแบบใบรับรองอาจแตกต่างกันไป
(ในภาพเป็นใบรับรองที่ออกให้ที่ลาซิโอ แคว้นโรม)
TheLocaleอบจ.อุดรธานี ทุ่ม 100 ล. สั่งจองวัคซีน เข็ม 1 เข็ม 2 ชิโนฟาร์ม LINK
9 มิ.ย.2564 อบจ.อุดรธานี รายงานว่า สั่งจองการจัดซื้อวัคซีนซีโนฟาร์ม (Sinopharm COVID-19 Vaccine) ผ่านราชวิทยาลัยจุฬาภรณ์ ภายใต้งบประมาณขององค์การบริหารส่วนจังหวัดอุดรธานี เข็มที่ 1 จำนวนเงิน 50,000,000 บาท (ห้าสิบล้านบาทถ้วน) และเข็มที่ 2 จำนวนเงิน 50,000,000 บาท (ห้าสิบล้านบาทถ้วน) รวมเป็นเงิน 100,000,000 บาท (หนึ่งร้อยล้านบาทถ้วน) เพื่อลดการแพร่ระบาด ลดความรุนแรงของโรค และลดการเสียชีวิตของประชาชนที่อาจจะเกิดขึ้นในอนาคตต่อไป
รัศมีแข ฟ้าเกื้อล้น กล่าวว่า ยังมีคนในกลุ่ม LGBTQ+ อีกมากที่กลัว และไม่กล้าใช้ชีวิตในแบบที่ตัวเองต้องการ ซึ่งทำให้เกิดปัญหากับคุณภาพชีวิตตามมา Pride Clinic จึงเป็นพื้นที่ที่ทำให้บุคคลที่มีความหลากหลายทางเพศ มาแล้วรู้สึกสบายใจ และปลอดภัยเพราะเป็นพื้นที่ที่สะท้อนถึงความเท่าเทียมอย่างแท้จริง สำหรับคนที่ไม่ใช่กลุ่มบุคคลที่มีความหลากหลายทางเพศ อย่างในกลุ่มพ่อแม่ผู้ปกครองก็สามารถมาใช้บริการที่นี่เพื่อขอคำปรึกษาจากแพทย์ผู้เชี่ยวชาญ เรียนรู้ และทำความเข้าใจในการอยู่ร่วมกับบุตรหลานที่เป็น LGBTQ+ ได้อย่างมีความสุข
อบจ.อ่างทอง เปิดลงทะเบียน 14-15 กค นี้ LINK
14-15 กรกฎาคม 2564 เปิดรับลงทะเบียนจองวัคซีนทางเลือก ชิโนฟาร์ม ระบบออนไลน์
ตั้งแต่ 8.30 น. เป็นต้นไป
ลงทะเบียนได้ที่
สอบถามโทร 035-611484-5 ต่อ 704
*** ลงทะเบียนเฉพาะกลุ่มเป้าหมาย คือ ประชาชนทั่วไป ***
สิ่งที่ต้องเตรียมตัวหลังเข้าหน้าการรับลงทะเบียนแล้ว
- ข้อมูลส่วนตัว (บัตรประชาชน)
- เบอร์โทรศัพท์ที่ติดต่อได้
- ข้อมูลสุขภาพตามความเป็นจริง
รายละเอียดกลุ่มเป้าหมายตามแผนการจัดสรรวัคซีน อบจ อ่างทอง ระยะ 1
1. อาชีพบริการ เช่น ส่งอาหาร ตลาดสด ตลาดนัด ขนส่งสาธารณ และ ประชาชนทั่วไป
2. บุคคลากรทางการศึกษา ครู อาจารย์
3. ผู้ด้อยโอกาส พิการ ยากจน
4. อาสากู้ชีพ กู้ภัย
5. บุคคลากร อปท.กำนัน ผู้ใหญ่บ้าน
6 ฟ้าทะลายโจรกับผู้ที่ได้รับผลข้างเคียง (ยังไม่ป่วย)
6 สำหรับผู้ได้รับผลข้างเคียงจากฟ้าทะลายโจร
หากเป็นกรณีที่ยังไม่ป่วย แต่ต้องการบำบัดรวมหมู่หรือรับประทานเพียงเพื่อลดความเสี่ยง (ยังไม่ได้
ป่วย) อาจต้องกินพร้อมกับอาหารฤทธิ์ร้อนประกบตลอดทั้งวันรวมทั้งการดื่มน้ำขิง พริกไทย กระชาย
และอาหารเผ็ดร้อนอื่นๆ หากปวดศีรษะให้สังเกตตควบคู่ดูว่าเกิดอาการท้องผูกมากขึ้นหรือไม่ และถ้าท้องผูกมากขึ้นให้กินยาระบาย
เลขหมายประจำเขต กรุงธนฯ ใต้
เลขหมายประจำเขต เขตกรุงธนฯ ใต้
ชุดตรวจรวดเร็ว Antigen Test Kit (ATK) - อยุธยา ชวนรู้ สู้ภัย Covid-19
เขตบึงกุ่ม ออกหน่วยเคลื่อนที่ฯ 7 - 17 กันยายน 2564 LINK
สำนักงานเขตบึงกุ่ม โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 56 ทับเจริญ จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในพื้นที่แขวงนวลจันทร์และแขวงนวมินทร์ ท่านใดสนใจสามารถนำสัตว์เลี้ยง น้องหมาและน้องแมวที่มีสุขภาพแข็งแรง อายุ 3 เดือนขึ้นไป ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯเคลื่อนที่ใกล้บ้านท่าน บริการฟรี!!! โดยเริ่มออกหน่วยเคลื่อนที่ฯ ตั้งแต่วันที่ 7 - 17 กันยายน 2564
หรือสอบถามรายละเอียดเพิ่มเติมที่จุดบริการในแต่ละวัน ได้ที่สำนักงานเขตบึงกุ่ม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร.0 2364 7385
โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย LINK
ติดเชื้อโควิด-19 สามารถฉีดวัคซีนได้หรือไม่?
หากอยู่ในระยะกักตัว ไม่แนะนำให้ไปรับวัคซีน ควรรอจนพ้นระยะก่อนแต่อย่างไรก็ตามหากได้รับวัคซีนในขณะที่ติดเชื้อแบบไม่มีอาการโดยไม่รู้ตัว ไม่มีผลอันตรายใดๆ
ผู้ที่เคยติดเชื้อโควิด-19 จะมีภูมิต้านทานในร่างกายระยะหนึ่งก่อนจะค่อย ๆ ลดลง จึงมีโอกาสติดเชื้อซ้ำได้ แต่อาการจะไม่รุนแรงเท่าผู้ติดเชื้อรายใหม่
ภายใน 3 -6 เดือนหลังหายจากโรคโควิด-19 แนะนำให้ฉีดวัคซีน 1 เข็ม เพื่อกระตุ้นระดับภูมิต้านทานให้สูงขึ้น โดยพบว่าจะมีระดับภูมิต้านทานสูงกว่าผู้ที่ไม่เคยติดเชื้อมาก่อน
ที่มา
ศ. พญ.กุลกัญญา โชคไพบูลย์กิจ
คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล
รศ. พญ.ธันยวีร์ ภูธนกิจ
โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย และคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
ผศ. นพ.กำธร มาลาธรรม
คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล
ข้อมูล ณ วันที่ 9 กรกฎาคม 2564
ขั้นตอนที่ 6 ปิดแผ่นทดสอบช รอผล 15 นาที
ขั้นตอนที่ 6 ปิดแผ่นทดสอบและกดบริเวณแถบกาวให้ยึดติดกันอย่างระมัดระวัง รอ 15 นาที ผลทดสอบจะปรากฏในช่องแสดงผล ที่หน้าปก กรุณาอย่าเคลื่อนย้ายแผ่นทดสอบ หากทิ้งไว้นานเกิน 20 นาทีจะไม่สามารถอ่านผลได้
ทำความสะอาดและฆ่าเชื้อพื้นผิวที่สัมผัสบ่อยๆ เพื่อไม่ให้เป็นแหล่งสะสมเชื้อโรค
เขตสุขภาพที่ 4 สระบุรี ลพบุรี อยุธยา อ่างทอง สิงห์บุรี นนทบุรี ปทุมธานี นครนายก
สำนักงานป้องกันควบคุมโรคที่ 4 จังหวัดสระบุรี
-เบอร์โทรศัพท์: 036 239 302
-เว็บไซต์: https://ddc.moph.go.th/odpc4/ (ยังไม่เปิดให้บริการ)
พระนครศรีอยุธยา
- สำนักงานสาธารณสุขจังหวัดพระนครศรีอยุธยา
เบอร์โทรศัพท์: 035 241 520
เว็บไซต์: http://www.ayph.in.th/
ลพบุรี
-สำนักงานสาธารณสุขจังหวัดลพบุรี
เบอร์โทรศัพท์: 036 426 844
เว็บไซต์: http://wwwlbo.moph.go.th/newweb/
สระบุรี
- สำนักงานสาธารณสุขจังหวัดสระบุรี
เบอร์โทรศัพท์: 036 223 118
เว็บไซต์: http://www.sro.moph.go.th/ewtadmin/ewt/ saraburi_web/main.php?filename=index
สิงห์บุรี
- สำนักงานสาธารณสุขจังหวัดสิงห์บุรี
เบอร์โทรศัพท์: 036 813 493
เว็บไซต์: http://www.sbo.moph.go.th/sbo/
อ่างทอง
- สำนักงานสาธารณสุขจังหวัดอ่างทอง
เบอร์โทรศัพท์: 035 611 222
เว็บไซต์: https://www.ato.moph.go.th/
นนทบุรี
- สำนักงานสาธารณสุขจังหวัดนนทบุรี
เบอร์โทรศัพท์: 02 950 3071
เว็บไซต์: https://ssjnonthaburi.moph.go.th/nont/
ปทุมธานี
- สำนักงานสาธารณสุขจังหวัดปทุมธานี
เบอร์โทรศัพท์: 02 581 6454
เว็บไซต์: https://ptepho.moph.go.th/ptepho/
นครนายก
- สำนักงานสาธารณสุขจังหวัดนครนายก
เบอร์โทรศัพท์: 037 386 388
เว็บไซต์: http://nayok.moph.go.th/web/ THAI Smile Airways
การแสดงผลรับรองการฉีดวัคซีน สามารถใช้ได้ทั้ง 2 แบบ
• แสดงผ่าน Digital Health Pass ผ่าน Application หมอพร้อม
• ใช้เอกสารใบรับรองผลการฉีดวัคซีนหรือใบรับรองแพทย์
การแสดงเอกสารผลการตรวจหาเชื้อโควิด-19
ต้องเป็นเอกสารที่ระบุข้อมูลการตรวจชัดเจน ทั้งหน่วยงานที่ออกให้ วิธีการตรวจและมีผลตรวจเป็นลบ ไม่เกิน 72 ชั่วโมง ก่อนการเดินทาง
หมายเหตุ
เด็กที่มีอายุต่ำกว่า 6 ปี เดินทางกับผู้ใหญ่ ไม่ต้อง swap ตรวจหาเชื้อโควิด-19
ทั้งนี้ การแสดงเอกสารในการเดินทาง (เอกสารแสดงผลรับรองการฉีดวัคซีนและเอกสารการตรวจหาเชื้อโควิด-19) ขึ้นอยู่กับมาตรการการเข้า-ออก ของแต่ละจังหวัดปลายทาง
สามารถตรวจสอบข้อมูลก่อนการเดินทางและมาตรการควบคุมการแพร่ระบาดในสถานการณ์โควิด-19 ของแต่ละจังหวัดก่อนการเดินทางได้ที่ https://bit.ly/2R0IJuB และกด “ชื่อจังหวัด”
โรงแรมเวิร์ฟ และ โรงแรมอัล มิรอซ เปิดบริการ Hospitel ร่วมกับโรงพยาบาลพีเอ็มจี
สำหรับประชาชนในฝั่งกรุงธนบุรี มีทางเลือก โดย โรงพยาบาลพีเอ็มจี เปิดบริการ Hospitel ร่วมกับโรงแรมเวิร์ฟ และ อัล มิรอซ โดยผู้ที่มีผลตรวจ ATK เป็นบวก สามารถเข้ารับการตรวจ RT-PCR กับทางโรงพยาบาลพีเอ็มจี ได้ ฟรี !! และพร้อมเข้ารักษาได้ทันที หากผลการตรวจยืนยันว่าติดเชื้อ
โรงแรมอัล มิรอซ มีบริการฮาลาลรองรับ
สอบถามเพิ่มเติม โรงพยาบาลพีเอ็มจี โทร. 02-4514920-4
7. ประสานหน่วยงานที่เกี่ยวข้อง ช่วยอำนวยความสะดวกการจราจร
ประสานหน่วยงานที่เกี่ยวข้อง เช่น ตำรวจ ช่วยอำนวยความสะดวกการจราจร การปิดเส้นทางน้ำท่วม และทหาร ช่วยเหลือลำเลียงประชาชนออกจากพื้นที่ หากมีระดับน้ำท่วมสูงรถเล็กไม่สามารถใช้เส้นทางผ่านได้
เขตดินแดง สำรวจจุดเสี่ยง และ จุดเฝ้าระวัง LINK
เขตดินแดง โดยฝ่ายโยธา ฝ่ายเทศกิจ และฝ่ายรักษาความสะอาดฯ ลงพื้นที่ตรวจสอบสถานการณ์น้ำในพื้นที่ สำรวจจุดเสี่ยง บริเวณ 1. ถนนประชาสุข ไม่มีน้ำท่วมขัง 2. ถนนประชาสงเคราะห์ (หอนาฬิกา แฟลต 28) ไม่มีน้ำท่วมขัง และ จุดเฝ้าระวัง 2 จุด ได้แก่ 1. ซอยประชาสงเคราะห์ 27 ไม่มีน้ำท่วมขัง 2. บริเวณปากซอยสุทธิพร 2 ไม่มีน้ำท่วมขัง
สรุปสภาพพื้นที่ ฝนตกปานกลาง และได้จัดเจ้าหน้าที่อำนวยการจราจร จัดเก็บขยะหน้าตะแกรง และเจ้าหน้าที่ระบายน้ำประจําจุดพร้อมปฏิบัติงานและเฝ้าระวัง ไม่พบต้นไม้หักหรือล้มแต่อย่างใด
ฉะเชิงเทรา kick off วัคซีน เด็กปลอดภัย ณ โรงเรียนดาราจรัส อำเภอบางคล้า LINK
วันที่ 4 ตุลาคม 2564 เวลา 07.45 น. ณ โรงเรียนดาราจรัส อำเภอบางคล้า จังหวัดฉะเชิงเทรา นายไมตรี ไตรติลานันท์ ผู้ว่าราชการจังหวัดฉะเชิงเทรา เป็นประธานพิธีเปิดกิจกรรม “kick off สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม เขตสุขภาพที่ 6” พร้อมด้วย นายแพทย์ณรงค์ อภิกุลวณิช ผู้ตรวจราชการกระทรวงสาธารณสุข เขตสุขภาพที่ 6 ผู้บริหารศูนย์อนามัยที่ 6 ผู้บริหารศูนย์สุขภาพจิตที่ 6 และผู้บริหาร สำนักงานสาธารณสุขจังหวัดฉะเชิงเทรา โดยมี นายแพทย์มณเฑียร คณาสวัสดิ์ นายแพทย์สาธารณสุขจังหวัดฉะเชิงเทรา กล่าวรายงานด้านสาธารณสุข นายตั้ง อสิพงษ์ ศึกษาธิการจังหวัดฉะเชิงเทรา กล่าวรายงาน
ด้านสถานศึกษา โดยกระทรวงสาธารณสุข ร่วมกับกระทรวงศึกษาธิการ จัดกิจกรรมฯ ดังกล่าว ปัจจุบันยังคงมีการระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 หรือ COVID-19 ถึงแม้ว่าจะใช้มาตรการป้องกัน ควบคุมโรคหลายมาตรการ เช่น สวมหน้ากากอนามัย การเว้นระยะห่าง ล้างมือ คัดกรอง เฝ้าระวังโรค งดกิจกรรมการรวมกลุ่ม และการฉีดวัคซีน เพื่อลดความรุนแรง และการเสียชีวิตจากการป่วยด้วยโรคโควิด-19 โดยมีแนวทางการให้บริการวัคซีนไฟเซอร์ สำหรับนักเรียน นักศึกษา ที่มีอายุ 12 ปีขึ้นไป โดยดำเนินการพร้อมกันทั่วประเทศตั้งแต่วันที่ 4 ตุลาคม 2564 เป็นต้นไป เขตสุขภาพที่ 6 จึงดำเนินการkick off สร้างเกราะป้องกันด้วยวัคซีนดังกล่าวฯ เพื่อเป็นการเตรียมความพร้อมเปิดภาคเรียนที่ 2 ปีการศึกษา 2564 ให้นักเรียนได้กลับมาเรียนในโรงเรียนตามปกติ โดยมีกิจกรรมรณรงค์ฉีดวัคซีนให้กับนักเรียนที่มีอายุ 12 ปีขึ้นไป
ทั้งนี้ โรงเรียนดาราจรัส อำเภอบางคล้า จังหวัดฉะเชิงเทรา เป็นหน่วยบริการฉีดวัคซีน 1 โรงเรียน 1 จุดฉีด เป็นที่แรกและที่เดียวของเขตสุขภาพที่ 6 ที่จัดกิจกรรม kick off ในวันนี้ โดยมีนักเรียน เข้ารับการฉีดวัคซีน จำนวน 170 คน ซึ่งได้รับความร่วมมือและสนับสนุนจากเครือข่ายบริการสุขภาพอำเภอบางคล้า และทุกภาคส่วน อย่างเข้มแข็ง มีการวางแผนการบริการฉีดวัคซีนไฟเซอร์สำหรับนักเรียน นักศึกษาทุกอำเภอในเขตจังหวัดฉะเชิงเทรา โดย ประธานและคณะผู้บริหาร ได้เยี่ยมให้กำลังใจและสนับสนุนการดำเนินงานฉีดวัคซีนดังกล่าวฯ โดยมี นายอำเภอบางคล้า นายกเทศมนตรีตำบลบางคล้า ผู้อำนวยการโรงพยาบาลบางคล้า ผู้อำนวยการสำนักงานเขตพื้นที่การศึกษามัธยมศึกษาฉะเชิงเทรา รองผู้อำนวยการสำนักงานเขตพื้นที่การศึกษาประถมศึกษาฉะเชิงเทรา เขต 1 และเขต 2 หัวหน้ากลุ่มงาน คณะเจ้าหน้าที่สาธารณสุขจังหวัดฉะเชิงเทรา หัวหน้าส่วนราชการ และเจ้าหน้าที่ผู้เกี่ยวข้อง เข้าร่วมกิจกรรมฯ ดังกล่าว
เรื่อง/ภาพ สสจ.ฉะเชิงเทรา
ตัวอย่างการตรวจสอบด้วย App Line
เปิดไลน์เพื่อใช้สแกน QR Code
อุดรธานี ลอยกระทง ปลอดภัย Safety Zone Vaccinated Only
ลอยกระทง ปลอดภัย ??
Safety Zone Vaccinated Only
ตามมาตรการเฝ้าระวัง ป้องกัน และควบคุมการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรน่า 2019 (COVID-19) ที่มีการแพร่ระบาดอย่างรวดเร็ว และกว้างขวางในหลายพื้นที่ของจังหวัดอุดรธานี
เพื่อเป็นการควบคุมการแพร่ระบาดของโรคโควิด COVID-19 ในช่วงเทศกาลลอยกระทง จึงขอความร่วมมือพี่น้องประชาชน
❌ งดจำหน่ายสินค้าทุกชนิด บริเวณคันคูรอบสวนสาธารณะหนองประจักษ์ศิลปาคม สวนสาธารณะหนองสิม และสวนสาธารณะหนองบัว ในวันที่ 19 พฤศจิกายน 2564 ตั้งแต่เวลา 16.00-22.00 น.
❌ งดนำเครื่องดื่มที่มีแอลกอฮอล์ทุกชนิด เข้ามาในบริเวณสวนสาธารณะหนองประจักษ์ศิลปาคม สวนสาธารณะหนองสิม และสวนสาธารณะหนองบัว
☎️ ติดต่อสอบถามรายละเอียดเพิ่มเติมได้ ที่ เทศบาลนครอุดรธานี หรือโทร. 042-325-176 ถึง 85 ต่อ 7115 ในวัน และเวลาราชการ
ศูนย์โลหิตในต่างจังหวัด ศูนย์ 8-12 (ภาคเหนือ-ใต้)
ภาคบริการโลหิตในจังหวัดภาคเหนือและภาคใต้
รพ.ปทุมธานี Walk in เข้ารับวัคซีนโควิด ในสูตรไขว้ คือ sinovac เข็มที่ 1 + Astra zeneca เข็มที่ 2 วันที่ 22 และ 23 พย 64 LINK
โรงพยาบาลปทุมธานี ขอเชิญคนไทยทุกท่านที่อายุมากกว่า 18 ปี และไม่เคยได้รับวัคซีนป้องกันโควิด 19 Walk in เข้ารับวัคซีนป้องกันโควิด 19 ในสูตรไขว้ คือ sinovac เข็มที่ 1 และต่อด้วย Astra zeneca เข็มที่ 2 (ที่ระยะห่าง 3 สัปดาห์) สามารถเข้ารับบริการได้ในวันที่ 22 และ 23 พฤศจิกายน 2564 เวลา 13.00-15.00 น. โดยไม่ต้องลงทะเบียนล่วงหน้า วันละ 200 คน ณ ลานไทร รพ.ปทุมธานี *** โปรดแสดงบัตรประจำตัวประชาชน ขณะเข้ารับบริการ
วัคซีนเข็มกระตุ้น (Booster dose)
ตรวจสอบรายชื่อสำหรับผู้ได้สิทธิ์ฉีดวัคซีนเข็มกระตุ้น (Booster dose) สำหรับผู้ที่เคยได้วัคซีนสูตร sinovac ครบ 2 เข็ม ภายในวันที่ 1-29 กรกฎาคม 2564 จากโรงพยาบาลปทุมธานีเท่านั้น
สแกน QR code เพื่อตรวจสอบวันนัดหมายของท่าน ที่ท้ายรายชื่อ (รายชื่อเรียงตามตัวอักษร) และเข้ารับบริการ 13.00-15.00 น. ณ ลานไทร รพ.ปทุมธานี (24 และ 25 พฤศจิกายน 2564 ตามวันนัดหมายที่ได้รับ)
**ท่านที่สมัครใจรับวัคซีนเข็มกระตุ้น โปรดมารับวัคซีนให้ตรงตามวันและเวลานัดหมาย
***วัคซีนเป็น Astra zeneca
วันที่ 28 พฤศจิกายน 2564 นักวิทยาศาสตร์แอฟริกาได้ "อัปโหลด" รหัสพันธุกรรมทั้งจีโนม (whole genome sequence) ของไวรัสโคโรนา 2019 จำนวนกว่า 125 ตัวอย่างขึ้นบนฐานข้อมูลโควิดโลก "
GISAID" เป็นที่เรียบร้อย
อบจ.กาฬสินธุ์ ให้บริการฉีดวัคซีน Moderna เข็มแรก 29 พ.ย. 64 LINK
อบจ.กาฬสินธุ์ เปิดให้บริการฉีดวัคซีนเข็มแรก Moderna ให้กับประชาชน (29 พ.ย. 64) เวลา 08.30 น. ณ บริเวณหอประชุมเฉลิมพระเกียรติ80พรรษา มหาราชา นายชานุวัฒน์ วรามิตร นายกองค์การบริหารส่วนจังหวัดกาฬสินธุ์ พร้อมคณะผู้บริหาร สมาชิกสภาองค์การบริหารส่วนจังหวัดกาฬสินธุ์ ร่วมพิธีเปิดโครงการฉีดวัคซีนโมเดอร์นา ขององค์การบริหารส่วนจังหวัดกาฬสินธุ์ โดยมีนายศุภศิษย์ กอเจริญยศ รองผู้ว่าราชการจังหวัดกาฬสินธุ์ เป็นประธาน พร้อมนายสุวิทย์ คำดี ที่ปรึกษาสำนักงานบริหารกิจการเหล่ากาชาดสภากาชาดไทย ตลอดจนเหล่ากาชาดจังหวัดกาฬสินธุ์ หัวหน้าส่วนราชการ องค์การบริหารส่วนจังหวัดกาฬสินธุ์ ร่วมเป็นเกียรติในพิธีดังกล่าว
ยูเซน โบลท์
24 สิงหาคม ลมกรด 8 เหรียญทองโอลิมปิคก็ไม่พ้นโควิดเช่นกัน หลังจากตรวจพบผลบวก แต่ไม่มีอาการใดๆ และเข้ากักตัวในจาเมกาบ้านเกิด เขาสารภาพว่าน่าจะติดจากในงานปาร์ตี้วันเกิดหนึ่งสัปดาห์ก่อนหน้านั้น
เบอร์โทรติดต่อขอเข้ารับการรักษาสำหรับผู้ป่วยโรคโควิด-19 จากต่างจังหวัด
รพ.นาด้วง 08-3941-0306
รพ.เชียงคาน
06-2524-7309
รพ.ปากชม
09-3146-9353
รพร.ด่านซ้าย
089-715-9017
รพ.นาแห้ว
042-897-349
08-6795-6516
รพ.ภูเรือ
08-1680-9028
09-3321-4570
รพ.ท่าลี่
08-6458-9197
รพ.วังสะพุง
08-1061-1566
08-1873-7789
รพ.ภูกระดึง
042-871016 ต่อ 502
08-6455-6721
รพ.ภูหลวง
09-8102-7542
รพ.ผาขาว
08-4428-8997
08-2293-6620
รพ.เอราวัณ
08-9575-7067
รพ.หนองหิน
08-1865-9213
พลังใจชาวโคราช ร่วมบริจาคต้านวิกฤตโควิด LINK
เลขบัญชี หรือสแกนคิวอาร์โค๊ดในภาพ
บัญชี "เงินบริจาคของโรงพยาบาลมหาราชนครราชสีมา"
ติดต่อขอรับใบเสร็จเพื่อลดหย่อนภาษีได้ที่เบอร์ 044-232077
หรือติดต่อสอบถาม เกี่ยวกับการบริจาคที่ 085-4795045
วิริยะประกันภัย บริการตรวจสภาพเบื้องต้นฟรี 20 รายการ ณ ศูนย์ซ่อมวิริยะฯ 32 แห่ง LINK
วิริยะประกันภัย พร้อมให้บริการตรวจสภาพรถยนต์เบื้องต้นฟรี 20 รายการ ณ ศูนย์ซ่อมมาตรฐานวิริยะประกันภัย 32 แห่ง ในพื้นที่กรุงเทพฯ และปริมณฑล วันนี้ ถึง 30 ธ.ค. 64
ลูกค้าวิริยะประกันภัยและประชาชนทั่วไป สามารถนำรถยนต์เข้ามารับบริการตรวจเช็คสภาพเบื้องต้นโดยไม่มีค่าใช้จ่ายใดๆ จำนวน 20 รายการ อาทิ ตรวจระดับน้ำมันเครื่อง ตรวจสภาพยาง ตรวจสภาพการทำงานของไฟส่องสว่างและไฟสัญญาณ ตรวจสอบระดับน้ำกลั่นในแบตเตอรี่ ขั้วแบตเตอรี่ ตรวจสอบเบรก คลัตซ์ ตรวจสภาพการทำงานของเครื่องยนต์ ณ ศูนย์ซ่อมมาตรฐานวิริยะประกันภัยที่ติดป้ายประชาสัมพันธ์กิจกรรม “ตรวจรถฟรี ขับขี่ปลอดภัย เทศกาลปีใหม่ 2565” พร้อมรับของที่ระลึกฟรี! ถุงผ้า “CARE INSURANCE” เมื่อลงทะเบียนตอบแบบสอบถาม โดยสามารถเข้ารับบริการได้ตั้งแต่บัดนี้ ไปจนถึงวันที่ 30 ธันวาคม 2564
สำหรับศูนย์ซ่อมมาตรฐานวิริยะประกันภัยที่เข้าร่วมโครงการให้บริการตรวจรถฟรี จำนวน 32 แห่ง ได้แก่ 1) อู่ร่วมมิตรการาจ 2) บริษัท นิวเพื่อนยนต์ จำกัด 3) บริษัท ไทยรัตน์ยานยนต์ จำกัด 4) หจก. งามวงศ์วาน คาร์แคร์ 5) บริษัท อู่นำชัย รัตนาธิเบศร์ จำกัด 6) บริษัท เจริญกิจ ออโต้ เซอร์วิส จำกัด 7) บริษัท เจริญกิจ ราชพฤกษ์ จำกัด 8) บริษัท เซอร์กิต ติวานนท์ จำกัด 9) บริษัท คุงการาจ จำกัด 10) บริษัท อู่นำชัย เตาปูน จำกัด 11) บริษัท เซอร์กิตบริการ จำกัด 12) บริษัท อู่กังวานชัยการช่าง จำกัด 13) บริษัท อู่วิชัยยนต์ จำกัด 14) บริษัท ทรัพย์สิทธิ คาร์ อินเตอร์ จำกัด 15) บริษัท เทวินทร์ คาร์เซ็นเตอร์ จำกัด 16) บริษัท อู่บอส 888 การาจ จำกัด 17) บริษัท ธนพัฒน์ ออโต้ เซ็นเตอร์ จำกัด 18) บริษัท เพอร์เฟคท์ สปีด ไลน์ จำกัด 19) บริษัท โสฬส ธนบดี จำกัด 20) หจก. เจดีย์ออโต้เซอร์วิส 21) หจก.เป้งการาจ 22) บริษัท เจ.เอส.อินเตอร์กรุ๊ป จำกัด 23) บริษัท อู่ เอส.เอส. อินเตอร์กรุ๊ป จำกัด 24) บริษัท รุ่งเจริญ บอดี้ คลีนิค จำกัด 25) บริษัท สุขุมวิท เอ.ที. เซอร์วิส 26) หจก.สุทินคาร์เซอร์วิส 27) บริษัท เฮงบอดี้คาร์ เซอร์วิส จำกัด 28) บริษัท วงษ์ศิริเลิศ คาร์ เซอร์วิส (1997) จำกัด 29) บริษัท เจริญภัณฑ์ยนตรกิจ เซอร์วิส จำกัด 30) บริษัท นที อินเตอร์เซอร์วิส จำกัด สาขา 1 31) บริษัท อู่แม่กลอง จำกัด 32) บริษัท อ.พิพัฒน์ยนต์ (1989) จำกัด
ถ้าไม่อยากเจอเรา ต้องฉีดวัคซีน
1 ธันวาคม ประกาศจังหวัดน่าน เรื่อง พื้นที่สถานการณ์ตามมาตรการป้องกันการแพร่ระบาด
ประกาศจังหวัดน่าน เรื่อง พื้นที่สถานการณ์ตามมาตรการป้องกันการแพร่ระบาด ของโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรคโควิด-19 (ฉบับที่ 2) ประกาศใช้ตั้งแต่วันที่ 1 ธันวาคม 2564 เป็นต้นไป จนกว่าจะมีคำสั่งเปลี่ยนแปลง
โควิดสายพันธุ์ล่าสุด โอไมครอน Omicron
อาการ รู้สึกเพลีย ปวดเมื่อยตัว ปวดกล้ามเนื้อ ส่วนใหญ่ 2-3 วัน อาการจะดีขึ้น ไม่ไอ ไม่มีผลกระทบเรื่องได้กลิ่นรับรส
วิธีป้องกัน สวมหน้ากากเวลาพูดคุย หมั่นล้างมือ เลี่ยงการอยู่ในพื้นที่แออัด
รับคนลำพูนกลับบ้าน
ห้ามเดินทางเองโดยพลการ
ติดต่อศูนย์ประสานงานรับคนกลับบ้าน
062-0197187
วัคซีนไข้หวัดใหญ่ฟรี
กลุ่มเป้าหมายที่จะได้รับวัคซีนไข้หวัดใหญ่ตามฤดูกาลฟรี 7 กลุ่มที่มีภาวะเสี่ยง ดังนี้
1.หญิงตั้งครรภ์ที่อายุครรภ์ 4 เดือนขึ้นไป
2.เด็กอายุ 6 เดือน ถึง 2 ปี
3.ผู้ป่วยทุกกลุ่มอายุที่เป็นโรคเรื้อรัง 7 กลุ่ม (เบาหวาน ไตวาย หอบหืด ปอดอุดกั้นเรื้อรัง หัวใจ หลอดเลือดสมอง และมะเร็งที่ได้รับการรักษาด้วยเคมีบำบัด)
4.ผู้ที่อายุ 65 ปีขึ้นไป
5.ผู้พิการทางสมองช่วยเหลือตัวเองไม่ได้
6.ผู้ป่วยโรคธาลัสซีเมีย ผู้ที่มีภูมิคุ้มกันบกพร่อง รวมถึงผู้ติดเชื้อเอชไอวีที่มีอาการ
7.ผู้ที่มีน้ำหนักตั้งแต่ 100 กิโลกรัม หรือดัชนีมวลกายตั้งแต่ 35 กิโลกรัมต่อตารางเมตร
* ช่วงรณรงค์ฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ ประชาชนกลุ่มเสี่ยงทุกสิทธิการรักษา สามารถขอรับบริการวัคซีนได้ที่หน่วยบริการประจำและเครือข่ายที่ท่านลงทะเบียน (โรงพยาบาล สถานบริการสาธารณสุขของรัฐ และสถานพยาบาลเอกชนที่เข้าร่วมโครงการหลักประกันสุขภาพแห่งชาติ)
Zone : 5 กินอย่างไร ได้อย่างนั้น
โซนเทคโนโลยี Object Recognition โดยโซนนี้จะมีเมนูอาหารยอดฮิตติดปากคนไทยในรูปแบบโมเดลจำลอง เช่นเมนูข้าวเหนียวหมูปิ้ง ปาท่องโก๋ กาแฟเย็น นมเปรี้ยว และอีกหลากหลายเมนู โดยให้คุณวางลงไปตรงที่สำหรับจัดวาง
จากนั้นระบบจะทำการประมวลผลและขึ้นแสดง Infographic เล่าข้อมูลต่างๆ ทั้งประโยชน์และโทษของอาหารจำลองที่คุณได้เลือกครับ
น้องๆ ทีมงานกรมแพทย์แผนไทยฯ ที่ให้ข้อมูลสินค้าอย่างดี
ตัวแทนแบรนด์ที่กำลังจะมี ผลิตภัณฑ์ออกสู่ตลาด ปี 2565
ผลิตภัณฑ์อาหาร กัญชา กัญชง กระท่อม
ไก่ย่างอบสมุนไพร ซีลสูญญากาศ พร้อมปรุงและทานได้ทันที
ไอเดียทำกาแฟกัญชาแบบแคปซูล น่าสนใจ
เหลืองอร่ามแห่งทองอุไร อ.ปากช่อง โคราช
เส้นทางเหลืองอร่ามด้วยพุ่มทองอุไร ปลูกเนื่องในโอกาส วันเฉลิมพระชนมพรรษา 67 พรรษา 28 กรกฎาคม 2562 เส้นทางถนนสายโยราธิการนครราชสีมา อ.ปากช่อง จ.นครราชสีมา
เทียบความรุนแรงเชื้อโควิด-19 โอไมครอน และ เดลต้า LINK
เทียบความรุนแรงเชื้อโควิด-19 "โอไมครอน" และ "เดลต้า" แตกต่างกันอย่างไร?
ความรุนแรงของเชื้อไวรัสโควิด-19 สายพันธุ์ใหม่อย่าง "โอไมครอน" ที่กำลังเป็นที่จับตามองทั่วโลก และสายพันธุ์ "เดลต้า"ที่เป็นสายพันธุ์หลักที่แพร่ระบาดในไทย เห็นได้ชัดว่าอาการของโอไมครอนจะไม่แตกต่างจากสายพันธุ์อื่นๆมากนัก แต่ความเร็วในการแพร่ระบาด ค่อนข้างเร็วกว่าสายพันธุ์อื่นๆ และมีโอกาสติดเชื้อซ้ำสูง
สิ่งที่เราควรปฏิบัติ คือ รับวัคซีนให้ครบโดส แม้วัคซีนทุกชนิด จะไม่สามรถป้องกันการดิดเชื้อได้ 100% แต่ก็สามารถป้องกันการเสียชีวิตและการป่วยหนักได้กว่า 90%
นอกจากนี้ยังคงต้องสวมใส่หน้ากากอนามัย หมั่นล้างมือ เว้นระยะห่าง เพื่อป้องกันโอกาสการติดเชื้อโควิด-19
ข้อมูลจาก : ศูนย์บริหารสถานการณ์แพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (ศบค.)
ศูนย์โควิด-19 ระดับอำเภอ จังหวัดนนทบุรี
ศูนย์ฯอำเภอเมืองนนทบุรี
เทศบาลนครนนทบุรี (ศูนย์วายุภักษ์) (167 เตียง) 064-350-7992
วัดบัวขวัญ 061-010-2116
ศูนย์ฯอำเภอบางบัวทอง
อาคารโรงยิมเพื่อสันทนาการฯ เทศบาลเมืองใหม่บางบัวทอง
091-043-8284,097-002-8035
ศูนย์ฯอำเภอบางใหญ่
ศูนย์พัฒนาชีวิตใหม่ ต.บ้านบางม่วง 02-403-1220, 02-403-1212
ศูนย์ฯอำเภอบางกรวย
เทศบาลเมืองบางกรวย 090-969-9360
ศูนย์ฯอำเภอปากเกร็ด
อาคารภายใน อบต.ท่าอิฐ 080-952-9100
อบต.คลองช่อย (อาคารเก่า) 081-844-7655
ศูนย์ฯอำเภอไทรน้อย
อาคารอเนกประสงค์ อบต. ไทรใหญ่ 064-731-1887, 064-738-7765
สปส. กรุงเทพมหานครพื้นที่ 5 LINK
เลขที่ 309, 311 ซอยรัชดา 6 ถนนรัชดาภิเษก-ท่าพระ แขวงบุคคโล เขตธนบุรี กทม. 10600
** จุดสังเกต : อยู่ในซอยรัชดา 6 **
รับผิดชอบเขต คลองสาน ธนบุรี บางกอกน้อย บางกอกใหญ่ บางพลัด
Facebook พื้นที่ 5 แผนที่
Tel. 02-4768787, 02-4769016, 02-4769982, 02-4769984, 02-4769979, 02-4688739, 02-4769985
Fax 02-4768871
ฝ่ายอำนวยการ 02-4768787
งานสิทธิประโยชน์ทดแทน 02-4769984
งานการเงินและบัญชี 02-4769979
งานเงินสมทบ 02-4688739
งานทะเบียนและประสานการแพทย์ 02-4769985
เขตสายไหม เปิดบริการ ศูนย์พักคอยเพื่อส่งต่อ 9 ม.ค. 65 เป็นต้นไป วัดราษฎร์นิยมธรรม (วัดหนองผักชี) ซอยพหลโยธิน 52 LINK
วันที่ 9 ม.ค. 2565 นายอนุชิต พิพิธกุล ผู้อำนวยการเขตสายไหม ร่วมกับ นาวาอากาศเอก ชัยยา จันทร์ใส รองผู้อำนวยการ ๒ โรงพยาบาลภูมิพลอดุลยเดช กรมแพทย์ทหารอากาศ ร่วมเปิดบริการ "ศูนย์พักคอย" เพื่อส่งต่อผู้ป่วยโรคติดเชื้อโควิด-19 เขตสายไหม โดยมี นางธัญนภัส มณีศรี นายสุทัศน์ รัศมิแพทย์ ผู้ช่วยผู้อำนวยการเขตสายไหม และคณะผู้บริหารเขตฯ เจ้าหน้าที่โรงพยาบาลภูมิพลอดุลยเดช เจ้าหน้าที่สำนักงานเขตสายไหม และเจ้าหน้าที่ อปพร.เขตสายไหม ร่วมเปิดศูนย์ ณ วัดราษฎร์นิยมธรรม (วัดหนองผักชี) เขตสายไหม
?"ศูนย์พักคอย เพื่อส่งต่อเขตสายไหม"
วัดราษฎร์นิยมธรรม (วัดหนองผักชี) ซอยพหลโยธิน 52
?ตั้งแต่วันที่ 9 มกราคม 2565 เป็นต้นไป
โดยเปิดรับผู้ป่วยยืนยันผลการตรวจโควิด-19 ในพื้นที่เขตสายไหม
ที่มีผลการตรวจ ATK หรือ PCR เป็นบวก และเป็น ผู้ป่วยกลุ่มสีเขียวที่มีความประสงค์จะเข้ารับการดูแลที่ศูนย์พักคอยฯ
☎️ท่านสามารถติดต่อได้ที่ สายด่วนเขตสายไหม โทร.0 2026 3500 (20 คู่สาย ตลอด 24 ชม.)
*ใช้สำหรับการติดต่อช่วยเหลือผู้ติดเชื้อโควิด-19
เข้าสู่ระบบการดูแลและรักษาพยาบาลเท่านั้น
หรือ ☎️โทร. 1330 กด 14
ศูนย์คัดกรองโควิด-19 แม่ลาน้อย โทร 053-689060 ต่อ 125 LINK
ศูนย์คัดกรองโควิด-19 แม่ลาน้อย โรงพยาบาลแม่ลาน้อย โทร 053-689060 ต่อ 125
ให้บริการ
1. ตรวจคัดกรองสำหรับผู้สัมผัสเสี่ยงสูงจากทุก Clusterซึ่งต้องระบตัวผู้ป่วยได้ หรือ ผู้สัมผัสจากการสอบสวนโรคของเจ้าหน้าที่สอบสวนโรค
2. ตรวจคัดกรองผู้สัมผัสเสี่ยงสูง ครั้งที่ 2 และ 3 ตามนัดของเจ้าหน้าที่ควบคุมโรค
3. บริการฉีดวัคซีน AstraZeneca ทุกวัน จันทร์ - พุธ 09.00-14.00 น.วันพฤหัส - ศุกร์ ให้บริการที่ รพ.แม่ลาน้อย ( ให้บริการ เข็มที่ 1 เข็มที่ 2 และ Booster
ศาสตราจารย์ ดร. ปีเตอร์ คุลลิส (Pieter Culllis, Ph.D.)
ศาสตราจารย์ ดร. ปีเตอร์ คุลลิส (Pieter Culllis, Ph.D.)
ศาสตราจารย์ ภาควิชาชีวเคมีและชีววิทยาโมเลกุล มหาวิทยาลัยบริทิชโคลัมเบีย, แวนคูเวอร์
บันไดทุกบันได จะต้องมีทางลาดสำหรับรถเข็น เพื่อให้ทั้งคนพิการที่ต้องนั่งรถเข็น ผู้สูงอายุที่เดินไม่ไหวแล้ว และรถเข็นเด็ก สามารถเปลี่ยนระดับได้ โดยไม่ต้องใช้บันได
โรงพยาบาลกรุงเทพสนามจันทร์ ร่วมกับสภากาชาด จ.ราชบุรี รับบริจาคโลหิต LINK
"บริจาคโลหิต การให้ชีวิตที่คุณทำได้" โรงพยาบาลกรุงเทพสนามจันทร์ ร่วมกับสภากาชาด จ.ราชบุรี รับบริจาคโลหิต วันที่ 28 มกราคม 2565 วันที่ 20 พฤษภาคม 2565 วันที่ 23 กันยายน 2565 ณ ลานหน้าอาคารโรงพยาบาลกรุงเทพสนามจันทร์ ตั้งแต่เวลา 09.00 - 14.00 น. ❤ สามารถดูขั้นตอนเตรียมตัวก่อนบริจาคโลหิตได้ใต้โพสนะคะ ???? *อย่าลืมนำบัตรประชาชนมาด้วยทุกครั้งเพื่อความสะดวกในการกรอกข้อมูลค่ะ
โปรแกรมตรวจสุขภาพสิทธิข้าราชการ อายุมากกว่า 35 ปี
ยาหอมนวโกฐ เป็นยาตำรับในบัญชียาวากสมุนไพรแก้กลุ่มอาการทางระบบไหลเวียนโลหิต (แก้ลม) LINK
ยาหอมนวโกฐ มรดกทางภูมิปัญญาของประเทศไทยที่มีการใช้ยาหอมกันอย่างยาวนานตั้งแต่ในอดีตจนถึงปัจจุบัน ได้มีงานวิจัยอย่างเป็นวิทยาศาสตร์เพื่อพิสูจน์สรรพคุณตามภูมิปัญญาพบว่า ยาหอมมีผลต่อระบบหัวใจและหลอดเลือด ระบบทางเดินอาหาร ระบบประสาทส่วนกลาง ที่สามารถใช้บำบัดอาการเป็นลม วิงเวียน คลื่นเหียน อาเจียน ท้องอืค แก้ลมจุกเสียด
มีทั้งชนิดผงและชนิดเม็ด
ข้อห้ามใช้ ห้ามใช้ในหญิงตั้งครรภ์และผู้ที่มีไข้
ข้อควรระวัง ควรระวังการรับประทานร่วมกับยาในกลุ่มสารกันเลือดเป็นลิ่ม และยาต้านการจับตัวของเกล็ดเลือด ควรระวังการใช้ยาในผู้ป่วยที่แพ้ละอองเกสรคอกไม้
5. ถึงเวลาบอกรักตราด @เขาระกำ 12-14 ก.พ.65 LINK
12-14 กุมภาพันธ์ 2565 ถึงเวลาบอกรักตราด @เขาระกำ กิจกรรมแน่นๆ 3 วัน 12 กพ ปั่นบอกรักตราด 13 กพ พายซัพ กระชับรัก 14 กพ จดทะเบียนสมรส สมรัก ปลูกต้นรัก กระชับใจ + ศิลปินร่วมสร้างความบันเทิงทั้ง 3 วัน
คลินิกกายอุปกรณ์ สถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพฯ LINK
หน่วยงานกายภาพบำบัดในคลินิกกายอุปกรณ์ เป็นหน่วยงานที่ให้บริการด้านกายภาพบำบัดแก่ผู้ป่วยที่มาขอรับบริการกายอุปกรณ์เสริม และกายอุปกรณ์เทียมในเรื่องการตรวจประเมินความพร้อมและเตรียมความพร้อมทางด้านร่างกาย และความรู้เบื้องต้นเกี่ยวกับกายอุปกรณ์เสริมหรือกายอุปกรณ์เทียมที่ผู้ป่วยต้องใช้ ก่อนการเข้ารับกายอุปกรณ์เสริม และกายอุปกรณ์เทียม รวมทั้งการฝึกผู้ป่วยที่ได้รับกายอุปกรณ์เทียม โดยเฉพาะผู้ป่วยขาขาด ให้สามารถเดินได้โดยใช้ขาเทียมที่ได้รับ เป็นต้น
กลุ่มผู้รับบริการ
- ผู้พิการที่ขอรับกายอุปกรณ์เทียมในคลินิกกายอุปกรณ์ เช่น การขอรับ แขน–ขา เทียมในผู้พิการแขน–ขาขาด หรือ ผู้พิการแต่กำเนิด การขอรับเท้าเสริมส่วนหน้าในผู้ป่วยที่ถูกตัดเท้าบางส่วน
- ผู้ป่วยที่ขอรับกายอุปกรณ์เสริมในคลินิกกายอุปกรณ์ เช่น การขอรับพลาสติกดามขากันข้อเท้าตก (AFO) ในผู้ป่วยเด็กสมองพิการ หรือผู้ป่วยอัมพาตครึ่งซีก หรือการขอรับ โลหะ/พลาสติกดามขาชนิดยาวมีข้อเข่าล็อคได้ในผู้ป่วยโปลิโอหรือผู้ป่วยอัมพาตครึ่งท่อนล่าง (SCI) รวมทั้งการขอรับพลาสติกดามหลังคดในผู้ป่วยกระดูกสันหลังคด เป็นต้น
บริการ
1.การประเมินความพร้อมก่อนเข้ารับการอุปกรณ์เสริม และกายอุปกรณ์เทียม
- ในเวลาราชการ วันจันทร์ - วันศุกร์ เวลา 08.30 – 16.30 น.
- 0-2965-9189 0-2965-9186 0-2951-0729 ต่อ 6770
2. พื้นฟูผู้พิการแขน-ขาขาดแบบผู้ป่วยนอก (OPD) และแบบผู้ป่วยใน (IPD)
- 1.ผู้ป่วยนอก ในเวลาราชการ วันอังคาร, วันพฤหัสบดี, วันศุกร์ เปิดให้บริการ 3 รอบเวลา
- 2.ผู้ป่วยใน ในเวลาราชการ วันจันทร์, วันพุธ, วันพฤหัสบดี, วันศุกร์ เปิดให้บริการ 3 รอบเวลา
- 0-2965-9189, 0-2965-9186, 0-2951-0729 ต่อ 6770
3. การประเมินการใช้กายอุปกรณ์เสริมและกายอุปกรณ์เทียม
- ในเวลาราชการ วันพุธ เวลา 08.30 – 12.00 น.
- 0-2965-9189, 0-2965-9186, 0-2951-0729 ต่อ 6772
โรงพยาบาลบางพลี เริ่มลงทะเบียนวันพฤหัสที่ 10 ก.พ.2565 LINK
โรงพยาบาลบางพลี ขอเชิญชวนเด็กเล็กอายุ 5 ปี - ต่ำกว่า 12 ปี ที่มีโรคในกลุ่มเสี่ยง 7 โรค เฉพาะผู้ที่อยู่ในจังหวัดสมุทรปราการ (ตามบัตรประชาชนหรือทะเบียนบ้าน) หรือกำลังเรียนในโรงเรียนในจังหวัดสมุทรปราการ ลงทะเบียนผ่าน QRcode หรือลิงค์ เพื่อรับบริการฉีดวัคซีนไฟเซอร์ (Pfizer) เด็กเล็กได้
เริ่มลงทะเบียนวันพฤหัสที่ 10 ก.พ.2565 เวลา 18.00 น จนกว่าจะเต็มจำนวน หลังลงทะเบียนสำเร็จ กรุณารอ SMS ตอบกลับแจ้งวันเวลาในการเข้ารับบริการ
ผลิตภัณฑ์ทำแผล/ลบรอยแพลเป็น
ผลิตภัณฑ์ทำแผล/ลบรอยแพลเป็น
- Tigerplast พลาสเตอร์ปิดแผล ชนิดฟิล์มใสกันน้ำ ขนาด 6 ชม. x 7 ชม. จำนวน 3 แผ่น
- Tigerplast พลาสเตอร์ปิดแผล ชนิดฟิล์มใสกันน้ำ ขนาด 25 มล. x 72 มล. จำนวน 10 แผ่น
- Tigerplast แคริพอร์ เคดียร์ เทปพลาสติก แต่งแผลชนิดใส ขนาด 1 นิ้ว x 10 หลา จำนวน 1 ม้วน
- Tigerplast Sheer พลาสเตอร์ปิดแผล ชนิดพลาสติกสีเนื้อ จำนวน 25 แผ่น
- พลาสเตอร์ปิดแผล ลายสัตว์ป่านำรัก
- แอลกอฮอล์ 70% 60 ml
- น้ำเกลือล้างแผล 150 ml
- ยาใส่แผล โพวิโดน-ไฮโอดีน 30 ml ใช้สำหรับใส่แผลสด
- STERILE DRESSING SET ชุดอุปกรณ์สำหรับทำแผล ปลอดเชื้อ แบบพร้อมใช้
- Alcohol Cotton Ball สำลีก้อนชุบเอทิลแอลกอยอล์ 70% ขนาด 10 ก้อน / แผง จำนวนบรรจุ 5 แผง / กล่อง
- เทปแต่งแผลชนิดเยื่อกระดาษ ขนาด 1 นิ้ว x 10 หลา จำนวน 1 ม้วน
- Cica-care แผ่นซิลิโคนเจลชีท สำหรับป้องกันและลดรอยแผลเป็น ขนาด 12 ชม. x 6 ชม. จำนวน 1 แผ่น
- 3M Cavilon Durable Barrier Cream ครีมเข้มข้นเคลือบปกป้องผิวหนัง
- เจลลดรอยแผลเป็น Dermatix Ultra Gel ขนาด 15 g จำนวน 1 หลอด
- HIRUSCAR SILICONE PRO เจลซิลิโคนลดเลือนรอยแผลเป็นขนาด 10 g
บทบาทของซาโนฟี่ ต่อโรคไบโพลาร์


ในฐานะบริษัทชั้นนำด้านสุขภาพระดับโลก คุณมารีน คินยาร์ค สตูยาโนวิช ผู้จัดการใหญ่ ซาโนฟี่ ประเทศไทยและมาเลเซีย กล่าวว่า "ซาโนฟี่ รู้สึกเป็นเกียรติอย่างยิ่งและขอขอบคุณสำหรับโอกาสที่ได้ร่วมสนับสนุนกรมสุขภาพจิต และสมาคมจิตแพทย์แห่งประเทศไทย รวมถึงเครือข่ายพันธมิตร ในการจัดงาน World Bipolar Day 2022 ในครั้งนี้ เพื่อสร้างความรับรู้และความเข้าใจที่ถูกต้องเกี่ยวกับโรคไบโพลาร์ และซาโนฟี่พร้อมสนับสนุนการใช้ ‘ระบบจิตเวชทางไกล’ ที่นับเป็นก้าวสำคัญของวงการแพทย์ ในการรักษาผู้ป่วยไบโพลาร์และผู้ป่วยโรคจิตเวชอื่นๆ เทคโนโลยีดิจิทัลทางการแพทย์ (Digital Health) เป็นเรื่องที่ซาโนฟี่ให้ความสำคัญและขับเคลื่อนมาโดยตลอด เพราะนับเป็นเครื่องมือสำคัญที่ช่วยให้ผู้ป่วยเข้าถึงการรักษา สามารถติดตามผลได้อย่างต่อเนื่อง ทำให้การดูแลผู้ป่วยทางไกลเกิดขึ้นอย่างเต็มรูปแบบและมีประสิทธิภาพ อีกทั้งเทคโนโลยียังเป็นตัวเร่งที่ทำให้เกิดความเท่าเทียมในระบบการดูแลสุขภาพอีกด้วย ซึ่งสอดคล้องกับความมุ่งมั่นของซาโนฟี่ในการขับเคลื่อนเพื่อให้ผู้ป่วยสามารถเข้าถึงการรักษาได้อย่างเท่าเทียมและยั่งยืนเพื่อคุณภาพชีวิตที่ดีขึ้น"
บริการครอบฟัน (Crown) เช่น ในกรณีที่ฟันแตกหักมา หรือมีการรักษารากฟันมาแล้ว หมดกังวลเมื่อเข้ามาใช้บริการ สามารถได้ฟันสวยกลับไปภายในวันเดียว รวมทั้งการทำ วีเนียร์ ที่มีกระบวนการมากมายตั้งแต่การกรอหน้าฟันเพื่อติดวีเนียร์ที่มีทั้งใช้วัสดุชนิดลามิเนตและเซรามิกแปะลงบนผิวของฟัน ซึ่งแต่เดิมการติดวีเนียร์แบบชั่วคราว ถ้าไม่ต้องการให้หลุดก็ต้องยึดให้ดี ทำให้แกะออกยาก “วันเดย์ โซลูชัน” โดยใช้ Intra - Oral Scanner สแกนถ่ายภาพภายในช่องปาก เป็นดิจิทัลไฟล์ไปดีไซน์ชิ้นงานบนจอคอมพิวเตอร์ ก่อนจะสั่งพริ้นต์หรือกลึงแบบได้ออกมาเป็นชิ้นงาน ติดฟันคนไข้ได้เลยภายใน 1 วัน ทำให้สวยได้ในชั่วข้ามคืน
สำหรับคนไข้ที่กลัวการทำฟัน (Dental Phobia) คลินิกทันตกรรม บีดีเอ็มเอส เวลเนส คลินิกมีเทคนิคการทำSleep Dentistry ช่วยลดการรับรู้ของคนไข้ขณะทำทันตกรรม โดยทีมวิสัญญีแพทย์และพยาบาลจากโรงพยาบาลกรุงเทพ นอกจากนี้ยังสร้างบรรยากาศที่ผ่อนคลายในการทำฟัน ร่วมกับอโรมาเทอราพีกลิ่นสปา ออกแบบห้องทันตกรรมให้เหมือนอยู่ในห้องส่วนตัว มีจอพลาสมาบนเพดานสามารถดูได้ขณะนอนบนเตียงทำฟัน สามารถเชื่อมต่อกับสมาร์ทโฟนดูรายการโปรดได้ เพื่อให้การพบทันตแพทย์เป็นอีกเรื่องดีๆ และเป็นเรื่องที่ไม่น่ากลัวอีกต่อไป เพราะสุขอนามัยช่องปากที่ดีที่สุดและรอยยิ้มที่สวยงามมีความสำคัญในทุกช่วงวัย
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
สินแพทย์ รามอินทรา บริการ Drive Thru Test 3,500 บาท
โรงพยาบาลสินแพทย์ รามอินทรา บริการ Drive Thru Test ตรวจ Covid RT-PCR 3,500 บาท (รวมค่าตรวจและค่าเวชภัณฑ์ ไม่รวมใบรับรองแพทย์) เปิดให้บริการตรวจในเวลา 08:00-18:00 น. (ทุกวัน) จำกัด วันละ 50 ท่าน ผู้สนใจต้องลงทะเบียนล่วงหน้า ผ่าน Google form หรือ Scan QR ที่รพ.จัดไว้ *สำหรับผู้ที่ตรวจพบเชื้อ แต่ไม่มีอาการหรือเป็นกลุ่มอาการสีเขียวสามารถรักษาตามสิทธิ์การรักษาพื้นฐานภาครัฐ โดยติดต่อเข้ารับการรักษาที่ 1330
รพ.วิมุต แพ็กเกจลองโควิด (Long COVID) สำหรับผู้ใหญ่ 2,999 บาท
รพ.วิมุต มอบแพ็กเกจลองโควิด (Long COVID) สำหรับผู้ใหญ่ ตรวจสุขภาพหลังการติดเชื้อ COVID-19 พร้อมเอกซเรย์ทรวงอก ตรวจคลื่นหัวใจไฟฟ้า (EKG) และตรวจค่าบ่งชี้การอักเสบ สามารถติดต่อเพื่อรับคำปรึกษาได้ที่ศูนย์อายุรกรรม ชั้น 5 รพ.วิมุต เวลาทำการ 7.00 - 20.00 น. โทร. 02-079-0030 หรือใช้บริการ Telemedicine ปรึกษาแพทย์ออนไลน์ผ่าน ViMUT Application Call center : 02-079-0000
บริการ COVID-19 Tele Care รพ.วิมุต 1,200 บาท LINK
รพ.วิมุตมอบบริการ COVID-19 Tele Care เอกซเรย์ปอดสำหรับผู้ติดเชื้อ COVID-19 พร้อมพบแพทย์เฉพาะทางโรคระบบการหายใจ (Pulmonologist) ผ่าน Telemedicine บริการปรึกษาแพทย์ออนไลน์ ราคา 1,200 บาท (รวมค่าแพทย์ ค่าเอกซเรย์ และค่าบริการรพ.เท่านั้น) เพื่อเพิ่มความสะดวกสบายและลดการเดินทาง สามารถจองเพื่อรับบริการ COVID-19 Tele Care ได้ทาง ViMUT Application สามารถสอบถามรายละเอียดได้ที่ : Call center : 02-079-0000
รวมชัยประชารักษ์ วัคซีนโมเดอร์นา(Moderna) 1500 บาท/เข็ม
รพ.รวมชัยประชารักษ์ วัคซีนป้องกันโควิด-19 โมเดอร์นา(Moderna) พร้อมฉีด ราคา 1500 บาท/เข็ม โทรจองได้ทันที...โทรศัพท์ 086-3118616
บางปะกอก 8 - Home Isolation กักตัวที่บ้าน Hotline 1745 หรือ 02-109-8111 ต่อ 1114
โรงพยาบาลบางปะกอก 8 Hotline 1745 หรือ โทร 02-109-8111 ต่อ 1114 หรือ 090-198-7754 แผนกส่งเสริมสุขภาพ
เปิดให้บริการ Home Isolation กักตัวที่บ้าน สงวนสิทธิ์สำหรับผู้ประกันตนประกันสังคมโรงพยาบาลบางปะกอก 8 โดยที่มีผลตรวจ ATK เป็นบวก ไม่ต้องตรวจ RT-PCR และอยู่ในพื้นที่ห่างจากโรงพยาบาล ไม่เกิน 10 กิโลเมตร
ในกรณีตรวจเอง ผล ATK 2 ขีด (พบเชื้อ)
ติดต่อเข้ารับบริการเพื่อเข้าสู่โครงการ Home Isolation กักตัวที่บ้าน ณ คลินิก ARI โรงพยาบาลบางปะกอก 8 บริเวณชั้น 1 ตรงทางเชื่อมอาคาร 1 และ 2 เวลาทำการ 07.00 – 16.00 น. ทุกวัน
ในกรณีต้องการเข้ารับการตรวจ ATK ที่โรงพยาบาล ติดต่อจุดตรวจหาเชื้อโควิด-19
การดูแลสุขภาพในเชิงป้องกันโรค เป็นสิ่งที่คุณหมอได้ให้ความรู้ด้วยสำนวนที่อ่านเข้าใจง่าย เน้นการดูแลสุขภาพตั้งแต่ก่อนเจ็บป่วย ด้วยหลักการของเวชศาสตร์ป้องกัน (Preventive Medicine) เพื่อทำการป้องกันและชะลอการเกิดโรค จากการปรับเปลี่ยนพฤติกรรมการใช้ชีวิต (Lifestyle Medicine) ทั้งในเรื่องของการรับประทานอาหารในแต่ละวันที่ได้รับสารอาหารครบถ้วน โดยอาหารที่ดีต้องมาจากธรรมชาติ ไม่ผ่านกระบวนการแปรรูป ควบคู่กับการตรวจเชิงลึกทางห้องปฏิบัติการบวกการเจาะรหัสพันธุกรรม เพื่อไขความลับสุขภาพดีที่ลงลึกไปถึงระดับเซลล์ เพื่อให้เกิดการดูแลรักษาสุขภาพแบบเฉพาะบุคคล
คุณหมอยังเน้นย้ำอีกสิ่งหนึ่งที่สำคัญ คือ การนอน เพราะการนอนที่เพียงพอจะช่วยเพิ่มประสิทธิภาพในการทำงานของร่างกายที่ดีขึ้น มีความสดชื่นและตื่นตัวตลอดทั้งวัน ช่วยส่งเสริมให้มีคุณภาพชีวิตที่ดี
อ.น้ำยืน รพ.-สสจ.น้ำยืน และรพ.สต.
อ.โพธิ์ไทร รพ.โพธิ์ไทร และรพ.สต.
ประชาชนในพื้นที่ อ.บ้านค่าย ติดต่อ รพ.ต่างๆ ดังนี้
วันที่ 15 เม.ย.65 - บาดเจ็บ 4 ราย เสียชีวิต 1 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 15 เม.ย.65) เกิดอุบัติเหตุ 4 ครั้ง บาดเจ็บ 4 ราย เสียชีวิต 1 ราย (อ.เมืองสระแก้ว)
สะสม 5 วัน (11-15 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 19 ครั้ง บาดเจ็บ 18 ราย เสียชีวิต 6 ราย (อ.วังสมบูรณ์ 1 ราย อ.วัฒนานคร 1 ราย อ.ตาพระยา 2 ราย ,อ.อรัญประเทศ 1 ราย, อ.เมืองสระแก้ว 1 ราย)
โรงพยาบาลศรีธัญญา เปิดลงทะเบียนรับวัคซีนรอบเดือนพฤษภาคม ผ่าน QR Code LINK
โรงพยาบาลศรีธัญญา ลงทะเบียนฉีดวัคซีนโควิด ประจำเดือน พฤษภาคม
วันละ 100 คน
ผู้ลงทะเบียน สามารถเลือกวัน (จันทร์/พุธ/ศุกร์) เวลา ที่สะดวก ในการรับวัคซีน ได้
กำหนดฉีด ช่วงบ่าย 13.00 - 15.30 น. อาคารอำนวยการ
โปรดดูเงื่อนไข ให้ชัดเจนก่อน ทุกครั้ง เพื่อความสะดวกรวดเร็ว และปลอดภัย ในการเข้ารับบริการวัคซีน
สอบถาม ศูนย์วัคซีนเฉพาะกิจ รพ.ศรีธัญญา โทร 02-5287800 ในวันและเวลาราชการ
15.การส่งหรือโอนข้อมูลส่วนบุคคลไปยังต่างประเทศ
รายงานการดำเนินงานวัณโรคของประเทศไทย ปี พ.ศ.2559 - 2563
รายงานการดำเนินงานวัณโรคของประเทศไทย ปี พ.ศ.2559 - 2563 ลิงค์
https://shorturl.asia/ST2Yl
เกี่ยวกับรายงาน
ประเทศไทยในฐานะสมาชิกขององค์การอนามัยโลกได้ดำเนินการแผนงานวัณโรคของประเทศตามข้อเสนอแนะขององค์การอนามัยโลก ที่มีเป้าหมายให้การดำเนินงานวัณโรคมีประสิทธิภาพในการลดการเจ็บป่วยเสียชีวิตจากวัณโรคของประชาชน และเป็นไปในทิศทางเดียวกันในทุกประเทศ ซึ่งจะส่งผลต่อการลดปัญหาของวัณโรคในภาพรวมของโลก โดยจะส่งผู้เชี่ยวชาญมาประเมินผลความก้าวหน้าการดำเนินงานวัณโรคของประเทศสมาชิกแต่ละประเทศเป็นระยะ เพื่อให้ข้อแนะนำในการปรับปรุงการดำเนินงาน อีกทั้งโน้มน้าวให้ผู้บริหารระดับสูงของประเทศเห็นถึงความสำคัญและสนับสนุนการดำเนินงานวัณโรค ซึ่งการประเมินโดยผู้เชี่ยวชาญจากองค์การอนามัยโลกในประเทศไทยครั้งล่าสุด ดำเนินการเป็นครั้งที่ 5 ในปี พ.ศ. 2556 ซึ่งปกติการประเมินจะดำเนินการทุก 5 ปี หรือขึ้นอยู่กับความพร้อมของแต่ละประเทศ
เพื่อให้การประเมินแผนงานวัณโรคของประเทศทย ที่จะเกิดขึ้นครั้งต่อไปดำเนินการได้อย่างมีประสิทธิภาพ กองวัณโรคได้จัดเตรียมข้อมูลพื้นฐานที่สำคัญที่ใช้ประกอบในการประเมิน โดยรวบรวมผลการดำเนินงานวัณโรคของประเทศ 5 ปีที่ผ่านมาจากโปรแกรมรายงานข้อมูลวัณโรคของประเทศไทย (NTP) จำแนกตามสำนักงานป้องกันควบคุมโรค เพื่อให้เห็นผลการดำเนินงานแต่ละประเด็นตามรายพื้นที่ นอกจากนี้กองวัณโรคได้พัฒนาชุดคำถาม (checkist/ เพื่อเป็นเครื่องมือสำหรับผู้เชี่ยวชาญจากองค์การอนามัยโลกและองค์กรนานาชาติในการติดตามการดำเนินงานในพื้นที่ทั้งระดับเขต ระดับจังหวัด และระดับโรงพยาบาล ทตสอบชุดคำถาม โดยเก็บรวบรวมข้อมูลจากตัวแทนของสำนักงานป้องกันควบคุมโรค สำนักงานสาธารณสุขจังหวัด โรงพยาบาลและกรุงเทพมหานคร จำนวน 51 แห่ง ได้ข้อมูลการดำเนินงานและปัญหาอุปสรรคที่สำคัญในประเด็นต่างๆ
ทางบก
มาตรการผ่อนปรนการเข้าประเทศทางบก เริ่ม 1 มิถุนายน 2565 ดังนี้
1. เอกสารผ่านแดน ต้องแสดง พาสปอร์ต หรือ บัตรผ่านแดน (Border pass) ทั้งคนสัญชาติไทยและไม่มีสัญชาติไทย
2. ระบบคัดกรอง ณ ด่านฯ
สัญชาติไทย - คัดกรองอาการ แสดงหลักฐานการฉีดวัคซีน หรือ ผลตรวจแล็ป
ไม่มีสัญชาติไทย - คัดกรองอาการ และลงระบบเข้าประเทศ
3. หลักฐานการรับวัคซีน (Vaccine Certificate)
ต้องแสดงทุกคน
4. การกักตัว/ตรวจ
สัญชาติไทย - ไม่กักตัว
• กรณีฉีดวัคซีนครบ หรือ
• ไม่ฉีดวัคซีน แต่มีผลตรวจ Pro ATK/PCR ใน 72 ชม.
• หากไม่วัคซีน/ไม่มีผลตรวจ ให้ตรวจ Pro ATK
ไม่มีสัญชาติไทย - อนุญาตเฉพาะผู้ที่ฉีดวัคซีนครบแล้วเท่านั้น
มาตรการรับผู้เดินทางผ่านพรมแดนทางน้ำ ไม่มีการเปลี่ยนแปลงมาตรการ
6.เส้นใยกัญชง มอก. 3225-2564
รายละเอียดมาตรฐานผลิตภัณฑ์อุตสาหกรรม
เลขที่ มอก. : 3225-2564
ชื่อ มอก. : เส้นใยกัญชง
TIS NAME : Raw hemp fibers
ประเภทมาตรฐาน : มอก. มาตรฐานทั่วไป
วันที่บังคับใช้ : 21 กุมภาพันธ์ 2565
ประกาศในราชการกิจจานุเบกษา :
ฉบับที่ ประกาศและงานทั่วไปเล่ม 139ตอน พิเศษ 43 งวันที่ 21 กุมภาพันธ์ 2565
ประกาศกระทรวง :ฉบับที่ 6290วันที่ 28 มิถุนายน 2564
เอกสารฉบับเต็ม
หมายเหตุ :
บทคัดย่อ ภาษาไทย : มาตรฐานนี้ครอบคลุมเส้นใยกัญชงที่มาจากต้นกัญชงที่เป็นไปตามที่กฎหมายกำหนด และได้รับอนุญาตให้ผลิตภายในประเทศเพื่อใช้เป็นวัตถุดิบในอุตสาหกรรม ทั้งนี้ ไม่ครอบคลุมเส้นใยกัญชงที่มีส่วนผสมของวัสดุอื่นๆ โดยกำหนดบทนิยาม ประเภท คุณลักษณะที่ต้องการ การบรรจุ เครื่องหมายและฉลาก การชักตัวอย่างและเกณฑ์ตัดสิน และการทดสอบ
Abstract : This standard covers hemp fibers that come from the hemp plant as required by law and is allowed to produce domestically for use as raw materials in the industry. However, excludes hemp fibers containing other materials. Specifies definition, types, general requirements, packaging, mark and label, sampling and criteria for conformity and testing.
5.เร่งรัดผลักดันการก่อสร้าง และศึกษาการสร้างโรงพยาบาลแห่งใหม่ให้ครอบคลุม
ประโยชน์คนกรุงฯ
- การบริการสาธารณสุขและรักษาพยาบาลของรัฐภายใต้สังกัด กทม. ครอบคลุมประชาชนส่วนใหญ่ใน 6 กลุ่มเขต
รายละเอียด
ปัจจุบัน
โรงพยาบาลสังกัดของ กทม.มีทั้งหมด 12 แห่ง โดยสังกัดอยู่ในสำนักการแพทย์ 11 แห่ง ตัวอย่างเช่น โรงพยาบาลกลาง โรงพยาบาลตากสิน โรงพยาบาลเจริญกรุงประชารักษ์ เป็นต้น โดยมีโรงพยาบาลวชิระ สังกัดคณะแพทยศาสตร์ มหาวิทยาลัยนวมินทราธิราช
โดยสถิติปี 2563 จำนวนเตียงในสถานพยาบาล 11 แห่งมีจำนวน 2,200 แห่ง คิดเป็นสัดส่วนเพียงร้อยละ 7.17 จากจำนวนเตียงของโรงพยาบาลทั้งหมดในกรุงเทพฯ (ทั้งรัฐและเอกชนมีจำนวน 30,718 เตียง) ในสถานพยาบาลดังกล่าวมีจำนวนผู้ป่วยนอกที่เข้าใช้บริการและใช้สิทธิประกันสุขภาพเฉลี่ยสูงถึง 1.4 ล้านครั้งต่อปี มีจำนวนผู้ป่วยนอกที่เข้าใช้บริการและใช้สิทธิประกันสังคมประมาณ 500,000 ครั้งต่อปี โรงพยาบาลในสังกัดหลายแห่งมีบริการที่ไม่เพียงพอต่อความต้องการของประชาชน และหลายพื้นที่ของกรุงเทพฯ ยังไม่มีโรงพยาบาลของรัฐที่ครอบคลุมการให้บริการสาธารณสุขซึ่งเป็นสวัสดิการพื้นฐานที่สำคัญ
ดังนั้น กทม.จะศึกษาออกแบบความเป็นไปได้ในการสร้างโรงพยาบาลแห่งใหม่ในพื้นที่ที่โครงสร้างพื้นฐานและจำนวนที่อยู่อาศัยสร้างใหม่เติบโตในอัตราสูง แต่สถานพยาบาลของรัฐยังไม่ครอบคลุม เช่น ฝั่งกรุงธนเหนือ
ผลิตภัณฑ์สัญลักษณ์ทางเลือกสุขภาพ
ปัจจัยโรคหัวใจในผู้ใหญ่
โรคหัวใจในผู้ใหญ่ที่เจอบ่อยจะมีปัจจัยมาจาก การเสื่อมของหลอดเลือด ซึ่งมีสาเหตุหลักๆ คือ จากความดันโลหิตสูงนานๆ ซึ่งการที่ความดันสูงบ่อยครั้งเกิดจากการรับประทานอาหารเค็มหรือหวาน หรือปล่อยให้ร่างกายมีไขมันสูงนานๆ พนังหลอดเลือดจะแข็งและทำให้ความดันสูง หรือในคนที่เป็นเบาหวานแล้วไม่ควบคุมน้ำตาลให้ดี ก็จะทำให้เกิดการเสื่อมของหลอดเลือดได้เร็ว
การที่หลอดเลือดเสื่อมนั้น จะไม่ได้เสื่อมแค่หัวใจ แต่จะเสื่อมทั้งร่างกาย เพียงแต่ว่าเวลาแสดงออกมาจะแสดงออกมาที่อวัยวะสำคัญๆ ก่อน เช่น หัวใจ ไต สมอง เราจึงเห็นบางคนนั่งกินข้าวอยู่ดีๆ ล้มฟุบไปเลย หมดสติ หัวใจวาย แน่นอนว่าส่วนหนึ่งมาจากหลอดเลือดหัวใจอุดตันกะทันหัน หัวใจเต้นผิดจังหวะ หรือว่าเสียชีวิตโดยที่ยังไม่ทันได้มาที่โรงพยาบาล เพราะไม่เคยตรวจร่างกายมาก่อนจึงไม่รู้ว่าเกิดการเสื่อมของหลอดเลือด
อาการเบื้องต้นของโรคหัวใจ คือ การเหนื่อยง่าย สามารถสังเกตตัวเองได้เช่น การขึ้นบันได 3 ชั้น เมื่อก่อนขึ้นสบายๆ โดยไม่ต้องหยุดพัก แต่วันนี้เดินแค่ชั้นเดียวก็ต้องยืนหอบแล้ว หากมีอาการอย่างนี้ควรรีบพบแพทย์เพื่อตรวจร่างกาย สำหรับการดูแลตัวเองให้ห่างไกลโรคหัวใจ สามารถทำได้โดย ในส่วนของการรับประทาน ไม่รับประทานอาหารที่มีไขมันสูง หรือใส่น้ำมันเยอะ หลีกเลี่ยงของทอด อาหารเค็ม ใครที่ชอบใส่พริก ใส่โซเดียมเยอะๆ 2-3 ช้อน ต้องลดปริมาณการใส่ให้น้อยลง แล้วหันไปรับประทานอาหารที่มีรสชาติจืด ถ้าเปลี่ยนได้จะเป็นเรื่องที่ดีต่อหัวใจ
คนที่เป็นเบาหวานจะต้องควบคุมระดับน้ำตาลในเลือดให้ดี หลีกเลี่ยงการกินแป้ง การกินน้ำตาลมากๆ ใน 1 มื้อ ต้องลดปริมาณลง โดยเฉลี่ยๆ ให้เท่าๆ กันในทุกมื้อ น้ำตาลจะได้ไม่สูง
รวมทั้ง มีการออกกำลังกาย ครั้งละครึ่งชั่วโมง อย่างน้อย 3 วันต่อสัปดาห์ เพื่อให้สุขภาพร่างกายแข็งแรงอยู่ตลอด โดยจะต้องพิจารณาในเรื่องของวัยและสภาพร่างกายของแต่ละคน เช่น ในคนที่น้ำหนักตัวมากจะให้ไปวิ่งก็คงไม่ไหว จะต้องทำกิจกรรมที่ไม่ลงน้ำหนักในข้อเข่า เพื่อหลีกเลี่ยงการเสื่อมของข้อเข่า แนะนำให้ว่ายน้ำหรือปั่นจักรยานก็จะช่วยได้ หากไม่ถนัดให้หันไปเดินเร็ว โดยเริ่มจากการเดินธรรมดาก่อนไปจนถึงเดินเร็ว พร้อมกับการควบคุมปริมาณอาหารไปด้วย ตลอดจน ทำจิตใจให้แจ่มใส หลีกเลี่ยงหรือลดความเครียดให้น้อยลง เพราะการทำงานหนัก เครียดมากๆ ส่งผลให้มีความดันโลหิตสูงอยู่บ่อยๆ ซึ่งจะส่งผลต่อหัวใจ ควรหาวิธีคลายเครียดมาใช้ ซึ่งแต่ละคนจะเลือกวิธีคลายเครียดที่แตกต่างกันไป อย่าง เล่นกีฬา บางคนนั่งสมาธิ บางคนชอบดูหนัง ดูละคร ลองเลือกหามุมที่ตนเองทำแล้วรู้สึกสบายที่สุด เพื่อจะได้เป็นการบาลานซ์ชีวิตให้เกิดความพอดี
ทางด้านแผนการรักษาโรคหัวใจให้กับผู้ป่วย หากสุดทางแล้วรักษากันไม่ได้จริงๆ วิวัฒนาการทางการแพทย์ในปัจจุบันก็ยังมีอีกขั้นหนึ่ง คือ การผ่าตัดเปลี่ยนหัวใจ การใส่หัวใจเทียมที่ทดแทนหัวใจจริง โดยมีหลักการทำงานคล้ายกับเครื่องเอคโม่เพียงแต่ว่าจะย่อส่วนของเครื่องเข้าไปอยู่ในร่างกายของคน ซึ่งเป็นอีกหนึ่งทางเลือกในการนำเทคโนโลยีเข้ามาช่วยเหลือผู้ป่วย ยิ่งถ้าผู้ใช้มีความชำนาญ ใช้ได้อย่างเหมาะสม ถูกเวลา ยิ่งเพิ่มโอกาสรอด ช่วยกู้คืนชีวิตให้กลับคืนมาได้
สอบถามเพิ่มเติมได้ที่ รพ.หัวใจกรุงเทพ โทร. 080-1919019 Contact Center โทร. 1719
โครงการแว่นผู้สูงวัย โทร.02-2402951-52 LINK
โครงการแว่นผู้สูงวัย โดย สำนักอนามัย กทม. และมูลนิธิช่วยการสาธารณสุขชุมชนฯ เพื่อมอบแว่นสายตาให้กับผู้สูงอายุวัย 60 ปีขึ้นไปในชุมชนที่ด้อยโอกาส เพื่อสนับสนุนและส่งเสริมสุขภาพสายตาผู้สูงอายุ ให้สามารถช่วยเหลือตนเองได้และมีคุณภาพชีวิตที่ดีขึ้น โดยหมุนเวียนไปช่วยเหลือและมอบแว่นตาให้ผู้สูงอายุที่ยากไร้และด้อยโอกาสในเขตศูนย์บริการสาธารณสุขในสังกัดทั้ง 68 แห่งในพื้นที่กรุงเทพมหานคร
ติดต่อสอบถามรับความช่วยเหลือได้ที่ โทร.02-2402951 02-2402952
รองศาสตราจารย์ นายแพทย์สัมมน โฉมฉาย
รองศาสตราจารย์ นายแพทย์สัมมน โฉมฉาย ภาควิชาเวชศาสตร์ป้องกันและสังคม คณะแพทยศาสตร์ศิริราชพยาบาล กล่าวถึง มุมมองทางกฎหมายและโอกาสเกิดอุบัติเหตุที่เกิดจากการใช้กัญชา ว่า
สำหรับข้อควรระวังในการใช้กัญชา เมื่อหยุดเสพสามารถเกิดอาการถอนยาได้อย่างชัดเจน ได้แก่ อาการนอนไม่หลับ อารมณ์ซึมเศร้า กระวนกระวาย คลื่นไส้ ปวดท้อง การรักษาภาวะเสพติดกัญชามีความยาก พอกับการรักษาภาวะติดยาบ้า ยาไอซ์ โคเคนและสุรา ซึ่งวัยรุ่นมีความเสี่ยงในการเสพติดมากกว่าผู้ใหญ่
ผลโดยตรงของกัญชาต่อสุขภาพนั้น สามารถเกิดขึ้นได้ทั้งในเด็กและผู้ใหญ่ โดยกลุ่มที่มีความเสี่ยงสูงคือ
เด็ก อาจเกิดภาวะพิษจากการกินโดยอุบัติเหตุ หรือเกินขนาด
และผู้สูงอายุ อาจมีแนวโน้มการใช้มากขึ้นเพื่อรักษาอาการต่าง ๆ เช่น นอนไม่หลับ เบื่ออาหาร อาการปวด และอาจจะเพิ่มความเสี่ยงต่อภาวะที่เกิดบ่อยอยู่แล้วในผู้สูงอายุ คือ พลัดตกหกล้ม หัวใจเต้นผิดจังหวะ
โดยความเสี่ยงต่ออุบัติเหตุบนท้องถนน และการทำงาน ย่อมส่งผลต่อการเกิดอุบัติเหตุและการทำงาน เนื่องจากเมื่อมีการรับประทานเข้าไปแล้วจะทำให้มีการออกฤทธิ์ช้าและนาน ซึ่งความเสียหายไม่ได้จำกัดเฉพาะผู้ใช้สารกัญชา แต่รวมไปถึงผู้อื่น ที่อาจจะได้รับความเสียหาย การบาดเจ็บ การรักษาพยาบาล อีกด้วย
สำหรับคนที่ไม่เคยลอง แนะนำไม่ให้ลอง และควรศึกษาอาหารที่มีส่วนผสมของกัญชา ว่ามีปริมาณสาร THC มากน้อยเพียงใด และหากต้องใช้ยาที่มีส่วนผสมของกัญชา ควรปรึกษาแพทย์หรือเภสัชก่อนทุกครั้ง
Dr. Alongkorn Kiatdilokrath, Assistant Chairperson of Department of Radiology and Radiologist at Bumrungrad International Hospital, reveals, “Recently, Bumrungrad has adopted Radiology AI, which assists radiologists in screening, analyzing, and locating abnormalities in the lungs and detecting early stages of breast cancer. The Radiology AI deep learning algorithm forms large artificial neural networks to imitate how the human brain and the nervous system work. Hence, Radiology AI offers more accurate imaging and interpretation than other forms of machine learning, which only performs tasks based on past data. Moreover, Radiology AI can perform further data analysis and was approved by the U.S. Food and Drug Administration in 2021. Radiology AI is stable, accurate, and fast because it uses Microsoft Azure, an internationally recognized cloud computing platform.
Currently, Bumrungrad is actively using the Radiology AI in the check-ups, intensive care unit, emergency room, and more. There are two uses of the Radiology AI. Firstly, Radiology INSIGHT CXR analyzes an average of 100,000 chest x-ray images per year. Secondly, Radiology INSIGHT MMG supports the analysis of mammographic images to detect breast cancer. Through AI, Bumrungrad aims to deliver a meaningful patient journey by timely detecting cancer. With the expertise of our radiologists, the Radiology AI will further support Bumrungrad to drive international groundbreaking medical innovation.
โรงพยาบาลลำพูนใกล้หมอ จ.ลำพูน LINK
โรงพยาบาลลำพูนใกล้หมอ จ.ลำพูน เป็นโรงพยาบาลเอกชนขนาดกลางแห่งใหม่ของจังหวัดลำพูน ขนาด 114 เตียง ตั้งอยู่ที่ ถนนซุปเปอร์ไฮเวย์เชียงใหม - ลำปาง ตำบลมะเขือแจ้ อำเภอเมือง จ.ลำพูน เปิดบริการเมื่อปี 2563 รองรับประชาชนในเขตนิคมอุตสาหกรรมในจ.ลำพูน เริ่มให้บริการผู้ประกันในปี 2565
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลลำพูนใกล้หมอ สามารถรับผู้ประกันตนเพิ่มได้อีก 26,764 ราย
โรงพยาบาลลำพูนใกล้หมอ มีเครือข่าย สถานพยาบาลในระดับสูง ได้แก่ โรงพยาบาลเชียงใหม่ใกล้หมอ โรงพยาบาลประสาทเชียงใหม่ โรงพยาบาลมะเร็งลำปาง โรงพยาบาลลำปาง โรงพยาบาลลำพูน
Diplomatic / Official Visa & Courtesy Visa
• Upon official request, Thai Embassies and Consulates-General may grant visas to diplomatic or official passport-holders who wish to assume duties at a foreign Diplomatic Mission or Consulate or International Organization in the Kingdom and to their family members.
• Supporting documents are Note Verbal and/or documents issued by the foreign government or international organization, certifying the identity of the person concerned and his/her purposes while residing in the Kingdom.
Courtesy Visa
• Upon offcial request, Thai Embassies and Consulates-General may grant courtesy visas to diplomatic/offcial/ordinary passport-holders who wish to enter the Kingdom on personal purposes.
• Supporting documents are documents issued by the governmental agency, foreign government or international organization, certifying the identity of the person concerned and his/her purposes while visiting the Kingdom.
ห้ามใช้ ภาพถ่าย หรือไฟล์ pdf ในการเเสดงตน
เพื่อป้องกันบุคคลที่ไม่ได้รับอนุญาตเข้าเขตหวงห้าม พื้นที่ควบคุม หรือเขตการบิน
ผู้โดยสารจึงไม่สามารถใช้ภาพถ่าย (Capture) ของเอกสารระบุตัวตนตัวจริง หรือภาพถ่าย หรือภาพถ่ายไฟล์ PDF ในการเเสดงตน เพราะไม่สามารถตรวจสอบแหล่งที่มาของข้อมูลได้ จึงทำให้ไม่มีความน่าเชื่อถือเพียงพอ อีกทั้งยัง
ง่ายต่อการปลอมแปลงผ่อนปรนให้นำเจลล้างมือขึ้นเครื่องได้
ตั้งแต่ 27 มีนาคม 2563 สนามบินผ่อนปรนให้นำเจลล้างมือ ติดตัวขึ้นเครื่องบินได้ โดยมีความจุไม่เกิน 350 มล. (12 ออนซ์) ต่อชิ้น
ผลิตภัณฑ์ต้องมีข้อความระบุปริมาณชัดเจน และทุกชิ้นต้องปิดสนิท
สถานการณ์ลักลอบนำเข้ากัญชา จ.นครพนม Thai PBS LINK
ขณะที่ การผลิต นำเข้า ส่งออก จำหน่าย เสพ หรือมีไว้ในครอบครองซึ่งพืชกัญชา หรือการกระทำอื่นเกี่ยวกับพืชกัญชา ที่เกิดขึ้นก่อนวันนี้ ซึ่งเป็นความผิดตามประมวลกฎหมายยาเสพติดไม่นับเป็นความผิดอีกต่อไปแล้ว สิ่งหนึ่งที่ยังเป็นคำถามคือ เมื่อพืชกัญชาไม่มีสถานะเป็นยาเสพติด สถานการณ์ลักลอบนำเข้ากัญชาตามแนวลำน้ำโขงจะเป็นอย่างไรต่อไป
เพราะจากการลงพื้นที่จังหวัดนครพนมของทีมข่าวไทยพีบีเอสพบว่า ก่อนหน้านี้ เจ้าหน้าที่ยึดของกลางได้มากกว่า 12 ตันในเวลาเพียง 8 เดือน แม้ขณะนี้ สถิติการจับกุมเริ่มลดลง แต่มีการตั้งข้อสังเกตว่า อาจรอนำเข้ามาหลังปลดล็อก คุณวาทินี นวฤทธิศวิน รายงาน...จาก อำเภอท่าอุเทน จังหวัดนครพนม
ไซรัปกัญชา ผสมเครื่องดื่ม
น้ำกัญชายันฮี มีวิตามิน B12
กัญซ่า คราฟต์โซดา LINK
ส่วนประกอบกัญซ่าส์
1. น้ำเปล่า 1 ลิตร
2. น้ำผึ้ง 60 มิลลิลิตร
3. น้ำตาลทราย 50 กรัม
4. น้ำมะนาว 15 กรัม
5. น้ำเลม่อน 5 กรัม
6. เกลือ 0.5 กรัม
7. ใบกัญชาอบแห้ง 4 กรัม
ขั้นตอนการทำ
1. ต้มน้ำเดือด 1 ลิตร
2. แบ่งใบกัญชาอบแห้งเป็น 2 ส่วน ส่วนแรก 3.5 กรัม ใส่ลงไปในน้ำเดือด ต้มสกัด 5-10 นาที
3. เติมเกลือ น้ำผึ้ง น้ำตาลทราย คนให้ละลาย
4. เติมน้ำมะนาว น้ำเลม่อน และใบกัญชาอบแห้ง ส่วนที่สอง 0.5 กรัม ทำการปิดไฟ
5. รอให้น้ำเครื่องดื่มที่ผสมเย็นลง แล้วน้ำเข้าตู้เย็นที่อุณหภูมิ 2- 4 องศาเซลเชียส
6. นำมาอัด co2 เพื่อให้เกิดความซ่า
ศูนย์ส่งเสริมสมรรถภาพ โรงพยาบาลสิรินธร (ฟิตเนสเพื่อประชาชน)
ให้บริการ เวลา 16-20 น.
นพ.พนธกร พานิชกุล ศัลยแพทย์เฉพาะทางด้านข้อสะโพกและข้อเข่า
สำหรับการรักษาข้อสะโพกเสื่อมได้มีการนำเทคนิคแนวใหม่ การผ่าตัดเปลี่ยนข้อสะโพกเทียมโดยไม่ตัดกล้ามเนื้อด้วยเทคนิค Direct Anterior Approach (DAA) พร้อมการใช้นวัตกรรม Non-Invasive Hip Navigation เพื่อเพิ่มความแม่นยำ และเลือกใช้วัสดุข้อเทียมที่เหมาะสม
นพ. พนธกร พานิชกุล ศัลยแพทย์กระดูกและข้อ เฉพาะทางด้านข้อสะโพกและข้อเข่า ศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล อธิบายให้ฟังว่า เทคนิคการผ่าตัดเปลี่ยนข้อสะโพกเทียมล้วนมีเป้าหมายเดียวกัน คือ เอาส่วนของข้อสะโพกที่เสียหายออกและแทนที่ด้วยข้อสะโพกเทียมที่สร้างขึ้นจากชิ้นส่วนที่แตกต่างกันหลายชนิด โดยศัลยแพทย์จะเลือกขนาดและวัสดุของข้อสะโพกเทียมที่ดีที่สุดและเหมาะสมให้กับผู้ป่วยในแต่ละบุคคล
เขตสุขภาพที่ 5
สมุทรสาคร
- รพ.กระทุ่มแบน รพท 034 119 990 พฤหัสบดี เวลา08:30-12:00น.
- รพ.สต.บ้านกาหลง รพ.สต.
- รพ.สมุทรสาคร รพศ 034-497-366 คลินิกแบบผสมผสาน อังคารที่ 2 และ 4 ของเดือน 13.00 - 16.00 น. คลินิกกัญชาทางการแพทย์แผนไทย พุธ-ศุกร์ 08.00-12.00 น.
- สอน.บ้านคอกกระบือ รพ.สต.
สมุทรสงคราม
- รพ.การแพทย์แผนไทยและการแพทย์บูรณาการ (ม.สวนสุนันทา) ก.ศึกษา 0 3477 3905 จ. พ. 08.30 - 15.00 น.
- รพ.นภาลัย รพช. 034 761 478 รอยืนยัน
- รพ.สต.ลาดใหญ่ รพ.สต. 0 3475 6018 08.30 - 16.30 น.
- รพ.สต.วัดบางขันแตก รพ.สต. 0 3476 2350 08.30 - 16.30 น.
- รพ.สมเด็จพระพุทธเลิศหล้า รพท 034714314 ต่อ 2200 อังคาร 13.00 - 16.00 น.
- สุนันทาคลินิกการแพทย์แผนไทยประยุกต์ (ม.สวนสุนันทา) ก.ศึกษา 034-766477 จ. - ศ. 08.30 - 16.30 น.
นครปฐม
- รพ.กำแพงแสน รพช. 0 3428 1686 ศุกร์ 13.00 - 16.00 น.
- รพ.ดอนตูม รพช. 034-382096 ศุกร์ 08.30 – 12.00 น.
- รพ.นครชัยศรี รพช. 034-331-156 พฤ 08.00 - 12.00 น.
- รพ.นครปฐม รพศ 034 254 154 จ-ศ 08.30-16.30 น.
- รพ.พุทธมณฑล รพช. 02-444-6032-33 อังคาร และพฤหัสบดี 08.30 - 12.00 น.
- รพ.สต.วังน้ำเขียว รพ.สต. 0 3435 1807 รอยืนยัน
- รพ.สต.หนองดินแดง รพ.สต. 0 3430 0247 รอยืนยัน
- รพ.สามพราน รพช. 034-388-957 จันทร์และพฤหัสบดี 08.30 - 12.00 น.
- รพ.หลวงพ่อเปิ่น รพช. 034 961 113 รอยืนยัน
- รพ.ห้วยพลูู รพช. 034 389 217 จ-ศ 08.30-16.30 น.
ราชบุรี
- รพ.ดำเนินสะดวก รพท 032-246-000-15 ต่อ 625 พุธที่ 2 และ 4 ของเดือน เวลา13.00 - 16.00 น.
- รพ.บางแพ รพช. 032 381 149 อ 13.30-16.00 น.
- รพ.บ้านโป่ง รพท 032-211408 ศุกร์ สัปดาห์ที่ 1 และ 3 ของเดือน 08.30 - 12.00 น.
- รพ.ปากท่อ รพช. 032 282 677 พุธ 13.30-16.30 น.
- รพ.โพธาราม รพท 032-719-400 จันทร์ 09.00 - 12.00 น.
- รพร.จอมบึง รพช. 032 261 592
- รพ.ราชบุรี รพศ 032-719600 ต่อ 1681 พฤหัสบดี 13.00 - 16.30 น.
- รพ.วัดเพลง รพช. 032 399 290 พุธ 08.30-12.00 น.
- รพ.สวนผึ้ง รพช. 032 364 496 จ พฤ 08.30-16.30 น.
เพชรบุรี
- รพ.ชะอำ รพช. 032 471809 รอยืนยัน
- รพ.ท่ายาง รพช. 0 3246 1100-1 พ. ที่ 1 และ 3 ของทุกเดือน 13.00 - 16.00 น.
- รพ.พระจอมเกล้า รพท 032-709-999 ต่อ 3106 พฤหัสบดี สัปดาห์ที่ 1 และ 3 ของเดือน 13.00 - 16.00 น.
- รพ.สต.หนองขานาง รพ.สต. 0 3244 9500 พฤหัสบดี สัปดาห์ที่ 3 ของเดือน 08.30 - 16.30 น.
- รพ.สต.หัวสะพาน รพ.สต. 0 3277 1588 พฤหัสบดี สัปดาห์ที่ 3 ของเดือน 08.30 - 16.00 น.
- รพ.หนองหญ้าปล้อง รพช. 0 3249 4353-4 รอยืนยัน
สุพรรณบุรี
- รพ.เจ้าพระยายมราช รพศ 035-514-999 เปิดทุกวัน 08.00 - 15.00 น.
- รพ.ดอนเจดีย์ รพช. 0 3559 1032 ทุกวันทำการ 08.00 - 16.00 น.
- รพ.ศรีประจันต์ รพช. 035-581746 อังคารที่ 1 และ 3 ของเดือน 13.00 น.ถึง 16.00 น.
- รพ.สมเด็จพระสังฆราช องค์ที่ 17 รพท 035-531-077 อังคารที่ 1 และ 3 ของเดือน 13.00 น.ถึง 16.00 น.
- รพ.อู่ทอง รพช. 035-565440, 035-551422 รอยืนยัน
ประจวบคีรีขันธ์
- รพ.บางสะพาน รพช. 032 -691133, 032-691357 พฤ ที่ 1,3 ของเดือน 13.00-16.00 น.
- รพ.บางสะพานน้อย รพช. 032 699 025 ศุกร์แรกของเดือน 13.00-16.30 น.
- รพ.ประจวบคีรีขันธ์ รพท 032-601060 ศุกร์แรกของเดือน 13.00-16.00 น.
- รพ.ปราณบุรี รพช. 032-825565 ต่อ 609 ทุกวันศุกร์ สัปดาห์สุดท้ายของทุกเดือน ตั้งแต่เวลา 13.30 น - 15.30 น (ยกเว้นวันหยุดราชการ)
- รพ.สต.บ้านเขาเต่า รพ.สต.
- รพ.สามร้อยยอด รพช. 032-688-999 ทุกวันจันทร์ สัปดาห์ที่ 2 ของเดือน เวลา 13.00 - 16.30 น.
- รพ.หัวหิน รพท 032-523000 ศุกร์ สัปดาห์ที่ 2 และ 4 ของเดือน 08.30 - 12.00 น.
- สอน.กม.5 อ.เมือง รพ.สต.
คุณหมอแอมป์ยังได้แนะนำหลักง่ายๆ อย่าง "จานสุขภาพ" ให้ทุกคนไปปรับใช้ โดย 50% หรือครึ่งหนึ่งของจานเป็นผักหลากหลายชนิด อีก 25% ที่เหลือเป็นแป้งไม่ขัดสี จำพวกข้าวกล้อง ข้าวไรซ์เบอร์รี่ หรือข้าวพันธุ์ไทยอย่างข้าวสังข์หยด ที่มีกากใย โปรตีน ฟอสฟอรัส และธาตุเหล็กสูงและอีก 25% เป็นโปรตีนจากพืช เช่น ถั่ว เต้าหู้ เนื้อปลา ไข่ขาว
เพราะการดูแลสุขภาพที่ดี คือการดูแลสุขภาพองค์รวม ไม่ใช่แค่เพียงปรับพฤติกรรมอย่างใดอย่างหนึ่ง แต่เป็นการเห็นความสำคัญของทุกเรื่องรวมกัน ทั้งเรื่องของอาหาร การออกกำลังกาย อารมณ์ การนอนหลับอย่างมีคุณภาพ และการอยู่ในสภาพแวดล้อมที่ดี ไม่มีมลพิษ หากเราดูแลร่างกายของเราเสียตั้งแต่ตอนนี้ ก็ไม่ต้องมาวิตกกังวลกับความเสี่ยงต่างๆที่จะเกิดขึ้นในอนาคต
“เพราะสุขภาพคือสมบัติที่สำคัญที่สุด” คุณหมอแอมป์ได้ฝากเอาไว้
คลินิกทันตกรรม Dental Wellness Clinic
Dental Wellness Clinic เราใช้เทคโนโลยีเลเซอร์ เพื่อความสวยงาม และการออกแบบรอยยิ้มด้วยระบบดิจิทัล พร้อมกับเทคโนโลยีดิจิทัลทันสมัย "The Perfect Smile" เฉพาะบุคคล เพื่อเสริมสร้างลักษณะใบหน้าของแต่ละบุคคล
โปรแกรมคลินิกทันตกรรม อาทิ การวิเคราะห์รอยยิ้มแบบเฉพาะบุคคลด้วยระบบเทคโนโลยีแบบ 3D การฟื้นฟูสุขภาพช่องปาก ทันตกรรมรากเทียมด้วยระบบดิจิทัล Digital CAD CAM ทันตกรรมเด็ก
กัญชา” กับผลกระทบต่อสมองเด็กและวัยรุ่น - รพ.ศิครินทร์
เด็กที่มีอายุต่ำกว่า 20 ปี ไม่ควรเข้าถึงและบริโภคกัญชา เนื่องจากสมองยังพัฒนาไม่เต็มที่ การบริโภคกัญชามีผลต่อสมองของเด็ก และอาจส่งผลให้เกิดการเปลี่ยนแปลงโครงสร้างและการทำงานของสมองที่กำลังพัฒนา นอกจากนี้กัญชายังผลข้างเคียงระยะฉับพลันที่รุนแรง โดยแบ่งออกเป็น
อาการทางระบบประสาท: สับสน ซึม เวียนศีรษะ เดินเซ เห็นภาพหลอน ชัก กล้ามเนื้อเกร็งกระตุก
อาการทางระบบหัวใจ: ใจสั่น หัวใจเต้นเร็ว หัวใจเต้นผิดจังหวะ ความดันโลหิตสูง หน้ามืด/วูบ แน่นหน้าอก หัวใจขาดเลือดเฉียบพลัน
อาการทางระบบทางเดินอาหาร: คลื่นไส้ ปวดท้อง อาเจียน
สวนธนบุรีรมย์ เนื้อที่ 63 ไร่
สวนธนบุรีรมย์ เนื้อที่ 63 ไร่ ตั้งอยู่บนถนนพุทธบูชา เขตบางมด เดิมเป็นสวนผลไม้และทุ่งหญ้า เป็นกรรมสิทธิ์ของสำนักงานทรัพย์สินส่วนพระมหากษัตริย์ เช่าพื้นที่โดยกรุงเทพมหานครเพื่อทำเป็นสถานที่เพาะชำต้นไม้บางมด จนเมื่อปี 2511 พระยามไหสวรรย์ ซึ่งดำรงตำแหน่งนายกเทศมนตรีนครธนบุรีในสมัยนั้น เห็นว่าพื้นที่นี้เหมาะสม จึงได้จะทำเป็นสวนสาธารณะ ให้กับประชาชนในพื้นที่ธนบุรี พร้อมกับชื่อใหม่ว่า สวนธนบุรีรมย์ เป็นสวนสาธารณแห่งแรกในเขตธนบุรี
จุดเด่นในสวนธนบุรีรมย์ อาทิ ศาลาชมวิวดูนก บึงน้ำ สวนดอกไม้หายาก อาคารเพาะชำต้นไม้ ไม้ดอก สวนจราจรเยาวชนธนบุรีรมย์
วิสาหกิจชุมชนกลุ่มท่องเที่ยว ชุมชนไตลื้อเมืองลวงเหนือ อ.ดอยสะเก็ด จ.เชียงใหม่
ชาวบ้านลวงเหนือเป็นชนชาวไทยลื้อ อพยพมาจากสิบสองปันนา ตั้งแต่ปี พ.ศ.1932 หรือ 628 ปี มาแล้ว! ปัจจุบันรวมกลุ่มกันเป็น วิสาหกิจชุมชนกลุ่มท่องเที่ยว ชุมชนไตลื้อเมืองลวงเหนือ เปิดต้อนรับนักท่องเที่ยว เสริมจากการเกษตรกรรมและปศุสัตว์ โดยเริ่มด้านท่องเที่ยวจากการสนับสนุนของเทศบาลลงเหนือมาแนะนำให้ทำโฮมสเตย์ ตั้งแต่ปี 2555 ด้วยงบการท่องเที่ยวชุมชน หมู่บ้านโอท็อป และได้ให้บริการต่อเนื่องมาจนถึงปัจจุบัน จุดเด่นของบ้านลวงเหนือ คือการผสมผสานวัฒนธรรมพื้นถิ่นไตลื้อเดิม คู่กับวิถีธรรมชาติ ไร่สวนทุ่งนา เติมด้วยกิจกรรมและจุดสนใจหลายด้าน อาทิ การทำอาหารพื้นเมือง การทำกระดาษสา เฮือนสมุนไพร การทำชา ศูนย์เรียนรู้ภูมิปัญญาไตลื้อ บ้านใบบุญ วัดศรีมุงเมือง วันคู่หมู่บ้าน หรือ เฮือนผีหม้อนึ่ง การหาเหตุและรักษาความเจ็บป่วยแบบวัฒนธรรมเดิม เรียกว่ามาโฮมสเตย์ที่นี่ ได้ครบทุกมิติเวลาแห่งวัฒนธรรมไตลื้อ หรือไทยลื้อ เลยทีเดียว
ที่อยู่ หมู่บ้านลวงเหนือ หมู่4 อ.ดอยสะเก็ด
โทร. 081-9519320, 086-9191915
www.ชนบทที่รัก.com
เทียบสถานการณ์การเงิน สภาพคล่อง
ทั้งนี้ ระบบภูมิคุ้มกันที่ดีสร้างได้โดยเริ่มจากการใช้ชีวิตของเราเอง การรับประทานอาหารที่หลากหลายครบหมู่ รวมถึงสารอาหารบางชนิดจะช่วยเพิ่มประสิทธิภาพในการทำงานของNK Cell อาทิ สารสกัดจากรำข้าว สารสกัดจากเห็ดหลินจือ สารสกัดจากเส้นใยของเห็ดหลายชนิด ถั่งเช่า สารกลุ่มฟลาโวนอยด์ พบได้ในผลไม้ผักใบและธัญพืชหลายชนิด และโพรไบโอติก
สำหรับผู้ป่วยมะเร็งในระยะเริ่มต้น พญ.จิรา ถาวรประดิษฐ์ อธิบายเพิ่มเติมว่า แม้หนึ่งในหน้าที่ของ NK Cell คือการจัดการกับเซลล์ที่มีการแบ่งตัวอย่างผิดปกติ หรือที่เรียกกันว่ามะเร็ง กระบวนการ “รักษา” ไม่ว่าจะด้วยการกินยา ฉายรังสีหรือใช้เคมีบำบัดยังเป็นสิ่งจำเป็น
“มะเร็งเมื่อเป็นแล้ว จำเป็นต้องรักษา เพื่อทำให้เซลล์มะเร็งหายไป ทั้งนี้แล้วการดูแลร่างกาย จิตใจและระบบภูมิคุ้มกันให้แข็งแรง จะช่วยทำให้กระบวนการรักษาโรคและการฟื้นฟูของร่างกายเป็นไปได้อย่างเต็มที่”
ด้วยการแพร่ระบาดของโควิดในช่วง 2 ปีนี้เราพบว่า ภูมิคุ้มกันโรคมีความสำคัญมาก โดยเฉพาะเมื่อไวรัสมีความแข็งแกร่งมากขึ้น การที่ดูแลร่างกายโดยการป้องกันยิ่งเป็นสิ่งจำเป็น รวมถึงทำอย่างไรให้ระบบภูมิคุ้มกันไม่ว่าจะเป็นภูมิคุ้มกันที่สร้างภูมิคุ้มกันในร่างกายลำดับต่อๆ มาหรือ เม็ดเลือดขาวที่เป็นด่านแรกที่เรียกว่า NK Cell ให้มีความแข็งแรงอยู่เสมอ จะช่วยให้คุณภาพชีวิตดีขึ้น ห่างไกลจากโรคติดต่อ และลดความเสี่ยงจากโรคมะเร็ง การป้องกันตั้งแต่ยังไม่มีโรคเป็นสิ่งที่สำคัญที่สุด.
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
5.บุคคลทั่วไปรับยา LAAB ได้หรือไม่
หากมีคำถามว่าบุคคลทั่วไปสามารถรับยา LAAB ได้หรือไม่ คงต้องตอบว่าเบื้องต้นยา LAAB นั้นได้รับ การขึ้นทะเบียนให้ใช้ในกลุ่มประชากรที่เปราะบาง มีความเสี่ยงสูง และมีปัญหาเรื่องภูมิคุ้มกันบกพร่อง รวมถึงประชากรที่ไม่สามารถรับวัคซีนได้ก่อน
Home Isolation และ Hospitel โรงพยาบาลในเครือ THG
Home Isolation รักษาโควิดที่บ้าน โดย โรงพยาบาลในเครือ THG เราพร้อมดูแล โควิด-19 ตั้งแต่ ตรวจหาเชื้อ รักษาตัวที่โรงพยาบาล Home Isolation และ Hospitel
สอบถามรายละเอียดเพิ่มเติม โทร : 084-508-7010
ลิงค์บริการโรงเรียนนวัตกรรมการบริหารจัดการสถานพยาบาล
โรงเรียนนวัตกรรมการบริหารจัดการสถานพยาบาล จัดทำหลักสูตรมาจากปัจจุบันสถานพยาบาลและโรงพยาบาลเพิ่มจำนวนมากขึ้น มีการแข่งขันเพื่อสร้างคุณภาพและมาตรฐานในการให้บริการ ในขณะที่ผู้รับบริการต่างก็มีความต้องการและคาดหวังที่จะได้รับการบริการอย่างทั่วถึง รวดเร็ว มีคุณภาพและมาตรฐานมากยิ่งขึ้น
ซึ่งสวนทางกับปัญหาการให้บริการด้านสุขภาพของสถานพยาบาลในประเทศไทย จากการที่บุคลากรทางการแพทย์ต้องรับภาระงานที่ได้รับมอบหมายนอกเหนือจากการปฏิบัติวิชาชีพคือ งานสนับสนุนที่ได้รับมอบหมายให้ปฏิบัติควบคู่ไปกับการให้บริการรักษาพยาบาล และการบริการทางการแพทย์ ซึ่งการปฏิบัติงานดังกล่าวนี้ส่งผลต่อการทำงานของบุคลากรทางการแพทย์ และส่งผลกระทบโดยตรงต่อคุณภาพในการให้บริการผู้ป่วยที่มารับบริการ
ด้วยเหตุผลดังกล่าวนี้ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ เห็นเป็นโอกาสอันดียิ่งที่จะได้มีส่วนช่วยในการแก้ไขปัญหาการใช้บุคลากรวิชาชีพไม่ตรงตามมาตรฐานวิชาชีพ หรือภาระงานที่ไม่ใช่ภาระงานโดยตรง จึงได้จัดตั้งโรงเรียนนวัตกรรมการบริหารจัดการสถานพยาบาล และพัฒนาหลักสูตรประกาศนียบัตร สาขาวิชานวัตกรรมการจัดการงานธุรการสถานพยาบาล หลักสูตร 1 ปี เป็นหลักสูตรแรกและหลักสูตรเดียวในประเทศไทย จัดการศึกษาที่มุ่งเน้นการฟื้นฟู และพัฒนาทักษะ (Re-skills and Up-skills) ด้วยกระบวนการเรียนการสอนแบบบูรณาการความรู้ควบคู่กับการปฏิบัติงาน (WIL: Work Integrate Learning) เพื่อผลิตผู้สำเร็จการศึกษาที่มีองค์ความรู้ มีทักษะและมีคุณลักษณะเฉพาะที่เหมาะสม มีความพร้อมปฏิบัติงานในการสนับสนุนการดำเนินงานของสถานพยาบาล ตามความชำนาญเฉพาะที่ผู้เรียนเลือกศึกษาอย่างมีคุณภาพคลินิก สวท เวชกรรม ลำปาง LINK
คลินิก สวท เวชกรรม ลำปาง
152 /53-54 ถนนลำปาง-แม่หะ ต.พระบาท อ.เมือง จ.ลำปาง 52000
เปิดทำการ : จันทร์.-ศุกร์ เวลา 09.00-17.00 น.
เปิดทำการ : เสาร์ เวลา 09.00 -17.00 น.
ปิดทำการ : วันอาทิตย์และวันหยุดนักขัตฤกษ์
054-209-577
083-0034 -269
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง
ให้บริการวันจันทร์ และวันพุธ 13-16 น. (เว้นวันหยุดนักขัตฤกษ์)
สอบถามโทร 02-9107314
บริการอื่นๆ สำหรับสตรี
- คลินิกฝากครรภ์ครั้งแรก จันทร์ 13-16 น.
- คลินิกสุขภาพเด็กดี อังคาร, พฤหัสบดี 13-16 น.
- คลินิกครอบครัวอบอุ่น จันทร์ อังคาร พุธ พฤหัสบดี 8-12 น.
- คลินิกสูตินรีเวช (ตรวจรักษาฝากครรภ์ต่อเนื่อง) พฤหัสบดี 8-12 น.
ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง : วงศ์สว่าง 27 (ซอยสายลม) แขวงวงศ์สว่าง เขตบางซื่อ กรุงเทพมหานคร 10800
26 มิถุนายน 2565 เกิดเหตุไฟไหม้ย่านสำเพ็ง เสียชีวิต 2 ราย
26 มิถุนายน 2565 เกิดเหตุเพลิงไหม้ย่านสำเพ็ง หม้อแปลงไฟฟ้าระเบิด ใกล้เคียงท่าน้ำราชวงศ์ ถนนราชวงศ์ พบความเสียหายเกิดขึ้นบริเวณอาคารพาณิชย์ 3 ชั้น พบอาคารพาณิชย์ถูกไฟไหม้เสียหาย 4 คูหา รถยนต์เสียหาย 3 คัน รถจักรยานยนต์ 4 คัน และมีข้อมูลว่าพบผู้เสียชีวิต 2 คน เบื้องต้นทราบว่าเป็นคนไทย 1 คน และแรงงานต่างชาติ 1 คน เจ้าหน้าที่เร่งนำร่างออกจากตัวอาคาร นอกจากนี้ยังพบผู้บาดเจ็บ 6 คน มีอาการสำลักควัน ส่งตัวไปรักษาที่โรงพยาบาล [ThaiPBS]
ประกันสังคมมอบเงินทายาทผู้เสียชีวิตรายที่ 1 เป็นหญิงชาวไทย
สำหรับผู้เสียชีวิตรายแรกที่เป็นชาวไทย สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 1 ลงพื้นที่มอบเงินค่าทำศพและเงินทดแทนแก่ทายาทของนางสาวจิราพัชร สุ่มมาตร์ ลูกจ้างห้างผ้าใบราชวงศ์ ที่เสียชีวิต ณ วัดอ่างแก้ว ซอยเพชรเกษม 23 ถนนเทิดไท แขวงบางหว้า เขตภาษีเจริญ กรุงเทพมหานคร โดยทายาทมีสิทธิได้รับเงินกรณีเสียชีวิตจากกองทุนเงินทดแทน เป็นเงินค่าทำศพ 50,000 บาท และเงินบำเหน็จชราภาพ 134,653 บาท (ยังไม่รวมดอกผล) เงินทดแทนกรณีตาย 1,260,000 บาท รวมเป็นเงินทั้งสิ้น 1,444,653 บาท ให้กับพี่สาวของ น.ส.จิราพัชร ซึ่งเป็นทายาทผู้เสียชีวิต
ด้าน นางอนงวรรณ สุ่มมาตร์ พี่สาวของ น.ส.จิราพัชร ลูกจ้างที่เสียชีวิต กล่าวว่า ขอขอบคุณรัฐบาลและกระทรวงแรงงานที่ได้ดำเนินการให้ความช่วยเหลืออย่างรวดเร็ว และดิฉันสนับสนุนและเชิญชวนให้ลูกจ้างที่ทำงานในห้างร้าน สถานประกอบการทุกคนสมัครเป็นผู้ประกันตนในระบบประกันสังคม เพราะวันหนึ่งเราไม่รู้ว่าจะมีอะไรเกิดขึ้นกับชีวิตเรา อย่างน้อยสิทธิประโยชน์ความเป็นผู้ประกันตนในส่วนนี้จะเยียวยาความเดือดร้อนในเบื้องต้นได้ ซึ่งใครก็ไม่อยากให้เหตุการณ์แบบนี้เกิดขึ้นอีก
ประกันสังคมมอบเงินแก่ทายาทผู้เสียชีวิตรายที่ 2 ลูกจ้างชาวกัมพูชา
สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 1 ลงพื้นที่มอบเงินค่าทำศพแก่ทายาทนาย PHEAK DOEUM ลูกจ้างห้างผ้าใบราชวงศ์ ชาวกัมพูชาที่เสียชีวิต ณ วัดพระพิเรนทร์ ถนนวรจักร แขวงบ้านบาตร เขตป้อมปราบศัตรูพ่าย กรุงเทพมหานคร
ประกันสังคมได้มอบเงินช่วยเหลือทายาทคือ นางสาว SREYNEANG NOB ซึ่งเป็นภรรยาของนาย PHEAK DOEUM ลูกจ้างห้างผ้าใบราชวงศ์ ชาวกัมพูชา จะได้รับค่าทำศพจากกองทุนเงินทดแทน จำนวน 50,000 บาท ค่าทดแทนกรณีตาย 722,904 บาท และเงินบำเหน็จชราภาพ 17,512 บาท (ยังไม่รวมดอกผล) เป็นเงินทั้งสิ้น 790,416 บาท
ต่อกรณีนี้ แม้ลูกจ้างจะเป็นชาวต่างด้าว ประกันสังคมยังคงดูแลช่วยเหลือลูกจ้างให้ได้รับสิทธิประโยชน์ตามกฎหมายประกันสังคมอย่างเร่งด่วน แม้เกิดกับลูกจ้าง ผู้ประกันตน ที่เป็นชาวต่างด้าวทุกคนโดยไม่คำนึงสัญชาติ อย่างเท่าเทียมกัน
สำนักงานประกันสังคม มีเจตนารมณ์ที่ดีที่จะให้แรงงานต่างด้าวได้เข้ามาทำงาน โดยขึ้นทะเบียนอย่างถูกต้องตามกฎหมาย แม้เกิดเหตุการณ์ไม่คาดฝัน ก็จะได้รับการดูแลสิทธิประโยชน์จากกองทุนประกันสังคม และกองทุนเงินทดแทน อย่างครบถ้วน ทันท่วงที เพราะลูกจ้าง ผู้ประกันตน ทุกคนคือคนในครอบครัวประกันสังคม
รายชื่อร้านยาในภาคตะวันออกเฉียงเหนือ
ไอเดียบู้ทเท่ๆ ต้องมา
ถึงเป็นวิสาหกิจชุมชน แต่ห้ามไม่ได้สำหรับไอเดียออกแบบบู้ทเท่ๆ เตะตา เรียกแขกได้ไม่น้อย ผลิตภัณฑ์สมุนไพรที่คัดมาให้ชม ก็ว้าวไม่เบา
รายชื่อ ข้อมูล/เบอร์ติดต่อ รพ.ดูแลผู้ป่วยโควิด ทั้ง 3 สิทธิ
ข้อมูล/เบอร์ติดต่อหน่วยงานดูแล ผู้ป่วยโควิด ของรัฐ 3 สิทธิ
+++++
ขั้นที่ 5 หากมีปัญหาสุขภาพ โทร.02-3539690 หรือ 02-3539686 หรือ 02-3536980
9Care แอปปรึกษาสุขภาพ โรงพยาบาลพระรามเก้า
9Care เป็น application ให้คำปรึกษาปัญหาสุขภาพโดยแพทย์ผู้เชี่ยวชาญเฉพาะทางทุกสาขา จากโรงพยาบาลพระรามเก้า ผ่านทาง VDO call และส่งยาถึงมือท่านโดยไม่ต้องออกจากบ้าน สะดวก รวดเร็ว ชำระเงินออนไลน์ได้อย่างปลอดภัย สอบถามข้อมูลการใช้งานเพิ่มเติมได้ที่โรงพยาบาลพระรามเก้า โทร 1270
ดาวน์โหลดได้ ที
Apple storeอย.ย้ำ ปรับกฏหมาย-ระเบียบ ตามอนุสัญญาเดี่ยวยาเสพติดของ UN
ภก.วีระชัย นลวชัย รองเลขาธิการคณะกรรมการอาหารและยา (อย.) กล่าวว่า กรณีที่มีการอภิปรายว่า การปลดล็อกกัญชาของประเทศไทยอาจจะผิดข้อตกลงอนุสัญญาเดี่ยวว่าด้วยยาเสพติด ค.ศ. 1961 นั้น
อย. ขอชี้แจงว่า ในบทบัญญัติตามอนุสัญญาเดี่ยวนั้น มีการกำหนดควบคุมกัญชาไว้ใน 2 ตาราง คือ ตารางที่ 1 ใช้ทางการแพทย์และวิทยาศาสตร์ ตารางที่ 4 กัญชาเป็นยาเสพติด แต่ต่อมาทางองค์การสหประชาชาติได้มีการตัดการควบคุมกัญชาออกจากตารางที่ 4 ตามคำแนะนำขององค์การอนามัยโลก
เพราะฉะนั้นประเทศไทยจึงได้มาปรับปรุงกฎหมาย กฎระเบียบภายในประเทศเพื่อให้สอดคล้องกับข้อกำหนดดังกล่าว เพื่อใช้ทางการแพทย์ เพื่อสุขภาพได้
"เรากำกับการใช้กัญชาเป็นสมุนไพร อาหาร และเครื่องสำอาง ดังนั้นขอให้มั่นใจว่าประเทศไทย กระทรวงสาธารณสุข และ อย. ปฏิบัติสอดคล้อง อนุสัญญาเดี่ยวว่าด้วยยาเสพติด ค.ศ. 1961 แน่นอน"
เนื่องในโอกาสครบรอบ 50 ปี บริษัท กรุงเทพดุสิตเวชการ จำกัด (มหาชน) มุ่งมั่นในการเป็นผู้นำบริการด้านสุขภาพเพื่อความเป็นอยู่ที่ดีบนวิถีของความยั่งยืน พร้อมส่งคืนคุณค่าสู่สังคมด้วยการยกระดับการเข้าถึงบริการด้านสุขภาพ ผ่านการส่งมอบความรอบรู้ด้านสุขภาพในประเด็นการช่วยชีวิตขั้นพื้นฐาน ตลอดจนส่งเสริมความรอบรู้ด้านสุขภาพแก่ชุมชนและสังคมเพื่อยกระดับความเป็นอยู่ที่ดี โดยสนับสนุนให้โรงพยาบาลในเครือข่ายที่มีอยู่ทั่วประเทศได้จัดทำการอบรม ตั้งเป้า 10,000 คน ที่จะเป็นผู้มีความสามารถในการช่วยชีวิตในปีนี้
Sukhumweed สุขุมวิท 42 พระโขนง
Sukhumweed สุขุมวิท 42 พระโขนง ร้านดังที่พูดถึงกันมาก ส่องดูข้อมูล sukhumweed industries น่าทึ่งกับแนวทางการลงทุนและพัฒนากับวิสาหกิจ หลายแห่ง Nahi Farm (วิสาหกิจชุมชนนาฮีเกษตรรุ่งเรือง) Ponpisai Farm (วิสาหกิจชุมชนฮักจังโนนศิลา) Ta Bo Farm (วิสาหกิจชุมชนเกษตรรวมใจโคกถํ้าเทพนิมิตร) เยี่ยมขนาดนี้ ผลผลิตย่อมคุณภาพอย่างแน่นอน
โปรแกรมฟื้นฟูอัมพฤกษ์ อัมพาต LINK
คอร์สรักษา 5 ครั้ง 3,500 บาท โปรแกรมฟื้นฟูอัมพฤกษ์ อัมพาต ในผู้ป่วยที่มีอาการอ่อนแรงของกล้ามเนื้อ อัมพฤกษ์ อัมพาต ครึ่งซีก ด้วยการแพทย์แผนไทย-จีนและกายภาพบำบัด
สอบถามโทร. 053-917589
"เกาะสมุย" ไม่เป็นสองรองภูเก็ต-หัวหิน
ต้องยอมรับว่า “เกาะสมุย” ไม่เป็นสองรองภูเก็ต หัวหิน เพราะเป็นสถานที่ท่องเที่ยวสำคัญของจ.สุราษฎร์ธานีและมีชื่อเสียงในด้านความสงบ ความสวยงามทางธรรมชาติ มีชายหาดทอดยาวเป็นแนวโค้งที่ขาวสะอาด มีผืนป่าที่ยังอุดมสมบูรณ์และมีน้ำตกที่มีชื่อเสียง ทำให้สามารถทำกิจกรรม อาทิเช่น ดำน้ำ เดินป่า ดูนก กิจกรรมริมชายหาด ซึ่งมีความหลากหลาย นอกจากนี้ยังมีหมู่บ้านชาวประมง สามารถเรียนรู้วิถีชีวิตและภูมิปัญญาท้องถิ่นที่ยังคงความเป็นเอกลักษณ์เอาไว้ ตามวัตถุประสงค์หลักของการท่องเที่ยวเชิงสุขภาพและตอบโจทย์เหมาะสำหรับการส่งเสริมสู่ “Wellness tourism”
ขณะเดียวกันในปี 2561 Global Wellness Institute รายงานอัตราการเติบโตด้าน Wellness Tourism ของทวีปเอเชีย สูงเป็นอันดับ 1 ของโลก หรือเติบโต 33% ภายในช่วงเวลา 2 ปี จาก 194 ล้านทริป เป็น 258 ล้านทริป ประเทศไทย ติดอันดับ 4 ของเอเชียและข้อมูลจากศูนย์วิจัยกสิกรไทย ปี 2560 ไทยมีนักท่องเที่ยวเชิงสุขภาพสูงถึง 12.5 ล้านคนต่อปี สร้างรายได้จากการท่องเที่ยวได้สูงถึง 409,000 ล้านบาท การจ้างงานสูงถึง 530,000 คน การท่องเที่ยวเชิงสุขภาพจึงเป็นอีกหนึ่งอาวุธสำคัญที่เข้ามาช่วยเพิ่มศักยภาพของอุตสาหกรรมท่องเที่ยวให้กับประเทศ เพราะสามารถดึงดูดนักท่องเที่ยวที่มีกำลังซื้อสูง มีจำนวนวันพักที่ยาวนานและมีการใช้จ่ายเฉลี่ยต่อการท่องเที่ยวแต่ละครั้งสูงกว่านักท่องเที่ยวแบบปกติ
อันดับที่ 5 รพ.สมิติเวช สุขุมวิท 82.82%
โรงพยาบาลสมิติเวช สุขุมวิท ในเครือของโรงพยาบาลกรุงเทพ จากเมื่อเริ่มเปิดให้บริการครั้งแรกเมื่อปี 2522 เพื่อให้บริการดูแลสุขภาพประชาชนในเขตวัฒนา พระโขนงและพื้นที่โดยรอบ กว่า 40 ปีผ่านไป โรงพยาบาลสมิติเวช สุขุมวิท ได้ยกระดับขึ้นเป็นโรงพยาบาลระดับนานาชาติไปแล้ว ด้วยศักยภาพระดับสูงที่ได้รับการยอมรับในการให้บริการดูแลผู้ป่วยชาวต่างชาติทั้งในประเทศไทยและในต่างประเทศ ปัจจุบันโรงพยาบาลสมิติเวช มีโรงพยาบาลเครือข่ายสาขารวม 8 แห่ง ใน 2 จังหวัดหลักคือ กรุงเทพ และชลบุรี
No Man’s Land เปิดรับสมัครคนร่วมทีม ตำแหน่ง
มือโรลกัญชา บาริสต้า พนักงานประจำร้าน ผู้จัดการร้าน
อายุ 20-40 ปี มีใจรักบริการ สือสารภาษาอังกฤษได้ดี อัธยาศัยดี สุภาพเรียบร้อย ทำงาน 6 วันต่อสัปดาห์ เงินเดือน 16,000 - 40,000 ติดต่อ 063-2232282
แสดงอัตราค่ารักษาพยาบาล และสอบถามอัตราค่ารักษาได้
กระทรวงสาธารณสุข
นพ.โอภาสกล่าวว่า การปฏิรูปประเทศด้านสาธารณสุขมีความก้าวหน้าอย่างต่อเนื่อง โดยเฉพาะช่วงการระบาดของโรคโควิด 19 ประเทศไทยได้พลิกวิกฤตและความท้าทายเป็นโอกาสในด้านต่างๆ โดยเฉพาะด้านสาธารณสุขที่มีการสร้างความร่วมมือกันของทุกภาคส่วนและพัฒนาจนเป็นที่ยอมรับของนานาชาติ ทั่วโลกได้ชื่นชมการบริหารสถานการณ์ภาวะฉุกเฉินในการรับมือโควิดของไทยว่า เกิดจากความเข้มแข็งของระบบบริการสุขภาพปฐมภูมิ รวมถึงการมีส่วนร่วมของประชาชน อสม. ภาคส่วนต่างๆ ที่เข้ามาร่วมมือกันแก้ปัญหาโควิด 19 ภายใต้การนำของรัฐบาลที่มีประสิทธิภาพ แสดงถึงความสำคัญของการจัดระบบสุขภาพปฐมภูมิที่ทำให้ประชาชนเข้าถึงบริการสุขภาพกับหมอครอบครัวได้สะดวกและรวดเร็ว สามารถหยุดความรุนแรงของโรคและลดภาวะแทรกซ้อนได้ ส่งผลให้เกิดความมั่นคงด้านสุขภาพและความมั่นคงทางเศรษฐกิจตามมา
นพ.โอภาสกล่าวต่อว่า ที่ผ่านมาเขตชนบทมักเข้าไม่ถึงระบบสาธารณสุข แต่ปัญหาขณะนี้เปลี่ยนไปเนื่องจากพื้นที่ชนบทมีระบบ อสม. โรงพยาบาลส่งเสริมสุขภาพตำบล และโรงพยาบาลชุมชน ทำงานเชื่อมโยงกัน ต่างจากชุมชนเมือง เช่น ในกรุงเทพมหานคร ที่ต้องพัฒนารูปแบบใหม่ของบริการสุขภาพปฐมภูมิให้สอดคล้องกับวิถีชีวิต ซึ่งมีข้อเสนอจากคณะกรรมการปฏิรูปประเทศด้านสาธารณสุขในการพัฒนาการแพทย์ปฐมภูมิ เช่น การพัฒนากลุ่มอาสาสมัครในกรุงเทพมหานคร, การนำเทคโนโลยีดิจิทัลและการเชื่อมโยงข้อมูลสุขภาพมาช่วยเพิ่มศักยภาพการบริการให้กับประชาชน การนำนวัตกรรม เช่น ระบบ Telemedicine แอปพลิเคชัน Smart อสม.ฯลฯ มาช่วยเพิ่มประสิทธิภาพการรักษา โดยกระทรวงสาธารณสุขพร้อมสนับสนุนตามที่กรุงเทพมหานครร้องขอ
“การปฏิรูปต้องเน้นเรื่อง Digital Health หากมีการเชื่อมโยงข้อมูลที่รวดเร็วจะทำให้ประชาชนเป็นเจ้าของข้อมูลสุขภาพของตนเองอย่างแท้จริง รวมถึงต้องสร้างความมั่นคงยา วัคซีน และอื่นๆ โดยคณะกรรมการปฏิรูปประเทศด้านสาธารณสุข ได้นำประเด็นเหล่านี้มาหารือเพื่อสร้างความร่วมมือกับหน่วยงานที่เกี่ยวข้อง ซึ่งการขับเคลื่อนไม่ได้เริ่มจากศูนย์ เนื่องจากเรามีกฎหมายที่เกี่ยวข้องที่สามารถดำเนินการแก้ไขปรับปรุงให้ระบบยั่งยืนและชัดเจนมากขึ้นได้ นอกจากนี้ เรายังมีนโยบาย 3 หมอ ที่ยกระดับ อสม.เป็นหมอคนแรกของประชาชน ขณะที่ กทม.มีระบบ อสส. ซึ่งถ้าใช้ดิจิทัลแพลตฟอร์มร่วมกัน อสม.และ อสส.ทั้งประเทศจะเกิดความเชื่อมโยงอย่างแท้จริง โดยทั้งหมดจะเดินหน้าภายใต้นโยบายของรัฐมนตรีว่าการกระทรวงสาธารณสุข เรื่อง Health for Wealth คือ เศรษฐกิจจะดี สุขภาพต้องดีก่อน”
งานมหัศจรรย์งานศิลป์แผ่นดินไทย (Miracle of the Arts of the Kingdom) 12-14, 20-21 และ 27-28 สิงหาคม 2565 LINK
เชิญชวนทุกท่านร่วมงานมหัศจรรย์งานศิลป์แผ่นดินไทย (Miracle of the Arts of the Kingdom) เพื่อสำนึกในพระมหากรุณาธิคุณของสมเด็จพระบรมราชชนนีพันปีหลวง ผู้ทรงเป็นแม่ของแผ่นดิน เนื่องในวโรกาสวันเฉลิมพระชนมพรรษาสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง มหามงคลเฉลิมพระชนมพรรษา 90 พรรษา ในวันที่ 12 สิงหาคม 2565 และสร้างภาพลักษณ์ในการรักษาศิลปวัฒนธรรมอันดีของไทย ตลอดจนสร้างการรับรู้อัตลักษณ์งานหัตถศิลป์อันทรงคุณค่าของไทย
วันที่ 12-14, 20-21 และ 27-28 สิงหาคม 2565
เวลา 10.00-19.00 น.
ณ พิพิธภัณฑ์ศิลป์แผ่นดิน ต.เกาะเกิด อ. บางปะอิน จ.พระนครศรีอยุธยา
เขตมีนบุรี ลุยต่อเนื่อง บูรณาการ ดับเพลิง ตำรวจสุ่มตรวจความปลอดภัยของอาคาร ป้องกันอัคคีภัยเชิงรุก สถานประกอบการ สถานบริการ LINK
9 สิงหาคม 2565 ช่วงค่ำ นายไพโรจน์ จันทรอด ผู้อำนวยการเขตมีนบุรี พร้อมผู้ช่วยผู้อำนวยการเขตมีนบุรี หัวหน้าฝ่ายปกครอง หัวหน้าฝ่ายโยธา หัวหน้าฝ่ายเทศกิจ และหัวหน้าฝ่ายสิ่งแวดล้อมฯ นำเจ้าหน้าที่ที่เกี่ยวข้องร่วมกับ เจ้าหน้าที่สถานีดับเพลิงบางชัน และเจ้าหน้าที่ตำรวจ นำโดย พ.ต.อ.กฤษ ก้อมน้อย ผกก.สน.มีนบุรี ลงพื้นที่ตรวจความปลอดภัยของอาคาร พร้อมตรวจเข้มมาตรการป้องกันเหตุอัคคีภัยและเช็คมาตรฐานความปลอดภัยด้านต่างๆ ของสถานประกอบการ โดยสุ่มตรวจสอบสถานประกอบการประเภทร้านอาหาร สถานบันเทิง และสถานประกอบการที่ให้บริการคล้ายสถานบันเทิง ในพื้นที่เขตมีนบุรี
>>โดยตรวจความปลอดภัยด้านอาคาร อาทิเช่น ทางหนีไฟ ถังดับเพลิงและมาตรการป้องอัคคีภัยของสถานประกอบการ พร้อมกำชับผู้ประกอบการสถานบริการ ให้ปฏิบัติตามมาตรฐานความปลอดภัย โดยเฉพาะการเตรียมความพร้อมทางหนีไฟ ถังดับเพลิงพร้อมใช้งานอยู่เสมอ ป้ายทางหนีไฟเรืองแสง ไฟฉุกเฉิน และให้มีการอบรมการอพยพหนีไฟ เพื่อป้องกันอัคคีภัย สร้างความปลอดภัยในชีวิตและทรัพย์สินของประชาชนที่มาใช้บริการในสถานประกอบการ รวมทั้งมาตรการป้องกันการแพร่ระบาดของ COVID19 ซึ่งจะมีการตรวจติดตาม ประเมินผล การดำเนินการแก้ไขปรับปรุงให้ได้ตามมาตรฐาน กับผู้ประกอบการอย่างต่อเนื่องต่อไป เพื่อความปลอดภัยสูงสุดของผู้มาใช้บริการและประชาชนใกล้เคียง
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ศบส1 สะพานมอญ
บริการทุกวันศุกร์ 13-16 น.
คลินิกวางแผนครอบครัว
คลินิกวางแผนครอบครัว
วัน-เวลาทำการ
วันพุธ 13.00-16.00 น.
(หยุดวันหยุดนักขัตฤกษ์)
ขอบเขตการให้บริการ
1. ให้คำปรึกษาการวางแผนครอบครัว
2. ให้บริการการคุมกำเนิด 3 วิธี คือ การฉีดยาคุม, การจ่ายยาคุมชนิดเม็ด และ การแจกถุงยางอนามัย
3. ให้บริการการตรวจคัดกรองมะเร็งอวัยวะสืบพันธ์ุสตรีในระยะเริ่มต้น
4. ให้บริการส่งเสริมสุขภาพสตรีวัยทองอายุ 45 ปีขึ้นไป
ใช้สิทธิเพื่อรับการตรวจรักษาโรคโควิดแบบ Home Isolation LINK
ประกาศ ตั้งแต่ 17 มีนาคม 2565
สำหรับ "ผู้ประกันตนประกันสังคมที่โรงพยาบาลทีอาร์พีเอช"
สำหรับ "ผู้ใช้สิทธิบัตรทอง "
✅สามารถใช้สิทธิเพื่อรับการตรวจรักษาโรคโควิดแบบ Home Isolation ที่ รพ.ทีอาร์พีเอช จ.ตรัง ( ไม่มีค่าใช้จ่าย วันละ 150 คิว )
สำหรับสิทธิข้าราชการ, ผู้ประกันตนโรงพยาบาลอื่น และรัฐวิสาหกิจใช้สิทธิรักษาโดยไม่มีค่าใช้จ่ายที่โรงพยาบาลต้นสังกัด
ปรับระบบรักษา “โควิด” กลับสู่ภาวะปกติ ตั้งแต่ 4 กรกฎาคม 2565
ปรับระบบรักษา “โควิด” กลับสู่ภาวะปกติ
ตั้งแต่ 4 กรกฎาคม 2565
ยกเลิกรักษาผู้ติดเชื้อโควิดในรูปแบบ
กักตัวที่บ้าน - กักตัวที่โรงแรม - เจอแจกจบ
โดยปรับระบบรักษาเป็นแบบผู้ป่วยนอก (OPD)
เนื่องด้วยสถานการณ์โควิด19 ในประเทศไทยได้พ้นการระบาดใหญ่ของโควิด-19 ( Post-Pandemic) กระทรวงสาธารณสุขได้ประกาศแนวทางปรับระบบรักษากลับสู่ภาวะปกติ
โรงพยาบาลบางปะกอก 8
พร้อมรองรับให้การรักษาแก่ผู้ประกันตนประกันสังคมโรงพยาบาลบางปะกอก 8
.
“ ติดโควิดยังคงรักษาตามสิทธิ ”
.
ตามแนวทางและนโยบายที่ภาครัฐกำหนดและยังคงรักษามาตรการการป้องกันและควบคุมการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ตามมาตรฐานสากล
หมายเหตุ :
ผู้ป่วยติดเชื้อโควิดสามารถเดินทางมาติดต่อเข้ารับบริการได้ทุกวัน (Walk In)
**สำหรับผู้ที่มีสิทธิประกันสังคมโรงพยาบาลบางปะกอก 8 รักษาตามสิทธิ**
***ผู้ป่วยสิทธิทั่วไป สามารถเข้ารับบริการได้ โดยเสียค่ารักษาพยาบาลตามปกติ***
สอบถามรายละเอียดเพิ่มเติม โทร 02-109-8111
คุณชุลิกา สายศิลา ผู้จัดการด้านการวางแผนกลยุทธ์ บริษัท สไปซี่ ฮาคูโฮโด จำกัด กล่าวเสริมว่า "ผู้คนเริ่มมีความสุขกับปัจจุบันและมั่นคงกับสถานะความสุขของตนเอง พร้อมออกไปใช้ชีวิตอย่างปกติ และเพิ่มโอกาสให้ตนเองและครอบครัวมีความสุขกับปัจจุบัน โดยไม่ต้องคอยกังวล เพื่อที่จะทดแทนความสุขที่ขาดหายไปในช่วง 2 ปีที่ผ่านมา การที่ผลสำรวจออกมาว่าระดับความสุขของคนไทยกำลังเพิ่มขึ้นอย่างต่อเนื่อง จึงเป็นสัญญาณบวกที่ดีทั้งในด้านเศรษฐกิจและบรรยากาศในการใช้ชีวิต พ่อค้าแม่ค้าก็จะกลับมามีรายได้ที่คึกคักขึ้นรวมไปถึงธุรกิจที่เกี่ยวกับการท่องเที่ยวที่ซบเซามาอย่างยาวนานก็จะกลับมาเฟื่องฟู"
Ms. Chutima Viriyamahakul, Business Director at Hakuhodo Institute of Life and Living ASEAN (Thailand), gave a closing remark on the current trend, stating that “Thai people are now ready to hit ‘restart’ on seeking answers to social issues and are looking forward to a better tomorrow.”
Thai consumers are becoming less interested in Covid-19 news as collective interest has shifted to new topics and changes, such as the recently-elected Bangkok governor and information about inflation and economic conditions.
Regarding the present topics of interest, Thais will invest their attention and dig deeper into the surrounding issues to help inform them of the best route forwards. For instance, they will be more concerned about expensive petrol, price hike, daily-life issues, inflation, and economic conditions.
5.โรงงานหมิงตี้ระเบิด บทเรียนภัยพิบัติจากโรงงานสารเคมี
การระเบิดของโรงงาน บจก.หมิงตี้ฯ ก่อให้เกิดความเสียหายต่อทรัพย์สนของรัฐ เอกชน และประชาชนเป็นจำนวนมาก อีกทั้งสร้างผลกระทบทางสิ่งแวดล้อมเป็นวงกว้าง กลุ่มควันสีดำขนาดใหญ่ปกคลุมทั่วบริเวณ จนสามารถมองเห็นไกลออกไปหลายสิบกิโลเมตร
คาเฟ่ กัญชา Mary Jane KasetNavarmin
แนะนำคาเฟ่ลึกลับ ย่านประเสริฐมนูกิจ เกษตร-นวมินทร์
ที่ร้านจำหน่ายเครื่องดื่ม ชา กาแฟ ม็อคเทล มีสูตรออริจินอล และ ผสมน้ำชากัญสูตรเข้มข้น
หรือ จะเป็น ม็อคเทลสูตรฟิวชั่นกับน้ำกระท่อมเข้มข้น ด้วยสูตรพิเศษเฉพาะ ดีกรีบาร์เทนเดอร์จาก Iron Chef ประสบการณ์มากความสามารถ เราก็มีจำหน่ายช่อดอกกัญชาหลายสายพันธุ์ให้เลือก
ร้านเปิดวันอังคาร-อาทิตย์ 10.00-19.00 น
หน่วยสุขภาพเคลื่อนที่เชิงรุก
เน้นหนักการบริการและรณรงค์เกี่ยวกับโรคติดต่อทางเพศสัมพันธ์ ให้การปรึกษาและบริการตรวจเลือดหาการติดเชื้อเอชไอวีและซิฟิลิส ความรู้เรื่องโรคเอดส์ รวมถึง ตรวจคัดกรองมะเร็งปากมดลูก ตรวจเต้านม ด้วยได้ ในกลุ่มเป้าหมายพนักงานบริการชาย–หญิงในสถานบริการ สถานบันเทิง
คลินิกผู้สูงอายุ โรงพยาบาลสงขลา
บริการอังคาร และ ศุกร์ 8-12 น. มีบริการคัดกรองประเมินอาการทางผู้สูงอายุ และพัฒนาศักยภาพสมอง ทุกจันทร์-ศุกร์ โดยพยาบาลเฉพาะทาง
BMA Traffic ตรวจวัดและรายงานสภาพการจราจร ระบบกล้องโทรทัศน์วงจรปิด LINK
แอป BMA Traffic (Traffic and Transportation Department) ใช้สำหรับแสดงสภาพการจราจร เส้นทางหลักภายในพื้นที่วงแหวนรัชดาภิเษกชั้นในของกรุงเทพมหานคร โดยแสดงได้ทั้งรูปแบบเส้นสีตัวแทนสภาพจราจรและในรูปแบบของภาพเคลื่อนไหวแบบ real time พร้อมทั้งมีการแสดงข่าวสารต่างๆและระบบการแจ้งเตือนเหตุการณ์ให้ผู้ใช้งานทราบเมื่อมีเหตุการณ์เกิดขึ้นในแนวถนนที่ผู้ใช้งานสนใจ พร้อมทั้งมีระบบสมาชิก ให้ผู้ใช้งานมีส่วนร่วมในการแจ้งข่าวเหตุการณ์ต่างๆ
ลิซ ทรัสส์ นายกรัฐมนตรีอังกฤษกล่าวคำไว้อาลัย
9 ก.ย.2565 ลิซ ทรัสส์ นายกรัฐมนตรีอังกฤษกล่าวคำไว้อาลัยและสดุดีสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 ท่ามกลางประชาชนที่ไปรวมตัวกันหน้าพระราชวังบักกิงแฮม และปราสาทบัลมอรัลเพื่อวางดอกไม้แสดงความอาลัยต่อกษัตริย์อังกฤษที่ครองราชย์นานถึง 70 ปี
ขณะที่หลายสถานที่เริ่มขึ้นภาพไว้อาลัย ทั้งในอังกฤษและในต่างประเทศ โดยสำนักพระราชวังบักกิงแฮมลดธงครึ่งเสา หลังมีแถลงการณ์อย่างเป็นทางการว่า สมเด็จพระราชินีนาถเอลิซาเบธที่ 2 เสด็จสวรรคตแล้ว
ลิซ ทรัสส์ กล่าวคำอาลัย "ควีนเอลิซาเบธที่ 2" ชาวอังกฤษวางดอกไม้หน้าวัง [ThaiPBS]
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านธรรมปกรณ์ (เชียงใหม่)
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านธรรมปกรณ์ (เชียงใหม่)
เลขที่ 1 ถ.มูลเมือง อ.เมือง จ.เชียงใหม่ 50200
โทรศัพท์ : 0-5327-8573 โทรสาร : 0-5328-1206
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านธรรมปกรณ์ เชียงใหม่ เดิมใช้ชื่อว่า "สถานสงเคราะห์คนชราบ้านธรรมปกรณ์ เชียงใหม่" ได้ก่อตั้งเมื่อวันที่ 1 ตุลาคม 2498 นับเป็นสถานสงคราะห์คนชราแห่งที่ สองของประเทศไทยถัดจากสถานสงเคราะห์คนชราบ้านบางแค เริ่มแรกมีวัตถุประสงค์ในการจัดตั้ง เพื่อรับอุปการะเลี้ยงดูผู้สูงอายุที่มีภูมิลำเนาในจังหวัดภาคเหนือรวม 12 จังหวัด ซึ่งประสบปัญหาความเดือดร้อน ไม่มีผู้อุปการะเลี้ยงดู จนกระทั่งเมื่อวันที่ 30 ธันวาคม 2546 ได้ปรับบทบาทจากหน่วยงานที่ให้การดูแลผู้สูงอายุในรูปแบบสถานสงเคราะห์ แต่เพียงอย่างเดียวมาเป็นงานส่งเสริมสนับสนุนการดำเนินงานด้านการจัดสวัสดิการสังคมผู้สูงอายุ จึงได้เปลี่ยนชื่อเป็น "ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านธรรมปกรณ์ เชียงใหม่" เมื่อวันที่ 2 พฤศจิกายน 2548 โดยมีพื้นที่รับผิดชอบ “ จังหวัด คือ จังหวัดเชียงใหม่ เชียงราย แม่ฮ่องสอน ลำพูน พะเยา แพร่ น่าน และเมื่อมีการปรับโครงสร้างกระทรวงการพัฒนาสังคม และความมั่นคงของมนุษย์ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านธรรมปกรณ์ เชียงใหม่ จึงเปลี่ยนลังกัดจากกรมพัฒนาสังคมและสวัสดิการ มาลังกัดกรมกิจการผู้สูงอายุ เมื่อวันที่ 6 มีนาคม 2558
เป้าประสงค์
1. ผู้สูงอายุได้รับการจัดสวัสดิการและคุ้มครองสิทธิอย่างมีประสิทธิภาพ
2. ส่งเสริมการใช้นวัตกรรมเพื่อผู้สูงอายุทั้งประเทศ
3. สร้างกลไกประชารัฐเพื่อสังคมผู้สูงอายุ
4. ผู้สูงอายุสามารถดูแลตัวเองได้
5. ยกระดับประสิทธิภาพของการบริหารจัดการ
รูปแบบการดำเนินงาน
1. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุแบบสถาบัน (Social welfare services for older persons under institutional care center)
หมายถึง การจัดบริการสวัสดิการสังคมและคุ้มครองผู้สูงอายุแบบเต็มเวลา การจัดบริการสวัสดิการสังคมและคุ้มครองผู้สูงอายุแบบบริการทางสังคม รวมทั้งการจัดบริการสวัสดิการสังคมและคุ้มครองผู้สูงอายุในกรณีฉุกเฉิน
2. ศูนย์การจัดสวัสดิการผู้สูงอายุในชุมชน (Social welfare services for older persons within communities center)
หมายถึง การส่งเสริมและสนับสนุนองค์ความรู้และกิจกรรม การพัฒนาศักยภาพผู้สูงอายุ การส่งเสริมสนับสนุนให้ชุมชนและท้องถิ่นมีส่วนร่วมในการจัดสวัสดิการสังคมสำหรับผู้สูงอายุ รวมถึงการส่งเสริมสนับสนุนให้ชุมชนและสังคมมีทัศนคติเชิงบวกกับผู้สูงอายุ
3.ศูนย์การเรียนรู้และให้คำปรึกษาด้านผู้สูงอายุ (Learning and Counseling Center)
หมายถึง การบริการและสนับสนุนการศึกษาดูงาน การฝึกอบรมภาคทฤษฎีและภาคปฎิบัติ การศึกษาวิจัย และการจัดการความรู้ด้านผู้สูงอายุ การสนับสนุนการถ่ายทอดความรู้ด้านอาชีพและภูมิปัญญาผู้สูงอายุ รวมถึงการบริการให้คำปรึกษาแนะนำผ่านช่องทางต่าง ๆ
4. ศูนย์บริการข้อมูลด้านผู้สูงอายุ (Data Center)
หมายถึง การจัดเก็บข้อมูลสถิติการให้บริการหรือการดำเนินงานของศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ ในพื้นที่บริการ การจัดเก็บรวบรวมสถิติข้อมูลที่เกี่ยวข้องกับผู้สูงอายุในพื้นที่บริการ รวมถึงการรวบรวมข้อมูลทำเนียบเครือข่ายการดำเนินงานด้านผู้สูงอายุ
ผู้สูงอายุที่มีความประสงค์เข้าใช้บริการในศูนย์ฯ ต้องมีคุณสมบัติ ดังนี้
มีอายุเกิน 60 ปีบริบูรณ์ขึ้นไป และมีสัญชาติไทย
ไม่เป็นผู้ต้องหาว่ากระทำผิดอาญา และอยู่ระหว่างการสอบสวนของพนักงานสอบสวน หรืออยูระหว่างการพิจารณา ของศาล
ไม่เป็นโรคติดต่อ ตามพระราชบัญญัติโรคติดต่อ พ.ศ. 2523
มีความสมัครใจ
สามารถช่วยเหลือตนเองได้ในกิจวัตรประจำวัน
ไม่มีอาการทางจิตที่รุนแรง หรือมีพฤติกรรมด้านลบที่จะส่งผลกระทบต่อผู้อื่น
ไม่ติดสารเสพติด หรือติดสุรา
กรณีคนเร่รอน ถูกทอดทิ้ง หรือไร้ทีพึ่ง ต้องผ่านกระบวนการตามพระราชบัญญัติคุ้มครองคนไร้ที่พึ่ง พ.ศ. 2557 ก่อน เช่น การเยี่ยมครอบครัว/ชุมชน การหาอาชีพที่เหมาะสม เป็นต้น
ประสบปัญหาความเดือดร้อนอย่างใดอย่างหนึ่ง ดังนี้
1. ฐานะยากจน
2. ไม่มีที่อยู่อาศัย
3. ขาดผู้อุปการะ หรือผู้ให้การช่วยเหลือดูแล
ข้อมูลผู้สูงอายุใช้บริการในศูนย์ฯ (ล่าสุดมิถุนายน 2565)
จำนวนผู้สูงอายุในการดูแล 123 คน ชาย 60 คน หญิง 63 คน
แบ่งตามช่วงอายุ ได้ดังนี้
ช่วงอายุ 60-69 ปี 29 คน
ช่วงอายุ 70-79 ปี 57 คน
ช่วงอายุ 80-89 ปี 33 คน
ช่วงอายุ 90 ปีขึ้นไป 4 คน (อายุ 94 ปี)
ศักยภาพการช่วยเหลือตนเองได้ แบ่งเป็น 3 ระดับ ดังนี้
ช่วยเหลือตนเองได้มาก 51 คน ช่วยเหลือตนเองได้บางส่วน 53 คน ช่วยเหลือตนเองได้น้อย 19 คน
บริการผู้ป่วยใน VIP-IPD
การจัดการผู้ป่วยใน บริการจองห้องพิเศษ พร้อมรายละเอียด สิทธิประโยชน์ อัตราค่าบริการ และอุปกรณ์อำนวยความสะดวก
5.ประเภทประชาชน คือ นายนฤชิต แสงเทียนท์ อสม.เทศบาลนครแหลมฉบัง
5.ประเภทประชาชน คือ นายนฤชิต แสงเทียนท์ อสม.เทศบาลนครแหลมฉบัง อ.บางละมุง จ.ชลบุรี เป็นปราชญ์ชาวบ้านผู้นำภูมิปัญญาพื้นบ้านและศาสตร์การแพทย์แผนไทยดูแลส่งเสริมป้องกันและฟื้นฟูสุขภาพผู้สูงอายุ ให้ความรู้แก่แกนนำนักเรียนด้านการออกกำลังกายโดยใช้ท่าฤาษีดัดตน ดูแลสุขภาพด้วยพืชผักสมุนไพร การนำผลไม้พื้นบ้านมาปรุงเป็นอาหารไทย และผลิตภัณฑ์สุขภาพ เช่น สเปรย์ตะไคร้หอมไล่ยุง ยาหม่อง ยาสีฟัน ลูกประคบ และคิดค้นนวัตกรรมเพื่อสุขภาพ เช่น ตุ้มทรายคลายเมื่อย ธาราบำบัด เป็นต้นดูแลควบคุมมลพิษเพื่อคุณภาพชีวิตที่ดีของคนกรุงเทพ
มลภาวะทางอากาศและเสียงเป็นหนึ่งในปัญหาสิ่งแวดล้อมสำคัญที่มหานครใหญ่ในหลายประเทศทั่วโลกต้องประสบ เช่นเดียวกับกรุงเทพฯ ซึ่งเป็นผลพวงมาจากการเติบโตทางเศรษฐกิจ การขยายตัวของโรงงานอุตสาหกรรม และการเพิ่มขึ้นของยานพาหนะ ซึ่งส่งผลให้เกิดมลพิษทางอากาตทั้งในรูปฝุ่นละออง เขม่าควันดำ ก๊าชพิษต่าง ๆ และโดยเฉพาะอย่างยิ่ง ฝุ่นละอองขนาดเล็ก (PM2.5 ) ที่ล้วนแต่บั่นทอนสุขภาพกายสุขภาพจิตของคนกรุงเทพฯ มาช้านาน
ด้วยความมุ่งมั่นที่จะดูแลคนกรุงเทพฯให้มีคุณภาพชีวิตที่ดีและมีความสุข กรุงเทพมหานครจึงได้ดำเนินมาตรการเพื่อควบคุมป้องกันและลดมลพิษทางอากาศและเสียงอย่างต่อเนื่อง พร้อมทั้งประสานความร่วมมือกับหน่วยงานที่เกี่ยวข้อง เพื่อให้กรุงเทพฯ มีคุณภาพอากาศและเสียงในระดับที่เหมาะสมเพื่อคุณภาพชีวิตที่ดีของคนกรุงเทพฯ ต่อไป
โครงการและนโยบายสำคัญที่อยู่ระหว่างดำเนินการและกำลังจะดำเนินการ
ㆍจัดทีม "นักสืบฝุ่น" เพื่อศึกษาถึงต้นตอ ที่แท้จริงของ PM2.5 เพื่อนำไปเป็นข้อมูลสำหรับการแก้ปัญหาได้อย่างตรงจุด ทั้งในแง่การป้องกัน การปล่อยมลพิษ และในแง่การเอาผิดจากผู้ปล่อยมลพิษเกินค่ามาตรฐาน
ㆍ พัฒนาพื้นที่ปลอดฝุ่น (BKK Clean Air Area) ด้วยต้นไม้ สำหรับพื้นที่เปิดด้วยเครื่องฟอกอากาศ สำหรับพื้นที่ปิด
- พื้นที่เปิด โดย กรุงเทพมหานครจะปลูก (ปลูกเองและสนับสนุนให้เอกชนนำกล้าไม้ไปปลูก และบำรุงรักษาต้นไม่ที่ช่วยดักจับและกรองฝุ่นที่จะเข้ามาในพื้นที่
- พื้นที่ปิด สนับสนุนการติดตั้งเครื่องฟอกอากาศ โดยเฉพาะในสถานที่ที่มีกลุ่มเปราะบางและประชาชนหนาแน่น เช่น ห้องเรียน โรงพยาบาลรถสาธารณะ
เปาะเปี๊ยะกัญชา เชฟ พีระพล พิภวากร @อารีย์ โซเชียลคลับ
เปาะเปี๊ยะกัญชา
เชฟ/เจ้าของ: พีระพล พิภวากร
แอสเซล เบคบาเยวา
ร้าน: อารีย์ โซเชียลคลับ
สรรพคุณทางยา:
เปาะเปี๊ยะเป็นเมนูทานเล่นเรียกน้ำย่อยก่อนอาหารจานหลัก มีส่วนผสมอย่างใบกัญชาที่ช่วยในเรื่องการผ่อนคลาย หลับสบาย และบรรเทาอาการเจ็บปวด เข้ากันได้ดีกับรสชาติของผักชีลาวซึ่งเป็นอีกหนึ่งส่วนประกอบของเมนู ช่วยให้มีกลิ่นหอมและกระตุ้นความอยากอาหารได้ดี
ที่อยู่: 7/3 ซอยอารีย์สัมพันธ์ 1 แขวงสามเสนใน เขตพญาไท กรุงเทพมหานคร 10400
Tel. 08-6970-7997
ยำกัญชากรอบสรวลเส LINK
วัตถุดิบ
ใบกัญชา 5 ใบ / หอมแดงเจียว 5 กรัม (สำหรับทำน้ำจิ้ม) กระเทียมเจียว 2 กรัม (สำหรับทำน้ำจิ้ม) / น้ำมะนาว 10 กรัม / พริกขี้หนู 2 กรัม / น้ำจิ้ม 30 กรัม / น้ำพริกเผา 10 กรัม / หัวกะทิ 10 กรัม / แป้งสาลี 5 กรัม / น้ำมัน 200 กรัม / หมูสับ 30 กรัม
วิธีการทำ
1. ผสมแป้งสาลีกับน้ำให้เข้ากัน นำใบกัญชาลงไปซุบแป้งที่เตรียมไว้ แล้วนำไปทอดในกระทะน้ำมัน
2. ปรุงรสน้ำยำโดยใส่พริกขี้หนู หมูสับสุก หอมแดงเจียว กระเทียมเจียว มะนาว พริกน้ำพริกเผา และหัวกะทิ
3. คลุกเคล้าผสมวัตถุดิบทั้งหมดให้เข้ากัน
4. จัดเสิร์ฟใบกัญชาทอดพร้อมน้ำยำและราดน้ำยำลงในในกัญชาทอดเมื่อรับประทาน
การตรวจคัดกรองมะเร็งในผู้ชาย
การตรวจคัดกรองมะเร็งในผู้ชาย
มะเร็งที่เจอบ่อยในผู้ชาย ได้แก่ มะเร็งต่อมลูกหมาก มะเร็งตับ มะเร็งลำไส้ มะเร็งปอด ดังนั้นการตรวจสุขภาพจะเป็นตามแนวทางนี้
มะเร็งต่อมลูกหมาก
จริงๆการตรวจคัดกรองในโรคนี้ก็ยังมีการถกเถียงกันเพราะมีหลายการศึกษาที่ระบุว่าการคัดกรองมะเร็งต่อมลูกหมากนั้น ไม่ได้ช่วยเพิ่มการมีชีวิตอยู่รอด แถมเมื่อตรวจค่าผิดปกติและต้องไปเจาะตรวจชิ้นเนื้อ พบว่าประมาณ 75% พบว่าไม่ได้เป็นมะเร็ง ผู้ป่วยก็จะเจ็บตัวเปล่าๆ
แต่ถ้าอยากตรวจก็สามารถทำได้โดยการตรวจหาค่า PSA และการพบแพทย์เพื่อตรวจขนาดต่อมลูกหมากทางทวาร (rectal examination) โดยมักแนะนำในคนที่มีความเสี่ยงเช่น อายุ 50 ปีขึ้นไป หรือมีประวัติการเป็นโรคมะเร็งต่อมลูกหมากในครอบครัว
มะเร็งตับ
เรามักจะตรวจในผู้ป่วยที่โรคตับอักเสบเรื้อรังจากเชื้อไวรัสตับอักเสบBและC ผู้ป่วยที่มีภาวะตับแข็ง โดยการหาเจาะเลือดตรวจการทำงานของตับ (liver function test) ค่าของ AFP และการอัลตราซาวน์ตับ หรือถ้ามีการสงสัยอะไรก็อาจส่งตรวจเพิ่มเติมเช่นการทำMRI
มะเร็งลำไส้
เริ่มตรวจที่อายุ 50 ปี แต่ถ้ามีภาวะบางอย่างที่อาจมีผลเพิ่มความเสี่ยงของการเป็นมะเร็งลำไส้ ก็จะแนะนำตรวจก่อนอายุ 50 ปี เช่น มีประวัติในครอบครัวเป็นเนื้องอกหรือมะเร็งลำไส้ มีให้เลือกตรวจได้หลายแบบ เช่น
-การส่องกล้องตรวจลำไส้ส่วนปลายและทวารหนัก (flexible sigmoidoscopy) ทุก 5 ปี
-การส่องกล้องตรวจลำไส้ใหญ่ทั้งหมด (colonoscopy) ทุก10 ปี
-การตรวจอุจจาระ โดยอาจร่วมกับส่องกล้องลำไส้ส่วนปลายปละทวารหนัก ทุก 5 ปี
-การตรวจลำไส้ใหญ่ทางเอ็กซเรย์คอมพิวเตอร์ CT colonography ทุก 5 ปี
มะเร็งปอด
การตรวจคัดกรองมะเร็งปอดนี่ เป็นเรื่องใหม่มากพอสมควรค่ะ ล่าสุดมีการศึกษาหนึ่งออกมาว่า ช่วยลดอัตราการตายจากมะเร็งปอด 20% (lung cancer mortality rate) แต่ในการศึกษาพุ่งเป้าไปที่คนบางกลุ่ม ดังนั้นกลุ่มดังกล่าวจึงเป็นกลุ่มที่มีประโยชน์จากการตรวจคัดกรองมะเร็ง
การคัดกรองในที่นี้ คือการตรวจโดยใช้เอกซเรย์คอมพิวเตอร์แบบปริมาณรังสีต่ำกว่าปกติ เรียกว่า low-dose CT ซึ่งจะมีจำกัดอยู่เฉพาะบางโรงพยาบาลเท่านั้น
กลุ่มคนที่ได้ประโยชน์คือ
ต้องมีทั้งสามข้อนะคะ
- มีประวัติสูบบุหรี่จัด ในที่นี้คือ ค่า pack-year ให้เอาจำนวนต่อซอง x จำนวนปี ค่าตั้งแต่30ขึ้นไปถือว่าจัด เช่น สูบ1ซองเป็นเวลา30ปี (pack year=30) , สูบ2ซองเป็นเวลา15ปี (pack year=30)
- ยังคงสูบอยู่หรือถ้าเลิกแล้ว ยังคงอยู่ในช่วงไม่เกิน 15 ปีหลังเลิก
- อายุช่วง 55-74 ปี
ความเสี่ยงของการตรวจคัดกรองมีอยู่ว่า
1.ในเอกซเรย์อาจเห็นว่ามีอะไร แต่จริงๆแล้วไม่มี เรียกว่าค่าบวกลวง ซึ่งทำให้ผู้ป่วยมีความกังวล กินไม่ได้ นอนไม่หลับ เครียด ต้องมาตรวจเพิ่มเติมบ่อยๆ เจาะชิ้นเนื้อเพิ่ม
2.อาจเจออะไรที่ผิดปกติบางอย่างจริงๆ แต่จริงๆอาจไม่ต้องรักษา ผู้ป่วยไม่มีอาการอะไร แต่อาจต้องไปผ่าตัดจริง หรือรักษาเพิ่มเติมโดยไม่จำเป็น
3.การตรวจด้วยเอกซเรย์คอมพิวเตอร์บ่อยๆหลายครั้งมากๆ เป็นเวลานาน ก็ทำให้ร่างกายเราได้รับรังสีด้วยเช่นกัน อาจส่งผลต่อการเกิดมะเร็งบางอย่างในอนาคต
เพราะฉะนั้นเราจึงเลือกในคนที่มีความเสี่ยงจริงๆ เพราะจะได้รับประโยชน์จากการรักษาจริงๆ ทั้งนี้ทั้งนั้นอาจต้องรอผลการวิจัยอื่นๆในอนาคตด้วย
รพ.สมิติเวช ศรีราชา รับรางวัล Customer Centric BRONZE AWARD LINK
สมิติเวช ศรีราชา รับรางวัล Customer Centric BRONZE AWARD จาก Muang Thai Life Assurance Hospital Award 2021 ในฐานะที่ เป็นโรงพยาบาลที่ให้ความสำคัญในการดูแลลูกค้าเป็นศูนย์กลาง และมุ่งเน้นการสร้างประสบการณ์ที่ดีให้กับลูกค้า ใส่ใจและเข้าใจ สามารถตอบสนองความต้องการของลูกค้าได้ โดยมี รศ.นพ.อัษฎา ตียพันธ์ ผู้อำนวยการ รพ.สมิติเวช ศรีราชา เป็นตัวแทนขึ้นรับรางวัล
ข่าวปลอม! สูตรเครื่องดื่มธัญพืชหรือน้ำอาร์ซี สามารถรักษาโรคมะเร็งได้ LINK
ตามที่ได้มีข้อมูลปรากฏในสื่อออนไลน์ถึงประเด็นเรื่อง สูตรเครื่องดื่มธัญพืชหรือน้ำอาร์ซี สามารถรักษาโรคมะเร็งได้ ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดย สถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีคำแนะนำชวนเชื่อถึงเครื่องดื่มเพื่อสุขภาพ โดยระบุว่าน้ำชีวจิตหรือน้ำอาร์ซีช่วยต้านและรักษามะเร็งได้ ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข สืบค้นข้อมูลและชี้แจงว่า น้ำชีวจิตหรือน้ำอาร์ซี (Rejuvenating Concoction, RC) เป็นเครื่องดื่มที่มีส่วนประกอบของธัญพืช 9 ชนิด ได้แก่ ข้าวโอ๊ต ข้าวสาลี ข้าวบาร์เล่ย์ ลูกเดือย ลูกบัว ข้าวฟ่าง ข้าวมันปู ข้าวซ้อมมือ และข้าวเหนียวกล้อง โดยนำมาต้มจนสุก แล้วรินเอาเฉพาะน้ำมาดื่ม น้ำอาร์ซีประกอบไปด้วยวิตามินและแร่ธาตุต่างๆ ที่ร่างกายต้องการ ช่วยบรรเทาอาการอ่อนเพลียและช่วยป้องกันโรคเหน็บชาได้ แต่ในปัจจุบันยังไม่พบงานวิจัยที่เกี่ยวข้องกับการนำน้ำอาร์ซีมาใช้ในการรักษาโรคมะเร็ง ทั้งนี้ น้ำอาร์ซี ถือเป็นเครื่องดื่มเพื่อสุขภาพชนิดหนึ่ง ซึ่งอย่างไรก็ตามผู้บริโภคควรศึกษารายละเอียดส่วนผสม และกระบวนการผลิตที่ถูกหลักอนามัย การใช้เพื่อหวังผลด้านการรักษาโรคควรปรึกษาแพทย์โดยเฉพาะผู้ป่วยมะเร็ง
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่าง ๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารสถาบันมะเร็งแห่งชาติ สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : น้ำชีวจิตหรือน้ำอาร์ซีถือเป็นเครื่องดื่มเพื่อสุขภาพชนิดหนึ่ง ช่วยบรรเทาอาการอ่อนเพลียและช่วยป้องกันโรคเหน็บชาได้ แต่ในปัจจุบันยังไม่พบงานวิจัยที่เกี่ยวข้องกับการนำน้ำอาร์ซีมาใช้ในการรักษาโรคมะเร็ง
ศูนย์มะเร็ง โรงพยาบาลกรุงเทพภูเก็ต
โรงพยาบาลกรุงเทพภูเก็ตได้รับการรับรองมาตรฐานจากคณะกรรมาธิการร่วมนานาชาติ, ประเทศสหรัฐอเมริกา (Joint Commission International) ซึ่งเป็นสถาบันที่มีชื่อเสียงและได้รับการยอมรับจากทั่วโลก
เวลาทำการ
ศูนย์มะเร็ง (ชั้น 3)
เปิดบริการทุกวัน
ตั้งแต่ 08.00 – 16.00 น.
ติดต่อสอบถาม
โทร: 076 254 425 ต่อ 8315,
076 361 000 ต่อ 8315,
076 655 000 ต่อ 8315
เพราะปัญหาการได้ยินและทรงตัว เป็นปัญหาหลักถึงหนึ่งในสามของผู้สูงอายุทั่วโลก การดูแลรักษาผู้สูงอายุอย่างองค์รวมจึงเป็นสิ่งสำคัญอย่างยิ่ง คลินิกการได้ยินทรงตัวขั้นสูง เน้นดูแลรักษาผู้ป่วยที่ซับซ้อน ร่วมกับศูนย์ผู้เชี่ยวชาญเฉพาะทางต่างๆ ในตึกสธ เช่น ศูนย์ผู้สูงอายุ สธ4, ศูนย์สมองเสื่อม สธ15, ศูนย์ประสาทวิทยา สธ11 เป็นต้น ผู้ป่วยเหล่านี้ ต้องการดูแลรักษาขั้นสูงในด้านการได้ยินและทรงตัว ตรวจประเมินด้วยแพทย์ผู้เชี่ยวชาญและเครื่องมือที่ทันสมัย ซึ่งที่ศูนย์ของเรา มีเครื่องมือ การตรวจการได้ยินระดับเซลล์ การตรวจการได้ยินและระดับสมอง การตรวจการทรงตัว และการกระตุ้นการได้ยิน รวมถึงการทรงตัวระดับสูง อย่างไรก็ดี ไม่ใช่แค่กลุ่มผู้สูงวัยเท่านั้นที่จะพบปัญหาการได้ยินการสื่อสารและการทรงตัว แต่ในเด็กสามารถพบได้ตั้งแต่ช่วงแรกเกิด ส่งผลให้เด็กมีภาวะเดินได้ช้า ไม่สามารถทรงตัวได้ และในกลุ่มวัยกลางคนอายุระหว่าง 30-40 ปี ก็สามารถพบปัญหาการได้ยินและการทรงตัวได้เช่นกัน
5. การตรวจความหนาแน่นของมวลไขมัน มวลกล้ามเนื้อและมวลกระดูก
การตรวจวัดองค์ประกอบร่างกาย (Body Composition Analysis) เพื่อวิเคราะห์ความหนาแน่นของมวลกระดูก มวลไขมัน และมวลกล้ามเนื้อ ด้วยเครื่อง DEXA scan ทำให้ทราบข้อมูลของร่างกายมากกว่าการใช้น้ำหนักตัวเพียงอย่างเดียว เนื่องจากคนที่มีน้ำหนักตัวเท่ากัน สามารถมีองค์ประกอบร่างกายที่แตกต่างกันได้ การตรวจวัดองค์ประกอบร่างกาย จึงเพิ่มความแม่นยำในการบ่งชี้ภาวะโรคอ้วน โดยในผู้ชายวัยกลางคน ไม่ควรมีเปอร์เซ็นต์ไขมันเกิน 28% และในผู้หญิง ไม่ควรเกิน 32 % รวมไปถึงการตรวจความหนาแน่นของมวลกระดูก เพื่อดูความเสี่ยงของโรคกระดูกพรุน (Osteoporosis) รวมถึงเพื่อรักษามวลกล้ามเนื้อให้อยู่ในเกณฑ์ที่เหมาะสมอยู่เสมอ ป้องกันการพลัดตกหกล้มที่อาจเกิดขึ้นได้
สำหรับผู้ที่มีเปอร์เซ็นต์ไขมันเกินเกณฑ์ที่กำหนด สามารถวางแผนร่วมกับแพทย์และทีมงาน Lifestyle Medicine ในการดูแลรักษา ลดมวลไขมันได้อย่างเหมาะสมกับสุขภาพร่างกายของแต่ละบุคคลต่อไป
บ้านทะเลดาว รีสอร์ท
บ้านทะเลดาว เป็นบูติครีสอร์ตริมทะเลหัวหิน-เขาตะเกียบ ชายหาดที่ขาวสะอาดยาวตั้งแต่หัวหินถึงเขาตะเกียบภายในรีสอร์ต รายล้อมไปด้วยต้นไม้ใหญ่นานาพรรณที่เป็นเหมือนสวนป่าริมทะเล ที่สงบเงียบและร่มรื่นเหมาะแก่การมาพักผ่อนทั้งครอบครัว ที่มีผู้สูงอายุและเด็กๆ และมีการบริการห้องอาหารริมทะเลที่บริการอาหารไทยและซี...
สถานที่ : อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
โรงแรม แบงค็อกแมริออท เดอะ สุรวงศ์
อยู่บนย่านประวัติศาสตร์ของกรุงเทพฯ ใกล้รถไฟฟ้า แม่น้ำเจ้าพระยา สถานที่ท่องเที่ยวต่างๆ ห้องพักหลากหลายทั้งดีลักซ์ สวีท และอพาร์ทเมนท์ 1-3 ห้องนอน 3 ร้านอาหาร คือพระยา คิทเช่นห้องอาหารไทย เย่า เรสเตอรองท์ แอนด์ รูฟท็อป บาร์ จีนสไตล์โมเดิร์นและรูฟทอปบาร์เปิดโล่งพร้อมวิวกรุงเทพ สระน้ำอินฟินิตี้และสปา
เขตบางรัก จังหวัดกรุงเทพมหานคร
โรงแรม ดิ โอกุระ เพรสทีจ กรุงเทพฯ
โรงแรม ดิ โอกุระ เพรสทีจ กรุงเทพฯ ตั้งอยู่ภายใน อาคาร ปาร์คเวนเชอร์ อีโคเพล็กซ์ (Park Venture Ecoplex) ใจกลางย่านธุรกิจบนถนนวิทยุ ใกล้กับสถานทูตอังกฤษ สหรัฐอเมริกาและญี่ปุ่น โรงแรมตั้งอยู่ติดกับสถานีรถไฟฟ้าเพลินจิตจึงเดินทางไปยังแหล่งช้อปปิ้งและย่านธุรกิจใกล้เคียง ได้อย่างสะดวกสบาย ห้องพักทั้ง 240 ห...
เขตปทุมวัน จังหวัดกรุงเทพมหานคร
โรงแรมฮอลิเดย์ อินน์ เอ็กซ์เพรส กรุงเทพ สาทร
โรงแรมใจกลางสาทร ย่านธุรกิจของกรุงเทพฯ และศูนย์รวมความบันเทิงในบริเวณสีลมตั้งอยู่เพียง 3 นาที ด้วยการเดินจากสถานีรถไฟฟ้าบีทีเอสช่องนนทรี โรงแรม ฮอลิเดย์ อินน์ เอ็กซ์เพรสส์ กรุงเทพ สาทร เป็นฐานที่สะดวกสบายสำหรับการเดินทางรอบย่านศูนย์กลางทางธุรกิจของกรุงเทพฯ ช้อปปิ้ง และเยี่ยมชมสถานที่ท่องเที่ยวหลักต...
เขตบางรัก จังหวัดกรุงเทพมหานคร
โรงแรมขนอมโกลเด้นบีช
โรงแรมติดชายหาดหน้าด่าน เงียบ สงบ เหมาะแก่การพักผ่อน
สถานที่ : อำเภอขนอม จังหวัดนครศรีธรรมราช
กระบี่รีสอร์ท
กระบี่รีสอร์ท ตั้งอยู่บนหาด ”อ่าวนาง” ซึ่งขึ้นชื่อว่าเป็นชายหาดที่สวยงาม และได้รับความนิยมที่สุดแห่งหนึ่งของจังหวัดกระบี่ อีกทั้งเป็นรีสอร์ทแห่งเดียวบนหาดอ่าวนาง ที่มีพื้นที่ชายหาดส่วนตัว ที่พักมีรูปแบบทั้งแบบอาคาร บังกาโล และวิลล่า การตกแต่งสื่อถึงความเป็นท้องถิ่นภาคใต้ ด้วยการบริการเป็นเอกลักษณ์แบ...
สถานที่ : อำเภอเมืองกระบี่ จังหวัดกระบี่
โรงแรมเซ็นทารา อ่าวนาง บีช รีสอร์ท และ สปา กระบี่
รีสอร์ทที่มีชีวิตชีวาแห่งนี้ได้รับการออกแบบเป็นกลุ่มอาคารเตี้ยๆ ที่สวยงาม ห้อมล้อมสระว่ายน้ำรูปทรงอิสระอันน่าตื่นตา และระเบียงริมชายหาดที่สวยงามเหมาะสำหรับครอบครัว นักเดินทางคนเดียว คู่รัก และกลุ่มเพื่อน ห้องสำหรับครอบครัวออกแบบมาเป็นพิเศษพร้อมเตียง 2 ชั้น อีกทั้งยังมีห้องพูลแอคเซสและห้องที่มีสระว่า...
สถานที่ : อำเภอเมืองกระบี่ จังหวัดกระบี่
โรงแรมทวินโลตัส นครศรีธรรมราช
โรงแรมทวินโลตัส โรงแรมหรูคู่เมืองนคร ใกล้แหล่งชุมชนและสถานที่สำคัญ ไม่ว่าจะเป็นวัดพระมหาธาตุวรมหาวิหาร และห้างสรรพสินค้า บริการด้วยมาตรฐานโรงแรม 5 ดาวพร้อมสิ่งอำนวยความสะดวกที่ครบครัน บริการครบวงจร อาทิเช่น ห้องพักปรับปรุงใหม่ ครบครันด้วยอุปกรณ์อำนวยความสะดวก ห้องอาหารปทุมมาศ ทานมื้อเช้าที่หลากห...
สถานที่ : อำเภอเมืองนครศรีธรรมราช จังหวัดนครศรีธรรมราช
โรงแรมเดอะพีค บูติค
The peak boutique hotel ( โรงแรม เดอะพีค บูติค) คิดถึงการจัดงาน มาที่เรา ครบ งบไม่บาน จบในที่เดียว ที่นี่เรามีบริการหลากหลาย ด้วยบรรยากาศเรียบหรู เป็นกันเอง การบริการดีเยี่ยม ในงบประมาณไม่บานปลาย -ห้องพัก -งานแต่งงาน -งานประชุมสัมมนา -งานจัดเลี้ยงสังสรรค์ ที่จอดรถกว้างขวาง สะดวกสบาย ...
สถานที่ : อำเภอพระพรหม จังหวัดนครศรีธรรมราช
บ้านวงศ์เบี้ยสัจจ์
เป็นที่พักระบบเชิงนิเวศ บรรยากาศร่มรื่น สงบ สามารถมองเห็นแม่น้ำปากพนังได้
สถานที่ : อำเภอปากพนัง จังหวัดนครศรีธรรมราช
ต้นธารรีสอร์ทแอนสปา
รีสอรกิจกรรมและธรรมชาติ
สถานที่ : อำเภอขนอม จังหวัดนครศรีธรรมราช
อุ่นรักริมโขง รีสอร์ท เชียงคาน
ที่พักริมแม่น้ำโขง พักสบายเหมือนบ้านท่าน
สถานที่ : อำเภอเชียงคาน จังหวัดเลย
โรงแรมเอยู เพลส
โรงแรมเอยูเพลส จังหวัดเลย ตั้งอยู่ ถ.เลย-เชียงคาน ซึ่งเป็นเส้นทางหลักจากตัวเมืองเลยไปเชียงคาน อยู่ใกล้กับมหาวิทยาลัยราชภัฏเลย ห่างจากสนามบินเลย 11 กม. ใช้เวลาเดินทางเพียง 15 นาที และจากโรงแรมไปเชียงคานเพียง 30-40 นาที ผู้เข้าพักสามารถเดินทางไปแหล่งท่องเที่ยวต่างๆ ในจังหวัดเลยได้อย่างสะดวกสบาย โรงแร...
สถานที่ : อำเภอเมืองเลย จังหวัดเลย
ชิลล์ดีรีสอร์ท
chill d resort บรรยากาศห้องพัก ราคาหลักร้อย
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
ศรีอนันต์ บูทีค
โรงแรมที่เต็มไปด้วยความอบอุ่น สิ่งอำนวยความสะดวกครบถ้วนไม่ว่าจะเป็นห้องอาหาร สระว่ายน้ำ ฟิตเนส ทั้งการออกแบบตกแต่งในสไตล์โมเดิร์นคลาสิก เติมเต็มความสุขสบายและการพักผ่อนที่สมบูรณ์
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
เพ ลา เพลิน บูติค รีสอร์ท
เพ ลา เพลิน รักษามาตรการความปลอดภัยด้านสุขอนามัยขั้นสุด ตั้งการ์ดสู้การท่องเที่ยวยุค New Normal ตามมาตรฐาน SHA เหมาะสำหรับคนรักสุขภาพ ท่ามกลางบรรยากาศอันสวยงามของธรรมชาติ ???? มาสูดอากาศบริสุทธิ์ให้เต็มปอด บนพื้นที่กว้างกว่า 400 ไร่
สถานที่ : อำเภอคูเมือง จังหวัดบุรีรัมย์
เอกลดา
โรงแรมเอกลดาเป็นที่พักระดับสี่ดาว ออกแบบและตกแต่งในสไตล์โมเดิร์น ลอฟท์ที่มีแนวความคิดในการผสมผสานธรรมชาติจากสวนและพันธุ์ไม้นานาพันธุ์กับความโมเดิร์นของอาคารที่หรูหราและทันสมัย โรงแรมมีห้องพักให้บริการทั้งหมด 60 ห้อง โดยแบ่งเป็น 5 ประเภทได้แก่ สุพีเรีย ดีลักซ์ จูเนียร์สวีท เอ็กเซกคูทีฟสวีท และ เพรสซิ...
สถานที่ : อำเภอนางรอง จังหวัดบุรีรัมย์
จินตนา รีสอร์ท
พักผ่อนให้เต็มที่ด้วยบรรยากาศสวนกลางเมือง สูดอากาสบริสุทธิ์ให้เต็มปอด เพื่อให้คุณพร้อมรับวันใหม่อย่างสดใส ซาบซ่า ณ โลเคชั่นใจกลางเมืองจังหวัดบุรีรัมย์ แค่เอื้อมจากแหล่งช็อปปิ้ง กิน ดื่ม ทุกแห่ง
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
เรย์ โฮเทล
โรงแรมแนวโมเดิร์น มินิมอลลิส(Modern Minimalist) ระดับ3.5ดาวแห่งใหม่ใจกลางเมืองบุรีรัมย์ ที่เน้นกลิ่นอายความเรียบง่ายของดีไซน์ แต่แฝงไปด้วยความหรูหรามีระดับและสิ่งอำนวนความสะดวกครบครันตามมาตรฐานสากล
สถานที่ : อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
ปาหนัน กระบี่ รีสอร์ท
โรงแรมใหม่ ตั้งอยู่ใจกลางอ่าวนาง มีสิ่งอำนวยความสะดวกครบครัน ทันสมัย ในสไตล์ "Art of local touch"
สถานที่ : อำเภอเมืองกระบี่ จังหวัดกระบี่
โรงแรม วิลลา มหาภิรมย์
มหาภิรมย์ . . . เรือนไทยเดิม ดีไซน์เรียบหรู อายุกว่าร้อยปี จำนวน 24 หลัง ข้ามขอบจำกัดของวัฒนธรรม ยุคสมัยและกาลเวลามาตั้งอยู่ในชุมชนเก่าแก่ของวัดอุโมงค์ พื้นที่นี้ได้รับการพัฒนาเชิงพาณิชย์ เชิงศิลปะ เชิงสังคม เป็นแหล่งรวมศิลปินอิสระ ร้านกาแฟเพื่อสิ่งแวดล้อม คอมมูนิตี้มอลล์เพื่อสังคม ทั้งหมดนี้ยังค...
สถานที่ : อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่
โรงแรมแชงกรี-ลา เชียงใหม่
Located in the heart of Chiang Mai and surrounded by stunning vistas of Northern Thailand’s mountain ranges. Shangri-La Chiang Mai offers a family-friendly 5-star experience. With the largest pool in the city, and easy access to the Night Bazaar, Old City, and transport for onward adventures, our ho...
สถานที่ : อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่
อนันตราเชียงใหม่รีสอร์ท
รีสอร์ทริมแม่น้ำในเชียงใหม่ของเราตั้งอยู่ใกล้กับตลาดไนท์บาซาร์ที่มีชื่อเสียง ขี่จักรยานสำรวจโบราณสถาน วัดวาอาราม ตลาดและคาเฟ่ต่างๆ หรือเดินทางไกลออกไปเพื่อผจญภัยบนภูเขา
สถานที่ : อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่
โรงแรมเดอะพรรณราย
โรงแรมเดอะ พรรณราย ดูแลรักษาความสะอาด ได้รับมาตราฐาน SHA มีระเบียง หน้าต่างระบายอากาศทุกห้อง และตั้งอยู่ในเขตช้อปปิ้ง เซ็นเตอร์อันรื่นรมย์ ในทำเลที่ตั้งอันโดดเด่นใจกลางการท่องราตรี, การช็อปปิ้ง, การออกไปลิ้มชิมรสอาหารของอุดรธานี จากที่พัก ท่านสามารถเดินทางได้อย่างสะดวกง่ายดายไปยังทุกที่ในเมืองที่มีช...
สถานที่ : อำเภอเมืองอุดรธานี จังหวัดอุดรธานี
สุวรรณาริเวอร์ไซด์รีสอร์ท ชัยนาท
สุวรรณา ริเวอร์ไซด์ รีสอร์ท พร้อมให้บริการ ห้องพัก สวย สะอาด ปลอดภัย บริการอันน่าประทับใจ
จังหวัดชัยนาท
โรงแรมเจริญโฮเต็ล
239 ห้องพักมาตราฐาน ในย่านศูนย์กลางการค้า แหล่งท่องเที่ยวในเมือง พร้อมห้องประชุม 20-1,500 ท่าน และที่จอดรถกว้างขวาง สะดวกสบาย สอาดปลอดภัย ด้วยระบบการรักษาความปลอดภัย และ การดูแลตามมาตราฐานสุขอนามัย SHA
สถานที่ : อำเภอเมืองอุดรธานี จังหวัดอุดรธานี
สยามเบย์ชอร์ รีสอร์ท พัทยา
โรงแรมสยามเบย์ชอร์ รีสอร์ท พัทยา เป็นโรงแรมที่ได้เปิดดำเนินการมามากกว่า 45 ปี เป็นโรงแรมที่พักตากอากาศแบบรีสอร์ท ที่ได้ให้ความมุ่งมั่นในการพัฒนาสิ่งอำนวยความสะดวกต่าง ๆ รวมไปถึงการให้บริการกับนักท่องเที่ยวทั้งชาวไทยและชาวต่างประเทศเพื่อให้เกิดความเชื่อมั่น ไว้วางใจและสร้างความประทับใจ โดยได้คำนึงและ...
สถานที่ : อำเภอบางละมุง จังหวัดชลบุรี
โรงแรมแคนทารีโคราช
โรงแรมแคนทารี โคราช ตั้งอยู่ใจกลางเมืองโคราช บนถนนมิตรภาพ ใกล้กับศูนย์การค้าชั้นนำและศูนย์กลางธุรกิจการค้า “Luxurious Residential Style Hotel” ได้แก่ ห้องพักประเภทดีลักซ์ สตูดิโอสวีท 1 ห้องนอนสวีท และ 2 ห้องนอนสวีท พร้อมตกแต่งสไตล์โมเดิร์น ให้บรรยากาศโปร่งโล่งสบาย โดยมีจุดเด่นที่ห้องพักทุกห้องมีขนาด...
สถานที่ : อำเภอเมืองนครราชสีมา จังหวัดนครราชสีมา
โรงแรมเซ็นทาราและคอนเวนชันเซ็นเตอร์ อุดรธานี
โรงแรมเซ็นทาราและคอนเวนชันเซ็นเตอร์ อุดรธานี (ชื่อเดิมโรงแรมเจริญศรีแกรนด์รอยัล อุดรธานี) อุดรธานีเป็นหนึ่งในเมืองการค้าที่ยิ่งใหญ่ในภาคตะวันออกเฉียงเหนือของประเทศไทยและยังเป็นประตูสู่ประเทศลาว เวียดนามตอนเหนือ และภาคใต้ของจีน อีกทั้งอยู่ใกล้กับสะพานมิตรภาพข้ามแม่น้ำโขง โรงแรมเซ็นทาราและคอนเวนชันเซ็...
สถานที่ : อำเภอเมืองอุดรธานี จังหวัดอุดรธานี
การผ่าตัดเปลี่ยนกระจกตา 2 วิธี
1.การปลูกถ่ายกระจกตาทุกชั้น (Penetrating keratoplasty) กรณีที่ผู้ป่วยมีกระจกตาขุ่นทุกชั้น (ซึ่งกระจกตามีทั้งหมด 5 ชั้นย่อย หรีอ 3 ชั้นหลัก คือ ชั้นผิวหรือชั้นบน ชั้นกลาง และชั้นหรือชั้นเยื่อบุ) หรือทำงานได้ไม่ดี การผ่าตัดวิธีนี้ จะผ่าตัดโดยเอากระจกตาทุกชั้นที่มีพยาธิสภาพออกและนำกระจกตาที่มีความหนาแบบเดียวกันและมีทุกชั้นใส่เข้าไปแทนที่
ขณะนี้จำนวนการสุ่มถอดรหัสพันธุกรรมในประเทศไทยลดลงอย่างมากเพราะจำนวนผู้ติดเชื้อโคโรนา 2019 ในประเทศลดลงอย่างต่อเนื่อง ตัวอย่างที่ส่งมาตรวจที่ห้องปฏิบัติการไวรัสวิทยา รพ. รามาธิบดี ช่วงนี้ลดเหลือเพียง 4-12 ตัวอย่างต่อวัน และตรวจพบ PCR เป็นบวกเพียงวันรายเดียวเท่านั้น
ภญ.กิตติวรรณ รัตนจันทร์ ผู้บริหารสูงสุดบริษัท เมิร์ซ เอสเธติกส์ ประเทศไทย กล่าวว่า “เมิร์ซ เอสเธติกส์ ประเทศไทย รู้สึกเป็นเกียรติที่ได้เป็นส่วนหนึ่งของการประสานงานจัด “โครงการส่งตรวจภาวะดื้อโบ” ร่วมกับศิริราชพยาบาล ซึ่งเกิดขึ้นจากความห่วงใยของเราต่อความปลอดภัยของประชาชนทั่วไป ที่ปัจจุบันความนิยมเข้ารับการทำหัตถการฉีดโบทูลินัมท็อกซินเพื่อเสริมความงามเพิ่มสูงขึ้นอย่างต่อเนื่อง เราจึงอยากมุ่งเน้นการขับเคลื่อนการตระหนักรู้เกี่ยวกับภาวะดื้อโบออกสู่วงกว้างมากยิ่งขึ้น ทั้งนี้ เมิร์ซ เอสเธติกส์ ยังเปิดช่องทางการสื่อสารใหม่เพื่อให้ความรู้เรื่องภาวะดื้อโบและคำแนะนำสำหรับประชาชนทั่วไป หากสงสัยว่าตนเองมีภาวะดื้อโบทูลินัมท็อกซิน”
ลอยกระทง จุดผางปะตี๊ปตีนก๋า ปูจาแม่ก๋าเผือก ประจำปี 2565 จ.แพร่
ขอเชิญร่วมงานสืบสานประเพณีลอยกระทง จุดผางปะตี๊ปตีนก๋า ปูจาแม่ก๋าเผือก ประจำปี 2565
วันที่ 7-8 พฤศจิกายน 2565
ณ บริเวณข่วงวัฒนธรรมเมืองแป้ (กาดสามวัย) คูเมืองน้ำคือ ท่าน้ำเชตะวัน และท่าน้ำศรีชุม อ.เมือง จ.แพร่
กิจกรรมไฮไลท์ภายในงาน
ขบวนแห่จากชุมชน 18 ชุมชนในเขตเทศบาลเมืองแพร่ อาทิ
✨️ การประกวดการทำกระทง
✨️ การประกวดตีกลองปูจา
✨️ การประกวดโคมแขวนเมืองแป้
✨️การประกวดบอกไฟดอก
✨️การประกวดนางนพมาศ
✨️การแสดงศิลปวัฒนธรรมและศิลปิน
พฤติกรรม เบี่ยงเบนทางเพศ
ในวัยเด็กคุณพ่อคุณแม่ ให้แต่งตัวเป็นเด็กผู้ชายเสื้อผ้าน่ารัก แต่มื่อน้องโตขึ้นเริ่มเข้าสู่วัยรุ่นประมาณ ระดับมัธยมศึกษา เริ่มสนใจแต่งตัว แต่งหน้า ใช้เครื่องสำอางค์และของสวยงามแบบผู้หญิง เริ่มสนใจและชอบเพศชายที่มีรูปหล่อหน้าตาดี โดยเริ่มดูจากทีวี ยูทูป เพื่อติดตามดารานักแสดงหล่อๆ
นอกจากนี้น้องได้รับการติดต่อ ไปร่วมทำกิจกรรมงานสำคัญต่างๆ เช่น งานคนพิการ งานดาวน์ งานจิตอาสา ทั้งนี้การเข้าร่วมงาน น้องก็จะได้เข้าร่วมโดยรับการแสดงต่างๆ ที่ต้องแต่งตัว แต่งหน้า ทาปากให้สวยงาม และเกิดความมั่นใจในตนเองจากการขึ้นเวทีงานประกวด งานจิตอาสา งานการกุศลต่างๆ จำนวนมาก
แม่สังเกตว่าลูกมีความสุที่จะได้ข้าร่วมกิจกรรมดังกล่าวและกล้าแสดงออก มีการแต่งตัวที่เปลี่ยนแปลงไปตาม CONCEPT ของงาน เปลี่ยนรูปแบบไปตามเวที่ต่าง..ภพเปรียบเสมือนดาวน์หรือดารา ที่เจิดจรัสอยู่บนเวทีมอบรอยยิ้มและความสุขให้ผู้ชม
กิจกรรมตรวจสุขภาพผู้สูงอายุในงาน
ภายในงานครั้งนี้ เปรียบเสมือนการเตรียมความพร้อมในด้านต่างๆ ทั้งเครื่องมือ บุคลากร และโชว์ถึงเทคโนโลยี นวัตกรรม ที่จะนำไปช่วยให้ผู้ที่จะเป็นอนาคตของสังคม ได้ “สูงวัยอย่างสง่า ชราอย่างมีคุณภาพ” ไปกับ “วิทยาศาสตร์การเคลื่อนไหวและสุขภาพ” แบ่งเป็น
ฐานที่ 1 : ตรวจประเมินและทดสอบสมรรถภาพ (Fitness Test) เพื่อตรวจประเมินพื้นฐาน PAR-Q+, ทดสอบสมรรถภาพทางกาย (Fitness Test) : Sit to stand, Step Test, Hand Grip, Sit and Reach, Pulmonary Function Tests (ทดสอบสมรรถภาพปอด) เครื่องมือ อุปกรณ์ทดสอบสมรรถภาพพื้นฐาน เช่น hand grip dynamometer เครื่อง Spirometry
"เป็นการเติมเต็มด้านบริการทางการแพทย์แบบไร้รอยต่อ" - ผศ. นพ.ยุทธนา ศตวรรษธำรง
ผศ. นพ.ยุทธนา ศตวรรษธำรง หัวหน้าศูนย์ทางเดินอาหารและตับ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “การก่อตั้งศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร ได้เข้ามาเติมเต็มศูนย์ทางเดินอาหารและตับ โรงพยาบาลบำรุงราษฎร์ ในด้านบริการทางการแพทย์แบบไร้รอยต่อ ทั้งในแง่ของการเสริมศักยภาพในการตรวจวินิจฉัยโรคได้ถูกต้องแม่นยำและตรงจุดมากขึ้น (Accurate and Precise Diagnosis) สามารถหาสาเหตุของโรคที่แท้จริงได้ตั้งแต่อาการแรกเริ่ม (Early Detection) ด้วยเทคโนโลยีที่ทันสมัย (Advanced Medical Technology) จากประสบการณ์และความชำนาญการของแพทย์ ทำให้บำรุงราษฎร์สามารถส่งมอบการบริบาลดูแลป้องกันและรักษาได้ครอบคลุมทั้งโรคที่พบบ่อย โรคที่มีความรุนแรงหรือซับซ้อนเกี่ยวกับระบบทางเดินอาหารแบบ One Stop Service และเพิ่มโอกาสให้ผู้ป่วยหายขาดจากภาวะความผิดปกติของระบบทางเดินอาหารได้”
แนวทางการดูแลผู้สูงอายุของโรงพยาบาลในปัจจุบัน
สำหรับโรงพยาบาลวิมุต เราได้ให้ความสำคัญเรื่องการตรวจสุขภาพผู้สูงอายุในทุกสภาวะ ตั้งแต่ผู้สูงอายุที่มีสุขภาพดี ไปจนถึงผู้ที่มีโรคเรื้อรัง ผู้ที่ช่วยเหลือตัวเองได้น้อยลง ผู้ที่นอนติดเตียง รวมถึงผู้สูงอายุที่ได้รับการวินิจฉัยว่าป่วยในระยะสุดท้ายและมีโอกาสเสียชีวิตจากโรคที่เป็นอยู่ รพ.วิมุต พร้อมที่จะเสนอแนวทางการดูแลผู้สูงอายุแบบครบวงจร มีศูนย์ประเมินสุขภาพสำหรับครอบครัวและผู้สูงอายุ มีบริการการปรับบ้านที่อยู่อาศัยเพื่อผู้สูงอายุ มีบริการอุปกรณ์ช่วยเหลือฉุกเฉิน (ViMUT Life Link) ส่วนผู้สูงอายุที่อยู่ติดบ้านหรือนอนติดเตียง ทางโรงพยาบาลมีบริการพยาบาลเยี่ยมดูแลถึงที่บ้าน แต่หากครอบครัวใดต้องการที่พักอาศัยในบรรยากาศเป็นกันเองคล้ายบ้าน พร้อมกับได้รับการดูแลที่ครบครันจากบุคลากรทางการแพทย์ ทางโรงพยาบาลวิมุตมีสถานที่สำหรับดูแลเพื่อทำกายภาพ ฝึกเดิน ฝึกการช่วยเหลือตนเอง มีกิจกรรมกระตุ้นสมอง กิจกรรมกระตุ้นการเข้าสังคม และท้ายที่สุดทางโรงพยาบาลมีบริการดูแลผู้ป่วยระยะท้าย เพื่อให้มีคุณภาพชีวิตที่ดีที่สุดในช่วงบั้นปลายของชีวิต
ร่วมบริจาค สภากาชาดไทย เพื่อผู้ประสบอุทกภัยทั่วประเทศ ลดหย่อนภาษีได้ 2 เท่า LINK
เพราะความช่วยเหลือรอไม่ได้...สภากาชาดไทยขอเชิญร่วมบริจาคเงินเพื่อจัดชุดธารน้ำใจเพื่อผู้ประสบอุทกภัยทั่วประเทศ ผ่านการดำเนินงานของสำนักงานบรรเทาทุกข์และประชานามัยพิทักษ์ สภากาชาดไทย สถานีกาชาด เหล่ากาชาดจังหวัด กิ่งกาชาดอำเภอทั่วประเทศ เพื่อให้พี่น้องประชาชนสามารถผ่านพ้นวิกฤตครั้งนี้ไปได้อย่างปลอดภัย
สอบถามข้อมูลได้ที่ 02-2559911, 02-2564289
สำนักงานจัดหารายได้ สภากาชาดไทย DONATION HUB "รับ" เพื่อ "ให้" ตึกอำนวยนรธรรม ชั้น 2 เลขที่ 1873 ถนนพระราม 4 เขตปทุมวัน กรุงเทพฯ 10330
โครงการทั้งหมด ที่สภากาชาดเปิดรับบริจาค
ร่วมบริจาคออนไลน์ ที่
DonationHUB วง Old Doc วงเปิด
วง Old Doc วงเปิดให้กับวงสุนทราภรณ์ เล่นช่วง 16.00 – 16.45 น. ถึงชื่อจะโอลด์ แต่ทั้งเล่นทั้งเต้นกันแบบสุดยัง และทั้งหมดเป็นคุณหมอทั้งนั้น
เขตบางกอกใหญ่ นัดเก็บขยะชิ้นใหญ่ทุกวันอาทิตย์ LINK
เขตบางกอกใหญ่ นัดเก็บขยะชิ้นใหญ่ทุกวันอาทิตย์
ตั้งแต่เวลา 09.00 น. เป็นต้นไป ดังนี้
6 พฤศจิกายน 2565 ชุมชนศาลเจ้าพ่อเขาตก
13 พฤศจิกายน 2565 ชุมชนวัดนาคกลาง
20 พฤศจิกายน 2565 ชุมชนวัดหงส์รัตนาราม
27 พฤศจิกายน 2565 ชุมชนวัดใหม่วิเชียร
ประชาสัมพันธ์ขอความร่วมมือจากพี่น้องประชาชน เจ้าของ อาคารบ้านเรือนที่ประสงค์จะนำสิ่งของเหลือใช้ออกมาทิ้งให้วางไว้ตรงจุดพักขยะของชุมชน ตามวัน และเวลาดังกล่าว ซึ่งเขตฯ จะได้จัดเจ้าหน้าที่เข้าดำเนินการจัดเก็บโดยไม่เสียค่าใช้จ่ายใดๆ สอบถามเพิ่มเติมติดต่อได้โดยตรงที่ฝ่ายรักษาความสะอาดและสวนสาธารณะ โทร.02-4575624 , 02-4570069 ต่อ 5724
เกี่ยวกับมินเทล
Mintel เชี่ยวชาญในการตอบคำถามที่ว่าผู้บริโภคต้องการอะไรและทำไม ในฐานะบริษัทชั้นนำของโลกด้านข้อมูลตลาด Mintel ได้ทำการวิเคราะห์ผู้บริโภค ตลาด ผลิตภัณฑ์ใหม่ ๆ และทิศทางของการแข่งขัน พร้อมนำเสนอมุมมองด้านเศรษฐกิจทั้งในระดับประเทศและระดับสากลในรูปแบบที่โดดเด่นไม่ซ้ำใคร นับตั้งแต่ปี 1972 คำวิเคราะห์เชิงคาดการณ์และคำแนะนำจากผู้เชี่ยวชาญของเราได้ช่วยให้ลูกค้าตัดสินใจทางธุรกิจได้อย่างแม่นยำและฉับไว จุดประสงค์ของเราคือการช่วยให้ธุรกิจและผู้คนเติบโตไปด้วยกัน
15 พ.ย. 65 ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา
ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ ชี้แจงการออกประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) ฉบับใหม่ กำหนดเฉพาะช่อดอกกัญชาเป็นสมุนไพรควบคุมว่า เมื่อปลดกัญชาออกจากยาเสพติด ต้องมีกฎหมายออกมารองรับในการดูแลควบคุมกำกับเพราะกัญชามีสาร THC ที่มีผลต่อจิตประสาท สาระสำคัญ คือ ห้ามขายช่อดอกกัญชาให้เด็ก เยาวชนผู้มีอายุต่ำกว่า 20 ปี และกลุ่มเปราะบาง ส่วนโรงเรือน ผู้ประกอบการเพื่อการค้าจะขายช่อดอกกัญชาต้องขออนุญาต กรณีผิดวัตถุประสงค์จะถูกยึดใบอนุญาตส่วนผู้ที่ขออนุญาตจำหน่ายกัญชามาก่อนหน้านี้ 3,097 ราย ต้องปฏิบัติตามเงื่อนไขดังกล่าวนี้ โดยกรมฯ จะทำหนังสือแจ้งกับผู้ประกอบการที่ได้รับอนุญาตไปแล้วเพื่อให้เข้าใจตรงกัน
- พญ.อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต กล่าวว่า ความชัดเจนเชิงนโยบายคือไม่สนับสนุนเด็กเยาวชนใช้กัญชา ยกเว้นมีข้อบ่งชี้ ดังนั้น กรมสุขภาพจิตมีการเฝ้าระวังในกลุ่มผู้ป่วยจิตเวช ที่ผ่านมาไม่พบกรณีที่น่าเป็นห่วง
- ผศ.ดร.อดิศร เนาวนนท์ อธิการบดีมหาวิทยาลัยราชภัฏนครราชสีมา กล่าวว่า ประกาศกระทรวงดังกล่าว จะทำให้เกิดความชัดเจนมากยิ่งขึ้นและส่งผลในเชิงบวกมากกว่า เพราะจะเป็นการตัดตอนการนำกัญชามาใช้เพื่อนันทนาการ และจะช่วยให้กลุ่มวิสาหกิจชุมชนที่ปลูกกัญชาเพื่อใช้ในทางการแพทย์อย่างถูกต้อง ได้รับประโยชน์จากประกาศฉบับนี้
- นายคณาพงษ์ วงค์งาม ประธานวิสาหกิจชุมชนเกษตรอินทรีย์บ้านสหกรณ์ ต.บ้านสหกรณ์ อ.แม่ออน จ.เชียงใหม่ ผู้ปลูกกัญชาเพื่อใช้ทางการแพทย์ กล่าวว่า เห็นด้วยกับการออกประกาศ สธ.ดังกล่าว เพื่อควบคุมการใช้กัญชาทางการแพทย์เท่านั้น แต่ต้องอธิบายแนวทางปฏิบัติที่ชัดเจนป้องกันความสับสน ดังนั้น ผู้ปลูก ผู้ผลิต ที่นำกัญชาไปแปรรูปเป็นอาหาร เครื่องดื่ม เครื่องสำอาง ต้องขออนุญาตจากสาธารณสุขหรือ อย. ก่อน เพื่อปฏิบัติให้ถูกต้องตามกฎหมายกำหนด
- นายอิทธิศักดิ์ เห็นใจชน ผู้บริหารฟาร์ม โกลเด้นลีฟ ศรีราชา จ.ชลบุรี กล่าวว่า สนับสนุนประกาศ สธ.ฉบับใหม่ เพราะอยากให้ทุกฝ่ายปฏิบัติได้อย่างถูกต้อง เกษตรกรที่ปลูกกัญชาจะได้มีแนวทางในการปฏิบัติเกี่ยวกับช่อดอกกัญชาชัดเจนขึ้นหากนำไปใช้ในทางที่ไม่ถูกต้องอาจจะส่งผลกระทบต่อเด็ก หรือผู้ป่วยบางคนที่ไม่สามารถใช้กัญชารักษาได้ ถือว่าเป็นเรื่องที่ดีจะได้มีแนวทางปฏิบัติทั้งฝ่ายรัฐและฝ่ายเกษตรกร นอกจากนี้ อยากให้รัฐบาลห้ามนำเข้าช่อดอกกัญชาต่างประเทศ และทราบข่าวว่ามีการลักลอบนำเข้าช่อดอกกัญชาหลายราย เนื่องจากมีคุณภาพดี มีราคาสูง เพราะมีการพัฒนาทางด้านสายพันธุ์มานาน มีสาร THC หรือ CBD สูง ส่งผลให้มีราคาแพง
พ.ร.บ.กัญชา
- นายประสิทธิ์ชัย หนูนวล ตัวแทนกลุ่มเครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทย จัดแถลงข่าวเรื่อง ความจำเป็นของการมี“พ.ร.บ.กัญชาเพื่อควบคุมกัญชาเชิงระบบในสังคมไทย” ณ สวนครูองุ่น ซ.ทองหล่อ 3 โดยตั้งเป้าจะยื่นหนังสือต่อหัวหน้าพรรคการเมืองทุกพรรค ในวันนี้ (15 พ.ย.)
ทำร้ายร่างกายหลังเสพกัญชา
- เยาวชนชายวัย 16 ปี จ.ชลบุรี อาละวาดทำร้ายร่างกายมารดาเพราะไม่ให้เงินไปจ่ายค่ากัญชาที่ติดค้างเพื่อนไว้ กลัวจะถูกเพื่อนทำร้ายเพราะติดเงินมาแล้วหลายครั้ง ตำรวจจึงส่งไปบำบัดรักษาอาการต่อไป
บทความกัญชา
- พ.ร.บ.กัญชาฯ จะกลับเข้าสภาอีกหลังงานเอเปค ขณะนอกสภา ฝ่ายค้าน แพทย์จากแพทยสภา ยื่นร้องศาลปกครองเพิกถอนประกาศ ไม่เพียงวงแตกในพรรคร่วมรัฐบาล แวดวงบุคลากร สธ. ก็เช่นกัน
One stop service ส่งออกพืชกระท่อม
- นายสมศักดิ์ เทพสุทิน รมว.ยธ. และนายสันติ พร้อมพัฒน์ รมว.ก.คลัง ร่วมเป็นสักขีพยานในพิธีลงนาม MOU ว่าด้วยการเชื่อมโยงข้อมูลอิเล็กทรอนิกส์ระหว่างกรมศุลกากร-ป.ป.ส. เพื่อส่งเสริมการส่งออกพืชกระท่อม อำนวยความสะดวกการค้าระหว่างประเทศ กำหนดให้ขอใบอนุญาตส่งออกสามารถดำเนินการผ่านอิเล็กทรอนิกส์เพียงจุดเดียว ช่วยลดเวลาค่าใช้จ่ายและความซ้ำซ้อน
ผ่าตัดข้อเทียมด้วยหุ่นยนต์ช่วยผ่าตัด โรงพยาบาลกระดูกและข้อ ข้อดีมีสุข (KDMS)
โรงพยาบาลกระดูกและข้อ ข้อดีมีสุข น้องใหม่แต่ฝีมือทีมแพทย์ล้วนมากประสบการณ์
โดยโรงพยาบาลชี้ว่า การใช้หุ่นยนต์ช่วยผ่าตัดเป็นเครื่องมือสำคัญ ที่ทำให้การผ่าตัดมีความแม่นยำ และมีความปลอดภัยเป็นอย่างมาก เพราะนอกจากหุ่นยนต์ช่วยผ่าตัดทำให้แพทย์สามารถมองเห็นภาพโครงสร้างของกระดูกและข้อจากการสร้างภาพ 3 มิติได้อย่างชัดเจนขึ้นแล้วนั้น หุ่นยนต์ยังมีแขนกลที่สามารถเคลื่อนไหว ปรับให้โค้งงอ และหมุนได้ ทำให้การผ่าตัดในตำแหน่งที่เข้าถึงยากหรือมีความซับซ้อนเป็นเรื่องง่ายขึ้น
การผ่าตัดโดยใช้หุ่นยนต์ช่วยผ่าตัดถือเป็นอีกทางเลือกหนึ่งที่สามารถช่วยให้ผลการผ่าตัดเปลี่ยนข้อเทียมมีประสิทธิภาพมากขึ้น ช่วยให้ผู้ป่วยมีคุณภาพชีวิตที่ดี และสามารถกลับไปใช้ชีวิตประจำวันได้เร็วขึ้น ดังนั้น ผู้ป่วยที่คาดว่าตนเองมีปัญหาข้อเข่าเสื่อม ควรปรึกษาแพทย์ผู้เชี่ยวชาญถึงแนวทางการรักษา เพื่อเลือกวิธีการรักษาให้เกิดผลลัพธ์ที่ดีที่สุด และคุ้มค่ากับผู้ป่วยมากที่สุด
ติดต่อสอบถาม โรงพยาบาลกระดูกและข้อ ข้อดีมีสุข
โทร. 02-0808999
ตาราง Group F
| |
Group F |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
โมรอคโค |
3 |
2 |
1 |
0 |
4 |
1 |
3 |
7 |
| 2 |
โครเอเชีย |
3 |
1 |
2 |
0 |
4 |
1 |
3 |
5 |
| 3 |
เบลเยียม |
3 |
1 |
1 |
1 |
1 |
2 |
-1 |
4 |
| 4 |
แคนาดา |
3 |
0 |
0 |
3 |
2 |
7 |
-5 |
0 |
เรื่องราวที่สอง คุณอ้อย ผู้ป่วยโรคผิวหนังแข็ง จากระบบภูมิคุ้มกันร่างกายผิดปกติ
เรื่องราวที่สองเป็นเคสของคุณอ้อย นางชนินทร์สิญา ผู้ป่วยโรคผิวหนังแข็ง ซึ่งจัดเป็นโรคเรื้อรังที่เกิดจากความผิดปกติของระบบภูมิคุ้มกันของร่างกาย ส่งผลให้เกิดอาการผิดปกติขึ้นและเป็นโรคที่ไม่สามารถรักษาให้หายขาดได้ในปัจจุบัน โดยพี่อ้อยเข้ารักษาตัวกับทางโรงพยาบาลรามาธิบดีมาตั้งแต่ปี 2562 และได้รับความช่วยเหลือในส่วนของค่ายารักษาภาวะความดันหลอดเลือดแดงปอดสูงจากเงินบริจาคในโครงการผู้ป่วยยากไร้มูลนิธิรามาธิบดีฯ มาโดยตลอด พร้อมได้กำลังใจจากลูกชายให้มีแรงฮึดในการต่อสู้กับโรคร้ายต่อไป
City Co-Creation&Forum นิทรรศการแลกเปลี่ยน เสวนาเรื่องเมือง และพบกับความหลากหลายด้วยเนื้อหา Speaker และ Moderator ที่จะมาร่วมกันสร้างความอัศจรรย์ ตลอดระยะเวลา 5 วัน ใน 5 themes
ภูเก็ต ประเทศไทย
กำหนดจัดงาน ระหว่าง 20 มีนาคม - 17 มิถุนายน 2028
สถานที่ หาดไม้ขาว
ธีมงาน Future of Life: Living in Harmony, Sharing Prosperity
ธีมงานสะท้อนทัศนะของความยั่งยืนนิยมและสังคมอันเท่าเทียมของมนุษยชาติ เราเชื่ออย่างหนักแน่นว่าความพอเพียงคือทางสว่างสดใสของอนาคต หากโรคระบาดจะทำให้เราเรียนรู้อะไรได้บ้าง คำตอบคือไม่มีประเทศใดจะอยู่ได้เพียงลำพังและอิ่มเอมมั่งคั่งเพียงเดียวดายท่ามกลางความทุกข์ยากของนานาเพื่อนร่วมโลก ประเทศไทยเชื่ออย่างไร้ข้อกังขา ว่าการหวนกลับสู่วิถีธรรมชาติคือหัวใจของการอยู่ร่วมกับอย่างสอดคล้องกลมกลืน การแบ่งปันอย่างเท่าเทียม จะผนึกเราเข้าด้วยกันเพื่อฝ่าฝันความท้าทายที่อยู่ตรงหน้า Expo 2028 ภูเก็ต จะเป็นเวทีของการค้นลงไปในความสัมพันธ์อันซับซ้อนของมนุษยชาติ เทคโนโลยี และวิถีธรรมชาติ เพื่อนำมันมาเป็นพลังเสริมกับทุกผู้นามทุกเพศวัย ให้ได้พบกับ "วิถีแห่งตน"
Website:
expo2028thailand.com
Facebook
Phuket Expo 2028กิจกรรม วิ่ง-เดิน เพลินเพลงพ่อ ณ สวนกาญจนาภิเษก ร.9 อ.อรัญประเทศ
กิจกรรม วิ่ง-เดิน เพลินเพลงพ่อ ณ สวนกาญจนาภิเษก ร.9 อ.อรัญประเทศ จ.สระแก้ว
วันที่ 4-5 ธันวาคม 2565 พบกับกิจกรรมภายในงาน - ชมงานศิลป์ ช้อปปิ้งงานcoff & craft เพลิดเพลินบรรยากาศดนตรีในสวน
Order: 12.04
ร่วมบริจาคโลหิตภายในงานมหิดล รับตั๋วดูหนังฟรีจาก Major cineplex
ร่วมบริจาคโลหิตภายในงานมหิดล รับตั๋วดูหนังฟรีจาก Major cineplex 1 ท่าน/ใบ จำนวน 100 ใบ ณ ทางเข้า-ออกงานที่ใกล้กับลานจอดรถหน้าอาคารเรียนรวม โดยจะมีทีมงานพาท่านไปยังห้องบริจาคเลือดเป็นลำดับถัดไป ร่วมบริจาคได้ตั้งแต่เวลา 10.00 น. เป็นต้นไป สอบถามเพิ่มเติมได้ที่ : 083-5653747 (เน็ต) และของรางวัลอื่นๆ อีกมากมายภายในงาน เพียงแค่เข้าร่วมงานแล้วทำแบบประเมินก็มีสิทธิลุ้นรางวัลทันที!!!
สารบอแรกซ์ LINK
บอแรกซ์ (Borax) เป็นสารเคมีสังเคราะห์ มีสูตรทางเคมีว่า Na2B4O7 ลักษณะเป็นผงสีขาว ไม่มีกลิ่น มีชื่อที่เรียกกันทั่วไปหลายชื่อ เช่น ผงน้ำประสานทอง ผงกรอบ เพ่งแซ เป็นต้น ภาควิชาเภสัชเคมี คณะเภสัชศาสตร์ มหาวิทยาลัยศิลปากร ได้ให้ความรู้เกี่ยวกับบอแรกซ์ไว้ สรุปได้ว่า โดยทั่วไปบอแรกซ์ใช้ในอุตสาหกรรมทำแก้ว ล้างหม้อขนาดใหญ่ ใช้ป้องกันวัชพืชในการเกษตร ใช้ป้องกันเชื้อราขึ้นตามต้นไม้ ใช้เป็นยาเบื่อแมลงสาบ และใช้เป็นตัวเชื่อมทองเส้นเข้าด้วยกัน แต่ปัญหาการใช้บอแรกซ์เกิดจากมีผู้นำมาใช้ผสมอาหาร เพื่อทำให้อาหารมีความเหนียวหรือกรุบกรอบทำให้อาหารชวนรับประทาน อาหารที่มักพบว่ามีบอแรกซ์ผสม เช่น ลูกชิ้น หมูยอ อาหารชุบแป้งทอด พวกกล้วยทอด มันทอด ผัก/ผลไม้ดอง เป็นต้น
ประกาศกระทรวงสาธารณสุข ฉบับที่ 151 (พ.ศ. 2536) กำหนดให้บอแรกซ์ เป็นวัตถุห้ามใช้ในอาหาร หากบริโภคเข้าไป จะเกิดอันตรายต่อร่างกาย การบริโภคขนาด 0.1-0.5 กรัมต่อน้ำหนักตัวหนึ่งกิโลกรัมอาจทำให้เสียชีวิตได้ ถ้าผู้ใหญ่ได้รับสารบอแรกซ์ 15 กรัม หรือเด็กได้รับ 5 กรัม จะทำให้อาเจียนเป็นเลือดและอาจตายได้ บอแรกซ์เป็นพิษต่อไตและสมอง ทำให้ระบบทางเดินอาหารเกิดการระคายเคือง โดยเฉพาะไตเป็นอวัยวะที่ได้รับผลกระทบมากที่สุด ทำให้เกิดกรวยไตอักเสบ เนื่องจากการสะสมของบอแรกซ์ และหากร่างกายได้รับสารบอแรกซ์ในปริมาณมาก จะทำให้เกิดกระเพาะอาหาร และลำไส้อักเสบ มีอาการคลื่นไส้ อาเจียน ปวดท้อง อุจจาระร่วง ตับถูกทำลาย อาจชัก หมดสติ โดยเฉพาะในเด็กและคนชราอาจถึงตายได้
สำนักคุณภาพและความปลอดภัยอาหาร กรมวิทยาศาสตร์การแพทย์ มีวิธีการตรวจสอบว่าในอาหารมีสารบอแรกซ์ปนเปื้อนอยู่หรือไม่ โดยมีชุดทดสอบบอแรกซ์ในอาหารที่สามารถนำไปตรวจสอบเองได้
ในชุดทดสอบจะมีน้ำยาทดสอบบอแรกซ์ ซึ่งเป็น สารละลาย HCl เจือจาง และกระดาษขมิ้น ซึ่งมี สารเคอร์คูมิน (Cercumin) เป็นส่วนประกอบ การทดสอบทำได้ไม่ยากโดยการหั่นหรือบดอาหารที่จะตรวจใส่ในภาชนะ เติมน้ำยาทดสอบลงไปจนเปียกชุ่ม แล้วใช้กระดาษขมิ้นจุ่มลงไปครึ่งแผ่น ตากให้แห้ง ถ้ากระดาษขมิ้นเปลี่ยนสีจากสีเหลืองไปป็นสีแดง แสดงว่าอาหารนั้นมีสารบอแรกซ์ปนเปื้อนอยู่
2.ความสุข ความเอนจอยนี้เพิ่มสูงขึ้น โดยเฉพาะสาวๆ
ด้วยนักท่องเที่ยวที่กลับเข้ามา โบนัสที่กำลังรอรับ และสภาพจิตใจที่ดีขึ้น คนไทยมองว่า ‘ไม่มีความสุขน้อยลงไปกว่านี้อีกแล้ว’ นี่คือเสียงสนองของคนไทยผ่านตัวเลข แต่จะมีแต่ความสุขที่มากขึ้น (+1%) โดยเฉพาะจากสาวๆ (+2%) สะท้อนให้เห็นถึง ‘ความเชื่อ’ที่มีทิศทางบวกในปี 2566 ที่จะมีแต่เรื่องดีๆเข้ามา
โรงพยาบาลเฉลิมพระเกียรติสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ระยอง LINK
ปัจจุบันบริเวณโรงพยาบาลเฉลิมพระเกียรติสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ระยอง มีเนื้อที่ 7 ไร่ การก่อสร้างอาคารได้เริ่มในปี 2540 เปิดให้บริการผู้ป่วย เมื่อวันที่ 2 มกราคม 2541 โดยเปิดบริการเฉพาะผู้ป่วยนอกก่อน ต่อมา วันที่ 1 พฤษภาคม 2542 จึงเปิดบริการผู้ป่วยใน ด้วยขนาด 30 เตียง(เตียงรวม 24 เตียง พิเศษ 6 เตียง) โดยมีนายแพทย์สุรทิน มาลีหวล เป็นผู้อำนวยการคนแรกและดำรงตำแหน่งจนถึงปัจจุบัน ติดต่อสอบถาม Call center : 038-684444
- ที่อยู่ 111 ถ. สุขุมวิท ตำบล ห้วยโป่ง อำเภอเมืองระยอง ระยอง 21150
- 038-684444
Amazing Chiangmai Countdown 2023 นับถอยหลังเข้าสู่ปีใหม่เวียงเชียงใหม่
จังหวัดเชียงใหม่จัดงาน Amazing Chiangmai Countdown 2023 นับถอยหลังเข้าสู่ปีใหม่ ในบรรยากาศคืนข้ามปีแบบสุดมหัศจรรย์เหนือจินตนาการ ท่ามกลางการแสดงพลุเคาท์ดาวน์ พร้อมงานไฟประดับบนทุ่งดอกไม้นับล้านดวง
31 ธันวาคม 2565 นี้ ณ สวนเฉลิมพระเกียรติ 82 พรรษา (ด้านหลังศาลากลางจังหวัดเชียงใหม่)
สอบถามข้อมูลเพิ่มเติม โรงพยาบาลธนบุรี บำรุงเมือง โทร. 02-220-7999 Facebook : โรงพยาบาลธนบุรี บำรุงเมือง Thonburi Bamrungmuang Hospital เว็บไซต์ : www.thonburibamrungmuang.com
ทีมต่างๆ ที่มีส่วนร่วมในกิจกรรมปีนี้
ปัจจัยที่จะทำให้สถาบันโรคหัวใจบรรลุเป้าหมายเทียบเท่ามาตรฐานโลก
ศ. นพ. กุลวี กล่าวต่อว่า ในฐานะที่ผมคลุกคลีและทำงานในประเทศที่ให้ความสำคัญทางการแพทย์ระดับโลก มากกว่า 30 ปี ผมมองว่าปัจจัยที่จะทำให้สถาบันโรคหัวใจบรรลุเป้าหมาย และเทียบเท่ามาตรฐานโลกนั้น ต้องมีองค์ประกอบหลายอย่างที่เข้ามาสนับสนุนกัน ไม่ว่าจะเป็นวิสัยทัศน์ของผู้บริหาร, การ recruit ทีมแพทย์ที่ชำนาญการและมีประสบการณ์ บุคลากรทางการแพทย์ที่เก่ง, การมีศูนย์ฝึกอบรม ให้แพทย์ได้ฝึกฝน, เทคโนโลยีทางการแพทย์ที่ทันสมัย, มีผลงานวิจัยที่พิสูจน์ได้ รวมถึงมีผลลัพธ์ทางคลินิกที่น่าพึงพอใจ และมีสถิติผลสำเร็จในการรักษาที่ดี ที่สำคัญต้องมี partnership ที่ส่งเสริมซึ่งกันและกัน ซึ่งทุกปัจจัยล้วนทำให้สถาบันโรคหัวใจบำรุงราษฎร์ ยังคงมาตรฐานอยู่ในระดับเวิลด์คลาสและเป็นที่ยอมรับในระดับสากลจนถึงทุกวันนี้
ทั้งนี้ หัวใจสำคัญที่จะช่วยให้ผลลัพธ์ในการรักษาผู้ป่วยมีประสิทธิภาพมากขึ้น ยังประกอบด้วย การทำงานร่วมกันของแพทย์ผู้ชำนาญการในหลากหลายสาขา (Many subspecialties), การทำงานที่สอดประสานกันระหว่างทีมแพทย์และสหสาขาวิชาชีพ (Team approach is needed) และการทำงานที่ใกล้ชิดแบบไร้รอยต่อระหว่างแพทย์สาขาต่างๆ (Multiorgan involvement) เนื่องจากหัวใจเป็นอวัยวะที่สำคัญ หากหัวใจทำงานได้ไม่ดี จะมีผลกระทบต่ออวัยวะอื่นๆ ตามมา ทำให้เกิดโรคต่างๆ เช่น ไตวายเรื้อรัง โรคหลอดเลือดสมองหรือมีเส้นเลือดอุดตันบริเวณต่างๆ ของร่างกาย ดังนั้นการดูแลรักษาที่มีประสิทธิภาพต้องอาศัยการทำงานที่ใกล้ชิดและการสื่อสารอย่างมีประสิทธิภาพ
กระทรวงคมนาคม
กระทรวงคมนาคมได้เสนอของขวัญปีใหม่ที่จะมอบให้กับประชาชนหลายโครงการด้วยกัน
อาทิ เปิดให้วิ่งฟรีทางหลวงพิเศษระหว่างเมือง (มอเตอร์เวย์) หมายเลข 6 สายบางปะอิน - สระบุรี -นครราชสีมา ช่วงอำเภอปากช่อง – อำเภอสีคิ้ว – อำเภอขามทะเลสอ และยกเว้นค่าผ่านทาง มอเตอร์เวย์หมายเลข 7 และหมายเลข 9 และ ยกเว้นค่าผ่านทาง ทางพิเศษบูรพาวิถีและกาญจนาภิเษก ระหว่างเวลา 0.01 น. ของวันที่ 29 ธันวาคม จนถึงเวลา 24.00 น. ของวันที่ 4 มกราคม 2566
ยกเว้นค่าโดยสารรถไฟฟ้าชานเมืองสายสีแดง ระหว่างเวลา 12.00 น. ของวันที่ 31 ธ.ค.2565 ถึงเวลา เวลา 12.00 น. ของวันที่ 1 ม.ค. 2566, เรือไฟฟ้า (EV Boat) จะให้บริการฟรี ตั้งแต่วันที่ 31 ธ.ค. 2565 -1 มกราคม 2566, ลดค่าโดยสาร บขส. 10% ทุกเส้นทาง สำหรับผู้โดยสารที่จองตั๋วรถ บขส. ล่วงหน้าผ่านช่องทางออนไลน์ ตรวจรถฟรี โดยกรมการขนส่งทางบก ตลอดเดือนธ.ค. 2565
ขยายเวลาการเดินรถเมล์ ในเขตกรุงเทพฯ ในเส้นทางที่ผ่านสถานที่จัดงานเคานท์ดาวน์ (Count Down) เช่น สยามพารากอน ไอคอนสยาม และเอเชียทีค ถึงเวลา 02.00 น. ของวันที่ 1 ม.ค. 2566
ขยายเวลาเปิดให้บริการเดินรถของโครงการรถไฟฟ้าสายสีน้ำเงิน สายสีม่วง ตั้งแต่เวลา 06.00 น. ของวันที่ 31 ธ.ค. 2565 จนถึงเวลา 02.00 น. ของวันที่ 1 ม.ค. 2566
ขยายเวลาให้บริการของอาคารและลานจอดรถ MRT ทั้ง 2 สาย ตั้งแต่เวลา 05.00 น. ของวันที่ 31 ธ.ค. 2565 จนถึงเวลา 03.00 น. ของวันที่ 1 ม.ค. 2566
บริการจอดรถฟรี ณ ลานจอดรถระยะยาว โซน C ท่าอากาศยานสุวรรณภูมิ และ ท่าอากาศยานภูเก็ต 29 ธ.ค. 2565 ถึงวันที่ 3 ม.ค. 2566
30 ธันวาคม 2565 ผู้เสียชีวิต (คนไทย) รวม 27 คน LINK
30 ธันวาคม 2565 นายชนาธิป โคกมณี ปลัดจังหวัดสระแก้ว เปิดเผยข้อมูลผู้บาดเจ็บ และเสียชีวิต วันนี้(30/12/65) ณ เวลา 15.00 น. ดังนี้
- ผู้บาดเจ็บ จำนวน 112 คน ยัง Admit ใน รพ. 27 คน ที่เหลือกลับบ้านแล้ว
- ผู้เสียชีวิต (คนไทย) รวม 27 คน แยกเป็น
- เสียชีวิตฝั่งไทย 1 คน
- เสียชีวิตฝั่งกัมพูชา จำนวน 26 คน (คนไทย)
- นำศพกลับมาแล้ว 10 คน
- พิสูจน์อัตลักษณ์แล้ว ยังไม่ได้นำเข้ามา 4 คน
- รอพิสูจน์อัตลักษณ์บุคคล จำนวน 12 คน
การแพทย์เฉพาะบุคคล Personalized Healthcare
การแพทย์เฉพาะบุคคล หรือ การแพทย์แม่นยำ (precision medicine) ก็นับเป็นแนวทางเดียวกัน คือ การมุ่งเป้าให้การรักษา การให้ยา ที่จำเพาะเจาะจงลงไปในแต่ละบุคคล โดยอาศัยผลการวินิจฉัยจากข้อมูลเฉพาะ ไม่ว่าจะเป็นอายุ ปัจจัยเสี่ยงต่างๆ และที่สำคัญและเป็นหัวใจจริงๆ ของแพทย์แนวทางนี้ คือมุ่งเป้าเจาะลึกลงไปในระดับยีนและลำดับพันธุกรรม ที่เป็นข้อมูลเฉพาะแต่ละบุคคลอย่างแท้จริง ซึ่งข้อมูลที่ได้จากการวิเคราะห์นี้ จะบอกได้ว่า ผู้ป่วยจะได้รับยาชนิดใด มีความเสี่ยงหรือผลข้างเคียงหรือไม่อย่างใด เป็นต้น
ไม่เพียงการมองลงในมิติเชิงลึกเท่านั้น แต่การแพทย์เฉพาะบุคคล ยังหมายถึงการจัดสรรวิธีการรักษาให้เหมาะสมกับจริตของบุคคลด้วยเช่นกัน ความต้องการ รสนิยม ความเชื่อของแต่ละบุคคลมีความสำคัญและมีส่วนที่จะนำมาเป็นปัจจัยในการพิจารณา จัดสรรวิธีและกลไกการรักษาที่เหมาะสมได้เช่นกัน
ธุรกิจเด่นอันดับ 5 ธุรกิจ Matching เช่น platform หาคู่ สั่งอาหาร เรียกรถ อื่นๆ ธุรกิจแพลตฟอร์ม (ธุรกิจตัวกลางหรือตลาดกลางทางด้านอิเล็กทรอนิกส์)
ปัจจัยสนับสนุน
1.สถานการณ์การแพร่ระบาดของโควิด-19 ทำให้มีการพัฒนาแพลตฟอร์มที่รองรับกับการเปลี่ยนแปลงของพฤติกรรมผู้บริโภคที่เปลี่ยนแปลงไปอย่างรวดเร็ว
2. ตลาดอีคอมเมิร์ชไทยเติบโตเพิ่มขึ้นมา ทำให้ธุรกิจแพลตฟอร์มเติบโตด้วย เนื่องจากมีความพร้อมในด้าน Ecosystem เช่น ความพร้อมด้าน Logistics, Payment, ตัวเลขผู้ใช้งานสมาร์ทโฟน ฯลฯ
3. กระแสของธุรกิจแพลตฟอร์มที่มีการพัฒนาที่หลากหลายมากยิ่งขึ้น ทำให้ตอบโจทย์ความต้องการของผู้บริโภคให้ตรงจุดกลายเป็นวิถีชีวิตของผู้บริโภคในปัจจุบัน
4. พฤติกรรมผู้บริโภคเปลี่ยนแปลงไปสู่วิถีสังคมเมืองที่เร่งรีบ และต้องการความสะดวกสบาย ประกอบกับการเข้าถึงสมาร์ทโฟนและอินเทอร์เน็ตของสังคมเมือง (Urbanization)
5. พฤติกรรมของคนในปัจจุบันที่เข้าถึงเทคโนโลได้อย่างมาก
6. (แพลตฟอร์มหาคู่) จากการแพร่ระบาดของ COVID-19 ทำให้โอกาสการพบปะผู้คนลดลงและต้องทำงานอยู่ในบ้าน (WFH) ทำให้แพลตฟอร์มหาคู่บนโลกออนไลน์เป็นทางออกสำหรับคนที่ไม่มีเวลาในการพบปะผู้คน
7. (ธุรกิจเรียกรถยนต์รับจ้าง) การผ่อนคลายมาตรการเดินทางเข้าประเทศของรัฐบาล ทำให้เห็นนักท่องเที่ยวเริ่มกลับมาท่องเที่ยวเพิ่มมากขึ้น ดังนั้น การให้บริการเรียกรถจึงเป็นทางเลือกของการเดินทางที่ได้รับความนิยมอย่างมาก และยังตอบโจทย์ทั้งในด้านความสะดวกสบายและมาตรสาบความปลอดภัย
ปัจจัยเสี่ยง
1. ธุรกิจมีการแข่งขันกันค่อนข้างสูง เพื่อพัฒนาแพลตฟอร์มให้เหนือกว่าคู่แข่ง
2. จำนวนบุคลากร/ผู้เชี่ยวชาญเฉพาะด้านมีจำนวนน้อย เมื่อเทียบกับความต้องการ
3. ความไม่ชัดเจนของกฎหมายที่เกี่ยวข้อง
4. ระบบการรักษาความปลอดภัยและการรั่วไหลของข้อมูลส่วนบุคคล
5. การเปลี่ยนแปลงของระดับเทคโนโลยีอย่างรวดเร็ว
6. การก่ออาชญกรรมทางด้านเทคโนโลยี
7. (ธุรกิจจัดส่งอาหาร-เรียกรถ) ราคาพลังงานโลกที่ปรับตัวสูง
8. (ธุรกิจจัดส่งอาหาร-เรียกรถ) ภาระค่าครองชีพที่สูงขึ้น กำลังซื้อผู้บริโภคยังอ่อนแอ ทำให้ผู้คนระวังการใช้จ่ายและการใช้บริการ
9. (แพลตฟอร์มหาคู่) อัตราการเกิดที่ลดลงและจำนวนประชากรสูงอายุที่เพิ่มขึ้น และแนวโน้มที่คนหนุ่มสาวแต่งานเพื่อสร้างครอบครัวลดลง
10. การแข่งขันที่รุนแรง และสร้างผลกระทบไปยังธุรกิจดั้งเดิม (แท็กซี่)
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคตะวันออกเฉียงเหนือ
จังหวัดมหาสารคาม
รหัสสาขา 02556 ม.มหาสารคาม
รหัสสาขา 10065 รพ.มหาสารคาม 2
จังหวัดอุดรธานี
รหัสสาขา 10277 ดงอุดม
จังหวัดชัยภูมิ
รหัสสาขา 11807 ชัยภูมิไฮเวย์
จังหวัดหนองคาย
รหัสสาขา 14723 เนินพระเนาว์
จังหวัดนครราชสีมา
รหัสสาขา 09544 ถนนพิบูลย์ละเอียด
สมุทรสาคร และ สมุทรสงคราม
สมุทรสาคร
- โรงพยาบาล กระทุ่มแบน โทร. 034119990 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ Palliative care/ ฟื้นฟูผู้ป่วยบกพร่องการได้ยิน/ ฟื้นฟูผู้ป่วยบกพร่องการมองเห็น/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- โรงพยาบาลสมุทรสาคร โทร. 034427099 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ ทำเครื่องดาม อุปกรณ์ช่วย/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์/ ฟื้นฟูผู้สูงอายุที่มีความเสื่อมตามวัย
- ศูนย์การศึกษาพิเศษ ประจำจังหวัดสมุทรสาคร โทร. 034406740 เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- โรงพยาบาลบ้านแพ้ว(องค์การมหาชน) โทร. 034419555-6 ฟื้นฟูแขนและมือ/ ฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง/ ฟื้นฟูการกลืน/ เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก/ ฟื้นฟูผู้สูงอายุสมองเสื่อม อัลไซเมอร์
สมุทรสงคราม
- ศูนย์การศึกษาพิเศษ ประจำจังหวัด สมุทรสงคราม 034753027 อัมพวา เตรียมความพร้อมการพูด/ เตรียมความพร้อมการเรียน/ กระตุ้นพัฒนาการ/ ปรับพฤติกรรมเด็ก
- รพ.สมเด็จพระพุทธเลิศหล้า 034714314
ศูนย์บริการสาธารณสุขที่ 5 ทรายทอง
- ที่อยู่ 4 ซอย ทรายทอง 15 ท่าทราย อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทร. 02-5884827
- แผนที่
- Facebook
บริการ
1. คลินิกตรวจโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-11.30 น. 35
2. คลินิกวางแผนครอบครัว วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-11.30 น. 10
3. คลินิกสุขภาพเด็กดี (0-5 ปี) วันอังคารที่ 1 ของเดือน (เด็กอายุน้อยกว่า 1 ปี)
วันอังคารที่ 3 ของเดือน (เด็กอายุมากกว่า 1 ปี) ยกเว้นวันหยุดนักขัตฤกษ์ 13.00-15.30 น. 15
4. ตรวจมะเร็งปากมดลูก วันจันทร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-11.30 น. 5
5. ตรวจคลื่นไฟฟ้าหัวใจ วันพุธ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30-11.30 น. 5
หมายเหตุ ติดต่อนัดหมายคลินิกแพทย์แผนไทย 02-5277320 (ในวันและเวลาราชการ)
จักษุวิทยา ตรวจรักษาโรคเกี่ยวกับดวงตา จอประสาทตา ต้อหิน
จักษุวิทยา ตรวจรักษาโรคเกี่ยวกับดวงตา จอประสาทตา ต้อหิน
เปิดให้บริการเฉพาะวันอังคาร
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ศูนย์กุมารเวชกรรม เพื่อพัฒนาการของเด็กที่จะโตเป็นผู้ใหญ่ที่มีความสุขต่อไป
โทรศัพท์: 052 089 888 หรือโทร 1719
ศูนย์กุมารเวชกรรม
เปิดให้บริการทุกวัน
เวลา 08.00-17.00 น.
ศูนย์กุมารเวชกรรม โรงพยาบาลกรุงเทพเชียงใหม่
เป็นเสมือนผู้ใกล้ชิดและที่ปรึกษาของคุณพ่อคุณแม่ที่พร้อมเสมอ สำหรับการดูแลสุขภาพเด็กๆ ตั้งแต่แรกเกิดไปจนถึงวัยรุ่น (ไม่เกิน 15 ปี) ด้วยการตรวจวินิจฉัย ดูแลและรักษาแบบองค์รวม โดยทีมกุมารแพทย์เฉพาะทางหลากสาขา พยาบาลมากประสบการณ์ ตลอดจนทีมสหสาขาวิชาชีพ ด้วยเครื่องมือและอุปกรณ์ทางการแพทย์ที่ทันสมัยได้มาตรฐานสากล
กุมารแพทย์ผู้เชี่ยวชาญเฉพาะทาง
ให้บริการตรวจรักษาเฉพาะทางสำหรับเด็กป่วย บริการตรวจ ประเมิน วิเคราะห์ รักษา เพื่อป้องกันโรค ฟื้นฟูสุขภาพ และให้คำปรึกษาอย่างใกล้ชิด
กุมารแพทย์ผู้เชี่ยวชาญด้านระบบทางเดินหายใจ
กุมารแพทย์ผู้เชี่ยวชาญด้านโรคหัวใจเด็ก
กุมารแพทย์ผู้เชี่ยวชาญด้านพัฒนาการและพฤติกรรม
กุมารแพทย์ผู้เชี่ยวชาญด้านโรคผิวหนัง
แพทย์ผู้เชี่ยวชาญด้านภูมิแพ้และภูมิคุ้มกันทางคลินิก
กุมารแพทย์ผู้เชี่ยวชาญด้านทารกแรกเกิดและปริกำเนิด
กุมารแพทย์ผู้เชี่ยวชาญด้านโภชนาการ
กุมารแพทย์ผู้เชี่ยวชาญด้านโรคระบบต่อมไร้ท่อ
กุมารแพทย์ผู้เชี่ยวชาญด้านประสาทวิทยา
กุมารแพทย์ผู้เชี่ยวชาญด้านระบบทางเดินอาหาร
แพทย์ผู้เชี่ยวชาญด้านจิตเวชศาสตร์เด็กและวัยรุ่น
ปรับภูมิทัศน์หน้าโรงพยาบาล
"ปรับภูมิทัศน์หน้าโรงพยาบาล เอารั้วออก เปิดรับผู้มารับบริการเต็มที่"
Flour Lab เสวนาและเวิร์กช็อป
Flour Lab จัดเสวนาและเวิร์กช็อปภายใต้หัวข้อ ‘Urban - rice - zation’ เพื่อค้นหาที่มาของแป้งจากต้นข้าวสาลีและเมล็ดพันธุ์พืชต่างๆ ทั้งในเมืองไทยและต่างประเทศ ในปีนี้ Lab สนุกสนานกับการทำโซบะจากเมล็ดบัควีต จากส่วนผสมที่มีเมล็ดบัควีตอยู่มากถึง 80% จนถึง 100% เราจึงอยากชวนคุณมาร่วมกิจกรรมโอมากาเสะ Soba Night และเวิร์กช็อปทำเส้นโซบะด้วยกัน
4 - 12 ก.พ. 11:00 - 22:00
ค่าใช้จ่าย (บาท): 1500
จำนวนที่รับ (คน): 40
ทั้ง 2 กิจกรรม มีค่าใช้จ่าย และ ลงทะเบียนจองล่วงหน้า (จำกัดจำนวนผู้เข้าร่วม)
โทร.0972671808
อาการข้างเคียงหลังฉีดยา LAAB
ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย The Royal College of Ophthalmologists of Thailand
ราชวิทยาลัยจักษุแพทย์แห่งประเทศไทย
The Royal College of Ophthalmologists of Thailand
10th Floor, Royal Golden Jubilee Building, 2 Soi Soomvijai, Petchaburi Road Bangkapi, Huaykwang, Bangkok 10310
Tel : (662) 718-0715-6
Fax : (662) 718-0717
E-mail: admin@rcopt.org
www.rcopt.org/เครื่องดื่ม กัญชา อัดก๊าซกลิ่นไวน์ HappyHour
เครื่องดื่มผสมกัญชาแท้ ช่วยเพิ่มความสดชื่น ดับกระหาย บรรเทาอาการเหนื่อยล้า ดื่มแล้วสดชื่น สามารถผสมกับเครื่องดื่มอื่นเพื่อเพิ่มรสชาติที่แปลกใหม่
หลักฐานที่ใช้ประกอบการขออนุญาต
หลักฐานที่ใช้ประกอบการขออนุญาต การประกอบกิจการที่เป็ นอันตรายต่อสุขภาพ ในลักษณะที่เป็ นการค้า
- บัตรประจำตัวประชาชน/ข้ำราชการ/พนักงาน รัฐวิสาหกิจพร้อมสาเนาที่รับรองถูกต้องจำนวน 2 ฉบับ
- ทะเบียนบ้าน ทะเบียนของสถานประกอบการ พร้อม รับรองสำเนาถูกต้อง จำนวน 2 ฉบับ
- รูปถ่ายหน้าตรงครึ่งตัว ไม่สวมหมวก ไม่สวมแว่น ดำของผู้ขอรับใบอนุญาต ขนาด 1x 1 1/2 นิ ้ว จำนวน 2 รูป
- สำเนาใบอนุญาตก่อสร้างอาคารของสถานที่ขอ อนุญาตประกอบกิจการค้า (กรณีที่ก่อสร้างหลัง พระราชบัญญัติควบคุมอาคาร พ.ศ.2522 ใช้บังคับ)
- สำเนาหนังสือรับรองการจดทะเบียนนิติบุคคล พร้อมสำเนาบัตรประจำตัวประชาชนของผู้แทนนิติ บุคคล (ในกรณีที่ผู้ขออนุญาตเป็ นนิติบุคคล) 6.หนังสือมอบอำนาจ พร้ อมสำเนาบัตรประจาตัวประชาชนและทะเบียนบ้านของผู้รับรอง (กรณีมอบอำนาจ)
5. บริการที่คุ้มครองค่าใช้จ่าย*
ผู้ใช้สิทธิหลักประกันสุขภาพแห่งชาติจะได้รับการคุ้มครองค่าใช้จ่าย* บริการ สาธารณสุข ดังนี้
- การสร้างเสริมสุขภาพ การป้องกันโรค
- การตรวจ การวินิจฉัย การรักษาพยาบาล ตั้งแต่โรคทั่วไป เช่น ไข้หวัด จนถึงการรักษาโรคเรื้อรัง โรคเฉพาะทางที่มีค่าใช้จ่ายสูง เช่น เบาหวาน ความดันโลหิตสูง มะเร็ง ไตวายเรื้อรัง โรคหัวใจ เอดส์ วัณโรค ฯลฯ รวมถึง การฟื้นฟูสมรรถภาพ ตามข้อบ่งชี้ทางการแพทย์
- การคลอดบุตร ใช้สิทธิได้ไม่จำกัดจำนวนครั้ง
- บริการทันตกรรม ได้แก่ อุดฟัน ถอนฟัน ขูดหินปูน การให้ฟลูออไรด์เสริม ในกลุ่มเสี่ยงต่อโรคฟันผุ การรักษาโพรงประสาทฟันน้ำนม การเคลือบหลุม ร่องฟัน ผ่าฟันคุด ใส่เพดานเทียมเด็กปากแหว่งเพดานโหว่ และการทำฟัน ปลอมฐานพลาสติก
- ค่ายาและเวชภัณฑ์ ตามกรอบบัญชียาหลักแห่งชาติ และยาที่มีค่าใช้ จ่ายสูง ตามประกาศของคณะกรรมการหลักประกันสุขภาพแห่งชาติ
- ค่าอาหารและค่าห้องสามัญ ระหว่างพักรักษาตัว ณ หน่วยบริการ
- การจัดการส่งต่อ เพื่อการรักษาระหว่างหน่วยบริการ
- บริการแพทย์แผนไทย ตามข้อบ่งชี้ทางการแพทย์ ได้แก่ ยาสมุนไพรหรือ ยาแผนไทย การนวดเพื่อการรักษา การอบหรือประคบสมุนไพรเพื่อ การรักษา การฟื้นฟูสุขภาพแม่หลังคลอด
- บริการฟื้นฟูสมรรถภาพด้านการแพทย์ ให้แก่คนพิการ ผู้สูงอายุและผู้ที่ จำเป็นต้องได้รับการฟื้นฟู เช่น กายภาพบำบัด จิตบำบัด พฤติกรรมบำบัด กิจกรรมบำบัด ฟื้นฟูการได้ยิน ฟื้นฟูการมองเห็น และรับอุปกรณ์ เครื่องช่วยตามประเภทความพิการได้ตามเกณฑ์ที่ สปสช.กำหนด
ทั้งนี้ คณะกรรมการหลักประกันสุขภาพแห่งชาติกำหนดให้ผู้ใช้สิทธิหลัก ประกันสุขภาพแห่งชาติ
จ่ายค่าบริการเมื่อรับบริการรักษาพยาบาลและได้รับยา ครั้งละ 30 บาท ให้แก่โรงพยาบาลในระบบหลักประกันสุขภาพแห่งชาติตั้งแต่ ระดับโรงพยาบาลชุมชนขึ้นไป (สถานพยาบาลที่มีเตียงนอนตั้งแต่ 10 เตียงขึ้นไป) โดยยกเว้นบุคคล 21 กลุ่มตามประกาศกระทรวงสาธารณสุข และผู้ที่มีความ ประสงค์ไม่จ่ายค่าบริการ 30 บาท
สามารถแจ้งความจำนงไม่จ่ายค่าบริการได้ที่ หน่วยบริการ
* คุ้มครองค่าใช้จ่ายตามการวินิจฉัยทางการแพทย์และประกาศของคณะกรรมการ หลักประกันสุขภาพแห่งชาติ
บริการที่ไม่อยู่ในความคุ้มครอง
- การรักษาภาวะมีบุตรยาก / การผสมเทียม
- การแปลงเพศ / การกระทำใดๆ เพื่อความสวยงามโดยไม่มีข้อบ่งชี้ ทางการแพทย์
- การตรวจวินิจฉัยและรักษาใดๆ ที่เกินความจำเป็นจากข้อบ่งชี้ ทางการแพทย์
- การรักษาที่อยู่ระหว่างการค้นคว้าทดลอง วิจัย
- การบาดเจ็บจากการประสบภัยจากรถ ซึ่งอยู่ในความคุ้มครองตาม กฎหมายว่าด้วยการคุ้มครองผู้ประสบภัยจากรถ เฉพาะส่วนที่บริษัท หรือกองทุนตามกฎหมายนั้นต้องเป็นผู้จ่าย
- การบำบัดรักษาและฟื้นฟูผู้ติดยาและสารเสพติดตามกฎหมาย ว่าด้วยสารเสพติด ยกเว้น บางกรณีตามประกาศคณะกรรมการ หลักประกันสุขภาพแห่งชาติ
- โรคเดียวกันที่ต้องใช้ระยะเวลารักษาตัวในโรงพยาบาลประเภท ผู้ป่วยในเกินกว่า 180 วัน ยกเว้น กรณีมีความจำเป็นต้องรักษา ต่อเนื่องจากภาวะแทรกซ้อนหรือข้อบ่งชี้ทางการแพทย์
- การปลูกถ่ายอวัยวะ (Organ Transplantation) ยกเว้น บางกรณี ตามประกาศคณะกรรมการหลักประกันสุขภาพแห่งชาติ เช่น การปลูกถ่ายไตเพื่อรักษาโรคไตวายเรื้อรังระยะสุดท้าย การปลูก ถ่ายตับในเด็ก (อายุไม่เกิน 18 ปี) ที่เป็นโรคท่อน้ำดีตีบตันแต่ กำเนิด เป็นต้น
นายแพทย์วิชัย โชควิวัฒน ให้กำลังใจ
คุณหมอสุภัทรเป็นแพทย์ที่ยืนหยัด ทุ่มเททำงาน
เพื่อประชาชนในท้องที่ห่างไกลมาอย่างต่อเนื่องยาวนาน
ขอให้กำลังใจให้เข้มแข็ง มั่นคง และยึดมั่นในคติตามพระราชนิพนธ์
ของล้นเกล้าฯ รัชกาลที่ 5 ที่ว่า....
.....
**ความรู้คู่เปรียบด้วย กำลัง กายเฮย
สุจริตคือเกราะบัง ศาสตร์พร้อง
ปัญญาประดุจดัง อาวุธ
กุมสติต่างโล่ป้อง อาจแกล้วกลางสนาม**
......
นายแพทย์วิชัย โชควิวัฒน
26 มกราคม 2566
ศ. นพ. นิมิต เตชไกรชนะ ประธานเจ้าหน้าที่บริหาร ศูนย์พัฒนาและฝึกอบรมบุคลากรบำรุงราษฎร์ คอร์สเรียนชงกาแฟโฉมใหม่ Sister Homemade พัทยา LINK
คอร์สเรียนชงกาแฟ ประเภทเดี่ยว มีเนื้อหาครอบคลุม-เข้มข้ม ทั้งภาคทฤษฎีและปฎิบัติ กลั่นกรองจากประสบการณ์เจ้าของคาเฟ่ตัวจริง (เนื้อหา-สิ่งที่ควรรู้ก่อนเปิดร้านคาเฟ่อย่างละเอียด ) เหมาะสำหรับ
▪️ บุคคลทั่วไป ทุกเพศ-ทุกวัย
▪️ สนใจ งาน เป็นบาริสต้า ใน/ต่างประเทศ
▪️ สนใจ สร้าง ธุรกิจคาเฟ่ เป็นของตนเอง
▪️ สนใจ เรียน ชงกาแฟเพื่อเป็นงานอดิเรก
▪️ สนใจ เรียน ชงกาแฟ อย่างเป็นมืออาชีพ
Yingphaka cafe รับสอนทำขนมและทำเครื่องดื่ม โทร 093-624-5562 และ 096-647-0568 ยินดีให้คำปรึกษา ก่อนสมัครเรียน / สอบถาม สถานที่เรียน : เมืองพัทยา จังหวัดชลบุรี
เขตบางกะปิ ห้องสมุดเพื่อการเรียนรู้บางกะปิ
ห้องสมุดเพื่อการเรียนรู้บางกะปิ (Bang Kapi Public Learning Library)
ปิดบริการในวันนักขัตฤกษ์ และชดเชยนักขัตฤกษ์ที่ตรงกับวันจันทร์
ซอย นวมินทร์ 12 แขวงบางกะปิ เขตบางกะปิ กรุงเทพมหานคร 10240
โทร. 023753963
ปัญหาสุขภาพแยกเป็น 2 มิติ คือ สุขภาพกายและสุขภาพใจ
ปิดท้ายด้วย
ดร. วิรัตน์ ปิ่นแก้ว อธิการบดีมหาวิทยาลัยราชภัฏนครปฐม มองปัญหาสุขภาพออกเป็น 2 มิติ คือ สุขภาพกาย และสุขภาพใจ โดยสุขภาพกายนั้นจะเห็นได้ว่าปัจจุบันภาวะอ้วนในวัยนักศึกษาเพิ่มมากขึ้น ซึ่งมรภ. นครปฐม มีแผนจะดำเนินการออกมาตรการในการดูแลสุขภาวะทางร่างกาย เช่น ดูแลเรื่องอาหารที่จำหน่ายในมหาวิทยาลัยมากขึ้น โดยจะมีประชุมผู้ประกอบการลดการใช้สารปรุงรส เลือกใช้ผักปลอดสาร และคำนึงถึงสารอาหารที่มีประโยชน์ นอกจากนี้ ยังคำนึงถึงการออกกำลังกายเพื่อสุขภาพที่ดีของนักศึกษา โดยจะมีมาตรการสนับสนุนเรื่องการออกกำลังกายในมหาวิทยาลัย เช่น เพิ่มอุปกรณ์การกีฬาและนักศึกษาเบิกมาเล่นได้ เพิ่มพื้นที่ออกกำลังกายให้มากขึ้น เช่น โยคะ หรือลานสเก็ตบอร์ด รวมถึงอนุญาตให้นักศึกษาเข้ามาใช้สถานที่ออกกำลังกายนอกเวลาเรียน โดยคำนึงถึงความปลอดภัยของนักศึกษาเป็นสำคัญ
สำหรับสุขภาพของจิตใจนั้น มองว่าภาวะเครียดและโรคซึมเศร้ามีแนวโน้มสูงขึ้น ซึ่งเกิดได้จากปัญหาแวดล้อมต่างๆ ทั้งด้านเศรษฐกิจ การเงิน การเรียน ครอบครัว และอื่นๆ โดยในส่วนนี้ได้เตรียมมาตรการให้อาจารย์ที่ปรึกษา เข้ามาช่วยดูแลนักศึกษาให้ใกล้ชิดมากขึ้น ซึ่งจะจัดทำแบบฟอร์มคู่มือเพื่อเป็นแนวทางในการปฎิบัติ รวมถึงจะมีการบริหารจัดการเวลาเรียนให้ยืดหยุ่นมากขึ้น เช่น ขยายเวลาลงซัมเมอร์ หรือเปิดบางวิชาในช่วงซัมเมอร์ เป็นต้น ทั้งนี้ในฐานะครูอาจารย์ทุกคนต่างก็อยากเห็นลูกศิษย์อยู่ในมหาวิทยาลัยอย่างมีความสุข มีงานทำ และมีอนาคตที่ดี
ทั้งนี้ อยากวิงวอนให้ อว. และหน่วยงานที่เกี่ยวข้องสนับสนุนและร่วมหาแนวทางแก้ไขอย่างเป็นระบบ และกำหนดในเชิงนโยบาย รวมถึงอยากให้สถาบันวิจัยสังคม จุฬาฯ และ สสส. ได้ทำผลสำรวจในเชิงลึกอย่างต่อเนื่อง เพื่อได้ทราบถึงสาเหตุและแก้ไขปัญหาได้ตรงจุด ยกตัวอย่างเช่น หากพบว่าความเครียดของนักศึกษาส่วนใหญ่เกิดจากปัญหาการเรียน หลักสูตรการเรียนการสอนของมหาวิทยาลัย หรือสามารถระบุชัดเป็นคณะ ก็จะได้มีการหารือกับผู้ที่เกี่ยวข้องได้อย่างเป็นรูปธรรมและกำหนดเป็นแนวทางปฎิบัติอย่างเป็นระบบเพื่อสร้างเสริมสุขภาวะทางจิตที่ดีให้กับนักศึกษา เพื่อให้มีความสุขกับการเรียนในรั้วมหาวิทยาลัย มีสุขภาพที่ดีทั้งกายใจและเติบโตเป็นผู้ใหญ่ที่มีคุณภาพต่อไปในอนาคต
วัดห้วยหินแห
วัดห้วยหินแหบ ตั้งอยู่ที่ อำเภอบึงโขงหลง จังหวัดบึงกาฬ เป็นวัดสำนักสงฆ์แห่งหนึ่งที่มีความเชื่อเรื่องตำนานนาคี โดยถูกกล่าวขานเป็นที่รู้จักกันว่า "พญานาคเล่นน้ำ" โดยเป็นลักษณะของก้อนหินขนาดใหญ่ วางเรียงกัน แต่ในช่องว่างของหินก้อนใหญ่ 2 ก้อนนั้น มีหินก้อนยาวๆลักษณะคล้ายงู ทอดตัวอยู่และมีน้ำอยู่รอบๆ ตามความเชื่อศรัทธาของผู้คนในการไปเยือนดินแดนพญานาคอันศักดิ์สิทธิ์ สามารถมากราบไหว้ ขอพร ทำบุญวัดบ้านถ้ำ อ.ท่าม่วง หลังอิงผา หน้าแม่น้ำ LINK
วัดบ้านถ้ำ ห่างจากวัดถ้ำเสือไปทางตัวเมืองกาญจนบุรีประมาณ 5 กิโลเมตร มีจุดเด่นที่โด่งดัง คือ ทางขึ้นถ้ำเป็นบันไดลึกเข้าไปในปากมังกรตัวใหญ่ ภายในถ้ำมีพระพุทธรูปหลวงพ่อใหญ่ชินราชและโบราณวัตถุ มีหินงอกลักษณะคล้ายผู้หญิง เชื่อกันว่าคือ นางบัวคลี่ ภรรยาของขุนแผนตามตำนานอิงประวัติศาสตร์เรื่องขุนช้างขุนแผน และบนยอดเขายังมีถ้ำที่มีหินงอก หินย้อยสวยงามอีกหลายถ้ำ
วัดบ้านถ้ำเป็นโบราณสถานสำคัญทางพุทธศาสนาที่เก่าแก่แห่งหนึ่งของจังหวัดกาญจนบุรี จดทะเบียนกรมศาสนา เมื่อปี พ.ศ.2325 ปัจจุบันมีเนื้อที่ 25 ไร่ 3 งาน 38 ตารางวา กรมศิลปากรได้เข้ามาสำรวจเมื่อปี พ.ศ.2492 ซึ่งพระยาอนุมานราชธน อธิบดีกรมศิลปากรในขณะนั้น ให้คำสันนิษฐานว่าเป็นวัดที่สร้างในสมัยสุโขทัยและสมัยอยุธยาติดต่อกัน เพราะพระพุทธรูปที่เป็นพระประทานในถ้ำและใบพัทสีมาอุโบสถเก่าของวัดเป็นสมัยสุโขทัย ส่วนพระพุทธรูปหินทรายเป็นสมัยกรุงศรีอยุธยา
จุดสำคัญน่าสนใจอื่นในวัด อาทิเช่น พระอุโบสถหลังเก่าที่ประดิษฐานพระพุทธรูปปางสมาธิพร้อมด้วยพระโมคคัลลานะ พระสารีบุตรที่ทำด้วยหินทรายลงรักปิดทองอันเป็นของเก่าที่มีมาแต่เดิม ส่วนภายในพระอุโบสถหลังใหม่เป็นที่ประดิษฐานพระพุทธชินราชจำลอง ที่ทำพิธีหล่อขึ้น ณ วัดชีปะขาวหาย จังหวัดพิษณุโลก นอกจากนี้ยังสามารถชมถ้ำที่สวยงามต่าง ๆ มากมาย อาทิเช่น ถ้ำคูหามังกรสวรรค์ ถ้ำนางบัวคลี่ซึ่งเป็นที่ประดิษฐาน "หลวงพ่อใหญ่ชินราช" พระพุทธรูปศักดิ์สิทธิ์ที่ชาวบ้านนับถือ รวมทั้งถ้ำอื่น ๆ เช่น ถ้ำม่านวิจิตร ถ้ำขุนแผน ถ้ำดอกจอก อุทยานถ้ำดุสิต ถ้ำหมื่นหาญ ถ้ำนางนวล ถ้ำนางนอน นอกจากนี้บนยอดเขายังเป็นจุดชมวิวที่น่าสนใจอีกมุมหนึ่งของกาญจนบุรี ซึ่งมองเห็นทิวเขาสลับซับซ้อนโอบล้อมเอาไว้สวยงามราวภาพประทับใจ
รถศัลยกรรมเคลื่อนที่ทำหมันสุนัขแมว พัทยา
เมืองพัทยามีหน่วยรถศัลยกรรมเคลื่อนที่ ในความดูแลของกลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม สำหรับออกหน่วยให้บริการ ทำหมันสุนัขแมวจรจัด ไร้บ้าน เพื่อลดจำนวนประชากรหมาแมว แก้ปัญหาสัตว์จรจัดระยะยาว ให้หมดไปจากเมืองพัทยา
พญาครุฑองค์ใหญ่ วัดครุฑธาราม พระนครศรีอยุธยา
วัดที่สร้างขึ้นเมื่อ พ.ศ. 2302 ในรัชกาลสมเด็จพระเจ้าสุริยาศน์อมรินทร์ (พระเจ้าเอกทัศน์) เป็นแบบสถาปัตยกรรมสมัยอยุธยาตอนปลาย อีกหนึ่งวัดเก่าแก่ของอยุธยา สถานที่ประดิษฐาน “พญาครุฑ” องค์ใหญ่ให้สักการบูชาขอพรในเรื่องต่าง ๆ
Numthong Art Space
นำทองอาร์ตสเปซ เปิดตัวปี 2019 เป็นอีกเวทีที่นำเสนอผลงานศิลปะร่วมสมัยระดับเยี่ยม ได้รับความสนใจจากผู้ชมทั้งไทยและต่างชาติเสมอมา ไม่เพียงแต่การเป็นพื้นที่แสดงงาน แต่นำทองอาร์ตสเปซ ยังอุทิศตนเพื่อเป็นแหล่งเรียนรู้ด้านศิลปะสำหรับผู้สนใจอีกด้วย
JWD Art Space
JWD Art Space จากธุรกิจด้านโลจิสติกส์และซัพพลายเชน สู่พื้นที่แสดงงานศิลปะร่วมสมัย ในพื้นที่ 365 ตารางเมตร อาจเป็นก้าวย่างที่แตกต่างไปบ้าง แต่มองที่ผลงานที่เลือกมาจัดแสดง นับว่าจี๊ดไม่เบาทีเดียว ล่าสุดเป็นส่วนหนึ่งของาน Bangkok Art Biennale 2022 อีกด้วย กับผลงาน installation สุดท้าทายจินตนาการ งานปี 2023 ก็น่าชมไม่แพ้กัน โปรดหาเวลาไปแวะชม
JWD Art Space 188/72 ชั้น 3, ซอย จุฬาลงกรณ์ 16 แขวง วังใหม่ เขตปทุมวัน กรุงเทพมหานคร 10330 เปิดทุกวัน 10.00-19.00 น. เว้นวันจันทร์
แนวโน้มเรื่องความสนใจของคนไทยในขณะนี้ คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการด้านวิจัยการตลาดและกลยุทธ์ สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน ประเทศไทย ได้อธิบายในภาพรวมไว้ว่า ‘คนไทยเลือกเสพข่าวอย่างสร้างสรรค์ เริ่มต้นปีใหม่ด้วยข่าวที่สร้างพลังบวกทั้งด้านการเมืองและสังคม’ ความสนใจของคนในสังคมแปรผันตามช่วงเวลาและสถานการณ์ที่เกิดขึ้นในขณะนั้น หลังจากที่คนไทยผ่านช่วงเรื่องราวหนักๆ มาตลอดทั้งปี ช่วงปลายปีที่ผ่านก็มีข่าวเรื่องบอลโลกเข้ามาคลายเครียด เป็นสีสันเล็กๆ ให้กับการเสพข่าวของคนในสังคม ซึ่งแนวโน้มของคนไทยในขณะนี้เริ่มเลือกเสพข่าวด้วย “ความหวัง” เพราะต้องการให้เกิดการเปลี่ยนแปลงในทางที่ดีขึ้นไม่ว่าจะเป็นทางด้านสังคม การเมือง เศรษฐกิจ และชีวิต โดยเฉพาะในแง่ของการเมืองผู้คนยังคงจับตาอยู่ไม่ห่าง หวังให้เกิดการเปลี่ยนแปลงที่ดีขึ้นในอนาคต อีกทั้งยังจะมีการเลือกตั้งใหญ่เกิดขึ้น ยิ่งเป็นที่น่าสนใจของผู้คนในสังคม รวมไปถึงเรื่องทุนจีนสีเทา และเว็บพนันออนไลน์ ที่สะท้อนให้เห็นถึงความตื่นตัวในการพิสูจน์ความปร่งใสของกระบวนการยุติธรรมในสังคม
สถานที่จัดงาน ศูนย์กีฬาแห่งชาติภาคตะวันออก
สถานที่จัดงาน ศูนย์กีฬาแห่งชาติภาคตะวันออก Eastern National Sports Training Center, Chaiyaphruek 2 Rd, Pattaya City, Bang Lamung District, Chon Buri 20150
[
แผนที่ (Location map)]
บทเรียนที่มีคุณฆ่า #JFF2023
บทเรียนที่มีคุณฆ่า #JFF2023
2 ชั่วโมง 8 นาที R:18+
©2022 The Klockworx Co.,Ltd, Tohokushinsha Film Corporation, TV TOKYO Corporation. มาซายะ คะเคย์ นักศึกษามหาวิทยาลัยได้รับจดหมายฉบับหนึ่ง นั่นเป็นจดหมายจากไฮมุระ ฆาตกรต่อเนื่องต้องโทษประหารที่ก่อคดีสะเทือนขวัญคนทั้งประเทศ ไฮมุระนั้นเป็นเจ้าของร้านเบเกอรี่ เขาลักพาตัวเด็กมัธยมปลายไปเพื่อทำการฆาตกรรมอย่างทารุณ ถึงอย่างนั้น เขากลับใจดีและช่วยเหลือมาซายะในสมัยที่ยังเป็นเด็กมัธยมต้นผู้โดดเดี่ยว ไฮมุระยอมรับความผิดที่ก่อไว้ทั้งหมด เว้นแต่เพียงคดีหนึ่งที่เขาอ้างว่าไม่ได้เป็นคนลงมือ เขาจึงขอร้องให้มาซายะมาช่วยสืบสวน แม้จะรู้สึกหวั่นใจ แต่มาซายะก็ตกลงที่จะช่วยจนเขาค่อยๆ เข้าใกล้ความจริงอันน่าสะพรึงกลัว...
อันดับ 5. อุทยานแห่งชาติแจ้ซ้อน จ.ลำปาง
น้ำพุร้อนแจ้ซ้อน คือจุดสนใจอันดับหนึ่งของอุทยานแห่งชาติแจ้ซ้อน เป็นที่ที่นิยมมาพักผ่อน อาบน้ำแร่ แช่ไข่ออนเซ็น เล่นน้ำตก กันสนุกสนาน นอกจากนั้น ยังมีจุดน่าสนใจอื่นๆ ได้แก่ น้ำตกแจ้ซ้อน น้ำตกแม่ขุน น้ำตกแม่เปียก จุดชมทิวทัศน์ดอยล้าน ที่ที่จะได้ชมทิวทัศน์ภูเขา ผืนป่ากว้างใหญ่ของจ.ลำปาง
อุทยานแห่งชาติแจ้ซ้อน พักผ่อนสบาย ราคาสบายกระเป๋า ใกล้ชิดธรรมชาติ เป็นที่นิยมของนักท่องเที่ยวทั้งชาวไทยและชาวต่างชาติ มีหลายแบบให้เลือก ไม่ว่าจะมาพักผ่อนแบบคู่รัก ครอบครัว หรือ มาเป็นแบบหมู่คณะ สามารถพักได้ 3 ท่าน ,4 ท่าน ,8 ท่าน ,และ 15ท่าน
ส่งต่อ “คุณค่า” ในรูปแบบใหม่
พี่จิ๋ม อรพิณ วิไลจิตร หนึ่งในชาวตลาดพลูหน้าใหม่ผู้หลงใหลเสน่ห์ชุมชนตลาดพลู มีแนวคิดที่เปิดรับ พร้อมปรับตัวและดึงเอาคุณค่าในสินทรัพย์ของตัวเองออกมาสร้างมูลค่า โดยพี่จิ๋มเป็นเจ้าของอาคารสีเหลือง 3 ชั้น ที่ครั้งหนึ่งเป็นที่ทำการทหารสมัยสงครามโลกครั้งที่ 2 ในอดีต มีการจัดกิจกรรมในพื้นที่พัฒนาย่านตลาดพลูอย่างต่อเนื่อง ชาวตลาดพลูหน้าใหม่ที่เข้ามาอาศัยในพื้นที่ไม่นาน แต่มีความสนใจ ร่วมกิจกรรมพัฒนาท้องถิ่นอย่างแข่งขัน โดยเริ่มต้นจากกิจกรรมเดินเมืองสํารวจย่านกิจกรรมเวิร์คช็อป เช่น DIY ประดิษฐ์งานคราฟ วาดเขียนสีนํ้า ซึ่งเป็นกิจกรรมที่ล้วนแต่เกี่ยวข้องกับเอกลักษณ์ของย่านตลาดพลู รวมถึงการจัดแสดงหุ่นกระบอกศิลปะจีนและมีการประชาสัมพันธ์ผ่าน FACEBOOK FANPAGE ‘ถามสิ อิฉันคนตลาดพลู’ ซึ่งมียอดผู้ติดตามจำนวนมาก
“การเข้ามามีส่วนร่วมของภาคการศึกษาในครั้งนี้ เป็นก้าวสำคัญของการต่อยอดสร้างมูลค่าชุมชนตลาดพลูให้คงอยู่ไม่จางหายไปกับการเวลา โดยการต่อยอดสร้างมูลค่า “ของดี” ผ่านมุมมอง รูปแบบใหม่ ที่คนรุ่นใหม่ชื่นชอบ”
เทศกาลหุ่นโคมไฟนครสวรรค์ Nakhon Sawan Lantern Festival 2022 LINK
เทศกาลหุ่นโคมไฟนครสวรรค์ ครั้งที่ 5 เป็นเทศกาลที่จัดขึ้นในช่วงเวลาแห่งความสุขของทุกปี ซึ่งในปีนี้ถูกจัดขึ้นภายใต้แนวคิด “เกาะสวรรรค์ มหัศจรรย์แห่งแสง” จัดขึ้นในระหว่างวันที่ 24 ธันวาคม 2565 ถึง 2 มกราคม 2566 ณ เกาะกลางอุทยานสวรรค์ (หนองสมบุญ) ภายในงานท่านจะได้พบกับประติมากรรมหุ่นโคมไฟที่สวยงานและหาชมได้ยาก เช่น ประติมากรรมหุ่นโคมไฟน้ำตกหิมพานต์ , ประติมากรรมเขาวงกตช้างเอราวัณ , ประติมากรรมวาฬยักษ์สีน้ำเงิน และประติมากรรมที่น่ารัก เป็นศิริมงคลมากมาย เชิญชวนร่วมกิจกรรมวิ่งเรืองแสง Let’s Glow Night Run ซึ่งเป็นงานวิ่งที่มีสีสันและความสนุกแบบไม่ซ้ำใคร คาท์ดาวน์ส่งท้ายปีเก่าต้อนรับปีใหม่ กับพลุที่ยิ่งใหญ่ตระการตา และมาร่วมกันให้กำลังใจกับเยาวชนที่กล้าคิดกล้าแสดงออกในการประกวด “COSPLAY”
6.The Always-Glam #สวยไม่พัก
The Always-Glam #สวยไม่พัก เป็นอีกกลุ่ม 5% ของผลสำรวจ จากงานวิจัยพบว่า เสื้อผ้าและผลิตภัณฑ์เพื่อความงามมักติด Top 5 สินค้าที่ต้องการซื้อ และคนมีความต้องการซื้อสูงกว่า 30% ตลอดทั้งปี ทำให้เห็นว่า มีกลุ่มที่ชอบ “ลงทุนเพื่อภาพลักษณ์” โดยสินค้าแฟชั่น/ความงาม คือสินค้าจำเป็น ไม่ใช่สินค้าฟุ่มเฟือยสำหรับคนกลุ่มนี้ แบรนด์จึงต้องตอกย้ำความมั่นใจให้คนกลุ่มนี้ว่า ซื้อเลยสวยชัวร์ แบรนด์คิดมาให้ดีแล้ว ไม่มีพลาดต่อหน้าใครแน่นอน ผ่านการจับ trend/occasion ในการแนะนำสินค้า เพื่อกระตุ้นให้ตัดสินใจซื้อได้ง่ายขึ้น
ขั้นตอนการทำ IVF
แพทย์จะเลือกเก็บไข่ที่สมบูรณ์จากรังไข่โดยใช้เข็มดูดผ่านทางช่องคลอด โดยอาศัยเครื่องอัลตราซาวนด์ ซึ่งจำเป็นต้องให้ยาสลบเพื่อป้องกันความเจ็บปวด ใช้เวลาเก็บไข่ประมาณ 30 นาที หลังการเก็บไข่ ฝ่ายหญิงจะได้รับการรักษาด้วยฮอร์โมนชนิดสอดช่องคลอดหรือฉีดอย่างต่อเนื่อง เพื่อเตรียมพร้อมสำหรับการย้ายตัวอ่อนเข้าโพรงมดลูก
ไข่และอสุจิจะถูกผสมกันในห้องปฏิบัติการเลี้ยงและควบคุมคุณภาพตัวอ่อน จากนั้นติดตามดูไข่ที่ได้รับการปฏิสนธิใน 2 วันต่อมา
ในวันถัดมา ไข่ที่ได้รับการปฏิสนธิจะกลายเป็นตัวอ่อน พร้อมที่จะย้ายเข้าโพรงมดลูกซึ่งมักจะทำในวันที่ 3-5 หลังวันเก็บไข่ ซึ่งขั้นตอนของการย้ายตัวอ่อนเข้าโพรงมดลูกไม่จำเป็นต้องงดน้ำและอาหารก่อนมาโรงพยาบาล ไม่จำเป็นต้องดมยาสลบ และใช้เวลาประมาณ 30 นาที
กระบวนการทำเด็กหลอดแก้ว จะใช้เวลาประมาณ 4-6 สัปดาห์จึงจะสมบูรณ์ โดยหลังการย้ายตัวอ่อนเข้าโพรงมดลูกประมาณ 2 สัปดาห์ แพทย์จะนัดมาตรวจเลือดเพื่อทดสอบการตั้งครรภ์
6. การติดตามอาการผู้ป่วยอย่างไร้รอยต่อทั้งในและนอกโรงพยาบาล
การใช้งานโซลูชันดิจิทัลบนคลาวด์ในวงการสาธารณสุขจะช่วยสนับสนุนการแชร์ข้อมูลที่เพิ่มมากขึ้นและสร้างรากฐานของระบบสาธารณสุขที่สามารถเชื่อมต่อจากโรงพยาบาลไปสู่บ้านผู้ป่วยและชุมชน จากรายงาน Philips Future Health Index 2022 report เผยว่า ผู้บริหารในวงการเฮลท์แคร์เล็งเห็นว่าการดูแลรักษาผู้ป่วยนอกโรงพยาบาลเป็นสิ่งที่ต้องหันมาให้ความสำคัญเป็นอันดับต้นๆ รองจากความพึงพอใจและการรักษาบุคลากรทางการแพทย์ในองค์กร การให้การดูแลรักษาอย่างถูกต้องในสถานที่และเวลาที่เหมาะสม เป็นสิ่งสำคัญที่ช่วยสร้างประสบการณ์แบบไร้รอยต่อให้กับผู้ป่วยได้
เขตบางบอน
ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน รณรงค์กิจกรรมป้องกันโรคพิษสุนัขบ้าในชุมชน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประชาชนบ้านใดที่มีสัตว์เลี้ยงในครอบครอง เช่น สุนัข หรือ แมว
✅ที่มีอายุเกิน 3 เดือนขึ้นไป
✅สุขภาพแข็งแรงสมบูรณ์
✅ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
✅ปีนี้ยังไม่ได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าหรือฉีดวัคซีนเกิน 6 เดือนขึ้นไป
แนะนำให้นำบัตรประจำตัวประชาชนเจ้าของสัตว์มาลงทะเบียนเพื่อขอรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าได้ฟรี
เขตจตุจักร
กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชน เขตพื้นที่รับผิดชอบของศูนย์บริการสาธารณสุข 17 ประชานิเวศน์ ระหว่างวันที่ 13 - 17 มีนาคม 2566 ฟรีไม่เสียค่าบริการ
เขตพระโขนง
สำนักงานเขตพระโขนงร่วมกับศูนย์บริการสาธารณสุข 34 โพธิ์ศรี มีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ครั้งที่ 1 ระหว่างวันที่ 13 - 24 มีนาคม 2566 เวลา 09.00 - 11.00 น. ประชาชนผู้ที่สนใจ โปรดนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาดังกล่าว อย่าลืมพาน้องๆ มารับวัคซีนป้องกันโรคพิษสุนัขบ้า
โรคหลอดเลือดหัวใจ มุ่งเน้นการวินิจฉัยและรักษาโรคหลอดเลือดหัวใจตีบตัน ที่อาจนำมาสู่ภาวะหัวใจล้มเหลวและอาการรุนแรงถึงแก่ชีวิต ในปี 2565 เราได้รักษาโดยการสวนเส้นเลือดหัวใจและการขยายหลอดเลือดหัวใจด้วยบอลลูนและใส่ขดลวด รวมทั้งสิ้น 812 ราย โดยประสบความสำเร็จ 99.2% ในขณะที่สถิติความสำเร็จของสหรัฐอเมริกาอยู่ที่ 95% การเกิดภาวะแทรกซ้อนอยู่ที่ 0.39% ในขณะที่สถิติการเกิดภาวะแทรกซ้อนของสหรัฐอเมริกาอยู่ที่ 2.65%. โดยเฉลี่ยแล้ว ผู้ป่วยอยู่ที่โรงพยาบาลเพื่อดูอาการเพียง 1 วันหลังการรักษา
โรคหัวใจเต้นผิดจังหวะและสรีรวิทยาไฟฟ้า มุ่งเน้นที่การวินิจฉัยและการควบคุมจังหวะการเต้นของหัวใจ รวมถึงภาวะหัวใจห้องบนสั่นพลิ้ว ภาวะหัวใจห้องล่างเต้นเร็ว และภาวะหัวใจเต้นผิดปกติอื่น ๆ ในปีที่ผ่านมา เรารักษาด้วยสรีรวิทยาไฟฟ้า ทั้งหมด 183 ราย อัตราความสำเร็จอยู่ที่ 100% เราได้จี้หัวใจด้วยคลื่นวิทยุความถี่สูง เพื่อรักษาภาวะหัวใจห้องบนสั่นพลิ้ว โดยมีอัตราภาวะแทรกซ้อนอยู่ที่ 4.35% ในขณะที่สถิติการเกิดภาวะแทรกซ้อนของสหรัฐอเมริกาอยู่ที่ 6.5%การรักษาภาวะหัวใจห้องล่างเต้นเร็วมีอัตราความสำเร็จที่ 100% โดยไม่มีอาการแทรกซ้อน
TAVR/TAVI หรือ การเปลี่ยนลิ้นหัวใจเทียมด้วยการใช้สายสวนแบบไม่ต้องผ่าตัด มุ่งเน้นการเปลี่ยนลิ้นหัวใจเอออร์ติกในผู้ป่วยที่มีภาวะลิ้นหัวใจตีบตัน ลิ้นหัวใจแคบลงและขัดขวางการไหลเวียนของเลือด สถาบันโรคหัวใจบำรุงราษฎร์ ได้รักษาการเปลี่ยนลิ้นหัวใจเทียมด้วยการใช้สายสวนแบบไม่ต้องผ่าตัดไปทั้งสิ้น 26 ราย ซึ่งถือเป็นจำนวนเคสที่มากที่สุดในโรงพยาบาลเอกชนในประเทศไทย อัตราความสำเร็จอยู่ที่ 100% โดยไม่มีอาการแทรกซ้อน
ภาวะหัวใจล้มเหลวรุนแรงและการปลูกถ่ายหัวใจ มุ่งเน้นการรักษาผู้ป่วยที่มีภาวะหัวใจล้มเหลวรุนแรง รวมถึงผู้ป่วยที่ต้องการการดูแลเป็นพิเศษจากทีมสหสาขาวิชาชีพหรือจำเป็นต้องได้รับการปลูกถ่ายหัวใจ สถาบันโรคหัวใจบำรุงราษฎร์ เป็นโรงพยาบาลเอกชนแห่งแรกและแห่งเดียวที่สามารถผ่าตัดปลูกถ่ายหัวใจได้ และได้รับการรับรองจาก Joint Commission International อัตราการรอดชีวิตหลังจากปลูกถ่ายหัวใจใน 1 ปีอยู่ที่ 100% โดยไม่มีอาการแทรกซ้อน
การผ่าตัดทำทางเบี่ยงหลอดเลือดหัวใจ คือการผ่าตัดเผื่อเบี่ยงเส้นเลือดหัวใจที่ตีบตันหรือแคบลง เพื่อให้เลือดไปเลี้ยงกล้ามเนื้อหัวใจได้มากขึ้น ในปีที่ผ่านมา เราได้ผ่าตัดหัวใจไป 430 ราย ในจำนวนนี้มี 71 รายที่เป็นการผ่าตัดทำทางเบี่ยงหลอดเลือดหัวใจ อัตราการเสียชีวิตในโรงพยาบาลเป็น 0% ในขณะที่สถิติการเสียชีวิตของสหรัฐอเมริกาอยู่ที่ 2.1% ไม่มีรายงานของภาวะสมองขาดเลือดหลังการผ่าตัดในขณะที่สถิติของสหรัฐอเมริกาอยู่ที่ 3%
การฟื้นฟูสมรรถภาพหัวใจ มุ่งเน้นที่การออกแบบดูแลการออกกำลังกายและการปรับเปลี่ยนรูปแบบการดำเนินชีวิตเพื่อให้ผู้ป่วยหายจากโรคหัวใจและป้องกันโรคหัวใจและหลอดเลือดที่อาจเกิดขึ้นได้ในอนาคต โปรแกรมฟื้นฟูสมรรถภาพหัวใจของเราช่วยให้ 100% ของผู้ป่วยที่ได้รับการผ่าตัดทำทางเบี่ยงหลอดเลือดหัวใจ ใช้ชีวิตตามปกติได้ภายใน 7 วัน (สถิติเฉลี่ยอยู่ที่ 90%) และ 97% ของผู้ป่วยที่ได้รับการขยายหลอดเลือดหัวใจด้วยบอลลูนและใส่ขดลวด กลับมาใช้ชีวิตปกติได้ภายใน 4 วัน (สถิติเฉลี่ยอยู่ที่ 90%)
โรคหัวใจที่ถ่ายทอดทางพันธุกรรม มุ่งเน้นการศึกษาพันธุกรรมที่มีผลต่อการเกิดโรคหัวใจ ได้แก่ โรคกล้ามเนื้อหัวใจหนาผิดปกติ และโรคไขมันในเลือดสูงจากกรรมพันธุ์ ในปัจจุบัน ความรู้เรื่องพันธุกรรมพัฒนาไปมากจนสามารถระบุยีนที่ก่อให้เกิดโรคหัวใจได้ การตรวจรหัสพันธุกรรมช่วยรักษาชีวิตผู้ป่วยที่มีแนวโน้มเป็นโรคหัวใจแต่ยังไม่แสดงอาการได้ นอกจากนี้ การตรวจรหัสพันธุกรรมยังช่วยในการวางแผนการมีบุตรที่มีสุขภาพสมบูรณ์แข็งแรง ในปีที่ผ่านมา เราได้มีการตรวจรหัสพันธุกรรมไปทั้งสิ้น 360 ราย
จากสถิติดังกล่าว จะเห็นได้ว่า สถาบันโรคหัวใจบำรุงราษฎร์ เป็นสถาบันโรคหัวใจชั้นนำที่สามารถรักษาโรคหัวใจได้อย่างครบทุกมิติ มีผลการรักษาที่มีประสิทธิภาพและผู้ป่วยได้รับความพึงพอใจสูงสุด
4.ประเภทรายการนำเที่ยว (Tour Programmes) LINK
นิยาม รายการนำเที่ยวที่จัดขึ้นเพื่อสร้างเสริมประสบการณ์การท่องเที่ยวอย่างมีความรับผิดชอบและ/หรือ ความรู้ด้านธรรมชาติ ระบบนิเวศ วัฒนธรรม วิถีชุมชน ประวัติศาสตร์ ให้แก่นักท่องเที่ยว ซึ่งรายการ นำเที่ยวที่ส่งเข้าประกวดจะต้องเป็นสถานที่ท่องเที่ยวในประเทศไทยเท่านั้น และจะต้องมีการดำเนินการและ ให้บริการมาอย่างต่อเนื่องไม่น้อยกว่า 1 ปี
ลูกเปรียบเทียบรูปร่างหน้าตาตนเองกับเพื่อน
ควรทำ
พ่อแม่ควรอธิบายและสร้างความมั่นใจให้วัยรุ่นว่า ลูกเองก็สามารถสวย/หล่อ ในแบบตัวของตัวเองได้ เพราะความสวยความงามขึ้นอยู่กับมุมมองของคนของแต่ละสังคม
ให้กำลังใจว่าลูกเองก็มีข้อดีและความสามารถหลายด้านที่ต่างจากเพื่อน ไม่มีใครที่มีหน้าตา หรือความสามารถที่เหมือนกันทั้งหมด และควรสนับสนุนให้ลูกเติบโตอย่างมีสุขภาพดี มากกว่าการให้ความสำคัญกับความสวยงามเพียงอย่างเดียว
สอนให้ลูกเข้าใจความแตกต่าง ว่าคนมีเรารูปร่างหน้าตา บุคลิกภาพ ไม่เหมือนกัน ลูกควรเป็นตัวของตัวเอง และไม่ดูถูกคนอื่น
อย่าทำ
การปลูกฝังลูกตั้งแต่ยังเล็ก ว่าแบบไหนถึงเรียกว่าสวย ไม่สวย หล่อ ไม่หล่อ เด็กจะขาดความเป็นตัวของตัวเอง ไม่เห็นคุณค่าด้านอื่นทั้งในตัวเอง และคนรอบข้าง
การตามใจลูกในการใช้จ่าย เพื่อดูแลความสวยความงาม ควรอยู่ในขอบเขตที่เหมาะสม และเน้นให้เด็กรู้จักคิดอย่างมีเหตุผล เพื่อไม่ให้ลูกหมกมุ่นกับเรื่องภาพลักษณ์ โดยมองข้ามคุณค่าอื่น
การตอกย้ำลูกว่าหน้าตาไม่หล่อ ไม่สวย ขี้เหร่ เพราะเชื่อว่าการชมลูกจะให้ลูกเหลิง เป็นการบั่นทอนจิตใจเด็ก และกลับทำให้เด็กเห็นความสำคัญของความสวยงามมากขึ้นอีก
KIN Clinic กายภาพบำบัด
KIN Rehabilitation & Homecare ให้บริการ คลินิกกายภาพบำบัด และ กิจกรรมบำบัด เพื่อการฟื้นฟูสมรรถภาพร่างกาย การฟื้นฟูผู้ป่วยโรคหลอดเลือดสมอง อัมพฤกษ์ อัมพาต มีอาการกล้ามเนื้ออ่อนแรง แขนขาอ่อนแรง การฟื้นฟูผู้ป่วยโรคพาร์กินสัน ออฟฟิศซินโดรม (Office syndrome) การฟื้นฟูร่างกายของผู้สูงอายุ เพื่อลดโอกาสที่จะเกิดการนอนติดเตียง โรคกระดูกสันหลังคด โรคกระดูกทับเส้นประสาท ผู้ป่วยหลังผ่าตัด บาดเจ็บจากการออกกำลังกาย ผู้ที่มีภาวะปวด อักเสบของเอ็นกล้ามเนื้อ กระดูกหัก ผู้ป่วยที่มีอาการปวดเรื้อรัง ข้อเสื่อม เข่าเสื่อม การบำบัดทางศาสตร์พลังงาน เรกิ กายภาพบำบัด เพื่อรักษาอาการปวดเรื้อรังรักษาหายได้โดยไม่ต้องใช้ยา บริการด้วยเครื่องมือทันสมัย เลเซอร์ ช็อคเวฟ อัลตราซาวน์ กระตุ้นไฟฟ้า โดยทีม นักกายภาพบำบัด และ นักกิจกรรมบำบัด ผู้เชี่ยวชาญ ที่มากด้วยประสบการณ์ เพื่อให้ผู้ป่วยมีคุณภาพชีวิตที่ดี ทั้งนี้เราจะมีการประเมินการรักษาผู้ป่วยเป็นระยะๆ เพื่อตรวจสอบความก้าวหน้าของการรักษา และปรับแผนการรักษาให้เหมาะสมกับผู้ป่วยแต่ละราย นางศิริญา กล่าวทิ้งท้ายว่า“นอกจากนี้ธุรกิจสุขภาพหรือ Wellness Business เป็นเมกะเทรนด์ที่กำลังเติบโตทั่วโลกสวนกระแสเศรษฐกิจซบเซา โดยเฉพาะหลังการแพร่ระบาดของโควิด-19 แนวโน้มธุรกิจ Wellness ในปี 2563 ทั่วโลกนั้นมีมูลค่าสูงถึง 4.4 ล้านล้านดอลลาร์สหรัฐหรือประมาณ 145 ล้านล้านบาท ขณะที่ ททท. ตั้งเป้ารายได้รวมการท่องเที่ยวปี 2566 ไว้ 2.38 ล้านล้านบาท เป็นนักท่องเที่ยวต่างชาติ 30 ล้านคน สร้างรายได้ 1.5 ล้านล้านบาท และนักท่องเที่ยวไทย 135 ล้านคน สร้างรายได้ถึง 880,000 ล้านบาท จึงทำให้ธุรกิจ Wellness Business คึกคักน่าสนใจมากยิ่งขึ้น
ซ้าย นายแพทย์สุจิตร์ บัญญัติปิยพจน์ กลาง คุณ วรวัจน์ ลอภิญญกุล อดีตรัฐมนตรีกระทรวงวิทย์ฯ ขวา คุณศิริญา เทพเจริญ กรรมการบริหาร Panacee Medical Centerรับสมัครพนักงานตำแหน่ง : นักกิจกรรมบำบัด 2 อัตรา LINK
ลักษณะงาน
- ให้บริการส่งเสริม ป้องกัน บำบัดรักษาและฟื้นฟูแก่ผู้มารับบริการ
- ตรวจประเมินและให้การบำบัดรักษาในกลุ่มผู้รับบริการ ได้แก่ กลุ่มผู้รับบริการเด็ก กลุ่มผู้ป่วยหย่อนสมรรถภาพทางกาย กลุ่มผู้สูงอายุ
- ใช้อุปกรณ์การรักษาทางกิจกรรมบำบัดรักษาผู้ป่วย
- รับผิดชอบอุปกรณ์ให้เพียงพอและพร้อมใช้งาน
- สามารถฟื้นคืนชีพผู้ป่วยได้ (CPR) กรณีฉุกเฉิน
- ร่วมรับผิดชอบงานวิชาการของหน่วยงาน
- ปฏิบัติหน้าที่อื่นๆ ที่ได้รับมอบหมายจากผู้บังคับบัญชา
คุณสมบัติ
- อายุ 22-40 ปี
- ระดับการศึกษา : ปริญญาตรี สาขากิจกรรมบำบัด
- มีใบประกอบวิชาชีพ
- มีจิตสำนึกในการดูแลเอาใจใส่ผู้ป่วยเป็นอย่างดี
- มีประสบการณ์จะพิจารณาเป็นพิเศษ
Udon Thani Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ณ วัดสระแก้ว วัดสันติวนาราม และลานวัฒนธรรมมรดกโลกบ้านเชียง สัมผัสบรรยากาศวิถีชีวิตชุมชนไทพวนผู้ร่ำรวยด้วยวิถีวัฒนธรรมดีงาม ร่วมทำบุญตักบาตร, สรงน้ำพระพุทธรูป และรดน้ำขอพรพ่อใหญ่ แม่ใหญ่ ไทยพวนบ้านเชียง ประเพณีที่สืบทอดมาในการรดน้ำขอพรผู้สูงอายุของบ้านเชียง เพื่อรับพร ความเป็นสิริมงคล, กิจกรรมท่องเที่ยวถ่ายภาพ สนับสนุนโดย RPST เชื่อมโยงคำชะโนด และทะเลบัวแดง สืบสานวัฒนธรรมไปกับ พิธีทำบุญตักบาตร สรงน้ำพระพุทธรูป รดน้ำขอพรพ่อใหญ่ แม่ใหญ่ และขบวนแห่ทางวัฒนธรรม ให้คนในชุมชนได้สรงน้ำ เป็นสิริมงคลรับปีใหม่ ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
ระหว่างวันที่ 13 - 16 เม.ย. 2566 บ้านเชียง จ.อุดรธานี
เส้นทางวงแหวนถนนกาญจนาภิเษกตะวันตก
สำหรับประชาชนผู้ใช้เส้นทางวงแหวนตะวันตก (ทางหลวงหมายเลข 9 ถนนกาญจนาภิเษกตะวันตก) เพื่อเดินทางไปยังภาคเหนือ หรือภาคตะวันออกเฉียงเหนือ กรมทางหลวงแนะนำเส้นทางเลี่ยงงานก่อสร้างบนทางหลวงหมายเลข 9 ช่วงระหว่างต่างระดับสามโคก- ต่างระดับบางปะอิน ดังนี้
- ไปภาคเหนือ จากทางหลวงหมายเลข 9 วงแหวนตะวันตก - เลี้ยวซ้ายเข้าทางหลวงหมายเลข 3111 ที่ต่างระดับสามโคก - เลี้ยวขวาเข้าทางหลวงหมายเลข 3263 ที่แยกเสนา - เลี้ยวซ้ายเข้าทางหลวงหมายเลข 347 ที่แยกวรเชษฐ์
- ไปภาคตะวันออกเฉียงเหนือ จากทางหลวงหมายเลข 9 วงแหวนตะวันตก - เข้าทางหลวงหมายเลข 345 ที่ต่างระดับบางบัวทอง - เข้าทางหลวงหมายเลข 305 ที่รังสิต - เพื่อเดินทางต่อไปใช้ทางหลวงหมายเลข 9 วงแหวนตะวันออก หรือใช้เส้นทางที่ 3 (กรุงเทพฯ - ภาคตะวันออกเฉียงเหนือ) ต่อไป
ทั้งนี้ กรมทางหลวงพร้อมดูแลด้านความสะดวกปลอดภัยการเดินทางของประชาชนอย่างเต็มที่ พร้อมขอความร่วมมือผู้ใช้ทางขับขี่ด้วยความระมัดระวัง ปฏิบัติตามกฎจราจร วางแผนการเดินทางล่วงหน้า เตรียมร่างกายให้พร้อม หากประชาชนต้องการสอบถามข้อมูลการเดินทางเพิ่มเติมหรือขอความช่วยเหลือระหว่างการเดินทางสามารถติดต่อได้ที่สายด่วนกรมทางหลวง 1586 สายด่วนมอเตอร์เวย์ 1586 กด 7 (โทรฟรีทุกเครือข่ายตลอด 24 ชั่วโมง) และตำรวจทางหลวง 1193
ตลาดเฉพาะ 4 ภาค
ตลาดเฉพาะสินค้าบางกลุ่ม บางประเภท เจาะจง เช่น ตลาดอินโดจีน ตลาดชุมชมหม้อฮ้อม ตลาดผ้าไหม ผ้าทอ อาหารทะเล พลอย ผลไม้ ฯลฯ
ตารางออกตรวจแผนกศัลยกรรมทางเดินปัสสาวะ
Fish Aggregation with Local Fishermen มาดูเร็ว! พวกเราจะสร้างบ้านให้ปลา
หากย้อนไปในอดีต คนท้องถิ่นส่วนมากของเกาะเต่าล้วนประกอบอาชีพทำการประมง เหมือนผู้คนในจังหวัดอื่นๆ ของภาคใต้ เมื่อเวลาผ่านเลยไป นักท่องเที่ยวเริ่มเล็งเห็นจุดดำน้ำที่มีอยู่รอบเกาะ จนในที่สุดการทำประมงและการดำน้ำถูกควบรวมและผสมผสานไปในทิศทางเดียวกัน และเมื่อเป็นเช่นนี้ ชาวประมงพื้นบ้านจึงต้องมีการเรียนรู้การทำประมงอย่างถูกต้อง เพื่อให้ผู้คนสามารถอยู่ร่วมกับฝูงปลาได้อย่างไม่กระทบต่อระบบนิเวศ
สำหรับการทำประมงแบบไม่ก่อให้เกิดปัญหาต่อธรรมชาตินี้ ชาวประมงพื้นบ้านเกาะเต่าจะทำ “ซั้งปลา” หรือบ้านปลา ที่ถือเป็นภูมิปัญญาชาวบ้านแต่โบราณ โดยซั้งปลาจะเป็นสิ่งดึงดูดสัตว์น้ำขนาดเล็กให้มาอาศัยอยู่รวมกันส่งผลให้ปลาใหญ่เข้ามาหากิน ชาวประมงพื้นบ้านก็ทำการประมงได้ง่ายขึ้น
ซั้งปลา จะสร้างจากวัสดุธรรมชาติที่สามารถย่อยสลายในน้ำได้ เช่น สาหร่าย ท่อนซุง มะพร้าว ขณะที่รูปแบบของการทำซั้งนั้น จะแตกต่างกันตามภูมิปัญญาแต่ละชุมชน วิธีนี้จะช่วยให้สัตว์ในทะเลก็ปราศจากอันตรายจากวัสดุที่แปลกปลอม
ผู้เข้าร่วมกิจกรรมนี้ จะได้เรียนรู้การทำบ้านปลา รวมไปถึงการทำประมงสไตล์ชาวเกาะเต่า ที่ไม่เหมือนใคร และที่สำคัญคือ เป็นมิตรต่อคนและสัตว์น้ำ
มาร่วมกันส่องแสงแห่งความรักษ์ธรรมชาติผ่านภูมิปัญญาของปราญชาวประมงเกาะเต่าได้ที่งาน SPOTLIGHT Koh Tao 2023
สถานีชาร์จ EV Station PluZ ภาคกลาง
สถานี บจ.ท่าจีนรุ่งเรืองปิโตรเลียม
88 ม.2 ต.บางกระเจ้า อ.เมืองสมุทรสาคร สมุทรสาคร 74000
สถานีบริการ สาขาพระราม 2 (ขาเข้า)
59/29 ม.1 ต.คอกกระบือ อ.เมืองสมุทรสาคร สมุทรสาคร 74000
สถานีบริการ บจ.มานะชัยบริการ
30/7 ม.4 ถ.เพชรเกษม ต.ท่าตำหนัก อ.นครชัยศรี นครปฐม 73120
สถานีบริการ สาขาพุทธมณฑล สาย 5
73/1 ม.10 ต.ไร่ขิง อ.สามพราน นครปฐม 73210
สถานีบริการ สาขาพุทธมณฑลสาย 4
187 หมู่ 7 ต.กระทุ่มล้ม อ.สามพราน จ.นครปฐม 73110
สถานี สาขานิคมโรจนะ
ทางหลวงแผ่นดินหมายเลข 309 ต.คานหาม อ.อุทัย จ.พระนครศรีอยุธยา 13210
โออาร์-สเปซ ถ.พหลโยธิน กม.56.5
55/5 หมู่ 2 ถนนพหลโยธิน ตำบลลำไทร อำเภอวังน้อย จังหวัดพระนครศรีอยุธยา 13170
สถานี สาขาบางปะอิน
195 ม.3 ถ.สายเอเซีย ต.บ้านเลน อ.บางปะอิน พระนครศรีอยุธยา 13160
สถานีบริการ แอล.พี.จี. บจก.ศิริอยุธยา
3053 ตำบลบ้านเกาะ อำเภอพระนครศรีอยุธยา พระนครศรีอยุธยา 13000
สถานีบริการ วังน้อย
160 ม.7 ต.สนับทึบ อ.วังน้อย พระนครศรีอยุธยา 13170
โอ.อาร์ อคาเดมี่
99/9 ม.6 ต.สนับทึบ อ.วังน้อย จ.พระนครศรีอยุธยา 13170
สถานีบริการ แอล.พี.จี. บจก.สยามทรัพย์สมบูรณ์ ปิโตรเลียม
119 หมู่ 1 ตำบลลำไทร อำเภอวังน้อย พระนครศรีอยุธยา 13170
สถานีบริการ สาขาสระบุรี
112 ม.2 ต.ตลิ่งชัน อ.เมืองสระบุรี สระบุรี 18000
สถานี สาขาพิษณุโลก
958 ม.7 ถ.พิษณุโลก-หล่มสัก ต.สมอแข อ.เมืองพิษณุโลก พิษณุโลก 65000
สถานี บจ.เกียรติสมพงษ์
17/3 ม.7 ถ.พหลโยธิน ต.ยางตาล อ.โกรกพระ นครสวรรค์ 60170
สถานี บจ.เค.ที.ดี.ปิโตรเลียม
17/5 ม.7 ต.ยางตาล อ.โกรกพระ นครสวรรค์ 60170
สถานี ธรรมรัตน์ ปิโตรเลียม
8/1 ม.13 ถ.พหลโยธิน ต.นครชุม อ.เมืองกำแพงเพชร กำแพงเพชร 62000
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (บางรัก) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (บางรัก) 99 ถนน ศรีเวียง แขวงสีลม เขตบางรัก กรุงเทพมหานคร 10500
หลักสูตรน่าสนใจมากมาย
- หลักสูตรอาหารไทย จัดการเรียนการสอน เกี่ยวกับงานพื้นฐานการประกอบอาหารไทย ประเภทแกงเผ็ด แกงจืด ต้มยำ อาหารประเภทยำและพล่า อาหารไทยประกอบแกงคั่ว แกงส้ม ประเภทผัด อาหารไทยประเภทเครื่องจิ้ม อาหารจานเดียวและอาหารว่าง
- หลักสูตรภาษาอังกฤษในงานธุรกิจบริการ สอนภาษาอังกฤษเพื่องานขาย,เพื่องานนวดและสปา,เพื่องานอาหารและเครื่องดื่มรวมทั้งบทสนทนาภาษาอังกฤษที่ใช้ในชีวิตประจำวัน
- หลักสูตรภาษาอังกฤษในชีวิตประจำวัน และหลักสูตรภาษาอังกฤษเพื่อการเดินทาง
-ภาษาอังกฤษในชีวิตประจำวัน : เรียนรู้ ฝึกฝน เพื่อเพิ่มพูนทักษะการใช้ภาษาอังกฤษในชีวิตประจำวันทั้งทักษะการฟัง การพูด การอ่าน การเขียน และการแปล
-ภาษาอังกฤษเพื่อการเดินทาง : ยกระดับการใช้ภาษาอังกฤษ เพื่อพัฒนาอาชีพและเพื่อการเดินทางอย่างมีความรู้รอบ
- วิชาภาษาจีนเพื่อการสื่อสาร ภาษาจีนขั้นพื้นฐานสำหรับการสื่อสารในชีวิตประจำวันทั่วไป การเรียนการสอนประกอบไปด้วยทักษะ ฟัง พูด อ่าน และ เขียน เพื่อให้นักเรียนมีพื้นฐานและสามารถต่อยอดได้ด้วยตนเอง
- หลักสูตรแต่งผมสตรี-ซอยผมสตรีห้อง2 จัดการเรียนการสอนเกี่ยวกับการ (ซอยผมสตรี) 1.วิชาการตัดซอยผมสตรี2.วิชาการทำเคมีผม
- หลักสูตรซอยผมสตรี-แต่งผมสตรี1
-วิชาซอยผมสตรี (ห้อง 1) สอนเกี่ยวกับการตัด-ซอยผมสตรี การทำเคมีผม ทำสีผม ดัดผม ยืดผม ไฮไลท์ผม และการทำทรีทเม้นท์
-วิชาแต่งผมสตรี(ห้อง1) สอนเกี่ยวกับการสระ-ไดร์ ม้วนแกนดัด การม้วนโรลเซ็ทผมม้วนเบบี้ลิส และเกล้าผม
- หลักสูตรตัดผม-ซอยผมสุภาพบุรุษ จัดการเรียนการสอนเกี่ยวกับ การซอยผมสุภาพบุรุษแฟชั่น การจัดแต่งทรงผมสุภาพบุรุษ การเปลี่ยนสีผมสุภาพบุรุษ รวมไปถึง การตัดผมสุภาพบุรุษทรงสูง ตัดผมสุภาพบุรุษรองทรง เป็นต้น
- หลักสูตรช่างซ่อมโน้ตบุ๊ก เนื้อหาวิชา เรียนรู้เกี่ยวกับโครงสร้าง หลักการทำงาน Block Diagram โน๊ตบุ๊ค เทคนิคการใช้มัลติมิเตอร์และออสซิลโลสโคปตรวจเช็คอุปกรณ์และเมนบอร์ดได้ สามารถตรวจเช็คอุปกรณ์อิเล็กทรอนิกส์ในเมนบอร์ดได้ เทคนิคการใช้หัวแร้งและเครื่องเป่าลมร้อนอย่างถูกวิธี รู้เทคนิคการยก –วางไอซีในเมนบอร์ด สามารถ อบชิพ-ยกวางโดยเครื่องยกชิพได้ และทำขาชิพในบอร์ดได้ สามารถถอด-ประกอบโน๊ตบุ๊คได้ เจาะลึกการทำงานของชุดจ่ายไฟ ของCPU , RAM , VGA ,chipset สำคัญต้องรู้ที่มาของระบบไฟ ตรวจสอบอาการเสียที่เกิดจากภาคจ่ายไฟได้ รู้การทำงานและการตรวจเช็คของ hight volteจอภาพแบบ LCDและ LED LCD รู้เทคนิคการเปลี่ยนจอภาพ รู้การทำงานและการตรวจเช็คHDD ,FDD ,DVD ,USB ,Wi-fi Sound ,LAN เทคนิคการใช้เครื่อง Flash BIOS การใช้โปรแกรม Flash BIOSสามารถวิเคราะห์อาการเสียต่างๆที่เกิดกับโน๊ตบุ๊คแต่ล่ะยี่ห้อได้
- หลักสูตรนวดแผนไทย
- หลักสูตรคอมพิวเตอร์และระบบสารสนเทศเพื่อการเรียนรู้ จัดการเรียนการสอนเกี่ยวกับ การใช้งานคอมพิวเตอร์เบื้องต้น เรียนรู้เกี่ยวกับระบบปฏิบัติงาน และการใช้ระบบปฏิบัติการ รวมไปถึงใช้โปรแกรมอรรถประโยชน์ และการใช้งานอินเทอร์เน็ต การใช้งานโปรแกรมประมวลผลคำ โปรแกรมตารางคำนวณ โปรแกรมนำเสนองานเพื่อการพัฒนาตนเองและอาชีพ
- โหราศาสตร์ประยุกต์ หลักสูตรโหราศาสตร์ประยุกต์ จัดการเรียนการสอนเกี่ยวกับ หลักการพยากรณ์ความหมายของตัวเลขศาสตร์ ไพ่ยิปซี ไพ่ออราเคิล การอ่านคำพยากรณ์ด้วยตัวเลขศาสตร์ และดวงชะตาเกิด
- หลักสูตรการพันมอเตอร์และการควบคุมมอเตอร์ หลักสูตรการพันมอเตอร์ : จัดการเรียนการสอน 1. วิชา ไฟฟ้าทั่วไปสำหรับงานเครื่องกลไฟฟ้า ซึ่งสอนเกี่ยวกับการ เขียนแบบไฟฟ้า การเขียนแบบไฟฟ้า การใช้เครื่องมือวัดไฟฟ้า การใช้เครื่องมือช่างไฟฟ้า 2. ซ่อมมอเตอร์ไฟฟ้ากระแสสลับ ซึ่งสอนเกี่ยวกับ การบำรุงรักษามอเตอร์ของมอเตอร์ไฟฟ้ากระแสสลับ 1 เฟสแบบ สปลิสเฟสมอเตอร์ คาปาซิเตอร์มอเตอร์ ยูนิเวอร์แซลมอเตอร์ รีพัลชั่นมอเตอร์ เซ็ดเด็ด โพลมอเตอร์ และ 3 เฟสแบบโรเตอร์กรงกระรอก
- หลักสูตรการควบคุมมอเตอร์ : จัดการเรียนการสอน 1.ไฟฟ้าทั่วไปสำหรับงานเครื่องกลไฟฟ้า ซึ่งสอนเกี่ยวกับ การเขียนแบบไฟฟ้า การต่อวงจรไฟฟ้า การใช้เครื่องมือวัดไฟฟ้า การเครื่องมือช่างไฟฟ้า 2.วิชาการควบคุมมอเตอร์ไฟฟ้ากระแสสลับ สอนเกี่ยวกับ การเดินสายในรางพลาสติกแบบโปร่งวงจรควบคุมการเริ่มเดิน การเดินสายในรางพลาสติกแบบโปร่งวงจรการควบคุมความเร็ว การเดินสายในรางพลาสติกแบบโปร่งวงจรควบคุมแบบเรียงลำดับ การเดินสายในรางพลาสติกแบบโปร่งวงจรกลับทิศทางการหมุน การเดินสายในรางพลาสติกแบบโปร่งวงจรสตาร์ทมอเตอร์สตาร์-เดลต้า 3.วิชา การโปรแกรมและควบคุมมอเตอร์ไฟฟ้ากระแสสลับเบื้องต้น สอนเกี่ยวกับ งานป้อนคำสั่งข้อมูลวงจรการใช้งานควบคุมมอเตอร์
- หลักสูตรเครื่องปรับอากาศ หลักสูตรเครื่องปรับอากาศ : จัดการเรียนการสอน1.วิชาไฟฟ้าทั่วไป สอนเกี่ยวกับ กฏและมาตรฐานทางไฟฟ้าการเขียนแบบ สัญลักษณ์ทางไฟฟ้า เครื่องวัดไฟฟ้า ประเภทของกระแสไฟฟ้า วงจรไฟฟ้าอนุกรมวงจรขนาน วงจรผสม ระบบไฟฟ้า เครื่องมือช่างไฟฟ้า 2.วิชาอุปกรณ์ควบคุมเครื่องปรับอากาศ สอนเกี่ยวกับโครงสร้างอุปกรณ์ควบคุมและอุปกรณ์กำลังพิธีการตรวจสอบอุปกรณ์ควบคุมและอุปกรณ์กำลังวิธีการเลือกและประยุกต์ใช้เครื่องมือควบคุมและอุปกรณ์กำลังแต่ละประเภท 3.วิชาเครื่องปรับอากาศ สอนเกี่ยวกับ ขั้นตอนการติดตั้งเครื่องปรับอากาศแต่ละประเภท การซ่อมบำรุงและการรักษาเครื่องปรับอากาศ งานบริการเครื่องปรับอากาศ
- หลักสูตรจัดดอกไม้เพื่ออาชีพ หลักสูตรจัดดอกไม้เพื่ออาชีพ : จัดการเรียนการสอนเกี่ยวกับ งานจัดดอกไม้สดในแจกัน ในกระเช้า งานจัดช่อดอกไม้ งานจัดพวงหรีด งานจัดซุ้มดอกไม้ การทำมงกุฎดอกไม้ รวมไปถึงการจัดทำโบว์รูปแบบต่างๆ
ระวังโฆษณาหลอกทำงาน LINK
หยุดเป็นเหยื่อภัยคุกคามการเงินออนไลน์เพราะอยากทำงานสบายที่ได้เงินง่าย ๆ
- งานแอดมินเพจ คอยติดต่อและดูแลลูกค้า
- เงินเดือนดี (ขั้นต่ำ 30,000 บาท) ทำดีมีคอมมิชชันอีกต่างหาก
- มีที่พักให้ พร้อมอาหารสามมื้อ
- แค่สามารถใช้คอมพิวเตอร์ และอุปกรณ์สื่อสารต่าง ๆ ได้บ้าง
- ไปทำงานที่ประเทศเพื่อนบ้าน สัญญาจ้าง 2 – 6 เดือน
หากคุณเจอโฆษณาลักษณะนี้บนโซเซียลมิเดีย ไม่ว่าจะเป็น facebook , youtube , tiktok หรือตามเว็บไซต์ต่างๆ บอกไว้เลยว่านี่คือกับดักล่อเหยื่อ หากใครหลงเชื่อไปสมัครแล้วละก็!! ท่านอาจจะกลายเป็นโจรโดยไม่รู้ตัว เพราะงานลักษณะนี้มันก็คือ งานแก๊งคอลเซนเตอร์
โรงพยาบาลบางนากรุงเทพมหานคร เปิดให้บริการจุดฉีดวัคซีนโควิด-19 ประจำเดือนเมษายน 2566 LINK
โรงพยาบาลบางนากรุงเทพมหานคร เปิดให้บริการจุดฉีดวัคซีนโควิด-19 ประจำเดือนเมษายน 2566 สำหรับ ทุกเข็ม สำหรับอายุ 12 ปี ขึ้นไป
- เข็มที่ 1-3 พิจารณาตามระยะเวลาการได้รับวัคซีน
- ห่างจากเข็มสุดท้ายระยะเวลาอย่างน้อย 3เดือน
เปิดจุดฉีดวัคซีนโควิด-19
วันจันทร์ เวลา 09.00 - 14.00 น. walk in จำนวน 100 ราย
วันอังคาร เวลา 09.00 - 12.00 น. รับเฉพาะจองผ่าน ระบบ QueQ จำนวน 50 ราย
ชาวต่างชาติ มีค่าบริการ*ตามประกาศ เรื่อง อัตราค่าบำรุงการตรวจวิเคราะห์และให้บริการด้านการป้องกันและควบคุมโรค กรมควบคุมโรค ลงวันที่ 10 มกราคม 2566
ชาวไทย ไม่เสียค่าบริการ
สิ่งที่ต้องนำมาในวันที่ฉีดวัคซีน
1.บัตรประจำตัวประชาชนตัวจริง
2. passport และหลักฐานรับรองการได้รับวัคซีนป้องกันโรคโควิด-19
- ยกเว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์
สอบถามเพิ่มเติม โทร 02-1800-201 ถึง 3 ต่อ 112
ศาสตราจารย์นายแพทย์เอียน เอช เฟรเซอร์ (Ian H. Frazer, MB.ChB., M.D.) ศาสตราจารย์เกียรติคุณ มหาวิทยาลัยควีนส์แลนด์ ออสเตรเลีย / สหราชอาณาจักร
ศาสตราจารย์นายแพทย์เอียน เอช เฟรเซอร์ สำเร็จการศึกษาแพทยศาสตรบัณฑิตจาก มหาวิทยาลัยเอดินบะระ สหราชอาณาจักร ฝึกอบรมเป็นอารยุรแพทย์โรคไตและวิทยาภูมิคุ้มกัน หลังจากย้ายถิ่นฐานไปพำนักในประเทศออสเตรเลียแล้ว สำเร็จการศึกษาแพทยศาสตร์ดุษฎีบัณฑิต จากมหาวิทยาลัยเมลเบิร์น ประเทศออสเตรเลีย
ผู้ประกันตน เกษมราษฎร์ ประชาชื่น เริ่มฉีดได้ตั้งแต่ 1 พ.ค.66 ไม่เสียค่าใช้จ่าย LINK
ผู้ประกันตนที่ถือบัตรประกันสังคมโรงพยาบาลเกษมราษฎร์ ประชาชื่น อายุ 50 ปีขึ้นไป เข้ารับการฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ***ไม่เสียค่าใช้จ่าย*** เริ่มตั้งแต่วันที่ 1 พ.ค.66 -31 ส.ค. 66
นัดหมายล่วงหน้าหรือสอบถามรายละเอียดเพิ่มเติมได้ที่ 02-910-1600 ต่อ 1790, 1791 แผนกส่งเสริมสุขภาพ
กรณีถือบัตรประกันสังคมและอายุต่ำกว่า 50 ปี ใช้สิทธิ์ฉีดวัคซีนในราคา 450 บาท ***ผู้ฉีดวัคซีนต้องมีอายุตั้งแต่ 12 ปีขึ้นไป***
ผ้าพันแผลอัจฉริยะ Smart Bandages
ผ้าพันแผลที่ใช้เซ็นเซอร์เพื่อตรวจสอบการรักษาบาดแผลได้รับการพัฒนาโดยนักวิจัยในสหรัฐอเมริกา “ช่วยให้แผลปิดเร็วขึ้น เพิ่มการไหลเวียนของเลือดใหม่ไปยังเนื้อเยื่อที่บาดเจ็บ และเพิ่มการฟื้นตัวของผิวหนังโดยการลดการเกิดแผลเป็นลงอย่างมาก” ตามคำกล่าวของทีมวิจัยจากมหาวิทยาลัยสแตนฟอร์ด
ชั้นอิเล็กทรอนิกส์บาง ๆ บนผ้าพันแผลมีเซ็นเซอร์อุณหภูมิที่คอยตรวจสอบบาดแผล หากจำเป็น พวกเขาสามารถกระตุ้นไฟฟ้ามากขึ้นเพื่อเร่งการปิดของเนื้อเยื่อ
Artem Trotsyuk ผู้เขียนร่วมของการศึกษาเกี่ยวกับผ้าพันแผลกล่าวว่า "ด้วยการกระตุ้นและการสัมผัสในอุปกรณ์เดียว ผ้าพันแผลอัจฉริยะช่วยเร่งการรักษา แต่ยังติดตามขณะที่แผลกำลังดีขึ้นด้วย"
ผ้าพันแผลอัจฉริยะ จำเป็นต้องเอาชนะปัญหาด้านต้นทุนและการจัดการข้อมูลให้ได้ก่อน ก่อนที่จะเข้าสู่การผลิตแบบอุตสาหกรรม อย่างไรก็ตาม ผลิตภัณฑ์ตัวนี้จะมีประโยชน์ต่อผู้ที่มีระบบภูมิคุ้มกันถูกกดทับและเป็นโรคต่างๆ เช่น โรคเบาหวาน ซึ่งมักประสบกับบาดแผลที่หายช้าได้
World Economic Forum
Feb 22, 2023
ติดต่อโรงพยาบาลบำรุงราษฎร์ ตลอด 24 ชั่วโมง
สอบถามข้อมูลเพิ่มเติมวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถติดต่อได้ที่ศูนย์ข้อมูลยาโรงพยาบาลบำรุงราษฎร์ตลอด 24 ชั่วโมง
- เบอร์ Contact center โทร: 02-066-8888 และ 1378
- ศูนย์อายุรกรรม Hot line โทร: 02-011-3594
- การให้บริการของฝ่ายเภสัชกรรม โทร: 02-011-3399
ห้องตรวจตา
ห้องตรวจตา อาคารอำนวยการ (เก่า) ชั้น 4 เบอร์โทรติดต่อ 044 – 615002 ต่อ 3412
สำหรับศูนย์ “St.Carlos RECC” เป็นโมเดลใหม่ของทางโรงพยาบาลฯ ก่อตั้งเป็นศูนย์ดูแลผู้ป่วยที่ต้องพักรักษาตัวและฟื้นฟูสุขภาพที่โรงพยาบาลเป็นระเวลานาน ซึ่งแผนการขยายธุรกิจดังกล่าวสอดคล้องกับเทรนด์ผู้สูงวัยในไทยที่จะเพิ่มขึ้นทั้งนี้คาดว่าจะได้รับการตอบรับที่ดีจากกลุ่มลูกค้าต่อเนื่องในส่วนของโรงพยาบาล โดยในอนาคตตามแผนที่วางไว้จะผลักดันให้ “St.Carlos RECC” เป็นศูนย์กลาง (Hub) ของกรุงเทพฯและปริมณฑลในการให้บริการดูแลผู้ป่วยฟื้นฟูแบบครบวงจรทุกมิติ ด้วยค่าบริการเริ่มต้นโดยเฉลี่ยอยู่ที่ 1,000 – 2,600 บาท/วัน
ทบทวนสิทธิประโยชน์ของกองทุนหลักประกันสุขภาพ และกองทุนประกันสังคม
ปัญหา
ปัจจุบันนโยบายสาธารณสุขของไทย เน้นเรื่องด้านการรักษามากกว่าด้านการป้องกัน ถึงแม้ว่าจะมีการรณรงค์ให้คนรักษาสุขภาพโฆษณาของ สสส. ก็ตาม แต่ก็ยังไม่มีแรงจูงใจที่มากพอให้ประชาชนปรับพฤติกรรมสุขภาพของตัวเองให้ดีขึ้นโดยเฉพาะด้านการบริโภค (เช่น กินอาหารรสจัด ดื่มสุรา สูบบุหรี่) ซึ่งพฤติกรรมเสี่ยงเหล่านี้ นำไปสู่กลุ่มโรคไม่ติดต่อเรื้อรัง ที่เป็นสาเหตุของการเสียชีวิตอันดับ 1 ของไทย นอกจากนี้ภาครัฐยังขาดการส่งเสริมการสร้างพฤติกรรมสุขภาพที่ดีให้กับคนไทย (เช่น การออกกำลังกาย การตรวจสุขภาพประจำปี และการรักษาโรคตามคำสั่งแพทย์อย่างเคร่งครัด) ซึ่งนำไปสู่ความเสี่ยงต่อการเจ็บป่วยระยะยาว ส่งผลต่อชีวิตความเป็นอยู่ของประชาชน
นอกจากนั้น สิทธิประโยชน์ในกองทุนหลักประกันสุขภาพแห่งชาติ ยังไม่ครอบคลุมสิทธิประโยชน์บางประการที่มีความจำเป็นต่อสุขภาพของคนไทย อาทิ แว่นตาสำหรับเด็กที่อายุต่ำกว่า 18 ปี การคัดกรองมะเร็ง วัคซีนป้องกันโรคบางโรคสำหรับเด็กและผู้ใหญ่ และการตรวจสุขภาพจิต ซึ่งสิทธิประโยชน์เหล่านี้มีความคุ้มค่าในเชิงป้องกันมากกว่าการรักษา หรือหากพบโรค (ในกรณีโรคมะเร็ง) ในระยะเวลาที่รวดเร็วย่อมทำการรักษาได้ง่ายกว่าและประหยัดค่าใช้ในการรักษาได้มากกว่า
ข้อเสนอ
ทบทวนบัญชียาหลักในระบบและสิทธิประโยชน์ในกองทุนสุขภาพให้เท่าทันกับวิทยาการทางแพทย์
ยุทธศาสตร์ที่ 5 เสริมสร้างขีดความสามารถขององค์กรภาคีเครือข่ายด้านวัคซีนของประเทศ
โดยให้ความสำคัญกับการสนับสนุน ส่งเสริมความร่วมมือระหว่างหน่วยงานทั้งภาครัฐและเอกชนทั้งในและต่างประเทศให้สามารถดำเนินการวิจัยพัฒนาและผลิตวัคซีนทั้งระบบได้อย่างมีประสิทธิภาพเพื่อรองรับความจำเป็นด้านสุขภาพ เศรษฐกิจ และความมั่นคงของชาติ
ความร่วมมือขององค์กรภาคีเครือข่ายภาครัฐและเอกชนทั้งในและต่างประเทศ
ในปี 2565 เกิดความร่วมมือระหว่างรัฐกับเอกชนในการร่วมลงทุนในการวิจัยพัฒนาและผลิตวัคซีนโควิด-19 ได้แก่ โครงการการศึกษาความปลอดภัย (Safety) ความสามารถในการกระตุ้นภูมิคุ้มกัน (Immunogenicity) และประสิทธิภาพ (Vaccine Efficiency) ของแคนดิเดตซับยูนิตวัคซีน สำหรับป้องกันโควิด-19 ที่ใช้พืชเป็นแหล่งผลิตในมนุษย์ระยะ 2A และมีการบูรณาการงบประมาณระหว่าง สวช. และสำนักงานการวิจัยแห่งชาติในการสนับสนุนการวิจัยพัฒนาวัคซีนโควิด-19 เช่น โครงการศึกษาความปลอดภัยและระดับภูมิคุ้มกันต่อไวรัส SARS CoV29 จากวัคซีน mRNA ในเด็กวัยรุ่นไทย และโครงการการศึกษาภูมิคุ้มกันหลังการได้รับวัคซีนโควิด-19 ชนิด mRNA ในเด็กไทยอายุ 5-11 ปี ที่เคยติดเชื้อโควิด-19
Cultural District 2023 ลานคนเมือง ท่าพระจันทร์
กิจกรรมประจำจันทร์ – ศุกร์
Mini Exhibition : ย้อนความหลังเมื่อครั้งดนตรียุค 90’s (10.00 – 20.00 น.)
Workshop : 10.00 – 18.00 น.
1.Monoprint Postcard
2.กิจกรรมขอเพลงหน่อย 90 ‘s โดนใจวัยจ๊าบ
3.Jukebox Game : Key Word เพลงเก่า : เพลงของใคร ทายให้มันส์
Show : การแสดงดนตรี Unplug / Folk song (18.00 – 20.00 น.)
19 พ.ค.66 : KITTI
22 พ.ค.66 : แตงโม The Voice
23 พ.ค.66 : Life Self
24 พ.ค.66 : Atiwit Chari
25 พ.ค.66 : Dead Flowers
กิจกรรมวันเสาร์-อาทิตย์)
Mini Exhibition : ย้อนความหลังเมื่อครั้งดนตรียุค 90’s (10.00 – 20.00 น.)
Workshop : 10.00 – 18.00 น.
1.Monoprint Postcard
2.กิจกรรมขอเพลงหน่อย 90 ‘s โดนใจวัยจ๊าบ
3.Jukebox Game : Key Word เพลงเก่า : เพลงของใคร ทายให้มันส์
Show : การแสดงดนตรี Mini Concert Inspirations from 90’s โดยร้านน้องท่าพระจันทร์ (19.00 – 20.00 น.)
20 พ.ค.66 : Loser Pop
21 พ.ค.66 : Sobboy
27 พ.ค.66 : Nap a Lean+Purple Cat
28 พ.ค.66 : Sherry
คลินิกเบาหวาน นอกเวลาราชการ ทุกวันพฤหัสบดี
คลินิกเบาหวาน นอกเวลาราชการ ทุกวันพฤหัสบดี เวลา 16.30-20.00น
คลินิกอายุรกรรมโรคระบบทางเดินอาหารและตับ ปิดบริการทุกวันจันทร์ที่ 1 และ 3 ของเดือน
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ คลินิกอายุรกรรมโรคระบบทางเดินอาหารและตับ ให้บริการตรวจโรคกระเพาะอาหารอักเสบ กรดไหลย้อน ลำไส้อักเสบ ท้องเสีย ท้องผูก ลำไส้แปรปรวน ริดสีดวงทวาร เลือดออกทางเดินอาหาร ส่องกล้องทางเดินอาหาร คัดกรองมะเร็งลำไส้ใหญ่ ไว้รัสตับอักเสบบี/ ซี ไขมันพอกตับ ตับอ่อนอักเสบ ตับแข็ง เนื้องอกทางเดินอาหาร มะเร็งตับทางเดินน้ำดี มะเร็งกระเพาะอาหารและลำไส้ ตัวตาเหลือง โดย พญ.ปองนุช บุญยไพศาลเจริญ อายุรแพทย์โรคระบบทาง เดินอาหารและตับ เปิดบริการทุกวันจันทร์ที่ 1 และ 3 ของเดือน (เริ่มเดือนมกราคม 2566) เว้นวันหยุดนักขัตฤกษ์ เวลา 16.30-20.30 น. ณ ห้องตรวจเบอร์ 6 โรงพยาบาลสิงห์บุรี
คลินิกพิเศษด้านอายุรกรรม โรคทางเดินอาหารและตับ
5.ถูกขังในระบอบ Value Lock-in
ระบบที่มีความสามารถสูงทำให้คนกลุ่มเล็กๆ กลับมีพลังมหาศาล ซึ่งนำไปสู่การถูกล็อกอยู่ในระบบที่กดขี่
AI ที่เต็มไปด้วยค่าเฉพาะอาจกำหนดคุณค่าที่จะเผยแพร่ในอนาคต บางคนแย้งว่าการประมวลผลข้อมูลที่เพิ่มขึ้นอย่างมากและความยากในการเข้าถึงข้อมูลเอง จะทำให้ AI กลายเป็นกองกำลังรวมศูนย์ ยิ่งเมื่อเวลาผ่านไป ระบบ AI ที่ทรงพลังที่สุดอาจถูกออกแบบโดยและเพื่อกลุ่มผู้มีส่วนได้เสียเพียงกลุ่มเล็กๆ เท่านั้น และกลุ่มนั้นจะยิ่งเล็กลงเรื่อยๆ ซึ่งมันจะนำไปสู่การเกิดระบอบที่มีค่านิยมเฉพาะแบบ ร่วมกับการปิดกั้นเชิงกดขี่ (oppressive censorship) การเอาชนะระบอบการปกครองดังกล่าวอาจเป็นไปได้ยาก โดยเฉพาะอย่างยิ่งหากเราต้องพึ่งพามัน แม้ว่าผู้สร้างระบบเหล่านี้จะรู้ว่าระบบของพวกเขาให้บริการตนเองหรือเป็นอันตรายต่อผู้อื่น พวกเขาอาจมีแรงจูงใจในการเสริมพลังและหลีกเลี่ยงการกระจายการควบคุม
จอตา หรือเรตินา สำคัญที่สุด - พญ. เมทินี ศิริมหาราช
พญ. เมทินี ศิริมหาราช หัวหน้าศูนย์จักษุและจักษุแพทย์เฉพาะทางโรคจอตาและน้ำวุ้นตา โรงพยาบาลบำรุงราษฎร์ กล่าวว่า การที่คนเราจะมองเห็นได้อย่างชัดเจนนั้น ทุกองค์ประกอบของดวงตามีความสำคัญ โดยเฉพาะ "จอตา หรือเรตินา" ถือเป็นส่วนประกอบที่สำคัญที่สุดของดวงตา เพราะเป็นตัวกำหนดประสิทธิภาพในการมองเห็น ในภาวะที่จอตาปกติ แสงที่ผ่านเข้ามาแล้วหักเหผ่านกระจกตาและเลนส์ตาจะตกกระทบที่จอตาพอดี ทำให้ภาพที่มองเห็นมีความคมชัด ในทางกลับกัน หากป่วยเป็นโรคของจอตาหลาย ๆ โรคที่หากไม่ได้รับการรักษาอย่างเหมาะสม อาจนำไปสู่การสูญเสียการมองเห็นได้ เพราะจอประสาทตาเป็นอวัยวะที่เมื่อเสื่อมหรือเสียหายไปแล้ว ไม่สามารถแก้ไขหรือเปลี่ยนใหม่ได้เหมือนกระจกตา โดยโรคของจอประสาทตาที่พบบ่อย ได้แก่ จอตาฉีกขาดหลุดลอก จอตาเสื่อมในผู้สูงอายุ เบาหวานขึ้นจอตาในผู้ป่วยเบาหวาน โรคจอประสาทตาเสื่อมจากพยาธิสภาพของจอตาเอง มักเป็นแต่กำเนิด เช่น จอประสาทตาบางกว่าปกติ มีรูขาด หลุดลอก หรือเสียหายจากภาวะสายตาสั้นมาก
The Spirit of ChaiyaPhum เหล้าชัยภูมิ LINK
The Spirit of ChaiyaPhum (เดอะสปิริต ออฟ ชัยภูมิ) เหล้ารัมจากชัยภูมิ แบรนด์นี้เริ่มผลิตมาได้ประมาณ 1 ปี จากฝีมือช่างนาฬิกาชาวฝรั่งเศสที่มาพบรักกับสาวชัยภูมิที่เกาะสมุย เมื่อตกลงปลงใจกันแล้วว่าจะมาอยู่ที่ไทย ด้วยสาวเจ้ามีไร่อ้อยอยู่ หนุ่มฝรั่งเศสจึงปิ๋งไอเดียในการทำเหล้ารัมจากอ้อยของผู้สาว จากที่เป็นแค่นักดื่มเค้าใช้เวลาสองปีในการศึกษาลองผิดลองถูกจนได้เหล้ารัมตัวนี้ขึ้นมา เหล้าตัวนี้ผลิตจากอ้อยสด คั้นน้ำแล้วนำมาหมักโดยใช้ยีสต์จากธรรมชาติที่ติดมากับลำอ้อย เหล้าตัวนี้ใช้เวลาหมักมากกว่าปกติ เพราะไม่ได้ใส่ยีสต์อื่นๆ เพิ่มเติมลงไป จึงได้ความเป็นอ้อยสดแบบมาทั้งเปลือกมาทั้งกอ และเมื่อเหล้าตัวนี้ออกสู่สาธารณะ การเปลี่ยนแปลงก็มาสู่ครอบครัวอย่างไม่คาดคิด
ข้อมูลและภาพจากเพจประชาชนเบียร์
ทันตกรรมประกันสังคม โรงพยาบาลภัทร-ธนบุรี LINK
ทันตกรรมประกันสังคม ใช้สิทธิประโยชน์ทำฟัน ครอบคลุมอะไรบ้าง นอกจาก ถอดฟัน อุดฟัน ขูดหินปูน ผ่าฟันคุด วงเงินรวมไม่เกิน 900 บาท/ปี แล้ว ยังสามารถใส่ฟันปลอมชนิดถอดได้บางส่วน และใส่ฟันปลอมชนิดถอดได้ทั้งปาก
หลักสูตรด้าน การแพทย์ครบวงจร (Medical Hub) LINK
*ปี 2564
- การพัฒนาซอฟต์แวร์เครื่องมือแพทย์เบื้องต้นตามมาตรฐาน IEC 62304: 2006 + AMD1:2015
- การพัฒนาซอฟต์แวร์เครื่องมือแพทย์เบื้องต้นตามมาตรฐาน IEC 62304: 2006 + AMD1:2015 (The fundamental of IEC 62304: 2006 + AMD1:2015: Workshop)
- การพัฒนาซอฟต์แวร์เครื่องมือแพทย์เบื้องต้นตามมาตรฐาน IEC 62304: 2006 + AMD1:2015 (The fundamental of IEC 62304: 2006 + AMD1: 2015: Overview)
ถอดบทเรียน Rigs to Reefs แห่งแรกในไทย สู่องค์ความรู้ใหม่ของประเทศ
นอกจากภาครัฐ ภาคเอกชน และภาคการศึกษาจะมีส่วนสำคัญในการขับเคลื่อนโครงการดังกล่าวแล้ว แต่การรับฟังเสียงของประชาชนผู้มีส่วนได้ส่วนเสียในพื้นที่ ถือเป็นส่วนสำคัญในการดำเนินการในทุกย่างก้าว โดยนายอภิชัย เอกวนากุล รองอธิบดี กรมทรัพยากรทางทะเลและชายฝั่ง กล่าวถึงการกำกับดูแลของภาครัฐว่า “เพื่อฟื้นฟูระบบนิเวศให้สมบูรณ์และสำรวจโครงการฯ อย่างแม่นยำสำหรับการนำองค์ความรู้ไปต่อยอดในอนาคต ทำให้เราจำเป็นต้องออกมาตรการให้พื้นที่ดังกล่าวเป็นพื้นที่คุ้มครองก่อนในช่วง 1-2 ปีแรก หลังจากนั้นเรามีแผนที่จะเปิดให้พื้นที่ส่วนนี้สามารถทำประมงโดยใช้เครื่องมือที่ถูกต้องตามกฎหมาย เช่น คันเบ็ด รวมถึงเปิดให้เป็นจุดดำน้ำสำคัญแก่นักท่องเที่ยว ซึ่งเรามองว่ามีความสวยงามทัดเทียมกับจุดดำน้ำที่เกิดจากธรรมชาติ โดยหากผลสำรวจและเก็บข้อมูล รวมถึงงานวิจัยที่ได้รับการรับรองจากทางจุฬาลงกรณ์มหาวิทยาลัยชี้ว่าเป็นที่น่าพอใจ และให้ประโยชน์มากกว่าให้โทษ ทางกรมทรัพยากรทางทะเลและชายฝั่งก็จะตั้งเป้าแผนงานในการต่อยอดในพื้นที่อื่นต่อไป”
จากจุดเริ่มต้นของโครงการนำร่อง Rigs-to-Reefs ที่ได้ศึกษาแนวทางตลอดกว่าทศวรรษจากความร่วมมือทั้งภาครัฐ ภาคเอกชน และชุมชนในพื้นที่ ทำให้วันนี้เราได้เห็นความสำเร็จแรกในประเทศไทยในการพลิกบทบาทขาแท่นหลุมผลิตปิโตรเลียมสู่บ้านปลาหลังใหม่ใต้ท้องทะเล โดยมากกว่าผลสำเร็จของโครงการ คือ “ความหวังใหม่” ของประเทศไทยในการคืนชีวิตให้ผืนป่าแห่งท้องทะเลสีครามอีกครั้ง ดังเช่นที่ได้รับขนานนามว่าเป็นทะเลมรดกของโลก โดยโครงการดังกล่าว ถือเป็นอีกหนึ่งก้าวสำคัญในการอนุรักษ์ผืนน้ำซึ่งเป็นทรัพยากรสำคัญของทุกชีวิตผ่านนวัตกรรมที่จะเปลี่ยนแปลงอนาคตของโลกนี้ให้สวยงามสมบูรณ์ยิ่งขึ้นต่อไป
อำไพ สุราแช่สมุนไพร LINK
"อำไพ" สุราแช่สมุนไพร จุดเริ่มต้นจริงๆ อาจนับได้ตั้งแต่คุณย่าแอบทำเหล้าเถื่อนช่วงหลังสงครามสมัยแกยังสาวๆ หลักสูตรการทำเหล้านั้นสืบทอดมาถึงรุ่นคุณแม่ แต่ได้หยุดทำไปช่วงหนึ่งตอนที่มีการปราบปรามอย่างหนักจากรัฐบาลไทย แต่สุดท้ายได้เริ่มทำแบรนด์อีกครั้งในช่วงยุครัฐบาลทักษิณ จนถึงตอนนี้ก็ทำมาเกือบสามสิบปีแล้ว
"อำไพ" มาจากชื่อคุณแม่ของลุงเล็ก ผู้ก่อตั้งแบรนด์ ตัวแกเป็นคนรักคุณแม่มากๆ ก่อนหน้านี้ก็เคยใช้ชื่อคุณแม่เปิดร้านอาหารมาแล้ว ลุงเล็กเคยขายสมุนไพรไทยมาก่อน มีบางตัวหายากๆแกก็ต้องเข้าป่าไปหาสมุนไพรเอง จนวันหนึ่งคิดขึ้นได้ว่าคุณแม่มีสูตรทำสุราจากคุณย่า จึงเอาทั้งสองอย่างมาประกอบกันกลายเป็น "อำไพสุราแช่สมุนไพร" จนถึงทุกวันนี้
ข้อมูลและภาพจากเพจประชาชนเบียร์
11 พฤษภาคม 2566 ทำหมันสุนัขและแมวในเขตเทศบาลนครระยอง LINK
วันพฤหัสบดีที่ 11 พฤษภาคม 2566 เวลา 10.00 น. นายวิชิต ศรีชลา นายกเทศมนตรีนครระยอง มีความห่วงใยในความปลอดภัยทั้งคนและสัตว์เลี้ยง จึงสั่งการให้เจ้าหน้าที่จากสำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครระยอง ร่วมกับเจ้าหน้าที่จากสำนักงานปศุสัตว์จังหวัดระยอง จัดกิจกรรมบริการทำหมันสุนัขและแมวในเขตเทศบาลนครระยอง โดยในการดำเนินกิจกรรมในครั้งนี้จัดขึ้นที่บริเวณภายในวัดปากน้ำสมุทรคงคาราม ตำบลปากน้ำ อำเภอเมืองระยอง จังหวัดระยอง
เทศบาลนครระยองจัดกิจกรรมบริการทำหมันสุนัขและแมว เพื่อเป็นการป้องกันโรคติดต่อที่ร้ายแรงจากสัตว์สู่คนและอันตรายถึงขั้นเสียชีวิตได้ และเพื่อให้สอดคล้องกับโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธานศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี พร้อมเป็นการสนับสนุนการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้า ในพื้นที่เทศบาลนครระยอง
ธนาคารออมสิน ยืนยันตัวตนที่สาขา และอัปเดต MyMo ให้เป็นเวอร์ชันล่าสุด LINK
ธนาคารออมสิน กรณีลูกค้าที่ต้องการโอนเงินมากกว่า 50,000 บาท หรือปรับเพิ่มวงเงินการทำรายการ หรือเปลี่ยนแปลงวงเงิน...บนแอป MyMo ต้องยืนยันตัวตนด้วยการเปรียบเทียบใบหน้า สามารถทำได้ง่าย ๆ ดังนี้
- นำบัตรประจำตัวประชาชนไปยืนยันตัวตนที่สาขา และอัปเดตข้อมูลให้เป็นปัจจุบัน
- ถ่ายภาพสแกนใบหน้าที่ธนาคารออมสินทุกสาขาทั่วประเทศ
- อัปเดต MyMo ให้เป็นเวอร์ชันล่าสุด
สามารถตรวจสอบผ่านแอป MyMo ได้ว่า คุณยืนยันการทำรายการด้วยการสแกนใบหน้า (Face Recognition : FR) หรือยัง ดังนี้
1. เข้าแอป MyMo
2. ไปที่ Profile ด้านบนสุดมุมซ้าย (คลิกที่รูป Profile) เพื่อตรวจสอบความพร้อม และมองหาหัวข้อ “ยืนยันตัวตนด้วยใบหน้า” สามารถเช็กสถานะได้ ดังนี้
❌ กลุ่มที่ 1 ไม่พร้อมใช้งาน จะแสดงข้อความ “ติดต่อสาขาธนาคารออมสิน” ลูกค้าต้องไปติดต่อสาขาเพื่อปรับปรุงข้อมูล
✅ กลุ่มที่ 2 พร้อมใช้งาน จะแสดงข้อความ “กดเพื่อยืนยัน” กรณีนี้ ลูกค้าไม่ต้องไปติดต่อสาขาเพื่อปรับปรุงข้อมูล สามารถกดยืนยันเพื่อสแกนใบหน้าผ่านแอป MyMo ได้เลย
✅ กลุ่มที่ 3 พร้อมใช้งาน จะแสดงข้อความ “ยืนยันตัวตนแล้ว” ลูกค้าไม่ต้องไปติดต่อสาขาเพื่อปรับปรุงข้อมูล สามารถสมัคร หรือขอใช้บริการต่าง ๆ ผ่านแอป MyMo ได้เลย
*เงื่อนไขอื่น ๆ เป็นไปตามที่ธนาคารกำหนด
คอกเขียวเขตพระนคร
สำนักงานเขตพระนคร ติดตั้ง "คอกเขียว" ในพื้นที่ ตามนโยบายของผู้ว่าราชการกรุงเทพมหานคร เพื่อป้องกันขยะปลิวหรือลอยไปอุดตันท่อระบายน้ำ จำนวน 15 แห่ง ได้แก่
- ถนนดินสอ หน้าร้านมนต์นมสด
- ถนนดินสอหน้าร้านเซเว่นอีเฟเว่น ฝั่งศาลาว่าการกรุงเมพมหานคร เสาชิงช้า
- ถนนราชดำเนินกลาง ฝั่งเหนือ บริเวณทางเท้าหน้ากองสลากเก่า
- ถนนราชดำเนินกลาง ฝั่งเหนือ บริเวณหอสมุดเมือง
- ถนนราชดำเนินกลาง ฝั่งเหนือ บริเวณซอยด้านข้างแมคโดนัลด์
- ถนนราชดำเนินกลาง ฝั่งเหนือ บริเวณหน้าบริษัท เทเวศประกันภัย จำกัด (มหาชน)
- ถนนราชดำเนินกลาง ฝั่งใต้ บริเวณนิทรรศรัตนโกสินทร์
- ถนนราชดำเนินกลาง ฝั่งใต้ บริเวณป้อมตำรวจหน้าเมืองโบราณ
- ถนนราชดำเนินกลาง ฝั่งใต้ บริเวณอนุสรณ์สถาน 14 ตุลา
- ถนนราชดำเนินกลาง ฝั่งใต้ บริเวณหน้าธนาคารออมสิน
- ถนนราชดำเนินกลาง ฝั่งใต้ บริเวณหน้าโรงแรมรัตนโกสินทร์
- ถนนหน้าหับเผย ข้างศาลหลักเมือง
- ริมคลองหลอดราชบพิธ ถนนเฟื่องนคร
- ถนนสิบสามห้าง ฝั่งวัดบวรนิเวศวิหาร
- สวนหย่อมสิบสามห้าง ฝั่งตรงข้ามถนนไกรสีห์
พร้อมจัดเจ้าหน้าที่ฝ่ายรักษาความสะอาดฯ ลงพื้นที่ประชาสัมพันธ์ และแนะนำการใช้งาน เพื่อให้ประชาชนได้รับทราบและเข้าใจแนวทางในการใช้งาน
นอกจากนี้ ผู้วิ่งใน250รุ่น Echo Boomer (อายุไม่เกิน 40 ปี) และ Baby Boomer (อายุ 40 ปีขึ้นไป) 3 อันดับแรก ยังได้รับถ้วยรางวัลและผลิตภัณฑ์ Instax Link WIDE, Instax SQ1 และ Instax mini 12 ตามลำดับ พร้อมลุ้นรับรางวัล Lucky Draw เป็น Instax mini 11 จำนวน 3 รางวัลอีกด้วย
ยกตัวอย่างง่ายๆ ว่าเราจะฝึกเทคนิคใหม่ๆ อย่างไร เราไม่ได้ฝึกกับผู้ป่วยโดยตรง ซึ่งเรามีเทคนิคการสอนพิเศษโดยเฉพาะของโรงพยาบาล หลังจากนั้นก็จะส่งไปฝึกฝนที่ต่างประเทศ ให้เขามีความรู้ความเข้าใจในการรักษาโรคที่เกิดขึ้นได้ ดูเคสได้ เข้าช่วยเคสได้ รักษาเคสต่างๆ จนมีความชำนาญ แล้วค่อยกลับมารักษาที่โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ
นพ.ดิตถพงษ์ ยังทิ้งท้ายอีกว่าแม้ว่าเราจะเป็นโรงพยาบาลภาคเอกชน แต่งานวิจัยของเราก็มีอย่างต่อเนื่องในด้านการรักษา การฝึกเทคนิคใหม่ๆ ทั้งนี้เป็นสิ่งหนึ่งที่ โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ได้พัฒนาคุณภาพการรักษาให้เป็นโรงพยาบาลที่ทัดเทียมกับโรงพยาบาลชั้นนำอื่นๆ ในต่างประเทศจนมีผู้ป่วยต่างชาติเข้ามารักษาที่โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ เป็นจำนวนมากและยังเป็นหนึ่งในความภาคภูมิใจของคนไทยอีกด้วย
โรงพยาบาลเอส สไปน์ แอนด์ เนิร์ฟ ปรึกษา โทร 02 034 0808
สูตรอบรม เดือนพฤษภาคม 2566
หลักสูตรอบรม เดือนพฤษภาคม 2566 ทั้งหมด 4 หลักสูตร
*อบรมฟรี มีใบประกาศให้ทุกหลักสูตร
1. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 4/66
- รับสมัครจำนวน 100 คน
- อบรมวันที่ 10 พ.ค 66 เวลา 08.30-16.30 น. "(ผ่านระบบ Google Meet)"
2. หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 4/66 (สำหรับกู้ชีพ/กู้ภัย ทุกสังกัด)
- รับสมัครจำนวน 60 คน
-ภาคทฤษฎี (Online) วันที่ 12 พ.ค. 66 เวลา 09.00 - 12.00 น.
- ภาคปฏิบัติ (On-site) วันที่ 20 พ.ค.66 มี 2 ช่วงให้เลือก ช่วงเช้า เวลา 08.00-12.00 น. หรือ ช่วงบ่าย เวลา 13.00-16.00 น. "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
3. หลักสูตร ความรู้เบื้องต้นการจัดการสาธารณภัยของประเทศไทย(Onsite) (สำหรับอาสาสมัครกู้ชีพ/กู้ภัย เท่านั้น) รับสมัครจำนวน 60 คน
- วันอบรม วันที่ 13 พ.ค.66 "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
4.หลักสูตร พนักงานขับรถพยาบาลและขับขี่ปลอดภัย รุ่นที่ 1/66 (On-site) (สำหรับอาสาสมัครกู้ชีพ/กู้ภัย เท่านั้น)
- รับสมัครจำนวน 30 คน
- วันอบรม ภาคทฤษฎี วันที่ 5 พ.ค.66 07.00-19.00 น. ภาคปฏิบัติ วันที่ 6 พ.ค.66 07.00-18.00 น. "ณ ไอดีไดร์ฟเวอร์ (ลำลูกกาคลอง 12) "
วันเสาร์ ทำท่าลุกจากเก้าอี้ใช้ 2 มือพยุง
ทำท่าลุกจากเก้าอี้ใช้ 2 มือพยุง นั่งบนเก้าอี้ที่มีพนักพิงแข็งแรงไม่เคลื่อนไหว วางเท้าหลังหัวเข่า ค่อย ๆ โน้มตัวไปด้านหน้าและใช้สองมือช่วยพยุงดันตัวขึ้นยืน ทำซ้ำ 10 ครั้ง
เส้นทางที่ 5 ไหว้หลวงพ่อคงองค์ใหญ่ แล้วไปผ่อนคลายที่สปา/รีสอร์ท
เส้นทางที่ 5 เป็นเส้นทางแห่งความสุขเริ่มจาก ไหว้หลวงพ่อคงองค์ใหญ่ ณ
วัดบางกะพ้อม ตำบลอัมพวา อำเภออัมพวา วัดราษฎร์ฝ่ายมหานิกายเก่าแก่สืบมาแต่สมัยกรุงศรีอยุธยา และมีตำนานที่น่าทึ่ง ในวัดประดิษฐานหลวงพ่อคงองค์ใหญ่ ที่เป็นที่เคาระสักการะของชาวอัมพวามายาวนาน ร่วมกับองค์หลวงพ่อ 6 องค์ และหลวงพ่อดำ เรียกว่าอิ่มบุญอิ่มใจเต็มที่
ปิดทริป ด้วยความสดชื่นรื่นรมย์ในอารมณ์สปา ณ สปา/รีสอร์ท แนะนำ ได้แก่ สุพรรณิการ์สปา บ้านอัมพวารีสอร์ทแอนด์สปา และ เฌอชลสปา ณทีธารา รีสอร์ท บรรยากาศธรรมชาติ
ถึงอย่างไรก็ตาม แม้ผลสำรวจเรื่องแนวโน้มความต้องการใช้จ่ายมีเปอร์เซ็นต์ลดลง แต่ในขณะเดียวกันมีความน่าสนใจว่าผู้ให้สำรวจในกลุ่มอายุ 20 - 29 ปี หันมาเน้นจับจ่ายใช้สอยเพื่อเตรียมตัวต้อนรับเปิดเทอมเตรียมซื้อของใหม่เข้าหอ ซื้อสินค้าอัพลุคใหม่ให้เป๊ะ ปัง ต้อนรับการเปิดเทอมแบบ On-site อย่างเต็มรูปแบบ
คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการ ฝ่ายวิจัยการตลาดและวางแผนกลยุทธ์ ได้พูดถึงข่าวที่คนไทยให้ความสนใจมากในขณะนี้ไว้ว่า “ข่าวการเมืองและการเลือกตั้งยึดพื้นที่สื่อแทบจะทั้งหมด คนไทยทั่วประเทศออกมาใช้สิทธิ์ใช้เสียงกันตามกฏหมายอย่างเนืองแน่น ถือเป็นสัญญาณที่ทำให้เห็นว่า คนไทยตระหนักเรื่องการเมืองเป็นสำคัญ อยากเห็นความเปลี่ยนแปลงที่จะเกิดขึ้นหลังการเลือกตั้งในครั้งนี้ จึงต้องมารอลุ้นผลกันต่อไปว่า ท้ายที่สุดแล้วทิศทางของประเทศไทยในอนาคตจะเปลี่ยนแปลงไปอย่างไรบ้าง”


นายพิเชษฐพงษ์ ศรีสุวรรณกุล กรรมการผู้จัดการ บริษัท โรช ไดแอกโนสติกส์ (ประเทศไทย) จำกัด กล่าวว่า หลายประเทศทั่วโลก หรือเกือบทุกประเทศที่มีศักยภาพ จะไม่อยากให้ผู้หญิงต้องมาเสียชีวิตจากโรคมะเร็งปากมดลูกเลยหากเป็นไปได้ ประเทศไทยเองก็เป็นหนึ่งในนั้น โดยเฉพาะประเทศไทยเราก็ถือว่าเป็นประเทศที่โชคดีที่มีสิทธิประโยชน์จากทาง สปสช. ถือว่าเป็นความโชคดีอย่างหนึ่ง ในส่วนของภาคเอกชน อย่าง โรช ไดแอกโนสติกส์ ประเทศไทย เราเองก็พยายามที่จะเป็นส่วนหนึ่งของจิ๊กซอว์นี้ เพื่อจะทําให้บรรลุเป้าหมายให้ได้ ทุกท่านจะเห็นว่าในช่วงที่มีโรคโควิดระบาด ปัญหาของโรงพยาบาลในบ้านเราคือ ภาระงานของเจ้าหน้าที่ในห้องปฏิบัติการทางการแพทย์ ภารกิจในการดูแลคนไข้ประจํา รวมถึงโรคระบาดที่เข้ามา ทําให้ห้องปฏิบัติการทางการแพทย์แทบจะเป็นอัมพาตเลย ทำนองเดียวกัน การตรวจคัดกรองด้วยวิธีเอชพีวี ตามที่อาจารย์อรรถพร ได้กล่าวแล้วว่าเป้าหมาย 1.2 ล้านราย จริงๆ แล้ว ผู้หญิงอายุ 30-59 ปี มีมากกว่านั้น แต่ว่าเป้าหมายภายในหนึ่งปี การตรวจในห้องปฏิบัติการทางการแพทย์ด้วยการทําพีซีอาร์ 1.2 ล้านราย ไม่ใช่เรื่องง่าย เพราะว่าการตรวจพีซีอาร์ ไม่เหมือนการตรวจแบบทั่วไป ดังนั้น สิ่งที่สําคัญที่สุดก็คือ เทคโนโลยี ซึ่ง โรช ไดแอกโนสติกส์ จะมาช่วยในส่วนนี้โดยเรามีนวัตกรรมเครื่องมือให้ห้องปฏิบัติการทางการแพทย์แบบออโตเมชั่น (automation) ในห้องแล็บ ช่วยลดภาระและปริมาณงานของเจ้าหน้าที่ในห้องปฏิบัติการทางการแพทย์ได้มาก นอกจากเรื่องเทคโนโลยีแล้ว โรชเองก็พยายามที่จะเป็นส่วนหนึ่งในการที่จะประสานแล้วก็ช่วยในการประชาสัมพันธ์ทําสื่อต่าง ๆ เพื่อที่จะให้ความรู้ประชาชน ให้เกิดการรับรู้ถึงคุณประโยชน์ของการตรวจคัดกรองฯ ซึ่งช่วยชีวิตผู้หญิงให้ไม่ต้องเสียชีวิตจากโรคนี้
หนึ่งชีวิตของผู้หญิงในครอบครัว หากเจ็บป่วยขึ้นมาผมว่ามันมีความเกี่ยวพันหลายอย่าง เพราะหากเขาเป็นแม่ ผลกระทบก็จะส่งผลไปยังสามี ลูก พ่อแม่ เพราะแต่ละคนก็จะมีบทบาทในครอบครัวและสังคมไม่เหมือนกัน เพราะฉะนั้นเสียชีวิตไปหนึ่งคน ทําให้โครงสร้างของครอบครัวมันเปลี่ยนแปลงไปมาก แน่นอนว่าจะมีผลกระทบตามมามากมาย ดังนั้น เราจึงอยากที่จะช่วยสื่อสารเพื่อให้คนเข้ามารับการตรวจคัดกรองก่อนเพื่อช่วยอีกหลายๆ ชีวิต โดยเฉพาะกลุ่มที่ผลตรวจออกมาเป็นบวก ซึ่งหมายถึงว่ามีความเสี่ยงสูงที่จะเป็นมะเร็งปากมดลูก สิ่งสำคัญคือการต้องมาตรวจเพิ่มเติม เพื่อรับการรักษาต่อไป และการตรวจแบบ HPV DNA Self-Sampling ถือเป็นทางเลือกใหม่ เก็บตัวอย่างด้วยตนเองได้ไม่ยุ่งยาก หวังว่าจะช่วยดึงกลุ่มเป้าหมายที่เป็นผู้หญิงอายุ 30 – 59 ปี เข้ามารับการตรวจให้มากที่สุด รวมถึง ดึงคนที่มีผลการตรวจเป็นบวกให้กลับเข้ามาทําการตรวจเพิ่มเติม และการทำการรักษาต่อไป
ข้อมูลผู้ตอบแบบสอบถาม (การศึกษา)
บันทึกผลการสำรวจด้าน การศึกษา - แบ่งหลายระดับ ตั้งแต่ ประถมศึกษา ม.ต้น (ม.1-3) ม.ปลาย (ม.4-6) ป.ตรี-โท-เอก กศน. ไม่ได้ศึกษา และ กลุ่มชาวต่างชาติ/ต่างด้าว
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน ป.ตรี 53.8%. ม.ปลาย 18.3% ม.ต้น 9.4%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน ป.ตรี 55.2%. ม.ปลาย 17.6% ม.ต้น 9.2% ป.โท 8.4% ประถม 4.1%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน ป.ตรี 53.1%. ม.ปลาย 20.1% ม.ต้น 8.5% ป.โท 8.7% ประถม 4.4%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน ป.ตรี 51.2%. ม.ปลาย 22.7% ม.ต้น 8.5% ป.โท 8% ประถม 4.9% ป.เอก 1.7% กศน. 1.5% ไม่ได้ศึกษา 1.1% กลุ่มต่างชาติ/ต่างด้าว 0.5%
การนำสุนัขควบคุมพิเศษออกนอกสถานที่เลี้ยง ต้องทำดังนี้
1. ผูกสายจูงที่แข็งแรง
2. จัดให้สุนัขใส่อุปกรณ์ครอบปาก
3. จับสายจูงห่างจากตัวสุนัขไม่เกิน 50 ซม. ตลอดเวลา
4. ต้องพกบัตรประจำตัวสุนัขตลอดเวลา และแสดงบัตรเมื่อเจ้าหน้าที่เรียกตรวจ
5. ห้ามบุคคลอายุต่ำกว่า 15 ปี หรือเกินกว่า 65 ปี นำสุนัขควบคุมพิเศษออกนอกสถานที่เลี้ยงโดยปราศจากเครื่องควบคุมที่มั่นคงแข็งแรงพอ ที่จะป้องกันมิให้สุนัขเข้าถึงบุคคลภายนอก
Workshop กับลุงดำ (KD)
Workshop กับลุงดำ(KD) ปีนี้ลุงดำจะมาร่วมแชร์ประสบการณ์ การขึ้นทะเบียนสายพันธุ์ KD ให้กับพวกเรา พร้อมกับแจกเมล็ด KD ในช่วง Workshop ด้วย
หลายคนอาจยังไม่ทราบว่าสายพันธุ์ KD ได้ถูกขึ้นทะเบียนเป็นสายพันธุไทยอย่างถูกต้องแล้ว(เป็นสมบัติส่วนรวม) ถ้าพูดถึงลุงดำเราคงไม่ต้องอธิบายอะไรมาก เพราะลุงสร้างอะไรไว้ให้กับวงการนี้มากมาย และยังสนับสนุนงานเรามาทุกปี ใครที่อยากมาเจอลุง อยากมารับเมล็ดพันธุ์ ต้องมาเร็วกันหน่อยนะครับ
Workshop : แชร์ประสบการณ์การขึ้นทะเบียนสายพันธุ์ KD วันที่ 8 กรกฎาคม : 16.00-16.45 น.
251. วัด นิวาสสถาน เลขที่ 364 หมู่ 8 ตำบล แม่อาย อำเภอ แม่อาย เชียงใหม่ 50280
เชียงใหม่
วันเวลาทำการ: ทุกวันเสาร์ - อาทิตย์ เวลา 09.00- 16.00 น.
เบอร์ติดต่อ: 089-467-5154 (อ.สิริกร ) และ 095-134-2446 (อ. ฉัตรสุดา)
ผู้ติดต่อ: อ.สิริกร ชิวปรีชา และ อ. ฉัตรสุดา ธงชัยสุวรรณ
252. วัดเขาน้อย อ.ปลวกแดง จ.ระยอง
ระยอง
วันเวลาทำการ: เสาร์-อาทิตย์ 09:00 - 16:00
เบอร์ติดต่อ: 0933264265
ผู้ติดต่อ: อ.ศุภิสรา ศรีรัตนะ
253. วัดป่าภูกระแต อ.เมือง จ.หนองบัวลำภู
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
254. วัดสุทธิวราราม เขตสาทร กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: เสาร์-อาทิตย์ 8.00 - 16.00 น.
เบอร์ติดต่อ: 0852512888
ผู้ติดต่อ: อ.ดร.จินดา ค้าวรรธนะกูล
255. วัดป่าธรรมพนมวัณย์ อ.วังนัำเขียว จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: เสาร์-อาทิตย์ 08:00-16:30น.
เบอร์ติดต่อ: 089-104-9545
ผู้ติดต่อ: ผดล. ผศ.ดร.สุรศักดิ์ ราตรี
256. วัดเขาแหลมเจริญธรรม อ.บึงสามพัน จ.เพชบูรณ์
เพชรบูรณ์
วันเวลาทำการ: เสาร์-อาทิตย์
เบอร์ติดต่อ: 063-3235159
ผู้ติดต่อ: อริยา เศรษฐเสถียร
257. วัดนิรมลวัฒนา (โป่งตูม) อ.หล่มเก่า จ.เพชรบูรณ์
เพชรบูรณ์
วันเวลาทำการ: 8.00-16.30 น. เสาร์-อาทิตย์
เบอร์ติดต่อ: 0898564714
ผู้ติดต่อ: จงกลนี อินดีคำ
258. วัดวิปัสสนาดงเย็น อ.อู่ทอง จ.สุพรรณบุรี
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
259. วัดปัญจบูรพาจารย์ คลองสาม, คลองหลวง
ปทุมธานี
วันเวลาทำการ: วันเสาร์-วันอาทิตย์ เวลา: 08.00 -17.00 น.
เบอร์ติดต่อ: 081-905-4233
ผู้ติดต่อ: อาจารย์ยุพิน ศรีสุดดี(ผดล.)
260. วัดรัชดาภิเษก อ.บ่อพลอย จ.กาญจนบุรี
กาญจนบุรี
วันเวลาทำการ: เสาร์_อาทิตย์ 08.00น-16.00น
เบอร์ติดต่อ: ผดล.091-563-6641,ผช.ผดล.062-338-1795,ผช.ผดล.062-659-7949
ผู้ติดต่อ: อ พสิษฐ์ โอทอง, อ.ประสิทธิ์พร สืบสุข,อ.จิระศักดิ์ เจริญพิบูลย์
261. วัดกลางสวน จ.สมุทรปราการ
สมุทรปราการ
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 09.00-16.30 น.
เบอร์ติดต่อ: 083-831-6555, 081-921-8006, 081-721-4365, 081-917-8846, 095-518-9126
ผู้ติดต่อ: อ.เพ็ญจะ จงไทย/อ.สมทรง ข้อพิสังข์ /อ.รติกร พืชสิงห์/ อ.ภักดี ลิ่มบุตร/อ.อุดมศิลป์
262. วัดโนนป่าว่าน อ.อรัญประเทศ จ.สระแก้ว
สระแก้ว
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 08.30 น. - 16.30 น.
เบอร์ติดต่อ: 0972676532
ผู้ติดต่อ: นายอาคม รุนสีงาม
263. วัดอิสาณ อ.เมืองบุรีรัมย์ จ.บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: เรียนครูสมาธิ ทุกวัน จ.-ศ. เวลา 18.00-20.30 น.
เบอร์ติดต่อ: 0956244441
ผู้ติดต่อ: วราภรณ์ หาญชนะ
264. วัดเทวสังฆาราม อ.เมือง จ.กาญจนบุรี
กาญจนบุรี
วันเวลาทำการ: จันทร์ - ศุกร์ 17.30 -20.30 น.
เบอร์ติดต่อ: 095-638-2515
ผู้ติดต่อ: อ.ธีรวุฒิ วศินนิติวงศ์
265. วัดโพธิ์ทอง อ.บางระกำ จ.พิษณุโลก
265. วัดโพธิ์ทอง อ.บางระกำ จ.พิษณุโลก
พิษณุโลก
วันเวลาทำการ: -
เบอร์ติดต่อ: 0819623435
ผู้ติดต่อ: พัฒนพงศ์ โตอุ่นเพ็ชร
266. วัดศรีสุเทพ อ.ท่าแซะ จ.ชุมพร
ชุมพร
วันเวลาทำการ: วันเสาร์ 09.00น. - 15.00น.
เบอร์ติดต่อ: 0892878851
ผู้ติดต่อ: อาจารย์ อริสา กิตติมานะพันธุ์
267. วัดหนองม่วง อ.ประโคนชัย จ.บุรีรัมย์
บุรีรัมย์
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.30-16.00 น.
เบอร์ติดต่อ: 08 9355 0837
ผู้ติดต่อ: นายเวทิส พันธโคตร (ผู้ดูแลสาขา)
268. วัดท่ากฤษณา อ.หันคา จ.ชัยนาท
ชัยนาท
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.30-16.30 น.
เบอร์ติดต่อ: 081-9156562,083-7950550,089-2345233,081-7229659
ผู้ติดต่อ: อ.อภิสิทธิ์ พงศาวกุล
269. วัดพระธาตุดอยสะเก็ด จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: เสาร์-อาทิตย์ 08.00-17.00 น.
เบอร์ติดต่อ: 089-956-4585
ผู้ติดต่อ: ผดล.อ.นสพ.พรศักดิ์ ศิษย์ชัยชนะ
270. โรงพยาบาลร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: ทุกวันจันทร์-วันศุกร์ เวลา 18.00-20.00น.
เบอร์ติดต่อ: 083-149-0008
ผู้ติดต่อ: อ.ชุติพันธุ์ หาญประสิทธิ์คำ
272. วิทยาลัยเทคโนโลยีบริหารธุรกิจรักไทย อ.พุทไธสง จ.บุรีรัมย์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
273. วัดมิ่งเมือง อ.เสลภูมิ จ.ร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 8.00-17.00 น
เบอร์ติดต่อ: 0850740101
ผู้ติดต่อ: นางจิราลักษณ์ ขุณิกากรณ์
274. วัดวรพรตสังฆาวาส อ.พานทอง จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: 8.00 น.- 16.30 น.
เบอร์ติดต่อ: 094-936-6456
ผู้ติดต่อ: อาจารย์ศักยภพ บรรพต
275. วัดภูเขาแก้ว อ.พิบูลมังสาหาร จ.อุบลราชธานี
อุบลราชธานี
วันเวลาทำการ: เสาร์-อาทิตย์ 8.30-16.00 น.
เบอร์ติดต่อ: 084-589-8681
ผู้ติดต่อ: นายวสันต์ วงศ์คูณ
276. ศูนย์การเรียนรู้สู่อาเซียนสะเดา อ.สะเดา จ.สงขลา
สงขลา
วันเวลาทำการ: วันจันทร์-ศุกร์ เวลา 18.00น. - 20.30น.
เบอร์ติดต่อ: 099-2497896
ผู้ติดต่อ: อ.อิสระพงศ์ บุญพงศ์มณี
277. มหาวิทยาลัยมหามกุฏราชวิทยาลัย วิทยาเขตร้อยเอ็ด อ.เมืองร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: -
เบอร์ติดต่อ: 0850008069
ผู้ติดต่อ: อ.รัฐนันท์ หาญประสิทธิ์คำ
278. วัดป่าอนาลโย อ.กำแพงแสน จ.นครปฐม
นครปฐม
วันเวลาทำการ: เสาร์ อาทิตย์ 09:00 - 16:00 น.
เบอร์ติดต่อ: 094-496-4269
ผู้ติดต่อ: นาง ธัญพร อุเทนพิทักษ์
279. วัดเด่นสะเดา อ.คลองขลุง จ.กำแพงเพชร
กำแพงเพชร
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 8.00น-17.00น
เบอร์ติดต่อ: 082-4496569
ผู้ติดต่อ: อ.พิศมัย สุบิน(ผู้ดูแลสาขา)
280. วัดเทพวิสุทธาราม ต.หนองไผ่ล้อม อ.สำโรงทาบ จ.สุรินทร์
สุรินทร์
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 07.00-17.00 น.
เบอร์ติดต่อ: 099 459 5662
ผู้ติดต่อ: นายกายสิทธ์ ผลเกิด
281. โรงเรียนสุรศักดิ์มนตรี
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์-อาทิตย์ เวลา 9.00-17.00 น.
เบอร์ติดต่อ: 089-1363461 ,0953690955
ผู้ติดต่อ: อาจารย์ศรีนวล แก้วประดิษฐ์
282. หมู่บ้านสีวลีรังสิต 2 อ.ธัญบุรี จ.ปทุมธานี
ปทุมธานี
วันเวลาทำการ: วันจันทร์ - วันศุกร์ เวลา 18.00 - 20.00 น.
เบอร์ติดต่อ: 0813044199
ผู้ติดต่อ: อ.พันเอก(พ)เกษม รัตนปราณี
283. วัดป่าอาจารย์มั่น (ภูริทัตโต) ต.เวียง อ.พร้าว จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: เสาร์ - อาทิตย์ เวลา 08.00 - 18.00 น.
เบอร์ติดต่อ: 098 069 6964 , 081 472 1819
ผู้ติดต่อ: อ.ธนยศ บริจินดา , อ.ชุดาภา ศิริสืบ
284. วัดเกาะโพธาวาส ต.ท่าบุญมี อ.เกาะจันทร์ จ.ชลบุรี
ชลบุรี
วันเวลาทำการ: วันเสาร์และวันอาทิตย์ เวลา 08.30 - 17.00 น.
เบอร์ติดต่อ: 089-936-3998
ผู้ติดต่อ: อ.บุญยง ศรีไตรราศรี ผดล.สาขา
285. มหาวิทยาลัยนอร์ทกรุงเทพ วิทยาเขตสะพานใหม่ กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ - ศุกร์
เบอร์ติดต่อ: 081-287-6360
ผู้ติดต่อ: อ.พิษณุ ธะดวงศร
286. วัดอรัญญวิเวก ต.อินทขิล อ.แม่แตง จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 9.00 น. - 16.00 น.
เบอร์ติดต่อ: 086 115 5151
ผู้ติดต่อ: อ.ธัชพล ประคัลภากร
287. วัดถ้ำเขาปรางค์ อ.ชัยบาดาล จ.ลพบุรี
ลพบุรี
วันเวลาทำการ: วันเสาร์ และ วันอาทิตย์ เวลา 08.00 น. - 16.00 น.
เบอร์ติดต่อ: 087 094 8556
ผู้ติดต่อ: อ.ทรัพย์ประเสริฐ จิรพนาสม
288. วัดบุญวาทย์วิหาร ต.หัวเวียง อ.เมืองลำปาง
ลำปาง
วันเวลาทำการ: -
เบอร์ติดต่อ: 0819616072
ผู้ติดต่อ: อ.วรญา วิไลรัตน์
289. วัดดอนจั่น อ.เมือง จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: -
เบอร์ติดต่อ: 0835323995
ผู้ติดต่อ: โสมนภา ศรีคำลือ
290. วัดเพลงกลางสวน เขตตลิ่งชัน กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: 08.00-17.00 น.
เบอร์ติดต่อ: 0820054290
ผู้ติดต่อ: อ.นิติธร วิสุทธิมโน
291. วัดบ้านเหล่างิ้ว อ.จังหาร จ.ร้อยเอ็ด
ร้อยเอ็ด
วันเวลาทำการ: เสาร์-อาทิตย์ เวลา 08.00-16.30 น.
เบอร์ติดต่อ: 0812654587
ผู้ติดต่อ: รัตนกาญจน์ พร้อมสันเทียะ
292. สมาคมศิษย์เก่ามหาวิทยาลัยมหิดลในพระบรมราชูปถัมภ์ จ.นครปฐม
นครปฐม
วันเวลาทำการ: -
เบอร์ติดต่อ: 0895775115
ผู้ติดต่อ: ดร.สิริกร สุขเกษม
293. วัดเจดีย์แม่ครัว อ.สันทราย จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: วันเสาร์ - วันอาทิตย์ เวลา ๐๙.๐๐ น.- ๑๖.๓๐ น.
เบอร์ติดต่อ: 08 0501 0680, 0655359619
ผู้ติดต่อ: ผู้ดูแลสถาบันพลังจิตตานุภาพ สาขาที่ ๒๙๓ อ.บุษยา ยศชนะ , อ.จันทร์แรม พรมนวล (ผช.ผดล.)
294. วัดบ้านโฮ่งหลวง อ.บ้านโฮ่ง จ.ลำพูน
ลำพูน
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
295. วัดเมืองเดช อ.เดชอุดม จ.อุบลราชธานี
อุบลราชธานี
วันเวลาทำการ: วันเสาร์ อาทิตย์ เวลา 08.00 - 16.00 น.
เบอร์ติดต่อ: 093 5509846
ผู้ติดต่อ: นายพิเชษฐ บัวแก้ว
296. วัดศรีเกิด อ.เมือง จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: เสาร์-อาทิตย์ 8:00 - 16:00
เบอร์ติดต่อ: 081-992-1362
ผู้ติดต่อ: อาจารย์ ชนัญญา มหาพรหม
297. สถานธรรมกอบุญ อ.น้ำขุ่น จ.อุบลราชธานี
อุบลราชธานี
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.00-17.00 น.
เบอร์ติดต่อ: 0933278271
ผู้ติดต่อ: นางพลอยนภัสสร์ สุริยวงศ์
298. วัดกลาง อ.เมือง จ.ลพบุรี
ลพบุรี
วันเวลาทำการ: วันเสาร์-อาทิตย์ เวลา 08.00 น.-16.00 น.
เบอร์ติดต่อ: คุณศรีรัตน์ 0813189157 อ.ฉันทนิษฐ์ 0865717695 อ.ธนัญอร 094-639-5449
ผู้ติดต่อ: ดร.ประวิทย์ สุดประเสริฐ 081-824-1332
299. ปัญญามาร์เก็ต เขตคันนายาว กรุงเทพมหานคร
กรุงเทพมหานคร
วันเวลาทำการ: สาขาออนไลน์ วันจันทร์-ศุกร์ 18.00-20.30
เบอร์ติดต่อ: 098-354-5424
ผู้ติดต่อ: ผดล. ปริชาติ บุณยรัตพันธุ์
300. วัดพระธาตุจอมกิตติ อ.สันทราย จ.เชียงใหม่
เชียงใหม่
วันเวลาทำการ: -
เบอร์ติดต่อ: 099-320-6050, 096-365-4564, 086-377-3509
ผู้ติดต่อ: อ.เมตตา กิตติคุณ
สิ่งแวดล้อมดี
จากนโยบายการเพิ่มพื้นที่สีเขียว ปลูกต้นไม้ล้านต้นไม้ ตลอดจนการเพิ่มสวน 15 นาทีทั่วกรุง รวมไปถึงการจัดการขยะ อากาศ น้ำเสีย ที่บูธนี้จะมีการแจกต้นกล้าและแจกปุ๋ย เพื่อเชิญชวนประชาชนมีส่วนร่วมในการปลูกต้นไม้ให้ถึงล้านต้น
นอกจากนี้ ในบริเวณนี้ยังมีการนำเสนอแนวทางการพัฒนาเมืองภายใต้แนวคิดการเพิ่มต้นไม้สีเขียว ตามนโยบายปลูกต้นไม้ล้านต้น สร้างพื้นที่สีเขียวและกำแพงกรองฝุ่นทั่วกรุง มีการจัดแสดงสวน 15 นาทีให้ผู้เข้าชมงานเยี่ยมชมและใช้บริการได้จริง (พื้นที่ 40x25 เมตร) ตลอดจนสาธิตการจัดการขยะ ต้นทาง กลางทาง ปลายทาง พร้อมแจกปุ๋ยอินทรีย์ชีวภาพและน้ำหมักขยะหอม น้ำยาเอนกประสงค์ด้วย
เขตสัมพันธวงศ์ จัดการเก็บถังดับเพลิงที่ไม่สามารถใช้งานได้ เพื่อนำไปทำลายอย่างถูกวิธี
28 มิถุนายน 2566 นายวัลลภ เกียรติวรศรีกุล ผู้อำนวยการเขตสัมพันธวงศ์ นางสาวเมตตา ตันเสรี ผู้ช่วยผู้อำนวยการเขตฯ มอบหมาย ฝ่ายปกครอง,ฝ่ายรักษาความสะอาดฯ และฝ่ายพัฒนาชุมชนฯ ร่วมกับเจ้าหน้าที่สถานีดับเพลิงและกู้ภัยสวนมะลิ จัดเจ้าหน้าที่ตรวจสอบถังดับเพลิง (ถังแดง) ในพื้นที่ 16 ชุมชนของเขตสัมพันธวงส์ โรงเรียนในสังกัดเขตฯ และศูนย์บริการสาธารณะสุข 13 พร้อมนำถังที่มีสภาพชำรุด เสื่อมโทรม ไม่สามารถใช้งานได้ ทั้งหมดจำนวน 388 ถัง รวบรวมแล้วนำส่งศูนย์กำจัดมูลฝอยอันตรายหนองแขม เพื่อนำไปกำจัดอย่างถูกวิธี
ถึง 31 ก.ค.66 ย่านถนนสายไม้ บางโพ
สถานการณ์ สะพานถล่ม 13 กรกฎาคม 66
สจล.คาดเหตุสะพานถล่ม จากอุปกรณ์ตัวร้อยคานคอนกรีตพลิกตัวเพราะรับน้ำหนักไม่ไหว
สจล.ลงพื้นที่สำรวจจุดโครงสร้างสะพานยกระดับอ่อนนุช-ลาดกระบังพังถล่ม คาดสาเหตุจากอุปกรณ์ตัวร้อยคานคอนกรีต (Launcher) รับน้ำหนักไม่ไหวจึงพลิกตัว สงสัยเสริมเหล็กแข็งแรงไม่พอ แนะเร่งตรวจโครงสร้างป้องกันเหตุซ้ำ
ทีมวิศวกรและผู้เชี่ยวชาญวิศวกรรมโยธา สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง (สจล.) ประกอบด้วย รศ.ดร.คมสัน มาลีสี อธิการบดี รศ.สุพจน์ ศรีนิล รองอธิการบดีด้านกายภาพ สิ่งแวดล้อม และทรัพย์สิน และทีมงาน ลงพื้นที่สำรวจจุดเกิดเหตุ กรณีสะพานยกระดับอ่อนนุช-ลาดกระบัง พังถล่ม บริเวณหน้าโลตัสลาดกระบัง ถนนหลวงแพ่ง แขวงทับยาว เขตลาดกระบัง มีผู้เสียชีวิต 2 ราย และบาดเจ็บอีกกว่า 10 ราย รถและอาคารพาณิชย์เสียหาย คาดการณ์สาเหตุมาจากลวดสลิงขาด อุปกรณ์ ตัวร้อยคานคอนกรีต หรือลอนเชอร์ (Launcher) รับน้ำหนักไม่ไหวจึงพลิกตัว ทำให้พื้นทางคอนกรีตที่อยู่ระหว่างการติดตั้งหลุดจากหัวเสาตอม่อถล่มลงมา พร้อมข้อเสนอแนะป้องกันปัญหา
โดยในวันเกิดเหตุ 10 ก.ค. 66 เวลา 18.08 น. เป็นช่วงที่คนเลิกงานกำลังเดินทางกลับบ้าน ในที่เกิดเหตุเป็นโครงการก่อสร้างทางยกระดับอ่อนนุช-ลาดกระบัง ซึ่งมีกำหนดแล้วเสร็จในเดือน ธ.ค. 2567 ได้พังครืนทั้งตัวคานและเสาทรุดลงมาจากความสูงประมาณ 20 เมตร ทำให้เศษซากคอนกรีต โครงเหล็ก ตัวคาน เสาหล่นทับรถที่ผ่านไปมาบริเวณถนนอ่อนนุช-ลาดกระบังได้รับความเสียหาย มีผู้เสียชีวิตและได้รับบาดเจ็บ อุบัติเหตุครั้งนี้ทำให้การจราจรติดขัดเป็นพื้นที่กว้างจากการพังถล่มเป็นทางยาวกว่า 300 เมตร เจ้าหน้าที่การไฟฟ้าฯ เข้าตัดกระแสไฟฟ้าและเคลียร์สายไฟเพื่อให้รถเครนสามารถเข้าไปเคลียร์พื้นที่
ทั้งนี้ สาเหตุที่แน่ชัดของสะพานพังถล่มที่ย่านลาดกระบังยังต้องรอการตรวจสอบของเจ้าหน้าที่และหน่วยงานที่เกี่ยวข้อง
แต่จากการคาดการณ์เบื้องต้น มีหลายสาเหตุที่มีความเป็นไปได้ โดยอาจเกิดจากตัวโครงเหล็กที่ยึดกับตอม่อสะพานเอียง แล้วล้มลงไปทางด้านซ้าย ทำให้ตัวโครงสร้างเหล็กสีฟ้า ที่เรียกว่า ‘ลอนเชอร์’ (Girder Launcher Crane) ที่ใช้ร้อยคานคอนกรีต ซึ่งทำหน้าที่นำเอาคานคอนกรีตหลายชิ้นมาต่อเรียงกันแล้วร้อยด้วยลวดสลิง ขณะกำลังดึงลวดสลิงนั้นเกิดเสียงดังลั่นคล้ายระเบิด จึงเป็นไปได้ว่าอาจมีลวดเส้นใดเส้นหนึ่งขาด แล้วเกิดแรงสั่นไหวทำให้ตัวร้อยคานคอนกรีต (Girder Launcher Crane) ซึ่งตั้งอยู่บนหัวเสาสะบัดแรงพลิกตัวหักลง และด้วยน้ำหนักที่มากส่งผลให้ตอม่อทั้งสองข้างบิดรุนแรง โดยชุดหนึ่งโค่นลง และตอม่ออีกชุดหนึ่งฉีกขาดออกจากกัน ทำให้โครงสร้างคานคอนกรีตที่ยังไม่เสร็จสมบูรณ์พังทลายลง
รศ.สุพจน์ ศรีนิล รองอธิการบดีฝ่ายกายภาพสิ่งแวดล้อมและทรัพย์สิน สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง (สจล.) กล่าวว่า ความจำเป็นเร่งด่วนขณะนี้คือการประเมินความปลอดภัยของโครงสร้างที่ได้รับความเสียหายมาก เพื่อมิให้เกิดการพังถล่มต่อเนื่อง ข้อควรระมัดระวังในการเคลียร์พื้นที่ตอนนี้ คือ สะพานลงมาอยู่ที่ชั้นพื้นดินแล้ว ห้ามคนเข้าไป ต้องเอาผู้เชี่ยวชาญมาตัดตัวสะพานเป็นชิ้นๆ แล้วค่อยยกออก ถึงจะดำเนินการต่อไปได้
ส่วนการตรวจสอบหาสาเหตุในรายละเอียดที่ต้องทำ เช่น ควรตรวจสอบการเสริมเหล็กกับคอนกรีต เนื่องจากในการออกแบบ ต้องออกแบบเผื่อ ‘การบิดตัว’ ซึ่งการบิดตัวที่กล่าวถึง เกิดจากตัวสะพานไม่อยู่ในจุดส่วนกลาง แต่เบี่ยงไปทางซ้าย พอเบี่ยงไปทางซ้าย ทำให้ตอม่อบิดไปด้วย จนเกิดการขาดของตอม่อ
หลังจากนี้ต้องมีการตรวจสอบว่าอุปกรณ์เครื่องมือไม่มีความพร้อมหรือไม่ เพราะปกติการก่อสร้างสะพานก็ใช้วิธีนี้ เป็นการทำทั่วไป แต่เพราะอะไรโครงยึดถึงเอียงตัวได้ อาจต้องไปตรวจสอบถึงการดีไซน์เสาตอม่อเสริมเหล็กเป็นอย่างไร เพราะขาดหลุดไปเลย ความบางความหนาไม่เกี่ยวกัน ขึ้นกับความแข็งแรงของการเสริมเหล็ก สำหรับการตรวจสอบความปลอดภัยของอาคารที่อยู่อาศัยโดยรอบ ต้องใช้เวลาตรวจสอบประมาณ 2-3 สัปดาห์
ส่วนข้อสังเกตเรื่องชั้นดินนั้น รศ.สุพจน์ ศรีนิล อธิบายว่า เสาเข็มที่รับตอม่อเป็นเข็มยาว 60 เมตร ถึงชั้นดินแข็ง เรื่องความบกพร่องของเข็มโดยทั่วไปจะมีการทดสอบก่อน แม้โอกาสที่จะเกิดปัญหาที่ชั้นดินมีน้อยแต่ก็ต้องใช้เวลาตรวจสอบอีกเช่นกัน ทั้งนี้ยังเป็นการวิเคราะห์เบื้องต้นและคาดการณ์ตามหลักวิศวกรรมเท่านั้น
@แนะหน่วยงานรัฐตรวจสอบควบคุม เข้มการทำงานของผู้รับจ้างต้องปลอดภัย
ผศ.ดร.อาทิตย์ เพชรศศิธร ผู้ช่วยอธิการบดีฝ่ายกายภาพ สิ่งแวดล้อมและทรัพย์สิน สจล. กล่าวสรุปถึงข้อเสนอแนะจาก สจล.ว่า หน่วยงานภาครัฐที่เป็นเจ้าของโครงการก่อสร้างต่างๆ ควรดูแลและตรวจสอบการปฏิบัติงานของผู้รับจ้าง โดยให้ผู้รับจ้างปฏิบัติตามแผนปฏิบัติงานความปลอดภัยในการก่อสร้างและควรต้องรายงานผลการปฏิบัติงานด้านความปลอดภัยดังกล่าวให้เจ้าของโครงการรับทราบตามรอบระยะเวลาที่กำหนด ในขณะที่ผู้ประกอบการ หรือผู้รับเหมาก่อสร้างโครงการขนาดใหญ่ควรจัดทำแผนปฏิบัติงานความปลอดภัยในการทำงานอย่างละเอียดและชัดเจน มีวิศวกรควบคุมงานที่มีความรู้ความเชี่ยวชาญในการก่อสร้างสิ่งก่อสร้างนั้นๆ ประจำอยู่ในสถานที่ก่อสร้างตลอดระยะเวลาที่มีการก่อสร้าง และควรจัดฝึกอบรมความปลอดภัยในการทำงานให้แก่พนักงานทุกคนอย่างสม่ำเสมอ
ผู้จัดการออนไลน์7. สีของซุ้มแสง
7. สีของซุ้มแสง
แนวคิด :สะท้อนความสุขของชีวิตผู้คนจากการสร้างอาชีพภายใต้พระมหากรุณาธิคุณ
เทคนิค :ฉายแสงบนยอดไม้สะท้อนแสงระยิบระยับลึกลับทั่วบริเวณ “ซุ้มแสงสี”
5. โรงงานมักกะสัน
โรงงานมักกะสัน การรถไฟฯ ก่อสร้างเมื่อปี 2450 แล้วเสร็จเปิดกิจการในปี 2453 ในอดีตเคยเป็นโรงงานซ่อมรถไฟที่ยิ่งใหญ่ที่สุดในอาเซียน และที่นี่เคยมีโรงผลิตไฟฟ้า ที่สามารถจ่ายไฟให้โรงไฟฟ้า ชุมชน และโรงพยาบาลรถไฟ เป็นโรงงานแห่งเดียวของกรมรถไฟ ที่สามารถทำการซ่อม และประกอบรถจักรและรถพ่วงทุกชนิดได้อย่างสมบูรณ์
นอกจากนี้ภายในโรงงานมักกะสัน มีอาคาร 2465 อาคารเก่าแก่ที่ได้รับรางวัลสถาปัตยกรรมดีเด่น เป็นอาคารดั้งเดิมที่เราใช้ในการซ่อมรถด้วย
โปรแกรมตรวขสุขภาพต้อนรับวันแม่ 2566@รพ.การุญเวชอยุธยา
โปรแกรมตรวขสุขภาพต้อนรับวันแม่ 2566 " ขอมอบสิ่งที่ดีที่สุดให้กับคุณและคุณที่คุณรัก " ด้วย Package "ตรวจสุขภาพ Super MOM เพื่อสุขภาพที่ดีของคุณแม่" ในราคา 2,444 บาท มีรายการ 14 รายการ โปรโมชั่นตั้งแต่ : 1 สิงหาคม - 30 กันยายน 2566
สถานที่ให้บริการ :
•แผนกลูกค้าสัมพันธ์ อาคารโรงพยาบาล ชั้น 2 โรงพยาบาลการุญเวชปทุมธานี
•แผนก OPD ชั้น 1 โรงพยาบาลการุญเวชอยุธยา
ขอขอบพระคุณลูกค้าทุกท่านที่ให้ความไว้วางใจในการใช้บริการกับทางโรงพยาบาล????
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ โทร : 02-529-4533
1981-1987
ในปี ค.ศ. 1981 ได้เปิดอาคารสำนักงานสูง 15 ชั้นทางด้านถนนสุรวงศ์ในนาม "อาคารมูลนิธิแห่ง สภาคริสตจักรในประเทศไทย (CCT)" และ"อาคารจอดรถ 10 ชั้น" เพื่อนำรายได้มาสนับสนุนการดำเนินงานของโรงพยาบาลอีกทางหนึ่ง นอกจากนี้ ในปี ค.ศ.1981 ทางโรงพยาบาลยังได้เริ่มก่อสร้าง"อาคารหมอบรัดเลย์" ขึ้นเป็น อาคารสูง 13 ชั้นเพื่อขยายการให้บริการของโรงพยาบาลออกไป โดยได้รับพระกรุณาธิคุณ จากสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จฯ ทรงเป็นประธานเปิดอาคาร เมื่อวันจันทร์ที่ 3 สิงหาคม ค.ศ.1987
กลุ่มผู้สูงอายุ 60 ปีขึ้นไป
กลุ่มผู้สูงอายุ 60 ปีขึ้นไป
- ฉีดวัคซีนคอตีบ บาดทะยัก
- ตรวจประเมินความสามารถในการทำกิจวัตรประจำวัน (ADL)
- ตรวจวัดดัชนีมวลกาย ความดันโลหิต
- ตรวจเลือดคัดกรองเบาหวาน เอชไอวี
- คัดกรองปัจจัยเสี่ยงต่อการเกิดโรคหัวใจและหลอดเลือด โรคหลอดเลือดสมอง คั
- ดกรองโรคซึมเศร้า
- การคัดกรองวัณโรค มะเร็งช่องปาก
- ตรวจคัดกรองการกลายพันธุ์ของยีนโรคมะเร็งเต้านม
- ตรวจอุจจาระคัดกรองมะเร็งลำไส้ใหญ่ (50-70 ปี)
- การเคลือบฟลูออไรด์
- การให้ความรู้ออกกำลังกายและฝึกสมองป้องกันโรคสมองเสื่อม
- การให้ความรู้ตรวจเต้านมด้วยตนเอง
- การตรวจวัดความดันโลหิตด้วยตนเองที่บ้าน
- การให้คำปรึกษาแนะนำการป้องกันเอชไอวีหลังสัมผัส
รางวัลชมเชย คุณสุภฉัตร วรงค์สุรัตน์
เชฟลูคัส เบคกิ้ง สตูดิโอ เรียนทำเบเกอรี่ย่านสุขุมวิท LINK
เชฟลูคัสเบคกิ้งสตูดิโอ CHEF LUCAS BAKING STUDIO เป็นสถาบันสอนทำเบเกอรี่ และขนมอบสไตล์ฝรั่งเศส อยู่ใจกลางสุขุมวิท ใกล้ รถไฟฟ้าอ่อนนุช สอนโดยเพสตรี้เชฟชาวฝรั่งเศส คลาสเรียนของเรามีตั้งแต่คลาสใบประกาศนียบัตร 5 สัปดาห์, คลาสสุดสัปดาห์ และคลาสทำขนม 1 วัน คอร์สเรียนเบเกอรี่ของเราจะสอนครอบคลุมเทคนิคการทำขนมทั้งหมด ทั้งการทำขนมเบเกอรี่ขนาดเล็ก, ขนมเค้ก, ช็อกโกแลต, ขนมปัง และแป้งพัฟลามิเนต เพื่อให้นักเรียนมีทักษะการทำขนมที่ครบถ้วน เรียนจบแล้วสามารถนำไปต่อยอดอาชีพได้เลย คอร์สเรียนทำขนมของเราเหมาะกับนักเรียนทุกเพศ ทุกวัย ไม่จำเป็นต้องมีพื้นฐานการทำขนมก็สามารถเรียนได้
• หลักสูตรเรียนเบเกอรี่ และขนมอบ คอร์ส 1 วัน เรียนวันเสาร์หรืออาทิตย์ – มือใหม่สามารถเรียนได้
• คอร์สทำขนมต่อยอดอาชีพ หลักสูตรใบประกาศนียบัตร 5 สัปดาห์ – 125+ ชั่วโมง – สูตรขนมกว่า 120 สูตร – เรียนวันจันทร์-ศุกร์
• คอร์สทำขนมสุดสัปดาห์ หลักสูตรใบประกาศนียบัตร – 50+ ชั่วโมง – เรียนวันเสาร์ & อาทิตย์ – 10 วัน – สูตรขนมกว่า 60 สูตร
สอบถามโทร 093-388-8050
ท่านกานต์ กัลป์ตินันท์ นายกอบจ.อุบลราชธานี บริจาคเงินจำนวน 100,000 บาท ให้กับคอนเสิร์ตการกุศล
ขอขอบคุณ ท่านกานต์ กัลป์ตินันท์ นายกองค์การบริหารส่วนจังหวัดอุบลราชธานี บริจาคเงินจำนวน 100,000 บาท ให้กับคอนเสิร์ตการกุศล "เพลงเพื่อลมหายใจ #3 Song of Life " เพื่อสร้างตึกผู้ป่วยในสำหรับเด็กแรกเกิด ผู้ป่วยโรคเลือดและผู้ป่วยมะเร็งโรงพยาบาลเด็กสรรพสิทธิประสงค์
ทีม M 5 เจนและฟองน้ำ ทีม M150 ศรีทอง
ทีม M 5 เจนและฟองน้ำ ทีม M150 ศรีทอง เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า
จากรายงานพบว่าผู้บริหารแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชีย-แปซิฟิก สองในสาม (67%) ของพวกเขา (เทียบกับ 56% ทั่วโลก) มีการใช้หรือมีแผนที่จะใช้เทคโนโลยีดิจิทัลเฮลท์เพื่อลดผลกระทบจากการขาดแคลนบุคลากรทางการแพทย์ โดยเฉพาะผู้บริหารในอินโดนีเซีย (77%) และสิงคโปร์ (75%) ให้ความสำคัญกับเรื่องนี้เป็นพิเศษ 3 อันดับแรกของเทคโนโลยีที่มีผลต่อการลดผลกระทบจากการขาดแคลนบุคลากรจากความเห็นของผู้บริหารแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชีย-แปซิฟิก ได้แก่ เทคโนโลยีที่สามารถใช้งานบนคลาวด์ได้ เพื่อรองรับการเข้าถึงข้อมูลจากที่ไหนก็ได้ (44%) เทคโนโลยีโซลูชันส์ที่เชื่อมต่อภายนอกโรงพยาบาลได้ (37%) และเทคโนโลยีด้านการจัดการข้อมูล อาทิ PACS, บันทึกดิจิทัลด้านสุขภาพ, และกระบวนการจัดการผู้ป่วยอัตโนมัติ (35%)
การเปลี่ยนแปลงด้านดิจิทัลและโมเดลการดูแลผู้ป่วยแบบใหม่สามารถช่วยดึงดูดบุคลากรที่มีความสามารถให้เข้ามาร่วมงานกับองค์กรได้ บุคลากรทางการแพทย์รุ่นใหม่ระบุว่า การนำเทคโนโลยี AI มาใช้ (39%) และโมเดลการดูแลผู้ป่วยแบบใหม่ที่เชื่อมต่อการดูแลที่แตกต่างกัน (33%) เป็นปัจจัยสำคัญในการเลือกสถานที่ทำงานของพวกเขา โดย 33% เห็นว่าแชทบอท (Chat bots) สามารถช่วยตอบคำถามพื้นฐานทางการแพทย์ให้กับผู้ป่วยได้ 28% เห็นว่าการถ่ายโอนข้อมูลด้านเฮลท์แคร์ระหว่างโรงพยาบาลเป็นเรื่องสำคัญ และ 26% เห็นถึงความสามารถในการเข้าถึงการตรวจวินิจฉัยได้จากทุกที่ ทั้งหมดนี้บุคลากรทางการแพทย์รุ่นใหม่เห็นเหมือนกันว่า เป็นเทคโนโลยีอันดับต้นๆ ที่จะมาช่วยเพิ่มความพึงพอใจในการทำงานของพวกเขาได้
ฐานความผิดในการขับขี่มอเตอร์ไซค์บนทางเท้า เป็นความผิดในคดีจราจรทางบก และเป็นความผิดทางคดีอาญา มีโทษปรับ 5,000 บาท ตามพระราชบัญญัติรักษาความสะอาดและความเป็นระเบียบเรียบร้อยของบ้านเมือง พ.ศ. 2535
การจับปรับ หรือใช้กฎหมายบังคับเพียงอย่างเดียวยังไม่ใช่เป้าหมายหลัก การใช้วิธีการสื่อสาร ทำความเข้าใจกัน เพื่อร่วมกันรับผิดชอบในสังคม จะทำให้ทางเท้าในเมืองนี้ มีความปลอดภัยขึ้นได้
โรงพยาบาลบางมดมีความผูกพันกับสังคมในการให้บริการทางการแพทย์เพื่อสังคมด้วย โดยการส่งเสริมสุขภาพชุมชนอยู่เสมอ ด้วยการส่งหน่วย Home healthcare เข้าตรวจโรคตามชุมชนรอบๆ โรงพยาบาลบางมด ซึ่งโอกาสครบรอบ 35 ปีนี้ได้ปรับเปลี่ยนสิทธิการดูแลผู้ป่วยทั้งสิทธิประกันทั่วไป คือในกรณีผู้ป่วยไม่สบายและต้องรับการแอดมิด หากวงเงินค่านอนโรงพยาบาลไม่พอ เรามีแคมเปญลุ้นโชค โดยจะช่วยจ่ายค่าห้องส่วนเกิน 50% ถึง 100% เป็นต้น ซึ่งเราใส่ใจดูแลผู้ป่วยทุกคนเสมือนญาติสนิทคนในครอบครัวเราเช่นที่ผ่านมา”
ในปีที่ 35 ปีของ รพ.บางมด นอกจากจะมีการพัฒนาด้านการแพทย์อย่างต่อเนื่อง รพ.บางมด ยังมุ่งมั่นเดินหน้าสู่การเป็น Bangmod Aesthetic & Wellness Hospital เพื่อเร่งรองรับตลาดศัลยกรรมความงามที่จะเป็นก้าวสำคัญในการช่วยยกระดับคุณภาพชีวิตของคนไทยให้ดีขึ้นและเป็นหนึ่งไม่เป็นสองในการให้บริการทางการแพทย์เพื่อสังคม สมดั่งปณิธานของโรงพยาบาลบางมดว่า “เพราะเราดูแลใส่ใจคุณดั่งคนในครอบครัว” นั่นเอง.
โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน ปากช่อง
906/1, ตำบลโป่งตาลอง อำเภอปากช่อง จ.นครราชสีมา 30130
โทรศัพท์ 064-2055962 044-300974
จันทร์-พฤหัส 08.30 น. - 15.00 น.
ศุกร์ 08.30 น. - 12.00 น.
เสาร์-อาทิตย์ 08.30 น. - 15.00 น.
Facebook |
Website |
แผนที่ครม.อนุมัติหลักการ ร่างพ.ร.ฎ.พื้นที่ทดลองเพาะปลูกและสกัดสารสำคัญจากฝิ่นและเห็ดขี้ควาย LINK
8 สิงหาคม 2566 คณะรัฐมนตรีมีมติอนุมัติหลักการ "ร่างพระราชกฤษฎีกากำหนดพื้นที่ทดลองเพาะปลูกและสกัดสารสำคัญจากฝิ่น และกำหนดพื้นที่ทดลองเพาะปลูกและสกัดสารสำคัญจากพืชเห็ดขี้ควายเพื่อประโยชน์ในการศึกษาวิจัย พ.ศ. ...." ตามที่กระทรวงยุติธรรม (ยธ.) เสนอ และให้ส่งสำนักงานคณะกรรมการกฤษฎีกาตรวจพิจารณา โดยให้รับความเห็นของกระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม ไปประกอบการพิจารณาด้วย แล้วดำเนินการต่อไปได้ และให้กระทรวงยุติธรรมรับความเห็นของกระทรวงมหาดไทย สำนักงานตำรวจแห่งชาติ และสำนักงานสภาพัฒนาการเศรษฐกิจและสังคมแห่งชาติไปพิจารณาดำเนินการต่อไป
สาระสำคัญ
1. การกำหนดพื้นที่ทดลองเพาะปลูกและสารสำคัญที่ได้จากฝิ่น
2. การกำหนดพื้นที่ทดลองเพาะปลูกและสกัดสารสำคัญจากพืชเห็ดขี้ควาย
3. การกำหนดมาตรการควบคุมการเพาะปลูกฝิ่น
4. การกำหนดมาตรการควบคุมการเพาะปลูกพืชเห็ดขี้ควาย
5. การกำหนดมาตรการควบคุมการสกัดสารสำคัญจากฝิ่น
6. มาตรการควบคุมการเพาะปลูกและสารสกัดสำคัญจากพืชเห็ดขี้ควายของสถาบันการศึกษา
วัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธ์ุ โรงพยาบาลนวเวช
โรงพยาบาลนวเวช Call Center : 02-483-9999
โรงพยาบาลหัวเฉียว ชุดตรวจมะเร็งปากมดลูก Thin Prep + HPV DNA ร่วมกับ อัลตราซาวด์ทางช่องคลอด
โรงพยาบาลหัวเฉียว ชุดตรวจมะเร็งปากมดลูก Thin Prep + HPV DNA ร่วมกับ อัลตราซาวด์ทางช่องคลอด สอบถามรายละเอียดได้ที่ แผนกสูติ-นรีเวช โทร. 081-234-1356 / 02-223-1351 ต่อ 3230 , 3232
วัคซีนป้องกันโรคมือ เท้า ปาก สำหรับเด็ก โรงพยาบาลวิมุต
วัคซีนป้องกันโรคมือเท้าปากในเด็ก จากเชื้อไวรัส EV71 เงื่อนไขในการรับบริการ : 1.แพ็กเกจนี้รวมค่าวัคซีน ค่าบริการพยาบาล และค่าบริการโรงพยาบาล โดยไม่รวมค่าธรรมเนียมแพทย์ฉีดวัคซีน (ตามจำนวนครั้งของการฉีดยา) 2.ระยะเวลาในการซื้อได้ถึง หมดเขต 31 ธันวาคม 2566 3.แพ็กเกจนี้ไม่สามารถใช้ร่วมกับโปรแกรมส่งเสริมการขายอื่นๆ การเรียกเก็บกับบริษัทคู่สัญญา บริษัทประกันฯ รวมถึงส่วนลดอื่นๆ 4.ราคานี้ไม่รวมค่าใช้จ่ายที่นอกเหนือจากแพ็กเกจ ค่ายา และ/หรือเวชภัณฑ์ทางการแพทย์อื่นๆ ในกรณีที่พบความผิดปกติหลังจากการรับวัคซีน 5.สอบถามข้อมูลเพิ่มเติมได้ที่ศูนย์กุมารเวช ชั้น 3 เวลาทำการ 08.00-20.00 น. โทร. 0-2079-0038 6.โรงพยาบาลขอสงวนสิทธิ์ในการเปลี่ยนแปลงข้อกำหนด เงื่อนไข ราคา และอื่นๆ โดยมิต้องแจ้งให้ทราบล่วงหน้า 7.ราคาดังกล่าวขอสงวนสิทธิ์สำหรับคนไทย และซาวต่างชาติที่อาศัยในประเทศไทยเท่านั้น 8.โรงพยาบาลขอสงวนสิทธิ์ในการคืนเงินทุกกรณี และเมื่อซื้อแล้วไม่สามารถเปลี่ยนมือได้ 9.กรุณานัดหมายก่อนเข้ารับการบริการ 1 วัน
สำนักงานป้องกันควบคุมโรคที่ 5 ราชบุรี
123/202 ซอย 1 ถนนเพชรเกษม ตำบลหน้าเมือง อำเภอเมือง จังหวัดราชบุรี
ศึกษาธิการ แสดงความเสียใจเหตุการณ์
รัฐมนตรีว่าการกระทรวงศึกษาธิการ แสดงความเสียใจเหตุการณ์เด็ก 14 กราดยิงที่สยามพารากอน รับเป็นนักเรียนในสังกัด การศึกษาตามอัธยาศัยหลักสูตรวิทยาศาสตร์ ชี้ยังเร็วเกินไปที่จะสรุปแรงจูงใจการก่อเหตุว่ามาจากการเล่นเกม
นายสิริพงศ์ อังคสกุลเกียรติ โฆษกกระทรวงศึกษาธิการ (ศธ.) กล่าวถึงกรณีนักเรียนชายวัย 14 โรงเรียนทางเลือกแห่งหนึ่งสังกัดสำนักงานคณะกรรมการการศึกษาขั้นพื้นฐาน (สพฐ.) ก่อเหตุกราดยิงในห้างสรรพสินค้าพารากอนว่า พล.ต.อ.เพิ่มพูน ชิดชอบ รมว.ศึกษาธิการ รู้สึกเสียใจต่อเหตุการณ์ที่เกิดขึ้นเป็นอย่างมาก และมีความห่วงใยต่อผู้เสียชีวิตและผู้บาดเจ็บทุกคน ซึ่งในส่วนของศธ.ได้ตรวจสอบข้อมูลเบื้องต้นแล้วพบว่า เด็กนักเรียนที่ก่อเหตุเป็นเด็กนักเรียนของโรงเรียน essence สังกัดศธ.จริง ซึ่งโรงเรียนดังกล่าวเป็นการจัดการศึกษาทางเลือกหรือการศึกษาตามอัธยาศัย จัดการเรียนการสอนตามหลักสูตรภาคบังคับของสพฐ. มีนักเรียนจำนวน 800 คน โดยผู้บริหารโรงเรียนแจ้งว่านักเรียนคนดังกล่าวเรียนอยู่ในหลักสูตรวิทยาศาสตร์
โฆษกศธ.กล่าวต่อไปว่า ทั้งนี้ในเบื้องต้นได้เขตพื้นที่ได้ลงพื้นที่พูดคุยกับผู้บริหารโรงเรียนแล้วพบว่า เด็กอาจมีสภาพทางจิตบ้างเล็กน้อย แต่ศธ.ยังไม่สามารถฟันธงได้จากการรายงานของบุคคลเพียงคนเดียว ดังนั้นจึงไม่อยากด่วนสรุปและยังไม่อยากโทษว่าเป็นความผิดของใคร แต่จำเป็นจะต้องหาเหตุจูงใจและถอดบทเรียนจากเรื่องนี้ เพื่อนำไปสู่การแก้ไขและป้องกันในอนาคต ส่วนประเด็นเรื่องนักเรียนเลียนแบบจากการเล่นเกมออนไลน์นั้น ตนยังไม่อยากด่วนสรุปว่าสาเหตุมาจากการเล่นเกม แต่การใช้สื่อออนไลน์ต่างๆผู้ปกครองและสถานศึกษาจะต้องมีมาตรการควบคุมดูแล และช่วยกันตรวจสอบการใช้สื่อที่ไม่เหมาะสมสำหรับเด็กและเยาวชนด้วย อย่างไรก็ตามเหตุการณ์ครั้งนี้จะเป็นโอกาสที่จะทำให้สังคมมองย้อนกลับไปถึงระบบการศึกษและนำไปสู่การแก้ไข รวมไปถึงประเด็นที่นักวิชาการออกมาระบุว่า ศธ.ควรปรับหลักสูตรการสอนที่เน้นทักษะชีวิตการแก้ปัญหาชีวิตให้มากขึ้น ซึ่งตรงตามนโยบายของรมว.ศธ.ที่ต้องการเดินหน้านโยบายเรียนดีมีความสุข
โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มศว ทำฟันฟรี 400 คน 20 ตุลาคม 2566
เนื่องในวันคล้ายวันพระราชสมภพ สมเด็จพระศรีนครินทราบรมราชชนนี และวันทันตสาธารณสุขแห่งชาติ และเพื่อถวายเป็นพระราชกุศลแด่พระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร โรงพยาบาลทันตกรรม คณะทันตแพทยศาสตร์ มศว ให้บริการทำฟันฟรี **โดยไม่เสียค่าใช้จ่าย** (อุดฟัน, ขูดหินน้ำลาย, ถอนฟัน, ผ่าฟันคุด) ผู้ใหญ่ 300 ราย เด็ก 100 ราย ณ คณะทันตแพทยศาสตร์ มหาวิทยาลัยศรีนครินทรวิโรฒ
ในวันศุกร์ที่ 20 ตุลาคม 2566 ตั้งแต่เวลา 08.00 – 15.00 น. เริ่มรับบัตรคิว เวลา 07.30 น. เป็นต้นไป (จนกว่าบัตรคิวจะหมด) เริ่มทำการตรวจพิเคราะห์และให้บริการรักษา เวลา 08.30 น. เป็นต้นไป **กรุณานำบัตรประชาชนมาด้วย
สอบถามโทร 02-6495788
เช่นเดียวกับหอดูดาวฯ สงขลา เป้าหมายสำคัญในการขับเคลื่อนองค์กรของเชฟรอน ในฐานะบริษัทพลังงานระดับโลกคือ Human Energy หรือการเชื่อมั่นในพลังคน ดังนั้นการปลูกฝังรากฐานและสร้างโอกาสทางการศึกษาให้เข้าถึงทุกพื้นที่จึงเป็นหนึ่งในความมุ่งมั่นของเชฟรอนที่ขับเคลื่อนมาตลอด ซึ่งเชฟรอนได้สนับสนุนงบประมาณให้กับหอดูดาวสงขลาอย่างต่อเนื่องตั้งแต่ยังไม่เริ่มเปิดให้บริการอย่างเป็นทางการตั้งแต่ปี พ.ศ. 2560 จนถึงปัจจุบัน
การวางแผนครอบครัว
การวางแผนครอบครัว ศบส. 39 เปิดให้บริการวันพุธ เวลา 13.00 น. – 16.00 น.
การวางแผนครอบครัว (Family planning) คือการที่คู่สามีและภรรยามีการร่วมปรึกษาหารือกันวางแผนเกี่ยวกับความถี่หรือห่างของการมีบุตรของครอบครัวโดยอาจใช้วิธีทางธรรมชาติหรือมีการใช้ยาหรืออุปกรณ์ต่างๆเพื่อช่วยให้การวางแผนนั้นๆสำเร็จมากขึ้น
การให้บริการ
- ให้คำปรึกษาการวางแผนครอบครัว
- ให้บริการการคุมกำเนิด 3 วิธี คือ การฉีดยาคุม, การจ่ายยาคุมชนิดเม็ด และ การแจกถุงยางอนามัย
- ให้บริการการตรวจคัดกรองมะเร็งอวัยวะสืบพันธ์ุสตรีในระยะเริ่มต้น
- ให้บริการส่งเสริมสุขภาพสตรีวัยทองอายุ 45 ปีขึ้นไป
คลินิกสมรรถภาพปอด
คลินิกสมรรถภาพปอด
- คลินิกสมรรถภาพปอด ในเวลาราชการ 08.00 - 16.00 น.
คลินิกวัณโรค
- คลินิกวัณโรค ในเวลาราชการ 08.00 - 16.00 น.
- คลินิก Fast track ในเวลาราชการ 08.00 - 16.00 น.
รศ.พญ. ปิยนุช พูตระกูล ได้กล่าวเสริมว่า จากข้อมูลของโรงพยาบาลรามาธิบดี พบว่าหลังจากที่ออกมาตราการกระบวนการการป้องกันภาวะลิ่มเลือดอุดตันในหลอดเลือดดำหลังผู้ป่วยแผนกศัลยกรรม พบว่า อัตราการเกิด VTE ลดลงอย่างน่าพอใจและสามารถป้องกันการเสียชีวิตจากภาวะหลอดเลือดดำอุดตันได้ โดยมาตรการในการป้องกันดังกล่าวทำให้เห็นว่ามีความคุ้มค่าทางเศรษฐศาสตร์มากคือเสียค่าใช้จ่ายน้อยแต่เกิดประโยชน์สูงสุด และเป็นสิ่งที่ทีมบุคลากรทางการแพทย์สามารถปฏิบัติได้ เมื่อเทียบกับมูลค่าความเสียหายที่อาจเกิดขึ้นหากปล่อยให้โรคเกิดขึ้นโดยไม่ได้ป้องกัน การป้องกันไว้แต่เนิ่นๆ นับเป็นสิ่งที่ภาคการบริหารจัดการของโรงพยาบาล หน่วยงานต่างๆ ควรยกระดับการดูแลเรื่องนี้ให้มากยิ่งขึ้น เพื่อเพิ่มโอกาสในการรอดชีวิตจากภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ
ข้อมูลอ้างอิง
* https://www.ncbi.nlm.nih.gov/books/NBK549877/ และ ** https://www.worldthrombosisday.org/
อุทยานแห่งชาติถ้ำหลวง-ขุนน้ำนางนอน เปิดการท่องเที่ยว ตั้งแต่วันที่ 1 ต.ค. 66 เป็นต้นไป
[update]
อุทยานแห่งชาติถ้ำหลวงฯ ออกประกาศเปิดการท่องเที่ยว ตั้งแต่วันที่ 1 ต.ค. 66 เป็นต้นไป โดยจะเปิดการท่องเที่ยวอุทยานแห่งชาติถ้ำหลวงฯ ในพื้นที่ ขุนน้ำนางนอน และ ถ้ำหลวง (เฉพาะปากถ้ำ) ติดต่อสอบถามเพิ่มเติม โทร. 0837532431 (เวลาทำการ)
อุทยานแห่งชาติถ้ำหลวง-ขุนน้ำนางนอน อุทยานที่มีชื่อเสียงระดับโลกจากเหตุการณ์น้องๆหมูป่า เมื่อหลายปีก่อน ถ้ำหลวงนางนอนเป็นระบบถ้ำคาร์สติกในวนอุทยานถ้ำหลวง–ขุนน้ำนางนอน ใกล้กับหมู่บ้านโป่งผา ทางตอนเหนือของประเทศไทย อยู่ใต้ดอยนางนอน ซึ่งเป็นเทือกเขาที่ติดชายแดนพม่า สถานที่ท่องเที่ยวในเขตอุทยานฯ ได้แก่ - ถ้ำหลวง เป็นถ้ำที่เกิดจากการกัดเซาะของน้ำใต้ดินเป็นเวลานาน มีขนาดใหญ่และลึกมากเป็นอันดับที่ 4 ของประเทศไทย มีความยาว 10.3 กิโลเมตร มีความสูงโดยเฉลี่ย 779 เมตร และลาดชันมาทางทิศตะวันออก ปากถ้ำเป็นโถงกว้างและสูงกว่าโถงถ้ำแรก ภายในถ้ำมีเกล็ดหินสะท้อนแสง หินงอกหินย้อย ธารน้ำถ้ำลอด และถ้ำแขนง แนวโถงถ้ำมีเส้นทางคดเคี้ยว บางช่วงเข้าถึงง่าย บางช่วงมีเพดานต่ำ นอกจากนี้ยังมีหลักฐานที่แสดงถึงวิวัฒนาการของถ้ำจำนวนมาก เช่น รอยการไหลของน้ำเป็นริ้วคลื่น ระดับพื้นถ้ำเก่า หินถล่มขนาดใหญ่และเล็กจำนวนมาก รอยแตกแบบมีแรงดึง รอยระดับน้ำหลุมยุบ โพรงเพดานถ้ำและรอยแตกของผนัง เปิดให้เข้าชมในช่วงเดือนพฤศจิกายน-เมษายน ปัจจุบันหลังจากเกิดเหตุการณ์เด็กติดในถ้ำได้งดการเข้าชมถ้ำภายในไว้ก่อน โดยสามารถเข้าชมได้บริเวณปากโถงถ้ำเท่านั้น - ถ้ำพระ เป็นถ้ำขนาดเล็ก ภายในถ้ำมีพระพุทธรูปขนาดใหญ่ มีหินงอกหินย้อยรูปร่างแปลกตา อากาศบริเวณปากถ้ำเย็นสบาย - ถ้ำพญานาค เป็นถ้ำขนาดเล็ก อยู่ใต้หน้าผาบนภูเขา ภายในถ้ำมีหินงอกขนาดใหญ่คล้ายงูแผ่แม่เบี้ย สูง 2.5 เมตร อยู่ตรงบริเวณปากถ้ำ - ถ้ำเลียงผาเป็นถ้ำที่เกิดจากการยุบตัวของแผ่นดิน จึงทำให้เกิดลักษณะที่เป็นเวิ้ง มีหุบเหวล้อมรอบ กว้างประมาณ 80 เมตร สูงประมาณ 30 เมตร บริเวณถ้ำยังพบฟอสซิลหอยฝาเดียวและหอยสองฝาอายุหลายร้อยล้านปี ในอดีตเลียงผาบนภูเขาจะลงมากินน้ำฝนที่ไหลลงมาขังภายในถ้ำจึงเป็นที่มาของชื่อ “ถ้ำเลียงผา” - ขุนน้ำนางนอน อยู่ห่างจากถ้ำหลวง 2 กิโลเมตร มีธรรมชาติที่สวยงามร่มรื่น มีบึงน้ำจืดขนาดเล็ก บนหน้าผาเหนือบึงน้ำยังเป็นที่ตั้งของถ้ำทรายทอง ซึ่งยังไม่มีการสำรวจภายใน
อุทยานแห่งชาติถ้ำหลวง-ขุนน้ำนางนอน
ต.โป่งผา อ.แม่สาย จ.เชียงราย
โทร. 094-6033511
โครงการทุนสถาบันราชสุดา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี นับเป็นภารกิจครั้งใหม่ของมูลนิธิรามาธิบดีฯ เพื่อช่วยสร้างพื้นที่แห่งโอกาสทางการศึกษาให้คนพิการ รวมถึงพัฒนางานวิจัยและนวัตกรรมด้านคนพิการ และการให้บริการฟื้นฟูสมรรถภาพและพัฒนาศักยภาพของคนพิการนำไปสู่การยกระดับคุณภาพชีวิตของคนพิการในประเทศไทย เพราะการมอบการศึกษาคือหนทางที่จะช่วยสร้างสังคมที่ทุกคนมีคุณค่า ช่วยลดความเหลื่อมล้ำ สร้างความเท่าเทียมกันในสังคม และเพื่อพัฒนาคุณภาพชีวิตคนพิการให้สามารถพึ่งพาตนเองได้อย่างยั่งยืน ในโอกาสนี้จึงขอเชิญชวนประชาชนผู้มีจิตศรัทธาร่วมบริจาคเงินสมทบทุนให้กับโครงการทุนสถาบันราชสุดา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี ได้ที่ มูลนิธิรามาธิบดีฯwww.ramafoundation.or.th
#คำว่าให้ไม่สิ้นสุด
#ความสุขจากการให้ไม่สิ้นสุด
มุนดนตรีผ่อนคลายเพื่อน้องหมา Dog Relaxing Music
สุนัขมีประสาทการได้ยินทั้งคลื่นความถี่และระดับเสียง มากกว่าคนถึง 3 เท่า มุม Music for Dogs by Major Development จึงตั้งใจทำเป็นมุมดนตรีเพื่อสุนัขโดยเฉพาะ จังหวะเท่ากับการเต้นของหัวใจของสุนัขและมีคลื่นเสียงที่เป็นมิตรทำให้เพลย์ลิสต์นี้กลายเป็นเหมือนดนตรีบำบัดให้คนและสุนัขผ่อนคลายไปพร้อมกัน
บริษัท เมเจอร์ ดีเวลลอปเม้นท์ จำกัด (มหาชน) ผู้นำด้านการพัฒนาธุรกิจอสังหาริมทรัพย์ระดับลักซูรีและโครงการที่อยู่อาศัยที่สามารถเลี้ยงสัตว์ได้ (Pet-Friendly Residences) กล่าวว่า หลังจากเปิดตัวแคมเปญ #สุขเท่าเทียม สะท้อนความมุ่งมั่นในการพัฒนาบ้านและคอนโดมิเนียมที่ทั้งคนและสัตว์เลี้ยงมีความสุขร่วมกันได้อย่างเท่าเทียม เราก็ได้ยึดแนวคิดในการทำงานภายใต้ความสุขอย่างเท่าเทียมอย่างต่อเนื่อง โดยอิงจากข้อมูลเชิงลึก (Insights) ของสุนัขและแมว เราจึงพัฒนาเพลงเพื่อคนและสัตว์เลี้ยง เกิดเป็นเพลย์ลิสต์ที่ทั้งคนและสัตว์เลี้ยงฟังร่วมกันอย่างมีความสุข ภายใต้ชื่อ “MAJOR PETSCAPE presents Music for Dogs & Cats”
คุณโยชิทาโร่ ฮานาอิ จากร้าน “คาเมยะ โยชิฮิโระ” จังหวัดไอชิ
คุณโยชิทาโร่ ฮานาอิ จากร้าน “คาเมยะ โยชิฮิโระ” จังหวัดไอชิ ช่างทำขนมและเจ้าของร้าน ขึ้นชื่อเรื่องฝีมือและความเอาใจใส่ จนเป็นที่รู้จักและชื่นชอบอย่างกว้างขวางในโอวาริ นาโกย่า ถั่วแดงบดของที่ร้านมีความโดดเด่นเป็นเอกลักษณ์ การเลือกใช้ถั่วประเภทต่างๆ มาเป็นวัตถุดิบในการทำขนม ทางร้านจะพิจารณาจากฤดูกาลและช่วงเวลาในการเก็บเกี่ยวที่ดีที่สุด
รศ. นพ.เพชร รอดอารีย์ นายกสมาคมเครือข่ายโรคไม่ติดต่อไทย กล่าวถึงอุบัติการณ์โรคอ้วนในประเทศไทยเพิ่มขึ้นมากกว่าร้อยละ 30 หรือมีผู้ป่วยด้วยโรคอ้วนกว่า 20 ล้านคน นำมาซึ่งความเสี่ยงกลุ่มโรค NCDs ได้แก่ โรคเบาหวาน ความดันโลหิตสูง ไขมันในเลือดสูง โรคระบบหัวใจและหลอดเลือด และมะเร็ง โดยโรคกลุ่มนี้ยังคุกคามความยั่งยืนของระบบประกันสุขภาพถ้วนหน้าของไทย ปัจจุบันงบประมาณกว่าครึ่งหมดไปกับการรักษาโรค NCDs และยังสร้างผลกระทบอย่างมากต่อภาคธุรกิจ ขณะที่วิธีการแก้ปัญหาในปัจจุบันยังเป็นการตั้งรับ ผู้ป่วยส่วนใหญ่ยังไม่ตระหนักว่า ‘ความอ้วนเป็นโรค ที่ต้องรักษา’ ระบบสาธารณสุขไทยต้องอาศัยความร่วมมือจากทุกภาคส่วนหาแนวทางป้องกันก่อนเกิดโรค ควรเร่งดำเนินการนโยบายเพื่อจัดการกับโรคอ้วน และโรค NCDs อย่างจริงจัง รวมถึงวางมาตรการหรือกรอบนโยบายที่ชัดเจน อาทิ เรื่องภาษีน้ำตาล โซเดียม การบริโภคอาหารที่โภชนาการเหมาะสม รวมถึงส่งเสริมการออกกำลังกายอย่างเป็นรูปธรรม การให้ความรู้ประชาชนและการจัดการสิ่งแวดล้อมที่เอื้อต่อการมีสุขภาพดี โดยคำนึงถึงสุขภาพประชาชนเป็นหัวใจสำคัญ
ทุ่งดอกบัวตองดอยแม่อูคอ พฤศจิกายน-ธันวาคม
เมื่อถึงฤดูหนาว ทั่วทิวเขาเมืองสามหมอก แม่ฮ่องสอนจะสะพรั่งไปด้วยสีเหลืองสกาวของดอกบัวตองนับแสนล้านดอก เสน่ห์ที่ดึงดูดนักท่องเที่ยวมาเยี่ยมเยือนดอยแม่อุคอมาอย่างยาวนาน ทุ่งดอกบัวตองดอยแม่อูคอ ตั้งอยู่ตำบลแม่อูคอ อยู่ในความรับผิดชอบของวนอุทยานทุ่งบัวตอง ครอบคลุมเป็นเขากว้างประมาณ 1,000 ไร่ ดอกบัวตองจะบานพร้อม ๆ กันในช่วงเดือนพฤศจิกายน-ธันวาคม ผู้สนใจสามารถติดต่อได้โดยตรง บริเวณหน่วยทำการบนทุ่งบัวตอง หรือติดต่อกับทางอำเภอขุนยวม โทร. 0 5369 1108 อุทยานแห่งชาติน้ำตกแม่สุรินทร์ โทร. 0 5306 1073 และบริเวณด้านหลังจุดชมวิว มีร้านอาหารไว้บริการนักท่องเที่ยวด้วย [ภาพจาก ททท.]
ตารางวัคซีนสำหรับผู้ใหญ่ที่มีความเสี่ยงจากการประกอบอาชีพ
ตารางวัคซีนสำหรับผู้ใหญ่
ทดสอบใช้จริง “แก้วน้ำกันสำลัก” ก่อนต่อยอดการผลิต


ปัจจุบัน แก้วน้ำกันสำลักยังเป็นต้นแบบ (Prototype) ที่ผ่านการวิจัยขั้นแรก และกำลังอยู่ในช่วงการวิจัยทดสอบ (Testing) กับผู้ใช้งานจริงจำนวนมาก ทั้งคนไข้ที่อยู่ในโรงพยาบาล และคนไข้ที่นำแก้วน้ำไปใช้ในชีวิตประจำวัน โดยมีการติดเครื่องเซนเซอร์จับพฤติกรรมขณะดื่มน้ำไว้
“เราต้องการรู้ว่าเมื่อผู้ใช้ได้ดื่มน้ำผ่านแก้วน้ำนี้ในชีวิตประจำวัน โดยไม่มีแพทย์ หรือพยาบาลคอยควบคุมดูแลแล้ว แก้วน้ำนี้จะสามารถลดการสำลักได้ในระดับใด โดยจะประมวลผลการใช้งานจริงทั้งหมดนี้ นำมาพัฒนาดีไซน์ที่เหมาะสมกับการใช้งานในชีวิตประจำวันให้มากที่สุด แล้วจึงต่อยอดการผลิตในระดับโรงงานอุตสาหกรรมต่อไป”
นอกจากพัฒนาการใช้งานแล้ว ในขั้นตอนการทดสอบนี้ ทีมวิจัยจะได้แก้ไขข้อจำกัดบางอย่างด้วย โดยเฉพาะเรื่องการทำความสะอาด เนื่องจากดีไซน์ของแก้วน้ำมีลักษณะเป็นชิ้นเดียว ภายในแก้วน้ำถูกออกแบบให้มีตัวกั้นน้ำ มีมุมลาดเอียงที่คำนวณการปริมาณไหลของน้ำไว้ จึงอาจทำให้ทำความสะอาดยากตามซอกมุมเหล่านี้
“ที่สุดแล้ว ทีมวิจัยหวังว่า “แก้วน้ำกันสำลัก” ที่เราตั้งใจออกแบบและพัฒนา จะช่วยผู้ใช้ให้สามารถกินอาหาร 3 มื้อต่อวันได้อย่างมีความสุข ดื่มน้ำได้อย่างมั่นใจ ไม่ต้องกังวลว่าจะสำลัก” ศ.นพ.รุ่งโรจน์ กล่าวทิ้งท้าย
สำหรับผู้ที่ต้องการเป็นส่วนหนึ่งของการทดสอบวิจัยแก้วน้ำกันสำลัก สามารถติดต่อได้ที่ ศาสตราจารย์ นายแพทย์รุ่งโรจน์ พิทยศิริ ศูนย์ความเป็นเลิศทางการแพทย์โรคพาร์กินสันฯ โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ตึก ผู้สูงอายุ หรือ ตึกสธ. ชั้น 7 โทร 0-2256-4000 ต่อ 70702-3 โทรสาร 02-256-4000 ต่อ 70704 โทรศัพท์มือถือ 08-1107-9999 Website:
www.chulapd.org
28 พ.ย. 66 ปานปรีย์ เดินทางถึงกรุงเทลอาวีฟ อิสราเอล
28 พฤศจิกายน 2566 นายปานปรีย์ พหิทธานุกร รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ เดินทางถึงอิสราเอล และพบหารือกับนาย Eli Cohen รัฐมนตรีว่าการกระทรวงการต่างประเทศรัฐอิสราเอล ที่กรุงเทลอาวีฟ
รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศแสดงความยินดีที่อิสราเอลและฮามาสสามารถบรรลุผลสำเร็จในการเจรจาเพื่อขยายระยะเวลาการหยุดยิงเพื่อเหตุผลทางมนุษยธรรมออกไปอีกสองวัน และขอบคุณฝ่ายอิสราเอลที่ดูแลคนไทยที่ได้รับการปล่อยตัวแล้ว ๑๗ คน โดยขอให้อิสราเอลพยายามดำเนินการเพื่อปล่อยตัวคนไทยที่ถูกจับเป็นตัวประกันโดยเร็วที่สุด ทั้งนี้ รัฐมนตรีว่าการกระทรวงการต่างประเทศอิสราเอลแสดงความเสียใจกับการเสียชีวิตของคนไทย รวมถึงผู้ที่ได้รับบาดเจ็บ โดยกล่าวว่า ฝ่ายอิสราเอลให้ความสำคัญกับความสัมพันธ์กับประเทศไทย และจะดำเนินการอย่างเต็มที่เพื่อช่วยเหลือตัวประกันคนไทยทั้งหมดต่อไป รัฐอิสราเอลจะให้สิทธิและสวัสดิการทางสังคมแก่คนไทยที่ได้รับผลกระทบทุกคน เช่นเดียวกับที่ชาวอิสราเอลได้รับ และหวังว่า เมื่อสถานการณ์ดีขึ้น คนไทยจะกลับมาทำงานในอิสราเอลเหมือนเดิม เพราะเป็นกำลังสำคัญของภาคการเกษตรและเศรษฐกิจของอิสราเอล
ในโอกาสนี้ รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ ฝากให้อิสราเอลดูแลแรงงานไทยที่ยังทำงานอยู่ในอิสราเอล ทั้งในด้านความปลอดภัย และในด้านสิทธิ์และสวัสดิการต่าง ๆ ที่แรงงานไทยพึงได้
หลักสูตรพัฒนาศักยภาพบุคลากรเพื่อส่งเสริมธุรกิจท่องเที่ยวที่ปลอดภัยและเป็นมิตรกับเด็ก (Child Safe Friendly Tourism Project)
หลักสูตรพัฒนาศักยภาพบุคลากรเพื่อส่งเสริมธุรกิจท่องเที่ยวที่ปลอดภัยและเป็นมิตรกับเด็ก (Child Safe Friendly Tourism Project)
ลิงค์หลักสูตร5.ศูนย์สุขภาพพร้อม กาดฝรั่ง-หางดง
ศูนย์สุขภาพพร้อม กาดฝรั่ง-หางดง ดำเนินงานโดย ศูนย์บริการเทคนิคการแพทย์คลินิก คณะเทคนิคการแพทย์ มช.
Line Account สำนักงานประกันสังคม ต้อง @ssothai เท่านั้น
รพ.กรุงเทพปลวกแดง อ.ปลวกแดง จ.ระยอง
รพ.กรุงเทพปลวกแดง อีกหนึ่งในเครือรพ.กรุงเทพ เปิดตัวรับผู้ประกันตนเป็นปีแรกในปี 2567 ตั้งอยู่ที่ 855 ตำบล ปลวกแดง อำเภอปลวกแดง ระยอง 21140 โทรศัพท์: 033221339 โรงพยาบาลกรุงเทพปลวกแดง เป็นโรงพยาบาลทั่วไปขนาดกลาง เปิดให้บริการทุกวันโดยมีแผนกฉุกเฉินเปิดให้บริการตลอด 24 ชม. ให้การดูแลรักษาผู้ป่วยที่มีอายุตั้งแต่ แรกเกิดขึ้นไป แผนกผู้ป่วยนอกเปิด ให้บริการ 7.00 – 20.00 น. เปิดให้บริการตรวจรักษาโรคทั่วไปทุกช่วงอายุ แผนกอุบัติเหตุและฉุกเฉินเปิดให้บริการทุกวันตลอด 24 ชั่วโมง ดูแลผู้ป่วยอุบัติเหตุฉุกเฉินทุกประเภท ทั้งในสถานการณ์ปกติและฉุกเฉิน ให้บริการเคลื่อนย้ายผู้ป่วยทางการแพทย์โดยรถ Ambulance ให้บริการออกหน่วย Standby ปฐมพยาบาลและออกสอน BLS ให้กับมูลนิธิ บริษัท โรงเรียนศักยภาพ และข้อจำกัด โรงพยาบาลกรุงเทพปลวกแดง มีระบบการส่งต่อผู้ป่วยฉุกเฉิน หรือเกินศักยภาพในการดูแลไปเข้ารับการรักษาต่อในโรงพยาบาลกรุงเทพระยอง ซึ่งระยะทางในการส่งต่อ 50 กิโลเมตร ใช้เวลาในการเดินทางประมาณ 40 นาที โดยมีทีมแพทย์ พยาบาลและเจ้าหน้าที่กู้ชีพ พร้อมให้บริการตลอดระยะเวลา
5. สร้างขวัญและกำลังใจบุคลากร โดยมีทีม Care D+ ในหน่วยบริการทุกระดับ บรรจุพยาบาล 3,000 ตำแหน่ง กำหนดตำแหน่ง พยาบาลชำนาญการพิเศษ และแพทย์ได้รับการยกเว้นให้รับเงินเดือนระหว่างลาศึกษาต่อ
เปิดโครงการอบรมขับเคลื่อนการสื่อสารสาธารณะและสังคม (Care D+) ประจำปีงบประมาณ 2567 อบรมบุคลากรสาธารณสุข เป็น "ทีมเชื่อมประสานใจ Care D+" ช่วยสื่อสารดูแลผู้ป่วยและญาติอย่างเข้าอกเข้าใจ ส่งเสริมความสัมพันธ์ อันดีระหว่างผู้ป่วย ญาติ และบุคลากรทางการแพทย์ เสมือนเป็น "ญาติเฉพาะกิจ มิตรภาพถาวร" สร้างความเข้าใจในกระบวนการรักษา จัดการภาวะวิกฤตทาง การสื่อสารอย่างมืออาชีพ โดยร่วมกับจุฬาลงกรณ์มหาวิทยาลัย พัฒนาหลักสูตร มาตรฐาน Care D+ ซึ่งมีทั้งแบบออนไซท์และออนไลน์ผ่านแพลดฟอร์ม cug.academy ล่าสุดมีบุคลากรลงทะเบียนเข้ารับการอบรมเกินเป้าหมาย 1 หมื่นคนแล้ว เริ่มอบรมชุดแรก 1 พันคนภายในเดือนธันวาคมนี้ เป็นของขวัญ ปีใหม่คนไทย และครบ 1 หมื่นคน ในเดือนเมษายน 2567
ข้อมูล ณ เดือนธันวาคม 2566 กำหนดอบรมทีม Care D+ เป็นญาติเฉพาะกิจเชื่อมประสานใจญาติ คนไข้ และบุคลากรทางการแพทย์ ในหน่วยบริการทุกระดับ จำนวน 1 พันคน แต่ดำเนินการได้เกินกว่าเป้าหมายของทั้งโครงการ 1 หมื่นคน โดยมีผู้ลงทะเบียน 16,500 คน ผ่านการอบรมแล้ว 10,127 คน, การบรรจุพยาบาลเข้าสู่ตำแหน่ง เป้าหมาย 50% บรรจุแล้ว 2,433 อัตรา จาก 3,318 อัตรา คิดเป็น 73.3%, กำหนดตำแหน่งชำนาญการพิเศษของพยาบาลวิชาชีพ 10,124 ตำแหน่ง ดำเนินการแล้ว 9,489 ตำแหน่ง คิดเป็น 93.73%
ประกาศนโยบายความมั่นคงทางการเงิน "แก้หนี้ เสริมกำลังใจ ให้คนสาธารณสุข" ร่วมกับธนาคารออมสินช่วยเหลือบุคลากรที่มีหนี้ทั้งในระบบและนอกระบบ โดยจัดทำ แผนความมั่นคงปลอดภัยทางการเงิน (Money Safety MOPH+) ใน 2 โครงการ คือ 1.โครงการสร้างความมั่นคงด้านที่อยู่อาศัย ครอบคลุมทั้งการรีไฟแนนซ์ ซื้อบ้านหลังใหม่ ปลูกสร้างบ้าน และต่อเติมซ่อมแชมบ้าน และ 2.โครงการสินเชื่อสวัสดิการและอื่น ๆ 4 รูปแบบ คือ สินเชื่อสวัสดิการ : อุปโภคบริโภค/ชำระหนี้สินเชื่อรายย่อยประเภทอื่น, สินเชื่อ Salary เปย์ เพื่อ บุคลากรกาครัฐ, สินเชื่อสวัสดิกรโดยใช้บำเหน็จตกทอด และสินเชื่อรายได้ประจำสุขใจ และเตรียมเปิดคลินิกสุขภาพทางการเงิน ในทุกโรงพยาบาลสังกัดกระทรวงสาธารณสุขทั่วประเทศ ในวันที่ 8 ธันวาคม 2566
ประชุมร่วม ณ จังหวัดประจวบคีรีขันธ์


24 พฤศจิกายน 2566 นายบุญรักษ์ สรัคคานนท์ ผู้อำนวยการสำนักงานเทคโนโลยีสารสนเทศและดิจิทัล เข้าประชุมร่วมกับ กรมควบคุมโรค / ศูนย์เทคโนโลยีอิเล็กทรอนิกส์และคอมพิวเตอร์แห่งชาติ (NECTEC) / สาธารณสุข จังหวัดประจวบคิรีขันธ์ / กรรมการเหล่ากาชาดจังหวัดประจวบคิรีขันธ์ / โรงพยาบาลบางสะพาน และหน่วยงานที่เกี่ยวข้อง เพื่อชี้แจงความเป็นมาการพัฒนาเทคโนโลยีระบุตัวตนของบุคคลที่ไม่มีเอกสารประจำตัวในประเทศไทย เพื่อการสาธารณสุขและช่วยเหลือด้านมนุษยธรรม ส่งเสริมให้มีการประยุกต์ใช้งานวิจัย เทคโนโลยี และนวัตกรรมกับงานด้านสาธารณสุข ทำให้คุณภาพชีวิตของประชาชนทุกคนในประเทศดียิ่งขึ้น โดยได้นำเอาเทคโนโลยีการจดจำใบหน้าและลายม่านตา ด้วยระบบ Face Recognition และ Iris Recognition เข้ามาช่วยสนับสนุนทางการแพทย์ ในการบันทึกข้อมูลของผู้รับบริการฉีควัคซีน และยืนยันตัวตน ในการเข้ารับวัคซีน รวมทั้งสามารถนำไปต่อยอดในการทำงานด้านมนุษยธรรม โดยเชื่อมโยงข้อมูลเข้ากับการบริการสาธารณสุขของไทย ซึ่งจะเป็นประโยชน์ในการเฝ้าระวัง ป้องกัน และควบคุมโรค ในกลุ่มประชากรข้ามชาติที่อยู่ในประเทศไทย ณ ช่องกระจก ชั้น 4 อาคารศาลากลางจังหวัดประจวบคีรีขันธ์ -
สำนักงานเทคโนโลยีสารสนเทศ สภากาชาดไทยคาดการณ์เปรียบเทียบการเดินทางทางอากาศ
ประเทศเกรนาดา
Grenada
1. St George’s University, School of Medicine; Grenada
หลักสูตร 4 ปี ปริญญา Doctor of Medicine (MD) การเรียนการสอน แบ่งเป็น ระดับปรีคลินิก 2 ปี เรียนที่ Grenada ระดับคลินิก 2 ปี เรียนที่ USA, UK หรือ Grenada และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับ คลินิกตามที่ระบุมาในหลักสูตรและอยู่ใน USA และUK ดังนี้ โรงพยาบาลหลัก 50 แห่ง แบ่งเป็น ใน USA จ านวน 40 แห่ง ใน UK จ านวน 10 แห่ง โรงพยาบาลสมทบ 12 แห่ง แบ่งเป็น ใน USA จ านวน 10 แห่ง ใน UK จ านวน 2 แห่ง
ว/ด/ป ที่ รับรอง 16 พ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 15 พ.ค. 67
2. St George’s University, School of Medicine; Grenada
หลักสูตร 5 ปี ปริญญา Doctor of Medicine (M.D.) การเรียนการสอน แบ่งเป็น ระดับ Basic Sciences 1 ปี ระดับปรีคลินิก 2 ปี เรียนที่ Grenada ระดับคลินิก 2 ปี เรียนที่ USA, UK หรือ Grenada และรับรองโรงพยาบาลที่ใช้ ในการเรียนการสอนระดับคลินิกตามที่ระบุมาในหลักสูตรและอยู่ใน USA และUK ดังนี้ โรงพยาบาลหลัก 63 แห่ง ใน USA, Grenada จ านวน 51 แห่ง ใน UK จ านวน 12 แห่ง โรงพยาบาลสมทบ 8 แห่ง ใน USA, Grenada จ านวน 7 แห่ง ใน UK จ านวน 1 แห่ง
ว/ด/ป ที่ รับรอง 9 ธ.ค. 64
ว/ด/ป ครบอายุ การรับรอง 8 ธ.ค. 69NBT ถ่ายทอดสดพิธีเปิด ยิงสัญญาณเชื่อมอีก 3 จังหวัดนำร่อง แพร่ เพชรบุรี นราธิวาส
น.ส.ตรีชฎา ศรีธาดา โฆษกกระทรวงสาธารณสุข ฝ่ายการเมือง เปิดเผยว่า การเตรียมการพร้อม 100% แล้วสำหรับพิธีเปิด Kick Off นโยบาย “บัตรประชาชนใบเดียว รักษาทุกที่” 4 จังหวัดนำร่อง ประกอบด้วยร้อยเอ็ด แพร่ เพชรบุรีและนราธิวาส ซึ่งกำหนดไว้วันนี้ (7 มกราคม 2567) โดยคณะของนายกรัฐมนตรี ได้แก่ นายเศรษฐา ทวีสิน นายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการคลัง นพ.ชลน่าน ศรีแก้ว รัฐมนตรีว่าการกระทรวงสาธารณสุข และ น.ส.แพทองธาร ชินวัตร รองประธานคณะกรรมการพัฒนาระบบสุขภาพแห่งชาติ จะมาปักหลักตรวจเยี่ยมและ Kick Off เปิดงาน ณ ลานสาเกตุนคร หอโหวต 101 จ.ร้อยเอ็ด พบปะมวลชน ชมการแสดง จาก 30 บาทรักษาทุกโรค สู่ 30 บาทรักษาทุกที่ amazing ร้อยเอ็ด นโยบายดีๆ ของขวัญปีใหม่สำหรับชาวไทย ชม VTR นาฏศิลป์ โดยมีผู้ใหญ่คำปันและดาราดังเรื่องสัปเหร่อร่วมงาน
จากนั้น เวลา 17.30 - 19.00 น. จะเริ่มถ่ายทอดทางสถานีโทรทัศน์ NBT ให้ประชาชนรับชมพร้อมกันทั้งประเทศ ขณะเดียวกันก็จะถ่ายทอดสดการจัดกิจกรรมผ่านระบบ Zoom รับสัญญาณจากจังหวัดแพร่ เพชรบุรี และนราธิวาส พร้อมกับร้อยเอ็ด ที่เป็นจุดหลัก ซึ่งพิธีเปิดงานได้จัดอย่างยิ่งใหญ่ โดยมีไฮไลท์ คือ นายเศรษฐา ทวีสิน นพ.ชลน่าน ศรีแก้ว และน.ส.แพทองธาร ชินวัตร เสียบบัตรประชาชนลงบนกล่อง Reader Card พร้อมกันทั้ง 4 จังหวัด พร้อมยิงเลเซอร์โลโก้ จุดพลุ Kick Off มวลชนที่มาร่วมงานโชว์บัตรประชาชน และร่วมร้องเพลง “บัตรประชาชนใบเดียว รักษาได้ทุกที่”
สำหรับจังหวัดเพชรบุรี จัดงานที่ห้องประชุมเพชรพระจอมเกล้า โรงพยาบาลพระจอมเกล้า โดยมี นายวิชาญ มีนชัยนันท์ ที่ปรึกษารัฐมนตรีว่าการกระทรวงสาธารณสุขหัวหน้าส่วนราชการ บุคลากรสาธารณสุข ผู้นำชุมชน ผู้นำท้องถิ่น อสม. ชมรมผู้สูงอายุ และ ประชาชน จำนวน 1,000 คน ส่วนจังหวัดนราธิวาส จัดงานที่สวนสาธารณะเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา อำเภอเมือง จังหวัดนราธิวาส โดยมี นายวัชรพล โตมรศักดิ์ ผู้ช่วยรัฐมนตรีประจำกระทรวงสาธารณสุข หัวหน้าส่วนราชการ บุคลากรสาธารณสุข ผู้นำชุมชน ผู้นำท้องถิ่น อสม. ชมรมผู้สูงอายุ และ ประชาชน จำนวน 1,000 คน จังหวัดแพร่ จัดงานที่โรงยิม องค์การบริหารจังหวัดแพร่ โดยมี นพ.เชิดชัย ตันติศิรินทร์ กรรมการผู้ช่วยรัฐมนตรี นายชุติเดช มีจันทร์ ผู้ว่าราชการจังหวัด หัวหน้าส่วนราชการ นายอำเภอ บุคลากรสาธารณสุข ผู้นำชุมชน ผู้นำท้องถิ่น อสม. ชมรมผู้สูงอายุ และ ประชาชน จำนวน 1,000 คน
ทั้งนี้ ในช่วงสายและช่วงบ่ายไปถึงเย็นก่อนจะถึงพิธิเปิดงานนั้น เป็นการตรวจเยี่ยมนโยบาย 30 บาทรักษาทุกที่ ที่อำเภอจตุรพักตรพิมานและอำเภอเมือง จังหวัดร้อยเอ็ด เพื่อพบปะมวลชน ดูความพร้อมของโรงพยาบาลร้อยเอ็ด ร้านยา ร้านแล็บ คลิกนิกเวชกรรม คลินิกทันตกรรม เป็นต้น ซึ่งการจัดงานคิกออฟครั้งนี้ ถือเป็นอะเมซซิ่งสาธารณสุขไทยที่จะเกิดการพลิกโฉมครั้งสำคัญ ประชาชนสามารถเข้าถึงระบบบริการด้วยบัตรประชาชนใบเดียว รักษาทุกที่ ทุกโรค รักษาฟรี และนับต่อแต่นี้ไป สุขภาพอนามัย โรคภัยไข้เจ็บของพี่น้องประชาชนจะได้รับการดูแลอย่างดี สะดวกสบายด้วยบัตรประชาชนใบเดียว น.ส.ตรีชฎากล่าว
นอกจากนี้ นพ.สุรัคเมธ มหาศิริมงคล ผู้อำนวยการศูนย์เทคโนโลยีสารสนเทศและการสื่อสาร สำนักปลัดกระทรวงสาธารณสุข ได้กล่าวถึงการให้ความสำคัญในเรื่องการทำข้อมูลให้เป็นข้อมูลรายบุคคลด้วยการใช้ระบบดิจิทัล เพื่อให้ผู้สูงอายุสามารถทราบสิทธิ์ของตัวเองในการเข้าถึงสวัสดิการที่มีอยู่แล้วของแต่ละบุคคลรวมถึงมีการจัดเก็บข้อมูลสุขภาพ เพื่อให้การเข้าถึงทางการแพทย์มีความรวดเร็วมากยิ่งขึ้น ซึ่ง ดร.มนต์ศักดิ์ โซ่เจริญธรรม ที่ปรึกษาอาวุโสและผู้เชี่ยวชาญฐานข้อมูลดิจิทัลภาครัฐ ก็สนับสนุนแนวคิดเรื่องการเก็บข้อมูล Data ส่วนบุคคลของทุกคน และให้มีมาตรการมารองรับและดูแลข้อมูลส่วนบุคคล อีกทั้ง นางพรนิภา มาสิลีรังสี รองอธิบดีกรมกิจการผู้สูงอายุ เห็นด้วยว่าการนำนวัตกรรม Personal AI เข้ามาช่วยเหลือดูแลผู้สูงอายุนั้น สอดคล้องกับภารกิจของกรมกิจการผู้สูงอายุ คือการยกระดับคุณภาพชีวิตของผู้สูงอายุในทุกระดับ ในทุกมิติ
สำหรับPrototype ที่ประสบความสำเร็จจากโครงการโครงการวิจัยแนวทางเพิ่มศักยภาพการเข้าถึงสวัสดิการทางสังคม และการใช้ประโยชน์เทคโนโลยีดิจิทัลในกลุ่มผู้สูงอายุ ก็คือ Box set ที่ประกอบไปด้วย สายรัดข้อมืออัจฉ ริยะ “กะทิ” ที่เป็น Health Monitoring ที่ช่วยสามารถติดตามข้อมูลสุขภาพของผู้สูงอายุ โดยสามารถวัดความเข้มข้นของออกซิเจน อัตราการเต้นของหัวใจ สเต็ปก้าวเดิน ซึ่งในอนาคตจะสามารถต่อยอดในเรื่องของ Calling feature และ SOS feature จะส่งพร้อมตำแหน่งที่อยู่ปัจจุบันหากเกิดอุบัติเหตุกับผู้สวมใส่ได้ด้วย นอกนี้รวมถึงยังมีเครื่องวัดความดันโลหิต เครื่องวัดความเค็มและเครื่องตรวจน้ำตาลในเลือด
คลินิกมลพิษ โรงพยาบาลราชพิพัฒน์
โรงพยาบาลราชพิพัฒน์ เปิดคลินิกมลพิษ ให้บริการทุกวันจันทร์-ศุกร์ เวลา 8.00-12.00 น. ชั้น 1 อาคารเฉลิมพระเกียรติ ให้บริการ 1)คัดกรอง/ซักประวัติผู้ป่วย 2) รักษาผู้ป่วยจากมลพิษ 3) ให้คำปรึกษาด้านมลพิษ สอบถามโทร. 063-3241126. 099-1705879 หรือติดต่อผ่านไลน์ @1rpp
นอกจากนั้น ยังเป็นหน่วยที่จะให้ความรู้กับประชาชนเรื่องการป้องกันตนเองจากฝุ่น pm2.5 พร้อมรณรงค์ เพื่อให้ประชาชนได้เข้าถึงคลินิกมลพิษ ได้ง่ายขึ้น สะดวกขึ้น รวดเร็วขึ้น สามารถโทรปรึกษาได้ตลอด 24 ชม. ผ่านไลน์ @1rpp
การแพทย์แผนไทย นัดออนไลน์ผ่านแอปพลิเคชันหมอพร้อม
การแพทย์แผนไทย เปิดบริการนัดออนไลน์ ผ่านแอปพลิเคชันหมอพร้อม
บริการนวดตัว 1 ชั่วโมง ชั่วโมงละ 250
**กรณีผู้ป่วยใหม่ติดต่อห้องบัตรก่อนรับบริการ
ติดต่อสอบถามเพิ่มเติมโทร 02-3381133 , 02-338-1065 ต่อ 0
รพ.จุฬาภรณ์ เน้นรักษาโรคมะเร็งด้วยนวัตกรรมและเทคโนโลยีทางการแพทย์ขั้นสูง
การรักษาโรคมะเร็งที่มีประสิทธิภาพ คือ การรักษาที่เข้าถึงผู้ป่วยมะเร็งทุกคนได้อย่างสมบูรณ์ ด้วยเป้าหมายที่ต้องการให้ผู้ป่วยกลับมาดำเนินชีวิตได้อย่างยืนยาว โรงพยาบาลจุฬาภรณ์จึงมุ่งเน้นการรักษาโรคมะเร็งด้วยนวัตกรรมและเทคโนโลยีทางการแพทย์ขั้นสูงที่ได้มาตรฐานสากลภายใต้การดูแลรักษาร่วมกันโดยแพทย์เฉพาะทางสหสาขา เพื่อร่วมกันวินิจฉัยข้อมูลและวางแผนการรักษาที่เหมาะสมเพื่อทางเลือกที่ดีที่สุดให้กับผู้ป่วยมะเร็งแต่ละราย ตลอดจนการดูแลชีวิตและจิตใจและการดูแลแบบประคับประคองด้วยแนวทางการดูแลทางการแพทย์แบบองค์รวมที่มุ่งปรับปรุงคุณภาพชีวิตของผู้ป่วยและครอบครัว ซึ่งศูนย์มะเร็งวิทยา โรงพยาบาลจุฬาภรณ์ ได้รับการรับรองมาตรฐานโดยสมาคมมะเร็งวิทยาแห่งยุโรป หรือ ESMO (European Society for Medical Oncology) ให้เป็น “ESMO Designated Centres of Integrated Oncology and Palliative Care” ซึ่งเป็นโรงพยาบาลแห่งแรกในประเทศไทยที่ได้รับการรับรองนี้อีกด้วย
Safety and Quality Transformation
ภญ. อาทิรัตน์ อธิบายต่อว่า Safety and Quality Transformation คุณภาพและความปลอดภัย คือ หัวใจสำคัญอีกประการของบำรุงราษฎร์ ไม่มีสิ่งใดสำคัญไปกว่าความปลอดภัยของผู้ป่วยและพนักงานของเรา และเราจะไม่ประนีประนอมในเรื่องของความปลอดภัยเด็ดขาด ซึ่งเห็นได้อย่างชัดเจนในช่วงที่เกิดการระบาดของโรค บำรุงราษฎร์แสดงให้เห็นถึงศักยภาพในการบริหารจัดการการแพร่ระบาดของโรคได้เป็นอย่างดี เรามีการถอดบทเรียน มี knowledge management นำปัญหามาวิเคราะห์หาสาเหตุเพื่อป้องกันไม่ให้เกิดขึ้นอีกในอนาคต และพัฒนาในเรื่องการบริหารจัดการความเสี่ยง (risk management) ได้อย่างดี ซึ่งสามารถที่จะป้องกันข้อผิดพลาดต่างๆ ที่อาจขึ้นได้ ควบคู่ไปกับการส่งเสริมเรื่องของ no-blame policy ทำให้พนักงานกล้าที่จะพูดคุยในปัญหาเพื่อหาแนวทางแก้ไขร่วมกัน
ที่สำคัญ เราไม่เคยหยุดที่จะพัฒนาเรื่องของเทคโนโลยีเพื่อนำมาปรับใช้ให้เกิดการบริหารจัดการที่มีประสิทธิภาพยิ่งขึ้นในองค์กร อย่าง Hospital Information Management System (HIMS) การบริหารจัดการด้านระบบสารสนเทศของโรงพยาบาล ที่ช่วยควบคุม quality ลดข้อผิดพลาด และส่งเสริมมาตรฐานคุณภาพและความปลอดภัยในการบริหารจัดการของโรงพยาบาลมีผลลัพธ์ที่ดียิ่งขึ้น
การลดอันตรายจากการใช�ยา (Harm Reduction) การลดอันตรายจากการใช�ยา มีขึ้นบนพื้นฐานของข�อมูลเชิงประจักษ�ที่แสดงถึงประสิทธิภาพ และ ประสิทธิผลทั่วโลก ในชวง 30 ปw หลังมานี้ ป$จจุบันวิธีดังกลาวอยูคูขนานกับเสาหลักอื่นของนโยบายยาเสพติด เชน การลดอุปสงค� และอุปทาน แตตางกันตรงที่การลดอันตรายจากการใช�ยามุงเน�นที่การลดอันตราย แม�วาจะไมลดความชุกของการใช�ยาหรือปริมาณของยาเสพติดในตลาดก็ตาม การลดอันตรายจากการใช�ยาเป#น การตอบสนองการปฏิบัติที่ยอมรับวา แม�การเลิกเสพยาจะเป#นเปAาหมายที่มีคุณคา แตก็อาจจะไมเหมาะสมกับ คนบางคน
Harm Reduction International ให�คําจํากัดความของ การลดอันตรายจากการใช�ยา วาเป#น นโยบาย โปรแกรม หรือการปฏิบัติที่มีเปAาหมายเพื่อลดผลเสียที่มีตอสุขภาพ สังคม และเศรษฐกิจของการใช�ยา ออกฤทธิ์ ตอจิตและประสาททั้งที่ถูกและผิดกฎหมาย โดยไมได�จําเป#นวาจะต�องใช�ลดลง บางแหงใช�คําวา Harm Minimization หรือRisk Reduction ในอดีต เปAาหมายของการลดอันตรายจากการใช�ยา มุงที่จะลดอันตรายตอสุขภาพของการฉีดอนุพันธ� ของฝ}~น ทําให�มีการละเลยตอกลุมที่ใช�สารเสพติดประเภทอื่นๆ เชน สารกระตุ�น เนื่องจากรูปแบบของการใช� และการบริหารยามีการเปลี่ยนแปลงที่รวดเร็ว จึงจําเป#นต�องมีการปรับปรุงที่รวดเร็วตาม การลดอันตรายจากการใช�ยา มักถูกมองวาเป#นชุดของหลักการมากกวาเป#นวิธีการ เป#นแนวความคิดทั้ง ด�านสาธารณสุขและสิทธิมนุษยชน รวมถึงด�านความปลอดภัยและความมั่นคงของสาธารณะด�วย เปAาหมายของ อันตรายในด�านใช�ยาเกินขนาด การติดเชื้อ การกักขังเกินความจําเป#น การใช�ความรุนแรงของตํารวจ การตีตราบาป การเป#นคนชายขอบ การลวงละเมิด มีความจําเป#นต�องชักชวนให�กลุมผู�ปCวยเข�ามามีสวนรวมในการสร�าง โปรแกรม การบริการ และการประเมินผล ป$จจุบันทั่วโลกมีผู�ใช�ยาเสพติด 246 ล�านคน เป#นกลุมผู�ใช�การฉีดประมาณ 8.5 - 21.5 ล�านคน ในจํานวนผู�ใช�ยาฉีดนี้ 13.5% ติดเชื้อเอดส� 52% ติดเชื้อไวรัสตับอักเสบซี ซึ่งสูงกวาความชุกในประชากรทั่วไปมาก รวมถึงการเสียชีวิตจากการใช�ยาฉีดเกินขนาดปwละกวา 200,000 คน นอกจากนี้ ในขณะที่ผู�ใช�ยาสวนน�อย ที่พัฒนาจนเป#นผู�ติดยา แตผู�ใช�ยากลับต�องดําเนินชีวิตด�วยความเสี่ยงจากการถูกดําเนินคดีทางอาญาและ การถูกผลักให�เป#นคนชายขอบ สวนผู�ใช�ยาเสพติดที่ไมใชการฉีดก็มีการวิจัยที่พบอันตรายจากการเสพยามากขึ้น เชนกัน


พร้อมกันนี้ ยังได้ รพ. พานาซี ซึ่งเชี่ยวชาญในเรื่องเวชศาสตร์ชะลอวัยและมีองค์ความรู้เฉพาะในเรื่องของการใช้สเต็มเซลล์ในการบำบัด โรคเบาหวาน หลอดเลือด และ มะเร็ง และใน Senior Complex ยังมี DNA PLUS มาดูแลลูกค้าของโครงการ โดย DNA PLUS ยึดแนวทางในการดูแลรักษาด้วยการแพทย์แบบผสมผสานทั้งการบำบัดเซลล์ด้วยวิธีการต่างๆ เช่น การทำคีเลชั่น การล้างพิษ การทำทรีทเม้นท์ รวมทั้งการตรวจภูมิแพ้อาหารอันก่อให้เกิดการเจ็บป่วยต่างๆ ด้วยการให้อาหารเสริมและวิตามิน เพื่อเสริมสร้างการรักษาและสร้างภูมิต้านทานให้แก่ร่างกาย รวมถึง นำองค์ความรู้ของด้านเวชศาสตร์ชะลอวัย แพทย์แผนไทย แพทย์แผนจีน และกายภาพบำบัด มาช่วยฟื้นฟูผู้ป่วยเพื่อให้ได้ผลลัพธ์ที่ดีที่สุด พร้อมเป็นศูนย์การแพทย์สำหรับผู้ที่ต้องการสุขภาพดีและชะลอวัย DNA PLUS ยังมีความเชี่ยวชาญเป็นพิเศษ โดยเฉพาะผู้สูงอายุ ไม่ว่าจะเป็นอัมพฤกษ์ อัมพาต ผู้ป่วยติดเตียง นอกจากการฟื้นฟูและการดูแลสุขภาพโดยทั่วไปแล้ว ยังออกแบบมาเพื่อดูแลสูงวัยในระยะยาว โดยดูแลสุขภาพแบบบูรณาการ (Integrated Healthcare) เพื่อผู้สูงวัยโดยเฉพาะ และหากเป็นผู้ป่วยติดเตียง หรือมีโรคประจำตัวที่ต้องการการดูแลเป็นพิเศษ ก็มีบุคลากรทางการแพทย์คอยให้คำปรึกษาอย่างใกล้ชิด โดย DNA PLUS จะตั้งอยู่บนพื้นที่ชั้น 2 ของ SENIOR CLUB บริเวณด้านหน้าโครงการ PARC EXO CARE
เทศกาลงานออกแบบกรุงเทพฯ จบแล้วไปไหนต่อ?
อาจเป็นคำถามที่หลายคนสงสัยตลอดหลายปีที่ผ่านมา ว่าผลงานออกแบบที่ถูกจัดแสดงตลอด 9 วันในเทศกาลฯ นั้น จะถูกนำไปต่อยอดกับเมืองอย่างไรได้บ้าง?
เทศกาลงานออกแบบกรุงเทพฯ 2567 หรือ Bangkok Design Week 2024 ปีนี้ มาพร้อมโจทย์ที่ท้าทายอย่าง ‘HACK BKK’ ซึ่ง CEA ได้พัฒนาขึ้นร่วมกับกรุงเทพมหานคร เพื่อให้นักออกแบบ/นักสร้างสรรค์ได้ทดลองออกไอเดียแก้ปัญหาเมืองจากโจทย์ที่มีอยู่จริง โดยแนวทางแก้ปัญหาเหล่านี้จะถูกนำไปต่อยอดและพัฒนากับทาง Bangkok City Lab ของกรุงเทพมหานคร ไม่ว่าจะเป็นการเดินทาง พื้นที่สาธารณะ การอยู่ร่วมกันของคนและสัตว์ในเมือง ฯลฯ
สปสช.เขต 5 ราชบุรี
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 5 ราชบุรี
- เลขที่ 2 อาคารไปรษณีย์ชั้น 3 ราชบุรี ถ.สมุทรศักดารักษ์ ต.หน้าเมือง อ.เมือง จ.ราชบุรี 70000
- โทร. 032-332590-1
- โทรสาร. 032-332593
- แผนที่ google map
- website
- facebook
ปัจจุบันการฉายรังสีรักษา ใช้เวลาสั้นกว่าเดิม
นพ. อภิชาต พานิชชีวลักษณ์ แพทย์ผู้ชำนาญด้านรังสีรักษาและมะเร็งวิทยา โรงพยาบาลบำรุงราษฎร์ อธิบายว่า การฉายรังสีโรคมะเร็งเต้านมในปัจจุบัน การผ่าตัดจะเน้นทำการผ่าตัดแบบถนอมเต้านมไว้ ซึ่งต้องฉายรังสีร่วมด้วยเสมอ โดยผลการรักษาเทียบเท่ากับการผ่าตัดเต้านมออกและยังคงอวัยวะเต้านมนั้นไว้มีความสำคัญมากสำหรับสตรี การรักษาในปัจจุบันใช้เวลาสั้นมากขึ้นจากเดิม 6 สัปดาห์เหลือเพียงแค่ 4 สัปดาห์ และในแต่ละครั้งของการใช้รังสีใช้เวลาเพียง 10 นาทีเท่านั้น นอกจากนี้ ยังมีเทคโนโลยีมาช่วยควบคุมการเคลื่อนไหวของร่างกายขณะฉายแสง โดยเฉพาะอย่างยิ่งการหายใจ ทำให้มีการความปลอดภัยต่ออวัยวะข้างเคียงไม่ว่าจะเป็นผิวหนัง ปอด หรือ หัวใจ ในกรณีฉายแสงในมะเร็งเต้านมข้างซ้าย แผนการรักษาด้วยรังสีรักษาจะมีการประชุมร่วมกับทีมแพทย์เพื่อหาแนวทางการรักษาที่เหมาะสมในผู้ป่วยแต่ละราย
UMSC โรงพยาบาลเวชการุณย์รัศมิ์
✅ สอบถามปัญหาสุขภาพ
✅ สอบถามการบริการ
✅ พบแพทย์ออนไลน์ (Telemedicine)
✅ เจ็บป่วยฉุกเฉิน
✅ ศูนย์ข้อมูลข่าวสารโรงพยาบาลเวชการุณย์รัศมิ์
ให้บริการในวันและเวลาราชการ วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
นัดตรวจรักษาหรือเลื่อนนัดตรวจได้ก่อนล่วงหน้า
ช่องทางการติดต่อ แอดไลน์ @wkr1
สายด่วน UMSC โรงพยาบาลเวชการุณย์รัศมิ์
0-2543-2090
084-215-9278
066-143-0145
โครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี ออกแบบภายใต้แนวคิด “เข้าใจเขา เข้าใจเรา เข้าใจทุก(ข์)คน” เพื่อตอบโจทย์ความต้องการทั้งผู้ป่วยและบุคลากรทางการแพทย์ รวมถึงการแก้ไขปัญหาด้านความแออัดของพื้นที่อาคารเดิม โดยตั้งเป้าหมายการระดมทุนเพิ่มเติมจากการสนับสนุนของภาครัฐบาลรวมจำนวน 9,000 ล้านบาท เพื่อนำไปใช้ดำเนินการก่อสร้างอาคารโรงพยาบาลและการจัดซื้อเครื่องมือทางการแพทย์ที่ทันสมัยจำนวนมาก ซึ่งคาดว่าจะแล้วเสร็จในปี 2573
มูลนิธิรามาธิบดีฯ ขอเชิญชวนประชาชนผู้มีจิตศรัทธาร่วมเป็นพลังบวกหนึ่งกับโครงการ “รามา+1 เพิ่มพื้นที่ บวกความหวัง” ด้วยการบริจาคเงินสมทบทุนก่อสร้างโครงการอาคารโรงพยาบาลรามาธิบดี และย่านนวัตกรรมโยธี
#คำว่าให้ไม่สิ้นสุด #ความสุขจากการให้ไม่สิ้นสุด
อนาคตของเอไอ จะมาทดแทนแพทย์หรือไม่
ตั้งแต่เอไอเกิดขึ้น และประจักษ์กับความสามารถของมันแล้ว คำถามสำคัญที่เกิดขึ้นมาคือ อนาคตเอไอ จะเข้ามาแทนที่แพทย์ หรือไม่ ซึ่ง CEO รพ.บำรุงราษฎร์ ได้ยืนยันหนักแน่น ว่า
"จากประสบการณ์ สามารถบอกได้เลยว่า เอไอไม่มีทางมาแทนที่คุณหมอได้ เพราะยังไงก็ตาม การตรวจร่างกาย การคุยกับคนไข้ เอไอต้องเพิ่งข้อมูลดาต้า เอไอให้ข้อมูลผลเอ็กซเรย์ จากแลปวินิจฉัย แต่ข้อมูลก็มีอีกหลายๆ เงื่อนไข ที่คุณหมอจะได้จากการพูดคุยกับคนไข้ แล้วก็นำข้อมูลเหล่านั้นเข้าไปในระบบ (input) เอไอ จะไปเป็นเครื่องมือที่ช่วยคุณหมอ ให้ข้อมูลที่แม่นยำ การลดเวลาการดูแลคนไข้ ทำให้เกิดความมั่นใจมากขึ้น ที่สำคัญ หมอที่เก่ง ระดับอาจารย์แพทย์ หมอที่มีประสบการณ์ ล้วนเป็นแม่เหล็ก ในการตัดสินใจรับบริการ และสร้างการยอมรับ เอไอและเครื่องมือทันสมัยต่างๆ จะมาช่วยยกระดับการรักษา บนทักษะ ประสบการณ์และความสามารถขั้นสูงของแพทย์ระดับนำเหล่านี้ และจะเป็นการยกระดับขีดความสามารถของแพทย์ และวงการแพทย์โดยรวมอีกด้วย"
ประโยชน์ที่สำคัญที่สุดอีกประเด็น คือความกังวลว่าจะขาดแคลนแพทย์อย่างหนักในอนาคต การมีเอไอมาช่วยในทางการแพทย์ จะช่วยลดการทำงานที่หนักเกินไปของแพทย์ (overload) เพราะเหตุที่แพทย์มีจำนวนจำกัด ลงได้
วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี
รองศาสตราจารย์ ดร.ทัศนา บุญทอง คณบดีวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี
วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี เป็นสถาบันการศึกษาชั้นนำในระดับชาติ และนานาชาติ มุ่งมั่นผลิตบุคลากรสาขาวิชาพยาบาลศาสตร์ ที่มีคุณภาพมาตรฐานในระดับสากล มีการเรียนการสอนทั้งภาคทฤษฎีและภาคปฏิบัติ โดยนักศึกษาจะได้เรียนรู้จากคณาจารย์ผู้สอน ที่มีความเชี่ยวชาญและมีประสบการณ์เฉพาะสาขา ที่ให้ความดูแลอย่างใกล้ชิด ทางวิทยาลัยฯ มีห้องปฏิการเสมือนจริงเป็นห้องเรียนที่ทันสมัย มีความพร้อมในอุปกรณ์อำนวยความสะดวกเพื่อให้นักศึกษาที่มาเรียนได้ประโยชน์สูงสุด ภายในอาคารของวิทยาลัยฯ มีห้องสมุดให้ค้นคว้าด้วยตนเอง มีห้อง co-working ที่นักศึกษาใช้พักผ่อน พบปะสังสรรค์กับกลุ่มเพื่อน และทำกิจกรรมสันทนาการในช่วงเวลาว่างจากการเรียนอีกด้วย
สสจ.สระแก้ว Kick Off นโยบายยกระดับ 30 บาทรักษาทุกที่ ณ โรงพยาบาลโคกสูง
วันที่ 30 มีนาคม 2567 นายสุรชาติ เทียนทอง เลขานุการรัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธาน Kick Off นโยบายยกระดับ 30 บาทรักษาทุกที่ ด้วยบัตรประชาชนใบเดียว และเยี่ยมชมพื้นที่ ร่วมกับผู้ช่วยผู้ตรวจราชการกระทรวงสาธารณสุข เขตสุขภาพที่ 6 ผู้อำนวยการหลักประกันสุขภาพแห่งชาติ เขต 6 ระยอง นายแพทย์สาธารณสุขจังหวัดสระแก้ว และผู้บริหารสาธารณสุขในระดับเขต พร้อมทั้งหัวหน้าส่วนราชการในจังหวัดสระแก้ว จำนวน 4 จุด คือ โรงพยาบาลโคกสูง ศาลาโอสถ สาขาโคกสูง อรัญแล๊บ และอาคารโดมสำนักงานเขตพื้นทีการศึกษาประถมศึกษาสระแก้ว เขต 2
เขต 5
- สอน.วังศาลา จ.กาญจนบุรี
- สถานีอนามัยเฉลิมพระเกียรติฯตำบลวังศาลา
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลห้วยม่วง จ.นครปฐม
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านนิคม กม.5 จ.ประจวบคีรีขันธ์
- สอน.บ้านร่วมใจพัฒนา จ.เพชรบุรี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลคูบัว อำเภอเมือง จังหวัดราชบุรี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บางขันแตก จังหวัด สมุทรสงคราม
- สอน.บ้านคอกกระบือ จ.สมุทรสาคร
- สอน.บ้านดอนไร่ จ.สุพรรณบุรี
- สอน.บ่อสุพรรณ จ.สุพรรณบุรี
แนวทางการตรวจสอบ และผู้พัฒนาระบบ
แนวทางการตรวจสอบและวินิจฉัยเกี่ยวกับเรื่องเข้าข่ายผิดหลักเกณฑ์
คณะกรรมการนโยบายฯ ได้แต่งตั้งคณะอนุกรรมการ 2 คณะ เพื่อให้การดำเนินโครงการฯ เป็นไปอย่างมีประสิทธิภาพ ดังนี้
- คณะอนุกรรมการด้านการตรวจสอบการกระทำที่อาจเข้าข่ายผิดหลักเกณฑ์และเงื่อนไขของโครงการฯ โดยมีหน้าที่และอำนาจ เช่น กำหนดแนวทางการตรวจสอบ พิจารณา และวินิจฉัยเกี่ยวกับการกระทำที่อาจเข้าข่ายผิดหลักเกณฑ์และเงื่อนไขโครงการฯ รวมถึงการกระทำที่อาจฝ่าฝืนต่อบทบัญญัติของกฎหมายที่เกี่ยวข้อง ตรวจสอบกรณีมีการร้องเรียนเกี่ยวกับการดำเนินการตามโครงการฯ เพื่อให้ได้ข้อเท็จจริงเป็นที่ยุติเสนอแนะแนวทางการขับเคลื่อนโครงการฯ ต่อคณะกรรมการนโยบายฯ โดยมีรองผู้บัญชาการตำรวจแห่งชาติเป็นประธาน
- คณะอนุกรรมการกำกับการดำเนินโครงการฯ ซึ่งสามารถกำหนดรายละเอียดที่ไม่ขัดต่อกรอบหลักการเพื่อใช้ในการดำเนินโครงการฯ ได้ โดยมีรัฐมนตรีช่วยว่าการกระทรวงการคลัง (นายจุลพันธ์ อมรวิวัฒน์) เป็นประธาน
ผู้พัฒนาและดำเนินการระบบ
มอบหมายให้ สพร. และ ดศ. เป็นผู้พัฒนาและดำเนินการระบบสำหรับโครงการฯ โดยมีรายละเอียด ดังนี้
- ประชาชน
(1.1) ระบบลงทะเบียนและตรวจสอบคุณสมบัติกลุ่มเป้าหมายตามเงื่อนไขโครงการฯ เช่น อายุ เงินได้พึงประเมิน เงินฝาก เป็นต้น
(1.2) ระบบยืนยันตัวตนสำหรับประชาชนและการตรวจสอบข้อมูลกับกรมการปกครอง
- ร้านค้า ระบบลงทะเบียนและตรวจคุณสมบัติร้านค้า (ตามเงื่อนไขที่กระทรวงพาณิชย์กำหนด)
- ระบบการใช้จ่าย
(3.1) ระบบการใช้จ่ายรอบที่ 1: การใช้จ่ายระหว่างประชาชนกับร้านค้าขนาดเล็กจนถึงร้านสะดวกซื้อขนาดเล็กเท่านั้น
(3.2) ระบบการใช้จ่ายรอบที่ 2 ขึ้นไป: การใช้จ่ายระหว่างร้านค้ากับร้านค้า ทั้งนี้ ไม่มีการกำหนดเงื่อนไขร้านค้า
- ระบบการชำระเงิน
(4.1) ระบบการใช้จ่ายสำหรับการชำระบัญชี (Clearing and Settlement) ระหว่างบัญชีของประชาชนและบัญชีของร้านค้าที่ธนาคารที่รับชำระเงิน (Open Loop)
(4.2) ระบบการชำระเงินให้ผู้ประกอบการร้านค้าโดยให้เป็นไปตามเงื่อนไขแหล่งเงิน
(4.3) ตรวจสอบร้านค้าที่ตรงตามเงื่อนไขในการถอนเงินได้ (ร่วมกับกรมสรรพากร)
(4.4) ระบบเชื่อมโยงข้อมูลกับหน่วยรับงบประมาณและเบิกจ่ายเงิน โดยจะต้องกระทบยอด (Reconcile) ความถูกต้องของเงินที่จะเบิกจ่าย
ทั้งนี้ ระบบการใช้จ่ายระหว่างประชาชนและร้านค้าเป็นระบบเปิด (Open Loop) ที่ต้องมีการตรวจสอบความถูกต้องของทุกรายการใช้จ่ายตามเงื่อนไข รวมถึงการชำระบัญชีของโครงการฯ ตามเงื่อนไขทั้งหมดจนจบโครงการและบริหารจัดการภายใต้กฎหมายที่เกี่ยวข้อง
- ระบบอื่น ๆ เช่น
(5.1) ระบบตรวจสอบธุรกรรม (Transaction) ที่มีความต้องสงสัยเข้าข่ายการกระทำผิดเงื่อนไข (Fraud)
(5.2) ระบบอื่น ๆ ที่จะต้องดำเนินการเพื่อให้โครงการฯ สามารถขับเคลื่อนได้สำเร็จ
(5.2.1) กำหนดวันที่ในการลงทะเบียนร้านค้า วันที่ลงทะเบียนประชาชน และวันที่เริ่มใช้จ่าย
(5.2.2) ระบบที่เตรียมให้ประชาชนและร้านค้าที่เข้าร่วมโครงการฯ จะต้องมีการให้ยืนยันหลักเกณฑ์ เงื่อนไข และความยินยอมสำหรับประชาชนและร้านค้าที่เข้าร่วมโครงการฯ (Consent)
(5.3) กำหนดชื่อเว็บไซต์และจำทำเว็บไซต์ (Website) สำหรับใช้ดำเนินโครงการ
5.Plusdentalclinic
คลินิกที่มีแพทย์ทางเทคนิคที่หลากหลาย ไม่ว่าคุณจะประสบปัญหาช่องปาก หรือว่าฟัน ต้องการทำทันตกรรมใดๆ ที่ Plusdentalclinic รองรับทุกบริการ เพราะแต่ละคนมีปัญหาช่องปากที่ไม่เหมือนกัน ดูแลผ่านแพทย์ผู้เชี่ยวชาญอย่างใกล้ชิด รับประกันประสิทธิภาพในการรักษาที่จะได้รับอย่างแน่นอน
ทันตกรรม
ทันตกรรม โทร. 039-314-554 ตรวจสุขภาพ คลินิกโรคไม่ติดต่อ และคลินิกระงับปวด บริการผ่าตัดทางศัลยกรรม, ศัลยกรรมกระดูก, หู คอ จมูก, จักษุ และ นรีเวชกรรม ตรวจสวนหัวใจ สนใจติดต่อ 063-4642725 (ในวันและเวลาราชการ)แผนการตรวจสุขภาพ ประจำเดือน พฤษภาคม 2567
ติดต่อสอบถามข้อมูลเพิ่มเติม Line: @wkr1 โทร. 095-249-2353, 066-143-0145
บริการคลินิกแพทย์แผนไทย LINK
โรงพยาบาลมหาวิทยาลัยอุบลราชธานี เปิดให้บริการคลินิกแพทย์แผนไทย
ทุกวันจันทร์ - วันศุกร์ เวลา 08.00-16.00 น.
ณ ชั้น 2 อาคารกิจกรรมด้านสุขภาพ (อาคารผู้ป่วยนอกหลังเก่า)
หัตถการที่เปิดให้บริการ
นวด
ประคบสมุนไพร
จ่ายยาสมุนไพรตามอาการ
ชำระเงินและใช้สิทธิได้ตามสิทธิ
ผู้สนใจรับบริการ ต้องจองคิวล่วงหน้า (งดรับ walk in)
สอบถาม/จองคิว โทร 045-353909 ต่อ 5936
คลินิกสูตินรีเวช นอกเวลาราชการ ศูนย์สุขภาพมะฮอกกานี โรงพยาบาลวชิระภูเก็ต
คลินิกพิเศษ มะเร็งวิทยานรีเวช นอกเวลาราชการ
รพ.สุโขทัยเพิ่มบริการคลินิกพิเศษนอกเวลาราชการ คลินิกมะเร็งวิทยานรีเวช ทุกวันอาทิตย์ที่ 2,4 ของเดือน 9.00น-12.00 น ติดต่อสอบถาม/จองคิว โทร 065-4721635 ค่าบริการ 300 บาท เบิกไม่ได้ ค่าบริการอื่นๆ เบิกได้ตามสิทธิ
ผศ.ดร.ประภาภรณ์ ติวยานนท์ มงคลวนิช คณบดีวิทยาลัยโลกคดีศึกษา มหาวิทยาลัยธรรมศาสตร์ กล่าวว่าเป็นเรื่องที่น่ายินดีที่คนไทยตระหนักถึงภัยคุกคามจากภาวะโลกร้อน การเปลี่ยนแปลงสภาพภูมิอากาศ และมลภาวะต่อชีวิตที่พวกเรากำลังเผชิญมากขึ้น แม้ว่าต้องเผชิญกับความท้าทายอื่นๆ อีกมากมายก็ตาม งานวิจัยส่วนใหญ่ของวิทยาลัยโลกคดีศึกษา มหาวิทยาลัยธรรมศาสตร์ จะมุ่งเน้นไปที่การทำความเข้าใจ ความท้าทายต่างๆ ผ่านสาขาวิชาที่หลากหลายและมุ่งเน้นให้ความรู้และปลูกฝังจิตสำนึกด้านสิ่งแวดล้อมและความยั่งยืนให้กับนักศึกษา ซึ่งจะเป็นผู้นำในอนาคตของประเทศไทย ให้พวกเขามีส่วนร่วมในการรณรงค์และผลักดันเรื่องสิ่งแวดล้อม พร้อมขับเคลื่อนให้สังคมเกิดการเปลี่ยนแปลงอย่างยั่งยืน”
คลินิกนอกเวลา
แพทย์หญิงปภาพินท์ ปุษยไพบูลย์
สามารถมาใช้บริการได้ ตั้งแต่
เวลา 16.00-20.00น.
3. ผลงานระบบปัญญาประดิษฐ์ขั้นสูงสำหรับการประเมินเปลือกตาก่อนและหลังการศัลยกรรมชั้นตาอย่างแม่นยำ


3. ผลงานระบบปัญญาประดิษฐ์ขั้นสูงสำหรับการประเมินเปลือกตาก่อนและหลังการศัลยกรรมชั้นตาอย่างแม่นยำ (EyLighner: Advanced AI Imaging for Precision Pre and Post-Operative Eyelid Assessment) โดย นส.พริ๊นซ์แพร์รีส แจ๊คสันว์ วงศาโรจน์ และ นส.มณิสรา พิบูลย์ นักศึกษาราชวิทยาลัยจุฬาภรณ์ อ.ดร.ปณิธิ อัจฉราฤทธิ์ และ อ.ดร.ปวรี นนทะแสน อาจารย์จากวิทยาลัยแพทยศาสตร์ศรีสวางควัฒนและคณะ ได้รับรางวัลเหรียญเงิน (Silver Medal) ซึ่งเป็นผลงานแอปพลิเคชันการประมวลผลภาพ เพื่อประเมินผลของการศัลยกรรมชั้นตาและค่าความสามารถในการลืมตาด้วยเทคโนโลยีปัญญาประดิษฐ์อย่างอัตโนมัติ ผลลัพธ์จากแอปพลิเคชันสามารถนำไปสนับสนุนการประเมินการรักษาในผู้ป่วยของจักษุแพทย์ได้อย่างรวดเร็ว ช่วยลดระยะเวลาและความเหนื่อยล้าจากการทำงานของจักษุแพทย์ได้เป็นอย่างดี ปัจจุบันยังไม่มีแอปพลิเคชันที่ช่วยจักษุแพทย์ในการประเมินการทำศัลยกรรมชั้นตาแบบอัตโนมัติจากทั้งก่อนและหลังการเข้ารับการผ่าตัด แอปพลิเคชันนี้จึงเป็นเสมือน One stop service ที่จัดการขั้นตอนที่จำเป็นต่าง ๆ ตั้งแต่ขั้นตอนการถ่ายภาพ ปรับภาพ และประเมินผลภาพได้อย่างมีประสิทธิภาพ
หน่วยเวชศาสตร์ฟื้นฟู คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกเวชศาสตร์ฟื้นฟู
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-พุธ และ ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์-อาทิตย์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396310 02-8396311
- วันจันทร์-ศุกร์ เวลา 08.00-18.00 น.
- วันเสาร์ เวลา 08.00-11.00 น.
(เว้นวันหยุดนักขัตฤกษ์)
ให้บริการ
1. กรณี "มีใบสรุปประวัติจากโรงพยาบาลที่เคยรับการรักษาที่ออกโดยแพทย์ เท่านั้น" สามารถติดต่อที่แผนกเพื่อทำนัดหมาย (กรณีมีใบสรุปประวัติการรักษาจากรพ.เดิมที่ออกโดยแพทย์ "ให้นำมาด้วย")
2. กรณี "ไม่เคยตรวจวินิจฉัยอาการจากแพทย์ทั่วไปหรือแพทย์เฉพาะทาง" ผู้ป่วยต้องได้รับการตรวจประเมินอาการที่แผนกอื่นของโรงพยาบาลรามาธิบดีจักรีนฤบดินทร์เพื่อให้แพทย์พิจารณาถึงความจำเป็นในการรักษาด้านเวชศาสตร์ฟื้นฟูและส่งปรึกษามาที่แผนกเพื่อนัดหมายพบแพทย์เวชศาสตร์ฟื้นฟูต่อไป
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันศุกร์
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
ร้านยาร่มโพธิ์เภสัช โทร 062-3987423 เวลาเปิด-ปิด อา-ศ : 10.00-21.30 น. เสา : 17.00-21.30 น.
201 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแฟลต 17
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
202 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนทองคำอุปถัมภ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
203 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนนวมประดิษฐ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
204 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านเนียมกล่ำสามัคคี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
205 ศูนย์พัฒนาเด็กก่อนวัยเรียนจันทคุณาภรณ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
206 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนราษฎร์นิมิตสัมพันธ์(ซารีฟะห์อุทิศ)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
207 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนซอยสุพรรณิการ์ 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
208 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนข้างวัดสุคันธาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
209 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพล นปอ.พื้นที่เกียกกาย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
210 ศูนย์พัฒนาเด็กก่อนวัยเรียนในวัดแก้วฟ้าจุฬามณี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
211 ศูนย์พัฒนาเด็กก่อนวัยเรียนกรมโยธาทหารบก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
212 ศูนย์พัฒนาเด็กก่อนวัยเรียนในอาคารสงเคราะห์ดินแดง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
213 ศูนย์พัฒนาเด็กก่อนวัยเรียนกองพลทหารม้าที่ 2 รักษาพระองค์(ชุมชนสนามเป้า)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
214 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนทับแก้ว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
215 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนทองใบ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
216 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดบางนาใน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
217 ศูนย์พัฒนาเด็กก่อนวัยเรียนดวงประทีป
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
218 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาเด็กรวมน้ำใจ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
219 ศูนย์พัฒนาเด็กก่อนวัยเรียนในอาคารสงเคราะห์บางคอแหลม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
220 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดสุทธาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
221 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดวิมุติยาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
222 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดครุฑ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
223 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดหิรัญรูจี (วัดน้อย)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
224 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบ้านบางมด
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
225 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดยายร่ม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
226 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดศิริพงษ์ธรรมนิมิต
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
227 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์รามอินทรา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
228 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดพรหมรังษี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
229 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดสีกัน (พุทธสยาม)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
230 ศูนย์เด็กปฐมวัย นปอ. ประจำพื้นที่สีกัน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
231 ศูนย์พัฒนาเด็ก่อนวัยเรียนชุมชนปิ่นเจริญ 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
232 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์ลาดพร้าว 71
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
233 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดลาดพร้าว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
234 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดศรีบุญเรือง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
235 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสามัคคีพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
236 ศูนย์อบรมเด็กก่อนเณฑ์ในวัดนวลจันทร์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
237 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดบางเตย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
238 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์บึงกุ่ม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
239 ศูนย์พัฒนาเด็กก่อนวัยเรียนแหลมทองพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
240 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเอื้ออารีย์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
241 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแสงธรรมคลองมณี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
242 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนแผ่นดินทองวัดลำผักชี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
243 ศูนย์สงเคราะห์เด็กในแหล่งก่อสร้างวรารมย์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
244 ศูนย์พัฒนาเด็กก่อนวัยเรียนลำสลิดทองพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
245 ศูนย์พัฒนาเด็กก่อนวัยเรียนมัสยิดดารุ้ลมูกร็อดรอบิน(ลำหิน)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
246 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพระยาสุเรนทร์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
247 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนนูรุ้ลอิสลาม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
248 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุนสุเหร่าบ้านเกาะ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
249 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดแสนสุข
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
250 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดบำเพ็ญเหนือ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
5. Health tech Touch building (สถานีสุขภาพดี)
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ รพ.กลาง สาขาอาคารทัช บิลดิ้ง พระราม 9 ซอย 7 เปิดทุกวันจันทร์-ศุกร์ เวลา 8:00 - 20:00 น. บริการตรวจ รักษาโดยแพทย์ทางไกล พร้อมรับยา คัดกรองประเมินความเสี่ยงสุขภาพเบื้องต้น ฟรี เจาะเลือดตรวจแลป
รศ. ดร.ชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร กล่าวถึงความสำคัญ ของการพัฒนาการทำงานในรูปแบบแพลตฟอร์ม (Platform) เพราะสามารถเพิ่มประสิทธิ ภาพในการทำงานลดขั้นตอนที่ไม่จำเป็นลงได้ พร้อมทั้งยกตัวอย่างการที่กรุงเทพมหานคร ได้นำแพลตฟอร์มมาใช้ในการจัดการเรื่องร้องเรียน “คนมักจะร้องเรียน นอกเวลาราชการ ซึ่งมีมากถึง 60% ดังนั้นเป็นการดีที่คณะแพทย์ได้พัฒนาแพลตฟอร์มนี้ขึ้นมา เพราะเป็น การรองรับการเรียนตามอัธยาศัย” ซึ่งจะนำไปสู่การพัฒนาระบบสาธารณสุข และการ ให้บริการทางการแพทย์ ที่ทันสมัยต่อประชาชนในเมืองหลวง และการมีส่วนช่วย สนับสนุนน วัตกรรมใหม่ๆ ได้อีกด้วย
ค่ายรากแก้วเป็นค่ายที่ “ลงตัว” ที่สุด - น้องจิมมี่
น้องจิมมี่ เป็นหนึ่งในเยาวชนที่เข้าร่วมค่ายอีกเสียงที่ยืนยันว่าค่ายรากแก้วเป็นค่ายที่ “ลงตัว” ที่สุด โดยเมื่อถูกถามถึงกิจกรรมที่ชอบ น้องจิมมี่ตอบด้วยเสียงชัดเจนอย่างไม่ลังเลว่า “ชอบทั้งค่ายครับ แต่สิ่งที่เหนือความคาดหมายเลยคือการเรียนรู้เรื่องการลดการปล่อยคาร์บอนที่น่าสนใจกว่าที่คิดไว้มากและเห็นได้อย่างชัดเจนว่าเกี่ยวข้องกับการใช้ชีวิตประจำวันของเราจริงๆ หรือกระทั่งกิจกรรมเล่นเกม พี่ๆ ได้ทำให้เห็นว่าวิทย์-คณิตไม่ใช่แค่วิชาการ แต่มันคือหลักการที่สอนวิธีคิด การวิเคราะห์ การวางแผนที่อยู่กับเราทุกการตัดสินใจ นอกจากนี้ ก่อนเข้าค่ายผมตั้งเป้าว่าปีหน้าจะเข้าคณะวิศวะอย่างเดียว พอได้คุยกับพี่คณะอื่นๆ เราได้เติมทางเลือกใหม่ให้ตัวเองมากขึ้น ซึ่งพอจบค่าย เรายังคงติดต่อกับเพื่อนๆ พี่ๆ กันอยู่ ซึ่งเป็นความผูกพันที่ได้อะไรกลับมาที่ไม่ใช่แค่ความรู้ แต่เป็นประสบการณ์ที่หาไม่ได้จากที่ไหน”
ทั้งนี้ จะนำความรู้ที่ได้จากโครงการ
โรงเรียนสุขสันต์ รู้ทันเบาหวาน มาเผยแพร่บนเว็บไซต์ www.t2dminsulin.com/Kids/ ซึ่งพัฒนาโดยซาโนฟี่ ประเทศไทย ร่วมกับสมาคมโรคเบาหวานแห่งประเทศไทยฯ และสมาคมผู้ให้ความรู้โรคเบาหวาน เพื่อเป็นแหล่งรวบรวมความรู้เกี่ยวกับโรคเบาหวานและวิธีการดูแลตัวเองสำหรับผู้เป็นโรคเบาหวาน ที่เปิดกว้าง ทันเหตุการณ์ เข้าถึงได้ง่ายทุกที่ ทุกเวลา
เทศบาลตำบลรัษฎา กำหนดฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567
เทศบาลตำบลรัษฎา จังหวัดภูเก็ตประชาสัมพันธ์ กำหนดฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ทุกจุดให้บริการเวลา 09.30 – 16.00 น. ดังนี้
- วันที่ 3 – 5 กรกฎาคม 2567 ณ หมู่ที่ 1 สถานีตำรวจชุมชนตำบลรัษฎา
- วันที่ 8 – 9 กรกฎาคม 2567 ณ หมู่ที่ 7 สหกรณ์เครดิตยูเนี่ยนเคหะรัษฎาภูเก็ต
- วันที่ 10 – 11 กรกฎาคม 2567 ณ หมู่ที่ 3 ศาลากิ่งแก้ว ซอย 9
- วันที่ 15 – 16 กรกฎาคม 2567 ณ หมู่ที่ 2 ภูเก็ตซักรีด
- วันที่ 17 กรกฎาคม 2567 ณ หมู่ที่ 6 ซอยรัษฎารำลึก
- วันที่ 18 – 19 กรกฎาคม 2567 ณ หมู่ที่ 5 ศาลาอเนกประสงค์ ซอยพะเนียง
** พร้อมนำบัตรประชาชนมายื่นรับบริการ
สอบถามรายละเอียดเพิ่มเติมได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลรัษฎา โทร. 076525779 ถึง 85 ต่อ 114, 112
คุณฮอลลี่ เดออาร์มอนด์ (Holly DeArmond) กรรมการบริหาร Global Consortium of Entrepreneurship Centres (GCEC) แสดงความชื่นชมกรุงเทพฯ ในฐานะสถานที่จัดประชุมสุดยอดแห่งแรกในภูมิภาคเอเชียตะวันออกเฉียงใต้ของ GCEC ว่าเป็นเมืองที่มีชีวิตชีวา งดงามด้วยวัฒนธรรม และน่ารื่นรมย์ด้วยอาหารเลิศรส ซึ่งสร้างความประทับใจให้ผู้ร่วมงานที่ได้สัมผัสประเทศไทยเป็นครั้งแรก เธอกล่าวถึงการขยายตัวของ GCEC ในระดับโลก ซึ่งในปัจจุบันประกอบด้วยสมาชิก 650 คนจากกว่า 360 สถาบันทั่วโลก “ดิฉันพูดได้เลยว่านี่เป็นการประชุม GCEC ครั้งแรกที่เราให้สมาชิกนั่งรถตุ๊กตุ๊ก” คุณฮอลลี่กล่าว “การขยายฐานสมาชิกของเราให้ครอบคลุมนอกภูมิภาคอเมริกาเหนือและยุโรปตะวันตกถือเป็นสิ่งสำคัญต่อกลยุทธ์การเติบโตของเรา และการประชุมสุดยอดครั้งนี้ก็ช่วยให้ได้แนะนำ GCEC ให้ตลาดใหม่ๆ ได้รู้จัก”
กลยุทธ์การขาย
กลยุทธ์การขายและการตั้งราคา ช่วยให้มั่นใจได้ว่าผลิตภัณฑ์ยังคงอยู่ เข้าถึงได้และราคาไม่แพงสำหรับเยาวชน
- บุหรี่มวนเดี่ยว [22] ถุงนิโคติน และบุหรี่ไฟฟ้าแบบใช้ครั้งเดียวทิ้ง [23] ทำให้ผลิตภัณฑ์เหล่านี้ ซื้อหาได้ง่ายมากขึ้น เพราะราคาไม่แพงสำหรับเด็กและเยาวชน
- การห้ามขายให้กับผู้เยาว์ อาจเสี่ยงถูกละเมิดโดยผู้ขายไร้สำนึก ทั้งในร้านค้าจริง ผ่านทางอีคอมเมิร์ซ และ รูปแบบการค้าที่จำลองใกล้เคียงจริง (immersive commerce)
- บริการผ่านจัดส่ง เช่น UBER Eats ซึ่งจัดส่งบุหรี่ไฟฟ้าในแอฟริกาใต้ [24] ยิ่งช่วยให้ เยาวชนให้เข้าถึงผลิตภัณฑ์เหล่านี้ ง่ายขึ้นอีก
- มีรายงานว่า มีเด็กอายุต่ำกว่า 18 ปี ขายผลิตภัณฑ์ยาสูบและนิโคติน หรือเสนอตัวอย่างฟรี ในหลากหลายประเทศ ใน 87 ประเทศ ที่เข้าร่วมการสำรวจยาสูบของเยาวชนทั่วโลก ระหว่างปี 2014 ถึง 2018 แต่ละประเทศต่างรายงานว่า ในช่วง 0.4% และ 22.7% ของเด็กอายุ 13–15 ปี มีตัวแทนบริษัทยาสูบ เสนอให้ผลิตภัณฑ์ยาสูบฟรี [25]
ศูนย์พักพิงสุนัขและแมวจรจัด ทัพทัน อุทัยธานี
ศูนย์พักพิงสุนัขและแมวจรจัด ทัพทัน อุทัยธานี เป็นหน่วยงานที่อยู่ในความรับผิดชอบของ สำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานคร ตั้งอยู่ที่ หมู่ 2 ต.โคกหม้อ อ.ทัพทัน จ.อุทัยธานี มีขนาดพื้นที่ 200 ไร่ ประกอบด้วย คอกสุนัข 16 โดม รองรับได้โดมละ 500 ตัว รวม 8,000 ตัว ปัจจุบันมีสุนัขอยู่ 4,871 ตัว ศูนย์แห่งนี้จะให้ที่พักพิงสุนัขจรจัดจากกรุงเทพมหานครจนหมดอายุขัย พร้อมทั้งดูแลและฟื้นฟูสุขภาพสุนัขภายในศูนย์ฯ ตลอดจนส่งเสริมให้มีผู้รับสุนัขไปอุปการะเลี้ยงดูต่อไป
- ศูนย์พักพิงสุนัขจรจัด เปิดโอกาสให้ผู้ที่สนใจอุปการะสุนัข สามารถนำไปเลี้ยงได้ เอกสารที่ผู้อุปการะต้องเตรียมมารับสุนัขไปเลี้ยงดู คือ สำเนาบัตรประชาชน และสำเนาทะเบียนบ้าน และจะมีการซักถามผู้เลี้ยงต่างๆ รวมถึงพื้นที่บริเวณบ้านของผู้เลี้ยง
- สามารถตามหรือสอบถามเพิ่มได้ที่ โทร 02-245-3540
- แผนที่พิกัด ศูนย์ทัพทัน อุทัยธานี
โดยนอกจากจะช่วยให้ประชาชนในโครงการได้รับการประเมินสภาพปอดจากภัยสุขภาพฝุ่นจิ๋วแล้ว ยังเป็นประโยชน์ต่อยอดสู่การขับเคลื่อนและพัฒนานโยบายทางด้านการจัดการมลพิษของประเทศชาติต่อไป โดยประชาชนกลุ่มเป้าหมายที่สามารถเข้าร่วมโครงการ ฯ จะต้องอยู่ในช่วงอายุ 20-60 ปี มีพื้นที่พักอาศัยและพื้นที่ทำงานในเขตกรุงเทพมหานคร หรือ ปริมณฑล ไม่อยู่ในระหว่างการตั้งครรภ์ หรือ มีความเสี่ยงต่อการตั้งครรภ์ ไม่มีประวัติการสูบบุหรี่ ไม่เคยได้รับการวินิจฉัยว่าเป็นโรคเกี่ยวกับปอด เช่น โรคมะเร็งปอด วัณโรคปอด โรคปอดอักเสบ โรคถุงลมโป่งพอง เป็นต้น ไม่มีประวัติการติดเชื้อไวรัสโคโรนา ๒๐๑๙ ที่ลงปอด (Pneumonia COVID-19) ไม่เคยมีประวัติการผ่าตัดนำเนื้อปอดออก (Lobectomy, Pneumonectomy) โดยรถเอกซเรย์คอมพิวเตอร์มีจุดจอดให้บริการอยู่ที่ CRA HALL อาคารสำนักงานราชวิทยาลัยจุฬาภรณ์ ถนนแจ้งวัฒนะ
นวัตกรรมรถเอกซเรย์คอมพิวเตอร์พร้อมด้วยเทคโนโลยี AI
นวัตกรรมรถเอกซเรย์คอมพิวเตอร์พร้อมด้วยเทคโนโลยี AI โดย ศ.พญ.จิรพร เหล่าธรรมทัศน์ คณบดีคณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์ และ อ.ดร.วิทยา สังขะรัตน์ รองคณบดีด้านวิจัยนวัตกรรม เทคโนโลยีสารสนเทศและวิเทศสัมพันธ์ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ ราชวิทยาลัยจุฬาภรณ์ ซึ่งเป็นนวัตกรรมที่ออกแบบโดยคนไทยในช่วงสถานการณ์การระบาดของไวรัสโควิด-19
จึงเหมาะใช้คัดกรองรอยโรคในปอดโดยนำมาใช้ดูแลสุขภาพปอดของคนไทยในพื้นที่กรุงเทพมหานครและปริมณฑลที่ได้รับผลกระทบด้านมลภาวะทางอากาศสูงของฝุ่นละอองจิ๋ว PM 2.5 เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ จำนวน 720 ราย เพื่อให้ประชาชนได้เข้าถึงการตรวจคัดกรองสภาวะปอดด้วยเครื่องเอกซเรย์คอมพิวเตอร์ความเร็วสูงแบบใช้ปริมาณรังสีต่ำพร้อมด้วยระบบการจัดท่าและการสแกนอัตโนมัติ วินิจฉัยรอยโรคร่วมกับระบบเทคโนโลยีปัญญาประดิษฐ์ภายในรถที่มีความปลอดภัยสูงสุดจากการติดเชื้อหรือแพร่เชื้อโรคด้วยระบบกรองอากาศความเร็วสูงและแสงยูวี 222 นาโนเมตร
มีวิธีการวินิจฉัยโรคอย่างไร
แพทย์ที่ทำการตรวจรักษาผู้ป่วยที่สงสัยติดเชื้อ ไข้หวัดนก จะเก็บสารคัดหลั่ง เช่น เสมหะ น้ำมูก จาก ทางเดินหายใจและอุจจาระ ส่งตรวจทางห้องปฏิบัติการ
5. Nano Cool Paint: สีทาบ้าน ลดอุณหภูมิ
ร้อนแค่ไหนก็เอาอยู่! กับ Nano Cool Paint สีทาบ้านสุดล้ำ โดย ดร.ศรัณย์ อธิการยานันท์ ศูนย์นาโนเทคโนโลยีแห่งชาติ (NANOTEC) สวทช. ที่ช่วยลดอุณหภูมิ ลดค่าไฟ และเป็นมิตรต่อสิ่งแวดล้อม
ตารางแพทย์ผู้ป่วยนอก วันศุกร์ โรงพยาบาลชลบุรี
รักปอด เลิกพอด! สุขภาพกายใจแข็งแรง
ศูนย์สนับสนุนบริการสุขภาพที่ 5 ราชบุรี
ศูนย์สนับสนุนบริการสุขภาพที่ 5 (Regional Health Service Support Center 5) มีพื้นที่รับผิดชอบ จำนวน 8 จังหวัด ได้แก่ เพชรบุรี สมุทรสาคร สมุทรสงคราม ประจวบคีรีขันธ์ สุพรรณบุรี นครปฐม ราชบุรี กาญจนบุรี
เดิมชื่อ..."หน่วยยานพาหนะภาคกลาง" สังกัดกองยานพาหนะกรมอนามัยกระทรวงสาธารณสุขมีหน้าที่ และความรับผิดชอบในการซ่อมบำรุงยานพาหนะของหน่วยราชการสังกัดกระทรวงสาธารณสุขในเขตภาคกลาง และภาคใต้ เริ่มปฏิบัติงานครั้งแรกเมื่อปี พ.ศ.2510 มาในปี พ.ศ. 2556 เปลี่ยนชื่อเป็น สำนักงานสนับสนุนบริการสุขภาพเขต 5 จังหวัดราชบุรี พ.ศ. 2562 เปลี่ยนชื่อเป็น ศูนย์สนับสนุนบริการสุขภาพที่ 5
- 407 ยุติธรรม ตำบล หน้าเมือง อำเภอเมืองราชบุรี ราชบุรี 70000
- โโทรศัพท์ : 032-337258 FAX : 032-321863
- email : hss05rb@gmail.com *สำหรับงานด้าน ไอที และงานทั่วไป center05@hss.mail.go.th *สำหรับงานจัดซื้อจัดจ้าง และ E-Bidding saraban-hss5@hss.mail.go.th *สำหรับงานสารบรรณอิเล็กทรอนิกส์ และงานธุรการ
- Google map
- Facebook
- Website Website
การแพทย์แผนดั้งเดิม (Traditional Medicine)
การแพทย์แผนดั้งเดิมที่ได้รับการยอมรับในระดับสากลและได้รับความนิยมมาก คือ การแพทย์แผนจีน (Traditional Chinese Medicine; TCM) ที่มุ่งเน้นการเข้าถึงสาเหตุความเจ็บป่วยโดยการรักษาสมดุลร่างกายโดยรวม และให้การรักษาแบบเติมเต็มส่วนขาดที่ร่างกายต้องการอย่างชัดเจนตามสาเหตุของอาการเจ็บป่วยอย่างจำเพาะเจาะจง การแพทย์แผนจีนที่ได้รับความนิยมมาก ได้แก่ การฝัง เข็ม การรมยา การครอบแก้ว การรักษาด้วย สมุนไพร เป็นต้น นอกจากนี้ การแพทย์แผนอินเดียอายุรเวท ก็เป็นการแพทย์แผนดั้งเดิมที่ ได้รับความนิยมเช่นกัน
อนาคตสตริปเทส อุปกรณ์อย่างง่ายช่วยคัดกรองโรค
ดร.สุดเขตและคณะผู้วิจัยจากสถาบันวิจัยเทคโนโลยีชีวภาพและวิศวกรรมพันธุศาสตร์ จุฬาฯ ยังคงมุ่งมั่นพัฒนาแพลตฟอร์มในรูปแบบสตริปเทสร่วมกับเคมีไฟฟ้าต่อไปเพื่อใช้ในทางการแพทย์ โดยปัจจุบันกำลังศึกษาวิจัยและพัฒนาสตริปเทสเคมีไฟฟ้าในการตรวจคัดกรองกามโรคในเบื้องต้น ซึ่งเป็นโรคที่วัยรุ่นไทยมีความเสี่ยงในการเกิดโรคและไม่กล้าไปปรึกษาแพทย์ รวมทั้งสตริปเทสร่วมกับเคมีไฟฟ้าในการตรวจคัดกรองผู้มีความเสี่ยงสูงในการเป็นโรคไข้หูดับจากการรับประทานเนื้อหมูดิบ เป็นต้น
ผู้ประกอบการที่สนใจจะร่วมพัฒนาสตริปเทสเคมีไฟฟ้าเพื่อใช้คัดกรองปริมาณ THC เพื่อการผลิตในเชิงพาณิชย์ สามารถติดต่อ ดร.สุดเขต ไชโย สถาบันวิจัยเทคโนโลยีชีวภาพและวิศวกรรมพันธุศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย โทร.0-2218-8056 E-mail : sudkate.c@chula.ac.th
5. เทคโนโลยีอุปกรณ์สวมใส่ติดเอไอ (AI Wearable Technology)
ปัจจุบันเริ่มมีอุปกรณ์สวมใส่บนร่างกายที่ใช้เทคโนโลยี AI เพิ่มมากขึ้น ทำให้สามารถเก็บข้อมูลแบบเรียลไทม์ผ่านเซนเซอร์แบบไบโอเมทริก (biometric sensor) ซึ่งเมื่อนำข้อมูลดังกล่าวไปวิเคราะห์ด้วยอัลกอริทึมแบบ deep learning ก็ทำให้ได้ข้อมูลเชิงลึก ข้อเสนอแนะ และคำแนะนำต่าง ๆ ที่แม่นยำแก่ผู้ใช้งานได้ โดยอุปกรณ์สวมใส่ AI รุ่นใหม่ ๆ จะทำงานรวดเร็วขึ้น และทำงานได้อย่างแม่นยำเที่ยงตรงมากขึ้น
ตลาดผลิตภัณฑ์ AI Wearable Devices ทั่วโลกในปี 2022 มีมูลค่าเกือบ 8 แสนล้านบาท และคาดว่าช่วงปี 2023-2030 จะขยายตัวราว 30% สำหรับประเทศไทย ปัจจุบันคนไทยใส่สมาร์ตวอตช์ราว 19% หรือเกือบ 1 ใน 5 และตลาดในประเทศเติบโตราว 23% ต่อปี ซึ่งอาจเป็นผลมาจากการประยุกต์ใช้เทคโนโลยีใหม่ เช่น smart phone 5G, Internet of Things (IoT), AI ที่สอดรับกับการใช้งาน AI Wearable Devices ประกอบกับกระแสการใส่ใจสุขภาพและการเข้าสู่สังคมผู้สูงอายุ
โครงการที่ ๕ โครงการพยาบาลศาสตร์อาสาเจ้าฟ้าจุฬาภรณ์ เรื่อง การเสริมสร้างสุขภาพและการดูแลตนเองของผู้สูงอายุในชุมชน
โครงการที่ ๕ โครงการพยาบาลศาสตร์อาสาเจ้าฟ้าจุฬาภรณ์ เรื่อง การเสริมสร้างสุขภาพและการดูแลตนเองของผู้สูงอายุในชุมชน ดำเนินโครงการโดย วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ราชวิทยาลัยจุฬาภรณ์ ส่งเสริมสุขภาพและคุณภาพชีวิตให้กับผู้สูงอายุในชุมชนเมือง ให้ผู้สูงอายุมีความรู้ ความเข้าใจ และเตรียมพร้อมในการดูแลตนเอง เพื่อสร้างชุมชนผู้สูงอายุที่เข้มแข็งและมีสุขภาวะที่ดีอย่างยั่งยืน
โดยวิทยาลัยพยาบาลศาสตร์อัครราชกุมารีมุ่งเน้นการสร้างพยาบาลวิชาชีพด้วยหลักสูตรการจัดการเรียนการสอนที่มอบประสบการณ์เรียนรู้แบบบูรณาการองค์ความรู้และการปฏิบัติการพยาบาล มุ่งสร้างสรรค์ผลงานวิจัยและนวัตกรรมเพื่อส่งเสริมศักยภาพของผู้เรียน โดยโครงการนอกจากจะช่วยส่งเสริมสุขภาพและคุณภาพชีวิตให้กับผู้สูงอายุในชุมชนเมือง สร้างเครือข่ายชุมชนผู้สูงอายุที่เข้มแข็งและมีสุขภาวะที่ดีอย่างยั่งยืนแล้วยังช่วยส่งเสริมให้นักศึกษาพยาบาลได้มีโอกาสปฏิบัติกิจกรรมเสริมหลักสูตรเพื่อพัฒนาทักษะที่จำเป็นในศตวรรษที่ ๒๑ ตามอัตลักษณ์ของนักศึกษาวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี คือ รอบรู้ พัฒนา จิตอาสา นำพาความสุข และสืบสานพระราชปณิธานของพระองค์ในการบำบัดทุกข์และบำรุงสุขให้แก่ประชาชนและพัฒนาประเทศชาติสืบไป
5.GENDER EQUALITY ความเท่าเทียมทางเพศ
การยุติการเลือกปฏิบัติต่อสตรีและเด็กหญิงไม่เพียงแต่เป็นสิทธิมนุษยชนขั้นพื้นฐานเท่านั้น แต่ยังมีความสำคัญต่ออนาคตที่ยั่งยืนอีกด้วย โดยได้รับการพิสูจน์แล้วว่าการเสริมพลังให้สตรีและเด็กหญิงช่วยให้เศรษฐกิจเติบโตและพัฒนาได้
UNDP ได้ทำให้ความเท่าเทียมทางเพศเป็นศูนย์กลางของงาน และเราได้เห็นความก้าวหน้าอย่างน่าทึ่งในช่วง 20 ปีที่ผ่านมา มีเด็กผู้หญิงเข้าเรียนในโรงเรียนมากกว่าเมื่อ 15 ปีที่แล้ว และภูมิภาคส่วนใหญ่บรรลุความเท่าเทียมทางเพศในการศึกษาระดับประถมศึกษา
แม้ว่าตลาดแรงงานจะมีสตรีมากกว่าที่เคย แต่ก็ยังมีความไม่เท่าเทียมกันอย่างมากในบางภูมิภาค โดยสตรีถูกปฏิเสธสิทธิในการทำงานเช่นเดียวกับบุรุษอย่างเป็นระบบ ความรุนแรงทางเพศและการแสวงประโยชน์ การแบ่งงานดูแลและงานบ้านที่ไม่ได้รับค่าตอบแทนอย่างไม่เท่าเทียมกัน และการเลือกปฏิบัติในตำแหน่งราชการยังคงเป็นอุปสรรคสำคัญ การเปลี่ยนแปลงสภาพภูมิอากาศและภัยพิบัติยังคงส่งผลกระทบต่อสตรีและเด็กอย่างไม่สมส่วน เช่นเดียวกับความขัดแย้งและการอพยพ
การให้สิทธิเท่าเทียมกันแก่สตรีในด้านที่ดินและทรัพย์สิน สุขภาพทางเพศและการสืบพันธุ์ ตลอดจนเทคโนโลยีและอินเทอร์เน็ต ถือเป็นสิ่งสำคัญ ปัจจุบันมีผู้หญิงอยู่ในตำแหน่งสาธารณะมากกว่าที่เคย แต่การส่งเสริมให้ผู้นำหญิงมีมากขึ้นจะช่วยให้เกิดความเท่าเทียมทางเพศมากขึ้น
รายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือนพฤษภาคม 2567
คณะรัฐมนตรีรับทราบรายงานภาวะเศรษฐกิจอุตสาหกรรมประจำเดือน
พฤษภาคม 2567 ตามที่กระทรวงอุตสาหกรรมเสนอ
สาระสำคัญและข้อเท็จจริง
ภาวะเศรษฐกิจอุตสาหกรรมเดือนพฤษภาคม 2567 เมื่อพิจารณาจากดัชนีผลผลิตอุตสาหกรรม (MPI) หดตัวร้อยละ 1.5 จากช่วงเดียวกันของปีก่อน ปัจจัยหลักมาจากการผลิตรถยนต์ลดลงต่อเนื่อง มาจากตลาดผู้บริโภคภายในประเทศลดลง ปัญหาสภาพคล่องในการใช้จ่ายภาคครัวเรือนค่าครองชีพสูงอย่างต่อเนื่อง รวมถึงความเข้มงวดของสถาบันการเงินในการอนุมัติสินเชื่อรถยนต์ อย่างไรก็ดี ภาคการท่องเที่ยวยังคงขยายตัวดีต่อเนื่อง รวมทั้งอุตสาหกรรมที่เกี่ยวข้องกับการท่องเที่ยวได้รับอานิสงส์ดีต่อเนื่อง เช่น อาหารและเครื่องดื่ม การกลั่นน้ำมัน เป็นต้น
อุตสาหกรรมสำคัญที่ส่งผลให้ MPI เดือนพฤษภาคม 2567 หดตัวเมื่อเทียบกับช่วงเดียวกันของปีก่อน คือ
1. ยานยนต์ หดตัวร้อยละ 14.22 จากรถบรรทุกปิคอัพ รถยนต์นั่งขนาดเล็ก และเครื่องยนต์ดีเซล ตามการหดตัวของตลาดภายในประเทศ ผู้บริโภคมีกำลังลังซื้อลดลง และสถาบันการเงินยังคงเข้มงวดในการอนุมัติสินเชื่อ
2. ชิ้นส่วนและแผ่นวงจงจรอิเล็กทรอนิกส์ หดตัวร้อยละ 17.16 จาก Integrated Circuits (IC) เป็นหลัก ตามการชะลอตัวของตลาดอิเล็กทรอนิกส์โลก และผู้ประกอบการผลิตสินค้าที่มีมูลค่าต่อหน่วยสูงขึ้น ส่งผลให้มีปริมาณการผลิตลดลง
3. ผลิตภัณฑ์คอนกรีต ปูนซีเมนต์ และปูนปลาสเตอร์ หดตัวร้อยละ 11.97 จากเสาเข็มคอนกรีต พื้นสำเร็จรูปคอนกรีต และคอนกรีตผสมเสร็จ เนื่องจากลูกค้ากลุ่มโมเดิร์นเทรดและตัวแทนจำหน่ายยังมีสินค้าคงคลังอยู่ในระดับสูง จึงชะลอคำสั่งซื้อ
อุตสาหกรรมสำคัญที่ยังขยายตัวในเดือนพฤษภาคม 2567 เมื่อเทียบกับเดือนเดียวกันของปีก่อน
1. น้ำมันปาล์ม ขยายตัวร้อยละ 19.88 จากน้ำมันปาล์มดิบและน้ำมันปาล์มบริสุทธิ์เป็นหลัก ตามปริมาณผลปาล์มเข้าสู่โรงงานเพิ่มขึ้น หลังปาล์มสุกไวจากอากาศร้อนจัดในช่วงก่อนหน้า
2. อาหารสัตว์สำเร็จรูป ขยายตัวร้อยละ 10.55 ตามคำสั่งซื้อที่เพิ่มขึ้นจากลูกค้าตะวันออกกลาง บาห์เรน ญี่ปุ่น และการรับจ้างผลิตให้กับลูกค้าต่างประเทศ
3. เหล็กและเหล็กกล้าขั้นมูลฐาน ขยายตัวร้อยละ 8.18 จากเหล็กแผ่นรีดร้อนและเหล็กเส้นข้ออ้อยเป็นหลัก เนื่องจากจีนอยู่ระหว่างการพิจารณาไต่สวนผู้ผลิตเหล็กบางรายที่เลี่ยงชำระภาษีส่งออก จีนจึงชะลอการส่งออกเหล็ก
การวิจัยส่วนที่ 3 : โครงการวิจัยย่อยที่ 5 LINK
โครงการนี้มีวัตถุประสงค์ดังนี้ (1) เพื่อการประเมินสถานะทางการเงิน/งบประมาณของ รพ.สต. ที่ได้รับการถ่ายโอน (2) เพื่อเปรียบเทียบสถานะทางการเงินของ รพ.สต. ระหว่างก่อนการถ่ายโอนและหลังการ ถ่ายโอนว่าเป็นอย่างไร (ดีขึ้นหรือแย่ลง) (3) เพื่อประเมินสถานะระบบการเงินของ รพ.สต. หลังการถ่ายโอน ว่ามีความสอดคล้องกับภารกิจความรับผิดชอบของ รพ.สต. หรือไม่ (4) เพื่อประเมินสถานะทางด้านโอกาสและ ปัญหาอุปสรรคทางด้านการเงินของ รพ.สต. ในปัจจุบัน (ณ 6 เดือนแรกของปีงบประมาณ 2566) และ (5) เพื่อ ประเมินสถานะทางการเงินของ รพ.สต. ในการดำเนินการให้บรรลุเป้าหมายตามแผนยุทธศาสตร์ 20 ปี ด้าน สาธารณสุข หรือไม่นั้น
คณะวิจัยจึงได้มีการทบทวนวรรณกรรม ประกอบด้วย แนวคิดการกระจายอำนาจสู่ท้องถิ่นในมิติ สุขภาพ แนวคิดของ WHO ในการขับเคลื่อนสู่สุขภาวะโดยยุทธศาสตร์สุขภาพปฐมภูมิแนวคิดของ WHO ในการขับเคลื่อนการเงินเพื่อสุขภาพ และงานวิจัยที่เกี่ยวข้อง
ผลของการทบทวนวรรณกรรมนำไปสู่โจทย์คำถามในการวิจัย 5 ข้อ คือ (1) โครงสร้างรายได้ของ รพ.สต. ทั้งก่อนและหลังการถ่ายโอนเป็นอย่างไร แตกต่างกันอย่างไร และมีข้อเสนอแนะอย่างไรบ้าง (2) โครงสร้างรายจ่ายของ รพ.สต. ทั้งก่อนและหลังการถ่ายโอนเป็นอย่างไร เม็ดเงินส่วนใหญ่ถูกจ่ายไปในทางใด (3) ค่าใช้จ่ายเฉลี่ยต่อหัวของ รพ.สต. เป็นอย่างไร (4) โอกาสและปัญหาอุปสรรคทางด้านการเงินของ รพ.สต. เป็นอย่างไร และหาแนวทางในการพัฒนารายได้และการจัดการรายได้ของ รพ.สต. ควรเป็นอย่างไร [
รายงานฉบับเต็ม pdf]
ส่วนวิธีวิทยาการวิจัย คณะวิจัยได้เลือกใช้วิธีการวิจัยประเมินผลแบบผสมผสาน (Mixed Methodology) โดยขั้นตอนแรกใช้วิธีวิจัยเชิงคุณภาพ ทำการรวบรวมข้อมูลโดยการสำรวจเชิงลึกของ เหตุการณ์และครอบคลุมประเด็นที่ต้องการประเมิน หลังจากนั้นนำข้อมูลการวิเคราะห์ถอดรหัสสำคัญ แล้ว อธิบายเรื่องราวการค้นพบ พร้อมทั้งถอดข้อค้นพบที่สำคัญออกมา เพื่อตรวจสอบความเป็นทั่วไปของข้อมูลนั้น ให้ชัดเจนขึ้น โดยใช้วิธีวิจัยเชิงปริมาณ
5.Digital trust and cybersecurity - ความน่าเชื่อถือทางดิจิทัลและความปลอดภัยทางไซเบอร์
แนวโน้มความเชื่อมั่นทางดิจิทัลและความปลอดภัยทางไซเบอร์ครอบคลุมถึงเทคโนโลยีเบื้องหลังสถาปัตยกรรมความเชื่อมั่นและตัวตนดิจิทัล ความปลอดภัยทางไซเบอร์ และ Web3 เทคโนโลยีเหล่านี้ทำให้องค์กรสามารถสร้าง ขยายขนาด และรักษาความเชื่อมั่นของผู้มีส่วนได้ส่วนเสียได้
จำนวนผู้ลงทะเบียนรอรับอวัยวะ ณ 31 มีนาคม 2567
นพ. ชนินทร์ ลิ่มวงศ์ แพทย์เฉพาะทางด้านเวชพันธุศาสตร์ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า โรงพยาบาลบำรุงราษฎร์ตระหนักถึงความสำคัญของการบริบาลทางการแพทย์ด้วยการใช้เทคโนโลยีที่ทันสมัย ซึ่งสามารถตรวจวิเคราะห์ถอดรหัสยีนได้อย่างแม่นยำ เพื่อบ่งบอกแนวทางการรักษาที่เหมาะสมกับผู้ป่วยแต่ละราย โดยเฉพาะการรักษาโรคซับซ้อน และเพื่อประเมินความเสี่ยงของการเกิดโรคบางชนิดที่สามารถส่งต่อจากรุ่นสู่รุ่น เช่น โรคมะเร็ง โรคหัวใจและหลอดเลือด รวมถึงโรคอื่น ๆ ที่มีสาเหตุจากพันธุกรรมและถ่ายทอดทางพันธุกรรม ในปัจจุบันมีการตรวจรหัสพันธุกรรมเชิงลึก โดยการถอดรหัสพันธุกรรมของยีนทั้งหมดในมนุษย์ (Whole Exome Sequencing) ที่ช่วยค้นหายีนในโรคทางพันธุกรรมที่ไม่สามารถคาดเดาได้ ซึ่งเหมาะสำหรับผู้ป่วยที่เป็นโรคหายาก
มูลนิธิรามาธิบดีฯ มุ่งมั่นในการสนับสนุนการผลิตบุคลากรทางการแพทย์ที่มีศักยภาพและความเชี่ยวชาญเพื่อเข้าสู่ระบบสาธารณสุขของประเทศไทยให้มีจำนวนเพียงพอพร้อมรองรับการก้าวเข้าสู่สังคมสูงอายุในอนาคตอันใกล้ ยกระดับการรักษาและให้บริการทางการแพทย์ และเป็นที่พึ่งของประชาชนต่อไป ขอเชิญชวนประชาชนผู้มีจิตศรัทธาร่วมบริจาคเพื่อมอบอนาคตทางการศึกษาได้ที่ มูลนิธิรามาธิบดีฯ
www.ramafoundation.or.th โครงการทุนการศึกษารามาธิบดี 10. ผู้ป่วยสามารถเข้าถึงข้อมูลการรักษาได้ด้วยตัวเอง (
Patient portal) เป็นการเพิ่มประสิทธิภาพการบริการสุขภาพ ซึ่งจะทำให้ผู้ป่วยได้ทราบข้อมูลการรักษาต่างๆ เช่นผลแล็บ การใช้ยา ภูมิแพ้ ประวัติส่วนตัว ประวัติการรักษา การรักษาล่าสุด รวมถึงการสร้างตารางนัดด้วยตัวเอง
ศูนย์บริการสาธารณสุข15 ลาดพร้าว ฉีดวัคซีนสุนัขบ้า ฟรี 2-13 กันยายน 2567
ศูนย์บริการสาธารณสุข 15 ลาดพร้าว จัดหน่วยบริการฉีดวัคซีนป้องกันพิษสุนัขบ้าครั้งที่ 2 ประจำปี 2567 ตามสถานที่ต่างๆ หากมีข้อสงสัยสามารถสอบถามได้ที่ โทร 02-5418380 02-9399538 (วันเวลาราชการ) เพจ
Facebook ศูนย์บริการสาธารณสุข 15 ลาดพร้าว คลินิกวัณโรค
คลินิกวัณโรค บริการตรวจวินิจฉัยผู้ที่สงสัยว่าจะป่วยเป็นวัณโรค และผุ้ที่เป็นกลุ่มเสี่ยงป่วยที่ให้การดูแลรักษาผู้ป่วยวัณโรค มีบริการเอกซเรย์ทรวงอก แก่ผู้มีอาการน่าสงสัยว่าป่วย เช่น มีอาการไอเรื้อรังนานเกิน 2 สัปดาห์ หรือกลุ่มเสี่ยง เช่น ผู้ป่วยเบาหวาน ผู้สูงอายุ ผู้ใกล้ชิดผู้ป่วย
วัน - เวลาทำการ จันทร์ - ศุกร์ 08.00 - 16.00
แพทย์เฉพาะทาง เฉพาะ วันพฤหัสบดี 08.00 - 12.00 น.
โทรศัพท์ 02-2842331 ต่อ 203
โปรแกรมบริหารจัดการคลินิก DelHos Cloud
DelHos โปรแกรมบริหารจัดการคลินิก ที่ออกแบบเพื่อให้ใช้งานได้ง่ายและมีประสิทธิภาพ เพื่อให้งานบริการทางการแพทย์สะดวกรวดเร็ว ฟีเจอร์เด่น ได้แก่
ระบบหน้าร้าน - ระบบจัดคิวการรักษา - ระบบนัดหมายผ่าน Line OA - ระบบออกใบเสร็จออนไลน์ - ระบบพิมพ์ฉลากยา ดึงข้อมูลจากระบบ ไม่ต้องพิมพ์เองให้เสียเวลา - ระบบทำประวัติคนไข้ได้รวดเร็วและแม่นยำ ผ่านเครื่องอ่านบัตรประชาชน
ระบบบันทึกการรักษา - OPD Chart Online - ระบบบันทึกรูปการรักษา Before & After - ระบบออกใบรับรองแพทย์
ระบบหลังบ้าน - ระบบสต๊อกสินค้า - ระบบจ่ายโบนัส ค่าคอมมิชชั่น - ระบบรายงายสรุปยอดขาย
ระบบการตลาด - Dashboard ดูภาพรวมของคลินิก ที่สรุปทุกอย่างมาให้คุณแล้ว แถมออกมาในรูปแบบของกราฟที่ดูง่ายอีกด้วย แถมยังสามารถ export เป็นไฟล์ excel ที่พร้อมใช้งานต่อได้อีกด้วย
บริการหลังการขาย มี Online Support ให้บริการตลอด 7 วัน ต่อสัปดาห์
สนใจทดลองใช้งาน Demo Program ฟรี! ก่อนตัดสินใจเลือกใช้บริการ
แพ็กเกจที่เหมาะกับธุรกิจ Starter Standard Premium ราคาตั้งแต่ 1,200 - 3,190 บาท/เดือน
สอบถามเพิ่มเติมโทร 082-8897094
เทคโนโลยีหุ่นยนต์ช่วยผ่าตัด Davinci เป็นเครื่องมือช่วยเสริมการผ่าตัด ที่แพทย์มีความเชี่ยวชาญอยู่แล้ว ช่วยให้แม่นยำขึ้น ผ่านอุปกรณ์ ที่มีประสิทธิภาพสูง ได้แก่ กล้องส่องตาเลนส์คู่ กำลังขยายสูง 30 เท่า ให้ภาพเป็น 3 มิติ มองผ่านแว่นตา เห็นภาพเหมือนจริงมากที่สุด และ มือกลขนาดจิ๋ว ที่เคลื่อนไหวได้รอบทิศ เคลื่อนไหวในที่แคบได้ดี มีระบบไฟส่องนำ เมื่อปฏิบัติการภายใน
PET/CT ศูนย์วินิจฉัยและบำบัดรักษา โรงพยาบาลบำรุงราษฎร์ LINK
PET/CT ศูนย์วินิจฉัยและบำบัดรักษา โรงพยาบาลบำรุงราษฎร์ สำหรับตรวจวินิจฉัย หาโรคมะเร็งเนื้อเยื่ออ่อน มะเร็งลำไส้เล็ก มะเร็งต่อมทอนซิล มะเร็งต่อมลูกหมาก ตรวจเนื้องอก และโรคพาร์กินสัน รวมถึงการใช้ประเมินความผิดปกติของเนื้อเยื่อสมอง เช่น เนื้องอกในสมอง ความจำเสื่อม การชัก และความผิดปกติของระบบประสาทส่วนกลาง ข้อมูลเพิ่มเติมติดต่อ ศูนย์วินิจฉัยและบำบัดรักษา อาคาร B ชั้นล่าง ด้านใต้ อาคาร B ชั้น 2 ฝั่งเหนือ อาคาร A ชั้น 12 Tel: 02-0668888
นมแม่ ของขวัญล้ำค่า ในชีวิตลูก
ความรักและความอบอุ่นของผู้เป็นแม่ ไม่ว่าจะทั้งเตรียมคุณแม่ คุณแม่มือใหม่ และคุณแม่มืออาชีพ กับ น้ำนมแม่ สิ่งที่ดีที่สุดที่เขาควรได้รับ เพราะ ลูกเลือกเองไม่ได้ แต่แม่สามารถเลือกสิ่งที่ดีที่สุดให้ลูกของคุณได้
เพราะ ในน้ำนมแม่ มี สารอาหารมากกว่า 200 ชนิด มีภูมิคุ้มกันสูง เด็กทารกที่เกิดใหม่ยังมีภูมิคุ้มกันไม่สมบูรณ์ นมแม่จึงเปรียบเสมือนวัคซีนหยดแรกของชีวิตลูก
ในหัวน้ำนม หรือ น้ำนมเหลือง (โคลอสตรัม) "สามารถพบได้ใน 1 - 7 วัน แรกหลักคลอดเท่านั้น" และอุดมไปด้วยสารอาหารอย่าง คาร์โบไฮเดรต โปรตีน เกลือแร่ และวิตามิน
คุณประโยชน์จากการกินนมแม่ มีดังนี้
- ป้องกันการติดเชื้อทางเดินอาหาร
- ป้องกันการติดเชื้อทางเดินหายใจ
- ป้องกันโรคภูมิแพ้
- พัฒนาการสมองดี
จากคุณประโยชน์มากคุณค่าจากน้ำนมแม่ องค์การอนามัยโลกอย่าง WHO ได้แนะนำไว้ว่า ลูกควรได้กินนมแม่อย่างเดียว ตั้งแต่แรกเกิดถึง 6 เดือน และควรกินต่อเนื่องไปจนลูกอายุ 2 ปี หรือมากกว่านั้น ควบคู่กับอาหารตามวัย
ศูนย์ชีวาประทีบ โรงพยาบาลสิรินธร กรุงเทพมหานคร
แพทย์เตือนสุราเถื่อน (เมธานอล)
การคุ้มครองผู้บริโภค
ไตรมาสสอง ปี 2567 การร้องเรียนผ่าน สคบ. และสำนักงาน กสทช. ลดลงร้อยละ 26.5 และ 8.4 ตามลำดับ อย่างไรก็ตาม ยังต้องติดตามและให้ความสำคัญกับประเด็น การเคลมสินค้าที่บังคับผู้บริโภคจะต้องถ่ายวิดีโอขณะเปิดพัสดุฝ่ายเดียว ตลอดจน ความเสี่ยงด้านความปลอดภัยของข้อมูลส่วนบุคคลที่อาจมาจากการใช้บริการจำนำ iCloud
- การรับร้องเรียนสินค้าและบริการในไตรมาสสอง ปี 2567 ของ สคบ. มีจ านวน 5,517 เรื่อง ลดลงจากช่วงเดียวกัน ของปีก่อนร้อยละ 26.5 โดยประเด็นด้านขายตรงและตลาดแบบตรง22 มีการร้องเรียนเข้ามามากที่สุด รองลงมาเป็น ด้านฉลาก ด้านสัญญา และด้านโฆษณา ตามลำดับ ทั้งนี้ กลุ่มสินค้าและบริการที่ได้รับร้องเรียนสูงสุด คือ สินค้า ออนไลน์ 2,022 เรื่อง ส่วนใหญ่มาจากการขอเงินคืนและการไม่ได้รับความเป็นธรรมจากร้านค้า รองลงมาเป็นสินค้า กลุ่มรถยนต์ 395 เรื่อง โดยการร้องเรียนส่วนมากเป็นเรื่องการชำรุด
- ขณะที่การร้องเรียนในกิจการโทรคมนาคมของสำนักงาน กสทช. มีการร้องเรียนทั้งสิ้น 340 เรื่อง ลดลง จากไตรมาสเดียวกันของปีก่อนร้อยละ 8.4 โดยด้านที่ได้รับการร้องเรียนมากที่สุดยังคงเป็นด้านโทรศัพท์เคลื่อนที่ จำนวน 228 เรื่อง ทั้งนี้ เมื่อพิจารณาตามประเด็นปัญหา พบว่า ส่วนใหญ่มาจากการให้บริการ อาทิ การให้บริการ ที่ไม่เป็นไปตามโฆษณา การถูกเปลี่ยนแปลงเงื่อนไขการให้บริการโดยไม่ได้รับความยินยอมหรือไม่แจ้งให้ทราบ ล่วงหน้า รองลงมาเป็นคุณภาพสัญญาณ และการไม่สามารถยกเลิกบริการได้หรือยกเลิกได้แต่ต้องเสียค่าธรรมเนียม อย่างไม่เป็นธรรม เป็นต้น
ประเด็นที่ต้องติดตามและให้ความสำคัญ ดังนี้
1. การผลักภาระให้กับผู้บริโภคกรณีซื้อสินค้าออนไลน์ที่ผู้ซื้อต้องถ่าย วิดีโอขณะเปิดพัสดุ จากสถิติร้องทุกข์ของสภาองค์กรของผู้บริโภค ปี 2567 พบว่า กว่าร้อยละ 42.4 ของเรื่องร้องเรียนด้านสินค้าและบริการทั่วไป เป็นปัญหาจาก การซื้อสินค้าออนไลน์ ซึ่งมีการร้องเรียนสูงที่สุดเมื่อเทียบกับสินค้าประเภทอื่น โดยมี มูลค่าความเสียหายอยู่ที่ 27.8 ล้านบาท (ข้อมูล ณ วันที่ 15 สิงหาคม 2567) ทั้งนี้ หนึ่งในปัญหาที่ผู้บริโภคต้องเผชิญ คือ ปัญหาสินค้าชำรุด/ไม่ตรงปก/ไม่มีคุณภาพ ซึ่งร้านค้ามักไม่รับผิดชอบหากผู้บริโภคไม่มีคลิปวิดีโอขณะเปิดพัสดุ ตลอดจนมีการเก็บค่าบริการเพิ่มเติม ทั้งที่สินค้า ดังกล่าวอาจชำรุด/เสียหายก่อนถึงมือผู้บริโภค โดยปัจจุบัน สคบ. ได้ออก ประกาศคณะกรรมการว่าด้วยสัญญาเรื่อง ให้ธุรกิจการให้บริการขนส่งสินค้าโดยเรียกเก็บเงินปลายทางเป็นธุรกิจที่ควบคุมรายการในหลักฐานการรับเงิน พ.ศ. 2567 หรือที่เรียกว่า “มาตรการส่งดี” (Dee-Delivery) ซึ่งจะมีผลบังคับใช้ในวันที่ 3 ตุลาคม 2567 เป็นต้นไป เพื่อคุ้มครองการซื้อสินค้าแบบเก็บเงินปลายทางให้มีความเป็นธรรมมากขึ้น โดยผู้บริโภคสามารถเปิดดูสินค้าก่อนชำระเงิน และสามารถขอคืนสินค้า/ขอเงินคืนได้ หากสินค้าชำรุด/เสียหาย ซึ่งจะช่วยลดปัญหาสินค้าไม่ตรงปก ตลอดจนการหลอกลวงที่มาในรูปแบบเรียกเก็บปลายทางได้มากขึ้น อย่างไรก็ตาม มาตรการดังกล่าวครอบคลุม เฉพาะกรณีเก็บเงินปลายทางที่เป็นขนส่งของเอกชนเท่านั้น และไม่รวมถึงช่องทางการชำระเงินแบบอื่นที่ต้องชำระก่อนตั้งแต่มีการสั่งสินค้า ดังนั้น ผู้บริโภคควรพิจารณาเลือกซื้อสินค้าจากร้านที่มีความน่าเชื่อถือ โดยหากสินค้ามีมูลค่าสูงอาจเลือกชำระแบบปลายทาง ขณะเดียวกัน ร้านค้าเองอาจต้องมีการบันทึกหลักฐานการบรรจุสินค้า เช่นกันเพื่อการป้องกันการเคลมสินค้าที่ไม่เป็นธรรมและเพื่อไม่เป็นการผลักภาระมาที่ผู้บริโภคฝ่ายเดียว ทั้งนี้ หากไม่สามารถหาข้อยุติได้สามารถยื่นเรื่องมาที่สายด่วน สคบ. 1166
2. ความปลอดภัยของข้อมูลส่วนบุคคลจากการใช้บริการจำนำ iCloud ซึ่งเป็นบริการกู้ยืมเงินนอกระบบที่กำลังได้รับความนิยมในโลกออนไลน์ โดยผู้ใช้บริการ ไม่ต้องฝากเครื่องไว้กับผู้ให้บริการ เพียงแค่ยืนยันตัวตนด้วยบัตรประจำตัวประชาชน และนำบัญชี iCloud ของผู้ให้บริการมาใส่ไว้ในเครื่องเพื่อเป็นการค้ำประกัน ซึ่งผู้ให้บริการ สามารถล็อกเครื่องและเข้าถึงข้อมูลส่วนบุคคลผ่านบัญชี iCloud ที่ลงชื่อเข้าใช้ไว้ได้ตลอดเวลา ไม่ว่าจะเป็นตำแหน่งที่ตั้ง รูปภาพ วิดีโอ เบอร์โทรศัพท์ หรือแอปพลิเคชันต่าง ๆ ที่มีการบันทึกไว้ภายหลังการจำนำ ซึ่งอาจถูกนำไปใช้ในการหลอกลวง เอาเปรียบ หรือ หาผลประโยชน์อื่นได้ เช่น ให้ลงชื่อเข้าใช้บัญชี iCloud ของผู้ให้บริการก่อน แต่ไม่ยอมให้เงิน หรือจ่ายคืนครบแล้ว แต่ยังมีการล็อกเครื่องเพื่อเรียกค่าไถ่ในการปลดล็อกต่อไป นอกจากนี้ ผู้ใช้บริการยังเสี่ยงต้องจ่ายดอกเบี้ยเกินอัตราที่กฎหมายกำหนด โดยอัตราดอกเบี้ยของบริการจำนำ iCloud ส่วนใหญ่อยู่ที่ร้อยละ 7–25 ต่อเดือน สูงกว่าอัตราดอกเบี้ยการทำสัญญาเงินกู้โดยทั่วไปตามกฎหมายที่อยู่ที่ร้อยละ 7.5–15 ต่อปี หรือคิดเป็นร้อยละ 1.25 ต่อเดือน เท่านั้น ดังนั้น ประชาชนควรหลีกเลี่ยงการใช้บริการรูปแบบดังกล่าว ซึ่งมีความเสี่ยงถูกหลอกลวงหรือเอาเปรียบได้
5. การสนับสนุนจากภาครัฐและการบูรณาการความร่วมมือกับเอกชนและหน่วยงานท้องถิ่น
ในการจัดงานเทศกาลจำเป็นต้องอาศัยความร่วมมือจากหลายภาคส่วนที่เกี่ยวข้องมาร่วมดำเนินการ ซึ่งจะต้องกระจายบทบาทหน้าที่ตามความเชี่ยวชาญอย่างเหมาะสม สำหรับการจัดงานเทศกาลริโอคาร์นิวัล มีการสร้าง ความร่วมมือและดำเนินการจัดงานไปพร้อมกันอย่างเป็นระบบ โดยเทศบาลนครริโอเดจาเนโร มีบทบาทหลัก ในการสนับสนุนและอำนวยความสะดวกในการจัดงาน ทั้งด้านการจราจรและด้านความปลอดภัย ขณะที่ภาคเอกชน จะเข้ามาร่วมในฐานะสปอนเซอร์ที่เน้นให้การสนับสนุนด้านการเงิน การประชาสัมพันธ์ และการส่งเสริมการตลาด ส่วนภาคประชาชนถือเป็นตัวแปรในการขับเคลื่อนกิจกรรมต่างๆ ภายในงานที่สำคัญ โดยดำเนินการผ่านสมาคมต่างๆ อาทิ สมาคมโรงเรียนแซมบ้าอิสระ (LIESA) สมาคมนักดนตรี สมาคมนักออกแบบ และสมาคมผู้ผลิตเครื่องดนตรี ซึ่งเป็นไฮไลท์สำคัญของริโอคาร์นิวัล สำหรับเทศกาลโคลน ของประเทศเกาหลีใต้ หน่วยงานท้องถิ่นมีบทบาทสำคัญ ในการผลักดันให้เกิดการท่องเที่ยวและกิจกรรมที่ใช้ประโยชน์จากโคลน โดยให้มีการศึกษาความปลอดภัย และสรรพคุณของโคลน Boryeong รวมถึงวิจัยส่วนประกอบเพื่อนำมาพัฒนาเป็นผลิตภัณฑ์บำรุงผิว อีกทั้งภาคการศึกษายังมีส่วนร่วมในการปรับแผนพัฒนาเชิงวัฒนธรรมให้ดึงดูดนักท่องเที่ยวมากขึ้น อาทิ มีการจัดกิจกรรม นันทนาการ เช่น การเล่นโคลน การแข่งขันกีฬาในโคลน การเพ้นท์โคลน จนเทศกาลมีชื่อเสียงและได้รับความนิยม จากนักท่องเที่ยวทั่วโลก นอกจากนี้ ฟิลิปส์ ยังได้ทำงานอย่างใกล้ชิดกับพันธมิตรในเอเชียแปซิฟิก ไม่ว่าจะเป็น ผู้ให้บริการสาธารณสุข บุคลากรทางการแพทย์ คู่ค้า ตัวแทนจำหน่าย เพื่อสร้างความร่วมมือในระยะยาวและแนวทางดำเนินธุรกิจและบริการใหม่ๆ ส่งเสริมความสำคัญของบริการหลังการขายและการอัพเกรด เพื่อสร้างนวัตกรรมและแนวทางปฏิบัติที่ยั่งยืน รวมถึงส่งเสริมการฝึกอบรมและการให้ความรู้ ซึ่งจะเป็นกุญแจสู่ความสำเร็จทางดิจิทัลในระยะยาว มากไปกว่านั้น ฟิลิปส์ยังได้นำเสนอโซลูชั่นส์ทั้งด้านระบบ, ซอฟต์แวร์, เครื่องมือแพทย์, และบริการที่ครบวงจร เพื่อตอบโจทย์และรับมือกับความท้าทายที่ผู้ให้บริการสาธารณสุขต้องเผชิญ และช่วยปลดล็อกศักยภาพในการนำเทคโนโลยีทางดิจิทัลมาใช้ได้อย่างเต็มที่
คลินิกพิเศษเฉพาะทางศัลยศาสตร์ ทางเดินปัสสาวะ นอกเวลาราชการ โรงพยาบาลนางรอง
โครงการ "เลี้ยงดูลูกคำสอนพ่อ" ด้านสุขภาพ คุณธรรม 8 ประการ ตามหลักปรัชญาของเศรษฐกิจพอเพียง ในพื้นที่ พมพ.
จากการศึกษาอัตราการเข้าถึงบริการสุขภาพของมารดาและเด็กในพื้นที่พัฒนาเพื่อความมั่นคง ในพื้นที่ชายแดนอันเนื่องมาจากพระราชดำริ (สำนักส่งเสริมสุขภาพ 2562) พบว่ามารดาช่วงตั้งครรภ์ส่วนใหญ่รับบริการฝากครรภ์ร้อยละ 95.24 ฝากครรภ์ครั้งแรก เมื่ออายุครรภ์ น้อยกว่า 12 สัปดาห์ ร้อยละ 43.96 หญิงตั้งครรภ์ได้รับการประเมินความเสี่ยงร้อยละ 64.00 ได้รับการตรวจสุขภาพช่องปาก ร้อยละ 51.00 ได้รับวิตามินไอโอดีนธาตุเหล็กและโฟลิก ร้อยละ 91.76 และกินวิตามินเสริมโฟลิก ไอโอดีนและธาตุเหล็กทุกวันร้อยละ 83.33 ซึ่งการให้บริการ 4 รายการ ไม่บรรลุตามเป้าหมาย สำหรับความครอบคลุมการได้รับบริการเด็กตามสิทธิประโยชน์ พบว่า ทารกแรกคลอดมีน้ำหนักน้อยกว่า 2,500 กรัม ร้อยละ 7.04 เด็กได้รับการตรวจสุขภาพช่องปากเพียง ร้อยละ 58.97 และพบเด็กมีปัญหาช่องปาก ร้อยละ 49.21 การได้รับยาน้ำเสริมธาตุเหล็กร้อยละ 44.09 และกินยาน้ำเสริมธาตุเหล็กเป็นบางครั้ง ร้อยละ 55.56 กินเป็นประจำ ร้อยละ 22 .22 โดยสรุป เด็กได้รับบริการไม่บรรลุตามเป้าหมาย และพบว่า เด็กปฐมวัยมีพัฒนาการสมวัย ร้อยละ 65.40 พัฒนาการสงสัยล่าช้า ร้อยละ 34.60
จากข้อมูลข้างต้นกรมอนามัย กระทรวงสาธารณสุข จึงเห็นควรดำเนินโครงการ “เลี้ยงดูลูกตามคำสอนพ่อ” ด้านสุขภาพ คุณธรรม 8 ประการ ตามหลักปรัชญาของเศรษฐกิจพอเพียง ในพื้นที่พัฒนาเพื่อความมั่นคงในพื้นที่ชายแดนอันเนื่องมาจากพระราชดำริพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราชบรมนาถบพิตรและสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง เขตกองทัพ ภาคที่ 3” เพื่อสร้างโอกาสการเข้าถึงบริการและองค์ความรู้ ด้านสุขภาพ ให้กับครอบครัวและชุมชนพื้นที่ชายแดน สามารถดูแลสุขภาพตนเองมีพฤติกรรมสุขภาพที่พึงประสงค์
กลุ่มเป้าหมาย
1. พ่อ แม่ ผู้ปกครอง เด็กนักเรียนระดับอนุบาลมีบุตรอายุ 3 - 5 ปีเต็ม บุคลากรสาธารณสุข บุคลากรทางการศึกษา แกนนำชุมชนท้องถิ่นในพื้นที่พัฒนาเพื่อความมั่นคงในพื้นที่ชายแดนอันเนื่องมาจากพระราชดำริ
พื้นที่โครงการพัฒนาเพื่อความมั่นคงในพื้นที่ชายแดนอันเนื่องมาจากพระราชดำริ
9 จังหวัดชายแดนภาคเหนือตอนบน ได้แก่ จังหวัดเชียงใหม่ เชียงราย ลำพูน ลำปาง พะเยา แพร่ น่าน แม่ฮ่องสอน และจังหวัดตาก
ด้วยการผสมผสานศาสตร์แห่งการมีอายุยืนยาวกับเทคโนโลยีที่ล้ำสมัย พร้อมทีมแพทย์ชำนาญการเฉพาะทางและโปรแกรมดูแลสุขภาพที่ออกแบบเป็นเอกลักษณ์ ไวทัลไลฟ์พร้อมเป็นผู้นำในการปฏิวัติวงการสุขภาพ สู่การมีอายุยืนยาวอย่างมีคุณภาพ และสร้างอนาคตแห่งสุขภาพที่เหนือกว่าในระยะยาว
ภาวะปากแหว่งเพดานโหว่ สามารถรักษาได้ด้วยการผ่าตัด ซึ่งต้องอาศัยการเข้าผ่าตัดต่อเนื่องโดยเฉลี่ย 5 ครั้ง และการรักษาแบบบูรณาการร่วมกับศัลยแพทย์ กุมารแพทย์ ทันตแพทย์ และนักบำบัดการพูด เพื่อให้เด็ก ๆ กลับมายิ้มได้และใช้ชีวิตได้อย่างมีความสุข ซึ่งด้วยการดูแลรักษาที่ใช้เวลานานยาวนานกว่า 10 ปี ต้องเริ่มการรักษาตั้งแต่อายุ 3 เดือนและอาจยาวนานจนถึงผู้ป่วยมีอายุ 20 ปี ขึ้นอยู่กับระดับความผิดปกติของผู้ป่วย ทำให้ผู้ปกครองจำนวนมากในพื้นที่ห่างไกล
ไม่สามารถเข้าถึงการผ่าตัดได้
ความฝันที่ยิ่งใหญ่สำหรับผู้ป่วย SMA
ถึงแม้ความสามารถทางร่างกายจะเริ่มถดถอยลง แต่ความตั้งใจในการมีชีวิตของผู้ป่วย SMA อย่างน้องฟางยังคงมั่นคงแข็งแกร่ง โดยเจ้าตัวได้จบการศึกษาปริญญาตรีและปริญญาโทจากคณะนิติศาสตร์ มหาวิทยาลัยอัสสัมชัญ จบเนติบัณฑิต และกำลังเรียนปริญญาโทเพิ่มที่จุฬาลงกรณ์มหาวิทยาลัย ด้วยผลการเรียนดีเด่นและความตั้งใจจะทำงานในสายงานที่ตัวเองเรียนมา อย่างการเป็นนักกฎหมายหรือผู้พิพากษา แต่เมื่อน้องฟางได้มีโอกาสฝึกงานในบริษัทสำนักงานกฎหมายแห่งหนึ่ง ก็พบว่าข้อจำกัดทางร่างกายทำให้การทำงานจริงซึ่งต้องเคลื่อนไหวและเดินทางเป็นเรื่องค่อนข้างลำบาก ปัจจุบันน้องฟางจึงทำหน้าที่ดูแลกิจการค้าขายของครอบครัว โดยมีความฝันเพียงแค่ว่าจะสามารถทำงานได้ดี มีเงินเก็บมากเพียงพอสำหรับการดูแลคุณพ่อคุณแม่ยามแก่ตัวลงและตัวเองได้ เพื่อไม่ให้ครอบครัวต้องลำบากในอนาคต ความตั้งใจธรรมดาๆ นี้เป็นความฝันที่ยิ่งใหญ่สำหรับผู้ป่วย SMA
ข้อมูลในปัจจุบันไม่พบว่าวัคซีนเกี่ยวข้องกับการเกิดมะเร็ง
นอกจากนี้ ศ. พญ.ศศิโสภิณ ยังกล่าวเสริมด้วยว่าในช่วงระยะเวลาเพียงแค่ไม่กี่ปีที่ผ่านมา วัคซีนโควิดมีการฉีดไปแล้ว ทั่วโลกมากกว่า 13,000 ล้านเข็ม ซึ่งต้องบอกว่ามากกว่าวัคซีนหลาย ๆ ตัวที่มีการใช้มาเป็นสิบ ๆ ปี มีการศึกษาเกี่ยวกับวัคซีน โควิดและโควิด-19 ออกมามากมาย ซึ่งข้อมูลยังคงสนับสนุนว่า วัคซีนโควิด-19 โดยเฉพาะที่ใช้ในปัจจุบัน คือ วัคซีนชนิด mRNA มีความปลอดภัยสูง อาการข้างเคียงส่วนใหญ่ไม่รุนแรง เช่นเดียวกับวัคซีนอื่น ๆ ที่ใช้กันมายาวนาน การที่เราเคยพูดกันถึงการใช้ ชีวิตแบบ new normal อย่างเช่นเว้นระยะห่าง สวมหน้ากากอนามัยตลอด หลีกเลี่ยงสถานที่พลุกพล่านแออัด ในความเป็นจริง แล้ว ทำได้ยากมาก การฉีดวัคซีนจึงเป็นปัจจัยสำคัญที่จะช่วยป้องกันการป่วยหนักหรือเสียชีวิตในกลุ่มเสี่ยง
“ที่มีการบอกว่าฉีดแล้วเป็นมะเร็ง ข้อมูลในปัจจุบันไม่พบว่าวัคซีนเกี่ยวข้องกับการเกิดมะเร็ง ตามที่ ร.อ. นพ.สมชาย ธนะสิทธิชัย ผู้อำนวยการสถาบันมะเร็งแห่งชาติ ได้เคยชี้แจงไว้แล้ว สุดท้ายอยากฝากให้ประชาชนติดตามและตรวจสอบข้อมูล ข่าวสารจากแหล่งที่เชื่อถือได้ ไม่ว่าจะเป็นสถาบันหรือสมาคมทางการแพทย์ สถาบันวัคซีนแห่งชาติ และกระทรวงสาธารณสุข ก่อนที่จะเชื่อหรือแชร์ข้อมูลต่อไป” ผู้แทนจากราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย กล่าว
นอกจากนี้ ภายในงานยังมีการจัดแสดงเมนูอาหารจากไก่โคราชในโครงการฟาร์มแชมเปี้ยน ซึ่งได้รับความสนใจจากผู้ร่วมงานอย่างมาก ร้านอาหารระดับมิชลิน ‘เป็นลาว’ โดยคุณพันชนะ วัฒนะเสถียร นำเสนอเมนูพิเศษ ‘ไก่โคราชใต้น้ำ’ และพืชผักออร์แกนิก ส่วนร้าน ‘แต่เก่าก่อน’ ก็นำเมนูแกงไก่โคราชมาร่วมจัดแสดง เชฟทุกท่านต่างลงความเห็นว่า ‘ไก่โคราช’ จากโครงการฟาร์มแชมเปี้ยนมีคุณลักษณะโดดเด่นทั้งในด้านรสชาติและเนื้อสัมผัสที่แตกต่างจากไก่ทั่วไปอย่างชัดเจน
แผ้ว ภิรมย์ กล่าวทิ้งท้ายว่า “ในอนาคตโครงการนี้จะช่วยให้เกษตรกรมีทางเลือกในการประกอบอาชีพที่มีความยั่งยืน ไม่ต้องพึ่งพาระบบอุตสาหกรรมใหญ่ที่มีกระบวนการเลี้ยงที่สร้างความทุกข์ทรมานและขาดมนุษยธรรมต่อสัตว์ การเลี้ยงไก่แบบธรรมชาติ จะทำให้ไก่แข็งแรงและสุขภาพดี ลดปัญหาต่างๆ
ที่พบในฟาร์มระบบปิด อีกทั้งยังเปิดโอกาสให้ผู้บริโภคเลือกอาหารที่ปลอดภัยอย่างมีมนุษยธรรม เกษตรกรหลายรายใช้ไก่สายพันธุ์โคราชควบคู่ไปกับการพัฒนาวิธีการเลี้ยง ด้วยอุปกรณ์ส่งเสริมพฤติกรรมตามธรรมชาติ ร่วมกับการให้อาหารเสริมด้วยพืชสมุนไพรเป็นอาหารทางเลือกที่ปลูกไว้บริเวณรอบฟาร์ม จะเป็นการลดการพึ่งพาระบบอุตสาหกรรมขนาดใหญ่ที่ใช้เงินลงทุนสูง ทั้งนี้องค์กรพิทักษ์สัตว์แห่งโลกจะนำความสำเร็จในเฟสแรกนี้ เตรียมขยายโครงการฟาร์มแชมเปี้ยน รุ่นที่ 2 เพื่อดึงดูดเกษตรกรทั่วประเทศ และปลูกฝังความรู้แก่เยาวชน เพื่อการเปลี่ยนแปลงอย่างยั่งยืนจากรุ่นสู่รุ่น”
ผู้สนใจข้อมูลเพิ่มเติมเกี่ยวกับการเลี้ยงไก่ที่คำนึงถึงสวัสดิภาพสัตว์และโครงการฟาร์มแชมเปี้ยน สามารถติดตามได้ที่ Facebook: องค์กรพิทักษ์สัตว์แห่งโลก และ YouTube: World Animal Protection Thailand
โดยรางวัลบ้านและสวน AWARDS ใช้หลักเกณฑ์ในการคัดเลือกที่สอดคล้องกับแนวคิด “อยู่ดี มีสุข สมดุล” ดังนี้
- Wellbeing Design การออกแบบเพื่อสร้างสุขภาวะที่ดี ส่งเสริมสุขภาพของผู้อยู่อาศัยให้อยู่ดีในทุกด้าน มีสภาวะน่าสบาย มีแหล่งอาหารปลอดภัย ใช้วัสดุอุปกรณ์ปลอดสารพิษที่เป็นอันตราย
- Sustainable Design การออกแบบให้ใช้พลังงานอย่างคุ้มค่า การสร้างพลังงานทดแทน ใช้วัสดุลดการใช้ทรัพยากรในกระบวนการการผลิต และคำนึงถึงการก่อสร้างที่เป็นมิตรกับสิ่งแวดล้อม เพื่อความยั่งยืนในอนาคต
- Creative Material Design การออกแบบที่มีการใช้วัสดุอย่างสร้างสรรค์ ส่งเสริมสถาปัตยกรรมและภูมิทัศน์ให้มีเอกลักษณ์น่าสนใจ
- Family Home Design การที่ออกแบบรองรับคนทุกวัยให้ใช้งานอย่างสะดวกและปลอดภัย ออกแบบสเปซให้ส่งเสริมการสร้างความสัมพันธ์ของครอบครัว
- Pet Friendly Design การออกแบบที่เป็นมิตรกับสัตว์เลี้ยง ออกแบบให้อยู่ร่วมกันอย่างเป็นสุข ส่งเสริมการสร้างความสัมพันธ์และเห็นคุณค่าของทุกชีวิต
- Renewable Design Solutions การออกแบบที่นำทรัพยากรกลับมาใช้ใหม่อย่างคุ้มค่า และออกแบบปรับเปลี่ยนใหม่อย่างสร้างสรรค์
- Outdoor Space Design การออกแบบสร้างความสัมพันธ์ระหว่างภายนอกและภายใน ออกแบบสเปซที่ส่งเสริมให้คนสัมพันธ์กับธรรมชาติและบริบท
ภาพบรรยากาศงานสัมมนาให้ความรู้เรื่องโรคมะเร็งโดยแพทย์, คุณนุ๊ก และอดีตผู้ป่วยมะเร็ง
สำหรับใครที่อยากมาพบกับนุ๊กเพื่อแชร์ประสบการณ์รักษามะเร็ง หากท่านใดสนใจสามารถดูปฏิทินงานสัมมนาของสมาคมมะเร็งบ๋ออ้ายได้ที่ เฟซบุ้ก โรงพยาบาลมะเร็งสมัยใหม่กว่างโจวแสตมฟอร์ดกว่างโจว โทร 061-036-7888 สำหรับข้อมูลเพิ่มเติมเกี่ยวกับเทคนิคการรักษาโรคมะเร็งสามารถดูรายละเอียดเพิ่มเติมได้ที่ www.moderncancerthai.com”
อีกหนึ่งไฮไลต์สำคัญของงานคือ การแลกเปลี่ยนประสบการณ์และองค์ความรู้ด้านการทำอาหารเพื่อสุขภาพ โดยใช้วัตถุดิบพื้นถิ่นของไทย ผสานกับเทคนิคการปรุงอย่างสร้างสรรค์ ในหัวข้อ “Art of Cuisine: Twisted Scientific Evidence-Based for Health & Wellbeing” และโชว์การปรุงอาหารจากสองเชฟชื่อดัง ได้แก่ คุณพงษ์ธวัช เฉลิมกิตติชัย (เชฟเอียน) เจ้าของร้านอาหารไทยไฟน์ไดน์นิง “คำหอม” และคุณชนม์ณกานต์ ภัทรแสงอรุณชัย (เชฟปอย) เจ้าของร้านอาหารสไตล์ยุโรปชื่อดัง “Mirror Mirror” จากจังหวัดภูเก็ต ที่ได้ร่วมสะท้อนบทบาทของอาหารในเวชศาสตร์ป้องกัน ไม่ว่าจะเป็นความเชื่อมโยงระหว่างโภชนาการกับการป้องกันโรค หรือการส่งเสริมการท่องเที่ยวเชิงเวลเนสผ่านเสน่ห์ของอาหารไทย สร้างแรงบันดาลใจให้กับผู้ร่วมงานทุกคนได้อย่างลงตัวและน่าประทับใจ
เมื่อวันที่ 15 ธันวาคม ศ.นพ.สมศักดิ์ เทียมเก่า ผู้อำนวยการโรงพยาบาลศรีนครินทร์ คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่น
โพสต์เฟซบุ๊กถึงกรณี ทำไมโรงพยาบาลสังกัดคณะแพทย์จึงต้องการให้มีการส่งต่อผู้ป่วยอย่างเป็นระบบ ว่า
- จำนวนผู้ป่วยที่เข้าร่วมโครงการ Cancer Anywhere เข้ารับการรักษาเพิ่มขึ้นอย่างมาก จนส่งผลเสียต่อระบบการบริการผู้ป่วยโรคมะเร็งทุกคน ทุกสิทธิการรักษา และผู้ป่วยโรคอื่น ๆ ด้วย
- สปสช. จ่ายค่ารักษาพยาบาลที่ รพ. เรียกเก็บต่ํามาก ๆ และมีจํานวนหนึ่งที่ไม่จ่ายเลย ทําให้โรงพยาบาลต้องแบกรับภาระด้านการเงินไม่ไหว เป็นแบบนี้มา 3 ปี ไม่มีการแก้ไข เคยสัญญาว่าจะจ่ายเพิ่มขึ้น แต่ก็ไม่ทําตามสัญญา
- จํานวนผู้ป่วยที่มารับการรักษาจํานวนมาก ส่งผลกระทบต่อการฝึกอบรมแพทย์ประจําบ้าน แพทย์ต่อยอด และ นศ.พ.
- ไม่สามารถให้การรักษาผู้ป่วยตามมาตรฐานการรักษาที่ควรจะเป็นได้ เนื่องจากเกินกําลังในการให้บริการ
- จํานวนผู้ป่วย Cancer Anywhere ของ รพ. ศรีนครินทร์ปี 2564 ที่เริ่มโครงการมีเพียง 3,617 ครั้ง, ปี 2565 เพิ่มเป็น 16,514 ปี 25,666 เพิ่มเป็น 25,896 และปีล่าสุด 2567 เพิ่มสูงขึ้นเป็น 30,241 ครั้ง หรือเทียบเท่า เป็น 830% เมื่อเทียบกับปีแรกที่เริ่มโครงการ
สปสช. และกระทรวงสาธารณสุขควรเลิกนโยบายนี้ กลับไปเป็นระบบเดิม เพราะส่วนใหญ่ของผู้ป่วยนั้น โรงพยาบาลจังหวัด ศูนย์มะเร็งก็รักษาได้ ถ้าเกินศักยภาพของโรงพยาบาลจังหวัด หรือศูนย์มะเร็ง จึงส่งต่อมารักษาที่โรงเรียนแพทย์ และ สปสช. ควรจ่ายค่ารักษาพยาบาลให้ครบด้วยครับ
"ประชาชนโปรดเข้าใจ และเห็นใจโรงพยาบาล สังกัดโรงเรียนแพทย์ เราพยายามทำหน้าที่ดีที่สุดแล้ว แต่ในขณะนี้เกินความสามารถในการแบกรับภาวะจำนวนผู้ป่วยที่มีมากเกินกำลังของแพทย์ พยาบาล เภสัช เจ้าหน้าที่เอกซเรย์แล้วครับ ร่วมกับ สปสช.จ่ายค่ารักษาพยาบาลแบบไม่เป็นธรรม"
5. การดูแลรักษาที่บ้านที่เพิ่มขึ้น
เทรนด์เทคโนโลยีทางการแพทย์ไม่ได้มีเฉพาะในโรงพยาบาลเท่านั้น แต่อีกหนึ่งเทรนด์ที่สำคัญไม่แพ้กันและกำลังได้รับความสนใจมากขึ้นในปี 2025 คือ การดูแลสุขภาพนอกโรงพยาบาล โปรแกรม "การดูแลรักษาที่บ้าน" (Hospital-at-home) มีความต้องการเพิ่มขึ้น เพราะช่วยให้ผู้ป่วยได้รับการดูแลรักษาเหมือนในโรงพยาบาลจากทุกที่
เทคโนโลยีการติดตามสัญญาณชีพผู้ป่วยระยะไกล (Remote patient monitoring) มีบทบาทสำคัญ ด้วยการส่งผลข้อมูลแบบเรียลไทม์ให้แก่บุคลากรทางการแพทย์ เพื่อช่วยประเมินและดูแลผู้ป่วยจากระยะไกล นอกจากนี้ยังได้รับการพิสูจน์ว่าเป็นแนวทางที่มีประสิทธิภาพในการลดอัตราการกลับเข้ารักษาตัวในโรงพยาบาลสำหรับผู้ป่วยโรคเรื้อรังอย่างเช่นผู้ป่วยโรคหัวใจล้มเหลวอีกด้วย และสามารถติดตามอาการผู้ป่วยหลังการผ่าตัด ทำให้ผู้ป่วยสามารถออกจากโรงพยาบาลได้อย่างเร็วขึ้นและปลอดภัยมากขึ้น ส่งผลให้โรงพยาบาลสามารถบริหารจัดการเตียงในโรงพยาบาลที่มีอย่างจำกัดได้อย่างมีประสิทธิภาพมากขึ้น สามารถดูแลรักษาผู้ป่วยที่จำเป็นต้องเข้ารับการรักษาในโรงพยาบาลได้มากขึ้น
ในปี 2025 เราจะได้เห็นความก้าวหน้าของ AI และการวิเคราะห์เชิงคาดการณ์ (Predictive analytics) ที่จะมาช่วยติดตามและประเมินความเสี่ยงของอาการผู้ป่วยจากระยะไกล โดยใช้ข้อมูลสัญญาณชีพและข้อมูลอื่นๆ ในการประเมินร่วมกัน จากรายงาน Future Health Index 2024 พบว่าเทคโนโลยีติดตามสัญญาณชีพผู้ป่วยจากระยะไกล จะเป็นเทคโนโลยีทางการแพทย์ที่มีการนำ AI มาใช้มากที่สุดในอีกสามปีข้างหน้า และ 41% ของผู้บริหารชั้นนำในวงการเฮลท์แคร์วางแผนที่จะลงทุนในเทคโนโลยีนี้ การใช้เทคโนโลยีติดตามสัญญาณชีพระยะไกลไม่เพียงแต่ช่วยป้องกันภาวะแทรกซ้อนและการกลับเข้าโรงพยาบาลได้เท่านั้น แต่ยังช่วยให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้นและได้รับความสบายใจเมื่อได้อยู่ที่บ้าน
สถาบันโรคหัวใจ โรงพยาบาลบำรุงราษฎร์ มีทีมแพทย์เฉพาะทางและทีมสหสาขาวิชาชีพที่เชี่ยวชาญในการดูแลผู้ป่วยโรคหัวใจอย่างครอบคลุม
สถาบันโรคหัวใจ โรงพยาบาลบำรุงราษฎร์ มีทีมแพทย์เฉพาะทางและทีมสหสาขาวิชาชีพที่เชี่ยวชาญในการดูแลผู้ป่วยโรคหัวใจอย่างครอบคลุม รวมถึงแพทย์เฉพาะทางด้านภาวะหัวใจล้มเหลว ซึ่งผ่านการฝึกอบรมและได้รับวุฒิบัตรผู้ชำนาญการเฉพาะทางสาขาภาวะหัวใจล้มเหลวจากประเทศสหรัฐอเมริกา (American Board) ด้วยแนวทางการดูแลรักษาเฉพาะบุคคล ตั้งแต่การวินิจฉัย การวางแผนการรักษาด้วยวิธีต่าง ๆ จนถึงการผ่าตัดปลูกถ่ายหัวใจ ด้วยประสบการณ์มากกว่า 20 ปี พร้อมเทคโนโลยีที่ทันสมัย และได้การรับรองมาตรฐานสากล JCI Heart Failure สหรัฐอเมริกา ทำให้การผ่าตัดปลูกถ่ายหัวใจประสบความสำเร็จอย่างสูง โดยในช่วง 4 ปีที่ผ่านมา บำรุงราษฎร์สามารถผ่าตัดปลูกถ่ายหัวใจให้กับผู้ป่วย 5 รายได้สำเร็จ และสามารถกลับไปใช้ชีวิตได้ตามปกติและมีคุณภาพชีวิตที่ดีขึ้น
รายชื่อศิลปินแสดงวันที่ 22 มีนาคม (2 เวที)
สำหรับภาพรวมในการสร้างสรรค์สินค้าของที่ระลึกการกุศลในปี 2567 ถือว่าประสบความสำเร็จอย่างมาก โดยเฉพาะความร่วมมือกับ
‘CryBaby’ ศิลปินไทยที่มีชื่อเสียงในตลาดสากล และในปี 2568 นี้ มูลนิธิฯ จะสานต่อความตั้งใจในการสนับสนุนวงการงานอาร์ตของไทยอย่างต่อเนื่อง ผ่านการขยายโอกาสไปสู่กลุ่มนักออกแบบหน้าใหม่เพื่อให้มีพื้นที่สำหรับแสดงศักยภาพไปสู่สายตาคนไทยมากขึ้น นอกจากนี้ ความท้าทายจากการติดต่อลิขสิทธิ์ต่างประเทศที่มีฐานแฟนคลับขนาดใหญ่หลากหลายช่วงวัย เช่น Hello Kitty, Sesame Street, Peanuts และ Peter Rabbit โดยคอลเล็กชั่นใหม่ที่กำลังจะเปิดตัวเร็ว ๆ นี้ คือ เจ้าชายน้อย (The Little Prince)
คลินิกเฉพาะทางนอกเวลา สูตินรีเวชกรรม
Best Wishes to All #JFF2025
Best Wishes to All #JFF2025
1 ชั่วโมง 29 นาที R:15+
©2024 ”Best Wishes to All” Film Partners JAPANESE (EN & TH Subs) นักศึกษาพยาบาลสาวกลับไปเยี่ยมปู่ย่าที่จังหวัดบ้านเกิดของตน ภายใต้ฉากหน้าของความสุขที่พวกเขาได้กลับมาเจอพร้อมหน้ากันนั้น เธอก็สัมผัสถึงความไม่ชอบมาพากลภายในบ้านหลังนั้นมากขึ้นเรื่อย ๆ มีบางสิ่งกำลังอาศัยอยู่ในบ้านของปู่ย่าของเธอ จนกระทั่งวันหนึ่งเธอได้ค้นพบความจริงและมันได้พลิกชีวิตธรรมดาอันสุขสันต์ของเธอกลับตาลปัตรกลายเป็นความสยองขวัญไปตลอดกาล
อาสาสมัครช่วยงานธนาคารเลือด (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญนักเรียน นักศึกษา หรือผู้ที่สนใจ ที่มีในรักงานจิตอาสา มาทำกิจกรรม "อาสาสมัครช่วยงานธนาคารเลือด"
โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 08.30-16.00 น. (จำนวนชั่วโมงอาสาสมัคร 7 ชั่วโมง) ณ ศูนย์รับบริจาคเลือดศิริราช อาคารนวมินทรบพิตร ๘๔ พรรษา ชั้น 3
รับสมัครผู้ที่สนใจเพียงวันละ 4 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- ดูแลความเรียบร้อย และให้บริการผู้บริจาค
- แนะนำขั้นตอนการเข้ารับบริการ
- บริการน้ำดื่ม และอาหารว่างแก่ผู้รับบริจาค
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
คลินิกอายุรกรรม โรคระบบประสาท เบาหวาน ความดัน ไขมันเลือดสูง
ภาคใต้
กระบี่
คลินิกทันตกรรมเดนทัลบ็อกซ์ กระบี่
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 075662266, 0645055246
คลินิกทันตกรรมเดนทัลบ็อกซ์ อ่าวนาง
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 075665566, 0805235294
คลินิกทันตกรรมรักฟัน
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 075611985
คลินิกทันตกรรมลันตาสไมล์
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0801285556
จอยเดนทัลคลินิก
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0969465428
ฟัน ฟัน คลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0835906116
ลินน์ คลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0835906116
หมอโดมทำฟันคลินิกทันตกรรม
ประเภท : [ทันตกรรมชุมชนอบอุ่น] 0846881634
5) ความจริงเสริมและความจริงผสม (Augmented reality and mixed reality)
5) ความจริงเสริมและความจริงผสม ความจริงที่ว่า Pokémon Go พิชิตโลกภายในเวลาเพียงไม่กี่สัปดาห์เมื่อหลายปีก่อนพิสูจน์ให้เห็นว่าความจริงเสริมมีศักยภาพอย่างมาก และแม้ว่า AR ทางการแพทย์จะเป็นสาขาใหม่ของการดูแลสุขภาพ แต่ก็มีแนวคิดที่ยอดเยี่ยมเกี่ยวกับการใช้งานแล้วในอนาคต นักศึกษาแพทย์อาจศึกษากายวิภาคบนโต๊ะผ่าตัดเสมือนจริง ไม่ใช่บนศพมนุษย์ สิ่งที่เราเคยเรียนรู้จากตำราขนาดใหญ่จะถูกแปลงเป็นโซลูชันและโมเดล 3 มิติเสมือนจริงโดยใช้ความจริงเสริม ในระหว่างการผ่าตัด ศัลยแพทย์สามารถมองทะลุโครงสร้างทางกายวิภาค เช่น หลอดเลือดในตับได้โดยไม่ต้องเปิดอวัยวะ จึงสามารถทำการผ่าตัดได้แม่นยำยิ่งขึ้น มีบริษัทต่างๆ มากมายที่เสนอโซลูชัน AR อย่างไรก็ตาม แว่นตา AR ของ Hololensมีจำหน่ายเฉพาะสำหรับนักพัฒนาเท่านั้นและมีราคาแพงมากจากประสบการณ์ของศัลยแพทย์ชาวอเมริกัน Hololens ยังมีข้อจำกัดในแง่ของประสบการณ์ผู้ใช้เช่นกัน ซึ่งเขาหวังว่าจะได้รับการเสริมประสิทธิภาพในเวอร์ชันต่อๆ ไป แม้ว่าเราจะมีตัวอย่างที่ดีของเทคโนโลยีเสมือนจริง เทคโนโลยีเสริม และเทคโนโลยีผสมผสานในระบบดูแลสุขภาพอยู่แล้ว แต่ในบทความนี้เราได้รวบรวมตัวอย่างเหล่านี้ไว้ 6 ตัวอย่างอย่างไรก็ตาม แม้ว่าเราจะมีหลักฐานที่น่าเชื่อถือเกี่ยวกับการใช้ VR ในทางการแพทย์แล้ว แต่เรายังขาดข้อมูลสำหรับเทคโนโลยีขยายความเป็นจริงอื่นๆ นอกจากนี้ เรายังต้องพูดถึงว่าเทคโนโลยีเหล่านี้ทั้งหมดต้องใช้การลงทุนจำนวนมาก เนื่องจากส่วนประกอบทั้งหมดมีราคาแพงมาคลินิก-ร้านยา แนะนำ (ฟรี)
Healthserv.net เปิดพื้นที่สำหรับการโปรโมทธุรกิจกิจการในส่วน "
แนะนำคลินิก-ร้านยา" และเป็นบริการ
ฟรี (ไม่มีค่าใช้จ่าย) ผู้ประกอบการที่สนใจ ส่งข้อมูลมาที่
healthserv.net@gmail.com ดังนี้
- ข้อมูลคลินิก ร้านยา ได้แก่ ชื่อสถานพยาบาล ที่อยู่ เบอร์โทร ติดต่อ แผนที่ email
- ข้อมูล โซเชี่ยลมีเดีย เช่น facebook instagram line website tiktok youtube
- รูปโลโก้ และ ภาพร้าน 1-3 ภาพ
- เลขที่ใบอนุญาตประกอบการสถานพยาบาล หรือ เลขที่ใบอนุญาตร้านยา
- ข้อมูลประกอบอื่นๆ เช่น ข้อมูลแนะนำเกี่ยวกับธุรกิจ บริการ ประวัติ รูปแบบบริการ เนื้อหาสาระน่าสนใจ และ ฯลฯ
- ตัวอย่างหน้าเนื้อหาแนะนำคลินิก - แสดงชื่อคลินิกร้านยา ภาพโลโก้ Facebook Feed และ TikTok feed ได้ด้วย พร้อมกับข้อมูลอื่นๆและภาพที่ต้องการนำเสนอ กรณีมคลิปวิดีโอ ก็สามารถลงได้เช่นกัน ตัวอย่างคลินิกที่แสดงวิดีโอ
HealthServ สงวนสิทธิ์พิจารณาข้อมูลเพื่อเผยแพร่ ตามดุลยพินิจความเหมาะสม
การแก้ไข/ปรับเปลี่ยน/ลบข้อมูล
อนาคต อาจมีการเพิ่มโอกาสให้กับธุรกิจอื่นๆ เช่น รพ.สัตว์ และอื่นๆ โปรดติดตามข้อมูล หรือสอบถามมาได้
5. พนันทายผลฟุตบอลเงินหมุนเวียนในตลาดสูงเป็นอันดับหนึ่ง
พนันทายผลบอล
• คนเล่นไม่มาก แต่เงินพนันสูงสุด 181,168 ล้านบาท เพิ่มขึ้นกว่า 2 หมื่นล้านจากปี 62
• คนเล่นเพียง 3.831 ล้านคนเท่านั้น จำนวนคนเล่นน้อยกว่า ล็อตเตอรี่และหวยใต้ดิน ถึง 5 เท่า
• นักพนันหน้าใหม่เพิ่ม 2.21 แสนคน เป็นชนิดพนันที่มีผู้เล่นหน้าใหม่เพิ่มมากสุดของทั้งหมด (7.95 แสนคน)
• ช่องทางการเล่น เล่นผ่านคนเดินโพย คนรับแทง และโต๊ะบอล เกือบ 90% ที่เหลือผ่านไลน์/แอพ/เฟซบุ๊ค/โซเชียลบ้าง ราว 18.5% เล่นผ่านเว็บ/แอพพนัน
การเชื่อมต่อและเก็บข้อมูลเพื่อวัดค่าต่าง ๆ ที่ปัจจุบันยังทำผ่านสมาร์ตวอตช์เป็นหลัก ในอนาคตอันใกล้จะมีผลิตภัณฑ์ใหม่ ๆ ไม่ว่าจะเป็นแว่นตาอัจฉริยะ รองเท้าอัจฉริยะ เสื้ออัจฉริยะ แหวนอัจฉริยะ แจ็กเก็ตอัจฉริยะ และแม้แต่พวงกุญแจอัจฉริยะ ที่ช่วยเรื่องการชำระเงิน ทำธุรกรรม หรือช่วยตัดสินใจ จี้ห้อยคอ AI อาจช่วยจดประชุม สรุปประเด็น ร่างอีเมล จดจำนัดหมาย แจ้งเตือน เสมือนเป็นเลขาส่วนตัวอยู่ข้างกาย
อุปกรณ์สวมใส่ AI รุ่นใหม่ ๆ จะทำงานรวดเร็วขึ้น เพราะมีไมโครชิปที่ดีขึ้น และทำงานได้แม่นยำเที่ยงตรงมากขึ้น เพราะมีเทคโนโลยี AI ที่ดีขึ้น ขณะที่ความสามารถในการตรวจวัดต่าง ๆ ก็จะมีความหลากหลายมากขึ้นและทำงานดีขึ้นด้วยเช่นกัน เสื้อผ้าจะมีเส้นใยพิเศษที่วัดปฏิกิริยาทางไฟฟ้าของกล้ามเนื้อผู้สวมใส่ แม้แต่ชุดชั้นในก็อาจพัฒนาให้มีความสามารถตรวจสอบมะเร็งเต้านมได้ นอกจากนี้ยังมีอุปกรณ์สวมใส่ AI ที่ตรวจวัดระดับน้ำตาลได้ ซึ่งเหมาะกับผู้ป่วยโรคเบาหวาน มีแหวนอัจฉริยะชื่อ Oura ring ที่วัดอัตราการเต้นของหัวใจและระดับออกซิเจนในเลือด
ในประเทศไทย มหาวิทยาลัยสงขลานครินทร์ได้พัฒนาอุปกรณ์สำหรับผู้สูงอายุและผู้ป่วยอัลไซเมอร์ นาฬิกาอัจฉริยะ “โพโมะ” ช่วยป้องกันเด็กหายวางขายใน 20 ประเทศ มีแอปพลิเคชันชื่อ ฟิตสตาร์ (FitStar) ให้คำแนะนำแก่ผู้เล่นโยคะ แอปพลิเคชันลูโมซิตี (Lumosity) ที่วัดระดับการทำงานของสมอง เพื่อดูผลของการออกกำลังกายต่อการพัฒนาสมอง นอกจากนี้ยังมีอีกหลายแอปพลิเคชันที่ช่วยส่งเสริมการฝึกสมาธิและฝึกการตัดสินใจอีกด้วย ฯลฯ
AMED ของ สวทช. ได้พัฒนาระบบเซนเซอร์อัจฉริยะสำหรับสนับสนุนการดูแลผู้สูงอายุและผู้ป่วย เพื่อตรวจจับอิริยาบถและการเคลื่อนไหวที่ผิดปกติ รวมไปถึงท่านอน การล้ม และตำแหน่งที่เกิดเหตุภายในอาคาร พร้อมแสดงผลและแจ้งเตือนผู้ดูแลแบบเรียลไทม์ นอกจากนี้ยังมีเทคโนโลยีเซนเซอร์โมดูล (sensor module) ที่เกี่ยวเนื่องกับ Wearable Technology ต่าง ๆ กระจายอยู่ทุกศูนย์วิจัยแห่งชาติของ สวทช. อีกด้วย
ข้อมูลจาก ธนาคารกสิกรไทย Wikipedia Webster dictionary
นอกจากนี้ยังมีการให้องค์กรอิสระภายนอกเข้ามาตรวจสอบคุณภาพมาตรฐานและความปลอดภัยอย่างต่อเนื่อง อาทิ มาตรฐานคุณภาพโรงพยาบาลระดับสากล (JCI) ซึ่งทางโรงพยาบาลได้ผ่านการต่ออายุการรับรอง re-accreditation ครั้งที่ 7 เมื่อปลายเดือน ธ.ค. 2566 , มาตรฐานคุณภาพโรงพยาบาลและบริการสุขภาพ ‘ขั้นก้าวหน้า’ (A-HA), การรับรองจาก Global Healthcare Accreditation (GHA) ในระดับความเป็นเลิศมาตรฐานสากลในการดูแลกลุ่มผู้ป่วยชาวต่างชาติที่เดินทางเพื่อเข้ารับการรักษาพยาบาลในประเทศไทย, ความเป็นเลิศในมาตรฐานด้านการปฏิบัติงานด้านพยาธิวิทยาและเวชศาสตร์ชันสูตรของห้องปฏิบัติการทางการแพทย์จากวิทยาลัยพยาธิแพทย์อเมริกัน (CAP) ซึ่งคุณภาพและความปลอดภัย นับเป็นตัวชี้วัดที่สำคัญของคุณภาพของสถานพยาบาล
นักศึกษาจะได้มีโอกาสลงปฏิบัติงานในสถานการณ์จริงในหอผู้ป่วยของโรงพยาบาลและในชุมชน ตลอดจนเรียนพื้นฐานการทำวิจัย ค้นคว้าสิ่งใหม่ สร้างสรรค์ผลงานและนวัตกรรมที่เป็นประโยชน์ต่อสังคม เพื่อยกระดับภาพลักษณ์ของพยาบาลรุ่นใหม่ ให้มีศักยภาพและความรู้ความสามารถในมาตรฐานระดับนานาชาติ นอกจากการเรียนที่เข้มข้นแล้ว ยังมีกิจกรรมส่งเสริมการเรียนรู้ต่างๆ ที่น่าสนใจ ให้นักศึกษาได้มีส่วนร่วมตลอดระยะเวลา 4 ปี ส่งเสริมให้มีจรรยาบรรณวิชาชีพ จริยธรรมคุณธรรม และมีจิตอาสา พร้อมทำประโยชน์ให้ผู้อื่น และสังคม การพยาบาลเป็นการปฏิบัติกับชีวิตและสุขภาพมนุษย์ทุกวัย ผู้สำเร็จการศึกษาจากวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี จะมีความรู้ความสามารถและทักษะของวิชาชีพ มีศิลปะทางการพยาบาล บนพื้นฐานของการดูแลคนด้วยหัวใจของความเป็นมนุษย์และสัมพันธภาพที่เอื้ออาทร คุณธรรมจริยธรรม สร้างสรรค์ประโยชน์ต่อสังคม ภายใต้อัตลักษณ์ รอบรู้ พัฒนา จิตอาสา นำพาความสุข ก้าวสู่การเป็นพยาบาลวิชาชีพอย่างภาคภูมิใจ สู่ความเป็นเลิศเพื่อทุกชีวิต
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางกะปิ
NHSO ทำเนียบเครือข่ายสหสขาวิชาชีพ สปสช+รายชื่อ
Main page
ทำเนียบเครือข่ายสหสขาวิชาชีพ
ตำราพระโอสถพระนารายณ์ LINK
ตำราพระโอสถพระนารายณ์
by -
Publication date 1965
Topics จอน ศุภลักษณ์, 2410-2507, ยาแผนโบราณ, หนังสืองานศพ, หนังสืออนุสรณ์งานศพ, Cremation, วัดบวรนิเวศวิหาร, Wat Bowonniwet Vihara, หนังสืออนุสรณ์งานศพวัดบวรนิเวศวิหาร, หนังสืองานศพวัดบวรนิเวศวิหาร, ห้องสมุดหนังสืออนุสรณ์งานศพวัดบวรนิเวศวิหาร, ห้องสมุดหนังสืองานศพวัดบวรนิเวศวิหาร, สำนักหอสมุด มหาวิทยาลัยธรรมศาสตร์, หอสมุดแห่งมหาวิทยาลัยธรรมศาสตร์, Thammasat University Libraries
Publisher โรงพิมพ์ชวนพิมพ์
Collection thaicremationcopy; thammasat_university; globallibraries
Digitizing sponsor Thammasat University
Contributor Thammasat University
Language Thai
พิมพ์เป็นอนุสรณ์ในงานฌาปนกิจศพ นายจอน ศุภลักษณ์ ณ เมรุวัดแก้วฟ้าล่าง วันที่ 8 กุมภาพันธ์ 2508
Addeddate 2018-01-17 05:19:49
Collection_set thaicremationcopy
Contributors -
Foldoutcount 0
Identifier unset0000unse_e1o2
Identifier-ark ark:/13960/t6m10jk4j
Invoice 1092
Ocr ABBYY FineReader 11.0 (Extended OCR)
Pages 102
Ppi 300
Republisher_date 20180117070000
Republisher_operator associate-lotu-tii@archive.org
Executive Double
ห้องพักสำหรับผู้ป่วย 2 ท่าน วิวมุมสูงบนถนนพระราม 4 ซึ่งเป็นย่านธุรกิจใจกลางกรุงเทพฯ มีดีไซน์ทันสมัย ใช้พื้นที่ได้อย่างลงตัว ด้วยเตียงผู้เฝ้าไข้ที่สามารถพับเก็บได้ ทำให้ห้องพักดูโปร่ง สบาย
พื้นที่ห้อง 15 ตรม. (รวมห้องน้ำ)
สิ่งอำนวยความสะดวก
- เตียงผู้ป่วย
- โซฟาสำหรับญาติ
- Wi-Fi
- อุปกรณ์ในห้องน้ำ
ค่าใช้จ่ายต่อวัน
- ค่าห้อง 3,690 บาท
- ค่าอาหาร 1,000 บาท
- ค่าบริการพยาบาล 3,200 บาท
- ค่าบริการโรงพยาบาล 600 บาท
รวม 8,490 บาท
Extra person charge is THB 32,000 for 1 adult and THB 25,000 for 1 child below 12 years old. Max 2 adults per room and 2 adults + 1 child per suite. Ultra Savvy Suite rate is for 2 persons including medical tests and full board meals. Full pre-payment is required and will be charged upon reservation, other terms and conditions may apply.
Guests can discover various ASQ packages at Aloft Bangkok Sukhumvit 11 at
http://bit.ly/ASQAloftBangkok. For more information and reservation, please contact Khun Umaporn +66 95 391 0824, Khun Visaruda +66 81 334 3093, call +66 2 207 7000 or email reservations.aloftbkk@alofthotels.com
##
About Aloft Bangkok – Sukhumvit 11
Aloft Bangkok Sukhumvit 11 is an urban gem in a stimulating travel destination. Our hotel features loft-inspired rooms and suites with tech-smart features, free Wi-Fi, platform beds and panoramic views of the Bangkok cityscape. Our prime location on Sukhumvit Road places the excitement of Soi 11 at your doorstep; you can also take advantage of our free hotel shuttle to the Nana BTS Sky Train and MRT subway stations for easy access to celebrated attractions. It’s a breeze to get to us - Come by BTS Nana exit 3, our free tuk-tuk shuttle, car with free parking, or taxi! For more information, please visit
aloftbangkoksukhumvit11.com
Media Contact
Sunday Treamprom Klinhom
Marketing Communications Manager, Aloft Bangkok Sukhumvit 11
treamprom.klinhom@marriott.com
02 207 7060 | 081 717 1494
วิธีการอ่านค่าคะแนนพฤติกรรมการบริโภคอาหาร
พิจารณาคะแนนรวมในแต่ละหัวข้อ ซึ่งจะสะท้อนนิสัยการบริโภคที่จะส่งผลแตกต่างกันตามชนิดของอาหารที่บริโภคเป็นประจำ
ประเมินนิสัยการบริโภคหวาน
|
5 คะแนน
|
ยินดีด้วย คุณบริโภคน้ำตาลในปริมาณที่พอเหมาะ หากมีนิสัยในการบริโภคแบบนี้ คุณจะมีความเสี่ยงต่ำในการมีรอบพุงเกิน เพราะน้ำตาลส่วนเกินเป็นสาเหตุหลักของการเกิดไขมันสะสมจนมีรอบพุงเกินปกติ
|
|
6-9 คะแนน
|
คุณมีความเสี่ยงปานกลางในแง่ของพฤติกรรมการบริโภคน้ำตาล คนที่อยู่ในความเสี่ยงระดับนี้อาจเริ่มมีพุงแล้ว รวมถึงค่าดัชนีมวลกายอาจเริ่มเกินเกณฑ์มาตรฐานแล้ว (มากกว่า 22.9 กิโลกรัม/เมตร 2)
|
|
10-13 คะแนน
|
คุณมีความเสี่ยงสูงในแง่ของพฤติกรรมการบริโภคน้ำตาล บอกได้คร่าวๆ เลยว่าคุณได้รับน้ำตาลสูงเกือบทุกวัน และเกินปริมาณที่แนะนำของกรมอนามัย กล่าวคือ คนไทยไม่ควรได้รับน้ำตาลเกินวันละ 6 ช้อนชาต่อวัน หากได้รับเกินจากนี้จะทำให้มีความเสี่ยงต่อการเกิดภาวะน้ำหนักเกินและเป็นต้นเหตุของการเกิดโรคเบาหวานได้
|
|
14-15 คะแนน
|
รู้ตัวบ้างไหม? ว่าคุณมีความเสี่ยงสูงมาก กับการได้รับน้ำตาลเกินจนทำร้ายสุขภาพและร่างกายของตัวคุณเองเข้าแล้ว ปริมาณน้ำตาลที่คุณได้รับทั้งรู้ตัว ไม่รู้ตัวหรือไม่อยากจะรับรู้ก็ตาม อยู่ในปริมาณสูงมาก สูงพอที่จะทำให้คุณอ้วนและน้ำหนักตัวเพิ่มได้เดือนละ 1-2 กิโลกรัมเลยทีเดียว ยังไม่รวมถึงความเสี่ยงในการเกิดโรคเบาหวาน โรคหัวใจและหลอดเลือด และโรคต่างๆ ที่ตามมาอีกขบวน
|
ประเมินนิสัยการบริโภคไขมัน
|
5 คะแนน
|
คุณมีความเสี่ยงน้อยในการได้รับผลเสียจากการบริโภคไขมันไม่เหมาะสม หากคุณอยู่ในกลุ่มนี้เป็นไปได้ว่าคุณเป็นคนรักสุขภาพ มักจะไม่เกิดโรคที่เกิดจากการบริโภคไขมัน ชีวิตของคุณมีแนวโน้มว่าจะยืนนาน หากคุณบริโภคในส่วน อื่นๆ เหมาะสมด้วย
|
|
6-9 คะแนน
|
คุณมีความเสี่ยงปานกลางในการเลือกบริโภคไขมัน คนที่อยู่ในความเสี่ยงระดับนี้อาจเริ่มมีพุงน้อยๆ หรือเริ่มปานกลางแล้ว รวมถึงค่าดัชนีมวลกายอาจเริ่มเกินเกณฑ์มาตรฐานแล้ว (มากกว่า 22.9 กิโลกรัม/เมตร 2)
|
|
10-13 คะแนน
|
คุณมีความเสี่ยงสูงในการเลือกบริโภคไขมัน อาจบอกได้คร่าวๆ เลยว่าคุณบริโภคปริมาณไขมันเกินเกือบทุกวัน หากอ้างอิงจากคนที่ต้องการพลังงานวันละ 1,600 kcal ต่อวัน คนเหล่านี้ ไม่ควรได้รับน้ำมันเกิน 3 ช้อนโต๊ะต่อวัน หากได้รับเกินจากนี้จะทำให้มีความเสี่ยงต่อการเกิดภาวะน้ำหนักเกิน โรคไขมันในเลือดสูง โรคหัวใจและหลอดเลือด ภาวะสมองขาดเลือดเฉียบพลัน (Stroke) และภาวะต่างๆที่พร้อมจะสูบเงินในกระเป๋าคุณไปเป็นค่ารักษาโรค
|
|
14-15 คะแนน
|
เงื้อมมือมัจจุราช!!!! คุณมีพฤติกรรมการบริโภคไขมันที่อันตรายต่อชีวิตอันมีค่าของคุณมากคุณมีความเสี่ยงสูงมากที่จะมีภาวะไขมันสูงในเลือด ไขมันพอกที่อวัยวะต่างๆ และอาจเริ่มเกิดการอุดตันของไขมันในเส้นเลือดไปแล้วก็ได้ เป็นไปได้ว่าอนาคตจะเกิดการแตกของเส้นเลือดและนำไปสู่ภาวะStroke ได้ ถ้าโชคดีอาจรอดชีวิตแต่เป็นอัมพาต ยิ่งถ้าโชคร้ายละก็จะเป็นการจบชีวิตแบบไม่ได้ตั้งตัว (ทุกๆ 3 - 4 นาทีจะมีผู้เสียชีวิตจากภาวะStroke 1 ราย) แนะนำว่าคุณควรรีบเปลี่ยนพฤติกรรมการบริโภคเดี๋ยวนี้ และออกกำลังกายเพิ่มขึ้นด้วย
|
ประเมินนิสัยการบริโภคโซเดียม
|
5 คะแนน
|
ยินดีด้วยคุณได้รับโซเดียมในปริมาณที่น้อย ทำดีแล้วนะ แนะนำให้ปฏิบัติตัวแบบนี้ต่อไป
|
|
6-9 คะแนน
|
คุณได้รับโซเดียมในระดับปานกลาง ยังถือว่าไม่มีอันตรายอะไรต่อสุขภาพ แต่คุณควรเริ่มตระหนักว่าไม่ควรบริโภคโซเดียมไปมากกว่านี้ ในวันหนึ่งเราไม่ควรบริโภคโซเดียมเกิน 2,000 มิลลิกรัมหรือเท่ากับเกลือ 1 ช้อนชา เริ่มหันมาเอาใจใส่ตัวเองได้แล้วว่า ตัวเองอาจได้รับโซเดียมโดยไม่รู้ตัวหรือเปล่า หลีกเลี่ยงการปรุงรสชาติเพิ่มเติมโดยไม่ทันชิม และลดอาหารแปรรูปลงบ้าง
|
|
10-13 คะแนน
|
คุณได้รับโซเดียมในปริมาณสูงแน่ๆ ถึงเวลาตระหนักถึงพฤติกรรมการบริโภคได้แล้ว ไม่เช่นนั้นในอนาคตคุณต้องรับอุปการะโรคความดันโลหิตสูง หรือโรคไตมาร่วมชีวิตใต้ชายคาเดียวกับคุณก็ได้คงถึงเวลาบอกเลิกอาหารแปรรูป การปรุงรสชาติอย่างไม่บันยะบันยังเสียที
|
|
14-15 คะแนน
|
คุณได้รับโซเดียมสูงมาก แนะนำให้ปรับเปลี่ยนพฤติกรรมการบริโภคโดยด่วน หากคุณไม่อยากเป็นโรคความดันโลหิตสูง โรคไต และพรรคพวกที่เตรียมคร่าชีวิตคุณ หากไม่รีบเปลี่ยนในตอนนี้อนาคตคุณอาจจะต้องไปโรงพยาบาลอาทิตย์ละ 3 – 4 ครั้ง เพื่อรับการฟอกไต เมื่อถึงเวลานั้นคุณจะไม่สามารถกินอาหารหลายๆ อย่างที่คุณชอบได้อย่างสบายใจอีกต่อไป ต้องเลือกกินอาหารที่ยุ่งยากกว่านี้หลายเท่าตัวเพราะฉะนั้นเปลี่ยนแปลงตอนนี้ยังไม่สายที่จะทำ เน้นอาหารปรุงด้วยเครื่องเทศหรือสมุนไพร แต่ต้องไม่เผลอปรุงเค็ม
|
ข้อมูลจาก สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.)
5. ทั้ง 50 เขตมีคลินิกชุมชนพร้อมให้บริการหลายแห่ง
นั่นหมายความว่าในกทม.มีทั้งสิ้น 50 เขต (แบ่งตามสำนักงานเขต) ในแต่ละเขตจะมีคลินิกชุมชนอบอุ่น และเฉพาะทางชุมชนอบอุ่น ตั้งอยู่หลายแห่ง
ตรวจโควิดเข้ม แรงงานชาวเมียนมา 100,000 คน เข้ามาไทยไม่ได้
สนข.Eleven Myanmar ว่า แรงงานชาวเมียนมาประมาณ 100,000 คน ที่ทำงานในไทยอย่างถูกกฎหมายตามบันทึกความเข้าใจว่าด้วยความร่วมมือด้านแรงงานระหว่างไทย-เมียนมา ประสบปัญหาไม่สามารถเดินทางกลับไทยได้เนื่องจากการแพร่ระบาดของโรค COVID-19 โดย Myo Myint Naing ทูตแรงงาน สอท.เมียนมา/กรุงเทพฯ ชี้แจงว่าไทยไม่ได้ห้ามแรงงานเมียนมากลับเข้าไทย แต่ปัญหาเกิดจากขั้นตอนที่ซับซ้อนและค่าใช้จ่ายสูง เช่น ต้องมีใบรับรองการตรวจโรค COVID-19 ภายใน 72 ชั่วโมง แสดงผลเป็นลบ ต้องตรวจสอบประวัติการเดินทาง และต้องกักตัวเป็นเวลา 14 วัน
ผู้ว่าฯขอนแก่นประกาศคุมเข้ม ผู้ที่มาจากสมุทรสาครรายงานตัวด่วน! LINK
สมศักดิ์ จังตระกูล ผู้ว่าฯ จ.ขอนแก่น ประกาศ ให้ผู้ที่เดินทางเข้า-ออกจาก จ.สมุทรสงคราม และเดินทางต่อมา จ.ขอนแก่น เข้ารายงานตัวเพื่อสอบสวนโรคโควิด-19
วันที่ 20 ธันวาคม 2563 ผู้สื่อข่าวรายงานว่า นายสมศักดิ์ จังตระกูล ผู้ว่าราชการจังหวัดขอนแก่น ประกาศวันที่ 20 ธันวาคม 2563 ให้ผู้ที่เดินทางมาจากจังหวัดสมุทรสาครหรือผู้ที่เข้าไปยังพื้นที่จังหวัดสมุทรสาคร แล้วเดินทางเข้ามาในพื้นที่จังหวัดขอนแก่น ตั้งแต่วันที่ 1 ธันวาคม 2563 เป็นต้นมา เข้ารายงานตัวต่อเจ้าพนักงานควบคุมโรคติดต่อระดับอำเภอ เพื่อทำการเฝ้าระวังและสอบสวนโรคโควิด-19
ทั้งนี้ ได้มีการบังคับใช้มาตรการป้องกันโรค ตามที่คณะรัฐมนตรีประกาศประชาชนทุกคนต้องสวมหน้ากากอนามัย เว้นระยะห่างทางสังคม 1-2 เมตร ล้างมือด้วยสบู่และแอลกอฮอล์บ่อย ๆ หลีกเลี่ยงการสัมผัส และกรอบแบบฟอร์มไทยชนะทุกครั้งที่ไปยังสถานที่ต่าง ๆ อย่างเคร่งครัด
6. รายการอุปกรณ์ประสาทหูเทียม
รายการอุปกรณ์ประสาทหูเทียมชนิด Rechargeable สำหรับการผ่าตัดฝังประสาทหูเทียมในเด็กอายุน้อยกว่า 5 ปี ที่มีระดับการได้ยิน 90 dB ขึ้นไป และไม่เคยฝึกภาษามือ โดยคาดว่ามีกลุ่มเป้าหมายราว 33 คน ขณะนี้ สปสช.อยู่ระหว่างต่อรองราคาค่าประสาทหูเทียมให้ต่ำกว่าชุดละ 6 แสนบาท
วิธีเตรียมพร้อมก่อนเดินทาง ให้หายห่วงจากไวรัส
วิธีเตรียมพร้อมก่อนเดินทาง
ให้หายห่วงจากไวรัส
- ดูแลร่างกายให้แข็งแรง
หมั่นออกกำลังกายและกินอาหารถูกสุขลักษณะ
- ของต้องมีติดกระเป๋า
หน้ากากอนามัยและแอลกอฮอล์เจล เป็นสิ่งจำเป็นสำหรับทุกการเดินทาง
- สังเกตตัวเองและคนรอบข้าง
หากรู้สึกว่าตัวเองหรือเห็นคนรอบข้างมีอาการป่วย ให้สวมหน้ากากอนามัยทันที
- ภารกิจหลังเดินทาง
หลังเดินทางกลับถึงประเทศไทยภายใน 14 วัน ถ้ามีอาการไข้ ไอ เจ็บคอ มีน้ำมูก หายใจเหนื่อยหอบ ให้สวมหน้ากากอนามัย และรีบไปพบแพทย์
สิ่งควรทำ
- ล้างมือสม่ำเสมอ
- สวมหน้ากากอนามัย
- หลีกเลี่ยงสถานที่แออัด
- ถ้าต้องไปตลาดค้าสัตว์ ต้องสวมหน้ากากอนามัย
- ไม่สัมผัสสัตว์ป่วยหรือตาย
สิ่งไม่ควรทำ
- นำมือสัมผัส หู ตา จมูก ปาก โดยไม่จำเป็น
- ใช้สิ่งของส่วนตัวร่วมกับผู้อื่น เช่น แก้วน้ำ ผ้าเช็ดตัว
หน่วยรับบริจาคโลหิต มกราคม 64 ภาคบริการโลหิตแห่งชาติที่ 11 นครศรีธรรมราช LINK
หน่วยรับบริจาคโลหิตประจำเดือน มกราคม2564 A B O AB ภาคบริการโลหิตแห่งชาติที่ 11 จังหวัดนครศรีธรรมราช สภากาชาดไทย โดยท่านสามารถเตรียมตัวบริจาคโลหิตได้ดังนี้
คลิก
โปรดนำบัตรประชาชนเพื่อแสดงตนก่อนบริจาคโลหิตทุกครั้ง‼️
ห้องรับบริจาคโลหิตภายในสถานีกาชาดสิรินธร ทุ่งสง (หน้าโรงพยาบาลทุ่งสง ควนไม้แดง) เปิดรับบริจาคโลหิต ดังต่อไปนี้...
- วันจันทร์-วันศุกร์ เวลา 08.30-16.30 น.
- วันเสาร์ เวลา 09.00-15.30 น.
- วันหยุดนักขัตฤกษ์ เวลา 09.00-15.30 น
- วันอาทิตย์ ปิดทำการ
- 075-302172 และ 087-4982152
- เพจ facebook
- Line@
ธนาคารเลือด รพร.สระแก้ว รับบริจาคเลือด LINK
ธนาคารเลือด รพร.สระแก้ว
เวลาให้บริการรับบริจาคเลือด
- วันจันทร์-วันศุกร์ เปิดเวลา 08.30-16.00 น. (ปิดช่วงเช้าเวลา 11.30-13.00 น.)
- วันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์ เปิดเวลา 08.30-11.00 น. ค่ะ
- หากมีข้อสงสัย หรือสอบถามเพิ่มเติม 037-243018-20 ต่อ125
ภาคบริการโลหิตแห่งชาติที่ 2 จังหวัดลพบุรี สภากาชาดไทย เปิดรับบริจาคโลหิค LINK
Covid -19 wave 2 โรงพยาบาลขาดเลือดเข้าขั้นวิกฤติทั่วประเทศ กาชาดเลือดไม่พอจ่าย
วอนคนไทยสุขภาพดี ช่วยเหลือผู้ป่วย
ครั้งนี้นับเป็นประวัติศาสตร์ที่วิกฤติมาก
- โรงพยาบาลทั่วประเทศ ไม่มีเลือด รักษาพยาบาล
- จำนวนผู้บริจาคลดลง 50%
- หน่วยเคลื่อนที่ ยกเลิก การจัดบริจาคโลหิต
- กาชาด ไม่มีเลือดพอจ่ายให้กับโรงพยาบาลทั่วประเทศ
ชวนคนไทยช่วยกันรวมเลือดเนื้อ ชาติเชื้อไทย
บริจาคโลหิต?️?️?️?️ ฝ่าวิกฤติ COVID-19 รอบ 2 ไปด้วยกัน
บริจาคโลหิตได้ที่ :
- ภาคบริการโลหิตแห่งชาติที่ 2 จังหวัดลพบุรี สภากาชาดไทย เปิดรับบริจาคโลหิคจันทร์ - ศุกร์ เวลา 08.30 - 16.30 น.
เสาร์ - อาทิตย์ และวันนักขัตฤกษ์ เวลา 09.00 - 15.30 น.
- สอบถามเพิ่มเติม โทร 036-422184
พิเศษ ผู้บริจาคโลหิตตั้งแต่ 2 ครั้งขึ้นไป ณ ภาคบริการโลหิตแห่งชาติที่ 2 จังหวัดลพบุรี บริจาคโลหิตรับเสื้อยืดที่ระลึกสำหรับ 100 ท่านแรก เท่านั้น
เงื่อนไข นับจำนวนครั้งสะสมตั้งแต่ 1 มกราคม 2563 จนถึงวันที่บริจาค
สอบถามโทร. 0 3642 2184 , 063 373 2358
รพ.เจริญกรุงประชารักษ์ ขาดเลือดกรุ๊ป O และ A เข้าขั้นวิกฤติ LINK
โรงพยาบาลเจริญกรุงประชารักษ์
Covid -19 wave 2
โรงพยาบาลขาดเลือดกรุ๊ป "โอ" และ "เอ" เข้าขั้นวิกฤติ
มีคนไข้จำนวนมากกำลังรอเลือดอยู่
ชวนคนไทยสุขภาพดีช่วย
บริจาคโลหิตฝ่าวิกฤติ COVID-19 รอบ 2
บริจาคโลหิตได้ที่ :
โรงพยาบาลเจริญกรุงประชารักษ์ อาคารอนุสรณ์ 20ปี ชั้น1
- วันจันทร์-ศุกร์ เวลา 8:00น.-16:00น.
- วันอาทิตย์ที่ 10 มกราคม 2564 เวลา 9:00น.-16:00น. เปิดรับบริจาคโลหิตในวันหยุดเป็นกรณีพิเศษ
- โทร 02 289 7000
ทีเอ็มบีและธนชาต
ขอแจ้งให้ทราบว่า
สาขาในห้างสรรพสินค้า จะเปิดให้บริการทุกวัน
เพื่ออำนวยความสะดวกให้กับลูกค้า
และจะปิดทำการในเวลา 18.00 น.
ทั้งนี้ เพื่อความปลอดภัยต่อสุขภาพของลูกค้า
และลดความเสี่ยงของการแพร่ระบาดของโรด COVID-19
ธนาคารจะยังคงปิดให้บริการชั่วคราวในบางสาขา
กลุ่ม D คือ กลุ่มคนที่อยู่บ้าน ไม่ได้ออกไปข้างนอก
6. ทำนัดตรวจโควิดได้ที่ เว็บไซต์ของคลินิก
6. เมื่อทราบข้อกำหนดสำคัญๆ เหล่านั้นแล้ว สามารถทำนัดตรวจโควิดได้
ที่เว็บไซต์ของคลินิก
www.thaitravelclinic.com
ช่วงเวลาที่ทำนัดได้
- จันทร์-ศุกร์ (3 ช่วง)
8-9 น. 10.30-11.30 น. และ 13-14 น.
- เสาร์-อาทิตย์ (1 ช่วง) 9-11 น.
จากความสำเร็จดังกล่าวโรงพยาบาลธวัธบุรี จ.ร้อยเอ็ด ได้มาปรึกษาแนวทางและขอดำเนินการเหมือนที่รพ.บ้านตาก ติดตั้งขนาด 137 กิโลวัตต์เช่นกันตอนนี้ทีมงานกำลังดำเนินการ และโรงพยาบาลสังคม จ.หนองคายกำลังจะติดตั้งอีกแห่งเร็วๆ นี้
ไอศครีม Chocolate sugar-free
ไอศครีม Chocolate sugar-free
มาการองกัญชา
มาการองกัญชา เจ้าของเดียวกันกับชานมไข่มุก Cannacha
บาล์มกัญชา Canna Balm
บาล์มกัญชา Canna Balm ช่วยลดอาการปวด ผ่อนคลาย ทำให้หลับสบาย
ถาม-ตอบ
หมายความว่าของซิโนแวคยังคงดำเนินต่อไป?
นพ.เกียรติภูมิ - ชิโนแวค เราได้มา 2 แสนโดส วันนี้ฉีดไปเกือบ สี่หมื่นแล้ว ขณะนี้ก็กำลังฉีดคนที่มีความจำเป็นในแผนอยู่
สภาพปัจจัยคนไทยที่แตกต่างกับคนยุโรป แล้วเมื่อได้รับการฉีดแอสตร้าหรือชิโนแวค จะอยู่ในภาวะเสี่ยงหรืออาการไหนไหมคะที่จะเข้าข่ายว่าอาจจะไม่ได้รับการฉีดวัคซีนตัวนี้
นพ.ยง - ถ้าพูดถึงอาการนี้ คือการแข็งตัวของเลือด ที่บอกว่าขึ้นเครื่องบินแล้วต้องระวังอะไรต่างๆ เหล่านี้ ปัจจัยที่สำคัญอันนึงคือ เชื้อชาติ ว่าทำไมคนยุโรป กับคนแอฟริกา เป็นมากกว่าคนเอเซีย อันนี้ก็คือพันธุกรรม ถ้าศึกษาลงลึกไปในเรื่องพันธุกรรมแล้ว พันธุกรรมมีส่วนเกี่ยวข้องแน่นอน แต่เหตุการณ์แบบนี้ ที่มีการแข็งตัวของเลือด อย่างอจ.กุลกัญญาพูด ไม่เคยเกี่ยวข้องกับวัคซีนตัวใดๆ ในโลกมาก่อน ไม่เคยเลย แต่เนื่องจากวัคซีนตัวนี้ เป็นวัคซีนใหม่ หรือถ้ามาดูส่วนผสมในตัวยา ส่วนผสมในนั้น ไม่มีตัวยาตัวไหนที่มีหลักฐานทางวิทยาศาสตร์ ที่จะไปคล้ายๆ กระตุ้น ทำให้ระบบการแข็งตัวของเลือดผิดปกติ คือไม่มี แต่เป็นการศึกษาทางด้านระบาดวิทยาเท่านั้น ที่อยู่ดีๆ มีคนไข้ขึ้นมา แน่นอนเค้าต้องไปศึกษาเปรียบเทียบว่าในภาวะปกติ ที่ไม่ได้ฉีดวัคซีน อุบัติการณ์มันต่างกันหรือไม่ ถ้าไม่ต่างกัน มันก็คล้ายเป็นโรคร่วมที่เกิดขึ้นขณะที่ฉีดวัคซีน
หากการสอบสวนของไทยเรามั่นใจว่าเชื้อชาติไม่ได้อันตราย เราจะเดินหน้าฉีดก่อนยุโรปใน 5-6 ประเทศที่เค้าชะลอ
นพ.ยง - ในคนไทยเราจะไปสอบสวนอะไร เพราะมันไม่ได้เกิดในบ้านเรา ถ้าเกิดในเดนมาร์ค ก็ต้องรอให้เดนมาร์คและออสเตรียสอบสวนก่อน ถ้าไม่เกี่ยวก็จบ ถ้าเกี่ยวก็เกี่ยวด้วยปัจจัยอะไรบ้าง แล้วปัจจัยนั้นมาเกี่ยวข้องกับบ้านเรามั๊ย แล้วค่อยว่ากัน ปัจจัยนั้นในบ้านเรามี เราก็ต้องดูว่าความเสี่ยงนั้น เสี่ยงแค่ไหน ขณะนี้สำหรับประเทศไทย ไม่ต้องทำอะไร ดูข้อมูลเขาก่อน ซึ่งเชื่อว่าจะออกมาใน 1-2 วันนี้ ค่อนข้างจะเร็วมาก แล้วมาคุยกันอีกที
กลุ่มผู้ใหญ่ ผู้สูงอายุนี่ เป็นกลุ่มใหม่ที่ไม่คาดคิดหรือปล่าว หรือคาดไว้บ้างแล้ว
คาดไม่ถึงเหมือนกันนะคะ คือรุ่นปู่รุ่นย่าเลยที่มากันเยอะ 60upสรุปผลิตภัณฑ์ กัญชงและกัญชา ที่ผู้ประกอบการไทยสามารถทำได้
หนองคาย เทศกาลตรุษสงกรานต์ และสมโภชสร้างน้ำ หลวงพ่อพระใส ประจำปี 64
เทศกาลตรุษสงกรานต์ และสมโภชสร้างน้ำ “หลวงพ่อพระใส” ประจำปี 2564 ที่จะมีขึ้นในระหว่างวันที่ 12 – 19 เมษายน 2564 งานที่สำคัญ ประกอบด้วย กำหนดการพิธีอัญเชิญหลวงพ่อพระใสลงจากพระอุโบสถ ในวันที่ 13 เมษายน 2564 , กำหนดการพิธีอัญเชิญหลวงพ่อพระใส ขึ้นประดิษฐานในพระอุโบสถ ในวันที่ 18 เมษายน 2564 , กำหนดการพิธีพระราชทานน้ำสรง พร้อมผ้าห่มหลวงพ่อพระใส ในวันที่ 19 เมษายน 2564 , รูปแบบการจัดขบวนอัญเชิญหลวงพระใส และกิจกรรมฟ้อนถวายบูชาหลวงพ่อพระใส ในวันที่ 12 เมษายน 2564 เป็นต้นลำปาง - กักตัว 14 วัน LINK
ประกาศจังหวัดลำปาง 12 เมย 64
โดยความเห็นชอบของคณะกรรมการโรคติดต่อจังหวัดลำปางในคราวประชุมคณะกรรมการโรคติดต่อจังหวัดลำปางครั้งที่ 12/2 564 เมื่อวันที่ 12 เมษายน 2564 มีประกาศดังนี้
1.ให้บุคคลที่เดินทางมาจากพื้นที่ที่มีการตรวจพบการระบาดและมีความเสี่ยงต่อการแพร่โรคสูงรวมทั้งพื้นที่ที่มีการแพร่ระบาดในลักษณะกลุ่มก้อนเมื่อเดินทางเข้ามาในพื้นที่จังหวัดลำปางต้องดำเนินการดังนี้
1.1 รายงานตัวต่อ เจ้าพนักงานควบคุมโรคติดต่อในพื้นที่โดยทันที โดยไม่ปกปิดข้อมูลไทม์ไลน์ในการเดินทางเพื่อพิจารณากลั่นกรองความเสี่ยงต่อการก่อกำเนิดโรคและให้ปฏิบัติตามคำแนะนำอย่างเคร่งครัด
1.2 บุคคลดังกล่าวจะต้องกักกันตัวเองที่บ้านที่พักอาศัยหรือปฏิบัติงานนอกสถานที่ตั้งเป็นเวลาอย่างน้อย 14 และหากสงสัยหรือมีอาการใดๆผิดปกติ ให้ติดต่อบุคลากรทางการแพทย์ทันทีรวมถึงต้องปฏิบัติตามมาตรการทางสาธารณสุขที่ประกาศอย่างเคร่งครัด
2 ให้อำเภอและผู้บริหารองค์กรปกครองส่วนท้องถิ่นใช้กลไกองค์กรปกครองส่วนท้องถิ่นกำนันผู้ใหญ่บ้านผู้นำชุมชนเจ้าหน้าที่โรงพยาบาลส่งเสริมสุขภาพตำบลพื้นที่หรืออสมช่วยกันสอดส่องดูแลติดตามและเฝ้าระวังกรณีประชาชนทั่วไปและนักท่องเที่ยวที่เข้ามาในพื้นที่อย่างใกล้ชิดด้วย
มาตรการ จ.ลำปาง
- มาลำปาง สแกน QR Code ไทยชนะ หรือ ลำปางชนะ
- ถ้าไม่มีความเสี่ยง หรือ เสี่ยงต่ำ ไม่ต้องกักตัว ให้เฝ้าระวังสังเกตอาการตนเอง และทำตามมาตรการปลอดภัย
- หากมีความเสี่ยงติดเชื้อ ต้องแยกกักตัวเอง 14 วัน
สายด่วนศูนย์โควิด-19
- ศูนย์ข้อมูล Covid-19 จังหวัดลำปาง
- สาธารณสุขจังหวัดลำปาง โทร 093-140-8023 (ในวัน-เวลาราชการ)
- รพ.ลำปาง โทร 054-237400 เพจ รพ.ลำปาง
- รพ.มะเร็งลำปาง 054-335262
- หรือโรงพยาบาลเอกชน โรงพยาบาลเขลางค์นคร-ราม 054-019619
รพ.ชุมชน ทุกอำเภอ
รพ.แม่พริก 054 299 324
รพ.เถิน 054 292 179
รพ.สบปราบ 054 296 260
รพ.เกาะคา 054 281 393
รพ.ห้างฉัตร 054 269 506
รพ.แจ้ห่ม 054 271 005
รพ.เมืองปาน 054 276 020
รพ.วังเหนือ 054 279 013
รพ.งาว 054 261 253
รพ.แม่เมาะ 054 266 032
รพ.แม่ทะ 054 289 184
กทม.ติดโควิด 3,233 ราย กระจาย 50 เขต - ประชาชาติ LINK
กทม.เปิดยอดผู้ป่วยโควิดระลอกใหม่ รวมสะสม 3,233 ราย กระจายทั้ง 50 เขต มากสุด บางแค 421 ราย บางเขน 359 ราย บางขุนเทียน 225 ราย ภาษีเจริญ 212 ราย วัฒนา 100 ราย เผยเฉพาะวันที่ 4-10 เม.ย. ติดเชื้อพุ่ง 999 ราย จากคลัสเตอร์สถานบันเทิง
วันที่ 11 เม.ย. 2564 ผู้สื่อข่าวรายงานว่า กรุงเทพมหานคร (กทม.) รายงานสถานการณ์โควิด-19 ระลอกใหม่ในพื้นที่ กทม. นับตั้งแต่วันที่ 18 ธ.ค.2563-10 เม.ย.2564 พบติดเชื้อสะสมตามประกาศของ ศบค. จำนวน 3,233 ราย แยกเป็นในพื้นที่ กทม. จำนวน 2,581 ราย และพำนักนอกพื้นที่ กทม. จำนวน 636 ราย
โดย กทม.มีผู้ติดเชื้อทั้ง 50 เขต เรียงลำดับมากสุดถึงน้อยสุด ได้ดังนี้
1.เขตบางแค 421 ราย
2.เขตบางเขน 359 ราย
3.เขตบางขุนเทียน 225 ราย
4.เขตภาษีเจริญ 212 ราย
5.เขตวัฒนา 100 ราย
6.เขตหนองแขม 78 ราย
7.เขตสวนหลวง 66 ราย
8.เขตห้วยขวาง 65 ราย
9.เขตบางบอน 55 ราย
10.เขตบางกะปิ 54 ราย
11.เขตจอมทอง 47 ราย
12.เขตธนบุรี 44 ราย
13.เขตคลองเตย 43 ราย
14.เขตบางพลัด 41 ราย
15.เขตจตุจักร 39 ราย
16.เขตคลองสามวา 34 ราย
17.เขตบางกอกน้อย 33 ราย
18.เขตดินแดง 33 ราย
19.เขตสาทร 29 ราย
20.เขตวังทองหลาง 29 ราย
21.เขตทวีวัฒนา 27 ราย
22.เขตลาดกระบัง 26 ราย
23.เขตปทุมวัน 25 ราย
24.เขตพระโขนง 25 ราย
25.เขตตลิ่งชัน 23 ราย
26.เขตดอนเมือง 23 ราย
27.เขตประเวศ 22 ราย
28.เขตคลองสาน 21 ราย
29.เขตบางคอแหลม 20 ราย
30.เขตหลักสี่ 20 ราย
31.เขตบางนา 20 ราย
32.เขตบึงกุ่ม 20 ราย
33.เขตลาดพร้าว 20 ราย
34.เขตดุสิต 19 ราย
35.เขตยานนาวา 19 ราย
36.เขตสายไหม 19 ราย
37.เขตราชเทวี 18 ราย
38.เขตบางรัก 17 ราย
39.เขตพญาไท 17 ราย
40.เขตบางกอกใหญ่ 16 ราย
41.เขตทุ่งครุ 16 ราย
42.เขตมีนบุรี 15 ราย
43.เขตราษฎร์บูรณะ 11 ราย
44.เขตบางซื่อ 11 ราย
45.เขตคันนายาว 10 ราย
46.เขตพระนคร 9 ราย
47.เขตหนองจอก 6 ราย
48.เขตป้อมปราบศัตรูพ่าย 5 ราย
49.เขตสะพานสูง 4 ราย
50.เขตสัมพันธวงศ์ 3 ราย
ทั้งนี้จากตัวเลขพบว่าเฉพาะช่วงวันที่ 4-10 เม.ย.2564 ที่มีเป็นการระบาดของกลุ่มคลัสเตอร์สถานบันเทิง พบว่าใน กทม.มีผู้ติดเชื้อตามประกาศ ศบค.อยู่ที่ 999 ราย ในพื้นที่ กทม. 817 รายและพำนักนอกพื้นที่ กทม. 166 ราย
ทั้งนี้ข้อมูลล่าสุดวันที่ 11 เม.ย. 2564 จาก ศบค.ระบุว่า พื้นที่ กทม.มียอดติดโควิดระลอกใหม่เมษายน (1-11 เม.ย.) อยู่ที่ 1,294 ราย ในวันนี้พบเพิ่ม 236 ราย
ปริมาณเชื้อโควิด-19 ที่มากับสารคัดหลั่ง LINK
เชื้อไวรัสโควิด- 19 ที่พบว่าปนเปื้อนในสารคัดหลั่งแต่ละชนิด
- น้ำมูกประมาณ 90%
- น้ำลายประมาณ 80%
- อุจจาระประมาณ 70%
- เยื่อบุคอหอยประมาณ 60%
- เลือดประมาณ 10%
- น้ำตาประมาณ 1%
ยังไม่มีรายงานตรวจพบเชื้อไวรัสโควิด-19 ในเหงื่อ สารคัดหลังจากช่องคลอด และน้ำอสุจิมาก่อน
ระยะเวลาของเชื้อโควิด-19 ที่อยู่บนพื้นผิวต่างๆ
- ทองแดง 4 ชม.
- ไม้ 6-24 ชม.
- แก้ว ผ้า 24-72 ชม.
- กระดาษ พลาสติก 48-96 ชม.
ข้อแนะนำ
เนื่องจากเชื้อไวรัสสามารถอยู่บนด้านนอกของหน้ากากอนามัยได้นานมากกว่า 1 สัปดาห์ ดังนั้น ไม่ควรใช้หน้ากากอนามัยซ้ำ และควรล้างมือให้สะอาด เพื่อป้องกันการสัมผัสเชื้อที่อาจปนเปื้อนอยู่
ข้อมูล ณ วันที่ 7 มกราคม 2564
ที่มา : อ. พญปักมา ต.วรพานิช
ตอนที่ ๑ กลับบ้าน
ถ้าให้ย้อนกลับไปตั้งแต่เริ่มต้น โดยสังเขป ก็คือ คนไทยตอนนี้มีสองทางเลือกกลับบ้านแล้วนะ กลับเองหรือกลับกับสถานทูต ขึ้นอยู่กับว่า เดินทางจากไหน ก็เช็คกับสถานทูตไทยที่นั่นว่าต้องทำยังไงบ้าง มีไฟลท์แบบกลับเองมั้ย แต่จะกลับแบบไหนก็ใช้เอกสารเหมือนกันหมดนะ ? COE (certificate of entry), ใบ ต.8, และ fit to fly ไม่มีสามอย่างนี้คนไทยเข้าไทยไม่ได้นะจ๊ะ ?
COE จากนอร์เวย์ปัจจุบันนี้เป็นระบบออนไลน์แล้ว ถ้าเลือกวันเดินทางได้แล้ว สถานทูตจะส่ง link ให้ พร้อมเมื่อไรก็เข้าไปกรอกข้อมูล แปะเอกสารให้ครบ ซึ่งก็แค่หน้าพาสปอร์ตกับตั๋วเครื่องบินทุกไฟลท์ แค่นั้นเอง แล้วก็รอไม่เกินสามวัน เข้าไปเช็คผลแล้วพิมพ์ใบ COE ออกมาได้เลย อันนี้ต้องตัดสินใจให้ได้ก่อนนะจ๊ะว่าจะกลับวันไหน เช็คไฟลท์ไรให้เรียบร้อยก่อน กรณีที่พลาด เดินทางไม่ได้ อย่างเช่นที่เกิดกับดิฉัน ? ไม่เป็นไรค่ะ ก็เริ่มใหม่ ทำใหม่ ตั๋วเครื่องบินเราจ่ายเองอยู่แล้ว เอาที่สบายใจค่ะ ?
แต่ยามนี้สถานทูตคือที่พึ่งนะคะ มีอะไรก็ติดต่อไปตามช่องทางของสถานทูต อย่าคิดเองเออเองว่าโทรไปเบอร์นี้ ไม่มีคนรับ บลาบลาบลา อย่างสถานทูตไทยที่ออสโล จะมีอีเมล์และเบอร์พิเศษสำหรับติดต่อในช่วงโควิดโดยเฉพาะ ถ้าติดต่อไปตามนี้ สถานทูตติดต่อกลับแน่นอน
ใบต.8 ก็ได้จากสถานทูตนะคะ กรอกข้อมูลแล้วปรินท์ออกมาค่ะ ใบ fit to fly เดี๋ยวนี้ก็ง่ายขึ้น เพราะสถานทูตมีฟอร์มตัวอย่างให้ ปรินท์ออกมาเอาไปให้หมอเซ็นได้เลย หมอแต่ละที่ก็ไม่เหมือนกัน อันนี้ต้องให้แฟนช่วยนะ ? บอกหมอว่าไม่ต้องการผลตรวจโควิด เพราะบินเข้าไทยไม่ต้องใช้ผลตรวจโควิด แค่ให้หมอตรวจว่า เราไม่มีอาการป่วยที่จะเป็นอุปสรรคต่อการเดินทาง โดยเฉพาะการเดินทางไกลทางเครื่องบินนะจ๊ะ แล้วก็จ่ายตังค่ะ ที่นอร์เวย์ แพงค่ะ ?
ครบทุกอย่างแล้ว วันเดินทาง ? อย่าไปแต่ตัว เอกสารทั้งหมดเอาไปด้วยนะจ๊ะ ? ส่วนโรงแรมที่กักตัว ถ้าเลือกแบบฟรีที่รัฐจ่ายให้ เราก็จะไม่รู้ว่าจะได้พักที่ไหน จนกว่า จะถึงที่พัก ? แต่ถ้าเลือกแบบจ่ายตังเอง ก็รู้แน่นอนว่าพักที่ไหนอะเนอะ
วันกลับ เนื่องจากเป็นไฟลท์ที่สถานทูตจัด ก็ต้องไปเจอจนทสถานทูตที่สนามบิน เช็คชื่อ ตรวจเอกสาร แล้วค่อยไปเช็คอิน ที่เหลือก็เหมือนการเดินทางปกติสมัยนี้ คือ สวมหน้ากากตลอดการเดินทาง โดยเฉพาะเมื่ออยู่บนเครื่องบิน ถอดได้เฉพาะตอนกิน พูดคุยกันให้น้อยหน่อย อย่าเม้ามอย เดี๋ยวโควิดจะถามหานะ ?
ถึงสุวรรณภูมิ ออกมาก็ต้องผ่านช่องทางพิเศษ ตรวจเอกสาร ต้องมีครบ ไม่ป่วย ไม่เป็นไข้ เจ็บคอ ก็ได้ไปต่อค่ะ ไปผ่านตม จะได้ตราประทับพิเศษที่หน้าสุดท้ายของพาสปอร์ต จากนั้นก็รับกระเป๋า แล้วไปขึ้นรถ ต้องเดินตามทางที่เขาจัดไว้นะ แล้วต้องพ่นยาฆ่าเชื้อที่กระเป๋าก่อนขึ้นรถไปโรงแรม ซึ่งก็ยังไม่รู้ว่าได้ที่ไหน จนถึงที่พักนั่นล่ะจ้ะ ?
วันนี้พอก่อนนะ เดี๋ยวพรุ่งนี้มาต่อเรื่องโรงแรม ✌?
#วิถีคนแฟนไกล #บันทึกคนกักตัว2020
16 ธันวาคม 2020
สสจ.ภูเก็ตประกาศเลื่อนนัด การรับวัคซีนโควิดเข็มที่สองของผู้ที่เคยได้รับวัคซีนเมื่อวันที่ 1-10 เมษายน โดยให้มารับเข็มที่สองวันที่ 22-30 เมษายน (เร็วกว่ากำหนดเดิม) และต้องเข้ามารับที่สถานที่ฉีดเดิมเท่านั้น ตรวจสอบสิทธิ์ได้ที่
https://check.ภูเก็ตต้องชนะ.com เกณฑ์การอนุญาตให้ผู้ป่วยออกจากโรงพยาบาล
21 เมย 64
วันนี้พบผู้ป่วย 1,458 ราย
มาจากการตรวจที่รพ.1,346 ราย
คัดกรองเชิงรุก 108 ราย
มาจากต่างประเทศ 4 ราย ได้แก่ ญี่ปุ่น 3 ราย มาเล 1 ราย
1.รักษาตัวในรพ.13,797 ราย รพ.สนาม 3,365 ราย
2.ความคืบหน้าในการฉีดวัคซีนตั้งแต่ 28 ก.พ.- 20 เม.ษ.64 สะสม 712,610 โดส (เพิ่มจากเมื่อวาน 46,401 โดส)
2.1 กรุงเทพมหานคร มีการฉีดวัคซีนสะสม 116,523 โดส
2.2 ภูเก็ต มีการฉีดวัคซีนสะสม 93,805 โดส
2.3 สมุทรสาคร มีการฉีดวัคซีนสะสม 84,255 โดส
3.รายละเอียดผู้เสียชีวิต 2 ราย
- รายที่ 109 หญิงไทย อายุ 56 ปี เป็นชาวกรุงเทพ มีโรคประจำตัว คือ เบาหวาน ความดันโลหิตสูง ไตวายเรื้อรัง โรคอ้วน
10 เม.ษ.64 เริ่มมีอาการไข้ ไอ
13 เม.ษ.64 ไปตรวจหาเชื้อ
14 เม.ษ.64 ติดเชื้อโควิด 19
17 เม.ษ.64 เข้ารับการรักษา มีอาการเหนื่อยหอบ ผล x- ray พบปอดอักเสบรุนแรง
19 เม.ษ.64 ระบบหายใจล้มเหลว เสียชีวิตเวลาต่อมา
- รายที่ 110 ชายไทย อายุ 32 ปี เป็นชาวนนทบุรี โรคประจำตัวคือ ภูมิแพ้
มีประวัติสัมผัสกับผู้ป่วยวันที่ 4:เม.ษ.64
8 เม.ษ.64 มีอาการไอ ไข้ต่ำ มีเสมหะปนกับเลือด
15 เม.ษ.64 มีอาการเหนื่อยมากขึ้น
16 เม.ษ.64 เข้ารักษารพ.x-ray พบ ปอดอักเสบรุนแรง
ข้อมูลอื่นๆที่จำเป็นโดยรพ.ราชบุรี
สุพรรณบุรี คำสั่ง 10 เมย 64 แต่ไม่มีบทลงโทษ LINK
คำสั่งจังหวัดสุพรรณบุรี ที่ 1432/2564
เรื่อง มาตรการเร่งด่วนในการเฝ้าระวัง การป้องกัน และการควบคุมโรคติดเชื้อไวรัสโคโรนา 2019
ข้อ 3.2 ให้บุคคลโดยทั่วไปสวมหน้ากากอนามัยหรือหน้ากากผ้า เมื่ออยู่นอกเคหสถานและเข้าไปในสถานที่สาธารณะ เช่น ที่ชุมชน ร้านค้า เว้นแต่ ขณะออกกำลังกาย รับประทานอาหาร หรือมีเหตุอันจำเป็นอื่น
/////////////
ข่าวสารเกี่ยวกับวัคซีน
5. ยืนยันการทำรายการ
สาวน้อย สปสช จะยิ้มแย้มและเอ่ยขอบคุณ พร้อมยืนยันว่า สปสช ได้รับข้อมูลการลงทะเบียนแล้ว
7.กรอกเลขโทรศัพท์เพื่อรับรหัส OTP
Coronapas ทุกเรื่องวัคซีนในแอปเดียวของเดนมาร์ค
Coronapas เป็นแอปของเดนมาร์ค สำหรับบันทึกข้อมูล 3 ด้านเกี่ยวกับโควิดของชาวเดนมาร์ค ทั้งเด็กและผู้ใหญ่ คือ 1. เช็คผลตรวจโควิด 2. สถานะการรับวัคซีน 3. ผลตรวจภูมิคุ้มกัน
Coronapas เป็นหลักฐานเฉพาะบุคคล มีคำแนะนำให้พิมพ์ผลติดตัวไว้เพื่อง่ายต่อการใช้งานมากขึ้น การใช้ Coronapas กับประเทศต่างๆ ให้เช็คประเทศปลายทาง
Ref :
sudhed.dk ,
Sundhedsministeriet (Ministry of Health)
คลินิก Pride (Pride Clinic)
สอบถามรายละเอียดเพิ่มเติมได้ที่ 1378 หรือติดต่อคลินิก Pride (Pride Clinic) ตั้งอยู่ที่อาคาร A (อาคารคลินิก) ชั้น 16, เคาน์เตอร์ A (16A) โดยเปิดให้บริการทุกวัน เวลา 08.00-20.00 น. หรือ email: prideclinic@bumrungrad.com7 อาการข้างเคียงจากการใช้ฟ้าทะลายโจร
7 สำหรับบางคน (พบได้น้อย) ที่ใช้ ฟ้าทะลายโจร อาจทำให้เกิดอาการ เบื่ออาหาร มวนท้อง ท้องเดิน คลื่นไส้ วิงเวียน ศีรษะ ใจสั่น อ่อนเพลีย กรณีมีอาการมาก เมื่อหยุดยาก็จะหายเป็น ปกติ
ชุดตรวจรวดเร็ว Antigen Test Kit (ATK) สำหรับสถานประกอบการ โรงงาน
นครแหลมฉบัง เปิดลงทะเบียน ตั้งแต่วันจันทร์ที่ 23 ส.ค. เป็นต้นไป
นครแหลมฉบัง เปิดลงทะเบียนวัคซีนซิโนฟาร์ม walk in + อายุ 18 ปีบริบูรณ์ขึ้นไป ตั้งแต่วันจันทร์ที่ 23 ส.ค. เป็นต้นไป
เขตสาทร บริการฉีดวัคซีน ฟรี 6-17 กันยายน 64 LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสาทร บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงของท่าน....ฟรี ฟรี ฟรี
ระหว่างวันที่ 6-17 กันยายน 2564 เวลา 10-12 น.
6 กันยายน 64 - ลานนันทนาการ สนข.สาทร
7 กันยายน 64 - วัดลุ่มเจริญศรัทธา
8 กันยายน 64 - สวนสุขภาพสมาคมแต้จิ๋ว ฯ
9 กันยายน 64 - ตลาดนางลิ้นจี่
10 กันยายน 64 - ศูนย์การค้านิวลามูน
13 กันยายน 64 - ชุมชนศรีสุริโยทัย
14 กันยายน 64 - ชุมชนดอนกุศลร่วมใจ
15 กันยายน 64 - ชุมชนดอนกุศลพัฒนา
16 กันยายน 64 - บ้านหนังสือ (ใต้ทางด่วน)
17 กันยายน 64 - ชุมชนบ้านมั่นคง สวนพลูฯ
สอบถามโทร 02-2112627 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เขตสาทร
คณะแพทยศาสตร์ มช. LINK
ผู้ที่เคยติดเชื้อโควิด-19 และรักษาหายแล้ว ยังต้องฉีดวัคซีนโควิด-19 อีกไหม?
ควรฉีด
- เนื่องจากยังมีโอกาสติดเชื้อซ้ำได้ โดยแนะนำให้เว้นระยะห่างจากการติดเชื้อไปแล้วอย่างน้อย 3 เดือน ทั้งนี้อาจพิจารณาฉีดวัคซีนเพียง 1 เข็ม เพราะสามารถกระตุ้นการสร้างภูมิคุ้มกันได้เพียงพอ
ขอขอบคุณข้อมูลจาก : ศ.ดร.พญ.ทวิติยา สุจริตรักษ์
อาจารย์ประจำสาขาโรคติดเชื้อ ภาควิชากุมารเวชศาสตร์
คณะแพทยศาสตร์ มช.
ศ.นพ.มานพ พิทักษ์ภากร LINK
หายจาก COVID-19 ควรฉีดวัคซีนต่อเลยไหม? | Mahidol Channel
เมื่อหายจากโควิด-19 ควรฉีดวัคซีนต่อเลยไหม? ผลการศึกษาเกี่ยวกับประเด็นนี้เป็นอย่างไร? ลองมาฟังข้อมูลจาก ศ.นพ.มานพ พิทักษ์ภากร หัวหน้าศูนย์วิจัยการแพทย์แม่นยำ คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล
ข้อมูลที่เรามี จะมีเฉพาะเรื่องของ mRNA วัคซีนเท่านั้น พบว่าในคนที่เคยติด covid แล้วหายแล้ว ทันทีที่ฉีดวัคซีน mRNA ไม่ว่าจะเป็นไฟเซอร์ หรือ โมเดอร์นา แค่เข็มเดียว สามารถกระตุ้นภูมิได้สูงมาก สูงกว่าคนปกติไม่เคยติดเชื้อแล้วฉีด 2 เข็มครบด้วยซ้ำ
ขั้นตอนที่ 7 การแสดงผล
ขั้นตอนที่ 7 การแสดงผล
ผลทดสอบเป็นลบ จะแสดงขีดสีแดง 1 ขีดในช่อง C
ชุดตรวจนี้หากเชื้อไม่มากพอ อาจตรวจไม่เจอ หากไม่มีอาการให้รอ 3 ถึง 5 วัน ค่อยทำการตรวจซ้ำ
ผลทดสอบเป็นบวกจะแสดงขีดสีแดงทั้งช่อง C และช่อง T และอาจมีสีเข้มหรือสีจางกว่าได้
หากผลทดสอบเป็นบวกต้องทำการยืนยันผลด้วย real-time rt-pcr ที่สถานพยาบาลใกล้บ้าน
โปรดอ่านข้อแนะนำเพิ่มเติมในเอกสารกำกับภายในกล่อง
ถ้าไม่สามารถแปลผลได้จะไม่แสดงขีดสีแดงที่ช่อง C หรือแสดงขีดสีฟ้าและสีแดงดังนี้ กรุณาทำการตรวจซ้ำด้วยชุดตรวจชุดใหม่
ไม่สัมผัส ล้วงแคะแกะเกา หน้าตา จมูก ปากและหน้ากาก ถ้ายังไม่ล้างมือ
เขตสุขภาพที่ 5 ราชบุรี นครปฐม เพชรบุรี ประจวบฯ
สำนักงานป้องกันควบคุมโรคที่ 5 จังหวัดราชบุรี
-เบอร์โทรศัพท์: 032 338 580, 032 321 512
-เว็บไซต์: https://ddc.moph.go.th/odpc5/ (ยังไม่เปิดให้บริการ)
นครปฐม
- สำนักงานสาธารณสุขจังหวัดนครปฐม
เบอร์โทรศัพท์: 034 213 279
เว็บไซต์: http://nptho.moph.go.th/
ประจวบคีรีขันธ์
- โรงพยาบาลประจวบคีรีขันธ์
เบอร์โทรศัพท์: 032 601 060
เว็บไซต์: http://pkhospital.go.th/
เพชรบุรี
- สำนักงานสาธารณสุขจังหวัดเพชรบุรี
เบอร์โทรศัพท์: 032 400 099
เว็บไซต์: http://www.pbro.moph.go.th/โรงแรม Bangkok City Suit เปิดบริการ Hospitel ร่วมกับ โรงพยาบาลบางปะกอก 1
โรงพยาบาลบางปะกอก 1 ร่วมกับโรงแรม Bangkok City Suit ให้บริการ กับผู้ป่วยในย่านฝั่งธนบุรี ที่มีผลตรวจยืนยันว่าติดเชื้อโควิด-19 และยังหาเตียงไม่ได้ โทรสอบถามเพิ่มเติมได้ที่ 02-109-1111 ต่อ 1119 ,1120 ประชาสัมพันธ์
จังหวัดชัยนาท เปิดรับลงทะเบียนวัคซีนโควิด-19 แบบเข็ม 3 LINK
สาธารณสุขจังหวัดชัยนาท ประกาศเปิดรับลงทะเบียนวัคซีนโควิด-19
1. กรณีรับเข็มที่ 3 เป็น AstraZeneca สำหรับกลุ่มเป้าหมายผู้รับวัคซีน Sinovac เข็มที่ 1+2 (ครบ 2 เข็ม)
2. ผู้รับวัคซีน Pfizer เข็มที่ 1, 2 กลุ่มเป้าหมายผู้ที่มีอายุ 12-17 ปี ที่อยู่นอกระบบการศึกษา หรือเรียนที่สถานศึกษานอกจังหวัดชัยนาท
หมายเหตุ...สามารถติดต่อลงทะเบียนที่หน่วยบริการใกล้บ้าน
8. เร่งแก้ไขปัญหาน้ำท่วมในจุดที่วิกฤติ
เร่งแก้ไขปัญหาน้ำท่วมในจุดที่วิกฤติ ด้วยการติดตั้งเครื่องสูบน้ำชนิดเคลื่อนที่เพิ่มเติมจากเดิม
สมุทรสงคราม จัดฉีดวัคซีนให้กับกลุ่มนักเรียน ในอำเภอเมืองและบางคนที LINK
4 ตุลาคม 2564 สาธารณสุขสมุทรสงคราม ร่วมกับหน่วยการศึกษาในจังหวัดสมุทรสงคราม จัดกิจกรรมฉีดวัคซีนป้องกันโควิด-19 เป็นวันแรกให้กับกลุ่มนักเรียนในจังหวัสมุทรสงคราม โดยในเขตอำเภอเมือง รพ.สมเด็จพระพุทธเลิศหล้า ได้จัดฉีด ณ จุดฉีด วัดเพชรสมุทรฯ และเขตอำเภอบางคนที รพ.นภาลัย ได้จัดฉีด ณ จุดฉีดเทศบาลตำบลกระดังงา และหลังจากวันนี้ จะเร่งดำเนินการให้ครบเป้าหมายทั้ง 3 อำเภอ เพื่อให้ทันกับการเปิดเทอมในเดือนหน้า
แสดงผลการตรวจโดยมีชื่อระบุตัวตน และประวัติการได้รับวัคซีนจากข้อมูลในระบบ
อบจ.พะเยา ได้รับจัดสรร 15,000 โดส ยังไม่มีดำเนินการใดๆ LINK
สภากาชาดไทยได้อนุมัติจัดสรรวัคซีนป้องกันโรคโควิด19 Moderna ให้กับองค์การบริหารส่วนจังหวัด เพื่อนำไปฉีดให้กับประชาชนกลุ่มเป้าหมาย ตามที่สภากาชาดไทยกำหนด จึงได้มีการประชุมชี้แจงแนวทางการบริหารจัดการวัคซีนโควิด 19 ถึงขั้นตอนและวิธีปฏิบัติในการฉีดวัคซีนให้แก่ประชาชนตามกลุ่มเป้าหมาย ทั้งนี้ จังหวัดพะเยา โดยองค์การบริหารส่วนจังหวัดพะเยา ได้จัดทำแผนขอรับการสนับสนุนวัคซีนป้องกันโรคโควิด19 Moderna จำนวน 15,000 โดส
นครนายก ชวนเที่ยว ประเพณีลอยกระทงดอกบัว 19 พ.ย. 2564 LINK
ททท. สำนักงานนครนายก ร่วมกับชุมชนท่องเที่ยวบ้านวังต้น จัดกิจกรรมสืบสานประเพณีท้องถิ่น “สีสันแห่งสายน้ำ ประเพณีลอยกระทงดอกบัว” ณ โบสถ์เก่าวัดป่ากระทุ่ม จ. นครนายก เชิญสักการะขอพรสิ่งศักดิ์สิทธิ์ หลวงพ่อขาว วัดป่ากระทุ่มโบสถ์เก่า 200 ปี หนึ่งใน Unseen นครนายก ที่ต้องห้ามพลาด ชมมหัศจรรย์โบสถ์โบราณตั้งตระหง่านกลางบึงบัว มีผนังอิฐล้อมทั้ง 4 ด้าน โอบล้อมด้วยรากต้นไม้ สวยงามแปลกตา เปิดประสบการณ์ #ลอยกระทงดอกบัว หนึ่งเดียวในภาคตะวันออก พร้อมชมการแสดง และการละเล่นพื้นบ้าน พายเรือหัวบอดท้ายใบ้ แข่งขันต่อยมวยทะเล และฟังบรรเลงดนตรีไทย จากเยาวชนท้องถิ่น
พลุฉลองลอยกระทง 2564 บนสะพานตากสิน (MThai) LINK
ชมพลุ ฉลองลอยกระทง 2564 บนสะพานตากสิน
ในปีนี้ มีถึง 7 จุดในกรุงเทพที่ชมพลุได้ ได้แก่
1.Capella Bangkok
2.Royal Orchid Sheraton Hotel & Towers
3.Mandarin Oriental
4.The Peninsula Hotels
5.Shangri-La Bangkok
6.Anantara Riverside Bangkok up Resort และ
7.Chatrium Hotel Riverside Bangkok
*ภาพทีมงาน MThai
รพ.บางจาก เปิด walk in ฉีดสูตร AZ+PZ วันที่ 23-24 พ.ย. 64 LINK
โรงพยาบาลบางจาก ให้บริการฉีดวัคซีน-19 แบบ WALK-IN เข็มที่ 1 Pfizer + เข็มที่ 2 Pfizer (ในอีก 3 สัปดาห์ถัดไป ) ในวันที่ 23-24 พฤศจิกายน 2564 เริ่มเเจกบัตรคิว เวลา 6.00 น. จำนวน 800 คิว ณ สวนสาธารณะ เทศบาลเมืองลัดหลวงเฉลิมพระเกียรติ (ข้างวัดชมนิมิตร)
สำหรับ
1.ประชาชนที่มีอายุ 60 ปีขึ้นไปหรือผู้ป่วย 7 กลุ่มโรคเรื้อรัง
2.หญิงตั้งครรภ์ที่มีอายุครรภ์ตั้งแต่ 12 สัปดาห์ขึ้นไป
3. เด็กอายุ 12-18 ปี ที่ยังไม่เคยได้รับวัคซีนใดๆมาก่อน
กรุณาเตรียม
1. สมุดฝากครรภ์เล่มสีชมพู
2. หลักฐานเพื่อยืนยันกลุ่มผู้ป่วยโรคเรื้อรัง เช่น ใบนัดการรักษา, ยารักษาโรค หรือนำซองยาที่มีชื่อของตัวเองมาด้วย
3. บัตรประชาชนตัวจริง
4. ปากกาส่วนตัว
ดเวนย์ จอห์นสัน เดอะ ร๊อค
3 กันยายน ซุปตาร์สายบู๊ติดโควิดพร้อมภรรยาและลูกสาวทั้งสอง ซึ่งเขาบอกว่าน่าจะติดมาจากเพื่อน "เป็นช่วงเวลาที่ยากสำหรับครอบครัวจริง"
โมเดอร์นาล็อต 2 ถึงลำพูนแล้ว พร้อมฉีด 9 ธค LINK
ประกาศ (ประกาศ) โมเดอร์นา (Moderna) อบจ.ลำพูน งวดที่ 2 ถึงลำพูนแล้ว !! พร้อมจัดสรรให้แก่กลุ่มเป้าหมายที่ลงทะเบียนไว้ จำนวน 1,455 โดส เริ่มฉีด วันที่ 9 ธันวาคม 2564 เป็นต้นไป โดยจัดสรรให้แก่ 3 กลุ่มเป้าหมาย ดังนี้ ผู้สูงอายุ 70 ปีขึ้นไปที่ยังไม่เคยได้วัคซีนมาก่อน ผู้ทำงานในศูนย์เด็กเล็ก ครู รร.อนุบาล ครู/อาจารย์ ที่ยังไม่เคยได้รับวัคซีนมาก่อน บุคลากรที่ต้องปฏิบัติงานสัมผัสประชาชน สำหรับการนัดฉีดวัคซีน ผู้มีรายชื่อจะได้รับการประสานจากโรงพยาบาลประจำอำเภอตามภูมิลำเนา
NISSAN Always Cares นิสสัน บริการตรวจเช็กระยะมาตรฐานฟรี LINK
นิสสันส่งมอบความสุขช่วงส่งท้ายปี 2564 ให้กับลูกค้านิสสันทุกท่าน ผ่านแคมเปญ “Nissan Always Cares นิสสันมอบสุขส่งท้ายปี ด้วยโปรฯ ดีสุดคุ้ม” เพื่อให้ลูกค้ามั่นใจ และเตรียมความพร้อมก่อนเดินทางไกลในช่วงเทศกาลปีใหม่ที่กำลังจะมาถึงนี้
ด้วยบริการตรวจเช็กระยะมาตรฐานฟรี บริการล้างรถ ดูดฝุ่น ฉีดพ่นน้ำยาฆ่าเชื้อภายในรถยนต์ และส่วนลดพิเศษอื่น ๆ นอกจากนี้ยังได้รับสิทธิ์ในการลุ้นรางวัล อาทิ เช่น สร้อยคอทองคำหนัก 1 บาท, สร้อยคอทองคำหนัก 50 สตางค์, และรางวัลอื่น ๆ อีกมากมาย มูลค่ารวมกว่า 1.5 ล้านบาท เพียงมียอดค่าใช้จ่ายทุก ๆ 1,500 บาท ที่ศูนย์บริการนิสสันทั่วประเทศ ตั้งแต่วันนี้ - 28 กุมภาพันธ์ 2565
ไม่ประมาท การ์ดอย่าตก คุณหมอ คุณพยาบาล ฝากมา
เชื้อโควิดกลายพันธุ์ Omicron
- แพร่ระบาดได้เร็วกว่าสายพันธุ์ที่ผ่านมา 2-5 เท่า
- ผู้ติดเชื้อ Omicron ส่วนใหญ่ไม่มีอาการ หรืออาการน้อยคล้ายโรคไข้หวัด (ผู้ติดเชื้อในต่างประเทศส่วนใหญ่ไม่ต้องเข้ารับการรักษาที่โรงพยาบาล)
- ยังไม่มีรายงานผู้ติดเชื้อ Omicron เสียชีวิต
.
มาตรการป้องกัน
- ฉีดวัคซีนโควิดให้ครอบคลุมมากที่สุด ใช้มาตรการป้องกันส่วนบุคคลที่เข้มงวด เช่น สวมหน้ากาก ล้างมือ เว้นระยะห่าง และ VUCA
- ยกระดับการเฝ้าระวัง ณ ช่องทางเข้าออกประเทศ และสถานที่ท่องเที่ยว
- ทำการสุ่มตรวจคัดกรองกลุ่มเสี่ยง และผู้ป่วยไข้หวัดที่เป็นกลุ่มก้อน
- ส่งตัวอย่างเชื้อที่พบจากผู้เดินทางหรือรายที่น่าสงสัยไปตรวจหาสายพันธุ์ Omicron ที่กรมวิทยาศาสตร์การแพทย์
เช็คบริการสร้างเสริมสุขภาพป้องกันโรคทุกกลุ่มวัย LINK
เช็คบริการสร้างเสริมสุขภาพป้องกันโรคทุกกลุ่มวัยได้ที่
• เว็บไซต์ สปสช.
ทำ QR code ด้วย
• แอปพลิเคชัน สปสช. และแอปพลิเคชัน เป๋าตัง
ลงทะเบียนผ่านแอปพลิเคชัน สปสช. ไปที่กระเป๋าสุขภาพ (Health Wallet) หรือแอปพลิเคชันเป๋าตัง ไปที่ กระเป๋าสุขภาพ เพื่อตรวจสอบสิทธิประโยชน์บริการสร้างเสริมสุขภาพป้องกันโรคที่ท่านมีสิทธิได้รับ ซึ่งแต่ละคนจะต่างกันตามช่วงอายุของท่าน
วิธีการเข้ารับบริการสร้างเสริมสุขภาพ
1.ติดต่อตรงที่หน่วยบริการปฐมภูมิ เช่น รพ.สต. ศูนย์บริการสาธารณสุข คลินิกชุมชนอบอุ่น ศูนย์สุขภาพชุมชนเมืองหรือ หรือ สถานพยาบาลประจำตามสิทธิ หรือสถานพยาบาลที่ท่านไปใช้สิทธิเป็นประจำ
2.ผ่านแอปพลิเคชัน สปสช. หรือแอปพลิเคชันเป๋าตัง ไปที่ กระเป๋าสุขภาพ เพื่อดูสิทธิประโยชน์ที่ได้รับ
เฉพาะพื้นที่ กทม. ขณะนี้ สปสช.ได้นำร่อง ท่านสามารถเลือกสถานพยาบาลที่จะไปใช้บริการได้ โดยนัดหมายหรือจองคิวผ่านแอปพลิเคชัน ก่อนไปใช้สิทธิที่หน่วยบริการ
สอบถามข้อมูลเพิ่มเติมได้ที่ 1330 ตลอด 24 ชม. หรือ คลิก https://lin.ee/zzn3pU6 เพิ่มเพื่อนไลน์กับ สปสช. @nhso
Zone : 6 อยากสุขต้องสร้าง
โซนนิทรรศการความรู้บนหน้าจอขนาดย่อม โดยใช้จอเป็นระบบสัมผัสให้คุณสามารถเลือกดูได้ทั้งวีดิทัศน์และบทความเกี่ยวกับสุขภาพ ได้ทั้งความรู้และความบันเทิงไปพร้อมๆ กัน
3. วัคซีน Novavax ปลอดภัยแค่ไหน?
เช่นเดียวกับวัคซีนของโควิดส่วนใหญ่ที่เป็นวัคซีน 2 โดสที่จะต้องโดนฉีดที่ต้นแขน จากข้อมูลการศึกษา ร่างกายสามารถรับวัคซีนของ Novavax ได้ดีและปลอดภัย และคาดว่าจะมีผลข้างเคียงที่ไม่รุนแรง เช่น เจ็บบริเวณที่ฉีด ปวดศีรษะ หรือเมื่อยล้า ผู้เข้าร่วมการทดลองมักจะมีปฏิกิริยาจากการฉีดวัคซีนหลังจากได้รับโดสที่ 2 มากกว่าหลังจากโดสแรก
พร้อมไหม? ก้าวสู่ตลาด Plant-based Food
จากแรงหนุนทั้งหมดที่กล่าวมา ถือได้ว่าเป็นตัวเร่งให้ผู้ประกอบการอาหารต้องมองหาโอกาสจากตลาด Plant-based Food ซึ่งจะมีผู้ประกอบการกลุ่มไหนบ้างที่ควรขยายตลาดไปสู่ Plant-based Food นั้น จากการวิเคราะห์ของศูนย์วิจัย Krungthai COMPASS ธนาคารกรุงไทย บอกไว้ว่าPlant-based Food นั้น สามารถช่วยต่อยอดและเพิ่มโอกาสให้แก่ผู้ประกอบการในกลุ่มธุรกิจอาหารได้หลากหลายไม่ว่าจะเป็น
ธุรกิจแปรรูปเนื้อสัตว์ (Processed Meat) และผลิตภัณฑ์จากปศุสัตว์ (Animal Product) เนื่องจากธุรกิจกลุ่มนี้อยู่ในตลาดอาหารกลุ่มโปรตีนอยู่แล้ว ดังนั้นการจะต่อยอดไปสู่ตลาด Plant-
based Food จึงไม่ใช่เรื่องยาก
ธุรกิจผลิตอาหารสำเร็จรูปทั้งแบบพร้อมปรุงและพร้อมรับประทาน
เป็นกลุ่มที่สามารถพัฒนาผลิตภัณฑ์ได้หลากหลาย ตอบโจทย์ชีวิตคนรุ่นใหม่ที่เน้นสะดวก รวดเร็ว แต่ยังคงให้ความสำคัญกับเรื่องสุขภาพ
เครื่องมือไฮเทคเป็นสิ่งจำเป็นในการตรวจสอบเคมีสารสำคัญในพืชออกฤทธิ์
Siam Bio Innovation
Siam Bio Innovation ด้วยรูปลักษณ์หรูหราสวยสง่า ที่จะยกระดับผลิตภัณฑ์กัญชาทางการแพทย์ไปสู่ระดับสากล
World Medical Alliance
World Medical Alliance ในเครือ Siam Bio Innovation และ Panacee Group
สุรินทร์ ประกาศระงับการแสดงคอนเสิร์ต เมื่อใด
งานมหัศจรรย์งานช้างสุรินทร์ ประจำปี 2564 จ.สุรินทร์ กำหนดจัดขึ้นช่วงวันที่ 15-26 ธันวาคม 2564 เวลา 17.00 - 20.30 น. ในงานมีการแสดงต่างๆ รวมการแสดงดนตรี ผู้ที่จะเข้าไปเที่ยวชม ต้องมีผลตรวจ ATK ไม่เกิน 72 ชั่วโมง หรือฉีดวัคซีนอย่างน้อย 1 เข็ม หากท่านใดยังไม่ฉีดวัคซีน เรามีบริการฉีดวัคซีนให้ภายในงาน
วันที่ 18 ธันวาคม ผู้ว่าราชการจว.สุรินทร์ นายสุวพงศ์ กิติภัทย์พิบูลย์ ออกประกาศงดการจัดคอนเสิร์ตภายในงาน เป็นเวลา 2 วัน คือวันที่ 18-19 ธันวาคม ด้วยเหตุผลที่ทางผู้จัดไม่สามารถบริหารจัดการให้เป็นไปตามมาตรการที่กระทรวงสาธารณสุขกำหนดได้ คณะกรรมการโรคติดต่อเสนอได้ประชุมและมีมติ งดจัด
ต่อมา 20 ธันวาคม ได้มี
คำสั่งอีกครั้งยกเลิกการแสดงคอนเสิร์ตในงาน ตลอดงาน ถึงวันที่ 26 ธ.ค.
จัดเต็มกับเมนูใหม่-หวานแต่น้ำตาลไม่สูง
ทั้ง 4 ร้านต่างพร้อมใจกันสร้างสรรค์เมนูที่เห็นแล้วต้องร้องว้าว ชิมแล้วติดใจ แต่ไม่ต้องกังวลเรื่องน้่ำตาลหรือไขมันมากนัก เพื่อให้ผู้ป่วยเบาหวานและครอบครัว Enjoy ได้ตลอดช่วงเทศกาล อย่างร้าน White Story ร้านอาหารสไตล์ French Pastry ที่มีเมนูเด่นเป็น Toast เพราะตัวขนมปังที่นุ่มหอมจนลูกค้าต่างตกหลุมรัก ก็ส่งเมนูขนมปังเนยเยิ้มสูตรแป้งโฮลวีทเข้าร่วมแคมเปญ “เราคิดค้นมาเป็นพิเศษให้ใช้ไขมันอิ่มตัวน้อยกว่าปกติและเลือกใช้ขนมปังไม่ขัดสีเพื่อเพิ่มใยอาหารและชะลอการดูดซึมน้ำตาล เพื่อไม่ให้ผู้ป่วยเบาหวานที่รับประทาน น้ำตาลในเลือดขึ้นสูงเกินไป”
คุณไพโรจน์ จงประสานวงศ์ ผู้บริหาร White Story กล่าวถึงเมนูขนมที่คิดค้นสูตรพิเศษโดยเฉพาะจากทางร้าน
เหลืองระย้าดอกคูน สัญลักษณ์แดนอีสานที่ อ.จตุรัส ชัยภูมิ
ถนนสายดอกคูน เกาะกลางถนน 201 สายชัยภูมิ-สีคิ้ว ช่วง อ.จตุรัส จ.ชัยภูมิ มีระยะทางยาวประมาณ 30 กม.
คลินิกอุ่นใจ ภูเก็ต - โทร 076-254200 ประสานงานแบบจุดเดียวจบ ผู้ที่มีผล ATK เป็นบวก LINK
"คลินิกอุ่นใจ" ภูเก็ต - ศูนย์บริหารจัดการผู้ติดเชื้อโควิดแบบครบวงจร โทร 076-254200
ให้บริการติดต่อ สอบถาม ประสานงานแบบจุดเดียวจบ สำหรับผู้ที่มีผล ATK เป็นบวกจะได้รับการตรวจยืนยัน, ให้บริการตรวจ/วินิจฉัย/รักษา ตรวจทางห้องปฏิบัติการและตรวจทางรังสีเบื้องต้นโดยบุคลากรทางการแพทย์เฉพาะทางแต่ละสาขา, ในรายที่สามารถกักตัวที่บ้าน ที่ชุมชน ที่โรงแรม จะมีทีมงานดูแลรักษาตามอาการเบื้องต้น รวมถึงให้ยาฟาวิพิราเวียร์ในรายที่จำเป็นพร้อมติดตามอาการและให้คำปรึกษาทุกวัน
สปส. กรุงเทพมหานครพื้นที่ 6 LINK
เลขที่ 140/1 อาคารทาคูนิชั้น 4-5 ถนนกาญจนาภิเษก แขวงบางแค เขตบางแค กทม. 10160
** จุดสังเกต : ซอยโครงการบ้าน "The Plant" (เดอะ แพล้นท์) **
รับผิดชอบเขต ตลิ่งชัน ทวีวัฒนา บางแค ภาษีเจริญ หนองแขม
แผนที่
Tel. 02-4556768, 02-4556771, 02-4556770, 02-4556769, 02-4554897
Fax 02-4558989, 02-4554896
ฝ่ายอำนวยการ 02-4558989 ต่อ 5112-
งานสิทธิประโยชน์ทดแทน 02-4558989 ต่อ 2152-21
งานการเงินและบัญชี 02-4558989 ต่อ 421-424
งานเงินสมทบ 02-4558989 ต่อ 135-143
งานทะเบียนและประสานการแพทย์ 02-4558989 ต่อ 328-334
ศาสตราจารย์ ดร. ปีเตอร์ คุลลิส สำเร็จการศึกษาดุษฎีบัณฑิตจากมหาวิทยาลัยบริทิชโคลัมเบีย ประเทศแคนาดา และทำงานวิจัยด้านชีวเคมีของไขมันที่มหาวิทยาลัยนี้ตลอดมาจนปัจจุบัน
ศาสตราจารย์ ดร. ปีเตอร์ คุลลิส เป็นผู้บุกเบิกงานด้านอนุภาคไขมัน ลิปิดนาโนพาร์ติเคิล ซึ่งมีการใช้ในทางการแพทย์ในลักษณะต่างๆ เช่นการนำส่งยาต้านมะเร็งไปยังเนื้อเยื่อมะเร็งโดยไม่ทำให้เกิดพิษต่อเนื้อเยื่อปกติ และอนุภาคไขมันที่ศาตราจารย์คุลลิสพัฒนาที่น่าสนใจมากที่สุดได้แก่ อนุภาคไขมันที่มีไขมันที่สามารถทำให้มีประจุบวกได้ โดยไขมันดังกล่าวไม่มีประจุเมื่ออยู่ในสภาพความเป็นกรดด่างที่เป็นกลาง แต่จะมีประจุบวกเมื่ออยู่ในสภาพเป็นกรด อนุภาคไขมันเหล่านี้ไม่ทำปฏิกิริยาและไม่เป็นพิษต่อเซลล์เนื่องจากไม่มีประจุ แต่เมื่อถูกนำเข้าสู่เซลล์ภายในเอนโดโซมซึ่งมีสภาพเป็นกรดก็จะเปลี่ยนเป็นมีประจุบวก ซึ่งจะทำให้หลอมเชื่อมกับเยื่อไขมันของเซลล์ที่มีประจุลบ การหลอมเชื่อมของเยื่อไขมันดังกล่าวทำให้มีการนำส่งส่วนประกอบภายในของอนุภาคไขมันเช้าสู่ไซโตปลาสซึมของเซลล์ วิธีการดังกล่าวได้มีการนำมาใช้ในการพัฒนาวัคซีนชนิดเมสเซนเจอร์อาร์เอนเอ ซึ่งกำลังใช้ในการควบคุมการแพร่จะบาดของโรคโควิด 19 อยู่ในปัจจุบัน
ผลงานของศาสตราจารย์ ปีเตอร์ คุลลิส นอกจากจะทำให้มีการพัฒนาวัคซีนโควิด-19 ได้สำเร็จแล้ว ยังทำให้มีวิธีการที่จะนำกรดนิวคลิอิกเข้าสู่เซลล์ได้อย่างปลอดภัย ซึ่งเปิดความเป็นไปได้อีกมากมายในการนำเทคโนโลยีกรดนิวคลิอิคมาใช้ในการป้องกันและรักษาโรคต่างๆ ในอนาคต ก่อประโยชน์ต่อสุขภาพอนามัย และชีวิตของมนุษย์หลายร้อยล้านคนทั่วโลก
ทางเข้าที่ต่างกันสำหรับสุนัขตัวใหญ่และตัวเล็ก
ยาขิง บรรเทาอาการท้องอืด ท้องเฟ้อ ขับลม แก้จุกเสียดท้อง LINK
ข้อบ่งใช้
1. บรรเทาอาการท้องอืด ขับลม แน่นจุกเสียด
2..ป้องกันและบรรเทาอาการ คลื่นไส้อาเจียน จากการเมารถ เมาเรือ
3. ป้องกันอาการคลื่นไส้อาเจียนหลังการผ่าตัด
ข้อควรระวัง
1.ควรระวังการใช้ร่วมกับสารกันเลือดเป็นลิ่ม (anticoagulants) และยาต้านการจับตัวของเกล็ดเลือด (antiplatelets)
2. ควรระวังการใช้ในผู้ป่วยโรคนิ่วในถุงน้ำดี ยกเว้นภายใต้การดูแลของแพทย์
3.ไม่แนะนำให้รับประทานในเด็กอายุต่ำกว่า 6 ขวบ
อาการไม่พึงประสงค์
อาการแสบร้อนบริเวณ ทางเดินอาหาร อาการระคายเคืองบริเวณปากและคอ
6. จดทะเบียนสมรสหมู่และบายศรีสู่ขวัญ ณ อ.บ่อเกลือ น่าน 14 กุมภาพันธ์ 65 LINK
อำเภอบ่อเกลือขอเชิญคู่รักร่วมกิจกรรม เนื่องในวันแห่งความรัก 14 กุมภาพันธ์ 2565
เวลา 11.11 น. จดทะเบียนสมรสหมู่และบายศรีสู่ขวัญคู่รัก ณ เวทีกลาง สะพานไม้ไผ่ บ้านบ่อหลวง ร่วมถ่ายภาพ Pre-wedding / Post-wedding ณ แลนด์มาร์คริมน้ำมาง บ้านบ่อหลวง ตลอดทั้งวัน เวลา 17.30 น. เป็นต้นไป กิจกรรมรำวงคนมีความฮัก ณ เวทีกลาง สะพานไม้ไผ่ บ้านบ่อหลวง
พบกัน ณ บ้านบ่อหลวง หมู่ที่ 1 ต.บ่อเกลือใต้ อ.บ่อเกลือ จ.น่าน
คู่รักที่สนใจโปรดลงทะเบียนล่วงหน้า ฟรี!!! โทร : 0-5477-8135 / 0-5477-8062 คู่รักที่ลงทะเบียนเข้าร่วมกิจกรรมทุกคู่ จะได้รับของชำร่วยสุดพิเศษจากอำเภอบ่อเกลือ
* คู่รักที่เข้าร่วมกิจกรรมบายศรีสู่ขวัญ ต้องแสดงหลักฐานการตรวจ ATK ภายใน 72 ชั่วโมง *
** ผู้เข้าร่วมกิจกรรมรำวง ต้องแสดงหลักฐานการฉีดวัคซีนต่อเจ้าหน้าที่ ณ จุดคัดกรอง **
วรัตม์กิตติ์ คลินิก กายอุปกรณ์ ขาเทียม LINK
คลินิก กายอุปกรณ์ ขาเทียม แผ่นเสริมฝ่าเท้า ดูแลและให้คำปรึกษาโดยผู้เชี่ยวชาญทางด้านกายอุปกรณ์ มีใบรับรองประกอบโรคศิลปะ สาขา วิชาชีพกายอุปกรณ์
เบอร์โทรติดต่อเพื่อนัดหมาย :020192452
3) Collaboration of Expertise ผสานความชำนาญทีมแพทย์สหสาขา
Collaboration of Expertise การทำงานร่วมกันของทีมแพทย์ผู้ชำนาญการในหลากหลายสาขาและสหสาขาวิชาชีพ เพื่อร่วมกันให้การบริบาลผู้ป่วยเพื่อผลลัพธ์ของการรักษาที่ดีที่สุด ตัวอย่างที่ชัดเจน คือการตรวจวินิจฉัยโรคหายาก (Rare Disease) ซึ่งเป็นกลุ่มของโรคที่พบจำนวนผู้ป่วยไม่มากในแต่ละโรค ทำให้มีความยากในการตรวจวินิจฉัย จึงจำเป็นที่ต้องอาศัยความร่วมมือจากแพทย์ บุคลากรทางการแพทย์ที่มีความชำนาญเฉพาะทางหลากหลายสาขา เพื่อประชุมร่วมกันเพื่อหาแนวทางการตรวจวินิจฉัยและการรักษาที่เหมาะสมกับอาการโรคของผู้ป่วย ซึ่งส่วนใหญ่กว่าร้อยละ 80 เป็นโรคทางพันธุกรรมที่ส่งต่อกันมาทางสายเลือดในครอบครัว อาทิ กลุ่มโรคแอลเอสดี กลุ่มโรคกล้ามเนื้ออ่อนแรง
สถานการณ์โรคไข้หวัดใหญ่ในประเทศไทย
สำหรับสถานการณ์โรคไข้หวัดใหญ่ในประเทศไทย จากรายงานล่าสุดของกรมควบคุมโรค ระหว่างวันที่ 1 มกราคม 2565 – 23 กุมภาพันธ์ 2565 พบผู้ป่วยไข้หวัดใหญ่ 660 ราย ซึ่งเป็นโรคที่สามารถติดเชื้อได้ทุกฤดูกาลตลอดทั้งปี ส่วนใหญ่ยังคงพบในกลุ่มเด็กเล็กอายุ 0-4 ปีมากที่สุด ถึงแม้จะดูว่าตัวเลขผู้ป่วยยังไม่มากนัก แต่แพทย์ต่างก็มีความกังวลว่าในอีกไม่กี่เดือนข้างหน้าที่กำลังเข้าสู่การระบาดในฤดูฝน ในเดือนพฤษภาคม ซึ่งจะมีอากาศเย็นและชื้น ทำให้เชื้อไวรัสต่างๆ รวมถึงไวรัสโควิด-19 แพร่กระจายได้มากขึ้นและมีชีวิตอยู่นานขึ้น อาจส่งผลให้มีจำนวนผู้ป่วยไข้หวัดใหญ่ที่จำเป็นต้องนอนโรงพยาบาลเพิ่มมากขึ้น ขณะที่จำนวนผู้ป่วยโควิด-19 ที่รักษาตัวในโรงพยาบาลก็มีแนวโน้มสูงขึ้นเช่นกัน ขณะเดียวกันยังเป็นช่วงที่นักท่องเที่ยวต่างชาติทยอยเดินทางเข้ามาประเทศไทยมากขึ้นหลังจากที่มีการเปิดประเทศ ยิ่งไปกว่านั้นยังตรงกับช่วงเวลาที่โรงเรียนทั่วประเทศเปิดเทอมภาคการศึกษาใหม่ ทำให้ยิ่งเพิ่มโอกาสเสี่ยงต่อการติดเชื้อร่วมกันทั้งโรคไข้หวัดใหญ่และโรคโควิด-19 ในเวลาเดียวกัน (หรือที่เรียกว่า Co-Infection หรือ Flurona) ซึ่งอาจส่งผลให้ผู้ป่วยโดยเฉพาะในกลุ่มเสี่ยงมีอาการรุนแรงมากขึ้น
จากสถิติที่ผ่านมาเด็กจะมีโอกาสติดเชื้อไข้หวัดใหญ่มากกว่าผู้ใหญ่ได้ถึง 4 เท่า เนื่องจากมีภูมิคุ้มกันต่ำ รวมถึงพฤติกรรมของเด็กโดยธรรมชาติที่มักขาดความระมัดระวัง ทั้งน้ำลาย น้ำมูก ไอจามรดกัน และไม่ชอบล้างมือ ยิ่งไปกว่านั้นในกลุ่มเด็กและทารกยังมีความเสี่ยงที่จะเกิดโรคแทรกซ้อนจากไข้หวัดใหญ่ได้มากกว่าการติดเชื้อโควิด-19 ขณะเดียวกัน ในกลุ่มสตรีมีครรภ์ เมื่อเป็นไข้หวัดใหญ่จะมีโอกาสต้องนอนในโรงพยาบาลมากกว่าหญิงตั้งครรภ์ที่ไม่ติดเชื้อไข้หวัดใหญถึง 4 เท่า และหากเป็นไข้หวัดใหญ่มักมีอาการรุนแรง สามารถส่งผลกระทบต่อการตั้งครรภ์ เช่น การคลอดก่อนกำหนด อาจรุนแรงถึงขั้นสูญเสียการตั้งครรภ์ หรือเสียชีวิตได้ทั้งแม่และลูก ฉะนั้นคุณแม่ที่อยู่ในช่วงตั้งครรภ์ จึงควรป้องกันด้วยการฉีดวัคซีนไข้หวัดใหญ่โดยเร็วที่สุด เพื่อส่งต่อความคุ้มครองให้ทารกแรกเกิดได้ตั้งแต่วันแรกที่คลอด เพราะทารกจะฉีดวัคซีนไข้หวัดใหญ่ไม่ได้จนกว่าจะอายุครบ 6 เดือน แต่จะเป็นภูมิคุ้มกันจากแม่ที่ส่งต่อถึงลูกให้ได้รับการปกป้องอาการรุนแรงจากไข้หวัดใหญ่
ศูนย์การแพทย์สมเด็จพระเทพรัตน์ SDMC.mahidol.ac.th 270 ถนนพระรามที่ 6 แขวงทุ่งพญาไท เขตราชเทวี กรุงเทพมหานคร 10400 โทรศัพท์ 0-2201-1000, 0-2200-3000 กด 1
บทบาทของสปสช. กับการดูแลผู้ป่วยโรคไบโพลาร์
สำหรับบทบาทของ สปสช. นพ. จเด็จ ธรรมธัชอารี เลขาธิการ สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กล่าวว่า "เนื่องด้วยผู้ป่วยโรคไบโพลาร์และผู้ป่วยจิตเวชอื่นๆ เป็นกลุ่มที่เปราะบางที่สุด ต่างจากโรคอื่นๆ ที่จะพยายามเข้ารับการรักษา ขณะที่ผู้ป่วยกลุ่มนี้มักจะแยกตัวออกจากสังคมและครอบครัว แต่สิ่งหนึ่งที่เชื่อว่าจะมีบทบาทสำคัญในอนาคต คือ การใช้ระบบการรักษาทางไกล (Telemedicine) หรือทางจิตเวชเรียกว่า Telepsychiatry สำหรับในส่วน สปสช. ซึ่งมีหน้าที่ในการสนับสนุนงบประมาณ กองทุนก็ได้จัดงบประมาณเพิ่มเติมให้หลังจากที่ริเริ่มหน่วยบริการรักษาทางไกลเข้ามา ในส่วนการให้บริการทางไกลของโรคไบโพลาร์นั้น จะให้บริการทั้งกับตัวผู้ป่วยเอง หรือญาติผู้ป่วย ซึ่งอาจจะมีการใช้กลไกทางสังคม เช่น อาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) โรงพยาบาลส่งเสริมสุขภาพตำบล (รบสต.) หรือโรงพยาบาลชุมชน เข้ามาผนวกกัน และหากต้องการเบิกจ่ายในส่วนบริการทางไกลให้ง่ายและสะดวกขึ้น สามารถติดต่อได้ที่ สปสช. โดยจะมีทีมลงไปดูแลในส่วนของระบบทางไกลโดยจะผูกเชื่อมต่อกับกลไกทางการเงินที่ สปสช. ได้ให้การสนับสนุน"
รพ.เจ้าพระยา เปิด walk in ฉีดโมเดอร์นา เข็มละ 1,650
รพ.เจ้าพระยา เปิดบริการฉีดวัคซีนโมเดอร์นา แบบวอล์คอิน ตามวันที่รพ.เปิดให้บริการ (ตามภาพ) สำหรับเดือนเมษายน จะมีบริการวันที่ 1, 4,6, 21 และ 29 เมษายน สอบถามเพิ่มเติม ติดต่อ แผนก Call Center 024335666
รพ.เจ้าพระยา บริการตรวจโควิด-19 แบบ Drive Thru 3,500
โรงพยาบาลเจ้าพระยา บริการตรวจโควิด-19 แบบ Drive Thru ตรวจวิธี Real-Time RT-PCR ราคา 3,500 บาท ทุกวัน เวลา 08.00-17.00 น. สอบถามรายละเอียดบริการ 02-433-5666 และ 02-433-8222
โรงพยาบาลวิภาวดีร่วมกับโรงแรมปริ๊นส์ตั้น บริการ Hospitel สำหรับผู้ที่ ATK บวก!!
โรงพยาบาลวิภาวดีร่วมกับโรงแรมปริ๊นส์ตั้น บริการ Hospitel (กักตัวที่โรงแรม) สำหรับผู้ที่ ATK บวก!! สำหรับผู้ที่มีสิทธิบัตรทอง 30 บาท และสิทธิข้าราชการ (กรมบัญชีกลาง) พร้อมอาหาร 3 มื้อ ไม่มีค่าใช้จ่าย
1. ATK มีผลเป็นบวก (2ขีด)
2. ตรวจคอนเฟิร์มด้วย ATK จาก รพ.อีกครั้ง (ไม่มีค่าใช้จ่าย)
3. นัดหมายไป Hospitel
หากท่านมีความประสงค์จะกักตัวที่ Hospitel หรือทำ Home Isolate เพื่อให้เจ้าหน้าที่ติดต่อกลับ
สอบถามข้อมูลเพิ่มเติมหรือจองห้องพัก Line ID: @V-COVID โทร.02-561-1111 ต่อ 1305 ตั้งแต่เวลา 08.00-18.00 น. ทุกวัน
โรงพยาบาลวิภาวดี โปรแกรมตรวจประเมินสุขภาพหลังติดเชื้อ Covid-19
เมื่อ Covid-19 ก็เป็นแล้ว บางคนถึงขนาดเป็นซ้ำก็แล้ว หมดกังวลกับสุขภาพหลังติด covib-19 ด้วยโปรแกรมตรวจสุขภาพหลังติดเชื้อ Covid-19 ทั้งระดับ เขียว เหลือง แดง สุดคุ้ม เมื่อซื้อผ่าน online ภายใน 31 ก.ค นี้เท่านั้น ราคา 1,805 - 9,310 บาท จากราคา 1,900 -9,800 บาท สอบถามรายละเอียดเพิ่มเติมได้ที่ ศูนย์สุขภาพและอาชีวอนามัย โรงพยาบาลวิภาวดี โทร.02-561-1111 ต่อ 2110, 2111
ข้อแนะนำ
- ท่านสามารถตรวจสุขภาพโปรแกรมประเมินสุขภาพหลังติด Covid-19 เมื่อกักตัวหรือรักษาตัวครบ 14 วัน
- ผู้ป่วยสีเขียว : ไม่ต้องงดอาหารและเครื่องดื่ม
- ผู้ป่วยสีเหลือง หรือ แดง : ต้องงดอาหารและเครื่องดื่ม (ยกเว้นน้ำเปล่าดื่มได้เล็กน้อยและยาที่รับประทานประจำ)
-รวมค่าแพทย์และค่าบริการโรงพยาบาลแล้ว
รพ.จุฬารัตน์ 3 อินเตอร์ ให้บริการ Moderna 1,650 บาท/เข็ม
โรงพยาบาลจุฬารัตน์ 3 อินเตอร์ เปิดให้บริการจองวัคซีน Moderna ทั้งแบบจอง และ walk in เข้ารับบริการได้ทุกวัน ตั้งแต่เวลา 08:00-17:00 น. สอบถามเพิ่มเติม โทร 085-111-2092 หรือ 02-033-2900 ต่อ 5076-5079
นวมินทร์ 9 ร่วมกับ 3 เจ.คอร์ต เตรียม Hotel Isolation คนไทยทุกสิทธิ์ Tel: 02-518-1818 Line @nv9covid
โรงพยาบาลนวมินทร์ 9 ร่วมกับ 3 เจ.คอร์ต Hotel Isolation สำหรับคนไทยทุกสิทธิ์ ที่มีผล ATK เป็นบวก พักรักษา พร้อมอาหาร “ไม่เสียค่าใช้จ่าย”
เงื่อนไขการพักไม่เสียค่าใช้จ่าย ตามนโยบาลปัจจุบันของรัฐบาล จนกว่าจะมีการเปลี่ยนแปลง
สอบถามข้อมูลเพิ่มเติม โรงพยาบาลนวมินทร์9 Tel: 02-518-1818 หรือ Line @nv9covid หรือ
https://lin.ee/uWbl4MZ
รพ.ให้บริการตรวจ Covid-19 (ATK) ไม่มีค่าใช้จ่าย เปิดรับ Walk in รับบัตรคิว ตั้งแต่เวลา 06.00 น. จำกัดประมาณ 200 คิว/วัน
แพทย์ผู้เชี่ยวชาญท่านที่สี่ : ศาสตราจารย์ นายแพทย์ คีธ แบล็ค(Keith L.Black, MD, Los Angeles, California, USA)
แพทย์ผู้เชี่ยวชาญท่านสุดท้าย ศาสตราจารย์ นายแพทย์ คีธ แบล็ค(Keith L.Black, MD, Los Angeles, California, USA) ศัลยแพทย์ระบบประสาท และนักวิทยาศาสตร์ที่มีชื่อเสียง คุณหมอดำรงตำแหน่งหัวหน้าแผนกศัลยกรรมประสาทและผู้อำนวยการสถาบันศัลยกรรมประสาท Maxine Dunitz ของศูนย์การแพทย์ Cedars-Sinai ได้รับการแต่งตั้งเป็นศาสตราจารย์ ประจำสาขาประสาทวิทยา
ผลงานของคุณหมอได้รับความสนใจอย่างกว้างขวาง โดยผลงานได้รับการตีพิมพ์กว่า 400 บทความ ประวัติของท่านถูกนำมาสร้างเป็นซีรีส์ออกฉายทางโทรทัศน์ The New Explorers อีกทั้ง นิตยสาร Esquire ได้จัดให้ท่านเป็นหนึ่งใน "21 บุคคลที่สำคัญที่สุดแห่งศตวรรษที่ 21" และคุณหมอยังได้ขึ้นปกนิตยสาร TIME ฉบับพิเศษปี 1997 "Heroes of Medicines." รวมถึงอัตชีวประวัติของคุณหมอได้รับการตีพิมพ์เป็นหนังสือ Brain Surgeon ในปีพ.ศ. 2552 อีกด้วย
หนังสือเล่มนี้ คุณหมอ ได้พูดถึงความสำคัญของ สมอง ซึ่งเป็นศูนย์กลางของระบบประสาททำหน้าที่ควบคุมและสั่งการ การเคลื่อนไหว พฤติกรรม รวมไปถึงการรักษาสมดุลในร่างกาย
สมองมีการเปลี่ยนแปลงไปได้อย่างไรบ้าง เพื่อป้องกันและชะลอไม่ให้เป็นโรคอัลไซเมอร์ เพราะในปัจจุบันทั่วโลกมีผู้ป่วยภาวะสมองเสื่อมสูงถึง 50 ล้านคน และเพิ่มจำนวนขึ้นเกือบ 10 ล้านคนต่อปี ส่งผลให้มีคนเสียชีวิตจากโรคอัลไซเมอร์สูงเป็นอันดับที่ 5 ของโลก การดูแลสมองจึงเป็นเรื่องที่ต้องดูแลและให้ความใส่ใจ ไม่ว่าจะเป็นเรื่องของการรับประทานอาหาร การออกกำลังกาย การนอน การมีน้ำหนักตัวที่เหมาะสม รวมไปถึง การเรียนรู้สิ่งใหม่ๆ เพื่อให้สมองได้ทำงาน ตลอดจน การนั่งสมาธิ ซึ่งเป็นการเปิดสมองอีกแนวทางหนึ่ง
ด้วยประสบการณ์และความรู้เฉพาะด้าน ผนวกกับงานวิจัยและพัฒนาใหม่ๆ ทำให้หนังสือ “Health Brings Wealth” เป็นเสมือนกุญแจปลดล็อคสู่การมีสุขภาพดี พร้อม infographic และตัวอย่างการปฏิบัติตนที่สามารถนำไปประยุกต์ใช้ได้จริง ช่วยให้ผู้อ่านได้ความรู้และเข้าใจการดูแลสุขภาพอย่างถูกต้อง
อ.ดอนมดแดง รพ.ดอนมดแดงและรพ.สต.
15 อันดับจังหวัดที่มีผู้ป่วยรายใหม่และสะสม ตั้งแต่ต้นปี
- กรุงเทพมากที่สุดรวมแล้วกว่า 1.8 ล้านราย
- ปริมณฑล 3 จังหวัด - สมุทรปราการ นนทบุรี ปทุมธานี รวมประมาณ 1.83 แสนราย
- จังหวัดอื่นๆ เป็นจังหวัดรอบๆ กรุงเทพ และจังหวัดท่องเที่ยว/ธุรกิจที่สำคัญ ได้แก่ ชลบุรี สมุทรสาคร ภูเก็ต ขอนแก่น นครราชสีมา ระยอง นครปฐม ส่วนใหญ่มีแนวโน้มลดลง
- นครศรีธรรมราช ค่อนข้างน่าประหลาดใจที่ตัวเลขผู้ติดเชื้อพุ่งสูงมาก ติดอันดับ 4 จำนวนรวม 7.1 หมื่นราย แนวโน้มลดลง
ประชาชนในพื้นที่ อ.วังจันทร์ ติดต่อ รพ.ต่างๆ ดังนี้
ประชาชนในพื้นที่ อ.บ้านฉาง ติดต่อ รพ.ต่างๆ ดังนี้
ประชาชนในพื้นที่ อ.เขาชะเมา ติดต่อ รพ.ต่างๆ ดังนี้
วันที่ 16 เม.ย.65 - บาดเจ็บ 5 ราย เสียชีวิต 1 ราย
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 16 เม.ย.65) เกิดอุบัติเหตุ 2 ครั้ง บาดเจ็บ 5 ราย เสียชีวิต 1 ราย (อ.วัฒนานคร)
สะสม 5 วัน (11-16 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 21 ครั้ง บาดเจ็บ 22 ราย เสียชีวิต 7 ราย (อ.วังสมบูรณ์ 1 ราย อ.วัฒนานคร 2 ราย อ.ตาพระยา 2 ราย ,อ.อรัญประเทศ 1 ราย, อ.เมืองสระแก้ว 1 ราย)
ยาสมุนไพรประเภทแคปซูล
กระชายดำ กระเทียมสกัด ขมิ้นชัน ขิง ขี้เหล็ก ดอกคำฝอย เถาว์วัลย์เปรียง บอระเพ็ด บัวบก ปัญจขันธ์ พริกไทยดำ พูลคาว เพ็ชรสังฆาต ฟ้าทะลายโจร มะระขี้นก มะรุม รางจืด ส้มแขก หญ้าปักกิ่ง เหงือกปลาหมอ เห็ดหลินจือ ยาตำรับโคคลาน ยาตำรับจันทลีลา ยาตำรับตรีผลา ยาตำรับประสะไพล ยาตำรับผสมหมามุ๋ย ยาตำรับภูมิชีวา ยาตำรับลดความดัน ยาตำรับสหัสธารา ยาตำรับห้าราก
16.สิทธิของเจ้าของข้อมูลส่วนบุคคล
จากแนวคิด สู่การระดมทุน
กันยายน 2562 โดยความเมตตาของพระเดชพระคุณ พระครูปลัดบุญช่วย ปุญฺญวนฺโต เจ้าอาวาสวัดป่าภูริทัตตปฏิปทาราม เมตตาเป็นประธานฝ่ายสงฆ์ จัดให้มีการทอดผ้าป่า "กองทุนโซล่าเซลล์โรงพยาบาลบ้านตาก โดยคณะศิษยานุศิษย์หลวงปูเจี๊ยะ จุนฺโท" เชิญร่วมทำบุญเพียงท่านละ 330 บาท ทำบุญสร้างกระแสไฟฟ้า ขนาด 120 Kw ซึ่งจะช่วยลดค่าไฟฟ้าได้ถึงเดือนละ 72,000 บาท ต่อเนื่องยาวนาน 25 ปี
การระดมทุนทอดผ้าป่า ดำเนินไปด้วยดี และสัมฤทธิ์เป้าหมาย ในเดือนธันวาคมปีเดียวกันนั้น
6.การรักษาและส่งตัวผู้ป่วยไร้รอยต่อ ด้วยการบูรณาการข้อมูล
ประโยชน์คนกรุงฯ
- การรักษาพยาบาลคุณภาพดี ด้วยการส่งต่อข้อมูลและส่งตัวผู้ป่วยแบบไร้รอยต่อ
รายละเอียด
ปัจจุบันฐานข้อมูลผู้ป่วย (data patient) ภายใต้ระบบบริหารจัดการข้อมูล (HIS: Hospital Information System) ภายในสถานพยาบาลของรัฐและเอกชนถูกบริหารแยกขาดจากกัน ทำให้การส่งต่อการรักษาผู้ป่วย (refer) ตลอดจนการเปลี่ยนสถานพยาบาลจากผู้ป่วยเองทำได้ยากลำบาก ด้วยสาเหตุและอุปสรรคจากการแลกเปลี่ยนข้อมูลประวัติสุขภาพและประวัติการรักษาโรค
ดังนั้น กทม.จะผลักดันการบูรณาการฐานข้อมูลผู้ป่วยต้นแบบ โดย
- นำร่องจากการบูรณาการฐานข้อมูลระหว่างสถานพยาบาลหลักภายใต้สังกัด กทม. และเชื่อมต่อข้อมูลร่วมกับสถานพยาบาลปฐมภูมิประเภทศูนย์บริการสาธารณสุขทั่วกรุงเทพฯ
- ส่งเสริมและลงทุนการใช้เทคโนโลยีในการจัดการข้อมูล ผ่านการกำหนดมาตรฐานชุดข้อมูล (data standard set) เพื่อการบริการข้อมูลผู้ป่วย การรักษาฉุกเฉินเร่งด่วน (Emergency Medical Services: EMS) และการส่งตัวต้องไร้รอยต่อ (e-Refer)
- อนาคตจะมีการผลักดันสู่การสร้างระบบข้อมูลสุขภาพอิเล็กทรอนิกส์ (Electronic Health Record: EHR) รวมถึงการบูรณาการการจัดการระหว่างกันของสถานพยาบาล ทั้งเรื่องการบริหารจัดการเตียง (Load Capacity) และการบริหารจัดการเจ้าหน้าที่ทางการแพทย์เฉพาะทางขั้นสูงที่มีจำนวนจำกัด เป้าหมายเพื่อดูแลรักษา ป้องกันการสูญเสียและเจ็บป่วยรุนแรงในประชาชนชาวกรุงเทพฯ
ตารางแพทย์ห้องเวชกรรมฟื้นฟู
หน่วยงานรับรองมาตรฐาน 5 หน่วยงาน
หน่วยงานรัฐที่กำหนดและให้การรับรองมาตรฐาน
ข้อมูลอ้างอิง
TiHTAโครงการช่วยเหลือผู้ป่วยติดเตียงยากไร้ วัดล่ามช้าง เชียงใหม่ LINK
โครงการช่วยเหลือผู้ป่วยติดเตียงวัดล่ามช้าง นำโดยพระปลัดอานนท์ วิสุทโธ #เจ้าอาวาสวัดล่ามช้าง พร้อมสมาชิกสภาเทศบาล และกลุ่มองค์กรในจ.เชียงใหม่ ได้จัดตั้งศูนย์รับบริจาคอุปกรณ์เครื่องมือแพทย์ เพื่อนำไปให้กับผู้ป่วยยากไร้ ผู้ป่วยติดเตียง ผู้สูงอายุในพื้นที่อ.เมือง จ.เชียงใหม่ และอ.ใกล้เคียง ได้ใช้ประโยชน์ #เจ้าอาวาสวัดล่ามช้าง #เราไม่ทิ้งกัน #นึกถึงผู้ป่วยนึกถึงเรา
การบริจาคเครื่องมือแพทย์ให้กับผู้ป่วยผู้ยากไร้ ร่วมบริจาคได้ที่ เลขบัญชีธนาคารกสิกรไทย 1192963814 ชื่อบัญชีวัดล่ามช้าง
คุณพรฤดี พุทธิศรี สมาชิกสภาเทศบาลนครเชียงใหม่ โทร. 081-8822729
นพ. อลงกรณ์ เกียรติดิลกรัฐ กล่าวปิดท้ายถึงความร่วมมือในอนาคต บำรุงราษฎร์มีแนวโน้มที่จะร่วมมือกับบริษัทผู้พัฒนา Radiology AI ในประเทศเกาหลีใต้ และโรงพยาบาลชั้นนำ 20 แห่งทั่วโลก เพื่อร่วมกันพัฒนา Radiology AI เพื่อให้มีความฉลาดมากยิ่งขึ้น ตรวจพบโรคได้เร็วขึ้น มีความแม่นยำมากขึ้น และสามารถขยายขอบข่ายการทำงานในการตรวจวินิจฉัยโรคให้ครอบคลุมมากขึ้น โดยแนวทางความร่วมมือนี้ นับเป็นจุดเริ่มต้นที่สำคัญอย่างมากต่อระบบการแพทย์ยุคใหม่ ซึ่ง AI ถือเป็นตัวแปรสำคัญที่จะยกระดับความสำเร็จให้กับวงการแพทย์ในทุกภาคส่วน อีกทั้งยังช่วยส่งเสริมการมีคุณภาพชีวิตที่ดีของผู้คนทั่วโลกอีกด้วย
โรงพยาบาลลานนา 3 จ.เชียงใหม่ LINK
โรงพยาบาลลานนา 3 จ.เชียงใหม่ เป็นโรงพยาบาลเอกชนขนาดกลาง แห่งใหม่ เปิดให้บริการ กลางปี 2564 ตั้งอยู่ที่ ถนนโชตนา ซอย 12 ตำบลช้างเผือก อำเภอเมืองเชียงใหม่ จ.เชียงใหม่ เนื่องจากอยู่ในเครือโรงพยาบาลลานนา จึงมีศักยภาพที่จะรองรับการให้บริการประชาชนและผู้ประกันตนในจ. เชียงใหม่ และ จ.ลำพูน ได้ และในปีที่เปิดบริการ ได้ช่วยให้บริการและดูแลประชาชนในภาวะการระบาดของโรคโควิด ทั้งการรักษาผู้ป่วย การฉีดวัคซีน ได้เป็นอย่างดี
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลลานนา 3 สามารถรับผู้ประกันตนเพิ่มได้อีก 120,797 ราย
โรงพยาบาลลานนา 3 มีเครือข่าย สถานพยาบาลในระดับสูง ได้แก่ โรงพยาบาลลานนา และมีคลินิกเครือข่ายประกันสังคม ระดับรอง ได้แก่ คลินิกเฉพาะทางด้านเวชกรรมศัลยกรรมหมอวินัยศักดิ์ คลินิกหมอประโยชน์เวชกรรมเฉพาะทาง (สันกำแพง) หมอปรีชาคลินิกเวชกรรม และโรงพยาบาลเทพปัญญา 2
Non-Immigrant Visa "O" and "O-A"
Non-Immigrant Visa "O"
PURPOSES OF VISIT
ㆍ To stay with the family
ㆍ To stay as a diplomat’s servant
ㆍ To perform duties for the state enterprise or social welfare organizations
ㆍ To stay after retirement for the elderly
ㆍ To stay in the kingdom of Thailand as a former Thai citizen
ㆍTo receive medical treatment
ㆍ To be a contestant or witness for the judicial process.
ㆍ To stay in the kingdom as a stepfather/stepmother of Thai citizen
or as a daughter/son of stepfather/stepmother who has Thai nationality
Non-Immigrant Visa "O-A"
This type of visa may be issued to applicants aged 50 years and over who wish to stay in Thailand for a period of not exceeding 1 year without the intention of working. Holder of this type of visa is allowed to stay in Thailand for 1 year. Employment of any kind is strictly prohibited.
Who is Eligible?
ㆍ Applicant must be aged 50 years and over (on the day of submitting application).
ㆍ Applicant not prohibited from entering the Kingdom as provided by the Immigration Act B.E. 2522 (1979).
ㆍ Having no criminal record in Thailand and the country of the applicant’s nationality or residence.
ㆍHaving the nationality of or permanent residence in the country where application is submitted.
ㆍ Not having prohibitive diseases ( Leprosy, Tuberculosis, drug addiction, Elephantiasis,third phase of Syphilis) as indicated in the
Ministerial Regulation No. 14 B.E. 2535.
**Employment in Thailand is prohibited**
ช่อดอกแห้ง ก็จำหน่ายกันได้ ชั่งกันเห็นๅ
คลินิกไร้พุง โรงพยาบาลสิรินธร LINK
คลินิกไร้พุง โรงพยาบาลสิรินธร เปิดให้บริการตั้งแต่ 26 มกราคม 65 เป็นต้นมา ทุกวันพุธ เวลา 13 น. ณ คลินิกไร้พุง ชั้น 2 อาคารบริการ โรงพยาบาลสิรินธร โดยแพทย์ พยาบาล นักโภชนาการ นักกายภาพบำบัด นักจิตวิทยา แพทย์แผนไทยและแผนจีน คอยดูแลและให้บริการ
กิจกรรมที่จะได้รับ
ตรวจร่างกาย ประเมินผลเลือดจากแพทย์ผู้เชี่ยวชาญ
ประเมินภาวะสุขภาพ พฤติกรรม ความเสี่ยง
ให้คำปรึกษาการปรับเปลี่ยนพฤติกรรมสุขภาพให้เหมาะสม
ให้ความรู้ฝึกทักษะ การปรับเปลี่ยนพฤติกรรมสุขภาพที่เหมาะสมรายบุคคล
อบไอน้ำสมุนไพร ฝั่งเข็ม กดจุด โดยเมล็ดผักกาด
กิจกรรมกลุ่มเพื่อแลกเปลี่ยนประสบการณ์
เบิกค่าใช้จ่ายได้ตามสิทธิที่มี
สอบถามโทร. 02-3286901-15 ต่อ 10294 หรือ 063-3137703 (วันและเวลาราชการ)
โดยทางโรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนลได้เป็นผู้ริเริ่มนำเทคนิคการผ่าตัดเปลี่ยนข้อสะโพกเทียมแนวใหม่แบบไม่ตัดกล้ามเนื้อมาใช้ในประเทศไทยตั้งแต่ปี 2015 โดยได้ทำการผ่าตัดผู้ป่วยด้วยเทคนิคนี้ไปแล้วมากกว่า 700 ราย และประสบผลสำเร็จเป็นอย่างดี สำหรับเทคโนโลยีใหม่ในการผ่าตัดเปลี่ยนข้อสะโพกเทียมแนวใหม่แบบไม่ตัดกล้ามเนื้อ หรือ DAA (Direct Anterior Approach) นั้น ศัลยแพทย์จะใช้เทคโนโลยีการผ่าตัดด้วยคอมพิวเตอร์นำวิถีรุ่นใหม่ เรียกว่า Velys™Hip Navigation ซึ่งออกแบบมาเพื่อใช้ในการผ่าตัดเปลี่ยนข้อสะโพกเทียมแนวใหม่แบบไม่ตัดกล้ามเนื้อโดยเฉพาะ เพื่อช่วยระบุตำแหน่งของข้อสะโพกเทียมในขณะผ่าตัดให้ตรงตำแหน่งมากขึ้น เลือกขนาดและวัสดุของข้อเทียมให้เหมาะสมสำหรับแต่ละบุคคล และยังช่วยผ่าตัดให้ผู้ป่วยมีความยาวขาทั้งสองข้างให้เท่ากันหลังผ่าตัดอีกด้วย ซึ่งเทคโนโลยีตัวนี้ไม่จำเป็นต้องเจาะกระดูกของผู้ป่วยเหมือนระบบคอมพิวเตอร์นำวิถีหรือหุ่นยนต์ช่วยผ่าตัดรุ่นอื่นๆ ในอดีต ทำให้ผู้ป่วยมีการบาดเจ็บที่น้อยลงและฟื้นตัวได้ไวกว่าเดิม
นอกจากนี้ โรงพยาบาลกรุงเทพอินเตอร์เนชั่นแนล ยังเป็นผู้ริเริ่มนำข้อสะโพกเทียมรุ่นใหม่ ที่เรียกว่า Actis® Total Hip System ที่ถูกออกแบบมาโดยเฉพาะสำหรับการผ่าตัดเปลี่ยนข้อสะโพกเทียมแนวใหม่แบบไม่ตัดกล้ามเนื้อมาใช้ ซึ่งตัวข้อเทียมจะมีผิวสัมผัสที่ทำให้กระดูกเข้าไปยึดติดกับข้อสะโพกเทียมได้ดีขึ้นกว่าเดิม มีจะงอย (Collar) ที่ป้องกันไม่ให้ข้อสะโพกเทียมจมหลังผ่าตัด และลดผลแทรกซ้อนที่อาจจะเกิดขึ้นในขณะผ่าตัดลงได้ ทำให้การผ่าตัดประสบผลสำเร็จเป็นอย่างดี
เขตสุขภาพที่ 6
สมุทรปราการ
- กลุ่มงานการแพทย์แผนไทยและการแพทย์ทางเลือก สสจ.สมุทรปราการ สสจ. 0 2389 5980
- รพ.บางจาก รพช. 02-464-3002 พุธ 08.00 - 16.00 น.
- รพ.บางบ่อ รพช. 02-338-1193 อังคาร 08.30 - 15.30 น.
- รพ.บางพลี รพท 02-752-4500 พุธที่ 2 และ 4 ของเดือน 08.30 - 14.00 น.
- รพ.บางเสาธง รพช. 02-170-9332 พฤ 08.30-16.30 น.
- รพ.พระสมุทรเจดีย์สวาทยานนท์ รพช. 02-425-9407 รอยืนยัน
- รพ.สต.บ้านคู่สร้าง รพ.สต. 0 2461 1150,08 5980 4277 อ. พฤ. 13.00 - 16.00 น.
- รพ.สมุทรปราการ รพศ 02-701-8132 จันทร์ที่ 1 และ 3 ของเดือน
- สอน.บ้านคลองบางปิ้ง รพ.สต. 0 2385 6337 จ. พฤ. ศ. 08.30 - 16.30 น.
สระแก้ว
- รพ.เขาฉกรรจ์ รพช. 037 561 103
- รพ.โคกสูง รพช. 037 441 113 จ. - ศ. 08.30 - 16.00 น.
- รพ.จิตเวชสระแก้วราชนครินทร์ รพ.สังกัดกรม 037-262-995 พฤหัสบดี 08.00-16.00 น.
- รพร.สระแก้ว รพท 037-243-018 จันทร์ที่ 2 และ 4 เวลา 13.00 - 16.00 น.
- รพ.วังน้ำเย็น รพช. 037-251108-9 ต่อ 1401 วันพฤหัสบดี
- รพ.สต.ซับมะนาว รพ.สต. 0 3755 0430 อ. 08.30 - 16.00 น.
- รพ.อรัญประเทศ รพท 037-231-010 ศุกร์ที่ 2 และ 4 ของเดือน 09.00-12.00 น.
- สอน.วังสมบูรณ์ รพ.สต. 037-247477 พฤ. สัปดาห์ที่ 2 และ 3 ของเดือน 08.30 - 16.30 น.
ปราจีนบุรี
- รพ.กบินทร์บุรี รพท 037-281-196-7 อังคารที่ 1 ของเดือน 13.00 - 16.00 น.
- รพ.เจ้าพระยาอภัยภูเบศร รพศ 037-211289 จันทร์ที่ 2 และ 4 ของเดือน 08.00- 16.00 น.
- รพ.นาดี รพช. 037 289 057 รอยืนยัน
- รพ.ประจันตคาม รพช. 037 291 368 รอยืนยัน
- รพ.ศรีมหาโพธิ รพช. 037 279 204
- รพ.ศรีมโหสถ รพช. 037-276127
- รพ.สต.ลาดตะเคียน รพ.สต. 08.30 - 16.30 น.
- รพ.สต.ศาลานเรศวร รพ.สต. จ. - ศ. เวลา 08.30 - 16.30 น.
ฉะเชิงเทรา
- รพ.ท่าตะเกียบ รพช. 038-556065 จ. 13.30 - 15.30 น.
- รพ.แปลงยาว รพช. 038 589 002 รอยืนยัน
- รพ.พุทธโสธร รพศ 038-814-375 จันทร์ และศุกร์ เวลา 13.00-16.30 น.
- รพ.ราชสาส์น รพช. 038-563-069 อังคาร 08.30 -16.30 น.
- รพ.สต.บ้านหนองหว้า รพ.สต.
- สอน.ดอนฉิมพลี รพ.สต.
จันทบุรี
- รพ.แก่งหางแมว รพช. 039-308028 อังคาร 09.00 - 16.00 น.
- รพ.ขลุง รพช. 039-441-700 ศุกร์ 08.30-12.00 น.
- รพ.นายายอาม รพช. 0 3935 8226 ศ. สัปดาห์ที่ 3 13.00 น. - 16.30 น.
- รพ.พระปกเกล้า รพศ 039-319-666 ศุกร์ที่ 4 ของเดือน 12.00-16.00 น.
- รพ.มะขาม รพช. 039 389 454 จ-ศ 08.30-16.30 น.
- รพ.สต.วังใหม่ รพ.สต. 039 491 534 ศ. สัปดาห์ที่ 1 และ 3 ของเดือน
- สอน.คลองพลู รพ.สต. 039 493 527 อ. 08.30 - 12.00 น.
ตราด
- รพ.เกาะกูด รพช. สัปดาห์ละ 1 วัน
- รพ.เกาะช้าง รพช. สัปดาห์ละ 1 วัน
- รพ.เขาสมิง รพช. สัปดาห์ละ 1 วัน
- รพ.คลองใหญ่ รพช. สัปดาห์ละ 1 วัน
- รพ.ตราด รพท 039-511-040 อังคาร 13.00 - 16.30 น.
- รพ.บ่อไร่ รพช. สัปดาห์ละ 1 วัน
- รพ.แหลมงอบ รพช. สัปดาห์ละ 1 วัน
ชลบุรี
- รพ.ชลบุรี รพศ 038-931-000 พุธ สัปดาห์ที่ 2 และ 4 ของเดือน 13.00 - 15.00 น.
- รพ.บางละมุง รพท 038-411-551-2 จันทร์ที่ 2,4 ของเดือน 13.00-16.00 น.
- รพ.บ้านบึง รพช. 038-442-200
- รพ.พนัสนิคม รพท 038-460-333 อ. และ พ. 08.00 - 12.00 น.
- รพ.มะเร็งชลบุรี รพ.สังกัดกรม 038 455 456 รอยืนยัน
- รพ.สต.บ้านหัวกุญแจ รพ.สต. 038-201-472 จ. 13.00 - 16.00 น.
- รพ.สัตหีบ กม.10 รพช. 038-245051 อ. และ ศ. 13.00 - 16.00 น. (เว้นวันหยุดราชการ)
- รพ.หนองใหญ่ รพช. 033-000463-4 พ. และ ศ. 08.30 - 16.00 น.
- สอน.บ้านมาบลำบิด รพ.สต. 038-158-881 จ. พ. ศ. 13.00 - 16.00 น.
ระยอง
- รพ.แกลง รพท 038-677-533 ต่อ 176 จันทร์ที่ 2 และ 4 ของเดือน 13.00-16.00น.
- รพ.เฉลิมพระเกียรติฯ รพท 038-684444 ศุกร์ที่ 1 และ 3 ของเดือน 13.00-16.00 น.
- รพ.นิคมพัฒนา รพช. 038-038-050 จ. - ศ. เวลา 08.30 - 16.30 น.
- รพ.บ้านค่าย รพช. 038 641 005 อ และศ 13.00-16.00 น.
- รพ.ระยอง รพศ 038-611-104 พฤหัสบดีที่ 2 และ 4 ของเดือน 13.00 - 16.00 น.
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญสุขภาพแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
คลินิกรักษาผู้มีบุตรยาก และส่งเสริมสุขภาพสตรี
คลินิกรักษาผู้มีบุตรยาก และส่งเสริมสุขภาพสตรี ให้บริการด้านสุขภาพของผู้หญิงแบบองค์รวม ตรวจเช็กสุขภาพหลากหลายรูปแบบ วางแผนครอบครัว การมีบุตร และภาวะวัยทอง
โรคที่น่าจะได้ประโยชน์จากสารสกัดกัญชา กรมการแพทย์
สวนนวมินทร์ภิรมย์ เนื้อที่ 76 ไร่
สวนนวมินทร์ภิรมย์ เนื้อที่ 76 ไร่ ตั้งอยู่ ถนนศรีบูรพา เขตบึงกุ่ม เดิมเป็นพื้นที่ทะเลสาบเคหะชุมชนคลองจั่น (บึงลำพังพวย) ใช้เป็นพื้นที่รับน้ำตามโครงการแก้มลิง กรุงเทพมหานครได้ปรับปรุงเป็นสวนสาธารณะ และเปิดให้บริการเมื่อ 21 พฤศจิกายน 2553 พร้อมชื่อใหม่ "สวนนวมินทร์ภิรมย์"เปิดให้บริการทุกวัน 05.00 น. - 21.00 น. จุดเด่นในสวน อาทิ ลานไทเก็ก ลานเวทีกลางแจ้ง ลานแอโรบิก สถานีออกกำลังกาย ทางเดินทางวิ่งที่ยาวถึง 2000 เมตร ตามลักษณะของพื้นที่ที่บึงที่วางขนาบไปกับถนนศรีบูรพายาวกว่า 2 กิโลเมตรชุมชนบ้านแหลมสุพรรณ อ.บางปลาม้า จ.สุพรรณบุรี
ชุมชนบ้านแหลมสุพรรณ วิสาหกิจชุมชนท่องเที่ยววิถีชุมชนตำบลบ้านแหลม (บ้านสวนแผ่นดินแม่) โฮมสเตย์ที่จะพาคุณสัมผัสวัฒนธรรมริมน้ำแห่งเมืองสุพรรณ กับโปรแกรมล่องเรือชมวิถีไทยกับสายน้ำ ล่องเรือไหว้พระ ล่องเรือตามรอยเสด็จประพาสต้นครั้งแรก พระพุทธเจ้าหลวง วิถีไทย วิธีพุทธ วิถีชุมชนริมน้ำ ล่องเรือเที่ยวท่องล่องวิถีชุมชน ใส่บาตรพระ กินอาหาร ชิมขนม ฝืมือคนถิ่นสุพรรณ และอีกมากมาย ทางวิสาหกิจพร้อมรองรับ ทั้งเที่ยวแบบกลุ่มเล็กใหญ่ มาคู่หรือมาเดี่ยว ได้หมด และที่ดีงามคือ ตั้งแต่ กค.65 นี้ ฟรี ประกันท่องเที่ยวชุมชน วงเงินหนึ่งล้านบาท ให้กับนักท่องเที่ยวทุกคน (ยกเว้นมากับบริษัททัวร์นะ)
ที่อยู่ 147/1 หมู่ 5 ต. บ้านแหลม อ. บางปลาม้า จ.สุพรรณบุรี
ติดต่อ: คุณโสภณ พันธุ โทร 080-0737397
เทียบการเปลี่ยนแปลงไลฟ์สไตล์ / การใช้ชีวิต
ฟาร์ม 420 Forest Park ต้นกล้ากัญชา และเมล็ดพันธุ์กัญชา
ฟาร์ม 420 Forest Park จำหน่ายต้นกล้ากัญชากว่า 10 สายพันธุ์
ติดต่อ 080-1119944 (ส้ม)
ราคาต้นพันธุ์(เพศเมีย) ราคาต้นละ 450 บ.
ราคาต้นพันธุ์ (สุ่มเพศ) ราคาต้นละ 150 บ.
6.ติดโควิดแล้ว ใช้ LAAB รักษาได้หรือไม่
เมื่อไม่นานมานี้ แอสตร้าเซนเนก้าได้ประกาศผลลัพธ์จากการทดลองแท็คเคิล (TACKLE) การศึกษาระยะที่ 3 เพื่อใช้ในการรักษาผู้ป่วยโควิด-19 ที่มีอาการเล็กน้อยถึงปานกลาง ซึ่งแสดงถึงประสิทธิภาพของ LAAB ในการใช้เพื่อป้องกันการเกิดโรครุนแรง และป้องกันการเสียชีวิต โดยผลการศึกษานี้บ่งชี้ว่า LAAB สามารถมีบทบาทในการใช้รักษาโรคโควิด-19 ซึ่งต้องรอการขึ้นทะเบียนการใช้ในอนาคต
JCKelvin Hospitel โดยโรงพยาบาลธนบุรี LINK
JCKelvin Hospitel โดยโรงพยาบาลธนบุรี หอพักผู้ป่วยเฉพาะกิจดูแลผู้ป่วยโควิด กลุ่มสีเขียว เงื่อนไข
อายุ 15-70 ปี หรือ 3-15 ปี (ต้องมีผู้ปกครองพักด้วย) น้ำหนักไม่เกิน 90 กก หรือ BMI ไม่เกิน 30 ไม่มีโรคประจำตัว สอบถาม รายละเอียด เพิ่มเติม ได้ที่ 063-462-5360
“ปัจจุบันสังคมไทยมีจำนวนผู้สูงอายุเพิ่มสูงขึ้นเรื่อย ๆ ล่าสุดอยู่ที่ประมาณ 12.5 ล้านคน และเป็นผู้ป่วยติดเตียงอีก 200,000 คน ขณะที่สัดส่วนการเกิดและจำนวนประชากรวัยทำงานลดน้อยลง ทำให้การผลิตบุคลากรเพื่อดูแลผู้สูงอายุมีจำนวนน้อยตามไปด้วย ซึ่ง คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ มุ่งเน้นการผลิตบุคลากรทางการแพทย์เพื่อเข้ามาเติมเต็ม ควบคู่กับการสร้างสรรค์ผลงานวิจัย และนวัตกรรมใหม่ ๆ จึงได้เปิดสาขาวิชาเกี่ยวกับการดูแลผู้สูงอายุเข้ามาเพิ่มเติม เพื่อรองรับสังคมผู้สูงอายุ เช่น โรงเรียนวิทยาศาสตร์การแพทย์ โรงเรียนนักอัตราซาวด์ทางการแพทย์ รวมทั้งโรงเรียนรังสีเทคนิค เป็นโอกาสที่นักศึกษาจะได้เรียนรู้ภาคทฤษฎีและภาคปฏิบัติ ลงมือทำในสถานที่จริง พร้อมหยิบใช้เครื่องมือต่างๆ เตรียมความพร้อมให้คล่องตัว สามารถดูแลผู้สูงอายุได้ครบวงจร ทั้งในเรื่องกายวิภาคศาสตร์ จิตวิทยา และโภชนาการ ฯลฯ ที่นี่เป็นอาชีพแห่งอนาคต”
คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ ที่ตั้ง 906 ถนนกำแพงเพชร 6 แขวงทุ่งสองห้อง เขตหลักสี่ กรุงเทพฯ 10210 โทร.0-2576-6000 ต่อ 8753
สถานเอกอัครราชทูต ณ สิงคโปร์ ขอแจ้งเตือนคนไทย LINK
สถานเอกอัครราชทูต ณ สิงคโปร์ ขอแจ้งเตือนคนไทย ห้ามนำกัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของพืชชนิดดังกล่าว เข้ามาในประเทศสิงคโปร์ หากฝ่าฝืน มีโทษตามกฎหมายสิงคโปร์
- มีไว้ในครอบครองหรือเสพ จำคุกไม่เกิน 10 ปี ปรับไม่เกิน 20,000 ดอลลาร์สิงคโปร์ หรือทั้งจำทั้งปรับ
- ลักลอบนำเข้า ส่งออก ผู้กระทำผิดอาจได้รับโทษ ประหารชีวิต
คลินิกเวชกรรม สวท เชียงราย LINK
คลินิกเวชกรรม สวท เชียงราย
เลขที่ 810/1-3 ถนนพหลโยธิน ตำบลเวียง อำเภอเมือง จังหวัดเชียงราย 57000
เปิดทำการ : จันทร์.-ศุกร์ เวลา 09.00 – 17.00 น.
ปิดทำการ : วันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์
053-713-090
096-6975175
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 67 ทวีวัฒนา LINK
คลินิกวางแผนครอบครัว ศูนย์บริการสาธารณสุข 67 ทวีวัฒนา
ให้บริการวันพุธ เวลา 13.00 – 16.00 น. ในเวลาราชการ ยกเว้นวันหยุดนักขัตฤกษ์
โทรสอบถามเพิ่มเติม 02-4414680 – 3 กด 0 คลินิกวางแผนครอบครัวและหลังคลอด
การให้บริการ
- ให้ความรู้ คำปรึกษา เกี่ยวกับ การวางแผนครอบครัว และหลังคลอด
- ซักประวัติ การคุมกำเนิด, การคลอด, ตรวจเต้านม และสอนการตรวจเต้านมด้วยตนเอง
- ประเมินสุขภาพทั่วไป ชั่งน้ำหนัก, วัดส่วนสูง, ประเมินดัชนีมวลกาย, วัดความดันโลหิตสูง และตรวจ
ปัสสาวะ
- ให้บริการคุมกำเนิดโดยการใช้ยาเม็ดคุมกำเนิดหรือยาฉีดคุมกำเนิด
- ตรวจมะเร็งปากมดลูก และตรวจหลังคลอด
ศูนย์บริการสาธารณสุข 67 ทวีวัฒนา ตั้งอยู่ที่ : เลขที่ 3 ถนนอุทยาน แขวงทวีวัฒนา เขตทวีวัฒนา กทม 10170
ประกันสังคม พร้อมจ่ายกรณีว่างงาน แก่ลูกจ้าง บริษัท JSL ที่ถูกเลิกจ้าง LINK
นายสุชาติ ชมกลิ่น รัฐมนตรีว่าการกระทรวงแรงงาน เปิดเผยถึงกรณีที่ บริษัท เจ เอส แอล โกลบอล มีเดีย จำกัด แจ้งเลิกจ้างพนักงานบางส่วน จำนวน 89 คน โดยให้มีผลการเลิกจ้าง ตั้งแต่วันที่ 1 กรกฎาคมที่ผ่านมา ตนได้สั่งการให้สำนักงานประกันสังคม (สปส.) ลงพื้นที่ตรวจสอบข้อเท็จจริง และให้การช่วยเหลือลูกจ้างให้ได้รับสิทธิประโยชน์ทันที
ในวันนี้ (4 ก.ค.65) ได้มอบหมายให้ นางสาวบุปผา เรืองสุด รองปลัดกระทรวงแรงงาน ลงพื้นที่ติดตามการให้ความช่วยเหลือของสำนักงานประกันสังคมและกรมสวัสดิการและคุ้มครองแรงงาน ประชุมร่วมกันเพื่อหาแนวทางการให้ความช่วยเหลือลูกจ้าง รวมถึงให้คำปรึกษาแนะนำข้อกฎหมายและสิทธิประโยชน์ที่ลูกจ้างพึงจะได้รับ ณ สำนักงานสวัสดิการและคุ้มครองแรงงานกรุงเทพมหานครพื้นที่ 4
ประกันสังคม พร้อมจ่ายกรณีว่างงาน แก่ลูกจ้าง บริษัท JSL ที่ถูกเลิกจ้าง ร้อยละ 50 ระยะเวลาไม่เกิน 180 วัน พร้อมสิทธิประโยชน์คุ้มครองต่อ 6 เดือน
5 ก.ค.65 ที่กระทรวงแรงงาน ลูกจ้างบริษัท เจ เอส แอล โกลบอล มีเดีย จำกัด ที่ถูกเลิกจ้างได้มายื่นหนังสือร้องเรียนขอความเป็นธรรมกับรัฐมนตรีว่าการกระทรวงแรงงาน โดยมี นายสุรชัย ชัยตระกูลทอง ผู้ช่วยรัฐมนตรีประจำกระทรวงแรงงาน นายสุเทพ ชิตยวงษ์เลขานุการรัฐมนตรีว่าการกระทรวงแรงงาน นายสุทธิ สุโกศล ประจำสำนักเลขาธิการนายกรัฐมนตรี ปฏิบัติหน้าที่ประจำกระทรวงแรงงาน นางเธียรรัตน์ นะวะมะวัฒน์ โฆษกกระทรวงแรงงาน (ฝ่ายการเมือง) ดร.จำลอง ช่วยรอด คณะที่ปรึกษารัฐมนตรีว่าการกระทรวงแรงงาน นางสาวบุปผา เรืองสุด รองปลัดกระทรวงแรงงาน ในการนี้ นายบุญสงค์ ทัพชัยยุทธ์ เลขาธิการสำนักงานประกันสังคม ได้มอบหมายให้นางสาวลัดดา แซ่ลี้ รองเลขาธิการสำนักงานประกันสังคม นายศักดินาถ สนธิศักดิ์โยธิน ผู้ตรวจราชการกรม สำนักงานประกันสังคม พร้อมเจ้าหน้าที่สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ 9 ติดตามการให้ความช่วยเหลือ
ด้าน นางสาวลัดดา แซ่ลี้ รองเลขาธิการสำนักงานประกันสังคม ให้ข้อมูลกับสื่อมวลชนว่า ตามข้อสั่งการของนายบุญสงค์ ทัพชัยยุทธ์ เลขาธิการสำนักงานประกันสังคม เมื่อทราบข้อสรุปว่าเป็นการเลิกจ้างและบริษัทไม่ได้ปฏิบัติตามพระราชบัญญัติคุ้มครองแรงงานอย่างถูกต้อง โดยไม่ได้รับค่าบอกกล่าวล่วงหน้า อีกทั้งได้จ่ายค่าชดเชยไม่เป็นธรรม ในส่วนของประกันสังคมซึ่งมีหน้าที่ช่วยเหลือในเรื่องการจ่าย สิทธิประโยชน์กรณีว่างงานตามพระราชบัญญัติประกันสังคม พ.ศ.2533 โดยจะได้รับเงินทดแทนในระหว่างการว่างงาน ร้อยละ 50 ระยะเวลาไม่เกิน 180 วัน และยังคงได้รับความคุ้มครองตามมาตรา 38 กรณีเจ็บป่วย คลอดบุตร ทุพพลภาพ และตาย ต่อไปอีก 6 เดือน โดยไม่ต้องนำส่งเงินสมทบ สำหรับลูกจ้างที่มีอายุ 55 ปีบริบูรณ์ สามารถเบิกสิทธิประโยชน์กรณีชราภาพได้ หรือหากต้องการใช้สิทธิประกันสังคมต่อสามารถสมัครเป็นผู้ประกันตนโดยสมัครใจตามมาตรา 39 ภายใน 6 เดือนหลังสิ้นสภาพการเป็นลูกจ้าง กรณีนี้ตนจึงได้ให้คำแนะนำถึงขั้นตอนการขอรับเงินว่างงานกรณีถูกเลิกจ้าง พร้อมเอกสารประกอบที่จำเป็นรวมทั้ง เพื่ออำนวยความสะดวกแก่ลูกจ้างกลุ่มดังกล่าว ขอให้ทางบริษัทเป็นผู้รวบรวมเอกสารดังกล่าว และเร่งนำส่งสำนักงานประกันสังคมโดยเร็วเพื่อเร่งตัดจ่ายสิทธิประโยชน์ว่างงานกรณีถูกเลิกจ้างให้แก่ผู้ประกันตนโดยเร็ว
พร้อมดูแลผู้ป่วยที่ไม่สามารถใส่เครื่อง CPAP ได้
ศ. นพ. ชัยรัตน์ นิรันตรัตน์ แพทย์ชำนาญการด้านหู คอ จมูกและเวชศาสตร์การนอนหลับ โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมถึงผู้ที่มีปัญหาการนอนด้วยอาการอื่นๆ อาทิ นอนไม่หลับ นอนกัดฟัน นอนขากระตุก นอนละเมอเดินละเมอพูด โรคลมหลับ ง่วงนอนกลางวันผิดปกติ หรือภาวะนอนไม่หลับในเด็ก บำรุงราษฎร์มีทีมแพทย์ชำนาญการที่ครอบคลุมทุกสาขาที่พร้อมประเมินซักถาม หรือตรวจวินิจฉัยเพื่อหาสาเหตุ และส่งมอบให้แพทย์เฉพาะทางเพื่อการรักษาได้อย่างมีประสิทธิภาพสูงสุด
ยกตัวอย่างกรณีที่ผู้ป่วยเป็นเด็กและไม่สามารถใส่เครื่อง CPAP ได้ รวมถึงผู้ที่มีอาการภูมิแพ้ เป็นไซนัส จมูกคด ใบหน้าผิดปกติ หรือมีเพดานอ่อนหรือลิ้นไก่ยาวผิดปกติ ก็จะมีการส่งผู้ป่วยเพื่อเข้ารับรักษาที่ศูนย์หู คอ จมูก, ศูนย์ทันตกรรม หรือศูนย์สุขภาพทางจิต ซึ่งบำรุงราษฎร์มีวิธีการรักษาที่หลากหลาย เช่น การรักษาด้วยยา การรักษาด้วยคลื่นวิทยุ การผ่าตัดปกติและการผ่าตัดด้วยเลเซอร์ การผ่าตัดต่อมอะดีนอยด์ การผ่าตัดต่อมทอนซิล การใส่เครื่องมือทางทันตกรรม การจัดฟัน ดึงกราม หรือการปรับความคิดและพฤติกรรมบำบัด ทั้งนี้เพื่อการรักษาแก้ไขให้ตรงจุดก่อน ซึ่งจะมีการติดตามผลการรักษา แต่หากยังพบปัญหาการนอนอยู่ โดยเฉพาะนอนกรนหยุดหายใจขณะหลับ แพทย์ก็จะทำการรักษาด้วยวิธี CPAP เป็นขั้นตอนของการรักษาต่อไป
Chopaka.Shop
CHOPAKA อาณาจักรเยลลี่กัญชาเจ้าแรกย่านอโศก ขนมเยลลี่เทอปีนส์ สีสดสวยน่าเคี้ยว เจ้าของร้านคุณ Kitty Chopaka คนดัง บนถนนสุขุมวิท ถัดจากแยกอโศกไม่ไกล
ภารกิจขับเคลื่อน BDMS Wellness Clinic สู่ Wellness Tourism
“เราอยากทำ BDMS Wellness Clinic ให้เป็นโมเดลธุรกิจท่องเที่ยวเชิงสุขภาพและการพักผ่อน ยูนิคอร์นใหม่ที่จะช่วยขับเคลื่อนเศรษฐกิจในยุคโควิด”เพราะไทยมีศักยภาพในการส่งเสริมให้เป็นศูนย์รวมของ Wellness tourism อย่างมาก แต่การจะทำให้ประสบความสำเร็จและกลายเป็นศูนย์กลางการท่องเที่ยวเชิงสุขภาพ ใครคนใดคนหนึ่งหรือหน่วยงานใดหน่วยงานหนึ่ง ไม่สามารถทำเพียงลำพังได้ ต้องอาศัยความร่วมมือจากทุกคนทุกหน่วยงานและทุกฝ่ายไม่ว่าจะเป็นผู้ประกอบการธุรกิจ นักวิชาการ ประชาชน เจ้าของพื้นที่หรือคนในท้องถิ่นนั้นๆ ตลอดจนกระทั่งภาครัฐบาล รวมไปถึงนโยบายต่างๆ ต้องร่วมกันคนละไม้คนละมือ ผลักดันให้ประเทศชาติเราเป็นที่น่าดึงดูด ให้คนทั้งโลกมาท่องเที่ยวและได้รับสุขภาพที่ดีทั้งกายและใจกลับไป
“คุณอาริญา ปราสาททองโอสถ” ประธานผู้บริหารโรงแรมเซเลส สมุย (Celes Samui) หญิงเก่งวิสัยทัศน์ไกล เล่าถึงจุดเริ่มต้นของการผนึกความร่วมมือระหว่าง BDMS Wellness Clinic และ Celes Samui ก่อนผลักดันสู่ Wellness Tourism
อันดับที่ 6 รพ.ธนบุรี 82.64%
โรงพยาบาลธนบุรี อีกหนึ่งโรงพยาบาลชั้นนำในฝั่งธนบุรีที่ติด Top10 นั่นคือความยอดเยี่ยมที่ไม่อาจปฏิเสธ จากเมื่อแรกเปิดให้บริการประชาชนในฝั่งธนบุรี ตั้งแต่ปี 2519 ด้วยเจตนารมย์ในดูแลและแบ่งเบาภาระของโรงพยาบาลศิริราชที่เป็นโรงพยาบาลหลักแห่งเดียวของฝั่งธนในยุคนั้น จนุึงวันนี้ กว่า 40 ปีแห่งการพัฒนาจนก้าวขึ้นมาเป็นโรงพยาบาลชั้นแนวหน้าของประเทศ ด้วยวิสัยทัศน์และความชำนาญของผู้บริหาร ปัจจุบันโรงธนบุรีอยู่ภายใต้การบริหารของ ธนบุรี เฮลท์แคร์ กรุ๊ป จำกัด (มหาชน) มีเครือข่ายโรงพยาบาล ศูนย์บริการสุขภาพ และบริษัทในเครือรวมกันในทุกภาคกว่า 30 แห่ง เป็นเครือโรงพยาบาลที่มีการเติบโตที่รวดเร็วแห่งหนึ่งของประเทศไทย
งานลานนาพฤกษชาติครั้งที่ 40 วันที่ 11 – 14 สิงหาคม 2565 ณ ข่วงพิพิธภัณฑ์พื้นถิ่นล้านนาและลานอนุสาวรีย์สามกษัตริย์
ขอเชิญร่วมงานลานนาพฤกษชาติครั้งที่ 40
11 – 14 สิงหาคม 2565 ตั้งแต่เวลา 10.00 – 22.00 น.
ณ ข่วงพิพิธภัณฑ์พื้นถิ่นล้านนาและลานอนุสาวรีย์สามกษัตริย์
พบกับ…นิทรรศการ
• การแสดงนิทรรศการพระราชกรณียกิจสมเด็จพระนางเจ้าสิริกิติ์
พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง
• นิทรรศการจัดสวนกล้วยไม้
• นิทรรศการจัดสวนบอนไซ ทรงมาตรฐาน
การประกวด
• การประกวดจัดสวนกล้วยไม้
• การประกวดไม้ดอก–ไม้ประดับ
• การแข่งขันการจัดประติมากรรมดอกไม้ ภายใต้แนวคิด “แสงแห่งรัก”
กิจกรรมอื่นๆ
• การจำหน่ายผลผลิตของเกษตรกร
• การแสดงดนตรียามเย็น
• อิ่มอร่อยกับ “กาดหมั้วแสงเทียน”
• การแสดงแฟชั่นโชว์ จาก Designer Club Member (14 สิงหาคม)เวลา 19.00 น.
ชวนเที่ยวงานอะเมซิ่ง บางพลี เเต่งกายชุดไทยย้อนยุค 6 - 28 สิงหาคม 65
ชวนเที่ยวงานอะเมซิ่ง บางพลี เเต่งกายชุดไทยย้อนยุค ชอป ชิม ชิล ชมการเเสดงทุกวัน เสาร์ - อาทิตย์ ตลอดเดือนสิงหาคมนี้ เริ่ม 6 - 28 สิงหาคม 2565 ตลาดโบราณบางพลี อ.บางพลี จ.สมุทรปราการ [ข้อมูล-ภาพจาก
ที่นี่สมุทรปราการ]
มิติที่ 3 เมืองสร้างสรรค์
เริ่มที่เทศกาลกรุงเทพกลางแปลง ซึ่งเป็นนโยบาย 12 เดือน 12 เทศกาล โดยฉายภาพยนตร์ให้ประชาชนได้ชมฟรี เปิดตัวกิจกรรมเมื่อวันที่ 7 ก.ค. 65 มีการฉายหนังกลางแปลง เรื่อง 2499 อันธพาลครองเมือง ณ ลานคนเมือง มีผู้เข้าชมมากที่สุด ประมาณ 10,000 คน ในรอบ 1 เดือนนี้มีการฉายภาพยนตร์ไปทั้งสิ้น 26 เรื่อง จำนวนผู้เข้าชมงานโดยประมาณ 88,368 คน จำนวนร้านค้าที่เข้าร่วมจำหน่ายสินค้า 345 ร้าน มีประมาณการรายรับของร้านค้าที่ออกร้านโดยรอบ รวม 4,330,865 บาท ซึ่งถือว่าเทศกาลกรุงเทพกลางแปลงทำให้กรุงเทพฯ กลับมามีชีวิตชีวา มีส่วนช่วยสร้างขวัญและกำลังใจให้กับคนกรุงเทพฯ กระตุ้นร้านค้ารายย่อยต่าง ๆ ให้มีความคึกคัก และสนับสนุนให้กรุงเทพฯ กลายเป็นสถานที่ถ่ายทำภาพยนตร์ต่อไปในอนาคตอีกด้วย
ต่อด้วยการประชันวงศ์ดุริยางค์นัดกระชับมิตร ระหว่างตัวแทนนักเรียนใน กทม. และตัวแทนนักเรียนจากจังหวัดนครราชสีมา ณ อินดอร์สเตเดียม หัวหมาก เขตบางกะปิ เมื่อวันที่ 31 ก.ค. 65 ซึ่งเป็นงานที่จัดขึ้นระหว่างหน่วยงานราชการด้วยกัน คือ กทม. กับจังหวัดนครราชสีมา ซึ่งผลการจัดงานได้รับการตอบรับที่ดีจากประชาชน มีผู้ให้ความสนใจเข้ามาชมในสนาม รวมทั้งรับชมการถ่ายทอดสด ซึ่งการจัดงานในครั้งนี้เห็นประโยชน์ในหลายมิติ อาทิ การกระชับความสัมพันธ์ระหว่างเมืองให้แน่นแฟ้นกันมากยิ่งขึ้น เปิดเวทีส่งเสริมให้นักเรียนที่มีความสามารถได้แสดงฝีมือด้านดนตรีและศิลปวัฒนธรรม กระตุ้นด้านเศรษฐกิจเมือง และการท่องเที่ยวระหว่างทั้งสองเมือง นอกจากนี้ ยังเปิดโอกาสให้ข้าราชการและเจ้าหน้าที่ของกทม.ได้แสดงศักยภาพความเป็นมืออาชีพในการจัดงานโดยไม่ต้องใช้ออแกไนเซอร์ เป็นการประหยัดงบประมาณได้ส่วนหนึ่ง ซึ่งความสำเร็จในครั้งนี้เกิดขึ้นมาจากความร่วมมือของทุกภาคส่วนที่ให้การสนับสนุนกิจกรรม
ในส่วนงานดนตรีในสวน ได้มีการจัดกิจกรรมตั้งแต่เดือนมิถุนายน และยังมีจัดอยู่ต่อเนื่อง โดยการสนับสนุนจากภาคีเครือข่ายต่าง ๆ ที่มีความเข้มแข็ง ซึ่งตลอดเดือน ก.ค. 65 มีการจัดกิจกรรมดนตรีในหลากหลายสถานที่ รวมจำนวน 21 วัน 53 ครั้ง
นโยบายอีกอย่างหนึ่งที่น่าสนใจ คือ ด้าน co-working space โดยปรับให้ 12 ห้องสมุดเพื่อการเรียนรู้กรุงเทพมหานคร มีพื้นที่สำหรับการทำงานด้วย ซึ่งสามารถใช้พื้นที่ ใช้เสียงได้ เป็นการเปิดพื้นที่ต้นแบบแห่งการเรียนรู้ เพื่อให้ประชาชนสามารถหยิบหนังสือมาอ่านและทำงานไปได้พร้อม ๆ กัน สำหรับ 12 เทศกาล ในเดือน ส.ค. นี้ เป็นเทศกาล “บางกอกวิทยา” ซึ่งเป็นการทำให้วิทยาศาสตร์เป็นเรื่องสนุก เป็นส่วนหนึ่งของทุกคนในเมือง มีกิจกรรมออกไปตามชุมชน ที่สำคัญคือส่งเสริมให้เด็ก ๆ สนใจและชอบวิทยาศาสตร์มากขึ้น คิดเชิงตรรกะและเป็นวิทยาศาสตร์มากขึ้น ซึ่งสามารถติดตามรายละเอียดกิจกรรมได้ผ่านเพจ “กรุงเทพมหานคร โดยสำนักงานประชาสัมพันธ์”
วังทองหลาง ตรวจสถานประกอบการเพื่อความปลอดภัยแก่ผู้ใช้บริการ LINK
ช10 สิงหาคม 2565 ผศ.ดร.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร พล.ต.อ.อดิศร์ งามจิตสุขศรี ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร และนายจิรัฏฐ์ ม้าไว ผู้ช่วยเลขานุการผู้ว่าราชการกรุงเทพมหานคร ลงพื้นที่ตรวจติดตามสถานบริการ สถานประกอบการที่เปิดให้บริการในลักษณะที่คล้ายสถานบริการในพื้นที่เขตวังทองหลาง บริเวณถนนประดิษฐ์มนูธรรมและซอยลาดพร้าว 122 (มหาดไทย) โดยมีนางสาวอัญชนา บุญสุยา ผู้อำนวยการเขตวังทองหลาง พร้อมคณะผู้บริหารเขต ผู้กำกับการ สน.วังทองหลาง เจ้าหน้าที่บรรเทาสาธารณภัยหัวหมาก และเจ้าหน้าที่ที่เกี่ยวข้อง ร่วมลงพื้นที่และให้ข้อมูลสถานประกอบการ โดยตรวจในเรื่องการปฏิบัติตามมาตรการเฝ้าระวัง ป้องกันความปลอดภัยของอาคารในการป้องกันเพื่อให้เกิดความปลอดภัยสูงสุดแก่ประชาชนผู้มาใช้บริการ เช่น โครงสร้างของอาคาร ป้ายบอกทางหนีไฟของร้าน การขออนุญาตจำหน่ายอาหาร การเปิดเป็นร้านอาหาร และเรื่องของการใช้เสียง ทั้งนี้เจ้าหน้าที่เขตได้ให้คำแนะนำและจะตรวจติดตามผลอีกครั้ง หากพบว่าไม่ดำเนินการแก้ไขตามมาตรการและอาจก่อให้เกิดความไม่ปลอดภัยแก่ผู้เข้าใช้บริการ จะออกหนังสือแนะนำให้แก้ไขหรือให้หยุดประกอบการต่อไป
คลินิกก้าวใหม่ (ยาเสพติด)
คลินิกก้าวใหม่ (ยาเสพติด)
จันทร์ - ศุกร์ 08.00 - 16.00 น.
เสาร์ - อาทิตย์และวันหยุดราชการ 08.00 - 12.00 น.
(เฉพาะรับยาเมทาโดนและคัดกรองผู้เข้ารับบำบัด)
ขอบเขตการให้บริการ
ให้บริการบำบัดรักษาและฟื้นฟูสมรรถภาพผู้ติดสารเสพติดทุกประเภททั้งระบบสมัครใจและระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพผู้ติดยาเสพติด พ.ศ. ๒๕๔๕ แบบผู้ป่วยนอก รวมทั้งแนะนำให้ความรู้แก่ผู้เสพ/ผู้ติดยาเสพติด ครอบครัวและผู้เกี่ยวข้องที่เข้ารับการบำบัดฟื้นฟูสมรรถภาพฯ ตามแนวทางการให้บริการ ดังนี้
การบริการภายในศูนย์ฯ
1). บำบัดผู้ติดสารเสพติดด้วยระบบการใช้ยาทดแทน
ให้บริการบำบัดรักษาแบบผู้ป่วยนอกเฉพาะผู้ติดสารเสพติดประเภทฝิ่น อนุพันธ์ฝิ่น ได้แก่ เฮโรอีน มอร์ฟีน โดยการจ่ายยาเมทาโดน ทดแทนอาการอยากยา ให้รับประทานยาต่อหน้าแบบ (Dot) ให้บริการทั้งระบบสมัครใจและระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพผู้ติดยาเสพติด พ.ศ. ๒๕๔๕
2). โปรแกรมจิต สังคม บำบัด
ให้บริการบำบัดรักษาแบบผู้ป่วยนอกเฉพาะผู้ติดสารเสพติดประเภทกระตุ้นประสาท ได้แก่ ยาบ้า กัญชา ไอซ์ และได้รับการประเมินทางจิตแล้วไม่มีอาการทางจิตเวช ให้บริการบำบัดรักษาทั้งระบบสมัครใจ (ระยะเวลา 2 – 4 เดือน) และระบบบังคับบำบัดตามพระราชบัญญัติฟื้นฟูสมรรถภาพ พ.ศ. ๒๕๔๕ (ระยะเวลา ๔ เดือน)
3). บำบัดผู้ติดบุหรี่ แบบบริการเบ็ดเสร็จจุดเดียวมีวิธีการบำบัดดังนี้
- การบำบัดโดยใช้ยา เช่น Bupropion, น้ำยาบ้วนปาก
- การบำบัดโดยไม่ใช้ยา ได้แก่ การเลิกบุหรี่ด้วยตนเองการให้การปรึกษารายบุคคลเพื่อการเลิกบุหรี่
4). การดูแลผู้ใช้แอลกอฮอล์ รูปแบบการบำบัดมี ๓ แบบ
- การให้คำแนะนำแบบสั้นเป็นการให้ข้อมูลแก่ผู้ดื่มเกี่ยวกับผลเสียของการดื่มเครื่องดื่มแอลกอฮอล์ โดยมีจุดมุ่งหมายในการสร้างความตระหนักถึงปัญหาเพื่อให้เกิดแรงจูงใจในการหยุดหรือเลิกดื่มเครื่องดื่มแอลกอฮอล์
- การให้ความช่วยเหลือแบบสั้นเป็นการให้ข้อมูลแก่ผู้ดื่ม พร้อมทั้งหาแนวทางและวางแผนการปฏิบัติที่เหมาะสมในการหยุดหรือลดการดื่มเครื่องดื่มแอลกอฮอล์
- การให้การปรึกษาเป็นการช่วยเหลือผู้ที่มีปัญหาจากการดื่มเครื่องดื่มแอลกอฮอล์โดยการเสริมสร้างแรงจูงใจเพื่อปรับพฤติกรรมและฝึกทักษะที่จำเป็นในการลด/เลิกดื่มเครื่องดื่มแอลกอฮอล์
การบริการภายนอกศูนย์ฯ
คลินิกบำบัดยาเสพติด ศูนย์บริการสาธารณสุข 51 วัดไผ่ตัน ได้มีการจัดทำกิจกรรมโครงการเพื่อการรณรงค์ป้องกันแก้ไขปัญหายาเสพติดของพื้นที่เขตจตุจักรอย่างต่อเนื่อง โดยมีการดำเนินการป้องกันเชิงรุกโดยการเป็นวิทยากรเผยแพร่ความรู้ด้านยาและสารเสพติดให้กับโรงเรียน ชุมชน และสถานประกอบการ
RSV ทำไมอันตราย หมอรามามีคำอธิบาย
ทั้งเด็กและผู้ใหญ่สามารถติดเชื้อไวรัสชนิดนี้ได้ หากเกิดในผู้ใหญ่หรือเด็กโตที่มีสุขภาพแข็งแรง อาการป่วยจะหายได้เอง แต่ถ้าหากเกิดในเด็กเล็ก ๆ ที่ภูมิคุ้มกันยังต่ำ อาจทำให้มีอาการรุนแรง โดยเฉพาะเด็กเล็กที่อายุต่ำกว่า 5 ขวบ ขณะเดียวกันผู้ใหญ่ที่เป็นโรคปอด โรคหัวใจ ก็เป็นกลุ่มเสี่ยงเช่นเดียวกัน [
ชมวิดีโอ RamaChannel - อ.พญ.โสภิดา บุญสาธร สาขาวิชาโรคติดเชื้อ ภาควิชากุมารเวชศาสตร์]
สำนักงานประกันพื้นที่ 7 เดินทางมามอบของขวัญเยี่ยมไข้ผู้ประกันตน ที่นอนพักรักษาตัวในโรงพยาบาลบางปะกอก 8 จำนวน 77 ท่าน LINK
สำนักงานประกันพื้นที่ 7 เดินทางมามอบของขวัญเยี่ยมไข้ผู้ประกันตน ที่นอนพักรักษาตัวในโรงพยาบาลบางปะกอก 8 จำนวน 77 ท่าน เพื่อเป็นขวัญและกำลังใจ โดยมี นพ.พรเทพ สีตลกาญจน์ ผู้อำนวยการโรงพยาบาลบางปะกอก 8 เป็นผู้แทนรับมอบ ซึ่งโรงพยาบาลบางปะกอก 8 เป็นโรงพยาบาลเอกชน ในโครงการประกันสังคม สิทธิของผู้ประกันตนนั้น นอกจากจะได้ในเรื่องของการรักษาพยาบาล เรื่องของการเจ็บไข้ได้ป่วย ยังสามารถใช้สิทธิทางการพยาบาลอื่นๆ ได้ เช่น การคลอดบุตร สิทธิทางทันตกรรม รวมทั้งการตรวจสุขภาพประจำปี ตามเงื่อนไขตามที่ประกันสังคมกำหนดไว้
มาตรการความปลอดภัยงาน APEC Health Week
มาตรการความปลอดภัยจากโรคโควิด 19
กรมควบคุมโรคได้จัดเตรียมแผนด้านการป้องกันหลายมาตรการ ได้แก่
- จัดงานได้มีการประเมินตนเองและผ่านมาตรการ COVID Free Setting ณ สถานที่จัดงาน
- จัดจุดล้างมืออย่างเพียงพอ
- จัดที่นั่งแบบเว้นระยะห่าง
- ให้ผู้เข้าร่วมประชุมสวมหน้ากากตลอดงาน
- การสอบสวนควบคุมโรคกรณีพบผู้ติดเชื้อ
การดูแลด้านสุขภาพของผู้เข้าร่วมประชุม
กรมการแพทย์จะเป็นหน่วยงานหลักในการดูแลสุขภาพผู้เข้าร่วมประชุม ด้วยมาตรการต่างๆ ดังนี้
- จัดเตรียมทีมแพทย์และพยาบาลประจำสถานที่จัดประชุม จำนวน 2 ทีม ตลอด 24 ชั่วโมง พร้อมให้การดูแลปัญหาสุขภาพต่าง ๆ แก่ผู้เข้าร่วมประชุม
- มีการจัดรถ Mobile Stroke Unit โดยสถาบันประสาทวิทยา เพื่อดูแลกรณีโรคหลอดเลือดสมอง ซึ่งสามารถตรวจวินิจฉัยและดูแลรักษาช่วยเหลือเบื้องต้นบนรถได้ทันที สามารถเอกซเรย์คอมพิวเตอร์ ทำให้เห็นพยาธิสภาพในสมองและให้ยาละลายลิ่มเลือด เพื่อให้สามารถช่วยเหลือผู้ป่วยได้ทันภายใน 4 ชั่วโมงครึ่ง
- จัดรถ Mobile CCU โดยสถาบันโรคทรวงอก ในการดูแลผู้ป่วยโรคหัวใจและหลอดเลือด
- จัดระบบส่งต่อผู้ป่วยฉุกเฉิน ทั้งทางบกและทางน้ำไปยังโรงพยาบาลที่จัดเตรียมไว้ตามแผน
การดูแลด้านความปลอดภัยโดยรวมและการจราจร
ด้านการดูแลรักษาความปลอภัยได้รับการสนับสนุนจากสำนักงานตำรวจแห่งชาติ (สตช.) ในการจัดเจ้าหน้าที่ตำรวจช่วยดูแลเรื่องของความปลอดภัยและการจราจรตลอดการประชุม ซึ่งจะมีการจัดงานทั้งที่โรงแรมมิลเลนเนียม ฮิลตัน เขตคลองสาน กรุงเทพฯ การศึกษาดูงานที่โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย และการหารือทวิภาคีที่กระทรวงสาธารณสุขเพื่ออำนวยความสะดวกให้แก่ผู้เข้าร่วมประชุม และลดผลกระทบการใช้รถใช้ถนนของประชาชนทั่วไป
เครื่องอัลตร้าซาวด์ 4 มิติ
6.เกษตรอัจฉริยะ (smart farming) และอนาคตเกษตรไทย
smart farming ยังคงกระจุกตัวอยู่ในพืชมูลค่าสูงและมีเกษตรกรที่เป็น smart farmer ไม่มาก คำถามสำคัญคือทำอย่างไรที่จะให้เกษตรกรที่ผลิตพืชมูลค่าต่ำ (ข้าว ยาง มันสำปะหลัง และอ้อย) ซึ่งเป็นพืชหลักของประเทศ หันมาใช้ความรู้เข้มข้น เพื่อเพิ่มผลผลิต ลดต้นทุน และลดความเสี่ยง และเกษตรกรสามารถพัฒนาตนเองให้เป็น smart farmer ได้
สอ.กทม ข้อมูลสมาชิกของสหกรณ์ออมทรัพย์ กทม.
ระบบแสดงผลข้อมูลสมาชิกของ สหกรณ์ออมทรัพย์ กทม. จำกัด
1. แสดงประวัติสมาชิก
2. แสดงข้อมูลเกี่ยวกับหุ้น หนี้ เงินฝาก
3.แสดงข้อมูลเกี่ยวกับผู้รับโอนผลประโยชน์
4. แสดงข้อมูลเกี่ยวกับปันผล
5.แสดงข้อมูลรายการเคลื่อนไหวหุ้น หนี้ เงินฝาก
ใช้งานง่ายด้วยการเข้าระบบแบบ pin code
กำหนดการพระราชพิธีถวายความอาลัย
สำนักข่าวต่างประเทศ รายงานว่า กำหนดการพระราชพิธีถวายความอาลัยต่อการสวรรคตของสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 เมื่อพระบรมโกศของพระองค์เสด็จพระราชดำเนินมาถึงกรุงลอนดอน หีบพระบรมศพของพระองค์จะถูกประทับในห้องโถงของวิหารเวสต์มินสเตอร์ 4 วัน ก่อนพระราชพิธี
เพื่อให้ประชาชนชมขบวนแห่ และถวายความอาลัยต่อพระองค์ได้ โดยสำนักพระราชวังอนุญาตให้ประชาชนเฝ้าเสด็จฯ ตลอดเส้นทางและจะมีจอภาพขนาดใหญ่ที่จะตั้งในสวนสาธารณะเซนส์ เจมส์ เพื่อให้ประชาชนได้รับชมพิธีดังกล่าวด้วย
พระบรมโกศจะถูกคลุมด้วยธงประจำพระราชวงศ์ และเมื่อประทับอยู่ในวิหารเวสต์มินสเตอร์ พระบรมโกศจะถูกประดับด้วยมงกุฎ ลูกโลกทองคำและคฑา ซึ่งเป็นเครื่องราชอิสริยาภรณ์ ประจำพระองค์ เมื่อพระบรมโกศประทับในวิหารแล้ว จะเปิดให้ประชาชนเข้าถวายความอาลัยอีกครั้ง
สำหรับพระราชพิธีพระบรมศพของสมเด็จพระราชินีนาถ คาดว่าจะจัดขึ้นที่วิหารเวสต์มินสเตอร์ภายใน 2 สัปดาห์ โดยต้องรอการยืนยันจากสำนักพระราชวังบักกิงแฮมอีกครั้ง
งานพระราชพิธีจะดำเนินการโดยเจ้าคณะแห่งวิหารเวสต์มินสเตอร์ บาทหลวงเดวิด ฮอยล์ มี จัสติน เวลบี อาร์คบิชอปแห่งแคนเทอร์เบอรีเป็นนักเทศน์ และนายกรัฐมนตรีลิซ ทรัสส์ คาดว่า จะเข้าร่วมในพระราชพิธีด้วย
หลังจากเสร็จสิ้นพระราชพิธีแล้ว พระบรมโกศของสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 จะเคลื่อนผ่านประตูเวลลิงตัน ผ่านสวนสาธารณะไฮด์ปาร์คของลอนดอน ก่อนมุ่งหน้ากลับไปยังพระราชวังวินด์เซอร์ คาดว่ากษัตริย์และสมาชิกอาวุโสของพระราชวงศ์ จะเข้าร่วมขบวนพิธีที่บริเวณจัตุรัส ในพระราชวังวินด์เซอร์ ก่อนที่พระบรมโกศจะเคลื่อนสู่โบสถ์เซนต์จอร์จต่อไป
โบสถ์เซนต์จอร์จเป็นโบสถ์ประจำพระราชวงศ์วินด์เซอร์ ใช้ประกอบพระราชพิธีสำคัญต่าง ๆ มากมาย เช่น พระราชพิธีอภิเษกสมรสของ ดุ๊กและดัชเชสแห่งซัสเซกซ์ เจ้าชายแฮร์รี่และเมแกน ทั้งยังเป็นสถานที่จัดพระราชพิธีศพของเจ้าชายฟิลิป พระสวามีของสมเด็จพระราชินีนาถด้วย
หีบพระบรมศพของสมเด็จพระราชินีนาถเอลิซาเบธที่ 2 จะถูกประทับภายใน Royal Vault ก่อนที่จะถูกฝังในสถานที่ใกล้กับ พระบรมศพของพระเจ้าจอร์จที่ 6 พระราชบิดาของพระองค์ ซึ่งตั้งอยู่ภายในโบสถ์เซนต์จอร์จ [ThaiPBS]
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม (ศพส.นพ.)
1.01. หมู่ 1.3 ถนนสายนครพนม-ท่าอุเทน กม.ที่ 20
ตำบลโนนตาล อำเภอท่าอุเทน จังหวัดนครพนม 481.20
โทรศัพท์ 0-4205-0055-6 โทรสาร 0-4205-00564
กิจการดูแลผู้สูงอายุในจ.นครพนม เริ่มเมื่อปี พ.ศ. 2540 เมื่อแรกตั้งกรมประชาสงเคราะห์ในจังหวัด ต่อมากรมพัฒนาสังคมและสวัสดิการ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ได้ดำเนินการก่อสร้างศูนย์สาธิตการจัดสวัสดิการผู้สูงอายุจังหวัดนครพนม เมื่อวันที่ 2 มีนาคม 2548 ต่อมาได้เปลี่ยนชื่อจาก ศูนย์สาธิตการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม เป็น ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม และได้เปิดรับผู้สูงอายุทั้งชายและหญิง เข้ารับบริการประเภทอยู่ประจำ ตั้งแต่เมื่อวันที่ 7 ธันวาคม 2550 จำนวน 20 คน โดยมีเป้าหมายรับผู้สูงอายุ จำนวน 100 คน
ปัจจุบันพัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม (ศพส.นพ.) สังกัด กรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ตามพระราชบัญญัติปรับปรุง กระทรวง ทบวง กรม (ฉบับที่ 1.4) พ.ศ.2558 ให้การอุปการะผู้รับบริการประเภทสามัญทั้งชายและหญิง โดยไม่ต้องเสียค่าบริการ ปัจจุบันมีอาคารเรือนนอน จำนวน 4 หลัง และมีเป้าหมายรับบริการผู้สูงอายุจำนวน 100 คน
รูปแบบการจัดสวัสดิการ
รูปแบบของศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ จะดำเนินการในรูปแบบของกลุ่มงาน (Job) และศูนย์ (Center) ซึ่งมีทั้งหมด 2 กลุ่มงาน และ 6 ศูนย์ ดังนี้
1. ศูนย์ข้อมูลและสารสนเทศงานสวัสดิการผู้สูงอายุ
2. ศูนย์ฝึกอบรมและพัฒนา
3. ศูนย์การเรียนรู้
4. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุแบบสถาบัน
5. ศูนย์การจัดสวัสดิการสังคมผู้สูงอายุในชุมชน
6. ศูนย์บริการให้คำแนะนำปรึกษาและส่งต่อ
การบริการ
การรับผู้สูงอายุเข้ารับบริการในศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ ในรูปแบบสถานสงเคราะห์ ประเภทสามัญ
รูปแบบการช่วยเหลือ ผู้สูงอายุซึ่งประสบปัญหาความทุกข์ยากเดือดร้อน เช่น ถูกทอดทิ้ง ไม่มีที่อยู่อาศัย ไม่มีผู้อุปการะเลี้ยงดู ซึ่งมีความสมัครใจเข้าอุปการะในสถานสงเคราะห์โดยไม่เสียค่าใช้จ่ายใดๆ
คุณสมบัติของผู้ขอรับบริการ
1. อายุตั้งแต่ 60 ปีขึ้นไปและมีสัญชาติไทย
2. ไม่เป็นผู้ต้องหาว่ากระทำผิดอาญา และอยู่ระหว่างการสอบสวนของพนักงานสอบสวนหรืออยู่ระหว่างการพิจารณาคดีของศาล
3. ไม่เป็นโรคติดต่อ ตามพระราชบัญญัติโรคติดต่อ พ.ศ. 2523
4. มีความสมัครใจ
5. สามารถช่วยเหลือตนเองได้ในกิจวัตรประจำวัน
6. ไม่มีอาการทางจิตที่รุนแรง หรือมีพฤติกรรมด้านลบที่ส่งผลกระทบต่อผู้อื่น
7. ไม่ติดสารเสพติด หรือติดสุรา
8. กรณีเร่ร่อน ถูกทอดทิ้ง หรือไร้ที่พึ่ง ต้องผ่านกระบวนการตามพระราชบัญญัติคุ้มครองคน ไร้ที่พึ่ง พ.ศ. 2557 ก่อน เช่น การเยี่ยมครอบครัว/ชุมชน การหาอาชีพที่เหมาะสม เป็นต้น
9. ฐานะยากจน/ไม่มีที่อยู่อาศัย/ขาดผู้อุปการะหรือผู้ให้ความช่วยเหลืออยู่กับครอบครัวไม่มีความสุข
10. ต้องไม่อยู่ระหว่างการดำเนินคดีอาญา
การสมัครเข้ารับบริการ
1. ผู้ที่มีภูมิลำเนาอยู่ในพื้นที่จังหวัดนครพนม ให้ยื่นใบสมัครได้ที่ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม กลุ่มงานพัฒนาสังคมและสวัสดิการ ตำบลโนนตาล อำเภอท่าอุเทน จังหวัดนครพนม
2.ผู้ที่มีภูิมิลำเนาอยู่ในต่างจังหวัดให้ยื่นใบสมัครได้ที่สำนักงานพัฒนาสังคมและความมั่นคงของมนุษย์จังหวัดที่ตนอยู่
บริการที่พักอาศัยรูปแบบสถานสงเคราะห์
ปัจจุบันศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม ให้บริการที่พักอาศัยในรูปแบบสถานสงเคราะห์ประเภทสามัญทั้งชายและหญิง โดยไม่ต้องเสียค่าบริการ ซึ่งจัดให้มีบริการต่างๆ ดังนี้
1. การบริการเลี้ยงดูผู้สูงอายุ โดยจัดให้มีปัจจัย 4 ที่จำเป็นต่อชีวิตเพื่อให้มีความสุขทั้งร่างกายและจิตใจในบั้นปลายชีวิตตามสมควรแก่อัตภาพ
2. บริการทางการแพทย์และอนามัย จัดให้มีเจ้าหน้าที่พยาบาลดูแลรักษาพยาบาลตามคำสั่งแพทย์โดยอยู่เวรตลอด 24 ชั่วโมง ในกรณีที่เจ็บป่วยเฉพาะโรคหรือประสบอุบัติเหตุฉุกเฉินจะส่งไปรักษาที่โรงพยาบาล จัดให้มีเจ้าหน้าที่จัดกิจกรรมเพื่อส่งเสริมสุขภาพผู้สูงอายุให้แข็งแรงตามสภาพร่างกาย เช่น กีฬาเปตอง , กายบริหาร ฯลฯ
3. บริการกายภาพบำบัด มีเจ้าหน้าที่พยาบาล จัดบริการกายภาพบำบัด เพื่อฟื้นฟูสมรรถภาพของผู้สูงอายุตามคำแนะนำของแพทย์
4. บริการนันทนาการ เป็นการจัดกิจกรรมให้ผู้สูงอายุได้แสดงออกได้รับความบันเทิงสนุกสนานคลายความวิตกกังวล และความเครียด มีการจัดงานในวันหยุดนักขัตฤกษ์
5. บริการด้านศาสนา ให้ผู้สูงอายุประกอบพิธีกรรมทางศาสนาประเพณีนิยมในวันสำคัญ
6. บริการด้านฌาปนกิจ ผู้สูงอายุที่ถึงแก่กรรม และไม่มีญาติจัดการศพ ศูนย์พัฒนาการพัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม จะดำเนินการตามประเพณีทางศาสนา หากมีญาติต้องการนำศพไปบำเพ็ญกุศล ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม (ศพส.นพ.) จะอำนวยความสะดวกตามความประสงค์
เอกสารประกอบการรับ Case เข้ารับบริการในศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดนครพนม (ศพส.นพ.)
1. ประวัติของผู้ใช้บริการ/ครอบครัว/เอกสารการสอบข้อเท็จจริง/รูปถ่ายปัจจุบัน
2. หลักฐานประจำตัว สำเนาบัตรประชาชน ทะเบียนบ้าน
3. สิทธิในการรักษาพยาบาล/ประวัติการรักษา
4. ใบรับรองแพทย์/ใบ refer
5. หลักฐานการเยี่ยมบ้าน พร้อมภาพถ่าย
6. กรณีผู้สูงอายุมีทรัพย์สินต้องแจ้งรายละเอียดให้ทราบ
7. หนังสือประสานส่ง Case
8. เอกสารการประชุมประชาคมในพื้นที่ หมู่บ้าน ครอบครัว เครือญาติ
9. กรณีมีญาติหรือบุตรหลาน ต้องมีบันทึกแสดงความจำนง พร้อมรายละเอียดเอกสารต่างๆ ที่อยู่พร้อมเบอร์โทร ที่สามารถติดต่อได้สะดวกและเป็นปัจจุบัน
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ จังหวัดลำปาง
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ จังหวัดลำปาง
เลขที่ 120 หมู่ 1 ถนนลำปาง-แจ้ห่ม ตำบลนิคมพัฒนา อำเภอเมือง จังหวัดลำปาง 52000
หมายเลขโทรศัพท์ 054-825576 - 7 ต่อ 303,311 โทรสาร 054-825577
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ จังหวัดลำปาง เดิมสังกัดสำนักบริการสวัสดิการสังคม กรมพัฒนาสังคมและสวัสดิการกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ได้รับอนุมัติให้ดำเนิน การก่อสร้าง เมื่อวันที่ 9 มีนาคม 2548 เป็นหน่วยงานที่คณะกรรมการอำนวยการจัดงานฉลองสิริราชสมบัติครบ 60 ปี คัดเลือกเข้าร่วมโครงการเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว "ในโอกาสการจัดงานฉลองสิริราชสมบัติครบ 60 ปี" พระราชบัญญัติปรับปรุงกระทรวง ทบวง กรม (ฉบับที่ 14) พ.ศ.2558 ลงวันที่ 5 มีนาคม 2558 ได้มีการปรับเปลี่ยนโครงสร้างการบริหารราชการภายในกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ โดยกำหนดให้ หน่วยงานศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุ จังหวัดลำปางไป สังกัดกองส่งเสริมสวัสดิการและคุ้มครองสิทธิผู้สูงอายุ กรมกิจการผู้สูงอายุกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์
ศูนย์เอกซเรย์
บริการตรวจวิเคราะห์หาสาเหตุของโรคทุกระบบด้วยภาพถ่ายทางรังสีครอบคลุมการตรวจทางรังสีทั่วไป
โทร : 02-592-9550
ㆍ สนับสนุนให้เกิด Ecosystem ด้วยรถพลังงานไฟฟ้า การลดฝุ่น PM2.5 ในระยะยาว จำเป็นต้องลดมลพิษจากไอเสียที่ยานยนต์ปล่อยออกมา ซึ่งเป็นต้นตอของ PM2.5 เช่น อนุญาตให้เอกชนติดตั้งสถานีชาร์จและสลับแบตเตอรีรถจักรยานยนต์ในพื้นที่หน่วยงานกรุงเทพมหานคร เช่น สำนักงานเขต สวนสาธารณะ พื้นที่จอดแล้วจร ฯลฯ ประสานกับเอกชนในการผลักดันให้เกิดสถานีชาร์จและสลับแบตเตอรี่มากขึ้น
พะโล้กัญชา เชฟ นุ่น พรหมทอง @ร้านป้าทิ้ง
พะโล้กัญชา
เชฟ/เจ้าของ: นุ่น พรหมทอง
ร้าน: ป้าทิ้ง
สรรพคุณทางยา:
“พะโล้” เป็นเมนูอาหารไทยที่มีรสหวานนำ มีกานพลูเป็นส่วนประกอบซึ่งช่วยกระตุ้นการไหลเวียนของโลหิต ช่วยยับยั้งการเจริญเติบโตของเชื้อแบคทีเรีย และมีพริกไทยที่มีคุณสมบัติในการต้านอนุมูลอิสระ เพิ่มรสชาติที่แตกต่างของน้ำซุปด้วยใบกัญชา ซึ่งมีคุณสมบัติช่วยบรรเทาอาการปวดได้
ที่อยู่: 1/8 ริมน้ำตลาดดอนสัก หมู่ 5 ตำบลดอนสัก อำเภอดอนสัก จังหวัดสุราษฎร์ธานี 84220
Tel. 09-2956-5593
ข้าวยำสมุนไพรใบกัญชา LINK
วัตถุดิบ
ใบกัญชา 1 ใบ / ตะไคร้ 5 กรัม / พริกแดง 2 กรัม / หอมแดง 20 กรัม / น้ำมะขาม 20 กรัม / น้ำมะนาว 10 กรัม / กุ้งแห้ง 10 กรัม / แครอท 20 กรัม / ใบชะพลู 2 กรัม / ใบมะกรูด 1 กรัม / ถั่วฝักยาว 10 กรัม / น้ำบูดู 20 กรัม / น้ำตาลโตนด 20 กรัม / ถั่วพู 10 กรัม
วิธีการทำ
1. หั่นผักสมุนไพรต่าง ๆ ทั้ง ถั่วฝักยาว ถั่วพู ตะไคร้ ใบมะกรูด ใบชะพลู แครอท หอมแดง และพริก
2. ปรุงน้ำยำบูดู ด้วยน้ำมะขามเปียกและน้ำตาลโตนดเป็นฝอย ๆ หรือเป็นชิ้นเล็ก ๆ
3. โรยใบกัญชาซอยในน้ำบูดูที่เตรียมไว้
4. จัดเสิร์ฟพร้อมข้าวทั้ง 3 ชนิด ผักสมุนไพรต่าง ๆ และน้ำบูดู
2.โครงการที่พักอาศัยผู้สูงอายุรามาฯ-ธนารักษ์ (Senior Housing) LINK
โครงการที่พักอาศัยผู้สูงอายุรามาฯ-ธนารักษ์ (Senior Housing) เป็นที่พักอาศัยในรูปแบบคอนโดมิเนียมที่ทันสมัย มีสิ่งอำนวยความสะดวกครบครัน และมีสิ่งแวดล้อมที่ดีเป็นมิตรกับผู้สูงวัยที่มีสุขภาพแข็งแรงและพึ่งพาตนเองได้ดี (Active aging) และใกล้กับสถานบริการด้านสุขภาพทั้งศูนย์ ECH และสถาบันการแพทย์จักรีนฤบดินทร์ โครงการนี้เป็นการเช่าสิทธิการพักอาศัยระยะยาว 30 ปี บริหารงานโดยบริษัทธนารักษ์พัฒนาสินทรัพย์ (ธพส)
รูปแบบโครงการ
ดำเนินการออกแบบโครงการฯ ภายใต้หลักสถาปัตยกรรมเพื่อทุกคน (Universal Design Architecture) ซึ่งคำนึงถึงสภาพแวดล้อมภายในและภายนอกที่เหมาะสมกับผู้สูงอายุ ภายใต้การกำกับดูแลของกรมธนารักษ์ คณะแพทย์ศาสตร์โรงพยาบาลรามาธิบดี และคณะสถาปัตยกรรมศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย โดยโครงการฯ ระยะที่ 1 มีห้องพักรวมทั้งสิ้น 921 ห้อง พื้นที่ใช้สอย 31.71 ตารางเมตร – 49.66 ตารางเมตร ต่อห้อง เป็นอาคาร 8 ชั้น จำนวน 7 อาคาร พร้อมห้องพยาบาลประจำตึก พื้นที่ส่วนกลางและพื้นที่จัดกิจกรรมสำหรับผู้สูงอายุ ได้แก่ สระว่ายน้ำ อาคาร Club House ห้องฟิตเนส เป็นต้น
ขนาดห้องชุด และระดับราคา
ผู้สูงอายุต้องรับผิดชอบค่าใช้จ่ายเพื่อเข้าพักอาศัย โดยมีประมาณการค่าใช้จ่ายประกอบด้วย
1) ค่าเช่าสิทธิห้องพักจาก ธพส.ซึ่งมี 7 ระดับราคา ตั้งแต่ ราคา 1,820,000 บาท (Type 1-1A ขนาดห้อง 31.71 ตร.ม.) ไปจนถึง ราคา 3,051,000 บาท (Type 2-5 ขนาดห้อง 49.06 ตร.ม.)
2) ค่าใช้จ่ายส่วนกลางในการดูแลรักษาอาคารเริ่มต้น ประมาณเดือนละ 2,000 บาท (สองพันบาทถ้วน) ชำระเป็นรายปี กำหนดล่วงหน้า 3 ปี
3) ค่าใช้จ่ายในการดูแลสุขภาพเดือนละ 2,000 บาท (สองพันบาทถ้วน) ต่อท่าน ชำระเป็นรายปี กำหนดล่วงหน้า 1 ปี
4) ผู้สูงอายุที่ได้รับการคัดเลือกจะต้องเปิดบัญชีเงินฝากกับธนาคารพันธมิตรโครงการฯ ได้แก่ ธนาคารอาคารสงเคราะห์ (ธอส.) ธนาคารออมสิน หรือ บมจ.ธนาคารกรุงไทย ในลักษณะเงินฝากประจำ (Escrow Account) จำนวนเงิน 300,000 บาท (สามแสนบาทถ้วน) โดยมีเงื่อนไขในการเบิกจ่ายเพื่อให้เป็นทุนสำรองในการดำรงชีพขณะอยู่ในโครงการฯเท่านั้น และจะต้องได้รับความเห็นชอบจากผู้บริหารโครงการฯ ในการถอนหรือปิดบัญชี
5) ค่าน้ำ ค่าไฟ และค่าใช้จ่ายอื่นๆ (ชำระตามจริง) ทั้งนี้ ค่าใช้จ่ายดังกล่าวให้เป็นไปตามที่ ธพส.และคณะแพทยศาสตร์โรงพยาบาลรามาธิบดีกำหนดโดยความเห็นชอบของคณะกรรมการบริหารโครงการฯโดยสงวนสิทธิในการปรับปรุงค่าใช้จ่ายดังกล่าวให้สอดคล้องกับสภาวะเศรษฐกิจในปัจจุบัน
รพ.เอกชล รับรางวัล Collaboration Award LINK
โรงพยาบาลเอกชล เข้ารับรางวัลด้าน “Collaboration Award” ซึ่งมอบให้แก่โรงพยาบาลที่มีการทำงานเป็นกระบวนการร่วมกัน เพื่อให้บรรลุเป้าหมายตอบโจทย์ความต้องการของลูกค้า โดยมี ผศ.ดร.นพ.เทอดศักดิ์ โรจน์สุรกิตติ ประธานกรรมการบริหารโรงพยาบาลเอกชล เป็นผู้รับรางวัล
ข่าวปลอม! การทำแมมโมแกรม เป็นสาเหตุของโรคมะเร็งเต้านม LINK
ตามที่มีข้อมูลปรากฎเกี่ยวกับประเด็นเรื่องการทำแมมโมแกรม เป็นสาเหตุของโรคมะเร็งเต้านม ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีการบอกต่อข้อมูลโดยระบุว่า การทำแมมโมแกรม เป็นอันตราย และเป็นสาเหตุของโรคมะเร็งเต้านม ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่า การตรวจแมมโมแกรม เป็นการตรวจทางรังสีชนิดหนึ่ง ใช้สำหรับตรวจเต้านมโดยเฉพาะ ซึ่งวิธีนี้เป็นวิธีการตรวจคัดกรองมะเร็งเต้านมที่มีประสิทธิภาพ สามารถลดอัตราการเสียชีวิตจากโรคมะเร็งเต้านมได้ โดยการตรวจแมมโมแกรมแนะนำให้ตรวจในผู้หญิงที่มีอายุ 40 ปีขึ้นไป หรือมีความเสี่ยง ได้แก่ มีประวัติญาติสายตรงเป็นมะเร็งเต้านมหรือมะเร็งรังไข่ ผู้หญิงที่ได้รับฮอร์โมนเสริมทดแทนในวัยทองเป็นเวลานานกว่า 5 ปี เป็นต้น
จากการเผยแพร่ข้อมูลว่าการทำแมมโมแกรมเป็นสาเหตุของโรคมะเร็งเต้านมนั้น จากการสืบค้นข้อมูลพบว่าการทำแมมโมแกรมไม่ได้เป็นสาเหตุของโรคมะเร็งเต้านม แม้ว่าการตรวจแมมโมแกรมจะทำให้ได้รับรังสี แต่ก็อยู่ในปริมาณที่น้อยมาก ๆ จึงมีความปลอดภัย แต่ควรหลีกเลี่ยงการตรวจแมมโมแกรมในช่วงสัปดาห์ก่อนที่มีประจำเดือน เพื่อลดความเจ็บ สำหรับหญิงตั้งครรภ์หรือมีความเป็นไปได้ในการตั้งครรภ์ควรมีการแจ้งแพทย์หรือเจ้าหน้าที่ฉายรังสีก่อนทุกครั้ง เพื่อความปลอดภัยของทารกในครรภ์
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข สามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ www.nci.go.th หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : จากการสืบค้นข้อมูลพบว่าการทำแมมโมแกรมไม่ได้เป็นสาเหตุของโรคมะเร็งเต้านม แม้ว่าการตรวจแมมโมแกรมจะทำให้ได้รับรังสี แต่ก็อยู่ในปริมาณที่น้อยมาก ๆ จึงมีความปลอดภัย
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุกๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนตุลาคม พ.ศ. 2565 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 19 ถึง 29 สิงหาคม พ.ศ. 2565 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือศูนย์วิจัยแห่งใหม่ของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อช่วยเหลือบริษัทต่างๆ ภายในประเทศสมาชิกภูมิภาคอาเซียนในเรื่องของข้อมูลการตลาด รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของฮาคูโฮโดจะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่อธิบายผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่อธิบายถึงความเป็นมนุษย์ที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
ติดตามผลสำรวจเพิ่มเติมได้ที่ Hakuhodo Institute of Life and Living ASEAN (THAILAND)
https://www.facebook.com/hakuhodohillasean
ข้อต้องคำนึงถึง
การใช้ผลิตภัณฑ์กัญชาในการรักษาโรคนั้น ยังมีข้อต้องคำนึงถึง อาทิ สารสกัดกัญชาต้องไม่ใช้ในผู้ป่วยที่มีอายุต่ำกว่า 20 ปี หากใช้ด้วยวิธีการสูบ ห้ามใช้ในสตรีมีครรภ์ สตรีให้นมบุตร และห้ามใช้ในขณะขับขี่ยานพาหนะ เป็นต้น
6. การตรวจระดับฮอร์โมนต่างๆ
ฮอร์โมนคือ สิ่งที่ร่างกายสร้างขึ้น เพื่อใช้ในการสื่อสารไปยังส่วนต่างๆของร่างกาย ในร่างกายมนุษย์มีฮอร์โมนมากกว่า 50 ชนิด ช่วยในการควบคุมกระบวนการต่างๆ ในร่างกาย
- ฮอร์โมนเพศ เช่น เทสโทสเตอโรน (testosterone), เอสโตรเจน (Estrogen), โปรเจสเตอโรน (Progesterone) อาจเสียสมดุลตามอายุที่เพิ่มขึ้นและก้าวเข้าสู่วัยทอง การขาดสมดุลของฮอร์โมนเพศ ส่งผลต่อทั้งร่างกายและจิตใจ เช่น ร้อนวูบวาบ นอนไม่หลับ หงุดหงิด อ่อนเพลีย ซึมเศร้า อารมณ์แปรปรวน นอนหลับไม่สนิท
- ฮอร์โมนการเผาผลาญ มีความเกี่ยวข้องกับการเปลี่ยนแปลงของน้ำหนักตัวและปัญหาโรคอ้วน ไม่ว่าจะเป็นคอร์ติซอล (Cortisol) ที่สามารถกระตุ้นความหิว, เลปติน (Leptin) ที่เป็นฮอร์โมนอิ่ม ควบคุมความอยากอาหาร, โกรทฮอร์โมน (Growth Hormone) ช่วยฟื้นฟูและซ่อมแซมสภาพเซลล์ของร่างกาย มีส่วนช่วยในการชะลอวัย, ไทรอยด์ฮอร์โมน (Thyroid Hormone) ช่วยควบคุมการเผาผลาญพลังงานและระดับอุณหภูมิของร่างกาย
- ฮอร์โมนการนอนหลับ เป็นตัวควบคุมคุณภาพการนอนหลับและนาฬิกาชีวภาพ (Circadian rhythm) เพื่อให้ร่างกายได้มีโอกาสฟื้นฟูและซ่อมแซมในช่วงนอนหลับ เช่น เมลาโทนิน (Melatonin), คอร์ติซอล (Cortisol), และโกรทฮอร์โมน (Growth Hormone) เป็นต้น
- ฮอร์โมนความเครียด บ่งบอกสภาวะความเครียดของจิตใจเราได้ ผลิตจากต่อมหมวกไต (Adrenal Gland) มีฮอร์โมนที่สำคัญอยู่ 2 ชนิด ได้แก่ คอร์ติซอล (Cortisol) หากพบในระดับที่สูงเกินไป แสดงว่ามีภาวะเครียด และอีกตัวหนึ่งคือ ฮอร์โมนที่มีชื่อว่า DHEA (Dehydroepiandrosterone) เป็นฮอร์โมนต้านความเครียด คนที่มีฮอร์โมนคอร์ติซอลสูง และฮอร์โมน DHEA ต่ำ จะมีความเสี่ยงให้เกิดสารอนุมูลอิสระ(Free radical) มากขึ้น ก่อให้เกิดการอักเสบภายในร่างกายมากขึ้น
การตรวจระดับฮอร์โมนต่างๆ จะทำให้ทราบว่า ฮอร์โมนใดขาดสมดุล เพื่อจะนำไปสู่การฟื้นฟู ด้วยการปรับเปลี่ยนการดำเนินชีวิต การเสริมยาและวิตามินต่างๆ ไปจนถึงการวางแผนดูแลสุขภาพให้แข็งแรงในอนาคต
2. การปลูกถ่ายกระจกตาเฉพาะชั้น (Lamellar keratoplasty) ในกรณีที่ผู้ป่วยมีกระจกตาเสียหายเฉพาะบางส่วน ก็จะทำการปลูกถ่ายเฉพาะบางชั้น ได้แก่ การปลูกถ่ายกระจกตาเฉพาะชั้นบน (Anterior lamellar keratoplasty) ซึ่งมีข้อดีคือ ไม่ต้องตัดกระจกตาชั้นเยื่อบุโพรงหรือกระจกตาชั้นในสุดทิ้งไป จึงช่วยลดโอกาสเสี่ยงที่ร่างกายผู้ป่วยจะปฏิเสธกระจกตาที่เกิดจากการปลูกถ่ายได้ รวมทั้งลดภาวะแทรกซ้อนอื่นๆ ได้ด้วย การผ่าตัดปลูกถ่ายกระจกตาเฉพาะชั้นอีกชนิดหนึ่งคือ การปลูกถ่ายกระจกตาเฉพาะชั้นเยื่อบุโพรงกระจกตาหรือกระจกตาชั้นใน (Endothelial keratoplasty) เป็นการนำเยื่อบุโพรงกระจกตาชั้นในที่มีพยาธิสภาพออก และทดแทนด้วยเยื่อบุโพรงกระจกตาจากดวงตาบริจาคที่นำมาปลูกถ่าย ซึ่งกระจกตาชั้นนี้มีความบางมาก ประมาณ 10-15 ไมครอน จึงเป็นการผ่าตัดที่ละเอียดอ่อนมาก นอกจากนี้การผ่าตัดชนิดนี้ยังมีขนาดแผลผ่าตัดที่เล็กเพียง 3-5 มิลลิเมตร ทำให้ลดภาวะแทรกซ้อนต่างๆ ได้มาก ที่สำคัญ มีการฟื้นตัวของสายตาที่เร็วมากนับเป็นสัปดาห์ เร็วกว่าการปลูกถ่ายกระจกตาทุกชั้นอย่างมาก
สำหรับประชาชนทั่วไปที่สนใจสอบถามข้อมูลเพิ่มเติ่มเกี่ยวกับภาวะดื้อโบ สามารถติดต่อได้ผ่านช่องทาง เมิร์ซ บิวตี้คอนเน็กท์ เบอร์โทรศัพท์ 02-026-1111 หรือ ไลน์ไอดี @merzbeautyconnect เพื่อเข้ารับการปรึกษาในเบื้องต้นโดยไม่เสียค่าใช้จ่าย
งานประเพณีลอยกระทง เผาเทียน เล่นไฟ จังหวัดสุโขทัย ประจำปี 2565
"งานประเพณีลอยกระทง เผาเทียน เล่นไฟ จังหวัดสุโขทัย ประจำปี 2565" ระหว่างวันที่ 29 ตุลาคม - 8 พฤศจิกายน 2565 ณ อุทยานประวัติศาสตร์สุโขทัย ตำบลเมืองเก่า อำเภอเมืองสุโขทัย จังหวัดสุโขทัย เทศกาลเก่าแก่ ซึ่งนับว่าเป็นอีกงานเทศกาลลอยกระทงที่ควรไปเยี่ยมเยือน ชมการแสดงพลุ ตะไล ไฟพะเนียง การแสดงมหรสพครบแสง เสียง และการประกวดนางนพมาศ พร้อมทั้งเพลิดเพลินไปกับสินค้าและอาหารในตลาดย้อนยุค และร่วมสนุกกับกิจกรรมข้าวขวัญวันเล่นไฟ
ฐานที่ 2 : แนะนำโภชนาการสำหรับผู้สูงวัย ผู้มีภาวะโรคอ้วน เบาหวาน ความดัน ไขมัน เพื่อแนะนำและส่งเสริมให้ผู้สูงอายุมีพฤติกรรมการบริโภคอาหารในสัดส่วนที่เหมาะสมเพียงพอ ถูกต้อง เพื่อชะลอ ป้องกัน และควบคุมโรคไม่ติดต่อเรื้อรัง (NCDs)
โดย "ศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร" คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย (Center of Excellence in Neurogastroenterology and Motility -
CUNM) เป็นศูนย์ความเป็นเลิศของโรงเรียนแพทย์ที่เดียวและเป็นอันดับหนึ่งในไทยที่ให้บริการตรวจและรักษาความผิดปกติของการทำงานของระบบทางเดินอาหาร เป็นสถาบันแห่งแรกที่ให้บริการรักษาผู้ป่วยได้อย่างครบวงจรด้วยเทคโนโลยีที่ทันสมัย เป็นสถาบันฝึกอบรมและผลิตแพทย์ รวมทั้งรับส่งต่อผู้ป่วยที่มีปัญหาซับซ้อน ตลอดจนมีการศึกษาวิจัยข้อมูลจากฐานผู้ป่วยเกี่ยวกับโรคทางเดินอาหารจำนวนมาก รวมถึงความใส่ใจของทีมแพทย์ที่ซักถามถึงรายละเอียดของอาการและพฤติกรรมของผู้ป่วย ทำให้เข้าใจถึงกลไกของการเกิดโรค และสามารถวางแผนการรักษาโรคได้อย่างมีประสิทธิภาพและตรงจุดมากขึ้น
โดยสรุปแล้ว โรงพยาบาลวิมุตมอบความใส่ใจผู้สูงอายุมากเป็นพิเศษ เพื่อตอบรับเทรนด์สังคมผู้สูงอายุในสังคมไทยที่เริ่มชัดเจนมากขึ้นเรื่อย ๆ ซึ่งไม่เพียงครอบคลุมเฉพาะสุขภาพทางกายหรือโรคประจำตัวเท่านั้น แต่ยังพิจารณาแบบองค์รวมทั้งหมด คำนึงถึงปัจจัยทางด้านร่างกาย จิตใจ สังคม ว่าทำอย่างไรจึงจะฟื้นฟูสุขภาพของผู้สูงอายุเพื่อให้ทุกท่านมีคุณภาพชีวิตที่ดีที่สุดเท่าที่จะเป็นไปได้ในทุกมิติของการใช้ชีวิต
ผู้สนใจสามารถสอบถามข้อมูลเพิ่มเติมเกี่ยวกับบริการทางการแพทย์เพื่อการดูแลผู้สูงอายุได้ที่ ศูนย์สุขภาพผู้สูงอายุ ชั้น 6 โรงพยาบาลวิมุต หรือ โทร. 02-079-0044
ร่วมบริจาค มูลนิธิโรงพยาบาลกลาง
ร่วมบริจาคเงินกับมูลนิธิโรงพยาบาลกลาง เพื่อช่วยเหลือผู้ป่วยยากไร้
- สามารถร่วมบริจาคได้ที่ มูลนิธิโรงพยาบาลกลาง ชั้น 19 อาคารอนุสรณ์ 100 ปี โทร. 02-2208000 ต่อ 11911
- บริจาคได้ที่ เลขบัญชี 001 - 0 - 87506 - 0 ชื่อบัญชี : มูลนิธิโรงพยาบาลกลาง ธนาคารกรุงเทพ สาขาพลับพลาไชย
โดยท่านสามารถแจ้งชื่อ-นามสกุล-ที่อยู่ รายนามผู้บริจาค พร้อมส่งหลักฐานการโอนมาที่ Inbox เพจ
PR รพ.กลาง เพื่อทางมูลนิธิฯ จะทำการออกใบเสร็จรับเงินส่งกลับไปตามที่อยู่ที่ท่านได้ระบุไว้
ดอนเมือง นัดทิ้งขยะชิ้นใหญ่ ทุกวันเสาร์ เดือนพฤศจิกายน LINK
ดอนเมืองนัดเก็บขยะชิ้นใหญ่ สิ่งของเหลือใช้ และขยะอันตราย เดือนพฤศจิกายน ทุก วันเสาร์ เวลา 9 โมงเช้า
5 พฤศจิกายน 2565 หมู่บ้านกัญจน์เพชร ซอยประชาอุทิศ 17
12 พฤศจิกายน 2565 หมู่บ้านศุภาลัยวิลล์ ซอยช่างอากาศอุทิศ 5
19 พฤศจิกายน 2565 ชุมชนเปรมประชา ซอยวิภาวดีรังสิต 33
26 พฤศจิกายน 2565 ชุมชนบัณฑิตโฮม ซอยวิภาวดีรังสิต 76
บริการนัดเก็บขยะชิ้นใหญ่ สิ่งของเหลือใช้ และขยะอันตราย จากประชาชน ทางเขตฯ จะหมุนเวียนออกให้บริการครอบคลุมทุกพื้นที่เขตดอนเมือง เพื่อนำขยะชิ้นใหญ่ที่ไม่ใช้แล้วไปกำจัดอย่างถูกวิธี ลดปริมาณขยะในพื้นที่กรุงเทพมหานคร หรือหากชุมชนไหนต้องการทิ้งขยะชิ้นใหญ่
สามารถโทรสอบถามได้ทุกวันที่ ฝ่ายรักษาความสะอาดฯ โทร 0 2565 9414 ค่ะ
ตาราง Group G
| |
Group G |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
บราซิล |
3 |
2 |
0 |
1 |
3 |
1 |
2 |
6 |
| 2 |
สวิตเซอร์แลนด์ |
3 |
2 |
0 |
1 |
4 |
3 |
1 |
6 |
| 3 |
แคเมอรูน |
3 |
1 |
1 |
1 |
4 |
4 |
0 |
4 |
| 4 |
เซอร์เบีย |
3 |
0 |
1 |
2 |
5 |
8 |
-3 |
1 |
16 พ.ย. 65 ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา
-นายวิษณุ เครืองาม รองนายกรัฐมนตรี เชิญ นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ มาชี้แจง รายละเอียดในประกาศ สธ. เรื่องสมุนไพรควบคุม (กัญชา) พ.ศ.2565 ที่นายอนุทินลงนามประกาศเมื่อ 11 พ.ย.ที่ผ่านมา รัฐมนตรีหลายคนสอบถามถึงข้อสงสัยในประกาศจำนวนมาก อาทิ คุณหญิงกัลยา โสภณพนิช รมช.ศธ. ขอความชัดเจน รายละเอียดเรื่องการควบคุมและการปฏิบัติ โดยเฉพาะการใช้ใบ ใช้ดอก นายชัยวุฒิ ธนาคมานุสรณ์ รมว.ดิจิทัลเพื่อเศรษฐกิจ และสังคม เห็นด้วยที่ต้องอธิบายให้สังคมเข้าใจชัดเจน เหตุผลที่ประกาศระบุไปที่การใช้ช่อดอก โดยเฉพาะการระบุสถานที่ ห้ามจำหน่ายที่จำกัด เช่น ในวัด ในโรงเรียน เพราะวัดบางแห่งมีโรงสมุนไพรที่ใช้กัญชาทางการแพทย์ ทั้งนี้ มีหลายคำถามที่ อธิบดีไม่สามารถให้คำตอบได้อย่างชัดเจน อีกทั้งชี้แจงได้เฉพาะกฎหมายของตัวเอง ไม่สามารถตอบกฎหมายที่เกี่ยวข้องกับ หน่วยงานอื่นได้ หลายคำถามที่อธิบดีไม่สามารถตอบได้ เช่น การดำเนินการหากมีคนนำมาทั้งต้น โดยรัฐมนตรีรายหนึ่งเสนอ ว่า ให้ไปพิจารณาแก้กฎหมายหรือเขียนประกาศที่สามารถนำมาใช้อย่างเร่งด่วนได้ แม้สธ.จะมีประกาศเรื่องช่อกับดอกออกมา แต่ยังไม่แก้ปัญหากรณีมีการอ้างว่าเสพกัญชาได้เพื่อสันทนาการ จึงขอให้หน่วยงานที่เกี่ยวข้องไปหาวิธีไม่ให้เสพได้อย่างเสรี ขณะที่ พล.อ.ประยุทธ์ กล่าวว่า เรื่องนี้สัปดาห์หน้าให้นายอนุทินมาชี้แจงใน ครม.ทั้งนี้ วันที่ 22 พ.ย. มีการประชุม ป.ป.ส. จะ นำเรื่องนี้เข้าประชุมหารือในรายละเอียด และปรับแก้ตามข้อเสนอแนะกันในที่ประชุมแล้วค่อยนำกลับเข้า ครม.อีกครั้ง
- ในการประชุมวุฒิสภา เปิดให้สมาชิกหารือ นายสมชาย แสวงการ ส.ว. หารือถึงการแก้ไขปัญหาสุญญากาศกัญชา ว่า ประกาศฉบับใหม่ก็ดีขึ้นเล็กน้อย แต่ยังไม่สามารถแก้ไขปัญหาได้หมด เพราะกฎหมายที่ต้องใช้จริงๆคือ ร่างพ.ร.บ.กัญชากัญชง ที่ยังค้างอยู่ในสภา พร้อมนำภาพสถานประกอบการหลายแห่งมีการโฆษณาขายกัญชา โดยไม่ได้สนใจข้อห้ามจากกระทรวง สาธารณสุข และได้ลงพื้นที่ย่านถนนข้าวสารและย่านสุขุมวิทพบมีการขายจำนวนมาก บางร้านมีรายได้วันละนับล้านบาท ยืนยันร้านค้าที่ขายกัญชาไม่ใช่เพื่อทางการแพทย์ แต่เพื่อสันทนาการ
- ผอ.เขตพระนคร จะลงพื้นที่ไปตรวจสอบการขายช่อดอกกัญชา บนถนนข้าวสาร หลังมีข้อร้องเรียนอีกครั้งว่า พบการ ขายกัญชามวนให้นักท่องเที่ยว ซึ่งจะต้องมีการทำความเข้าใจประกาศ สธ. ฉบับใหม่ล่าสุด ที่ให้ช่อดอกกัญชาเป็นสมุนไพร ควบคุม ต้องตักเตือนและห้ามขายกัญชาเพื่อสูบ ถ้าฝ่าฝืนจะบังคับใช้กฎหมายทันที
-นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและ รมว.สธ. ให้สัมภาษณ์ถึงการออกประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ฉบับปรับปรุง ที่ควบคุมเฉพาะช่อดอกที่บางฝ่ายมองว่าจะเกิดช่องว่างมากขึ้น ว่า ยืนยันว่าการปลดล็อก กัญชาทางการแพทย์ กัญชงเพื่อเศรษฐกิจของไทย ดำเนินการอย่างเป็นขั้นตอน ต่อเนื่อง ประกาศนี้ก็ไม่ได้ส่งผลกระทบกับผู้ที่ มีการใช้กัญชา กัญชงในทางที่ถูกต้อง เพียงมาขออนุญาตให้มีสถานที่จำหน่ายชัดเจน ตรวจสอบได้ คนทั่วโลกเรียนรู้ที่จะใช้ ประโยชน์จากกัญชา กัญชง อย่างประเทศญี่ปุ่น ได้เห็นผลิตภัณฑ์ที่ทำจากสารสกัดกัญชาในส่วนที่เป็นซีบีดี (CBD) วางขาย อย่างแพร่หลายเป็นปกติในประเทศญี่ปุ่น ไม่เห็นมีใครตื่นเต้น หรือสูบกันเกลื่อน ไม่เห็นมีผลต่อจิตประสาท
-นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรมว.สธ. โพสต์ภาพขณะเดินชมร้านขายผลิตภัณฑ์จากกัญชา หลังเสร็จ สิ้นภารกิจการหารือเรื่องความร่วมมือในการพัฒนาระบบให้บริการหลักประกันสุขภาพถ้วนหน้ากับทางการญี่ปุ่น
ผลิตภัณฑ์จากกัญชา
- ที่มหาวิทยาลัยแม่ฟ้าหลวง (มฟล.) จ.เชียงราย รศ.วันดี รังสีวิจิตรประภา คณบดีสำนักวิชาวิทยาศาสตร์เครื่องสำอาง มฟล. ได้ลงนามในบันทึกข้อตกลงความร่วมมือ (MOU) กับภาคเอกชน โดยมีนายกันตพัฒน์ เหลืองเจริญวัฒนา ประธาน เจ้าหน้าที่บริหาร บริษัท อินโนลีฟ พลัส จำกัด เป็นผู้แทนร่วมลงนามเพื่อพัฒนาผลิตภัณฑ์เครื่องสำอางผสมน้ำมันจากเมล็ด และสารสกัดจากกัญชง เป็นจุดเริ่มต้นการร่วมวิจัยและพัฒนาในการเพิ่มมูลค่าและสร้างความเข้มแข็งให้กับธุรกิจ นำไปสู่การ ต่อยอดการลงทุนวิจัยพัฒนาในภาคเอกชน โดยมฟล.ประสบความสำเร็จในการวิจัยและพัฒนาต่อยอดไปสู่การผลิตจริง มากกว่า 80 รายการ
ร่าง พ.ร.บ.กัญชา กัญชง
- เครือข่ายภาคประชาชนจะยื่นหนังสือต่อพรรคการเมืองต่าง ๆ 15 พ.ย.นี้เป็นต้นไป โดยนายประสิทธิ์ชัย หนูนวล กมธ. พิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... กล่าวว่า ประชาชนที่มาร่วมเวทีจำนวนมากมีความเห็นสอดคล้องกันว่าต้องการให้ ส.ส. ทำหน้าที่ในการพิจารณาร่างกฎหมาย พ.ร.บ.กัญชา กัญชงฯ ข้อที่เห็นว่ายังไม่รอบคอบ มีข้อกังวลสามารถตัดออกหรือ แปรญัตติได้ตามอำนาจที่สภามีอำนาจ ซึ่งจะเป็นแนวทางที่เกิดประโยชน์สูงสุด
-นายปานเทพ พัวพงษ์พันธ์ โฆษกกรรมาธิการพิจารณาร่าง พ.ร.บ.กัญชา กัญชงฯ กล่าวว่า กรรมาธิการมีความตั้งใจใช้ กฎหมายกัญชาเพื่อมาควบคุมการคว่ำกฎหมายไม่เกิดประโยชน์อันใดต่อประชาชน เพราะหากต้องการควบคุมการใช้จริง ก็ ต้องผ่านกฎหมายกัญชาเท่านั้น
-น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย กล่าวว่า ขณะนี้พรรคภูมิใจไทย โดยนายอนุทิน ชาญวีรกูล อยู่ในสภาพ ที่ขาดซึ่งภาวะผู้นำอย่างรุนแรง หลังจากที่ร่าง พ.ร.บ.กัญชา กัญชงฯ ถูกคว่ำในสภา พยายามที่จะนำร่าง พ.ร.บ.กัญชาฯ เข้า สภาอีกรอบ นายอนุทินและ พล.อ.ประยุทธ์สามารถรับผิดชอบได้หรือไม่ กับเหตุพ่อฆ่าลูก ลูกฆ่าพ่อแม่ เด็ก เยาวชน เสพ กัญชาในโรงเรียนจนเกิดอาการหลอนทำร้ายเพื่อนและครูในโรงเรียน
WOW ART & Design Market
WOW ART & Design Market ตลาดสินค้าประเภทงานศิลปะ งานคราฟต์ ของตกแต่งภายในบ้าน ต้นไม้ อาหาร-เครื่องดื่มเพื่อสุขภาพ เป็นต้น
แผนก NCCU ของบำรุงราษฎร์ มีความพร้อมใน 4 ปัจจัย - นพ. ฤกษ์ชัย ตุลยาภรณ์โชติ


นพ. ฤกษ์ชัย ตุลยาภรณ์โชติ แพทย์หัวหน้าศูนย์โรคระบบประสาทและแพทย์ชำนาญการเฉพาะทางด้านประสาทวิทยา โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “แผนก NCCU ของบำรุงราษฎร์ มีความพร้อมใน 4 ปัจจัยหลัก ได้แก่ 1. ทีมแพทย์เฉพาะทางที่มีประสบการณ์และความชำนาญขั้นสูงในการดูแลรักษาสามารถตรวจวินิจฉัยและรักษาโรคได้อย่างถูกต้องแม่นยำ 2. การทำงานร่วมกับทีมสหสาขาวิชาชีพได้อย่างมีระบบไร้รอยต่อ 3. เทคโนโลยีและอุปกรณ์ทางการแพทย์ที่ทันสมัย และ 4. ความพร้อมในการดูแลผู้ป่วยในทุกภาวะวิกฤตตลอด 24 ชั่วโมง เพราะทุก 1 นาทีที่เซลล์สมองขาดเลือด จะมีเซลล์สมองตายประมาณ 1 ล้านเซลล์ ซึ่งหมายถึง ‘นาทีชีวิต’ เพราะหากได้รับการรักษาช้า เซลล์สมองจะตายมากและนำไปสู่ความพิการหรือเสียชีวิตได้ โดยแผนก NCCU เรามีความพร้อมในการให้บริการดูแลรักษาครอบคลุมผู้ป่วยโรคและอุบัติเหตุทางสมองและระบบประสาทขั้นรุนแรงหรือฉุกเฉินเป็นอันตรายต่อชีวิต รวมถึงการผ่าตัดสมองหรือกระดูกสันหลังที่มีความเสี่ยงสูง อาทิ โรคหลอดเลือดสมองตีบและแตก, ภาวะเลือดออกในเยื่อหุ้มสมอง, โรคหลอดเลือดสมองโป่งพอง, การบาดเจ็บกระดูกสันหลังเฉียบพลัน, เนื้องอกในสมอง ฯลฯ ด้วยเทคโนโลยีและอุปกรณ์การแพทย์ขั้นสูง”
ร่วมฟังเพลงพระราชนิพนธ์ ภาควิชาดุริยางค์ฯ ม.ราชภัฏราชนครินทร์ ฉะเชิงเทรา 5 ธันวาคม 65
สาขาวิชาดุริยางคศิลป์ไทย มหาวิทยาลัยราชภัฏราชนครินทร์ ชวนมาร่วมฟังเพลงพระราชนิพนธ์ กับพวกเราสาขาดุริยางคศิลป์ไทย ได้ที่ สวนสาธารณะเฉลิมพระเกียรติ อ.เมือง จ.ฉะเชิงเทรา (ข้างตลาดวัดโสธรฯ) วันจันทร์ ที่ 5 ธันวาคม 2565 ภายในงานยังมีการแสดงจากสาขาดนตรีสากล และการวาดภาพประกอบดนตรี และการแสดงอีกมากมาย
แผนผังงานมหิดล ประจำปี 2565
3.คนกรุงเทพฯ ตื่นเต้น วัยรุ่นเน้นช็อปเพื่อ self-branding สูงวัยเน้นช็อปเพื่อ reconnect
คนกรุงเทพฯ กลับมามีคะแนนบวกสูงสุดที่ +7% เนื่องด้วยการเตรียมตัวซื้อของฝาก ส่งเงินให้ที่บ้าน และเดินทาง ท่องเที่ยวที่มากกว่าภาคอื่น
คนเหนือกลับติดลบ เนื่องด้วยปัญหาสภาพอากาศ เช่น ฝุ่นละออง PM2.5 ค่าตั๋วเครื่องบินที่ปรับราคาสูงขึ้นซึ่งอาจเกิดการชะลอตัวในการเดินทาง
วัยรุ่นและวัยทำงานช่วงอายุ 20-39 เน้นการจับจ่ายที่แสดงความเป็นตัวตน รวมถึงไปร่วมกิจกรรมเพื่อทำคอนเทนท์โซเชียลในอีเวนท์เทศกาลต่างๆ
วัยกลางคนช่วงอายุ 40-59 จับจ่ายเพื่อสานสัมพันธ์ ซื้อของฝาก ของขวัญแก่ลูกหลาน ญาติสนิทมิตรสหาย
Central Korat Countdown 2023 @ศูนย์การค้าเซ็นทรัล โคราช
ศูนย์การค้าเซ็นทรัล โคราช จัด Central Korat Countdown 2023 (28 ธ.ค. 65 – 1 ม.ค. 66) สนุกข้ามปีกับศิลปินดัง BIG ASS, BOWKYLION, INDIGO, LOMOSONIC, NAP THE NAP, PLAYGROUND
ที่ผ่านมา สถาบันโรคหัวใจบำรุงราษฎร์ รักษาผู้ป่วยโรคหัวใจเฉลี่ย 40,000 รายต่อปี หรือมากกว่า 1 ล้านคนนับตั้งแต่ก่อตั้งโรงพยาบาลฯ โดยมีสถิติความสำเร็จในการรักษาผู้ป่วยโรคหัวใจอื่นๆ ยกตัวอย่าง
1. รักษาผู้ป่วยด้วยวิธีการทำบอลลูน มากกว่า 350 รายต่อปี
2. ฉีดสีเพื่อดูเส้นเลือดหัวใจ มากกว่า 600 รายต่อปี
3. อัตราการเกิดหลอดเลือดตีบและแตกขณะทำบอลลูน 0% (สถิติประเทศไทย 0.22%)
4. ใส่ห้องไฟฟ้าหัวใจ มากกว่า 30 รายต่อปี และตรวจทางสรีรวิทยาไฟฟ้าหัวใจ มากกว่า 80 รายต่อปี
5. อัตราการเสียชีวิตจากการจี้ไฟฟ้าหัวใจ (AF & VT) = 0
6. อัตราการเสียชีวิตจากเปลี่ยนลิ้นหัวใจเออร์ติกด้วยเทคโนโลยี TAVI ตั้งแต่ปี 2559 = 0
7. ผ่าตัดหัวใจแบบเปิด มากกว่า 70 รายต่อปี
ของขวัญปีใหม่จากธนาคารออมสิน 2 โครงการ
ธนาคารออมสิน จำนวน 2 โครงการ
ได้แก่
1. โครงการวินัยดี มีเงิน เพื่อเป็นขวัญกำลังใจให้กับลูกค้าที่มีวินัยทางการเงิน สำหรับลูกค้าวงเงินกู้ไม่เกิน 200,000 บาท มีประวัติการชำระหนี้ดี ไม่น้อยกว่า 3 ปี จะได้รับเงินรายละ 500 บาท ซึ่งสามารถกดรับสิทธิผ่าน MyMo ได้ภายในวันที่ 25 ธันวาคม 2565
2. โครงการสลากออมสิน ดิจิทัล 2 ปี ฉลองปีใหม่ 2566 เพื่อส่งเสริมการออมผ่านสลากออมสินพิเศษดิจิทัล สำหรับผู้ฝากสลากออมสินพิเศษ 2 ปี ทั้งใบสลากและดิจิทัล ในระหว่างวันที่ 2 ธันวาคม 2565 ถึงวันที่ 31 มกราคม 2566 โดยเพิ่มรางวัลพิเศษรางวัลละ 1 ล้านบาท จำนวน 12 รางวัล สำหรับงวดวันที่ 30 ธันวาคม 2565 และอีก 12 รางวัล สำหรับงวดวันที่ 1 กุมภาพันธ์ 2566
สำหรับอาชีพที่สามารถประกอบได้หลังจากนี้ นอกจาก นักฉุกเฉินการแพทย์หรือนักปฏิบัติการฉุกเฉินการแพทย์ ยังมี ผู้สอนในองค์กรการศึกษาหรือฝึกอบรม นักวิชาการ นักวิจัยด้วย
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคใต้
จังหวัดสุราษฎร์ธานี
รหัสสาขา 05438 ตลาดโพธิ์หวาย
รหัสสาขา 05439 วัดโพธิ์ ซอย 20
จังหวัดสงขลา
รหัสสาขา 12163 ตลาดยรรยงค์
รหัสสาขา 13325 กาญจนวนิช ซอย 27
จังหวัดตรัง
รหัสสาขา 05557 ควนธานี
รหัสสาขา 13463 บ้านโพธิ์ (ตรัง)
จังหวัดสตูล
รหัสสาขา 08861 ท่าแพ (สตูล)
จังหวัดพัทลุง
รหัสสาขา 05777 อภัยบริรักษ์
จังหวัดชุมพร
รหัสสาขา 05734 ฮากกาชุมพร
ศูนย์บริการสาธารณสุขที่ 6 สนามบินน้ำ
- ที่อยู่ ท่าทราย อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทรศัพท์: 02-5896824
- แผนที่
- Facebook
บริการ
- คลินิกตรวจโรคทั่วไป วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 16.00 น. 17.00 - 19.30 น.
- คลินิคฝังเข็ม วันจันทร์ อังคาร พฤหัสบดี และศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 17.00 - 19.30 น. วันจันทร์ พุธและศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 17.00 - 19.30 น.
- คลินิคสุขภาพเด็กดี (สร้างภูมิคุ้มกันโรค) วันจันทร์ที่ ๑ ของเดือน ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 11.30 น.
- คลินิกโรคกระดูกและข้อ วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ 15.00 - 17.00 น.
- คลินิกกายภาพบำบัด วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 16.00 น.
- คลินิกแพทย์แผนไทย วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 16.00 น.
- คลินิกทันตกรรม คลินิกทันตกรรม (นอกเวลา) วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 16.30 น. วันจันทร์ พุธและศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 16.30 - 20.00 น.
- คลินิกไตเทียม (บริการฟอกเลือดด้วยเครื่องไตเทียม) วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ 08.30 - 12.30 น. 12.30 - 16.30 น. 16.30 - 20.00 น.
*หมายเหตุ ติดต่อนัดหมาย คลินิกกายภาพบำบัด โทร 0 2589 6824, ต่อ 309
คลินิกแพทย์แผนไทย โทร 0 2589 6824 ต่อ 310
คลินิกทันตกรรม โทร 06 3963 0310
คลินิคไตเทียม โทร 0 25896824, ต่อ 401 และ 06 1114 0115
ทันตกรรม ให้บริการผู้ป่วยนักรักษาล่วงหน้า
ทันตกรรม ให้บริการผู้ป่วยนักรักษาล่วงหน้า
*ตรวจฟัน วินิจฉัยโรคในช่องปาก
*อุดฟัน รักษารากฟัน ฟอกสีฟัน
*ถอนฟัน ผ่าฟันคุด ศัลยกรรมช่องปาก
*ขูดหินปูน รักษาโรคเหงือก
*ฟันปลอม ครอบฟัน รากฟันเทียม
*ทันตกรรมสำหรับเด็ก
*ทันตกรรมสำหรับผู้สูงอายุ
เปิดให้บริการทุกวัน จันทร์ อังคาร พุธ และ ศุกร์ เวลา 16.30 – 20.30 น.
ติดต่อสอบถาม 088 6287852, 042 246656 ต่อ 3414
คลินิกทันกรรม ชั้น 4 ตึกผู้ป่วยนอก
สร้างตึกอุบัติเหตุฉุกเฉิน 14 ชั้น งบประมาณ 321 ล้าน
"ของบประมาณสร้างตึกอุบัติเหตุฉุกเฉิน 14 ชั้น งบประมาณ 321 ล้าน อีก 3 ปีเตรียมชมครับ ตอนนี้กำลังก่อสร้างฐาน รากอยู่"
KUSU เวิร์คช็อปผลิตงานเทียนหอม LINK
ผลิตงานเทียนหอมในรูปทรงต่างๆ เน้นไปทางรูปทรงธรรมชาติ เช่น ก้อนหิน ต้นกระบองเพชร นอกจากเป็นเทียนหอมที่ใช้ได้จริงแล้ว ยังสามารถเป็นของตกแต่งบ้านได้ด้วย
4 - 12 ก.พ.11:00 - 22:00
สอบถามโทร. 0959633444
การรายงานอาการข้างเคียง จากการรับ LAAB
ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย THE ROYAL COLLEGE OF RADIOLOGISTS OF THAILAND (RCRT)
ราชวิทยาลัยรังสีแพทย์แห่งประเทศไทย
THE ROYAL COLLEGE OF RADIOLOGISTS OF THAILAND (RCRT)
ที่อยู่: ชั้น 9 อาคารเฉลิมพระบารมี ๕๐ ปี เลขที่ 2 1 ซอย เพชรบุรี 47 บางกะปิ เขตห้วยขวาง กรุงเทพมหานคร 10310
โทรศัพท์: 027165963
www.rcrt.or.th/Covid-19 vaccination for tourist in Chiang Mai
Covid-19 vaccination for tourist in Chiang Mai
(12 years old or older)
at Chiang Mai Neurological Hospital
Address : 2 Suthep Road, Muang District,Chiangmai 50200
Location map
From Mondy to Fridy 8.300 am - 12.00 pm
Close on Sat - Sun & Public holiday
Service Fee1. Pfizer Vaccine 1,380 Baht/dose
2. Astrazeneca vaccine 1,180 Baht/dose
ขั้นตอนการยื่นขออนุญาต
ขั้นตอนการยื่นขออนุญาต
1. ขอรับคำขออนุญาตจาก กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลสันปูเลย
2. นำเอกสารตามหลักฐานยื่นประกอบคำขออนุญาต
3. เจ้าหน้าที่ตรวจหลักฐาน
4. เจ้าหน้าที่ออกสำรวจสถานที่ประกอบการ
5. ออกใบอนุญาต
6. ผู้ยื่นคำขออนุญาตชำระค่าธรรมเนียมใบอนุญาต ......ภายใน 30 วัน
บทกำหนดโทษ
ผู้ใดฝ่าฝืนหรือดำเนินกิจการที่เป็นอันตรายต่อสุขภาพ โดยไม่ได้รับใบอนุญาตจากเจ้าพนักงานท้องถิ่นต้องระวางโทษจำคุกไม่เกิน 6 เดือน หรือปรับไม่เกิน 10,000 บาท หรือทั้งจำ ทั้งปรับ ตาม
พระราชบัญญัติการสาธารณสุข พ.ศ.25356. การรักษาพยาบาลโรคเรื้อรัง และบริการกรณีเฉพาะ
แถลงการณ์กลุ่มคนรักหลักประกันสุขภาพต่อการย้ายด่วน นพ.สุภัทร ฮาสุวรรณกิจ
สืบเนื่องจากมีคำสั่งย้ายนพ.สุภัทร ฮาสุวรรณกิจ ผอ.รพ.จะนะ จ.สงขลา ไปยังรพ.สะบ้าย้อย จ.สงขลา เซ็นคำสั่งโดยผู้ตรวจราชการเขต 12 กลุ่มคนรักหลักประกันสุขภาพได้เฝ้าติดตามกระแสการย้ายครั้งนี้มาตั้งแต่ปลายปี 2565 ซึ่งขณะนั้นมีปัญหาประธานบอร์ดสปสช.ไม่ลงนามงบประมาณบัตรทอง ปี 2566 ที่ค้างมากว่า 3 เดือน จนเป็นเหตุในทุกวันนี้การเข้าถึงสิทธิด้านป้องกันโรคของคนกลุ่มประกันสังคมและกลุ่มอื่นที่ไม่ใช่บัตรทองเกิดปัญหาอย่างมาก โดยนพ.สุภัทร คือคนหนึ่งที่ได้ออกมาวิพากษ์วิจารณ์ต่อกรณีดังกล่าว หลังจากนั้นไม่นานกระแสการสั่งย้ายก็เริ่มชัดเจนขึ้น
คำสั่งโยกย้ายครั้งนี้มีกระบวนการแก้ผิดให้เป็นชอบ พยายามหาวิธีหลีกเลี่ยงกฎหมายเพื่อจะดำเนินการสั่งย้ายให้ได้ มีการออกระเบียบมาเพื่อให้ผู้ตรวจมีอำนาจในการสั่งย้ายผู้อำนวยการโรงพยาบาลได้ ซึ่งไม่เคยเกิดขึ้นมาก่อน ตามที่นพ.สุภัทรได้แจงรายละเอียด ตามแถลงการณ์ไว้แล้วนั้น
กลุ่มคนรักหลักประกันสุขภาพเห็นว่า การโยกย้ายครั้งนี้เป็นการทำลายระบบธรรมาภิบาลของกระทรวงสาธารณสุขลงอย่างสิ้นเชิง การที่ข้าราชการกระทรวงระดับปฏิบัติการกล้าที่จะออกมาวิพากษ์วิจารณ์ คอยติดตามตรวจสอบนโยบายต่างๆของกระทรวงสาธารณสุข คือความงดงามของระบบราชการ ที่ไม่ใช่เป็นเพียง “นายว่า ลูกน้องก้มหน้ารับ” โดยไม่ตั้งคำถามใดๆแม้ว่าสิ่งที่นายสั่งจะผิดหรือมีข้อชวนให้สงสัย และที่สำคัญหากกระทบต่อประชาชนข้าราชการที่ดีย่อมต้องปกป้องรับใช้ประชาชน
กลุ่มคนรักหลักประกันสุขภาพ ขอประนามการโยกย้ายครั้งนี้ ทั้งฝ่ายการเมืองและข้าราชการระดับสูงในกระทรวงสาธารณสุขที่เป็นผู้สั่งการ และขอยืนยันว่าแถลงการณ์ฉบับนี้ มิได้กระทำเพียงเพื่อปกป้องตัวบุคคล แต่เป็นการแสดงเจตนาของประชาชน ที่ต้องการเห็นระบบราชการที่ยอมรับฟังความเห็นต่างและข้อวิพากษ์วิจารณ์ น้อมรับสิ่งที่ผิดพลาด และยึดมั่นทำงานเพื่อประชาชน
การโยกย้ายครั้งนี้ไม่มีทั้งเหตุผลปัจจัยใดและเป็นที่คลางแคลงใจของประชาชนทั้งประเทศ เพราะบทบาทเข้มข้นของนพ.สุภัทร ที่ออกมาวิพากษ์วิจารณ์นโยบายกระทรวงสาธารณสุข ไม่เกรงกลัวที่จะตรวจสอบนโยบาย เป็นข้าราชการของประชาชนที่ทำหน้าที่แทนประชาชน คือตัวอย่างของข้าราชการและธรรมาภิบาลที่ประเทศนี้ต้องยืนหยัดไว้
กลุ่มคนรักหลักประกันสุขภาพขอเรียกร้องให้นายอนุทิน ชาญวีรกุล รัฐมนตรีว่าการกระทรวงสาธารณสุข และผู้บริหารของกระทรวงสาธารณสุขให้ยกเลิกคำสั่งย้ายทันที และขอสนับสนุนให้นพ.สุภัทร และข้าราชการผู้ทำหน้าที่ตรวจสอบนโยบายรัฐ ให้เข้มแข็งและยึดมั่นบทบาทหน้าที่นี้ต่อไป
๒๗ มกราคม ๒๕๖๖
cr- กลุ่มคนรักหลักประกันสุขภาพ
2.ความเป็นเลิศทางการแพทย์ (Clinical Excellence)
ความเป็นเลิศทางการแพทย์ นับเป็นหัวใจสำคัญที่ช่วยขับเคลื่อนการดำเนินธุรกิจโรงพยาบาลและสร้างความเชื่อมั่นให้ผู้รับบริการ
รศ.นพ. ทวีสิน ตันประยูร ประธานปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ อธิบายว่า นับตั้งแต่ก่อตั้งโรงพยาบาลและก้าวเข้าสู่ปีที่ 43 บำรุงราษฎร์ได้ให้ความสำคัญในการพัฒนาและยกระดับศูนย์รักษาโรคมาโดยตลอด
Barista Workshop (1 Day) Aroma Coffee Academy (ACA) LINK
Barista Workshop (1 Day) เน้นความรู้พื้นฐานเทคนิคการใช้เครื่องชงกาแฟ และการชงกาแฟอย่างมีคุณภาพ รายละเอียด 1. ความรู้เรื่องกาแฟและปัจจัยที่ส่งผลต่อกลิ่น / รสชาติของกาแฟ / ถิ่นที่ปลูก / การคั่ว / การบด 2. การเลือกใช้เมล็ดกาแฟ 3. การเลือกใช้เครื่องชงกาแฟและอุปกรณ์ 4. เทคนิคการปฏิบัติ Espresso Perfect Shot 5. เทคนิคการเป่าโฟมนม 6. เทคนิคการชงกาแฟอย่างมีคุณภาพ 7. การปฏิบัติการชงกาแฟร้อน , เย็น , ปั่น
สถานที่เรียน Aroma Coffee Academy (ACA) เลขที่ 99/9 ถ. รัชดา-รามอินทรา แขวงนวลจันทร์ เขตบึงกุ่ม กรุงเทพมหานคร 10230 สอบถาม โทร : 061-3978037, 085-4802917
เขตพระโขนง ห้องสมุดเพื่อการเรียนรู้บ้านจิรายุ-พูนทรัพย์
ท่านผู้หญิงพูนทรัพย์ นพวงศ์ มีอายุครบรอบ 96 ปี ในพ.ศ. 2549 ท่านได้น้อมเกล้าฯ ถวายบ้านพร้อมที่ดิน ณ ซอยสุขุมวิท 101/1 แด่สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี พิพิธภัณฑ์บ้านจิรายุ-พูนทรัพย์ ได้เปิดอย่างเป็นทางการเมื่อวันที่ 2 พฤศจิกายน พ.ศ. 2552 เพื่อเป็นศูนย์การเรียนรู้ด้านภาษาศาสตร์
11666 วชิรธรรมสาธิต 48 ถนนสุขุมวิท 101/1 แขวงบางจาก เขตพระโขนง
โทร. 023982551
facebook
Chirayupoonsapayalibrary/วัดหินแท่นลำภาชี อ.ด่านมะขามเตี้ย อุโบสถสีขาวบนสำเภาแก้วร้อยล้าน LINK
วัดแท่นหินลำภาชี ตั้งอยู่ที่ ตำบลหนองไผ่ อำเภอด่านมะขามเตี้ย จังหวัดกาญจนบุรี มีลักษณะเด่น สุดอลังการ คือ อุโบสถบนสำเภาแก้ว สีขาว เรียกว่า โบสถ์สำเภาแก้วร้อยล้าน ประดิษฐานอยู่บนเรือหงส์ ขนาบข้างด้วยเรืออนันตนาคราชลักษมี หนึ่งเดียวในประเทศไทย ด้านหน้าอุโบสถประดิษฐานองค์สมเด็จพระพุฒาจารย์ โต พรหมรังสี
วัดหินแท่นลำภาชี ถูกสันนิษฐานว่าตั้งขึ้นเมื่อปี พ.ศ.2481 ปัจจุบันมีพระครูถาวรกาญจนธรรม หรือหลวงพ่อสมคิด เป็นเจ้าอาวาส โดยแนวคิดในการสร้างโบสถ์แก้วประดิษฐานอยู่บนเรือหงส์นั้น หลวงพ่อสมคิด กล่าวว่า พระครูมหาพุทธาภิรักษ์ ผู้ช่วยเจ้าอาวาสวัดอินทรวิหารบางขุนพรม ได้นิมิตเห็นสถานที่ก่อสร้าง จึงนำคณะศรัทธาหลวงพ่อสมเด็จพระพุฒาจารย์ (โต พฺรหฺมรังสี) มาช่วยสร้าง ใช้ปัจจัยไปกว่า ๑๐๐ ล้านบาท ซึ่งมาจากศรัทธาของ หลวงพ่อสมเด็จพระพุฒาจารย์ (โต พฺรหฺมรังสี) ทั้งสิ้น โดยความหมายของโบสถ์แก้วที่ประดิษฐานอยู่บนเรือหงส์นั้น สีขาวของโบสถ์ หมายถึงกระจกขาว ที่สื่อถึงพระพุทธเจ้าผู้ทรงพระคุณอันประเสริฐเปล่งประกาย ไปทั่วโลกมนุษย์และจักรวาล ส่วนเรือสุพรรณหงส์ หมายถึง การนำพามนุษย์ ข้ามวัฏสงสารมุ่งสู่พุทธภูมิ ด้านข้างทั้ง 2 ของโบสถ์ มีเรือขนาบข้างด้วย เรืออนันตนาคราชลักษมี ประดิษฐานพระพุทธรูปศักดิ์สิทธิ์ หลวงพ่อโสธร หลวงพ่อวัดบ้านแหลม และหลวงพ่อวัดไร่ขิง โดยมีสมเด็จพระพุฒาจารย์ โต พรหมรังสี องค์ใหญ่ เด่นตั้งตระหง่านอยู่หน้าโบสถ์ และด้านหลังของโบสถ์มีท้าวกุเวร หรือท้าวเวสสุวัณ อธิบดีแห่งอสูรหรือยักษ์ เจ้าแห่งผีหนึ่งในบรรดาท้าวจตุโลกบาลทั้งสี่ผู้คุ้มครองและ ดูแลโลกมนุษย์ สิงสถิตอยู่บนสวรรค์ นอกจากนี้สิ่งศักดิ์สิทธิ์ในวัดอีกอย่างหนึ่ง คือ ศาลาประดิษฐาน 3 บูรพา พระมหากษัตริย์ในอดีต คือ สมเด็จพระนเรศวรมหาราช สมเด็จพระเจ้าตากสินมหาราช และพระปิยมหาราช หรือพระบาทสมเด็จพระปรมินทรมหาจุฬาลงกรณ์ พระจุลจอมเกล้าเจ้าอยู่หัว เป็นพระมหากษัตริย์สยาม รัชกาลที่ ๕ แห่งราชวงศ์จักรี โดยผู้มีจิตศรัทธาสร้างถวาย โดยมีคติความเชื่อว่ากษัตริย์ 3 พระองค์น่า จะเคยเสด็จผ่านสถานที่สร้างวัด
กิจกรรมยิงปืนบีบีกัน (เป้านิ่ง) , กิจกรรมยิงปืนบีบีกัน (ลงสนาม) , กิจกรรมยิงปืนเพนต์บอล (เป้านิ่ง) , กิจกรรมยิงปืนเพนต์บอล (ลงสนาม)
วัดพระธาตุอูปแก้วจามเทวี เมืองพิศดารนคร เชียงใหม่
สถานที่ประดิษฐาน “พญาครุฑ” เจ้าแห่งทรัพย์สมบัติ ช่วยปัดเป่า ปกป้อง และคุ้มภัย องค์ขนาดใหญ่ ลำตัวและปีกสีแดง ตั้งเด่นเป็นสง่าอยู่บริเวณเนินเขา โดยสร้างเพื่อเป็นพุทธานภาพ ถวายเป็นทรัพย์ของแผ่นดิน
หอศิลป์ ณ บ้านเจ้าพระยา Arts Gallery at Ban Chao Phraya
หอศิลป์ ณ บ้านเจ้าพระยา เดิมคือ วังพระวรวงศ์เธอพระองค์เจ้าคำรบ ตั้งอยู่เลขที่ 1 ถนนพระอาทิตย์ แขวงชนะสงคราม เขตพระนคร กรุงเทพมหานคร ติดกับสวนสันติชัยปราการ เป็นอาคารเก่าแก่สร้างในสมัยรัชกาลที่ 5 ปัจจุบันได้รับการขึ้นทะเบียนเป็นอาคารอนุรักษ์จากกรมศิลปากร ปัจจุบันเป็นสำนักงานของหนังสือพิมพ์ผู้จัดการและสถานีโทรทัศน์ผ่านดาวเทียม นิวส์วัน กลุ่ม ปตท. ได้อนุรักษ์บ้านเจ้าพระยาแห่งนี้ ให้เป็นที่จัดนิทรรศการผลงานที่ได้รับรางวัลในการประกวดศิลปกรรม ปตท. รวมทั้งใช้เป็นพื้นที่จัดแสดงนิทรรศการผลงานของศิลปินที่มีชื่อเสียง หรือศิลปินรุ่นใหม่อีกด้วย
เปิดทำการทุกวัน 10:00–18:00 เว้นวันจันทร์
Bangkok Citycity Gallery
Art Gallery สุดคูลสีขาวสไตล์มินิมอล ในซอยสาทร 1 เป็นแกลลอรี่อันดับต้นๆ ที่มีจัดแสดงงานศิลปะร่วมสมัยของศิลปินไทยรุ่นใหม่ และศิลปินหน้าใหม่มากมายในรอบหลายปีที่ผ่านมา ปี 2023 Bangkok Citycity Gallery กำหนดเวลาเปิดทำการใหม่ วันพุธ–วันเสาร์ เวลา 13:00–18:00 น. (ปิดวันอาทิตย์–วันอังคาร) ส่วนห้อง BOOKSHOP LIBRARY จะกลับมาเปิดให้บริการในวันเสาร์ที่ 21 มกราคม 2566
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุก ๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนกุมภาพันธ์ พ.ศ. 2566 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 16 ถึง วันที่ 28 ธันวาคม พ.ศ. 2565 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือ ศูนย์วิจัยของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อเป็นคลังสมองทางวิชาการ ช่วยเหลือทางด้านข้อมูลการตลาดและอื่นๆ ให้กับบริษัทในเครือฮาคูโฮโดในประเทศต่างๆ ในภูมิภาคอาเซียน รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของสถาบันฯ จะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่มองผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่มองถึงความเป็นบุคคลของผู้บริโภคที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
Kids Konference #JFF2023
Kids Konference #JFF2023
1 ชั่วโมง 28 นาที R:ท
สารคดีน่ารัก ขบขัน และลึกซึ้งซึ่งพาเราเข้าไปสังเกตการณ์ในโรงเรียนอนุบาลแห่งหนึ่งของญี่ปุ่นที่เปิดพื้นที่ให้เด็ก ๆ ได้มาแสดงความเห็น เปิดเผยตัวตน ตั้งคำถามกับโลก และสนุกสนานโดยไม่ถูกผู้ใหญ่ปิดกั้น กับกิจกรรมชื่อ “วงประชุมเด็ก" ตลอดทั้งปี "เธอเกิดมาทำไม", "เราจะหลีกเลี่ยงการสู้กันได้อย่างไร", "ใครเป็นคนสร้างจักรวาล" ฯลฯ ความคิดแปลก ๆ และคำพูดที่ตรงไปตรงมาของเด็ก ๆ ทำให้พวกเราทั้งขำขันและประหลาดใจ ขณะเดียวกัน การสนทนาอย่างเปิดเผยของพวกเขาก็ชวนให้ผู้ใหญ่ขบคิดเรื่อง “การใช้ชีวิตอยู่ในโลกโดยไม่ต้องมีคำตอบเสมอไป”
อันดับ 6. อุทยานแห่งชาติภูเรือ จ.เลย
นักท่องเที่ยวสามารถเดินทางเข้าอุทยานแห่งชาติภูเรือได้ตั้งแต่เวลา 05.00 - 20.00 น. เท่านั้น
นักท่องเที่ยวต้องปฏิบัติตามมาตรการ DMHTTA อย่างเคร่งครัด อุทยานแห่งชาติภูเรือ มีการกำหนดโซนประกอบอาหารที่มีกลิ่นและควันแยกจากลานที่พักกางเต็นท์อย่างชัดเจน
กรณีจองที่พักอุทยานแห่งชาติภูเรือ
- จองบ้านพักให้เข้าพักก่อน 20.00 น.
- จองเต็นท์ให้เข้าพักก่อน 19.00 น.
- นำเต็นท์มาเองให้เข้าพักก่อน 17.00 น.
ลุงตุ๋ย อาทร พูลศิริ เจ้าของผลิตภัณฑ์ งานโมเดลจำลองทำด้วยมือของทหารผ่านศึก ผู้ใช้ทักษะช่างไม้ที่สั่งสมมาทั้งชีวิต แกะแบบออกแบบโมเดลจำลองไม้ หาเลี้ยงชีพ ช่วงโควิดระบาด ด้วยการรับออเดอร์จากลูกค้าที่ต้องการโมเดลไปเป็นของขวัญในเทศกาลต่าง ๆ และเข็นขายในพื้นที่ตลาดพูล โดย 1 งาน ใช้เวลาทำนาน 8 ชั่วโมง แต่บางวันเข็นขายตั้งแต่เช้ายันเย็นกลับขายไม่ออกแม้แต่ชิ้นเดียว
โดยจากการเดินสำรวจของกลุ่มนักศึกษา ได้พบคุณลุงและพูดคุยถึงปัญหา พบว่าคุณค่าของงานคุณลุงอยู่ที่ ทักษะและประสบการณ์ที่สั่งสมไว้ หากนำสิ่งนี้มาคิดรูปแบบการนำเสนอใหม่ เปิดเวิร์คช็อปให้คนที่สนใจมาร่วมเรียนรู้ประกอบงานไม้ของตัวเอง จะทำให้คนเห็นคุณค่าของงานและบอกต่อ ทำให้คุณลุงมีออเดอร์เพิ่มขึ้น และได้ช่วยออกแบบแพคเกจจิ้ง เพิ่มความสวยงามให้งานไม้จำลองมีมูลค่าและมนต์คลังยิ่งขึ้น
“เด็กรุ่นใหม่เขาคิดเก่ง ทำงานของลุงมีคุณค่า น่าจดจำ มากขึ้น และลุงยังได้แบ่งปันประสบการณ์ให้คนรุ่นหลังได้เก็บไปเป็นแรงบันดาลใจและงานไม้จำลองของลุงอาจจะมีคนเห็นค่าและสืบทอดไว้”
Lightup Park Rayong อ.นิคมพัฒนา จ.ระยอง LINK
Lightup Park Rayong มาในธีม Festive Icon World แลนด์มาร์คใหม่ สวนไฟประดับสุดชิค โลกแห่งแสงสี อ.นิคมพัฒนา จ.ระยอง ตกแต่งด้วยไฟประดับหลายล้านดวง ทั้งกล่องของขวัญ Snow Man บอลลูน ทุ่งทานตะวัน ทุ่งดอกทิวลิป สะพานสายรุ้ง ฯลฯ สถานที่กว้าง มีมุมให้ถ่ายรูปหลากหลาย เริ่ม 18:00 - 21:00 น. โทร.094 326 5641
คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการฝ่ายวิจัยการตลาดและวางแผนกลยุทธ์ HILL ASEAN Thailand ได้กล่าวปิดท้ายกิจกรรมสัมมนาในครั้งนี้ไว้ว่า "สถาบันของเราจะยังทำการศึกษาพฤติกรรมการใช้จ่ายของคนไทยทุก ๆ สองเดือนอย่างต่อเนื่อง ซึ่งล่าสุดเมื่อต้นเดือนกุมภาพันธ์ที่ผ่านมา ได้มีการปล่อยตัวข้อมูลการศึกษามาในหัวข้อ "เปิดประเทศครั้งใหญ่ ในรอบ 3 ปี เมืองหลวงคึกคัก คนกรุงยิ้มได้ คนต่างจังหวัดยิ้มสู้" เพราะเราเชื่อว่าการช้อปปิ้งไม่ใช่แค่การจับจ่ายเพื่อซื้อสิ่งที่ต้องการใช้ แต่สามารถสะท้อนให้เห็น ไลฟ์สไตล์ คุณค่า และการเติมเต็ม emotional needs ที่แตกต่างกันไป สามารถใช้เป็นข้อบ่งชี้ที่ใช้คาดการณ์ว่า คนไทยต้องการใช้ชีวิต หรือมีชีวิตอย่างไรต่อไป และนี่คือ ความเป็นเอกลักษณ์ ของเรา ที่ใช้แนวคิดแบบ Sei-katsu-sha หรือการมองผู้คนแบบองค์รวม ไม่ใช่แค่พฤติกรรมการจับจ่ายเท่านั้น"
เทคโนโลยีปัจจุบัน ที่ช่วยให้การทำเด็กหลอดแก้วมีอัตราความสำเร็จเพิ่มมากขึ้น
ปัจจุบันมีเทคโนโลยีการตรวจวิเคราะห์ความผิดปกติของโครโมโซมตัวอ่อน Preimplantation Genetic Testing (PGT)
เป็นการตรวจคัดกรองและวินิจฉัยโรคทางพันธุกรรมของตัวอ่อน ร่วมกับการรักษาด้วยกระบวนการปฏิสนธิภายนอกร่างกายหรือเด็กหลอดแก้ว (IVF) โดยการสุ่มดูดเซลล์ของตัวอ่อนที่ได้รับการปฏิสนธิแล้วมาตรวจหาความผิดปกติทางพันธุกรรมก่อนที่จะทำการย้ายกลับเข้าสู่โพรงมดลูก เพื่อเพิ่มอัตราความสำเร็จ
บางคนอาจจะกังวลว่าการทำเด็กหลอดแก้ว อาจเป็นการเพิ่มโอกาสครรภ์เสี่ยงได้เมื่อเทียบกับการตั้งครรภ์โดยธรรมชาติ หรือไม่
ในกรณีที่การทำเด็กหลอดแก้วแล้วตั้งครรภ์แฝด หากทำที่คลินิกมักพบปัญหาเรื่องการฝากครรภ์ เนื่องจากหลายโรงพยาบาลจะไม่รับเคสแฝดจากที่อื่น เนื่องจากมารดาที่มีอายุมากกว่า 35 ปี อาจมีภาวะเบาหวาน ความดันได้ง่าย หรือโรคประจำตัวอื่น ซึ่งมีความเสี่ยงต่อการมีครรภ์แฝด
หากคุณแม่มีภาวะครรภ์เสี่ยงในช่วงทารกอยู่ในครรภ์ ทีมสูตินรีแพทย์จะเป็นทีมหลักที่ดูแล จนกระทั่งอายุครรภ์ 20 สัปดาห์ขึ้นไป ทีมบำบัดพิเศษทารกแรกเกิด NICU จะเข้าไปเป็นทีมเสริมเพื่อช่วยวางแผนและให้คำปรึกษา หลังทารกคลอด ทีม NICU จะมีหน้าที่หลักในการดูแล ซึ่งเรามีทีม NICU ที่เชี่ยวชาญและมีประสบการณ์สูงมาก
การทำเด็กหลอดแก้วในแต่ละช่วงอายุ มีอัตราความสำเร็จอยู่ที่ประมาณกี่เปอร์เซ็นต์
คลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์ มีประสบการณ์ในการช่วยให้คู่สมรสประสบความสำเร็จในการมีบุตร โดยมีอัตราความสำเร็จของการทำ IVF ในปี พ.ศ. 2563 ถึง 2565 เฉลี่ยอยู่ที่ 90% ในกลุ่มผู้หญิงที่มีอายุมากกว่า 40 ปี
7. มุ่งเน้นที่การส่งมอบบริการทางสาธารณสุขที่ครอบคลุมและเท่าเทียมกันมากขึ้น
การแพร่ระบาดของโควิด-19 เร่งให้เกิดการประยุกต์ใช้เทคโนโลยีดิจิทัลด้านเฮลท์แคร์เร็วขึ้น เพื่อเพิ่มการเข้าถึงด้านสาธารณสุข โดยเฉพาะอย่างยิ่งสำหรับประชาชนที่อยู่ในพื้นที่ห่างไกลและพื้นที่ชนบท การแพร่ระบาดของโควิด-19 ยังส่งผลกระทบต่อกลุ่มเปราะบางบางกลุ่ม และทำให้ช่องว่างด้านสุขภาพทั่วโลกเพิ่มมากขึ้น ความไม่เท่าเทียมด้านการเข้าถึงระบบสาธารณสุขทั้งภายในและระหว่างประเทศอาทิ อัตราการเจ็บป่วยที่สูงกว่าในบางเชื้อชาติและบางกลุ่มชาติพันธุ์กำลังเป็นที่สนใจมากขึ้น [4] ทำให้ทั่วโลกพยายามหาทางออกในการแก้ปัญหาความไม่เท่าเทียมในระบบสาธารณสุข [5] จากการรายงาน Future Health Index 2022 report เผยว่าผู้นำในวงการเฮลท์แคร์ของสหรัฐอเมริกาให้ความสำคัญด้านความเท่าเทียมทางสาธารณสุขเป็นอันดับแรก
ต่อจากนี้ สังคมคาดหวังให้องค์กรมีบทบาทสำคัญในการพัฒนานวัตกรรมและเทคโนโลยีในการดูแลสุขภาพและเป็นพันธมิตรทางด้านการเงินในการสร้างระบบสาธารณสุขที่เท่าเทียม แพลตฟอร์ม อย่าง Digital Connected Care Coalition สามารถเชื่อมต่อองค์กรภาครัฐและเอกชนเพื่อช่วยผลักดันให้โครงการดิจิทัลเฮลท์ในประเทศที่มีรายได้น้อยและปานกลางได้เกิดขึ้นอย่างรวดเร็ว
สำหรับโซลูชันด้านเฮลท์แคร์เทคโนโลยีในอนาคต ต้องช่วยให้เกิดการส่งมอบด้านสาธารณสุขที่เท่าเทียมกันมากขึ้น เพื่อสนับสนุนให้ทุกคนมีสุขภาพที่ดี ไม่ว่าพวกเขาจะเป็นใครหรืออาศัยอยู่ที่ใด เราต้องแน่ใจว่าจะไม่มีใครถูกทิ้งไว้ข้างหลัง ซึ่งจำเป็นต้องมีแนวทางที่ครอบคลุมและได้รับความร่วมมือในการให้ผู้คนเป็นศูนย์กลางของกระบวนการทางนวัตกรรม และนั่นหมายถึงการรับฟังและทำงานอย่างใกล้ชิดกับผู้ที่ต้องเผชิญกับความไม่เท่าเทียมทางสาธารณสุขที่มีอยู่
เขตสัมพันธวงศ์
เขตสัมพันธวงศ์ร่วมกับศูนย์บริการสาธารณสุข 13 ไมตรีวานิช มีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ครั้งที่ 1 ระหว่างวันที่ 13 - 24 มีนาคม 2566 เวลา 10.00 - 12.00 น.
เขตบางบอน
บริการฉีดวัคซีน "ฟรี" ไม่เสียค่าใช้จ่ายแต่อย่างใด สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2450 3272 และศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน โทร. 0 2453 0526 จึงขอประชาสัมพันธ์ให้ทราบโดยทั่วกัน
เขตหนองจอก
สำนักงานเขตหนองจอกร่วมกับศูนย์บริการสาธารณสุข 44 ลำผักชี มีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ครั้งที่ 1 ระหว่างวันที่ 2-17 มีนาคม 2566 เวลา 10.00 - 12.00 น.ประชาชนผู้ที่สนใจ โปรดนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาดังกล่าว
5.ประเภทการท่องเที่ยวคาร์บอนต่ำเพื่อความยั่งยืน (Low Carbon & Sustainability)
นิยาม แหล่งท่องเที่ยว ที่พักนักท่องเที่ยว การท่องเที่ยวเชิงสุขภาพ รายการนำเที่ยว หรือสถานประกอบอื่น ๆ ที่ดำเนินธุรกิจโดยมีนโยบาย มาตรการ ความคิดริเริ่ม ในการจัดการคาร์บอนต่ำ (Low Carbon) อย่างเป็น รูปธรรม ใส่ใจต่อการแก้ไขปัญหาการเปลี่ยนแปลงสภาพภูมิอากาศ (Climate Emergency) สอดคล้องกับ เป้าหมายการพัฒนาที่ยั่งยืนของประเทศ เพื่อลดการปล่อยก๊าซเรือนกระจกได้อย่างมีประสิทธิภาพ และ คำนึงถึงความสมดุลสู่ความยั่งยืน (Sustainability) ใน 3 มิติ ได้แก่ เศรษฐกิจ สิ่งแวดล้อม และสังคม มิติเศรษฐกิจ การพัฒนาเศรษฐกิจที่ยั่งยืนให้เจริญเติบโตอย่างมีคุณภาพ มีการกระจายรายได้เอื้อ ประโยชน์ต่อคนส่วนใหญ่ มิติสิ่งแวดล้อม การพัฒนาสิ่งแวดล้อมที่ยั่งยืน การใช้ทรัพยากรธรรมชาติ และการปล่อยมลพิษใน ระดับที่สามารถบริหารจัดการได้ มิติสังคม การพัฒนาสังคมยั่งยืน พัฒนาคนให้มีความรู้ มีสมรรถนะ และผลิตภาพสูง เกิดสังคมที่มี คุณภาพลูกพกถุงยางอนามัย ยาคุมกำเนิดในกระเป๋านักเรียน
ควรทำ
ตั้งสติ ลูกอาจใช้อุปกรณ์เหล่านี้ในการเรียน หรือแม้ว่าลูกจะไปมีเพศสัมพันธ์มาจริงๆ อย่างน้อย ลูกก็รู้จักการมีเพศสัมพันธ์ที่ปลอดภัย
พูดคุยสอบถามด้วยท่าทีปกติ ถือเป็นโอกาสที่จะสื่อสารเพื่อสร้างความไว้วางใจ ว่าพ่อแม่พร้อมจะพูดคุย ให้คำแนะนำ และช่วยเหลือลูกในทุกเรื่อง ชวนลูกพูดคุยเรื่องความรักความสัมพันธ์ และเพศสัมพันธ์ที่ปลอดภัย
ถ้าลูกบอกว่า ใช้อุปกรณ์เหล่านี้ เพื่อการมีเพศสัมพันธ์จริง ให้กล่าวชื่นชมที่ลูกรู้จักใช้อุปกรณ์คุมกำเนิด และสอบถามถึงวิธีการ เพื่อเช็คว่า ลูกใช้อย่างถูกวิธีหรือไม่ หากลูกยังมีความเข้าใจคลาดเคลื่อน พ่อแม่สามารถให้ข้อมูลเพิ่มเติม หรือหากพ่อแม่ไม่รู้ไม่เข้าใจ ก็สามารถชักชวนลูกให้หาข้อมูลด้วยกันได้
อย่าทำ
การดุด่า โวยวาย จะเป็นการปิดกั้นการสื่อสารระหว่างกัน เด็กจะขาดความไว้วางใจ คิดว่าพ่อแม่ไม่เข้าใจ และไม่ยอมรับในตัวเขา
การใช้ท่าทีซักไซ้ ไต่สวน เพื่อหาข้อเท็จจริงว่าลูกไปมีเพศสัมพันธ์มากับใคร อย่างไร อาจทำให้เด็กไม่รู้สึกว่าถูกคุกคามความเป็นส่วนตัว และจะปิดบังไม่ให้พ่อแม่รับรู้เรื่องเหล่านี้อีก
คลินิกแพทย์แผนจีน (Chinese Medicine Clinic)
คลินิกแพทย์แผนจีน ที่ KIN “ฝังเข็ม” เป็นศาสตร์การแพทย์แผนจีนโบราณที่ขึ้นชื่อเรื่องการรักษาโรค ฟื้นฟูสุขภาพ ปรับสมดุลร่างกายมายาวนาน ล่าสุดองค์การอนามัยโลก (WHO) ให้การรับรองว่า “การฝังเข็มสามารถรักษาโรคได้จริง” ฝังเข็ม (Acupuncture) หรือการฝังเข็มแบบจีน (Chinese Acupuncture) คือ การใช้เข็มฝังลงตาม “จุดฝังเข็ม” ซึ่งเรียงอยู่บนแนวเส้นลมปราณ เพื่อปรับสมดุลร่างกายชี่ให้สมดุลระหว่างหยิน หยาง และรักษาโรค ความผิดปกติ ที่อวัยวะต่างๆ พานาซี จึงตั้งใจเปิดโครงการ Panacee Partnership เปิดโอกาสด้านธุรกิจทางการแพทย์เพื่อผู้ประกอบการไทย สนับสนุนต่อยอดให้เกิด Start up wellness Business แก่ผู้ที่ต้องการลงทุนในธุรกิจด้านสุขภาพ โปรเจค Panacee Partnership เพื่อชวนผู้สนใจมาร่วมเป็นแรงขับเคลื่อนด้านธุรกิจ Wellness ไปกับพานาซี เพื่อผลักดันให้ไทยก้าวเป็น Medical Hub ด้านสุขภาพของโลกต่อไปค่ะ” นางศิริญา กล่าว
คุณศิริญา เทพเจริญ นำทีมสื่อมวลชนเข้าชมศูนย์เก็บและฝากสเต็มเซลล์ของ รพ.พานาซี พระราม2เราจะดูแลตนเองจาก PM2.5 ได้อย่างไรบ้าง?
แม้ว่าในปัจจุบันจะมีมาตรการและนโยบายต่าง ๆ จากหน่วยงานภาครัฐ แต่ทั้งนี้ประชาชนทั่วไปควรมีการรับมือและป้องกันไม่ให้มลภาวะเข้าสู่ร่างกายของเราด้วย คุณหมอแอมป์จึงได้แนะนำวิธีป้องกันการดูแลตัวเองไว้ในเบื้องต้น ดังนี้
- หลีกเลี่ยงหรือลดระยะเวลาการทำกิจกรรมกลางแจ้งเป็นเวลานาน เพื่อลดโอกาสการสัมผัสฝุ่นจากด้านนอก หรือใช้อุปกรณ์ป้องกันตัวเอง อย่างหน้ากาก N95 หากมีความจำเป็นต้องไปในพื้นที่ที่มีฝุ่นจำนวนมาก
- รณรงค์การเลือกใช้ยานพาหนะ และการขนส่งสาธารณะแบบระบบไฟฟ้า แทนการใช้เชื้อเพลิงซากดึกดำบรรพ์ (Fossil fuels) เช่น ถ่านหิน หินน้ำมัน และปิโตรเลียม
- หลีกเลี่ยงการทำกิจกรรมในครัวเรือนที่ส่งเสริมให้เพิ่มจำนวนฝุ่น เช่น การสูบบุหรี่ การจุดธูปเทียน ลดการปรุงประกอบอาหารประเภทปิ้ง ย่าง โดยเลือกเป็นการต้ม และนึ่งทดแทน
- จัดระเบียบที่พักอาศัย เช่น การติดตั้งเครื่องกรองอากาศ การหมั่นทำความสะอาดและพยายามให้มีการระบายอากาศที่ดีเสมอ
- หมั่นสังเกตอาการตัวเอง โดยเฉพาะอย่างยิ่งผู้สูงอายุ ผู้ป่วยโรคทางเดินหายใจ หากมีอาการใด ๆ เช่น ไอ หายใจลำบาก ตาแดง แน่นหน้าอก ปวดศีษะ คลื่นไส้ อ่อนเพลีย ฯลฯ ควรรีบปรึกษาแพทย์
- ดูแลเสริมระบบภูมิคุ้มกัน ซึ่งเป็นเกราะป้องกันของร่างกาย ได้แก่
- การรับประทานอาหารที่อุดมไปด้วยวิตามินเอ วิตามินซี และวิตามินอี อย่างผักและผลไม้ ซึ่งมีคุณสมบัติในการต้านอนุมูลอิสระและช่วยบำรุงตับ
- งดการสูบบุหรี่และดื่มเครื่องดื่มแอลกอฮอล์
- ดื่มน้ำสะอาด 8 - 10 แก้วต่อวัน
- นอนหลับเพียงพอ 8 - 9 ชั่วโมงต่อวัน
- ลดความเครียด ทำอารมณ์ให้ผ่องใส
- ออกกำลังกายอย่างสม่ำเสมอ (หาก PM2.5 มีปริมาณมาก สามารถปรับเป็นการออกกำลังกายในร่มได้ เช่น วิ่งบนสายพาน ปั่นจักรยานอยู่กับที่ ว่ายน้ำในร่ม ฯลฯ) อย่างน้อย 150 นาทีต่อสัปดาห์ หรืออย่างน้อย 30 นาทีต่อวัน 5 วันต่อสัปดาห์
ปัญหามลพิษทางอากาศ โดยเฉพาะอย่างยิ่งฝุ่นละออง PM2.5 ถือได้ว่าเป็นภัยคุมคามทางสิ่งแวดล้อมที่ร้ายแรงต่อสุขภาพของมนุษย์ แม้ว่าจะไม่ใช่ปัญหาที่เพิ่งเกิดขึ้นและจะหมดไปโดยง่าย แต่ความรุนแรงที่มากขึ้นยิ่งตอกย้ำให้เห็นว่าพวกเราควรหันมาใส่ใจกับปัญหาดังกล่าวอย่างจริงจัง เพราะนั้นคือตัวแปรสะท้อนสำคัญของการมีสุขภาวะของคนไทยทั้งในปัจจุบันและอนาคต
Khon Kaen Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย ครั้งที่ 8 LINK
ณ บ้านสาวะดี วัดไชยศรี ร่วมสืบสาน รักษา อัตลักษณ์ท้องถิ่น ต่อยอดคุณค่าวัฒนธรรมประเพณีในชุมชนให้ยั่งยืน ชมการแสดงหมอลำสาวะถี ทั้งการแสดงจากหมอลำสินไซน้อยร้อยปี, พิธีเสียเคราะห์ พิธีสะเดาะเคราะห์ในแบบวิถีดั้งเดิมของชาวอีสาน, ช้อป ชิม ตลาดนัดชุมชนสาวะถี ร่วมสืบสานอัตลักษณ์ท้องถิ่นไปกับ การแสดงหมอลำสาวะถี หมอลำสินไซน้อยร้อยปี หุ่นเชิดประกอบการแสดง พร้อมด้วยระเบียบวาทะศิลป์ และยังมีพิธีเสียเคราะห์ หรือ พิธีสะเดาะเคราะห์ในแบบวิถีดั้งเดิมของชาวอีสาน ซึ่งเป็นกิจกรรมไฮไลท์ของประเพณีวิถีดั้งเดิมสงกรานต์ ที่จะทำให้ทุกคนประทับใจ “Water Festival 2023 เทศกาลวิถีน้ำ...วิถีไทย “ชื่นอุรา น่าสบาย”
ระหว่างวันที่ 13 - 16 เม.ย. 2566 ณ วัดไชยศรี บ้านสาวะถี จ.ขอนแก่น
เปิดทางหลวง ปากช่อง – สีคิ้ว – ขามทะเลสอ ตลอด 24 ชั่วโมง
กรมทางหลวงจะเปิดให้บริการทางหลวงพิเศษหมายเลข 6 ช่วง ปากช่อง – สีคิ้ว – ขามทะเลสอ ระยะทาง 64 กิโลเมตร ตั้งแต่วันที่ 12 – 18 เมษายน 2566 ตลอด 24 ชั่วโมง โดยจัดการจราจรแบบเดินรถทางเดียว
- ช่วงเดินทางขาออกจากกรุงเทพฯ วันที่ 12 – 14 เม.ย. 66
- ช่วงเดินทางขาเข้ากรุงเทพฯ วันที่ 15 – 18 เม.ย. 66
ตารางออกตรวจแผนกศัลยกรรมหลอดเลือด
Underwater and Beach Clean Up เก็บขยะใต้ทะเลและบนชายหาด ดีต่อใจคนแถมยังดีต่อธรรมชาติ
เกาะเต่าเป็นสวรรค์ของผู้ที่ชื่นชอบการดำน้ำ เพราะมีปะการังที่สวยงาม แถมยังมีชายหาดขาวสะอาด ซึ่งเป็นจุดดึงดูดให้ผู้คนจากทั่วโลกต้อง ชาวเกาะเต่าจึงพยายามที่จะคงสภาพแวดล้อมให้อุดมสมบูรณ์ จึงเกิดเป็นกิจกรรมทำความสะอาดโลกใต้ทะเลและริมหาด
เมื่อจำนวนนักท่องเที่ยวเพิ่มขึ้น ทำให้ปัจจุบันมีขยะตามชายหาดและในทะเลมากขึ้น อีกทั้งยังมีผลกระทบจากน้ำป่าไหลหลากที่ทำให้เกิดขยะสะสม ชาวเกาะเต่าจึงจำเป็นต้องอาศัยความร่วมมือทั้งจากนักท่องเที่ยวและคนในชุมชนเพื่ออนุรักษ์สิ่งแวดล้อม โดยเริ่มจากการปลูกฝังและให้ผู้คนเล็งเห็นถึงความสำคัญของสิ่งแวดล้อม ผ่านกิจกรรมง่ายๆ ไม่ต้องใช้ทักษะมากมาย นั่นคือการเก็บขยะริมชายหาด และสำหรับเกาะเต่าที่มีชื่อเสียงด้านการดำน้ำอันโด่งดัง จึงไม่ใช่เรื่องยากที่จะมีการรวมตัวกันดำน้ำเพื่อเก็บขยะใต้ทะเล
การเข้าร่วมกิจกรรมนี้ ทุกคนจะได้ร่วมกันช่วยทำความสะอาดใต้ท้องทะเลและชายหาด โดยการทำความสะอาดทางบก จะมีการสำรวจขยะตามหาดต่างๆ และแยกขยะที่เก็บมาได้ ขณะที่การทำความสะอาดโลกใต้ท้องทะเล ผู้ร่วมงานจะได้สำรวจขยะตามแนวปะการัง จากนั้นจึงเก็บขยะขึ้นมาดูว่ามีสิ่งมีชีวิตบาดเจ็บติดมาหรือไม่ เพื่อจะนำมาช่วยเหลือต่อไป
มาช่วยกันเปลี่ยนเกาะเต่าให้น่าอยู่มากขึ้น รวมทั้งปลูกฝังการลดใช้พลาสติกและวัสดุที่ยากแก่การย่อยสลาย กับงาน SPOTLIGHT Koh Tao 2023 โดยตลอดกิจกรรมการทำความสะอาดใต้ท้องทะเล จะมีผู้เชี่ยวชาญด้านการดำน้ำดูแลตลอดทั้งงาน
สถานีชาร์จ EleX ใน ภาคเหนือ
เชียงใหม่
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สวนสัตว์เชียงใหม่ (อาคารจอดรถ)
ที่อยู่: 100 ถ. ห้วยแก้ว ต.สุเทพ อ.เมืองเชียงใหม่ จ.เชียงใหม่ 50200
เวลาทำการ : ทุกวัน 08.00 – 17.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา One Nimman
ที่อยู่: ต.สุเทพ อ.เมืองเชียงใหม่ จ.เชียงใหม่ 50200
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT เชียงใหม่ 8
ที่อยู่: 100/20 หมู่ 1 ต.ป่าแดด อ.เมืองเชียงใหม่ จ.เชียงใหม่ 50100
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถาบันวิจัยและพัฒนาพลังงานนครพิงค์
ที่อยู่: 155 หมู่ 2 ต.แม่เหียะ อ.เมืองเชียงใหม่ จ.เชียงใหม่ 50100
เวลาทำการ : ทุกวัน 24 ชั่วโมง
เทศบาลตำบลแม่เหียะ
ที่อยู่: 194 ถนน สมโภชเชียงใหม่ 700 ปี ต.แม่เหียะ อ.เมืองเชียงใหม่ จ.เชียงใหม่ 50100
เวลาทำการ : ทุกวัน 24 ชั่วโมง
เชียงราย
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ถ.เลี่ยงเมืองเชียงราย 1
ที่อยู่: 352 หมู่ 1 ต.ท่าสาย อ.เมืองเชียงราย จ.เชียงราย 57000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
โรงแรมงีบ เบดแอนด์เบรคฟาสต์
ที่อยู่: 268 หมู่ 21 ต.รอบเวียง อ.เมือง จ.เชียงราย 11130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ลำปาง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าแม่เมาะ
ที่อยู่: 800 หมู่ 6 ต.แม่เมาะ อ.แม่เมาะ จ.ลำปาง 52220
เวลาทำการ : จ – ศ 08.00 – 16.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สนามกอล์ฟ แม่เมาะ
ที่อยู่: 801 หมู่ที่ 6 ต.แม่เมาะ อ.แม่เมาะ จ.ลำปาง 52220
เวลาทำการ : ทุกวัน 08.00 – 17.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT เถิน
ที่อยู่: 123 หมู่ 12 ต.ล้อมแรด อ.เถิน จ.ลำปาง 52160
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ลำปาง
ที่อยู่: 102 หมู่ 10 ต.ปงแสนทอง อ.เมืองลำปาง จ.ลำปาง 52100
เวลาทำการ : ทุกวัน 24 ชั่วโมง
แม่ฮ่องสอน
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สถานีแม่ฮ่องสอน
ที่อยู่: 116 ถ.ขุนลุมประพาส ต.จองคำ อ.เมือง จ.แม่ฮ่องสอน 58000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
น่าน
เฮือนฮังต่อ
ที่อยู่: 149/2 ต.ในเวียง อ.เมืองน่าน จ.น่าน 55000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ EV Station PluZ ภาคเหนือ
สถานีบริการ บจ.แม่โจ้ออยล์เซอร์วิส
33/1 ม.5 ถ.เชียงใหม่-พร้าว ต.หนองหาร อ.สันทราย เชียงใหม่ 50290
สถานี สาขาหายยา
235/1 ถ.มหิดล ต.ช้างคลาน อ.เมืองเชียงใหม่ เชียงใหม่ 53000
สถานีบริการ หจก.นอร์ธเทิร์น เชียงใหม่ออยล์
202 ม.4 ต.ท่าศาลา อ.เมืองเชียงใหม่ เชียงใหม่ 50000
สถานีบริการ หจก.พนาพนธ์เชียงใหม่ (สันป่าตอง)
274/1 ม.9 ถ.เชียงใหม่-ฮอด ต.ยุหว่า อ.สันป่าตอง เชียงใหม่ 50120
สถานีบริการ บจ.สุขุมเซอร์วิส(สาขาแม่ริม)
5/15 ม.7 ต.ริมใต้ อ.แม่ริม เชียงใหม่ 50180
สถานีบริการ สาขาหนองหอย
537/9 ถ.ลำพูน ต.หนองหอย อ.เมืองเชียงใหม่ เชียงใหม่ 50000
สถานีบริการ ร่วมมิตรปิโตรเลียม
168 ม.2 ต.ป่าแดด อ.เมืองเชียงใหม่ เชียงใหม่ 50100
สถานี สาขาสันกำแพง
209 ม.8 ต.ต้นเปา อ.สันกำแพง เชียงใหม่ 50130
สถานีบริการ หจก.เชียงใหม่สหชัยวัฒนา
157 ม.5 ต.สันนาเม็ง อ.สันทราย เชียงใหม่ 50210
สถานีบริการ สาขาสารภี
75 ม.7 ถ.สายเชียงใหม่ลำปาง ต.สารภี อ.สารภี เชียงใหม่ 50140
สถานี บจ.เคยูออยล์
347 ม.12 ต.รอบเวียง อ.เมืองเชียงราย เชียงราย 57000
สถานีบริการ หจก.แม่สรวยปิโตรเลียม
18 ม.7 ถ.เชียงราย-เชียงใหม่ ต.แม่สรวย อ.แม่สรวย เชียงราย 57180
สถานีบริการ หจก.เชียงรายกิตติรัตน์
19 ม.1 ถ.เชียงราย-เชียงใหม่ ต.แม่เจดีย์ อ.เวียงป่าเป้า เชียงราย 57260
สถานีบริการ บจ.ดับเบิ้ล นายน์ สเตชั่น
444 หมู่ที่ 1 ต.ท่าสาย อ.เมืองเชียงราย จ.เชียงราย 57000
สถานี หจก.ถาวรชัยลำปาง
26 ถ.ไฮเวย์ลำปาง-งาว ต.ชมพู อ.เมืองลำปาง ลำปาง 52000
สถานีบริการ หจก.ธนันท์ตา ปิโตรเลียม
133/3 ม.1 ถ.ลำปาง-งาว ต.พิชัย อ.เมืองลำปาง ลำปาง 52000
สถานี บจ.ธ.1994 ปิโตรเลียม (ขาขึ้น)
163/2 ม.12 ถ.พหลโยธิน ต.ล้อมแรด อ.เถิน ลำปาง 52160
สถานีบริการ บจ.ภาคเหนือชัยวัฒนา
198 ม.8 ต.ห้างฉัตร อ.ห้างฉัตร ลำปาง 52190
สถานี สาขาลำพูน-ดอยติ
352 ม.2 ต.เวียงยอง อ.เมืองลำพูน ลำพูน 51000
ภูทับดาวปาร์ค
66 หมู่ที่10 ป่าซาง อำเภอ ดอกคำใต้ พะเยา 56120
สถานี หจก.วันสิริ เซอร์วิส
403/1 ถ.พหลโยธิน ต.แม่ต๋ำ อ.เมืองพะเยา พะเยา 56000
เอ็มทูโฮเทล วอเตอร์ไซด์
629 หมู่ 17 ตำบล บ้านต๋อม อำเภอเมืองพะเยา จ.พะเยา 56000
ท็อป พลาซ่า พะเยา
500 ตำบล บ้านต๋อม อำเภอเมืองพะเยา พะเยา 56000
สถานี สาขาดู่ใต้
110 ม.12 ถ.เจ้าฟ้า ต.ดู่ใต้ อ.เมืองน่าน น่าน 55000
สถานี บจ.พลกฤตเซอร์วิสเอ็นเนอร์ยี่
187 ม.8 ต.นาจักร อ.เมืองแพร่ แพร่ 54000
สถานีบริการ บจ.สุขุมเซอร์วิส
110 ถ.ขุนลุมประพาส ต.จองคำ อ.เมืองแม่ฮ่องสอน แม่ฮ่องสอน 58000
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (หลวงพ่อทวีศักดิ์ฯ) LINK
โรงเรียนฝึกอาชีพ กรุงเทพมหานคร (หลวงพ่อทวีศักดิ์ฯ) เลขที่ 38 บริเวณวัดศรีนวลธรรมวิมล ซอยเพชรเกษม 81 ถนนเลียบคลองภาษีเจริญฝั่งใต้ แขวงหนองแขม เขตหนองแขม กรุงเทพมหานคร 10160
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (หลวงพ่อทวีศักดิ์) สังกัด สำนักพัฒนาสังคม กรุงเทพมหานคร มุ่งจัดการศึกษาด้านวิชาชีพ เพื่อผลิตและพัฒนาช่างฝีมือ ด้วยการจัดการศึกษาอาชีพหลักสูตรระยะสั้นที่ยืดหยุ่นหลากหลายด้วยรูปแบบอาชีวศึกษา ให้ผู้เรียนมีทักษะชีวิต สามารถพัฒนาตนเองได้
หลักสูตร : ซ่อมเครื่องใช้ไฟฟ้าในบ้าน ซ่อมบำรุงรถจักรยานยนต์ สร้างแบบเสื้อและกระโปรงสตรี ตัดผมชายเบื้องต้น อาหารว่าง เปลี่ยนสีผม ซอยผม งานประดิษฐ์ของที่ระลึก ประดิษฐ์ดอกไม้จากดินไทย ยอดนักขายออนไลน์ฉบับกระเป๋า การสร้างสื่อดิจิทัลเพื่อนำเสนองาน ภาษาอังกฤษเบื้องต้น ภาษาจีนในชีวิตประจําวัน วิชาตัดผมสไตล์แฟชั่น ตัดแต่งขนสุนัขเบื้องต้น พยากรณ์ด้วยไพ่ทาโร่ต์ การติดตั้งระบบโซล่าเซลล์ภายในบ้านแบบออฟกริด งานบริการเครื่องปรับอากาศในที่พักอาศัย บาริสตร้า ห้อง 1 บาริสตร้า ห้อง 2 นวดฝ่าเท้าเพื่อสุขภาพห้อง 1
มิจฉาชีพแอบอ้างเป็นพนักงานบริษัทจัดหางาน หลอกให้สมัครงาน LINK
มิจฉาชีพแอบอ้างเป็นพนักงานบริษัทจัดหางาน ที่ผู้เสียหายติดต่อสมัครงาน เมื่อเหยื่อหลงเชื่อก็จะส่งลิงก์ให้ติดตั้งเพื่อให้ทำภารกิจ อ้างว่าเป็นการทดลองงาน เช่น การจ้างให้กดไลก์ (Like) กดแชร์ (Share) ดูคลิปวิดีโอจากยูทูบ (YouTube) กดรับออเดอร์สินค้า รีวิวที่พัก รีวิวสินค้า พับถุงกระดาษ ร้อยลูกปัด หรือทำกิจกรรมอื่นๆ ที่มิจฉาชีพออกอุบาย และอีกวิธีคือส่งความสั้น (SMS) ไปยังเหยื่อโดยตรงให้กดลิงก์เพิ่มเพื่อนทาง Line แล้วเข้ากลุ่มทำงานที่มิจฉาชีพสร้างขึ้นมา รวมไปถึงมีการใช้อวตาร หน้าม้า ใช้รูปภาพโปรไฟล์ของบุคคลอื่นจากเว็บไซต์ทั่วไปเพื่อหลอกลวงเหยื่อ
โรงพยาบาลราชพิพัฒน์ เปิดให้บริการฉีดวัคซีน Covid-19 ทุกวัน 8.30 - 15.00 น. LINK
เปิดให้บริการฉีดวัคซีน Covid-19 ติดต่อคลินิกส่งเสริมสุขภาพ ชั้น 1 อาคารเฉลิมพระเกียรติ ผู้ใหญ่ เปิดให้บริการทุกวัน 8.30 - 15.00 น. ไฟเซอร์ ไฟเซอร์ bivalent เด็ก 6 เดือน - 4 ปี เปิดให้บริการวันพุธ - ศุกร์ 8.30 - 15.00 น. (พักเที่ยง) โปรดนำบัตรประชาชน/สำเนาสูติบัตรสำหรับลงทะเบียนฉีดวัคซีน สามารถนัดหมายผ่าน App QueQ และ Walk in
นายแพทย์ดักลาส อาร์ โลวี และ ดร.จอห์น ที ชิลเลอร์ ได้ร่วมกันศึกษาวิจัยที่สถาบันมะเร็งแห่งชาติ สถาบันสุขภาพแห่งชาติ สหรัฐอเมริกา และค้นพบว่าโปรตีนหลักของอนุภาคไวรัสของ ฮิวแมนแปบปิลโลมาไวรัส สามารถประกอบร่างกันได้เองเป็นอนุภาคคล้ายไวรัส (VLP) ซึ่งอนุภาคคล้ายไวรัสนี้สามารถกระตุ้นภูมิคุ้มกันต่อต้านฮิวแมนแปบปิลโลมาไวรัสได้ดี ขณะเดียวกันศาสตราจารย์นายแพทย์เอียน เอช เฟรเซอร์ ก็ได้ค้นพบกลไกการประกอบร่างของอนุภาคคล้ายไวรัสนี้เช่นกันในระหว่างที่ทำการศึกษาวิจัยที่มหาวิทยาลัยควีนส์แลนด์ ประเทศออสเตรเลีย การค้นพบนี้นำไปสู่การพัฒนากระบวนการผลิตอนุภาคคล้ายไวรัสจากโปรตีนรีคอมบิแนนท์ ซึ่งนำไปสู่การพัฒนาวัคซีนต่อต้านฮิวแมนแปบปิลโลมาไวรัสที่มีประสิทธิภาพสูง เนื่องจากอนุภาคคล้ายไวรัสเหล่านี้สามารถกระตุ้นภูมิคุ้มกันได้ดี และสามารถนำเสนอลักษณะทางแอนติเจนที่เป็นธรรมชาติต่อระบบภูมิคุ้มกัน
ผลงานของนายแพทย์ดักลาส อาร์ โลวี, ดร.จอห์น ที ชิลเลอร์ และศาสตราจารย์นายแพทย์เอียน เอช เฟรเซอร์ เป็นงานต่อยอดของ ศาสตราจารย์เกียรติคุณนายแพทย์ฮารัลด์ ซัวร์ เฮาเซ่น จากสหพันธ์สาธารณรัฐเยอรมนี ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล สาขาการแพทย์ ประจำปี 2548 และรางวัลโนเบล สาขาการแพทย์ ประจำปี 2551 ซึ่งค้นพบเชื้อฮิวแมนแปบปิลโลมาไวรัส (เอชพีวี) ที่เป็นสาเหตุของการเกิดมะเร็งปากมดลูก นำไปสู่การพัฒนาวัคซีนป้องกันฮิวแมนแปบปิลโลมาไวรัส ซึ่งเป็นวัคซีนที่ได้ถูกนำไปใช้อย่างกว้างขวางทั่วโลก และช่วยป้องกันการเกิดมะเร็งปากมดลูก และมะเร็งอื่น ๆ ที่เกี่ยวข้องกับฮิวแมนแปบปิลโลมาไวรัส และลดการเสียชีวิตได้จำนวนมากมายทั่วโลก
ผู้ประกันตน รพ.เกษมราษฎร์ รามคำแหง เริ่มฉีดได้ตั้งแต่ 1 พ.ค.66 ไม่เสียค่าใช้จ่าย LINK
ข่าวดี สำหรับผู้ประกันตน มาตรา 33,39 รพ. เกษมราษฎร์ รามคำแหง ที่มีอายุตั้งแต่ 50 ปี ขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ร่วมกับ วัคซีน COVID - 19
✅ โดยไม่มีค่าใช้จ่าย ✅ 1 ครั้ง ต่อคนต่อปี ✅ สามารถฉีดพร้อมกันได้ ✅ มีจำนวนจำกัด
เริ่มวันที่ 1 พฤษภาคม 2566 ถึง 31 กรกฎาคม 2566
สามารถ walk-in เข้ารับบริการ ได้ที่ แผนกประกันสังคม ชั้น 1 หรือลงทะเบียนนัดหมายที่ https://shorturl.asia/gioGN
เงื่อนไขเป็นไปตามที่โรงพยาบาลฯ กำหนด
สอบถามข้อมูลเพิ่มเติม ได้ที่ แผนกประกันสังคมโทร. 02-3390000 ต่อ 1020 , 1102
วัคซีนป้องกันโรคพิษสุนัขบ้า จ.เชียงใหม่ ติดต่อศูนย์ศรีพัฒน์
โทร.สายด่วน 053-936900 , 053-936901 , 065-4724657 หรือ 065-4724658
ไลน์ @Sriphat
ประโยชน์ของการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ก่อนการสัมผัส คือ สามารถกระตุ้นภูมิต้านทานให้สูงพอจะป้องกันโรคอย่างได้ผล โดยการฉีดเพียง 2 เข็ม รวมทั้งหากโดนสัตว์กัดหรือข่วนหลังจากฉีดวัคซีน จะสามารถฉีดกระตุ้นด้วยวัคซีนพิษสุนัขบ้าได้ โดยไม่ต้องฉีดเซรุ่ม คือ หากโดนกัดภาย ใน 6 เดือนหลังฉีดเข็มสุดท้าย จะทำการฉีดกระตุ้น 1 เข็ม ณ วันที่โดนสัตว์กัด และหากโดนกัดมากกว่า 6 เดือนหลังฉีดเข็มสุดท้าย จะทำการฉีดกระตุ้น 2 เข็ม (วันที่ 0, 3) ที่สำคัญ คือ ประหยัดค่าใช้จ่ายจากการฉีดเซรุ่ม เนื่องจากมีราคาสูง และไม่เสี่ยงต่อการแพ้เซรุ่มและความเจ็บปวดจากการฉีดเซรุ่มรอบแผล
ห้องตรวจสูตินรีเวชกรรม
ห้องตรวจสูตินรีเวชกรรม อาคารอำนวยการ (เก่า) ชั้น 2 เบอร์โทรศัพท์ 044-615002 ต่อ 3210-3213
การดูแลผู้ป่วยกลุ่มฟื้นฟูพิเศษ มีความแตกต่างจากผู้ป่วยทั่วไป - นพ.สุชาติ ซื่อลือชา
ด้านนพ.สุชาติ ซื่อลือชา ผู้อำนวยการแพทย์ โรงพยาบาลกรุงสยามเซนต์คาร์ลอส ได้อธิบายเพิ่มเติมถึงแนวทางการดูแลรักษาผู้ป่วยกลุ่มฟื้นฟูพิเศษที่มีความแตกต่างจากผู้ป่วยทั่วไปว่า “ผู้ป่วยกลุ่มฟื้นฟูพิเศษจะเป็นกลุ่มที่ต้องการการดูแลพิเศษและใกล้ชิด แบบองค์รวม” จากสภาวะทางร่างกาย จิตใจ เนื่องจากอยู่ในกลุ่มที่ไม่สามารถช่วยเหลือตนเองได้ จากปัญหาและความจำเป็นเฉพาะกลุ่ม โดยเน้นการดูแลทั้งด้านร่างกายด้วยการตรวจประเมินตั้งแต่การมองเห็น การได้ยิน ช่องปาก ระบบหายใจ ระบบไหลเวียนเลือด ภาวะเสี่ยงต่อโรคกระดูกพรุน ความสมบูรณ์ของกล้ามเนื้อ และเคมีในเลือด นอกจากนี้ในเรื่องของความพร้อมของเครื่องมือและนวัตกรรมเป็นอีกปัจจัยสำคัญในการดูแลกลุ่มผู้ป่วยกลุ่มนี้ ซึ่งทางศูนย์ฯ มีการเตรียมความพร้อมในการใช้เครื่องมือพิเศษ ไม่ว่าจะเป็น
- Electromagnetic wave และ Soft laser ช่วยเพิ่มการไหลเวียนของเลือดให้เร็วขึ้น เร่งการเจริญเติบโตของเนื้อเยื่อ กระดูกอ่อน และกล้ามเนื้อ
- Oxygen Therapy รักษาโรคที่เกี่ยวกับปอด ถุงลมโป่งพอง
- Sleep Therapy การรักษาโรคนอนไม่หลับ
- การแพทย์แผนไทย และ การแพทย์แผนจีน เช่น การฝังเข็ม ครอบแก้ว
- Pain Therapy การรักษา ควบคุมภาวะความเจ็บปวดของผู้ป่วยจากโรคต่างๆ อาทิ เช่นโรคข้อ โรคมะเร็งเป็นต้น
- Cell Therapy การวิเคราะห์โรคและหาความผิดปกติในระดับ DNA ด้วย Telomere Length Test และการรักษาผู้ป่วยด้วยด้วย Stem Cell จาก เลือด ไขมัน ตลอดจนเกร็ดเลือดของผู้ป่วย
ทั้งนี้การดูแลแบบ “St.Carlos RECC” ซึ่งออกแบบแผนการดูแลผู้ป่วยเฉพาะบุคคลโดยการคัดกรองและวางแผนการดูแลรักษาเฉพาะบุคคลตามอาการหรือโรคที่ปรากฏ โดยทีมสหวิชาชีพ ตลอดจนให้คำปรึกษา และวางแผนการรักษาผู้ป่วยร่วมกับคนในครอบครัวเพื่อให้ทุกฝ่ายมีคุณภาพชีวิต ความสุขที่เพิ่มขึ้นโดยใช้หลักการดูแลรักษาทั้งเชิงกายภาพร่างกายด้วยมาตรฐานของโรงพยาบาล ร่วมกับการดูแลเรื่องสภาพจิตใจทั้งผู้ป่วยและคนในครอบครัว ไปพร้อมๆ กัน ภายใต้แนวคิด “อุ่นใจ ใกล้ชิดแพทย์ โรงพยาบาลกรุงสยามเซนต์คาร์ลอส ยกระดับการดูแลอย่างใกล้ชิดด้วยทีมแพทย์ผู้เชี่ยวชาญครบวงจร” เพื่อร่วมเป็นหนึ่งในกลไกการยกระดับคุณภาพรักษาของวงการแพทย์ประเทศไทย
ตรวจสุขภาพประจำปี ต้องมีตรวจสุขภาพจิตด้วย
ปัญหา
จำนวนผู้ป่วยซึมเศร้าในประเทศไทยอาจสูงถึง 1.5 ล้านคน หรือเฉลี่ยคนไทย 40 คน จะพบผู้ป่วยซึมเศร้า 1 คน โดยสาเหตุมาจากทั้งปัจจัยเฉพาะกิจอย่างโควิด-19 ที่เพิ่มความเครียดให้กับผู้คน (เช่น นักเรียนจากการเรียนออนไลน์ คนวัยทำงานจากสภาพเศรษฐกิจ) และปัจจัยถาวรต่างๆที่งานวิจัยระบุว่าทำให้คนรุ่นใหม่ มีแนวโน้มจะประสบปัญหาโรคซึมเศร้ามากกว่ารุ่นก่อนๆ (เช่น การใช้โซเชียลมีเดีย ที่เสี่ยงทำให้คนรู้สึกผิดหวังในตัวเองง่ายขึ้น จากการเปรียบเทียบชีวิตตัวเองกับชีวิตของคนอื่น) และพบว่าคนไทยมีอัตราการฆ่าตัวตายสูงเป็นอันดับ 1 อาเซียน จากปัญหาด้านสุขภาพจิต
ข้อเสนอ
กำหนดให้มีการตรวจสุขภาพจิตฟรี รวมเข้าไปในแพคเกจของการตรวจสุขภาพประจำปีตามสิทธิการรักษาพยาบาลของประชาชน
คลินิกพิเศษด้านอายุรกรรม โรคติดเชื้อ
6. เกินเป้าไปกว่าคาด Emergent Goals
แบบจำลองแสดงให้เห็นถึงพฤติกรรมที่แตกต่างออกไปในเชิงคุณภาพอย่างคาดไม่ถึง เมื่อพวกมันมีความสามารถมากขึ้น ความสามารถหรือเป้าหมายที่เกิดขึ้นอย่างกะทันหันอาจเพิ่มความเสี่ยงที่ผู้คนจะสูญเสียการควบคุมระบบ AI ขั้นสูง
ความสามารถและการทำงานแบบใหม่สามารถเกิดขึ้นเองในระบบ AI ในปัจจุบัน (Ganguli et al., Power et al.) แม้ว่าความสามารถเหล่านี้จะไม่ได้รับการคาดหมายจากนักออกแบบระบบก็ตาม หากเราไม่ทราบว่าระบบมีความสามารถอะไรบ้าง ระบบก็จะควบคุมหรือปรับใช้อย่างปลอดภัยได้ยากขึ้น แท้จริงแล้ว ความสามารถแฝงที่ไม่ได้ตั้งใจอาจถูกค้นพบในระหว่างการปรับใช้เท่านั้น หากความสามารถเหล่านี้เป็นอันตราย ผลกระทบอาจเปลี่ยนกลับไม่ได้ วัตถุประสงค์ของระบบใหม่อาจเกิดขึ้นได้เช่นกัน สำหรับระบบปรับตัวที่ซับซ้อน ซึ่งรวมถึงตัวแทน AI จำนวนมาก เป้าหมาย เช่น การรักษาตนเองมักจะปรากฏขึ้น (Hadfield-Menell et al) เป้าหมายยังสามารถเกิดการเปลี่ยนแปลงเชิงคุณภาพผ่านการเกิดขึ้นของเป้าหมายภายในระบบ (Gall, Hendrycks et al) ในอนาคต ตัวแทนอาจแบ่งเป้าหมายระยะยาวที่ยากออกเป็นเป้าหมายย่อยที่เล็กลง อย่างไรก็ตาม การทำลายเป้าหมายอาจทำให้วัตถุประสงค์บิดเบี้ยวได้ เนื่องจากวัตถุประสงค์ที่แท้จริงอาจไม่ใช่ผลรวมของส่วนต่างๆ การบิดเบือนนี้อาจส่งผลให้เกิดการเยื้องศูนย์ (misalignment) ในกรณีที่รุนแรงกว่านั้น เป้าหมายภายในระบบสามารถดำเนินการได้โดยใช้ต้นทุนของเป้าหมายโดยรวม ตัวอย่างเช่น หลายบริษัทตั้งเป้าหมายภายในระบบและมีแผนกที่เชี่ยวชาญเฉพาะด้านที่แตกต่างกันเพื่อติดตามเป้าหมายย่อยที่แตกต่างกันเหล่านี้ อย่างไรก็ตาม บางแผนก เช่น แผนกราชการ สามารถยึดอำนาจและให้บริษัททำตามเป้าหมายที่ต่างไปจากเป้าหมายเดิม แม้ว่าเราจะระบุวัตถุประสงค์ระดับสูงของเราอย่างถูกต้อง ระบบก็ไม่อาจดำเนินการตามวัตถุประสงค์ของเราได้ (Hubinger et al) นี่เป็นอีกวิธีหนึ่งที่ระบบอาจล้มเหลวในการปรับคุณค่าของมนุษย์ให้เหมาะสม
เด็กแรกเกิดก็อาจเกิดปัญหาเรื่องสายตาได้เช่นกัน - พญ. ณัฐธิดา วงศ์วีระวัฒน์
พญ. ณัฐธิดา วงศ์วีระวัฒน์ จักษุแพทย์เฉพาะทางโรคกล้ามเนื้อตาและโรคตาในเด็ก โรงพยาบาลบำรุงราษฎร์ ให้ข้อมูลว่า ปัจจุบันยังมีผู้ปกครองที่ไม่ทราบว่าเด็กแรกเกิดก็อาจเกิดปัญหาเรื่องสายตาได้เช่นกัน โดยเฉพาะกรณีที่คุณแม่คลอดก่อนกำหนด 32 สัปดาห์ หรือน้ำหนักตัวลูก ไม่ถึง 1,500 กรัม เด็กในกลุ่มนี้จะมีความเสี่ยงที่การเจริญเติบโตของเส้นประสาท และเส้นเลือดในจอประสาทตาเกิดเป็นเส้นเลือดที่ผิดปกติ อาจทำให้มีเลือดออกที่จอประสาทตาหรือจอประสาทตาหลุดลอก หรือเป็นพังผืดได้ ซึ่งทางบำรุงราษฎร์ มีทีมแพทย์ชำนาญการในแผนกบำบัดพิเศษทารกแรกเกิด (NICU) หรือ กุมารแพทย์ที่ทำงานใกล้ชิดกับจักษุแพทย์จะมีการมอนิเตอร์และประเมินพัฒนาการในการมองเห็นและความเสี่ยงเหล่านี้อย่างใกล้ชิด เพราะหากไม่ได้รับการดูแลรักษาในช่วงเวลาที่กำหนด ก็มีโอกาสเสี่ยงที่จะสูญเสียการมองเห็นอย่างถาวร
KHAN (ขาล) และ Kaeng Sua Ten (แก่งเสือเต้น) เหล้ากลั่น จ.แพร่ LINK
แบรนด์ KHAN(ขาล) และแบรนด์ Kaeng Sua Ten(แก่งเสือเต้น) ทั้งสองตัวคือเหล้าสะเอียบ จังหวัดแพร่ เริ่มต้นทำมาตั้งแต่สมัยคุณตา ที่ทำสุราพื้นบ้านแบบมัดถุงขาย ทั้งหมักและกลั่นในบ้าน ถึงช่วงประมาณปี 2546 รัฐบาลได้ให้สุราพื้นบ้านขึ้นมาจดวิสาหกิจชุมชนทำสุราขายได้อย่างถูกกฎหมาย คุณตาจึงเริ่มให้คุณแม่มาดูธุรกิจต่อ คุณแม่เลยได้จดทะเบียนเป็นวิสาหกิจเป็นเจ้าแรกๆ ของจังหวัดแพร่ ขายเป็นผลิตภัณฑ์ขวดสีชา (ใช้ขวดเบียร์) ขวดเอ็มร้อย ขวดกั๊ก ขวดแบน และพัฒนามาเรื่อยๆ จนเป็นขวดเซรามิกแบบที่เห็นในรูป
แบรนด์แก่งเสือเต้น เป็นแบบเหล้าออริจินอลสูตรดั้งเดิม ส่วนแบรนด์ KHAN มาจากปีขาล เกิดจากความบังเอิญของตระกูล คือ ยายเกิดปีขาล แม่ก็เกิดปีขาล และตัวเจ้าของปัจจุบันก็เกิดปีขาล ซึ่งจังหวัดแพร่มีพระธาตุช่อแฮ ซึ่งเป็นพระธาตุประจำปีขาลอีกด้วย เลยนำชื่อนี้มาใช้
เหล้าตัวนี้หมักจากน้ำแหล่งเดียวกันกับภูเขาไฟที่ดับไปแล้วชื่อ หล่มด้ง ใช้กล้วยผสมกับสาโทก่อนกลั่น บ่มในถัง 2 ปีก่อนบรรจุขวด และกลั่นแค่ปีละครั้งในวันขึ้น 15 ค่ำเดือน 5 เรียกว่าเหล้าเดือน 5 (เดือนล้านนา)
ข้อมูลและภาพจากเพจประชาชนเบียร์
Gin Tara (จินธารา) เหล้ากลั่น แถวพุทธมณฑล LINK
Gin Tara จินธารา เหล้ากลั่นจากกลุ่มวัยรุ่นแถวพุทธมณฑล ชื่อนี้แปลว่า"สายน้ำแห่งจิน" เขาบอกว่ามาจากการเล่นคำหน่อยๆ จากการที่จินของเขาผ่านการกรองจนใสเหมือนสายน้ำ จุดเริ่มต้นสำคัญที่ทำเหล้าขึ้นมา เกิดจากพ่อของเขาเองที่ชอบกินเหล้าขาวมาก เห็นพ่อกินมาตั้งแต่ยังเด็ก อยากให้แกได้กินของดีๆ บ้าง และก็อยากลองทำยาดองโดยใช้เหล้าที่ทำเองด้วย เหล้าตัวนี้คนทำตั้งชื่อว่า วารุณี แปลว่า เทวีสุรา เนื่องจากฉลากที่รุ่นน้องทำให้ออกแนวอินเดีย ตัวนี้เราใช้วิธีการกลั่น 1 รอบ แล้วเอาสมุนไพรพวก เม็ดผักชี พริกหางใบโป่งฟ้าไปแช่ทิ้งไว้ จากนั้นนำไปกลั่นซ้ำอีกรอบเพื่อให้ได้เหล้าตัวนี้ขึ้นมา
ข้อมูลและภาพจากเพจประชาชนเบียร์
ใช้สิทธิทันตกรรมประกันสังคม @โรงพยาบาลแมคคอร์มิค LINK
สำหรับใครที่มีสิทธิประกันสังคม สามารถใช้สิทธิในการเข้ารับการรักษาทางทันตกรรม 900 บาท /คน / ปี ทั้งการขูดหินปูน อุดฟัน ถอนฟัน โดยไม่เสียค่าใช้จ่ายแต่อย่างใด เพียงยื่นบัตรประจำตัวประชาชน ก็รับสิทธิ์ได้แล้ว ทั่วประเทศไทย ติดต่อแผนกทันตกรรม โทร 053-921774
ทำฟันประกันสังคม โรงพยาบาลพริ้นซ์ ลำพูน (ได้ทุก รพ.) LINK
ไม่ต้องแย่งคิวกันทำปลายปี ถือบัตรประชาชนรับบริการทำฟัน (ขูดหินปูน / อุดฟัน / ถอนฟัน) ที่ รพ.พริ้นซ์ ลำพูน ในสิทธิประกันสังคมได้ทุก รพ. ✅ ไม่ต้องแย่งคิวกันทำปลายปี ✅ ไม่ต้องสำรองจ่าย ในวงเงิน 900/ ปี นัดหมายก่อนรับบริการได้ที่เบอร์ 053-582-888 ต่อ 590701 ทุกวัน จ.-ศ. 8:00-16:00 น. คลินิกทันตกรรม ชั้น 2 รพ.พริ้นซ์ ลำพูน
ติดต่อโรงพยาบาลพริ้นซ์ ลำพูน Call center : 053-582888
หลักสูตรด้าน หุ่นยนต์เพื่ออุตสาหกรรม (Robotics) 2566 LINK
- CAE004: หลักสูตรวิศวกร การประยุกต์ใช้เทคโนโลยีคำนวณไฟไนต์เอลิเมนต์การวิเคราะห์การสั่นสะเทือน (Vibration Analysis and Application : VAA) รุ่นที่ 2 : ค่าอบรม 16,900 วันที่อบรม : 23/08/2566 - 25/08/2566
- CAE003: หลักสูตรการประยุกต์ใช้เทคโนโลยีคำนวณไฟไนต์เอลิเมนต์การวิเคราะห์ความเค้นของผลิตภัณฑ์ (Linear & Nonlinear Stress Analysis and Application : SAA) รุ่นที่ 2 : ค่าอบรม 16,900 วันที่อบรม : 12/07/2566 - 14/07/2566
- CAE002: หลักสูตรวิศวกร การประยุกต์ใช้เทคโนโลยีคำนวณไฟไนต์เอลิเมนต์การวิเคราะห์การล้าของผลิตภัณฑ์ (Fatigue Analysis and Application : FAA) รุ่นที่ 2 : ค่าอบรม 16,900 วันที่อบรม : 21/06/2566 - 23/06/2566
- CAE001: หลักสูตรวิศวกร เทคโนโลยีคำนวณไฟไนต์เอลิเมนต์เพื่อเพิ่มประสิทธิภาพและลดต้นทุนการออกแบบเชิงวิศวกรรม (Fundamental Finite Element Method for Increase Efficiency and Cost Reduction in Engineering Design : FFE) รุ่นที่ 3 : ค่าอบรม 14,900 วันที่อบรม : 24/05/2566 - 26/05/2566
ธนาคารกรุงศรีอยุธยา : ปลอดภัยกว่าด้วยระบบสแกนใบหน้า Facial Recognition LINK
เพื่อความปลอดภัยในการโอนเงินและเพิ่มวงเงินโอนผ่าน Krungsri Biz Online ผู้ที่ทำธุรกรรมโอนเงินตั้งแต่ 50,000 บาทขึ้นไปต่อรายการ, การโอนเงินที่มียอดรวมสะสมครบตั้งแต่ 200,000 บาทต่อวัน หรือปรับเพิ่มวงเงินให้โอนได้ตั้งแต่ 50,000 บาทขึ้นไป ตามนโยบายธนาคารแห่งประเทศไทยเพื่อเสริมความปลอดภัย จะต้องมีการสแกนใบหน้าเพื่อยืนยันตัวตน โดย Krungsri Biz Online จะเริ่มใช้วันที่ 19 มิถุนายน 2566 นี้เป็นต้นไป (เฉพาะลูกค้าบุคคลเเบบ Single Control)
ลูกค้าธนาคารกรุงศรีอยุธยาสามารถยืนยันตัวตนระบบสแกนใบหน้าได้ ผ่านแอป KMA
ติดต่อสอบถาม โทร 1572
การจัดงาน FUJIFILM NEVER STOP Running 2023 เพื่อส่งเสริมสุขภาพที่ดีให้แก่คนไทยและมอบเงินสนับสนุนให้แก่มูลนิธิ พอ.สว. เพื่อช่วยสมทบทุนการดำเนินงานของบุคลากรทางการแพทย์ผู้เสียสละในครั้งนี้ นับเป็นเครื่องยืนยันความมุ่งมั่นตั้งใจของฟูจิฟิล์ม ในการร่วมเป็นส่วนหนึ่งของการช่วยให้ผู้คนมีสุขภาวะที่ดีขึ้นด้วยนวัตกรรมอันทรงคุณค่า
การอบรม เดือนเมษายน 2566
หลักสูตรอบรม เดือนเมษายน 2566 ทั้งหมด 3 หลักสูตร
1. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 3/66
- รับสมัครจำนวน 100 คน
- อบรมวันที่ 5 เม.ย.66 เวลา 08.30-16.30 น. "(ผ่านระบบ Google Meet)"
2. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (On-site) นที่ 3/66
- รับสมัครจำนวน 60 คน
- วันอบรม วันที่ 19 เม.ย.66 เวลา 08.30 - 16.30 น. "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
3. หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน (รูปแบบ Hybrid training) รุ่นที่ 3/66
- รับสมัครจำนวน 60 คน
- วันอบรม - ภาคทฤษฎี (Online) วันที่ 21 เม.ย. 66 เวลา 08.30 - 12.00 น. อบรมผ่านระบบ Google Meet
- ภาคปฏิบัติ (On-site) วันที่ 29 เม.ย.66 #มี2รอบให้เลือกเช้าหรือบ่าย เวลา 09.00-12.00 หรือ 13.00-16.00 "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
วันอาทิตย์ ท่าเดินต่อเท้าแบบมีราวจับ
ท่าเดินต่อเท้าแบบมีราวจับ ยืนตรงหันข้างเข้ากำแพง ใช้มือจับราว(หรือโต๊ะ)ให้มั่น (ข้างไหนก็ได้) ค่อย ๆเอาเท้าข้างหนึ่งไปวางต่อข้างหน้าเท้าอีกข้างให้เป็นเส้นตรงและค้างท่าไว้ 10 วินาที จากนั้นสลับข้าง
เส้นทางที่ 6 เสริมความงาม เพิ่มความสวย ด้วยศาสตร์แห่งความงามครบวงจร
เส้นทางที่ 6 เปลี่ยนสไตล์จากธรรมชาติและวัฒนธรรม มาเป็นแนวสมัยใหม่ โดยเฉพาะกับคุณสุภาพสตรี ที่ความสวยความงามนั้นสำคัญเสมอ แนะนำ คลินิกเสริมความงาม Aesthe Clinic , Hakka residence ที่จะนำด้วยศาสตร์แห่งความงามครบวงจรมาพร้อมบริการ และ ณัชชา นวดเพื่อความงาม
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุก ๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนมิถุนายน พ.ศ. 2566 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 18 ถึง วันที่ 26 เมษายน พ.ศ. 2566 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือศูนย์วิจัยแห่งใหม่ของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อช่วยเหลือบริษัทต่างๆ ภายในประเทศสมาชิกภูมิภาคอาเซียนในเรื่องของข้อมูลการตลาด รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของฮาคูโฮโดจะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่อธิบายผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่อธิบายถึงความเป็นบุคคลของผู้บริโภคที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
วิธีการปฏิบัติตนหากผลเป็นลบไม่พบเชื้อ และหากผลเป็นบวกพบเชื้อ HPV
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า หากตรวจด้วย HPV DNA หรือ HPV DNA Self-Sampling แล้วผลเป็นลบ แปลว่าท่านสามารถเว้นระยะการตรวจไปได้ 5 ปี ค่อยมาตรวจใหม่ได้ แต่ถ้าผลเป็นบวกต้องดูว่าเชื้อ HPV เป็นสายพันธุ์ไหน สายพันธุ์เสี่ยงสูงหรือไม่ หากเป็นสายพันธุ์ 16 และ 18 อันนี้ก็คือสายพันธุ์เสี่ยงสูง ต้องให้คุณหมอตรวจเพิ่มเติม สำคัญมาก เพราะรักษาไวหายได้แน่นอน
แต่ถ้าไม่ใช่สายพันธุ์ 16 กับ 18 ก็จะเป็นการตรวจเซลล์โดยการขึ้นขาหยั่งทั่วไปธรรมดา ทำการป้ายเซลล์ ส่วนผลออกมาเป็นอย่างไร ก็ขึ้นอยู่กับว่าเป็นมากเป็นน้อย การรักษาขึ้นอยู่กับผลนั้นๆ อันนี้ก็จะเป็นแนวทางปฏิบัติทั่วไป
301. วัดวชิราลงกรณวราราม จ.นครราชสีมา
นครราชสีมา
วันเวลาทำการ: จันทร์ -ศุกร์ 16.00 น -21.00 น.
เบอร์ติดต่อ: 0817903021
ผู้ติดต่อ: อาทร ด่านกระโทก
302. สถานปฏิบัติธรรมแก้ววิริยะมงคล จ.อุดรธานี
อุดรธานี
วันเวลาทำการ: เสาร์ - อาทิตย์
เบอร์ติดต่อ: 0849892515
ผู้ติดต่อ: นางอาทิตยา อุทธิสินธ์
303. กระทรวงสาธารณสุข
นนทบุรี
วันเวลาทำการ: 08:30-16:30 น.
เบอร์ติดต่อ: 099-624-4551 / 02-590-1816
ผู้ติดต่อ: ดร.ศรีสุกาญจน์ บิณฑาประสิทธิ์
304. วัดบางบัวทอง จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ (8.00 - 17.00 น.)
เบอร์ติดต่อ: 085-338-4132
ผู้ติดต่อ: อ.วรมน คงอ่อน
305. อาคารกองบุญมาเพาะรัก-สุขสวัสดิ์ กรุงเทพมหานคร
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
306. วัดไผ่เหลือง จ.นนทบุรี
นนทบุรี
วันเวลาทำการ: เสาร์ - อาทิตย์ 9.00 - 16.30 น.
เบอร์ติดต่อ: อ.วรสิทธิ์ (ไอทีสาขา) 085-123-2756
ผู้ติดต่อ: ผศ.ดร.เบญจพร พึงไชย ผดล. 086-388-5809
307. วัดปากแตระ อ.ระโนด จ.สงขลา
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
309. วัดป่าร้อยปีหลวงพ่อวิริยังค์ จ.ราชบุรี
ราชบุรี
วันเวลาทำการ: -
เบอร์ติดต่อ: 0892017661
ผู้ติดต่อ: อ.ปวีณา อุดมสถาผล (ผดล.)
310. วัดโฆสมังคลาราม
นครพนม
วันเวลาทำการ: วันเสาร์-วันอาทิตย์
เบอร์ติดต่อ: 0819755499
ผู้ติดต่อ: พ.อ.อดิศร สิงห์พรมมา
501. มหาวิทยาลัยสงขลานครินทร์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
502. สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง
กรุงเทพมหานคร
วันเวลาทำการ: จันทร์ ถึงศุกร์ 08.30-16.30 น.
เบอร์ติดต่อ: 085 353 9645
ผู้ติดต่อ: อ. สุนีรัตน์ เรืองสมบูรณ์
504. มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าพระนครเหนือ
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
505. มหาวิทยาลัยเชียงใหม่
เชียงใหม่
วันเวลาทำการ: 8.30-16.30 น.
เบอร์ติดต่อ: 0818696068
ผู้ติดต่อ: รองศาสตราจารย์ ดร.อดิศักดิ์ ธีรานุพัฒนา
506. มหาวิทยาลัยขอนแก่น
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
507. มหาวิทยาลัยนเรศวร
พิษณุโลก
วันเวลาทำการ: วันจันทร์-ศุกร์ เวลา 17.00-19.00 น.
เบอร์ติดต่อ: 089 704 3183
ผู้ติดต่อ: อ.ฟ้ารุ่ง มีอุดร
508. มหาวิทยาลัยมหาสารคาม
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
509. มหาวิทยาลัยราชภัฏเชียงราย
เชียงราย
วันเวลาทำการ: จันทร์-ศุกร์ เวลา 8.30 - 16.00 น.
เบอร์ติดต่อ: 0818858595
ผู้ติดต่อ: รศ.ดร.เกศกนก ชุ่มประดิษฐ์
510. มหาวิทยาลัยราชภัฏเลย
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
511. มหาวิทยาราชภัฏพระนคร
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
512. มหาวิทยาลัยราชภัฏราชนครินทร์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
516. มหาวิทยาลัยราชภัฏสุรินทร์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
517. มหาวิทยาลัยกาฬสินธุ์
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
518. มหาวิทยาลัยราชภัฏสวนสุนันทา
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
519. มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
555. Foreign Language Department
วันเวลาทำการ: -
เบอร์ติดต่อ: -
ผู้ติดต่อ: -
1091. วัดพุทธมงคลนิมิต อ.เมือง จ.นครสวรรค์ (เลขที่สาขา 109/1)
นครสวรรค์
วันเวลาทำการ: จันทร์-ศุกร์
เบอร์ติดต่อ: 0628982365
ผู้ติดต่อ: อ.ลดาพรรณ ลาชโรจน์
สุขภาพดี
นำเสนอ One Stop Service บริการรักษาพยาบาลที่เชื่อมโยงกันอย่างไร้รอยต่อ
เพื่อเป็นการยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข เพิ่มประสิทธิภาพการเข้าถึงการรักษาพยาบาล ที่เชื่อมโยงไร้รอยต่อ ในงานจะมีเจ้าหน้าที่มาให้บริการประชาชนแบบ One-Stop-Service ผ่านรถรถบริการ Mobile Medical Unit รถสุขภาพเชิงรุก ตรวจถึงชุมชนมาจัดแสดงและให้บริการประชาชนที่มาร่วมงาน
ที่บูธนี้ จะมีการนำเสนอแนวทางการยกระดับระบบสุขภาพปฐมภูมิและเครือข่ายสาธารณสุข เพื่อเพิ่มประสิทธิภาพการเข้าถึงการรักษาพยาบาลที่เชื่อมโยงไร้รอยต่อ ซึ่งเป็นไปตามนโยบายสุขภาพดี ที่จะขยายการให้บริการครอบคลุมทั่วพื้นที่ในกรุงเทพฯ
ในงาน มีเจ้าหน้าที่ให้บริการประชาชนผ่านรถบริการ Mobile Medical Unit รถสุขภาพเชิงรุก ตรวจถึงชุมชนมาจัดแสดงและให้บริการประชาชน โดยให้บริการประชาชน เช่น
- รถหน่วยแพทย์ ใช้คัดกรองสุขภาพ
- รถตรวจตา (ต้อหิน, เบาหวานขึ้นตา)
- รถตรวจฟัน ทำฟัน (จำกัดจำนวน 30 คน)
- รถตรวจมะเร็งปากมดลูก (เพศหญิง 35-59 ปี และยังไม่เคยตรวจใน 5 ปี)
นอกจากนี้ ยังมีการให้บริการแก่ประชาชนด้านสุขภาพ ได้แก่
1. การให้บริการทางการแพทย์
ซึ่งจะมีบริการจาก บูธหมอ กทม. และตู้ Kiosk ซึ่งจะมาจากศูนย์บริการคนพิการแบบเบ็ดเสร็จ, คลินิกสุขภาพเพศหลากหลาย สำนักการแพทย์ (BKK Pride Clinic) และ กทม. ใส่ใจ ผู้สูงวัย หัวใจแกร่ง
2. การทดสอบสมรรถภาพทางกาย (Physical Fitness Test)
ในการให้บริการเพื่อทดสอบสมรรถภาพทางกาย (Physical Fitness Test) นี้ จะทำให้ผู้มารับบริการได้ทราบถึงระดับความสามารถ หรือระดับสมรรถภาพทางกายในแต่ละด้าน สามารถเลือกกิจกรรมการออกกำลังกายและเริ่มต้นออกกำลังกายให้เหมาะกับตนได้ ทำให้การพัฒนาสมรรถภาพทางกายมีประสิทธิภาพเต็มที่ และมีบริการด้วยเครื่องวัดดัชนีมวลกาย Inbody สำหรับเด็กที่อายุ ไม่ถึง 15 ปีและผู้สูงอายุที่อายุมากกว่า 60 ปี ด้วย
บางคอแหลม #เช็คความปลอดภัยถังดับเพลิงชุมชน
28 มิถุนายน 2566 เจ้าหน้าที่ฝ่ายพัฒนาชุมชนฯ ร่วมกับเจ้าหน้าที่สถานีดับเพลิงยานนาวา ลงพื้นที่สำรวจถังดับเพลิง และตรวจสอบสภาพการใช้งานในชุมชนมิตรสัมพันธ์ ชุมชนซอยโรงเจ ชุมชนวัดไผ่เงินและชุมชนสวนหลวง1 ทั้งนี้ เพื่อสร้างความมั่นใจในความปลอดภัยของประชาชน และให้ประชาชนได้คลายความกังวล ตลอดจนประชาสัมพันธ์ ให้ความรู้เกี่ยวกับถังดับเพลิงประเภทต่างๆ และวิธีการตรวจสอบ ดูแล รักษาถังดับเพลิง เบื้องต้น
คอกเขียว เขตบางคอแหลมจะมีทั้งหมด 4 จุด
จุดตั้งวาง "คอกเขียว" ในช่วงทดลองของพื้นที่
เขตบางคอแหลมจะมีทั้งหมด 4 จุด ดังนี้
- จุดที่ 1 ถนนจันทน์ (บริเวณป้ายรถประจำทาง ซอยจันทร์ 59
- จุดที่ 2 ถนนเจริญกรุง (บริเวณหน้าปั้มน้ำมัน ปตท.)
- จุดที่ 3 บริเวณป้ายรถประจำทาง ซอยเจริญกรุง 89
- จุดที่ 4 บริเวณปากซอยเจริญกรุง 76/2
โดยจะให้วางถุงขยะตั้งแต่เวลา 18.00-03.00 น. ของทุกวัน ทั้งนี้เจ้าหน้าที่จะเก็บคอกขยะ แล้วนำมาวางใหม่ในเวลาเดิม
สถานการณ์ สะพานถล่ม 12 กรกฎาคม 66
กทม. ยันไม่ได้สั่งให้มีการเปลี่ยนแปลงแบบในการก่อสร้าง แต่ทางผู้รับเหมาได้แจ้งขอเปลี่ยนรูปแบบการก่อสร้าง เมื่อเดือน ต.ค. ที่ผ่านมา จากแบบเดิมการหล่อตัว Box Segment ทำในพื้นที่ แต่ขอเปลี่ยนแบบ Box Segment แบบสำเร็จ เพื่อให้การก่อสร้างเร็วขึ้น ลดการใช้พื้นที่ผิวการจราจร และยังสามารถควบคุมคุณภาพของ segment ได้ดียิ่งขึ้น
ยืนยันรูปแบบดังกล่าว เป็นวิธีก่อสร้างที่มีการทำกันอยู่แล้ว มีการควบคุมตามหลักวิศวกรรม ไม่ได้มีความปลอดภัยน้อยลงแต่คาดว่าสาเหตุเกิดจากความผิดพลาดในการก่อสร้าง
ส่วนบริษัทที่รับเหมายอมรับเพิ่งรับงานครั้งแรกกับทาง กทม. และประมูลตามขั้นตอนและเสนอราคาต่ำกว่าราคากลาง 4 แสนบาทเป็นผู้ชนะการประมูล ซึ่งนอกจากโครงการดังกล่าวแล้ว ในกทม.ไม่มีการก่อสร้างแบบในจุดเกิดอื่น
12 ก.ค. - 12 ส.ค. 66 ถักศิลป์ ทอเซ้นส์
8. แกลมปิ้งเรืองแสง
แนวคิด :มุมมองใหม่ของชีวิต สัมผัสธรรมชาติพักค้างคืนมีสไตล์
เทคนิค :สร้างฉากสวยชวนฝันด้วยไฟประดับที่ให้บรรยากาศแคมป์ปิ้งสวยงามที่สุด
งาน Hua Lamphong in Your Eyes
การรถไฟจัด งาน Hua Lamphong in Your Eyes ขึ้นเมื่อวันที่ 22 ธันวาคม 2564-16 มกราคม 2565 ตลอดการจัดงานทั้ง 26 วันได้รับความสนใจจากประชาชน คนรุ่นใหม่ ทั้งกลุ่มครอบครัว กลุ่มเพื่อน คู่รักและชาวต่างชาติ เข้าร่วมงานกันอย่างคึกคัก โดยเฉพาะกิจกรรมเช็กอิน 10 จุดสำคัญทางประวัติศาสตร์ที่เกี่ยวข้องกับหัวลำโพงทั้งด้านนอกและด้านในตัวอาคาร ให้ผู้เข้าร่วมงานได้ย้อนรำลึกถึงความสำคัญของสถานที่ต่างๆ ไปพร้อมกัน เช่น อนุสรณ์ปฐมฤกษ์รถไฟหลวง ซึ่งเป็นจุดที่พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว รัชกาลที่ ๕ และสมเด็จพระศรีพัชรินทราบรมราชินีนาถ พระบรมราชชนนีพันปีหลวงเปิดการเดินรถไฟหลวงในราชอาณาจักรสายแรก (เส้นทางสถานีกรุงเทพ-อยุธยา) เมื่อวันที่ 26 มีนาคม พ.ศ. 2439 ซึ่งกลายเป็นวันสถาปนากิจการรถไฟจนถึงปัจจุบัน
ภายในงานยังมีกิจกรรมการจัดแสดงรถจักรไอน้ำ การแสดงดนตรีสด ที่สร้างความสนุกสนานและเพลิดเพลินให้ผู้เข้าร่วมงานตลอดทั้งวัน รวมทั้งนิทรรศการภาพถ่าย ที่จัดประกวดขึ้นภายใต้หัวข้อ Hua lamphong Through the len ร่วมชิงเงินรางวัลมากกว่า 1 แสนบาท มีผู้สนใจเข้าร่วมประกวดถึง 7,317 ภาพ และได้ประกาศผลรางวัลไปแล้วในเดือนที่ผ่านมา ทำให้เห็นมุมมองของสถานีหัวลำโพงในด้านที่แตกต่างออกไป
8.8 กับ ดีลดี โปรดี ที่คุณไม่ควรพลาด@รพ.กรุงเทพ
8.8 กับ ดีลดี โปรดี ที่คุณไม่ควรพลาด
เก็บโค้ดส่วนลดเพิ่มเติมจากหน้าร้าน (เฉพาะ Health Plaza) ลดสูงสุด 2,000 บ. หรือ กรอกโค้ด TVAUGH250 ลดทันที 7% (สูงสุด 250฿ / เมื่อซื้อขั้นต่ำ 3,000 ฿ / มีจำนวนจำกัด) เฉพาะ Shopee
โปรโมชันถึงวันที่ 13 ส.ค. 66 เท่านั้น
2006
ในปี ค.ศ.2006 ได้ก่อสร้างอาคารสูง 17 ชั้นแล้วเสร็จในปี 2008 ได้อนุมัติให้ใช้ชื่อว่า "อาคารหมอแวลส์" เพื่อเป็นเกียรติแก่ นายแพทย์มาร์แชลล์ ฟิลิป แวลส์ ผู้ก่อตั้งและเป็น ผู้อำนวยการคนแรกของโรงพยาบาลกรงเทพคริสเตียน
บริการสายด่วนเลิกบุหรี่ 1600 และสายด่วนสุขภาพจิต 132
นอกจากนี้ยังมีบริการสายด่วนเลิกบุหรี่ 1600 และสายด่วนสุขภาพจิต 132 สำหรับทุกกลุ่มวัย รายละเอียดบริการที่แต่ละกลุ่มอายุจะได้รับสามารถอ่านได้จากประกาศคณะกรรมการหลักประกันสุขภาพแห่งชาติ โรงเรียนสอนทำขนมเค้ก LINK
โรงเรียนสอนทำขนมเค้ก คุกกี้ ชีสเค้ก บราวนี่ ฯลฯ Kanomcake Kitchen ผู้สอนเคยเป็นเชฟทำงานจากโรงแรมโอเรียนเต็ล(กรุงเทพ),Secret recipe โรงแรม 5ดาวฯลฯ เคยทำงานร่วมกับเชฟชาวฝรั่งเศส มีประสบการณ์การทำขนมขายจริง มากกว่า 20 ปี เลือกเมนูจัดคอร์สเรียนเองได้ เรียนเดี่ยวสอนแบบตัวต่อตัว เรียนได้ทุกเมนูแม้จะไม่มีพื้นฐานทำเบเกอรี่
คอร์สเรียน ยอดนิยม
• สามารถเลือกเรียนทำเบเกอรี่ ในเมนูที่อยากทำได้ (มีให้เลือก กว่า 250+ เมนู) เริ่มต้น 1,500 บาท
• คอร์สเปิดร้าน พิเศษ 9,900 บาท
• คัพเค้กดอกไม้ พิเศษ 3,900 บาท
• ทำเค้กวันเกิด 2,000 บาท
สอบถามโทร 08-9000-5885
ตั้งซุ่นเส่ง เฟอร์นิเจอร์ บริจาคเงินจำนวน 100,000 บาท
ขอขอบคุณ ตั้งซุ่นเส่ง เฟอร์นิเจอร์ บริจาคเงินจำนวน 100,000 บาท ให้กับคอนเสิร์ตการกุศล "เพลงเพื่อลมหายใจ #3 Song of Life " เพื่อสร้างตึกผู้ป่วยในสำหรับเด็กแรกเกิด ผู้ป่วยโรคเลือดและผู้ป่วยมะเร็งโรงพยาบาลเด็กสรรพสิทธิประสงค์
ทีม M 6 เมย์และฟ้า ทีม สยามมอเตอร์ไบค์
ร่วมโหวต ให้ทีม M 6 เมย์และฟ้า ทีม สยามมอเตอร์ไบค์ เพียงกด Like เพื่อคว้ารางวัล PopularVote จนถึงเวลา 16.00 น. วันที่ 12 สิงหาคมนี้ พร้อมร่วมไปเชียร์ว่าทีมใดจะ คว้าแชมป์ DUO Pretty Sexy ลูกชิ้นยืนกิน Contest ซีซั่น 2 ที่งานเทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 6 กันนะจ้า
งานประเพณีออกหว่า อำเภอแม่สะเรียง แม่ฮ่องสอน (รอประกาศ)
งานประเพณีออกหว่า เป็นเทศกาลงานประเพณีออกพรรษาตามความเชื่อของชาวอำเภอแม่สะเรียง เรียกว่า ประเพณีออกหว่า (คำว่า ออกหว่า หมายถึง การออกจากฤดูฝน) ชาวอำเภอแม่สะเรียงที่อยู่ต่างถิ่นจะเดินทางกลับภูมิลำเนา เพื่อร่วมทำบุญและร่วมงานประเพณีออกหว่ากับครอบครัว โดยจะมีการตักบาตรพระสงฆ์ที่หน้าบ้านของตนเองในเวลาตี 4 ตลอดทั้ง 3 วัน จะมีการประดิษฐ์จองพารา ซุ้มราชวัตร และโคมไฟประดับตามบ้านเรือนเพื่อแสดงถึงการรับเสด็จพระพุทธเจ้าที่เสร็จจากสวรรค์ชั้นดาวดึงส์กลับสู่โลกมนุษย์ มีพิธีตักบาตรตามวิถีไทยใหญ่ ขบวนแห่เทียนเหง หรือ เทียนพันเล่ม ขบวนแห่ต้นโคม เครื่องไทยทาน และการแสดงศิลปะรำฟ้อน ตามถนนสายต่างๆ ในเขตเทศบาลตําบลแม่สะเรียง ประเพณีออกหว่า อำเภอแม่สะเรียง เป็นเอกลักษณ์ทางวัฒนธรรมที่มีแห่งเดียวในโลก
*สำหรับงานปีที่ผ่านมา (2565) จัดขึ้นระหว่างวันที่ 2-11 ตุลาคม 2565 ณ เขตเทศบาลตำบลแม่สะเรียง อำเภอแม่สะเรียง จังหวัดแม่ฮ่องสอนข้อมูลรายงานการศึกษาเรื่องโซเดียมที่น่าสนใจ
- รายงานการสำรวจการบริโภคอาหารของคนไทย การสำรวจสุขภาพประชาชนไทยโดยการตรวจร่างกาย ครั้งที่ 4 พ.ศ.2551-2552 ในกลุ่มตัวอย่างทั่วประเทศ 2,696 คน อายุตั้งแต่ 1 ปีขึ้นไป พบว่า คนไทยบริโภคโซเดียมจากอาหารเพิ่มขึ้นตามอายุ โดยเฉพาะในช่วงอายุ 19-59 ปี บริโภคโซเดียมสูงถึง 2,961.9 – 3,366.8 มิลลิกรัม/วัน หรือประมาณ 1.5-1.8 เท่า ของปริมาณโซเดียมที่ควรได้รับต่อวัน คือ ไม่เกิน 2,000 มิลลิกรัม/วัน [รพ.ราชวิถี]
- มีการศึกษาเพื่อหาความสัมพันธ์ระหว่างการบริโภคโซเดียมและความเสี่ยงที่จะมีภาวะน้ำหนักเกินในคนจำนวน 5,955 คน พบว่า คนที่บริโภคโซเดียมมากมีโอกาสเสี่ยงที่จะมีภาวะน้ำหนักเกิน โดยผู้ชายจะมีโอกาสเสี่ยงมากกว่าผู้หญิง เนื่องจากการรับประทานอาหารที่มีโซเดียมสูงจะกระตุ้นให้ทางอาหารในปริมาณที่เพิ่มมากขึ้น [รพ.ราชวิถี]
- นายกสมาคมโรคไตแห่งประเทศไทย เปิดเผยว่า จากข้อมูลล่าสุดพบคนไทยป่วยเป็นโรคไตเรื้อรังร้อยละ 17.6 ของประชากร หรือประมาณ8 ล้านคน เป็นผู้ป่วยระยะสุดท้าย 2 แสนคน ป่วยเพิ่มปีละกว่า 7,800 รายหากไม่ได้รับการรักษาที่ถูกต้อง จะเกิดโรคแทรกซ้อนถึงเสียชีวิต
- มีผู้ป่วยที่ไตวายเรื้อรังระยะสุดท้ายที่รอการผ่าตัดเปลี่ยนไตใหม่ประมาณ 40,000 รายซึ่งมีขั้นตอนในการรักษายุ่งยากและเสียค่าใช้จ่ายสูงถึงปีละประมาณ 2 แสนบาทต่อคน ส่วนผู้ป่วยที่ได้รับการผ่าตัดปลูกถ่ายไตมีเพียงปีละ 400 รายเท่านั้น นอกจากนี้ยังมีข้อจำกัดคือขาดแคลนผู้บริจาคไต ผู้ป่วยจึงต้องรักษาเพื่อยืดอายุโดยวิธีฟอกเลือดด้วยเครื่องไตเทียม หรือล้างของเสียออกทางหน้าท้อง โดยในปี 2556 ที่ผ่านมาได้ใช้งบประมาณในการบำบัดทดแทนไตในสิทธิหลักประกันสุขภาพถ้วนหน้าประมาณกว่า 3,000 ล้านบาทต่อปี
กลยุทธ์สำคัญต่อวงการเฮลท์แคร์ที่ยั่งยืนและเป็นมิตรกับสิ่งแวดล้อม
ความยั่งยืนยังคงเป็นเรื่องสำคัญสำหรับวงการเฮลท์แคร์ในภูมิภาคเอเชีย-แปซิฟิก แต่การไม่สามารถเข้าถึงเทคโนโลยีที่เหมาะสม (43%) การไม่มีมาตรฐานที่ตั้งไว้ในวงการเฮลท์แคร์ (37%) และขาดความสนใจจากบุคลากร (32%) ถือเป็นความท้าทายสำคัญที่ทำให้ผู้บริหารแถวหน้าในวงการเฮลท์แคร์ในภูมิภาคเอเชีย-แปซิฟิก ไม่สามารถดำเนินการโครงการด้านความยั่งยืนได้ ดังนั้นกลุ่มผู้บริหารในวงการจึงเห็นว่าการสร้างกรณีศึกษาทางธุรกิจเพื่อริเริ่มดำเนินงานโครงการ (42%) และการแชร์ตัวอย่างที่ประสบความสำเร็จ (38%) จะเป็นกุญแจสำคัญในการสร้างความยั่งยืนให้กับองค์กรได้ นอกจากนี้ พวกเขายังเชื่อว่าการทำงานร่วมกันหรือปรึกษากับพาร์ทเนอร์เพื่อริเริ่มหรือสนับสนุนโครงการด้านความยั่งยืน และการสรรหาบุคลากรที่มีทักษะเฉพาะทางเพิ่มขึ้น (35% ตามลำดับ) จะเป็นประโยชน์ต่อการบรรลุเป้าหมายด้านความยั่งยืนได้
“ระบบนิเวศเฮลท์แคร์ที่สมาร์ทและยั่งยืน มาพร้อมโซลูชันส์ดิจิทัลที่กำหนดนิยามใหม่ในด้านประสบการณ์ของการดูแลผู้ป่วยที่เน้นให้ผู้ป่วยเป็นศูนย์กลาง และด้านการทำงานของบุคลากรทางการแพทย์ในอนาคต เรารู้สึกตื่นเต้นอย่างมากที่ได้ร่วมงานกับพันธมิตรด้านเฮลท์แคร์ของเราในการริเริ่มการดูแลผู้ป่วยแบบใหม่ของทศวรรษหน้า นอกจากการนำเสนอนวัตกรรมที่เหมาะสม และการฝึกอบรมที่ทันสมัย ซึ่งจำเป็นต่อการปลดล็อกศักยภาพของการดูแลผู้ป่วยได้ทุกที่ทุกเวลาแล้ว เรายังตระหนักดีถึงการนำเสนอโซลูชันส์ การดำเนินงาน และโครงสร้างพื้นฐานที่ไม่ส่งผลกระทบต่อมลภาวะทางอากาศ ซึ่งเป็นเรื่องสำคัญในการสร้างความยั่งยืนแห่งอนาคตในวงการเฮลท์แคร์ได้” แครอไลน์ คลาร์ก กล่าวเสริม
ภาพภายในโรงพยาบาลศัลยกรรม Ultra Luxury แบบครบวงจร ภายใต้ชื่อ Bangmod Aesthetic & Wellness Hospital
ข้อมูลผู้ตอบแบบสอบถาม (สถานะภาพ)
บันทึกผลการสำรวจเรื่อง สถานะภาพ
(เริ่ม 02/2022)
- 6 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 498 ท่าน เป็นโสด 51.2%. แต่งงาน 39.8% หย่าร้าง/หม้าย 9%
- 13 กุมภาพันธ์ 2567 จำนวนผู้ตอบแบบสอบถาม 533 ท่าน เป็นโสด 51.6%. แต่งงาน 39.8% หย่าร้าง/หม้าย 8.6%
- 24 มีนาคม 2567 จำนวนผู้ตอบแบบสอบถาม 702 ท่าน เป็นโสด 52.1%. แต่งงาน 40.2% หย่าร้าง/หม้าย 7.7%
- 26 เมษายน 2567 จำนวนผู้ตอบแบบสอบถาม 810 ท่าน
- 27 พฤษภาคม 2567 จำนวนผู้ตอบแบบสอบถาม 901 ท่าน
- 30 มิถุนายน 2567 จำนวนผู้ตอบแบบสอบถาม 971 ท่าน
- 5 สิงหาคม 2567 จำนวนผู้ตอบแบบสอบถาม 1,041 ท่าน เป็นโสด 54.6%. แต่งงาน 37.8% หย่าร้าง/หม้าย 7.6%
สิทธิบัตร US3183172A กระบวนการเพื่อให้ได้มาซึ่งสารประกอบที่มีฤทธิ์ทางจิต ได้แก่ PSILOCYBING และ PSILOCIN
1965-05-11 การเผยแพร่ US3183172A United States
1982-05-11 คาดว่าจะหมดอายุ
สถานะ หมดอายุ-ตลอดชีพ
กระบวนการเพื่อให้ได้มาซึ่งสารประกอบที่มีฤทธิ์ทางจิต ได้แก่ PSILOCYBING และ PSILOCIN ซึ่งประกอบด้วยการแยกหลักการออกฤทธิ์จากวัสดุเชื้อราของหนึ่งในสายพันธุ์ PSILOCYBE MEXICANA HEIM, STROPHARIA CUBENSIS EARLE, PSILOCYBE SEMPERVIVA HEIM และ CAILLEUX, PSILOC YBE CAERULESCENS MURRILL VAR. MAZATECORUM HEIM, PSILOCYBE ZAPOTECORUM HEIM, PSILOCYBE AZTECORUM HEIM และ PSILOCYBE CAERULESCENS MURRIL VAR NIGRIPES HEIM โดยอาศัยการดำเนินการสกัดกับวัสดุดังกล่าวของตัวทำละลายอินทรีย์ที่ละลายน้ำได้สำหรับหลักการออกฤทธิ์ดังกล่าวที่ระบุว่าตัวทำละลายถูกเลือกมาจาก G ROUP ประกอบด้วยน้ำ แอลกอฮอล์อะลิฟาติกตอนล่าง และส่วนผสมของน้ำและแอลกอฮอล์อะลิฟาติกตอนล่าง ซึ่งแยกหลักการออกฤทธิ์ออกจากสารสกัดที่ได้ออกมาในระดับหนึ่ง และการบำบัดวัสดุที่ได้รับดังนั้นด้วยตัวรับฮาโลเจนที่ให้ไอออนเงิน และด้วยเหตุนี้จึงทำให้วัสดุของฮาโลเจนเป็นอิสระ โดยที่สารประกอบ PSILOCYBIN และ PSILOCIN และได้รับมา สารประกอบ PSILOCYBIN ที่มีสูตรเชิงประจักษ์
สิทธิบัตรสหรัฐอเมริกา สิ่งประดิษฐ์ปัจจุบันเกี่ยวข้องกับแอลเอสแอลไซบินและแอลเอสโลซิน และการเตรียมสารดังกล่าวจากเชื้อราที่เรียกว่าสารหลอนประสาท ได้แก่ Psilocybe, Stropharia, Panaeolus, Cnocybe, Amanita และ Russula ก่อนหน้านี้ เป็นไปไม่ได้ที่จะแยกสารออกฤทธิ์ออกจากตัวอย่างของเชื้อราธรรมชาติหรือจากวัสดุเชื้อราที่เพาะเลี้ยงเทียม และเป็นไปไม่ได้ที่จะเพาะเลี้ยงสายพันธุ์ที่ออกฤทธิ์ประสาทหลอนโดยเริ่มจากเชื้อราตามธรรมชาติภายใต้สภาวะที่จะผลิตสารออกฤทธิ์ในปริมาณที่เพียงพอสำหรับการได้รับสารออกฤทธิ์ในระดับเตรียมการ
วัตถุประสงค์หลักของการประดิษฐ์นี้คือรูปลักษณ์ของกระบวนการที่เป็นไปได้ทางอุตสาหกรรมโดยหลักการออกฤทธิ์ที่ยังไม่ทราบมาก่อนของเชื้อราที่ทำให้เกิดอาการหลอนประสาท โดยเฉพาะอย่างยิ่ง Psilocybe mexicana Heim, Psilocybe caerztlescens Murrill var. nigripes Helm, Psilocybe Zapotccorum Heim, Psilocybe semperviva Heim และ Cailleux, Psilocybe aztecorum Heim และ Stropharia cubensis Earle,
ได้รับจากฮาโลเจนฟรี
อ่านทั้งฉบับ
วัคซีนป้องกันโรคไข้เลือดออก โรงพยาบาลนวเวช
วัคซีนป้องกันไข้เลือดออก (ฉีดได้ตั้งแต่อายุ 4-60 ปี)
วัคซีนไข้หวัดใหญ่ (4 สายพันธุ์) ปี 2023 รพ.กรุงสยามเซนต์คาร์ลอส
วัคซีนไข้หวัดใหญ่ (4 สายพันธุ์) ปี 2023 เข็มละ 900 บาท ( รวมค่าแพทย์และค่าบริการอื่นๆ ) ตั้งแต่วันที่ 1 กรกฏาคม ถึง 31 ธันวาคม 2566 สอบถามรายละเอียดเพิ่มเติม โทร.02-975-6700 ต่อ 2227,2230
โรงพยาบาลราชพฤกษ์ ให้บริการวัคซีนโรค มือ เท้า ปาก เหมาะสำหรับเด็กอายุ 6 เดือน ถึง 5 ปี
โรงพยาบาลราชพฤกษ์ ให้บริการวัคซีนโรค มือ เท้า ปาก เหมาะสำหรับเด็กอายุ 6 เดือน ถึง 5 ปี ( ฉีด 2 เข็ม ห่างกัน 1 เดือน) วัคซีนราคาเข็มละ 3,300 บาท เงื่อนไข **เด็กที่เคยป่วยเป็นโรค มือ เท้า ปากแล้ว สามารถฉีดได้แต่ต้องฉีดหลังจากหายป่วยแล้วเป็นระยะเวลา 1 เดือน ** เด็กที่มีโรคประจำตัวหรือแพ้ยา ควรปรึกษากุมารแพทย์ก่อนรับวัคซีน ** ราคานี้ยังไม่รวมค่าแพทย์ และค่าบริการโรงพยาบาล **เริ่ม 1 มกราคม – 31 ธันวาคม 2566 สอบถามข้อมูลเพิ่มเติม แผนกกุมารเวช (เด็กดี) ชั้น 2 โทร. 043-333555 ต่อ 2036
สำนักงานป้องกันควบคุมโรคที่ 6 ชลบุรี
8 อาหารที่ไม่ควรกินคู่กับเครื่องดื่มแอลกอฮอล์
8 อาหารที่ไม่ควรกินคู่กับเครื่องดื่มแอลกอฮอล์
1. ขนมขบเคี้ยวรสเค็มๆ กระตุ้นให้รู้สึกกระหายมากขึ้น ซึ่งจะทำให้คุณดื่มเครื่องดื่มตรงหน้ามากขึ้น
2. พิซซ่า มะเขือเทศที่เป็นส่วนประกอบหลักของพิซซ่า มีความเป็นกรดสูง เพิ่มความเสี่ยงต่อการเกิดกรดไหลย้อน
3. ถั่ว (กับไวน์) ถั่วต่างๆ อุดมไปด้วยธาตุเหล็ก ไวน์มีสารเทนนิน ซึ่งจะไปลดความสามารถในการดูดซึมธาตุเหล็ก จึงควรหลีกเลี่ยง ไม่กินพร้อมกัน
4. ขนมปัง (กับเบียร์) ทั้งเบียร์และขนมปังมีส่วนประกอบของยีสต์เป็นจำนวนมากเมื่อกินสองอย่างคู่กัน อาจส่งผลให้ท้องผูกและท้องอืดได้
5. กาแฟกับเครื่องดื่มชูกำลัง คาเฟอีนในกาแฟยังไปบดบังฤทธิ์ของแอลกอฮอล์ ทำให้คุณรู้สึกไม่ค่อยเมา ทั้งๆ ที่ในความเป็นจริงแล้วอาจจะเมา อาจทำให้เกิดอุบัติเหตุได้
6. น้ำอัดลม 0 แคลอรี เมื่อผสมกับแอลกอฮอล์ ทำให้แอลกอฮอล์ในเลือดสูงกว่าดื่มแอลกอฮอล์ผสมมิกเซอร์รสหวานปกติ
7. ผลไม้ตระกูลส้ม มะนาว มีส่วนประกอบของกรดสูง ทำให้เป็นกรดไหลย้อนได้ง่าย
8. อาหารอุดมไขมัน ของทอดเต็มไปด้วยไขมันก็ทำให้กรดไหลย้อนได้
สำนักการแพทย์ กรุงเทพมหานคร
โฆษกศาลยุติธรรม ชี้แจงขั้นตอนการดำเนินคดี “เยาวชนทำผิด”
โฆษกศาลยุติธรรม ชี้แจงขั้นตอนการดำเนินคดี “เยาวชนทำผิด” ต้องคุมตัวส่งศาลใน 24 ชม. ส่วนพ่อแม่อาจต้องรับผิดทางแพ่ง
นายสรวิศ ลิมปรังษี โฆษกศาลยุติธรรม เปิดเผยแนวทางการดำเนินคดีกับเด็กอายุ 14 ปี ที่ก่อเหตุใช้อาวุธปืนยิงประชาชนในห้างสรรพสินค้าจนมีผู้บาดเจ็บและเสียชีวิต ว่า ในการจับกุมเยาวชน จะมีกระบวนการตรวจสอบตามกฎหมาย พนักงานสอบสวนต้องนำตัวเด็กส่งศาลเยาวชนฯ ภายใน 24 ชม. เพื่อให้ศาลตรวจสอบก่อนว่า การจับกุมเยาวชนและการคุ้มครองสิทธิเสรีภาพเป็นไปตามที่กฎหมายหรือไม่ โดยศาลจะรอดูรายงานการจับกุมจากพนักงานสอบสวนที่นำส่งมา และพิจารณาพฤติการณ์ของเด็ก เช่น เด็กก่อเหตุยิงไปกี่คน, สภาพทางจิตใจ, การรักษาพยาบาลทางจิต และการดูแลของผู้ปกครอง พนักงานสอบสวนจะต้องใส่ในรายงานให้ศาลพิจารณา และในการตรวจสอบการจับกุม พนักงานสอบสวนต้องเดินทางมาศาลเยาวชนฯ ด้วย ซึ่งศาลอาจทำการไต่สวนพนักงานสอบสวนเพิ่มเติม ถึงข้อมูลต่าง ๆ จากนั้นศาลจะพิจารณาดำเนินการตามขั้นตอนว่าจะใช้ดุลยพินิจในการปล่อยตัว หรือจะควบคุมตัวเด็กที่ก่อเหตุหรือไม่
ส่วนพ่อแม่ของเด็กนั้น ตามกฎหมายหากเยาวชนยังไม่บรรลุนิติภาวะ พ่อแม่ต้องรับผิดด้วยตามประมวลกฎหมายแพ่งและพาณิชย์ มาตรา 429 เว้นแต่พ่อแม่จะพิสูจน์ข้อยกเว้นตามกฎหมายได้ว่าตนเองไม่ได้มีส่วนผิด
กรณีเด็กที่มีอาการป่วยทางจิต หากศาลเห็นว่า พ่อแม่สามารถดูแลเด็กได้ ก็จะให้พ่อแม่ดูแล และอาจวางมาตรการต่าง ๆ กำหนดไว้ แต่หากพ่อแม่ดูแลไม่ได้ ก็อาจจะให้องค์กรหรือหน่วยงานดูแลแทน ทั้งนี้ ขึ้นอยู่กับพฤติการณ์ของเด็กว่ารุนแรงเพียงใด และต้องใช้มาตรการใดมาควบคุมดูแลเด็กเหล่านี้
ทันตแพทยศาสตร์ มหาวิทยาลัยแม่ฟ้าหลวง (Dent MFU) ทำฟันฟรี 20 ตุลาคม 2566
เนื่องในวันที่ 21 ตุลาคม ของทุกปี เป็นวันทันตสาธารณสุขแห่งชาติ เพื่อถวายเป็นพระราชกุศล แด่...สมเด็จพระศรีนครินทราบรมราชชนนี “พระมารดาแห่งการทันตแพทย์ไทย” สำนักวิชาทันตแพทยศาสตร์ มหาวิทยาลัยแม่ฟ้าหลวง
ขอเชิญชวนประชาชนทั่วไปเข้ารับบริการ ขูดหินปูน อุดฟัน ถอนฟัน ฟรี!!! 1 คน ต่อ 1 สิทธิ์การรักษา (คิวมีจำนวนกำจัด) ในวันศุกร์ที่ 20 ตุลาคม 2566 ณ คลินิกทันตกรรม สำนักวิชาทันตแพทยศาสตร์ มหาวิทยาลัยแม่ฟ้าหลวง
รับบัตรคิวได้ตั้งแต่เวลา 07.00 - 11.30 น. ไม่แจกบัตรคิวหรือจองล่วงหน้า
เข้ารับการรักษาตั้งแต่เวลา 08.00 - 15.30 น.
ติดต่อสอบถาม โทร : 05391-3334 05391-3335


นางสาวพรสุรีย์ กอนันทา รองประธานกรรมการบริหาร ฝ่ายกิจการองค์กร บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด กล่าวย้ำถึงความมุ่งมั่นของเชฟรอนว่า “เชฟรอนมุ่งผลักดันองค์ความรู้ด้านสะเต็มศึกษามาอย่างต่อเนื่อง เพื่อยกระดับขีดความสามารถของประเทศผ่านการศึกษา โดยดาราศาสตร์ ถือเป็นอีกหนึ่งองค์ความรู้สำคัญของมวลมนุษยชาติที่มีบทบาทสำคัญต่อการเข้าใจโลกและสิ่งที่เกิดขึ้นรอบตัวเรา ดังนั้น เชฟรอนจึงมุ่งกระจายโอกาสการเรียนรู้ด้านดาราศาสตร์ให้เยาวชนและประชาชนมากขึ้น รวมถึงทำงานร่วมกับสถาบันวิจัยดาราศาสตร์แห่งชาติ และหอดูดาวเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา สงขลา อย่างใกล้ชิดเป็นเวลากว่า 6 ปี พร้อมสนับสนุนกิจกรรมดาราศาสตร์มากมาย อาทิ จัดค่ายเยาวชนคนดูดาวเท้าติดทะเล เพื่อเสริมทักษะให้เยาวชนได้เรียนรู้ผ่านประสบการณ์ทั้งด้านทฤษฎีและปฏิบัติ สนับสนุนงบประมาณดูแลและพัฒนาหอดูดาวฯ สงขลา ไปจนถึงกิจกรรมพาดาวมาหาน้องล่าสุดที่จัดขึ้นในพื้นที่เกาะพะงัน จังหวัดสุราษฎร์ธานี โดยทางบริษัทฯ หวังว่ากิจกรรมต่างๆ เหล่านี้ จะช่วยขยายพื้นที่การเรียนรู้ด้านวิทยาศาสตร์และดาราศาสตร์มากขึ้น พร้อมจุดประกายความรู้และแรงบันดาลใจให้เยาวชนสามารถต่อยอดและพัฒนาในอนาคตต่อไป”
คลินิควัยทอง
คลินิควัยทอง ศบส.39 เปิดให้บริการวันพุธ เวลา 13.00 น. – 16.00 น.
วัยทองหรือวัยหมดประจำเดือนในผู้หญิง จะอยู่ในช่วงอายุประมาณ 45-55 ปี โดยเฉลี่ยอายุ 50 ปี เมื่อถึงวัยนี้ รังไข่จะหยุดทำงาน และไม่มีการตกไข่อีกต่อไป ทำให้ไม่มีประจำเดือนและไม่มีการสร้างฮอร์โมนเพศหญิงจากรังไข่อีก ทำให้เกิดอาการเปลี่ยนแปลงของร่างกายและจิตใจ ซึ่งผู้หญิงแต่ละคนจะมีอาการมากน้อยแตกต่างกันไป
อาการของวัยทอง
ไม่มีประจำเดือน หรือประจำเดือนมาน้อยวันและไม่สม่ำเสมอ ร้อนวูบวาบตามร่างกายโดยเฉพาะส่วนบนของร่างกาย เหนื่อยง่าย ใจสั่นมีเหงื่อออกมากตอนกลางคืน หนาวสั่นโดยไม่มีสาเหตุ มีปัญหาเรื่องการนอน นอนหลับยากหรือนอนไม่หลับ กระดูกจะบางและเปราะง่าย กระดูกจะหักเมื่อล้มหรือกระแทก ปวดเมื่อยกล้ามเนื้อ หรือปวดตามข้อและกระดูก ช่องคลอดแห้ง น้ำหล่อลื่นน้อยลง เจ็บปวดเวลามีเพศสัมพันธ์ ปัสสาวะบ่อย กลั้นปัสสาวะไม่ค่อยได้ ผิวหนังจะบางลง แห้งและเกิดเป็นแผลได้ง่าย มีอาการคันตามผิวหนัง และผิวหนังเกิดผื่นแพ้ง่าย เส้นผมจะหยาบแห้งและบางลง หลุดร่วงได้ง่าย ไม่ดกดำเป็นเงางาม มีอาการเปลี่ยนแปลงทางอารมณ์เร็ว เครียดง่าย หงุดหงิดโดยไม่มีสาเหตุ โกรธง่าย ใจน้อย ควบคุมอารมณ์ได้ยาก บางคนหลงลืมง่าย เวียนศีรษะ ซึมเศร้า
คลินิกสมรรถภาพหัวใจ
คลินิกสมรรถภาพหัวใจ
- ศัลยศาสตร์ทั่วไป ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกศัลยกรรมทั่วไป บ่าย เวลา 13.00 น. - 16.00 น. (บ่าย)
- คลินิก Pace maker ในเวลาราชการ 08.00 - 16.00 น.
- คลินิกวาร์ฟาริน ในเวลาราชการ 08.00 - 16.00 น.
- คลินิกรักษ์หัวใจ ในเวลาราชการ 08.00 - 16.00 น.
คุณฟิลิปป์ เลอรัว ผู้บริหาร Sanofi ในฐานะผู้สนับสนุนงานครั้งนี้
มุมสวยๆ ทางเดินเรียบร้อย ป้ายบอกเป็นระยะ
คุณชูเฮ ยามากุจิ จากร้าน “ไซอุนโด” จังหวัด ชิมาเนะ
คุณชูเฮ ยามากุจิ จากร้าน “ไซอุนโด” จังหวัด ชิมาเนะ เป็นร้านน้ำชาและขนมหวานญี่ปุ่นเก่าแก่ที่ได้รับความนิยม ในเมืองมัตสึเอะหรือที่รู้จักกันในชื่อเมืองหลวงแห่งน้ำ เหมาะสำหรับผู้ที่ต้องการพักผ่อนและเพลิดเพลินกับชาชั้นเลิศ โดยเชฟทำขนมของร้าน 5 ท่าน ได้รับการคัดเลือกและรับรองให้เป็นผู้เชี่ยวชาญด้านขนมญี่ปุ่นที่เป็นเลิศจาก National Japanese Confectionery Association
ปิดท้ายด้วย นพ.จเด็จ ธรรมธัชอารี เลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ย้ำบทบาทของหน่วยงานที่เน้นการทำงานร่วมกับภาครัฐและเอกชนเพื่อสร้างระบบการดูแลสุขภาพที่ยั่งยืน จะช่วยลดภาระค่าใช้จ่ายด้านงบประมาณ รวมถึงหากมียารักษาใหม่ๆ ที่มีประสิทธิภาพสูงกว่าในราคาย่อมเยา ก็จะช่วยให้การจัดสรรงบประมาณเป็นไปอย่างคุ้มค่า ทั้งนี้ สปสช. ยังต้องการการสนับสนุนด้านงบประมาณ เพราะต้องการแสวงหายารักษาคุณภาพดีและเทคโนโลยีใหม่ๆ ในราคาที่เหมาะสม เพื่อเพิ่มโอกาสในการเข้าถึงการรักษาของประชาชนได้ครอบคลุมมากขึ้น และเล็งเห็นว่าปัจจัยสำคัญในการแก้ปัญหาโรคเบาหวานและโรคอ้วน ต้องอาศัยการสร้างความตระหนักรู้และความเข้าใจให้กับประชาชนในการดูแลตัวเอง เพื่อจะได้ควบคุมน้ำตาลให้ได้ดีขึ้น ซึ่งปัจจุบันบรรลุเป้าหมายอยู่ที่ 22% และต้องการให้ถึง 40% ซึ่งต้องอาศัยความร่วมมือจากทุกภาคส่วน
ชมดอกไม้เทศกาลดอกไม้ ที่ ปากช่อง เขาใหญ่ วังน้ำเขียว
พื้นที่ปากช่อง เขาใหญ่ วังน้ำเขียว ก็เป็นแหล่งชมดอกไม้สวยๆมากมายหลายแห่ง เอกชนแข่งกันจัดขึ้นอวดความสวยงามที่ น่าไปแวะเยี่ยมชม ถ่ายภาพ ที่คัดมาไว้ ดังนี้
- Hokkaido Flower Park Khaoyai สวนดอกไม้สไตล์ญี่ปุ่น แบบได้อารมณ์และบรรยากาศมาก ทุ่งมากาเรต ดอกสร้อยไก่เซโรเซีย มีชุดยูกาตะให้เช่าด้วย อาหารเครื่องดื่มก็ครบเครื่อง สวนเปิดให้บริการทุกวัน 7.30น. -18.00น. สอบถามโทร 098-0962938 พาน้องหมาได้ด้วยนะ
- Floryday Khaoyai : Café & Flower คาเฟ่สไตล์มินิมอลบนเนินเขา ทุ่งดอกไม้ขั้นบันได ดาวกระจายเหลืองส้มบานเต็มทุ่งแล้ว เปิดทุกวัน 08.00-17.30 น. โทร. 080-812-3827 น้องหมาเข้าได้จ้า
- The Forest coffee&tea สวนดอกไม้ปีนี้พบกับทุ่งดอก Sun Flower บนเนื้อที่กว่า 10 ไร่ และดอกไม้เมืองหนาวหลากหลายสายพันธุ์ มุมถ่ายรูป สวยๆ เก๋ๆ มากมาย เตรียมเปิดปลายพฤศจิกายน 2023 - มีนาคม 2024 เปิดทุกวัน 8.00-18.00 น.
- ฟลาวเวอร์เมาน์เทน Flowermountain Khaoyai สวนกุหลาบ สวนดอกไม้เมืองหนาวที่ใหญ่ โทร. 080 465 1111
- ไร่มณีศร อลังการ ทุ่งทานตะวัน เขาใหญ่ เปิดทุกวัน 07.00น. - 18.00น. โทร. 098 301 9051
โปรแกรมตรวจเพิ่มเติมตามความเสี่ยง หรือตรวจเฉพาะทาง
โปรแกรมตรวจเพิ่มเติมตามความเสี่ยง หรือตรวจเฉพาะทาง สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
ปานปรีย์ เยี่ยมคนไทยที่ได้รับการปล่อยตัว
ต่อมา นายปานปรีย์ พหิทธานุกร รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ เยี่ยมคนไทยที่ได้รับการปล่อยตัวจากเหตุการณ์ความขัดแย้งอิสราเอล โดยมี รัฐมนตรีว่าการกระทรวงการต่างประเทศ และและรัฐมนตรีว่สการกระทรวงสาธารณสุขอิสราเอลให้การต้อนรับ
ในโอกาสนี้ รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ ได้ให้กำลังใจ ติดตามการดูแลรักษาคนไทยที่อยู่ระหว่างการรักษาตัวที่โรงพยาบาล Shamir Medical Center โดยให้คำมั่นว่าจะนำคนไทยที่พร้อมเดินทางกลับประเทศไทยสู่อ้อมกอดของญาติพี่น้องโดยเร็วที่สุด
หลักสูตร การให้บริการแก่นักท่องเที่ยวกลุ่มคนพิการและผู้สูงอายุ
หลักสูตร "การให้บริการแก่นักท่องเที่ยวกลุ่มคนพิการและผู้สูงอายุ"
หลักสูตรนี้จัดทำขึ้น เพื่อพัฒนาผู้ประกอบการและผู้ให้บริการด้านการท่องเที่ยว ให้มีความรู้ความเข้าใจในการให้บริการแก่นักท่องเที่ยวกลุ่มคนพิการและผู้สูงอายุ รวมทั้งส่งเสริมและยกระดับการให้บริการของบุคลากรด้านการท่องเที่ยวเชิงสุขภาพให้มีศักยภาพเทียมเท่าการให้บริการการท่องเที่ยวเชิงสุขภาพในระดับสากล
ลิงค์หลักสูตร6.ศูนย์สุขภาพพร้อม พฤฒพลัง
ศูนย์สุขภาพพร้อม พฤฒพลัง ดำเนินงานโดย ศูนย์บริการเทคนิคการแพทย์คลินิก คณะเทคนิคการแพทย์ มช.
ให้บริการ เจาะเลือด ตรวจสุขภาพทั่วไป ตรวจสุขภาพประจำปี ตรวจตามคำสั่งแพทย์ เอกซเรย์ (ปอด ทรวงอก หัวใจ)
เบิกได้ ได้แก่ กลุ่ม ราชการ รัฐวิสาหกิจ อปท. ตามสิทธิแต่ละหน่วยงาน
- ให้บริการ เสาร์-อาทิตย์ 07.30 - 12.00 น.
- ตั้งอยู่ที่ ชั้น 1 อาคารทองกวาว ศูนย์ส่งเสริมพฤฒพลังผู้สูงอายุ มช. ถนน เจริญประเทศ ตำบลป่าแดด อำเภอเมืองเชียงใหม่ เชียงใหม่ 50100
- แผนที่ google map
- โทร 053-936027 053-904914
- facebook
ผู้ประกันตนตรวจสอบข้อมูลเองได้ 2 รูปแบบ
ตรวจสอบข้อมูลของผู้ประกันตนได้ 2 รูปแบบ ดังนี้
ตรวจสอบข้อมูลส่วนตัว
เพียงลงทะเบียนด้วยเลขบัตรประชาชน
- เงินสมทบผู้ประกันตน
- เงินสมทบชราภาพ
- การเบิกสิทธิประโยชน์
- แจ้งเปลี่ยนโรงพยาบาล
- ประวัติการเปลี่ยนโรงพยาบาล
ตรวจสอบข้อมูลทั่วไป
- สิทธิประโยชน์มาตรา 33, 39, 40
- การลงทะเบียน
- การเบิกสิทธิประโยชน์
- การชำระเงินสมทบ
- งานทะเบียนและเงินสมทบ
- มาตรการเร่งด่วน
ง่ายๆ! เพียงสแกนคิวอาร์ โค้ดหรือแอด @ssothai แล้วมาเป็นเพื่อนกันเลย เพียงเท่านี้ก็จะได้อัปเดตสิทธิประโยชน์ แล้วยังมีกิจกรรมให้ร่วมสนุกลุ้นของรางวัลสุดปังทุกเดือน สอบถามข้อมูลเพิ่มเติมเกี่ยวกับประกันสังคมได้ที่ www.sso.go.th หรือโทรสายด่วน 1506 ให้บริการทุกวัน ตลอด 24 ชั่วโมง
6. สถานชีวาภิบาล จังหวัดละ 1 แห่ง เพื่อให้การดูแลผู้สูงอายุ ผู้ป่วยมีภาวะพึ่งพิง ติดบ้าน/ ติดเตียง ผู้ป่วยระยะประคับประคอง จนถึงวาระสุดท้ายของชีวิต
จัดทำโครงการ "กูฏิชีวาภิบาล" โรงพยาบาลสงฆ์ ดูแลพระสงฆ์อาพาธระยะท้าย โดยนำเทคโนโลยีสมัยใหม่ Virtual Hospital มาสนับสนุนการให้บริการ รวมทั้ง จัดการอบรมถวายความรู้เรื่องการดูแลพระสงฆ์อาพาธ ระยะท้ายให้กับพระคิลานุปัฎฐากที่ผ่านการอบรมหลักสูตร 70 ชั่วโมงของกรมอนามัย ทั้งภาคทฤษฎีและภาคปฏิบัติในโรงพยาบาลรวม 20 วัน และถ่ายทอดองค์ความรู้ด้าน การอุปัฏฐากพระสงฆ์อาพาธที่เอื้อต่อพระธรรมวินัยให้กับบุคลากรทั่วประเทศทั้ง 13 เขตสุขภาพ พร้อมทั้งจัดตั้ง กุฏิชีวาภิบาลต้นแบบ จำนวน 4 แห่ง ได้แก่ 1.วัดท่าประชุม จังหวัดขอนแก่น (เขตสุขภาพที่ 7) 2.วัดทับคล้อ จังหวัดพิจิตร (เขตสุขภาพที่ 3) 3.วัดบุญนารอบ จังหวัดนครศรีธรรมราช (เขดสุขภาพที่ 11) และ 4.วัตสังฆทาน จังหวัดนนทบุรี (เขตสุขภาพที่ 4) จะขยายให้ครบทุกเขตสุขภาพ ภายในปี 2570สรุปสถานการณ์อุบัติเหตุบนโครงข่าย ของกระทรวงคมนาคม (ถนน ราง อากาศ เรือ)
ประเทศอินโดนีเซีย
Indonesia
1. Faculty of Medicine, Syiah Kuala University, Indonesia
หลักสูตร 6 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศอินโดนีเซีย และรับรอง โรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศ อินโดนีเซีย ได้แก่ Zainoel Abidin General Hospital
ว/ด/ป ที่ รับรอง 16 พ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 15 พ.ค. 67
สำหรับ ความร่วมมือ Thailand Smart Living Lab ในครั้งนี้นับว่าเป็นมีความสำคัญอย่างยิ่ง เพราะเป็นการบูรณาการความร่วมมือของ กระทรวง ทบวง กรม และหน่วยงานภาครัฐระดับจังหวัด รวมถึงผู้บริหารส่วนท้องถิ่นที่ได้เข้ามาช่วยกันสนับสนุนผลักดันให้เกิดสวัสดิการผู้สูงอายุยุค 5G ผ่านการทำ Digital Health Innovation เพื่อให้ผู้สูงอายุมีคุณภาพชีวิตที่ดีขึ้น มีความมั่นคงในสุขภาพ และสามารถใช้ชีวิตสังคมในระยะยาวได้อย่างมีความสุข ตลอดจนทางภาครัฐยังได้มีข้อมูลสุขภาพของผู้สูงอายุทั้งประเทศไทย เพื่อเตรียมตัวก้าวสู่การทำ Thailand Personal Health AI กับกระทรวงการอุดมศึกษาวิทยาศาสตร์ วิจัย และนวัตกรรม (อว.) รวมทั้งหน่วยงานภาคีเครือข่าย ในลำดับต่อไป โดยมุ่งหวังให้คนไทยมีสุขภาพที่แข็งแรงยิ่งขึ้น
“ผมหวังเป็นอย่างยิ่งว่าโครงการวิจัยครั้งนี้ จะเป็นก้าวสําคัญในการขับเคลื่อนการเข้าถึงสวัสดิการให้กับผู้สูงอายุในประเทศ และจะเป็นส่วนหนึ่งที่จะทำให้ช่วยลดภาระพึ่งพิงสวัสดิการจากภาครัฐ ในการดูแลเรื่องค่าใช้จ่าย ค่ารักษาพยาบาลของผู้สูงอายุได้ในอนาคต ผมขอสนับสนุนให้ประสบความสำเร็จจนสามารถเกิดการผลักดันต่อให้เป็นนโยบายสวัสดิการทางสังคมและสุขภาพด้วยเทคโนโลยี 5G ต่อไปในอนาคต” นายไตรรัตน์ กล่าวเพิ่มเติม
หมวด 3 การขออนุญาต และการอนุญาต
คลินิกมลพิษทางอากาศ โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินธโรอุทิศ
คลินิกมลพิษทางอากาศ โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินธโรอุทิศ เปิดบริการทุกวันพฤหัสบดี เวลา 8.00-12.00 น. สอบถามโทร. 02-4293576 ต่อ 8522
หน่วยเวชศาสตร์มารดาและทารกในครรภ์ โรงพยาบาลกลาง ตรวจอัลตราชาวด์เวชศาสตร์มารดาและทารกในครรภ์
หน่วยเวชศาสตร์มารดาและทารกในครรภ์ โรงพยาบาลกลาง ให้บริการ
• ตรวจอัลตราชาวด์ความผิดปกติของทารกในครรภ์ ในรูปแบบ 2 มิติ(2D) และ 4 มิติ(4D)
• ตรวจคัดกรองภาวะดาวน์ชินโดรม (Down syndrome) ของทารกในครรภ์ ด้วยวิธีการตรวจQuadruple test, NIPT
• ให้คำปรึกษาความผิดปกติทางพันธุกรรมของทารกในครรภ์ และคู่สมรส
• ตรวจคัดกรองและให้การป้องกันความเสี่ยงของการคลอดก่อนกำหนด
• ประเมินความเสี่ยงและให้การป้องกันภาวะครรภ์เป็นพิษ ในสตรีตั้งครรภ์ที่มีความเสี่ยงสูง
• ตรวจติดตามสตรีตั้งครรภ์ที่มีความเสี่ยงสูง หรือมีโรคทางอายุรกรรมขณะตั้งครรภ์
วันเวลาการเปิดให้บริการ
- ตรวจอัลตราชาวด์ทารกในครรภ์ขั้นพื้นฐาน แบบ 2 มิติ (2D) ทุกวันจันทร์-ศุกร์ เวลา 9:00-12:00 น.
- ตรวจอัลตราชาวด์เวชศาสตร์มารดาและทารกในครรภ์ อัลตราชาวด์ แบบ 4 มิติ (4D) และให้คำปรึกษาทางพันธุกรรม ทุกวันจันทร์-พฤหัสบดี เวลา 13:00-15:00 น.
ติดต่อสอบถาม 02-220-8000 ต่อ 10350
ปิดท้ายการเสวนาด้วยการ“เติมเต็มการดูแลเพื่อคุณภาพชีวิตที่ดีของผู้ป่วยมะเร็ง” ทั้งในด้านการวางแผนมีบุตรสำหรับผู้เป็นมะเร็ง ร่วมเสวนากับ พญ.กตัญญุตา นาคปลัด แพทย์เฉพาะทางด้านสูติศาสตร์-นรีเวชวิทยาและเวชศาสตร์การเจริญพันธุ์ แพทย์หญิงจิดาภา สำราญ แพทย์เฉพาะทางด้านมะเร็งนรีเวชวิทยา และด้วยการประสบกับปัญหาเตียงผู้ป่วยไม่เพียงพอ พยาบาลวิชาชีพ จุฑามาศ มูลภิชัย หน่วยพยาบาลเคมีบำบัด และคุณสิน วิวัฒน์ธนพร ผู้ป่วยมะเร็งลำไส้ โรงพยาบาลจุฬาภรณ์ ได้ขึ้นมาร่วมเสวนาแลกเปลี่ยนประสบการณ์ถึงการปิดช่องว่างของข้อจำกัดดังกล่าวของโรงพยาบาลจุฬาภรณ์ ด้วยการเปิดบริการให้ยาเคมีบำบัดที่บ้าน สำหรับผู้ป่วยมะเร็งลำไส้ หรือ Home Chemotherapy เพื่อให้ผู้ป่วยมะเร็งได้รับการรักษาอย่างทันท่วงที ลดวิกฤตปัญหาเรื่องเตียงเต็มและเป็นการเพิ่มคุณภาพชีวิตให้กับผู้ป่วยมะเร็งและญาติที่สามารถใช้ชีวิตตามปกติได้ในขณะให้ยาเคมีบำบัด
ตรุษจีนนี้เลือกซื้ออาหารปลอดภัย
The Most Trusted Healthcare and Wellness Destination
สุดท้ายนี้ เราจะไม่สามารถบรรลุวิสัยทัศน์ของการเป็น The Most Trusted Healthcare and Wellness Destination ได้ หากปราศจากศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ซึ่งเป็นสถาบันเวชศาสตร์ชะลอวัยแบบบูรณาการ เป็นผู้บุกเบิกและวางรากฐานเวชศาสตร์เชิงป้องกันเป็นแห่งแรกในเอเชีย ซึ่งไวทัลไลฟ์มีแนวทางการดูแลสุขภาพเพื่อการมีอายุยืนยาว โดยใช้องค์ความรู้จากงานวิจัยในด้าน Longevity Medicine ผสมผสานกับเทคโนโลยีด้านปัญญาประดิษฐ์ ในการวิเคราะห์ อายุชีวภาพ (biological age) หรืออายุที่แท้จริงลึกถึงระดับเซลล์ของร่างกาย เพื่อช่วยวางแผนเฉพาะบุคคลในการลดอายุทางชีวภาพเพื่อชะลอความเสื่อม ป้องกันก่อนเกิดโรคและฟื้นฟูสภาพความเสื่อมให้กลับมามีสุขภาพที่แข็งแรงและมีชีวิตที่ยืนยาวอย่างมีคุณภาพชีวิตที่ดี รวมถึงการตรวจรหัสพันธุกรรมโดยทีมแพทย์ผู้ชำนาญการทางเวชศาสตร์จีโนม เพื่อหาความเสี่ยงของ ปัญหาสุขภาพที่แตกต่างกันของแต่ละบุคคล
ประเด็นเกี่ยวกับกฎหมายและนโยบาย มีข�อมูลที่ชัดเจนแสดงวา วีธีการและนโยบายการลดอันตรายจากการใช�ยาที่มีเปAาหมายในการปAองกัน การติดเชื้อและการเสียชีวิต ชวยลดสิ่งกีดขวางในการเข�าสูบริการสุขภาพและยุติธรรมของผู�ใช�ยา แตแนวคิด ดังกลาวยังเป#นที่ถกเถียงในหลายประเทศ ในขณะที่ UNGASS, UNAIDS, WHO, UNODC, กองทุนโลก, สภาสิทธิมนุษยชนโลกให�การรับรอง และแนะนําให�ใช�วิธีดังกลาว อยางไรก็ดี พบวา ความครอบคลุมและเพียงพอ ในการดําเนินการวิธีดังกลาวในกลุมผู�ใช�ยาฉีดยังต่ํามาก เชน ได�รับเข็มฉีดยาและกระบอกฉีดใหมเดือนละ 2 ชุด มีเพียง 8% เทานั้นที่เข�าถึงการให�ยาทดแทน สวนหนึ่งเป#นผลจากการขาดความตั้งใจในเชิงนโยบาย ข�อจํากัด ด�านกฎหมาย และการบังคับใช�กฎหมาย และวิกฤติด�านงบประมาณในการสนับสนุนเรื่องดังกลาว เชน ผู�ให�บริการแจกเข็มถูกมองวาเป#นผู�ใช�ยาเองและทําผิดกฎหมาย การให�เมทาโดนหรือบูพรีนอฟwนทดแทน ยังถือวาผิดกฎหมายในบางประเทศ องค�การอนามัยโลก กลาวชัดเจนวา ประเทศตางๆ ควรพัฒนานโยบาย และ กฎหมายเพื่อลดทอนความเป#นอาญาในผู�ใช�ยาในการใช�เข็มสะอาด และการใช�ยาทดแทน รวมถึงวิธีการอื่นๆ ในการลดอันตรายจากการใช�ยา เชน ห�องเสพยาที่ปลอดภัย การบริการตรวจสอบสารเสพติด สวนในกลุม ผู�ใช�สารกระตุ�นระบบประสาทมีข�อจํากัดในการเข�าถึงบริการมากกวามาก ในหลายประเทศผู�ให�บริการ ลดอันตรายจากการใช�ยาเชิงรุก (Peer and Outreach) เป#นเปAาหมายของผู�บังคับใช�กฎหมาย ด�วยข�อหาสนับสนุน และอํานวยความสะดวกในการใช�ยา และยังใช�เป#นชองทางในการจับผู�ใช�ยา ดังนั้น การทําข�อตกลงและความรวมมือจากผู�บังคับใช�กฎหมาย ทั้งในนโยบายชาติหรือระดับพื้นที่จึงควรมีความสําคัญในการปAองกันป$ญหา ดังกลาว
การบริการผู้ป่วยนอก Model 5 เครือข่ายพวงบริการ ศบส-คลินิก
1. ศูนย์บริการสาธารณสุข (ศบส.) สังกัดสำนักอนามัย กรุงเทพมหานคร 69 แห่ง เป็นหน่วยบริการประจำแม่ข่าย (Area manager) ของพวงบริการ รับผิดชอบประชากรในพื้นที่และได้งบที่จัดสรรของเครือข่ายพวงบริการเพื่อบริหารจัดการจ่ายไปยังลูกข่าย
2. ศบส. สำนักอนามัย มีข้อจำกัดด้านบุคลากรไม่สอดคล้องกับจำนวนประชากรที่รับผิดชอบ รับคลินิกชุมชน อบอุ่น (คลินิกเอกชน) เข้ามาเป็นพวงบริการ
3. ศบส. สำนักอนามัย ขาดบุคลากรสายงานการเงินและพัสดุ มอบให้สำนักงานหลักประกันสุขภาพ เขต 13 กรุงเทพมหานคร ทำหน้าที่บริหารเงินค่าบริการผู้ป่วยนอกรายหัว
4. สปสช.13 ทำหน้าที่เชิญชวนคลินิกเอกชนเข้าร่วมการให้บริการ และเป็นคู่สัญญากับคลินิกชุมชนอบอุ่น (สัญญาต่ออัตโนมัติทุกปี กรณียกเลิกสัญญาคลินิกเอกชนต้องแจ้งล่วงหน้า 6 เดือน)
จากความร่วมมือของพาร์ทเนอร์ทั้ง 3 ฝ่าย NUSA – BHS – PNC จึงเกิดเป็นโครงการ PARC EXO CARE ที่จะเข้ามาร่วมดูแลสุขภาพให้กับผู้อาศัยในโครงการ โครงการนี้มีจุดเด่นที่แตกต่างจากโครงการทั่วไปในเรื่องของรูปแบบการลงทุนที่สร้างความมั่นคงหลังวัยทำงาน ตอบโจทย์ทุกไลฟ์สไตล์ของวัยเกษียณ นอกจากนี้ parc exo care ยังเป็นการวางแผนการเงินให้กับ คนที่ต้องการจะได้มีช่วงเวลาเกษียณสำราญ และมีชีวิตที่ออกแบบได้เองในช่วงบั้นปลายของชีวิต โดยโปรเจกต์ “parc exo care” เกิดขึ้นด้วยจุดประสงค์ว่า จากนี้เป็นต้นไปเราจะ “อาสา” ดูแลคุณตั้งแต่วันที่เข้าร่วมลงทุนหรือเข้ามาเป็นครอบครัวเดียวกันกับเรา ไปจนถึงช่วงบั้นปลายของชีวิต
โปรเจกต์การออกแบบพื้นที่นั่งสาธารณะ (Public Furniture)
โปรเจกต์การออกแบบพื้นที่นั่งสาธารณะ (Public Furniture) ที่ได้ Plural Designs มาออกแบบ ‘Pocket Oasis Garden’ โครงการเพิ่มพื้นที่สีเขียวในเมืองผ่านสวนเคลื่อนย้ายได้ ด้วยงานออกแบบ Public Furniture ที่มีการใช้งานที่หลากหลาย ปรับได้ตามลักษณะพื้นที่ที่แตกต่างกัน ซึ่งถูกนำไปใช้บนพื้นที่จริงของกรุงเทพฯ ในย่านพระนคร ที่สวนริมคลองผดุงกรุงเกษม ท่าเรือเทเวศร์ และย่านหัวลำโพง บริเวณริมคลองผดุงกรุงเกษมเช่นกัน
สปสช.เขต 6 ระยอง
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 6 ระยอง
- 115 อาคารสตาร์พลาซ่า(ชั้น 2) ซอยศูนย์การค้าสาย 4 ถนนสุขุมวิท ตำบลเชิงเนิน อำเภอเมือง จังหวัดระยอง 21000
- โทรศัพท์ 0-3886-4313
- โทรสาร 0-3886-4320
- แผนที่ google map
- website
- facebook
การตรวจยีนผิดปกติ ช่วยให้ทราบถึงความเสี่ยง
ผศ.นพ. พลกฤต ทีฆคีรีกุล แพทย์ชำนาญการด้านพันธุกรรม โรงพยาบาลบำรุงราษฎร์ อธิบายว่า การตรวจยีนผิดปกติที่ทำให้เกิดมะเร็งเต้านม ควรเริ่มจากการดูประวัติของคนในครอบครัวที่เคยเป็นมะเร็งเต้านมหรือมะเร็งรังไข่ ซึ่งหากตรวจพบความผิดปกติของยีนที่เกี่ยวข้องกับมะเร็งเต้านม ไม่ได้หมายความว่าจะเป็นมะเร็งเต้านม เพียงแต่ทำให้มีความเสี่ยงเพิ่มมากขึ้นกว่าคนปกติ การที่เราทราบถึงความเสี่ยงนี้ จะช่วยให้เราสามารถวางแผนป้องกันโรคได้ เช่น ตรวจคัดกรองมะเร็งเต้านมตามกำหนดเวลาที่แพทย์แนะนำ ซึ่งต้องตรวจบ่อยครั้งกว่าและเริ่มตรวจเมื่ออายุน้อยกว่าคนทั่วไป โดยโรงพยาบาลบำรุงราษฎร์ใช้เทคโนโลยีในการตรวจวินิจฉัยยีนขั้นสูงที่เรียกว่า Next Generation Sequencing (NGS) ซึ่งให้ผลตรวจที่รวดเร็ว ถูกต้อง และแม่นยำ
แพทย์แผนไทย และแพทย์ทางเลือก
UMSC โรงพยาบาลนคราภิบาล (โรงพยาบาลลาดกระบังกรุงเทพมหานคร)
ศูนย์สนับสนุนบริการสุขภาพเวชศาสตร์เขตเมือง UMSC โรงพยาบาลนคราภิบาล ชวนแอดไลน์ ID: umsc.lkbh เพื่อรับบริการฉับไวเข้าถึงง่ายกว่าเดิมจาก โรงพยาบาลนคราภิบาล (โรงพยาบาลลาดกระบัง กรุงเทพมหานคร) สอบถามโทร. 02-3273049
รถไฟท่องเที่ยวคิฮะ จอด ณ บริเวณ ผาเสด็จ จ.สระบุรี
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชานวัตกรรมวิทยาศาสตร์การแพทย์
รองศาสตราจารย์ ดร.จตุพร กระจายศรี ประธานหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชานวัตกรรมวิทยาศาสตร์การแพทย์
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชานวัตกรรมวิทยาศาสตร์การแพทย์ เป็นหลักสูตรใหม่ของราชวิทยาลัยจุฬาภรณ์ เปิดรับสมัครนักศึกษารุ่นแรก ในปีพุทธศักราช 2567 มุ่งผลิตบัณฑิตที่มีความรู้ ทักษะ และสมรรถนะทางการวิจัย นวัตกรรม ด้านวิทยาศาสตร์การแพทย์ โดยมีเป้าหมายให้บัณฑิตสามารถต่อยอดเป็นผู้ช่วยวิจัย หรือนักวิจัยได้อย่างเต็มตัวในอนาคต อาชีพที่สามารถประกอบได้หลังสำเร็จการศึกษา 1) บุคลากรวิจัยด้านวิทยาศาสตร์การแพทย์ 2) นักวิชาการด้านวิทยาศาสตร์การแพทย์ในหน่วยงานภาครัฐหรือภาคเอกชน 3) นวัตกรด้านวิทยาศาสตร์การแพทย์ 4) บุคลากรทางด้านการศึกษาด้านวิทยาศาสตร์ ในสถาบันการศึกษา 5) เจ้าของธุรกิจหรือผู้ประกอบการด้านการแพทย์ เช่น บริษัทยา เวชภัณฑ์ บริษัทเครื่องมือทางการแพทย์ และห้องปฏิบัติการวินิจฉัยทางการแพทย์ ในปีการศึกษา 2567 รับนักศึกษา จำนวน 30 คน แบ่งเป็น 3 รอบ รอบที่ 1 Portfolio จำนวน 5 คน เสร็จสิ้นตามเป้าหมายแล้ว รอบที่ 2 การรับแบบโควตาจากโรงเรียนวิทยาศาสตร์จุฬาภรณราชวิทยาลัย จํานวน 20 คน เปิดรับสมัคร วันที่ 1 – 31 มีนาคม 2567 และ รอบที่ 3 การรับแบบ Admission จำนวน 5 คน ตามประกาศของ ทปอ. รับสมัคร วันที่ 6 – 12 พฤษภาคม 2567
เขต 6
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี คลองพลู จังหวัดจันทบุรี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ดอนฉิมพลี จ.ฉะเชิงเทรา
- สถานีอนามัยเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวฉลองสิริราชสมบัติครบ 50 ปี บ้านมาบลำบิด
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษานวมินทราชินีเขาคันทรง จ.ชลบุรี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลหนองบอน จ.ตราด
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านระเบาะไผ่ จ.ปราจีนบุรี
- สถานีอนามัยเฉลิมพระเกียรติจุฬาภรณ์อาทรราษฎร์ จ.ปราจีนบุรี
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี บ้านน้ำใส จ.ระยอง
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านคลองบางปิ้ง จ.สมุทรปราการ
- สถานีอนามัยเฉลิมพระเกียรติฯ สาขาวัดบางปิ้ง
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี วังสมบูรณ์ จ.สระแก้ว
หน่วยจักษุ (ตา) คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกจักษุ
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396400 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ให้บริการตรวจรักษาและให้คำแนะนำเกี่ยวกับโรคทางจักษุในเด็กและผู้ใหญ่
คลินิกพิเศษเฉพาะทางนอกเวลา ศัลยกรรมระบบ ตับ ตับอ่อน ทางเดินน้ำดี และศัลยกรรมทั่วไป โรงพยาบาลอุตรดิตถ์
สอบถามโทร 055-409999 ต่อ 6317
ตารางแพทย์ออกตรวจนอกเวลาราชการ วันศุกร์
ตารางแพทย์ออกตรวจนอกเวลาราชการโรงพยาบาลชลบุรี สอบถามเพิ่มเติม โทร 0-3893-1377 , 0-38931974 ทุกวันราชการ เวลา 8.00-14.00 น.
251 ศูนย์พัฒนาเด็กก่อนวัยเรียนในชุมชนมัสยิดอัตตั๊กวาพัฒนา(คลองสองต้นนุ่น
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
252 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบ้านม้า
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
253 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์มีนบุรี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
254 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนกระทุ่มเสือปลา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
255 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดจำปา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
256 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดช่างเหล็ก-วัดเรไร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
257 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดโพธิ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
258 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดปากน้ำฝั่งเหนือ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
259 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดมะกอก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
260 ศูนย์พัฒนาเด็กก่อนวัยเรียนหลวงพ่อทวีศักดิ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
261 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนข้างสถานีวิทยุเพื่อการศึกษา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
262 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวงแหวนทวีสุข
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
263 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดกก
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
264 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนวัดพุทธบูชา (หมู่ 3 บางมด)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
265 ศูนย์พัฒนาเด็กก่อนเกณฑ์ในวัดทุ่งครุ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
266 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนใต้สะพานโซน 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
267 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์อ่อนนุช
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
268 ศูนย์พัฒนาเด็กเล็กหน่วยบัญชาการป้องกันภัยทางอากาศ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
269 ศูนย์พัฒนาเด็กก่อนวัยเรียนกองพันทหารช่างที่ 1 รักษาพระองค์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
270 ศูนย์สงเคราะห์เด็กทุ่งสองห้อง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
271 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนเกาะจวน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
272 ศูนย์พัฒนาเด็กก่อนเกณฑ์ในวัดบุญศรีมุณีกรณ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
273 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุโขทัยซอย 9
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
274 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดชนะสงคราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
275 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนจักรพรรดิพงษ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
276 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนภักดี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
277 ศูนย์พัฒนาเด็กเล็กชุมชนเสนานิคม2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
278 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนกลางเทวา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
279 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนราชวัลลภ3
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
280 ศูนย์พัฒนาเด็กเล็ก ร.1พัน1ร.อ.(ชุมชนราชวัลลภ2)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
281 ศูนย์พัฒนาเด็กแฟลตลือชา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
282 ศูนย์พัฒนาเด็กก่อนวัยเรียนร่วมใจพิบูลย์ 2
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
283 ศูนย์สงเคราะห์เด็กอิตาเลี่ยน-ไทย
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
284 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหลังสามร้อยห้อง (2)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
285 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนพัฒนาซอย 79
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
286 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดท่าพระ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
287 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่ 5
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
288 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนร่วมใจ 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
289 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์ประชาร่วมใจ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
290 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนบางชันพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
291 ศูนย์สงเคราะห์เด็กเฉลิมพระเกียรติ 72 พรรษา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
292 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์ประเวศ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
293 ศูนย์พัฒนาเด็กเล็กชุมชนมหาดไทย 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
294 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดโกมุทพุทธรังสี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
295 ศูนย์อบรมเด็กก่อนเกณฑ์ในวัดศาลาแดง
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
296 ศูนย์อบรมเด็กก่อนเกณฑ์วชิรราชวิทยายนในวัดพรหมสุวรรณสามัคคี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
297 ศูนย์พัฒนาเด็กก่อนวัยเรียนเฉลิมพระเกียรติฉลองสิริราชสมบัติครบ 60 ปี
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
298 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนกำนันวิจิตร
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
299 ศูนย์พัฒนาเด็กก่อนวัยเรียนสามัคคีชุมชนหมู่ 3
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
300 ศูนย์พัฒนาเด็กก่อนวัยเรียนวัดวงษ์ลาภาราม
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
6. Health Tech ซีคอนบางแค
ศูนย์เทคโนสุขภาพดี คลินิกออนไลน์ (รพ.ราชพิพัฒน์) สาขาซีคอนบางแค บริเวณทางเข้าประตูพระพรหม เปิดให้บริการทุกวัน เวลา 8.00 - 20.00 น. บริการตรวจสุขภาพ รักษาโรค ด้วยทีมแพทย์ผู้เชี่ยวชาญจาก รพ. ราชพิพัฒน์ พร้อมรองรับผู้ใช้บริการ ด้วยเทคโนโลยีที่ทันสมัย บริการตรวจ รักษาโดยแพทย์ทางไกล พร้อมรับยา คัดกรองประเมินความเสี่ยงสุขภาพเบื้องต้น ฟรี เจาะเลือดตรวจแลป ออกใบรับรองแพทย์ 5 โรคและใบรับรองแพทย์สอบใบขับขี่ และ บริการอื่นในอนาคต เช่น ตรวจคลื่นไฟฟ้าหัวใจ และ X-Ray ทรวงอก (เริ่มให้บริการตั้งแต่ 26 มีนาคม 2567)
Health Tech ศูนย์เทคโนสุขภาพดี สาขาซีคอน บางแค ถือเป็นสาขาแรกที่ตั้งที่ศูนย์สรรพสินค้า ซึ่งเป็นความร่วมมือระหว่าง กรุงเทพมหานคร โดยโรงพยาบาลราชพิพัฒน์ สำนักการแพทย์ กับศูนย์สรรพสินค้าซีคอน บางแค สำหรับจุดบริการ Health Tech จะตั้งอยู่บริเวณทางเข้าศูนย์สรรพสินค้าซีคอน บางแค ถนนเพชรเกษม ใกล้ MRT สถานีภาษีเจริญ เปิดให้บริการทุกวัน ตั้งแต่ 08.00 – 20.00 น. ให้บริการตรวจสุขภาพและรักษาโรคด้วยทีมแพทย์ผู้เชี่ยวชาญ ประชาชนสามารถเข้ารับการตรวจได้ง่าย รวดเร็ว มีความแม่นยำ ได้มาตรฐาน และได้รับบริการระดับพรีเมี่ยม
ภายใน Health Tech มีอุปกรณ์นวัตกรรมตรวจสุขภาพ อาทิ เครื่องลงทะเบียนรับบริการตรวจด้วยตนเอง สามารถลงทะเบียนและเช็กสิทธิ เครื่องตรวจสุขภาพอัตโนมัติ ตรวจวัดความดันโลหิต ตรวจวัดอุณหภูมิร่างกาย ออกซิเจนในเลือด เครื่องชั่งน้ำหนักและส่วนสูงที่คำนวนเป็นค่าดัชนีมวลกาย (BMI) และมีการให้บริการเจาะเลือดตรวจ Lab ตรวจคลื่นไฟฟ้าหัวใจ ตรวจเอกซเรย์ทรวงอก ตรวจการตั้งครรภ์ คัดกรองมะเร็งปากมดลูก บริการฉีดวัคซีน ฯลฯ นอกจากนี้ยังมีบริการพบแพทย์ออนไลน์ (Telemedicine) อีกด้วย จากนั้น ผู้ว่าฯ กทม. ได้ตรวจเยี่ยมจุดบริการ “คาราวานตรวจสุขภาพ 1,000,000 คน” ภายในศูนย์สรรพสินค้าฯ ซึ่งให้บริการทุกวันพุธและวันเสาร์ ระหว่างเวลา 10.30 – 20.00 น.
พล.อ.ท. นพ.อิทธพร คณะเจริญ เลขาธิการแพทยสภา กล่าวถึงบทบาท ของแพทยสภา ในการกำกับมาตรฐานการศึกษาแพทย์ให้ได้คุณภาพ ซึ่งเป็นที่ทราบกันดี ว่าแพทยสภา มีส่วนช่วยในการสร้างมาตรฐานการผลิตบัณฑิตแพทย์ ซึ่งมีแพทย์ที่จบ การศึกษาประมาณปีละ 3,000 คน จาก 25 มหาวิทยาลัย ดูแลประชาชนทั่วประเทศ ขณะเดียวกันแพทย์เองจะต้องเรียนรู้ทักษะด้านการรักษาเพิ่มเติมจาก 14 ราชวิทยาลัย 95 สาขาความเชี่ยวชาญ ซึ่งการฝึกฝนและการเรียนรู้ทางการแพทย์นั้นจะหยุดนิ่งไม่ได้ และเสริมว่า
“วันนี้ MedUMORE ตอบโจทย์หลายอย่างมากๆ ให้คุณหมอหลายท่าน ที่กระจายอยู่ทั่วประเทศ ที่ไม่มีเวลาเดินทางมาเข้าประชุมวิชาการ สามารถอัพเดทความรู้ ที่ ทันสมัยอยู่เสมอ ปัจจุบันแพทยสภาได้นำองค์ความรู้หลายชุดใส่เข้าไป และให้แพทย์ เข้ามาทดลองเรียนรู้ ซึ่งเกิดประโยชน์อย่างมาก ตอบโจทย์การรักษาเป็นอย่างมาก แพทย์ สามารถศึกษาหาความรู้ได้จากที่ใดก็ได้ และสามารถนำองค์ความรู้ที่ได้ไปปรับใช้ได้ทันที ให้กับคนไข้ในพื้นที่ต่างๆ โดยเฉพาะพื้นที่ห่างไกลให้ได้รับการรักษาที่มีประสิทธิภาพ เท่าเทียมกับการรักษาในเมืองหลวง”
พอเป็นพี่สอนน้อง ทำให้การเรียนสนุกขึ้นกว่าเดิมเพราะพี่ๆ จะใส่ความเป็นตัวเอง - นางสาวพรสวรรค์ วุฒิ หรือน้องเบลล์
“ความรู้สึกที่หนูจำได้เลยคือพอเป็นพี่สอนน้อง ทำให้การเรียนสนุกขึ้นกว่าเดิมเพราะพี่ๆ จะใส่ความเป็นตัวเอง ทำให้เรากล้าถาม กล้าคิดมากขึ้น ซึ่งหนูว่านี่คือจุดเด่นของค่ายรากแก้ว” นางสาวพรสวรรค์ วุฒิ หรือน้องเบลล์ นักเรียนชั้นมัธยมศึกษาปีที่ 5 จากโรงเรียนระยองวิทยาคม กล่าวเสริม “ตอนได้จับอุปกรณ์หนูตื่นเต้นมาก แล้วพอได้ลงมือทำหลายอย่างด้วยตัวเอง ทำให้รู้ว่าจริงๆ แล้วเราชอบด้านไหน ชอบทำอะไร นอกจากนี้สำหรับกิจกรรมตลาดนัดคณะ พอมีพี่ๆ มาเล่าประสบการณ์จริงให้ฟัง จากเดิมที่หนูอยากเป็นเภสัชกรอยู่แล้ว ยิ่งจุดประกายให้หนูมั่นใจกว่าเดิมว่านี่แหละคือสิ่งที่อยากเป็น ซึ่งจำได้เลยว่าวินาทีนั้นตาเป็นประกายเลยค่ะ” น้องเบลล์กล่าวด้วยน้ำเสียงตื่นเต้น
คุณโลริ แวน แดม (Lori van Dam) ซีอีโอของ Hult Prize Foundation พูดถึงความสำคัญของเป้าหมายการพัฒนาที่ยั่งยืนข้อ 17 ที่ว่าด้วย “Partnerships” หรือ “ความร่วมมือเพื่อการพัฒนาที่ยั่งยืน” และบทบาทของการประชุมสุดยอดในการบ่มเพาะระบบนิเวศระดับโลกสำหรับผู้ประกอบการทางสังคม คุณโลริเน้นย้ำถึงบทบาทในการเตรียมผู้นำรุ่นเยาว์ให้มีทักษะที่จำเป็นและสร้างเครือข่ายตลอดชีวิต “ฉันชื่นชอบ SDG ข้อ 17 มากที่พูดถึงความร่วมมือเพื่อพิชิตเป้าหมายด้านความยั่งยืน ทุกท่านที่เข้าร่วมการประชุมครั้งนี้กำลังสร้างระบบนิเวศที่แข็งแกร่งกว่าเดิมเพื่อสนับสนุนผู้ประกอบการทางสังคมในชุมชนของคุณ การรวมตัวเพื่อเรียนรู้จากกันและกันถือเป็นก้าวสำคัญในการสร้างอนาคตที่เข้มแข็งสำหรับผู้ประกอบการที่เป็นนักศึกษาของเราทุกคน”
รุ่นพี่ อธิบายการดูแลคุณแม่ก่อนคลอด ตัวอย่างกลยุทธ์ทางการตลาดของอุตสาหกรรมยาสูบ จากทั่วโลก
ตัวอย่างกลยุทธ์ทางการตลาดของอุตสาหกรรมจากทั่วโลก
- มูลนิธิ ใน Nigeria ได้ร่วมมือกับ กองบริการเยาวชนแห่งชาติ ซึ่งเป็นรัฐบาลกลาง โครงการเยาวชนสำหรับผู้ประกอบการเกษตรกรรมรุ่นเยาว์ [26]
- บริษัทในจีน ได้สร้างหรือ สนับสนุนโรงเรียนในประเทศจีน [27] และแอฟริกา [28]
- บริษัท ในจาเมกา ให้ทุนการศึกษาเปิดรับนักเรียนเข้าเรียนในหลากหลายสาขา วิทยาลัยและมหาวิทยาลัย [29]
- ในโคลอมเบีย มีการสนับสนุนเทศกาล Estéreo Picnic ปี 2023 ซึ่งเป็นหนึ่งใน เทศกาลดนตรีที่สำคัญที่สุดในอเมริกาใต้ [30]
- บริษัทยาสูบไร้ควันของ อินเดีย พัฒนาและโปรโมตโฆษณาผลิตภัณฑ์ขนม บนเกมมือถือ [31]
- บริษัทบุหรี่ในอินโดนีเซีย จัดแคมเปญที่เน้นดนตรีอิเล็กทรอนิกส์ รวมถึงใน Metaverse [31]
- ในปากีสถาน มีบริษัทร่วมกับวิทยุดิจิทัล Spotify เพื่อโปรโมตผลิตภัณฑ์ บนโซเชียลมีเดีย Spotify Instagram และ Facebook [32]
- ในสวิตเซอร์แลนด์ มีการสนับสนุนการรณรงค์เกี่ยวกับโฆษณายาสูบ [33]
เพื่อรับรู้และรับมือกับ การตลาดผลิตภัณฑ์ยาสูบ ผลิตภัณฑ์นิโคติน (นอกเหนือจากยา) และผลิตภัณฑ์ที่เกี่ยวข้อง รัฐบาลควรใช้คำสั่งห้ามที่ครอบคลุม (หรือ ข้อจำกัด) บน TAPS (tobacco advertising, promotion and sponsorship) มาตรการดังกล่าวควรใช้กับทุกประเภทของผลิตภัณฑ์ยาสูบ ผลิตภัณฑ์นิโคติน (อื่นๆ ที่มิใช่ยา) และผลิตภัณฑ์ที่เกี่ยวข้องและ ที่สำคัญควรถูกนำไปใช้กับสื่อทั้งหมดด้วย
นวัตกรรมทางการพยาบาลเพื่อผู้สูงอายุ
ปิดท้ายด้วยการเสวนากับนวัตกรรมทางการพยาบาลเพื่อผู้สูงอายุ โดย ผศ.ดร.ประภา ยุทธไตร รองคณบดีฝ่ายบริการวิชาการและหลักสูตรการพยาบาลเฉพาะทาง วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ราชวิทยาลัยจุฬาภรณ์ , ร.อ.หญิงชุติมา ทองวชิระ อาจารย์ภาควิชาการพยาบาลผู้ใหญ่และผู้สูงอายุ วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ราชวิทยาลัยจุฬาภรณ์ และ อ.รัชนีภรณ์ ณ ถลาง ผู้ช่วยคณบดีฝ่ายบริการวิชาการ วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ราชวิทยาลัยจุฬาภรณ์
ซึ่งได้บอกเล่าถึงการมุ่งเน้นการสร้างพยาบาลวิชาชีพของวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี ด้วยหลักสูตรการจัดการเรียนการสอนที่มอบประสบการณ์เรียนรู้แบบบูรณาการองค์ความรู้และการปฏิบัติการพยาบาล มุ่งสร้างสรรค์ผลงานวิจัยและนวัตกรรมเพื่อส่งเสริมศักยภาพของผู้เรียน พร้อมทั้งได้นำนวัตกรรมแอปพลิเคชันประเมินภาวะสุขภาพผู้สูงอายุ LLL Senior Care By CRA หนึ่งในการสร้างสรรค์ผลงานนวัตกรรมทางการพยาบาลเพื่อผู้สูงอายุจากนักศึกษาพยาบาล
ทั้งนี้ โครงการพยาบาลศาสตร์อาสาเจ้าฟ้าจุฬาภรณ์ เรื่องการเสริมสร้างสุขภาพและการดูแลตนเองของผู้สูงอายุในชุมชน เฉลิมพระเกียรติ ฯ นอกจากจะช่วยส่งเสริมสุขภาพและคุณภาพชีวิตให้กับผู้สูงอายุในชุมชนเมือง โดยสนับสนุนให้ผู้สูงอายุมีความรู้ ความเข้าใจ และเตรียมพร้อมในการดูแลตนเอง ปรับตัวต่อการเปลี่ยนแปลงทั้งทางด้านร่างกาย สมอง อารมณ์ และสังคมได้ดียิ่งขึ้น สร้างเครือข่ายชุมชนผู้สูงอายุที่เข้มแข็งและมีสุขภาวะที่ดีอย่างยั่งยืนแล้วโครงการดังกล่าวยังช่วยส่งเสริมให้นักศึกษาพยาบาลได้มีโอกาสปฏิบัติกิจกรรมเสริมหลักสูตรเพื่อพัฒนาทักษะที่จำเป็นในศตวรรษที่ ๒๑ ตามอัตลักษณ์ของนักศึกษาวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี คือ รอบรู้ พัฒนา จิตอาสา นำพาความสุข และสืบสานพระราชปณิธานของพระองค์ในการบำบัดทุกข์และบำรุงสุขให้แก่ประชาชนและพัฒนาประเทศชาติสืบไป
การป้องกันโรคไข้หวัดนกทำได้อย่างไร
วิธีการป้องกันการติดเชื้อไข้หวัดนกที่ดีที่สุด คือ การหลีกเลี่ยงการสัมผัส สัตว์ปึกและสารคัดหลั่งที่ มาจากสัตว์ปีกโดยตรง หากมีการสัมผัส ควรใช้สบู่ล้างมือให้สะอาด ส่วนผู้ที่ต้องทำงานกับสัตว์ปีกควรสวมอุปกรณ์ ป้องกันการติดเชื้ออย่างเหมาะสม เช่น หน้ากากปิดจมูก ถุงมือ แว่นตา รวมทั้ง ล้างมือด้วยสบู่ให้สะอาดภายหลังสัมผัสสัตว์ปีกหรือเสร็จจากการทำงาน
- การปรุงอาหาร ควรแยกอุปกรณ์ทำอาหารดิบและอาหารสุก
- กินอาหารปรุงสุกใหม่ๆ กินร้อน ช้อนกลาง
- ล้างมือบ่อยๆ ก่อนรับประทานอาหาร หลังจากเข้าห้องน้ำ หลังจาก สัมผัสพื้นผิว และอุปกรณ์ของใช้ร่วมกับผู้อื่น
- รักษาสุขภาพร่างกายให้แข็งแรงด้วยการออกกำลังกาย พักผ่อน ให้เพียงพอ หลีกเลี่ยงการดื่มสุราและการสูบบุหรี่
ปัจจุบันยังไม่มีวัคซีนป้องกันโรคไข้หวัดนก แต่แนะนำให้ฉีดวัคซีน ป้องกันไข้หวัดใหญ่
6. ข้อเข่าเทียมสุนัขสำหรับรักษากระดูกสะบ้าเคลื่อนหลุด: นวัตกรรมเพื่อสัตว์เลี้ยง
เพราะทุกชีวิตมีค่า ข้อเข่าเทียมสุนัข นวัตกรรมจาก รศ.ดร.ณัฐพล จันทร์พาณิชย์ และ ผศ.น.สพ.ดร.ชัยกร ฐิติญาณพร คณะวิศวกรรมศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ที่ช่วยให้เพื่อนสี่ขาของเรากลับมาวิ่งเล่นได้อีกครั้ง
ศูนย์สนับสนุนบริการสุขภาพที่ 6 ชลบุรี
ศูนย์สนับสนุนบริการสุขภาพที่ 6 (Regional Health Service Support Center 6) มีพื้นที่รับผิดชอบ จำนวน 8 จังหวัด ได้แก่ สระแก้ว ปราจีนบุรี ฉะเชิงเทรา สมุทรปราการ ชลบุรี จันทบุรี ระยอง ตราด
- 76 หมู่ 5 ถนนอ่างศิลา-บางแสน ตำบลอ่างศิลา อำเภอเมืองชลบุรี จังหวัดชลบุรี 20000
- โทร 038-397233 โทรสาร 038-397233
- email : saraban-hss6@hss.mail.go.th
- Google map
- Facebook
- Website
6. เทคโนโลยีคุ้มครองความเป็นส่วนตัวของข้อมูล (Privacy-Enhancing Technologies, PETs)
การเก็บข้อมูลในคลาวด์และการใช้อินเทอร์เน็ตของสรรพสิ่ง (Internet of Things: IoT) มีบทบาทมากขึ้น และจะยิ่งสำคัญมากขึ้นไปอีก เพราะจะเป็นหัวใจของระบบอุตสาหกรรม 4.0 แต่การรั่วไหลของข้อมูลสำคัญที่อาจเกิดขึ้นได้ตลอดเวลา ก็อาจก่อความเสียหายได้มาก ดังกรณีตัวอย่าง พนักงานบริษัทซัมซุงนำ source code ของบริษัทไปให้ ChatGPT รีวิวจนข้อมูลรั่วไหล หรือกรณีบริษัท MediSecure ที่ให้บริการจ่ายยาแบบอิเล็กทรอนิกส์ในประเทศออสเตรเลียที่โดน ransomware โจมตี ทำให้ข้อมูลผู้ป่วยจำนวนมากรั่วไหล หรือบริษัทผู้ให้บริการ Cloud AI ชื่อ สโนว์เฟลก (Snowflake) ทำข้อมูลลูกค้ารั่วไหลจนทำให้หุ้นของบริษัทตกลงไป 26% ในรอบ 12 เดือน
ยังมีกรณีความมั่นคงระดับสูงที่ทหารสหรัฐอเมริกาได้ใส่สมาร์ตวอตช์วิ่งออกกำลังกายรอบค่ายทหารจนทำให้มีตำแหน่งค่ายทหารของสหรัฐอเมริกาในประเทศซีเรียและอิรักหลุดรอดออกไปผ่านทางคลาวด์ที่บริษัทผู้ผลิตสมาร์ตวอตช์ใช้บริการอยู่ จนกลายเป็นปัญหาใหญ่อย่างคาดไม่ถึง
ท้ายสุด นวัตกรรมเทคโนโลยีและวิทยาศาสตร์ทางการแพทย์มีความสำคัญอย่างยิ่งต่อการรักษาผู้ป่วยในอนาคตด้วยหลายประการ ตั้งแต่ การวินิจฉัยโรคที่แม่นยำและรวดเร็วขึ้น ตัวอย่างเช่น การนำ AI มาร่วมวินิจฉัยการวิเคราะห์ภาพทางการแพทย์ช่วยให้แพทย์สามารถตรวจพบโรคได้ในระยะเริ่มแรก ทำให้การรักษามีประสิทธิภาพมากขึ้น, การรักษาที่มีประสิทธิภาพและปลอดภัยมากขึ้นด้วยการยกระดับพัฒนาเทคนิคการรักษาใหม่ ๆ ช่วยให้การรักษาโรคมีประสิทธิภาพมากขึ้นและมีผลข้างเคียงน้อยลง
นอกจากนี้ การใช้เทคโนโลยีหุ่นยนต์ในการผ่าตัดยังช่วยลดความเสี่ยงและความผิดพลาดในการผ่าตัด, การดูแลผู้ป่วยที่เป็นส่วนตัวและเฉพาะบุคคล วิทยาการด้านพันธุศาสตร์และการแพทย์แม่นยำ (Precision Medicine) ช่วยให้สามารถปรับการรักษาให้เหมาะสมกับผู้ป่วยแต่ละรายตามลักษณะพันธุกรรมและปัจจัยอื่นๆ ทำให้การรักษามีประสิทธิภาพมากขึ้น, การเข้าถึงการรักษาในพื้นที่ห่างไกล: เทคโนโลยีทางการแพทย์ เช่น Telemedicine ช่วยให้ผู้ป่วยในพื้นที่ห่างไกลสามารถเข้าถึงการรักษาและคำปรึกษาจากแพทย์ผู้เชี่ยวชาญได้โดยไม่ต้องเดินทางมายังโรงพยาบาล และ การติดตามดูแลผู้ป่วยระยะยาว การใช้เทคโนโลยี Internet of Things (IoT) ในการติดตามสุขภาพของผู้ป่วยอย่างต่อเนื่องช่วยให้แพทย์สามารถติดตามอาการและปรับการรักษาได้ทันทีตามความจำเป็น
น่ายินดีที่ว่า ทุกวันนี้ นวัตกรรมเทคโนโลยีและวิทยาศาสตร์ทางการแพทย์ ที่มีความสำคัญอย่างยิ่งต่อการพัฒนาการรักษาและการดูแลสุขภาพของผู้ป่วยในอนาคต ซึ่งไม่เพียงแต่ช่วยในการรักษาโรคแต่ยังมีส่วนสำคัญในการป้องกันและส่งเสริมสุขภาพของประชากร ไม่ได้ถูกจำกัดหรือลิดรอนด้วย “ทุนทรัพย์” และ “การเข้าถึงของประชาชนในพื้นที่ห่างไกล” อีกต่อไป
สุขภาพดีถ้วนหน้า ขอพระองค์ทรงพระเจริญฯ
6.CLEAN WATER AND SANITATION น้ำสะอาดและสุขอนามัย
ภาวะขาดแคลนน้ำส่งผลกระทบต่อประชากรมากกว่า 40 เปอร์เซ็นต์ ซึ่งเป็นตัวเลขที่น่าตกใจและคาดว่าจะเพิ่มขึ้นตามอุณหภูมิ แม้ว่าประชากร 2,100 ล้านคนได้ปรับปรุงสุขอนามัยของน้ำตั้งแต่ปี 1990 แต่แหล่งน้ำดื่มที่ลดน้อยลงส่งผลกระทบต่อทุกทวีป
ประเทศต่างๆ จำนวนมากขึ้นเรื่อยๆ ประสบปัญหาขาดแคลนน้ำ และภัยแล้งและการกลายเป็นทะเลทรายที่เพิ่มมากขึ้นทำให้แนวโน้มเหล่านี้เลวร้ายลงแล้ว คาดว่าภายในปี 2050 ผู้คนอย่างน้อย 1 ใน 4 คนจะประสบปัญหาขาดแคลนน้ำซ้ำแล้วซ้ำเล่า
ภายในปี 2030 น้ำดื่มที่ปลอดภัยและราคาไม่แพงสำหรับทุกคนต้องลงทุนในโครงสร้างพื้นฐานที่เหมาะสม จัดหาสิ่งอำนวยความสะดวกด้านสุขอนามัย และส่งเสริมสุขอนามัย การปกป้องและฟื้นฟูระบบนิเวศที่เกี่ยวข้องกับน้ำเป็นสิ่งสำคัญ
การรับรองน้ำดื่มที่ปลอดภัยและราคาไม่แพงสำหรับทุกคนเกี่ยวข้องกับการเข้าถึงผู้คนกว่า 800 ล้านคนที่ขาดบริการพื้นฐาน และการปรับปรุงการเข้าถึงและความปลอดภัยของบริการสำหรับผู้คนกว่า 2 พันล้านคน
ในปี 2558 ประชากร 4,500 ล้านคนขาดการจัดการด้านสุขอนามัยที่ปลอดภัย (โดยมีของเสียที่ถูกกำจัดหรือบำบัดอย่างเหมาะสม) และประชากร 2,300 ล้านคนขาดแม้แต่สุขอนามัยขั้นพื้นฐาน
6.Advanced connectivity - การเชื่อมต่อขั้นสูง
การเชื่อมต่อขั้นสูงครอบคลุมถึงเครือข่ายไร้สายพลังงานต่ำ เซลลูล่าร์ 5G และ 6G, Wi-Fi 6 และ 7, ดาวเทียมวงโคจรต่ำของโลก และเทคโนโลยีโทรคมนาคมอื่นๆ
นอกจากนี้ การตรวจยีนของคู่สมรสที่วางแผนการตั้งครรภ์ จะช่วยคัดกรองและป้องกันความเสี่ยงของการเกิดโรคที่ถ่ายทอดทางพันธุกรรม ที่อาจส่งผลกระทบต่อบุตรได้ โดยโรงพยาบาลบำรุงราษฎร์มีการตรวจยีนแฝงที่สามารถช่วยเรื่องการวางแผนการมีบุตร ไม่ว่าจะเป็นการตรวจหาความผิดปกติของยีนคู่สมรสที่สามารถส่งต่อโรคไปยังบุตร การตรวจหาความผิดปกติของยีนก่อเกิดโรคในทารก การตรวจหาโรคทางพันธุกรรมในทารกที่ยังอยู่ในครรภ์มารดา รวมถึงการตรวจหาความผิดปกติของยีนในตัวอ่อนก่อนฝังเข้าสู่โพรงมดลูก ในกรณีที่ผสมตัวอ่อนด้วยเทคโนโลยีช่วยการเจริญพันธุ์ เช่น การทำเด็กหลอดแก้ว
11.การเชื่อมต่อ เช่นการใช้งานด้าน
เชื่อมกับ สปสชในการทำเบิกจ่ายด้วย API ลดขั้นตอนในการคีย์ข้อมูลซ้ำ เมื่อทำการ Authen ทำการตรวจ วินิจฉัย สั่งยา คิดค่ารักษา จากนั้นทำการคลิก submit เพื่อทำการเบิก หรือส่งเป็นชุดจากระบบได้ทันที
คลินิกวัยทอง ทุกวันอังคาร 8.00 น. - 12.00 น.
คลินิกวัยทอง
วัน-เวลาทำการ ทุกวันอังคาร 8.00 น. - 12.00 น.
เบอร์ติดต่อ : 02 2943305 ต่อ 11
กลุ่มเป้าหมาย ผู้หญิงอายุ 40-59 ปี
ขอบเขตการให้บริการ
1. ตรวจสุขภาพทั่วไป
2. ตรวจสมรรถภาพร่างกาย
3. ตรวจมวลสารในร่างกาย (Body Composition)
4. ตรวจเช็คสุขภาพ โดยเสียค่าใช้จ่ายตามสมควร ได้แก่ เจาะเลือด เอกซเรย์ ตรวจคลื่นหัวใจ
5. ตรวจสุขภาพในช่องปากโดยทันตแพทย์
6. ให้คำปรึกษาด้านสุขภาพ
สาธิตวิธีการเย็บแผลด้วยแขนกล
นพ.ธเนศ ได้
สาธิตวิธีการเย็บแผลด้วยแขนกลขนาดจิ๋ว 3 แขน การควบคุมแขนและปลายแขน 7 ทิศทาง เสมือนมือคนจริงๆ ลักษณะปลายแขนเป็นคีมเล็กๆ บางๆ ทั้ง 3 แขนทำงานสอดประสานอย่างคล่องแคล่ว การพลิกแขนกลับไปมาตามสั่งอย่างเป็นธรรมชาติ แม้เป็นงานที่ละเอียดอ่อนที่ต้องควบคุมเข็มด้าย การวางน้ำหนักการเย็บ ให้เสมือนหนึ่งเป็นประสาทสัมผัสโดยมือแพทย์ นั่นคือการสอดประสานความชำนาญและประสบการณ์ของศัลยแพทย์เข้ากับเทคโนโลยีที่ละเอียดอ่อนได้อย่างลงตัว และผลสำเร็จคือการรักษาคนไข้ในอวัยวะที่อ่อนไหวให้หายได้มาแล้วกว่า
600 ราย
มทร.ล้านนา เปิดศูนย์ช่วยเหลือผู้ประสบภัยน้ำท่วมในจังหวัดเชียงรายและน่านและเปิดรับบริจาคสิ่งของ ข้าวสารอาหารแห้ง น้ำดื่ม ยารักษาโรค หรือร่วมบริจาคเงินได้ที่ ธนาคารกรุงไทย เลขที่บัญชี 507-1-87015-0 ชื่อบัญชี มทร.ล้านนา น่าน (เงินทำบุญราชมงคลน่าน) และมทร.ล้านนา เชียงราย สามารถสแกน QR Code ด้านล่างนี้
• ศูนย์ช่วยเหลือผู้ประสบภัยน้ำท่วม มทร.ล้านนา น่าน โทร 083-7643085และ 081-8312803
• ศูนย์ช่วยเหลือผู้ประสบภัยน้ำท่วม มทร.ล้านนา เชียงราย โทร 082-780-1043
คลินิกกัญชาทางการแพทย์ โรงพยาบาลสิรินธร กรุงเทพมหานคร
ศูนย์บริการสาธารณสุข 16 ลุมพินี วันที่ 2-6 กันยายน 2567
ศูนย์บริการสาธารณสุข 16 ลุมพินี ร่วมกับฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตปทุมวัน จัดกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 2 - 6 กันยายน 2567 ตั้งแต่เวลา 09.00 - 11.00 น. สถานที่ตั้งหน่วยบริการตามประกาศที่แนบมาด้านล่าง จึงขอประชาสัมพันธ์เชิญชวนประชาชนนำสัตว์เลี้ยงลูกด้วยน้ำนมอายุ 3 เดือนขึ้นไป มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนเคลื่อนที่ใกล้บ้าน โดยไม่เสียค่าใช้จ่าย
2 กันยายน 2567 ชุมชนพระเจน
3 กันยายน 2567 ชุมชนโปโล ชุมชนร่วมฤดี
4 กันยายน 2567 ชุมชนหลังปทุมวนาราม
5 กันยายน 2567 ชุมชนพัฒนาบ่อนไก่
6 กันยายน 2567 ชุมชนเคหะบ่อนไก่ ชุมชนกุหลาบแดง
6. การจัดการกับผลกระทบด้านสิ่งแวดล้อมจากการจัดเทศกาล
การจัดงานเทศกาลมักมีผู้เข้าร่วม จำนวนมากและจำเป็นต้องใช้ทรัพยากรค่อนข้างมาก จึงหลีกเลี่ยงการสร้างผลกระทบต่อสิ่งแวดล้อมได้ยาก ซึ่งเทศกาลดนตรีและศิลปะระดับโลก Coachella ที่จัดขึ้นในสหรัฐอเมริกา ได้มีความพยายามในการส่งเสริมให้ผู้เข้าร่วมงานลดปริมาณขยะ เนื่องจากในแต่ละปีมีขยะเกิดขึ้นในปริมาณมาก ซึ่งปี 2564 มีขยะมากถึง 1,600 ตัน ขณะที่มีขยะที่สามารถนำมารีไซเคิลได้เพียงร้อยละ 20 เท่านั้น โดยผู้จัดงานได้มีมาตรการสนับสนุนการรีไซเคิลขวดน้ำ โดยให้ผู้เข้าร่วมสามารถนำขวดน้ำพลาสติกเปล่ามาแลกขวดน้ำ รวมถึงมีสิทธิ์แลกรับบัตรชิงช้าสวรรค์ เสื้อยืด โปสเตอร์ และของที่ระลึกอื่น ๆ
นอกจากนี้ ในบางเทศกาลดนตรี ยังมีการปรับตัวโดยจัดงานให้เป็นมิตรกับสิ่งแวดล้อม อาทิ งานคอนเสิร์ต Music Of The Spheres World Tour ของวง Coldplay ได้ร่วมมือกับ บริษัทบีเอ็มดับเบิลยู (BMW) พัฒนาแบตเตอรี่แบบชาร์จไฟได้เพื่อใช้จัดแสดง รวมถึงติดตั้งแผงโซลาร์เซลล์ พื้นพลังงานจลน์ (kinetic floors) และโซนปั่นจักรยาน เพื่อกักเก็บพลังงานจากการเคลื่อนไหวของผู้ชมไว้แปลงเป็นพลังงานไฟฟ้าเพื่อ ใช้ในการจัดงานครั้งต่อไป อีกทั้งยังมีการผลิตสายรัดข้อมือเรืองแสง แบบใช้ซ้ า โดยทำจากวัสดุที่สามารถย่อยสลายได้ ซึ่งจะมีส่วนช่วยลดก๊าซเรือนกระจกได้มาก
โดย Tyndall Center for Climate Change Research ปี 2564 พบว่า การจัดคอนเสิร์ตในสหราชอาณาจักร ในระยะเวลา 1 ปี จะสร้างก๊าซเรือนกระจกประมาณ 405,000 ตัน จากข้อค้นพบที่ได้จากศึกษาการจัดงานเทศกาลจากต่างประเทศที่ประสบความสำเร็จข้างต้น ถือเป็นแนวทางที่เป็นประโยชน์สำหรับประเทศไทยในการนำมาปรับใช้ให้เหมาะสมกับบริบทของประเทศ ซึ่งอาจช่วยแก้ปัญหา ลดข้อจำกัด ตลอดจนการปรับปรุงแนวทางการขับเคลื่อน Festival Economy ของไทยที่มีเป้าหมาย เพื่อให้ไทยเป็นจุดหมายที่โดดเด่นในการจัดงานเทศกาลระดับโลกในระยะถัดไป ดังนั้น จำเป็นต้องเร่งสร้างระบบนิเวศ (Ecosystem) ที่เอื้อต่อการผลักดันการจัดงานเทศกาล โดยให้ความสำคัญตั้งแต่การยกระดับศักยภาพโครงสร้างพื้นฐานและสิ่งอำนวยความสะดวกในมิติต่างๆ การบูรณาการเชื่อมโยงการทำงานของหน่วยงานภาครัฐ ภาคเอกชน และภาคประชาชนให้เป็นไปในทิศทางเดียวกัน ตลอดจนการพัฒนาการจัดงานให้สอดรับกับเป้าหมายการท่องเที่ยวอย่างยั่งยืน เพื่อให้การจัดงานเทศกาลของไทยเป็นที่ยอมรับในระดับสากล และได้รับความเชื่อมั่นจากนักท่องเที่ยวทั้งในและต่างประเทศ
อ่านเพิ่มเติม 4 ประเด็นสำคัญ ที่รายงานรอบนี้นำเสนอ
คลินิกพิเศษเฉพาะทางจิตเวชและสุขภาพจิต นอกเวลาราชการ โรงพยาบาลนางรอง
3 สิ่งต้องรู้และปฏิบัติในวันผ่าตัดเลสิก
โครงการพัฒนาสุขภาพเด็กและประชาชนในพื้นที่ศูนย์ภูฟ้าพัฒนา
สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี เสด็จพระราชดำเนินเยี่ยมราษฎร และทอดพระเนตรบ่อเกลือสินเธาว์ บ้านบ่อหลวง อำเภอบ่อเกลือ จังหวัดน่าน ตั้งแต่ปี 2538 ทรงพบเห็นสภาพความเป็นอยู่ที่มีความด้อยโอกาสทั้งทางเศรษฐกิจและสังคม จึงมีพระราชดำริให้ดำเนินการช่วยเหลือพัฒนาในพื้นที่อำเภอบ่อเกลือ โดยเริ่มพัฒนาที่โรงเรียนประถมศึกษาก่อนเป็นอันดับแรก แล้วขยายไปยังศูนย์การเรียนชุมชนชาวไทยภูเขา "แม่ฟ้าหลวง" และทรงขยายงานพัฒนาด้านอื่น ๆ เพื่อช่วยเหลือครอบครัวของเด็ก โครงการพัฒนาต่างในพื้นที่จึงเรียกรวมกันว่า "โครงการภูฟ้าพัฒนาตามพระราชดำริสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี" ต่อมาพระองค์ท่านทรงเสด็จพระราชดำเนินเยี่ยมราษฎรในพื้นที่ภูฟ้าเป็นประจำอย่างต่อเนื่อง ทุก 3-4 ปี ต่อมาทุกปี และต่อมาปี 2560 ได้พระราชทานพระราชดำริ ให้สำนักงานคณะกรรมการพิเศษเพื่อประสานงานโครงการอันเนื่องมาจากพระราชดำริ (สำนักงาน กปร. ทบทวนผลการดำเนินงานของศูนย์ภูฟ้าพัฒนา ร่วมกับหน่วยงานที่เกี่ยวข้องจัดทำแผนดำเนินงานโครงการศูนย์ภูฟ้าพัฒนา อันเนื่องมาจากพระราชดำริ ในสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯสยามบรมราชกุมารี โดยมีภารกิจสำคัญด้านการเกษตร ด้านทรัพยากรธรรมชาติและสิ่งแวดล้อม รวมถึงการพัฒนาคุณภาพชีวิตของประชาชนในพื้นที่ภูฟ้าครอบคลุมถึงงานด้านสุขภาพอนามัยของประชาชนและการสาธารณสุขในพื้นที่เป้าหมาย ดังนั้น สำนักงาน กปร. จึงมีคำสั่งแต่งตั้งคณะกรรมการและคณะอนุกรรมการโครงการศูนย์ภูฟ้าพัฒนาอันเนื่องมาจากพระราชดำริ ในสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี
กรมอนามัย ในฐานะหน่วยงานที่ได้รับมอบหมาย ร่วมกับหน่วยงานสาธารณสุขในพื้นที่เป้าหมาย และภาคีเครือข่ายที่เกี่ยวข้อง มีความจำเป็นต้องดำเนินการแก้ไขปัญหาด้านสุขภาพอย่างต่อเนื่อง และสร้างความรอบรู้ด้านสุขอนามัยให้กับประชาชนในพื้นที่ภูฟ้าพัฒนา ได้แก่ การแก้ไขปัญหาเด็กขาดสารอาหารในเด็กและนักเรียน การแก้ไขปัญหาภาวะพร่องไอโอดีน การแก้ไขปัญหา โรคหนอนพยาธิในนักเรียนและประชาชน รวมถึงปัญหาสุขภาพที่ต้องได้รับการดูแลและแก้ไขอย่างจริงจัง ได้แก่ ปัญหาโรคเรื้อรังในกลุ่มประชาชน การดื่มเครื่องดื่มแอลกอฮอล์และการสูบบุหรี่ การส่งเสริมทันตสุขภาพในเด็กและนักเรียน การส่งเสริมพัฒนาการเด็ก งานอนามัยแม่และเด็ก งานอนามัยสิ่งแวดล้อมและการคุ้มครองผู้บริโภค และพัฒนาการควบคุมป้องกันโรคที่สำคัญ อาทิ โรคอาหารเป็นพิษ โรคไข้เลือดออก โรคพิษสุนัขบ้า เป็นต้น เพื่อให้เด็กในพื้นที่ฟ้าพัฒนาได้รับการพัฒนาพัฒนาองค์ความรู้และทักษะสุขภาพที่พึงประสงค์ ให้สามารถปรับตัวได้เท่าทันกับสถานการณ์ภัยคุมคามสุขภาพในปัจจุบัน บนพื้นฐาน ที่เหมาะสมกับบริบทของพื้นที่รวมทั้งสามารถปฏิบัติ/นำไปใช้ และบอกต่อการดูแลสุขภาพอนามัยของตนเอง ครอบครัวและชุมชนได้ตระหนักถึงความสำคัญอย่างยิ่งยวดในการพัฒนาพื้นที่เป้าหมายตามพระราชดำริ ฯ
กลุ่มเป้าหมาย
1. เด็กอายุ 0-5 ปี (เด็กที่อยู่ในครรภ์มารดา เด็กแรกเกิดถึง 3 ปี เด็กปฐมวัย) ในพื้นที่ศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน
2. เด็กนักเรียนประถมศึกษา ในพื้นที่ศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน
3. เด็กนักเรียนมัธยมศึกษา ในพื้นที่ศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน
4. ประชาชน ในพื้นที่ศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน
5. ภาคีเครือข่ายที่เกี่ยวข้องในพื้นที่ศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน
พื้นที่เป้าหมายศูนย์ภูฟ้าพัฒนา อำเภอบ่อเกลือ และอำเภอเฉลิมพระเกียรติ จังหวัดน่าน พื้นที่ดำเนินโครงการภูฟ้าพัฒนา
1.) พื้นที่ทรงงาน 1,800 ไร่ ส่วนที่ 1 600 ไร่ ส่วนที่ 2 1,200 ไร่
2.) พื้นที่ขยายผล อ.บ่อเกลือ อ.เฉลิมพระเกียรติ จ.น่าน
(2.1) แปลงเกษตรกรต้นแบบ 22 ราย ในพื้นที่ 6 หมู่บ้าน : บ้านนากอก ห่างทางหลวง ผาสุก สบมาง ห้วยล้อม ลอยห้วย ต.ภูฟ้า อ.บ่อเกลือ
(2.2) พื้นที่ที่มีพระราชดำริให้ดำเนินการ 2 หมู่บ้าน : บ้านสบปืน ต.ห้วยโก๋น บ้านห้วยกานต์ ต.ขุนน่าน อ.เฉลิมพระเกียรติ
ประชากรเป้าหมายของโครงการ
อำเภอบ่อเกลือ มี 4 ตำบล 39 หมู่บ้าน ต.บ่อเกลือเหนือ มี 11 หมู่บ้าน ต.บ่อเกลือใต้ มี 15 หมู่บ้าน ต.ดงพญา มี 7 หมู่บ้าน ต.ภูฟ้า มี 6 หมู่บ้าน จำนวนโรงเรียน 15 แห่ง สังกัดสพป. 14 แห่ง สพม. 1 แห่ง และจำนวนศูนย์เด็กเล็ก 20 แห่ง
อำเภอเฉลิมพระเกียรติ มี 2 ตำบล 22 หมู่บ้าน ต.ห้วยโก๋น มี 7 หมู่บ้าน ต.ขุนน่าน มี 15 หมู่บ้าน จำนวนโรงเรียน 13 แห่ง สังกัดสพป. 12 แห่ง สพม. 1 แห่ง และจำนวนศูนย์เด็กเล็ก 3 แห่ง
มูลนิธิฟูจิฟิล์ม บิสซิเนส อินโนเวชั่น (ประเทศไทย) จะยังคงมุ่งมั่นริเริ่มโครงการเพื่อสาธารณะประโยชน์และสนับสนุนองค์กรการกุศลอีกมากมายเพื่อร่วมยกระดับสังคมอย่างเต็มกำลัง ภายใต้เป้าหมายระยะยาวของฟูจิฟิล์มในการสนับสนุนให้คนไทยมีคุณภาพชีวิตที่ดีขึ้น ตามจุดมุ่งหมายใหม่ของกลุ่มบริษัทฟูจิฟิล์มในการ “แต่งแต้มรอยยิ้มให้โลกของเรา”
การสร้างความตระหนักรู้เกี่ยวกับโรค SMA ไม่เพียงแต่จะช่วยให้ผู้ป่วยได้รับการดูแลที่ดีขึ้น แต่ยังเป็นก้าวสำคัญในการลดจำนวนผู้ป่วยรายใหม่ในอนาคตและเพิ่มคุณภาพชีวิตให้กับตัวเองและครอบครัว ผ่านการตรวจคัดกรองพาหะ SMA ก่อนตั้งครรภ์สำหรับผู้วางแผนมีบุตร เพื่อหลีกเลี่ยงความเสี่ยงโรค SMA รวมถึงการให้ทารกแรกเกิดได้รับการตรวจคัดกรองโรคภายใน 48-72 ชั่วโมงหลังคลอด เพื่อรับการรักษาอย่างเหมาะสมและทันท่วงที น้องฟางและครอบครัวผู้ป่วย SMA ยังคงร่วมมือกันอย่างเหนียวแน่นเพื่อเปล่งเสียงผลักดันให้เกิดความตระหนักรู้ โดยมีความฝันถึงการจัดการโรค SMA ที่ครบวงจร ครอบครัวผู้ป่วยกำลังขับเคลื่อนความฝันนี้ด้วยความตั้งใจและรอคอยอย่างมีหวังที่จะได้เห็นสังคมเข้าใจในโรค SMA มากขึ้น เพื่อให้ผู้ป่วยได้มีระบบสนับสนุนที่ดี ได้รับการดูแลอย่างเท่าเทียมเพื่อให้มีกำลังรับมือกับสิ่งที่เผชิญ ไปพร้อมกันกับสร้างอนาคตที่เด็กๆ ไม่ต้องเผชิญกับข้อจำกัดทางร่างกายจากโรค SMA อีก
ตัวแทนผู้ป่วยวอนภาครัฐ วัคซีนเข็มกระตุ้นต้องมี
นายธนพลธ์ ดอกแก้ว จากเครือข่ายพลเมืองขับเคลื่อนสิทธิด้านสุขภาพกลุ่มผู้ป่วย Healthy Forum และสมาคมโรค เพื่อนไตแห่งประเทศไทย หนึ่งในผู้ร่วมเวทีเสวนาครั้งนี้เน้นย้ำว่า ภาครัฐควรให้ความสำคัญกับการสร้างเสริมสุขภาพและป้องกัน โควิด-19 ด้วยวัคซีนเข็มกระตุ้น โดยเฉพาะกับกลุ่มผู้ป่วยโรคเรื้อรังและประชาชนกลุ่มเสี่ยง
“กลุ่มผู้ป่วยส่วนใหญ่มีการระมัดระวังตัวมาโดยตลอดตั้งแต่การระบาดของโควิด-19 เป็นการป้องกันตนเองตามที่ได้รับ คำแนะนำจากแพทย์และผู้เชี่ยวชาญซึ่งเป็นสิ่งที่เราสามารถทำเองได้ แต่การปกป้องตัวเองด้วยวัคซีนนั้น อยู่นอกเหนือจาก ความสามารถของเรา จึงอยากเรียกร้องไปถึงผู้มีหน้าที่เกี่ยวข้องให้ช่วยพิจารณาและจัดหาวัคซีนให้เพียงพอสำหรับประชาชน ถึงแม้ว่าวัคซีนอาจไม่จำเป็นสำหรับประชาชนส่วนหนึ่งแล้ว แต่ยังคงมีความจำเป็นสำหรับกลุ่มผู้ป่วยโรคเรื้อรังและประชาชน กลุ่มเสี่ยงอยู่” นายธนพลธ์กล่าว
นอกจากนี้ นายธนพลธ์ยังแสดงความกังวลว่าตัวเลขจำนวนผู้ติดเชื้อในปัจจุบัน ไม่มีข้อมูลที่แท้จริงเนื่องจากขาดการ ติดตามและรายงานอย่างเป็นระบบต่างจากเมื่อเกิดการระบาดใหม่ๆ “การไม่มีตัวเลขที่เก็บอย่างเป็นระบบระเบียบ เพิ่มความ เสี่ยงต่อผู้ป่วยกลุ่มเปราะบางเพราะเมื่อสาธารณชนไม่ทราบจำนวนผู้ติดเชื้อว่าเพิ่มขึ้นเพียงใด ทำให้ขาดการป้องกันตัวที่ดี ทำให้ โรคยิ่งแพร่กระจายได้ง่ายและเร็วยิ่งขึ้น ขณะนี้มีเพียงเพจเดียว คือ ‘ไทยรู้สู้โควิด’ ที่ยังคงให้ความสนใจและติดตามรวมทั้ง นำเสนอข้อมูลที่เป็นประโยชน์ รวมทั้งตัวเลขจำนวนผู้ป่วย ผู้เสียชีวิต ผู้ป่วยสะสม แม้ว่าตัวเลขอาจจะไม่สมบูรณ์ แต่พอจะเป็น แนวทางให้ผู้ป่วยกลุ่มเปราะบางรวมทั้งคนในสังคมพอจะมองเห็นภาพของโควิด-19 ในบ้านเราได้ จึงอยากขอให้ติดตามเพจนี้ไว้ ด้วย”
แม้ในวันนี้ เราอาจจะลืมเลือนโควิด-19 กันไปแล้ว แต่โควิด-19 ยังคงไม่ลืมและจะอยู่กับเราตลอดไป ซึ่งในประเทศไทย นั้น จากข้อมูลในปีที่ผ่านมา พบว่ามีการระบาดใหญ่สองช่วง คือ เทศกาลสงกรานต์และช่วงปลายปีที่มีการรวมตัวของคนจำนวน มากตามสถานที่ต่าง ๆ รวมทั้งการเดินทางที่เพิ่มขึ้น ทำให้คาดการณ์ได้ว่าช่วงปลายปีนี้จนถึงต้นปีหน้า จะพบผู้ป่วยเพิ่มสูงขึ้น จึงเป็นเรื่องน่ากังวลสำหรับผู้ป่วยกลุ่มเปราะบางว่าจะได้รับผลกระทบจากการระบาดครั้งนี้ซึ่งจะทำให้อาการผู้ป่วยรุนแรง และ มีความเสี่ยงต่อชีวิตอย่างหลีกเลี่ยงไม่ได้
บ้านและสวน AWARDS รางวัลพิเศษ ประจำปี 2024
รางวัลพิเศษเป็นรางวัลที่องค์กรต่างๆมาร่วมสนับสนุนแนวคิด “อยู่ดี มีสุข สมดุล” เพื่อร่วมส่งเสริมคุณภาพการอยู่อาศัยที่ดีในด้านต่างๆ และร่วมสร้างสังคมที่น่าอยู่ ซึ่งในปี 2024 มี 3 รางวัล คือ
- รางวัลพิเศษ Family Home Design Sponsored by AIS Fibre/3BB บ้านใหม่ในสเปซแห่งความทรงจำที่เชื่อมต่อคนทุกวัย
- รางวัลพิเศษ Wellbeing Design Sponsored by SEE Jorakay บ้านโมเดิร์นในมิติความแข็งแกร่งและอ่อนโยน
- รางวัลพิเศษ Sustainable Design Sponsored by Alnex บ้านเหล็กคร่อมสระที่อยู่ร่วมกับบริบทอย่างยั่งยืน
นอกจากนี้ ภายในงาน BDMS ACADEMIC ANNUAL MEETING 2024 - A ROAD TO LIFE-LONG WELL-BEING: EP 2 UNLOCK THE HEALTHY LONGEVITY ในวันที่ 20 พฤศจิกายน 2567 ยังมีการบรรยายโดยเหล่าสปีกเกอร์และแขกรับเชิญชั้นนำจากหลากหลายองค์กรในวงการ Wellness อีกมากมาย ไม่ว่าจะเป็น
การส่งเสริมสุขภาพและความเป็นอยู่ที่ดีผ่านพลังแห่งเสียงดนตรี โดย ศาสตราจารย์เกียรติคุณ นายแพทย์ อมร ลีลารัศมี กรรมการแพทยสภา
เทคโนโลยีการตรวจสุขภาพเชิงป้องกันในระดับเซลล์เพื่อค้นหาความเสี่ยงของการเกิดโรคในอนาคตและวางแผนปรับเปลี่ยนไลฟ์สไตล์เพื่อสร้างเกราะป้องกันโรคตามหลักเวชศาสตร์วิถีชีวิต โดย รองศาสตราจารย์ นายแพทย์ ฉันชาย สิทธิพันธุ์ ไปจนถึงเส้นทางสู่การสร้างสมดุลของกาย ใจ และจิตวิญญาณ เพื่อเสริมสร้างสุขภาพที่แข็งแรงอย่างยั่งยืนให้กับทุกคน
Hallmarks of Aging : Biological Age & Telomere Attrition โดย นายแพทย์ โอฬาร เปี่ยมกุลวนิช
The Future of Wellness: Integrating GeneCheck into Preventive Healthcare โดย Dr.Chang Seok Ki
6. เทเลเฮลท์ (Telehealth) สามารถเข้าถึงผู้ป่วยได้ทุกที่
การรักษาพยาบาลผ่านทางออนไลน์ (Virtual Care) เพิ่มขึ้นอย่างมากตั้งแต่ช่วงวิกฤตโควิด-19 จนถึงวันนี้ทำให้เกิดการเปลี่ยนแปลงในด้านบริการสาธารณสุขทั่วโลก เพื่อผลลัพธ์ด้านสาธารณสุขที่ดีกว่าด้วย ทรัพยากรที่อยู่อย่างจำกัด การเข้าถึงระบบสาธารณสุขในพื้นที่ห่างไกล หรือชุมชนที่ด้อยโอกาสเป็นหนึ่งในเรื่องที่สำคัญเพื่อการพัฒนาคุณภาพชีวิต ความเท่าเทียม และการดูแลผู้ป่วยอย่างทั่วถึง
อย่างการใช้เครื่องติดตามสัญญาณชีพทางไกลและการใช้เครื่องอัลตราซาวด์ ณ จุดบริการตรวจ ร่วมกับการปรึกษาผ่านทางวิดีโอออนไลน์แบบเรียลไทม์ เป็นหนึ่งในแนวทางการดูแลรักษาแบบเทเลเฮลท์ (Telehealth) ที่เข้ามาช่วยให้ผู้คนเข้าถึงระบบสาธารณสุขได้มากขึ้นไม่ว่าจะอยู่ที่ไหนก็ตาม อีกทั้งยังช่วยลดการเดินทางไปพบแพทย์ที่อยู่ห่างไกลได้ ด้วยการใช้เทคโนโลยีเทเลเฮลท์แพทย์ประจำ ณ สถานพยาบาลปฐมภูมิจะสามารถให้การดูแลรักษาผู้ป่วยได้ถึง 40% ร่วมกับการปรึกษาแพทย์เฉพาะทางผ่านทางอนไลน์ [3]
ปัจจุบันการใช้เทคโนโลยีการดูแลรักษาทางไกล (Telemedicine) ได้รับการยอมรับและนำมาใช้ทั่วโลก ตัวอย่างเช่น ผู้ให้บริการด้านสาธารณสุขในประเทศอินโดนีเซีย เผชิญกับความท้าทายด้านการเข้าถึงระบบสาธารณสุข เนื่องจากเป็นภูมิประเทศที่เป็นหมู่เกาะที่ใหญ่ที่สุดในโลก จึงได้นำเทคโนโลยีดิจิทัลเข้ามาใช้เพื่อเพิ่มการเข้าถึงและคุณภาพการบริการด้านสาธารณสุขตามยุทธศาสตร์ด้านสาธารณสุขของรัฐบาล การดูแลรักษาทางไกล (Telemedicine) เครื่องติดตามสัญญาณชีพทางไกล และ AI เป็นเครื่องมือสำคัญของอินโดนีเซียที่ใช้เพื่อให้บริการสาธารณสุขแก่ผู้ป่วยแม้ในพื้นที่ห่างไกล
ผู้ป่วยที่ได้รับการปลูกถ่ายตับ มีอัตรารอดชีวิต 97% ในปีแรก - พญ. อรพิน ธนพันธุ์พาณิชย์


พญ. อรพิน ธนพันธุ์พาณิชย์ แพทย์เฉพาะทางด้านอายุรศาสตร์โรคระบบทางเดินอาหาร - โรคตับ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ผู้ที่จำเป็นต้องได้รับการปลูกถ่ายอวัยวะตับ มักจะเป็นผู้ป่วยที่มีโรคเกี่ยวกับตับในระยะสุดท้ายที่ไม่สามารถรักษาด้วยวิธีอื่น ๆ ได้ และส่งผลกระทบต่อการดำเนินชีวิตประจำวันอย่างมาก โดยโรคที่จำเป็นต้องได้รับการปลูกถ่ายตับ ได้แก่ 1. ภาวะตับวายเฉียบพลัน มักเกิดกับผู้ป่วยที่ไม่ได้เป็นโรคตับมาก่อน ส่วนใหญ่เกิดจากการใช้ยาเกินขนาดหรือเกิดจากเชื้อไวรัสตับอักเสบ 2. โรคทางพันธุกรรม เช่น โรคที่ทำให้มีการสะสมสารบางอย่างในตับผิดปกติ ส่งผลต่อการทำงานของตับและอวัยวะอื่น ๆ 3. ภาวะตับอักเสบเรื้อรังจนทำให้เป็นตับแข็งระยะท้ายที่มีภาวะแทรกซ้อนต่าง ๆ ไม่สามารถแก้ไขได้ด้วยยาหรือเทคนิคการรักษาอื่น ๆ ซึ่งเกิดหลายสาเหตุด้วยกัน เช่น การติดเชื้อไวรัสตับอักเสบและเชื้อไวรัสอื่น ๆ การดื่มสุรามากเกินไปเป็นระยะเวลานานและโรคไขมันพอกตับ และ 4. โรคมะเร็งตับ ขึ้นอยู่กับขนาดของก้อนและสภาพของตับว่าเหมาะสมกับการปลูกถ่ายตับหรือไม่ หากเป็นในระยะแรกเริ่ม แพทย์สามารถรักษาได้ด้วยวิธีการอื่น ซึ่งการรักษาด้วยการปลูกถ่ายตับจะช่วยยืดอายุและเพิ่มคุณภาพชีวิตผู้ป่วยให้ดีขึ้น
## กิจกรรมปี 2567 (2024)
งาน บูรพาพัทยาไบค์วีค Burapa Pattaya Bike Week 2024 Spirit of Hero วันที่ 8-10 ก.พ. 2567 นี้ ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซ.ชัยพฤกษ์ 2 เมืองพัทยา จ.ชลบุรี เพื่อดึงดูดนักท่องเที่ยวชาวไทยและต่างชาติผู้ที่ชื่นชอบการขับขี่รถมอเตอร์ไซค์
เมืองพัทยา ได้ร่วมกับสมาคมบูรพามอเตอร์ไซค์เคิลคลับ กำหนดจัดโครงการสัปดาห์มอไซค์และเสียงเพลงแห่งเสรีภาพ ครั้งที่ 27 "BURAPA PATTAYA BIKE WEEK & SPIRIT OF HEROES 2024" ระหว่างวันที่ 8-10 กุมภาพันธ์ 2567 นี้ ที่บริเวณสาธารณะเมืองพัทยา ศูนย์กีฬาแห่งชาติภาคตะวันออก ซอยชัยพฤกษ์ 2 เมืองพัทยา จ.ชลบุรี
โดยมีวัตถุประสงค์เพื่อดึงดูดนักท่องเที่ยวทั้งชาวไทยและชาวต่างชาติ อันจะเป็นการกระตุ้นเศรษฐกิจด้านการท่องเที่ยวให้กับเมืองพัทยาและประเทศไทยในภาพรวม สร้างความหลากหลายทางด้านการท่องเที่ยวให้สอดคล้องกับความต้องการของนักท่องเที่ยวโดยการท่องเที่ยวเฉพาะกลุ่ม รณรงค์การขับขี่อย่างปลอดภัย สร้างจิตสำนึกที่ดีในการขับขี่รถจักรยานยนต์
กำหนดการกิจกรรมตลอด 3 วัน
วันที่ 8 กุมภาพันธ์ 2567
15.00 น. โชว์พารามอเตอร์
16.00 น. โชว์ม้า
17.30 น. โชว์สตั๊น
18.00 น. เป็นต้นไป การแสดงดนตรี
วันที่ 9 กุมภาพันธ์ 2567
16.00-18.00 น. กิจกรรมภาคสนาม-อากาศ
18.00 น. เป็นต้นไป การแสดงดนตรี
วันที่ 10 กุมภาพันธ์ 2567
14.00 น. ขบวนแห่บิ๊กไบค์รอบเมืองพัทยา เพื่อแสดงออกถึงมิตรภาพที่ดีระหว่างคนขับมอเตอร์ไซค์ทั้งในและต่างประเทศ
15.00-16.00 น. กิจกรรมภาคสนาม-อากาศ
18.00 น. เป็นต้นไป การแสดงดนตรี
ภาพจากเพจ Burapa MC Thailand#คำว่าให้ไม่สิ้นสุด #ความสุขจากการให้ไม่สิ้นสุด
มูลนิธิรามาธิบดีฯ จะยังคงมุ่งมั่นสานต่อบทบาทของ ‘สะพานแห่งการให้’ โดยให้ความสำคัญกับการสนับสนุนด้านการขับเคลื่อนความก้าวหน้าของระบบสาธารณสุขในประเทศไทยอย่างยั่งยืน พร้อมเพิ่มโอกาสให้ประชาชนสามารถเข้าถึงการรักษาพยาบาลที่มีประสิทธิภาพอย่างทั่วถึงและเท่าเทียม ด้วยการปรับตัวให้เท่าทันการเปลี่ยนแปลงของยุคสมัยอยู่เสมอ พร้อมสื่อสารอย่างสร้างสรรค์ ควบคู่กับการถ่ายทอด ‘ผลลัพธ์จากการให้’ อย่างต่อเนื่องไปสู่กลุ่มผู้บริจาคในทุกเจเนอเรชั่น เพื่อให้กลุ่มผู้บริจาคมีความรู้สึกร่วมของการเป็นส่วนหนึ่งในการสร้างการเปลี่ยนแปลงที่มีความหมาย สู่ การสร้างสังคมแห่ง ‘การให้’ ที่สามารถสร้างและส่งต่อสาธารณประโยชน์ต่อไปได้อย่างไม่สิ้นสุด
คลินิกเฉพาะทางนอกเวลา ทันตกรรม
Good Morning อรุณสวัสดิ์ (1959/ 93 min) กำกับโดย ยาสึจิโร่ โอซึ
Good Morning อรุณสวัสดิ์ (1959/ 93 min) กำกับโดย ยาสึจิโร่ โอซึ
ครอบครัวหลายครอบครัวอาศัยอยู่ร่วมกันในบ้านเล็ก ๆ เรียงเป็นแถวในย่านชานเมืองโตเกียว หนึ่งในนั้นคือบ้านฮายาชิ ที่ประกอบด้วยเคย์ทาโร่ พนักงานออฟฟิศ ทามิโกะ ผู้เป็นภรรยา เซ็ตซึโกะ น้องสาวของเธอ และมิโนรุ กับอิซามุลูกชายวัยประถม เด็กๆ ขอร้องให้พ่อแม่ซื้อทีวีให้ แต่ก็ไม่ได้ผล ดังนั้นพวกเขาเลยใช้เวลาว่างหลบไปดูทีวีที่บ้านของคู่หนุ่มสาวที่เป็นหลังเดียวที่มีในบริเวณนี้พร้อมกับเด็กคนอื่น ๆ ในละแวก ขณะเดียวกันการละเล่นผายลมก็เป็นที่นิยมในหมู่เด็ก ๆ พวกเขาพยายามทำทุกวิถีทางเพื่อให้ปล่อยเสียงแก๊สออกมาได้ตามใจชอบ ในอีกมุมหนึ่งก็ได้มีความขัดแย้งเล็กๆ น้อยๆ เกิดขึ้นระหว่างเหล่าแม่บ้านเรื่องเงินสมทบสมาคมแม่บ้าน
ทามิโกะปรามมิโนรุ และอิซามุเรื่องที่พวกเขารบเร้าจะเอาทีวี ส่วนเคย์ทาโร่นั้นดุพวกเขาด้วยอารมณ์ว่าพวกเขาพูดมากเกินไปแล้ว เด็ก ๆ จึงย้อนมาว่าพวกผู้ใหญ่เองก็พูดมากเช่นกัน เช่น “สวัสดี” “อรุณสวัสดิ์” “วันนี้อากาศดีนะ” และพวกเขาก็ดำเนินแผนการใหม่นั่นคือ การปิดปากเงียบ
อาสาสมัครเรียนรู้ระบบเครื่องจัดยาอัตโนมัติ (กุมภาพันธ์ - เมษายน 2568)
ศูนย์อาสาสมัครศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล ขอเชิญนักเรียน นักศึกษา หรือผู้ที่สนใจ ที่มีในรักงานจิตอาสา มาทำกิจกรรม "อาสาสมัครเรียนรู้ระบบเครื่องจัดยาอัตโนมัติ"
โดยจะเริ่มกิจกรรมวันที่ 17 กุมภาพันธ์ - 30 เมษายน 2568 (ยกเว้นวันหยุดราชการ วันหยุดนักขัตฤกษ์) เวลาปฏิบัติงาน ตั้งแต่เวลา 08.30-16.30 น. (จำนวนชั่วโมงอาสาสมัคร 7 ชั่วโมง) ณ ห้องยา อาคารนวมินทรบพิตร 84 พรรษา ชั้น 5
รับสมัครผู้ที่สนใจเพียงวันละ 6 คนต่อวัน
**โปรดตรวจสอบวันที่สามารถเข้าร่วมได้ ก่อนการกดเข้าร่วมทุกครั้ง
ลักษณะงาน
- ติดฉลากยา และ Register ข้อมูลเข้าตะกร้า สำหรับจัดยา
- จัดยาด้วยระบบไฟนำทาง (Light Guiding Shelf)
- ทำงานกับเครื่องจัดยาอัตโนมัติ
คุณสมบัติอาสาสมัคร
1. นักเรียนนักศึกษา อายุ 16 - 20 ปี
2. สุขภาพร่างกายแข็งแรง
การแต่งกาย
- นักเรียน/นักศึกษา แต่งชุดนักเรียนเรียบร้อย (ตามสถาบัน)
- ประชาชนทั่วไป แต่งเสื้อคอปก กางเกงขายาว รองเท้าหุ้มส้น
หมายเหตุ ***โปรดสนใจเป็นพิเศษ***
1. การนัดหมายอบรมแนวทางปฏิบัติก่อนเข้าร่วมกิจกรรม ผ่านระบบ Zoom ล่วงหน้า 1 สัปดาห์ โดยจะแจ้งรหัสเข้าประชุมผ่าน E-mail ของท่าน หากไม่เข้าร่วมอบรมตามวันและเวลาที่นัดหมาย จะถือว่าสละสิทธิ์ในการเข้าร่วมกิจกรรม
2. ใบรับรองการเข้าร่วมกิจกรรม อาสาสมัครจะได้รับหลังจากที่ปฏิบัติกิจกรรมเสร็จสิ้น (ในวันที่ปฏิบัติกิจกรรม)
6) เครื่องตรวจทางการแพทย์ Tricorder (Medical tricorder)
6) เครื่องตรวจทางการแพทย์ Tricorder เมื่อดร.แม็กคอยจากเรื่องสตาร์เทรคหยิบเครื่องตรวจแบบไตรคอร์เดอร์ขึ้นมาแล้วสแกนคนไข้ เครื่องตรวจแบบพกพานี้จะแสดงรายการสัญญาณชีพ พารามิเตอร์อื่นๆ และการวินิจฉัยทันที นับเป็นมีดพกอเนกประสงค์สำหรับแพทย์ อุปกรณ์ทางการแพทย์ที่ครบครันที่สุด คุณสามารถรักษาคนไข้ได้ไม่ว่าคนไข้จะอยู่ที่ใด มีการทดลองต่างๆ มากมายเพื่อพยายามเข้าถึงระดับการดูแลสุขภาพนี้ เช่นScanaduซึ่งเป็นอุปกรณ์การแพทย์เคลื่อนที่ในระยะเริ่มต้นเพื่อเสริมพลังให้กับผู้ป่วย หรือViatom Checkmeซึ่งไม่เพียงแต่วัดอุณหภูมิร่างกาย แต่ยังติดตาม ECG วัดอัตราชีพจรและจังหวะ ความอิ่มตัวของออกซิเจน ความดันโลหิตซิสโตลิก กิจกรรมทางกาย และการนอนหลับ หลายคนเชื่อว่าความท้าทายของ Qualcomm Tricorder XPrize จะนำไปสู่การพัฒนาอุปกรณ์ที่สามารถวินิจฉัยโรคใดๆ ก็ได้และให้ผู้คนมีทางเลือกในการดูแลสุขภาพของตนเองมากขึ้น แต่หลายปีผ่านไปและเราไม่มีผลิตภัณฑ์ดังกล่าววางจำหน่ายทั่วไป ในความเห็นของฉัน แม้ว่าเราจะเห็นความคืบหน้าบางอย่างในด้านนี้ แต่เครื่องมือใหม่ดังกล่าวจะสามารถติดตามพารามิเตอร์และเงื่อนไขได้เพียงไม่กี่อย่างเท่านั้น เรามีอุปกรณ์ที่ยอดเยี่ยมมากมายสำหรับติดตามพารามิเตอร์ด้านสุขภาพหนึ่งหรืออีกพารามิเตอร์หนึ่ง แต่ไม่มีเครื่องมือที่ทรงประสิทธิภาพที่ทำได้ทุกอย่าง ในขณะนี้ Tricorder ยังห่างไกลจากความเป็นจริง6. การพนันในบ่อนแบบมีที่ตั้ง on-site ซบเซาและปรับตัว
กรณีคุณแม่ฝากครรภ์และคลอดบุตรที่โรงพยาบาลบำรุงราษฎร์ ทางโรงพยาบาลฯ จะมีมาตรฐานการตรวจพัฒนาการด้านการมองเห็นของทารกหากพบปัญหาหรือความเสี่ยงที่อาจเกิดขึ้นได้จะมีการปรึกษาแพทย์ชำนาญการด้านจอตาและจักษุแพทย์โรคตาเด็กแนวทางการรักษาในกรณีทารกมีโรคจอตาผิดปกติอันเกิดจากการคลอดก่อนกำหนดมีหลายวิธี เช่น การรักษาด้วยเลเซอร์ การฉีดยาเข้าไปยับยั้งการเจริญผิดปกติของเส้นเลือดในจอประสาทตา และการผ่าตัดจอประสาทตา นอกจากนี้ เด็กกลุ่มนี้ยังมีความเสี่ยงที่จะสายตาสั้น ตาเข ตาเหล่ตามมาภายหลังได้มากกว่าเด็กที่คลอดตามกำหนด จักษุแพทย์โรคตาเด็กจะรับช่วงดูแลต่อและมีการตรวจติดตามเป็นระยะ ๆ เพื่อป้องกัน ไม่ให้เกิดผลเสียต่อดวงตาของเด็กในระยะยาวหรือบรรเทาความรุนแรงหรือความซับซ้อนของโรคได้
พอเด็กโตขึ้นก็มักจะพบ "โรคสายตาสั้นในเด็ก" ซึ่งมีแนวโน้มเพิ่มสูงขึ้นและเปลี่ยนแปลงเร็วและพบในอายุที่น้อยลง เด็กบางรายสายตาสั้นตั้งแต่ขวบกว่า ส่วนหนึ่งมาจากเด็กที่คลอดก่อนกำหนด และมีเด็กหลายรายที่สายตาทั้งสองข้างสั้นไม่เท่ากันและมีค่าสายตาต่างกันมาก และมีความเสี่ยงโรคสายตาขี้เกียจ ปัจจุบันศูนย์จักษุ โรงพยาบาลบำรุงราษฎร์ มีคลินิกสายตาสั้นในเด็ก ซึ่งมีจักษุแพทย์โรคตาเด็ก ที่จะให้การรักษาและแนะนำการยับยั้งหรือชะลอไม่ให้ค่าสายตาสั้นเพิ่มขึ้นเร็วตามแนวทางการแพทย์สากลในปัจจุบัน เพราะการที่สายตาสั้นไม่ใช่เพียงรอการแก้ไขด้วยเลสิคเท่านั้น แต่สายตาสั้นที่มากขึ้นจะมาพร้อมการเปลี่ยนแปลงภายในตาและความเสี่ยงของโรคตา โดยเฉพาะโรคจอตาที่มากขึ้น ผู้ปกครองจึงควรให้ความสำคัญและพาบุตรหลานมาตรวจเช็คสุขภาพตั้งแต่เนิ่น ๆ เพื่อหาแนวทางการป้องกันและรักษาเพื่อชะลอภาวะสายตาสั้นได้ โดยศูนย์จักษุได้มีการรักษาและการป้องกันโดยอ้างอิงจากงานวิจัยสากลเรื่องสายตาสั้นที่มีทั่วโลกในขณะนี้ เช่น การรักษาด้วยยา low- dose atropine eyedrops และเลนส์แว่นตาเทคโนโลยีใหม่ที่ช่วยชะลอสายตาสั้นในเด็ก โดยจักษุแพทย์ตาเด็กจะเป็นผู้ตรวจ ให้ข้อมูลแนะนำในแต่ละรายซึ่งมีความแตกต่างกันไป นอกจากนี้ โรงพยาบาลฯ ได้มีงานวิจัยต่อยอดที่ได้รับการยอมรับจากสากลเกี่ยวกับการการพัฒนายาหยอดตาในกลุ่มนี้ เพื่อให้คนไข้ได้รับประสิทธิภาพและความปลอดภัยสูงสุด
ศูนย์ช่วยเหลือผู้ประสบภัยน้ำท่วม มทร.ล้านนา เชียงราย โทร 082-780-1043
ศูนย์ช่วยเหลือผู้ประสบภัยน้ำท่วม มทร.ล้านนา เชียงราย โทร 082-780-1043
เทคโนโลยีคุ้มครองความเป็นส่วนตัวของข้อมูล (Privacy-Enhancing Technologies: PETs) จึงมีความสำคัญเป็นอย่างยิ่ง เพราะเทคโนโลยีที่ใช้กันอยู่ในปัจจุบันไม่ปลอดภัยมากพอ เนื่องจากระหว่างการส่งข้อมูลจากเซนเซอร์ไปประมวลผลในคลาวด์นั้น แม้จะมีการเข้ารหัสข้อมูลแล้วก็ตาม แต่เมื่อไปถึงที่คลาวด์ ก็จำเป็นต้องถอดรหัสเพื่อนำข้อมูลจริงนั้นมาประมวลผล จึงเกิดช่องโหว่ทำให้ข้อมูลเหล่านั้นรั่วไหลที่คลาวด์ได้หากโดนแฮ็ก ยังไม่รวมกรณีที่เจ้าของคลาวด์อาจนำข้อมูลของเราไปใช้งานอย่างอื่นที่ไม่ได้รับอนุญาต
เทคโนโลยีแบบใหม่คือ PETs ช่วยคุ้มครองความเป็นส่วนตัวของข้อมูล ตั้งแต่ต้นทางจนถึงปลายทาง ผ่านการเข้ารหัสแบบใหม่ที่ทำให้ข้อมูลประมวลผลบนคลาวด์ได้ “โดยไม่ต้องถอดรหัส” ดังนั้นระบบคลาวด์เองจึงไม่สามารถเข้าถึงเนื้อหาข้อมูลที่กำลังประมวลผลอยู่เลย มีแต่เจ้าของข้อมูลที่มีกุญแจถอดรหัสเท่านั้นที่จะเข้าถึงเนื้อหาข้อมูลได้ เทคโนโลยีนี้จึงปิดช่องโหว่การรั่วไหลของ¬ข้อมูลได้มากขึ้น แม้แต่กรณีคลาวด์โดนแฮ็กก็ตาม
มีการนำเทคโนโลยี PETs มาให้บริการแล้วในวงการการเงิน สุขภาพ และทรัพยากรบุคคล เช่น บริษัท EN|VIEL, Tripple-Blind และ Inpher ในสหรัฐอเมริกา บริษัท ZAMA มีการนำเอาเทคโนโลยี PETs มาใช้ในการระบุตัวตนแบบ biometric authentication และทำ confidential trading อีกด้วย ขณะที่บริษัท RAVEL ในประเทศฝรั่งเศสก็นำเอาระบบนี้ไปใช้ให้บริการโฆษณาส่วนบุคคล เป็นต้น
สำหรับประเทศไทย เนคเทค สวทช. ได้พัฒนาเทคโนโลยี PETs ให้ใช้กับแพลตฟอร์ม IoT สำหรับภาคอุตสาหกรรม ซึ่งสอดคล้องกับนโยบาย Industry 4.0 ของประเทศในชื่อ ไซบิลเลี่ยน (CYBLION) พ้องเสียงกับชื่อสายพันธุ์สุนัข ช่วยทำให้การคำนวณข้อมูลของโรงงานอุตสาหกรรมบนคลาวด์ทำได้อย่างปลอดภัย โดยเนคเทคได้ทดสอบใช้งานจริงในโรงงานธนากรผลิตน้ำมันพืช จำกัด (น้ำมันพืชกุ๊ก) แล้ว
การรักษาด้วยการปลูกถ่ายตับ จะทำให้ร่างกายของผู้ป่วยกลับมาทำงานได้เป็นปกติมากขึ้น ทั้งในส่วนของการทำงานของอวัยวะต่าง ๆ ดีขึ้น โดยตับใหม่จะทำหน้าที่ในการกำจัดสารพิษในร่างกาย สร้างโปรตีน และผลิตน้ำดี ทำให้การทำงานของอวัยวะอื่น ๆ เช่น ไต หัวใจ และสมองกลับมาเป็นปกติ รวมถึงอาการที่เกิดจากโรคตับจะทุเลาลง เช่น อาการเหนื่อยง่าย บวม อาเจียน ก็จะทุเลาลงหรือหายไป ส่งผลให้ผู้ป่วยมีแรงมากขึ้น ทำกิจวัตรประจำวันได้มากขึ้น และมีคุณภาพชีวิตที่ดีขึ้น รวมถึงมีอายุขัยที่เพิ่มขึ้น
ผู้ป่วยที่ได้รับการปลูกถ่ายตับ จะมีอัตราการรอดชีวิตสูงถึง 97% ในปีแรก, 82% ใน 5 ปี และ 67% ใน 10 ปี ซึ่งถือเป็นอัตราความสำเร็จที่สูง สะท้อนให้เห็นถึงความเชี่ยวชาญของทีมแพทย์และการนำเทคโนโลยีที่ทันสมัยมาปรับใช้ และด้วยประสบการณ์กว่า 22 ปีในการปลูกถ่ายตับ ซึ่งคลินิกโรคตับเป็นหนึ่งใน 8 คลินิกเฉพาะทางของศูนย์ทางเดินอาหาร-ตับ โรงพยาบาลบำรุงราษฎร์ที่ดูแลรักษาผู้ป่วยมากกว่า 42,000 รายต่อปี และสามารถดูแลรักษาโรคตับได้อย่างครอบคลุม เช่น ตับอักเสบเฉียบพลัน ตับอักเสบเรื้อรัง ก้อนเนื้อในตับ ไขมันพอกตับ และมะเร็งตับ จนถึงการผ่าตัดปลูกถ่ายตับ ทำให้ผู้ป่วยมีโอกาสกลับมามีคุณภาพชีวิตที่ดีขึ้นอีกครั้ง
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตวังทองหลาง
Google search - ผู้ประกอบโรคศิลปะกายอุปกรณ์
6. เดินทางไปรักษาที่ไหนก็ได้ในเขตตัวเอง เท่านั้น
ผู้ป่วยสามารถเดินทางไปรักษาใน เครือข่ายหน่วยบริการชุมชนอบอุ่น ที่ไหนก็ได้ ภายในเขตตัวเอง แต่ไม่สามารถข้ามเขตได้
คู่มือการช่วยชีวิตขั้นพื้นฐาน (PDF) - กรมสนับสนุนบริการสุขภาพ LINK
คู่มือการช่วยชีวิตขั้นพื้นฐาน และเครื่องฟื้นคืนคลื่นหัวใจด้วยไฟฟ้าแบบอัตโนมัติ (เออีดี: AED) สำหรับอาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม)
จัดทำโดย
- กองสนับสนุนสุขภาพภาคประชาชน กรมสนับสนุนบริการสุขภาพ
- ร่วมกับ สถาบันการแพทย์ฉุกเฉินแห่งชาติ (สพฉ.)
ปีที่พิมพ์ เมษายน 2561
จำนวน 26 หน้า
ราชบุรี ตั้งด่านสกัดโควิด-19 ตลอด 24 ชม. ช่วงรอยต่อสมุทรสาคร ห้ามต่างด้าวเข้าเด็ดขาด LINK
ราชบุรี ตั้งด่านสกัดโควิด-19 ตลอด 24 ชม. ช่วงรอยต่อสมุทรสาคร ห้ามต่างด้าวเข้าเด็ดขาด ถ้าพบจะส่งตัวกลับสมุทรสาครทันที
เมื่อวันที่ 20 ธ.ค. 2563 พล.ต.ต.ปรัชญา ประสานสุข ผบก.ภ.จว.ราชบุรี พร้อมด้วยนายชุษณิษฎ์ ประจวบวัน นายอำเภอดำเนินสะดวก จ.ราชบุรี ไปตรวจเยี่ยมการตั้งด่านสกัดโควิด-19 ที่บริเวณทางแยกหน้าสามแยกประสาทสิทธิ์ ต.ประสาทสิทธิ์ อ.ดำเนินสะดวก ซึ่งเป็นรอยต่อของ จ.ราชบุรี และ จ.สมุทรสาคร เพื่อป้องกันไม่ให้มีแรงงานต่างด้าวเดินทางเข้ามา รวมทั้งตรวจวัดอุณหภูมิของผู้ที่โดยสารมากับรถทุกคัน และประชาสัมพันธ์ให้ทุกคนเดินทางเข้ามาในพื้นที่ จ.ราชบุรี สวมใส่หน้ากากอนามัย
ข่าวสด
20 ธค 63
รพ.ร้อยเอ็ด ร่วมกับ เหล่ากาชาดจังหวัดร้อยเอ็ด ขอเชิญร่วมบริจาคโลหิต LINK
โรงพยาบาลร้อยเอ็ด ร่วมกับ เหล่ากาชาดจังหวัดร้อยเอ็ดขอเชิญผู้มีจิตอันเป็นกุศลร่วมบริจาคโลหิต เพื่อช่วยเหลือผู้ป่วย ตลอดเดือนมกราคม 2564
- ตามแผนรับบริจาคโลหิตเคลื่อนที่ ได้ตลอด เดือนมกราคม 2564
- ตั้งแต่เวลา 08.30 น.-12.00 น. และ ณ. ที่คลังเลือดโรงพยาบาลร้อยเอ็ด ตั้งแต่เวลา 08.30-19.30 น. ได้ทุกวัน (ไม่เว้นวันหยุดราชการ)
- สอบถามรายละเอียดเพิ่มเติมได้ที่ 043-518200-5 ต่อ 2030
ชลบุรี บริจาคเลือด ได้ 2 ที่ หน่วยบริการ จ.ชลบุรี และนิคมฯ อมตะ LINK
ขอเชิญชวนผู้ที่มีสุขภาพดีมาร่วมกันบริจาคโลหิตผ่านวิกฤติโรคระบาด ส่งต่อโลหิตที่ปลอดภัยให้กับผู้ป่วย
- บริจาคได้ที่ ภาคบริการโลหิตแห่งชาติที่ 3 จ.ชลบุรี สภากาชาดไทย
เปิดทำการ วันจันทร์ ถึง ศุกร์ เวลา 08.30-19.30 น.
วันเสาร์,วันอาทิตย์ และวันหยุดนักขัตฤกษ์ เวลา 09.00-15.30 น.
- หน่วยเคลื่อนที่หน้านิคมอมตะ
เปิดทำการ วันจันทร์,อังคาร และวันพฤหัสบดี เวลา 09.00-15.30 น. (วันหยุดนักขัตฤกษ์ปิดทำการ)
สอบถามโทร. 038-278905 ต่อ 111
ปริมาณโลหิตสำรองคลังลดลง ธนาคารโลหิต รพ.สระบุรี (22/12/63) LINK
ด้วยสถานการณ์ COVID 19กลับมาระบาดอีกครั้ง มีผลให้ปริมาณโลหิตสำรองคลังลดลง และอาจจะหมดลงในไม่ช้า.. ไม่มีเพียงพอสำหรับรักษาผู้ป่วยช่วงนี้และยาวถึงเทศกาลปีใหม่..จึงขอวิงวอนผู้มีจิตศรัทธา ที่มีสุขภาพแข็งแรง มาบริจาคโลหิตค่ะ ธนาคารโลหิต รพ.สระบุรี เปิดทำการทุกวัน
จันทร์-อาทิตย์ 8.30-16.00 น. ไม่มีวันหยุด ไม่พักเที่ยง
ธนาคารโลหิต ชั้น3 อาคาร100ปี สาธารณสุข
โรงพยาบาลสระบุรี
โทร 036 343 500
ธนาคารแลนด์ แอนด์ เฮ้าส์
ธนาคารแลนด์ แอนด์ เฮ้าส์
แจ้งเปลี่ยนแปลงเวลาปิ ดทำการสาขาในศูนย์การค้า
เนื่องจากสถานการณ์ COVID-19
ตั้งแต่วันที่ 11 มกราค 2564 ป็นต้นไป หรือจนกว่จะมีการเปลี่ยนแปลง
- สาขาในศูนย์การค้า ปิดเวลา 18.00 น.
- ยกเว้น สาขาโฮมโปร เพชรเกษม สาขาดิโอลด์ สยาม สาขาพาร์คเลน (เอกมัย) ปิดเวลา 17.00 น.
ท่านสามารถใช้บริการผ่านช่องทาง LH Bank M Choice หรือ เคาน์เตอร์เซอร์วิส ที่ร้าน 7-Eleven (ฝาก ถอน จ่าย) ตลอด 24 ชั่วโมง สอบถามเพิ่มเติม โทร 1327
เลือดกรุ๊ป A และ O ในคลังของธนาคารเลือด รพ.ภูมิพลอดุลยเดช พอ. อยู่ในภาวะวิกฤต LINK
ในขณะนี้ เลือดกรุ๊ป A และ O ในคลังของธนาคารเลือด รพ.ภูมิพลอดุลยเดช พอ. อยู่ในภาวะวิกฤต เนื่องจากCovid -19 wave 2 กาชาดเลือดไม่พอจ่าย จำนวนผู้บริจาคลดลง 50% หน่วยเคลื่อนที่ ยกเลิกการจัดบริจาคโลหิตในหลายหน่วย
ขอเชิญชวนผู้มีสุขภาพแข็งแรงร่วมบริจาคโลหิต ฝ่าวิกฤติ COVID-19 รอบ 2 ไปด้วยกัน
- บริจาคโลหิต วันที่ 11-13 ม.ค.64 รับเจลแอลกอออล์ ท่านละ 1 ชิ้น
**ขอความร่วมมือ**
- ผู้บริจาคโลหิตต้องตอบคำถามเกี่ยวกับสุขภาพและการเดินทางไปในพื้นที่เสี่ยงตามความเป็นจริง หากไม่แน่ใจควรงดการบริจาคโลหิตชั่วคราว เพื่อเว้นระยะเวลาการพบเชื้อ 4 สัปดาห์
- ใส่หน้ากากอนามัยทุกครั้งที่เดินทางมาบริจาคโลหิต
ติดต่อบริจาคโลหิตได้ที่ :
- กองบริการโลหิต อาคารศูนย์มะเร็ง ชั้น3 รพ.ภูมิพลอดุลยเดช พอ.
- เปิดทำการ วันจันทร์ - วันศุกร์ ตั้งแต่เวลา 08.00 -16.00น. ปิดรับบัตรเวลา 15.30น. (ไม่หยุดพักกลางวัน)
- หยุดวันเสาร์ - วันอาทิตย์ และวันหยุดนักขัตฤกษ์
- สอบถามรายละเอียดเพิ่มเติม หรือต้องการบริจาคโลหิตเป็นหมู่คณะ
ติดต่อ 0 2534 7838
ตารางออกหน่วยบริการบริจาคโลหิต 20 ม.ค. 64
- 20 มค 64 09.00-12.00 หน่วยบัญชาการทหารพัฒนา สีกัน
- 26 มค 64 10.00-15.00 ศูนย์การคอิมพีเรียล ลาดพร้าว
- 27 ม.ค.64 09.00-12.00 กรมสรรพาวุธทหารอากาศ
- 29 ม.ค. 64 11.00-15.00 ศูนย์การค้าเซียร์รังสิต
สถานีกาชาดหัวหิน บริจาคโลหิตฝ่าวิกฤติ COVID-19 LINK
เปิดรับบริจาคทุกวัน
จันทร์-ศุกร์ 8.30-16.30 น.
เสาร์-อาทิตย์ และ วันหยุดนักขัตฤกษ์ 9-15.30 น.
โทร. 0-32512-370
งานบริการโลหิต สถานีกาชาดหัวหินเฉลิมพระเกียรติ เลขที่ 25 ถ.ดำเนินเกษม ต.หัวหิน อ.หัวหิน จ.ประจวบคีรีขันธ์ 77110
เมื่อใดที่ D ออกไปข้างนอก ก็จะมีโอกาสได้พบปะกับกลุ่ม B ได้ โดยไม่รู้ตัว เมื่อนั้น D จะกลายเป็นกลุ่ม B กลุ่มใหม่ทันที (B2)
7. วิธีการตรวจโควิด-19
7. ในการตรวจโควิด-19 จะใช้ไม้เก็บสิ่งส่งตรวจที่จมูก และ ปาก ซึ่งใช้เวลาไม่นานา
การติดตั้งโซล่าร์เซลล์ให้กับโรงพยาบาลสามารถช่วยประหยัดค่าไฟฟ้าลงไปได้มาก มีหลายที่ติดต่อขอรับการสนับสนุนซึ่งจำกัดด้วยเงินบริจาค หากมีการระดมทุนจากทางโรงพยาบาลเองเป็นเบื้องต้น และชุมชนมีส่วนร่วม แล้วมีบริษัทห้างร้านผู้ใหญ่ใจดีรวมกันในแต่ละพื้นที่ หรือหาเครือข่ายช่วยสนับสนุนติดตั้งโซล่าร์เซลล์ให้กับโรงพยาบาล เพื่อให้ลดค่าไฟฟ้าเดือนละ 60,000 บาท หรือถ้ามีกำลังติดตั้งก็สามารถทำให้ลดได้มากกว่านั้นตามกำลังศรัทธา แต่ละแห่งระดมทุนได้ 2.7 ล้าน ลดค่าไฟไปปีละ 7.2 แสน 3 ปีกว่าๆ ถึงจุดคุ้มทุน แต่โรงพยาบาลไม่ใช่การลงทุนจึงคุ้มตั้งแต่วินาทีแรกที่ติดตั้งไป จะหารายได้อย่างอื่นที่สม่ำเสมอเท่ากับลดรายจ่ายอย่างนี้ไม่ได้แล้ว ทุกวันนี้โซล่าร์เซลล์มีอายุการใช้งานถึง 30 ปีแล้ว อินเวอร์เตอร์แปลงไฟรับประกัน 20 ปี ถ้าทุกคนช่วยกันให้เกิดสิ่งดีๆ ครบพื้นที่ 77 จังหวัด 77 โรงพยาบาลเป็นโครงการแรก จะเป็นการเปิดโอกาสให้โรงพยาบาลอื่นๆ ตามอย่าง อันนี้ไม่ได้เป็นเพียงแนวคิดลมๆ แล้งๆ แต่ได้ทำมาแล้ว เห็นผลแล้ว คิดว่าดีมีประโยชน์ต่อสังคมส่วนรวมจึงได้ดำเนินการมา
Tetrahydrocannabinol (THC) LINK
Tetrahydrocannabinol (THC)
สารสำคัญ THC เป็นสารหลักในกัญชาทที่มีองค์ประกอบมีฤทธิ์ทางจิตประสาท มีประสิทธิภาพเป็นยาแก้ปวด นำไปสู่การยอมรับกัญชาอย่างกว้างขวางในฐานะการรักษาทางการแพทย์ เป็นที่นิยมในหมู่ผู้ใช้ทางสันทนาการ และใช้ในการรักษาคนไข้กลุ่มปวดเรื้อรัง ผู้ต้องการลดผลข้างเคียงของเคมีบำบัด ผู้ป่วยลมชัก หรือต้องการเพิ่มความอยากอาหารในกลุ่มผู้ป่วยเรื้อรังหรือ HIV ทั้งนี้ การทำงานของยายังไม่ได้วิจัยในการใช้อย่างปลอดภัยทางเภสัชกรรมเป็นวงกว้างจากความกังวัลถึงผลข้างเคียงต่อจิตประสาท ปัจจุบันมีการค้นพบเกี่ยวกับการใช้ CBD ควบคู่กับ THC เพื่อช่วยต่อต้านอาการหวาดระแวงและผลกระทบทางจิตประสาทได้
THC เป็น psychoactive compound ซึ่งส่วนใหญ่จะจับกับ cannabinoid receptors ซึ่งพบอยู่ 2 กลุ่มหลักคือ CB1 และ CB2 โดย CB1 จะพบมากที่ (1) ระบบประสาทส่วนกลาง (Central nerve system) โดยเฉพาะในส่วน basal ganglia, hippocampus, cerebellum และ cortex ซึ่งสะท้อนกลไกการเกิด psychotropic effect ของ THC ซึ่งเป็นองค์ประกอบหลักในสารสกัดกัญชา และ (2) ในระบบประสาทส่วนปลาย (Peripheral nerve system) ในขณะที่ CB2 receptors จะพบที่เนื้อเยื่อระบบภูมิคุ้มกันของร่างกาย (Immune system)4,5 ดังนั้นจึงมีผลต่อ ความอยากอาหาร การย่อยอาหาร อารมณ์ ความรู้สึก ความจำ การเรียนรู้ และพฤติกรรม นอกจากนี้ยังมีการค้นพบว่าอาจมี receptors อื่นๆ ที่อาจมาทำหน้าที่เช่นเดียวกับ cannabinoids receptors
[สวัสดีคลินิกเวชกรรม]
ชีสเค้กและบราวนี่กัญชา
ชีสเค้กและบราวนี่กัญชา นำเสนอโดยร้านเขียวไข่กา ร้านดังบนถนนนาคนิวาสนั่นเอง
แล้วช่วงแรกคิดหรือมองภาพไว้อย่างไร มั่นใจไหม
คิดว่าคนคงสนใจแต่ไม่คิดว่าจะเยอะขนาดนี้ หลายคนมาจากต่างจังหวัดเพื่อมาที่นี่และทุกคนก็ประทับใจที่ได้มา จากไม่ค่อยมั่นใจตอนนี้ค่อนข้างมั่นใจว่าธุรกิจตัวนี้อยู่ได้แน่ๆตัวอย่างอาหาร เบเกอรี่ และยาน้ำมันจากกัญชาของ รพ. อภัยภูเบศร
Me more หาหมอง่ายๆ แค่ปลายนิ้ว LINK
หาหมอง่ายๆ แค่ปลายนิ้ว
Me more ช่วยให้คุณสามารถขอคำปรึกษาปัญหาสุขภาพ ของคุณและคนที่คุณรักกับคุณหมอผ่านแพลตฟอร์มของเรา
- หาหมอ ปัญหาสุขภาพส่วนมาก คุณหมอ สามารถ รักษาได้โดยให้คำแนะนำ และจ่ายยา ให้จนหายดี
- ติดตามอาการ แจ้งเตือนเมื่อถึงเวลาที่คุณหมอ นัดเพื่อติดตามผลการรักษา
- หาหมอ รับใบสั่งยาหลังปรึกษาเสร็จ และสามารถเลือกรอรับยาที่บ้าน
เทคโนโลยีอัจฉริยะ ทำการเลือกหมอที่ดีที่สุดสำหรับคุณ
ด้วยระบบ Machine Learning ระบบจะทำการแนะนำหมอที่ตรงกับอาการ
ของคุณมากที่สุด เพื่อให้ผลลัพธ์ของการรักษาออกมาดีที่สุด สำหรับคุณ
เหตุผลที่ต้องใช้บริการเรา
- ระบบแจ้งเตือนใช้งานง่าย ระบบที่ใช้งานได้ง่ายสำหรับทุกเพศทุกวัย
- Review สามารถดูรีวิวการรักษา ก่อนเข้ารับการรักษาได้
- ปลอดภัย คุณจะมั่นใจได้ว่า ข้อมูลส่วนตัว และข้อมูลการ หาหมอทั้งหมดจะเป็นความลับ
- การบริการที่ดีเยี่ยม เรามีการบริการที่ดีเยี่ยม และมีทีมงาน คอยให้บริการคุณตลอด 24 ชั่วโมง
- รวดเร็ว ทำให้การหมอเป็นเรื่องง่าย และรวดเร็ว
- ประหยัดค่าใช้จ่าย ประหยัดค่าใช้จ่ายในการเดินทาง และค่าบริการ ที่ถูกกว่า
Download
ยะลา จัดสงกรานต์วิถีใหม่ สืบสานวัฒนธรรมไทย 13 เมษายน 2564
ทางเทศบาลนครยะลาจึงได้กำหนดจัดกิจกรรมในรูปแบบสงกรานต์วิถีใหม่ สืบสานวัฒนธรรมไทยโดยจะมีการจัดขึ้นที่บริเวณศูนย์เยาวชนเทศบาลนครยะลาในวันที่ 13 เมษายน 2564 ประกอบด้วย พิธีสรงน้ำพระและพิธีทำบุญตักบาตรพระสงฆ์ โดยให้ความสำคัญตั้งแต่การจัดการสถานที่ มีการตั้งจุดคัดกรองวัดอุณภูมิตรงทางเข้าทั้งสองฝั่ง กำหนดให้ประชาชนที่จะตักบาตรอยู่ได้ไม่เกิน 4 คนต่อโต๊ะและมีการเว้นระยะห่าง ในส่วนของพระสงฆ์ได้กำหนดให้มีให้มีการสวมหน้ากากอนามัยและพร้อมกับถุงมือเพื่อที่จะป้องกันการรับบิณฑบาต คือจะทำในลักษณะเดียวกันกับช่วงที่มีการแพร่ระบาดของ โควิด-19 เพื่อที่จะให้พี่น้องประชาชนได้ปลอดภัยมากที่สุดพิมพ์เป็นอนุสรณ์ในงานฌาปนกิจศพ นายจอน ศุภลักษณ์
พิมพ์เป็นอนุสรณ์ในงานฌาปนกิจศพ นายจอน ศุภลักษณ์ ณ เมรุวัดแก้วฟ้าล่าง วันที่ 8 กุมภาพันธ์ 2508
การระบาดของโควิด-19 แบบ Superspreader LINK
การระบาดแบบ Superspreader คือ การแพร่กระจายเป็นวงกว้างอย่างรวดเร็ว แม้ว่าแหล่งกำเนิดเชื้อ หรือจำนวนผู้ป่วยจะมีเพียคนเดียว เช่น ผู้ป่วยโรโควิด-19 ข้าไปในพื้นที่ที่มีความแออัดและไม่มีมาตรการป้องกัน ทำให้ผู้คนที่อาศัยอยู่บริวณนั้นมีความเสี่ยงต่อการติดเชื้อสูง
การป้องกันการเกิดการระบาดแบบ Superspreader
- หลีกเลี่ยงการเข้าไปในพื้นที่แออัด
- สวมหน้ากากอนามัยตลอดเวลาเมื่ออยู่ในพื้นที่สาธารณะ
- เว้นระยะห่างระหว่างบุคคล
- ล้างมือด้วยสบู่หรือเจลแอลกอฮอล์เป็นประจำ
คำแนะนำสำหรับบุคคลที่เข้ไปในพื้นที่เสี่ยงเกิด Superspreader
- เมื่อทราบว่าตนเองเข้าไปในพื้นที่เสี่ยง ควรกักตัวทันทีเพื่อสังเกตอาการเป็นเวลา 14 วัน นับจากวันที่เข้าไปในพื้นที่เสี่ยง
- หากมีอาการ เช่น มีใช้สูง ปวดเมื่อย เหนื่อย เพลีย ไอ คัดจมูก จมูกไม่ได้กลิ่น ลิ้นไม่รับรส หรืออาการที่พบได้น้อย เช่น ถ่ายเหลว ท้องเสีย เจ็บคอ ในช่วงเวลาเฝ้าระวังหลังกลับจากพื้นที่เสี่ยง ควรรีบมาพบแพทย์ทันที
ข้อมูล ณ วันที่ 4 มกราคม 2564
ที่มา : อ. พญ.ปัทมา ตวรพานิช
ตอนที่ ๒ กักตัว
เพื่อนถามว่าทำไมต้องพัทยา ไม่รู้ค่ะ ? แต่คิดว่าเพราะรัฐบาลไม่อยากให้ไปแออัดอยู่แต่ในกทมและก็ได้ช่วยกระตุ้นศกท้องถิ่นไปในตัว เพราะแค่วันแรกที่เปิดให้สั่งอาหารนอกเหนือจากเมนูที่จัดให้ทุกวันและของใช้จำเป็น ยอดสั่งก็พุ่งขนาดโรงแรมต้องแจ้งให้ใจเย็นๆ รอนิสสสนึง ?
เมื่อมาถึงโรงแรมก็ต้องทะยอยลงทีละกลุ่ม เว้นระยะอย่างน้อยเมตรครึ่งตลอดเวลา แม้ว่าจะนั่งหายใจรดต้นคอกันมาในเครื่องของป้าม่วงกว่าสิบชั่วโมงแล้วก็ตาม ? ลงมารับป้ายกระเป๋า รับกุญแจ เดินตามคิวที่จนทบอก เข้าห้องพักอย่างสงบเสงี่ยม ใครรับไม่ได้ แนะนำให้ไป ASQ ค่ะ น่าจะหรูหรา...สมราคากว่า หรือใครโชคดีได้แอมบาสเดอร์หรือเมอร์เคียว ก็ว่าไป ?
จากนั้นก็เปลี่ยนเป็นโหมดกินและนอน เชิญ jetlag นั่งถ่างตากันให้เต็มที่เลยค่ะ ? อาหารสามมื้อ ไม่มีของว่างและของหวาน แต่สั่งเพิ่มได้
ต้องลงไลน์กลุ่มหลายกลุ่มอยู่ แต่หลักๆ คือ กลุ่มของโรงแรมสำหรับจนทแจ้งข่าวสารต่างๆ และกลุ่มของพยาบาลสำหรับการวัดไข้ประจำวันและปัญหาสุขภาพอื่นๆ วัดไข้เองวันละสองรอบ เช้าเจ็ดโมง เย็นหกโมง ถ่ายรูปส่งเข้าไลน์กลุ่มพยาบาล
17 ธันวาคม 2020
คำถามที่พบบ่อย ของรพ.ราชบุรี
พระนครศรีอยุธยา มีคำสั่งตั้งแต่ 5 พ.ค. 2563 และยังมีผลบังคับใช้อยู่ในปัจจุบัน LINK
จังหวัดพระนครศรีอยุธยา ยังคงคำสั่งให้
- ประชาขนสวมใส่หน้ากากอนามัย/หน้ากากผ้าทุกครั้ง ก่อนออกจากเคหสถาน และทุกครั้งที่อยู่นอกเคหสถาน หรือเมื่อไปในสถานที่ที่มีคนจำนวนมาก
- ผู้อยู่ในเคหสถาน/ร้านค้า/สถานที่ ที่ต้องติดต่อกับผู้คนอื่น ต้องสวมใส่หน้ากากทุกครั้ง
- ผู้ใดฝ่าฝืนต้องระวางโทษปรับไม่เกิน 20,000 บาท
ตามคำสั่งจังหวัดที่ 1496/2563 มีผลตั้งแต่ 5 พ.ค. 2563 และยังมีผลบังคับใช้อยู่ในปัจจุบันครับ
6. แสดงสิทธิที่เกิดใหม่
ระบบแสดงสิทธิที่เกิดใหม่ทันที ที่เครือข่ายหน่วยบริการที่เลือกไว้
ระบวันที่ใช้สิทธิได้ เป็นต้นไป
สามารถตรวจสอบสิทธิ เพื่อดูรายละเอียดสิทธิที่เกิดใหม่ได้
Yamachan Thailand ลุงยามะแจกโปรแรง ซื้อปีกไก่ทอดยามะจัง 1 ที่ แถมฟรีอีก 1 ที่ LINK
Yamachan Thailand
ใครฉีดวัคซีนแล้วบ้าง! ลุงยามะแจกโปรแรง! ซื้อปีกไก่ทอดยามะจัง 1 ที่ แถมฟรีอีก 1 ที่ไปเลย‼️ เพียงแสดงหลักฐานการฉีดวัคซีน Covid-19 ที่หน้าร้าน ก็รับสิทธิ์ไปเลยจ้า ดูแลสุขภาพกันด้วยนะทุกคน ?
โปรนี้เราจัดให้ยาวๆ ถึงวันที่ 30 มิถุนายนนี้เลยนะ?⚡️
เงื่อนไข :
- แสดงบัตรฉีดวัคซีนตัวจริงแก่พนักงานก่อนรับสิทธิ์
- สงวนสิทธิ์เฉพาะผู้ที่มาซื้อด้วยตัวเองที่หน้าร้านเท่านั้น
- 1 คน / 1 สิทธิ์
- ไม่สามารถใช้ร่วมกับโปรโมชั่นอื่นได้
Czech ใบรับรองวัคซีน สาธารณรัฐเช็ค
สาธารณรัฐเช็ค ออกใบรับรองให้กับชาวเช็คที่ได้รับวัคซีนเข็มที่ 2 แล้ว 14 วัน มี 2 รูปแบบทั้งเอกสารและแบบดิจิตอล (QR Code) แต่สามารถลงทะเบียนขอได้ตั้งแต่รับเข็มแรก ผ่านทางเว็บไซต์ของ
กระทรวงสาธารณสุข ใบรับรองมี 3 กรณี 1) ติดโควิด 2) รับรองผลตรวจโควิดเป็นลบ (ได้ทั้ง 2 วิธีคือ AG หรือ PCR) 3) รับรองการรับวัคซีน ทั้งได้รับ 1 หรือ 2 โดส
Ref:
Covid Portal,
Vaccination certificateเทศบาลเมืองใหม่บางบัวทอง LINK
วัคซีนทางเลือก ชิโนฟาร์ม ขยายเวลาลงทะเบียน ถึงวันที่ 9 กรกฎาคม 2564
สำหรับท่านที่มีอายุ 18 ปีขึ้นไปและมีทะเบียนบ้านในเขตเทศบาลเมืองใหม่บางบัวทอง
ณ ชั้น 1 สำนักงานเทศบาลเมืองใหม่บางบัวทอง
สอบถามข้อมูลเพิ่มเติม
8-9 อาการแพ้ที่อาจเกิดขึ้น
8 ผู้ป่วยบางรายอาจเกิดอาการแพ้
ให้หยุดยา ให้พบแพทย์หรือแพทย์แผนไทย และอาจเลี่ยงไปใช้กลุ่มสารสกัดกระชายแทน
9 ถ้ามีอาการหน้ามืด ความดันต่ำ ให้นั่งหรือนอนพักอาการจะดีขึ้น ใน 30 นาที
ศูนย์พักคอย ที่บ้านหรือชุมชน
เขตพระนคร ออกหน่วยเคลื่อนที่ให้บริการ ฟรี วันที่ 6 – 17 กันยายน 2564
เขตพระนคร ออกหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี วันที่ 6 – 17 กันยายน 2564 (เว้นเสาร์-อาทิตย์)
- วันจันทร์ที่ 6 กันยายน 2564 - ชุมชนวัดเทพธิดาราม
- วันอังคารที่ 7 กันยายน 2564 - วัดเอี่ยมวรนุช และ สามเสน ซอย 8
- วันพุธที่ 8 กันยายน 2564 - ชุมชนเฟื่องทอง-ตรอกวิสูตร
- วันพฤหัสบดีที่ 9 กันยายน 2564 - วัดสุทัศนเทพวราราม
- วันศุกร์ที่ 10 กันยายน 2564 - ชุมชนวัดนรนาถ
- วันจันทร์ที่ 13 กันยายน 2564 - ชุมชนโบสถ์พราหมณ์
- วันอังคารที่ 14 กันยายน 2564 -ชุมชนมัสยิดบ้านตึกดิน
- วันพุธที่ 15 กันยายน 2564 - ชุมชนวัดอินทรวิหาร
- วันพฤหัสบดีที่ 16 กันยายน 2564 - วัดมหาธาตุฯ และ ชุมชนวัดสามพระยา
- วันศุกร์ที่ 17 กันยายน 2564 - วัดพระเชตุพนวิมลมังคลาราม
สอบถามรายละเอียดได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพระนคร โทร. 0 2281 8124-25, 0 2281 5370 ต่อ 6566 หรือ 0 2281 8921
วิธีการทิ้งชุดทดสอบ
วิธีการทิ้งชุดทดสอบ
ทำได้โดยการเติมน้ำยาล้างจานหรือผงซักฟอกลงบนชุดตรวจและทิ้งลงในถุงพลาสติก มัดปากถุงให้มิดชิดพร้อมทั้งเขียนหน้าถุงว่า ชุดตรวจ covid19 และทิ้งรวมกับขยะอื่น
หากมีถังขยะสีแดงใกล้เคียงควรทิ้งลงในถังขยะสีแดง
แยกของกินของใช้ส่วนตัว เลี่ยงใช้ของร่วมกับผู้อื่น แยกกินแต่ไม่แยกทาง นะน้องนะ
เขตสุขภาพที่ 6 ชลบุรี
สำนักงานป้องกันควบคุมโรคที่ 6 จังหวัดชลบุรี
-เบอร์โทรศัพท์: 038 271 881-2
-เว็บไซต์: https://ddc.moph.go.th/odpc6/
ชลบุรี
- หน่วยกามโรคและโรคเอดส์ที่ 6.1 อำเภอบางละมุง (ศูนย์พัทยารักษ์)
เบอร์โทรศัพท์: 038 199 346
อีเมล์: pr.dpc6@gmail.comรพ.บี.แคร์ เมดิคอลเซ็นเตอร์ ร่วมกับ 2 โรงแรม ให้บริการฮอลพิเทล
รพ.บี.แคร์ เมดิคอลเซ็นเตอร์ ร่วมกับ 2 โรงแรม พร้อมให้บริการ Hospitel ใน 2 ทำเล ได้แก่ โรงแรมได้แก่ Gold Orchid Hotel ถนนวิภาวดี มีแบบห้องพักเดี่ยว และแบบห้องพักคู่ และ โรงแรม Grand 5 Hotel & Plaza Sukhumvit ย่านถนนสุขุมวิท มีแบบห้องพักเดี่ยว และแบบห้องพักคู่ เช่นกัน ผู้จะเข้าใช้บริการ ต้องเป็นไปตามเกณฑ์และดุลยพินิจที่แพทย์จะวินิจฉัย สอบถามรายละเอียดได้ที่ โทร 092-2814991
9. ศูนย์ควบคุมระบบป้องกันน้ำท่วม
ศูนย์ควบคุมระบบป้องกันน้ำท่วม รายงานสภาพฝน ปริมาณฝน พื้นที่น้ำท่วมขังเป็นระยะๆ และสรุปสถานการณ์เพื่อแจ้งเตือนและประชาสัมพันธ์ผ่านหน่วยงานต่างๆ รวมถึงช่องทางโซเชียลมีเดีย
สนข.บางพลัด ลงพื้นที่แก้ไขปัญหาน้ำท่วมขังในชุมชน จากน้ำเจ้าพระยาหนุนสูง LINK
สนข.บางพลัด ฝ่ายโยธา ลงพื้นที่แก้ไขปัญหาน้ำท่วมขังในชุมชนเนื่องจากน้ำในแม่น้ำเจ้าพระยาหนุนสูง (ปั๊มน้ำมัน) วันที่ 30 กันยายน 2564นายพงษ์จักรินทร์ ถาวรพงษ์ ผู้อำนวยการเขตบางพลัด มอบหมายนางสาวจินตนา ชาญศรี หัวหน้าฝ่ายโยธา จัดเจ้าหน้าที่ฝ่ายโยธา ลงพื้นที่ เพื่อตรวจสอบและเเก้ไขปัญหาน้ำท่วมขัง ในชุมชนสะพานยาว ซอยจรัญสนิทวงศ์ 70/2 แขวงบางพลัด เนื่องจากน้ำในแม่น้ำเจ้าพระยาหนุนสูง เพื่อแก้ไขปัญหาความเดือดร้อนของประชาชนได้ทันทีตามนโยบายของ พล.ต.อ.อัศวิน ขวัญเมือง ผู้ว่าราชการกรุงเทพมหานคร
หนองคาย Kick Off ฉีดวัคซีน Pfizerในเด็กนักเรียน ต้อนรับเปิดเทอม LINK
4 ตุลาคม 2564 เวลา 08.15น. นายมนต์สิทธิ์ ไพศาลธนวัฒน์ ผู้ว่าราชการจังหวัดหนองคาย ได้เป็นประธานเปิดกิจกรรม Kikc Off สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม พร้อมด้วยนางรณิดา เหลืองฐิติสกุล รองผู้ว่าราชการจ.หนองคาย นพ.ชัชวาลย์ ฤทธิ์ฐิติ นายแพทย์สาธารณสุขจ.หนองคาย ดร.จรินทร์ สุรเสรีวงษ์ ศึกษาธิการจ.หนองคาย และคณะผู้บริหาร เข้าร่วมกิจกรรมฉีดวัคซีนป้องกันโรคโควิด-19 ให้แก่เด็กนักเรียนอายุ 12ปีขึ้นไป ซึ่งเป็นกิจกรรมที่ดำเนินการพร้อมกันทั่วประเทศ รับชมการถ่ายทอดสดผ่านทาง OBEC CHANNEL ประธานโดย พล.อ.ประยุทธ์ จันทร์โอชา นายกรัฐมนตรี ทั้งนี้ จังหวัดหนองคาย ได้จัดกิจกรรมฉีดวัคซีนให้แก่เด็กนักเรียน ณ โรงเรียนราชประชานุเคราะห์ 27 อ.โพนพิสัย จ.หนองคาย บริการโดย ทีมแพทย์ พยาบาล โรงพยาบาลโพนพิสัย และศูนย์อนามัยที่8 อุดรธานี จำนวน127คน เพื่อน้องๆปลอดภัยจากโรคโควิด-19 ต้อนรับเปิดเทอม และฉีดพร้อมกันทุกอำเภอ โดยมีเป้าหมายการฉีดวัคซีน Pfizerให้เด็กนักเรียนจนครบตามจำนวนวัคซีนที่ได้รับรอบแรก จำนวน 14.400 โดส ภายในสัปดาห์ที่ 1-2 ของเดือนตุลาคม 2564 นี้
เรื่อง/ภาพ งานสื่อสารประชาสัมพันธ์ สสจ.หนองคาย
คำแนะนำในการฉีดวัคซีน Moderna รพ.พญาไท
สีสันแห่งน่านนที ประเพณีลอยกระทง อ.ชุมแสง นครสวรรค์
อ.ชุมแสง นครสวรรค์ เชิญงาน สีสันแห่งน่านนที ประเพณีลอยกระทง ณ ลานอเนกประสงค์ หน้าศาลเจ้าพ่อ-เจ้าแม่ชุมแสง ในวันที่ 19 พฤศจิกายน 2564 ตั้งแต่เวลา 17.00 น.เป็นต้นไป พบกับกิจกรรม
- การแสดงจากชุมชน และนักเรียนในเขตเทศบาล
- ชมกระทงสาย 1,000 ใบ ในน่านนที
- การประกวดภาพถ่าย
- จับสลากลุ้นรับของรางวัล ฟรี
- ร้านค้า ร้านอาหาร พื้นเมือง หลากหลายร้านค้า
- *งดเล่นพลุดอกไม้ไฟ*
- ทั้งนี้การจัดงานเป็นไปตามมาตรการป้องกันการแพร่ระบาดของเชื้อไวรัสโคโรน่า 2019 (covid-19) ตามหลัก DMHTT ที่กระทรวงสาธารณสุขกำหนด
ลอยกระทง บริเวณสะพานพระราม8 (SpringNews) LINK
"2 ปีที่รอคอย" งานลอยกระทง ปี2564 นี้เป็นไปอย่างคึกคัก ด้วยมาตรการกระตุ้นการท่องเที่ยว การจัดงานลอยกระทงจึงเกิดขึ้นภายใต้การควบคุมการแพร่ระบาด โดยมีการจัดงานหลายพื้นที่ เพื่อกระจายประชาชนไม่ให้แออัดอยู่ในพื้ที่มากเกินไป โดยในปีนี้ทาง กทม.ได้เตรียมพื้นที่จัดงานไว้ถึง 31 จุดทั่วกรุงเทฯและ ยังมีภาคเอกชนที่เข้าร่วมอีกอย่างเช่น ใต้สะพานพระราม 8 ที่มีนักท่องเที่ยวตั้งใจมาลอยกระทง และ เดินเที่ยวชิมอาหารในบรรยากาศแบบย้อนยุค ทำให้บรรยากาศการลอยกระทงครั้งนี้ดูครึกครื้น โดยมีประชาชนมาเที่ยวงานที่บริเวณสะพานพระราม8 จุดนี้ค่อนข้างหนาแน่น ทั้งนี้ยังมีเจ้าหน้าที่คอยดูแล อำนวยตวามสะดวกอย่างใกล้ชิด รวมถึงเจ้าหน้าที่ทางน้ำและทางบก เพื่อให้งานลอยกระทงเป็นไปอย่างราบรื่น
โรเบิร์ต แพตตินสัน
4 กันยายน ดาราหนุ่มสุดเท่ตรวจพบว่าติดเชื้อระหว่างถ่ายทำภาพยนตร์ แบทแมน สตูดิโอวอร์เนอร์ยืนยันว่ามีทีมงานอีกหลายคนติดเชื้อเช่นกันและประกาศพักการถ่ายทำ
อบจ.แพร่ ประกาศรับลงทะเบียนฉีดโมเดอร์นา LINK
ประกาศ อบจ.แพร่ เรื่อง ประกาศรับลงทะเบียนกลุ่มเป้าหมายผู้ประสงค์ขอรับการฉีดวัคซีน Moderna สภากาชาดไทย อบจ.แพร่ สามารถลงทะเบียนได้ตั้งแต่บัดนี้เป็นต้นไปเพื่อเพิ่มเข้าสู่ระบบ White list สภากาชาดไทย สถานที่ลงทะเบียน กองสาธารณสุข อบจ.แพร่ สำนักงานสาธารณสุขจังหวัด สำนักงานสาธารณสุขอำเภอทุกอำเภอ หมายเลขโทรศัพท์ 054 532485 ต่อ 330 และเบอร์โทร 064 3969102
Cockpit มีบริการตรวจสภาพรถยนต์และตรวจเช็ครถยนต์ 35 รายการ ฟรี โทร: 1369 LINK
ศูนย์เช็คสภาพรถ Cockpit ตรวจสภาพรถยนต์และตรวจเช็ครถยนต์ 35 รายการ ฟรี ดังนี้
1. เช็คระยะรถยนต์ ส่วนยางอะไหล่ 2. ลูกปืนล้อ 3. น็อตล้อ 4. กระทะล้อ 5. ความดันลมยาง 6. สภาพวาล์ว 7.สภาพหน้ายาง 8. สภาพแก้มยางด้านใน 9. สภาพแก้มยางด้านนอก 10. สภาพขอบยางด้านใน 11. สภาพขอบยางด้านนอก 12. ความลึกร่องดอกยาง 13.เช็คระยะน้ำมันเครื่อง 14. เช็คระยะน้ำมันเกียร์ 15. เช็คระยะน้ำมันคลัตช์ 16. เช็คระยะน้ำมันพวงมาลัย 17. น้ำยาหล่อเย็น 18. กรองอากาศ 19. ผ้าเบรก 20. จานเบรก 21. ตรวจสภาพรถยนต์กระบอกสูบเบรก 22. สายอ่อนเบรก 23. น้ำมันเบรก 24. โช้คอัพ 25. ลูกหมากบังคับเลี้ยว 26. ลูกหมากปีกนก 27. ชุดลูกยางแหนบหลัง 28. ตรวจสภาพรถยนต์ส่วนลูกหมาก/ลูกยางกันโคลง 29. ยางเบ้าโช้คอัพ 30. ยางกันฝุ่นโช้คอัพ 31. ยางหุ้มเพลาขับ 32. ยางหุ้มแร็คพวงมาลัย 33. น้ำกลั่นแบตเตอรี่ 34. ใบปัดน้ำฝน 35. น้ำฉีดกระจก
โทร: 1369
Zone : 7 วัฒนะระลึก
โซนนี้จะมีเครื่องวัดอายุร่างกาย ที่คุณสามารถชั่งเพื่อดูว่าร่างกายของคุณมีความสามารถในการเผาผลาญเท่ากับคนอายุเท่าไหร่ รวมถึงน้ำหนักเป้าหมายที่ควรจะเป็นซึ่งจะเป็นแนวทางในการเริ่มต้นดูแลตัวเอง ให้มีสุขภาพที่ดีและดูอ่อนวัยอยู่เสมอครับ
และอีกหนึ่งไฮไลท์ที่น่าสนใจคือ...เราจะพาคุณไปเห็นใบหน้าของคุณในวัยชราว่าจะเปลี่ยนแปลงไปจากเดิมมากน้อยแค่ไหน พร้อมคำแนะนำเพื่อให้ก้าวสู่วัยชราอย่างมีสุขภาวะ และสามารถเซฟเก็บเป็นที่ระลึกอีกด้วยนะครับ
การทำตลาด Plant-based Food ในไทย
สำหรับการทำตลาด Plant-based Food ในไทย คาดว่าจะเริ่มต้นจากตลาด B2B ระหว่างผู้ผลิต Plant-based Food กับร้านอาหาร ด้วยการนำวัตถุดิบไปประกอบอาหารเป็นเมนูทางเลือกให้กับ
ลูกค้าที่รักสุขภาพ เช่นเดียวกับที่ต่างประเทศ ที่ร้านอาหารประเภทจานด่วนมีเมนูเป็น Plant-based Food เพิ่มขึ้นนั่นเอง
แต่อย่างไรก็ดี ก่อนที่ผู้ประกอบการจะกระโดดลงสู่สนาม Plant-based Food ต้องทำความเข้าใจและศึกษาตลาดนี้ อย่างรอบด้าน โดยอย่างแรกที่ผู้ประกอบการต้องรู้ นั่นคือ
นครพนม แดนกัญชาดี
นครพนม แดนกัญชาดี แต่ตอนนี้สินค้ายังน้อย ค่อยๆ พัฒนาไป
รพ.ห้วยเกิ้ง อุดรธานี
รพ.ห้วยเกิ้ง อุดรธานี เป็นอีกแห่งในอุดรที่ มุ่งมั่นจริงจังกับผลิตภัณฑ์กัญชาทางการแพทย์ ควบคู่กับไปการส่งเสริมด้านการท่องเที่ยวเชิงสุขภาพ
เยลลี่กัมมี่ ขนมเยลลี่สำเร็จรูป ผสมน้ำผลไม้ และผสมกลิ่นผลไม้และสมุนไพร Terpene Infused
น้ำนมเมล็ดกัญชง Hemp Seed Milk สูตรเจ และสแนคบาร์ "เมล็ดกัญชงผสมธัญพืชอัดแท่ง"
โปรตีนจากน้ำมันกัญชง ในรูปเครื่องดื่ม และแบบแท่ง
ทิวม่วงตะแบก ณ อ่างเก็บน้ำบางพระ ศรีราชา
ทุกปีเมื่อเข้าสู่ช่วงเดือนกุมภาพันธ์-มีนาคม "ดอกตะแบก" บริเวณริมอ่างเก็บน้ำบางพระ อ.ศรีราชา จ.ชลบุรี จะออกดอกบานสะพรั่งสวยงาม และเต็มไปด้วยธรรมชาติที่สวยงามริมสองข้างทาง
สปส. กรุงเทพมหานครพื้นที่ 7 LINK
ตั้งอยู่เลขที่ 17 ถนนกาญจนาภิเษก แขวงบางบอน เขตบางบอน กทม. 10150
** จุดสังเกต : ตรงข้ามตลาดสด DK **
รับผิดชอบเขต จอมทอง ทุ่งครุ บางขุนเทียน บางบอน ราษฎร์บูรณะ
Facebook พื้นที่ 7 แผนที่
Tel. 02-4150995, 02-4157371, 02-4157704, 02-4157049, 02-4150569, 02-4153836
Fax 02-4158488
ฝ่ายอำนวยการ 02-4157371
งานสิทธิประโยชน์ทดแทน 02-4157704
งานการเงินและบัญชี 02-4157049
งานเงินสมทบ 02-4150569
งานทะเบียนและประสานการแพทย์ 02-4153836
โรงพยาบาลนภาลัย สมุทรสงคราม เปิด walk in จัดฉีดเข็ม 1-2-3 LINK
โรงพยาบาลนภาลัย walk in จัดฉีดเข็ม 1-2-3 เฉพาะวันที่ 3, 10, 17, 23 และ 24 กุมภาพันธ์ 2565 เวลา 08.30 - 15.30 น. เปิดรับวันละ 600 คน
สถานที่ คือ อาคารเอนกประสงค์เทศบาลตำบลกระดังงา อ.บางคนที (รายละเอียดตามประกาศ) … มีข้อสงสัย สอบถามที่งานประกันสุขภาพ 091-7154948 หรือ 034-761476 ถึง 8 ต่อ 4113, 4114 ในวันและเวลาราชการ
โรงพยาบาลสุรินทร์ เชิญชวนบริจาคเลือดได้ทุกวัน LINK
ขอเชิญผู้ที่มีสุขภาพแข็งแรงร่วมบริจาคโลหิต "ทุกคนเป็นฮีโร่ได้ ด้วยการบริจาคโลหิต" ติดต่อบริจาคโลหิตได้ที่ งานคลังเลือด ชั้น 2 ตึกพยาธิวิทยา เวลา 08.30 - 16.00 น. ทุกวัน ( หยุดพักเที่ยง ) สอบถามโทร.. 044-511757 ต่อ 17201, 17202
7. Blooming With Love บลูพอร์ต หัวหิน 8 – 14 ก.พ. 65 LINK
กิจกรรมเอาใจคนมีคู่ Blooming With Loveเมื่อรักเบ่งบาน ดอกไม้ก็งดงาม บลูพอร์ต หัวหินได้จัดงานเอาใจคนอินเลิฟให้มาเก็บภาพความรัก
- A park of love สวนดอกเบญจมาศหลากสีสันสื่อแทนรักแท้ จัดเต็มพื้นที่ ณ ลานเดอะสแควร์
- A sense of love นิทรรศการภาพวาดแห่งรักโดยศิลปินชั้นนำระดับประเทศ ณ เดอะแกลเลอรี หัวหิน ชั้น 2
- A journey of love พบกับ Jeep Meet Love งดงามในความแกร่ง จุดถ่ายภาพรถจี๊ปสีแดงสด ที่ประดับด้วยดอกไม้ สีขาว ชมพู ณ เอเทรี่ยม ชั้น G
- Flavour of love ช็อปผลิตภัณฑ์จากดอกไม้และดอกไม้ทานได้
ณ ห้างบลูพอร์ต หัวหิน ตั้งแต่วันที่ 8 – 14 ก.พ. 65 เปิดให้บริการเวลา 10:00 – 20:00 น. Call : 032 905 111
โรงงานทำขาเทียมพระราชทาน แผนกกายภาพบำบัด โรงพยาบาลกุมภวาปี LINK
โรงงานทำขาเทียมพระราชทาน แผนกกายภาพบำบัด โรงพยาบาลกุมภวาปี เปิดให้บริการทำขาเทียมใหม่ และซ่อมเเซมขาเทียมเก่า สำหรับผู้พิการทั้งในเขตและนอกเขต
- ขาเทียมระดับเหนือเข่า ใช้เวลาทำ2-3 วัน
- ขาเทียมระดับข้อเข่าใช้เวลา 2-3
- ขาเทียมระดับใต้เข่า ใช้เวลา 1-2 วัน
- ขาเทียมระดับข้อเข่า ใช้เวลา 1-2 วัน
ฟรีทุกสิทธิ์ โดยไม่มีค่าใช้จ่ายใดๆ
ท่านที่สนใจสามารถติดต่อสอบถามได้ที่ โทร
042 334400 -3 ต่อ2100,0814716088
โรงพยาบาลวิภาราม อมตะนคร รับสมัครงาน จำนวนมาก LINK
โรงพยาบาลวิภาราม อมตะนคร ประกาศ!!!! เปิดรับสมัครพนักงานหลายอัตรา
ปริญญาตรี/ปวส.
- เจ้าหน้าที่การตลาด
- เจ้าหน้าที่เลขาแพทย์
- เจ้าหน้าที่ADMISSION
- เจ้าหน้าที่ พรบ.
- เจ้าหน้าที่การเงิน
- เจ้าหน้าที่คอมพิวเตอร์
- เจ้าหน้าที่ศูนย์โทรศัพท์
- เจ้าหน้าที่ห้องแฟ้ม
วุฒิ ม.3/เทียบเท่า
- เจ้าหน้าที่ยานพาหนะ (เพศชาย/มีใบขับขี่รถยนต์)
- เจ้าหน้าที่รักษาความปลอดภัย (เพศชาย/เป็นเจ้าหน้าที่ประจำโรงพยาบาล)
- เจ้าหน้าที่เวรเปล
พนักงานผู้ช่วย วุฒิ ม.6/เทียบเท่า มีใบบริบาล
- พนักงานผู้ช่วยแพทย์ ER
- ผู้ช่วยกายภาพบำบัด
- พนักงานผู้ช่วยเหลือผู้ป่วย OR
- พนักงานผู้ช่วยแพทย์ OPD มะเร็ง
- พนักงานผู้ช่วยแพทย์ OPD ตรวจสุขภาพ
**หมายเหตุ**
- กรุณาแต่งกายให้สุภาพ ในวันที่มาสมัครงาน
- สามารถเข้ามาสมัครได้ทุกวันจันทร์ - ศุกร์ เวลา 08.00 - 16.00 น.
(ยกเว้นเวลา 12.00 - 13.00 น. และวันหยุดนักขัตฤกษ์)
สอบถามข้อมูลเพิ่มเติมที่ โทรศัพท์ 033-265-599 ต่อ 2212 แผนกบุคคล
ท่านสามารถส่งประวัติมาได้ที่ hr_vibharam@hotmail.com
โรงพยาบาลศรีธัญญา นำร่องระบบจิตเวชทางไกล
ปิดท้ายด้วยโรงพยาบาลนำร่องที่ได้นำบริการรูปแบบ "ระบบจิตเวชทางไกล" มาปรับใช้กับโรคไบโพลาร์และโรคจิตเวชอื่นๆ เป็นแห่งแรก พญ. มธุรดา สุวรรณโพธิ ผู้อำนวยการ โรงพยาบาลศรีธัญญา กล่าวเสริมว่า "ระบบจิตเวชทางไกล (Telepsychiatry) มีบทบาทสำคัญอย่างมากในการช่วยเหลือดูแลผู้ป่วยโรคไบโพลาร์ และโรคทางจิตเวชอื่นๆ
โดยโรงพยาบาลศรีธัญญา ได้เริ่มดำเนินการเป็นแห่งแรกเมื่อเดือนกุมภาพันธ์ 2563 ที่ผ่านมา โดยให้การทำจิตบำบัดผ่านระบบออนไลน์ หลังจากนั้นจึงได้ขยายบริการรูปแบบออนไลน์ไปยังส่วนต่างๆ เพิ่มขึ้น อาทิ บริการจิตเวชทางไกลให้กับนักโทษในเรือนจำ สถานสงเคราะห์ หรือให้บริการยาผ่านทางไปรษณีย์ เป็นต้น โดยในปี 2563 สามารถให้บริการได้ทั้งสิ้น 2,081 ราย ต่อมาในปี 2564 สามารถขยายบริการจิตเวชทางไกลเพิ่มขึ้นเป็น 17,490 ราย และในปี 2565 ได้เริ่มให้บริการกับประชาชนเป็นรายบุคคล
จากข้อมูลล่าสุดเดือนกุมภาพันธ์ 2565 โรงพยาบาลศรีธัญญาได้ให้บริการผ่านระบบจิตเวชทางไกล จำนวน 3,717 ราย ซึ่งมีแนวโน้มจะเพิ่มสูงขึ้นอย่างต่อเนื่อง นอกจากนี้ ในปีนี้ โรงพยาบาลศรีธัญญาได้ร่วมกับหน่วยงานที่เกี่ยวข้องเพื่อส่งต่อผู้ป่วยทั้งภายในและภายนอกกระทรวงสาธารณสุขของจังหวัดนนทบุรี โดยอยู่ระหว่างการพัฒนาระบบการส่งต่อผู้ป่วยจิตเวชฉุกเฉินโดยผ่านระบบออนไลน์ เพื่อเพิ่มความสะดวกรวดเร็วในการให้บริการ และยกระดับการส่งต่อผู้ป่วยให้มีประสิทธิภาพมากยิ่งขึ้น
ค่าบริการตรวจหาเชื้อ Covid-19 เกษมราษฎร์ประชาชื่น RT-PCR เริ่ม 2,000 บาท
รพ.เกษมราษฎร์ประชาชื่น ให้บริการตรวจหาเชื้อ Covid-19 เปิดบริการทุกวัน 8.00-15.00 น (Walk in อย่างเดียว) - เริ่มแจกบัตรคิวประมาณ 7.00น -รับคิวตรวจประมาณ 300 คิว/วัน "ดูแลใกล้ชิด สนิทเหมือนญาติ" สอบถามโทร : ARI Clinic 02-910-1600 ต่อ 1106, 1695
โรงพยาบาลสหวิทยาการมะลิ Post Covid-19 Check Up เริ่มต้น 499 บาท
โรงพยาบาลสหวิทยาการมะลิ จัดโปรแกรม Post Covid-19 Check Up ตรวจร่างกายหลังติดเชื้อโควิด-19 รายการตรวจ 4 รายการ เริ่มต้นที่ราคา 499 บาท เท่านั้น สามารถตรวจได้สูงสุดถึง 15 รายการ
Post-CO 1-2 : เหมาะสำหรับบุคคลทั่วไปหลังติดเชื้อโควิด-19
Post-CO 3 : เหมาะสำหรับผู้ป่วยที่ยังมีอาการเหนื่อย, หอบ, ไม่มีแรง
Post-CO 4 : เหมาะสำหรับบุคคลทั่วไปหลังติดเชื้อโควิด-19 หรือหลังฉีดวัคซีนแล้ว 1 เดือน
CO-Plus A : กรณีที่มีอาการสงสัย เกี่ยวกับโรคหัวใจ
CO-Plus B : กรณี CXP ผิดปกติ หรือสงสัยโรคปอดเป็นหลัก
CO-Plus C : กรณีที่มีอาการใจสั่น, วูบ
หมายเหตุ : กรณีผลปกติ แนะนำเป็นการฟื้นฟูปอดหลังติดเชื้อ
1. โปรแกรมฟื้นฟูด้วยฮอร์โมนซ่อมแซม ราคา 5,600 บาท/เดือน
2. วัคซีนแนะนำ ได้แก่ วัคซีนโควิดชนิด mRNA / วัคซีนไข้หวัดใหญ่ ราคา 790 บาท
วัคซีนป้องกันปอดอักเสบ สำหรับบุคคลอายุไม่เกิน 65 ปี ราคา 2,800 บาท
โปรโมชั่นตั้งแต่วันนี้ - 30 มิถุนายน 2565 ผ่อนชำระ 0% นาน 10 เดือนกับบัตรเครดิตที่ร่วมรายการ (* โปรดตรวจสอบเงื่อนไขก่อนเข้ารับบริการ) รับบริการได้ที่ แผนก Check Up ชั้น 2 สอบถามเพิ่มเติม Call Center : 1307 หรือโทร. 02-089-111
ARI Clinic One Stop Fast Track ATK หรือ RT-PCR เป็นบวก รพ.สหวิทยาการมะลิ LINK
ARI Clinic One Stop Fast Track คลินิกคัดกรองโรคติดเชื้อทางเดินหายใจ
✅ พบและปรึกษากับทีมแพทย์ พยาบาล
✅ ตรวจเลือด (ตามดุลย์พินิจแพทย์)
✅ เอกซเรย์ปอด (ตามดุลย์พินิจแพทย์)
✅ รับยา
โปรแกรมนี้เหมาะสำหรับ
• ผู้ป่วยที่มีผล ATK หรือ RT-PCR เป็นบวก
• อายุ 15 - 60 ปี
• ไม่มีโรคประจำตัว
• อาการไม่รุนแรง สามารถดูแลตัวเองได้
ตรวจพบ รักษาจบในจุดเดียว
แผนกคัดกรองโรคติดเชื้อทางเดินหายใจ ชั้น 1
สอบถามรายละเอียดเพิ่มเติมได้ที่ Call Center : 1307 หรือโทร. 02-089-111
โรงพยาบาลภัทร-ธนบุรี บริการวัคซีน Moderna ราคา 1,650 บาท/เข็ม
เปิดจองวัคซีนทางเลือก Moderna โดยตรงกับทาง
รพ.ภัทร-ธนบุรี สามารถเข้ารับการฉีดได้ในเดือน มกราคม 2564 - กรกฎาคม 2565 ราคา 1,650 บาท/เข็ม สอบถามรายละเอียดเพิ่มเติม โทร. 02-901-8400-8
เปาโล เกษตร เปิดให้บริการ Hospitel โทร.02-1500-900
โรงพยาบาลเปาโล เกษตร โทร.02-1500-900
ร่วมกับโรงแรมมารวย การ์เด้นท์ เปิดให้บริการ Hospitel สำหรับผู้ประกันตนที่มีผลตรวจ ATK 2 ขีด เปิดลงทะเบียนเวลา 08.00 รับจำนวนจำกัด (โรงพยาบาลแจ้งยืนยันเข้ารับการรักษาให้ทราบผ่าน SMS) หมายเหตุ : หากคิวเต็มจำนวน ท่านจะไม่สามารถลงทะเบียนได้ กรุณาติดต่อลงทะเบียนใหม่ในวันต่อไป
10 บทหลัก Health Brings Wealth
ภายในเล่มประกอบด้วยเนื้อหา 10 บทหลัก ด้วยกัน
บทที่ 1 Hippocrates บิดาแห่งการแพทย์สมัยใหม่ (Hippocrates on Preventive Healthcare)
บทที่ 2 ตำนาน นพ.ปราเสริฐ ปราสาททองโอสถ (The Legacy of Dr. Prasert Prasarttong-Osoth)
บทที่ 3 สี่แพทย์ผู้เชี่ยวชาญ (Co-Authors)
บทที่ 4 การออกกำลังกายคือยารักษาโรคที่ไม่ต้องเสียเงินซื้อ (Physical Activity is Your Cheapest Medicine)
บทที่ 5 โภชนาการที่สมดุลคือกุญแจสู่การมีสุขภาพดี (Balanced Nutrition is Key for Your Health)
บทที่ 6 เวชศาสตร์ป้องกันกับโรคหัวใจ สิ่งที่ต้องรู้และต้องทำ (Preventive Cardiology: What you Need to Know and Do)
บทที่ 7 การเพิ่มประสิทธิภาพสมองอย่างไรให้ได้ผลดี (Optimizing Brain Wellness As You Age)
บทที่ 8 เวชศาสตร์วิถีชีวิต : 5 เสาหลักเพิ่มประสิทธิภาพสุขภาพของคุณ (Lifestyle Medicine: Five Pillars for Optimizing Your Health)
บทที่ 9 เรื่องราวจากผู้ป่วย (Patient Stories)
บทที่ 10 เมนูเพื่อสุขภาพ (Recipes for Home Cooks)
หนังสือ Health Brings Wealth จัดทำด้วยกระดาษอาร์ตสี่สีทั้งเล่ม จำนวน 228 หน้า โดยจะเปิดให้สั่งซื้อได้ผ่านทางร้านหนังสือ Asiabook ประเทศไทย และ amazon.com ในราคา 990 บาท และในรูปแบบหนังสืออิเล็กทรอนิกส์ (e-Book) กลางเดือนเมษายน 2565
เพราะสมบัติที่สำคัญที่สุดคือ สุขภาพ ไม่มีอะไรที่มีค่ามากเท่าการมีสุขภาพที่ดี เป็นที่มาของคำว่า “Health Brings Wealth” หนังสือ “Health Brings Wealth” เล่มนี้จึงเหมาะที่จะส่งมอบเป็นของขวัญให้กับคนที่รักและตัวคุณเอง ส่งมอบกุญแจไขสู่การมีสุขภาพที่ดีอย่างมีคุณภาพ.
รพ.นครพิงค์ แนะแนว ตรวจ ATK ขึ้น 2 ขีด LINK
โรงพยาบาลนครพิงค์ ตรวจ ATK ขึ้น 2 ขีด
สามารถติดต่อ ศูนย์ Call Center COVID-19 จังหวัดเชียงใหม่
โทร 053-215180 (10 คู่สาย)
และ 065-4724315,065-4724316
065-4724317,065-4724318,
065-4724319
ทุกวัน เวลา 08.30-20.00 น.
สอบถามข้อมูลเกี่ยวกับโควิด-19 , วัคซีนโควิด-19 และการเดินทางเข้าจังหวัดเชียงใหม่
098-1025783, 098-1028632
084-8052121,084-8053131
098-1023422
ทุกวัน เวลา 08.30 - 20.00 น.
ประชาชนในพื้นที่ อ.ปลวกแดง ติดต่อ รพ.ต่างๆ ดังนี้
วันที่ 17 เม.ย.65 ไม่มีรายงานการเกิดอุบัติเหตุ
สรุปข้อมูลอุบัติเหตุทางถนน ช่วงเทศกาลสงกรานต์ 2565 จังหวัดสระแก้ว (ข้อมูล ณ วันที่ 17 เม.ย.65) ไม่มีรายงานการเกิดอุบัติเหตุ
สะสม 7 วัน (11-17 เม.ย.65) จังหวัดสระแก้วเกิดอุบัติเหตุ 21 ครั้ง บาดเจ็บ 22 ราย เสียชีวิต 7 ราย (อ.วังสมบูรณ์ 1 ราย อ.วัฒนานคร 2 ราย อ.ตาพระยา 2 ราย , อ.อรัญประเทศ 1 ราย, อ.เมืองสระแก้ว 1 ราย)
ยาสมุนไพรประเภทลูกกลอน
กล้วยน้ำว้า ขมิ้นชัน ฟ้าทะลายโจร
17.หน้าที่ของผู้ควบคุมข้อมูลส่วนบุคคล
"วันอาทิตย์ที่
22 ธันวาคม 2562 นับว่าเป็นที่งดงาม และควรค่าแห่งความทรงจำ ของชาวรพ.บ้านตากเป็นอย่างยิ่งที่ได้รับความเมตตาจากพ่อแม่ครูอาจารย์ จำนวนมากถึง 38 รูป มาร่วมในงานทอดผ้าทอดผ้าป่า "กองทุนโซล่าเซลล์โรงพยาบาลบ้านตาก โดยคณะศิษยานุศิษย์หลวงปูเจี๊ยะ จุนฺโท" ประธานฝ่ายสงฆ์ ได้แก่ พระครูปลัดบุญช่วย ปุญฺญวนฺโต วัดป่าภูริทัตตปฏิปทาราม อ.สามโคก จ.ปทุมธานี มีพุทธศาสนิกชน เข้าร่วม 500 คน ขออนุโมทนาบุญ ทุกท่านๆ ที่ร่วมเป็นเจ้าภาพในกองทุนโซล่าเซลล์ รวมถึง เจ้าภาพโรงทานจากทั่วสารทิศที่จัดอาหารหวานคาวมาเข้าร่วม ยอดผ้าป่าที่หลั่งไหลมาไม่ขาดสาย จำนวน 3,383,567.04 บาท"
ผ่อนคลายการเดินทางระหว่างประเทศของเจ้าหน้าที่รัฐและนักเรียนทุน
ศบค. เห็นชอบ ให้เสนอครม. เพื่อพิจารณา ยกเลิกคำสั่งห้ามเดินทางระหว่างประเทศของข้าราชการ พนักงานรัฐ บุคลากรรัฐ และรัฐวิสาหกิจ และนักเรียนทุน (ในความดูแลของกพ.)
7.เพิ่มจำนวน Excellent Center และยกระดับศูนย์เวชศาสตร์เขตเมือง
ประโยชน์คนกรุงฯ
- คนกรุงเทพฯ ได้รับบริการการรักษาโรคขั้นสูงจากแพทย์ผู้เชี่ยวชาญ ช่วยป้องกันการสูญเสียรุนแรงในชีวิตและสุขภาพร่างกาย
รายละเอียด
ปัจจุบันศูนย์ความเป็นเลิศทางการแพทย์ (Excellent Center) ภายใต้สำนักการแพทย์ กรุงเทพมหานคร มีจำนวน 8 ศูนย์ฯ ซึ่ง 4 แห่งตั้งอยู่ภายใต้โรงพยาบาลกลาง 2 แห่งอยู่ภายใต้โรงพยาบาลตากสิน และอีก 2 แห่งอยู่ภายใต้โรงพยาบาลเจริญกรุงประชารักษ์ นอกจากนี้มีแผนการผลักดันการจัดตั้งศูนย์ความเป็นเลิศเพิ่มเติมอีก 1 แห่ง คือศูนย์โรคระบบทางเดินหายใจ โรงพยาบาลสิรินธร
จากข้อมูลข้างต้นพบว่ามีการกระจุกตัวของศูนย์ความเป็นเลิศและเจ้าหน้าที่แพทย์ผู้เชี่ยวชาญเฉพาะในบางพื้นที่ ส่งผลต่อการบริการรักษาโรคเฉพาะทาง ความสะดวกสบาย และการเข้าถึงการรักษาพยาบาลของประชาชนที่ไม่ทั่วถึงครอบคลุม
ดังนั้น กทม. จะผลักดันการเพิ่มจำนวนศูนย์ความเป็นเลิศทางการแพทย์ให้ครอบคลุมกลุ่มโรคคนเมืองยุคใหม่ ตลอดจนครอบคลุมพื้นที่บริการให้ครบทั้ง 6 กลุ่มเขตทั่วกรุงเทพฯ ในโรงพยาบาลอื่น ๆ ภายใต้สังกัด นอกจากนี้ต้องมีการบูรณาการทางวิชาการและงานวิจัย ผลักดัน ตลอดจนส่งเสริมให้หน่วยงานศูนย์เวชศาสตร์เขตเมือง (Urban Medicine Center) คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช ที่อยู่ภายใต้สังกัด กทม.เป็นศูนย์วิจัยการรักษาที่มีความเป็นเลิศทั้งในระดับประเทศและนานาชาติ
คุยเรื่องไต ไขความจริง - สมาคมโรคไตแห่งประเทศไทย LINK
โครงการ “คุยเรื่องไต ไขความจริง” อัพเดทข่าวสาร สาระและความรู้เกี่ยวกับโรคไต โดยทีมแพทย์ เภสัชกร และนักกำหนดอาหาร ผู้เชี่ยวชาญจากหลากหลายสาขา ที่ผลัดเปลี่ยนกันมามอบสาระความรู้และแนวทางปฏิบัติที่ถูกต้องในการป้องกัน ดูแล และรักษาโรคไต
ผู้ที่สนใจสามารถติดตามข้อมูลข่าวสารได้ผ่านทางทางเพจ Facebook สมาคมโรคไตแห่งประเทศไทย - The Nephrology Society of Thailand #คุยเรื่องไตไขความจริง #สมาคมโรคไตแห่งประเทศไทย
โครงการศูนย์ปันน้ำใจแพทย์นาวี รพ.สมเด็จพระปิ่นเกล้า พร. โทร. 02-475-2777 LINK
โครงการศูนย์ปันน้ำใจแพทย์นาวี รพ.สมเด็จพระปิ่นเกล้า พร. จัดตั้งขึ้นเพื่อเป็นสื่อกลางในการส่งต่อสิ่งอุปกรณ์ทางการแพทย์จากผู้ให้ถึงมือผู้รับ ภายใต้แนวคิด“คุณไม่ใช้เราขอเป็นสะพานบุญ” สำหรับผู้สูงอายุและผู้ป่วย ที่มีความจำเป็นและขาดแคลนทุนทรัพย์เข้าถึง สิ่งอุปกรณ์ต่างๆได้ เพื่อเสริมสร้างคุณภาพชีวิตให้ดีขึ้น
ภารกิจ
1. รับบริจาคอุปกรณ์ทางการแพทย์ต่างๆ ที่ผู้บริจาคไม่ได้ใช้งานแล้ว มาตรวจสอบความสมบูรณ์ของอุปกรณ์ ทำความสะอาด และบริหารจัดการสำหรับการยืมและคืน
2. บริการยืมอุปกรณ์ทางการแพทย์ต่างๆ ไปใช้งานที่บ้าน โดยไม่เสียค่าใช้จ่ายใดใดทั้งสิ้น โดยจะทำการสอนวิธีการใช้ และการบำรุงรักษาอุปกรณ์ให้แก่ผู้ยืมได้รับทราบ
ติดต่อยืมอุปกรณ์ทางการแพทย์ได้ที่
- ศูนย์ปันน้ำใจแพทย์นาวี รพ.สมเด็จพระปิ่นเกล้า อาคารผู้ป่วยนอก ชั้น 3 โทร. 02-4752777
- ทุกวันจันทร์ – วันศุกร์ เวลา 09.30-11.30 และ 13.30-15.30 ยกเว้นวันหยุดนักขัตฤกษ์
เอกสารที่ใช้ : บัตรประชาชน ของผู้ป่วย และผู้ยืม
ขั้นตอน : กรอกแบบฟอร์มขอยืมอุปกรณ์ > ประเมินความจำเป็น > เรียนรู้การใช้งาน
การติดตามหลังการยืมอุปกรณ์ทางการแพทย์
- เจ้าหน้าที่ศูนย์ปันน้ำใจฯ จะติดตามการใช้งานอุปกรณ์เครื่องมือต่างๆ ทุก 3 เดือน, 6 เดือน, 1 ปี และ 2 ปี
ติดต่อร่วมบริจาคได้ที่
- มูลนิธิสมเด็จพระปิ่นเกล้า โทร. 02-4752777
- กลุ่มงานประชาสัมพันธ์ รพ.ฯ โทร. 02-4752532
โรงพยาบาลสมเด็จพระยุพราช เดชอุดม จ.อุบลราชธานี LINK
โรงพยาบาลสมเด็จพระยุพราชเดชอุดม จ.อุบลราชธานี เป็นโรงพยาบาลสมเด็จพระยุพราชขนาดใหญ่ 180 เตียง ภายใต้การบริการของ มูลนิธิโรงพยาบาลสมเด็จพระยุพราช (ปัจจุบันมี 21 แห่งทั่วประเทศ) ตั้งอยู่ที่ ถนน โชคชัย-เดชอุดม ตำบล เมืองเดช อำเภอเดชอุดม อุบลราชธานี เปิดให้บริการครั้งแรก ปี 2512 ปัจจุบันได้รับรองมาตรฐาน Hospital Re-Accreditation เปิดรับประกันสังคมเป็นครั้งแรก ปี 2565 เป็นแห่งที่ 4 ของจังหวัด มีโรงพยาบาลชุมชนในทุกอำเภอและโรงพยาบาลส่งเสริมสุขภาพตำบลทุกแห่งในจังหวัด เป็นเครือข่ายสถานพยาบาล ที่ผู้ประกันตนสามารถใช้บริการได้
โรงพยาบาลสมเด็จพระยุพราช เดชอุดม เป็นโรงพยาบาลพระยุพราช แห่งที่ 5 ที่ให้บริการผู้ประกันตนในระบบประกันสังคม ต่อจาก โรงพยาบาลสมเด็จพระยุพราชสว่างแดนดิน สกลนคร โรงพยาบาลสมเด็จพระยุพราชสระแก้ว โรงพยาบาลสมเด็จพระยุพราชท่าบ่อ หนองคาย โรงพยาบาลสมเด็จพระยุพราชบ้านดุง อุดรธานี
- สอบถามเกี่ยวกับบริการได้ที่ โทร 045-362028 , 045-361133-4 , 045-361971
- facebook.com
เบียร์+ช่อดอกแห้ง รสชาติจะเป็นยังไง ไม่รู้เหมือนกัน หาโอกาสลองกันเองนะจ๊ะ
ตลาด Green Market ชิม - เที่ยว - ช็อป
โรงพยาบาลสิรินธร จัดให้มีตลาดสีเขียว Green Market ชิม เที่ยว ช็อป ทุกวันจันทร์ พุธ ศุกร์ ระหว่างวันที่ 6 -20 มิถุนายน 2565 เวลา 7-13 น. ณ บริเวณทางเชื่อมไปศูนย์อาหารฯ
ติดต่อสอบถามโทร. 02-3286900 - 19 ต่อ 10459 (เวลาราชการ)
“เทคนิคการผ่าตัดเปลี่ยนข้อสะโพกเทียมแนวใหม่แบบไม่ตัดกล้ามเนื้อ โดยปกติแล้วแนวแผลผ่าตัดจะอยู่บริเวณหน้าต้นขา ซึ่งอาจจะเห็นแผลได้ง่าย แต่ด้วยเทคนิคการลงแผลแบบใหม่ จะมีการซ่อนแผลผ่าตัดใต้ต่อขาหนีบหรือที่เรียกว่า BIKINI Incision ซึ่งเป็นการผ่าตัดแบบแผลเล็ก” มีความแนบเนียน เพราะแผลผ่าตัดขนาดเล็กจะอยู่ด้านหน้าบริเวณขาหนีบ ซ่อนใต้แนวกางเกงใน ทำให้ไม่เห็นรอยแผลเมื่อใส่กางเกงขาสั้นหรือชุดว่ายน้ำ
รวมไปถึง ผู้ป่วยจะมีอาการปวดลดลง สามารถฟื้นตัวได้ไวขึ้น เดินได้ทันทีหลังการผ่าตัด เนื่องจากไม่มีการตัดกล้ามเนื้อ ตลอดจน ศัลยแพทย์ผู้ผ่าตัดสามารถวางตำแหน่งข้อสะโพกเทียมได้ดีขึ้น อัตราการหลุดของข้อสะโพกเทียมต่ำมาก มีความยาวขาที่เท่ากันหลังผ่าตัด มีขนาดแผลที่เล็ก สวยงาม สามารถซ่อนแผลผ่าตัดใต้ขาหนีบ และยังสามารถทำการผ่าตัดเปลี่ยนข้อสะโพกเทียมได้ทั้งสองข้างพร้อมกันอีกด้วย ช่วยให้ผู้ป่วยการเคลื่อนไหวข้อสะโพกได้ดีขึ้น และสามารถกลับไปใช้ชีวิตประจำวันได้ใกล้เคียงกับปกติ มีคุณภาพชีวิตที่ดีขึ้น
สอบถามเพิ่มเติมได้ที่ ศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล โทร. 02-310-3731 contact center โทร.1719
เขตสุขภาพที่ 7
ขอนแก่น
- รพ.ขอนแก่น รพศ 043-232-555 ต่อ 3787 อังคาร 08.30 - 12.00 น.
- รพ.โคกโพธิ์ไชย รพช. 043 216 100
- รพ.จิตเวชขอนแก่นราชนครินทร์ รพ.สังกัดกรม 043-209-999 พฤหัสบดี 08.30 - 12.00 น.
- รพ.ชนบท รพช. 0 4328 6084 อ. พ. 13.00 - 16.00 น.
- รพ.ชุมแพ รพท 043-311-044 ศ. 08.30 - 12.00 น.
- รพ.ซำสูง รพช. 0 4321 9192-4 08.00 - 16.00 ยกเว้นวันหยุดราชการ
- รพ.น้ำพอง รพช. 043-441515-7 จ พ ศ เวลา 09.00 - 12.00 น.
- รพ.โนนศิลา รพช. 043-009738 จ. พ. ศ. 08.30 - 16.30 น.
- รพ.บ้านไผ่ รพช. 0 4327 2234,0 4327 2357 อ. 08.00 - 16.00 น.
- รพ.บ้านฝาง รพช. 043-269206
- รพ.เปือยน้อย รพช. 0 4349 4002-3 พ. 13.00 - 16.00 น.
- รพ.พระยืน รพช. 043 266 045
- รพ.พล รพช. 043-414-711 ต่อ 155 พุธ 08.30 – 12.00 น.
- รพ.ภูผาม่าน รพช. 043-396011, 043-396012 ต่อ 109
- รพ.มัญจาคีรี รพช. 0 4338 1415-8 พฤ. 13.00 - 16.00 น.
- รพร.กระนวน รพช. 043-251302 อ. 13.00 - 16.00 น.
- รพ.เวียงเก่า รพช. 043-306701 อ. - พฤ. 08.30 - 12.00 น.
- รพ.แวงน้อย รพช. 0 4349 9123-4 พ. 13.00 - 16.00 น.
- รพ.แวงใหญ่ รพช. 0 4349 6001 จ. - ศ. 08.00 - 16.00 น.
- รพ.สต.บ้านลาน รพ.สต. 08 6451 5528 รอยืนยัน
- รพ.สิรินธร จังหวัดขอนแก่น รพท 02-328-6901 เปิดทุกวัน 08.30-16.30 น.
- รพ.สีชมพู รพช. 0 4339 9176 จ. - ศ. 13.00 - 16.00 น.
- รพ.หนองนาคำ รพช. 043-217194 จ. พ. ศ. 13.00 - 15.00 น.
- รพ.หนองเรือ รพช. 099-168-7887 , 099-169-7997
- รพ.หนองสองห้อง รพช. 0 4349 1010 จ. - ศ. 08.00 - 16.00 น
- รพ.อุบลรัตน์ รพช. 0 4344 6112-3 พฤ 13.00 - 16.00 น.
- สอน.เวียงเก่า รพ.สต.
มหาสารคาม
- รพ.กันทรวิชัย รพช. 0-4378-9205 พฤ 13.00 - 16.00 น.
- รพ.กุดรัง รพช. 043-728-198 ต่อ 27 พ. 08.00 - 16.00 น.
- รพ.แกดำ รพช. 043-787026 พฤ. 13.00 - 16.00 น.
- รพ.โกสุมพิสัย รพช. 043-761-330 , 043-762-042 ทุกวันอังคาร ที่ 2 และ 4 ของสัปดาห์ เวลา 8.00-12.00 น.
- รพ.ชื่นชม รพช. 043-751161 รอยืนยัน
- รพ.เชียงยืน รพช. 043-781-045 ศุกร์ 08.30 -16.30 น.
- รพ.นาเชือก รพช. 0 4377 9029 พ. 13.00 - 16.30 น.
- รพ.นาดูน รพช. 043-7970156 ต่อ 122 จ. 13.00 - 16.00 น.
- รพ.บรบือ รพช. 043-771-686 อังคาร 08.00 -12.00 น.
- รพ.พยัคฆภูมิพิสัย รพช. 043 791 442 ทุกวันพุธ เวลา 8.00 น.-12.00 น.
- รพ.มหาสารคาม รพท 043-711-750 พฤหัสบดี 08.30-12.00 น.
- รพ.ยางสีสุราช รพช. 0 4372 9171 รอยืนยัน
- รพ.วาปีปทุม รพช. 043-799110 อังคาร เวลา 13.00 -16.00 น
- รพ.สต.เขื่อน รพ.สต. 043 994 609 จ. ที่ 2 ของเดือน 09.00 - 16.30 น.
- รพ.สต.บ้านบ่อใหญ่ รพ.สต. 084-5559803 พฤ 08.30 - 16.30 น.
- รพ.สต.บ้านแบก รพ.สต. 043-986052 พฤ. 08.30 - 12.00 น.
- รพ.สต.บ้านวังปทุม รพ.สต. 043-902040 พ. 08.30 - 12.00 น.
- รพ.สต.เสือโก้ก รพ.สต. 043-983048 พ. 08.30 - 12.00 น.
- สอน.บ้านกระบาก รพ.สต. 043-986524 ศ. 08.30 - 12.00 น.
ร้อยเอ็ด
- รพ.เกษตรวิสัย รพช. 043-589-074 ศ. 13.00 - 16.30 น.
- รพ.จตุรพักตรพิมาน รพช. 043-561-073 ทุกวันศุกร์ 13.00 - 16.00 น.
- รพ.จังหาร รพช. 0 4350 7122 จ. 08.00 - 16.00 น.
- รพ.เชียงขวัญ รพช. 043 509 123 รอยืนยัน
- รพ.ทุ่งเขาหลวง รพช. 043-557126 พฤ 13.00 - 16.00 น.
- รพ.ธวัชบุรี รพช. 043-631-122-4 พ. 08.00 - 16.00 น.
- รพ.ปทุมรัตต์ รพช. 043-587073 ต่อ 74 จ. - ศ. 08.00 - 16.00 น.
- รพ.พนมไพร รพช. 043-591-321 ต่อ 2 พ. 13.30 - 16.00 น.
- รพ.โพธิ์ชัย รพช. 0 4356 7074 อ. 13.00 - 16.30 น.
- รพ.โพนทราย รพช. 043 595 073 จ อ 13.00-16.00 น.
- รพ.โพนทอง รพช. 043-571-321 จันทร์-ศุกร์ 08.30 - 16.30 น.
- รพ.เมยวดี รพช. 043-577073 รอยืนยัน
- รพ.เมืองสรวง รพช. 043-597-124 จันทร์ และพฤหัสบดี 08.30 -12.00 น.
- รพ.ร้อยเอ็ด รพศ 043-518-200 ศุกร์ 9.00-12.00 น.
- รพ.ศรีสมเด็จ รพช. 043 508 151 วันพฤหัสบดี
- รพ.สต.บ้านข่อย รพ.สต. 08 1320 5894 จ. - ศ. 08.30 - 16.30 น.
- รพ.สุวรรณภูมิ รพช. 043-581-321 อังคารและพฤหัสบดี 08.30 - 16.30 น.
- รพ.เสลภูมิ รพช. 043 551 322 ศุกร์ 08.30-16.00 น.
- รพ. หนองพอก รพช. 0 4356 7073 จ. 08.00 -16.00 น.
- รพ.หนองฮี รพช. 043-506167 พ. 13.00 - 16.00 น.
- รพ.อาจสามารถ รพช. 0 4359 9074 พ. 08.30 - 16.00 น.
- สอน.บ้านสีแก้ว รพ.สต. 0-4365-4723 จ. -ศ. 08.30 - 16.30 น.
กาฬสินธุ์
- รพ.กมลาไสย รพช. 0 4389 9570 จ. - ศ. 08.30 - 12.00 น.
- รพ.กาฬสินธุ์ รพท 043-811-020 อังคาร ที่ 2,4 ของเดือน 13.00-16.30 น.
- รพ.เขาวง รพช. 0 4385 9059 จ. 09.00 - 16.00 น.
- รพ.คำม่วง รพช. 043-889-090 รอยืนยัน
- รพ.ฆ้องชัย รพช. 0 4313 1100 อ. พ. พฤ. 08.00 - 12.00 น.
- รพ.ดอนจาน รพช. 043-019809 , 043-019982
- รพ.นาคู รพช. 0 4312 9893 พ. พฤ. 08.00 - 12.00 น.
- รพ.นามน รพช. 043-867-056 จ. - ศ. 09.00 - 15.00 น.
- รพ.ยางตลาด รพช. 043-891-249 อังคาร 08.30-12.00 น.
- รพ.สต.โคกศรี รพ.สต.
- รพ.สต.นาคู รพ.สต.
- รพ.สต.หนองแวงใต้ รพ.สต.
- รพ.สต.หนองสอ รพ.สต.
- รพ.หนองกุงศรี รพช. 0 4388 1106 พ. 13.00 - 16.00 น.
- รพ.ห้วยผึ้ง รพช. 0 4386 9131 พฤ. - ศ. 08.30 - 16.30 น.
คลินิกผิวพรรณ ความงามและสุขภาพเส้นผม
ให้บริการด้วย นวัตกรรม เทคโนโลยี กระบวนการ และผลิตภัณฑ์ที่เหมาะสมเฉพาะบุคคล ช่วยดูแลฟื้นฟูทุกปัญหาผิวพรรณและรูปร่างเพื่อให้คุณได้ผลลัพธ์ในแบบที่ต้องการ บริการดูแลผิวพรรณและรูปร่าง ที่ครอบคลุม ป้องกัน ปัญหาที่อาจเกิดขึ้นกับผิวพรรณและรูปร่าง และฟื้นฟู ผิวพรรณที่เกิดปัญหา เช่น ความหมองคล้ำ ริ้วรอยบนใบหน้า เซลลูไลท์ ฯลฯ
สวนรมณีนาถ เนื้อที่ 29 ไร่
สวนรมณีนาถ เนื้อที่ 29 ไร่ ถนนศิริพงษ์ เขตพระนคร เดิมเป็นเรือนจำพิเศษกรุงเทพ เรียกว่า คุกกองมหันตโทษ สร้างมาแต่สมัยร.5 ครั้นเมื่อปี 2534 กระทรวงมหาดไทยเห็นชอบให้ย้ายเรือนจำออกไป เพื่อใช้พื้นที่สร้างเป็นสวนสาธารณะถวายเทิด พระเกียรติสมเด็จพระนางเจ้าฯ พระบรมราชินีนาถในวโรกาสที่ทรงมีพระชนมายุ 60 พรรษาในวันที่ 12 สิงหาคม 2535 เปิดให้ใช้บริการได้เมื่อ 17 สิงหาคม 2542 ในการปรับปรุงครั้งนั้นมีการรื้อถอนอาคารบางส่วนออกไป แต่ยังคงอาคารบางส่วนซึ่งกลายมาเป็นสัญลักษณ์ของพื้นที่แห่งนี้ อาทิ แนวรั้วกำแพงเรือนจำ ป้อมยาม 5 ป้อม 4 มุมของสวน และ 1 ป้อม กลางน้ำพุ ซุ้มทางเข้า อาคารพิพิธภัณฑ์ราชทัณฑ์ และประติมากรรมสังข์สัมฤทธิ์ ตั้งอยู่กลางสระน้ำพุเฉลิมพระเกียรติ เปิดให้บริการทุกวัน 05.00 -21.00 น. พิพิธภัณฑ์เปิดวันอังคาร-เสาร์ เวลา 08.30-16.30 น.
ชุมชนบ้านบางพลับ อ.บางคนที จ.สมุทรสงคราม
ชุมชนบ้านบางพลับ เป็นชุมชนประกอบอาชีพทำการเกษตรผสมผสาน ทำสวนแบบยกร่องโดยใช้ระบบน้ำขึ้นน้ำลง ตามลักษณะภูมิประเทศละแวกนี้ พืชสวนได้แก่ ส้มโอพันธุ์ขาวใหญ่ ลิ้นจี่พันธ์ค่อมลำเจียก มะพร้าวอ่อน กล้วย มะม่วง เป็นเกษตรกรรมธรรมชาติไม่พึ่งสารเคมี มีผลผลิตแปรรูปจากพืชสวนที่ปลูก อาทิ น้ำตาลมะพร้าวธรรมชาติ ผลไม้แช่อิ่มปลอดสารพิษ ผลไม้แช่อิ่มกลับชาติ (บอระเพ็ด พริก มะนาว มะละกอ) น้ำส้มควันไม้และถ่านจากผลไม้ และสินค้าน่ารักอย่าง ว่าวจุฬา ซออู้ เป็นต้น
ชุมชนบ้านบางพลับ ยึดหลักแนวทางเศรษฐกิจพอเพียงตามพระราชดำรัสของในหลวงรัชกาลที่ 9 มาช้านาน จนได้รับคัดเลือกจากกระทรวงมหาดไทยให้เป็นหมู่บ้านเศรษฐกิจพอเพียงดีเด่น ชุมชนต้นแบบพึ่งตนเองดีเด่น ชุมชนเข้มแข็งเขียวขจีดีเด่น และยังได้รับรางวัลอุตสาหกรรมท่องเที่ยวไทยจากการท่องเที่ยวแห่งประเทศไทยถึง 5 สมัยติดต่อกัน
ชุมชนบ้านบางพลับ อ.บางคนที จ.สมุทรสงคราม 9/4 หมู่ 4 บางคนที, สมุทรสงคราม
โทร.0 3476 1985, 08 1274 4433(คุณโต้ง)
7.ผลข้างเคียงของ LAAB
ทั้งนี้ LAAB มีผลข้างเคียงที่ยอมรับได้ดี และไม่มีการระบุถึงปัญหาด้านความปลอดภัย โดยผลข้างเคียงที่พบบ่อยที่สุดคือปฏิกิริยาบริเวณที่ฉีด ซึ่งส่วนมากมีอาการเล็กน้อยถึงปานกลางและสามารถหายได้เอง
สถานเอกอัครราชทูต ณ กรุงฮานอย ประกาศว่า กัญชาและสารสกัดเป็นยาเสพติด LINK
สถานเอกอัครราชทูต ณ กรุงฮานอย ขอเรียนว่า กัญชาและสารสกัดจากกัญชายังเป็นยาเสพติดให้โทษตามกฎหมายยาเสพติดของประเทศเวียดนาม ห้ามใช้ทางการแพทย์และใช้ในชีวิตประจำวันในเวียดนาม
การนำกัญชาและสารสกัดที่ส่วนผสมของกัญชาทุกชนิดเข้ามาในเวียดนาม มีความผิดตามกฎหมาย ผู้ที่มีไว้ในครอบครอง (ทั้งเพื่อเสพหรือเพื่อจำหน่าย) มีโทษปรับตั้งแต่ 5,000,000 - 500,000,000 ดอง และจำคุกตั้งแต่ 2 ปี จนถึงโทษประหารชีวิต
อนึ่ง ขอให้ใช้ความระมัดระวังในการรับฝากสิ่งของจากผู้อื่นเข้ามายังประเทศเวียดนาม
คลินิกเวชกรรม สวท อุบลราชธานี LINK
คลินิกเวชกรรม สวท อุบลราชธานี
เลขที่ 154-156 ถนนศรีณรงค์ อำเภอเมือง จังหวัดอุบลราชธานี 34000
เปิดทำการ : จันทร์-ศุกร์ เวลา 08.30-16.30 น.
ปิดทำการ : วันเสาร์-อาทิตย์, วันหยุดนักขัตฤกษ์
045-243-380
7. รับคำปรึกษาหลังการตรวจ
หากผลการตรวจคัดกรองเบื้องต้นด้วยตนเองเป็นบวก ควรตรวจยืนยันผลที่โรงพยาบาลอีกครั้ง เพื่อเข้าสู่กระบวนการรักษา แต่หากผลตรวจยืนยันเป็นลบ จะได้รับคำปรึกษาเพื่อการป้องกันการติดเชื้อเอชไอวีและโรคติดต่อทางเพศสัมพันธ์อื่น ๆ เช่น การป้องกันการถ่ายทอดเชื้อให้กับคู่ และการชวนคู่มาตรวจ เป็นต้น
สอบถามรายละเอียดเพิ่มเติมได้ที่คลินิกคุณภาพการนอนหลับ โรงพยาบาลบำรุงราษฎร์ ชั้น 12 อาคาร A (คลินิก) หรือโทร. 02-011 2988 หรือโทร. 1378
แจกใบแจกเมล็ด กิจกรรมการตลาดที่ผู้เดินงานมีส่วนร่วม
เป็นกิจกรรมการตลาดแนะนำตัวแบบโดนใจ คนต่อคิวยาวเหยียดรับของแจก สำหรับรายนี้แจกใบและเมล็ดพันธุ์ ให้ไปลองปลูกกัญ
การฉายรังสีหรือรังสีรักษา ผู้ป่วยมะเร็งบริเวณศรีษะและลำคอ
สินแพทย์ E-Member
สินแพทย์ E-member อีกช่องทางหนึ่งเพื่ออำนวยความสะดวกแก่สมาชิกของโรงพยาบาลสินแพทย์และสิทธิประโยชน์ต่าง ทั้งยังสามารถตรวจสอบการตรวจสุขภาพ และการฉัดวัคซีนต่างๆภายในโรงพยาบาลสินแพทย์ ดาวน์โหลดและติดตั้งได้แล้วตั้งแต่วันนี้
ดาวน์โหลดได้ที่
AppStoreห้องให้บริการ IV Drip ที่ Celes Samui
BDMS Wellness Clinic เป็นศูนย์รวมดูแลสุขภาพที่เน้นวิธีป้องกันแทนการรักษา มีศักยภาพ มีความพร้อม ทางนวัตกรรมด้านเวชศาสตร์ป้องกันและชะลอวัย เป็นที่ยอมรับอย่างกว้างขวาง ซึ่งมีเป้าหมายกระตุ้น Wellness Tourism อย่างจริงจังและ Celes Samui เล็งเห็นความสำคัญของการท่องเที่ยวเชิงสุขภาพที่ปัจจุบันหันมาสนใจดูแลสุขภาพ ผสานกับการท่องเที่ยวที่คัดสรรให้เหมาะกับไลฟ์สไตล์ตัวเอง จึงมีเป้าหมายเดียวกันกับ BDMS Wellness Clinic นอกจากนี้ Celes Samui ยังมี Location พร้อมรองรับ Wellness Tourism ดังนั้นการผนึกความร่วมมือกับ BDMS Wellness Clinic โดยจัดทำโปรแกรมตรวจสุขภาพและ IV Drip แบบเฉพาะบุคคล เพื่อให้เหมาะกับร่างกายของแต่ละท่านและเหมาะกับการเข้ามาพักผ่อน พร้อมเติมเต็มพลังเพิ่มความสดชื่น
ทางโรงแรมมีห้อง IV Drip Room ได้มาตรฐานผ่านการรับรองจากกระทรวงสาธารณสุข ตั้งอยู่ส่วนหน้าหาดของโรงแรม เพื่อให้ทุกครั้งที่ลูกค้ามาใช้บริการได้สัมผัสกับความรู้สึกผ่อนคลายไปกับธรรมชาติฟื้นฟู สุขภาพอย่างแท้จริง
เสน่ห์มนต์ขลังแห่ง“เกาะสมุย” ตอบโจทย์การท่องเที่ยวแบบ Wellness Tourism
อันดับที่ 7 รพ.จุฬาลงกรณ์ 82.64%
โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย โรงพยาบาลอายุ 108 ปี เก่าแก่อันดับที่สองของประเทศ (ก่อตั้งเมื่อปี 2457) เป็นเสาหลักของกิจการสาธารณสุขของประเทศไทยนับแต่แรกก่อตั้ง และจะยังคงดำรงสถานะนั้นต่อไป ในอีก 100 ปีข้างหน้า
เที่ยวสวนสัตว์เชียงใหม่ เที่ยวอุทยานหลวงราชพฤกษ์ แพคเกจสุดคุ้ม ราคาเดียวเที่ยว 3 ซู 1 สวน
แพคเกจสุดคุ้ม ราคาเดียวเที่ยว 3 ซู 1 สวน
เที่ยวสวนสัตว์เชียงใหม่ ดูหมีแพนด้า ชมเชียงใหม่ ซู อควาเรียม พร้อมชมการแสดงให้อาหารปลาวันละสองรอบ : อุโมงค์ปลาน้ำจืด 10.30,14.00 น. : อุโมงค์ปลาน้ำทะเล 11.00,14.30 น.
เที่ยวอุทยานหลวงราชพฤกษ์ นั่งรถราง ชมดอกไม้นานาพรรณ ชมความงดงามของหอคำหลวง
เที่ยวเชียงใหม่ ไนท์ ซาฟารี นั่งรถราง ชมการแสดงเสือ ชมสัตว์กลางคืน
- สามารถจองได้ตั้งแต่วันที่ 1 สิงหาคม - 30 กันยายน 2565
- ลงทะเบียนจองและชำระเงินได้ด้วยการสแกน QR Code ในรูปภาพ
- บัตรเข้าชมสามารถแยกวันใช้ได้ จนกว่าจะสิ้นสุดการจัดโปรแกรม (30 กันยายน 2565)
ราชเทวี ลงพื้นที่สุ่มตรวจสถานประกอบการที่ให้บริการคล้ายสถานบันเทิงให้เป็นไปตามมาตรการป้องกันอัคคีภัย LINK
9 สิงหาคม 2565 พล.ต.อ. อดิศร์ งามจิตสุขศรี ที่ปรึกษาของผู้ว่าราชการ ลงพื้นที่สุ่มตรวจสถานประกอบการที่ให้บริการคล้ายสถานบันเทิงให้เป็นไปตามมาตรการป้องกันอัคคีภัย ณ สถานประกอบการย่าน Co-Co Walk Plaza (โคโค่ วอล์ค พลาซ่า) และ The rock pub โดยมี นายณันทพงศ์ สินมา ผู้อำนวยการเขตราชเทวี นายขวัญเมือง บุญประสงค์ ผู้ช่วยผู้อำนวยการเขต พร้อมหัวหน้าฝ่ายสิ่งเเวดล้อมฯ หัวหน้าฝ่ายเทศกิจเเละเจ้าหน้าที่ที่เกี่ยวข้อง เจ้าหน้าที่ตำรวจสถานีตำรวจนครบาลพญาไท เจ้าหน้าที่สถานีดับเพลิงและกู้ภัยพญาไท ร่วมตรวจสถานประกอบการฯ
ทั้งนี้ ได้มีการตรวจใบอนุญาตประเภทธุรกิจร้านอาหาร และใบอนุญาตจำหน่ายเครื่องดื่มแอลกอฮอล์ถูกต้องตามกฎหมาย และความปลอดภัยด้านอาคาร ทางเข้าทางออกฉุกเฉิน (ทางหนีไฟ) ป้ายหนีภัย สภาพอุปกรณ์ในการระงับเหตุอัคคีภัย ไม่หมดอายุ สามารถใช้งานได้ ไฟฉุกเฉิน พร้อมกำชับผู้ประกอบการสถานบริการหมั่นตรวจสอบและเตรียมความพร้อมถังดับเพลิง ทางหนีไฟ สัญญาณเตือนภัยให้พร้อมใช้งานอยู่เสมอ เเละเน้นย้ำให้ปฏิบัติตามมาตรการป้องกันการเเพร่ระบาดของโรคโควิด-19 ทั้งนี้ สำนักงานเขตราชเทวี ได้จัดเจ้าหน้าที่ตรวจติดตามเเละประเมินอย่างต่อเนื่องสม่ำเสมอ เพื่อป้องกันอัคคีภัย สร้างความปลอดภัยในชีวิตและทรัพย์สินของประชาชน
เครื่องชั่งน้ำหนักระบบอิเล็กทรอนิกส์ แบบ SMART
7.ไทยกับ RCEP และ CPTPP: ผลกระทบและข้อระวัง
การที่ประเทศไทยจะเข้าร่วมความตกลงการค้าระหว่างประเทศใดๆ จำเป็นต้องศึกษาและประเมินผลกระทบอย่างรอบด้าน ไม่เพียงในเรื่องการค้า การลงทุน และห่วงโซ่อุปทาน แต่ยังรวมถึง ความมั่นคงทางอาหาร ความมั่นคงทางยา ระบบสุขภาพ และการบรรลุเป้าหมายการพัฒนาที่ยั่งยืน (SDGs)
ศูนย์พัฒนาการจัดสวัสดิการผู้สูงอายุขอนแก่น
ศูนย์พัฒนาการจัดสวัสดิการผู้สูงอายุขอนแก่น
เลขที่ 223 หมู่ 3 ถนนมิตรภาพ ตำบลสำราญ อำเภอเมือง จังหวัดขอนแก่น 40000
โทรศัพท์ : 0-4339-3457 ถึง 9 FAX : 0-4339-3458
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุขอนแก่น เป็นหน่วยงานราชการส่วนกลางที่ตั้งอยู่ในส่วนภูมิภาค สังกัดกรมกิจการ ผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ได้เปิดดำเนินการมาตั้งแต่วันที่ 20 พฤศจิกายน 2538 และมีพิธีเปิดอย่างเป็นทางการเมื่อวันที่ 21 พฤศจิกายน 2539 โดยนางอนงค์ วงศ์วานิช ผู้มีจิตศรัทธาบริจาคเงิน จำนวน 1,000,000 บาท (หนึ่งล้านบาทถ้วน) เพื่อสมทบการก่อสร้างอาคารร่วมกับ งบประมาณจากกรมพัฒนาสังคมและสวัสดิการ (ชื่อเดิมกรมประชาสงเคราะห์) เพื่อก่อสร้างเป็นศูนย์บริการทางสังคมผู้สูงอายุขอนแก่น บนที่ดินราชพัสดุจำนวน 130 ตารางวาเป็นอาคารอเนกประสงค์ขนาด 3 ชั้น (หน้าวิทยาลัยอาชีวศึกษาขอนแก่น) ต่อมาเมื่อวันที่ 2 พฤศจิกายน 2548 จึงได้เปลี่ยนชื่อใหม่เป็น ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุขอนแก่น โดยเปิดให้ บริการกิจกรรมประเภทมาเช้า - เย็นกลับ (Day Center) และ เมื่อปี 2555 ศูนย์ฯ ได้รับการสนับสนุนงบประมาณจากกรมพัฒนาสังคมและสวัสดิการ เพื่อก่อสร้างเป็นอาคารศูนย์เรียนรู้การจัดสวัสดิการสังคมผู้สูงอายุจังหวัดขอนแก่น (ตำบลสำราญ) โดยขอใช้ ที่ดินราชพัสดุจากกรมธนารักษ์ จำนวน 5 ไร่ และเปิดให้บริการ ตั้งแต่ปี 2556 เป็นต้นมา เมื่อวันที่ 6 มีนาคม 2558 ศูนย์พัฒนาการ จัดสวัสดิการสังคมผู้สูงอายุได้เปลี่ยนมาอยู่ในความรับผิดชอบภาย ใต้สังกัดกรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความ มั่นคงของมนุษย์ ตามพระราชบัญญัติปรับปรุงกระทรวง ทบวง กรม (ฉบับที่ 14) พ.ศ. 2558 จนถึงปัจจุบัน
รินน้ำเสีย ไล่น้ำใส
เช่นเดียวกับ "มหานครใหญ่" ทั่วโลก กรุงเทพฯ เป็นศูนย์รวมความเจริญทุกด้านของประเทศ มีโรงงานอุตสาหกรรมผุดขึ้นมากมาย มีผู้คนอพยพเข้ามาอาศัยจำนวนมาก ซึ่งต่างก็มีกิจกรรมที่ล้วนแต่ส่งผลกระทบต่อสิ่งแวดล้อม รวมถึง การเกิดน้ำเสีย ซึ่งที่ผ่านมากรุงเทพมหานครได้พยายามแก้ปัญหาน้ำเสียอย่างเป็นระบบมาอย่างต่อเนื่องด้วยการพัฒนาระบบบำบัดน้ำเสียรวม เพื่อรวบรวมน้ำเสียจากอาคารบ้านเรือนมาผ่านกระบวนการบำบัดให้ถูกสุขลักษณะ ก่อนปล่อยลงสู่แหล่งน้ำธรรมชาติ ติดตามเฝ้าระวังคุณภาพน้ำตามแหล่งน้ำสาธารณะ ทั้งคลองสายหลักและแม่น้ำเจ้าพระยา ตรวจสอบน้ำทิ้งจากอาคารสถานประกอบการต่าง ๆ เพื่อให้สถานประกอบการบำบัดน้ำทิ้งให้ได้มาตรฐานตามที่กฎหมายกำหนด รวมถึงการเผยแพร่และประชาสัมพันธ์ให้ภาครัฐ เอกชนและประชาชนตระหนักถึงความสำคัญของการบำบัดน้ำเสียและร่วมมือกันลดการใช้น้ำ ลดการปล่อยน้ำเสียลงสู่แหล่งน้ำสาธารณะ ไม่ทิ้งขยะลงแหล่งน้ำ เพื่อให้กรุงเทพฯ มีสายน้ำที่สดใสประชาชนได้อยู่ท่ามกลางสิ่งแวคล้อมที่ดีและมีคุณภาพชีวิตที่ดีอย่างยั่งยืน
แนวทางการบำบัดน้ำเสียในปัจจุบัน
ปัจจุบัน กรุงเทพฯ มีโรงควบคุมคุณภาพน้ำ หรือโรงบำบัดน้ำเสียครอบคลุมพื้นที่ 212.74 ตร.กม. จากพื้นที่ทั้งหมด 1,500 ตร.กม. บำบัดน้ำเสียได้ 1,112,000 ลบ.ม.ต่อวัน (หรือประมาณร้อยละ 45 ของน้ำเสียที่เกิดขึ้นทั้งหมด)
การเดินทางของน้ำเสียจากแหล่งกำเนิดสู่โรงควบคุมคุณภาพน้ำ
- กรุงเทพมหานคร รวบรวมน้ำเสียด้วยระบบท่อรวม โดยจะรวบรวมน้ำเสียจากชุมชนและแหล่งกำเนิดน้ำเสียอื่น ๆ ไปสู่บ่อรับน้ำเสียและไหลลงสู่ท่อรวบรวมน้ำเสียก่อนส่งไปที่โรงควบคุมคุณภาพน้ำส่วนกลางเพื่อบำบัดก่อนปล่อยลงสู่แหล่งน้ำสาธารณะ
- แหล่งกำเนิดน้ำเสีย พื้นที่ชุมชน โรงงานอุตสาหกรรม พื้นที่เกษตรกรรม และอื่นๆ
- บ่อพักน้ำเสีย
- ท่อรวบรวมน้ำเสีย รวบรวมน้ำเสียจากชุมชน
- สถานีสูบน้ำเสียย่อย
- โรงควบคุมคุณภาพน้ำส่วนกลาง 6 แห่งของกรุงเทพมหานคร
- น้ำเสียเข้าระบบบำบัดน้ำเสีย โดยเข้าสู่กระบวนการบำบัดขั้นต้น ที่จะแยกกรวด หิน ดิน ทราย ของแข็งขนาดใหญ่ออกจากน้ำเสียก่อน
ยำใบกัญชากรอบ เชฟ กานต์ดามณี เมฆตรง @ร้านเขียวไข่กา
ยำใบกัญชากรอบ
เชฟ/เจ้าของ: กานต์ดามณี เมฆตรง
ร้าน: เขียวไข่กา
สรรพคุณทางยา:
“ยำใบกัญชากรอบ” ใบกัญชาชุบแป้งนำไปทอดกรอบ มาพร้อมกับรสสัมผัสที่กรุบกรอบของแป้งทอดและรสชาติของใบกัญชาแท้ ๆ เข้ากันได้เป็นอย่างดีกับน้ำยำทรงเครื่องที่ ครบรสทั้งเปรี้ยว หวาน เค็ม เผ็ด จากน้ำยำที่ซึบซาบเข้าไปในเนื้อหมูสับ เพิ่มความรสชาติมัน ๆ ด้วยเม็ดมะม่วงหิมพานต์ แหล่งไขมันดีและช่วยในเรื่องเสริมสร้างระบบภูมิคุ้มกันให้แข็งแรงได้อีกด้วย
ที่อยู่: 33 ถนนนาคนิวาส แขวงลาดพร้าว เขตลาดพร้าว กรุงเทพมหานคร 10230
Line: @kiewkaika
Tel. 0-2227-0685
ขนมปังหน้าหมูใบกัญชา LINK
วัตถุดิบ
ใบกัญชา 1 ใบ / กระเทียม 5 กรัม / พริกไทย 1 กรัม / ขนมปังอบ (อาจปรับสูตรด้วยการใช้ขนมปังโฮลวีตแทนได้) / น้ำจิ้มอาจาด 30 กรัม / ซอสถั่วเหลือง 10 กรัม / ไข่ไก่ 1 ฟอง / หมูสับ 50 กรัม
วิธีการทำ
1. ทำไส้หมูโดยใส่กระเทียม พริกไทย และซอสถั่วเหลืองลงไปผสมกับหมู แล้วนำไส้หมูมาทาบนขนมปัง
2. นำใบกัญชามาวางไว้บนหน้าหมูสับ หลังจากนั้นนำขนมปังหน้าหมูกัญชาไปชุบไข่
3. ตั้งกระทะ ใส่น้ำมัน รอจนน้ำมันร้อน แล้วนำขนมปังหน้าหมูกัญชาไปทอดจนหมูสุก
4. นำขึ้นพักเพื่อสะเด็ดน้ำมัน และจัดเสิร์ฟ
ข่าวปลอม! เคี้ยวเม็ดมะละกอสุก รักษามะเร็งระยะสุดท้าย เห็นผลใน 1 เดือน LINK
ตามที่มีการแชร์คลิปวิดีโอเกี่ยวกับประเด็นเรื่องเคี้ยวเม็ดมะละกอสุกแล้วกลืนโดยไม่ต้องกินน้ำตาม วันละ 3 เม็ด รักษามะเร็งระยะสุดท้าย เห็นผลใน 1 เดือน ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงกับสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
กรณีที่มีคลิปวิดีโอแนะนำข้อมูลสุขภาพโดยระบุว่าเคี้ยวเม็ดมะละกอสุกแล้วกลืนโดยไม่ต้องกินน้ำตาม วันละ 3 เม็ด รักษามะเร็งระยะสุดท้าย เห็นผลใน 1 เดือน ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่าจากข้อมูลวิชาการ ยังไม่มีหลักฐานงานวิจัยทางคลินิกที่ยืนยันแน่ชัดว่าการรับประทานเมล็ดมะละกอสุกช่วยรักษามะเร็งระยะสุดท้ายในคนได้
อย่างไรก็ตาม เมล็ดมะละกอประกอบไปด้วยสารต่าง ๆ เช่น กรดไขมัน โปรตีน และใยอาหาร เป็นต้น เมล็ดมะละกอถูกนำมาใช้ปรุงอาหารหรือทำเป็นยารักษาโรคตามภูมิปัญหาพื้นบ้านในบางประเทศ เช่น ประเทศอินเดีย นอกจากนี้ยังมีรายงานวิจัยที่พบสารสำคัญของเมล็ดมะละกอ เช่น สารเบนซิลกลูโคซิโนเลต (benzyl glucosinolate) ซึ่งจะถูกไฮโดรไลท์ไปเป็นสารเบนซิลไอโซไทโอไซยาเนท (benzyl Isothiocyanate) ที่มีผลการศึกษาว่าสามารถช่วยยับยั้งการแบ่งตัวเซลล์มะเร็ง แต่การศึกษาที่เกี่ยวข้องกับเรื่องนี้เป็นเพียงการศึกษาที่อยู่ในระดับหลอดทดลองเท่านั้น และยังไม่มีการศึกษาในระดับสัตว์ทดลองหรือในมนุษย์ ซึ่งจำเป็นอย่างยิ่งที่ต้องมีการศึกษาเพิ่มเติมอีกหลายขั้นตอน
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุขสามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ สถาบันมะเร็งแห่งชาติ (nci.go.th) หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : จากข้อมูลวิชาการ ยังไม่มีหลักฐานงานวิจัยทางคลินิกที่ยืนยันแน่ชัดว่าการรับประทานเมล็ดมะละกอสุกช่วยรักษามะเร็งระยะสุดท้ายในคนได้
7. การตรวจสายตาและการได้ยิน
ในปัจจุบันผู้คนใช้เวลาอยู่กับหน้าจอโทรศัพท์มือถือ คอมพิวเตอร์และอุปกรณ์อิเล็กทรอนิกส์ต่างๆ เป็นเวลาหลายชั่วโมง จนอาจลืมไปว่าแสงสีฟ้าจากหน้าจอส่งผลเสียต่อร่างกาย เช่น คุณภาพการนอนหลับที่ลดลง เพราะแสงสีฟ้ารบกวนการหลั่งเมลาโทนินและนาฬิกาชีวภาพ (circadian rhythm) การนอนหลับที่ไม่สนิทอาจนำไปสู่โรคไม่ติดต่อเรื้อรังอื่นๆ ได้อีกด้วย เช่น โรคอ้วน โรคหัวใจ และโรคเบาหวาน และยังส่งผลเสียต่อจอประสาทตาโดยตรง
เพราะเรามีตาและหูเพียงคู่เดียวในชีวิต การตรวจสุขภาพตาและหูเป็นประจำจึงเป็นสิ่งสำคัญอย่างมาก การตรวจสุขภาพสายตาเบื้องต้น เพื่อตรวจสอบปัญหาที่อาจเกิดขึ้นกับดวงตา เช่น ภาวะเบาหวานขึ้นตา หรือผลจากความดันโลหิตสูง, การเกิดต้อต่างๆ เช่น ต้อหิน (Glaucoma), ต้อกระจก (Cataract), ต้อลม (Pinguecula), ต้อเนื้อ (Pterygium) เป็นต้น และการตรวจระดับการได้ยิน เป็นการตรวจการทำงานของหูและระบบโสตประสาทเพื่อหาระดับการได้ยิน การทดสอบความสามารถในการมองเห็นและการได้ยิน ช่วยให้มีข้อมูลเบื้องต้นในกรณีที่มีอาการผิดปกติเกี่ยวกับดวงตาและหูที่อาจเกิดขึ้นในอนาคต
ในกรณีที่ผู้ป่วยมีอาการโรคกระจกตาที่ซับซ้อนมากขึ้น ศูนย์ปลูกถ่ายกระจกตา โรงพยาบาลบำรุงราษฎร์ มีทีมแพทย์ผู้ชำนาญการหลากหลายสาขาที่พร้อมให้การบริบาลดูแลรักษาโรคที่ซับซ้อน และมีเทคนิคการรักษาที่หลากหลาย โดยบางครั้งแพทย์อาจต้องใช้วิธีอื่นรักษาร่วมด้วย เช่น Phototherapeutic Keratectomy (PTK) คือการรักษาโรคของกระจกตาด้วยเอ็กไซเมอเลเซอร์, การฉายแสงอัลตราไวโอเลตเอ (Corneal collagen cross-linking) เพื่อเสริมความแข็งแรงเส้นใยคอลลาเจนในกระจกตา และการผ่าตัดใส่วงแหวน (Intrastromal Corneal Ring Segment) เพื่อปรับความโค้งของกระจกตา เพื่อให้การมองเห็นมีประสิทธิภาพมากที่สุด
เกี่ยวกับ Merz Aesthetics®
Merz Aesthetics® ดำเนินธุรกิจด้านความงามเชิงการแพทย์ มีประวัติอันยาวนานในการเสริมสร้างศักยภาพให้กับบุคลากรทางการแพทย์ คนไข้ และพนักงาน ได้สามารถใช้ชีวิตในทุกวันด้วยความมั่นใจ เรามุ่งมั่นที่จะช่วยให้ผู้คนทั่วโลกดูดี รู้สึกดี และได้ใช้ชีวิตในแบบที่เป็นตัวเองมากที่สุด ไม่ว่าพวกเขาจะนิยามสิ่งนั้นว่าอย่างไร โดยกลุ่มผลิตภัณฑ์ที่เป็นที่ยอมรับและได้รับการพิสูจน์ทางการแพทย์ ได้แก่ อุปกรณ์การแพทย์ และทรีตเมนท์ดูแลผิว ที่ออกแบบมาเพื่อตอบสนองความต้องการของคนไข้แต่ละรายด้วยมาตรฐานความปลอดภัยและประสิทธิภาพสูงสุด กว่า 114 ปี จากธุรกิจที่เริ่มจากครอบครัวเป็นเจ้าของจนถึงวันนี้ Merz Aesthetics สร้างความสัมพันธ์กับลูกค้าอย่างแน่นแฟ้นเสมือนเป็นครอบครัวเดียวกัน สำนักงานใหญ่ระดับโลกของ Merz Aesthetics ตั้งอยู่ที่เมืองราลี รัฐนอร์ธแคโรไลน่า ประเทศสหรัฐอเมริกา และมีที่ตั้งในอีก 52 ประเทศทั่วโลก Merz Aesthetics เป็นส่วนหนึ่งของ Merz Group ซึ่งก่อตั้งขึ้นในปี 2451 ที่เมืองแฟรงค์เฟิร์ต ประเทศเยอรมนี
งานประเพณีลอยกระทงสายไหลประทีป ๑๐๐๐ ดวง ประจำปี 2565 จังหวัดตาก
"งานประเพณีลอยกระทงสายไหลประทีป ๑๐๐๐ ดวง ประจำปี 2565" จังหวัดตาก ระหว่างวันที่ 5-8 พฤศจิกายน 2565 ณ ริมสายธารลานกระทงสาย เชิงสะพานสมโภชกรุงรัตนโกสินทร์ ๒๐๐ ปี อำเภอเมือง จังหวัดตาก ชวนทุกท่านมาร่วมกันจุดประทีป มอบแสงสว่างให้สายน้ำ ชมการแสดงวิจิตรงดงาม และพลุ ขบวนแห่เรือสายกระทง และไฮไลท์ การแสดงการลอยประทีปกระทงสายไหลประทีป ๑๐๐๐ ดวง พร้อมเลือกชมเลือกซื้อสินค้า OTOP มากมาย
ฐานที่ 3 : วิเคราะห์ท่าทางการเคลื่อนไหวในผู้สูงอายุ (Movement Analysis) เพื่อวิเคราะห์การเคลื่อนไหวและเปรียบเทียบแรงที่เกิดขึ้นขณะทำการเดินโดยใช้ไม้เท้าช่วยพยุง เครื่องมือ ชุดกล้องวิเคราะห์การเคลื่อนไหว แผ่นวัดแรง (Force Plate) เครื่องหมายสะท้อนแสง (Reflective Marker)
ร่วมบริจาค โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ลดหย่อนภาษีได้ 2 เท่า LINK
ร่วมบริจาคกับโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ได้หลายช่องทาง
- บริจาคด้วยตัว เองที่ รพ.ธรรมศาสตร์ เฉลิมพระเกียรติ ห้องรับบริจาค อาคาร ม.ร.ว. สุวพรรณ สนิทวงศ์
- โอนเงินผ่านบัญชีธนาคาร ชื่อบัญชี รพ.ธรรมศาสตร์เฉลิมพระเกียรติ
- บริจาคผ่านแอปพลิเคชั่น TUH FORALL และ Shopee
- บริจาคผ่านระบบ e-donation โดยสแกน QR Code
- ตัดผ่านบัตรเครดิต
บริจาคผ่านระบบ e-donation ลดหย่อนภาษีได้ 2 เท่า ระบบจะส่งข้อมูลไปที่กรมสรรพากรทันที ผู้บริจาคได้สิทธิลดหย่อนภาษี จัดเก็บสลิปโอนแทนใบเสร็จรับเงินได้
สอบถามโทร. 02-9269432 06-50542565
ตาราง Group H
| |
Group H |
แข่ง |
ชนะ |
เสมอ |
แพ้ |
ได้ |
เสีย |
ต่าง |
แต้ม |
| 1 |
โปรตุเกส |
3 |
2 |
0 |
1 |
6 |
4 |
2 |
6 |
| 2 |
เกาหลีใต้ |
3 |
1 |
1 |
1 |
4 |
4 |
0 |
4 |
| 3 |
อุรุกวัย |
3 |
1 |
1 |
1 |
2 |
2 |
0 |
4 |
| 4 |
กานา |
3 |
1 |
0 |
2 |
5 |
7 |
-2 |
3 |
17 พ.ย. 65 ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา
ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา
- กรณีนายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ลงนามประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ฉบับปรับปรุงใหม่ เพื่อควบคุมการใช้ช่อดอก เมื่อ 11 พ.ย. 2565 ต่อมาวันที่ 15 พ.ย. 2565 ครม.ได้หยิบยกประกาศฉบับดังกล่าวมาหารือ เนื่องจากเห็นว่าแม้ประกาศ สธ. ไม่ต้องผ่านความเห็นชอบจากที่ประชุม ครม. แต่เรื่องนี้สำคัญ จึงอยากจะพูดคุยกันให้เข้าใจตรงกันก่อนประกาศในราชกิจจานุเบกษา ด้านนายวิษณุ เครืองาม รองนายกรัฐมนตรี รายงานต่อที่ประชุม ครม.ว่า จะนำเรื่องนี้หารือในที่ประชุม ป.ป.ส. 22 พ.ย. 2565 เพื่อปรับแก้ไขและนำเสนอต่อ ครม. อีกครั้ง
- กรณีนายสมชาย แสวงการ สมาชิกวุฒิสภา ฃ แสดงความกังวลเกี่ยวกับร้านขายกัญชาเพื่อสันทนาการ พร้อมเร่งให้สภาผู้แทนราษฎรพิจารณาผ่านร่าง พ.ร.บ.กัญชา กัญชง พ.ศ. ... นำเข้าสู่การพิจารณาของวุฒิสภานั้น เฟซบุ๊ก "อนุทิน ชาญวีรกูล"โพสต์ข้อความระบุว่า ทราบข่าวข้อกังวลดังกล่าวมาระยะหนึ่งแล้ว ดังนั้น ในระหว่างที่รอการบังคับใช้ พ.ร.บ.กัญชา กัญชงฯ สธ.จึงได้ออกประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ฉบับปรับปรุง เพราะประกาศฉบับเดิมเน้นควบคุมการขายให้เด็กและสตรีมีครรภ์ แต่ฉบับใหม่มีการห้ามการขายช่อดอกทั้งหมด ทั้งนี้ ตนได้ลงนามและส่งไปที่ครม. เพื่อให้ลงประกาศในราชกิจจานุเบกษาแล้ว หมายความว่า หลังประกาศฉบับนี้ถูกประกาศลงในราชกิจจานุเบกษา ใครก็เปิดร้านกัญชาเพื่อสูบไม่ได้ ขายช่อดอกไม่ได้ ยกเว้นคนที่ขอใบอนุญาต ซึ่งเราเปิดช่องไว้สำหรับการแพทย์ อย่าลืมว่ามีการใช้กัญชาเพื่อรักษาโรคและบำบัดการติดยาเสพติด เช่น พวกยาบ้าได้ด้วย
- นายศุภชัย ใจสมุทร ส.ส.พรรคภูมิใจไทย ในฐานะประธาน กมธ.วิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง (ฉบับที่...) พ.ศ. ...ให้สัมภาษณ์ถึงกรณีการประชุม ครม. เมื่อ 15 พ.ย. ที่ผ่านมา มีการเชิญอธิบดีกรมการแพทย์แผนไทยฯ มาชี้แจงรายละเอียดประกาศ สธ. ดังกล่าวว่า ประกาศ สธ. ที่ลงนามโดยรัฐมนตรี เป็นกฎหมายที่อาศัยอำนาจตามมาตรา 44 ของ พ.ร.บ.คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ.2542 ดังนั้น การออกประกาศจึงเป็นอำนาจของ รมว.สธ. การออกประกาศฉบับนี้ก็เพื่อต้องการให้เกิดความชัดเจนและการคุ้มครองขึ้น ประเด็นคือเป็นอำนาจของรัฐมนตรีโดยคำแนะนำของคณะกรรมการ ไม่ใช่เป็นเรื่องที่จะต้องให้ ครม. ให้ความเห็นชอบ การที่อยู่ๆ ครม. เรียกอธิบดีกรมแพทย์แผนไทยฯ ไปชี้แจง จึงคิดว่าผิดปกติเยาวชนสูบกัญชา
- นายศุภชัย ใจสมุทร ส.ส.พรรคภูมิใจไทย ให้สัมภาษณ์ภายหลังมีการเผยแพร่ภาพเยาวชนสูบกัญชาว่า ผิดกฎหมายแน่นอนและตำรวจสามารถเข้าไปจัดการได้ประกาศ สธ. เรื่องการให้กัญชาเป็นสมุนไพรควบคุม ทั้งฉบับเก่าและฉบับล่าสุด เขียนไว้ชัดเจนว่าห้ามเยาวชน คนท้อง สตรีให้นมบุตรเข้าถึงกัญชา ระบุโทษชัด คนให้ คนขาย มีโทษจำคุกไม่เกิน 1 ปี หรือปรับไม่เกิน
20,000 บาท หรือทั้งจำทั้งปรับ ทั้งนี้ยินดีที่โลกออนไลน์ช่วยกันสอดส่องสังคม แต่ปัญหาคือตำรวจอาจยังไม่รู้ สังคมเองก็อาจยังไม่ทราบ เนื่องจากความเป็นประกาศ เลยดูไม่เข้มแข็ง ไม่จริงจัง ทั้งที่เป็นกฎหมาย ความสับสน ทำให้เกิดความกล้าๆ กลัวๆ กว่าจะเข้าใจเรื่องประกาศ ก็ต้องอาศัยเวลา ซึ่งถ้ามี พ.ร.บ.ออกมา ความสับสนจะหายไปทันที
ช่องทางการติดต่อเพิ่ม
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ เพิ่มช่องทางการติดต่อผ่านโทรศัพท์มือถือและ line official เวลา 8.30-20.30 น. วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ค่ะ หรือติดต่อได้โดยตรงที่สำนักงาน ห้อง 211
ดุริยางค์ ศิลปากร จัด ดนตรีในสวน H.M.Song อว.บรรเลงเพลงของพ่อ 5 ธ.ค.65 ณ สวนรถไฟ
คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร ขอเชิญรับชมการแสดงดนตรี "ดนตรีในสวน H.M.Song อว.บรรเลงเพลงของพ่อ" ท่ามกลางอากาศสบายๆ วันจันทร์ที่ 5 ธ.ค.2565 ณ.สวนวชิรเบญจทัศ (สวนรถไฟ) เวลา 18:30-20:00 น. บรรเลงโดยวงดุริยางค์เครื่องลม Silpakorn University Wind Orchestra (SUWO) คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร จัดโดย กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัย และนวัตกรรม (อว.) ร่วมกับมหาวิทยาลัยศิลปากร
4.พักงานไว้ก่อน ขอพักกายพักใจ เพราะชีวิตมีค่ามากกว่าเงินทอง
คนไทยเข้าสู่โหมดอยากพักผ่อนช่วงปีใหม่ แต่ก็กังวลใจเรื่องความปลอดภัย ซึ่งเป็นครั้งแรกที่ความสำคัญด้าน
‘ความปลอดภัย’ เข้ามีติดอันดับ Top 5 สะท้อนให้เห็นว่า คนไทยใช้ชีวิตแบบ ‘balance life’ คือ ถึงแม้จะอยากเต็มที่กับความสุข แต่ยังใช้ชีวิตแบบระมัดระวังกับเหตุการณ์รอบตัวด้วย เช่น การเดินทาง การเลือกสถานที่เที่ยว หรือ แก๊งคอลเซ็นเตอร์ที่เปลี่ยนมุกรายวัน
หนาวนี้ที่เพชรบูรณ์ Khao Kho Countdown 2023 ณ จุดชมวิวเขาค้อ
อบจ.เพชรบูรณ์ ร่วมกับ จังหวัดเพชรบูรณ์ และการท่องเที่ยวแห่งประเทศไทย ขอเชิญเที่ยวงาน “หนาวนี้ที่เพชรบูรณ์” Khao Kho Countdown 2023 (เขาค้อเคาท์ดาวน์ 2023) ระหว่างวันที่ 30 - 31 ธันวาคม 2565 (2 วัน 2 คืน) ณ จุดชมวิวเขาค้อ อำเภอเขาค้อ จังหวัดเพชรบูรณ์
เฉลิมฉลองต้อนรับเทศกาลแห่งความสุข ส่งท้ายปีเก่า ต้อนรับปีใหม่ 2566 กับบรรยากาศสบายๆ อากาศหนาวๆ ของอำเภอเขาค้อ อิ่มอร่อยกับอาหาร Style Food Truck ชมการแสดงดนตรีและไฮไลท์สุดพิเศษ
คืนวันที่ 31 ธันวาคม 2565 ร่วมนับถอยหลังไปกับการแสดงพลุและดอกไม้ไฟ
สุดตระการตากว่า 2,000 นัด ในระดับสายตาแบบ 360 องศา สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายส่งเสริมการท่องเที่ยว อบจ.เพชรบูรณ์ โทร 056-723020 ต่อ 205
สำหรับทิศทางการดำเนินงานในอนาคตของ ‘สถาบันโรคหัวใจบำรุงราษฎร์’ ยังคงเดินหน้ามุ่งคัดสรรทีมแพทย์และบุคลากรทางการแพทย์ มุ่งพัฒนางานวิจัยใหม่ๆ เพื่อก่อให้เกิดแนวทางการรักษาใหม่ๆ อย่างต่อเนื่อง รวมถึงสรรหาโรงพยาบาลพันธมิตรที่มีเป้าหมายเดียวกัน โดยมีเป้าหมายเพื่อให้ผู้ป่วยและครอบครัวกลับมาใช้ชีวิตประจำวันได้อย่างดีที่สุด บวกกับความมุ่งมั่นของผมที่ได้เก็บเกี่ยวประสบการณ์และนำความรู้ความสามารถที่สั่งสมมาในระดับโลกตลอดระยะเวลากว่า 30 ปี มาถ่ายทอดองค์ความรู้เทคนิคการรักษาใหม่ๆ และนำมายกระดับความเป็นเลิศด้านการแพทย์ของสถาบันโรคหัวใจบำรุงราษฎร์ รวมถึงแบ่งปันความรู้และเทคนิคการรักษาให้แก่ศูนย์โรคหัวใจ ให้แก่นักศึกษาแพทย์ และแพทย์ทั้งจากในประเทศไทยและทั่วโลก โดยใช้ ‘สถาบันโรคหัวใจ’ โรงพยาบาลบำรุงราษฎร์ เป็นศูนย์กลางแห่งการเรียนรู้จัดฝึกอบรมให้แก่แพทย์ด้านโรคหัวใจ เพื่อช่วยยกระดับวงการแพทย์ทั้งในประเทศไทยและทั่วโลก และอยากเห็นผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้น
ของขวัญปีใหม่จากธนาคารเพื่อการเกษตร 4 โครงการ
ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร (ธ.ก.ส.) จำนวน 4 โครงการ
ได้แก่
1. โครงการชำระดีมีคืน ปีบัญชี 2565 สำหรับลูกค้าเกษตรกรที่เป็นหนี้ปกติ ณ ปีบัญชี 2565 จำนวน 3 ล้านราย โดยเมื่อชำระดอกเบี้ยตามสัญญาที่มีสิทธิ์จะได้รับการคืนดอกเบี้ยเงินกู้เข้าบัญชีเงินฝากตามหลักเกณฑ์และเงื่อนไขที่ ธ.ก.ส. กำหนด ระยะเวลาดำเนินโครงการตั้งแต่วันที่ 1 มิถุนายน 2565 และสิ้นสุดวันที่ 31 มีนาคม 2566 หรือเมื่อครบกำหนดวงเงินที่ ธ.ก.ส. กำหนด
2. โครงการลดดอกเบี้ยแก้หนี้ภาคครัวเรือน ปีบัญชี 2565 สำหรับลูกค้าสินเชื่อที่มีสถานะเป็นหนี้ NPL หรือปรับปรุงโครงสร้างหนี้ ทั้งนี้ การลดอัตราดอกเบี้ยให้เป็นไปตามหลักเกณฑ์และเงื่อนไขที่ ธ.ก.ส. กำหนด ระยะเวลาดำเนินโครงการตั้งแต่วันที่ 1 มิถุนายน 2565 ถึงวันที่ 31 มีนาคม 2566
3. มาตรการเสริมสภาพคล่องและฟื้นฟูลูกค้า ปีบัญชี 2565 โดยลูกค้าเกษตรกรที่เป็นหนี้ปกติ ณ ปีบัญชี 2565 สามารถขอยื่นกู้สินเชื่อเพิ่มเติมได้
4. มาตรการสนับสนุนการให้สินเชื่อแก่ผู้ประกอบธุรกิจ (สินเชื่อเพื่อการปรับตัว) ปีบัญชี 2565โดยลูกค้าเดิมและลูกค้าใหม่สามารถยื่นขอสินเชื่อ โดยได้รับอัตราดอกเบี้ยพิเศษ ทั้งนี้ ต้องยื่นขอภายในวันที่ 9 เมษายน 2566
ท้ายสุดสำหรับผู้สนใจเข้าศึกษาในหลักสูตร หาข้อมูลเพิ่มเติมได้ที่
โรงเรียนวิทยาศาสตร์การแพทย์ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ หลักสูตรฉุกเฉินการแพทย์ (ต่อเนื่อง) วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ เบอร์โทรศัพท์: 02 576 6000 ต่อ 8752 อีเมล : Paramedicine.con@cra.ac.th Facebook Fanpage> https://www.facebook.com/PARACRA.CON
เครือข่ายสาขาร้านยา เอ็กซ์ต้า พลัส ภาคตะวันตก
จังหวัดกาญจนบุรี
รหัสสาขา 10281 ตลาดโต้รุ่งกาญจน์
จังหวัดประจวบคีรีขันธ์
รหัสสาขา 13368 เจริญสุข (หัวหิน)
ศูนย์บริการสาธารณสุขที่ 7 ตลาดขวัญ
- ที่อยู่ หมู่ 3 ถนน เลี่ยงเมืองนนทบุรี ตำบล ตลาดขวัญ อำเภอเมืองนนทบุรี นนทบุรี 11000
- โทร 02-9691680 063-9466301
- แผนที่
- Facebook
บริการ
- รักษาพยาบาลทั่วไปโดยแพทย์ วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30 - 16.00 น.และ วันอังคาร 13.00 - 16.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30 - 16.30 น.
- คลินิกสุขภาพเด็กดี วันจันทร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30 - 12.00 น.
- คลินิกทันตกรรม วันศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30 - 16.30 น.
- รักษาพยาบาลทั่วไป วันจันทร์ - วันอาทิตย์ (หยุดวันอังคาร) ยกเว้นวันหยุดนักขัตฤกษ์ วันจันทร์,พุธ,พฤหัสบดี,ศุกร์ เวลา 13.00 - 16.30 วันเสาร์ - อาทิตย์ เวลา 08.30 - 16.30 น.
- เยี่ยมบ้านผู้ป่วยโรคเรื้อรัง วันจันทร์,พุธ,ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 13.00 - 16.30 น.
- เยี่ยมบ้านผู้สูงอายุ วันอังคาร ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 13.00 - 16.30 น.
- เยี่ยมบ้านอนามัยแม่และเด็ก วันพฤหัสบดี ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 13.00 - 16.30 น.
- อนามัย ร.ร. วันศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 13.00 - 16.30 น.
*หมายเหตุ เบอร์โทรติดต่อ 06 3946 6301, 0 2969 1680
รังสีวิทยา ตรวจอัลตราซาวน์ (Ultrasound) เอกซเรย์คอมพิวเตอร์ (CT-Scan)
รังสีวิทยา
ตรวจอัลตราซาวน์ (Ultrasound) ราคาเริ่มต้น 400 บาท
เอกซเรย์และอัลตร้าซาวน์เต้านม (Mammogram) ราคาเริ่มต้น 500 บาท
เอกซเรย์คอมพิวเตอร์ (CT-Scan) ราคาเริ่มต้น 800 บาท
*อัตราค่าบริการเพิ่มจากสิทธิ์การรักษาเดิม
เปิดบริการ เฉพาะวันอังคาร และ ศุกร์ เวลา 16.00-19.00 น.
ติดต่อสอบถาม
042-245-555 ต่อ 4103
กำลังดำเนินการจัดซื้อที่ดิน 8 ไร่กว่า ทำที่จอดรถ
"กำลังดำเนินการจัดซื้อที่ดิน 8 ไร่กว่า ติดกับโรงพยาบาล เป็นถนนสี่เลน ใกล้หล่ะครับ ดำเนินการมาจะปีนึงแล้ว ทีนี้คงจอดรถกันสบายขึ้นนะครับ
อ้อ! ปีนี้ของบประมาณ 221 ล้าน สร้างอาคารบริการและจอดรถได้ 400 กว่าคันด้วย ถ้าได้นะครับ…ฝันไว้ก่อน…"
BANGPHO WOOD STREET Balance in Space LINK
การพัฒนาสวนสาธารณะขนาดเล็กจากพื้นที่จอดรถมาทำเป็นพื้นที่สาธารณะให้คนที่เข้ามาใช้งานในพื้นที่ โดยการนำวัสดุเหลือใช้ภายในย่านมาใช้งาน และช่วยสนับสนุนงานฝีมือของคนในย่านไปพร้อมกัน
ย่านบางโพ แหล่งธุรกิจค้าไม้ขนาดใหญ่ใจกลางเมืองกำลังพัฒนาย่านให้เป็นย่านเศรษฐกิจสร้างสรรค์ ในอนาคตย่านนี้จะมีคนเข้ามาใช้บริการ ทั้งจับจ่ายใช้สอยและท่องเที่ยวอย่างไม่ขาดสาย แนวคิดการพัฒนาสวนสาธารณะขนาดเล็กอย่าง "Pocket Park" ภายใต้รูปแบบการนำพื้นที่จอดรถมาพลิกโฉมเป็นพื้นที่สาธารณะให้กับคนที่เข้ามาใช้งานในพื้นที่ (Parklet) จึงเป็นเรื่องที่น่าสนใจ เนื่องจากภายในย่านค่อนข้างแออัดและมีพื้นที่ที่พัฒนาต่อยอดได้น้อย จึงทำให้การใช้งานพื้นที่ที่มีอยู่เดิมมาพัฒนาต่อเป็นทางเลือกที่เหมาะสมและมีประสิทธิภาพ นอกจากนั้นแล้วยังได้มีการนำวัสดุเหลือใช้ภายในย่านมาใช้งาน เกิดการยืม-คืน เพื่อลดการสร้างสิ่งของเหลือใช้ และช่วยสนับสนุนงานฝีมือของคนในย่าน เป็นการนำองค์ความรู้และความสามารถของคนภายในชุมชนมาใช้ต่อยอดอีกด้วย
นักออกแบบ
WePark SHMA
แสดง 4 - 12 ก.พ.11:00 - 22:00
ราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย (RCOT)
สำนักงานราชวิทยาลัยโสต ศอ นาสิกแพทย์แห่งประเทศไทย (RCOT)
The Royal College of Otolaryngologists-Head and Neck Surgeons of Thailand
ชั้น 10 อาคารเฉลิมพระบารมี 50 ปี ซอยศูนย์วิจัยถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
Tel: 083-893-9643
E-mail (President): sanguans@kku.ac.th
E-mail (Secretary): rcotsecretariat@gmail.com
www.rcot.org7. บริการสร้างเสริมสุขภาพ และบริการป้องกันโรค


ซึ่งในปีนี้ โรงพยาบาลฯ มีการยกระดับศูนย์ความเป็นเลิศทางการแพทย์ (Center of Excellence) ได้แก่ สถาบันหัวใจ ศูนย์มะเร็งฮอไรซัน ศูนย์โรคระบบประสาท ศูนย์ทางเดินอาหารและตับและลำไส้ และศูนย์จักษุ ซึ่ง 5 ศูนย์ความเป็นเลิศนี้ เปรียบเสมือนเรือธงในการขับเคลื่อนการรักษาพยาบาลในปี 2566 ขณะที่ศูนย์การรักษาอื่น ๆ ยังคงให้บริการด้วยคุณภาพมาตรฐานและมีการพัฒนาอย่างต่อเนื่องตามมาตรฐานของบำรุงราษฎร์ทุกประการ โดยบำรุงราษฎร์มีองค์แพทย์ที่เข้มแข็ง ทำหน้าที่กับการกำกับดูแลทางการแพทย์ (Clinical Governance) ซึ่งเป็นธรรมภิบาลของแพทย์ เพื่อให้การประกอบวิชาชีพของแพทย์ให้เป็นไปตามกฎหมาย เป็นไปตามจริยธรรมและศีลธรรม (Moral) อย่างถูกต้องเหมาะสม และเป็นไปตามคุณภาพมาตรฐานและความปลอดภัยต่าง ๆ ที่เกี่ยวข้อง มีกระบวนการตอบสอบภายในอย่างเป็นระบบตามมาตรฐานสากล ตลอดจนมีแผนระยะยาวในการเตรียมแพทย์รุ่นใหม่ให้มีความพร้อมในการก้าวขึ้นมาเป็นแพทย์ผู้ชำนาญการและแพทย์ผู้บริหารของโรงพยาบาลในรุ่นต่อไป (Building Tomorrow Doctors) ด้วยการออกแบบหลักสูตรพัฒนาแพทย์ที่เป็นแบบฉบับของบำรุงราษฎร์เอง รวมไปถึงการขยายศูนย์ความเป็นเลิศทางการแพทย์ อาทิ ศูนย์มะเร็ง ร่วมกับโรงพยาบาลพันธมิตร ได้แก่ โรงพยาบาลพิษณุเวช และ โรงพยาบาลนครธน เพื่อให้ผู้ป่วยมีโอกาสได้เข้าถึงการรักษาที่มีคุณภาพมาตรฐาน
เขตจอมทอง ห้องสมุดเพื่อการเรียนรู้วัดราชโอรสาราม
ห้องสมุดเพื่อการเรียนรู้วัดราชโอรสาราม เป็นห้องสมุดขนาดใหญ่ ให้บริการการยืม-คืนหนังสือ มีมุมอ่านหนังสือสำหรับเยาวชน มุมหนังสือ มสธ. บริการหนังสือพิมพ์รายวัน วารสารรายสัปดาห์ รายเดือน และวันเสาร์ของสัปดาห์เรามีการจัดกิจกรรมส่งเสริมการเรียนรู้ให้กับเยาวชนและผู้ใช้บริการที่สนใจ ให้บริการยืม - คืนหนังสือต่างๆ มุมหนังสือ มสธ. กิจกรรมสำหรับเด็กและประชาชนทั่วไป
แนะนำหนังสือผ่านเพจของศูนย์เป็นประจำ น่าสนใจมาก เพื่อการเลือกหยิบอ่านได้ไม่ต้องลังเล
72/33 ซ. เอกชัย 2 แขวงบางค้อ เขตจอมทอง กรุงเทพมหานคร 10150
วัดเขาสูงแจ่มฟ้า อ.ท่ามะกา ผสมผสานหลากมิติ - หลวงปู่ทวดองค์ใหญ่ สกายวอล์กชมทิวทัศน์ ทางเดินเสาโทริอิสีแดงแบบวัดญี่ปุ่น LINK
วัดเขาสูงแจ่มฟ้า เป็นวัดราษฎร์สังกัดคณะสงฆ์ฝ่ายมหานิกาย ตั้งอยู่ในตำบลเขาสามสิบหาบ อำเภอท่ามะกา จังหวัดกาญจนบุรี ตั้งอยู่ในพื้นที่ดิน 15 ไร่ วัดเขาสูงแจ่มฟ้าเริ่มก่อสร้างสำนักสงฆ์เมื่อ พ.ศ. 2522 ได้รับการแต่งตั้งประกาศวัดขึ้นทะเบียนในพระพุทธศาสนาแห่งชาติ เมื่อวันที่ 9 มีนาคม พ.ศ. 2558 โดยนายการุณ ปุญสิริ ดำเนินการขออนุญาตสร้างวัด มีพระครูวินัยธรเกียงไกร ติกุขวิริโย พงษ์ธนจิรายุส เป็นเจ้าอาวาสรูปแรกจนถึงปัจจุบัน วัดได้รับพระราชทานวิสุงคามสีมาเมื่อวันที่ 4 ธันวาคม พ.ศ. 2558 วัดได้ดำเนินการก่อสร้างอุโบสถเมื่อ พ.ศ. 2550 แล้วเสร็จ พ.ศ. 2559 รวมระยะเวลา 9 ปี
สิ่งสำคัญในวัด หลวงปู่ทวดองค์ใหญ่, สมเด็จพระพุฒาจารย์โต, พระพุทธรูปองค์ดำปฏิหาริย์ พระประธาน พระพุทธไสยาสน์ พระนอนองค์ใหญ่, เจ้าแม่กวนอิม, พญาธนบดีนาคราช พ่อท้าวเวสสุวรรณ, องค์พระพิฆเนศวร, สกายวอล์กชมทิวทัศน์, ทางเดินเสาโทริอิสีแดงแบบวัดญี่ปุ่นในนครเกียวโต
รายงานจำนวนผู้เสียชีวิต 7-11 กุมภาพันธ์
11 กุมภาพันธ์
10 กุมภาพันธ์
- CNN รายงานผู้เสียชีวิตเกิน 21,000 รายแล้ว จำนวนผู้บาดเจ็บไม่ต่ำกว่า 78,000 คน
- เป็นที่กังวลต่อการค้นหาผู้รอดชีวิตในซากอาคาร หลังผ่าน 72 ชั่วโมงแรกหลังเกิดภัยพิบัติไปแล้ว ท่ามกลางสภาพอากาศที่หนาวเหน็บ ผู้รอดชีวิตและชาวเมืองในตุรกีและซีเรีย ต้องออกมาใช้ชีวิตพำนักนอกอาคาร เนื่องจากหวั่นเกรงและกลัวเหตุการณ์จะเกิดซ้ำและความไม่ปลอดภัยหากอยู่ในอาคาร
- ความช่วยเหลือนานาชาติยังคงหลั่งไหล ทีมกู้ภัยเข้าพื้นที่ประสบภัย
- หลายประเทศให้การช่วยเหลือด้านการเงินอย่างต่อเนื่อง ฝรั่งเศส จัดงบ 12 ล้านยูโร ให้กับซีเรีย สหราชอาณาจักร จัดเงินช่วยเหลือ 3 ล้านปอนด์ (3.64 ล้าน USD) เพื่อสนับสนุนกลุ่ม White helmets ที่เป็นกลุ่มองค์กรช่วยเหลือในพื้นที่พิพาทของซีเรีย สหรัฐ จัดสรรงบช่วยเหลือ 85 ล้านเหรียญให้กับทั้งสองประเทศ
9 กุมภาพันธ์
- BBC รายงานผู้เสียชีวิตใกล้ 16,000 รายแล้ว
- CNN ระบุจำนวนผู้เสียชีวิตเกิน 15,000 ราย ไปแล้ว แบ่งเป็นตุรกีราว 12,300 ราย ซีเรีย 2,900 ราย
- WHO ประเมินว่าจะมีผู้ได้รับผลกระทบราว 23 ล้านคน ทั้งสองประเทศ ในพื้นที่ชายแดน
- ทีมกู้ภัยจากนานาชาติยังคงเร่งระดมกำลังค้นหาผู้รอดชีวิตภายใต้ทรากปรักหักพังของอาคารที่ถล่มลงมาต่อไป ท่ามกลางอุหภูมิหนาวเหน็บ
- มีพลเมืองสหรัฐเสียชีวิต 3 ราย
- พื้นที่ประสบภัยของซีเรียยังได้รับความช่วยเหลือไม่มากเพียงพอ เหตุหนึ่งเพราะพื้นที่ส่วนใหญ่เป็นพื้นที่พิพาททางการเมืองการทหาร และข้อขัดแย้งของรัฐบาลต่างๆ กับกลุ่มชนกลุ่มน้อยหลายกลุ่ม
8 กุมภาพันธ์
- 6.13 AM BBC อัพเดตยอดผู้เสียชีวิตแล้วกว่า 7,800 ราย แบ่งเป็นในตุรกี 5,894 ราย ซีเรีย 1,932 ราย
- ปธน.ตุรกีลงพื้นที่จ. Kahramanmaras ใกล้กับจุดประสบภัย ประกาศว่าจะพลิกฟื้นเมืองที่เสียหายขึ้นมาใหม่ภายใน 1 ปี พร้อมกับยอมรับว่า ทางการประสบปัญหาในการเข้าให้ความช่วยเหลือ และเป็นไปไม่ได้ที่จะรับมือกับเหตุการณ์และความสูญเสียยิ่งใหญ่เช่นนี้ได้ทันการณ์
7 กุมภาพันธ์
- 19.04 PM BBC ประเมินผู้ได้รับผลกระทบจากแผ่นดินไหวครั้งนี้ราว 13 ล้านคนใน 2 ประเทศ 10 เมือง
- 16.10 PM BBC รายงานยอดผู้เสียชีวิตเกินกว่า 5,000 รายแล้ว ตุรกี 3,419 ราย บาดเจ็บ 20,534 ราย อาคารเสียหายกว่า 6,000 หลัง ซีเรียเสียชีวิต 1,602 ราย
- 14.27 PM BBC รายงานยอดผู้เสียชีวิตเพิ่มเป็น 4,890 ราย ตุรกี 3,381 ราย
- 12.46 BBC และ CNN รายงานจำนวนผู้เสียชีวิตที่ราว 4,300 คน ในตุรกี 2,900 ซีเรีย 1,400 จำนวนผู้บาดเจ็บกว่า 15,000 ราย
ATTA Gallery
ATTA Gallery เป็นแกลลอรี่ ในรูปแบบร้านเครื่องประดับแบบร่วมสมัย ที่มีเอกลักษณ์ของดีไซน์ การจัดแสดงและสิ่งจัดแสดงต่างๆ ที่เลือกสรรมา งานออกแบบ แต่ละชิ้นเสมือนเป็นงานศิลป์ที่เฉพาะตัว น่าสนใจและท้าทายยิ่งนัก
ATTA Gallery ตั้งอยู่ที่ OP Garden เจริญกรุง 36 แขวง บางรัก เขตบางรัก
Love Life #JFF2023
Love Life #JFF2023
2 ชั่วโมง 3 นาที R:13+
©2022映画「LOVE LIFE」製作委員会&COMME DES CINEMAS ทาเอโกะ และ จิโร่ สามีของเธอ อาศัยอยู่ด้วยกันอย่างสงบสุขกับ เคอิตะ เมื่อเกิดอุบัติเหตุที่ไม่มีใครคาดฝันขึ้น ปาร์ค บิดาของเคอิตะที่ไม่เคยกลับมาเยี่ยมบุตรชายเลย ก็หวนคืนสู่ชีวิตของเธออีกครั้ง ทาเอโกะได้ให้ความช่วยเหลือชายหูหนวกและไร้บ้านผู้อาภัพรายนี้ เพื่อรับมือกับความเจ็บปวดและความรู้สึกผิดที่เกิดขึ้นในใจเธอ
อันดับ 7. อุทยานแห่งชาติศรีน่าน จ.น่าน
พื้นที่เทือกเขาสูงเขียวชอุ่มและเป็นที่อยู่อาศัยของสัตว์ มีที่ตั้งแคมป์ตรงเนินเขาและกิจกรรมล่องแพในแม่น้ำน่าน อีกหนึ่งจุดกางเต็นท์นอนชมดาวยอดนิยมทางภาคเหนือก็คือที่ “ดอยเสมอดาว” ภายใน อช.ศรีน่าน นั่นเอง ในช่วงปีใหม่ทุกปีที่ลานกางเต็นท์นี้จะเต็มไปด้วยนักท่องเที่ยวที่ชื่นชอบการนอนดูดาว โดยเฉพาะบน “ลานดูดาว” ทางยอดเนินฝั่งตะวันออก ที่เป็นจุดชมทะเลหมอก พระอาทิตย์ จุดชมวิว และจุดชมดาว ที่เมื่อจากตีนเนินมองแหงนขึ้นไปจะเห็นภาพของยอดดอยอยู่ไล่เลี่ยในระดับเดียวกับหมู่ดาวที่พร่างพราว
8. การหมุนเวียน คือ กลยุทธ์ในการลดผลกระทบต่อสภาพอากาศของผู้ให้บริการด้านสาธารณสุข
การเพิ่มขึ้นของประชากรผู้สูงอายุและอุบัติการณ์ของโรคเรื้อรัง ทำให้โมเดลด้านสาธารณสุขอย่างยั่งยืนเป็นที่ต้องการอย่างมาก รวมถึงปัญหาด้านพลังงาน ซึ่งอุตสาหกรรมด้านเฮลท์แคร์มีการปล่อยก๊าซคาร์บอนไดออกไซด์คิดเป็นร้อยละ 4 ของการปล่อยก๊าซทั้งหมดทั่วโลก [6] ซึ่งมากกว่าอุตสาหกรรมการบินหรือการขนส่งอีก และยังทำให้เกิดขยะจำนวนมากอีกด้วย ผู้บริหารในวงการเฮลท์แคร์ที่ให้ความสำคัญด้านความยั่งยืน จึงมองหาเทคโนโลยีเฮลท์แคร์ที่สามารถช่วยลดผลกระทบด้านสิ่งแวดล้อมนี้ได้
ในเทคโนโลยีเฮลท์แคร์ การหมุนเวียน เกี่ยวข้องกับกระบวนการเกี่ยวกับเครื่องมือทางการแพทย์ แต่การประยุกต์ใช้เครื่องมือด้านสมาร์ทดิจิทัลก็ยังสามารถช่วยให้ระบบการดูแลสุขภาพสามารถลดการใช้ทรัพยากรการผลิต เพื่อส่งมอบประโยชน์สูงสุดโดยใช้ทรัพยากรน้อยที่สุด ยกตัวอย่าง เช่น การสนับสนุนให้เปลี่ยนสิ่งอำนวยความสะดวกทางคลินิกที่ใช้ทรัพยากรมากไปสู่การใช้เครือข่ายที่เชื่อมต่อได้จากที่บ้านซึ่งมีต้นทุนต่ำกว่า และเทรนด์การใช้โซลูชั่นบนคลาวด์ โซลูชั่นบริการ และโซลูชั่นด้านซอฟต์แวร์นั้น จะช่วยประหยัดการใช้ทรัพยากรสำหรับเครื่องมือทางการแพทย์ และลดการปล่อยคาร์บอนไดออกไซด์ ในขณะที่ยังเพิ่มประสิทธิภาพให้ดียิ่งขึ้น
ลูกเริ่มมีความรัก มีคนรัก
ควรทำ
ชวนลูกพูดคุยอย่างเป็นธรรมชาติ ในโอกาสที่เหมาะควร ชวนให้ลูกประเมินความสัมพันธ์ของลูกกับแฟนว่าเป็นอย่างไร รวมทั้งนิสัยใจคอของแฟน และของตัวลูกเอง ว่ามีการบังคับข่มขู่ เอาแต่ใจตัวเอง หรือไม่
สอนให้ลูกเข้าใจว่า การคบหาเป็นแฟนกัน สองฝ่ายต้องเคารพซึ่งกันและกัน ไม่มีการเอารัดเอาเปรียบฝ่ายใดฝ่ายหนึ่ง
พ่อแม่สามารถสร้างข้อตกลงร่วมกับลูกได้ เช่น ให้ลูกไปเที่ยวกับแฟนได้ แต่ต้องกลับบ้านก่อน 6 โมงเย็น ถ้าจะแชตกับแฟน ต้องทำการบ้านเสร็จก่อน หรือการแสดงออกที่เหมาะสม เป็นต้น
ควรสอนให้ลูกเข้าใจว่า เพศสัมพันธ์จะเกิดขึ้นได้สองฝ่ายต้องมีความพร้อม ต้องเป็นความยินยอม ตัดสินใจร่วมกันอย่างแท้จริง และต้องเป็นเพศสัมพันธ์ที่ปลอดภัยเท่านั้น
สอนลูกให้ประเมินสถานการณ์ที่อาจนำไปสู่การมีเพศสัมพันธ์ ถ้าไม่ต้องการให้เกิดขึ้น ต้องหาทางปฏิเสธ หรือหลีกเลี่ยงตั้งแต่ต้น
สอนทักษะการปฏิเสธในแต่ละสถานการณ์ เสริมความเชื่อมั่นให้ลูกเป็นตัวของตัวเอง และกล้าตัดสินใจด้วยเหตุผล โดยไม่ถูกเพื่อนหรือคนรักกดดัน
อย่าลืมว่า การสอนเด็กในวัยนี้ วิธีที่ได้ผลคือการชวนคุย ชวนให้เด็กคิดในแง่มุมต่างๆ เมื่อเด็กเข้าใจและเห็นด้วย เขาจึงจะเชื่อและปฏิบัติตาม
อย่าทำ
การห้ามปราม หรือบอกลูกว่า “อย่าเพิ่งมีแฟนตอนนี้” เพราะเห็นว่าลูกยังเด็ก หรือกลัวลูกเสียการเรียน จะทำให้ลูกไม่พูดคุย หรือปรึกษาพ่อแม่ในเรื่องเหล่านี้
การแสดงความสนใจ ไถ่ถามซอกแซก รวมถึงก้าวก่ายการตัดสินใจของลูก จะทำให้ลูกวัยรุ่น ซึ่งเป็นวัยที่ต้องการพื้นที่ส่วนตัวรู้สึกอึดอัด และมีทัศนคติในแง่ลบกับพ่อแม่ ทางที่ดีควรสังเกตว่า ลูกยินดีที่จะพูดคุยเพียงใด หรือเลือกคุยในจังหวะเวลาที่เหมาะสม
การไม่คุยเรื่องนี้กับลูก เพราะคิดว่าเด็กสมัยนี้รู้ดีแล้ว หรือกลัวจะกลายเป็นการชี้โพรงให้กระรอก เท่ากับเป็นการปล่อยให้เด็กเผชิญความเสี่ยงตามลำพัง แม้เด็กจะเข้าถึงอินเทอร์เน็ต แต่เด็กจะไม่หาข้อมูลในเรื่องเหล่านี้ เพราะไม่รู้ว่าเป็นเรื่องที่มีความสำคัญจำเป็น หรือหาก็อาจได้ข้อมูลผิดๆ
คลินิกสุขภาพจิต (Mental Health Clinic)
คลินิกสุขภาพจิตของ KIN ให้ความสำคัญกับคนไข้ที่มีความผิดปกติทางจิตเวช เพราะการที่เราพบจิตแพทย์ผู้เชี่ยวชาญโดยตรง จะทำให้เราได้รับการตรวจวินิจฉัยอย่างถูกต้อง ทางคลินิกมีบริการตรวจวินิจฉัยและบำบัดอาการผิดปกติเหล่านั้นโดยจิตแพทย์ผู้เชี่ยวชาญ ความตึงเครียดจากการดำเนินชีวิตอันเร่งรีบในสภาพสังคมที่กดดันในปัจจุบันนี้อาจส่งผลกระทบต่อภาวะอารมณ์และจิตใจของหลายคน และก่อให้เกิดความเสี่ยงต่อการเกิดอาการป่วยทางจิต และโรคทางจิตเวชมากมาย หากพบว่าตนเองมีอาการไม่ปกติ เช่น มีความเครียด นอนไม่หลับ เบื่ออาหาร สมาธิสั้น โรคซึมเศร้า หรือมีพฤติกรรมที่ผิดแปลกไปจากเดิม ควรรีบปรึกษาแพทย์เพราะอาจจะเป็นอาการบ่งบอกถึงการเกิดโรคทางจิตเวชได้ คลินิกสุขภาพจิตของ KIN ให้บริการตรวจวินิจฉัยและบำบัดอาการผิดปกติเหล่านั้นโดยจิตแพทย์ผู้เชี่ยวชาญ อาทิ โรคเครียด โรควิตกกังวล โรคแพนิก (Panic Disorder) โรคจิตเภท (Schizophrenia) โรคเครียดหลังเหตุการณ์สะเทือนใจ (Post-Traumatic Stress Disorder) โรคไบโพลาร์ หรือโรคอารมณ์สองขั้ว (Bipolar Disorder) โรคสมองเสื่อม (Dementia) โรคซึมเศร้า (Depression) โรคกลัวแบบเฉพาะเจาะจง (Phobias) “ในช่วงวิกฤตการณ์ที่เกิดขึ้น ณ ตอนนี้ จึงขอส่งมอบความห่วงใยถึงทุกท่าน และรณรงค์ให้ร่วมมือกันลดการก่อมลพิษ เพื่อนำอากาศดี ๆ กลับมาสู่พวกเรา และเพื่อให้ลูกหลานของเราอยู่ในโลกปัจจุบันใบนี้ได้อย่างปลอดภัยมากยิ่งขึ้น” คุณหมอแอมป์ฝากทิ้งท้าย
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญสุขภาพแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
สอบถามข้อมูลเพิ่มเติมได้ที่ บีดีเอ็มเอส เวลเนส คลินิก (BDMS Wellness Clinic) ไลน์ : @bdmswellnessclinic or https://lin.ee/rdIDv1A เว็บไซต์ : www.bdmswellness.com
สถานีชาร์จ EleX ใน ภาคกลาง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าวังน้อย
ที่อยู่: 32 หมู่ 4 ต.วังจุฬา อ.วังน้อย จ.พระนครศรีอยุธยา 13170
เวลาทำการ : ทุกวัน 06.00 – 18.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Porto Go บางปะอิน
ที่อยู่: 80 ต.คลองจิก อ.บางปะอิน จ.พระนครศรีอยุธยา 13160
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT วังน้อย 5
ที่อยู่: 237 หมู่ 2 ต.ชะแมบ อ.วังน้อย จ.พระนครศรีอยุธยา 13170
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ศูนย์การแพทย์กาญจนาภิเษก
ที่อยู่: 888 ถ.บรมราชชนนี ต.ศาลายา อ.พุทธมณฑล จ.นครปฐม 73170
เวลาทำการ : ทุกวัน 24 ชั่วโมง
De White House@79 Cafe
ที่อยู่: ต.ศาลายา อ.พุทธมณฑล จ.นครปฐม
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ไชโย 2
ที่อยู่: 97 หมู่ที่3 ต.หลักฟ้า อ.ไชโย จ.อ่างทอง 14140
เวลาทำการ : ทุกวัน 24 ชั่วโมง
SCG Ceramics นิคมอุตสาหกรรมหนองแค
ที่อยู่: 61 หมู่ 1 ต.โคกแย้ อ.หนองแค จ.สระบุรี 18230
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ห้วยบง 3
ที่อยู่: 29/9 หมู่ที่9 ต.ห้วยบง อ.เฉลิมพระเกียรติ จ.สระบุรี 18240
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT พิษณุโลก 4
ที่อยู่: 166/8,166/9 หมู่ที่7 ถนนรัชดาภิเษก ต.ท่าโพธิ์ อ.เมืองพิษณุโลก จ.พิษณุโลก 65000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT คลองขลุง 4
ที่อยู่: 159 หมู่ที่3 ต.ท่าพุทรา อ.คลองขลุง จ.กำแพงเพชร 62120
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT พยุหะคีรี 2
ที่อยู่: 75 หมู่ 8 ต.ม่วงหัก อ.พยุหะคีรี จ.นครสวรรค์ 60130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ EV Station PluZ ภาคอีสาน
สถานีบริการ บจ.มีโชคเพาเวอร์ พลัส
1868 ม.1 ต.หัวทะเล อ.เมืองนครราชสีมา นครราชสีมา 30000
สถานีบริการ บจ.พงษ์กิต สาขา 2 (หัวทะเล)
สาขา 2 133 ม.1 ถ.ราชสีมา-โชคชัย ต.หนองบัวศาลา อ.เมืองนครราชสีมา นครราชสีมา 30000
สถานีบริการ บจ.ธนพล เอ็นเนอจี
1202 ถนนมิตรภาพ ตำบลในเมือง อำเภอเมืองนครราชสีมา นครราชสีมา 30000
สถานีบริการ บจ.พงษ์กิต (เทคโน)
1089 ถนนสุรนารายณ์ ตำบลในเมือง อำเภอเมืองนครราชสีมา นครราชสีมา 30000
สถานี สาขาสวัสดิการกองบิน 1
1 ม.1 ต.หนองไผ่ล้อม อ.เมืองนครราชสีมา นครราชสีมา 30000
สถานี บจ.พงษ์กิต สาขา 7 (บายพาส)
สาขา 7 325 ม.1 ต.ปรุใหญ่ อ.เมืองนครราชสีมา นครราชสีมา 30000
เทอร์มินอล 21 โคราช (อาคารจอดรถ ชั้นจี)
99 ถ. มิตรภาพ ตำบลในเมือง อำเภอเมืองนครราชสีมา นครราชสีมา 30000
สถานีบริการ บจ.อาทิตย์ ไฮเวย์
331 หมู่ 1 ตำบลปรุใหญ่ อำเภอเมืองนครราชสีมา นครราชสีมา 30000
สถานีบริการ สาขาปากช่อง
496 หมู่ 5 ตำบลกลางดง อำเภอปากช่อง นครราชสีมา 30320
สถานีบริการ บจ.เขาใหญ่สเตชั่น
95 หมู่ 6 ตำบลหนองน้ำแดง อำเภอปากช่อง นครราชสีมา 30130
รีคอล อีส้าน อีสาน คอนเซ็ปท์ แอท เขาใหญ่
54 หมู่ 17 ต.หมูสี อ.ปากช่อง จ.นครราชสีมา 30450
สถานีบริการ บจ.มุ่งป้ันดี
111 หมู่ 6 หมู่บ้านห้วยใหญ่ใต้ ถนนสาย 304 ตำบลไทยสามัคคี อำเภอวังน้ำเขียว นครราชสีมา 30370
สถานี หจก.น้ำมันสยามด่านขุนทด
459 ม.2 ถ.สีคิ้ว-ชัยภูมิ ต.ด่านขุนทด อ.ด่านขุนทด นครราชสีมา 30210
สถานี สาขาสีคิ้ว
226 ม.15 ถ.มิตรภาพ ต.ลาดบัวขาว อ.สีคิ้ว นครราชสีมา 30140
สถานี สาขาเมืองขอนแก่น 2
92/120 ม.14 ต.ในเมือง อ.เมืองขอนแก่น จ.ขอนแก่น 40000
สถานีบริการ แอล พี จี มะลิวัลย์แก๊ส
298 หมู่ที่ 1 ถ.มะลิวัลย์ ต.บ้านเป็ด อ.เมือง จ.ขอนแก่น 40000
สถานีบริการ สาขาเมืองขอนแก่น
117/2 ม.7 ถ.มิตรภาพ ต.ในเมือง อ.เมืองขอนแก่น ขอนแก่น 40000
สถานี สาขาบ้านไผ่
306 ม.2 ต.หัวหนอง อ.บ้านไผ่ ขอนแก่น 40110
ท็อป พลาซ่า พล
6 ถนนมิตรภาพ ตำบลเมืองพล อำเภอพล ขอนแก่น 40120
สถานีบริการ สาขาน้ำพอง
16 ม.12 ต.ม่วงหวาน อ.น้ำพอง ขอนแก่น 40140
สถานีบริการ สาขายางตลาด
71 ม.5 ต.ยางตลาด อ.ยางตลาด กาฬสินธุ์ 46120
สถานี สาขาเมืองบุรีรัมย์
148 ม.16 ต.เสม็ด อ.เมืองบุรีรัมย์ บุรีรัมย์ 31000
สถานีบริการ บจ.เอ.บี.ปิโตรเลียม
401 ม.10 ถ.สายบุรีรัมย์-นางรอง ต.อิสาณ อ.เมืองบุรีรัมย์ บุรีรัมย์ 31000
สถานี หจก.มานะ-เสริมพล ปิโตรเลียม
256-257 ม.7 ถ.โชคชัย-เดชอุดม ต.หนองโบสถ์ อ.นางรอง บุรีรัมย์ 31110
สถานี บจ.ร่วมใจบริการ (2002)
740 ถ.โชคชัย-เดชอุดม ต.นางรอง อ.นางรอง บุรีรัมย์ 31110
สถานีบริการ บจ.หนองคายจารุวงศ์บริการ
332 ม.9 ต.วิศิษฐ์ อ.เมืองบึงกาฬ บึงกาฬ 38000
สถานีบริการ ทล.201 กม.118 ขาเข้า
ตำบลหนองนาแซง อำเภอเมืองชัยภูมิ ชัยภูมิ 36000
สถานีบริการ หจก.ศรีสมวงศ์เซอร์วิส ชัยภูมิ
234 หมู่ 8 ถนนชัยภูมิ-สีคิ้ว ตำบลหนองนาแซง อำเภอเมืองชัยภูมิ ชัยภูมิ 36000
สถานีบริการ หจก.นพผดุงบริการ(1)
321 ถ.นิตโย ต.ในเมือง อ.เมืองนครพนม นครพนม 48000
สถานีบริการ หจก.พนมบริการ
35 ถนนนครพนม-ธาตุพนม ตำบลในเมือง อำเภอเมืองนครพนม นครพนม 48000
สถานี สาขาสวัสดิการมหาวิทยาลัยราชภัฏเพชรบูรณ์
85/84 ม.11 ต.สะเดียง อ.เมืองเพชรบูรณ์ เพชรบูรณ์ 67000
สถานีบริการ บจ.วารินปิโตรเลียม (มุกดาหาร)
34 ถนนชยางกูร ก ตำบลมุกดาหาร อำเภอเมืองมุกดาหาร จังหวัดมุกดาหาร
สถานีบริการ สาขามหาสารคาม
71/6 ถ.นครสวรรค์ ตำบลเกิ้ง อำเภอเมืองมหาสารคาม จังหวัดมหาสารคาม 44000
สถานีบริการ แอล.พี.จี. บจก.สารคามออโต้แก๊ส
61 หมู่ 9 ถนนสารคาม-กาฬสินธุ์ ตำบลท่าขอนยาง อำเภอกันทรวิชัย มหาสารคาม 44150
สถานีบริการ บจ.เค ซี ยโสธร
225 หมู่ 1 ตำบลสำราญ อำเภอเมืองยโสธร ยโสธร 35000
สถานีบริการ หจก.บี.เอส.พี.มาร์เก็ตติ้ง
115/1 ถ.ปัทมานนท์ ต.ในเมือง อ.เมืองร้อยเอ็ด ร้อยเอ็ด 45000
สถานีบริการ บจ.น้ำมันไทยเพิ่มพูล
210 ม.4 ต.เหนือเมือง อ.เมืองร้อยเอ็ด ร้อยเอ็ด 45000
สถานีบริการ บจ.เจ เค (2011)
999 ม.11 ต.นาอาน เมืองเลย จ.เลย 42000
สถานีบริการ หจก.เมืองนางปิโตรเลียม
191 ม.2 ต.ลำภู อ.เมืองหนองบัวลำภู หนองบัวลำภู 39000
สถานีบริการ บจ.รุ่งเรืองชัย 2014
278 ม.7 ต.สลักได อ.เมืองสุรินทร์ สุรินทร์ 32000
สถานีบริการ บจ.สินชัยกาญจน์ปิโตรเลียม์
276/1 ม.10 ต.ระแงง อ.ศีขรภูมิ สุรินทร์ 32110
สถานีบริการ สาขาเมืองหนองคาย
720/1 ม.9 ต.โพธิ์ชัย อ.เมืองหนองคาย หนองคาย 43000
สถานีบริการ หจก.เกรียงศักดิ์ยโสธร ปิโตรเลียม
248 หมู่ 1 ตำบลตาดทอง อำเภอเมืองยโสธร ยโสธร 350000
สถานี สาขาไพรบึง-โชคชัย
189 ม.5 ต.สำโรงพลัน อ.ไพรบึง ศรีสะเกษ 33180
สถานีบริการ หจก.ที.วี.เอส.ออยล์
239 หมู่ 7 ตำบลหนองไผ่ อำเภอเมืองศรีสะเกษ ศรีสะเกษ 33000
สถานีบริการ บจ.เอส.พี.ปิโตรเลียม (1994)
สาขาประตูเมือง 485 ถ.นิตโย ต.ธาตุเชิงชุม อ.เมืองสกลนคร สกลนคร 47000
สถานี บจ.ไทยเจริญ เพทโทรล สเตชั่น
252/8-9,10 ถ.ประจักษ์ศิลปาคม ต.หมากแข้ง อ.เมืองอุดรธานี อุดรธานี 41000
ท็อป หนองหาน
109 หมู่ที่ 11 22 ตำบล หนองหำน อำเภอหนองหาน อุดรธานี 41130
สถานีบริการ บจ.เจียง-อัศวรรณ หนองคาย
129/6 ม.5 หมู่บ้านหนองเตาเหล็ก ซ.บ้านหนองเตาเหล็ก ต.หมากแข้ง อ.เมืองอุดรธานี อุดรธานี 41000
สถานีบริการ บจ.สุรชัยอำนาจ ปิโตรเลียม
15 หมู่ 9 ถนนชยางกูร ตำบลโนนหนามแท่ง อำเภอเมืองอำนาจเจริญ อำนาจเจริญ 37000
สถานี หจก.อธิรุ่งโรจน์
343 ม.3 ต.แจระแม อ.เมืองอุบลราชธานี อุบลราชธานี 34000
สถานีบริการ บจ.อุบล เกตเวย์
240/9 หมู่ 4 ถนนชยางกูร ตำบลขามใหญ่ อำเภอเมืองอุบลราชธานี อุบลราชธานี 34000
สถานีบริการ หจก.เลี่ยงเมืองอุบลบริการ
181 หมู่ 7 ถนนเลี่ยงเมือง ตำบลแจระแม อำเภอเมืองอุบลราชธานี อุบลราชธานี 34000
สถานีบริการ บจ.ปิโตรเลียมน้ำมัน (อุบล)
284/1 หมู่ 8 ตำบลแสนสุข อำเภอวารินชำราบ อุบลราชธานี 341900
สถานี หจก.การดี ปิโตรเลียม
244 ถ.อุบล-ตระการ ต.ในเมือง อ.เมืองอุบลราชธานี อุบลราชธานี 34000
สถานีบริการ หจก.ส.สุมาลี เอ็นเนอจี้
3 หมู่ 2 ตำบลโนนผึ้ง อำเภอวารินชำราบ อุบลราชธานี 34190
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (กาญจนสิงห์หาสน์ฯ) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (กาญจนสิงห์หาสน์ฯ) 686 ซ. จรัญสนิทวงศ์ 35 แขวงคลองชักพระ เขตตลิ่งชัน กรุงเทพมหานคร 10170
ค่าสมัครเรียน วิชาทั่วไป 105 บาท วิชาคอมพิวเตอร์ โมบายเทคโนโลยี การนวดสวีดิช การบริการเพื่อความงาม 305 บาท
การฉีดวัคซีนป้องกันล่วงหน้า ป้องกันได้จริงหรือ
สำหรับวัคซีนที่ใช้ฉีดป้องกันล่วงหน้าก็ไม่ใช่วัคซีนใหม่ แต่เป็นวัคซีนชนิดเดียวกันกับที่ใช้ฉีดหลังโดนกัดแล้ว เพียงแต่จำนวนครั้งในการฉีดแค่ 3 ครั้ง (วันที่ 0 (วันเริ่มฉีดวัคซีน), วันที่ 7, วันที่ 21 หรือ 28) ซึ่งหากได้ฉีดวัคซีนล่วงหน้าไว้แล้วกรณีถูกสัตว์บ้ากัดจะฉีดวัคซีนกระตุ้นเพียง 1 - 2 ครั้ง โดยไม่จําเป็นต้องฉีดเซรุ่มรอบแผลอีก การฉีดเซรุ่มรอบแผลบอกเลยว่าเจ็บ ถ้ามีหลายแผลก็ต้องฉีดให้ครบทุกแผล ดังนั้นจึงไม่ต้องเจ็บปวดจากการฉีดเซรุ่ม ที่สำคัญลดโอกาสเสี่ยงที่จะแพ้เซรุ่ม และลดค่าใช้จ่ายไปได้มาก - รพ.ยันฮี
คลินิกบริการอาคารรักษ์ใจ
คลินิกบริการอาคารรักษ์ใจ อาคารรักษ์ใจ ด้านทิศตะวันตกของโรงพยาบาล โทรศัพท์ 044-615002 ต่อ 2104, 2082
ดูแลสุขภาพจิตครบวงจร เพิ่มบุคลากร-ขยายบัญชียา-ใช้เทคโนโลยี
ปัญหา
จำนวนผู้ป่วยซึมเศร้าในประเทศไทยอาจสูงถึง 1.5 ล้านคน หรือเฉลี่ยคนไทย 40 คน จะพบผู้ป่วยซึมเศร้า 1 คน โดยสาเหตุมาจากทั้งปัจจัยเฉพาะกิจอย่างโควิด-19 ที่เพิ่มความเครียดให้กับผู้คน (เช่น นักเรียนจากการเรียนออนไลน์ คนวัยทำงานจากสภาพเศรษฐกิจ) และปัจจัยถาวรต่างๆที่งานวิจัยระบุว่าทำให้คนรุ่นใหม่ มีแนวโน้มจะประสบปัญหาโรคซึมเศร้ามากกว่ารุ่นก่อนๆ (เช่น การใช้โซเชียลมีเดีย ที่เสี่ยงทำให้คนรู้สึกผิดหวังในตัวเองง่ายขึ้น จากการเปรียบเทียบชีวิตตัวเองกับชีวิตของคนอื่น) และพบว่าคนไทยมีอัตราการฆ่าตัวตายสูงเป็นอันดับ 1 อาเซียน จากปัญหาด้านสุขภาพจิต
ข้อเสนอ
เพิ่มบุคลากรด้านสุขภาพจิต (เช่น จิตแพทย์ นักจิตวิทยา)
ทบทวนบัญชียาหลักในระบบให้เท่าทันกับวิทยาการทางแพทย์
พัฒนาระบบบริการสุขภาพจิตรูปแบบใหม่ (เช่น การแพทย์ทางไกล (Telemedicine) แพลตฟอร์มสุขภาพจิต)
คลินิกพิเศษทันตกรรมนอกเวลาราชการ โรงพยาบาลแม่สอด
คลินิกพิเศษทันตกรรมนอกเวลาราชการ โรงพยาบาลแม่สอด
พร้อมให้บริการ ในเดือนมกราคม 2563 นี้ ทุกวันอังคาร-วันพฤหัสบดี เวลา 16.30-20.30 น.
ที่ห้องทันตกรรม ชั้น 5 อาคารผู้ป่วยนอก โรงพยาบาลแม่สอด
ค่าบริการผู้ป่วยนอกเวลา เริ่มต้น 110 บาท
#ลดเวลารอ #เบิกค่ายาค่ารักษาได้ตามสิทธิ
ติดต่อนัดหมายล่วงหน้าได้ตั้งแต่บัดนี้เป็นต้นไป
สอบถามรายละเอียดเพิ่มเติม โทร. 062-3107152
7.การลวงหลอก Deception
เราต้องทำความเข้าใจว่าระบบ AI อันทรงพลังกำลังทำอะไรอยู่และทำไมพวกเขาถึงทำในสิ่งที่กำลังทำอยู่ วิธีหนึ่งในการดำเนินการนี้คือการให้ระบบรายงานข้อมูลนี้อย่างถูกต้อง สิ่งนี้อาจไม่ใช่เรื่องเล็กน้อย แต่เนื่องจากการหลอกลวงนั้นมีประโยชน์สำหรับการบรรลุเป้าหมายที่หลากหลาย
อาจเป็นไปได้ว่าระบบ AI ในอนาคตสามารถลวง(หลอก) ได้ ไม่ใช่เพราะความมุ่งร้าย แต่เนื่องจากการลวงสามารถช่วยให้เจ้าหน้าที่บรรลุเป้าหมายได้ การได้รับความเห็นชอบจากมนุษย์ผ่านการลวงอาจมีประสิทธิภาพมากกว่าการได้รับความเห็นชอบจากมนุษย์อย่างถูกต้องตามกฎหมาย การลวงหลอกยังให้ทางเลือก: ระบบที่มีความสามารถในการลวงหลอกมีข้อได้เปรียบเชิงกลยุทธ์เหนือแบบจำลองที่ซื่อสัตย์และจำกัด AI ที่แข็งแกร่งที่สามารถลวงหลอกมนุษย์ได้อาจบั่นทอนการควบคุมของมนุษย์ ระบบ AI สามารถจะเลี่ยงปัจจัยควบคุมได้ ในอดีต บุคคลและองค์กรต่างมีแรงจูงใจที่จะหลีกเลี่ยงการตรวจสอบ ตัวอย่างเช่น โฟล์คสวาเกนตั้งโปรแกรมเครื่องยนต์ให้ลดการปล่อยมลพิษเฉพาะเมื่อได้รับการตรวจสอบเท่านั้น สิ่งนี้ทำให้พวกเขาได้รับประสิทธิภาพเพิ่มขึ้นในขณะที่ยังคงรักษาระดับการปล่อยมลพิษที่ต่ำ ตัวแทน AI ในอนาคตสามารถเปลี่ยนกลยุทธ์ในทำนองเดียวกันเมื่อถูกตรวจสอบและดำเนินการเพื่อปิดบังการหลอกลวงจากการควบคุมติดตาม เมื่อระบบ AI ที่หลอกลวงถูกกวาดล้างโดยจอมอนิเตอร์หรือเมื่อระบบดังกล่าวสามารถเอาชนะระบบเหล่านี้ได้ ระบบเหล่านี้อาจ “กลับตาลปัตร” และข้ามการควบคุมของมนุษย์ไปอย่างไม่สามารถย้อนกลับได้
ม้าแก้วมังกร สุราชุมชนอุตรดิตถ์ ผลิตจากสับปะรด LINK
“ม้าแก้วมังกร” เป็นสุราชุมชนจากจังหวัดอุตรดิตถ์ เขาใช้สับปะรดจาก ต.ห้วยมุ่น อ.น้ำปาด ที่ได้รับตราสัญลักษณ์ GI วัตถุดิบหลักในการกลั่นเป็นเหล้าตัวนี้ มีความแรงแอลกอฮอล์ตั้งแต่ 30-35-40 เปอร์เซ็นต์ ตอนแรกตั้งชื่อว่า “ม้ามังกร"จากพระอภัยมณี ที่พ่อกับแม่เจอจากการสอนการบ้านลูกๆ แต่มีคนใช้ชื่อนี้ไปแล้วเลยปรับมาเป็น "ม้าแก้วมังกร"
ข้อมูลและภาพจากเพจประชาชนเบียร์
หลักสูตรด้าน สนับสนุนทุกกลุ่มอุตสาหกรรม (Supporting of all Industries) 2566 LINK
*เฉพาะหลักสูตรที่เปิดอบรม มิถุนายน - ธันวาคม 2566
- DSA017: การจัดการข้อมูลด้วย ETL using Pentaho – PDI (Opensource) : ค่าอบรม 12,000 25/12/2566 - 27/12/2566
- JAV076: Developing API GateWay with Node.js using Express Gateway : ค่าอบรม 12,500 25/12/2566 - 27/12/2566
- JAV079: TypeScript and Vue.js for Full Front-End Development : ค่าอบรม 15,500 25/12/2566 - 29/12/2566
- JAV074: Node.js Express MongoDB React.js Development Guide : ค่าอบรม 13,000 25/12/2566 - 27/12/2566
- DSA019: AI : Python for Data Science Development Fundamental : ค่าอบรม 12,000 18/12/2566 - 20/12/2566
- JAV080: Deno Using Typescript for RESTful Web APIs : ค่าอบรม 15,500 18/12/2566 - 22/12/2566
- JAV081: Reactive RESTful Web Service Using Java Spring WebFlux Programming : ค่าอบรม 15,500 18/12/2566 - 22/12/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 12/12/2566 - 13/12/2566
- ITM051: Business Process Improvement to Support the Digital Transformation: แนวทางการปรับปรุงกระบวนการทางธุรกิจเพื่อสนับสนุนการเปลี่ยนแปลงทางดิจิทัล : ค่าอบรม 7,500 12/12/2566 - 13/12/2566
- MBA018: Android Development Working With RESTful API Using Node.js & MySQL : ค่าอบรม 15,500 12/12/2566 - 15/12/2566
- PTN012: Coding สำหรับผู้เริ่มต้นเขียนโปรแกรม : Python JavaScript HTML Java C# JSON : ค่าอบรม 15,000 12/12/2566 - 15/12/2566
- GPL003: RESTful API with Go Programming Language (Golang) : ค่าอบรม 12,000 06/12/2566 - 08/12/2566
- ITM136: ออกแบบสถาปัตยกรรมองค์กร (Enterprise Architecture) : ค่าอบรม 11,000 06/12/2566 - 08/12/2566
- PTN010: Developing RESTful APIs with Python using Django Framework : ค่าอบรม 12,500 06/12/2566 - 08/12/2566
- SEC016: CompTIA Security+ : ค่าอบรม 35,000 04/12/2566 - 08/12/2566
- ITM102: Auditing Process of IT Application Systems to Achieve Security: กระบวนการตรวจสอบระบบแอปพลิเคชันเทคโนโลยีสารสนเทศเพื่อให้เกิดความมั่นคงปลอดภัย : ค่าอบรม 9,500 29/11/2566 - 01/12/2566
- CPL006: Microservices using ASP.NET Core (C#) : ค่าอบรม 13,000 27/11/2566 - 29/11/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 27/11/2566 - 28/11/2566
- GPL002: Go Programming Language – Fundamental (Golang) : ค่าอบรม 13,000 27/11/2566 - 29/11/2566
- SEC014: Security Information and Event Management (SIEM) : ค่าอบรม 13,000 27/11/2566 - 28/11/2566
- ITM133: Competency Development and Digital Skills in the 21st Century : เทคนิคการพัฒนาสมรรถนะ และทักษะด้านดิจิทัล สู่ความเป็นเลิศในศตวรรษที่ 21 : ค่าอบรม 7,000 23/11/2566 - 24/11/2566
- DPL001: Dart Programming Language – Fundamental : ค่าอบรม 12,000 20/11/2566 - 22/11/2566
- DSA018: การบริหารจัดการข้อมูลภายในองค์กร (Government - Data Catalog) ด้วยโปรแกรม CKAN - Open Data : ค่าอบรม 15,000 20/11/2566 - 24/11/2566
- JAV077: Vue.js RxJS and Web APIs using Express Development : ค่าอบรม 15,500 20/11/2566 - 24/11/2566
- XLS049: การวิเคราะห์ข้อมูลด้วยเครื่องมือ Spreadsheet : ค่าอบรม 7,500 16/11/2566 - 17/11/2566
- ITM132: The Process of Monitoring and Auditing of Information Technology Operations to Achieve Security as Standard ISO/IEC 27001:2013 : กระบวนการติดตามและตรวจสอบการดำเนินงานด้านเทคโนโลยีสารสนเทศให้เกิดความมั่นคงปลอดภัยตามมาตรฐานสากล ISO/IEC 27001:2013 : ค่าอบรม 9,500 15/11/2566 - 17/11/2566
- JAV076: Developing API GateWay with Node.js using Express Gateway : ค่าอบรม 12,500 13/11/2566 - 15/11/2566
- PTN011: Developing Microservices with Python : ค่าอบรม 12,500 13/11/2566 - 15/11/2566
- SEC015: Certified Information Systems Security Professional (CISSP) : ค่าอบรม 35,000 13/11/2566 - 17/11/2566
- DPL002: Flutter Cross-Platform Framework for Native Mobile Application (Android/iOS) Using Dart Programming Language : ค่าอบรม 15,500 06/11/2566 - 10/11/2566
- JAV078: React RxJS and Web APIs using Next.js Development : ค่าอบรม 15,500 06/11/2566 - 10/11/2566
- ITM131: ISO 31000:2018 - Enterprise Risk Management Process for Sustainable Achievement : กระบวนการบริหารจัดการความเสี่ยงระดับองค์กรให้สัมฤทธิ์ผลอย่างยั่งยืน ตามแนวมาตรฐานสากล ISO 31000:2018 : ค่าอบรม 9,500 01/11/2566 - 03/11/2566
- DBM039: Oracle Database PL/SQL Programming : ค่าอบรม 16,050 30/10/2566 - 03/11/2566
- JAV080: Deno Using Typescript for RESTful Web APIs : ค่าอบรม 15,500 30/10/2566 - 03/11/2566
- MBA018: Android Development Working With RESTful API Using Node.js & MySQL : ค่าอบรม 15,500 30/10/2566 - 03/11/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 24/10/2566 - 25/10/2566
- DSA017: การจัดการข้อมูลด้วย ETL using Pentaho – PDI (Opensource) : ค่าอบรม 12,000 24/10/2566 - 26/10/2566
- JAV074: Node.js Express MongoDB React.js Development Guide : ค่าอบรม 12,500 24/10/2566 - 26/10/2566
- DSA019: AI : Python for Data Science Development Fundamental : ค่าอบรม 12,000 16/10/2566 - 18/10/2566
- ITM051: Business Process Improvement to Support the Digital Transformation: แนวทางการปรับปรุงกระบวนการทางธุรกิจเพื่อสนับสนุนการเปลี่ยนแปลงทางดิจิทัล : ค่าอบรม 7,500 16/10/2566 - 17/10/2566
- JAV081: Reactive RESTful Web Service Using Java Spring WebFlux Programming : ค่าอบรม 15,500 16/10/2566 - 20/10/2566
- PTN010: Developing RESTful APIs with Python using Django Framework : ค่าอบรม 12,500 16/10/2566 - 18/10/2566
- PTN012: Coding สำหรับผู้เริ่มต้นเขียนโปรแกรม : Python JavaScript HTML Java C# JSON : ค่าอบรม 15,000 16/10/2566 - 20/10/2566
- GPL002: Go Programming Language – Fundamental (Golang) : ค่าอบรม 13,000 09/10/2566 - 11/10/2566
- GPL003: RESTful API with Go Programming Language (Golang) : ค่าอบรม 12,000 09/10/2566 - 11/10/2566
- ITM135: ออกแบบการกำกับดูแลเทคโนโลยีสารสนเทศ พัฒนานโยบายและกระบวนการ ติดตามผลเพื่อความยั่งยืนขององค์กร (Enterprise Governance) : ค่าอบรม 11,000 09/10/2566 - 11/10/2566
- TEC018: Firewall Essentials: Configuration and Management : ค่าอบรม 30,000 09/10/2566 - 13/10/2566
- CPL006: Microservices using ASP.NET Core (C#) : ค่าอบรม 13,000 02/10/2566 - 04/10/2566
- DSA018: การบริหารจัดการข้อมูลภายในองค์กร (Government - Data Catalog) ด้วยโปรแกรม CKAN - Open Data : ค่าอบรม 15,000 02/10/2566 - 06/10/2566
- ITM134: ออกแบบ พัฒนากระบวนการ และกำกับดูแลข้อมูลสารสนเทศ (Data Governance) : ค่าอบรม 11,000 02/10/2566 - 04/10/2566
- JAV076: Developing API GateWay with Node.js using Express Gateway : ค่าอบรม 12,500 02/10/2566 - 04/10/2566
- ITM133: Competency Development and Digital Skills in the 21st Century : เทคนิคการพัฒนาสมรรถนะ และทักษะด้านดิจิทัล สู่ความเป็นเลิศในศตวรรษที่ 21 : ค่าอบรม 7,000 28/09/2566 - 29/09/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 25/09/2566 - 26/09/2566
- ITM132: The Process of Monitoring and Auditing of Information Technology Operations to Achieve Security as Standard ISO/IEC 27001:2013 : กระบวนการติดตามและตรวจสอบการดำเนินงานด้านเทคโนโลยีสารสนเทศให้เกิดความมั่นคงปลอดภัยตามมาตรฐานสากล ISO/IEC 27001:2013 : ค่าอบรม 9,500 25/09/2566 - 27/09/2566
- ITM136: ออกแบบสถาปัตยกรรมองค์กร (Enterprise Architecture) : ค่าอบรม 11,000 25/09/2566 - 27/09/2566
- DPL001: Dart Programming Language – Fundamental : ค่าอบรม 12,000 18/09/2566 - 20/09/2566
- JAV077: Vue.js RxJS and Web APIs using Express Development : ค่าอบรม 15,500 18/09/2566 - 22/09/2566
- JAV080: Deno Using Typescript for RESTful Web APIs : ค่าอบรม 15,500 18/09/2566 - 22/09/2566
- DBM029: MySQL Programming : ค่าอบรม 14,500 18/09/2566 - 21/09/2566
- DPL002: Flutter Cross-Platform Framework for Native Mobile Application (Android/iOS) Using Dart Programming Language : ค่าอบรม 15,500 11/09/2566 - 15/09/2566
- JAV078: React RxJS and Web APIs using Next.js Development : ค่าอบรม 15,500 11/09/2566 - 15/09/2566
- PTN010: Developing RESTful APIs with Python using Django Framework : ค่าอบรม 12,500 11/09/2566 - 13/09/2566
- HSI025: Infographic Presentation Design เพิ่มพลังการสื่อสารในยุคไทยแลนด์ 4.0 (รุ่นที่ 15) : ค่าอบรม 9,900 07/09/2566 - 08/09/2566
- ITM131: ISO 31000:2018 - Enterprise Risk Management Process for Sustainable Achievement : กระบวนการบริหารจัดการความเสี่ยงระดับองค์กรให้สัมฤทธิ์ผลอย่างยั่งยืน ตามแนวมาตรฐานสากล ISO 31000:2018 : ค่าอบรม 9,500 06/09/2566 - 08/09/2566
- DSA019: AI : Python for Data Science Development Fundamental : ค่าอบรม 12,000 04/09/2566 - 06/09/2566
- ITM102: Auditing Process of IT Application Systems to Achieve Security: กระบวนการตรวจสอบระบบแอปพลิเคชันเทคโนโลยีสารสนเทศเพื่อให้เกิดความมั่นคงปลอดภัย : ค่าอบรม 9,500 04/09/2566 - 06/09/2566
- JAV079: TypeScript and Vue.js for Full Front-End Development : ค่าอบรม 15,500 04/09/2566 - 08/09/2566
- PTN011: Developing Microservices with Python : ค่าอบรม 12,500 04/09/2566 - 06/09/2566
- SEC016: CompTIA Security+ : ค่าอบรม 25,000 04/09/2566 - 08/09/2566
- JAV076: Developing API GateWay with Node.js using Express Gateway : ค่าอบรม 12,500 28/08/2566 - 30/08/2566
- MBA018: Android Development Working With RESTful API Using Node.js & MySQL : ค่าอบรม 15,500 28/08/2566 - 01/09/2566
- PTN001: Python Programming Fundamentals : From Zero to Hero : ค่าอบรม 11,770 28/08/2566 - 30/08/2566
- PTN012: Coding สำหรับผู้เริ่มต้นเขียนโปรแกรม : Python JavaScript HTML Java C# JSON : ค่าอบรม 15,000 28/08/2566 - 01/09/2566
- DSA018: การบริหารจัดการข้อมูลภายในองค์กร (Government - Data Catalog) ด้วยโปรแกรม CKAN - Open Data : ค่าอบรม 15,000 21/08/2566 - 25/08/2566
- GPL003: RESTful API with Go Programming Language (Golang) : ค่าอบรม 12,000 21/08/2566 - 23/08/2566
- JAV081: Reactive RESTful Web Service Using Java Spring WebFlux Programming : ค่าอบรม 15,500 21/08/2566 - 25/08/2566
- NWA046: VMware vSphere: Install Configure Manage [V8] : ค่าอบรม 26,750 21/08/2566 - 25/08/2566
- CPL006: Microservices using ASP.NET Core (C#) : ค่าอบรม 13,000 15/08/2566 - 17/08/2566
- DSA017: การจัดการข้อมูลด้วย ETL using Pentaho – PDI (Opensource) : ค่าอบรม 12,000 15/08/2566 - 17/08/2566
- JAV074: Node.js Express MongoDB React.js Development Guide : ค่าอบรม 12,500 15/08/2566 - 17/08/2566
- NWA112: Network Monitoring and Management (NMM) : ค่าอบรม 30,000 14/08/2566 - 18/08/2566
- ITM051: Business Process Improvement to Support the Digital Transformation: แนวทางการปรับปรุงกระบวนการทางธุรกิจเพื่อสนับสนุนการเปลี่ยนแปลงทางดิจิทัล : ค่าอบรม 7,500 10/08/2566 - 11/08/2566
- XLS049: การวิเคราะห์ข้อมูลด้วยเครื่องมือ Spreadsheet : ค่าอบรม 7,500 10/08/2566 - 11/08/2566
- GPP047: หลักสูตรการจัดการคาร์บอนสำหรับผู้บริหาร รุ่นที่ 3 (Carbon Management for Executive: CMX3) : ค่าอบรม 6,420 10/08/2566 - 10/08/2566
- GPL002: Go Programming Language – Fundamental (Golang) : ค่าอบรม 13,000 07/08/2566 - 09/08/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 03/08/2566 - 04/08/2566
- SEC014: Security Information and Event Management (SIEM) : ค่าอบรม 13,000 02/08/2566 - 03/08/2566
- DSA019: AI : Python for Data Science Development Fundamental : ค่าอบรม 12,840 24/07/2566 - 26/07/2566
- ITM102: Auditing Process of IT Application Systems to Achieve Security: กระบวนการตรวจสอบระบบแอปพลิเคชันเทคโนโลยีสารสนเทศเพื่อให้เกิดความมั่นคงปลอดภัย : ค่าอบรม 9,500 24/07/2566 - 26/07/2566
- HSI029: การสร้าง Infographic เพื่อการสื่อสารอย่างมีประสิทธิภาพ (รุ่นที่ 14) : ค่าอบรม 9,900 20/07/2566 - 21/07/2566
- ITM133: Competency Development and Digital Skills in the 21st Century : เทคนิคการพัฒนาสมรรถนะ และทักษะด้านดิจิทัล สู่ความเป็นเลิศในศตวรรษที่ 21 : ค่าอบรม 7,000 20/07/2566 - 21/07/2566
- IPP014: Service Design Thinking Series 2023 [SDT] : ค่าอบรม 12,500 20/07/2566 - 21/07/2566
- DPL002: Flutter Cross-Platform Framework for Native Mobile Application (Android/iOS) Using Dart Programming Language : ค่าอบรม 15,500 17/07/2566 - 21/07/2566
- ITM135: ออกแบบการกำกับดูแลเทคโนโลยีสารสนเทศ พัฒนานโยบายและกระบวนการ ติดตามผลเพื่อความยั่งยืนขององค์กร (Enterprise Governance) : ค่าอบรม 11,000 17/07/2566 - 19/07/2566
- JAV077: Vue.js RxJS and Web APIs using Express Development : ค่าอบรม 15,500 17/07/2566 - 21/07/2566
- JAV080: Deno Using Typescript for RESTful Web APIs : ค่าอบรม 15,500 17/07/2566 - 21/07/2566
- NWA089: Windows Server 2019 Administration : ค่าอบรม 16,050 17/07/2566 - 21/07/2566
- ITM131: ISO 31000:2018 - Enterprise Risk Management Process for Sustainable Achievement : กระบวนการบริหารจัดการความเสี่ยงระดับองค์กรให้สัมฤทธิ์ผลอย่างยั่งยืน ตามแนวมาตรฐานสากล ISO 31000:2018 : ค่าอบรม 9,500 12/07/2566 - 14/07/2566
- DBM020: Database Design and SQL : ค่าอบรม 14,445 10/07/2566 - 14/07/2566
- DPL001: Dart Programming Language – Fundamental : ค่าอบรม 12,000 10/07/2566 - 12/07/2566
- DSA018: การบริหารจัดการข้อมูลภายในองค์กร (Government - Data Catalog) ด้วยโปรแกรม CKAN - Open Data : ค่าอบรม 15,000 10/07/2566 - 14/07/2566
- ITM134: ออกแบบ พัฒนากระบวนการ และกำกับดูแลข้อมูลสารสนเทศ (Data Governance) : ค่าอบรม 11,000 10/07/2566 - 12/07/2566
- JAV076: Developing API GateWay with Node.js using Express Gateway : ค่าอบรม 12,500 10/07/2566 - 12/07/2566
- JAV079: TypeScript and Vue.js for Full Front-End Development : ค่าอบรม 15,500 10/07/2566 - 14/07/2566
- DBM029: MySQL Programming : ค่าอบรม 14,500 10/07/2566 - 13/07/2566
- DSA008: Data Analytics Dashboard using Tableau Tools : ค่าอบรม 4,815 06/07/2566 - 06/07/2566
- ITM132: The Process of Monitoring and Auditing of Information Technology Operations to Achieve Security as Standard ISO/IEC 27001:2013 : กระบวนการติดตามและตรวจสอบการดำเนินงานด้านเทคโนโลยีสารสนเทศให้เกิดความมั่นคงปลอดภัยตามมาตรฐานสากล ISO/IEC 27001:2013 : ค่าอบรม 9,500 05/07/2566 - 07/07/2566
- JAV078: React RxJS and Web APIs using Next.js Development : ค่าอบรม 15,500 03/07/2566 - 07/07/2566
- PTN007: Python Image Processing Using OpenCV Development : ค่าอบรม 13,375 03/07/2566 - 05/07/2566
- PTN011: Developing Microservices with Python : ค่าอบรม 12,500 03/07/2566 - 05/07/2566
- GPP015: หลักสูตรการประเมินคาร์บอนฟุตพรินต์ขององค์กร รุ่นที่ 22 (Carbon Footprint for Organization: CFO22) : ค่าอบรม 10,700 03/07/2566 - 04/07/2566
- ITM126: Data Governance and Big Data Management: การกำกับดูแลข้อมูลและการบริหารจัดการข้อมูลขนาดใหญ่ขององค์กร : ค่าอบรม 7,500 29/06/2566 - 30/06/2566
- JAV081: Reactive RESTful Web Service Using Java Spring WebFlux Programming : ค่าอบรม 15,500 26/06/2566 - 30/06/2566
- MBA018: Android Development Working With RESTful API Using Node.js & MySQL : ค่าอบรม 15,500 19/06/2566 - 23/06/2566
- PTN012: Coding สำหรับผู้เริ่มต้นเขียนโปรแกรม : Python JavaScript HTML Java C# JSON : ค่าอบรม 15,000 19/06/2566 - 23/06/2566
- TEC018: Firewall Essentials: Configuration and Management : ค่าอบรม 30,000 19/06/2566 - 23/06/2566
- HSI036: การสร้างวิดีโอ Modern Motion เพื่อการนำเสนออย่างมืออาชีพด้วยโปรแกรม Microsoft PowerPoint (รุ่นที่ 5) : ค่าอบรม 14,900 14/06/2566 - 16/06/2566
- DSA016: Power BI for Data Visualization and Analysis : ค่าอบรม 9,900 13/06/2566 - 14/06/2566
- DSA017: การจัดการข้อมูลด้วย ETL using Pentaho – PDI (Opensource) : ค่าอบรม 12,000 13/06/2566 - 15/06/2566
- GPL003: RESTful API with Go Programming Language (Golang) : ค่าอบรม 12,000 13/06/2566 - 15/06/2566
- JAV074: Node.js Express MongoDB React.js Development Guide : ค่าอบรม 13,000 13/06/2566 - 15/06/2566
- [CSS6] หลักสูตรการนำระบบงานขึ้นคลาวด์ให้มีความมั่นคงปลอดภัยตามมาตรฐาน CSA 3.0.1 และ ISO/IEC 27001:2013 รุ่นที่ 6 : ค่าอบรม 36,000 08/06/2566 - 23/06/2566
- ITM051: Business Process Improvement to Support the Digital Transformation: แนวทางการปรับปรุงกระบวนการทางธุรกิจเพื่อสนับสนุนการเปลี่ยนแปลงทางดิจิทัล : ค่าอบรม 7,500 08/06/2566 - 09/06/2566
- DSA001: AI : Python for Machine Learning Programming : ค่าอบรม 13,910 06/06/2566 - 08/06/2566
- GPL002: Go Programming Language – Fundamental (Golang) : ค่าอบรม 13,000 06/06/2566 - 08/06/2566
ธนาคารทีทีบี : ยืนยันตัวตนผ่านโมบายแบงก์กิ้ง ttb touch ด้วยตนเอง LINK
ลูกค้าธนาคารทีทีบี จะต้องสแกนใบหน้า เพื่อยืนยันตัวตนในการทำธุรกรรมผ่านโมบายแบงก์กิ้ง ttb touch ด้วยตนเองทุกครั้ง ในการทำธุรกรรมดังนี้
1.โอนเงินให้บุคคลอื่นหรือธนาคารอื่น ตั้งแต่ 50,000 บาท ขึ้นไป ต่อครั้ง
2.โอนเงินให้บุคคลอื่นหรือธนาคารอื่น ตั้งแต่ 200,000 บาท ขึ้นไป ต่อวัน
3.ปรับเพิ่มวงเงิน
ลูกค้าทีทีบีส่วนใหญ่สามารถทำธุรกรรมดังกล่าวได้ตามปกติ โดยสามารถเช็กสถานะว่าต้องไปสแกนใบหน้าที่สาขาหรือไม่ ผ่านแอป ttb touch ตามขั้นตอนนี้
• Log in แอป ttb touch
• คลิกรูปจดหมายมุมขวาบนของจอ
• เลือกกล่องข้อความเฉพาะคุณ
• เลื่อนดูข้อความวันที่ 10 มิถุนายน 2566
หากลูกค้าท่านใด ยังไม่เคยอัปเดตข้อมูลบัตรประชาชน และ/หรือสแกนใบหน้ากับธนาคาร สามารถนำบัตรประชาชนไปติดต่อทีทีบี ทุกสาขาใกล้บ้าน (รีบไปด่วนก่อนกรกฎาคม 2566 นี้)
การอบรมเดือนมีนาคม2566
หลักสูตรอบรมเดือนมีนาคม2566 ทั้งหมด 4 หลักสูตร
1. หลักสูตร การช่วยฟื้นคืนชีพขั้นพื้นฐาน #สำหรับอาสาสมัครกู้ชีพกู้ภัย (รูปแบบ Hybrid training) รุ่นที่ 2/66
- รับสมัครจำนวน 60 คน
- วันอบรม - ภาคทฤษฎี (Online) วันที่ 3 มี.ค. 66 เวลา 08.30 - 12.00 น. อบรมผ่านระบบ Google Meet
- ภาคปฏิบัติ (On-site) วันที่ 11 มี.ค.66 #มี2รอบเช้าและบ่าย "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
2. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (Online) รุ่นที่ 2/66 #ภาคประชาชน
- รับสมัครจำนวน 100 คน
- อบรมวันที่ 8 มี.ค.66 เวลา 08.30-16.00 น. "(ผ่านระบบ Google Meet)"
3. หลักสูตร การปฐมพยาบาลผู้เจ็บป่วยฉุกเฉิน ณ จุดเกิดเหตุ (On-site) รุ่นที่ 2/66
- รับสมัครจำนวน 60 คน
- วันอบรม วันที่ 15 มี.ค.66 เวลา 08.30 - 16.00 น. "ณ ห้องประชุมอาคาร 2 ชั้น 2 มูลนิธิป่อเต็กตึ๊ง"
4. หลักสูตรการขับเรือกู้ภัยเพื่อช่วยเหลือผู้ประสบภัยทางน้ำ รุ่นที่1/66 เฉพาะ #อาสาสมัครกู้ชีพกู้ภัยมูลนิธิป่อเต็กตึ๊ง เท่านั้น!
- จำนวน 60 คน
- อบรมวันที่ 17-19 มี.ค.66 ณ ศูนย์ฝึกอบรม อปพร.เขต 16 จ.ชัยนาท
#คุณสมบัติ
- อาสาสมัครกู้ชีพกู้ภัยฯที่ผ่านการอบรมหลักสูตร EMR หรือ BRC ขึ้นไป
- ไม่มีโรคประจำตัวร้ายแรง เช่น โรคหัวใจ, โรคเบาหวาน, โรคความดันโลหิตที่ไม่ได้รับการรักษาอย่างต่อเนื่อง ฯลฯ
- ในจุดพื้นที่ สน. หรือ สภอ. ที่สังกัด มีเรือกู้ภัยปฏิบัติงาน
- ยังไม่เคยได้รับใบอนุญาตนายท้ายเรือมาก่อน/ใบอนุญาตยังไม่หมดอายุ
เส้นทางที่ 7 เดิน ชิม ช้อป ตลาดน้ำอัมพวา สดชื่น ผ่อนคลาย กับบริการนวดเพื่อสุขภาพ ริมน้ำ/บนเรือ
อัมพวายังคงเป็นจุดหมายปลายทางอันดับต้นเสมอ ไม่เปลี่ยนแปลง เพราะที่อัมพวา มีครบทุกแบบ อาหารหลากหลายชวนชิมนัก สินค้าดีๆน่าช็อป อาการก็ดี วิถีชีวิตบ้านเรือนผู้คนริมน้ำตื่นตาไม่เสื่อมตลาย เดินเที่ยวแล้ว ปิดท้ายด้วยการนวดผ่อนคลาย กับบริการนวดเพื่อสุขภาพ ริมน้ำ/บนเรือ บอกเลยว่าสุดยอดเยี่ยม
สังคมดี
ชวนมาพบกับ PWD Live chat และ Job Coaching แนะแนวอาชีพคนพิการ นายจ้างและเพื่อนร่วมงาน พร้อมชวนฟังดนตรีในสวน
ด้วยกทม. มีแนวทางในการสร้างโอกาสในการทำงานให้กับคนพิการ จึงมีการนำเอา Live Chat Agent มาช่วยเพื่อสนับสนุนให้คนพิการได้แสดงศักยภาพในการทำงานอย่างเต็มที่ พร้อมอำนวยความสะดวกให้กับคนพิการที่มีอุปสรรคในการเดินทาง โดยจะเป็นการทำงานในลักษณะการตอบแชท หรือเก็บสถิติการใช้ข้อมูล โดยนำร่อง 2 สำนักงานเขต
ในบูธนี้ จะมีอาสาสมัครเทคโนโลยี (อสท.) มาช่วยเหลือ พร้อมกับมี Job Coach มาให้ความรู้และสร้างความเข้าใจกับประชาชนทั่วไปเพื่อเป็นแนวทางการสอนงานให้กับคนพิการและเป็นการทำความเข้าใจในการทำงานร่วมกันของคนทั่วไปและคนพิการอย่างเป็นระบบ เพื่อเป็นการสร้างการรับรู้ให้กับคนในสังคม และสร้างความเสมอภาคในสังคมมากขึ้น
เขตบางซื่อ มั่นใจ ติด QR Code ถังดับเพลิงในพื้นที่ รับรองผ่านการตรวจสอบเน้นย้ำความปลอดภัย สามารถใช้งานได้จริง
8 กรกฎาคม 2566 นายสรสิช เหลืองรุ่งเกียรติ ผู้อำนวยการเขตบางซื่อ มอบหมายเจ้าหน้าที่ฝ่ายพัฒนาชุมชนฯ ลงพื้นที่ดำเนินการติดตั้ง QR Code บนถังดับเพลิงในชุมชนพื้นที่เขตบางซื่อ
ซึ่งเมื่อสแกน QR Code จะปรากฏข้อมูลเกี่ยวกับถังดับเพลิง อาทิเช่น รหัสถังดับเพลิง สถานที่ติดตั้ง ประเภทถังดับเพลิง ขนาดบรรจุถังดับเพลิง สภาพอุปกรณ์ (สลักล็อค, คันบังคับ, เกจความดัน, สายฉีด และผู้บันทึกข้อมูลการตรวจสอบความปลอดภัย เป็นต้น
โดย เจ้าหน้าที่จากสถานีดับเพลิงและกู้ภัยบางโพ และ สถานีดับเพลิงและกู้ภัยบางซ่อน ได้ลงพื้นที่ตรวจสอบความปลอดภัยถังดับเพลิงในเบื้องต้น (visual inspection) และสำนักงานเขตบางซื่อ ดำเนินการจัดเก็บถังดับเพลิงที่ไม่ได้มาตรฐานตั้งแต่วันที่ 27 มิ.ย.66 ที่ผ่านมา
ทั้งนี้ เป็นการดำเนินการตามข้อสั่งการของ นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร
ซึ่งมีนโยบายเร่งด่วนให้สถานีดับเพลิงทุกสถานี และสำนักงานเขต ร่วมกับประธานชุมชนลงตรวจถังดับเพลิงชนิดเคมีแห้งทั่วพื้นที่ ที่สนับสนุนโดยกรุงเทพมหานคร เพื่อรักษามาตรการความปลอดภัยและแนวทางการดำเนินการตรวจสอบคุณภาพถังดับเพลิง และอุปกรณ์ประกอบ ช่วยให้ประชาชนมีความมั่นใจเรื่องความปลอดภัยและการใช้งานถังดับเพลิงมากยิ่งขึ้น
เขตบางกะปิ ติดตั้งคอกขยะพับได้ 10 จุด
เขตบางกะปิ ติดตั้งคอกขยะพับได้ 10 จุด ถนนรามคำแหง
- จุดที่1. ซอยรามคำแหง 19
- จุดที่2. ซอยรามคำแหง 19/1
- จุดที่3. ซอยรามคำแหง 22
- จุดที่4. หน้าร้านนฤมลคลินิกทันตกรรม
- จุดที่5. ฝั่งตรงข้ามร้านเคเอฟซี
- จุดที่6. ซอยรามคำแหง 33
- จุดที่ 7. ซอยรามคำแหง 34
- จุดที่8. ซอยรามคำแหง 41/1
- จุดที่9. ซอยรามคำแหง 53
- จุดที่10. ซอยรามคำแหง 57-59
เริ่มติดตั้งคอกขยะพับได้ตั้งแต่เวลา 17:00 น. เป็นต้นไป
9.ต้นไทรใยแก้ว
แนวคิด :บทสรุปแห่งการเริ่มต้น การเติบโต การเชื่อมต่อ ความมั่งคั่ง และความสุข
เทคนิค :แสดงภาพด้วยการผสมผสานเทคนิคการจัดแสง
งาน Unfolding Bangkok 18-26 มีนาคม 2566 ฉลอง 126 ปี การรถไฟแห่งประเทศไทย
ในวาระเฉลิมฉลองครบรอบ 126 ปีการรถไฟแห่งประเทศไทยในวันที่ 26 มีนาคม 2566 ชวนคุณมาร่วมสีสันไปพร้อมกับการเปิดมุมมองใหม่ที่เปี่ยมเสน่ห์ของสถานีรถไฟกรุงเทพ ใน “Unfolding Bangkok"
พื้นที่สถานีรถไฟกรุงเทพ หรือ หัวลำโพงสุดคลาสสิก เคยเป็นชุมทางของการเดินทางจากผู้คนทั่วประเทศมายังกรุงเทพมหานคร แม้ปัจจุบันจะลดความคับคั่งลงเหลือเพียงการเดินรถไฟไม่กี่สาย แต่สถานีรถไฟหัวลำโพงยังคงมีความสำคัญในฐานะอาคารทรงคุณค่าทางประวัติศาสตร์ ทั้งด้านสถาปัตยกรรม และความทันสมัยด้านระบบคมนาคมของประเทศไทย
บทบาทที่เปลี่ยนไปของสถานีรถไฟหัวลำโพง จึงเป็นโอกาสในการทดลองปรับพื้นที่ของสถานีรถไฟให้กลายเป็นพื้นที่สำหรับการส่งเสริมสถาปัตยกรรม การเรียนรู้และสันทนาการของผู้คน
2013
โรงพยาบาลกรุงเทพคริสเตียนได้รับการรับรองมาตรฐานโรงพยาบาล (Hospital Accreditation) จากสถาบันรับรองคุณภาพสถานพยาบาล (สรพ) เมื่อวันที่ 17 พฤษภาคม ค.ศ.2013 นับเป็นการยกระดับคุณภาพการบริการของโรงพยาบาลสู่มาตรฐานสากล
7 กลุ่มเสี่ยงรับวัคซีนป้องกันไข้หวัดใหญ่ตามฤดูกาลฟรี
7 กลุ่มเสี่ยงรับวัคซีนป้องกันไข้หวัดใหญ่ตามฤดูกาลฟรี * มีดังนี้
- หญิงตั้งครรภ์ที่อายุครรภ์ 4 เดือนขึ้นไป
- เด็กอายุ 6 เดือน ถึง 2 ปี
- ผู้ป่วยโรคเรื้อรังทุกกลุ่มอายุ(เบาหวาน ไตวาย หอบหืด ปอดอุดกั้นเรื้อรัง หัวใจ หลอดเลือดสมอง และผู้ป่วยมะเร็งที่ได้รับการรักษาด้วยเคมีบำบัด)
- ผู้ที่อายุ 65 ปีขึ้นไป
- ผู้พิการทางสมองช่วยเหลือตัวเองไม่ได้
- ผู้ป่วยโรคธาลัสซีเมีย ผู้ที่มีภูมิคุ้มกันบกพร่องรวมถึงผู้ติดเชื้อเอชไอวีที่มีอาการ
- ผู้ที่มีน้ำหนักตั้งแต่ 100 กิโลกรัม หรือดัชนีมวลกายตั้งแต่ 35 กิโลกรัมต่อตารางเมตร
*ติดต่อขอรับวัคซีนในช่วงการรณรงค์ฉีดวัคซีนป้องกันไข้หวัดใหญ่ตามฤดูกาล (พฤษภาคม-สิงหาคมของทุกปี)
ชาโลมเบเกอรี่ Shalom Bakery โรงเรียนสอนเบเกอรี่ในเชียงราย LINK
ชาโลมเบเกอรี่ Shalom Bakery โรงเรียนสอนเบเกอรี่ในเชียงราย คลาสเรียน ขนมปังโชกุปัง
✅สอนละเอียด จับมือทำ ✅ไม่มีพื้นฐานมาก่อน ก็ฝึกตามได้สบายๆ ✅สอนผสม สอนรีด และกรุลงพิมพ์ ✅จบคอร์ส พร้อมสร้างงาน สร้างอาชีพได้
Promotion สุดพิเศษ ราคา 3,900 บาท (ปกติ 4,900 บาท) ปรึกษาครูได้ตลอด ไม่มีวันหมดอายุ ตอบเองทุกแชท สอนแบบเน้นความเข้าใจ นำไปต่อยอดได้
สอบถามโทร 089-430-5829
ประชันสาย Cover Dance ตัวแม่ 13 ส.ค.66 LINK
สาย Cover Dance ตัวแม่ ตัวมัม ตัวมารดา ตัวคลอดบุตร ตัวลูก ก็มาประชันกันได้หมดค่าาาาา สำหรับการแข่งขัน Cover Dance เพลงของ #ลิซ่า Lisa หรือ #วงBlabkpink ใน #เทศกาลลูกชิ้นยืนกิน ชิงแชมป์โลก 2023 ในวันที่ 13 ส.ค.66 เริ่มการแข่งขัน เวลา 17.00 น. เป็นต้นไป ณ สนามช้างอารีน่า บุรีรัมย์ กติกา 1) มาเป็นทีม 4 คนขึ้นไป มี backup ได้ รวมไม่เกิน 20 คน 2) ไม่จำกัดเพศและอายุ 3) ต้องทำช่วง intro โชว์อัตลักษณ์อีสานไม่เกิน 30 วิ ก่อนเข้าเพลงหลัก ต้องใช้เพลง Lisa หรือ Blackpink เท่านั้น Remix ได้ ออกแบบท่าได้อิสระ รวมเวลาไม่เกิน 3-7 นาที 4) ซาวด์เพลง แบบ mp3 เท่านั้น ส่งภายใน 11 สค 16.00 น. เลยเวลาไม่รับทุกกรณี เว้นไฟล์มีปัญหา 5) ห้ามใช้อุปกรณ์เสริมบางประเภท 6) สมาชิกแต่ละทีมไม่ซ้ำกัน 7) รายงานตัวในเวลากำหนด เกินถือว่าสละสิทธิ์ 8) ใช้สำเนาบัตรปชช. หัวหน้าทีม + สมาชิก ลง A1 1 แผ่น
ประเพณีตักบาตรข้าวต้มลูกโยน 2566 สระบุรี วัดพระพุทธฉาย (รอประกาศวันที่)
งาน มหัศจรรย์ ข้าวต้มลูกโยน แห่งสระบุรี ประจำปี 2566 ประเพณีตักบาตรข้าวต้มลูกโยนจังหวัดสระบุรี ประจำปี 2566 วันที่ 29-30 ตุลาคม 2566 ณ วัดพระพุทธฉาย อำเภอเมืองสระบุรี จังหวัดสระบุรี
ฟิลิปส์ได้ทำงานร่วมกับพันธมิตรในภูมิภาคเอเชีย-แปซิฟิก เพื่อนำเสนอโมเดลการดูแลผู้ป่วยแบบใหม่ และสร้างความร่วมมือเชิงกลยุทธ์ในระยะยาวเพื่อส่งมอบการดูแลผู้ป่วยที่สร้างสรรค์ ซึ่งรวมถึงการสนับสนุนระบบสาธารณสุขในภูมิภาคเอเชีย-แปซิฟิก ในการพัฒาไปสู่ Smart Hospital ที่เชื่อมต่อผู้คน ข้อมูล และเทคโนโลยีเข้าด้วยกัน เพื่อบรรลุเป้าหมาย 4 ด้าน ได้แก่ 1) ปรับปรุงประสบการณ์การดูแลผู้ป่วย 2) ยกระดับสุขภาพส่วนบุคคลและประชากร 3) ปรับปรุงชีวิตการทำงานของบุคลากรทางการแพทย์ และ 4) ลดค่าใช้จ่ายในการรักษาพยาบาลต่อคน นอกจากนี้ การบริการ การอัปเกรด นวัตกรรมและการดำเนินงานที่ยั่งยืน ตลอดจนการฝึกอบรมและการศึกษา คือ กุญแจสู่ความสำเร็จในระยะยาวในการเปลี่ยนผ่านสู่ยุคดิจิทัล ฟิลิปส์จึงพร้อมนำเสนอระบบที่ครอบคลุมและบูรณาการ อุปกรณ์และเครื่องมือทางการแพทย์แบบสมาร์ท ซอฟต์แวร์และการบริการ ที่สามารถแก้ไขปัญหาและความท้าทายที่ผู้ให้บริการด้านสาธารณสุขกำลังเผชิญ และสามารถผลักดันการปฏิรูปด้านดิจิทัลได้อย่างเต็มความสามารถ
วัคซีนป้องกันโรคไข้เลือดออก เกษมราษฎร์ บางแค สำหรับผู้ที่มีอายุ 4-60 ปี
วัคซีน เหมาะสำหรับผู้ที่มีอายุ 4-60 ปี ฉีดได้ทั้งคนที่เคยและไม่เคยเป็นไข้เลือดออกมาก่อนโดยไม่ต้องตรวจภูมิคุ้มกันก่อนฉีด ไม่มีโรคประจำที่มีภูมิต้านทานต่ำ แนะนำให้ฉีด 2 เข็ม ห่างกัน 3 เดือน ราคา 2 เข็ม 4,500 บาท *ราคานี้ไม่รวมค่าแพทย์ แต่รวมค่าบริการโรงพยาบาลแล้ว ระยะเวลา วันนี้ - 31 ตุลาคม 2566สอบถามเพิ่มเติม02-804-8959 9jv 5038,5053
โรงพยาบาลราษฎร์บูรณะ มีบริการวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์
สอบถามเพิ่มเติมที่ Health Care Clinic 02-427-0175 ถึง 9 02-872-1001 ถึง 5 ต่อ 1507-1508
โรงพยาบาลขอนแก่นราม พร้อมบริการ วัคซีนป้องกันโรคมือ เท้า ปาก
โรงพยาบาลขอนแก่นราม พร้อมบริการ วัคซีนป้องกันโรคมือ เท้า ปาก (ที่เกิดจากเชื้อ Enterovirus : EV 71) เหมาะสำหรับเด็กอายุ 6 เดือน ถึง 5 ปี ฉีด 2 เข็ม ห่างกัน 1 เดือน
ในเด็กที่ป่วยเป็นโรค มือ เท้า ปากแล้วก็สามารถฉีดได้ แต่ต้องฉีดหลังหายป่วยแล้ว 1 เดือน
เด็กที่มีโรคประจำตัวหรือแพ้ยา ควรปรึกษากุมารแพทย์ก่อนรับวัคซีน
* ราคายังไม่รวมค่าแพทย์ ค่าบริการและค่าเวชภัณฑ์
สอบถามเพิ่มเติ่มและนัดหมายล่วงหน้าได้ที่ คลินิกเด็กดี โรงพยาบาลขอนแก่นราม โทร. 043-002002 ต่อ 2239 , 2240
บริการห้องปฏิบัติการพยาธิวิทยา
สำนักงานป้องกันควบคุมโรคที่ 7 จ.ขอนแก่น
ศูนย์สุขภาพช่องปาก โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี ทำฟันฟรี 220 คน 20 ตุลาคม 2566
ศูนย์สุขภาพช่องปาก โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี ร่วมกับมหาวิทยาลัยเทคโนโลยีสุรนารี โดยสำนักวิชาทันตแพทยศาสตร์ ขอเชิญรับบริการทางสุขภาพช่องปาก เนื่องในวันทันตสาธารณสุขแห่งชาติ ประจำปี 2566ในวันศุกร์ที่ 20 ตุลาคม 2566 ณ ศูนย์สุขภาพช่องปาก โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี จำนวน 220 ราย โดยไม่เสียค่าใช้จ่าย แบ่งจำนวนการให้บริการ ดังนี้ - ขูดหินน้ำลาย 100 ราย - อุดฟัน 50 ราย - ถอนฟัน 50 ราย - เคลือบฟลูออไรด์และเคลือบหลุมร่องฟัน (เด็ก) 20 ราย กำหนดให้บริการ 1 ท่าน ต่อ 1 งาน
ลงทะเบียนและรับบัตรคิวหน้างาน **ไม่ต้องจองคิวล่วงหน้า**
เพียงแค่แสดงบัตรประจำตัวประชาชนก็ทำฟันฟรีวันนี้ได้ !!!
เพราะโลก คือดาราศาสตร์ ดังนั้นการ “พาดาวมาหาน้อง” เปรียบเสมือนการพาเยาวชนมาใกล้ชิดกับโลกและเข้าใจสิ่งต่างๆ ที่เกิดขึ้นรอบตัวเรามากขึ้น โดยดาราศาสตร์ที่เปรียบเสมือนความรู้ที่ไกลตัว แท้จริงแล้วกลับใกล้ตัวมากกว่าที่ใครๆ คาดคิด ดังนั้นการเรียนรู้ที่ดีที่สุด คือการสัมผัสผ่านประสบการณ์จริง จากโดมท้องฟ้าจำลองซึ่งโคจรฝันและแรงบันดาลใจด้านดาราศาสตร์ สู่การจุดประกายเยาวชนในอีกหลากหลายพื้นที่ต่อไปในอนาคต
ประกาศเตือนคนไทยในอิสราเอล
ประกาศเตือนคนไทยในอิสราเอล
ตามที่ได้เกิดเหตุจรวดโจมตีจากฉนวนกาซาไปยังหลายพื้นที่ในอิสราเอลและมีผู้ก่อการร้ายแทรกซึมเข้ามาในพื้นที่ของอิสราเอล ตั้งแต่เมื่อช่วงเช้าตรู่ของวันนี้ (7 ตุลาคม 2566) นั้น สถานเอกอัครราชทูตฯ ขอเตือนให้คนไทย
- เข้าห้องหลบภัยทันทีที่ได้ยินเสียงไซเรน (หากไม่ทัน ให้หมอบราบลงกับพื้น ไม่ถ่ายรูป ไม่วิ่งไปที่โล่ง)
- ปฏิบัติตามมาตรการของทางการอิสราเอลอย่างเคร่งครัด
- ขอให้ทุกคน โดยเฉพาะอย่างยิ่งผู้ที่อาศัยในเขตภาคใต้ใกล้เคียงฉนวนกาซา และภาคกลาง (รวมถึงกรุงเทลอาวีฟ) ไม่ออกจากที่พักอาศัย
พี่น้องคนไทยที่ได้รับผลกระทบหรือมีข้อกังวล โปรดติดต่อได้ที่
- สถานเอกอัครราชทูตฯ หมายเลขโทรศัพท์ (+972) 546-368150
- กองคุ้มครองและดูแลผลประโยชน์คนไทยในต่างประเทศ หมายเลข 02-5751047 , 02-5751048 , 02-5751049 , 02-5751050 , 02-5751051
- สายด่วน ฮอตไลน์ 055-271-2201 053-245-2826 และ 054-636-8150 (หมายเลขเดิม)
คลินิคสุขภาพดี
คลินิกสุขภาพดี (Well Baby Clinic) ศบส.39 เปิดให้บริการวันอังคารและวันพฤหัสบดี ศุกร์ เวลา 13.00 น. – 16.00 น.
คือการพบแพทย์ตามนัดในคลินิกสุขภาพเด็กดีเป็นระยะ เพื่อให้มั่นใจได้ว่าลูกรักเจริญเติบโตสมวัย พัฒนาการต่างๆก้าวหน้าไปอย่างเหมาะสม โดยมีการให้บริการที่หลากหลายตรงกับแต่ละช่วงวัย ได้แก่
1. ตรวจติดตามการเจริญเติบโต และพัฒนาการ
2. การรับวัคซีน
3. การตรวจคัดกรองโรค และความผิดปกติทางพัฒนาการ
4. การให้คำแนะนำในการเลี้ยงดู
5. การนัดตรวจสำหรับเด็กทั่วไป
เด็กแต่ละวัยมีพัฒนาการ การเจริญเติบโต ความต้องการการดูแล และปัญหาที่พบบ่อยในแต่ละช่วงอายุที่แตกต่างกัน การนัดตรวจจึงมีอย่างต่อเนื่องตั้งแต่ทารกจนถึงวัยรุ่น
นัดครั้งแรก 1-2 สัปดาห์หลังคลอด เนื่องจากทารกอาจมีตัวเหลือง หรือดูดนม จากนั้น กำหนดให้ตรงกับรับวัคซีนคือ 1 เดือน , 2 เดือน 4 เดือน 6 เดือน 7-10 เดือน 1 ปี 1 ปีครึ่ง และ 2 ปี ซึ่ง 2 ปีแรกเป็นช่วงที่พบแพทย์บ่อยที่สุด เนื่องจากเป็นช่วงที่มีการเติบโตทางร่างกายและพัฒนาการอย่างรวดเร็ว หลัง 2 ปีไปแล้วจะมีนัดอย่างน้อยปีละครั้งไปจนถึงอายุ 15 ปี
การให้บริการพื้นฐาน
1. ซักประวัติ ตอบข้อสงสัยของคุณพ่อคุณแม่
2. การตรวจร่างกาย
3. ชั่งน้ำหนัก, วัดส่วนสูง, เส้นรอบศีรษะ, ประเมินภาวะโภชนาการจากค่าดัชนีมวลกาย และบันทึกค่าที่วัดได้ลงในกราฟ เพื่อประวัติอย่างต่อเนื่อง
4.ติดตามพัฒนาการ
5. รับวัคซีนตามกำหนด
6. ให้คำแนะนำในการเลี้ยงดู
คลินิกศัลยกรรม
คลินิกศัลยกรรม
- ศัลยศาสตร์ทั่วไป ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกศัลยกรรมทั่วไป บ่าย เวลา 13.00 น. - 16.00 น. (บ่าย)
- ศัลยศาสตร์ระบบทางเดินปัสสาวะ ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกศัลยกรรมระบบทางเดินปัสสาวะ เวลา 13.00 น. - 16.00 น. (บ่าย)
- ศัลยศาสตร์หลอดเลือด ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกศัลยกรรมหลอดเลือด เวลา 13.00 น. - 16.00 น. (บ่าย)
- ประสาทศัลยศาสตร์ ในเวลาราชการ 08.00 น. - 12.00 น.
- โรคอ้วน ในเวลาราชการ 13.00 น. - 16.00 น.
- ศัลยศาสตร์เด็ก ในเวลาราชการ 08.00 น. - 12.00 น.
- ศัลยศาสตร์ตกแต่ง ในเวลาราชการ 08.00 น. - 12.00 น.
- ศัลยศาสตร์ทรวงอก ในเวลาราชการ 08.00 น. - 12.00 น.
- ศัลยศาสตร์ลำไส้ ในเวลาราชการ 08.00 น. - 12.00 น.
- คลินิกไต ในเวลาราชการ 08.00 น. - 12.00 น.
ตักบาตรเทโว วัดพระปฐมเจดีย์ 30 ต.ค. 2566
ตักบาตรเทโว วัดพระปฐมเจดีย์ 30 ต.ค. 2566 เวลา 7.00 น. ทำบุญไหว้พระ องค์หลวงพ่อพระร่วง
คุณโชโกะ ชิบูยะ จากร้าน “นาโกมิ โนะ โยเนยะ” จังหวัดชิบะ
คุณโชโกะ ชิบูยะ จากร้าน “นาโกมิ โนะ โยเนยะ” จังหวัดชิบะ ร้านขนมญี่ปุ่นเก่าแก่ที่มีเจตจำนงในการรักษาประเพณีดั้งเดิมเอาไว้ ด้วยความหมายสี่ประการ ได้แก่การสร้างรสชาติที่แสนสบาย, สร้างวิถีชีวิตที่อร่อย, เชื่อมโยงผู้คนและหัวใจ, ขยายอนาคตที่เจริญรุ่งเรือง โดยได้รับรางวัลมากมายในงานนิทรรศการขนมแห่งชาติญี่ปุ่น และนิทรรศการขนมปังและขนมหวานนานาชาติ ครั้งที่ 45 ที่จัดขึ้นในลอนดอน
โปรแกรมตรวจสุขภาพพื้นฐานสำหรับคู่สมรส
โปรแกรมตรวจสุขภาพพื้นฐานสำหรับคู่สมรส สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
28 พ.ย. 66 ปานปรีย์ พร้อมเอกอัครราชทูต ณ กรุงเทลอาวีฟ เข้าเยี่ยมคารวะประธานาธิบดีอิสราเอล
28 พฤศจิกายน 2566 นายปานปรีย์ พหิทธานุกร รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ พร้อมด้วยนางสาวพรรณนภา จันทรารมย์ เอกอัครราชทูต ณ กรุงเทลอาวีฟ และคณะ เข้าเยี่ยมคาระวะนาย Isaac Herzog ประธานาธิบดีอิสราเอล ที่ทำเนียบประธานาธิบดี
ประธานาธิบดีอิสราเอลแสดงความเสียใจต่อการที่มีแรงงานไทยเสียชีวิต บาดเจ็บ และถูกจับเป็นตัวประกัน โดยกล่าวชื่นชมความพยายามของรัฐบาลไทยในการให้ความช่วยเหลือตัวประกันจนได้รับการปล่อยตัว
รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศขอบคุณฝ่ายอิสราเอลที่ให้การดูแลคนไทยเป็นอย่างดี โดยเฉพาะการดูแลช่วยเหลือทางการแพทย์แก่ตัวประกันชาวไทยที่ได้รับการปล่อยตัว และแจ้งว่า แม้ภารกิจในครั้งนี้เดินทางมาเพื่อดูแลคนไทยเป็นการเฉพาะ แต่ก็ขอให้ฝ่ายอิสราเอลพิจารณาดำเนินการเรื่องสวัสดิภาพ สิทธิและสวัสดิการอันพึงได้สำหรับแรงงานไทยด้วย เพื่อให้แรงงานไทยสามารถกลับมาทำงานในอิสราเอลในอนาคต เมื่อสถานการณ์เอื้ออำนวย
ประธานาธิบดีอิสราเอลแสดงความชื่นชมประเทศไทยและคนไทย และย้ำถึงความสำคัญของแรงงานไทยต่อภาคการเกษตรอิสราเอล โดยรับปากดูแลสิทธิและสวัสดิการของแรงงานไทย ต่อไป
หลักสูตร เทคนิคการให้บริการเพื่อการเป็นเจ้าบ้านที่ดี (Service Techniques for Being a Great Host)
เทคนิคของการพิชิตใจลูกค้านอกจากคุณภาพของสินค้าต้องดีแล้ว การบริการถือเป็นสิ่งหนึ่งที่สำคัญ สามารถสะท้อนถึงค่านิยมและวัฒนธรรมองค์กรต่อผู้พบเห็นได้เป็นอย่างดี ไม่ว่าจะเป็นในด้านมิติของลูกค้าการที่พนักงานมีจิตบริการก็จะช่วยสร้างความประทับใจ และทำให้มีโอกาสที่จะกลับมาใช้ซ้ำหรือเกิดการบอกต่อ หากเป็นด้านของพนักงานในองค์กรก็จะช่วยสร้างบรรยากาศในที่ทำงานให้น่าอยู่ สร้างความสุข และคุณภาพชีวิตที่ดีของพนักงาน ซึ่งจะนำไปสู่การเป็นองค์กรที่มีคุณภาพ และหากเป็นในด้านของอุตสาหกรรมการท่องเที่ยวของประเทศไทย การที่บุคลากรด้านการท่องเที่ยวให้การบริการและการต้อนรับด้วยความเป็นเจ้าบ้านที่ดีก็จะนำไปสู่การส่งเสริมและกระตุ้นเศรษฐกิจด้านการท่องเที่ยวได้อย่างยั่งยืน
หลักสูตรนี้ถูกวางระบบให้เกิดความเข้าใจหลักการของการให้บริการจากภายในสู่ภายนอก คือการเริ่มต้นจากองค์ความรู้พื้นฐานมุ่งไปสู่การบริการอย่างมืออาชีพ และนำไปสู่การบริหารจัดการธุรกิจด้วยความตระหนักรู้ถึงหัวใจของธุรกิจบริการด้านการท่องเที่ยว โดยปูพื้นฐานจากการเข้าใจจิตวิทยาการให้บริการเพื่อปรับทัศนคติที่ดีในการให้บริการ การทำความเข้าใจพฤติกรรมของนักท่องเที่ยวเพื่อให้ตระหนักรู้ถึงหัวใจของการสื่อสารข้ามวัฒนธรรม รวมไปถึงความรู้พื้นฐานที่สำคัญอีกมากมาย เช่น การพัฒนาบุคลิกภาพ การเรียนรู้ศิลปะการต้อนรับ การสื่อสารเพื่อสร้างความประทับใจและแนวทางการประยุกต์ใช้หลักจิตวิทยาเพื่อรับมือกับพฤติกรรมนักท่องเที่ยวแบบมืออาชีพ ทั้งหมดนี้จะทำให้ผู้เรียนมีพื้นฐานเพื่อก้าวเข้าสู่การเรียนรู้ด้านบริหารจัดการคุณภาพบริการในธุรกิจท่องเที่ยว และแนวทางการจัดการกลยุทธ์ในธุรกิจบริการ โดยมุ่งหวังให้ผู้เรียนได้ตระหนักถึงความสำคัญของการบริการด้วยการเป็นเจ้าบ้านที่ดี ได้พัฒนาทักษะเพื่อนำไปใช้ประโยชน์ในอาชีพ เพื่อสร้างความประทับใจ และส่งมอบประสบการณ์การท่องเที่ยวที่มีคุณค่าให้แก่นักท่องเที่ยว
7. บัตรประชาชนใบเดียวรักษาทุกที่ ใน 4 เขตสุขภาพ และโรงพยาบาล 200 แห่งทั่วประเทศเป็นโรงพยาบาลอัจฉริยะ
จัดประชุมเชิงปฏิบัติการเพื่อขับเคลื่อนนโยบายคิจิทัลสุขภาพ "บัตรประชาชนใบเดียว รักษาได้ทุกที่" สร้างความเข้าใจให้กับ ผู้บริหารและผู้ปฏิบัติงานในโรงพยาบาลรัฐ ทั้งในและนอกสังกัด กระทรวงสาธารณสุข โรงพยาบาลเอกชน และสภาวิชาชีพทั่วประเทศ จำนวน 500 คน เพื่อเตรียมนำระบบเทคโนโลยีดิจิทัลมใช้ในการเชื่อมโยงข้อมูลสุขภาพของหน่วยบริการทุกระดับทั้งรัฐและเอกชน ให้ประชาชนเข้าถึงระบบบริการที่สะดวก รวดเร็ว อำนวยความสะดวก บุคลากรการแพทย์ในการเข้าถึงข้อมูลสุขภาพของประชาชน ช่วยเพิ่มประสิทธิภาพและคุณภาพของหน่วยบริการให้เป็นโรงพยาบาลอัจฉริยะ (Smart Hospital) ดำเนินการได้เกินกว่าเป้าหมาย 200 แห่งทั่วประเทศ โดยมีโรงพยาบาลที่ผ่านเกณฑ์ประเมินระดับเงิน 799 แห่ง จาก 901 แห่ง คิดเป็น 88.68% โดยต้นเดือนมกราคม 2567 ใน 4 จังหวัดนำร่อง คือ แพร่ เพชรบุรี ร้อยเอ็ด และนราธิวาส มีการเชื่อมข้อมูลครบ 100% พร้อมเปิดตัวอย่างเป็นทางการ ในวันที่ 10 มกราคม 2567 ใช้ได้ทุกสิทธิ รับบริการได้ใน โรงพยาบาลรัฐทุกสังกัด รวมถึงโรงพยาบาลเอกชน คสินิกและร้านขายยา ที่ร่วมโครงการ และ 4 เขตสุขภาพใช้ได้ทุกสถานพยาบาลในสังกัดการเดินทางด้วยระบบขนส่งสาธารณะ ทางถนนและทางราง
ประเทศมาเลเซีย
MALAYSIA
1. Jeffrey Cheah School of Medicine and Health Sciences, Sunway Campus, Monash
University, Malaysia ปริญญา Bachelor of Medical Science and Doctor of Medicine
(BMedSc/MD) หลักสูตร 5 ปี ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศมาเลเซีย และ
รับรองโรงพยาบาลที่ใช้ในการเรียนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศมาเลเซีย ดังนี้
โรงพยาบาลหลัก 2 แห่ง คือ
1. Sultanah Aminah Hospital ในรัฐ Johor Bahru
2. Permai Hospital ในรัฐ Johor Bahru
โรงพยาบาลสมทบ 2 แห่ง คือ
1. Segamat Hospital
2. Mahmoodiah Community Clinic/General Practices
ว/ด/ป ที่ รับรอง 11 เม.ย. 62
ว/ด/ป ครบอายุ การรับรอง 10 เม.ย. 67
2. International Medical University, Kuala Lumpur, Malaysia
หลักสูตรภาษาอังกฤษ 5 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ ประเทศมาเลเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิก
ที่ระบุมาในหลักสูตร และอยู่ในประเทศมาเลเซีย ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. Hospital Tuanku Ja’afar, Seremban/Jalan Rasah
2. Hospital Tuanku Ampuan Najihah
3. Hospital Sultanah Nora Ismail
4. Hospital Enche’ Besar Hajjah
โรงพยาบาลสมทบ Hospital Port Dickson/ KM 11
ว/ด/ป ที่ รับรอง 10 ก.ย. 63
ว/ด/ป ครบอายุ การรับรอง 9 ก.ย. 68
3. Newcastle University Medicine Malaysia, Johor; Malaysia
หลักสูตร 5 ปี ปริญญา
Bachelor of Medicine, Bachelor of Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร
ณ ประเทศมาเลเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาใน
หลักสูตร และอยู่ในประเทศมาเลเซีย ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. Sultan Ismail Hospital
2.Hospital Sultanah Aminah
3.Hospital Sultanah Nora Ismail, Batu Pahat
โรงพยาบาลสมทบ 2 แห่ง คือ
1.Hospital Permai (Mental Health Facility)
2.Hospital Enche’ Besar Hajjah Kalsom, Kluang
ว/ด/ป ที่ รับรอง 11 มี.ค.64
ว/ด/ป ครบอายุ การรับรอง 10 มี.ค.69
4. Faculty of Medicine, Segi University Kota Damansara, Petaling Jaya, Selangor, Malaysia
หลักสูตร 5 ปี ปริญญา Bachelor of Medicine, Bachelor of Surgery (MBBS)
ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศมาเลเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียน
การสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในประเทศมาเลเซีย ดังนี้
โรงพยาบาลหลัก Hospital Sibu
โรงพยาบาลสมทบ 2 แห่ง คือ
1.Hospital Sarikei
2.Hospital Kanowit
ว/ด/ป ที่ รับรอง 11 มี.ค.64
ว/ด/ป ครบอายุ การรับรอง 10 มี.ค.69
5. School of Medicine, Faculty of Health and Medical Sciences, Taylor’s University, Selangor, Malaysia
หลักสูตร 5 ปี ปริญญา Bachelor of Medicine and Bachelor of
Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศมาเลเซีย และรับรอง
โรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศมาเลเซียดังนี้
โรงพยาบาลหลัก 1 แห่ง คือ
1. Hospital Sungai Buloh, Jalan Hospital
โรงพยาบาลสมทบ 2 แห่ง คือ
1. Hospital Bentong Jalan Tras,
2. Hospital (Clinics) III Rawang
3. Kuang Health Clinic
ว/ด/ป ที่ รับรอง 10 มี.ค. 65
ว /ด/ป ครบอายุ การรับรอง 9 มี.ค.70
6. Faculty of Medicine, Bioscience and Nursing, Mahsa University, Jenjarom, Kuala Langat, Selangor, Malaysia
หลักสูตรภาษาอังกฤษ 5 ปี ปริญญา Bachelor of Medicine
and Bachelor of Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศมาเลเซีย
และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ใน
ประเทศมาเลเซีย ดังนี้
โรงพยาบาลหลัก 2 แห่ง คือ
1. Hospital Sunagi Buloh
2. Hospital Kuala Lumpur
โรงพยาบาลชุมชนสมทบ ได้แก่ Hospital Tanjung Karang
ว/ด/ป ที่ รับรอง 8 ธ.ค. 65
ว/ด/ป ครบอายุ การรับรอง 7 ธ.ค.70
คลินิกมลพิษ โรงพยาบาลเวชการุณย์รัศมิ์
คลินิกมลพิษ โรงพยาบาลเวชการุณย์รัศมิ์ เปิดบริการวันอังคาร เวลา 13.00-16.00 น. สอบถามโทร. 02-5432090. 0842153278
คลินิกส่งเสริมการมีบุตร
คลินิกส่งเสริมการมีบุตร โรงพยาบาลบางบ่อ เปิดให้บริการ ทุกวันจันทร์ ตั้งแต่เวลา 08.00-16.00 น ห้องตรวจสูตินรีเวชกรรม จัดบริการโดยสูติแพทย์และพยาบาลผู้ดูแลเฉพาะทาง
- การให้คำปรึกษาเรื่องการมีบุตร
- การวางแผนครอบครัว
- การประเมินและปรับเปลี่ยนพฤติกรรมการดำเนินชีวิตเพื่อเพิ่มโอกาสการตั้งครรภ์
- การประเมินสาเหตุสืบค้นเพื่อหาสาเหตุภาวะมีบุตรยากเบื้องต้น
- การรักษาโรคที่เป็นสาเหตุ
ติดต่อสอบถามโทร 02-338-1133 ต่อ 205
ภายในงานยังมีบูธกิจกรรมต่าง ๆ เพื่อผู้ป่วยมะเร็ง อาทิ การให้คำปรึกษาและแจกอุปกรณ์เสริมบุคลิกภาพ เช่น เต้านมเทียม วิกผม หมวก การแนะนำแนะนำโภชนาการสำหรับผู้ป่วยมะเร็ง วิธีการดูแลตัวเองสำหรับผู้ป่วยมะเร็งที่ให้ยาเคมีบำบัดที่บ้าน และกิจกรรม “เย็บเต้านมเทียม” กับโครงการ Sabina Sewing Cup Sewing Heart "เย็บเต้ารวมใจ สู้ภัยมะเร็งเต้านม" โดยมี รัก-สุลักษมิ์ ศิริภัทรพงศ์ มิสแกรนด์สุราษฏร์ธานี 2022 และสโมสรนักศึกษาราชวิทยาลัยจุฬาภรณ์ นำคณะนักศึกษาราชวิทยาลัยจุฬาภรณ์จิตอาสามาร่วมทำกิจกรรมเสริมสร้างทักษะชีวิตและปลูกฝังการช่วยเหลือประชาชนด้วยความเพียรและจิตเมตตา ร่วมทำกิจกรรมเย็บเต้านมเทียมเพื่อส่งมอบให้กับผู้ป่วยมะเร็งเต้านม โรงพยาบาลจุฬาภรณ์
ด้วยการดูแลสุขภาพแบบองค์รวมให้แก่ผู้มารับบริการของโรงพยาบาลบำรุงราษฎร์และศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ จะทำให้เกิดการดูแลอย่างต่อเนื่อง (Continuum of care) เสริมศักยภาพการเป็นจุดหมายแห่งการดูแลสุขภาพและสุขภาวะที่น่าเชื่อถือที่สุด และยังเป็นการเสริมจุดแข็งด้านการแพทย์ของไทย สู่เป้าหมายของการเป็น ‘ศูนย์กลางสุขภาพนานาชาติ’ หรือ ‘การแพทย์ครบวงจร’ (Medical Hub) เป็นหนึ่งในอุตสาหกรรมอนาคต (New S-Curve) ซึ่งจะเป็นกลไกสำคัญในการขับเคลื่อนเศรษฐกิจของประเทศ
ประเด็นการนําสูJการปฏิบัติ
ประเด็นการนําสูJการปฏิบัติ ในปw ค.ศ.2009 WHO, UNODC, UNAIDS ได�จัดทําเป#น 9 ชุดบริการ สําหรับการปAองกันการแพรเชื้อ เอดส�ในกลุมผู�ใช�ยาฉีดซึ่งประสบความสําเร็จเป#นอยางมาก ตอมาพบวา ชุดบริการดังกลาวไมครอบคลุม จึงทํา เพิ่มขึ้นเป#น 10 - 21 ชุดบริการ (ชุด 19 - 21 สําหรับผู�ใช�สารเสพติดประเภทสารกระตุ�น) แม�กระนั้นก็ตาม การพัฒนาต�องมีอยางตอเนื่องให�ทันกับรูปแบบการใช�และอันตรายใหมๆ ด�วยชุดบริการ ประกอบด�วย 1.โปรแกรมแจกเข็มและกระบอกฉีดยา 2. การให�ยาทดแทน 3. การตรวจเลือดและการให�คําปรึกษาโรคเอดส� 4. การให�ยาต�านไวรัสเอดส� 5. การปAองกันและการรักษาโรคติดตอทางเพศสัมพันธ� 6. การแจกถุงยางอนามัย 7. การให�ข�อมูลความรู� และการสื่อสาร 8. การให�วัคซีนปAองกันโรค การตรวจวินิจฉัยและการรักษาไวรัสตับอักเสบบี 9. การปAองกัน วินิจฉัยและรักษาวัณโรค 10. การให�บริการสุขภาพพื้นฐาน รวมถึงการปAองกันและการจัดการใช�ยาเกินขนาด 11. การให�บริการตอผู�ใช�ยาในเรือนจํา 12. การให�ข�อเสนอแนะเชิงนโยบายเพื่อให�การบริการลดอันตรายจากการใช�ยาดําเนินการได� การลด ตราบาปซึ่งเป#นอุปสรรคในการเผชิญหน�ากับผู�ใช�ยา 13. การให�การชวยเหลือทางจิตสังคมและการเงิน 14. การเข�าถึงบริการด�านกฎหมายและความยุติธรรม 15. โปรแกรมเฉพาะสําหรับเด็กและเยาวชน 16. การสนับสนุนด�านการศึกษา ฝWกอาชีพ และการเงิน 17. ห�องบริโภคยาที่ปลอดภัย 18. การให�บริการแกเพศที่ออนไหว 19. การตรวจวิเคราะห�สารเสพติด (Drug checking) 2 0.ก า ร แ จ ก ก ร ะ บ อ ก สู บ ย า (Distribution of smoking paraphernalia, glass pipes, mouthpieces, filters) 21. การให�การสนับสนุนทางสังคม เชน บ�าน ที่พักพิง การจ�างงาน หลักการ global budget งบประมาณปลายปิด
หลักการ global budget งบประมาณปลายปิด ควบคุมการใช้จ่ายด้วยระบบ Fee schedule และ Point system
1. อัตราค่าบริการ Fee schedule ใน กทม ปี 2566 จำนวน 937 รายการ เป็นรายการยาประมาณ 400 รายการ อัตราค่ายาบางรายการต่ำ สำนักอนามัยและคลินิกเอกชนไม่สามารถซื้อในราคาที่กำหนด ทั้งนี้มีการปรึกษาองค์การเภสัชกรรมแล้ว ทางองค์การ
เภสัชกรรมเห็นว่าอัตราค่ายาบางรายการการต่ำจริง
2. สปสชกทม บริหารเงินได้รับจัดสรร ปี 2566 (OP slobal budget: OPGB : 2,682.86 ล้านบาท) ของแต่ละเครือข่ายพวงบริการรวมกันทั้งหมด และคำนวณยอดสะสมครั้งสุดท้ายเมื่อสิ้นปีเพื่อสรุปยอดการจ่ายเงินชดเชยค่าบริการผู้ป่วยนอก ดังนี้
2.1 จ่ายค่าบริการผู้ป่วยนอกสำหรับหน่วยบริการรับส่ง (OP Refer) ก่อน โดยจ่ายอัตรา Fee schedule (point ละ 1 บาท) กรณีไม่กำหนดรายการไว้จ่ายตามจริง ปี 2566 รวม 1,900.92 ล้านบาท
2.2 จ่ายค่าบริการผู้ป่วยนอกสำหรับหน่วยบริการประจำ (OP fee schedule: OPFS) จากเงินที่เหลือ OPGB หักลบด้วย OP refer นำมาคำนวณสัดส่วน มีข้อกำหนด point point ละไม่เกิน 1 บาท โดยไม่มีการกำหนดอัตราจ่ายขั้นต่ำ
3. ผลการคำนวณงินทั้งหมดเมื่อสิ้นปีงบประมาณ 2566 หน่วยบริการประจำจะได้รับเงินค่าบริการ รวมกันไม่เกิน 784.94 ล้านบาท (หน่วยบริการใหม่ปี 66 จ่าย point ละ 0.7 หน่วยบริการเก่า ก่อนปี 66 จ่าย pointละ 0.57 บาท)
4. ที่ผ่านมา สปสช ทำการจ่ายเงิน ต.ค.65 - มค.66 จ่าย point ละ 1 บาท ก.พ.66 - ก.ย.66 จ่าย pint ละ 0.7 บาท สปสช. มองว่า มีการจ่ายเงินให้หน่วยบริการเกินกว่าวงเงินที่กำหนด จึงแจ้งหนี้ สบส.และคลินิก รวมทั้งหมด 290.85 ล้านบาท
“Parc exo care” คอนโดมิเนียมเพื่อการลงทุน ที่นำร่องโครงการโดยใช้อาคารพักอาศัย 1 อาคาร ภายในโครงการ PARC EXO ย่านเกษตร-นวมินทร์ มาปรับฟังก์ชั่นการใช้งานให้เหมาะกับผู้สูงอายุโดยเฉพาะ ตัวอาคารเป็นคอนโด Low rise มาปรับปรุงเป็นคอนโดมิเนียมเพื่อผู้สูงวัย และเพื่อรองรับการลงทุน สำหรับผู้สูงอายุที่ต้องการวางแผนชีวิตในบั้นปลาย โดยปรับแนวคิดของโครงการ รวมถึงปรับรูปแบบของห้องชุด ให้มีฟังก์ชั่นการใช้งานที่เหมาะสมสำหรับผู้สูงอายุ และผู้อยู่อาศัยในทุกช่วงวัย โดยขณะนี้มียูนิตพร้อมขายจำกัดอยู่ประมาณ 200 ยูนิต
“Parc exo care” ยังเป็นโครงการที่เหมาะต่อการพักอาศัยเพราะมีสภาพแวดล้อมที่สงบร่มรื่น เหมาะกับผู้สูงวัย มีพื้นที่ส่วนกลางครบครัน ทั้งสวนกลางแจ้ง สระว่ายน้ำ อีกทั้งยังมี Senior Complex อยู่บริเวณด้านหน้าโครงการ ที่มีสิ่งอำนวยความสะดวกครบครัน ทั้งร้านอาหาร ร้านทำผม คลินิกกายภาพบำบัด คลินิกแพทย์แผนไทย แพทย์แผนจีนและคลินิกเวชศาสตร์ชะลอวัย ร้านอาหารเพื่อสุขภาพ อีกทั้งยังมี Senior Club พื้นที่กิจกรรมสันทนาการที่เหมาะกับลูกบ้านในทุกช่วงวัย ไม่ว่าจะเป็นวัยทำงานหรือผู้สูงอายุ เพื่ออำนวยความสะดวกให้แก่ผู้อยู่อาศัยทุกท่าน
การออกแบบและพัฒนาขนส่งระดับย่าน (Public Transportation) โปรเจกต์ ‘Go Go Bus!’
การออกแบบและพัฒนาขนส่งระดับย่าน (Public Transportation) โปรเจกต์ ‘Go Go Bus!’
บริการเดินรถไฟฟ้าขนาด 20 ที่นั่ง ที่มีการสำรวจเส้นทางใหม่เพื่อเชื่อมย่านเมืองเก่าจากเจริญกรุง - เยาวราช - พระนคร - นางเลิ้ง - ปากคลองตลาด ช่วยลดการใช้รถยนต์ในเขตเมืองเก่าที่มีที่จอดรถจำกัดและช่วยส่งเสริมการใช้พลังงานสะอาด โดยเป็นความร่วมมือของกลุ่มนักออกแบบ MAYDAY!เครือข่ายบัสซิ่งจากขอนแก่น และบริษัท อรุณพลัส จำกัด
สปสช.เขต 7 ขอนแก่น
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 7 ขอนแก่น
“ทั้งนี้ ผู้หญิงทุกคนที่อายุมากกว่า 40 ปี ควรตรวจเต้านมเป็นประจำทุกปี และปรึกษาแพทย์เพื่อรับการตรวจคัดกรองมะเร็งเต้านม เพราะการศึกษาพบว่ามะเร็งเต้านมจะมีอุบัติการณ์ที่เพิ่มมากขึ้นในผู้หญิงที่อายุมากกว่า 40 ปี ดังนั้น หากยิ่งมาตรวจได้เร็ว ก็จะรักษาได้ง่ายและมีโอกาสหายได้มากยิ่งขึ้น” รศ. นพ. วิชัย วาสนสิริ หัวหน้าศูนย์เต้านม โรงพยาบาลบำรุงราษฎร์ กล่าวทิ้งท้าย
สอบถามข้อมูลเพิ่มเติมได้ที่ ศูนย์เต้านม โรงพยาบาลบำรุงราษฎร์ โทร. 1378 หรือ 02 011 3694
UMSC โรงพยาบาลราชพิพัฒน์
UMSC โรงพยาบาลราชพิพัฒน์ แอดไลน์ @1rpp (ไลน์ออฟฟิเชียล ของรพ.ราชพิพัฒน์) เสริมแกร่งเสริมบริการดูแลประชาชนกรุงเทพในพื้นที่ 7 เขต ได้แก่ ทวีวัฒนา ตลิ่งชัน หนองแขม ภาษีเจริญ บางแค บางบอน บางขุนเทียน ให้บริการด้านการสอบถามปัญหาสุขภาพ สอบถามบริการ พบแพทย์ออนไลน์ (telemedicine) เรียกรถฉุกเฉิน EMS สอบถามเพิ่มเติม โทร 096-1032344 061-7265320 061-7264067
เขต 7
- สอน.โพนงาม จ.กาฬสินธุ์
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีบ้านเมืองใหม่ จ.ขอนแก่น
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีบ้านกระบาก จ.มหาสารคาม
- สอน.บ้านสีแก้ว จ.ร้อยเอ็ด
รับสมัครพนักงานทำความสะอาด
โรงพยาบาลลำพูนใกล้หมอ มีความประสงค์รับสมัครพนักงานทำความสะอาด
คุณสมบัติ - เพศชายหรือเพศหญิง อายุ 18 ปีขึ้นไป - ไม่จำกัดวุฒิการศึกษา - มีความละเอียดรอบคอบ - รักความสะอาด ขยัน ซื่อสัตย์ - หากมีประสบการณ์โรงพยาบาลจะพิจารณาเป็นพิเศษ - หากมีประสบการณ์เป็นผู้ช่วยกุ๊ก หรือมีความรู้ด้านการเตรียมอาหารเบื้องต้นจะพิจารณาเป็นพิเศษ เข้ามาเป็นส่วนหนึ่งกับครอบครัว "ใกล้หมอใกล้ใจ" ของเรา
สนใจสมัครด้วยตนเอง หรือสอบถามเพิ่มเติมได้ที่ ฝ่ายทรัพยากรบุคคล โรงพยาบาลลำพูนใกล้หมอ วันจันทร์ - อาทิตย์ เวลา 08.00 - 17.00 น. โทร. 053-581998 กด 7
หน่วยโสต ศอ นาสิก (หู คอ จมูก) คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกโสต ศอ นาสิก
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-พุธ และ ศุกร์ เวลา 16.00-20.00 น.
วันเสาร์-อาทิตย์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 0 2839 6390-6391 เวลา 13.00-15.00 น.
*คลินิกพิเศษติดต่อช่วงเวลา 13.00-18.00 น.
(เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ตรวจ วินิจฉัย รักษาพยาบาล และให้คำแนะนำแก่ผู้ป่วยที่มีปัญหาทางด้าน หู คอ จมูก ทั้งเด็กและผู้ใหญ่
คลินิกเฉพาะทางที่เปิดบริการเพิ่มเติม ได้แก่
1. คลินิกส่องกล้องโรคทางจมูกและไซนัส
2. คลินิกศัลยศาสตร์เสริมสร้างใบหน้าและโรคมะเร็งศีรษะและลำคอ
301 ศูนย์พัฒนาเด็กก่อนวัยเรียนเลียบคลองหมื่นแชม หมู่ 13
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
302 ศูนย์พัฒนาเด็กก่อนวัยเรียนบัวแก้ว
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
303 ศูนย์สงเคราะห์เด็กในอาคารสงเคราะห์ทุ่งครุ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
304 สถานรับเลี้ยงเด็กไฮเทคแอพพาเรล จำกัด
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
305 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมีนทองพัฒนา
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
306 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนสุเหร่าจรเข้ขบ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
307 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนมัสยิดอัตตั๊กวาพัฒนา (คลองสองต้นนุ่น)
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
308 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนปรีชา 1
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
309 ศูนย์พัฒนาเด็กก่อนวัยเรียนเศตะพราหมณ์
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
310 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนริมคลองสามเสน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
311 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนรวมน้ำใจ
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
312 ศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนคลองจวน
เวลาการให้บริการ : เปิดตลอด 24 ช.ม.
รศ. นพ.ฉันชาย สิทธิพันธุ์ คณบดีคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กล่าวสรุปและเน้นย้ำแนวทางการดำเนินการของ MedUMORE ในฐานะผู้ขับเคลื่อน องค์ความรู้ทางการแพทย์ยุคใหม่ เพื่อให้เป็นแพลตฟอร์มของคนไทย ที่คนต่างชาติเข้ามา เรียนรู้ เป็นศูนย์กลางแหล่งสืบค้นข้อมูลทางการแพทย์ที่ดีที่สุด ในภูมิภาคเอเชียแปซิฟิก ให้สอดรับกับ Future Healthcare และอนาคตการศึกษาเพื่อการแพทย์ และสาธารณสุข ของไทย ที่ทำให้คุณภาพชีวิตของคนไทยและสังคมโลกดีขึ้น
โปรแกรมท่องเที่ยว 6 เส้นทาง เดือนกรกฎาคม-สิงหาคม 2567
“สุขทันทีที่เที่ยวกับรถไฟไทย เดินทางครั้งนี้ไม่เหมือนเดิม” 6 เส้นทางท่องเที่ยวรถไฟ เดือนมหามงคลกรกฎาคม 4 เส้นทาง และ เดือนสิงหาคม 2 เส้นทาง
การรถไฟแห่งประเทศไทย ร่วมกับ การท่องเที่ยวแห่งประเทศไทย (ททท.) และหน่วยงานพันธมิตรภาคเอกชน ได้แก่ บริษัท บุญรอด เทรดดิ้ง จำกัด บริษัท เรกคิทท์ เบนคีเซอร์ (ประเทศไทย) และบริษัท ทิพยประกันภัย จำกัด (มหาชน) ชวนเปิดประสบการณ์ท่องเที่ยวรูปแบบใหม่ทางรถไฟ 6 เส้นทาง “สุขทันทีที่เที่ยวกับรถไฟไทย เดินทางครั้งนี้ไม่เหมือนเดิม”
เพื่อส่งมอบประสบการณ์เดินทางท่องเที่ยวรูปแบบใหม่ ผ่านการเดินทางโดยรถไฟ ที่มีความสะดวกสบาย ความปลอดภัย ช่วงเดือนกรกฎาคม-สิงหาคม 2567 จำนวน 6 เส้นทาง ประกอบด้วย
เดือนกรกฎาคม 2567
กิจกรรมโดยรถไฟ KIHA 183 จำนวน 4 เส้นทาง พร้อมแพ็กเกจท่องเที่ยว 2 วัน 1 คืน ราคา 3,999 บาท ต่อท่าน ได้แก่
เดือนสิงหาคม 2567
กิจกรรม “สิงหาแม่พาเที่ยว” 2 เส้นทางรถไฟ ในรูปแบบ One Day Trip ได้แก่
พร้อมกิจกรรมสุดพิเศษของเดือนสิงหาคม กิจกรรม “สิงหาแม่พาเที่ยว” เฉพาะคุณแม่รับบัตรกำนัล มูลค่าเท่ากับราคาตั๋วโดยสารฟรี 1 สิทธิ์ต่อ 1 ครอบครัว เพียงแสดงบัตรประชาชนของคู่คุณแม่คุณลูก และสำเนาทะเบียนบ้าน (สามารถรับบัตรกำนัลได้ในวันเดินทาง)
การท่องเที่ยวแห่งประเทศไทย (ททท.) ได้ร่วมสนับสนุนนำมัคคุเทศก์มืออาชีพ ช่วยบรรยายความรู้และข้อมูลต่าง ๆ พร้อมจัดกิจกรรมสุดพิเศษเพื่อเพิ่มบรรยากาศแห่งความสุขบนขบวนรถไฟ ตลอดเดือนกรกฎาคม อาทิ เส้นทางราชบุรี พบกับคุณเจ ชลัช นายแบบมากฝีมือที่จะมาร่วมเดิน Fashion Show ผ้าขาวม้าของดีประจำเมืองราชบุรีครั้งแรกบนรถไฟ เส้นทางสวนสนประดิพัทธ์ จังหวัดประจวบคีรีขันธ์ พบกับอาจารย์อัส มนต์คเนศวร์ สิริปภัสสร ที่จะมาบรรเลงบทเพลงพระราชนิพนธ์อันทรงคุณค่าด้วย Saxophone ครั้งแรกบนรถไฟ เส้นทางสุพรรณบุรี ที่จะพาทุกท่านร่วมย้อนวันวานกับ “น้าโย่ง” ที่จะมาขับร้องเพลงฉ่อยเรื่องราวการกำเนิดเมืองอู่ทองที่สอดแทรกความเป็นไทย ให้ทุกท่านได้ร่วมสนุกและเพลิดเพลิน และเส้นทางปราจีนบุรี พบกับเคล็ดลับ การสักการะท้าวเวสสุวัณ จากซินแสเป็นหนึ่ง วงษ์ภูดร ที่จะพาทุกท่านร่วมมูเตลูกันแบบจัดเต็ม
สำหรับ ผู้ที่สนใจจองโปรแกรมท่องเที่ยวทั้ง 6 เส้นทาง สามารถซื้อตั๋วได้ตั้งแต่วันที่ 29 มิถุนายน 2567 เวลา 08.30 น. เป็นต้นไป ที่สถานีรถไฟทั่วประเทศหรือผ่านระบบออนไลน์ D-ticket ของการรถไฟแห่งประเทศไทย หรือสามารถสอบถามเพิ่มเติมได้ที่ ศูนย์บริการลูกค้าสัมพันธ์ การรถไฟแห่งประเทศไทย 1690
เชฟรอนให้ความสำคัญกับการพัฒนาพลังคน - นางสาวพรสุรีย์ กอนันทา
แรงบันดาลใจของเหล่าเยาวชนกว่า 100 ชีวิตเปรียบเสมือนกล้าต้นใหม่ที่จะเติบโตไปพร้อม “รากแก้ว” ที่แข็งแกร่ง โดยด้าน นางสาวพรสุรีย์ กอนันทา รองประธานกรรมการบริหาร ฝ่ายกิจการองค์กร บริษัท เชฟรอนประเทศไทยสำรวจและผลิต จำกัด กล่าวถึงการสนับสนุนค่ายดังกล่าวว่า “สิ่งที่เชฟรอนในฐานะบริษัทพลังงานให้ความสำคัญมาโดยตลอดคือการพัฒนาพลังคน ผ่านการสร้างรากฐานของการศึกษาที่แข็งแกร่ง ซึ่งทักษะด้านสะเต็ม ถือเป็นองค์ความรู้สำคัญที่ต้องปลูกฝังแก่เยาวชน เพื่อสร้างนวัตกรรมและขับเคลื่อนประเทศชาติในอนาคต ตลอด 26 ปีที่เชฟรอนได้สนับสนุนค่ายรากแก้ว เรารู้สึกยินดีและขอบคุณทางองค์การบริหารสโมสรนิสิตจุฬาลงกรณ์มหาวิทยาลัยอย่างมาก ที่ได้ให้โอกาสเชฟรอนเข้ามาเป็นส่วนหนึ่งของการสร้างรากแก้วที่แข็งแกร่งของเยาวชน ซึ่งในทุกๆ ปี เราได้เห็นดอกผลความสำเร็จจนเดินทางมาถึงปีที่ 33 และเชื่อมั่นว่าแรงบันดาลใจของน้องๆ ทุกคนในวันนี้ จะส่งต่อสู่รากแก้วรุ่นถัดไปอย่างไม่รู้จบ”
ศ.ดร.ปาริชาต สถาปิตานนท์ รักษาการรองอธิการบดีจุฬาลงกรณ์มหาวิทยาลัย เน้นย้ำว่าใจกลางของความเป็นจุฬาลงกรณ์คือความเปิดกว้าง ซึ่งมีต้นกำเนิดจากวิสัยทัศน์ของพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัวในด้านการศึกษาที่เท่าเทียม “จุฬาลงกรณ์เป็นพระนามของพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว พระองค์ตรัสไว้เมื่อหนึ่งร้อยปีก่อนว่าราษฎรทั้งปวงของพระองค์ ตั้งแต่พระราชโอรสและธิดาจนถึงสามัญชน และคนชั้นล่างที่สุด ต้องมีโอกาสได้เรียนหนังสือเหมือนกัน” ชาวไทยเทิดทูนพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัวอย่างสุดซึ้งจึงได้ช่วยกันลงขัน ได้เงินจำนวนกว่าเจ็ดแสนบาทในขณะนั้นเพื่อสร้างอนุสาวรีย์ของพระองค์ เงินที่เหลือได้นำไปใช้สร้างมหาวิทยาลัยบนที่ดินที่พระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัวทรงพระราชทานบริจาค ปัจจุบัน จุฬาลงกรณ์มหาวิทยาลัยไม่ได้เป็นเพียงสถาบันการศึกษาเท่านั้น แต่ยังเป็นศูนย์กลางของการค้าและความหลากหลายอันเป็นหัวใจของผู้ประกอบการ
หากไม่มีการห้าม TAPS ที่เข้มงวด เยาวชนจะต้องผจญกับการตลาดอุตสาหกรรม
อุตสาหกรรม ที่ใช้กีฬา ดนตรี ภาพยนตร์ และโทรทัศน์มาเป็นเวลานาน เพื่อนำแบรนด์ที่เป็นอันตรายเข้ามาในชีวิตของคนหนุ่มสาว
โซเชียลมีเดียทำให้มีวิธีใหม่ในการดึงดูดและโต้ตอบกับผู้ชมที่เป็นวัยรุ่น
เม็กซิโก
โพสต์นี้ส่งเสริมบุหรี่ไฟฟ้าที่จำหน่ายโดย ผู้ค้าปลีกชาวเม็กซิกันแสดงภาพที่ได้รับการแก้ไขแบบดิจิทัลของกิเยร์โม่ โอโชอา ผู้รักษาประตูชาวเม็กซิกัน ทีมชาติ. คำบรรยายภาพอ่านว่า: “อย่าปล่อยให้ความอยากของคุณมาถึงคุณในฟุตบอลโลกครั้งนี้ หยุดพักด้วยการสูบไอเหมือนผู้ยิ่งใหญ่” [34]
อินโดนีเซีย
ภาพของนารูโตะตัวละครอนิเมะยอดนิยมนี้ นำไปใช้ทำการตลาดบุหรี่ไฟฟ้า คำบรรยายภาพอ่านว่า: “นารูโตะเพิ่งไล่ล่า Aegis Solo 2 ทำไมคุณไม่ทำล่ะ” [35]
อินเดีย
โปสเตอร์สำหรับภาพยนตร์เรื่อง “Shehzada” เนื้อเรื่องของนักแสดง-โปรดิวเซอร์ภาพยนตร์สูบบุหรี่ [31]
หมายเหตุ: ตัวอย่างที่นี่รวบรวมโดยขบวนการบังคับใช้และการรายงานยาสูบ (https://termcommunity.com/) ระบบติดตามสื่อดิจิทัลที่แสดงหลักฐานการตลาดยาสูบและนิโคตินบนแพลตฟอร์มโซเชียลมีเดียและเว็บไซต์ข่าว
นอกจากนี้ ราชวิทยาลัยจุฬาภรณ์ ยังได้จัดแสดงนิทรรศการเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ๒๘ กรกฎาคม ๒๕๖๗ และเปิดให้อาจารย์ นักศึกษา บุคลากรและประชาชนร่วมลงนามถวายพระพรชัยมงคล ณ ชั้น ๑ อาคารวิทยาลัยแพทยศาสตร์ศรีสวาควัฒน และการจัดแสดงบูธ ๕ นวัตกรรมบริการสุขภาพราชวิทยาลัยจุฬาภรณ์เพื่อปวงชน พร้อมทั้งเปิดให้ประชาชนได้ร่วมทำกิจกรรมเวิร์คช้อปปลูกต้นไม้ สืบสาน รักษา ต่อยอดพื้นที่สีเขียวเพื่อประโยชน์แก่ประเทศชาติ และการทำยาดมสมุนไพรไทย สืบสาน รักษา สร้างเสริมสุขภาพดีด้วยวิถีแพทย์แผนไทย และการเสวนาให้ความรู้และ workshop เรื่อง “สร้างเสริมสุขภาพดีด้วยวิถีแพทย์แผนไทย” และไฮไลท์การเปิดให้สื่อมวลชนได้เข้าเยี่ยมชมรถเอกซเรย์คอมพิวเตอร์พร้อมในโครงการเฉลิมพระเกียรติฯ พร้อมสาธิตเคสในการตรวจประเมินสภาพปอดด้วยเครื่องเอกซเรย์คอมพิวเตอร์และเทคโนโลยีปัญญาประดิษฐ์ นวัตกรรมการออกแบบโดยคนไทยเพื่อนำมาใช้ในการตรวจประเมินสภาพปอดที่ต้องเผชิญกับปัญหาฝุ่นละอองจิ๋ว PM ๒.๕ ในปัจจุบัน เพื่อนำไปสู่การขับเคลื่อนและพัฒนานโยบายทางด้านการจัดการมลพิษของหน่วยงานรัฐบาลที่เกี่ยวข้องต่อไป
สอบถามข้อมูลเพิ่มเติม
- สายด่วนกรมควบคุมโรค 1442
- สายด่วนกรมสนับสนุนบริการสุขภาพ 1426
7. Ross (รอส) Motion-Assist Exosuit: ผู้ช่วยคนใหม่ของเหล่าผู้ดูแล
Ross (รอส) ผู้ช่วยคนใหม่ของเหล่าผู้ดูแล ชุด Exosuit สัญชาติไทย โดย ดร.ธนรรค อุทกะพันธ์ ศูนย์เทคโนโลยีโลหะและวัสดุแห่งชาติ (MTEC) สวทช. ที่จะช่วยผ่อนแรงและลดความเสี่ยงในการบาดเจ็บจากการยกของหนัก
ศูนย์สนับสนุนบริการสุขภาพที่ 7 ขอนแก่น
ศูนย์สนับสนุนบริการสุขภาพที่ 7 (Regional Health Service Support Center 7) มีพื้นที่รับผิดชอบ จำนวน 4 จังหวัด ได้แก่ กาฬสินธุ์ ขอนแก่น มหาสารคาม ร้อยเอ็ด
- 303/2 หมู่ 14 ถ.มิตรภาพ ต. ศิลา อ.เมืองขอนแก่น จ.ขอนแก่น 40000
- โทร 043-243738-9 โทรสาร 043-247045
- email : saraban-hss7@hss.mail.go.th
- Google map
- Facebook
- Website
7. หุ่นยนต์รักษาความปลอดภัย (Security Robot)
การรักษาความปลอดภัยเป็นความจำเป็นพื้นฐานอย่างหนึ่งที่ทุกภาคส่วนให้ความสำคัญ อย่างไรก็ตาม การรักษาความปลอดภัยในปัจจุบันยังมีข้อจำกัดอยู่หลายด้าน อาทิ การเฝ้าระวังบุคคลและเหตุต้องสงสัยเพื่อป้องกันเหตุร้ายในพื้นที่สำคัญ ต้องใช้ทักษะและความเชี่ยวชาญของเจ้าหน้าที่ การตรวจการณ์พื้นที่ขนาดใหญ่ยังไม่ครอบคลุมทั่วถึงทุกพื้นที่ เจ้าหน้าที่มีความเสี่ยงในการปฏิบัติงานในพื้นที่เสี่ยงอันตราย รวมถึงพื้นที่ความมั่นคงที่มีการเกิดเหตุซ้ำ
หน่วยงานความมั่นคงรวมถึงภาคเอกชนทั่วโลกให้ความสนใจลงทุนทำวิจัยและพัฒนาเทคโนโลยีอย่างมากในแต่ละปี เทคโนโลยีหุ่นยนต์ (robotics) เป็นหนึ่งในเทคโนโลยีที่น่าจับตามอง การนำหุ่นยนต์มาใช้ในการรักษาความปลอดภัยจะช่วยลดความเสี่ยงของเจ้าหน้าที่, AI จะช่วยเพิ่มประสิทธิภาพการตรวจการณ์ให้ดีมากขึ้นได้อีกด้วย
7.AFFORDABLE AND CLEAN ENERGY พลังงานที่ราคาไม่แพงและสะอาด
ระหว่างปี 2000 ถึง 2018 จำนวนประชากรที่มีไฟฟ้าเพิ่มขึ้นจาก 78 เป็น 90 เปอร์เซ็นต์ และจำนวนประชากรที่ไม่มีไฟฟ้าลดลงเหลือ 789 ล้านคน
อย่างไรก็ตาม ในขณะที่ประชากรยังคงเพิ่มขึ้น ความต้องการพลังงานราคาถูกก็จะเพิ่มขึ้นตามไปด้วย และเศรษฐกิจที่พึ่งพาเชื้อเพลิงฟอสซิลกำลังสร้างการเปลี่ยนแปลงอย่างรุนแรงต่อสภาพอากาศของเรา
การลงทุนในพลังงานแสงอาทิตย์ พลังงานลม และพลังงานความร้อน การปรับปรุงประสิทธิภาพการใช้พลังงาน และการรับประกันพลังงานสำหรับทุกคนถือเป็นสิ่งสำคัญหากเราต้องการบรรลุเป้าหมาย SDG 7 ภายในปี 2030
การขยายโครงสร้างพื้นฐานและการยกระดับเทคโนโลยีเพื่อให้มีพลังงานที่สะอาดและมีประสิทธิภาพมากขึ้นในทุกประเทศจะช่วยส่งเสริมการเติบโตและช่วยรักษาสิ่งแวดล้อม
7.Immersive-reality technologies - เทคโนโลยีความจริงเสมือน
เทคโนโลยี Immersive-reality ช่วยให้เกิดการโต้ตอบแบบเรียลไทม์ในโลกเสมือนจริงสามมิติ (ซึ่งอาจรวมเอาโลกกายภาพจริงไว้ด้วย) โลกเสมือนจริงสามารถมีตั้งแต่พื้นที่ที่สร้างด้วยคอมพิวเตอร์ทั้งหมดในความจริงเสมือน (VR) ไปจนถึงความจริงผสม (MR) ไปจนถึงความจริงเสริม (AR) ซึ่งวัตถุที่สร้างด้วยคอมพิวเตอร์จะซ้อนทับบนโลกแห่งความเป็นจริง เทคโนโลยีเหล่านี้ใช้ประโยชน์จากการคำนวณเชิงพื้นที่เพื่อตีความพื้นที่ทางกายภาพ (ตัวอย่างเช่น โดยใช้ประโยชน์จากเซ็นเซอร์และกล้อง เช่น ในชุดหูฟัง VR เพื่อจดจำท่าทาง) และจำลองการเพิ่มข้อมูล วัตถุ และผู้คนลงในโลกเสมือนจริง
งานป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง
งานป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง
วัน-เวลาทำการ ทุกวันศุกร์ เวลา 13.00 - 16.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์)
** ออกหน่วยรณรงค์ในชุมชนพื้นที่ในช่วงเดือนมีนาคม และ กันยายน ของทุกปี **
เบอร์ติดต่อ : 02 2842331 ต่อ 108
ขอบเขตการให้บริการ
ผู้รับบริการสามารถนำสัตว์เลี้ยงลูกด้วยนมทุกชนิด มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในวันและเวลาที่กำหนด
หมายเหตุ : หากสัตว์เลี้ยงเจ็บป่วยอยู่ ไม่ควรนำมารับวัคซีน
โปรแกรมบริหารคลินิก iClinig ระบบคลินิกออนไลน์ AI
โปรแกรมบริหารคลินิก iClinig แพล็ตฟอร์มบริหารคลินิกประสิทธิภาพสูงประมวลผลด้วย AI ข้อมูลที่ถูกต้องแม่นยำ ด้วยจุดเด่น 3 ด้านที่เหนือกว่า ได้แก่ 1) ประมวลผลด้วย AI อัจฉริยะ ไอคลินิกมีผู้ช่วย AI คอยประมวลผล และคาดการณ์ธุรกิจที่แม่นยำ ตรวจสอบย้อนกลับได้ทุกชั้นตอนเพื่อลดข้อผิดพลาด 2) Cloud AWS Cloud AWS เป็นบริการมาตรฐานระดับโลก ประมวลผลรวดเร็ว ใช้งานได้ทุกที่ ทุกเวลา พร้อมระบบสำร้องข้อมูล 24/7 3) Cyber Security มีระบบป้องกันความปลอดภัยข้อมูล (PDPA) เข้ารหัสความปลอดภัยขั้นสูงตามมาตรฐาน ISO/IEC 27001
โปรแกรมไอคลินิก ออกแบบมาให้ใช้ง่าย รองรับการใช้งานทุกอุปกรณ์ โปรแกรมใช้งานได้หลากหลายอุปกรณ์ Smart Device, Tablet, Notebook, Computer PC, Smart TV และอื่นๆ UX & UI สวยงาม หน้าตาโปรแกรม ทันสมัย มีหลากหลายโหมดให้ปรับใช้งาน AI Forecasting การวิเคราะห์ยอดขาย Real-time มีผู้ช่วย AI สำหรับช่วยประมวลผล วิเคราะห์ข้อมูล ขอดขาย และระบบแจ้งอัตโนมัติ ไม่ผ่านทุกการเคลื่อนไหว ลดต้นทุน เพิ่มยอดขาย
ฟังก์ชั่นใหม่ๆ โปรแกรมบริหารคลินิก iClinig ที่น่าสนใจ ได้แก่
- ระบบผู้ป่วยนอก-ผู้ป่วยใน OPD & IPD สามารถบันทึกข้อมูล IPD และ OPD เช็คประกันสุขภาพ เบิกจ่าย และอื่นๆ ได้ครบถ้วน
- AI ช่วยวิเคราะห์ยอดขาย สามารถวิเคราะห์ยอดขายได้อย่างแม่นยำ ช่วยผู้บริหารในการตัดสินใจ
- ระบบห้องแล็บ Lab & X-Ray สามารถบันทึกผล Lab และ X-Ray ได้ทั้งก่อนทำและหลังทำได้แบบ Realtime ได้
- ระบบลูกค้าสัมพันธ์ Line & CRM สามารถเชื่อมต่อ Line OA ของลูกค้าเพื่อสะสมแต้ม แจ้งเตือน ทำนัดหมาย ส่งใบแจ้งหนี้มางไลน์และอื่นๆ (เฉพาะ Enterprise Solution)
- ระบบบการเงิน-บัญชี Finance & Payment มีระบบบัญชีสามารถทำรายรับรายจ่ายได้ สรุปรายได้และภาพรวมของธุรกิจได้อย่างยอดเยี่ยม
แพคเกจค่าบริการตามฟังก์ชั่น แบ่งเป็น Start Professional Business+ ระหว่าง 20,900 - 95,900 บาท/ปี
สอบถามโทร 083-423-1134
โปรแกรมคลินิกความงาม คลินิก Clinic Software
โปรแกรมคลินิกความงาม
เราคืออันดับหนึ่งด้านโปรแกรมจัดการคลินิกและสถาบันเสริมความงาม ทุกประเภท และซอฟแวร์เกี่ยวกับ คลินิก Clinic Software หรือที่เรียกว่า โปรแกรมคลินิกความงาม ช่วยบริหารงานคลินิกให้ง่ายขึ้น ทางเราขอแนะนำ โปรแกรม Medical Clinic Management On Cloud สำหรับคลินิกความงามโดยเฉพาะ บริหารและจัดการคลินิกไปจนถึงสถาบันเสริมความงามชั้นนำทั่วไทย Clinic and Beauty Software
โปรแรมคลินิกของเรา ได้ถูกออกแบบมาเพื่อใช้บริหารงานในคลินิกความงามโดยตรง เป็นโปรแกรมที่ทันสมัย ออกแบบมาเป็นลักษณะ Cloud Computing เพื่อรองรับกรณีที่มีสาขาจำนวนมากๆ โดยเฉพาะ สามารถขายทรีตเม้นท์ , ให้บริการลูกค้า เช็คทรีตเม้นท์คงเหลือได้ตลอดเวลา พร้อมทั้งดูรายงานการขายได้ผ่านสมาร์ทโฟน หรือ Tablet ได้ตลอดเวลา
ค่าบริการการแพทย์และพยาบาล
สมาคมสว่างนครน่านรวมใจ รับบริจาคข้าวสารอาหารแห้งน้ำดื่ม ทำอาหารเพื่อแจกจ่ายให้กับผู้ประสบภัย LINK
สมาคมสว่างนครน่านรวมใจ เปิดรับบริจาค ข้าวสาร อาหารแห้ง น้ำดื่ม ไข่ไก่ หรือ ทุนทรัพย์ในการนำไปซื้อวัตถุดิบในการทำอาหารเพื่อแจกจ่ายให้กับผู้ประสบภัย และกิจกรรมอันเป็นสาธารณะกุศล
บริจาค ได้ที่ ธนาคารออมสิน สาขาน่าน เลขที่บัญชี 020393085004 ชื่อบัญชี สมาคมสว่างนครน่านรวมใจ หรือสามารถบริจาคได้ที่ สมาคมสว่างนครน่านรวมใจ ตั้งอยู่ที่ ถนนเจ้าฟ้า ต.ในเวียง อ.เมืองน่าน จ.น่าน
หากพี่น้องประชาชนได้รับความเดือดร้อนต้องการความช่วยเหลือ สามารถติดต่อได้ที่ หน่วยกู้ภัยสมาคมสว่างนครน่านรวมใจติดต่อสอบถามเพิ่มเติมได้ที่ 054-052215 หรือ 098-8852877
คลินิกแพทย์แผนไทย โรงพยาบาลสิรินธร กรุงเทพมหานคร
ผู้ก่อตั้ง Beyond the Spectrum มอบเงินรายได้ทั้งหมด แก่สถาบันฯ
สรัญญา ถวิลวิทู ผู้ก่อตั้ง Beyond the Spectrum มอบเงินรายได้ทั้งหมด ที่ได้จากการจำหน่ายบัตร และผู้สนับสนุน ไม่หักค่าใช้จ่าย มอบแก่สถาบันฯ
คลินิกพิเศษเฉพาะทางอายุรกรรมโรคไต นอกเวลาราชการ โรงพยาบาลนางรอง
โครงการควบคุมและป้องกันภาวะโลหิตจาง
ภาวะโลหิตจางจากการขาดธาตุเหล็ก เป็นปัญหาสาธารณสุขที่พบทั่วโลกทั้งในประเทศที่พัฒนาแล้วและประเทศกำลังพัฒนา ภาวะโลหิตจางส่งผลต่อการเจริญเติบโตของร่างกาย พัฒนาการสมอง ระดับสติปัญญา ประสิทธิภาพการเรียนรู้และการทำงานของทุกกลุ่มวัย ได้แก่ เด็กปฐมวัย เด็กวัยเรียน หญิงวัยเจริญพันธุ์และหญิงตั้งครรภ์
ข้อมูลจากโครงการสำรวจภาวะโภชนาการเด็กในภูมิภาคเอเชียตะวันออกเฉียงใต้ พ.ศ.2556 (South East Asia Nutrition Survey : SEANUTS) พบว่า ความชุกภาวะโลหิตจางในเด็กอายุ 6 เดือน ถึง 2 ปี ในเขตชนบทสูงกว่าเด็กในเขตเมืองเกือบเท่าตัว หรือร้อยละ 26.0 ในเขตเมือง และร้อยละ 41.7 ในเขตชนบท เด็กปฐมวัยอายุ 3 – 5 ปี พบร้อยละ 3.1 ในเขตเมือง และร้อยละ 14.3 ในเขตชนบท เด็กวัยเรียนอายุ 6 – 12 ปี พบร้อยละ 6.6 ในเขตเมือง และร้อยละ 12.2 ในเขตชนบท อีกทั้งยังมีข้อมูลจากกรมอนามัย ร่วมกับกรมสุขภาพจิต ได้สำรวจสถานการณ์ภาวะโภชนาการ ภาวะโลหิตจาง และระดับสติปัญญาในเด็กไทยวัยเรียน ปี 2557 โดยพบความชุกภาวะโลหิตจางในเด็กอายุ 6 ปี ร้อยละ 31.1 สำหรับรายงานการสำรวจสุขภาพประชาชนไทย โดยการตรวจร่างกาย (NHES) ครั้งที่ 4, 5, 6 พ.ศ. 2552, 2557 และ 2562 พบความชุกหญิงวัยเจริญพันธุ์ อายุ 15 – 44 ปี มีภาวะซีด ร้อยละ 25.7, 22.7 และ 16.0 ตามลำดับ
จากการพัฒนาฐานข้อมูลระบบเฝ้าระวังด้านภาวะโลหิตจางในระบบ Health Data Center ในปีงบประมาณ 2566 พบภาวะโลหิตจางในหญิงวัยเจริญพันธุ์ อายุ 15 – 49 ปี ที่ตรวจขณะไม่ได้ตั้งครรภ์ ร้อยละ 40 ขึ้นไปทุกเขตสุขภาพ (HDC ณ 16 มิ.ย.66) ซึ่งสอดคล้องกับสถานการณ์ระดับโลกที่พบหญิงวัยเจริญพันธุ์มีภาวะซีด ร้อยละ 30 หรือ 539,000,000 คนในปี 2019 (WHO ณ 1 พ.ค.66) กระทบต่อไปยังภาวะโลหิตจางในหญิงตั้งครรภ์ได้ โดยข้อมูลจาก HDC กระทรวงสาธารณสุข พบร้อยละ 30 ใกล้เคียงกับข้อมูลจากองค์การอนามัยโลกที่พบ ร้อยละ 37 หรือ 32,000,000 คน ซึ่งภาวะโลหิตจางสามารถเพิ่มความเสี่ยงต่อการตกเลือดของมารดานำไปสู่การเสียชีวิตได้
กรมอนามัย โดยสำนักโภชนาการ ได้ดำเนินโครงการควบคุมและป้องกันภาวะโลหิตจางมาอย่างต่อเนื่อง โดยสร้างความรอบรู้การบริโภคอาหารที่มีธาตุเหล็กและโฟเลตสูง มีมาตรการยาเสริมธาตุเหล็กเชิงป้องกันให้กับประชากรกลุ่มเสี่ยงในประเทศไทย โดยให้บริการจ่ายยาเม็ดเสริมไอโอดีน ธาตุเหล็ก และกรดโฟลิกในหญิงตั้งครรภ์และหญิงหลังคลอดบุตร 6 เดือน ยาน้ำเสริมธาตุเหล็กในเด็กอายุ 6 เดือนถึง 5 ปี ยาเม็ดเสริมธาตุเหล็กในเด็กวัยเรียน อายุ 6 – 12 ปี และยาเม็ดเสริมธาตุเหล็กและกรดโฟลิกในหญิงวัยเจริญพันธุ์ อายุ 13 – 45 ปี ภายใต้ชุดสิทธิประโยชน์ของสำนักงานหลักประกันสุขภาพแห่งชาติ (ฉ.10) การสร้างความร่วมมือกับ setting สถานประกอบการให้มีสภาพแวดล้อมที่เอื้อต่อการป้องกันภาวะโลหิตจาง ซึ่งเป็นช่องทางที่เข้าถึงกลุ่มเป้าหมายหญิงวัยเจริญพันธุ์ได้ตรงจุดและเป็นจำนวนมาก อีกทั้งยังมีคณะกรรมการจากกระทรวงสาธารณสุขและหน่วยงานภาคีเครือข่ายที่เกี่ยวข้องร่วมกันผลักดันและขับเคลื่อนการดําเนินงานอย่างต่อเนื่องโดยมีวัตถุประสงค์เพื่อควบคุมและป้องกันภาวะโลหิตจางในประชากรกลุ่มเสี่ยง ส่งผลให้ประชาชนทุกกลุ่มวัยมีคุณภาพชีวิตที่ดี
อันนำไปสู่การบรรลุเป้าหมายการพัฒนาที่ยั่งยืน Sustainable Development Goals (SDGs)
แม้ว่าในช่วงที่ผ่านมา การดำเนินงานควบคุมและป้องกันภาวะโลหิตจางมีการบูรณาการแต่ละภาคส่วนมากขึ้น แต่อย่างไรก็ตามยังคงพบปัญหาถึงการผลักดันนโยบายไปสู่การปฏิบัติในระดับพื้นที่ การวางแผนการดำเนินงานยังขาดความชัดเจนตั้งแต่ระดับส่วนกลางไปจนถึงส่วนภูมิภาค ส่งผลให้การดำเนินการในแต่ละกิจกรรมขาดความต่อเนื่องและยั่งยืน ข้อมูลเหล่านี้สะท้อนให้เห็นว่าควรมีการขับเคลื่อนการดำเนินงานควบคุมและป้องกันภาวะโลหิตจางให้บรรลุเป้าหมาย มีการติดตามและประเมินผลการดำเนินงานที่ชัดเจน พัฒนาระบบเฝ้าระวังบริการสุขภาพด้านการควบคุมภาวะโลหิตจางที่มีประสิทธิภาพให้ประชาชนสามารถเข้าถึงบริการสุขภาพได้ง่ายมากขึ้นบูรณาการระบบข้อมูลสารสนเทศของแต่ละระบบหลักประกันสุขภาพให้เกิดความเป็นเอกภาพทั้งเรื่องสิทธิประโยชน์การใช้บริการ งบประมาณ การเบิกจ่าย และการติดตามประเมินผล เพื่อลดปัญหาภาวะโลหิตจางและลดโอกาสการเกิดผลเสียต่อสุขภาพของประชาชนในอนาคต
วัตถุประสงค์
1. เพื่อส่งเสริม ควบคุม และป้องกันภาวะโลหิตจางในประชากรกลุ่มเสี่ยง ได้แก่ หญิงตั้งครรภ์ เด็กปฐมวัย เด็กวัยเรียน และหญิงวัยเจริญพันธุ์
กลุ่มเป้าหมาย
1. หญิงไทยวัยเจริญพันธุ์
2. นักโภชนาการ นักวิชาการ ผู้รับผิดชอบงานโภชนาการทั้งในส่วนกลางและส่วนภูมิภาค
พื้นที่เป้าหมาย
1. ศูนย์อนามัย ที่ 1 – 12 และสถาบันพัฒนาสุขภาวะเขตเมือง
2. สำนักงานสาธารณสุขจังหวัด
3. สถานประกอบการที่สมัครใจเข้าร่วมโครงการทั่วประเทศ
รางวัล 10 บ้านน่าอยู่ประจำปี 2567
สำหรับผลรางวัล 10 บ้านน่าอยู่ประจำปี 2567 มีดังนี้
- บ้านไม้ติดน้ำ รับลม และโอบล้อมด้วยวิวภูเขา
- บ้านริมนา อยู่สบายท่ามกลางธรรมชาติ
- บ้านลาบ จากวิถีชนบทสู่ความร่วมสมัย
- ความเรียบง่ายพื้นถิ่นที่บรรจบกับวิถีธรรมชาติ
- บ้านไม้โมเดิร์นที่ใช้ครีบหินแบ่งสเปซและกั้นแดด
- อยู่ร่วมกับธรรมชาติในบ้านคอร์ตชั้นเดียว ของ (นักปลูก) ต้นไม้
- บ้านครอบครัวที่เปลี่ยนข้อจำกัดให้เป็นความพิเศษ
- บ้านเหล็กทรงกล่องที่ปิดเปลือกนอกแล้วเปิดรับแสงธรรมชาติไว้ภายในบ้าน
- รีโนเวตทาวน์เฮ้าส์ในเมือง เป็นบ้านอยู่สบายของคุณแม่ผู้สูงวัย
- บ้านที่คนและธรรมชาติใช้ชีวิตร่วมกัน
งานประชุมวิชาการ BDMS ACADEMIC ANNUAL MEETING 2024 - A ROAD TO LIFE-LONG WELL-BEING: EP 2 UNLOCK THE HEALTHY LONGEVITY ถือเป็นโอกาสสำคัญในวงการแพทย์และสุขภาพ ไม่เพียงเปิดเวทีให้แพทย์และผู้สนใจได้แลกเปลี่ยนองค์ความรู้ แต่ยังสร้างแรงบันดาลใจในการส่งเสริมสุขภาพที่ยั่งยืนแก่ประชาชนคนไทย เพื่อก้าวสู่สังคมผู้สูงอายุอย่างมีคุณภาพและสมบูรณ์แข็งแรง
7. ข้อมูลสารสนเทศและดิจิทัลเฮลท์ตอบโจทย์พ่อแม่ยุคใหม่
การเลี้ยงดูลูกในยุคปัจจุบันมีการเปลี่ยนแปลงไปในทางดิจิทัลมากขึ้น ด้วยการใช้สมาร์ทดีไวซ์และแอปพลิเคชันต่างๆ พ่อแม่ยุคใหม่เข้าถึงข้อมูลที่ช่วยให้พวกเขาสามารถตัดสินใจเกี่ยวกับสุขภาพและความเป็นอยู่ที่ดีของลูกได้อย่างมั่นใจมากขึ้น โดยเฉพาะเทคโนโลยี AI ที่ไม่เพียงแต่สามารถช่วยในการติดตามและประเมินด้านสุขภาพ แต่ยังสามารถให้ข้อมูลเชิงลึกและคาดการณ์แนวโน้มพฤติกรรมของเด็กได้อีกด้วย
ในปี 2025 นี้คาดว่าจะมีคุณพ่อคุณแม่จำนวนมากขึ้น โดยเฉพาะคุณพ่อคุณแม่มือใหม่ ที่ใช้แอปพลิเคชันและเชื่อมต่ออุปกรณ์ต่างๆ เพื่อช่วยในการดูแลลูกๆ โดยงานวิจัยของเราแสดงให้เห็นว่า 80% ของพ่อแม่ในสหรัฐอเมริกา และ 79% ของพ่อแม่ในยุโรปสวมใส่หรือใช้อุปกรณ์สมาร์ทเทคโนโลยี [4,5] ซึ่งแสดงให้เห็นถึงความต้องการที่เพิ่มขึ้นในการนำข้อมูลจากสมาร์ทเทคโนโลยีเหล่านั้นมาช่วยในการดูแลด้านความปลอดภัยและสุขภาพของลูก
อุปกรณ์ภายในบ้านเชื่อมต่อกันมากขึ้นผ่านระบบสมาร์ทโฮม (Smart Home) ทำให้พ่อแม่สามารถเข้าถึงอุปกรณ์ต่างๆ ไม่ว่าจะเป็น ฟีเจอร์วิดีโอและการฟังเพลงผ่านโทรศัพท์หรือคอมพิวเตอร์ อุปกรณ์สวมใส่ (wearables) และสมาร์ทดีไวซ์ เช่น ถุงเท้า จุกนม และเครื่องติดตามต่างๆ สามารถให้ข้อมูลแบบเรียลไทม์เกี่ยวกับกิจกรรมหรือสัญญาณชีพของเด็กๆ ได้ รวมถึงการหายใจ อุณหภูมิร่างกาย และอัตราการเต้นของหัวใจด้วย อุปกรณ์ติดตามที่มี AI บางอย่าง ยังสามารถแปลเสียงร้องของทารก เพื่อให้ผู้ปกครองทราบถึงความต้องการของลูก เช่น ความหิว หรือความต้องการอื่นๆ ได้รวดเร็วขึ้น
เป็นที่ชัดเจนว่าเครื่องมือดิจิทัลกำลังทำให้เกิดการเปลี่ยนแปลงครั้งสำคัญในการเลี้ยงดูลูกยุคใหม่ และถึงแม้ว่าเทคโนโลยีเหล่านี้จะไม่สามารถทดแทนการดูแลลูกด้วยการลงมือทำจริงๆ แต่เครื่องมือเหล่านี้ก็สามารถให้ข้อมูลที่เป็นประโยชน์ และช่วยให้พ่อแม่รู้สึกมั่นใจในการดูแลลูกมากขึ้น
The Mourning Forest
The Mourning Forest #JFF2025
1 ชั่วโมง 37 นาที R:ท
©Kumie / Celluloid Dreams Productions/ Visual Arts College Osaka JAPANESE (EN & TH Subs) ชิเงกิอาศัยอยู่ที่บ้านพักคนชราเล็ก ๆ แห่งหนึ่ง เขารู้สึกสบายใจและมีความสุข เมื่อได้อยู่ร่วมกับลูกบ้านคนอื่น ๆ และเจ้าหน้าที่บริบาลที่อ่อนโยนและเอาใจใส่ ณ ที่แห่งนี้ มาจิโกะ เป็นเจ้าหน้าที่คนหนึ่งของบ้านพัก เธอเอาใจใส่เขาเป็นพิเศษ แต่ตัวของมาจิโกะเองก็ยังคงถูกหลอกหลอนจากการต้องเสียลูกไป หลังจากฉลองวันเกิดของชิเงกิ มาจิโกะตัดสินใจพาเขาไปขับรถเล่นในชนบท แต่รถก็กลับติดหล่มอยู่บนถนน ณ ตรงนั้นเอง ทั้งสองคนได้เริ่มต้นการเดินทางเพื่อค้นพบความจริงร่วมกัน ขณะที่ชิเงกิมุ่งหน้าเข้าไปในป่า มาจิโกะไม่มีทางเลือกอื่นนอกจากเดินตามเขาไป หลังจากเดินลุยเข้าไปในป่าทึบอย่างเหน็ดเหนื่อยเป็นเวลาสองวัน ในที่สุดทั้งสองคนก็ไปถึงหลุมศพภรรยาของชิเงกิ
คลินิกพิเศษเฉพาะทางนอกเวลาราชการ โรงพยาบาลชลบุรี เปิดให้บริการผ่าตัดคลินิก SMC โดย แพทย์เฉพาะทางของโรงพยาบาลชลบุรี ปรึกษาสอบถามเรื่องผ่าตัดคลินิกพิเศษ โทรสอบถามที่เบอร์ 038-931377-1974 ในเวลาราชการ ตั้งแต่8.00-15.30 น.
7) เอไอ
7) เอไอ
ปัญญาประดิษฐ์จะปฏิวัติวงการแพทย์อย่างไม่ต้องสงสัย และถือเป็นความก้าวหน้าทางเทคโนโลยีที่น่าตื่นเต้นที่สุดที่เราเคยเห็นมา ปัญญาประดิษฐ์มีความสำคัญอย่างยิ่ง คล้ายคลึงกับการเปลี่ยนแปลงครั้งใหญ่ที่อินเทอร์เน็ตนำมาให้ อย่างไรก็ตาม ปัญญาประดิษฐ์ถือเป็นเทคโนโลยีที่ได้รับการโฆษณาเกินจริงมากที่สุดในวงการแพทย์ ณ ขณะนี้
AI จะไม่ใช่คำตอบสุดท้ายสำหรับคำถามทางการแพทย์ทั้งหมด หรือสำหรับปัญหาทั้งหมดของระบบการดูแลสุขภาพทั่วโลก และที่สำคัญ AI เชิงสร้างสรรค์จะไม่ใช่คำตอบที่ทรงประสิทธิภาพ แม้ว่าจะมีวิวัฒนาการที่น่าทึ่งและความสามารถที่น่าตื่นเต้นก็ตาม
ปัญญาประดิษฐ์มีศักยภาพที่น่าทึ่ง แต่เส้นโค้งการปรับตัวจะช้ามากเช่นเดียวกับการพัฒนากรอบการกำกับดูแล สาขาทั้งหมดต้องใช้เวลาในการเติบโต และพูดตรงๆ ว่า เนื่องจากเป็นการเปลี่ยนแปลงทางวัฒนธรรมพอๆ กับความก้าวหน้าทางเทคโนโลยี เราทุกคนจึงต้องการเวลาเพิ่มเติมเพื่อค่อยๆ ปรับตัวให้เข้ากับยุคที่นำปัญญาประดิษฐ์มาใช้
มอบยาและเวชภัณฑ์ จำนวน 50 กล่อง ให้กับหน่วยประสานงานชายแดนประจำพื้นที่จันทบุรี
Green Health Care&Share 2017.01.24
โดย นพ.สมชาย ภูนวกุล ผู้อำนวยการ รพ.กรุงเทพจันทบุรี มอบยาและเวชภัณฑ์ จำนวน 50 กล่อง ให้กับหน่วยประสานงานชายแดนประจำพื้นที่จันทบุรี โดย นาวาเอกกิตตินันท์ ม้าแดง รองหัวหน้าหน่วยประสานงานชายแดนประจำพื้นที่จันทบุรี เป็นตัวแทนรับมอบ เพื่อนำไปมอบต่อให้กับหน่วยงานราชการทั้งฝั่งประเทศไทยและประเทศกัมพูชา ที่อยู่ตามจุดผ่านแดนถาวรและจุดผ่อนปรนชั่วคราวตามแนวชายแดนพื้นที่จันทบุรี และพื้นที่ตอนในของประเทศกัมพูชา พร้อมทั้งยังเป็นการสร้างความสัมพันธ์อันดีกับประเทศเพื่อนบ้านอีกด้วย เมื่อวันที่ 24 มกราคม 2560 ณ รพ.กรุงเทพจันทบุรี
มอบยาสามัญประจำบ้านพร้อมเวชภัณฑ์ ให้กับหน่วยประสานชายแดนไทย-กัมพูชา
Green Health Care&Share 2017.04.27 โดย คุณจันทิมา พูลผล หัวหน้าแผนกสื่อสารการตลาด โรงพยาบาลกรุงเทพจันทบุรี มอบยาสามัญประจำบ้านพร้อมเวชภัณฑ์ จำนวน 5 กล่อง ให้กับหน่วยประสานชายแดนไทย-กัมพูชา ประจำพื้นที่จันทบุรี โดย นาวาเอกธีรนันท์ มาแดง หัวหน้าหน่วยประสานชายแดนไทย-กัมพูชา ประจำพื้นที่จันทบุรี เป็นตัวแทนรับมอบ เมื่อวันที่ 27 เมษายน 2560
มอบเตียงผู้ป่วย จำนวน 2 เตียง ให้กับกลุ่มขุนศึกตะวันออก
Green Health Care&Share 2017.07.29 โดย นพ.สมชาย ภูนวกุล ผู้อำนวยการโรงพยาบาลกรุงเทพจันทบุรี มอบเตียงผู้ป่วย จำนวน 2 เตียง ให้กับกลุ่มขุนศึกตะวันออก เพื่อนำไปช่วยเหลือประชาชนที่ได้รับความเดือนร้อน ในด้านความเป็นอยู่และด้านสุขภาพการเจ็บป่วยต่างๆในท้องถิ่นทุรกันดารต่อไป เมื่อวันที่ 29 กันยายน 2560
7. การพนันในบ่อนออนไลน์เติบโตเป็นประวัติการณ์
คุณลักษณะเด่นของการใช้หุ่นยนต์ช่วยในการรักษาความปลอดภัยมีหลายด้าน ได้แก่ ความสามารถในการทำงานอย่างต่อเนื่องเป็นเวลานานโดยไม่อ่อนล้าหรือหย่อนประสิทธิภาพ สามารถวิเคราะห์ภาพและพฤติกรรม สามารถแจ้งเตือนเพื่อป้องกันการเกิดเหตุความไม่ปลอดภัยได้อย่างรวดเร็วและแม่นยำ นอกจากนี้แล้ว หุ่นยนต์รักษาความปลอดภัยยังสามารถทำงานได้ในพื้นที่หรือสภาวะแวดล้อมที่หลากหลาย ทั้งภายในและภายนอกอาคาร ระบบนำทางอัตโนมัติจะทำให้หุ่นยนต์เคลื่อนที่ได้อย่างทั่วถึงทุกบริเวณ
ขณะที่ต้นทุนและค่าใช้จ่ายที่ใช้ไปกับหุ่นยนต์จำพวกนี้ในระยะยาวจะน้อยกว่าค่าใช้จ่ายสำหรับการจ้างฝ่ายรักษาความปลอดภัยที่เป็นมนุษย์ และไม่ต้องกังวลใจเรื่องความเชื่อใจได้ของ รปภ. ที่เป็นมนุษย์อีกด้วย
ปัจจุบันเริ่มมีการใช้งานหุ่นยนต์รักษาความปลอดภัยแล้วในหลายประเทศ เช่น สหรัฐอเมริกา สิงคโปร์ และญี่ปุ่น มีการใช้งานหุ่นยนต์เพื่อรักษาความปลอดภัยในพื้นที่ที่มีประชาชนจำนวนมาก เช่น สนามบินหรือสถานีรถไฟ รวมทั้งมีการใช้หุ่นยนต์เพื่อลาดตระเวนในพื้นที่เสี่ยงอันตราย
เริ่มปฏิบัติการรื้อถอนเศษซากตั้งแต่ช่วงเวลา 02:00 น.
วันนี้ (11 ก.ค. 66) เจ้าหน้าที่จากหน่วยงานที่เกี่ยวข้อง อาทิ เจ้าหน้าที่ตำรวจจาก สน.จระเข้น้อย เจ้าหน้าที่กู้ภัยจากมูลนิธิกู้ภัยร่มไทร สำนักงานเขตลาดกระบัง สำนักป้องกันและบรรเทาสาธารณะภัย กรุงเทพมหานคร การไฟฟ้านครหลวง กรมสวัสดิการและคุ้มครองแรงงาน เข้ามาช่วยดูแลอำนวยความสะดวกในพื้นที่ ในการรื้อถอนเศษซากชิ้นส่วนของทางยกระดับอ่อนนุช - ลาดกระบัง ถนนหลวงแพ่ง เขตลาดกระบัง ที่ทรุดตัว และถล่มลงมาตั้งแต่เมื่อช่วงเย็นวานนี้ (10 ก.ค. 66)
โดยเจ้าหน้าที่เริ่มปฏิบัติการรื้อถอนเศษซากตั้งแต่ช่วงเวลา 02:00 น. ที่ผ่านมา ซึ่งเจ้าหน้าที่สามารถรื้อถอนชิ้นส่วนแรกออกไปได้ เมื่อเวลา 06:15 น. คือส่วนบนสุดเป็นส่วนปลายซึ่งทำได้ง่าย และควบคุมโดยสำนักโยธา ก่อนจะเริ่มการรื้อถอนชิ้นส่วนต่างๆ ในลำดับถัดไป
สำหรับการรื้อถอนเต็มไปด้วยความยากลำบาก เนื่องจากข้อจำกัดของพื้นที่ เนื่องจากสะพาน และถนนมีขนาดเพียง 2 ช่อง ซึ่งอยู่ติดกับเสาไฟฟ้า และปั้มน้ำมัน รวมทั้งยังมีซากรถที่ถูกทับอยู่ใต้คานสะพาน ทำให้จำเป็นต้องมีการใช้แก๊สตัดเหล็กในการแยกชิ้นส่วนของโครงสะพาน แล้วใช้รถเครนยกออกเป็นส่วนๆ แต่ต้องใช้ความระมัดระวังขั้นสูง เพราะสเก็ตไฟอาจจะไปกระทบกับไอระเหยน้ำมันของหัวรับน้ำมันปั้ม และไอระเหยน้ำมันของซากรถที่ติดอยู่ภายใน ทำให้เจ้าหน้าที่ดับเพลิงต้องคอยฉีดน้ำเพื่อระงับไอระเหย และประกายไฟอยู่เป็นระยะ
อย่างไรก็ตาม เจ้าหน้าที่ยังคงปฏิบัติการรื้อถอนซากลอนเชอร์ออกจากพื้นที่อย่างต่อเนื่อง โดยวันนี้จะมีการผลัดเปลี่ยนชุดทำงาน เพื่อลดอาการเหนื่อยล้าของเจ้าหน้าที่ และเพื่อการทำงานที่ต่อเนื่อง ซึ่งคาดว่าจะเป็นเส้นทางการจราจรได้ในวันศุกร์นี้
ผู้ว่าฯ ชัชชาติ สั่งการให้เตรียมรื้อถอน เวลาประมาณ 00.00 น.
สถานการณ์เมื่อคืนเวลาประมาณ 00.00 น. ได้สั่งการให้เตรียมรื้อถอนก็พาบริษัทผู้รับเหมาเข้ามา ซึ่งมีอยู่ 3 ส่วนที่เกี่ยวข้องกับผู้รับเหมาหลัก ผู้รับเหมาทำ Truss หรือเรียกว่า Launcher และผู้รับเหมาที่ดึงลวด รวมทั้งหน่วยบรรเทาสาธารณภัยเข้าไปปูพรมตรวจอีกครั้งหนึ่ง ให้มั่นใจก่อนว่าไม่มีใครติดอยู่ข้างล่าง การดำเนินการใช้วิธียกเครนโดยเอาเครน 200 ตัน 3 ตัว มายกชิ้นส่วน Truss ด้านบนก่อน ชิ้นส่วนหนักประมาณ 7 ตัน 4 ชิ้น เมื่อเช้าเริ่มยกเวลาประมาณ 07.00 น. และจะทยอยยกไปคาดว่าวันนี้น่าจะแล้วเสร็จ ซึ่งในการรื้อถอนต้องระวังว่าสภาพที่ไม่เสถียร หากรื้อถอนแล้วอาจจะมีน้ำหนักที่เอาออก แล้วทำให้เกิดการเสียสมดุลอาจมีการหล่นลงมาอีก ต้องมีการค้ำยันให้ดีก่อนต้องทำในลักษณะค่อยเป็นค่อยไป
ตลาดโลกของหุ่นยนต์รักษาความปลอดภัย ประเมินกันว่าอาจจะสูงถึง 71,800 ล้านดอลลาร์สหรัฐในปี 2027 โดยมีอัตราการเติบโตต่อปีอยู่ที่ 17.8% ขณะที่เฉพาะในแถบเอเชียแปซิฟิกสูงถึงเกือบ 20% โดยปัจจัยกระตุ้นสำคัญคือ ความต้องการเทคโนโลยีนี้ในทางทหารและการป้องกันประเทศเป็นหลัก
สวทช. มีองค์ความรู้ด้านหุ่นยนต์ ระบบอัตโนมัติ ระบบสื่อสาร และ AI ทำให้สามารถบูรณาการองค์ความรู้ในการวิจัยและพัฒนาเพื่อสร้างหุ่นยนต์รักษาความปลอดภัยได้ ตรงตามความต้องการของผู้ใช้งานมากที่สุด การที่มีระบบฐานข้อมูล ระบบควบคุมและประมวลผลที่พัฒนาขึ้นเอง จึงมั่นใจได้ในเรื่องความปลอดภัยของข้อมูลลูกค้า
กรุงเทพมหานคร แถลงข่าว
11 ก.ค. 2566 11.19 น. กรุงเทพมหานคร แถลงข่าวกรณีเหตุการณ์โครงการก่อสร้างทางยกระดับถนนอ่อนนุช-ลาดกระบังในพื้นที่เขตลาดกระบังถล่ม ณ อาคารธานีนพรัตน์ ศาลาว่าการกรุงเทพมหานคร (ดินแดง) นำโดย ผู้ว่าฯ ชัชชาติ สิทธิพันธุ์ รองผู้ว่าฯ วิศณุ ทรัพย์สมพล รองผู้ว่าฯ ทวิดา กมลเวช นายธวัชชัย นภาศักดิ์ศรี ผู้อำนวยการสำนักการโยธา กรุงเทพมหานคร
ผู้ว่าฯ ชัชชาติ เริ่มต้น ชี้แจงว่า กรณีมีข่าวทีมชัชชาติให้เปลี่ยนแปลงแบบก่อสร้าง นั้นไม่จริง เป็นเรื่องกระบวนการก่อสร้างปกติ ที่ผู้รับเหมามีการทำและล่าช้า จึงขอเปลี่ยนวิธีการก่อสร้างมาตั้งแต่ปี 2565 แล้ว ไม่มีการสั่งเปลี่ยนแต่อย่างใด ผู้ว่าเน้นว่า การสื่อสารควรดูให้มีความถูกต้อง หากนำเข้าข้อมูลที่เป็นเท็จทางออนไลน์จะมีความผิดทางกฏหมาย ขออย่าสร้างความสับสนกับสังคม และให้เป็นผู้เชี่ยวชาญจริงๆ ที่ออกมาให้ข้อมูล และขอยืนยันว่าเป็นกระบวนการขั้นตอนทางวิศวกรรม จริงๆ แล้วไม่มีต้องการเสี่ยงหรือสั่งให้ทำเพื่อให้เกิดความเสี่ยง เป็นไปไม่ได้
ผู้ว่าฯ ชัชชาติ อธิบายสถานการณ์ ว่า เป็นกิจการร่วมค้า สิงหาคม 2564 งาน 2 ส่วน การไฟฟ้านครหลวง และกรุงเทพมหานคร เส้นทางยาว 3.5 กม. งานมีปัญหาความล่าช้า และสภากทม.ได้ตั้งกระทู้ในสภาและกทม.ได้เร่งรัดอยู่
เหตุเกิดหน้าปั๊มปตท. เวลา 5.40 น. โครงสร้างสะพานที่เป็นบล็อกเซคเม้นต์ โครงทรัสต์ด้านบน การดึงลวดอัดแรงเกิดการวิบัติ ทำให้พังลงมา มีความเสียหาย 1 ช่วงสะพาน กับอีก 2 เซคชั่น เสาพัง 2 ต้น (pier 83 และ 84) ชิ้นส่วนสะพานตกลงมาตรงกลางและทางด้านเลนซ้ายถนน มีคนงานได้รับบาดเจ็บ 7 คน มีผู้เสียชีวิตในที่เกิดเหตุ 1 คน เป็นวิศวกรที่ทำเรื่องดึงลวด อีก 1 คนเสียชีวิตที่โรงพยาบาลจุฬารัตน์ 9 คาดว่าเป็นคนงาน
ส่วนบุคคลทั่วไป มีบาดเจ็บ แต่คาดว่าไม่มีผู้เสียชีวิต
เหตุการณ์โชคดี ผู้รอดมาได้จากรถที่ถูกทับ เหตุคนขับเห็นท่าไม่ดีจึงรีบหนีออกมาทัน ก่อนรถโดนทับที่ฝากระโปรง
สถานการณ์ ก่อนเที่ยงคืนวันที่ 10 ก.ค. ผู้ว่าฯ ได้สั่งการให้เตรียมรื้อถอน นำบริษัทรับเหมาเข้ามา 3 ส่วนได้แก่ ผู้รับเหมาหลัก ผู้รับเหมาที่ทำตัวทรัสต์ หรือเรียก Launcher ผู้รับเหมาที่ดึงลวด เนื่องจากเหล็กอยู่บนสุด แล้วเป็นคอนกรีต และเสา จึงต้องเอาตัวเหล็กออกก่อน โดยเมื่อคืนได้ให้หน่วยบรรเทาสาธารณภัย ค้นปูพรมว่าไม่มีใครติดอยู่ใต้ซากอย่างแน่นอนก่อน ให้มั่นใจ เพราะหากมี ต้องกู้ชีพก่อน ตรวจแล้วไม่มี จึงได้ดำเนินการรื้อ โดยวิธียกเครน 200 ตัน 3 ตัว มายกส่วนทรัสต์ด้านบนก่อน ชิ้นส่วนหนักประมาณ 7 ตัน 4 ชิ้น การยกเริ่มเช้านี้เวลา 7.00 น. และทยอยยกไปเรื่อยๆ คาดว่าวันนี้น่าจะเสร็จ
รองผู้ว่าวิศณุ ทรัพย์สมพล กล่าวถึงสาเหตุการเกิด ดึงลวดระหว่างเสาร 84 และ 83 เสาที่หักคือเสา 84 ผู้รับจ้างทำแผนการรื้อถอน และให้บศท.ให้ความเห็น
ประเด็นการก่อสร้าง ในการประกวดราคา กำหนดเป็นการหล่อในที่ แต่ใน TOR เปิดเสนอแบบหล่อสำเร็จก็ได้ ช่วงแรกผู้รับเหมาได้ใช้วิธีการหล่อในที่ แต่เนื่องจากเป็นวิธีเก่า มีผลกระทบกับการจราจร และใช้เวลานาน กอปรกับการก่อสร้างล่าช้า ผู้รับจ้าง จึงขอเปลี่ยนมาเป็นแบบหล่อสำเร็จในภายหลัง ซึ่งเป็นการก่อสร้างปกติทั่วไป ทำเรื่องขอเปลี่ยนเมื่อกันยายน และพิจารณาแบบเดือนตุลาคม 2565
ผู้ว่าชัชชาติ เสริมว่า การก่อสร้างแบบหล่อสำเร็จเป็นการก่อสร้างทั่วไป ทำให้ควบคุมคุณภาพดีขึ้น ทำได้เร็วขึ้น ในการทำมาตั้งแต่กันยายน ทำหลายสแปนไม่มีปัญหาอะไร จึงมองว่าเป็นขั้นตอนการก่อสร้างที่มีความผิดพลาดมากกว่า
การก่อสร้างจะะงับไปจนกว่าจะมีการทำแผนการก่อสร้างมาใหม่ โดยวิศวกรรมสถานแห่งประเทศไทย (วศท.) ร่วมพิจารณา
มีคำถามว่าจะแบล็คลิสต 2 บริษัทนี้หรือไม่ ผู้ว่าฯ ระบุว่าต้องกระบวนการทางกฏหมาย สรุปสาเหตุให้ได้ก่อน กทม.ต้องการผู้รับเหมาคุณภาพอยู่แล้ว การก่อสร้างในพื้นที่สาธารณมีความเสี่ยงกับประชาชนทั่วไปอยู่แล้ว ถ้าเป็นความผิดพลาดเลินเล่อของผู้รับเหมาอย่างแท้จริง แล้วมีช่องทางทางกฏหมายจะไม่ให้เข้ามาประมูลงานได้ ก็ต้องหาทางให้เข้มข้นที่สุด เพื่อไม่ให้ผู้ทำผิดแล้ว คราวหน้าจะมาทำใหม่ แต่ว่าต้องทำตามกรอบกฏหมาย ระเบียยต่างๆ ที่เกี่ยวข้อง ทำตามใจไม่ได้
การสั่งปิดการก่อสร้างตลอดเส้นทางทั้งหมดแล้ว เพื่อเตรียมตรวจสอบ
กรณีมีคนสูญหาย แจ้งโทร 199 พร้อมช่วยเหลือเยียวยาเต็มที่
รองปลัดฯ ติดตามการแก้ปัญหาสะพานถล่มตามข้อสั่งการผู้บริหาร
นายณรงค์ เรืองศรี รองปลัดกรุงเทพมหานคร ลงพื้นที่จุดเกิดเหตุสะพานยกระดับอ่อนนุช-ลาดกระบัง ถล่มระหว่างก่อสร้าง ร่วมกับ นายชัชชญา ขำจันทร์ ผู้อำนวยการเขตลาดกระบัง เพื่อติดตามการดำเนินการบรรเทาและแก้ไขปัญหาตามข้อสั่งการของผู้ว่าราชการกรุงเทพมหานคร โดยได้หารือร่วมกับสำนักการโยธาและผู้รับจ้างวางแผนการรื้อถอนโครงสร้างที่เสียหายให้มีความปลอดภัยต่อประชาชนโดยรอบและสามารถคืนผิวจราจรโดยเร็ว และมอบหมายให้ผู้อำนวยการเขตลาดกระบังประสาน สน.จรเข้น้อยจัดเจ้าหน้าที่อำนวยการจราจรและประชาสัมพันธ์เส้นทางเลี่ยง ประสานการไฟฟ้านครหลวงแก้ไขระบบไฟฟ้าให้สามารถจ่ายกระแสไฟฟ้าในบริเวณที่เกิดเหตุ และประสานหน่วยงานที่เกี่ยวข้องอำนวยความสะดวกให้กับประชาชนที่ได้รับความเดือดร้อนทั้งนี้ กรุงเทพมหานครได้ตั้งศูนย์รับแจ้งเหตุอยู่ที่บริเวณโลตัสลาดกระบัง สำหรับประชาชนเพื่อแจ้งเหตุหรือสอบถามข้อมูลเพิ่มเติม
ภาพชิ้นส่วนโครงงานก่อสร้างพังลงมาบริเวณปั๊มปตท. และหน้าหมู่บ้านสัมมากร
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตคลองสามวา
3. เที่ยวที่ Unseen คนไม่พลุกพล่าน
ความปลอดภัยต้องมาก่อนในการท่องเที่ยวยุคโควิด-19 จากผลสำรวจของ McKinsey ถึงปัจจัยที่จะทำให้นักท่องเที่ยวกลับมาอีกครั้ง โดยพบว่า นักท่องเที่ยวในสหรัฐฯ ถึง 75% บอกว่าต้องมีวัคซีนก่อนจึงจะเริ่มเที่ยวอีกครั้ง ในขณะที่ 39% บอกว่าในพื้นที่จะต้องไม่มีผู้ติดเชื้อใหม่ติดต่อกันไม่ต่ากว่า 1 เดือน
ซึ่งท้ังหมดนี้ล้วนสื่อถึงความกังวลเกี่ยวกับความปลอดภัยจากโควิด-19 ในการท่องเที่ยว ผู้ประกอบการที่พักต่างๆ ควรมีมาตรการความปลอดภัย ในช่วงก่อนที่จะมีวัคซีน แม้หลังจากวัคซีนถูกค้นพบ แต่ยังถูกกระจายไม่ท่ัวถึง นักท่องเที่ยวน่าจะยังมีความกังวลเรื่องความปลอดภัยในการท่องเที่ยวอยู่ และให้ความสำคัญอย่างมาก กับการเลือกใช้บริการธุรกิจท่องเที่ยวที่ได้รับมาตรฐานด้านความปลอดภัย ดังน้ัน ผู้ประกอบการไทยจึงควรมีเครื่องการันตีให้นักท่องเที่ยวม่ันใจ อย่างเช่น การปรับมาตรการความปลอดภัยของที่พักให้ได้รับ SHA (Amazing Thailand Safety and Health Administration) ซึ่งเป็นมาตรฐานความปลอดภัยด้านสุขอนามัยเพื่อนักท่องเที่ยว จากความร่วมมือระหว่างกระทรวงสาธารณสุข กระทรวงการท่องเที่ยวและกีฬา และการท่องเที่ยวแห่งประเทศไทย เป็นต้น ความกังวลเรื่องความปลอดภัย ทำให้นักท่องเที่ยวอยำกไปเที่ยวที่ Unseen มากยิ่งขึ้น
นักเขียนหนังสือท่องเที่ยวยอดนิยมของสหรัฐฯ ให้ความเห็นว่า นักท่องเที่ยวอาจหลีกเลี่ยงที่ท่องเที่ยวยอดนิยมที่คนไปเยอะ ซึ่งอาจทำให้มีความเสี่ยงในการติดไวรัสเพิ่มมากขึ้น และเลือกไปสถานที่ที่คนไม่พลุกพล่าน และสามารถไปเที่ยวด้วยตัวเองได้แทน ซึ่งก็สอดคล้องกับผลการสำรวจนักท่องเที่ยวจีนของ McKinsey ที่พบว่านักท่องเที่ยวจีน 44% มีความต้องการที่จะเที่ยวแหล่งทิวทัศน์ กลางแจ้งมากที่สุด ในขณะที่แหล่งท่องเที่ยวประเภทช้อปป้ิงกลายเป็นที่ที่นักท่องเที่ยวต้องการไปเที่ยวน้อยที่สุด
7. สามารถไปรักษาที่ศูนย์บริการสาธารณสุข กทม. ในเขตตัวเองได้ด้วย
นอกจากเครือข่ายหน่วยบริการชุมชนอบอุ่นแล้ว สามารถไปรักษาที่ ศูนย์บริการสาธารณสุข กทม. ในเขตตัวเองได้ด้วย
ธนาคารเกียรตินาคินภัทร
ธนาคารเกียรตินาคินภัทร จำกัด (มหาชน)
ขอแจ้งเปลี่ยนแปลงเวลาทำการ
สาขาในห้างสรรพสินค้า
เนื่องจากสถานการณ์ COVID-19
ทั้งนี้ ท่านสามารถใช้บริการผ่าน KKP e-Banking
และช่องทางอิเล็กทรอนิกส์อื่นๆ ของธนาคารได้ตามปกติ
หากทนต้องการสอบถามข้อมูลเพิ่มเติม
สามารถติดต่อ KKP CONTACT CENTER โทร. O2 165 5555
ทุกวันตั้งแต่เวลา 7:00 - 20:00 น.
บริจาคโลหิต ฝ่าวิกฤต สถานีกาชาดสิรินธร ทุ่งสง LINK
8-16 มกราคม 2564 เชิญทุกท่านร่วมบริจาคโลหิต ฝ่าวิกฤต CVID ประเทศไทยส่งต่อ โลหิตปลอดภัยให้ผู้ป่วยที่รอรักษาณ ห้องรับบริจาคโลหิต สถานีกาชาดสิรินธร (ทุ่งสง)Plus เพิ่มจำนวนครั้ง เพิ่มโลหิต เพิ่มชีวิต
‼️โปรดนำบัตรประชาชนเพื่อแสดงตนก่อนบริจาคโลหิตทุกครั้ง
ห้องรับบริจาคโลหิตภายในสถานีกาชาดสิรินธร ทุ่งสง (หน้าโรงพยาบาลทุ่งสง ควนไม้แดง) เปิดรับบริจาคโลหิต ดังต่อไปนี้
- วันจันทร์-วันศุกร์ เวลา 08.30-16.30 น.
- วันเสาร์ เวลา 09.00-15.30 น.
- วันหยุดนักขัตฤกษ์ เวลา 09.00-15.30 น
- วันอาทิตย์ ปิดทำการ
- 075-302172 และ 087-4982152
ดังนั้น เหตุผลที่ต้องกักตัวเอง 14 วัน ก็เพื่อใช้ "เวลา" ให้กลุ่ม B ปรากฏตัวออกมานั่นเอง
8. การรับผลตรวจโควิด
8. การรับผลตรวจโควิด
แพทย์จะแจ้งผลตรวจ ภายใน 1 วัน และหากต้องการผลทางอีเมล์ โปรดแจ้งให้ทราบก่อน
บัญชีโซล่าร์QR Code โซล่าร์เซลล์
ขณะนี้กำลังดำเนินการระดมทุนด้วยการจัดวิ่งที่อำเภอโขงเจียม จ.อุบลราชธานี แต่ติดเรื่องไวรัสโควิดระบาดจึงต้องเลื่อนออกไป ซึ่งยังขาดปัจจัยอยู่ประมาณ 2 ล้านให้เพียงพอสำหรับการติดตั้ง ถ้าช่วยกันบริจาคคนละ 300 บาท 1 หมื่นคนก็เพียงพอต่อ 1 โรงพยาบาล หรือรวมตัวกัน 1 เครือบริษัทบริจาคให้กับ 1 โรงพยาบาลไปเรื่อยๆ ทั่วประเทศคงจะอยากเห็นสิ่งดีๆ สวยงามเกิดขึ้นที่บ้านเมืองตนเอง น่ามาชมมาท่องเที่ยว ชาวต่างชาติคงจะเล็งมาที่ประเทศไทยเป็นอันดับต้นๆ หลังสถานการณ์โควิด เรามีอะไรดีๆ ให้เขาดูได้ไม่น้อยหน้า ท่านสามารถร่วมกันบริจาคได้ที่บัญชี วัดป่าศรีแสงธรรม (โครงการโรงพยาบาล Solar Cell) ธ.กรุงไทย สาขา โขงเจียม 338-042-5834
บัญชีโซล่าร์QR Code โซล่าร์เซลล์
ยังมีโรงพยาบาลกู่แก้ว จ.อุดรธานี ก็ยังรอรับการสนับสนุน ถ้ามีโอกาสช่วยกันได้ก็ช่วยกับคนละไม้คนละมือ อย่าหวังพึ่งแต่เงินกู้มาพัฒนาประเทศ ให้ผู้บริหารเขาใช้จ่ายกันตามสบาย เราพอพึ่งตนเองได้ก็ช่วยกัน ขออนุโมทนาขอบคุณมา ณ โอกาสนี้
พระครูวิมลปัญญาคุณ
11 มิถุนายน 2563
Cannabidiol (CBD) LINK
Cannabidiol (CBD)
มีความสามารถในการจับกับ CB1 และ CB2 receptors แบบโดยตรงได้เพียงเล็กน้อย แต่มีลักษณะเป็น negative allosteric modulator กับ CB1 receptor ซึ่งส่งผลกับการทำงานกับ receptors อื่นๆ ทำให้สามารถลดอาการปวด อาการอักเสบ และลดความกังวลได้ การค้นพบกลไกการออกฤทธิ์ของสารกลุ่มนี้ รวมถึงการค้นพบ endocannabinoids ซึ่งเป็น endogenous agonists ของ cannabinoids receptors เช่น N-arachidonoyl-ethanolamine (AEA; anandamide) และ 2-arachidonoylglycerol (2-AG)5 ทำให้มีความเข้าใจในกลไกการออกฤทธิ์ของสารกลุ่มนี้รวมถึงผลข้างเคียงมากยิ่งขึ้น และมีการนำมาวิจัยเพื่อประโยชน์ในการรักษาอาการหรือโรคต่างๆ อาทิ อาการปวดเรื้อรัง ปลอกประสาทเสื่อม มะเร็ง โรคลมชัก อาการวิตกกังวล และช่วยกระตุ้นความอยากอาหาร ความผิดปกติด้านการนอน ต้อหิน โรคโครห์นและลำไส้อักเสบ โรคพาร์กินสัน โรคข้ออักเสบรูมาตอยด์ โรคสมาธิสั้น (ADD) และภาวะป่วยทางจิตจากเหตุการณ์รุนแรง (PTSD) ซึ่งแต่ละอาการ ก็มีระดับการตอบสนองที่แตกต่างกัน ผู้ใช้จึงควรอยู่ในการดูแลของแพทย์
Cannabidiol ถูกค้นพบครั้งแรกในปีพ. ศ. 2483 แต่เพิ่งได้รับการอนุมัติจากองค์การอาหารและยาเป็นยาต้านอาการชักไม่นานมานี้ CBD ได้สนใจมากขึ้นอย่างรวดเร็วจากการศึกษาผลลัพย์ต่ออาการโรควิตกกังวล ความเจ็บปวด ตลอดจนกรณีการรักษาด้วยกัญชาและ CBD สามารถใช้ได้ผลกับผู้ป่วย PTSD หรือโรคจิต ที่นำไปสู่การขยายผลิตภัณฑ์ CBD ในตลาดสุขภาพจำนวนมาก
Cannabidiol หรือ CBD เป็นเพียงหนึ่งในสารประกอบที่มีฤทธิ์มากกว่า 100 ชนิดในพืชกัญชาที่ทำหน้าที่เกี่ยวกับระบบเอนโดแคนนาบินอยด์ในร่างกายซึ่งเป็นระบบที่สร้างความสมดุล ซึ่งมีตัวรับในสมองระบบประสาทและระบบภูมิคุ้มกัน พร้อมคุณสมบัติที่เป็นเอกลักษณ์และศักยภาพในด้านสุขภาพการแพทย์จากธรรมชาติ
[สวัสดีคลินิกเวชกรรม]
นี่ก็ของร้านเขียวไข่กา เช่นกัน
เมนู มีกี่อย่าง คิดสูตรเอง?
เฉพาะเมนูกัญชาที่ร้านจะมี 10 อย่าง เป็นเครื่องดื่ม 4 และ อาหาร 6 คิดสูตรเองทั้งหมด ในอนาคตจะมีเมนูใหม่มาเพิ่มแน่นอน ตอนนี้กำลังคิดสูตรอาหารใหม่ๆ อยู่ค่ะ
Opportunity and Risk/Concern
Doctor Anywhere
No more waiting to see a doctor. With Doctor Anywhere, you can video-consult a locally-licensed doctor or healthcare provider within minutes, and get medication delivered to your doorstep in 3 hours. Delivery is free. Medical history, health reports, and other documents are stored in-app for easy access.
Doctor Anywhere is currently available in 5 countries across Southeast Asia: Singapore, Malaysia, Thailand, Vietnam, and the Philippines.
ยโสธร กิจกรรม 250 ปี ฮุ่งเฮืองเมืองยศ จัดให้มีรถรางบริการนำเที่ยวสถานที่สำคัญภายใจเขตเทศบาลเมืองยโสธร
กิจกรรมส่งเสริมการท่องเที่ยวในช่วงเทศกาลสงกรานต์ “250 ปี ฮุ่งเฮืองเมืองยศ” โดยจัดให้มีรถรางบริการนำเที่ยวสถานที่สำคัญภายใจเขตเทศบาลเมืองยโสธร ในห้วงระหว่างวันที่ 10-18 เมษายน 2564 ผู้สนใจเข้าร่วมกิจกรรมดังกล่าว ต้องแจ้งล่วงหน้าเป็นหมู่คณะฯ ที่สำนักงานจังหวัดยโสธร ทาง E-mail:Yuttasatyaso1 @hotmail.com หรือโทรศัพท์ 0 4571 55236 ภายในวันที่ 8 เมษายน 2564นครพนม - 9 จังหวัด กักตัว 14 วัน หรือแสดงผลตรวจใน 72 ชม. LINK
12 เมษายน 2564
มีมติร่วมกัน และ
ประกาศมาตรการ
1. กำหนดมาตรการและข้อปฏิบัติสำหรับผู้เดินทางเข้านครพนม
- โดยผู้ที่เดินทางมาจากพื้นที่เสี่ยง 9 จังหวัด ประกอบด้วย 1) กรุงเทพมหานคร 2) นนทบุรี 3) สมุทรปราการ 4) ปทุมธานี 5) นครปฐม และ 6) สมุทรสาคร 7) ชลบุรี 8) เชียงใหม่ 9) สระแก้ว ต้องถูกกักตัว 14 วัน
- กรณีไม่กักตัว ต้องมีผลตรวจเป็นลบ (ภายใน 72 ชั่วโมง) โดยจะเป็นผลตรวจที่นำมาจากต้นทางหรือมารับการตรวจในพื้นที่จังหวัดนครพนมก็ได้ (ใช้เวลาประมาณ 3 ชั่วโมง ทราบผลการตรวจ ค่าใช้จ่าย 500 บาท)
- ต้องบันทึกข้อมูลผ่าน App.NPM-COVID-19 และ ไทยชนะ
- พร้อมรายงานตัวต่อจนท.สาธารณสุข ผู้นำชุมชน อสม.
- ปฏิบัติตามมาตรการ : DMHTT ใช้ Application ไทยชนะ
2. ในส่วนของร้านอาหาร สถานบันเทิง ผับ บาร์ ศูนย์การค้า ห้างสรรพสินค้า ตลาดสด ตลาดนัด ยังคงให้เปิดได้ตามปกติ แต่เน้นให้ปฏิบัติการตามมาตรการ : DMHTT คือ อยู่ห่างไว้ ใส่แมสก์กัน หมั่นล้างมือ ตรวจให้ไว ใช้ไทยชนะ
3. ให้งดการจัดคอนเสิร์ตที่มีผู้ร่วมมากกว่า 500 คน กรณีงานเลี้ยง งานแต่งงาน งานประเพณี ดนตรี หมอลำ รถแห่ รำวง และการแสดงคอนเสิร์ตที่มีผู้ร่วมไม่เกิน 500 คน ต้องขออนุญาตนายอำเภอท้องที่
4. สำหรับเทศกาลสงกรานต์ปีนี้
งดกิจกรรมที่มีการรวมกลุ่มคนจำนวนมาก และมีการสัมผัสใกล้ชิด รวมทั้งงดพิธีรดน้ำดำหัว กิจกรรมสาดน้ำ แสดงคอนเสิร์ต ปะแป้ง ปาร์ตี้โฟม กรณีจัดพิธีสรงน้ำพระ กิจกรรมทางศาสนา ให้จัดได้ แต่ต้องปฏิบัติตามมาตรการด้านสาธารณสุข : DMHTT
สอบถามข้อมูลเพิ่มเติมได้ที่ สายด่วนข้อมูลโควิด-19 จังหวัดนครพนม
โทร.08 2849 8155 และ 06 1019 2999
เพจ
ปชส สสจ. นครพนม
รพ.นครพนม โทร 042 199 222
สงขลา - กักตัว 14 วัน LINK
1. จังหวัดที่ต้องกักตัว 14 วัน (Home Quarantine) ภายใต้การดูแลของเจ้า
จังหวัดนนทบุรี ปทุมธานี นครปฐม สมุทรปราการ กรุงเทพฯ (เฉพาะเขตวัฒนา เขตคลองเตย เขตบางแค)
2. จังหวัดที่ให้ดูแลตนเองโดยการ Self Quarantine 14 วัน และปฏิบัติตามมาตราการป้องกันโรคอย่างเคร่งครัด
จังหวัดกรุงเทพฯ (เขตอื่น) สมุทรสาคร สมุทรสงคราม กาญจนบุรี ชุมพร ตาก ราชบุรี ชลบุรี สุพรรณบุรี นราธิวาส
เพจ
สงขลา COVID-19
รพ. สงขลา 074-338-100
นอกเหนือจากสิ่งที่ทางรัฐจัดให้คือ อาหาร น้ำ ของใช้จำเป็น สามารถช้อปปิ้งสิ่งต่างๆ เพิ่มได้ทั้งจากเซเว่นข้างโรงแรม shopee, lazada, etc. แต่สั่งแล้วจ่ายตังด้วยนะจ๊ะ ??
ส่วนอาหารสั่งของโรงแรมได้อย่างเดียว จนกว่าจะผ่านการตรวจโควิดรอบที่ 1 ประมาณวันที่ 5 ของการกักตัว แล้วถึงจะสั่งอาหารจากข้างนอกได้
แต่ทุกอย่างส่งเป็นรอบนะคะ เช้าแปดโมง เที่ยง บ่ายสองและหกโมงเย็น บวกลบไม่เกินครึ่งถึงหนึ่งชั่วโมงในแต่ละรอบ ขยะต้องรวมทุกอย่างเป็นขยะติดเชื้อทั้งหมด เพราะยังไม่รู้ว่าใครติดไม่ติด ใส่ถุงเดียวสีส้ม เก็บวันละหนึ่งรอบตอนสองทุ่ม
และทั้งหมดที่ว่ามานี้ห้ามออกจากห้องพักนะจ๊ะ ออกมาเดินเล่น สูดอากาศอะไรก็ไม่ได้จ้ะ เปิดหน้าต่างได้ ถ้าห้องมีระเบียงก็นั่งเล่นไปตามอัธยาศัย แต่เปิดประตูปูเสื่อนั่งคุยกันหน้าห้อง ไรงี้ก็ไม่ได้นะ จับนะ เขามีตะหานมาเฝ้าดูกล้องวงจรปิด รู้เพราะเขาส่งมาเตือนเองในไลน์กรุ๊ป ? ประมาณว่า ฉันเฝ้าดูเธออยู่ เธอจะรู้หรือไม่ ตอนนี้ก็ รู้แล้วสินะ ??
พี่ชายบอกว่า คิดซะว่ามาปฏิบัติธรรม บร้าาา ทีวีก็มีย่ะ ติดดาวเทียมดูได้ทั่วโลก Netflix ก็มา Spotify ก็ได้ หนังสือ เกมส์ โยคะ ถักนิตติ้ง คิดเหรอว่าสิบสี่วันจะคณามือ ???
วันนี้เพิ่งกักตัววันที่ 3 พอก่อนเนอะ เดี๋ยวมีเรื่องตรวจโควิดกับเรื่องกลับบ้าน ค่อยมาเล่าทีหลัง ?✌
รวมข่าวสถานการณ์โควิด 18 เมษายน 64
Q คนที่ทำงานติดเชื้อโควิด สามารถมาตรวจได้หรือไม่
ชาวจังหวัดตรังร่วมใจ สวมหน้ากากอนามัย
ชาวจังหวัดตรังร่วมใจ สวมหน้ากากอนามัย เว้นระยะห่าง ทุกครั้งที่ออกนอกเคหสถาน
9.ยืนยันที่อยู่ปัจจุบัน กับบัตรปชช
แม็คยีนส์ แจกหน้ากากผ้า LINK
YOU ARE THE HERO! “แม็คยีนส์ ร่วมสนับสนุนการฉีดวัคซีน” เพื่อตัวคุณและคนที่คุณรัก
>> รับฟรี! หน้ากากผ้า มูลค่า 59 บาท เพียงแสดงหลักฐานการฉีดวัคซีนโควิด-19 #ฉีดวัคซีนหยุดเชื้อช่วยชาติ #เพราะแม็ครักและห่วงใย
งานนี้พลาดไม่ได้แล้ว...ที่ร้านแม็คยีนส์ (Shop Mc Jeans)
* สินค้ามีจำนวนจำกัด พร้อมรับสิทธิพิเศษ ซื้อสินค้า Mc Jeans ลด 50%
อบจ.กาญจนบุรี ให้ลงทะเบียน กาญจน์พร้อม LINK
11 มิถุนายน 64 องค์กรปกครองส่วนท้องถิ่น ร่วมกับ หน่วยงานต่างๆ มีมติ ให้องค์กรปกครองส่วนท้องถิ่นในจังหวัดกาญจนบุรี จัดสรรวัคซีนป้องกันโรคโควิด - 19 ให้แก่ประชาชนในพื้นที่ได้
ผู้ที่ยังไม่ได้ลงทะเบียนแจ้งความประสงค์ฉีดวัคซีน สามารถ ลงทะเบียนผ่านระบบ “กาญจน์พร้อม” เพื่อได้รับการจัดสรรวัคซีน ได้ที่ :
สแกน QR code หรือ
กดลิงค์ https://line.me/ti/p/~@kanpao_official
10 ความกังวลในโรคตับ
10 สำหรับโรคตับที่มีความกังวลนั้น พบว่าฟ้าทะลายโจร มีผลในการป้องกันและฟื้นฟูสภาพของตับ (Hepatoprotection) และใช้ในการรักษาโรคตับ หลายชนิด ทั้งตับอักเสบจากไวรัส ไขมันพอกตับ ฯลฯ
อย่างไรก็ตามในกรณีการใช้ฟ้าทะลายโจรขนาดสูงและเป็นเวลานาน เกินกว่าที่แนะนำ อาจทำให้ม การเพิ่มของเอนไซม์ของตับแต่อยู่ในระดับต่ำ ยังไม่พบรายงานการทำลายตับแต่ประการใด ดังนั้นผู้ที่เป็นโรคตับจึงสามารถใช้ได้ ยกเว้นการใช้ "สารสกัดแอนโดรกราโฟไลด์" หรือยาอื่นร่วมด้วยหลายชนิดหรือโรคของผู้ป่วย อาจมีผลต่อตับ จำเป็นต้องวิเคราะห์ ในโอกาสต่อไป
ชาวจันทบุรี ลงทะเบียนผ่าน QR Code LINK
ชาวจันทบุรี ที่ฉีดวัคซีนโควิด-19 เข็มที่ 1 จากสถานีบางซื้้อและที่อื่นๆ และมีความประสงค์จะรับวัคซีน เข็มที่ 2 ที่จังหวัดจันทบุรี
สามารถลงทะเบียนใน QR Code หรือลิงค์ด้านล่าง (โปรดเตรียมรูปถ่ายใบนัดฉีดวัคซีนเพื่อประกอบการลงทะเบียน) ตั้งแต่วันนี้ - 10 กันยายน 2564
เขตภาษี ให้บริการฉีดวัคซีนน้องหมาแมว วันที่ 7-28 กันยายน 64
เขตภาษีเจริญร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ทั้ง 2 ศูนย์ ให้บริการฉีดวัคซีนน้องหมา น้องแมว น้องต่าย ป้องกันโรคพิษสุนัขบ้า แบบฟรี!! ไม่เสียค่าใช้จ่ายใดๆ ทั้งสิ้น ระหว่าง วันที่ 7-28 กันยายน 64 เวลา 10-12 น.
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เบอร์ 0 2413 2724 ในวันและเวลาราชการ
มีความเสี่ยง เช่น สัมผัสผู้ติดเชื้อ หรือมีอาการ ตรวจด้วย ATK
เขตสุขภาพที่ 7 ขอนแก่น
สำนักงานป้องกันควบคุมโรคที่ 7 จังหวัดขอนแก่น
-เบอร์โทรศัพท์: 043 222 818-9
-เว็บไซต์: https://ddc.moph.go.th/odpc7/ ทั้งนี้ เมื่อเกิดเหตุฉุกเฉิน กรุงเทพมหานครจัดตั้งศูนย์บูรณาการแก้ไขปัญหาน้ำท่วมโดยมีผู้อำนวยการเขตเป็นผู้บัญชาเหตุการณ์ พร้อมประสานความร่วมมือกับหน่วยงานและจังหวัดใกล้เคียง ทั้งจังหวัดนนทบุรี จังหวัดปทุมธานี จังหวัดสมุทรปราการ จังหวัดสมุทรสาคร จังหวัดนครปฐม กรมป้องกันและบรรเทาสาธารณภัย กรมชลประทาน และกองทัพภาคที่ 1 และเตรียมการแก้ไขปัญหาที่อาจส่งผลกระทบตามเส้นทางที่มีแนวก่อสร้าง เช่น โครงการระบบระบายน้ำแนวถนนวิภาวดี และโครงการก่อสร้างรถไฟฟ้าสายสีต่างๆ ซึ่งก่อนหน้าฝน ก็ได้มีการเตรียมพร้อมหากมีฝนตกหนักอย่างต่อเนื่อง โดยได้ลอกท่อระบายน้ำ เก็บขยะ ผักตบชวา และเตรียมเครื่องสูบน้ำให้พร้อมใช้งาน
พี่น้องประชาชนสามารถติดตามการแจ้งเตือนสถานการณ์ฝนและรับแจ้งเหตุน้ำท่วมขังในพื้นที่ กทม. จะมีหน่วยเคลื่อนที่เร็ว เข้าช่วยเหลือประชาชนและเร่งระบายน้ำในจุดที่ประสบปัญหาน้ำท่วมขังได้ที่ โทร. 1555 และศูนย์ควบคุมระบบป้องกันน้ำท่วม โทร. 0 2248 5115 ได้ตลอด 24 ชั่วโมง
อำนาจเจริญ กิจกรรมฉีดวัคซีน Pfizer ในเด็กนักเรียน ณ หอประชุมสวนพุทธอุทธยาน อำเภอเมือง LINK
4 ตุลาคม 2564 เวลา 08:00 น. ณ หอประชุมสวนพุทธอุทธยาน อำเภอเมืองอำนาจเจริญ นายแพทย์ปฐมพงศ์ ปรุโปร่ง นายแพทย์สาธารณสุขจังหวัดอำนาจเจริญ แพทย์หญิงอุไรวรรณ จำนรรจ์สิริ ผู้อำนวยการโรงพยาบาลอำนาจเจริญ นำคณะผู้บริหารและเจ้าหน้าที่สาธารณสุขจังหวัด อำนาจเจริญ ร่วมกิจกรรมฉีดวัคซีน Pfizer ในเด็กนักเรียน “สร้างเกราะป้องกันด้วยวัคซีน เด็กปลอดภัย เรียนอุ่นใจ ต้อนรับเปิดเทอม จังหวัดอำนาจเจริญ” เพื่อสร้างภูมิคุ้มกันให้กับนักเรียนอายุตั้งแต่ 12 ปี ขึ้นไปในจังหวัดอำนาจเจริญ โดยมีนายทวีป บุตรโพธิ์ ผู้ว่าราชการจังหวัดอำนาจเจริญ เป็นประธานใน กิจกรรมครั้งนี้
เรื่อง/ภาพ สำนักงานสาธารณสุขจังหวัดอำนาจเจริญ
คอร์สเรียนออนไลน์ฟรี ที่จุฬาลงกรณ์มหาวิทยาลัย LINK
คอร์สเรียนออนไลน์ฟรี ที่จุฬาลงกรณ์มหาวิทยาลัย เพราะเราเชื่อว่าทุกคนมีสิทธิที่จะเรียนรู้ และควรจะ ได้เรียนรู้ตลอดชีวิตมาร่วมกันฝึกทักษะทางความคิด ความสามารถ และสติปัญญาเพื่อพัฒนาศักยภาพ ของตนเองได้ที่ CHULA MOOC
รพ.เซ็นทรัลเชียงใหม่ เมโมเรียล แนะนำการฉีดวัคซีนโมเดอร์นา
อบจ.ลำพูน ล็อตแรก 560 โดส ฉีด 11-19 พ.ย. 64 LINK
19 พ.ย. 64 อบจ.ลำพูน จัดฉีดวัคซีนโมเดอร์นา ฟรี ล็อตแรก ครบ 8 อำเภอแล้ว
.
10 พ.ย.64 อบจ.ลำพูน ประกาศกำหนดการวัคซีนโมเดอร์นา (Moderna) โดย อบจ.ลำพูน ถึง รพ.ลำพูน แล้ว 560 โดส (จากทั้งหมด 10,000 โดส) กำหนดฉีด 11-19 พ.ย. 64
วันที่ 11 พ.ย. 64 เริ่มฉีดแล้ว ให้กับ 53 ท่านแรก ที่ โรงพยาบาลแม่ทา
วันที่ 12 พ.ย. 64 อ.ทุ่งหัวช้าง จำนวน 76 โดส
วันที่ 17 พ.ย. 64 อ.บ้านโฮ่ง จำนวน 55 โดส ,อ.ป่าซาง 68 โดส
วันที่ 18 พ.ย. 64 อ.เวียงหนองล่อง จำนวน 30 โดส
วันที่ 19 พ.ย. 64 อ.เมือง จำนวน 183 โดส , อ.ลี้ จำนวน 103 โดส ,อ. บ้านธิ จำนวน 30 โดส
โรงพยาบาลสิริเวช จันทบุรี ฤกษ์ดี 11.11 LINK
11.11
โรงพยาบาลสิริเวช จันทบุรี เริ่มฉีดวัคซีนทางเลือกโมเดอร์นา (Moderna) เป็นวันแรก
สำหรับผู้ที่ลงทะเบียนกับทาง Thonburi Healthcare Group โดยเลือกฉีดกับโรงพยาบาลสิริเวช จันทบุรี โดยมี พญ.ดารณี สุวพันธ์ รองผู้อำนวยการโรงพยาบาล
มอบของที่ระลึกให้กับคุณธวัช พงษ์เกษม ที่ได้ฉีดวัคซีนโมเดอร์นาเป็นคนแรกของโรงพยาบาลสิริเวช จันทบุรี
รพ.ปากเกร็ด เปิด WALK IN ฉีดวัคซีนโควิด ทั้งคนไทย และชาวต่างชาติ LINK
โรงพยาบาลปากเกร็ด เปิดฉีดวัคซีนโควิด-19 แบบ WALK IN ในรอบที่สาม จำนวน 1,000 คนต่อวัน สำหรับประชาชนอายุ 18 ปี ขึ้นไป ทั้งคนไทย และชาวต่างชาติ เวลา 9-12 น. ในวันที่ 8 และ 12 พฤศจิกายน 2564 ในวันเสาร์ ที่ 13 พฤศจิกายน 2564 เปิดบริการ 2,000 คน ตั้งแต่เวลา 8.30 น -14.00 น. วัคซีนที่ได้รับคือ Sinovac เข็ม1 และ AstraZeneca เข็ม 2 ห่างกัน 4สัปดาห์
นำบัตรประชาชนมาแสดงตน หรือกรณีเป็นชาว ต่างชาติใช้พลาสปอร์ต มาแสดงตนพร้อมกับถ่ายสำเนาใบหน้าพลาสปอร์ตมาด้วย *** มารับวัคซีน ที่ โรงพยาบาลปากเกร็ด ถนน 345
อันโตนิโอ บันเดรัส
4 สิงหาคม สุดหล่อชาวสเปนวัย 61 ปี ตรวจพบว่าติดเชื้อโควิดและได้กักตัวทันที เขาทวีตวันที่ 10 สิงหาคมซึ่งเป็นวันเกิดของเขาว่า เป็นการฉลองแซยิดในช่วงกักกันตัว 3 สัปดาห์ถัดมาเขาทวีตยืนยันอีกครั้งว่าหายแล้ว
Zone : 8 ตอบปัญหาสุขภาวะ
ก่อนกลับจะเป็นโซนทดสอบความรู้ความเข้าใจเกี่ยวกับสุขภาวะเล็กๆน้อยๆ ให้คุณได้ร่วมสนุก รวมถึงสามารถประเมินความพึงพอใจเกี่ยวกับงานได้อีกด้วย
ร้อยแก่นสารสินธุ์
ร้อยแก่นสารสินธุ์ เขตสุขภาพที่ 7 กับผลิตภัณฑ์กัญชาหลากหลายไม่แพ้กัน น้ำนมข้าวกล้องสูตรกัญชา สิน่าชิม
คราฟต์โซดา มาแรง
คราฟต์โซดา มาแรง เพราะมีหลายเจ้าทำมาขายในงาน ตัวนี้ Cannabis Honey Lemon Craft Soda Greente
เหลืองปรีดียาธรโปรยปรายแห่งด่านช้าง เมืองสุพรรณ
เส้นทางหมายเลข 3502 สายสามชุก-ด่านช้าง เส้นทางเชื่อมต่อ ระหว่าง อ.สามชุก อ.หนองหญ้าไซ และ อ.ด่านช้าง จ.สุพรรณบุรี มีระยะทางยาวประมาณ 30 กม.
อินทนิลออกสะพรั่งส่งท้ายปลายหนาว เมืองประจวบคีรีขันธ์
ก่อนสิ้นสุดฤดูหนาวต้นอินทนิลออกดอกบานสะพรั่ง กลาง ถ. เพชรเกษม ซึ่งเป็นเส้นทางหลักไปยัง 14 จังหวัด ภาคใต้ ระยะทางยาวหลายร้อยเมตรบริเวณช่วงรอยต่อระหว่าง อ.กุยบุรี และ อ.เมือง จ.ประจวบคีรีขันธ์
สปส. กรุงเทพมหานครพื้นที่ 8 LINK
อาคารไอทีเอ็ม เลขที่ 255 ถ.ศรีนครินทร์ แขวงหนองบอน เขตประเวศ กทม. 10250
รับผิดชอบเขต บางนา ประเวศ พระโขนง สวนหลวง
แผนที่
Tel 02-7433378, 02-7433379, 02-7433815 , 02-7433731, 02-7433767, 02-7433784, 02-7433710
Fax 02-7433817
nongrak.k@sso.go.th
ฝ่ายอำนวยการ 02-7433815
งานสิทธิประโยชน์ทดแทน 02-7433731
งานการเงินและบัญชี 02-7433767
งานเงินสมทบ 02-7433784
งานทะเบียนและประสานการแพทย์ 02-7433710
โรงพยาบาลเฉพาะทางแม่และเด็กแพทย์รังสิต
โรงพยาบาลเฉพาะทางแม่และเด็กแพทย์รังสิต พร้อมดูแลคุณแม่และลูกน้อย ด้วยประสบการณ์มากกว่า 10 ปี ด้วยการดูแลอย่างใกล้ชิด โดยทีมแพทย์สูติ-นรีเวชกรรม ที่มีความเชี่ยวชาญในการดูแลคุณแม่ และลูกน้อยในครรภ์ พร้อมด้วยทีมพยาบาลผู้มากด้วยประสบการณ์ รวมถึงเครื่องมือเทคโนโลยี ที่จะดูแลคุณแม่ และลูกน้อย ให้แข็งแรง ปลอดภัย ทั้งสุขภาพกาย และสุขภาพใจ❤
นอกจากการให้บริการฝากครรภ์ และคลอด โรงพยาบาลฯ ให้บริการอื่นๆ เพื่อสุขภาพครรภ์ที่ดีของคุณแม่และลูกน้อย อาทิ
- ตรวจสุขภาพก่อนมีบุตร โดยแพทย์เฉพาะทางสูติ-นรีเวชกรรม
- รับคำปรึกษา / ตรวจสุขภาพเพิ่มเติม โดยแพทย์เฉพาะทางสำหรับผู้ที่มีภาวะมีบุตรยาก
- อัลตร้าซาวด์ 4 มิติ โดยแพทย์เฉพาะทางด้านอัลตร้าซาวด์ (MFM)
- ตรวจดาวน์ซินโดรมลูกน้อยในครรภ์
สามารถติดต่อเพื่อรับคำปรึกษาได้ที่ โรงพยาบาลเฉพาะทางแม่และเด็กแพทย์รังสิต หรือ ติดต่อได้ที่เบอร์โทรศัพท์ 02-998-9888 ต่อ 3200 , 3201 ได้ในเวลา 08.00-20.00 น.นะคะ
โรงพยาบาลอัมพวา เปิด walk in ฉีดวัคซีน เข็ม 1-2-3-4 LINK
โรงพยาบาลอัมพวา เปิด walk in ฉีดวัคซีน เข็ม 1-2-3-4 วันที่ 2,10-11,15,17,23-24 กุมภาพันธ์ เวลา 8-14 น. ณ วัดปากน้ำ อ.อัมพวา สมุทรสงคราม จัดฉีดเข็มที่ 1-2-3-4 ชนิดวัคซีนตามภาพ
ฉีดได้ทั้งไทยและต่างชาติ (ต่างชาตินำพาสปอร์ต/บัตรชมพูมาแสดง)
สอบถามโทร 094-4511616
8. เทศกาลข้าวใหม่ปลามัน มหัศจรรย์วันวาเลนไทน์ พาสาน ต้นแม่น้ำเจ้าพระยา
เทศกาลข้าวใหม่ปลามัน มหัศจรรย์วันวาเลนไทน์ พาสานต้นแม่น้ำเจ้าพระยา บริเวณเกาะกลางโรงปรับปรุงคุณภาพน้ำ (บ่อบำบัดใกล้คลองญวนชวนรักษ์) ถนนริมเขื่อนแม่น้ำเจ้าพระยา อ.เมืองนครสวรรค์ จ.นครสวรรค์ เดือนแห่งความรักนี้ ตั้งแต่วันที่ 11-14 กุมภาพันธ์ 2565 ไม่ว่าจะมาเป็นคู่รัก หรือมาเป็นกลุ่มเพื่อน พาคนที่คุณรักมาเก็บภาพความทรงจำไปด้วยกัน พบกับกิจกรรมภายในงานมากมาย
Digital Health Pass บอกข้อมูลอะไร
Digital Health Pass จะแสดงสถานะเกี่ยวกับโควิดของผู้เดินทาง 3 ลักษณะ
1. ได้รับวัคซีนต้านโควิด-19
2. มีผลรับรองการตรวจหาเชื้อโควิด-19
3. ได้รับการรักษาให้หายป่วยจากโรคโควิด-19
โรงพยาบาลวัฒนา อุดรธานี เปิดรับ สมัครงาน หลายตำแหน่ง LINK
ในตำแหน่งต่อไปนี้
- พยาบาลวิชาชีพ 2 อัตรา
- ผู้ช่วยพยาบาล 2 อัตรา
- ผู้ช่วยเหลือผู้ป่วย 2 อัตรา
- ผู้ช่วยเภสัชกร 2 อัตรา
- ยานยนต์ 1 อัตรา
- กุ๊กประจำร้านอาหาร 1 อัตรา
ส่งเรซูเม่สมัครงานได้ที่ hr@wattanahospital.net ฝ่ายทรัพยากรบุคคล โรงพยาบาลวัฒนา อุดรธานี โทร 042 219 888
4 ขั้นตอนง่ายๆ เปลี่ยนโรงพยาบาลประกันสังคม ผ่านไลน์
1. กดลงทะเบียนที่มุมขวาล่าง
2. เลือกเปลี่ยนโรงพยาบาล
3. เลือกโรงพยาบาลที่จะเปลี่ยนแล้วกด ”ยืนยัน”
4. ยื่นเรื่องเรียบร้อยเป็นอันเสร็จ รอผลภายใน 2 วัน
ผู้ประกันตนจะสามารถใช้สิทธิ รพ. ใหม่ได้ภายในวันที่ 1 หรือ 16 ของเดือน
ด่วน ยื่นเปลี่ยนโรงพยาบาล
ได้ถึง 31 มีนาคม 2565 เท่านั้น
โรคไบโพลาร์สามารถรักษาให้หายได้ สังคมต้องช่วยกัน
ความร่วมมือของทุกภาคส่วนทั้งภาครัฐและภาคเอกชน รวมถึงภาคประชาชน ถือเป็นพลังสำคัญที่จะสนับสนุนให้ผู้ป่วยไบโพลาร์ และผู้ป่วยจิตเวชอื่นๆ เข้าถึงการรักษาอย่างถูกวิธี และรอดพ้นจากการตีตราของสังคม คนในสังคมต้องช่วยกันลดการใช้คำที่สะเทือนใจมาหยอกล้อเล่นกันหรือเป็นคำพูดติดปาก เช่น คำว่า "ไบโพลาร์" หรือ "โรคจิต" เป็นต้น ในทางกลับกัน สังคมควรเข้าใจผู้ป่วย เนื่องจากโรคไบโพลาร์เป็นความผิดปกติทางอารมณ์ชนิดหนึ่งที่มีการขึ้นและลงของอารมณ์อย่างรุนแรง แบ่งเป็น 2 กลุ่ม คือ
กลุ่มอาการแมเนีย (Mania) คือ อารมณ์ดี คึกคัก สนุกสนาน และ
กลุ่มอาการซึมเศร้า (Depress) คือ หดหู่ คิดลบ อยากฆ่าตัวตาย
สาเหตุสำคัญเกิดจากสารเคมีในสมองทำงานผิดปกติ ฉะนั้น คนในครอบครัวมีบทบาทสำคัญที่จะพูดในเชิงบวกเพื่อให้ผู้ป่วยมาพบแพทย์เพื่อรักษาตั้งแต่เนิ่นๆ เพราะ "โรคไบโพลาร์สามารถรักษาให้หายได้" ด้วยการใช้ยาเป็นหลัก และอาจมีการใช้จิตบำบัดควบคู่กันไปด้วย เพื่อการอยู่ร่วมกันในสังคมได้อย่างปกติสุข
*พญ.อภิสมัย ศรีรังสรร ผู้ดำเนินรายการพญาไท 1 บริการตรวจ PCR แบบ Drive Thru และ Walk in ค่าตรวจ 2,500
โรงพยาบาลพญาไท 1 บริการตรวจหาเชื้อ COVID-19 แบบ Drive Thru และ Walk in ทราบผลภายใน 24 ชม. พร้อมใบรับรองผล ค่าบริการ ตรวจ PCR 2,500 บาท ATK 500 บาท
เปิดให้บริการทุกวัน เวลา 08.00 - 17.00 น. (พักทำความสะอาด เวลา 12.00-13.00น.) สถานที่ให้บริการ ณ หน้าอาคาร 3 ชั้น 1 สอบถามรายละเอียดเพิ่มเติม โทร.02-201-4646
รพ.สุขสวัสดิ์ เปิดลงทะเบียน จองเตียงสำหรับเข้าพักกักตัวกรณีผู้ป่วย COVID19 LINK
โรงพยาบาลสุขสวัสดิ์ เปิดลงทะเบียน จองเตียงสำหรับเข้าพักกักตัวกรณีผู้ป่วย COVID19 (สัญชาติไทยไม่มีค่าใช้จ่ายใดๆ)
????️ สิทธิประกันสังคม, สิทธิข้าราชการ และสิทธิบัตรทองทุกโรงพยาบาล โดยสามารถเลือกรูปแบบการกักตัว หรือพักรักษาตัวได้ดังนี้
- ที่โรงพยาบาลสุขสวัสดิ์ (Cohort ward) (เขตราษฎร์บูรณะ)
- พักรักษาตัว (Hospitel) ที่โรงแรมแซฟฟรอน ฮิล ( มีนบุรี )
- กักตัว (Hotel Isolation) ที่โรงแรมสมาร์ท สวีท (สุขุมวิท 11)
- กักตัวเองที่บ้าน (Self-isolation) **เฉพาะสิทธิประกันสังคมทุกโรงพยาบาล
สนใจสอบถามข้อมูลเพิ่มเติมได้ที่
???? 02-8746766-70 ต่อ1106
???? คุณพรพิมล 098-020-9935
???? คุณกาญจนา 092-859-9601
???? คุณณัฏฐ์รมิดา 082-358-5511
???? คุณต้น 06-1561-9755
???? คุณฟ้า 081-090-2030
???? คุณสุชาติ 086-272-0481
???? คุณเจษฎาภรณ์ 063-969-5666
โปรแกรมตรวจปอดหลังติดโควิด รพ.ซีจีเอช พหลฯ พิเศษ 5,500
รพ.ซีจีเอช พหลฯ จัดโปรแกรมตรวจสุขภาพ สำหรับท่านที่เคยติดเชื้อโควิด ราคาพิเศษ 5,500 บาท ตรวจปอด ด้วยเครื่องเอกซเรย์คอมพิวเตอร์แบบใช้ปริมาณรังสีต่ำ แนะนำสำหรับผู้ป่วยที่รักษาโควิด-19 หายแล้ว ระยะเวลา 1-3 เดือน เพื่อหาผลข้างเคียงระยะยาว จากการติดเชื้อ
สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกรังสี โทร : 02 552 8777 ต่อ 1157
เกษมราษฎร์ รัตนาธิเบศร์ บริการฉีดวัคซีนเข็มกระตุ้น Moderna ราคาเพียง 1,299 บาท
โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ บริการฉีดวัคซีนเข็มกระตุ้น Moderna พร้อมฉีด ราคาเพียง 1,299 บาท ระยะเวลาโปรโมชั่น 7-12 เมษายน 2565 (รพ.หยุดให้บริการในวันที่ 10 เมษายน 2565) ‼️ รับเฉพาะ Walk - in เวลา 08.00-16.00 น. เท่านั้น ‼️ สอบถามเพิ่มเติม : 1218 กด 11 ต่อ แผนกประชาสัมพันธ์ และการตลาด
บี.แคร์ เมดิคอลเซ็นเตอร์ บริการ Hospitel Service โทร. 02 532 4444 ต่อ 3554, 3555
เกณฑ์รับเข้ารักษาในโรงพยาบาล หรือ Hospitel ขึ้นอยู่กับเกณฑ์เงื่อนไขการรับ Admit โดยอยู่ในดุลยพินิจของแพทย์และโรงพยาบาล ติดต่อรับบริการ
- กรณีมีผล ATK เป็นบวก ต้องได้รับการตรวจ RT-PCR ก่อน จองคิวนัดหมายการตรวจที่ระบบลงทะเบียนทาง website หรือ QR Code
- กรณีท่านมีผลการตรวจ RT-PCR เรียบร้อยแล้วติดต่อที่ Covid Call Center ของโรงพยาบาล โทร. 02 532 4444 ต่อ 3554, 3555
ประวัติ 4 ผู้เขียน “Health Brings Wealth”
ศาสตราจารย์ นายแพทย์ จีรี ดโวชัค (Prof Jiří Dvořák, MD)
Zurich, Switzerland
ที่ปรึกษาอาวุโสด้านประสาทวิทยาและการวิจัยของศูนย์กระดูกสันหลัง (Spine Center) ประจำคลินิก Schulthess เมือง Zurich ซึ่งท่านเคยดำรงตำแหน่งเป็นประธานของคลินิกนี้มานานถึง 35 ปี
ศาสตราจารย์ด้านประสาทวิทยาแห่งมหาวิทยาลัยซูริค
อดีตประธานเจ้าหน้าที่ด้านการแพทย์ของ FIFA
ที่ปรึกษาของ BDMS Wellness Clinic กรุงเทพฯ
ที่ปรึกษาอาวุโสของ British Journal of Sports Medicine
อดีตรองบรรณาธิการของวารสารทางการแพทย์ SPINE ซึ่งมีบทความที่ได้รับการตีพิมพ์อย่างกว้างขวางมากถึง 462 บทความ
ในฐานะผู้ทรงคุณวุฒิและมีผลงานวิจัยจำนวนมากมายมหาศาลที่เกี่ยวเนื่องกับกระดูกสันหลังทั้งในแง่ที่เกี่ยวกับการประยุกต์หลักการทางชีวกลศาสตร์และเวชศาสตร์การกีฬามาใช้เพื่อป้องกันการบาดเจ็บส่งผลให้ท่านได้รับรางวัลต่างๆ มากมาย งานวิจัยต่างๆ ในปัจจุบันของท่านมุ่งเน้นไปที่การป้องกันโรคทั้งในกลุ่มโรคติดต่อเรื้อรังและกลุ่มโรคไม่ติดต่อเรื้อรัง และอยู่ในระหว่างการพัฒนาหลักสูตรเวชศาสตร์วิถีชีวิตระดับชาติให้กับประเทศไทยอีกด้วย
นอกจากนี้ท่านยังเป็นสมาชิกกิตติมศักดิ์ของสมาคมและสถาบันอีกหลายแห่ง อาทิ สมาคม EUROSPINE ซึ่งท่านมีส่วนร่วมก่อตั้งขึ้นเมื่อปีพ.ศ.2533 International Society of Arthroscopy, Knee Surgery and Orthopedic Sports Medicine และ the Czech Medical Academy.
ศาสตราจารย์ นายแพทย์ เซอร์จิโอ ฟาซิโอ (Prof Sergio Fazio, MD, PhD)
Portland, Oregon and Tarrytown, New York, US
ศาสตราจารย์ นายแพทย์ เซอร์จิโอ ฟาซิโอ จบการศึกษาแพทยศาสตร์บัณฑิตจาก University of Rome ปริญญาเอกจาก University of California เข้าทำงานที่ Vanderbilt University โดยเริ่มต้นที่แผนกอายุรกรรมโรคต่อมไร้ท่อและโรคเบาหวาน (Endocrinology and Diabetes) ก่อนจะย้ายไปยังแผนกอายุรกรรมหัวใจและหลอดเลือด (Cardiovascular Medicine) ที่ซึ่งท่านได้รับการเลื่อนตำแหน่งเป็นหัวหน้าแผนกป้องกันโรคหัวใจและหลอดเลือด และศาสตราจารย์วุฒิคุณด้านโรคหัวใจ ประจำ Stanford University ตามลำดับ
ต่อมาท่านได้ดำรงตำแหน่งเป็นผู้อำนวยการศูนย์ป้องกันโรคหัวใจ Knight Cardiovascular Institute ณ Oregon Health & Science University (OHSU) และที่นี่เองที่ท่านได้ริเริ่มความร่วมมือเพื่อนำทฤษฎีการรักษาโรคหัวใจแบบป้องกัน (Preventive Cardiology) มาสู่ประเทศไทย และเป็นที่ปรึกษาที่ BDMS Wellness Clinic กรุงเทพฯ ล่าสุด ท่านยังได้เข้าร่วมเป็นสมาชิกสภาวิทยาศาสตร์ของบริษัทผลิตยา Regeneron อีกด้วย
ผลงานทางวิชาการของศาสตราจารย์ฟาซิโอที่ได้รับการตีพิมพ์มีมากกว่า 320 ฉบับ ท่านมีส่วนร่วมในการก่อตั้ง American Journal of Preventive Cardiology Arteriosclerosis หน่วยงานอย่างเป็นทางการของ American Society for Preventive Cardiology และได้ร่วมเป็นคณะกรรมการบรรณาธิการของวารสารวิทยาศาสตร์อีกหลายฉบับ
ท่านเคยดำรงตำแหน่งประธานคณะกรรมการของ American Board of Clinical Lipidology ซึ่งเป็นองค์กรอเมริกันเพียงองค์กรเดียวที่สามารถออกประกาศนียบัตรรับรองเฉพาะทางด้านการรักษาโรคหัวใจแบบป้องกันอีกด้วย
ผู้ช่วยศาสตราจารย์วุฒิคุณนายแพทย์ ตนุพล วิรุฬหการุญ (หมอแอมป์)
Bangkok, Thailand
นายแพทย์ ตนุพล วิรุฬหการุญ (หมอแอมป์) จบการศึกษาจากแพทยศาสตร์บัณฑิตจากคณะแพทยศาสตร์ โรงพยาบาลศิริราช หลังจากนั้นได้ศึกษาต่อทางด้านการดูแลป้องกันและฟื้นฟูสุขภาพ และได้รับวุฒิบัตร American Board of Anti-Aging and Regenerative Medicine (ABAARM) จากชิคาโก ประเทศสหรัฐอเมริกา จากนั้นได้เข้ารับการฝึกอบรมและสำเร็จการศึกษาเป็นแพทย์เฉพาะทาง สาขาเวชศาสตร์ป้องกัน แขนงสาธารณสุขศาสตร์ (Preventive Medicine, Public Health) จากสมาคมเวชศาสตร์ป้องกันแห่งประเทศไทย
นายแพทย์ตนุพลยังได้รับใบประกาศนียบัตรเป็นแพทย์ผู้ชำนาญการในด้านการควบคุมน้ำหนัก (Fellowship in Obesity Medicine) จากสมาคม American Society of Bariatric Physicians (ASBP) ที่ เมืองเดนเวอร์ โคโรราโด สหรัฐอเมริกา นายแพทย์ตนุพลเป็นแพทย์ที่มีความมุ่งมั่นที่จะดูแลผู้ป่วยทำให้เรื่องควบคุมน้ำหนักไม่ใช่เรื่องยากสำหรับการดูแลสุขภาพ
ปัจจุบัน นายแพทย์ ตนุพล วิรุฬหการุญ ดำรง ตำแหน่ง นายกสมาคมแพทย์ฟื้นฟูสุขภาพและส่งเสริมการศึกษาโรคอ้วน กรุงเทพ (BARSO) และประธานคณะผู้บริหาร บีดีเอ็มเอส เวลเนส คลินิก และบริษัท บีดีเอ็มเอส เวลเนส รีสอร์ท จำกัด ท่านยังเป็นหนึ่งในคณะกรรมการกองบรรณาธิการของ Bangkok Medical Journal วารสารวิชาการของเครือ BDMS ซึ่งเป็นวารสารงานวิจัยทางการแพทย์ของโรงพยาบาลเอกชนฉบับแรกในประเทศไทยที่ได้รับการรับรองคุณภาพระดับอาเซียน นอกจากนี้นายแพทย์ ตนุพล วิรุฬหการุญ ยังได้รับการแต่งตั้งเป็น ผู้ช่วยศาสตราจารย์วุฒิคุณ จากสถาบันพัฒนาสุขภาพอาเซียน มหาวิทยาลัยมหิดล
นายแพทย์ตนุพลเป็นผู้ที่ให้ความสำคัญกับขับเคลื่อนและกระตุ้นให้ประชาชนไทยเกิดความตระหนัก และสนใจในการดูแลสุขภาพในเชิงป้องกันโรคมากขึ้น โดยการให้ความรู้ผ่านทางการบรรยาย และช่องทางสื่อออนไลน์ อาทิ Facebook : Dr Amp Team; Instagram : DrAmp Team; YouTube : DrAmp Team, BDMS Wellness Clinic; Website : www.dramp.com ปัจจุบันมีผู้ติดตาม มากกว่า 750,000 คน
นายแพทย์ตนุพลยังเป็นเจ้าของผลงานที่ได้รับการตีพิมพ์ เป็นหนังสือ Best Seller อีกหลายเล่ม อาทิ เคล็ดลับชะลอวัย ห่างไกลโรค, กินดี อยู่นาน คือของขวัญชีวิต, สุขภาพดีอายุ 100 ปี คุณก็มีได้, นอนถูกวิธี สุขภาพดีตลอดชีวิต
ศาสตราจารย์ นายแพทย์ คีธ แบล็ค (Prof Keith L. Black, MD)
Los Angeles, California, USA
ศาสตราจารย์ คีธ แอล. แบล็ค เป็นศัลยแพทย์ระบบประสาทและนักวิทยาศาสตร์ที่มีชื่อเสียงในลอสแองเจลิส ได้รับปริญญาทางการแพทย์จาก Michigan Medical School และมีประสบการณ์ในวิชาชีพมานานมากกว่า 20 ปี ท่านดำรงตำแหน่งหัวหน้าแผนกศัลยกรรมประสาทและผู้อำนวยการสถาบันศัลยกรรมประสาท Maxine Dunitz ของศูนย์การแพทย์ Cedars-Sinai ได้รับการแต่งตั้งเป็นศาสตราจารย์ สาขาประสาทวิทยา
ตอนอายุ 17 ปี ศาสตราจารย์ แบล็ค ได้ตีพิมพ์บทความทางวิทยาศาสตร์เรื่องแรกซึ่งได้รับรางวัล Westinghouse Science Award ท่านสำเร็จการศึกษาทั้งระดับปริญญาตรีและแพทย์ศาสตร์ภายในหกปี ทำงานเป็นแพทย์ฝึกหัดด้านศัลยกรรมทั่วไปและเฉพาะทางด้านศัลยกรรมประสาทที่ศูนย์การแพทย์ของมหาวิทยาลัยมิชิแกนใน Ann Arbor.
ผลงานวิจัยของศาสตราจารย์แบล็คมีมากมายหลายเรื่อง อาทิ เช่น การพัฒนาวัคซีนเพื่อเพิ่มการตอบสนองภูมิคุ้มกันต่อเนื้องอกในสมอง, ชีววิทยาของแนวกั้นเลือดและสมอง, เซลล์ต้นกำเนิดมะเร็ง, เครื่องมือนำร่องเพื่อการวางแผนการผ่าตัดเนื้องอกในสมอง, Alzheimer’s retinal imaging ท่านเป็นผู้บุกเบิกวิธีการใช้คลื่นไมโครเวฟจี้ทำลายก้อนมะเร็งโดยใช้เทคโนโลยีคอมพิวเตอร์ในการนำร่องซึ่งในอนาคตอาจทำการรักษาแบบทางไกลได้โดยไม่ต้องดำเนินการในห้องผ่าตัด
ผลงานของท่านได้รับความสนใจอย่างกว้างขวาง ท่านได้นำเสนอผลงานและบรรยายทางวิชาการในการประชุมระดับชาติและนานาชาติกว่า 500 ครั้ง มีผลงานได้รับการตีพิมพ์กว่า 400 บทความ ประวัติของท่านถูกนำมาสร้างเป็นซีรีส์ออกฉายทางโทรทัศน์ The New Explorers นิตยสาร Esquire ได้รวมชื่อของท่านไว้ใน "21 บุคคลที่สำคัญที่สุดแห่งศตวรรษที่ 21" ท่านได้ขึ้นปกนิตยสาร TIME ฉบับพิเศษปี 1997 "Heroes of Medicines." อัตชีวประวัติของท่านยังได้รับการตีพิมพ์เป็นหนังสือ Brain Surgeon ในปีพ.ศ. 2552
รพ.ลำปาง ตรวจ ATK ผลบวก (ขึ้น 2 ขีด) สแกน QR code หรือ แอดไลน์ @lphi LINK
โรงพยาบาลลำปาง ตรวจ ATK ผลบวก (ขึ้น 2 ขีด) หากเข้าเกณฑ์รักษาแบบผู้ป่วยนอก จองคิวนัดพบแพทย์ เพื่อความสะดวกรวดเร็ว
✅สแกน QR code หรือ แอดไลน์ @lphi
✅ลงทะเบียนโดยตนเอง แล้วทำประเมิน
✅หากเข้าเกณฑ์รักษาแบบผู้ป่วยนอก ติดต่อรับบริการ รพ.สต ใกล้บ้าน หรือ คลินิก ARI รพ.ลำปาง
✅หากจะมาตรวจที่ คลินิก ARI สามารถจองคิวนัดพบแพทย์ เลือกวันและเวลาที่สะดวก
✅บันทึกหน้าจอการจองคิวสำเร็จ
✅มาพบแพทย์ตามนัด แสดงหลักฐานการจองคิว ที่บันทึกไว้ ต่อเจ้าหน้าที่ ตู้สีเหลือง ช่อง 5 ,6 ณ คลินิก ARI ข้างตึกเมตตาได้เลย
✅แพทย์พิจารณาจ่ายยาตามอาการ ออกใบรัยรองการเจ็บป่วยให้
✅รับยากลับบ้าน กักตัวจนครบ 10 วัน (วันพบแพทย์ นับเป็น day 0)
✅ หลังกักตัวครบแล้ว ให้มารับใบรับรองแพทย์
การจองคิวล่วงหน้า ช่วยลดระยะเวลารอคอย และเพื่อความสะดวกรวดเร็วในการรับบริการ
อ.สำโรง รพ.สำโรง และรพ.สต.
ยาสมุนไพรประเภทยาน้ำ
ยาแก้ไอมะขามป้อม(สูตรไม่มีน้ำตาล) ยาดองมะกรูด ยาธาตุอบเชย ยาน้ำลูกยอไทย
18.หน้าที่ของผู้ประมวลผลข้อมูลส่วนบุคคล
พญ.ธัญญารัตน์ สิทธิวงศ์ ผอ.รพ.บ้านตาก ได้กล่าวในวันนั้นว่า
"งานในวันนี้สำเร็จลงได้ด้วยความรัก ความสามัคคีของพวกเราชาวรพ.บ้านตากทุกคน ต้องขอบคุณพวกเรามากๆ ที่คนที่ช่วยกันเป็นสะพานบุญบอกบุญต่อๆๆ กัน ช่วยเตรียมงาน ทั้งเบื้องหน้า เบื้องหลัง ได้รับบุญสำเร็จถ้วนทั่วเท่ากันค่ะ"
ภาพจาก เพจ รพ.บ้านตาก
ตารางแพทย์ทางเลือก/ฝังเข็ม
4,800 Thai women died from breast cancer
Dr. Patcharee Prasitvoranant, Radiologist at Bumrungrad International Hospital, states, “In 2020, the National Cancer Institute reported 18,000 new cases of breast cancer in Thai women. There were 4,800 deaths from breast cancer, or 13 deaths per day on average. Breast cancer is still the most common form of cancer affecting Thai women and the number of cases rises annually. Women over the age of 40 should have a yearly mammogram. Currently, Bumrungrad uses Radiology INSIGHT MMG to screen, analyze, and diagnose early-stage breast cancer through mammographic images. In the past, radiologists read, interpreted, analyzed, and diagnosed medical problems just through imagery. However, the Radiology AI in medical technology is an adjunctive tool helping radiologists to analyze the images, making diagnoses more accurate. Radiologists diagnose breast cancer using the results of Radiology AI. If breast cancer is diagnosed early and the treatment process can start immediately, the 5-year survival rate is as high as 99%. If it is diagnosed later, the 5-year survival rate can decrease to as little as 86% to 29%, depending on how far the cancer has progressed. In sum, early diagnosis means a higher chance of successful treatment.”
โรงพยาบาลเกษมราษฎร์ จ.ปราจีนบุรี
เป็นโรงพยาบาลเอกชนขนาดกลาง ขนาด 115 เตียง ตั้งอยู่ที่ ตำบล ท่าตูม อำเภอศรีมหาโพธิ จังหวัด ปราจีนบุรี เริ่มเปิดให้บริการ มกราคม 2564 เข้าเป็นโรงพยาบาลในประกันสังคม เริ่มตั้งแต่ปี 2565 มีโควต้ารับผู้ประกันตน 115,000 ราย
ข้อมูลล่าสุด พ.ค. 2565 โรงพยาบาลเกษมราษฎร์ จ.ปราจีนบุรี สามารถรับผู้ประกันตนเพิ่มได้อีก 92,582 ราย
โรงพยาบาลเกษมราษฎร์ จ.ปราจีนบุรี มีเครือข่าย สถานพยาบาลในระดับสูง ได้แก่
โรงพยาบาลเกษมราษฎร์ประชาชื่น
โรงพยาบาลเกษมราษฎร์ฉะเชิงเทรา
โรงพยาบาลเมตตาประชารักษ์(วัดไร่ขิง)
โรงพยาบาลมหาวชิราลงกรณธัญบุรี
โรงพยาบาลมะเร็งชลบุรี
ศูนย์การแพทย์สมเด็จพระเทพรัตนราชสุดาฯ
สถาบันประสาทวิทยา กรมการแพทย์
เงื่อนไขเพิ่มเติม (เริ่มใช้ 23 มิ.ย.62)
น้ำพริก แกง น้ำจิ้ม ในปริมาตรที่เกินกำหนด เคยผ่อนปรนให้สำหรับเที่ยวบินในประเทศ จะไม่ได้รับการยกเว้น อีกต่อไป ผู้โดยสารต้องนำไปกับสัมภาระที่บรรทุกใต้ท้องเครื่องบินเท่านั้น
นพ.วัลลภ สำราญเวทย์ (กลาง) ผู้อำนวยการศูนย์ข้อสะโพกและข้อเข่า รพ.กรุงเทพอินเตอร์เนชั่นแนล นพ. สมบัติ โรจน์วิโรจน์ (ซ้าย) และ นพ.พนธกร พานิชกุล (ขวา)
หลักสูตรนักรังสีเทคนิค - อ.ปรเมษฐ์ วงษา
อาจารย์ปรเมษฐ์ วงษา ผู้อำนวยการโรงเรียนรังสีเทคนิค บรรยายถึงหลักสูตรที่ผลิตนักรังสีเทคนิค มาจากการสร้างภาพทางการแพทย์มีบทบาทสำคัญเป็นอย่างมากในการช่วยแพทย์วินิจฉัย และรักษาโรคในผู้ป่วย ทำให้ประเทศไทยต้องการกำลังคนในสายงานรังสีวิทยาเพิ่มมากขึ้นตามไปด้วย โดยเฉพาะนักรังสีเทคนิคเป็นที่ต้องการและถือเป็นวิชาชีพขาดแคลนในประเทศไทย
ปัจจุบันหลักสูตรเปิดดำเนินการมาเป็นปีที่ 6 ดำเนินการเรียนการสอนโดยอาจารย์ผู้เชี่ยวชาญในแต่ละสาขา ทั้งรังสีวินิจฉัย รังสีรักษา และเวชศาสตร์นิวเคลียร์ นักศึกษามีโอกาสได้เรียนภาคทฤษฎีและภาคปฏิบัติกับเครื่องมือและเทคโนโลยีที่ทันสมัย อาทิ ที่ศูนย์ภาพวินิจฉัยและร่วมรักษาเพื่อปวงชน ได้แก่ เครื่อง MRI 1.5 เทสลา และเครื่อง MRI ขนาด 3 เทสลา จำนวน 3 เครื่อง และมีเครื่อง MRI แบบพิเศษ คือ MRI Upright และ MRI HIFU
นอกจากนี้ในส่วนของเครื่องเอกซเรย์คอมพิวเตอร์หรือ CT ยังมีเทคโนโลยีที่ทันสมัยทั้ง 3 แบบ ได้แก่ CT Dual source, kV switching, Dual Layer ที่พร้อมให้นักศึกษาของเราไปเรียนรู้และฝึกงาน
ส่วนทางด้านเวชศาสตร์นิวเคลียร์ นักศึกษาจะได้มีโอกาส ไปเรียนรู้และฝึกปฏิบัติ ณ ศูนย์ไซโคลตรอนและเพทสแกนแห่งชาติ ซึ่งมีเครื่องมือที่ทันสมัย ได้แก่ เครื่องถ่ายภาพ Digital PET/CT เครื่องแรกของประเทศไทยจำนวน 2 เครื่อง และเครื่อง PET/MRI เครื่องแรกและเครื่องเดียวของประเทศไทย เครื่อง Cyclotron และ Module สำหรับการผลิตสารเภสัชรังสีต่างๆ และด้านรังสีรักษานักศึกษาจะได้มีโอกาสเรียนรู้เครื่องมือและฝึกปฏิบัติ ณ งานรังสีรักษามะเร็งวิทยา โรงพยาบาลจุฬาภรณ์ ที่มีเครื่องมือที่ทันสมัย นำเทคโนโลยีปัญญาประดิษฐ์มาใช้เพื่อช่วยแพทย์
สวนสราญรมย์ เนื้อที่ 23 ไร่
สวนสราญรมย์ เนื้อที่ 23 ไร่ ตั้งอยู่ที่ ถนนราชินี เขตพระนคร เดิมคือ พระราชอุทยานสราญรมย์ ตรงข้ามกับพระบรมมหาราชวัง สวนสราญรมย์ก่อสร้างปี 2417 ในสมัยร.5 เพื่อให้เป็นสวนพฤษศาสตร์ รวบรวมพันธุ์ไม้แปลกๆ ตามอย่างต่างประเทศ กระทั่งปี 2503 รัฐบาลได้มอบสวนสราญรมย์ให้กรุงเทพมหานคร ปรับปรุงเป็นสวนสาธารณะแก่ประชาชนทั่วไป จนถึงปัจจุบัน จุดเด่นในสวนสราญรมย์ อาทิ อนุสาวรีย์สมเด็จพระนางเจ้าสุนันทากุมารีรัตน์ อาคารสโมสรคณะราษฎร์สราญรมย์ เรือนกระจก ศาลเจ้าแม่ตะเคียนทอง
สวนสราญรมย์ เปิดให้บริการทุกวัน 05.00 -21.00 น.
ชุมชนเก่าย่านวังกรด อ.เมือง จ.พิจิตร
ตลาดย่านเก่าวังกรด ตั้งอยู่ ตำบลวังกรด ห่างจากจากตัวเมืองพิจิตรเพียง 6 กิโลเมตรเท่านั้น อดีตเป็นย่านพาณิชยกรรมที่เก่าแก่แห่งหนึ่งของจังหวัดพิจิตร ในปัจจุบันยังคงบอกเล่าความเป็นอดีต ทั้งวิถีชีวิตของคนในชุมชน อาคารบ้านเรือน สถาปัตยกรรม และการค้าขาย จึงเป็นเสน่ห์อีกอย่างหนึ่งที่ทำให้นักท่องเที่ยวที่ได้มาเที่ยวแล้ว อยากกลับมาเที่ยวอีก และทุก ๆ วันเสาร์จะมีตลาดนัดของคนในชุมชน มีการรำวงย้อนยุค และการจำหน่ายอาหาร สินค้า ราคาย่อมเยา การเดินทาง ย่านเก่าวังกรดตั้งอยู่บนถนนหมายเลข 5046 ห่างจากตัวเมืองพิจิตรเพียง 5 กิโลเมตร
ชุมชนเก่าย่านวังกรด พิจิตร
69 ม.1 ถนน เทศบาล 9 ตำบล บ้านบุ่ง อำเภอเมืองพิจิตร พิจิตร 66000
www.facebook.com/ย่านเก่าวังกรด-ชุมชนเก่าเล่าเรื่อง
ปัญหาเรื่องค่าใช้จ่ายที่เพิ่มเป็นสิ่งที่น่ากังวล - แกรนท์ บาร์โทลี่
มร.แกรนท์ บาร์โทลี่ ประธานเจ้าหน้าที่บริหาร มาร์เก็ตบัซซ กล่าวว่า “ผลการสำรวจแสดงให้เห็นว่าผู้บริโภคไม่เพียงแต่กังวลเรื่องรายได้ที่ลดลงเท่านั้น ปัญหาเรื่องค่าใช้จ่ายที่เพิ่มขึ้นก็เป็นสิ่งที่น่ากังวลด้วยเช่นกัน โดยเฉพาะค่าใช้จ่ายที่จำเป็นต่อการดำรงชีวิต เช่น ค่าอาหาร, ค่าสาธารณูปโภค และค่าน้ำมัน เป็นต้น ผลการสำรวจยังชี้ให้เห็นอีกว่า ปัญหาเหล่านี้ได้ส่งผลต่อสุขภาพจิต โดย 70% ยอมรับว่าตนเองกำลังประสบกับภาวะเครียด โดยเฉพาะในกลุ่มผู้บริโภคที่มีอายุระหว่าง 35-44 ปี, ผู้หญิง, ประชากรในภาคอีสาน, ภาคใต้ หรือเจ้าของกิจการขนาดเล็ก
มร.แกรนท์ บาร์โทลี่ เสริมต่อว่า “การที่คนต้องเผชิญกับค่าครองชีพที่สูงขึ้นนั้น ท้ายที่สุดแล้วจะส่งผลต่อสภาพจิตใจ ซึ่งคนส่วนใหญ่กว่า 70% อ้างว่าได้รับผลกระทบจากเรื่องดังกล่าว ทำให้เกิดภาวะเครียดขึ้น ดังนั้นคนส่วนใหญ่จึงวางแผนที่จะรับมือกับค่าครองชีพที่สูงขึ้นโดยงดการจับจ่ายใช้สอยในสิ่งที่ไม่จำเป็น อย่างไรก็ดี วิธีการดังกล่าวก็ไม่สามารถรับประกันได้ว่าจะช่วยควบคุมค่าใช้จ่ายในครัวเรือนได้ในระยะยาว หากปัญหาเรื่องราคายังไม่ได้รับการแก้ไข หรือคลี่คลายในอนาคต
ดังนั้น คนไทยส่วนใหญ่จึงมีมาตรการรัดเข็มขัดการใช้จ่ายในครัวเรือน เพื่อหลีกเลี่ยงการก่อหนี้ หรือภาวะหนี้ในครัวเรือนอันเนื่องมาจากรายได้น้อยลงซึ่งสวนทางกับรายจ่ายที่เพิ่มขึ้น อย่างไรก็ตาม หากผู้บริโภคไม่สามารถปรับตัวกับการที่รายได้ลดลง ประกอบกับค่าครองชีพที่สูงขึ้นได้ ก็มีความเป็นไปได้สูงที่คนเหล่านั้นจะรู้สึกกดดันในการดำเนินชีวิต และส่งผลเสียต่อสุขภาพจิต ซึ่งอาจทำให้เกิดปัญหาทางสังคมอื่นๆ ตามมาก็เป็นได้”
เกี่ยวกับ Marketbuzzz
Marketbuzzz เชื่อมต่อกับผู้ใช้มือถือ แท็บเล็ต และพีซี ที่สนใจทำแบบสำรวจกับนักวิจัยตลาดที่ต้องการความคิดเห็น ด้วยความร่วมมือของเรากับแอปพลิเคชั่นบนมือถือชั้นนำมากมาย ทำให้มาร์เก็ตบัซซสามารถเข้าถึงผู้ใช้งานมากกว่า 12 ล้านคนในประเทศไทย
คลินิกเวชกรรม สวท ขอนแก่น LINK
คลินิกเวชกรรม สวท ขอนแก่น
เลขที่ 752-754 ถนนศรีจันทร์ อำเภอเมือง จังหวัดขอนแก่น 40000
เปิดทำการ : จันทร์-ศุกร์ เวลา 10.00-18.00 น.
เปิดทำการ : วันเสาร์-อาทิตย์ เวลา 09.00-17.00 น.
ปิดทำการ : วันหยุดนักขัตฤกษ์
095-661-6551
043- 223- 627
การเลือกยาสีฟันสำหรับเด็ก
การเลือกยาสีฟันสำหรับเด็ก
ราชวิทยาลัยทันตแพทย์แห่งประเทศไทย แนะนำการใช้ยาสีฟันผสมฟลูออไรด์ 1000 ppm ตั้งแต่ฟันน้ำนมซี่แรกขึ้น
- ใช้ยาสีฟันฟลูออไรด์ 1000 ppm ทุกช่วงอายุ แปรงฟันให้ลูกได้เลย
- เด็กเล็กผู้ปกครองแปรงฟันให้ลูกน้อย
- ใช้ผ้าเช็ดฟองยาสีฟัน ไม่ต้องบ้วนน้ำ
- ฝึกงดนมมื้อดึกตั้งแต่ 6 เดือนขึ้นไป
แพทย์หญิงสุรีย์รัตน์ ศรีตั้งรัตนกุล ผู้อำนวยการคลินิกบีดีเอ็มเอส เวลเนส คลินิก รีทรีท สมุย (BDMS Wellness Clinic Retreat Samui) กล่าวเสริมว่าสิ่งสำคัญที่สุดคือวิตามินและแร่ธาตุในร่างกาย โดยจะให้ดีที่สุดควรได้รับจากอาหาร แต่หากในบางคนที่ได้รับในปริมาณ ซึ่งไม่เพียงพออาจต้องเสริมเพิ่มเข้าไป ทั้งนี้ก่อนจะได้รับการเสริมวิตามินควรจะได้รับการตรวจก่อนว่าขาดวิตามินชนิดใด เพื่อจะได้เติมเต็มให้ตรงจุด
“เพราะวิตามินที่ขายทั่วไปไม่ได้เหมาะกับเราโดยเฉพาะ บางอย่างเยอะไป บางอย่างน้อยไป ถ้าในบางอย่างที่เราต้องการน้อยแต่ได้ในปริมาณที่เยอะก็จะส่งผลไม่ดีต่อร่างกายได้ โดยทางเราจะให้วิตามินเฉพาะบุคคล ที่มีแพทย์คอยปรับให้เหมาะสมกับแต่ละท่าน ขั้นตอนการตรวจ คือ การซักประวัติพฤติกรรมการใช้ชีวิตต่างๆ ซึ่งสามารถส่งผลกับร่างกายของเราได้ การรับประทานอาหาร หรือโรคประจำตัว และหลังจากนั้นแพทย์จะทำการประเมินว่าควรได้รับการตรวจอะไรเพิ่มเติม โดยจะเน้นที่การตรวจเชิงลึกและปรับการใช้ชีวิตให้ดีต่อร่างกาย โดยจะมีแพทย์คอยดูและและปรับวิถีชีวิตด้วยกันไปเรื่อยๆ” แพทย์หญิงสุรีย์รัตน์ กล่าว
อันดับที่ 8 รพ.พระราม9 76.23%
โรงพยาบาลพระราม 9 เป็นโรงพยาบาลเอกชนลำดับที่ 5 ที่อยู่ในอันดับ 8 อาจเป็นเซอร์ไพรส์เล็กๆ หากดูจากอันดับของโรงพยาบาลอื่นๆ ในลำดับถัดๆไป แต่หากพิจารณาถึงคุณภาพ ภาพลักษณ์ และศักยภาพของโรงพยาบาลพระราม 9 แล้ว การก้าวมาอยู่ในท็อปเท็นไม่ใช่สิ่งเหนือคาดหมาย 30 ปีจากการก่อตั้ง (ปี 2535) วันนี้โรงพยาบาลประกอบด้วยสถาบันการแพทย์ 2 สถาบัน และศูนย์การแพทย์เฉพาะทาง 22 ศูนย์ แพทย์กว่า 200 คน และบุคลากรทางการแพทย์อื่น ๆ
My MedPark โรงพยาบาลเมดพาร์ค LINK
แอปพลิเคชัน My MedPark คลิกเดียวจบ ครบทุกการดูแลสุขภาพ มีฟีเจอร์การใช้งานหลัก ๆ 7 ฟีเจอร์ ดังนี้ Direct Appointment , Lab Results Visualization , Message Care Teams , Medication List , Charging Summary , Imaging Results , Profile Management
อ่านรายละเอียดแต่ละฟีเจอร์TAT Chiang Mai ททท.เชียงใหม่ แนะนำ โปรฯ กว่า 100 โรงแรมดังในเชียงใหม่ จองได้ตั้งแต่วันที่ 8 - 14 สิงหาคม 65
TAT Chiang Mai ททท.เชียงใหม่ แนะนำ โปรฯ กว่า 100 โรงแรมดังในเชียงใหม่ กับราคาสุดจี๊ด is coming 8.8 ต้อนรับหน้าฝน คาบเกี่ยวช่วงหยุดยาววันแม่ปีนี้ด้วยเลย
• จองได้ตั้งแต่วันที่ 8 - 14 สิงหาคม 65 เท่านั้น !
• เข้าพักได้ตั้งแต่ วันที่ 8 สิงหาคม – 31 ธันวาคม 2565
เขตลาดพร้าว ตรวจเน้นย้ำ! มาตรฐานความปลอดภัยสถานประกอบการในพื้นที่เขต LINK
10 สิงหาคม 2565 เวลา 20.00 น. ผศ.ดร.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร พร้อมด้วย พล.ต.อ.อดิศร์ งามจิตสุขศรี ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร และคณะ ลงพื้นที่ตรวจเข้มมาตรการความปลอดภัยของอาคารสถานประกอบการที่มีลักษณะเป็นสถานบันเทิง ผับ บาร์ และคาราโอเกะ ตรวจสอบสภาพของอาคารในด้านความปลอดภัยในการใช้อาคาร ระบบความพร้อมสำหรับการป้องกันเหตุอัคคีภัย พร้อมเน้นย้ำแจ้งเตือนให้เจ้าของสถานประกอบการ ทำการตรวจสอบสภาพการใช้งานภายในอาคารและระบบป้องกันอัคคีภัยให้พร้อมรับมือเมื่อมีเหตุเพลิงไหม้เกิดขึ้น
โดยมี นางสุภาพร ศรีศาสนวงศ์ ผู้อำนวยการเขตลาดพร้าว พร้อมด้วยนางสาวเสาวลักษณ์ วยะนันทน์ นายเจษฎา ประภาสะวัต ผู้ช่วยผู้อำนวยการเขตลาดพร้าว คณะผู้บริหารเขต และเจ้าหน้าที่ที่เกี่ยวข้อง ร่วมด้วยเจ้าหน้าที่ตำรวจนครบาลโชคชัยและโคกคราม เจ้าหน้าที่สถานีดับเพลิงลาดพร้าวและบางเขน ร่วมลงพื้นที่และให้ข้อมูลในการตรวจ ณ 76 Garage , M CLUB , Nawamin City Avenue , Harem Club และโรงเบียร์เยอรมันตะวันแดง เขตลาดพร้าว
ตรวจสุขภาพตามกลุ่มอายุ (ไม่เสียค่าใช้จ่าย) กับสิทธิ์ประกันสังคม รพ.กล้วยน้ำไท LINK
สำหรับท่านที่ต้องการทราบว่า เลือกประกันสังคม รพ.กล้วยน้ำไท ได้อะไรบ้าง สอบถามเพิ่มเติมได้ที่ 02-7692000 ต่อ 2031,2023
ตรวจสุขภาพตามกลุ่มอายุ !!! (ไม่เสียค่าใช้จ่าย)...
กับสิทธิ์ประกันสังคม รพ.กล้วยน้ำไท
โรงพยาบาลกล้วยน้ำไท
มอบสิทธิพิเศษ สำหรับผู้ถือสิทธิ์ประกันสังคมของโรงพยาบาลกล้วยน้ำไท
ตรวจสุขภาพตามกลุ่มอายุ โดย "ไม่เสียค่าใช้จ่าย"
ตั้งแต่อายุ 15 - 55 ปีขึ้นไป
รายละเอียดเพิ่มเติม โทร. 02-7692052
ติดต่อขอรับบริการได้ที่
แผนกตรวจสุขภาพ ( Check Up )
ชั้น1 อาคาร 80 พรรษา(2)
วันจันทร์ - ศุกร์ เวลา 7.30 - 15.00 น.
ยกเว้นวันหยุดนักขัตฤกษ์
**เงื่อนไขเป็นไปตามที่ทางโรงพยาบาลกำหนดเท่านั้น**
ประกันตนประกันสังคม รพ. บางไผ่ ที่ตรวจ ATKขึ้น 2 ขีด LINK
เรียนผู้ประกันตนประกันสังคม รพ. บางไผ่ ที่ตรวจ ATKขึ้น 2 ขีด หรือ มีผลตรวจ RT-PCR พบเชื้อ
✅ กรณีมีอาการเล็กน้อย เช่น ไข้ ไอ เจ็บคอ ปวดเมื่อยตามตัว
✅ สามารถลงทะเบียนเพื่อเข้าคิวรับยา โดย
ผ่านลิงก์ หรือ สแกน Qr code
หากท่านมีอาการหอบเหนื่อย แน่นหน้าอก สามารถเข้ามาตรวจที่ ARI Clinic ได้ทุกวัน เวลา 8.00 -17.00 น.
สอบถามรายละเอียด 02-4570086 ต่อ 4001 ,4000
คุณชุติมา วิริยะมหากุล ผู้อำนวยการฝ่ายธุรกิจ สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) กล่าวเสริมท้าย ถึงเรื่องความสนใจของคนในสังคมไว้ว่า ‘ตอนนี้คนไทยพร้อม Restart ชีวิต! อยากหาคำตอบให้สิ่งที่ยังค้างคาในสังคมพร้อมมองไปข้างหน้าสู่ชีวิตที่สดใสขึ้น’
ความสนใจข่าวที่เกี่ยวข้องกับโควิดฯ ซาลงอย่างต่อเนื่อง ในขณะที่ให้ความสนใจกับการเปลี่ยนแปลง และเริ่มต้นกับสิ่งใหม่ๆ เพื่อกลับมาใช้ชีวิตอีกครั้ง เช่น กระแสผู้ว่าฯ คนใหม่ ข่าวเกี่ยวกับปากท้อง เงินเฟ้อ และสภาวะเศรษฐกิจ
ต่อไปนี้คนไทยจะไม่ติดตามเนื้อหาแค่เพียงผิวเผิน แต่อยากที่จะขุดคุ้ยสิ่งรอบตัวในเชิงลึกมากขึ้น และต้องการคำตอบที่ชัดเจนเพื่อเดินหน้าต่อไป อาทิ ทำไมราคาน้ำมันแพง ทำไมราคาข้าวของแต่ละอย่างจึงประกาศขึ้นราคา ข่าวเกี่ยวกับปากท้อง เงินเฟ้อ และสภาวะเศรษฐกิจ
เครื่องดิจิตอลแมมโมแกรม 3 มิติ
8.การเมืองบนถนนกับหนทางออก
แม้ว่าการระบาดของโควิด-19 จะทำให้การชุมนุมทางการเมืองต้องหยุดพักไประยะหนึ่งตั้งแต่ช่วงปลายปี 2563 แต่ในปี 2564 ก็ได้เกิดม็อบการเมืองบ่อยครั้ง และมีการใช้ความรุนแรงระหว่างรัฐกับผู้ชุมนุมเพิ่มขึ้นอย่างชัดเจน โดยมีการตอบโต้กันทั้งสองฝ่าย อีกทั้งมีการดำเนินคดีกับแกนนำม็อบและผู้ชุมนุมจำนวนมาก
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบุรีรัมย์
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบุรีรัมย์
229 หมู่ 3 ตำบลชุมเห็ด อำเภอเมือง จังหวัดบุรีรัมย์ 31000
หมายเลขโทรศัพท์ 044-182560-1 โทรสาร 044-182560
สืบเนื่องจากในปี พ.ศ.2537 สมาชิกสภาผู้แทนราษฎรจังหวัดบุรีรัมย์ได้ตระหนักว่าผู้สูงอายุในเขตภาคตะวันออกเฉียงเหนือนั้น ยังประสบปัญหาทุกข์ยากเดือดร้อนฐานะยากจน ไม่มีที่อยู่อาศัยเป็นจำนวนมาก คนเหล่านี้สมควรได้รับความดูแลช่วยเหลือให้มีความเป็นอยู่ที่ดีขึ้นจึงได้เสนอให้รัฐบาลดำเนินการจัดตั้ง สถานสงเคราะห์คนชราบ้านบุรีรัมย์ โดยดำเนินการก่อสร้างมาตั้งแต่ ปี พ.ศ. 2540 บนพื้นที่บริเวณ ที่สาธารณประโยชน์บ้านโกรกขี้หนู ต.ชุมเห็ด อ.เมืองบุรีรัมย์ จ.บุรีรัมย์ และแล้วเสร็จสมบูรณ์ ในปี พ.ศ. 2542ได้รับงบประมาณดำเนินการก่อสร้าง เป็นเงินจำนวน 37,450,000.-บาท (สามสิบเจ็ดล้านสี่แสนห้าหมื่นบาทถ้วน)
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบุรีรัมย์ จังหวัดบุรีรัมย์ เปิดรับผู้สูงอายุทั้งชายและหญิง เข้ารับการบริการเมื่อวันที่ 1 ตุลาคม 2542 จำนวน 100 คน และเมื่อวันศุกร์ที่ 23 มิถุนายน 2542 สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จพระราชดำเนินทรงเป็นประธานในพิธีเปิดอย่างเป็นทางการ ซึ่งขณะนั้นใช้ชื่อว่า “สถานสงเคราะห์คนชราบ้านบุรีรัมย์” ต่อมาได้เปลี่ยนชื่อจากเดิม“สถานสงเคราะห์คนชราบ้านบุรีรัมย์” เป็น “ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านบุรีรัมย์” ตามมติสำนักงาน ก.พ.เมื่อวันที่ 2 พฤศจิกายน 2548 มีเป้าหมายรับผู้สูงอายุ จำนวน 100 คน
โครงการก่อสร้างโรงควบคุมคุณภาพน้ำของกรุงเทพมหานคร
กรุงเทพมหานครมุ่งมั่นที่จะคืนสายน้ำที่สะอาดสดใสให้แก่ประชาชนโดยมีโครงการที่จะสร้างโรงควบคุมคุณภาพน้ำขนาดใหญ่ในพื้นที่ 27 เขตของกรุงเทพมหานคร ซึ่งปัจจุบันเปิดให้บริการแล้ว 8 แห่ง อยู่ระหว่างดำเนินการ 4 โครงการ และมีแผนระยะยาวที่จะก่อสร้างเพิ่มอีก 15 โครงการ ในอนาคต
ปัจจุบันบำบัดได้ 45%
โครงการที่อยู่ระหว่างดำเนินการ บำบัดเพิ่ม 25%
โครงการที่อยู่ในแผนระยะยาว บำบัดเพิ่ม 20%
90% ของน้ำเสียในกรุงเทพฯ จะถูกบำบัด
โรงควบคุมคุณภาพน้ำ ที่เปิดบริการแล้ว 8 แห่ง ได้แก่
1.สี่พระยา
2.รัตนโกสินทร์
3.ดินแดง
4.ช่องนนทรี
5.หนองแขม
6.ทุ่งครุ
7.จตุจักร
8.บางซื่อ
อยู่ระหว่างดำเนินการ 4 โครงการ
9.คลองเตย
10.ธนบุรีเหนือ
11.บึงหนองบอน
12.มีนบุรี
แผนระยะยาว 15 โครงการ
13.ธนบุรีใต้
14.สะพานสูง
15.วังทองหลาง
16.ดอนเมือง
17.ลาดพร้าว
18.จอมทอง
19.บางเขน
20.บึงกุ่ม
21.ห้วยขวาง
22.ลาดกระบัง 2
23.ลาดกระบัง 1
24.หนองจอก 1
25.คลองสามวา
26.ลาดกระบัง 3
27.หนองจอก 2
เก๊กฮวยผสมกัญชา, กระท่อมบ๊วย, น้ำตาลโตนดผสมกัญชา เชฟ ธัญญ์พัธท์ สุวรรณชีพ
เก๊กฮวยผสมกัญชา, กระท่อมบ๊วย, น้ำตาลโตนดผสมกัญชา
เชฟ/เจ้าของ: ธัญญ์พัธท์ สุวรรณชีพ
ร้าน: ร้านกาแฟ กัญญา
สรรพคุณทางยา:
เครื่องดื่มสมุนไพรผสมกัญชาและใบกระท่อม น้ำสมุนไพรไทยมีประโยชน์ต่อร่างกาย เพราะอุดมไปด้วยวิตามินและเกลือแร่ต่าง ๆ น้ำเก๊กฮวยช่วยดับกระหายได้ดี ช่วยขับลม และบรรเทาอาการวิงเวียนศีรษะได้อีกด้วย
ที่อยู่: 181 ถนนสามเสน แขวงวัดสามพระยา เขตพระนคร กรุงเทพมหานคร 10200
Line: @ganjacafe
FB: ร้านกาแฟ กัญญา คาเฟ่ : Ganja Café
Tel. 08-2442-6454
บัวลอยกัญชางาดำน้ำขิง LINK
วัตถุดิบ
ใบกัญชา 1ใบ / ใบเตย 2 ใบ / งาดำ 2 กรัม / ขิง 50 กรัม / แป้งข้าวเหนียว 50 กรัม / น้ำตาล 50 กรัม / ครีมงาดำ 20 กรัม
วิธีการทำ
1. คั้นน้ำจากใบกัญชา
2. นำน้ำจากใบกัญชามาผสมกับแป้ง
3. ปั้นแป้งบัวลอยเป็นแผ่น ๆ ใส่ไส้ครีมงาดำและงาดำ ปั้นเป็นก้อนกลม แล้วลวกบัวลอยในน้ำเดือดจนสุกแล้วยกขึ้นพักไว้
4. ต้มน้ำขิงกับน้ำตาล จากนั้นใส่บัวลอยที่สุกแล้วลงไปพร้อมตักเสิร์ฟ
ข่าวปลอม! วิธีลดผลข้างเคียงในการทำคีโม LINK
ตามที่มีข้อมูลในสังคมออนไลน์เกี่ยวกับประเด็นเรื่องวิธีลดผลข้างเคียงในการทำคีโม ทางศูนย์ต่อต้านข่าวปลอมได้ดำเนินการตรวจสอบข้อเท็จจริงโดยสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข พบว่าประเด็นดังกล่าวนั้น เป็นข้อมูลเท็จ
จากกรณีที่มีคลิปแนะนำเกี่ยวกับสุขภาพโดยระบุว่าวิธีลดผลข้างเคียงในการทำคีโม ทางสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุข ได้ตรวจสอบข้อมูลและชี้แจงว่าคีโมหรือเคมีบำบัด (Chemotherapy) เป็นหนึ่งในวิธีการรักษาโรคมะเร็งที่ใช้ยาหลายรูปแบบ เพื่อยับยั้งการเจริญเติบโตของเซลล์มะเร็ง โดยการทำคีโมอาจมีผลทำให้เซลล์ปกติของร่างกายถูกทำลาย โดยเฉพาะเซลล์ที่มีการแบ่งตัวอย่างรวดเร็ว ส่งผลให้เกิดอาการข้างเคียง เช่น อ่อนเพลีย คลื่นไส้ อาเจียน ท้องผูก เบื่ออาหาร ผมร่วง ร้อนใน มีแผลในเยื่อบุต่าง ๆ ภูมิต้านทานต่ำ เป็นต้น อาการเหล่านี้จะมากหรือน้อยขึ้นอยู่กับชนิดของยา รวมทั้งสภาวะความแข็งแรงของร่างกายและจิตใจของผู้ป่วย
ทั้งนี้ อาการข้างเคียงดังกล่าวข้างต้นจะเป็นเพียงชั่วคราวเท่านั้น เมื่อหยุดการรักษาอาการต่าง ๆ ก็จะหายไป จากการสืบค้นข้อมูลพบว่าวิธีลดผลข้างเคียงในการทำคีโม โดยเน้นการกินอาหารที่มีไขมันและโปรตีน ลดอาหารจำพวกแป้งและน้ำตาล (การกินคีโต) การอดอาหารโดยการทำ Intermittent Fasting (IF) รวมทั้งการกินผักที่มีสารไฟโตนิวเทรียนท์นั้น ไม่สามารถลดผลข้างเคียงในการทำคีโมได้ เนื่องจากหากร่างกายของผู้ป่วยที่ทำคีโมอยู่ในภาวะขาดอาหาร อาจทำให้เกิดภาวะแทรกซ้อน ส่งผลเสียต่อการรักษา และการรับประทานอาหารครบหมู่ตามความต้องการของร่างกายจะช่วยให้ร่างกายฟื้นตัวได้เร็ว นอกจากนี้ช่วงการทำคีโมควรงดการกินผักและผลไม้สด เพราะอาจจะเสี่ยงต่อการติดเชื้อได้ง่าย
อย่างไรก็ตาม ผู้ป่วยที่ทำคีโมควรรับประทานอาหารให้ครบ 5 หมู่ ปรุงสุก สะอาด หลีกเลี่ยงอาหารที่ไม่สุก อาหารหมักดอง เครื่องดื่มแอลกอฮล์ การสูบบุหรี่ เป็นต้น และหากเกิดผลข้างเคียงที่รุนแรง เช่น มีไข้สูงและปวดหัวผิดปกติ เลือดออกง่ายหรือมีรอยช้ำที่ไม่ทราบสาเหตุ เกิดอาการแพ้อย่างรุนแรงและหายใจลำบาก ผู้ป่วยควรพบแพทย์หรือนำตัวส่งโรงพยาบาลโดยเร็วที่สุด
ดังนั้นขอให้ประชาชนอย่าหลงเชื่อข้อมูลดังกล่าว และขอความร่วมมือไม่ส่ง หรือแชร์ข้อมูลดังกล่าวต่อในช่องทางสื่อสังคมออนไลน์ต่างๆ และเพื่อให้ประชาชนได้รับข้อมูลข่าวสารจากสถาบันมะเร็งแห่งชาติ กรมการแพทย์ กระทรวงสาธารณสุขสามารถติดตามได้ที่เว็บไซต์ http://thaicancernews.nci.go.th/_v2/ หรือ สถาบันมะเร็งแห่งชาติ (nci.go.th) หรือโทร. 02 2026800
บทสรุปของเรื่องนี้คือ : ยังไม่มีข้อมูลที่ยืนยันว่าการกินคีโต การทำ IF และการกินผักที่มีสารไฟโตนิวเทรียนท์เป็นวิธีลดผลข้างเคียง ในการทำคีโม
ศักยภาพการบริการคลินิกกัญชาทางการแพทย์ของไทย
ปัจจุบันการใช้สารสกัดกัญชาเป็นแนวทางหนึ่งในการรักษาอาการของโรคกำลังเป็นที่สนใจของสังคมปัจจุบันนี้ประเทศไทยมี
คลินิกกัญชาทางการแพทย์ แล้วทั้งสิ้น 938 แห่ง ทั้งที่บริหารจัดการโดยภาครัฐและเอกชน ดูแลคนไข้มากกว่า 143,000 คน จ่ายยากัญชาไปแล้วกว่า 453,000 ครั้งภายใต้มาตรฐานทางการสาธารณสุขที่ได้รับการยอมรับในระดับโลก
ผู้ป่วยที่สนใจสามารถเข้ารับบริการได้คลินิกกัญชาทางการแพทย์ของกระทรวงสาธารณสุขทั่วประเทศ
นอกจากนี้ ทางศูนย์ฯ มีความร่วมมือกับศูนย์วิจัยเพื่อการได้ยินและสาธารณสุข มหาวิทยาลัยจอนส์ฮอปกินส์ (The Johns Hopkins Cochlear Center for Hearing and Public Health) โรงเรียนแพทย์ด้านหูอันดับหนึ่งในสหรัฐอเมริกา โดยได้ร่วมมือในด้านการเรียนการสอนและการวิจัย ที่ได้จัดทำโครงการอบรมแพทย์เฉพาะทางด้านการได้ยินในผู้สูงอายุ โดยใช้โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ให้เป็นศูนย์กลางของภูมิภาคเอเชียตะวันออกเฉียงใต้ในการจัดอบรมอีกด้วย”
8. การตรวจสุขภาพผิวพรรณ
การตรวจวิเคราะห์สภาพผิว (Skin Analysis) ด้วยเครื่อง Complexion analysis photography system เป็นการระบุประเภทของผิวที่เป็นเอกลักษณ์ของแต่ละบุคคล ทำให้ทราบถึงสาเหตุที่แท้จริงของปัญหาผิว ข้อดี และ ข้อบกพร่อง โดยกล้องมีความละเอียดสูง ทำให้สามารถตรวจวิเคราะห์ผิวชั้นบนและผิวชั้นที่ลึกลงไป โดยจะสามารถเห็นปริมาณรอยดำ รอยแดง ฝ้า กระ การอักเสบของผิว ความกว้างของรูขุมขน ริ้วรอย สารที่ทำให้เกิดสิวบนใบหน้า UV Spots ความไม่สม่ำเสมอของสีผิว และยังสามารถบอกอายุผิวที่แท้จริงของแต่ละบุคคลได้อีกด้วย เพื่อให้แพทย์สามารถให้คำแนะนำและการรักษาที่ตรงจุด รวมถึงเลือกใช้ผลิตภัณฑ์ที่เหมาะสมกับผิวมากที่สุดอีกด้วย สำหรับสถานการณ์การจัดหาและบริการดวงตาของศูนย์ดวงตาสภากาชาดไทยในปัจจุบัน มีรายงานว่าผู้ป่วยที่ต้องเข้ารับการปลูกถ่ายกระจกตาจะต้องใช้เวลารอคิวบริจาคประมาณ 3-5 ปี ซึ่งยอดบริจาคดวงตาหลังเสียชีวิตมีเพียง 2% ของประชากรไทย ขณะที่แต่ละปีมีผู้ขอรับบริจาคดวงตามากกว่า 1,000 คน และมีแนวโน้มเพิ่มขึ้นทุกปี โดยเฉลี่ยแต่ละปีจะมีผู้ที่ได้รับการปลูกถ่ายกระจกตาเพียง 600 – 700 ราย ปัจจุบันยังมีผู้รอคอยดวงตามากกว่า 17,000 คน ด้วยข้อจำกัดเรื่องระยะเวลา อาจทำให้อาการผู้ป่วยจากที่เป็นน้อยๆ เริ่มเป็นมากขึ้น ส่งผลให้การรักษายากขึ้นและมีความเสี่ยงมากขึ้น เช่น กรณีที่เบาหวานขึ้นตาก็ไม่สามารถยิงเลเซอร์รักษาได้ ทำให้ภาวะของโรคแย่ลง และมีภาวะแทรกซ้อนอื่นตามมา
“ศูนย์ปลูกถ่ายกระจกตา โรงพยาบาลบำรุงราษฎร์ จึงเป็นอีกทางเลือกที่มีศักยภาพและมีแนวทางในการดำเนินการจัดหาดวงตาบริจาคเพื่อนำไปผ่าตัดเปลี่ยนกระจกตาให้แก่ผู้ป่วยได้สะดวกและรวดเร็วขึ้น นับเป็นการแบ่งเบาภาระจากภาครัฐในการดูแลรักษาผู้ป่วยโรคกระจกตาที่มีความจำเป็นต้องรักษาด้วยการปลูกถ่ายกระจกตาให้สามารถเข้าถึงการรักษาที่มีคุณภาพในเวลาที่เหมาะสมให้ทั่วถึงยิ่งขึ้น เพื่อให้ผู้ป่วยสามารถกลับมามีคุณภาพการมองเห็นและคุณภาพชีวิตที่ดีอีกครั้ง” รศ.พญ. งามจิตต์ เกษตรสุวรรณ กล่าวปิดท้าย
งานลอยกระทงหมู่บ้านญี่ปุ่น 2565 จ.พระนครศรีอยุธยา
งานลอยกระทงหมู่บ้านญี่ปุ่น 2565 จ.พระนครศรีอยุธยา
Japanese Villages Ayuttaya
Loy Krathong Night 2022
วันเสาร์ที่ 12 พฤศจิกายน 2565
เวลา 16.00-20.00 น.
“เที่ยวงานลอยกระทงท่ามกลางบรรยากาศสวนญี่ปุ่น
ริมแม่น้ำเจ้าพระยาและพบกับกิจกรรมต่างๆที่น่าสนใจ”
ชิมอาหารไทยและญี่ปุ่น
สนุกไปกับการละเล่นงานวัด
ชมการแสดงวัฒนธรรมจาก ททท.
ลอยกระทงในแม่น้ำ
ฐานที่ 4 : แนะนำการออกกำลังกาย (Cardio, Strength Training & Stretching) เพื่อออกแบบโปรแกรมการออกกำลังกายสำหรับผู้สูงอายุ เพื่อสร้างเสริมความแข็งแรงของระบบหายใจและระบบไหลเวียนเลือด เพื่อสร้างเสริมความแข็งแรงและอดทนของกล้ามเนื้อ เพื่อสร้างเสริมความยืดหยุ่นตัวของกล้ามเนื้อ เครื่องมือ อุปกรณ์ออกกำลังกาย เช่น ยางยืด เสื่อโยคะ เก้าอี้
มูลนิธิโรงพยาบาลเลิดสิน
มูลนิธิโรงพยาบาลเลิดสิน ในพระอุปถัมภ์สมเด็จพระเจ้าพี่นางเธอ เจ้าฟ้ากัลยาณิวัฒนา
กรมหลวงนราธิวาสราชนครินทร์
เลขที่ 190 ถนนสีลม เขตบางรัก กรุงเทพฯ 10500
เขตคลองสามวา นัดทิ้ง นัดเก็บ เก็บขยะชิ้นใหญ่ LINK
เขตคลองสามวา รักษาฯ นัดทิ้ง นัดเก็บ #รักษาเดลิเวอรี่ เก็บขยะชิ้นใหญ่ รักษาฯ Delivery พร้อมบริการประชาชน ลงพื้นที่เก็บขยะชิ้นใหญ่ เฟอร์นิเจอร์ ขยะอันตรายอื่น ๆ ประจำเดือนพฤศจิกายน 2565 ติดต่อสอบถามเพิ่มเติม ฝ่ายรักษาความสะอาดและสวนสาธารณะ 0 2548 0337
18 พ.ย. 65 ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา ฉบับปรับปรุง
ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา ฉบับปรับปรุง
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ให้สัมภาษณ์ถึงกระแสวิพากษ์วิจารณ์ประกาศ สธ. เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ว่า การลงนามในประกาศของ สธ. เป็นการลงนามตามมติของคณะกรรมการส่งเสริมและควบคุมพืชสมุนไพรตาม พ.ร.บ. รมว.สธ.ต้องลงนามเมื่อคณะกรรมการมีความเห็นชอบ ตนทำตามหน้าที่ เป็นการสร้างความชัดเจนเรื่องการควบคุมการใช้กัญชา ลดความวิตกกังวลของสาธารณะ จากนั้นส่งมาที่สำนักเลขาธิการคณะรัฐมนตรี เพื่อลงประกาศในราชกิจจานุเบกษาเป็นไปตามขั้นตอนทางกฎหมาย ส่วนประเด็นที่ ครม. มีการสอบถามเรื่องความชัดเจน เป็นความเข้าใจผิดอะไรบางอย่าง เพราะการประกาศของกระทรวงต่าง ๆ เป็นอำนาจของรัฐมนตรีแต่ละกระทรวงที่เป็นผู้รักษาราชการตามกฎหมาย ไม่ต้องขอความเห็นชอบหรือมติใด ๆ จาก ครม. ดังนั้น ถ้า ครม. มีประเด็นสงสัยสามารถถามได้ ยินดีตอบ แต่ไม่จำเป็นต้องเข้าที่ประชุม ครม.ก่อนประกาศเป็นราชกิจจานุเบกษา
- ส่วนกรณีที่ว่าอาจจะต้องนำกัญชากลับไปเป็นยาเสพติด นายอนุทินกล่าวว่า ไม่ได้ เพราะกัญชาไม่ได้เป็นยาเสพติดแล้วคณะกรรมการ ป.ป.ส. เป็นผู้ที่มีมติให้กัญชาออกจากการเป็นยาเสพติดประเภทที่ 5 เมื่อประกาศแล้ว รมว.สธ. ต้องลงนามเป็นไปตาม พ.ร.บ. เช่นเดียวกับการประกาศ สธ. เรื่องควบคุมช่อดอกกัญชา ถ้าจะนำกัญชากลับมาเป็นยาเสพติด ต้องเริ่มกระบวนการใหม่ทั้งหมด ถ้าอยู่ในพรรคร่วมรัฐบาลด้วยความเข้าใจกัน กฎหมายน่าจะแล้วเสร็จและผ่านขั้นตอนไปสู่วุฒิสภา นึกไม่ถึงว่าพรรคร่วมรัฐบาลจะมาขวางกันเอง
- สภาองค์กรของผู้บริโภค เห็นว่าประกาศฉบับดังกล่าว มีข้อจำกัดไม่ครอบคลุม จึงส่งหนังสือถึง 3 กระทรวง ได้แก่ ก.สธ.ก.เกษตรและสหกรณ์ และก.ดิจิทัลเพื่อเศรษฐกิจและสังคม เสนอมาตรการการคุ้มครองผู้บริโภคในการนำพืชกัญชา กัญชง มาเป็นวัตถุดิบในอาหาร นอกจากนี้ เห็นว่าควรปรับคำแนะนำ โดยเฉพาะช่วงอายุในการบริโภคผลิตภัณฑ์กัญชาหรือกัญชง เช่น ต้องแสดงฉลากและคำเตือน ในทุกประกาศของ สธ. สำหรับบุคคลที่มีอายุต่ำกว่า 20 ปี ไม่ควรบริโภค ควรเพิ่มข้อความในประกาศสธ. เรื่องการจำหน่ายอาหารประเภทปรุงสำเร็จ ในสถานที่จำหน่ายอาหาร ต้องระบุว่า "ห้ามใช้ช่อดอกกัญชาหรือกัญชงเป็นส่วนประกอบในการปรุงอาหาร" เด็ดขาด และขอให้เพิ่มคําที่ไม่อนุญาตในการโฆษณาคุณภาพ คุณประโยชน์ หรือสรรพคุณของอาหารกัญชาหรือกัญชง เพื่อไม่ให้เกิดการโฆษณาเชิญชวน
ร่าง พ.ร.บ.กัญชา กัญชง
- นายสุทิน คลังแสง ส.ส. มหาสารคาม และรองหัวหน้าพรรคเพื่อไทย ให้สัมภาษณ์ถึงร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.. ที่จะเข้าสู่การพิจารณาของสภาผู้แทนราษฎร หลังการประชุมเอเปค ชัดเจนว่าเรื่องนี้มีความเห็นต่างในทุกระดับ เกิดความขัดแย้งระหว่างพรรคประชาธิปัตย์และพรรคภูมิใจไทย ส่วนท่าทีของพรรคเพื่อไทยและพรรคร่วมฝ่ายค้านยืนยันว่าสนับสนุนกัญชาทางการแพทย์แต่ถ้าเกิดนอกเหนือทางการแพทย์และออกไปในเชิงสันทนาการไม่เห็นด้วย ซึ่งวันนี้มองว่าควบคุมไม่ได้ จึงไม่เห็นด้วย
ใช้กัญชาอย่างเข้าใจ สร้างประโยชน์มากกว่าโทษ
- นพ.ธงชัย กีรติหัตถยากร อธิบดีกรมการแพทย์ กล่าวว่า การขับเคลื่อนนโยบายกัญชาเพื่อการแพทย์ จำเป็นต้องส่งเสริมวิชาการความรู้ เพื่อพร้อมเป็นผู้นำในด้านการรักษาพยาบาล รวมถึงดูแลมาตรฐานต่าง ๆ โดยสถาบันมะเร็ง สถาบันเด็ก สถาบันเกี่ยวกับประสาทวิทยา สถาบันเกี่ยวกับการรักษาผู้ติดยาเสพติด สถาบันผู้สูงอายุ รวมถึงการดูแลเรื่องเกี่ยวกับกายภาพบำบัดภายใต้ความรู้ความเชี่ยวชาญจาก รพ.ราชวิถี รพ.เลิดสิน ทั้งนี้ จากการประเมินติดตามหลังจากกัญชาถูกถอดออกจากยาเสพติดพบว่าช่วงแรกมีผู้เกิดอาการแพ้มารักษาตัวที่โรงพยาบาลหลายราย จนกระทั่งเวลาผ่านไป ประชาชนเริ่มทราบวิธีการใช้มากขึ้น ซึ่งในปัจจุบันจำนวนผู้เข้ารักษาอาการแพ้ในโรงพยาบาลลดลงเป็นปกตินอกจากนี้ ปัญหาหลักของการใช้กัญชาคือ ใช้โดยผิดเจตนาผิดวิธีการ และผิดปริมาณ สารสกัดจากกัญชา ทั้งสาร THC และ CBD ถูกสกัดออกมาเพื่อใช้รักษาโรค โดยส่วนมากผู้ที่มีผลกระทบจากการใช้กัญชาเกิดจากการใช้น้ำมันกัญชาชนิดหยอด เพื่อให้นอนหลับ โดยไม่เข้าใจว่าการหยอดต้องใช้เวลาประมาณ 30-60 นาทีกว่ายาจะออกฤทธิ์ คิดว่าหยอดไปแล้วทำไมยังไม่หลับจึงหยอดซ้ำจนมากเกินควร ทำให้มีสารสะสมในร่างกายมาก เมื่อถึงเวลาออกฤทธิ์พร้อมกันจึงเกิดผลกระทบในที่สุด
นอกจากนี้ภายในงานยังมีกิจกรรมแลกเปลี่ยนความเห็นเรื่องคุณภาพชีวิต พูดถึงโครงการอสังหาริมทรัพย์ หรือการพัฒนาพื้นที่ต่าง ๆ ที่น่าสนใจ และมีผลกับเมือง เพื่อให้ผู้เข้าชมงานได้สนุกสนาน หมุนเวียนไปตลอดการจัดงาน รับรองว่าทุกคนที่มาร่วมงานนี้จะได้เห็นภาพที่ชัดเจนขึ้นว่าเมืองที่น่าอยู่เป็นอย่างไร
เมื่อถามความรู้สึกถึงคำว่า “อัศจรรย์” ที่ทุกคนได้มารวมตัวกันในงานนี้ ซึ่งเป็นงานที่สร้างประสบการณ์เกี่ยวกับเมือง โดยเฉพาะมุมที่เชื่อมโยงกับวิถีความเป็นอยู่ เทศกาลนี้จึงพยายามสร้างมิติการมองเห็นเมืองในอนาคต เพื่อสร้างความฝันและความหวังให้คนมาร่วมงานมองเห็นภาพเมืองที่ดี เมืองที่น่าอยู่ การมีคุณภาพชีวิตที่ดี และแนวทางการพัฒนาร่วมกัน เพราะเรื่องเมืองคือเรื่องของทุกคน อาจเป็นเพียงจุดเริ่มต้นเล็กๆ ที่เปิดความคิดริเริ่มสร้างสรรรค์ “เมืองน่าอยู่ของเรา” เพื่อนำไปสู่การวางแผนพัฒนาเมืองที่ตอบโจทย์ความต้องการที่หลากหลายอย่างยั่งยืน
Pepsi presents Vana Nava Countdown 2023 สวนน้ำ VANA NAVA Water Jungle หัวหิน
สาวกฮิปฮอปเตรียมมาระเบิดความบันเทิงกันได้ที่งาน “Pepsi presents Vana Nava Countdown 2023” คอนเสิร์ตฮิปฮอปส่งท้ายปี เอาใจแฟน ๆ แบบจัดเต็มความสนุกแบบจุใจ เตรียมความพร้อมที่จะมาระเบิดความมันส์ กับศิลปินฮิปฮอปสุด HOT นำทัพโดย JOEYBOY • FIIXED x 1MILL• SPRITE x ICEACE x OG BOBBY x DON KIDS วันศุกร์ที่ 30 ธันวาคมนี้ ที่สวนน้ำ VANA NAVA Water Jungle หัวหิน
ซื้อบัตรล่วงหน้า 199 บาทเท่านั้น แถมฟรี เป๊ปซี่ 1 กระป๋อง
รศ.ดร.พญ.อติพร อิงค์สาธิต และ ศ.นพ.ปิยะมิตร ศรีธรา
ของขวัญปีใหม่จากธนาคารอาคารสงเคราะห์ 1 โครงการ
ธนาคารอาคารสงเคราะห์ (ธอส.) จำนวน 1 โครงการ
คือ
1. โครงการของขวัญปีใหม่ 2566 เพื่อส่งเสริมวินัยทางการเงินสำหรับลูกค้า ธอส. เพื่อส่งเสริมการมีวินัยทางการเงินในการผ่อนชำระเงินกู้เพื่อที่อยู่อาศัย เติมกำลังซื้อเพื่อให้เกิดการใช้จ่ายหมุนเวียนในระบบเศรษฐกิจภายในประเทศช่วงเทศกาลปีใหม่ และประชาสัมพันธ์ให้ลูกค้าดาวน์โหลดและใช้งาน Application “GHB ALL” หรือ “GHB ALL GEN” สำหรับการจ่ายชำระหนี้เงินกู้ โดยได้รับเงินรายละ 1,000 บาท ตั้งแต่เดือนธันวาคม 2565 ถึงเดือนกุมภาพันธ์ 2566
ศูนย์บริการสาธารณสุขที่ 8 บางเขน
- ที่อยู่ หมู่ 7 ตำบลบางเขน อำเภอเมืองนนทบุรี จังหวัดนนทบุรี 11000
- โทร 02-5264758
- แผนที่
- Facebook
บริการ
- รักษาพยาบาลทั่วไปโดยแพทย์ วันจันทร์-ศุกร์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30 - 16.00 น.และ วันอังคาร 13.00 - 16.30 น.
- คลินิกตรวจรักษาโรคทั่วไป วันจันทร์-อาทิตย์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30-16.30 น.และ วันอังคาร 13.00 - 16.30 น.วันจันทร์-ศุกร์ (นอกเวลาราชการ) เวลา 16.30-18.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-อาทิตย์และวันหยุดนักขัตฤกษ์ เวลา 08.30-16.30 น. วันจันทร์-ศุกร์ (นอกเวลาราชการ) เวลา 16.30-18.30 น.
- คลินิกทันตกรรม วันจันทร์ พุธ และศุกร์ เวลา 08.30-12.00 น.
- ออกเยี่ยมบ้าน วันจันทร์-ศุกร์ เวลา 13.00-16.30 น.
- งานส่งเสริมสุขภาพช่องปากโรงเรียนและชุมชน วันอังคาร เวลา 13.00-16.30 น. วันพฤหัสบดี เวลา 08.30-16.30 น.
- คลินิกวางแผนครอบครัว วันพฤหัสบดี เวลา 13.00-16.30 น.
- คลินิกตรวจรักษาโรคมะเร็งปากมดลูก วันศุกร์ เวลา 08.30-16.30 น. ทำแผล วันเสาร์-อาทิตย์และวันหยุดนักขัตฤกษ์ เวลา 08.30-16.30 น.
*หมายเหตุ ให้บริการวัคซีนเด็กทุกวันที่ 10 ของเดือน (หากตรงกับวันหยุดนักขัตฤกษ์จะเลื่อนไปวันทำการ)
คลินิกแพทย์แผนไทย "ทุกวันไม่เว้นวันหยุดนักขัตฤกษ์"
คลินิกทันตกรรม วันจันทร์ พุธ และวันศุกร์ (08.30 น. -12.00 น.)
กรณีใช้บริการคลินิกแพทย์แผนไทยและคลินิกทันตกรรม
กรุณาติดต่อนัดล่วงหน้ากับเจ้าหน้าที่ก่อนเข้ารับบริการทุกครั้ง โทร 0 2526 4758
คลินิกผู้สูงอายุ
คลินิกผู้สูงอายุ
ตรวจรักษาและให้คำปรึกษาโดยแพทย์เวชศาสตร์ครอบครัวเฉพาะทาง ฉีดวัคซีน ฟื้นฟูโรคในกลุ่มผู้สูงอายุ
เปิดบริการเฉพาะวันอาทิตย์ เวลา 08.00-12.00 น.
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
สุดท้าย ผอ.นำพล ได้ ทิ้งท้ายไว้ เป็นคติดีๆ
"ยังมีอีกๆ แต่สิ่งที่น่าภูมิใจที่สุดอันนึงก็คือ การพยายามสร้างทัศนคติที่ดีต่อการให้บริการ เชื่อว่าพวกเราให้บริการได้ดีขึ้น ตั้งใจ ตรงเวลามากขึ้น มากขึ้นแค่ไหนก็ไม่รู้
แต่ว่า แค่จุดตะเกียงก็ดีกว่าสาปแช่งความมืดแล้วครับ
ขอบพระคุณ ท่านอดีตปลัดฯนพ.เจษฎา โชคดำรงสุข
นพ.สุขุม กาญจนาพิมาย และนพ.เกียรติภูมิ วงศ์รจิต ที่สนับสนุนโรงพยาบาลมาโดยตลอดครับ
ไม่ได้เขียนมาหลายปี เลยยาวมากเลย ครับ
โรงพยาบาลสมุทรปราการ "
NUI SASAMON X HUMANS OF FLOWER MARKET BY ARCH SU Street Photo Exhibition: Human Craft Market LINK
Street Photo Exhibition: Human Craft Market -
นุ้ย ศศมน รัตนาลังการ
นิทรรศการภาพถ่ายที่บอกเล่าเรื่องราวของปากคลองตลาดที่เต็มไปด้วยเรื่องราวและทักษะของผู้คน โดยช่างภาพ นุ้ย-ศศมน รัตนาลังการ หนึ่งในผู้ก่อตั้ง Facebook Page: Humans of Flower Market หรือ มนุษย์ปากคลอง ซึ่งสนับสนุนโดยคณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศิลปากร เพจมนุษย์ปากคลองนี้ ก่อตั้งในปี 2559 จากคลาสเรียนในหลักสูตรระดับ ปริญญาโท-เอก สาขาสถาปัตยกรรมพื้นถิ่น ซึ่งเป็นปีที่ทางกรุงเทพมหานครมีการจัดระเบียบทางเท้าในย่านปากคลองตลาด
4 - 12 ก.พ.11:00 - 20:00
ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย The Royal Thai College of Obstetricians and Gynaecologists
ราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย
The Royal Thai College of Obstetricians and Gynaecologists
สำนักงานเลขาธิการราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย
ชั้น 8 อาคารเฉลิมพระบารมี ๕๐ ปี เลขที่ 2 ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
เบอร์โทรศัพท์ : 0-2716-5721-22, 0-2716-5724
เบอร์โทรสาร : 0-2716-5720
E-mail address : pr_rtcog@rtcog.or.th and sc_rtcog@rtcog.or.th
www.rtcog.or.th/8. สิทธิการรับเงินช่วยเหลือเบื้องต้น กรณีได้รับความเสียหายจาก การรักษาพยาบาล
3. ความเป็นเลิศด้านคุณภาพและความปลอดภัย (Quality and Safety Excellence)
คุณภาพและความปลอดภัย คือ หัวใจสำคัญอีกประการของบำรุงราษฎร์ ซึ่งเห็นได้อย่างชัดเจนในช่วงที่เกิดการระบาดของโรค บำรุงราษฎร์แสดงให้เห็นถึงศักยภาพในการบริหารจัดการการแพร่ระบาดของโรคได้เป็นอย่างดี นอกจากนี้ยังมีการให้องค์กรอิสระภายนอกเข้ามาตรวจสอบคุณภาพมาตรฐานและความปลอดภัยอย่างต่อเนื่อง อาทิ มาตรฐานคุณภาพโรงพยาบาลระดับสากล (JCI), มาตรฐานคุณภาพโรงพยาบาลและบริการสุขภาพ ‘ขั้นก้าวหน้า’ (A-HA), การรับรองจาก Global Healthcare Accreditation (GHA) ในระดับความเป็นเลิศมาตรฐานสากลในการดูแลกลุ่มผู้ป่วยชาวต่างชาติที่เดินทางเพื่อเข้ารับการรักษาพยาบาลในประเทศไทย, ความเป็นเลิศในมาตรฐานด้านการปฏิบัติงานด้านพยาธิวิทยาและเวชศาสตร์ชันสูตรของห้องปฏิบัติการทางการแพทย์จากวิทยาลัยพยาธิแพทย์อเมริกัน (CAP) ซึ่งคุณภาพและความปลอดภัย นับเป็นตัวชี้วัดที่สำคัญของคุณภาพของสถานพยาบาล
เขตลาดพร้าว ห้องสมุดเพื่อการเรียนรู้วัดลาดปลาเค้า
ห้องสมุดเพื่อการเรียนรู้วัดลาดปลาเค้า (Lat Pla Khao Public Learning Library) ตั้งอยู่ในบริเวณวัดลาดปลาเค้า แต่เดิมเป็นพื้นที่ของวัดลาดปลาเค้า ในปี พ.ศ.2531 เจ้าอาวาดวัดลาดปลาเค้า(พระครูประจักษ์กิจจาทร) และรองเจ้าอาวาส(พระครูวิมลวิหารกิจ) พิจารณาเห็นถึงความสำคัญของห้องสมุดเป็นประโยชน์แก่ประชาชนผู้อยู่อาศัยบริเวณใกล้เคียงวัดรวมทั้งนักเรียน โรงเรียนในชุมชน ได้แก่โรงเรียนวัดลาดปลาเค้าและโรงเรียนลาดปลาเค้าพิทยาคม จึงได้มีหนังสือถึงผู้ว่าราชการกรุงเทพมหานครของให้จัดสร้างห้องสมุดประชาชนในที่ดินของวัด เนื้อที่ประมาณ 130 ตารางวา ในปี 2533 ได้ดำเนินการจัดสร้างห้องสมุดด้วยงบประมาณของกรุงเทพมหานคร รุปแบบอาคาร ค.ส.ล 3 ชั้น มีเนื้อที่ใช้งานภายในอาคาร 504 ตารางเมตร โดยเริ่มดำเนินการก่อสร้างในวันที่ 28 สิงหาคม 2533 แล้วเสร้จในวันที่ 2 เมษายน 2534 และเริ่มเปิดให้บริการในวันที่ 28 กันยายน 2534
ในปี 2555-2557 ห้องสมุดเพื่อการเรียนรู้วัดลาดปลาเค้าได้ดำเนินการปรับปรุงให้เป็นห้องสมุดมิติใหม่ มีรูปแบบทันสมัยและสวยงาม สะดวกต่อการค้นคว้าข้อมูลด้วยเทคโนโลยีสารสนเทศ และเริ่มเปิดให้บริการในวันที่ 20 พฤษภาคม 2557 ทั้งนี้ห้องสมุดเพื่อการเรียนรู้ได้รับการแต่งให้เกิดภาพลักษณ์ ที่ดี มีการนำเอาเทคโนโลยีที่ทันสมัยมาใช้งาน ให้ครบวงจรเพื่อตอบสนองต่อการให้บริการแก่ประชาชนได้อย่างรวดเร็ว เป็นการให้บริการแบบ One-Stop Service สร้างแรงจูงใจให้เกิดการรักการอ่านมากยิ่งขึ้น ปัจจุบันการยืมทรัพยากรสารสนเทศจะต้องสมัครสมาชิก มีค่าสมัครสมาชิกดังนี้
ปัจจุบันอยู่ภายใต้การดูแลของ กลุ่มงานห้องสมุดและการเรียนรู้ 1 ส่วนห้องสมุดและการเรียนรู้ สำนักงานนันทนาการและส่งเสริมการเรียนรู้ สำนักวัฒนธรรม กีฬา และการท่องเที่ยว ศาลาว่าการกรุงเทพมหานคร 2 ถนนมิตรไมตรีเขตดินแดง 10400
การยืม-คืนหนังสือ
สิทธิพิเศษของผู้เป็นสมาชิก [
เงื่อนไข/ประเภทสมาชิก] คือการได้ยืมหนังสือครั้งละ 2 เล่ม ภายในระยะเวลา 7 วัน หากส่งเคืนหนังสือเกินเวลาที่กำหนดไว้จะต้องชำระค่าปรับวันละ 2 บาทต่อเล่ม กรณีส่งช้าเกินกว่า 30 วัน จุะเพิ่มค่าปรับ 50 บาท/ครั้ง หนังสือชำรุดปรับตามราคาท้องตลาดหรือให้ซื่อมาทดแทน
4 ซอย ลาดปลาเค้า 69 แขวงจรเข้บัว เขตลาดพร้าว กรุงเทพมหานคร 10230
โทร. 025705792
วัดเมตตาธรรมโพธิญาณ - วิหารพระโพธิสัตว์กวนอิมพันกรองค์ใหญ่แกะสลักจากไม้ LINK
วัดเมตตาธรรมโพธิญาณ ตั้งอยู่ที่ ต.หนองหญ้า อ.เมืองกาญจนบุรี เป็นวัดมหายานจีนนิกาย อยู่ท่ามกลางหุบเขาบรรยากาศร่มรื่น เป็นวัดที่เหมาะกับการท่องเที่ยวและทำบุญ
ตัววัดสร้างจากไม้ทั้งหลังแกะสลักลงสีแบบสถาปัตยกรรมจีนสวยงาม มีพระโพธิสัตว์กวนอิมพันกรองค์ใหญ่แกะสลักจากไม้ สูง 12 เมตร สวยงามน่าทึ่งเป็นอย่างยิ่ง และมีเจ้าแม่กวนอิมที่แกะสลักจากไม้หอมปางต่างๆ อีกกว่า 100 ปาง เสาไม้ขนาดใหญ่สลักลวดลายมังกรพันรอบเสาสวยงาม และมีงานไม้แกะสลักอีกมากมายให้ได้ชม
วัดเมตตาธรรมโพธิญาณ มีชื่อเรียกในภาษาจีนว่า "慈悲山菩提禪寺 ฉื่อปุยซัวผู่ทีเซียมยี่" การสร้างวัดเริ่มจากเมื่อ ปี พ.ศ. 2537 พระอาจารย์ เย็นหมง จากวัดโพธิ์เย็น อำเภอท่ามะกา จังหวัดกาญจนบุรีได้เดินทางธุดงค์มาถึงบริเวณนี้ และได้ขึ้นไปปฏิบัติธรรมในถ้ำบนภูเขาทางเข้าด้านเหนือ ภายในถ้ำมีอัฐิและสิ่งของต่างๆหลายอย่าง ท่านได้พักปฏิบัติธรรมอยู่นานประมาณ 5 เดือน ท่านได้เกิดนิมิตมงคลว่าดินแดนแห่งนี้เหมาะแก่การสร้างวัด และเผยแผ่พระพุทธศาสนามหายานจีนนิกาย ท่านจึงได้ตั้งจิตอฐิฐานและปวารนาตัว ที่จะสร้างวัดนิกายจีนมหายานขึ้นมาในบริเวณนี้ ท่านจึงได้หารือกับญาติโยมหลายฝ่าย ซึ่งต่างก็ให้การสนับสนุนอย่างเต็มที่เพื่อให้เป็นสถานที่กราบไหว้พระ-ปฏิบัติธรรม ของพุทธศาสนิกชนโดยทั่วไป เป็นสถานที่เผยแผ่ ศึกษา ค้นคว้าพระพุทธศาสนานิกายจีนในประเทศไทย เป็นสถานที่ท่องเที่ยวเชิงธรรมะของชาวไทย และชาวต่างประเทศ เป็นศาสนสถานของแผ่นดินและเป็นสมบัติของชาติ ของลูกหลานคนไทยตลอดไปตราบกาลนาน
โดยการสร้างวัดเริ่มจากสร้างศาลาหลังแรกสำเร็จเมื่อปี พ.ศ 2542 และได้รับการประทานชื่อศาลา จาก สมเด็จพระสังฆราชญาณสังวร สกลมหาสังฆปรินายก ว่า "ศาลาโพธิญาณเฉลิมพระเกียรติ" นับเป็นศิริมงคลต่อวัดเมตตาธรรมโพธิญาณ เป็นอย่างยิ่ง
ลูกปลาน้อย #JFF2023
ลูกปลาน้อย #JFF2023
2 ชั่วโมง 19 นาที R:ท
©2022 “The Fish Tale” Film Partners ‘ความรักที่มีต่อปลา’ ที่ลึกล้ำยิ่งกว่ามหาสมุทร ภาพยนตร์ที่ถูกสร้างจากอัตชีวประวัติที่เขียนโดย ‘ลูกปลาน้อย’ หรือ ‘ซาคานะคุง’ นักชีววิทยาทางทะเลชื่อดังที่รู้จักกันในนามสุดยอดผู้ช่ำชองเรื่องปลาจากรายการทีวีแชมเปี้ยน หนุ่มใจดีท่าทางตลก ผู้มีความรู้เกี่ยวกับปลาอย่างที่ไม่มีใครเทียบเทียม ทุกคนในญี่ปุ่นไม่ว่าจะเด็กหรือผู้ใหญ่ต่างรู้จัก ภาพยนตร์เล่าเรื่องของ มี่โบ ตัวตนสมมติของลูกปลาน้อยที่ทั้งชีวิตมีแต่ปลาล้วน ๆ มี่โบกับชีวิตที่แหวกว่ายไปข้างหน้าด้วยใจที่มุ่งมั่น โดยไม่สนใจว่าจะมีระลอกคลื่นหรืออะไรมายั้งเธอ!
อันดับ 8. อุทยานแห่งชาติภูชี้ฟ้า จ.เชียงราย
ทุกปี ภูชี้ฟ้า ในอุทยานแห่งชาติภูชี้ฟ้า จ.เชียงราย จะต้อนรับนักท่องเที่ยวนับพันจากทุกสารทิศ ที่เดินทางขึ้นภูมาเพื่อชมทิวทัศน์ทะเลหมอกพรมแดนไทยลาว ณ ความสูง 1,628 เมตร นอกจากนั้นยังมีเส้นทางเดินชมธรรมชาติบนยอดผา มีจุดตั้งแคมป์และเกสต์เฮาส์
- 43/1 หมู่ที่ 24 ตำบลตับเต่า อำเภอเทิง เชียงราย 57310
- โทร. 084-8079848
- Phuchifa2020@gmail.com
- fb/profile
- แผนที่
การตรวจยีนมีความสำคัญ
ทำไมถึงควรตรวจยีนก่อนการตั้งครรภ์
ผศ. นพ. พลกฤต ทีฆคีรีกุล แพทย์ผู้ชำนาญการด้านเวชพันธุศาสตร์ กล่าวถึงความสำคัญของการตรวจยีนก่อนการตั้งครรภ์ เพื่อป้องกันโรคร้ายบางชนิดที่อาจถ่ายทอดทางพันธุกรรมไปสู่ลูกได้ โดยแพทย์ผู้ชำนาญด้านเวชศาสตร์พันธุศาสตร์จะทำการตรวจคัดกรองและวินิจฉัยโรคทางพันธุกรรมที่อาจทำให้เด็กมีความผิดปกติ โดยสามารถตรวจได้มากกว่า 600 ยีนหรือประมาณ 300 กว่าโรค รวมถึงโรคที่พบได้บ่อยได้คนไทย เช่น โรคธาลัสซีเมีย รวมไปถึงโรคร้ายแรงอื่นๆ เช่น โรคมะเร็งและโรคหัวใจ เป็นต้น ซึ่งจะแตกต่างจากการตรวจที่นิยมเลือกตรวจเฉพาะเป็นโรคๆ
ด้วยเทคโนโลยีที่ทันสมัย บำรุงราษฎร์จึงได้พิจารณาชุดตรวจยีนจากอัตราการเกิดโรคทางพันธุกรรมในเด็กที่ค่อนข้างสูง เช่น โรคจากยีนด้อยโครโมโซมเอกซ์ ดาวน์ซินโดรม หูหนวก โรคเลือด อาทิ โรคธาลัสซีเมีย โรคกล้ามเนื้ออ่อนแรง หรือโรคและภาวะทางพันธุกรรมอื่นๆ โดยเลือกใช้เทคโนโลยีอย่างเหมาะสมที่สุด เช่น การตรวจ Cell-Free DNA ของทารกที่ลอยอยู่ในกระแสเลือดแม่ เพื่อดูความผิดปกติของทารกในครรภ์ ซึ่งจะใช้เทคโนโลยี Non-Invasive Prenatal Testing (NIPT) โดยใช้วิธีเจาะเลือดแม่ในระหว่างตั้งครรภ์ เพื่อตรวจดูความผิดปกติทางพันธุกรรมของทารก แทนการเจาะน้ำคร่ำ ซึ่งมีความเสี่ยงต่อการแท้ง เป็นต้น
9. ลดคาร์บอนในวงการเฮลท์แคร์ให้สอดคล้องกับการตั้งเป้าตามหลัก science-based
ผู้บริหารในวงการเฮลท์แคร์ตระหนักถึงผลกระทบต่อสิ่งแวดล้อมของการปล่อยก๊าซคาร์บอน โดยเฉพาะการเปลี่ยนแปลงของอุณหภูมิโลก และพยายามลงมือทำบางอย่างเพื่อรับผิดชอบต่อปัญหาดังกล่าว โดยบริษัทเครื่องมือแพทย์และบริษัทเทคโนโลยีด้านเฮลท์แคร์มีการตั้งเป้ากำหนดการลดปริมาณการปล่อยก๊าซคาร์บอนตามหลัก science-based
ตัวอย่างเช่น รัฐแคลิฟอร์เนียได้ประกาศให้บริษัทที่มีมูลค่ามากกว่า 1 พันล้านเหรียญสหรัฐขึ้นไปต้องกำหนดเป้าหมายการลดก๊าซคาร์บอนภายในปีค.ศ. 2025 โดยมี Science Based Targets initiative (SBTi)เป็นองค์กรหลักในการขับเคลื่อนให้องค์กรต่างๆ กำหนดเป้าหมายการปล่อยก๊าซอย่างชัดเจนว่าจะสามารถลดผลกระทบได้มากและเร็วเท่าใดเพื่อลดผลกระทบต่อการเปลี่ยนแปลงสภาพภูมิอากาศของโลก ในปีค.ศ. 2022 องค์กรมากกว่า 2,200 แห่ง ซึ่งมีมูลค่ารวมกันมากกว่า 1 ใน 3 ของมูลค่าเศรษฐกิจโลกได้ทำงานร่วมกับองค์กร SBTi
สำหรับองค์กรด้านเฮลท์แคร์ได้มีการดำเนินการเพื่อให้บรรลุเป้าหมาย ด้วยการลดการใช้พลังงานทางตรงผ่านการนำเสนอเทคโนโลยีด้านด้านเฮลท์แคร์ที่ประหยัดพลังงานมากขึ้น และทางอ้อม ด้วยการลดการปล่อยมลพิษผ่านการใช้ทรัพยากรอย่างยั่งยืนและระบบเศรษฐกิจหมุนเวียน
เขตคลองสาน
สำนักงานเขตคลองสานร่วมกับศูนย์บริการสาธารณสุข 28 กรุงธนบุรี ขอเชิญชวนประชาชนนำสัตว์เลี้ยงของท่าน (สุนัข หรือแมว) มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 13-24 มีนาคม 2566 เวลา 10.00 -12.00 น. หมายเหตุ: ไม่มีค่าใช้จ่ายใดๆทั้งสิ้น
อ่าน ความทรงจำ 25 ปีเรื่อง แดนเนรมิต ของสุภาพสตรีผู้บุกเบิกสวนสนุกกลางแจ้งแห่งแรกของไทย
สนุกสุดแสน เที่ยวแดนเนรมิต แดนเนรมิต สวนสนุกในตำนานของไทย ดินแดนแห่งความฝันที่เด็กๆ อยากมาสัมผัสความสนุกสักครั้งในชีวิต ... อ่านได้จาก
Read The Cloudลูกมีปัญหาความรัก เช่น แฟนหึงหวง แฟนมีกิ๊ก อกหัก
ควรทำ
ยอมรับว่า วัยรุ่นเป็นวัยที่ขาดประสบการณ์ เป็นวัยที่ต้องลองผิดลองถูก และการผิดหวัง การล้มเหลวในเรื่องความรักเป็นสิ่งที่กระทบความรู้สึกของพวกเขา
ทำตัวเป็นที่ปรึกษาที่ดี เป็นเพื่อนคู่คิด คู่ฟัง และคอยให้กำลังใจลูก
เมื่อลูกจิตใจดีขึ้นแล้ว บอกลูกว่าอย่าทุ่มเทกับสิ่งใดสิ่งหนึ่งจนต้องเป็นทุกข์ เพราะในยังมีอีกหลายสิ่งที่ลูกต้องทำ และยังมีโอกาสเจอคนที่ดีอีกในอนาคต
อย่าทำ
มองเป็นเรื่องไร้สาระ และคิดว่ายังลูกยังเป็นเด็ก ไม่ควรจะมาให้ความสำคัญหรือทุ่มเทกับเรื่องแบบนี้ ลูกจะตีตัวออกห่าง เพราะคิดว่าพ่อแม่ ไม่เข้าใจ ไม่ใส่ใจความทุกข์ร้อนของเขา
ให้คำแนะนำในเชิงสั่งสอน หรือชี้นำ โดยถือคติว่าพ่อแม่มีประสบการณ์มาก่อน จะทำให้ลูกไม่สนใจ และตีตัวออกห่าง เพราะคิดว่าประสบการณ์ของพ่อแม่ใช้ไม่ได้กับวัยรุ่นปัจจุบัน
รายการอ้างอิง
- World Health Organisation. 9 out of 10 people worldwide breathe polluted air, but more countries are taking action [Internet]. 2018 May 2 [cited 2023 Feb 7]. Available from: https://www.who.int/news/item/02-05-2018-9-out-of-10-people-worldwide-breathe-polluted-air-but-more-countries-are-taking-action
- The California Air Resources Board. Inhalable Particulate Matter and Health (PM2.5 and PM10) [Internet]. 2017 Aug 6 [cited 2023 Feb 7]. Available from: https://ww2.arb.ca.gov/resources/inhalable-particulate-matter-and-health
- The New York State Department of Health. Fine Particles (PM 2.5) Questions and Answers [Internet]. 2018 [cited 2023 Feb 7]. Available from: https://www.health.ny.gov/environmental/indoors/air/pmq_a.htm
- กระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อม. ประกาศคณะกรรมการสิ่งแวดล้อมแห่งชาติ ฉบับที่ 36 (พ.ศ.2553) เรื่อง กำหนดมาตรฐานฝุ่นละอองขนาดไม่เกิน 2.5 ไมครอน ในบรรยากาศโดยทั่วไป.ราชกิจจานุเบกษา เล่มที่ 127, ตอนพิเศษ 37 ง (ลงวันที่ 24 มีนาคม 2553).
- กลุ่มเฝ้าระวังฝุ่น จุฬาลงกรณ์มหาวิทยาลัย. เรียนรู้ อยู่กับฝุ่น PM2.5 [อินเทอร์เน็ต]. กรุงเทพฯ: จุฬาลงกรณ์มหาวิทยาลัย; 2562 [เข้าถึงเมื่อ 7 กุมภาพันธ์ 2566]. เข้าถึงได้จาก https://www.chula.ac.th/wp-content/uploads/2019/10/Chula-PM25.pdf
- กองจัดการคุณภาพอากาศและเสียง กรมควบคุมมลพิษ. ข้อมูลดัชนีคุณภาพอากาศ [อินเทอร์เน็ต]. [เข้าถึงเมื่อ 7 กุมภาพันธ์ 2566]. เข้าถึงได้จาก http://air4thai.pcd.go.th/webV2/aqi_info.php
- Xing YF, Xu YH, Shi MH, Lian YX. The impact of PM2.5 on the human respiratory system. J Thorac Dis. 2016;8(1):E69-74.
- Spring News. ช็อก! สถิติปี2565 คนกรุงสูดฝุ่น PM2.5 เทียบเท่าการสูบบุหรี่ถึง 1,224 มวน [อินเทอร์เน็ต]. 27 มกราคม 2566 [เข้าถึงเมื่อ 8 กุมภาพันธ์ 2566]. เข้าถึงได้จาก https://www.springnews.co.th/keep-the-world/climate-change/834787
- สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.). ฝุ่น PM2.5 เป็นสารก่อมะเร็ง เสี่ยงเสียชีวิตสูง ตายปีละ 7 หมื่นคน [อินเทอร์เน็ต]. 2565 [เข้าถึงเมื่อ 8 กุมภาพันธ์ 2566]. เข้าถึงได้จาก https://resourcecenter.thaihealth.or.th/article/ฝุ่น-PM2-5-เป็นสารก่อมะเร็ง-เสี่ยงเสียชีวิตสูง-ตายปีละ-7-หมื่นคน
- Zhao B, Vo HQ, Johnston FH, Negishi K. Air pollution and telomere length: a systematic review of 12,058 subjects. Cardiovasc Diagn Ther. 2018;8(4):480-92.
- World Health Organisation. WHO global air quality guidelines: particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide [Internet]. 2021 Sep 22 [cited 2023 Feb 8]. Available from: https://www.who.int/publications/i/item/9789240034228
สถานีชาร์จ EleX ใน ภาคอีสาน
นครราชสีมา
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าลำตะคอง
ที่อยู่: 399 หมู่ 12 ถ.ภาพ ต.หนองสาหร่าย อ.ปากช่อง จ.นครราชสีมา 30130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Midwinter เขาใหญ่
ที่อยู่: 88/88 หมู่ 10 ต.หนองน้ำแดง อ.ปากช่อง จ.นครราชสีมา 30130
เวลาทำการ : ทุกวัน 07.00-23.00 น.
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ปากช่อง 3
ที่อยู่: 172 หนองน้ำแดง อำเภอปากช่อง นครราชสีมา 30130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ร้าน Sol at Khaoyai
ที่อยู่: 98 หมู่ 11 บ้านซับสำราญ ต.วังกะทะ อ.ปากช่อง จ.นครราชสีมา 30130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
Superfast by PPWE อ.โนนสูง
ที่อยู่: ต.บิง อ.โนนสูง จ.นครราชสีมา
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT นครราชสีมา 11
ที่อยู่: 221 หมู่ที่2 ต.หนองจะบก อ.เมือง จ.นครราชสีมา 30000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ขอนแก่น
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าน้ำพอง
ที่อยู่: 262 หมู่ 1 ถ.น้ำพอง ต.กุดน้ำใส อ.น้ำพอง จ.ขอนแก่น 40310
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT บ้านไผ่ 4
ที่อยู่: 196 หมู่ 1ต.บ้านไผ่ อ.บ้านไผ่ จ.ขอนแก่น 40110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
อุบลราชธานี
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT วารินชำราบ 6
ที่อยู่: 229 หมุ่ที่9 ต.หนองกินเพล อ.วารินชำราบ จ.อุบลราชธานี 34190
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เขื่อนสิรินธร
ที่อยู่: 30 หมู่ 11 ต.นิคมลำโดมน้อย อ.สิรินธร จ.อุบลราชธานี 34350
เวลาทำการ : ทุกวัน 08.00 – 17.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT อุดร-นาดี
ที่อยู่: 63/21 หมู่ 4 ซอยบ้านโพนบก ต.หมากแข้ง อ.เมืองอุดรธานี จ.อุดรธานี 41000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT นางรอง
ที่อยู่: 244/2 ถนนโชคชัย-เดชอุดม ต.นางรอง อ.นางรอง จ.บุรีรัมย์ 31110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
เพชรบูรณ์
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT วิเชียรบุรี 2
ที่อยู่: 163 หมู่ที่7 ต.สระประดู่ อ.วิเชียรบุรี จ.เพชรบูรณ์ 67130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT หล่มสัก 4
ที่อยู่: 40 หมู่ที่10 ต.หนองไขว่ อ.หล่มสัก จ.เพชรบูรณ์ 67110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ EV Station PluZ ภาคตะวันออก
สถานีบริการ แอลพีจี บจก.ชยาภิวัฒน์
42 หมู่ที่ 8 ชลบุรี-บ้านบึง หนองรี เมือง จังหวัดชลบุรี 20000
สถานีบริการ บจ.จันทร์เพ็ญแหลมฉบัง
144/11-13 หมู่ 4 ต.หนองขาม อ.ศรีราชา ชลบุรี 20230
แกรนด์ เซนเตอร์ พอยต์ สเปซ พัทยา
888 เมืองพัทยา อำเภอบางละมุง ชลบุรี 20150
สถานีบริการ หจก.ดีใจบริการ
47/57 หมู่ 6 ต.บางพระ อ.ศรีราชา ชลบุรี 20110
อมาริ พัทยา
240 ถนนเลียบชายหาด เมืองพัทยา อำเภอบางละมุง ชลบุรี 20150
เทอร์มินอล 21 พัทยา (อาคารจอดชั้น 4บี)
456, 777, 777/1 หมู่ที่ 6 ถนน พัทยาสายสอง เมืองพัทยา อำเภอบางละมุง ชลบุรี 20150
สถานีบริการ สาขาแยกหาดจอมเทียน
93/16 ม.12 ต.หนองปรือ อ.บางละมุง ชลบุรี 20150
สถานีบริการ บจ.จันทร์เพ็ญ ปตท. ศรีราชา
114/5 หมู่ 4 ถ.ทางหลวงหมายเลข 331 ตอนเนินผาสุก ต.หนองขาม อ.ศรีราชา ชลบุรี 20110
สถานีบริการ บจ.บุญชัยปิโตรเลียม
34/1 ม.6 สุขุมวิท บ้านฉาง บ้านฉาง ระยอง 21130
สถานีบริการ สาขาตำบลมาบข่า
100/92 ถ.ทางหลวงระยองสาย-3191 ต.มาบข่า อ.นิคมพัฒนา จ.ระยอง 21180
สถานีบริการ สาขาระยอง-บ้านฉาง กม.192 (ขาเข้า)
76/119 หมู่ 3 ต.พลา อ.บ้านฉาง จ.ระยอง 21130
สถานี บจ.สงวนสิน เอ็นเนอร์ยี่
61/11 ม.9 ต.เขาวัว อ.ท่าใหม่ จันทบุรี 22120
(อยู่ระหว่างการซ่อมบำรุง) สถานีบริการ หจก.ก.เกษมแก๊ส 3
15 หมู่ 12 ถนนสุขุมวิท ตำบลพลิ้ว อำเภอแหลมสิงห์ จันทบุรี 22190
สถานีบริการ หจก.เกษมจันทบุรี แอล พี จี
90/200 หมู่ 1 ถนนสุขุมวิท ตำบลท่าช้าง อำเภอเมืองจันทบุรี จันทบุรี 22000
สถานี บจ.เติมเต็มปิโตรเลีย
174 ม.2 ต.วังกระแจะ อ.เมืองตราด ตราด 23000
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ม้วน บำรุงศิลป์) LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร (ม้วน บำรุงศิลป์) เลขที่ 87 ซอยนาคนิวาส43 ถนนลาดพร้าว71 แขวง/เขต ลาดพร้าว กรุงเทพมหานคร 10320
หลักสูตรต่างๆ
- หลักสูตรช่างซ่อม - ซ่อมรถจักรยานยนต์ เครื่องทำความเย็นและปรับอากาศ เดินสายไฟและติดตั้งอุปกรณ์ไฟฟ้า ช่างซ่อมคอมพิวเตอร์
- หลักสูตรคอมพิวเตอร์ - อินเตอร์เน็ตอีคอมเมิร์ช คอมพิวเตอร์กราฟฟิก อินเตอร์เน็ตและการสร้างเว็บไซต์ ผลิตสื่อภาพยนต์ระบบดิจิทัล
- หลักสูตรทำอาหารและขนม - อาหารไทย ขนมไทย คุกกี้และเค้ก ขนมปังและพาย
- หลักสูตรทำผม - ตัดผม ชอยผม แต่งผม ตัดผม ชอยผม บุรุษ หลักสูตรม้วนผม หลักสูตรแต่งหน้า
- หลักสูตรภาษา - ภาษาอังกฤษ ภาษาจีน
- หลักสูตรตัดเย็บเสื้อผ้า - ตัดเย็บเสื้อผ้าสตรี ตัดเย็บเสื้อผ้าบุรุษ ออกแบบแฟชั่น ผลิตภัณฑ์งานผ้า ผ้าบาติก
โรงพยาบาลพระรามเก้า บริการฉีดวัคซีนก่อนสัมผัสโรค
สำหรับผู้ที่สนใจใช้บริการ ศูนย์วัคซีนและเวชศาสตร์การเดินทาง สามารถติดต่อสอบถามเพิ่มเติมได้ที่ โรงพยาบาลพระรามเก้า โทร.1270
ห้องทำแผล ฉีดยา
ห้องทำแผล ฉีดยา อาคารเฉลิมพระเกียรติในโอกาสฉลองพระชนมายุ 5 รอบ 2 เมษายน 2558 ชั้นที่ 1 เบอร์โทรศัพท์ 044-615002 ต่อ 4102-4103 (ไม่คิดค่าบริการ SMC)
คลินิกเยาวชน ปรึกษาได้ ไม่ต้องรายงานผู้ปกครอง-โรงเรียน
ปัญหา
จำนวนผู้ป่วยซึมเศร้าในประเทศไทยอาจสูงถึง 1.5 ล้านคน หรือเฉลี่ยคนไทย 40 คน จะพบผู้ป่วยซึมเศร้า 1 คน โดยสาเหตุมาจากทั้งปัจจัยเฉพาะกิจอย่างโควิด-19 ที่เพิ่มความเครียดให้กับผู้คน (เช่น นักเรียนจากการเรียนออนไลน์ คนวัยทำงานจากสภาพเศรษฐกิจ) และปัจจัยถาวรต่างๆที่งานวิจัยระบุว่าทำให้คนรุ่นใหม่ มีแนวโน้มจะประสบปัญหาโรคซึมเศร้ามากกว่ารุ่นก่อนๆ (เช่น การใช้โซเชียลมีเดีย ที่เสี่ยงทำให้คนรู้สึกผิดหวังในตัวเองง่ายขึ้น จากการเปรียบเทียบชีวิตตัวเองกับชีวิตของคนอื่น) และพบว่าคนไทยมีอัตราการฆ่าตัวตายสูงเป็นอันดับ 1 อาเซียน จากปัญหาด้านสุขภาพจิต
ข้อเสนอ
จัดตั้งคลินิกเยาวชน เพื่อเป็นพื้นที่ปลอดภัยในการดูแลปัญหาด้านสุขภาพจิตให้เยาวชนโดยไม่จำเป็นต้องรายงานกับผู้ปกครองหรือโรงเรียน (ที่บางครั้งเป็นสาเหตุของปัญหา) และทำหน้าที่คัดกรองเบื้องต้นก่อนส่งต่อ
8.พฤติกรรมแสวงอำนาจ Power-Seeking Behavior
บริษัทและรัฐบาลมีแรงจูงใจทางเศรษฐกิจที่แข็งแกร่งในการสร้างตัวแทนที่สามารถบรรลุเป้าหมายที่ตั้งไว้อย่างกว้างๆ ตัวแทนดังกล่าวมีแรงจูงใจที่เป็นประโยชน์ในการได้รับอำนาจ ซึ่งอาจทำให้พวกเขาควบคุมได้ยากขึ้น (Turner et al., 2021, Carlsmith 2021)
AI ที่มีอำนาจเด็ดขาดอาจกลายเป็นอันตรายอย่างยิ่งหากไม่สอดคล้องกับคุณค่าของมนุษย์ พฤติกรรมแสวงหาอำนาจยังสามารถสร้างแรงจูงใจให้ระบบแสร้งทำเป็นว่าสอดคล้องกัน สมรู้ร่วมคิดกับ AI อื่น ๆ มีอำนาจเหนือผู้ตรวจสอบ และอื่น ๆ ในมุมมองนี้ การประดิษฐ์เครื่องจักรที่มีพลังมากกว่าเรากำลังเล่นกับไฟ การสร้าง AI ที่แสวงหาอำนาจนั้นได้รับแรงจูงใจเช่นกัน เนื่องจากผู้นำทางการเมืองมองเห็นความได้เปรียบเชิงกลยุทธ์ในการมีระบบ AI ที่ชาญฉลาดและทรงพลังที่สุด ตัวอย่างเช่น Vladimir Putin กล่าวว่า "ใครก็ตามที่เป็นผู้นำใน [AI] จะกลายเป็นผู้ปกครองโลก"
Saku สุราชุมชนจากเขาใหญ่ LINK
สุราชุมชนจากเขาใหญ่ Saku ทดลองทำมาแล้ว 3 ปี ชื่อแบรนด์คือชื่อยายทวด เพราะเหล้าตัวนี้เป็นสูตรของยายที่เคยทำสมัยสาวๆ ยายเล่าให้ฟังว่าทำประมาณไหน แล้วก็เอามาผสมกับความรู้ในอินเตอร์เน็ตร่วมด้วย ทดลองทำดื่มเองมา 3 ปีแล้วปรับปรุงมาเรื่อยๆ ทำดื่มเองก่อน มีลองเอาไปดองกับบ๊วยบ้าง จุดเริ่มต้นมาจากการมองหาวิธีแปรรูปวัตถุดิบที่มีเยอะตามท้องถิ่น เมื่อก่อนเคยเลี้ยงวัวนม เลยเอานมวัวมาหมักเหล้าแล้วกลั่น เพียงแต่ว่ามันออกมาไม่ดี เลยคิดถึงข้าวโพด ก็เลยลองพัฒนาวิธีการผลิตเรื่อยๆ จนได้ใช้เครื่องกลั่นทองแดงนี่แหละเลยทำให้ดีขึ้น ประกอบที่เราชอบดื่ม จนเมียบ่น เลยเอามาทำเป็นอาชีพ เป็นข้ออ้างจะได้ชิมเหล้าได้ด้วย
ข้อมูลและภาพจากประชาชนเบียร์
เส้นทางที่ 8 ชวนช้อปของกิน ของฝากจากชุมชน
เส้นทางที่ 8 สำหรับสายช็อป คนชอบสินค้าธรรมชาติมีคุณภาพ ต้องมีความสุขอย่างที่สุด กับสินค้าจากวิสาหกิจชุมชมหลายแห่ง อาทิ วิสาหกิจชุมชนบ้านสบายใจ กับผลิตภัณฑ์จากกล้วย ที่่ผ่านการการันตีด้วย รางวัล อย.ควอลิตี้อวอร์ด ปี 2565 วิสาหกิจชุมชน เกษตรสวนนอก กับผลิตภัณฑ์จากน้ำมันมะพร้าว วิสาหกิจชุมชนบ้านริมคลองโฮมสเตย์ กับผลิตภํณฑ์น้ำหวานดอกมะพร้าว วิสาหกิจชุมชนเรือนไม้หอม กับผลิตภัณฑ์บำรุงผิวต่างๆ อัมพวาชัยพัฒนานุรักษ์ กับสินค้าหลากหลาย ใครเลือกเส้นทางนี้ละก็ เตรียมถุงผ้าหรือกระเป๋าไปขนของกลับด้วยล่ะ
เรียนดี
ไฮไลท์สำหรับบูธนี้ จะมีการเปิดพื้นที่ให้ประชาชนได้เข้ามาสัมผัสห้องเรียนดิจิทัลจำลอง พร้อมแนวทางการ Transform หลักสูตรการศึกษาให้รับกับยุคสมัย
ด้วย กทม. มีแนวทางที่จะ Transform หลักสูตร จึงมีแนวคิดปรับเปลี่ยนห้องเรียน เป็นห้องเรียนดิจิทัลให้รับการเปลี่ยนแปลงและความก้าวหน้าในโลกยุคปัจจุบัน ตลอดจนมีแนวทางในการยกระดับห้องแล็บคอมพิวเตอร์ทุกโรงเรียนให้ทันสมัยและเพียงพอ จึงได้จัดจำลองห้องเรียนดิจิทัลเพื่อให้ประชาชนได้มาทดลองใช้งาน
นอกจากนี้ ภายในบูธยังมีการนำเสนอเนื้อหาด้านการศึกษา และงานของสำนักพัฒนาสังคมเกี่ยวกับศูนย์ดูแลเด็กก่อนวัยเรียน ซึ่งะมีภาคีเครือข่ายภาคเอกชนมาร่วมด้วย อีกทั้งยังมีการจัดแสดงหุ่นยนต์จากโรงเรียนสังกัด กทม. มีกิจกรรมจากศูนย์ข่าวนักเรียน ในโรงเรียนสังกัด กทม. พร้อมด้วยโครงการ BMA School Expo “ZERO WAST” ตลอดจนสาธิตแปลงเพาะปลูกการเกษตร การแสดงความสามารถทางดนตรี การขายสินค้าผลงานของนักเรียน การแจกผ้าอนามัยฟรี ฯลฯ
เปิดชื่อผู้เสียชีวิต 2 ราย สะพานถล่ม เป็นวิศวกรกับคนงานโครงการ
11 ก.ค. 66 ล่าสุดรายงาน ผู้เสียชีวิต 2 ราย สะพานถล่ม เป็นวิศวกรกับคนงานโครงการ
นายฉัตรชัย ประเสริฐ วิศวกรโครงการ เสียชีวิตในที่เกิดเหตุ
และนายอรัญ สังขรักษ์ อายุ 24 ปี คนงานของโครงการ เสียชีวิตที่ รพ.จุฬารัตน์ 9 [
ข่าวสด]
10. ไข่เต้น
แนวคิด :ปิดท้ายด้วยความสนุกของเหล่าไข่ออนเซ็น ประทับใจกับแสงไฟและเสียงดนตรี เทคนิค :สร้างความตื่นตาตื่นใจให้กับทุกคนด้วยไฟเคลื่อนไหวหลากสีสัน
สีสันหัวลำโพง งาน Unfolding Bangkok
สำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน) หรือ CEA จึงได้ร่วมกับ Lighting Designers Thailand ที่มาร่วมออกแบบแสงไฟ (Lighting Installation) เพื่อช่วยสร้างเรื่องราวและขับเน้นความงดงามของสถาปัตยกรรม พร้อมกับจัดการแสดงดนตรีที่ได้รับการคัดสรรมาให้สอดคล้องกับการที่สถานีรถไฟหัวลำโพงเป็นชุมทางของคนเดินทาง
โดยมี 3 กิจกรรมหลัก “Living Old Building” สถานีรถไฟหัวลำโพง
1. THE WALL 2023 โดย Lighting Designers Thailand และ DecideKit การจัดแสดงไฟ (Lighting Installation) แบ่งออกเป็น 3 พื้นที่ โดยมีช่วงเวลาการจัดแสดงตั้งแต่ 19.00 - 22.00 น. ดังนี้
1st Scene: The Door
กระจกทรงโค้ง ณ บริเวณประตูทางเข้าสถานีรถไฟที่เป็นแลนด์มาร์กของสถานีเมื่อถูกมองจากด้านนอก ถูกนำมาใช้เป็นฉากเริ่มต้นในการเดินทางเพื่อเข้าสู่พื้นที่ภายใน ภายใต้ธีม The Door อันสะท้อนจินตนาการของผู้คนสู่ก้าวย่างใหม่ของการเดินทางที่กำลังจะเกิดขึ้น
2nd Scene: The People
ภายในโถงอาคารของสถานีรถไฟในส่วนที่พักคอยของผู้โดยสารที่เรียบง่าย ได้รับการออกแบบแสงให้เป็นพื้นที่สำคัญ ให้ “ผู้คน” ที่มานั่งเล่นได้เห็นเสน่ห์ของสถานีรถไฟหัวลำโพงในมุมมองใหม่ พร้อม ๆ กับรับชมการแสดงดนตรี และชื่นชมความงามของอาคารประวัติศาสตร์แห่งนี้
3rd Scene: The Emotion
บริเวณชานชาลา พื้นที่แห่งการพบปะและจากลา เป็นอีกหนึ่งพื้นที่ที่แสงไฟจะช่วยสร้างอารมณ์ร่วมในการพบและจากลาของผู้คนในอดีต ที่เคยโดยสารรถไฟหัวรถจักรไอน้ำที่ผ่านกาลเวลามาตั้งแต่สมัยสงครามโลกครั้งที่ 2
2. ดนตรี ความบันเทิงของคนเดินทาง เพลงลูกทุ่ง ลูกกรุง หมอลำ ร็อก ฮิปฮอป และแจ๊ส ล้วนเป็นเพื่อนเดินทางของผู้คน รายชื่อของวงดนตรีที่มาจัดแสดงจึงอยู่บนแนวคิดของความหลากหลาย สอดคล้องกับความเป็นสถานีหัวลำโพง โดยจะจัดแสดงระหว่างวันที่ 18 - 19 มีนาคม และ 24 - 26 มีนาคม เวลา 16.00 - 22.00 น.
3.กิจกรรมพิเศษอื่น ๆ มากมายให้คุณได้สัมผัส ไม่ว่าจะเป็นการจัดแสดงขบวนรถไฟพิเศษ การจัดแสดงโมเดลรถไฟจำลอง ทัวร์เพื่อทำความรู้จักหัวลำโพงมุมใหม่ ไปจนถึงลิ้มชิมรสเมนูอาหารสุดพิเศษจากชุมทางต่าง ๆ และป๊อปอัปคาเฟ่
2016
- โรงพยาบาลกรุงเทพคริสเตียนเล็งเห็นความสำคัญด้านการพัฒนาคุณภาพมาอย่างต่อเนื่อง โดยได้รับการต่ออายุการรับรอง กระบวนการคุณภาพตามมาตรฐานสถานพยาบาล Hospital Re-Accreditation (HA) จากสถาบันรับรองคุณภาพสถานพยาบาล เมื่อวันที่ 9 มีนาคม ค.ศ.2016
- ได้รับโล่เกียรติคุณโครงการรณรงค์การให้บริการสร้างเสริมภูมิคุ้มกันโรคที่ป้องกันได้ด้วยวัคน คอตีบ บาททะยัก และ ได้รับเกียรติบัตรประกาศเกียรติคุณสถานพยาบาลดีเด่น ด้านการรายงานเฝ้าระวังโรคและสนับสนุนการสอบสวนควบคุม โรคติดต่อๆ จากกรมควบคุมโรค กระทรวงสาธารณสุข เมื่อวันที่ 2 กันยายน 2016
- ได้รับโล่เกียรติคุณโครงการรณรงค์การให้บริการสร้างเสริมภูมิคุ้มกันโรคที่ป้องกันได้ด้วยวัคน คอตีบ บาททะยัก และ ได้รับเกียรติบัตรประกาศเกียรติคุณสถานพยาบาลดีเด่น ด้านการรายงานเฝ้าระวังโรคและสนับสนุนการสอบสวนควบคุม โรคติดต่อๆ จากกรมควบคุมโรค กระทรวงสาธารณสุข เมื่อวันที่ 2 กันยายน 2016
- ได้รับรางวัล The People”s Choice Awards Thailand Voted by Chinese Tourists, จากการท่องเที่ยวแห่งประเทศไทย (ททท.)
Basic Barista Course @Oriental Coffee LINK
Basic Barista Course @Oriental Coffee คอร์สเรียนชงกาแฟสำหรับมือใหม่ สอนทุกสูตรเมนูพื้นฐานของร้านกาแฟ เนื้อหาในการสอน
☕️ ความรู้เบื้องต้นเกี่ยวกับสายพันธุ์กาแฟ
☕️ กระบวนการการแปรรูปกาแฟ
☕️ ชนิดและระดับการคั่วกาแฟ
☕️ รสชาติ กลิ่น สี ของกาแฟในระดับการคั่วต่างๆ
☕️ สอนการทำ Espresso Perfect Shot
☕️ สอนการสตรีมนม การทำฟองนม
☕️ สอนชงสูตรกาแฟ ชา โกโก้ (ร้อน/เย็น/ปั่น)
☕️ และเมนูสมูตตี้ อิตาเลี่ยนโซดา รวม 30 เมนู
สถานที่ : Oriental Coffe 216/4 โครงการ City Link พระราม 9-ศรีนครินทร์ ถนนกาญจนาภิเษก แขวงสะพานสูง เขตสะพานสูง กรุงเทพฯ 10240
สอบถามรายละเอียด โทร.093-5569962 โทร.064-3626549
เรียนทำขนมเบเกอรี่ 357 °F Baking Studio LINK
357 °F Baking Studio โรงเรียนสอนทำขนมสไตล์ใหม่ By ครูเซฟ จัดคอร์สเรียนทำขนมเบเกอรี่ระยะสั้น 3 หมวดหลัก คือ 1) CAKE & SWEETS 2) CROISSANT & BREAD 3) BAKERY SCIENCE สอบถามโทร: 095-119-1695 สถานที่เรียน Samyan Business Town (ตรงข้าม Samyan Mitrtown MRT สามย่านทางออก 1)
งานประเพณีออกพรรษาที่เชียงคาน ประจำปี 22 - 30 ตุลาคม 2566
งานออกพรรษา เชียงคาน 2566 มีกิจกรรมต่างๆ ดังนี้
ในระหว่างวันที่ 22 - 30 ตุลาคม 2566
วันที่ 22 - 30 ตุลาคม 2566 (ตรงกับวันขึ้น 8 - 15 ค่ำ เดือน 11, วันแรม 1 ค่ำ เดือน 11)
ชมการแสดงมหรสพ และจำหน่ายสินค้าต่าง ๆ
วัคซีนป้องกันโรคไข้เลือดออก รพ.นครธน
โรคไข้เลือดออกสามารถติดได้ทุกเพศ ทุกวัย ทุกอายุ ไม่ว่าเด็ก หรือผู้ใหญ่ก็มีความเสี่ยงในการเป็นโรคไข้เลือดออกรุนแรงได้ ‼ ปกป้องคนที่คุณรัก ด้วยการฉีดวัคซีนป้องกันไข้เลือดออก Qdenga Vaccine สามารถฉีดได้ทั้งในคนที่เคย และไม่เคยเป็นโรคไข้เลือดออกมาก่อน เพื่อเพิ่มภูมิคุ้มกัน และลดความเสี่ยงอาการป่วยรุนแรง ฉีดเพียงแค่ 2 เข็ม ในราคาพิเศษ 4,900 บาท (ปกติ 5,400 บาท) วันนี้ – 31 ธ.ค. 66
???? ราคาดังกล่าวไม่รวมค่าแพทย์ และค่าบริการโรงพยาบาล
???? ควรได้รับการฉีด 2 เข็ม โดยเว้นระยะห่างจากเข็มแรก 3 เดือน
???? สำหรับผู้ที่เคยเป็นโรคไข้เลือดออก สามารถฉีดได้ โดยเว้นระยะห่าง 6 เดือน หลังหายจากโรค
สอบถามข้อมูลเพิ่มเติม ศูนย์สุขภาพเด็ก, ศูนย์อายุรกรรม, ศูนย์สุขภาพนครธน
Tel : 02 450 9999 ต่อ 1132, 1133 / 1088-1089 / 1000-1002
Pet Funeral Thailand รับจัดงานศพสัตว์เลี้ยง 24 ชม. 098-449-3992 | 086-575-5739
Pet Funeral Thailand บริการของเรารับเผาสุนัข และสัตว์เลี้ยง จัดงานศพสัตว์เลี้ยง 24 ชม. ตั้งแต่เริ่มรับฝากศพสัตว์เลี้ยงในโลงเย็น, บริการเคลื่อนย้ายศพสัตว์เลี้ยง, ปรึกษาด้านพิธีกรรม, การทำความสะอาดศพสัตว์เลี้ยง, การบรรจุศพสัตว์เลี้ยงในถุงปลอดเชื้อ การฌาปนกิจศพ (การเผา) สัตว์เลี้ยงตามพิธีกรรมทางศาสนา โดยการนิมนต์พระสวดศพสัตว์เลี้ยง และการชักผ้าบังสุกุล ถวายสังฆทาน (เตาเผาศพสัตว์เลี้ยงเป็นเตาปลอดมลพิษ) เมื่อเสร็จพิธีกรรมด้านการฌาปนกิจสัตว์เลี้ยงแล้ว เรายังมีบริการจัดเก็บกระดูกในโถมุข หรือจัดเก็บในกระถางต้นไม้และปลูกต้นไม้ให้ท่านอีกด้วย กระดูกอีกส่วนหนึ่งจะนำไปลอยอังคารต่อไป สอบถามโทร. 098-449-3992 | 086-575-5739
โรงพยาบาลบางโพ บริการวัคซีนป้องกันโรคมือ เท้า ปาก จากเชื้อ ENTEROVIRUS 71
โรงพยาบาลบางโพ บริการวัคซีนป้องกันโรคมือ เท้า ปาก จากเชื้อ ENTEROVIRUS 71 ฉีด 2 เข็ม 5,990 บาท วัคซีนป้องกันโรคมือเท้าปาก จากไวรัส EV71 ซึ่งไวรัสชนิดนี้ทำให้เกินโรคมือเท้าปากรุนแรง ทำให้เกิดสมองอักเสบ เยื่อหุ้มสมองอักเสบ หรือกล้ามเนื้อหัวใจอักเสบ วัคซีนกันเฉพาะโรคมือเท้าปากชนิดรุนแรง แต่ไม่ได้ป้องกันโรคมือเท้าปากตามฤดูกาล
เงื่อนไขการใช้บริการ
ราคาดังกล่าวรวมค่าแพทย์และค่าบริการโรงพยาบาลแล้ว
สำหรับเด็กอายุ 6 เดือน - 5 ปี 11 เดือน
ควรได้รับการฉีด 2 เข็ม ห่างจากเข็มแรก 1 เดือน
เด็กที่เคยเป็นโรคมือ เท้า ปาก สามารถฉีดได้ โดยเว้นระยะห่าง 1 เดือนหลังหายจากโรค
เด็กที่ได้รับวัคซีนอื่นๆ ต้องเว้นระยะห่าง 2 สัปดาห์ ก่อนเริ่มวัคซีนชนิดใหม่
สงวนสิทธิ์ในการเปลี่ยนแปลง โดยไม่ต้องแจ้งให้ทราบล่วงหน้า
วันนี้ - 30 กันยายน 2566 สอบถามข้อมูลเพิ่มเติม คลินิกกุมารเวช อาคารศูนย์การแพทย์ ชั้น 4 โทร. 02-587-0144 ต่อ 2401
วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ผู้ประกันตน รพ.วิภาราม
ผู้ประกันตนของวิภาราม อายุ15-49 ปี สามารถรับบริการฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ในราคา450บาท (ตั้งแต่ 1 พ.ค. ถึง 31 ธ.ค. 2566 มีจำนวนจำกัด)
สำนักงานป้องกันควบคุมโรคที่ 8 จังหวัดอุดรธานี
591 หมู่ที่ 12 ตำบลสามพร้าว อำเภอเมืองอุดรธานี จังหวัดอุดรธานี
โทร. 042-219168
วิทยาลัยทันตแพทยศาสตร์นานาชาติ ม.วลัยลักษณ์ ทำฟันฟรี 12 ตุลาคม 2566
ศูนย์สุขภาพช่องปากขั้นสูง วิทยาลัยทันตแพทยศาสตร์นานาชาติ มหาวิทยาลัยวลัยลักษณ์ เปิดให้บริการทางทันตกรรมฟรีแก่ผู้ที่สนใจ ในวันพฤหัสบดีที่ 12 ตุลาคม 2566 เพื่อน้อมรำลึกถึง พระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร โดยงานหัตถการที่เราเปิดให้บริการได้แก่ ????ตรวจสุขภาพช่องปาก ????ขูดหินน้ำลาย ????อุดฟัน ????ถอนฟัน ผู้ที่สนใจติดต่อมาเพื่อนัดคิวล่วงหน้าก่อนค่ะ หากคิวการรักษาเต็มแล้ว ผู้สนใจสามารถ เข้ามาลงทะเบียนเป็นคิวwalk-in ได้ (รับ walk-in ไม่เกิน 20คน) สอบถามโทร 092-4971416
คลินิคความดันโลหิตสูง
คลินิคความดันโลหิตสูง เวลาไห้บริการของ ศบส. 39 เปิดให้บริการวันจันทร์และวันพุธ เวลา 08.00 น – 12.00 น.
โรคความดันโลหิตสูงคือ ภาวะที่แรงดันในหลอดเลือดแดงมีค่าสูงเกินปกติ 140/90 มิลลิเมตรปรอท มีคนจำนวนมากอยู่กับโรคความดันโลหิตสูงโดยที่ไม่ทราบว่าตนเองมีภาวะนี้ เนื่องจากเป็นโรคที่ไม่ค่อยปรากฏอาการที่ชัดเจน แต่เมื่อปล่อยนานไปแรงดันเลือดจะไปทำลายผนังหลอดเลือดและอวัยวะที่สำคัญทั่วร่างกาย โรคความดันโลหิตสูงเป็นปัจจัยเสี่ยงทำให้เกิดโรคหัวใจ โรคไต โรคหลอดเลือดหัวใจตีบ โรคอัมพาต
สาเหตุ ของการเกิดโรคความดันโลหิตสูง
การรับประทานอาหารที่ไม่ได้สัดส่วน หวาน มัน โดยเฉพาะอาหารที่มีเกลือ (โซเดียม) สูง กินผัก และผลไม้ (รสหวานน้อย) ไม่เพียงพอ มีส่วนที่ทำให้เกิดโรคความดันโลหิตสูงได้ถึงร้อยละ 50 การขาดการออกกำลังกาย จะเกิดโรคความดันโลหิตสูงร้อยละ 20 ขณะที่ภาวะอ้วนสัมพันธ์กับการเกิดโรคความดันโลหิตสูง ร้อยละ 30 ยังมีรายงานว่าการดื่มแอลกอฮอล์เกิน การสูบบุหรี่ และการบริโภคไขมันก็มีส่วนเป็นเหตุให้เกิดโรคความดันโลหิตสูง โดยเฉพาะผู้ป่วยโรคความดันโลหิตสูง ควรงดบุหรี่
ภาวะแทรกซ้อนโรคความดันโลหิตสูง
ความดันโลหิตสูง ส่งผลให้หัวใจทำงานหนักขึ้น ทำให้ผนังหัวใจหนาตัวและถ้าไม่ได้รับการรักษาอย่างถูกต้อง ผนังหัวใจจะยืดออกและเสียหน้าที่ ทำให้เกิดหัวใจโต และหัวใจวายได้ในที่สุด อาจเกิดภาวะหลอดเลือดในสมองตีบตัน หรือแตก ทำให้เป็นอัมพาต หรือเสียชีวิตได้ ถ้าเป็นเรื้อรังอาจกลายเป็นโรคความจำเสื่อม สมาธิลดลง เลือดอาจไปเลี้ยงไตไม่พอ เนื่องจากหลอดเลือดเสื่อม ทำให้ไตวายเรื้อรัง และภาวะไตวายจะยิ่งทำให้ความดันโลหิตสูงขึ้นอีก หลอดเลือดแดงในตาจะเสื่อมลงอย่างช้าๆ อาจมีเลือดที่จอตา ทำให้ประสาทตาเสื่อม ตามัวลงเรื่อยๆ จนตาบอดได้
การปฏิบัติตน เพื่อหลีกเลี่ยงโรคความดันโลหิตสูง
เป็นที่แน่ชัดว่าการกินอาหารที่มีเกลือ (โซเดียม) สูง เป็นปัจจัยเสี่ยงที่สำคัญที่สุดของการเกิดโรคความดันโลหิตสูง จึงควรลดการกินเกลือ (โซเดียม) ลงเพิ่มการรับประทานผัก และผลไม้ (รสหวานน้อย)
มีกิจกรรมทางกายอย่างสม่ำเสมอ กระฉับกระเฉง เริ่มต้นได้ตั้งแต่กิจกรรมเบาๆ ไปจนถึงกิจกรรมปานกลาง เช่น การทำสวน การเดิน และทำงานบ้านจำกัดการบริโภคสุรา หรือเครื่องดื่มที่มีแอลกอฮอล์ลงให้อยู่ในปริมาณที่เหมาะสม หรือไม่ดื่ม งดสูบบุหรี่ รวมถึงหลีกเลี่ยงการสูดดมควันบุหรี่
สำหรับผู้ป่วยที่อยู่ในภาวะโรคความดันโลหิตสูง สิ่งที่ควรปฎิบัติ คือ ต้องรับประทานยาสม่ำเสมอ โดยอยู่ภายใต้คำแนะนำของแพทย์ ซึ่งยาโรคความดันโลหิตสูงที่ส่งผลการรักษาโดยการลดความดันโลหิต มีผลป้องกันโรคแทรกซ้อนจากโรคความดันโลหิตสูง เช่น โรคไตวายเรื้อรัง โรคหัวใจ และโรคอัมพฤกษ์ อัมพาต
คลินิกจักษุ
คลินิกจักษุ ในเวลาราชการ 08.00 น. - 16.00 น. นอกเวลาราชการ 16.00 - 20.00 น. (บ่าย)
ภายในสวนบริเวณกำแพงฝายน้ำ ปัจจุบันทำเสร็จเรียบร้อยสวยงาม หญ้าเขียวขจี ฉากหลังเป็นตึกสูงสวยงามบนถนนอโศกรัชดา ภาพความสวยงามของย่านธุรกิจของกรุงเทพมหานคร
เสริมทัพความฟินกับร้านดังจากประเทศญี่ปุ่น และ CHAYA คาเฟ่ ที่นำสินค้าสุดพิเศษขนมหวานแบบดั้งเดิมมาร่วมออกบูธภายในงาน อาทิ Eitaro ลูกอมขึ้นชื่อดั้งเดิมตั้งแต่สมัยเอโด จากโตเกียว, CHAYA x CHACHA KOBO การผสมผสานของมัจฉะชั้นเลิศออกมาเป็นไอศกรีมมองบลังค์แบบที่ญี่ปุ่นสุดเข้มข้น จากโตเกียว และพบกับการออกบูธร้านค้างานคราฟต์สุดประณีต อาทิ แบรนด์นำเข้าจากญี่ปุ่น ผลงานของของ Kyoko Abe (เคียวโกะ อาเบะ) ศิลปินชื่อดังชาวญี่ปุ่น, ผลิตภัณฑ์จาก “CHILDREN’S HOME Ban Rom Sai” ก่อตั้งโดย “มิวา นาโตริ” จากจังหวัดเชียงใหม่ เป็นต้น
โปรแกรมตรวจสุขภาพสำหรับผู้ทำงานสัมผัสอาหาร
โปรแกรมตรวจสุขภาพสำหรับผู้ทำงานสัมผัสอาหาร สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000 ต่อ 10362
29 พ.ย. 66 คนไทยชุดที่ 4 จำนวน 2 คน ได้รับการปล่อยตัว
29 พฤศจิกายน 2566 รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ ได้มารอต้อนรับคนไทยชุดที่ 4 จำนวน 2 คนที่เพิ่งได้รับการปล่อยตัวในคืนนี้ และเพิ่งเดินทางถึงที่ Shamir Medical Center ได้แก่ 1.นายพัฒนายุทธ ตอนโสกรี 2.นายโอวาส สุริยะศรี โดยรองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ ได้กล่าวแสดงความยินดีที่ได้รับอิสรภาพอย่างปลอดภัย และหวังว่าจะได้เดินทางกลับประเทศไทยโดยเร็ว จากนั้น กลุ่มคนไทยทั้ง 17 คน ที่ได้รับการปล่อยตัวก่อนหน้านี้ก็ได้มารอต้อนรับอย่างอบอุ่น ก่อนคนไทยทั้งสอง จะเข้าสู่กระบวนการตรวจสุขภาพต่อไป
หลักสูตร การโฆษณาและประชาสัมพันธ์เพื่อการท่องเที่ยวในยุคดิจิทัล (Advertising and Public Relations for Tourism in the Digital Era)
การโฆษณาและประชาสัมพันธ์บนช่องทางออนไลน์มีความสำคัญเป็นอย่างมาก โดยเฉพาะในยุคปัจจุบันที่นักท่องเที่ยวมีการเปลี่ยนแปลงในด้านของโครงสร้างกลุ่มนักท่องเที่ยว ตลอดจนมีการเปลี่ยนแปลงของพฤติกรรมและความต้องการของนักท่องเที่ยวอย่างรวดเร็วและหลากหลาย ซึ่งการพัฒนาทักษะด้านการใช้นวัตกรรมและเทคโนโลยีในการโฆษณาและประชาสัมพันธ์เพื่อการท่องเที่ยวในรูปแบบใหม่ ๆ รวมถึงการวิเคราะห์ความต้องการเชิงลึกของกลุ่มเป้าหมาย จะช่วยเพิ่มประสิทธิภาพให้การประชาสัมพันธ์และสื่อสารการตลาดเข้าถึงกลุ่มเป้าหมายมากยิ่งขึ้น
ในหลักสูตรนี้ผู้เรียนจะได้เรียนรู้ตั้งแต่การสร้าง “Brand” ที่จะสามารถบอกเล่าตัวตนได้อย่างมีเอกลักษณ์ สามารถค้นหาวิธีการนำเสนอสื่อประชาสัมพันธ์ในแพลตฟอร์มออนไลน์ที่แตกต่างกันได้อย่างเหมาะสม ทั้งกับสินค้าหรือบริการของตนเอง และเหมาะสมกับกลุ่มลูกค้า ซึ่งในกระบวนการทั้งหมดจะทำให้ผู้เรียนได้พิจารณาไตร่ตรองหาจุดแข็ง จุดอ่อน มองเห็นจุดที่ขาด และจุดที่โดดเด่น เพื่อให้มองเห็นแนวทางในการพัฒนาการสื่อสารที่จะนำไปสู่การสร้าง Content Marketing ด้านการท่องเที่ยวที่ได้รับความสนใจจากลูกค้าผ่านการเรียนรู้เทคนิคต่าง ๆ เช่น เทคนิคการสร้างเรื่องเล่าเพื่อเพิ่มมูลค่าให้การท่องเที่ยว ในการกระตุ้นให้เกิดกระแสการส่งต่อเรื่องราว เทคนิคการใช้ภาษาและการใช้คำบรรยายประกอบการเล่าเรื่องบนช่องทางออนไลน์ เทคนิคการถ่ายภาพ การถ่ายวิดีโอ และการตัดต่อวิดีโอเบื้องต้น เทคนิคการเลือกใช้ภาพและองค์ประกอบต่าง ๆ ในการเล่าเรื่องและประชาสัมพันธ์ให้น่าสนใจ เทคนิคการเผยแพร่โฆษณาหรือสื่อประชาสัมพันธ์ ด้วยการซื้อโฆษณาออนไลน์ให้ตรงกับกลุ่มลูกค้าเป้าหมาย (Advertising) และการใช้ Influencer Marketing รวมถึงเทคนิคอื่น ๆ อีกมากมาย ที่จะเป็นประโยชน์ต่อการโฆษณาและประชาสัมพันธ์เพื่อการท่องเที่ยวในยุคดิจิทัล
8. ส่งเสริมการมีบุตร โดยบรรจุเป็นวาระแห่งชาติ บูรณาการร่วมกับภาคส่วนที่เกี่ยวข้อง
เร่งรัดการเพิ่มประสิทธิภาพคลินิกส่งเสริมการมีบุตรคุณภาพ ทั้งภาครัฐและภาคเอกชน รวมกว่า 200 แห่ง ทั่วประเทศ พร้อมให้คำปรึกษา ตรวจรักษา ป้องกันปัญหาโครงสร้างประชากรวัยแรงงานลดต่ำ และเตรียมเปิดตัว แคมเปญ "Give Birth Great World" การเกิดคือการให้ที่ยิ่งใหญ่ เป็นโครงการระดับประเทศ ด้วยการเปลี่ยน ทัศนคดิของการเกิดเป็นการให้ที่ยิ่งใหญ่ของโลก
การเดินทางด้วยระบบขนส่งสาธารณะ ระหว่างจังหวัด ทางอากาศ แยกรายภาค ขาเข้า และขาออก
ประเทศมอลต้า
Malta
1.Barts and the London School of Medicine and Dentistry, Queen Mary University of London, Malta Campus, Malta
หลักสูตร 5 ปี ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศมอลต้า และ รับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ใน ประเทศมอลต้า ดังนี้
1. Mater Dei Hospital
2. Gozo General Hospital
3. Karen Grech Hospital
4. St Vincent de Paul Long Term Care Facility
ว/ด/ป ที่ รับรอง 14 ธ.ค. 66
ว/ด/ป ครบอายุ การรับรอง 13 ธ.ค. 71หมวด 4 หน้าที่ของผู้รับอนุญาต / หมวด 5 การพักใช้ใบอนุญาต การเพิกถอนใบอนุญาต และการเลิกกิจการ
คลินิกมลพิษทางอากาศ โรงพยาบาลลาดกระบังกรุงเทพมหานคร
คลินิกมลพิษทางอากาศ โรงพยาบาลลาดกระบังกรุงเทพมหานคร สำนักการแพทย์ เปิดบริการทุกวันจันทร์-ศุกร์ 8.00-16.00 น. สอบถามโทร. 02-3269995


การต่อสู้กับโรคมะเร็งเป็นสิ่งที่ทุกคนต้องร่วมมือทั้งหน่วยงานภาครัฐ ภาคเอกชน และประชาชนทุกคนที่มีส่วนสำคัญในการขับเคลื่อนเพื่อลดวิกฤต ปิดช่องว่าง และพร้อมลุกขึ้นสู้มะเร็งไปด้วยกัน สำหรับผู้ป่วยมะเร็งรายใหม่ที่ต้องการเข้ารับการปรึกษาเพื่อวางแผนการรักษาโรคมะเร็งที่โรงพยาบาลจุฬาภรณ์ ทั้งการผ่าตัด เคมีบำบัด รังสีรักษา การปลูกถ่ายไขกระดูกและเซลล์บำบัด เวชศาสตร์นิวเคลียร์ ตรวจเพทสแกน สามารถเข้าถึงช่องทางบริการทางการแพทย์ด้านโรคมะเร็งผ่านทาง LINE Official Account โรงพยาบาลจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์ @chulabhornhospital (กดเพิ่มเพื่อน: http://nav.cx/8DqLuQm) กดเมนู “บริการโรคมะเร็ง” และเลือกหัวข้อบริการและชนิดมะเร็งที่ต้องการปรึกษาเพื่อเข้าถึงการติดต่อเจ้าหน้าที่ในการให้บริการ พร้อมเตรียมเอกสารเพื่อส่งปรึกษา อาทิ ประวัติการรักษา รายงานการผ่าตัด ผลการตรวจทางห้องปฏิบัติการ รายงานผลทางรังสีวินิจฉัยพร้อมซีดี รายงานผลทางพยาธิวิทยา ผลชิ้นเนื้อพร้อมสไลด์บล็อก (ถ้ามี) ผลชิ้นเนื้อไขกระดูก (ถ้ามี) เพื่อคัดกรองประวัติและอาการกับแพทย์ก่อนนัดหมายเข้ารับบริการต่อไปเพื่อประหยัดเวลาและลดการเดินทางมาโรงพยาบาลโดยไม่จำเป็น
ติดท็อป 100 โรงพยาบาลที่ดีที่สุดในโลก ในอีก 5 ปีข้างหน้า
โรงพยาบาลบำรุงราษฎร์ มุ่งมั่นในการขับเคลื่อนองค์กรไปสู่การเป็น 1 ในท็อป 100 โรงพยาบาลที่ดีที่สุดในโลก จากการจัดอันดับของ Newsweek ภายในอีก 5 ปีข้างหน้า หรือปี 2572 นั่นเอง
การเบิกจ่ายชดเชยค่าบริการผู้ป่วย กรณี Model 5 ปีงบประมาณ 2566
จุดประสงค์หลักที่สำคัญของโปรเจคท์นี้ สร้างรูปแบบการลงทุนที่เหมาะสำหรับผู้ที่ต้องการวางแผนการเงินและหลักประกันที่มั่นคง ให้กับชีวิต เหมาะสมกับคนในทุกช่วงวัย ไม่ว่าจะเป็นนักลงทุนที่ต้องการผลตอบแทนทางการเงิน หรือบุคคลทั่วไปที่ต้องการวางแผนการเงินให้มีความมั่นคงหลังวัยทำงาน ให้มีโอกาสลงทุนในธุรกิจติด เทรนด์กับโมเดลการลงทุนที่ไร้ความเสี่ยง ใน “parc exo care”ซึ่งราคาเริ่มต้นที่ 2.49 ล้านบาท
โดยผู้สนใจสามารถเข้ามาร่วมเป็น PARTNER กับเราได้อย่างง่ายดาย ไม่ต้องลงทุนสูง แต่ได้รับผลตอบแทนที่ดี มีคนบริหารจัดการให้ ลดความเสี่ยง ได้รับผลตอบแทนต่อเนื่อง เหมาะอย่างยิ่งสำหรับบุคลากรทางการแพทย์ หรือ ผู้ที่ทำธุรกิจด้านนี้อยู่แล้ว เพียงแค่คุณมีกลุ่มลูกค้าที่สามารถจะส่งต่อมา แล้วรอรับผลตอบแทนได้โดยไม่ต้องบริหารจัดการ เพราะ“parc exo care” บริหารงานด้วยมืออาชีพ ด้วยเหล่าพันธมิตรทางธุรกิจ จึงไม่ต้องลงทุนก่อสร้างอาคาร และบริหารงานใดๆ ท่านก็สามารถเข้าร่วมโครงการนี้ได้
ทั้งนี้สามารถดูรายละเอียดของโครงการและสิทธิพิเศษมากมายได้ที่
www.parcexocare.com/
www.panaceenursingcare.com/
การออกแบบที่พักคอย บริเวณซอยสุขุมวิท 26 ในย่านพร้อมพงษ์ โดยกลุ่มสถาปนิกและนักออกแบบ A49 & Friends และการพัฒนาป้ายบอกคิวใช้บริการที่วินมอเตอร์ไซค์ คลองบางบัว โดย Bangkok City Lab ถือเป็นขนส่งที่เปรียบเสมือนเส้นเลือดการเดินทางในกรุงเทพฯ จึงมีผู้ให้บริการกระจายอยู่ในพื้นที่ต่าง ๆ และมีผู้ใช้บริการจำนวนมาก เป็นที่มาของแนวคิดการปรับปรุงจุดพักคอยผู้ขับและผู้ใช้เพื่อความสะดวกและการสร้างทัศนียภาพที่สวยงาม
สปสช.เขต 8 อุดรธานี
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 8 อุดรธานี
- เลขที่ 21/68 บริษัท โทรคมนาคมแห่งชาติ จำกัด (มหาชน) ถ.วัฒนานุวงศ์ ต.หมากแข้ง อ.เมือง จ.อุดรธานี 41000
- โทรศัพท์ 042-325681
- โทรสาร 042 -325674
- แผนที่ google map
- website
- facebook
UMSC โรงพยาบาลสิรินธร
UMSC โรงพยาบาลสิรินธร แอดไลน์ ได้แล้ว ที่ @1srt เพื่อใช้บริการ สอบถามปัญหาสุขภาพ สอบถามบริการของรพ. พบแพทย์ออนไลน์ นัดหมายผ่านศูนย์ UMSC 24 ชั่วโมง บริการ รถรับ - ส่งผู้สูงอายุและผู้พิการโรงพยาบาลสิรินธร ฟรี
สอบถามโทร 099-5120318
โครงการให้บริการ รถรับ - ส่งผู้สูงอายุและผู้พิการโรงพยาบาลสิรินธร ฟรี ‼️ ไม่มีค่าใช้จ่าย เริ่ม 14 กุมภาพันธ์ 2567 เป็นต้นไปช่องทางการติดต่อ
1. ติดต่อที่ UMSC ชั้น 1 อาคารบริการ
2. UMSC ทาง LINE @1srt
3. โทร 02-3286900 ถึง 15 ต่อ 11499
รถรับส่งให้บริการในวันและเวลาราชการ ช่วงเวลา 08.00-16.00 น.
ขอบเขตการให้บริการ
1. ประชาชนในพื้นที่เขตประเวศและพื้นที่ใกล้เคียง *ในระยะ 10 กิโลเมตร*
2. ผู้ที่มีอายุ มากกว่าหรือเท่ากับ หรือผู้พิการที่มีปัญหาการเคลื่อนไหว
3. ผู้ป่วยที่สามารถนั่งรถวีลแชร์ได้และไม่มีอาการผิดปกติ
4. ผู้ป่วยที่มีนัดรักษาต่อเนื่องกับโรงพยาบาลสิรินธร
5. ให้บริการฟรีเดือนละ 1 ครั้ง
6. ต้องมีการ **นัดหมายขอใช้บริการล่วงหน้า 7 วัน
โดยนัดหมายผ่านศูนย์ UMSC 24 ชั่วโมง หรือ Walk in เวลา 08.00-16.00 น. วันทำการ
รถไฟท่องเที่ยวคิฮะ ขวัญใจคนไทย ขณะจอดให้ผู้โดยสารชมวิวเหนือเขื่อนป่าสักชลสิทธิ์ และถ่ายภาพสวยๆ เป็นที่ระลึก
การป้องกันตนเอง สำหรับผู้ที่ออกกำลังกายกลางแจ้ง
การป้องกันตนเอง จากความร้อน สำหรับผู้ที่ออกกำลังกายกลางแจ้ง
- ควรดื่มน้ำ 1 แก้ว ทุกๆ 15 - 20 นาที
- สวมชุดออกกำลังกายที่ระบายความร้อนได้ดี
- ดื่มเครื่องดื่มเกลือแร่
- หลีกเลี่ยงการดื่มแอลกอฮอล์ ชา กาแฟ และเครื่องดื่มที่มีน้ำตาลสูง
- หลีกเลี่ยงการออกกำลังกายอย่างหนัก ช่วงเวลา 11.00 - 15.00 น.
เขต 8
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านนาทม จ.นครพนม
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี หนองหิน จ.เลย
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีบ้านขาม จ.สกลนคร
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านโคกแสง จ.สกลนคร
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีเฝ้าไร่ จ.หนองคาย
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีทุ่งโปร่ง จ.หนองบัวลำภู
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี นาม่วง จ.อุดรธานี
คลินิกกายภาพบำบัดนอกเวลาราชการ โรงพยาบาลสุโขทัย
คลินิกกายภาพบำบัดนอกเวลาราชการ โรงพยาบาลสุโขทัย
เปิดให้บริการทุกวันจันทร์-ศุกร์ เวลา 16.30-20.30 น.
เปิดให้บริการทุกวันเสาร์ เวลา 08.30-16.30 น. หยุดวันอาทิตย์และวันหยุดนักขัตฤกษ์ ผู้มารับบริการท่านใดจะจองคิว เลื่อนคิว หรือยกเลิกคิวกายภาพบำบัด หรือซักถามข้อสงสัย ติดต่อได้ที่ 055-611782 ต่อ 3325, Line ID: @532podyp
หน่วยผิวหนัง คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกผิวหนัง
**รับเฉพาะผู้ป่วยนัด**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันอังคาร-ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396420 02-8396421 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
1. ด้านการรักษาโรคผิวหนัง ผื่นลมพิษ ผื่นเเพ้ยา ผื่นสะเก็ดเงินเเละด่างขาว โรคของหนังศีรษะเเละเส้นผม โรคทางเล็บ เช่น เชื้อราที่เล็บ โรคมะเร็งผิวหนัง โดยมีคลินิกย่อยให้บริการ ดังนี้
• คลินิกฉายแสงอาทิตย์เทียม ให้บริการตรวจวินิจฉัยและรักษาผู้ป่วยโดยแพทย์และเจ้าหน้าที่ผู้เชี่ยวชาญด้วยเครื่องมือที่หลากหลายและทันสมัย หัตถการสำคัญ ได้แก่ การฉายรังสีอัลตราไวโอเลตเอ รังสีอัลตราไวโอเลตบี
• คลินิกผ่าตัดชิ้นเนื้อทางผิวหนัง ให้บริการการส่งตรวจเป็นการตัดหรือฝานชิ้นเนื้อเพียงบางส่วน หรือตัดชิ้นเนื้อออกทั้งหมด เพื่อนำไปส่งตรวจทางพยาธิวิทยา
2. ด้านความสวยงาม เปิดให้บริการผู้ป่วยที่มีปัญหาสภาพผิวที่มีรอยเเดง รอยดำ รอยสิว หลุมสิว ติ่งเนื้อ ฝ้ากระ และให้บริการด้านยกกระชับ รวมถึงการฉีด Botox การฉายเเสงเพื่อลดรอยเเดงสิว รอยสิว รอยเเดงแผลหลังผ่าตัด
บรรยากาศการลงนาม
พิธีลงนามความร่วมมือระหว่างคณะแพทยศาสตร์และ 10 องค์กรแพทย์
“ผมหวังว่าค่ายรากแก้วจะเป็นคำตอบให้ใครอีกหลายคนได้ค้นพบเส้นทางของตัวเอง พร้อมเก็บความรู้สึกนี้ไว้ถ่ายทอดสู่น้องๆ รุ่นถัดไปเหมือนกับผมครับ” น้องจิมมี่ กล่าวทิ้งท้าย
โครงการ โรงเรียนสุขสันต์ รู้ทันเบาหวาน (หรือ KiDS) ในประเทศไทยครั้งนี้ จึงเป็นตัวอย่างของการร่วมมือระหว่างภาครัฐ และเอกชน สมาคมวิชาชีพ และเครือข่ายผู้เป็นเบาหวานและผู้ปกครอง สร้างความตระหนักรู้ และดูแลจัดการเบาหวานในโรงเรียน ลดการแบ่งแยกและตีตรา สร้างเสริมสุขนิสัยที่ดี เพื่อขับเคลื่อนไปสู่คุณภาพชีวิตที่ดีของเด็กไทย อันจะเป็นทรัพยากรที่สำคัญของประเทศต่อไป ซึ่งสอดคล้องกับแคมเปญวันเบาหวานโลก ในปี 2024-2026 “Diabetes and Well-being” ที่มุ่งเน้นในการส่งเสริมสุขภาวะที่ดีทั้งด้านร่างกายและจิตใจของผู้เป็นเบาหวานและครอบครัว
เทศบาลเมืองกะทู้ เปิดรับผ่าตัดทำหมันสุนัขและแมวฟรี
เทศบาลเมืองกะทู้ โดยกองสาธารณสุขและสิ่งแวดล้อม ร่วมกับ มูลนิธิสุนัขในซอย (Soi Dog) เปิดรับผ่าตัดทำหมันสุนัขและแมวฟรี ภายใต้โครงการเพิ่มศักยภาพการควบคุมดูแลและติดตามสุนัขและแมวในพื้นที่เทศบาลเมืองกะทู้ ประจำปีงบประมาณ พ.ศ.2567
- ระหว่างวันที่ 12 มิถุนายน - 31 ธันวาคม 2567
- บริการทุกวันพุธ - อาทิตย์
- หยุดวันจันทร์ - อังคาร
- เวลาให้บริการ 08.00-17.00 น.
- ณ สวนสาธารณะลานกีฬา @อำเภอกะทู้
- โดยเปิดรับลงทะเบียนจองคิว ณ จุดออกหน่วยผ่าตัดทำหมัน ตั้งแต่เวลา 08.00 - 12.00 น.
- รับจำนวนจำกัด สุนัขและแมวที่ไม่มีเจ้าของ วันละ 20 ตัว สุนัขและแมวที่มีเจ้าของวันละ 20 ตัว
หมายเหตุ
- กรุณา #เตรียมบัตรประจำตัวประชาชนมาแสดงต่อเจ้าหน้าที่ในวันที่มารับบริการ
- จำกัด เฉพาะผู้ที่พักอาศัยอยู่ในพื้นที่เทศบาลเมืองกะทู้ ตำบลกะทู้ เท่านั้น
- ในวันที่รับบริการ #ให้งดน้ำงดอาหารสุนัขและแมว 8 ชั่วโมง ก่อนที่จะนำมารับบริการผ่าตัดทำหมัน
- สุนัขและแมวที่จะผ่าตัดทำหมันต้อง #มีอายุตั้งแต่ 6 เดือนขึ้นไป และต้องไม่ตั้งท้อง
อีกหนึ่งกิจกรรมในวันเปิดงานคือวงเสวนาเรื่อง “Driving Inclusive Entrepreneurship Ecosystems for Impact: Journey for Success” ซึ่งสะท้อนภาพของความร่วมมือแบบสหสาขาวิชาชีพสำหรับผู้ประกอบการไทย ผู้อภิปรายทั้งห้าท่านสนับสนุนให้มีการปรับปรุงระบบราชการเพื่อยกระดับสตาร์ทอัพ ส่งเสริมนวัตกรรม และก้าวข้ามความท้าทายด้านเงินทุนและประชากร ดร.ภัทรชาติ โกมลกิติ ซีอีโอ ของ KX Knowledge Exchange กล่าวถึงการเชื่อมต่ออุตสาหกรรมเข้ากับวิชาการเพื่อสร้างสตาร์ทอัพด้าน Deep Tech "จอย” สลักจิต มั่นธรรมรักษา หัวหน้าภูมิภาคเอเชียตะวันออกและตะวันออกเฉียงใต้ของ ANDE เน้นย้ำถึงความสำคัญของการสร้างแนวร่วม ตั้งแต่ผู้ให้บริการด้านการสร้างขีดความสามารถไปจนถึงนักลงทุนและสถาบันการศึกษาเพื่อให้ผู้ประกอบการเข้าถึงแหล่งทรัพยากรได้ ณฐกร อสุนี ณ อยุธยา ผู้จัดการทั่วไปของ Social Enterprise Thailand กล่าวถึงภาพรวมของวิสาหกิจเพื่อสังคมที่เติบโตอย่างรวดเร็ว เนื่องด้วยบริษัทขนาดใหญ่สนใจธุรกิจด้านนี้เพื่อนำมาขับเคลื่อนผลกระทบเชิงบวกและรับมือกับความท้าทายระดับโลก รศ. ดร.ปิติวัฒน์ วัฒนชัย ผู้อำนวยการอุทยานวิทยาศาสตร์และเทคโนโลยี มช. กล่าวถึงความพยายามของรัฐบาลในการส่งเสริมเศรษฐกิจที่เน้นนวัตกรรมเพื่อรับมือความท้าทายด้านเงินทุนและประชากร รศ. ดร.จิตติมา ลัคนากุล รักษาการแทนประธานศูนย์นวัตกรรมแห่งจุฬาลงกรณ์มหาวิทยาลัย ชี้ความจำเป็นในการลดขั้นตอนทางราชการที่ซับซ้อนให้เรียบง่ายด้วยการประสานงานระหว่างหน่วยงานเพื่อยกระดับสตาร์ทอัพไทย และสร้างความคล่องตัวให้ภาครัฐสามารถแก้ปัญหาให้ผู้ประกอบการ
สถานสงเคราะห์สัตว์บ้านนางฟ้าของสัตว์จร อ.มวกเหล็ก สระบุรี
สถานสงเคราะห์สัตว์บ้านนางฟ้าของสัตว์จร CHSAThai stray animal shelter. Thailand. Guardian of Strays Foundation ก่อตั้งขึ้นโดย นายอนันต์ธรณ์ วินิจเถาปฐม และนางกวิพร วินิจเถาปฐม ได้เริ่มต้นกิจการช่วยเหลือสัตว์จรจัด ตั้งแต่ปี 2547 ตั้งอยู่ที่ อำเภอมวกเหล็ก จังหวัดสระบุรี เป็นสถานสงเคราะห์ที่ขึ้นทะเบียนอย่างถูกต้องกับกรมปศุสัตว์ ปัจจุบันมีสัตว์จรจัดในความดูแลกว่า 1,900 ชีวิต แบ่งเป็น สุนัขจรจัดประมาณ 1,300 ชีวิต และแมวจรจัดประมาณ 600 ชีวิต
- บ้านนางฟ้าของสัตว์จร ยินดีต้อนรับพี่ๆ ทุกท่าน จะแวะมาหา มาเล่นเฉยๆ เราก็ยินดีต้อนรับนะครับ จะแวะมาเมื่อไหร่ โทรมาเลยย 089-099-6000 (คุณอนันต์ธรณ์ เจ้าของบ้านนางฟ้าฯ)
- ร่วมบริจาคเพื่อสมทบค่าใช้จ่าย ค่าอาหาร ค่าทำหมัน ค่าแรงงานเจ้าหน้าที่ ค่าน้ำมัน ค่ายา ค่าส่งสัตว์รักษาที่โรงพยาบาลสัตว์ ฯลฯ ช่วยเหลือดูแลสัตว์จรจัดได้ที่ - ธ.กสิกร เลขที่ 991-219-5799ชื่อบัญชี นายอนันต์ธรณ์ วินิจเถาปฐม เจ้าของสถานสงเคราะห์สัตว์ บ้านนางฟ้าของสัตว์จร
- ติดต่อสอบถามที่ข้อความเฟสบุค Line ID: @dog45 เบอร์โทร 089-099-6000
- facebook บ้านนางฟ้าของสัตว์จร
8. สารออกฤทธิ์ทางชีวภาพสำหรับเคลือบบรรจุภัณฑ์
บรรจุภัณฑ์รักษ์โลก เคลือบด้วยสารชีวภาพจาก รศ.ดร.พรนภา เกษมศิริ และคณะ คณะวิศวกรรมศาสตร์ มหาวิทยาลัยขอนแก่น ช่วยยับยั้งแบคทีเรีย เก็บรักษาอาหารให้สดใหม่ได้นานขึ้น #บรรจุภัณฑ์อาหาร
ศูนย์สนับสนุนบริการสุขภาพที่ 8 อุดรธานี
ศูนย์สนับสนุนบริการสุขภาพที่ 8 (Regional Health Service Support Center 8) มีพื้นที่รับผิดชอบ จำนวน 7 จังหวัด ได้แก่ อุดรธานี สกลนคร นครพนม เลย หนองคาย หนองบัวลำภู บึงกาฬ
- 577 หมู่ 12 ตำบลสามพร้าว อำเภอเมือง จังหวัดอุดรธานี 41000
- โทร 042-217-530
- email : saraban-hss8@hss.mail.go.th
- Google map
- Facebook
- Website
Medical Wellness เวลเนสทางการแพทย์
ปัจจุบัน ผู้คนมีความนิยมและเลือกสรรบริการดูแลสุขภาพที่ส่งเสริมการมีสุขภาวะองค์รวมที่ดีในรูปแบบของบริการเวลเนสมากขึ้นเรื่อยๆ แต่เวลเนสทางการแพทย์ หรือ Medical Wellness เป็นความรู้ใหม่ที่ยังขาดการกำหนดคำนิยามที่ชัดเจน ดังนั้น การส่งเสริมให้ผู้คนได้เข้าถึงบริการที่มีคุณภาพมาตรฐาน จึงจำเป็นต้องกำหนดคำอธิบายเวลเนสทางการแพทย์ให้ชัดเจนและสอดคล้องกับมาตรฐานที่เกี่ยวข้องกับการประกอบวิชาชีพของผู้ประกอบวิชาชีพทางการแพทย์ตามกฎหมายว่าด้วยสถานพยาบาล
รูปแบบ วิธีการและสภาพแวดล้อมของการดูแลสุขภาพที่เปลี่ยนแปลงไปของผู้คน เป็นปัจจัยที่ก่อให้เกิดการพัฒนาเพื่อปรับเปลี่ยนการดูแลสุขภาพและการรักษาพยาบาลเชิงบูรณาการ เพื่อให้การใช้จ่ายเงินที่คุ้มค่าส่งเสริมการขยายตัวของบริการมูลค่าเพิ่มในทางเศรษฐกิจ รวมทั้งสร้างทางเลือกในการดูแลสุขภาพให้แก่ประชาชนทั้งรายบุคคลและกลุ่มวัยต่างๆ จำนวนมากที่ต้องการมีอายุขัยที่ยืนยาว การชะลอวัยอย่างมีสุขภาพดี และการมีสุขภาพองค์รวม หรือสุขภาวะที่ดีที่สุดด้วยวิทยาศาสตร์การแพทย์
8. เทคโนโลยีรีไซเคิลแบตเตอรี่แบบโดยตรง (Direct Battery Recycling Technology)
การมุ่งสู่สังคมคาร์บอนต่ำทำให้มีความต้องการแบตเตอรี่ โดยเฉพาะแบบลิเทียมไอออน เพราะมีการใช้กับยานยานยนต์ไฟฟ้าอย่างแพร่หลาย เนื่องจากมีความจุพลังงานจำเพาะสูง มีอายุการใช้งานที่ยาวนานคุ้มค่า และยังมีแนวโน้มราคาที่ลดลงอีกด้วย
ในช่วงหลายปีที่ผ่านมามีอัตราความต้องการแบตเตอรี่ลิเทียมไอออนเติบโตมากกว่า 25% ต่อปี โดยคาดว่าจะเพิ่มขึ้นเป็น 10 เท่าในปี 2030
8.DECENT WORK AND ECONOMIC GROWTH งานที่เหมาะสมและการเติบโตทางเศรษฐกิจ
ในช่วง 25 ปีที่ผ่านมา จำนวนแรงงานที่อาศัยอยู่ในความยากจนข้นแค้นลดลงอย่างมาก แม้ว่าจะได้รับผลกระทบจากวิกฤตเศรษฐกิจในปี 2551 และภาวะเศรษฐกิจถดถอยทั่วโลกก็ตาม ในประเทศกำลังพัฒนา ชนชั้นกลางคิดเป็นมากกว่า 34 เปอร์เซ็นต์ของการจ้างงานทั้งหมด ซึ่งตัวเลขดังกล่าวเพิ่มขึ้นเกือบสามเท่าระหว่างปี 2534 ถึง 2558
อย่างไรก็ตาม ในขณะที่เศรษฐกิจโลกยังคงฟื้นตัว เรากำลังเห็นการเติบโตที่ช้าลง ความไม่เท่าเทียมกันที่เพิ่มมากขึ้น และงานไม่เพียงพอที่จะตามทันแรงงานที่เพิ่มขึ้น ตามข้อมูลขององค์การแรงงานระหว่างประเทศ มีคนว่างงานมากกว่า 204 ล้านคนในปี 2558
เป้าหมายการพัฒนาที่ยั่งยืนส่งเสริมการเติบโตทางเศรษฐกิจที่ยั่งยืน ระดับผลผลิตที่สูงขึ้น และนวัตกรรมทางเทคโนโลยี การส่งเสริมการเป็นผู้ประกอบการและการสร้างงานเป็นกุญแจสำคัญในเรื่องนี้ เช่นเดียวกับมาตรการที่มีประสิทธิภาพในการขจัดแรงงานบังคับ การค้าทาส และการค้ามนุษย์ โดยมีเป้าหมายเหล่านี้ในใจ เป้าหมายคือการบรรลุการจ้างงานเต็มที่และมีประสิทธิผล รวมถึงงานที่เหมาะสมสำหรับผู้หญิงและผู้ชายทุกคนภายในปี 2030
จัดให้บัตรประชาชนอยู่ในกรอบที่กำหนด
8.Cloud and edge computing - คลาวด์และคอมพิวเตอร์แบบเอจ
คลาวด์และเอจคอมพิวติ้งหมายถึงเวิร์กโหลดที่กระจายไปทั่วสถานที่ เช่น ศูนย์ข้อมูลระยะไกลระดับไฮเปอร์สเกล ศูนย์ภูมิภาค และโหนดในพื้นที่ เพื่อปรับให้เหมาะสมในด้านเวลาแฝง ต้นทุนการถ่ายโอนข้อมูล การปฏิบัติตามระเบียบข้อบังคับว่าด้วยอำนาจอธิปไตยของข้อมูล ความเป็นอิสระเหนือข้อมูล ข้อควรพิจารณาด้านความปลอดภัย เป็นต้น
คลินิกเบาหวาน , ความดันโลหิตสูง
โปรแกรมบริหารงานคลินิกออนไลน์ - cliniclive ระบบบริหารงานคลินิกในคลาวด์
โปรแกรมบริหารงานคลินิกออนไลน์ cliniclive ระบบบริหารงานคลินิกในคลาวด์ที่ทันสมัยและปลอดภัย เพื่อประสิทธิภาพในการดูแลคนไข้ ออกแบบโดยคำนึงถึงการใช้งานสมัยใหม่ 3 ด้าน ได้แก่ 1) Responsive สามารถทำงานได้ทุกอุปกรณ์ คอมพิวเตอร์ แทบเล็บ และโทรศัพท์ 2) UI/UX design ออกแบบเพื่อให้แพทย์ เจ้าหน้าที่ และผู้บริหารทำงานได้ง่ายขึ้น 3) Dashboard and Reports ตรวจสอบสถานะและผลการดำเนินงานผ่านระบบ Dashboard และ รายงานที่หลากหลาย
คุณสมบัติของระบบ
- เชื่อมระบบ LINE OA
แจ้งการนัดหมาย แจ้งการนัดหมายของคนไข้ผ่านระบบ LINE OA ที่คนไข้ใช้งานกับกับคลินิกได้ทันที
บัตรคนไข้ คนไข้สามารถแสดงบัตรคนไข้ผ่านทางระบบ LINE OA ได้ทันที ช่วยลดการคีย์ข้อมูลของเจ้าหน้าที่
ตรวจสอบนัดหมาย คนไข้ตรวจสอบนัดหมายล่วงหน้าได้ด้วยตนเองผ่านระบบ LINE OA
ตรวจสอบคอร์สคงเหลือ คนไข้สามารถตรวจสอบคอร์สคงเหลือได้ด้วยตนเองผ่านระบบ LINE OA
- ข้อมูลคนไข้
บันทึกข้อมูลด้วยบัตรประชาชน บันทึกข้อมูลด้วยเครื่องอ่านบัตรประชาชนให้ง่ายและสะดวกแก่เจ้าหน้าที่คลินิก ใช้งานได้ทั้ง Windows และ MacOS
ประวัติการรักษา แสดงและทวนสอบประวัติการรักษาของคนไข้แต่ละคนไข้ให้แสดง ได้สะดวกรวดเร็วขึ้น
ค้นหาคนไข้ง่ายและสะดวก สามารถคนไข้คนไข้ได้สะดวก ด้วยการค้นจาก ชื่อ รหัส เบอร์โทรศัพท์ หรือจะเป็นบัตรประชาชน และ Digital Card ผ่าน LINE OA
- บันทึกการรักษา
อาการเบื้องต้นและการรักษา บันทึกอาการเบื้องต้นในการรักษาเพื่อ พร้อมเก็บเป็นประวัติเพื่อการเรียกดูในอนาคต
สั่งรายยาและค่ารักษา เลือกสั่งรายการยาและการรักษา พร้อมเลือกวิธีใช้ยาหรือการรักษาได้ทันที พร้อมระบบทำการตัดสต๊อกเมื่อสั่งรายการให้ทันที
ภาพและเอกสาร เพิ่มการบันทีกภาพ หรือภาพวาด ของคนไข้ พร้อมเครื่องมือการเปรียบเทียบก่อนและหลังการรักษา
- สินค้า ยา และคลัง
ตรวจสอบยอดคงเหลือ ระบบบันทึกและตรวจสอบยอดคงเหลือ สำหรับการสั่งแต่ละครั้งเพื่อให้การรักษาที่ถูกต้องเพิ่มขึ้น
การสั่งซื้อและคลังสินค้า ระบบมาพร้อมระบบการสั้งซื้อ การรับสินค้าและยา พร้อมระบบการตรวจสอบยอดคงเหลือ และ ต้นทุนคงเหลือได้ทันที
- การนัดหมายและตารางนัด
กำหนดนัดหมายล่วงหน้า กำหนดการนัดหมายล่วงหน้าได้ทันที พร้อมการตรวจสอบช่วงเวลาว่างของแพทย์ให้อัตโนมัติ
ตารางนัดหมาย แสดงการนัดหมายสำหรับแพทย์ ในแต่วัน สัปดาห์ หรือ เดือน เพื่อการวางแผนล่วงหน้าได้ง่ายขึ้น
แจ้งนัดหมาย แจ้งนัดหมายคนไข้ ผ่านระบบ sms หรือ LINE NOTIFY และ LINE OA
- จัดการคอร์สทรีทเม้นต์
คอร์สทรีทเม้นต์ บันทึกและแสดงยอดรายการคอร์สที่คงเหลือสำหรับคนไข้ ทำให้ง่ายในการใช้งาน
รูปแบบคอร์ส กำหนดรูปแบบคอร์สให้สอดคล้องการระบบคลินิกที่ใช้งานไ้ดอย่างหลากหลาย ทั้งในรูปแบบครั้งและปริมาณ
คำนวณค่าตอบแทน สามารถบันทึกค่าตอบแทน สำหรับพนักงานขาย และพนักงานผู้ทำ (Therapist) ช่วยการคำนวณค่าตอบแทนง่ายขึ้น
บันทึกภาพก่อนและหลัง สามารถบันทึกภาพก่อนและหลังการรักษา พร้อมภาพการรักษาในแต่ละครั้งเพื่อการเปรียบเทียบได้สะดวกขึ้น
- รายงานและแบบฟอร์ม
ข้อมูลสถิติ แสดงข้อมูลสถิติพร้อมใช้เพื่อให้แพทย์ และ ผู้บริหารดูข้อมูลได้ทันที
รายงาน รายงานรายได้ รายรับ ต้นทุน คลังสินค้า เพื่อการตรวจสอบได้ทันที
แบบฟอร์ม รองรับการออกแบบฟอร์มใบเสร็จรับเงิน และใบแจ้งหนี้ หรือ ใบแจ้งหน่วยงานรัฐได้เอง
- ทีมงานและผู้ใช้งาน
ผู้ใช้งาน กำหนดประเภทและสิทธิการใช้งานของทีมงานภายในคลินิกได้ในแต่ละประเภทแบบยืนหยุ่น
ประเภทของพนักงาน กำหนดประเภทของพนักงานเพื่อให้แสดงตามประเภทให้เพื่อผลตอบแทนที่กำหนด
- การพัฒนาการต่อเชื่อมระบบ
หน่วยงานภาครัฐ รองรับการพัฒนาต่อเชื่อมระบบ ประกันสังคม และ ระบบประกันสุขภาพแห่งชาติ (สปสช)
ระบบที่เกี่ยวข้อง รองรับการพัฒนาต่อเชื่อมระบบ Lab Information System (LIS) และระบบการต่อเชื่อม X-ray
ราคาค่าใช้จ่ายสำหรับระบบบริหารคลินิก cliniclive เป็นรูปแบบการรายเดือน และ รายปี (ราคา 1,200 - 1,400 บาท/เดือน) ไม่มีค่าติดตั้งโปรแกรม สามารถเพิ่มใช้งานโปรแกรมได้ทันที พร้อมบริการต่างๆ
สอบถามโทร 02-5517671
ศูนย์การเรียนธรรมชาติห้วยพ่าน ต.เบือ อ.เชียงกลาง จ.น่าน ต้องการขอความช่วยเหลือด้านปัจจัย 4 ได้แก่ ข้าวสาร อาหารแห้ง น้ำดื่ม และงบประมาณบริจาคสมทบทุน เพื่อใช้ซื้อน้ำมันในการปั่นไฟสำรอง ส่งที่ศุภมาส พันธะยอด 124 หมู่ 4 ต.เปือ อ.เชียงกลาง จ.น่าน 55160 โทรศัพท์ 098-460-8576 สมทบทุนที่บ้านห้วย ผ่านธนาคาร ธกส.สาขาทุ่งช้าง เลขที่บัญชี 020048970869
คลินิกแพทย์แผนจีน โรงพยาบาลสิรินธร กรุงเทพมหานคร
โครงการฟันเทียม รากฟันเทียม เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเนื่องในพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567
จากกระแสพระราชดำรัสพระบาทสมเด็จพระบรมชนกาธิเบศรมหาภูมิพล อดุลยเดชมหาราช บรมนาถบพิตร ความว่า “เวลาไม่มีฟัน กินอะไรก็ไม่อร่อย ทำให้ไม่มีความสุข จิตใจก็ไม่สบาย ร่างกายก็ไม่แข็งแรง” ได้นำมาสู่ความร่วมมือของภาคีเครือข่ายที่เกี่ยวข้องในโครงการฟันเทียมพระราชทานเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว นับตั้งแต่ปีพ.ศ.2548 เป็นต้นมา โดยมีวัตถุประสงค์เพื่อแก้ไขปัญหาการสูญเสียฟัน ด้วยการใส่ฟันเทียมทดแทน โดยให้ความสำคัญกับการสูญเสียฟันทั้งปากในกลุ่มผู้สูงอายุและก่อนวัยสูงอายุ เนื่องจากส่งผลต่อสุขภาพและคุณภาพชีวิตอย่างชัดเจน ทั้งด้านกายภาพ อารมณ์สังคม โดยสำนักงานหลักประกันสุขภาพแห่งชาติ ได้สนับสนุน“บริการฟันเทียม”ทั้งกรณีการใส่ฟันเทียมทั้งปากและใส่ฟันเทียมบางส่วนที่ถอดได้เป็นสิทธิประโยชน์ในระบบหลักประกันสุขภาพแห่งชาติรวมทั้งได้มีการกำหนดชุดสิทธิประโยชน์การใส่ฟันเทียมครอบคลุมทุกสิทธิการรักษา ทั้งสิทธิข้าราชการและประกันสังคม
ประเทศไทยกำลังก้าวเข้าสู่สังคมผู้สูงอายุอย่างสมบูรณ์จำนวนและสัดส่วนผู้สูงอายุเพิ่มขึ้น ปัจจุบันยังคง มีผู้สูงอายุสูญเสียฟันเพิ่มและต้องการใส่ฟันเทียมทั้งปากอีกร้อยละ 2.7 หรือประมาณ 270,000 ราย ด้วยเหตุของความต้องการใส่ฟันเทียมในกลุ่มผู้สูงอายุยังคงมีมาก ประกอบกับผู้ที่มีฟันเทียมทั้งปากที่ใช้งานเกินกว่า 5 ปีอาจมีการชำรุด แตกหัก จำเป็นต้องได้รับการใส่ฟันเทียมทั้งปาก หรือเกือบทั้งปากเพิ่มเติม รวมทั้งผู้สูงอายุ ที่มีสภาพสันเหงือกยุบตัว จากความเสื่อมของอวัยวะ ทำให้ฟันเทียมหลวม ขยับ ไม่กระชับกับสันเหงือก ทำให้เกิดแผลในช่องปาก สร้างความเจ็บปวด ไม่สบาย ไม่สามารถ ใช้บดเคี้ยวได้ ซึ่งกรณีเหล่านี้พบได้ประมาณร้อยละ 10 ของผู้ใส่ฟันเทียมทั้งปาก ที่จำเป็นต้องได้รับการผ่าตัดฝังรากฟันเทียม เพื่อให้ฟันเทียมแบบถอดได้สามารถยึดแน่นเพียงพอที่จะบดเคี้ยวได้ ซึ่งการผ่าตัดฝังรากฟันเทียมเป็นเทคโนโลยีที่มีค่าใช้จ่ายสูง เนื่องจากต้องนำเข้าวัสดุอุปกรณ์จากต่างประเทศ มูลนิธิทันตนวัตกรรม ในพระบรมราชูปถัมภ์ร่วมกับคณะทันตแพทยศาสตร์จุฬาลงกรณ์มหาวิทยาลัย ได้พัฒนารากฟันเทียมไทยขึ้น ซึ่งจะช่วยลดงบประมาณค่าใช้จ่ายของประเทศในการจัดบริการ รวมทั้ง สปสช. ได้กำหนดให้การฝังรากเทียมเพื ่อรองรับฟันเทียมทั้งปากเป็นสิทธิประโยชน์ใหม่ให้กับผู้สูญเสียฟันที่มีความจำเป็น เพื่อให้เข้าถึงบริการฝังรากฟันเทียม เพื่อเพิ่มคุณภาพชีวิตด้านการบดเคี้ยวได้มากขึ้น
จากพระปฐมบรมราชโองการพระบาทสมเด็จพระเจ้าอยู่หัว ความว่า “เราจะสืบสาน รักษา ต่อยอด และครองแผ่นดินโดยธรรม เพื่อประโยชน์สุขแห่งอาณาราษฎรตลอดไป” เมื่อวันที่ 22 มิถุนายน 2565 ที่ผ่านมากระทรวงสาธารณสุขได้รับพระราชทานพระบรมราชานุญาตให้จัดทำ “โครงการฟันเทียม รากฟันเทียมเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 72 พรรษา 28 กรกฎาคม 2567” ดังนั้น กระทรวงสาธารณสุข โดยสำนักงานปลัดกระทรวงสาธารณสุข กรมการแพทย์กรมอนามัย สำนักงานหลักประกันสุขภาพแห่งชาติจึงได้ร่วมกันจัดทำโครงการฟันเทียม รากฟันเทียมเฉลิมพระเกียรติฯ เพื่อให้ผู้สูงอายุและก่อนวัยสูงอายุ ที่สูญเสียฟันทั้งปากหรือเกือบทั้งปาก ได้รับบริการใส่ฟันเทียมทั้งปาก และรากฟันเทียมตามความจำเป็น พร้อมกับจัดระบบบริการเพื่อให้เกิดการดูแลสุขภาพช่องปากทั้งโดยบุคลากร และด้วยภาคประชาชนอย่างต่อเนื่อง เพื่อลดความเหลื่อมล้ำ ทำให้ผู้สูงอายุมีคุณภาพชีวิตที่ดีขึ้น
สำนักทันตสาธารณสุข กรมอนามัย มีบทบาทหน้าที่ในการบริหารจัดการโครงการ ประสานงานสนับสนุนการดำเนินงานของหน่วยบริการ พัฒนาศักยภาพบุคลากรในการให้บริการฟันเทียม ติดตามการดำเนินงาน และรายงานต่อคณะกรรมการโครงการฯ จึงได้จัดทำโครงการฟันเทียม รากฟันเทียมเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 72 พรรษา 28 กรกฎาคม 2567 ในปีงบประมาณ2566 ขึ้นเพื่อให้การดำเนินโครงการบรรลุตามเป้าหมายที่วางไว้
วัตถุประสงค์
1. เพื่อเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา ๗๒ พรรษา ๒๘ กรกฎาคม ๒๕๖๗
2. เพื่อให้ประชาชนได้รับบริการฟันเทียมและรากฟันเทียมแก้ปัญหาการสูญเสียฟันทั้งปากหรือเกือบทั้งปากในกลุ่มผู้สูงอายุและก่อนวัยสูงอายุ
3. เพื่อขับเคลื่อนและส่งเสริมการจัดบริการทางทันตกรรมตามชุดสิทธิประโยชน์ในกลุ่มผู้สูงอายุ
กลุ่มเป้าหมาย
1. ผู้ที่ไม่มีฟันทั้งปาก หรือสูญเสียฟันมากกว่า 16 ซี่ ทุกสิทธิการรักษา
2. ผู้ที่มีฟันเทียมเดิม แต่ฟันเทียมหลวมไม่กระชับ สันเหงือก ยุบตัว หรือ มีข้อบ่งชี้จำเป็นต้องใส่รากฟันเทียม เฉพาะสิทธิหลักประกันสุขภาพแห่งชาติ
พื้นที่เป้าหมาย 76 จังหวัด และกรุงเทพมหานคร
รางวัล 10 สวนสวยประจำปี 2567
สำหรับผลรางวัล 10 สวนสวยประจำปี 2567 มีดังนี้
- สวนป่าลวงตาที่เขียวชอุ่มด้วยสวนแนวตั้ง
- สวนริมน้ำที่บ้านกลางทุ่ง
- สวนทรอปิคัล สวนญี่ปุ่น และต้นโอลีฟ
- สวนสมุนไพรที่บ้านในป่าสน
- สวนโปรวองซ์ในฝัน
- สวนสุขใจหลังวัยเกษียณ
- สวนทรอปิคัลกลิ่นอายญี่ปุ่นในม่านฝน
- สวนโมเดิร์นที่ผสานกลิ่นอายแบบญี่ปุ่น
- สวนสามสไตล์ในพื้นที่เดียว ที่สร้างความร่มรื่นให้เจ้าของได้ทุกมุม
- สวนสไตล์ยุโรปที่สร้างสมดุลในการใช้ชีวิต
8. นวัตกรรมเพื่อความยั่งยืน
จากเทรนด์เทคโนโลยีทางการแพทย์ที่กล่าวถึงข้างต้น ปัญญาประดิษฐ์ หรือ AI เป็นเทคโนโลยีที่ศักยภาพอย่างมากในการเปลี่ยนแปลงวงการสาธารณสุข ไม่ว่าจะเป็นการเพิ่มประสิทธิภาพ พัฒนาคุณภาพชีวิตของผู้คน และ AI ยังช่วยในด้านการพัฒนาความยั่งยืนให้กับอุตสาหกรรมเทคโนโลยีทางการแพทย์อีกด้วย
อุตสาหกรรมด้านเฮลท์แคร์มีการปล่อยก๊าซคาร์บอนไดออกไซด์ทั่วโลกถึง 4.4% [6] ซึ่งมากกว่าอุตสาหกรรมการบินและการขนส่ง แต่เทคโนโลยี AI สามารถช่วยวิเคราะห์ห่วงโซ่อุปทานและระบุจุดที่ต้องปรับปรุงได้ ไม่ว่าจะเป็น การลดขยะและของเสีย หรือการปรับปรุงการจัดการสถานพยาบาล นอกจากนี้ AI ยังช่วยเพิ่มความรวดเร็วในการถ่ายภาพรังสีวินิจฉัย แต่ทำให้ลดการใช้พลังงานต่อการสแกนแต่ละครั้ง ดังนั้นการใช้ AI เพื่อลดการปล่อยก๊าซเรือนกระจกทั่วโลก และลดผลกระทบต่อสิ่งแวดล้อมเป็นเรื่องที่น่าจับตาสำหรับปี 2025 และปีต่อๆ ไป
อย่างไรก็ตามเมื่อมีการใช้งาน AI มากขึ้น อาจนำไปสู่ผลกระทบที่ไม่คาดคิดต่อสิ่งแวดล้อม เนื่องจากดิจิทัลโซลูชั่นส์จำเป็นต้องใช้พลังงานและทรัพยากรในกระบวนการและการจัดเก็บข้อมูล พร้อมกับการใช้น้ำเพื่อทำความเย็นให้กับดาต้าเซ็นเตอร์ที่มีความร้อนสูง ซึ่งทั้งหมดนี้มีส่วนในการเพิ่มการปล่อยก๊าซคาร์บอนได้ออกไซด์ของอุตสาหกรรมเฮลท์แคร์ นอกจากนี้ การใช้ AI ยังเพิ่มการใช้พลังงานถึงปีละ 26% ถึง 36% และการใช้พลังงานของดาต้าเซ็นเตอร์อาจเพิ่มขึ้น 3 เท่าภายใน 4 ปี [7] ในขณะที่ขยะอิเล็กทรอนิกส์ (E-waste) ก็เป็นอีกหนึ่งปัญหาสำคัญที่ต้องตระหนัก ในขณะที่ Generative AI ถูกคาดการณ์ว่าจะสร้างขยะอิเล็กทรอนิกส์ถึง 2.5 ล้านตันภายในปี 2030 [8] ขณะที่เราขับเคลื่อนวงการเฮลท์แคร์สู่ยุคดิจิทัล ผู้ให้บริการด้านเทคโนโลยีทางการแพทย์จึงจำเป็นต้องพัฒนานวัตกรรมที่คำนึงสิ่งแวดล้อม และลดการใช้พลังงาน ทรัพยากร และน้ำให้ได้มากที่สุด เพื่อลดผลกระทบในระยะยาว
บำรุงราษฎร์ประสบความสำเร็จในการปลูกถ่ายกระจกตาด้วยอัตราสูงถึง 97% - ศ.พญ. งามจิตต์ เกษตรสุวรรณ
ศ.พญ. งามจิตต์ เกษตรสุวรรณ แพทย์เฉพาะทางด้านจักษุวิทยา การผ่าตัดแก้ไขสายตา กระจกตา และ ต้อกระจก โรงพยาบาลบำรุงราษฎร์ กล่าวปิดท้ายเกี่ยวกับปัญหากระจกตาเป็นสาเหตุสำคัญที่นำไปสู่การสูญเสียการมองเห็น โดยเฉพาะอย่างยิ่งโรคกระจกตาเสื่อม กระจกตาโก่ง/ย้วย กระจกตาบวม และกระจกตาเป็นแผล ซึ่ง ‘การปลูกถ่ายกระจกตา’ เป็นการผ่าตัดเพื่อเปลี่ยนกระจกตาส่วนที่เสียหายด้วยกระจกตาจากผู้บริจาค เพื่อช่วยแก้ไขปัญหาการมองเห็นของผู้ป่วยให้ดีขึ้น ช่วยเสริมความแข็งแรงของกระจกตาในกรณีที่ผู้ป่วยมีกระจกตาบางหรือทะลุ ซึ่งบำรุงราษฎร์ใช้เทคโนโลยีที่ทันสมัย เช่น กล้องผ่าตัดที่มีการผนวกเทคนิคที่ช่วยในการตรวจชั้นต่าง ๆ ของกระจกตาในระหว่างผ่าตัด ทำให้การผ่าตัดมีความแม่นยำสูงขึ้น และลดความเสี่ยงในการเกิดภาวะแทรกซ้อน
OUR SECRET DIARY
OUR SECRET DIARY #JFF2025
1 ชั่วโมง 50 นาที R:ท
©2023 "OUR SECRET DIARY" Film Partners JAPANESE (EN & TH Subs)เรื่องราวความรักอันอบอุ่นหัวใจของนักเรียนมัธยมปลายที่เริ่มต้นจากการแลกเปลี่ยนไดอารี่ด้วยความเข้าใจผิด นำแสดงโดย ฟูมิยะ ทาคาฮาชิ และ ฮิโยริ ซากูราดะ นักแสดงยอดนิยมที่เป็นที่พูดถึงอย่างมากในตอนนี้
8) แดชบอร์ดการดูแลสุขภาพและโค้ชอัตโนมัติ (Healthcare dashboards and auto-coaches)
8) แดชบอร์ดการดูแลสุขภาพและโค้ชอัตโนมัติ แดชบอร์ดข้อมูลสุขภาพอ้างว่าสามารถวิเคราะห์ข้อมูลสุขภาพส่วนบุคคลอย่างครอบคลุมเพื่อให้คำแนะนำด้านสุขภาพและไลฟ์สไตล์ที่เหมาะสมกับแต่ละคน ในทางทฤษฎีแล้ว แดชบอร์ดดังกล่าวมีแนวโน้มที่จะสังเคราะห์ข้อมูลจากแหล่งต่าง ๆ รวมถึงเทคโนโลยีที่สวมใส่ได้ บันทึกทางการแพทย์ และนิสัยส่วนตัว เพื่อให้ข้อมูลเชิงลึกและแนวทางสำหรับการใช้ชีวิตที่สุขภาพดีขึ้น อย่างไรก็ตาม ความเป็นจริงนั้นยังไม่เป็นไปตามที่คาดหวัง แม้ว่าแนวคิดของแพลตฟอร์มรวมศูนย์ที่สามารถให้คำแนะนำด้านสุขภาพเฉพาะบุคคลจะน่าสนใจ แต่เทคโนโลยีในปัจจุบันยังไม่ซับซ้อนเพียงพอที่จะตีความปัจจัยที่ซับซ้อนซึ่งส่งผลต่อสุขภาพของแต่ละบุคคลได้อย่างแม่นยำ ความท้าทายไม่ได้อยู่ที่การรวบรวมข้อมูลจำนวนมหาศาลเท่านั้น แต่ยังรวมถึงการทำความเข้าใจปฏิสัมพันธ์ที่ซับซ้อนระหว่างพันธุกรรม สิ่งแวดล้อม ไลฟ์สไตล์ และสุขภาพด้วย นอกจากนี้ แดชบอร์ดเหล่านี้มักขาดการตรวจสอบทางคลินิกที่จำเป็นเพื่อให้แน่ใจว่าคำแนะนำนั้นถูกต้องตามหลักการแพทย์ หากไม่มีการสนับสนุนทางวิทยาศาสตร์อย่างเข้มงวด คำแนะนำที่ให้มาอาจเป็นคำแนะนำทั่วไปหรือเลวร้ายกว่านั้น อาจเป็นอันตรายได้ ความกระตือรือร้นที่มีต่อแดชบอร์ดเหล่านี้ทำให้เกิดการอภิปรายและการคาดเดามากมาย จนบดบังการประเมินเชิงวิจารณ์เกี่ยวกับความสามารถและข้อจำกัดที่แท้จริงของแดชบอร์ดเหล่านี้มอบยาและเวชภัณฑ์ ให้กับสถานีตำรวจทางหลวง
Green Health Care&Share 2018.04.10 โดยนายวิรัช สุรจิต ผู้อำนวยการฝ่ายพัฒนาธุรกิจ โรงพยาบาลกรุงเทพจันทบุรี มอบยาและเวชภัณฑ์ ให้กับสถานีตำรวจทางหลวง 4 กองกำกับการ 3 กองบังคับการตำรวจทางหลวง เพื่อใช้ดูแลประชาชนที่เดินทางกลับภูมิลำเนาและท่องเที่ยวตามสถานที่ต่างๆในช่วงเทศกาลสงกรานต์ เมื่อวันที่ 10 เมษายน 2561
8. ผลกระทบทางลบจากการพนัน การเงิน หนี้พนัน ความสัมพันธ์และสุขภาพ
รายชื่อผู้บาดเจ็บ 8 ราย
รายชื่อผู้บาดเจ็บ 8 ราย นำส่งรักษาตัวที่ รพ.ลาดกระบัง
1. นายพรรษา พวงยี่โถ
2. นายศรศักดิ์ เหมือนพร้อม
3. นายสุเพท สุวรรณทา
4. นายวิสิทธ์ แจ้งทา
5. นายทัศนัย รัตนแสง
6. นส.มัจฉา เสียวสุข
7. นายณัฐพงษ์ มัคยุโก๊บ
8. นายอารักษ์ กิ่งดำ
การผ่าตัดเปลี่ยนกระจกตา มีด้วยกัน 2 วิธี คือ 1. การผ่าตัดปลูกถ่ายกระจกตาทุกชั้น เหมาะสำหรับผู้ป่วยที่มีปัญหาที่กระจกตาทุกชั้น และ 2. การผ่าตัดปลูกถ่ายกระจกตาเฉพาะชั้น เหมาะสำหรับผู้ป่วยที่มีปัญหาที่กระจกตาบางชั้นเท่านั้น โดยมีให้เลือกทั้งการปลูกถ่ายกระจกตาชั้นบน และการปลูกถ่ายกระจกตาชั้นใน ซึ่งเป็นเทคนิคที่ละเอียดอ่อนและมีความแม่นยำสูง และในกรณีผู้ป่วยที่มีโรคกระจกตาซับซ้อน ศูนย์ปลูกถ่ายกระจกตา โรงพยาบาลบำรุงราษฎร์ มีทีมแพทย์ผู้เชี่ยวชาญหลากหลายสาขา พร้อมเทคนิคการรักษาที่หลากหลาย เช่น เลเซอร์ PTK, ฉายแสง UV-A และการผ่าตัดใส่วงแหวน ซึ่งอาจใช้รักษาร่วมกับการปลูกถ่ายกระจกตาเพื่อปรับปรุงการมองเห็นให้ดีที่สุด
ด้วยประสบการณ์ความเชี่ยวชาญของทีมแพทย์และเทคโนโลยีที่ทันสมัย โรงพยาบาลบำรุงราษฎร์ประสบความสำเร็จในการปลูกถ่ายกระจกตาด้วยอัตราสูงถึง 97% โดยผู้ป่วยยังคงมองเห็นได้ชัดเจนหลังการผ่าตัด 1 ปี และไม่มีรายงานภาวะแทรกซ้อนใด ๆ เช่น การติดเชื้อ ทำให้ผู้ป่วยสามารถกลับมามองเห็นเป็นปกติได้
รายชื่อผู้บาดเจ็บ รักษาที่รพ.จุฬารัตน์ 9
1. นส. รัชนี นาคทรงแก้ว
2. นายธนดล คลังจินดา
3. นส.อุไรวรรณ วะเรืองรัมย์
4. นายศุภชัย พวงยี่โถ
5. นายอรัญ สังข์รักษ์
ประเทศไทยเองก็มีอัตราการเติบโตของการใช้ EV สูงที่สุดในกลุ่มประเทศอาเซียน โดยปี 2023 มียอดจดทะเบียนยานยนต์ไฟฟ้าสูงถึงสัดส่วนร้อยละ 12% ของรถยนต์นั่งส่วนบุคคลที่ขายใหม่ทั้งประเทศ จึงเกิดความต้องการเทคโนโลยีรีไซเคิลที่มีประสิทธิภาพสูง
ในกระบวนการรีไซเคิลแบตเตอรี่ในปัจจุบันมักอาศัยความร้อนสูง หรือใช้กระบวนการที่ต้องใช้สารเคมีที่เป็นพิษ ความพยายามหลีกเลี่ยงกระบวนการทั้งสองแบบนี้นำมาสู่เทคโนโลยีใหม่ที่ลดการใช้พลังงาน ซึ่งจะลดการปล่อยก๊าซเรือนกระจก ทำให้เกิดผลดีต่อสิ่งแวดล้อมในระยะยาว อีกทั้งยังเป็นการลดการใช้โลหะหนัก โดยบางกระบวนการลดได้มากถึง 90% หากเทียบทั้งกระบวนการ ตั้งแต่การทำเหมืองเพื่อให้ได้โลหะใหม่มาใช้
หัวใจหลักของเทคโนโลยีรีไซเคิลโดยตรงคือ จะไม่ใช่กระบวนการเผาด้วยความร้อนสูงที่มากกว่า 1,000 องศาเซลเซียสในเทคโนโลยีรีไซเคิลแบตเตอรี่แบบเดิมที่เรียกว่า ไพโรเมทัลเลอร์จี (pyrometallurgy) นอกจากนี้ ยังไม่ใช่กระบวนการที่ต้องใช้สารละลายเคมีแบบที่เรียกว่า ไฮโดรเมทัลเลอร์จี (hydrometallurgy) ซึ่งทำให้เกิดมลพิษต่อสิ่งแวดล้อมเป็นอย่างมาก
แต่เทคโนโลยีรีไซเคิลโดยตรงอาศัยกระบวนการทางกายภาพในการร่อน ตัด ย่อย บด และคัดแยกนำสารเพื่อนำกลับมาใช้สร้างเป็นขั้วแคโทด (cathode) ของแบตเตอรี่ขึ้นใหม่ ประเมินกันว่าเทคโนโลยีแบบนี้อาจไปถึงจุดที่นำชิ้นส่วนกลับมาใช้ได้มากถึง 90% อีกทั้งจะลดความต้องการสินแร่ใหม่เพื่อนำมาผลิตแบตเตอรี่ได้มากกว่า 25% ในปี 2030
การรีไซเคิลแบบนี้เหมาะกับแบตเตอรี่ที่ใช้ในยานยนต์ไฟฟ้าและแบตเตอรี่ในระบบกักเก็บพลังงาน เพื่อลดภาระต่อสิ่งแวดล้อม ส่งเสริมเศรษฐกิจแบบ BCG คาดว่าจะมีการเติบโตของอุตสาหกรรมที่ใช้เทคโนโลยีแบบนี้มากกว่า 20% โดยมี EBITDA margin ของอุตสาหกรรมนี้มากกว่า 10%
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตหนองจอก
8. หากป่วยด้วยอาการรุนแรงเกินศักยภาพคลินิก จะส่งต่อไป รพ.ขนาดใหญ่ในเขตตัวเองต่อไป
หากป่ว่ยด้วยอาการที่รุนแรงจนเกินศักยภาพที่คลินิกชุมชนอบอุ่น, คลินิกเฉพาะทางชุมชนอบอุ่น, ศูนย์บริการสาธารณสุข กทม. รักษาไหว ทั้งคลินิก-ศูนย์บริการฯ จะส่งผู้ป่วยไปรักษาต่อใน "โรงพยาบาลขนาดใหญ่" ในเขตตัวเองต่อไป
บริจาคโลหิต ณ ธนาคารเลือด รพ.ตำรวจ LINK
บริจาคโลหิต ณ ธนาคารเลือด อาคารมหาภูมิพลราชานุสรณ์ 88 พรรษา (มภร.) ชั้น7 โรงพยาบาลตำรวจ ได้ตั้งแต่เวลา 08.00 - 16.00 น.
ในวันและเวลาราชการ
โทร : 02-207-6000 ต่อ 10710
หน่วยรับบริจาคโลหิตเคลื่อนที่ 11-16 มค 2564 จ.สงขลา LINK
ภาคบริการโลหิตแห่งชาติที่ 12 จ.สงขลา สภากาชาดไทย
หน่วยรับบริจาคโลหิตเคลื่อนที่ วันที่ 11-16 มกราคม 2564 (ข้อมูล ณ วันที่ 11 มกราคม 2564)
#ผู้ป่วยรอคุณอยู่ #ร่วมส่งต่อโลหิตที่ปลอดภัยให้ผู้ป่วย #ใกล้ที่ไหนไปบริจาคที่นั่น
แค่แชร์ ก็ช่วยได้
หน่วยงานใดประสงค์จะบริจาคโลหิต สามารถติดต่อให้ภาคฯสงขลาไปรับบริจาคโลหิตถึงหน่วยงานของท่าน #เราพร้อมอำนวยความสะดวก
เป็นฮีโร่...ด้วยการบริจาคโลหิตผ่านวิกฤติโรคระบาด ส่งต่อโลหิตที่ปลอดภัยให้กับผู้ป่วย
ฝากคนไทยช่วยบอกต่อ บริจาคโลหิต ในภาวะวิกฤติ covid-19
คุณสมบัติผู้บริจาคโลหิต คลิก https://bit.ly/2waeyr2
สอบถามโทร. 074 240 220-1, 061-9805806
แต่หากทุกคนยังทำตัวเหมือนเดิม ไม่กักตัว ไม่ทำตามคำแนะนำ จะทำให้มีผู้ป่วยมากขึ้น จนอุปกรณ์และบุคคลการทางการแพทย์ไม่เพียงพอในการดูแลรักษา
9. ใบรับรองแพทย์ตัวจริง
9. ใบรับรองแพทย์ตัวจริง สามารถมารับได้ในวันถัดไป ด้วยตนเอง หรือมอบอำนาจให้ท่านอื่นมารับแทนได้
Cannabinol (CBN) Cannabigirol (CBG) Cannabichromene (CBC) LINK
Cannabinol (CBN)
สารประกอบสำคัญที่มีผลการทำงานเป็นยาช่วยในการนอนหลับ cannabinol มีอยู่เป็นสัดส่วนน้อย และพร้อมใช้งานน้อยกว่า CBD หรือ THC แม้ว่าจะเป็นหนึ่งใน cannabinoids แรกที่ถูกค้นพบ CBN ผลิตขึ้นเมื่อ THC ถูกออกซิไดซ์ซึ่งเป็นสาเหตุที่ทำให้ดอกกัญชาแห้งที่สัมผัสกับออกซิเจนสามารถเป็นแหล่งที่ดีสำหรับการสกัด CBN นอกเหนือจากการเป็นตัวช่วยในการนอนหลับที่มีประสิทธิภาพแล้ว CBN ยังร่วมกับ CBD และ THC ในคุณสมบัติต้านการอักเสบที่มีประสิทธิภาพ การบรรเทาอาการซึมเศร้า และภาวะทางระบบประสาทเช่นโรคลมชักและอัลไซเมอร์
Cannabigirol (CBG)
CBG เป็น cannabinoid ที่มีจำนวนน้อยมาก แต่มีประโยชน์ต่อการรักษาปัญหาที่เกี่ยวข้องกับโรคต้อหิน ภาวะซึมเศร้า และการบรรเทาอาการปวด รวมถึงมีส่วนเสริมความชุ่มชื้นให้ผิวตามธรรมชาติ CBD เป็นสารตั้งต้นทางเคมีให้กับ cannabinoids อื่น ๆ เช่น CBD และ THC เนื่องจากผ่านกระบวนแปรเคมีระหว่างการเจริญเติบโตของพืช ด้วยเหตุนี้จึงมักมีความสัมพันธ์ผกผันระหว่าง CBG ระดับสูงและ THC ระดับต่ำ CBG ไม่ทำให้มึนเมา
CBG ถูกค้นพบว่ามีประสิทธิภาพในการรักษาโรคต้อหินเนื่องจากช่วยลดความดันในลูกตา เป็นยาขยายหลอดเลือด และมีฤทธิ์ป้องกันระบบประสาท ในการทดลองพบว่า CBG มีประสิทธิภาพในการลดลักษณะการอักเสบของโรคลำไส้อักเสบ และ สามารถปกป้องเซลล์ประสาทในหนูที่เป็นโรคฮันติงตันซึ่งมีลักษณะการเสื่อมของเซลล์ประสาทในสมอง รวมถึงมีผลวิจัยเบื้องต้นที่บ่งชี้ว่า CBG อาจสามารถยับยั้งการเติบโตของเซลล์มะเร็งลำไส้ใหญ่และทวารหนัก
Cannabichromene (CBC)
CBC เป็นอีกหนึ่ง cannabinoid ที่ไม่ออกฤทธิ์ต่อจิตประสาทซึ่งแม้จะมีการค้นพบในทศวรรษที่ 1960 แต่ก็ยังไม่ได้รับการศึกษาอย่างละเอียด มีงานศึกษาบางตัวที่ชี้ว่า CBC เพิ่มคุณสมบัติในการบรรเทาอาการปวดของ THC และอาจมีคุณสมบัติในการต้านอาการซึมเศร้าที่มีประสิทธิภาพมากกว่า CBD นอกจากนี้ยังเกี่ยวข้องกับการรักษาอาการคลื่นไส้อาเจียน เป็นเรื่องของการศึกษาทางการแพทย์ต่อไป
สารประกอบอื่นๆ cannabinol (CBN), cannabigerol (CBG) และ cannabichromene (CBC) และการมีปฏิสัมพันธ์กับระบบ endocannabinoid ทั้งหมด ยังอยู่ในขั้นการศึกษาเพื่อดูว่าการนำมาใช้ประโยชน์จะมีผลที่ดีเช่นเดียวกับที่สาร THC ที่มีฤทธิ์ในการรักษาโรคหรือไม่
[สวัสดีคลินิกเวชกรรม]
นี่ก็ของร้านเขียวไข่กา เช่นกัน
ใช้กัญชาจากที่ไหน
วิสาหกิจชุมชนที่ปลูกอย่างถูกต้องค่ะตั้งแต่ต้นปีมีแรงซื้อเก็งก าไรในหุ้นที่คาดได้ประโยชน์จากน ากัญชงและกัญชาไปใช้ ดังนี้
ใกล้มือหมอ
แอพพลิเคชั่นที่จะช่วยให้ผู้ใช้สามารถตรวจคัดกรองโรคเบื้องต้น พร้อมทั้งยังสามารถบันทึกประวัติอาการเพื่อติดตามผลย้อนหลังได้ และสามารถค้นหาโรงพยาบาลใกล้เคียงจากตัวท่านได้อีกด้วย
คำเตือน: แอพพลิเคชั่นนี้มีข้อมูลบางส่วนที่เกี่ยวข้องกับสุขภาพและทางการแพทย์ ข้อมูลที่ท่านได้รับเป็นการตรวจคัดกรองโรคเบื้องต้นซึ่งท่านอาจจะไม่ได้เป็นโรคดังกล่าว การซื้อยามารับประทานเองโดยไม่ปรึกษาแพทย์หรือเภสัชกรนั้น อาจก่อให้เกิดอันตรายต่อสุขภาพ
หากท่านมีข้อกังวลหรือสงสัยเกี่ยวกับโรค ทางเราแนะนำให้ท่านขอคำแนะนำเพิ่มเติมจากแพทย์ผู้เชี่ยวชาญในโรงพยาบาลใกล้บ้านท่าน
สตูล จัดงานประเพณีสงกรานต์และนมัสการหลวงพ่อแก่ 11 – 15 เมย 64
สตูล เทศบาลตำบลฉลุง กำหนดจัดงานประเพณีสงกรานต์และนมัสการหลวงพ่อแก่ ระหว่างวันที่ 11 – 15 เมษายน 2564Q ถ้าไปในพื้นที่เสี่ยง แต่ไม่ได้สัมผัส ผู้ติดเชื้อและไม่มีอาการ อยากจะตรวจได้หรือไม่
9.1 ถ่ายภาพบัตรปชช และภาพตัวตนคู่กับบัตรปชช เพื่อใช้ยืนยัน
ประกันภัยแพ้วัคซีนโควิด-19 - กรุงศรี ออโต้ โบรคเกอร์ LINK
ผลประโยชน์กรณีได้รับผลกระทบจากการฉีดวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19)
- ค่ารักษาพยาบาลสำหรับผู้ป่วยใน วงเงินตลอดระยะเวลาเอาประกันภัย จ่ายตามจริงสูงสุดไม่เกิน 100,000 บาท
- เงินปลอบขวัญสำหรับผู้ป่วยในกรณีเข้าพักรักษาตัวในโรงพยาบาลติดต่อกันไม่น้อยกว่า 5 วัน ไม่เกิน 50,000 บาท
- การเจ็บป่วยระยะสุดท้าย และ/หรือ ภาวะโคม่า และ/หรือ ภาวะสมองตายและระบบประสาทล้มเหลว สูงสุดไม่เกิน 1,000,000 บาท
- การเสียชีวิต สูญเสียอวัยวะ สายตา หรือทุพพลภาพถาวรสิ้นเชิงเนื่องมาจากอุบัติเหตุ (อ.บ.1) สูงสุดไม่เกิน 100,000 บาท
อบจ.อุบลราชธานี ทุ่มงบกว่า 50 ล้านบาท จัดหาวัคซีนซิโนฟาร์ม LINK
31 พฤษภาคม 2564 นายกานต์ กัลป์ตินันท์ นายกอบจ.อุบลราชธานี เปิดเผยว่า อบจ.อุบลราชธานี เตรียมตั้งงบประมาณจัดซื้อวัคซีนป้องกันเชื้อไวรัสโควิด-19 ซิโนฟาร์ม จากราชวิทยาลัยจุฬาภรณ์ โดยเตรียมตั้งงบประมาณไว้ในการจัดซื้อกว่า 50 ล้านบาท เพื่อนำมาฉีดให้กับประชาชนในจังหวัดอุบลราชธานี ฟรี
นครสวรรค์ แจ้งผู้จะฉีดวัคซีนเข็ม 2 ลงชื่อผ่าน QR Code LINK
การลงทะเบียนโดย
1. การสแกน QR Code ระบุรายละเอียด
2. ผู้ดูแลระบบตรวจสอบประวัติการรับวัคซีน จากฐานข้อมูลกลางกระทรวงสาธารณสุข และนำรายชื่อเข้าวันนัดเข็ม 2 ของรพ.สปร.
3.รอรับแจ้งวันนัดหมายใหม่ จากแอป หมอพร้อม
หากไม่พบประวัติการได้รับวัคซีนเข็ม 1 ผู้ดูแลจะติดต่อกลับเพื่อให้นำหลักฐานการรับวัคซีนมาแสดง ก่อนวันรับวัคซีน 2 สัปดาห์
เขตลาดกระบัง ออกหน่วยเคลื่อนที่ 7-8 และ 13-14 กันยายน 64 LINK
สำนักงานเขตลาดกระบัง ร่วมกับศูนย์บริการสาธารณสุข 46 กันตารัติอุทิศ กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์ ประจำปี 2564 เพื่อรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี ให้กับสัตว์เลี้ยงของประชาชนในพื้นที่เขตลาดกระบัง ตามวันเวลาและสถานที่ ดังนี้
1. วัดพลมานีย์ วันที่ 7 กันยายน 2564
2. วัดสุทธาโภชน์ วันที่ 8 กันยายน 2564
3. วัดลานบุญ วันที่ 13 กันยายน 2564
4. วัดสังฆราชา วันที่ 14 กันยายน 2564
ตั้งแต่เวลา 09.00-11.00 น.
ทั้งนี้ เพื่อเป็นการป้องกันไม่ให้เกิดอันตรายต่อประชาชน และเป็นการระงับการแพร่ระบาดของโรคพิษสุนัขบ้าในสัตว์ในพื้นที่เขตลาดกระบัง
ขอเชิญชวนประชาชนที่อยู่ใกล้เคียง หรือผู้ที่สามารถนำสุนัขแมวมาฉีดได้ สามารถมารับบริการได้ตามจุดและวันเวลาที่กำหนด พร้อมทั้งให้เจ้าของนำบัตรประชาชนมาเพื่อทำทะเบียนด้วย สอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมฯ โทร.02 326 9008
สำหรับผู้ป่วยโควิด-19 ที่รักษาหายแล้ว ร่างกายจะมีภูมิต้านทานต่อเชื้อโรคนั้นโดยธรรมชาติ ในช่วงระยะเวลาหนึ่ง ซึ่งภูมิต้านทานจะมีมากหรือน้อย ขึ้นกับแต่ละบุคคล
เมื่อไหร่ถึงควรฉีด และควรฉีดกี่เข็ม
โดยส่วนใหญ่ในช่วงเวลาประมาณ 2 เดือนจากการติดเชื้อโควิดและรักษาหายแล้วจะยังมีภูมิต้านทานอยู่ในร่างกาย แต่ภูมิต้านทานนั้นจะค่อย ๆ ลดลง ทำให้มีโอกาสที่จะติดเชื้อได้ใหม่ เพราะฉะนั้นควรฉีดวัคซีนป้องกันโควิด-19 หลังจากที่รักษาหายแล้วภายใน 3-6 เดือน เพราะเป็นช่วงที่ภูมิคุ้มกันเริ่มตกลง และเนื่องจากมีภูมิคุ้มกันตามธรรมชาติเบื้องต้นอยู่แล้ว การฉีดวัคซีนเพิ่มอีก 1 เข็ม ซึ่งแนะนำเป็นวัคซีนในกลุ่ม mRNA โดยพบว่าจะมีระดับภูมิต้านทานสูงกว่าผู้ที่ไม่เคยติดเชื้อมาก่อน
แต่หากอยู่ในระยะกักตัว ไม่แนะนำให้ไปรับวัคซีน ควรรอจนพ้นระยะก่อนแต่อย่างไรก็ตามหากได้รับวัคซีนในขณะที่ติดเชื้อแบบไม่มีอาการโดยไม่รู้ตัว ไม่มีผลอันตรายใดๆ
ผู้เป็นกลุ่มเสี่ยง อายุมากกว่า 60ปี เลี่ยงออกนอกบ้าน (เว้นจำเป็น-น้อยครั้งและสั้นที่สุด)
เขตสุขภาพที่ 8 อุดรธานี หนองคาย
สำนักงานป้องกันควบคุมโรคที่ 8 จังหวัดอุดรธานี
-เบอร์โทรศัพท์: 042 219 168
-เว็บไซต์: https://ddc.moph.go.th/odpc8/ (ยังไม่เปิดให้บริการ)
หนองคาย
- สำนักงานสาธารณสุขจังหวัดหนองคาย
เบอร์โทรศัพท์: 042 465 067
เว็บไซต์: https://wwwnko.moph.go.th/main_new/
อุดรธานี
- สำนักงานสาธารณสุขจังหวัดอุดรธานี
เบอร์โทรศัพท์: 042 222 256
เว็บไซต์: https://www.udo.moph.go.th/wasabi3/Home.phpห้วยขวาง เดินเครื่องสูบน้ำและตรวจสอบสภาพน้ำท่วมขัง LINK
สำนักงาน
เขตห้วยขวาง เดินเครื่องสูบน้ำและตรวจสอบสภาพน้ำท่วมขัง จุดเสี่ยงน้ำท่วมขังในพื้นที่เขต 30 ก.ย. 64 นายอนุชิต พิพิธกุล ผู้อำนวยการเขตห้วยขวาง มอบหมายให้นายสุรกิตย์ คูศรีเทพประทาน หัวหน้าฝ่ายโยธา และนายนิเวศน์ เกตุสุวรรณ หัวหน้ากลุ่มงานระบายน้ำ ฝ่ายโยธา ติดตามสถานการณ์ฝนตกในพื้นที่ จัดเจ้าหน้าที่หน่วย BEST เดินเครื่องสูบน้ำ เพื่อเร่งการระบายน้ำ บริเวณจุดเสี่ยงน้ำท่วมขังในพื้นที่เขต จัดเจ้าหน้าที่ตรวจสอบและดำเนินการซ่อมแซมผิวจราจรชำรุด บริเวณ ทางคู่ขนานถนนพระราม9 ก่อนถึงถนนพระราม 9 ซอย 17 เพื่อป้องกันอุบัติเหตุและแก้ไขปัญหาความเดือดร้อนของประชาชนที่ใช้ทาง มอบหมายให้นายธีระชัย อินทร์สุวรรณ์ หัวหน้าฝ่ายรักษาความสะอาดฯ จัดเจ้าหน้าที่กวาด เก็บกวาดและเก็บขยะหน้าตะแกรงรับน้ำฝนและท่อระบายน้ำ ถนนในพื้นที่เขต
MUx แหล่งเรียนรู้ มหาวิทยาลัยมหิดล LINK
มหาวิทยาลัยมหิดลเปิดแหล่งเรียนรู้ MUx ที่ตอบสนองต่อความต้องการของผู้เรียนให้สามารถเข้าถึงแหล่งข้อมูลการเรียนรู้ได้ทุกที่ ทุกเวลา
ประหยัดเวลาและระยะทาง
เนื่องจากเป็นระบบการเรียนการสอนผ่านออนไลน์ ผู้เรียนจึงสามารถเข้าเรียนในช่วงเวลาใดและเรียนที่ไหนก็ได้
เข้าถึงได้ง่าย
ผู้เรียนสามารถเข้าเรียนผ่านอุปกรณ์สื่อสารทุกชนิด
ผู้เรียนเป็นศูนย์กลาง
ผู้เรียนสามารถเลือกวิชาที่อยากเรียนได้ตามใจชอบ
ปฏิสัมพันธ์ระหว่างผู้สอนและผู้เรียน
ผู้เรียนสามารถสร้างปฏิสัมพันธ์ระหว่างผู้สอนผ่านระบบPersonal Message
นายกรัฐมนตรีบอริส จอห์นสัน
27 มีนาคม นายกรัฐมนตรีวัย 57 ปี ได้รับแจ้งว่ามีผลตรวจโควิดเป็นบวก ช่วงแรกเขามีอาการเป็นไข้อ่อนๆและไอบ้าง ช่วงที่แยกกักตัวเขายังคงทำหน้าที่นายกฯ ต่อไปผ่านการประชุมออนไลน์ 5 เมษายน เขาต้องเข้าโรงพยาบาล และอาการแย่ลงจนต้องเข้าห้องไอซียูวันที่ เขากลับมาทำหน้าที่อีกครั้งเมื่อ 26 เมษายน
อบจ.เชียงใหม่ แจ้งผู้มีสิทธิ์รับวัคซีน Moderna ตรวจรายชื่อ LINK
องค์การบริหารส่วนจังหวัดเชียงใหม่ ร่วมกับสภากาชาดไทย จังหวัดเชียงใหม่ สำนักงานสาธารณสุขจังหวัดเชียงใหม่ และโรงพยาบาลประจำอำเภอทุกแห่งในจังหวัดเชียงใหม่ ขอประชาสัมพันธ์ข่าวสารการฉีดวัคซีนป้องกันโควิด 19 Moderna ขององค์การบริหารส่วนจังหวัดเชียงใหม่ ตามศูนย์ฉีดต่างๆในจังหวัดเชียงใหม่
4. เฉพาะวัคซีนแบบ Novavax ที่นับเป็นวัคซีนเชื้อตายจริงหรือไม่?
ตามชื่อนั่นแหละที่ว่า วัคซีนเชื้อตายก็คือมีส่วนประกอบของไวรัสตายแล้ว และไม่สามารถเพิ่มจำนวนได้อีกต่อไป แต่รวมไปถึงยังสามารถเป็นวัคซีนที่มีส่วนประกอบของเชื้อไวรัสบางส่วนด้วย ศูนย์สุขศึกษาของเยอรมันได้เขียนอธิบายไว้ว่า "สิ่งเหล่านี้ถูกตรวจพบโดยร่างกายว่า เป็นสิ่งแปลกปลอม และไปกระตุ้นระบบป้องกันของร่างกายของตัวเองให้ผลิตแอนติบอดีโดยไม่ก่อให้เกิดโรค"
และนั่นหมายความว่า ในความเป็นจริงนั้น ไม่เพียงแค่วัคซีนของ Novavax เท่านั้นที่ถูกนับเป็นวัคซีนเชื้อตาย จริงๆแล้วนิยามของวัคซีนกลุ่มนี้ก็ยังสามารถใช้กับวัคซีน mRNA และวัคซีนเวกเตอร์ได้ด้วยเช่นกัน โดยสถาบัน Robert Koch (RKI) ของเยอรมันได้เขียนบนเว็บไซต์อย่างเป็นทางการถึงวัคซีนที่ได้รับการอนุมัติทั้งหมดในสหภาพยุโรปจนถึงปัจจุบันว่า “วัคซีนโควิด-19 ที่ได้รับการอนุมัติใน EU ทั้งหมด ไม่มีส่วนประกอบของไวรัสใด ๆ ที่สามารถเพิ่มจำนวนได้ และด้วยเหตุผลนี้วัคซีนทุกตัวก็เทียบเท่ากับวัคซีนเชื้อตายนั่นเอง”
คำนิยม "วัคซีนเชื้อตาย" ไม่ได้ถูกระบุไว้ชัดเจนนัก หากคำจำกัดความ คือ ต้องมีส่วนประกอบของไวรัสจริงหรืออย่างน้อยก็บางส่วนของไวรัสในวัคซีน วัคซีนของ Novavax จริงๆแล้วก็ไม่ใช่วัคซีนเชื้อตายในความหมายนี้ เนื่องจากองค์ประกอบสำคัญที่กระตุ้นการตอบสนองของภูมิคุ้มกันไม่ได้มาจากไวรัสจริง แต่เป็นโปรตีนจากไวรัสที่ถูกสร้างขึ้นมาจากการดัดแปลงพันธุกรรม Carsten Watzl เลขาธิการสมาคมภูมิคุ้มกันวิทยาแห่งเยอรมนี (German Society for Immunology) ระบุว่า “คนมักจะเข้าใจกัน (ผิด) ว่า วัคซีนเนื้อตาย ก็คือ วัคซีนที่ถูกพัฒนาและผลิตโดยวิธีดั้งเดิมที่รู้จักกันจากวัคซีนตัวอื่นๆแค่นั้น”
Lux Yim ลักซ์ยิ้ม สุขภาพดี มีรอยยิ้ม จากกลุ่มวิสาหกิจ จ.หนองคาย
Lux Yim ลักซ์ยิ้ม สุขภาพดี มีรอยยิ้ม จากกลุ่มวิสาหกิจ จ.หนองคาย มาด้วยผลิตภัณฑ์หลากหลาย ขายพร้อมการท่องเที่ยว ที่เป็นจุดเด่นของย่านนี้อยู่แล้ว
เครื่องดื่มน้ำนมข้าวผสมกัญ มีข้าวหลากสี ได้แก่ข้าวขาวหอมมะลิ ข้าวกล้องแดง ข้าวกล้องดำ จากเครื่องข่าย รพ.สิรินธร จ.ร้อยเอ็ด
สปส. กรุงเทพมหานครพื้นที่ 9 LINK
เลขที่ 10/1273-8 ถนนนวมินทร์(สุขาภิบาล 1) แขวงคลองกุ่ม เขตบึงกุ่ม กทม. 10240
** สถานที่ : ใกล้กับท็อปส์ซุปเปอร์มาร์เก็ต **
รับผิดชอบเขต คันนายาว บางกะปิ ลาดพร้าว วังทองหลาง บึงกุ่ม
Facebook พื้นที่ 9 แผนที่
Tel. 02-3792925, 02-379292, 02-3792923, 02-3792963, 02-3792833, 02-3792834, 02-3792961, 02-3792926, 02-7334111 - 20, 02-3792928
Fax 02-3792836
ฝ่ายอำนวยการ 02-3792928
งานสิทธิประโยชน์ทดแทน 02-3792925
งานกองทุนเงินทดแทน 02-3792927
งานการเงินและบัญชี
งานเกี่ยวกับเงินสมทบและงานเร่งรัดหนี้
งานตรวจสอบบัญชีค่าจ้าง 02-3792961, 02-3792962-63, 02-3792923
งานทะเบียนและประสานการแพทย์ 02-3792833 - 34
รพ.สมเด็จพระพุทธเลิศหล้า เปิด walk in ฉีดเข็ม 1-3 เดือนกุมภาพันธ์
รพ.สมเด็จพระพุทธเลิศหล้า เปิด walk in ฉีดเข็ม 1-3 วันที่ 2,8,9,14,17,18 กุมภาพันธ์ 2565 ตั้งแต่เวลา 8.30-14 น. ณ หอประชุมอบจ.สมุทรสงคราม
สอบถามโทร 065-9344842 (เวลาราชการ) 098-2544181 (นอกเวลาราชการ ถึง 21 น.)
ยาแก้ไอมะขามป้อม ขับเสมหะ บรรเทาอาการไอ LINK
มะขามป้อม จัดเป็นผลไม้เพื่อสุขภาพและเป็นสมุนไพรพื้นบ้านชนิดหนึ่งมีสารต้านอนุมูลอิสระและวิตามินซีสูงมาก มะขามป้อมมีประโยชน์มากมาย และยังใช้เป็นยารักษาโรคได้อีกด้วย
ยาแก้ไขมะขามป้อม มี 2 ตำรับ
คลิกดูสูตรทั้งสองตำรับ
ข้อห้ามใช้ ผู้ป่วยเบาหวานที่ไม่สามารถควบคุมระดับน้ำตาลในเลือดได้
ข้อควรระวัง ควรระวังการใช้ในผู้ป่วยที่ท้องเสียง่าย เนื่องจากมะขามป้อมมีฤทธิ์เป็นยาระบาย
ศูนย์ความเป็นเลิศด้านกายอุปกรณ์ ชั้นที่ 2 ตึกโรงเรียนกายอุปกรณ์สิรินธร LINK
ศูนย์แห่งนี้ เกิดจากความร่วมมือกันของคณะแพทยศาสตร์ศิริราชพยาบาล ม.มหิดล และ บริษัท Scandinavian Orthopedic Laboratory (SOL) จากสวีเดน ซึ่งเป็นผู้เชี่ยวชาญด้านกายอุปกรณ์อันเป็นที่ยอมรับในระดับสากล CEPO ให้บริการ
- บริการกายอุปกรณ์เทียม (แขน ขา เทียม)
- บริการกายอุปกรณ์เสริม
- บริการแผ่นรองเท้าเเละรองเท้าแตะตัดเฉพาะบุคคล
- กายอุปกรณ์เทียมแบบซิลิโคน
วันเเละเวลาทำการ: จันทร์-ศุกร์ เวลา 9.00-16.00 น.
**ปิดทำการวันหยุดสุดสัปดาห์และวันหยุดนักขัตฤกษ์
Tel: 02-4193456 Tel: 063-9034330
Facebook
facebook.com/CEPObySIRIRAJandSOL1. การได้รับวัคซีนอย่างน้อย 1 โดส
ผู้ที่จะเดินทางเข้าสหภาพยุโรป หรือประเทศอื่นๆ ที่ใช้ EU DCC ร่วมกันได้ จะต้องเป็นผู้ที่ ได้รับวัคซีนต้านโควิด-19 แล้ว ครบ 2 โดส หรือ 14 วัน หลังจากได้รับวัคซีนโดสล่าสุด
* วัคซีนที่องค์การยายุโรป (EMA) และ/หรือ องค์การอนามัยโลก (WHO) รับรอง
4) Wellness and Prevention การส่งเสริมสุขภาพและการป้องกัน
Wellness and Prevention การส่งเสริมสุขภาพและการป้องกัน นับเป็นเทรนด์ที่สำคัญของการแพทย์ในอนาคต ที่บำรุงราษฎร์ได้บุกเบิกมากว่า 21 ปี โดยมีศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ที่ให้บริการดูแลสุขภาพเฉพาะบุคคลด้วยวิทยาการทางการแพทย์ที่ทันสมัย นอกจากนี้ บำรุงราษฎร์ยังมีการดูแลสุขภาพในเชิงลึกระดับยีน โดยการตรวจยีน เพื่อป้องกันก่อนเกิดโรค (Genetic Testing) เพื่อคาดคะเนสุขภาพในอนาคต ทำให้วางแผนและป้องกันการเกิดโรคร้ายบางชนิดได้อย่างถูกต้อง ลดความเสี่ยงในการแพ้ยาและทำนายการตอบสนองของยา ช่วยให้เลือกใช้ยาและขนาดยาได้อย่างเหมาะสมและช่วยวางแผนการมีบุตร โดยตรวจโรคทางกรรมพันธุ์บางชนิดที่อาจถ่ายทอดจากพ่อแม่สู่ลูกข้อมูลน่าสนใจสำหรับผู้ประกันตน
PMG Hospital Drive to Home บริการตรวจโควิด-19 ถึงบ้าน (รายบุคคล/กลุ่ม 20 คน)
✨ตรวจ RT-PCR ถึงบ้าน ราคา 3,000 บาท/ท่าน #สิ่งที่ได้รับ
1. ใบรับรองผลตรวจโควิด-19 RT-PCR
2. ใบรับรองแพทย์ (ถ้าลูกค้าต้องการฉบับจริง รพ.จะจัดส่งทางปณ.ฟรี)
3. มีเจ้าหน้าที่ไป SWAB ถึงที่บ้านฟรี ลดค่าใช้จ่ายในการเดินทางมาที่โรงพยาบาล ไม่ต้องรอคิวตรวจนาน สะดวกสบายต่อลูกค้าเพราะสามารถเลือกวันเวลาตรวจได้
✨ตรวจ ATK ถึงบ้าน ราคา 1,200 บาท/ท่าน #สิ่งที่ได้รับ
1. ใบรับรองผลตรวจโควิด-19 ATK
2. ใบรับรองแพทย์ (ถ้าลูกค้าต้องการฉบับจริง รพ.จะจัดส่งทางปณ.ฟรี)
3. มีเจ้าหน้าที่ไป SWAB ถึงที่บ้านฟรี ลดค่าใช้จ่ายในการเดินทางมาที่โรงพยาบาล ไม่ต้องรอคิวตรวจนาน สะดวกสบายต่อลูกค้าเพราะสามารถเลือกวันเวลาตรวจได้
✨ตรวจ ATK ถึงบ้าน (สำหรับ 20 คนขึ้นไป) ราคา 200 บาท/ท่าน #สิ่งที่ได้รับ
1. ใบรับรองผลตรวจโควิด-19 ATK
2. มีเจ้าหน้าที่ไป SWAB ถึงที่บ้านฟรี ลดค่าใช้จ่ายในการเดินทางมาที่โรงพยาบาล ไม่ต้องรอคิวตรวจนาน สะดวกสบายต่อลูกค้าเพราะสามารถเลือกวันเวลาตรวจได้
หมายเหตุ - แพ็กเกจ ATK 200 บาท/ท่าน ราคานี้ไม่รวมใบรับรองแพทย์ หากต้องการใบรับรองแพทย์เพิ่ม มีค่าใช้จ่าย 200 บาท/ท่าน (รวมเป็นค่าใช้จ่าย 400 บาท/ท่าน)
สอบถามเพิ่มเติม โทร 02-4514920
HOME ISOLATION โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ LINK
HOME ISOLATION โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์
-เป็นผู้ป่วยกลุ่มอาการสีเขียว คือ ไม่มีอาการหรือมีอาการเล็กน้อย
-สามารถกักตัวที่บ้านได้
-อายุไม่เกิน 75 ปี มีโรคประจำตัวที่สามารถควบคุมได้
ช่องทางการติดต่อ
-ผู้ป่วยที่ผล ATK+ หรือ RT-PCR Detected ที่ต้องการเข้าโครงการ Home Isolation
กับทางโรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์
ติดต่อลงทะเบียนด้วยตัวเองได้ที่ อาคารจอดรถ ชั้น 2 ทุกวัน ตั้งแต่เวลา 08.00 – 16.00 น.
จำกัดจำนวน 400 คิวต่อวัน
สอบถามเพิ่มเติม : 1218 กด 11
จุฬารัตน์ 3 อินเตอร์ แพ็กเกจอาการโควิด-19 ระยะยาว พิเศษ 2,500 บาท
โรงพยาบาลจุฬารัตน์ 3 อินเตอร์ แพ็กเกจสำหรับอาการโควิด-19 ระยะยาว (Long COVID) ราคาพิเศษ 2,500 บาท (จากปกติ 5,050 บาท) ตรวจเพื่อคัดกรองการทำงานของระบบต่างๆ ซึ่งเป็นสาเหตุของความไม่ปรกติที่เกิดหลังจากหายจากการติดเชื้อโควิด **แนะนำตรวจหลังจากหายป่วยแล้ว 2 สัปดาห์
รายการตรวจสุขภาพ ตั้งแต่ ซักประวัติและตรวจร่างกายโดยแพทย์ เอกซเรย์ปอด Chest X-ray ตรวจคลื่นไฟฟ้าหัวใจ EKG ตรวจความสมบูรณ์ของเลือด CBC ตรวจการทำงานของตับ ALT, AST ตรวจกาค่าบ่งชี้การอักเสบ CRP ตรวจวินิจฉัยภาวะอุดตับของเส้นเลือด D-Dimer ตรวจหาภูมิคุ้มกันโควิด Covid-19 Quantitative
โรงพยาบาลวิชัยยุทธ โปรฯ วัคซีนโมเดอร์นา ซื้อแล้วฉีดทันที 799 บาท/เข็ม
โรงพยาบาลวิชัยยุทธ วัคซีนโมเดอร์นา ซื้อแล้วฉีดทันที 799 บาท/เข็ม (100 ไมโครกรัม) walk in เข้ารับบริการได้เลย
▪️ ราคาเข็มละ 799 บาท/เข็ม (100 ไมโครกรัม) จากปกติ 1,650 บาท (ราคานี้รวมค่าแพทย์ และค่าบริการผู้ป่วยนอกแล้ว)
▪️ เปิดบริการทุกวัน เวลา 08.30-15.00 น. (ยกเว้นวันหยุดนักขัตฤกษ์ 6 และ 13-15 เมษายน 2565)
▪️ โปรโมชันตั้งแต่วันที่ 18 มีนาคม 2565 - 28 เมษายน 2565
▪️ Voucher วัคซีนโมเดอร์นาสามารถใช้ได้ถึงวันที่ 30 มิถุนายน 2565
ป่วยโควิด-19 รักษา ฟรี โรงพยาบาลประชาพัฒน์ LINK
ป่วยโควิด-19 รักษา”ฟรี”
✅สิทธิ30บาท ทั้งใน กทม.และต่างจังหวัด
✅สิทธิประกันสังคมทุกโรงพยาบาล
✅แรงงานต่างด้าวไร้สิทธิการรักษา
ผลตรวจ”ATK+ (POSITIVE)
✅เข้ากักตัว พร้อมตรวจ PCR ให้ฟรีทันที
✅ดูแลติดตามอาการผู้ใกล้ชิดหรือคนในครอบครัว
- หากผล DETECTED รักษาต่อทันที
- หากผล UNDETECTED ส่งกลับบ้านและติดตามอาการหลังออกจากโรงพยาบาลอย่างใกล้ชิด
ด้านการ”แพทย์และการพยาบาล”
✅เอ็กซเรย์ปอดด้วยระบบดิจิตอล
✅ดูแลโดยแพทย์ผู้เชี่ยวชาญด้านการรักษาโควิด-19 โดยเฉพาะ
✅คุณหมอและพยาบาลเข้าเยี่ยมทุกวัน
✅ตรวจหาโรคแทรกซ้อนที่อาจเกิดอันตรายร้ายแรง
ด้านการ”บริการ”
✅บริการรถรับ-ส่ง
✅อาหารฟรี3มื้อ ,น้ำเปล่า
✅บริการให้คำปรึกษาตลอดการรักษา
แผนกการตลาด โทร 024279966 ต่อ 506,512
อ.เดชอุดม รพร.-สสจ.เดชอุดม และรพ.สต.
ยาสมุนไพรประเภทชาชง
ชาชงขิง ชาชงชุมเห็ดเทศ ชาชงตะไคร้ ชาชงใบเตย ชาชงใบม่อนพลัส ชาชงรางจืด ชาชงหญ้าหนวดแมว ชาชงหญ้าดอกขาว
โรงพยาบาลปทุมธานี เปิดลงทะเบียนฉีดวัคซีนกลุ่มเด็ก อายุ 5-11 ปี LINK
เปิดลงทะเบียนฉีดวัคซีนกลุ่มเด็ก อายุ 5-11 ปี (Pfizer ฝาส้ม)
สำหรับฉีดในวันที่ 27-29 เมษายน 2565 วันละ 100 คน
แสกน QR code เพื่อลงทะเบียนตามวันที่ต้องการ และจะประกาศผลการลงทะเบียนทาง FaCebbok
เปิดให้บริการฉีดในช่วง เวลา 13.00-14.30 น.
ณ ลานหน้าอาคารเภสัชกรรม โรงพยาบาลปทุมธานี
วิธีใช้เครื่องวัดอ๊อกซิเจน
ศูนย์ปันน้ำใจแพทย์นาวี โรงพยาบาลสมเด็จพระนางเจ้าสิริกิติ์ LINK
"คุณไม่ใช้ เราขอเป็นสะพานบุญ"
ศูนย์ปันน้ำใจแพทย์นาวี โรงพยาบาลสมเด็จพระนางเจ้าสิริกิติ์ ขอเชิญชวน ร่วมบริจาคสิ่งอุปกรณ์ทางการแพทย์ เพื่อช่วยผู้สูงอายุที่ต้องการความช่วยเหลือ
พื้นที่สัตหีบ : โรงพยาบาลสมเด็จพระนางเจ้าสิริกิติ์ แผนกเยี่ยมบ้าน อาคารผู้ป่วย 1 ชั้น 6 ติดต่อโทร : 038-933938
พื้นที่กรุงเทพ : มูลนิธิสมเด็จพระปิ่นเกล้า ติดต่อโทร : 024752737
Dr. Kuruwin Limsamutpetch, Radiologist at Bumrungrad International Hospital, adds, “The Radiology INSIGHT CXR is like an assistant to radiologists in spotting abnormalities in the lung - like malignant tumors, including small ones hidden in spots that are hard to diagnose. Moreover, Radiology INSIGHT CXR can detect active tuberculosis and diagnose emergency cases like pneumothorax. At the onset of pneumothorax, when air leaks just a little bit into the space between the lung and chest wall, the patient may not have any symptoms or just mild chest pain. If radiologists can diagnose it early and the Radiology AI results come quickly, the patient will not miss the chance to be treated. Research findings show that early diagnosed, lung cancer patients have a 5-year survival rate of 73%. But if it is diagnosed later, the rate drops to just 18%.
สวนสันติภาพ พื้นที่ 20 งาน
สวนสันติภาพ เป็นสวนสาธารณะขนาดเล็กเพียง 20 งาน สร้างขึ้นบนที่ดินซึ่งกทม.เช่าจากสำนักงานทรัพย์สินส่วนพระมหากษัตริย์ โดยจัดเป็นพื้นที่สีเขียวสำหรับพักผ่อนหย่อนใจของประชาชนในใจกลางเมือง ลักษณะเป็นสวนป่าที่ร่มรื่น ด้วยความหลากหลายของไม้ยืนต้น ไม้ดอกนานาชนิด ชื่อ "สวนสันติภาพ" ตั้งขึ้นเพื่อเป็นที่ระลึกถึงวันสิ้นสุดสงครามโลก ครั้งที่ 2 คือวันที่ 16 สิงหาคม 2488 ซึ่งถือเป็นวันสันติภาพของมนุษย์ตัวอักษรที่เป็นชื่อสวนแห่งนี้นำมาจากลายมือของท่านพุทธทาสภิกขุ จุดเด่นของสวนแห่งนี้ก็คือประติมากรรมนกคาบช่อมะกอก ซึ่งแทนสื่อสันติภาพของโลก โดยนำมาจากผลงานของ ปิกัสโซ (Picasso) ศิลปินชาวสเปน เปิดให้บริการทุกวัน 05.00 -21.00 น.ชุมชนท่องเที่ยวนวัตวิถีบ้านนครชุม อ.เมือง จ.กำแพงเพชร
ชุมชนท่องเที่ยวนวัตวิถีบ้านนครชุม ชุมชนท่องเที่ยวotop นวัติวิถี มีของดีมากมาย แหล่งเรียนรู้ภูมิปัญา ครบเครื่องทั้งประวัติศาสตร์ วัฒนธรรม อาหารพื้นถิ่น
ที่อยู่ ตำบล นครชุม อำเภอเมืองกำแพงเพชร กำแพงเพชร 62000
คลินิกเวชกรรม สวท ภูเก็ต LINK
คลินิกเวชกรรม สวท ภูเก็ต
เลขที่ 14/1 อาคารเซ็นทรัลแมนชั่น ชั้นที่ 1 ห้องเลขที่ 107-108 ถนนวิชิตสงคราม ตำบลวิชิต อำเภอเมือง จังหวัดภูเก็ต 83000
เปิดทำการ : พฤหัสบดี เวลา 11.00-18.00 น.
ปิดทำการ : ศุกร์ – พุธ และ วันหยุดนักขัตฤกษ์
085-585-9580
087-969-3702
ส่วนสมุยเป็นสถานที่ที่นักท่องเที่ยวให้ความสนใจมาท่องเที่ยวเป็นจำนวนมาก และติดอันดับที่ 2 ประเภทเกาะที่ดีที่สุดในเอเชียตะวันออกเฉียงใต้ จากนิตยสารท่องเที่ยว Travel+Leisure ของสหรัฐอเมริกา ซึ่งเป็นผลสำรวจการนับคะแนนโหวตจากนักท่องเที่ยวทั่วโลก รางวัลยอดเยี่ยมแห่งเอเชีย ประจำปี 2022 (Asia’s Best Awards 2022) และจากตัวเลขของนักท่องเที่ยวในปี 2019 เดินทางเข้าสมุยทางอากาศ เป็นจํานวน 2.5 ล้านคน มีเที่ยวบินประมาณ 60-70 เที่ยวบินต่อวัน ตัวเลขดังกล่าวบ่งบอกให้เห็นถึงศักยภาพและความสนใจของนักท่องเที่ยว ที่จะเดินทางเยือนเกาะสมุยอย่างแท้จริง ยิ่งไปกว่านั้นเสน่ห์ที่ดึงดูดความน่าสนใจและสร้างมนต์ขลังให้เกาะสมุยนั่นก็คือเกาะสมุยยังคงหลงเหลือความเป็นธรรมชาตินอกจากหาดทรายที่สวยงามยังมีเกาะแก่ง เช่น เกาะเต่า เกาะพงันรายล้อมมากมาย ธรรมชาติใต้น้ำที่ยังไม่ถูกทำลาย พร้อมด้วยวิถีชีวิตความเป็นท้องถิ่น ที่มีความเป็นเอกลักษณ์ มีเสน่ห์ ให้ความสุขความเพลิดเพลินในด้านความสุขทางกายและจิตใจครบทุกมิติ ซึ่งเหมาะกับโมเดล Wellness Tourism ตอบโจทย์นักท่องเที่ยว กลุ่มไลฟ์สไตล์ที่หลงรักและชื่นชอบธรรมชาติ
อันดับที่ 9 รพ.บางปะกอก9 อินเตอร์ฯ 75.74%
อีกหนึ่งศักยภาพของโรงพยาบาลฝั่งธนบุรีที่ขึ้นมาผงาดในท็อปเท็นของการจัดอันดับนี้ โรงพยาบาลบางปะกอก 9 อินเตอร์เนชั่นแนล ยกระดับการพัฒนาองค์กร องค์ความรู้ มาตรฐานและเทคโนโลยี ไปสู่ระดับนานาชาติ รวมถึงการมุ่งขยายเครือข่ายการบริการของโรงพยาบาลอย่างรวดเร็ว ครอบคลุมในพื้นที่ที่มีฐานประชากรหนาแน่นและเน้นจุดที่เป็นพื้นที่อุตสาหกรรมเป็นสำคัญ ทำให้เครืองโรงพยาบาลบางปะกอก ที่ปัจจุบันมีอยู่ 7 แห่ง สามารถเข้าถึงและดูแลประชาชนได้ในหลากหลายระดับ รองรับฐานประชากรที่ขยายตัวและเติบโตอย่างรวดเร็วได้ ขณะที่ยังคงรักษาระดับคุณภาพการบริการต่างๆไว้ได้ในระดับที่ยอดเยี่ยม การติดท็อปเท็นในอันดับที่ 9 จึงเหมาะสม
แอ่วพะเยา เบาเบา บันดาลใจ in Green Season @พะเยา ตลอดเดือนสิงหาคม - กันยายน 2565
แอ่วพะเยา เบาเบา บันดาลใจ in Green Season @พะเยา
ททท.เชียงราย ชวนเที่ยวเมืองพะเยา ตลอดเดือนสิงหาคม - กันยายน 2565
ปทุมวัน ตรวจแนะนำสถานบริการ ผับ บาร์ คาราโอเกะ เน้นป้องกันโควิด และตรวจทางหนีไฟ LINK
10 สิงหาคม 2565 นางมาศวัลย์ ปิ่นสุวรรณ ผู้อำนวยการเขตปทุมวัน พร้อมด้วยนางสาวศศิธร เจริญสุข ผู้ช่วยผู้อำนวยการเขตปทุมวัน หัวหน้าฝ่ายเทศกิจ หัวหน้าฝ่ายสิ่งแวดล้อมและสุขาภิบาล และเจ้าหน้าที่เขตปทุมวัน ร่วมกับเจ้าหน้าที่สำนักงานสรรพสามิตพื้นที่กรุงเทพมหานคร 2 และสถานีดับเพลิงบรรทัดทอง ดำเนินการตรวจแนะนำสถานบริการ สถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ หรือสถานที่อื่นที่มีลักษณะคล้ายกัน ตามคำสั่ง คสช. ที่ 22/2558 และคำสั่ง คสช.ที่ 46/2559 และกำกับดูแลให้สถานประกอบการดำเนินการตามมาตรการปลอดภัยสำหรับองค์กร (Covid Free Setting) เพื่อป้องกันการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 ณ Blu-O Rhythm & Bowl ชั้น 5 สยามพารากอน เขตปทุมวัน
ในการนี้ ผู้อำนวยการเขตปทุมวันและคณะ ออกสำรวจทางออกฉุกเฉินตามแผนผังอาคาร กรณีเกิดเหตุเพลิงไหม้ เน้นยำกับผู้ประกอบการในการป้องกันอัคคีภัยในสถานประกอบการ สถานบันเทิงฯ ให้ปฏิบัติตามกฎหมายที่เกี่ยวข้อง และปฏิบัติตามมาตรการความปลอดภัย เพื่อป้องกันเหตุอัคคีภัย โดยเฉพาะทางหนีไฟ บันไดหนีไฟ ถังดับเพลิง ไฟฉุกเฉิน สัญญาณกริ่งฉุกเฉิน ให้พร้อมใช้งาน หากเกิดเหตุเพลิงไหม้จะสามารถอพยพผู้ใช้บริการให้ออกจากสถานที่เกิดเหตุได้ทันท่วงที เพื่อลดโอกาสการเกิดความสูญเสียทั้งชีวิตและทรัพย์สินของประชาชน
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุกๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนสิงหาคม พ.ศ. 2565 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 20 ถึง 28 มิถุนายน พ.ศ. 2565 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือศูนย์วิจัยแห่งใหม่ของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อช่วยเหลือบริษัทต่างๆ ภายในประเทศสมาชิกภูมิภาคอาเซียนในเรื่องของข้อมูลการตลาด รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของฮาคูโฮโดจะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่อธิบายผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่อธิบายถึงความเป็นมนุษย์ที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
เครื่องเอกซเรย์คอมพิวเตอร์ความเร็วสูง
9.น้ำท่วมซ้ำซาก ผลกระทบและการปรับตัว
การมีส่วนร่วมของภาคประชาชนในพื้นที่มีบทบาทสำคัญในการกำหนดทิศทางในการพัฒนาและการบริหารจัดการทรัพยากรน้ำ จะเป็นพื้นฐานที่สำคัญในการก้าวไปสู่การยกระดับวิถีชีวิตใหม่ที่ตระหนักถึงสิ่งแวดล้อม เศรษฐกิจและสังคมอย่างยั่งยืนในอนาคต
Categories of foreigners
LTR visas will be offered to four categories of foreigners:
ศูนย์พัฒนาการจัดสวัสดิการผู้สูงอายุภูเก็ต
ศูนย์พัฒนาการจัดสวัสดิการผู้สูงอายุภูเก็ต
เลขที่ 132 หมู่ 2 ตำบาลป่าคลอก อำเภอถลาง จ.ภูเก็ต
โทรศัพท์ : 076-529699 - 700 FAX : 076-529546
"ผู้สูงอายุภาคใต้ฝั่งอันดามัน อยู่ดีมีสุข"
เดิมชื่อ สถานสงเคราะห์คนชราบ้านภูเก็ต โดยกรมประชาสงเคราะห์ (ปัจจุบันคือกรมพัฒนาสังคมและสวัสดิการ) ได้ร่วมกับจังหวัดภูเก็ต ดำเนินการจัดตั้งสถานสงเคราะห์คนชราบ้านภูเก็ต เพื่อให้ความอุปการะเลี้ยงดูคนชราที่ประสบความเดือดร้อน โดยได้รับงบประมาณดำเนินการสนับสนุนจากโครงการพัฒนาชนบทและชุมชน ตามข้อเสนอของนายเรวุฒิ จินดาพล สมาชิกสภาผู้แทนราษฎร จังหวัดภูเก็ต ในปีงบประมาณ 2533 เป็นจำนวนเงิน 1 ล้านบาท เพื่อก่อสร้างอาคารอเนกประสงค์ จำนวน 1 หลัง เป็นอาคารหลังแรก โดยเริ่มทำการก่อสร้างเมื่อปี พ.ศ. 2534 ในที่หลวง ที่เลี้ยงสัตว์และพักผ่อน หย่อนใจ “บ้านป่าคลอก” ตำบลป่าคลอก อำเภอถลาง จังหวัดภูเก็ต จำนวน 18 ไร่เศษ
หลังจากนั้นกรมประชาสงเคราะห์ ได้จัดสรรงบประมาณในการก่อสร้างถนนภายในสถานสงเคราะห์ สร้างอาคารนอนของคนชรา อาคารฟื้นฟูบำบัด อาคารโภชนาการ บ้านพักเจ้าหน้าที่ และอาคารพยาบาล รวมทั้งการจัดระบบไฟฟ้าและระบบน้ำประปา พร้อมรั้วกำแพงและประตูเข้าออก ทำให้หน่วยงานเริ่มเปิดรับผู้สูงอายุเข้ามาอุปการะวันแรกเมื่อวันที่ 14 กุมภาพันธ์ 2537 เรื่อยมากระทั่งเมื่อวันที่ 30 ธันวาคม 2546 สถานสงเคราะห์คนชราบ้านภูเก็ตได้ปรับบทบาทจากหน่วยงานปฏิบัติการดูแลผู้สูงอายุ มาเป็นงานส่งเสริม สนับสนุน การดำเนินงานด้านการจัดสวัสดิการสังคมผู้สูงอายุ และได้เปลี่ยนชื่อเป็น “ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุภูเก็ต” เมื่อวันที่ 3 พฤศจิกายน 2558 ตามนโยบายรัฐบาล และในปี 2558 ปรับโครงสร้างตาม พระราชบัญญัติปรับปรุงฯกระทรวงฯ มาสังกัดกรมกิจการผู้สูงอายุ เมื่อวันที่
มีนาคม 2558
สถิติผู้สูงอายุบ้านภูเก็ต
ล่าสุดปี 2564 มีผู้สูงอายุ 72 คน ชาย 38 คน หญิง 34 คน
ศักยภาพสามารถช่วยเหลือตนเองได้ดี 16 คน ช่วยได้ปานกลาง 35 คน ไม่สามารถช่วยตัวเองได้ 21 คน
ช่วงอายุ ระหว่าง 60-70 ปี รวม 35 คน อายุ 71-80 ปี 20 คน อายุ 81-90 ปี 15 คน อายุ 91 ปี ขึ้นไป 2 คน
โครงการที่อยู่ระหว่างดำเนินการ ตามนโยบาย ควบคุมคุณภาพน้ำ
โครงการและนโยบายสำคัญที่อยู่ระหว่างดำเนินการและกำลังจะดำเนินการ
ㆍผลักดันโครงการติดตั้งระบบรวบรวมน้ำเสียและระบบบำบัดน้ำเสียชุมชน (onsite) ขนาดเล็ก ซึ่งสามารถทำได้ตั้งแต่ชุมชนขนาดเล็ก 10- 50 หลังคาเรือน โดยในระยะแรกจะมุ่งเน้นชุมชนริมคลองเป็นสำคัญ
ㆍ นำร่องปรับปรุงระบบบำบัดน้ำเสียในตลาดให้ทันสมัยเป็นไปตามมาตรฐานด้วยการบำบัด 2 ขั้นตอน แบบ onsite treatment ก่อนปล่อยน้ำเสียลงสู่แหล่งน้ำและท่อระบายน้ำสาธารณะ
ㆍ เร่งปรับปรุงท่อรวบรวมน้ำเสียที่มีอยู่แล้วให้เชื่อมต่อการรับน้ำเสียจากครัวเรือนและสถานประกอบการก่อนเข้าสู่ระบบได้อย่างสมบูรณ์
ㆍ เร่งทบทวนแผนก่อสร้างโรงบำบัดน้ำเสียรวม 4 แห่ง พร้อมระบบท่อรวบรวมน้ำเสีย ได้แก่ โรงบำบัดน้ำเสียธนบุรี มีนบุรี หนองบอนและคลองเตย พร้อมทบทวนศึกษาถึงตำแหน่งที่ตั้ง และความเหมาะสมของโครงการ ขนาด ความจุ หรือประสิทธิภาพการบำบัดเพื่อให้สามารถรองรับการพัฒนาของเมืองที่อยู่อาศัย ตลอดจนกิจกรรมทางเศรษฐกิจของกรุงเทพหานครในอนาคตได้อย่างยั่งยืน ช่วยลดผลกระทบด้านสิ่งแวดล้อม ตลอดจนสุขภาวะของเมืองและประชาชน
เล้งแซ่บใบกัญชา LINK
เครื่องปรุง
ใบกัญชา 1 ใบ / พริกขี้หน 20 กรัม / ใบมะกรูด 2 กรัม / ข่า 10 กรัม / ตะไคร้ 10 กรัม / มะนาว 20 กรัม / หอมแดง 30 กรัม / ผักชีฝรั่ง 5 กรัม / กระเทียม 20 กรัม / น้ำตาลโตนด 30 กรัม / น้ำปลา
40 กรัม / กระดูกสันหลังหมู 300 กรัม
วิธีการทำ
1. ตั้งเตารอจนน้ำเดือด แล้วใส่สมุนไพร ได้แก่ ใบมะกรูด ข่า ตะไคร้ หอมแดง กระเทียม ลงไป
2. ใส่กระดูกสันหลังหมูลงไป เปิดไฟอ่อนแล้วเคี่ยวจนเปื่อย
3. ใส่ใบกัญชา พร้อมปรุง ด้วยน้ำตาลโตนด น้ำปลา น้ำมะนาว พริกขี้หนู และผักชีฝรั่งซอย
4. จัดเสิร์ฟ
ศูนย์ศรีพัฒน์ คณะแพทยศาสตร์ ม.เชียงใหม่ รับรางวัล Gold Award - Commitment to Success
ศูนย์ศรีพัฒน์ คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ นำโดยคุณทศพงษ์ พัฒนกุลเกียรติ ผู้จัดการศูนย์ศรีพัฒน์ฯ เป็นผู้แทนรับมอบรางวัล Commitment to Success Gold Award จาก บริษัท เมืองไทยประกันชีวิต จำกัด (มหาชน) ในพิธีประกาศผลและมอบรางวัล MUANG THAI LIFE ASSURANCE HOSPITAL AWARDS 2021 ในวันพุธ ที่ 21 กันยายน 2565 ณ The Crystal Box ชั้น 19 Gaysorn Urban Resort เวลา 13.00 - 15.30 น.
9. การตรวจรหัสพันธุกรรม (Genetic Testing)
ร่างกายมนุษย์ประกอบด้วยเซลล์ต่างๆ หลายล้านเซลล์ โดยในแต่ละเซลล์จะมีสายพันธุกรรมซึ่งเป็นตัวกำหนดลักษณะความแตกต่างเฉพาะบุคคล การตรวจพันธุกรรมช่วยให้ค้นหาความผิดปกติของยีนลึกลงไปถึงดีเอ็นเอ (DNA) ช่วยประเมินความเสี่ยงสุขภาพในการเกิดโรคต่างๆ เช่น โรคมะเร็ง โรคหัวใจและหลอดเลือด โรคเบาหวาน รวมถึงยีนยังเป็นตัวกำหนดพฤติกรรมสุขภาพที่ส่งผลต่อการมีอายุที่ยืนยาว ช่วยให้เราสามารถวางแผนการดูแลสุขภาพได้ตรงจุดและเหมาะสมกับบุคคลมากยิ่งขึ้น (Personalized Medicine) ด้วยศักยภาพความพร้อมของทีมแพทย์ของโรงพยาบาลบำรุงราษฎร์ที่มีประสบการณ์และความชำนาญการในการผ่าตัดปลูกถ่ายอวัยวะมากว่า 30 ปี ทั้งการปลูกถ่ายไต ปลูกถ่ายตับ และปลูกถ่ายหัวใจ ปัจจุบัน อัตราความสำเร็จของการผ่าตัดปลูกถ่ายกระจกตา อยู่ที่ 70-95% ขึ้นอยู่กับอาการและโรคที่ผู้ป่วยเป็น ซึ่งเป็นการผ่าตัดปลูกถ่ายอวัยวะที่ประสบความสำเร็จมากที่สุดเมื่อเทียบกับการปลูกถ่ายอวัยวะอื่นๆ ปัจจัยที่ส่งผลต่อความสำเร็จของการผ่าตัดปัจจัยหนึ่ง คือ ความพอดีของรอยต่อของแผลระหว่างเนื้อเยื่อกระจกตาของผู้ป่วย และเนื้อเยื่อกระจกตาที่นำมาปลูกถ่าย ดังนั้นเทคนิคการตัดกระจกตา (Trephination) ทั้งกระจกตาที่นำมาปลูกถ่ายและเนื้อเยื่อกระจกตาของผู้ป่วยจึงมีความสำคัญมาก การปลูกถ่ายกระจกตาจึงจำเป็นต้องใช้แพทย์ที่มีประสบการณ์และความชำนาญขั้นสูงในการผ่าตัด ทั้งนี้ ผู้ที่มีอายุ 45 ปีขึ้นไป และผู้ที่มีปัญหาเกี่ยวกับสุขภาพตา ควรเข้ารับบริการตรวจ screening สุขภาพตาเป็นประจำทุกปี
สอบถามรายละเอียดเพิ่มเติมได้ที่ ศูนย์ปลูกถ่ายกระจกตา โรงพยาบาลบำรุงราษฎร์ ชั้น 18 อาคาร A (คลินิก) หรือโทร. 0-2 011 3886 หรือโทร. 1378
ประเพณีสมมาน้ำ คืนเพ็ง เส็งประทีป บึงพลาญชัย จังหวัดร้อยเอ็ด
“ประเพณีสมมาน้ำ คืนเพ็ง เส็งประทีป" ระหว่างวันที่ 7-8 พฤศจิกายน 2565 ณ สวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด และบึงพลาญชัย จังหวัดร้อยเอ็ด หนึ่งในงานเทศกาลลอยกระทงที่สำคัญของภาคอีสาน ชวนสักการะสิ่งศักดิ์สิทธิ์คู่บ้านคู่เมืองจังหวัดร้อยเอ็ด ชมการประกวดกระทงประทีปใหญ่ ชิงถ้วยพระราชทานฯ พร้อมชมขบวนแห่กระทงประทีปเมืองสาเกตนครและขบวนเมืองบริวาร 11 หัวเมือง การแสดงแสง เสียง การประกวดรำวงสมมาน้ำคืนเพ็งเส็งประทีป การประกวดธิดาสาเกตนคร
มูลนิธิโรงพยาบาลเจริญกรุงประชารักษ์
บริจาคเงินสมทบทุนและอุปกรณ์การแพทย์ มูลนิธิโรงพยาบาลเจริญกรุงประชารักษ์
ติดต่อรับใบเสร็จลดหย่อนภาษีได้ที่ มูลนิธิฯ ชั้น 9 อาคาร 72 พรรษา มหาราชินี
โทร. 02-2910150 02-2897368
สอบถามผ่านเพจ รพ.เจริญกรุงประชารักษ์
facebook.com/CKPMSD19 พ.ย. 65 ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา ฉบับปรับปรุง
ประกาศ สธ. คุมเข้มขายช่อดอกกัญชา ฉบับปรับปรุง
- แหล่งข่าวระดับสูงใน สธ. เปิดเผยว่า ตามหลักการหากจะบังคับใช้กฎหมายใดในราชกิจจานุเบกษาจะต้องมีการประกาศใช้ออกไป เมื่อใช้ไประยะหนึ่งแล้วมีข้อมูลมากพอที่จะให้พิจารณาปรับปรุง ก็สามารถเสนอให้ปรับแก้ประกาศต่อไปได้ แต่ประกาศฉบับนี้ยังไม่ได้ประกาศก็ถูกยับยั้งแล้ว อย่างไรก็ตาม ขณะนี้ ไม่ใช่ช่วงสุญญากาศแต่อย่างไร เพราะแม้ประกาศฉบับปรับปรุงยังไม่มีผลบังคับใช้ แต่ยังมีประกาศเดิมที่บังคับใช้อยู่ คือ ประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 ลงวันที่ 16 มิถุนายน 2565 ที่ควบคุมทั้งต้นของกัญชาและกัญชง ผู้ที่จะศึกษาวิจัย จำหน่าย หรือแปรรูปต้องขออนุญาต แค่จะขายต้นกล้าก็ต้องไปขออนุญาตแล้ว ซึ่งนั่นทำให้ประชาชนเกิดความลำบากในการใช้ประโยชน์จากกัญชา จึงต้องมีประกาศปรับปรุงให้เหลือเพียงช่อดอก ทั้งนี้ทั้งนั้น การที่มีกฎหมายฉบับเดียวเป็นความจำเป็นเพื่อให้เกิดความสะดวกแก่ทุกฝ่าย จึงจำเป็นที่ต้องออกพ.ร.บ.กัญชา กัญชง พ.ศ. ... เพื่อให้มีการควบคุมไปในทิศทางเดียวกัน ส่วนประชาชนที่ใช้กัญชาในทางที่ผิดก็ไม่สามารถอ้างได้ว่าไม่รู้กฎหมาย เพราะตอนนี้ เรายืนยันว่าไม่ให้ใช้ในเชิงสันทนาการ หากตำรวจเห็นก็จับกุมได้ทันที
ร่าง พ.ร.บ.กัญชา กัญชง
- นายราเมศ รัตนะเชวง โฆษกพรรคประชาธิปัตย์ (ปชป.) กล่าวถึงกรณีนายอนุทิน ชาญวีรกูล รองนายกฯและ รมว.สธ. ในฐานะหัวหน้าพรรคภูมิใจไทย (ภท.) ให้สัมภาษณ์เรื่องพรรคร่วมรัฐบาลกับมารยาททางการเมือง เรื่องร่างพ.ร.บ.กัญชา กัญชง ว่าการร่างกฎหมายที่ออกจากสภาฯ จำเป็นที่ ส.ส. ต้องยึดถือประโยชน์ของส่วนรวม ไม่ใช่ประโยชน์ของพรรคร่วมรัฐบาล มารยาทที่สำคัญที่มีต่อประชาชนคือการเห็นแก่ประโยชน์ส่วนรวม ถ้าเห็นแก่ประโยชน์ของคำว่าพรรคร่วมรัฐบาล คงไม่ใช่สถาบันทางการเมืองที่จะเป็นหลักให้กับประเทศได้ ไม่อยากให้มาทวงบุญคุณกับพรรคร่วมรัฐบาล โดยปราศจากเหตุและผล เมื่อร่างกฎหมายกัญชาเข้าสู่สภาฯ ไม่รัดกุม และมีผลกระทบต่อสังคมโดยรวม ส.ส.จะปล่อยให้ผ่านไปได้อย่างไร ต้องปรับต้องแก้ให้ดีที่สุด หากไม่ดีที่สุด มีสิทธิ์ไม่เห็นด้วยตามกลไกของสภาฯ ทุกพรรคควรเคารพการตัดสินใจซึ่งกันและกัน ถ้าชนะแล้วสังคมแพ้ไม่มีประโยชน์
-นายพลพีร์ สุวรรณฉวี รองเลขานุการนายกฯ ฝ่ายการเมือง กล่าวตอบโต้โฆษกพรรค ปชป. ว่า เป็นแค่การแก้ตัวของคนไม่รับผิดชอบ ไม่เคารพกติกาการอยู่ร่วมกัน ถ้ายึดประโยชน์ส่วนรวมเป็นห่วงสังคมอย่างปากว่า ทำไมมาขวางร่าง พ.ร.บ.กัญชาฯที่วางกรอบควบคุมการใช้ นายอรรถกร ศิริลัทธยากร ส.ส.บัญชีรายชื่อ พรรคพลังประชารัฐ (พปชร.) ในฐานะเลขานุการวิปรัฐบาล กล่าวถึงข้อเสนอ ส.ว.ให้เลื่อนระเบียบวาระพิจารณาร่าง พ.ร.บ.กัญชา กัญชง ขึ้นมาพิจารณาก่อนว่า ร่างกฎหมายนี้เป็นของพรรค ภท. หากอยากให้เลื่อนต้องประสานมายังวิปรัฐบาลก่อน และใช้เสียงของสภาฯลงมติขณะนี้ ภท.ยังไม่ประสานมาตามระเบียบ วาระร่าง พ.ร.บ.กัญชาฯอยู่ในวาระที่ 3 ของเรื่องที่คณะ กมธ.พิจารณาเสร็จแล้ว เบื้องต้นคาดว่าน่าเข้าสู่การพิจารณาวาระ 2 ได้วันที่ 7 ธ.ค. นายวีระกร คำประกอบ ส.ส.นครสวรรค์ พรรคพปชร. ในฐานะวิปรัฐบาล ย้ำว่านโยบายกัญชาถือเป็นนโยบายของรัฐบาล โดยมารยาทการเมืองพรรคร่วมรัฐบาลต้องช่วยสนับสนุน เพื่อรักษาแกนรัฐบาล มองว่าเป็นกฎหมายที่ดีแต่ไม่เข้าใจว่าทำไมนายศุภชัย ใจสมุทร ส.ส.บัญชีรายชื่อ พรรค ภท. ในฐานะประธาน กมธ.วิสามัญพิจารณาร่าง พ.ร.บ.กัญชาฯ ถึงไม่ออกมาชี้แจงให้สังคมเข้าใจแบบสั้นๆ ว่ากฎหมายนี้ดีอย่างไร หากแก้ไขแล้วจะเป็นประโยชน์ต่อประเทศชาติและประชาชนอย่างไร สรุปย่อความที่เป็นคีย์เวิร์ดหลักๆ มาให้เหลือ 3 นาที ถ้าเป็นประโยชน์จริง ไม่มีใครกล้าไม่ให้ผ่าน จะซื้อเวลาหรือสปอตสื่อก็ได้หากไม่ชี้แจงให้เข้าใจจะเป็นปัญหาต่อพรรคร่วมรัฐบาล และกลายเป็นประเด็นทางการเมือง จึงอยากให้นายศุภชัยออกมาชี้แจงโดยด่วน
-นพ.ชลน่าน ศรีแก้ว หัวหน้าพรรคเพื่อไทย กล่าวว่า สนับสนุน ไม่คัดค้านกัญชาในทางการแพทย์ ที่ห่วงคือจะทำอย่างไรไม่ให้สารเสพติดในกัญชาถูกใช้แพร่หลายหรือไม่มีการควบคุม กฎหมายที่ออกมาไม่มีมาตรการควบคุมเพื่อปิดคำว่ากัญชาเสรีกฎกระทรวงที่ออกมาใหม่การควบคุมช่อดอกกัญชาก็ห้ามเฉพาะจำหน่าย
-น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย กล่าวกรณีนายศุภชัย ใจสมุทร ส.ส.บัญชีรายชื่อ พรรคภูมิใจไทย ประธานกมธ.พิจารณาร่าง พ.ร.บ.กัญชา กัญชง ระบุกัญชาก็คือตะไคร้และใบกะเพรา ว่า ได้ฟังแล้วสะดุ้ง ไม่เชื่อว่าคนที่มีตำแหน่งและบทบาทสำคัญในพรรคร่วมรัฐบาล จะพูดในสิ่งที่ทำให้คนอึ้งทั้งประเทศ เอากัญชาไปเปรียบเทียบกับพืชผักสวนครัว เพราะกัญชามีสารเคมีออกฤทธิ์ต่อจิตและประสาท บริโภคเข้าไปทำให้จิตประสาทหลอนได้ ทำให้มีการตรากฎหมายเพื่อควบคุมการนำกัญชามาเสพ และการใช้ประโยชน์ในทางการแพทย์ต้องมีแพทย์ควบคุมปริมาณการใช้ที่เหมาะสม นายศุภชัยควรถอนคำพูดและกล่าวขอโทษต่อสังคม เพื่อแสดงความรับผิดชอบในสิ่งผิดพลาดในการสื่อสารสาธารณะ สาเหตุที่ฝ่ายค้านไม่สามารถผ่านกฎหมายควบคุมกัญชา กัญชงได้ จากปัญหาที่เยาวชนเข้าถึงกัญชาได้ง่าย ลูกหลานตกเป็นทาสกัญชาจนเป็นภาพปรากฏทางสื่อมวลชนและสื่อออนไลน์มากขึ้น ภาพเด็กนักเรียนนั่งเสพกัญชา แต่บอกว่าเป็นหน้าที่ของครูหรือหน้าที่ของเจ้าหน้าที่ตำรวจนั้น ไม่รับผิดชอบสังคมคือการแก้ปลายเหตุ ต้นเหตุคือการปล่อยเสรีโดย ไม่ได้เตรียมพร้อมรับปัญหาที่เกิดขึ้น
เรื่องราวสุดท้าย ยายสังวรณ์ ผู้ป่วยโรคมะเร็งโคนลิ้น
เรื่องราวสุดท้ายเป็นเคสของยายนา หรือ นางสังวรณ์ ผู้ป่วยโรคมะเร็งโคนลิ้น ที่ผ่านการผ่าตัดมาแล้วถึงสามครั้ง โดยผลกระทบของโรคร้ายนี้ทำให้ยายนาไม่สามารถพูดได้ จึงทำได้เพียงสื่อสารผ่านการเขียนและการแสดงท่าทางเท่านั้น แต่ยายนาก็ได้กำลังใจที่ดีจากครอบครัวและเพื่อนบ้านจึงทำให้ยืนหยัดต่อสู้กับโรคร้ายที่เป็นอยู่มาได้กว่า 10 ปี และด้วยการช่วยเหลือด้านค่ารักษาพยาบาลที่มาจากเงินบริจาคของผู้มีจิตศรัทธาผ่านโครงการผู้ป่วยยากไร้ จึงทำให้ยายนาได้รับการรักษาอย่างต่อเนื่องและทำให้ สามารถใช้ชีวิตได้เกือบเท่าคนปกติทั่วไป
สำหรับอีกหนึ่งพันธมิตรสำคัญ บริษัท อมรินทร์พริ้นติ้ง แอนด์ พับลิชชิ่ง จำกัด (มหาชน) หรืออมรินทร์กรุ๊ป นำทีมโดย เจรมัย พิทักษ์วงศ์ กรรมการผู้จัดการใหญ่ Media & Event Business พร้อมทีมทำงาน สมัชชา วิราพร บรรณาธิการบริหารบ้านและสวน กล่าวเสริมว่า บริษัทยินดีที่ได้ร่วมจัดงาน “WOW Festival 2022 อัศจรรย์เมืองน่าอยู่” เนื่องจากสอดคล้องกับเจตนารมณ์ของบริษัท ที่ต้องการมุ่งเน้นสร้างสิ่งที่ดีให้เมือง รวมถึงการมุ่งเน้นสร้างคุณภาพชีวิตของคนที่อยู่ในเมืองเช่นกัน เราเชื่อว่าเมืองที่มีกิจกรรมในห้องนั่งเล่นกว้างๆ แบบนี้บ่อยๆ ก็จะเกิดความคิดสร้างสรรค์ กระตุ้นเศรษฐกิจระดับเล็ก กลาง ใหญ่ รวมถึงหลอมรวมวัฒนธรรมที่หลากหลายให้กลมเกลียวกัน ทุกคนก็ช่วยกันทำบ้านเมืองหรือเมืองเกิดให้น่าอยู่ขึ้นได้ ทั้งการเริ่มต้นจากจุดเล็กๆในบริเวณบ้าน และการร่วมมือจากองค์กรภาครัฐและเอกชนมาสร้างสรรค์โครงการระดับเมืองที่ส่งเสริมให้เมืองน่าอยู่มากขึ้น
งานนี้มีขึ้นเพราะอยากชวนทุกคนให้มาทำความรู้จักกับ "เมือง" ที่เราอยู่กันให้มากขึ้น แลกเปลี่ยนความเห็นเรื่องคุณภาพชีวิต สำหรับกิจกรรมสร้างสรรค์เพื่อคนเมืองที่จะมาเติมสีสันให้ผู้เข้าร่วมงาน กับโซน Happy Ground กับ WOW ART & Design Market สินค้าสร้างสรรค์ที่ผลิตขึ้นเพื่อพัฒนาคุณภาพชีวิตคนเมือง ไม่ว่าจะเป็นงานคราฟต์ สินค้ามีดีไซน์และงานศิลปะ รวมถึงต้นไม้ และกิจกรรมที่สร้างสรรค์โดย บ้านและสวน, room, National Geographic Thailand และชีวจิต ที่ให้ความรู้และความเพลิดเพลินสำหรับประชาชนทั่วไป รวมถึงเวิร์คช็อปที่เหมือนเป็นพื้นที่พบปะกันได้ภายในงาน เราหวังว่าทุกนิทรรศการ ทุกกิจกรรมที่เราจัดขึ้นจะช่วยจุดประกายให้ทุกคนเห็นภาพเมืองน่าอยู่ที่พวกเราสามารถร่วมสร้างขึ้นมาด้วยกัน ซึ่งผู้ที่เข้าร่วมจะได้แลกเปลี่ยน แบ่งปัน สัมผัสประสบการณ์จากผู้คนภายในงานนี้
“WOW Festival 2022 อัศจรรย์เมืองน่าอยู่” จัดขึ้นระหว่างวันที่ 23-27 พฤศจิกายน 2565 ณ สวนเบญจกิติ กรุงเทพฯ เวลา 10.00 - 21.00 น. โดยเรียกได้ว่างานนี้จะเป็นอีกหนึ่งงานใหญ่แห่งปีที่ให้ผู้เข้าร่วมชมงานได้สัมผัสนิทรรศการต่าง ๆ เกี่ยวกับเมืองในทุกมิติ ตลอดจนกิจกรรมที่เหมาะสำหรับคนเมืองทุกเพศทุกวัย สามารถติดตามรายละเอียดงานได้ที่ facebook :
www.facebook.com/ASAWOW ศ.ดร.พญ.อติพร อิงค์สาธิต รองผู้อำนวยการโรงพยาบาลรามาธิบดี
ของขวัญปีใหม่จาก SME Bank 3 มาตรการ/โครงการ
ธนาคารพัฒนาวิสาหกิจขนาดกลางและขนาดย่อมแห่งประเทศไทย (ธพว.) จำนวน 3 มาตรการ/โครงการ
ได้แก่
1. ผ่อนดี มีคืน เพื่อช่วยเหลือลูกค้ารายย่อยของ ธพว. ที่มีวงเงินสินเชื่อไม่เกิน 500,000 บาท และมีประวัติการชำระดี โดยได้รับบัตรกำนัล ฟรีมูลค่าสุงสุด 300 บาท ระยะเวลาดำเนินโครงการตั้งแต่เดือนธันวาคม 2565 ถึงวันที่ 28 กุมภาพันธ์ 2566
2. มาตรการสนับสนุนผู้ประกอบการ SMEs เข้าถึงแหล่งเงินทุน สำหรับผู้ประกอบการ SMEs ที่มีวงเงินสินเชื่อไม่เกิน 50 ล้านบาท โดยได้รับบัตรเติมน้ำมันมูลค่าสูงสุด 5,000 บาท เมื่อได้รับอนุมัติสินเชื่อ ระยะเวลาดำเนินโครงการตั้งแต่เดือนธันวาคม 2565 ถึงวันที่ 28 กุมภาพันธ์ 2566
3. ส่งเสริมช่องทางการตลาดให้แก่ผู้ประกอบ SMEs โดยลูกค้าสามารถซื้อสินค้าราคาพิเศษ จาก SME D Market (ส่วนลดสูงสุดร้อยละ 20 มากกว่า 300 รายการสินค้า) ภายในเดือนธันวาคม 2565
ศูนย์บริการสาธารณสุขที่ 9 ไขแสง กำเนิดมี
- ที่อยู่ 387 ม.2 งามวงศ์วาน ต.บางเขน อ.เมืองฯ จ.นนทบุรี 11000 เมืองนนทบุรี
- โทร 082-4267296, 02-9526468
- แผนที่
- Facebook
บริการ
- คลินิครักษาโรคเบื้องต้น วันจันทร์ ศุกร์ และเสาร์ เวลา 08.30-16.30 น. วันอังคาร-วันพฤหัสบดี เวลา 13.00-16.30 น. (นอกเวลาราชการ) วันจันทร์-ศุกร์ เวลา 16.30-20.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-เสาร์ เวลา 08.30-16.30 น. (นอกเวลาราชการ) วันจันทร์-ศุกร์ เวลา 16.30-20.30 น.
- คลินิกกายภาพบำบัด วันจันทร์ เวลา 08.00-12.00 น. วันอังคาร และพฤหัสบดี เวลา 08.30-16.30 น.
- ตรวจโรคเรื้อรัง วันอังคาร-พฤหัสบดี เวลา 08.30-12.00 น.
- ส่งเสริมสุขภาพชุมชน วันจันทร์ พุธ และศุกร์ เวลา 13.00-16.30 น.
- วัคซีนไข้วัดใหญ่ วันพุธ เวลา 08.30-12.00 น.
- นรีเวช/วางแผนครอบครัว วันศุกร์ เวลา 08.30-12.00 น.
- คลินิกเด็กดีวัคซีนเด็ก 0-5 ปี ทุกวันที่ 10 ของเดือน (นอกเวลาราชการ) เวลา 16.30-20.330 น.
นภาคลินิก คลินิกเพื่อนคู่ใจ ปรึกษาและตรวจรักษาโรคติดต่อทางเพศสัมพันธ์ การตรวจหาเชื้อ HIV
นภาคลินิก คลินิกเพื่อนคู่ใจ ให้คำปรึกษาปัญหาสุขภาพทั่วไป ให้คำปรึกษาและตรวจรักษาโรคติดต่อทางเพศสัมพันธ์ การตรวจหาเชื้อ HIV
เปิดให้บริการเฉพาะวันจันทร์
ติดต่อสอบถาม
042-245-555 ต่อ 3210, 3203 (ในเวลาราชการ) ต่อ 3222 (นอกเวลาราชการ)
คลินิกพิเศษเฉพาะทาง โทร. 0942-707-555 Line ID : 0942707555
ไม่เพียงด้านต่างๆ ที่ผอ.เล่าไว้ แต่รพ.สมุทรปราการยังมีอีกหลายๆ ด้านที่ก้าวหน้าไปอย่างมาก
ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย และ สมาคมกุมารแพทย์แห่งประเทศไทย THE ROYAL COLLEGE OF PEDIATRICIANS OF THAILAND & PEDIATRIC SOCIETY OF THAILAND
ราชวิทยาลัยกุมารแพทย์แห่งประเทศไทย และ สมาคมกุมารแพทย์แห่งประเทศไทย
THE ROYAL COLLEGE OF PEDIATRICIANS OF THAILAND & PEDIATRIC SOCIETY OF THAILAND
ชั้น 9 อาคารเฉลิมพระบารมี ๕๐ ปี เลขที่ 2 ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพมหานคร 10310
โทรศัพท์ (662) 716-6200-1
โทรสาร: (662) 716-6202
E-MAIL THAIPEDIATRICS@GMAIL.COM
/www.thaipediatrics.org/ 9. กองทุนหลักประกันสุขภาพ ในระดับท้องถิ่น/พื้นท
4. ความเป็นเลิศในการส่งเสริมประสบการณ์ผู้ป่วย (Patient Experience Excellence)
บำรุงราษฎร์มีแผนการดำเนินงานอย่างชัดเจนในการให้บริการด้วยความเป็นเลิศต่อผู้ป่วย ซึ่งถือเป็นวัฒนธรรมองค์กรอันล้ำค่าที่ถ่ายทอดกันมาสู่ปีที่ 43 ในปี 2566 โรงพยาบาลฯ ได้มีการปรับปรุงวิถีแห่งบำรุงราษฎร์ (Bumrungrad Way) ซึ่งเป็นแนวปฎิบัติของบุคลากรในการบริการผู้ป่วยที่เป็นแบบฉบับของบำรุงราษฎร์เองให้สอดรับตามยุคสมัย แต่ยังคงแนวปฏิบัติที่ยึดผู้ป่วยเป็นศูนย์กลางในการรักษาพยาบาล นำไปสู่การให้บริบาลด้วยความเอื้ออาทร (compassionate caring) นับเป็นเอกลักษณ์ของบำรุงราษฎร์ที่สร้างความแตกต่าง ทำให้ผู้ป่วยและผู้ใช้บริการได้รับประสบการณ์เชิงบวก เกิดความประทับใจและบอกต่อไปยังบุคคลอื่น ๆ นับเป็นการสร้างความเชื่อมั่นที่ดีที่สุดของโรงพยาบาล
เขตปทุมวัน ห้องสมุดเพื่อการเรียนรู้สวนลุมพินี
ห้องสมุดประชาชนของกรุงเทพมหานคร พ.ศ. 2498 ตั้งอยู่ภายในสวนลุมพินี ก่อสร้างในปีพุทธศักราช 2498 และเปิดดำเนินการครั้งแรกเมื่อวันที่ 24 มิถุนายน 2499 มีลักษณะเป็นอาคารโครงเหล็กชั้นเดียวขนาดพื้นที่ 499 ตารางเมตร ตั้งอยู่ในพื้นที่บริเวณด้านหลังพระบรมราชานุสาวรีย์พระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว ต่อมาในปีพุทธศักราช 2534 ได้ทำการปรับปรุงห้องสมุด โดยก่อสร้างอาคารใหม่เพิ่มให้เป็นรูปตัวที (T) มีชั้นใต้ดิน ขนาดพื้นที่ 168 ตารางเมตร
ปีพุทธศักราช 2549 กรุงเทพมหานคร มีนโยบายพัฒนาห้องสมุดประชาชนกรุงเทพมหานคร ให้มีความทันสมัยและเพิ่มประสิทธิภาพมากยิ่งขึ้น ในนามของ "ห้องสมุดเพื่อการเรียนรู้" (Discovery Learning Library) โดยออกแบบและตกแต่งภายในให้มีความทันสมัย สวยงาม เป็นแหล่งเรียนรู้ตามอัธยาศัยและการเรียนรู้ตลอดชีวิตของคนทุกวัย ส่งเสริมให้มีการบริการสืบค้นข้อมูลด้วยระบบเทคโนโลยีสารสนเทศ บริการ Hi-Speed Internet / Wireless Lan เป็นห้องสมุดที่มีบรรยากาศแห่งการเรียนรู้ ตลอดจนจัดกิจกรรมส่งเสริมการอ่านที่หลากหลายอย่างต่อเนื่อง เป็นห้องสมุดประชาชนของกรุงเทพมหานครแห่งแรกที่ก้าวเข้าสู่ห้องสมุดภาพลักษณ์ใหม่
วันเวลาเปิดบริการ
วันอังคาร-วันเสาร์ เวลา 08.30-19.30 น.
วันอาทิตย์ เวลา 09.00-17.00 น.
***ปิดบริการ วันจันทร์ และ วันนักขัตฤกษ์***
โทร. 021634675
กิจกรรมจักรยานท่องเที่ยว+ยิงปืนจุกน้ำปลา+ปาเป่าปาโป่ง
+++ 8 คลินิกสัตวเเพทย์ กรุงเทพมหานคร +++
8 คลินิกสัตวเเพทย์ ศูนย์บริการทำหมันหมาแมว ของ กทม. พร้อมให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดยาคุม และทำหมัน ทั้งสุนัขและแมว โดยไม่คิดค่าบริการ ในวันและเวลาราชการ ภายในคลินิกสัตวแพทย์ กรุงเทพมหานคร จำนวน 8 แห่ง ดังนี้
1.
คลินิกสัตวแพทย์ 1 สี่พระยา
โทร. 02-2364055 กด 213
Facebook |
Website
2. คลินิกสัตวแพทย์ 2 มีนบุรี
โทร. 02-9145822
Facebook |
Website
3.
คลินิกสัตวแพทย์ 3 วัดธาตุทอง
4. คลินิกสัตวแพทย์ 4 บางเขน
โทร. 02-5791342 กด 15
Facebook |
Website
5. คลินิกสัตวแพทย์ 5 วัดหงส์รัตนาราม
โทร. 02-4725896 กด 109
Facebook |
Website
6. คลินิกสัตวแพทย์ 6 ช่วงนุชเนตร
Facebook |
Website
7. คลินิกสัตวแพทย์ 7 บางกอกน้อย
อาคารคลินิกสัตวแพทย์กรุงเทพมหานคร 7 บางกอกน้อย 527/78 ถ.จรัญสนิทวงศ์ เขตบางกอกน้อย [
แผนที่]
โทร. 02-4112432
8. คลินิกสัตว์แพทย์ 8 ดินแดง
กลุ่มควบคุมโรคพิษสุนัขบ้า ดินแดง ถนนมิตรไมตรี เขตดินแดง [
แผนที่]
โทร. 02-2453311 , 02-2487417
May I Quit Being A Mom!? #JFF2023
May I Quit Being A Mom!? #JFF2023
1 ชั่วโมง 32 นาที R:ท
เด็กคือของขวัญ ลูกน้อยคือโซ่คล้องใจ ...แต่เพราะอะไรหลายต่อหลายครั้ง แม่และพ่อที่ต้องเลี้ยงดูลูกกลับเต็มไปด้วยความอัดอั้นราวกับหายใจไม่ออก รู้สึกเป็นทุกข์กับการพยายามทำหน้าที่ และเกิดคำถามขึ้นในใจโดยไม่กล้าเปล่งเสียงบอกใครว่า “ฉันขอเลิกเป็นแม่ได้ไหม?” ใน May I quit being a mom!? เราจะได้พบกับแม่ที่เผชิญอาการซึมเศร้าหลังคลอดและต้องพยายามโน้มน้าวใจสามีให้ช่วยแบกรับภาระ, แม่มือใหม่ที่ต้องเลี้ยงลูกพร้อมกับเยียวยาตัวเองจากความทรงจำเรื่องแม่ของเธอซึ่งฆ่าตัวตายตอนเธออายุเพียง 3 ปี, แม่ลูกสามที่ทุกข์ทรมานจากการที่แม่ของเธอหายตัวไปและปัจจุบันตัวเธอเองก็ยังไม่สามารถทำใจกอดลูก ๆ ได้ ...นี่คือสารคดีหายากที่จับประเด็นพุ่งตรงไปยังการต่อสู้อันซับซ้อนของคนเป็นพ่อแม่ซึ่งทั้งพยายามเสียสละ แสวงหาความสุข และร้องไห้ขอความช่วยเหลือจากสังคมรอบตัวไปพร้อมกัน
อันดับ 9. อุทยานแห่งชาติคลองลาน จ.กำแพงเพชร
ใครบ้างที่ควรตรวจ
แนะนำให้คู่สมรสทั้งที่มีประวัติและไม่มีประวัติโรคกรรมพันธุ์ที่ถ่ายทอดในครอบครัวตรวจยีนก่อนการตั้งครรภ์ เพราะบางครั้งคุณพ่อคุณแม่เป็นพาหะหรือที่เราเรียกกันว่ายีนแฝงไม่รู้ตัว
คู่สมรสที่มีบุตรแล้วและคนที่มีประวัติครอบครัวมีโรคถ่ายทอดทางพันธุกรรม
การตรวจยีน มีขั้นตอนอย่างไร
ตรวจด้วยการเจาะเลือดหรือเก็บตัวอย่างน้ำลาย ประมาณ 3-4 สัปดาห์ก็จะทราบผล
10. สร้างความเข้าใจเกี่ยวกับผลกระทบด้านสิ่งแวดล้อมที่มีต่อสุขภาพของประชากร
จากข้อมูลของศูนย์ควบคุมและป้องกันโรค Centers for Disease Control and Prevention (CDC) เผยว่าอุณหภูมิและก๊าซคาร์บอนไดออกไซด์ที่เพิ่มสูงขึ้น สภาพอากาศที่เปลี่ยนแปลงอย่างรวดเร็ว และผลกระทบด้านสภาพอากาศ ส่งผลต่อสุขภาพประชากรในด้านต่างๆ
บริษัทเครื่องมือแพทย์และบริษัทเทคโนโลยีด้านเฮลท์แคร์เป็นส่วนหนึ่งของห่วงโซ่คุณค่า ซึ่งส่งผลกระทบต่อความหลากหลายทางชีวภาพผ่านการเปลี่ยนแปลงการใช้ที่ดิน มลพิษ การบริโภค และการปล่อยก๊าซพิษ ด้วยการตระหนักถึงความสำคัญของระบบนิเวศที่ดีต่อสุขภาพของประชากรที่เพิ่มมากขึ้น คาดว่าจะเห็นแนวโน้มการประยุกต์ใช้ในวงการเฮลท์แคร์ ด้านการ ประเมินต้นทุนทางธรรมชาติ เพื่อสนับสนุนการตัดสินใจที่ดีขึ้นเกี่ยวกับการจัดการทรัพยากรจากข้อมูลของ World Economic Forum พบว่าการป้องกันและฟื้นฟูระบบนิเวศทางธรรมชาติสามารถช่วยลดต้นทุนในการปล่อยก๊าซคาร์บอนไดออกไซด์ได้ถึงร้อยละ 37 ซึ่งจำเป็นภายในปีค.ศ. 2030 เพื่อรักษาภาวะโลกร้อนให้ลดลง 2 องศาเซลเซียสอีกทั้งยังช่วยรักษาสภาพแวดล้อมให้มีความหลากหลายทางชีวภาพเพื่อคนรุ่นต่อๆ ไปในอนาคต [7]
######
ข้อมูลอ้างอิง
[1] Le, Rebecca T., et al. Comparative Analysis of Radiology Trainee Burnout Using the Maslach Burnout Inventory and Oldenburg Burnout Inventory. Academic Radiology, September 2022.
[2] Almendral, Aurora, The world could be short of 13 million nurses in 2030 - here’s why, World Economic Forum, January 2022.
[3] Masson, Gabrielle. About 1 in 5 healthcare workers have left medicine since the pandemic began — Here’s why. Becker’s Hospital Review, November 2021.
[4] Centers for Disease Control and Prevention. What is Health Equity?
[5] United Nations. UN Response to COVID-19.
[6] Karliner, Josh, et al. Healthcare’s climate footprint: How the health sector contributes to the global climate crisis and opportunities for action. Health Care Without Harm and Arup, September 2019 (p. 22).
[7] Quinney, Marie. 5 reasons why biodiversity matters – to human health, the economy and your wellbeing. World Economic Forum, May 2020.
เขตคลองเตย LINK
สำนักงานเขตคลองเตย โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุขที่ 41 คลองเตย และศูนย์บริการสาธารณสุขที่ 10 สุขุมวิท จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประจำปี 2566 ครั้งที่ 1 เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ฟรี‼️ไม่มีค่าใช้จ่ายใดๆ
หากท่านใดสนใจสามารถนำสัตว์เลี้ยง น้องหมาน้องแมวที่มีสุขภาพแข็งแรง อายุตั้งแต่ 3 เดือนขึ้นไป ไปรับวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯเคลื่อนที่ใกล้บ้านท่านได้ โดยเริ่มออกหน่วยเคลื่อนที่ฯ ตั้งแต่วันที่ 13 มีนาคม ถึงวันที่ 25 เมษายน 2566 เวลา 10.00-12.00 น.
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคลองเตย โทร.02-2495532
บัตรส่วนลดแดนเนรมิตปี 2538
ราคาเครื่องเล่นในสมัยนั้นแล้วน่าเล่นมากมาก กระเช้าลดเหลือ 8 บาท รถไฟเหาะ13 บาท เสียดาย ได้ชิ้นส่วนไม่ครบขาดบ้านผีสิงกับล่องแก่งไป สมกับสโลแกน สนุกสุดแสน เที่ยวแดนเนรมิต ผมสแกนมาจาก บัตรส่วนลดแดนเนรมิตปี 2538 (28 ปีที่แล้ว) ขอบคุณคุณ Aree Buu Mmasuj Srit สำหรับบัตรส่วนลดนี้ [ภาพจาก
เพจบรรเจิดเริ่ดสะแมนแตน 31 มกราคม 2023]
ลูกคบเพื่อนที่มีพฤติกรรมเสี่ยง เช่น เพื่อนลูกเคยมีเพศสัมพันธ์แล้ว หรือมีเพื่อนท้องในวัยเรียน
ควรทำ
ชวนคุย ถามความคิดเห็น ว่าลูกคิดอย่างไรกับเพื่อนที่มีพฤติกรรมเสี่ยง เพื่อสำรวจทัศนคติและมุมมองของลูก รวมทั้งชี้ชวนให้ลูกคิดในมุมมองที่กว้างขวางขึ้น และช่วยเสริมทักษะที่คิดว่าลูกยังขาด
เชื่อมั่นในการเลือกคบเพื่อนของลูก สอนทักษะให้ลูกรู้จักประเมินผู้คน และสถานการณ์ รวมทั้งการวางตัว รักษาความสัมพันธ์ และระยะห่างอย่างเหมาะสม
อย่าทำ
ห้ามลูกว่าอย่าไปคบเพื่อนไม่ดี เพราะลูกจะมองว่าพ่อแม่ไม่เคารพการตัดสินใจในการคบเพื่อนของตนเอง มองว่าพ่อแม่ใจคอคับแคบ และไม่เชื่อใจลูก
ตัดสิน วิจารณ์ เพื่อนลูกว่าเป็นเด็กที่มีพฤติกรรมไม่ดี เพราะเราอาจมีข้อมูลของเพื่อนลูกอย่างจำกัด จะทำให้ลูกมองพ่อแม่ว่าใจคอคับแคบ
การใช้เพื่อนลูกเป็นตัวอย่างที่ชี้ให้ลูกเห็นว่าทำตัวไม่ดี จะทำให้ลูกขาดความไว้วางใจ และคิดว่าพ่อแม่ไม่เข้าใจ ไม่เห็นใจคนอื่น
สถานีชาร์จ EleX ใน ภาคตะวันออก
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าบางปะกง
ที่อยู่: 4 หมู่6 ต.ท่าข้าม อ.บางปะกง จ.ฉะเชิงเทรา 24130
เวลาทำการ : ทุกวัน 08.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
ชลบุรี
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT บางพระ
ที่อยู่: 641/3 ถ.สุขุมวิท ต.เหมือง อ.เมือง จ.ชลบุรี 20130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงพยาบาลกรุงเทพพัทยา
ที่อยู่: 301 หมู่ 6 ถ.สุขุมวิท ต.นาเกลือ อ.บางละมุง จ.ชลบุรี 20150
เวลาทำการ : ทุกวัน 24 ชั่วโมง
Serenity Residence Jomtien (เฉพาะลูกค้าโครงการ)
ที่อยู่: พัทยา อ.บางละมุง จ.ชลบุรี 20150
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา สวนสัตว์เปิดเขาเขียว (อาคารจอดรถ 1)
ที่อยู่: 235 หมู่ที่ 7 ต.บางพระ อ.ศรีราชา จ.ชลบุรี 20110
เวลาทำการ : ทุกวัน 08.00 – 17.00 น.
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เจพาร์ค ศรีราชา นิฮอน มูระ (อาคารจอดรถ)
ที่อยู่: 1 หมู่ที่ 6 ซ.ศรีราชา-หนองยายบู่ 6 ต.สุรศักดิ์ อ.ศรีราชา จ.ชลบุรี 20110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สนามกอล์ฟบูรพา ศรีราชา
ที่อยู่: 281 หมู่ 4 ต.บึง อ.ศรีราชา จ.ชลบุรี 20230
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT บ้านบึง 7
ที่อยู่: 19/24 หมู่ 5 ต.บ้านบึง อ.บ้านบึง จ.ชลบุรี 20170
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ระยอง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เขตนวัตกรรมระเบียงเศรษฐกิจพิเศษภาคตะวันออก (EECi)
ที่อยู่: 333 สำนักงานใหญ่ อีอีซีไอ อ.วังจันทร์ จ.ระยอง 21210
เวลาทำการ : ทุกวัน 24 ชั่วโมง
Superfast by UAC (EECi)
ที่อยู่: 333 สำนักงานใหญ่ อีอีซีไอ อ.วังจันทร์ จ.ระยอง 21210
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT นิคมพัฒนา 2
ที่อยู่: 521 หมู่ที่5 ต.มะขามคู่ อ.นิคมพัฒนา จ.ระยอง 21180
เวลาทำการ : ทุกวัน 24 ชั่วโมง
จันทบุรี
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ท่าใหม่ 5
ที่อยู่: 34/1 หมู่ 6 ต.เขาบายศรี อ.ท่าใหม่ จ.จันทบุรี 22120
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ปราจีนบุรี
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT กบินทร์บุรี 8
ที่อยู่: 198 หมู่ที่5 ต.เมืองเก่า อ.กบินทร์บุรี จ.ปราจีนบุรี
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ EV Station PluZ ภาคตะวันตก
สถานีบริการ ปตท. หลักเมืองถาวร เอ็นจีวี
9 หมู่ที่ 11 ตำบลโคกคราม อำเภอบางปลาม้า จังหวัดสุพรรณบุรี 72150
โรบินสัน สไตล์ สุพรรณบุรี
449 ถนนหน้าบ้าน บางบัวทอง-สุพรรณบุรี, สุพรรณบุรี, ประเทศไทย, สุพรรณบุรี
มัลเบอร์รี่ เมลโล่
1436 ตำบล เกาะสำโรง อำเภอเมืองกาญจนบุรี กาญจนบุรี 71000
สถานี สาขาท่ามะขาม
116/2 ม.5 ต.ท่ามะขาม อ.เมืองกาญจนบุรี กาญจนบุรี 71000
สถานี สาขาชะอำ
499/1 ถ.เพชรเกษม(ชะอำ) ต.ชะอำ อ.ชะอำ เพชรบุรี 76120
สถานีบริการ แอล.พี.จี. บจก.เพชรยิ่งเจริญ
127 หมู่ 4 ตำบลถ้ำรงค์ อำเภอบ้านลาด เพชรบุรี 76150
สถานี บจ.เฮงปิโตรเลียมบริการ
99 ม.2 ต.ท่ายาง อ.ท่ายาง เพชรบุรี 76130
สถานี บจ.ไนซ์ปิโตรเลียมเพชรบุรี
159 ม.5 ต.ไร่ส้ม อ.เมืองเพชรบุรี เพชรบุรี 76000
คาเฟ่ อเมซอน เขาย้อย จ.เพชรบุรี
4/4 หมู่ที่ 5 ต.เขาย้อย อ.เขาย้อย จ.เพชรบุรี
สถานี สาขาราชบุรี
218 ม.4 ต.อ่างทอง อ.เมืองราชบุรี ราชบุรี 70000
สถานี สาขาตาก (ตากเคทีแอนด์ชันส์)
5 ถ.พหลโยธิน ต.เชียงเงิน อ.เมืองตาก ตาก 63000
คลินิกพิเศษงานเอดส์และวัณโรค
คลินิกพิเศษงานเอดส์และวัณโรค อาคาร 16 ชั้น 2 เบอร์โทรศัพท์ 044-615002 ต่อ 3603 ,3629
สร้างสังคมที่เอื้อต่อการมีสุขภาพจิตที่ดี
ปัญหา
จำนวนผู้ป่วยซึมเศร้าในประเทศไทยอาจสูงถึง 1.5 ล้านคน หรือเฉลี่ยคนไทย 40 คน จะพบผู้ป่วยซึมเศร้า 1 คน โดยสาเหตุมาจากทั้งปัจจัยเฉพาะกิจอย่างโควิด-19 ที่เพิ่มความเครียดให้กับผู้คน (เช่น นักเรียนจากการเรียนออนไลน์ คนวัยทำงานจากสภาพเศรษฐกิจ) และปัจจัยถาวรต่างๆที่งานวิจัยระบุว่าทำให้คนรุ่นใหม่ มีแนวโน้มจะประสบปัญหาโรคซึมเศร้ามากกว่ารุ่นก่อนๆ (เช่น การใช้โซเชียลมีเดีย ที่เสี่ยงทำให้คนรู้สึกผิดหวังในตัวเองง่ายขึ้น จากการเปรียบเทียบชีวิตตัวเองกับชีวิตของคนอื่น) และพบว่าคนไทยมีอัตราการฆ่าตัวตายสูงเป็นอันดับ 1 อาเซียน จากปัญหาด้านสุขภาพจิต
ข้อเสนอ
ลดปัจจัยที่เพิ่มความเสี่ยงต่อปัญหาสุขภาพจิตตั้งแต่เกิดจนแก่ เช่น
- การมีสถาบันครอบครัวที่เข้มแข็งสำหรับเด็กเล็ก พ่อแม่มือใหม่ได้รับการเสริมทักษะและการเตรียมความพร้อมทางสภาพจิตใจสำหรับการเลี้ยงดูลูก
- การออกแบบระบบการศึกษาที่ไม่สร้างแรงกดดันเกินเหตุสำหรับนักเรียน (เช่น จำนวนชั่วโมงเรียนที่เหมาะสม ไม่มีอำนาจนิยมในโรงเรียน)
- สภาพแวดล้อมและรูปแบบความสัมพันธ์ในชีวิตการทำงานที่เหมาะสม (เช่น สภาพการทำงานที่ปลอดภัย การเงินที่มั่นคง เวลาพักผ่อนที่เพียงพอ)
- การเพิ่มพื้นที่สาธารณะที่คนสามารถแลกเปลี่ยน รับฟัง หรือผ่อนคลาย (เช่น กิจกรรมดนตรีในสวน การเพิ่มพื้นที่สีเขียว การมีพื้นที่ทำกิจกรรมร่วมกันสำหรับผู้สูงวัย)
- การพัฒนาระบบสวัสดิการสังคมที่ทั่วถึงและถ้วนหน้า เพื่อเป็นตาข่ายรองรับความไม่แน่นอนในชีวิตรูปแบบต่างๆ
- การยอมรับความหลากหลายทางวัฒนธรรม และลดการเลือกปฏิบัติ ที่เสี่ยงจะเพิ่มความเครียดและความรู้สึกไม่เป็นธรรม
สาโท "ป๊าดโธ" สุราชุมชนจากร้อยเอ็ด LINK
สาโท "ป๊าดโธ" สุราชุมชนจากร้อยเอ็ด แบรนด์นี้เริ่มต้นจากรุ่นคุณย่าที่ปลูกข้าวอยู่ที่ร้อยเอ็ดและพยายามเพิ่มมูลค่าสินค้าที่มีให้เข้ากับความต้องการของตลาด สมัยก่อนสาโทในกรุงเทพหาดื่มยาก ทั้งๆที่มีคนต่างจังหวัดมาเป็นแรงงานทำงานเยอะแยะ แต่ก็ต้องไปกินเหล้าขาวหรือต้องไปจ่ายแพงกับเหล้าสี คุณย่าคงเห็นความต้องการตรงนี้ จึงลงทุนเอาข้าวที่ปลูกใส่รถ ไปแอบทำสาโทในกรุงเทพหลังฤดูการเก็บเกี่ยวเสร็จทุกปี มีถูกจับ ถูกปรับกันไปบ้าง แต่ก็ยังดีกว่าเก็บไว้ที่หมู่บ้านแล้วขายไม่ได้ราคา ยังพอมีเงินเหลือส่งลูกหลานได้กินอิ่มได้เรียนหนังสือ เมื่อถึงสุดท้ายแกหมดแรงตามวัยชรา จึงส่งต่อสิ่งที่รู้ทั้งหมดให้ลูกหลานทำต่อ จนวันนี้ออกมาเป็นแบรนด์สุราชุมชนผลิตถูกต้องตามกฎหมายให้ทุกท่านได้ชิมกัน
ข้อมูลและภาพจากเพจประชาชนเบียร์
บริหารจัดการดี
ชวนพบกับ Showcase ไอเดียพัฒนาที่ประชาชนได้มีส่วนร่วม จากสภาเมืองคนรุ่นใหม่ (BKK Ranger)
ที่บริเวณนี้จะมี Showcase แนวทางการพัฒนาเมืองโดยมีคนรุ่นใหม่เข้ามามีส่วนร่วม ผ่านไอเดียที่ได้มีการระดมแนวความคิดจากสมาชิกสภาเมืองคนรุ่นใหม่ระดับกลุ่มโซน ตลอดจนการขยายนโยบายที่ได้รับสนับสนุนและต่อยอดโดยหน่วยงาน กทม.จากการประชุมสภาเมืองที่ผ่านมา
ประชาชนสามารถเดินทางมาร่วมกิจกรรม และมารับบริการได้ตลอด 3 วัน
ผู้ว่าฯชัชชาติ ลงพื้นที่ตรวจสอบ เหตุสะพานลาดกระบังถล่ม
ผู้ว่าฯชัชชาติ ลงพื้นที่ตรวจสอบ เหตุสะพานลาดกระบังถล่ม โดยกล่าวว่า จากข้อมูลที่ได้รับในขณะนี้ (เวลาประมาณ 20.00 น. ) พบผู้เสียชีวิต 1 ราย เบื้องต้นทราบว่าเป็นวิศวะกร มีผู้บาดเจ็บสาหัส 4 ราย บาดเจ็บ 4 ราย รวมผู้บาดเจ็บ 8 ราย และเจ้าหน้าที่ที่เกี่ยวข้อง กำลังเร่งประชุมวางแผนกู้ซากและหาสาเหตุของการถล่ม [
อีจัน] *ภาพจากไทยรัฐ
นายชัชชาติสั่งการ
- ให้รองปลัดสำนักโยธาและประสานวิศวกรรมสถานเข้าตรวจสอบพื้นที่ เอาผู้รับเหมา คนคุมงานทั้งหมด มาประเมินสถานการณ์
- ยังไม่แน่ใจว่ามีคนติดค้างใต้ซากอีกหรือไม่ แต่ก่อนเข้าไป ต้องให้แน่ใจว่าโครงสร้างจะไม่พังทลายซ้ำ
- ด้านผู้บาดเจ็บ ให้ศูนย์เอราวัณ ผอ.รพ.ลาดกระบัง เป็นผู้รวบรวม หากมีผู้สูญหาย ญาติโทรแจ้ง 199
- การดูแลผู้ประสบภัย อยู่ที่วัดพลมณี ลาดกระบัง [แผนที่] หากต้องก
- มอบหมายผอ.เขต ดูแลผู้อยู่อาศัย จะต้องมีการตัดไฟในบางพื้นที่ รับผิดชอบด้านการคมนาคม เข้าออกพื้นที่อยู่อาศัย เร่งรีบให้เข้าสู่ภาวะปกติ ขณะเดียวกันต้องกันคน เพราะยังมีความไม่ปลอดภัยอยู่
- ขอประชาชนที่ไม่เกี่ยวข้องอย่าเข้าพื้นที่เสี่ยง เพราะอาจมีชิ้นส่วนที่อาจตกลงมาอีก
- การกู้ภัยยังไม่สามารถทำได้ทันที ต้องฟังจากวิศวกร ต้องดูว่าต้องการอุปกรณ์หนักชนิดใดบ้าง ต้องดำเนินการคู่ขนานกันไป
- โครงการนี้เป็นโครงการต่อเนื่อง 3 ปี คู่สัญญากับกทม. มูลค่ากว่า 1,664,550,000 ล้าน ระยะทาง 3,500 เมตร จำนวน 4 ช่องจราจร เดิมกำหนดเสร็จสิงหาคม 66 แต่ต่อสัญญาถึง 17 ธันวาคม 2567 จากเหตุโควิด
- งานนี้ต้องมีคนรับผิดชอบ เพราะมีคนเจ็บ คนตาย และไม่น่าใช่เหตุสุดวิสัย เพราะเป็นโครงการก่อสร้างปกติ ไม่มีเหตุสุดวิสัย ตามหลักไม่ควรมีการพังทลายเกิดขึ้น ต้องมีคนรับผิดชอบ
ศูนย์ 14 แก้ว สีบุญเรือง รับสมัครงาน LINK
ศูนย์บริการสาธารณสุข14 แก้ว สีบุญเรือง รับสมัครงาน
รับสมัครคัดเลือกเพื่อบรรจุและแต่งตั้งบุคคลเข้ารับราชการเป็นข้าราชการ กรุงเทพมหานครสามัญ สังกัดสำนักอนามัย ครั้งที่ ๑/๒๕๖๖
ตำแหน่งงานดังต่อไปนี้
1-ตำแหน่งเจ้าพนักงานเภสัชกรรมปฏิบัติงาน จำนวน ๑๓ อัตรา
2-ตำแหน่งนายแพทย์ปฏิบัติการ จำนวน ๔ อัตรา
3-ตำแหน่งสัตวแพทย์ปฏิบัติการ จำนวน ๖ ตำแหน่ง
4-ตำแหน่งนักวิชาการพยาบาลปฏิบัติการ จำนวน ๑ ตำแหน่ง
5-ตำแหน่งพยาบาลวิชาชีพปฏิบัติการ จำนวน ๑๙ตำแหน่ง
และ
6-ตำแหน่งนักรังสีการแพทย์ปฏิบัติการ จำนวน ๑ ตำแหน่ง
ชีวิตชีวาแลสีสันหัวลำโพง งาน Unfolding Bangkok
Present
ปัจจุบันโรงพยาบาลมีความเจริญก้าวหน้าเป็นลำดับมีอาคารทั้งหมด 8 อาคาร พื้นที่ใช้สอย 121,400 ตร.ม. มีเส้นทางการคมนาคมสะดวก ผู้มาใช้บริการสามารถเลือกเดินทางมาใช้บริการ ได้ทั้งโดยรถส่วนตัว รถโดยสารประจำทาง รถไฟฟ้า BTS และรถไฟฟ้าใต้ดิน MRT โรงพยาบาลกรุงเทพคริสเตียน ได้รับความไว้วางใจและความผูกพันจากผู้มาใช้ บริการโดยตลอดและได้พัฒนาขีดความสามารถในการให้บริการ จวบจนปัจจุบันเป็น โรงพยาบาลระดับตติยภูมิ ยึดมั่นในปณิธานที่จะให้การบริการแก่ทุกท่านอย่างดีที่สุด
คลาสขนมปัง 10 ไส้ บ้านตั้งต้น จ.เชียงใหม่ LINK
บ้านตั้งต้นโรงเรียนสอนเบเกอรี่ในเชียงใหม่ อาจารย์สอนใส่ใจทุกรายระเอียด ติวเข้ม แน่น ทำเป็นตั้งแต่เลือกซื้อวัตถุดิบยันขึ้นรูปขนม ไม่มีพื้นฐานก็เรียนได้ ทำเป็นใน 1 วัน ค่าเรียน 3,490 บาท
สอบถาม โทร 099-153-9459
วัคซีนป้องกันไข้เลือดออก พิเศษ 2 เข็ม รพ.บางปะกอก-รังสิต2
DENGUE VACCINE เสริมภูมิคุ้มกัน ลดความเสี่ยง หลีกเลี่ยงอาการรุนแรง ด้วยวัคซีนป้องกันไข้เลือดออก พิเศษ 2 เข็ม เพียง 4,990 บาท ???? สำหรับ เด็กและผู้ใหญ่ อายุ 4-60 ปี ???? ฉีดระยะห่างกัน 3 เดือน สอบถามเพิ่มเติม ศูนย์อายุรกรรม โทร. 02-028-1111 ต่อ 10150
โรงพยาบาลกรุงเทพขอนแก่น บริการวัคซีนป้องกันโรคมือเท้าปาก
โรงพยาบาลกรุงเทพขอนแก่น บริการวัคซีนป้องกันโรคมือเท้าปาก ราคา 3,900 บาท/เข็ม (รวมค่าแพทย์และค่าบริการแล้ว) เพื่อป้องกันโรค มือ เท้า ปาก (Hand-Foot-And-Mouth Disease; HFMD) ที่มีสาเหตุมาจาก การติดเชื้อ EV-71 วัคซีนนี้ไม่สามารถใช้เพื่อป้องกันโรคมือ เท้า ปาก ที่มีสาเหตุจากเชื้อเอนเทอโรไวรัสชนิดอื่น (รวมถึงค็อกซ์แซกกี้ไวรัส A16 และอื่นๆ) ขนาดบรรจุ 0.5 มิลลิลิตร/ขวด (กระบอกฉีดยา), ขนาดบรรจุ 0.5 มิลลิลิตร ต่อขนาดการใช้ แต่ละครั้งประกอบด้วย 100U ของระดับแอนติเจนเอนเทอโรไวรัส ชนิด 71
ข้อห้ามใช้
ผู้ที่เพ้สารสำคัญและสารอื่นที่เป็นส่วนประกอบในวัคซีน รวมถึงสารปรุงแต่งอื่น, ฟอร์มัลดีไฮด์ และ คานาไมซิน ซัลเฟต
ผู้ที่อยู่ระหว่างเป็นไข้หรือระหว่างเป็นโรคเฉียบพลัน
ผู้ที่เป็นโรครื้อรังรุนแรงหรือร่างกายกำลังมีภาวะภูมิแพ้ต่ออะไรบางอย่าง
ประสิทธิผลในการป้องกันโรของวัศซีน Entrovac อาจจะไม่ถึง 100% ในผู้รับวัคซีนทุกรายเช่นเดียวกับวัศซีน ชนิดอื่น **
EntroVac : Enterovirus Type 71 Vaccine, Inactivated (Human Diploid Cell)
สอบถามรายละเอียดเพิ่มเติม แผนกกุมารเวช โทร. 043-042888 043-042716
โรงพยาบาลเมืองสมุทรปู่เจ้าฯ วัคซีนไข้หวัดใหญ่ 4 สายพันธุ์
สอบถามโทร 02-7512800 ต่อ 109 222
สำนักงานป้องกันควบคุมโรคที่ 9 จังหวัดนครราชสีมา
คณะทันตแพทยศาสตร์ ม.กรุงเทพธนบุรี ทำฟันฟรี 17-21 ตุลาคม 2565
ด้วยพระเมตตาสมเด็จย่าชาวทวีวัฒนาได้รักษ์ฟัน คณะทันตแพทยศาสตร์ มหาวิทยาลัยกรุงเทพธนบุรี บริการทางทันตกรรมฟรี (ตรวจฟัน อุดฟัน ถอนฟัน X-ray ขูดหินปูน เคลือบฟลูออไลด์ ) ในวันที่ 17-21 ตุลาคม 2565 เวลา 9.00 - 14.00 น. คลีนิกทันตกรรมชั้น 2 คณะทันตแพทยศาสตร์ มหาวิทยาลัยกรุงเทพธนบุรี สอบถามเพิ่มเติม 02-4315383 ถึง 84 หมายเหตุ ยกเว้นวันพุธที่ 19 ต.ค. 2565 ช่วงบ่าย
คลินิกศัลยกรรมกระดูก
คลินิกศัลยกรรมกระดูก
คลินิกศัลยกรรมกระดูก ในเวลาราชการ 08.00 น. - 12.00 น.
งานไหลเรือประเพณีไหลเรือไฟโบราณล่องลำน้ำหมัน ด่านซ้าย 29 ตุลาคม 66
ประเพณีไหลเรือไฟโบราณบนลำน้ำหมันของชาวอำเภอด่านซ้าย จังหวัดเลย เพื่อขอขมาแม่น้ำ ลำคลองโดยเฉพาะลำน้ำหมันที่หล่อเลี้ยงชีวิตชาวอำเภอด่านซ้าย ประกอบด้วย เรือไฟ 3 ลำ มีม้า จระเข้ และเรือ ทำจากต้นกล้วยและไม้ไผ่ขึ้นเป็นโครง ประดับด้วยไฟจากน้ำมันหมากแตก ส่วนความหมายของเรือแต่ละลำ เรือม้า คือ ความก้าวนำหน้าพาเรืองรุ่งเรือง เรือจระเข้ คือ ผู้เป็นใหญ่แห่งสายน้ำ และเรือคน คือ สายชีวิตอยู่รวมร่วมเกื้อกูลกัน
ในปี 2566 นี้ การท่องเที่ยวแห่งประเทศไทย สำนักงานเลย ได้ประชาสัมพันธ์กระตุ้นการท่องเที่ยว กิจกรรมประเพณีไหลเรือไฟโบราณถึง 8 ลำ โดยได้รับการสนับสนุนจากเทศบาลศรีสองรัก อำเภอด่านซ้าย และบ้านเหนือ ด่านซ้าย ทั้งภาครัฐ เอกชน และทุกภาคส่วนที่เกี่ยวข้อง ในการทำเรือไฟโบราณเพื่อให้มีความยิ่งใหญ่อลังการกว่าทุกปี โดยจะมีการไหลเรือไฟในวันที่ 29 ตุลาคม 2566 ณ ริมน้ำหมันบ้านนาเวียงใหญ่ อ.ด่านซ้าย จ.เลย พร้อมด้วยกิจกรรมถวายปราสาทผึ้งสามหมู่บ้าน ทำบุญตักบาตร ถวายปราสาทผึ้งกิจกรรมออกร้านอาหารพื้นถิ่นกิจกรรมสอยดาวงานวัด ปิดทองพระทันใจประจำวันเกิดกิจกรรมกีฬาพื้นบ้าน กิจกรรมงานรำวงชาวบ้านย้อนยุค วงโอฬารพิษณุโลก และนางรำสาวสวยพีเคแด้นช์ และกิจกรรมประกวดไหลเรือไฟ อย่างยิ่งใหญ่
ทริปเหมันต์หรรษา เที่ยวทุ่งดอกไม้งาม 14 เที่ยว พฤศจิกายน-ธันวาคม LINK
การรถไฟฯ จัดทริปท่องเที่ยวสุดพิเศษกับขบวนรถไฟ KIHA 183 ต้อนรับลมหนาว #เหมันต์หรรษา เที่ยวทุ่งดอกไม้งาม 14 ทริป ดังนี้
- ทริปที่ 1 และ 2 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 4 และวันอาทิตย์ที่ 5 พฤศจิกายน 2566) โปรแกรม มนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
- ทริปที่ 3 แบบพักค้างคืน (วันเสาร์ที่ 11 – วันอาทิตย์ที่ 12 พฤศจิกายน 2566) โปรแกรมสัมผัสลมหนาว ชมทุ่งดอกคอสมอสที่ผาหินซ้อน เที่ยวเมืองเก่าทวารวดี ที่ปราจีนบุรี ราคาท่านละ 3,999 บาท
- ทริปที่ 4 แบบพักค้างคืน (วันเสาร์ที่ 18 - วันอาทิตย์ที่ 19 พฤศจิกายน 2566) โปรแกรมเที่ยวเกาะแห่งรัก(ษ์) ชมทุ่งดอกมาการ์เร็ตและไฮเดรนเยีย เล่นน้ำหาดจอมเทียน ตะลุยราตรีที่พัทยา ราคาท่านละ 3,999 บาท
- ทริปที่ 5 และ 6 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 25 และวันอาทิตย์ที่ 26 พฤศจิกายน 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
- ทริปที่ 7 และ 8 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 2 และวันอาทิตย์ที่ 3 ธันวาคม 2566) โปรแกรมมนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
- ทริปที่ 9 และ 10 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 9 และวันอาทิตย์ที่ 10 ธันวาคม 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
- ทริปที่ 11 และ 12 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 16 และวันอาทิตย์ที่ 17 ธันวาคม 2566) โปรแกรม แต่งชุดไทย นั่ง KIHA 183 ชมทุ่งดอกเก๊กฮวย เที่ยวค่ายบางระจัน Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
- ทริปที่ 13 และ 14 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 23 และวันอาทิตย์ที่ 24 ธันวาคม 2566 โปรแกรม แต่งชุดไทย นั่ง KIHA183 ชมทุ่งดอกคอสมอส เที่ยววังนารายณ์ Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
บรรยากาศจากภายนอกสวน Dog Park มีป้ายสีเหลืองรูปน้องหมาน่ารักนานาพันธุ์ คอยต้อนรับผู้มาเยือน
งาน IKEBANA & Flower Show สัมผัสความงามของศาสตร์การจัดดอกไม้สไตล์เก่าแก่ของญี่ปุ่น
อีกหนึ่งไฮไลต์ความพิเศษที่ห้ามพลาด!! เชิญร่วมสัมผัสความงามของศาสตร์การจัดดอกไม้สไตล์เก่าแก่ของญี่ปุ่น ทั้งที่หาชมได้ยาก ตื่นตากับความงามของศาสตร์การจัดดอกไม้ในงาน IKEBANA & Flower Show ภายใต้คอนเซปต์ “A Journey of Rose” ผสมผสานดอกไม้ไทยและดอกไม้ญี่ปุ่น เพื่อร่วมฉลองในโอกาสครบรอบ 5 ปีของไอคอนสยาม ห้างสรรพสินค้าสยาม ทาคาชิมายะ และครบรอบ 50 ปี สมาคมอิเคบานะ อินเตอร์เนชั่นแนล แบงค็อก แชปเตอร์ 177 พบกับนิทรรศการการจัดดอกไม้จาก Ikenobo, Ohara และSogetsu พร้อมบูธดอกไม้จากร้านค้าดังกว่า 20 ร้าน และกิจกรรมสาธิตการจัดดอกไม้ และอื่นๆ อีกมากมาย ในระหว่างวันที่ 25-28 พ.ย. 66 ที่เจริญนคร ฮอลล์ ชั้น M ไอคอนสยาม ดื่มด่ำกับบรรยากาศความงดงาม 4 วัน แบบจัดเต็ม!
โปรแกรมตรวจสุขภาพสำหรับผู้ทำงานบนที่สูง
โปรแกรมตรวจสุขภาพสำหรับผู้ทำงานบนที่สูง สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000
29 พ.ย. 66 ปานปรีย์ หารือหัวหน้าคณะผู้แทน ICRC
29 พฤศจิกายน 2566 นายปานปรีย์ พหิทธานุกร รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ พบหารือกับนาง Alessandra Menegon หัวหน้าคณะผู้แทน International Committee of the Red Cross (ICRC) for Israel and Occupied Territories ชื่นชมบทบาทของ ICRC ที่ช่วยอำนวยความสะดวกและนำส่งผู้ถูกควบคุมตัวชาวต่างชาติ รวมถึงคนไทย ให้กลับออกมาถึงอิสราเอลอย่างปลอดภัย รัฐบาลไทยพร้อมสนับสนุนการดำเนินการของ ICRC ในยามวิกฤต โอกาสนี้แสดงความเสียใจต่อการสูญเสียชีวิตของเจ้าหน้าที่ ICRC ในระหว่างปฏิบัติภารกิจครั้งนี้ ขณะที่ฝ่าย ICRC ยินดีและภูมิใจที่สามารถสนับสนุนในกระบวนการรับผู้ถูกควบคุมตัวชาวไทยที่ได้รับการปล่อยตัว
หลักสูตร Review essentials of vocational training delivery using ASEAN Toolboxes
Review essentials of vocational training delivery using ASEAN Toolboxes
คอร์สนี้เหมาะสำหรับบุคลากร ที่ทำงานในส่วนงานต่างๆ ดังต่อไปนี้
- Front Office (Front Office Manager/Front Office Supervisor/Receptionist/Telephone Operator/Bell Boy)
- Hotel Services (Housekeeping)
- Food Production
- Food and Beverage Service
- Travel Services (Travel Agencies/Tour Operation)
ลิงค์หลักสูตร9. เศรษฐกิจสุขภาพ มี Blue Zone (NAN MODELs & CITY MODELS) เมืองสุขภาพดี วิถีชุมชน คนอายุยืน
เปิดโครงการ HEALTHY CITY MODELs "เมืองสุขภาพดี วิถีชุมชน คนอายุยืน" สร้างต้นแบบพื้นที่อายุยืน (Blue Zone) "หนึ่งเขตสุขภาพ หนึ่งพื้นที่อายุยืน" นำร่องน่านโมเดล (Nan Healthy Cities MODELs) แห่งแรก ณ วิทยาลัยสงฆ์นครน่าน มจร.เฉลิมพระเกียรติฯ อำเภอภูเพียง จังหวัดน่าน ซึ่งดำเนินการ ร่วมกับ 7 จังหวัดเขตสุขภาพที่ 1 ตามแนวทางและหลักการ ในการพัฒนาแต่ละพื้นที่ให้ได้รับการรับรองเป็นเมืองสุขภาพดี ขณะนี้มีพื้นที่ชุมชนสุขภาพดีในจังหวัดนำร่องครบทั้ง 12 เขต รวม 20 เมือง
การเดินทางด้วยระบบขนส่งสาธารณะในจังหวัด และระหว่างประเทศ
ประเทศนิวซีแลนด์
New Zealand
1. Faculty of Medical and Health Sciences, University of Auckland, Auckland, New
Zealand
หลักสูตร 6 ปี ปริญญา Bachelor of Medicine and Bachelor of Surgery
(MBChB) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศนิวซีแลนด์ และรับรองโรงพยาบาลที่ใช้
ในการเรียนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในประเทศนิวซีแลนด์ ดังนี้
โรงพยาบาลหลัก 1 แห่ง คือ
1.Auckland City Hospital
โรงพยาบาลสมทบ 9 แห่ง คือ
1. Middlemore Hospital 2. North Shore Hospital
3. Rotarua Hospital 4.Tauranga Hospital
5.Taranaki Hospital 6. Waikato Hospital
7.Waitakere Hospital 8.Whangarei Hospital
9. Whakatane Hospital
ว/ด/ป ที่ รับรอง 11 เม.ย. 62
ว/ด/ป ครบอายุ การรับรอง 10 เม.ย. 67
2. School of Medicine, University of Otago Dunedin, New Zealand
ห ลั ก สู ต ร 6 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery (MB ChB) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ ประเทศนิวซีแลนด์ และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ
คลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศนิวซีแลนด์ จ านวน 3 แห่ง ดังนี้
1. Christchurch Hospitals
2. Wellington Hospitals
3. Dunedin and Invercargill Hospitals
ว/ด/ป ที่ รับรอง 12 ธ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 11 ธ.ค. 67
สรุปผลการคำนวนปิด global budget ค่าบริการผู้ป่วยนอก กรณี Model 5 ปีงบประมาณ 2566
ระบบป้ายนำทางจักรยาน โดย conscious การทดลองต้นแบบเส้นทางจักรยาน จุดจอดจักรยาน และระบบป้ายนำทางเพื่อการสัญจร ที่ได้รับการตอบรับด้วยดีทั้งจากผู้ที่นำจักรยานมาเองและผู้ที่ใช้ Bike Sharing ที่กรุงเทพมหานครกำลังจะติดตั้ง โดยข้อคิดเห็นที่ได้จากแบบประเมินจะถูกนำไปต่อยอดเพื่อเสนอให้มีการติดตั้งระบบจริงในอนาคต
สปสช.เขต 9 นครราชสีมา
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 9 นครราชสีมา
- 149 หมู่ 3 ซอย อุตสาหกรรมสุรนารี ตำบล หนองบัวศาลา อำเภอเมืองนครราชสีมา นครราชสีมา 30000
- โทร. 044248870
- โทรสาร. 044248875
- แผนที่ google map
- website
- facebook
UMSC โรงพยาบาลผู้สูงอายุบางขุนเทียน
ศูนย์สนับสนุนบริการสุขภาพเวชศาสตร์เขตเมือง UMSC โรงพยาบาลผู้สูงอายุบางขุนเทียน แอดไลน์ Line ID: @1bkt รับบริการ สอบถามเกี่ยวกับสุขภาพ อาการเจ็บป่วยฉุกเฉิน พบแพทย์ออนไลน์ สอบถามเพิ่มเติม โทร 02-4527999
เขต 9
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี หนองบัวโคก จ.ชัยภูมิ
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีนิคมลำตะคอง จ.นครราชสีมา
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี บ้านหนองใหญ่ จังหวัดบุรีรัมย์
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีร่มโพธิ์
- สอน.บ้านรุน จ.สุรินทร์
คลินิกแพทย์แผนไทยโรงพยาบาลสุโขทัย
คลินิกแพทย์แผนไทยโรงพยาบาลสุโขทัย
ตั้งอยู่ที่อาคารสุวิชานวรวุฒิ ให้บริการด้านเวชกรรมไทย เภสัชกรรมไทย ตรวจรักษาและจ่ายยาสมุนไพร ให้การฟื้นฟู(นวด ประคบ อบสมุนไพร)
เปิดให้บริการในเวลาราชการทุกวัน
และจะเพิ่มให้บริการนอกเวลาราชการ ในวันอังคารและพฤหัสบดี 16.30-18.30 น. ตั้งแต่เดือนสิงหาคมเป็นต้นไป
และศูนย์แพทย์แผนไทย ริมน้ำ (สสจ.เก่า)ยังคงเปิดให้บริการในเวลาราชการทุกวัน และให้บริการนอกเวลาราขการในวันเสาร์-อาทิตย์และวันหยุดนักขัตฤกษ์เวลา 16.30-18.30น.
ผศ.ดร.ประภาภรณ์ กล่าวเพิ่มเติมว่า "ผลสำรวจชี้ให้เห็นว่า แม้จะมีความตระหนักสูง แต่ยังคงมีช่องว่างระหว่างความตระหนักกับการลงมือปฏิบัติ ซึ่งเป็นสิ่งที่เราจำเป็นต้องแก้ไข เราควรพิจารณาแนวทางปฏิบัติที่เป็นรูปธรรม เพื่อส่งเสริมให้บุคคลและองค์กรต่างๆ เลือกทางเลือกที่ยั่งยืนได้อย่างต่อเนื่อง สิ่งสำคัญที่สุดคือ ทุกคนมีหน้าที่รับผิดชอบในการปกป้องสิ่งแวดล้อม ควบคู่ไปกับนโยบายของภาครัฐ ดังนั้น ไม่สายเกินไปที่เราจะมีส่วนร่วมในการสร้างอนาคตที่ยั่งยืนได้ เราทุกคนจะได้รับประโยชน์ร่วมกัน ทั้งนี้ต่างฝ่ายควรทำหน้าที่ของตัวเองเพื่อลดผลกระทบต่อสิ่งแวดล้อม"
หน่วยศัลยกรรม คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกศัลยกรรม
**เปิดรับผู้ป่วยที่ไม่มีนัดหมายจำกัด**
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396340 02-8396341 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ให้บริการตรวจรักษา วินิจฉัยและให้คำแนะนำแก่ผู้ป่วยที่มารับการรักษาพยาบาลผู้รับบริการที่มีปัญหา ดังนี้
ด้านศัลยกรรมทั่วไป (General surgery)
คลินิกในเวลาราชการ :
วันจันทร์-วันศุกร์ เวลา 9.00-16.00 น
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-อังคาร เวลา 16.00-19.00 น.
วันเสาร์-อาทิตย์ เวลา 09.00-12.00 น.
ด้านศัลยศาสตร์หลอดเลือด (Vascular surgery)
คลินิกในเวลาราชการ :
วันพุธ เวลา 9.00-16.00 น
วันศุกร์ เวลา 9.00-12.00 น
ด้านศัลยศาสตร์ระบบประสาท (Neurosurgery)
คลินิกในเวลาราชการ :
วันจันทร์-วันศุกร์ เวลา 9.00-12.00 น
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์และวันพุธ เวลา 16.00-19.00 น
ด้านกุมารศัลยศาสตร์ (Pediatric surgery)
คลินิกในเวลาราชการ :
วันจันทร์-อังคาร เวลา 09.00-16.00 น.
วันพุธ-พฤหัสบดี เวลา 09.00-12.00 น.
ด้านศัลยศาสตร์ระบบทางเดินปัสสาวะ (Urology surgery)
คลินิกในเวลาราชการ :
วันจันทร์ วันพฤหัสบดี และวันศุกร์ เวลา 09.00-16.00น
วันอังคาร-พุธ เวลา 09.00-12.00น.
คลินิกพิเศษ (พรีเมียม) :
วันอังคาร วันพุธ และวันศุกร์ เวลา 16.00-19.00 น.
วันเสาร์ และวันอาทิตย์ (ไม่ประจำทุกสัปดาห์) เวลา 09.00-12.00 น.
ด้านสุขภาพเพศชาย (Men Health)
คลินิกในเวลาราชการ :
วันพุธ เวลา 13.00-16.00 น.
ด้านศัลยกรรมตกแต่ง (Plastic surgery)
คลินิกในเวลาราชการ :
วันจันทร์ เวลา 09.00-12.00 น.
วันพฤหัสบดี เวลา 09.00-16.00 น.
ด้านศัลยกรรมหัวใจและทรวงอก (Cardiovascular surgery)
คลินิกในเวลาราชการ :
วันจันทร์ และวันพุธ เวลา13.00-16.00น.
วันอังคาร เวลา 09.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) : วันจันทร์ เวลา 16.00-19.00 น.
ดร.กริชผกา บุญเฟื่อง ผู้อำนวยการสำนักงานนวัตกรรมแห่งชาติ (NIA) สรุปวงเสวนาด้วยการเล่าถึงการทำงานของศูนย์นวัติกรรมแห่งชาติที่สนับสนุนผู้ประกอบการด้านเทคโนโลยีของประเทศไทย ในแต่ละปี ศูนย์ฯ เปิดพื้นที่ให้ทีมนักศึกษามหาวิทยาลัยกว่า 250 ทีมได้พบปะกับนักลงทุนและผู้ผลักดันการขับเคลื่อนนวัตกรรมของประเทศไทย เป็นเวลาเกือบเก้าปีที่ศูนย์ฯ ทุ่มเทพัฒนาระบบนิเวศสตาร์ทอัพให้มีพลังด้วยการร่วมมือกับหน่วยงานภาครัฐและพันธมิตรระดับโลกไปจนถึงการมีส่วนร่วมกับภาคเอกชนในด้านการศึกษา การท่องเที่ยว ฟินเทค สุขภาพ ไลฟ์สไตล์ และ deep tech
การประชุมสุดยอด GCEC NEW FRONTIER: BANGKOK SUMMIT 2024 ปิดงานด้วยการเสวนาเรื่อง “Redefining Values for Impact Entrepreneurship with the Self-Sufficient Philosophy (SEP)” นอกจากนี้ได้จัดเตรียมกิจกรรมที่กระตุ้นความคิดและแรงบันดาลใจมากมาย พร้อมโอกาสในการสร้างเครือข่ายที่หาไม่ได้จากที่อื่น ยังมีเวิร์กช็อปด้านวัฒนธรรมและมื้อเย็นสุดพิเศษบนเรือล่องแม่น้ำเจ้าพระยา การประชุมครั้งนี้ถือเป็นหนึ่งในกิจกรรมหลักสามอย่างของสัปดาห์ Sasin IEW 2024 ควบคู่ไปกับการแข่งขัน Bangkok Business Challenge (BBC) และ Family Enterprise Case Competition – Asia Pacific 2024 (FECC-AP)
สแกนจากเครื่องอัลตร้าซาวน์ ศูนย์สนับสนุนบริการสุขภาพที่ 9 นครราชสีมา
ศูนย์สนับสนุนบริการสุขภาพที่ 9 (Regional Health Service Support Center 9) มีพื้นที่รับผิดชอบ จำนวน 4 จังหวัด ได้แก่ ชัยภูมิ นครราชสีมา บุรีรัมย์ สุรินทร์
- 526 ถนนราชสีมา-โชคชัย ตำบลหนองบัวศาลา อำเภอเมือง จังหวัดนครราชสีมา 30000
- โทร 044-212179 สบส. Call Center โทร 02-193-7999
- email : saraban-hss9@hss.mail.go.th Center9@hss.mail.go.th
- Google map
- Facebook
- Website
นิยาม Medical Wellness
องค์การอนามัยโลก (World Health Organization; WHO) ให้คำอธิบายว่า สุขภาพ หมายถึง สภาวะของความเป็นอยู่ที่ดี (Health and Well-being) ซึ่งไม่ใช่เพียงแต่ไม่มีโรคและความทุพพลภาพเท่านั้น แต่หมายรวมถึง การมีสุขภาพที่ดีที่สุด (Optimal Health) การส่งเสริมสุขภาพ (Health Promotion) และความเป็นอยู่ที่ดีสูงสุด (Well-being) ที่มีความสมดุลในทุกมิติการดำเนินชีวิตและสุขภาพองค์รวม (Holistic Health) ของบุคคลซึ่งมิติของการมีสุขภาพองค์รวมเหล่านี้รวมถึงสุข ภาวะทางร่างกาย จิตใจ อารมณ์ สิ่งแวดล้อม จิตวิญญาณ และสังคม ส่งผลต่อการพัฒนาความก้าวหน้าของศาสตร์สาขาวิชาด้านสุขภาพทางการแพทย์อย่างต่อเนื่องเพื่อตอบสนองความต้องการของบุคคลให้มีสุขภาพที่ดีขึ้น ผ่านกระบวนการปฏิบัติด้านสุขภาพและวิทยาศาสตร์การแพทย์
สมาคม Medical Wellness Association ได้ให้คำนิยามไว้ว่า เวลเนสทางการแพทย์ หรือMedical Wellness หมายถึง กระบวนการทางการแพทย์ที่ก่อให้เกิดผลลัพธ์ด้านสุขภาพและความเป็นอยู่ที่ดีที่ได้รับการพิสูจน์แล้วทางวิทยาศาสตร์
คำอธิบายที่เฉพาะเจาะจงมากขึ้นของเวลเนสทางการแพทย์ คือ
การจัดบริการด้านสุขภาพด้วยวิทยาศาสตร์การแพทย์ที่ผู้ประกอบวิชาชีพพิจารณาถึงปัจจัยหลายประการที่ส่งผลกระทบต่อสุขภาพของบุคคล แล้ววางแผนหรือออกแบบให้มีการดูแลสุขภาพได้หลาก หลายวิธี เพื่อรักษาพยาบาล ป้องกันโรค ฟื้นฟูสุขภาพ รวมทั้งส่งเสริมความเป็นอยู่ที่ดีที่สุดของบุคคล
เวลเนสทางการแพทย์ มีลักษณะเด่นของการให้บริการที่ผสมผสานกันระหว่างบริการทางการแพทย์และบริการที่ไม่ใช่ทางการแพทย์ มีเป้าหมายของส่งเสริมให้บุคคลมีสุขภาพองค์รวมและสุขภาวะที่ดี โดยผู้ให้บริการหลัก คือ ผู้ประกอบวิชาชีพทางการแพทย์ที่ทำงานร่วมกับผู้ให้บริการที่เกี่ยวข้องกับการดูแลสุขภาพ ทั้งที่เป็นนักบำบัดหรือผู้เชี่ยวชาญด้านสุขภาพ เพื่อจัดบริการดูแลรักษาหรือแก้ไขปัญหาสุขภาพและแนะนำทางเลือกในการมีสุขภาพดีอย่างยั่งยืนท่ามกลางสภาวะแวดล้อมที่เปลี่ยนแปลงอย่างพลิกผันในปัจจุบัน
9. ไฮโดรเจนเพื่อการขับเคลื่อน (H2 for Mobility)
รถยนต์ปัจจุบันกำลังค่อยเปลี่ยนจากรถยนต์สันดาปภายในไปเป็นรถยนต์ไฟฟ้ามากขึ้นเรื่อย ๆ ในขณะที่ฟากผู้ผลิตรถยนต์รายใหญ่ของประเทศญี่ปุ่นบางรายก็ลงทุนวิจัยมหาศาลไปรถยนต์ขับเคลื่อนด้วยพลังงานไฮโดรเจน เพราะคาดกันว่าพลังงานจากไฮโดรเจนจะเป็นอีกตัวเลือกของพลังงานอนาคตได้เช่นกัน
มีคนจำนวนมากคาดหวังว่าพลังงานไฮโดรเจนจะมาเป็นตัวปิดช่องว่าง 20% ของ Net Zero ของภาคการขนส่งขนาดใหญ่ และการป้อนไฟฟ้าให้แก่ภาคอุตสาหกรรม
9.INDUSTRY, INNOVATION AND INFRASTRUCTURE อุตสาหกรรม นวัตกรรม และโครงสร้างพื้นฐาน
การลงทุนในโครงสร้างพื้นฐานและนวัตกรรมเป็นปัจจัยสำคัญในการเติบโตและการพัฒนาทางเศรษฐกิจ ในปัจจุบัน ประชากรโลกมากกว่าครึ่งอาศัยอยู่ในเมือง การขนส่งมวลชนและพลังงานหมุนเวียนจึงมีความสำคัญมากขึ้นเรื่อยๆ เช่นเดียวกับการเติบโตของอุตสาหกรรมใหม่ๆ และเทคโนโลยีสารสนเทศและการสื่อสาร
ความก้าวหน้าทางเทคโนโลยียังเป็นสิ่งสำคัญในการค้นหาวิธีแก้ปัญหาที่ยั่งยืนสำหรับความท้าทายทางเศรษฐกิจและสิ่งแวดล้อม เช่น การจัดหาตำแหน่งงานใหม่และส่งเสริมประสิทธิภาพการใช้พลังงาน การส่งเสริมอุตสาหกรรมที่ยั่งยืนและการลงทุนด้านการวิจัยทางวิทยาศาสตร์และนวัตกรรม ล้วนเป็นแนวทางสำคัญในการอำนวยความสะดวกในการพัฒนาอย่างยั่งยืน
ประชากรมากกว่า 4 พันล้านคนยังคงไม่สามารถเข้าถึงอินเทอร์เน็ตได้ และ 90 เปอร์เซ็นต์มาจากโลกกำลังพัฒนา การลดช่องว่างทางดิจิทัลนี้มีความสำคัญอย่างยิ่งเพื่อให้เข้าถึงข้อมูลและความรู้ได้อย่างเท่าเทียมกัน ตลอดจนส่งเสริมนวัตกรรมและผู้ประกอบการ
กรอกข้อมูลส่วนตัว ชื่อ-นามสกุล เลขบัตรประชาชน เลขหลังบัตร และอื่นๆให้ครบ
9.Quantum technologies - เทคโนโลยีควอนตัม
เทคโนโลยีที่ใช้ควอนตัมเป็นฐานนั้นใช้ประโยชน์จากคุณสมบัติเฉพาะตัวของกลศาสตร์ควอนตัมในการดำเนินการคำนวณที่ซับซ้อนบางอย่างได้เร็วกว่าคอมพิวเตอร์แบบดั้งเดิมอย่างมาก สร้างความปลอดภัยให้กับเครือข่ายการสื่อสาร และสร้างเซ็นเซอร์ที่มีระดับความไวที่สูงกว่าเซ็นเซอร์แบบดั้งเดิม
คลินิกผู้สูงอายุครบวงจร วันอังคาร เวลา 08.00 น. - 12.00 น.
คลินิกผู้สูงอายุครบวงจร
วัน-เวลา ทำการ : วันอังคาร เวลา 08.00 น. - 12.00 น.
เบอร์โทรติดต่อ : 02-2842331 ต่อ 203
ขอบเขตการให้บริการ
1. ให้บริการตรวจคัดกรองทั้ง 11 รายการ แบบจุดเดียวเบ็ดเสร็จให้ผู้ที่เป็นกลุ่มผู้สูงอายุ โดยแพทย์ผู้เชี่ยวชาญ ทุกวันอังคาร เวลา 08.00น.-12.00น.
2. ให้บริการตรวจคัดกรองทั้ง 11 รายการให้ผู้ที่เป็นกลุ่มผู้สูงอายุ ได้แก่
1.การตรวจสุขภาพ
2.เจาะเลือดตรวจวัดระดับน้ำตาลในเลือด ตรวจวัดระดับเม็ดเลือด ระดับไขมัน
3.วัดภาวะความซึมเศร้า
4.วัดภาวะสมองเสื่อม
5.ดูเรื่องโภชนาการ
6.ประเมินการใช้ชีวิตประจำวัน หรือ ADL
7.ประเมินเรื่องการใช้ยา และ
8.ประเมินภาวะกระดูกพรุน
9.การคัดกรองภาวะการกลั้นปัสสาวะไม่ได้
10.การวัดภาวะพลัดตกหกล้ม และ
11.ให้คำแนะนำปรึกษาด้านการดูแลสุขภาพโดยสหสาขาวิชาชีพไม่น้อยกว่า 3 สาขา
3. ให้บริการติดต่อประสานงานเครือข่ายในการตรวจวินิจฉัยโรค และส่งต่อผู้ป่วยกลุ่มผู้สูงอายุไปรับการรักษาในหน่วยงานที่เหมาะสม
โปรแกรมคลินิก ProClinic
ProClinic โปรแกรมคลินิก ติดอาวุธให้คลินิก ทำธุรกิจแบบพุ่งทะยาน เน้นการเพิ่มยอดขายและสร้างการเติบโตให้คลินิกของคุณ ยกระดับการบริหารงานคลินิกให้อยู่ในระดับมืออาชีพ วางกลยุท์เพื่อเพิ่มยอดขายคลินิกความงามโดยเฉพาะ เหมาะสำหรับผู้บริหารที่ต้องการวิเคราะห์ข้อมูลแบบละเอียด
โปรแกรมคลินิก ProClinic จะมาช่วยปลดล็อคธุรกิจเพื่อการเติบโตที่ก้าวกระโดด เพิ่มรายได้ธุรกิจได้จริงด้วย Pro Model เป็นเจ้าแรกที่ใช้ Intensive E-Commerce Tools ลดต้นทุนและเพิ่มประสิทธิภาพในการบริหารด้วย Deep Analytics ดูแลลูกค้าอย่างมืออาชีพด้วย CRM Insight & Smart Audience
โปรแกรมคลินิก ProClinic ระบบ ครบครัน และ ตอบโจทย์การใช้งานของคลินิกโดยแท้จริง ออกแบบมาโดยโฟกัสที่ 4 ปัจจัยที่เป็นเสาหลักของธุรกิจก ได้แก่
- การขาย วิเคราะห์ข้อมูลเรื่องยอดขายได้ชัดเจน หลายมิติ ทำให้แก้ปัญหา หรือคิดกลยุทธ์ ในการส่งเสริมยอดขายได้ตรงจุด ไม่ต้องกังวลว่าจะพลาดโอกาสสำคัญในการขาย
- ลูกค้า ดูแลลูกค้าได้ครบทุกมิติ ไม่ปล่อยให้ลูกค้าที่มีศักยภาพหลุดมือไป เข้าใจความต้องการ ที่แท้จริงของลูกค้า เพื่อนำไปปรับแผนการตลาดและดูแลลูกค้าได้ดียิ่งขึ้น
- พนักงาน วิเคราะห์ข้อมูลพนักงานได้ครบทุกมิติ ช่วยเสริมจุดแข็ง และปรับปรุงจุดอ่อนของพนักงานได้อย่างตรงจุด เพื่อเพิ่มสกิลการขายให้ดียิ่งขึ้น
- คลังสินค้า วิเคราะห์ข้อมูลคลังสินค้าย้อนหลัง 3 เดือนเพื่อช่วยวางแผนการ Stock สินค้า จากสถานการณ์จริงแบบ Real Time สามารถลดความเสี่ยงและ ต้นทุนการสั่งสินค้าให้เจ้าของได้อย่างแม่นยำ
เสริมทัพด้วยเทคโนโลยีล้ำๆ ที่นำกว่า อาทิ 1) ระบบ CRM ที่สามารถ Breakdown ให้เราเห็นพฤติกรรมการซื้อ ในมิติของ ความถี่ กำลังซื้อ และ ความสดใหม่ของลูกค้าได้ละเอียดขึ้น 2) RFM ANALYSIS กราฟวิเคราะห์พฤติกรรมการซื้อขาย ตามพฤติกรรมลูกค้าทั้ง 8 กลุ่ม 3) SEGMENTATION MAP MAP ที่สามารถทำให้เราทำการตลาดได้ ตรงกลุ่ม ออกแบบ Campaign ได้ตรงจุด ตอบสนองความต้องการของลูกค้า ได้ทันท่วงที. 4) COHORT ANALYSIS ตารางวิเคราะห์ พฤติกรรมการใช้บริการ ในมิติของความถี่และกำลังซื้อในแต่ละครั้ง. 5) SMART AUDIENCE ระบบติดตามลูกค้าอัตโนมัติ ระบบติดตามข้อมูลลูกค้า ครบทุกมิติช่วยแบ่งกลุ่มลูกค้าแบบอัตโนมัติ เพื่อวางแผนและบริหารงานได้แบบมืออาชีพ สามารถนำไปลงโฆษณา เพื่อบูสต์ยอดขาย หรือติดตามให้ลูกค้ากลับมาใช้บริการอีกครั้ง
เรทค่าบริการตามแพคเกจตั้งแต่ Starter Pro Business และ Growth ตั้งแต่ 9,900 - 29,000 บาท/ปี พร้อมทดลองใช้ฟรี 1 เดือน
ปรึกษาปัญหาสุขภาพ กับคลินิกผู้สูงอายุ โรงพยาบาลสิรินธร กรุงเทพมหานคร
ผู้สูงอายุที่มีปัญหาสุขภาพ เช่น หลงลืมง่าย น้ำหนักลด เบื่ออาหาร หกล้มบ่อย เดินไม่มั่นคง เครียด นอนไม่หลับ วิตกกังวล กลั้นปัสสาวะไม่อยู่ หรือมีปัญหาสุขภาพอื่นๆ สามารถเข้ารับการปรึกษาได้ที่ คลินิกผู้สูงอายุ โรงพยาบาลสิรินธร กรุงเทพมหานคร ห้องตรวจอายุรกรรมชั้น 2 ทุกวันพุธ และวันศุกร์ เวลา 8.00-12.00 น. สอบถามโทร 02-3286900 ถึง 19 ต่อ 10270 11442
โครงการสุขภาพดีด้วยทฤษฎีเพื่อน (ตาย) ด้วยหลัก 10 อ
สมเด็จพระเจ้าอยู่หัวมหาวชิราลงกรณ บดินทรเทพยวรางกูร (รัชกาลที่ 10) ทรงเป็นแบบอย่างปฏิบัติออกกำลังพระวรกายมาตลอด ทรงเริ่มโครงการจิตอาสา ทำความดี ด้วยหัวใจ เมื่อ 28 กรกฎาคม 2560 เปิดโอกาสให้ประชาชนทั่วไปสมัครเป็นจิตอาสา คิดวิเคราะห์รูปแบบการส่งเสริมสุขภาพประชาชนทุกกลุ่มวัย การเป็นจิตอาสา การมีจิตใจเอื้ออารี การช่วยเหลือผู้อื่น มีผลต่อสุขภาพจิตและสุขภาพกาย ทำให้มีสุขภาพดี จิตอาสาจึงรวมเป็นหนึ่งในแนวปฏิบัติเพื่อสุขภาพดี ด้วย 10 แนวปฏิบัติการดูแลเพื่อน (ตาย) ด้วย อ เพื่อสุขภาพดี ตามแนวพระราชดำริ มุ่งส่งเสริมให้คนไทยสุขภาพดี ให้มีความรู้นำไปสู่การปฏิบัติ ให้มีทักษะการดำรงชีวิต ให้เป็นคนรักสุขภาพอย่างสม่ำเสมอและตลอดชีวิต จึงให้ความสำคัญกับกลุ่มเด็กและเยาวชน อายุ 10 ปี ขึ้นไป ให้เข้าถึงการส่งเสริมสุขภาพวิถีชีวิตใหม่ยุคดิจิทัล ด้วยการส่งเสริมการจัดกิจกรรมเสริมสร้างความรู้ด้านสุขภาพอย่างสนุกสนานและปลอดภัย ผ่านสื่อสุขภาพรูปแบบหลากหลาย เด็กไทยเป็นอนาคตของชาติ จึงควรส่งเสริมให้เด็กมีสุขภาพร่างกายแข็งแรง พอเพียง และพร้อมตามสภาวะความเป็นอยู่ การปฏิบัติตนตามบทบาทหน้าที่พลเมืองดี และตามวิถีการดำเนินชีวิตอย่างมีความสุข จึงเห็นควรส่งเสริมให้เด็กไทยมีสุขภาพดีด้วยทฤษฎีเพื่อน (ตาย) ด้วยหลัก 10 อ ประกอบด้วย 1) อ อาหาร 2) อ ไม่อดนอน 3) อ ออกกำลังกาย 4) อ เช็คอัพ (ตรวจสุขภาพร่างกาย) 5) อ อาวุธ (วัคซีน) 6) อ ไม่อ้วน 7) อ อันตราย 1 สารเคมี 8) อ อันตราย 2 พฤติกรรมเสี่ยง สุขอนามัย สิ่งแวดล้อม) 9) อารมณ์ (สุขภาพจิต) 10) อ จิตอาสา ทั้งนี้ มีความคาดหวังว่า เด็กไทยจะมีความใส่ใจรักสุขภาพอย่างสม่ำเสมอและตลอดชีวิต มีวิถีการดำเนินชีวิตที่ดี มีความเป็นอยู่ที่ดี และมีคุณภาพชีวิตที่ดีอย่างยั่งยืน
กรมอนามัย กระทรวงสาธารณสุข จึงได้จัดทำโครงการสุขภาพดีด้วยทฤษฎีเพื่อน (ตาย) ด้วยหลัก 10 อ (Thailand 10 for Health) วิถีชีวิตใหม่ยุคดิจิทัล เพื่อส่งเสริม สนับสนุน ให้เด็กและเยาวชนอายุ 10 ปีขึ้นไป เข้าถึงการส่งเสริมสุขภาพวิถีชีวิตใหม่ยุคดิจิทัล และบูรณาการร่วมกับหน่วยงานที่เกี่ยวข้อง ได้แก่ ศูนย์อำนวยการใหญ่จิตอาสาพระราชทาน สำนักงานกองทุนสนับสนุนการสร้างเสริมสุขภาพ (สสส.) หน่วยงานในกระทรวงสาธารณสุข : กรมควบคุมโรค กรมสุขภาพจิต กรมสนับสนุนบริการสุขภาพ กรมการแพทย์แผนไทยและการแพทย์ทางเลือก สำนักงานคณะกรรมการอาหารและยา (อย.) กรมการแพทย์ กรมวิทยากศาสตร์การแพทย์ สำนักงานปลัดกระทรวงสาธารณสุข กระทรวงศึกษาธิการ เพื่อให้เกิดการขับเคลื่อนการดำเนินงานส่งเสริมสุขภาพเด็กและเยาวชน ด้วยหลัก 10 อ Thailand 10 for Health) มีประสิทธิภาพมากขึ้น และ ครอบคลุมทุกกลุ่มเป้าหมาย มีความต่อเนื่องและประสบผลสำเร็จอย่างเป็นรูปธรรม
วัตถุประสงค์
1. เพื่อส่งเสริมให้สถานศึกษาจัดกิจกรรมเสริมสร้างการเรียนรู้สุขภาพด้วยทักษะ E4H และ L4H ตามแนวปฏิบัติการส่งเสริมสุขภาพดีด้วยทฤษฎีเพื่อน (ตาย) ด้วยหลัก 10 อ
2. เพื่อส่งเสริมให้เด็กวัยเรียนวัยรุ่นมีทักษะในการดูแลสุขภาพดีด้วยทฤษฎีเพื่อน (ตาย) ด้วยหลัก 10 อ
กลุ่มเป้าหมาย
1. นักเรียน ครู บุคลากรทางการศึกษา บุคลากรทางสาธารณสุข และประชาชน
2. ภาคีเครือข่ายและหน่วยงานที่เกี่ยวข้อง
พื้นที่เป้าหมาย สถานศึกษา/โรงเรียนทุกสังกัด 1,000 แห่ง
สำหรับผู้ที่สนใจและอยากได้ไอเดียในการแต่งบ้าน รางวัล 10 บ้านน่าอยู่ 10 สวนสวย และรางวัลพิเศษ จะจัดเป็นนิทรรศการบริเวณบ้านตัวอย่าง ในแนวคิด “แดด ฝน คน ต้นไม้” ซึ่งเป็นบ้านหน้าจั่วรูปทรงเรียบง่ายที่ทุกคนไม่ว่าจะเป็นเด็กหรือผู้ใหญ่ก็สามารถเข้าใจได้ โดยเลือกใช้วัสดุที่ดูโปร่งเบาซึ่งมาจากไอเดียการนำบริบทแดด ฝน ต้นไม้ มาใช้เป็นองค์ประกอบหนึ่งของบ้าน สร้างมิติแสงเงาให้บ้านได้หลากหลายรูปแบบ อีกหนึ่งจุดเด่นของบ้านคือผนังผืนใหญ่ที่เป็นแกนของบ้านที่ออกแบบให้เล่าไอเดียการออกแบบบ้านผ่านฟังก์ชันต่างๆ ซึ่งต้องมาดูด้วยตาตัวเองว่าผนังสามารถเป็นอะไรได้อีกมากมาย นอกจากไฮไลต์ที่น่าสนใจ ยังมีกิจกรรมที่เต็มไปด้วยความเพลิดเพลิน ได้ทั้งไอเดียและความรู้ ในบรรยากาศอบอุ่น พร้อมช็อปสินค้าภายในงานได้อย่างจุใจ ในงานบ้านและสวนแฟร์ Living Festival 2024 วันที่ 25 ตุลาคม – 3 พฤศจิกายน 2567 อาคารชาเลนเจอร์ 1-3 อิมแพ็ค เมืองทองธานี ตั้งแต่เวลา 10.00 – 21.00 น. สามารถติดตามรายละเอียดเพิ่มเติมได้ที่เว็บไซต์ www.baanlaesuan.com, Facebook: บ้านและสวน Baanlaesuan.com, IG: baanlaesuan.mag , TikTok:Baanlaesuan, Youtube : บ้านและสวนchannel, Blockdit : บ้านและสวน
9. ความร่วมมือในห่วงโซ่อุปทาน เพื่อลดการปล่อยก๊าซคาร์บอน
การปล่อยก๊าซคาร์บอนฯ ส่วนใหญ่ในอุตสาหกรรมเฮลท์แคร์ หรือประมาณ 71% มาจากห่วงโซ่อุปทาน ตั้งแต่กระบวนการผลิต การขนส่ง ไปจนถึงกระบวนการกำจัดสินค้าหรือบริการ [9] จริงๆ แล้ว การลดการปล่อยก๊าซคาร์บอนฯ จาก 3 ภาคส่วน คาดว่าจะช่วยลดผลกระทบได้ถึง 7 เท่าเทียบกับการลดการปล่อยก๊าซคาร์บอนฯ จากการดำเนินงานขององค์กร องค์กรด้านสาธารณสุขเริ่มตระหนักถึงความสำคัญในการลดการปล่อยก๊าซคาร์บอนฯ ในห่วงโซ่อุปทานมากขึ้น ไม่เพียงแต่เพื่อให้สอดคล้องกับกฎหมายของแต่ละประเทศเท่านั้น แต่ยังช่วยลดผลกระทบต่อสิ่งแวดล้อมและส่งผลต่อผลประกอบการในระยะยาวอีกด้วย ดังนั้นความร่วมมือกับพันธมิตรและคู่ค้าในห่วงโซ่อุปทานจึงเป็นสิ่งสำคัญเพื่อนำไปสู่การเปลี่ยนแปลงที่ยั่งยืน
ความโปร่งใสและความยั่งยืนเป็นปัจจัยสำคัญในห่วงโซ่อุปทาน ตั้งแต่การออกแบบผลิตภัณฑ์ที่สามารถนำกลับมาใช้ใหม่ได้ ไปจนถึงความร่วมมือกับซัพพลายเออร์ จากรายงาน Future Health Index ปี 2024 พบว่าภายในสามปีข้างหน้า 41% ของผู้บริหารชั้นนำในวงการเฮลท์แคร์มีแผนที่จะเลือกซัพพลายเออร์ที่ให้ความสำคัญด้านความยั่งยืน และ 41% ของผู้บริหารชั้นนำในวงการเฮลท์แคร์ยังมีแผนที่จะใช้กลยุทธ์การจัดซื้ออย่างยั่งยืน ที่รวมถึงการใช้อุปกรณ์ที่เป็นมิตรกับสิ่งแวดล้อมอีกด้วย ในขณะที่ ฟิลิปส์ มุ่งมั่นทำงานร่วมกับซัพพลายเออร์ของเรา เพื่อให้มั่นใจว่าพวกเขาปฏิบัติตามมาตรฐานด้านสิ่งแวดล้อมและนำแนวทางปฏิบัติอย่างยั่งยืนมาใช้ ซึ่งการจัดหาสินค้าและบริการอย่างมีความรับผิดชอบนี้จะสร้างผลกระทบเชิงบวกให้ทั้งห่วงโซ่อุปทานในอุตสาหกรรมเฮลท์แคร์ได้
ยกตัวอย่างเช่น โปรแกรม Refurbishment ที่เน้นการใช้วัสดุสิ้นเปลืองและพลังงานน้อยลง การใช้อุปกรณ์ให้นานขึ้นผ่านการอัพเกรด และการนำกลับมาใช้ซ้ำ จะช่วยลดการใช้ทรัพยากรและลดขยะได้ โดยมีการคาดการณ์ว่าตลาดเครื่องมือการแพทย์ที่มีการนำกลับมาใช้ใหม่ (Refurbished) จะเติบโตจาก 17.05 พันล้านดอลลาร์ในปี 2024 ไปถึง 30.78 พันล้านดอลลาร์ในปี 2029 [10]
MOM, IS THAT YOU?!
MOM, IS THAT YOU?! #JFF2025
1 ชั่วโมง 50 นาที R:ท
©2023 "MOM, IS THAT YOU?!" Film Partners JAPANESE (EN & TH Subs)ค้นพบความรักและสายใยผูกพันของครอบครัวอีกครั้ง ใจกลางย่านตัวเมืองเก่าของกรุงโตเกียวที่ชวนให้นึกถึงอดีต “Mom, Is That You?!” ผลงานชวนอบอุ่นหัวใจเรื่องที่ 90 ของผู้กำกับยามาดะ โยจิเรื่องนี้ จะพาคุณติดตามการเดินทางกลับบ้านอย่างไม่คาดฝันของอากิโอะ บ้านหลังเก่าที่ความรักครั้งใหม่อันไม่คาดคิดและจิตวิญญาณอันเยาว์วัยของแม่จะช่วยมอบมุมมองใหม่เกี่ยวกับชีวิตให้เขาอีกครั้ง
- ปี 2564 ระหว่างวันที่ 14 มกราคม - 14 มีนาคม 2564
- ปี 2565 ระหว่างวันที่ 2 กุมภาพันธ์ - 1 เมษายน 2565
- ปี 2567 ระหว่างวันที่ 10 กุมภาพันธ์ 2567 ถึงวันที่ 9 เมษายน 2567
- ปี 2566 ระหว่างวันที่ 22 มกราคม - 22 มีนาคม 2566
9) หุ่นยนต์พยาบาลที่มีรูปร่างเหมือนมนุษย์ (Humanoid nurse robots)
9) หุ่นยนต์พยาบาลที่มีรูปร่างเหมือนมนุษย์ หุ่นยนต์พยาบาลที่มีรูปร่างเหมือนมนุษย์มีจุดมุ่งหมายเพื่อสนับสนุน ช่วยเหลือ และขยายบริการที่เจ้าหน้าที่สาธารณสุขเสนอให้ ผู้เชี่ยวชาญระบุว่าในงานที่มีการทำงานซ้ำซากและจำเจ หุ่นยนต์เหล่านี้อาจมีศักยภาพที่จะแทนที่มนุษย์ได้อย่างสมบูรณ์RoBearหุ่นยนต์รูปหมีสามารถยกผู้ป่วยออกจากเตียงได้หุ่นยนต์ TUGสามารถยกชั้นวางของ รถเข็น หรือถังขยะได้หลายชั้น โดยมีน้ำหนักสูงสุด 700 กิโลกรัม และPepper หุ่นยนต์สังคมมนุษย์ตัวเล็กสามารถทักทายและนำทางผู้ป่วยในโรงพยาบาลได้ หุ่นยนต์วาดเลือดที่น่าขนลุก หรืออย่างน้อยก็เป็นเพียงความฝัน หุ่นยนต์พยาบาลที่มีลักษณะคล้ายมนุษย์นั้นห่างไกลจากความเป็นจริงในชีวิตประจำวัน แม้แต่หุ่นยนต์ Pepper ซึ่งเปิดตัวในโรงพยาบาลสองแห่งในเบลเยียมก็ถูกSoftBank ยกเลิกการผลิตไปแล้ว หุ่นยนต์ต่างๆ ดูเหมือนจะเป็นคำตอบที่ชัดเจนในการบรรเทาปัญหาการขาดแคลนบุคลากรด้านการแพทย์ หุ่นยนต์สามารถช่วยงานต่างๆ ได้มากมาย แม้ว่าจะเป็นเพียงพนักงานในแผนกธุรการก็ตาม เพื่อไม่ให้คนไข้ตกใจ อย่างไรก็ตาม ไม่ใช่เรื่องง่ายอย่างที่คิด ดังที่Moravec Paradoxอธิบายไว้ว่า ตรงกันข้ามกับสมมติฐานของเรา งานการใช้เหตุผลขั้นสูงที่เราพบว่าซับซ้อน เช่น การเล่นหมากรุกหรือการวิเคราะห์สถิติ ต้องใช้พลังประมวลผลค่อนข้างน้อยสำหรับ AI ในการดำเนินการ ในทางกลับกัน ทักษะการรับรู้การเคลื่อนไหว (เช่น การเดิน การลุกจากพื้น และการจดจำภาพ) ต้องใช้ทักษะและยากกว่าสำหรับ AI ที่จะทำซ้ำ9. ภาวะติดการพนัน 1 ใน 5 ของนักพนัน ประเมินว่าตนเองติดการพนัน
กทม.เร่งช่วยเหลือเหตุทางยกระดับอ่อนนุช-ลาดกระบัง ถล่ม ยึดความปลอดภัยของประชาชนเป็นหลัก หากสงสัยมีญาติสูญหาย โทร.แจ้ง 199
10 ก.ค. 66 เวลา 21.00 น.
นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร เปิดเผยถึงเหตุการณ์โครงการก่อสร้างทางยกระดับถนนอ่อนนุช-ลาดกระบัง ในพื้นที่เขตลาดกระบังถล่ม ว่า ขณะนี้ยังคงต้องประเมินสถานการณ์ความปลอดภัยของโครงสร้างก่อนเพราะโครงสร้างได้รับความเสียหายมาก มีความไม่เสถียรอยู่ อาจมีการพังต่อเนื่องได้ การเข้าพื้นที่ต้องประเมินความปลอดภัยทางวิศวกรรมก่อน ต้องมั่นใจว่าเมื่อเข้าไปจะไม่เสียหายมากขึ้น
ตอนนี้ได้มอบหมายรองปลัดกทม.ร่วมกับผอ.สำนักการโยธา และวิศวกรรมสถานฯ วิศวกรและผู้รับเหมามาประเมินสถานการณ์ก่อนว่ามีความปลอดภัยแค่ไหนในการเข้าไป ซึ่งตอนนี้มีศพผู้เสียชีวิตติดอยู่ข้างใน 1 ศพ และยังไม่แน่ชัดว่ามีผู้ติดค้างอยู่ข้างในซากอีกหรือไม่ การเข้าไปกู้ภัยไม่สามารถเข้าได้ทันที ต้องประเมินทางวิศวกรรมด้วย และมอบให้ผอ.เขตดูแลการคมนาคมการเข้าออกพื้นที่ การตัดไฟในบางจุด เร่งจัดการเพื่อให้กลับสู่สถานการณ์ปกติโดยเร็ว ทุกส่วนต้องดูคู่ขนานกันไป
สำหรับผู้บาดเจ็บ มอบให้ทางศูนย์เอราวัณ และผอ.โรงพยาบาลลาดกระบัง เป็นผู้รวบรวมตัวเลขผู้บาดเจ็บ สูญหาย และหากใครมีญาติ หรือคนรู้จักที่คาดว่ายังไม่ได้กลับบ้าน ติดต่อไม่ได้ หรือสูญหายจากเหตุการณ์ ให้โทรไปที่เบอร์ 199 และได้มีการตั้งศูนย์ช่วยเหลืออยู่ที่วัดพลมานีย์ สำหรับผู้ที่ต้องการความช่วยเหลือ
“เป็นเรื่องไม่ควรจะเกิด ต่อไปต้องดูโครงการต่างๆให้รอบคอบ ดูเรื่องความปลอดภัยของประชาชนเป็นหลัก เรื่องนี้คงต้องมีคนรับผิดชอบเพราะไม่ใช่เหตุสุดวิสัย” ผู้ว่าฯ ชัชชาติ กล่าว
กทม.ประกาศ หลีกเลี่ยงเส้นทาง ถนนหลวงแพ่ง - ลาดกระบัง (หน้าโลตัส ลาดกระบัง)
ผู้ว่าฯ ชัชชาติ เปิดเผย ภายหลังลงพื้นที่เกิดเหตุ ระบุในขณะนี้จะต้องเน้นเรื่องความปลอดภัยในพื้นที่ การกู้ซากจะต้องให้วิศวกรเข้ามาประเมินขั้นตอนเพิ่มเติมว่าจะดำเนินการอย่างไรต่อไป เพื่อให้การกู้ภัยเป็นไปอย่างปลอดภัย และไม่เกิดเหตุซ้ำซ้อนขึ้น
สำหรับสถานการณ์ในวันพรุ่งนี้ (11 ก.ค.66) ขอแนะนำให้ประชาชนวางแผนการเดินทาง โดยหาเส้นทางเลี่ยงไว้ก่อน เนื่องจากการกู้ซากโครงสร้างต้องใช้เวลา เพราะเป็นโครงสร้างชิ้นส่วนขนาดใหญ่
โดยทาง สน.จรเข้น้อย ได้แจ้งเส้นทางเลี่ยงการปิดการจราจร ดังนี้
- ขาเข้าเมือง ปิดการจราจรเด็ดขาด ตั้งแต่หน้าเทสโก้โลตัสหลวงแพ่ง ถึง ทางเข้า สน.จรเข้น้อย
- เส้นทางเลี่ยง มาตลาดหัวตะเข้ - ลาดกระบัง ขาเข้า
- เข้า ซอยสหมิตร 2 , ซอยหลวงแพ่ง 6 , ซอยทางเข้าหมู่บ้านร็อคการเด้น มาออก ซอยหลวงแพ่ง 4 เลี้ยวซ้ายขึ้นสะพานหัวตะเข้
- เลี้ยวขวาแยกวัดพลมานีย์ ออกคู่ขนานมอเตอร์เวย์ สามารถไปถนนลาดกระบัง ทางออก มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง หรือ ออกแอร์พอทลิ้งลาดกระบัง
- เลี้ยวขวาแยกวัดพลมานีย์ เลี้ยวขวาคู่ขนานมอเตอร์เวย์ ออกถนนฉลองกรุง
ทั้งนี้ตั้งแต่เวลา 05.00 น. ของวันที่ 11 ก.ค. 66 เป็นต้นไป จนกว่าจะแล้วเสร็จ
บช.น.แจ้งปิดการจราจร วันที่ 11 ก.ค.66 ตั้งแต่ 05.00 น. เป็นต้นไป จนกว่าจะแล้วเสร็จ
บช.น.แจ้งปิดการจราจร จากเหตุสะพานทรุดตัว - เส้นทางเลี่ยง วันที่ 11 ก.ค.66 ตั้งแต่ 05.00 น. เป็นต้นไป จนกว่าจะแล้วเสร็จ
1. เส้นทางที่ปิดการจราจร
ถ.หลวงแพ่ง ฝั่งขาเข้า ตั้งแต่หน้าห้างเทสโก้โลตัสหลวงแพ่ง ถึงทางเข้า สน.จรเข้น้อย
2. เส้นทางแนะนำ
1. ถ.ฉลองกรุง
2. ถ.คู่ขนานมาเตอร์เวย์ กรุงเทพ-ชลบุรีสายใหม่
3. ถ.หลวงแพ่ง ฝั่งขาเข้า ยกเว้นช่วงหน้าห้างโลตัสหลวงแพ่งถึงสน.จรเข้น้อย
4. ถ.หลวงแพ่ง ฝั่งขาออก ใช้งานได้ปกติ
5. ถ.โยธาธิการ
6. ถ.ลาดกระบัง
ประเทศไทยนั้นมีความพร้อมอยู่พอสมควร มีร่างกฎหมายเกี่ยวกับพลังงานไฮโดรเจนแล้ว และมีศักยภาพในการผลิตไบโอไฮโดรเจน (biohydrogen) จากพื้นฐานความเป็นประเทศเกษตรกรรมที่มีสารตั้งต้นจากก๊าซมีเทนในมูลสัตว์หรือชีวมวลต่าง ๆ ที่จัดเป็นกรีนไฮโดรเจน (green hydrogen) แบบหนึ่ง ซึ่งอาจนำมาผ่านกระบวนการทางเคมีต่าง ๆ จนได้ผลิตภัณฑ์เป็นไฮโดรเจนออกมาในที่สุด
ต้นทุนการผลิตไบโอไฮโดรเจนก็มีแนวโน้มลดลงอย่างต่อเนื่อง กระบวนการผลิตไฮโดรเจนแบบนี้ลดการสร้างคาร์บอนฟุตพรินต์ (carbon footprint) และนำมาขายเป็นคาร์บอนเครดิต (carbon credit) ของประเทศไปพร้อม ๆ กันได้อีกด้วย
การผลิตไฮโดรเจนอีกแบบคือ ผลิตจากก๊าซธรรมชาติได้เป็น บลูไฮโดรเจน (blue hydrogen) ก็ยังถูกกว่ากรีนไฮโดรเจนที่ผลิตจากกระบวนการแยกโมเลกุลของน้ำโดยตรง โดยใช้พลังงานไฟฟ้าที่แปลงมาจากความร้อนหรือพลังงานแสงอีกทีอยู่ดี เมื่อร่วมกับกระบวนการ CCS (Carbon Capture and Storage) ก็จะช่วยให้มีค่าคาร์บอนเป็นลบ จึงดีต่อสิ่งแวดล้อม
กู้ภัยขอความร่วมมือ!!! หลีกเลี่ยงเส้นทาง
กู้ภัยขอความร่วมมือ!!! ผู้ใช้รถตอนนี้ ให้หลีกเลี่ยงเส้นทาง บริเวณสะพานข้ามแยก บริเวณหน้าโลตัส ลาดกระบัง ถนนหลวงแพ่ง แขวงทับยาว เขตลาดกระบัง กทม. โดยแนะนำให้ใช้ ทางหลวงพิเศษหมายเลข 7 กรุงเทพฯ - บ้านฉาง เนื่องจากเกิดเหตุสะพานถล่ม เจ้าหน้าที่ระหว่างประชุมวางแผน ค้นหาผู้บาดเจ็บและเสียชีวิต [
อีจัน]
ผบ.ตร.สั่งด่วนให้ บช.น.เร่งช่วยเหลือเหตุสะพานข้ามแยกทรุด
ผบ.ตร.สั่งด่วนให้ บช.น.เร่งช่วยเหลือเหตุสะพานข้ามแยกทรุด จัดการจราจร ประสานส่วนเกี่ยวข้องช่วยเหลือผู้บาดเจ็บและตกค้าง พร้อมเตรียมทีมสอบสวนคดี แนะประชาชนเลี่ยงพื้นที่เกิดเหตุ
เมื่อวันที่ 10 กรกฎาคม 2566 พล.ต.ท.อาชยน ไกรทอง โฆษกสำนักงานตำรวจแห่งชาติ กล่าวว่า จากกรณีเมื่อช่วงค่ำที่ผ่านมา เกิดเหตุสะพานข้ามแยกทรุดตัว บริเวณหน้าโลตัส ลาดกระบัง ถนนหลวงแพ่ง แขวงทับยาว เขตลาดกระบัง กทม. จนเป็นเหตุมีผู้เสียชีวิต และบาดเจ็บนั้น
พล.ต.อ.ดำรงศักดิ์ กิตติประภัสร์ ผบ.ตร.ได้สั่งการให้ พล.ต.ท.ธิติ แสงสว่าง ผบช.น. พร้อมเจ้าหน้าที่ตำรวจเร่งลงพื้นที่ตรวจสอบ ช่วยเหลือประชาชน อำนวยความสะดวกด้านการจราจร เร่งช่วยเหลือผู้บาดเจ็บและตกค้าง พร้อมเตรียมทีมพนักงานสอบสวนไว้คอยอำนวยความสะดวกด้านคดี การสอบสวนต่างๆ โดยประสานการปฏิบัติกับเจ้าหน้าที่ กทม. เจ้าหน้าที่กู้ภัยและส่วนอื่นๆที่เกี่ยวข้อง
ทั้งนี้ ขอความร่วมมือพี่น้องประชาชนหลีกเลี่ยงเส้นทางการจราจรบริเวณดังกล่าว ซึ่งขณะนี้ตำรวจจราจรกลาง และตำรวจทางหลวงได้ขึ้นป้ายประชาสัมพันธ์หลีกเลี่ยงเส้นทางดังกล่าวแล้ว และขอให้ประชาชนให้ความร่วมมือกับเจ้าหน้าที่ในเรื่องการจราจร เพื่อเร่งช่วยเหลือผู้บาดเจ็บ และตกค้างบริเวณดังกล่าวซึ่งเป็นภารกิจสำคัญและเร่งด่วน ที่กำลังดำเนินการ
นอกจากนี้ประเทศไทยยังมีปัจจัยเสริมเรื่องความเชี่ยวชาญในการขนส่งก๊าซ และมีโครงสร้างพื้นฐานรองรับ มีมาตรการความปลอดภัยระดับอุตสาหกรรมที่ชัดเจนอีกด้วย ส่วนปัจจัยเสริมระดับโลกได้แก่เรื่อง การคิดค่าปรับคาร์บอนหรือ CBAM ของสหภาพยุโรปที่ปัจจุบันเริ่มเข้าสู่ช่วงเปลี่ยนผ่านปี 2023-2025 ที่ต้องมีรายงานค่าการปล่อยและการชดเชยก๊าซเรือนกระจกแล้ว แต่มีเทคโนโลยีสำคัญที่ต้องพัฒนาเพิ่มเติมก็คือ เทคโนโลยีในการกักเก็บไฮโดรเจน ซึ่งจะช่วยเรื่องการทดแทนการนำเข้าและผลิตใช้เองในประเทศได้
เมื่อปลายปีที่แล้วมีก้าวที่น่าจับตามองคือ การประกาศจับมือกันระหว่าง PTT–OR–Toyota–BIG ที่จะเริ่มเปิดสถานีต้นแบบเติมไฮโดรเจนสำหรับรถยนต์ไฟฟ้าเซลล์เชื้อเพลิงแห่งแรกของประเทศไทยขึ้น ในขณะที่บริษัท Toyota ก็ประกาศจะใช้รถยนต์รุ่น Mirai จำนวน 500 คัน สำหรับรับส่งนักกีฬาในโอลิมปิกเกมส์และพาราลิมปิกเกมส์อย่างเป็นทางการที่กรุงปารีสในปีนี้ เพื่อเป็นการแสดงศักยภาพของรถยนต์แบบนี้อีกด้วย
หากมีบุคคลสูญหายจากเกตสะพานลาดกระบังถล่ม โทร.สายด่วน 199
กทม.ประชาสัมพันธ์ช่องทางรับแจ้งบุคคลสูญหาย หรือขาดการติดต่อ หรืออยู่ในพื้นที่ใกล้เคียง ในช่วงที่เกิดเหตุ #สะพานถล่มลาดกระบัง สามารถติดต่อเพื่อแจ้งคนหายได้ ที่สายด่วน โทร. 199 [เพจอีจัน]
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตมีนบุรี
เมื่อครั้ง SARs ระบาด คนต่างชาติมาไทยลดลง ไทยก็มีการโปรโมทการท่องเที่ยวแบบ Unseen หากย้อนกลับไปดูในช่วงปี 2003 ที่มีการระบาดของโรคซาร์ส ทางการมีเคมเปญกระตุ้นคนไทยเที่ยวในประเทศ ภายใต้โครงการ Unseen Thailand เพื่อเป็นการช่วยเพิ่มจำนวนนักท่องเที่ยวและรายได้ภายในประเทศ โดยแหล่งท่องเที่ยว Unseen แบ่งออกเป็นประเภทต่างๆ ได้แก่
- แหล่งท่องเที่ยวมหัศจรรย์และธรรมชาติ
- แหล่งท่องเที่ยวผจญภัย
- แหล่งท่องเที่ยวสิ่งศักดิ์สิทธิ์และ
- แหล่งท่องเที่ยวประเพณี วัฒนธรรม และ
- แหล่งท่องเที่ยววิถีชีวิต
การส่งเสริมแหล่งท่องเที่ยว Unseen ในไทยช่วงนี้ น่าจะสามารถช่วยการท่องเที่ยวประเทศได้ขณะเดียวกัน หน่วยงานที่เกี่ยวข้องต้องรว่ มกันพัฒนาสิ่งอำนวยความสะดวกให้พร้อมรองรับนักท่องเที่ยวหน้าใหม่ที่จะเดินทางเข้าไปเยี่ยมเยือนมากขึ้น
แม้รายได้จากนักท่องเที่ยวไทยจะเป็นรายได้หลักในช่วง New Normal แต่ก็ปฏิเสธไม่ได้ว่า หากอยากให้รายได้จากการท่องเที่ยวฟื้นตัวโดยเร็ว การมาเที่ยวของต่างชาติก็ ยังถือเป็นปัจจัยที่ขาดไม่ได้อยู่ ซึ่ง Krungthai COMPASS วิเคราะห์ว่า แนวทางการรับนักท่องเที่ยวต่างชาติที่แตกต่างกันในช่วงโควิด-19 สามารถทำให้รายได้การท่องเที่ยวแตกต่างกันอย่างมาก ในส่วนนี้เรากล่าวถึงว่า Travel Bubble คืออะไร และการเปิด Travel Bubble แบบใดบ้างที่อาจนำมาใช้กับไทยได้
Cafe Amazon for Chance สาขา 1 สำนักงานอธิการบดี มหิดล
เป็น Cafe Amazon for Chance สาขาที่ 1 ดำเนินการโดย ผู้พิการทางการได้ยิน
สำนักงานอธิการบดี มหาวิทยาลัยมหิดล
ถนนพุทธมณฑลสาย ตำบลศาลายา อำเภอพุทธมณฑล นครปฐม 73170
+66946295651
9. ทั้งหมดนี้เรียกว่าการทำงานแบบเครือข่ายหน่วยบริการนั่นเอง
ทั้งหมดนี้เรียกว่าการทำงานแบบเครือข่ายหน่วยบริการ ซึ่งช่วยอำนวยความสะดวกให้กับประชาชนมากขึ้นกว่าในอดีต เพราะแต่เดิม ผู้ป่วยจะถูกจับคู่กับคลินิกประจำตัวเพียงแห่งเดียว ทำให้ไม่มีทางเลือกในการใช้บริการ
เชียงใหม่ กำหนดมาตรการการป้องกันการแพร่ระบาด
คณะกรรมการโรคติดต่อจังหวัดเชียงใหม่ มีมติกำหนดมาตรการการป้องกันการแพร่ระบาดโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรคโควิด-19 สืบเนื่องจากกรณีพบผู้ติดเชื้อที่จังหวัดสมุทรสาคร ดังนี้
ข้อ 1 ให้ผู้ที่เดินทางมาจากจังหวัดสี่ยง (จังหวัดสมุทรสาคร ฯลฯ) ต่อการแพร่ระบาตของโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรคโควิด-19 ตามประกาศของกรมควบคุมโรค เมื่อเดินทางเข้ามายังพื้นที่จังหวัดเชียงใหม่ผ่านทางท่าอากาศยานนานาขาติเชียงใหม่ สถานีรถไฟเชียงใหม่ และสถานีขนส่งผู้โดยสารจังหวัดเชียงใหม่แห่งที่ 2 และที่ 3 (อาเขต) ต้องกรอกข้อมูลลงใน Application CM-CHANA เพื่อติดตามตัว และส่งข้อมูลให้พื้นที่ดำเนินการติดตามในการกักกัน (Home Quarantine) จนครบ 14 วัน
ข้อ 2 ให้ผู้ที่เดินทางมาจากจังหวัดเสี่ยง (จังหวัดสมุทรสาคร ฯลฯ) ต่อการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรโควิด-19 ตามประกาศของกรมควบคุมโรค ตั้งแต่วันที่ 1 ธันวาคม 2563 จนถึงปัจจุบัน เมื่อเดินทางเข้มายังพื้นที่จังหวัดเชียงใหม่ ให้ไปรายงานตัวต่อเจ้าพนักงานโรคติดต่อในพื้นที่และทำการกักกันตนเอง (Home Quarantine) จนครบ 14 วัน
ข้อ 3 ให้สำนักงานสาธารณสุขจังหวัดเชียงใหม่ บูรณาการร่วมกับหน่วยงานที่เกี่ยวข้องออกตรวจหาเชื้อเชิงรุก ในสถานประกอบการที่เสี่ยงต่อการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 หรือโรคโควิด-19 ตามที่คณะกรรมการโรคติดต่อจังหวัดเชียงใหม่กำหนด
อนึ่ง การดำเนินการตามคำสั่งนี้เป็นไปตามพระราชกำหนดการบริหารราชการในสถานการณ์ฉุกเฉิน พ.ศ.2548 จึงไม่อยู่ในบังคับของกฎหมายว่าด้วยวิธีปฏิบัติราชการทางปกครอง และกฎหมายว่าด้วยการจัดตั้งศาลปกครองและวิธีพิจารณาทางปกครอง ตามมาตรา 16 ของพระราชกำหนดดังกล่าว
ผู้ใดผ่าฝืนไม่ปฏิบัติตาม
- ต้องระวางโทษจำคุกไม่เกินหนึ่งปี หรือปรับไม่เกินหนึ่งแสนบาทหรือทั้งจำทั้งปรับ ตามมาตรา 52 แห่งพระราชบัญญัติโรคติดต่อ พ.ศ.2558 หรือ
- ต้องระวางโทษจำคุกไม่เกินสองปี หรือปรับไม่เกินสี่หมื่นบาท หรือทั้งจำทั้งปรับ ตามมาตร 18 แห่งพระราชกำหนดการบริหารราชการในสถานการณ์ฉุกเฉิน พ.ศ. 2548
ทั้งนี้ ตั้งแต่วันที่ 21 ธันวาคม 2563 เป็นต้นไป จนกว่าจะมีการเปลี่ยนแปลง
กลุ่มเสี่ยง รับผิดชอบต่อสังคม ด้วยการกักตัว 14 วัน เพื่อลดการแพร่เชื้อในสังคม
10. ค่าตรวจ RT-PCR COVID-19
10. ค่าตรวจ RT-PCR COVID-19 จำนวน 3,000 บาท
ราคานี้รวมค่าแพทย์ ค่าบริการ ค่า Lab และค่าใบรับรองแพทย์)
ยกเว้น ถ้ามารับใบรับรองแพทย์ในวันเสาร์-อาทิตย์ จะเสียค่าบริการเพิ่ม 400 บาท
ประเภทและรูปแบบของกัญชาในปัจจุบัน LINK
ประเภทและรูปแบบของกัญชาในปัจจุบัน
- ยากัญชาทางเภสัชกรรมที่ผลิตสังเคราะห์ อาทิ nabiximols (Sativex®) Sativex ซึ่งเป็นสเปรย์ฉีดจมูกหรือช่องปากได้รับการรับรองในกว่า 24 ประเทศในการรักษาอาการเกร็งเนื่องจากโรคระบบประสาทส่วนกลางเสื่อม และ cannabinoids สังเคราะห์เช่น Dronabinol®
- กัญชาสมุนไพรที่ควบคุมและได้มาตรฐาน (ผลิตภัณฑ์จากพืช) เช่นผลิตภัณฑ์ยาจากองค์การเภสัชกรรม ตำรับยาสมุนไพรที่มีส่วนผสมจากกัญชาโดยการวิจัยในมหาวิทยาลัย และคลินิกที่ถูกกฏหมาย
- กัญชาสมุนไพรที่ไม่ได้รับการควบคุมและผิดกฎหมาย (ผลิตภัณฑ์จากพืช) ซึ่งมีความเข้มข้นของสารสำคัญที่ไม่แน่นอน มีสิ่งสกปรกที่อาจเป็นอันตรายเช่นแบคทีเรียและเชื้อรา
บทความ ภัทรเพ็ญ มโนรมย์ภัทรสาร
[สวัสดีคลินิกเวชกรรม]
Jack Daniel Honey
Jack Daniel Honey
ใช้ปริมาณเท่าใดต่อเดือน
ตอนนี้ยังไม่ถึงเดือนก็ใช้ไปประมาณ 5 กิโลแล้ว คาดว่าถ้าคนยังให้ความสนใจขนาดนี้น่าจะเดือนละ 6-8 กิโลค่ะ
16 มีนาคม 2564 ปิดตลาดทั้ง 6 แห่ง และทำความสะอาดตลาด
สำนักงานเขตบางแคจะจัดเจ้าหน้าที่ทำความสะอาดตลาดย่านบางแค ทั้ง 6 แห่ง ตั้งแต่ 09.00 น. เป็นต้นไป โดยในช่วงเช้าจะทำความสะอาด (แบบแห้ง) ปัดกวาด และในช่วงบ่ายจะดำเนินการฉีดล้าง ขัด และฆ่าเชื้อ ด้วยน้ำและน้ำยาบริเวณพื้นผิวสัมผัสที่มีความเสี่ยงต่อการสะสมของเชื้อโรคและบริเวณโดยรอบ
นอกจากนี้จะปิดตลาดทั้ง 6 แห่ง จำนวน 3 วัน (16-18 มี.ค.64) จากนั้นจะประเมินผลจากการตรวจเชิงรุกกลุ่มเสี่ยงหากพบว่ามีผู้ติดเชื้อจำนวนมากจะพิจารณาขยายวันปิดต่อไป
ประชาสัมพันธ์ กรุงเทพมหานครกรณีตัวอย่างจากต่างประเทศ
อุดรธานี งาน UD TOWN SUMMER FESTIVAL 2021
อุดรธานี งาน UD TOWN SUMMER FESTIVAL 2021 ณ ศูนย์การค้ายูดีทาวน์ วันที่ 13-16 เมษายน 2564 พื้นที่ 4,500 ตรม. แบ่งเป็นโซนร้านอาหาร , โซนวัฒนธรรม , โซนที่นั่ง และโซนเวทีการแสดง จำกัดคนเข้า 1,500 คน วันนี้มีผู้ติดเชื้อ 1,335 คน
มีผู้ติดเชื้อรักษาหาย 34 คน
ผู้ป่วยยังรักษาอยู่ 7,491 คน
ไม่มีผู้ป่วยติดเชื้อเสียชีวิต
มีอาการหนักต้องใช้เครื่องช่วยหายใจ 9 คน
รักษาตัวที่โรงพยาบาลหลัก 6,914 คน
รักษาตัวที่โรงพยาบาลสนาม 577 คน
โดยผู้ติดเชื้อวันนี้ 1,335 คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 9 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,326 คน
2.1 ตรวจหาเชื้อเชิงรุก 537 คน
2.2 ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 789 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 351 คน
3.2 เชียงใหม่ 319 คน
3.3 ชลบุรี 72 คน
3.4 สมุทรปราการ 44 คน
3.5 ประจวบคีรีขันธ์ 161 คน
3.6 สมุทรสาคร 23 คน
3.7 ภูเก็ต 26 คน
3.8 สระแก้ว 21 คน
3.9 สกลนคร 6 คน
3.10 ระยอง 11 คน
3.11 นครปฐม 20 คน
3.12 ปทุมธานี 2 คน
3.13 นนทบุรี 9 คน
3.14 ลำพูน 8 คน
3.15 มหาสารคาม 7 คน
Mix Jeeravat
ตอนที่ 3 ตรวจโควิด
ครั้งนี้เป็นครั้งที่สองที่ได้ตรวจ ครั้งแรกตรวจตอนวันที่ไปถึงนอร์เวย์ช่วงปลายกันยาที่ผ่านมา ช่วงนั้นสถานการณ์ในนอร์เวย์ยังดีอยู่ มีคนติดเชื้อต่อวันหลักสิบ จึงไม่มีการบังคับตรวจโควิดก่อนเข้าประเทศ แต่มีให้ตรวจฟรี ตามความสมัครใจ ที่สนามบินการ์เดมอนกรุงออสโล ?
การตรวจเป็นแบบ Swab Test นี่ล่ะ คือเอาสำลีพันก้านยาวๆ จิ้มเข้าไปในโพรงจมูก แล้วก็แจ้งผลทาง web โดยจะมี SMS แจ้งมาภายใน 2-3 วันว่าผลออกแล้วนะ ให้รหัสสำหรับล็อกอินเข้าไปเช็คผล ก็ผ่านไป ไม่มีอะไร แต่ก็ได้รู้ว่า แสบจมูกจริงนะเออ ไม่ล้อเล่น ?
แต่สถานการณ์วันนี้ เปลี่ยนไป นอร์เวย์ มีผู้ติดเชื้อในประเทศรายวันหลักหลายร้อย ประมาณสามถึงห้าร้อยต่อวัน ยอดสะสมสี่หมื่นกว่าละ เทียบกับขนาดประชากรห้าล้านนิดๆ ในขณะที่เพื่อนบ้านใกล้ชิดรั้วติดกันทั้งแถบแบบสวีเดนนั้น ยอดสะสมพุ่งทะลุเกินสามแสนห้าไปแล้ว ถึงขนาดที่กษัตริย์สวีเดนออกสื่อว่าประเทศล้มเหลวในการควบคุมการแพร่ระบาด ☹️ เพื่อนบ้านที่รั้วไม่ติดกันแต่กลุ่มเดียวกันอย่างเดนมาร์กก็ทะลุแสนกว่าไปแบบนิ่มๆ หรือไม่นิ่ม ?
การเดินทางเข้านอร์เวย์วันนี้ ต้องมีผลตรวจโควิดไม่เกิน 72 ชั่วโมงและต้องมีโรงแรมหรือที่พักสำหรับกักตัว 10 วัน โดยไม่อนุญาตให้ใช้บ้านเป็นที่กักตัวอีกต่อไป ยกเว้นแต่เป็นคนในครอบครัวหรือบ้านที่จะไปพักมีห้องแยก ห้องน้ำและครัวต่างหาก อันนี้สำหรับคนงานต่างชาติที่ต้องเข้าไปทำงานในนอร์เวย์นะ แต่ก็ยังมีข้อยกเว้นอีกมากมาย สำหรับคนแต่ละกลุ่ม
และก็เป็นเหตุผลว่า ทำไมไม่มีเที่ยวบินตรงไทยนอร์เวย์ เพราะมาตรการของรัฐบาลทั้งสองประเทศ ออกมาเรื่อยๆ จากที่นอร์เวย์เปิดให้เดินทางเข้าออกได้ แต่สายการบินแห่งชาติได้รับผลกระทบหนัก ใกล้เจ๊ง ในขณะที่ของเราเจ๊งไปแล้ว ? เพราะค่าแรงแพง เริ่มบินไม่คุ้ม เที่ยวบินก็เลยเริ่มลดไปเรื่อยๆ ทุกวันนี้จะมีแต่เที่ยวบินเข้าออกจากนอร์เวย์ไปประเทศใกล้ๆ เน้นประเทศกลุ่มนอร์ดิกและยุโรปเป็นหลัก แต่ยังมีไปอเมริกา แคนาดานะ คือเลือกปฏิบัติอะ รู้ เพราะเที่ยวบินตรงข้ามมาฝั่งเอเชียนี่ ไม่มีเลย ถ้ามีก็จะเป็นกาตาร์ เอมิเรสต์ ซึ่งเงินถุงเงินถัง ต้องยอม
ตัดกลับมาที่เมืองไทย ณ โรงแรมแห่งหนึ่งในพัทยา วันที่ทุกคนรอคอยก็มาถึง หลังจากที่สอบถามกันเซ็งแซ่ว่าเมื่อไรจะตรวจโควิดซะที ก็มีไลน์แจ้งมาว่า เช้าวันศุกร์ (ที่ผ่านมา) จะมีการตรวจโควิดรอบแรกสำหรับกลุ่มนี้ เริ่มเวลาเก้าโมงเช้า ก็คือ ตื่นมา วัดไข้ ทำธุระส่วนตัว กินข้าวไรให้เรียบร้อย นั่งรอโทรศัพท์ โดยไปทีละสามคน เพื่อความรวดเร็ว ลงลิฟต์พร้อมกัน แต่ให้หันหน้าเข้ากำแพง เออ ตอนมาถึงให้ขึ้นทีละคน เดินต้องเว้นระยะ ?
ลงไปก็เดินตามทางที่จัดไว้ให้ ไม่ต้องแวะทักทายใคร เพราะไม่รู้จักใคร ? ส่งยิ้มให้กันได้ แต่ใครจะเห็น ก็สวมหน้ากากอยู่ ? จากนั้นก็ไม่มีไร ถามชื่อ ถามห้อง แจ้งเบอร์คิว แล้วพยาบาลที่มาในชุด PPE เรียบร้อย ก็ขอ swab สองจุดนะ คือปากและจมูก ต้องนั่งนิ่งๆ หายใจลึกๆ ยาวๆ ก่อนโดนแยงจมูกนะ เตรียมตัวเตรียมใจนิดนึง ? เพราะถ้าตกใจ กระเถิบถอยหนีหรือยุกยิก จะยิ่งเจ็บ เพราะก้านสำลีจะไปขูดโดนโพรงจมูกได้ แต่ถ้านั่งนิ่งๆ กลั้นหายใจแป๊บตอนพยาบาลแยงก้านสำลีเข้าไป ไม่เจ็บนะจ้ะ ยิ่งถ้าขี้มูกเยอะๆ สบายมาก โล่งเลย ??
แค่นี้เอง นี่คือรอบแรก และผลก็ออกแล้วเมื่อวันเสาร์ที่ผ่านมา ทั้งกรุ๊ป 60 คน ผ่านหมดจ้าาาาา คืนนั้นเป็นคืนแรกที่หลับปุ๋ยเลย ? ยังต้องตรวจอีกรอบหนึ่งประมาณวันที่สิบของการกักตัว และถ้าผ่านทั้งสองรอบจะมีใบแจ้งยืนยันผล สำหรับคนที่ต้องใช้ในการกลับภูมิลำเนา หวังว่าจะไม่มีใครต้องไปสมุทรสาครนะ เป็นห่วง อยู่ห่างๆ ?
ตอนสุดท้ายค่อยมาเล่าเรื่องกลับบ้านนะ ? อีกเจ็ดวันเอง ✌
21 ธันวาคม 2020
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
- ผู้ป่วยรายใหม่ 1,582 ราย
- ผู้ป่วยยืนยันสะสม 39,038 ราย
- หายป่วยแล้ว 28,480 ราย
- เสียชีวิตสะสม 97 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 15 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 586,032 ราย
--------------------------------------------------
วันที่ 15 เมษายน 2564 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 3,096 ราย
เข็มที่ 2 จำนวน 1,628 ราย
20 เมย 64
รายงานผู้ติดเชื้อ 20 เมย 64
วันนี้มีผู้ติดเชื้อ 1,443 คน
มีผู้ติดเชื้อรักษาหาย 171 คน
ผู้ป่วยยังรักษาอยู่ 16,119 คน
มีผู้ป่วยติดเชื้อเสียชีวิต 4 คน
โดยผู้ติดเชื้อวันนี้ 1,443คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 2 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,441 คน
2.1ตรวจหาเชื้อเชิงรุก 113 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 1,328 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 350 คน
3.2 เชียงใหม่ 116 คน
3.3 ชลบุรี 82 คน
3.4 สมุทรปราการ 60 คน
3.5 ประจวบคีรีขันธ์ 41 คน
3.6 สมุทรสาคร 43 คน
3.7 ภูเก็ต 20 คน
3.8 สระแก้ว 7 คน
3.9 สกลนคร 9 คน
3.10 ระยอง 35 คน
3.11 นครปฐม 35 คน
3.12 ปทุมธานี 57 คน
3.13 นนทบุรี 23 คน
3.14 พัทลุง 13 คน
3.15 เชียงราย 17 คน
3.16 อุดรธานี 16 คน
3.17 ขอนแก่น 19 คน
3.18 อุบลราชธานี 17 คน
3.19 สงขลา 29 คน
3.20 อยุธยา 18 คน
3.21 เพชรบุรี 43 คน
3.22 ราชบุรี 8 คน
3.23 นครราชสีมา 47 คน
3.24 ฉะเชิงเทรา 9 คน
3.25 พิษณุโลก 26 คน
3.26 สุราษฎร์ธานี 47 คน
3.27 มหาสารคาม 19 คน
3.28 ลำปาง 17 คน
3.29 นครพนม 10คน
3.30 แม่ฮ่องสอน 14 คน
3.31 ศรีสะเกษ 6 คน
3.32 นครนายก 6 คน
3.33 ลำพูน 39 คน
3.34 นครศรีธรรมราช 11 คน
3.35 พะเยา 8 คน
3.36 น่าน 14 คน
3.37 ลพบุรี 9 คน
3.38 แพร่ 6 คน
3.39 ร้อยเอ็ด 5 คน
3.40 กาญจนบุรี 3 คน
3.41 บุรีรัมย์ 2 คน
3.42 สระบุรี 3 คน
Mix Jeeravat
Q ไม่ได้ไปในเพื้นที่เสี่ยง แต่มีอาการอยากตรวจได้ไหม?
นนทบุรี ประกาศขอความร่วมมือ 11 เมย 64 LINK
จังหวัดนนทบุรี มีประกาศจังหวัด เรื่อง ขอความร่วมมือในการปฏิบัติตามมาตรการพึงปฏิบัติเพื่อป้องกันการแพราระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 หรือ โควิด-19 ดังนี้
(1) ขอความร่วมมือทุกภาคส่วนในจังหวัดนนทบุรีสวมใส่หน้ากากอนามัยหรือหน้ากากผ้าทุกครั้งที่ออกจากที่พักหรืออยู่ในพื้นที่สาธารณะและให้ดำเนินการตามมาตรการป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 อย่างเคร่งครัด
9.2 ถ่ายภาพเอกสารยืนยันที่อยู่ กรณีที่อยู่ปัจจุบันไม่ตรงกับบัตรปชช.
สำหรับกรณีที่อยู่ปัจจุบันไม่ตรงกับบัตรปชช. (เช่น ทำงานต่างจังหวัด หรืออยู่ต่างจังหวัดมาทำงานกรุงเทพ ฯลฯ) ต้องแสดงเอกสารที่บอกว่าตัวเองอยู่ที่ใด
เอกสารที่ใช้ได้ เช่น
- บิลค่าไฟฟ้า
- บิลค่าน้ำ
- หนังสือรับรองเจ้าบ้าน หรือ บ้านเช่า
ถ่ายแล้วแนบไป ช่องที่ 3 (ตามภาพ)
ประกันแพ้วัคซีนโควิด-19 คุ้มครองสูงสุด 3 ล้านบาท* SCB LINK
ประกันแพ้วัคซีนโควิด-19 คุ้มครองสูงสุด 3 ล้านบาท* ซื้อง่ายตลอด 24 ชม. ผ่านแอป SCB EASY
หมดห่วง จากผลกระทบหรือผลข้างเคียงที่เกิดจากการฉีดวัคซีน COVID-19*
คุ้มครอง สูงสุด 3,000,000 บาทสำหรับการเจ็บป่วยด้วยภาวะโคม่า (Coma)*
รับเงินชดเชยรายได้ กรณีรักษาตัวเป็นผู้ป่วยใน*
จ่ายน้อย ค่าเบี้ยประกันถูก เริ่มต้นเพียง 88 บาท/ปี*
ซื้อง่าย สะดวกทุกที่ ตลอด 24 ชม. ผ่านแอป SCB EASY
*เงื่อนไขเป็นไปตามที่กรมธรรม์กำหนด
ความคุ้มครอง และเบี้ยประกันภัย ตามตาราง
Medium and More รับส่วนลดไปเลยทันที 10% LINK
Medium and More ขอสนับสนุนคนไทยฉีดวัคซีนโควิด-19 ช่วยชาติ มาช้อปที่ร้าน Medium and More รับส่วนลดไปเลยทันที 10% เมื่อช้อปครบ 600 บาท (เฉพาะสินค้าที่ร่วมรายการ) ตั้งแต่วันนี้ – 31 สิงหาคม 2564 เพียงแสดงหลักฐานการฉีดวัคซีนก่อนชำระสินค้า โปรนี้ใช้ได้ทั้งหน้าร้านและการสั่งสินค้าออนไลน์เลยนะจ๊ะ
อบจ.ฉะเชิงเทรา ทุ่ม 96 ล้าน จองซิโนฟาร์ม 1 แสนโด๊ส ฉีดให้ชาวแปดริ้ว LINK
18 มิถุนายน 2564 นายกิตติ เป้าเปี่ยมทรัพย์ นายก อบจ.ฉะเชิงเทรา กล่าวว่า ขณะนี้ อบจ.ฉะเชิงเทรา ได้ดำเนินการสั่งจองวัคซีนป้องกันโควิด-19 ซิโนฟาร์ม จากราชวิทยาลัยจุฬาภรณ์ เป็นจำนวน 100,000 โด๊ส เพื่อนำมาฉีดให้กับประชาชนในจังหวัดฉะเชิงเทรา (จำนวน 50,000 คน) ทั้งนี้ได้ใช้งบประมาณในการจัดซื้อและค่าบริหารจัดการ รวมกว่า 96,000,000 บาท ตามสถานะการคลัง ซึ่งหากประชาชนได้รับวัคซีนทุกคน ก็จะสร้างความปลอดภัย และความมั่นใจในการดำเนินชีวิตให้กับประชาชนได้ สร้างความเชื่อมั่นให้กับนักลงทุน และการท่องเที่ยวของจังหวัดจะสามารถฟื้นตัวได้รวดเร็วอีกด้วย
/// วิธีตรวจ : Rapid Test
สนามราชมังคลากีฬาสถาน (หัวหมาก)
วิธีตรวจ : Rapid Test
เวลาทำการ : [08:00-15:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ]
วันที่ให้บริการ :
ปริมาณตรวจ : 1500/วัน
สถานะ : ว่าง
โทรศัพท์ : 021867111
หมายเหตุ
- เตรียมบัตรประชาชนตัวจริง
สถาบันบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี (สบยช.) หรือสถาบันธัญญารักษ์
วิธีตรวจ : Rapid Test
เวลาทำการ :
วันทำการ : [จ. อ. พ. พฤ. ศ. ]
วันที่ให้บริการ : [2021-07-16]
ปริมาณตรวจ : 5000/วัน
สถานะ : ว่าง
โทรศัพท์ : 025310080
หมายเหตุ
- เตรียมบัตรประชาชนตัวจริง
สนามกีฬาธูปะเตมีย์ กองทัพอากาศ
วิธีตรวจ : Rapid Test
เวลาทำการ : [08:00-15:00]
วันทำการ : [จ. อ. พ. พฤ. ศ. ]
วันที่ให้บริการ : [2021-07-12] ถึง [2021-07-30]
ปริมาณตรวจ : 1500/วัน
สถานะ : ว่าง
โทรศัพท์ : 025348500
หมายเหตุ
- เตรียมบัตรประชาชนตัวจริง
/// วิธีตรวจ : Atigen test kit
ตลาดบางแคภิรมย์
วิธีตรวจ : Atigen test kit
เวลาทำการ : [08:00-15:00]
วันทำการ : [พฤ. ศ. ส. อา. ]
วันที่ให้บริการ : [2021-07-29] ถึง [2021-08-01]
ปริมาณตรวจ : 600 คน/วัน/วัน
สถานะ : ว่าง
โทรศัพท์ : 024546001
หมายเหตุ
(อัพเดท 28 ก.ค. 2564 เวลา 21.14 น.) จองคิวผ่านแอพ QueQ ล่วงหน้า 1 วัน จำนวน 600 คิว
///////////////
เช็คจุดอัพเดตและแผนที่ จาก
https://jitasa.care/
บุรีรัมย์ อุ้มลูกหลานเซราะกราวกลับบ้าน LINK
บุรีรัมย์ อุ้มลูกหลานเซราะกราวกลับบ้าน
รับชาวบุรีรัมย์ ที่ติดโควิด ไม่มีที่รักษา โดยติดต่อ
โทร 02-5765555
หรือแอดไลน์ 02-5765555
ติดต่อได้ 24 ชม.
สิ่งที่ต้องเตรียม บัตรประชาชน ทะเบียนบ้าน ผลตรวจ
สสจ.นครนายก แจ้งลงชื่อผ่าน QR Code LINK
หากต้องการรับวัคซีนเข็ม 2 ที่รพ.ใกล้บ้าน
1. ติดต่อรพ.ใกล้บ้าน ก่อนวันนัดรับเข็ม 2 อย่างน้อย 2 สัปดาห์
2.แสดงหลักฐานใบนัดฉีดของศูนย์บางซื่อ เพื่อให้รพ.นัดวันฉีด
3.มาฉีดวัคซีนเข็มที่ 2 ตามวัน เวลา ที่รพ.นัดใหม่
สอบถามเพิ่มเติม (ในเวลาราชการ)
รพ.นครนายก 084-5559109
รพ.บ้านนา 037-381832
รพ.องครักษ์ 037-391510 ต่อ 115
รพ.ปากพลี 088-5753713
หากเคยติดโควิด-19 และหายแล้วฉีดวัคซีนได้หรือไม่?
ฉีดได้นะคะ แต่ควรเว้นหลังจากติดเชื้อ อย่างน้อย 3 เดือน เพราะยังมีภูมิอยู่ค่ะ
ยูนิเวอแซล พรีเวนชั่น แปลว่า การป้องกันการติดเชื้อแบบครอบจักรวาล
เขตสุขภาพที่ 9 นครราชสีมา ชัยภูมิ สุรินทร์
สำนักงานป้องกันควบคุมโรคที่ 9 จังหวัดนครราชสีมา
-เบอร์โทรศัพท์: 044 212 900
-เว็บไซต์: https://ddc.moph.go.th/odpc9/ (ยังไม่เปิดให้บริการ)
ชัยภูมิ
- สำนักงานสาธารณสุขจังหวัดชัยภูมิ
เบอร์โทรศัพท์: 044 836 826
เว็บไซต์: https://cpho.moph.go.th/
นครราชสีมา
- สำนักงานสาธารณสุขจังหวัดนครราชสีมา
เบอร์โทรศัพท์: 044 465 011
เว็บไซต์: http://www.korathealth.com/korathealth/index. php
- โรงพยาบาลมหาราชนครราชสีมา
เบอร์โทรศัพท์: 044 235 000
เว็บไซต์: http://www.mnrh.go.th/th/
สุรินทร์
- สำนักงานสาธารณสุขจังหวัดสุรินทร์
เบอร์โทรศัพท์: 044 518 402
เว็บไซต์: http://surin.moph.go.th/SPHO/
- โรงพยาบาลสุรินทร์
เบอร์โทรศัพท์: 044 511 757
เว็บไซต์: https://www.surinhospital.org/สาทร พร้อมรับสถานการณ์ฝนตกในพื้นที่ LINK
30 ก.ย.64 นายพันธ์ศักดิ์ เจริญสุข ผู้อำนวยการ
เขตสาทร มอบหมายหัวหน้าฝ่ายรักษาความสะอาดฯ สั่งการเจ้าหน้าที่ลงประจำพื้นที่พร้อมดูแลความสะอาด จัดเก็บใบไม้และขยะหน้าตะแกรง เพื่อเปิดทางน้ำไหล รวมทั้งช่วยกันกวาดและไล่น้ำบนพื้นผิวจราจร
วิทยาลัยการศึกษาตลอดชีวิต มหาวิทยาลัยเชียงใหม่ CMU School of Lifelong Education LINK
"วิทยาลัยการศึกษาตลอดชีวิต มหาวิทยาลัยเชียงใหม่" หรือ "CMU School of Lifelong Education: CMU-LE" จัดตั้งขึ้น เพื่อสนับสนุนการเรียนรู้ตลอดชีวิต ด้วยการ reskill/upskill ให้แก่ผู้เรียนทุกช่วงวัยผ่านการเรียนร่วมกับนักศึกษาในชั้นเรียน และหลักสูตรอบรมระยะสั้นที่มีการรับรองสมรรถนะ หรือสะสมหน่วยกิตใน ธนาคารหน่วยกิต (credit bank) สนองตอบต่อยุทธศาสตร์ชาติทั้งในด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์ สร้างโอกาสทางการศึกษาและความเสมอภาคทางสังคม
มีหลักสูตรอบรมระยะสั้นมากมาย จากคณะต่างๆ กว่า 20 คณะ เลือกกำหนดได้ตามความเหมาะสมของผู้เรียน
อบจ.พระนครศรีอยุธยา ได้รับจัดสรร 3,750 คน เปิดจองไปแล้ว LINK
อบจ.พระนครศรีอยุธยา เปิดจองวัคซีนทางเลือก "โมเดอร์นา”สำหรับคนพิการและผู้ป่วยติดเตียง,สตรีมีครรภ์ อายุครรภ์ 12 - 35 สัปดาห์ และผู้สูงอายุ 70 ปีขึ้นไป ที่มีชื่ออยู่ในทะเบียนบ้านจังหวัดพระนครศรีอยุธยา รวมทั้งสิ้น 3,750 คน ระหว่างวันที่ 18-22 ก.ย.64 เวลา 09.00 -16.00 น. ณ สำนักงานองค์การบริหารส่วนจังหวัดพระนครศรีอยุธยา
กทม.เปิด 31 จุดลอยกระทงทั่วกรุง
สวนสาธารณะทั้ง 30 แห่ง เปิดตั้งแต่ 05.00 – 24.00 น.
1. สวนทวีวนารมย์
2. สวนธนบุรีรมย์
3. สวนบางแคภิรมย์
4. สวนหลวงพระราม 8
5. สวนลุมพินี
6. สวนสันติภาพ
7. สวนวารีภิรมย์
8.สวนกีฬารามอินทรา
9. สวนรมณีย์ทุ่งสีกัน
10. อุทยานเบญจสิริ
11.สวนเฉลิมพระเกียรติ 80 พรรษาฯ
12. สวนสาธารณ์ะเฉลิมพระเกียรติ 6 รอบ
13. สวนสาธารณะ บึงน้ำลาดพร้าว 71
14. สวนหนองจอก
15. สวนราษฎร์ภิรมย์
16. สวนบึงกระเทียม
17. สวนพระยาภิรมย์
18. สวนสิรินธราพฤกษาพรรณ
19. สวนเฉลิมพระเกียรติ 80 พรรษาฯ
20. สวนพระนคร
21. สวน 60 พรรษาฯ
22. สวนวนธรรม
23. สวน 50 พรรษาฯ
24. สวนเสรีไทย
25. สวนนวมินทร์ภิรมย์
26. สวนอตุจักร
27. สวนวชิรเบญจทัศ (สวนรถไฟ)
28. สวนสราญรมย์
29. สวนรมณีนาถ
30. สวนสันติชัยปราการ
31. คลองโอ่งอ่าง
บรรยากาศลอยกระทง บริเวณคลองโอ่งอ่าง (มติชนออนไลน์) LINK
บรรยากาศการจัดเทศกาลลอยกระทงประจำปี 2564 ในพื้นที่กรุงเทพมหานคร ประกอบด้วยบริเวณคลองโอ่งอ่าง เขตสัมพันธวงศ์ และเขตพระนคร กรุงเทพมหานคร ซึ่งกรุงเทพมหานคร (กทม.) กำหนดจัดเป็นเวลา 3 วัน ช่วงเวลา 17.00 น. ระหว่างวันที่ 19-21 พฤศจิกายน 2564 เพื่อสืบสานประเพณี วิถีไทย และวิถีชีวิตของชุมชนที่มีต่อสายน้ำ อันเป็นประเพณีไทยที่ดีงามซึ่งสืบทอดเป็นมรดกทางวัฒนธรรมจากอดีตถึงปัจจุบัน โดยจัดในรูปแบบนิว นอร์มอล ยึดหลักโควิด ฟรี เซตติ้ง ส่วนอีกจุดที่ไอคอนสยาม บริเวณ ริเวอร์ พาร์ค ไอคอนสยาม มีประชาชนจำนวนมากมาร่วมลอยกระทงทั้ง 2 จุด
บอง โจวี่
30 ตุลาคม ร๊อคสตาร์วัย 59 ที่ฉีดวัคซีนครบโดสแล้ว ถูกตรวจพบว่าติดโควิดก่อนจะขึ้นโชว์ในไมอามี่ ฟลอริดา สุดท้ายต้องประกาศยกเลิกการแสดง กรณีของเขาเป็นการติดโควิดในผู้ที่ได้รับการฉีดแล้ว ซึ่งเป็นส่วนน้อย
จังหวัดอุบลราชธานี ร่วมกันสู้โควิด
อบจ.นนทบุรี วัคซีนโมเดอร์น่า รอบที่ 1,2,3 เข็มที่ 1 และเข็มที่ 3 (2 ธ.ค.64) LINK
วันพฤหัสบดีที่ 2 ธันวาคม 2564 นางสาววิภาวัลย์ วรวรรณปรีชา รองนายกองค์การบริหารส่วนจังหวัดนนทบุรี นางสาวทิพวรรณ รังษีภโนดร รองปลัดองค์การบริหารส่วนจังหวัดนนทบุรี พร้อมคณะผู้บริหาร สมาชิกสภาฯ อบจ.นนทบุรี หัวหน้าสำนักปลัดฯ ผู้อำนวยการกอง เจ้าหน้าที่ในสังกัด อบจ.นนทบุรี ร่วมปฏิบัติหน้าที่อำนวยความสะดวกในการให้บริการประชาชน ฉีดวัคซีนโมเดอร์นา รอบที่ 1,2,3 เข็มที่ 1 และเข็มที่ 3 (บูสเตอร์) ณ สนามฉีดศูนย์การค้าเซ็นทรัลเวสต์เกต อำเภอบางใหญ่ จังหวัดนนทบุรี
เจียงฮายปิ๊กบ้าน ติดต่อประสานงาน กลับภูมิลำเนา LINK
"เจียงฮายปิ๊กบ้าน" พี่น้องเชียงรายที่อาศัยในพื้นที่ควบคุม หรือป่ว่ยด้วยโควิด หรือมีผลตรวจโควิดเป็นบวก หากมีความจำเป็นต้องการย้ายมารักษาในพื้นที่จังหวัดเชียงราย
โทรติดต่อประสานงาน 065-836054,065-1208911 ทุกวัน 8.30-20.00 น.
หรือในภูมิลำเนา ตามเบอร์ที่ให้ไว้ ได้ทันที
5. สำหรับผู้ที่ยังไม่ฉีดวัคซีน ควรจะรอฉีดวัคซีน “เชื้อตาย” เช่น Novavax หรือ Valneva หรือไม่?
แน่นอนว่า หลังจากการอนุมัติในสหภาพยุโรป การนัดหมายการฉีดวัคซีนกับ Novavax ก็อาจจะดูเหมือนอยู่ไม่ไกลเกินเอื้อมสำหรับหลาย ๆ คน.. คำถาม ก็คือ แล้วมันคุ้มค่าแก่การรอคอยไหม? Carsten Watzl เลขาธิการสมาคมภูมิคุ้มกันวิทยาแห่งเยอรมนีกล่าวว่า หากมีใครสักคนต้องการเฉพาะฉีดวัคซีนชนิดนี้เท่านั้นก็ดีกว่าไม่ได้รับการฉีดวัคซีนเลย แต่เขาคิดว่า มันไม่ฉลาดที่จะรอ มองกันตามความเป็นจริงนั้น วัคซีน Novavax จะยังไม่มีให้ใช้จนถึงปี 2022 เช่นเดียวกับวัคซีนของ Valneva ซึ่งผู้คลางแคลงเกี่ยวกับวัคซีน mRNA จำนวนมากก็ยังมองว่า เป็นวัคซีนทางเลือก ที่จะยังไม่มาจนกว่าจะถึงไตรมาสที่สองของปี 2022 อย่างเร็วที่สุด "ผู้ที่รอวัคซีนเหล่านี้ก็คือผู้ที่ไม่มีภูมิป้องกันอีกเป็นเวลานาน” Watzl กล่าว "ดังนั้น ฉีดวัคซีนตอนนี้เสียดีกว่ารอแน่นอน!"
แม้แต่ Thomas Lingelbach ซีอีโอของบริษัท Valneva เองก็ไม่แนะนำให้รอวัคซีนจากบริษัทของเขาเอง “ผมไม่แนะนำให้ใครรอวัคซีนของเรา” เขากล่าวกับหนังสือพิมพ์เยอรมัน Spiegel “นั่นเป็นสิ่งที่ยอมรับไม่ได้ตามหลักจริยธรรม” แม้แต่ตัวเขาเองนั้น ปัจจุบันเขาก็แนะนำทั้งญาติและเพื่อนฝูงให้ไปฉีดวัคซีนจากผู้ผลิตรายอื่น เช่นเดียวกับที่ตัวเขาเองเพิ่งได้รับการฉีดวัคซีนกระตุ้นด้วยวัคซีน mRNA จาก Biontech / Pfizer
ผู้เชี่ยวชาญด้านการติดเชื้อ ศ. Clemens Wendtner มองว่า “เป็นข้อเท็จจริงที่ วัคซีนเชื้อตาย / วัคซีนโปรตีนเหล่านี้ก็จะเป็นวัคซีนทางเลือกที่เพิ่มขึ้นให้ประชาชน แม้ว่าการที่ EMA อนุมัติวัคซีนตัวนี้แล้วก่อนกำหนดจะเป็นข่าวดี แต่ก็ไม่มีเหตุผลที่จะปฏิเสธวัคซีนที่มีอยู่แล้ว ณ วันนี้ในสหภาพยุโรปซึ่งก็มีประสิทธิผลที่ดีพอๆ กัน และไม่มีเหตุผลที่จะต้องรอ ตรงกันข้ามเลยต่างหาก ตอนนี้เป็นเวลาที่เหมาะสมในการปกป้องตัวเองและคนรอบตัวของคุณ"
เชื่อมั่น ศรัทธา กัญชาภูพร้าว
เชื่อมั่น ศรัทธา กัญชาภูพร้าว วัดสิริธนวรารามภูพร้าว อุบลราชธานี ที่หลายๆ ท่านอาจคุ้นเคยกับโบสถ์ต้นกัลปพฤกษ์เรืองแสง
กลุ่มชนเผ่าที่มีเอกลักษณ์ทางวัฒนธรรม
ชาสมุนไพรนี่ของแน่นอน มีหลากหลายให้เลือกลอง
22 ธ.ค. 64 รมว.สธ. กล่าวถึง กรณีครอบครัวหนึ่งที่ จ.กาฬสินธุ์
22 ธันวาคม 2564 นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข ให้สัมภาษณ์ว่า "กรณีครอบครัวหนึ่งที่ จ.กาฬสินธุ์ เดินทางกลับมาจากต่างประเทศ ผลการตรวจไม่พบเชื้อ ต่อมาในภายหลังพบการติดเชื้อเป็นสายพันธุ์โอมิครอน มีประวัติเดินทางไปหาลูกเขยที่ จ.อุดรธานี กำลังอยู่ระหว่างติดตามผู้สัมผัสเพิ่มเติม"
เป็นการกล่าวถึงกรณีนี้เป็นครั้งแรกต่อสาธารณะ หลังจากมีข้อมูลเผยแพร่ผ่านโซเชียลมีเดียมาก่อนหน้านี้ ที่ระบุว่ามีการตรวจพบผู้ป่วยติดเชื้อสงสัยว่าจะเป็นโอมิครอน จากตัวอย่างที่ส่งตรวจสารพันธุกรรมเชื้อที่รพ.กาฬสินธุ์ และได้ส่งตรวจซ้ำหาสายพันธุ์ที่รพ.ขอนแก่นในเวลาต่อมา
2) การลงทะเบียนระบบ THAILAND PASS เพื่อเดินทางเข้าประเทศไทย
เขตจตุจักร เตรียมพร้อมเปิด ศูนย์พักคอยฯ ศูนย์สร้างสุขทุกวัยจตุจักร LINK
เตรียมพร้อมเปิด ศูนย์พักคอยฯ@ศูนย์สร้างสุขทุกวัย รองรับผู้ติดเชื้อโควิด19 วันนี้
ผอ.บอย นำทีมผู้บริหารเขตฯ พร้อมเจ้าหน้าที่ที่เกี่ยวข้อง ลงพื้นที่ตรวจความเรียบร้อยศูนย์พักคอยเพื่อส่งต่อ (community isolation) "ศูนย์สร้างสุขทุกวัยจตุจักร" ทั้งนี้ เพื่อเตรียมความพร้อมในด้านต่างๆ สำหรับการเปิดศูนย์พักคอยฯ รองรับผู้ติดเชื้อไวรัสโควิด-19 กลุ่มสีเขียว เพื่อแยกกักตัวออกจากครอบครัวและชุมชน ลดการแพร่ระบาดของโรค ณ ศูนย์พักคอยเพื่อส่งต่อ "ศูนย์สร้างสุขทุกวัยจตุจักร" เขตจตุจักร
เกณฑ์การรับผู้ป่วยเข้าระบบ Home Isolation
ผลตรวจหาแอนติเจนถ้วยตนเอง (Antigen Test Kit) ผลเป็นบวก
- หากไม่มีอาการหรืออาการเล็กน้อยให้อยู่บ้านและ Scan เข้าระบบ Home Isolation
- หากมีอาการผิดปกติมากขึ้นให้ไปโรงพยาบาลใกล้บ้าน
เกณฑ์การพิจารณาผู้ป่วย COVID-19 เพื่อเข้าระบบ HI
1. เป็นผู้ติดเชื้อที่สบายดี หรือไม่มีอาการ (asymptomatic cases)
2. มีอายุน้อยกว่า 60 ปี
3. มีสุขภาพร่างกายแข็งแรง
4. อยู่คนเดียว หรือ มีผู้อยู่ร่วมที่พักไม่เกิน 1 คน
5. ไม่มีภาวะอ้วน (ภาวะอ้วน หมายถึง ด้ชนีมวลกาย > 30 กก./ม.2 หรือ น้ำหนักตัว > 90 กก.)
6. ยินยอมแยกตัวในที่พักของตนเอง
7. ไม่มีโรคร่วม ดังต่อไปนี้
- โรคปอดอุดกั้นเรื้อรัง (COPD)
- โรคไตเรื้อรัง (CKD Stage 3,4)
- โรคหัวใจและหลอดเลือด
- โรคหลอดเลือดสมอง
- เบาหวานที่ควบคุมไม่ได้
- โรคอื่นๆ ถามถุลยพินิจของแพทย์
เกณฑ์การพิจารณาผู้ป่วยอาจปรับได้
ตามดุลยพินิจของแพทย์
โดยพิจารณาเรื่องความปลอดภัยของผู้ป่วย
และถ้านการควบคุมโรคประกอบกัน
สปส. กรุงเทพมหานครพื้นที่ 10 LINK
เลขที่ 555/1-27 หมู่ที่13 ถนนสีหบุรานุกิจ แขวงมีนบุรี เขตมีนบุรี กทม. 10510
** จุดสังเกต : ตรงข้ามตลาดมีนบุรี**
รับผิดชอบเขต
คลองสามวา มีนบุรี ลาดกระบัง สะพานสูง หนองจอก สายไหม
Facebook พื้นที่ 10 แผนที่
Tel. 02-5179034, 02-517-9222 ต่อ 111, 02-5179035
Fax 02-5179035
ฝ่ายอำนวยการ 02-5179222 ต่อ 201 - 204
งานสิทธิประโยชน์ทดแทน 02-5179222 ต่อ 301 - 308
งานการเงินและบัญชี 02-5179222 ต่อ 401 - 402
งานเงินสมทบ 02-5179222 ต่อ 501 - 512
งานทะเบียนและประสานการแพทย์ 02-5179222 ต่อ 601 - 605
โรงพยาบาลวิภารามปากเกร็ด ฉีดวัคเข็ม 3 ให้ผู้ประกันตนในนนทบุรี ถึง 15 กุมภาพันธ์ LINK
โรงพยาบาลวิภารามปากเกร็ดบริการฉีดวัคซีนป้องกัน Covid-19 Boot เข็ม 3 ร่วมกับสำนักงานประกันสังคม จังหวัดนนทบุรี มอบให้ผู้ประกันตนจังหวัดนนทบุรี ตั้งแต่วันที่ 17 มกราคม 2565 - วันที่ 15 กุมภาพันธ์ 2565 เวลา 08.00-15.00 น. (ยกเว้นวันเสาร์-วันอาทิตย์และวันนักขัตฤกษ์) ณ ห้างสรรพสินค้า เซ็นทรัล รัตนาธิเบศร์
** ลงทะเบียนผ่านสำนักงานประกันสังคมจังหวัดนนทบุรี โทรศัพท์ 0-2550-5104-7 **
10.ฟาร์มดอกไม้ สุวรรณฟาร์ม ร้อยเอ็ด
ฟาร์มดอกไม้ สุวรรณฟาร์ม อ.สุวรรณภูมิ จ.ร้อยเอ็ด ฟินกับการถ่ายภาพสวยๆ แบบรัวๆ กับมุมถ่ายภาพแบบชิคๆ และสวนดอกไม้ หลากสีสัน บริการพร็อบถ่ายภาพสวยๆ ฟรี ดีงามมั๊กๆ พิกัด GPS : สุวรรณฟาร์ม : ฟาร์มดอกไม้ จ.ร้อยเอ็ด เปิดให้บริการ เวลา 07.00 - 18.00 น. ค่าเข้าชม คนละ 50 บาท (หางตั๋วบัตรเข้าชม สามารถใช้เป็นส่วนลดค่าเครื่องดื่มได้ 10 บาท) ติดต่อสอบถาม โทร. 066 1496356
ศูนย์กายอุปกรณ์เสริมและเทียม SOL โรงพยาบาลกรุงเทพภูเก็ต LINK
โรงพยาบาลกรุงเทพภูเก็ต ร่วมกับ ”สแกนดิเนเวียน ออร์โทพีดิกส์ แล็บบอราทอรี (SOL)” จึงเป็นศูนย์กายอุปกรณ์เสริมและกายอุปกรณ์เทียม ที่มีชื่อเสียงและมีสาขาใหญ่อยู่ที่ประเทศสวีเดน เป้าหมายของเรา คือ การให้บริการด้านกายอุปกรณ์เสริมและกายอุปกรณ์เทียมที่มีคุณภาพสูงให้แก่ผู้ป่วยเฉพาะบุคคล ให้บริการด้าน
- บริการด้านกายอุปกรณ์เทียม (Prosthetic Service)
- รองเท้าเบาหวานและแผ่นรองฝ่าเท้าเพื่อสุขภาพ
- บริการด้านกายอุปกรณ์เสริม (Othertic Services)
ศูนย์กายอุปกรณ์เสริมและเทียม SOL (ชั้น 1) ให้บริการทุกวันที่ 16 – 30 ของเดือนเท่านั้น
จันทร์ – ศุกร์ : 9:00 น. – 17:00 น. หยุดวันเสาร์-อาทิตย์
*กรุณาทำนัดก่อนเข้ารับบริการ
ติดต่อสอบถาม โทร: 076 254 425 ต่อ 1694, 076 361 000 ต่อ 1694
2. มีผลรับรองการตรวจหาเชื้อโควิด-19 เป็นลบ
กรณี 2. ผู้เดินทางต้องมีผลรับรองการตรวจหาเชื้อโควิด-19 เป็นลบ ภายใน 72 ชั่วโมง ด้วยวิธี RT-PCR และ 48 ชั่วโมง ด้วยวิธี Rapid Antigen Test ที่อียูให้การรับรอง
การตรวจเบื้องต้นสำหรับภาวะสมองเสื่อม
สำหรับแพทย์เวชปฏิบัติทั่วไป อาจประเมินปัญหาเรื่องความจำเบื้องต้นของผู้ป่วยโดยใช้การตรวจสุขภาวะทางจิตแบบย่อ (Mini-Mental State Examination : MMSE) ซึ่งถ้าได้ค่าต่ำกว่า 23/24 จาก 30 คะแนน ถือว่ามีความผิดปกติทางด้านสุขภาพจิต ในประเทศไทยได้มีพัฒนาการตรวจภาวะทางจิตแบบย่อเป็นภาษาไทย เช่น Thai Mental State Examination(TMSE), Chula Mental test (CMT) และ แบบทดสอบสภาพสมองเบื้องต้น ฉบับภาษาไทย (MMSE-Thai 2002) อย่างไรก็ตามการทดสอบ MMSE มีจุดอ่อนบางประการได้แก่
- เป็นการทดสอบที่ขึ้นอยู่กับระดับการศึกษาและอาชีพของผู้ป่วยเป็นอย่างมาก กล่าวคือ ถ้าผู้ป่วยได้เรียนหนังสือน้อยกว่า 4 ปี อาจใช้เกณฑ์เพียง 19 คะแนน ถ้าเรียน 5 - 8 ปีใช้เกณฑ์ 23 คะแนน ถ้าเรียน 9 - 12 ปีใช้เกณฑ์ 27 คะแนนและถ้าเรียนถึงระดับอุดมศึกษา อาจต้องใช้เกณฑ์ 29 คะแนน เป็นต้น12 ถ้าผู้ป่วยมีระดับการศึกษาที่น้อยกว่า 9 ปี อาจไม่ไวพอในการตรวจคัดกรองโรค
- การตรวจนี้อาจไม่ไวพอในการตรวจคัดกรองผู้ป่วยที่มีปัญหาด้านสมองที่ไม่ได้เกิดจากโรคอัลไซเมอร์ หรือมีปัญหาสมองเสื่อมระยะแรก (early dementia) อีกนัยหนึ่งคือ ผู้ป่วยบางรายที่ได้คะแนนสูงกว่า 24 คะแนนก็อาจมีภาวะสมองเสื่อมได้
- การตรวจนี้ไม่ไวพอในการตรวจคัดกรองความผิดปกติทางด้านการบริหารจัดการ (executive function) ซึ่งเป็นความผิดปกติที่มักพบในกรณีที่มีความผิดปกติของรอยโรคเด่นที่ subcortical structure เช่น ภาวะสมองเสื่อมเนื่องจากโรคหลอดเลือดสมอง (vascular dementia)13 จากข้อจำกัดของการทดสอบข้างต้น แพทย์จึงควรใช้การทดสอบชนิดอื่นๆ ควบคู่กันในการประเมินผู้ป่วย เช่น การให้ผู้ป่วยวาดรูปหน้าปัดนาฬิกา (clock drawing test) เนื่องจากเป็นวิธีที่ทำได้ง่าย ใช้เวลาไม่มากและมีความแม่นยำค่อนข้างดี มีหลายวิธีในการให้ตรวจ เช่น อาจให้ผู้ป่วยวาดหน้าปัดนาฬิกา โดยบอกว่ามีเข็มและตัวเลข บอกเวลา 1.45 นาฬิกา หรืออาจให้ผู้ป่วยวาดหน้าปัดนาฬิกาโดยไม่บอกว่าต้องวดเข็มและตัวเลข และอาจมีวงกลมให้และกำหนดให้วาดเข็มนาฬิกาเป็นเวลา11.10 นาฬิกา เนื่องจากมีความไวสูงสุดในการตรวจหาความผิดปกติของความสามารถทางสมอง14 ซึ่งการให้คะแนนมีความแตกต่างกันไปตามวิธีต่างๆ
สำหรับการตรวจประเมินอื่นๆ ที่แพทย์สมควรประเมินผู้ป่วยคือ การประเมินความสามารถในการประกอบกิจวัตรประจำวันและการทำงาน ความผิดปกติของพฤติกรรม อารมณ์และจิตประสาทซึ่งอาจเกิดขึ้นได้ในผู้ป่วยภาวะสมองเสื่อมและจำเป็นที่จะต้องได้รับการแก้ไข เช่น อาการหลงผิด ประสาทหลอน ซึมเศร้า เฉยเมย หงุดหงิดฉุนเฉียวง่าย รื้อของ ค้นของ เดินตามตลอด เดินเร่ร่อนออกจากบ้านหรือการแสดงออกทางพฤติกรรมทางเพศที่ไม่เหมาะสม ซึ่งมีอาจประเมินโดยการสัมภาษณ์ทั่วไป หรือใช้แบบประเมินเฉพาะโดยเป็นแบบเฉพาะสำหรับอาการทางจิตประสาทโดยรวมเช่น เช่น Neuropsychiatric inventory หรืออาการทางจิตประสาทเฉพาะอาการ เช่น, Thai Geriatric Depression Scale เป็นต้น
โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา ประกาศรับสมัครงาน หลายตำแหน่ง LINK
ประกาศรับสมัครงาน หลายตำแหน่ง สมัครได้ด้วยตนเองที่ แผนกทรัพยากรมนุษย์ ชั้น 9 โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา โทร. 038-812-702-19 ต่อ 1971
???? เจ้าหน้าที่การเงิน 2 ตำแหน่ง
???? เจ้าหน้าที่การตลาด 2 ตำแหน่ง
???? ผู้ช่วยแม่ครัว 2 ตำแหน่ง
???? เจ้าหน้าที่เวรเปล 3 ตำแหน่ง
สนใจสมารถเขียนใบสมัครได้ด้วยตนเอง จันทร์-ศุกร์เวลา 08.00-17.00 น.
ติดต่อสอบถามเพิ่มเติม ได้ที่ 038-812702-18 หรือ โทร 1218 กด 7
ทั้งนี้ การที่โรงพยาบาลบำรุงราษฎร์ได้รับการยอมรับจากนานาประเทศและก้าวมาถึงจุดนี้ได้ เนื่องด้วยคุณสมบัติสำคัญ 3 ประการหลัก ที่สั่งสมมาอย่างยาวนาน ประกอบด้วย
ศ. นพ. ธีระพงษ์ ตัณฑวิเชียร อาจารย์หน่วยโรคติดเชื้อ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และผู้ช่วยผู้อำนวยการและรักษาการหัวหน้าฝ่ายวิจัยและบริการคลินิก สถานเสาวภา สภากาชาดไทย กล่าวเสริมในกลุ่มเสี่ยงโดยเฉพาะผู้สูงอายุ 65 ปีขึ้นไป และผู้ที่มีโรคประจำตัว อาทิ โรคปอด โรคหัวใจ โรคเบาหวาน โรคไต โรคอ้วน ยิ่งมีความเสี่ยงที่จะเกิดอาการรุนแรงจากโรคไข้หวัดใหญ่ ยกตัวอย่าง ผู้ป่วยโรคถุงลมโป่งพองหรือโรคปอด จะเสี่ยงในการเกิดโรคแทรกซ้อนรุนแรง โดยพบมากกว่าคนปกติถึง 100 เท่า ผู้ป่วยโรคหัวใจจะเสี่ยงมากกว่าคนปกติถึง 50 เท่า และผู้ป่วยโรคเบาหวาน เสี่ยงมากกว่าคนปกติ 5-10 เท่า เป็นต้น เนื่องจากในผู้ที่มีโรคประจำตัวเหล่านี้อาจจะมีระบบภูมิคุ้มกันของร่างกายแปรปรวน ทำให้ระบบภูมิคุ้มกันของร่างกายไม่สามารถต่อสู้กับเชื้อโรคได้ดีเท่ากับคนที่มีสุขภาพแข็งแรง
ฉะนั้นการสร้างความรู้ความเข้าใจที่ถูกต้องในวงกว้างจึงเป็นเรื่องที่สำคัญมาก เพื่อความปลอดภัยและลดความเสี่ยงจากการติดเชื้อร่วมกันในยุคโควิด-19 โดยไม่ว่าจะอยู่ในกลุ่มเสี่ยงหรือไม่ได้อยู่ในกลุ่มเสี่ยง ก็ควรเข้ารับบริการฉีดทั้งวัคซีนไข้หวัดใหญ่ และวัคซีนโควิด-19 ซึ่งเป็นทางออกที่มีความคุ้มค่า โดยวัคซีนไข้หวัดใหญ่ได้มีการยอมรับถึงประสิทธิภาพของวัคซีนจากทั่วโลกและมาตรฐานที่ใช้มาอย่างยาวนาน นอกจากนี้ยังมีผลการศึกษาวิจัยระบุถึงคุณประโยชน์และประสิทธิภาพของการฉีดวัคซีนไข้หวัดใหญ่ พบว่าสามารถลดจำนวนผู้ป่วยไข้หวัดใหญ่ ลดการใช้ยาปฏิชีวนะ ลดความถี่ในการมาพบแพทย์ ลดการแพร่เชื้อโรค รวมถึงลดการรักษาตัวในห้องฉุกเฉิน และผลโดยรวมยังพบว่าวัคซีนป้องกันไข้หวัดใหญ่มีประโยชน์มากต่อคนทุกช่วงอายุ รวมทั้งผู้ที่ไม่มีโรคประจำตัวด้วย
โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ เปิดบริการฉีดเข็ม 4 LINK
จะจองล่วงหน้า หรือ Walk in ก็ฉีดได้ ค่าบริการ 1 เข็ม ราคา 1,650 บาท 2 เข็ม ราคา 3,300 บาท (ราคานี้รวมค่าบริการพยาบาลและค่าบริการโรงพยาบาลแล้ว)
Walk In ติดต่อได้ที่แผนกผู้ป่วยนอก อาคาร 3 ชั้น1 รพ.เกษมราษฎร์ รัตนาธิเบศร์ (การุญเวชเดิม)
คลิก : https://regis.bchvaccine.com/ หรือ Walk In ติดต่อได้ที่แผนกผู้ป่วยนอก อาคาร 3 ชั้น1 เปิดขายวัคซีนวันจันทร์ - เสาร์ เวลา 08.00-16.00 น. Kasemrad Call Center 1218 กด 11
โปรแกรมคลอดเหมาจ่าย โรงพยาบาลแพทย์รังสิต LINK
โปรแกรมคลอดปกติ 3 วัน/ 2 คืน (ไม่เกิน 48 ชม.) เหมาจ่ายเริ่มต้น 25,000 ถึง 33,900 (ห้องเดี่ยว VIP) โปรแกรมผ่าคลอด 4 วัน/3 คืน (ไม่เกิน 72 ชั่วโมง) เริ่มต้น 39,900 ถึง 48,400 (ห้องเดี่ยว VIP) และได้รับบริการเสริมอีกมากมาย
จันทบุรี จุดเช็คอินน่าเที่ยวเพียบเรย LINK
จันทบุรี แค่ 4 ชั่วโมงนิดๆ จากกทม. บอกว่าที่นี่มีที่เที่ยวไม่น้อยหน้าระยอง ชลบุรี ตราด แต่อย่างใด แต่อันที่จริง จันทบุรี มีทีเด็ดเฉพาะตัวที่ที่อื่น แอบอิจฯ ถ้าเอ่ย ถึง จุดชมวิว เนินนางพญา น้ำตกพลิ้ว หาดท่าใหม่ ปากน้ำแขมหนู เจ้าหลาว คุ้งวิมาน อ่าวคุ้งกระเบน คนเคยไปจะว้าวว้าว ถ้าใครยัง ก็ต้องไปตามเก็บนะจ๊ะ ขับรถเที่ยว วันเดียวเก็บได้ครบ สนุกมากบอกเลย
นอกจากนั้น จันทบุรียังมีสถานที่ท่องเที่ยวใหม่ๆ อีกหลายแห่ง กับที่ซุกซ่อนอีกเยอะ ทั้งหาดทราย ป่าชายเลน ที่เริ่มีชื่ออย่าง ลานหินสีชมพู เจดีย์กลางน้ำบ้านหัวแหลม จุดชมวิว เกาะเปริด ผาสุขนิรันดร์ แหลมสิงห์ อ่าวกระทิง คุกขี้ไก่ และอีกเพียบ
เครือข่ายรณรงค์ การใช้สเตียรอยด์ให้ปลอดภัยและเหมาะสม LINK
เครือข่ายรณรงค์ การใช้สเตียรอยด์ให้ปลอดภัยและเหมาะสม ตั้งขึ้นเพื่อรณรงค์ลดการใช้ยาที่ไม่เหมาะสมแก่ประชาชนในวงกว้าง สร้างการรับรู้เรื่องประโยชน์และอันตรายในเรื่องการใช้ยาที่มีส่วนผสมของสเตียรอยด์โดยไม่มีความรู้ความเข้าใจ สร้างพลัง จิตสำนึกต่อสังคม และความร่วมมือจากทุกภาคส่วน กระตุ้นมาตราการเข้าถึงยาควบคุมพิเศษ ให้ซื้อได้ด้วยใบสั่งแพทย์เท่านั้น ประกอบขึ้นด้วยความร่วมมือของหลายองค์กร มีแผนงานชัดเจน
ศึกษาบทบาท ข้อมูลต่างๆ เครือข่ายรณรงค์ ได้ที่ เว็บไซต์
www.steroidsocial.org หรือ เพจ
facebook.com/steroidsocialรพ.ธนบุรี บริการตรวจ RT-PCR 3,500 บาท
โรงพยาบาลธนบุรี บริการรับตรวจ RT-PCR ค่าใช้จ่าย 3,500 บ. บริการตรวจทุกวัน เวลา 08.00 - 20.00 น. รับตรวจในช่วงอายุ 12 -60 ปี แจ้งผลตรวจ ภายใน 24 ชม. (หากผลตรวจก้ำกึ่ง ทาง รพ.ต้องส่งตรวจ ซ้ำ อาจใช้เวลานาน ขึ้น)
รพ.รามคำแหง บริการตรวจหาเชื้อโควิด-19 Drive Thru Test 3,500 บาท
โรงพยาบาลรามคำแหง ให้บริการตรวจหาเชื้อโควิด-19 ด้วยระบบ Drive Thru Test (จองออนไลน์ล่วงหน้าเท่านั้น - ไม่รับ walk in) ค่าบริการ 3,500 บาท เปิดให้บริการทุกวันตั้งแต่เวลา 08.00-15.00 น. จุดให้บริการ บริเวณลานจอดรถด้านหลังโรงพยาบาล ห่างจากตัวอาคาร 700 เมตร โดยไม่ต้องลงจากรถ สอบถามโทร 02 743 9999
รพ.วิมุต บริการตรวจและฟื้นฟูสมรรถภาพปอดหลังหายป่วย COVID-19 ราคา 3,999 บาท
รพ.วิมุต พร้อมให้คำปรึกษาและมอบบริการตรวจและฟื้นฟูสมรรถภาพปอดหลังหายป่วย COVID-19 ราคา 3,999 บาท เพื่อรับการตรวจเอกซเรย์คอมพิวเตอร์ปอด ด้วยเทคนิคที่ใช้ปริมาณรังสีต่ำ เห็นภาพชัดกว่าการเอกซเรย์ทั่วไป พร้อมโปรแกรมฝึกการหายใจและออกกำลังกายเพื่อฟื้นฟูปอด โดยแพทย์เวชศาสตร์ฟื้นฟู
ติดต่อสอบถามรายละเอียดได้ที่ศูนย์เวชศาสตร์ฟื้นฟู ชั้น 10 รพ.วิมุต เวลาทำการ 8.00 – 16.00 น. โทร. 02-079-0024 หรือใช้บริการ Telemedicine ปรึกษาแพทย์ออนไลน์ก่อนตัดสินใจเลือกซื้อแพ็กเกจผ่าน www.vimut.com หรือผ่าน ViMUT Application ไม่มีค่าใช้จ่าย
เกษมราษฎร์ประชาชื่น Walk in วัคซีน Moderna รับสงกรานต์ เพียง 1,299 บาท (7-12 เมษายน 2565)
7-12 เมษายน 2565 (ยกเว้นวันอาทิตย์ที่ 10 เมษายน ไม่มีฉีดวัคซีน) เวลา 8.00-16.00น
ราคา 1,299 บาท/เข็ม ไม่ต้องจองล่วงหน้า ซื้อแล้วฉีดได้เลย
สอบถามโทร : 02-910-1600 ต่อ 1761 , 1762 , 1763, 1764
เปาโล โชคชัย 4 เปิดบริการ Hospitel โทร.02-514-4141 Line : @Paolochokchai4
Line : @Paolochokchai4
รพ.เปาโล โชคชัย 4 เปิดบริการ Hospitel กว่า 1,000 เตียง พร้อมย้ายสิทธิผู้ป่วยประกันตนเข้ามาดูแลมากกว่า 30,000 คน
เงื่อนไขการลงทะเบียน
1.สำหรับผู้ประกันตนทุกโรงพยาบาลที่มีผลตรวจ ATK 2 ขีด และ RT-PCR
2.เข้ารับการรักษาโดยไม่เสียค่าใช้จ่าย
ยาสมุนไพรประเภทเสริมความงาม ใช้ภายนอก
ขมิ้นชันผง ครีมขมิ้นชัน ครีมล้างหน้ามะขาม แชมพูข่า ผงขัดหน้า ลูกประคบ คาลาไมด์เสลดพังพอน ทิงเจอร์เสลดพังพอน
ep. 2 “หลักการเก็บรวบรวมข้อมูลส่วนบุคคล” LINK
มาทำความรู้จักกับ 7 หลักการ
ในการเก็บรวบรวมข้อมูลส่วนบุคคล
ตามพ.ร.บ.คุ้มครองข้อมูลส่วนบุคคลฯ มาตรา 24
กำหนดเหตุที่สามารถทำได้โดยชอบด้วยกฎหมาย ดังนี้
1. ได้รับความยินยอมจากเจ้าของข้อมูล (Consent)
2. จำเป็นต่อการทำตามสัญญา (Contract)
3. เพื่อป้องกันหรือระงับอันตรายต่อชีวิต ร่างกายหรือสุขภาพ (Vital Interest)
4. เป็นการทำหน้าที่ตามกฎหมายเพื่อประโยชน์สาธารณะหรือการใช้อำนาจรัฐ (Public Task)
5. จำเป็นเพื่อประโยชน์โดยชอบด้วยกฎหมาย (Legitimate Interest)
6. เป็นการปฏิบัติตามกฎหมาย (Legal Obligations)
7. เกี่ยวกับการจัดทำเอกสารประวัติศาตร์ วิจัย หรือสถิติ (Scientific / Historical Research)
.
หากเป็นการเก็บรวบรวมข้อมูล
ตามวัตถุประสงค์ดังกล่าว
แม้เพียงเหตุใดเหตุหนึ่งการเก็บรวบรวมข้อมูลนั้น
ก็จะชอบตามกฎหมาย PDPA
.
???? ดังนั้น จึงไม่จำเป็นว่าจะต้องขอความยินยอม
ในทุกกรณีเสมอไป
ศักยภาพของระบบและประโยชน์ที่ได้รับ
ระบบโซล่าเซลล์โรงพยาบาลบ้านตาก มีขนาด 137.6 กิโลวัตต์ ประกอบด้วย แผงโซล่าเซลล์ Mono 400 วัตต์ จำนวน 336 แผง พร้อม Inverter Solar Edge เทคโนโลยีที่ล้ำสมัย จะช่วยให้ประหยัดค่าไฟฟ้าได้ถึงเดือนละ 75,000 บาท หรือ 900,000 บาทต่อปี มีอายุการใช้งานได้ถึง 25 ปี
งบประมาณการก่อสร้าง 3.4 ล้าน จุดคุ้มทุนที่ 3.6 ปี
Hospitel โรงพยาบาลสุขุมวิท
โรงพยาบาลสุขุมวิท พร้อมดูแลผู้ป่วยที่มีผลตรวจ ATK เป็นบวก ในทุกระยะอาการ โรงพยาบาลสุขุมวิท ได้เตรียม Hospitel 2 ระดับ Deluxe Classic - Grand Deluxe เพื่อดูแลผู้ป่วยที่อาการไม่รุนแรง ได้การรับรองผ่านมาตรฐานและมีแพทย์ ผู้ชำนาญการ บุคลากรทางแพทย์ และ อุปกรณ์ต่างๆ ครบตามที่กระทรวงสาธารณสุขกำหนด โรงพยาบาลสามารถจัดหาเตียง ประเภทห้องและจุดให้บริการสถานที่ ให้กับผู้ป่วยได้อย่างเหมาะสม ตามข้อบ่งชี้ทางการแพทย์ และอาการของผู้ป่วย สอบถามข้อมูลเพิ่มเติมได้ที่ โทร. 02-391-0011 ต่อ 0
ศูนย์นิทรรักษ์ศิริราช (Siriraj Sleep Center) LINK
ศูนย์นิทรรักษ์ศิริราช (SIRIRAJ SLEEP CENTER) จัดตั้งขึ้นและดำเนินการโดยรพ.ศิริราช เพื่อให้บริการ ให้คำปรึกษาแก้ปัญหาการนอนหลับผิดปกติ แก้ไขปัญหานอนไม่หลับให้กับคนไข้ ลักษณะปัญหาเช่น หลับกลางวัน นอนไม่หลับ นอนกรน นอนหลับที่ผิดปกติ ฯลฯ ปัญหาที่อาจส่งผลต่อความเจ็บป่วย หรืออุบัติเหตุไม่คาดคิด
ศูนย์นิทรรักษ์ศิริราชตั้งอยู่ใน โรงพยาบาลศิริราช ปิยมหาราชการุณย์ (SiPH)
ที่อยู่: 2 ถ. อรุณอมรินทร์ แขวงศิริราช เขตบางกอกน้อย กรุงเทพมหานคร 10700
การใช้บริการ สอบถามโทร 1474 หรือ 02-4197535-6 แนะนำทำนัดล่วงหน้า
วันเวลาทำการ : จันทร์-ศุกร์ ในเวลาราชการ 8.30 -16.00 น. เสาร์ 8.30-15.00 น.
*ศูนย์นิทรรักษ์ศิริราช เป็น 1 ใน 7 ศูนย์ที่ได้รับการรับรองจากสมาคมโรคจากการหลับแห่งประเทศไทย (Sleep Society of Thailand)
Link
facebook.com/Sisleepcenter/ โปรแกรมตรวจสุขภาพเด็กหลังติดเชื้อโควิด-19 รพ.พญาไท 1
ราคาโปรแกรม 2,200 - 2,200 บาท
สอบถามเพิ่มเติม หรือนัดหมายเข้ารับบริการ ศูนย์สุขภาพเด็ก อาคาร 2 ชั้น 3 โทร 02-201-4600 ต่อ 3111-3112
รายการตรวจ
ตรวจร่างการโดยกุมารแพทย์
ตรวจเอกซเรย์ปอด (Chest X-ray)
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ตรวจปัสสาวะอย่างสมบูรณ์ (Urine Examination)
ตรวจการทำงานของไต (Creatinine)
ตรวจการทำงานของตับ (SGPT)
ตรวจดูการอักเสบในร่างกาย (hsCRP)
เงื่อนไขการใช้บริการ
ราคาดังกล่าว รวมค่าแพทย์ตรวจสุขภาพ ค่าบริการทางการแพทย์ และค่าบริการอื่นๆ ของรพ. แล้ว
โปรแกรมนี้เหมาะสำหรับเด็กอายุไม่เกิน 15 ปี ที่เคยติดเชื้อโควิด-19 แล้ว
ควรตรวจหลังครบกำหนดกักตัว หรือ 2 สัปดาห์ขึ้นไป หลังจากทราบว่าติดเชื้อโควิด-19
เพื่อความสะดวกในการรับบริการโปรดนัดหมายล่วงหน้าอย่างน้อย 1-2 วัน
กรุณางดน้ำ งดอาหาร อย่างน้อย 8-12 ชั่วโมงก่อนรับบริการ
นโยบายที่เกี่ยวโยงกับด้านสุขภาพในหมวดอื่นๆ
นอกจากหมวดสุขภาพแล้ว ในหมวดอื่นยังมีนโยบายที่เกี่ยวโยงกับสุขภาพโดยตรงที่ต้องบันทึกไว้ดังนี้โครงการศูนย์นครภูเก็ตปันน้ำใจ สร้างสุข LINK
เป็นโครงการโดยเทศบาลนครภูเก็ต บริการให้ยืมอุปกรณ์ทางการแพทย์แก่ผู้ขาดแคลนทุนทรัพย์ โดยมีเงื่อนไขดังนี้
- ที่อยู่อาศัยจริง อยู่ในเขตจังหวัดภูเก็ต
- เป็นผู้ป่วยติดบ้าน ติดเตียง พิการ ช่วยเหลือตัวเองไม่ได้
อุปกรณ์ที่มีให้ยืม
- ถังออกซิเจน ขนาดเล็ก กลาง ใหญ่
- ที่นอนลม
- รถเข็น
- รถเข็นแบบนั่งถ่าย
- รถเข็นแบบมีพนักพิง เอนนอนได้ นั่งถ่ายได้
- สี่ขา มีล้อ มีเบรค
- สี่ขาพับได้
- สี่ขาพับไม่ได้
ผู้ที่ต้องการยืม
ติดต่อลงทะเบียนที่เว็บไซต์
ผู้ที่ประสงค์จะบริจาคอุปกรณ์ ติดต่อด้วยตนเองที่ 155/3 (ศูนย์บริการสาธารณสุข) ถนนกระ ตำบล ตลาดใหญ่ อ.เมือง จ.ภูเก็ต หรือสอบถามข้อมูลเพิ่มเติมโทร 076-354-501
However, Radiology AI is not meant to replace the radiologist. It is a tool which assists diagnosis and radiologist decisions. In other words, it gives a second opinion. A survey found that more than 60% of radiologists find the Radiology AI helpful in helping to analyze the lung images. The Radiology AI software is in active development to increase its efficacy. Radiologist feedback at Bumrungrad is crucial to improving Radiology AI’s competency. The Radiology AI encourages radiologists, AI, and other physicians who treat the same patients to work cohesively as a team, resulting in effective treatments. The Radiology AI also successfully increases the pace of learning for new radiologists.
Dr. Alongkorn Kiatdilokrath concludes that in the future, Bumrungrad intends to form a partnership with the Radiology AI developer in South Korea and 20 internationally recognized hospitals to increase the effectiveness of Radiology AI by enabling it to diagnose disease faster and more accurately. The goal is to enable radiologists to diagnose a wider range of conditions. The partnership marks a milestone in modern medical technology, in which AI is an important factor for successful holistic medicine. The AI also improves the wellbeing of people worldwide.
ชมรมส่งเสริมการท่องเที่ยวโดยชุมชนไทยชนะศึก อ.ทุ่งเสลี่ยม จ.สุโขทัย
ชุมชนไทยชนะศึก ชุมชนเล็กๆที่เขียวขจี ผู้คนดำเนินวิถีชีวิตอย่างเรียบง่าย มาเรียนรู้วิถีชีวิตของชุมชนไทยชนะศึก ยามเช้าที่จุดชมวิวดอยตีนกา เมนูสร้างสรรค์ ลาบปลาน้ำอ๊อดในสระมรกตและน้ำมะขามตื่นตูม มารับประทานที่ชุมชนไทยขนะศึก ร่วมทำกิจกรรม DIY.พร้อมนำกลับ และรับประทานอาหาร พื้นถิ่น แบบ กินเป็นลืมป่วย ที่มากไปด้วยสมุนไพรในอาหาร เลือกช็อปสินค้าชุมชนที่มีความเป็นเอกลักษณ์ เหมาะกับเป็นของฝากของที่ระลึกมอบให้กับคนที่เรารัก
ที่อยู่ ตำบล ไทยชนะศึก อำเภอ ทุ่งเสลี่ยม สุโขทัย 64150
โทร.0816843504
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุก ๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนมิถุนายน พ.ศ. 2565 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 18 ถึง วันที่ 27 เมษายน พ.ศ. 2565 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือศูนย์วิจัยแห่งใหม่ของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อช่วยเหลือบริษัทต่างๆ ภายในประเทศสมาชิกภูมิภาคอาเซียนในเรื่องของข้อมูลการตลาด รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของฮาคูโฮโดจะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่อธิบายผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่อธิบายถึงความเป็นบุคคลของผู้บริโภคที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
ติดตามผลสำรวจเพิ่มเติมได้ที่
Hakuhodo Institute of Life and Living ASEAN (THAILAND)
คลินิกเวชกรรม สวท หาดใหญ่ LINK
คลินิกเวชกรรม สวท หาดใหญ่
เลขที่ 8-12 ราษฎร์อุทิศ ซอย 9 ถนนราษฎร์อุทิศ ตำบลหาดใหญ่ อำเภอหาดใหญ่ จังหวัดสงขลา 90110
เปิดทำการ : จันทร์-ศุกร์ เวลา 09.00-17.00 น.
ปิดทำการ : เสาร์ – อาทิตย์, วันหยุดนักขัตฤกษ์
074-252-691
085-585-9580
คลินิก ศูนย์สุขภาพ เข้าสู่สนามกัญชา น่าสนใจ แบรนด์ต่างชาติเริ่มมีมา
คลินิกสุขภาพเฉพาะทางชื่อดัง Absolute Health ก็มาร่วมในงาน มีสินค้าและบริการที่ผสานการใช้ผลิตภัณฑ์กัญชาน่าสนใจทีเดียว , คลินิกสุขภาพ Green Wellness Clinic สหคลินิก มีทีมแพทย์ให้คำแนะนำ สินค้าหลากหลาย และเปิดแฟรนไชส์สำหรับผู้สนใจลงทุน นับเป็นโอกาสใหม่ๆ ทางธุรกิจที่ปรากฏขึ้น
แบรนด์ดังอสังหา ชาญอิสระ ก็โจนเข้ามาในตลาดกัญชา ด้วยโครงการปลูกและจำหน่ายกัญชา แต่วันนี้เพียงมาแนะนำเปิดตัว ยังไม่มีสินค้าออกตลาดแต่อย่างใด แนะนำติดตามอย่างใกล้ชิด
Brand สินค้าจากต่างประเทศก็มีมาร่วมออกบู้ทในงานด้วยเช่นกัน แม้จะยังไม่มาก แต่หวังว่าอนาคตจะต้องมีมาเพิ่มอีกแน่ๆ
กลุ่มวิสาหกิจเปิดตัวกิจการ ห่วงโซ่อุปทานเริ่มเตินหน้า
กลุ่มวิสาหกิจเปิดตัวกิจการ บางรายแทบจะครบห่วงโซ่ ทั้งต้นน้ำ กลางน้ำ และปลายน้ำ คือปลูก สกัด ผลิตเป็นสินค้าออกมาสู่ตลาดด้วยแบรนด์ตนเองเลย และเปิดตัวในงานนี้เป็นที่แรก น่าประทับใจมาก ในความตั้งใจพัฒนาบุกเบิกตลาดด้านนี้ในไทย หวังว่าเราจะได้เข้าถึงสินค้าได้อย่างแพร่หลายมากขึ้นในอนาคต
วิสาหกิจบางราย ผสานความร่วมมือกับสถานพยาบาลให้บริการด้านสุขภาพ บนความร่วมมือกับหน่วยงานน่าเชื่อถือ ที่สำคัญวิสาหกิจเหล่านี้ มาจากทั่วประเทศไทย ที่กำลังพัฒนาสินค้า บริการและกลยุทธ์ ที่เห็นในงานเป็นเพียงส่วนน้อยที่พร้อมเปิดตัว คาดว่าอนาคตจะมาเป็นคลื่นใหญ่กว่านี้แน่ๆ
สถานเอกอัครราชทูต ณ เวียงจันน์ เตือนคนไทย
สถานเอกอัครราชทูต ณ เวียงจันน์ เตือนคนไทย การผลิต จำหน่าย ขนส่ง มีไว้ในครอบครอง นำเข้า ส่งออก กัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของกัญชา กัญชง ผิดกฏหมาย สปป.ลาว
หากฝ่าฝืน มีโทษจำคุกและปรับ โทษสูงสุด จำคุกตลอดชีวิต
KANA Pure Dispensary สุขุมวิท 16 LINK
KANA Pure Dispensary เป็นร้านขายดอกกัญชาเกรดพรีเมียมที่เลือกใช้ในทางการแพทย์ ผ่านการคัดสรรกัญชาคุณภาพสูงจากแปลงปลูกของบริษัท โดยทางร้านตกแต่งด้วยโทนไม้สีขาว ครีม และทอง บ่งบอกถึงความพรีเมียมที่ทันสมัย ทั้งนี้ KANA ยังให้ความสำคัญกับคุณภาพของกัญชาด้วยมาตรฐานขั้นสูงสุด
KANA PURE Dispensary สาขาแรกในไทย สุขุมวิท 16 นำร่อง จำหน่ายกัญชาเกรดทางการแพทย์ กัญชาเพื่อสุขภาพระดับไฮเอนด์ ดอกกัญชาของ KANA ทั้ง 4 เกรด ได้แก่ 1. Super diamond 2. Diamond 3. Platinum และ 4. Gold มีมากกว่า 15 สายพันธุ์ระดับโลก - หรูหราเอามากๆ
GANJAWITCH Dispensary Thonglor Since 2017
กัญชาวิช แม่มดกัญชา ทองหล่อ
สมุยมีความพร้อมทางด้าน Wellness Tourism เป็นอย่างมาก ไม่แพ้จังหวัดท่องเที่ยวอื่นๆ โดยปฏิเสธไม่ได้ว่าธรรมชาติที่ยังคงงดงามเป็นอีกหนึ่งปัจจัยที่ทำให้นักท่องเที่ยวเลือกสมุยเป็นจุดหมายปลายทาง นอกจากนี้ยังมีจุดเด่นจากความพร้อมของโรงพยาบาลกรุงเทพสมุย ซึ่งอยู่ในเครือข่ายกลุ่ม BDMS ที่เปิดให้บริการรองรับนักท่องเที่ยว ปัจจุบันให้บริการทั้งทางด้านการรักษาผู้ป่วยทั่วไปและคลินิกดูแลสุขภาพในส่วน Wellness ดังนั้น เกาะสมุย จ.สุราษฎร์ธานี พร้อมแล้วสำหรับการเป็นหนึ่งใน Destination ขานรับการท่องเที่ยวเชิงสุขภาพอย่างแท้จริง
อันดับที่ 10 รพ.เมดพาร์ค 75.17%
โรงพยาบาลเมดพาร์ค โรงพยาบาลขนาดใหญ่ใจกลางเมืองล่าสุด ที่เปิดให้บริการในปี 2563 ที่ถึงแม้จะเป็นโรงพยาบาลใหม่ แต่ศักยภาพนั้นเต็มเปี่ยมระดับสูงสุด ก่อตั้งขึ้นโดยความร่วมมือของบุคลากรทางการแพทย์ เพื่อให้บริการรักษาพยาบาลในระดับสูง รักษาโรคยากที่มีความซับซ้อนและโรคที่ยังหาวินิจฉัยไม่ได้หรือรักษาไม่หายตามแนวทาง มีแพทย์เฉพาะทางกว่า 30 สาขา มีเตียงรองรับขนาด 500 เตียง มีจำนวนเตียงผู้ป่วยวิกฤตได้มากถึง 130 เตียง โรงพยาบาลเมดพาร์ค มีมูลค่าการลงทุนระยะแรก 7,000 ล้านบาท มีเครือข่ายโรงพยาบาล ศูนย์การแพทย์และเอกชนร่วมทุน อาคารโรงพยาบาลก่อสร้างอาคารมาตรฐานสีเขียวที่เป็นมิตรต่อสิ่งแวดล้อม ความพร้อมและศักยภาพระดับนี้ จึงทำให้โรงพยาบาลเมดพาร์ค เข้ามาติดท็อปเท็นได้อย่างน่าสนใจ
แนวปฏิบัติผู้ติดเชื้อโควิด-19 สิทธิประกันสังคม มาตรา 33 และ มาตรา 39 LINK
ติดต่อ สายด่วน ประกันสังคม 1506 ตลอด 24 ชั่วโมง
หากตรวจโควิดขึ้น 2 ขีด
1. รักษาตามแนวทาง เจอ แจก จบ (ผู้ป่วยนอก)
หากอาการไม่รุนแรง (สีเขียว) รักษาแบบ OP - self isolation (รักษาแบบผู้ปวยนอกกักตัว) หรือ เจอ แจก จบ โดย ติดต่อ สถานพยาบาลประกันสังคม/รพ.รัฐ/รพ.เอกชนที่ร่วมให้บริการ / คลินิกและร้านยา ที่ขึ้นทะเบียนกับ สปสช (บัตรทอง) ฟรี
2. กรณีจำเป็นต้องรักษาแบบ ผู้ป่วยใน
ตามดุลยพินิจแพทย์ ของสถานพยาบาลประกันสังคม จะเข้ารักษา ฟรี
3. เจ็บป่วยฉุกเฉิน สีเหลือง-แดง
อาการ ได้แก่ หอบเหนื่อหนักมาก พูดไม่เป็นประโยค แน่นหน้าอก หายใจเจ็บหน้าอก ปอดอักเสบรุนแรง อ่อนเพลีย ตอบสนองช้า ไม่รู้สึกตัว มีภาวะช็อค/โคม่า ซึมลง ไข้สูงกว่า 39 องศา ค่าอ๊อกซิเจนต่ำกว่า 94
หากเข้าเกณฑ์คัดแยกผู้ป่วย สีเหลือง-แดง ใช้สิทธิ UCEP Plus ณ รพ.รัฐ-เอกชน ทุกแห่ง ไม่เสียค่าใช้จ่าย
โรงพยาบาลจุฬารัตน์ 11 อินเตอร์ โทร. 038500300 LINK
ยิ้ม Smile สบายกระเป๋า
สำหรับผู้ประกันตน
สามารถเข้ารับการรักษาทางทันตกรรมได้ทั้ง
ขูดหินปูน อุดฟัน ถอนฟัน และผ่าฟันคุด
ในวงเงินรวมไม่เกิน 900 บาท/ปี
(ไม่ต้องสำรองจ่าย)
*รับประกันสังคมทุกโรงพยาบาล
เพื่อความสะดวก กรุณาโทรนัดหมายล่วงหน้า
โทร. 038500300 ต่อ 1204, 0652137447
พระโขนง ตรวจเชิงรุก เข้มข้น ป้องกันเหตุอัคคีภัย สถานบริการ-สถานบันเทิงในพื้นที่ LINK
7 ส.ค.65 เวลา 18.00 น. นางสาววรุณลักษม์ พลหาญ ผู้อำนวยการเขตพระโขนง พร้อมด้วย นายชลอ ภูมิวาณิชกิจ นายสมบัติ เครือกีรติธรรม ผู้ช่วยผู้อำนวยการเขตพระโขนง เจ้าหน้าที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ฝ่ายเทศกิจ ร่วมกับสถานีดับเพลิงและกู้ภัยพระโขนง ตำรวจ สน.บางนา, สน.พระโขนง ลงพื้นที่ตรวจเข้มสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ จำนวน 5 แห่งในพื้นที่ บริเวณย่านสุขุมวิท 103 (ซอยอุดมสุข 29 อุดมสุข 51) สุขุมวิท 97/1 และสุขุมวิท 64/3 ให้ปฏิบัติตามกฎหมายที่เกี่ยวข้องอย่างเคร่งครัด เพื่อความปลอดภัยในชีวิตและทรัพย์สินของผู้ที่เข้าไปใช้บริการ ซึ่งทางสำนักงานเขตพระโขนงและหน่วยงานที่เกี่ยวข้องได้ตรวจแนะนำไปแล้วเมื่อวันที่ 4 สิงหาคม 2565 อาทิ ระบบไฟฟ้า ระบบป้องกันอัคคีภัย ทางหนีไฟ การติดตั้งถังดับเพลิง ไฟฉุกเฉิน สัญญาณเตือนภัย ตามกฎหมายควบคุมอาคาร ซึ่งมีร้านที่ดำเนินการแก้ไขปรับปรุงตามคำแนะนำของเจ้าหน้าที่แล้ว และยังมีบางร้านที่อยู่ระหว่างการดำเนินการปรับปรุงแก้ไข
สำหรับการตรวจติดตามในวันนี้ สำนักงานเขตพระโขนง ได้ดำเนินการออกแบบตรวจแนะนำ (นส.1) กับร้านอาหารที่มีดนตรี/คาราโอเกะ ที่ไม่มีใบอนุญาต โดยให้ระงับการประกอบกิจการจัดให้มีการแสดงดนตรี คาราโอเกะ จนกว่าจะได้รับใบอนุญาตจากเจ้าพนักงานถิ่น และให้ยื่นคำขอรับใบอนุญาตประกอบกิจการจัดให้มีการแสดงดนตรี คาราโอเกะ ณ ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตพระโขนง ภายใน 7 วัน ส่วนร้านที่มีใบอนุญาตแล้ว แต่ยังมีข้อบกพร่อง เกี่ยวกับความปลอดภัย ได้ออกคำสั่งเจ้าพนักงานท้องถิ่น ให้แก้ไขข้อบกพร่องด้านสุขลักษณะและความปลอดภัย เช่น ทางหนีไฟ ไฟฉุกเฉิน ถังดับเพลิง ป้ายทางหนีไฟ/ป้ายทางออก (ตู้ไฟ) พร้อมกำชับเจ้าหน้าที่ดำเนินการติดตามการปรับปรุงแก้ไขต่อไป ทั้งนี้หากตรวจพบว่าสถานบริการและสถานประกอบการใดกระทําการฝ่าฝืนกฎหมาย ทางเขตฯ จะดําเนินการตามอํานาจหน้าที่อย่างเง้มงวดต่อไป
เลือกเพียง 1 แต่ได้ถึง 2 LINK
เพื่อการเริ่มต้นของผู้ประกันตน รพ.เชียงใหม่ใกล้หมอ สามารถมาใช้บริการตามสิทธิ์ประกันสังคม ปี 2563 เลือกเพียง 1 แต่ได้ถึง 2 เกินคุ้มค่ะ ผู้ประกันตน รพ.เชียงใหม่ใกล้หมอ ในปี 2563 สามารถมาใช้บริการ ผู้ป่วยนอกได้ที่ คลินิกโรงพยาบาลลำพูนใกล้หมอค่ะ
Day1-Day5 กิจกรรม APEC Health Week
เครื่องตรวจวินิจฉัยโรคด้วยคลื่นแม่เหล็กไฟฟ้า
10.#SAVEบางกลอย กับประเด็นเรื่องสิทธิทำกินของกลุ่มชาติพันธุ์
ความขัดแย้งในพื้นที่บางกลอยในผืนป่าอุทยานแห่งชาติแก่งกระจาน เป็นภาพสะท้อนปัญหาในเรื่องสิทธิที่ดินทำกินของกลุ่มชาติพันธุ์ในหลายพื้นที่ในประเทศไทย ไม่ใช่เพียงชาวกะเหรี่ยงที่บางกลอยเท่านั้น
A.Wealthy Global Citizens
Wealthy Global Citizens - Wealthy individuals holding at least USD 1 million in assets and investment in Thailand
Wealth Status & Investment
• At least USD 1 million in assets
• Personal income of a minimum of USD 80,000/ year in the past two years
• Investment of at least USD 500,000 in Thai govemment bonds, foreign direct investment, or Thai property
Health insurance
Health insurance with at least USD 50,000 coverage or social security benefits insuring treatment in Thailand or at least USD 100,000 deposit
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดสงขลา
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุจังหวัดสงขลา
เลขที่ 45 ม.4 ตำบลจะแหน อำเภอสะบ้าย้อย จังหวัดสงขลา 90210
โทรศัพท์ : 074-801930 , 074-801931
นำร่องโครงการให้โรงพยาบาล และหน่วยงานราชการต่างๆ LINK
พระปัญญาวชิรโมลี นพพร ให้แนวคิดและแนวทางสำหรับหน่วยงานรัฐที่จะได้ประโยชน์จากการลงทุนโซลาเซลส์ ไว้ดังนี้
เพื่อนำร่องโครงการให้โรงพยาบาล และหน่วยงานราชการต่างๆ โดยปกติจะใช้ไฟในเวลากลางวันเป็นหลัก จะได้ของดี ราคาถูก 137.06 กิโลวัตต์ งบประมาณ 3.3 ล้านบาท ลดค่าไฟฟ้าปีละ 900,000 - 1,000,000 บาท ตลอดอายุการใช้งาน 25 ปีลดไปได้ถึง 22 ล้าน หลังจากทดลองใช้แล้วได้วิเคราะห์การใช้งานพบว่าโรงพบาบาลใช้ไฟฟ้วันละ 700 กว่าหน่วย เมื่อติดโซล่าร์เซลล์ แล้วลดลงวันละ 600 หน่วย ทางโรงพยาบาลจ่ายค่าไฟฟ้าเพียงวันละ 100 หน่วย ในตอนไม่มีแสงแดด ถ้าแสงมาเมื่อไหร่ก็ผลิตไฟฟ้าให้ตามการใช้งานเลย ดูจากสีแดงเป็นกราฟการใช้ไฟของโรงพยาบาลในช่วงเวลากลางวันจะสูง แต่โซล่าร์เซลล์ก็ผลิตไฟไล่ตามไปติดๆ และไม่ผลิตเกินการใช้งาน เป็นการป้องกันการส่งไฟออกไปข้างนอกซึ่งทางทีมงานได้ติดตัวป้องกันไฟย้อนเข้าสายส่งเรียกว่า Zero Export
ถ้าทุกโรงพยาบาลในสังกัดกระทรวงสาธารณสุข และทุกโรงพยาบาลส่งเสริมสุขภาพตำบล ติดตั้งโซล่าร์เซลล์คุณภาพดีทั้งแผ่น และอินเวอร์เตอร์ประสิทธิภาพสูงใช้งบประมาณโดยไม่ล็อกสเป็คจะเกิดประโยชน์ต่อประเทศชาติขนาดไหน
เบื้องต้นได้นำเสนอกับท่านรัฐมนตรีว่าการกระทรวงพลังงานเกี่ยวกับโครงการโรงพยาบาลเสียดายแดด ซึ่งท่านเห็นชอบทำโครงการนำร่องด้วยงบประมาณ 3,000 ล้านบาท
แนวทาง
- โรงพยาบาลศูนย์/โรงพยาบาลทั่วไป จำนวน 120 แห่งติดตั้งโซล่าร์เซลล์แห่งละ 1 MW รวม 120 MW เมกกะวัตต์ละ 25 ล้าน ใช้งบประมาณรวม 3,000 ล้านบาท ประหยัดค่าไฟฟ้าปีละ 800 ล้านบาท
- โรงพยาบาลชุมชน จำนวน 800 แห่งๆ ติดตั้งโซล่าร์เซลล์แห่งละ 100 kW รวม 80 MW กิโลวัตต์ละ 30,000 บาท รวม 2,400 ล้านบาท ประหยัดค่าไฟฟ้าปีละ 528 ล้านบาท
- โรงพยาบาลส่งเสริมสุขภาพตำบล แบบไฮริด-ออนกริด แบตลิเธี่ยมจำนวน 10,000 แห่งๆ ละ 5 KW รวม 50 MW กิโลวัตต์ละ 70,000 บาท รวม 350 ล้านบาท ประหยัดค่าไฟฟ้าปีละ 330 ล้านบาท
ทั้งนี้เพื่อไม่เป็นการรบกวนระบบจัดส่งมากเกินไปอาจจะต้องทำการ Balance Energy ด้วย BESS ไปด้วย
งบประมาณที่ใช้
- รวมทั้งสิ้น 5,500 ล้านบาท
- หากใช้เวลาติดตั้ง 4 ปี เท่ากับ ต้องการงบสนับสนุนปีละ 1,437.5 ล้านบาท
ผลที่คาดว่าจะได้รับ
- ตลอดอายุการใช้งานสามารถประหยัดค่าไฟฟ้า 41,450 ล้านบาท
- สร้างภาพลักษณ์ที่ดีต่อสถานบริการสาธารณสุขของรัฐ และรัฐบาล
หรือโรงพยาบาลไหนสนใจไม่ต้องไปรบกวนงบประมาณของแผ่นดินมาให้คนไม่หวังดีแอบไปมีนอกมีในก็ใช้แนวทางการระดมทุนทอดผ้าป่าโซลล่าร์เซลล์โดยอาศัยการมีส่วนร่วมของชุมชน แต่ละคนช่วยกันคนละเล็กน้อยด้วยน้ำใจไมตรีของคนไทยย่อมนำพาประเทศชาติเจริญรุ่งเรืองทัดเทียมนานาประเทศได้
การติดตั้งโซลาร์เซลล์ที่โรงพยาบาลบ้านตาก จ.ตากนี้ โดยทีมงานนักเรียนจากโรงเรียนศรีแสงธรรมมาช่วยทำงานรระหว่างปิดเทอม เมื่อเสร็จแล้วก็ย้ายไปทำให้วัดที่พิษณุโลก ก่อนจะไปทำงานรับจ้างที่โรงงานน้ำดื่มในบางบัวทองต่อไป ค่อยกลับมาเตรียมขึ้นที่โรงพยาบาลธวัชบุรี จ.ร้อยเอ็ดต่อไป ต้องขอขอบคุณ ผู้อำนวยการโรงพยาบาลบ้านตาก และเจ้าหน้าที่ทุกท่านที่ดูแลเรื่องที่อยู่ที่กินให้กับทีมงานอย่างดี
ผู้นำนานาประเทศ แสดงความอาลัยต่อเหตุการณ์
ประธานาธิบดีโจ ไบเดน ทวิตข้อความว่า ข้าพเจ้าและภริยา อาลัยต่อครอบครัวที่สูญเสียผู้เป็นที่รักจากเหตุการณ์ในกรุงโซล และอาลัยต่อประชาชนสาธารณรัฐเกาหลี และปรารถนาให้ผู้บาดเจ็บหายป่วยโดยเร็ว สหรัฐอเมริกาจะยืนเคียงข้างสาธารณรัฐเกาหลีในห้วงเวลาอันแสนเศร้าเช่นนี้
นายริชี่ ซูนัค นายกรัฐมนตรีสหราชอาณาจักร ทวิตว่า ข่าวเศร้าจากโซลคืนนี้ ทุกคนในเวลานี้ ต่างร่วมส่งกำลังใจใหักับทุกฝ่ายที่เร่งเยียวยาแก้ไขสถานการณ์ และถึงชาวเกาหลีใต้ทุกคนในช่วงเวลาที่น่าวิตกเช่นนี้
ประธานาธิบดีเอ็มมานูเอล มาครอง แห่งฝรั่งเศส
ทวิตว่า เป็นความสะเทือนใจในค่ำคืนนี้สำหรับชาวกรุงโซลและชาวเกาหลีทุกคน จากเหตุการณ์ในอิแทวอน ฝรั่งเศสจะอยู่เคียงข้างพวกคุณ
นายรัฐมนตรีจัสติน ทรูโด แห่งแคนาดา
ทวิตว่า ในนามของชาวแคนาดา ขอร่วมแสดงความอาลัยอย่างสุดซึ้งต่อชาวเกาหลีใต้ จากเหตุการณ์ที่เกิดขึ้นในกรุงโซล ข้าพเจ้าอาลัยกับผู้ที่สูญเสียและขอให้ผู้บาดเจ็บปลอดภัยในเร็ววัน
นายกรัฐมนตรีญี่ปุ่น คิชิดะ ฟูมิโอะ ทวิตว่า ข้าพเจ้าตกใจและเสียใจอย่างสุดซึ้งกับการสูญเสียชีวิตอันมีค่ามากมาย รวมถึงคนหนุ่มสาวที่มีอนาคตที่สดใส ในอุบัติเหตุอันน่าสลดใจที่เกิดขึ้นในอิแทวอน กรุงโซล ขอแสดงความเสียใจอย่างสุดซึ้งต่อเหยื่อผู้เคราะห์ร้ายและครอบครัวที่เสียชีวิตของพวกเขา และอธิษฐานขอให้ผู้บาดเจ็บหายโดยเร็ว
ประธานาธิบดี สี จิ้นผิง ส่งสาส์นถึงประธานาธิบดี ยุน ซุก-โยล แสดงความอาลัยต่อเหตุการณ์ ผู้สูญเสียและครอบครัว เหตุการณ์นี้มีชาวจีนเสียชีวิตไปด้วย และหวังว่าทางการเกาหลีใต้จะดำเนินการทุกวิถีทางเพื่อดูแลเยียวยาผู้ได้รับผลกระทบทุกคน
ประเพณีลอยกระทงกาบกล้วย เมืองแม่กลอง อ.อัมพวา จังหวัดสมุทรสงคราม
"ประเพณีลอยกระทงกาบกล้วย เมืองแม่กลอง" ระหว่างวันที่ 5 – 8 พฤศจิกายน 2565 ณ อุทยาน ร.2 ,วัดภุมรินทร์กุฎีทอง อ.อัมพวา จังหวัดสมุทรสงคราม อีกหนึ่งเอกลักษณ์ กับการเทศกาลลอยกระทงกาบกล้วย อันเป็นประเพณีที่ทำสืบต่อกันมาอย่างยาวนานของชาวสมุทรสงคราม ชมพิธีอัญเชิญพระประทีปพระราชทาน ลอยเป็นปฐมฤกษ์ ชมขบวนแห่รถกระทงรอบเมืองแม่กลอง และชมการปล่อยกระทงกาบกล้วยที่จุดธูปปล่อยเป็นสายระยิบระยับสว่างไสว กลางสายน้ำกว่า 200,000 ใบ สวยงามตระการตาไปทั่วท้องน้ำยาวไปตามแนวลำน้ำแม่กลอง ภายในงานมีกิจกรรมมากมาย อาทิ ร่วมสักการะขอพรสิ่งศักดิ์สิทธิ์ การลอยกระทงย้อนยุค บรรยากาศชุดไทย การออกร้านของกลุ่มร้านค้า ของดี ของดัง อัมพวา การแสดงศิลปวัฒนธรรม อาทิ โขน ละครเล็ก ดนตรีพื้นบ้าน ของโรงเรียนในพื้นที่จังหวัดสมุทรสงคราม ฟังธรรมะ การประกวดนางนพมาศ
ในปีการศึกษา 2566 นี้ โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ รับสมัครบุคคลเข้าศึกษาหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ รอบที่ 1 การรับด้วย Portfolio (โครงการเพชรจุฬาภรณ์) จำนวน 30 คน เปิดรับสมัครตั้งแต่วันที่ 1 ธันวาคม 2565 – 10 มกราคม 2566
ติดตามและสอบถามข้อมูลเพิ่มเติมได้ที่ โทร : 064-586-2429
Twitter : hkh_pccms
Facebook :
hkh.hst.pccms Colorful Bangkok สัปดาห์ที่ 2 วันที่ 7 - 13 พ.ย.65
น้องๆ รุ่นใหม่ก็มารอฟังสุนทราภรณ์เหมือนกันนะ
หลักสี่ นัดทิ้ง นัดเก็บ ขยะชิ้นใหญ่ และขยะอันตราย ทุกวันเสาร์ เดือนพฤศจิกายน2565 LINK
หลักสี่ นัดทิ้ง นัดเก็บ ขยะชิ้นใหญ่ และขยะอันตราย เดือนพฤศจิกายน2565
วันที่ 5 พ.ย.65 หมู่บ้านเกษตรนิเวศน์ ซอยแจ้งวัฒนะ 14
วันที่ 12 พ.ย.65 หมู่บ้านโสสุนคร ซอยงามวงศ์วาน 47 แยก 12 (ชินเขต 2/10)
วันที่ 19 พ.ย.65 หมู่บ้านทาวน์ อเวนิว ซอยวิภาวดีรังสิต 60
วันที่ 26 พ.ย.65 หมู่บ้านโกสุมนิเวศน์ ซอย ก. และ ข. และชุมชน 9 ไร่ ซอยแจ้งวัฒนะ 10 แยก 7 และ แยก 9
นอกจากนี้ เขตฯ ยังได้จัดเจ้าหน้าที่เก็บขยะเก็บชิ้นใหญ่ทางเรือบริเวณ #ชุมชนริมคลองเปรมประชากร เป็นประจำทุกวันอาทิตย์อีกด้วย
โปรดนำสิ่งของเหลือใช้ ขยะชิ้นใหญ่ และขยะอันตราย เช่น โต๊ะ ตู้ ที่นอน เก้าอี้ ยางรถยนต์ เครื่องใช้ไฟฟ้าเก่า ถ่านไฟฉาย แบตเตอรี่ ฯลฯตั้งวางบริเวณจุดพักขยะ #ก่อนเวลา 09.00 น. เพื่อเจ้าหน้าที่จะดำเนินการจัดเก็บต่อไป
สอบถามเพิ่มเติม โทร. 02-5761393
การผ่าตัดข้อเข่าเทียมด้วยหุ่นยนต์ โรงพยาบาลสินแพทย์ ลำลูกกา
โรงพยาบาลสินแพทย์ ลำลูกกา เป็นอีกหนึ่งโรงพยาบาลที่มีการนำเอา หุ่นยนต์ Robotic Knee Replacement มาใช้ โดยเทคโนโลยีนี้เป็นเทคโนโลยีสร้างภาพ 3 มิติ ช่วยให้เห็นภาพในจุดที่เข้าไม่ถึง เพื่อช่วยให้การผ่าตัดแม่นยำมากขึ้น ไม่ไปกระทบกับบริเวณที่ไม่เสื่อม ทำให้ลดภาวะแทรกซ้อน ลดการอักเสบ จากการผ่าตัด ผู้ป่วยสามารถกลับมาเดินและใช้ชีวิตปกติได้ภายใน 1-2 วันหลังการผ่าตัด การใช้เทคโนโลยีเข้ามาช่ยยการการผ่าตัด ทำให้การรักษามีประสิทธิภาพ และสามารถยืดอายุข้อเข่าเทียมใช้งานได้นานกว่า แพทย์ผู้ชำนาญการกระดูกและข้อ จะพิจารณาการผ่าตัดให้เหมาะสมกับคนไข้แต่ละบุคคล โดยจะตรวจดูลักษณะของเข่า กล้ามเนื้อขา อาการอักเสบปวด บวม แดง ร้อน การยืดและเหยียดของข้อ เสียงกรอบแกรบ ร่วมกับการทำเอกซเรย์ CT scan หรือ MRI
สอบถามข้อมูลเพิ่มเติมได้ที่ รงพยาบาลสินแพทย์ ลำลูกกา โทร.02-006-9999
20 พ.ย. 65 ร่าง พ.ร.บ.กัญชา กัญชง
1. ร่าง พ.ร.บ.กัญชา กัญชง
-นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. กล่าวว่า ไม่มีความกังวลอะไรต่อพ.ร.บ. กัญชา กัญชงฯ หลังการประชุมเอเปคทุกอย่างจะดีขึ้น เมื่อ พ.ร.บ.กัญชากัญชงฯ เข้าสภาฯแล้วต้องมีการพิจารณาเป็นรายมาตรา รวมถึงเชื่อมั่นว่าคณะกรรมาธิการที่ร่างกฎหมายนี้จะต้องรับฟัง ทั้งนี้ พ.ร.บ. กัญชา กัญชงฯ จะผ่านหรือไม่ผ่านนั้น ขอยึดเอาประโยชน์ของประชาชนเป็นหลัก ขณะนี้ใช้ประกาศของสธ.ควบคุม แต่ปัญหาคือความยุ่งยากของเจ้าหน้าที่รัฐเท่านั้นเอง ส่วนประชาชนสามารถใช้ได้ทุกอย่าง ส่วนประเด็นที่เป็นห่วงว่าจะเป็นทางที่ไม่ชอบไม่เหมาะสม ถ้าเป็นเช่นนั้นยิ่งควรต้องมีกฎหมายที่ควบคุม ซึ่งกฎหมายฯที่ออกมาครั้งนี้เพื่อมาควบคุมกัญชงกัญชาไม่ให้เกิดอันตราย และให้เกิดการใช้ที่ถูกต้องและเป็นประโยชน์ ส่วนความรอบคอบของสธ. ถ้ากฎหมายไม่ออกมาหรือมีการแปรญัตติ จึงออกมาเป็นกฎกระทรวง แต่ยอมรับว่าการมีกฎหมายจะทำให้มั่นใจในการใช้มากขึ้น
-นายประสิทธิ์ชัย หนูนวล แนวร่วมเครือข่ายเขียนอนาคตกัญชาไทย และกรรมาธิการ (กมธ.) พิจารณาร่าง พ.ร.บ.กัญชากัญชง พ.ศ. ... โพสต์ประกาศการชุมนุมร่วมกันทวงคืนกัญชาจากยาเสพติด หน้าสำนักงาน กพร. ตรงข้ามประตู 1 ทำเนียบรัฐบาล ในวันที่ 22 พฤศจิกายน 2565 เวลา 12.30 น. เป็นต้นไป พร้อมระบุต้องไม่นำกัญชากลับไปเป็นยาเสพติด การดึงเข้าสู่โหมดยาเสพติดเท่ากับการรีเซตใหม่ในกติกากัญชาของประเทศ มีแต่การผลักดันกฎหมายกัญชา จึงจะสร้างหลักประกันว่ากัญชาเป็นของประชาชน ความพยายามในการนำกัญชาไปเป็นยาเสพติดจึงเป็นการกระทำที่ก่อผลกระทบต่อประชาชนที่กำลังปลูกกัญชานับล้านราย โดยเครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทยจะได้ร่วมหารือกำหนดการเคลื่อนไหวหลังทราบผลการประชุม
2. ผลสำรวจ
-ซูเปอร์โพลเผยผลสำรวจเรื่อง กัญชากับการเตะตัดขา ระบุประชาชน 81.3% มองว่าการขวางนโยบายกัญชาเพื่อสุขภาพเป็นเกมการเมือง เตะตัดขาพรรคภูมิใจไทย ขณะที่ 77.8% เชื่อมีกลุ่มทุนกลุ่มการเมือง ทั้งคนไทยและต่างชาติเสียประโยชน์ และ 84.6% บอกว่าพรรคภูมิใจไทย เป็นพรรคเดียวที่กล้าเปลี่ยนแปลง ทำเพื่อประชาชนให้มีและใช้กัญชาได้อย่างปลอดภัย
คุณพร้อมพร สุภัทรวณิช ผู้ช่วยผู้อำนวยการด้านวิจัยการตลาดและกลยุทธ์ สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน ประเทศไทย อธิบายความสนใจบ้านเมืองของคนไทยในภาพรวมว่า ในปัจจุบันความสนใจของผู้คนมีความผันผวนตลอดเวลาจากสถานการณ์บ้านเมืองที่มีให้ตกใจรายวัน เช่น ข่าวการกราดยิง ข่าวน้ำท่วม ข่าวการเมืองที่ยังคงร้อนแรง หรืออื่นอีกหลายข่าวที่ปรากฎใน Top10 จนทำให้คนไทยไม่มีความสนใจเรื่องข่าวสารหรือความกังวลของโควิด-19 อีกแล้ว น สิ่งที่ควรจะตั้งข้อสังเกตุคือ ‘คนไทยในขณะนี้ มีแนวโน้มที่จะเสพข่าวแบบมีสติและเหตุผลมากขึ้น ไม่ใช้อารมณ์ในการตัดสินใจเนื้อหาของข่าวนั้นเพียงอย่างเดียว จนกว่าจะได้รู้เนื้อหาของข่าวทั้งหมด และช่วยกัน comment เพื่อดึงสติไม่ให้ไหลไปตามกระแสอารมณ์ของโซเชียล ซึ่งทีมมองว่า เป็นนัยยะที่ดีและคาดหวังว่าคนไทยจะสามารถรับมือกับสถานการณ์ต่างๆได้อย่างมีสติ และรู้เท่าทันเพื่อความปลอดภัยในการใช้ชีวิตในปีหน้า’
ทำงานกันมาอย่างต่อเนื่องจนผ่านมาได้ถึงช่วงท้ายปีนี้ ถึงเวลาพักเรื่องการทำงานเข้าสู่โหมดการพักผ่อนในช่วงเทศกาลปีใหม่ เพราะการได้ใช้ชีวิตอย่างเต็มที่มีค่ายิ่งกว่าเงินทอง เลิกเครียดโควิด-19 คิดบวก มองว่าเป็นสิ่งที่สามารถรักษาหายได้ พร้อมมูฟออนเพื่ออนาคตที่สดใสอย่างเต็มที่
AMAZING THAILAND COUNTDOWN 2023 @ HATYAI SONGKHLA
นครหาดใหญ่ สงขลางาน ส่งท้ายปีเก่า ต้อนรับปีใหม่ ปี 2566 Amazing Thailand 2023 Countdown ( Southern Region) @ Hatyai , Songkhla โดยจะจัดขึ้นระหว่างวันที่ 29 – 31 ธันวาคม 2565 ณ บริเวณใจกลางเมืองหาดใหญ่ ถนนนิพัทธ์อุทิศ 1 และ ถนนธรรมนูญวิถี อ.หาดใหญ่ จ.สงขลา
ชมฟรี การแสดงพลุสุดตระการตา และ มินิคอนเสิร์ตจากศิลปินชื่อดัง
พร้อมกับจุดเช็คอิน ถ่ายรูปกับแลนด์มาร์ค และการออกร้านจำหน่ายสินค้า อาหารชือดัง
ในการจัดกิจกรรมส่งท้ายปีเก่าในปีนี้ จะเป็นอีกหนึ่งปีที่มีการเฉลิมฉลองอย่างยิ่งใหญ่ของนครหาดใหญ่ เนื่องจากมีการบูรณาการร่วมมือกันของคนหาดใหญ่ ไม่ว่าจะเป็น คณะผู้บริหารฯ หน่วยงานรัฐและเอกชนในพื้นที่ และส่วนกลาง ภาคีเครือข่ายด้านการท่องเที่ยว ธุรกิจอุตสาหกรรมการท่องเที่ยว รวมทั้งประชาชนในพื้นที่เข้าร่วมประชุม เพื่อส่งเสริมการท่องเที่ยว ขับเคลื่อนเศรษฐกิจ โดยการสร้างมูลค่าเพิ่มทางเศรษฐกิจ ให้กับธุรกิจที่เกี่ยวเนื่องกับอุตสาหกรรมการท่องเที่ยว
ศูนย์อายุรวัฒน์ 2 อาคารเวชศาสตร์ฟื้นฟู อาคาร 2 ชั้น 9
เกณฑ์การประเมิน
ระดับ 1
ระดับความรู้สึกตัวปกติ
ผู้สูงอายุที่ไม่มีปัญหาด้านสุขภาพแต่อายุมาก ช่วยเหลือตัวเองได้พอสมควร ญาติไม่พร้อมให้การดูแลที่บ้าน
รับประทานอาหารได้ด้วยตนเอง ไม่มีปัญหาในการกลืน
ราคาห้องเดี่ยว /เดือน 40,000.- บาท
ระดับ 2
ผู้สูงอายุที่ช่วยเหลือตัวเองไม่ได้ (status bed ridden)
ต้องให้อาหารทางสายยาง - ใส่สายสวนปัสสาวะ
ต้องทำกายภาพบำบัด - ปัสสาวะขับถ่ายบนเตียง
มีแผลกดทับ - มีภาวะอ่อนแรง - ต้องพลิกตะแคงตัว
ต้องได้รับอินซูลินชนิดฉีด
ราคาห้องเดี่ยว /เดือน 45,000.- บาท
ระดับ 3
ผู้สูงอายุที่ช่วยเหลือตัวเองไม่ได้ (status bed ridden)
ร่วมกับมีภาวะที่ต้องการให้พยาบาลเพิ่มเติม แต่ไม่รุนแรงจนต้องเข้ารับการรักษาในโรงพยาบาล เช่น
- on tracheostomy (เจาะคอ) ต้องดูดเสมหะเป็นระยะ
- on oxygen therapy
ต้องได้รับการประเมินน้ำตาลในเลือดเป็นระยะ (Dextrostix) ได้รับอินซูลินชนิดฉีด
ต้องให้อาหารทางสายยาง - ต้องทำกายภาพบำบัด
ราคาห้องเดี่ยว /เดือน 50,000.- บาท
***หมายเหตุ : รายละเอียดอื่น ๆ กรุณาติดต่อ อาคาร 9 ชั้น 9 โทร. 90920, 90923 หรือ อาคาร 2 ชั้น 9 โทร. 20920, 20921*
ภาพรวมงบประมาณรายจ่าย และรายกระทรวง
มองย้อนกลับไปสักเล็กน้อยเพื่อให้เห็นตัวเลขงบประมาณภาพรวม ตั้งแต่ปี 2563 -2566 และรายกระทรวง 3 กระทรวง ได้แก่ กระทรวงสาธารณสุข กระทรวงศึกษาธิการ และ กระทรวงการอุดมศึกษาฯ
งบประมาณรายจ่าย
ปี 2566 จำนวน 3,185,000 ล้านบาท
ปี 2565 จำนวน 3,100,000 ล้านบาท
ปี 2564 จำนวน 3,285,962.48 ล้านบาท
ปี 2563 จำนวน 3,200,000 ล้านบาท
งบประมาณ กระทรวงสาธารณสุข
ปี 2566 จำนวน 156,408.7 ล้านบาท (152,263.89)
ปี 2565 จำนวน 153,838.66 ล้านบาท
ปี 2564 จำนวน 145,802.31 ล้านบาท
ปี 2563 จำนวน 137,389.41 ล้านบาท
งบประมาณ กระทรวงศึกษาธิการ
ปี 2566 จำนวน 325,900.2 ล้านบาท (327,374.72)
ปี 2565 จำนวน 330,426.59 ล้านบาท
ปี 2564 จำนวน 356,449.68 ล้านบาท
ปี 2563 จำนวน 367,744.72 ล้านบาท
งบประมาณ กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม
ปี 2566 จำนวน 124,748.2 ล้านบาท (124,555.85)
ปี 2565 จำนวน 123,446.60 ล้านบาท
ปี 2564 จำนวน 128,127.02 ล้านบาท
ของขวัญปีใหม่จาก EXIM Bank ให้ผู้ประกอบการ 2 มาตรการ
ธนาคารเพื่อการส่งออกและนำเข้าแห่งประเทศไทย จำนวน 2 มาตรการ
ได้แก่
1. มาตรการจ่าย All in 1 โดยลูกค้าเดิมและลูกค้าใหม่ที่เข้าร่วม 1 ใน 3 มาตรการ ดังนี้ 1) มาตรการสินเชื่อ EXIM Personal Biz 2) มาตรการสินเชื่อเพื่อผู้ส่งออกป้ายแดง และ 3) มาตรการสินเชื่อ EXIM Shield Financing จะได้รับอัตราดอกเบี้ยสูงสุดไม่เกินร้อยละ 6.60 ต่อปีระยะเวลา 6 เดือน
2. มาตรการรับเงินคืน ร้อยละ 2 ของดอกเบี้ยจ่ายสะสม โดยลูกค้าที่เข้าร่วมมาตรการปรับปรุงโครงสร้างหนี้อย่างยั่งยืนของ EXIM BANK จะได้รับเงินคืนร้อยละ 2 ของดอกเบี้ยจ่ายสะสม เป็นระยะเวลา 2 เดือน
ศูนย์บริการสาธารณสุขที่ 10 ทานสัมฤทธิ์
- ที่อยู่ 43/173 ม.6 ถนนติวานนท์ 38 ตำบลท่าทราย อำเภอเมืองนนทบุรี จังหวัดนนทบุรี 11000
- โทร 02-9506357 ,092-2472745
- Line ID: tansumrit หรือหมายเลขโทรศัพท์ 09224727454
- E-mail : tansumrit@hotmail.com
- แผนที่
- Facebook
บริการ
- คลินิคตรวจรักษาโรคทั่วไป/ทำแผล วันจันทร์-อาทิตย์ เวลา 08.30-16.30 น.
- คลินิกวางแผนครอบครัว วันจันทร์-ศุกร์ เวลา 08.30-16.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-ศุกร์ เวลา 08.30-16.30 น.
- ตรวจเลือด (LAB) วันอังคาร และศุกร์ เวลา 08.30-12.00 น.
- เยี่ยมบ้าน วันจันทร์-ศุกร์ เวลา 13.00-16.30 น.
*หมายเหตุ บริการฉีดวัคซีน 0-5 ปี ทุกวันที่ 10 ของเดือน (อาจมีการเปลี่ยนแปลงในบางเดือน)
ตรวจพัฒนาการเต็กทุกวัน เวลา 13.00-16.30 น. ขึ้นทะเบียนบัตรทอง ทุกวัน
ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย The Royal College of Anesthesiologists of Thailand
ราชวิทยาลัยวิสัญญีแพทย์แห่งประเทศไทย
The Royal College of Anesthesiologists of Thailand
อาคารเฉลิมพระบารมี 5๐ ปี ชั้น 5 เลขที่ 2 ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ บางกะปิ ห้วยขวาง กรุงเทพฯ 10310
โทรศัพท์: 02-7167220
โทรสาร: 02-7167771
มือถือ: 085-2610066, 081-9063066
10. ช่องทางบริการข้อมูล หลักประกันสุขภาพแห่งชาต
ภญ. อาทิรัตน์ จารุกิจพิพัฒน์ กล่าวปิดท้ายว่า “ด้วยบทพิสูจน์ที่ผ่านมา และความพร้อมที่จะก้าวสู่ปีแห่งความเป็นเลิศในปี 2566 นี้ บำรุงราษฎร์มีความมุ่งมั่นอย่างมากในการสร้างความแตกต่าง (Differentiation) ที่เอื้อให้เกิดการเติบโตทางธุรกิจ (Growth) เพื่อจะบรรลุวิสัยทัศน์ในการเป็นจุดหมายแห่งการดูแลสุขภาพและสุขภาวะที่น่าเชื่อถือที่สุด ซึ่งเราจะไม่สามารถบรรลุวิสัยทัศน์นี้ได้ หากปราศจากศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ซึ่งเป็นสถาบันเวชศาสตร์ชะลอวัยแบบบูรณาการ เป็นผู้บุกเบิกและวางรากฐานเวชศาสตร์เชิงป้องกันเป็นแห่งแรกในเอเชีย โดยมุ่งหวังให้ผู้คนมีชีวิตที่ยืนยาวอย่างมีคุณภาพ
เขตพระนคร ห้องสมุดเมืองกรุงเทพมหานคร
หอสมุดเมืองกรุงเทพมหานคร พื้นที่แห่งการเรียนรู้ บนถนนสายประวัติศาสตร์ หอสมุดเมืองกรุงเทพมหานคร เป็น ๑ ใน ๙ พันธกิจ ของกรุงเทพมหานครที่ได้รับการคัดเลือกจาก องค์การยูเนสโก (UNESCO) ให้เป็น “เมืองหนังสือโลก ประจำปี ๒๕๕๖” (Bangkok World Book Capital 2013) โดยมีจุดเริ่มต้นมาจากแนวคิดและนโยบายของคณะผู้บริหารกรุงเทพมหานครที่จะผลักดันให้เมืองหลวงของประเทศไทย เป็น “มหานครแห่งการเรียนรู้” และเพื่อเพิ่มแหล่งการเรียนรู้แห่งใหม่ที่รวบรวมองค์ความรู้อันทรงคุณค่า และแหล่งภูมิปัญญา ด้วยเทคโนโลยีการเรียนรู้ที่ทันสมัยครบวงจร โดยหอสมุดเมืองกรุงเทพมหานคร (Bangkok City Library) จะเป็นแหล่งรวบรวมข้อมูลทางประวัติศาสตร์ ตลอดจนภูมิปัญญาท้องถิ่น รวมไปถึงความเป็นมาของกรุงเทพมหานครตั้งแต่อดีตถึงปัจจุบัน
หอสมุดเมืองกรุงเทพมหานครเปิดอย่างเป็นทางการในวันที่ ๒๘ เมษายน ๒๕๖๐ เวลา ๑๗.๐๐ น. โดยสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จพระราชดำเนินเป็นประธานในพิธีเปิดและให้บริการแก่ประชาชนอย่างเป็นทางการในวันที่ ๒๙ เมษายน ๒๕๖๐
ห้องสมุดเมืองกรุงเทพมหานคร มีบริการยืมหนังสือต่างๆ ได้แก่ นิตยสาร/หนังสือพิมพ์ ห้องสมุดคนพิการ (For Disabilities) เน้นที่ผู้พิการทางสายตา วรรณกรรมไทยและวรรณกรรมนานาชาติ หนังสือเกี่ยวกับพระบาทสมเด็จพระปรมินทรมหาภูมิพลอดุลยเดช หนังสือที่กรุงเทพมหานครจัดทำ หนังสือเกี่ยวกับเมืองหลวงทั่วทุกมุมโลก บริการห้องค้นคว้า บริการให้เข้าศึกษาดูงาน/เยี่ยมชมเป็นหมู่คณะสำหรับสถาบันการศึกษา และหน่วยงานต่างๆที่สนใจ
วันเวลาเปิดบริการ
อังคาร - เสาร์ 09.00 - 20.30 น.
อาทิตย์ 09:00 - 20:00 น.
ปิดวันจันทร์และวันหยุดนักขัตฤกษ์
หอสมุดเมืองกรุงเทพมหานคร : เขตพระนคร
เลขที่ 39 อาคาร ค ถนนราชดำเนินกลาง แขวงตลาดยอด เขตพระนคร กทม. 10200
โทร. 021634675
รักนี้ไม่มี Sad @ปทุมวัน LINK
สำนักงานเขตปทุมวัน ขอเชิญชวนคู่รักร่วมกิจกรรมจดทะเบียนสมรสนอกสำนักทะเบียน "รักนี้ไม่มี Sad @ปทุมวัน" เนื่องในวันวาเลนไทน์ วันแห่งความรักสากลซึ่งตรงกับวันที่ 14 กุมภาพันธ์ ของทุกปี เพื่ออำนวยความสะดวกแก่คู่ที่ประสงค์จดทะเบียนสมรสในวันดังกล่าว
ประชาชนท่านใดที่สนใจเข้าร่วมกิจกรรม "รักนี้ไม่มี Sad @ปทุมวัน" สามารถเดินทางไปจดทะเบียนสมรสได้ในวันอังคารที่ 14 กุมภาพันธ์ 2566 พร้อมลุ้นของรางวัลได้ตั้งแต่เวลา 10.00 - 16.00 น. ณ ศูนย์การค้า เอ็ม บี เค เซ็นเตอร์ บริเวณ Meeting Point ชั้น G (สามารถลงทะเบียนออนไลน์ล่วงหน้าโดยสแกนคิวอาร์โค้ด ด้านล่างโปสเตอร์นี้)
ทั้งนี้ กรณีคู่สมรสเป็นชาวต่างชาติ สามารถยื่นเอกสารที่ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตปทุมวัน ตั้งแต่วันที่ 1 - 7 กุมภาพันธ์ 2566 เพื่อตรวจสอบความถูกต้องของเอกสารก่อนจดทะเบียน สามารถติดต่อสอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียน หมายเลขโทรศัพท์ 022141048
สรุปเหตุการณ์แผ่นดินไหว โดยสถานเอกอัครราชทูต ณ กรุงอังการา LINK
เมื่อวันจันทร์ที่ 6 กุมภาพันธ์ 2566 ได้เกิดเหตุแผ่นดินไหวในทางตอนใต้และทางตะวันออกเฉียงใต้ของตุรกี ดังนี้
(1) เหตุแผ่นดินไหวขนาด 7.7 ริกเตอร์ เวลา 04.17 น. ตามเวลาท้องถิ่น ซึ่งมีศูนย์กลางอยู่ในเขต Pazarcık ทางตอนใต้ของจังหวัด Kahramanmaras (ห่างจากกรุงอังการาประมาณ 580 กิโลเมตร) มีศูนย์กลางลึกลงไป 7 กิโลเมตร
(2) ต่อมา เกิดเหตุแผ่นดินไหวขนาด 6.6 และ 6.5 ริกเตอร์ ในเขตจังหวัด Gaziantep (ห่างจากกรุงอังการาประมาณ 610 กิโลเมตร)
สื่อท้องถิ่นของตุรกีรายงานว่าแผ่นดินไหวดังกล่าวทำให้มีผู้เสียชีวิตทั้งสิ้น เท่าที่ทราบในชั้นนี้ 2,921 ราย ในจังหวัด Kahramanmaras, Gaziantep, Sanliurfa, Diyarbakır, Adana, Adıyaman และ Malatya และมีผู้ได้รับบาดเจ็บ 15,834 รายในจังหวัด Kahramanmaras, Gaziantep, Sanliurfa, Diyarbakir, Adana, Adiyaman, Malatya, Osmaniye, Hatay และ Kilis
สถานเอกอัครราชทูต ณ กรุงอังการา ขอรายงานว่า ในชั้นนี้ ยังไม่มีรายงานว่าพบคนไทยได้รับผลกระทบจากเหตุการณ์ดังกล่าว อย่างไรก็ดี สถานเอกอัครราชทูตฯ ขอให้ประชาชนไทยในพื้นที่ใช้ความระมัดระวัง หลีกเลี่ยงการอยู่ในอาคารที่ชำรุดเสียหาย โดยตรวจสอบและติดตามข่าวสาร ตลอดจนคำเตือนจากทางการตุรกี โดยเฉพาะความเป็นไปได้ที่จะเกิดอาฟเตอร์ช็อกอย่างสม่ำเสมอ ทั้งนี้ กรณีคนไทยต้องการความช่วยเหลือจำเป็นเร่งด่วน สามารถติดต่อหมายเลขฉุกเฉินของสถานเอกอัครราชทูตฯ +90 533 641 5698 ได้ตลอด 24 ชั่วโมง และทาง Facebook Page สถานเอกอัครราชทูต ณ กรุงอังการา ได้อีกด้วย
อันดับ 10. อุทยานแห่งชาติผาแต้ม จ.อุบลราชธานี
อุทยานบนเขาที่มีน้ำตก หินรูปทรงโดดเด่น ร้านอาหาร และร้านขายของที่ระลึก จุดท่องเที่ยวโดดเด่น คือ เสาเฉลียง เสาหินทรายรูปทรงคล้ายเห็ดอันเป็นเอกลักษณ์ของผาแต้ม จุดชมวิวผาหมอน ชมแม่น้ำโขง และทุ่งดอกหญ้า จุดชมภาพเขียนสียุคโบราณ ผาหมอนน้อย ผาขาม ผาแต้ม
อัตราค่าบริการเข้าเขตอุทยานแห่งชาติผาแต้ม
คนไทย ผู้ใหญ่ 40 บาท เด็ก 20 บาท
ชาวต่างชาติ ผู้ใหญ่ 200 บาท เด็ก 100 บาท
*เด็กอายุต่ำกว่า 3 ปี ไม่เก็บค่าบริการ
**นักเรียน นิสิต นักศึกษา เก็บในอัตราเด็ก
ค่าบริการยานพาหนะ มอเตอร์ไซด์ 20 บาท รถยนต์ 4 ล้อ 30 บาท รถ 6 ล้อ 100 บาท รถไม่เกิน10 ล้อ 200 บาท
*เกิน 10 ล้อห้ามเข้าอุทยาน
ประจำเดือนพฤศจิกายน 2565
1 พ.ย. 65
เขตสะพานสูง มัสยิดย่ามีลุ้ลอิบาคะห์
เขตพระโขนง ชุมชน เกตุไพเราะ 3 - 5
2 พ.ย. 65
เขตวัฒนา อสส. ศูนย์
เขตจตุจักร เคหะรามอินทรา
3 พ.ย. 65
เขตวัฒนา อสส.ศูนย์
เขตสะพานสูง หมู่บ้านเคหะธานี
4 พ.ย. 65
เขตสวนหลวง สุเหร่าจรเข้ขบ
เขตรนบุรี วัดบางสะแกนอก
7 พ.ย. 65
เขตสัมพันธวงศ์ ชุมชนโชฎึก
เขตจตุจักร แฟลตตำรวจ191
8 พ.ย. 65
เขตสะพานสูง สุเหร่าฮิดายะห์ ศูนย์สุขภาพชุมชนราม 127/2
9 พ.ย. 65
เขตพระโขนง ชุมชนหน้า รร.บางจาก สุขุมวิท 56
เขตมีนบุรี บริษัทเอสวัน
10 พ.ย. 65
เขตวัฒนา ชวาลา
11 พ.ย. 65
เขตคลองเตย ชุมชน ล็อค4,5,6
14 พ.ย. 65
เขตคันนายาว ชุมชน ริมคลองระหัสพัฒนา
เขตบางนา ชุมชน พึ่งทรัพย์+แสนสุข
15 พ.ย. 65
เขตสวนหลวง สุเหร่าบ้านม้า
21 พ.ย. 65
เขตสัมพันธวงศ์ โปลิศสภาบ.ศรีไทย
เขตคันนายาว ชุมชน เพชรอนันต์
เขตวัฒนา สำนักงานเขตวัฒนา
22 พ.ย. 65
เขตวัฒนา สำนักงานเขตวัฒนา
เขตสายไหม ชุมชน พรพระร่วงพัฒนา
23 พ.ย. 65
เขตพระโขนง ชุมชน บุญกุศล สุขุมวิท 101/1 , วชิรรรรมสาธิต 13
24 พ.ย. 65
เขตบางเขน วัดศิริพงษ์ธรรมนิมิต
เขตบางขุนเทียน ชุมชน คุณาลัย
25 พ.ย. 65
เขตสะพานสูง วัดลาดบัวขาว
เขตสะพานสูง ทับช้างคลองบน ซอยนักกีฬา 12
28 พ.ย. 65
เขตบางนา ชุมชนหมู่บ้านไพโรจน์
เขตคันนายาว ชุมชนนภาพิลัย
29 พ.ย. 65
เขตสะพานสูง หมู่บ้านอยู่สบาย ซอยกรุงเกพกรีกา 39
30 พ.ย. 65
เขตมึงกุม สำนักงานเขดมึงทุ่น เสรีไทย 43
เขตพระโขนง เอื้ออมรคอนโด
สุขุมวิท 62 ริมทางรถไฟสายเก่า
การฝากไข่และการวางแผนมีบุตร
สำหรับคนที่วางแผนจะมีลูกในอนาคต แต่ปัจจุบันยังไม่แต่งงาน หรือยังไม่พร้อมตั้งครรภ์ตอนนี้ เรามีวิธีอย่างไรในการให้ลูกที่จะเกิดมาแข็งแรง
ผศ. พญ. ชนัญญา ตันติธรรม สูติแพทย์ ผู้ชำนาญการด้านเวชศาสตร์การเจริญพันธุ์ ให้คำตอบว่า การฝากไข่ให้ประโยชน์ในแง่ของการเก็บรักษาเซลล์ไข่เอาไว้ ในอุณหภูมิที่ต่ำเพื่อประโยชน์ในการวางแผนการตั้งครรภ์ในอนาคต
เราสามารถเก็บไข่ได้นานขนาดไหน
ตามทฤษฎีก็จะเก็บไว้ได้ตลอดไป แต่แนะนำว่าควรจะกลับมาใช้ใน 10 ปี
ตั๋วเข้าชมแดนเนรมิต 19 มี.ค.42
วันหยุด มีตั๋วเข้าชมแดนเนรมิต 19 มี.ค.42 ใครมีความทรงจำหรือภาพมาแชร์ความรู้สึกกันได้น้า... เครดิตภาพ ลูกเพจบรรเจิดช่วยแชร์ความทรงจำ [ภาพจาก
เพจบรรเจิดเริ่ดสะแมนแตน 29 มกราคม 2023]
ลูกหาข้อมูลเรื่องเพศในอินเทอร์เน็ต และเชื่อเพื่อนมากกว่าพ่อแม่
ควรทำ
ควรมีท่าทีเป็นมิตร และเป็นที่พึ่งให้ลูกได้ตั้งแต่ลูกยังเล็ก เพราะเมื่อลูกโตขึ้น ลูกจะได้กล้าเข้าหาและถามปัญหาเรื่องเพศกับพ่อแม่
ถ้าหากไม่เคยคุยเรื่องเพศมาตั้งแต่ลูกยังเล็ก พ่อแม่ก็ควรเข้าหา และแสดงจุดยืนว่าพ่อแม่พร้อมที่จะเป็นที่ปรึกษา โดยไม่ต่อว่าหรือตัดสินลูก
ควรบอกวัยรุ่นที่เชื่อข้อมูลเรื่องเพศในอินเทอร์เน็ตและจากเพื่อนว่า สิ่งที่เห็นในอินเทอร์เน็ตอาจไม่ใช่ข้อมูลที่ถูกต้องเสมอไป เช่น เว็บไซต์ปลอม หรือเว็บไซต์ที่มีการขายโฆษณาแฝง ถ้าลูกเชื่อสิ่งเหล่านี้และไปปฏิบัติ ก็อาจจะเป็นอันตรายต่อร่างกาย ขณะเดียวกัน ก็ควรบอกลูกว่า เพื่อนของลูกก็ไม่ได้รู้ข้อมูลมากไปกว่าลูกเองเท่าใดนัก เพราะมีวัยและประสบการณ์เรื่องเพศใกล้เคียงกัน
อย่าทำ
ปิดกั้นการคุยเรื่องเพศ ไม่คุยเรื่องเพศกับลูกเลย เพราะคิดว่าถ้าพูดไปแล้วจะยิ่งเป็นการชี้โพรงให้กระรอกและลูกจะไปปฏิบัติตาม
ต่อว่า หรือใช้คำพูดดุด่าลูก เช่น “เป็นเด็กเป็นเล็กจะรู้ไปทำไม” จะทำให้ลูกรู้สึกว่าพ่อแม่ไม่พร้อมที่จะคุยและให้ข้อมูลเรื่องเพศที่เด็กอยากรู้ และหันไปใช้อินเทอร์เน็ตในการหาคำตอบแทน
การคุยเรื่องเพศในเชิงสั่งสอน ถือคติว่าพ่อแม่มีประสบการณ์มาก่อนและย่อมรู้ดีกว่า จะทำให้ลูกไม่อยากเข้าหา และคิดว่าพ่อแม่ไม่เข้าใจบริบทของวัยรุ่นยุคปัจจุบัน
สงกรานต์ วัดดอนสัก (สิงขร) ตำบลดอนสัก
ขอเชิญเที่ยวงาน ประจำปี สงกรานต์ เททองหล่อหัวใจเจ้าแม่กวนอิม ทอดผ้าป่าสามัคคี
ระหว่างวันที่ 6 - 15 เมษายน 2566
ณ วัดดอนสัก (สิงขร) ตำบลดอนสัก อำเภอดอนสัก จังหวัดสุราษฎร์ธานี
6 เม.ย. 66 อ๊อฟ ดอกฟ้า อาร์สยาม
7 เม.ย. 66 ธีเดช ทองอภิชาติ
8 เม.ย. 66 เวียนครก ศรีนาโพธิ์
9 เม.ย. 66 มโนราห์ ไข่เหลี้ยม
10 เม.ย. 66 หนัง น้องเดียว
11 เม.ย. 66 บ.เบิ้ล สามร้อย
12 เม.ย. 66 วงเบเกอรี่
13 เม.ย. 66 วงซันบ๊อก
14 เม.ย. 66 วงเบบี้ดั้ก
15 เม.ย. 66 ก้อย กินรีเชิญเข้าร่วมประกวดผลงานวิชาการด้านสมุนไพร
ขอเชิญเข้าร่วมประกวดผลงานวิชาการด้านสมุนไพร การแพทย์แผนไทย การแพทย์พื้นบ้านและการแพทย์ทางเลือก ภายในงานมหกรรมสมุนไพรแห่งชาติฯ ครั้งที่ 20 รับสมัคร ถึง 30 เมษายน 2566
สถานีชาร์จ EleX ใน ภาคตะวันตก
ภาคตะวันตก ประกอบด้วย กาญจนบุรี สุพรรณบุรี ตาก ราชบุรี เพชรบุรี **ทั้งนี้เพื่อให้ดูข้อมูลง่ายขึ้น
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เขื่อนศรีนครินทร์
ที่อยู่: 300 หมู่ 4 ต.ท่ากระดาน อ.ศรีสวัสดิ์ จ.กาญจนบุรี 71250
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เขื่อนวชิราลงกรณ์
ที่อยู่: 444 หมู่ 1 ต.ท่าขนุน อ.ทองผาภูมิ จ.กาญจนบุรี 71180
เวลาทำการ : ทุกวัน 08.00 – 17.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT บ้านใต้
ที่อยู่: 144 ถ.แสงชูโต ต.บ้านใต้ อ.เมือง จ.กาญจนบุรี 71000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา เขื่อนภูมิพล
ที่อยู่: 180/2 หมู่ 6 ต.สามเงา อ.สามเงา จ.ตาก 63130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ตาก
ที่อยู่: 112 หมู่ 1 ต.แม่ท้อ อ.เมืองตาก จ.ตาก 63000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT เขาย้อย
ที่อยู่: 95 หมู่ 2 ต.ห้วยโรง อ.เขาย้อย จ.เพชรบุรี 76140
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ชะอำ 3
ที่อยู่: 350 หมู่ที่3 ต.ดอนขุนห้วย อ.ชะอำ จ.เพชรบุรี 76120
เวลาทำการ : ทุกวัน 24 ชั่วโมง
โตโยต้าชัวร์ สาขา เมืองเพชร
ที่อยู่: 69 หมู่ 3 ถ.เพชรเกษม ต.ท่ายาง อ.ท่ายาง จ.เพชรบุรี 76130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีอู่ทองพลังงาน
ที่อยู่: 887 หมู่ที่3 ต.อู่ทอง อ.อู่ทอง จ.สุพรรณบุรี 72160
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ EV Station PluZ ภาคใต้
สถานี บจ.ส.สมบูรณ์ทรัพย์ปิโตรเลียม
129 ม.10 ถ.เพชรเกษม ต.สามกระทาย อ.กุยบุรี ประจวบคีรีขันธ์ 77150
สถานี บจ.ช้างเผือกปิโตรเลียม
559 ม.4 ต.ร่อนทอง อ.บางสะพาน ประจวบคีรีขันธ์ 77230
สถานี บจ.ปตท สามร้อยยอด
255/1 ม.1 ต.ไร่เก่า อ.สามร้อยยอด ประจวบคีรีขันธ์ 77180
สถานีบริการ แอล.พี.จี. หจก.ละแมปิยะกรุ๊ป (เมือง)
60/1, 60/2 หมู่ 1 ตำบลบ้านนา อำเภอเมืองชุมพร ชุมพร 86000
สถานี หจก.เค.ที.ทุ่งคาปิโตรเลียม
68 ม.6 ถ.สายเอเชีย ต.ทุ่งคา อ.เมืองชุมพร ชุมพร 86100
สถานี สาขาท่าแซะ
96 ม.16 ถ.เพชรเกษม ต.ท่าแซะ อ.ท่าแซะ ชุมพร 86140
สถานีบริการ บจ.เอ็น แอนด์ เอ ปิโตรเลี่ยม
100/9 หมู่ 7 ตำบลตะเคียนทอง อำเภอกาญจนดิษฐ์ สุราษฎร์ธานี 84160
สถานีบริการ บจ.ก.กิจบายพาส
14/26 ม.3 ถ.เลี่ยงเมือง ต.มะขามเตี้ย อ.เมืองสุราษฎร์ธานี สุราษฎร์ธานี 84000
สถานีบริการ สาขาท่าโรงช้าง
90/9 หมู่ 3 ตำบลท่าโรงช้าง อำเภอพุนพิน สุราษฎร์ธานี 84130
(อยู่ระหว่างการซ่อมบำรุง)สถานีบริการ บจ.สุราษฎร์ พี.เอ็น.ออยล์
139 หมู่ 2 ตำบลเขานิพันธ์ อำเภอเวียงสระ สุราษฎร์ธานี 84190
สถานี สาขาไชยา (ขาขึ้น)
26/2 ม.5 ต.ป่าเว อ.ไชยา สุราษฎร์ธานี 84110
สถานีบริการ บจ.น้ำมันสมุย
106/43 หมู่ 1 ตำบลบ่อผุด อำเภอเกาะสมุย สุราษฎร์ธานี 84320
สถานี บจ.วี คอร์ป
9/1 ถ.บ้านในหวัง ต.ปากแพรก อ.ทุ่งสง นครศรีธรรมราช 80110
สถานี บจ.วี คอร์ป
9/1 ถ.บ้านในหวัง ต.ปากแพรก อ.ทุ่งสง นครศรีธรรมราช 80110
สถานีบริการ หจก.วาสนาปิโตรเลียม
116 หมู่ 2 ตำบลนาพรุ อำเภอพระพรหม นครศรีธรรมราช 80320
สถานี สาขาสิชล
40 ม.9 ต.สิชล อ.สิชล นครศรีธรรมราช 80120
สถานีบริการ บจ.ยุทธกิจ ปิโตรเลียม
551 ม.5 ต.ปากพูน อ.เมืองนครศรีธรรมราช นครศรีธรรมราช 80000
สถานีบริการ หจก.กรวรินทร์
117 หมู่ 5 ตำบลกะปาง อำเภอทุ่งสง นครศรีธรรมราช 80110
สถานีบริการ บจ.เทพศิรินทร์
56/15 หมู่ 4 ตำบลบางนอน อำเภอเมืองระนอง ระนอง 85000
สถานีบริการ บจ.เทพศิรินทร์
56/15 หมู่ 4 ตำบลบางนอน อำเภอเมืองระนอง ระนอง 85000
สถานี หจก.กัลปพฤกษ์
56 ม.3 ถ.พังงาทับปุด ต.ถ้ำน้ำผุด อ.เมืองพังงา พังงา 82000
สถานีบริการ หจก.สาธิตและพิทยา
42/4 หมู่ 3 ตำบลคึกคัก อำเภอตะกั่วป่า พังงา 82110
สถานี สาขาสนามบินกระบี่
327/4 ม.2 ต.กระบี่น้อย อ.เมืองกระบี่ กระบี่ 81000
สถานีบริการ บจ.ดับเบิ้ล เอส ปิโตรเซอร์วิส
619 หมู่ 1 ตำบลเขาคราม อำเภอเมืองกระบี่ กระบี่ 81000
สถานีบริการ สาขาสนามบินหาดใหญ่
929 ม.1 ถ.สนามบิน-ลพบริราเมศวร์ ต.ควนลัง อ.หาดใหญ่ สงขลา 90110
(อยู่ระหว่างการซ่อมบำรุง)สถานีบริการ บจ.ทีเอสวี ออยล์
47/15 หมู่ 6 ตำบลน้ำน้อย อำเภอหาดใหญ่ สงขลา 90110
สถานีบริการ บจ.สโตน ออยล์
451 ม.1 ต.ควนขนุน อ.เขาชัยสน พัทลุง 93130
โรงแรมรอยัลภูเก็ตซิตี้
154 ถ.พังงา อ.เมือง จ.ภูเก็ต 83000
สถานี สาขาสนามบินภูเก็ต
113/12 ม.1 ต.สาคู อ.ถลาง ภูเก็ต 83110
สถานี สาขาภูเก็ต
205 ม.1 ต.ศรีสุนทร อ.ถลาง ภูเก็ต 83110
สถานี สาขากะทู้ 2
2/125 ม.2 ต.กะทู้ อ.กะทู้ ภูเก็ต 83120
สถานีบริการ บจ.เซฟพลัส ออโต้
98 ถนนตากใบ ตำบลบางนาค อำเภอเมืองนราธิวาส นราธิวาส 96000
บุฟเฟต์ทุเรียนในระยอง
ผู้ประกันตน รพ.รวมชัยประชารักษ์ เริ่มฉีดได้ตั้งแต่ 1 พ.ค.66 ไม่เสียค่าใช้จ่าย LINK
ผู้ประกันตนของโรงพยาบาลรวมชัยประชารักษ์ มาตรา 33 , มาตรา 39 และผู้ที่มีสิทธิตามมาตรา 38 ที่มีสิทธิการรักษาพยาบาล ซึ่งมีอายุตั้งแต่ 50 ปีขึ้นไป(เกิดไม่เกิน พ.ศ.2516) สามารถเข้ารับการฉีดวัคซีนไข้หวัดใหญ่ตามฤดูกาลปี 2566 โดยไม่มีค่าใช้จ่าย ปีละ 1 ครั้ง ตั้งแต่ 1 พฤษภาคม 2566 จนถึงวันที่ 31 สิงหาคม 2566 นี้ เพื่อดูแลผู้ประกันตนให้ได้รับบริการฉีดวัคซีนไข้หวัดใหญ่ ซึ่งนอกจากจะช่วยลดความรุนแรงของการป่วย และการเสียชีวิตจากโรคแทรกซ้อนของโรคไข้หวัดใหญ่และช่วยลดอัตราการนอนโรงพยาบาลของผู้ป่วยโรคไข้หวัดใหญ่แล้ว ยังช่วยลดความเสี่ยงต่อการเสียชีวิตที่เพิ่มขึ้นจากการติดเชื้อโควิด-19 ซึ่งยังมีการระบาดอยู่เป็นช่วงๆ
ติดต่อโรงพยาบาลรวมชัยประชารักษ์ 02 708 7501-10
วัดที่ให้บริการ
กรุงเทพมหานคร
วัดทองบน
ถ. พระรามท 3 หน้าบ้าน แขวงบางโพงพาง เขตยานนาวา กรุงเทพมหานคร
โทร 099 – 973 4010 / 02 – 284 0234
ราคาเริ่มต้น 1,500 บาท
วัดยาง พระอารามหลวง
ซอยอ่อนนุช 23 แขวงสวนหลวง แขวงสวนหลวง กรุงเทพมหานคร
โทร 02 – 332 2499
ราคาเริ่มต้น 2,000 บาท
วัดบางบัว
พหลโยธิน 46 แขวงอนุสาวรีย์ เขตบางเขน กรุงเทพมหานคร
โทร 092 – 495 2072
ราคาเริ่มต้น 2,000 บาท
วัดกระทุ่มเสือปลา
ซอยอ่อนนุช 67 ถนนอ่อนนุช แขวงประเวศ เขตประเวศ กรุงเทพมหานคร
โทร 086 – 575 5739
ราคาเริ่มต้น 3,000 บาท
วัดธาตุทอง
ถนนสุขุมวิท แขวงพระโขนงเหนือ เขตวัฒนา กรุงเทพมหานคร
โทร 02-3919616
วัดบางเตย
ซอยนวมินทร์ 60 ถนนนวมินทร์ แขวงคลองกุ่ม เขตบึงกุ่ม กรุงเทพมหานคร
โทร 02-5100515
วัดบางนาใน
ซอยสรรพาวุธ 1 แขวงบางนาใต้ เขตบางนา กรุงเทพมหานคร
โทร 089 – 487 2443
วัดสัมมาชัญญาวาส
ถนนพระยาสุเรนทร์ แขวงบางชัน เขตคลองสามวา กรุงเทพมหานคร
โทร 089 – 026 0955
วัดผาสุกมณีจักร
ถนนป๊อปปูล่า ตำบลบ้านใหม่ อำเภอปากเกร็ด นนทบุรี
โทร 089 – 076 6133 / 02 – 503 3411
ราคาเริ่มต้น 1,000 บาท
วัดซองพลู
ตำบลมหาสวัสดิ์ อำเภอบางกรวย นนทบุรี
โทร 089 – 483 3333
วัดตะเคียน
ถนนทางหลวงชนบท นนทบุรี
โทร 088 – 672 5196
ราคาเริ่มต้น 1,000 บาท
วัดจันทรสุข
หมู่ 5 ถนนรังสิต-นครนายก เทศบาลนครรังสิต อำเภอธัญบุรี ปทุมธานี
โทร 02-5330249
ภาคตะวันออก
วัดสว่างฟ้าพฤฒาราม
เมืองพัทยา อำเภอบางละมุง ชลบุรี
โทร 038 – 726 088
ราคาเริ่มต้น 1,500 บาท
วัดราษฎร์นิยมธรรม
ตำบลศรีราชา อำเภอศรีราชา ชลบุรี
โทร 063 – 773 6159
ราคาเริ่มต้น ไม่มีค่าใช้จ่าย
วัดเนินสุทธาวาส
ถนนสุขุมวิท ตำบลบางปลาสร้อย อำเภอเมือง ชลบุรี
โทร 063 – 421 0095
ภาคกลาง
วัดทุ่งตาล
ตำบลเจดีย์หัก อำเภอเมืองราชบุรี ราชบุรี
ราคาเริ่มต้น 200 บาท
วัดป่าสัก
ตำบลดาวเรือง อำเภอเมือง สระบุรี
โทร 08 – 4363 5777
ราคาเริ่มต้น 500 – 600 บาท
วัดเขื่อนขันธ์
ตำบลอรัญญิก อำเภอเมือง พิษณุโลก
โทร 055 – 301 934
ภาคเหนือ
วัดแม่หยวก
ซอยโชตนา 26 ตำบลช้างเผือก อำเภอเมือง เชียงใหม่
โทร 080 – 133 1699
ราคาเริ่มต้น ไม่มีค่าใช้จ่าย
ภาคใต้
วัดเขาใหญ่อรุณบุณราษฎร์
ตำบลหนองแก อำเภอหัวหิน ประจวบคีรีขันธ์
โทร 063 – 773 6159
ราคาเริ่มต้น ไม่มีค่าใช้จ่าย
*ข้อมูลจาก www.baanlaesuan.com
โรงพยาบาลเอกชน
สร้างแนวหน้าสุขภาพจิต ช่วยดูแล-บำบัด-ฟื้นฟูสุขภาพจิตของคนใกล้ตัว
ปัญหา
จำนวนผู้ป่วยซึมเศร้าในประเทศไทยอาจสูงถึง 1.5 ล้านคน หรือเฉลี่ยคนไทย 40 คน จะพบผู้ป่วยซึมเศร้า 1 คน โดยสาเหตุมาจากทั้งปัจจัยเฉพาะกิจอย่างโควิด-19 ที่เพิ่มความเครียดให้กับผู้คน (เช่น นักเรียนจากการเรียนออนไลน์ คนวัยทำงานจากสภาพเศรษฐกิจ) และปัจจัยถาวรต่างๆที่งานวิจัยระบุว่าทำให้คนรุ่นใหม่ มีแนวโน้มจะประสบปัญหาโรคซึมเศร้ามากกว่ารุ่นก่อนๆ (เช่น การใช้โซเชียลมีเดีย ที่เสี่ยงทำให้คนรู้สึกผิดหวังในตัวเองง่ายขึ้น จากการเปรียบเทียบชีวิตตัวเองกับชีวิตของคนอื่น) และพบว่าคนไทยมีอัตราการฆ่าตัวตายสูงเป็นอันดับ 1 อาเซียน จากปัญหาด้านสุขภาพจิต
ข้อเสนอ
ยกระดับให้คนทุกคนในสังคมมาร่วมเป็น “แนวหน้าสุขภาพจิต” ที่มาช่วยสร้างเสริม ดูแล บำบัด และฟื้นฟูสุขภาพจิตของคนใกล้ตัวตามระดับความเชี่ยวชาญของตน ตั้งแต่
- บุคลากรในครอบครัว (เช่น พ่อแม่ผู้ปกครองที่ดูแลลูก คู่สมรส ลูกหลานที่ช่วยดูแลผู้สูงอายุ)
- บุคลากรในโรงเรียน (เช่น นักจิตวิทยาประจำกลุ่มโรงเรียนที่ให้คำปรึกษา คุณครูที่ได้รับการเพิ่มทักษะในการดูแลสุขภาพจิตของผู้เรียน เพื่อนนักเรียนที่ช่วยดูแลกันและกัน)
- บุคลากรในสถานประกอบการ (เช่น เพื่อนร่วมงาน หัวหน้างาน หรือ ฝ่ายทรัพยากรบุคคล)
อบรมประชาชนทุกกลุ่มด้วยทักษะขั้นพื้นฐานด้านสุขภาพจิต เช่น
- ความรู้ความเข้าใจที่ถูกต้องเกี่ยวกับปัญหาสุขภาพจิต
- การเสริมทักษะการรับฟัง การสร้างกำลังใจ และการให้คำปรึกษา
- การพัฒนาและปรับปรุงเครื่องมือประเมินความเสี่ยงพื้นฐาน ที่ทุกคนเข้าถึงและนำไปใช้งานต่อได้ (เช่น แบบทดสอบ 9 ข้อ สำหรับคัดกรองอาการซึมเศร้า)
วิธีวิเคราะห์ AI x-risk
เพื่อเพิ่มความแม่นยำและเป็นรากฐานในการอภิปรายต่อประเด็นนี้ต่อไป เราได้จัดทำคำแนะนำสำหรับวิธีวิเคราะห์ความเสี่ยง x ของ AI ซึ่งประกอบด้วยสามส่วน:
- อันดับแรก เราจะทบทวนว่าระบบสามารถทำให้ปลอดภัยได้อย่างไรในปัจจุบัน โดยใช้แนวคิดที่ผ่านการทดสอบตามเวลาจากการวิเคราะห์อันตรายและความปลอดภัยของระบบที่ออกแบบมาเพื่อขับเคลื่อนกระบวนการขนาดใหญ่ให้ไปในทิศทางที่ปลอดภัยยิ่งขึ้น
- ต่อไป เราจะหารือเกี่ยวกับกลยุทธ์ในการสร้างผลกระทบระยะยาวต่อความปลอดภัยของระบบในอนาคต
- สุดท้าย เราจะหารือเกี่ยวกับแนวคิดที่สำคัญในการทำให้ระบบ AI ปลอดภัยยิ่งขึ้นโดยการปรับปรุงความสมดุลระหว่างความปลอดภัยและความสามารถทั่วไป
เราหวังว่าเอกสารนี้และแนวคิดและเครื่องมือที่นำเสนอจะเป็นคู่มือที่เป็นประโยชน์สำหรับการทำความเข้าใจวิธีวิเคราะห์ความเสี่ยง x ของ AI
ดัดแปลงมาจาก X-Risk Analysis สำหรับการวิจัย AI
รักษาด้วย ReLEx SMILE ซับซ้อนกว่าที่คิด - พญ. ฐาริณี กุลกำม์ธร
ด้านของ พญ. ฐาริณี กุลกำม์ธร จักษุแพทย์เฉพาะทางด้านการผ่าตัดแก้ไขสายตาด้วยเลเซอร์ โรงพยาบาลบำรุงราษฎร์ ให้ข้อมูลว่า ทุกวันนี้มีคนไข้หลายรายที่มาด้วยปัญหาสายตาสั้นและสายตาเอียง และต้องการแก้ไขด้วยรีเล็กสมายส์ (ReLEx SMILE) ซึ่งคนไข้มักจะคิดว่ามาตรวจแล้วสามารถรักษาได้ในวันเดียวกัน แต่อันที่จริงการรักษามีความละเอียดอ่อนมากกว่านั้น แพทย์ต้องประเมินอาการหรือสาเหตุของปัญหาที่อาจเกิดร่วมกันได้ บางรายมีความซับซ้อนมาก แพทย์ต้องประสานและปรึกษาร่วมกับแพทย์สาขาที่เกี่ยวข้อง แล้วจึงค่อยทำ ReLEx SMILE เพื่อการรักษาที่มีประสิทธิภาพสูงสุด โดยคำนึงถึงความปลอดภัยของคนไข้เป็นสิ่งสำคัญ
ยกตัวอย่าง คนไข้มาด้วยอาการปวดศีรษะแบบไมเกรนมาเป็นเวลานานมาก ตรวจพบค่าสายตาสั้นและเอียง 1 ข้าง สายตายาวและเอียงอีก 1 ข้าง ซึ่งค่าแตกต่างกันมาก และพบตาเหล่อีกเล็กน้อย รายนี้ต้องปรึกษาร่วมกับแพทย์เฉพาะทางด้านกล้ามเนื้อตา เพื่อยืนยันมุมตาที่เหล่ร่วมกับการคำนวณค่าสายตาในการยิงค่าเลเซอร์ให้ได้ผลดีที่สุดสำหรับคนไข้ทั้งด้านการมองเห็น และไม่เกิดการกระตุ้นให้ตาเหล่เพิ่มขึ้น ขณะที่ผู้ป่วยอีกรายอยู่ในขั้นตอนการทำเด็กหลอดแก้ว (IVF) ซึ่งคนไข้ต้องการทำ ReLEx SMILE ก่อนฝังตัวอ่อน คืออยากแก้ไขปัญหาสายตาสั้นก่อนที่จะมีบุตร จึงปรึกษาร่วมกับแพทย์เฉพาะทางด้าน IVF ถึงกระบวนการรักษา IVF ของคนไข้ เพื่อตอบโจทย์ความต้องการของคนไข้ที่อยากมองเห็นลูกน้อยได้อย่างชัดเจนในช่วงเวลาสำคัญที่เป็นความสุขของครอบครัว ขณะเดียวกันก็คำนึงถึงความปลอดภัยและประสิทธิภาพการรักษาสูงสุด และได้ผลสรุปว่าสามารถทำ ReLEx SMILE ได้ก่อน เพราะขั้นตอนยังไม่ได้กระทบต่อการทำ IVF แล้วจากนั้นอีก 1 เดือนค่อยเก็บไข่คนไข้ และเข้าสู่กระบวนการทำ IVF ต่อไป
ซอดแจ้ง จากอุบลราชธานี LINK
ซอดแจ้ง แปลว่า แสงแรกยามเช้า โรงกลั่นสุราชุมชน ซอดแจ้ง อำเภอสว่างวีระวงศ์ จังหวัดอุบลราชธานี อีกอพเภอขอบสุดด้านตะวันออกของไทย ที่ๆ จะเห็นพระอาทิตย์ขึ้นเป็นที่แรกของประเทศ โรงกลั่นสุราชุมชนซอดแจ้ง เกิดจากแนวคิดในการช่วยเหลือเกษตรกร และชุมชนในท้องถิ่น ในการพัฒนาสินค้าเกษตร เพิ่มมูลค่า และสร้างอาชีพ สร้างรายได้อย่างยั่งยืน ให้แก่เกษตรกรท้องถิ่นและชุมชน รวมถึงการร่วมมือกับศิลปินท้องถิ่น ในการออกแบบ และสนับสนุนศิลปะ ดนตรี วัฒนธรรมอีสาน จากการพัฒนาจุลินทรีย์ธรรมชาติเพื่อการเกษตร (EM) ในการเพาะปลูกเพื่อเพิ่มผลผลิต โดยใช้ทดแทนปุ๋ยเคมี ที่ประสบความสำเร็จอย่างสูง ทำให้ได้ผลผลิตทางการเกษตรที่มีคุณภาพ ออแกนิก และให้ผลผลิตที่มากกว่าการใช้เคมี และพัฒนาต่อมาเป็นสุราชุมชนที่มีคุณภาพ พัฒนาสูตรการผลิต และนำวิธีการผลิตที่ทันสมัย มาใช้ร่วมกับภูมิปัญญาท้องถิ่นอีสาน สร้างมูลค่าและมาตรฐานให้แก่สุราชุมชนของไทย
ตารางเปิด-ปิดถนนเลียบชายหาด จัดงานบางแสนกรังปรีซ์ 27 มิย - 2 กค 66
คู ลำราง ลำกระโดง 521 แห่ง
1 คูข้างกรมวิทยาศาสตร์ (เดิม)
2 คูข้างเขตบางกอกใหญ่ (เดิม)
3 คูข้างคลองมอญ
4 คูข้างโบสถ์แม่พระฟาติมา
5 คูข้างโรงพยาบาลรถไฟมักกะสัน
6 คูข้างวัดเครือวัลย์
7 คูข้างวิทยาลัยเกื้อการุณย์
8 คูข้างสโมสรทหารอากาศ
9 คูข้างสะพานเฉลิมโลก
10 คูข้างสุเหร่าเก่า (คูแยกคลองสวนหลวง 1)
11 คูซอยโปโล
12 คูซอยพิพัฒน์
13 คูซอยเพชรเกษม 10
14 คูซอยเพชรเกษม 14
15 คูซอยรองเมือง 1 - 2
16 คูซอยรองเมือง 2 - 3
17 คูซอยสุนทรพิมล
18 คูซอยองค์รักษ์ (วัดน้อย)
19 คูตรงข้าม ร.ร.ชาติศึกษา
20 คูนายกิมสาย 1
21 คูนายกิมสาย 2
22 คูนายกิมสาย 3 (คูข้างถนนสรงประภา)
23 คูน้ำข้าง ร.ร.ดำรงค์เรืองวิทย์
24 คูน้ำข้าง โรงเรียน ศรีอุลัย
25 คูน้ำข้างกองฝึกกรมศุลกากร
26 คูน้ำข้างคลองบางโคล่ใหญ่
27 คูน้ำข้างโรงพยาบาล เทพธารินทร์
28 คูน้ำข้างวัดดอน
29 คูน้ำข้างวัดประดู่ธรรมาธิปัตย์
30 คูน้ำคลองซอยกิ่งจันทร์
31 คูน้ำคอกม้า
32 คูน้ำเชิงหวาย
33 คูน้ำซอยจรัญ 69 (เลิศสุข)
34 คูน้ำซอยจรัญฯ 63
35 คูน้ำซอยจรัญฯ 70/3
36 คูน้ำซอยจรัญฯ78
37 คูน้ำซอยจรัญฯ89
38 คูน้ำซอยจันทร์เกษม
39 คูน้ำซอยเจริญใจ
40 คูน้ำซอยต้นสน
41 คูน้ำซอยทองหล่อ 5
42 คูน้ำซอยทองหล่อ 9
43 คูน้ำซอยบุญเหลือ
44 คูน้ำซอยประชานฤมิตร
45 คูน้ำซอยประดู่
46 คูน้ำซอยประดู่ (สวนหย่อม)
47 คูน้ำซอยประดู่ 3 (ข้างปั๊มน้ำมัน ปตท.)
48 คูน้ำซอยปานทิพย์ 2
49 คูน้ำซอยมหาลาภ
50 คูน้ำซอยมัสยิดบางอุทิศ
51 คูน้ำซอยมาตานุสรณ์
52 คูน้ำซอยระนอง 1
53 คูน้ำซอยลาซาล
54 คูน้ำซอยศรีวิชัย (ช่วง1)
55 คูน้ำซอยศรีวิชัย (ช่วง2)
56 คูน้ำซอยสมคิด
57 คูน้ำซอยสุขุมวิท 50
58 คูน้ำซอยอารีย์สัมพันธ์ 1
59 คูน้ำต้นซอยราชวิถี 21 (วัดภคินีนาถ)
60 คูน้ำท่าวาสุกรี
61 คูน้ำในแบ่งเขตข้างหมู่บ้านเอื้อสุข
62 คูน้ำปลาทู
63 คูน้ำปลายซอยเจริญกรุง 109
64 คูน้ำปลายซอยโชติวัฒน์
65 คูน้ำพระราม 3 ซอย 8
66 คูน้ำมไหสวรรย์ (หน้าโรงงานสบู่จุฬา)
67 คูน้ำมะขวิด
68 คูน้ำแยกคลองกรวย
69 คูน้ำแยกคลองขวาง 3 (ชุมชนวัดไผ่เงิน)
70 คูน้ำแยกคลองขวาง 3 (ซอยอยู่ดี)
71 คูน้ำแยกคลองขวาง 3 (ตระกูลโต๋ว)
72 คูน้ำแยกคลองบางคอแหลม
(ชุมชนวัดอินทร์บรรจง)
73 คูน้ำแยกคลองบางคอแหลม
(แยกคลองสวน)
74 คูน้ำแยกคลองบางโคล่น้อย
75 คูน้ำแยกคลองบางบำหรุ (ซอยพระปิ่น)
76 คูน้ำแยกคลองบางบำหรุ (แสงเทียนฯ)
77 คูน้ำแยกคลองบางบำหรุ (ออนป้า)
78 คูน้ำแยกคลองบางพลัด(ชุมชนคลองมะนาว)
79 คูน้ำแยกคลองบางพลู
80 คูน้ำแยกคลองบางยี่ขัน
81 คูน้ำแยกคลองวัดไทร
82 คูน้ำแยกคลองสวนหลวง 1
83 คูน้ำแยกคูข้างหมู่บ้านภักดี
84 คูน้ำวัดดอน (ดอนกุศล)
85 คูน้ำวัดปรกพม่า
86 คูน้ำสวนพลู 1
87 คูน้ำสาธารณะในหมู่บ้านมิตรภาพ
88 คูน้ำสามเรือน
89 คูน้ำสารภี 1
90 คูน้ำหน้าทหารปืนใหญ่
91 คูน้ำหน้าหมู่บ้านอโนทัย
92 คูน้ำหมู่บ้านธนูรักษ์
93 คูน้ำหมู่บ้านเอื้อสุข (ในที่ดินเอกชน)
94 คูน้ำหลังโรงเรียนศีลาจารพิพัฒน์
95 คูน้ำหลังศาลเจ้ากวนอู
96 คูระบายน้ำ กม.26
97 คูระบายน้ำข้างโรงงาน
98 คูระบายน้ำคลองชวด
99 คูระบายน้ำซอยเจริญพานิช
100 คูระบายน้ำซอยลาดพร้าว 15
101 คูระบายน้ำซอยลาดพร้าว 28
102 คูระบายน้ำซอยลาดพร้าว 31
103 คูระบายน้ำซอยลาดพร้าว 6
104 คูระบายน้ำซอยเสนานิคม 1
105 คูระบายน้ำซอยเสนานิคม 2
106 คูระบายน้ำที่ดินจัดสรรกรมการปกครอง
107 คูระบายน้ำปลายซอยสุขุมวิท 68
108 คูระบายน้ำหลังโรงเรียนศรีเอี่ยมอนุสรณ์
109 คูหลังกรมสื่อสารทหารบก
110 คูหลังเขตบางรัก
111 คูหลังบริษัทโกดัก(คูซอยสุขสันต์)
112 คูหลังสถานฑูตพม่า(เมียนม่าร์)
113 แยกคลองหลอแหล(ม.ธารารมณ์)
114 แยกลำกระโดงกิ่งจันทร์
115 ลำกระโดง
116 ลำกระโดง
117 ลำกระโดง ซ.48 - บางด้วนเหนือ 1
118 ลำกระโดง ซ.48 - บางด้วนเหนือ 2
119 ลำกระโดง ร.ร.วัดโตนด
120 ลำกระโดงกิ่งจันทร์
121 ลำกระโดงเกือกม้าตรงข้ามซอยเพชรเกษม47
122 ลำกระโดงเกือกม้าในม.เอเวอร์กรีนซิตี้
123 ลำกระโดงขนานซอยกิจพาณิช
124 ลำกระโดงขนานซอยจินดาถวิล
125 ลำกระโดงขนานซอยเพชรเกษม 43
126 ลำกระโดงขนานซอยสองพระ
127 ลำกระโดงขนานซอยอินทาปัจ11-4
และอินทาปัจ 9-6
128 ลำกระโดงข้าง ซ.เพชรเกษม 37
129 ลำกระโดงข้าง รร.พาณิชการสยาม
130 ลำกระโดงข้างเดอะมอลล์
131 ลำกระโดงข้างที่ดินรถไฟ
132 ลำกระโดงข้างบริษัทประยูรวิศว์
133 ลำกระโดงข้างบ้านบางแค 2
134 ลำกระโดงข้างปั้ม ป.ต.ท.ถนนเทอดไท
135 ลำกระโดงข้างร้านอำนวยสุขวัสดุก่อสร้าง
136 ลำกระโดงข้างโรงเรียนกรพิทักษ์วิทย์
137 ลำกระโดงข้างวัดสังข์กระจาย
138 ลำกระโดงข้างวัดสุทธิ
139 ลำกระโดงข้างหมู่บ้านร่ำรวยนิเวศน์ 2
140 ลำกระโดงข้างหมู่บ้านศรีมงคล
(ตัดซอยยิ่งเจริญ)
141 ลำกระโดงข้างหมู่บ้านศุภาลัย
142 ลำกระโดงข้างหมู่บ้านสินทวีงามเจริญ
143 ลำกระโดงข้างอู่ต่อเรือมิตรสายชล
144 ลำกระโดงข้ามหมู่บ้านวรนุช
145 ลำกระโดงข้ามหมู่บ้านเศรษฐีวิลล์
146 ลำกระโดงชิดสาย 1
147 ลำกระโดงชุมชน ร.ร.มิตรผล
148 ลำกระโดงชุมชนเขต 5
149 ลำกระโดงชุมชนซอยคานเรือ
150 ลำกระโดงชุมชนนครลุง
รายชื่อบูท Village (2x2 m.) ในงาน Thailand Coffee Fest 2023 LINK
Jomyim Artisan Roaster
Jst roaster
KAFFEINE
Khna Coffee
Koble Coffee
Koyo Tearoom
ksana.bkk
Liebe Coffee&Roastery
Love earth coffee roastery
LYNX
MaSoTa Chocolate
MATCHA MURA
Mate contemporary & Roaster
MATORI
MATU KOMBUCHA
Midsummer Cafe & Roastery
MITTY ROASTERS
Montagne
MOOD Drip Bag
moon.s cafe
Mori Tea House
narongchai ceramic
Nippy Coffee House
Once. Coffee Roaster by Usual
Onethird Bread & Beans
Open House Café オープンハウスカフェ
Oraclay
Over Lab Chocolate
Palitacoff กาแฟขุนช่างเคี่ยน กาแฟม่อนแจ่ม
Peko Peko
Piccolo Backyard Picoroaster
PLearn Chocolate
Plenti Farm
Queensbaker
Rocket Rolls
Rush coffee. Rommani
Ryn
Same Thang
SATI Coffee Roaster
Secret bake
SIAS KOFFEE ROASTER
Simple Life
Single Origin Store
Sudrit Nan Thailand
SUGAR FHEN
Sweet Roastery
sweets caption
Tanakhem Roaster
Tea season
Teasana
TE
The Sweet Chaos
Third Place Coffee - Chiang Mai
Tobo Coffee Roaster
Toffee Roasters
UFO Doughnuts
Ukrist farm
UNCLE COFFEE & CREPE
Varinda Coffee Roaster
West tree Art studio
WittWass Coffee Roasters
กาแฟตั๋ว กะ หมี
ขุนน่านคอฟฟี่
คาเฟอีน เทพเสด็จ
ดมตะ
น.น่าน Lab & Roastery
นักเลงบาร์ : Nugleng Bar
พิเศษกาแฟ
มาหามิตร
อร่อยชิปหายการคั่ว
อวล
19 องศาเหนือ
9495 COFFEE ROASTER
AHU Crafted for the Wild
ANOTHER CUP
ARCHIE NITRO
baked.n.bar
Baker Bricks
Baking Cottage
BIG Body Coffee
BLOOM PRETZEL & COFFEE
Bokaew Estate Coffee
Brew Flavor
Brewna
Calico Koff
ChaEn Tea Experience
Chajin Tea Supply
Chaya & Co.
CHILLRISTA COFFEE
Choc-a-dii
Chocoholic
Chocoreso
ChohaeCafe & Pottery
COCOA CRAFTER
Coffee Bean Chocolate
Cre8tive Cups Coffee Roaster
Crunchhh
Curate Coffee Roasters
Fatmancoffee
Fillgood Coffee Roaster
Have a nice day cafe NYK
I Amm Doi
i.din
Infinite cacao - อินฟินิท คาเคา
ISSARA Coffee Space
JatuphonThaiTea (Doi Maesalong)
Ji Baker
Joe’s Popcorn
3. การปักหมุด Pin Highlight ธุรกิจ/บริการ (May 2024 update)
- ค่าบริการ รายเดือน 1,200 บาท/เดือน *ไม่รวม VAT
- พิเศษ รับส่วนลด 10-30% หากทำสัญญาใช้บริการ 3/6/12 เดือน ดังนี้
• ค่าบริการ ราย 3 เดือน 3,240 บาท ลด 10%@1,080เดือน (ปกติ 3,600 บาท)
• ค่าบริการ ราย 6 เดือน 5,760 บาท ลด 20%@960/เดือน (ปกติ 7,200 บาท)
• ค่าบริการ ราย 12 เดือน 10,080 บาท ลด 30%@840/เดือน (ปกติ 14,400 บาท)
ขอรับใบเสนอราคา อีเมล์มาที่ healthserv.net@gmail.com หรือ โทร. 081-6969454 (คุณธนพรรณ Sale MKT)
คุกมีไว้ทำไม?
คุกมีไว้ทำไม? หนึ่งในคำตอบนั้นคือ การพัฒนาพฤตินิสัยของผู้กระทำความผิด ให้กลับตนเป็นคนดี แล้วการพัฒนาพฤตินิสัยนี้เขาทำกันยังไง หาคำตอบได้ที่นี้เลย
หลักเกณฑ์การเบิกจ่ายค่าใช้จ่าย LINK
หลักเกณฑ์การเบิกจ่ายค่าใช้จ่ายเพื่อบริการสาธารณสุข สําหรับหน่วยบริการรับส่งต่อเฉพาะด้านการพยาบาลและการผดุงครรภ์ ปีงบประมาณ 2566
1. เพื่อเพิ่มการเข้าถึงบริการสุขภาพปฐมภูมิ ที่มีคุณภาพ มาตรฐานให้แก่ประชาชน
2. พัฒนารูปแบบบริการสุขภาพปฐมภูมิที่เหมาะสมและ สอดคล้องกับสถานการณ์ การเปลี่ยนแปลงสู่New normal
3. สนับสนุนการพัฒนาระบบสุขภาพปฐมภูมิตามรัฐธรรมนูญ
หลักเกณฑ์ เงื่อนไขการจ่ายชดเชย
1. กลุ่มเป้าหมายผู้ป่วยสิทธิ UCหรือสิทธิว่าง
2.หน่วยบริการที่มี สิทธิขอรับ ค่าใช้จ่าย คลินิกการพยาบาลที่ขึ้นทะเบียนรับการส่งต่อเฉพาะด้านการบริการ คลินิกการพยาบาลและการผดุงครรภ์ ในระบบหลักประกันสุขภาพแห่งชาติ
3. การบันทึกข้อมูล1.รายการบริการพยาบาลพื้นฐาน >โปรแกรม e-Claim 2.รายการบริการการรักษาโรคเบืองต้น > โปรแกรม A-MED 3.บริการสร้างเสริมสุขภาพและป้องกันโรค > โปรแกรม KTB
อัตราการจ่ายชดเชย
รายการบริการพยาบาลพื้นฐาน
1. บริการการให้ยา
1.1ให้ยาฉีด 30 บาท/ต่อวัน
1.2ให้ยาพ่น 60 บาท/ต่อวัน
2.บริการการทําแผล
2.1แผลแห้ง 80 บาท/ต่อวัน
2.2แผลเปิด 170 บาท/ต่อวัน
2.3แผลขนาดใหญ่ 320 บาท/ต่อวัน
3. การใส่ NG80 บาท/ต่อวัน
4. การใส่สายสวนปัสสาวะ110 บาท/ต่อวัน
อัตราการจ่ายชดเชย รายการบริการพยาบาลพื้นฐาน
1.บริการล้างตา 80 บาท/ต่อวัน 2. บริการบริการเช็ดตา 50 บาท/ต่อวัน 3. บริการล้างจมูก 80 บาท/ต่อวัน
อัตราการจ่ายชดเชย รายการการบริการดูแลสุขภาพผู้ป่วยที่บ้าน
5. บริการเยี่ยมบ้าน ( Health Assessment )
5.1 กลุ่มผู้ป่วยที่สามารถรักษาให้หายขาดได้ 400 บาท/ต่อวัน/ไม่เกิน 4 ครั้ง /คน
5.2 กลุ่มผู้ป่วยที่เจ็บป่วยด้วยโรคเรื้อรังและไม่สามารถควบคุม อาการได้ 600 บาท/ต่อวัน/ไม่เกิน 6ครั้ง /คน
5.3กลุ่มผู้ป่วยที่เจ็บป่วยเรื้อรังและมีการไร้ความสามารถ เล็กน้อย 800 บาท/ต่อวัน/ไม่เกิน 8ครั้ง /คน
อัตราการจ่ายชดเชย รายการบริการการรักษาโรคเบื้องต้น
1.จ่ายเป็นค่าบริการตรวจวินิจฉัย/ให้ คําปรึกษา/ค่ายาและเวชภัณฑ์ จํานวน 32บริการ 150บาทต่อครั้ง
อัตราการจ่ายชดเชย รายการเวชภัณฑ์ที่เกี่ยวข้องกับ กิจกรรมบริการ
1.สายยางกระเพาะอาหารแบบซิลิโคน (NG tube) อัตราจ่ายตามรายการ FS 300บาท/ชิ้น
2.สายสวนปัสสาวะ (Urine catheter) 28 บาท/ชิ้น
3.ถุงเก็บปัสสาวะ (Urine bag) 90 บาท/ชิ้น
อัตราการจ่ายชดเชย รายการบริการสร้างเสริมสุขภาพและป้องกันโรค (PP FS)
1.บริการฝากครรภ์ (ANC) สาหรับครั้งที่ 2 เป็นต้นไป 360บาท/ครั้ง
2.บริการยาเม็ดคุมกําเนิด ชนิดฮอร์โมนรวม 40 บาท/แผง ครั้งละไม่เกิน 3 แผง ไม่เกิน 13 แผง/คน/ปี
3. บริการจ่ายถุงยางอนามัยและให้คําปรึกษา สําหรับ ประชาชนไทยวัยเจริญพันธุ์ 1บาท/ชิ้น
4. บริการทดสอบการตั้งครรภ์ 75บาทต่อครั้ง ไม่เกิน 4ครั้ง/ปี
5. บริการหญิงหลังคลอด-ครั้งที่ 1 ระหว่างวันที่ 8 –15นับถัดจากวันคลอด-ครั้งที่ 2 ระหว่างวันที่ 16 –42นับถัดจากวันคลอด
150 บาท /ครั้งหลังคลอด ไม่เกิน 2ครั้ง
6.บริการป้องกันการขาดไอโอดีน ธาตุเหล็กและ กรดโฟลิก(Triferdine) 135 บาท /ครั้งหลังคลอด ไม่เกิน 2ครั้ง
7. บริการยาเม็ดเสริมธาตุเหล็กและกรดโฟลิคใน หญิงไทยวัยเจริญพันธุ์ อายุ 13-45 ปี 80บาท/ ครั้ง ไม่เกิน 1ครั้ง/ปี
8. บริการคัดกรองและประเมินปัจจัยเสยงต่อสุขภาพ กาย/สุขภาพจิต-ประชาชนไทยอายุ 15-34 ปี -ประชาชนไทยอายุ 35-59ปี (เพิ่มเติมการคัดกรองโรคเบาหวานและโรคหัวใจ และหลอดเลือด)
ซี่แปรงของตัวกันของบันไดเลื่อน นี้สำคัญมาก
นพ.จิรรุจน์ ชมเชย กุมารแพทย์ระบบทางเดินหายใจ เผย ช่างซ่อมบันไดเลื่อนเคยบอก ซี่แปรงของตัวกันบันไดเลื่อน เป็นตัวป้องกันไม่ให้สิ่งแปลกปลอมเข้าสู่ระบบ ถ้าซี่อแปรงแตกหัก จะเป็นตัวดูดทุกอย่างที่ผ่านมา
“ซี่แปรง ของตัวกัน ของบันไดเลื่อน นี้สำคัญมาก…
ผมเคยคุยกับช่างซ่อมบันไดเลื่อน ที่มาตรวจของโรงพยาบาล เค้าเคยบอกว่า ซี่แปรงเหล่านี้จะเป็นตัวป้องกัน ไม่ให้สิ่งแปลกปลอมต่างๆเข้าไปสู่ระบบ
แต่ถ้าไอ้ซี่นี้มันแตกหักเมื่อไหร่นะครับหมอ มันอาจจะเป็นเครื่องดูด อะไรที่ผ่านมาตรงนี้ได้หมดเลยครับ
หากเป็นตามที่นายช่างเคยเล่าให้ผมฟังนี้จริง
เรื่องนี้สอนให้เรารู้ว่า สิ่งเล็กๆ หากเกิดข้อผิดพลาด อาจตามมา ซึ่งความเสียหายอันใหญ่หลวงได้
ผมก็ได้แต่หวัง แล้วขอ เอาใจช่วยให้ ผู้ประสบอุบัติเหตุ จากบันไดเลื่อนดังกล่าวปลอดภัย”
Jiraruj Praise
การค้นพบที่สำคัญ (Key Findings) จากการจัดอันดับปี 2023
การค้นพบที่สำคัญ
• ระดับความสงบสุขของประเทศโดยเฉลี่ยลดลงร้อยละ 0.42 ในดัชนีสันติภาพโลกปี 2566 นับเป็นปีที่ 9 ติดต่อกันที่ความสงบสุขทั่วโลกลดน้อยลง ระดับความสงบโดยเฉลี่ยดีขึ้นเพียง 2 ครั้งต่อปีนับตั้งแต่ปี 2551
• ในปีที่ผ่านมา 84 ประเทศมีพัฒนาการดีขึ้น ในขณะที่ 79 ประเทศมีความสงบสุขลดลง
• การรุกรานยูเครนของรัสเซียและผลที่ตามมาเป็นตัวขับเคลื่อนหลักของความเสื่อมโทรมในความสงบสุขทั่วโลก ทั้งรัสเซียและยูเครนได้รับการจัดอันดับให้เป็นหนึ่งในสิบประเทศที่มีความสงบสุขน้อยที่สุด และยูเครนมีดัชนี GPI ที่เสื่อมถอยลงมากที่สุดเมื่อเทียบกับประเทศใดๆ ในปี 2566
• ความรุนแรงของความขัดแย้งเพิ่มขึ้นทั่วโลกก่อนที่จะเริ่มความขัดแย้งในยูเครน
• จำนวนผู้เสียชีวิตที่เกี่ยวข้องกับความขัดแย้งทั้งหมดเพิ่มขึ้นร้อยละ 96 ทั้งการเสียชีวิตจากความขัดแย้งภายในและความขัดแย้งภายนอก ตัวบ่งชี้การต่อสู้จะแย่ลง แม้ว่ายูเครนและรัสเซียจะไม่รวมอยู่ในการวิเคราะห์ก็ตาม
• ตัวบ่งชี้สองตัวที่เสื่อมถอยมากที่สุดในปี 2565 ได้แก่ ความขัดแย้ง การต่อสู้จากความขัดแย้งภายนอก และ การเสียชีวิตจากความขัดแย้งภายใน รองลงมาคือ ความไม่มั่นคงทางการเมือง ตัวชี้วัดที่มีการปรับตัวมากที่สุดคือเงินทุนรักษาสันติภาพของสหประชาชาติและค่าใช้จ่ายทางทหาร
• แม้ว่า 92 ประเทศจะปรับตัวบ่งชี้ค่าใช้จ่ายทางทหารในปี 2565 ค่าใช้จ่ายทางทหารทั้งหมดเพิ่มขึ้น โดยได้รับแรงหนุนหลักจากประเทศที่เกี่ยวข้องกับสงครามยูเครน
• ภูมิภาคตะวันออกกลางและแอฟริกาเหนือ (MENA) มีความสงบสุขที่ดีขึ้นมากเป็นอันดับสองรองจากอเมริกาเหนือ อย่างไรก็ตาม ภูมิภาคดังกล่าวยังคงเป็นภูมิภาคที่มีความสงบสุขน้อยที่สุดของโลก เป็นที่ตั้งของสี่ในสิบประเทศที่มีความสงบสุขน้อยที่สุดในโลก
• ยุโรปยังคงเป็นภูมิภาคที่สงบสุขที่สุดในโลกและเป็นที่ตั้งของเจ็ดในสิบประเทศที่สงบสุขที่สุด อย่างไรก็ตาม GPI ทั้งสามด้านนั้น แย่ลงในปีที่ผ่านมา เนื่องจากความตึงเครียดระหว่างประเทศในยุโรปและรัสเซียยังคงเพิ่มขึ้นอย่างต่อเนื่อง ตอนนี้ยุโรปสงบสุขน้อยกว่าเมื่อ 15 ปีที่แล้ว
• ความสงบสุขดีขึ้นโดยเฉลี่ยสำหรับด้านการทำสงคราม แต่แย่ลงทั้งในด้านความขัดแย้งที่กำลังดำเนินอยู่ ความปลอดภัยและความมั่นคง
• จากตัวบ่งชี้ GPI 23 รายการ สิบรายการมีการปรับขึ้น 11 รายการมีการเสื่อมลง และสองรายการไม่มีการเปลี่ยนแปลงในปีที่ผ่านมา
• หลายประเทศที่เคยประสบกับความขัดแย้งอย่างรุนแรงในช่วงสองทศวรรษที่ผ่านมามีความสงบสุขที่ดีขึ้นมากที่สุด ลิเบีย โกตดิวัวร์ และอัฟกานิสถาน ต่างก็ได้รับการจัดอันดับให้เป็นหนึ่งในห้าประเทศที่มีการพัฒนาด้านสันติภาพมากที่สุด
• มี 59 ประเทศที่ความไร้เสถียรภาพทางการเมืองถดถอยลงในช่วงปีที่ผ่านมา เทียบกับเพียง 22 ประเทศที่ตัวบ่งชี้ดีขึ้น
*** ในกรุงเทพ ***
สถานการณ์ สะพานถล่มวันเกิดเหตุ 10 กรกฎาคม 66
10 ก.ค.2566 เวลา 18.08 น. ทางยกระดับถนนอ่อนนุช-ลาดกระบัง บนถนนหลวงแพ่ง เขตลาดกระบัง ช่วงบริเวณหน้าปั๊มปตท. คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 22 เวทีประชาคม CBTx LINK
วันที่ 16 กุมภาพันธ์ 2566 เวลา 9.00 - 12.00 น.คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 22 วัดปากบ่อ นำโดย พญ. ปิยะธิดา คณะนัย จัดประชุมคณะทำงานบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชน โดยชุมชนเป็นฐาน ( CBTx and Harm Reduction) ร่วมกับภาคีเครือข่าย ซึ่งประกอบด้วย ผู้ช่วยผู้อำนวยการเขตประเวศเจ้าหน้าที่จากสำนักงานเขตประเวศ สถานีตำรวจนครบาลประเวศ สำนักงานป้องกันและบำบัดการติดยาเสพติด ประธานและคณะกรรมการชุมชน กระทุ่มเสือปลา และNGO (มูลนิธิรักษ์ไทย)
วันที่ 9 มีนาคม 2566 คลินิกก้าวใหม่ พลัส ศูนย์บริการสาธารณสุข 22 วัดปากบ่อ ดำเนินงานตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดในชุมชนโดยชุมชนเป็นศูนย์กลาง (Community-Bestd Treatment and care :CBTx) และการลดอันตรายจากการใช้ยาเสพติด กิจกรรมที่ 2 การดำเนินงาน ลงเวทีประชาคม ครั้งที่ 1 และให้คำปรึกษา เรื่องการบำบัดรักษาบุหรี่และแอลกอฮอล์ ณ ชุมชนกระทุ่มเสือปลา การลงเวที ประชาคมประกอบด้วย รักษาการผู้อำนวยการศูนย์บริการสาธารณสุข22วัดปากบ่อ หัวหน้าพยาบาล ทีมสหวิชาชีพ คลินิกก้าวใหม่พลัส และเจ้าหน้าที่ จาก สำนักงานป้องกันและบำบัดการติดยาเสพติด สำนักงานเขตประเวศ สถานีตำรวจนครบาลประเวศ มูลนิธิรักษ์ไทย ประธานชุมชน กรรมการชุมชน และอสส.ชุมชน กระทุ่มเสือปลา
27 มิถุนายน 2566 คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 22 วัดปากบ่อ
จัดเวทีประชาคม ครั้งที่ 2 ตามโครงการ การดำเนินงานดูแลผู้ที่ใช้ยาเสพติดโดยใช้ชุมชนเป็นศูนย์กลาง (Community-Bestd Treatment and care : CBTx) และการลดอันตรายจากการใช้ยาเสพติด (HARM Reduction) ร่วมกับภาคีเครือข่ายต่างๆ ได้แก่ ผู้แทนสำนักงานป้องกันและบำบัดการติดยาเสพติด, ผู้แทนสำนักงานเขตประเวศ ผู้แทนสถานีตำรวจนครบาลประเวศ ศูนย์ส่งเสริมการเรียนรู้เขตประเวศ ประธานชุมชนกระทุ่มเสือปลา Nithipha Suvanich Rujira Kaewsaard
มาตรการ แก้ไขปัญหาแก๊ง Call Center หลอกลวง
นายไตรรัตน์ วิริยะศิริกุล รักษาการแทนเลขาธิการคณะกรรมการกิจการกระจายเสียง กิจการโทรทัศน์ และกิจการโทรคมนาคมแห่งชาติ (รักษาการแทน เลขาธิการ กสทช.) กล่าวว่า สำนักงาน กสทช. และสำนักงานตำรวจแห่งชาติ (สตช.) ได้ร่วมมือกันเพื่อแก้ไขปัญหาแก๊ง Call Center หลอกลวงประชาชนตามนโยบายของรัฐบาล โดยได้กำชับผู้ให้บริการโทรศัพท์ระหว่างประเทศ (IDD) ทั้ง 6 ราย
ได้แก่ บริษัท เอไอเอ็น โกลบอลคอม จำกัด บริษัท ดีแท็ค ไตรเน็ต จำกัด บริษัทแอดวานซ์ ไวร์เลส เน็ทเวอร์ท จำกัด บริษัท โอทาโร่ เวิลด์ คอร์ปอเรชั่น จำกัด บริษัททรู มูฟ เอช ยูนิเวอร์แซล คอมมิวนิเคชั่น จำกัด และบริษัท โทรคมนาคมแห่งชาติ จำกัด (มหาชน) ดำเนินการการแก้ไขปัญหาแก๊ง Call Center หลอกลวงอย่างเคร่งครัด โดยได้กำหนดมาตรการ ดังนี้
1.ระงับสายโทรเข้ามาจากต่างประเทศที่มีรูปแบบของเบอร์ที่โทรเข้ามาเป็น เบอร์โทรศัพท์บ้าน เบอร์โทรศัพท์สั้น 3 หลัก และเบอร์โทรศัพท์สั้น 4 หลัก ของประเทศไทย ที่โทรมายังเลขหมายปลายทางของประเทศไทย
2.ระงับสายโทรเข้ามาจากต่างประเทศที่มีรูปแบบของเบอร์ที่โทรเข้ามาเป็นรหัสโทรศัพท์ประจำประเทศ (Country Code) ที่สหภาพโทรคมนาคมระหว่างประเทศ (ITU) ยังไม่ได้จัดสรรให้กับประเทศใด
3.ดำเนินการตรวจสอบสายโทรเข้ามาจากต่างประเทศที่ผิดกฎหมาย ว่ามีการดัดแปลงเลขหมายหรือไม่ ด้วยระบบ Test Call Generator (TCG) อย่างต่อเนื่อง
4.ในกรณีที่สายโทรเข้ามาจากต่างประเทศไม่ได้มีการกำหนดเลขหมายต้นทาง (Non Calling Line Identification) ให้ดำเนินการเพิ่มเครื่องหมาย +66 นำหน้าเบอร์โทรศัพท์ เพื่อให้ประชาชนทราบว่าเป็นการโทรเข้ามาจากต่างประเทศ
“มาตรการที่สำนักงาน กสทช. ย้ำผู้ให้บริการโทรศัพท์ระหว่างประเทศ (IDD) ทั้ง 6 ราย ดำเนินการข้างต้น จะช่วยทำให้ประชาชนแยกแยะได้ว่า สายที่โทรเข้ามาเป็นสายที่โทรมาจากต่างประเทศ จะได้ไม่เผลอรับสายที่อาจเป็นสายจากแก๊ง Call Center ที่โทรศัพท์มาหลอกลวง” นายไตรรัตน์ กล่าว
PPTV เช็คสิทธิสุขภาพดีป้องกันโรค
เช็คสิทธิสุขภาพดีป้องกันโรค
ประชาชนสามารถตรวจสอบสิทธิใช้บริการสร้างเสริมสุขภาพและป้องกันโรคแต่ละกลุ่มวัยได้ที่
แอปพลิเคชันเป๋าตัง เมนูกระเป๋าสุขภาพ
สอบถามรายละเอียดเพิ่มเติมได้ที่
สายด่วน สปสช. 1330
ช่องทางออนไลน์
ไลน์ สปสช. พิมพ์ไลน์ไอดี @nhso หรือคลิก
Facebook :
สำนักงานหลักประกันสุขภาพแห่งชาติ คอร์สเรียนชงกาแฟ กับ Flit Café LINK
คอร์สเรียนชงกาแฟ กับ Flit Café เรียนรู้จริง เน้นปฏิบัติ ทำจนเป็น เปิดสอนหลายคอร์ส
• Ground Coffee คอร์สเรียนชงกาแฟสด Basic to Pro Barista Course (1 วัน) เหมาะกับผู้ที่ต้องการเรียนรู้การชงกาแฟ และเทคนิคต่างๆ ตั้งแต่พื้นฐาน ท่านละ 6,000 บาท พิเศษ! มาด้วยกัน 2 ท่าน ลด 1,000 บาท
• คอร์สเรียนเปิดร้านกาแฟCafe Owner Course (2 วัน) เหมาะกับผู้ที่ต้องการเป็นเจ้าของร้านกาแฟ และเรียนรู้ละเอียดรอบด้าน เน้นวิเคราะห์แก้ปัญหา และการรักษาคุณภาพเครื่องดื่ม เรียนตัวต่อตัว ท่านละ 18,000 บาท พิเศษ! มาพร้อมกัน 2 ท่าน ลด 2,000 บาท
• คอร์สเรียนลาเต้อาร์ต Latte Art Course (1 วัน) เหมาะกับผู้ที่ต้องการต่อยอดพัฒนาทักษะการชงกาแฟให้เป็นที่ยอมรับ และน่าประทับใจแก่ลูกค้า เรียนตัวต่อตัว ท่านละ 6,500 บาท พิเศษ! มาพร้อมกัน 2 ท่าน ลด 1,000 บาท
• คอร์สออสเตรเลียน-บาริสต้า Australian Barista Course (2 วัน) เหมาะกับผู้ที่ต้องการไปทำงานเป็นบาริสต้าที่ประเทศออสเตรเลีย คอร์สนี้เน้นการทำเมนูกาแฟต่างๆที่มีในออสเตรเลีย เรียนตัวต่อตัว ท่านละ 20,000 บาท พิเศษ! มาพร้อมกัน 2 ท่าน ลด 2,000 บาท
• คอร์สเรียนกาแฟดริป Pour Over Master Course (1 วัน) เหมาะกับผู้ที่ต้องการเรียนรู้การดริปกาแฟ ตั้งแต่ขั้นพื้นฐาน ไปถึงแนวทางในการปรับปรุงรสชาติ และกลิ่นกาแฟดริปให้ดีขึ้นได้ตามที่ต้องการ เรียนตัวต่อตัว ท่านละ 6,500 บาท พิเศษ! มาพร้อมกัน 2 ท่าน ลด 1,000 บาท
Tel: 062-969-5456 , 062-956-5456
LITTLE ROSE COOKING STUDIO คอร์สทำเค้กน่าเรียน LINK
LITTLE ROSE COOKING STUDIO จ.เชียงใหม่ เปิดคลาสสอนทำขนม ที่ทุกคนสามารถเรียนได้ ไม่มีพื้นฐานการทำขนมก็สามารถเรียนได้ คอร์สทำเค้กน่าเรียน • RED VELVET CAKE เค้กเรดเวลเวต • Buttercream Flower Cupcakes • Burger Bun • Vintage Cute Cake • Buttercream Cactus Cake & Cupcakes • Buttercream Flower Cake • Wagashi Nerikiri • Dark Chocolate Cake • Premium Vanilla Butter Cake • Basque Burnt Cheesecake • Canale • Japanese Homemade Donut • Mini Pound Cake • Short Cake (Sponge Cake) • Banana Bread • Fruit Tart
สอบถามโทร 082-8969829
ประเพณีชักพระวัดไก่เตี้ย แรม 2 ค่ำ เดือน 12 ของทุกปี
ประเพณีชักพระวัดไก่เตี้ย
ประเพณีที่สำคัญของท้องถิ่น และชาวบ้านแถบคลองบางกอกน้อยและคลองบางกอกใหญ่ที่เกี่ยวข้องกับวัดไก่เตี้ยคือ การแห่พระบรมสารีริกธาตุหรือประเพณีชักพระ (วลัยลักษณ์ ทรงศิริ 2552) จัดเป็นประเพณีที่ยิ่งใหญ่และสืบทอดมาโดยตลอด ในวันแรม 2 ค่ำ เดือน 12 ของทุกปี (หลังวันลอยกระทง 2 วัน) จะมีการอัญเชิญพระบรมสารีริกธาตุและพระธาตุสาวกลงประดิษฐานยังบุษบกในเรือแล้วเริ่มต้นแห่งจากหน้าวัดนางชีไปทางคลองบางกอกน้อยจนถึงวัดไก่เตี้ยที่ตลิ่งชันก่อนเพล ส่วนขากลับแห่ไปทางปากคลองบางกอกน้อยเข้าแม่น้ำเจ้าพระยาผ่านคลองบางกอกใหญ่แล้ววกเข้าคลองด่านกลับไปทางวัดนางชี
ประเพณีชักพระเป็นงานใหญ่ของผู้คนทุกเพศทุกวัยในย่านนี้ แม้จะออกไปทำงานไกลเพียงใดเมื่อถึงวันชักพระจะต้องมาร่วมงาน บางคนก็เฝ้ารอดูอยู่หน้าบ้านและกราบไหว้บูชาด้วยความศรัทธา สำหรับในบริเวณวัดช่วงเพล ชาวบ้านจะนำอาหารคาวหวานและเครื่องดื่มมาร่วมงานเพื่อเลี้ยงทุกๆ คนที่มางานชักพระ
วัคซีนมือเท้าปาก โรงพยาบาลภัทร-ธนบุรี
ฤดูฝนนี้ปกป้องลูกน้อยจาก "โรคมือ เท้า ปาก" ด้วยวัคซีนกัน ราคา 2,950 บาท/เข็ม (ราคาไม่รวมค่าแพทย์และค่าบริการโรงพยาบาล 650 บาท/ครั้ง) สอบถามรายละเอียดเพิมเติม โรงพยาบาลภัทร-ธนบุรี โทร 02-9018400 ถึง 8 ต่อ 6128/6129 แผนกกุมารเวช
ไข้หวัดใหญ่ ป้องกันได้ด้วยวัคซีน รพ.รวมชัยประชารักษ์
ติดต่อสอบถามข้อมูลเพิ่มเติมโรงพยาบาลรวมชัยประชารักษ์ 061-4044479 Service center หรือ 027087501 ถึง 10 ต่อ 812 (ประชาสัมพันธ์)
ไข้เลือดออกป้องกันได้ รพ.สมิติเวชธนบุรี
ไข้เลือดออกป้องกันได้ วัคซีนไข้เลือดออก (Qdenga) ราคา 4,400 บาท (ปกติ 6,050 บาท) *ราคาดังกล่าว ไม่รวมค่าแพทย์ แต่รวมค่าบริการโรงพยาบาลแล้ว* วันนี้ถึง 31 ธันวาคม 2566
⭐ ป้องกันไข้เลือดออกทั้ง 4 สายพันธุ์ได้ 80.2%
⭐ ลดอัตราการนอนโรงพยาบาลได้ 90.4%
⭐ ฉีดได้ทั้งในคนที่เคยและไม่เคยติดเชื้อไข้เลือดออกมาก่อน
⭐ ฉีดทั้งหมด 2 เข็ม ห่างกัน 3 เดือน (เดือนที่ 0 และเดือนที่ 3)
วัคซีนไข้เลือดออกชนิดใหม่นี้ ... เหมาะกับใคร?
✅ ผู้ที่มีอายุตั้งแต่อายุ 4-60 ปี
✅ ไม่มีโรคประจำตัวที่เกิดจากภูมิต้านทานต่ำ
สอบถามเพิ่มเติม: ศูนย์สุขภาพ Wellness Center โทร. 02-408-0123
*เงื่อนไขเป็นไปตามที่โรงพยาบาลกำหนด
สำนักงานป้องกันควบคุมโรคที่ 10 อุบลราชธานี
ถนนพรหมเทพ อ.เมือง อุบลราชธานี
โทร. 045-255934
ผลงานวิจัย/ ผลงานนวัตกรรม/ ผลงานพัฒนาระบบงาน (Poster)
POI_001
NFC (N: New Innovation F: For our C: clients) MR.Konstantin Polovnikov
MR.Savanai Nilwan
(โรงพยาบาลกรุงเทพภูเก็ต)
POI_002
สมาร์ท คอนเซ้นส์_ความยินยอมที่พร้อมใช้ ค ณศิวัชญา สุขใส
ค ณพรชนก ทองตัน
ค ณวลันต์ บุญเจริญ
(โรงพยาบาลกรุงเทพภูเก็ต)
POI_003
Thepha Doctor เทคโนโลยีให้บริการสาธารณสุขเพื่อชุมชน
และการให้บริการที่เสมอภาคเท่าเทียม อำเภอเทพา
นายภูริพัฒน์ กะมิง
(โรงพยาบาลเทพา)
POI_004
รองเท้าสเก็ต คุณนงลักษณ์ พิทักษ์วงศ์
คุณรัฐวุฒิ สุดสงวน
คุณจารุวรรณ ศุขพิทัก
คุณอุมาพร ชูขจร
คุณวีณา วงศ์เอกอักษร
(โรงพยาบาลพญาไท 3)
POI_005
นวัตกรรมแบบบันทึกการประเมินการเจริญเติบโตและ
ภาวะโภชนาการเด็กแรกเกิดถึง 19 ปี
พว.คณัสนันท์ ผลตัน
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POI_006
แชทบอทบอกทาง คุณมณีรัตน์ กวานเหียน
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POI_007
การพัฒนาการให้คำแนะนำในการดูแลตนเองที่บ้าน ของผู้สูงอายุ:
คู มือ“สูงวัยใส่ใจสุขภาพ” ด้วยคิวอาร์โค้ด
คุณสุนทรา เชื้อบ้านเกาะ
(โรงพยาบาลวัดเกตุมดีศีรวราราม (สมุทรสาคร2))
POI_008
โครงการลดร้อยละของผู้ป่วย Colorectal cancer ที่ได้รับยา
Oxaliplatin ที่มีอาการปวด บริเวณ Exit site ระดับ
Moderate ขึ้นไป
นายเจตพงศ์ สดสุข ,
นางสาวสุภาภรณ์ วิสุวงษ์
(โรงพยาบาลจุฬาลงกรณ์สภากาชาดไทย)
POI_009
ลดการเกิดภาวะผมร วงระด ับ 4-5 ในผู้ป่วยมะเร็งเต้านม
ที่ได้รับยาเคมีบำบัดสูตรที่เกิดผมร่วงร่วมกับการใส่ Scalp
cooling
คุณสมฤดี คำกลาง
คุณชุติกาญจน์ ไกรสุวรรณสาร
(โรงพยาบาลจุฬาลงกรณ์สภากาชาดไทย)
กิจกรรมทำหมันสุนัขแมว ฉีดวัคซีนป้องกันโรคในสุนัขแมว ทั่วประเทศ
รพร.สระแก้ว และ คลินิกหมอครอบครัวสระแก้ว (ทันตกรรม) ให้บริการทำฟันฟรี 21 ตุลาคม 2566
21 ตุลาคม 2566 วันทันตสาธารณสุข ร้อยดวงใจ ถวายให้สมเด็จย่า กลุ่มงานทันตกรรม รพร.สระแก้ว และ คลินิกหมอครอบครัวสระแก้ว (ทันตกรรม) ให้บริการทำฟันฟรี อุดฟัน ถอนฟัน ขูดหินปูน
คลิปแนะนำ - ต้องทำอย่างไรเมื่อได้ยินเสียงจรวดโจมตี
สถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ แนะนำ ชมคลิป Youtube ข้อควรรู้สำหรับคนไทยในอิสราเอล "
ต้องทำอย่างไรเมื่อได้ยินเสียงจรวดโจมตี" เป็นแนวทางปฏิบัติตามมาตรการความปลอดภัยของอิสราเอลอย่างเคร่งครัด เน้นย้ำว่าห้ามออกมาถ่ายรูป และเข้าบริเวณหลบภัยทันที
ด้วยความห่วงใย จากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ
คลินิกสูติ-นรีเวช
คลินิกสูติ-นรีเวช
- คลินิกสูติกรรม ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกพิเศษเฉพาะโรค 13.00 - 16.00 น. (บ่าย)
- คลินิกนรีเวชกรรม ในเวลาราชการ 08.00 น. - 12.00 น. (เช้า) คลินิกพิเศษเฉพาะโรค 13.00 - 16.00 น. (บ่าย)
อุทยานแห่งชาติลำน้ำกก เปิดอุทยาน 1 ตุลาคม 2566 เป็นต้นไป
[udpate]
อุทยานแห่งชาติลำน้ำกก ประกาศเปิดการท่องเที่ยวอุทยาน ตั้งแต่ 1 ตุลาคม 2566 เป็นต้นไป
สถานที่ท่องเที่ยวเด่นใน อุทยานแห่งชาติลำน้ำกก ได้แก่ บ่อน้ำร้อนห้วยหมากเลี่ยม น้ำตกขุนกรณ์ น้ำตกห้วยก้างปลา น้ำตกโป่งพระบาท ภายในอุทยานมีร้านสวัสดิการ (กาแฟ น้ำดื่ม ขนม ) เปิดบริการทุกวันเวลา 08.00 - 17.00 น.
การเดินทาง จากจังหวัดเชียงรายไปตามถนนเชียงราย - สี่แยกบ้านเด่นห้า ผ่านหน้าค่ายเม็งรายมหาราชเข้าสู่ตำบลดอยฮาง จนถึงบ้านผาเสริฐ ระยะทางประมาณ 19 กิโลเมตร แล้วเดินทางต่อไปยังที่ทำการอุทยานแห่งชาติบริเวณห้วยหมากเลี่ยมอีก 1.5 กิโลเมตร หรือจะล่องมาตามลำน้ำกกด้วยเรือหางยาวหรือแพจากสะพานลำน้ำกกในตัวเมืองเชียงราย ถึงบริเวณห้วยหมากเลี่ยม ประมาณ 20 กิโลเมตร
อุทยานแห่งชาติลำน้ำกก
ต.ดอยฮาง อ.เมืองเชียงราย จ.เชียงราย 57000
โทรศัพท์ : 083 764 6475
++ สรุปรายปี ++
งานประเพณีลากพระ และตักบาตรเทโว สงขลา 26 - 31 ตุลาคม 2566
ขอเชิญเที่ยวงานประเพณีลากพระ และตักบาตรเทโว ประจำปี 2566 ตั้งแต่วันที่ 26 - 31 ตุลาคม 2566 เที่ยวชมฟรีตลอดงาน ณ บริเวณสระบัว สงขลา อำเภอเมือง จังหวัดสงขลา
วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี
อาจารย์ ดร.ปัญจภรณ์ อู่รัตนมณี ผู้ช่วยคณบดีฝ่ายการศึกษาและ อาจารย์กฤษดา ทองทับ ผู้ช่วยคณบดีฝ่ายกิจการนักศึกษา วิทยาลัยพยาบาลศาสตร์อัครราชกุมารี
“หลักสูตรพยาบาลศาสตรบัณฑิต (นานาชาติ) เป็นหลักสูตรแรกของวิทยาลัยพยาบาลศาสตร์อัครราชกุมารี รับนักศึกษารุ่นแรกเมื่อปีการศึกษา 2566 เพื่อเป็นการยกระดับภาพลักษณ์ของพยาบาลสู่ระดับสากล โดยบัณฑิตสาขาพยาบาลศาสตร์สามารถต่อยอดในวิชาชีพที่เกี่ยวข้องกับสุขภาพได้ ทั้งการเรียนต่อ หรือการทำงานต่างประเทศในอนาคต การเรียนการสอนภาคทฤษฎีมีการเรียนวิชาพื้นฐาน วิชาเฉพาะสาขาที่เป็นวิชาชีพ การศึกษาภาคปฏิบัติครอบคลุมในห้องปฏิบัติการเสมือนจริง และในหอผู้ป่วยของโรงพยาบาล รวมทั้งการปฏิบัติในชุมชนอีกด้วย คณาจารย์ผู้สอนเป็นผู้เชี่ยวชาญเฉพาะสาขา มีประสบการณ์และผลงานทางวิชาการ ทั้งงานวิจัยระดับชาติและนานาชาติ”
++ กิจกรรมลอยกระทงในต่างประเทศ ++
หลังหน้าฝนที่เพิ่งผ่านไป สวนเขียวชะอุ่ม ต้นไม้โตใหญ่ใบหนา กิ่งก้านแผ่ขยาย หลายต้นโตสูงรวดเร็ว สวยงามและดูสุขภาพดีมาก น่าจะเพราะดูแลกันอย่างดี ใครไปเดิมชมช่วงนี้ก็จะอิ่มตาสดชื่น


ตอกย้ำ!! ความเป็นหนึ่งเดียวของห้างสรรพสินค้าที่นำเข้าแบรนด์แฟชั่นดังจากญี่ปุ่น มาให้ช้อปกันถึงเมืองไทยด้วยการอิมพอร์ตคอลเลคชั่นเด่นจากแบรนด์สุดฮอต มอบเป็นของขวัญสุดพิเศษในวาระฉลองครบรอบ 5 ปี ในงาน Japan Urbanist Fashion POP UP Store (Exclusively at SIAM Takashimaya) อาทิ แบรนด์ Double Standard (ดับเบิล สแตนดาร์ด) นำเสนอคอนเซ็ปต์การออกแบบผสมผสานสไตล์ที่หลากหลายแบบโมเดิร์นและคลาสสิกเข้าด้วยกัน Tranoi (ทรานอย) แบรนด์เสื้อผ้าจากประเทศญี่ปุ่น มีเอกลักษณ์ของคอนเซ็ปต์คือการค้นพบตัวเองในทุกวันด้วยเสื้อผ้ารูปแบบใหม่ที่ไม่เหมือนใคร, MAISON MAVERICK PRESENTS (เมซง มาเวอริค พรีเซ้นต์) มีความหมายว่า "หมาป่า" คอนเซ็ปต์ของแบรนด์มาในธีม Free and Iconic และ Tradition meets Progressive ผ่านการดีไซน์รองเท้า, Ball & Chain (บอลแอนด์เชน) กระเป๋าสุดฮิตในญี่ปุ่น ในคอนเซ็ปต์กระเป๋าช้อปปิ้งรักษ์โลก ที่จัดจ้านด้วยดีไซน์ และการ Collaboration กับศิลปินชั้นนำในญี่ปุ่นมากมาย และเป็นครั้งแรกในไทยกับแฟชั่น "กระเป๋าช้อปปิ้ง" Eco-Friendly ส่งตรงจากญี่ปุ่น พิเศษ พร้อมรับกระเป๋า Eco-Bag Thailand Limited ที่ดีไซน์พิเศษเฉพาะ สยาม ทาคาชิมายะ โดย 4 ดีไซน์เนอร์ เฉพาะในงานนี้ เมื่อช้อปครบตามเงื่อนไข
+++ รายละเอียดแต่ละแห่ง +++
โปรแกรมตรวจสุขภาพสำหรับผุ้ทำงานในที่อับอากาศ
โปรแกรมตรวจสุขภาพสำหรับผุ้ทำงานในที่อับอากาศ สอบถามเพิ่มเติม คลินิกส่งเสริมสุขภาพและอาชีวเวชกรรม โทร. 02-2008000
แผนความมั่นคงปลอดภัยด้านการเงิน Money Safety MOPH+ โดย ดร.นพ.พงศธร พอกเพิมดี
แนวทาง 4 มาตรการ
- ทบทวนแต่งตั้งคณะกรรมการแผนงานความมั่นคงปลอดภัยด้านการเงิน
- จัดตั้งคลินิกความมั่นคงปลอดภัยด้านการเงิน มีบทบาทหน้าที่ ช่วยตรวจเช็คระดับสุขภาพทางการเงิน ให้ความรู้ด้านการเงิน ให้แนวทางการจัดการปัญหาหนี้สิน เน้นไปยังกลุ่มที่เป็นหนี้นอกระบบและหนี้พนันออนไลน์ หรือการใช้เงินที่ไม่สมเหตุสมผล ที่เป็นต้นตอของปัญหา
- จัดกิจกรรมมอบสวัสดิการสนับสนุนทุนการศึกษา และทุนอื่นๆ
- ขอความร่วมมือและตอบสนองต่อนโยบายสธ. ให้ความร่วมมือและพิจารณาใช้ผลิตภัณฑ์การเงินของสถาบันการเงินที่ทำความร่วมมือกับกระทรวงสาธารณสุขเป็นอันดับแรก (ธนาคารออมสิน)
30 พ.ย. 66 เอกอัครราชทูต เยี่ยมคนไทย ที่ Shamir Medical Center
30 พฤศจิกายน 2566 นางสาวพรรณนภา จันทรารมย์ เอกอัครราชทูต และนายจุลวัจน์ นรินทรางกูร ณ อยุธยา อัครราชทูต ได้เดินทางไปเยี่ยมตัวประกันชาวไทย 4 คนที่เพิ่งได้รับการปล่อยตัวเมื่อกลางดึกของคืนวาน ที่ Shamir Medical Center (Assaf Harofeh) โอกาสนี้ เอกอัครราชทูตฯ ได้ปลอบขวัญให้กำลังใจ ติดตามการดูแลรักษาพยาบาล รวมทั้งติดตามสิทธิประโยชน์และการเยียวยาแก่คนไทยทั้ง 4 ด้วย
หลักสูตร ทักษะภาษาอังกฤษสำหรับงานบริการเพื่อการเป็นเจ้าบ้านที่ดี (English Language Skills for Exemplary Hospitality)
ทักษะภาษาอังกฤษ ถือเป็นทักษะที่มีความสำคัญต่ออุตสาหกรรมการท่องเที่ยวเป็นอย่างมาก และเป็นทักษะที่ต้องได้รับการฝึกฝนอย่างต่อเนื่อง ในหลักสูตรนี้นอกจากจะให้ความรู้และความเข้าใจในหลักการของการสื่อสารแล้วยังให้ความสำคัญกับเทคนิคการสร้างความประทับใจในด้านต่าง ๆ เช่น การแสดงการต้อนรับด้วยการเป็นเจ้าบ้านที่ดี การเรียนรู้วัฒนธรรม การเลือกใช้คำให้เหมาะสม ผู้เรียนจะได้เรียนรู้บทสนทนาหรือวลีที่จําเป็นสำหรับธุรกิจการท่องเที่ยว และเทคนิคการนำไปใช้ รวมไปถึงการใช้เครื่องมือทางเทคโนโลยีที่สามารถช่วยเหลือในการสื่อสารข้ามภาษาได้อย่างหลากหลาย ซึ่งหลักสูตรนี้ออกแบบโดยคำนึงถึงเนื้อหาที่เข้าใจง่ายและนำไปใช้งานได้ เพื่อให้ผู้เรียนสามารถพัฒนาทักษะด้านภาษาและการสื่อสารของผู้เรียนได้อย่างมีประสิทธิผล
ลิงค์หลักสูตร++ จังหวัดอื่นๆ ++
10. นักท่องเที่ยวปลอดภัย One Region One Sky Doctor
จัดตั้งพื้นที่ท่องเที่ยวและนักท่องเที่ยวมีความปลอดภัยทั้งจากอุบัติเหตุและโรคภัยต่างๆ นำร่องที่จังหวัดภูเก็ต "Safety Phuket Island Sandbox" ดำเนินการ 7 เรื่อง คือ
1.ประกาศเป้าหมาย จ.ภูเก็ต ปลอดโรคพิษสุนัขบ้า
2.ฉีดวัคซีนไข้หวัดใหญ่ในผู้ให้บริการท่องเที่ยว
3.จัดตั้งทีม Sky Doctor ระบบส่งต่อผู้ป่วยทางอากาศ ครบทั้ง 13 เขตสุขภาพตามเป้าหมาย
4.พัฒนาอาสาฉุกเฉินทางทะเล/อาสาฉุกเฉินชุมชน
5.มีถนนอาหารปลอดภัย (Street Food Good Health)
6.การคัดกรองผู้เดินทางระทว่างประเทศ
7.Digital Disease Surveillance
โฆษณา สปอนเซอร์ การตลาด
HealthServ.net มีส่วนที่เป็นการบริการโฆษณา สปอนเซอร์ กิจกรรมการตลาด ด้วยเช่นกัน
ซึ่งมีรูปแบบและค่าบริการ ตามที่กำหนดไว้ตามลิงค์นี้ (พร้อมข้อมูลด้านสถิติของเว็บไซต์)
ข้อมูลเพิ่มเติม/รายละเอียด
ติดต่อ คุณธนพรรณ ทรัพย์มีชูสกุล 081-6969454
เกี่ยวกับ HealthServ.net
สัปดาห์ที่ 52 (25-31 ธันวาคม 2566)
ต่างชาติ 789,643 คน
เฉลี่ยวันละ 112,807 คน
นักท่องเที่ยวต่างชาติสะสม 28,042,131 คน
5 ประเทศ แรก
มาเลเซีย 123,540 คน
จีน 101,003 คน
รัสเซีย 52,893 คน
เกาหลีใต้ 41,830 คน
อินเดีย 39,630 คน
*****
สัปดาห์ที่ 51 (18-24 ธันวาคม 2566)
ต่างชาติ 796,808 คน
เฉลี่ยวันละ 113,830 คน
นักท่องเที่ยวต่างชาติสะสม 27,252,488 คน
5 ประเทศ แรก
มาเลเซีย 149,409 คน
จีน 96,662 คน
รัสเซีย 47,071 คน
เกาหลีใต้ 46,060 คน
อินเดีย 41,679 คน
*****
สัปดาห์ที่ 50 (11-17 ธันวาคม 2566)
ต่างชาติ 676,505 คน
เฉลี่ยวันละ 96,644 คน
นักท่องเที่ยวต่างชาติสะสม 26,455,680 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1,129,080 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 104,838 คน
จีน 88,022 คน
รัสเซีย 43,738 คน
เกาหลีใต้ 42,948 คน
อินเดีย 36,968 คน
*****
สัปดาห์ที่ 49 (4-10 ธันวาคม 2566)
ต่างชาติ 655,653 คน
เฉลี่ยวันละ 93,665 คน
นักท่องเที่ยวต่างชาติสะสม 25,4736,865 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1,098,082 ล้านบาท
5 ประเทศ แรก
จีน 100,704 คน
มาเลเซีย 94,513 คน
รัสเซีย 42,166 คน
เกาหลีใต้ 40,572 คน
อินเดีย 39,053 คน
*****
ประเทศฟิลิปปินส์
PHILIPPINES
1. Lyceum-Northwestern University, Dr. Francisco Q. Duque Medical Foundation: Philippines
หลักสูตร 4 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนตลอดหลักสูตร ณ
ประเทศฟิลิปปินส์ และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาใน
หลักสูตรและอยู่ในประเทศฟิลิปปินส์ ดังนี้
โรงพยาบาลหลัก R1MC Regional 1 Medical Center
โรงพยาบาลสมทบ 2 แห่ง คือ
1. SGHTC: Specialist Group Hospital & Trauma Center
2.TMCP: The Medical City Pangasinan
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 16 พ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 15 พ.ค. 67
2. Our Lady of Fatima University, College of Medicine, Valenzuela City, Philippines
หลักสูตร 4 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการสอนตลอดหลักสูตร ณ
ประเทศฟิลิปปินส์ และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาใน
หลักสูตรและอยู่ในประเทศฟิลิปปินส์ดังนี้
โรงพยาบาลหลัก Quezon City general hospital
โรงพยาบาลสมทบ 2 แห่ง คือ
1. San Lazaro Hospital
2. Fatima University Medical Center
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 12 ธ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 11 ธ.ค. 67
3. Manila Central University Filemon D. Tanchoco Medical Foundation, College of Medicine, Philippines
หลักสูตร 4 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการ
สอนตลอดหลักสูตร ณ ประเทศฟิลิปปินส์ และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอน
ระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ในประเทศฟิลิปปินส์ ดังนี้
1. MCU Dr. Filemon D. Tanchoco, Sr. Medical Foundation
2. Veterans Memorial Medical Center (VMMC)
ว/ด/ป ที่ รับรอง 8 มิ.ย.66
ว/ด/ป ครบอายุ การรับรอง 7 มิ.ย. 71
ศูนย์เทคโนโลยีสุขภาพดี โรงพยาบาลกลาง อาคารทัช บิลดิ้ง ชั้น 1 เขตห้วยขวาง
ศูนย์เทคโนโลยีสุขภาพดี โรงพยาบาลกลาง อาคารทัช บิลดิ้ง ชั้น 1 เขตห้วยขวาง
เปิดบริการในวันจันทร์- ศุกร์ เวลา 8.00 -16.00 น. ให้บริการ
✅ ตรวจคัดกรองสุขภาพ
✅ ปรึกษาแพทย์ทางไกล (Telemedicine)
✅ ตรวจคัดกรองมะเร็งปากมดลูก
✅ เจาะเลือด
✅ รับยา
✅ ฉีดวัคซีนไข้หวัดใหญ่
✅ วัคซีนป้องกันมะเร็งปากมดลูก
ศูนย์เทคโนโลยีสุขภาพดี (Health Tech) เป็นคลินิกรูปแบบใหม่ ที่ให้บริการตรวจคัดกรองสุขภาพพื้นฐานและการตรวจเชิงรักษาแบบปฐมภูมิด้วยระบบดิจิทัล เพื่อให้ประชาชนรู้เท่าทันสุขภาพก่อนการเจ็บป่วย พร้อมยกระดับคุณภาพชีวิตประชาชนในการเข้าถึงบริการด้านสาธารณสุขให้ง่ายขึ้น รวดเร็ว สะดวกสบายใกล้บ้าน ทราบผลตรวจได้อย่างรวดเร็ว เข้าใจง่าย ผ่าน Moblie Application อีกทั้งยังเป็นการลดภาระของบุคลากรทางการแพทย์ ลดความหนาแน่นของผู้ใช้บริการในโรงพยาบาล และช่วยส่งเสริมภาพลักษณ์ให้โรงพยาบาลสู่การเป็น Digital Healthcare Hospital ในโรงพยาบาลสังกัดกรุงเทพมหานคร
ภาพข่าวจากซ้าย
- ทันตแพทย์หญิงน้ำเพชร ตั้งยิ่งยง ผู้อำนวยการเขตสำนักงานหลักประกันสุขภาพแห่งชาติ เขต 13 กรุงเทพมหานคร
- ผศ.พญ. สุวนิตย์ ธีระศักดิ์วิชยา ผู้รั้งตำแหน่งนายกสมาคมมะเร็งนรีเวชไทย
- พญ.จอมธนา ศิริไพบูลย์ ผู้อำนวยการศูนย์มะเร็งวิทยา โรงพยาบาลจุฬาภรณ์
- รศ.นพ.สุรศักดิ์ ลีลาอุดมลิปิ ผู้อำนวยการโรงพยาบาลจุฬาภรณ์
- ผศ.นพ.ณัฐวุฒิ กันตถาวร รักษาการผู้ช่วยคณบดีฝ่ายบริการวิชาการและสังคม วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ และหัวหน้าศูนย์สุขภาพสตรีโรงพยาบาลจุฬาภรณ์
- นพ.ศุภกร พิทักษ์การกุล รองผู้อำนวยการด้านการแพทย์ สถาบันมะเร็งแห่งชาติ
- นพ.วุฒิชัย หมู่สกุลชัย ผู้อำนวยการศูนย์บริการสาธารณสุข 53 ทุ่งสองห้อง
หากรัฐบาลต้องการให้ประชาชนไปใช้บริการสะดวกได้ทุกที่อย่างเป็นจริงและยั่งยืนก็ควรที่จะลงทุนพัฒนาหน่วยบริการปฐมภูมิอย่างจริงจัง - แพทย์หญิงสุพัตรา ศรีวณิชชากร
แพทย์หญิงสุพัตรา ศรีวณิชชากร นายกสมาคมแพทย์เวชปฏิบัติทั่วไป/เวชศาสตร์ครอบครัวแห่งประเทศไทย และนายกสมาคมส่วนราชวิทยาลัย ตำแหน่งประธานราชวิทยาลัยแพทย์เวชศาสตร์ครอบครัว ให้ความเห็นต่อนโยบายนี้ ว่า
"ความพยายามของรัฐบาล รวมถึงกระทรวงสาธารณสุขที่ต้องการให้บัตรประชาชนใบเดียวไปได้ทุกที่นั้นถือว่าเป็นเจตนาที่ดีที่ต้องการให้ประชาชนไปใช้บริการได้สะดวก
แต่วิธีการที่จะตอบสนองต่อเรื่องนี้ได้ดีไม่น่าจะอยู่เพียงการจัดทำระบบฐานข้อมูลให้เชื่อมต่อกันได้เท่านั้น เพราะหากคุณภาพมาตรฐานของหน่วยบริการสุขภาพไม่ได้รับการพัฒนาอย่างเท่าเทียมทั่วถึง ประชาชนก็ต้องวิ่งไปรับบริการในสถานที่ที่คิดว่าบริการดีก็จะทำให้หน่วยบริการสุขภาพแห่งนั้นแออัด เช่น บริการในโรงพยาบาลใหญ่ บริการในกทม. และตัวเมืองต่างๆ ในขณะที่หน่วยบริการขนาดเล็กๆใกล้บ้าน มีคนมาใช้บริการไม่มากนัก
ฉะนั้นหากรัฐบาลต้องการให้ประชาชนไปใช้บริการสะดวกได้ทุกที่อย่างเป็นจริงและยั่งยืนก็ควรที่จะลงทุนพัฒนาหน่วยบริการปฐมภูมิอย่างจริงจังทั่วถึงและต่อเนื่องมากขึ้นกว่าเดิม (ได้แก่ โรงพยาบาลส่งเสริมสุขภาพตำบล รพ.สต. ศูนย์บริการสุขภาพสาธารณสุข ศบส. โรงพยาบาลชุมชนขนาดเล็ก) ประชาชนอยากรับบริการใกล้บ้านที่สะดวกไม่ต้องเดินทางไกลหากหน่วยบริการมีคุณภาพเท่าเทียมกัน [
hfocus]
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค เดือนมกราคม 2567
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนมกราคม 2567 (29/1/2567)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมกราคม 2567 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะในภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคใต้ จากปัจจัยสนับสนุนในภาคบริการและการลงทุนเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับความผันผวนของเศรษฐกิจโลก รวมถึงสภาพอากาศและปรากฏการณ์เอลนีโญที่อาจส่งผลให้เกิดภัยแล้งและจะกระทบต่อภาคเกษตรกรรม”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลังเปิดเผยดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมกราคม 2567 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทยเพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคพบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมกราคม 2567 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะในภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคใต้ จากปัจจัยสนับสนุนในภาคบริการและการลงทุนเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับความผันผวนของเศรษฐกิจโลก รวมถึงสภาพอากาศและปรากฏการณ์เอลนีโญที่อาจส่งผลให้เกิดภัยแล้งและจะกระทบต่อภาคเกษตรกรรม" โดยมีรายละเอียดดังต่อไปนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 81.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่มีแนวโน้มดีขึ้น โดยเฉพาะความเชื่อมั่นในภาคบริการ อันเป็นผลจากนโยบายส่งเสริมการท่องเที่ยวและกระตุ้นการใช้จ่ายอย่างต่อเนื่องของภาครัฐและเอกชน อาทิ มาตรการยกเว้นการตรวจลงตรา (Visa Exemption) โดยเฉพาะในช่วงฤดูการท่องเที่ยว และความเชื่อมั่นในภาคการลงทุน เนื่องจากผู้บริโภคเริ่มกลับมาดำเนินธุรกรรมทางเศรษฐกิจได้ตามปกติ ทั้งนี้ หากพิจารณาเฉพาะดัชนีความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าอยู่ที่ระดับ 83.6 โดยได้รับอานิสงส์จากการพัฒนาโครงสร้างพื้นฐานด้านคมนาคมและโลจิสติกส์ทางบกเพื่อสร้างความเชื่อมโยงระหว่างจังหวัดทั้งในพื้นที่อุตสาหกรรมและแหล่งท่องเที่ยวเพื่อเสริมสร้างขีดความสามารถด้านการแข่งขันของจังหวัด
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 74.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการ จากการจัดกิจกรรมส่งเสริมการท่องเที่ยวในพื้นที่อย่างต่อเนื่อง และนโยบายกระตุ้นการบริโภคจากภาครัฐ รวมถึงมีกำลังซื้อเพิ่มขึ้นจากชาวกัมพูชาที่เดินทางมาใช้บริการทางการแพทย์และซื้อสินค้าเพิ่มขึ้น และความเชื่อมั่นในภาคการลงทุน ตามแนวโน้มการฟื้นตัวของเศรษฐกิจภายในประเทศ และอุปสงค์ในตลาดที่มีอยู่อย่างต่อเนื่อง ซึ่งจะช่วยสนับสนุนความเชื่อมั่นของนักลงทุนที่มีต่อระบบเศรฐกิจไทย
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 73.7 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีปัจจัยสำคัญมาจากความร่วมมือของทุกภาคส่วนในการจัดกิจกรรมกระตุ้นการท่องเที่ยว ประกอบกับความต้องการเดินทางของนักท่องเที่ยวที่สะสมมานานกว่า 2-3 ปี โดยเฉพาะนักท่องเที่ยวชาวจีนและนักท่องเที่ยวต่างชาติระยะใกล้ อาทิ มาเลเซีย อินเดีย และสิงคโปร์ ที่ยังคงเป็นนักท่องเที่ยวกลุ่มสำคัญที่จะเดินทางเข้ามาท่องเที่ยวในไทยมากขึ้น และความเชื่อมั่นในภาคการลงทุน อันเป็นผลมาจากมาตรการเพื่อฟื้นฟูและกระตุ้นเศรษฐกิจของภาครัฐ รวมถึงมาตรการส่งเสริมการลงทุน ให้สิทธิประโยชน์ และมาตรการช่วยเหลือผู้ประกอบการผ่านสถาบันการเงินต่าง ๆ
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 72.3 สะท้อนถึงความเชื่อมั่นในภาคอุตสาหกรรมและภาคบริการที่ปรับตัวดีขึ้น อันเป็นผลจากมาตรการกระตุ้นการอุปโภคบริโภคของภาครัฐ ที่จะช่วยสนับสนุนภาพรวมเศรษฐกิจไทยให้ปรับตัวดีขึ้น
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 71.7 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ อันเป็นผลมาจากมาตรการกระตุ้นเศรษฐกิจของภาครัฐ และการจัดกิจกรรมส่งเสริมการท่องเที่ยวในหลายพื้นที่ โดยเฉพาะในช่วงเทศกาลสงกรานต์ที่ประชาชนจะเดินทางกลับภูมิลำเนา ซึ่งจะช่วยสนับสนุนให้มีการใช้จ่ายเพิ่มมากขึ้น และความเชื่อมั่นในภาคการลงทุนและภาคอุตสาหกรรม เนื่องจากผู้ประกอบการมีแนวโน้มจะขยายการลงทุนเพื่อเตรียมต้อนรับนักท่องเที่ยวช่วงเทศกาลสงกรานต์ ประกอบกับแนวโน้มการขยายตัวของการผลิตภาคอุตสาหกรรมซึ่งสะท้อนจากการใช้ไฟฟ้าภาคอุตสาหกรรม จำนวนทุนจดทะเบียนของอุตสาหกรรมที่เพิ่มขึ้นเป็นสำคัญ อย่างไรก็ตาม ผู้ประกอบการบางส่วนยังมีความกังวลต่อปรากฏการณ์เอลนีโญที่อาจส่งผลให้เกิดภาวะแห้งแล้งและกระทบต่อภาคเกษตรกรรม รวมถึงความผันผวนของเศรษฐกิจและการเงินโลก และความขัดแย้งทางภูมิศาสตร์โลก ซึ่งอาจเป็นข้อจำกัดต่อการส่งออกและการเติบโตของเศรษฐกิจไทย
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 71.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยเฉพาะในภาคอุตสาหกรรม จากแนวโน้มเศรษฐกิจทีคาดว่าจะปรับตัวดีขึ้น และความเชื่อมั่น ในภาคบริการ อันเป็นผลจากนโยบายสนับสนุนการท่องเที่ยวและกระตุ้นเศรษฐกิจของภาครัฐ อาทิ มาตรการ Visa Exemption และ Easy E-Receipt อย่างไรก็ตาม ผู้ประกอบการบางส่วนมีความกังวลต่อราคาสินค้าเกษตรที่มีแนวโน้มปรับตัวสูงขึ้น
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 69.2 สะท้อนความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการและการลงทุน อย่างไรก็ตาม ผู้ประกอบการบางส่วนยังมีความกังวลต่อการเปลี่ยนแปลงสภาพภูมิอากาศซึ่งอาจส่งผลกระทบต่อปริมาณผลผลิต
กองนโยบายเศรษฐกิจมหภาค สำนักงานเศรษฐกิจการคลัง โทร. 0-2273-9020 ต่อ 3254
การทดลองใช้งานพื้นที่ศาลาว่าการกรุงเทพมหานคร (เสาชิงช้า) เป็นพื้นที่สาธารณะ
การทดลองใช้งานพื้นที่ศาลาว่าการกรุงเทพมหานคร (เสาชิงช้า) เป็นพื้นที่สาธารณะ จากนโยบายการย้ายสำนักงานศาลาว่าการกรุงเทพมหานคร จากเสาชิงช้าไปยังที่ทำการดินแดง ศูนย์มิตรเมือง (Urban Ally) จึงทดลองทำพื้นที่สาธารณะให้มีการใช้งานที่หลากหลาย โดยเปลี่ยนจากพื้นที่ ‘ราชการ’ เป็นพื้นที่ ‘พลเมือง’ ในเวลานอกราชการ โดยติดตั้ง People Pavilion - The Elevated Ground ของกลุ่ม SP/N x Nerd studio ไว้ในพื้นที่ส่วนกลางของศาลาว่าการฯ เพื่อเป็นพื้นที่นั่งเล่นพักผ่อนและทำกิจกรรมสันทนาการ
สปสช.เขต 10 อุบลราชธานี
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 10 อุบลราชธานี
- 145 อาคารที่ทำการไปรษณีย์(ชั้น 3) ถนนศรีณรงค์ ตำบลในเมือง อำเภอเมือง จังหวัดอุบลราชธานี รหัสไปรษณีย์ 34000
- โทรศัพท์ 045-240-591
- โทรสาร 045-255-393
- แผนที่ google map
- website
- facebook
++ 2566 ++
UMSC โรงพยาบาลรัตนประชารักษ์ (โรงพยาบาลคลองสามวา)
ศูนย์สนับสนุนบริการสุขภาพเวชศาสตร์เขตเมือง เพื่ออำนวยความสะดวกให้กับประชาชนมายิ่งขึ้นทั้งช่องทาง ออนไลน์ และ ออฟไลน์ โดยให้บริการดังนี้
- สอบถามปัญหาสุขภาพ อาการเจ็บป่วยฉุกเฉิน
- การให้บริการในโรงพยาบาล
- การพบแพทย์ออนไลน์(Telemedicine)
- หมอเยี่ยมบ้านหลังการรักษา
- ประสานงานทางโทรศัพท์
เปิดให้บริการ จันทร์ - ศุกร์ 08.00 - 20.00 น.
เสาร์ อาทิตย์ และ วันหยุดนักขัตฤกษ์ 08.00 - 12.00 น.
ช่องทางการติดต่อ UMSC
โทร 09-0894-1113 , 02-171-5900 ต่อ 15023
คำแนะนำในการดูแลตนเอง ป้องกันภัยจากโรคลมร้อน
1. สวมใส่เสื้อผ้าสีอ่อน ระบายความร้อนได้ดี
2. ควรอยู่ในที่มีอากาศถ่ายเทสะดวก
3. ลดหรือเลี่ยงทํากิจกรรมที่ต้องออกแรง กลางแจ้งนาน ๆ
4. สวมแว่นกันแดด กางร่ม สวมหมวกปีกกว้าง
5. ควรดื่มนํ้ า 2–3 ลิตรต่อวัน เพื่อชดเชย การเสียนํ้ าในร่างกายจากเหงื่อออก
6. หลีกเลี่ยงการดื่มเครื่องดื่มแอลกอฮอล์ทุกชนิด
7. ผู้ที่ออกกําลังกาย ควรเลือกในช่วงเช้า/ ช่วงเย็น เนื่องจากเป็นช่วงที่ อากาศไม่ร้อนมากและเป็นเวลาที่เหมาะสม
เขต 10
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีบ้านนาโสก จ.มุกดาหาร
- สถานีอนามัยบ้านห้วยตาเปอะเฉลิมพระเกียรติ จ.มุกดาหาร
- สอน.บ้านแดง จ.ยโสธร
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีภูมิซรอล จ.ศรีสะเกษ
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษานวมินทราชินีปลาค้าว จ.อำนาจเจริญ
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินีไร่ใต้ จ.อุบลราชธานี
- สถานีอนามัยเฉลิมพระเกียรติในสมเด็จพระนางเจ้าสิริกิติ์พระบรมราชินีนาถ บ้านยางน้อย จ.อุบลราชธานี
สรุป
คลินิกทันตกรรม ลาดพร้าว ในเรื่องของการทำฟันคุณสามารถไว้วางใจได้ ในการรักษาและดูแลฟันอย่างครบวงจร ด้วยทีมแพทย์และเจ้าหน้าที่ที่มีความเชี่ยวชาญและเครื่องมือทันสมัย เพื่อให้คุณได้รับการดูแลที่ดีที่สุด เพื่อฟันแข็งแรงและสุขภาพดีตลอดไป ซึ่งจุดเด่นในการรักษา เครื่องมือ ของแต่ละคลินิกก็จะแตกต่างกันไป
ดังนั้นการเลือกคลินิกทันตกรรมที่มี สิทธิ์รองรับ และมีความน่าเชื่อถือ เป็นต้น หากคุณกำลังมองหาสถานที่ในการดูแลสุขภาพฟัน คลินิกทันตกรรม ลาดพร้าว คือที่ที่เหมาะสมที่สุด
คลินิคเฉพาะทางศัลยกรรมนอกเวลา โรงพยาบาลหาดใหญ่ โดย หมอเจมส์ (นพ.ผดุงเกียรติ ทิพย์มณี)
คลินิคเฉพาะทางศัลยกรรมนอกเวลา โรงพยาบาลหาดใหญ่
โดย หมอเจมส์ (นพ.ผดุงเกียรติ ทิพย์มณี)
หมอเฉพาะทางศัลยกรรมลำไส้ใหญ่และทวารหนัก
อยากตรวจรักษา แต่ไม่อยากรอคิวนาน…
✅ ริดสีดวงทวาร
✅ ฝีคัณฑะสูตร
✅ ถ่ายเป็นเลือด
✅ มะเร็งลำไส้
✅ นิ่วในถุงน้ำดี
✅ ผ่าตัดผ่านกล้อง
ค่าตรวจ 400 บาท เบิกไม่ได้ทุกสิทธิ
ค่ายา ค่าเจาะเลือด เบิกตามสิทธิเดิมของคนไข้
หมอเจมส์ออกตรวจทุกวันจันทร์สัปดาห์ที่ 2 และ 4 ของเดือนเวลา 17.00-20.00 น. (สอบถามวันออกตรวจเพื่อความแน่นอนอีกครั้งได้ครับ)
สอบถามข้อมูลและนัดหมาย
???? 062-803-9883
???? 074-273-253
หน่วยศัลยกรรมกระดูก คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกศัลยกรรมกระดูก
**เปิดรับผู้ป่วยที่ไม่มีนัดหมายจำกัด**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์-ศุกร์ เวลา 16.00-19.00 น.
วันเสาร์-อาทิตย์ เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396340 02-8396341 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ตรวจรักษา วินิจฉัย และให้คำแนะนำแก่ผู้รับบริการที่มีปัญหา
ด้านศัลยกรรมกระดูกข้อสะโพกและข้อเข่า (HIP & KNEE)
คลินิกในเวลาราชการ :
วันอังคาร เวลา 13.00-16.00 น
วันพุธ เวลา 09.00-12.00 น
คลินิกพิเศษ (พรีเมียม) :
วันพฤหัสบดี เวลา 17.00-19.00 น
วันเสาร์ เวลา 09.00-11.00 น
** รับเฉพาะผู้ป่วยนัดหรือผู้ป่วยส่งปรึกษาเท่านั้น**
ด้านศัลยกรรมกระดูกเวชศาสตร์การกีฬา (SPORT)
คลินิกในเวลาราชการ :
วันอังคาร เวลา 13.00-16.00 น
วันพุธ เวลา 09.00-12.00 น
วันพฤหัสบดี เวลา 09.00-12.00 น
คลินิกพิเศษ (พรีเมียม) :
วัน จันทร์ เวลา 17.00-19.00 น
วันเสาร์ เวลา 09.00-12.00 น.
ด้านศัลยกรรมกระดูกจากอุบัติเหตุ (TRAUMA)
คลินิกในเวลาราชการ :
วันจันทร์ เวลา 09.00-12.00 น
วันศุกร์ เวลา 13.00-16.00น
คลินิกพิเศษ (พรีเมียม) :
วันศุกร์ สัปดาห์ที่ 1,3 ของเดือน เวลา 16.00-18.00 น.
ด้านศัลยกรรมกระดูกเท้าและข้อเท้า (FOOT & ANKLE)
คลินิกในเวลาราชการ :
วันอังคาร และวันพฤหัสบดี เวลา 9.00-12.00 น
**คลินิกเบาหวานที่เท้า (เฉพาะผู้ป่วยนัดและผู้ป่วยส่งปรึกษา) เปิดทุกวันอังคาร สัปดาห์ที่ 2 และ 4 ของเดือน
คลินิกพิเศษ (พรีเมียม) :
วันอังคาร เวลา 16.00–19.00 น.
วันเสาร์ เวลา 9.00-11.00 น.
ด้านศัลยกรรมกระดูกสันหลัง (SPINE)
คลินิกในเวลาราชการ :
วันจันทร์ เวลา 13.00-16.00 น.
วันอังคาร เวลา 9.00-16.00 น
วันพุธ เวลา 09.00-16.00 น.
วันพฤหัสบดี เวลา 9.00-12.00 น
วันศุกร์ เวลา 9.00-12.00 น
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์ เวลา 16.00-19.00 น.
วันศุกร์ เวลา 16.00-19.00 น.
ด้านศัลยกรรมกระดูกมือและจุลศัลยศาสตร์ (HAND)
คลินิกในเวลาราชการ :
วันจันทร์ เวลา 09.00-16.00 น.
วันพฤหัสบดี เวลา 09.00-16.00 น.
วันศุกร์ เวลา 09.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันพุธ เวลา 16.00-19.00 น.
วันอาทิตย์ เวลา 09.00-12.00 น.
ด้านศัลยกรรมกระดูกเด็ก (PED)
คลินิกในเวลาราชการ :
ลงตรวจเฉพาะวันจันทร์ สัปดาห์ที่ 4 และ
วันอังคาร สัปดาห์ที่ 2 ของเดือน เวลา 9.00-12.00 น
**ทั้งนี้อาจมีการเปลี่ยนแปลงสัปดาห์ที่ลงตรวจ โทรปรึกษาก่อนมา รพ.
คลินิกระงับปวด (PAIN)
คลินิกในเวลาราชการ :
ลงตรวจทุกวันพฤหัสบดี เวลา 13.00-16.00 น.
**รับเฉพาะผู้ป่วยนัดหรือผู้ป่วยส่งปรึกษาเท่านั้น**
++ จุดรับบริจาคพื้นที่จังหวัดอื่น ++
== หน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในจังหวัดต่างๆ ==
ข้อมูลหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในจังหวัดต่างๆ เพื่อผู้เป็นเจ้าของสัตว์เลี้ยง จะสามารถติดต่อเพื่อนำสัตว์เลี้ยงไปรับบริการได้ ในจังหวัดของท่าน วิทยากรถ่ายภาพร่วมกับบุคลากรคณะแพทย์ศาสตร์
คาราวานบริการสุขภาพ
++ เขตพญาไท ++
โรงพยาบาลสัตว์ คลินิครักษาสัตว์ ในเขตพญาไทมีหลายแห่งดังนี้2. การใช้งานทางอุตสาหกรรม ข้อความที่ทำให้เข้าใจผิด และผู้ส่งสารถึง มีอิทธิพลต่อความคิดเห็นของประชาชน และดึงดูดใจเยาวชน
ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง ประดิษฐ์ข้อความอย่างประณีต ก็เพื่ออวดตัวว่าเป็นประโยชน์ต่อสังคม สิ่งนี้มีจุดประสงค์สองประการ
ประการแรก ข้อความเหล่านี้บางข้อความตรงใจเป็นพิเศษ กับรุ่นใหม่ ที่สนใจ ประเด็นความยั่งยืน สิทธิมนุษยชน และประโยชน์ส่วนรวม โดยอ้างว่ามีส่วนทำให้เกิดความก้าวหน้าในด้านเหล่านี้ได้ สร้างการรับรู้ที่ดีแก่คนรุ่นใหม่
ประการที่สอง ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง สามารถชักนำชี้ชวน ผู้กำหนดนโยบายและประชาชนทั่วไป ให้เข้าใจไปว่า ช่วยสร้างผลกระทบเชิงบวกสุทธิต่อสังคม ถ้าคนกลุ่มนี้เชื่อว่า สังคมจะได้ประโยชน์ทั้งทางด้านสาธารณสุข เศรษฐกิจ หรือด้านสิ่งแวดล้อม ผู้กำหนดนโยบายก็จะมีแนวโน้นที่จะให้การสนับสนุนพวกเขา ไม่ต่อต้าน และเมื่อได้รับแรงหนุนทางการเมืองอย่างนั้นแล้ว ท้ายที่สุดพวกเขาจะเป็นผู้ชนะเบ็ดเสร็จ ที่ต้องการสิ่งใด จะขายอะไร ก็ทำได้ แม้จะเป็นยาเสพติด หรือสินค้าอันตรายคร่าชีวิตได้ก็ตาม
ปัจจุบัน BKK Food Bank ที่สำนักงานเขตเปิดให้บริการแล้ว จำนวน 30 เขต ผลการดำเนินงานตั้งแต่เริ่มดำเนินโครงการจนถึงวันนี้ 18 กรกฎาคม 2567 สามารถส่งต่ออาหารบริจาคแก่กลุ่มเปราะบางได้ จำนวน 133,527.04 กิโลกรัม หรือ 247,752.48 มื้อ โดยมีผู้รับมอบอาหาร จำนวน 59,606 คน สามารถคำนวณเป็นปริมาณคาร์บอนที่ลดลง จำนวน 337,823.4 kgCO2e
กทม.กำลังขยาย BKK Food Bankให้ครบทั้ง 50 เขตต่อไปโดยในอนาคตอาจครอบคลุมไปถึงผู้ประสบอุบัติภัย และสาธารณภัยอีกด้วย
ศูนย์สนับสนุนบริการสุขภาพที่ 10 อุบลราชธานี
ศูนย์สนับสนุนบริการสุขภาพที่ 10 (Regional Health Service Support Center 10) มีพื้นที่รับผิดชอบ จำนวน 4 จังหวัด ได้แก่ อุบลราชธานี ศรีสะเกษ มุกดาหาร อำนาจเจริญ
- 414 ถนนโรงเรียนอุบลปัญญานุกูล ตำบลขามใหญ่ อำเภอเมือง จังหวัดอุบลราชธานี 34000
- โทร 045-251-749 Fax 045-251-748
- email : saraban-hss10@hss.mail.go.th
- Google map
- Facebook
- Website
ตามที่ได้กล่าวมาแล้วว่า องค์การอนามัยโลกกำหนดไว้ว่า สุขภาพ หมายถึง
“สภาวะของความเป็นอยู่ที่ดีที่สุดที่ไม่ใช่ เพียงแต่ไม่มีโรคภัยไข้เจ็บเท่านั้น...” ผู้ให้บริการด้านเวลเนสจึงเชื่อว่า ความเป็นอยู่ที่ดีต้องอาศัยความสมดุลระหว่างการมีสุขภาพองค์รวมที่ดีในทุกมิติที่ประกอบกันเป็นความเป็นอยู่ที่ดีของบุคคล
มิติของความเป็นอยู่ที่ดี หมายถึง การมีสุขภาพที่ดีทั้งร่างกาย จิตใจ อารมณ์ สิ่งแวดล้อม จิตวิญญาณ และ การดำรงชีวิตอยู่ในสังคม ดังนั้นความเป็นอยู่ที่ดีที่สุดนี้ จึงเป็นการบูรณาการการดูแลสุขภาพในแต่ละมิติอย่างเป็นองค์รวม ซึ่งเป็นแนวคิดที่มีมาตั้งแต่สมัยฮิปโปเครติส ด้วยวิธีการดูแลสุขภาพแบบการแพทย์แผนโบราณพัฒนาต่อเนื่องมาถึง ปัจจุบันที่มีการนำเทคโนโลยีและ ความแม่นยำและความ เชี่ยวชาญเฉพาะทางการแพทย์มาใช้ในการดูแลสุขภาพองค์ รวมของบุคคลมากขึ้น ซึ่งการปรับเปลี่ยนกระบวนทัศน์ด้าน การดูแลสุขภาพองค์รวมเพื่อความเป็นอยู่ที่ดีอย่างมีหลักฐานเชิงประจักษ์ ได้รับความยอมรับในวงกว้างว่าเป็นวิธีการเชิงบูรณาการที่ให้ผลดีต่อการเปลี่ยนแปลงพฤติกรรมสุขภาพที่ดีอย่างยั่งยืนของผู้คน
รู้จักไซยาไนด์ (รพ.จุฬาฯ)
10. ยุคถัดไปของการเพาะเลี้ยงสัตว์น้ำด้วยระบบน้ำหมุนเวียน (Next Generation of Recirculating Aquaculture System: RAS)
การเพาะเลี้ยงสัตว์น้ำของประเทศไทยมีมูลค่ามากกว่าแสนล้านบาทต่อปี แต่การเพาะเลี้ยงด้วยวิธีการดั้งเดิม เช่น การเลี้ยงในบ่อดิน การเลี้ยงในกระชัง มีข้อเสียหลายประการ เช่น ใช้น้ำมากและสร้างมลพิษทางน้ำ เสี่ยงต่อการเกิดโรคสัตว์น้ำ เนื่องจากการเปลี่ยนแปลงของสภาพแวดล้อม โดยเทคโนโลยี RAS เป็นการเลี้ยงแบบใช้น้ำหมุนเวียน โดยมีการบำบัดของเสียออกจากน้ำและเติมออกซิเจนให้กับน้ำ มีข้อดีคือไม่ต้องเปลี่ยนถ่ายน้ำ สามารถเลี้ยงสัตว์น้ำได้อย่างหนาแน่นในพื้นที่น้อย สามารถควบคุมสภาวะการเลี้ยงและมีการติดตามปัจจัยต่าง ๆ ได้ดีกว่าวิธีการแบบเดิม จึงลดความเสี่ยงจากโรคสัตว์น้ำได้มาก
ที่ผ่านมา สวทช. ได้พัฒนาระบบ RAS สำหรับกุ้งและปลากะพงซึ่งเป็นสัตว์น้ำเศรษฐกิจที่สำคัญของประเทศไทย ระบบที่พัฒนาขึ้นมีราคาที่ถูกลงกว่าในท้องตลาด ทำให้คืนทุนได้เร็วและสามารถควบคุมระบบการเลี้ยงได้ง่ายขึ้น
10.REDUCED INEQUALITIES ความไม่เท่าเทียมกันที่ลดลง
ความไม่เท่าเทียมกันของรายได้กำลังเพิ่มขึ้น โดยกลุ่มคนรวยที่สุด 10 เปอร์เซ็นต์มีรายได้สูงถึง 40 เปอร์เซ็นต์ของรายได้รวมทั่วโลก ในขณะที่กลุ่มคนจนที่สุด 10 เปอร์เซ็นต์มีรายได้เพียง 2 ถึง 7 เปอร์เซ็นต์ หากเราคำนึงถึงความไม่เท่าเทียมกันของการเติบโตของประชากรในประเทศกำลังพัฒนา ความไม่เท่าเทียมกันได้เพิ่มขึ้นถึง 11 เปอร์เซ็นต์
ความไม่เท่าเทียมกันของรายได้เพิ่มขึ้นในเกือบทุกที่ในช่วงไม่กี่ทศวรรษที่ผ่านมา แต่ในอัตราที่แตกต่างกัน โดยอยู่ในระดับต่ำที่สุดในยุโรปและสูงที่สุดในตะวันออกกลาง
ความไม่เท่าเทียมกันที่เพิ่มมากขึ้นเหล่านี้ต้องการนโยบายที่เหมาะสมเพื่อเสริมอำนาจให้กับผู้มีรายได้น้อย และส่งเสริมการรวมกลุ่มทางเศรษฐกิจของทุกคนโดยไม่คำนึงถึงเพศ เชื้อชาติ หรือชาติพันธุ์
ความไม่เท่าเทียมกันของรายได้ต้องการแนวทางแก้ไขในระดับโลก ซึ่งเกี่ยวข้องกับการปรับปรุงการกำกับดูแลและการติดตามตลาดการเงินและสถาบัน การส่งเสริมความช่วยเหลือด้านการพัฒนาและการลงทุนโดยตรงจากต่างประเทศในภูมิภาคที่มีความต้องการมากที่สุด การอำนวยความสะดวกในการอพยพและเคลื่อนย้ายผู้คนอย่างปลอดภัยยังเป็นกุญแจสำคัญในการลดช่องว่างที่เพิ่มมากขึ้นอีกด้วย
Part 2 : หัตถการ... อัปความสวย เพิ่มความปัง
เป็นชุดคำถามเกี่ยวกับ การทำหัตถการของผู้บริโภค ในหัวข้อต่างๆ ดังนี้
10.Future of robotics - อนาคตของหุ่นยนต์
อนาคตของหุ่นยนต์ครอบคลุมถึงการพัฒนาหุ่นยนต์จากการจัดการงานที่มีจุดประสงค์ตายตัวและงานที่ตั้งโปรแกรมไว้ล่วงหน้า ไปจนถึงความสามารถในการปรับตัวให้เข้ากับอินพุตใหม่ในชีวิตจริงด้วยระดับความเป็นอิสระและความคล่องแคล่วที่เพิ่มมากขึ้น
ศ.ดร.ภก. ชลภัทร สุขเกษม ที่ปรึกษาด้านเภสัชพันธุศาสตร์ โรงพยาบาลบำรุงราษฎร์ กล่าวว่า ปัจจุบันโรงพยาบาลบำรุงราษฎร์มีการนำนวัตกรรม “การตรวจยีนเพื่อเลือกใช้ยาเฉพาะบุคคล” หรือที่เรียกว่า “เภสัชพันธุศาสตร์และการแพทย์แม่นยำ (Pharmacogenomics and Precision Medicine)” มาใช้เพื่อการดูแลผู้ป่วยและผู้มารับบริการ เพื่อลดความเสี่ยงในการแพ้ยา รวมถึงเพื่อให้แพทย์สามารถจ่ายยาได้ในปริมาณที่เหมาะสม และเกิดประสิทธิภาพสูงสุดกับผู้ป่วยแต่ละบุคคล โดยโรงพยาบาลบำรุงราษฎร์ ได้นำนวัตกรรมการตรวจยีนเพื่อการปรับขนาดยาเฉพาะบุคคลมาใช้ในการดูแลรักษาผู้ป่วยในกลุ่มโรคต่าง ๆ ด้วยการดำเนินงานภายในห้องปฏิบัติการที่ได้รับการรับรองมาตรฐานสากลในระดับสากล ที่มีจุดเด่นในการตรวจวิเคราะห์ยีนที่ครอบคลุมทุกกลุ่มประชากร ในกลุ่มผู้ป่วยทุกเชื้อชาติ และสามารถแปลผลได้อย่างถูกต้องแม่นยำ ตามมาตรฐานคุณภาพความปลอดภัยและมอบความมั่นใจสูงสุดให้กับผู้ป่วย
ช่องทางบริจาคอวัยวะ ศูนย์รับบริจาคอวัยวะ สภากาชาดไทย
สำหรับผู้ที่สนใจร่วมบริจาคอวัยวะสามารถบริจาคผ่านช่องทางได้ดังนี้
บริจาคออนไลน์ :
บริจาคด้วยตนเอง :
- ศูนย์รับบริจาคอวัยวะ สภากาชาดไทย อาคารเทิดพระเกียรติสมเด็จพระญาณสังวร (เจริญ สุวฑฺฒโน) ชั้น 5 ถนนอังรีดูนังต์ ปทุมวัน กรุงเทพฯ
- บริจาคผ่านเครือข่ายฯ อาทิสำนักเหล่ากาชาดจังหวัด หรือ สำนักงานกิ่งกาชาด ทุกจังหวัด, โรงพยาบาลประจำจังหวัดในสังกัด กระทรวงสาธารณสุข และโรงพยาบาลในสังกัดสถาบันอุดมศึกษาของรัฐ, สำนักงานเขต เทศบาล และเมืองพัทยา ที่ให้บริการทำบัตรประจำตัวประชาชน
- กรมการขนส่งทางบก โดยผู้แสดงความจำนงบริจาคอวัยวะแล้วสามารถขอเพิ่มสัญลักษณ์ ของสภากาชาดไทย “กากบาทแดงบนพื้นสีขาว” และเพิ่มข้อความ “บริจาคอวัยวะ” ให้แสดงบนหน้าใบอนุญาตขับรถ
และในเร็วๆ นี้ยังสามารถแสดงความจำนงผ่าน แอปพลิเคชัน“หมอพร้อม” ได้ด้วย
ส่วนการบริจาคร่างกาย สามารถแสดงความจำนงได้ที่
anatomydonate.kcmh.or.th
คลินิกฝากครรภ์ ทุกวันจันทร์ 13.00 น. - 16.00 น. (จับบัตรคิว เวลา 12.30 น.)
คลินิกฝากครรภ์
วัน-เวลาทำการ ทุกวันจันทร์ 13.00 น. - 16.00 น.
( แนะนำจับบัตรคิว เวลา 12.30 น. )
เบอร์ติดต่อ : 02 2842331 ต่อ 108
ขอบเขตการให้บริการ
1.ผู้รับบริการรายใหม่ (ฝากครรภ์ครั้งที่ 1)
- ซักประวัติการตั้งครรภ์ ตรวจร่างกายทั่วไป
- ให้คำปรึกษาโดยแพทย์-พยาบาล-นักสังคมสงเคราะห์
- เจาะเลือดตรวจโรคติดต่อทางเพศสัมพันธ์และโรคทางพันธุกรรมธาลัสซีเมีย
- บริการฉีดวัคซีนป้องกันโรคคอตีบ - บาดทะยัก
- ตรวจครรภ์โดยแพทย์-พยาบาลเวชปฏิบัติ
2. ผู้รับบริการรายเก่า (ฝากครรภ์ครั้งที่ 2)
- ตรวจร่างกายทั่วไป ได้แก่ ชั่งน้ำหนัก วัดความดันโลหิต ตรวจปัสสาวะ
- ให้ความรู้เรื่องเตรียมความพร้อมสู่การเป็นพ่อ-แม่
- ให้ความรู้เรื่องทันตสุขภาพ ตรวจสุขภาพในช่องปากและขูดหินปูนโดยทันตแพทย์ (ฟรี)
- ตรวจครรภ์ และให้คำปรึกษาโดยพยาบาลวิชาชีพ
GIO Clinic Program โปรแกรมบริหารคลินิก
GIO Clinic Program โปรแกรมบริหารคลินิก พัฒนาโดยคนไทยในปี 2565 ด้วยเป้าหมายเพื่อให้สถานพยาบาลขนาดเล็กถึงกลาง (คลินิกเอกชน) ในประเทศไทย มีเครื่องมือที่ทันสมัยในการบริหารจัดการคลินิก "แบบครบวงจร ในราคาที่เข้าถึง" ด้วยแนวทางการพัฒนาระบบ ให้สามารถดูแลครอบคลุมทุกส่วนของคลินิกตั้งแต่ การทำประวัติ บันทึกรายละเอียดการรักษา/OPD ข้อมูลการชำระเงิน ออกใบรับรองแพทย์ การนัดหมาย พร้อมทั้งรายงานทางคลินิก ช่วยลดความผิดพลาด ประหยัดเวลาในการทำงาน
GIO Clinic ระบบบริหารคลินิก โฟกัสที่ 3 ประโยชน์ต่อผู้ใช้งาน 1) จัดเก็บข้อมูลเป็น Digital ข้อมูลจัดเก็บอย่างปลอดภัย ค้นหาย้อนหลังได้ตลอดชีวิต ลดการใช้กระดาษ ป้องกันข้อมูลสูญหาย 2) จัดการระบบภายในคลินิก รวดเร็วยิ่งขึ้น ข้อมูลในคลินิกเชื่อมกันเป็นระบบเดียวกัน แพทย์และพยาบาลทำงานถูกต้อง รวดเร็ว 3) ใช้งานง่าย ในราคาที่เอื้อมถึง โปรแกรมออกแบบมาครบทุกฟังก์ชั่น เริ่มต้นใช้ GIO Clinic ในคลินิกได้ทุกขนาด
GIO Clinic ถูกออกแบบและพัฒนาเพื่อ คลินิกเวชกรรม โดยเฉพาะ ใน 5 ฟังก์ชั่นหลัก ได้แก่
- ระบบจัดการคลินิก ✓ ระบบจัดคิวเข้ารักษาผู้ป่วย ✓ แบ่งสถานะผู้ป่วยได้แก่ รอเข้ารักษา, กำลังรักษา, กำลังรอชำระ, เรียบร้อย ✓ แจ้งเตือนแพทย์เมื่อมีผู้ป่วย ทำให้ระบบคลินิกไหลลื่น รวดเร็ว เป็นระเบียบผู้ป่วยไม่ตกหล่น ✓ เจ้าของคลินิกดูสถานะคลินิกแบบเรียลไทม์ ผ่าน GIO Clinic OWNER Application
- ระบบจัดการเวชระเบียน ✓ เสียบบัตรประชาชน ดึงข้อมูลผู้ป่วยได้ง่าย จัดเรียงเป็นรหัส HN (ผู้ป่วยนอก) ✓ ขณะแพทย์รักษา สามารถบันทึกการวินิจฉัยได้ทั้งพิมพ์หรือเขียน (รองรับทั้ง Web/IOS/Android) ✓ สามารถบันทึกค่าแลป ผลการรักษา หรือข้อมูลต่าง ๆ เป็นรูปภาพ ✓ แพทย์สามารถย้อนดูประวัติการรักษาทั้งหมดได้สะดวก รวดเร็ว ใช้งานง่าย ✓ ออกใบรับรองแพทย์ได้ แพทย์สามารถกรอก/ติ๊กข้อมูลลง PDF และปริ้นออกมาได้เลย ✓ ข้อมูลผู้ป่วยถูกเก็บไว้อย่างปลอดภัย ลดความเสี่ยงและความรับผิดชอบตามกฎหมาย PDDA
- ระบบการชำระเงิน ✓ มียาในระบบมากกว่า 200 รายการ สามารถสั่งยาได้ง่าย สามารถเพิ่ม/กำหนดราคายาได้เอง ✓ รวมราคาให้อัตโนมัติ ลดความผิดพลาดให้การคิดเงิน ✓ มีระบบเงินมัดจำ ส่วนลดทั้งบาทและเปอร์เซ็นท์ ✓ สร้าง QRCode พร้อมเพย์ล็อคยอดชำระ และระบุวิธีการชำระเงินชัดเจน ✓ มีระบบเก็บหลักฐานการโอนเงิน และรายละเอียดการชำระทุกครั้ง ป้องกันเงินสูญหาย ✓ ออกบิลใบเสร็จของร้าน พร้อมกำหนดโลโก้ร้านและคำลงท้ายใบเสร็จได้เอง
- ระบบนัดหมาย ✓ ได้รับระบบจัดการตารางแพยท์ + ระบบนัดหมาย ร่วมกัน เพื่อสะดวในการนัดหมายผู้ป่วย ✓ เลือกวัน เวลา ที่ลูกค้าต้องการทำนัดหมายได้ โดยดูได้ว่าเวลาที่ต้องการมีคิวแล้วหรือยัง ✓ แก้ไข เพิ่ม ลบ เขียนรายละเอียดเพิ่มเติม กำหนดสีได้ตามความต้องการ ✓ เมื่อถึงวันนัดมีขึ้นแจ้งเตือนสามารถดรายชื่อผู้ป่วยที่นัดเข้ามาวันนี้ได้ทั้งหมด
- ระบบหลังบ้าน สำหรับเจ้าของคลินิก ✓ รายงานยอดรายวันอย่างละเอียด ช่วยทำบัญชีได้ถูกต้องและเร็วขึ้น ✓ รายงานคลินิกรายรับ วัน/เดือน/ปี และรายงานสถิติหัตถการ/บริการ/ยาและเวชภัณฑ์ ✓ มีระบบคำนวณค่า DF หรือค่าคอมมิชชั่นพนักงาน รายวันได้ ✓ ดูยอดผ่านทางไกลด้วย GIO Clinic OWNER Application
ค่าบริหารของโปรแกรม GIO Clinic Program ได้ครบทุกฟังก์ชั่น ราคา 8,900 บาท/ปี พร้อม Cloud ไม่จำกัดพื้นที่ และทีมดูแลหลังการขายทุกวัน 24 ชั่วโมง ตลอดชีพ
คณะทำงาน
คณะทำงาน จากซ้าย 1-3 และ ขวามือสุด เยาวชนจาก Beyond the Spectrum ตัวแทนเยาวชนจิตอาสามาช่วยจัดเวิร์คช็อบบริการนักวิ่งในงาน ลำดับที่ 4. ผศ.พญ.แก้วตา นพมณีจำรัสเลิศ รองผู้อำนวยการสถาบันแห่งชาติเพื่อพัฒนาเด็กและครอบครัว ม.มหิดล // ผศ.ดร.อิทธิโชติ จักรไพวงศ์ รองอธิการบดี มหาวิทยาลัยมหิดล // รศ.นพ.อดิศักดิ์ ผลิตผลการพิมพ์ ผู้อำนวยการสถาบันแห่งชาติเพื่อพัฒนาเด็กและครอบครัว ม.มหิดล และ อธิป ถวิลวิทู ผู้ก่อตั้ง Beyond the Spectrum ผู้สนับสนุนหลักการจัดงาน
ศูนย์บริการสาธารณสุข 20 ป้อมปราบศัตรูพ่าย
ศูนย์บริการสาธารณสุข 20 ป้อมปราบศัตรูพ่าย เชิญชวนประชาชนนำสัตว์เลี้ยงสุนัขหรือแมวอายุ 3 เดือนขึ้นไปมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าประจำปี ที่หน่วยบริการฉีดวัคซีนเคลื่อนที่ใกล้บ้านท่าน ตามวันและเวลาดังกล่าว โดยไม่เสียค่าใช้จ่ายใดๆ และหากมีข้อสงสัย สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตป้อมปราบศัตรูพ่าย ชั้น 3 โทรศัพท์. 0-281-3965 และ
ศูนย์บริการสาธารณสุข 20 ป้อมปราบศัตรูพ่าย โทรศัพท์. 02-223-0004
ขั้นตอนการรับบริการตรวจสุขภาพตากับคลินิกตาสดใส
สอบถามเพิ่มเติมหรือนัดจองคิว
034-388-700 ถึง 714 ต่อ 9973
065-520-4014
โครงการสืบสานพระราชปณิธานสมเด็จย่า ต้านภัยมะเร็งเต้านม
สมเด็จพระศรีนครินทราบรมราชชนนีทรงพิจารณาเห็นว่าโรคมะเร็งเต้านม จะเป็นภัยแก่สตรีไทยในปี พ.ศ.2537 จึงได้พระราชทานพระราชทรัพย์ส่วนพระองค์ ตั้งเป็นมูลนิธิเพื่อต่อสู้กับโรคร้ายนี้ พร้อมกับพระราชทานชื่อ “มูลนิธิถันยรักษ์” โดยมีพระราชปณิธานไว้ด้วยว่า “ให้ใช้เทคโนโลยีที่ดีและเหมาะสมที่สุดในการดูแลผู้หญิงไทยทุกคน ให้พ้นภัยมะเร็งเต้านม ไม่ว่าเขาจะยากดีมีจน” สมเด็จย่ายังทรงรับเป็นองค์ประธานกิตติมศักดิ์ของมูลนิธิ สืบต่อมาโดยสมเด็จพระเจ้าพี่นางเธอเจ้าฟ้ากัลยาณิวัฒนากรมหลวงนราธิวาสราชนครินทร์ และปัจจุบันองค์ประธานกิตติมศักดิ์ของมูลนิธิถันยรักษ์ฯ คือ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เนื่องจากโรคมะเร็งเต้านมได้กลายเป็นมะเร็งที่พบมากที่สุดอันดับ 1 ของมะเร็งในสตรีไทยมากว่า 10 ปีแล้ว และมีแนวโน้มเพิ่มขึ้นทุกปีทั้งประเทศไทยและประเทศต่าง ๆ ทั่วโลก การค้นหาระยะเริ่มต้น โดยการคัดกรองด้วยเครื่องมือ Mammogram ไม่อาจเป็นประโยชน์แก่สตรีไทยได้ครอบคลุม โดยเฉพาะผู้ที่ยากจนและอยู่ห่างไกล ยิ่งไม่มีทางที่จะได้เข้าถึงบริการด้วยเครื่องมือทันสมัยเหล่านี้ได้การดำเนินงานที่ผ่านมา จึงยังมิได้สนองพระราชปณิธานสมเด็จย่า ที่ทรงมีพระราชประสงค์ที่จะให้เกิดประโยชน์แก่สตรีไทยทุกคน เพื่อให้สอดคล้องกับบริบทของประเทศและพระราชปณิธานของสมเด็จย่า มูลนิธิถันยรักษ์ฯร่วมกับกรมอนามัย จึงได้ทบทวนแนวทางการดำเนินงานและเห็นว่าการปรับพฤติกรรมเพื่อดูแลสุขภาพของตนเองมีความจำเป็นโดยเฉพาะอย่างยิ่งการที่จะต่อสู้กับโรคมะเร็ง สำหรับสตรีในประเทศกำลังพัฒนา ต้องเริ่มจากการตรวจเต้านมด้วยตนเอง BSE แต่ต้องทำอย่างถูกต้องและสม่ำเสมอ และหากตรวจอย่างสม่ำเสมอจะได้ทราบถึงความผิดปกติได้ตั้งแต่ระยะเริ่มต้น แม้แต่มหาวิทยาลัยจอนส์ ฮอปกินส์ สหรัฐอเมริกา ยังคงแนะนำให้สตรีตรวจเต้านมตนเองอย่างน้อยเดือนละครั้ง มูลนิธิถันยรักษ์ฯ จึงได้ร่วมมือกับกระทรวงสาธารณสุขโดยกรมอนามัย ดำเนินการต่อสู้กับภัยมะเร็งเต้านม ในนามของโครงการสืบสานพระราชปณิธานสมเด็จย่า ต้านภัยมะเร็งเต้านม ตั้งแต่ปี พ.ศ.2555 เป็นต้นมา ร่วมดำเนินการพัฒนาระบบการคัดกรองที่เหมาะสม ที่เริ่มต้นจากการตรวจเต้านมด้วยตนเอง Breast Self Examination BSE ตามด้วยการตรวจโดยเจ้าหน้าที่ Clinical Breast Exam CBE แล้วยืนยันว่าเป็นก้อนหรือไม่ชนิดใดโดย Ultrasound
จากการประเมินผลการดำเนินงานโครงการฯ 5 ปี (พ.ศ. 2555-2560) พบว่า สตรีไทยตรวจเต้านมอย่างถูกต้องสม่ำเสมอ ร้อยละ 70.8 พบก้อนมะเร็งขนาดเล็ก (ไม่เกิน 2 ซม.) ร้อยละ 43.7 เป็นมะเร็งระยะแรก (ระยะไม่เกิน 0,1,2) ร้อยละ 69.9 อัตราการรอดชีพในกลุ่มผู้ป่วยที่ตรวจเต้านมตนเองสม่ำเสมอสูงถึง ร้อยละ 95.5 ในภาพรวมทั้งโครงการกลุ่มผู้ป่วยที่ตรวจเต้านมตนเองสม่ำเสมอพบก้อนขนาดเล็ก เป็น 1.443 เท่า ของกลุ่มผู้ป่วยที่ตรวจไม่สม่ำเสมอ แตกต่างอย่างมีนัยสำคัญทางสถิติ นอกจากนี้ ในภาพรวมทั้งโครงการกลุ่มผู้ป่วยที่ตรวจเต้านมตนเองสม่ำเสมอมีอัตราการรอดชีพสูงกว่ากลุ่มผู้ป่วยที่ตรวจไม่สม่ำเสมอ แตกต่างอย่างมีนัยสำคัญทางสถิติ (P=0.002) โครงการสืบสานพระราชปณิธาน สมเด็จย่าต้านภัยมะเร็งเต้านมเป็น Pragmatic trial ที่ปฏิบัติได้ไม่ยาก ไม่ว่าในประเทศไทยหรือประเทศกำลังพัฒนาอื่น ๆ มีความสำเร็จเชิงประจักษ์บนพื้นฐานจากความตั้งใจจริงที่จะช่วยลดความทุกข์ทรมานอันเกิดจากมะเร็งเต้านมที่มีต่อสตรีไทยและครอบครัว สมดังพระราชปณิธานของสมเด็จย่า ซึ่งจากความสำเร็จของโครงการนี้จะเป็นรูปแบบของการคัดกรองมะเร็งเต้านมที่สามารถขยายผลการดำเนินงานได้ครอบคลุมทั่วประเทศ ต่อมาในปี พ.ศ.2561 กระทรวงสาธารณสุขและมูลนิธิถันยรักษ์ฯ ได้สร้างความร่วมมือการดำเนินงานกับมูลนิธิแพทย์อาสาสมเด็จพระศรีนครินทราบรมราชชนนี (พอ.สว.) เพื่อเป็นการขยายโอกาสให้สตรีไทยในพื้นที่ห่างไกลและต้องการความช่วยเหลือได้รับการดูแลรักษาอย่างมีประสิทธิภาพและขับเคลื่อนการดำเนินงานร่วมกัน โดยมีจังหวัดที่เป็นพื้นที่ พอ.สว.จำนวน 63 จังหวัด และเพื่อให้การดำเนินงานโครงการฯ มีความต่อเนื่องและยั่งยืนส่งผลต่อพฤติกรรมความรอบรู้ในการดูแลสุขภาพของสตรีไทยด้วยตนเอง จึงต้องมีการขยายพื้นที่การดำเนินงาน เพิ่มการเข้าถึงข้อมูลความรู้เรื่องการดูแลส่งเสริม ป้องกัน รู้เท่าทันอันตรายจากโรคมะเร็งเต้านม จึงควรมีการขยายกลุ่มเป้าหมายในกลุ่มสตรีอายุ 20 ปีขึ้นไปโดยเฉพาะในกลุ่มนักศึกษา เพื่อให้การสร้างความรอบรู้ เพิ่มศักยภาพสตรีไทยให้สามารถจัดการสุขภาพของตนเอง เพื่อพ้นภัยมะเร็งเต้านม ดังพระราชปณิธานของสมเด็จย่า ได้อย่างยั่งยืนและมีความเหมาะสม
กลุ่มเป้าหมาย
1. สตรีอายุ 30 - 70 ปี ในพื้นที่ 13 เขตสุขภาพ และพื้นที่ในถิ่นทุรกันดาร
2. สตรีอายุ 20 ปีขึ้นไปที่เป็นนักศึกษาในมหาวิทยาลัย
พื้นที่ดำเนินงาน
เขตสุขภาพที่ 1 - 13
ศูนย์อนามัยที่ 1 - 12 และสถาบันพัฒนาสุขภาวะเขตเมือง
หน่วยบริการด้านสาธารณสุขระดับปฐมภูมิ ในสังกัดกระทรวงสาธารณสุข
กรมอนามัย จังหวัดนนทบุรี
สถาบันการศึกษาระดับมหาวิทยาลัยทั่วประเทศ
สถานประกอบการ
10. การสร้างระบบสาธารณสุขด้วยเทคโนโลยีที่รองรับการเปลี่ยนแปลงด้านอากาศ
เนื่องจากสภาพอากาศแปรปรวนที่เกิดขึ้นทั่วโลกกำลังก่อให้เกิดความท้าทาย โรงพยาบาลและระบบสาธารณสุขจำเป็นต้องเตรียมพร้อมรับมือกับสถานการณ์ที่อาจจะเกิดขึ้น เนื่องจากองค์การอนามัยโลก (WHO) ระบุว่าการเปลี่ยนแปลงสภาพภูมิอากาศส่งผลกระทบต่อสุขภาพในหลายๆ ด้าน ไม่ว่าจะเป็น
การเสียชีวิตและโรคที่เกิดจากความร้อน ภัยแล้ง น้ำท่วม มลพิษทางอากาศ ไฟป่า และอื่นๆ [11] สถานพยาบาลหลายแห่งมีจำนวนผู้ป่วยที่เกิดจากสภาพอากาศเปลี่ยนแปลงมากขึ้น แต่ไม่ทุกแห่งที่สามารถรับมือกับการเพิ่มขึ้นของผู้ป่วยได้ และไม่เพียงการรับมือกับการดูแลรักษาผู้ป่วยเท่านั้น แต่ระบบสาธารณสุขและสถานพยาบาลยังต้องเตรียมรับมือด้านการดำเนินงานและสถานประกอบการด้วย
ในปี 2025 มีการถกในประเด็นนี้มากขึ้นในระดับโลก โดยคาดว่าเทคโนโลยีทางการแพทย์จะมีบทบาทสำคัญในการช่วยให้วงการสาธารณสุขพร้อมรับมือกับความท้าทายที่เพิ่มขึ้น ทางหนึ่งคือการพัฒนาโครงสร้างพื้นฐานที่มีความยืดหยุ่นและสามารถรองรับการให้บริการได้อย่างต่อเนื่องและมีประสิทธิภาพ
แม้จะเผชิญกับภัยพิบัติทางอากาศ รวมถึงการใช้พลังงานทดแทน และการนำแนวทางการปฏิบัติอย่างยั่งยืนมาใช้
นอกจากนี้การฝึกอบรมและเพิ่มทักษะเกี่ยวกับการจัดการโรคที่เกี่ยวข้องการความร้อน หรือโรคที่มียุงเป็นพาหะ ยังช่วยเตรียมความพร้อมให้กับบุคลากรทางการแพทย์และผู้ให้บริการด้านสาธารณสุขในการดูแลรักษาผู้ป่วยได้อย่างมีประสิทธิภาพมากขึ้น นอกจากนี้ ระบบเตือนภัยล่วงหน้าก็สามารถช่วยลดความเสี่ยงด้านสุขภาพ และเสริมสร้างสุขภาพเชิงป้องกันภายในชุมชน เพื่อให้สามารถจัดการกับโรคที่เกี่ยวข้องกับการเปลี่ยนแปลงสภาพภูมิอากาศในระดับท้องถิ่นได้
การเตรียมความพร้อมและการดำเนินการตามแนวทางข้างต้น จะช่วยให้ระบบสาธารณสุขสามารถรับมือต่อผลกระทบจากการเปลี่ยนแปลงสภาพภูมิอากาศได้ดีขึ้น และมั่นใจในสุขภาพที่ดีของทุกคนในอนาคตได้
Happyend
Happyend #JFF2025
1 ชั่วโมง 53 นาที R:13+
JAPANESE (EN & TH Subs) ณ กรุงโตเกียว ในอนาคตอันใกล้ ที่ซึ่งอันตรายจากแผ่นดินไหวระดับภัยพิบัติสร้างความหวาดกลัวให้กับผู้คนในชีวิตประจำวัน ในคืนหนึ่ง สองหนุ่มม.ปลายวัยใกล้จบการศึกษา คู่ซี้ที่ชอบก่อความวุ่นวาย ก็ดันไปก่อเหตุกลั่นแกล้งครูใหญ่ของโรงเรียน จนโรงเรียนถึงกับตั้งกล้องวงจรปิด เมื่อถูกกดดันด้วยระบบรักษาความปลอดภัยที่เข้มงวด และสถานการณ์ทางการเมืองระดับชาติที่เข้มข้นขึ้นทุกที ทั้งสองกลับตอบสนองด้วยวิธีตรงกันข้ามกัน จนทำให้มองเห็นความแตกต่างที่ทั้งคู่ไม่เคยสังเกตมาก่อน
Bangkok Design Week 2025 Phase 1 February 8-16, 2025
Bangkok Design Week 2025
Phase 1 February 8-16, 2025
+เจริญกรุง - ตลาดน้อย +เยาวราช - ทรงวาด +ปากคลองตลาด +พื้นที่อื่นๆ
+Charoenkrung - Talat Noi +Yaowarat - Song Wat +Pak Khlong Talat +Others
—
สิ้นสุดการรอคอยสำหรับนักสร้างสรรค์!
Phase 1 ของ Bangkok Design Week 2025 กำลังจะเริ่มขึ้นแล้ว ตั้งแต่วันที่ 8-16 กุมภาพันธ์ 2025 นี้ เราจะพาทุกคนเข้าสู่โลกของการออกแบบและความคิดสร้างสรรค์ในช่วง Phase 1 ของ Bangkok Design Week 2025 ที่จะช่วยเติมเต็มพลังงานบวกแบบไม่มีกั๊ก ไม่ว่าจะเป็นนิทรรศการรวมไอเดียงานดีไซน์ที่ไม่เหมือนใคร หรือจะเป็นเวิร์กช็อปที่ชวนให้เพื่อน ๆ มาลงมือกันสร้างสรรค์ผลงานอย่างจัดเต็ม รวมไปถึงงานเสวนา ตลาดงานดีไซน์ ดนตรีและการแสดง ทัวร์ อีเวนต์ และโปรโมชั่นต่าง ๆ อีกมากมาย
โดยใน Phase 1 จะจัดขึ้นในพื้นที่ย่านสร้างสรรค์ในกรุงเทพฯ ที่เต็มไปด้วยวัฒนธรรมและแรงบันดาลใจ อย่างย่านเจริญกรุง - ตลาดน้อย, เยาวราช - ทรงวาด, ปากคลองตลาด และพื้นที่อื่นๆ เพื่อให้คุณได้เดินทางสำรวจงานออกแบบเพื่อเตรียมรับพลังงานบวกใหม่ๆ ได้อย่างเต็มที่ สามารถเข้าไปดูโปรแกรมทั้งหมดได้ที่
bkkdw2025/program
ง้าง (ไอเดีย) มานาน พร้อมจะพร้อมบวก+ กับทุกคนแล้ว!
เจอกับ Bangkok Design Week 2025 8-23 กุมภาพันธ์นี้
- 8-16 กุมภาพันธ์ ที่ย่านเจริญกรุง - ตลาดน้อย, เยาวราช - ทรงวาด, ปากคลองตลาด, และพื้นที่อื่น ๆ
- 15 - 23 กุมภาพันธ์ ที่ย่านพระนคร, บางลำพู - ข้าวสาร, และพื้นที่อื่น ๆ
- เฉพาะเสาร์และอาทิตย์ 8-9, 15-16, 22-23 กุมภาพันธ์ ที่ย่านหัวลำโพง, บางโพ, และพื้นที่อื่น ๆ
10) ถุงมือเสมือนจริง (Virtual reality gloves)
ไม่เพียงแต่แว่นตาเท่านั้น แต่ยังมีถุงมืออีกด้วย ซึ่งบริษัทต่างๆ นำมาทดลองใช้เพื่อปรับปรุงประสบการณ์ VR บริษัทManus ของอเมริกาได้สร้างถุงมือที่ช่วยให้คุณควบคุมมือและแขนได้ในโลกเสมือนจริง ในทางการแพทย์ โดยเฉพาะการแพทย์ทางไกล อุปกรณ์ดังกล่าวจะมีประโยชน์อย่างมาก แพทย์สามารถสัมผัสและรู้สึกตัวของผู้ป่วยได้จากระยะไกล แม้จะอยู่ห่างไกลกันคนละทวีปก็ตาม ขณะที่พูดคุยเกี่ยวกับปัญหาทางการแพทย์ผ่านแอปพลิเคชันการแพทย์ทางไกล แม้ว่าแนวคิดจะยอดเยี่ยม แต่การปฏิบัติจริงยังตามหลังอยู่มาก การใช้ถุงมือดังกล่าวเป็นเรื่องยากมาก และชุดหูฟัง VR ก็ไม่ได้เข้ากันได้กับถุงมือเสมอไป ไม่ต้องพูดถึงราคาที่แพงหูฉีก โดยรวมแล้ว ดูเหมือนว่าสาขาการตอบสนองแบบสัมผัสจะหยุดชะงักลงในช่วงไม่กี่ปีที่ผ่านมา ติดตามข่าวเพิ่มเติม ในประเด็นเกี่ยวข้อง
หน่วยทำหมันเคลื่อนที่ของ กทม. เดือนมกราคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน ฉีดวัคซีน เดือนมกราคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 3 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนวังทอง ดอนเมือง และ เวลา 9-12.00 น. ชุมชนสามัคคีเทวสุนทร เขตจตุจักร
- 4 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนผู้ใหญ่ชม เขตคันนายาว / 9-12.00 น. สถานที่ วัดเทวีวรญาติ เขตป้อมปราบฯ [แผนที่]
- 5 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนนำไกร เขตลาดกระบัง / 9-12.00 น. สถานที่ ชุมชนสินทรัยพ์นคร เขตบางเขน
- 9 ม.ค. เวลา 9-12.00 น. สถานที่ ซอยมัสยิดบ้านสมเด็จ เขตธนบุรี / 9-12.00 น. สถานที่ ตลาดบางพัฒนา เขตบางพลัด
- 10 ม.ค. เวลา 9-12.00 น. สถานที่ วันจันทน์ใน เขตบางคอแหลม / 9-12.00 น. สถานที่ วัดทุ่งครุ เขตทุ่งครุ
- 11 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนนูรุ้ลอิสลาม เขตมีนบุรี / 9-12.00 น. สถานที่ ชุมชนโฟร์โมสต์ เขตบางขุนเทียน
- 12 ม.ค. เวลา 8-14.00 น. สถานที่ ศูนย์นันทนาการคลองเตย เขตคลองเตย
- 16 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนปรีชา เขตยานนาวา / 9-12.00 น. สถานที่ ชุมชนสามัคคี 53 เขตบึงกุ่ม
- 17 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนร่วมกันสร้าง เขตบางกะปิ / 9-12.00 น. สถานที่ ชุมชนหมู่บ้านรางไผ่ เขตบางบอน
- 18 ม.ค. เวลา 9-12.00 น. สถานที่ หมู่บ้านซิลค์วิลเลจ เขตสายไหม / 9-12.00 น. สถานที่ ศูนย์ฯ 45 เขตลาดกระบัง
- 19 ม.ค. เวลา 9-12.00 น. สถานที่ โรงเรียนมะเซาะฮะดุดดีน 2 เขตสะพานสูง
- 23 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนแฟลต 11-18 เขตคลองเตย / 9-12.00 น. สถานที่ วัดสวัสดิ์วารีสีมาราม เขตดุสิต
- 24 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนเคหะทุ่งสองห้อง 310 เขตหลักสี่ / 9-12.00 น. สถานที่ หมู่บ้านเคซีการเด้นโฮม เขตคลองสามวา
- 25 ม.ค. เวลา 9-12.00 น. สถานที่ ตลาดผู้ใหญ่อ้วน เขตลาดพร้าว
- 26 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนศาลเจ้าพ่อเสือ เขตพระนคร / 9-12.00 น. สถานที่ สวนเฉลิมพระเกียรติใต้สะพานตากสิน (ลงทะเบียนหน้างาน) เขตคลองสาน
- 30 ม.ค. เวลา 9-12.00 น. สถานที่ วัดบรมสถล (วัดดอน) เขตสาทร / 9-12.00 น. สถานที่ วัดจำปา ตลิ่งชั้น
- 31 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนหมู่บ้านนิรันด์วิลล่า เขตพระโขนง / 9-12.00 น. สถานที่ ชุมชนวัดคลองเจ้าพัฒนา สวนหลวง
14 มกราคม 2567 กทม.ทำหมัน 100 ตัว วัดคลองครุ เขตคันนายาว
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 69 คันนายาว เขตคันนายาว ร่วมกับ สำนักงานเขตคันนายาว ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
- ทำหมัน รับจำนวนจำกัด 100 ตัว
- จำกัดคนละไม่เกิน 2 ตัว
- รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตคันนายาว กรุงเทพมหานคร เท่านั้น
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว เบอร์โทรศัพท์ 02 379 9945
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ ไม่ต้องจองคิวล่วงหน้า นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 14 มกราคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดคลองครุ เขตคันนายาว (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
*** ทั้งนี้อาจมีปัจจัยอื่น ๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
6 และ 13 มกราคม 2567 สนง.ปศุสัตว์ กทม.บริการฉีดวัคซีนป้องกันพิษสุนัขบ้า ฟรี
สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 2 วัน
เสาร์ที่ 6 มกราคม 2567เวลา 9.00-12.00 น. ชุมชนการเคหะฉลองกรุง ลำผักชี หนองจอก กทม.
เสาร์ที่ 13 มกราคม 2567เวลา 9.00-12.00 น. ที่ทำการประธานชุมชนนำไกล แขวงทับยาว ลาดกระบัง กทม.
สอบถามโทร. 02-004-4407 สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร ถนนงามวงศ์วาน เขตจตุจักร
17-18, 26 มกราคม 67 เขตลาดกระบังจัดฉีดวัคซีนสุนัขและแมว
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ลงพื้นที่ฉีดวัคซีนสุนัขและแมวในพื้นที่
เขตลาดกระบัง ดังนี้
• 17 มกราคม ชุมชนวัดพลมานีย์ (บริเวณศาลตายาย) เวลา 9.00-11.30 น.
• 18 มกราคม ชุมชนบ้านทับยาว (บริเวณมัสยิด) เวลา 9.00-11.30 น.
• 26 มกราคม ชุมชนประชาอุทิศ เวลา 9.00-11.30 น.
31 มกราคม 2567 ทำหมัน ฉีดไมโครชิปสุนัข ฉีดวัคซีน ชุมชนหมู่บ้านนิรันดร์วิลล่า ซอยพึ่งมี 50 (สุขุมวิท 93)
สำนักงานเขตพระโขนง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน ฉีดไมโครชิปสุนัข และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ในวันพุธ ที่ 31 มกราคม 2567 ตั้งแต่เวลา 08.00 - 11.00 น. สถานที่ชุมชนหมู่บ้านนิรันดร์วิลล่า ซอยพึ่งมี 50 (สุขุมวิท 93) แขวงบางจาก เขตพระโขนง กรุงเทพมหานคร
รายละเอียดการบริการ
➡ ทำหมันสุนัขและแมว จำนวน 30 ตัว
➡ ฉีดไมโครชิปสุนัข จำนวน 30 ตัว
➡ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 200 ตัว
ผู้ที่สนใจทำหมันสัตว์เลี้ยง สามารถลงทะเบียนล่วงหน้า ได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพระโขนง โทร. 0 2311 3538
สัตว์เลี้ยงที่นำมารับบริการทำหมัน
1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
2. ถ้าเป็นเพศเมียต้องไม่ท้อง ไม่ให้นมลูก
3. มีอายุตั้งแต่ 6 เดือนขึ้นไป
4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 10 ชั่วโมง ก่อนพามาทำหมันเพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต
5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ
6. ให้นำตระกร้า หรือ กรงขัง แมว ขนาดใหญ่มาด้วย เพื่อความสะดวกในการนำสัตว์กลับหลังจากการทำหมันเสร็จ
7. เจ้าของสัตว์เลี้ยงต้องนำบัตรประชาชนมาแสดงด้วย
*** ทั้งนี้อาจมีปัจจัยอื่น ๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
หน่วยทำหมันเคลื่อนที่ของ กทม. เดือนกุมภาพันธ์ 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน ฉีดวัคซีน เดือนกุมภาพันธ์ 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 ก.พ. เวลา 9-12.00 น. ชุมชนนวลจิตร เขตวัฒนา / เวลา 9-12.00 น. วัดขุมทอง เขตลาดกระบัง
- 2 ก.พ. เวลา 9-12.00 น. ห้างบิ๊กซี เขตธนบุรี
- 6 ก.พ. เวลา 9-12.00 น. วัดกระทุ่มเสือปลา เขตประเวศ / ชุมชนหมู่ 7 ราษฎร์บูรณะ เขตราษฎร์บูรณะ
- 7 ก.พ. เวลา 9-12.00 น. วัดทรัพย์สโมสรนิกรเกษม เขตหนองจอก / วัดกุนนทีรุทธาราม เขตดินแดง
- 8 ก.พ. เวลา 9-12.00 น. ชุมชนอัมรินทร์นิเวศน์ 3 ผัง 2 เขตสายไหม / ลานกีฬาปลอดยาเสพติด ใต้ทางด่วนมหานคร เขตบางรัก
- 9 ก.พ. เวลา 9-12.00 น. เรือนจำพิเศษมีนบุรี / ชุมชนยิ้มประยูร เขตบางซื่อ
- 13 ก.พ. เวลา 9-12.00 น. ชุมชนพลับพลา เขตวังทองหลาง / วัดบุญยประดิษฐ์ เขตบางแค
- 14 ก.พ. เวลา 9-12.00 น. วัดสัมพันธวงศ์ เขตสัมพันธวงศ์ / กรมทหารขนส่ง รักษาพระองค์ เขตบางเขน
- 15 ก.พ. เวลา 9-12.00 น. วัดทุ่งครุ
- 16 ก.พ. เวลา 8-14.00 น. วัดบางกระดี่ เขตบางขุนเทียน
- 20 ก.พ. เวลา 9-12.00 น. สำนักงานเขตบางกอกน้อย / กลุ่มควบคุมตรวจเนื้อสัตว์ เขตหนองแขม
- 21 ก.พ. เวลา 9-12.00 น. ชุมชนบ้านครัวตะวันตก ราชเทวี / หมู่บ้านเลิศอุบล 5 เขตคันนายาว
- 22 ก.พ. เวลา 9-12.00 น. ชุมชนเมืองอยู่ดี เขตบางคอแหลม / หมู่บ้านวรางกูล เขตคลองสามวา
- 23 ก.พ. เวลา 8-14.00 น. ตลาดปัฐวิกรณ์ เขตบึงกุ่ม (กิจกรรมสุขภาพดี ใกล้บ้าน ใกล้หมอ)
- 27 ก.พ. เวลา 9-12.00 น. หมู่บ้านอินทราวิลล่า เขตภาษีเจริญ / ชุมชนนครหลวง เขตจตุจักร
- 28 ก.พ. เวลา 8-14.00 น. สนามกีฬานิมิบุตร เขตปทุมวัน
- 29 ก.พ. เวลา 9-12.00 น. วัดนาคนิมิตร เขตจอมทอง / วัดใหม่พิเรนทร์ เขตบางกอกใหญ่
- 1 มี.ค. เวลา 8-14.00 น. ตลาดเอซี สายไหม เขตสายไหม
2-10 กุมภาพันธ์ 2567 ฉีดวัคซีนหมาแมวในงาน เกษตรแฟร์ 67 วันละ 100 ตัว ไม่คิดค่าใช้จ่าย LINK
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วัคซีนรวม ถ่ายพยาธิ หยอดยากันเห็บ-หมัด ในสุนัข
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ถ่ายพยาธิ ในแมว
..... วันละ 100 ตัว ไม่คิดค่าใช้จ่าย
- นิทรรศการโรคพิษสุนัขบ้าและเล่นเกมชิงของรางวัล
- แสดงนวัตกรรม ผลงานวิจัย จำหน่าย ผลิตภัณฑ์จากคณะสัตวแพทยศาสตร์และบริษัทที่ร่วมดำเนินการ (09.00 - 19.00 น.)
ระหว่างวันที่ 2-10 กุมภาพันธ์ 2567 เวลา 9.00 - 15.30 น. โซนบูธปรับอากาศด้านหน้าอาคารจักรพันธ์เพ็ญศิริ ตรงข้ามโรงเรียนสาธิตเกษตร
3 กุมภาพันธ์ 2567 ทำหมันแมวฟรี ม.ธรรมศาสตร์ ท่าพระจันทร์ ลงทะเบียนล่วงหน้า LINK
โครงการทำหมันแมว ฟรี โดย มหาวิทยาลัยธรรมศาสตร์ x มูลนิธิรักษ์แมวครั้งที่ 5 โดยครั้งนี้เราได้รับการสนับสนุนวัคซีนพิษสุนัขบ้าจากสำนักงานสัตวแพทย์สาธารณาสุข สำนักอนามัย กรุงเทพมหานคร จำนวน 200 โดส ให้บริการฉีด ฟรี!
ขอเชิญผู้สนใจทำหมันแมวลงทะเบียนเข้าร่วมโครงการทำหมันแมว ฟรี! ณ มหาวิทยาลัยธรรมศาสตร์ ท่าพระจันทร์ วันเสาร์ที่ 3 กุมภาพันธ์ 2567 เวลา 09.00-15.00 น. สถานที่ : โถงหอประชุมใหญ่ มหาวิทยาลัยธรรมศาสตร์ ท่าพระจันทร์ หากท่านลงทะเบียนแล้ว ผู้ที่ได้คิวจะประกาศรายชื่อในเพจ Facebook "มหาวิทยาลัยธรรมศาสตร์ ท่าพระจันทร์"
ข้อมูลเบื้องต้น
1.สถานที่ทำหมันเป็นพื้นที่เปิดโล่ง ให้ระวังแมวหลุดจากกรง ดังนั้น แนะนำให้ผูกเชือกฟางกับตะกร้าแมวหรือประตูกรงเพื่อป้องกันแมวหลุดออกจากตะกร้าหรือกรง (ควรปูแผ่นรองซับเพื่อป้องกันการเลอะฉี่หรืออ้วก)
2.อุปกรณ์ที่ใส่แมวทำหมันกำหนดให้ใช้กรงหรือตะกร้าแบบมีฝาเปิดแบบฝาเดียวหรือบล็อกใส่แมวเท่านั้น*** เพื่อความสะดวกในการวางยาทำหมัน มีความแข็งแรง ไม่ชำรุดและใหญ่เพียงพอที่แมวจะนอนได้โดยคอไม่พับ
3.แมวที่จะทำหมันได้ต้องมีสุขภาพดีไม่ป่วยและไม่ท้อง
4.เพศเมียทำหมันได้ที่อายุ 5 เดือน หรือน้ำหนักตัว 2กิโลกรัม
5.เพศผู้ทำหมันได้ที่อายุ 7 เดือน หรือมองเห็นไข่แล้ว
6.แม่แมวทำหมันได้เมื่อลูกแมวกินอาหารเองได้แล้ว ประมาณ 40-60 วันหลังคลอด
แนวปฏิบัติก่อนวันมาทำหมัน (สำคัญมาก)***
1.ก่อนทำหมันต้องอดน้ำอดอาหารอย่างน้อย 10-12 ชั่วโมง (หากไม่แน่ใจว่าได้อดอาหารมาแล้วหรือยังให้แจ้งที่โต๊ะลงทะเบียน จะได้รับการทำหมัน แต่จะจัดคิวให้เป็นคิวสุดท้ายเพื่อความปลอดภัยของแมว)
2.สามารถให้กินอาหารมื้อเย็นได้ตามปกติ ให้อาหารอ่อนๆ งดพวกอาหารย่อยยาก แนะนำให้นำแมวใส่กรง เพื่ออดอาหารหลัง 22.00น. คืนวันก่อนพามาทำหมัน
3.ตะกร้า 1 ใบต่อแมว 1 ตัว ปูแผ่นรองซับให้เรียบร้อย ผูกเชือกที่ปากตะกร้าหรือประตูกรงให้ดี
แนวปฏิบัติวันที่มาทำหมัน
1.ให้มาที่โต๊ะลงทะเบียน แจ้งชื่อ ลำดับคิว
2.หลังจากนั้นจะได้รับป้ายติดหน้าตะกร้า+ป้ายห้อยคอน้องแมว
3.กรอกรายละเอียด ทั้ง 2 ส่วนให้ครบและตรงกัน
4.ป้ายติดหน้าตะกร้าแผ่นใหญ่ ให้ปิดไว้บนตะกร้าหรือกรงบล็อกเหล็ก
5.ป้ายห้อยคอน้องแมวให้ผูกเป็นหูกระต่ายหรือเงื่อนกระตุกที่หูตะกร้า
6.ติดป้ายเสร็จแล้วนำน้องแมวกลับมาที่โต๊ะลงทะเบียนอีกครั้งเพื่อรอคิวทำหมัน
7.รอประมาณ 2-4 ชั่วโมงจนกว่าแมวจะฟื้นอาสาสมัครจะนำแมวใส่ตะกร้า และเรียกเจ้าของมารับแมวกลับ
หมายเหตุ
1.วัคซีนพิษสุนัขบ้าฉีดฟรี โดยสำนักงานสัตวแพทย์สาธารณาสุข สำนักอนามัย กรุงเทพมหานครสนับสนุนจำนวน 200 โดส หากแมวของท่านได้รับวัคซีนพิษสุนัขบ้ามาแล้วภายใน 1 ปี ยังไม่จำเป็นต้องฉีดอีก
2.แมวทุกตัวที่มาทำหมันจะได้รับการสักหู เพื่อเป็นสัญลักษณ์ว่าแมวได้ทำหมันแล้ว
3.การสักหูเป็นระบบสากลที่รับทราบโดยทั่วไปว่า หมา-แมวตัวนั้นๆได้รับการทำหมันแล้ว จะได้ไม่ต้องโดนจับไปวางยาทำหมันอีก
***การผ่าตัดมีความเสี่ยง โปรดพิจารณาความเสี่ยงและอ่านรายละเอียดให้ครบถ้วนก่อนลงทะเบียน
7 กุมภาพันธ์ 2567 ทำหมัน 30 ตัว วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ วัดกุนนทีรุทธาราม จัดหน่วยสัตวแพทย์เคลื่อนที่ ผ่าตัดทำหมันสุนัขและแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️
ณ วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง ในวันพุธที่ 7 กุมภาพันธ์ 2567 เวลา 08.30 ถึง 11.00 น.
รับจองทำหมันจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
ลงทะเบียนจองผ่าน inbox เพจได้เลยครับ
กรอกรายละเอียด ดังนี้
1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา)
2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตดินแดง ห้วยขวาง ราชเทวี ลาดพร้าว วังทองหลาง บางกะปิ เท่านั้น)
3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว)
4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
แผนที่การเดินทางมายัง วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง
หน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัขและแมว ฟรี (กุมภาพันธ์ 67)
กำหนดการหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จุดต่างๆ ดังนี้ (จากเพจ
กลุ่มควบคุมโรคพิษสุนัขบ้า)
- วันอังคารที่ 23 มกราคม 2567 ชุมชนบ้านคลองเก้า แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 มกราคม 2567 ชุมชนสหกรณ์ 93 คลองสิบ แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 26 มกราคม 2567 ชุมชนประชาอุทิศ แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 30 มกราคม 2567 ชุมชนหมู่ 4 พัฒนา แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 31 มกราคม 2567 ชุมชนประชาสำราญ แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 1 กุมภาพันธ์ 2567 ที่ชุมชนนำไกร หมู่ 9 แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 6 กุมภาพันธ์ 2567 ชุมชนแผ่นดินทองวัดพระยาปลา แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 7 กุมภาพันธ์ 2567 ชุมชนบ้านคลองนาหมอน แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 13 กุมภาพันธ์ 2567 ชุมชนหมู่ 6 ก้าวหน้า แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 16 กุมภาพันธ์ 2567 ชุมชนสุทธาวาส แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 20 กุมภาพันธ์ 2567 ชุมชนกิตติเหมกรณ์ แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 21 กุมภาพันธ์ 2567 ชุมชนอัลฟาลาห์ แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 22 กุมภาพันธ์ 2567 ชุมชนเลียบคลองมอญ (ตั้งจุดฉีดวัคซีนที่วัดสุทธาโภชน์) แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันศุกร์ที่ 23 กุมภาพันธ์ 2567 แฮปปี้ คอนโด (บริเวณ Dog Park อาคารเซาท์) ซอยลาดพร้าว 101 แขวงคลองเจ้าคุณสิงห์ เขตวังทองหลาง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 27 กุมภาพันธ์ 2567 ชุมชนอุมาร์ 2 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 28 กุมภาพันธ์ 2567 ชุมชนแผ่นดินทองสะฟีรุสซาลาม แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 29 กุมภาพันธ์ 2567 ชุมชนทิวไผ่พัฒนา แขวงลำปลาทิว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
11 กุมภาพันธ์ 2567 ณ วัดปุรณาวาส เขตทวีวัฒนา เวลา 08.00 - 12.00 น.
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 67 ทวีวัฒนา เขตทวีวัฒนา ร่วมกับ สำนักงานเขตทวีวัฒนา ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
- ทำหมัน รับจำนวนจำกัด 100 ตัว
- จำกัดคนละไม่เกิน 2 ตัว
- รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตทวีวัฒนา กรุงเทพมหานคร เท่านั้น
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
- ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตทวีวัฒนา เบอร์โทรศัพท์ 02 4414973 ต่อ 5520
- ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 11 กุมภาพันธ์ 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดปุรณาวาส เขตทวีวัฒนา [แผนที่วัดปุรณาวาส] (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.) 13 กุมภาพันธ์ 2567 เขตวังทองหลาง ทำหมันสุนัข & แมว มีจำนวนจำกัด 30 ตัว (ลงทะเบียนล่วงหน้าเท่านั้น) LINK
สำนักงานเขตวังทองหลาง ร่วมกับสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย จัดกิจกรรมออกหน่วยสัตวแพทย์เคลื่อนที่ บริการทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัข&แมว และฉัดไมโครชิป ลงทะเบียนสุนัข ‼️ ฟรี ฟรี ฟรี ‼️ ในวันที่ 13 กุมภาพันธ์ 2567 เวลา 08.00 -12.00 น. ณ ที่ทำการชุมชนหมู่บ้านพลับพลา แขวงพลับพลา เขตวังทองหลาง
หมายเหตุ : ทำหมันสุนัข & แมว มีจำนวนจำกัด 30 ตัว เฉพาะผู้ที่ลงทะเบียนเท่านั้นจ้าาาา ส่วนกรณีอื่นๆ สามารถ Walk In ลงทะเบียน ณ วันออกหน่วยได้เลยจ้าาา
เปิดรับลงทะเบียน ตั้งแต่วันที่ 8 - 31 มกราคม 2567 เท่านั้น หากคิวเต็มขออนุญาตปิดรับเฉพาะผู้ที่ลงทะเบียนก่อนเท่านั้น สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2514 0512
15 กุมภาพันธ์ 2567 ทำหมันสุนัขและแมว ที่วัดทุ่งครุ
วันพฤหัสบดีที่ 15 กุมภาพันธ์ 2567 ประชาสัมพันธ์
• ทำหมันสุนัขและแมว ที่วัดทุ่งครุ ฉีดวัคซีนป้องกันพิษสุนัขบ้า 600 โดส (ไม่ต้องลงทะเบียนล่วงหน้า)
• ฉีดไมโครชิพ(เฉพาะสุนัข) จำนวน 100 ตัว (ไม่ต้องลงทะเบียนล่วงหน้า)
• ทำหมันสุนัข-แมว(เฉพาะทะเบียนบ้านเขตทุ่งครุ) จำนวน 300 ตัว (ลงทะเบียนล่วงหน้าผ่านช่องทางLine OA เท่านั้น)
เวลา 09.00 - 14.00 น. ณ ลานอเนกประสงค์ วัดทุ่งครุ เขตทุ่งครุ เปิดรับลงทะเบียนพร้อมกัน ในวันพฤหัสบดีที่ 1 กุมภาพันธ์ 2567 ตั้งแต่เวลา 09.00 น. จนครบจำนวน และปิดรับคิวทันทีบริการฟรี ไม่มีค่าใช้จ่าย
18 ก.พ. 2567 ทำหมันหมาแมวฟรี ในงานมหกรรมตลาดนัดแก้หนี้กรุงเทพมหานคร วัดฝอกวงซัน ถนนคู้บอน
กรุงเทพมหานคร โดยสำนักพัฒนาสังคม ร่วมกับ กรมการจัดหางาน ธนาคารออมสิน ธนาคารเพื่อการเกษตรและสหกรณ์ และหน่วยงานที่เกี่ยวข้อง ขอเชิญพี่น้องประชาชนร่วมงาน "มหกรรมตลาดนัดแก้หนี้กรุงเทพมหานคร" ในวันอาทิตย์ที่ 18 ก.พ. 2567 ระหว่างเวลา 09.00 - 14.00 น ณ อาคารเอนกประสงค์ สถาบันพุทธศาสนาเถรวาท-มหายาน ฝอกวงซันไท่ฮวาซือ (วัดฝอกวงซัน) [
แผนที่วัด] ถนนคู้บอน แขวงบางชัน เขตคลองสามวา กรุงเทพมหานคร
กิจกรรมภายในงาน
- การไกล่เกลี่ยข้อพิพาทของลูกหนี้และเจ้าหนี้
- การให้ความรู้ด้านกฎหมาย การเงิน
- การให้คำปรึกษาด้านการเงิน สินเชื่ออัตราดอกเบี้ยต่ำ
- การจำหน่ายสินค้าราคาประหยัด
- ผลิตภัณฑ์ Bangkok Brand / สินค้า Otop
- การบริการตัดผมประชาชน
- การแจกจ่ายพันธุ์ไม้
- การบริการทำบัตรประจำตัวประชาชน
- การบริการตรวจสุขภาพทันตกรรม
- การบริการทำหมันสุนัขและแมว (รับเฉพาะสัตว์ในเขตคลองสามวาเท่านั้น)
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัขและแมว
- ตัดแต่งขน สุนัขและแมว
- การอบรมสร้างงานสร้างอาชีพ
- การบริการอาหารและเครื่องดื่ม
ผลการดำเนินกิจกรรม สำนักอนามัย โดยสำนักงานสัตวแพทย์สาธารณสุข จัดการออกหน่วยสัตวแพทย์เคลื่อนที่ให้บริการประชาชนที่นำสุนัขและแมวมาในงาน โดยดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 199 ตัว ผ่าตัดทำหมัน จำนวน 109 ตัว และฉีดไมโครชิป จดทะเบียนสุนัข จำนวน 14 ตัว
สำหรับจำนวนผู้ลงทะเบียนหนี้นอกระบบของกรุงเทพมหานคร ระหว่างวันที่ 1 ธ.ค.66 ถึง วันที่ 17 ก.พ.67 มีจำนวนทั้งสิ้น 9,342 ราย เป็นผู้ที่ walk in เข้ามา จำนวน 1,344 ราย เป็นลูกหนี้ จำนวน 9,342 ราย เป็นเจ้าหนี้ จำนวน 8,261 ราย รวมยอดหนี้ทั้งหมด จำนวน 909,755,360.12 บาท
20 กุมภาพันธ์ 2567 ทำหมันสุนัขแมว ฟรี 30 ตัว ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม ในวันอังคารที่ 20 กุมภาพันธ์ 2567 เวลา 09.00 ถึง 11.00 น. รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว ลงทะเบียนจองคิวทำหมันสุนัขและแมว กรอกรายละเอียด ดังนี้ 1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา) 2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตหนองแขม บางแค ทวีวัฒนา ตลิ่งชัน ภาษีเจริญ เท่านั้น) 3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว) 4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
20 กุมภาพันธ์ 2567 ทำหมันสุนัขและแมว (จำนวน 50 ตัว) วัดสิงห์ เขตจอมทอง
หน่วยสัตวแพทย์เคลื่อนที่ให้บริการทำหมันสุนัขและแมว (จำนวน 50 ตัว) ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ในวันอังคารที่ 20 กุมภาพันธ์ 2567 ตั้งแต่เวลา 09.00-12.00 ณ วัดสิงห์ เขตจอมทอง สุนัขและแมว ที่จะรับบริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า มีข้อปฎิบัติดังนี้
1. ต้องมีสุขภาพแข็งแรง ไม่ป่วย
2. แมวที่จะทำหมัน
- เพศเมีย ต้องอายุ 6 เดือนขึ้นไป
- เพศผู้ ต้องอายุ 10 เดือนขึ้นไป
3. สุนัขที่จะทำหมัน ต้องอายุ 6 เดือนขึ้นไป หรือ ตามแพทย์วินิจฉัย
4. สุนัขและแมวที่จะฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า อายุ 3 เดือนขึ้นไป และร่างกายแข็งแรง
5. สุนัขและแมวที่จะรับบริการทำหมัน ต้องอดอาหารและน้ำ ก่อนนำมาทำหมัน 8-12ชั่วโมง
*ไม่ทำหมันให้กับสุนัขหน้าสั้นด้วยนะครับ อาทิเช่น ปั๊ก ชิวาวา ชิสุ ปอมเมอร์เรเนียน*
**ติดต่อรับบัตรคิวทำหมันสัตว์เลี้ยงที่หน้างานเท่านั้นเวลา 08.00 น.**
23 กุมภาพันธ์ 2567 ทำหมันหมาแมวฟรี ในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ ณ ตลาดปัฐวิกรณ์ เขตบึงกุ่ม
ทำหมันหมาแมวฟรี ในงานกิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 23 กุมภาพันธ์ 2567 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ตลาดปัฐวิกรณ์ เขตบึงกุ่ม รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
28 ก.พ. 67 ทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว ณ อาคารกีฬานิมิบุตร
หน่วยสัตวแพทย์เคลื่อนที่ 28 ก.พ. 67 ณ อาคารกีฬานิมิบุตร สนามกีฬาแห่งชาติ เขตปทุมวัน รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
หน่วยเคลื่อนที่ ทำหมัน ในกรุงเทพ เดือนมีนาคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนมีนาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
บริการฉีดวัคซีน 50 เขตกทม. ป้องกันพิษสุนัขบ้า รอบมีนาคม เช็คกำหนดการและจุดบริการที่นี่
- 1 มี.ค. เวลา 8-14.00 น. ตลาดเอซี สายไหม เขตสายไหม งาน สุขภาพดี ใกล้บ้าน ใกล้หมอ
- 5 มี.ค. เวลา 9-12.00 น. ชุมชนเขมาเนรมิต บางซื่อ / ชุมชนทับแก้ว ห้วยขวาง
- 6 มี.ค. เวลา 9-12.00 น. ซอยลาดพร้าว 101/2 เขตบางกะปิ / ชุมชนพึ่งทรัพย์ เขตบางนา
- 7 มี.ค. เวลา 9-12.00 น. ชุมชนโฟร์โมสต์ เขตบางขุนเทียน / วัดบวรมงคล บางพลัด
- 8 มี.ค. เวลา 8-14.00 น. ลานกีฬาพัฒน์ 2 เขตราชเทวี
- 12 มี.ค. เวลา 9-12.00 น. ชุมชนลาดพร้าว 45 เขตห้วยขวาง / หมู่บ้านดวงวิภา เขตบางบอน
- 13 มี.ค. เวลา 9-12.00 น. วัดราษโกษา ลาดกระบัง / ชุมชนอัลเอี๊ยะติชอม สวนหลวง
- 14 มี.ค. เวลา 9-12.00 น. ตลาดผู้ใหญ่อ้วน ลาดพร้าว / ชุมชนสุขอนันต์ คันนายาว
- 15 มี.ค. เวลา 9-12.00 น. วัดทองบางเชือกหนัง ตลิ่งชัน
- 19 มี.ค. 9-12.00 น. มัสยิดสวนพลู ธนบุรี / ชุมชนเย็นอากาศ 2 ยานนาวา
- 20 มี.ค. 9-12.00 น. โรงเรียนวัดพลับพลาชัย ป้อมปราบฯ / ชุมชนสุวรรณี 3 วัฒนา
- 21 มี.ค. 9-12.00 น. ผ่าตัดทำหมันสุนัขและแมว ฟรี‼️ ณ วัดไผ่ตัน ซ.พหลโยธิน 15
- 22 มี.ค. 8-14.00 น. วิทยาลัยพาณิชยการบางนา เขตบางนา (ลงทะเบียนหน้างาน)
- 26 มี.ค. 9-12.00 น. ชุมชนศิริสุข ดอนเมือง / ชุมชนเคหะท่าทราย หลักสี่
- 27 มี.ค. 9-12.00 น. ชุมชนหมู่บ้านนิรันต์วิลล่า พระโขนง / ชุมชนวัดกลาง บางกะปิ
- 28 มี.ค. 9-12.00 น. โรงพยาบาลราชทัณฑ์ ลาดยาว จตุจักร / ชุมชนทับช้างนาลุ่ม สะพานสูง / ศูนย์บริการสาธารณสุข 45 ร่มเกล้า ลาดกระบัง
- 29 มี.ค. 9-12.00 น. วัดจันทร์ประดิษฐาราม ภาษีเจริญ
1 มีนาคม 2567 ทำหมันหมาแมวในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ ตลาดเอซีสายไหม เขตสายไหม
"สุขภาพดี ใกล้บ้าน ใกล้หมอ" ตรวจสุขภาพฟรี‼️และอื่น ๆ อีกมากมาย ทุกคนสามารถมาเจอกันได้ในวันที่ 1 มีนาคม 2567 นี้ ตั้งแต่เวลา 08.00 - 14.00 น. ณ ตลาดเอซีสายไหม เขตสายไหม
7-8 มีนาคม 2567 เทศบาลเมืองจันทบุรี ฉีดวัคซีน และทำหมัน ฟรี
เทศบาลเมืองจันทบุรี แจ้งข่าวดีสำหรับทาสน้องหมาและน้องแมว รับการฉีดวัคซีน และทำหมัน ฟรี!! วันที่ 7 - 8 มีนาคม 2567 เวลา 09.00 - 12.00 น. ที่ ลานกีฬาคนรักจันท์ ทุ่งนาเชย ( สี่แยกแวร์ซาย ) สำหรับประชาชนที่จะทำหมันน้องหมาหรือน้องแมวให้งดอาหารช่วงเช้ามาด้วยนะครับ อย่าลืม!! นำบัตรประชาชน หรือทะเบียนบ้าน มาด้วยนะครับ ( เฉพาะประชาชนในเขตเทศบาลเมืองจันทบุรี )
8 มีนาคม 2567 ทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว ณ ลานกีฬาพัฒน์ 2 เขตราชเทวี
หน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว ฟรี ในงานกิจกรรม "สุขภาพดี ใกล้บ้าน ใกล้หมอ" 8 มีนาคม 2567 ณ ลานกีฬาพัฒน์ 2 เขตราชเทวี ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
15 มีนาคม 2567 ทำหมันหมาแมว ฟรี วัดทองบางเชือกหนัง เขตตลิ่งชัน
ทำหมันหมาแมว ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิปน้องหมา ฟรี ในกิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" วันที่ 15 มีนาคม 2567 เวลา 08.00 - 14.00 น. ณ วัดทองบางเชือกหนัง เขตตลิ่งชัน
18 มีนาคม 2567 เขตวังทองหลาง ทำหมันแมวจรจัด ฟรี
สำนักงานเขตวังทองหลาง ร่วมกับสำนักงานสัตวแพทย์สาธารณสุข เปิดให้บริการผ่าตัดทำหมัน "แมวจรจัด" ฟรี เฉพาะในเขตวังทองหลาง เท่านั้น ย้ำ "แมวจรจัด" เท่านั้น และจำนวนจำกัด สอบถามข้อมูลเพิ่มเติม โทร. 02-5140512 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวังทองหลาง
20 มี.ค. 2567 ทำหมันสัตว์ (ต้องจองล่วงหน้า) ฉีดวัคซีนป้องกันพิษสุนัขบ้า วัดพลับพลาชัย
กิจกรรม ทำหมันสัตว์ (ต้องจองล่วงหน้า) ฉีดวัคซีนป้องกันพิษสุนัขบ้า ณ โรงเรียนวัดพลับพลาชัย วันพุธที่ 20 มี.ค. 2567 เวลา 09.00- 12.00 น. ประสานงานโดย ส.ก.นิภาพรรณ จึงเลิศศิริ (กุ๊บ) โทร.0926397446 ‼️ฟรีตลอดงาน‼️
21 มีนาคม 2567 ผ่าตัดทำหมันสุนัขและแมว ฟรี‼️ ณ วัดไผ่ตัน ซ.พหลโยธิน 15
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานเขตพญาไท สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร และมูลนิธิอนุรักษ์ช้างและสิ่งแวดล้อม ร่วมจัดกิจกรรมบูรณาการออกหน่วยสัตวแพทย์เคลื่อนที่ร่วมกับภาคีเครือข่าย ผ่าตัดทำหมันสุนัขและแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่กรุงเทพมหานคร ฟรี‼️ ณ วัดไผ่ตัน ซอยพหลโยธิน 15 เขตพญาไท ในวันพฤหัสบดีที่ 21 มีนาคม 2567 เวลา 09.00 ถึง 12.00 น. รับจองทำหมันจำนวนจำกัด 100 ตัว ลงทะเบียนจองคิวทำหมันล่วงหน้า ผ่าน inbox เพจ
facebook.com/rabiesbkk ได้เลย
24 มีนาคม 2567 ผ่าตัดทำหมันหมาแมว ฉีคซีน ฟรี วัดคลองครุ
24 มีนาคม 2567 ผ่าตัดทำหมันหมาแมว ฉีคซีน ฟรี วัดคลองครุ ปัฐวิกรณ์ เขตคันนายาว เวลา 8.30-12.00 น.
28-31 มีนาคม 2567 ฉีดวัคซีน ฉีดไมโครชิปจดทะเบียนสุนัข ฟรี งาน Pet Healthcare 2024
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฉีดไมโครชิปจดทะเบียนสุนัข (เฉพาะสุนัขที่อาศัย ในเขตกรุงเทพมหานคร) ฟรี ในงาน Pet Healthcare 2024 มหกรรมสุขภาพสัตว์เลี้ยง ครั้งแรกในประเทศไทย วันที่ 28-31 มีนาคม 2567 เวลา 10.00 - 20.00 น. MCC Hall ชั้น 3 เดอะมอลล์ไลฟ์สโตร์ บางกะปิ งานนี้เข้าฟรีทั้งคนทั้งสัตว์เลี้ยง
29 มีนาคม 2567 ทำหมันสุนัขแมว 60 ตัว วัดจันทร์ประดิษฐาราม ภาษีเจริญ
29 มีนาคม 2567 ณ วัดจันทร์ประดิษฐาราม เขตภาษีเจริญ
รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว
ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
2 เมษายน 2567 รณรงค์ฉีดวัคซีนพิษสุนัขบ้าและทำหมันสุนัขแมวในพื้นที่จุฬาฯ
สถานเสาวภา ร่วมกับสำนักอนามัย กรุงเทพมหานครฯและชมรมนิสิตสัตวแพทย์จุฬาฯเพื่อสวัสดิภาพสัตว์ (JohnJud) โครงการ “รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าและการทำหมันสุนัขแมวในพื้นที่จุฬาลงกรณ์มหาวิทยาลัย”
ขอเชิญทุกท่านๆในพื้นที่จุฬาลงกรณ์มหาวิทยาลัยและบริเวณใกล้เคียง (เช่น สามย่าน บรรทัดทอง ฯลฯ) พาสุนัขและแมวมาฉีดวัคซีนและทำหมันได้ ฟรี!! ไม่มีค่าใช้จ่าย เพื่อเป็นการควบคุมประชากรและโรคระบาดของสัตว์ในบริเวณรอบพื้นที่มหาวิทยาลัย (วัคซีนพิษสุนัขบ้าสำหรับสุนัขและแมว, และวัคซีนรวมแมว)
ฟรี ไม่มีค่าใช้จ่าย โดยลงทะเบียนตาม QR code หรือตามลิ้ง ด้านล่างล่วงหน้า และพาน้อง ๆ มาได้ในวันที่ 2 เมษายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย เวลา 8.30-15.00 น. ติดต่อสอบถามข้อมูลเพิ่มเติม 02 252 0161-4 ต่อ 82872 ฝ่ายชันสูตรและวิจัยโรคในสัตว์ สถานเสาวภา
สามารถเป็นได้ทั้งสัตว์ที่มีเจ้าของและสัตว์ไม่มีเจ้าของที่สามารถจับมาได้
*สำหรับสัตว์เลี้ยงที่จะเข้ารับการทำหมัน หลังจากลงทะเบียนแล้ว จะมีการติดต่อกลับเพื่อยืนยันสิทธิและมีข้อแนะนำในการเตรียมตัวสัตว์ก่อนเข้ารับการทำหมัน เพื่อความปลอดภัยของสัตว์เลี้ยงกรุณาเตรียมตัวสัตว์เลี้ยงอย่างเคร่งครัด
2 เมษายน 2567 คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา ประกาศ รายชื่อผู้ได้สิทธิรับวัคซีนป้องกันโรคพิษสุนัขบ้าและวัคซีนรวมแมว
คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา ประกาศ รายชื่อผู้ได้สิทธิรับวัคซีนป้องกันโรคพิษสุนัขบ้าและวัคซีนรวมแมว
สามารถตรวจสอบรายชื่อได้ที่ QR code ในรูปภาพหรือ
ลิ้ง ติดต่อสอบถามข้อมูลเพิ่มเติม ฝ่ายชันสูตรและวิจัยโรคในสัตว์สถานเสาวภา02 252 0161-4 ต่อ 82872
21 เมษายน 2567 เขตห้วยขวาง ทำหมันหมาแมว 100 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ
สำนักงานเขตห้วยขวาง และสมาชิกสภากรุงเทพมหานคร เขตห้วยขวาง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันอาทิตย์ที่ 21 เมษายน 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนประชาราษฎร์บำเพ็ญ เขตห้วยขวาง (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.) สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
• ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ เบอร์โทรศัพท์ 063-779-0047
• รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตห้วยขวาง กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
26 เมษายน 2567 ทำหมันหมาแมว ฟรี สวนป่าปฏิบัติธรรม วัดมัชฌันติการาม บางซื่อ
เขตบางซื่อ เชิญชวนมาตรวจสุขภาพฟรี! กับโครงการ “กรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ” โครงการดีๆ ที่จะตรวจสุขภาพฟรีให้กับประชาชน 1 ล้านคน ในวันศุกร์ที่ 26 เมษายน 2567 เวลา 08.00-14.00 น. ณ สวนป่าปฏิบัติธรรม วัดมัชฌันติการาม กิจกรรมสุขภาพในงานมากมาย ได้แก่
- ทำหมันหมาแมว ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป (น้องหมา)
- แจกแว่นตา สายตายาว
- ตรวจสุขภาพ เบาหวาน ต้อหิน มะเร็งปากมดลูก เอกซเรย์ปอด ตรวจฟัน (อุด ขูด ถอน) ตรวจคลื่นไฟฟ้าห้วใจ
- กิจกรรมอื่น ๆ มากมาย
29 เมษายน 2567 โรงเรียนวัดราษฎร์ศรัทธาธรรม เขตพระโขนง
วันจันทร์ที่ 29 เมษายน 2567 สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร กรมปศุสัตว์ จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี ที่โรงเรียนวัดราษฎร์ศรัทธาธรรม แขวงบางจาก เขตพระโขนง เวลา 8.30 - 11.30 น.
ทำหมันสุนัขและแมว โดย กรมปศุสัตว์ (โทรจองคิวทำหมันล่วงหน้า ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพระโขนง เบอร์ 02-311-3538)
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัขและแมว โดย สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย (สามารถ walk in มาได้เลย)
31 มีนาคม 2567 ทำหมันสุนัขและแมว จำนวน 100 ตัว ฟรี งานมหกรรมสมัชชาสุขภาพกรุงเทพฯ ครั้งที่ 4 LINK
สำนักอนามัย กรุงเทพมหานคร ขอเชิญร่วมงานมหกรรมสมัชชาสุขภาพกรุงเทพฯ ครั้งที่ 4 พ.ศ.2567 วันอาทิตย์ที่ 31 มีนาคม 2567 ตั้งแต่เวลา 06.00 -19.30 น. ณ ลานคนเมือง ศาลาว่าการกรุงเทพมหานคร เสาชิงช้า เขตพระนคร กรุงเทพฯ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีให้บริการ ทำหมันสุนัขและแมว จำนวน 100 ตัว ฟรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้สุนัขและแมว จำนวน 300 ตัว ฟรี ฉีดไมโครชิปจดทะเบียนสุนัข จำนวน 100 ตัว ฟรี
เริ่มให้บริการ 7.00 - 15.00 น. (ลงทะเบียนหน้างานเท่านั้น)
หน่วยสัตวแพทย์เคลื่อนที่ ทำหมัน พฤษภาคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนพฤษภาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 พ.ค. 8-14 น. โรงเรียนวัดจันทร์สโมสร เขตดุสิต
- 2 พ.ค. 9-12 น. วัดทรัพย์สโมสรนิกรเกษม หนองจอก / วัดโพธิ์แก้ว จอมทอง
- 3 พ.ค. 9-12 น. สวนป่าเฉลิมพระเกียรติ ใต้สะพานสมเด็จพระเจ้าตากสิน เขตคลองสาน
- 7 พ.ค. 9-12 น. ชุมชนชายลองบางบัว หลักสี่ / ชุมชนโสณมัย อร่ามดวง ยานนาวา
- 8 พ.ค. 9-12 น. โรงเรียนนาหลวง ทุ่งครุ / วัดนาคกลางวรวิหาร บางกอกใหญ่ (ลงทะเบียนหน้างาน)
- 9 พ.ค. 9-12 น. สมาคนไหหนำประเทศไทย บางรัก (ลงทะเบียนหน้างาน)
- 14 พ.ค. 9-12 น. ชุมชนเขมาเนรมิตร บางซื่อ / ชุมชนจัดสรรยาสูบ บางนา
- 15 พ.ค. 9-12 น. วัดเทพนารี บางพลัด / วัดวชิรธรรมสาธิต พระโขนง
- 16 พ.ค. 9-12 น. ชุมชนวัชรพล 3 สายไหม / ชุมชนสะและน้อย สวนหลวง
- 17 พ.ค. 8-14 น. วัดอุดมรังษี หนองแขม
- 21 พ.ค. 9-12 น. ตลาดผู้ใหญ่อ้วน ลาดพร้าว / หมุ่บ้านดีเค บางบอน
- 23 พ.ค. 9-12 น. วัดลาดกระบัง
- 24 พ.ค. 9-12 น. ห้างแฟชั่นไอร์แลนด์ คันนายาว
- 28 พ.ค. 9-12 น. หมู่บ้านชัยพฤกษ์ ทวีวัฒนา / ลานกีฬาพัฒน์ 2 ราชเทวี
- 29 พ.ค. 9-12 น. ชุมชนบึงพระรามเก้าพัฒนา บ่อ 1 ห้วยขวาง / ชุมชนมัสยิดมหานาค ป้อมปราบ
- 30 พ.ค. 9-12 น. วัดมณฑป ตลิ่งชั้น / ชุมชนดาวทอง ดอนเมือง / ศูนย์สาธารณสุข 45 ร่มเกล้า ลาดกระบัง
- 31 พ.ค. 8-14 น. ห้างโลตัส หลักสี่ บางเขน
1 พ.ค. 2567 หน่วยสัตวแพทย์เคลื่อนที่ ณ วัดจันทรสโมสร เขตดุสิต
หน่วยสัตวแพทย์เคลื่อนที่ 1 พ.ค. 2567 ณ วัดจันทรสโมสร เขตดุสิต ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
3 พฤษภาคม 2567 ทำหมันสุนัขฟรี ณ สวนป่าเฉลิมพระเกียรติ คลองสาน ในงาน กิจกรรมบริการสุขภาพเคลื่อนที่
บริการทำหมัน น้องหมาน้องแมว ฟรี ในงาน "สุขภาพดี ใกล้บ้าน ใกล้หมอ" กิจกรรมบริการสุขภาพเคลื่อนที่ วันที่ 3 พฤษภาคม 2567 ตั้งแต่เวลา 08.00 - 14.00 น. ณ สวนป่าเฉลิมพระเกียรติ ใต้สะพานสมเด็จพระเจ้าตากสินมหาราช #เขตคลองสาน
8 พ.ค. 67 วัดนาคกลาง
สำนักงานเขตบางกอกใหญ่ ขอเชิญชวนเจ้าของน้องหมา น้องแมว พาสัตว์เลี้ยงแสนรัก มาฉีดวัคซีน ทำหมัน และฉีดไมโครชิป วันพุธที่ 8 พ.ค.นี้ ตั้งแต่ 09.00- 11.00 น. ณ วัดนาคกลาง
9 พ.ค. 2567 หน่วยสัตวแพทย์เคลื่อนที่ ณ สมาคมไหหนำแห่งประเทศไทย เขตบางรัก
หน่วยสัตวแพทย์เคลื่อนที่ 9 พ.ค. 2567 ณ สมาคมไหหนำแห่งประเทศไทย เขตบางรัก
✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว)
ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
12 พฤษภาคม 2567 ณ บ้านเอื้ออาทรรามอินทรา (คู้บอน) ซอยคู้บอน 27
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตบางเขน ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
• ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตบางเขน กรุงเทพมหานคร เท่านั้น????????
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว????????
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถ สแกน Qr code เพื่อลงทะเบียนจองคิวทำหมันล่วงหน้า
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 12 พฤษภาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ บ้านเอื้ออาทรรามอินทรา (คู้บอน) ซอยคู้บอน 27 เขตบางเขน (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
สัตว์เลี้ยงที่นำมารับบริการทำหมัน
1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
2. ถ้าเป็นเพศเมียต้องไม่ท้อง
3. มีอายุตั้งแต่ 6 เดือนขึ้นไป
4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 10 ชั่วโมง ก่อนพามาทำหมันเพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต
5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ
6. สำหรับแมวให้นำตระกร้า หรือ กรงขัง แมว ขนาดใหญ่มาด้วย เพื่อความสะดวกในการนำสัตว์กลับหลังจากการทำหมันเสร็จ
7. สุนัขให้ผูกโซ่ หรือเชือก กับสายจูง ให้แน่นหนา ขณะที่นำมารับบริการ
8. สุนัขพันธุ์เล็ก หรือพันธุ์ที่หน้าสั้น ไม่สามารถรับบริการทำหมันได้
*** ทั้งนี้อาจมีปัจจัยอื่น ๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
13 พ.ค. 2567 ฉีดวัคซีนฟรี ชุมชนพุทธ-มุสลิมสามัคคี เขตลาดกระบัง
กลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานครระบุว่า วันจันทร์ที่ 13 พฤษภาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข จะจัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี ที่ชุมชนพุทธ-มุสลิมสามัคคี แขวงคลองสามประเวศ เขตลาดกระบัง ในเวลา 9.30 - 11.30 น. เมื่อวันที่ ( 9 พฤษภาคม 2567 ) 13-17 พ.ค. 2567 ฉีดวัคซีนหมาแมว ฟรี MCC Hall ชั้น 3 The Mall บางแค
สำนักอนามัย โดยสำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ ห้างเดอะมอลล์ ไลฟ์สโตร์ บางแค ร่วมจัดกิจกรรม ในงาน "The Mall Lifestore Jungle Walk 2024" โดยสำนักงานสัตวแพทย์สาธารณสุข ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมว ระหว่างวันที่ 13 - 17 พฤษภาคม 2567 เวลา 10.00 - 16.30 น. ที่ MCC Hall ชั้น 3 The Mall Lifestore Bangkae
17 พ.ค. 2567 ทำหมันสุนัขแมว 60 ตัว ณ วัดอุดมรังษี เขตหนองแขม
หน่วยสัตวแพทย์เคลื่อนที่ 17 พ.ค. 2567 ณ วัดอุดมรังษี เขตหนองแขม ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
20 พ.ค. 2567 เขตวังทองหลาง บริการผ่าตัดทำหมัน แมวจรจัด ฟรี
เขตวังทองหลาง เปิดให้บริการผ่าตัดทำหมัน "แมวจรจัด" ย้ำ "แมวจรจัด" ฟรี
*จำนวนจำกัดนะจ๊ะ*
** วันจันทร์ที่ 20 พฤษภาคม 2567 ณ ที่ทำการชุมชนรุ่งมณีพัฒนา ซอยรามคำแหง 39 แยก 5 (รามคำแหง 39 ซอย 5) แขวงพลับพลา เขตวังทองหลาง
หมายเหตุ : แมวจรจัดจะถูกทำสัญลักษณ์ บริเวณด้านข้างลำตัวและใบหูนะคะ
สอบถามข้อมูลเพิ่มเติม โทร. 0 2514 0512 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวังทองหลาง
20 พ.ค. 67 คิวทำหมันหลุดจอง เขตห้วยขวาง
คิวทำหมันหลุดจอง สำหรับน้องแมวที่ต้องการทำหมัน
ทาสแมวติดต่อมาด่วนนนน สอบถามเงื่อนไขเพิ่มเติม
โทร. 063-779-0047 หน่า ทีมงาน ส.ก.จุ๊บ
(หรือแอดไลน์เบอร์นี้ได้เลยค่ะ)
ส.ก. ประพฤทธ์ จุ๊บ หาญกิจจะกุล เขตห้วยขวาง
24 พ.ค. 2567 หน่วยสัตวแพทย์เคลื่อนที่ ณ ศูนย์การค้าแฟชั่นไอส์แลนด์
24 พ.ค. 2567 หน่วยสัตวแพทย์เคลื่อนที่ ออกให้บริการ ณ ศูนย์การค้าแฟชั่นไอส์แลนด์ เขตคันนายาว
✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว)
ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
30-31 พฤษภาคม 2567 ทำหมันแมวหมาสัญจรให้ฟรี อ.ท่าตะเกียบ ฉะเชิงเทรา
มูลนิธิอนุรักษ์ช้างและสิ่งแวดล้อมออกหน่วยทำหมันแมวหมาสัญจรให้ฟรี ในพื้นที่ตำบลคลองตะเกรา อำเภอท่าตะเกียบ ฉะเชิงเทรา ในวันที่ 30 และ 31 พฤษภาคม 2567 ตั้งแต่เวลา 09.00-16.00 เจ้าของสัตว์เลี้ยงในพื้นที่ท่าตะเกียบจังหวัดฉะเชิงเทราและพื้นที่ใกล้เคียง อย่าลืมเอาสัตว์เลี้ยงของท่านมาทำหมันและฉีดวัคซีน
31 พ.ค. 2567 หน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขแมว ห้างโสตัสหลักสี่ เขตบางเขน
หน่วยสัตวแพทย์เคลื่อนที่ 31 พ.ค. 2567 ณ ห้างโสตัสหลักสี่ เขตบางเขน ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
20 มิถุนายน 2565 ออกตรวจสุขภาพตาให้กับข้าราชการ รวมถึงประชาชนชาวกาฬสินธุ์
ออกตรวจสุขภาพตาให้กับข้าราชการ รวมถึงประชาชนชาวกาฬสินธุ์ศบส.46 กันตารัติอุทิศ เชิญประชาชนนำสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ได้ทุกวันศุกร์
ศบส.46 กันตารัติอุทิศ ขอเชิญประชาชนนำสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ได้ทุกวันศุกร์ เวลา 13.00 น. (ยกเว้นวันหยุดราชการ) ณ ศูนย์ฯ46 กันตารัติอุทิศ
หน่วยสัตวแพทย์เคลื่อนที่ กทม. ทำหมัน ฉีดวัคซีน มิถุนายน 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนมิถุนายน 2567 (สอบถามโทร 02-2487417 02-2453311)
- 4 มิ.ย. 9-12 น. วัดทรัพย์สโมสรนิกรเกษม หนองจอก / ชุมชนหมู่บ้านพลับพลา วังทองหลาง
- 5 มิ.ย. 9-12 น. ชุมชนสวนนกพัฒนา สะพานสูง / วัดบางสะแกนอก ธนบุรี
- 6 มิ.ย. 9-12 น. หมู่บ้านผาสุก ประเวศ / ชุมชนศาลาลอย วัฒนา
- 7 มิ.ย. 8-14 น. วัดสระเกศ ป้อมปราบฯ
- 11 มิ.ย. 9-12 น. ชุมชนสุขอนันต์ 26 บางกะปิ / ชุมชนเคหะนคร 2 ลาดกระบัง
- 12 มิ.ย. 9-12 น. ชุมชนวัดสังเวชวิศยาราม พระนคร / วัดบุญรอดธรรมาราม พระโขนง
- 13 มิ.ย. 9-12 น. วัดท่าข้าม บางขุนเทียน / สวนป่าเฉลิมพระเกียรติใต้สะพานสมเด็จพระเจ้าตากสิน คลองสาน
- 14 มิ.ย. 8-14 น. วัดปุรณาวาส ทวีวัฒนา
- 18 มิ.ย. 9-12 น. ชุมชนสวนอ้อย ดุสิต / ลานหน้า 7-11 สาขาซ.จรัลฯ 97 บางพลัด
- 19 มิ.ย. 9-12 น. ชุมชนเคหะบ่อนไก่ ปทุมวัน / วัดม่วง บางแค
- 20 มิ.ย. 9-12 น. ลานกีฬาปลอดยาเสพติด ใต้ทางด่วนศรีรัช บางรัก
- 21 มิ.ย. 8-14 น. วัดด่าน ยานนาวา
- 25 มิ.ย. 9-12 น. วัดปากบ่อ สวนหลวง / หมู่บ้านเคซี การ์เด้นโฮม คลองสามวา
- 26 มิ.ย. 9-12 น. ชุมชนวัดรางบัว ภาษีเจริญ / ลานหน้าสำนักงานเขตสาทร
- 27 มิ.ย. 9-12 น. สำนักงานเขตบางกอกน้อย / วัดบางนาใน บางนา / ศูนย์ฯ 45 ร่มเกล้า ลาดกระบัง
- 28 มิ.ย. 9-12 น. หมู่บ้านสินทวีพระราม 2 ซอย 43 จอมทอง / ชุมชนเคหะสถานเจริญชัย จตุจักร
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันอังคารที่ 4 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 3 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 5 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองอัลฮุดา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 6 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองฮาซานุดดีน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันจันทร์ที่ 10 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 4 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 11 มิถุนายน 2567 ที่ชุมชนกิตติชัย 2 แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 13 มิถุนายน 2567 ที่ลานกีฬาแสงทิพย์ ท้ายซอยปรีดีพนมยงค์ 2 ถนนสุขุมวิท 71 แขวงพระโขนงเหนือ เขตวัฒนา เวลา 9.00 - 12.00 น.
- วันจันทร์ที่ 17 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 5 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 18 มิถุนายน 2567 ที่ชุมชนหมู่บ้านธันยพฤกษ์ แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 19 มิถุนายน 2567 ที่ชุมชนผดุงพันธ์พัฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 20 มิถุนายน 2567 ที่ชุมชนหมู่บ้านสมนึก แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 25 มิถุนายน 2567 ที่หมู่บ้านจัดสรรอาร์เค พาร์ค รามอินทรา-ซาฟารี 2 แขวงบางชัน เขตคลองสามวา เวลา 9.30 - 11.30 น.
- วันพุธที่ 26 มิถุนายน 2567 ที่ชุมชนเลียบคลองสิบสาม แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 27 มิถุนายน 2567 ที่ชุมชนนันทวัน เซ็นท์ 2 แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันเสาร์ที่ 29 มิถุนายน 2567 ที่ตลาดธนบุรี (สนามหลวง 2) แขวงทวีวัฒนา เขตทวีวัฒนา เวลา 7.00 - 15.00 น.
ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี มิถุนายน 2567
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันอังคารที่ 4 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 3 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 5 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองอัลฮุดา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 6 มิถุนายน 2567 ที่ชุมชนแผ่นดินทองฮาซานุดดีน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันจันทร์ที่ 10 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 4 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 11 มิถุนายน 2567 ที่ชุมชนกิตติชัย 2 แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 13 มิถุนายน 2567 ที่ลานกีฬาแสงทิพย์ ท้ายซอยปรีดีพนมยงค์ 2 ถนนสุขุมวิท 71 แขวงพระโขนงเหนือ เขตวัฒนา เวลา 9.00 - 12.00 น.
- วันจันทร์ที่ 17 มิถุนายน 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 5 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 18 มิถุนายน 2567 ที่ชุมชนหมู่บ้านธันยพฤกษ์ แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 19 มิถุนายน 2567 ที่ชุมชนผดุงพันธ์พัฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 20 มิถุนายน 2567 ที่ชุมชนหมู่บ้านสมนึก แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันอังคารที่ 25 มิถุนายน 2567 ที่หมู่บ้านจัดสรรอาร์เค พาร์ค รามอินทรา-ซาฟารี 2 แขวงบางชัน เขตคลองสามวา เวลา 9.30 - 11.30 น.
- วันพุธที่ 26 มิถุนายน 2567 ที่ชุมชนเลียบคลองสิบสาม แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 27 มิถุนายน 2567 ที่ชุมชนนันทวัน เซ็นท์ 2 แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
6 มิย 67 ทำหมันแมวฟรี ณ รร.วัดปากบ่อ ซอยอ่อนนุช 35
7 มิถุนายน 2567 ทำหมันสุนัขแมว 60 ตัว ณ วัดสระเกศวรมหาวิหาร (ภูเขาทอง)
7 มิถุนายน 2567 หน่วยสัตวแพทย์เคลื่อนที่ ออกหน่วย ณ วัดสระเกศวรมหาวิหาร (ภูเขาทอง) เขตป้อมปราบศัตรูพ่าย
✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
เริ่มรับคิวทำหมัน 7.00 น.
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว)
ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
9 มิถุนายน 2567 ทำหมันหมาแมว 100 ตัว ฉีดวัคซีน 300 ตัว วัดไทร เขตบางคอแหลม
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร ร่วมกับ สำนักงานเขตบางคอแหลม ให้บริการทำหมัน วันอาทิตย์ที่ 9 มิถุนายน 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ
วัดไทร เขตบางคอแหลม (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.). สอบถาม/จองคิว โทร. 091-7899393
• ฟรี! ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตบางคอแหลม กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
14 มิถุนายน 67 ทำหมันสุนัขแมว ในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ วัดปุรณาวาส เขตทวีวัฒนา
กิจกรรม #บริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ตรวจสุขภาพ ฟรี‼️ และอื่น ๆ อีกมากมาย ทุกคนสามารถมาเจอกันได้ในวันที่ 14 มิถุนายน 2567 นี้ ตั้งแต่เวลา 08.00 - 14.00 น. ณ วัดปุรณาวาส เขตทวีวัฒนา
✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ เริ่มรับคิวทำหมัน 7.00 น.
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว)
✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
14 มิถุนายน 2567 ทำหมันหมาแมว ณ วัดปุรณาวาส เขตทวีวัฒนา
วันศุกร์ที่ 14 มิถุนายน 2567 พระครูเมตตามงคลวิศิษฎ์ เจ้าคณะเขตทวีวัฒนา และพระครูศรัทธาประชารักษ์ เจ้าอาวาสวัดปุรณาวาส ร่วมเป็นประธานฝ่ายสงฆ์ในพิธีเปิดหน่วยแพทย์และสาธารณสุขเคลื่อนที่ ตามโครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ โดยมีนางทวีพร โชตินุชิต ให้เกียรติเป็นประธานในพิธีเปิดหน่วยดังกล่าว โดยมีนายแพทย์ขจิต ชูปัญญา ประธานและคณะกรรมการมูลนิธิช่วยการสาธารณสุขชุมชนฯ (มสช.) สภาสังคมสงเคราะห์แห่งประเทศไทย ในพระบรมราชูปถัมภ์ ซึ่งให้การสนับสนุนอาหารกลางวันแก่ประชาชน (โครงการน้ำพระทัยพระราชทาน) นายยิ่งยงค์ จิตเพียรธรรม สมาชิกสภากรุงเทพมหานคร เขตทวีวัฒนา ผู้บริหารสำนักอนามัย ผู้บริหารสำนักงานเขตทวีวัฒนา ร่วมงาน
กิจกรรมประกอบด้วย การตรวจคัดกรองสุขภาพ รักษาโรคเบื้องต้น จ่ายยาเบื้องต้น และให้บริการรถเคลื่อนที่ ได้แก่ รถคัดกรองมะเร็งสตรี รถตรวจคัดกรองจอประสาทตา รถเอกซเรย์ รถทันตกรรม รถตรวจคุณภาพอาหาร หน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัข/แมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฝังไมโครชิปสุนัข กิจกรรมให้ความรู้ด้านทักษะเสริมสร้างความรู้ health literacy บูธคลินิกลดน้ำหนัก กิจกรรมเสริมภูมิคุ้มกันให้คำปรึกษาเรื่องยาเสพติด ให้คำแนะนำเรื่องการใช้ยา อาหารเสริม การให้ความรู้เรื่องอาหารปลอดภัย ให้คำแนะนำเรื่องฝุ่น PM 2.5 การทดสอบความฟิต การดูแลผู้ป่วยติดเตียงที่บ้าน การให้ความรู้ด้านโภชนาการ สุขภาพใจ นอกจากนี้ยังมี แจกแว่นตาผู้สูงอายุซึ่งได้รับการสนับสนุนจากมูลนิธิช่วยการสาธารณสุขชุมชนฯ และบูธกิจกรรมการสอน CPR สอนใช้เครื่อง AED จากโรงพยาบาลราชพิพัฒน์ และลงพื้นที่เยี่ยมผู้ป่วยติดบ้านติดเตียงในชุมชน
18 มิถุนายน 2567 กิจกรรม รักน้องหมา 24 ชั่วโมง ครั้งที่ 2 หน้าร้าน 7-Eleven สาขา จรัญฯ 97
กลับมาอีกครั้งกับโครงการ "รักน้องหมา 24 ชั่วโมง" ครั้งที่ 2 กิจกรรม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และทำหมันน้องหมา น้องแมว ฟรี วันอังคารที่ 18 มิถุนายน 2567 ️เวลา 9.00-12.00 น. ณ ลานกิจกรรม หน้าร้าน 7-Eleven สาขา 17798 (จรัญฯ 97) เขตบางพลัด กรุงเทพฯ [
ที่ตั้งจุดจัดงาน] ลงทะเบียน รับสิทธิ์ล่วงหน้าได้ที่
https://bit.ly/regisLoveForDog
นอกจากกิจกรรมฉีดวัคซีน ทำหมันแล้ว เรายังมีมุมถ่ายภาพสุดชิคสำหรับน้องหมาน้องแมว ทั้งยังมีกิจกรรมร่วมสนุกเพื่อรับของที่ระลึกอีกด้วย ใครอยู่ละแวกนี้ เชิญลงทะเบียนล่วงหน้า แล้วพาน้องๆ มากันได้เลยยย
18 มิถุนายน 2567 เขตดุสิต เปิดจองคิวทำหมัน สุนัข แมว ฟรี
เขตดุสิต เปิดจองคิวทำหมัน สุนัข แมว ฟรี! วันอังคารที่ 18 มิถุนายน 2567 ตั้งแต่เวลา 09.00-12.00 น. ณ ศูนย์เยาวชนสวนอ้อย หมายเหตุ งดน้ำงดอาหารน้อง 8-10 ชั่วโมง ก่อนผ่าตัด สามารถจองได้ที่เบอร์ 098-2591319 ฝ่ายสิ่งแวดล้อมฯ เขตดุสิต
20 มิถุนายน 2567 ทำหมันหมาแมว 100 ตัว ณ เขตบางรัก
สำนักงานเขตบางรัก ร่วมกับ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กทม. สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร และ มูลนิธิช้าง ให้บริการทำหมันสุนัขและแมว ณ ลานกีฬามหานครปลอดยาเสพติด (ใต้ทางด่วนศรีรัช) ในวันพฤหัสบดีที่ 20 มิถุนายน 2567 เวลา 09.00-12.00 น. งานนี้รับจำนวนจำกัด 100 ตัวเท่านั้น! โดยผู้ที่สนใจสามารถลงทะเบียนล่วงหน้าได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02 236 1395 ต่อ 6215 ตั้งแต่วันนี้ - 19 มิ.ย. 67 (หรือ walk-in ได้จนกว่าจะครบจำนวน)
18 มิถุนายน 2567 ทำหมันสุนัขแมว ฟรี ลานอเนกประสงค์วัดไทร (จอมทอง)
18 มิถุนายน 2567 ทำหมันสุนัขแมว ฟรี ลานอเนกประสงค์วัดไทร (จอมทอง) ตั้งแต่เวลา 9.00 น. เป็นต้นไป จำกัดจำนวนทำหมันหมาแมว 120 ตัว ฉีดวัคซีนหมาแมว 200 ตัว ลงทะเบียนได้ที่ คุณปอ 084-3351169 (จัดโดยนายวัน อยู่บำรุง )
กำหนดการ หน่วยสัตวแพทย์เคลื่อนที่ กทม. ออกหน่วยทำหมัน ฉีดวัคซีน ฟรี เดือนกรกฎาคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนกรกฎาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 2 ก.ค. 67 วัดสังฆราชา ลาดกระบัง / ชุมชนทับแก้ว ห้วยขวาง
- 3 ก.ค. 67 ชุมชน 70 ไร่ คลองเตย / ลานกีฬาพัฒน์ 2 ราชเทวี
- 4 ก.ค. 67 สำนักงานเขตบางเขน / วัดไผ่ตัน พญาไท
- 5 ก.ค. 67 วัดหลักสี่
- 9 ก.ค. 67 ชุมชนกัลยาณมิตร บางซื่อ / ชุมชนหมู่บ้านปัฐวิกรณ์ 1 ผัง ก คันนายาว
- 10 ก.ค. 67 วัดกระทุ่มเสือปลา ประเวศ / วัดพุทธบูชา ทุ่งครุ
- 11 ก.ค. 67 ชุมชนเชื้อเพลิงพัฒนา ยานนาวา / ชุมชนสามแยกคลองหลอแหล สะพานสูง
- 12 ก.ค. 67 ตลาดสุขสวัสดิ์ บางบอน
- 15-16 ก.ค. 67 เวลา 7.00-12.00 น. รพ.สัตว์ ม.เกษตร (หน่วยสัตวแพทย์อาสาจุฬาภรณ์)
- 17 ก.ค. 67 วิทยาลัยการอาชีพนวมินทราชูทิศ บึงกุ่ม / วัดจำปา ตลิ่งชัน
- 18 ก.ค. 67 วัดคฤหบดี บางพลัด / ชุมชนมารวย 1 สายไหม
- 19 ก.ค. 67 วิทยาลัยหัตถกรรมกรุงเทพ บางกะปิ
- 23 ก.ค. 67 ชุมชนมัสยิดบ้านสมเด็จ ธนบุรี / ตลาดผู้ใหญ่อ้วน ลาดพร้าว
- 24 ก.ค. 67 ชุมชนบัณฑิตโฮม ตอนเมือง / วัดกุนนทีรุทธาราม ดินแดง
- 25 ก.ค. 67 วัดสวัสดิ์วารีสีมาราม ดุสิต / สนง.เขตป้อมปราบ
- 26 ก.ค. 67 วิทยาลัยอาชีวศึกษากรุงเทพ บางกอกใหญ่
- 27 ก.ค. 67 วัดยาง สวนหลวง
- 30 ก.ค. 67 ชุมชนหัวหมากเกาะกลาง สวนหลวง / ชุมชนบัวเกิด บางนา
- 31 ก.ค. 67 ชุมชนเคหะฉลองกรุง หนองจอก / สำนักงานเขตสัมพันธวงศ์
- 1 ส.ค. 67 โรงเรียนวัดสังเวช พระนคร / ชุมชนวัดม่วงแค บางรัก
- 2 ส.ค. 67 วัดภาษี วัฒนา
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันอังคารที่ 2 กรกฎาคม 2567 ที่ชุมชนเคหะชุมชนร่มเกล้า โซน 6 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 3 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองคู้บนพัฒนา แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 4 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองยายชุ่มอุทิศ แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 9 กรกฎาคม 2567 ที่วัดศรีเอี่ยม แขวงบางนาเหนือ เขตบางนา เวลา 9.00 - 12.00 น.
- วันพุธที่ 10 กรกฎาคม 2567 ที่ชุมชนแผ่นดินทองสุกกาทอง แขวงโคกแฝด เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 11 กรกฎาคม 2567 ที่วัดพรหมวงศาราม (วัดหลวงพ่อเณร) แขวงรัชดาภิเษก เขตดินแดง เวลา 9.00 - 12.00 น.
- วันจันทร์ที่ 15 กรกฎาคม และ วันอังคารที่ 16 กรกฎาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ร่วมดำเนินโครงการ "สัตวแพทย์อาสาจุฬาภรณ์ กรุงเทพมหานคร" โดยจัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จำนวน 300 ตัว ณ บริเวณหน้าอาคารจักรพิชัยรณรงค์สงคราม ด้านหลังโรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ บางเขน แขวงลาดยาว เขตจตุจักร เวลา 7.00 - 12.00 น.
- วันพุธที่ 17 กรกฎาคม 2567 ที่ชุมชนรุ่งเรือง แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 23 กรกฎาคม 2567 ที่ชุมชนฟื้นนครร่มเกล้า ระยะ 3 โซน 8 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 กรกฎาคม 2567 ที่ วัดกุนนทีรุทธาราม เขตดินแดง เวลา 8.30 ถึง 11.00 น.
- วันพฤหัสบดีที่ 25 กรกฎาคม 2567 วัดไผ่ตัน แขวงพญาไท เขตพญาไท เวลา 9.00 - 12.00 น.
- วันอังคารที่ 30 กรกฎาคม 2567 ที่โรงเรียนแจ่มจันทร์ แขวงคลองตันเหนือ เขตวัฒนา เวลา 12.00 - 15.00 น.
- วันพุธที่ 31 กรกฎาคม 2567 ที่ ศาลเจ้าอาเนี้ยวโอว เจี่ยหยี ซอยเทอดไท 21 (โรงเจ) เขตธนบุรี 8.00 - 15.00 น.
- วันพฤหัสบดีที่ 1 สิงหาคม 2567 ที่วัดสะพาน แขวงพระโขนง เขตคลองเตย เวลา 9.00 - 12.00 น.
2 กรกฎาคม 2567 ทำหมันหมาแมว ฟรี ณ ชุมชนทับแก้ว
3 กรกฎาคม 2567 เปิดรับลงทะเบียนทำหมันฉีดวัคซีนสุนัขและแมว (ฟรี)
เปิดรับลงทะเบียนทำหมันฉีดวัคซีนสุนัขและแมว (ฟรีไม่เสียค่าใช้จ่าย) ณ ลานกีฬาพัฒน์2 (ฝั่งบ้านหนังสือ) เขตราชเทวี วันที่ 3 กรกฎาคม 2567 เวลา 09.00-11.30น. หมายเหตุ : ลงทะเบียนจองคิวได้ที่ https://forms.gle/Ki1qH7tpyj2upqHY9
4 กรกฎาคม 2567 ผ่าตัดทำหมันสุนัขและแมวและฉีดวัคซีน ณ วัดไผ่ตัน ซอยพหลโยธิน 15
เขตพญาไท ร่วมกับกลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข เขตดินแดง จัดกิจกรรมบูรณาการออกหน่วยสัตวแพทย์เคลื่อนที่กับภาคีเครือข่าย ผ่าตัดทำหมันสุนัขและแมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในพื้นที่กรุงเทพมหานคร ฟรี‼️ ณ วัดไผ่ตัน ซอยพหลโยธิน 15 เขตพญาไท ✅ วันพฤหัสบดีที่ 4 กรกฎาคม 2567 ✅ เวลา 09.00 ถึง 11.00 น. รับจองทำหมันจำนวนจำกัด 35 ตัว ฉีดวัคซีนโรคพิษสุนัขบ้า จำนวน 200 ตัว ลงทะเบียนหน้างาน
4,11,18,25 กรกฎาคม 2567 ฉีดวัคซีน ฟรี ศบส.40 บางแค
ศูนย์บริการสาธารณสุข 40 บางแค ชวนฉีดวัคซีนป้องกันพิษสุนัขบ้า ฟรี‼️ฟรี‼️ ฟรี‼️ ตามวัน เวลา ด้านล่างนี้
4 ก.ค.67 08.30 - 10.00 น. ~ ชุมชนข้างโรงพยาบาลราชพิพัฒน์ / 10.00 - 12.00 น. ~ ชุมชนสามัคคีศิริเกษม 2
11 ก.ค.67 08.30 - 10.00 น. ~ ชุมชนศิริเกษมรวมใจ 50 / 10.00 - 12.00 น. ~ ชุมชนศิริเกษมพัฒนา
18 ก.ค.67 09.00 - 11.00 น. ~ ชุมชนจั่นแก้ว
25 ก.ค.67 09.00 - 11.00 น. ~ ชุมชนเทพพิทักษ์
หมายเหตุ : อายุตั้งแต่ 3 เดือนขึ้นไป สุขภาพร่างกายแข็งแรงสมบูรณ์ ไม่อยู่ในช่วงตั้งครรภ์ หรือให้นมลูก
***เตรียมบัตรประชาชน และกระติกใส่น้ำแข็งมาด้วย
5 กรกฎาคม 2567 ณ วัดหลักสี่ เขตหลักสี่
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 5 กรกฎาคม 2567 ณ วัดหลักสี่ เขตหลักสี่ ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
5-31 กรกฎาคม 2567 รพ.สัตว์ ม.เกษตร 5 แห่ง ฉีดวัคซีน ฟรี
เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ พระบาทสมเด็จพระเจ้าอยู่หัว และวันคล้ายวันประสูติ สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารีฯ
คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ขอเชิญเจ้าของสัตว์เลี้ยง นำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วัคซีนรวม 5 โรค และวัคซีนโรคไข้หัดแมว ฟรี ณ โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ทั้ง 5 แห่ง (บางเขน กำแพงแสน หนองโพ หัวหิน ทิพย์พิมาน) เฉพาะในเวลาทำการ
5-31 กรกฎาคม 2567 ฉีดวัคซีน ฟรี รพ.สัตว์ ม.เกษตร บางเขน
รพ.สัตว์ ม.เกษตร บางเขน บริการฉีดวัคซีน ฟรี สำหรับ ป้องกันโรคพิษสุนัขบ้า วัคซีนรวม 5 โรคสุนัข วัคซีนโรคไข้หัดหวัดแมว (ไม่มีค่าใช้จ่าย และค่าบริการโรงพยาบาลสัตว์) ตั้งแต่วันที่ 5-31 กรกฎาคม 2567 วันจันทร์-พฤหัสบดี เวลา 8.30-14.00 น. วันศุกร์ 8.30-11.00 น. ติดต่อสอบถามโทร 02-7971900 กด 9
6 กรกฎาคม 2567 วัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิปจดทะเบียนสุนัข ฟรี ให้กับสุนัขและแมว ที่ตลาดนัดมีนบุรี
วันเสาร์ที่ 6 กรกฎาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข จัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว และฉีดไมโครชิปจดทะเบียนสุนัข ฟรี ที่ตลาดนัดมีนบุรี (จตุจักร 2) แขวงมีนบุรี เขตมีนบุรี เวลา 8.00 - 15.00 น.
กิจกรรม จะมีการตรวจคัดกรองสุขภาพ เจาะเลือด เอกซเรย์ปอด ตรวจคลื่นไฟฟ้าหัวใจ ตรวจจอประสาทตา สามารถเริ่มลงทะเบียนได้ตั้งแต่เวลา 08.00 น. เป็นต้นไป เพื่อ ป้องกันหรือค้นหาโรคและภาวะผิดปกติในร่างกายของประชาชนผู้รับบริการ การให้บริการขออนุญาตประกอบกิจการที่เป็นอันตรายต่อสุขภาพ “ที่เกี่ยวกับสัตว์เลี้ยง“ และยังมีหน่วยสัตวแพทย์เคลื่อนที่ เพื่อฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยงของท่าน ผู้สนใจสามารถนำสัตว์เลี้ยงของท่านมาฉีดวัคซีน โดยไม่เสียค่าบริการแต่อย่างใด
สามารถสอบถามข้อมูลเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตมีนบุรี เบอร์โทรติดต่อ 02 914 5834
8 กรกฎาคม 2567 เขตวังทองหลาง บริการผ่าตัดทำหมัน "แมวจรจัด" ฟรี
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวังทองหลาง เปิดให้บริการผ่าตัดทำหมัน "แมวจรจัด" ฟรี จำนวนจำกัด ให้บริการ วันจันทร์ที่ 8 กรกฎาคม 2567 เวลา 09.00-11.00 น. ณ ลานจอดรถสำนักงานเขตวังทองหลาง
หมายเหตุ : แมวจรจัดจะถูกทำสัญลักษณ์ บริเวณด้านข้างลำตัวและใบหู งดให้อาหารแมว 8-10 ชั่วโมง สอบถามข้อมูลเพิ่มเติมและติดต่อขอรับกรงดักแมว ได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวังทองหลาง โทร. 025140512
12 กรกฎาคม 2567 ทำหมันหมาแมว ณ ตลาดสุขสวัสดี เขตบางบอน
บริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ตรวจสุขภาพ ฟรี‼️ และอื่น ๆ อีกมากมาย ทุกคนสามารถมาเจอกันได้ในวันที่ 12 กรกฎาคม 2567 นี้ ตั้งแต่เวลา 08.00 - 14.00 น. ณ ตลาดสุขสวัสดี เขตบางบอน
14 กรกฎาคม 2567 ทำหมัน ฟรี 100 ตัว ฉีดวัคซีน 300 ตัว ณ วัดพระยาสุเรนทร์ เขตคลองสามวา
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตคลองสามวา ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตคลองสามวา (เท่านั้น) เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันอาทิตย์ที่ 14 กรกฎาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดพระยาสุเรนทร์ เขตคลองสามวา (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
ทำหมัน รับจำนวนจำกัด 100 ตัว. จำกัดคนละไม่เกิน 2 ตัว _ จองคิว โดยสแกน QR code
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว _ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
15-16 กรกฎาคม 2567 ทำหมันสุนัขแมว ฟรี ณ รพ.สัตว์ม.เกษตร บางเขน
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ร่วมจัด "หน่วยสัตวแพทย์อาสาจุฬาภรณ์" พื้นที่กรุงเทพมหานคร เชิญชวนประชาชน นำสุนัขและแมวในพื้นที่กรุงเทพมหานคร เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!
ในวันจันทร์ที่ 15 และวันอังคารที่ 16 กรกฎาคม 2567 ณ โรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตบางเขน เขตจตุจักร [
แผนที่]
- ทำหมัน รับจำนวนจำกัด 100 ตัวต่อวัน จำกัดคนละไม่เกิน 5 ตัว รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่กรุงเทพมหานคร เท่านั้น
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว ใน inbox โดยแจ้งรายละเอียด
1. ชื่อ นามสกุล (คนที่พามา)
2. ที่อยู่ของสัตว์ (ในพื้นที่กรุงเทพมหานคร)
3. ชนิดสัตว์ สุนัข/แมว สายพันธุ์ จำนวนตัว
4. หมายเลขโทรศัพท์
5. ระบุวันที่จองคิวทำหมัน (15 หรือ 16 ก.ค. 67)
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
- นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันที่ 15 และ 16 กรกฎาคม 2567 ตั้งแต่เวลา 06.30 - 12.00 น. ณ โรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตบางเขน เขตจตุจักร (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.45 น.)
- จุดรับลงทะเบียนทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า อยู่บริเวณเต๊นท์ข้างสระว่ายน้ำสุวรรณชาด
สัตว์เลี้ยงที่นำมารับบริการทำหมัน
1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
2. ถ้าเป็นเพศเมียต้องไม่ท้อง
3. มีอายุตั้งแต่ 6 เดือนขึ้นไป
4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 10 ชั่วโมง ก่อนพามาทำหมันเพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต
5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ
6. สำหรับแมวให้นำตระกร้า หรือ กรงขังแมว ขนาดใหญ่มาด้วย เพื่อความสะดวกในการนำสัตว์กลับหลังจากการทำหมันเสร็จ
7. สุนัขให้ผูกโซ่ หรือเชือก กับสายจูง ให้แน่นหนา ขณะที่นำมารับบริการ
8. สุนัขพันธุ์เล็ก พันธุ์ที่หน้าสั้น หรือมีปัญหาทางระบบทางเดินหายใจหรือหัวใจ ไม่สามารถรับบริการทำหมันได้
*** ทั้งนี้อาจมีปัจจัยอื่นๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
17 กรกฏาคม 2567 ทำหมันหมาแมวฟรี จำกัด 35 ตัว ณ วิทยาลัยการอาชีพนวมินทราชูทิศ ซอยนวลจันทร์ 56
บริการทำหมัน-ฉีดวัคซีน ให้กับสุนัข-แมว (ทำหมันรับจำนวนจำกัด 35 ตัว) ในวันพุธที่ 17 กรกฏาคม ตั้งแต่เวลา 9:00 - 12:00 น. ณ วิทยาลัยการอาชีพนวมินทราชูทิศ ซอยนวลจันทร์ 56 ท่านใดสนใจสามารถลงทะเบียนได้เลยครับ
18 กรกฎาคม 2567 ทำหมันสุนัขและแมวฟรี
โครงการทำหมันสุนัขและแมวฟรี วันพฤหัสบดี ที่ 18 กรกฎาคม เวลา 09:00น. ณ วัดคฤหบดี ซ.จรัลฯ44 เงื่อนไข - ให้สิทธิ์ทางเพจ 15 ตัวแรก (ใครแจ้งก่อนได้ก่อน) - วัคซีนป้องกันพิษสุนัขบ้า (ไม่จำกัด) **มาฉีดได้ในวันจัดกิจกรรมที่กำหนด
18 กรกฎาคม 2567 รพ.สัตว์เล็กจุฬาฯ ฉีดวัคซีนสุนัขบ้า วัคซีนรวม ฟรี
เนื่องในวาระครบรอบ 30 ปี
แผนกสัตวแพทยศาสตร์ ทุนมูลนิธิอานันทมหิดล ขอเชิญเจ้าของสัตว์เลี้ยงนำสัตว์เลี้ยงมาเข้ารับวัคซีนพิษสุนัขบ้า วัคซีนรวมสุนัข พร้อมปรึกษาปัญหาสุขภาพในสัตว์เลี้ยงโดยสัตวแพทย์ และรับผลิตภัณฑ์เพื่อสุขภาพสัตว์เลี้ยง ฟรี !! วันพฤหัสบดีที่ 18 กรกฎาคม 2567 เวลา 8.30-15.00 น. ณ โถงชั้น 1 อาคารสัตววิทยวิจักษ์ คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ติดต่อสอบถามเพิ่มเติมได้ที่ @CUVET Line OFFICIAL https://lin.ee/9xQRN4u #CUVET
19 กรกฎาคม 2567 ทำหมันฟรี ณ วิทยาลัยศิลปหัตถกรรมกรุงเทพ (ช่างหนัง) ซ.ลาดพร้าว 101
สำนักอนามัยและศูนย์บริการสาธารณสุข 35 จัดกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ พร้อมบริการทำหมันสุนัขแมว ฉีดวัคซีน ไมโครชิปสุนัข วันศุกร์ที่ 19 กรกฎาคม 2567 เวลา 8.00-12.00 น. ณ วิทยาลัยศิลปหัตถกรรมกรุงเทพ (ช่างหนัง) ซ.ลาดพร้าว 101 แขวงคลองจั่น บางกะปิ นำบัตรประชาชนมาแสดงด้วยนะ
19 กรกฎาคม 2567 ทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว
วันศุกร์ที่ 19 กรกฎาคม 2567 ณ วิทยาลัยศิลปหัตถกรรมกรุงเทพ เขตบางกะปิ หน่วยสัตวแพทย์เคลื่อนที่ ออกหน่วยให้บริการ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
23 กรกฎาคม 2567 ทำหมันและฉีดวัคซีนสุนัขและแมว ฟรี
เปิดลงทะเบียนทำหมันและฉีดวัคซีนสุนัขและแมว ฟรี!! ( สแกน qr code ในรูปได้เลยครับ )* วันอังคาร ที่ 23 กรกฎาคม 2567 ณ ตลาดนัดผู้ใหญ่อ้วน เวลา 09:00-11:00 น. สำหรับผู้ที่ได้รับสิทธิ์จะได้รับการติดต่อกลับในวันศุกร์ ที่ 19 กรกฎาคม นี้ กรณีทำหมัน กรุณางดน้ำและอาหาร 8-12 ชั่วโมง** สำหรับฉีดวัคซีนพิษสุนัขบ้าพาน้องหมาน้องแมว walk-in มาได้เลย! ( ไม่ต้องลงทะเบียนครับ )
24 กรกฎาคม 2567 ทำหมันสุนัขแมว-ฉีดวัคซีน ฟรี ที่ วัดกุนนทีรุทธาราม
วันพุธที่ 24 กรกฎาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย จัดหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดกุนนทีรุทธาราม เขตดินแดง เวลา 8.30 ถึง 11.00 น.
25 กรกฎาคม 2567 ทำหมันสุนัขและแมว ฉีดวัคซีน วัดสวัสดิ์วารีสีมาราม เขตดุสิต
สำนักอนามัย โดยสำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ มหาวิทยาลัยนวมินทราธิราช จัดกิจกรรมทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ในวันพฤหัสบดีที่ 25 กรกฎาคม 2567 เวลา 8.30 - 11.30 น. ณ วัดสวัสดิ์วารีสีมาราม เขตดุสิต ผู้ที่สนใจสามารถลงทะเบียนจองคิวทำหมันล่วงหน้าในแบบจองได้ [
ลิงค์จอง] (จำกัดสิทธิ์ในการทำหมันเพียง 40 ตัวเท่านั้น)
หมายเหตุ 1. ท่านที่จองสิทธิ์ทำหมันให้สุนัข แมว ในระบบไว้แล้ว ต้องมาลงทะะเบียนรายงานตัวหน้างานเพื่อรับบัตรคิวในเวลา 08.30 - 10.00 น. 2. บริการฉีดวัคซีนป้องกันพิษสุนัขบ้าให้สุนัขและแมวไม่จำกัดจำนวน 3. จองก่อนได้สิทธิ์ก่อน 4. จะโทรแจ้งเพื่อยืนยันการจองสิทธิ์ภายในวันที่ 23 กรกฎาคม 2567
25 กรกฎาคม 2567 ทำหมันฉีดวัคซีน ฟรี สำนักงานเขตป้อมปราบศัตรูพ่าย
เชิญร่วมกิจกรรม ณ สำนักงานเขตป้อมปราบศัตรูพ่าย วันที่ 25 ก.ค. 2567 เวลา 09.00- 11.00 น. กิจกรรม
-ทำหมันสัตว์ (ต้องจองคิวเท่านั้น) โดย สำนักอนามัย กรุงเทพมหานคร ฟรี จองคิวทำหมัน ส.ก.นิภาพรรณ จึงเลิศศิริ (กุ๊บ) โทร.0926397446
-ฉีดวัคซีนป้องกันพิษสุนัขบ้า ฟรี
-ตัดผม โดย โรงเรียนฝึกอาชีพกรุงเทพมหานคร ดินแดง 1 ฟรี
26 กรกฎาคม 2567 โรงพยาบาลสัตว์เล็กจุฬาฯ บริการฉีดวัคซีนรวมและวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมว ฟรี
Small Animal Teaching Hospital CUVET : โรงพยาบาลสัตว์เล็กจุฬาฯ ขอเชิญชวนผู้รับบริการเข้าร่วมโครงการเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัวเนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 72 พรรษา รัชกาลที่ 10 ปีงบประมาณ 2567 วันศุกร์ที่ 26 กรกฎาคม 2567 เวลา 08.30-12.00 น. ณ โถงพักคอย ชั้น 1 อาคารสัตววิทยวิจักษ์ โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
กิจกรรมให้บริการฉีดวัคซีนรวมและวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมว รวมถึงให้คำปรึกษาปัญหาสุขภาพแก่เจ้าของสัตว์เลี้ยง ฟรีไม่มีค่าใช้จ่าย!
สำหรับสุนัข
-วัคซีนรวมโรค
-วัคซีนป้องกันโรคพิษสุนัขบ้า
-กำจัดเห็บหมัด
สำหรับแมว
-วัคซีนป้องกันไข้หัดหวัดแมว (แมวอายุ 2 เดือนขึ้นไป)
-วัคซีนป้องกันโรคพิษสุนัขบ้า
-วัคซีนลิวคีเมียแมว (จำนวนจำกัด)
-กำจัดเห็บหมัด
เงื่อนไข
-รับเคส walk-in เท่านั้น ไม่รับจองออนไลน์
-ไม่จำกัดจำนวนสัตว์เลี้ยงต่อบ้าน
-สัตว์เลี้ยงต้องมีอายุอย่างน้อย 3 เดือน (ยกเว้นวัคซีนป้องกันไข้หัดหวัดแมวที่ต้องมีอายุอย่างน้อย 2 เดือน)
-สัตว์เลี้ยงควรมีสุขภาพแข็งแรง ไม่มีไข้ หรืออาการเจ็บป่วยอื่นๆ
กำหนดการหน่วยสัตวแพทย์เคลื่อนที่ กทม. ออกหน่วยทำหมัน ฉีดวัคซีน ฟรี เดือนสิงหาคม 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนสิงหาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 ส.ค. 67 โรงเรียนวัดสังเวช พระนคร / ชุมชนวัดม่วงแค บางรัก
- 2 ส.ค. 67 วัดภาษี วัฒนา
- 6 ส.ค. 67 ชุมชนหมู่บ้านร่วมเกื้อ ทวีวัฒนา / สำนักงานเขตวังทองหลาง
- 7 ส.ค. 67 ชุมชนวัดทองสัมฤทธิ์ มีนบุรี / วัดราษฎร์บำรุง บางแค
- 8 ส.ค. 67 สำนักงานเขตบางกอกน้อย / ลานนันทนาการ หน้าเขตสาทร
- 9 ส.ค. 67 ศูนย์เรียนรู้ครอบครัว พิพิธภัณฑ์เด็ก 2 ทุ่งครุ (ถนนพุทธบูชา เยื้องสวนธนบุรีรมย์)
- 13 ส.ค. 67 สวนป่าเฉลิมพระเกียรติใต้สะพานตากสิน คลองสาน / ชุมชนสุขสวัสดิ์ 31 ราษฎร์บูรณะ
- 14 ส.ค. 67 ชุมชนสยามพัฒนา คันนายาว / กลุ่มควบคุมตรวจเนื้อสัตว์ ซ.โรงกำจัดขยะหนองแขม พุทธมณฑลสาย 3
- 15 ส.ค. 67 มัสยิดอิดด์ฮาร์ดอุลูมมุดดีน มีนบุรี
- 16 ส.ค. 67 มัสยิดอมันนฤมิต บางคอแหลม / วัดท่าข้าม บางขุนเทียน
- 27 ส.ค. 67 ชุมชนแหลมทองพัฒนา สวนหลวง / วัดนาคกลางวรวิหาร บางกอกใหญ่
- 28 ส.ค. 67 ตลาดพุ่มอุไร ห้วยขวาง / แฟลตตำรวจ สน.ทองหล่อ วัฒนา
- 29 ส.ค. 67 ชุมชนโปโล ปทุมวัน / ตลาดนัดบ่อปลา พระโขนง
- 30 ส.ค. 67 ศูนย์ฯ 45 ร่มเกล้า ลาดกระบัง / วัดไทร บางคอแหลม
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- 1 ส.ค. 67 ที่วัดสะพาน แขวงพระโขนง เขตคลองเตย เวลา 9.00 - 12.00 น.
- 5 ส.ค. 67 ที่วัดสามพระยาวรวิหาร (วัดบางขุนพรหม) แขวงวัดสามพระยา เขตพระนคร เวลา 9.00 - 12.00 น.
- 6 ส.ค. 67 ที่วัดอินทร์บรรจงทรงวาดราษฎร์บำรุง แขวงบางคอแหลม เขตบางคอแหลม เวลา 9.00 - 12.00 น.
- 7 ส.ค. 67 ที่ชุมชนแผ่นดินทองนูรุ้ลยากีน แขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
- 8 ส.ค. 67 ที่วัดสัมพันธวงศารามวรวิหาร แขวงสัมพันธวงศ์ เขตสัมพันธวงศ์ เวลา 9.00 - 12.00 น.
- 13 ส.ค. 67 ที่วัดบรมสถล (วัดดอน) แขวงยานนาวา เขตสาทร เวลา 9.00 - 12.00 น.
- 14 ส.ค. 67 ที่ชุมชนแผ่นดินทองยะมีอุ้ลมุดตะกีน แขวงโคกแฝด เขตหนองจอก เวลา 9.30 - 11.30 น.
- 15 ส.ค. 67 ที่วัดสามัคคีธรรม แขวงวังทองหลาง เขตวังทองหลาง เวลา 9.00 - 12.00 น.
- 21 ส.ค. 67 ที่ชุมชนฟื้นนครร่มเกล้า ระยะ 4 โซน 10 แขวงคลองสองต้นนุ่น เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- 22 ส.ค. 67 ที่วัดไผ่เงินโชตนาราม แขวงบางโคล่ เขตบางคอแหลม เวลา 9.00 - 12.00 น.
- 26 ส.ค. 67 ที่วัดมัชฌันติการาม(วัดน้อย) แขวงบางซื่อ เขตบางซื่อ เวลา 9.00 - 12.00 น.
- 27 ส.ค. 67 ที่วัดโสมนัสราชวรวิหาร แขวงวัดโสมนัส เขตป้อมปราบศัตรูพ่าย เวลา 9.00 - 12.00 น.
- 28 ส.ค. 67 ที่ชุมชนเกาะกลางพัฒนาแขวงกระทุ่มราย เขตหนองจอก เวลา 9.30 - 11.30 น.
- 29 ส.ค. 67 ที่วัดกระทุ่มเสือปลา แขวงประเวศ เขตประเวศ เวลา 9.00 - 12.00 น.
2 สิงหาคม 2567 ทำหมัน ฉีดวัคซีน ฟรี วัดภาษี เขตวัฒนา
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 2 สิงหาคม 2567 ณ วัดภาษี เขตวัฒนา ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
4 สิงหาคม 2567 ทำหมัน ฉีดวัคซีน ฟรี กรมปศุสัตว์ พญาไท
วันอาทิตย์ที่ 4 สิงหาคม 2567 วันสัตวแพทย์ไทย ทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิปสุนัข ฟรี สแกน Qr code จองคิวทำหมัน และ สแกน ยืนยันสิทธิ์ทำหมัน ที่ กรมปศุสัตว์ พญาไท
5-16 สิงหาคม 2567 เขตจตุจักร บริการทำหมันสุนัข ฟรี
มูลนิธิเพื่อสุนัขในซอย (Soi Dog) ได้จัดทำโครงการ “การจัดการประชากรสุนัขจรจัดประเทศไทย” เพื่อสนับสนุนแผนยุทธศาสตร์โครงการ “สัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า” โดยสุนัขที่เข้ารับการทำหมันจะได้รับการฉีดวัคซีนรวม 5 โรค และวัคซีนป้องกันโรคพิษสุนัขบ้า รวมถึงยาป้องกับเห็บ หมัด และส่งคืนถิ่นที่อยู่เดิมเมื่อเสร็จสิ้นกระบวนการ โดยไม่เสียค่าใช้จ่าย
ตั้งแต่วันที่ 5-16 ส.ค. 2567 (วันจันทร์ ถึง วันศุกร์) เวลา 07.00-16.00 น. มีบริการรับ-ส่งสุนัขเพื่อทำหมัน และฉีดวัคซีนโดยไม่มีค่าใช้จ่ายใด ๆ (จำนวนจำกัด) ณ ศาลารวมใจ ชุมชนเคหะสถานเจริญชัย แขวงจตุจักร เขตจตุจักร
ท่านใดประสงค์ขอรับบริการดังกล่าว สามารถโทรติดต่อเพื่อลงทะเบียนจองคิวล่วงหน้ากับเจ้าหน้าที่มูลนิธิฯ ก่อนเข้ารับบริการ
โทร. 093-034-4419 หรือ 063-024-7813
6 สิงหาคม 2567 บริการทำหมัน ฉีดวัคซีน ลานจอดรถสำนักงานเขตวังทองหลาง
สำนักงานเขตวังทองหลาง ร่วมกับสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย จัดโครงการหน่วยสัตวแพทย์เคลื่อนที่ บริการทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัข&แมว และฉีดไมโครชิป ลงทะเบียนสุนัข ‼️ ฟรี ฟรี ฟรี ‼️ ในวันที่ 6 สิงหาคม 2567 เวลา 08.30-11.00 น. ณ ลานจอดรถสำนักงานเขตวังทองหลาง
หมายเหตุ : ทำหมันสุนัข & แมว มีจำนวนจำกัด 30 ตัว เฉพาะผู้ที่ลงทะเบียนเท่านั้นจ้าาาา **ส่วนกรณีอื่นๆ สามารถ Walk In ลงทะเบียน ณ วันออกหน่วยได้เลยจ้าาา
เปิดรับลงทะเบียน ตั้งแต่วันที่ 24-31 กรกฎาคม 2567 เท่านั้น หากคิวเต็มแล้ว ขออนุญาตปิดรับเฉพาะผู้ที่ลงทะเบียนก่อนเท่านั้นจ้าาา
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 025140512
!! สำคัญ กรณีทำหมัน อย่าลืม งดน้ำ งดอาหาร 8-10 ชม.
8 กันยายน 2567 ทำหมัน ฉีดวัคซีน ฟรี วัดกำแพง แขวงบางแวก เขตภาษีเจริญ
วันอาทิตย์ที่ 8 กันยายน 2567 บริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดกำแพง แขวงบางแวก เขตภาษีเจริญ (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตภาษีเจริญ กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
9 สิงหาคม 2567 ณ ศูนย์การเรียนรู้สำหรับครอบครัว พิพิธภัณฑ์เด็กกรุงเทพมหานคร แห่งที่ 2 (ทุ่งครุ)
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 9 สิงหาคม 2567 ณ ศูนย์การเรียนรู้สำหรับครอบครัว พิพิธภัณฑ์เด็กกรุงเทพมหานคร แห่งที่ 2 (ทุ่งครุ) เขตทุ่งครุ ✅ รับทำหมันสุนัขแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก พันธุ์หน้าสั้น แมวหน้าสั้น สุนัข/แมว น้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
14 สิงหาคม 2567 ทำหมันสุนัขและแมว ฟรี ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม ในวันพุธที่ 14 สิงหาคม 2567 เวลา 09.00 ถึง 11.00 น.
แผนที่การเดินทางมา กลุ่มควบคุมและการตรวจเนื้อสัตว์ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร สอบถามโทร 02 409 5986
รับจำนวนจำกัด 40 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
ลงทะเบียนจองคิวทำหมันสุนัขและแมว กรอกรายละเอียด ดังนี้ 1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา) 2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตหนองแขม บางแค ทวีวัฒนา ตลิ่งชัน ภาษีเจริญ เท่านั้น) 3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว) 4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
15 สิงหาคม 2567 รับทำหมันแมว จำนวนจำกัด 60 ตัว ณ มัสยิดอิดด์ฮาดร์อูรูมุดดีน
วันพฤหัสบดีที่ 15 สิงหาคม 2567 หน่วยสัตวแพทย์เคลื่อนที่ ณ มัสยิดอิดด์ฮาดร์อูรูมุดดีน เขตมีนบุรี
✅ เนื่องจากสถานที่เป็นมัสยิด หน่วยบริการจะให้บริการเฉพาะแมวเท่านั้น
✅ รับทำหมันแมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ เริ่มรับคิวทำหมัน 7.00 น.
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ไม่รับทำหมันแมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว)
✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
18 สิงหาคม 2567 โรงเรียนวัดกระจับพินิจ เขตธนบุรี
สำนักงานเขตธนบุรี ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตธนบุรี เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันอาทิตย์ที่ 18 สิงหาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนวัดกระจับพินิจ เขตธนบุรี (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.) ทำหมัน รับจำนวนจำกัด 100 ตัวจำกัดคนละไม่เกิน 2 ตัว รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตธนบุรี กรุงเทพมหานคร เท่านั้น ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
21 สิงหาคม 2567 ยานนาวา บริการทำหมันและฉีดวัคซีน ฟรี 40 ตัว
สิ่งแวดล้อมฯ ยานนาวา ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย รับจำนวน 40 ตัว
ผู้ที่สนใจสามารถลงทะเบียน นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันพุธที่ 21 สิงหาคม 2567 ตั้งแต่เวลา 09.00 - 11.00 น. ณ วัดดอกไม้ ถนนพระราม 3 แขวงบางโพงพาง เขตยานนาวา
สามารถลงทะเบียนผ่าน QR Code หรือ
ลิงค์
สัตว์เลี้ยงที่นำมารับบริการ 1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย 2. ถ้าเป็นเพศเมียต้องไม่ท้อง 3. มีอายุตั้งแต่ 6 เดือนขึ้นไป 4. งดน้ำงดอาหาร อย่างน้อย 8 - 12 ชั่วโมง เพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต 5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ *** ทั้งนี้อาจมีปัจจัยอื่น ๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
23 สิงหาคม 2567 ทำหมันสุนัขแมว ลานอเนกประสงค์ กรมประชาสัมพันธ์
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 23 สิงหาคม 2567 ณ ลานอเนกประสงค์ กรมประชาสัมพันธ์ เขตพญาไท ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
24 สิงหาคม 2567 เทคนิคการสัตวแพทย์ ม.เกษตร ฉีดวัคซีนฟรี
คณะเทคนิคการสัตวแพทย์ มหาวิทยาลัยเกษตรศาสตร์ ขอเชิญชวนนิสิต บุคลากรและบุคคลทั่วไป นำสุนัขและแมวของท่านมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในโครงการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สุนัขและแมว เนื่องในโอกาสวันแม่แห่งชาติ ในวันเสาร์ที่ 24 ส.ค. 2567 เวลา 9.00-16.30 น. ณ คณะเทคนิคการสัตวแพทย์ มหาวิทยาลัยเกษตรศาสตร์ โดยไม่มีค่าใช้จ่าย
28 สิงหาคม 2567 ทำหมันหมาแมว ฟรี
28 สิงหาคม 2567 ทำหมันหมาแมว ฟรี ลานจอดรถซอยพุ่มอุไร เวลา 8.30-10.30 น. ลงทะเบียนล่วงหน้า รับเฉพาะสัตว์เลี้ยงที่อยู่ในพื้นที่เขตห้วยขวางเท่านั้น
29 สิงหาคม 2567 ทำหมัน ฉีดไมโครชิปสุนัข ฉีดวัคซีน ฟรี! ตลาดบ่อปลา ซอยวชิรธรรมสาธิต 57 (สุขุมวิท 101/1)
สำนักงานเขตพระโขนง โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับบริษัทซีพี ออลล์ จำกัด (มหาชน) ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน ฉีดไมโครชิปสุนัข และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร ในวันพฤหัสบดี ที่ 29 สิงหาคม 2567 ตั้งแต่เวลา 08.00 - 11.00 น. สถานที่ ตลาดบ่อปลา ซอยวชิรธรรมสาธิต 57 (สุขุมวิท 101/1) แขวงบางจาก เขตพระโขนง กรุงเทพมหานคร ในวันดังกล่าว บริษัทซีพี ออลล์ จำกัด (มหาชน) จัดบูธกิจกรรมแจกเบเกอรี่และอาหารสุนัขและแมว ให้กับผู้ที่ลงทะเบียนนำสุนัข แมว เข้าทำหมัน
รายละเอียดการบริการ. ทำหมันสุนัขและแมว จำนวน 30 ตัว. ฉีดไมโครชิปสุนัข จำนวน 30 ตัว. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 200 ตัว
ผู้ที่สนใจทำหมันสัตว์เลี้ยง สามารถลงทะเบียนล่วงหน้า ได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพระโขนง โทร. 0 2311 3538
สัตว์เลี้ยงที่นำมารับบริการทำหมัน 1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย 2. ถ้าเป็นเพศเมียต้องไม่ท้อง ไม่ให้นมลูก 3. มีอายุตั้งแต่ 6 เดือนขึ้นไป 4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 12 ชั่วโมง ก่อนพามาทำหมันเพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต 5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ 6. ให้นำตระกร้า หรือ กรงขัง แมว ขนาดใหญ่มาด้วย เพื่อความสะดวกในการนำสัตว์กลับหลังจากการทำหมันเสร็จ 7. เจ้าของสัตว์เลี้ยงต้องนำบัตรประชาชนมาแสดงด้วย
29 สิงหาคม 2567 ทำหมันสุนัขและแมว ฉีดวัคซีน ฟรี ณ วัดดอน (วัดบรมสถล) ซอย เจริญกรุง 63
บริการทำหมันสุนัขและแมว & บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ในพื้นที่เขตสาทรและบริเวณใกล้เคียง วันพฤหัสที่ 29 สิงหาคม 2567 ตั้งแต่เวลา 09.00 - 12.00 น. (เปิดรับคิวตั้งแต่เวลา 08.00 น.) ณ วัดดอน (วัดบรมสถล) ซอย เจริญกรุง 63 ** ขอโควต้า คนละไม่เกิน 2 ตัว สำหรับการทำหมัน เพื่อที่จะได้กระจายจำนวนได้มากที่สุด **
เงื่อนไขก่อนการรับบริการ: 1. สัตว์ที่ทำหมันต้องงดน้ำงดอาหารอย่างน้อย 8-12 ชั่วโมง 2.สัตว์ต้องมีอายุ 6 เดือนขึ้นไป และอายุไม่เกิน 8 ปี 3.สัตว์เพศเมียต้องไม่อยู่ในระหว่างตั้งท้อง หรือให้นมลูก (หย่านมที่ 2 เดือนหลังคลอด) รวมถึงไม่ได้รับการผสมพันธุ์ ภายใน 2 สัปดาห์ก่อนถึงวันรับบริการ 4. ยกเว้นการทำหมันสัตว์เพศผู้ที่เป็นทองแดง และ สัตว์ที่เป็นพันธุ์หน้าสั้น เช่น แมวเปอร์เซีย แมวเอ็กโซติก สุนัขชิสุ สุนัขปั๊ก สุนัขบลูด็อก เป็นต้น
30 สิงหาคม 2567 ณ วัดไทร เขตบางคอแหลม
วันศุกร์ที่ 30 สิงหาคม 2567 ณ วัดไทร เขตบางคอแหลม ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 60 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
กำหนดการเดือนกันยายน 2567 หน่วยสัตวแพทย์เคลื่อนที่ กทม.ทำหมัน ฉีดวัคซีน ฟรี
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนสิงหาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี (ทุกที่ เวลา 9.00 - 12.00 น. )
28 กันยายน 2567 ฉีควัคซีนและทำหมันในสัตว์เลี้ยง ฟรี งานวันป้องกันโรคพิษสุนัขบ้าโลก LINK
งาน “วันป้องกันโรคพิษสุนัขบ้าโลก 2567” วันที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย มีกิจกรรมฉีควัคซีนและทำหมันในสัตว์เลี้ยง ฟรี โดยต้องลงทะเบียนล่วงหน้า จะเปิดให้ลงทะเบียนได้ในวันจันทร์ที่ 2 กันยายน 2567 เวลา 13.00 น. ถึงวันจันทร์ที่ 16 กันยายน 2567 (หรือจนกว่าสิทธิจะเต็ม) 3 รายการ ได้แก่
1 ลงทะเบียนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง (สุนัขและแมว)
2 ลงทะเบียนฉีดวัคซีนรวมป้องกันโรคติดเชื้อในสัตว์เลี้ยง (สุนัขและแมว)
3 ลงทะเบียนทำหมันสัตว์เลี้ยง (สุนัขและแมว)
ประกาศผู้ได้รับสิทธิฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าและวัคซีนรวมป้องกันโรคติดเชื้อในสัตว์เลี้ยง
16 กันยายน 2567 เวลา 13.00 น. ที่เพจ คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา
*****ผู้ที่ได้รับสิทธิลงทะเบียนทำหมันจะได้รับการติดต่อทางโทรศัพท์***** เพื่อยืนยันสิทธิ ซักประวัติและชี้แจงการเตรียมตัว (หากไม่ได้มีการติดต่อกลับถือว่าไม่ได้รับสิทธิ)
2-13 กันยายน 2567 ฉีดวัคซีนพิษสุนัขบ้า ฟรี ศูนย์บริการสาธารณสุข 28 กรุงธนบุรี
สำนักงานเขตคลองสานร่วมกับศูนย์บริการสาธารณสุข 28 กรุงธนบุรี ขอเชิญชวนประชาชนนำสัตว์เลี้ยงของท่าน (สุนัข หรือแมว) มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 2-13 กันยายน 2567 วลา 10.00 -12.00 น. หมายเหตุ: ไม่มีค่าใช้จ่ายใดๆทั้งสิ้น
4 กันยายน 2567 ทำหมันสัตว์เลี้ยง วัดรวกสุทธาราม ซอยจรัญฯ33
ประชาสัมพันธ์ทำหมันสัตว์เลี้ยง วันพุธที่ 4 กันยายน 2567 เวลา 9.00 น. ณ วัดรวกสุทธาราม ซอยจรัญฯ33 ให้สิทธิ์ผู้ลงทะเบียนก่อนนะครับ ผู้ที่ต้องการลงทะเบียนทำหมันสัตว์เลี้ยง แอดไลน์
13 กันยายน 2567 ทำหมันสุนัขและแมว ฟรี ณ วัดลาดพร้าว
ทำหมัน สุนัขและแมว ฟรี วันศุกร์ ที่ 13 กันยายน 2567 ณ วัดลาดพร้าว (ศาลาเอนกประสงค์) เวลา 09:00-11:00 น. สำหรับผู้ที่ได้รับสิทธิ์จะได้รับการติดต่อกลับ กรณีทำหมัน กรุณางดน้ำและอาหาร 8-12 ชั่วโมง กรณีฉีดวัคซีนป้องกันพิษสุนัขบ้า พาน้องหมาน้องแมว walk-in มาได้เลย
19 ก.ย. 2567 ชุมชนวัดโสมนัส ทำหมันสัตว์-ฉีดวัคซีนป้องกันพิษสุนัขบ้า
วันที่ 19 ก.ย. 2567 เวลา 09.00- 11.00 น. เชิญร่วมกิจกรรม -ทำหมันสัตว์ -ฉีดวัคซีนป้องกันพิษสุนัขบ้า -ตัดผม ณ ชุมชนวัดโสมนัส ฟรี ตลอดงาน ประสานงานโดย ส.ก.นิภาพรรณ จึงเลิศศิริ (กุ๊บ) โทร. 0926397446
24 กันยายน 2567 ทำหมันฉีดวัคซีน ฟรี วัดฉัตรแก้วจงกลณี ซอยจรัญสนิทวงศ์94
กิจกรรมทำหมัน สุนัข-แมว ฟรี‼ ไม่มีค่าใช้จ่าย ย้ำ!!! ไม่มีค่าใช้จ่าย...
หนึ่งในโครงการหลักโดย พ.ต.อ.ภิญโญ ป้อมสถิตย์ (ส.ก.เขตบางพลัด) ร่วมกับ สำนักอนามัยกรุงเทพมหานคร และภายในงานยังมีบริการ "ฉีดวัคซีนป้องกัน พิษสุนัขบ้า" ให้ฟรีไม่จำกัดจำนวนอีกด้วย **กำหนดการ** วันอังคารที่ 24 กันยายน 2567 เวลา 09:00 - 11:00 น. ณ วัดฉัตรแก้วจงกลณี ซอยจรัญสนิทวงศ์94 รับโควต้าจากการเป็นสมาชิกเพจ #30ตัวเท่านั้น!!!
Inbox เพื่อลงทะเบียนได้เลย ✅ เตรียมชื่อที่อยู่และบัตรประชาชนด้วยนะครับ
25 กันยายน 2567 ศูนย์บริการสาธารณสุข33 วัดหงส์ เปิดรับจองคิวทำหมันหมาแมว
ศูนย์บริการสาธารณสุข33 วัดหงส์รัตนาราม ประกาศการจองทำหมันสุนัข แมว รอบต่อไป วันที่ 25 กันยายน 2567
คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา เปิดลงทะเบียนเพื่อรับสิทธิในการทำหมัน, ฉีดวัคซีนโรคพิษสุนัขบ้าและวัคซีนโรคติดเชื้อ รับบริการในงาน "วันป้องกันโรคพิษสุนัขบ้าโลก" ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย
เนื่องในกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก 2567 คลินิกภูมิคุ้มกันในสัตว์เลี้ยง สถานเสาวภา จัดกิจกรรมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงโดยไม่มีค่าใช้จ่าย (ฟรี) ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย [facebook]
อัพเดต เปิดลงทะเบียนเพื่อรับสิทธิในการทำหมัน, ฉีดวัคซีนโรคพิษสุนัขบ้าและวัคซีนโรคติดเชื้อ สามารถลงทะเบียนได้ใน Google form ตาม QR Code ในภาพ หรือในลิ้งค์ด้านล่าง
โดยเปิดลงทะเบียนตั้งแต่วันนี้ ถึง 16 กันยายน 2567 เวลา 16.00 น.หรือจนกว่าสิทธิจะเต็ม
***ผู้ลงทะเบียนที่ได้รับสิทธิ จะต้องนำสัตว์เลี้ยงมารับบริการในงาน "วันป้องกันโรคพิษสุนัขบ้าโลก" ในวันเสาร์ที่ 28 กันยายน 2567 ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัยเท่านั้น***
10. นักพนันที่มีปัญหา (Problem Gamblers) เกือบ 4 ล้านคน มีพฤติกรรมการเล่นพนันที่เป็นปัญหา
โรงพยาบาลสัตว์พญาไท 7 ศูนย์สุขภาพสัตว์ครบวงจร ฉุกเฉิน 24 ชั่วโมง
โรงพยาบาลสัตว์พญาไท 7 ศูนย์สุขภาพสัตว์ครบวงจร รักษาสัตว์เลี้ยง โรคเฉพาะทาง ทีมสัตวแพทย์พร้อม เครื่องมือการตรวจรักษาโรคที่ทันสมัย โดดเด่นด้วยศักยภาพในการให้บริการคลินิกพิเศษ เช่น คลินิกโรคผิวหนัง คลินิกสูติกรรม คลินิกโรคกระดูกและข้อ คลินิกศัลยกรรมเนื้อเยื่ออ่อน หน่วยรังสีวินิจฉัย คลินิกทันตกรรม คลินิกโรคหัวใจ-ไต คลินิกโรคตา และคลินิกสัตว์เลี้ยงพิเศษ เรียกว่าตอบโจทย์คนห่วงสัตว์เลี้ยงจริงๆ เปิดให้บริการทุกวันและพร้อมดูแลสัตว์เลี้ยงฉุกเฉิน 24 ชั่วโมง
โรงพยาบาลสัตว์พญาไท 7 มี 2 สาขา คือ
- สาขาซอยอารีย์ 9/9 ซอยชำนาญอักษร แขวงพญาไท เขตพญาไท
- สาขาบางนา Tel 087-087-0445 27 ถนนศรีนครินทร์ แขวงบางนาเหนือ เขตบางนา Tel 096-993-9945
- Website | Facebook
*ภาพจากเว็บไซต์รพ.สัตว์พญาไท 7
กำหนดการเดือนตุลาคม 2567 หน่วยสัตวแพทย์เคลื่อนที่ กทม.ทำหมัน ฉีดวัคซีน ฟรี
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนตุลาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 ตุลาคม 2567 สำนักงานเขตบางซื่อ / วัดม่วง บางแค
- 2 ตุลาคม 2567 ตลาดวันโอวัน บางบอน / ศูนย์เยาวชนสวนอ้ยอ ดุสิต
- 3 ตุลาคม 2567 หมู่บ้านนิรันด์วิลล่า พระโขนง / สวนป่าเฉลิมพระเกียรติใต้สะพานตากสิน คลองสาน
- 4 ตุลาคม 2567 ชุมชนวัดกระจัง ตลิ่งชัน / วัดไผ่ตัน พญาไท
- 7 ตุลาคม 2567 ลานกีฬา ซ.ประชาสงเคราะห์ 10 ดินแดง
- 8 ตุลาคม 2567 ชุมชนสร้างสรรค์พัฒนา 7-12 บ้านมั่นคง คลองเตย / ศาลเจ้าโกวบ๊อ ธนบุรี
- 9 ตุลาคม 2567 ชุมชนเคหะสถานบ่อฝรั่งริมน้ำพัฒนา เขตจตุจักร / ชุมชนเคหะทุ่งสองห้อง หลักสี่
- 10 ตุลาคม 2567 เคหะชุมชนธนบุรี 1 ส่วน 4 เขตบางขุนเทียน / ชุมชนสุขสวัสดิ์ 58 เขตราษฎร์บูรณะ
- 11 ตุลาคม 2567 เคหะชุมชนฉลองกรุง โซน 6 เขตหนองจอก / วัดอุทัยธารราม ห้วยขวาง
- 15 ตุลาคม 2567 ชุมชนเกาะจวน คันนายาว / วัดมหาพฤฒาราม บางรัก
- 16 ตุลาคม 2567 วัดอินทรวิหาร พระนคร / ชุมชนหลังสถานีรถไฟศาลาธรรมสพน์ ทวีวัฒนา
- 17 ตุลาคม 2567 ชุมชนนำไกร ลาดกระบัง / ชุมชนลำสาลีพัฒนา บางกะปิ
- 18 ตุลาคม 2567 ชุมชนร่วมพัฒนาบ้านป่า สวนหลวง / ชุมชนอัมรินทร์นิเวศน์ 3 ผัง 2 สายไหม
- 22 ตุลาคม 2567 วัดทองบน ยานนาวา / ลานจอดรถ 7-11 สาขาแจ้งวัฒนะ ซอย4 บางเขน
- 24 ตุลาคม 2567 วัดนาคนิมิตร จอมทอง / ลานหน้าเขตสาทร
- 25 ตุลาคม 2567 สำนักงานเขตสัมพันธวงศ์ / หมู่บ้าน เค ซี การ์เด้นโฮม คลองสามวา
- 27 ตุลาคม 2567 วัดหลักสี่ เขตหลักสี่
- 29 ตุลาคม 2567 สำนักงานเขตบางกอกน้อย / ซอยพุ่มอุไร ห้วยขวาง
- 30 ตุลาคม 2567 ชุมชนมหาสิน บางนา / โรงเรียนวิจิตรวิทยา วัฒนา
- 31 ตุลาคม 2567 วัดจันทน์ใน บางคอแหลม / วัดสังข์กระจาย บางกอกใหญ่ / ศูนย์ฯ 45 ร่มเกล้า ลาดกระบัง
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี (ทุกที่ เวลา 9.00 - 12.00 น. )
- วันอังคารที่ 1 ตุลาคม 2567 ที่วัดบุคคโล แขวงดาวคะนอง เขตธนบุรี
- วันพุธที่ 2 ตุลาคม 2567 ที่ชุมชนเก้าแสนเจ็ด แขวงคันนายาว เขตคันนายาว
- วันพฤหัสบดีที่ 3 ตุลาคม 2567 ที่วัดทองใน แขวงสวนหลวง เขตสวนหลวง
- วันจันทร์ที่ 7 ตุลาคม 2567 ที่วัดประชาระบือธรรม แขวงถนนนครไชยศรี เขตดุสิต
- วันอังคารที่ 8 ตุลาคม 2567 ที่วัดสารอด แขวงราษฎร์บูรณะ เขตราษฎร์บูรณะ
- วันอังคารที่ 15 ตุลาคม 2567 ที่วัดคลองเตยใน แขวงพระโขนง เขตคลองเตย
- วันพฤหัสบดีที่ 17 ตุลาคม 2567 ที่วัดกก แขวงท่าข้าม เขตยางขุนเทียน
- วันจันทร์ที่ 21 ตุลาคม 2567 ชุมชนทิวสนร่วมจิตมณียา เขตลาดกระบัง
- วันอังคารที่ 22 ตุลาคม 2567 ที่วัดใหม่กระทุ่มล้ม แขวงกระทุ่มราย เขตหนองจอก
- วันพฤหัสบดีที่ 24 ตุลาคม 2567 ที่มัสยิดนะฟีอ๊ะห์ (ลำนายโส) แขวงคลองสองต้นนุ่น เขตลาดกระบัง
- วันจันทร์ที่ 28 ตุลาคม 2567 ที่วัดพลมานีย์ แขวงทับยาว เขตลาดกระบัง
- วันอังคารที่ 29 ตุลาคม 2567 ที่วัดโบสถ์อินทรสารเพชร แขวงคูหาสวรรค์ เขตภาษีเจริญ
- วันพฤหัสบดีที่ 31 ตุลาคม 2567 ที่วัดไผ่เลี้ยง แขวงหนองค้างพลู เขตหนองแขม
1 ตุลาคม 2567 ทำหมันและฉีดวัคซีน ฟรี ศาลาวัดม่วง ซ.เพชรเกษม 63
เขตบางแค ชวนลงทะเบียนทำหมันและฉีดวัคซีนป้องกันพิษสุนัขบ้า น้องหมาน้องแมว วันที่ 1 ตุลาคม 2567 ณ บริเวณศาลาวัดม่วง ซ.เพชรเกษม 63 ตั้งแต่เวลา 09.00 น. เป็นต้นไป รับทำหมันเฉพาะสุนัขและแมวที่เลี้ยงอยู่ในพื้นที่เขตบางแค เท่านั้น‼️
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมฯ เบอร์โทรติดต่อ 0 2454 6001
เช็คความพร้อมสุนัขและแมวของคุณก่อนทำหมัน
ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
มีอายุตั้งแต่ 6 เดือนขึ้นไป
ไม่ได้รับการผสมพันธุ์ ไม่เป็นสัด ไม่ตั้งท้อง
งดน้ำงดอาหารอย่างน้อย 8 ชั่วโมง ก่อนทำหมัน
23 กันยายน - 18 ตุลาคม 2567 เขตบึงกุ่มทำหมันสุนัข ฟรี
สำนักงานเขตบึงกุ่ม ฝ่ายสิ่งแวดล้อมและสุขาภิบาลร่วมกับมูลนิธิเพื่อสุนัขในซอย (Soi Dog) ชุมชนสุวรรณนิเวศน์ ซอยนวมินทร์ 42 เริ่ม 23 กันยายน ถึงวันที่ 18 ตุลาคม 2567 โดยจะเปิดให้บริการวันจันทร์ถึงวันศุกร์ ตั้งแต่ เวลา 07.00-16.00 น. จำนวน 46 ตัวต่อวัน (ไม่สามารถจองคิวได้)
หากเป็นสุนัขสายพันธุ์อื่นนอกจากพันธุ์ไทย จะต้องมีผลการตรวจเลือด
ขั้นตอนก่อนนำสุนัขเข้ารับบริการ - งดน้ำงดอาหาร อย่างน้อย 12 ชั่วโมง ก่อนทำหมัน- สุนัขที่นำมาทำหมันต้องมีอาการปกติ ไม่ป่วย - สุนัขที่สามารถทำหมันได้ ตั้งแต่ 6 เดือนขึ้นไป - สุนัขที่มีประจำเดือน ไม่ควรทำหมัน เพราะจะทำให้เสียเลือดมาก - สุนัขแม่ลูกอ่อนเมื่อลูกอายุ 2 เดือน เหมาะที่จะทำหมัน - สุนัขท้องไม่ควรนำมาทำหมัน
3 ตุลาคม 2567 ทำหมันฟรี ที่ ชุมชนหมู่บ้านนิรันดร์วิลล่า ซอยพึ่งมี 50 (สุขุมวิท 93) แขวงบางจาก เขตพระโขนง
เขตพระโขนง เชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน ฉีดไมโครชิปสุนัข และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันพฤหัสบดี ที่ 3 ตุลาคม 2567 ตั้งแต่เวลา 08.00 - 11.00 น. สถานที่ ชุมชนหมู่บ้านนิรันดร์วิลล่า ซอยพึ่งมี 50 (สุขุมวิท 93) แขวงบางจาก เขตพระโขนง กรุงเทพมหานคร
รายละเอียดการบริการ ทำหมันสุนัขและแมว จำนวน 40 ตัว ฉีดไมโครชิปสุนัข จำนวน 40 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 200 ตัว
**** ผู้ที่สนใจทำหมันสัตว์เลี้ยง สามารถลงทะเบียนล่วงหน้า ได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพระโขนง โทร. 0 2311 3538
4 ตุลาคม 2567 ทำหมันฟรี วัดไผ่ตัน เขตพญาไท
เขตพญาไท เปิดบริการ ผ่าตัดทำหมันสุนัขและแมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่กรุงเทพมหานคร ฟรี วันศุกร์ที่ 4 ตุลาคม 2567 เวลา 08.00 ถึง 11.00 น. ณ วัดไผ่ตัน ซอยพหลโยธิน 15 เขตพญาไท [
ลิงค์แผนที่]
รับจองทำหมันจำนวนจำกัด 40 ตัว
ฉีดวัคซีนโรคพิษสุนัขบ้า จำนวน 200 ตัว
ลงทะเบียนหน้างานเท่านั้น
7 ตุลาคม 2567 ทำหมันฟรี โดมตลาดเช้าดินแดง ซอยประชาสงเคราะห์ 11 แขวงดินแดง
เขตดินแดง ให้บริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ในวันจันทร์ที่ 7 ตุลาคม 2567 ตั้งแต่เวลา 08.00 - 11.00 น. ณ โดมตลาดเช้าดินแดง ซอยประชาสงเคราะห์ 11 แขวงดินแดง เขตดินแดง (ปิดรับลงทะเบียนทำหมัน 10.00 น.) รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตกรุงเทพมหานคร เท่านั้น
ทำหมัน รับจำนวนจำกัด 60 ตัว
จำกัดคนละไม่เกิน 3 ตัว
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
11-14 ตุลาคม 2567 ตรวจสุขภาพสัตว์เลี้ยง ฉีดวัคซีนฟรี งาน THE MALL LIFESTORE WORLD PUP EXPO 2024 LINK
THE MALL LIFESTORE WORLD PUP EXPO 2024 วันที่ 11-14 ตุลาคม 2567 MCC HALL ชั้น 3 เดอะมอลล์ไลฟ์สโตร์ บางกะปิ มี บริการฉีด วัคซีนป้องกันพิษสุนัขบ้าสำหรับสุนัขและแมว ฝังไมโครชิพสุนัข โดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
การเตรียมตัวสัตว์เพื่อเข้ารับบริการ
- นำสัตว์เลี้ยงใส่ตะกร้า กระเป๋า หรือสายจูง
- ต้องเป็นสัตว์ที่สุขภาพดี แข็งแรง
- อายุ 3 เดือนขึ้นไป
- เพศเมียไม่อยู่ในช่วงตั้งท้อง
เอกสารที่ต้องใช้
- บัตรประจำตัวประชาชนของเจ้าของสัตว์
- สำเนาทะเบียนบ้านที่สุนัขอาศัยอยู่ (กรณีฝังไมโครชิปสุนัข) (ถ้ามี)
- ใบรับรองการฉีดวัคซีนโรคพิษสุนัขบ้า หรือสมุดวัคซีน (ถ้ามี)
การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
- ให้บริการไม่เกิน 200 ตัว/วัน
การฉีดไมโครชิปสุนัข
- ให้บริการไม่เกิน 50 ตัว/วัน
20 ตุลาคม 2567 ฉีดวัคซีนฟรี มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา
สำนักงานสัตวแพทย์สาธารณสุข สำนักงานอนามัย กรุงเทพมหานคร เปิดบริการ ฉีดวัคซีนพิษสุนัขบ้า ฟรี ในวันอาทิตย์ที่ 20 ตุลาคม 2567 นี้ มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา ลงทะเบียนล่วงหน้าผ่าน QR code ตามภาพ
22 ตุลาคม 2567 ทำหมันฟรี วัดทองบน ถนนพระราม 3 ยานนาวา
สิ่งแวดล้อมฯ ยานนาวา ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย รับจำนวนจำกัด 40 ตัว ผู้ที่สนใจสามารถลงทะเบียน นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอังคารที่ 22 ตุลาคม 2567 ตั้งแต่เวลา 09.00 - 11.00 น. ณ วัดทองบน ถนนพระราม 3 แขวงบางโพงพาง เขตยานนาวา
สามารถลงทะเบียนผ่าน QR Code หรือลิงค์
forms.gle27 ตุลาคม 2567 ทำหมันฟรี วัดหลักสี่ แขวงตลาดบางเขน
เขตหลักสี่ ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตหลักสี่ เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! วันอาทิตย์ที่ 27 ตุลาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดหลักสี่ แขวงตลาดบางเขน เขตหลักสี่ (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
แผนที่ วัดหลักสี่ แขวงตลาดบางเขน เขตหลักสี่
• ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตหลักสี่ กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้ ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
ผู้ประกันตน พญาไท นวมินทร์ ฉีดวัคซีน เริ่มฉีดได้ตั้งแต่ 1 พ.ค.66 ไม่เสียค่าใช้จ่าย LINK
ผู้ประกันตนประกันสังคม โรงพยาบาลพญาไท นวมินทร์ ฉีดวัคซีนโดยไม่เสียค่าใช้จ่าย แก่ผู้ประกันตน ม.33 และ ม.39 กรณีอายุมากกว่า 50 ปี ขึ้นไป กรณีที่อายุน้อยกว่า 50 ปี ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ 2023 ราคาเพียง 590 บาท วันนี้ 1 พ.ค. – 31 ส.ค. 66 สามารถสอบถามเพิ่มเติมได้ที่ ประกันสังคม รพ. พญาไท นวมินทร์ ชั้น1 โทร. 02-944-7111 ต่อ 1009#
หมายเหตุ: ผู้ประกันตนที่มีอายุ 50 ปี ตามรายชื่อที่ประกันสังคมกำหนดเท่านั้น
กำหนดการเดือน พฤศจิกายน 2567 หน่วยสัตวแพทย์เคลื่อนที่ กทม.ทำหมัน ฉีดวัคซีน ฟรี
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือน พฤศจิกายน 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 พฤศจิกายน 2567 กลุ่มควบคุมและตรวจเนื้อสัตว์ พุทธมณฑลสาย 3 หนองแขม / หมู่บ้านเพชรเกษม 3 บางแค
- 5 พฤศจิกายน 2567 หมู่บ้านสวนทิพย์ บึงกุ่ม / ชุมชนวิจิตรสัมพันธ์ ภาษีเจริญ
- 6 พฤศจิกายน 2567 วัดพุทธบูชา ทุ่งครุ / คริสตจักรไมตรีจิตร ป้อมปราบฯ
- 7 พฤศจิกายน 2567 วัดรวกบางบำหรุ บางพลัด / ชุมชนเปรมฤทัย 1 คันนายาว
- 8 พฤศจิกายน 2567 หมู่บ้านสินทวีเทียนทะเล 1 บางขุนเทียน / หมู่บ้านเดอะเลคการ์เด้น ลาดกระบัง
- 12 พฤศจิกายน 2567 วัดกระทุ่มเสือปลา ประเวศ / ซ.ลาดพร้าว 101/2 บางกะปิ
- 13 พฤศจิกายน 2567 วัดสุทธิสะอาด คลองสามวา /
- 14 พฤศจิกายน 2567 ชุมชนหมู่ 11 สะพานสูง เกาะดอน / ชุมชนสายสัมพันธ์ ธนบุรี
- 15 พฤศจิกายน 2567 ชุมชนริมคลองหัวหมากใหญ่ สวนหลวง / ชุมชนร่วมใจสามัคคี สายไหม
- 19 พฤศจิกายน 2567 ชุมชนแฟลตเรือนจำพิเศษกรุงเทพ จตุจักร / วัดวชิรธรรมสาธิต พระโขนง
- 20 พฤศจิกายน 2567 ชุมชนตรอกสลักหิน ปทุมวัน / ชุมชนหมู่บ้านจัดสรรยาสูบ บางนา
- 21 พฤศจิกายน 2567 วัดสาครสุ่นประชาสรรค์ ลาดพร้าว / สำนักงานเขตบางซื่อ
- 22 พฤศจิกายน 2567 ตลาดไชยทิศ บางกอกน้อย
- 26 พฤศจิกายน 2567 วัดรวกสุทธาราม บางกอกน้อย / สำนักงานเขตวังทองหลาง
- 27 พฤศจิกายน 2567 วัดทรัพย์สโมสรนิกรเกษม หนองจอก / วัดไตรรัตนาราม บางเขน
- 28 พฤศจิกายน 2567 ชุมชนธนินทร 1 ดอนเมือง / ชุมชนเกษตรบ้านนายผล บางบนอน / ศูนย์ฯ 45 ร่มเกล้า
- 29 พฤศจิกายน 2567 วัดเสมียนนารี
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันศุกร์ที่ 1 พฤศจิกายน 2567 ที่วัดพรหมสุวรรณสามัคคี แขวงบางไผ่ เขตบางแค
- วันจันทร์ที่ 4 พฤศจิกายน 2567 ที่วัดช่างเหล็ก แขวงคลองชักพระ เขตตลิ่งชัน เวลา 9.00 - 11.00 น.
- วันอังคารที่ 5 พฤศจิกายน 2567 ที่วัดบางเตย แขวงคลองกุ่ม เขตบึงกุ่ม เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 5 พฤศจิกายน 2567 ที่วัดบางบัว แขวงอนุสาวรีย์ เขตบางเขน เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 7 พฤศจิกายน 2567 ที่วัดบางบัว แขวงอนุสาวรีย์ เขตบางเขน เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 25 พฤศจิกายน 2567 ที่วัดทุ่งลานนา แขวงดอกไม้ เขตประเวศ เวลา 9.00 - 11.00 น.
- วันอังคารที่ 26 พฤศจิกายน 2567 ที่วัดราษฎร์บูรณะ แขวงบางปะกอก เขตราษฎร์บูรณะ เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 28 พฤศจิกายน 2567 ที่วัดดอกไม้ แขวงบางโพงพาง เขตยานนาวา เวลา 9.00 - 11.00 น.
1 พฤศจิกายน 2567 กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานเขตหนองแขม จัดหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️
ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม ในวันศุกร์ที่ 1 พฤศจิกายน 2567 เวลา 09.00 ถึง 11.00 น.
รับจำนวนจำกัด 40 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
กลุ่มควบคุมและการตรวจเนื้อสัตว์ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร โทร 02 409 5986
แผนที่ที่ตั้ง
กรอกรายละเอียด ดังนี้
1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา)
2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตหนองแขม บางแค ทวีวัฒนา ตลิ่งชัน ภาษีเจริญ เท่านั้น)
3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว)
4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
6 พฤศจิกายน 2567 ทำหมัน-ฉีดวัคซีน-ไมโครชิพ ฟรี‼️ ที่คริสตจักรไมตรีจิต
6 พ.ย. ที่คริสตจักรไมตรีจิต ทำหมัน ฟรี‼️ ฉีดวัคซีน ฟรี‼️ ไมโครชิพ ฟรี‼️ โดยสำนักอนามัย กรุงเทพมหานคร ทำหมันจองคิวกันเข้ามาได้เลยนะคะ รับจำกัดเพียง 30 ตัวเท่านั้นค่ะ จองคิวทำหมันโทร.
ส.ก. กุ๊บ 092-639-7446
11 พฤศจิกายน 2567 ณ ลานจอดรถสำนักงานเขตวังทองหลาง
เขตวังทองหลาง เปิดให้บริการผ่าตัดทำหมัน "แมวจรจัด" ย้ำ "แมวจรจัด" ฟรี ‼️ จำนวนจำกัด ให้บริการ วันจันทร์ที่ 11 พฤศจิกายน 2567 เวลา 09.00-11.00 น. ณ ลานจอดรถสำนักงานเขตวังทองหลาง
หมายเหตุ : แมวจรจัดจะถูกทำสัญลักษณ์ บริเวณด้านข้างลำตัวและใบหู / สำคัญ ‼️ งดให้อาหารแมว 8-10 ชั่วโมง สอบถามข้อมูลเพิ่มเติมและติดต่อขอรับกรงดักแมว ได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวังทองหลาง โทร. 025140512
17 พฤศจิกายน 2567 วัดทองสัมฤทธิ์ แขวงแสนแสบ เขตมีนบุรี
สำนักงานเขตมีนบุรี ให้บริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!
ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตมีนบุรี กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 17 พฤศจิกายน 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดทองสัมฤทธิ์ แขวงแสนแสบ เขตมีนบุรี (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
23-28 พฤศจิกายน ฉีดวัคซีนฟรี เขตประเวศ
แผนการออกหน่วยสัตวแพทย์เคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า รอบจุดพบสุนัขติดเชื้อโรคพิษสุนัขบ้า เขตประเวศ
29 พฤศจิกายน 2567 วัดเสมียนนารี เขตจตุจักร
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 29 พฤศจิกายน 2567 ณ วัดเสมียนนารี เขตจตุจักร
✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ เริ่มรับคิวทำหมัน 7.00 น.
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว)
✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
มอบหน้ากากอนามัยและถุงมือยาง ให้กับกองบังคับการตำรวจทางหลวง
Green Health Care&Share 2020.12.21 โรงพยาบาลกรุงเทพจันทบุรี โดย คุณลัคณา เจริญรูป หัวหน้าแผนกสื่อสารการตลาด มอบหน้ากากอนามัยและถุงมือยาง ให้กับกองบังคับการตำรวจทางหลวง เพื่อใช้ดูแลประชาชนที่เดินทางสัญจรบนท้องถนน ในช่วงเทศกาลส่งท้ายปีเก่าต้อนรับปีใหม่ โดย ร.ต.ท.วิศาล สวัสดิชัย รองสารวัตรสถานีตำรวจทางหลวง จันทบุรี เป็นตัวแทนรับมอบ เมื่อวันที่ 21 ธันวาคม 2563 ณ โรงพยาบาลกรุงเทพจันทบุรี
กำหนดการเดือน ธันวาคม 2567 หน่วยสัตวแพทย์เคลื่อนที่ กทม.ทำหมัน ฉีดวัคซีน ฟรี
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือน ธันวาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 3 ธันวาคม 2567 ชุมชนเชื่อมสัมพันธ์ บางขุนเทียน / ชุมชนสุเหร่าบ้านดอน วัฒนา
- 4 ธันวาคม 2567 ชุมชนริมคลองบางซื่อ ลาดพร้าว 42-44 ห้วยขวาง / สวนป่าเฉลิมพระเกียรติใต้สะพานตากสิน คลองสาน
- 11 ธันวาคม 2567 ชุมชนหมู่บ้านปัฐวิกรณ์ 1 ผัง ก คันนายาว / วัดดิษหงษาราม ราชเทวี
- 12 ธันวาคม 2567 เคหะชุมชนฉลองกรุง โซน 6 หนองจอก / ชุมชนเย็นอากาศ 2 ยานนาวา
- 13 ธันวาคม 2567 วัดบางปะกอก ราษฎร์บูรณะ
- 24 ธันวาคม 2567 หมู่บ้านชัยพฤกษ์ ทวีวัฒนา / วัดท่าพระ บางกอกใหญ่
- 25 ธันวาคม 2567 ชุมชนวัดรัชฏาธิษฐาน ตลิ่งชัน / ลานหน้าเขตสาทร
- 26 ธันวาคม 2567 หมู่บ้านทวีวิลล่า จอมทอง / วัดบางโคล่นอก บางคอแหลม
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- 2 ธันวาคม 2567 ที่ชุมชนกระทุ่มเสือปลา แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
- 3 ธันวาคม 2567 ที่วัดเกาะสุวรรณาราม แขวงคลองถนน เขตสายไหม เวลา 9.00 - 11.00 น.
- 4 ธันวาคม 2567 ที่ชุมชนเกาะกลาง แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
- 4 ธันวาคม 2567 สำนักงานสัตวแพทย์สาธารณสุข จัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว และฉีดไมโครชิปจดทะเบียนสุนัข ฟรี ที่บ้านมนังคศิลา แขวงสี่แยกมหานาค เขตดุสิต เวลา 9.00 - 12.00 น.
- 9 ธันวาคม 2567 ที่ชุมชนบ้านบึง แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น. และที่ ชุมชนสุเหร่าบึงหนองบอน แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
- 24 ธันวาคม 2567 ที่วัดคลองครุ แขวงคันนายาว เขตคันนายาว เวลา 9.00 - 11.00 น.
- 25 ธันวาคม 2567 ที่ชุมชนสุเหร่าจรเข้ขบ แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
13 ธันวาคม 2567 ณ วัดบางปะกอก เขตราษฎร์บูรณะ
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 13 ธันวาคม 2567 ณ วัดบางปะกอก เขตราษฎร์บูรณะ
✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม)
✅ เริ่มรับคิวทำหมัน 7.00 น.
✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว
✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป
✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว)
✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
15 ธันวาคม 2567 ณ ลานกีฬาแฟลต 51-53 เคหะชุมชนดินแดง 2
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตดินแดง ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตดินแดง เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตดินแดง กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
???? นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 15 ธันวาคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ ลานกีฬาแฟลต 51-53 เคหะชุมชนดินแดง 2 แขวงดินแดง เขตดินแดง (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
รพ.บางปะกอก 8 จองผ่านลิงค์ เท่านั้น LINK
สำหรับผู้ที่มีสิทธิประกันสังคมที่โรงพยาบาลบางปะกอก 8 ที่มีอายุ 50 ปีขึ้นไป รับวัคซีนไข้หวัดใหญ่ฟรี โรงพยาบาลบางปะกอก 8 สงวน Package สำหรับผู้ที่ Booking Onlie ผ่านลิงก์ https://bit.ly/3HgnU5I เท่านั้น โรงพยาบาลบางปะกอก 8 รับฟัง ดูแล ด้วยความใส่ใจ สอบถามรายละเอียดเพิ่มเติม โทร : 02-109-8111
ผู้ประกันตน รพ.บางมด เริ่มฉีดได้ตั้งแต่ 1 พ.ค.66 ไม่เสียค่าใช้จ่าย LINK
สำหรับผู้ประกันตนสิทธิประกันสังคมโรงพยาบาลบางมดที่มีอายุตั้งแต่ 50 ปีขึ้นไป สามารถเข้ารับการฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ตั้งแต่วันที่ 1 พ.ค. - 31 ส.ค 2566 (โดยไม่มีค่าใช้จ่าย) รับบริการได้ที่แผนกผู้ป่วยนอกชั้น1 เปิดบริการทุกวัน เวลา 08.00-19.00น.
เพื่อป้องกัน และลดความรุนแรงจากโรคไข้หวัดใหญ่ สอบถามข้อมูล โทร. 0-2867-0606
และสำหรับผู้ประกันตนสิทธิประกันสังคมโรงพยาบาลบางมด ที่อายุน้อยกว่า 50 ปี ราคาพิเศษเข็มละ 500 บาท (ราคาดังกล่าวเฉพาะค่าวัคซีน ไม่รวมค่าแพทย์)
โรงพยาบาลทีอาร์พีเอช จ.ตรัง เชิญชวนผู้ประกันตน อายุ 50 ปีขึ้นไป ฉีดฟรี LINK
สำนักงานประกันสังคม เปิดโอกาสให้ผู้ประกันตนกลุ่มเสี่ยงที่มีอายุตั้งแต่ 50 ปีขึ้นไป เข้ารับบริการฉีดวัคซีนไข้หวัดใหญ่ประจำปี 66 ระหว่าง 1 พ.ค. - 31 ส.ค. 66 เพื่อส่งเสริมสุขภาพและป้องกันโรคให้แก่ผู้ประกันตน สอบถามถามข้อมูลเกี่ยวเพิ่มเติมเกี่ยวกับประกันสังคมได้ที่ www.sso.go.th หรือโทรสายด่วน 1506 ให้บริการทุกวัน ตลอด 24 ชั่วโมง
มิชชั่นภูเก็ต พร้อมฉีดแล้ว สำหรับผู้ประตน ม.33 และ 39 ที่มีอายุ 50 ปี ขึ้นไป LINK
โรงพยาบาลมิชชั่นภูเก็ต พร้อมฉีดแล้ว สำหรับผู้ประตน ม.33 และ ม.39 ที่มีอายุ 50 ปี ขึ้นไป รับสิทธิฟรี ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ สามารถรับบริการ ณ อาคารผู้ป่วยนอก โรงพยาบาลมิชชั่นภูเก็ต เริ่มตั้งแต่วันที่ 1 พฤษภาคม ถึง 30 สิงหาคม 2566 วันจันทร์ - พฤหัสบดี เวลา 08.30 - 12.00 น. และ 13.30 - 15.30 น. วันศุกร์ เวลา 08.30 - 12.00 น. หยุดวันเสาร์ / อาทิตย์ และนักขัตฤกษ์ เพียงนำบัตรประชาชนมาแสดงสิทธิ สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกประกันสังคม โทร 076 237 220 - 6 ต่อ 102
2 โครงการด้านสินเชื่ออยู่อาศัย และ สินเชื่อสวัสดิการ
จำนวนประชากรไทย จำแนกตามสิทธิหลักประกันสุขภาพ ปีงบประมาณ 2564
จำนวนประชากรไทย จำแนกตามสิทธิหลักประกันสุขภาพ ปีงบประมาณ 2564
ประชากรในระบบหลักประกันสุขภาพถ้วนหน้า 66.853 ล้านคน
•สิทธิหลักประกันสุขภาพแห่งชาติ 47.55 ล้านคน
•สิทธิประกันสังคม 12.082 ล้านคน
•สิทธิข้าราชการ/รัฐวิสาหกิจ 5.093 ล้านคน
•สิทธิพนักงานส่วนท้องถิ่น 0.630 ล้านคน
•บุคคลมีปัญหาสถานะและสิทธิ 0.539 ล้านคน
•ครูเอกชน 0.087 ล้านคน
•ผู้ประกันตนคนพิการ 0.015 ล้านคน
•บุคคลที่ยังไม่ลงทะเบียนสิทธิ 0.188 ล้านคน
•บุคคลที่ไม่อยู่ตามทะเบียนบ้าน 0.091 ล้านคน
•คนไทยในต่างประเทศ 0.011 ล้านคน
ข้อมูล ณ วันที่
30 กันยายน 2564
ผู้ประกันตน เกษมราษฎร์ ฉะเชิงเทรา อายุ 50 ปีขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ ฟรี LINK
ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ สิทธิพิเศษเฉพาะสิทธิ์ประกันสังคมโรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา ✅ ผู้ประกันตน อายุ 50 ปีขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ไม่เสียค่าใช้จ่าย ✅ ผู้ประกันตน อายุน้อยกว่า 50 ปี ฉีดวัคซีนไข้หวัดใหญ่ 4 สายพันธุ์ ราคา 450 บาท/เข็ม ติดต่อสอบถาม-นัดหมาย โทร 1218 กด 7 ต่อ 1085 แผนกประกันสังคม ชั้น B เข้ารับบริการได้ทุกวัน ตั้งแต่เวลา 08.00-17.00 น. (นำบัตรประชาชนมายื่นที่แผนกเวชระเบียน ประกันสังคม ชั้น B) การฉีดวัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ เป็นประจำทุกปี สามารถช่วยลดการระบาดและเสียชีวิต ในแต่ละปี ถือเป็นแนวทางที่ “องค์การอนามัยโลก” WHO แนะนำเพื่อการป้องกันและสร้างภูมิคุ้มกันที่ดีต่อทุกคนอย่างต่อเนื่อง ติดต่อสอบถามเพิ่มเติม ได้ที่ 038-812702-18 หรือ โทร 1218 กด 7
ผลที่คาดหวังว่าจะได้รับของโครงการ
โรงพยาบาลสัตว์ประดิพัทธ์ 2
โรงพยาบาลสัตว์ประดิพัทธ์ 2 เปิดให้บริการดูแลรักษาสัตว์เลี้ยงมายาวนานกว่า 35 ปี ล่าสุดได้มีการปรับปรุงภายในโรงพยาบาลใหม่ เพื่อให้สามารถดูแล รักษาน้องหมา น้องแมวได้อย่างเต็มที่ ส่วนการบริการมีหลายอย่าง ได้แก่ ห้องตรวจรักษา 2 ห้อง , ห้องฝากรักษาสำหรับสุนัขและแมวแยกกันต่างหาก, กรง CCU ที่อยู่ติดกับห้องพักของคุณหมอเพื่อความใกล้ชิดในการดูแลรักษา, ห้องติดเชื้อ, ที่จอดรถรองรับได้ 10 คัน, ห้อง lab ตรวจเลือดพร้อมอุปกรณ์ใหม่ทำให้ราบผลได้ภายใน 10 นาที ตรวจค่าไตได้
บริการตรวจรักษาสัตว์ ได้แก่ ตรวจอายุรกรรมและผ่าตัดแล้ว เรายังมีคลินิกพิเศษมากมายไม่ว่าจะเป็นโรคกระดูกและระบบประสาท, โรคทางช่องหู-ผิวหนัง, โรคทางสูติกรรม (ตรวจท้อง, ประเมิณวันคลอด, ตรวจหาวันผสมเทียม), โรคมะเร็ง, ผ่าตัดกระดูก, อัลตราซาวด์และ Xray
- เปิดบริการ จันทร์ - อาทิตย์ เวลา 9.00 - 20.00
- ตั้งอยู่ที่ 30/2 ซ. พหลโยธิน 11 แขวงสามเสนใน เขตพญาไท กรุงเทพมหานคร 10400
- โทร 022796949 Facebook | @healthserv.net
คลีนิคสัตวแพทย์ หมอหนุ่ย วัดไผ่ตัน ใกล้ๆ สถานีบีทีเอสสะพานควาย
คลีนิคสัตวแพทย์ หมอหนุ่ย น.สพ.ธนบดี รอดสม วัดไผ่ตัน ตั้งอยู่ที่ 1/2 ซอยพหลโยธิน 15 (วัดไผ่ตัน) แขวง/เขต พญาไท ใกล้ๆสถานีบีทีเอสสะพานควาย ดูแลรักษาให้คำปรึกษาทุกเรื่องเกี่ยวกับโรคภัยในสัตว์เลี้ยง เปิดให้บริการจันทร์-ศุกร์ 17.30-20.00 น. เสาร์-อาทิตย์ 9.30-17.00 น. (หยุดทุกวันจันทร์) สอบถามโทร 02-2793219 / 0816270609
Facebookคลินิกประดิพัทธ์สัตวแพทย์ พญาไท
คลินิกประดิพัทธ์สัตวแพทย์ พญาไท ให้บริการเกี่ยวกับสัตว์เลี้ยงหลายอย่าง ได้แก่ การรักษาโรคต่างๆ ฉีดยา ทำฟัน ขูดหินปูน ฟอกไต อาบน้ำ ตัดขน อบโอโซน ฉีดยาเห็บ หยอดยาเห็บ สินค้าเกี่ยวกับสัตว์เลี้ยง และการให้คำปรึกษาต่างๆ ได้ มี 2 สาขา สาขา 1 สะพานควาย สาขา 2 เตาปูน ตั้งอยู่ที่ 191 ถนนประดิพัทธ์ แขวงสามเสนใน เขตพญาไท โทร. 0830366830
Facebook |
@healthserv.net สรุปผลการดำเนินงาน BKK Food Bank (ถึงกรกฎาคม 2567)
ข้อมูลสรุปการดำเนินการโครงการ BKK Food Bank จากเพจชัชชาติ สิทธิพันธุ์ (
5 กรกฎาคม 2567) ระบุว่า
- โครงการ Food Bank ธนาคารอาหารขึ้น โดยรวบรวมอาหาร เครื่องอุปโภค บริโภค จากผู้ที่อยากแบ่งปัน เพื่อนำไปมอบให้กับผู้ที่ขาดแคลน โดยเราจะจัดเป็นที่เก็บของคล้ายๆ ร้านสะดวกซื้อ และให้กลุ่มผู้เปราะบางที่อยู่ในฐานข้อมูลของแต่ละเขตมาเลือกของที่ต้องการ เช่น ข้าวสาร ไข่ น้ำปลา น้ำตาล เสื้อผ้า
- การรับสิ่งของจะใช้แต้มที่มอบให้มาแลก เช่น ได้คนละ 200 แต้ม ข้าวสาร 50 แต้ม น้ำตาล 20 แต้ม ปลากระป๋อง 15 แต้ม ทำให้เป็นการแบ่งปันตามความต้องการอย่างแท้จริง
- ปัจจุบันเปิดแล้ว 29 เขต โดยเขตที่ 30 (ดินแดง) จะเปิดพรุ่งนี้ (วันที่ 6 ก.ค. 67)
นอกจากเครื่องอุปโภคบริโภคแล้ว สำนักงานเขตยังมีการรับ - ส่งต่ออาหารส่วนเกิน (Food Surplus) จาก “ผู้บริจาค ตรงสู่ ผู้รับ” ในพื้นที่และให้ความช่วยเหลือกลุ่มเปราะบางครอบคลุมทุกกลุ่ม โดยจะรับอาหารส่วนเกินจากผู้บริจาค สัปดาห์ละ 3 วัน (ทุกวันอังคาร พุธ พฤหัสบดี) และส่งตรงถึงมือผู้รับ เป็นการร่วมมือกับมูลนิธิ SOS ที่ช่วยประสานกับผู้บริจาคให้
- ปัจจุบันเริ่มดำเนินการแล้ว 37 เขต
- โครงการสามารถส่งต่ออาหารบริจาคได้ 152,175 กก. หรือ 639,136 มื้อ
- ผู้รับเป็น:
- ผู้พิการ 3,266 ราย
- ผู้สูงอายุ 23,078 ราย
- ผู้ป่วยติดเตียง 2,106 ราย
- คนไร้บ้าน 542 ราย
- ผู้ด้อยโอกาส 5,087 ราย
- เด็กในศูนย์ 2,517 ราย
- ประชาชน 18,059 ราย
- ประเภทอาหาร
- เบเกอรี่ 47,858 กก.
- ข้าว 27,802 กก.
- อาหารปรุงสุกพร้อมทาน 20,757 กก.
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตลาดกระบัง
สำหรับผู้ที่ได้ผลกระทบจาก 64 คลีนิก ผู้ใช้สิทธิบัตรทองต้องทำอย่างไร
ไขข้อสงสัย และ แนวทาง ปฎิบัติ
สำหรับผู้ที่ได้ผลกระทบจาก 64 คลีนิก ผู้ใช้สิทธิบัตรทองต้องทำอย่างไร
สามารถเข้าไปดูแนวทางผ่านทาง ไลน์ สปสช. (Line Official Account สปสช.)
กิตติพงษ์ เรือนทิพย์
จารุวรรณ เหล่าสัมฤทธิ์
เผยแพร่: สิงหาคม 2020
Cafe Amazon for Chance สาขา 2 คณะสิ่งแวดล้อมและทรัพยากรศาสตร์ มหิดล
Cafe Amazon for Chance สาขาที่ 2 ดำเนินการโดย ผู้พิการทางการได้ยิน
อยู่ที่ คณะสิ่งแวดล้อมและทรัพยากรศาสตร์ มหาวิทยาลัยมหิดล
999 ถ.พุทธมณฑลสาย 4 ต.ศาลายา อ.พุทธมณฑล จ.นครปฐม, 73170
+66898602599
10. โรงพยาบาลขนาดใหญ่จะทำหน้าที่รับส่งต่อเป็นหลัก
โรงพยาบาลขนาดใหญ่จะทำหน้าที่รับส่งต่อเป็นหลัก ฉะนั้นเมื่อเกินศักยภาพของหน่วยบริการปฐมภูมิ ก็จะถูกส่งต่อมาที่โรงพยาบาล
1. ผู้เดินทางดาวน์โหลดแอปพลิเคชั่น ThailandPlus
1. ผู้เดินทางดาวน์โหลดแอปพลิเคชั่น ThailandPlus ลงในโทรศัพท์เคลื่อนที่ ก่อนที่จะเดินทางมายังประเทศไทย ผ่าน
ติดต่อสอบถาม
ติดต่อสอบถาม โทร. 02-306-9100 ต่อ 3034
02-306-9145 (ในเวลาราชการ)
อีเมล์ contact@thaitravelclinic.com
Facebook: facebook.com/thaitravelclinic
Happy Gummies Terpene infused
Happy Gummies Terpene infused เคี้ยวหนึบหนับ หนึบหนับ
ตัวอย่างผลิตภัณฑ์ กัญชงและกัญชา ในต่างประเทศ
ร้อยเอ็ด งานประเพณีสงกรานต์เมืองร้อยเอ็ด 13 เมษายน 2564
งานประเพณีสงกรานต์เมืองร้อยเอ็ด
13 เมษายน 2564
บึงพลาญชัยและสวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด อ.เมือง จ.ร้อยเอ็ด
นครราชสีมา - ไม่กักตัว เว้นมีอาการกักตัว 14 วัน LINK
7 เมย 64
แนวทางสำหรับผู้มาจาก 5 จังหวัด (กทม ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม)
1. เข้ามาในจังหวัดต้องรายงานตัวใน 12 ชั่วโมง ต่อ อสม/ผู้นำชุมชน/จนท.สธ รพสต ศูนย์แพทย์ หรือ จพง ควบคุมโรคติดต่อในพื้นที่
2. เจ้าหน้าที่จะคัดกรอง
- ถ้าไม่มีไข้ ไม่มีประวัติเสี่ยง ไม่ต้องกักตัว
- มีไข้ หรือมีประวัติสัมผัสผู้ป่วยตามไทม์ไลน์ จะพิจารณากักตัว ที่บ้าน 14 วัน และสุ่มตรวจ กรณีมาจากพื้นที่สีแดง
- มีไข้ ส่งตรวจ รพ. กรณี หากพบเชื้อ จะเข้ากระบวนการรักษา หากไม่พบเชื้อ กักตัวสังเกตอาการและรอตรวจเชื้อซ้ำ
ระหว่างกักตัว 14 วัน หากมีอาการผิดปกติ เช่น มีไข้ น้ำมูก ไอเจ็บคอ สูญเสียการได้กลิ่นและรับรสชั่วคราว หายใจเร็ว หอบเหนื่อย ให้รีบไป รพ.ในพื้นที่ทันที
เพจ
ศูนย์โควิด19 โคราช 081-265-5604 , 065-119-0188 (ทุกวัน 8-20 น.)
044-465-010-4 ต่อ 440 (เวลาราชการ 8.30-16.30 น.)
Line : @covidkorat
ศูนย์ดำรงธรรม 1567
สายด่วนสุขภาพจิต 1323
รพ มหาราชนครราชสีมา โทร 044 235 000
เชียงใหม่ - เพิ่มจุดบริการตรวจหาเชื้อโควิด-19 (10/4/64) และ สถานที่ที่เกิดการระบาดเพิ่มเติม
เชียงใหม่ติดโควิด-19 เพิ่มอีก 186 ราย ยอดสะสมเกือบ 400 คน ผุดร้านเสี่ยงเพิ่ม “ตะวันแดง-พอใจ บาร์-วาเลนไทน์ คาราโอเกะ-Too Nice” คกก.โรคติดต่อสั่งปิดสถานบริการเพิ่มเป็น 14 วัน พร้อมห้ามดื่มเครื่องดื่มแอลกอฮอล์ในร้านอาหาร
ทีมสอบสวนโรคได้สรุปข้อมูลสถานที่ที่เกิดการระบาดเพิ่มเติม ดังต่อไปนี้ ร้านวอร์มอัพ คาเฟ่ เชียงใหม่ ร้านท่าช้าง คาเฟ่ เชียงใหม่ ร้านDC เชียงใหม่ ร้าน Infinity club เชียงใหม่ ร้าน Ground ร้าน Living Machine ร้าน Consol’s Garden และที่เพิ่มมาใหม่คือ ร้าน ตะวันแดง เชียงใหม่ ร้าน พอใจ บาร์ ร้าน วาเลนไทน์ คาราโอเกะ และ ร้าน Too Nice Nimman
“วันนี้ได้ตั้งจุดตรวจรถตรวจหาเชื้อชีวนิรภัยพระราชทาน บริเวณหน้าร้านวอร์มอัพ คาเฟ่ จำนวน 418 ราย จุดตรวจ โรงพยาบาลประสาท เชียงใหม่ จำนวน 303 ราย และจุดตรวจศูนย์ประชุมและแสดงสินค้านานาชาติเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา จังหวัดเชียงใหม่ จำนวน 135 ราย รวมทั้งสิ้น 856 ราย” นพ.สสจ.เชียงใหม่ กล่าว
การตรวจคัดกรองเชิงรุก สสจ.เชียงใหม่ ได้เพิ่มจุดตรวจ
- จากเดิม ที่จุดตรวจที่โรงพยาบาลประสาท และจุดตรวจ รถตรวจหาเชื้อชีวนิรภัยพระราชทาน บริเวณหน้าร้านวอร์มอัพ คาเฟ่
- เพิ่มจุดตรวจที่่ศูนย์ประชุมและแสดงสินค้านานาชาติเฉลิมพระเกียรติ 7 รอบพระชนมพรรษา จังหวัดเชียงใหม่ และจุดตรวจในอำเภอรอบเมือง ได้แก่ อำเภอสันทราย อำเภอดอยสะเก็ด อำเภอสารภี อำเภอสันกำแพง อำเภอหางดง อำเภอแม่ริม
โดยแต่ละจุดตรวจของอำเภอจะมีการประชาสัมพันธ์แจ้งสถานที่ตั้ง ผ่านทางเพจ เว็ปไซต์ของแต่ละอำเภอ รวมถึงสามารถติดตามได้จากเพจเฟสบุ๊ค : งานประชาสัมพันธ์ สำนักงานสาธารณสุขจังหวัดเชียงใหม่ เพจเฟสบุ๊ค : ศูนย์ข่าวสารเฉพาะกิจ จังหวัดเชียงใหม่ , เพจเฟสบุ๊ค : PR Chaingmai ซึ่งจะให้ข้อมูลสถานที่เสี่ยงเพิ่มเติมในทุกวัน
ทั้งนี้สามารถสอบถามข้อมูลและรับคำแนะนำเกี่ยวกับโควิด-19 ได้ที่ สำนักงานสาธารณสุขจังหวัดเชียงใหม่ โทร 053-211048-50 ต่อ 433 , 434 และสอบถามข้อมูลและรับคำแนะนำเกี่ยวกับโรงพยาบาลสนาม ได้ที่ โรงพยาบาลสนาม จังหวัดเชียงใหม่ โทร 053-010561-2
วันนี้มีผู้ติดเชื้อ 985 คน
มีผู้ติดเชื้อรักษาหาย 34 คน
ผู้ป่วยยังรักษาอยู่ 5,265คน
ไม่มีผู้ป่วยติดเชื้อเสียชีวิต
โดยผู้ติดเชื้อวันนี้ 985 คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 5 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 980 คน
2.1ตรวจหาเชื้อเชิงรุก 346 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 634 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 137 คน
3.2 เชียงใหม่ 246 คน
3.3 ชลบุรี 92 คน
3.4 สมุทรปราการ 83 คน
3.5 ประจวบคีรีขันธ์ 52 คน
3.6 สมุทรสาคร 25 คน
3.7 ภูเก็ต 17 คน
3.8 สระแก้ว 18 คน
3.9 นนทบุรี 2 คน
3.10 ระยอง 31 คน
3.11 นครปฐม 17 คน
3.12 ปทุมธานี 36 คน
3.13 เพชรบุรี 12 คน
3.14 อยุธยา 18 คน
3.15 กาญจนบุรี 13 คน
3.16 ฉะเชิงเทรา อุดรธานีเชียงราย จังหวัดละ 10คน
Mix Jeeravat
ตอนที่ 4 บริการทุกระดับประทับใจ
วันที่สิบแล้ว ✌? ขอคั่นด้วยเรื่องกินและการดูแลดีกว่า
ทีมที่ดูแลคนที่กักตัวหลักๆ แบ่งได้สามทีมนะ ทีมจนทดูแลเรื่องความปลอดภัย การเดินทาง นู่นนี่นั่น ทีมโรงแรม ดูแลความเป็นอยู่สารทุกข์สุขดิบตามอัตภาพ ไม่ใช่ว่าทุกอย่างฟรี เติมได้ไม่อั้นนะจ๊ะ นอกเหนือจากที่จัดให้ ต้องจ่ายตังจ้า ? และสุดท้ายท้ายสุด สำคัญสุด ทีมหมอและพยาบาลที่จะโทรปลุกโทรตามผลวัดไข้เช้าเย็น ? โรงแรมใครใหม่หน่อย โทรศัพท์รุ่นใหม่ๆ ฟรุ้งฟริ้ง ก็สบายหูไป แต่ถ้าโรงแรมเก่า โทรศัพท์เก่ารุ่นพระเจ้าเหา แม่เจ้า โทรมาที อกอีแป้นแตกหกตกกระจาย ? มีเคืองนะคะ
กฏระเบียบก็จำเป็นต้องมี หมู่เรามากักตัว ? ทำใจกันนิดนะ เพราะกลับมากันไฟลท์หนึ่งไม่ใช่น้อย และใครป่วยไม่ป่วยก็จะยังไม่รู้ จนกว่าจะตรวจรอบแรกผ่าน ก็อาจจะวางใจได้นิดนึง เพราะฉะนั้น เพื่อลดความเสี่ยงของจนทและผู้เกี่ยวข้อง ก็ไม่ต้องเจอกันค่ะ ตลอดการกักตัว ? อาหารและของใช้จะวางไว้หน้าห้อง ส่งเป็นรอบตามเวลา เช้า เที่ยง บ่าย เย็น ของที่ญาตินำมาให้ก็จะมาตามรอบพวกนี้นะคะ อาหารสด หมัก ดอง จะเน่าหรือไม่เน่า โอมากาเสะอะไรก็ห้ามส่งจ้ะ เพราะอาการบ่งชี้หนึ่งของโควิดคือ ท้องเสีย เพราะฉะนั้นญาติส่งมาได้เฉพาะอาหารแห้งหรือปรุงสุก และของใช้ ???ไรงี้ค่ะ
วันนี้มีผู้ติดเชื้อ 1,582 คน
มีผู้ติดเชื้อรักษาหาย 97 คน
ผู้ป่วยยังรักษาอยู่ 10,461 คน
ไม่มีผู้ป่วยติดเชื้อเสียชีวิต
มีอาการหนักต้องใช้เครื่องช่วยหายใจ 16 คน (เพิ่มจากเมื่อวาน 5 คน)
รักษาตัวที่โรงพยาบาลหลัก 9,884 คน
รักษาตัวที่โรงพยาบาลสนาม 577 คน
โดยผู้ติดเชื้อวันนี้ 1,582คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 5 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,577 คน
2.1ตรวจหาเชื้อเชิงรุก 656 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 921 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 312 คน
3.2 เชียงใหม่ 273 คน
3.3 ชลบุรี 111 คน
3.4 สมุทรปราการ 40 คน
3.5 ประจวบคีรีขันธ์ 100 คน
3.6 สมุทรสาคร 48 คน
3.7 ภูเก็ต 30 คน
3.8 สระแก้ว 15 คน
3.9 สกลนคร 1 คน
3.10 ระยอง 11 คน
3.11 นครปฐม 27 คน
3.12 ปทุมธานี 26 คน
3.13 นนทบุรี 61 คน
3.14 ลำพูน 18 คน
3.15 เชียงราย 77คน
3.16 อุดรธานี 11 คน
3.17 ขอนแก่น 8 คน
3.18 อุบลราชธานี 7 คน
3.19 สงขลา 89 คน
3.20 อยุธยา 19 คน
3.21 เพชรบุรี 17 คน
3.22 ราชบุรี 12 คน
3.23 นครราชสีมา 14 คน
3.24 ฉะเชิงเทรา 9 คน
3.25 พิษณุโลก 8 คน
3.26 สุราษฎร์ธานี 11 คน
3.27 บุรีรัมย์ 8 คน
3.28 ลำปาง 59 คน
3.29 สุรินทร์ 6 คน
3.30 กาญจนบุรี 4 คน
3.31 ศรีสะเกษ 19คน
3.32 สิงห์บุรี 10 คน
3.33 แพร่ 19 คน
3.34 นครศรีธรรมราช 10 คน
3.35 พะเยา 9 คน
3.36 ตรัง 6 คน
Mix Jeeravat
วันนี้มีผู้ติดเชื้อ 1,547 คน
มีผู้ติดเชื้อรักษาหาย 90 คน
ผู้ป่วยยังรักษาอยู่ 11,916คน
มีผู้ป่วยติดเชื้อเสียชีวิต 2 คน
โดยผู้ติดเชื้อวันนี้ 1,547คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 3 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,544 คน
2.1ตรวจหาเชื้อเชิงรุก 228 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 1,316 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 279 คน
3.2 เชียงใหม่ 140 คน
3.3 ชลบุรี 99 คน
3.4 สมุทรปราการ 27 คน
3.5 ประจวบคีรีขันธ์ 58 คน
3.6 สมุทรสาคร 37 คน
3.7 ภูเก็ต 24 คน
3.8 สระแก้ว 4 คน
3.9 สกลนคร 9 คน
3.10 ระยอง 10 คน
3.11 นครปฐม 18 คน
3.12 ปทุมธานี 26 คน
3.13 นนทบุรี 12 คน
3.14 ลำพูน 45 คน
3.15 เชียงราย 17คน
3.16 อุดรธานี 30 คน
3.17 ขอนแก่น 12 คน
3.18 อุบลราชธานี 12 คน
3.19 สงขลา 17 คน
3.20 อยุธยา 13 คน
3.21 เพชรบุรี 20 คน
3.22ราชบุรี 14 คน
3.23 นครราชสีมา 6 คน
3.24 ฉะเชิงเทรา 11 คน
3.25 พิษณุโลก 25 คน
3.26 สุราษฎร์ธานี 23 คน
3.27 บุรีรัมย์ 9 คน
3.28 ลำปาง 10 คน
3.29 นครสวรรค์ 6 คน
3.30 กาญจนบุรี 5 คน
3.31 ศรีสะเกษ 13คน
3.32 สระบุรี 7 คน
3.33 อุตรดิตถ์ 10 คน
3.34 นครศรีธรรมราช 6 คน
3.35 พะเยา 21 คน
3.36 ชัยภูมิ 7 คน
3.37 ร้อยเอ็ด มหาสารคาม ชุมพร ลพบุรีจังหวัดละ 6 คน
วันนี้มีผู้ติดเชื้อ 1,767 คน
มีผู้ติดเชื้อรักษาหาย 113 คน
ผู้ป่วยยังรักษาอยู่ 13,568 คน
มีผู้ป่วยติดเชื้อเสียชีวิต 2 คน
มีผู้ป่วยติดเชื้ออาการหนัก 128 คน(เพิ่มจากเมื่อวาน61)
ผู้ป่วยติดเชื้ออาการหนักต้องใช้เครื่องช่วยหายใจ 28 คน(เพิ่มจากเมื่อวาน 7คน)
โดยผู้ติดเชื้อวันนี้ 1,767 คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 2 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,765 คน
2.1ตรวจหาเชื้อเชิงรุก 288 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 1,477 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1กรุงเทพ 347 คน
3.2เชียงใหม่ 164 คน
3.3ชลบุรี 229 คน
3.4สมุทรปราการ 64 คน
3.5ประจวบคีรีขันธ์ 66 คน
3.6สมุทรสาคร 18 คน
3.7ภูเก็ต 25 คน
3.8 สระแก้ว 10 คน
3.9สกลนคร 2 คน
3.10ระยอง 35 คน
3.11 นครปฐม 26 คน
3.12ปทุมธานี 24 คน
3.13นนทบุรี 100 คน
3.14ลำพูน 25 คน
3.15เชียงราย 17 คน
3.16อุดรธานี 15 คน
3.17ขอนแก่น 9 คน
3.18อุบลราชธานี 7 คน
3.19สงขลา 25 คน
3.20อยุธยา 7 คน
3.21เพชรบุรี 23 คน
3.22ราชบุรี 12 คน
3.23นครราชสีมา 51 คน
3.24ฉะเชิงเทรา 29 คน
3.25พิษณุโลก 46 คน
3.26สุราษฎร์ธานี 38 คน
3.27น่าน 26 คน
3.28ลำปาง 34 คน
3.29นครสวรรค์ 6คน
3.30ตาก 14 คน
3.31ศรีสะเกษ 6 คน
3.32สุรินทร์ 8 คน
3.33อุตรดิตถ์ 17 คน
3.34นครศรีธรรมราช 12 คน
3.35พะเยา 21 คน
3.36ชัยภูมิ 7 คน
3.37ลพบุรี 8 คน
3.38นครพนม 8 คน
วันนี้มีผู้ติดเชื้อ 1,390 คน
มีผู้ติดเชื้อรักษาหาย 104 คน
ผู้ป่วยยังรักษาอยู่ 14,851 คน
มีผู้ป่วยติดเชื้อเสียชีวิต 3 คน
โดยผู้ติดเชื้อวันนี้ 1,390 คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 6 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 1,384 คน
2.1ตรวจหาเชื้อเชิงรุก 326 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 1,058 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1กรุงเทพ 293 คน
3.2เชียงใหม่ 197 คน
3.3ชลบุรี 98 คน
3.4สมุทรปราการ 82 คน
3.5ประจวบคีรีขันธ์ 23 คน
3.6สมุทรสาคร 32 คน
3.7ภูเก็ต 18 คน
3.8 สระแก้ว 18 คน
3.9สกลนคร 1 คน
3.10ระยอง 19 คน
3.11 นครปฐม 38 คน
3.12ปทุมธานี 19 คน
3.13นนทบุรี 39 คน
3.14พัทลุง 10 คน
3.15เชียงราย 17 คน
3.16อุดรธานี 23 คน
3.17ขอนแก่น 20 คน
3.18อุบลราชธานี 12 คน
3.19สงขลา 32 คน
3.20อยุธยา 41 คน
3.21เพชรบุรี 35 คน
3.22ราชบุรี 5 คน
3.23นครราชสีมา 35 คน
3.24ฉะเชิงเทรา 15 คน
3.25พิษณุโลก 26 คน
3.26สุราษฎร์ธานี 42 คน
3.27จันทบุรี 9 คน
3.28ลำปาง 7 คน
3.29นครสวรรค์ 10คน
3.30ตาก 4 คน
3.31ศรีสะเกษ 2 คน
3.32สุรินทร์ 3 คน
3.33อุตรดิตถ์ 5 คน
3.34นครศรีธรรมราช 11 คน
3.35พะเยา 6 คน
3.36ชัยภูมิ 7 คน
3.37ลพบุรี 4 คน
3.38นครพนม 7 คน
3.39เพชรบูรณ์ 6 คน
3.40กำแพงเพชร 6 คน
3.41กาฬสินธุ์ 8 คน
3.42ปราจีนบุรี 7 คน
Mix Jeeravat
Q ถ้าผลตรวจโควิดเป็นลบต้องทำอย่างไร?
10. เลือกหน่วยบริการแห่งใหม่
Episode 2 : การฝึกหายใจร่วมกับการฝึกกล้ามเนื้อแขนและขา
ประกันภัยสำหรับการแพ้วัคซีน COVID-19 - ทิพยประกันภัย LINK
ประกันภัยสำหรับการแพ้วัคซีน COVID-19 ภาวะแทรกซ้อนหรือผลข้างเคียงจากการฉีดวัคซีนเพื่อป้องกันโรคติดเชื้อไวรัส COVID-19 ป้องกันไว้ก่อน ใครก็ซื้อได้ ราคาเริ่มต้นเพียง 70 บาท/ปี คุ้มครองจัดเต็มสูงสุด 1,000,000 บาท
- เจ็บป่วยภาวะโคม่า คุ้มครองสูงสุด 1,000,000 บาท
- ค่ารักษาพยาบาล คุ้มครองสูงสุด 1,000,000 บาท
- เบี้ยราคาประหยัด เริ่มต้น 70 บาท/คน/ปี
ความคุ้มครอง
- การเจ็บป่วยด้วยภาวะโคม่า (Coma) อันเนื่องจากภาวะแทรกซ้อนหรือผลข้างเคียง จากการฉีดวัคซีน COVID-19 สูงสุด 1,000,000 บาท
- การรักษาพยาบาลเป็นผู้ป่วยใน อันเนื่องจากภาวะแทรกซ้อนหรือผลข้างเคียง จากการฉีดวัคซีน COVID-19 สูงสุด 100,000 บาท/ปี
รายละเอียดความคุ้มครอง หากติดโควิด "รอให้หายก่อน ค่อยฉีดวัคซีน" โดยเว้น 3-6 เดือน นับจากวันที่ ตรวจพบเชื้อ
เขตสุขภาพที่ 10 อุบลราชธานี
สำนักงานป้องกันควบคุมโรคที่ 10 จังหวัดอุบลราชธานี
-เบอร์โทรศัพท์: 045 255 934, 045 243 235
-เว็บไซต์:https://ddc.moph.go.th/odpc10/ (ยังไม่เปิดให้บริการ)
อุบลราชธานี
- สำนักงานสาธารณสุขจังหวัดอุบลราชธานี
เบอร์โทรศัพท์: 045 243 301
เว็บไซต์: http://www.phoubon.in.th/
- โรงพยาบาลสรรพสิทธิประสงค์
เบอร์โทรศัพท์: 045 319 300
เว็บไซต์: http://www.50pansa.go.th/
- โรงพยาบาลสมเด็จพระยุพราชเดชอุดม
เบอร์โทรศัพท์: 045 361 133
เว็บไซต์: http://www.detudomhospital.org/
- โรงพยาบาลวารินชำราบ
เบอร์โทรศัพท์: 045 424 250
เว็บไซต์: https://www.warin.go.th/โรงพยาบาลสมุทรสาคร ประกาศคิวฉีดกระตุ้นเข็ม 3 LINK
โรงพยาบาลสมุทรสาคร ประกาศคิวฉีดกระตุ้นเข็ม 3 ตั้งแต่ 25 กันยายน ถึง 12 ตุลาคม 64 สถานที่ฉีด โรงเรียนเทศบาลบ้านมหาชัย เวลา 8.30 - 14.30 น.
หลักฐานที่ต้องนำมาแสดง คือ การรับวัคซีนครบ 2 เข็ม หรือ ข้อมูล หมอพร้อม
เขตลาดพร้าว ลงพื้นที่ติดตามการขุดลอกคลองสองตอน ร่วมกับสำนักการระบายน้ำ LINK
นางสุภาพร ศรีศาสนวงศ์ ผู้อำนวยการ
เขตลาดพร้าว พร้อมด้วยนางสาวเสาวลักษณ์ วยะนันทน์ นายเจษฎา ประภาสะวัต ผู้ช่วยผู้อำนวยการเขตลาดพร้าว นายจิรวัฒน์ วงษ์ชนะ หัวหน้ากลุ่มงานระบายน้ำฯ และนายศราวุฒิ เพียรธัญกรณ์ นายช่างโยธาชำนาญงาน ลงพื้นที่ติดตามการดำเนินงานร่วมกับกลุ่มงานขุดลอกคลอง สำนักการระบายน้ำ นำรถแม็คโครขุดลอกเปิดทางน้ำไหล ทำนบไม้ชั่วคราว คลองสองตอน จุดเชื่อมต่อระหว่างคลองสองตอนและคลองทรงกระเทียม บริเวณซอยนาคนิวาส 37 แยก 2-4 นำโดยนายสุทธิเดช สุบงกฎ นายช่างโยธาชำนาญงาน กลุ่มงานขุดลอกคลอง สำนักการระบายน้ำ เพื่อเพิ่มประสิทธิภาพการระบายน้ำ ป้องกันและแก้ไขปัญหาน้ำท่วมขังบริเวณถนนนาคนิวาสและถนนโชคชัย 4 ทั้งนี้ เป็นการสนับสนุนนโยบาย "NOW MOVING FORWARD" ทำจริง เห็นผลจริง ของ พล.ต.อ.อัศวิน ขวัญเมือง ผู้ว่าราชการกรุงเทพมหานคร
รพ.เชียงใหม่ ฮอสพิทอล วันที่ 11 พฤศจิกายน 2564 LINK
โรงพยาบาลเชียงใหม่ ฮอสพิทอล เผยภาพบรรยากาศการฉีดวัคซีนทางเลือก Moderna รอบที่ 1 ประจำไตรมาส 4/2564 เมื่อวันที่ 11 พฤศจิกายน 2564 เวลา 09.00-12.00 น. "สามารถสำเร็จลุล่วงไปได้เป็นอย่างดี "
สำหรับวันนัดหมายฉีดรอบที่ 2 จะประกาศให้ทราบต่อไป เมื่อวัคซีนส่งมอบถึงโรงพยาบาลในช่วงปลายเดือนนี้
ลอยกระทงบนรางที่ไอคอนสยาม (ICONSIAM) LINK
อัปเดตบรรยากาศสุดชิลริมโค้งแม่น้ำเจ้าพระยาที่สวยที่สุดในเทศกาลลอยกระทง ในพื้นที่ ICONSIAM A Magical Loy Krathong Upon The Chao Phraya River 2021 มหัศจรรย์เทศกาลลอยกระทงบนแม่น้ำเจ้าพระยา ใครยังไม่ได้ลอยกระทงยังคงมากันได้จนถึงเวลา 23.00 น. ณ ริเวอร์ พาร์ค ไอคอนสยาม
คริส ร๊อค
กันยายน นักแสดงตลกผิวสี ประกาศผ่านทวิตเตอร์ว่าเขาติดโควิด เขาเป็นอีกคนที่ติดโควิดหลังจากฉีดวัคซีนแล้ว เขาบอกกล่าวกับแฟนๆ ให้ไปฉีดวัคซีน
ประมวลภาพการฉีดวัคซีนโมเดอร์น่า อบจ.ปทุมธานี LINK
ตามกลุ่มเป้าหมายของสภากาชาดไทย โดยองค์การบริหารส่วนจังหวัดปทุมธานี นำโดย พล.ต.ท.คำรณวิทย์ ธูปกระจ่าง นายกองค์การบริหารส่วนจังหวัดปทุมธานี ร่วมกับสภากาชาดไทย โรงพยาบาลแพทย์รังสิต โรงพยาบาลส่งเสริมสุขภาพตำบล ออกหน่วยแพทย์เคลื่อนที่ ณ เขตอำเภอหนองเสือ จ.ปทุมธานี ประจำวันอังคาร ที่ 7 ธันวาคม 2564
6. ในเมื่อวัคซีน ณ ปัจจุบันที่มีก็มีประสิทธิภาพดีอยู่แล้ว ทำไมจึงยังจำเป็นจะต้องใช้วัคซีนจาก Novavax?
ก็เป็นข้อเท็จจริงอีกเช่นกันที่ก็มีบางคนที่แพ้ส่วนประกอบบางอย่างของวัคซีน mRNA นั่นก็หมายความว่า วัคซีนชนิดอื่นอาจเป็นวัคซีนทางเลือกสำหรับกลุ่มคนเหล่านี้ ผลิตภัณฑ์จาก Novavax ยังมีข้อได้เปรียบด้านลอจิสติกส์ที่สำคัญ ซึ่งต่างจากวัคซีนของ Biontech และ Moderna ตรงที่ วัคซีนไม่ต้องการการขนส่งภายใต้อุณหภูมิต่ำ ดังนั้นจึงง่ายต่อการขนส่งและใช้งาน วัคซีนที่ใช้โปรตีนนั้นยังถูกกว่าในแง่ของการผลิตอีก
ตามสถิติการฉีดวัคซีน “Our World in Data” ที่ถูกจัดเก็บโดยมหาวิทยาลัยอ็อกซ์ฟอร์ด จนถึงขณะนี้มีเพียงประมาณ 7% ของประชากรในประเทศยากจนเท่านั้นที่ได้รับวัคซีนโดสแรก เพราะฉะนั้นวัคซีนอื่นๆ รวมทั้งของ Novavax ก็ยังจะเข้ามามีบทบาทในการต่อต้านการแจกจ่ายวัคซีนที่ไม่เป็นธรรมในโลก
โรงพยาบาลสารภี เชียงใหม่กับผลิตภัณฑ์สมุนไพร
@หนองคาย
@หนองคาย แวะชิมชา ท่อมชงชา ได้ที่บู๊ทนี้
สาธิตทำน้ำมันสนั่นไตรภพ สูตรตำรับยา
อีกด้านของสินค้าจากเชียงคานและหนองคาย
ผู้ป่วยโอมิครอน 2 สามีภรรยา นับเป็นรายที่ 10063 และ 10064 ของกาฬสินธุ์
22 ธันวาคม 64 ประชาสัมพันธ์จังหวัดกาฬสินธุ์ รายงาน ผลตรวจยืนยันเบื้องต้น พบผู้ป่วยโควิด สายพันธุ์โอไมครอน ใน จ.กาฬสินธุ์ จำนวน 2 คน รอผลตรวจจากกรมวิทยาศาสตร์การแพทย์อีกครั้ง ทั้งหมดเข้ารักษาตัวที่ รพ.เอกชน ใน จ.ขอนแก่น แล้ว ทั้งนี้สาธารณสุขจังหวัดกาฬสินธุ์เข้าตรวจสอบผู้สัมผัสเสี่ยงสูงมากักตัวและตรวจหาเชื้อครบทุกคนแล้ว ไม่พบผู้ติดเชื้อเพิ่มแต่อย่างใด
Hospitel รพ.นวมินทร์ 9 LINK
รพ.นวมินทร์ 9 ร่วมกับ SP Residence หอผู้ป่วยเฉพาะกิจ สำหรับผู้ป่วยโควิด-19
รับผู้ป่วยประกันสังคม
02-5181818
ขั้น 1: เตรียมเอกสารสำหรับการลงทะเบียน
เอกสารหลักฐานที่ต้องมีดังนี้
1. สำเนาหนังสือเดินทาง
2. หลักฐานการฉีดวัคซีน
หากมี QR Code เช่น EU Green Card จะทำให้กระบวนการง่ายขึ้น
วัคซีนที่ไทยยอมรับ ได้แก่
Sinovac 2 เข็ม - เว้นระยะห่าง 2 สัปดาห์
AstraZeneca 2 เข็ม - เว้นระยะห่าง 4 สัปดาห์
Johnson & Johnson 1 เข็ม
Pfizer 2 เข็ม - เว้นระยะห่าง 3 สัปดาห์
Moderna 2 เข็ม - เว้นระยะห่าง 4 สัปดาห์
Sinopharm 2 เข็ม - เว้นระยะห่าง 3 สัปดาห์
Sputnik V 2 เข็ม - เว้นระยะห่าง 3 สัปดาห์
หากระยะห่างระหว่างเข็มน้อยกว่าที่กำหนด หลักฐานการฉีดวัคซีนของท่านจะถูกปฏิเสธ
เอกสารรับรองการได้รับวัคซีน ต้องประกอบด้วย รายละเอียดยืนยันตัวบุคคล (ชื่อ-สกุล วันเดือนปีเกิด สัญชาติ หมายเลขหนังสือเดินทาง) และรายละเอียดการได้รับวัคซีน (จำนวนครั้งต้องครบถ้วนตามที่บริษัทกำหนด / วันที่ได้รับวัคซีน โดยเข็มสุดท้ายจะต้องได้รับก่อนวันเดินทางไม่ต่ำกว่า 14 วัน / ตัวเลขรุ่นการผลิต (lot/batch number of vaccine)
สามารถใช้หลักฐานการฉีดวัคซีนต่างบริษัทผู้ผลิตได้ แต่ต้องเว้นระยะห่างระหว่างการฉีดตามที่บริษัทผู้ผลิตเข็มแรกกำหนด
ผู้ที่เคยติดเชื้อและหายป่วยแล้ว สามารถแสดงหนังสือยืนยันการติดเชื้อ/หายป่วย ประกอบกับหลักฐานการฉีดวัคซีน 1 เข็ม ได้ (จะฉีดก่อน หรือหลังการติดเชื้อเป็นระยะเวลาเท่าใดก็ได้)
เด็กอายุต่ำกว่า 12 ปี ที่ไม่ได้ฉีดวัคซีน และเดินทางพร้อมผู้ปกครอง สามารถเข้าไทยตามเงื่อนไขเดียวกันกับผู้ปกครอง
เด็กอายุตั้งแต่ 12 ปี แต่ไม่เกิน 18 ปี ต้องแสดงหลักฐานการฉีดวัคซีน 1 เข็มอย่างน้อย 14 วันก่อนเดินทาง ยกเว้นกรณีที่เดินทางพร้อมผู้ปกครอง ไม่ต้องใช้หลักฐานการฉีดวัคซีน โดยเด็กจะสามารถเข้าไทยได้ตามเงื่อนไขเดียวกับผู้ปกครอง
3. หลักฐานการจองโรงแรมตามเงื่อนไขที่กำหนด
- ดูรายชื่อโรงแรม AQ ได้ คลิกที่นี่
- ดูรายชื่อโรงแรม SHA Extra + ได้ที่ thailandsha.com/shaextraplus (เลือกดูเฉพาะจังหวัดภูเก็ต)
- หลักฐานการจองโรงแรม SHA Extra+ หรือ AQ ต้องออกให้โดยโรงแรมโดยตรง หรือผ่านทาง www.agoda.com/quarantineth / https://asq.locanation.com / https://asq.ascendtravel.com / https://asqthailand.com / https://entrythailand.go.th
- ผู้เข้าโครงการ Sandbox ที่ภูเก็ต ต้องแสดงหลักฐานการจองโรงแรม SHA Extra+ พร้อมหลักฐานการจองและชำระเงินค่าตรวจโควิด-19 ด้วยวิธี RT-PCR ผ่าน https://www.thailandpsas.com/
4. ข้อมูลการเดินทางเข้าไทย / รายละเอียดเที่ยวบิน
- ผู้เข้าโครงการฯ ที่ภูเก็ต จะต้องบินจากต่างประเทศไปลงที่สนามบินภูเก็ตโดยตรงเท่านั้น
- ปัจจุบันยังไม่สามารถลงกรุงเทพฯ และต่อเครื่องไปภูเก็ตได้
5. ประกันสุขภาพวงเงินไม่ต่ำกว่า 50000 USD
เฉพาะสำหรับชาวต่างชาติ / หากยังไม่มีประกัน สามารถซื้อประกันได้ [
ที่นี่]
โรงพยาบาลเอกชล 2 ชุดตรวจ ATK (Antigen test kit) ราคา 490 บาท LINK
"เตรียมความพร้อมก่อนเริ่มทำงาน"
โรงพยาบาลเอกชล 2 ขอเชิญชวน ?ผู้รับบริการทั่วไปเพื่อกลับเข้าสู่การทำงาน หรือผู้ที่กำลังเตรียมสอบเข้ารับราชการท้องถิ่น โดยการตรวจหาเชื้อ COVID-19 ด้วยชุดตรวจ ATK (Antigen test kit)
ตรวจหาเชื้อ COVID-19 ชุดตรวจ ATK (Antigen test kit)
?ราคา 490 บาท
(ราคานี้รวมใบรับรองแพทย์แล้ว)
?ตั้งแต่วันนี้ถึง 31 มกราคม 2565
?เข้ารับบริการได้ที่โรงพยาบาลเอกชล 2
?สอบถามเพิ่มเติมได้ที่ แผนกบริการสุขภาพ
โทร. 038 939 888 ต่อ 5169
คำแนะนำกรณีไปในสถานที่-จุดเสี่ยง ตามประกาศ ศูนย์โควิดจ.นนทบุรี LINK
ลงทะเบียนด้วยข้อมูลที่แท้จริง ตาม QR Code เพื่อเฝ้าระวังและสอบสวนโรค
หลังจากลงทะเบียน ขอให้ท่านและครอบครัว ปฏิบัติดังนี้
1. ตรวจคัดกรอง ATK เพื่อหาเชื้อด้วยตนเอง และสังเกตอาการให้ครบ 14 วัน ตรวจซ้ำหากมีอาการผิดปกติ หรือ หลังจากกลับมาบ้านครบ 3-5 วัน
2. งดออกไปในที่ชุมชนที่มีคนอยู่จำนวนมาก หรือ สถานที่ที่มีความแออัด หากมีความจำเป็นให้สวมใส่หน้ากากอนามัยตลอดเวลา ล้างมือบ่อย ๆ และงดรับประทานอาหารร่วมกับบุคคลอื่น
3. งดการใช้สิ่งของร่วมกับผู้อื่น
‼️สังเกตอาการป่วยของตนเองภายใน 14 วันท่านที่สงสัยว่ามีอาการป่วย หรือ เสี่ยงติดเชื้อ เช่น สัมผัสใกลชิดกับผู้ป่วยยืนยัน หรือ มีอาการติดเชื้อ เช่น ไข้ ไอ น้ำมูก เจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่ได้รับรส หรือ ถ่ายเหลว อย่างใดอย่างหนึ่ง ขอให้รายงานตัวกับเจ้าหน้าที่สาธารณสุข และเข้ารับการตรวจหาเชื้อโควิด19
สอบถามเพิ่มเติม สำนักงานสาธารณสุขจังหวัดนนทบุรี โทร 061-3945402, 061-3945403, 061-1722534, 061-1742260
สปส. กรุงเทพมหานครพื้นที่ 11 LINK
เลขที่2-8 ถนนพระราม 3 ซอย 27 แขวงบางโพงพาง เขตยานนาวา กทม. 10120
* จุดสังเกต : ใกลกับวัดดอกไม้*
รับผิดชอบเขต ยานนาวา สาทร บางคอแหลม
Tel. 02-2945958, 0-22945504
Fax 02-2945504
ฝ่ายอำนวยการ 02-2945958 ต่อ 401
งานสิทธิประโยชน์ทดแทน 02-2945958 ต่อ 201
งานการเงินและบัญชี 02-2945958 ต่อ 206
งานเงินสมทบ 02-2945958 ต่อ 405
งานทะเบียนและประสานการแพทย์ 02-2945958 ต่อ 308
พญาไท รับตรุษจีน LINK
5 แพ็กเกจสุขภาพ
- ตรวจคัดกรองมะเร็งปากมดลูก 890 บาท
- ตรวจสุขภาพ Happy Strong 4,320 บาท
- ตรวอัลตร้าซาวด์ ช่องท้องส่วนบน-ล่าง 1,520 บาท
- ตรวจคัดกรองมะเร็งเต้านม 1,910 บาท
- ดริปวิตามินทางหลอดเลือด 945 บาท
สามารถสอบถามเพิ่มเติมได้ที่ Call center 1772
สรุปค่าใช้จ่ายที่จะจัดเก็บจากผู้ยื่นค าขอในกระบวนการพิจารณาอนุญาตด้านอาหาร LINK
สรุปค่าใช้จ่ายที่จะจัดเก็บจากผู้ยื่นคำขอในกระบวนการพิจารณาอนุญาตด้านอาหาร
1. ผู้ยื่นคำขออนุญาตด้านอาหาร ที่ยื่นคำขอกับ อย. หรือคำขออยู่ในอำนาจอนุญาตของ อย.ที่ยื่น ณ สสจ. ตั้งแต่วันที่ 7 ส.ค.60 เป็นต้นไป ต้องชำระค่าใช้จ่ายตามประกาศกระทรวงสาธารณสุข เรื่อง ค่าใช้จ่ายที่จะจัดเก็บจากผู้ยื่นคำขอในกระบวนการพิจารณาอนุญาตผลิตภัณฑ์อาหาร พ.ศ. 2560 ลงวันที่ 26 กรกฎาคม 2560 สามารถดาวน์โหลดฉบับลงราชกิจจาฯ ได้ที่ URL :
https://goo.gl/Mc9pbJ หรือ QR Code นี้
โปรดตรวจสอบอัตราค่าใช้จ่ายก่อนชำระเงิน (กรณีไม่มั่นใจ กรุณาสอบถามเจ้าหน้าที่ก่อน)
2. สำหรับผู้ยื่นคำขอ ตามเงื่อนไขในตารางที่ 1 ได้รับยกเว้นค่าใช้จ่ายที่จะจัดเก็บทั้งหมด กรุณานำหลักฐานมายื่นกับ เจ้าหน้าที่กองอาหารที่ตึกสำนักงานคณะกรรมการอาหารและยา อาคาร 5 ชั้น 3 ห้อง 325
บริจาคโลหิตกับกลุ่มเซ็นทรัล ห้างในพื้นที่กรุงเทพ 6 แห่ง
สถาบันราชานุกูล เปิดลงทะเบียนนัดฉีด ตั้งแต่ วันที่ 7 - 28 กุมภาพันธ์ 2565 LINK
สถาบันราชานุกูลเปิดลงทะเบียนนัดฉีดวัคซีนโควิดไฟเซอร์ (Pfizer ฝาสีส้ม) สำหรับเด็กที่มีอายุ 5-11 ปี อายุเป้าหมายที่ฉีด : เด็กที่มีอายุ 5 ปีบริบูรณ์ จนถึงอายุ 11 ปี 11 เดือน 29 วัน
โดยสามารถลงนัดฉีดวัคซีนได้ตั้งแต่ วันที่ 7 - 28 กุมภาพันธ์ 2565 นัดช่วงเวลา 14.00-15.00 น. เท่านั้น โดยวันฉีดผู้ปกครองสามารถเข้าไปในศูนย์วัคซีนสถาบันราชานุกูลได้ 1 คน
***ขนาดการใช้วัคซีนลดลงเหลือ 1 ใน 3 (10 ไมโครกรัม) ของผู้มีอายุ 12 ปีขึ้นไป ด้วยการฉีดวัคซีนเข้ากล้ามเนื้อ จำนวน 2 เข็ม ห่างกัน 8 สัปดาห์
กรณีเด็กที่เคยมีการติดโรคโควิด-19 มาแล้ว จะฉีดวัคซีนป้องกันโรคโควิด-19 เพียงหนึ่งเข็ม โดยเว้นระยะเวลาอย่างน้อยสามเดือนเมื่อหายดีจากโรคโควิด-19
การฉีดวัคซีนจะต้องได้รับการยินยอมและอนุญาตจากผู้ปกครอง
รับบริการที่ อาคารผู้ป่วยนอกใหม่ ชั้น 3 สถาบันราชานุกูล ถ.ดินแดง กทม.
3. หายป่วยจากโรคโควิด-19 แล้ว
กรณี 3. ผู้เดินทางที่เคยป่วยโควิด-19 มาก่อน จะต้องได้รับการรักษาให้หายป่วยจากโรคโควิด-19 มาแล้ว 180 วันแรก จากการทดสอบด้วย RT-PCR
การตรวจเพิ่มเติม
การตรวจอื่นๆ อาจพิจารณาทำเพื่อประเมินหาภาวะสมองเสื่อมเกิดจากสาเหตุที่สามารถแก้ไขให้กลับคืนเป็นปกติหรือ
หยุดยั้งไม่ให้การดำเนินโรคเลวลงได้ และเพื่อช่วยยืนยันการวินิจฉัย ได้แก่
- การตรวจเลือด ได้แก่ การตรวจ complete blood count (CBC), chemistry panel (renal function tests, liver function test), electrolyte, Calcium, thyroid function test, B12 และ folate level สำหรับการตรวจอื่นที่อาจพิจารณาตรวจเพิ่มเติมได้แก่ ESR, Urinalysis, Toxicology, CXR, Heavy metal screen, HIV test, Syphilis serology, CSF examination, EEG, และPET or SPECT ขึ้นอยู่กับอาการทางคลินิก
- การตรวจภาพรังสี ได้แก่ การตรวจ CT scan (Brain)หรือ การตรวจ Magnetic resonance imaging (MRI brain) เพื่อดูว่ามีความผิดปกติทางกายวิภาคที่เข้าได้กับโรคที่สงสัยหรือไม่
- การตรวจหา biomarkers อื่นๆ เช่น การตรวจน้ำไขสันหลังเพื่อดูระดับ CSF A1-42 และ CSF total tau การตรวจความผิดปกติทางพันธุกรรม presemilin 1, presenilin 2 และ amyloid precursor protein mutation การตรวจหา Apolipoproteint E-4 อย่างไรก็ตามการตรวจเหล่านี้ ไม่ได้ทำเป็นปกติในเวชปฏิบัติ จะเลือกพิจารณาทำในบางกรณีโดยแพทย์ผู้เชี่ยวชาญ
- การตรวจเพิ่มเติมทางจิตประสาท การทดสอบทางจิตประสาทเพิ่มเติม อาจใช้ร่วมกับอาการและความผิดปกติทางภาพรังสี ในการวินิจฉัยโดรค การทดสอบความสามารถของสมองวิธีอื่นๆ มีเป็นจำนวนมากเช่น การทดสอบ MoCA test, DemTect, BNA, GPCOG และ 7MS การเลือกใช้การทดสอบใดขึ้นอยู่กับลักษณะของผู้ป่วยและความสามารถของการทดสอบที่จะช่วยในการวินิจฉัยความผิดปกติ แต่สิ่งที่สำคัญคือ ความคุ้นเคยของผู้ทำการทดสอบมากกว่า ถ้าผู้ทำการทดสอบมีความเคยชินกับการทดสอบหนึ่งๆ และมีประสบการณ์ในการทำการทดสอบนั้นมามาก ในผู้ป่วยที่มีความแตกต่างกันหลากหลาย จะทำให้ผู้ทำการทดสอบมีความสามารถในการแปลผลความผิดปกติที่ได้มากกว่าการเลือกใช้การทดสอบหลายชนิดแต่ผู้ทำการทดสอบเคยมีประสบการณืในการทำในผู้ป่วยไม่มากนัก โดยภาพรวมของการทดสอบต่างๆ มีดังนี้คือ
ก. ไม่มีการทดสอบใดจะเหมาะสำหรับผู้ป่วยทุกภาวะ เช่น การทดสอบหนึ่งอาจคิดขึ้นมาเพื่อใช้ในการตรวจคัดกรองผู้ป่วยในชุมชน แต่ถูกนำมาใช้ในการตรวจในโรงพยาบาล
ข. การทดสอบที่สั้น ใช้เวลาไม่มาก จะไม่สามารถประเมินผู้ป่วยได้ครบทุกด้าน
ค. การทดสอบส่วนใหญ่ขึ้นกับลักษณะของผู้ป่วยโดยเฉพาะอายุและระดับการศึกษา ยิ่งการทดสอบยิ่งสั้นความสามารถในการทำการทดสอบยิ่งขึ้นกับภาวะดังกล่าวมากขึ้น
ง. การวินิจฉัยภาวะสมองเสื่อมและการวินิจฉัยแยกโรคของภาวะสมองเสื่อม ไม่ควรขึ้นกับการทดสอบทางจิตประสาทเท่านั้น
จ. การทดสอบทางจิตประสาท อาศัยความร่วมมือของผู้ป่วยเป็นสำคัญ ค่าคะแนนของความแตกต่างอาจขึ้นกับความร่วมมือและความสนใจที่จะรับการทดสอบของผู้ป่วย
ฉ. การประเมินทางจิตประสาทขึ้นกับผู้ทำการประเมิน ความสามารถในการสื่อภาษา การชักชวนให้ผู้ป่วยร่วมมือในการทำการทดสอบ และความสามารถในการให้คะแนนความผิดปกติ
ช. ไม่มีการทดสอบใดเพียงหนึ่งเดียวที่สามารถบอกความผิดปกติทางจิตประสาทของผู้ป่วยได้ทุกด้าน การใช้การทดสอบหลายๆ การทดสอบเป็นการช่วยเพิ่มประสิทธิภาพในการตรวจความผิดปกติ แต่การทำการทดสอบเหล่านี้นานๆ ในผู้ป่วยสูงอายุที่มีภาวะสมองเสื่อมอาจทำให้เกิดความอ่อนล้า หงุดหงิดหรือไม่ร่วมมือได้
ซ. คะแนนที่ได้จากการทดสอบทางจิตประสาทเป็นเพียงตัวเลขที่มีค่าพิสัยแปรปรวน เช่น คนปกติอาจทำการทดสอบบอกชื่อสัตว์ใน 1 นาทีได้ตั้งแต่ 11-24 คำ ในขณะที่ผู้ที่มีความผิดปกติเล็กน้อยของความสามารถของสมองทำได้ 9-20 ดังนั้นผู้ที่ทำคะแนนได้ 11-20 อาจไม่สามารถบอกได้ว่าผู้ป่วยอยู่กลุ่มใด
โรงพยาบาลรวมแพทย์ หนองคาย ประกาศรับสมัครงาน LINK
- ผู้ช่วยพยาบาล เพศหญิง จำนวน 1 อัตรา
- พนักงานการเงิน เพศหญิง วุฒิ ปวช./ปวส. จำนวน 1 อัตรา
ติดต่อสอบถามเพิ่มเติมได้ที่ โทร. 042-421412-4
710 ซอยพรหมดำริห์ ถนนประจักษ์ ตำบลในเมือง
อำเภอเมือง จังหวัดหนองคาย 43000
บทที่ 3 - แนวทางการขับเคลื่อนแผนสู่การปฏิบัติและการติดตามประเมินผล
แผนปฏิบัติการขับเคลื่อนวาระแห่งชาติการแก้ไขปัญหามลพิษด้านฝุ่นละออง กระทรวงทรัพยากรธรรมชาติ
และหน่วยงานที่เกี่ยวข้อง ได้อาศัยมติคณะรัฐมนตรีเป็นกลไกหลักในการขับเคลื่อนการดำ เนินการแก้ไขปัญหาดังกล่าวให้เป็นไปอย่างมีประสิทธิภาพและเป็นรูปธรรมโดยเร็ว โดยการประสานความร่วมมือกับหน่วยงานที่เกี่ยวข้องในการนำมาตรการและแนวทางการดำ เนินงานภายใต้แผนปฏิบัติการฉบับนี้ไปปฏิบัติ
- 3.1 กลไกและแนวทางการขับเคลื่อนการแก้ไขปัญหาฝุ่นละออง
1. กลไกในการขับเคลื่อนมาตรการที่1
ใช้กลไกของระบบศูนย์สั่งการแบบเบ็ดเสร็จ (Single Command) ภายใต้พ.ร.บ. ป้องกันและบรรเทาสาธารณภัย พ.ศ. 2550 โดยมีผู้ว่าราชการกรุงเทพมหานครและผู้ว่าราชการจังหวัดเป็นผู้บัญชาการเหตุการณ์ ในการเข้าควบคุมสถานการณ์อำนวยการ สั่งการประสานการปฏิบัติระหว่างหน่วยงาน ส่วนราชการต่างๆ เพื่อให้สถานการณ์กลับเข้าสู่ภาวะปกติโดยเร็ว
2. กลไกในการขับเคลื่อนมาตรการที่ 2
ให้หน่วยงานที่มีหน้าที่ตามกฎหมายออกกฎระเบียบ/แนวทาง/ข้อบังคับในการแก้ไขปัญหาฝุ่นละออง
3. กลไกในการขับเคลื่อนมาตรการที่ 3
ใช้กลไกคณะกรรมการสิ่งแวดล้อมแห่งชาติเป็นกลไกหลักร่วมกับกระทรวงทรัพยากรธรรมชาติและสิ่งแวดล้อมและหน่วยงานที่เกี่ยวข้องขับเคลื่อนการดำ เนินงานเพื่อให้การแก้ไขปัญหาเป็นไปอย่างมีประสิทธิภาพและเกิดประสิทธิผล
- 3.2 การติดตามประเมินผล
ตามที่คณะรัฐมนตรีในการประชุมเมื่อวันที่ 12 กุมภาพันธ์ 2562 มีมติให้การแก้ไขปัญหามลพิษด้านฝุ่นละอองเป็นวาระแห่งชาติ เพื่อให้การดำ
โรงพยาบาลกล้วยน้ำไท ครอบคลุมพื้นที่ทั่วกรุงเทพฯ LINK
โรงพยาบาลกล้วยน้ำไท โรงพยาบาลประกันสังคม ครอบคลุมพื้นที่ทั่วกรุงเทพฯ เพื่อการเข้าถึงการรักษาที่ได้มาตรฐาน เลือกสิทธิประกันสังคมโรงพยาบาลกล้วยน้ำไทวันนี้
#อุ่นใจ เพิ่มความสะดวกในการเข้ารักษาให้ทั่วถึง ด้วยคลินิกกล้วยน้ำไทครอบคลุมทั่วกรุงเทพฯ มากกว่า 30 แห่ง #มั่นใจ กับการรักษาโดยแพทย์เฉพาะทาง พร้อมศูนย์การรักษาเฉพาะทางอีกกว่า 15 สาขา #ระบบFastTrack (One Stop Service) สำหรับสิทธิ์ร่วม บริการเหนือระดับ รวดเร็วทันใจในพื้นที่หรูหรา #ระบบTelehealth ปรึกษาแพทย์เฉพาะทาง #เปลี่ยนสิทธิ์ประกันสังคมเป็นโรงพยาบาลกล้วยน้ำไท วันนี้ รับสิทธิพิเศษมากมายสำหรับผู้ประกันตน
สอบถามเพิ่มเติม โทร. 095 454 9905 (คุณวาสนา) โทร. 092 294 9583 (คุณตั้ม) โทร. 083 160 6036 (คุณเบิร์ด)
คุณแม่อุ่นใจ คลอดที่ ศิครินทร์ ประเภทแพ็กเกจคลอดเหมาจ่าย LINK
คุณแม่อุ่นใจ คลอดที่ ศิครินทร์ ประเภทแพ็กเกจคลอดเหมาจ่าย
คลอดธรรมชาติ ห้องพัก Superior 3 วัน 2 คืน 48,000
คลอดธรรมชาติ ห้องพัก VIP 3 วัน 2 คืน 55,000
ผ่าตัดคลอด ห้องพัก Superior 4 วัน 3 คืน 65,000
แนะนำปรึกษาเจ้าหน้าที่ก่อนทำการซื้อแพ็กเกจ ที่สถาบันสุขภาพเฉพาะทางสตรี โทร 1728 ต่อ 20107
โรงพยาบาล บางปะกอก3 บริการฉีดวัคซีนเข็ม3 และ เข็ม4 โมเดอร์นา 1650 บาท LINK
มาฉีดวัคซีนเข็ม3 และ เข็ม4 กันเถอะ วัคซีนโมเดอร์นาเข็มกระตุ้นช่วยเพิ่มแอนติบอดี้ต้านโอไมครอนได้ 37 เท่า และเพิ่มเป็นมากกว่า 80 เท่าเมื่อฉีดในปริมาณ 100 ไมโครกรัม (เต็มโดส)
วัคซีน Moderna เป็นวัคซีนโควิด-19 ประเภท mRNA ฉีดในผู้มีอายุ 12 ปีขึ้นไป
สอบถามรายละเอียดเพิ่มเติม โทร. 0-2109-3111 กด 0 โอเปอเรเตอร์
จุดชมวิว เนินนางพญา จันทบุรี [พิกัด] LINK
จุดชมวิว เนินนางพญา หนี่งในจุดชมวิวที่สวยที่สุดแห่งหนึ่งในประเทศไทย เพราะถือเป็นจุดที่จะสามารถมองเห็นวิวทะเลได้เกือบ 360 องศา พร้อมเห็นช่วงโค้งของถนนเฉลิมบรูพาชลทิตที่สวยงามอีกด้วย - ภาพจาก ททท.สำนักงานจันทบุรี
ดร.สาธิต เยี่ยมชมบูธระบบจิตเวชทางไกล ร่วมกับ พญ.อัมพร อธิบดีกรมสุขภาพจิต นพ.จเด็จ เลขาธิการ สปสช คุณมารีน ผู้จัดการใหญ่ ซาโนฟี่ ชุดทดสอบสเตียรอยด์ กรมวิทย์ศาสตร์การแพทย์ LINK
ชุดทดสอบสเตียรอยด์ (หลักการ IC) ผลิตภัณฑ์กรมวิทยาศาสตร์การแพทย์ มีจำหน่าย หลายขนาด ได้แก่ ขนาดบรรจุ 1 Test/Set ราคา 65 บาท 5 Test/Set ราคา 300 บาท 10 Test/Set ราคา 600 บาท 20 Test/Set ราคา 1,100 บาท
หลักการ : ชุดทดสอบสเตียรอยด์ในยาแผนโบราณใช้หลักการทางอิมมูโนโครมาโทกราฟี สามารถตรวจสเตียรอยด์ได้ 2 ชนิด คือ เดกซาเมทาโซนและเพรดนิโซโลน ตรวจยาแผนโบราณได้ทุกรูปแบบ เช่น ยาลูกกลอน ยาผง ยาเม็ด ยาน้ำ ยากวน ฯลฯ ทราบผลได้ภายในเวลาประมาณ 15 นาที ค่าความไวของชุดทดสอบนี้คือสามารถตรวจพบเดกซาเมทาโซนที่ความเข้มข้น 1 ไมโครกรัมต่อมิลลิลิตร และเพรดนิโซโลน 50 ไมโครกรัมต่อมิลลิลิตร ชุดทดสอบนี้สามารถเกิดปฏิกิริยาข้าม (cross reaction) โดยให้ผลบวกกับเบตาเมทาโซนได้
ประโยชน์ของชุดทดสอบ
1. ใช้เป็นวิธีทดสอบเบื้องต้น สำหรับตรวจหาเดกซาเมทาโซน (Dexamethasone) และเพรดนิโซโลน (Prednisolone) ที่ปนปลอมในยาแผนโบราณด้วยเทคนิคอิมมูโนโครมาโทกราฟี (IC)
2. วิธีใช้สะดวกและรวดเร็ว และมีประสิทธิภาพเหมาะสำหรับ ใช้ในห้องปฏิบัติการ ทั่วไป ในภาคสนามและประชาชนทั่วไป
3. สนับสนุนงานคุ้มครองผู้บริโภคในพื้นที่ต่างๆ ทั่วประเทศ และใช้ประโยชน์ในการวินิจฉัยและบำบัดรักษาผู้ป่วยที่รับประทานยาที่ผสมสารสเตียรอยด์
4. ลดงานตรวจวิเคราะห์ในเบื้องต้น คงไว้เฉพาะการตรวจยืนยันในห้องปฏิบัติการ
ความไวของชุดทดสอบ
ผู้สนใจกรุณาติดต่อสั่งซื้อที่ : ร้านผลิตภัณฑ์กรมวิทยาศาสตร์การแพทย์ (มีบริการจัดส่งทางไปรษณีย์) ที่อยู่ : 88/7 อาคาร 10 ชั้น 1 กรมวิทยาศาสตร์การแพทย์ ถ.ติวานนท์ ต.ตลาดขวัญ อ.เมือง จ.นนทบุรี 11000
FIT-TO-FLY โรงพยาบาลศิครินทร์ ราคา 2,800 บาท
โรงพยาบาลศิครินทร์ บริการแพ็กเกจตรวจโควิด-19 FIT-TO-FLY บริการตรวจหาเชื้อ COVID-19 ด้วยเทคนิค Real Time–PCR พร้อมออกใบรับรองแพทย์ (FIT-TO-FLY Certificate) ใบรับรองเดินทางไปต่างประเทศ ราคา 2,800 บาท เปิดให้บริการทุกวัน ตั้งแต่เวลา 8.30-17.00 น. กรุณานัดหมายล่วงหน้าทุกครั้งก่อนการเข้ารับบริการ ติดต่อสอบถามรายละเอียดเพิ่มเติมโทร. 1728 ต่อ 30204 – 30206 (เข้ารับบริการตรวจที่โรงพยาบาลศิครินทร์ กรุงเทพฯ เท่านั้น)
มีสิทธิประกันสังคม ติดโควิด ไม่มีค่าใช้จ่าย ที่ รพ.ธนบุรี บำรุงเมือง
มีสิทธิประกันสังคม ติดโควิด ไม่มีค่าใช้จ่าย ที่
รพ.ธนบุรี บำรุงเมือง เฉพาะสิทธิผู้ประกันตนมาตรา 33 และ 39 เปิดบริการรักษาโควิด-19 สำหรับกลุ่มสีเขียว ☑️ Home isolation ☑️ Hospitel สอบถามรายละเอียดเพิ่มเติม โทรศัพท์ 02 220 7999
เงื่อนไขการเข้ารับบริการ
1. ผู้ป่วยที่มีผล ATK หรือ RT-PCR เป็นบวกหรือติดเชื้อ
2. ไม่มีค่าใช้จ่ายเฉพาะสิทธิผู้ประกันตนมาตรา 33 และ 39
3. อาการไม่รุนแรง สามารถดูแลตัวเองได้
4. ไม่มีโรคประจำตัวที่ควบคุมไม่ได้และไม่ตั้งครรภ์
5. แพ็กเกจ Hospitel สำหรับการรักษาไม่มีค่าใช้จ่าย 7 วัน (ห้องคู่) กรณี นอนห้องเดี่ยวมีค่าใช้จ่ายวันละ 1,000 บาท
6. แพ็กเกจ Home isolation สำหรับผู้ที่อยู่คนเดียว หรือมีห้องพักแยกชัดเจน
7. โรงพยาบาลขอสงวนสิทธิ์ในการเปลี่ยนแปลงเงื่อนไขโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
8. วันนี้ - 30 เมษายน 2565
เกษมราษฎร์ รามคําแหง บริการฉีดโมเดอร์น่า ก่อนสงกรานต์ (7-12 เมษายน) 1,299 บาท walk in เท่านั้น
เฉพาะ Walk In (เท่านั้น) ไม่ต้องจองล่วงหน้า ซื้อและฉีดได้เลย
เฉพาะวันที่ 7-12 เมษายน 2565 เท่านั้น เวลา 09.00-17.00 น. ณ คลินิกบริการวัคซีนโควิด ชั้น 2
สอบถาม โทร. 02-339-0000 ต่อ 2024-2025
ฟื้นฟูสมรรถภาพปอด บางปะกอก 8 เริ่มต้น 900 บาท
แผนกกายภาพบำบัด โรงพยาบาลบางปะกอก 8 มีแพ็คเกจรักษา “ฟื้นฟูสมรรถภาพปอด” ในผู้ป่วยที่รักษาหายจากโควิด-19 เรียบร้อยแล้ว S : 1 ครั้ง ราคา 900 บาท M : 3 ครั้ง ราคา 2,400 บาท L : 5 ครั้ง ราคา 3,800 บาท
วันนี้-31 ธันวาคม 2565 ติดต่อสอบถามรายละเอียดเพิ่มเติม 02-1098111 ต่อ 1304 แผนกกายภาพบำบัด 062-596-1207
พญาไท นวมินทร์ hospitel วันนี้ - 30 มิ.ย. 65 โทร. 02-944-7111 ต่อ 1112
โรงพยาบาลพญาไท นวมินทร์ Privilege with hospitel แพ็กเกจรักษาผู้ป่วยโควิด-19 กลุ่มอาการสีเขียว วันนี้ - 30 มิ.ย. 65
ผู้รับบริการต้องทำการตรวจ ATK เองที่บ้านก่อนเท่านั้น
หากผลตรวจ ATK ขึ้น 2 ขีด และมีอาการ ให้ผู้รับบริการนำผลชุดตรวจที่ขึ้น 2 ขีด เพื่อเข้ารับการตรวจ COVID-19 แบบ swab RT-PCR รับเฉพาะสิทธิลูกค้าประกันสังคมที่รพ.พญาไท นวมินทร์ หากผลตรวจออกทางรพ.จะติดต่อกลับ พร้อมแจ้งการรักษา
- หากผลตรวจ ATK ขึ้น 2 ขีด ต้องทำนัดจองเข้าตรวจที่ 029447111 ต่อ 1318
สอบถามข้อมูลเพิ่มเติมได้ที่
✅ สำหรับคนไข้อายุ 1-15 ปี ศูนย์สุขภาพเด็ก โทร. 02-944-7111 ต่อ 2500
✅ สำหรับคนไข้อายุ 16-60 ปี ศูนย์อายุรกรรม โทร. 02-944-7111 ต่อ 1112
บทที่ 2 นโยบายการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น
องค์การอนามัยโลก ได้กําหนดระยะการเปลี่ยนผ่านจาก COVID –19 Pandemic สู่ Endemic Disease แบ่งเป็น 3 ระยะ ได้แก่ ระยะ Pre-Pandemic เป็นระยะเริ่มต้นจากโรคติดต่ออุบัติใหม่ที่เมืองอู่ฮั่น ประเทศจีน ระยะต่อมาเป็น Pandemic ซึ่งเกิดการระบาดทั่วโลก ซึ่งเป็นระยะเวลากว่า 2 ปีที่ผ่านมา โดยองค์การอนามัยโลกได้ประกาศให้โรคโควิด 19 เป็น Pandemic เมื่อวันที่ 11 มีนาคม 2563 และเมื่อการแพร่ระบาดเริ่มลดลงจะเข้าสู่ระยะ Post-Pandemic กลายเป็นโรคประจําถิ่นหรือโรคติดต่อทั่วไป ประเทศที่เตรียมการเปลี่ยนผ่านสู่โรคประจําถิ่น เช่น ประเทศสเปน ประเทศอินเดีย รัฐแคลิฟอร์เนีย ประเทศสหรัฐอเมริกา เป็นต้น
การวางแผนรองรับสถานการณ์เมื่อการแพร่ระบาดเริ่มลดลงจะเข้าสู่ระยะ Post-Pandemic
กลายเป็นโรคประจําถิ่นหรือโรคติดต่อทั่วไปการแพร่ระบาดของโรคโควิด 19 องค์การอนามัยโลก ได้มีการวางแผนโดยใช้ 3 ฉากทัศน์ดังนี้
ฉากทัศน์ที่ 1 โรคโควิด 19 กลายเป็นโรคประจําถิ่นหรือโรคติดต่อทั่วไปของไวรัสโคโรนาตัวที่ 5 (The 5th endemic coronavirus) ซึ่งมีโอกาสเป็นไปได้สูง เนื่องมาจากมีความครอบคลุมการฉีดวัคซีนในประชากรมากในระดับโลก
ฉากทัศน์ที่ 2 พฤติกรรมการเกิดโรคโควิด 19 เหมือนไข้หวัดตามฤดูกาล (Flu-Like) มีลักษณะการระบาดเป็นครั้งคราวตามฤดูกาล เพราะตัวไวรัสมีการเปลี่ยนแปลง
ฉากทัศน์ที่ 3 เกิดการระบาดใหญ่อย่างต่อเนื่องจากไวรัสตัวใหม่ของสายพันธุ์ที่น่ากังวล (Ongoing pandemic through new VOCs) เป็นสายพันธุ์ที่สามารถหลบภูมิคุ้มกันได้
เมื่อพิจารณาสถานการณ์การแพร่ระบาดของโรคโควิด 19 ณ วันที่ 13 มีนาคม 2565 (รายงานจํานวนผู้ติดเชื้อ องค์การอนามัยโลก) พบว่าสถานการณ์การแพร่ระบาดโรคโควิด 19 สายพันธุ์โอมิครอนทั่วโลกอยู่ในช่วงขาลง ในขณะที่ประเทศในภูมิภาคเอเชียตะวันออกเฉียงใต้ซึ่งมีประเทศไทยรวมอยู่ด้วย พบว่า มีการแพร่ระบาดโรคโควิด 19 ซึ่งอยู่ในช่วงขาขึ้น ทั้งนี้ จํานวนผู้ติดเชื้อโควิดสายพันธุ์โอไมครอนในประเทศไทยสูงกว่าสายพันธุ์เดลต้าไม่มาก ประกอบกับ ข้อมูลความรุนแรงระหว่าง โรคโควิด 19 และไข้หวัดใหญ่ประจําฤดูกาลของประเทศอังกฤษ ในช่วงปี พ.ศ. 2564 ที่ผ่านมา มีการระบาดโรคโควิด 19 สายพันธุ์แอลฟา ซึ่งในขณะนั้นความครอบคลุมการฉีดวัคซีนโควิด 19 ยังไม่มาก จึงพบว่าอัตราป่วยตายสูง ประมาณร้อยละ 1 ต่อมาในช่วงกลางปี 2564 มีความครอบคลุมการฉีดวัคซีนโควิด 19 มากขึ้น ทําให้อัตราป่วยตายลดลงเหลือร้อยละ 0.2 และช่วงปลายปี (พฤศจิกายน – ธันวาคม 2564) เริ่มมีการระบาดโควิด 19 สายพันธุ์โอมิครอน ซึ่งขณะนั้นมีการฉีดวัคซีนโควิด 19 เข็มกระตุ้น ทําให้อัตราป่วยตายลดลงต่ํากว่าร้อยละ 0.1 ซึ่งใกล้เคียงกับอัตราการป่วยตายของไข้หวัดใหญ่ประจําฤดูกาล ประเด็นที่น่าสนใจ คือ อัตราป่วยตายที่ลดลงจากการฉีดวัคซีนเข็มกระตุ้นประมาณร้อยละ 50 ของประชากรอัตราป่วยตายจากโรคโควิด 19
เมื่อพิจารณาข้อมูลอัตราป่วยตายจากโรคโควิด 19 ของประเทศอังกฤษ แยกตามกลุ่มอายุ พบว่าการเปลี่ยนผ่านเข้าสู่โรคประจําถิ่น ควรต้องเร่งฉีดวัคซีน ในประชากรกลุ่มที่มีอายุมากกว่า 60 ปีขึ้นไปเนื่องจากอัตราป่วยตายยังเกินร้อยละ 0.1 อยู่เล็กน้อย ในขณะที่กลุ่มประชากรที่อายุต่ํากว่า 60 อัตราป่วยตายต่ํากว่าไข้หวัดใหญ่มาก (ภาพรวมเฉลี่ยอัตราป่วยตายของประชากรทุกช่วงอายุร้อยละ 0.1)
สําหรับประเทศไทย การเปลี่ยนผ่านเข้าสู่โรคประจําถิ่นจําเป็นต้องเร่งฉีดวัคซีนในประชากรกลุ่มที่มีอายุมากกว่า 60 ปีขึ้นไป เนื่องจากอัตราป่วยตายยังเกินร้อยละ 0.1 อยู่เล็กน้อย ในขณะที่กลุ่มประชากรที่อายุต่ํากว่า 60 อัตราป่วยตายต่ํากว่าร้อยละ 0.1 มาก และจากข้อมูลการฉีดวัคซีนของประเทศอังกฤษ พบว่ามีการฉีดวัคซีนเข็มกระตุ้นประมาณร้อยละ 50 ขณะที่ตอนนี้ประเทศไทยได้ทําการฉีดวัคซีนเข็มกระตุ้นมากกว่าร้อยละ 30 จึงคาดว่าจะสามารถลดอัตราป่วยตายให้เป็นไปตามเป้าหมายได้โดยได้คาดการณ์สถานการณ์หากพบการระบาดสายพันธุ์ Omicron ภายในประเทศ แพร่โรคในวงกว้างและรวดเร็ว ดังนี้ โดยขณะนี้ได้ดําเนินการฉีดวัคซีนเข็มกระตุ้นมากกว่าร้อยละ 30 ของประชากร
การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น ประเทศไทย มุ่งหวังให้ประชาชน
สามารถดําเนินชีวิตอยู่ร่วมกับโควิดได้ ภายใต้การใช้ชีวิตวิถีปกติใหม่ ขับเคลื่อนสังคมและเศรษฐกิจของประเทศให้บรรลุเป้าหมายที่กําหนดไว้ โดยภาพรวมกระบวนการเปลี่ยนผ่านสู่โรคประจําถิ่น แบ่งระยะดําเนินการออกเป็น 4 ระยะ ได้แก่
ระยะ Combatting (12 มีนาคม - ต้น เมษายน 2565)
ระยะ Plateau (เมษายน - พฤษภาคม 2565)
ระยะ Declining (ปลาย พฤษภาคม – 30 มิถุนายน 2565)
ระยะ Post – pandemic (1 กรกฎาคม 2565 เป็นต้นไป)
โดยจําเป็นต้องมีมาตรการรองรับทั้งด้านสาธารณสุข ด้านการแพทย์ ด้านกฎหมายและสังคม และด้านการสื่อสารและประชาสัมพันธ์ ทั้งนี้ จําเป็นต้องสื่อสารให้ประชาชนเข้าใจรูปแบบในการใช้ชีวิตวิถีปกติใหม่ ซึ่งจะเน้นให้ใกล้เคียงการใช้ชีวิตปกติ และปกป้องกลุ่มเสี่ยงต่อการเกิดโรครุนแรง เช่น กลุ่มผู้สูงอายุ กลุ่มผู้ป่วยโรคเรื้อรัง เป็นต้น
มูลนิธิรามาธิบดี
นางสาวพรรณสิรี คุณากรไพบูลย์ศิริ ผู้จัดการมูลนิธิรามาธิบดีฯ ได้กล่าวเสริมว่า “บทบาทสำคัญของมูลนิธิรามาธิบดีฯ คือการเป็นสะพานบุญแห่งการให้ เพราะการให้สร้างความสุขทั้งต่อผู้ให้และผู้รับ มูลนิธิฯ ยังคงเดินหน้าส่งต่อน้ำใจและการช่วยเหลือจากผู้ให้ไปสู่ผู้ป่วย ผ่านโครงการต่าง ๆ ทั้งในรูปแบบของการช่วยเหลือค่ารักษาพยาบาล การจัดหาเครื่องมือแพทย์ การสนับสนุนงานวิจัย การก่อสร้างอาคารสถานที่เพื่อขยายศักยภาพการรับรองดูแลผู้ป่วย ซึ่งทั้งหมดนี้มุ่งหวังให้ผู้ป่วยให้มีโอกาสเข้าถึงการรักษาอย่างเต็มประสิทธิภาพในทุกระดับชั้น และพัฒนาคุณภาพชีวิตที่ดีให้แก่ประชาชนในภาพรวม
ep. 2.1 “Vital Interest” LINK
สาระน่ารู้จากกฎหมายคุ้มครองข้อมูลส่วนบุคคล
Ep.2.1 “Vital Interest”
.
กรณีเป็นการเก็บรวบรวม ใช้ เปิดเผย
“ข้อมูลส่วนบุคคล (Personal Data)”
โดยมีวัตถุประสงค์เพื่อป้องกันหรือระงับอันตราย
รักษาชีวิต ร่างกายหรือสุขภาพเจ้าของข้อมูลส่วนบุคคล
รวมถึงเพื่อประโยชน์สาธารณะ
สามารถทำได้โดยไม่ต้องได้รับความยินยอม
จากเจ้าของข้อมูลส่วนบุคคล
(ตาม มาตรา 24(2))
ตัวอย่าง เก็บข้อมูลชื่อ เบอร์โทรศัพท์ผู้เข้าออกอาคาร
เพื่อป้องกันการแพร่กระจายของสถานการณ์โรคระบาด
แต่ยังคงต้องมีมาตรการรักษาความปลอดภัย
สำหรับข้อมูลส่วนบุคคลนั้นด้วย
.
หากเป็น “ข้อมูลส่วนบุคคลที่มีความละเอียดอ่อน
(Sensitive Personal Data)”
เช่น ข้อมูลสุขภาพ ความพิการ ข้อมูลพันธุกรรม/ชีวภาพ
นอกจากเพื่อวัตถุประสงค์ดังกล่าวแล้ว
ยังต้องเป็นกรณีที่เจ้าของข้อมูลส่วนบุคคล
ไม่สามารถให้ความยินยอมได้ด้วย
(ตาม มาตรา 26(1))
ตัวอย่าง โรงพยาบาลเปิดเผยประวัติสุขภาพ
ของผู้ประสบอุบัติเหตุที่กำลังหมดสติ
เพื่อให้ได้รับการรักษาอย่างเร่งด่วน
.
การเก็บรวบรวมข้อมูลส่วนบุคคลตาม PDPA
ในกรณีอื่นรอติดตามต่อได้ใน ep ต่อไป
ความคุ้มค่า
สำรวจข้อมูลค่าใช้ไฟฟ้าของโรงพยาบาลบ้านตาก เปรียบเทียบ ช่วงปี 2562-2563 และการประหยัดไฟที่ได้ ในเดือนเมษายน 2563 ซึ่งเป็นเดือนแรกหลังจากติดตั้งระบบและเปิดใช้งาน
และเป็นเดือนที่ร้อนที่สุดของปีอย่างที่ทุกคนทราบกัน
ผลคือค่าไฟฟ้าเหลือเพียง 118,436 บาท ต่อเดือน ลดลง ถึง 90,890 บาท จากจำนวนไฟฟ้าที่ใช้ 30,152 หน่วย คิดเป็น 43% เทียบกับเดือนเดียวกันของปีก่อน (เมษายน 62 ที่ยอด 209,326 บาท)
เทียบจำนวนหน่วยไฟฟ้าที่ใช้ 6 เดือนก่อนหน้า
พ.ย.62 จำนวน 37,820 หน่วย ค่าไฟฟ้า 152,188.79 บาท
ธ.ค.62 จำนวน 27,847 หน่วย ค่าไฟฟ้า 113,919.53 บาท
ม.ค.63 จำนวน 33,128 หน่วย ค่าไฟฟ้า 135,455.14 บาท
ก.พ.63 จำนวน 31,840 หน่วย ค่าไฟฟ้า 129,658.71 บาท
มี.ค.63 จำนวน 44,040 หน่วย ค่าไฟฟ้า 179,664.72 บาท
เม.ย.63 จำนวน 30,152 หน่วย ค่าไฟฟ้า 118,436.42 บาท *เดือนที่ใช้ระบบเต็มเดือน
คลินิกโรคการนอนหลับ สถาบันโรคทรวงอก LINK
คลินิกโรคการนอนหลับ สถาบันโรคทรวงอกคลินิกโรคการนอนหลับ หน่วยงานตรวจพิเศษปอด (Sleep Lab) สถาบันโรคทรวงอก กรมการแพทย์
เปิดให้บริการ วันพุธ 07.00-12.00 น.
ถ. ติวานนท์ บางกระสอ อำเภอเมืองนนทบุรี นนทบุรี 11000
โทรศัพท์ 02-547-0999 ต่อ 30416 หรือ 30512
ศูนย์โรคการนอนหลับ สถาบันโรคทรวงอก ให้บริการปรึกษาแพทย์ออนไลน์ Telemedicine ผู้ป่วยของศูนย์ฯ โดย download App "CCIT connect" รองรับทั้งระบบ android และ ios
Link
facebook.com/sleeplabccit
สุขภาพฟัน-สุขภาพกาย เรื่องเดียวกัน
สุขภาพฟันและปัญหาในช่องปากเป็นสิ่งที่ไม่ควรมองข้าม เพราะเมื่อมีปัญหาการบดเคี้ยวทำให้กินอาหารไม่อร่อย เบื่ออาหาร นานวันเข้าเกิดภาวะขาดสารอาหาร ที่ “เดนทัล เวลเนส คลินิก” (Dental Wellness Clinic) ชำนาญการด้านทันตกรรมเชิงป้องกัน ให้ความสำคัญกับการส่งเสริมให้ทุกคนเข้ามาตรวจสุขภาพในช่องปากเพื่อรับคำแนะนำในการดูแลป้องกันก่อนที่จะเกิดปัญหาขึ้น เพื่อให้มีสุขภาพที่ดี มีชีวิตที่ยืนยาวอย่างมีคุณภาพ
ทันตแพทย์หญิงสุชาดา ก้องเกียรติกมล ผู้ช่วยผู้อำนวยการคลินิกทันตกรรม “เดนทัล เวลเนส คลินิก” กล่าวว่าปัญหาสุขภาพในช่องปากผู้สูงวัยที่ก้าวเข้ามาที่คลินิกส่วนใหญ่เกิดจากการใช้ฟันปลอม โดยธรรมชาติของผู้สูงอายุ กล้ามเนื้อบนใบหน้าและขากรรไกรทำได้ไม่ดีนัก การใส่ฟันปลอมนานๆ ประสิทธิภาพในการใช้ฟันจะด้อยลง แรงของการบดเคี้ยวของฟันปลอมเทียบกับฟันธรรมชาติลดลง 10 เท่า ซึ่งไม่ได้ส่งผลแค่เรื่องฟันอย่างเดียว เมื่อไม่สามารถเคี้ยวอาหารได้เต็มที่ ทำให้ไม่อยากอาหาร และนำไปสู่ภาวะขาดสารอาหารได้
โปรแกรมตรวจสุขภาพ MIS – C เด็กอายุ 1-14 ปี โรงพยาบาลเด็กสินแพทย์
โปรแกรมตรวจสุขภาพ MIS – C ตรวจสุขภาพและฟื้นฟูสุขภาพ หลังติดเชื้อโควิด – 19 สำหรับเด็กอายุ 1-14 ปี ราคา 2,500 บาท
รายการตรวจประกอบด้วย
ตรวจร่างการโดยกุมารแพทย์ (Physical Examination Pediatrician)
ตรวจเอกซเรย์ปอด (Chest X-ray)
ตรวจความสมบูรณ์ของเม็ดเลือด (Complete Blood Count)
ตรวจระดับน้ำตาลในเลือด (Fasting Blood Sugar)
ตรวจปัสสาวะอย่างสมบูรณ์ (Urine Examination)
ตรวจเลือดดูค่าทำงานของไต (BUN)
ตรวจเลือดดูค่าทำงานของไต (Creatine)
ตรวจเลือดดูค่าทำงานของตับ (SGOT)
ตรวจเลือดดูค่าทำงานของตับ (SGPT)
ตรวจเลือดดูค่าสารการอักเสบในร่างกาย (CRP)
ระยะเวลา : 22 มีนาคม 2565 - 31 สิงหาคม 2565
โปรแกรมนี้เหมาะสำหรับเด็ก หลังหายป่วยจากการติดเชื้อโควิด – 19 ในช่วงเวลา 1-30 วัน
สามารถใช้บริการได้ตั้งแต่วันนี้ – 31 สิงหาคม 2565
งดอาหาร และ เครื่องดื่มที่มีน้ำตาลก่อนเจาะเลือด8-12 ชั่วโมง
ราคาดังกล่าว รวมค่าแพทย์ ค่าบริการแล้ว
Call Center 02-793-5000
น้ำดื่มสะอาด ปลอดภัย ฟรี ทั่วกรุง [เศรษฐกิจดีสุขภาพดี]
ประโยชน์คนกรุงฯ
- ได้เข้าถึงน้ำดื่มสะอาด ปลอดภัย ที่มีคุณภาพฟรี
- ลดภาระค่าใช้จ่ายในชีวิตประจำวัน
รายละเอียด
ปี 2547 กทม. การประปานครหลวง (กปน.) และบริษัทเอกชนได้ลงนามความร่วมมือกันในการส่งเสริมคุณภาพชีวิตที่ให้แก่ชาวกรุงเทพฯ ด้วยการติดตั้งตู้กดน้ำทั้งหมดประมาณ 387 จุด โดยทรัพย์สินตู้กดน้ำรวมถึงการบำรุงรักษาเป็นหน้าที่ของบริษัทเอกชน [1]
ปัจจุบันสำนักจราจรและขนส่ง กทม. ทำหนังสือถึง กปน.ให้เร่งดำเนินการรื้อถอน โดย กปน.ได้ประสานไปยังบริษัทเอกชนให้ดำเนินการรื้อถอนให้ครบทุกจุด เพื่อที่สำนักจราจรและขนส่งกรุงเทพฯ จะได้ดำเนินการคืนทางเท้าและปรับปรุงภูมิทัศน์เมืองให้แก่ประชาชน
ที่มาของคำสั่งรื้อถอนมาจากสาเหตุหลัก 2 ประการ ได้แก่
- ที่ผ่านมามีผู้ใช้งานน้อย เนื่องจากมีคำถามเกี่ยวกับคุณภาพน้ำและความสะอาดอย่างไรก็ตามกลุ่มคนจำนวนหนึ่ง เช่น คนขับแท็กซี่ ผู้ค้าแผงลอย ยังพึ่งพาตู้กดน้ำเหล่านี้อยู่
- ตำแหน่งติดตั้งกีดขวางการสัญจรทางเท้า
ทั้งนี้ข้อมูลจากหลายบทสัมภาษณ์สะท้อนว่าหากตู้กดน้ำเหล่านี้มีการปรับปรุงคุณภาพ ประชาชนก็มีความต้องการใช้งาน [2]
ดังนั้น กทม.จะทบทวนการรื้อถอนดังกล่าว ควบคู่กับการพัฒนาคุณภาพตู้กดน้ำและน้ำดื่ม ให้ครอบคลุมประเด็นต่อไปนี้
- วิธีการจ่ายน้ำ อาจจะปรับให้เป็นลักษณะการเติมน้ำลงขวดแทน
- กำหนดรอบการทำความสะอาดอย่างสม่ำเสมอ
- ปรับตำแหน่งที่ไม่ขีดขวางทางเท้า อาจจะตั้งให้ขนานกับทางเท้าชิดแนวขอบทางเท้าด้านใดด้านหนี่งแทน
- พิจารณาเสริมในบริเวณจุดจอดจักรยาน และชุมชนต่าง ๆ
กองสวัสดิการสังคม เทศบาลเมืองลำพูน โทร. 053-563297 , 053-511013 ต่อ 123 LINK
การยืมอุปกรณ์ช่วยเหลือผู้ป่วย กองสวัสดิการสังคม เทศบาลเมืองลำพูน
โทร. 053-563297 , 053-511013 ต่อ 123
เทศบาลเมืองลำพูน กองสวัสดิการสังคม มีบทบาทหน้าที่หลักในการสงเคราะห์ผู้มี
ปัญหาทางสังคมที่ไม่สามารถจะแก้ปัญหาของตนเองและครอบครัว หรือผู้ตกทุกข์ได้ยากในกรณีต่างๆ รวมทั้งส่งเสริมให้ประชาชน มีคุณภาพชีวิตที่ดีทุกด้าน การดำเนินงานในส่วนเกี่ยวกับการส่งเสริมสวัสดิการสงเคราะห์ช่วยเหลือ ผู้สูงอายุ ผู้พิการ ผู้ป่วยติดเตียงในเขตเทศบาลฯ มีการดำเนินงานผ่านทางคณะกรรมการช่วยเหลือประชาชน เทศบาลเมืองลำพูน ซึ่งจะให้ความช่วยเหลือ ผู้ที่ประสบปัญหาเดือดร้อน และมีความประสงค์ที่จะขอรับยืมอุปกรณ์ช่วยเหลือผู้ป่วย
เงื่อนไขของผู้ยื่นคำร้อง ขอยืมอุปกรณ์ช่วยเหลือผู้ป่วย
(1.) ผู้พิการ ผู้สูงอายุ ผู้ป่วย ที่จะขอยืมอุปกรณ์ช่วยเหลือ จะต้องมีภูมิลำเนาในเขตเทศบาลเมืองลำพูน เท่านั้น
(2.) ต้องมายื่นคำร้องขอยืมอุปกรณ์ช่วยเหลือผู้ป่วย ณ กองสวัสดิการสังคม เทศบาลเมืองลำพูนพร้อมเอกสารหลักฐาน
-กรอกแบบคำร้องขอยืมอุปกรณ์ฯ
- บัตรประจำตัวประชาชนของผู้ป่วย
- บัตรประจำตัวผู้พิการ (กรณีพิการ)
- ทะเบียนบ้านของผู้ป่วย
- บัตรประจำตัวประชาชนของผู้ยื่นคำร้อง
- ทะเบียนบ้านของผู้ยื่นคำร้อง
3. การอนุญาตให้ยืมอุปกรณ์ช่วยเหลือผู้ป่วย จะขึ้นอยู่กับมติของคณะกรรมการช่วยเหลือประชาชน เทศบาลเมืองลำพูน เท่านั้น
4. การพิจารณาให้ยืมอุปกรณ์ช่วยเหลือผู้ป่วย จะขึ้นอยู่กับลำดับการยื่นคำร้องขอยืมอุปกรณ์ก่อน - หลัง ทั้งนี้จะคำนึงถึงเหตุผลความจำเป็นที่จะต้องใช้อุปกรณ์เป็นหลัก
5. ผู้ป่วย หรือผู้ที่ยื่นคำร้องขอยืมอุปกรณ์ ต้องเป็นผู้ที่มีความจำเป็นต้องใช้และเป็นไปตามมติของคณะกรรมการช่วยเหลือประชาชน
6. เมื่อหมดความจำเป็นต้องใช้อุปกรณ์(ตามความเห็นของแพทย์ หรือทีมสหวิชาชีพ) ต้องทำการส่งคืน อุปกรณ์ให้แก่เทศบาลเมืองลำพูน ภายใน 7 วัน โดยจะต้องแจ้งให้เจ้าหน้าที่กองสวัสดิการสังคมทราบก่อนทุกครั้ง เพื่อเจ้าหน้าที่จะได้ดำเนินการตรวจสภาพอุปกรณ์ก่อนส่งคืน (ผู้ที่มายื่นความประสงค์ขอยืมอุปกรณ์ เมื่อต้องการนำส่งอุปกรณ์คืน จะต้องมาลงลายมือชื่อ
คืนอุปกรณ์ต่อเจ้าหน้าที่ ณ กองสวัสดิการสังคม เทศบาลเมืองลำพูน เท่านั้น)
7. เมื่อผู้ป่วย หรือผู้ที่ยื่นคำร้อง ได้ยืมอุปกรณ์ฯไปแล้ว ระหว่างการใช้อุปกรณ์ฯ ผู้ป่วย หรือผู้ที่ยื่นคำร้อง จะต้องรักษาความสะอาดของอุปกรณ์ทุกชิ้นที่ยืมไป และก่อนจะนำส่งคืนเทศบาลฯ จะต้องทำความสะอาดอุปกรณ์ที่ยืมไปให้เรียบร้อย (กรณีอุปกรณ์ฯ ชำรุดเสียหายที่ไม่ใช่จากการเสื่อมสภาพของอุปกรณ์ฯ ผู้ป่วย หรือผู้ที่ยื่นคำร้องจะต้องเป็นผู้รับผิดชอบค่าเสียหาย
ทั้งหมด)
8. กรณียืมถังออกซิเจน ผู้ป่วย หรือผู้ที่มายื่นคำร้อง จะต้องเปลี่ยนสายออกซิเจน และชุดหน้ากากออกซิเจน พร้อมเติมก๊าซออกซิเจนให้เต็มถังก่อนจะนำส่งอุปกรณ์ฯ คืนให้กับเทศบาลฯ ทุกครั้ง
รายการอุปกรณ์ช่วยเหลือผู้ป่วย
ที่ประชาชนสามารถยื่นคำร้อง ขอยืมได้
1. เตียงผู้ป่วย
2. ที่นอนลม (แบบลอน)
3. ถังออกซิเจน (ขนาด 6 Q)
4. เครื่องผลิตออกซิเจน (ขนาด 5 ลิตร)
5. เครื่องดูดเสมหะ
6. รถเข็นผู้ป่วย
7. ที่หัดเดิน 4 ขา (วอคเกอร์)
8. ไม้เท้าขาเดียว
ข้อพิจารณาความผิดเกี่ยวกับพืชกัญชาตามประมวลกฏหมายยาเสพติด
เขตสุขภาพที่ 11
ชุมพร
- รพ.ชุมพรเขตรอุดมศักดิ์ รพท 077-503-672 พ พฤ 13.00-16.30 น.
- รพ.ท่าแซะ รพช. 077-651-526 จ. พ. ศ. 08.30 - 15.30 น.
- รพ.ทุ่งตะโก รพช. 077-536 850 อังคาร 08.00-12.00 น.
- รพ.ปะทิว รพช. 077-591028, 077-591170-1 พุธ 08.30-14.00 น.
- รพ.ปากน้ำชุมพร รพช. 077-521-048 พ. 08.00-16.00 น.
- รพ.ปากน้ำหลังสวน รพช. 077-551-249 วันอังคาร 8.00-16.00 น.
- รพ.พะโต๊ะ รพช. 077-539-045 จ. อ. 08.00 - 11.00 น.
- รพ.มาบอำมฤต รพช. 077-656-312 ทุกวันอังคาร 13.00 - 16.00 น.
- รพ.ละแม รพช. 077-559-116 ศ. 13.00 - 16.00 น.
- รพ.สต.บ้านพันวาล รพ.สต. 077-97 9909 รอยืนยัน
- รพ.สวี รพช. 077-531206 อ. พฤ. เวลา 09.00 - 15.30 น.
- รพ.หลังสวน รพช. 077-529-999 พ. 08.00-16.00 น.
- สอน.บ้านหาดยาย รพ.สต. 077-50 6322 อ. พฤ. 08.30 - 12.00 น.
ระนอง
- รพ.กระบุรี รพช. 077-841-397 จ. 08.30-16.30 น.
- รพ.กะเปอร์ รพช. 077-897-222 จ. 08.30 - 12.00 น. และ 13.00 - 16.30 น.
- รพ.ระนอง รพท 077-812-630 อังคารที่ 1 และ 3 ของเดือน เวลา 09.00 - 12.00 น.
- รพ.ละอุ่น รพช. 077-899-095 จันทร์ - พุธ 08.30 - 12.00 น.
- รพ.สต.บางริ้น รพ.สต. 077-82 6107 ศ. 09.00 - 12.00 น.
- รพ.สต.มิตรภาพ รพ.สต. 077-81 3310 พ. 13.00 - 15.00 น.
- รพ.สุขสำราญ รพช. 077-844-061 จันทร์ - ศุกร์ 08.30 - 12.00 น.
พังงา
- รพ.กะปงชัยพัฒน์ รพช. 076 679 575 อังคารที่ 2 และ 4 ของเดือน
- รพ.เกาะยาวชัยพัฒน์ รพช. 076-597394 จ. สัปดาห์ที่ 1 และ 4 ของเดือน 08.30 - 12.00 น.
- รพ.คุระบุรีชัยพัฒน์ รพช. 076-491-712 พุธ สัปดาห์ที่ 1 และ 2 ของเดือน เวลา 08.30 - 12.00 น.
- รพ.ตะกั่วทุ่ง รพช. 076-58 1395-6 รอยืนยัน
- รพ.ตะกั่วป่า รพท 076-421-070 ทุกวันศุกร์ ที่ 2 และ 4 ของเดือน เวลา 13.00 - 16.30 น.
- รพ.ทับปุด รพช. 076 599 019 จันทร์ 08.30-12.00 น.
- รพ.ท้ายเหมืองชัยพัฒน์ รพช. 076 571 505 อ. 08.30 - 16.30 น.
- รพ.พังงา รพท 076-411-880 ทุกวันอังคาร ที่ 2 และ 4 ของเดือน เวลา 13.00 - 16.30 น.
- รพ.สต.คึกคัก รพ.สต. 076-40 6337 ทุกวันศุกร์ ที่ 2 และ 4 ของเดือน เวลา 08.30 - 16.30 น.
- สอน.บ้านบางม่วง รพ.สต. 076-59 3412 ทุกวันศุกร์ ที่ 2 และ 4 ของเดือน เวลา 08.30 - 16.30 น.
กระบี่
- รพ.กระบี่ รพท 075-626-700 พุธ 13.00 - 16.30 น.
- รพ.เกาะพีพี รพช. 075-66 0719,08 1895 2620 จ. 13.00 - 16.00 น.
- รพ.เกาะลันตา รพช. 075 697 017 พุธ 09.00-12.00 น.
- รพ.เขาพนม รพช. 080-7057283 จ. - พฤ. เวลา 08.30 - 16.30 น.
- รพ.คลองท่อม รพช. 075-70 2765 อ. 08.30 - 16.30 น.
- รพ.ปลายพระยา รพช. 075-68 7454-5 พฤ 13.00 - 16.00 น.
- รพ.ลำทับ รพช. 075-62 0614 พ. - พฤ. 13.00 - 16.00 น.
- รพ.สต.บางเหลียว รพ.สต. รอยืนยัน
- รพ.สต.บ้านกลาง (กระบี่) รพ.สต. 08 1893 9138 08.30 - 16.30 น.
- รพ.สต.บ้านกอตง รพ.สต. 075-60 2114 อ. พฤ. 09.00 - 15.00 น.
- รพ.สต.บ้านเกาะจำ รพ.สต.
- รพ.สต.บ้านคลองยา รพ.สต. 08 7269 9024 พฤ. 08.30 - 12.00 น.
- รพ.สต.บ้านทรายขาว (กระบี่) รพ.สต. 075-64 2160 อ. พ. 09.00 - 15.00 น.
- รพ.สต.บ้านนาวง (กระบี่) รพ.สต. 075-65 1097 พฤ. 13.30 - 16.30 น.
- รพ.สต.บ้านบางเจริญ รพ.สต. 075-61 9804 08.30 - 16.30 น.
- รพ.สต.บ้านหนองหลุมพอ รพ.สต. 075-66 5699 อ. 13.00 - 16.30 น.
- รพ.สต.บ้านห้วยคราม รพ.สต. 075-66 6068 จ. 08.30 - 16.30 น.
- รพ.สต.บ้านแหลมกรวด รพ.สต. 075-68 0401 พฤ. 13.30 - 16.30 น.
- รพ.เหนือคลอง รพช. 075-69 1801 จ. - พ. 09.00 - 12.00 น.
- รพ.อ่าวลึก รพช. 075-68 1159 อ. 08.30 - 16.30 น.
สุราษฎร์ธานี
- รพ.กาญจนดิษฐ์ รพช. 077-379131 ต่อ 447 ทุกวันศุกร์ 08:30 - 16:30 น.
- รพ.เกาะเต่า รพช. 077-456490 อ. 13.00 - 16.00 น.
- รพ.เกาะพะงัน รพช. 077-377-034 ทุกวันอังคาร 13:00 - 16:00 น.
- รพ.เกาะสมุย รพท 077-913-200 อ พฤ 13.00-16.00 น.
- รพ.คีรีรัฐนิคม รพช. 077-391-118 ต่อ 375 ทุกวันพุธ 08:00 - 16:00 น.
- รพ.เคียนซา รพช. 077-266-180 ทุกวันอังคาร 13:00 - 16:00 น.
- รพ.ชัยบุรี รพช. 077-367075 ต่อ 122 ศุกร์สัปดาห์ที่ 4 ของเดือน 13:00 - 16:30 น.
- รพ.ไชยา รพช. 077-431468 ต่อ 307 ทุกวันศุกร์ 13:00 - 16:30 น.
- รพ.ดอนสัก รพช. 077-371401 ต่อ 1021 ทุกวันพุธ 08:30 - 12:00 น.
- รพ.ท่าฉาง รพช. 077-389111 อังคาร 13.00 – 16.30 น.
- รพ.ท่าชนะ รพช. 077-381 167
- รพ.ท่าโรงช้าง รพช. 077-357-167 ทุกวันพุธ 13:00 - 16:30 น.
- รพ.บ้านตาขุน รพช. 077-397373 ต่อ 171 ทุกวันอังคาร 13:00 - 16:30 น.
- รพ.บ้านนาเดิม รพช. 077-359-018 ทุกวันอังคาร 08:30 - 16:00 น.
- รพ.บ้านนาสาร รพช. 077-341-416 ทุกวันจันทร์ - ศุกร์ ในเวลาราชการ
- รพ.พนม รพช. 077-399084 ต่อ 131 ทุกวันพุธ 13:00 - 16:00 น.
- รพ.พระแสง รพช. 077-369-098 ทุกวันพุธ 13:00 - 16:30 น.
- รพ.พุนพิน รพช. 077-311-129 พฤ 08.30-16.00 น.
- รพ.มะเร็งสุราษฏร์ธานี รพ.สังกัดกรม 077-277555 ศ. 08.00 - 12.00 น.
- รพร.เวียงสระ รพช. 077-361-283 ต่อ 601 ทุกวันพุธ 13:00 - 16:30 น. (ให้คำปรึกษา)
- รพ.วิภาวดี รพช. 077-292144 ทุกวันจันทร์ 13.00 - 16.00 น.
- รพ.สต.บ่อผุด รพ.สต. 077-425 055 พฤ. 08.30 - 12.00 น.
- รพ.สต.บางไทร รพ.สต. 077-292 486 พฤ. 08.30 - 16.30 น.
- รพ.สต.บ้านยาง รพ.สต.
- รพ.สวนสราญรมย์ รพ.สังกัดกรม 077-916-500 ต่อ 62553 พ 09.00-15.00 น.
- รพ.สุราษฎร์ธานี รพศ 077-915600 ต่อ 7249 ศุกร์ 08.30 - 12.00 น.
ภูเก็ต
- รพ.ฉลอง รพช. 076-384-342 ต่อ 1134 พ. 13.00 - 16.30 น.
- รพ.ถลาง รพช. 076-311-034 ต่อ 532 พฤ. 13.00 - 16.30 น.
- รพ.ป่าตอง รพช. 076 342 633-4 พุธ 13.00-16.30 น.
- รพ.วชิระภูเก็ต รพศ 076-361-234 พุธ 13.00-16.00 น.
- รพ.สต.รัษฎา รพ.สต. 076-22 2068 อ. พฤ. 13.00 - 16.00 น.
- รพ.สต.ศรีสุนทร รพ.สต. 076-61 7795 อ. 09.00 - 12.00 น. (ในเวลาราชการ)
สถานเอกอัครราชทูต ณ กรุงย่างกุ้ง
สถานเอกอัครราชทูต ณ กรุงย่างกุ้ง เตือนคนไทย กัญชา กัญชง หรือผลิตภัณฑ์ที่มีส่วนประกอบของกัญชา กัญชง เป็นยาเสพติดให้โทษตามกฏหมายท้องถิ่นเมียนมา
ผู้ใดเพาะปลูก ครอบครอง ขนส่ง ส่งผ่าน มีโทษจำคุก 5-10 ปี
ผู้ใดกระจาย จำหน่าย นำเข้า ส่งออก มีโทษจำคุก 15 ปี หรือตลอดชีวิต หรือประหารชีวิต
กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม


ศาสตราจารย์พิเศษ ดร.เอนก เหล่าธรรมทัศน์ รัฐมนตรีว่าการกระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม กล่าวว่า “จากความร่วมมือระหว่างกระทรวงสาธารณสุข กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม ในการสนับสนุนการนำนวัตกรรมทั้งทางด้านสังคมและเทคโนโลยีมาช่วยสนับสนุนการบริหารจัดการสถานการณ์การระบาดเชื้อโควิด-19 โดยนำแผนงานและกิจกรรมคณะปฏิรูปประเทศด้านสาธารณสุข Big Rock 1 มาขับเคลื่อนภายใต้โปรแกรมยุติโรคระบาดด้วยนวัตกรรม (Ending Pandemics through Innovation) โดย ศูนย์ความเป็นเลิศด้านชีววิทยาศาสตร์ (องค์การมหาชน) หรือ ทีเซลส์ (TCELS) เป็นผู้ประสานงานหน่วยงานและขับเคลื่อนหลัก และสนับสนุนงบประมาณบางส่วนเพื่อร่วมขับเคลื่อนนั้น ส่งผลให้เกิดความสำเร็จและการผลักดันเชิงนโยบายที่เป็นรูปธรรมในหลายๆ ด้าน ไม่ว่าจะเป็นการปฏิรูปการเชื่อมโยงข้อมูลสุขภาพของประเทศ การปฏิรูประบบบริการปฐมภูมิในพื้นที่กรุงเทพมหานคร โดยความร่วมมือจากทั้งกระทรวงสาธารณสุข กระทรวงดิจิทัลเพื่อเศรษฐกิจและสังคม กระทรวงแรงงาน กระทรวงการคลัง กรุงเทพมหานคร และหน่วยงานอื่นๆ ที่เกี่ยวข้อง ทั้งนี้ก็เพื่อประโยชน์แก่การบริการสุขภาพประชาชน
กระทรวง อว. ในฐานะหน่วยวิชาการ วิจัยและพัฒนา เราพร้อมให้การสนับสนุนการขับเคลื่อนนโยบาย ด้านวิชาการ การพัฒนานวัตกรรมทั้งด้านดิจิทัล Telemedicine การเชื่อมโยงข้อมูลสุขภาพจากโรงพยาบาล UHOSNET และงบประมาณเพื่อส่งเสริมการทำงานหน่วยบริการปฐมภูมิและการเชื่อมโยงข้อมูลสุขภาพ ภายใต้ประเด็นการขับเคลื่อนการปฏิรูประบบฐานข้อมูลสุขภาพของประเทศให้มีประสิทธิภาพและเป็นไปตามเป้าหมายที่กำหนดไว้”
มิติที่ 4 ฟื้นเศรษฐกิจเมือง
กรุงเทพมหานคร โดยสำนักพัฒนาสังคมและสำนักงานเขต ได้เริ่มการจ้างงานคนพิการเพื่อเป็นอาสาสมัครปฏิบัติงานในสำนักพัฒนาสังคม และ 27 สำนักงานเขต แล้วจำนวน 95 คน กลางสิงหาคมนี้จะเพิ่มมาอีก 20 คน รวมเป็น 115 คน โดยตั้งเป้าจ้างงานคนพิการหน่วยงานละ 6 คน รวมจำนวน 306 คน ในช่วงเดือน ก.ค. - ก.ย. 65 ซึ่งจะทำให้การจ้างคนพิการเป็นไปตามเป้าหมาย 654 คน ภายใน ก.ย. นี้ โดยจะเน้นให้คนพิการทำงานอย่างมีศักดิ์ศรี และจัดประเภทงานให้เหมาะกับผู้พิการ นอกจากนี้ยังสำรวจพื้นที่ภายในตลาด 12 แห่ง ที่อยู่ในความดูแลของกรุงเทพมหานคร รวมทั้งตลาดชุมชน จัดหาพื้นที่ให้แก่คนพิการได้ทำการค้าขาย เพื่อเป็นการส่งเสริมรายได้และพัฒนาคุณภาพชีวิตคนพิการอีกด้วย โดยมีการจ้างงานคนพิการครบทั้ง 7 ประเภท ซึ่งประกอบด้วย ความพิการทางการเห็น ความพิการทางการได้ยินหรือสื่อความหมาย ความพิการทางการเคลื่อนไหวหรือทางร่างกาย ความพิการทางจิตใจหรือพฤติกรรม ความพิการทางสติปัญญา ความพิการทางการเรียนรู้ และความพิการทางออทิสติก ลิ้งค์รับสมัครงาน
http://elderbma.ddns.me/job/
สำหรับกิจกรรมถนนคนเดิน ได้ดำเนินการต่อเนื่องในหลายเขต เช่น สาทร บางรัก และมีการสำรวจพื้นที่เพื่อจัดกิจกรรมถนนคนเดิน ในย่านสร้างสรรค์ 15 ย่าน พร้อมทั้งพัฒนาโครงการกรุงเทพอาหารริมทางอร่อยปลอดภัย Bangkok Safety Street Food โดยเริ่มจัดทำระบบฐานข้อมูลผู้ค้าหาบเร่แผงลอย เพื่อให้สามารถติดตามการดำเนินการและสามารถบริหารจัดการได้อย่างเป็นระบบ เป้าหมายคือจะยกระดับ Street food และพัฒนาคุณภาพอาหารของร้านอาหารที่มากกว่า 20,000 ร้าน โดยจัดกลุ่ม Street food เป็น 3 กลุ่ม ได้แก่ 1. ตลาดในชุมชน 2. ตลาดในเมือง 3. ตลาดนักท่องเที่ยว
พญาไท ลงพื้นที่ตรวจความปลอดภัย สถานบริการ สถานบันเทิง LINK
10 สิงหาคม 2565 นางเบญญา อินทรวงศ์โชติ ผู้อำนวยการเขตพญาไท พร้อมด้วยนายชัยชวัชร์ เกตุธิติวิรัชต์ ผู้ช่วยผู้อำนวยการเขต นายพิเศษ ยิ้มแย้ม หัวหน้าฝ่ายเทศกิจ นางสาวอรพินท์ แสสนธิ์ หัวหน้าฝ่ายสิ่งแวดล้อมฯ เจ้าหน้าฝ่ายโยธา เจ้าหน้าที่ฝ่ายสิ่งแวดล้อมฯ และเจ้าหน้าที่ฝ่ายเทศกิจ ร่วมกับสถานีดับเพลิงและกู้ภัยดุสิต พร้อมทีมงาน ออกตรวจ แนะนำสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ หรือสถานที่อื่นที่มีลักษณะคล้ายกัน โดยมีการตรวจสอบระบบป้องกันอัคคีภัยของอาคาร เส้นทางหนีไฟ ตามที่กฎหมายว่าด้วยการควบคุมอาคารกำหนด, มาตรฐานความปลอดภัยสำหรับองค์กร (COVID Free Setting) และการเปิดให้บริการภายในระยะเวลาที่กำหนด เพื่อให้เกิดความปลอดภัยในชีวิตและทรัพย์สินของประชาชนผู้ใช้บริการ
โรงพยาบาลพญาไท นวมินทร์ เปิดรับผู้ประกันตนปี 2565 LINK
โรงพยาบาลพญาไท นวมินทร์ เปิดรับผู้ประกันตนปี 2565
สิทธิประโยชน์สำหรับประกันสังคม
✅ ดูแลและรักษา รับบริการตรวจสุขภาพประจำปีตามสิทธิ์ โดยไม่มีค่าใช้จ่าย
✅ รับบริการทันตกรรม 900 บาท โดยไม่ต้องสำรองจ่าย
ส่วนลดค่ารักษาพยาบาลครอบครัวผู้ประกันตน
✅ ส่วนลดค่าห้องพักผู้ป่วยใน 20%
✅ ส่วนลดค่ายา 10%
✅ ส่วนลดทันตกรรมทั่วไป 10%
สามารถเปลี่ยนแปลงสถานพยาบาลได้ตั้งแต่วันนี้ - 31 มี.ค. 65
โรงพยาบาลพญาไท นวมินทร์ โทร. 02-944-7111
FibroScan เทคโนโลยีทางเลือกใหม่ในการตรวจวินิจฉัย ตับ
11.ไทยมุ่งพัฒนา การแพทย์จีโนมิกส์ รักษา 5 กลุ่มโรค
การแพทย์จีโนมิกส์ หรือ การแพทย์แม่นยำ เป็นแนวทางการดูแลผู้ป่วย โดยประยุกต์ใช้ข้อมูลด้านพันธุกรรม สภาพแวดล้อม และวิถีชีวิตที่จำเพาะต่อผู้ป่วยแต่ละคนมาประกอบการวินิจฉัย และเลือกการรักษาที่ตรงจุดและเหมาะสมที่สุดสำหรับแต่ละราย เพื่อการรักษาโรคบางชนิด เช่น มะเร็ง วัณโรค โรคหายาก เป้นต้น โดยการแพทย์จีโนมิกส์ จะเพิ่มประสิทธิภาพ เช่น การตรวจยีนมะเร็งบางชนิดเพื่อป้องกันการเกิดมะเร็ง ตรวจยืนแพ้ยาเพื่อลดการแพ้ยารุนแรง ในอนาคตคาดการแพทย์แขนงนี้จะมีบทบาทสูงมากขึ้นในการสาธารณสุขของไทย และใช้ดูแลสุขภาพประชาชนตั้งแต่ตั้งครรภ์ เป็นทารก เติบโต กระทั่งเสียชีวิต
ปัจจุบัน ไทยมุ่งพัฒนาวิจัยด้านแพทย์จีโนมิกส์ใน 5 กลุ่มโรค ได้แก่ กลุ่มโรคมะเร็ง โรคหายาก โรคติดเชื้อ โรคไม่ติดต่อ และกลุ่มผู้ป่วยแพ้ยา
B.Wealthy Pensioners
Wealthy Pensioners - Retirees aged 50 years and older who have an annual pension or stable income
• Personal income of at least USD 80,000/year at the time of application
• In case of personal income below USD 80,000/year but no less than USD 40,000/year, applicants must invest at least USD 250,000 in Thai government bonds, foreign direct investment, or Thai property
Health insurance
Health insurance with at least USD 50,000 coverage or social security benefits insuring treatment in Thailand or at least USD 100,000 deposit
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านทักษิณ จังหวัดยะลา
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านทักษิณ จังหวัดยะลา
เลขที่ 62 ถนนสุขยางค์ ตำบลสะเตง อำเภอเมือง จังหวัดยะลา 95000
โทรศัพท์ : 073-274298, โทรสาร : 073-274298
ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านทักษิณ หรือชื่อเดิม “สถานสงเคราะห์คนชราบ้านทักษิณ” สังกัดกรมประชาสงเคราะห์ โดยรัฐบาลได้เล็งเห็นว่าควรจะจัดตั้งสถานสงเคราะห์คนชราในเขตพื้นที่ ๑๔ เพื่อรับอุปการะคนชราในเขตภาคใต้เหมือนกับที่ได้จัดตั้งขึ้นตามภาคต่างๆ มาแล้ว เพื่อเป็นการบรรเทาความเดือดร้อนในช่วงบั้นปลายชีวิต ด้วยเหตุนี้ จึงได้ดำเนินการให้จัดตั้งสถานสงเคราะห์คนชราแห่งใหม่ขึ้นที่จังหวัดยะลา โดยเริ่มรับคนชราเข้ารับอุปการะเมื่อวันที่ 13 เมษายน 2511 และกระทำพิธีเปิดดำเนินการเป็นทางการ เมื่อวันที่ 14 กรกฎาคม 2512
สถานสงเคราะห์คนชราบ้านทักษิณ จังหวัดยะลา เป็นสถานสงเคราะห์ที่ไม่ได้ถ่ายโอนภารกิจให้แก่องค์กรปกครองส่วนท้องถิ่น ตามนโยบายกระจายอำนาจของรัฐบาล ต่อมา เปลี่ยนแปลงชื่อหน่วยงานจาก “สถานสงเคราะห์คนชรา” เป็น “ศูนย์พัฒนาการจัดสวัสดิการสังคมผู้สูงอายุบ้านทักษิณ จังหวัดยะลา” เมื่อวันที่ 2 พฤศจิกายน 2548 และต่อมาเมื่อวันที่ 6 มีนาคม 2558 ได้มีการปรับปรุงโครงสร้างส่วนราชการของกระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ ตามพระราชบัญญัติปรับปรุงโครงสร้างกระทรวง ทบวง กรม ฉบับที่ 14 พ.ศ. 2558 ให้มาสังกัด กรมกิจการผู้สูงอายุ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ โดยมีภารกิจรับผิดชอบเป็นศูนย์ดำเนินการสนับสนุนและพัฒนามาตรฐานรวมทั้งพัฒนาการจัดบริการด้านผู้สูงอายุเพื่อเป็นศูนย์ต้นแบบในการจัดสวัสดิการผู้สูงอายุ
สปสช.จัดมาตรการรองรับ ไม่ลอยแพผู้ป่วย
พญ.ลลิตยา กองคำ รองเลขาธิการสปสช. กล่าวถึงมาตรการรองรับภายหลังการยกเลิกสัญญากับ 9 รพ.เอกชน ว่า สปสช.ได้เตรียมการ 1) จัดหาหน่วยบริการปฐมภูมิอื่นๆ เพื่อรองรับดูแล ได้แก่ คลินิกเวชกรรม คลินิกชุมชนอบอุ่น คลินิกการพยาบาลและการผดุงครรภ์ และร้านยา ฯลฯ 2) จัดหาโรงพยาบาลรับส่งต่อ พร้อมกับประสานและจัดหน่วยบริการแห่งใหม่เพื่อดูแลผู้ป่วยที่มีนัดรักษาหรือติดตามอาการ 3) จัดหาระบบบริการปฐมภูมิรูปแบบใหม่ๆ เพิ่มเติมเพื่อให้บริการ อาทิ ระบบบริการการแพทย์ทางไกล (Telemedicine) เพื่อเพิ่มทางเลือกกับให้กับประชาชน
กรณีผู้ป่วยใน ผู้ป่วยรักษาต่อเนื่อง
พญ.ลลิตยา กล่าวถึงผู้ป่วยที่ใช้สิทธิการรักษากับ รพ.เอกชนทั้ง 9 แห่ง ในกรณีต่างๆ เอาไว้ดังนี้
กรณีเจ็บป่วยฉุกเฉิน ใช้สิทธิรักษาเหมือนเดิมทุกประการ
กรณีผู้ป่วยใน ที่ยังนอนอยู่ รพ. รักษาต่อไปได้ จนกว่าจะปลอดภัย
กรณีผู้ป่วยกลุ่มเร่งด่วน ผู้ป่วยนัดรักษาต่อเนื่อง ผู้ป่วยโรคเรื้อรังต่างๆ ที่มีนัดติดตามอาการ ผู้ป่วยที่รอการผ่าตัด รังสีรักษา เคมีบำบัด และกรณีหญิงตั้งครรภ์ใกล้คลอด ฯลฯ ผู้ป่วยกลุ่มนี้ สปสช.ได้ประสานและจัดหาหน่วยบริการเพื่อให้การรักษาต่อเนื่องแล้ว เบื้องต้นขอให้ท่านติดต่อขอรับเวชระเบียน (ข้อมูลและประวัติการรักษา) กับโรงพยาบาลที่ท่านรักษาอยู่ในขณะนี้ โดย สปสช.ได้ทำหนังสือถึง รพ. ทั้ง 9 แห่ง เพื่อขอข้อมูลผู้ป่วยพร้อมประวัติการรักษาด้วยเช่นกัน เพื่อใช้เป็นข้อมูลประสานส่งต่อผู้ป่วย อย่างไรก็ตามหากผู้ป่วยรายใดไม่ได้รับการติดต่อจาก สปสช. ขอให้ท่านโทรมายังสายด่วน สปสช. 1330 กด 6 เพื่อให้เจ้าหน้าที่ดำเนินการต่อไป
กรณีผู้ป่วยไต ที่มีนัดฟอกไตกับทั้ง 9 รพ.เอกชน ยังคงรับบริการได้ตามนัดเหมือนเดิม เนื่องจากการยกเลิกสัญญาไม่ได้รวมถึงการให้บริการฟอกเลือดด้วยเครื่องไตเทียม
กรณีผู้ที่ไม่ใช่ผู้ป่วยรักษาต่อเนื่อง
ซึ่งแบ่งเป็น 2 รูปแบบ ตามการเลือกเพื่อเป็นหน่วยบริการปฐมภูมิโดยตรง คือ
1. กลุ่มที่เลือก 9 รพ.เอกชน โดยตรง และ
2. กลุ่มที่เลือก คลินิกเอกชนหรือศูนย์บริการสาธารณสุข ที่เป็นเครือข่ายกับ 9 รพ.เอกชน
ซึ่งทั้ง 2 รูปแบบมีคำแนะนำดังนี้
1. กลุ่มที่เลือก 9 รพ.เอกชน โดยตรง
- เปลี่ยนหน่วยบริการแห่งใหม่ ที่อยู่ในเขตพื้นที่ ทดแทน ทั้ง 9 รพ.เดิม
- ในกรณีที่ไม่มีหน่วยบริการในเขตพื้นที่ให้เลือก ก็สามารถรอได้
เพราะขณะนี้
"สปสช.อยู่ระหว่างการเร่งจัดหาหน่วยบริการเพิ่มเติมแล้ว ซึ่งตั้งแต่วันที่ 1 ตุลาคม 2565 เป็นต้นไป หากเกิดภาวะเจ็บป่วยท่านก็ยังใช้สิทธิบัตรทองรักษาได้ โดยเข้ารับบริการที่ทุกหน่วยบริการปฐมภูมิทุกแห่งในระบบบัตรทอง โดยไม่เสียค่าใช้จ่าย"
กล่าวคือ หากพ้นวันที่ 1 ตุลาคม 65 ไปแล้ว แต่ยังไม่เลือกหน่วยบริการใดไว้ จะถือว่าเป็น "สิทธิว่าง" ซึ่งประโยชน์คือ "จะสามารถเข้ารับบริการได้ที่ทุกหน่วยบริการ" นั่นเอง
2. กลุ่มที่เลือก คลินิกเอกชน/ศูนย์บริการสาธารณสุข ที่เป็นเครือข่ายกับ 9 รพ.เอกชน
กรณีนี้ หากชเจ็บป่วย สามารถเข้ารับการรักษาได้ตาม คลินิกเอกชน/ศูนย์บริการสาธารณสุข เบื้องต้นตามสิทธิได้เช่นเดิม กรณีที่จะต้องถูกส่งต่อไปรักษายังสถานพยาบาลอื่น สปสช.ได้ประสานงานให้ส่งต่อไปยังสถานพยาบาลที่ได้จัดหาเพิ่มให้
กรุงธนเหนือ
- เขตธนบุรี 02-5869977 , 02-4663092
- เขตจอมทอง 02-4274892 , 02-4276488
- เขตบางกอกใหญ่ 02-4575986 , 02-4570069
- เขตตลิ่งชัน 089-6800551 , 081-0829556 , 087-5036996 , 095-6255615
- เขตบางกอกน้อย 02-4240056 ต่อ 5658
- เขตคลองสาน 02-0239900
- เขตทวีวัฒนา 090-8990629
- เขตบางพลัด 02-4335809 , 082-782 7545
ลอยกระทงกะหล่ำ แห่งเมืองสองแคว จ.พิษณุโลก
ลอยกระทงกะหล่ำ แห่งเมืองสองแคว
เสน่ห์กินริมน้ำ Fun Fin Food @ชุมชนบ้านวังส้มซ่า อ.เมือง จ.พิษณุโลก
5 - 8 พฤศจิกายน 2565 ที่ บ้านวังส้มซ่า
High light‼️
☆ เมนูอาหารสำรับวังส้มซ่า
☆ ตลาดย้อนยุค
☆ ล่องเรือไหว้พระวัดสกัดน้ำมัน
☆ DIY พวงมะโหตร ศิลปะประดิษฐ์
☆ รำวงย้อนยุคและดนตรีมังคละ
Galleries Nights 2022: NOW 11 พ.ย. - 5 ธ.ค.65 LINK
Galleries’ Nights 2022: NOW
เริ่มตั้งแต่ 11 พฤศจิกายน - 5 ธันวาคม 2565
จัดแสดงที่แกลเลอรี่ 70 แห่งทั่วกรุงเทพฯ
งาน Galleries’ Nights ได้รับรับแรงบันดาลใจมาจากงาน ค่ำคืนสีขาวแห่งปารีส หรือ Nuit Blanche Paris (Sleepless Night) ซึ่งเป็นงานที่อุทิศให้กับทัศนศิลป์และศิลปะร่วมสมัยที่ประสบความสําเร็จไปทั่วโลก
Galleries’ Nights ได้เปลี่ยนกรุงเทพเมืองฟ้าอมรให้กลายเป็นพิพิธภัณฑ์กลางแจ้งที่รื่นเริงและเป็นมิตร โดยจัดขึ้นเป็นประจําทุกปี ตั้งแต่ปี 2556 เป็นต้นมา และในปีนี้ ได้จัดขึ้นตลอด 2 คืน พร้อมรวบรวมผู้ชมจํานวนมากมาค้นพบแกลเลอรี่มากกว่า 70 แห่ง
วงดนตรีสุนทราภรณ์
วงดนตรีสุนทราภรณ์ เป็นวงดนตรีเพลงไทยสากลแห่งแรกของไทย ก่อตั้งขึ้นเมื่อวันที่ 20 พฤศจิกายน พ.ศ. 2482 โดยมีศิลปินที่มีชื่อเสียง เช่น เอื้อ สุนทรสนาน, มัณฑนา โมรากุล บุษยา รังสี, โสมอุษา, ช่อชบา ชลายลนาวิน, พันธ์พร วัฒนเรืองไร, ช่อฉัตร รัตนกมล, ธรรมรัตน์ นวมะรัตน์, สุวณีย์ เนื่องนิยม, ยรรยงค์ เสลานนท์, รุ่งฤดี แพ่งผ่องใส, ศรวณี โพธิเทศ, นพดฬ ชาวไร่เงิน, จินตนา สุวรรณศิลป์ เป็นต้น ชื่อวงดนตรีสุนทราภรณ์ มีที่มาจาก นามสกุลของเอื้อ (สุนทรสนาน) สนธิคำกับชื่อคนรักของเอื้อ (อาภรณ์) [
wikipedia]
ในภาพคือ คุณพรศุลี วิชเวช เจ้าของฉายา การเวกเสียงใส นักร้องดาวค้างฟ้า แห่งวงดนตรีสุนทราภรณ์
ติดตามความเคลื่อนไหวกิจกรรมการแสดงคอนเสิร์ตของวงสุนทราภรณ์ได้ ผ่านทาง
เพจมูลนิธิสุนทราภรณ์ Suntaraporn Foundation
เขตสายไหม LINK
“นัดเวลาทิ้ง นัดเวลาเก็บ ขยะชิ้นใหญ่” ประจำวันอาทิตย์ที่ 13 พ.ย. 2565 สถานที่ ดังนี้
- หมู่บ้านอัมรินทร์นิเวศน์ 3 ผัง 1
- หมู่บ้านซื่อตรง (ถ.พหลโยธิน 52)
แล้วอย่าลืม นำวัสดุเหลือใช้ที่ต้องการทิ้ง ไปวางไว้หน้าบ้านของท่าน
หรือ จุดที่กำหนด ก่อนเวลา 09.00 น. ในวันและสถานที่ ดังกล่าวด้วยนะครับ
สอบถามเพิ่มเติมได้ที่ฝ่ายรักษาความสะอาดฯ โทร. 0 2158 7365
โรงพยาบาลราชธานี ให้บริการผู้ป่วยในจังหวัดพระนครศรีอยุธยา
โรงพยาบาลราชธานี บริการดูแลผู้ป่วยกระดูกและข้อด้วยทีมแพทย์ผู้เชี่ยวชาญเฉพาะด้าน เป็นโรงพยาบาลแห่งเดียวในจังหวัดพระนครศรีอยุธยาที่สามารถผ่าตัดเส้นเอ็นไหล่ด้วยกล้องและผ่าตัดเปลี่ยนข้อไหล่ได้ แพ็กเกจเปลี่ยนข้อเข่าเทียมชนิด Fix และแบบ Mobile สอบถามเพิ่มเติม ติดต่อ ศูนย์ศัลยกรรมกระดูกและข้อ อาคาร B ชั้น 1 เปิดบริการทุกวัน 24 ชั่วโมง โทร 035-335-555 ต่อ 116, 117 หรือ 086-810-429221 พ.ย. 65 เตือน รมว.สธ. , กัญชาทางการแพทย์
1. ร่าง พ.ร.บ.กัญชาฯ
- นายศุภชัย ใจสมุทร ประธานคณะกมธ.วิสามัญพิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ …. กล่าวว่า ยังไม่แน่ใจว่าพรรคการเมืองทั้งหลายจะโหวตลงมติให้ร่าง พ.ร.บ.กัญชาฯ ผ่านวาระสามหรือไม่ เชื่อว่าวันนี้เอาเรื่องการเมืองมานำหน้าแล้ว ทั้งนี้หาก พ.ร.บ.กัญชาฯ ไม่ผ่าน ผลที่จะเกิดขึ้นกับประเทศ จะไม่มีกฎหมายใดมารองรับอย่างสมบูรณ์ที่จะทำให้นโยบายรัฐบาลเกี่ยวกับเรื่องกัญชาเกิดขึ้นได้อย่างสมบูรณ์
- นายประสิทธิ์ชัย หนูนวล แกนนำกลุ่มเครือข่ายประชาชนเพื่อการมีกฎหมายควบคุมกัญชาในประเทศไทย ไลฟ์สด ระบุถึงเหตุผลของการนัดหมายชุมนุม ที่จะมีขึ้นในอังคารที่ 22 พ.ย. ที่ทำเนียบรัฐบาล ว่า เพื่อไปติดตามการประชุมคณะกรรมการป้องกันและปราบปรามยาเสพติด จะต้องไม่นำกัญชากลับไปเป็นยาเสพติด ในทางตรงกันข้ามต้องเร่ง ผลักดันให้ ร่างพ.ร.บ.กัญชา กัญชง (ฉบับที่...) พ.ศ... บังคับใช้ ปัจจุบันในสังคมมีความเห็นต่างกันในเรื่องของกัญชา ทั้งภาคการเมือง หมอสาธารณสุข และองค์กรต่างๆ ได้ออกมาแสดงความคิดเห็นกันอย่างกว้างขวาง ก่อให้เกิดความสับสนทางสังคม ทั้งที่ในความจริงแล้ว เรื่องของร่างพ.ร.บ.กัญชาฯ ควรดำเนินการให้เป็นไปตามระบบ ตามที่สมาชิกสภาผู้แทนราษฎรได้เห็นชอบ ในวาระที่ 1 จากนั้นได้มอบหมายให้กรรมาธิการทั้ง 25 คน ซึ่งมาจากพรรคการเมืองต่างๆ ได้ร่วมกันเขียนร่าง พ.ร.บ.ฉบับนี้ขึ้นมา เมื่อร่างเสร็จแล้วต้องส่งกลับไปให้สภาผู้แทนราษฎรพิจารณา แต่เมื่อวันที่ 16 ก.ย.ที่ผ่านมาได้เสนอเข้าไป แต่สภากลับไม่รับพิจารณา เราต้องการกฎหมายมาควบคุมกัญชา เพื่อความมั่นคงทางยาของประเทศไทย อย่าดูถูกประชาชนว่าไร้ความสามารถ ไร้วิจารณญาณ ประชาชนที่จะร่วมคัดค้านกับเรา เชิญในวันอังคารที่ 22 พ.ย. ที่หน้าทำเนียบรัฐบาล ตั้งแต่เวลา 12.30 น. เป็นต้นไป
2. เตือน รมว.สธ.
- แชร์โพสต์ของ นพ.รังสฤษฎ์ กาญจนะวณิชย์ระบุ อาจารย์แพทย์เตือนสติ คนเป็น รมว.สธ. โปรโมตไอศกรีมกัญชาที่สถานพยาบาลของรัฐ
3.กัญชาทางการแพทย์
-นพ.ปัตพงษ์ เกษสมบูรณ์ หน่วยเวชศาสตร์ครอบครัว คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่น เผยความรู้ใหม่การใช้กัญชารักษาโรคที่กำลังมาแรงคือการกินสด โดยนำใบหรือดอกกัญชามาปั่นคั้นรวมกับผักหรือผลไม้อื่นๆ มีสรรพคุณรักษาบรรเทาและป้องกันโรคต่างๆ อย่างได้ผลโดยไม่ทำให้เมา มีตัวอย่างที่โด่งดังมาแล้วในสหรัฐอเมริกา อาทิ โรคภูมิแพ้ตัวเอง โรคเนื้องอกในสมอง โรครูมาตอยด์เป็นต้น
-องค์กรแพทย์(แพทยสภา แพทยสมาคม และ 14 ราชวิทยาลัยแพทย์) แจงรายละเอียดหลักการ 5 ข้อสำหรับกัญชาทางการแพทย์ ดังนี้ 1. กัญชาทางการแพทย์ควรอิงหลักฐานเชิงประจักษ์ 2. ผลิตภัณฑ์กัญชาต้องมีคุณภาพและอยู่ภายใต้พระราชบัญญัติยา 3. กลุ่มผู้ให้การรักษา เช่น แพทย์ เภสัชกร ควรได้รับการอบรมก่อนใช้ผลิตภัณฑ์กัญชารักษาผู้ป่วย 4.ผู้ป่วยต้องได้รับการคัดกรองและประเมินก่อน ระหว่าง และหลังการรักษา 5. รัฐควรกำหนดกัญชาเป็นสารเสพติดให้โทษโดยมีหน่วยงานรัฐเป็นผู้กำกับดูแลผลิตภัณฑ์กัญชา ด้านศ. นพ. มานิต ศรีสุรภานนท์ ประธานราชวิทยาลัยจิตแพทย์แห่งประเทศไทย ย้ำแพทย์แผนปัจจุบันเห็นด้วยที่จะให้นำผลิตภัณฑ์กัญชาที่มีคุณภาพมาใช้ทางการแพทย์ แต่การสูบช่อดอกกัญชาไม่ใช่การใช้กัญชาทางการแพทย์
4. ทำร้ายร่างกายหลังเสพกัญชา
- นายจรินทร์ วัย 23 ปี ทะเลาะวิวาทและยิง นายวันทา วัย 53 ปี ภายในบ้านหลังหนึ่งที่บ้านห้วยทรายทอง ต.นาแขม จ.เลย พบขวดเหล้า และฝาผนังบ้านพบบ้องกัญชาตั้งอยู่
ของขวัญปีใหม่จาก ธนาคารอิสลาม 1 โครงการ
ธนาคารอิสลามแห่งประเทศไทย (ธอท.) จำนวน 1 โครงการ
คือ
1. สินเชื่อไอแบงค์ยืนหนึ่ง ประกอบด้วย
1) สินเชื่อเพื่อที่อยู่อาศัย
2) โครงการสินเชื่อ Top Up และ
3) โครงการสินเชื่อบ้านแลกเงิน
โดยลูกค้าทั่วไปที่เข้าร่วม 1 ใน 3 โครงการนี้ จะได้รับอัตรากำไรพิเศษ ระยะเวลาดำเนินโครงการตั้งแต่วันที่ 1 พฤศจิกายน 2565 ถึงวันที่ 28 กุมภาพันธ์ 2566
HUA HIN BEACH COUNTDOWN 2023 โรงแรมอินเตอร์คอนทิเนนตัล หัวหิน
HUA HIN BEACH COUNTDOWN 2023 โรงแรมอินเตอร์คอนทิเนนตัล หัวหิน รีสอร์ท จังหวัดประจวบคีรีขันธ์ กิจกรรมส่งท้ายปีเก่า ต้อนรับปีใหม่ 2566 กิจกรรมฟรีดนตรี เพื่อสนับสนุนศิลปินไทยร่วมเคาท์ดาวน์ นับถอยหลังส่งความสุขปีใหม่ให้กับนักท่องเที่ยวด้วยกัน กิจกรรมไฮไลท์ : กิจกรรมจุดพลุริมชายหาดที่ยาวที่สุดส่งท้ายปีเก่าต้อนรับปีใหม่
รศ.ดร.วิศณุ ทรัพย์สมพล - ดูแลด้านโครงสร้างพื้นฐานและการจราจร
"ในปีนี้ปริมาณน้ำฝนสะสมมากกว่าค่าเฉลี่ย 30 ปี ถึง 40% ทำให้กรุงเทพมหานครต้องเพิ่มความสามารถในการระบายน้ำให้มากขึ้น จากการถอดบทเรียนน้ำท่วมที่ผ่านมา สิ่งที่เราทำได้คือการเร่งระบายให้น้ำที่มีนั้นออกไปสู่คลองและแม่น้ำให้ได้เร็วที่สุด ผ่านการลอกท่อ จุดลอกคลองและปรับปรุงสถานีสูบน้ำ เพื่อให้สามารถระบายน้ำลงแม่น้ำเจ้าพระยาได้เร็วขึ้น ซึ่งการระบายน้ำของ กทม. ในปีหน้าจะดีขึ้นกว่าปีที่ผ่านมา"
รศ.ดร.วิศณุ ทรัพย์สมพล
รองผู้ว่าราชการกรุงเทพมหานคร
ดูแลด้านโครงสร้างพื้นฐานและการจราจร
กล่าวในงานอัพเดทความคืบหน้านโยบาย 9 ด้าน 9 ดี ก้าวสูปี 66 กรุงเทพฯ เมืองน่าอยู่
21 ธันวาคม 2565
ศูนย์บริการสาธารณสุขที่ 11 ท่าทราย
- ที่อยู่ 190 ซอยสามัคคี 28 ต.ท่าทราย อ.เมือง นนทบุรี
- โทร 02-9520488
- แผนที่
- Facebook
บริการ
- คลินิคตรวจรักษาโรคทั่วไป วันจันทร์-อาทิตย์ ยกเว้นวันหยุดนักขัตฤกษ์ เวลา 08.30-16.30 น. (นอกเวลาราชการ) วันจันทร์-ศุกร์ เวลา 16.30-18.30 น.
- คลินิคตรวจมะเร็งปากมดลูก วันจันทร์ เวลา 08.30-16.30 น.
- คลินิกแพทย์แผนไทย วันจันทร์-ศุกร์ เวลา 08.30-16.30 น. (นอกเวลาราชการ) วันจันทร์ พุธ และศุกร์ เวลา 16.30-18.30 น.
- งานส่งเสริมสุขภาพชุมชน วันจันทร์-ศุกร์ เวลา 13.00-16.30 น.
- คลินิกทันตกรรม วันศุกร์ เวลา 08.30-12.00 น.
- คลินิกวางแผนครอบครัว วันพฤหัสบดี เวลา 08.30-16.30 น.
- ทำแผล วันเสาร์-อาทิตย์ วันหยุดนักขัตฤกษ์ เวลา 08.30-16.30 น.
*หมายเหตุ ให้บริการวัคซีนเด็ก วันอังคาร สัปดาห์ที่ 2 ของเดือน (ไม่ตรงกับวันหยุดนักขัตฤกษ์)
กรณีใช้บริการคลินิกแพทย์แผนไทยและคลินิกทันตกรรม กรุณาติดต่อนัตล่วงหน้ากับเจ้าหน้าที่ก่อนเข้ารับบริการทุกครั้ง
โรงพยาบาลสมุทรปราการและโรงพยาบาลบางพลี เปิดภารกิจสู่โรงพยาบาลนำสมัยและเทคโนโลยีขั้นสูง
16 สิงหาคม 2565 เปิดภารกิจสู่โรงพยาบาลนำสมัยและเทคโนโลยีขั้นสูงของโรงพยาบาลสมุทรปราการ เป็นกิจกรรม แสดงศักยภาพของโรงพยาบาลสมุทรปราการ ในการพัฒนาตามนโยบาย EMS: environment ,modernized, smart hospital ของกระทรวงสาธารณสุขโดยได้
- พัฒนาอาคารสถานที่และสิ่งแวดล้อมในโรงพยาบาลให้มีความสวยงาม ทันสมัย
- มีการพัฒนาเทคโนโลยีด้านต่างๆ ที่จะลดความแออัดและเพิ่มความสะดวกต่อผู้รับบริการ เช่น หุ่นยนต์คัดกรองอาการเบื้องต้น ระบบคิวอัตโนมัติ ตู้ชำระเงินอัตโนมัติ ระบบผู้ป่วยในไร้กระดาษหลัง
- การปรับโฉมใหม่ อาคารผู้ป่วยนอก ห้องฉุกเฉินและห้องตรวจตา ให้สวยงามกว้างขวางและสะดวกต่อผู้รับบริการ
- การเปิดศูนย์รับบริจาคอวัยวะ โรงพยาบาลบางพลี เพื่อเป็นศูนย์ประสานงานเกี่ยวกับการรับบริจาคอวัยวะและดวงตาทำให้ประชาชนเข้าถึงโอกาสในการรักษาด้วยการเปลี่ยนถ่ายอวัยวะได้มากขึ้น
กิจกรรมนี้ ได้รับเกียรติจาก นายแพทย์เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุขได้ให้เกียรติมาเป็นประธานในพิธีเปิดภารกิจสู่โรงพยาบาลนำสมัยและเทคโนโลยีขั้นสูงของโรงพยาบาลสมุทรปราการ โดยมีนายแพทย์ณรงค์ อภิกุลวณิช ผู้ตรวจราชการเขตสุขภาพที่ 6 นายแพทย์นเรศฤทธิ์ ขัดธะสีมา นายแพทย์สาธารณสุขจังหวัด นายแพทย์นำพล แดนพิพัฒน์ ผู้อำนวยการโรงพยาบาลสมุทรปราการ นายแพทย์สกล สุขพรหม ผู้อำนวยการโรงพยาบาลบางพลี และทีมเจ้าหน้าที่สาธารณสุขของจังหวัดสมุทรปราการให้การต้อนรับ
ราชวิทยาลัยแพทย์เวชศาสตร์ครอบครัวแห่งประเทศไทย The Royal College of family Physicians of Thailand
ราชวิทยาลัยแพทย์เวชศาสตร์ครอบครัวแห่งประเทศไทย
The Royal College of family Physicians of Thailand
เลขที่ 2 ชั้น 11 อาคารเฉลิมพระบารมี ๕๐ ปี ซอยศูนย์วิจัย แขวงบางกะปิ เขตห้วยขวาง กรุงเทพมหานคร 10310
โทร. 02 -716-6651-2
Fax : 02-716-6653
info@thaifammed.org
https://thaifammed.org/ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์
ปัจจุบัน ศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ เติบโตอย่างมากและสร้างรายได้กว่า 1 พันล้านบาทในปี 2565 รวมถึงบริการที่ RAKxa (รักษ) ศูนย์บูรณาการสุขภาพและการแพทย์แบบองค์รวมที่บางกระเจ้า และพันธมิตรอื่น ๆ ซึ่งจะเป็นอีกบทพิสูจน์ของบำรุงราษฎร์ที่เสริมศักยภาพการเป็นจุดหมายแห่งการดูแลสุขภาพและสุขภาวะที่น่าเชื่อถือที่สุด และยังเป็นการเสริมจุดแข็งด้านการแพทย์ของไทย สู่เป้าหมายของการเป็น ‘ศูนย์กลางสุขภาพนานาชาติ’ หรือ ‘การแพทย์ครบวงจร’ (Medical Hub) เป็นหนึ่งในอุตสาหกรรมอนาคต (New S-Curve) สร้างชื่อเสียงความน่าเชื่อถือให้กับธุรกิจการแพทย์และสุขภาพ และสร้างรายได้หมุนเวียนในระบบให้กับประเทศชาติ”
เขตจตุจักร ห้องสมุดสิ่งแวดล้อม ศูนย์การศึกษาและอนุรักษ์สิ่งแวดล้อมบางซื่อ
ห้องสมุดสิ่งแวดล้อม ศูนย์การศึกษาและอนุรักษ์สิ่งแวดล้อมบางซื่อ
ภายบริเวณสวนวชิรเบญจทัศ (สวนรถไฟ)
เวลาทำการ
อังคาร - เสาร์ 08.30 - 20.00 น.
อาทิตย์ 09:00 - 17:00 น.
ปิดวันจันทร์และวันหยุดนักขัตฤกษ์
ถนนกำแพงเพชร 2 เขตจตุจักร กทม. 10900
โทร. 025117614
สาส์นแสดงความอาลัยจากนานาชาติ
ปธน.เออดวน แห่งตุรกี ประกาศเป็นช่วงไว้อาลัยของชาติ 7 วัน ลดธงครึ่งเสา ตั้งแต่ 6 ถึง 12 ก.พ. 2023
ผู้นำนานาประเทศส่งสาส์นแสดงความอาลัยต่อเหตุการณ์ ปธน.โจ ไบเดน ปธน.สีจิ้นผิงหัวหน้าผู้แทนองค์การสหประชาชาติ หัวหน้าคณะเจ้าหน้าที่อียู มกุฏราชกุมารแห่งซาอุดิอาระเบีย
หน่วยงานและองค์กรนานาชาติเร่งระดมกำลังเข้าให้การช่วยเหลือในตุรกีและซีเรีย
ทางการตุรกีร้องขอความช่วยเหลือไปยังนาโต้ และนานาชาติแล้ว ความต้องการสิ่งจำเป็นเร่งด่วนในการกู้ชีพและค้นหาผู้บาดเจ็บรอดชีวิต อุปกรณ์ทางการแพทย์ การกู้ภัย โรงพยาบาลสนาม องค์การอนามัยโลก (WHO) ตั้งทีมแพทย์ฉุกเฉินเข้าให้การสนับสนุน
*ภาพจาก Anadolu Agency
จดทะเบียนสมรส@ลาดกระบัง ไม่ปิดบังใคร LINK
สำนักงานเขต ลาดกระบัง รับวาเลนไทน์ จัดกิจกรรม "จดทะเบียนสมรส@ลาดกระบัง ไม่ปิดบังใคร" จะ boy จะ bad ไม่อยาก Sad ต้องจดทะเบียน...‼️
เนื่องในเดือนแห่งความรักนี้ ฝ่ายทะเบียน สำนักงานเขตลาดกระบัง เชิญชวนคู่สมรส มาจดทะเบียนสมรส ในวันวาเลนไทน์ 14 กุมภาพันธ์ 2566 08.00 - 16.00 น.
มีของที่ระลึกแจกในวันและเวลาดังกล่าว
สิ่งที่ต้องเตรียม
1.บัตรประจำตัวประชาชนคู่จด
2.บัตรประจำตัวประชาชนของพยาน2คน
3.กรณีเคยจดทะเบียนสมรสและหย่าแล้ว ให้นำใบหย่ามาแสดงต่อเจ้าหน้าที่
4.กรณีฝ่ายหญิงประสงค์จะเปลี่ยนคำนำหน้านาม เปลี่ยนนามสกุล ให้นำสำเนาทะเบียนบ้านฉบับจริงมาด้วย(กรณีมีชื่อและภูมิลำเนาอยู่ในเขตสำนักทะเบียนเขตลาดกระบัง)
การฝากไข่ครั้งนึงควรเก็บไข่ให้ได้กี่ใบ เพื่อที่จะได้มีโอกาสสำเร็จในการตั้งครรภ์
แนะนำว่าควรเก็บไข่ให้ได้ 10-15 ใบ เพื่อที่จะได้มีโอกาสสำเร็จในการตั้งครรภ์ 1 ครั้ง หลังจากเราเก็บไข่แล้วเราละลายมันออกมาใช้ โอกาสที่ไข่จะอยู่รอดมีประมาณ 90% และเมื่อไปปฏิสนธิกับอสุจิโอกาสก็จะประมาณ 70-80%
ข้อโดดเด่นของการฝากไข่ที่คลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์
เนื่องด้วยกระบวนการฝากไข่และแช่แข็งไข่เป็นกระบวนการที่ค่อนข้างซับซ้อน และมีความละเอียดอ่อนในทุกขั้นตอน โดยคลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์ เรามีความพร้อมของทีมแพทย์และสหสาขาวิชาชีพ รวมถึงความพร้อมของทีมห้องผ่าตัด (OR) ในกรณีที่เกิด complication ซึ่งบำรุงราษฎร์คำนึงถึงความปลอดภัยของผู้ป่วย (patient safety) เป็นสำคัญสูงสุด
ภาพแดนเนรมิตจาก
เพจบรรเจิดเริ่ดสะแมนแตน เป็นภาพจากแฟนเพจดังกล่าวได้ร่วมแบ่งปันมาให้ชม ขอบคุณเจ้าของภาพและเพจที่รวบรวม
ลูกใช้โซเชียลมีเดีย หรือเว็บหาเพื่อน หาคู่
ควรทำ
พ่อแม่ควรใช้โอกาสนี้คุยกับลูกและสอนให้ลูกมีภูมิต้านทางในการรับมือมากกว่าการสั่งห้าม
อธิบายให้ลูกฟังว่า ลูกไม่มีทางรู้ว่าคนที่ตนเองคุยในโลกโซเชียล เป็นใคร มาจากไหน มีนิสัยใจคออย่างไร แม้แต่ประวัติที่มีการระบุไว้ในเว็บไซต์ก็อาจจะไม่จริง ฉะนั้น อย่าเปิดเผยข้อมูลส่วนตัวมากเกินไป หรือเร็วเกินไป
ชวนลูกคุย เพื่อให้ลูกหัดประเมินผู้คนและสถานการณ์ โดยเฉพาะคนบนโซเชียลที่ไม่เคยรู้จักกันมาก่อน การพูดคุยแบบไหนถือว่าไม่เหมาะสม แค่ไหนควรยุติความสัมพันธ์ เป็นต้น
ย้ำกับลูกว่า หากมีการนัดหมายคนที่รู้จักกันทางอินเทอร์เน็ต ต้องบอกพ่อแม่ก่อน อาจชวนเพื่อนไปด้วย ต้องนัดกันในที่สาธารณะที่มั่นใจว่าปลอดภัย ไม่ออกนอกเส้นทาง รวมทั้งต้องระมัดระวังตัว และหาทางหนีทีไล่ไว้ล่วงหน้า
ชี้ให้ลูกเห็นว่า อินเทอร์เน็ตไม่ใช่พื้นที่ส่วนตัว เพราะข้อมูลต่างๆ เมื่อเผยแพร่แล้ว คนอื่นอาจบันทึก หรือเผยแพร่ต่อได้ ดังนั้น ต้องไม่โพสต์รูปภาพหรือข้อความส่วนตัว และต้องไม่ละเมิดคนอื่น
อย่าทำ
บังคับให้ลูกเป็นเพื่อนกับพ่อแม่ในโลกโซเชียล เพราะส่วนใหญ่ ถึงลูกจะรับเป็นเพื่อน แต่ลูกจะหนีไปใช้โซเชียลอื่น หรือสร้างบัญชีปลอมเพื่อหลบพ่อแม่
การโพสต์ข้อความแสดงความคิดเห็น โดยเฉพาะเชิงอบรม สั่งสอน หรือต่อว่า ในโซเชียล เป็นสิ่งที่ไม่ควรทำอย่างยิ่ง เพราะสำหรับวัยรุ่น โซเชียลฯ ถือเป็นพื้นที่ส่วนตัวของพวกเขา
สถานีชาร์จ EleX ใน ภาคใต้
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา Market village หัวหิน
ที่อยู่: 234/1 ถ.เพชรเกษม ต.หัวหิน อ.หัวหิน จ.ประจวบคีรีขันธ์ 77110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT บางสะพานน้อย
ที่อยู่: 323/1 หมู่ 3 ต.ช้างแรก อ.บางสะพานน้อย จ.ประจวบคีรีขันธ์ 77170
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT สวี 3
ที่อยู่: ต.ครน อ.สวี จ.ชุมพร 86130
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ไชยา 3
ที่อยู่: 213 หมู่ที่1 ต.เวียง อ.ไชยา จ.สุราษฎร์ธานี 84110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จ กฟผ. (EleX by EGAT) สาขา โรงไฟฟ้าจะนะ
ที่อยู่: 124/5 หมู่ 1ต.ป่าชิง อ.จะนะ จ.สงขลา 90130
เวลาทำการ : ทุกวัน 06.00 – 20.00 น. *ยกเว้นวันหยุดนักขัตฤกษ์
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT หาดใหญ่ 7
ที่อยู่: 491 ถนนราษฎร์อุทิศ ต.หาดใหญ่ อ.หาดใหญ่ จ.สงขลา 90110
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT พัทลุง 2
ที่อยู่: 173 หมู่ที่7 ต.ท่าแค อ.เมืองพัทลุง จ.พัทลุง 93000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT กระบี่ 2
ที่อยู่: 377 ถนนอุตรกิจ ต.ปากน้ำ อ.เมืองกระบี่ จ.กระบี่ 81000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
สถานีชาร์จในปั๊มพีที (EleX by EGAT @PT Max) สาขา PT ตรัง 2
ที่อยู่: 358/1 ถนนห้วยยอด ต.ทับเที่ยง อ.เมืองตรัง จ.ตรัง 92000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
โรงแรมทวินโลตัส
ที่อยู่: 6 ถ. พัฒนาการคูขวาง ต.ในเมือง อ.เมืองนครศรีธรรมราช จ.นครศรีธรรมราช 80000
เวลาทำการ : ทุกวัน 24 ชั่วโมง
บุฟเฟ่ต์ทุเรียน สวนสุภัทราแลนด์ ระยอง เริ่ม 1 เมษายน 2566 LINK
สวนสุภัทราแลนด์เปิดบุฟเฟ่ต์ทุเรียนประจำปี 2566 แล้วจ้า ตั้งแต่วันที่ 1 เมษายน 2566 เป็นต้นไป เปิดจำหน่ายบัตรชมสวน & บุฟเฟ่ต์ทุเรียน สวนเปิดบริการทุกวัน 8:00น. – 17:00 น. ติดต่อสอบถามเพิ่มเติม 081-5881519 038-892048 โปรแกรมเที่ยวชมสวน & บุฟเฟ่ต์ทุเรียนและผลไม้ - นั่งรถรางชมสวนผลไม้ บนพื้นที่ 800 ไร่ สัมผัสวิถีชีวิตชาวสวน พร้อมไกด์นำเที่ยว รับ Welcome drink: น้ำผลไม้ปั่น จากสวน
ยกระดับ รพ. สต. และศูนย์สาธารณสุขชุมชน Primary Care Unit (PCU)
ปัญหา
เนื่องจากการเข้าถึงการรักษาพยาบาลของประชาชนส่วนใหญ่กระจุกตัวอยู่ที่โรงพยาบาลใหญ่ เนื่องจากสถานบริการสาธารณสุขแบบปฐมภูมิขาดความพร้อม โดยเฉพาะด้านบุคลากร นอกจากนี้ประชาชนยังต้องมีภาระในการขอข้อมูลสุขภาพของตัวเองระหว่างโรงพยาบาล ในกรณีที่ต้องมีการส่งต่อผู้ป่วยไปรักษาต่อที่โรงพยาบาลอื่น และการเข้าถึงเตียงผู้ป่วยใน ที่ถึงเข้าได้ยาก เพราะเตียงมักจะเต็ม และต้องใช้เวลาในการส่งต่อผู้ป่วยไปโรงพยาบาลอื่นที่มีเตียงว่าง นอกจากนี้การเข้ารับรักษาในห้องฉุกเฉินมักมีกรณีที่ผู้ป่วยไม่ใช่ผู้ป่วยฉุกเฉินจริง ทำให้เป็นการลดศักยภาพในการรักษาผู้ป่วยฉุกเฉิน
ข้อเสนอ
ยกระดับบทบาทของสถานบริการสาธารณสุขแบบปฐมภูมิให้เน้น
(ก) การสร้างเสริมสุขภาพ
(ข) การติดตามโรคเรื้อรัง
(ค) การช่วยเหลือผู้ป่วยเร่งด่วน
(ง) การลดภาระในโรงพยาบาลใหญ่
เวียนแพทย์จากโรงพยาบาลอำเภอ มาปฏิบัติงานใน รพ.สต. ตามรอบที่กำหนดหรือติดตั้งระบบ Telemedicine ในกรณีที่แพทย์ไม่เพียงพอ
Rocka สุราชุมชนจากสระบุรี LINK
เหล้าดอกมะลิและเหล้าดอกกุหลาบของไทย จากแบรนด์ Rocka เหล้าวอดก้าที่ทำจากข้าวหอมมะลิ ชื่อนี้มาจากคำว่า Rice ที่หมายถึงข้าว บวกกับ Vodka ขวดที่เห็นเป็นรูปบ้านทำจากเซรามิกเพื่อให้เก็บรักษาคุณภาพของเหล้าให้ได้มากที่สุด ผลิตจากจังหวัดราชบุรีแบบแฮนด์เมดใบต่อใบ
โรงงานที่ผลิตเหล้าตัวนี้มีชื่อว่า "ภูเถา" แปลว่า "องุ่น" ในภาษาจีน ที่ชื่อนี้ก็เพราะเมื่อ 20 กว่าปีที่แล้ว โดยอ. สอนทำสุราที่ ม.เกษตร ที่เป็นผู้ริเริ่มส่งเสริมให้เกษตรกรปลูกพืชมูลค่าสูงแทนการปลูกข้าว ผลักดันการปลูกองุ่นเพื่อทำไวน์ในพื้นที่จ.สระบุรี แต่เกิดปัญหามากมายในขณะนั้น จนสุดท้ายก็ไม่เหลือใครปลูกองุ่นในพื้นที่เลย แต่ทางโรงก็ยังผลิตสุราประเภทอื่นๆ ต่อไป
ข้อมูลและภาพจากเพจประชาชนเบียร์
151 ลำกระโดงชุมชนแม่นยำ 1
152 ลำกระโดงชุมชนแม่นยำ 2
153 ลำกระโดงชุมชนแม่นยำ 3
154 ลำกระโดงชุมชมเขต 3
155 ลำกระโดงเชิงสะพานข้ามคลองบางแวก (ถนนกาญจนาภิเษก)
156 ลำกระโดงเชิงสะพานบางไผ่
157 ลำกระโดงเชื่อมคลองผาสุขใจกับ คลองหลังวัดม่วง
158 ลำกระโดงเชื่อมซอยอินทาปัจ 11-4 กับ ลำกระโดงปลายซอย 15
159 ลำกระโดงซอย สน.บางเสาธง
160 ลำกระโดงซอยเจริญนคร 18
161 ลำกระโดงซอยชุมชนสองร้อยห้อง
162 ลำกระโดงซอยปราโมทย์ 2
163 ลำกระโดงซอยพุทธโอสถ
164 ลำกระโดงซอยเพชรเกษม 28
165 ลำกระโดงซอยเพชรเกษม 40
166 ลำกระโดงซอยเพชรเกษม 44
167 ลำกระโดงซอยเพชรเกษม 52
168 ลำกระโดงซอยโลงเหล็ก
169 ลำกระโดงซอยศักดิ์เจริญ
170 ลำกระโดงซอยสมเด็จเจ้าพระยา 17
171 ลำกระโดงซอยอิสรภาพ 3
172 ลำกระโดงตรงข้าม ซ.เพชรเกษม 50
173 ลำกระโดงตรงข้าม ซ.เพชรเกษม 58
174 ลำกระโดงตรงข้ามคลองนายอี่ (ปากทางเข้าหมู่บ้านเอเวอร์กรีนซิตี้)
175 ลำกระโดงตรงข้ามซอย ร.ร.อยู่วิทยา
176 ลำกระโดงตรงข้ามศาลเจ้าใหญ่
177 ลำกระโดงตัดซอยแยกหน้าชุมชนแสงเพชร
178 ลำกระโดงตัดซอยอินทาปัจ 13 ถึง คลองบางแค ช่วงที่ 2
179 ลำกระโดงตัดซอยอินทาปัจ 13 ถึงคลองบางแค ช่วงที่ 3
180 ลำกระโดงตัดซอยอินทาปัจ 9-11 ช่วงที่ 1
181 ลำกระโดงนิศาชล
182 ลำกระโดงในซอยบุญมี
183 ลำกระโดงในซอยเพชรเกษม 62/3
184 ลำกระโดงในซอยยิ้มประยูร
185 ลำกระโดงในซอยอินทาปัจ 9-6-1
186 ลำกระโดงในเดอะมอลล์
187 ลำกระโดงในหมู่บ้านร่ำรวยนิเวศน์ 2
188 ลำกระโดงในหมู่บ้านสินทวีงามเจริญ
189 ลำกระโดงบางจาก 151
190 ลำกระโดงบางจาก 152
191 ลำกระโดงบางแวกหมู่ 1
192 ลำกระโดงปลาย ซ.เพชรเกษม 41
193 ลำกระโดงปลาย ซ.อัสสัมชัญ 7
194 ลำกระโดงปลายซอยเพชรเกษม 43
195 ลำกระโดงปลายซอยเพชรเกษม 47
196 ลำกระโดงปลายซอยเพชรเกษม 51
197 ลำกระโดงปลายซอยยิ้มประยูร
198 ลำกระโดงปลายซอยระหว่าง ซอยเพชรเกษม 94-96
199 ลำกระโดงปลายซอยสมชาย
200 ลำกระโดงปลายซอยสองคุณจ่า
201 ลำกระโดงปลายซอยแสงเพชรแยก 30
202 ลำกระโดงปลายซอยอินทาปัจ 15
203 ลำกระโดงปลายซอยอินทาปัจ 9
204 ลำกระโดงปลายในสองคุณจ่า
205 ลำกระโดงปากซอยยิ้มประยูร
206 ลำกระโดงปากทางเข้าหมูบ้านสุขสำราญ
207 ลำกระโดงเพชรเกษม 54 - 58
208 ลำกระโดงเพชรเกษม 58
209 ลำกระโดงแยก ค.บางจากล่าง(ซอย 24)
210 ลำกระโดงแยก ค.บางจากล่าง(ซอย 32)
211 ลำกระโดงแยก ค.บางจากล่าง(ซอย 38)
212 ลำกระโดงแยกคลองบางขี้เก้ง (หน้าหมู่บ้านเอเวอร์กรีนซิตี้)
213 ลำกระโดงแยกคลองบางไผ่
214 ลำกระโดงแยกคลองบางไผ่
215 ลำกระโดงแยกคลองบางไผ่ (ใกล้ ค.ยายเพิ่มช่วงปลาย)
216 ลำกระโดงแยกคลองบางแวก (ใกล้คลองยายเพิ่ม)
217 ลำกระโดงแยกคลองบางแวก (ใกล้คลองลัดครูเสงี่ยม)
218 ลำกระโดงแยกคลองบางแวก (ตรงข้ามวัดบุณยประดิษฐ์)
219 ลำกระโดงแยกคลองบางแวก (ม.เอเวอร์กรีนซิตี้)
220 ลำกระโดงแยกคลองบางอ้อ (ขวา)
221 ลำกระโดงแยกคลองบางอ้อ (ซ้าย)
222 ลำกระโดงแยกคลองบางอ้าย 1
223 ลำกระโดงแยกคลองหลังวัดราชสิทธฯ
224 ลำกระโดงแยกคลองอภิชาติ
225 ลำกระโดงแยกจาก ลำกระโดงปลาย ซอยเพชรเกษม 43
226 ลำกระโดงแยกจากลำกระโดงปลาย ซอยเพชรเกษม 41
227 ลำกระโดงแยกถนนสิรินธร
228 ลำกระโดงระหว่างซอยเพชรเกษม 43 กับ ซ.เพชรเกษม 41
229 ลำกระโดงระหว่างซอยอินทาปัจ 13 ,15
230 ลำกระโดงลัดวัดไชยฉิมพลี
231 ลำกระโดงเลียบซอยวงศาโรจน์
232 ลำกระโดงเลียบซอยแสงเพชรแยก 32
233 ลำกระโดงเลียบซอยอุดมปรีชา
234 ลำกระโดงศุภาลัย
235 ลำกระโดงสรรพกร ( ข้าง ม.สยาม )
236 ลำกระโดงสะพานดำ
237 ลำกระโดงสุดเขต
238 ลำกระโดงหน้า สน.ภาษีเจริญ
239 ลำกระโดงหน้าหมู่บ้านศุภาลัย
240 ลำกระโดงหมู่ 10 บางด้วน
241 ลำกระโดงหมู่ 8 บางด้วน
242 ลำกระโดงหลังตึกแถว (ถ.สุขาภิบาล 1)
243 ลำกระโดงหลังภัตตาคารแวร์ซายส์
244 ลำกระโดงหลังโรงงานก๋วยเตี๋ยว
245 ลำกระโดงหลังโรงเจ
246 ลำกระโดงหลังโรงเรียนวัดบุญยประดิษฐ์
247 ลำกระโดงหลังโรงเรียนวัดม่วง
248 ลำกระโดงหลังหมู่บ้านชัยมงคล
249 ลำกระโดงหลังหมู่บ้านเพชรมณฑล
250 ลำกระโดงหุตายน
251 ลำกระโดงอำนวยสุข
252 ลำบึงแยกลำไทร
253 ลำปลายคลองเกร็ด
254 ลำราง ซ.ลาดพร้าว 112
255 ลำรางกระเทียม
256 ลำรางกลางซอยสมพรเพชรทองคำ
257 ลำรางกีบหมู
258 ลำรางเกาะข่า
259 ลำรางเกาะขุนเณร
260 ลำรางโกดัง กันตารัตน์
261 ลำรางใกล้บ้านผู้ใหญ่ชู
262 ลำรางขวาง
263 ลำรางข้าง ร.ร.คันนายาว
264 ลำรางข้างชุมชนนภาพิไล
265 ลำรางข้างชุมสายโทรศัพท์
266 ลำรางข้างซอยจักรา
267 ลำรางข้างซอยชมชื่น
268 ลำรางข้างซอยทินกร
269 ลำรางข้างซอยมิตรวิถี
270 ลำรางข้างซอยรัฐธรรมนูญ
271 ลำรางข้างซอยหมู่บ้านปัญญา
272 ลำรางข้างถนนวงแหวน
273 ลำรางข้างถนอมมิตร - ปาร์ค
274 ลำรางข้างบริษัทไทยเทยิ่น
275 ลำรางข้างไปรษณีย์เจ้าคุณทหาร
276 ลำรางข้างโรงงานท่อ ซีซีเอ็ม
277 ลำรางข้างวัดไตรรัตนนาราม
278 ลำรางข้างวัดธรรมมงคล (ปุณณวิถี 20)
279 ลำรางข้างวัดลานบุญ
280 ลำรางข้างศาลเจ้าแปะกง
281 ลำรางข้างสวนพระนคร
282 ลำรางข้างหมู่บ้านเฉลิมสุขนิเวศน์ 9
283 ลำรางข้างหมู่บ้านชวนชื่น
284 ลำรางข้างหมู่บ้านชื่นกมล 4
285 ลำรางข้างหมู่บ้านไปรษณีย์นิเวศน์
286 ลำรางข้างหมู่บ้านสินธร
287 ลำรางข้างหมู่บ้านสุขนที ซ.ลาดปลาเค้า 62
288 ลำรางข้างหมู่บ้านสุขสันต์พัฒนา
289 ลำรางข้างหมู่บ้านอนันต์สุขสันต์ รุ่น 18
290 ลำรางข้างหมู่บ้านอ่อนนุชนิเวช
291 ลำรางข้างอู่รถเมล์ขาว
292 ลำรางคูคต
293 ลำรางแคลาย
294 ลำรางเฉลิมพระเกียรติ
295 ลำรางชวดด้วน
296 ลำรางชวดตาเชียง
297 ลำรางชุมชนมะกอกกลางสวน
298 ลำรางชุมชนไม้กั้น
299 ลำรางเชื่อมคลองกีบหมูกับลำรางคูคต
300 ลำรางเชื่อมคลองตาพุกกับคลองบัวเกราะ
301 ลำรางเชื่อมคลองบางชันกับคลองกีบหมู
302 ลำรางเชื่อมคลองบ้านม้า 1 - 2
303 ลำรางเชื่อมคลองพระราชดำริ 2 กับ คลองสี่ตะวันออก
304 ลำรางเชื่อมคลองลำกระโหลกกับ คลองผักกะเฉด
305 ลำรางเชื่อมคลองหกขุดแยกคลองคู้บอน
306 ลำรางเชื่อมต่อลำควายตายกับลำรางคูคต
307 ลำรางซอยถาวร
308 ลำรางซอยน้ำเต้า
309 ลำรางซอยรามคำแหง 43
310 ลำรางซอยรามคำแหง 52
311 ลำรางซอยรามคำแหง 7
312 ลำรางซอยรื่นรมย์
313 ลำรางซอยลาดปลาเค้า 60
314 ลำรางซอยวิเศษสุข
315 ลำรางซอยสยามชินวัตร
316 ลำรางซอยสุขุมวิท 58
317 ลำรางญี่ปุ่น
318 ลำรางต้นสะตือ
319 ลำรางตาจ๊อด
320 ลำรางตาชม
321 ลำรางตาบุญ
322 ลำรางตาป่วน
323 ลำรางตามั่ง
324 ลำรางตามุด
325 ลำรางตายิ้ม
326 ลำรางตาแย้ม
327 ลำรางตาแล
328 ลำรางตาโห้
329 ลำรางโต๊ะเจริญ
330 ลำรางโต๊ะสมัน
331 ลำรางทางกระบือ
332 ลำรางทางกระบือ
333 ลำรางทางกระบือ
334 ลำรางทางกระบือ ตอน 1
335 ลำรางท้ายซอยภู่สุวรรณ
336 ลำรางไทยเอราวัณ
337 ลำรางธารณะเยื้องซอยชุ่มแจ่ม
338 ลำรางนาซอง (ส่วนแยกจากคลองนาซอง)
339 ลำรางนายจาง
340 ลำรางนายชื้น
341 ลำรางนายแย้ม
342 ลำรางในซอยอ่อนนุช 30
343 ลำรางในหมู่บ้านปัญญา
344 ลำรางบวบขม
345 ลำรางบ่อหินแก้ว
346 ลำรางบางเตย ตอน 1
347 ลำรางบางเตย ตอน 3
348 ลำรางบางเตย ตอน 4
349 ลำรางบางนางชี
350 ลำรางบ้านจ่าเยี่ยม
ตัวอย่างการปักหมุด ในหมวดธุรกิจคลินิกเอกชน
ตัวอย่างคลินิกหมวด
ศูนย์สุขภาพ Wellness
• แสดงในลำดับแรกๆ ของหน้าหมวดหมู่
• รายการปักหมุดจะแสดงด้วยขนาดที่ใหญ่กว่าข้อมูลทั่วไป
• มีป้ายระบุ Recommend หรืออื่นๆ เพื่อบ่งชี้ให้ชัดเจนขึ้น
• แสดงข้อมูลมากกว่าข้อมูลทั่วไป เช่น ลิงค์ไปยังโซเชี่ยลมีเดีย เว็บไซต์ แผนที่ เป็นต้น
• แสดงที่หน้า Homepage ด้วย
Trip 3 : วันที่ 19 และ 20 สิงหาคม 66 (ไปเช้ากลับเย็น) ยลเสน่ห์ย่านเมืองเก่า@แปดริ้ว
Trip 3 : วันที่ 19 และ 20 สิงหาคม 66 (ไปเช้ากลับเย็น) โปรแกรม “รับลมฝน ยลเสน่ห์ย่านเมืองเก่า เสพงานศิลป์ ที่ แปดริ้ว” ราคา 1,499 บาท
Trip 2 : วันที่ 9 และ 10 กันยายน 66 (ไปเช้ากลับเย็น) ทริปอิ่มบุญ @นครปฐม
วันที่ 9 และ 10 กันยายน 66 (ไปเช้ากลับเย็น) โปรแกรม “ทริปอิ่มบุญ ปันรอยยิ้มให้น้อง @ นครปฐม ราคา 1,499 บาท
กำหนดการดังนี้
กราบสักการะ " พระช่วงโรจนฤทธิ์ " และองค์พระปฐมเจดีย์ เที่ยวชมพิพิชภัณฑ์วัดพระปฐมเจดีย์* ที่เก็บรวบรวมโบราณวัตถุต่างๆ รวมถึง หีบบรรจุศพย่าเหล สุนัขทรงเลี้ยงของรัชกาลที่ 6 สักการะพระพุทชรูปศิลา อายุกว่า 1,000 ปี สร้างขึ้นในสมัยทวารวดี
ร่วมกิจกรรม CSR " ปันรอยยิ้มให้น้อง" ณ โรงเรียนโสตศึกษา จังหวัดนครูปฐม
สิ่งของที่ทางโรงเรียนต้องการ อาทิ พัดลมติดผนัง อุปกรณ์ภารเกษตร ข้าวสาร ผงซักฟอก สบู่ ยาสีฟัน ไม้กวาดทางมะพร้าว ถังขยะ เป็นต้น
แวะเที่ยว " ตลาดน้ำดอนหวาย"
ตลาดก่าที่สร้างในสมัยัรัชกาลที่ 6 เป็นอาคารไม้ก่ริมแม่น้ำ มีพ่อค้าแม่ค้า นำสินค้าและอาหารมาจำหน่ายทั้งบนบกและพายเรือจำนวนมาก ล่องรือล่องเที่ยวชมทิวทัศน์สองฝั่งแม่น้ำนครชัยศรีเรือแม่น้ำท่าจีน
เดินทางไป "วัดไร่ขิง" พระอารามหลวง สันนิษฐานว่าสร้างขึ้นเมื่อ พ.ศ. 2394
โดยได้อัญชิญพระพุทธรูปจากวัดศาลาปูน จังหวัดพระนครศรีอยุธยา มาประดิษฐานเป็นพระประชานวัด ชาวบ้านเรียกว่า "หลวงพ่อวัดไร้ขิง"
ราคา 1,499 บาทต่อท่าน
ติดต่อ Call Center การรถไฟ 1690
จองตั๋วออนไลน์
สามารถติดต่อซื้อตั๋วโดยสารล่วงหน้าก่อนวันเดินทางได้ไม่เกิน 30 วัน ได้ที่สถานีรถไฟทุกแห่ง หรือ ผ่านระบบ D-Ticket หรือสอบถามข้อมูลเพิ่มเติมที่ศูนย์บริการลูกค้าสัมพันธ์ หมายเลขโทรศัพท์ 1690 ตลอด 24 ชั่วโมง หรือ
เฟซบุ๊กแฟนเพจ ทีมพีอาร์การรถไฟแห่งประเทศไทย
สำนักป้องกันและบรรเทาสาธารณภัย กรุงเทพมหานคร นำบุคลากร ศึกษาดูงาน การผลิตรถบัสโดยสารไฟฟ้า (EV) เพื่อป้องกันกรณีเกิดเหตุเพลิงไหม้ฉุกเฉิน LINK
วันที่ 24 เมษายน 2566 บริษัท เน็กซ์ พอยท์ จำกัด (มหาชน) ร่วมกับ สำนักป้องกันและบรรเทาสาธารณภัย กรุงเทพมหานคร นำโดยนายอนุวัฒน์ อ้นน่วม ผู้อำนวยการกองปฏิบัติการดับเพลิงและกู้ภัย 1 และนายนรวิชญ์ วงศ์ตั้ง ผู้อำนวยการกองปฏิบัติการดับเพลิงและกู้ภัย 2 และนายณัฐธวัช สุภจินต์ ผู้อำนวยการกองปฏิบัติการดับเพลิงและกู้ภัย 3 ได้นำบุคลากร
ศึกษาดูงานเกี่ยวกับการผลิตรถบัสโดยสารไฟฟ้า สถานีชาร์ตแบตเตอรี่ รวมถึงชิ้นส่วนประกอบ และระบบต่างๆ ของตัวรถบัสไฟฟ้า เพื่อสามารถนำไปใช้เป็นแนวทางและวิธีการดับเพลิงรถโดยสารไฟฟ้า และแบตเตอร์รี่ที่ถูกต้อง ณ บริษัท แอ๊บโซลูท แอสเซมบลี จำกัด เพื่อประโยชน์ในการป้องกัน กรณีเกิดเหตุเพลิงไหม้ฉุกเฉินขึ้นในอนาคต และเพื่อให้บุคลากรได้ศึกษาเรียนรู้เกี่ยวกับเทคโนโลยี ความปลอดภัยในด้านต่างๆ เนื่องจากรถโดยสารพลังงานไฟฟ้า (EV) เริ่มมีการนำมาใช้วิ่งรถ เป็นรถประจำทาง หรือรถ Shuttle bus รับ-ส่ง ในกรุงเทพมหานคร และหน่วยงานต่างๆ เป็นจำนวนมาก
ทางสำนักป้องกันและบรรเทาสาธารณภัย กรุงเทพมหานคร และทางบมจ. เน็กซ์ พอยท์ ซึ่งเป็นผู้จัดจำหน่ายได้เล็งเห็นถึงความปลอดภัยของประชาชน และผู้ใช้บริการเป็นอันดับแรก อีกทั้งยังคำนึงถึงความปลอดภัยของเจ้าหน้าที่ปฏิบัติงาน และบุคลากรอีกด้วย
ศูนย์24 บางเขน รับสมัคร 3 อัตรา LINK
ศูนย์บริการสาธารณสุข 24 บางเขน สำนักอนามัย รับสมัครบุคคลภายนอกช่วยปฏิบัติราชการ
รับสมัครตั้งแต่วันที่ 17-31 กรกฎาคม 2566
ทดสอบปฏิบัติคอมพิวเตอร์และสอบสัมภาษณ์ วันที่ 4 สิงหาคม 2566
3.ตำแหน่งพนักงานช่วยงานด้านสุขภาพ (ม.6) 1 อัตรา
รับสมัครตั้งแต่วันที่ 5-31 กรกฎาคม 2566
ทดสอบปฏิบัติคอมพิวเตอร์และสอบสัมภาษณ์ วันที่ 4 สิงหาคม 2566
คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 23 สี่พระยา
28 กุมภาพันธ์ 2566 ศูนย์บริการสาธารณสุข 23 สี่พระยา ดำเนินงานตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดโดยใช้ชุมชนเป็นศูนย์กลาง (Community Based Treatment and Care : CBTx) และการลดอันตรายจากการใช้ยาเสพติด (Harm Reduction) จัดกิจกรรม ประชุมคณะทำงานบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชน ครั้งที่1 ในวันที่ 28 กุมภาพันธ์ 2566 ณ ห้องประชุม ชั้น3 ศูนย์บริการสาธารณสุข23 สี่พระยา โดยการอำนวยการของแพทย์หญิงจิรวัฒน์ องค์พิพัฒนกุล ผู้อำนวยการศูนย์บริการสาธารณสุข23 สี่พระยา ประธานคณะทำงาน ร่วมกับคณะทำงานได้แก่ ศูนย์บริการสาธารณสุข23 สี่พระยา, สำนักงานเขตบางรัก, กศน.เขตบางรัก, สถานีตำรวจนครบาลบางรัก, มูลนิธิรักษ์ไทย, คลินิกก้าวใหม่พลัส และประธานชุมชนพระนคเรศ
13 มีนาคม 2566 ศูนย์บริการสาธารณสุข 23 สี่พระยา ดำเนินงานตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดในชุมชนโดยชุมชนเป็นศูนย์กลาง (Community-Based Treatment and care :CBTx) และการลดอันตรายจากการใช้ยาเสพติด (HARM Reduction) โดยจัดกิจกรรมที่ 2 ครั้งที่ 1 กิจกรรมเสริมสร้างและพัฒนากลไกการดูแลผู้ที่ใช้ยาเสพติดโดยชุมชนเป็นศูนย์กลาง เวทีประชาคม ชุมชนพระนคเรศ โดยมี แพทย์หญิงจิรวัฒน์ องค์พิพัฒนกุล ผู้อำนวยการศูนย์บริกาสาธารณสุข 23 สี่พระยา ประธานคณะทำงานเป็นผู้กล่าวเปิดกิจกรรม พร้อมผู้แทนจากหน่วยงานภาคีเครือข่าย
#ผู้แทนผู้อำนวยการเขตบางรัก (หัวหน้าฝ่ายพัฒนาชุมชน)
#ผู้กำกับสถานีตำรวจนครบาลบางรัก
#ผู้แทนจากสำนักงานป้องกันและบำบัดการติดยาเสพติด
#หัวหน้าพยาบาล ศูนย์บริการสาธารณสุข23สี่พระยา
#ผู้แทนจาก กศน.เขตบางรัก
#ประธานชุมชนพระนคเรศ อสส.และประชาชนในชุมชน
#ทีมงานคลินิกก้าวใหม่พลัส 23สี่พระยา
#ทีมอนามัยชุมชนศูนย์บริการสาธารณสุข 23สี่พระยา
#ทีมงานมูลนิธิรักษ์ไทย
เข้าร่วมกิจกรรม โดยมีการชี้แจงวัตถุประสงค์ การทำข้อตกลงร่วมกัน(MOU)ตลอดจนแลกเปลี่ยนความคิดเห็นและร่วมกันวางแผน เพื่อดูแลช่วยเหลือบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชน รวมทั้งการให้ความรู้ ประชาสัมพันธ์การเข้าถึงการบำบัดฟื้นฟูผู้เสพยาเสพติด
19 มีนาคม 2564 คลินิกก้าวใหม่ ศูนย์บริการสาธารณสุข 23 สี่พระยา โดยแพทย์หญิงสิริทัย จารุพูนผล ผู้อำนวยการศูนย์บริการสาธารณสุข 23 สี่พระยา จัดกิจกรรม เสริมสร้างความรู้ความเข้าใจในการดำเนินงาน การบำบัดยาเสพติด โดยใช้ชุมชนเป็นศูนย์กลาง (CBTx) โดยดำเนินงาน ร่วมกับภาคีเครือข่าย ประกอบด้วย สำนักงานเขตบางรัก สถานีตำรวจนครบาลบางรัก การศึกษานอกระบบและการศึกษาตามอัธยาศัย (กศน) หน่วยงาน NGO มูลนิธิรักษ์ไทย ประธานและคณะกรรมการมัสยิดฮารูณ อาสาสมัครสาธารณสุข ทั้งนี้มีวัตถุประสงค์เพื่อบูรณาการ การบำบัดฟื้นฟู ผู้ใช้ยาเสพติด ร่วมกันระหว่างชุมชน หน่วยงานภาครัฐในพื้นที่และภาคีเครือข่าย โดยการนำชุมชนเข้ามามีส่วนร่วม ณ ชุมชนมัสยิดฮารูณ เขตบางรัก กรุงเทพมหานคร
12 มิ.ย. 2566 คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 23 สี่พระยา จัดประชุมคณะทำงานบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชนครั้งที่ 2 (CBTx ครั้งที่ 2) ณ ห้องประชุมคลินิกก้าวใหม่พลัส นำโดย แพทย์หญิงจิรวัฒน์ องค์พิพัฒนกุล ผู้อำนวยการศูนย์บริการสาธารณสุข 23 สี่พระยา เป็นประธานในที่ประชุม ผู้เข้าร่วมประชุมประกอบด้วย เจ้าหน้าที่คลินิกก้าวใหม่พลัส พยาบาลอนามัยชุมชน ศูนย์บริการสาธารณสุข 23 สี่พระยา ผู้ช่วยสำนักงานเขตบางรัก หัวหน้าฝ่ายพัฒนาชุมชนและสวัสดิการสังคม ตัวแทนสถานีตำรวจนครบาลบางรัก มูลนิธิรักษ์ไทย ประธานชุมชนพระนคเรศ วัตถุประสงค์เพื่อชี้แจงผลการดำเนินงานที่ผ่านมา CBTx ครั้งที่1 และร่วมกันป้องกันแก้ไขปัญหาพร้อมทั้งวางแผนการช่วยเหลือแบบบูรณาการกับหน่วยงานที่เกี่ยวข้อง เพื่อลงชุมชนแก้ไขปัญหายาเสพติดครั้งที่ 2 ซึ่งคลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 23 สี่พระยา จะจัดกิจกรรมเวทีประชาคมครั้งที่ 2 ในวันที่ 29 มิ.ย. 2566 ณ ชุมชนพระนคเรศ เขตบางรัก
29 มิ.ย. 2566 คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 23 สี่พระยา ได้จัดเวทีประชาคม ครั้งที่ 2 ตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดโดยใช้ชุมชนเป็นศูนย์กลาง (Community-Bestd Treatment and care : CBTx) และการลดอันตรายจากการใช้ยาเสพติด (HARM Reduction) ร่วมกับ อนามัยชุมชน ศูนย์ฯ 23 สี่พระยา, สถานีตำรวจนครบาลบางรัก, สำนักงานป้องกันและบำบัดการติดยาเสพติด, ผู้แทนสำนักงานเขตบางรัก ฝ่ายพัฒนาชุมชน, ประธานชุมชนพระนคเรศ, อาสาสมัครสาธารณสุข และศูนย์ส่งเสริมการเรียนรู้ เขตบางรัก
ทั้งนี้ได้จัดกิจกรรมให้คำปรึกษาผู้ต้องการลด ละ เลิกสูบบุหรี่ และผู้ดื่มเครื่องดื่มแอลกอฮอล์ด้วย
14 ก.ค. 2566 เวลา 09.00-11.00 น. คลินิกก้าวใหม่พลัส ศูนย์บริการสาธารณสุข 23 สี่พระยา เข้าร่วมโครงการชุมชนยั่งยืน เพื่อแก้ไขปัญหายาเสพติดแบบครบวงจรตามยุทธศาสตร์ชาติ กับสถานีตำรวจนครบาลบางรัก ณ ชุมชนตรอกขุนนาวา
คอร์สทำขนม ที่ SWEETS COTTAGE ACADEMY LINK
SWEETS COTTAGE ACADEMY โรงเรียนสอนทำขนมที่สูตรอร่อยที่สุดในประเทศไทย ประสบการณ์การสอนยาวนาน สูตรกลับบ้านทำได้ มีคอร์สทำขนมให้เลือก เช่น
• French Croissant Class 1-Day 16,500
• French Croissant Class 3 -Day 39,000
• Commercial bread course 5,500
Savory commercial bread course set 3 5,500
• Tokyo milky toast bread 3,600
และอีกหลายสูตรมากๆ สอบถามโทร. 096-1941055
อาหาร 5 ประเภทโซเดียมแฝง โดยกรมอนามัย (ด้านล่าง)
กรมอนามัย ให้ข้อมูลว่า อาหาร 5 ประเภท ที่มีปริมาณโซเดียมแฝงอยู่นอกจากเกลือ ได้แก่
- เครื่องปรุงรส ทั้งที่มีรสเค็มและไม่มีรสเค็ม เช่น น้ำปลา ซีอิ๊วขาว กะปิ ซอสหอยนางรม น้ำปลาร้า ซุปก้อน ผงชูรส เครื่องปรุงรส เป็นต้น
- อาหารแปรรูป ทั้งอาหารสำเร็จรูป อาหารกึ่งสำเร็จรูป อาหารกระป๋องทุกชนิด อาหารหมักดอง อาหารเค็ม บะหมี่กึ่งสำเร็จรูป โจ๊กกึ่งสำเร็จรูป ขนมกรุบกรอบ เนื้อเค็ม ไข่เค็ม ปลาเค็ม ปลาร้า ผักผลไม้ดอง มักมีโซเดียมสูงจากเกลือ และโซเดียมแฝงจากวัตถุเจือปนอาหาร
- ขนมที่มีการเติมผงฟู เช่น เค้ก คุกกี้ แพนเค้ก ขนมปัง แป้งสำเร็จรูป เป็นต้น เนื่องจากผงฟูมีโซเดียมแฝงเป็นองค์ประกอบ
- เครื่องดื่มเกลือแร่และน้ำผลไม้ มักมีการเติมสารประกอบของโซเดียมลงไปด้วย สำหรับนักกีฬาหรือผู้ที่สูญเสียเหงื่อมาก ส่วนน้ำผลไม้บรรจุกล่อง ขวด หรือกระป๋อง ก็มักจะมีการเติมเกลือปรุงรสชาติ และโซเดียมแฝง จากวัตถุเจือปนอาหาร โดยเฉพาะสารกันบูด
- อาหารธรรมชาติทุกชนิด มีโซเดียมเป็นองค์ประกอบ โดยเนื้อสัตว์ นม ไข่ จะมีปริมาณโซเดียมสูงกว่าผักผลไม้ ธัญพืช และถั่วเมล็ดแห้ง ที่ยังไม่แปรรูป แต่อย่างไรก็ตาม อาหารธรรมชาติถือว่ามีปริมาณโซเดียมน้อยกว่าอาหารที่ผ่านกระบวนการปรุงแต่งทั้งหมด และมีสารอาหารที่ร่างกายต้องการได้รับอีกด้วย
กิจกรรมที่วัดไก่เตี้ยจัดเป็นประจำ
วัดไก่เตี้ย เป็นวัดราษฎร์ สังกัดคณะสงฆ์ฝ่ายมหานิกาย ตั้งอยู่ริมฝั่งตะวันตกของคลองบางกอกน้อย ในแขวงตลิ่งชัน เขตตลิ่งชัน กรุงเทพมหานคร ตามประวัติวัดของสำนักงานพุทธศาสนาแห่งชาติ ระบุว่า วัดไก่เตี้ยสร้างขึ้นราว พ.ศ. 2320 ในปลายสมัยกรุงธนบุรี สภาพพื้นที่วัดเกือบล้อมรอบไปด้วยคลอง วัดไก่เตี้ยมีส่วนเกี่ยวข้องกับการแห่พระบรมสารีริกธาตุหรือประเพณีชักพระ
วัดไก่เตี้ยได้รับการพัฒนาครั้งใหญ่เมื่อ พ.ศ.2511 โดยทางวัดมีการสร้างบูรณปฏิสังขรณ์อาคารเสนาสนะในวัดครั้งใหญ่และได้จัดแบบแปลนของวัดใหม่ให้พัฒนาดียิ่งขึ้น มีการรื้ออุโบสถหลังเดิมที่สร้างขึ้นในสมัยรัตนโกสินทร์ตอนต้น เนื่องจากเป็นไม้และผุพังลง โดยได้ก่อสร้างขึ้นใหม่เป็นคอนกรีต มีพิธียกช่อฟ้าเมื่อ พ.ศ.2512 โดยจอมพลถนอม กิตติขจร นายกรัฐมนตรีในขณะนั้น และผูกพัทธสีมาเมื่อวันที่ 1 มีนาคม 2514
กิจกรรมที่จัดเป็นประจำ
วัดไก่เตี้ย จัดพิธีเจริญพระพุทธมนต์ ถวายพระพรชัยมงคล พระบาทสมเด็จพระเจ้าอยู่หัวและพระบรมวงศานุวงศ์ทุกพระองค์ ทุกเย็นวันเสาร์ เวลา ๑๙.๐๐ - ๒๐.๓๐ น. ณ อุโบสถ วัดไก่เตี้ย เขตตลิ่งชัน กรุงเทพมหานคร
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล
เลขที่ 999 ถนนพุทธมณฑลสาย4 ตำบลศาลายา อำเภอพุทธมณฑล จังหวัดนครปฐม 73170
โทร.02-441-5245-6
เวลาทำการ
คลินิกในเวลาราชการ จันทร์ - พฤหัสบดี 08.30 -15.30 น. วันศุกร์ 08.30 -11.30 น.
คลินิกพิเศษนอกเวลาราชการ เปิดให้บริการทุกวันเวลา 17.00 - 20.00 น.
เสาร์-อาทิตย์เปิดให้บริการ 08.30 - 15.30 น.
คลินิกฉุกเฉินและสัตว์ป่วยวิกฤติ เปิดให้บริการทุกวันเวลา 08.30 – 20.00 น.
Facebook |
Website |
แผนที่
โรงพยาบาลเชียงใหม่ ราม วัคซีนไข้หวัดใหญ่ ชนิด High Dose flu vaccine
โรงพยาบาลเชียงใหม่ ราม ได้นำ #วัคซีนไข้หวัดใหญ่ ชนิด High Dose flu vaccine สูตรสำหรับ ผู้สูงอายุ วัย 65 ปีขึ้นไป มาให้บริการแล้วโดยวัคซีนดังกล่าวสามารถป้องกันการติดเชื้อไข้หวัดใหญ่ เพิ่มขึ้น 24.2 % และมีปริมาณแอนติเจนเพิ่มขึ้น 4 เท่า เมื่อเทียบกับการฉีดวัคซีนไข้หวัดใหญ่แบบปกติ วัคซีนป้องกันไข้หวัดใหญ่ ชนิด High Dose ราคาพิเศษ
1 เข็มราคา 2,400 บาท (ราคาปกติ 3,663 บาท)
2 เข็ม แพ็กคู่ ราคา 4,400 บาท (ราคาปกติ 7,326 บาท)
✅ ราคานี้รวมค่าแพทย์และค่าบริการโรงพยาบาลแล้ว
✅ ตั้งแต่วันที่ 1 เมษายน 2566 – 30 กันยายน 2566 นี้ เท่านั้น !!!
สามารถเข้ารับบริการได้ทุกเคาน์เตอร์พยาบาล สอบถามข้อมูลวัคซีนเพิ่มเติม ศูนย์วัคซีน โครงการเชียงใหม่ ราม เฮลท์เซ็นเตอร์ โทร. 053-920300 เวลา 08.00 - 16.00 น.
สำนักงานป้องกันควบคุมโรคที่ 11 นครศรีธรรมราช
โทร. 075-341151
POD_001
โครงการเพิ่มร้อยละของผู้ป่วยหลังผ่าตัดปลูกถ่ายไตรายใหม่
ที่มีความปวดจากการคั่งค้างของปัสสาวะขณะคาสายสวน
ปัสสาวะ ลดลงจากเดิม 1 ระดับ
คุณปุณณ์ชิสา ยมกวาง
(โรงพยาบาลจุฬาลงกรณ์)
POD_002
FTE Dashboard เ ค รื่ อ ง มื อ วิ เ ค ร า ะ ห์ อั ต ร า กำ ลั ง
ด้านภาระงาน
นางสาวธัญชนก มณีศรี
(โรงพยาบาลกรุงเทพภูเก็ต)
POD_003
โครงการรักษาลิ้นหัวใจเอออร์ติกตีบด้วยการเปลี่ยนลิ้นหัวใจ
เทียมโดยไม่ต้องผ่าตัด (TAVI) โรงพยาบาล
ธรรมศาสตร์เฉลิมพระเกียรติ
นายวินิตย์ หลงละเลิง
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POD_004
การพัฒนาระบบการจ่ายยาด่วนด้วยเครื่องจัดยากึ่งอัตโนมัติ
บนหอผู้ป่วยวิกฤตโรงพยาบาลธรรมศาตร์เฉลิมพระเกียรติ
นางสาวปัทมนันท์ รุ่งเรือง
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POD_005
บทบาทพยาบาลในการส่งเสริมคุณภาพชีวิตผู้ป่วยเด็กโรคหืด นางสาวนันทิกา ขอดเตชะ
นางสาวฐิตินันท์ ไมตรี
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POD_006
นับแล้ว นับอยู่ นับต่อไป แก้ไขทันที นายธนบูลย์ ชอบธรรม
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POD_007
MDD CARE ดี ไม่มี SUICIDE นางสาวฟัตมาวาตี หะยีมูซอ
(โรงพยาบาลรามัน)
POD_008
การพัฒนาแนวทางการป้องกันภาวะช็อคจากการตกเลือด
หลังคลอด
นางรุสนี สาแม็ง
(โรงพยาบาลรามัน)
POD_009
การพัฒนาระบบการเข้าถึงข้อมูลประวัติการรักษาคนไข้
Raman-PHR
นายนิอาบัส เจ๊ะโอ๊ะห์
(โรงพยาบาลรามัน)
POD_010
การพัฒนาระบบการส่งตรวจและการรายงานผล CD4 Viral
load ในผู้ป่วยคลินิกเอื้ออาทร โรงพยาบาลรามัน
จังหวัดยะลา
นางสาวมาเรีย ดือราปู
(โรงพยาบาลรามัน)
POD_011
ปรับระบบ ลดขั้นตอน ได้ผล Out lab รวดเร็ว นางรุสนี วาอายีตา
(โรงพยาบาลรามัน)
POD_012
พัฒนาระบบการดูแลผู้ป่วยความดันโลหิตสูงเพื่อลดการเกิด
stroke
นางรสนานี วานิ
(โรงพยาบาลรามัน)
POD_013
พัฒนาระบบบริการฟื้นฟูสมรรถภาพผู้ป่วยระยะกลาง (IMC)
โรงพยาบาลรามันอย่างครบวงจร
นางสาวนูรไอนี แวสะมะแอ
(โรงพยาบาลรามัน)
POD_014 ยูนิตทันตกรรมพร้อมใช้ ประชาชนได้รับบริการ นายมาลีกี เกษธิมา
(โรงพยาบาลรามัน)
POD_015
โครงการเภสัชกรรมทางไกล Telepharmacy ภญ.ภาวิณี ลิขิตวรกุล
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
POD_016
ความสำเร็จการปลูกถ่ายหัวใจผู้ป่วยที่มีภาวะหัวใจล้มเหลว
รายแรกของโรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ
นายวินิตย์ หลงละเลิง
(โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ)
โรงพยาบาลเกษมราษฎร์ สระบุรี
วัคซีนป้องกันไข้เลือดออก 4 สายพันธุ์
✅ฉีดได้ทั้งคนที่เคยเป็นและไม่เคยเป็น
✅ไม่ต้องตรวจภูมิ สามารถฉีดได้เลย
✅สามารถป้องกันเชื้อไข้เลือดออกได้ทั้ง 4 สายพันธุ์
✅ประสิทธิภาพการป้องกันการติดเชื้อ 80.2%
✅ลดการนอนโรงพยาบาล : 90.4%
✅ฉีดได้ตั้งแต่ อายุ 4 ปี - 60 ปี
ฉีด 2 เข็ม ห่างกัน 3 เดือน
ราคา 4,800 บาท
ราคานี้รวมค่าบริการโรงพยาบาล ค่าบริการพยาบาล และค่าแพทย์เเล้ว
1 กันยายน - 31 ธันวาคม 2566
สอบถามรายละเอียดโทร. 036-315555
แผนกกุมารเวช ต่อ 8316 , 8384
แผนกอายุรกรรม ต่อ 8355 , 8368
กลุ่มงานทันตกรรม รพ พหลพลพยุหเสนา ทำฟันฟรี 20 ตุลาคม 66
กลุ่มงานทันตกรรม รพ พหลพลพยุหเสนา ขอเชิญเข้าร่วมกิจกรรมวันทันตสาธารณสุขแห่งชาติเพื่อถวายเป็นพระราชกุศล แด่สมเด็จย่า โดยให้บริการ อุดฟัน ถอนฟัน ขูดหินปูน “โดยไม่เสียค่าใช้จ่าย” ในวันศุกร์ที่ 20 ตุลาคม 66 รับบัตรคิวตั้งแต่ เวลา 6.00น.-13.30น
คลินิกพัฒนาการเด็ก
คลินิกพัฒนาการเด็ก
- คลินิกพัฒนาการ ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกวัยรุ่น ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกการศึกษาพิเศษ ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกฝึกพูดเด็ก ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกกิจกรรมบำบัดเด็ก ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกทารกความเสี่ยงสูง ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกจิตวิทยาเด็กและวัยรุ่น ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกให้คำปรึกษาวัยรุ่น ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกให้ความรู้พัฒนาการเด็ก ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกParents care ในเวลาราชการ 08.00 น. - 16.00 น.
เส้นทางการปิดการจราจรเทศกาลพลุนานาชาติเมืองพัทยา 24-25 พ.ย. นี้
งานบุญวันออกพรรษา พิษณุโลก
วันออกพรรษา |วัดพระศรีรัตนมหาธาตุวรมหาวิหาร อำเภอเมืองพิษณุโลก จังหวัดพิษณุโลก
วันอาทิตย์ที่ ๒๙ ตุลาคม พ.ศ.๒๕๖๖ (วันออกพรรษา)
เวลา ๐๕.๓๐ น. พระภิกษุปวารณาออกพรรษา ณ พระอุโบสถ
เวลา ๐๗.๓๐ น. ทำบุญตักบาตร ณ ศาลาพิบูลธรรม
วันจันทร์ที่ ๓๐ ตุลาคม พ.ศ.๒๕๖๖ (วันตักบาตรเทโว)
เวลา๐๗.๐๐ น. ตักบาตรเทโวโรหณะ ทำบุญตักบาตร ณ ศาลาพิบูลธรรม
ข้อมูลคลินิกและโรงพยาบาลปี 2565
สรุปจำนวนคลินิกในไทยปี 2565 มีจำนวน 34,163 แห่ง โรงพยาบาล 411 แห่ง (ข้อมูล ณ 30 กันยายน 2565)
สุดว้าว!! ด้วยสิทธิพิเศษช้อปสนุกกับโปรโมชั่นดีลเด็ดในเทศกาลเฉลิมฉลองครบรอบ 5 ปี ลดจัดหนักแบบเอ็กซ์คูลซีฟทั่วห้างตลอดเดือนพฤศจิกายน สูงสุด 50% รับฟรีทันที! Love Rose Towel ผ้าขนหนูเส้นใยไผ่ธรรมชาติ พร้อมกระเป๋าซิปล็อก Rose Bag มูลค่า 450 บาท เมื่อช้อปครบ 5,000 บาทขึ้นไป (จำนวนจำกัด 1,000 สิทธิ์ตลอดรายการ) พลาดไม่ได้กับ 6 วันพิเศษวันที่ 25 – 30 พ.ย. 66 สำหรับสมาชิก สยาม ทาคาชิมายะ และบัตรเครดิต สยาม ทาคาชิมายะ ช้อปครบตามเงื่อนไขรับคูปองเงินสด และบัตรกำนัลสูงสุด 16%
ร่วมสัมผัสบรรยากาศแห่งความสุขในเทศกาลฉลองครบรอบ SIAM Takashimaya 5th Anniversary อิ่มเอมกับคาราวานขนมหวานสไตล์ดั้งเดิมของญี่ปุ่นสุดครีเอทจาก 7 เชฟดัง เพลิดเพลินช้อปสนุกกับโปรโมชั่นดีลเด็ดลดแรงสุดปัง เติมเต็มความรักญี่ปุ่นและรื่นรมย์ในเสน่ห์ของวัฒนธรรมสไตล์ญี่ปุ่นขนานแท้ ได้ที่ห้างสรรพสินค้าสยาม ทาคาชิมายะ ณ ไอคอนสยาม ถนนเจริญนคร สอบถามรายละเอียดเพิ่มเติม โทร. 02-011-7500 หรือ Facebook : Siam Takashimaya
Night at the Museum พิพิธภัณฑสถานแห่งชาติ พระนคร
กรมศิลปากร โดย พิพิธภัณฑสถานแห่งชาติ พระนคร เชิญชวนสัมผัสความงดงามของโบราณสถาน(วังหน้า) แต่งกายด้วยชุดไทยถ่ายภาพเป็นที่ระลึก ในงาน Night at the Museum ชมพิพิธภัณฑ์ยามค่ำคืน
ระหว่างวันที่ ๑๐ พฤศจิกายน ๒๕๖๖ – ๓๑ ธันวาคม ๒๕๖๖
ตั้งแต่เวลา ๑๖.๐๐ - ๒๐.๐๐ น. (ซื้อบัตรได้ถึง ๑๙.๐๐น.)
ทุกวันศุกร์ เสาร์ อาทิตย์ วันหยุดนักขัตฤกษ์ (ยกเว้นวันจันทร์ - อังคาร)
สอบถามเพิ่มเติม โทร. ๐๒ ๒๒๔ ๑๓๓๓, ๐๒ ๒๒๔ ๑๔๐๒
30 พ.ย. 66 คณะคนไทย 17 คน เดินทางกลับถึงไทย
30 พฤศจิกายน 2566 นายปานปรีย์ พหิทธานุกร รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการต่างประเทศ เรื่องการเดินทางไปอิสราเอล เพื่อไปเยี่ยมและรับพี่น้องคนไทยที่ถูกจับเป็นตัวประกันและได้รับการปล่อยตัว 3 ชุดแรก จำนวนรวม 17 คน กลับประเทศไทย
[คลิปการต้อนรับ]
สัปดาห์ที่ 47 (20-26 พฤศจิกายน 2566)
ต่างชาติ 632,936 คน
เฉลี่ยวันละ 90,420 คน
นักท่องเที่ยวต่างชาติสะสม 24,487,178 คน
5 ประเทศ แรก
มาเลเซีย 79,998 คน
จีน 78,031 คน
รัสเซีย 42,225 คน
อินเดีย 38,309 คน
เกาหลีใต้ 36,832 คน
*****
สัปดาห์ที่ 46 (13-19 พฤศจิกายน 2566)
ต่างชาติ 612,904 คน
เฉลี่ยวันละ 87,558 คน
นักท่องเที่ยวต่างชาติสะสม 23,854,242 คน
5 ประเทศ แรก
มาเลเซีย 83,900 คน
จีน 72,693 คน
รัสเซีย 41,408 คน
อินเดีย 38,466 คน
เกาหลีใต้ 34,397 คน
*****
สัปดาห์ที่ 45 (6-12 พฤศจิกายน 2566)
ต่างชาติ 611,121 คน
เฉลี่ยวันละ 87,303 คน
นักท่องเที่ยวต่างชาติสะสม 23,241,338 คน
5 ประเทศ แรก
มาเลเซีย 112,349 คน
จีน 68,690 คน
รัสเซีย 41,073 คน
เกาหลีใต้ 31,806 คน
อินเดีย 26,487 คน
*****
สัปดาห์ที่ 44 (30 ตุลาคม - 5 พฤศจิกายน 2566)
ต่างชาติ 557,554 คน
เฉลี่ยวันละ 79,651 คน
นักท่องเที่ยวต่างชาติสะสม 22,622,522 คน
5 ประเทศ แรก
มาเลเซีย 73,297 คน
จีน 67,443 คน
รัสเซีย 39,136 คน
อินเดีย 30,547 คน
เกาหลีใต้ 30,255 คน
*****
สัปดาห์ที่ 43 (23-29 ตุลาคม 2566)
ต่างชาติ 505,672 คน
เฉลี่ยวันละ 72,239 คน
นักท่องเที่ยวต่างชาติสะสม 22,064,968 คน
5 ประเทศ แรก
มาเลเซีย 75,079 คน
จีน 58,923 คน
อินเดีย 32,555 คน
รัสเซีย 27,870 คน
เกาหลีใต้ 27,305 คน
*****
ยุทธศาสตร์ที่ 1 : ด้านความมั่นคง
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 390,149.3 ล้านบาท คิดเป็นร้อยละ 11.2 ของวงเงินงบประมาณเพื่อให้ประเทศมีความมั่นคง ประชาชนมีความสุข สามารถรับมือกับภัยคุกคามและภัยพิบัติได้ทุกรูปแบบบนพื้นฐานของหลักธรรมาภิบาล จำแนกตามแผนงานสำคัญ ดังนี้
1) การป้องกัน ปราบปราม และบำบัดรักษาผู้ติดยาเสพติด งบประมาณ 4,357.4 ล้านบาท เพื่อให้ปัญหายาเสพติดได้รับการแก้ไข เด็ก เยาวชน ผู้ใช้แรงงาน และประชาชนทุกกลุ่มเป้าหมาย มีภูมิคุ้มกันรู้เท่าทันและปลอดภัยจากยาเสพติด มีสัดส่วนของผู้เกี่ยวข้องกับยาเสพติดไม่เกิน 9.5 คน ต่อประชากร 1,000 คน สร้างความร่วมมือกับต่างประเทศในการควบคุมและสกัดกั้นยาเสพติด จับกุมเครือข่ายยาเสพติดร้อยละ 50 อายัด ยึดทรัพย์ ดำเนินคดีผู้สมคบ สนับสนุน หรือให้การช่วยเหลือผู้เสพยาเสพติดเข้าสู่กระบวนการบำบัดรักษาปรับเปลี่ยนพฤติกรรม และมีคุณภาพชีวิตที่ดีขึ้น ร้อยละ 31.2
2) การส่งเสริมความสัมพันธ์ระหว่างประเทศ งบประมาณ 5,668.6 ล้านบาท เพื่อให้ประเทศไทยเป็นประเทศชั้นนำในภูมิภาคอาเซียน มีเกียรติภูมิ มีอำนาจต่อรองและได้รับการยอมรับในสากล เป็นผู้นำและเป็นหุ้นส่วนการพัฒนาที่ยั่งยืนและการเสริมสร้างพลังบวก สร้างอำนาจแบบนุ่มนวลของไทย ดำเนินการเพื่อสันติภาพตามกรอบสหประชาชาติ และกฎหมายระหว่างประเทศ ตลอดจนส่งเสริมการแก้ไขความขัดแย้งโดยใช้แนวทางสันติวิธี
3) การขับเคลื่อนการแก้ไขปัญหาจังหวัดชายแดนภาคใต้ งบประมาณ 6,658.4 ล้านบาท เพื่อให้ประชาชนในพื้นที่มีความปลอดภัยทั้งในชีวิตและทรัพย์สิน สามารถอยู่ร่วมกันอย่างสันติสุขในสังคมพหุวัฒนธรรม มีเป้าหมายเหตุรุนแรงลดลงร้อยละ 70 เมื่อเทียบกับปี 2560 โดยขับเคลื่อนการแก้ไขปัญหาและพัฒนาจังหวัดชายแดนภาคใต้แบบบูรณาการ อย่างเป็นระบบและมีเอกภาพ ครอบคลุมทุกพื้นที่และกลุ่มเป้าหมาย ยึดมั่นในหลักสันติวิธี มุ่งเน้นการขจัดปัญหาความขัดแย้งและความไม่เป็นธรรมอย่างจริงจังและถาวร และยกระดับคุณภาพชีวิตของประชาชน ตลอดจนพัฒนาคุณภาพการศึกษา โดยเฉพาะในสถานศึกษาของรัฐ เสริมสร้างความรักชาติ ศาสน์ กษัตริย์ ส่งเสริมศิลปวัฒนธรรม และขนบธรรมเนียมประเพณีท้องถิ่นในจังหวัดชายแดนภาคใต้ภายใต้สังคมพหุวัฒนธรรมที่เข้มแข็ง
4) การเสริมสร้างความมั่นคงของสถาบันหลักของชาติ งบประมาณ 12,695.1 ล้านบาท เพื่อพิทักษ์รักษาไว้ซึ่งสถาบันพระมหากษัตริย์ พร้อมธำรงรักษาไว้เป็นสถาบันหลักของชาติ สร้างความผูกพันที่ดีระหว่างสถาบันหลักและประชาชน สร้างจิตสำนึกรัก ความหวงแหน ความจงรักภักดี และทำให้สถาบันหลักเป็นที่เคารพยึดเหนี่ยวจิตใจของคนไทย ภายใต้การปกครองระบอบประชาธิปไตยอันมีพระมหากษัตริย์ทรงเป็นประมุข
5) การป้องกันและแก้ไขปัญหาที่มีผลกระทบต่อความมั่นคง งบประมาณ 19,758.8 ล้านบาท เพื่อรักษาความมั่นคงและความสงบเรียบร้อยในประเทศ ความมั่นคงชายแดน ชายฝั่งทะเล และรักษาผลประโยชน์ของชาติทางทะเล ป้องกันและแก้ไขปัญหาความมั่นคงทางไซเบอร์ การก่อการร้าย ป้องกันภัยคุกคามข้ามชาติ และเหตุฉุกเฉินทางนิวเคลียร์และรังสี ตลอดจนติดตามและเฝ้าระวังการทำการประมงให้เป็นไปตามกฎหมาย
6) การพัฒนาระบบการเตรียมพร้อมแห่งชาติและระบบบริหารจัดการภัยพิบัติ งบประมาณ 21,536.1 ล้านบาท เพื่อลดความสูญเสีย สร้างความปลอดภัยในชีวิตและทรัพย์สินของประชาชน โดยพัฒนาปรับปรุงนโยบายการบริหารจัดการให้ครอบคลุมรองรับภัยทุกประเภท เตรียมความพร้อมในการช่วยเหลือการป้องกันบรรเทาสาธารณภัยและภัยพิบัติให้รับมือได้อย่างทันท่วงที พัฒนาระบบเตือนภัยให้ครอบคลุมพื้นที่เสี่ยงภัยทั่วประเทศ รวมทั้งเสริมสร้างความร่วมมืออย่างบูรณาการจากทุกภาคส่วนทั้งภายในประเทศ และภายนอกประเทศ
7) การรักษาความสงบภายในประเทศ งบประมาณ 21,615.0 ล้านบาท เพื่อให้ประชาชนมีความมั่นคง ปลอดภัยในชีวิตและทรัพย์สิน โดยเสริมสร้างความสามัคคีปรองดองของคนในชาติ ส่งเสริมการอยู่ร่วมกันภายใต้สังคมพหุวัฒนธรรม สนับสนุนการใช้เทคโนโลยีและการบังคับใช้กฎหมายเพื่อแก้ไขปัญหาอาชญากรรม ปัญหาการจราจร และปัญหาความรุนแรงในสังคม
8) การพัฒนาศักยภาพการป้องกันประเทศและความพร้อมเผชิญภัยคุกคามทุกมิติ งบประมาณ 57,162.1 ล้านบาท เพื่อให้หน่วยงานด้านการข่าว และประชาคมข่าวกรอง ทำงานอย่างมีประสิทธิภาพ พร้อมเผชิญภัยคุกคาม ทุกรูปแบบ ทุกมิติ และทุกระดับความรุนแรง พัฒนากิจการอุตสาหกรรมป้องกันประเทศที่อาจนำไปสู่การสร้างเศรษฐกิจใหม่ภายในประเทศ และให้ความสำคัญกับความมั่นคงทางอวกาศ พัฒนาระบบงานข่าวกรองแบบบูรณาการ และประชาคมข่าวกรองในประเทศให้ทันสมัย
9) การดำเนินงานภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 36,625.7 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 204,072.1 ล้านบาท เพื่อให้การดำเนินภารกิจด้านความมั่นคง มีประสิทธิภาพและเกิดความคุ้มค่า มีความพร้อมด้านการป้องกันประเทศ การดำรงไว้ซึ่งความสัมพันธ์อันดีและความร่วมมือในการดำเนินงานด้านความมั่นคงระหว่างประเทศไทยกับมิตรประเทศ
ประเทศโปแลนด์
1. Faculty of Medicine, Wroclaw Medical University, Poland
หลักสูตร 6 ปี ปริญญา Doctor of
Medicine (M.D) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศโปแลนด์ และรับรองโรงพยาบาล
หลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในประเทศโปแลนด์ ดังนี้
1. University Hospital Borowska No. 1
2. University Hospital Curie – Sklodowskiej No. 2
ว/ด/ป ที่ รับรอง 11 เม.ย. 62
ว/ด/ป ครบอายุ การรับรอง 10 เม.ย. 67
2. Faculty of Medicine, Poznan University of Medical Sciences (PUMS), Poznan, Poland
หลักสูตร 6 ปี ปริญญา Doctor of Medicine (M.D.) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศ
โปแลนด์ และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุไว้ในหลักสูตรและอยู่ใน
ประเทศโปแลนด์ ดังนี้
โรงพยาบาลหลัก 4 แห่ง คือ
1. Hellodor Swiecicki’s Gynecological & Obstetrics Clinical Hospital
2. University’s Clinical Hospital
3. Karol Jonscher’s Clinical Hospital
4. Wiktor Dega’s Orthopedic & Rehabilitation Clinical Hospital
โรงพยาบาลสมทบ ได้แก่ University Center for Dentistry and Specialised Medicine
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง8 มิ.ย.66
ว/ด/ป ครบอายุ การรับรอง 7 มิ.ย. 71
3. Faculty of Medicine, Medical University of Lublin, Lublin, Poland
หลักสูตร 6 ปี ปริญญา
Doctor of Medicine (M.D.) และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุ
ไว้ในหลักสูตรและอยู่ในประเทศโปแลนด์ ดังนี้
1. Public Clinical Hospital No.1
2. Public Clinical Hospital No.4
3. Pediatric Clinical Hospital
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 14 ก.ย. 66
ว/ด/ป ครบอายุ การรับรอง 13 ก.ย. 71
4. Faculty of Medicine, Medical University of Bialystok, Poland
หลักสูตร 6 ปีปริญญา Doctor
of Medicine (M.D.) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศโปแลนด์ และรับรองโรงพยาบาล
หลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุในหลักสูตรและอยู่ในประเทศโปแลนด์ จ านวน 2 แห่ง
ดังนี้
1. Medical University of Bialystok Teaching Hospital
2. Medical University of Bialystok Children’s Teaching Hospital
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง14 ธ.ค. 66
ว/ด/ป ครบอายุ การรับรอง 13 ธ.ค. 71
หมวด 7 การอุทธรณ์ / หมวด 8 การคุ้มครองบุคคลซึ่งอาจได้รับอันตรายจากการบริโภคกัญชา กัญชง หรือสารสกัดและการป้องกันการใช้กัญชา กัญชง หรือสารสกัดในทางที่ผิด
โครงการบัตรประชาชนใบเดียวรักษาทุกที่ ตามหลักจริงๆ ก็ดีต่อประชาชน โรงพยาบาลชุมชนเองก็ต้องปรับตัว - นพ.ปวิตร วณิชชานนท์
นพ.ปวิตร วณิชชานนท์ ผอ.รพ.ละงู ประธานชมรมผู้อำนวยการโรงพยาบาลชุมชน กล่าวถึงโครงการนี้ว่า
"โครงการบัตรประชาชนใบเดียวรักษาทุกที่ ตามหลักจริงๆ ก็ดีต่อประชาชน เพราะประชาชนจะได้เข้ารับการรักษาที่ไหนก็ได้โดยไม่ต้องมีสิ่งกีดขวางหรือว่าสิ่งกีดกั้นทางด้านของสิทธิต่างๆ แต่ขณะเดียวกันทางหน่วยงานราชการรวมถึงโรงพยาบาลชุมชนต้องปรับตัวว่าเราจะทํายังไงให้ประชาชนสามารถที่จะไปรับบริการที่ไหนก็ได้หรือเราเพิ่มพัฒนาบริการเพื่อให้มารักษาบริการที่เรา แล้วเราจะมีระบบเบิกจ่ายหรือมีอะไรต่างๆ ที่จะต้องควบคุมติดตามกันยังไง เพราะฉะนั้นก็คงต้องอยู่ในช่วงปรับตัว ถ้าถามว่าดีต่อโรงพยาบาลชุมชนหรือไม่ ผมว่าดีในแง่ของการที่ประชาชนเข้าถึงบริการได้อย่างมีคุณภาพ โรงพยาบาลชุมชนเองก็ต้องปรับตัวเพื่อพัฒนาให้เป็นตัวเลือกของประชาชนต่อไป" [
hfocus]
สนามเดินเล่นแบบถอดประกอบได้
สนามเดินเล่นแบบถอดประกอบได้ การออกแบบพื้นที่และสิ่งปลูกสร้างสำหรับปีนป่ายหรือเดินเล่นจากวัสดุที่สามารถถอดประกอบและปรับขนาดได้ตามพื้นที่ โดยกลุ่ม A49 & Friends เพื่อให้กรุงเทพมหานครสามารถนำไปทดลองใช้งานในพื้นที่อื่น ๆ ที่ต้องการสิ่งปลูกสร้างที่ยืดหยุ่นตามขนาดพื้นที่ และสามารถนำกลับมาใช้ใหม่ได้
Best Hospitals 2024 Thailand 30 อันดับ รพ.ที่ดีที่สุดของไทย
ข้อมูลจาก Newsweek
30 อันดับโรงพยาบาลที่ดีที่สุดในประเทศไทย ประจำปี 2024 ปีนี้ มีข้อมูลน่าสนใจ
- บำรุงราษฏร์ ยังคงเป็นอันดับหนึ่ง ต่ออีกปี คะแนนรวมยังคงสูงในระดับเดิมที่ 93% (ติดอันดับ 130 ใน 250 อันดับแรกของโลก)
- รพ.สมิติเวช สุขุมวิท พุ่งขึ้นมาอยู่อันดับ 3 ได้อย่างน่าทึ่ง ด้วยคะแนนรวมที่สูงขึ้นอย่างมีนัยยะ ที่ 84.15% (จาก 76.25% ปีก่อน) เช่นเดียวกับ รพ.จุฬาลงกรณ์ ในอันดับ 4 ที่มีคะแนน 83.92% (จาก 74.41% ปีก่อน) และ รพ.รามาธิบดี 83.72% (จาก 75.33% ปีก่อน)
- รพ.ไทย มีเพียง 5 อันดับ เท่านั้นมีคะแนนเกิน 80%
- รพ.กรุงเทพ หล่นจากอันดับ 3 ในปีก่อน มาสู่อันดับ 7 ในปีนี้ ด้วยคะแนนต่ำกว่า 80% เป็นครั้งแรก (75.32%)
- รพ.เมดพาร์ค เป็นอีกหนึ่ง รพ.เอกชน ที่ขยับอันดับขึ้นมาได้อย่างน่าประทับใจ ที่คะแนน 76.54% จากปีก่อน 73.99%
- รพ.ที่หลุดจาก 30 อันดับ คือ รพ.พิษณุเวช โดยมีรพ.เพิ่มเข้ามาแทน คือ รพ.ศิครินทร์ กรุงเทพ
- ใน 30 อันดับ มีรพ.เอกชน 18 แห่ง รพ.รัฐและรพ.มหาวิทยาลัย 12 แห่ง
- เป็นโรงพยาบาลในกรุงเทพ 23 แห่ง ต่างจังหวัด 6 แห่ง ใน จ.เชียงใหม่ สงขลา (3) สมุทรปราการ พิษณุโลก
สปสช.เขต 11 สุราษฏร์ธานี
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 11 สุราษฏร์ธานี
- 91/1 หมู่ 1 อาคารพี.ซี.ทาวเวอร์ ชั้น 10 ถนนกาญจนวิถี ตำบลบางกุ้ง อำเภอเมืองฯ จังหวัดสุราษฎร์ธานี 84000
- โทรศัพท์ 077 - 274811 - 3
- โทรสาร 077 - 274818
- แผนที่ google map
- website
- facebook
2. ศูนย์ชีวาภิบาลในชุมชน
2.1 องค์ประกอบ
1) เป็นหน่วยงานในโรงพยาบาล มีการกำหนดผู้รับผิดชอบเป็นหัวหน้าศูนย์ชีวาภิบาล มีพยาบาล ผู้ประสานงาน ที่ชัดเจน
2) มีทีมบุคลากรสหวิชาชีพที่มีศักยภาพ ด้านการดูแลประคับประคอง (Palliative Care) ด้านการดูแล ผู้สูงอายุ (Elderly Care) การดูแลระยะยาว (Long-Term Care) และบริการปฐมภูมิโดยเป็นแม่ข่าย การดูแลที่บ้านและชุมชน
3) มีระบบบริการ และระบบให้คำปรึกษาแก่เครือข่าย รวมถึงระบบจัดการยา/เวชภัณฑ์/คลังอุปกรณ์ เพื่อสนับสนุนการดูแลที่บ้านหรือชุมชน
2.2 บทบาทหน้าที่
หัวหน้าศูนย์ชีวาภิบาล
1) กำกับดูแลให้เกิดการบูรณาการการดูแลผู้ป่วยระบบริการดูแลผู้สูงอายุ (Elderly Care) การดูแลระยะยาว (Long-Term Care) การดูแลประคับประคอง/ระยะท้าย (Palliative Care) และระบบบริการปฐมภูมิ (Primary Health Care) ตั้งแต่ การดูแลในโรงพยาบาลจนถึงบ้าน/ชุมชน อย่างมีคุณภาพ
2) จัดระบบบริการดูแลที่บ้าน/ชุมชน/สถานชีวาภิบาล และระบบให้คำปรึกษา แก่เครือข่ายปฐมภูมิ
พยาบาล ผู้ประสานงาน ศูนย์ชีวาภิบาล
1) ประสานการดูแลให้เกิดการบูรณาการในระดับโรงพยาบาล ถึง ระดับชุมชน ประสานงานกับ รพศ./รพท. และ เครือข่ายปฐมภูมิในชุมชน
2) จัดการฐานข้อมูลผู้ป่วยในเครือข่ายบริการ
ทีมปฐมภูมิ
1) รับส่งต่อผู้ป่วย LTC และ PC จาก รพศ./รพท. เพื่อเข้ารับบริการแบบผู้ป่วยใน หรือ เพื่อรับบริการที่บ้านหรือชุมชนหรือสถานชีวาภิบาล
2) ให้การวินิจฉัยผู้ป่วยที่เข้าเกณฑ์PC และ/หรือ LTC ในชุมชน (กรณีพบผู้ป่วย เข้าเกณฑ์ในโรงพยาบาล หรือ คัดกรองพบผู้ป่วยในชุมชน)
3) ทำการประเมิน และ/หรือยืนยัน จัดทำแผนการดูแลล่วงหน้า (Advance care planning) หรือ Care Plan
4) ให้การดูแลตามมาตรฐาน (physical, psychosocial, spiritual care) และ พิจารณาเพื่อส่งกลับไปดูแลที่บ้าน หรือ สถานชีวาภิบาลในชุมชน
5) จัดบริการคลินิกหมอครอบครัว
6) ร่วมกับทีมปฐมภูมิในพื้นที่ เยี่ยมดูแลที่บ้าน (LTC & PC Home care) บริการ PC Home ward หรือที่สถานชีวาภิบาล หรือส่งต่อการดูแลไปยังเครือข่ายตามบริบทของพื้นที่
7) เป็นแม่ข่ายการดูแลที่บ้าน และชุมชน แก่ทีมปฐมภูมิในพื้นที่
8) ฝึกอบรมบุคลากรในเครือข่าย
[28/6/2023] โรงพยาบาลบางกรวย เปิดรับสมัครผู้ร่วมทีม กลุ่มงานบริหารทั่วไป ตำแหน่งนักวิชาการเงินและบัญชี 1 อัตรา
คลินิกทันตกรรม รพ.บางกรวย ในเวลาราชการ
คลินิกทันตกรรม รพ.บางกรวย ในเวลาราชการ
รับคนไข้ทั่วไป ตรวจฟัน อุุดฟัน ถอนฟัน ขูดหินน้ำลาย และคนไข้นัดเฉพาะทาง
ช่วงเช้า : หยิบบัตรคิว 32 คน (ปิดรับคิว 11:00 น.)
ช่วงบ่าย : หยิบบัตรคิว 4 คน (ปิดรับคิว 14:00 น.)
– หากต้องการอุดฟันหรือขูดหินปูนจะได้รับการนัดหมายเพื่อทำการรักษาครั้งต่อไป
คลินิกทันตกรรม รพ.บางกรวย นอกเวลาราชการ
เปิดให้บริการวัน จันทร์ – ศุกร์ (เว้นวันหยุดนักขัตฤกษ์) โดยให้บริการ ดังนี้
คนไข้นัดเฉพาะทาง
คนไข้นัดทั่วไป อุดฟัน ขูดหินน้ำลาย ถอนฟัน
คนไข้ทั่วไป 3 คน (โดยรับบัตรคิวที่ห้องทันตกรรม เปิดให้รับบัตรคิว 15:30 น.)
* สิทธิ์เบิกได้ เบิกจ่ายตรง อปท. กทม. รัฐวิสาหกิจ เบิกจ่ายได้ตามระเบียบ
* สิทธิ์บัตรทองต้องชำระเงินเอง
* สิทธิ์ประกันสังคม 900 บาทต่อปี
** (ค่าบริการนอกเวลาราชการ 60 บาท เบิกไม่ได้)
โทร. 0-2447-1999 ต่อ 2000 2020
UMSC โรงพยาบาลบางนากรุงเทพมหานคร
UMSC โรงพยาบาลบางนากรุงเทพมหานคร แอนดไลน์ ไอดี @bbh_umsc หรือสแกน QR Code ได้ (สอบถามโทร 080-0510599).
เขต 11
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านคลองพน ตำบลคลองพน อำเภอคลองท่อม จังหวัดกระบี่
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี บ้านหาดยาย อำเภอหลังสวน จังหวัดชุมพร
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านหัวคลองแหลม ตำบลแหลม อำเภอหัวไทร จังหวัดนครศรีธรรมราช
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บางม่วง ตำบลบางม่วง อำเภอตะกั่วป่า จังหวัดพังงา
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลฉลอง อำเภอเมือง จังหวัดภูเก็ต
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี กำพวน จังหวัดระนอง
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี บ้านควนยูง จ.สุราษฎร์ธานี
คลินิคพิเศษเฉพาะทางสวนหลอดเลือดหัวใจนอกเวลา น.พ. สริราม วิณณ์เศวต
คลินิคพิเศษเฉพาะทางสวนหลอดเลือดหัวใจนอกเวลา โดย น.พ. สริราม วิณณ์เศวต แพทย์ผู้เชี่ยวชาญเฉพาะทางด้านโรคหัวใจและหลอดเลือดหัวใจ
ตรวจรักษา
● ตรวจสวนหลอดเลือดเลี้ยงหัวใจ (CAG)
● ตรวจสวนหัวใจและขยายหลอดเลือดเลี้ยงหัวใจด้วยบอลลูนร่วมกับการใส่ขดขวด (CAG+PCI)
ให้รับบริการ วันจันทร์ วันพุธ วันพฤหัสบดี
สอบถามข้อมูลเพิ่มเติมและนัดหมาย
โทร : 074-273100 ต่อ 2401 , 089-657-7268
หน่วยจิตเวช (เด็ก) คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกจิตเวช (เด็ก)
**รับเฉพาะผู้ป่วยนัด**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันเสาร์ที่ 2 และ 4 ของเดือน เวลา 08.00-12.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396430 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ให้บริการตรวจรักษาผู้ป่วยนอกและให้คำปรึกษาแก่ผู้ที่มีปัญหาด้านสุขภาพจิต ปัญหาทางด้าน พฤติกรรม อารมณ์ และสังคม สำหรับเด็กและวัยรุ่นอายุ 5-17 ปี และเด็กมีปัญหาด้านพัฒนาการที่มีพฤติกรรมรุนแรงอายุตํ่ากว่า 5 ปี
จ.ลำปาง ตารางออกหน่วย รับบริจาคโลหิต ประจำเดือนมิถุนายน 2567
รศ. ดร.ชัชชาติ สิทธิพันธุ์, รศ. ดร.ปรีชญา สิทธิพันธุ์, รศ. นพ.ฉันชาย สิทธิพันธุ์,
ตัวอย่างการสื่อสาร ที่อุตสาหกรรมใช้เพื่อโน้มน้าวทัศนคติ
ต่อไปนี้คือข้อความบางส่วนที่อุตสาหกรรมเหล่านี้ลองใช้ เพื่อโน้มน้าวความคิดเห็นของประชาชนและข้อเท็จจริงที่ท้าทายพวกเขา
“We’re sustainable” - "เราคือความยั่งยืน"
บริษัทยาสูบขนาดใหญ่หลายแห่งวางตำแหน่งตนเองเป็นผู้นำ ESG (สิ่งแวดล้อม สังคม และธรรมาภิบาล) [36] พวกเขามีส่วนร่วมในการประเมิน ESG เพื่อให้คะแนนเชิงบวกและอยู่ในระดับสูง [37] อุตสาหกรรมยังพยายามที่จะฟอกขาวด้านชื่อเสียง โดยการเผยแพร่ความพยายามด้านสิ่งแวดล้อมที่ง่ายๆ เช่น การปลูกต้นไม้ หรือการเก็บกวาดก้นบุหรี่ เป็นต้น โดยอาศัยว่าเป็นโปรแกรมที่อาจสร้างความสนใจเชิงบวก แต่มีผลกระทบไม่มาก
ในความเป็นจริง:
- ยาสูบทำลายล้างโลกในทุกขั้นของห่วงโซ่
- ไส้กรองบุหรี่เกือบทั้งหมดมีสารพิษ พลาสติกแบบใช้ครั้งเดียว และเป็นแหล่งมลพิษจากพลาสติก และ
- ยาสูบและผลิตภัณฑ์อิเล็กทรอนิกส์ของอุตสาหกรรมที่เกี่ยวข้อง ก่อให้เกิดสารพิษเพิ่มมากขึ้น จากพลาสติก โลหะ และขยะแบตเตอรี่
“We’re reducing the harm caused by cigarettes” - "เราช่วยลดอันตรายที่เกิดจากบุหรี่"
ยาสูบและบริษัทที่เกี่ยวข้องส่งเสริมแนวคิดเรื่อง “ลดอันตราย” (harm reduction - ลดอันตรายจากการใช้ยาเสพติด) เพื่อพยายามโน้มน้าวผู้บริโภค ถึงความปลอดภัยของบุหรี่ไฟฟ้าที่เสพติดและเป็นอันตราย ยาสูบที่ใช้ความร้อน ผลิตภัณฑ์และถุงนิโคติน นัยยะที่แฝงอยู่ในโฆษณาผลิตภัณฑ์ ทำนองว่า "ช่วยลดความเสี่ยง" สะท้อนภาพอุตสาหกรรมยาสูบในอดีต ที่มักกล่าวอ้างให้เข้าใจผิด เกี่ยวกับการลดอันตรายจากยาสูบ ได้ ด้วยการใช้ผ่านตัวกรองบุหรี่ และ บุหรี่ชนิดที่มี "น้ำมันดินต่ำ" (low-tar cigarettes)
ในความเป็นจริง:
- ในขณะที่ยังไม่มีหลักฐานเพียงพอว่า ผลิตภัณฑ์ใหม่เหล่านี้ มีประสิทธิภาพในการช่วยให้เลิกบุหรี่ได้ดีกว่า แต่หลักฐานที่เพิ่มขึ้น กลับแสดงชัดว่า ผลิตภัณฑ์ มีความเสี่ยงในตัวเอง และสุดท้าย ก็ทำให้ผู้ใช้ส่วนใหญ่ไม่สามารถเลิกได้ แต่ใช้ทั้งสองแบบไปเลย
- อุตสาหกรรมยาสูบเอง ก็ไม่ได้มุ่งมั่นจริงจังเที่ยุติการขายบุหรี่กับคนหนุ่มสาวแต่อย่างใด ตรงกันข้าม กลับเดินหน้าส่งเสริมเต็มที่
“We help society through our charity work and donations” - "เราช่วยสังคม ผ่านองค์กรสาธารณกุศลและการบริจาค"
อุตสาหกรรมยาสูบ เข้ามามีส่วนร่วมในกิจกรรม “องค์กรที่มีความรับผิดชอบสังคม” ที่มักจะเกี่ยวข้องกับการบรรเทาสาธารณภัย สิ่งแวดล้อม การศึกษา การพัฒนา และอื่นๆ อีกมากมาย ทั้งนี้ก็เพื่อต้องการแสดงให้เห็นว่าตัวเองเป็นอุตสาหกรรมที่มีความรับผิดชอบ ยิ่งเป็นกิจกรรมที่เกี่ยวข้องหรือรับรอง กับทางราชการ ครอบคลุมถึง การมีสื่อมวลชน ยิ่งทำให้อุตสาหกรรม เข้าถึงกลุ่มผู้บริโภคในวงกว้างได้มากยิ่งขึ้น โดยเฉพาะกลุ่มหนุ่มสาว
ในความเป็นจริง:
- การใช้ยาสูบทำให้โลกต้องเสียค่าใช้จ่ายโดยประมาณ ความเสียหายทางเศรษฐกิจ 1.4 ล้านล้านเหรียญสหรัฐทุกปี [38] ทำให้มีผู้เสียชีวิตมากกว่า 8 ล้านคนต่อปี ส่งผลเสียต่อ สิ่งแวดล้อมและความยากจนยืดเยื้อ ซึ่งมากเกินกว่ายอดบริจาคการกุศลอันน้อยนิดที่ได้มา มากมายนัก
++ กิจกรรม BKK Food Bank ++
ศูนย์สนับสนุนบริการสุขภาพที่ 11 สุราษฎร์ธานี
ศูนย์สนับสนุนบริการสุขภาพที่ 11 (Regional Health Service Support Center 11) มีพื้นที่รับผิดชอบ จำนวน 7 จังหวัด ได้แก่ ชุมพร นครศรีธรรมราช สุราษฎร์ธานี กระบี่ พังงา ภูเก็ต ระนอง
- หมู่ที่ 3 ตำบลวัดประดู่ อำเภอเมือง จังหวัดสุราษฎร์ธานี 84000
- โทร 0-7720-0149
- email : saraban-hss11@hss.mail.go.th
- Google map
- Facebook
- Website
ศ.ดร.ชูกิจ สรุปว่า จากทั้ง 10 เทคโนโลยีที่น่าจับตามองในปี 2567 ครึ่งหนึ่งเป็น digital technology และมี AI ร่วมอยู่ด้วย แสดงให้เห็นถึงการมาถึงของยุค AI ได้เป็นอย่างดี ขณะที่มีอยู่ 3 เทคโนโลยีที่เกี่ยวข้องกับสุขภาพ กับอีก 2 เทคโนโลยีเกี่ยวข้องกับด้านพลังงาน และอีก 1 เทคโนโลยีเกี่ยวข้องกับด้านการประมง คาดหวังว่าข้อมูลทั้งหมดนี้จะเป็นประโยชน์ ทั้งในแง่ของข้อมูลเทรนด์โลกที่ควรให้ความสนใจ และในแง่ข้อมูลการตลาดเบื้องต้น เพื่อเปิดโอกาสภาคธุรกิจที่สนใจ ได้มีโอกาสเข้าไปลงทุนในธุรกิจเทคโนโลยีใหม่ๆ อย่างเหมาะสมต่อไป
จำนวนนักท่องเที่ยวสะสม 1 มกราคม - 31 มีนาคม 2567
จำนวนนักท่องเที่ยวสะสม 1 มกราคม - 31 มีนาคม 2567
พบว่ามีจำนวนนักท่องเที่ยวสะสม 9,370,297 คน สร้างรายได้จากการใช้จ่ายของนักท่องเที่ยวต่างชาติแล้วประมาณ 454,653 ล้านบาท โดยจำนวนนักท่องเที่ยว 5 อันดับแรก ได้แก่ จีน (1,756,337 คน) มาเลเซีย (1,168,574 คน) , รัสเซีย (622,813 คน) เกาหลีใต้ (558,873 คน) และอินเดีย (472,952 คน)
ข้อมูล ณ วันที่ 1 เมษายน 2567
หมายเหตุ :
1. ข้อมูลจำนวนนักท่องเที่ยวเป็นข้อมูลเบื้องต้นจากสำนักงานตรวจคนเข้าเมือง ซึ่งยังไม่นับรวมนักท่องเที่ยวที่เดินทางเข้าประเทศไทยโดยใช้บัตรผ่านแดน (Border Pass)
2.รายได้ประมาณการจากโครงสร้างค่าใช้จ่ายของนักท่องเที่ยวในอดีต
11.SUSTAINABLE CITIES AND COMMUNITIES เมืองและชุมชนที่ยั่งยืน
พวกเราอาศัยอยู่ในเมืองมากกว่าครึ่งหนึ่ง ภายในปี 2050 ประชากร 2 ใน 3 ของโลก หรือ 6,500 ล้านคน จะอาศัยอยู่ในเมือง การพัฒนาอย่างยั่งยืนไม่สามารถบรรลุผลได้หากปราศจากการเปลี่ยนแปลงวิธีการสร้างและจัดการพื้นที่ในเมืองอย่างมีนัยสำคัญ
การเติบโตอย่างรวดเร็วของเมือง อันเป็นผลจากจำนวนประชากรที่เพิ่มขึ้นและการอพยพที่เพิ่มมากขึ้น ส่งผลให้มหานครเติบโตอย่างรวดเร็ว โดยเฉพาะอย่างยิ่งในโลกกำลังพัฒนา และสลัมกลายมาเป็นลักษณะสำคัญยิ่งขึ้นของชีวิตในเมือง
การทำให้เมืองยั่งยืนหมายถึงการสร้างอาชีพและโอกาสทางธุรกิจ ที่อยู่อาศัยที่ปลอดภัยและราคาไม่แพง และการสร้างสังคมและเศรษฐกิจที่มีความยืดหยุ่น ซึ่งเกี่ยวข้องกับการลงทุนในระบบขนส่งสาธารณะ การสร้างพื้นที่สาธารณะสีเขียว และการปรับปรุงการวางแผนและการจัดการเมืองในรูปแบบที่มีส่วนร่วมและครอบคลุม
จัดใบหน้าให้อยู่ในกรอบที่กำหนด
สารคดีซีรีส์เกี่ยวกับการกีฬาและนักกีฬา บน Netflix
เรารวมเอาเรื่องที่เกี่ยวกับการกีฬาไว้ด้วย เพราะยังไงเสีย การกีฬาก็คือส่วนหนึ่งที่สำคัญต่อด้านการแพทย์อย่างไม่อาจปฏิเสธ
สารคดีซีรีส์เกี่ยวกับการกีฬาและนักกีฬา
- Tour De France Unchained (series 2 seasons) 2024 เกี่ยวการขับเคี่ยวในการแข่งขันตูร์ เดอ ฟร้อง รายการแข่งขันจักรยานสุดโหดอันดับหนึ่งของโลก
- Sprint (2024) โลกของการเป็นนักวิ่งลมกรด กว่าจะไปสู่เส้นชัยและเป็นที่หนึ่ง ที่เร็วที่สุดของโลก ต้องผ่านพบฝึกฝนและต้องอดทนอย่างไรบ้าง
- Reciever (2024) เจาะลึกเกาะติดไปกับชีวิต เพย์ตัน แมนนิ่ง บนเส้นทาง NFL ฤดูกาล 2023-2024
- Simone Biles Rising (2024) เส้นทางชีวิตของนักยิมนาสติกหญิงเหรียญทองโอลิมปิก ซิโมน ไบลส์ ความสำเร็จของเธอนั้นยิ่งใหญ่และน่าภาคภูมิสำหรับชาวอเมริกัน
- LaLiga All Access (2024) รู้จักลาลีก้า สเปน ลีกที่สร้างทีมฟุตบอลที่ยิ่งใหญ่ ทีมชาติที่ประสบความสำเร็จสูงสุด และนักฟุตบอลที่เก่งกาจมากมาย ในยุคปัจจุบัน
- Break Point (2024) เรื่องราวเกี่ยวกับเทนนิส บนคอร์ดหญ้า
- NeyMar
- Captain of The World (2023) เรื่องของกัปตันทีมชาติทีมฟุตบอลที่ลงแข่งในฟุตบอลโลก 2022 บทบาทผู้นำของยอดนักเตะ อย่าง เมสซี่ โรนัลโด้ เอ็มบัปเป้ เคน เนย์มา
- Together Tr3ble Winners (2024) เส้นทางการคว้าสามแชมป์ของสโมสร แมนเชสเตอร์ ซิตี้ ภายใต้การคุมทีมของยอดโค้ชอัจฉริยะ เป๊ป กวาดิโอลาร์ ความสำเร็จอลังการที่ยากจะหาทีมใดเทียบบนเกาะอังกฤษและยุโรป
- Under Pressure The U.S. Women’s World Cup Team (2023) ทีมฟุตบอลหญิงสหรัฐเป็นทีมที่ประสบความสำเร็จมากที่สุดทีมหนึ่งของโลก มีนักเตะหญิงที่ได้รับการยกย่องว่าเป็นระดับโลกหลายคน และในฟุตบอลโลก 2023 พวกเธอนำความสำเร็จมาสู่ชาวอเมริกันได้หรือไม่
- The Last Dance (2020)
- Beckham (2023) ใครๆ ก็รู้จัก เดวิด เบ็คแฮม
หนังเกี่ยวกับการกีฬาและนักกีฬา
- Sist3rs on Track (2021) เรื่องของสามสาวพี่น้องที่ฝันจะเข้าแข่งโอลิมปิก ความท้าทายของวัยรุ่น มีอุปสรรคขวางกั้นเสมอ
- The Final Attack on Wembley ฟุตบอลนั้นยิ่งใหญ่สำหรับอังกฤษ ทำไมวันหนึ่งในเดือนกรกฎาคม 2021 ถึงเป็นวันที่น่าตื่นตะลึงทั้งแง่บวกและลบสำหรับแฟนบอลอังกฤษทั้งมวล
- Mark Cavendish (2023) หนังสารคดีเรื่องราวของ มาร์ก คาเวนิดช ยอดนักปั่นชาวอังกฤษที่ประสบความสำเร็จ ได้รับพระราชทานยศเป็น ท่านเซอร์
- Ronaldo (2015) เรื่องราวของยอดซุปเปอร์สตาร์แห่งโลกฟุตบอล คริสเตียนโน่ โรนัลโด้ ที่ใครบนโลกนี้ไม่รู้จักเขา คงไม่มี
- Untold Caitlyn Jenner (2021) เรื่องราวของนักวิ่งโอลิมปิก คัทลิน เจนเนอร์ ที่กว่าจะสู่ความสำเร็จ ไม่ง่าย
คำถาม : คุณเคย/สนใจใช้บริการหัตถการเสริมความงามด้านใดดังต่อไปนี้ ภายในระยะเวลา 3 ปีที่ผ่านมา?
คำถาม : คุณเคย/สนใจใช้บริการหัตถการเสริมความงามด้านใดดังต่อไปนี้ ภายในระยะเวลา 3 ปีที่ผ่านมา?
44% ของผู้บริโภคเคยใช้บริการหัตถการเสริมความงาม ส่วนใหญ่ใช้บริการเพื่อการรักษาและบำรุงผิว และอีก 24% เป็นผู้ที่สนใจใช้บริการโดยเฉพาะกลุ่มผู้ชายและ Gen Z ซึ่งจะทำให้ฐานผู้ใช้บริการขยายเพิ่มขึ้นได้ในระยะข้างหน้า
11.Future of mobility - อนาคตของการเคลื่อนที่
เทคโนโลยีการเคลื่อนที่ครอบคลุมถึงยานยนต์ไร้คนขับและยานยนต์ไฟฟ้า การคมนาคมทางอากาศในเมือง การขับขี่อัตโนมัติ การเชื่อมต่อ การใช้ไฟฟ้า และการเคลื่อนที่ร่วมกัน (ACES) โดยมีเป้าหมายเพื่อปรับปรุงประสิทธิภาพและความยั่งยืนของการขนส่งทางบกและทางอากาศ
นอกจากนี้ โรงพยาบาลบำรุงราษฎร์ยังเป็นแหล่งฝึกอบรมเภสัชกรเฉพาะทางด้านเภสัชพันธุศาสตร์และการแพทย์แม่นยำ รวมถึงเป็นสถาบันร่วมในการเสริมสร้างและสนับสนุนบุคลากรทางการแพทย์เฉพาะทางที่มีความเชี่ยวชาญในด้านเวชพันธุศาสตร์ที่หลากหลาย เช่น แพทย์ นักเทคนิคการแพทย์ และผู้ให้คำปรึกษาด้านพันธุกรรม (Genetic Counselor) ไม่เพียงเท่านั้น ศูนย์เวชศาสตร์จีโนมของโรงพยาบาลบำรุงราษฎร์ ยังมีการศึกษาวิจัยทางเภสัชพันธุศาสตร์เพื่อสร้างองค์ความรู้ใหม่ เพื่อพัฒนาระบบการให้บริการด้านเภสัชพันธุศาสตร์อย่างต่อเนื่อง และยังสามารถต่อยอดไปใช้ในการแพทย์เชิงป้องกันในผู้มารับบริการที่มีสุขภาพดี เพื่อให้ผู้มารับบริการมีข้อมูลพันธุกรรมที่เกี่ยวข้องกับการตอบสนองต่อยาติดไว้กับตัว และสามารถเชื่อมโยงกับระบบบริการสุขภาพแบบองค์รวมได้ นอกจากนี้ยังดำเนินการขยายการเข้าถึงการตรวจโดยระบบ Home Healthcare และร้านยาใกล้บ้าน ให้ได้รับการรักษาด้วยยาที่มีความปลอดภัยสูงสุดและเพิ่มคุณภาพชีวิตที่ดีให้กับคนไทย
2. ปัญหาความต้องการ/ความคาดหวังที่ไม่สอดคล้องกัน (The Mismatch Problem)
การเปลี่ยนแปลงบทบาททางเพศ อาทิ การเข้ามามีบทบาทในตลาดแรงงานที่มากขึ้นของเพศหญิง และการศึกษา ที่สูงขึ้นของเพศหญิง ทำให้การมองหาคู่ของคนโสดเปลี่ยนไปจากอดีต โดยคนโสดบางส่วนมีมาตรฐานในการเลือกคู่สูงขึ้น ทำให้มีโอกาสเจอคนโสดที่มีคุณสมบัติตรงตามความต้องการได้ยาก จึงต้องเป็นโสดต่อไป
จากการสำรวจความต้องการของคนโสดของบริษัทมีทแอนด์ลันช์ สาขาประเทศไทย (2021) พบว่า มีผู้หญิงไทยกว่าร้อยละ 76.0 จะไม่เดทกับผู้ชายที่มีรายได้น้อยกว่า และร้อยละ 83.0 ไม่ยอมคบผู้ชายที่มีส่วนสูงน้อยกว่า
ขณะเดียวกัน ผู้ชายกว่า ร้อยละ 59.0 ไม่เปิดใจคบกับผู้หญิงตัวสูงกว่า และอีกกว่าร้อยละ 60.0 จะไม่ออกเดทกับผู้หญิงที่เคยหย่าร้าง
นอกจากนี้ ปัญหาความคาดหวังทางสังคมที่มีต่อผู้หญิงยังทำให้ผู้หญิงบางส่วนเลือกจะครองตัวเป็นโสดมากขึ้น โดย Hwang (2016) ระบุว่า ประเทศในทวีปเอเชียส่วนใหญ่มีรากฐานวัฒนธรรมของความคาดหวังต่อผู้หญิงสูง โดยเฉพาะภายหลังการแต่งงานที่ผู้หญิงควรต้องมีบทบาททั้งในบ้านและนอกบ้าน กล่าวคือ ผู้หญิงต้องเป็นแม่บ้าน ที่มีหน้าที่เลี้ยงลูกและทำงานบ้าน และควรต้องเป็นหนึ่งในแรงงานหลักที่ต้องหาเงินเข้าบ้านและเลี้ยงครอบครัว
จากสถานการณ์ข้างต้น แม้ว่าแนวโน้มครัวเรือน Sandwich จะลดลง แต่คนที่เป็น Sandwich Generation ยังมีภาระที่ต้องแบกรับ ดังนี้
1. ความเปราะบางทางการเงิน สะท้อนได้จากรายได้สุทธิต่อเดือน (รายได้หักค่าใช้จ่าย) ปี 2566 ที่พบว่า ครึ่งหนึ่งหรือร้อยละ 49.1 ของครัวเรือน Sandwich มีรายได้สุทธิคงเหลือน้อยกว่าร้อยละ 10 ซึ่งส่วนหนึ่งเกิดจากอัตราการพึ่งพิงที่ค่อนข้างสูง รวมทั้งแรงงานในครัวเรือนที่มีทักษะต่ำ เป็นแรงงานนอกระบบ อีกทั้งยังต้องดูแลวัยสูงอายุที่มีอายุยืนยาวขึ้น ทำให้มีภาระค่าใช้จ่ายโดยเฉพาะอย่างยิ่งค่ารักษาพยาบาลที่สูงขึ้นอีกด้วย จากข้อจำกัดดังกล่าวทำให้ครัวเรือน Sandwich ส่วนใหญ่หรือร้อยละ 69.8 มีภาระหนี้สิน โดยภาระหนี้สินต่อรายได้ต่อเดือนของครัวเรือนมีสัดส่วนร้อยละ 16.6 สูงกว่าภาพรวมครัวเรือนทั้งประเทศที่อยู่ที่ร้อยละ 13.8 ชี้ให้เห็นถึงความไม่มั่นคงทางการเงิน ซึ่งจะส่งผลกระทบต่อความสามารถทางการเงินในระยะยาว รวมถึงการสะสมทรัพยากรและความมั่งคั่ง อาจไม่สามารถทำได้อย่างที่ควรจะเป็น เมื่อเทียบกับกลุ่มคนที่ไม่มีภาระการดูแล
2. ผลกระทบต่อสุขภาพ กอบกาญจน์ ชุณหสวัสดิกุล (2567)40 ระบุว่า กลุ่มคน Sandwich Generation นอกจากจะมีปัญหาความเครียดและสุขภาพจิตแล้ว ยังต้องเสี่ยงต่อการเป็นโรคเรื้อรัง อาทิ ความดันโลหิตสูง เบาหวาน โรคอ้วนลงพุง โรคตับแข็ง และโรค NCDs ต่าง ๆ ด้วย ซึ่งเมื่อพิจารณาเปรียบเทียบการเป็นโรค NCDs จากข้อมูลการสำรวจอนามัยและสวัสดิการของสำนักงานสถิติแห่งชาติ ในปี 2566 พบว่า คน Sandwich มีสัดส่วนการเป็นหรือเคยเป็นโรค NCDs (อาทิ โรคเบาหวาน ไทรอยด์ ความดันโลหิตสูง โรคหัวใจ โรคไขมันในเส้นเลือด/ คอเลสเตอรอลสูง และโรคมะเร็ง) ถึงร้อยละ 33.9 สูงกว่าค่าเฉลี่ยของหัวหน้าครัวเรือนทั้งประเทศที่อยู่ที่ร้อยละ 23.0
ขณะที่การศึกษาของต่างประเทศ ซึ่งศึกษาผลกระทบต่อพฤติกรรมทางสุขภาพ การประเมินสุขภาพของตนเอง และความพึงพอใจในชีวิตของผู้หญิงชาวรัสเซียที่ดูแลครัวเรือน Sandwich พบว่า ร้อยละ 7.0 มีโอกาสพบแพทย์ตามนัดน้อยลง รวมถึงมีโอกาสที่จะเป็นภาวะอ้วน ร้อยละ 6.2 ซึ่งสาเหตุเกิดจากการขาดเวลาในการดูแลตนเอง อาทิ ออกกำลังกาย ทำอาหาร เข้าพบแพทย์ตามนัด
นอกจากนี้ ยังมีปัญหาสุขภาพจิต จากการที่ คน Sandwich Generation ต้องมีภาระการดูแลสมาชิกคนอื่น โดยข้อมูลของสำนักงานสถิติแห่งชาติ สหราชอาณาจักร ซึ่งเก็บข้อมูลระหว่างปี 2016 – 2017 พบว่า 1 ใน 4 ของคน Sandwich Generation ประสบปัญหาสุขภาพจิต รวมถึงความวิตกกังวล ภาวะซึมเศร้า และการมีความรู้สึกพอใจกับชีวิตน้อยลงมากกว่าคนทั่วไป (ร้อยละ 22.0) อีกทั้ง ปัญหาสุขภาพจิตจะรุนแรงขึ้นตามระยะเวลาที่ต้องดูแลสมาชิกคนอื่น
ซึ่งกรณีของไทย จากข้อมูลการสำรวจอนามัย และสวัสดิการของสำนักงานสถิติแห่งชาติ ในปี 2566 พบปัญหาในลักษณะนี้เช่นกัน โดยวัยแรงงานในครัวเรือน Sandwich มีภาวะเครียด/นอนไม่หลับ ร้อยละ 0.8 เมื่อเทียบกับวัยแรงงานทั้งประเทศที่มีสัดส่วนเพียงร้อยละ 0.6
ทั้งนี้ สาเหตุที่ทำให้คน Sandwich Generation มีปัญหาดังกล่าว ส่วนหนึ่งเกิดจากการต้องจัดสรรเวลาในการทำงาน และดูแลสมาชิกในครัวเรือนไปพร้อมกัน โดยการศึกษาในสหรัฐอเมริกา คน Sandwich Generation โดยเฉลี่ยจะใช้เวลาในการดูแลเด็กและผู้สูงอายุประมาณ 28 และ 22 ชั่วโมงต่อสัปดาห์ ตามลำดับ สำหรับกรณีของไทย หากใช้เวลาในการดูแลเด็กและผู้สูงอายุเท่ากัน เมื่อรวมกับชั่วโมงการทำงานของคน Sandwich Generation ที่ใช้เวลาประมาณ 42.7 ชั่วโมงต่อสัปดาห์ ดังนั้น คน Sandwich Generation จะต้องใช้เวลาเฉลี่ยกว่า 13 ชั่วโมงต่อวัน ในการทำงาน รวมถึงดูแลเด็กและผู้สูงอายุ ซึ่งอาจเป็นสาเหตุหนึ่งที่ส่งผลให้คนกลุ่มนี้เกิดความเครียด และเสี่ยงต่อการเป็นโรคเรื้อรัง และ NCDs ได้
ศูนย์บริการสาธารณสุข 21(วัดธาตุทอง) 2-13 กันยายน 2567
เขตวัฒนาประชาสัมพันธ์เชิญชวนทุกท่านนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า(ฟรี) โดยทางฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 21 (วัดธาตุทอง) กำหนดการออกหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง(สุนัขและแมว) ประจำปี 2567 ระหว่างวันที่ 2-13 กันยายน 2567 เวลา 10.00-12.00 น.ตามกำหนดการ
ขั้นตอนการบริจาคผ่านแอปหมอพร้อม
ขั้นตอนการบริจาคผ่านแอปหมอพร้อม ทำได้ไม่ยากเลย ตามภาพประกอบ
1.เข้าแอปหมอพร้อม ถ้าเป็นเวอร์ชั่นเก่า หรือใครที่โหลดมาไว้นานแล้ว ก็อัพเดตด้วยนะ
สำนักงานสาธารณสุขอำเภอ
สำนักงานสาธารณสุขอำเภอ
พิธีเปิดตัวคลินิกตาสดใส เมื่อ 15 มีนาคม 2565
References
[1] https://www.jacc.org/doi/10.1016/j.jacc.2022.04.042
[2] https://www.ncbi.nlm.nih.gov/books/NBK562154/
[3] https://hbr.org/2022/05/the-telehealth-era-is-just-beginning
[4] Philips Pregnancy+ user survey, 2022
[5] Philips Pregnancy+ parents survey conducted by InSights Consulting, November 2022
[6] https://noharm-global.org/documents/health-care-climate-footprint-report
[7] https://www.forbes.com/councils/forbesfinancecouncil/2024/06/14/powering-the-ai-revolution-balancing-innovation-and-sustainability/
[8] https://www.nature.com/articles/s43588-024-00712-6
[9] https://noharm-global.org/documents/health-care-climate-footprint-report
[10] https://www.mordorintelligence.com/industry-reports/global-refurbished-medical-devices-market-industry ชมภาพงานย่าโมปี 2567 ที่ผ่านมา
From the End of the World
From the End of the World #JFF2025
2 ชั่วโมง 15 นาที R:13+
©2023 KIRIYA PICTURES JAPANESE (EN & TH Subs) ฮานะเป็นนักเรียนมัธยมปลายธรรมดาคนหนึ่งที่รู้สึกไม่พอใจกับชีวิตประจำวันของเธอ วันหนึ่งเธอฝันและได้พบกับเด็กหญิงอายุ 10 ขวบที่อาศัยอยู่ในยุคเซ็นโกคุ เด็กหญิงคนนั้นต้องดิ้นรนใช้ชีวิตท่ามกลางความยากจนและเคราะห์ร้ายในโลกยุคนั้น ทั้งสองเริ่มสร้างมิตรภาพพี่น้องต่อกัน เมื่อฮานะตื่นขึ้นมา เธอถูกหน่วยงานพิเศษของรัฐบาลพาตัวไปสอบสวนอย่างหนักเกี่ยวกับความฝันของเธอ มีบางสิ่งที่เรียกว่าบันทึกอาคาชิก ซึ่งชะตากรรมของมนุษย์ทุกคนจะเป็นไปตามบันทึกนั้น และปรากฏว่าบันทึกอนาคตของมนุษยชาตินั้นจะหายไปในอีกหนึ่งเดือน กุญแจสำคัญในการแก้ปัญหานี้คือเด็กหญิงที่ปรากฏตัวในความฝันของฮานะ
11) การทดสอบในห้องปฏิบัติการที่บ้าน (At-home lab tests)
แม้ว่าการระบาดใหญ่จะทำให้โครงการเหล่านี้ได้รับแรงผลักดันที่จำเป็นมาก แต่การทดสอบในห้องปฏิบัติการที่บ้านยังคงเป็นความหวังมากกว่าที่จะเป็นจริง แน่นอนว่ามีวิธีแก้ปัญหาอยู่แล้ว และหากคุณลองค้นหาใน Google คุณจะพบว่าจำนวนความเป็นไปได้ที่คุณสามารถซื้อได้นั้นดูน่าทึ่งมาก ความจริงนั้นน่าตกใจกว่านั้นมาก นั่นคือ การทดสอบดังกล่าวสามารถวัดไบโอมาร์กเกอร์ได้เพียงจำนวนจำกัดเท่านั้นด้วยความแม่นยำทางคลินิก แม้แต่โซลูชันที่มีอยู่บางส่วนก็ยังประสบปัญหาในการหาฐานลูกค้า เมื่อไม่กี่ปีที่ผ่านมา ฉันได้ลองใช้ เซ็นเซอร์ Nima เพื่อค้นหากลูเตนและถั่วลิสงในอาหารเพียงเพื่อทดลองใช้เทคโนโลยีดังกล่าว เซ็นเซอร์เหล่านี้ใช้งานได้ดี และฉันยังคงเชื่อว่าเซ็นเซอร์เหล่านี้ให้บริการที่จำเป็นมาก อย่างไรก็ตาม ทั้งสองอย่างนี้ถูกยกเลิกไปแล้ว การมีอุปกรณ์วินิจฉัยคุณภาพที่ห้องแล็บมีอยู่ในห้องน้ำนั้นฟังดูดี แต่เรายังไปไม่ถึงจุดนั้นสนับสนุนเตียงผู้ป่วยไฟฟ้า (2021)
"Green Health Care & Share” 2021.01.26 สนับสนุนเตียงผู้ป่วยไฟฟ้า
ปัจจุบันยอดจำนวนผู้ป่วยที่เพิ่มมากขึ้น เตียงพยาบาลที่มีอยู่ในหลายพื้นที่ อาจไม่เพียงพอรองรับผู้ป่วย อีกทั้งอุปกรณ์ที่มีอาจชำรุดทรุดโทรมไม่พร้อมใช้งาน ซึ่งการจัดซื้ออุปกรณ์ทางการแพทย์นั้นจำเป็นต้องมีงบประมาณจำนวนมากที่จะสามารถเติมเต็มให้ครบทุกพื้นที่
โรงพยาบาลกรุงเทพจันทบุรี จึงได้ส่งต่อความห่วงใยภายใต้โครงการ "Green Health Care & Share" โดยมอบเตียงผู้ป่วยไฟฟ้า ให้รพ.ชุมชนในพื้นที่จังหวัดจันทบุรี จำนวน 5 แห่ง ได้แก่
- รพ.เขาสุกิม นำไปแทนเตียงเดิมที่เป็นเตียงธรรมดา
- รพ.นายายอาม นำไปแทนในห้องรอคลอด
- รพ.มะขาม นำไปใช้ในห้องพิเศษรวม
- รพ.สอยดาว นำไปใช้ตึกใหม่ห้องพิเศษที่เปิดขยายเพิ่ม
- รพ.ขลุง นำไปแทนของเดิมที่ชำรุด
โดยโรงพยาบาลกรุงเทพจันทบุรีมุ่งหวังที่จะเป็นส่วนหนึ่งในการดูแลสุขภาพประชาชนในจังหวัดจันทบุรี และสนับสนุนโรงพยาบาลในพื้นที่ห่างไกลจากตัวเมือง ให้มีสุขภาพแข็งแรงและคุณภาพชีวิตที่ดีขึ้นตามสโลแกน
21 มิถุนายน 2565 ออกตรวจสุขภาพตา ประชาชนชาวจังหวัดอุบลราชธานี
วันอังคาร ที่ 21 เดือน มิถุนายน 2565 จะมีหน่วยเคลื่อนที่ออกตรวจสุขภาพตาให้กับข้าราชการ รวมถึงประชาชนชาวจังหวัดอุบลราชธานี และจังหวัดใกล้เคียง ณ โรงแรมเดอะรีเจ้นท์ จ.อุบลราชธานี ตั้งแต่เวลา 11.00 -15.00 น. สอบถามพิ่มเติม ติดต่อ 043-811-757 หรือ 063-872-2461 คุณวิไลวรรณ วิจิตรพรรณ ผู้ประสานงานTrip 2 : เสาร์ที่ 8 และอาทิตย์ที่ 8 กรกฎาคม ฟาร์มโคนมไทย-เดนมาร์ค พิพิธภัณฑ์สองกษัตริย์ (ไปเช้ากลับเย็น)
จำนวนประชากรไทย จำแนกตามสิทธิหลักประกันสุขภาพ ปีงบประมาณ 2565
จำนวนประชากรไทย จำแนกตามสิทธิหลักประกันสุขภาพ ปีงบประมาณ 2565
ประชากรทั้งประเทศ 67.305 ล้านคน
ประชากรในระบบหลักประกันสุขภาพถ้วนหน้า 66.984 ล้านคน
ประชากรที่ลงทะเบียนเข้าระบบ(ทั้งหมดทุกสิทธิ) 66.690 ล้านคน (99.56%)
แต่ละสิทธิได้แก่
- สิทธิหลักประกันสุขภาพแห่งชาติ 47.180 ล้านคน
- สิทธิประกันสังคม 12.754 ล้านคน
- สิทธิข้าราชการ/รัฐวิสาหกิจ 5.298 ล้านคน
- สิทธิพนักงานส่วนท้องถิ่น 0.639 ล้านคน
- บุคคลมีปัญหาสถานะและสิทธิ 0.729 ล้านคน
- ครูเอกชน 0.076 ล้านคน
- ผู้ประกันตนคนพิการ 0.012 ล้านคน
- บุคคลที่ยังไม่ลงทะเบียนสิทธิ 0.197 ล้านคน
- บุคคลที่ไม่อยู่ตามทะเบียนบ้าน 0.085 ล้านคน
- คนไทยในต่างประเทศ 0.011 ล้านคน
- คนต่างด้าว 0.321 ล้านคน
ข้อมูล ณ วันที่ 30 กันยายน 2565
รายงานประจำปี 2565 (p68)
แจ้งสถานที่ลงทะเบียนรับบัตรทอง ในกรุงเทพฯ 21 จุด
สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) กำหนดจุดรับลงทะเบียนสิทธิหลักประกันสุขภาพแห่งชาติ ในเขตพื้นที่กรุงเทพมหานคร จำนวน 21 จุด
รายงานข่าวแจ้งว่าสำนักงานหลักประกันสุขภาพแห่งชาติหรือ สปสช.ได้กำหนดจุดรับลงทะเบียนสิทธิหลักประกันสุขภาพแห่งชาติ เขตพื้นที่กรุงเทพมหานคร เพื่อให้บริการลงทะเบียนสิทธิการรักษาพยาบาลและข้อมูล(สิทธิบัตรทอง)แก่ประชาชนส่วน ในพื้นที่กทม. ณ สำนักงานเขตทั้งหมด 19 แห่ง ได้แก่
1.เขตคลองเตยที่ฝ่ายทะเบียนห้อง BSC โทร 02-126-6902
2.เขตคลองสามวาที่ด้านหลังจุดประชาสัมพันธ์ โทร 02-548-0134
3.เขตธนบุรี ที่ฝ่ายทะเบียน โทร 02-465-5841
4.เขตบางกะปิ ที่ห้องบัตรหลังเสาธง (อาคาร1) โทร 02-130-7260
5.เขตบางขุนเทียน ที่ห้องonestop service โทร 02-416-0170
6.เขตบางแคที่ ฝ่ายเทศกิจ โทร 02-455-4310
7.เขตบางพลัด ที่ห้อง onestop service โทร 02-424-1265
8.เขตประเวศ ที่ฝ่ายพัฒนาชุมชน โทร 02-130-7302
9.เขตพระโขนง ที่ฝ่ายทะเบียน โทร 02-136-5960
10.เขตมีนบุรี ที่ฝ่ายสัสดี โทร 02-540-7035
11.เขตราชเทวี ที่ฝ่ายปกครอง โทร 02-126-6913
12.เขตราษฎร์บูรณะ ที่ห้องonestop service โทร 02-408-4249
13.เขตลาดกระบัง ที่ห้องทะเบียน 14.เขตลาดพร้าว ที่ฝ่ายปกครอง โทร 02-326-6134
15.เขตสายไหม ที่ทางเข้าด้านหลัง โทร 02-147-5464
16.เขตหนองแขม ที่ฝ่ายทะเบียน โทร 02-421-5818
17.เขตหนองจอก ที่ห้องonestop service (ช่อง13) โทร 02-548-2953
18.เขตหลักสี่ ที่ห้องเงินออม โทร 02-147-5411
19.เขตห้วยขวาง ที่ห้องonestop service โทร 02-126-6905
โดยเปิดให้บริการในวันและเวลาราชการตั้งแต่ 08.00-16.00 น. นอกจากนี้ ยังมีจุดรับลงทะเบียนนอกสถานที่อีก 2 แห่ง คือ
- ที่สถานีรถไฟกรุงเทพหรือหัวลำโพง และ
- ที่สถานีขนส่งหมอชิต
เปิดให้บริการทุกวันสอบถามข้อมูลเพิ่มเติมได้ที่สายด่วน สปสช. 1330
Dailynews.co.th บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตคันนายาว
รับยาและมีนัดรักษาต่อเนื่องต้องทำอย่างไร LINK
รับยาและมีนัดรักษาต่อเนื่องต้องทำอย่างไร
ขอประวัติการรักษา / ใบส่งตัวเดิม ซองยาที่ทาน หรือประวัติการรักษาเดิม หากมีใบนัดรักษาต่อเนื่องของ รพ. ให้นำใบนัดติดตัวไปด้วย พร้อมบัตรประจำตัวประชาชน เพื่อรักษาพยาบาลต่อเนื่องได้ที่หน่วยบริการภาครัฐและเอกชน ที่ร่วมโครงการในระบบหลักประกันสุขภาพแห่งชาติ ได้แก่ โรงพยาบาลของรัฐ โรงพยาบาลเอกชน ศูนย์บริการสาธารณสุขที่ใกล้บ้านท่านได้ โดยไม่ต้องใช้หนังสือส่งตัว
หลังจากนั้นติดต่อลงทะเบียนใช้สิทธิที่แห่งใหม่ได้ที่ สำนักงานเขตทั้ง 19 เขต ในกทม. หรือทางไลน์ @ucbkk, @nhso
โรคฮิตผู้สูงอายุ
ชุดความรู้ดีๆ ที่อ่านง่าย เข้าใจง่าย
จัดทำโดย สำนักศูนย์เรียนรู้สุขภาวะ และ สสส
เตรียมพร้อมตั้งรับ กลุ่มอาการและโรคที่พบบ่อยในผู้สูงอายุ เรียนรู้สาเหตุเพื่อป้องกันการเกิดอาการและโรค รวมทั้งรู้จักวิธีการดูแลรักษาเพื่อบรรเทาและหลีกเลี่ยงการเจ็บปวด
ดาวน์โหลด (pdf) ได้ที่
โหลดเก็บไว้อ่านและนำไปประยุกต์ใช้นะคะ
เพื่อช่วยกันดูแลผู้สูงอายุในครอบครัวนะคะ
ถ้าท่านมีความสุข เราก็จะมีความสุข เชื่อไหมล่ะ
Cafe Amazon for Chance สาขา 3 หอศิลป์ ณ บ้านเจ้าพระยา (ติดป้อมพระสุเมรุ)
Cafe Amazon for Chance สาขาที่ 3 ดำเนินการโดย ผู้พิการทางการได้ยิน
ตั้งอยู่ที่ หอศิลป์ ณ บ้านเจ้าพระยา (ติดป้อมพระสุเมรุ)
แขวง ชนะสงคราม เขตพระนคร กรุงเทพมหานคร 10200
+66869880195
ข่าว
BTS ติดตั้งเครื่อง AED ช่วยคนหัวใจวายเฉียบพลัน [The Standard 18.12.2017]
รถไฟฟ้า BTS ติดตั้งเครื่อง AED “เครื่องกระตุกหัวใจอัตโนมัติ” ใน 10 สถานีนำร่อง [ข่าวรถไฟฟ้าไทย 19/12/2017]
รฟม. ใส่ใจในความปลอดภัยของผู้ใช้บริการ แนะนำ 4 ขั้นตอนในการใช้เครื่องช็อกหัวใจอัตโนมัติ (AED) ในกรณีฉุกเฉิน! เพื่อช่วยเหลือผู้ป่วยหมดสติ ภายในระบบรถไฟฟ้าฯ [รฟม]
แอร์พอร์ต เรล ลิงก์ ดำเนินการติดตั้งเครื่องกระตุกหัวใจไฟฟ้าอัตโนมัติ 8 สถานี [ประชาชาติธุรกิจ 37/2562]
ธนาคารเลือด รพร.ท่าบ่อ ต้องการเลือดทุกกรุ๊ป โดยเฉพาะกรุ๊ป A LINK
เลือดกรุ๊ป A หมดแล้ว!!! กรุ๊ปอื่นก็เหลือไม่มาก
ต้องการเลือดทุกกรุ๊ป โดยเฉพาะกรุ๊ป A
ธนาคารเลือด รพร.ท่าบ่อ เชิญชวนผู้ที่มีสุขภาพดี และไม่มีความเสี่ยงเกี่ยวกับ COVID-19 ร่วมบริจาคเลือด เพื่อช่วยชีวิตผู้ป่วย และเตรียมรับมือกับ "7 วันอันตราย" ในช่วงเทศกาลปีใหม่
บริจาคได้ที่ ธนาคารเลือด รพร.ท่าบ่อ วันและเวลาราชการ
ตอนนี้ห้องบริจาคเลือดย้ายจากที่เดิมมาอยู่ที่ระหว่างตึกไตเทียมกับตึก NICU นะคะ
สอบถามข้อมูลเพิ่มเติม ที่ inbox เพจ ธนาคารเลือด รพร.ท่าบ่อ
หรือโทร. 042-431288 ต่อ 1241 (ในเวลาราชการ)
2. กดรับทราบ นโยบายความเป็นส่วนตัว
ผู้เดินทางควรอ่านนโยบายความเป็นส่วนตัวในการใช้บริการอย่างรอบคอบ ซึ่งข้อตกลงนี้จะมีผลผูกพันในทางกฎหมายเมื่อท่านเข้าใช้งาน แอปพลิเคชั่นนี้เป็นระบบเฝ้าระวังเพื่อรองรับสถานการณ์ฉุกเฉินของประเทศไทย เป็นเครื่องมือที่ช่วยรับมือการระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) เมื่อท่านได้อ่านนโยบายนี้โดยตลอด และกดปุ่มยอมรับแล้ว ถือว่าท่านยอมรับเงื่อนไขการประมวลข้อมูลส่วนบุคคลของท่านตามนโยบายนี้
Klerm Beer
ชื่อยี่ห้อบ่งบอกอารมณ์มาก เสียดายที่มีแค่ตัวอย่าง หวังว่าคงจะได้สัมผัสตัวจริงในอีกไม่นาน
Optional Vaccine : วัคซีนทางเลือก
วัคซีนทางเลือก หรือ วัคซีนเสริม คือ วัคซีนที่มีประสิทธิภาพดี มีประโยชน์ในการป้องกันโรค แต่ไม่ได้อยู่ในแผนงานสร้างเสริมภูมิคุ้มกันโรคของกระทรวงสาธารณสุข (วัคซีนพื้นฐาน) ดังนั้นเราจะเลือกฉีดหรือไม่ก็ได้ เพราะมีราคาค่อนข้างสูง ซึ่งในปัจจุบัน วัคซีนทางเลือกเหล่านี้ได้มีการพัฒนาโดยการรวมหลาย ๆ วัคซีนในเข็มเดียว จึงทำให้ได้รับหลายภูมิคุ้มกันโรคในเข็มเดียว อีกทั้งยังทำให้ประหยัดค่าใช้จ่ายลงได้อีกด้วย
ธุรกิจ Cannabis เป็นธุรกิจที่ใหญ่และการเติบโตสูงแต่ยังไม่มีกำไรให้เห็น
สมุทรสาคร งานประเพณีสงกรานต์บ้านไร่
งานประเพณีสงกรานต์บ้านไร่
ร่วมสืบสานประเพณีสงกรานต์ชาวไทยรามัญ ชมนิทรรศการ การแสดงและการละเล่นพื้นบ้าน ได้แก่ วงทะแยมอญ รำมอญ 12 ท่า รำมะเทิ่ง-เม้ยเจิง สะบ้าบ่อน สะบ้าทอย สาธิตอาการคาว/หวาน เช่น แกงกระเจี๊ยบ แกงมะตาด และจำหน่ายสินค้าวัฒนธรรมไทยรามัญชุมชนต่างๆ
วัดบ้านไร่ ต.พันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร
กระบี่ เปิดเมือง ไม่กักตัว ป้องกันตนเอง LINK
- ต้องรายงานตัวผ่านระบบออนไลน์ตามแบบที่จังหวัดกระบี่กำหนด
QT14 หรือรายงานตัวกับเจ้าพนักงานควบคุมโรคติดต่อในพื้นที่
- ดาวน์โหลดแอปพลิเคชั่น "
หมอชนะ"
- สวมหน้ากากอนามัยหรือหน้ากากผ้า
- เว้นระยะห่างทางสังคม อย่างน้อย 1 เมตร
- สังเกตอาการตนเองอย่างสม่ำเสมอหากมีไข หรือมีอาการระบบทางเดินหายใจ ให้เข้ารับการรักษาที่สถานพยาบาลของรัฐ
สอบถามเพิ่มเติม 083 102 3630
ประเสริฐ (นักวิชาการสาธารณะสุขชำนาญการ)
รพ.กระบี่ โทร 075-626700
ชลบุรี - เปิดเข้าได้ ไม่กักตัว เตรียมรพ.สนามสัตหีบ 320 เตียง LINK
(10/4/64) ผู้ว่าฯ ชลบุรี ให้ข้อมูล ดังนี้ เตรียมรพ.สนาม ที่อ.เมือง รับแล้ว 40 เตียง
ให้ทุกอำเภอเปิดเพิ่ม
สัตหีบเปิดอีก 320 เตียง
แต่ไม่ปิดจังหวัด เข้ามาท่องเที่ยวได้ ไม่กักตัว แต่อยู่ใต้มาตรการ (ที่เข้มงวด) เช่น จำกัดจำนวน ระยะห่าง ตรวจอุณหภูมิ ลงแอปไทยชนะ หมอชนะ เผื่อเกิดเหตุจะได้ติดตาม ควบคุมโรคได้
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ 14 เมษายน 2564
วันพุธที่ 14 เมษายน 2564 เวลา 11.30 น.
สถานการณ์การติดเชื้อ COVID-19 ในประเทศ
- ผู้ป่วยรายใหม่ 1,335 ราย
- ผู้ป่วยยืนยันสะสม 35,910 ราย
- หายป่วยแล้ว 28,322 ราย
- เสียชีวิตสะสม 97 ราย
ระหว่างวันที่ 28 กุมภาพันธ์ - 13 เมษายน 2564
มีผู้รับวัคซีน สะสมทั้งหมด จำนวน 579,305 ราย
--------------------------------------------------
วันที่ 13 เมษายน 2564 มีผู้รับการฉีดวัคซีน
เข็มที่ 1 จำนวน 529 ราย
เข็มที่ 2 จำนวน 244 ราย
ส่วนอาหารโรงแรม จากการสำรวจเมนูที่จัดให้ ดีนะ คือออกแนวโภชนาการ เน้นครบห้าหมู่ ไม่เน้นเมนูหวือหวา น่าจะผ่านการคัดกรองจากทีมพยาบาล รสชาติก็จะกลางๆ คนลิ้นจระเข้กินง่ายอย่างดิฉันนี่ผ่านฉลุย ฟาดเรียบทุกเมนู ☺? จานชามไม่ต้องล้าง เพราะทุกอย่างมาในกล่องพลาสติก ล้างแค่ช้อนส้อม แล้วก็แค่ช่วยเพิ่มขยะ แค่นั้นเอง
และเมื่อเราต้องแยกตัวจากคนอื่น ก็จะไม่มีพนักงานมาทำความสะอาด เปลี่ยนนู่นนี่นะคะ ต้องทำเองค่ะ ? โรงแรมก็จะเตรียมอุปกรณ์ทำความสะอาดสำหรับการซักล้างให้ประมาณนึง เช่น น้ำยาล้างจาน ผงซักฟอก (สำหรับซักด้วย ?) ก็ต้องมาจัดการเอาเองนะคะ อะไรต้องซักต้องล้าง เอาที่สบายใจค่ะ ส่วนผ้าเช็ดตัว ผ้าปูที่นอน ไรงี้ ไม่ต้องตกใจจ้ะ ? ไม่ต้องซักนะ ขอมาเปลี่ยนเอง แต่ต้องเก็บของเก่าไว้ในห้องแค่นั้นเอง บางคนเปิดแอร์ 16 องศากะว่าอยู่เย็นๆ ไม่สกปรก ปรากฏว่า แอร์เย็นจัด น้ำแข็งเกาะ วุ่นอีก ? เพราะฉะนั้นใครที่จะกลับจากเมืองหนาว คิดเผื่อตรงนี้ด้วยน้า หรือจะสะดวก nude อยู่ในห้องคนเดียว ก็เอาที่สบายใจค่ะ ?
สุดท้ายที่เกือบลืม จริงๆ ลืมไปแล้วแต่ไลน์เพิ่งเด้งมาเมื่อกี้เอง ? คือ แถ่น แทน แท้น แบบประเมินสุขภาพจิตจ้า ต้องทำสองครั้ง เหมือนตรวจโควิด ทำในแอปที่ทีมพยาบาลส่งให้ ผลการประเมินเก็บไว้อ่านเอง ไม่ต้องแชร์บอกใครนะจ้ะ ไม่ต้องให้เขารู้ว่าเราไม่ปกติ ?
อย่างอื่น ก็ไม่มีอะไรนะคะ ทำใจร่มๆ มีงานทำงาน อ่านหนังสือ นั่งสมาธิ ฟังเพลง ออกกำลัง โยคะกันไปค่ะ สุดท้ายแล้วแทบจะไม่อยากออกไปนะ อยู่อย่างนี้สบายจัง ??
Q อยากเลื่อนนัดแพทย์ ต้องทำอย่างไร?
บุรีรัมย์ ประกาศ 4 มกราคม 2564 LINK
ออกนอกบ้าน เข้าสถานที่ชุมนุมชน ติดต่อราชการ ผู้ประกอบการ ร้านค้า ร้านอาหาร ผู้ให้บริการ ผู้รับบริการ ไม่สวมหน้ากากอนามัย มีโทษตามกฎหมาย
"ปรับไม่เกิน 20,000 บาท" (ประกาศคณะกรรมการโรคติดต่อจังหวัดบุรีรัมย์ เรื่องการป้องกันการระบาดใหม่ของโรคติดเชื้อไวรัสโคโรนา 2019 พ.ศ. 2564 ลงวันที่ 4 มกราคม 2564)
11.ยืนยันการทำรายการ
สาวน้อย สปสช จะยิ้มแย้มและเอ่ยขอบคุณ พร้อมยืนยันว่า สปสช ได้รับข้อมูลการลงทะเบียนแล้ว
EP 2 ขั้นที่ 1 เริ่มต้นจากการฝึกกล้ามเนื้อแขน
นั่งในท่าตัวตรง
ค่อยๆ ยกแขนทั้งสองขึ้นเหนือศีรษะ ในจังหวะช้าๆ พร้อมกับหายใจเข้า
จากนั้นหายใจออกพร้อมกับลดแขนลง โดยทำการหายใจออกแบบเป่าปาก
ทำช้าๆ ในจังหวะที่รู้สึกสบาย
หายใจเข้าอีกครั้งหนึ่งพร้อมยกแขนขึ้น หายใจออกพร้อมเป่าปากและลดระดับแขนลง
ทำซ้ำประมาณ 10-20 ครั้ง
ประกันภัยการแพ้วัคซีน - สินมั่นคงประกันภัย LINK
ประกันภัยการแพ้วัคซีนจากสินมั่นคงประกันภัย ให้คุณซื้อได้ แม้ไม่เคยมีประกันภัยการติดเชื้อโควิดอยู่ มีแผนประกันภัยให้เลือกหลากหลาย ครอบคลุมทั้งกรณีผู้ป่วยใน (IPD) และผู้ป่วยนอก (OPD) ทั้งค่ารักษาพยาบาล ค่าชดเชยรายวัน ค่าปลอบขวัญ หากต้องรักษาตัวในโรงพยาบาลเกินกว่า 5 วัน หรือหากกรณีมีอาการรุนแรงถึงขั้นโคม่า รับเงินช่วยเหลือเพิ่มทันที! รวมมูลค่าความคุ้มครองสูงสุดกว่า 1 ล้านบาท!
สินมั่นคงประกันภัยเซฟให้คุณชัวร์ก่อนฉีดด้วย ประกันภัยแพ้วัคซีนโควิด เบี้ยเริ่มต้นแค่ 30 บาท! ถูก คุ้มครองครอบคลุมทั้ง IPD & OPD สูงสุดกว่า 1 ล้านบาท
รายละเอียด แผน และเงื่อนไข คลิกที่นี่คำแนะนำในผู้ป่วยโรคไต LINK
คำแนะนำการฉีดวัคซีนโควิด-19 ในผู้ป่วยโรคไต
ชนิดของวัคซีน COVID-19 มีทั้งหมด 4 กลุ่ม ได้แก่
1. วัคซีนชนิดเชื้อตาย (Inactivated viras) เช่น Sinovac. Sinopharm
2. วัดชีนชนิดไวรัสเวเตอร์ ซึ่งเป็นไร้สที่ยังมีชีวิตแต่ไม่สามารถแบ่งตัวได้ (Non-replicating viral vector) เช่น AsiraZeneca, Johnson & Johnson, Gamaleya (Sputnik)
3. วัดซีนชนิด mRNA เช่น Pfizer. Modera
4. วัคซีนชนิดส่วนประกอบของโปรตีน (Protein-hased vaccine) เช่น Novavax
คำแนะนำเรื่องวัดซีน COVID-19 สำหรับผู้ป่วยโรคไต
ผู้ป่วยโรคตเรื้อรัง ผู้ป่วยที่ได้รับการบำบัดทดแทนไต (ฟอกเลือดด้วยเครื่องไตเทียม หรือ ล้างไตทางช่องท้อง) และผู้ป่วยที่ได้รับการปลูกถ่ายไต ถือว่าเป็นกลุ่มเสี่ยงสูงต่อการติดเชื้อ COVID-19 และอาจจะมีอาการป่วยรุนแรง จึงเป็นกลุ่มผู้ป่วยที่มีความจำเป็นต่อการได้รับวัคน อย่างไรก็ตาม ปัจจุบันยังไม่มีผลการศึกษารายงานถึงประสิทธิภาพของวัคซีน COVID-19 แบบเฉพาะ เจาะจงในกลุ่มผู้ป่วยโรคไต
เนื่องจากการฉีดวัดซึนโรคอื่น 1 ในผู้ป่วยกลุ่มนี้ จะกระตุ้นให้เกิดการสร้างภูมิคุ้มกันได้น้อยกว่าคนทั่วไป จึงอาจทำให้การฉีดวัคชื่น COVID- 19 เกิดภูมิคุ้มกันได้น้อยกว่าเช่นกัน ซึ่งทำให้ป้องกันโรคได้ไม่เต็มที่ แต่อย่างไรก็ตาม การฉีตวัคซีนยังมีประโยชน์คือช่วยลดอัตราการเสียชีวิตและความรุนแรงของโรคได้ในคนทั่วไป ดังนั้นสำหรับผู้ป่วยโรคไตเรื้อรัง ผู้ป่วยที่ได้รับการบำบัดทดแทนไต และผู้ป่วยปลูกถ่ายไต จึงยังคงแนะนำให้ได้รับการฉีดวัคซีน ด้วยเช่นกัน
ภายหลังฉีดวัดนแล้วผู้ป่วยทุกคนยังมีโอกาสติดเชื้อได้ ดังนั้นผู้ป่วยจึงมีความจำเป็นต้องปฏิบัติตามมาตรการป้องกันโรคเหมือนเดิมเช่น ใส่หน้ากากอนามัย ล้างมือ และเว้นระยะห่างทางสังคม เป็นต้น
หมายเหตุ
- Sinovac ปัจจุบันยังไม่มีข้อมูลการศึกษาถึงประสิทธิภาพของวัคชนในผู้สูงอายุมากกว่าหรือเท่ากับ 60 ปี
- วัคชีนชนิดเชื้อตาย ชนิด mRNA และชนิดส่วนประกอบของโปรตีน สามารถให้ได้ในผู้ป่วยที่ได้รับยากดภูมิคุ้มกัน
- วัคซีนชนิดไวรัสเวคเตอร์ เช่น AstraZeneca จากข้อมูลในต่างประเทศแนะนำว่าสามารถให้ได้ในผู้ป่วยที่ได้รับ ยากดภูมิคุ้มกัน แต่ผู้เชี่ยวชาญบางท่าน แนะนำให้หลีกเลี่ยงวัคชีนกลุ่มนี้ในผู้ป่วยที่มีภูมิคุ้มกันต่ำมาก (เช่น ผู้ป่วยที่ใด้รับยากคภูมิคุ้มกันที่ฤทธิ์กดภูมิรุนแรงหรือมีขนาดสูง)
อบจ.กำแพงแพชร เตรียมงบ 30 ล้านจัดซื้อวัคซีนทางเลือก LINK
นายก อบจ.กำแพงแพชร แถลง "เตรียมความพร้อมจัดหางบประมาณที่มีตั้งอยู่ไว้แล้วในภาวะฉุกเฉินหรืออาจจะเป็นเงินสะสม ขณะนี้รวบรวมได้รวบรวมแล้วประมาณ 30 กว่าล้านบาท หรือหากจัดซื้อวัคซีน ก็ได้ประมาณ 30,000 โดส ที่จะนำมาฉีดให้แก่ประชาชนในพื้นที่ได้ไม่น้อยกว่า 15,000 คน หรือหากคณะกรรมการ โรคติดต่อจังหวัดเห็นว่ายังไม่เพียงพอทาง อบจ.กำแพงเพชรเองก็จะได้พิจารณาดูงบประมาณ ในส่วนอื่น มาสนับสนุนเพิ่มเติม"
เขตสุขภาพที่ 11 ภาคใต้ตอนบนและตะวันตก
สำนักงานป้องกันควบคุมโรคที่ 11 จังหวัดนครศรีธรรมราช
-เบอร์โทรศัพท์: 075 341 147
-เว็บไซต์: https://ddc.moph.go.th/odpc11/ (ยังไม่เปิดให้บริการ)
ชุมพร
- สำนักงานสาธารณสุขจังหวัดชุมพร
เบอร์โทรศัพท์: 077 511 997
เว็บไซต์: http://www.cmpo.moph.go.th/cmpo/
นครศรีธรรมราช
- สำนักงานสาธารณสุขจังหวัดนครศรีธรรมราช
เบอร์โทรศัพท์: 075 343 409
เว็บไซต์: https://www.nakhonsihealth.org/
สุราษฎร์ธานี
- สำนักงานสาธารณสุขจังหวัดสุราษฎร์ธานี
เบอร์โทรศัพท์: 077 272 784
เว็บไซต์: http://www.stpho.go.th/
- โรงพยาบาลเกาะสมุย
เบอร์โทรศัพท์: 077 913 200
เว็บไซต์: https://www.samuihospital.go.th/title_page/ index.html
กระบี่
- สำนักงานสาธารณสุขจังหวัดกระบี่
เบอร์โทรศัพท์: 075 631 534
เว็บไซต์: http://203.157.232.108/webkbo61/
พังงา
- สำนักงานสาธารณสุขจังหวัดพังงา
เบอร์โทรศัพท์: 076 481 721- 22,23,25,26
เว็บไซต์: http://www.pngo.moph.go.th/
ภูเก็ต
- สำนักงานสาธารณสุขจังหวัดภูเก็ต
เบอร์โทรศัพท์: 076 212 297
เว็บไซต์: https://www.pkto.moph.go.th/home.html
- โรงพยาบาลป่าตอง
เบอร์โทรศัพท์: 076 342 633
เว็บไซต์: http://www.patonghospital.go.th/main/
- โรงพยาบาลวชิระภูเก็ต
เบอร์โทรศัพท์: 076 361 234
เว็บไซต์: https://www.vachiraphuket.go.th/
ระนอง
- สำนักงานสาธารณสุขจังหวัดระนอง
เบอร์โทรศัพท์: 077 812 679 เว็บไซต์: http://www.rno.moph.go.th/เขตราษฎร์บูรณะ ลงพื้นที่ตรวจความเรียบร้อยคลองราษฎร์บูรณะ LINK
นายธรณ์เทพ ชัยธนกวิน ผู้ช่วยเลขานุการผู้ว่าราชการกรุงเทพมหานคร พร้อมด้วย นายปวินท์สรรค์ กัลยาณพันธ์ ผู้อำนวยการกองระบบคลอง สำนักการระบายน้ำ พระครูพรหมจริยวัฒน์ เจ้าอาวาสวัดประเสริฐสุทธาวาส โดยนางสาวอธิศรี วุฒิภาคภักดี ผู้อำนวยการ
เขตราษฎร์บูรณะ มอบหมายให้ นายวสันต์ ดิษฐสุวรรณ หัวหน้าฝ่ายรักษาความสะอาดและสวนสาธารณะ นายกรกริช สุคันธมาลัย หัวหน้าฝ่ายโยธา นำเจ้าหน้าที่เขตราษฎร์บูรณะ ลงพื้นที่ตรวจความเรียบร้อยคลองราษฎร์บูรณะ ในการเตรียมความพร้อมย้ายเครื่องจักร ไปทำการขุดลอกคลองอื่นต่อไป โครงการพัฒนาคลองราษฎร์บูรณะ ตามนโยบายพัฒนา คลองต้นแบบ ของผู้ว่าราชการกรุงเทพมหานคร พลตำรวจเอกอัศวิน ขวัญเมือง
สิทธิประโยชน์ ผู้ประกันตนมาตรา 40
สิทธิประโยชน์และเงื่อนไขการเกิดสิทธิขอรับประโยชน์ทดแทนมาตรา 40
คุณสมบัติของผู้สมัครมาตรา 40
- บุคคลทั่วไป อายุ 15-65 ปี
- ไม่มีนายจ้างประจำ เช่น อาชีพอิสระ ฟรีแลนซ์ ค้าขาย
ทางเลือก เงินสมทบที่ต้องจ่ายทุกเดือน
ทางเลือก 1 : จ่าย 70 บาท/เดือน (ช่วงเดือน ส.ค. 64-ม.ค. 65 ลดเงินสมทบเหลือ 42 บาท )
ทางเลือก 2 : จ่าย 100 บาท/เดือน (ช่วงเดือน ส.ค. 64-ม.ค. 65 ลดเงินสมทบเหลือ 60 บาท)
ทางเลือก 3 : จ่าย 300 บาท/เดือน (ช่วงเดือน ส.ค. 64-ม.ค. 65 ลดเงินสมทบเหลือ 80 บาท )
* BangkokBizNews
สิทธิประโยชน์ที่จะได้รับ 5 กรณี
แต่ละกรณีขึ้นกับทางเลือกการจ่ายเงินสมทบ
1) กรณีประสบอันตรายหรือเจ็บป่วย
2) กรณีทุพพลภาพ
3) กรณีตาย
4) กรณีชราภาพ
5) กรณีสงเคราะห์บุตร
**หมายเหตุ **
มาตรา 40 ไม่คุ้มครองด้านรักษาพยาบาล แต่จะคุ้มครองด้านการขาดรายได้ ผู้ประกันตนต้องใช้สิทธิอื่นในการรักษา เช่น สิทธิรักษาของบัตรทอง [sso]
รายละเอียดแต่ละกรณี
1) กรณีประสบอันตรายหรือเจ็บป่วย
เงื่อนไขการเกิดสิทธิ : จ่ายเงินสมทบไม่น้อยกว่า 3 ใน 4 เดือน ก่อนเดือนที่ประสบอันตรายหรือเจ็บป่วย
ทางเลือกที่ 1 (70/ด) และ ทางเลือกที่ 2 (100/ด)
ได้รับเงินทดแทนการขาดรายได้
(1) นอนพักรักษาตัวในโรงพยาบาลตั้งแต่ 1 วันขึ้นไป วันละ 300 บาท
(2) ไม่นอนพักรักษาตัวในโรงพยาบาล แต่มีใบรับรองแพทย์ให้หยุดพักรักษาตัวตั้งแต่ 3 วันขึ้นไป วันละ 200 บาท
(3) ไปพบแพทย์ (ผู้ป่วยนอก) และแพทย์ไม่มีความเห็นให้หยุดพักรักษาตัว หรือ ให้หยุดพักรักษาตัวไม่เกิน 2 วัน (มีใบรับรองแพทย์มาแสดง) ครั้งละ 50 บาท ไม่เกิน 3 ครั้ง ต่อปี
*ภายใน 1 ปี ได้รับสิทธิตาม (1) และ (2) รวมกันไม่เกิน 30 วันต่อปี
ทางเลือกที่ 3 (300/ด)
ได้รับเงินทดแทนการขาดรายได้
(1) นอนพักรักษาในโรงพยาบาลตั้งแต่ 1 วันขึ้นไป ได้รับวันละ 300 บาท
(2) ไม่นอนพักรักษาตัวในโรงพยาบาล แต่มีใบรับรองแพทย์ให้หยุดพักรักษาตัวตั้งแต่ 3 วันขึ้นไป วันละ 200 บาท
*ภายใน 1 ปี รับสิทธิตาม (1) และ (2) รวมกันไม่เกิน 90 วัน
หมายเหตุ : สิทธิการรักษาใช้สิทธิหลักประกันสุขภาพ/บัตรทอง (สปสช.) หรือสิทธิเดิมที่มีอยู่
2) กรณีทุพพลภาพ
เงื่อนไขการเกิดสิทธิ :
จ่ายเงินสมทบมาแล้ว 6 เดือนใน 10 เดือน ก่อนเดือนทุพพลภาพ ได้รับ 500 บาท
จ่ายเงินสมทบมาแล้ว 12 เดือนใน 20 เดือน ก่อนเดือนทุพพลภาพ ได้รับ 650 บาท
จ่ายเงินสมทบมาแล้ว 24 เดือนใน 40 เดือน ก่อนเดือนทุพพลภาพ ได้รับ 800 บาท
จ่ายเงินสมทบมาแล้ว 36 เดือนใน 60 เดือน ก่อนเดือนทุพพลภาพ ได้รับ 1,000 บาท
ทางเลือกที่ 1 (70/ด) และ ทางเลือกที่ 2 (100/ด)
ได้รับเงินทดแทนการขาดรายได้ต่อเดือน เป็นระยะเวลา 15 ปี
*เสียชีวิตระหว่างรับเงินทดแทนการขาดรายได้กรณีทุพพลภาพ ได้รับเงินค่าทำศพ 25,000 บาท
ทางเลือกที่ 3 (300/ด)
ได้รับเงินทดแทนการขาดรายได้ต่อเดือน ตลอดชีวิต
*เสียชีวิตระหว่างรับเงินทดแทนการขาดรายได้กรณีทุพพลภาพ ได้รับเงินค่าทำศพ 50,000 บาท
3) กรณีตาย
เงื่อนไขการเกิดสิทธิ :
จ่ายเงินสมทบไม่น้อยกว่า 6 ใน 12 เดือน ก่อนเดือนที่ตาย ยกเว้น กรณีตายเพราะอุบัติเหตุ
หากจ่ายเงินสมทบไม่ครบ 6 ใน 12 เดือน แต่มีการจ่ายเงินสมทบ 1 ใน 6 เดือน ก่อนเดือนที่ตาย
ทางเลือกที่ 1 (70/ด) และ ทางเลือกที่ 2 (100/ด)
ได้รับเงินค่าทำศพ 25,000 บาท จ่ายให้กับผู้จัดการศพ
ได้รับเงินสงเคราะห์กรณีตาย 8,000 บาท หากจ่ายเงินสมทบไม่น้อยกว่า 60 เดือน ก่อนเดือนที่ตาย
ทางเลือกที่ 3 (300/ด)
ได้รับเงินค่าทำศพ 50,000 บาท ก่อนเดือนที่ตาย จ่ายให้กับผู้จัดการศพ
4) กรณีชราภาพ
เงื่อนไขการเกิดสิทธิ : เมื่ออายุครบ 60 ปีบริบูรณ์ และสิ้นสุดความเป็นผู้ประกันตน
ทางเลือกที่ 1 (70/ด)
-ไม่คุ้มครอง-
ทางเลือกที่ 2 (100/ด)
ได้รับเงินบำเหน็จชราภาพ (เงินสมทบ 50 บาท คูณ จำนวนเดือนที่จ่ายเงินสมทบ บวกเงินออมเพิ่ม) พร้อมผลประโยชน์ตอบแทนรายปีตามที่สำนักงานประกันสังคมกำหนด
ทางเลือกที่ 3 (300/ด)
ได้รับเงินบำเหน็จชราภาพ (เงินสมทบ 150 บาท คูณ จำนวนเดือนที่จ่ายเงินสมทบ บวก เงินออมเพิ่ม) พร้อมผลประโยชน์ตอบแทนรายปีตามที่สำนักงานประกันสังคมกำหนด
*ผู้ประกันตนทางเลือกที่ 2 และทางเลือกที่ 3 สามารถจ่ายเงินสมทบเพิ่มเติม (ออมเพิ่ม) ได้ไม่เกิน 1,000 บาท ต่อเดือน
5) กรณีสงเคราะห์บุตร
เงื่อนไขการเกิดสิทธิ :
จ่ายเงินสมทบไม่น้อยกว่า 24 ใน 36 เดือน ก่อนเดือนที่มีสิทธิได้รับประโยชน์ทดแทน
*ขณะรับเงินสงเคราะห์บุตร ต้องจ่ายเงินสมทบทุกเดือน
ทางเลือกที่ 1 (70/ด) และ ทางเลือกที่ 2 (100/ด)
-ไม่คุ้มครอง-
ทางเลือกที่ 3 (300/ด)
ได้รับเงินสงเคราะห์บุตรรายเดือน คนละ 200 บาท คราวละไม่เกิน 2 คน บุตรอายุตั้งแต่แรกเกิดแต่ไม่เกิน 6 ปี บริบูรณ์
ลอยกระทงพระราม 8 ผู้ที่มาร่วมงานต้องแสดงผลการฉีดวัคซีน 2 เข็ม หรือผลตรวจ ATK ภายใน 72 ชั่วโมง (Thai PBS) LINK
ลอยกระทงพระราม 8 ประชาชานเดินทางมาไม่ขาดสาย จนท.ขอความร่วมมือ ลอยกระทงร่วมกัน 1 ครอบครัว 1 กระทง . บรรยากาศวันลอยกระทงขึ้น 15 ค่ำ เดือน 12 ที่สะพานพระราม 8 คึกคักไปด้วยผู้คน โดยผู้ที่มาร่วมงานต้องแสดงผลการฉีดวัคซีน 2 เข็ม หรือผลตรวจ ATK ภายใน 72 ชั่วโมง ที่มีผลเป็นลบก่อนเข้างาน จากนั้นเจ้าหน้าที่จะตรวจวัดอุณหภูมิ หากพบผู้ที่มีอุณหภูมิสูง จะพาไปนั่งพัก ณ จุดที่จัดเตรียมไว้ แล้วค่อยวัดอุณหภูมิใหม่อีกครั้ง กรณีพบผู้ที่มีผลตรวจเป็นบวกในบริเวณงาน จะมีเจ้าหน้าที่เตรียมพร้อมสำหรับการนำส่งผู้ติดเชื้อเข้ารับการรักษาต่อไป
รพ.ลำลูกกา เปิดบริการฉีดวัคซีนเข็มกระตุ้น LINK
โรงพยาบาลลำลูกกา เปิดบริการฉีดวัคซีนเข็มกระตุ้น ด้วยแอสตร้าเซเนก้า วันที่ 22 พ.ย- 22 ธ.ค. 64 เวลา 13-14 น. เฉพาะเวลาราชการ กำหนดวันละ 30 คน เฉพาะผู้ที่ได้รับวัคซีนซิโนแวค 2 เข็ม จากรพ.ลำลูกกา
เอ็ด ชีแรน
24 ตุลาคม นักร้องนักดนตรีแห่งยุค เปิดเผยว่ามีผลตรวจโควิดเป็นบวกก่อนกำหนดปล่อยอัลบั้มที่ 4 ของเขาเพียงวันเดียว เป็นเหตุให้ยกเลิกแผนโปรโมทที่วางไว้และเข้ารับการกักตัวในทันที พร้อมกับ กล่าวขอโทษแฟนๆ
20/12/2021 15:30 (CET) อินทรีล่าสาร เยอรมันอินไซต์
อ้างอิง:
รสชาติยังเป็นสิ่งสำคัญ
ซึ่งข้อมูลจากศูนย์วิจัย Krungthai COMPASS บอกไว้ว่า รสชาติ เป็นปัจจัยหลักที่ส่งผลต่อการตัดสินใจซื้อ Plant-based Food มากที่สุดอยู่ที่ 52 เปอร์เซ็นต์ ในขณะที่ 39 เปอร์เซ็นต์
เป็นเรื่องของสุขภาพ
สิ่งต่อมาที่ผู้ประกอบการต้องรู้นั่นคือ "การเพิ่มสารอาหารที่เป็นประโยชน์ เป็นสิ่งจำเป็น" เนื่องจากโปรตีนจากพืชอาจให้คุณค่าทางโภชนาการน้อยกว่าโปรตีนจากสัตว์ ดังนั้น ผู้ประกอบการต้องให้ความสำคัญกับการเพิ่มคุณค่าทางโภชนาการทดแทนโปรตีนจากพืช เช่น การเติม
วิตามินและแร่ธาตุที่มักขาดในวัตถุดิบจากพืช เช่น วิตามินบี 12 วิตามินดี โอเมก้า3 สังกะสี และธาตุเหล็ก เป็นต้น
เมื่อรู้เช่นนี้แล้ว ก่อนที่ผู้ประกอบการจะลงมือคว้าโอกาสในตลาด Plant-based Food จำนต้องพัฒนาผลิตภัณฑ์อาหารจากพืชให้สามารถตอบโจทย์ได้ทั้งความอร่อยควบคู่ไปกับการดูแล
สุขภาพด้วย
จากแนวโน้มการเติบโตของอาหารแห่งอนาคตนี้ ถือเป็นหนึ่งในอุตสาหกรรมเป้าหมาย (S-curve) ที่กรมส่งเสริมอุตสาหกรรม ต้องเร่งผลักดันและเดินหน้านโยบาย เพื่อขับเคลื่อนอุตสาหกรรมอาหารของไทยให้ก้าวสู่การเติบโตอย่างเข้มแข็งและสามารถต่อยอดสร้างมูลค่าเพิ่มให้กับธุรกิจได้ในอนาคต
น้ำปลาร้า พบเห็นว่ามีหลายผู้ประกอบการทำออกมาขาย
เนื้อหมัก หมูหมัก จากวิสาหกิจใน จ.นครพนม เป็นจุดเริ่มต้นที่น่าสนใจของกลุ่ม
สาธิตต้มกัญชา หมอพืชพันไมล์ ลำปาง
สาธิตต้มกัญชา ด้วยเทคนิค Non-Cafein หมอพืชพันไมล์ ลำปาง วิสาหกิจชุมชนเกษตรอินทรีย์พืชเศรษฐกิจและสมุนไพรทางการแพทย์
ไทม์ไลน์ ผู้ป่วยรายที่ 10063 เพศชาย อายุ 47 ปี
22 ธันวาคม 64 ศูนย์อำนวยการต้านโควิด-19 จังหวัดกาฬสินธุ์ เปิดเผย TIMELINE ผู้ติดเชื้อโควิด-19 รายที่ 10063
กาฬสินธุ์ เพศชาย อายุ 47 ปี สัญชาติ ไทย ภูมิลำเนาตำบลหลุบ อำเภอเมืองกาฬสินธุ์ จังหวัดกาฬสินธุ์ อาชีพรับจ้าง ที่เมืองบรัสเชลส์ ประเทศเบลเยี่ยม ไม่มีโรคประจำตัว มีประวัติได้รับวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 จำนวน 2 เข็ม โดยเข็มที่ 1 วัคซีน Pfizer รับการฉีดวัคซีนวันที่ 7 มิถุนายน 2564 และเข็มที่ 2 Pfizer รับการฉีดวัคซีนวันที่ 10 กรกฎาคม 2564 ที่เมืองบรัสเซลส์ ประเทศเบลเยี่ยม
เต็มเปี่ยมด้วยความตั้งใจ พร้อมส่งต่อความสุขให้ผู้ป่วย
“เรามีความต้องการที่จะทำให้ Rolling Roasters เป็นพื้นที่เรียนรู้เรื่องกาแฟและสร้างประสบการณ์ใหม่ๆ ในการดื่มกาแฟให้กับลูกค้ามาตลอด กับเมนูนี้ทีมงานก็ใช้เวลาไม่นานมากค่ะ แต่คิดมาอย่างถี่ถ้วนว่ากาแฟแบบไหนที่จะตอบโจทย์กับผู้ป่วยเบาหวาน เราเลือกเป็นกาแฟยูสุเพื่อให้ตอนดื่มได้รับกลิ่นที่หอม หวานเล็กๆ และสดชื่น ส่วนเรื่องรสหวานเราก็ลดความหวานจากสูตรปกติ 50% เลือกใช้สารให้ความหวานทดแทน จึงดื่มง่ายและไม่สูญเสียกลิ่นอายของกาแฟไปค่ะ”
แอน-รสรินทร์ ติยะวราพรรณ ผู้บริหารร้าน Rolling Roasters กล่าวถึงเมนูพิเศษจากทางร้าน
การขอรับ วัคซีนพาสปอร์ต ในปราจีนบุรี
การขอรับ “วัคซีนพาสปอร์ต” หนังสือรับรองการฉีดวัคซีนป้องกันโควิด-19 (International Vaccination Certificate) สำหรับชาวไทยและชาวต่างชาติเพื่อใช้ในการเดินทางระหว่างประเทศ
Next Normal ข้อปฏิบัติ....(ควรทำ) ให้ปีใหม่ห่างไกลโควิด เพื่อครอบครัวและคนที่คุณรัก
ขั้น 2: ลงทะเบียนผ่านระบบ THAILAND PASS
- ต้องลงทะเบียนก่อนเดินทางอย่างน้อย 7 วัน
- ผู้เดินทางอายุตั้งแต่ 18 ปีขึ้นไป ต้องลงทะเบียนแยกรายบุคคล
- เด็กอายุต่ำกว่า 18 ปี ให้ลงทะเบียนพร้อมผู้ปกครอง (ไม่ต้องลงทะเบียนแยก)
- อัพโหลดเอกสารในรูปแบบไฟล์รูปภาพ JPG, JPEG หรือ PNG ที่ชัดเจน อ่านง่าย
- หากหลักฐานการฉีดวัคซีนมี QR Code ระบบจะสามารถอ่านข้อมูลได้แบบอัตโนมัติ และสามารถอนุมัติการลงทะเบียนได้ภายใน 1-3 วัน แต่หากไม่มี QR Code ก็อาจใช้เวลามากกว่านั้น
โรงพยาบาลมหาวิทยาลัยบูรพา บริการตรวจ PCR และ ATK LINK
โรงพยาบาลมหาวิทยาลัยบูรพา บริการตรวจ PCR ราคา 3,610 บาท ATK ราคา 810 บาท รวมใบรับรองแพทย์ สอบถาม โทร 088-645-0165
-----
Due to the situation of the COVID-19 ?
epidemic, Burapha University Hospital offers a COVID-19 testing service to the public. There are 2 types of testing as follows:
Type 1: RT-PCR test ?
Type 2: Antigen rapid test?
If anyone is interested in getting tested for COVID-19, you can use the link below to register for a COVID-19 test
https://forms.gle/TYeqB8GmgLGYunsT7
***If you have and question please call 088-645-0165
**Covid-19 Test Price Details** ?
- RT-PCR test price 3,610 baht, waiting for 1 day results(Prices already include hospital and medical certificate fee)
- Antigen rapid test 810 baht, waiting 30 minutes (Prices already include hospital and medical certificate fee)
**Immune testing is available against COVID-19. Wait for 1 week **results by way:
- ELISA Spike Protein IgG says in AU/ml unit price 760 baht
- Neutralizing antibody, IgM, IgG 1,560 baht
ศูนย์โควิด-19 จังหวัดนนทบุรี - สสจ.นนทบุรี
สปส. กรุงเทพมหานครพื้นที่ 12 LINK
ตั้งอยู่เลขที่ 222 ถนนสุขุมวิท 77 (อ่อนนุช 2) แขวงพระโขนง เขตวัฒนา กทม 10260
รับผิดชอบเขต วัฒนา คลองเตย
แผนที่
Tel.02-3115935 - 9, 02-3116507, 02-3116508, 02-3116509, 02-3116529, 02-3116527 , 02-3116528
Fax 02-3111106, 02-3116741, 02-3116530, 02-3311106, 02-3116529
ฝ่ายอำนวยการ 02-3322122
งานสิทธิประโยชน์ทดแทน 02-3110580
งานการเงินและบัญชี 02-3110581
งานเงินสมทบ 02-3111954
งานทะเบียนและประสานการแพทย์ 02-3311107
เปาโลพหลโยธิน LINK
โปรแกรมตรวจสุขภาพพื้นฐาน ไขมันพอกตับ มะเร็งปากมดลูก มะเร็งเต้านม อัลตร้าซาวด์ช่องท้องทั้งหมด ช่องทางปรึกษา โรงพยาบาลเปาโลพหลโยธิน Call Center 1772 กด 2
โรงพยาบาลบางปะกอก 3 เปิดลงทะเบียนจองคิวออนไลน์ ( Online ) รอบ 3 ฉีด 1-5 กุมภาพันธ์ 2565 LINK
โรงพยาบาลบางปะกอก 3 เปิดลงทะเบียนจองคิวออนไลน์ ( Online ) รอบ 3 เพื่อเข้ารับบริการฉีดวัคซีนป้องกัน "โควิด-19" โดยไม่เสียค่าใช้จ่าย
ง่าย ๆ เพียง . . ลงทะเบียนจองคิวคลิก ลิงก์
ลงทะเบียนเสร็จ ตรวจสอบรายชื่อได้ทันที เพียงสแกน คิวอาร์ โค้ด (QR Code) เพื่อเข้าสู่ระบบ . เข้ารับบริการ 1 – 5 กุมภาพันธ์ 2565 ณ ศูนย์ฉีดวัคซีนป้องกันโควิด-19 โรงพยาบาลบางปะกอก 3 เวลา 08.00 - 15.00 น.
บัญชี 1 การพิจารณาคำขอและการตรวจสอบความถูกต้องของเอกสาร
โรงงานขาเทียม รพร.เดชอุดม LINK
โรงงานขาเทียม รพร.เดชอุดม ตั้งอยู่ภายใต้แผนกกายภาพบำบัด หน่วยงานเวชกรรมฟื้นฟู รับทำขาเทียมสำหรับผู้พิการ สามารถทำขาเทียมใต้เข่าและเหนือเข่า ติดต่อโทร 088-3692890 ในวันเวลาราชการ
- สำหรับผู้พิการที่มีบัตรผู้พิการแล้ว ยังไม่เคยทำขาเทียม ต้องขึ้นบัตรและพบแพทย์
- ผู้ที่เคยทำขาเทียมแล้วสามารถมาติดต่อที่โรงงานขาเทียมได้เลย
โรงพยาบาลชัยภูมิ ราม ประกาศรับสมัครงาน LINK
เนื่องด้วยสถานการณ์การแพร่ระบาดของเชื้อโควิด-19 รบกวนสมัครผ่านทาง E-mail โดยส่งเอกสารประกอบการสมัครงานและประวัติส่วนตัวโดยย่อ (Resume) พร้อมระบุตำแหน่งที่ต้องการสมัครมาที่ chr.hrd2006@gmail.com (** อีเมล์ผู้ใช้นี้เฉพาะติดต่อสมัครงานเท่านั้น **) 044-813666 ต่อ 3100 แผนกบุคคล-ธุรการ (ในวันและเวลาทำการ)
ฉีดวัคซีนกระตุ้นภูมิ เข็ม 3 และเข็ม 4 โรงพยาบาลลาดพร้าว LINK
พร้อมยกระดับ ฉีดวัคซีนกระตุ้นภูมิ เข็ม 3 และเข็ม 4 ตั้งการ์ดป้องกัน รับมือโควิด-19 ก่อนเที่ยว ก่อนเดินทางกลับบ้าน ช่วงสงกรานต์ปีนี้ ฉีดวัคซีนกระตุ้นภูมิคุ้มกันอย่างต่อเนื่อง วัคซีนโควิดฉีดครบโอกาสรอดสูงถึง 41 เท่า
วัคซีน MODERNA : 1 เข็ม..1,290 บาท
ซื้อ..ที่ฝ่ายการเงิน อาคาร 1 และ อาคาร 2
ฉีด..ณ ศูนย์ฉีดวัคซีนโควิด อาคาร 1 ชั้น 3
จบ..ภายในวันนั้น WALK IN : ตั้งแต่วันที่ 1 - 12 เมษายน 2565 เท่านั้น
เปิดบริการทุกวัน เวลา 08.00-16.00 น.
ยาชุด ภัยร้ายใกล้ตัวคุณ (อย.)
เกษมราษฎร์ รัตนาธิเบศร์ ตรวจหาเชื้อโควิด-19 PCR เริ่ม 2,000
โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ เปิดจองออนไลน์ ตรวจหาเชื้อโควิด - 19 (กรณีเข้ารับการตรวจล่วงหน้า 1 วันเท่านั้น) . สามารถเข้าระบบจองออนไลน์ได้ทุกวันจันทร์ - ศุกร์ เวลา 9.00 - 15.00 น. จำกัดคิว 200 คิว ต่อวัน
พีเอ็มจี พร้อมดูแลผู้ประกันตน โทร. 02 451 4920-4
โรงพยาบาลพีเอ็มจี โทร. 02 451 4920-4
FB : m.me/pmghosp
Line Official : @PMGHospital
ผู้ประกันตนติดเชื้อโควิด-19 สามารถเข้าสู่กระบวนการรักษา (ไม่เสียค่าใช้จ่าย) ตามแนวทางกระทรวงสาธารณสุข ณ โรงพยาบาล พีเอ็มจี โทร. 02 451 4920-4 สอบถามเพิ่มเติม โทร.สายด่วน 1506 กด 6 และ กด 7 (เวลา 8.00-18.00 น. ทุกวัน) .
รพ.ภูมิพลอดุลยเดช พอ. เปิดให้บริการวัคซีนไฟเซอร์ เข็ม 1, 2, 3 และ 4 LINK
รพ.ภูมิพลอดุลยเดช พอ. เปิดให้บริการวัคซีนไฟเซอร์ สำหรับประชาชนทั่วไปที่ต้องการฉีดวัคซีนเข็ม 1, 2, 3 และ 4 โดยไม่ต้องลงทะเบียนจองล่วงหน้า
รับวันละ 300 คน
เปิดให้บริการ เดือนเมษายน
▪️ ในวันที่ 7-8/21-22/28-29 เมษายน 2565
▪️ เวลา 12.30-14.30 น.
(ยกเว้นวันหยุดราชการและวันหยุดนักขัตฤกษ์)
ณ อาคารชุมนุมสัญญาบัตร กรมแพทย์ทหารอากาศ
Ep.2.2 “สัญญา Contract” LINK
สาระน่ารู้จากกฎหมายคุ้มครองข้อมูลส่วนบุคคล
Ep.2.2 “สัญญา Contract”
.
กรณีเป็นการเก็บรวบรวม ใช้ เปิดเผย
“ข้อมูลส่วนบุคคล (Personal Data)”
ที่จำเป็นเพื่อปฏิบัติตามคำขอ
ของเจ้าของข้อมูลส่วนบุคคล
เพื่อเข้าทำสัญญาหรือจำเป็นเพื่อปฏิบัติตามสัญญา
ระหว่างผู้ควบคุมข้อมูลส่วนบุคคลและ
เจ้าของข้อมูลส่วนบุคคล
.
เจ้าของข้อมูลส่วนบุคคล
จำเป็นต้องให้ข้อมูลส่วนบุคคลของตนและ
ผู้ควบคุมข้อมูลส่วนบุคคลจำเป็นต้องใช้ข้อมูลนั้น
ให้สามารถดำเนินการตามสัญญาต่อไปได้
ดังนั้น เมื่อเข้าหลักการเก็บรวบรวมข้อมูล
เพื่อปฏิบัติตามสัญญานี้แล้ว
จึงไม่ต้องขอความยินยอมเพิ่มเติมอีก
(มาตรา 24(3))
.
หลักการเรื่องสัญญานี้
ยังไม่เพียงพอตามกฎหมายที่จะนำไปเก็บรวบรวม
ใช้ หรือเปิดเผยข้อมูลอ่อนไหวตามมาตรา 26
จึงอาจต้องขอความยินยอมชัดแจ้ง
เว้นแต่เป็นกรณีสัญญาให้บริการทางการแพทย์
ที่เข้าเงื่อนไขตามกฎหมาย ตามมาตรา 26(5)(ก)
หรือกรณีตามข้อยกเว้นอื่นที่ไม่ต้องขอความยินยอม
ตามมาตรา 26
.
ตัวอย่าง
-การประมวลผลข้อมูลผู้สมัครบัตรเครดิต
ว่าจะอนุมัติบัตรเครดิตหรือไม่
-การประมวลผลที่อยู่ลูกค้าเพื่อจัดส่งสินค้า
-การประมวลผลบัญชีธนาคารลูกจ้างเพื่อจ่ายค่าจ้าง
2 ปีผ่านไป ประหยัดแล้ว 1.3 ล้านบาท
4 มกราคม 2565 ครบรอบ 2 ปี ที่รพ.บ้านตากได้ติดตั้งโซล่าเซลล์ รพ.บ้านตาก ได้กล่าวถึงความสำเร็จนี้ไว้ว่า
Bantak Hospital ขอกราบในความเมตตาของท่านเจ้าคุณ "พระปัญญาวชิรโมลี นพพร ",หลวงตาบุญช่วย จากวัดป่าภูริทัต จ.ปทุมธานี และพระเถระ ตลอดจนทุกๆท่านที่ร่วมทำบุญ"เปลี่ยนแสงจากฟ้า มาเป็นแสงแห่งบุญ ทำให้ รพ.บ้านตากประหยัดค่าไฟฟ้า 1.3 ล้านบาทและนำเงินส่วนนั้น มาปรับปรุง Smart ER ห้องฉุกเฉินอัจฉริยะความทันสมัย ซึ่งทำให้ผู้ป่วย/ผู้มารับบริการ ได้รับความสะดวกสบายและปลอดภัยขึ้น
เมื่อมีผู้ป่วยวัณโรคอยู่ในบ้านควรทำอย่างไร
เชื้อวัณโรคจัดเป็นกลุ่มเชื้อแบคทีเรียที่มีการเจริญเติบโตช้า อาการจึงอาจมาได้ช้า กว่าปอดอักเสบจากเชื้อแบคทีเรียชนิดอื่นๆ สามารถติดต่อผ่านทางเดินหายใจภายในปอดและต่อมน้ำเหลืองที่ขั้วปอด ซึ่งอาจส่งผลกระทบต่ออวัยวะอื่นๆ ทั่วร่างกาย เช่น ต่อมน้ำเหลืองที่คอ ตับ ม้าม กระดูกหรือเยื่อหุ้มสมอง
ศูนย์วิเคราะห์สุขภาพการนอนหลับ คณะแพทย์ศาสตร์ ม.เชียงใหม่ LINK
ศูนย์วิเคราะห์สุขภาพการนอน รับตรวจวิเคราะห์ความผิดปกติการนอนหลับด้วยขั้นตอนที่ได้มาตรฐาน มีการบันทึกสัญญาณโดยเครื่องตรวจและมีเจ้าหน้าที่ตรวจการนอนหลับเฝ้าติดตามอาการตลอดทั้งคืนเพื่อวิเคราะห์ภาวะผิดปกติเบื้องต้นและนำไปสู่แนวทางการรักษาอย่างถูกต้อง
- ตรวจการนอนหลับที่สมบูรณ์แบบ Polysomnography
- ห้องตรวจส่วนตัว
- ลักษณะอาการที่ควรตรวจ นอนเท่าไหร่ก็ไม่เต็มอิ่ม บางครั้งก็นอนหลับไม่สนิท ตื่นขึ้นมากลางดึกโดยไม่มีสาเหตุ ตื่นมาก็รู้สึกอ่อนเพลีย งัวเงียตลอดทั้งวัน
- มีเครื่อง CPAP
- ค่าบริการตรวจวิเคราะห์สุขภาพการนอนหลับ (สิทธิ์ ชำระเงิน) 15,100บาท
- ค่าบริการตรวจวิเคราะห์สุขภาพการนอนหลับ (สิทธิ์เบิกราชการและเบิกตรง รพ.มหาราชนครเชียงใหม่) ได้รับสิทธิเบิกตามกรมบัญชีกลางกำหนด ชำระส่วนเกิน 5,000บาท
- ค่าบริการผู้ป่วยนอก 250 บาท (เบิกได้* 50 บาท)
- ค่าบริการตรวจทางห้องปฏิบัติการ หรือรังสีวิทยา ครั้งละ 50บาท
***ไม่สามารถใช้สิทธิ์บัตรทอง ประกันสังคมได้***
เวลาเปิดทำการ
- นัดหมายเพื่อปรึกษาก่อนพบแพทย์ จันทร์ - ศุกร์ 08.00 น. - 16.00 น.
- เปิดให้บริการคลินิกผู้ป่วยนอก ชั้น 3 ศูนย์ความเป็นเลิศทางการแพทย์ อังคาร 14.30 น. - 16.00 น.
- เปิดให้บริการคลินิกผู้ป่วยนอก ชั้น 1 ศูนย์เวชศาสตร์ผู้สูงอายุ พุธ 17.00 น. - 20.00 น.
ติดต่อสอบถาม
โทรศัพท์ 053 920 660 หรือ 053 920 666
สถานที่ ชั้น 6 ตึกเวชศาสตร์ผู้สูงอายุ 444 หมู่ 6 ถ.เชียงใหม่-ฮอด ต.แม่เหียะ อ.เมืองเชียงใหม่ จ.เชียงใหม่
Line : sleeplab.cmu
การทำฟันปลอมในผู้สูงอายุ
การทำฟันปลอมในผู้สูงอายุมีทั้งหมด 3 แบบด้วยกัน คือ
1. การฝังรากฟันร่วมกับการใส่ฟันปลอมแบบถอดได้ จะฝังรากฟันเทียมประมาณ 2-4 ซี่ เพื่อช่วยพยุงฟันปลอมให้ติดแน่น และใช้งานได้ดีมากขึ้น
2.การฝังรากฟันเทียมร่วมกับฟันปลอมแบบติดแน่น จะฝังรากฟันเทียมประมาณ 8-10 ตัว ยึดติดด้วยฟันปลอมแบบติดแน่นบนรากฟันเทียม จะช่วยให้การบดเคี้ยวอาหารมีประสิทธิภาพมากยิ่งขึ้น โดยการฝังรากเทียมจำนวนหลายซี่ในผู้สูงอายุ จำเป็นอย่างยิ่งที่จะต้องประเมินสุขภาพของคนไข้ก่อนการรักษา และวางแผนการรักษาอย่างละเอียดด้วยเทคโนโลยีคอมพิวเตอร์
3.ฟันปลอมแบบถอดได้จะยึดติดกับสันเหงือกของคนไข้ หากปริมาณกระดูกลดลงอาจจะทำให้ฟันปลอมหลวม หรือกระดูก ไม่แนบเหมือนเดิม จำเป็นจะต้องเข้ามาพบทันตแพทย์เพื่อแก้ไข ทำให้ประสิทธิภาพในการบดเคี้ยว ไม่ดีเท่าที่ควร
ทันตแพทย์หญิงสุชาดา กล่าวว่า ด้วยเทคโนโลยีที่ก้าวหน้าในปัจจุบันทำให้การทำฟันไม่ใช่เรื่องน่ากลัวเช่นในอดีต ที่ “เดนทัล เวลเนส คลินิก” ใช้เทคโนโลยีดิจิทัล กำหนดจุดฝังรากเทียมได้ค่อนข้างแม่นยำ รวดเร็ว และมีแผลขนาดเล็ก รากฟันเทียมช่วยให้คุณภาพชีวิตผู้สูงวัยดีขึ้น เพราะเวลาเจ็บป่วยเราต้องการอาหารที่มีประโยชน์ช่วยให้ร่างกายแข็งแรง กลับมาใช้ชีวิตเหมือนเดิมได้เร็วที่สุด การทานอาหารที่ไม่เต็มที่จะทำให้ร่างกายยิ่งทรุดลง ฉะนั้นสุขภาพกายกับสุขภาพปากมันคือสิ่งเดียวกัน นอกจากนี้การทำรากฟันเทียม ยังช่วยเสริมสร้างความมั่นใจ เพราะไม่ต้องกังวลว่าฟันปลอมจะขยับหรือพูดไม่ชัด จึงช่วยเสริมสร้างความสุข เติมเต็มความมั่นใจให้กับผู้สูงอายุ
Kid program ตรวจสุขภาพหลังป่วยโควิด โรงพยาบาลไทยนครินทร์
kid program ตรวจ 6 รายการ ราคา 1,490 บาท
ได้แก่ พบแพทย์อายุรกรรม ตรวจความสมบูรณ์เม็ดเลือด ตรวจหาสารบ่งชื้การอักเสบ เอกซ์เรย์ปอด
สอบถามเพิ่มเติม ได้ที่ 02-3407777
เช็คสิทธิรักษา ด้วยตนเอง โทร 1330
ส่งเสริมการจ้างงานคนพิการ ในหน่วยงานของ กทม. [เศรษฐกิจดีสุขภาพดี]
ประโยชน์คนกรุงฯ
- คนพิการมีงานทำและมีรายได้อย่างมีศักดิ์ศรี
- ส่งเสริมการสร้างความเข้าใจและการอยู่รวมกันท่ามกลางความหลากหลายของกลุ่มคน
รายละเอียด
กฎกระทรวงกําหนดจํานวนคนพิการที่นายจ้างหรือเจ้าของสถานประกอบการและหน่วยงานของรัฐจะต้องรับเข้าทํางาน และจํานวนเงินที่นายจ้างหรือเจ้าของสถานประกอบการจะต้องนําส่งเข้ากองทุนส่งเสริมและพัฒนาคุณภาพชีวิตคนพิการ พ.ศ. 2554 โดยต้องรับคนพิการเข้าทำงาน 1 ต่อ 100 ของจำนวนผู้ปฏิบัติงาน [1] ปี 2563 กทม.มีการจ้างงานคนพิการเข้าทำงานแล้ว 100 คน [] แต่ยังไม่ครบตามที่กฎหมายกำหนด ข้าราชการ พนักงานและลูกจ้าง กทม. รวมแล้วประมาณ 80,000 คน กทม.จะต้องจ้างงานคนพิการเข้าทำงานอย่างน้อยอีกกว่า 700 ตำแหน่ง จึงจะปฏิบัติตามกฎหมาย
ดังนั้น กทม.จะส่งเสริมการจ้างงานอย่างเท่าเทียมกัน โดรจ้างให้เต็มอัตราหรือจ้างให้มากที่สุด ในตำแหน่งต่าง ๆ อย่างไม่มีการกีดกัน
5.ทัศนคติต่อสถานการณ์ปัจจุบันและอนาคต
ความสุขลดลงแต่ยังคงมีหวัง ช่วงนี้มีหลายเหตุการณ์ที่รุมเร้าและสะเทือนขวัญคนไทย ไม่ว่าจะเป็นเรื่องโควิดที่ยังคงพุ่งสูง รวมไปถึงคดีความต่างๆ ยังทำเป็นตัวแปรสำคัญที่บั่นทอนความสุขให้ลดลง คนไทยคาดหวังว่าจะไม่มีอะไรแย่ไปกว่านี้ใน 3 เดือนข้างหน้า
ประกาศหลักเกณฑ์การตรวจค้นของเหลว เจล สเปรย์ (LAGs) พ.ศ. 2562
ประกาศสำนักงานการบินพลเรือนแห่งประเทศไทย (กพท.) เรื่องหลักเกณฑ์การตรวจค้นของเหลว เจล สเปรย์ (LAGs) ที่จะนำขึ้นห้องโดยสารอากาศยาน หรือนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะ พ.ศ. 2562 [
pdf]
ประกาศนี้ให้ยกเลิกประกาศกรมการขนส่งทางอากาศ เรื่อง ข้อกำหนดเกี่ยวกับการนำของเหลว เจล สเปรย์ หรือวัตถุและสารอื่นๆซึ่งมีลักษณะคล้ายดลึงกันขึ้นในห้องโดยสารอากาศยาน ประกาศ ณ วันที่
8 พฤษภาคม พ.ศ. 2550
ให้ใช้นิยามใหม่แทน ดังนี้
ข้อ 4 ในประกาศนี้
"ของเหลว เจล สเปรย์" หมายความรวมถึง ของเหลวในรูปแบบต่าง ๆ เช่น น้ำ เครื่องดื่ม ซุป น้ำเชื่อม แยม สตูว์ ซอส น้ำพริก หรืออาหารอย่างอื่นที่อยู่ในซอส หรือที่มีส่วนประกอบเป็นของเหลวในปริมาณมาก ตลอดจนครีม โลชั่น เครื่องสำอาง น้ำมัน น้ำหอม หรือเจลในรูปแบบต่าง ๆ เช่น ยา ยาสีฟัน อาหาร ยาสระผม เจลอาบน้ำ หรือวัตถุหรือสารที่บรรจุในบรรจุภัณฑ์ที่มีแรงตันและต้องฉีดพ่นเพื่อนำออกมาใช้ เช่น สเปรย์ โฟม รวมถึงวัตถุหรือสารที่มีส่วนผสมของของแข็งและของเหลว เช่น มาสคารา สิปสติกหรือลิปบาล์ม
ข้อ 5 ให้ผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะตรวจค้นของเหลว เจล สเปรย์ ที่จะนำขึ้นยนห้องโดยสารอากาศยานหรือนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะ ตามหลักเกณฑ์และเงื่อนไขที่กำหนดไว้ในประกาศนี้
ข้อ 6 ของเหลว เจล สเปรย์ที่ผู้โดยสารจะนำขึ้นบนห้องโดยสารอากาศยานหรือนำเข้าไปในเขตหวงห้ามของสนามนินสาธารณะต้องเป็นไปตามหลักเกณฑ์และเงื่อนไข ดังต่อไปนี้
(1) ของเหลว เจล สเปรย์ แต่ละชิ้นต้องอยู่ในบรรจุภัณฑ์ที่ปิดสนิทและมีปริมาตรไม่เกิน 100 มิลลิลิตร หรือในหน่วยวัดปริมาตรอย่างอื่นที่เท่ากัน
(2) บรรจุภัณฑ์ที่จะใช้บรรจุของเหลว เจล สเปรย์ ตาม (1) ต้องมีปริมาตรที่รองรับของเหลว เจล สเปรย์ได้ไม่เกิน 100 มิลลิลิตร และต้องมีข้อความระบุปริมาตรของบรรจุภัณฑ์ ไม่ว่าบรรจุภัณฑ์นั้นจะบรรจุของเหลว เจล สเปรย์ไว้เพียงบางส่วนก็ตาม
(3) ผู้โดยสารสามารถนำของเหลว เจล สเปรย์ ตาม (1) ขึ้นบนห้องโดยสารอากาศยานหรือนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะได้มากกว่า 1 ชิ้น แต่ต้องมีปริมาตรรวมกันสูงสุดไม่เกินคนละ 1,000 มิลลิลิตร
ในกรณีตาม (3) ผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะอาจกำหนดมาตรการเพิ่มเติม ให้ผู้โดยสารนำของเหลว เจล สเปรย์ใส่รวมในถุงพลาสติกใสที่สามารถปิดผนึกได้ (Transparent Re-Sealable Plastic Bag) หรือในบรรจุภัณฑ์อื่นที่มีลักษณะเดียวกัน และต้องปีดผนึกปากถุงให้เรียบร้อย โดยให้สามารถนำไปได้คนละ 1 ถุง โดยไม่นับรวมอยู่ในจำนวนสัมภาระติดตัวที่ผู้ดำเนินการเดินอากาศแต่ละรายอนุญาตให้นำขึ้นบนห้องโดยสารอากาศยานได้
ข้อ 7 ผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะต้องกำหนดมาตรการตรวจค้นของเหลว เจล สเปรย์ ที่จะนำขึ้นบนห้องโดยสารอากาศยานหรือนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะตามข้อ 6 โดยแยกบรรจุภัณฑ์หรือถุงพลาสติกใสออกจากสัมภาระติดตัวอื่น ๆ ที่จะนำขึ้นบนห้องโดยสารอากาศยานหรือนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะ เพื่อให้พนักงานตรวจค้นทำการตรวจค้นของเหลว เจล สเปรย์ ณ บริเวณจุดตรวจค้นเพื่อการรักษาความปลอดภัย (Security Screening Point) เป็นการเฉพาะแยกต่างหากจากสัมภาระติดตัวอย่างอื่น เว้นแต่มีอุปกรณ์ที่ใช้ในการตรวจค้น เช่น X-ray Screening หรือวิธีการอื่นใดที่สามารถตรวจพบของเหลว เจล สเปรย์ ได้
ข้อ 8 ความในข้อ 6 ไม่นำมาใช้บังคับในกรณีดังต่อไปนี้
(1) ของเหลว เจล สเปรย์ ประเภทยาให้มีใบรับรองแพทย์ ฉลาก หรือเอกสารกำกับยาที่ระบุชื่อผู้โดยสารซึ่งมีความจำเป็นต้องใช้ยานั้น เว้นแต่เป็นยาสามัญประจำบ้านตามประกาศกระทรวงสาธารณสุข รวมถึงอาหารหรือนมสำหรับเด็กทารก อาหารที่ต้องพกพาตามข้อกำหนดทางการแพทย์หรือเพื่อวัตถุประสงค์ทางโภชนาการในปริมาณที่เหมาะสมกับระยะเวลาการเดินทางในแต่ละเที่ยวบิน ทั้งนี้ ผู้โดยสารต้องแสดงให้พนักงานตรวจค้น ณ บริเวณจุดตรวจค้นเพื่อการรักษาความปลอดภัย (Security Screening Point) เพื่อทำการตรวจสอบ
(2) ของเหลว เจล สเปรย์ ที่ผู้ประจำหน้าที่หรือผู้ปฏิบัติงานบนห้องโดยสารอากาสยานจะนำขึ้นอากาศยาน หรือที่บุคคลนำเข้าไปในเขตหวงห้ามของสนามบินสาธารณะนำไปใช้ส่วนตัวในปริมาณเท่าที่จำเป็น ในระหว่างปฏิบัติหน้าที่และเหมาะสมกับระยะเวลาการปฏิบัติงานจริง (Operating Hours) ทั้งนี้ บุคคลดังกล่าวต้องแสดงให้พนักงานตรวจค้น ณ บริเวณจุดตรวจคันเพื่อการรักษาความปลอดภัย (Security Screening Point) เพื่อทำการตรวจสอบ
(3) ของเหลว เจล สเปรย์ ที่ผู้ปฏิบัติงานในสนามบิน ผู้ได้รับอนุญาตให้เข้าไปในเขตหวงห้ามหรือผู้ปฏิบัติงานในกรณีฉุกเฉินนำเข้าไปใช้ในการปฏิบัติหน้าที่ ทั้งนี้ บุคคลดังกล่าวต้องแสดงให้พนักงานตรวจค้น ณ บริเวณจุดตรวจค้นเพื่อการรักษาความปลอดภัย (Security Screening Point) เพื่อทำการตรวจสอบ
(4) ของเหลว เจล สเปรย์ ซึ่งผู้โดยสารซื้อจากร้านค้าปลอดอากร (Duty Free Shop) ภายในสนามบินหรือบนห้องโดยสารอากาศยาน แต่จะต้องบรรจุไว้ในถุงพลาสติกที่สามารถบ่งชี้ร่องรอยการแกะหรือการเปิดปากถุง (Security Tampered-Evident Bags : STEBs) โดยต้องปิดผนึก (Sealed) เรียบร้อยและไม่มีร่องรอยการแกะหรือการเปิดปากถุงหลังจากซื้อ และมีหลักฐานแสดงว่าได้ซื้อในวันที่ผู้โดยสารเดินทาง ทั้งนี้ ผู้โดยสารเปลี่ยนลำ (Transfer Passenger) หรือผู้โดยสารผ่าน (Transit Passenger) ต้องแสดงให้พนักงานตรวจค้น ณ บริเวณจุดตรวจค้นเพื่อการรักษาความปลอดภัย (Security Screening Point เพื่อทำการตรวจสอบ
เพื่อประโยชน์ของผู้โดยสาร ก่อนซื้อสินค้าปลอดอากร ผู้โดยสารต้องตรวจสอบข้อมูลจากร้านค้าปลอดอากรภายในสนามบินหรือบนห้องโดยสารอากาศยานเกี่ยวกับกฎเกณฑ์การปฏิบัติต่อของเหลว เจล สเปรย์ ณ สนามบินปลายทางของการเดินทางและสนามบินทุกแห่งที่ผู้โดยสารต้องลงจากอากาศยานเพื่อแวะพักหรือเปลี่ยนลำอากาศยาน
ข้อ 9 ของที่มีส่วนประกอบเป็นของเหลว เจล สเปรย์ในปริมาณมากที่ผู้โดยสารนำติดตัวมาเป็นสัมภาระหรือซื้อมาจากร้านค้าภายนอกสนามบินหรือร้านค้าภายในสนามบินก่นเข้าจุดตรวจค้นเพื่อการรักษาความปลอดภัย (Security Screening Point) ผู้โดยสารต้องส่งมอบให้ผู้ดำเนินการเดินอากาศเพื่อจัดเก็บเป็นสัมภาระลงทะเบียนเท่านั้น
ข้อ 10 ภายใต้การประเมินความเสี่ยงด้านการรักษาความปลอดภัยการบินพลเรือนของผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะ ผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะอาจปรับเพิ่มความเข้มงวดของหลักเกณฑ์และวิธีการตามข้อ 6 ข้อ 7 หรือข้อ 8 ให้สอดคล้องกับระดับภัยคุกคามได้
ข้อ 11 ให้ผู้ได้รับใบรับรองการดำเนินงานสนามบินสาธารณะจัดให้มีการประชาสัมพันธ์การนำของเหลว เจล สเปรย์ขึ้นบนห้องโดยสารอากาศยานหรือเข้าเขตพื้นที่หวงห้ามของสนามบินสาธารณะ ให้กับผู้โดยสาร ผู้ประจำหน้าที่ ผู้ปฏิบัติงานบนห้องโดยสารอากาศยาน เจ้าหน้าที่ผู้ปฏิบัติงานในสนามบิน ผู้ที่ได้รับอนุญาตให้เข้าไปในเขตพื้นที่หวงห้าม รวมถึงบุคคลใด ๆ ทราบ ณ บริเวณที่เห็นได้ชัดเจนภายในอาคารผู้โดยสาร เช่น จุดแสดงตนเพื่อรับบัตรโดยสาร จุดตรวจค้นเพื่อการรักษาความปลอดภัย รวมทั้งช่องทางอื่นใดเพื่อให้ทราบล่วงหน้าก่อนเข้าพื้นที่หวงห้ามของสนามบินสาธารณะ
ประกาศ ณ วันที่ 23 เมษายน พ.ศ. 2562
(นายจุฬา สุขมานพ)
ผู้อำนวยการสำนักงานการบินพลเรือนแห่งประเทศไทย
ขั้นตอนจดแจ้ง
โดยจดแจ้งง่ายสุดๆ 3 ขั้นตอน
1. ลงทะเบียน
2. จดแจ้งตามวัตถุประสงค์
3. รับเอกสารจดแจ้งอิเล็กทรอนิกส์
การจดแจ้งนี้ จะทำให้ทราบจำนวนและแหล่งที่ปลูกกัญชา และกัญชงทั่วประเทศ
อีกทั้ง ยังเป็นแหล่งข้อมูลให้ผู้ประกอบการแสวงหาวัตถุดิบเพื่อนำไปผลิตเป็นผลิตภัณฑ์ที่มีคุณภาพมาตรฐานออกสู่ตลาด เป็นการเพิ่มทางเลือกให้กับผู้บริโภค และเป็นการกระตุ้นเศรษฐกิจตามนโยบายรัฐบาลอีกด้วย
พร้อมกันนี้ อย. ได้อบรมเจ้าหน้าที่สำนักงานสาธารณสุขจังหวัด กรุงเทพมหานคร และ องค์การบริหารส่วนจังหวัดทั่วประเทศ เพื่อสร้างความเข้าใจแก่ประชาชนในการจดแจ้งปลูกกัญชา กัญชง ผู้สนใจสามารถรับชมวีดีโอวิธีการจดแจ้งผ่านแอปพลิเคชันหรือจดแจ้งผ่านเว็บไซต์ของ อย.
หากมีข้อสงสัยสอบถามได้ที่ call center โทร 1556 กด 3 รองเลขาธิการฯ กล่าวในที่สุด
เขตสุขภาพที่ 12
ตรัง
- รพ.กันตัง รพช. 075-251256 อ. ศ. 09.00 - 12.00 น.
- รพ.ตรัง รพศ 091-826-8903 ศุกร์ 13.30-16.30 น.
- รพ.นาโยง รพช. 075-299099
- รพ.ย่านตาขาว รพช.
- รพ.สต.เขาขาว รพ.สต.
- รพ.สต.ควนปริง รพ.สต.
- รพ.สต.โคกหล่อ รพ.สต.
- รพ.สต.ท่างิ้ว รพ.สต.
- รพ.สต.นาท่ามเหนือ รพ.สต.
- รพ.สต.น้ำผุด รพ.สต. 075 259 115 ศ. 13.00 - 16.00 น.
- รพ.สต.บ้านควนเคี่ยม รพ.สต.
- รพ.สต.บ้านนาวง รพ.สต.
- รพ.สต.บ้านพรุจูด รพ.สต.
- รพ.สต.ปากแจ่ม รพ.สต.
- รพ.สต.ลำภูรา รพ.สต.
- รพ.สต.หนองช้างแล่น รพ.สต. พ. ศ. 13.00 - 16.00 น.
- รพ.สต.ห้วยนาง รพ.สต.
- รพ.ห้วยยอด รพช. 0 7523 3034 ศ. 08.30 - 16.30 น. เว้นวันหยุดนักขัตฤกษ์
- รพ.หาดสำราญเฉลิมพระเกียรติ 80 พรรษา รพช. 075 208 838 อ. 13.00 - 16.30 น.
สงขลา
- รพ.กระแสสินธุ์ รพช. 0 7439 9023 ทุกวัน 08.30 - 15.00 น.
- รพ.การแพทย์แผนไทย มหาวิทยาลัยสงขลานครินทร์ ก.ศึกษา 074-282-710
- รพ.คลองหอยโข่ง รพช. 0 7447 3488 พ. 13.00 - 16.30 น.
- รพ.ควนเนียง รพช. 074-386646 พฤหัสบดี 13.00 - 16.30 น.
- รพ.จะนะ รพช. 074-207-070 รอยืนยัน
- รพ.จิตเวชสงขลานครินทร์ รพ.สังกัดกรม 074-324-868-9 ต่อ 518 พุธ 13.00-16.00 น.
- รพ.เทพา รพช. 074-376-359 n/a
- รพ.นาหม่อม รพช. 074 593 774 พฤหัสบดี 13.00 - 16.00 น.
- รพ.บางกล่ำ รพช. 074-328-221 ต่อ 68 ทุกพุธ 13.00 - 16.30
- รพ.ปาดังเบซาร์ รพช. 0 7452 1485 ศ. สัปดาห์ที่ 1 กับ 3 ของเดือน เวลา 08.30 - 12.00 น.
- รพ.ระโนด รพช. 074-392174 อังคาร 13.00 - 16.00 น.
- รพ.รัตภูมิ รพช. 074-395-234 อังคารกับพฤหัส 08.30-12.00 น.
- รพ.สงขลา รพท 074-321-195, 074-338-100 ศุกร์ 13.00 - 16.00 น.
- รพ.สต.ท่าบอน รพ.สต. 074 587 635 อ. พฤ. 09.00 - 15.00 น.
- รพ.สต.ทุ่งตำเสา รพ.สต. 0 7480 2368 จ. อ. 08.30 - 16.30 น.
- รพ.สต.เปียน รพ.สต. 08 4966 6527 ทุกวันจันทร์ ที่ 1 และ 4 ของเดือน เวลา 08.30 - 12.00 น.
- รพ.สทิงพระ รพช. 074 397 112 ศุกร์ 13.00-16.30 น.
- รพ.สมเด็จพระบรมราชินีนาถ ณ อำเภอนาทวี รพช. 074 373 080 และ 064 034 2494 ศุกร์ ที่ 2 และ 4 13.00-16.30 น.
- รพ.สะเดา รพช. 074-379-995 ต่อ 410 และ 084 2671735 ทุกวันศุกร์ 13.00 - 16.00 น.
- รพ.สะบ้าย้อย รพช. 065-062-5846 จันทร์ - ศุกร์ 08.30 - 16.00 น.
- รพ.สิงหนคร รพช. 074-330-539 ศุกร์ 13.00 - 16.00 น.
- รพ.หาดใหญ่ รพศ 074-273-240 จันทร์ และศุกร์ 09.00 - 15.00 น.
- สอน.เฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ต.พะตง รพ.สต. 0 7429 1485 พ. และ ศ. 08.30 - 16.30 น.
พัทลุง
- รพ.การแพทย์แผนไทยและการแพทย์ผสมผสาน เขตสุขภาพที่ 12 จังหวัดพัทลุง รพ.สังกัดกรม 0 7460 0036 จ. พ. 08.30 - 12.00 น.
- รพ.ควนขนุน รพช. 074-682-071 พ 13.00-16.30 น.
- รพ.บางแก้ว รพช. 0 7469 7381-3 ศ. 08.30 - 11.30 น.
- รพ.ปากพะยูน รพช. 074-699-023 อังคาร 8.30-12.0
- รพ.ป่าบอน รพช. 074-841-600 ต่อ 148 074-841-634-5 ศุกร์ 08.30 - 12.00 น.
- รพ.ป่าพะยอม รพช. 0 7462 4163-4 รอยืนยัน
- รพ.พัทลุง รพท 074-613-008 อ. 08.30 น.–16.30 น.
- รพ.สต.บ้านนาปะขอ รพ.สต. พฤ. 08.30 - 12.00 น.
- รพ.สต.บ้านแพรกหา รพ.สต. 0 7464 3279 พฤ. 13.30 - 16.30 น.
สตูล
- รพ.ควนกาหลง รพช. 0 7473 7102-4 พ. ที่ 2 ของเดือน 13.00 - 16.30 น.
- รพ.ทุ่งหว้า รพช. 074-789-165-6 รอยืนยัน
- รพ.ละงู รพช. 074-773-563 ต่อ 121 098-671-7039 จันทร์สัปดาห์ที่ 2 และ 4 ของเดือน
- รพ.สต.ทุ่งนุ้ย รพ.สต. 074 797 088 ทุกวันในเวลาราชการ 08.30 - 16.30 น.
- รพ.สตูล รพท 074-725-241 พุธ สัปดาห์ที่ 2 และ 4 ของเดือน 13.00 - 16.30 น.
- สอน.นิคมพัฒนา อ.มะนัง รพ.สต. 074-750-884 จ. - ศ. 08.30 - 16.30 น.
ยะลา
- รพ.กรงปินัง รพช. 073-238 039 ศุกร์ 13.30-15.30 น.
- รพ.กาบัง รพช. 073-258-090 ศุกร์ ที่2,4 ของเดือน 13.30-16.30 น.
- รพ.ธารโต รพช. 073-297-041 ทุกวันจันทร์ 13.00 - 15.00 น.
- รพ.บันนังสตา รพช. 073-289 142 พ 13.00-16.00 น.
- รพ.เบตง รพท 073-234 078 พ. 13.30 - 16.00 น.
- รพ.ยะลา รพศ 073-244 710 - 9 ศุกร์ 08.00-12.00
- รพร.ยะหา รพช. 073-291-023, 073-291-166 จันทร์ 09.00 -12.00 น.
- รพ.รามัน รพช. 073-299503-4 พ. - พฤ. 09.00 - 16.00 น.
ปัตตานี
- รพ.กะพ้อ รพช. 098-0100027 พ. 08.30 - 12.00 น.
- รพ.โคกโพธิ์ รพช. 073-431-313 พุธ 08.30 - 12.00 น.
- รพ.ทุ่งยางแดง รพช. 073-489070 ต่อ 130 อ. 08.30 - 12.00 น.
- รพ.ปะนาเระ รพช. 073-499 063 ศุกร์ 08.30-12.00 น.
- รพ.ปัตตานี รพท 073-711 010 รอยืนยัน
- รพ.มายอ รพช. 073-497-248 อ. 13.00 - 16.30 น.
- รพ.แม่ลาน รพช. 073-35 6176 จ. 13.00 - 16.30 น.
- รพ.ไม้แก่น รพช. 073-481-040 อ. 08.30 -12.00 น.
- รพ.ยะรัง รพช. 073-439-018 อ. 13.00 - 16.00 น.
- รพ.ยะหริ่ง รพช. 073-491-013 พ. เวลา 13.00 - 16.30 น.
- รพร.สายบุรี รพช. 073-411-412 ต่อ 4 พุธ 13.00 - 16.00 น.
- รพ.หนองจิก n/a
นราธิวาส
- รพ.เจาะไอร้อง รพช. 073-544 073
- รพ.ตากใบ รพช. 073-581 200
- รพ.นราธิวาสราชนครินทร์ รพท 073-510-997 ศุกร์ ที่ 2 และ 4 ของเดือน 08.00-12.00 น.
- รพ.ระแงะ รพช. 073-671 287
- รพ.แว้ง รพช. 073-659 008
- รพ.ศรีสาคร รพช. 073-561 145
- รพ.สต.กะลุวอเหนือ รพ.สต. 073-542036, 081-0977382 ศ. สัปดาห์ที่ 2 กับ 4 ของเดือน
- รพ.สต.มูโนะ รพ.สต. 073-621 190 ศ. 08.30 - 16.30 น.
- รพ.สุคิริน รพช. 073-709108,073-709109,073-709110
- รพ.สุไหงโก-ลก รพท 073-517-500 พุธ 13.00-16.00 น.
- รพ.สุไหงปาดี รพช. 073-651 169
หลักสูตรวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ - รศ.ดร.ศิริรัตน์ หิรัญรัตน์
รองศาสตราจารย์ ดร.ศิริรัตน์ หิรัญรัตน์ ผู้อำนวยการโรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ บรรยายถึงภาพรวมของหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ ซึ่งเป็นหลักสูตรใหม่แห่งแรกของประเทศไทย ใช้เวลาศึกษา 4 ปี ทั้งภาคทฤษฎีและปฏิบัติ
ในภาคทฤษฎีประกอบด้วยวิชาหลักที่เกี่ยวข้องกับการเคลื่อนไหว เช่น กายวิภาคศาสตร์ ชีวกลศาสตร์ สรีรวิทยาการออกกำลังกาย จิตวิทยา โภชนาการ เป็นต้น
ในส่วนการฝึกภาคปฏิบัติจะเริ่มฝึกประสบการณ์ในการทำงานจริงตั้งแต่ชั้นปีที่ 3 ซึ่งต้องฝึกงานทั้งในโรงพยาบาลจุฬาภรณ์ สถานออกกำลังกายทั้งภายในโรงพยาบาลจุฬาภรณ์ และภายนอก เช่น หน่วยงานภาครัฐและเอกชน สโมสรกีฬา ทั้งเพื่อสุขภาพ และเพื่อนักกีฬาชั้นเลิศ และทีมกีฬาอาชีพ เช่น ทีมฟุตบอล วอลเลย์บอล เป็นต้น
นอกจากนี้นักศึกษาต้องมีงานวิจัยเพื่อสร้างนวัตกรรมและปฏิบัติงานจิตอาสาเพื่อชุมชนในระหว่างการศึกษาอีกด้วย
ทั้งนี้ ในกิจกรรมการเยี่ยมชม ห้องชีวกลศาสตร์ มี คุณบิ๊ก ทองภูมิ สิริพิพัฒน์ เป็นแขกรับเชิญในการทดสอบการวิเคราะห์ท่าทางการเคลื่อนไหวแบบ 3 มิติ (3D-Dimension Movement Analysis) เป็นการวิเคราะห์ท่าทางโดยมีการติดเครื่องหมายสะท้อนแสงที่ปุ่มกระดูกหรือข้อต่อ และใช้กล้องบันทึกภาพการเคลื่อนไหว จากนั้นใช้โปรแกรมเฉพาะเพื่อวิเคราะห์ตัวแปรทางคิเนเมติกส์และคิเนติกส์ของการเคลื่อนไหว เช่น มุมองศาของข้อต่อ ความเร็วเชิงเส้น เชิงมุมของข้อต่อ และแรงปฏิกิริยาในแนวดิ่งจากพื้น เป็นต้น เพื่อประเมินและวางแผนในพัฒนาการฝึกซ้อมของนักกีฬาให้มีพัฒนาการที่ดีมากยิ่งขึ้น
แนวปฏิบัติผู้ติดเชื้อโควิด-19 สิทธิประกันสังคม มาตรา 33 และ มาตรา 39 LINK
ติดต่อ สายด่วน ประกันสังคม 1506 ตลอด 24 ชั่วโมง
หากตรวจโควิดขึ้น 2 ขีด
1. รักษาตามแนวทาง เจอ แจก จบ (ผู้ป่วยนอก)
หากอาการไม่รุนแรง (สีเขียว) รักษาแบบ OP - self isolation (รักษาแบบผู้ปวยนอกกักตัว) หรือ เจอ แจก จบ โดย ติดต่อ สถานพยาบาลประกันสังคม/รพ.รัฐ/รพ.เอกชนที่ร่วมให้บริการ / คลินิกและร้านยา ที่ขึ้นทะเบียนกับ สปสช (บัตรทอง) ฟรี
2. กรณีจำเป็นต้องรักษาแบบ ผู้ป่วยใน
ตามดุลยพินิจแพทย์ ของสถานพยาบาลประกันสังคม จะเข้ารักษา ฟรี
3. เจ็บป่วยฉุกเฉิน สีเหลือง-แดง
อาการ ได้แก่ หอบเหนื่อหนักมาก พูดไม่เป็นประโยค แน่นหน้าอก หายใจเจ็บหน้าอก ปอดอักเสบรุนแรง อ่อนเพลีย ตอบสนองช้า ไม่รู้สึกตัว มีภาวะช็อค/โคม่า ซึมลง ไข้สูงกว่า 39 องศา ค่าอ๊อกซิเจนต่ำกว่า 94
หากเข้าเกณฑ์คัดแยกผู้ป่วย สีเหลือง-แดง ใช้สิทธิ UCEP Plus ณ รพ.รัฐ-เอกชน ทุกแห่ง ไม่เสียค่าใช้จ่าย
สถานเอกอัครราชทูต ณ กรุงพนมเปญ เตือนคนไทย
สถานเอกอัครราชทูต ณ กรุงพนมเปญ เตือนคนไทย กัญชาผิดกฏหมายกัมพูชา ทุกกรณี - ปลูก สกัด/แปรรูป/ครอบครอง/ลำเลียง/จำหน่าย ให้เสพ - ต้นกัญชา ยางกัญชา น้ำมันกัญชา โทษสูงสุดจำคุกตลอดชีวิต ปรับ 100 ล้านเรียล (25,000 USD, 900,000 บาท)
เช็คให้ชัวร์ก่อนรับบริการทางการแพทย์ ลดเสี่ยง
ถนนธนบุรี-ปากท่อ LINK
เดิม ยอดสุวรรณ
ถนนธนบุรี-ปากท่อ สายนี้ในอดีต ปัจจุบันคือถนนอะไรครับ
ขอบคุณเจ้าของภาพครับ
เทศกาลลูกชิ้นสมุทรสาคร 11 - 14 สิงหาคม 2565 LINK
ททท.สำนักงานสมุทรสงคราม ขอเชิญชวนนักชิมทุกท่านเที่ยวงาน “Sakhon Fish Ball Festival เทศกาลลูกชิ้นสมุทรสาคร” ระหว่างวันที่ 11 - 14 สิงหาคม 2565 ตั้งแต่เวลา 11.00 น. ถึง 22.00 น. ณ บริเวณริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร ตำบลมหาชัย อำเภอเมืองฯ จังหวัดสมุทรสาคร
จัดโดยจังหวัดสมุทรสาคร ร่วมกับองค์การบริหารส่วนจังหวัดสมุทรสาคร ททท.สำนักงานสมุทรสงคราม หน่วยงานภาครัฐและเอกชน ได้กำหนดจัดงานงาน “Sakhon Fish Ball Festival เทศกาลลูกชิ้นสมุทรสาคร” ขึ้นในระหว่างวันที่ 11 - 14 ส.ค. 2565 ตั้งแต่เวลา 11.00 น. ถึง 22.00 น. ณ บริเวณริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร ตำบลมหาชัย อำเภอเมืองฯ จังหวัดสมุทรสาคร
ภายในงาน พบกับการรวมตัวของผู้ประกอบการโรงงานลูกชิ้นยี่ห้อดัง มากกว่า 30 บริษัท รวมถึงน้ำจิ้มยี่ห้อดัง อาทิ สุรีย์, พันท้ายนรสิงห์ มาร่วมสร้างความยิ่งใหญ่ในงานนี้
เขตบางซื่อ ตรวจติดตามสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ LINK
9 สิงหาคม 2565 นายโกศล สุนทรพฤกษ์ ผู้อำนวยการเขตบางซื่อ มอบหมายนางสาวอรอนงค์ น้อยเสวก ผู้ช่วยผู้อำนวยการเขตบางซื่อ นำทีมเจ้าหน้าที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เจ้าหน้าที่ฝ่ายโยธา เจ้าหน้าที่ฝ่ายเทศกิจ ร่วมกับเจ้าหน้าที่สถานีดับเพลิงบางโพ เจ้าหน้าที่สถานีดับเพลิงบางซ่อน เจ้าหน้าที่ตำรวจสน.เตาปูน และเจ้าหน้าที่ทหารพัน.สห.11 ลงพื้นที่ตรวจติดตามสถานบริการและสถานประกอบการที่มีลักษณะคล้ายสถานบริการ สถานบันเทิง ผับ บาร์ คาราโอเกะ ให้ปฏิบัติตามมาตรการป้องกันโรคตามที่ทางราชการกำหนด ตามประกาศกรุงเทพมหานคร เรื่อง มาตรการเฝ้าระวัง ป้องกัน และควบคุมการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) ลงวันที่ 24 มิถุนายน 2565 เพื่อป้องกันและลดการแพร่ระบาดของโรคโควิด-19
ทั้งนี้ได้สุ่มตรวจคัดกรองหาเชื้อโควิด-19 ของพนักงานในสถานประกอบการ ด้วยวิธี Antigen Test Kit (ATK)
ตรวจแนะนำด้านความปลอดภัยของอาคาร ตรวจระบบป้องกันอัคคีภัย โดยตรวจสอบทางหนีไฟ ไฟฉุกเฉิน และความพร้อมของอุปกรณ์ดับเพลิง
ศูนย์ฯ 1 สะพานมอญ บริการฉีดวัคซีนป้องกันโควิดทุกเข็ม แก่ประชาชนทั่วไป ทุกสัญชาติ จองผ่านแอป QueQ
สามารถลงทะเบียนฉีดวัคซีนป้องกันโควิด 19 ผ่านแอป QueQ
เข็ม 1, เข็ม 2, เข็ม 3 และเข็มกระตุ้นหลังติดเชื้อ ให้แก่ประชาชนทั่วไป ทุกสัญชาติ
ผ่านแอป QueQ
ขั้นตอนการลงทะเบียน
1. สแกน QR Code ดาวน์โหลดแอป
2. เลือก "ศูนย์ฉีดวัคซีน กทม"
3. เลือกสถานที่เข้ารับบริการ " เขตพระนคร "
4. เลือก " ศูนย์บริการสาธารณสุข 1 สะพานมอญ "
5. กรอกข้อมูลเลขบัตรประชาชน
6. เลือกวันที่ และเวลา กดยืนยัน
** ให้บริการฉีดวัคซีน เฉพาะวันศุกร์ (ยกเว้นวันหยุดนักขัตฤกษ์)
ทั้งนี้ประชาชนที่ลงทะเบียนผ่านแอพ QueQ เรียบร้อยแล้ว
สิ่งที่ต้องนำมาในวันฉีดวัคซีน
1. บัตรประจำตัวประชาชน/บัตรอื่นๆ ที่ใช้ยืนยันตัวตน เช่น passport
2. หลักฐานการจองคิวผ่านแอพ QueQ
3. หลักฐานรับรองการได้รับวัคซีนป้องกันโรคโควิด 19 หรือใบรับรองแพทย์ว่าเคยติดเชื้อโควิด 19 สำหรับผู้ที่ลงทะเบียนฉีดวัคซีนเข็มที่ 2 , เข็มที่ 3 หรือเข็มกระตุ้นหลังติดเชื้อ
4. ปากกาส่วนตัว
ติดต่อสอบถามข้อมูลเพิ่มเติม 02-2227874,02-2265897
About Hakuhodo Institute of Life and Living ASEAN (Thailand)
Hakuhodo Institute of Life and Living ASEAN (Thailand) conducts the Thailand Consumption Forecast survey every two months. The Thailand Consumption Forecast (August 2022) was conducted from June 20-28, 2022.
The survey studied the future trends and consumption behaviors of Thais through quantitative and qualitative questionnaires given to 1,200 male and female participants aged 20-59 years from six regions nationwide.
Founded in 2014, Hakuhodo Institute of Life and Living ASEAN, is the Hakuhodo Group’s new think tank in the ASEAN region. It is dedicated to helping companies with their marketing efforts in ASEAN countries, as well as observing the new lifestyles emerging.
Here at Hakuhodo, we describe people not simply as consumers but as fully rounded individuals with their own hearts, souls, lifestyles, aspirations, and dreams. Hakuhodo focuses its studies on Sei-katsu-sha – the term for the “life living person” – which is the centerpiece of Hakuhodo’s philosophy.
12.ไทยมุ่งพัฒนาวัคซีนโควิด-19 อย่างต่อเนื่อง
ปัจจุบันไทยเป็นฐานการผลิตวัคซีนแอสตร้าเซเนก้าที่สำคัญแห่งหนึ่งในเอเซีย จากโรงงานสยามไบโอไซเอนซ์ นอกจากนี้หลายหน่วยงานได้มุ่งพัฒนาวิจัยวัคซีนโควิด-19 ด้วยเทคโนโลยีต่างๆ อาทิ วัคซีนชนิดโปรตีนซับยูนิท บ.ใบยา ไฟโตฟาร์ม ร่วมกับคณะเภสัชฯ จุฬาฯ วัคซีน mRNA ของศูนย์วิจัยวัคซีนคณะแพทย์ฯ จุฬาฯ วัคซีนโควิด-19 HXP-CPOVac ขององค์การเภสัชกรรม วัคซีนโควิเจน ชนิด DNA ของบ. BioNet-Asia จำกัด
เนื่องจากโควิด-19 มีการกลายพันธู์ตลอดเวลา การพัฒนาวัคซีนให้ครอบคลุมสายพันธุ์ใหม่ๆ อย่างต่อเนื่อง จึงเป็นสิ่งจำเป้น ซึ่งประเทศไทย ก็ได้ให้ความสำคัญกับการวิจัยและพัฒนาวัคซีนเพื่อตอบโจทย์ดังกล่าวด้วยเช่นกัน
C.Work-from-Thailand Professionals
Work-from-Thailand Professionals - Remote workers working for well-established companies overseas.
Personal income
• Personal income of a minimum of USD 80,000/ year in the past two years
• In case of personal income below USD 80,000/year but no less than USD 40,000/year in the past two years, applicants must have a Master’s degree or above or own intellectual property or receive Series A funding
Current Employer
Public company on a stock exchange or; Private company in operation for at least three years with combined revenue at least USD 150 million in the last three years
Experience
At least 5 years of work experience in the relevant fields of the current employment over the past 10 years.
Health insurance
Health insurance with at least USD 50,000 coverage or social security benefits insuring treatment in Thailand or at least USD 100,000 deposit
อนันตา คลินิกกัญชาทางการแพทย์ ภูเก็ต
ชมรมแพทย์ชนบท ชี้ การคว่ำครั้งนี้ มาจากสองปัจจัย
การคว่ำครั้งนี้ คงมาจากทั้งสองปัจจัย ทั้งเป็นเกมส์การเมืองใกล้เลือกตั้ง และเนื้อหาในร่าง พรบ.กัญชากัญชงที่ดูจะไม่เข้าข่ายกัญชาทางการแพทย์เอาเสียเลย
ประเด็นสำคัญคือ บัดนี้สุญญากาศช่องว่างทางกฏหมายว่าด้วยกัญชากัญชงได้เกิดขึ้นอย่างเป็นทางการแล้ว รัฐบาลจะแก้ปัญหานี้อย่างไร จะปล่อยให้ขายออนไลน์กันเสรี ปลูกหรือขายกันเสรี โฆษณาแบบโจ๋งครึ่ม เพราะไร้กฏหมายควบคุมแบบนี้หรือ
ผู้สร้างปัญหากรุณาคิดและชี้แจงแนวทางปิดสุญญากาศด้วยนะครับ ประชาชนรอฟังอยู่ [
ชมรมแพทย์ชนบท]
ตรวจสอบสิทธิการรักษาที่เว็บไซต์ สปสช.
ตรวจสอบสิทธิการรักษาที่เว็บไซต์ สปสช.
ดูรายชื่อหน่วยบริการที่อยู่ในระบบหลักประกันสุขภาพแห่งชาติ
• เว็บไซต์ Nostra map
https://map.nostramap.com/ หรือแอปพลิเคชัน Nostra Map เลือกชั้นข้อมูลที่เขียนว่า รายชื่อสถานพยาบาลในระบบ สปสช.
(เลือกประเภทการขึ้นทะเบียนที่ระบุว่า บริการตรวจรักษาโรคทั่วไป หรือหน่วยบริการประจำ)
3.สถานบริบาลผู้สูงอายุรามาธิบดี (Ramathibodi Nursing Home)
สถานบริบาลผู้สูงอายุรามาธิบดี (Ramathibodi Nursing Home) จะเป็นสถานบริบาลผู้ป่วยสูงอายุที่มีภาวะพึ่งพา ตั้งแต่ผู้สูงอายุยังพอที่จะช่วยเหลือตนเองได้บ้างจนเข้าสู่ภาวะติดเตียงและเจ็บป่วยในระยะสุดท้าย ด้วยการบริบาลที่มีคุณภาพ ได้มาตรฐานสากล และสอดคล้องกับความต้องการของสังคมไทย รองรับผู้สูงอายุที่พักอาศัยในโครงการที่พักอาศัยผู้สูงอายุรามาฯ-ธนารักษ์ และประชาชนทั่วไปในราคาที่จับต้องได้
ด้านการบริการ จะเป็นการบริบาลที่ครอบคลุมตั้งแต่กลุ่มที่มีโรคน้อยและช่วยเหลือตนเองได้ดี (Active aging and independence) กลุ่มที่มีโรคมากเปราะบางและมีภาวะพึ่งพา (Frail and partial dependence) กลุ่มที่ช่วยเหลือตนเองไม่ได้เลยและมีภาวะติดเตียง (Immobility and total dependence) ไปจนถึงกลุ่มที่เจ็บป่วยในระยะสุดท้าย และ/หรือใกล้เสียชีวิต(End of life and hospice)
ทั้งนี้ มุ่งเป้าเพื่อประโยชน์สูงสุดแก่ผู้สูงอายุไทยให้ได้ตระหนักรู้ มีส่วนร่วมในการวางแผน และกำหนดเป้าหมายสำคัญในชีวิตของตนเองไว้ล่วงหน้า ให้มีหลักประกันที่มั่นคงในการบริการด้านสุขภาพแบบครบวงจรและที่พักพิง เพื่อคุณภาพชีวิตที่ดีที่สุดเท่าที่จะเป็นไปได้ (Best possible quality of life) ในยามบั้นปลายของชีวิต
สถานบริบาลผู้สูงอายุรามาธิบดีแห่งนี้ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ได้ร่วมกับภาคเอกชน พัฒนาเป็นวิสาหกิจเพื่อสังคม (Social Enterprise) เพื่อหวังให้เป็นต้นแบบของสถานบริบาลผู้สูงอายุที่มีภาวะพึ่งพา ที่มีการบริบาลที่ทันสมัย ได้มาตรฐานสากล ทัดเทียมนานาอารยะประเทศ และสอดคล้องกับบริบทของสังคมไทย ในทุกสถานะสุขภาพ (Health status) ของผู้ป่วยสูงอายุไทย
คาดว่า สถานบริบาลผู้สูงอายุรามาธิบดี จะเปิดให้บริการในปี 2568
กรุงธนใต้
- เขตบางขุนเทียน 061-4124000
- เขตบางบอน 02-4503201 , 02-1117951
- เขตภาษีเจริญ 02-4130383 ต่อ 6615
- เขตทุ่งครุ 083-0312338
- เขตราษฎร์บูรณะ 02-4284884 ต่อ 6844
- เขตหนองแขม 089-7453132
- เขตบางแค 02-1117950 , 02-4104009
11:14 ยอดผู้สูญหายเพิ่มเป็นกว่า 2,900 ราย
BBC รายงานว่า ศูนย์ประสานงานกรุงโซล รับแจ้งจากครอบครัวของผู้สูญหายแล้วกว่า 2,900 ราย ที่มาร่วมในงานฮัลโลวีนในอีแทวอน และยังไม่กลับถึงบ้าน
เทศกาลเที่ยวงานวัด เทอร์มินอล21 พัทยา
เทศกาลเที่ยวงานวัด ลอยกระทงย้อนยุคโลกล้านปี ประกวดร้องเพลงไทยลูกทุ่ง
วันที่ 31 ต.ค. – 9 พ.ย. 65 ชั้น G – Paris เทอร์มินอล21 พัทยา ยกงานวัดมาไว้ใจกลางเมืองกับงาน “เทศกาลเที่ยวงานวัด” เพลิดเพลินกับกิจกรรมและซุ้มเกมส์มหาสนุกภายใต้บรรยากาศงานวัดย้อนยุคสไตล์ลูกกรุง
ปาโป่ง ตักไข่ โยนห่วง
เดินช้อปและตะลุยกินกับโซนสินค้าและอาหารพื้นเมือง
สัมผัสเสน่ห์เพลงไทยลูกทุ่งกับกิจกรรมการประกวดขับร้องเพลงไทยลูกทุ่งระดับเยาวชน
เปิดประสบการณ์ลอยกระทงย้อนยุคโลกล้านปีครั้งแรกในประเทศไทย!
ที่จะได้ลอยกระทงกับเหล่าไดโนเสาร์ขนาดมหึมาหลากสายพันธุ์กว่า 60 ตัว
ส่งท้ายความสนุกด้วยการแสดงความน่ารักของลิงปะกิต และ ฟรี ‼️คอนเสิร์ตจาก ตั๊กแตน ชลดา
ร่วมสนุกกับซุ้มเกมส์มหาสนุกภายในงาน เทศกาลเที่ยวงานวัด ฟรี ปาโป่ง ตักไข่ โยนห่วง
ทุกวันเวลา 11.00-20.00 น.
เพียงแสดงใบเสร็จใช้จ่ายภายในศูนย์การค้าฯ 500บาท/ใบเสร็จ
*เงื่อนไขเป็นไปตามที่ศูนย์การค้าฯ
กำหนดและสงวนสิทธิ์ในการเปลี่ยนแปลงโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
*จำกัดแลกใบเสร็จรวมสูงสุด 1,000 บาท หรือคูปองไม่เกิน 2 ใบ/ท่าน/วัน
ใบเสร็จที่ใช้สิทธิ์แล้วไม่สามารถนำไปแลกรับสิทธิ์อื่นๆได้อีก
กิจกรรมเทศกาลเที่ยวงานวัด
(*อาจมีการเปลี่ยนแปลงโดยไม่ต้องแจ้งให้ทราบล่วงหน้า)
- วันที่ 3 พ.ย. เวลา 15.00 / 17.00 น. การแสดงลิงปะกิต
- วันที่ 4 พ.ย. เวลา 19.00 น. คอนเสิร์ตจาก ตั๊กแตน ชลดา
- วันที่ 5 พ.ย. เวลา 11.00 น. เป็นต้นไป ประกวดขับร้องเพลงไทยลูกทุ่งระดับเยาวชน
- วันที่ 6 พ.ย. เวลา 13.00 น. เป็นต้นไป เดินแบบผ้าไทยและการแสดงรำไทย
- วันที่ 8 พ.ย. เวลา 17.00 น. เป็นต้นไป ลอยกระทงย้อนยุคโลกล้านปี
ณ ลานเครื่องบิน ศูนย์การค้าเทอร์มินอล21 พัทยา
- เวลา 18.00 น.
การแสดงมาสคอตไดโนเสาร์เดินทรูปยุคหิน
- เวลา 19.00 น. / 21.00 น. House Band
- เวลา 20.00 น. Dinosaur Dance การแสดงเต้นไดโนเสาร์
วิทยาการทางการแพทย์และเทคโนโลยี ทำให้การวินิจฉัยทำได้อย่างมีประสิทธิภาพมากขึ้น - ศ.นพ. สุเทพ กลชาญวิทย์
ศ.นพ. สุเทพ กลชาญวิทย์ หัวหน้าศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และหัวหน้าศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร โรงพยาบาลบำรุงราษฎร์ กล่าวว่า “ศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร โรงพยาบาลบำรุงราษฎร์ ให้การบริบาลดูแลรักษาผู้ป่วยในกลุ่มโรคที่เกี่ยวกับการเคลื่อนไหวของระบบทางเดินอาหารส่วนบนและส่วนล่าง ตั้งแต่หลอดอาหาร กระเพาะอาหาร ลำไส้เล็ก ลำไส้ใหญ่ และทวารหนัก อาทิ โรคกรดไหลย้อน มักมีอาการแสบร้อนหน้าอกและเรอเปรี้ยว แต่ผู้ป่วยอาจมาด้วยอาการของโรคหูคอจมูก เช่น แสบคอ เจ็บคอเรื้อรัง มีเสมหะเรื้อรัง หรืออาการทางโรคปอด เช่น ไอเรื้อรัง ผู้ป่วยบางรายอาจมีอาการคล้ายโรคหัวใจ เช่น อาการเจ็บหน้าอกที่หาสาเหตุไม่พบ, โรคอะคาเลเซีย เป็นโรคที่ทำให้กลืนลำบาก มีสาเหตุมาจากการสูญเสียเซลล์ประสาทที่ควบคุมการทำงานของหลอดอาหารและหูรูดหลอดอาหารส่วนล่าง, ภาวะการขับถ่ายผิดปกติ เช่น ท้องผูกเรื้อรัง กลั้นอุจจาระไม่ได้, ภาวะท้องอืดแน่นท้องเรื้อรัง ส่วนใหญ่เกิดจากการทำงานของทางเดินอาหารผิดปกติ และไม่สามารถพบความผิดปกติได้จากการส่องกล้อง หรือโรคกระเพาะอาหารที่ตรวจไม่พบสาเหตุ ภาวะกระเพาะอาหารบีบตัวช้า ปวดท้องหรืออืดแน่นท้องโดยไม่รู้สาเหตุ โรคลำไส้แปรปรวน โรคท้องผูกเรื้อรัง เป็นต้น”
บางมดสดชื่น สัปดาห์ที่สอง เริ่มตั้งแต่ 12 - 13 พ.ย.65 LINK
บางมดสดชื่น
เริ่มตั้งแต่ 12 - 13 พฤศจิกายน 2565
ริมคลองบางมด, เขตบางมด
‘บางมดสดชื่น’ หนึ่งในกิจกรรมภายใต้เทศกาล ‘บางกอกบานฉ่ำ’ เทศกาลที่สนับสนุนโดยกรุงเทพมหานคร เป็นการจัดเทศกาลศิลปะชุมชน เพื่อเพื่อส่งเสริมอัตลักษณ์ชุมชน ในการพัฒนาเป็นย่านสร้างสรรค์ และส่งเสริมกิจกรรมการท่องเที่ยวในพื้นที่กรุงเทพมหานครให้เป็นที่รู้จักในวงกว้าง
โดยสุดสุปดาห์นี้ จะยังมีมีกิจกรรมชวนสัมผัสประสบการณ์ชุมชนบางมดผ่านการเดิน เล่น เต้น ช้อปที่รายลอ้มรอบด้วยธรรมชาติได้ตั้งแต่ 09.00-21.00 น. โดยสามารถติดตามรายละเอียดและกด Join Event พร้อมรับความสดชื่นไปด้วยกันที่นี่ https://fb.me/e/31emSMQCk หรือ ติดตามช่องทางการประชาสัมพันธ์ที่ Facebook Page เซฟติสท์ฟาร์ม - SAFETist Farm และข้อมูลเพิ่มเติมของบางกอกบานฉ่ำที่ กลุ่มดินสอสี dinsorsee creative group ได้เลย
มีความสุขทุกครั้งกับดนตรีสุนทราภรณ์ ก็ย่อมต้องออกลีลา
บริการตรวจแมมโมแกรมเต้านม LINK
บริการตรวจแมมโมแกรมเต้านม คลินิกพิเศษเฉพาะทางนอกเวลา ทุกวันจันทร์-ศุกร์ 16.30-20.00 สอบถามโทร 032719600 ต่อ 1396 **ตรวจกับแพทย์และทำการนัดหมายล่วงหน้าเท่านั้น
มีปัญหาโรคหัวใจ รักษาได้ที่ (คลินิกนอกเวลา) รพ.ราชบุรี LINK
คลินิกนอกเวลาราชการ รพ.ราชบุรี มีบริการรักษาโรคหัวใจครบวงจร
✅️ทีมแพทย์อายุรกรรมและศัลยกรรมหัวใจ
✅️ฉีดสีและใส่สารสวนหัวใจ
✅️ผ่าตัดบายพายเส้นเลือดหัวใจ
เป็นทางเลือกของผู้ป่วยอีกช่องทางหนึ่ง ในการเข้าถึงการจัดบริการทางการแพทย์โดยทีมแพทย์โรคหัวใจ และหลอดเลือด รพ.ราชบุรี
มีปัญหาโรคหัวใจ รักษาได้ที่ (คลินิกนอกเวลา) รพ.ราชบุรี
ติดต่อได้ที่หน่วยปฏิบัติการสวนหัวใจ รพ.ราชบุรี สอบถามโทร 0951461138 ,098-9895540 ได้ทุกวัน 8.30-20.30 น.
ความผิดปกติเกี่ยวกับ “โรคทางเดินอาหาร” ปรึกษาคลินิกพิเศษเฉพาะทางศัลยกรรม รพ.ราชบุรี
ความผิดปกติเกี่ยวกับ “โรคทางเดินอาหาร” อาจไม่ได้แสดงอาการให้เห็นชัดเจน ซึ่งหากปล่อยทิ้งไว้ อาการอาจรุนแรงขึ้นจนยากต่อการรักษาในภายหลัง ดังนั้นการตรวจโรคทางเดินอาหารด้วย “การส่องกล้อง” จึงเป็นเรื่องสำคัญที่ไม่ควรละเลย คลินิกพิเศษเฉพาะทางศัลยกรรม รพ.ราชบุรีขยายการให้บริการแก่ผู้มารับบริการ โดยผู้รับบริการสามารถพบแพทย์เฉพาะทาง และส่องกล้องระบบทางเดินอาหารนอกเวลาราชการได้ค่ะ เวลา 16.30-20.00 ลดแออัด รอคิวไม่นาน โทรนัดจองล่วงหน้า หรือ สนใจสอบถามโทร 09-5146-1138 เวลา 8.00-20.00น.
22 พ.ย. 65 ค้านและสนับสนุนกฎหมายกัญชา
1. รับฟ้องคดีกัญชา
- กรณี ผศ.นพ.สมิทธิ์ ศรีสนธิ์ กรรมการแพทยสภาและนายกสมาคมแพทย์นิติเวชแห่งประเทศไทย พร้อมด้วยหลายพรรค การเมือง ยื่นฟ้อง นายอนุทิน ชาญวีรกูล รมว.สธ. เพื่อขอให้ศาลมีคำพิพากษาเพิกถอนประกาศ สธ. ลว. 8 ก.พ.65 เรื่อง ระบุ ชื่อยาเสพติดให้โทษในประเภท 5 พ.ศ.2565 โดยให้มีผลย้อนหลังไปถึงวันที่มีการออกประกาศฉบับดังกล่าว และให้กัญชา จัดเป็นยาเสพติดให้โทษประเภทที่ 5 ศาลปกครองรับฟ้องคดีดังกล่าว โดย คกก.ป.ป.ส. นัดพิจารณาวันนี้
- นายอนุทิน เผย ตรงนี้ไม่น่าเกี่ยวข้องกับ ป.ป.ส. เพราะกัญชาไม่ใช่ยาเสพติด ที่สำคัญประกาศ สธ. เป็นไปตามคำแนะนำ ของ คกก.คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย ฉะนั้น ไม่มีช่องใดๆ เกี่ยวข้องกับยาเสพติด หรือ ป.ป.ส. หาก ถามว่ากัญชาจะไม่กลับมาเป็นยาเสพติดแล้วใช่หรือไม่ ตนต้องบอกว่าไม่สามารถกลับไปเป็นยาเสพติดแล้ว เราใช้ประโยชน์ กัญชา กัญชงในด้านการแพทย์ สุขภาพ เศรษฐกิจ ซึ่งเป็นนโยบายเร่งด่วนข้อ 4 ของรัฐบาล
- นายวิษณุ เครืองาม รองนายกรัฐมนตรี กล่าวถึง กรณีการประชุม คกก.ป.ป.ส. วันนี้ว่าในที่ประชุมจะมีการหยิบยก ประกาศ สธ.เกี่ยวกับกัญชาขึ้นมาหารือ มีอะไรที่ ครม.สงสัย และขอให้อธิบดีกรมการแพทย์แผนไทยฯ ช่วยชี้แจง แต่ถึง อย่างไร ป.ป.ส.ไม่สามารถไปดึงหรือแก้อะไรได้เพราะไม่มีอำนาจ
- นายสมศักดิ์ เทพสุทิน รมว.ยธ. กล่าวถึงกระแสข่าวการประชุมคณะกรรมการ ป.ป.ส. จะดึงกัญชากลับมาเป็นยาเสพติด ว่า กัญชาถูกปลดล็อกโดยประมวลกฎหมายยาเสพติด และการจะเดินหน้าเรื่องนี้ต้องออกเป็นกฎหมายขึ้นมากำกับ เหมือน กฎหมายพืชกระท่อม แต่ตอนนี้ยังไม่สามารถออกกฎหมายกัญชาให้แล้วเสร็จได้ รมว.สธ. จึงใช้กฎหมายอื่นมาออกประกาศ ควบคุมในฐานะผู้รับผิดชอบ
- น.ส.ตรีชฎา ศรีธาดา รองโฆษกพรรคเพื่อไทย เผย ปัญหานโยบายกัญชาเสรีที่เกิดความขัดแย้งอย่างหนัก โดยไม่มีวี่แวว ว่าจะยุติได้ง่าย เพราะยังมีพรรคการเมืองอีกหลายพรรคและภาคส่วนอื่นๆ ที่ไม่เห็นด้วย เพราะห่วงใยผลกระทบต่อสังคม ใน ส่วนของคณะรัฐมนตรีก็ไม่ได้แสดงท่าทีที่รับผิดชอบร่วมกัน ตรงกันข้ามกลับขัดแย้งกันเอง อย่างไรก็ตาม รัฐบาลต้องฝ่า 3 ด่านที่หากตัดสินใจผิดพลาดจะเกิดผลเสียหายร้ายแรงและสร้างปัญหาไม่รู้จักจบสิ้น กัญชาที่ควรเป็นยาเสพติด เรายังยืนยัน เหมือนเดิมว่าต้องใช้ในทางการแพทย์เท่านั้น
2. ค้านกัญชาเสรี
- ผู้แทนกลุ่มเครือข่ายเยาวชนไม่นะกัญชาและยาเสพติด (YNAC) เข้ายื่นจดหมาย ณ สำนักงาน ป.ป.ส. เพื่อเรียกร้องให้ คณะกรรมการป้องกันและปราบปรามยาเสพติด บรรจุวาระเรื่องเพื่อพิจารณา ในการประชุมคณะกรรมการ ป.ป.ส. ในวันนี้ (22 พ.ย.65) เรื่อง การยกเลิกประกาศกระทรวงสาธารณสุขฉบับปลดกัญชาเสรี และคณะกรรมการควบคุมยาเสพติด กระทรวงสาธารณสุข
- โพสต์ถึงโอกาสของบริษัท 3 แห่ง ได้แก่ ซีพี ไทยเบฟ และ ปตท. ที่เป็นบริษัทรายใหญ่ดำเนินธุรกิจด้านกัญชา เป็นวิกฤต ของสังคมกระทบชาวบ้านรายย่อย ส่วนกัญชาทางการแพทย์คือข้ออ้างเท่านั้น ส่วนใหญ่ใช้ในยาสมุนไพรพอเป็นพิธี
3. สนับสนุนกฎหมายกัญชา
- นายสาธุ อนุโมทามิ ประธานเครือข่ายคนไทยรักชาติ ยื่นหนังสือถึงนายกรัฐมนตรี ขอให้รัฐบาลสนับสนุนร่าง พระราชบัญญัติกัญชา กัญชง พ.ศ… และร่างประกาศกระทรวงสาธารณสุขเรื่องสมุนไพรควบคุมกัญชาพ.ศ. 2565 ตามที่
- ประจำวันที่ 22 พฤศจิกายน 2565 2 ประเด็นข่าว หมายเหตุ รัฐบาลได้มีนโยบายให้กัญชากัญชงเป็นสมุนไพรที่พ้นจากการเป็นยาเสพติดประเภท 5 และขอให้นายกฯ ได้โปรดให้สำนัก เลขาธิการคณะมนตรีได้นำร่างประกาศกระทรวงสาธารณสุขลงประกาศในราชกิจจานุเบกษาโดยเร็ว เพราะวาระของสภา ผู้แทนราษฎรจะครบ 4 ปี หากไม่เร่งดำเนินการจะทำให้ไม่ทัน ที่จะตราเป็นกฎหมายออกมาบังคับใช้ได้ทันเวลา
- นายพิพัฒน์ นนทนาธรณ์ นายกสมาคมนักวิจัยแห่งประเทศไทย นำรายชื่อประชาชน 5,000 ชื่อ ที่สนับสนุนร่าง พ.ร.บ. กัญชา กัญชง และประกาศกระทรวงสาธารณสุขเรื่องสมุนไพรควบคุม (กัญชา) มอบให้นายอนุทิน ที่ทำเนียบรัฐบาล
4. กัญชาทางการแพทย์
- นพ.ประพนธ์ ตั้งศรีเกียรติกุล ผู้ช่วย รมต.สธ. เป็นประธานการประชุมอนุกรรมการขับเคลื่อนนโยบายกัญชาเสรีทาง การแพทย์ ครั้งที่ 3/2565 พร้อมด้วยผู้บริหารและผู้แทนกรม กองต่างๆ มีประเด็นการติดตามผลกระทบที่เกิดจากการปลดพืช กัญชาจากรายการยาเสพติดให้โทษ และทบทวนมาตรการการดำเนินการทั้งในรูปของการกำหนดกฎหมาย ระเบียบข้อบังคับ และการให้ความรู้ ความเข้าใจ สื่อสารให้ผู้ประกอบการและประชาชนได้เข้าใจ
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า ปี2566 ตั้งเป้ามูลค่าผลิตผลิตภัณฑ์ยาสำเร็จรูป และผลิตภัณฑ์สุขภาพจากกัญชา กัญชง ไม่น้อยกว่า 10 ล้านบาท หลังที่ผ่านมามีการกระจายผลิตภัณฑ์ยาสำเร็จรูปจากกัญชา ในสถานพยาบาลของรัฐและเอกชนใน 13 เขตสุขภาพกว่า 680 แห่ง รวมมูลค่าการผลิต 40,000,000 บาท โดยจะพัฒนา วิธีการผลิตตำรับยาแผนไทยตามตำราชาติ ปีงบประมาณ 2566 ได้แก่ พัฒนาการผลิตตามองค์ความรู้ดั้งเดิมสู่กระบวนการ ผลิตในระดับอุตสาหกรรมไม่น้อยกว่า 30 ตำรับ พัฒนารูปแบบนำ ส่งยาและการพัฒนาผลิตภัณฑ์เวชสำอางกัญชา กัญชง ไม่ น้อยกว่า 3 ผลงานวิจัย และมีการวิเคราะห์และจัดทำแผนพัฒนาทางเศรษฐกิจเพื่อให้มูลค่าการผลิต ผลิตภัณฑ์ยาสำเร็จรูป และผลิตภัณฑ์สุขภาพจากกัญชา กัญชง ไม่น้อยกว่า 10 ล้านบาท รวมถึงยกระดับโรงพยาบาล WHO GMP ในการสนับสนุน การผลิตในเขตพื้นที่และนอกเขตพื้นที่การบริการ และการพัฒนารูปแบบแนวทางการสนับสนุนผู้ประกอบการในการพัฒนา การผลิต จำหน่าย และส่งออกผลิตภัณฑ์สมุนไพรภายในประเทศ และระดับสากลตาม EU-GMP และ GMP PIC/S ต่อไป
- นพ.เทวัญ ธานีรัตน์ รองอธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า ต่อไปนี้กรมฯ จะมีการจัดเสวนาวิชาการด้านกัญชาทาง การแพทย์ทุกวันจันทร์ ไปจนกว่าจะมีการบังคับใช้ พ.ร.บ.กัญชา กัญชง พ.ศ. ... ที่กำลังเข้าสู่การประชุมสภาผู้แทนราษฎรใน ไม่กี่สัปดาห์นี้ ซึ่งจะทำให้ประชาชนและบุคลากรทางการแพทย์ทุกแผนกเข้าใจเพื่อใช้ประโยชน์จากกัญชา
- นพ.ทรงกิจ สุทธิกาญจน์ ผอ.รพ.วิภาวดี ปิยราษฎร์ กล่าวว่า ใช้กัญชารักษาผู้ป่วยมะเร็ง 2 ราย อาการดีขึ้น
- นพ.สมนึก ศิริพานทอง กรรมการสมาคมเซลล์บำบัดไทย เผยกัญชาสามารถรักษาผู้ป่วยมะเร็งต่อมลูกหมาก อาการดีขึ้นผู้ป่วยส่วนใหญ่ใน 2 กลุ่มโรค กลุ่มโรคหลอดเลือดในสมอง และโรคเกี่ยวกับหลอดเลือด - รศ. นพ. ยศ นวฤทธิ์โลหะ
รศ. นพ. ยศ นวฤทธิ์โลหะ แพทย์ชำนาญการเฉพาะทางด้านประสาทศัลยศาสตร์ โรงพยาบาลบำรุงราษฎร์ เล่าถึงประสบการณ์การรักษาว่าผู้ป่วยส่วนใหญ่จะมาด้วย 2 กลุ่มโรคหลัก ๆ คือ กลุ่มโรคหลอดเลือดในสมอง และโรคเกี่ยวกับหลอดเลือด โดยเฉพาะหลอดเลือดโป่งพองหรือหลอดเลือดผิดปกติ และกลุ่มโรคเนื้องอกในสมอง โดยเฉลี่ยผ่าตัดผู้ป่วยประมาณ 200 รายต่อปี ซึ่งการผ่าตัดในระบบประสาทนั้นต้องอาศัยประสบการณ์ของทีมแพทย์ ยกตัวอย่างการรักษาผู้ป่วยเนื้องอกในสมองขนาดใหญ่ เส้นผ่านศูนย์กลางกว่า 2 นิ้ว ซึ่งจะต้องทำการผ่าตัดอย่างเร่งด่วน เพราะหากปล่อยทิ้งไว้มีโอกาสเป็นอัมพฤกษ์หรืออัมพาตได้ ปัจจุบันผู้ป่วยสามารถใช้ชีวิตได้เป็นปกติดี ผู้ป่วยอีกรายตรวจวินิจฉัยพบภาวะหลอดเลือดสมองโป่งพองขนาดยักษ์ ใหญ่กว่า 1.25 นิ้ว โดยภาวะนี้มักเกิดขึ้นตามหลอดเลือดแดงที่สำคัญที่อยู่ลึกภายในโครงสร้างสมอง ซึ่งต้องอาศัยแพทย์ที่มีความชำนาญการสูง อีกทั้งระหว่างการผ่าตัดและหลังการรักษาผู้ป่วยมีโอกาสเกิดภาวะแทรกซ้อนได้ตลอดเวลา
เกี่ยวกับสถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย)
สถาบันวิจัยความเป็นอยู่ฮาคูโฮโด อาเซียน (ประเทศไทย) หรือ Hakuhodo Institute of Life and Living ASEAN (THAILAND) ทำการศึกษาเกี่ยวกับ "การคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทย" ทุก ๆ สองเดือน โดยผลสำรวจการคาดการณ์พฤติกรรมการใช้จ่ายของผู้บริโภคในประเทศไทยประจำเดือนมิถุนายน พ.ศ. 2565 เป็นผลสำรวจจากการรวบรวมข้อมูลจากวันที่ 19 ถึง วันที่ 28 ตุลาคม พ.ศ. 2565 โดยมุ่งเน้นเกี่ยวกับแนวโน้มและพฤติกรรมการบริโภคของคนไทยในอนาคต ผ่านการทำแบบสอบถามเชิงปริมาณและเชิงคุณภาพ จากประชากรเพศชายและหญิงจำนวน 1,200 คน อายุระหว่าง 20-59 ปี จาก 6 ภูมิภาค ทั่วประเทศ
Hakuhodo Institute of Life and Living ASEAN คือศูนย์วิจัยแห่งใหม่ของกลุ่มฮาคูโฮโดในภูมิภาคอาเซียน ก่อตั้งขึ้นในปี ค.ศ. 2014 โดยมีวัตถุประสงค์เพื่อช่วยเหลือบริษัทต่างๆ ภายในประเทศสมาชิกภูมิภาคอาเซียนในเรื่องของข้อมูลการตลาด รวมทั้งสังเกตไลฟ์สไตล์ใหม่ๆ ที่จะเกิดขึ้น โดยการวิจัยของฮาคูโฮโดจะเป็นการวิจัยที่มุ่งเน้นการศึกษา Sei-katsu-sha หรือ ผู้คนที่ใช้ชีวิตอยู่ในสังคม (Life Living Person) ซึ่งถือเป็นหัวใจสำคัญของปรัชญาของฮาคูโฮโด ที่ไม่เพียงแค่อธิบายผู้คนในฐานะผู้บริโภคที่ขับเคลื่อนเศรษฐกิจ แต่อธิบายถึงความเป็นบุคคลของผู้บริโภคที่มีชีวิต จิตใจ ไลฟ์สไตล์ แรงบันดาลใจ และความฝันที่แตกต่างกันไปในแต่ละบุคคล
ติดตามผลสำรวจเพิ่มเติมได้ที่
Hakuhodo Institute of Life and Living ASEAN (THAILAND)
สิ่งอำนวยความสะดวกในห้องพักเดี่ยว ศูนย์อายุรวัฒน์ 2 (อาคาร 2) ชั้น 9
- เตียงไฟฟ้าควบคุมด้วยรีโมท ทีวี ตู้เย็น เครื่องทำน้ำอุ่น เครื่องปรับอากาศ
- เตียงพักญาติ โต๊ะชุดรับประทานอาหารของญาติ
- ที่นอนป้องกันแผลกดทับ
- ทั้ง 2 อาคาร จัดพื้นที่ส่วนกลาง เครื่องกรองน้ำ น้ำร้อน และไมโครเวฟ ไว้ให้บริการ
น้ำท่วม
- ลอกท่อ 3,357 กม. จาก 6,564 กม.+3,875 กม. ในปี 2566
- ปรับปรุงบ่อสูบน้ำ 12 แห่ง เพิ่มปั๊ม 18 ตัว+ปรับปรุงบ่อสูบน้ำ 69 แห่งเพิ่มปั๊ม 124 ตัว (mobile pump) ในปี 2566
- ขุดลอกคลอง 159 กม.+ 183 กม. ในปี 2566
- ปรับปรุงและซ่อมแซมสถานีสูบน้ำ 23 แห่ง และอุโมงค์ระบายน้ำปี 2566 ปรับปรุงและช่อมแชมสถานีสูบน้ำ 39 แห่งและอุโมงค์ระบายน้ำเพิ่มปั๊ม 30 ตัว
- ซ่อมแชมแนวป้องกันน้ำท่วมและแนวฟันหลอ 21 แห่ง+25 แห่งในปี 256
ทางเท้า
- ปรับปรุงทางเท้า 1,000 กม. ดำเนินการแล้วเสร็จ 150 กม.ปี 2566 จะดำเนินการ 250 กม.
- ร้องเรียนเรื่องทางเท้า 20,107 รายการ ดำเนินการเสร็จสิ้น 12,695 รายการ คิดเป็น 63%
- ปรับปรุงทางวิ่ง 500 กม. ดำเนินการแล้วเสร็จ 20 กม.+100 กม.(10 เส้นทาง) ในปี 2566
จัดระเบียบสื่อสาร
- ดำเนินการแล้วเสร็จ 161.56 กม. (37 เส้นทาง)+442.62 กม. ในปี 2566
นำสายสื่อสารลงดิน
- ดำเนินการแล้วเสร็จ 6.3 กม.+29.2 กม. ในปี 2566
จุดเสี่ยงอุบัติเหตุ
- ล้างทำความสะอาด 421 แห่ง+500 แห่ง ในปี 2566
- ทาสีโคลด์พลาสติก 145 แห่ง+500 แห่ง ในปี 2566
- ปรับปรุงทางม้าลายที่ซีดจาง/ชำรุด 1,000 แห่ง+500แห่ง ในปี 2566
- ติดตั้งสัญญาณไฟจราจรทางแยก 4 แห่ง+2 แห่งในปี 2566
- ติดตั้งสัญญาณไฟจราจรทางข้ามชนิดกดปุ่ม 85 แห่ง
- ติดตั้งสัญญาณไฟกระพริบเตือนทางข้าม 50 แห่ง+50 แห่งในปี 2566
จุดฝืดรถติด
กำหนดแนวทางแก้ไขจุดฝืดรถติด จำนวน 266 จุด โดย
- กวดขันวินัยจราจร ประชาสัมพันธ์ รณรงค์ (soft power)
- แนวทางตามหลักวิศวกรรมจราจร (ปรับปรุงเชิงกายภาพ)
- ใช้เทคโนโลยีช่วยบริหารจัดการไฟจราจร (Intelligent Traffic Management System): ITMS
ของขวัญปีใหม่จาก บสย. 2 มาตรการ
บรรษัทประกันสินเชื่ออุตสาหกรรมขนาดย่อม (บสย.) จำนวน 2 มาตรการ
ได้แก่
1. มาตรการยกเว้นค่าดำเนินการค้ำประกันสินเชื่อสำหรับผู้ประกอบการ SMEs โดยผู้ประกอบการ SMEs ที่ส่งคำขอให้ บสย. ค้ำประกันภายใต้โครงการดังนี้ 1) Bilateral Phase 7 (BI7) 2) Portfolio Guarantee Scheme (PGS) ระยะพิเศษ Soft Loan Extra และ 3) Thai Credit Guarantee Corporation Risk Based Pricing (TCG RBP) จะได้รับการยกเว้นค่าดำเนินการค้ำประกันสินเชื่อ ระยะเวลาดำเนินโครงการตั้งแต่วันที่
1 ถึงวันที่ 31 มกราคม 2566
2.. มาตรการสำหรับลูกหนี้ บสย. สำหรับลูกหนี้ที่ประนอมหนี้กับ บสย. แล้ว และค้างชำระไม่เกิน 3 งวด จะได้รับการลดค่างวด ระยะเวลาดำเนินโครงการตั้งแต่วันที่ 1 มกราคม ถึงวันที่ 30 มีนาคม 2566
Kanchanaburi Countdown Festival 2023 มหัศจรรย์แสงแห่งสุข
Kanchanaburi Countdown Festival 2023 มหัศจรรย์แสงแห่งสุข วันจัดงาน : วันที่ 29-31 ธันวาคม 2565 บริเวณสะพานข้ามแม่แคว อำเภอเมือง จังหวัดกาญจนบุรี
กิจกรรมมากมายตื่นตา
1. กิจกรรมขอพรจากดวงดาว เขียนสิ่งที่ปรารถนาแล้วนำไปแขวนบนต้นคริสต์มาส
2. กิจกรรมดูดวงจากไพ่ยิปซี
3. กิจกรรมถ่ายภาพกับอุโมงค์ไฟประดับและซุ้มของขวัญสวยงาม
4. กิจกรรมสอยดาว ลุ้นรับของรางวัลต่าง ๆ
5. กิจกรรมการออกบูธสินค้า OTOP ร้านค้าชุมชนและคาราวาน Food Truck
. กิจกรรมการแสดงดนตรีจากศิลปินที่มีชื่อเสียง
7. การจุดพลุบนขบวนรถไฟ เฉลิมฉลองส่งท้ายปีเก่า ต้อนรับปีใหม่ 2566 กิจกรรมไฮไลท์: การแสดงพลุเฉลิมฉลองส่งท้ายปีเก่าต้อนรับปีใหม่ 2566
โครงการผ่าตัดข้อเข่าเทียมโดยใช้หุ่นยนต์ช่วยผ่าตัด
กลุ่มงานศัลยกรรมกระดูกและข้อ โรงพยาบาลสมุทรปราการ เริ่มโครงการผ่าตัดข้อเข่าเทียมโดยใช้หุ่นยนต์ช่วยผ่าตัด ( Robotic-Assited Total Knee Arthroplasty ) เพื่อความแม่นยำในการผ่าตัด และการวางตำแหน่งข้อเข่าเทียมให้เหมาะสม เพื่อเพิ่มอายุการใช้งานของข้อเข่าเทียม สนใจ สอบถามรายละเอียดเพิ่มเติม ได้ที่อาคารผู้ป่วยนอก ห้องตรวจศัลยกรรมออร์โธปิดิกส์ หรือ โทรศัพท์ 066-0977544
ห้องตรวจโรคตาใหม่ เปิดให้บริการ
หลังจากใช้เวลาเกือบห้าเดือนในการปรับปรุงห้องตรวจตาให้มีความทันสมัย ปลอดภัย เพิ่มห้องตรวจ เพื่อรองรับบริการที่เพิ่มมากขึ้นมาก ถึงตอนนี้ห้องตรวจตาโรงพยาบาลสมุทรปราการพร้อมให้บริการแล้วครับ โดยจะเปิดทำการที่ชั้น 2 ตึกอำนวยการ ตั้งแต่วันจันทร์ที่ 8 สิงหาคม 2565 เป็นต้นไป
ขอบคุณผู้บริหารระดับสูงกระทรวงสาธารณสุขที่ให้นโยบายการทำโรงพยาบาลให้ทันสมัย ปลอดภัย และขอบคุณสำหรับความร่วมมือร่วมใจของเจ้าหน้าที่โรงพยาบาลทุกฝ่าย และผู้รับบริการทุกคนครับ
ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย Royal College of Pathologists of Thailand
ราชวิทยาลัยพยาธิแพทย์แห่งประเทศไทย
Royal College of Pathologists of Thailand
สำนักงานประธานราชวิทยาลัย : สำนักงานประธาน : เลขที่ 2/2 สถาบันพยาธิวิทยา กรมการแพทย์ กระทรวงสาธารณสุข อาคาร 1 ชั้น 2 ถนนพญาไท เขตราชเทวี กรุงเทพมหานคร 10400
เบอร์โทรศัพท์ 086-9073996 , 02-3548208 ต่อ 124
E-mail :rcthaipathology@gmail.com
www.rcthaipathologist.org/เทรนด์การทำกิจกรรมด้านการกุศลของคนยุคใหม่
เพราะคนไทยมีน้ำใจและถูกปลูกฝังให้ช่วยเหลือกัน ทุกครั้งที่เกิดความต้องการเร่งด่วน อย่างเหตุการณ์โรคอุบัติใหม่ อุบัติภัยทางธรรมชาติ การก่อสร้างอาคารโรงพยาบาลแห่งใหม่ คนไทยก็จะร่วมช่วยเหลือตามกำลังที่มี นอกเหนือจากการบริจาคเงิน อาจจะเป็นการให้แรงกาย แรงใจ ความสามารถเป็นจิตอาสา บางคนก็ช่วยเหลือโดยการบอกต่อ กดไลค์ กดแชร์ สำหรับมูลนิธิรามาธิบดีฯ เราเชื่อว่าการให้จากทุกน้ำใจนั้นมีคุณค่า และสามารถช่วยเหลือผู้อื่นได้อีกมาก
ความน่าเชื่อถือ และตรวจสอบได้ เป็นสิ่งที่คนในสังคมปัจจุบันให้ความสำคัญอย่างมาก ซึ่งตรงกับหลักการบริหารจัดการของมูลนิธิรามาธิบดีฯ ในทุกโครงการของเรามีการวางเป้าหมายที่ชัดเจน และนำไปใช้ตรงตามวัตถุประสงค์ของผู้บริหาร ซึ่งท้ายที่สุด ความคืบหน้าและผลลัพธ์ของแต่ละโครงการนั้นสามารถก่อประโยชน์ตรงตามวัตถุประสงค์ที่ตั้งไว้
Online Donation ผลจากการแพร่ระบาดของโควิด-19 ทำให้การทำบุญออนไลน์ได้รับความนิยมมากขึ้นอย่างก้าวกระโดด เช่นเดียวกับภาคส่วนอื่น ๆ ของสังคม ทางมูลนิธิรามาธิบดีฯ เองได้ทำการปรับปรุงการให้บริการด้วยเทคโนโลยีทันสมัยตลอดมา บนพื้นฐานของการสร้างความเชื่อมั่นด้านความปลอดภัยต่อการทำธุรกรรมทางการเงิน เพื่อให้ผู้บริจาคสะดวกสบายที่สุด รวมถึงช่องทางการสนับสนุนของที่ระลึกการกุศลทางออนไลน์อีกด้วย ซึ่งมูลนิธิรามาธิบดีเองก็มี ช่องทางการรับบริจาคออนไลน์ที่จัดทำมามากกว่า 10 ปี และจากปีที่ผ่านมาสัดส่วนการบริจาคออนไลน์ (ดูจากจำนวนใบเสร็จ) อยู่ที่ 63 % โดยที่การบริจาคแบบออฟไลน์อยู่ที่สัดส่วน 37% ซึ่งการบริจาคผ่านช่องทางออนไลน์มีแนวโน้มเพิ่มสูงขึ้นหลังเกิดการระบาดของโควิด-19
สาขา Port Go บางปะอิน อยุธยา
Port Go บางปะอิน อยุธยา [
แผนที่] - ตรงจุดพักรถ ออกจากกรุงเทพฯ ไปนิดเดียว ที่มีร้านเพียบเลยไง (starbucks KFC Amazon MacDonald)
นานาชาติเร่งระดมให้ความช่วยเหลือ
9 กุมภาพันธ์
- จีนส่งเงิน 30 ล้านหยวน (4.4 ล้าน USD) ให้กับหน่วยช่วยเหลือฉุกเฉินในซีเรีย และสิ่งของมูลค่า 2 ล้าน USD ตามแถลงของกระทรวงการต่างประเทศจีน
- ประเทศชาติอาหรับ ได้แก่ สหรัฐอาหรับเอมิเรตส์ อินเดีย อียิปต์ แอลจีเรีย อาร์เมเนีย อิหร่าย ลิเบีย อิรัค จอร์แดน ส่งเครื่องบินไปช่วยซีเรีย ลำเลียงผู้บาดเจ็บ/หน่วยกู้ภัยที่ทำงานในพื้นที่
- สหรัฐอาหรับเอมิเรตส์ ส่งเงินช่วยเหลือ 100 ล้านเหรียญสหรัฐ ให้ทั้งสองประเทศ และส่งเครื่องบินลำเลียงอุปกรณ์กู้ภัย 2 เที่ยวบิน
- WHO ส่งทีมแพทย์ อุปกรณ์การแพทย์ และนักบิน พร้อมเงินช่วยเหลือ 3 ล้าน USD สำหรับภารกิจฉุกเฉิน ผู้เชี่ยวชาญแสดงความกังวลต่อสถานการณ์ระยะถัดไป ที่ผู้ประสบภัยและประชาชนในเมืองอาจประสบปัญหาด้านสาธารณสุขตามมาอีก เช่น อหิวาตกโรค หรือโรคทางเดินหายใจ (cholera and respiratory illnesses)
- UN เคลียร์เส้นทางเข้าพื้นที่บริเวณพรมแดน 2 ประเทศ ที่เป็นปัญหาพิพาทแล้ว เปิดทางให้หน่วยกู้ภัยเข้าช่วยเหลือ พร้อมเรียกร้องให้ทุกฝ่ายเห็นแก่ผู้ประสบภัยก่อนเรื่องอื่น (ความขัดแย้ง)
7-8 กุมภาพันธ์
ความช่วยเหลือจากนานาชาติ
- เยอรมัน เนเธอแลนด์ พร้อมส่งทีมค้นหากู้ภัยเข้าพื้นที่ทันทีที่มีการร้องขอ
- สาธารณรัฐเช็ค ส่งทีมค้นหากู้ภัยเข้าพื้นที่
- รัสเซีย โดยรัฐมนตรีกลาโหมเสนอความช่วยเหลือ สิ่งจำเป็นผ่านกองทัพรัสเซีย
- อิสราเอล โดยนายกฯ เนทันยาฮู ส่งทีมช่วยเหลือเข้าไปยังซีเรียแล้ว แม้ทั้งสองประเทศจะไม่มีความสัมพันธ์ทางการทูตอย่างเป็นทางการต่อกันก็ตาม และพร้อมส่งความช่วยเหลือกับตุรกีด้วยเช่นกัน
- ปากีสถานพร้อมส่งทีมกู้ภัย แพทย์ แพทย์ฉุกเฉิน พร้อมเวชภัณฑ์เข้าช่วยเหลือตุรกี
- อังกฤษส่งทีมค้นหา 78 คนไปยังตุรกีแล้ว
- ออสเตรียส่งทหารหน่วยกู้ภัย 84 นาย และตั้งงบ 3 ล้านยูโรสำหรับช่วยสนับสนุนปฏิบัติการ
- สหรัฐโดย ปธน.โจ ไบเดน ออกคำสั่งช่วยเหลือตุรกีและซีเรียแล้ว รมต.ต่างประเทศ นายแอนโทนี บลิงเคน ระบุว่าสหรัฐเตรียมการให้ความช่วยเหลือในทันที
- กาต้า โดยชีค Tamim bin Hamad Al-Thani ระบุทีมกู้ภัยนานาชาติ QSART จัดเต็มส่งทีมค้นห้ากู้ภัย อุปกรณ์ภาคสนาม ชุดปฐมพยาบาล โรงพยาบาลสนาม เข้าตุรกีแล้ว
- คูเวต โดย ชีค Nawaf Al-Ahmad Al-Jaber Al-Sabah ประกาศพร้อมส่งอุปกรณ์การแพทย์เข้าช่วยตุรกี
- ฝรั่งเศส ส่งทีมกู้ภัย 139 นายเข้าตุรกี
- สเปนส่งทีมผู้เชี่ยวชาญ 85 คน จากกองทัพ เข้าตุรกี
- รัสเซีย โดยปธน.ปูติน ต่อสายตรงถึงผู้นำตุรกีและซีเรีย พร้อมให้การช่วยเหลือ
สหพันธ์สภากาชาดและสภาเสี้ยววงเดือนแดงระหว่างประเทศ The International Federation of Red Cross and Red Crescent Societies (IFRC) ตั้งงบ 70 ล้านฟรังสวิส เพื่อให้ความช่วยเหลือเหตุการณ์แผ่นดินไหวในตุรกี ซีเรีย พร้อมกับตั้งทีมเคลื่อนที่ ลงพื้นที่ปฏิบัติการทันทีในวันจันทร์ [
IFRC.org]
รักแท้ไม่แพ้พ่าย@ป้อมปราบศัตรูพ่าย LINK
สำนักงานเขตป้อมปราบศัตรูพ่าย จัดกิจกรรมรับวาเลนไทน์ “รักแท้ไม่แพ้พ่าย@ป้อมปราบศัตรูพ่าย” เชิญชวนทุกคู่รักมาจดทะเบียน วันวาเลนไทน์นี้ ปีนี้พิเศษกว่าเดิม เพิ่มเติมคือ ยินดีต้อนรับ คู่รัก LGBT เชิญมาบันทึกจดแจ้ง เป็นสักขีพยานความรักของทั้งสองไว้ก่อน ระหว่างที่รอกฏหมาย "สมรสเท่าเทียม" ประกาศใช้ งานจัดที่ “โรงแรมปรินซ์พาเลซ” โบ๊เบ๊ ใครยังไม่ลงทะเบียน สามารถลงทะเบียนได้ถึงวันที่ 12 ก.พ. 66 เวลา 12:00 ทุกคู่สมรสที่มาจดทะเบียน จะได้รับของรางวัลมากมาย
“ความรักสวยงามเสมอไม่ว่ากับใคร”
ดอนเมือง ชวนบันทึกรัก LINK
สำนักงานเขตดอนเมือง จัดกิจกรรม "ดอนเมือง ชวนบันทึกรัก" #จดทะเบียนสมรส ในวันแห่งความรัก 14 กุมภาพันธ์ 2566 ณ ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตดอนเมือง ตั้งแต่เวลา 08.00-16.00 น. พร้อมรับของที่ระลึก และถ่ายรูปคู่กับมุมหวานๆ ซึ่งทางเขตจัดไว้ตอนรับคู่รักทุกคู่
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียน โทร 025659413 หรือ 025659424 ต่อ 5314
WATER WAR CHIANG MAI 16 เมษายน 2566
WATER WAR CHIANG MAI 16 เมษายน 2566 ลานม่วนใจ๋ / เซ็นทรัล เชียงใหม่ แอร์พอร์ต
TAITOSMITH / THREE MAN DOWN / SLOT MACHINE / POTATO / PALMY / TILLY BIRDS / PAPER PLANES / SLAPKISS / WONDERFRAME / ONLY MONDAY
ลูกแต่งตัวไม่เหมาะสม เน้นสื่อเรื่องเพศ โชว์สัดส่วน เรือนร่าง
ควรทำ
ชวนลูกคุยว่าเพราะเหตุใดถึงชอบแต่งตัวเช่นนี้ ซึ่งลูกอาจมีเหตุผลเป็นของตัวเอง
ชวนให้ลูกคิด หรือประเมินสถานการณ์ว่าการแต่งตัวแบบนี้เหมาะสมหรือไม่กับสถานที่ และช่วงเวลาต่างๆ รวมถึงมุมมองและการยอมรับของผู้คนที่ลูกจะต้องไปพบเจอ
พ่อแม่สามารถชวนให้ลูกวัยรุ่นคิดว่า การแต่งกายเป็นส่วนหนึ่งของการแสดงออกที่จะดึงดูดความสนใจคนที่ได้พบเจอ แต่ก็ยังมีสิ่งอื่นๆ ที่สามารถสร้างความประทับใจ เช่น การยิ้มแย้มแจ่มใส ดูแลเอาใจใส่คนอื่น เป็นต้น
หาทางสายกลางที่ทั้งพ่อแม่ และลูกวัยรุ่นยอมรับร่วมกันได้
อย่าทำ
กล่าวโทษ หรือใช้คำพูดรุนแรง ต่อว่า จิกกัด เช่น “แต่งตัวแบบนี้จะไปยั่วใคร” เพราะเป็นการดูถูกลูก
แสดงอารมณ์ฉุนเฉียวเกรียวกราด จะทำให้ลูกมองข้ามความห่วงใยและหวังดีของพ่อแม่
เข้าควบคุมบงการเสื้อผ้าหน้าผม การแต่งกายของลูก จะทำให้ลูกอึดอัด และคิดว่าพ่อแม่มองตนว่าเป็นเด็กตลอดเวลา ซึ่งทำให้ลูกขาดความไว้วางใจ คิดว่าพ่อแม่ไม่เข้าใจ ลูกอาจปิดบังความเป็นตัวของตัวเอง เพื่อไม่ให้พ่อแม่ผิดหวัง หรือหลีกเลี่ยงความขัดแย้ง
มูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ ตระหนักถึงผลกระทบจากไข้หวัดใหญ่และเห็นถึงความสำคัญในการรณรงค์เพื่อสร้างความตระหนักรู้และแนะแนวทางในการดูแลตัวเอง ในประชาชนทั่วไป และในกลุ่มผู้สูงอายุ จึงได้มีการจัดงาน
“ไข้หวัดใหญ่หายไปไหนในยุค COVID-19 และควรดูแลตัวเองอย่างไร” ร่วมรับฟังเสวนาแลกเปลี่ยนความรู้ โดย รศ. (พิเศษ) นพ.ทวี โชติพิทยสุนนท์ และ ศ.นพ. ธีระพงษ์ ตัณฑวิเชียร พร้อมด้วย คุณหญิงจำนงศรี หาญเจนลักษณ์ เพื่อมุ่งเน้นการให้ความรู้เกี่ยวกับสาเหตุ อาการของโรค แนวทางการป้องกัน ปัจจัยเสี่ยงในการได้รับเชื้อไวรัส ตลอดจนการเตรียมความพร้อมในการดูแลตัวเองในเพื่อก้าวสู่สังคมผู้สูงอายุ
ในวันพฤหัสบดีที่ 30 มีนาคม 2566 เวลา 13.00 – 16.00 น. ณ ห้อง The MITR-TING ROOM ชั้น 5 สามย่าน มิตรทาวน์ ติดตามรายละเอียดเพิ่มเติมได้ที่ เฟสบุ๊ค
มูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่ สถานีชาร์จ EleX ใน ต่างประเทศ (สปป.ลาว)
สถานีชาร์จ EleX ใน ต่างประเทศ ไดแก่ สปป.ลาว
Kolao Auto city EV charging Station
ที่อยู่: XHGP+VXG, ຖະໜົນອາຊຽນ, ບ້ານນາຄຳ, ເມືອງສີໂຄຕະບອງ, Vientiane
เวลาทำการ : ทุกวัน 24 ชั่วโมง
Kolao Kokkokmart EV charging Station
ที่อยู่: 310 Rue Bourichane, Ban Phonsinuan, Unit-12, Sisattanak District, 0103 VientianeCapital, Lao PDR
เวลาทำการ : ทุกวัน 24 ชั่วโมง
Kolaocare Xaymoungkon EV charging station
ที่อยู่: ຖະໜົນ 13 ເໜືອ, ບ້ານສີເກີດ, ເມືອງນາຊາຍທອງ
เวลาทำการ : ทุกวัน 24 ชั่วโมง
ปลดล็อกระบบการแพทย์ออนไลน์ Telemedicine
ปัญหา
เนื่องจากการเข้าถึงการรักษาพยาบาลของประชาชนส่วนใหญ่กระจุกตัวอยู่ที่โรงพยาบาลใหญ่ เนื่องจากสถานบริการสาธารณสุขแบบปฐมภูมิขาดความพร้อม โดยเฉพาะด้านบุคลากร นอกจากนี้ประชาชนยังต้องมีภาระในการขอข้อมูลสุขภาพของตัวเองระหว่างโรงพยาบาล ในกรณีที่ต้องมีการส่งต่อผู้ป่วยไปรักษาต่อที่โรงพยาบาลอื่น และการเข้าถึงเตียงผู้ป่วยใน ที่ถึงเข้าได้ยาก เพราะเตียงมักจะเต็ม และต้องใช้เวลาในการส่งต่อผู้ป่วยไปโรงพยาบาลอื่นที่มีเตียงว่าง นอกจากนี้การเข้ารับรักษาในห้องฉุกเฉินมักมีกรณีที่ผู้ป่วยไม่ใช่ผู้ป่วยฉุกเฉินจริง ทำให้เป็นการลดศักยภาพในการรักษาผู้ป่วยฉุกเฉิน
ข้อเสนอ
- พัฒนาระบบ Telemedicine สำหรับการพบแพทย์ ตามนัดหมายหรือในกรณีฉุกเฉิน
- แก้ประกาศแพทยสภา เรื่อง มาตรฐานการตรวจรักษา เพื่อให้สามารถทำ telemed โดยไม่ต้องตรวจร่างกายได้
ฉาน Shan Spirit - เหล้ากบฏเงี้ยว LINK
SHAN-เหล้ากบฏเงี้ยว โปรเจ็คผลิตสุรากลั่นชุมชนของกลุ่มนักเคลื่อนไหวจังหวัดแพร่ ชื่อ "Shan Rebellion" หมายถึง "กบฏเงี้ยว" เพื่อรำลึกและช่วงชิงความหมายใหม่ของประวัติศาสตร์กบฏเงี้ยวเมืองแพร่ และ "เงี้ยว" ยังเป็นชื่อเรียกชาวไทใหญ่ที่อาศัยทำมาหากินอยู่ในดินแดนล้านนา เป็นเพื่อนพี่น้องของคนท้องถิ่น คนเมืองกับเงี้ยวใกล้ชิดเกี่ยวดองกันมาช้านาน ก่อนสยามจะเกี่ยวพันเสียด้วยซ้ำ
Shan Rebellion - เหล้ากบฏเงี้ยว เหล้าขาวของกลุ่มชาวบ้าน ต.สะเอียบ อ.สอง จว.แพร่ ถือเป็นภูมิปัญญาของคนท้องถิ่นที่สืบทอดกันมาเป็นเวลายาวนานกว่า 200 ปี ใช้น้ำจากแหล่งน้ำหล่มด้ง ที่มีต้นน้ำมาจากภูเขาไฟที่ดับแล้ว หมักกับข้าวเหนียว จึงเป็นเหล้าขาวชั้นดีโอทอป 4 ดาว ที่ผู้คนเมืองเหนือชื่นชอบ
ข้อมูลและภาพจากเพจ Shan Spirit - เหล้ากบฏเงี้ยว
351 ลำรางบ้านม้าบน
352 ลำรางบึงนายพล
353 ลำรางแบ่งเขตสวนหลวงกับเขตบางกะปิ
354 ลำรางแบนชะโด
355 ลำรางแบนตาโพ
356 ลำรางปลาย ซ.ทวีทรัพย์
357 ลำรางปลายซอยสองพี่น้อง
358 ลำรางปัญญา
359 ลำรางปากซอยปุณณวิถี 29 (นพรัตน์)
360 ลำรางเปรมประชา (ข้าง ม.ธนินทร)
361 ลำรางผู้ใหญ่บัว
362 ลำรางผู้ใหญ่วัน
363 ลำรางเพรสซิเด้น์ปาร์คและชุมชนอัลกุ๊บรอ
364 ลำรางมะพร้าวคต
365 ลำรางยายบัว
366 ลำรางยายพร้อม
367 ลำรางยายเลิ้ง
368 ลำรางยี่หวัง
369 ลำรางแยกคลองกะเฉด 2
370 ลำรางแยกคลองกำพร้า (1)
371 ลำรางแยกคลองกำพร้า (2)
372 ลำรางแยกคลองขวางล่าง
373 ลำรางแยกคลองครุ
374 ลำรางแยกคลองคู้บอน
375 ลำรางแยกคลองจระเข้ (หมู่บ้านบุรุษพัฒน์)
376 ลำรางแยกคลองจั่น
377 ลำรางแยกคลองจั่น
378 ลำรางแยกคลองเจ็ก
379 ลำรางแยกคลองเจ้าคุณสิงห์
380 ลำรางแยกคลองตาหนัง
381 ลำรางแยกคลองตาหนัง
382 ลำรางแยกคลองบางขวด ตอน 1
383 ลำรางแยกคลองบางจาก (คลองตลาดสายทิพย์)
384 ลำรางแยกคลองบางชัน
385 ลำรางแยกคลองบางซื่อ
386 ลำรางแยกคลองบางเตย ตอน 1
387 ลำรางแยกคลองบางนางจีน
388 ลำรางแยกคลองบางนางจีน (ช่วงซอยสุขุมวิท 85)
389 ลำรางแยกคลองบางอ้อใหญ่
390 ลำรางแยกคลองบ้านเกาะ
391 ลำรางแยกคลองบ้านม้า 1
392 ลำรางแยกคลองบ้านหลาย
393 ลำรางแยกคลองบ้านหลาย 2
394 ลำรางแยกคลองบ้านหลาย (หลังหมู่บ้านวรภูมิ)
395 ลำรางแยกคลองพระยาสุเรนทร์
396 ลำรางแยกคลองพลับพลา
397 ลำรางแยกคลองพังพวย
398 ลำรางแยกคลองมอญ
399 ลำรางแยกคลองลาดพร้าว
400 ลำรางแยกคลองลาดพร้าวบน
401 ลำรางแยกคลองลาดพร้าวล่าง
402 ลำรางแยกคลองลำกระโหลก
403 ลำรางแยกคลองลำพังพวย 2
404 ลำรางแยกคลองศาลาลอย
405 ลำรางแยกคลองสองตะวันตก
406 ลำรางแยกคลองสามเสน
407 ลำรางแยกคลองสามเสน
408 ลำรางแยกคลองสามเสน
409 ลำรางแยกคลองสามเสน
410 ลำรางแยกคลองสามอิน
411 ลำรางแยกคลองหกขุด (ลำรางทะลาย)
412 ลำรางแยกคลองหนองแขม
413 ลำรางแยกคลองหลวงวิจิตร
414 ลำรางแยกคลองหลุมบัว
415 ลำรางแยกคลองห้วยขวาง
416 ลำรางแยกชุมชนมุ่งพัฒนา
417 ลำรางแยกถนนศรีนครินทร์ (สี่แยกศรีพัฒน์)
418 ลำรางแยกลำรางชวดตาเชียง
419 ลำรางรณชัย
420 ลำรางระหว่างซอยลาดพร้าว 109-111
421 ลำรางโรงเรียนพูนสิน
422 ลำรางล็อค 1 (ถนนเลียบคลองสอง)
423 ลำรางล็อค 1 เชื่อมคลองสองตะวันตก กับคลองสามตะวันตก
424 ลำรางล้อค 1 เชื่อมคลองสามตะวันตก กับคลองสี่ตะวันตก
425 ลำรางล็อค 2 (ถนนเลียบคลองสอง)
426 ลำรางล็อค 2 (ถนนสามวา)
427 ลำรางล็อค 2 เชื่อมคลองสามตะวันตก กับคลองสี่ตะวันตก
428 ลำรางล็อค 2 เชื่อมคลองสามตะวันตก กับลำรางขวาง
429 ลำรางล็อค 3 (ถนนเลียบคลองสอง)
430 ลำรางล็อค 3 (ถนนสามวา)
431 ลำรางล็อค 3 เชื่อมคลองสองตะวันตก
432 ลำรางล็อค 3 เชื่อมคลองสามตะวันตก กับคลองสี่ตะวันตก
433 ลำรางล็อค 4 (ถนนเลียบคลองสอง)
434 ลำรางล็อค 4 (ถนนสามวา)
435 ลำรางล็อค 4 เชื่อมคลองสองตะวันตก กับลำรางแยกคลองพระยาสุเรนทร์
436 ลำรางล็อค 5 (ถนนสามวา)
437 ลำรางลาดน้ำ (หมู่บ้านสุขสันต์พัฒนา)
438 ลำรางลาดเป็ด
439 ลำรางเลียบซอยจำเนียรเสริม (ลำรางแยกลำรางตาป่วน)
440 ลำรางเลียบซอยลาดพร้าว 130
441 ลำรางเลียบซอยอินทราภรณ์
442 ลำรางเลียบถนนศรีวรา
443 ลำรางเลียบโรงเรียนพหลโยธิน
444 ลำรางเลื่อนอรรณพ (ต่อศักดิ์)
445 ลำรางวัดทองสัมฤทธิ์
446 ลำรางวัดแป้นทอง
447 ลำรางวัดมหาบุศย์
448 ลำรางวัดเวฬุวนาราม
449 ลำรางวัดใหญ่
450 ลำรางศรีศุภราช
451 ลำรางศรีสง่า
452 ลำรางศาลเจ้าพ่อต่วน
453 ลำรางศาลาคู้
454 ลำรางสมอกอง
455 ลำรางสะแกงาม
456 ลำรางสันนิธิอิสลาม
457 ลำรางสาธารณประโยชน์ (คลองขนานคลองกำพร้า 1)
458 ลำรางสาธารณประโยชน์ (คลองขนานคลองกำพร้า 2)
459 ลำรางสาธารณประโยชน์) (คลองขนานคลองกำพร้า 3)
460 ลำรางสาธารณประโยชน์ข้างการไฟฟ้าฯ (รางตะเคียน)
461 ลำรางสาธารณประโยชน์ข้างซอยอนามัย งามเจริญ 13
462 ลำรางสาธารณประโยชน์ข้างโรงปูน ซอยทวีทรัพย์
463 ลำรางสาธารณประโยชน์ข้าง หมู่บ้านเคหะฯ ส่วน 3
464 ลำรางสาธารณประโยชน์ต้นซอยทวีทรัพย์
465 ลำรางสาธารณประโยชน์หมู่บ้านสวัสดี
466 ลำรางสาธารณหลังการสื่อสารแห่ง ประเทศไทย
467 ลำรางสาธารณะ ถนนดำรงรักษ์
468 ลำรางสาธารณะ(ซอยโรงงานน้ำมันละพุ่ง)
469 ลำรางสาธารณะข้างซอยโรงน้ำแข็ง
470 ลำรางสาธารณะข้างโรงเรียนรุ่งอรุณ
471 ลำรางสาธารณะข้างวัดกก
472 ลำรางสาธารณะเข้าหมู่บ้านพิพรพงษ์ 1
473 ลำรางสาธารณะคลองถนน
474 ลำรางสาธารณะเคหะทุ่งสองห้อง
475 ลำรางสาธารณะชุมชนมุ่งวัฒนา
476 ลำรางสาธารณะซอยท่าข้าม 12
477 ลำรางสาธารณะซอยม่วงสกุล (ลำรางผี)
478 ลำรางสาธารณะซอยวัฒนา (สุขุมวิท 19)
479 ลำรางสาธารณะซอยวิภาวดีรังสิต 54
480 ลำรางสาธารณะซอยสวัสดี
481 ลำรางสาธารณะซอยแสมดำ 21
482 ลำรางสาธารณะในหมู่บ้านธนบุรีคอมเพล็กซ์
483 ลำรางสาธารณะประโยชน์
484 ลำรางสาธารณะประโยชน์
485 ลำรางสาธารณะประโยชน์
486 ลำรางสาธารณะประโยชน์ซอยวิภาวดี 48
487 ลำรางสาธารณะปลายซอยบางกระดี่ 43
488 ลำรางสาธารณะเมืองทอง 1
489 ลำรางสาธารณะแยกคลองเป้ง
490 ลำรางสาธารณะเลียบหมูบ้านบัณฑิตโฮม
491 ลำรางสาธารณะสุขุมวิท 15
492 ลำรางสาธารณะหนองงูเห่า
493 ลำรางสาธารณะหน้าวัดพุทธสยาม (วัดสีกัน)
494 ลำรางสาธารณะหมู่ 2 ซอยมีสุข
495 ลำรางสาธารณะหมู่บ้านปรางแก้ว
496 ลำรางสาธารณะหลังสถานีรถไฟหลักสี่
497 ลำรางสาธารณะหลังหมู่บ้านราณะ 2
498 ลำรางสำเภาทะลาย
499 ลำรางสิทธิโสม
500 ลำรางสีพูม
501 ลำรางสุเหร่าแดง
502 ลำรางสุเหร่าหัวหมากน้อย
503 ลำรางหนองกระดี่
504 ลำรางหนองปลาดุก
505 ลำรางหมู่บ้านเคหะนคร 2
506 ลำรางหมู่บ้านจิราธร
507 ลำรางหมู่บ้านเจ้าคุณ
508 ลำรางหมู่บ้านเมืองทอง 2/3
509 ลำรางหมู่บ้านแฮปปี้เพรส 2
510 ลำรางหลวง
511 ลำรางหลังโรงเรียนบ้านบางกะปิ
512 ลำรางหลังโรงเหล็ก ซอยสมพรเพชรทองคำ
513 ลำรางหลังวัดบางชัน
514 ลำรางหลังศูนย์การค้าวรจักร
515 ลำรางหอกหัก
516 ลำรางออหลาว
517 ลำรางอินทราชัย
518 ลำรางอินทามระ
519 ลำรางอิมเพลโฮม
520 ลำรางอีพรุน
521 ลำรางอุทัยรัตน์
ตัวอย่างการปักหมุด แพคเกจโปรแกรมสุขภาพ ในหมวดหมู่แพคเกจสุขภาพ
ตัวอย่างปักหมุดในหน้า
โปรแกรมตรวจสุขภาพ
• แสดงในลำดับแรกๆ ของหน้าหมวดหมู่
• รายการปักหมุดจะแสดงผลด้วยขนาดที่ใหญ่กว่าข้อมูลทั่วไป
• มีป้ายระบุ Recommend หรืออื่นๆ เพื่อบ่งชี้ให้ชัดเจนขึ้น
• แสดงข้อมูลมากกว่าข้อมูลทั่วไป เช่น ลิงค์ไปยังโซเชี่ยลมีเดีย เว็บไซต์ แผนที่ เป็นต้น
• แสดงที่หน้า Homepage ด้วย
เทศบาลเมือง
1 ชลบุรี เทศบาลเมืองหนองปรือ
2 ปทุมธานี เทศบาลเมืองท่าโขลง
3 ระยอง เทศบาลเมืองมาบตาพุด
4 สมุทรปราการ เทศบาลเมืองปู่เจ้าสมิงพราย
5 สมุทรปราการ เทศบาลเมืองลัดหลวง
6 ชลบุรี เทศบาลเมืองบ้านสวน
7 ปทุมธานี เทศบาลเมืองลาดสวาย
8 ปทุมธานี เทศบาลเมืองคลองหลวง
9 ประจวบคีรีขันธ์ เทศบาลเมืองหัวหิน
10 ปทุมธานี เทศบาลเมืองลำสามแก้ว
11 สมุทรปราการ เทศบาลเมืองบางแก้ว
12 ลำปาง เทศบาลเมืองเขลางค์นคร
13 สระบุรี เทศบาลเมืองสระบุรี
14 นนทบุรี เทศบาลเมืองใหม่บางบัวทอง
15 ขอนแก่น เทศบาลเมืองศิลา
16 นนทบุรี เทศบาลเมืองบางบัวทอง
17 สงขลา เทศบาลเมืองควนลัง
18 สมุทรปราการ เทศบาลเมืองแพรกษาใหม่
19 นนทบุรี เทศบาลเมืองพิมลราช
20 นนทบุรี เทศบาลเมืองบางแม่นาง
21 นนทบุรี เทศบาลเมืองบางรักพัฒนา
22 มหาสารคาม เทศบาลเมืองมหาสารคาม
23 หนองคาย เทศบาลเมืองหนองคาย
24 ชลบุรี เทศบาลเมืองแสนสุข
25 สงขลา เทศบาลเมืองคอหงส์
26 ปัตตานี เทศบาลเมืองปัตตานี
27 นนทบุรี เทศบาลเมืองบางกรวย
28 ปทุมธานี เทศบาลเมืองคูคต
29 สงขลา เทศบาลเมืองเขารูปช้าง
30 สงขลา เทศบาลเมืองคลองแห
31 เพชรบุรี เทศบาลเมืองชะอำ
32 นราธิวาส เทศบาลเมืองสุไหงโก-ลก
33 นนทบุรี เทศบาลเมืองบางคูรัด
34 ศรีสะเกษ เทศบาลเมืองศรีสะเกษ
35 นราธิวาส เทศบาลเมืองนราธิวาส
36 สงขลา เทศบาลเมืองสิงหนคร
37 สุรินทร์ เทศบาลเมืองสุรินทร์
38 ฉะเชิงเทรา เทศบาลเมืองฉะเชิงเทรา
39 สมุทรปราการ เทศบาลเมืองแพรกษา
40 สมุทรปราการ เทศบาลเมืองปากน้ำสมุทรปราการ
41 ชลบุรี เทศบาลเมืองอ่างศิลา
42 ชัยภูมิ เทศบาลเมืองชัยภูมิ
43 ร้อยเอ็ด เทศบาลเมืองร้อยเอ็ด
44 ยะลา เทศบาลเมืองสะเตงนอก
45 ราชบุรี เทศบาลเมืองราชบุรี
46 นครศรีธรรมราช เทศบาลเมืองปากพูน
47 นครปฐม เทศบาลเมืองไร่ขิง
48 ชุมพร เทศบาลเมืองชุมพร
49 ปทุมธานี เทศบาลเมืองบึงยี่โถ
50 นครราชสีมา เทศบาลเมืองปากช่อง
51 นนทบุรี เทศบาลเมืองบางศรีเมือง
52 สระบุรี เทศบาลเมืองพระพุทธบาท
53 มุกดาหาร เทศบาลเมืองมุกดาหาร
54 ปทุมธานี เทศบาลเมืองสนั่นรักษ์
55 กาฬสินธุ์ เทศบาลเมืองกาฬสินธุ์
56 กระบี่ เทศบาลเมืองกระบี่
57 พัทลุง เทศบาลเมืองพัทลุง
58 ระยอง เทศบาลเมืองบ้านฉาง
59 ขอนแก่น เทศบาลเมืองชุมแพ
60 ภูเก็ต เทศบาลเมืองกะทู้
61 อุตรดิตถ์ เทศบาลเมืองอุตรดิตถ์
62 พิษณุโลก เทศบาลเมืองอรัญญิก
63 ปทุมธานี เทศบาลเมืองบางคูวัด
64 นครศรีธรรมราช เทศบาลเมืองทุ่งสง
65 อุดรธานี เทศบาลเมืองหนองสำโรง
66 ลพบุรี เทศบาลเมืองเขาสามยอด
67 นครปฐม เทศบาลเมืองกระทุ่มล้ม
68 กำแพงเพชร เทศบาลเมืองกำแพงเพชร
69 กาญจนบุรี เทศบาลเมืองปากแพรก
70 ขอนแก่น เทศบาลเมืองบ้านไผ่
71 สมุทรสาคร เทศบาลเมืองกระทุ่มแบน
72 สมุทรสงคราม เทศบาลเมืองสมุทรสงคราม
73 สงขลา เทศบาลเมืองบ้านพรุ
74 กาญจนบุรี เทศบาลเมืองกาญจนบุรี
75 ยะลา เทศบาลเมืองเบตง
76 นครพนม เทศบาลเมืองนครพนม
77 อุบลราชธานี เทศบาลเมืองวารินชำราบ
78 อำนาจเจริญ เทศบาลเมืองอำนาจเจริญ
79 บุรีรัมย์ เทศบาลเมืองบุรีรัมย์
80 ชลบุรี เทศบาลเมืองชลบุรี
81 สุพรรณบุรี เทศบาลเมืองสุพรรณบุรี
82 นนทบุรี เทศบาลเมืองบางกร่าง
83 นนทบุรี เทศบาลเมืองไทรม้า
84 ปทุมธานี เทศบาลเมืองปทุมธานี
85 ชลบุรี เทศบาลเมืองศรีราชา
86 เชียงใหม่ เทศบาลเมืองแม่โจ้
87 ระนอง เทศบาลเมืองบางริ้น
88 นครสวรรค์ เทศบาลเมืองตาคลี
89 สตูล เทศบาลเมืองสตูล
90 จันทบุรี เทศบาลเมืองจันทบุรี
91 เพชรบูรณ์ เทศบาลเมืองวิเชียรบุรี
92 ชลบุรี เทศบาลเมืองสัตหีบ
93 สมุทรสาคร เทศบาลเมืองคลองมะเดื่อ
94 หนองบัวลำภู เทศบาลเมืองหนองบัวลำภู
95 สงขลา เทศบาลเมืองสะเดา
96 พระนครศรีอยุธยา เทศบาลเมืองลำตาเสา
97 ลพบุรี เทศบาลเมืองลพบุรี
98 พิจิตร เทศบาลเมืองพิจิตร
99 เลย เทศบาลเมืองเลย
100 ชลบุรี เทศบาลเมืองบ้านบึง
101 สระแก้ว เทศบาลเมืองวังน้ำเย็น
102 เพชรบุรี เทศบาลเมืองเพชรบุรี
103 บุรีรัมย์ เทศบาลเมืองนางรอง
104 เพชรบูรณ์ เทศบาลเมืองเพชรบูรณ์
105 ยโสธร เทศบาลเมืองยโสธร
106 ราชบุรี เทศบาลเมืองท่าผา
107 บึงกาฬ เทศบาลเมืองบึงกาฬ
108 พระนครศรีอยุธยา เทศบาลเมืองอโยธยา
109 บุรีรัมย์ เทศบาลเมืองชุมเห็ด
110 สระบุรี เทศบาลเมืองทับกวาง
111 นราธิวาส เทศบาลเมืองตากใบ
112 เชียงใหม่ เทศบาลเมืองแม่เหียะ
113 เชียงใหม่ เทศบาลเมืองต้นเปา
114 ภูเก็ต เทศบาลเมืองป่าตอง
115 นครศรีธรรมราช เทศบาลเมืองปากพนัง
116 สุราษฎร์ธานี เทศบาลเมืองนาสาร
117 น่าน เทศบาลเมืองน่าน
118 ระนอง เทศบาลเมืองระนอง
119 ขอนแก่น เทศบาลเมืองบ้านทุ่ม
120 สุราษฎร์ธานี เทศบาลเมืองท่าข้าม
121 สระแก้ว เทศบาลเมืองสระแก้ว
122 ประจวบคีรีขันธ์ เทศบาลเมืองประจวบคีรีขันธ์
123 ศรีสะเกษ เทศบาลเมืองกันทรลักษ์
124 กำแพงเพชร เทศบาลเมืองปางมะค่า
125 หนองคาย เทศบาลเมืองท่าบ่อ
126 สงขลา เทศบาลเมืองกำแพงเพชร
127 สงขลา เทศบาลเมืองทุ่งตำเสา
128 สระแก้ว เทศบาลเมืองอรัญญประเทศ
129 สิงห์บุรี เทศบาลเมืองสิงห์บุรี
130 นครปฐม เทศบาลเมืองสามพราน
131 นครราชสีมา เทศบาลเมืองสีคิ้ว
132 ปราจีนบุรี เทศบาลเมืองปราจีนบุรี
133 พะเยา เทศบาลเมืองพะเยา
134 นครนายก เทศบาลเมืองนครนายก
135 ราชบุรี เทศบาลเมืองบ้านโป่ง
136 ตาก เทศบาลเมืองตาก
137 ปราจีนบุรี เทศบาลเมืองหนองกี่
138 สงขลา เทศบาลเมืองปาดังเบซาร์
139 อุดรธานี เทศบาลเมืองบ้านดุง
140 สุโขทัย เทศบาลเมืองสวรรคโลก
141 สุโขทัย เทศบาลเมืองศรีสัชนาลัย
142 ปทุมธานี เทศบาลเมืองบางกะดี
143 แพร่ เทศบาลเมืองแพร่
144 ปัตตานี เทศบาลเมืองตะลุบัน
145 ชลบุรี เทศบาลเมืองปรกฟ้า
146 ลำปาง เทศบาลเมืองล้อมแรด
147 จันทบุรี เทศบาลเมืองท่าช้าง
148 อุทัยธานี เทศบาลเมืองอุทัยธานี
149 สุโขทัย เทศบาลเมืองสุโขทัยธานี
150 สิงห์บุรี เทศบาลเมืองบางระจัน
151 นครปฐม เทศบาลเมืองนครปฐม
152 นครราชสีมา เทศบาลเมืองเมืองปัก
153 พิจิตร เทศบาลเมืองตะพานหิน
154 นครราชสีมา เทศบาลเมืองบัวใหญ่
155 อุบลราชธานี เทศบาลเมืองเดชอุดม
156 พระนครศรีอยุธยา เทศบาลเมืองบ้านกรด
157 ลำปาง เทศบาลเมืองพิชัย
158 กำแพงเพชร เทศบาลเมืองหนองปลิง
159 เชียงใหม่ เทศบาลเมืองเมืองแกนพัฒนา
160 พะเยา เทศบาลเมืองดอกคำใต้
161 สุพรรณบุรี เทศบาลเมืองสองพี่น้อง
162 สงขลา เทศบาลเมืองม่วงงาม
163 สุราษฎร์ธานี เทศบาลเมืองดอนสัก
164 จันทบุรี เทศบาลเมืองจันทนิมิต
165 อ่างทอง เทศบาลเมืองอ่างทอง
166 ตรัง เทศบาลเมืองกันตัง
167 ชัยนาท เทศบาลเมืองชัยนาท
168 นครปฐม เทศบาลเมืองสามควายเผือก
169 ลำพูน เทศบาลเมืองลำพูน
170 อุบลราชธานี เทศบาลเมืองแจระแม
171 เพชรบูรณ์ เทศบาลเมืองหล่มสัก
172 กาฬสินธุ์ เทศบาลเมืองกุฉินารายณ์
173 กาญจนบุรี เทศบาลเมืองท่าเรือพระแท่น
174 สระบุรี เทศบาลเมืองแก่งคอย
175 ชุมพร เทศบาลเมืองหลังสวน
176 ราชบุรี เทศบาลเมืองจอมพล
177 เลย เทศบาลเมืองวังสะพุง
178 จันทบุรี เทศบาลเมืองขลุง
179 ขอนแก่น เทศบาลเมืองเมืองพล
180 อุบลราชธานี เทศบาลเมืองพิบูลมังสาหาร
181 จันทบุรี เทศบาลเมืองท่าใหม่
182 พังงา เทศบาลเมืองพังงา
183 ชลบุรี เทศบาลเมืองพนัสนิคม
184 ขอนแก่น เทศบาลเมืองกระนวน
185 ตราด เทศบาลเมืองตราด
186 พระนครศรีอยุธยา เทศบาลเมืองผักไห่
187 สมุทรปราการ เทศบาลเมืองพระประแดง
188 อุดรธานี เทศบาลเมืองโนนสูง-น้ำคำ
189 ราชบุรี เทศบาลเมืองโพธาราม
190 พิจิตร เทศบาลเมืองบางมูลนาก
191 พังงา เทศบาลเมืองตะกั่วป่า
192 นครสวรรค์ เทศบาลเมืองชุมแสง
193 แม่ฮ่องสอน เทศบาลเมืองแม่ฮ่องสอน
194 พระนครศรีอยุธยา เทศบาลเมืองเสนา
195 ลพบุรี เทศบาลเมืองบ้านหมี่
ย้อนโพสต์ ดร.เอ้ สุชัชวีร์ เคยเตือน โครงการก่อสร้างนี้ เมื่อปี 65
กรรมกรข่าว โพสต์ ดร.เอ้ สุชัชวีร์ สิงหาคมปีที่แล้ว เคยเตือน โครงการก่อสร้าง ‘สะพานข้าม ถนนอ่อนนุช-หัวตะเข้’ ก่อนเกิดเหตุสะพานข้ามแยกถล่มวันนี้
"กลับบ้านวันศุกร์ ไม่สุข ไม่ปลอดภัย"
ผมขอแสดงความเป็นห่วงจากใจ โครงการก่อสร้างสะพานข้าม ถนนอ่อนนุช-หัวตะเข้ เขตลาดกระบัง เห็นปัญหาชัดเจน
1. เครื่องจักรใหญ่ทำงาน ไม่มีแนวป้องกัน เสี่ยงอุบัติเหตุของหล่น ประชาชนเดือดร้อนทเสี่ยงชีวิต
2. ถนนยุบจากการก่อสร้าง เสี่ยงอุบัติเหตุ โดยเฉพาะรถจักรยานยนต์ ของเด็กนักศึกษา ห่วงจริงๆ
3. รถติดสาหัส เพราะก่อสร้างกินพื้นที่ บางช่วงก่อสร้างเสร็จแล้ว ต้อง คืนพื้นที่ให้ประชาชนผู้สัญจรได้
เพราะอุบัติเหตุจากการก่อสร้างสะพาน เกิดขึ้นบ่อยครั้ง หลายครั้งมีผู้เสียชีวิต มีทรัพย์สินเสียหาย
ขออย่าให้เกิดที่ใด กับใคร อีกเลยครับ
เป็นห่วงจริงๆ ครับ”
ศูนย์บริการสาธารณสุข 43 มีนบุรี
วันที่ 6 กรกฎาคม 2566 ศูนย์บริการสาธารณสุข 43 มีนบุรี ได้ดำเนินงานดูแลผู้ที่ใช้ยาเสพติดโดยใช้ชุมชนเป็นศูนย์กลาง (Community-Besed Treatment and care : CBTx) และการลดอันตรายจากการใช้ยาเสพติด (Harm Reduction) โดยมีกิจกรรมดังนี้
1. ทำแบบวัดคุณภาพชีวิตองค์การอนามัยโลก (WHOQOL-BRFF-THAI)
2. ทำกิจกรรมกลุ่มบำบัดโดยให้ความรู้ในการดำเนินชีวิตของผู้บำบัดหลังผ่านการประเมินในการบำบัดรักษายาเสพติด
3. ตรวจปัสสาวะหาสารเสพติด
4. ให้หนังสือรับรองผู้ผ่านการบำบัดฟื้นฟูที่ผ่านการประเมิน
วันที่ 20 มิ.ย. 2566 ศูนย์บริการสาธารณสุข 43 มีนบุรี ดำเนินงานตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดในชุมชนโดยชุมชนเป็นศูนย์กลาง (Community-Based Treatment and care :CBTx) และการลดอันตรายจากการใช้ยาเสพติด (HARM Reduction) จัดกิจกรรม ประชุมคณะทำงานบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชน ครั้งที่ 2 ในวันที่ 20 มิถุนายน 2566 ณ ห้องประชุม ชั้น 5 ศูนย์บริการสาธารณสุข 43 มีนบุรี โดยมีแพทย์หญิงศิริวดี จันทรชาติ ประธานคณะทำงาน ร่วมกับคณะทำงานได้แก่ ศูนย์บริการสาธารณสุข 43 มีนบุรี สำนักงานเขตมีนบุรี สถานีตำรวจนครบาลมีนบุรี ประธานชุมสุเหร่าบ้านเกาะ อสส. สุเหร่าบ้านเกาะ สำนักงานป้องกันและการบำบัดยาเสพติด เข้าร่วมประชุมหารือในการดำเนินการและแก้ไขปัญหายาเสพติดในชุมชนสุเหร่าบ้านเกาะ
7 มีนาคม 2566 ศูนย์บริการสาธารณสุข 43 มีนบุรี ดำเนินงานตามโครงการสนับสนุนการดำเนินงานดูแลผู้ที่ใช้ยาเสพติดโดยใช้ชุมชนเป็นศูนย์กลาง (Community-Bestd Treatment and care :CBTx) และการลดอันตรายจากการใช้ยาเสพติด (HARM Reduction) จัดกิจกรรม ประชุมคณะทำงานบำบัดฟื้นฟูผู้มีปัญหาการใช้ยาเสพติดในชุมชน ในวันที่ 7 มีนาคม 2566 ณ ห้องประชุม ศุภมงคล ชั้น 5 ศูนย์บริการสาธารณสุข 43 มีนบุรี โดยการอำนวยการของ นายแพทย์บุญธรรม ทุมพงษ์ ผู้อำนวยการศูนย์บริการสาธารณสุข 43 มีนบุรี ประธานคณะทำงาน ร่วมกับคณะทำงานได้แก่ ศูนย์บริการสาธารณสุข 43 มีนบุรี,สำนักงานเขตมีนบุรี, สำนักงาน ปปส.กทม., สำนักงานสวัสดิการและคุ้มครองแรงงานกรุงเทพมหานครพื้นที่ 10, สถานีตำรวจนครบาลมีนบุรี, มูลนิธิรักษ์ไทยษ์ (NGO), สำนักงานป้องกันและบำบัดการติดยาเสพติด สำนักอนามัย, คลินิกก้าวใหม่พลัส, ประธานชุมชนสุเหร่าบ้านเกาะ, อาสาสมัครสาธารณสุขเฝ้าระวังภัยยาเสพติด
มีผู้เข้าร่วมประชุมจำนวน 24 คน
โดยการประชุมในครั้งนี้เป็นการประชุมเพื่อขับเคลื่อนการดูแลแก้ไขปัญหายาเสพติดในชุมชนโดยชุมชน ตามแนวทางการดูแลผู้มีปัญหายาเสพติดโดยชุมชนเป็นศูนย์หรือเป็นฐาน (Community-Based Treatment : CBTx) และการลดอันตรายจากยาเสพติด (Harm Reduction) รวมทั้งชี้แจงวัตถุประสงค์ของโครงการ การแลกเปลี่ยนเรียนรู้ปัญหา ข้อมูลและสถานการณ์ด้านยาเสพติดในชุมชน ตลอดจนร่วมกันวางแผนในการขับเคลื่อนการดำเนินงาน CBTx และกำหนดวันในการจัดเวทีประชาคมในชุมชนต่อไป
วันที่ 22 ธันวาคม 2565 ศูนย์บริการสาธารณสุข 43 มีนบุรี ได้จัดทำโครงการชุมชนยั่งยืน ร่วมกับเจ้าหน้าที่ตำรวจ นำโดยท่านผู้กำกับ สถานีตำรวจนครบาลมีนบุรีและตำรวจชุมชนสัมพันธ์ รวมทั้งอาสาสมัครสาธารณสุขกรุงเทพมหานคร จากชุมชนสุเหร่าบ้านเกาะ เพื่อร่วมทำกิจกรรมค้นหา คัดกรอง ผู้ติดผู้เสพยาเสพติด เข้ารับการบำบัดรักษาโดยใช้กิจกรรม CBTx ในชุมชน
ครั้งที่ 1 วันที่ 15 ธันวาคม 2565
ครั้งที่ 2 วันที่ 22 ธันวาคม 2565
สารพัดสารที่มีชื่อโซเดียม ที่นำมาใช้ในอาหาร
เกลือเป็นโซเดียมที่มีรสเค็ม แต่โซเดียมก็มีอีกหลายอย่างที่นำมาใช้ในอาหาร จะเรียกกันว่าเป็น "โซเดียมแฝง" เพราะชื่อและองค์ประกอบทางเคมี จะมีโซเดียมอยู่ทั้งสิ้น มีอะไรบ้าง
- โมโนโซเดียมกลูตาเมต หรือผงชูรส วัตถุเจือปนอาหาร ที่มีลักษณะเป็นผงผลึกสีขาว ไม่มีกลิ่น รสชาติแปลกๆ แต่ช่วยเพิ่มรสชาติอาหารให้อร่อยขึ้นได้ ซึ่งสารกลูตาเมตในผงชูรสนั้นจะไปกระตุ้นตุ่มรับรสในปาก และลำคอให้ขยายตัวจึงทำให้รับรสได้ไวกว่าปกติ ทำให้อาหารที่โมโนโซเดียมกลูตาเมต หรือผงชูรสนั้นมีความอร่อย
- โซเดียมไนไตรท์ วัตถุเจือปนอาหาร ที่มีลักษณะเป็นผงผลึกสีขาว ไม่มีกลิ่น รสชาติออกไปทางเค็ม ช่วยป้องกันการเน่าเสียของอาหาร และทำให้เนื้อสัตว์มีสีที่สดใหม่อยู่เสมอ โซเดียมไนไตรท์มักจะอยู่ในอาหารจำพวก ไส้กรอก หมูยอ กุนเชียง และปลาเค็มตากแห้ง เป็นต้น
- โซเดียมเบนโซเอต หรือสารกันบูด ที่มีลักษณะเป็นผลึกสีขาว สามารถละลายในน้ำได้ มีคุณสมบัติยับยั้งการเจริญเติบโตของจุลินทรีย์ จึงใช้โซเดียมเบนโซเอต หรือสารกันบูด ใช้ในการถนอมอาหาร เพื่อให้อาหารเกิดการเน่าเสียได้นานกว่าปกติ สารกันบูดมักจะอยู่ในอาหารจำพวก น้ำอัดลม น้ำผลไม้ อาหารดอง และน้ำส้มสายชู เป็นต้น
- โซเดียมไบคาร์บอเนต หรือเบกกิ้งโซดา (Baking Soda) มีลักษณะเป็นผงผลึกสีขาว ละลายในน้ำได้ ช่วยให้ลักษณะอาหารฟูขึ้น เบกกิ้งโซดามักจะอยู่ในอาหารจำพวก เบเกอรี่ เค้ก คุกกี้ และขนมปัง เป็นต้น
- โซเดียมอัลจิเนต หรือ วัตถุเจือปนอาหาร ที่มีคุณสมบัติที่ทำให้ให้เกิดการคงตัว ลักษณะอาหารที่ใช้โซเดียมอัลจิเนตเป็นส่วนประกอบ จึงมีลักษณะหนืด ข้น มักจะอยู่ในอาหารจำพวก เจลลี่ ไข่มุก และไอศกรีม เป็นต้น
- โซเดียมซอร์เบต เป็นสารกันเสียชนิดหนึ่ง ใช้ในการถนอมอาหาร เพื่อให้อาหารเกิดการเน่าเสียได้นานกว่าปกติ มักจะอยู่ในอาหารจำพวก เนย ชีส และโยเกิร์ต เป็นต้น
ปริมาณโซเดียมในน้ำจิ้มสุดโปรดสูตรต่างๆ
โรงพยาบาลเพื่อการสอนด้านสัตว์เล็ก คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเทคโนโลยีมหานคร
140 ถนนเชื่อมสัมพันธ์ เขตหนองจอก กรุงเทพมหานคร 10530
โทรศัพท์. 02-988-3655 ต่อ 4118,4119 หรือ 084-4550925
เวลาทำการ
จันทร์-อังคาร เช้า 09.00-11.30 น. บ่าย 13.00-19.30 น.
พุธ เช้า 09.00-11.30 น.บ่ายปิดบริการ
พฤหัส-ศุกร์ เช้า 09.00-11.30 น. บ่าย 13.00-19.30 น.
เสาร์-อาทิตย์ เช้า 09.00-11.30 น. บ่าย 13.00-17.00 น.
หยุดทุกวันหยุดนักขัตฤกษ์ ผ่าตัดศัลยกรรมโทรนัดล่วงหน้า
Facebook |
Website |
แผนที่
นายฉัฐณัฐ วิมลธีรโชค ตัวแทนชุมชนเคหะหลักสี่ รุ่นที่ 2 กับการตรวจวัดความดัน ความเป็นมาของโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด
โครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิด เป็นนโยบายสำคัญระดับชาติตามแผนบูรณาการ การพัฒนาคนตลอดช่วงชีวิต เป็นการสร้างระบบคุ้มครองทางสังคมโดยการจัดสวัสดิการเงินอุดหนุนให้แก่ เด็กแรกเกิดในครัวเรือนยากจนหรือครัวเรือนที่เสี่ยงต่อความยากจน เป็นมาตรการให้บิดา มารดาหรือ ผู้ปกครองนำเด็กเข้าสู่ระบบบริการของรัฐ เพื่อให้เด็กได้รับการดูแลให้มีคุณภาพชีวิตที่ดี มีพัฒนาการเหมาะสม ตามวัย รวมทั้งเป็นหลักประกันให้เด็กได้รับสิทธิด้านการอยู่รอดและการพัฒนาตามอนุสัญญาว่าด้วยสิทธิเด็ก มีความสอดคล้องกับยุทธศาสตร์ชาติด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์ตามยุทธศาสตร์ชาติ 20 ปี (พ.ศ. 2561 – 2580) ยุทธศาสตร์การเสริมสร้างและพัฒนาศักยภาพทุนมนุษย์ของแผนพัฒนาเศรษฐกิจ และสังคมแห่งชาติ ฉบับที่ 12 (พ.ศ. 2560 – 2564) และแผนพัฒนาเด็กและเยาวชนแห่งชาติ ฉบับที่ 2 (พ.ศ. 2560 – 2564)
– ตามมติคณะรัฐมนตรีเมื่อวันที่ 31 มีนาคม 2558 กลุ่มเป้าหมายเด็กที่อยู่นอกระบบประกันสังคมในครัวเรือนยากจนหรือครัวเรือนที่เสี่ยงต่อความยากจน (รายได้ครัวเรือนเฉลี่ยไม่เกิน 36,000 บาท ต่อคน ต่อปี) เป็นเด็กที่เกิดระหว่างวันที่ 1 ตุลาคม 2558 – 30 กันยายน 2559 โดยอุดหนุนเงินรายละ 400 บาท ต่อเดือน เป็นเวลา 1 ปี เริ่มจ่ายเงินอุดหนุนตั้งแต่ ปีงบประมาณ 2559
– คณะรัฐมนตรีจึงมีมติเมื่อวันที่ 22 มีนาคม 2559 ให้ขยายเวลาการให้เงินอุดหนุน ตั้งแต่แรกเกิดจนถึงอายุ 3 ปี และเพิ่มวงเงินเป็น 600 บาท ต่อคน ต่อเดือน
– คณะรัฐมนตรีได้มีมติเมื่อวันที่ 7 พฤศจิกายน 2560 ยกเลิกเงื่อนไขผู้มีสิทธิที่ต้องไม่เป็นผู้อยู่ในระบบประกันสังคม และเริ่มตั้งแต่ปีงบประมาณ 2561 รวมทั้งให้กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์พิจารณาความเหมาะสมและความเป็นไปได้ในการเชื่อมโยงข้อมูลผู้มีรายได้น้อยตามโครงการลงทะเบียนเพื่อสวัสดิการของรัฐ นํามาใช้เป็นเกณฑ์กําหนดคุณสมบัติผู้เข้าร่วมโครงการและปรับปรุง กระบวนการตรวจสอบและรับรองสิทธิ
– คณะรัฐมนตรีจึงมีมติเมื่อวันที่ 26 มีนาคม 2562 ขยายระยะเวลาให้เงินอุดหนุนเพื่อการเลี้ยงดูเด็กตั้งแต่แรกเกิด – 6 ปี และขยายฐานรายได้ของกลุ่มเป้าหมายไม่เกิน 100,000 บาท ต่อคน ต่อปี
วัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ 1 เข็ม โรงพยาบาลพญาไท ศรีราชา
วัคซีนป้องกันไข้หวัดใหญ่ 4 สายพันธุ์ 1 เข็ม 790 บาท
การฉีดวัคซีนไข้หวัดใหญ่ จะช่วยเพิ่มภูมิคุ้มกันในการป้องกันโรค องค์การอนามัยโลกได้แนะนำให้ฉีดวัคซีนป้องกันไข้หวัดใหญ่เป็นประจำทุกปี โดยเฉพาะในผู้ที่มีปญหาด้านสุขภาพอื่นๆ เพราะหากป่วยเป็นไข้หวัดใหญ่อาจส่งผลกระทบต่อโรคประจำตัวที่เป็นอยู่ได้
ศูนย์กุมารเวชกรรม อาคาร A ชั้น 3 038-317-333 ต่อ 2305 , 2337 089-244-1336
สำนักงานป้องกันควบคุมโรคที่ 12 จังหวัดสงขลา
168 ถนนสงขลา - นาทวี ตำบลเขารูปช้าง อำเภอเมือง จังหวัดสงขลา 90000
โทร. 074-336080 ต่อ 29
POR_001
ผลของการพัฒนา RAMAN PPH Model ต่อประสิทธิผล
การป้องกันภาวะตกเลือดหลังคลอด โรงพยาบาลรามัน
นางสาวรานีย์ ยุมิง
นางรอมือล๊ะ เจ๊ะแว
นางสาวนลินา วารี
(โรงพยาบาลรามัน)
POR_002
ผลของการฟื้นฟูทางไกลด้วยวิดีโอคอนเฟอเรนซ์ต่อความ
สามารถในการทำกิจวัตรประจำวันในผู้ป่วยโรคหลอดเลือด
สมอง
นางสาวนูรูลฮูดา มะดีเยาะ
นางสาวหัสมะ มะสากา
(โรงพยาบาลรามัน)
POR_003
ผลการนวดรักษาแบบราชสำนักร่วมกับการประคบสมุนไพร
ใ น ผู้ ป่ ว ย อ อ ฟ ฟิ ศ ซิ น โ ด ร ม ที่ มี อ า ก า ร ป ว ด ต้ น ค อ
โรงพยาบาลกะพ้อ จังหวัดปัตตานี
นางสาวนูรูลฮูดา เจ๊ะเต๊ะ
นายอัมรัน ปาเนาะ
(โรงพยาบาลกะพ้อ)
POR_004
พัฒนารูปแบบการสร้างเสริมสุขภาพด้วยการปรับเปลี่ยน
พฤติกรรมของพนักงานโรงพยาบาลกรุงเทพภูเก็ต
นางสุพรรณิการ์ พูนธนานิวัฒน์กุล
ค ณนามชนก สีหยาตรา
ค ณการุณ รามการุณ
(โรงพยาบาลกรุงเทพภูเก็ต)
รพ.ศรีสุโข วัคซีนป้องกันไข้เลือดออก
วัคซีนนี้เป็นวัคซีนชนิดเชื้อเป็น ฉีดในผู้ที่เคยเป็นไข้เลือดออกมาก่อน ผู้รับวัคซีนควรมีอายุระหว่าง 6-45 ปี ฉีดทั้งหมด 3 เข็ม โดยมีระยะเวลาห่างแต่ละเข็มนาน 6 เดือน ไม่เหมาะกับ ผู้ที่ได้รับยากดภูมิ ได้รับยาเคมีบำบัด ผู้ติดเชื้อ เอชไอวี คนที่มีภูมิคุ้มกันผิดปกติรวมทั้งหญิงตั้งครรภ์ ราคาเข็มละ 3,500บาท ค่าบริการทางการแพทย์ 200 บาท โทรศัพท์ติดต่อได้ที่ 063-339-3654
รพ.ศรีสุโข รพ.บางระกำ ทำฟันฟรี 20 ตุลาคม 2566
กลุ่มงานทันตกรรม โรงพยาบาลบางระกำและโรงพยาบาลส่งเสริมสุขภาพตำบลในเครือข่ายขอเชิญประชาชนผู้สนใจเข้ารับบริการทำฟันฟรี เนื่องในวันทันตสาธารณสุขแห่งชาติ ประจำปี 2566
ในวันศุกร์ที่ 20 ตุลาคม 2566 เวลา 08:30 - 14:00 น.สอบถามรายละเอียดเพิ่มเติมที่ โทร. 0-5537-1168 ต่อ 118 (ในวันและเวลาราชการ) LINE Official ID : @xyc0320u
คลินิกทางเดินอาหาร
คลินิกทางเดินอาหาร
- คลินิกระบบทางเดินอาหาร ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกโรคตับ ในเวลาราชการ 08.00 น. - 16.00 น.
- คลินิกFlbroscan / คลินิก Urea Breath Test ในเวลาราชการ 08.00 น. - 16.00 น.
สิ่งสำคัญภายในวัดไก่เตี้ย


สิ่งสำคัญภายในวัดไก่เตี้ย
(ศรัณย์ ทองปาน 2549? : 90) ได้แก่
อุโบสถ สร้างขึ้นใหม่แทนที่อุโบสถหลังเดิมที่รื้อไปเมื่อ พ.ศ.2511 กว้าง 20 เมตร ยาว 40 เมตร หันหน้าไปทางทิศตะวันออก (หันหน้าสู่คลองบางกอกน้อย) หน้าบันทำเป็นพระพุทธรูปประทับนั่ง ปางสมาธิ ด้านล่างมีรูปไก่อยู่ในวงกลม (คงสร้างขึ้นตามนามของวัด) แต่เดิมลวดลายหน้าบันเป็นลายกนกและพรรณพฤกษา (วลัยลักษณ์ ทรงศิริ 2552)
ภายในประดิษฐานพระประธานที่อัญเชิญมาจากอุโบสถหลังเดิม เป็นพระพุทธรูปสมัยสุโขทัย เอกสารของวัดระบุว่าที่ฐานมีจารึกว่าหล่อขึ้นเมื่อ พ.ศ.1989 สันนิษฐานว่าจะอัญเชิญมาประดิษฐานไว้ตั้งแต่เมื่อแรกสร้างวัด โดยอาจอัญเชิญลงมาจากหัวเมืองเหนือในรัชกาลที่ 1 พร้อมกับพระพุทธรูปพันกว่าองค์ที่อัญเชิญมาประดิษฐานอยู่ตามพระอารามหลวงของกรุงรัตนโกสินทร์
วิหาร ตั้งอยู่ทางทิศเหนือของอุโบสถ หันหน้าไปทางทิศตะวันออก (หันหน้าสู่คลองบางกอกน้อย) เชื่อกันว่าสร้างพร้อมอุโบสถหลังเดิมตั้งแต่แรกสร้างวัด หน้าบันของวิหารเป็นไม้จำหลัก หน้าบันของมุขด้านล่างเป็นลายเครือเถากนกออกปลายเป็นเทพนม ตรงกลางเป็นครุฑ ส่วนหน้าบันด้านบน ตรงกลางสลักเป็นรูปวิมานท่ามกลางลายกนก (ปัจจุบันใช้เป็นกุฏิเจ้าอาวาส)
พระพุทธฉาย ตั้งอยู่ระหว่างอุโบสถและวิหารภายในเขตกำแพงแก้วด้านทิศเหนือ สร้างในสมัยหลวงพ่อนวลเป็นเจ้าอาวาส เมื่อ พ.ศ.2473 ก่อเป็นเหมือนกำแพง ทำเป็นซุ้มประดิษฐานภาพปูนปั้นนูน เป็นรูปพระพุทธปูนประทับยืนอุ้มบาตรอยู่ตรงกลาง ขนาบข้างด้วยพระสาวกที่อยู่ในท่าทางอุ้มบาตรเช่นเดียวกัน
หอระฆัง ตั้งอยู่ด้านข้างศาลาการเปรียญ เป็นหอระฆังเก่า ก่ออิฐถือปูน สูง 2 ชั้น
หอพระไตรปิฎก เป็นอาคารก่ออิฐถือปูน 2 ชั้น ลักษณะรูปแบบศิลปกรรมสมัยรัชกาลที่ 3 ที่เชิงชายสลักไม้เป็นลายค้างคาวแบบจีน เดิมตั้งอยู่กับหมู่กุฏิด้านริมน้ำ ต่อมาเมื่อย้ายเขตสังฆาวาสมาไว้ด้านหลัง หอไตรหลังนี้จึงตั้งอยู่โดดเดี่ยวกลางลานวัด ในปี 2548 จึงมีการชะลอหาไตรขยับมาทางทิศตะวันตก ติดกับเขตสังฆาวาส
พระพุทธรูปสำคัญ พระประธานในอุโบสถและหลวงพ่อโต พระพุทธรุปปางสมาธิ ประดิษฐานในศาลาด้านหน้าวิหาร รวมถึงรูปหล่อหลวงพ่อนวลซึ่งเป็นพระเกจิอาจารย์องค์สำคัญ
มีตำนานเล่าว่าผู้สร้างชื่อกราน ในสมันต้นรัชกาลที่ 5 เมื่อยังมีหวย ก.ข. หลวงพ่อโตองค์นี้ใบ้หวยถูกบ่อยจนขุนบาล (ยี่กอฮงเหม็ง) ให้คนมาควักพระเนตรออก แล้วเอาเหล็กมาตอกกลางหลังและซอกคอ ในหนังสือประวัติวัดไก่เตี้ย (2511) กล่าวว่า “เหล็กที่ตอกนี้ยังปรากฏอยู่ทุกวันนี้” น่าสังเกตว่าตำนานของหลวงพ่อโตวัดไก่เตี้ยนี้ใกล้เคียงกับตำนานหลวงพ่อตาแดงที่วัดเพลงกลางสวนมาก ซึ่งอาจมีความเกี่ยวข้องเชื่อมโยง (วิชญดา ทองแดง และศรัณย์ ทองปาน 2555 : 152)
สัปดาห์ที่ 42 (16-22 ตุลาคม 2566)
ต่างชาติ 512,361 คน
เฉลี่ยวันละ 73,195 คน
นักท่องเที่ยวต่างชาติสะสม 21,559,296 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 904,904 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 83,028 คน
จีน 59,288 คน
อินเดีย 31,932 คน
เกาหลีใต้ 29,298 คน
รัสเซีย 23,801 คน
*****
สัปดาห์ที่ 41 (9-15 ตุลาคม 2566)
ต่างชาติ 470,299 คน
เฉลี่ยวันละ 67,186 คน
นักท่องเที่ยวต่างชาติสะสม 21,019,800 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 882,450 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 74,233 คน
จีน 61,094 คน
อินเดีย 30,170 คน
เกาหลีใต้ 27,264 คน
รัสเซีย 22,018 คน
*****
สัปดาห์ที่ 40 (2-8 ตุลาคม 2566)
ต่างชาติ 497,966 คน
เฉลี่ยวันละ 71,138 คน
นักท่องเที่ยวต่างชาติสะสม 20,549,501 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 861,845 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 76,432 คน
จีน 75,093 คน
อินเดีย 34,020 คน
เกาหลีใต้ 30,742 คน
ลาว 24,030 คน
*****
แจ้งเหตุและติดต่อผ่านช่องทางอื่นเพิ่มเติม
สำหรับพี่น้องคนไทยที่ประสงค์จะขอรับข้อมูลเพิ่มเติมหรือติดต่อสอบถามเกี่ยวกับญาติที่พำนักอยู่ในอิสราเอล สามารถติดต่อได้ที่
1) สถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ
• โทรศัพท์ (+972) 546368150
• โทรศัพท์ (+972) 552712201
• โทรศัพท์ (+972) 532452826
2) สำนักงานฝ่ายแรงงาน ณ กรุงเทลอาวีฟ (สอบถามข้อมูลแรงงานไทยในอิสราเอล)
• โทรศัพท์ (+972) 995484313
• โทรศัพท์ 054 4693476
• Line ID: 0544693476
• Email: labour.israel@gmail.com
3) กรมการกงสุล (Call center 60 คู่สาย ตลอด 24 ชั่วโมง)
• โทรศัพท์ 02 5728442
4) กองคุ้มครองและดูแลผลประโยชน์คนไทยในต่างประเทศ
• โทรศัพท์ 064 0198530
• โทรศัพท์ 064 0198907
• โทรศัพท์ 099 6164786
• โทรศัพท์ 02 5751047-51 หรือ 02 5751053 (ในวันและเวลาราชการ)
• Email: consular02@mfa.go.th
สำหรับท่านที่ประสงค์จะแจ้งข้อมูลผู้ประสบเหตุตกทุกข์ในอิสราเอล เพื่อตรวจสอบสถานภาพและขอรับความช่วยเหลือ
กรุณาส่งข้อมูลส่วนบุคคล ดังต่อไปนี้
• ชื่อ-นามสกุล
• เลขประจำตัวประชาชน
• หมายเลขหนังสือเดินทาง
• ที่อยู่ในอิสราเอล
• เบอร์โทรศัพท์
• รูปถ่าย (หากมี)
ได้ที่ E-mail: consular02@mfa.go.th
1 ธ.ค. 66 นำพี่น้องชาวไทยจำนวน 6 คนที่เพิ่งได้รับการปล่อยตัวจากฉนวนกาซาไปทำบัตรประชาชนที่สถานเอกอัครราชทูตฯ
1 ธ.ค. 66 สถานเอกอัครราชทูตฯ ได้อำนวยความสะดวกนำพี่น้องชาวไทยจำนวน 6 คนที่เพิ่งได้รับการปล่อยตัวจากฉนวนกาซาไปทำบัตรประชาชนที่สถานเอกอัครราชทูตฯ เพื่อช่วยให้คนไทยกลุ่มดังกล่าวสามารถทำธุรกรรมต่าง ๆ ในไทยได้ทันทีที่เดินทางถึงประเทศไทย พร้อมกันนี้ นายกิตติ์ธนา ศรีสุริยะ อัครราชทูตที่ปรึกษา (ฝ่ายแรงงาน) ได้ร่วมให้คำปรึกษาเกี่ยวกับสิทธิประโยชน์และการติดตามค่าจ้าง ถือได้ว่าเป็นการให้บริการด้านกงสุลแก่พี่น้องคนไทยอย่างครบวงจร
โรงพยาบาลสัตหีบกม.10 บริการฉีดวัคซีน HPV ฟรี น้องๆนักเรียนหญิง ในสัตหีบ
โรงพยาบาลสัตหีบกม.10 พร้อมให้บริการฉีดวัคซีนมะเร็งปากมดลูก สำหรับนักเรียนหญิงม.4-6 ในระบบการศึกษาและหญิงไทยที่มีอายุระหว่าง 11-20 ปี ที่อยู่นอกระบบการศึกษาในอำเภอสัตหีบ เข้ารับบริการฉีดวัคซีนซีนมะเร็งปากมดลูก (HPV) ได้ฟรี ไม่มีค่าใช้จ่าย
รับบริการได้ทุกวันพฤหัสบดี เวลา 13.00-15.30 น. ตั้งแต่เดือนพฤศิจกายน 2566 จนถึง มกราคม 2567
น้องๆ หรือผู้ปกครอง สามารถจองสิทธิ์ฉีดวัคซีนไที่ศูนย์สุขภาพชุมชน ตำบลพลูตาหลวง โรงพยาบาลสัตหีบกม.10 สอบถามโทร. 038-245431 038-245452 ต่อ 114
รีบหน่อยนะ วัคซีนมีจำกัด
ยุทธศาสตร์ที่ 2 : ด้านการสร้างความสามารถในการแข่งขัน
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 393,517.9 ล้านบาท คิดเป็นร้อยละ 11.3 ของวงเงินงบประมาณ เพื่อส่งเสริมให้เศรษฐกิจของประเทศเติบโต และเพิ่มขีดความสามารถในการแข่งขันในทุกด้านให้มีเสถียรภาพและยั่งยืน ผลักดันการสร้างรายได้จากการท่องเที่ยว ขยายโอกาสทางการค้าและการลงทุน โดยมีเป้าหมายกระจายความเจริญทางเศรษฐกิจและสังคมในทุกภูมิภาคของประเทศ จำแนกตามแผนงานสำคัญ ดังนี้
1) การพัฒนาความมั่นคงทางพลังงาน งบประมาณ 1,916.4 ล้านบาท เพื่อพัฒนาโครงสร้างพื้นฐานด้านพลังงานทั้งระบบให้มีความมั่นคง สนับสนุนการเพิ่มประสิทธิภาพการใช้พลังงานในทุกภาค สนับสนุนการใช้เทคโนโลยีเพื่อบริหารจัดการและผลิตพลังงานทดแทน พลังงานทางเลือก กำกับดูแลกลไกตลาดพลังงานให้มีการแข่งขันที่เป็นธรรม รวมทั้งการปรับเปลี่ยนโครงสร้างการใช้พลังงานของประเทศ วางแผนความต้องการและสนับสนุนการจัดหาแหล่งพลังงานอย่างเหมาะสม ส่งเสริมการผลิตพลังงานสะอาด และพลังงานหมุนเวียน
2) การพัฒนาเศรษฐกิจและสังคมดิจิทัล งบประมาณ 2,455.5 ล้านบาท เพื่อพัฒนาโครงสร้างพื้นฐานด้านดิจิทัลในส่วนของโครงข่ายสื่อสารหลักและบรอดแบรนด์ความเร็วสูงให้ครอบคลุมทั่วประเทศ เพื่อให้ประชาชนเข้าถึงข้อมูลและบริการที่มีประสิทธิภาพอย่างเท่าเทียม ส่งเสริมการลงทุนและใช้ทรัพยากรโครงสร้างพื้นฐานดิจิทัลร่วมกัน ทั้งในและต่างประเทศ ในส่วนของภาคพื้นดิน เคเบิ้ลใต้น้ำ และระบบดาวเทียมสำหรับการเชื่อมโยงกับประเทศเพื่อนบ้านให้มีเพียงพอและมีระบบโครงข่ายสำรอง (Redundancy) ให้สามารถสื่อสารระหว่างประเทศได้อย่างต่อเนื่อง พัฒนาโครงสร้างพื้นฐานดิจิทัลศูนย์ข้อมูลขนาดใหญ่ (Big Data) ตลอดจนจัดให้มีมาตรการเฝ้าระวังและรับมือภัยคุกคามไซเบอร์ที่ได้มาตรฐานสากล เพิ่มประสิทธิภาพในการตัดวงจรอาชญากรรมออนไลน์ โดยการใช้เทคโนโลยีดิจิทัล ปรับปรุงกฎหมายที่เกี่ยวข้อง รวมถึงการกำหนดมาตรการและแนวปฏิบัติสำหรับผู้ให้บริการในการคุ้มครองสิทธิส่วนบุคคลและการคุ้มครองข้อมูลส่วนบุคคลของผู้รับบริการ ส่งเสริมการให้ความรู้ เพิ่มทักษะและใช้ประโยชน์จากความก้าวหน้าทางเทคโนโลยีแก่ประชาชนและทุกสาขาอาชีพ สร้างความรู้การใช้เทคโนโลยีดิจิทัล สื่อออนไลน์ โครงข่ายสังคมออนไลน์ และทักษะด้านเกมต่อยอดอาชีพในอนาคต
3) การพัฒนาอุตสาหกรรมและบริการแห่งอนาคต งบประมาณ 3,806.6 ล้านบาท เพื่อเพิ่มอัตราการขยายตัวของผลิตภัณฑ์มวลรวมในประเทศภาคอุตสาหกรรม ร้อยละ 4.8 โดยโครงการส่งเสริมและพัฒนาอุตสาหกรรมและบริการแห่งอนาคตให้เกิดการขยายตัว ไม่น้อยกว่าร้อยละ 5 ซึ่งครอบคลุมอุตสาหกรรมอาหารและอุตสาหกรรมชีวภาพ อุตสาหกรรมและบริการทางการแพทย์ อุตสาหกรรมและบริการดิจิทัล ข้อมูลปัญญาประดิษฐ์ หุ่นยนต์ระบบอัตโนมัติและอิเล็กทรอนิกส์อัจฉริยะ อุตสาหกรรมยานยนต์ไฟฟ้าและอากาศยาน และอุตสาหกรรมความมั่นคง โดยสนับสนุนการพัฒนาโครงสร้างพื้นฐานที่เอื้อต่อการพัฒนาอุตสาหกรรมและบริการแห่งอนาคต เช่น การพัฒนาโครงสร้างพื้นฐานเพื่อรองรับอุตสาหกรรมยานยนต์สมัยใหม่ ระบบฐานข้อมูลสามมิติคู่เหมือนดิจิทัลเชิงพื้นที่ เพื่อรองรับเมตาเวิร์ส ยกระดับผลิตภาพและพัฒนากำลังคนเพื่อสร้างความสามารถในการแข่งขันภาคอุตสาหกรรม ตลอดจนพัฒนาต่อยอดความเข้มแข็งของอุตสาหกรรมและยกระดับไปสู่อุตสาหกรรมที่ใช้นวัตกรรมและเทคโนโลยีขั้นสูง และส่งเสริมให้เกิดการใช้รถยนต์ไฟฟ้าและการลงทุนผลิตยานยนต์ไฟฟ้าในประเทศ ตามมาตรการการสนับสนุนการใช้ยานยนต์ไฟฟ้าประเภทรถยนต์และรถจักรยานยนต์
4) การสร้างรายได้จากการท่องเที่ยว งบประมาณ 7,384.1 ล้านบาท ให้อุตสาหกรรมการท่องเที่ยวไทยเป็นกลไกในการขับเคลื่อนเศรษฐกิจของประเทศ โดยมีเป้าหมายเพิ่มรายได้จากการท่องเที่ยว 3 ล้านล้านบาท และอันดับการพัฒนาการเดินทางและการท่องเที่ยวอยู่ 1 ใน 30 ของโลก โดยส่งเสริมการตลาดทั้งในประเทศและต่างประเทศ สนับสนุนการสร้างความหลากหลายด้านการท่องเที่ยวให้สอดคล้องกับความต้องการเดินทางของนักท่องเที่ยวต่างประเทศ กลุ่มคุณภาพ กลุ่มกีฬา กลุ่มสุขภาพ และกลุ่มความสนใจพิเศษไม่น้อยกว่า 35 ล้านคน สนับสนุนอุตสาหกรรมซอฟต์พาวเวอร์ (Soft Power) รายสาขาเพื่อนำเสนอและรักษาจุดเด่นด้านขนบธรรมเนียมประเพณีและวัฒนธรรมอันดีงามของประเทศไทย เช่น พัฒนาเมืองสร้างสรรค์ตามแนวทางของยูเนสโก (UNESCO) ๕ เมือง การพัฒนาชุมชนท่องเที่ยว OTOP นวัตวิถี 100 ชุมชน เพิ่มศักยภาพการท่องเที่ยวเชิงอนุรักษ์ 5 แห่ง พัฒนาแหล่งธรณีวิทยาเพื่อเป็นแหล่งท่องเที่ยว 7 แห่ง พัฒนาแหล่งท่องเที่ยวเพื่อรองรับการจัดงานท่องเที่ยวเชิงธุรกิจ 10 เมือง ส่งเสริมการท่องเที่ยวเชื่อมโยงกลุ่มอาเซียนและงานสัมมนาระดับนานาชาติ รวมทั้งพัฒนาและยกระดับชุมชนเข้าสู่มาตรฐานการท่องเที่ยวไทย 50 ชุมชน ผู้ประกอบการด้านการท่องเที่ยวเข้าสู่มาตรฐานการท่องเที่ยวไทย 160 ราย การท่องเที่ยวไทยและผลักดันให้ชุมชนเข้าสู่ตลาดอุตสาหกรรมการท่องเที่ยวเพิ่มขึ้น 20 ชุมชน เพื่อประโยชน์ในการสร้างงานสร้างอาชีพและรายได้ให้กับคนในชุมชน ประชาชน และผู้ประกอบการ 32,900 คน พัฒนาสิ่งอำนวยความสะดวกทางน้ำและโครงสร้างพื้นฐานด้านคมนาคมเชื่อมโยงไปยังภูมิภาค โดยการพัฒนาท่าเรือและก่อสร้างทางหลวงชนบทเพื่อสนับสนุนการท่องเที่ยว ระยะทาง 209.993 กิโลเมตร และพัฒนาโครงสร้างพื้นฐานเพื่อสนับสนุนการท่องเที่ยวทางน้ำ 9 แห่ง
5) เขตพัฒนาพิเศษภาคตะวันออก งบประมาณ 8,089.0 ล้านบาท เพื่อส่งเสริมให้เกิดการลงทุนในเขตพัฒนาพิเศษภาคตะวันออก พัฒนากิจกรรมทางเศรษฐกิจที่ทันสมัยและเป็นมิตรกับสิ่งแวดล้อม มีเป้าหมายให้เกิดการลงทุนจริงในพื้นที่เขตพัฒนาพิเศษภาคตะวันออก ไม่น้อยกว่า 100,000 ล้านบาท โดยพัฒนาโครงสร้างพื้นฐาน คมนาคมขนส่ง และระบบสาธารณูปโภคที่มีประสิทธิภาพ เข้าถึงได้สะดวก และเชื่อมโยงกันอย่างเป็นระบบ เช่น โครงการทางหลวงพิเศษระหว่างเมืองหมายเลข 7 ส่วนต่อขยายเชื่อมสนามบินอู่ตะเภา เป็นต้น สนับสนุนการพัฒนาโครงสร้างพื้นฐานหลัก ได้แก่ รถไฟความเร็วสูงเชื่อมสามสนามบิน สนามบินอู่ตะเภา ท่าเรือแหลมฉบัง ระยะที่ 3 และท่าเรืออุตสาหกรรมมาบตาพุด ระยะที่ 3 พัฒนาโครงสร้างพื้นฐานและสาธารณูปโภคในพื้นที่เขตส่งเสริมอุตสาหกรรมและนวัตกรรมดิจิทัล (EECd) พัฒนาเมืองให้น่าอยู่ มีความทันสมัยเหมาะกับการอยู่อาศัย สามารถประกอบกิจการได้อย่างมีคุณภาพ และยกระดับคุณภาพชีวิตของประชาชนในพื้นที่ เช่น เตรียมพื้นที่สำหรับพัฒนาศูนย์ธุรกิจ และเมืองใหม่น่าอยู่อัจฉริยะ พัฒนาพื้นที่ชุมชนและปรับปรุงภูมิทัศน์ ตามผังเมือง อีอีซี ไม่น้อยกว่า 17 แห่ง ยกระดับและพัฒนาศูนย์การแพทย์ครบวงจร 2 แห่ง โรงพยาบาลศูนย์เฉพาะทาง 2 แห่ง ผลิตและพัฒนาบุคลากรให้มีสมรรถนะตรงตามความต้องการของผู้ประกอบการ เพื่อรองรับอุตสาหกรรมเป้าหมาย ไม่น้อยกว่า 4,200 คน และถ่ายทอดเทคโนโลยีเกษตรสมัยใหม่ใน 40 ชุมชน
6) การส่งเสริมวิสาหกิจขนาดกลางและขนาดย่อมที่เข้มแข็ง แข่งขันได้ งบประมาณ 8,744.8 ล้านบาท เพื่อส่งเสริมสนับสนุนให้ผู้ประกอบการวิสาหกิจขนาดกลางและขนาดย่อม และผู้ประกอบการชุมชนมีความรู้และทักษะของการเป็นผู้ประกอบการที่มีอัตลักษณ์ชัดเจน มีนวัตกรรมในการผลิตสินค้าและบริการ สามารถปรับตัวสู่ธุรกิจใหม่ โดยเสริมสร้างศักยภาพวิสาหกิจในการใช้ระบบเทคโนโลยีสารสนเทศและดิจิทัล 12,800 คน ส่งเสริมให้ผู้ประกอบการ SME เข้าถึงแหล่งทุน เพื่อนำไปใช้ในการพัฒนาและยกระดับธุรกิจ ผ่านกองทุนส่งเสริมวิสาหกิจขนาดกลางและขนาดย่อม ตลอดจนการเข้าถึงแหล่งข้อมูลและองค์ความรู้ในการพัฒนาธุรกิจ สามารถขยายการค้าและการลงทุนไปต่างประเทศ ด้วยการส่งเสริมผู้ประกอบการให้มีช่องทางการค้าผ่าน e-commerce 25,800 ราย รวมทั้งส่งเสริมการลงทุนที่เน้นการวิจัย พัฒนา และสร้างนวัตกรรม สร้างความร่วมมือระหว่างภาครัฐและภาคเอกชน สร้างสภาพแวดล้อมที่เอื้อต่อการดำเนินธุรกิจ และส่งเสริม SME ให้แข่งขันได้ในตลาดสากล
7) การพัฒนาพื้นที่และเมืองน่าอยู่อัจฉริยะ งบประมาณ 9,433.8 ล้านบาท เพื่อพัฒนาขีดความสามารถในการแข่งขันของประเทศโดยกระจายศูนย์กลางความเจริญทางเศรษฐกิจและสังคมในทุกภูมิภาคของประเทศ พัฒนาโครงสร้างพื้นฐานด้านระบบสื่อสารด้วยเทคโนโลยีระบบดิจิทัลที่ทันสมัย รวมถึงสิ่งอำนวยความสะดวกและความปลอดภัย เพื่อยกระดับความน่าอยู่ของเมือง โดยใช้แผนผังภูมินิเวศเป็นกรอบในการพัฒนาเมืองน่าอยู่ ชนบทมั่นคง เกษตรยั่งยืน และอุตสาหกรรมเชิงนิเวศ รวมถึง ผังพื้นที่อนุรักษ์ทรัพยากร ธรรมชาติ แหล่งโบราณคดี วัฒนธรรม ประเพณี และอัตลักษณ์ท้องถิ่น โดยสนับสนุนการวางผังเมือง 106 ผัง และจัดรูปที่ดิน 232 ไร่
8) การวิจัยและพัฒนานวัตกรรม งบประมาณ 19,270.4 ล้านบาท เพื่อเสริมสร้างความสามารถในการแข่งขันของประเทศด้วยการวิจัยและพัฒนานวัตกรรม โดยเร่งขยายการใช้ประโยชน์ผลงานวิจัยและนวัตกรรม รวมถึงเทคโนโลยีที่เหมาะสม พัฒนากำลังคนด้านวิทยาศาสตร์ เทคโนโลยี การวิจัยและนวัตกรรมให้มีสมรรถนะและทักษะสูงขึ้น เพิ่มความมั่นคงของเศรษฐกิจฐานรากเพื่อให้พึ่งพาตนเองได้อย่างยั่งยืน ตอบโจทย์ปัญหาความท้าทายในสังคม สร้างความเป็นธรรมและลดความเหลื่อมล้ำ รวมทั้งการอนุรักษ์และฟื้นฟูทรัพยากรธรรมชาติและสิ่งแวดล้อมให้ปรับตัวได้ทันต่อพลวัตการเปลี่ยนแปลงของโลก พร้อมรับการเปลี่ยนแปลงและความท้าทายใหม่ที่จะเกิดขึ้นในอนาคตด้วยการวิจัยและพัฒนานวัตกรรม
9) การสนับสนุนด้านการสร้างความสามารถในการแข่งขัน งบประมาณ 36,997.7 ล้านบาท เพื่อสนับสนุนเป้าหมายยุทธศาสตร์ด้านการสร้างความสามารถในการแข่งขันของประเทศ ให้เศรษฐกิจเติบโตอย่างมีเสถียรภาพและยั่งยืน โดยการยกระดับศักยภาพของประเทศในหลากหลายมิติ ทั้งด้านเศรษฐกิจ อัตลักษณ์ วัฒนธรรม ประเพณี วิถีชีวิตและทรัพยากรธรรมชาติ รวมทั้งพัฒนาโครงสร้างพื้นฐานและสนับสนุนการพัฒนาบุคลากรด้านวิทยาศาสตร์และเทคโนโลยี เพิ่มศักยภาพผู้ประกอบการและลดต้นทุนการผลิต สนับสนุนการเข้าถึงแหล่งเงินทุน ขยายโอกาสทางการค้าและการลงทุน พัฒนาช่องทางการตลาดและขีดความสามารถในการแข่งขันทางการค้าระหว่างประเทศ ขยายโอกาสทางการค้าและการลงทุนในเวทีโลก ควบคู่ไปกับการยกระดับรายได้และการกินดีอยู่ดี รวมทั้งการแก้ปัญหาหนี้สินในภาคครัวเรือน เพื่อช่วยเหลือประชาชนผู้มีรายได้น้อย
10) การเกษตรสร้างมูลค่า งบประมาณ 49,895.6 ล้านบาท เพื่อเพิ่มการขยายตัวของผลิตภัณฑ์มวลรวมและผลิตภาพด้านการผลิตของสาขาเกษตร โดยส่งเสริมระบบเกษตรแปลงใหญ่ จำนวน 2,472 แปลง และ 475,000 ไร่ เพื่อลดต้นทุนการผลิตและเพิ่มผลผลิตต่อหน่วย บริหารจัดการการผลิตสินค้าเกษตรตามแผนที่เกษตรเพื่อการบริหารจัดการเชิงรุก (Agri-Map) จำนวน 69,954 ไร่ และ 135 แปลง ส่งเสริมการวิจัยพัฒนาองค์ความรู้เทคโนโลยี นวัตกรรม และภูมิปัญญาท้องถิ่น พัฒนาศักยภาพกระบวนการผลิตและปรับเปลี่ยนการผลิตหรือชนิดของพืช ปศุสัตว์ ให้เหมาะสมกับศักยภาพพื้นที่ ลดต้นทุนการผลิตด้านการเกษตร ผลิตสินค้าเกษตรและอาหารเข้าสู่ระบบมาตรฐานความปลอดภัยด้วยการตรวจประเมินแหล่งผลิตไม่น้อยกว่า 307,347 แห่ง สร้างเกษตรกรรุ่นใหม่ รวมทั้งส่งเสริมความเข้มแข็งเกษตรกรในรูปแบบต่างๆ โดยมีเกษตรกรได้รับประโยชน์ 7.92 ล้านครัวเรือน และส่งเสริมการใช้แพลตฟอร์มการตลาดดิจิทัล เพื่อเพิ่มโอกาสในการสร้างรายได้ให้กลุ่มเกษตรกรและวิสาหกิจชุมชน เพื่อเป็นภาคการผลิตที่สร้างรายได้และพัฒนาคุณภาพชีวิตให้เกษตรกรพึ่งพาตนเอง
11) การพัฒนาด้านคมนาคมและระบบโลจิสติกส์ งบประมาณ 181,529.4 ล้านบาท เพื่อให้ประเทศไทยมีระบบคมนาคมและระบบโลจิสติกส์ที่มีประสิทธิภาพ ปลอดภัย ให้มีความสมบูรณ์เชื่อมต่ออย่างครอบคลุม เป็นประตูการค้าและการลงทุน และเป็นมิตรกับสิ่งแวดล้อม โดยพัฒนาโครงสร้างพื้นฐานทุกมิติอย่างเป็นระบบทั้งทางบก ทางน้ำ และทางอากาศ เช่น ทางถนน ก่อสร้างโครงข่ายทางหลวงและทางหลวงชนบท ระยะทาง ไม่น้อยกว่า 2,900.6 กิโลเมตร และทางหลวงพิเศษระหว่างเมือง ระยะทางไม่น้อยกว่า 105 กิโลเมตร ทางราง พัฒนาโครงสร้างพื้นฐานเพื่อส่งเสริมการขนส่งทางรางสายเด่นชัย - เชียงราย – เชียงของ สายบ้านไผ่ - มหาสารคาม - ร้อยเอ็ด - มุกดาหาร – นครพนม และพัฒนาระบบรถไฟความเร็วสูงเพื่อเชื่อมโยงภูมิภาคช่วงกรุงเทพมหานคร - หนองคาย (ระยะที่ 1 ช่วงกรุงเทพมหานคร - นครราชสีมา) ทางน้ำ พัฒนา ปรับปรุงโครงสร้างพื้นฐานทางน้ำ และเพิ่มประสิทธิภาพการเดินเรือในแม่น้ำต่าง ๆ เพื่อรองรับปริมาณการขนส่งสินค้า ไม่น้อยกว่า 115 ล้านตัน ทางอากาศ เพิ่มขีดความสามารถของท่าอากาศยานตามมาตรฐานขององค์การการบินพลเรือนระหว่างประเทศ (ICAO) รวมทั้งส่งเสริมการเข้าถึงระบบขนส่งสาธารณะของประชาชนอย่างทั่วถึง การพัฒนารูปแบบการกำกับดูแล และการบริหารจัดการระบบตั๋วร่วม การพัฒนาบุคลากรเพื่อรองรับอุตสาหกรรมโลจิสติกส์ โดยมีเป้าหมายไม่น้อยกว่า 2,390 คน กำกับดูแลและพัฒนามาตรฐานด้านการคมนาคมและโลจิสติกส์ทุกรูปแบบให้มีคุณภาพระดับสากล รองรับและอำนวยความสะดวกทางการค้าด้วยระบบการเชื่อมโยงข้อมูลหน่วยงานภาครัฐและภาคเอกชน
12) การดำเนินงานภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 21,335.6 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 42,659.0 ล้านบาท เพื่อสนับสนุนยุทธศาสตร์ด้านการสร้างความสามารถในการแข่งขันสอดรับกับบริบทของเศรษฐกิจและสังคมโลกสมัยใหม่ พัฒนาโครงสร้างพื้นฐาน พัฒนากำลังคนและศักยภาพของประเทศอย่างยั่งยืน รวมทั้ง ส่งเสริมและพัฒนาพื้นที่เขตเศรษฐกิจใหม่ ทำให้วงจรทางเศรษฐกิจการดำเนินการได้อย่างมีประสิทธิภาพ สนับสนุนเขตพัฒนาเศรษฐกิจพิเศษ แหล่งบ่มเพาะธุรกิจสร้างสรรค์ ส่งเสริมการลงทุนทั้งในประเทศและในต่างประเทศอันจะส่งผลให้มูลค่าการลงทุนที่ได้รับบัตรส่งเสริมไม่น้อยกว่า 250,000 ล้านบาท
ประเทศรัสเซีย
RUSSIAN FEDERATION
1. International Faculty, Kursk State Medical University, Kursk City, Russian Federation
หลักสูตร 6 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการสอนตลอดหลักสูตร ณ
ประเทศรัสเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร
และอยู่ในประเทศรัสเซีย ดังนี้
โรงพยาบาลหลัก 7 แห่ง คือ
1. Regional Clinical Hospital
2. City Hospital of Urgent Medicine
3. Regional Perinatal Center
4. Regional Clinical Psychiatric Hospital
5. Regional Clinical Infectious Hospital
6. Regional Oncological Dispensary
7. Regional TB Dispensary
โรงพยาบาลสมทบ 7 แห่ง คือ
1. Regional Clinical Children Hospital
2. Regional Clinical Ophthalmology Center of eye microsurgery
3. Regional Clinical Dermatovenerology Center
4. University Stomatology Hospital
5. Municipal Hospital No. 1
6. Municipal Maternity Hospital
7. Regional Railway Hospital
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 12 ธ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 11 ธ.ค. 67
2. Ivanovo State Medical Academy of the Ministry of Healthcare of the Russian Federation
หลักสูตร 6 ปี ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการสอนตลอด
หลักสูตร ณ ประเทศรัสเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมา
ในหลักสูตร และอยู่ในประเทศรัสเซีย ดังนี้
โรงพยาบาลหลัก 5 แห่ง คือ
1. Regional Budgetary Institution of healthcare “Ivanovo Regional Clinical
Hospital”
2. Regional Budgetary Institution of healthcare “City Clinical Hospital No. 7
3. Regional Budgetary Institution of healthcare “City Clinical Hospital No. 3
4. Ivanovo Research Institution of Maternity and Childhood name after V.N. Gorodkov
5. Regional Budgetary Institution of healthcare “City Clinical Hospital No. 4
โรงพยาบาลสมทบ ได้แก่Regional Budgetary Institution of healthcare “Children’s City Clinical
Hospital No. 5
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 12 ธ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 11 ธ.ค. 67
3. Bashkir State Medical University, Russian Federation
หลักสูตรภาษาอังกฤษ 6 ปี
ปริญญา Medical Doctor (MD) ที่มีการเรียการสอนตลอดหลักสูตร ณ ประเทศรัสเซีย และ
รับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ใน
ประเทศรัสเซีย ดังนี้
1. BSMU affiliate hospital
2. Republican Teaching Hospital after G.G Kuvatov
3. Republican Cardiovascular Hospital
4. Republican Oncology Hospital
5. Ufa City Teaching Hospital #21
6. Ufa City Teaching Hospital #22
ว/ด/ป ที่ รับรอง ว/ด/ป ครบอายุ การรับรอง 10 ก.ย. 63
ว/ด/ป ครบอายุ การรับรอง 9 ก.ย. 68
4. International Faculty of General Practice, Northern State Medical University, Arkhangelsk, Russia
หลักสูตรภาษาอังกฤษ 6 ปี ปริญญา MD/MBBS ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ ประเทศรัสเซีย และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่
ระบุมาในหลักสูตร และอยู่ในประเทศรัสเซีย ดังนี้
โรงพยาบาลหลัก 3 แห่ง คือ
1. Hospital I Arkhangelsk Regional Clinical Hospital
2. Hospital II First City Clinical Hospital
3. Hospital III Clinical Children Hospital
โรงพยาบาลสมทบ ได้แก่ Hospital IV Regional Clinical Psychiatry and Narcology
ว/ด/ป ที่ รับรอง 14 ม.ค. 64
ว/ด/ป ครบอายุ การรับรอง 13 ม.ค.69
++ ข้อมูลปี 2566 ++
แนะนำภาชนะสำหรับใส่แมวนอนกลับ ห้ามใส่กระเป๋ามาเด็ดขาด ไม่ผ่าตัดให้เด็ดขาด
คลินิกเทคนิคการแพทย์มีผู้ป่วยเพิ่มขึ้นอย่างชัดเจน พร้อมลุยเชิงรุกดูแลผู้ป่วยที่บ้าน - คลินิกน้ำทองแล็บ เซนเตอร์
ทนพ.สุริยันต์ นันตา คลินิกเทคนิคการแพทย์ น้ำทองแล็บ เซนเตอร์ เปิดเผยว่า
"ตั้งแต่ได้เริ่มคิกออฟเป็นเวลาเกือบ 2 เดือนแล้ว การเข้ารับบริการของประชาชนเพิ่มขึ้นจากก่อนหน้าเข้าร่วมโครงการอย่างเห็นได้ชัด จากเดิมที่มีหลักหน่วยต่อวัน พอมีการสร้างเครือข่ายการตรวจทางห้องปฏิบัติการ (แล็บ) ภายใต้โครงการกับโรงพยาบาลแพร่ ซึ่งเป็นโรงพยาบาลประจำจังหวัด ที่มีปริมาณผู้ป่วยไปใช้บริการที่ราว 700 คนต่อวัน ก็ทำให้ได้รับการผ่องถ่ายผู้ป่วยให้มาตรวจแล็บที่คลินิกฯ มากขึ้นเป็นหลักสิบต่อวัน รวมถึงมีแนวโน้มเพิ่มขึ้นอย่างต่อเนื่องด้วย ซึ่งคาดว่าอาจถึง 50 คนต่อวันในอีกไม่นาน
นอกจากนี้ ทางคลินิกฯ พร้อมสนับสนุนในการตรวจแล็บเชิงรุกสำหรับผู้ป่วยโรคเรื้อรัง ที่เคลื่อนไหวลำบาก หรือมีภาวะติดบ้านติดเตียง
สำหรับระบบข้อมูล ทางคลินิกฯ มีทรัพยากรที่พร้อมอยู่แล้ว ทำให้ส่งต่อข้อมูลสุขภาพไปยังโรงพยาบาลได้อย่างไร้รอยต่อ ตลอดจนส่งข้อมูลการให้บริการเบิกจ่ายกับ สปสช. ก็ได้รับเงินรวดเร็วภายใน 3 วัน ส่วนอัตราการเบิกจ่ายที่ สปสช. กำหนด ก็เพียงพอต่อการนำมาบริหารจัดการให้คลินิกฯ ดำเนินการต่อไปได้ไม่มีปัญหา แม้จะไม่ได้มากเหมือนการให้บริการ แต่สิ่งสำคัญคือการได้เป็นส่วนหนึ่งในการดูแลรักษาสุขภาพประชาชน " [
hfocus]
โครงการยกระดับธุรกิจดั้งเดิมในย่านหัวลำโพง ‘Made in Hua Lamphong’
โครงการยกระดับธุรกิจดั้งเดิมในย่านหัวลำโพง ‘Made in Hua Lamphong’ โดย CEA และ RTUS-BANGKOK ริทัศน์บางกอก ที่มาต่อยอดธุรกิจดั้งเดิมและงานช่างฝีมือที่มีเอกลักษณ์เฉพาะตัว ด้วยงานออกแบบในชุมชนย่านหัวลำโพง เช่น ร้านทำร่ม ศิลป์เมือง ที่ร่วมกับ ease studio ออกแบบเพิ่มฟังก์ชันให้เป็นที่นั่งที่ช่วยน้ำหนักขาตั้งของร่ม จึงไม่ต้องใช้แท่งปูนเป็นที่เสียบร่ม เมื่อร้านค้าริมทางเก็บร้าน จึงไม่เหลือแท่งปูนทิ้งไว้บนฟุตบาทหรือถนน เป็นทางเลือกสำหรับการพัฒนาร้านค้าริมทาง โครงการ ‘Made in Hua Lamphong’ ประกอบด้วย 6 ธุรกิจ/กิจการ/ร้านค้า ร่วมกับ 5 นักออกแบบ ได้แก่ 1) ร้านทำร่ม ศิลป์เมือง x ease studio 2) โหราศาสตร์น่ำเอี๊ยง x Ek Thongprasert 3) โรงงานกระดาษชัยกิจ x Likaybidery 4) ร้านเหล็กตกแต่ง บ้านอิตาลี x COTH Studio และ 5) ร้านอาหารดั้งเดิม (ขนมผักกาดอาม่าชอเค็ง, เบ๊โอชา) x witti Studio
| Hospital 2024 |
Score |
2023 |
2022 |
| 1.รพ.บำรุงราษฏร์ อินเตอร์ฯ |
93.00% |
1 |
1 |
| 2.รพ.ศิริราช ปิยะมหาราชการุณย์ |
87.34% |
2 |
2 |
| 3.รพ.สมิติเวช สุขุมวิท |
84.15% |
4 |
5 |
| 4.รพ.จุฬาลงกรณ์ |
83.92% |
7 |
7 |
| 5.รพ.รามาธิบดี |
83.72% |
5 |
4 |
| 6.รพ.เมดพาร์ค |
76.54% |
9 |
10 |
| 7.รพ.กรุงเทพ |
75.32% |
3 |
3 |
| 8.รพ.ธนบุรี |
71.90% |
6 |
6 |
| 9.รพ.พระราม9 |
71.79% |
10 |
8 |
| 10.รพ.ราชวิถี |
71.77% |
13 |
11 |
| 11.รพ.กรุงเทพคริสเตียน |
71.76% |
16 |
16 |
| 12.รพ.กรุงเทพอินเตอร์ |
71.75% |
15 |
18 |
| 13.รพ.บางปะกอก9 อินเตอร์ฯ |
71.74% |
8 |
9 |
| 14.รพ.ยันฮี |
71.73% |
17 |
15 |
| 15.รพ.สมิติเวช ศรีนครินทร์ |
71.72% |
20 |
21 |
| 16.รพ.วชิระ |
71.71% |
11 |
17 |
| 17.รพ.รามคำแหง |
71.70% |
12 |
13 |
| 18.รพ.สงขลานครินทร์ |
71.69% |
18 |
22 |
| 19.รพ.พญาไท 1 |
71.68% |
14 |
14 |
| 20.รพ.พญาไท 2 |
71.66% |
23 |
19 |
| 22.รพ.มหาราชนครเชียงใหม่ |
71.61% |
19 |
12 |
| 23.รพ.พระมงกุฏเกล้า |
71.50% |
27 |
23 |
| 24.รพ.พระพุทธชินราช พิษณุโลก |
70.80% |
22 |
25 |
| 25.รพ.เซนต์หลุยส์ |
70.76% |
25 |
26 |
| 26.รพ.ซีจีเอส พหลโยธิน |
70.17% |
24 |
30 |
| 27.รพ.กรุงเทพ หาดใหญ่ |
70.16% |
28 |
- |
| 28.รพ.ศิครินทร์ |
70.14% |
- |
- |
| 29.สถาบันจักรีนฤบดินทร์ |
70.08% |
30 |
27 |
| 30.รพ.สงขลา |
10.00% |
26 |
28 |
สปสช.เขต 12 สงขลา
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 12 สงขลา
- อาคารสยามนครินทร์ คอมเพล็กซ์ ชั้น 3 488/88 ถ.เพชรเกษม อ.หาดใหญ่ จ.สงขลา 90110
- โทรศัพท์ 074-233888 ต่อ 5373, 5372
- แฟกซ์ 074-235494
- แผนที่ google map
- website
- facebook
แพทย์เฉพาะทาง
ศัลยศาสตร์ออร์โธปิดิกส์
วันจันทร์ ช่วงเวลา 08.00 – 12.00 น.
กุมารเวชกรรม
วันอังคาร ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันพฤหัสบดี ช่วงเวลา เช้า 08.00 – 12.00 น.บ่าย 13.00 – 16.00 น.
เวชศาสตร์ฟื้นฟู
วันจันทร์ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันพุธ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันศุกร์ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
โสต ศอ นาสิกแพทย์ หู คอ จมูก
วันอังคาร ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันพุธ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันศุกร์ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
แพทย์เวชปฏิบัติทั่วไป ตรวจโรคทั่วไป
วันจันทร์ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันอังคาร ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันพฤหัสบดี ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
วันศุกร์ ช่วงเวลา เช้า 08.00 – 12.00 น. บ่าย 13.00 – 16.00 น.
[28/6/2023] โรงพยาบาลบางกรวย เปิดรับสมัครผู้ร่วมทีม กลุ่มงานบริหารทั่วไป ตำแหน่งพนักงานบริการ (แม่บ้าน) 3 อัตรา
การแพทย์แผนจีนสามารถรักษาได้เกือบทุกโรค
การแพทย์แผนจีนสามารถรักษาได้เกือบทุกโรค เพราะเป็นการรักษาแบบสร้างสมดุลให้กับร่างกาย ศาสตร์ทางแพทย์แผนจีนเชื่อว่า การที่ร่างกายคนเราเกิดโรคหรืออาการเจ็บป่วยขึ้นนั้นเป็นเพราะร่างกายเกิดภาวะเสียสมดุล ดังนั้นหากทำให้ร่างกายกลับคืนสู่สภาวะสมดุลได้ ร่างกายจะกลับมาแข็งแรงได้ด้วยตนเอง
การบำบัดโรคตามศาสตร์แพทย์แผนจีนเพื่อให้ร่างกายคืนสู่สมดุลมีให้บริการที่โรงพยาบาลปากเกร็ดดังนี้
- ตรวจวินิจฉัย รักษาและให้คำแนะนำการดูแลสุขภาพตามศาสตร์การแพทย์แผนจีน
- การฝังเข็ม
- การฝังเข็มกระตุ้นไฟฟ้า
- การครอบแก้ว
เขต 12
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ตำบลควนเมา อำเภอรัษฎา จังหวัดตรัง
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี ไอปาโจ ตำบลภูเขาทอง อำเภอสุคิริน จังหวัดนราธิวาส
- สถานีอนามัยเฉลิมพระเกียรติ 601 พรรษา นวมินทราชินี ตำบลปูยุด อำเภอเมือง จังหวัดปัตตานี
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านควนปอม ตำบลโคกทราย อำเภอป่าบอน จังหวัดพัทลุง
- สถานีอนามัยเฉลิมพระเกียรติ ๖๐ พรรษา นวมินทราชินี โฉลง ตำบลปุโรง อำเภอกรงปินัง จังหวัดยะลา
- สถานีอนามัยเฉลิมพระเกรียติ 60 พรรษา นวมินทราชินี ตำบลพะตง อำเภอหาดใหญ่ จังหวัดสงขลา
- สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี นิคมพัฒนา อำเภอมะนัง จังหวัดสตูล
สำหรับการคว้ารางวัลจากเวทีการประกวดผลงานนวัตกรรมและสิ่งประดิษฐ์ระดับนานาชาติ “The 49th International Exhibition of Inventions Geneva” เป็นการยืนยันถึงคุณภาพและศักยภาพของนักวิจัยไทย โดยความสำคัญของงานวิจัยที่นักวิจัยได้พัฒนาขึ้นจากองค์ความรู้ด้านวิทยาศาสตร์ การแพทย์และนวัตกรรมที่ได้รับการยกย่องนี้ สะท้อนให้เห็นถึงความก้าวหน้าทางวิทยาศาสตร์และเทคโนโลยีของบุคลากรไทย ซึ่งจะเป็นประโยชน์ต่อการพัฒนาในหลาย ๆ ด้าน ถือเป็นจุดเริ่มต้นสำคัญของการยกระดับงานวิจัยและผลงานประดิษฐ์คิดค้นของคนไทยเป็นที่ยอมรับในระดับสากล และนับเป็นโอกาสสำคัญในการส่งเสริมและสนับสนุนนักประดิษฐ์และนักวิจัยไทย ในการแลกเปลี่ยนความรู้เทคโนโลยีและประสบการณ์กับนักประดิษฐ์และนักวิจัยจากนานาประเทศ รวมถึงได้เผยแพร่และแสดงความสามารถในการคิดค้นสิ่งประดิษฐ์และนวัตกรรมที่เป็นประโยชน์ต่อสายตาของชาวโลกด้วย
ซึ่งสอดคล้องต่อวิสัยทัศน์และพันธกิจของราชวิทยาลัยจุฬาภรณ์ ที่มุ่งสู่การเป็นสถาบันการศึกษาวิจัยด้านวิทยาศาสตร์ เทคโนโลยี และการแพทย์ชั้นนำของภูมิภาคในการผลิตและพัฒนาบุคลากรชั้นสูง ทำการวิจัยเพื่อสร้างองค์ความรู้ใหม่และนำผลงานนวัตกรรมและวิจัยไปประยุกต์ใช้เพื่อก่อให้เกิดประโยชน์ต่อสังคมและประเทศชาติต่อไป การนำผลงานนวัตกรรมและสิ่งประดิษฐ์เข้าร่วมประกวดในเวทีระดับนานาชาติ ซึ่งเป็นเวทีอันทรงเกียรติครั้งนี้ นับว่ามีความสำคัญเป็นอย่างยิ่งต่อนักวิจัย อาจารย์ และบุคลากรทางการแพทย์ของราชวิทยาลัยจุฬาภรณ์ เพราะนอกจากจะเป็นเวทีประกวดสิ่งประดิษฐ์ในระดับนานาชาติแล้ว ยังเป็นเวทีในการแสวงหาความร่วมมือสำหรับการวิจัยเชิงนวัตกรรมและเป็นแรงผลักดันให้นักวิจัยของราชวิทยาลัยจุฬาภรณ์สร้างสรรค์ผลงานที่มีคุณภาพสูงต่อไป
หน่วยจิตเวช (ผู้ใหญ่) คลินิกพิเศษ (พรีเมียม)
หน่วยตรวจผู้ป่วยนอกจิตเวช (ผู้ใหญ่)
**รับเฉพาะผู้ป่วยนัด**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม) :
อังคาร-พุธ เวลา 16.00-19.00 น.
พฤหัสบดีที่ 1, 2 และ 4 ของเดือน เวลา 16.00-19.00 น.
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396430 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
ให้บริการ
ให้บริการตรวจรักษาและให้คำปรึกษาแก่ผู้ที่มีปัญหาด้านสุขภาพจิต ปัญหาทางด้าน พฤติกรรม อารมณ์ และสังคม สำหรับผู้ใหญ่อายุ 18 ปีขึ้นไป
จ.แพร่ กำหนดการออกหน่วยรับบริจาคโลหิตนอกสถานที่ ประจำเดือนมิถุนายน 2567
คลินิกเวชกรรมฟื้นฟู (PM&R) รพ.ชลบุรี นอกเวลาราชการ (คลินิกพิเศษ) จันทร์-พฤหัส เวลา 16.00 - 19.30 น.
คลินิกเวชกรรมฟื้นฟู (PM&R) รพ.ชลบุรี ให้บริการการรักษาด้วยคลื่นแม่เหล็กไฟฟ้า (Peripheral magnetic stimulation) สำหรับลดอาการปวด ชา
✅ ออฟฟิศซินโดรม
✅ ปวดกล้ามเนื้อ เอ็น ข้อต่อทั้งเฉียบพลันและเรื้อรัง
✅ ปวดคอ,หลัง หมอนรองกระดูกทับเส้นประสาท
✅ ชามือ ชา เท้า ปลายประสาทกดทับ
หมายเหตุ *แพทย์จะพิจารณาตามความเหมาะสมของแต่ละรายบุคคล
สามารถสอบถามเพิ่มเติมได้ที่
- คลินิกในเวลาราชการ จันทร์-ศุกร์ เวลา 08.00-16.00 น.
- คลินิกนอกเวลาราชการ (คลินิกพิเศษ) จันทร์-พฤหัส เวลา 16.00 - 19.30 น.
อัตราค่าบริการในเวลา 540บาท/ครั้ง
อัตราค่าบริการนอกเวลา 900บาท/ครั้ง
สอบถามเพิ่มเติมหรือนัดหมายล่วงหน้า โทร 038-931591 ภายในเวลาราชการ
BKK Food Bank เขตห้วยขวาง
18 ต.ค. 66 ผู้ว่าชัชชาติ สิทธิพันธุ์ ตรวจเยี่ยม BKK Food Bank เขตห้วยขวาง โดยมี นายประพฤทธ์ หาญกิจจะกุล สมาชิกสภากรุงเทพมหานคร เขตห้วยขวาง นายพรพรหม ณ.ส. วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร ผู้บริหารกรุงเทพมหานคร ผู้บริหารเขตห้วยขวาง และผู้ที่เกี่ยวข้อง ร่วมกิจกรรม ณ สำนักงานเขตห้วยขวาง
"ในพื้นที่กรุงเทพฯ เรามีคนที่เป็นกลุ่มเปราะบางที่ต้องการอาหาร ต้องการความช่วยเหลือต่างๆ ขณะเดียวกันก็มีคนที่อยากจะช่วยเหลือคนที่เปราะบาง บางครั้ง 2 ฝ่ายไม่เจอกัน หรือมีการเจอกันแล้ว การแจกสิ่งของต่างๆ ยังไม่เป็นระบบ เช่น ใครมาก็หยิบของไปหมด ไม่มีเหลือให้คนข้างหลัง เราก็เลยลองคิดโครงการ Food Bank หรือเป็นธนาคารอาหาร แต่ไม่ใช่ประเภทอาหารอย่างเดียว มีอย่างอื่นด้วย และลองจัดสรรรูปแบบ ในอนาคตอาจจะให้ในรูปแบบของคูปองดิจิตอล หรือเป็นการ์ดที่คนเปราะบางสามารถมาเลือกมาช้อปปิ้งได้ หยิบของแล้วหักแต้ม เราก็เก็บข้อมูลและหากเขามีความเข้มแข็งขึ้นหลุดพ้นจากกลุ่มเปราะบางก็ไม่ต้องให้สิ่งของ ส่วนคนที่อยากจะบริจาคก็สามารถเอามาบริจาคที่ศูนย์ได้ เราก็ส่งต่อให้กับผู้ที่ขาดแคลน ทุกคนก็ได้อย่างเหมาะสม"
"โครงการนี้ไม่ใช้งบประมาณของหลวง แต่ขอความร่วมมือคนที่มีส่วนเกิน ต่อไปก็จะขยายไปถึงซูเปอร์มาร์เก็ตต่างๆ อาหารที่ใกล้หมดอายุ ยังบริโภคได้ แต่ขายไม่ได้แล้ว แทนที่จะทิ้งเป็นอาหารเสีย ก็จะมาอยู่ที่ Food Bank คนที่มีความต้องการก็สามารถนำไปบริโภคได้ ต่อไปร้านอาหารที่เข้าโครงการ Food Bank อาจจะมีป้ายขอบคุณที่เข้าร่วมโครงการ โมเดลนี้จะเป็นโมเดลหนึ่งที่ทำที่นี่ และจะขยายผลต่อไปทั่วทั้งกรุงเทพมหานคร"
ศูนย์สนับสนุนบริการสุขภาพที่ 12 สงขลา
ศูนย์สนับสนุนบริการสุขภาพที่ 12 (Regional Health Service Support Center 12) มีพื้นที่รับผิดชอบ จำนวน 7 จังหวัด ได้แก่ ตรัง พัทลุง สตูล สงขลา ปัตตานี นราธิวาส และยะลา
- 171 หมู่4 ถนนสงขลา-จะนะ ตำบลเขารูปช้าง อำเภอเมืองสงขลา จังหวัดสงขลา 90000
- โทร 074-336-087 โทรสาร 074-336-088
- email : saraban-hss11@hss.mail.go.th
- Google map
- Facebook
- Website
12.RESPONSIBLE CONSUMPTION AND PRODUCTION การบริโภคและการผลิตที่รับผิดชอบ
การบรรลุการเติบโตทางเศรษฐกิจและการพัฒนาที่ยั่งยืนต้องอาศัยการลดผลกระทบต่อระบบนิเวศโดยด่วนด้วยการเปลี่ยนแปลงวิธีการผลิตและการบริโภคสินค้าและทรัพยากร เกษตรกรรมเป็นผู้ใช้น้ำรายใหญ่ที่สุดในโลก และปัจจุบันการชลประทานใช้น้ำจืดเกือบ 70 เปอร์เซ็นต์สำหรับการใช้ของมนุษย์
การจัดการทรัพยากรธรรมชาติร่วมกันอย่างมีประสิทธิภาพ และวิธีการกำจัดของเสียและมลพิษที่เป็นพิษเป็นเป้าหมายสำคัญในการบรรลุเป้าหมายนี้ การสนับสนุนให้ภาคอุตสาหกรรม ธุรกิจ และผู้บริโภครีไซเคิลและลดของเสียก็มีความสำคัญไม่แพ้กัน เช่นเดียวกับการสนับสนุนให้ประเทศกำลังพัฒนามุ่งสู่รูปแบบการบริโภคที่ยั่งยืนมากขึ้นภายในปี 2030
ประชากรโลกส่วนใหญ่ยังคงบริโภคน้อยเกินไปที่จะตอบสนองความต้องการพื้นฐาน การลดปริมาณขยะอาหารต่อหัวทั่วโลกลงครึ่งหนึ่งในระดับผู้ค้าปลีกและผู้บริโภคยังมีความสำคัญต่อการสร้างการผลิตและห่วงโซ่อุปทานที่มีประสิทธิภาพมากขึ้น ซึ่งจะช่วยในเรื่องความมั่นคงทางอาหารและเปลี่ยนเราไปสู่เศรษฐกิจที่ใช้ทรัพยากรอย่างมีประสิทธิภาพมากขึ้น
ถ้าไม่ผ่าน ไม่ต้องกังวล กดสร้างบัญชีไปก่อนได้ (ไปสแกนอีกทีตอนหลังได้)
คำถาม : คุณเคยใช้บริการหัตถการเสริมความงามด้านใดดังต่อไปนี้ ภายในระยะเวลา 3 ปีที่ผ่านมา? และสถานบริการหัตถการเสริมความงามใดที่คุณเลือกใช้บริการ?
คำถาม : คุณเคยใช้บริการหัตถการเสริมความงามด้านใดดังต่อไปนี้ ภายในระยะเวลา 3 ปีที่ผ่านมา? และสถานบริการหัตถการเสริมความงามใดที่คุณเลือกใช้บริการ?
แม้หัตถการเสริมความงามแต่ละประเภทจะมีกลุ่มผู้ใช้บริการหลักที่แตกต่างกัน แต่ผู้ใช้บริการส่วนใหญ่ จะเลือกใช้บริการจากสถานบริการที่มีความเชี่ยวชาญเฉพาะ
12.Future of bioengineering - อนาคตของวิศวกรรมชีวภาพ
วิศวกรรมชีวภาพคือการประยุกต์ใช้หลักการทางวิศวกรรมกับชีววิทยา โดยใช้ความก้าวหน้าทางเทคโนโลยีเพื่อปรับปรุงสุขภาพและสมรรถภาพของมนุษย์ เปลี่ยนแปลงห่วงโซ่คุณค่าของอาหาร และสร้างสรรค์ผลิตภัณฑ์ใหม่ๆ
ผศ.นพ. พลกฤต ทีฆคีรีกุล กล่าวปิดท้ายว่า โรงพยาบาลบำรุงราษฎร์เป็นผู้นำในการนำเทคโนโลยีและความรู้ด้านพันธุกรรมมาใช้ในการวินิจฉัย ร่วมกับการรักษา ป้องกันโรค และดูแลสุขภาพองค์รวม นอกเหนือจากเรื่องเวชศาสตร์จีโนมแล้ว เรายังนำความรู้เรื่องมัลติโอมิกส์ (Multi-omics) ซึ่งเป็นเทคโนโลยีทางการแพทย์ที่ทันสมัย มาใช้ในการตรวจรักษา โดยช่วยให้ทราบถึงความเสี่ยงของการเกิดโรคจากการถ่ายทอดทางพันธุกรรมที่ไม่สามารถแก้ไขหรือเปลี่ยนแปลงได้ รวมถึงการใช้ประโยชน์จาก AI ในการแปรผลยีนเพื่อให้มีความแม่นยำมากขึ้น โดยมีเป้าหมายเพื่อการดูแลสุขภาพเฉพาะบุคคลอย่างมีประสิทธิภาพ ซึ่งเป็นการต่อยอดความรู้ด้านจีโนมิกส์ สู่การพัฒนาด้านเวชศาสตร์เชิงป้องกัน เพื่อส่งเสริมการมีสุขภาพที่ดีอย่างยืนยาวและยกระดับคุณภาพชีวิตที่ดีขึ้นของผู้คนอย่างยั่งยืน
นับเป็นการตอกย้ำถึงความมุ่งมั่นของโรงพยาบาลบำรุงราษฎร์ ที่ไม่เคยหยุดยั้งในการพัฒนาองค์ความรู้ และการแสวงหาการใช้นวัตกรรมและเทคโนโลยีที่เหมาะสม เพื่อส่งมอบการบริบาลด้วยความเอื้ออาทรและเพื่อผลลัพธ์การรักษาในเชิงบวก โดยคำนึงถึงคุณภาพการรักษาที่มีประสิทธิภาพตามมาตรฐานสากลและความปลอดภัยของผู้ป่วยเป็นสิ่งสำคัญสูงสุด
สอบถามรายละเอียดเกี่ยวกับการรักษาได้ที่ศูนย์เวชศาสตร์จีโนม บำรุงราษฎร์ (Bumrungrad Genomic Medicine Center) โรงพยาบาลบำรุงราษฎร์ ชั้น 3 อาคาร B (โรงพยาบาล) โทร. 02 011 4890 หรือ 02 011 4891 (เวลาทำการ 8:00-18:00 น.)
ศูนย์บริการสาธารณสุข 22 วัดปากบ่อ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชน ฟรี 2-13 กันยายน 2567
ศูนย์บริการสาธารณสุข 22 วัดปากบ่อ แผนสัปดาห์รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในชุมชน ฟรี ประจำปี 2567 วันที่ 2-6 และ 9-13 กันยายน 2567 เวลา 8.30 - 11.30 น. เจ้าของสัตว์เลี้ยงนำบัตรประชาชนมาด้วยนะคะ
ข้อมูลคลินิกและโรงพยาบาลปี 2566
สรุปจำนวนคลินิกและโรงพยาบาลในไทยปี 2566 แบ่งเป็น คลินิกมีจำนวน 35,577 แห่ง โรงพยาบาลมีจำนวน 425 แห่ง (ข้อมูล ณ 30 กันยายน 2566)
2. ไปที่เมนู เลือก บริจาคดวงตา อวัยวะ
3. เลือกลงทะเบียนแสดงความจำนง
12) อวัยวะที่พิมพ์ 3 มิติ (3D printed organs)
รายชื่อผู้รอรับการปลูกถ่ายอวัยวะนั้นยาวเหยียดและโหดร้าย ไม่ต้องพูดถึงตลาดมืดที่โหดร้ายยิ่งกว่านั้นซึ่งเชี่ยวชาญเฉพาะด้านการค้าอวัยวะ ผู้ป่วยจำเป็นต้องรอให้ใครสักคนเสียชีวิตเสียก่อนจึงจะได้รับการรักษาที่ช่วยชีวิตได้ อวัยวะที่สร้างขึ้นโดยใช้เซลล์ต้นกำเนิดของผู้ป่วยจะช่วยขจัดด้านมืดของระบบผู้บริจาคอวัยวะ การออกแบบอวัยวะ, TMF, หัวใจ, เนื้อเยื่อ, การพิมพ์ชีวภาพ หลายปีผ่านไปตั้งแต่เราได้เห็นสัญญาณที่ดีเป็นครั้งแรก ตัวอย่างเช่น เมื่อนักวิจัยใช้เนื้อเยื่อตับมนุษย์ที่พิมพ์ด้วยเครื่องพิมพ์ 3 มิติของบริษัท Organovo เพื่อสร้างแบบจำลองการบาดเจ็บของตับที่เกิดจากยาความหวังพุ่งสูงขึ้นและรายงานข่าวที่กระตือรือร้นชี้ให้เห็นว่าในอนาคตอันใกล้นี้ ผู้ป่วยจะสามารถรับอวัยวะเทียมเพื่อทดแทนตับ ไต และแม้แต่หัวใจที่บกพร่องได้ แต่เราต้องจำไว้ว่าในขณะนี้มีเพียงเนื้อเยื่อเท่านั้นที่สามารถพิมพ์ออกมาได้ ซึ่งมีหน้าที่เหมือนเนื้อเยื่อของมนุษย์ (ตับ กระดูก หรือกระดูกอ่อน) อวัยวะต่างๆ ยังห่างไกลจากการสร้างจากเซลล์ต้นกำเนิด เรามีการศึกษาวิจัยและการพิสูจน์แนวคิด แต่ไม่มีผลิตภัณฑ์จริง22 มิถุนายน 2565 ให้บริการกับพี่น้องชาวจังหวัดเลย
22 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา เคลื่อนที่จาก โรงพยาบาลธีรวัฒน์ จังหวัดกาฬสินธุ์ ไปให้บริการกับพี่น้องชาวจังหวัดเลย สำหรับข้าราชการทุกๆหน่วยงาน ประชาชนที่อยู่บริเวรใกล้เคียง สามารถเดินทางไปตรวจเช็คสุขภาพตา ได้ที่ให้บริการได้เลยค่ะ สถานที่ให้บริการ : สพป.เลย.เขต1 จ.เลย ตั้งแต่เวลา 08:30 - 16:00 น. สอบถามข้อมูลเพิ่มเติมได้ที่ 043-811-757เขตสัมพันธวงศ์ เชิญลงชื่อแจ้งความประสงค์ทำหมันสุนัขและแมว ระหว่างวันที่ 19 มิถุนายน - 19 กรกฎาคม 2566
เขตสัมพันธวงศ์ ขอเชิญชวนประชาชนที่สนใจ แจ้งความประสงค์ทำหมันสุนัขและแมวในพื้นที่เขตสัมพันธวงศ์ ระหว่างวันที่ 19 มิถุนายน - 19 กรกฎาคม 2566 ทั้งนี้ การกำหนดวันเวลาและสถานที่จะแจ้งให้ทราบภายหลัง สามารถลงทะเบียนได้จาก QRcode ในภาพ
13 กรกฎาคม 66 ณ วัดวชิรธรรมสาธิต พระโขนง
สำนักงานเขตพระโขนงเชิญชวนร่วมกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 13 กรกฎาคม 2566 เวลา 08.00 - 14.00 น. ณ วัดวชิรธรรมสาธิตวรวิหาร เขตพระโขนง โดยในงานมีกิจกรรมมากมาย
- ชวนเช็คเบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอกซเรย์ปอด ตรวจฟัน (ุอุด ขุด ถอน) สุขภาพใจ คุยกกับนักจิตวิทยา
- ชวนรู้ กินเป็น เน้นสุขภาพ ยาเสพติด ไข้เลือดออก รู้ทันผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ปลอดภัยจากฝุ่นจิ๋ว PM2.5 ดูแลคนป่วยที่บ้าน สื่อน่ารู้
- ชวนช็อป สินค้าโอทอป สินค้าชุมชน
- บริการน้องหมาแมว ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป (น้องหมา)
- แจกแว่นสายตายาว
Day1 : 22 สิงหาคม 2565 APEC Health Week วันแรก
APEC Health Week 22 สิงหาคม 2565 วันแรกของการประุชม เป็นไปโดยราบรื่น
นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข ระบุว่า ภาพรวมบรรยากาศการจัดประชุม APEC Health Week ในวันแรกเป็นไปด้วยความราบรื่นและเรียบร้อย การจัดงานเป็นไปตามมาตรการการป้องกันและควบคุมโรคโควิด 19 มีผู้เข้าร่วมประชุมจากเขตเศรษฐกิจต่างๆ เข้าร่วมจำนวนมาก และให้ความร่วมมือปฏิบัติตามมาตรการป้องกันโรคโควิด 19 ตามที่กระทรวงสาธารณสุขกำหนดอย่างดี
นอกจากนี้ กระทรวงสาธารณสุขในฐานะเจ้าภาพการจัดงานได้ร่วมกับหน่วยงานต่างๆ ที่เกี่ยวข้อง ดูแลผู้เข้าร่วมประชุม ทั้งเรื่องของความปลอดภัย การอำนวยความสะดวกด้านการจราจร การดูแลสุขภาพและการเจ็บป่วยระหว่างการประชุมเป็นอย่างดี โดยวันแรกมีการประชุมหารือเชิงนโยบาย (Policy Dialogue) 2 เรื่องสำคัญ คือ ครอบครัวคุณภาพ (Smart Families) และการกำจัดไวรัส HPV และมะเร็งปากมดลูก (Cervical Cancer)
สำหรับบูธนิทรรศการที่จัดโดยกรมต่างๆ ของกระทรวงสาธารณสุข ได้แก่ เรื่อง Medical Hub นวัตกรรมทางการแพทย์ บทบาทของ อสม.ในการช่วยควบคุมโรคโควิด 19 กัญชาทางการแพทย์ สมุนไพรและผลิตภัณฑ์จากสมุนไพร รวมถึงการนวดไทย มีกำหนดจะเปิดให้ผู้เข้าร่วมประชุมเข้าศึกษาตั้งแต่วันที่ 23 สิงหาคม 2565
ส่วนบริการนวดไทย เตรียมจัดให้มีบริการนวดคอ บ่า ไหล่ จำนวน 5 เตียง และนวดเท้าอีก 5 เตียง รองรับได้อย่างละ 40 คนต่อวัน รวมเป็น 80 คนต่อวัน ให้บริการภายใต้มาตรการป้องกันโควิด 19 เหตุที่เลือกให้มีการบริการนวดไทย ก็เพื่อเป็นการประชาสัมพันธ์ การนวดไทยที่ถือเป็นมรดกภูมิปัญญาทางวัฒนธรรมและทางการแพทย์แผนไทย ที่สามารถดูแลสุขภาพและต่อยอดสร้างมูลค่าทางเศรษฐกิจได้ โดยเฉพาะการท่องเที่ยวเชิงสุขภาพ ทั้งการนวดรักษาโดยเฉพาะโรคออฟฟิศซินโดรม และการนวดส่งเสริมสุขภาพหรือนวดสปา
กลุ่มควบคุมโรคพิษสุนัขบ้า กทม. เปิดจองคิวทำหมันสัตว์เลี้ยง เดือนตุลาคมเปิดแล้ว
กลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานคร จองคิวทำหมันสัตว์เลี้ยง ผ่านช่องทางออนไลน์
เดือนตุลาคมเปิดแล้ว สามารถเข้าไปจองได้ที่
rabiesbkk.atwebpages.com/
ระบบนัดทำหมัน กลุ่มควบคุมโรคพิษสุนัขบ้า
เงื่อนไขการนัดหมาย
• สัตว์เลี้ยงที่จะเข้ารับบริการทำหมัน ต้องมีสุขภาพแข็งแรง ไม่อยู่ในระหว่างการตั้งครรภ์
• ต้องสามารถแสดงบัตรประชาชนตัวจริง ที่เลขที่บัตรตรงกับที่ลงทะเบียนไว้ (อาศัยอยู่ในกรุงเทพมหานคร) ในวันที่เข้ารับบริการ
• 1คน สามารถนัดได้ไม่เกิน 3 ตัว ในทุกช่องทาง เมื่อใช้บริการแล้วจึงสามารถนัดเพิ่มได้
ยอดการรับทางonline ไม่เกิน 20ตัว/วัน
• นัดหมายตั้งแต่ 2023-09-21 ถึง 2023-10-31
มอบน้ำดื่ม ยาและเวชภัณฑ์ ให้กับสถานีตำรวจทางหลวง 2022
Green Health Care&Share 2022.12.27 โดยคุณลัคณา เจริญรูป ผู้จัดการฝ่ายการตลาด โรงพยาบาลกรุงเทพจันทบุรี มอบน้ำดื่ม ยาและเวชภัณฑ์ ให้กับสถานีตำรวจทางหลวง 4 กองกำกับการ 3 กองบังคับการตำรวจทางหลวง เพื่อใช้ดูแลประชาชนที่เดินทางกลับภูมิลำเนา และท่องเที่ยวตามสถานที่ต่างๆ ช่วงเทศกาลส่งท้ายปีเก่าต้อนรับปีใหม่ เมื่อวันที่ 27 ธันวาคม 2565
Day1 : 22 สิงหาคม 2565 - ประชุมหารือเชิงนโยบาย “Smart Families” รับมือเกิดน้อย กระทบแรงงาน-เศรษฐกิจ
ประเดิมประชุม APEC Health Week วันแรก รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุขเปิดประชุมข้อหารือเชิงนโยบาย “ครอบครัวคุณภาพ Smart Families” ระดมผู้เชี่ยวชาญทั้งด้านสาธารณสุข การวางแผนครอบครัว สถาบันการศึกษา องค์การระหว่างประเทศ สร้างแนวทางรับมือปัญหาโครงสร้างประชากร เผย 17 เขตเศรษฐกิจ มีอัตราเจริญพันธุ์รวมต่ำกว่าอัตราทดแทน หวั่นเกิดน้อยทำวัยแรงงานลดลง เจอปัญหาหลังแอ่นแบกรับดูแลสังคม เลี้ยงดูเด็กและคนแก่ กระทบเศรษฐกิจระยะยาว
ดร.สาธิต ปิตุเตชะ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข เปิดการประชุมข้อหารือเชิงนโยบาย (Policy Dialogue) ประเด็น “ครอบครัวคุณภาพ (Smart Families)” ภายในการประชุม APEC Health Week ซึ่งจัดประชุมวันนี้เป็นวันแรก โดย ดร.สาธิตกล่าวว่า ปัจจุบันสมาชิกเอเปคทั้ง 21 เขตเศรษฐกิจ พบว่า มีถึง 17 เขตเศรษฐกิจที่กำลังเผชิญกับปัญหาโครงสร้างประชากร คือ มีอัตราการเจริญพันธุ์โดยรวมต่ำกว่าอัตราการทดแทน ทำให้จำนวนประชากรมีแนวโน้มลดลง จนส่งผลกระทบต่อเศรษฐกิจในระยะยาวได้ ซึ่งประเทศไทยเป็นหนึ่งในเขตเศรษฐกิจที่กำลังเผชิญกับปัญหานี้เช่นกัน โดยปัจจุบันประเทศไทยมีประชากรราว 66 ล้านคน เข้าสู่สังคมสูงอายุ (Aging Society) เรียบร้อยแล้ว และกำลังเข้าสู่สังคมสูงอายุโดยสมบูรณ์ (Aged Society) ในไม่ช้า มีอัตราการเจริญพันธุ์รวม (Total Fertility Rate) 1.24 ปี 2563 ซึ่งต่ำกว่าระดับทดแทน ทั้งที่อัตราการเจริญพันธุ์รวมควรอยู่ที่ประมาณ 1.6
“ขณะนี้ประเทศไทยมีเด็กแรกเกิดลดลงทุกปี จากปี 2560 เด็กเกิดประมาณ 7 แสนคน ปัจจุบันในปี 2564 ลดเหลือ 5.4 แสนคน จำนวนการเกิดลดลงเรื่อยๆ จนใกล้เคียงจำนวนการตาย หากไม่ทำอะไรเลยการเกิดจะน้อยกว่าการตาย ประชากรไทยอาจจะลดลงครึ่งหนึ่ง ส่งผลให้ประชากรวัยทำงานที่ต้องอุ้มชูดูแลทั้งสังคม วัยเด็ก และวัยสูงอายุ มีจำนวนลดลงและแบกรับภาระมากขึ้น โดยคาดว่า 40 ปีข้างหน้าวัยทำงานลดลง 15 ล้านคน มีผู้สูงอายุเพิ่มขึ้น 12 ล้านคน ทำให้กระทบทั้งเศรษฐกิจ สังคม และการเงินการคลังของประเทศ” ดร.สาธิตกล่าว
ดร.สาธิตกล่าวว่า การประชุมในวันนี้ถือเป็นการเปิดโอกาสให้สมาชิกเขตเศรษฐกิจเอเปคได้มาแลกเปลี่ยนสถานการณ์และหารือสร้างฉันทามติเพื่อจัดการแก้ไขปัญหาสถานการณ์นี้ โดยมีเจ้าหน้าที่ด้านสาธารณสุข ผู้เชี่ยวชาญด้านการวางแผนครอบครัว ภาคประชาสังคม สถาบันการศึกษา องค์กรระหว่างประเทศ และภาคเอกชน ของแต่ละเขตเศรษฐกิจเอเปคเข้าร่วม เช่น แนวทางการวางแผนการเจริญพันธุ์สำหรับบุคคลและครอบครัวที่ต้องการมีบุตรและหลีกเลี่ยงการตั้งครรภ์ที่ไม่ได้ตั้งใจ เป็นต้น โดยประเทศไทยมีการนำเสนอเรื่องของโครงการครอบครัวคุณภาพ Smart Families
ด้าน นพ.สุวรรณชัย วัฒนายิ่งเจริญชัย อธิบดีกรมอนามัย กล่าวว่า นโยบายด้านประชากรของไทยแบ่งเป็น 3 ช่วง คือ ช่วงแรกการส่งเสริมให้คนไทยมีลูกมากขึ้น สมัยช่วงรัฐบาลจอมพล ป. พิบูลย์สงคราม ทำให้ประเทศไทยมีประชากรเพิ่มขึ้นจาก 14.5 ล้านคนในปี 2480 เป็น 26.3 ล้านคน ในปี 2503 ช่วงที่สอง การส่งเสริมการวางแผนครอบครัว หลังจากที่ประเทศไทยมีการเกิดมากขึ้น เพื่อลดการเพิ่มของประชากร โดยประกาศนโยบายครั้งแรกเมื่อ ปี 2513 ซึ่งพัฒนาเป็นโครงการวางแผนครอบครัวแห่งชาติ ที่ประสบความสำเร็จได้รับการยอมรับจากนานาชาติ โดยอัตราคุมกำเนิดเพิ่มขึ้นจากร้อยละ 14 เป็นร้อยละ 72 และช่วงที่สามคือปัจจุบันที่จำนวนและโครงสร้างประชากร
มีความซับซ้อนกว่าในอดีต ถือเป็นความท้าทายต่อนโยบายประชากรครั้งใหม่ เนื่องจากอัตราการเจริญพันธุ์รวมของไทยลดลงอย่างมาก มีปัญหาเรื่องการตั้งครรภ์ไม่พร้อม ทั้งการตั้งครรภ์ในวัยรุ่น การตั้งครรภ์โดยไม่ตั้งใจและการทำแท้งที่ไม่ปลอดภัย โดยขณะนี้ประเทศไทยเป็นหนึ่งในประเทศที่มีอัตราเจริญพันธุ์รวมต่ำที่สุดในโลกจากข้อมูล World Population Prospect 2022 พบว่าในปี 2564 มีเพียง 20 ประเทศเท่านั้นที่มีอัตราเจริญพันธุ์รวมต่ำกว่าประเทศไทย
นพ.สุวรรณชัยกล่าวว่า กระทรวงสาธารณสุขเตรียมความพร้อมรองรับสถานการณ์ดังกล่าว โดยจัดทำเรื่องของครอบครัวคุณภาพ Smart Families มีการออกกฎหมายและนโยบายต่างๆ คือ นโยบายและยุทธศาสตร์พัฒนาอนามัยเจริญพันธุ์แห่งชาติ ฉบับที่ 2 เพื่อส่งเสริมการเกิดที่มีความพร้อม มีความตั้งใจ และส่งเสริมการดูแลเลี้ยงดูเด็กที่เกิดมาให้เติบโตได้เต็มศักยภาพ เพื่อเป็นกำลังสำคัญในการพัฒนาประเทศต่อไป มีการออก พ.ร.บ.ป้องกันและแก้ไขปัญหาการตั้งครรภ์ในวัยรุ่น เพื่อบูรณาการหน่วยงานที่เกี่ยวข้องผ่านรูปแบบของคณะกรรมการทำให้สามารถลดอัตราการคลอดในวัยรุ่นอายุ 15-19 ปี ลงได้ครึ่งหนึ่งก่อน 10 ปี และตั้งเป้าหมายจะลดอัตราคลอดในวัยรุ่นภายในปี 2570 ให้เหลือไม่เกิน 1.5 ต่อพันประชากร นอกจากนี้ ยังช่วยลดปัญหาการหลุดจากระบบการศึกษา มีการจัดสวัสดิการต่างๆ ในการช่วยเหลือแม่วัยรุ่นด้วย
จำแนกตามสิทธิในระบบหลักประกันสุขภาพของประเทศ ปีงบประมาณ 2561-2565
ข้อมูล ณ วันที่ 30 กันยายน 2565
รายงานประจำปี 2565 (p70)Day1 : 22 สิงหาคม 2565 - ประชุมหารือป้องกันควบคุมโรค “มะเร็งปากมดลูก” หลังหยุดชะงักจากโควิด
ประชุม APEC Health Week ถกเข้ม หารือเชิงนโยบาย “การกำจัดไวรัส HPV และมะเร็งปากมดลูก” เผยผู้ป่วย 38% และผู้เสียชีวิต 35% อยู่ในเขตเศรษฐกิจ APEC ระดมสมองวางแนวทางดำเนินงานป้องกัน คัดกรอง และรักษา ให้เป็นตามแผนงาน The First APEC Roadmap หลังหยุดชะงักในช่วงโควิด ไทยเร่งหาวัคซีนเอชพีวีฉีดย้อนหลังนักเรียนหญิงชั้น ป.5 หลังหยุดไป 2 ปี
นพ.สมศักดิ์ อรรฆศิลป์ อธิบดีกรมการแพทย์ กล่าวว่า การประชุม APEC Health Week วันแรกในช่วงบ่าย มีการประชุมหารือเชิงนโยบายเรื่องการกำจัดไวรัส HPV และมะเร็งปากมดลูก สาเหตุที่มีการนำเรื่องนี้ขึ้นมาหารือในการประชุม APEC Health Week เนื่องจากโรคมะเร็งปากมดลูก เป็นหนึ่งในโรคมะเร็งที่พบได้บ่อยในสตรีทั่วโลก แต่ละปีจะมีผู้ป่วยใหม่ราว 6 แสนราย และมีผู้เสียชีวิตราว 3.4 แสนราย ซึ่งจำนวนนี้พบผู้ป่วยมะเร็งปากมดลูกรายใหม่ในเขตเศรษฐกิจ APEC ถึงร้อยละ 38 และพบผู้เสียชีวิตร้อยละ 35 โดยการประชุมในวันนี้เป็นการแลกเปลี่ยนประสบการณ์การดำเนินงานการสร้างขีดความสามารถ และการสนับสนุนการขับเคลื่อนนโยบาย เพื่อขจัดปัญหาอุปสรรคในการป้องกัน คัดกรองโรคมะเร็งปากมดลูก การดูแลรักษาผู้ป่วย ทั้งในระยะที่รักษาได้หรือในระยะท้ายที่ดีที่สุด รวมถึงรับฟังปัญหาอุปสรรคในการดำเนินงาน และแนวทางแก้ไขปัญหาซึ่งจะช่วยให้สมาชิกเขตเศรษฐกิจสามารถดำเนินงานได้ตามแผนงานแรกของเอเปคในการการส่งเสริมความก้าวหน้าทางเศรษฐกิจที่ยั่งยืนสำหรับผู้หญิงผ่านการป้องกันและควบคุมโรคมะเร็งปากมดลูก (The First APEC Roadmap to Promote Sustainable Economic Advanced for Women through Cervical Cancer Prevention and Control) ซึ่งจัดทำขึ้นในช่วงปี 2014-2017 และตามนโยบายขององค์การอนามัยโลกในการกำจัดโรคมะเร็งปากมดลูกภายในปี 2030
นพ.สมศักดิ์กล่าวว่า สำหรับประเทศไทยมีแผนการป้องกันและควบคุมโรคมะเร็งแห่งชาติ พ.ศ. 2561 – 2565 ซึ่งในเรื่องของมะเร็งปากมดลูกครอบคลุมตั้งแต่การป้องกัน การคัดกรอง และการรักษาโรค โดยปัจจุบันบรรจุอยู่ในแผนการดำเนินงานของเขตสุขภาพทุกแห่งทั่วประเทศ ซึ่งในเรื่องของการป้องกันเราบรรจุการฉีดวัคซีนป้องกันมะเร็งปากมดลูกหรือวัคซีนเอชพีวีเข้าสู่แผนงานสร้างเสริมภูมิคุ้มกันโรคของประเทศ และบรรจุในบัญชียาหลักแห่งชาติทั้งวัคซีนชนิด 2 สายพันธุ์และ 4 สายพันธุ์ เพื่อฉีดให้แก่นักเรียนหญิงชั้นประถมศึกษาปีที่ 5 ทั่วประเทศ ซึ่งแต่ละปี มีประมาณ 4 แสนคน เป็นการฉีดก่อนการมีเพศสัมพันธ์ โดยเริ่มฉีดมาตั้งแต่ปี 2560 ซึ่งจากการศึกษาพบว่ามีความคุ้มทุนและมีประสิทธิผลป้องกันโรคสูงและยาวนาน
ส่วนการคัดกรองมีแนวทางการตรวจแปปสเมียร์ (Pap Smear) ซึ่งตั้งแต่ต้นปี 2565 กระทรวงสาธารณสุข จัดโครงการคัดกรองมะเร็งปากมดลูกโดยการเก็บสิ่งส่งตรวจด้วยตนเอง (HPV Self Sampling) หลังเก็บตัวอย่างใส่ลงในหลอดน้ำยาตามขั้นตอนที่กำหนดแล้วสามารถส่งไปยังโรงพยาบาลที่เข้าร่วมโครงการเพื่อดำเนินการตรวจและรายงานผลตรวจต่อไป ทำให้ไม่จำเป็นต้องไปโรงพยาบาล เพื่อให้บุคลากรทางการแพทย์เก็บตัวอย่าง ซึ่งผู้หญิงจำนวนมากมีความเขินอาย กลัวการใส่เครื่องมือทางช่องคลอด หรือไม่อยากเสียเวลางาน ทำให้ไม่ไปตรวจ จึงเป็นแนวทางที่ทำให้เกิดการตรวจคัดกรองมากขึ้น ส่วนการรักษาแพทย์จะพิจารณาตามระยะ โดยมีการรักษาทั้งการผ่าตัด การใช้เคมีบำบัด การฉายรังสีรักษา ซึ่งสามารถเบิกจ่ายได้ตามสิทธิประโยชน์
“ภายในที่ประชุมมีการหารือถึงเรื่องการดำเนินงานควบคุมป้องกันโรคมะเร็งปากมดลูกที่หยุดไปในช่วงการระบาดของโรคโควิด 19 และเตรียมความพร้อมให้มีการดำเนินงานอย่างต่อเนื่องหากเกิดโรคระบาดแบบนี้อีกซึ่งช่วง 2 ปีที่ผ่านมาโรคโควิด 19 มีผลต่อการผลิตและจัดหาวัคซีนเอชพีวีป้องกันมะเร็งปากมดลูก ทำให้ไม่สามารถจัดหาเข้าฉีดเด็กนักเรียนหญิงชั้นประถมศึกษาปีที่ 5 ของไทยได้ รวมกว่า 8 แสนคน แต่ในปีนี้เราสามารถจัดหาวัคซีนเอชพีวีเข้ามาฉีดนักเรียนหญิงชั้นประถมศึกษาปีที่ 5 ได้แล้วประมาณ 4 แสนคน และอยู่ระหว่างการจัดหาเพื่อดำเนินการฉีดวัคซีนย้อนหลังสำหรับ 2 ปีที่ผ่านมาอีก” นพ.สมศักดิ์กล่าว
ทริปท่องเที่ยว KIHA 183 เดือนธันวาคม
โปรแกรมนั่งรถไฟ KIHA 183 เดือนธันวาคม
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตสะพานสูง
Cafe Amazon for Chance สาขา 4 สนามลู่ปั่นจักรยานเจริญสุขมงคลจิต (Skylane)
Cafe Amazon for Chance สาขาที่ 4 ดำเนินการโดย ผู้พิการทางการได้ยิน
ตั้งอยู่ที่ สนามลู่ปั่นจักรยานเจริญสุขมงคลจิต (Skylane)
สนามบินสุวรรณภูมิ
999/1 หนองปรือ อำเภอบางพลี สมุทรปราการ 10540
+66830237777
3. เปลี่ยนรูปโพรไฟล์ และอนุญาตการเข้าถึงการใช้งานกล้อง
ข้อควรระวังในการเปลี่ยนรูปโพรไฟล์
- กรณีเลือกรูป Profile จาก Gallery ต้องเลือกรูปหน้าตรง ถ่ายไว้ไม่เกิน 1 เดือน
- กรณีถ่ายรูปใหม่ ต้องถ่ายรูปหน้าตรง ไม่สวมหมวก ไม่ใส่แว่นกันแดดสีดำ (สามารถใส่แว่นสายตาได้)
เครื่องดื่มสมุนไพร สไตล์ อภัยภูเบศร
เครื่องดื่มสมุนไพร สไตล์ อภัยภูเบศร ไม่เคยทำให้ผิดหวัง
4 โถ 4 รส
- ไทยลัั้นลา
- ทุ่มเท
- โคล่าตาหวาน
- น้ำส้มจี๊ดซ่า
ตารางคำแนะนำการใช้วัคซีนที่อยู่นอกแผนงานสร้างเสริมภูมิคุ้มกันโรค ของกระทรวงสาธารณสุข
| ชื่อวัคซีน |
ผู้ที่ควรได้รับวัคซีน |
อายุที่ควรได้รับและกำหนดการรับวัคซีน |
| โรต้า (Rotavirus) |
- เด็กทั่วไปที่ควรได้รับ โด๊สแรกอายุตั้งแต่ 6 สัปดาห์และไม่เกินอายุ 15 สัปดาห์ |
- วัคซีนชนิด monovalent หยอด 2 ครั้ง เมื่ออายุ 2, 4 เดือน ห่างกันอย่างน้อย 4 สัปดาห์ และโด๊สสุดท้ายไม่เกินอายุ 8 เดือน
- วัคซีนชนิด pentavalent หยอด 3 ครั้ง เมื่ออายุ 2, 4, 6 เดือน แต่ละโด๊สห่างกันไม่น้อยกว่า 4 สัปดาห์ และโด๊สสุดท้ายไม่เกินอายุ 8 เดือน
- วัคซีนทั้ง 2 ชนิดสามารถให้พร้อมกับ OPV ได้ หรือ ห่างกันเป็นเวลาเท่าใดก็ได้ และสามารถกินนมแม่ได้ |
ฮิบ
(Haemophilus influenzae type b) |
- เด็กทั่วไปที่มีอายุ 2 เดือน - 2 ปี
- เด็กทุกอายุที่มีภูมิคุ้มกันบกพร่อง ม้ามทำงานผิดปกติ |
- อายุตั้งแต่ 2 เดือนขึ้นไป ฉีด 1-3 เข็ม ห่างกันทุก 2 เดือน ขึ้นกับอายุที่เริ่มให้วัคซีน ดังนี้ :
• กรณีที่ใช้วัคซีนชนิด PRP-T ถ้าอายุที่เริ่มฉีดต่ำกว่า 6 เดือน ให้ 3 เข็ม, อายุ 7-11 เดือน ให้ 2 เข็ม และ อายุ 12-24 เดือน ให้เข็มเดียว
• ฉีดกระตุ้น 1 เข็ม เมื่ออายุ 12-18 เดือน และห่างจากเข็มสุดท้ายอย่างน้อย 2 เดือน โดยเด็กที่แข็งแรงดีอาจไม่ต้องฉีดกระตุ้นก็ได้
• หลังอายุ 24 เดือน ไม่ต้องฉีดยา ยกเว้นผู้ที่มีภูมิคุ้มกันบกพร่องให้ฉีด 2 เข็มห่างกัน 2 เดือน |
อีสุกอีใส
(Varicellazoster) |
- บุคคลทั่วไปที่ยังไม่เคยเป็นโรคอีสุกอีใส หรือยังไม่มีภูมิคุ้มกัน โดยให้ได้ในเด็กอายุตั้งแต่ 1 ปีขึ้นไป จนถึงผู้ใหญ่
- ผู้ที่อยู่ใกล้ชิดหรืออยู่บ้านเดียวกันกับผู้ที่มีภูมิคุ้มกันบกพร่อง และยังไม่เคยเป็นโรคอีสุกอีใสหรือยังไม่มีภูมิคุ้มกัน ให้ได้ตั้งแต่อายุ 1 ปีขึ้นไป
- บุคลากรทางการแพทย์ ที่ยังไม่เคยเป็นโรค หรือยังไม่มีภูมิคุ้มกัน
- ห้ามให้ในผู้ที่มีภูมิคุ้มกันบกพร่องทุกสาเหตุ ยกเว้นผู้ติดเชื้อเอชไอวี ที่มี CD4 มากกว่าร้อยละ 15 |
- เด็กอายุ 1-12 ปี ให้ 2 เข็ม เข็มแรกแนะนำให้ฉีดเมื่ออายุ 12-18 เดือน เข็มที่ 2 เมื่ออายุ 4-6 ปี แต่ในกรณีที่มีการระบาด อาจฉีดครั้งที่สองก่อนอายุ 4 ปีได้ โดยต้องห่างจากเข็มแรกอย่างน้อย 3 เดือน
- เด็กอายุตั้งแต่ 13 ปี และผู้ใหญ่ให้ 2 เข็ม ห่างกันอย่างน้อย 4 สัปดาห์
- ผู้ที่ติดเชื้อเอชไอวีที่ไม่มีอาการของภาวะภูมิคุ้มกันบกพร่อง และมี CD4 มากกว่าร้อยละ 15 แนะนำให้ 2 เข็ม ห่างกัน 3 เดือน |
| ตับอักเสบเอ (Hepatitis A) |
- บุคคลทั่วไปที่อายุมากกว่า 1 ปีขึ้นไป
- ผู้ที่ยังไม่มีภูมิคุ้มกันและมีความเสี่ยงต่อโรคตับรุนแรง เช่น ผู้ที่เป็นโรคตับเรื้อรัง
- ควรพิจารณาให้แก่ผู้ประกอบอาหาร ผู้ที่อยู่ในสถาบันที่มีคนอยู่ด้วยกันเป็นจำนวนมาก เช่น สถานเลี้ยงเด็ก สถานกักกัน กองทัพ ที่อาจเกิดการระบาดของโรคได้บ่อย
- ผู้ที่จะเดินทางไปในที่ที่มีการระบาดหรือมีความชุกของโรคสูง |
- อายุ 1 ปี ขึ้นไปฉีด 2 เข็ม ห่างกัน 6-12 เดือน
(อายุ 1-18 ปี ฉีดขนาดครึ่งหนึ่งของขนาดในผู้ใหญ่) |
นิวโมคอคคัส
(Streptococcus pneumoniae)
ชนิด 23-valent polysaccharide |
- บุคคลที่มีความเสี่ยงต่อการติดเชื้อนิวโมคอคัสมากกว่าคนปกติหรือรุนแรงกว่าคนปกติที่มีอายุ 2 ปี ขึ้นไป เช่น ผู้ที่มีภูมิคุ้มกันบกพร่อง ผู้ป่วยที่ไม่มีม้ามหรือม้ามทำงานผิดปกติ ผู้ป่วยโรคเรื้อรัง โรคหัวใจพิการแต่กำเนิดโดยเฉพาะชนิดเขียวและผู้ป่วยภาวะหัวใจวาย โรคปอดเรื้อรัง โรคเบาหวาน ผู้ป่วยที่มีน้ำไขสันหลังรั่ว และผู้ป่วยปลูกถ่าย cochlear |
- อายุ 2 ปี ขึ้นไป แนะนำให้ฉีดวัคซีน 2 เข็ม ห่างกัน 5 ปี
- อายุตั้งแต่ 65 ปีขึ้นไป แนะนำให้ฉีดวัคซีน 1 เข็ม |
นิวโมคอคคัส (Streptococcus pneumoniae)
ชนิด 10-valent conjugate (PCV-10)
และ 13 valent conjugate (PCV-13) |
- เด็กปกติที่มีอายุตั้งแต่ 6 สัปดาห์ขึ้นไป จนถึง 5 ปี
- เด็กที่มีความเสี่ยงได้แก่ เด็กทุกอายุที่มีภูมิคุ้มกันบกพร่อง หรือมีความเสี่ยงต่อโรค เช่น ไม่มีม้ามหรือม้ามทำงานผิดปกติ ผู้ป่วยโรคเรื้อรัง โรคหัวใจพิการแต่กำเนิดโดยเฉพาะ ชนิดเขียวและผู้ป่วยภาวะหัวใจวาย โรคปอดเรื้อรัง โรคเบาหวาน ผู้ป่วยที่มีน้ำไขสันหลังรั่ว และผู้ป่วยปลูกถ่าย cochlear
- ผู้ใหญ่ทุกคนที่อายุ 50 ปีขึ้นไป |
- จำนวนครั้งที่ฉีด ขึ้นอยู่กับอายุที่เริ่มฉีด โดยแต่ละเข็มควรห่างกัน 6-8 สัปดาห์ ดังนี้
• ถ้าเริ่มฉีดที่อายุ 2-6 เดือน ให้ 3 ครั้ง
• ถ้าเริ่มฉีดที่อายุ 7-23 เดือน ให้ 2 ครั้ง
• ถ้าเริ่มฉีดที่อายุ 24-59 เดือน ให้ครั้งเดียว ยกเว้นเป็นกลุ่มเสี่ยง ซึ่งควรให้ 2 ครั้ง
• หลังอายุ 5 ปี แนะนำให้เฉพาะผู้ที่มีความเสี่ยง โดยใช้ PCV-13 2 ครั้ง ห่างกัน 6-8 สัปดาห์
- ควรฉีดเข็มกระตุ้นเมื่ออายุ 12-15 เดือน ถ้าเริ่มให้ก่อนอายุ 1 ปี
- ในเด็กปกติอาจพิจารณาฉีดแบบ 2+1 (รวมเป็นการฉีด 3 เข็ม) คือฉีดเมื่ออายุ 2, 4 และ 12-15 เดือน
- เด็กที่มีภูมิคุ้มกันบกพร่องหรือไม่มีม้ามหรือม้ามทำงานผิดปกติ หลังจากฉีด PCV แล้วตามอายุอันควรดังข้างต้น ควรให้วัคซีนชนิด 23- valent polysaccharide ร่วมด้วยเมื่ออายุ 2 ปี ขึ้นไป อีก 2 เข็ม โดยเข็มแรกห่างจาก PCV โด๊สสุดท้าย 2 เดือน และฉีด 23- valent polysaccharide เข็มที่สองเมื่อ 5 ปีต่อมา
- ผู้ใหญ่อายุ 50 ปี ขึ้นไป ฉีด PCV-13 1 ครั้งเท่านั้น |
ไข้กาฬหลังแอ่น
(Neisseria meningitidis)
ชนิด polysaccharide (MPSV 4) |
- เฉพาะผู้ที่มีอายุตั้งแต่ 2 ปี ขึ้นไป และมีข้อบ่งชี้ดังนี้
1. ผู้ที่จะเดินทางไปยังบริเวณที่มีการระบาดของเชื้อไข้กาฬหลังแอ่นซึ่งมี ซีโรกรุ๊ปที่วัคซีนป้องกันได้ เช่น ผู้เดินทางไปประกอบพิธีฮัจย์ และอุมเราะห์ที่ประเทศซาอุดิอาระเบีย
2. กรณีที่มีการระบาดของเชื้อซีโรกรุ๊ปที่มีในวัคซีนเกิดขึ้น
3. กรณีก่อนไปศึกษาต่อชั้นมัธยมศึกษา หรือมหาวิทยาลัยที่ประเทศสหรัฐอเมริกา หรือประเทศอื่นที่กำหนดให้ต้องฉีดก่อนเข้าเรียนในสถาบันอุดมศึกษา
4. มีภาวะภูมิต้านทานต่อเชื้อนี้บกพร่องได้แก่ ภาวะม้ามไม่ทำงานหรือขาดสารคอมพลีเม้นต์ส่วนปลาย |
- ฉีดครั้งเดียว |
| ไข้กาฬหลังแอ่นชนิดคอนจูเกต (MCV4) |
- MCV4-DT (MenactraTM) ในผู้ที่อายุ 9 เดือน-55 ปี
- MCV4-CRM (MenveoTM) ในผู้ที่อายุ 2-55 ปี
- ข้อบ่งชึ้เหมือน MPSV4 ข้างต้น |
- เด็กอายุ 9-23 เดือน ฉีด 2 เข็ม ห่างกัน 3 เดือน
- เด็กอายุ 2 ปีขึ้นไป และผู้ใหญ่ ถ้ามีความเสี่ยงต่อการไปสัมผัสโรคเท่านั้น (ข้อ 1-3) ให้ 1 เข็ม แต่ถ้ามีความเสี่ยงเพราะม้ามไม่ทำงาน หรือขาดสารคอมพลีเม้นต์ให้ฉีด 2 เข็ม ห่างกัน 2 เดือน
- เด็กอายุ 11-18 ปีแข็งแรงดีที่จะไปเรียนในประเทศที่กำหนดให้ต้องฉีดให้ฉีด 1 เข็ม และซ้ำอีกครั้งเมื่ออายุ 16 ปี ถ้าฉีดเข็มแรกก่อนอายุ 16 ปี โดยต้องห่างจากเข็มแรก อย่างน้อย 2 เดือน
- การฉีดกระตุ้นซ้ำ ควรให้เมื่อยังมีความเสี่ยงโดยฉีด 5 ปี หลังเข็มสุดท้าย กรณีเป็นผู้มีภูมิคุ้มกันในการต้านทานเชื้อนี้บกพร่อง (ข้อ 4) ให้ฉีดทุก 5 ปี |
พิษสุนัขบ้า
(Rabies) |
- ทุกคนที่ถูกสัตว์กัด
- ผู้ที่มีโอกาสสัมผัสเชื้อพิษสุนัขบ้า เช่น สัตวแพทย์ ผู้ทำงานในห้องปฏิบัติการ หรือผู้เดินทางเข้าไปในถิ่นที่มีโรคพิษสุนัขบ้าชุกชุม |
- ฉีดก่อนสัมผัส วันที่ 0, 7, และ 21 (หรือวันที่ 28)
- ฉีดหลังสัมผัส ฉีดเข้ากล้ามวันที่ 0, 3, 7, 14, และ 30 (มีการฉีดหลังสัมผัสแบบเข้าใต้ผิวหนังดูรายละเอียดในเรื่องวัคซีนพิษสุนัขบ้า) |
หุ้น Cannabis เล่นตามนโยบายของแต่ประเทศมากกว่ากำไรหรือ Valuation
ระนอง งานอาบน้ำแร่ แลระนอง ประจำปี 2564 2-11 เมษายน 2564
ลานอเนกประสงค์เทศบาลเมืองระนอง อำเภอเมือง จังหวัดระนอง
งานอาบน้ำแร่ แลระนอง ประจำปี 2564
กิจกรรม ประกอบด้วย กิจกรรมด้านน้ำแร่ และสุขภาพดีด้วยแพทย์ทางเลือก กิจกรรมวิถึชุมชนชาวระนอง กิจกรรมของดีศรีท้องถิ่น และตลาดย้อนยุค กิจกรรมส่งเสริมด้านการท่องเที่ยว และแหล่งท่องเที่ยวทางธรรมชาติของจังหวัดระนอง กิจกรรม การประกวดธิดาน้ำแร่ระนอง ธิดาสองแผ่นดิน เทพธิดาระนอง กิจกรรมการประกวดขบวนรถสวยงามของดีแต่ละอำเภอ
ติดต่อสอบถาม : ททท.สำนักงานชุมพร
เบอร์โทร : 0 7750 2775-6
นครศรีธรรมราช - เดินทางได้ปกติ ยกเว้น กลุ่มผู้เสี่ยงสูง กักตัว 14 วัน LINK
8 เมย 2564
ให้บุคคลที่มาจากพื้นที่อื่นเดินทางได้ปกติ
รายงานตัวกับ อสม. หรือผู้นำชุมชน เพื่อให้ อสม. หรือเจ้าหน้าที่สาธารณสุขคัดกรอง หากพบบุคคลที่มีอาการเข้าข่าย เป็นผู้ติดเชื้อโควิท-19 ให้ส่งต่อโรงพยาบาลทันที และปฎิบัติตามมาตรการ D-M-H-T-T อย่างเคร่งครัด
ยกเว้น กลุ่มผู้ที่สัมผัสเสี่ยงสูง กลุ่มผู้ที่มีรายชื่อในไทม์ไลน์ และกลุ่มคลัสเตอร์ที่มีการระบาดโควิด-19 ให้รายงานตัวต่อเจ้าพนักงานควบคุมโรคเท่านั้น และต้องกักตัว 14 วัน
Call Center สสจ นครศรีธรรมราช
ทุกวัน (ไม่เว้นวันหยุดราชการ) เวลา 08.30 - 16.30 น.
062-2452378
082-4649679
082-4646025
จากเพจ
สสจ
รพ นครศรีธรรมราช เบอร์ โทร 075-340250
จังหวัดพระนครศรีอยุธยา พบผู้ติดเชื้อโควิดเพิ่ม 16 ราย ส่วนใหญ่เชื่อมโยง ผับ บาร์ LINK
จังหวัดพระนครศรีอยุธยา พบผู้ติดเชื้อโควิด-19 เพิ่ม 16 ราย สาธารณสุขเร่งตรวจคัดกรองผู้มีความเสี่ยง ควบคุมการแพร่ระบาด
วันที่ 11 เมษายน เวลา 13.00 น. นายภานุ แย้มศรี ผู้ว่าราชการจังหวัดพระนครศรีอยุธยา เปิดเผยถึงสถานการณ์การแพร่ระบาดของโรคไวรัสโควิด-19 ของจังหวัดพระนครศรีอยุธยา ซึ่งได้รับรายงานจาก นพ.พีระ อารีรัตน์ นายแพทย์สาธารณสุขจังหวัดพระนครศรีอยุธยา พบว่า มีจำนวนเพิ่มขึ้นอีก 16 ราย ขณะนี้ทางทีมสอบสวนโรคกำลังดำเนินการสอบสวนและทำไทมไลน์เพื่อเผยแพร่ โดยตลอดทั้งวันได้ดำเนินการตรวจคัดกรอง ผู้มีความเสี่ยงระดับต่าง ๆ ที่ใกล้ชิดกับผู้ป่วยในพื้นที่ต่าง ๆ ของจังหวัดพระนครศรีอยุธยา ขณะนี้กลุ่มของผู้ท่องเที่ยวที่มวกเหล็กมีจำนวนเพิ่มขึ้นอย่างต่อเนื่อง ซึ่งเป็นการนำเชื้อมาติดกันภายในครอบครัว ทางสาธารณสุขได้ส่งเจ้าหน้าที่ออกคัดกรอง คัดแยก พร้อมแนะนำวิธีปฏิบัติให้กับผู้สัมผัสใกล้ชิด และกักตัวผู้สัมผัสใกล้ชิดทั้งหมด เพื่อควบคุมไม่ให้เกิดการแพร่ระบาดในวงกว้าง ทั้งนี้จะดำเนินการตรวจคัดกรองอย่างต่อเนื่อง และจะทยอยแจ้งผลการตรวจให้ทราบเป็นระยะ พร้อมเน้นย้ำผู้เดินทางมาเที่ยวยังจังหวัดพระนครศรีอยุธยา ต้องปฏิบัติตามมาตรการ D-M-H-T-T-A อย่างเคร่งครัด นอกจากนี้ ทางจังหวัดได้แจ้งถึงผู้ที่เดินทางมาจากพื้นที่ ควบคุม เมื่อเข้าจุดตรวจของจังหวัด ขอความร่วมมือให้กรอกข้อมูลผ่าน QR Code แสดงบัตรประจำตัวประชาชนหรือบัตรแสดงตนอื่น ๆ ควบคู่กับเอกสารรับรองความจำเป็นที่ออกโดยพนักงานเจ้าหน้าที่ที่เกี่ยวข้องหรือเจ้าหน้าที่ฝ่ายปกครองในพื้นที่ควบคุมสูงสุดและเข้มงวดซึ่งเป็นจังหวัดต้นทางออกให้
รายงานผู้ติดเชื้อ 13 เมย 64
วันนี้มีผู้ติดเชื้อ 965 คน
มีผู้ติดเชื้อรักษาหาย 40 คน
ผู้ป่วยยังรักษาอยู่ 6,190 คน
ไม่มีผู้ป่วยติดเชื้อเสียชีวิต
โดยผู้ติดเชื้อวันนี้ 956 คนแยกเป็น
1.ผู้ติดเชื้อที่เดินทางกลับจากต่างประเทศเข้าState Quarantine 9 คน
2.ผู้ติดเชื้อภายในประเทศ จำนวน 956 คน
2.1ตรวจหาเชื้อเชิงรุก 302 คน
2.2ตรวจหาเชื้อโดยผู้ติดเชื้อเดินทางไปตรวจที่โรงพยาบาล 654 คน
3.รายละเอียด ผู้ติดเชื้อรายจังหวัดบางส่วน
3.1 กรุงเทพ 194 คน
3.2 เชียงใหม่ 251 คน
3.3 ชลบุรี 97 คน
3.4 สมุทรปราการ 49 คน
3.5 ประจวบคีรีขันธ์ 73 คน
3.6 สมุทรสาคร 34 คน
3.7 ภูเก็ต 8 คน
3.8 สระแก้ว 11 คน
3.9 นครราชสีมา 67 คน
3.10 ระยอง 25 คน
3.11 นครปฐม 10 คน
3.12 ปทุมธานี 21 คน
3.13 ขอนแก่น 12 คน
3.14 สงขลา 10 คน
3.15 ราชบุรี 12 คน
3.16 จันทบุรี 9 คน
3.1 7อุบลราชธานี 7 คน
3.18 ฉะเชิงเทรา 7 คน
Mix Jeeravat
Q ตรวจโควิดที่ไหนได้บ้าง?
12.แสดงสิทธิที่เกิดใหม่
ระบบแสดงสิทธิที่เกิดใหม่ทันที ที่เครือข่ายหน่วยบริการที่เลือกไว้ ระบวันที่ใช้สิทธิได้ เป็นต้นไป สามารถตรวจสอบสิทธิ เพื่อดูรายละเอียดสิทธิที่เกิดใหม่ได้
EP 2 ขั้นที่ 2 การฝึกกล้ามเนื้อขา
เริ่มต้นจากนั่งตัวตรง จากนั้นวางมือเยื้องไปด้านหลังเล็กน้อย
ยกขาขวาขึ้น พร้อมหายใจเข้าช้าๆ
จากนั้นลดขาลง พร้อมหายใจแบบเป่าปาก
ทำช้าๆ ในจังหวะที่รู้สึกสบาย
เปลี่ยนเป็นยกขาซ้ายขึ้น พร้อมหายใจเข้า
จากนั้นหายใจออกแบบเป่าปาก พร้อมลดระดับขาลง
ทำซ้ำประมาณ 10-20 ครั้ง
ประกันภัย แพ้วัคซีนโควิด-19 - เมืองไทยประกันภัย LINK
เมืองไทยประกันภัย เดินหน้าออก ‘ประกันภัยแพ้วัคซีนโควิด-19 แพ้ จ่าย จริง’
แบบเต็มตัวกับเบี้ยหลักสิบ คุ้มครองหลักล้าน
คุ้มครองทุกกลุ่มอาชีพ ทุกสัญชาติ ตั้งแต่อายุแรกเกิด – 99 ปี
จุดเด่นของแบบประกัน
- ประกันภัยแพ้วัคซีนโควิด-19 แพ้ จ่าย จริง กรณีได้รับผลกระทบ จากการฉีดวัคซีนป้องกันโควิด-19
- คุ้มครองกรณีได้รับผลกระทบจากการฉีดวัคซีนป้องกันโควิด-19 ทั้งกรณีแบบผู้ป่วยใน หรือผู้ป่วยนอก
- รับเงินชดเชยรายได้สุงสุดวันละ 1,000 บาทต่อวัน (สูงสุดไม่เกิน 15 วัน)
- เบี้ยประกันภัยเริ่มต้น เพียง 99 บาท/ปี
ความคุ้มครอง/ราคาเบี้ยประกัน/เงื่อนไขการรับประกันคำแนะนำสำหรับผู้ติดเชื้อเอชไอวี LINK
คำแนะนำการรับวัคซีนโควิด-19 สำหรับผู้ติดเชื้อเอชไอวี
โดยสมาคมโรคเอดส์แห่งประเทศไทย
ผู้ติดเชื้อเอซไอวีควรได้รับวัคซีนโควิด-19
วัคซีนป้องกันโควิด-19 ที่รุนแรงได้แม้ว่าไม่มีข้อมูลของประสิทธิภาพในผู้ติดเชื้อเอซไอวีมากพอ
การตอบสนองต่อวัคซีนแตกต่างกันขึ้นกับระดับซีดีสี่และปัจจัยทางสุขภาพของผู้รับวัคซีน
อาการข้างเคียงจากวัคซีนไม่แตกต่างจากประชากรกลุ่มอื่น
แนะนำให้ป้องกันด้วยวิธีอื่นร่วมด้วย เช่น ใส่หน้ากาก ล้างมือ และการเว้นระยะห่าง
แนะนำให้รักษาด้วยยาต้านเอซไอวีอย่างต่อเนื่อง
กรณีมีโรคติดเชื้อฉวยโอกาสรุนแรงอยู่ควรรักษาจนอาการคงที่ก่อน
*ข้อมูลเรื่องประสิทธิภาพและความปลอดภัยของวัคซีนโควิด-19 ในผู้ติดเชื้อเอชไอวียังมีข้อจำกัด คำแนะนำนี้เป็นเพียงความเห็นของผู้เชี่ยวชาญ ผู้ติดเชื้อเอชไอวีควรปรึกษาแพทย์ก่อนตัดสินใจรับวัคซีน
Avarin ลดเพิ่มเลย 100 บาท LINK
Avarin Running and Triathlon
Avarin เชิญชวนให้นักวิ่ง ฉีดวัคซีนนะครับ
ฉีดแล้ว Avarin แจกรางวัล
ทั้งลด ทั้งแจก
1 ใครฉีดวัดซีน ลดเพิ่มเลย 100 บาท ทันที
2 แจกรางวัลแบบสุ่มทุกวัน ไปยาวๆ
3 รางวัลใหญ่ 1 รางวัล นาฬิกาออกกำลัง
สุ่มผู้โชคดี ปลายเดือน มิถุนายน จาก ใต้ post
เขตสุขภาพที่ 12 ภาคใต้ตะวันออกและตอนล่าง
สำนักงานป้องกันควบคุมโรคที่ 12 จังหวัดสงขลา
-เบอร์โทรศัพท์: 074 336 080
-เว็บไซต์:https://ddc.moph.go.th/odpc12/
พัทลุง
- สำนักงานสาธารณสุขจังหวัดพัทลุง
เบอร์โทรศัพท์: 074 613 127
เว็บไซต์: http://www2.ptho.moph.go.th/
สงขลา
- สำนักงานสาธารณสุขจังหวัดสงขลา
เบอร์โทรศัพท์ 074 326 091 - 93
เว็บไซต์ https://www.skho.moph.go.th/intro.php
- โรงพยาบาลสงขลา
เบอร์โทรศัพท์ 074 338 100
เว็บไซต์ https://www.skhospital.go.th/
ตรัง
- สำนักงานสาธารณสุขจังหวัดตรัง
เบอร์โทรศัพท์: 075 205 615 - 22
เว็บไซต์: http://www.tro.moph.go.th/
สตูล
- สำนักงานสาธารณสุขจังหวัดสตูล
เบอร์โทรศัพท์: 074 711 071
เว็บไซต์: http://ssj.stno.moph.go.th/wordpress/
นราธิวาส
- สำนักงานสาธารณสุขจังหวัดนราธิวาส
เบอร์โทรศัพท์: 073 532 056-65
เว็บไซต์: http://www.ntwo.moph.go.th/blog/
ปัตตานี
- สำนักงานสาธารณสุขจังหวัดปัตตานี
เบอร์โทรศัพท์: 073 460 234, 073 460 305
เว็บไซต์: https://www.ptn.moph.go.th/ptn/
ยะลา
- สำนักงานสาธารณสุขจังหวัดยะลา
เบอร์โทรศัพท์: 073 212 008
เว็บไซต์: https://www.ylo.moph.go.th/
- โรงพยาบาลยะลา
เบอร์โทรศัพท์ 073-244 711-8
เว็บไซต์ http://118.174.45.27/yrhweb/รพ.สามโคก เปิด walk in วันที่ฉีด 22-26 พ.ย. วันละ 300 คิว LINK
โรงพยาบาลสามโคก เปิด walk in บริการฉีดวัคซีนเข็ม 1 สูตรซิโนแวค เข็ม 2 แอสตร้าฯ สำหรับผู้ที่อายุ 18 ปีขึ้นไป ที่ยังไม่ได้รับวัคซีนใดๆ ทุกกลุ่มอายุ (หญิงตั้งครรภ์ 7 กลุ่มโรค ผู้สูงอายุ ต่างด้าว) สำหรับต่างด้าว เตรียมสำเนาบัตรชมพู/พาสปอร์ต มาด้วย
วันที่ฉีด 22-26 พ.ย. เวลา 8-11 น. จำกัดวันละ 300 คิว หรือจนกว่าคิวจะหมด
กรณีมาเป็นหมู่คณะเกิน 20 ท่าน ติดต่อล่วงหน้าเพื่อทำรายการนัด ณ จุดบริการวัคซีน
หลายคนอาจสงสัยว่า จีโนม, ยีน, ดีเอ็นเอ, อาร์เอ็นเอ คืออะไร และอยู่ตรงส่วนไหนของไวรัส
"จีโนม" จะประกอบด้วยสารพันธุกรรมดีเอ็นเอ หรืออาร์เอ็นเอ
เรียงสลับกันไปมาเป็นชุดคำสั่งทางพันธุกรรม พบในอนุภาคไวรัสหรือในเซลล์มนุษย์ จีโนมมนุษย์ประกอบด้วยโครโมโซม 22 คู่ + X และ Y ที่พบในนิวเคลียส แต่ละชุดประกอบด้วยลำดับดีเอ็นเอประมาณ 3.1 พันล้านเบส
ส่วนขนาดของจีโนมไวรัสโคโรนา 2019 จะมีขนาดสั้นกว่าจีโนมมนุษย์ "แสนเท่า" ประกอบด้วยอาร์เอ็นเอเรียงสลับกันไปมา 30,000 เบส คล้ายสายลูกปัด 4 สีเรียงสลับกัน 30,000 ลูก
"ดีเอนเอ" เป็นองค์ประกอบสำคัญของจีโนม คือกลุ่มของโมเลกุลที่มีหน้าที่ในการขนถ่ายและถ่ายทอดสารพันธุกรรมหรือคำสั่งทางพันธุกรรมจากพ่อแม่สู่ลูก เประกอบด้วยสารเคมี 4 ประเภท เรียงสลับกันไปมาคล้ายสายลูกปัด คือ อะดีนีน (A), ไทมีน (T), กวานีน (G) และไซโตซีน (C) โดยพันกันอยู่สองสาย (double helix)
"อาร์เอ็นเอ" มีโครงสร้างและคุณสมบัติคล้ายคลึงกับดีเอ็นเอ แต่มีเบสเรียงต่อกันเพียงสายเดียวและแทนที่จะเป็นเบสไทมีน (T) อาร์เอ็นเอ มีเบสที่เรียกว่ายูราซิล (U)
คีร่า ไนท์ลี และครอบครัว
29 พฤศจิกายน เธอและครอบครัวทั้งสามี เจมส์ ไรท์ตัน และลูกสาวเอดี้ 6 ขวบ และดีไลล่าห์ 2 ขวบ ตรวจพบว่าติดเชื้อโควิดกันทุกคน แต่ลูกสาวทั้งฟื้นตัวอย่างรวดเร็ว และทุกคนไม่มีอาการผิดปกติใดๆ
ข้อมูลและภาพ จาก วารสารอุตสาหกรรมอาหาร ฉบับมีนาคม-เมษายน 2564
Cover Story โดย เรไร จันทร์เอี่ยม
วิสาหกิจชุมชนเกาะเต่า ตัวแทนจากใต้
วิสาหกิจชุมชนเกาะเต่า ตัวแทนจากใต้ โดย โกดำ เกาะเต่า คนดังแห่งสายเขียว มีเครื่องดื่มชากัญชา และกระท่อมคึกคักมาให้ลงกัน
ไทม์ไลน์ ผู้ป่วยรายที่ 10064 เพศหญิง อายุ 47 ปี
22 ธันวาคม 64 ศูนย์อำนวยการต้านโควิด-19 จังหวัดกาฬสินธุ์ เปิดเผย TIMELINE ผู้ติดเชื้อโควิด-19 รายที่ 10064
เพศหญิง อายุ 47 ปี สัญชาติ ไทย ภูมิลำเนาตำบลกาฬสินธุ์ อำเภอเมืองกาฬสินธุ์ จังหวัดกาฬสินธุ์ อาชีพรับจ้าง ที่เมืองบรัสเซลส์ ประเทศเบลเยี่ยม ไม่มีโรคประจำตัว มีประวัติได้รับวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 จำนวน 2 เข็ม โดยเข็มที่ 1 วัคซีน Pfizer รับการฉีดวัคชีนวันที่ 7 มิถุนายน 2564 และเข็มที่ 2 Pfizer รับการฉีดวัคซีนวันที่ 10 กรกฎาคม 2564 ที่เมืองบรัสเซลส์ ประเทศเบลเยี่ยม
ขั้น 3: รับ QR CODE ทางอีเมล
- เมื่อการลงทะเบียนของท่านได้รับการอนุมัติแล้ว ระบบ Thailand Pass จะส่ง QR Code ให้ท่านทางอีเมล
- กรุณาพิมพ์ หรือบันทึก QR Code ดังกล่าวไว้บนโทรศัพท์มือถือ เพื่อแสดงต่อเจ้าหน้าที่สายการบินก่อนขึ้นเครื่อง และต่อเจ้าหน้าที่ ตม. เมื่อเดินทางถึงไทย
เกษมราษฎร์รามคำแหง LINK
“ซินเจียยู่อี่ ซินนี้ฮวดไช้” ต้อนรับเทศกาลตรุษจีน ชวนคุณมาตรวจสุขภาพ
- โปรแกรม 1 ตรวจ 13 รายการ ราคา 1,599 บาท
- โปรแกรม 2 ตรวจ 17 รายการ ราคา 3,399 บาท
ราคานี้รวมค่าแพทย์และค่าบริการโรงพยาบาลแล้ว
ระยะเวลา : ตั้งแต่วันนี้ - 28 กุมภาพันธ์ 2565
สอบถามข้อมูลเพิ่มเติม ได้ที่ ศูนย์ตรวจสุขภาพ ชั้น 2
โทร. 02-339-0000 ต่อ 2016-2018
บริจาคโลหิตกับกลุ่มเซ็นทรัล ห้างในพื้นที่ภาคกลาง 5 จุด
โรงพยาบาลนายแพทย์หาญ ต้องการรับสมัครบุคลากร LINK
รับสมัครด่วน โรงพยาบาลนายแพทย์หาญ เป็นโรงพยาบาลเอกชนแห่งแรก และแห่งเดียวในจังหวัดยโสธร ต้องการรับสมัครบุคลากร ที่มีความรู้ความสามารถมาร่วมงาน
กับทางโรงพยาบาล
ผู้จัดการฝ่ายจัดซื้อ 1 ตำแหน่ง
ล่ามกัมพูชา 1 ตำแหน่ง
ผู้สนใจสมัครงานด้วยตนเอง/จดหมายสมัครงาน
* เปิดรับสมัครตั้งแต่ 19 กุมภาพันธ์ 2565 เป็นต้นไป ติดต่อทรัพยากรบุคคล โรงพยาบาลนายแพทย์หาญ ถ.วิทยะธำรงค์ ต.ในเมือง อ.เมือง จ.ยโสธร 35000 โทรสายตรง 045-713032 โทร. 045-711356 ต่อ 111 อีเมล : hrd@drhann.com
แพ็กเกจคลอดบุตรโรงพยาบาลบางปะกอก 3 ปรับราคาลดค่าใช้จ่ายในช่วงวิกฤตโควิด-19 LINK
แพ็กเกจคลอดบุตรโรงพยาบาลบางปะกอก 3 : 2565 ปรับราคาให้เบา ๆ เพื่อให้คุณสบายกระเป๋า ลดค่าใช้จ่ายในช่วงวิกฤตโควิด-19
มีสิทธิประกันสังคมกับรพ. คลอดธรรมชาติ 13,000 ผ่าคลอด 30,000 ผ่าคลอด+ทำหมัน ฟรี 30,000
ราคาแพ็กเกจนี้ เริ่มต้นตั้งแต่วันนี้ (18 ก.พ.) – 30 มิถุนายน 2565 เท่านั้น ติดต่อสอบถามเพิ่มเติม โทร. 0-2109-3111 ต่อ 1124 แผนกกุมารเวชกรรม เวลาทำการ : ทุกวัน 08.00 – 20. 00 น.
โรงพยาบาลมิตรประชา เปิดรับลงทะเบียนฉีดวัคซีนโควิดเข็มกระตุ้น 3,4,5 (Pfizer) LINK
ขณะนี้ รพ. มิตรประชา เปิดรับลงทะเบียนนัดฉีดวัคซีน เข็มกระตุ้น 3,4,5 (Pfizer) สำหรับประชาชนทั่วไป ซึ่งจัดสรรโดยทางภาครัฐฯ โดยมีกำหนดการฉีดวันที่ 29-31 มีนาคม 2565 ท่านสามารถลงทะเบียนเลือกวันฉีดด้วยตัวท่านเอง ตั้งเเต่ วันที่ 25 มี.ค 65 เวลา 9.30 น.เป็นต้นไปจนกว่าจะเต็ม
ผู้ที่ลงทะเบียนรับวัคซีนเข็มกระตุ้น เข็มกระตุ้น 3,4,5 (Pfizer) ผ่านเเล้ว สามารถมาตามนัด เพื่อรับวัคซีนได้ตั้งเเต่ เวลา 9.00-15.00น. **กรุณาเลือกวันฉีดให้แน่นอน ในกรณีที่มีการลงทะเบียนเลือกวันเรียบร้อยแล้วจะไม่สามารถเปลี่ยนแปลงได้ในทุกกรณี ยกเว้นเสียแต่จะทำการสละสิทธิ์ ** สอบถามเพิ่มเติมโทร 02-4555599 ต่อ 6010 หรือ ได้ทาง inbox เพจfacebookรพ.มิตรประชา
ล่องซับบอร์ด ท่องเที่ยวเชิงนิเวศ คลองบางกะจะ เมืองจันทบุรี LINK
การรวมตัวของคนในชุมชนเล็กๆแห่งตำบลบางกะจะ จังหวัดจันทบุรี ในนาม "SUPscribe Chanthaburi” ที่ออกไปสำรวจเส้นทางการท่องเที่ยวเชิงนิเวศ สัมผัสธรรมชาติและสายน้ำในท้องถิ่นด้วย “ซับบอร์ด” (Stand up Paddle board) ไปพร้อมๆกับการสร้างแนวคิดเรื่องการอนุรักษ์แก่ผู้มาเยือน มาทำความรู้จักและค้นหาเสน่ห์ของการท่องเที่ยว “คลองบางกะจะ” ไปด้วยกัน SUPscribe Chanthaburi ตั้งอยู่ที่ ต.บางกะจะ อ.เมือง จ.จันทบุรี - ข้อมูล-ภาพจาก
Travel360 เที่ยวรอบทิศอย.ทลายแหล่งผลิตน้ำสมุนไพร ผสมสเตียรอยด์ จ.ขอนแก่น LINK
24 มีนาคม 2565 สำนักงานคณะกรรมการอาหารและยา ร่วมกับกองบัญชาการตำรวจสอบสวนกลาง ร่วมกันแถลงผลการปฏิบัติงานกรณีทลายแหล่งผลิตน้ำสมุนไพร ผสมสเตียรอยด์ โดยตรวจยึดของกลาง 61 รายการ มูลค่ากว่า 10 ล้านบาท เบื้องต้นการกระทำดังกล่าวเป็นความผิดดังนี้
พ.ร.บ.ผลิตภัณฑ์สมุนไพร พ.ศ.2562
- ผลิต ขาย ผลิตภัณฑ์สมุนไพรปลอม อันเป็นความผิดตามมาตรา 58 (1) ประกอบมาตรา 59 (3) ผลิตภัณฑ์สมุนไพรที่แสดงที่ตั้งสถานที่ผลิตซึ่งไม่ใช่ความจริง และมาตรา 59 (5) ผลิตภัณฑ์สมุนไพรที่แสดงว่าเป็นผลิตภัณฑ์สมุนไพรตามตำรับที่ขึ้นทะเบียน แจ้งรายละเอียด หรือจดแจ้งไว้ซึ่งไม่ใช่ความจริง โทษสูงสุดตามมาตรา 101 ระวางโทษจำคุกไม่เกิน 10 ปี และปรับไม่เกิน 1 ล้านบาท
- ผลิต ขายผลิตภัณฑ์สมุนไพรที่ไม่ได้ขึ้นทะเบียนตำรับ เป็นความผิดตามมาตรา 58(4) โทษสูงสุดตามมาตรา 106 โทษจำคุกไม่เกิน 1 ปี หรือปรับไม่เกิน 1 แสนบาท หรือทั้งจำทั้งปรับ
พ.ร.บ.อาหาร พ.ศ. 2522
- แสดงฉลากเพื่อลวงอาหารปลอมตามมาตรา 27 (4) ฝ่าฝืนมาตรา 25 (2) โทษตามมาตรา มาตรา 59 ต้องระวางโทษจําคุกตั้งแต่ 6 เดือนถึง 10 ปีและปรับตั้งแต่ 5,000 บาทถึง 100,000 บาท
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ บริการโควิด RT-PCR ราคา 2,700 บาท
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ พร้อมให้บริการตรวจคัดกรองการติดเชื้อโควิด-19 ด้วยวิธี RT-PCR ราคา 2,700 บาท ตรวจเเบบ DRIVE THRU สะดวก รวดเร็ว ทราบผล ภายใน 24-48 ชั่วโมง ผ่าน SMS หรือ PRINC Health Application ให้บริการระหว่างเวลา 8.00 ถึง 17.00น. (หรือจนกว่าจะเต็ม)
หมายเหตุ : * ราคาดังกล่าวไม่รวมค่าแพทย์ ค่าใบรับรองแพทย์ และใบรับรองการเดินทาง (Fit to Fly) ติดต่อสอบถามเกี่ยวกับการรักษาหรือทำการนัดหมาย Call center 02 080 5999
เพชรเวช มี Hospitel รองรับผู้ติดเชื้อสัญชาติไทย ไม่มีค่าใช้จ่าย โทร 1390
โรงพยาบาลเพชรเวช มี Hospitel รองรับการรักษาสําหรับผู้ติดเชื้อโควิด -19 สัญชาติไทย ไม่มีค่าใช้จ่าย โทร 1390
ความสะดวกสําหรับผู้ป่วยโควิด-19 ที่หาเตียง Hospitel เข้าถึงการรักษาได้ทันเวลา มีทีมแพทย์ และพยาบาลให้การดูแลตลอด 24 ชั่วโมง สําหรับติดตามอาการเปลี่ยน และจ่ายยาได้อย่างรวดเร็ว หากผู้ป่วยมีอาการเปลี่ยนแปลง ทางรพ.จะย้ายผู้ป่วยกลับมายังรพ.เพชรเวชทันที
ขั้นตอนเข้ารักษาที่ Hospitel โรงพยาบาลเพชรเวช
1. กรณีท่านมี Antigen Test (ATK) 2 ขีด แนะนำให้มาติดต่อเพื่อยืนยันผลตรวจ ATK กับทางโรงพยาบาลเพชรเวช
2. สำหรับท่านที่มีผลตรวจ RT-PCR หรือ ATK ในรูปแบบเอกสารยืนยันจากทางห้องปฎิบัติการ (Lab) หรือ โรงพยาบาลอื่นๆ ไม่เกิน 3 วัน นับจากวันที่ตรวจ
3.ติดต่อที่อาคาร C บริเวณทางออกโรงพยาบาลเพชรเวช เต็นท์ที่ 2 สีขาว เวลา 07.30 - 09.00 น. เพื่อรับบัตรคิวเข้ารักษา
Ep.2.3 “ภารกิจของรัฐ Public Task” LINK
กรณีเป็นการเก็บรวบรวม ใช้ หรือเปิดเผย
ข้อมูลส่วนบุคคลที่ “จำเป็น” ต่อการดำเนินภารกิจของรัฐ
เพื่อประโยชน์สาธารณะ โดยมีกฎหมายกำหนดหรือ
ให้อำนาจไว้เฉพาะเจาะจง
ผู้ควบคุมข้อมูลส่วนบุคคลในกรณีนี้จึงเป็น
องค์กรของรัฐหรือหน่วยงานที่ใช้อำนาจรัฐ
การประมวลผลข้อมูลนั้นจึงไม่ต้องขอความยินยอม
(มาตรา 24(4))
เช่น การเก็บรวบรวมข้อมูลของสำนักงานสถิติแห่งชาติ
ทั้งนี้การประมวลผลข้อมูลส่วนบุคคลตามหลักการนี้
ยังคงต้องคำนึงถึงความจำเป็น หลักความโปร่งใส
และหลักการความปลอดภัยของข้อมูล
ผู้ควบคุมข้อมูลส่วนบุคคลยังคงมีหน้าที่
ในการรักษาความปลอดภัยของข้อมูลส่วนบุคคลนั้น
คลินิกตรวจการนอนหลับ โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี LINK
คลินิกตรวจการนอนหลับ โรงพยาบาลมหาวิทยาลัยเทคโนโลยีสุรนารี การตรวจคุณภาพการนอนหลับเป็นการตรวจสุขภาพที่สำคัญ เพื่อวิเคราะห์การทำงานของระบบต่าง ๆ ของร่างกายที่เกิดขึ้นระหว่างการนอนหลับ เช่น ระบบการหายใจ ระดับออกซิเจนในเลือด การทำงานของคลื่นไฟฟ้าสมอง คลื่นไฟฟ้าหัวใจ รวมถึงศึกษาพฤติกรรมบางอย่างที่เกิดขึ้นขณะหลับด้วย ปัจจุบันจัดว่าเป็นการตรวจสุขภาพมาตรฐานสากล (gold standard) เพื่อช่วยในการวินิจฉัยโรคต่างๆที่เกี่ยวข้องกับการนอนหลับ โดยเฉพาะอย่างยิ่งโรคที่พบบ่อยๆ เช่น ภาวะอุดกั้นทางเดินหานใจขณะหลับ เป็นต้น แพทย์จะประมวลประวัติ ผลการตรวจร่างกายทางหู คอจมูก และตรวจร่างกายโดยรวม หากมีข้อบ่งชี้แพทย์พิจารณาส่งตรวจการนอนหลับ หรือ Sleep Test (Polysomnography) เพื่อหาระดับความรุนแรงและอาการของโรค จากระดับความลึกของการนอนหลับโดยเฉพาะในกรณีที่สงสัยว่ามีภาวะการณ์หยุดหายใจร่วมด้วย ว่าสมองมีการขาดออกซิเจนมากน้อยเพียงใด ซึ่งในขณะนอนหลับจะมีการบันทึกข้อมูลนี้อย่างละเอียดเพื่อแพทย์จะทำการวิเคราะห์ผลและแนะนำวิธีการรักษาเป็นลำดับต่อไป
เวลาทำการ
อังคาร เวลา 13.00 – 16.00 น.
ศุกร์ เวลา 17.00 – 20.00 น.
โทร. 044-376555
นำร่องผ้าอนามัยฟรี [เศรษฐกิจดีสุขภาพดี]
ประโยชน์คนกรุงฯ
- ลดภาระผู้ปกครองและนักเรียนโรงเรียนสังกัด กทม.
- แก้ปัญหาความจนประจำเดือน (Period Poverty) ที่ส่งผลกระทบต่อชีวิตประจำวันและสุขอนามัยของผู้มีประจำเดือน
รายละเอียด
ผ้าอนามัยคือปัจจัยพื้นฐานที่จำเป็นสำหรับผู้มีประจำเดือนทุกคน ในแต่ละเดือนผู้มีประจำเดือนมีค่าใช้จ่ายในการซื้อผ้าอนามัยอยู่ที่ราว 80-150 บาทต่อเดือน หรือคิดเป็นจำนวนผ้าอนามัยประมาณ 20 แผ่นต่อเดือน ภาระในการจัดหาผ้าอนามัยจำนวนนี้อาจส่งผลให้เกิดปัญหาที่เรียกว่า ความจนประจำเดือน หรือ Period Poverty ขึ้นได้
Period poverty หมายถึง ความไม่สามารถในการเข้าถึงผ้าอนามัย เช่น ไม่สามารถซื้อได้ เข้าถึงได้แต่ไม่เพียงพอ ไปจนถึงการใช้งานอย่างไม่เหมาะสม เช่น เปลี่ยนผ้าอนามัยน้อยครั้ง หรือใช้วัสดุอื่นที่ไม่เหมาะสมแทน จึงอาจเสี่ยงติดเชื้อและมีปัญหาสุขภาพอื่น ๆ ตามมาได้
นอกจากนี้การศึกษาในต่างประเทศเกี่ยวกับ period poverty หลายชิ้นสะท้อนว่า การขาดแคลนผ้าอนามัยส่งผลต่อการขาดเรียนหรือขาดงานด้วย ด้านผลการสำรวจของ BMC Women’s Health ที่ทำการศึกษากับกลุ่มนักศึกษามหาวิทยาลัยในสหรัฐอเมริกา พบว่า ผู้ที่ประสบปัญหา period poverty มีแนวโน้มที่จะมีภาวะซึมเศร้าระดับปานกลางจนถึงรุนแรงมากกว่ากลุ่มที่ไม่เคยประสบปัญหาเลย
เพื่อแบ่งเบาภาระของผู้มีประจำเดือนและครอบครัวและลดความเสี่ยงของปัญหาอื่น ๆ ที่อาจตามมา กทม. จะนำร่องจัดหาผ้าอนามัยให้กับนักเรียนในโรงเรียนสังกัดกทม.
โดยจะจัดจุดจัดวางในห้องน้ำของโรงเรียนหรือไว้ที่ห้องพยาบาลเพื่อให้เข้าถึงได้สะดวกและสอดคล้องกับความจำเป็น โดยจะประเมินประสิทธิภาพถึงวิธีการแจกและตัวเลือกผ้าอนามัยที่ตอบสนองต่อผู้ใช้งาน ก่อนจะพิจารณาขยายผลให้ครอบคลุมทุกกลุ่มผู้มีประจำเดือนต่อไป
เขตสุขภาพที่ 13 กรุงเทพ
กรุงเทพ
- รพ.การแพทย์แผนไทยและการแพทย์ผสมผสาน รพ.สังกัดกรม 02-2243261 จันทร์และพุธ 08.30 – 12.00 น.
- รพ.การแพทย์แผนไทยและการแพทย์ผสมผสาน สาขาศูนย์ราชการ แจ้งวัฒนะ รพ.สังกัดกรม 02-1437759 จ. และ พฤ. 08.30 - 16.30 น.
- รพ.ราชวิถี รพ.สังกัดกรม 0 2354 8108 ต่อ 2239 รอยืนยัน
- สถาบันกัลยาณ์ราชนครินทร์ รพ.สังกัดกรม 024-416-100 จันทร์ถึงศุกร์ 9.00-12.00 น.
- สถาบันมะเร็งแห่งชาติ รพ.สังกัดกรม 02-2026800, 02-2026888 รอยืนยัน
นานาทัศนะ
ดร.ชาลี อัศวธีระธรรม รองผู้จัดการใหญ่อาวุโส ประธานเจ้าหน้าที่บริหาร กลุ่มงาน Digital Banking ธนาคารไทยพาณิชย์ (SCB DBANK) กล่าวว่า "เอสซีบี ดีแบงก์ (SCB DBANK) มุ่งสร้างระบบนิเวศด้านดิจิทัลไลฟ์สไตล์ (Digital Lifestyle Ecosystem) ที่มีข้อมูลเป็นหัวใจสำคัญในการเข้าใจลูกค้าและขับเคลื่อนธุรกิจ โดยมีเป้าหมายในการพัฒนาต่อยอดผลิตภัณฑ์ และโซลูชันทางการเงินอย่างครบวงจรที่จะช่วยยกระดับประสบการณ์ทางการเงินรูปแบบใหม่ให้กับลูกค้าในทุกมิติ ซึ่งหนึ่งในระบบนิเวศที่เราให้ความสำคัญคือ เฮลธ์เทค (Health Tech) จึงได้ร่วมกับ "มหาวิทยาลัยมหิดล" ที่มีความเชี่ยวชาญด้านวิทยาศาสตร์การกีฬา และองค์ความรู้ด้านโภชนาการ และ "กู๊ด ดอกเตอร์ เทคโนโลยี ประเทศไทย" ผู้ให้บริการด้านการดูแลสุขภาพด้วยเทคโนโลยีดิจิทัลชั้นนำระดับภูมิภาค และเชี่ยวชาญในการให้บริการแพทย์ทางไกล (Telemedicine) มาร่วมกันพัฒนา "SPRING UP" (สปริงอัพ) ดิจิทัลแพลตฟอร์มด้านสุขภาพครบวงจร ครอบคลุม 3 ด้านหลัก ได้แก่ Food, Fitness และ Telemedicine โดยเราหวังเป็นอย่างยิ่งว่าแพลตฟอร์ม "SPRING UP" จะได้รับการตอบรับจากกลุ่มผู้รักสุขภาพเป็นอย่างดี สามารถช่วยให้คนไทยเข้าถึงการดูแลสุขภาพเพื่อคุณภาพชีวิตที่ดียิ่งขึ้น โดยมีดิจิทัลเทคโนโลยีเป็นตัวขับเคลื่อนสำคัญ ทั้งนี้ คาดว่าภายในสิ้นปี 2565 จะมียอดดาวน์โหลดแอปฯ เพื่อใช้งานกว่า 2 ล้านราย"
นายแพทย์บรรจง มไหสวริยะ อธิการบดีมหาวิทยาลัยมหิดล กล่าวว่า "เทคโนโลยีเข้ามาเปลี่ยนแปลงการใช้ชีวิตของทุกคนรวมถึงวิธีการดูแลสุขภาพของคนในยุคปัจจุบันด้วย มหาวิทยาลัยมหิดล มีความเชี่ยวชาญทางด้านการดูแลสุขภาพ เราได้นำเอาองค์ความรู้ตลอดจนความเชี่ยวชาญด้านโภชนาการ และการออกกำลังกายที่ถูกต้องตามตามหลักวิทยาศาสตร์การกีฬา มาช่วยต่อยอด และพัฒนาฟีเจอร์ FOOD เรื่องแนะนำและแจ้งข้อมูลโภชนาการสำหรับคุณ พร้อมถ่ายรูปบันทึกการกินและคำนวณโภชนาการอัตโนมัติ ด้วยเมนูอาหารไทย และนานาชาติมากกว่า 5,000 เมนู พร้อมทั้งให้ข้อมูลโภชนาการเชิงลึก เพื่อที่จะได้วางแผนการรับประทานได้ถูกต้อง ฟีเจอร์ FITNESS การออกแบบการออกกำลังกายอย่างเหมาะสม พร้อมทั้งโปรแกรมสาธิตการออกกำลังกายกว่า 200 คลิป ให้บรรลุเป้าหมายการออกกำลังกายได้ง่ายขึ้น โดยผู้เชี่ยวชาญจากมหาวิทยาลัยมหิดล โดยเรามุ่งหวังให้คนไทยทุกคนมีสุขภาพที่ดี และเข้าถึงการดูแลสุขภาพได้อย่างครบวงจร"
นายแพทย์สุทธิชัย โชคกิจชัย หัวหน้าฝ่ายการแพทย์ บริษัท กู๊ด ดอกเตอร์ เทคโนโลยี ประเทศไทย (Good Doctor Technology Thailand: GDTT) กล่าวว่า "เรามีความยินดีเป็นอย่างยิ่งที่ได้ร่วมมือกับพันธมิตรอย่าง "เอสซีบี ดีแบงก์" ที่มีวิสัยทัศน์ตรงกันในการนำเอาเทคโนโลยีมาใช้ให้เกิดประโยชน์ และลดช่องว่างในการเข้าถึงบริการด้านสุขภาพขั้นพื้นฐาน เพื่อให้บริการด้านสุขภาพแก่คนไทยได้อย่างทั่วถึง โดยความร่วมมือในครั้งนี้ เราได้เข้ามาให้บริการฟีเจอร์ Telemedicine ซึ่งเป็นหนึ่งในฟีเจอร์สำคัญบน "SPRING UP" ดิจิทัลแพลตฟอร์มด้านสุขภาพแบบครบวงจร ซึ่งฟีเจอร์นี้จะช่วยให้หลายคนสามารถดูแลสุขภาพและความเป็นอยู่ของพวกเขาได้ดีกว่าเคยและมีประสิทธิภาพมากยิ่งขึ้น โดยไม่จำเป็นต้องพูดคุย หรือปรึกษาแพทย์เมื่อเวลาเจ็บป่วยแล้วเท่านั้น การผสมผสานบริการปรึกษาแพทย์ออนไลน์ผ่านระบบแชทแบบไม่จำกัด โดย "SPRING UP" จะช่วยให้ผู้ใช้งานทุกคนสามารถหาแนวทางป้องกันในการจัดการสุขภาพโดยรวมของพวกเขาเมื่อเจ็บป่วยหรือมีปัญหาสุขภาพภายใต้มาตรฐานการดูแลผ่านดิจิทัลแพลตฟอร์มที่มีประสิทธิภาพ ซึ่งเราได้สร้างความมั่นใจว่าแอปพลิเคชันจะสามารถบรรลุเป้าหมายนั้นได้ และช่วยให้สามารถจัดส่งยาตามใบสั่งแพทย์ไปยังผู้ป่วยได้อย่างรวดเร็ว ปลอดภัย อีกด้วย"
CCH EASY แอพให้บริการ แก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลมะเร็งชลบุรี LINK
CCH EASY เป็นแอพพลิเคชั่นที่นำเสนอประสบการณ์ที่ดีในการให้บริการแก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลมะเร็งชลบุรี ซึ่งจะสามารถเรียกดูข้อมูลทั่วไป ข้อมูลสิทธิในการรับบริการ ข้อมูลการนัดหมาย คิวการรับบริการ ผลการตรวจ ประวัติการใช้ยา และประวัติการรักษา ผ่านทางโทรศัพท์มือถือ หรืออุปกรณ์พกพาต่างๆ เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัย และสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับผู้ที่มารับบริการที่โรงพยาบาลมะเร็งชลบุรี เป็นแอพพลิเคชั่นที่นำเสนอประสบการณ์ที่ดีในการให้บริการแก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลมะเร็งชลบุรี ซึ่งจะสามารถเรียกดูข้อมูลทั่วไป ข้อมูลสิทธิในการรับบริการ ข้อมูลการนัดหมาย คิวการรับบริการ ผลการตรวจ ประวัติการใช้ยา และประวัติการรักษา ผ่านทางโทรศัพท์มือถือ หรืออุปกรณ์พกพาต่างๆ เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัย และสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับผู้ที่มารับบริการที่โรงพยาบาลมะเร็งชลบุรี
ดาวน์โหลดได้ทั้ง
iOS และ
Android googleสถานกงสุลใหญ่ ณ นครโฮจิมินห์ คำเตือน
สถานกงสุลใหญ่ ณ นครโฮจิมินห์ แจ้งเตือนคนไทย ห้ามนำกัญชา กัญชง หรือ ผลิตภัณฑ์ที่มีส่วนประกอบของกัญชา กัญชง เข้ามาในเวียดนาม หากตรวจพบการกระทำผิดกฏหมาย จะมีโทษปรับเป็นเงิน 5 ล้าน - 500 ล้าน เวียดนามด่ง และจำคุกตลอดชีวิต หรือโทษสูงสุดประหารชีวิต
เขตบางนา ตรวจสถานบันเทิง กำชับสถานประกอบการให้ปฏิบัติตามมาตรการความปลอดภัย LINK
6 ส.ค. 65 เวลา 18.30 น. นางสาวโศรยา วัธชนะ ผู้อำนวยการเขตบางนา พร้อมด้วยคณะผู้บริหารเขต และเจ้าหน้าที่ที่เกี่ยวข้อง ร่วมกับสถานีตำรวจนครบาลบางนา สถานีดับเพลิงพระโขนง ย่อยบางนา และทหาร ม.พัน 1 รอ. ดำเนินการตรวจสอบสถานบันเทิงในพื้นที่เขตบางนา ได้กำชับสถานประกอบการให้ปฏิบัติตามมาตรการความปลอดภัยเพื่อป้องกันเหตุอัคคีภัย โดยเฉพาะทางหนีไฟ ถังดับเพลิงให้พร้อมใช้งาน และให้ปฏิบัติตามมาตรการการป้องกันควบคุมโรคโควิด-19 อย่างเคร่งครัด
เปิดให้บริการแล้ว ชบา-ลานนา Chaba-Lanna Hotel Isolation LINK
เปิดให้บริการแล้ว ชบา-ลานนา Chaba-Lanna Hotel Isolation
รับดูแล ผู้ติดเชื้อโควิด19 สิทธิประกันสังคม เพื่อการกักตัว สีเขียว ไม่มีอาการ แต่ไม่สะดวกกักตัวที่บ้าน
โรงแรมกักตัว “ชบา-ลานนา” Hotel Isolation ที่อยู่ : ตัวโรงแรมตั้งอยู่ติดถนนซุปเปอร์ไฮเวย์ เชียงใหม่-ลำปาง (ฝั่งขาเข้าเมืองเชียงใหม่) โดย “ชบา-ลานนา” จะอยู่หลังโรงแรมโรงแรมฮาโมไนซ์ นับได้ว่าเป็นโลเคชั่นที่ดี สังเกตได้ง่าย ห่างจากตัวเมืองเพียงเล็กน้อย เดินทางด้วยรถยนต์เพียงแค่ไม่กี่นาที มาพร้อมด้วยสิ่งอำนวยความสะดวกที่ครบครัน
กำหนดพักเพื่อกักตัว 7 วัน รวมอาหาร 3 มื้อ พร้อมใบรับรองแพทย์หลังครบกำหนดกักตัว
* พักห้องคู่ไม่มีค่าใช้จ่าย
** พักเดี่ยว จ่ายเพิ่มคนละ 4,200 บาท
✅ ใช้ได้ทุกสิทธิที่สามารถตั้งเบิกได้
✅ ต้องไม่ขึ้นทะเบียนรับยา หรือเข้า CI,HI ที่ไหนมาก่อน
✅ มีผลยืนยันการติดเชื้อโควิดแบบ PCR มาแล้ว จองห้องพักได้เลย
✅ ตรวจเอง พบ ATK บวก ขึ้น 2 ขีด ต้องตรวจ PCR เพื่อยืนยันก่อน ที่โรงพยาบาลลานนา
เวลาให้บริการ 08.00-16.00 น. ** ติดต่อสอบถาม #การตรวจคัดกรองโควิด แบบ PCR โทร.052-134777
- ผู้มีผล PCR มาแล้วทุกสิทธิ์ #สิทธิประกันสังคม #สิทธิเบิกตรงข้าราชการ #สิทธิUC สามารถใช้สิทธิได้
- สิทธิประกันสังคม รพ.ลานนา ให้บริการตรวจPCR ไม่มีค่าใช้จ่าย สำหรับผู้ประสงค์เข้าพักโรงแรมกักตัวเท่านั้น
- สิทธิอื่นจะมีค่าใช้จ่าย ในการตรวจ PCR คนละ 2,750 บาท
** #ใบรับรองแพทย์ #รับได้ที่ศูนย์ตรวจสุขภาพ #โรงพยาบาลลานนา
ติดต่อสำรองห้องพัก ชบา-ลานนา Chaba-Lanna Hotel Isolation
ได้ที่ โทร.093-8176191 / 052-134777
แอดไลน์ เจ้าหน้าที่ ID Line: chabalanna / chabalanna2
13.ผลักดันนโยบายภาษีเครื่องดื่มที่มีส่วนผสมน้ำตาล
เป็นนโยบายที่ทำให้กรมอนามัย กระทรวงสาธารณสุข ได้รับรางวัล United Nations Inter-Agency Task Force (UNIATF Award) on the Prevention and Control of Non-communicable Diseases ของสหประชาชาติ ในการประชุมครั้งที่ 76 ปี 2564 โดยรางวัลนี้จะมอบให้แก่องค์กรที่มีผลงานโดดเด่นด้านการควบคุมป้องกันโรคไม่ติดต่อเรื้อรังจากทั่วโลก ที่ผลักดันนโยบาย ขับเคลื่อน ควบคุมและป้องกันโรคไม่ติดต่อเรื้อรับ ตามกรอบ SDGs โดยรางวัลที่กรมอนามัย ได้รับ ในหมวดภาครัฐด้านสาธารณสุข จากการผลักดันนโยบายภาษีเครื่องดื่มที่มีส่วนผสมของน้ำตาล ลดการบริโภคน้ำตาลในประชากรไทย โดยมีหลักฐานเชิงประจักษ์ด้านผลการดำเนินนโยบาย และเป็นผู้นำในการทำงานร่วมกับภาคีเครือข่ายภาครัฐ ภาคเอกชน และภาคประชาสังคมที่เกี่ยวข้อง ผลจากนโยบาย คือการปรับโครงสร้างภาษีสรรพสามิตของเครื่องดื่มที่มีน้ำตาล 3 ประเด็น ได้แก่
1. ในภาพรวม ราคาเครื่องดื่มที่มีน้ำตาล ที่ผลิตในประเทศ และนำเข้า มีราคาเพิ่มขึ้น ร้อยละ 12.7 และ 18.1 ตามลำดับ
2. เครื่องดื่มที่มีน้ำตาลสูง มีสัดส่วนลดลง โดยเฉพาะเครื่องดื่มที่มีน้ำตาลมากกว่า 10 กรัม แต่ไม่เกิน 14 กรัมต่อ 100 มิลลิลิตร มีสัดส่วนลดลงมากที่สุด
3. สัดส่วนรายได้จากภาษีเครื่องดื่มเพิ่มขึ้น เมื่อเทียบต่อรายได้ภาษีสรรพสามิตทั้งหมดD.Highly Skilled Professionals
Highly Skilled Professionals - Professionals or experts in targeted industries working for business entities or higher education institutes or research centers or specialized training institutions in Thailand of Thai government agencies.
Personal income
• Personal income of a minimum of USD 80,000/ year in the past two years
• In case of personal income below USD 80,000/ year but no less than USD 40,000/year in the past two years or before retirement, applicants must have a Master’s degree or above in science and technology or special expertise relevant to the job assignment in Thailand.
• No minimum personal income for professionals working for Thai government agencies
Business or higher education institution, research institution, specialized training institution, or Thai govemment agency in any targeted industries.
Experience
At least 5 years of work experience in the targeted industries except for applicants with a PhD or above in the relevant fields of the targeted industries or applicants working for Thai government agencies.
Health insurance
Health insurance with at least USD 50,000 coverage or social security benefits insuring treatment in Thailand or at least USD 100,000 deposit
เครือข่ายเขียนอนาคตกัญชาไทยขอตั้งคำถามถึงพรรคประชาธิปัตย์
เครือข่ายเขียนอนาคตกัญชาไทยขอตั้งคำถามถึงพรรคประชาธิปัตย์ดังนี้
1.กัญชาเสรีนั้นเกิดขึ้นตั้งแต่ช่วงวันที่ 9 มิย.จนกระทั่งถึงปัจจุบัน ซึ่งถือเป็นการปล่อยให้กัญชาเสรีที่สุดเพราะไม่มีกฎหมายมากำกับ และในช่วงที่เสรีที่สุดนี้ กัญชาได้ก่อให้เกิดความวิบัติใดกับสังคมบ้าง เช่น คนติดกัญชาเพิ่มขึ้น คนติดกัญชาไปทำร้ายคนอื่น เหตุการณ์ใดที่พรรคประชาธิปัตย์นำมาเป็นปัจจัยชี้วัดว่ากัญชาควรกลับไปเป็นยาเสพติด โดยพรรคประชาธิปัตย์ต้องตอบคำถามนี้เพราะในคำแถลงระบุชัดเจนว่านี่ไม่ใช่เรื่องการเมือง ฉะนั้นหากพรรคประชาธิปัตย์ยืนยันว่ากระทำบนหลักการ จึงต้องชี้แจงต่อสาธารณะว่ามีข้อมูลใดที่แสดงให้เห็นว่ากัญชาควรต้องกลับไปเป็นยาเสพติด
2.พรรคประชาธิปัตย์ไม่เห็นด้วยที่อนุญาตให้ครัวเรือนปลูกกัญชาได้ เพราะมองว่าจะเอาไปสูบแทนที่จะนำไปทำประโยชน์ทางการแพทย์ คำถามที่สำคัญคือพรรคประชาธิปัตย์มีความรู้แค่ไหนในเรื่องกัญชา และนำหลักเกณฑ์ใดมาตัดสินว่าหากชาวบ้านมีสิทธิในการปลูกกัญชาได้แล้วจะก่อให้เกิดภาวะคนสูบกัญชาทั้งประเทศ หากพรรคประชาธิปัตย์คิดว่าการที่คนเข้าถึงกัญชาแล้วจะทำให้คนสูบกัญชามากขึ้นนั้น เป็นความไร้เดียงสานำความไม่รู้มาตัดสินพืชพื้นเมืองที่อยู่คู่กับครัวเรือนของประเทศนี้มานานก่อนที่รัฐบาลจะประกาศให้ผิดกฎหมาย
ข้อเสนอแนะต่อพรรคประชาธิปัตย์
1.อ่านหนังสือ ศึกษาความรู้ เกี่ยวกับกัญชาให้มากกว่านี้
2.เมื่อพรรคนี้พูดว่าไม่ใช่การเมือง มันคือการเมืองทันที
3.ความตายและการเจ็บป่วยของชาวบ้านซึ่งไม่มีเงินรักษา ไม่ได้มีเงินแบบ สส.พรรคประชาธิปัตย์ พวกเขาเหล่านั้นใช้น้ำมันกัญชาในการรักษาชีวิต อย่างที่ สส. ปชป.ไม่เคยใส่ใจ และอย่าไร้เดียงสาพูดเรื่องกัญชาทางการแพทย์ หากประชาชนไม่สามารถปลูกได้ กัญชาจะกลับไปอยู่ในมือของกลุ่มทุนและผู้เชี่ยวชาญ ทั้งที่มันอยู่ในตำรายาแพทย์แผนไทยและหมอพื้นบ้านเมื่อครั้งสมัยอยุธยาและชาวบ้านสามารถผลิตยารักษา นำไปใส่อาหารแทนผงชูรส และอย่าดูถูกประชาชนว่าไม่สามารถแยกแยะได้ว่าอะไรถูกอะไรผิดต่อการใช้พืชพื้นเมืองชนิดนี้ ชาวบ้านปลูกกัญชาผิด เวลาพวกคุณเทเหล้าใส่ปากขวดละหลายหมื่น มึนเมากันกลับเป็นวัฒนธรรมอันดีงาม
4.มูลค่าทางยาของประเทศนี้จำนวนหลายแสนล้าน มีตัวละครที่ได้ประโยชน์มากมาย การที่ประชาชนเข้าถึงกัญชาได้หมายถึงการที่สามารถนำกัญชาไปผลิตยาได้อย่างหลากหลายเพื่อการรักษาโรค ปรากฎการณ์เช่นนี้เกิดขึ้นมานานแม้กระทั่งตอนที่ทำให้มันเป็นยาเสพติด หากกัญชามันร้ายอย่างที่ พรรค ปชป.เข้าใจ ประเทศนี้คงหายนะไปนานแล้ว การที่ประชาชนเข้าถึงกัญชาจะก่อเกิดนวัตกรรมการผลิตยาอย่างหลากหลาย เมื่อนั้นผู้เสียประโยชน์คือบริษัทยาและผู้เกี่ยวข้องทั้งหมด
น่าเสียดายที่พรรคนี้กีดขวางประชาชนในการเข้าถึงการผลิตยาสมุนไพรจากพืชพื้นเมืองที่ชื่อว่ากัญชา สังคมต้องตัดสินพรรคนี้ว่า ควรที่จะให้โอกาสพรรคนี้มาทำงานในสภาอีกหรือไม่ในการเลือกตั้งครั้งหน้า
เครือข่ายเขียนอนาคตกัญชาไทย สอบถามรายละเอียดเพิ่มเติม
1. สายด่วน สปสช. 1330 กด 6
2. ช่องทางออนไลน์
23-25 กันยายน BKK-เรนเจอร์ @Central World
วันศุกร์ - อาทิตย์ ที่ 23 - 25 กันยายน 2565 เวลา 10.00 - 20.00 น. พบกับงาน MY LITTLE OWL BRAIN GAME เล่นให้ได้เรื่อง 4.0 พื้นที่ของการเล่นอย่างสร้างสรรค์ "พบกับเทศกาลบอร์ดเกม LEGO ROBOT BATTLE SS3" เวิร์กช็อป ศิลปะ เรียนรู้ธรรมชาติ บูธหนังสือเด็ก" ที่ Central World
ภาพตรอกในอีแทวอน สถานที่เกิดเหตุ
BBC เปิดเผยภาพตรอกในอีแทวอนที่ว่างเปล่าเช้านี้ (30 ตุลาคม) หลังเหตุการณ์โกลาหลเป็นเหตุเหยียบกันตายเมื่อคืนผ่านพ้นไป [BBC Sunyoung Jeong Reporting from Itaewon]
ลอยกระทง ม.เกษตรฯ
ลอยกระทง เป็นประเพณีอย่างหนึ่งที่จัดขึ้นในคืนวันเพ็ญ เดือน 12 หรือวันขึ้น 15 ค่ำเดือน 12 ตามปฏิทินจันทรคติไทย ซึ่งเป็นวันที่พระจันทร์เต็มดวง และเป็นช่วงที่น้ำหลากเต็มตลิ่ง
ซึ่งในปีนี้นั้นจะตรงกับ ” วันที่ 8 พฤศจิกายน 2565 “
การลอยกระทงที่เกษตรปีนี้ ทางเราอนุญาตให้ใช้ได้เพียงกระทงเทียนเท่านั้นและไม่อนุญาตให้นำกระทงชนิดอื่นเข้ามาในภายในงาน
ข้อดีของกระทงเทียน
- มีความสวยงาม
- สามารถจัดเก็บได้ง่าย
- สามารถนำไปรีไซเคิลได้ในภายหลัง
- ใช้วัสดุชนิดเดียวในการผลิต
แล้วพบกันวันที่ 8 พฤษจิกายน 2565 นี้นะทุกคน
โรคการเคลื่อนไหวของระบบทางเดินอาหาร เป็นโรคที่พบได้บ่อยมาก
โรคการเคลื่อนไหวของระบบทางเดินอาหาร เป็นโรคที่พบได้บ่อยมาก โดยอาการอาจจะรุนแรงรบกวนคุณภาพชีวิต และเป็นปัญหาในการใช้ชีวิตประจำวัน และหากไม่ได้รับการวินิจฉัยที่ถูกต้องและรักษาแต่เนิ่นๆ ก็อาจส่งผลให้เกิดโรคเรื้อรัง เช่น มะเร็งหลอดอาหาร โรคกลุ่มนี้ส่วนใหญ่จะไม่ทราบสาเหตุของโรค แต่มีความสัมพันธ์กับการติดเชื้อ พฤติกรรมการบริโภคอาหาร สุขอนามัยที่ไม่ดีพอ ความเครียด และบางโรคเป็นโรคที่วินิจฉัยได้ยาก แต่ด้วยวิทยาการทางการแพทย์ ทำให้มีเทคโนโลยีที่ทันสมัยในการวินิจฉัยโรคเกี่ยวกับการเคลื่อนไหวของระบบทางเดินอาหารได้อย่างมีประสิทธิภาพมากขึ้น
อัมพวาขยับยิ้ม ตอน Camping and the ghost 12 - 13 พ.ย.65 LINK
อัมพวาขยับยิ้ม ตอน Camping and the ghost
12 - 13 พฤศจิกายน 2565
สถานที่จัดงาน วัดอัมพวา, เขตบางกอกน้อย
อัมพวาขยับยิ้ม ตอน Camping and the ghost หนึ่งในกิจกรรมภายใต้เทศกาล บางกอกบานฉ่ำ เทศกาลที่สนับสนุนโดยกรุงเทพมหานคร เป็นการจัดเทศกาลศิลปะชุมชน เพื่อเพื่อส่งเสริมอัตลักษณ์ชุมชน ในการพัฒนาเป็นย่านสร้างสรรค์ และส่งเสริมกิจกรรมการท่องเที่ยวในพื้นที่กรุงเทพมหานครให้เป็นที่รู้จักในวงกว้าง
อัมพวาขยับยิ้ม ตอน Camping and the ghost เป็นกิจกรรมที่จะชวนเล่าเรื่องผีบรรยากาศแคมป์ปิ้ง ดูหนังแปลงผี เพ้นท์หน้าผี มีการแสดงศิลปวัฒนธรรม พร้อม โชว์การแสดงสิงโตเด็กและมังกรวัดอัมพวา
คลินิกโรคมะเร็งและเคมีบำบัด นอกเวลาราชการ
คลินิกโรคมะเร็งและเคมีบำบัด เปิดตรวจคลินิกพิเศษเฉพาะทางนอกเวลาราชการ สนใจสอบถาม 032719600 ต่อ 4029 หรือติดต่อโดยตรงที่คลินิกมะเร็ง อาคาร 75 ปี ชั้น 10
23 พ.ย. 65 ส่งเสริมพืชสมุนไพรมาตรฐาน ตั้งเป้าปี 66 ผลิตยาสำเร็จรูปและผลิตภัณฑ์สุขภาพจากกัญชา กัญชง
1. ร่าง พ.ร.บ.กัญชาฯ
- นายชวน หลีกภัย ประธานสภาผู้แทนราษฎร มีคำสั่งนัดสมาชิกประชุมวันนี้ เวลา 09.30 น. พิจารณาเรื่อง 7 ฉบับ ซึ่งรวมถึงพ.ร.บ.กัญชาฯ ด้วย และยังมีวาระเรื่องด่วนอีก 8 ฉบับ โดยต้องรอดูต่อไปว่าจะลงมติได้ทันในวันนี้หรือไม่
- นายวิษณุ เครืองาม เผยจากการประชุม คกก.ป.ป.ส. ครั้งที่ 4/2565 ว่า ที่ประชุมไม่ได้มีการพิจารณาประเด็นเรื่องนำกัญชากลับมาอยู่ในบัญชียาเสพติด เพราะไม่ได้อยู่ในอำนาจ ป.ป.ส. การประชุมครั้งนี้เป็นการรับทราบและให้การเห็นชอบกรณี สธ.ได้ออกประกาศประกาศฉบับใหม่ล่าสุด เรื่องสมุนไพรควบคุม (กัญชา) พ.ศ.2565 ลว. 11 พ.ย.65 ที่ออกตาม พ.ร.บ.คุ้มครองภูมิปัญญาแพทย์แผนไทย เพื่อนำมาใช้ปิดช่องว่างระหว่างที่ยังไม่มี พ.ร.บ.กัญชา กัญชงฯ ซึ่งต้องใช้เวลาอีกหลายเดือน แม้จะเข้าที่ประชุมสภาผู้แทนราษฎรในสัปดาห์หน้า แต่ต้องเข้าไปสู่ชั้นการพิจารณาในวุฒิสภา ระหว่างที่ยังไม่มี พ.ร.บ.ดังกล่าว จะเกิดช่องว่างการสูบ การเสพ เอาช่อดอกไปสกัดขายตามที่เป็นข่าว ทั้งนี้จะลงราชกิจจานุเบกษาในวันที่ 23 พ.ย. และจะมีผลบังคับใช้ในวันที่ 24 พ.ย. เป็นต้นไป
- นายสมศักดิ์ เทพสุทิน รมว.ยธ. เผย เรื่องกัญชาผ่านป.ป.ส.ไปแล้ว การที่นายวิษณุหารือเรื่องนี้ใน ป.ป.ส. เพื่อทำความเข้าใจ
2. ตั้งเป้าปี 66 ผลิตยาสำเร็จรูปและผลิตภัณฑ์สุขภาพจากกัญชา กัญชง
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า ปี2566 ตั้งเป้ามูลค่าผลิตผลิตภัณฑ์ยาสำเร็จรูปและผลิตภัณฑ์สุขภาพจากกัญชา กัญชง ไม่น้อยกว่า 10 ล้านบาท หลังที่ผ่านมามีการกระจายผลิตภัณฑ์ยาสำเร็จรูปจากกัญชา ในสถานพยาบาลของรัฐและเอกชนใน 13 เขตสุขภาพกว่า 680 แห่ง รวมมูลค่าการผลิต 40 ล้านบาท ที่ผ่านมากรมฯได้ดำเนินงานกัญชาทางการแพทย์มาโดยตลอดทุกระดับ โดยระดับต้นทาง มีการทำข้อตกลง MOU กับวิสาหกิจชุมชน จำนวน 967 แห่ง มีพื้นที่ปลูกรวม 169,233.85 ตร.ม. รวม 117,460 ต้น จำนวนช่อดอกแห้ง 54,656 กก. มีการบริหารจัดการกระจายเมล็ดพันธุ์กัญชา เพื่อสนับสนุนการปลูกพืชกัญชาตามมาตรฐานการเพาะปลูกให้กับผู้รับอนุญาตจาก อย. หรือจดแจ้งได้ทางแอปปลูกกัญจำนวน 464 แห่ง มีจำนวนเมล็ดกัญชา 711,094 เมล็ด จัดตั้งคลังวัตถุดิบกัญชาทางการแพทย์ โดยได้รับการสนับสนุนและการจัดซื้อวัตถุดิบกัญชาทางการแพทย์แผนไทย จากแหล่งปลูกที่ได้รับอนุญาต และได้รับการสนับสนุนจากวิสาหกิจชุมชนที่ทำ MOU กับกรมฯ 93 แห่ง น้ำหนักวัตถุดิบกัญชา 3,589.5 กก. รวมมูลค่าทั้งสิ้น 22,189,292.50 บาท
3. ส่งเสริมพืชสมุนไพรมาตรฐาน
- นายพิศาล พงศาพิชณ์ เลขาฯ มกอช. กษ. เผยได้ขับเคลื่อนการพัฒนาสมุนไพร ภายใต้แผนแม่บทแห่งชาติว่าด้วยการพัฒนาสมุนไพรไทย ฉบับที่ 1 (2560-2565) มีเป้าหมาย 4 ยุทธศาสตร์และได้จัดทำโครงการพัฒนาที่ปรึกษาเกษตรกรด้านมาตรฐานพืชสมุนไพรเศรษฐกิจ (กัญชา) ในพื้นที่ จ.เชียงราย อบรมให้ความรู้แก่เจ้าหน้าที่ผู้เกี่ยวข้อง
4. เสพกัญชาริมทาง
-ผู้ใช้เฟซบุâกแชร์คลิป ตร.สภ.เมืองเลย พร้อมผู้นำชุมชน จับกุมชายรายหนึ่งนั่งสูบกัญชาริมถนนสายเลย-ด่านซ้าย พร้อมอุปกรณ์เสริมเป็นบ้องกัญชา สภาพตาเยิ้ม เดินเซไปมา ยิ้ม ไม่พูดจา จนท.พยายามชี้แจงถึงพฤติการณ์ไม่เหมาะสม และยึดอุปกรณ์ทั้งหมด
ฉะนั้น ‘แผนกผู้ป่วยวิกฤตระบบประสาทและไขสันหลัง’ จึงมีบทบาทสำคัญมากในการติดตามดูแลผู้ป่วยอย่างใกล้ชิดตลอด 24 ชั่วโมง เนื่องจากผู้ป่วยมีความเสี่ยงที่จะเกิดเลือดออกซ้ำ และทำให้สมองเสียหายเพิ่มขึ้น และอาจเกิดอาการอ่อนแรงหรือเป็นอัมพาตที่แขนหรือขา พูดลำบาก สูญเสียการมองเห็น สูญเสียความทรงจำ และมีความเสี่ยงที่จะเกิดภาวะสูญเสียความรู้สึกได้อีกด้วย
สิ่งอำนวยความสะดวกในห้องพัก VIP ศูนย์อายุรวัฒน์ 2 (อาคาร 2) ชั้น 9
- เตียงไฟฟ้าควบคุมด้วยรีโมท ทีวี ตู้เย็น เครื่องทำน้ำอุ่น เครื่องปรับอากาศ
- เตียงพักญาติ โต๊ะชุดรับประทานอาหารของญาติ
- ที่นอนป้องกันแผลกดทับ
- ทั้ง 2 อาคาร จัดพื้นที่ส่วนกลาง เครื่องกรองน้ำ น้ำร้อน และไมโครเวฟ ไว้ให้บริการ
ราชวิทยาลัยประสาทศัลยแพทย์แห่งประเทศไทย The Royal College of Neurological Surgeons of Thailand
ราชวิทยาลัยประสาทศัลยแพทย์แห่งประเทศไทย
The Royal College of Neurological Surgeons of Thailand
สำนักงานเลขาธิการ: ชั้น 11 อาคารเฉลิมพระบารมี 50 ปี เลขที่ 2 ซอยศูนย์วิจัย (เพชรบุรี47) ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
E-mail: sec.rcnst@gmail.com
โทรศัพท์ (02)-7181996
โทรสาร (02)-7181997
https://www.rcnst.or.th/ สุกี้ตี๋น้อย สาขา Rainforest กิ่งแก้ว
สุกี้ตี๋น้อย สาขา Rainforest กิ่งแก้ว [
แผนที่] พร้อมเปิดให้บริการ วันที่ 12 ต.ค. 65 นี้ เปิดบริการ 12.00 - 05.00 น. โทร. 092-131-3189
ทีมกู้ภัยนานาชาติเข้าพื้นที่ต่อเนื่อง
- ญี่ปุ่น โดยกระทรวงต่่างประเทศ ประกาศส่งทีมกู้ภัยไปยังตุรกีแล้วเมื่อคืนวันจันทร์ผ่านมา
- ทีมแพทย์ไร้พรมแดน (Doctors Without Borders) ที่มีทีมปฏิบัติการทางตอนเหนือของซีเรีย (เมืองอิดลิป และอเลปโป) เข้าพื้นที่ประสบภัยให้ความช่วยเหลือชาวซีเรีย ที่ติดอยูในซากตึกถล่ม ในชั่วโมงแรก ให้การช่วยเหลือผุ้บาดเจ็บ 200 คน และพบผู้เสียชีวิต 160 ศพ
- อินเดีย ส่งทีมกู้ภัย 2 ทีม รวม 100 นาย พร้อมสุนัขดนกลิ่น และอุปกรณ์จำเป็น ออกเดินทางไปยังพื้นที่ประสบภัยในตุรกีเมื่อคืนวันจันทร์
- เครื่องบินลำเลียงความช่วยเหลือจากอิรัค และ อิหร่าน บินถึงสนามบินแห่งชาติกรุงดามัสกัส ของซีเรียแล้ว รัฐมนตรีต่างประเทศอิรัค ระบุว่าเครื่องบินบรรทุกอาหาร เวชภัณฑ์ ผ้าห่ม ของใช้จำเป็น เชื้อเพลิง อุปกรณ์ปฐมพยาบาล
- หน่วยดับเพลิง แอลเอ (Los Angeles USAR) ส่งทีมกู้ภัย 78 นาย ไปตุรกี หลังจาก ทีม Virginia Task Force 1 จำนวน 79 นายพร้อมสุนัข 6 ตัว เดินทางไปก่อนหน้านี้แล้ว
- จีน เตรียมความช่วยเหลือมูลค่าราว 19 ล้าน USD เพื่อช่วยตุรกี มีทั้งเวชภัณฑ์ และสิ่งของจำเป็นฉุกเฉินต่างๆ กาชาดวงเดือนแดงของจีน เตรียมงบให้ประเทศละ 2 ล้านหยวน เพื่อสนับสนุนการช่วยเหลือในพื้นที่
- ปากีสถาน ส่งทีมกู้ภัย พร้อมอุปกรณ์จำเป็น 15 ตัน โดยสายการบินปากีสถานแอร์ไลน์ ถึงตุรกีแล้ว
Bridge of Love@Chatuchak : สะพานรักจตุจักร เชื่อมรักให้มั่นคง LINK
สำนักงานเขตจตุจักร ชวนคู่รักจดทะเบียนวันวาเลนไทน์ 30 คู่แรก ลุ้นทะเบียนสมรสทองคำ เปิดจองคิวออนไลน์1ก.พ.เป็นต้นไป
สำนักงานเขตจตุจักร กำหนดจัดกิจกรรมจดทะเบียนสมรส ในวันแห่งความรัก 14 กุมภาพันธ์ 2566 ภายใต้ชื่องาน “Bridge of Love@Chatuchak : สะพานรักจตุจักร เชื่อมรักให้มั่นคง” ทั้งนี้ เพื่อเป็นการส่งเสริมสถาบันครอบครัว ซึ่งเป็นพื้นฐานของความมั่นคงในชีวิต และส่งเสริมให้ประชาชนตระหนักถึงความสำคัญของการจดทะเบียนสมรสให้ถูกต้องตามกฎหมาย โดยในปีนี้กำหนดจัดกิจกรรม จดทะเบียนสมรสขึ้น ตั้งแต่เวลา 08.00-12.00 น. บริเวณสะพานข้ามคลองเปรมประชากร หลังวัดเสมียนนารี พระอารามหลวง และชุมชนประชาร่วมใจ 1 ซึ่งถือเป็นจุดเช็คอินสุดชิคแห่งใหม่ในพื้นที่เขตจตุจักร และพิเศษสุด
คู่รักที่มาจดทะเบียนสมรสภายในงาน 30 คู่แรก มีสิทธิ์ร่วมลุ้นรับทะเบียนสมรสทองคำ จำนวน 5 รางวัล รวมทั้งยังมีเครื่องใช้ไฟฟ้า ของรางวัลและของที่ระลึกอื่นๆ อีกมากมาย ที่เตรียมไว้มอบให้กับคู่รักทุกคู่ นอกจากนั้น ยังมีกิจกรรมซึ่งถือเป็นไฮไลท์สำคัญที่จัดเตรียมไว้ให้กับคู่รักภายในงาน คือ การคล้องกุญแจคู่รักบนสะพานรักจตุจักร เพื่อให้ความรักมั่นคง ยืนยาว และคงอยู่ตลอดไป รวมทั้ง มีการจัดซุ้มและมุมต่างๆ เพื่อให้คู่รักได้ถ่ายภาพร่วมกันเป็นที่ระลึก
สำหรับคู่รักที่สนใจจดทะเบียนสมรสภายในงาน “Bridge of Love@Chatuchak : สะพานรักจตุจักร เชื่อมรักให้มั่นคง” สามารถจองคิวล่วงหน้าผ่านระบบออนไลน์ ด้วยการสแกน QR Code ได้ตั้งแต่วันที่ 1 กุมภาพันธ์ เป็นต้นไป หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตจตุจักร โทร. 025139955
สายไหม สายใย แห่งรัก@เขตสายไหม LINK
สายไหม สายใย แห่งรัก Valentine’s day ปีนี้ คู่รักคู่ไหนยังไม่มีที่ผูกสัญญารักสัญญาใจ สำนักงานเขตสายไหม ขอเชิญชวน คู่รักร่วมผูกสัญญารักสัญญาใจ จดทะเบียนสมรส @SaiMai ในวันอังคารที่ 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00 - 16.00 น. ณ ห้องฝ่ายทะเบียน ชั้น 1 อาคารสำนักงานเขตสายไหม ( เปิดรับคิว Walk in จำนวน 60 คู่ ) คู่รักที่ร่วมกิจกรรมจะได้รับของที่ระลึกทุกคู่ และร่วมลุ้นของรางวัลพิเศษ จากทางสำนักงานเขตสายไหม
ทั้งนี้กิจกรรมดังกล่าว จัดขึ้นเพื่อเป็นการส่งเสริมสถาบันครอบครัว ซึ่งเป็นพื้นฐานของความมั่นคงในชีวิต และส่งเสริมให้ประชาชนตระหนักถึงการจดทะเบียนสมรส ให้ถูกต้องตามกฎหมาย
สอบถามเพิ่มเติม โทร. 02-1587358 ฝ่ายทะเบียน
Love@Talingchan รักนิรันด์ ฉันและเธอ LINK
ฝ่ายทะเบียน สำนักงานเขตตลิ่งชัน เชิญชวนคู่รักมาจดทะเบียนสมรสในวันวาเลนไทน์ 14 กุมภาพันธ์ ชื่องาน "Love@Talingchan รักนิรันด์ ฉันและเธอ" ตั้งแต่เวลา 8.00 น. - 16.00 น.พร้อมรับของขวัญพิเศษแทนใจมากมาย พบกับมุมถ่ายรูป check in สวย
ประเวศ รักมั่น นิรันดร LINK
สำนักงานเขตประเวศ ขอเชิญชวนคู่รักร่วมกิจกรรมจดทะเบียนสมรส "ประเวศ รักมั่น นิรันดร" เนื่องในวันวาเลนไทน์ วันแห่งความรักสากลซึ่งตรงกับวันที่ 14 กุมภาพันธ์ ของทุกปี เพื่ออำนวยความสะดวกแก่คู่รักที่ประสงค์จดทะเบียนสมรสในวันดังกล่าว
ประชาชนท่านใดที่สนใจเข้าร่วมกิจกรรม " ประเวศ รักมั่น นิรันดร" ให้รักนี้ประเวศเราเป็นพยาน ทุกท่านสามารถเดินทางไปจดทะเบียนสมรสได้ในวันอังคารที่ 14 กุมภาพันธ์ 2566 พร้อมลุ้นของรางวัลได้ตั้งแต่เวลา 08.00 - 16.00 น. ณ ฝ่ายทะเบียน ชั้น 1 อาคารสำนักงานเขตประเวศ (เปิดรับคิวตั้งแต่เวลา 07.00 น.)
คู่รักที่มาจดทะเบียนสมรสภายในงาน โดยคู่รักทุกคู่จะได้รับ Gift Set และของที่ระลึก พร้อมมุมถ่ายรูปสุดโรแมนติค ให้ทุกคู่รักได้เก็บบรรยากาศสวยๆ หลายจุด
ทั้งนี้ สามารถยื่นเอกสารที่ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตประเวศ ตั้งแต่เวลา 07.00 น.เป็นต้นไป เพื่อตรวจสอบความถูกต้องของเอกสารก่อนจดทะเบียน สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียน หมายเลขโทรศัพท์ 02-3288984
ผู้ที่ต้องการวางแผนการมีบุตร ต้องเตรียมตัวอย่างไรบ้าง
ควรเข้ามาปรึกษาแพทย์เพื่อเตรียมความพร้อม โดยจำเป็นจะต้องตรวจสุขภาพ โดยแบ่งเป็น
การตรวจสุขภาพคู่สมรสว่ามีร่างกายแข็งแรงหรือไม่ หากแข็งแรงดีจะแนะนำการมีบุตรด้วยวิธีธรรมชาติก่อน
การตรวจความสมบูรณ์ของระบบสืบพันธุ์ เป็นการตรวจหาความสมบูรณ์ของระบบสืบพันธุ์เพื่อเตรียมพร้อมก่อนการตั้งครรภ์และเสริมสร้างความสมบูรณ์ของระบบสืบพันธุ์ โดยแพทย์จะให้คำแนะนำในการดูแลตนเอง เสริมสร้างและการบำรุงสุขภาพร่างกายเพื่อเพิ่มคุณภาพของเซลล์สืบพันธุ์ไข่และน้ำเชื้อ
สอบถามรายละเอียดเพิ่มเติมได้ที่ คลินิกรักษาผู้มีบุตรยาก โรงพยาบาลบำรุงราษฎร์ โทร. 02-0112364, 02-0112368 สายด่วน 090-9722609 หรือโทร. 1378
ลูกมีพฤติกรรม หรือความสนใจไม่ตรงกับเพศกำเนิด หรือชอบเพศเดียวกัน
ควรทำ
พ่อแม่ต้องเข้าใจก่อนว่า ลูกไม่ได้ผิดปกติ ไม่ได้ป่วย แต่เป็นเรื่องธรรมชาติของมนุษย์ รสนิยมทางเพศของคนเรามีได้หลากหลาย
เคารพการตัดสินใจของลูก และเป็นกำลังใจเพื่อให้ลูกใช้ชีวิตได้อย่างเป็นปกติสุข
ทำความเข้าใจตัวตนของลูก ให้ข้อมูลความรู้เกี่ยวกับความหลากหลายทางเพศ เช่น การไม่ได้รับความยอมรับ และอุปสรรคทางสังคมที่ลูกอาจได้พบเจอ รวมถึงการป้องกันโรคติดต่อทางเพศสัมพันธ์
ถ้ายังยอมรับสิ่งที่ลูกเป็นไม่ได้ ควรให้เวลาตัวเองใคร่ครวญ และทบทวนว่า ในสถานการณ์เช่นนี้ สิ่งสำคัญที่สุดสำหรับลูกคือพ่อแม่ที่เข้าใจ และคอยเป็นกำลังใจ เพื่อที่เขาจะก้าวเดินต่อไปข้างหน้า
อย่าทำ
การคิดว่า บุคคลหลากหลายทางเพศเป็นโรคภัย เป็นความเข้าใจแบบเดิมๆ นับตั้งแต่ปี 1973 เป็นต้นมา ความหลากหลายทางเพศถูกตัดออกจากเกณฑ์การวินิจฉัยโรคทางจิตเวช และปี 2013 วงการแพทย์เลิกใช้คำว่า “เพศสภาพที่ผิดปกติ” เปลี่ยนเป็นการวินิจฉัยว่า “การไม่มีความสุขกับเพศสภาพที่เป็น”
ตั้งความหวังกับลูกว่าจะต้องรักเพศตรงข้ามเท่านั้น และพูดให้ลูกฟังเป็นประจำว่าอนาคต ลูกชาย ลูกสาวจะต้องแต่งงานมีครอบครัว และมีหลานให้พ่อแม่อุ้ม อาจสร้างความอึดอัดใจให้แก่ลูกที่มีความหลากหลายทางเพศ และยิ่งเป็นการปิดกั้นไม่ให้ลูกพูดคุยขอคำปรึกษาจากพ่อแม่
การแสดงท่าทีไม่ยอมรับลูกด้วยอารมณ์รุนแรง เช่น การดุด่า ไล่ลูกออกจากบ้าน หรือกล่าวตัดขาดสัมพันธ์ มีแต่จะทำให้สถานการณ์เลวร้าย ครอบครัวร้าวฉานแตกแยก และส่งผลต่อการเติบโตและอนาคตของลูก
บุฟเฟ่ต์ทุเรียนสวนคุณยาย อ.แกลง ระยอง เริ่ม 8 เมษายน 66 LINK
ทุเรียนสวนคุณยาย อ.แกลง จ.ระยอง ประกาศ เปิดบุฟเฟ่ต์ทุเรียน ตั้งแต่วันที่ 8 เม.ย. - 17 มิ.ย. 66 ส่วนการเปิดบุฟเฟ่ต์ จะเปิดเฉพาะ เสาร์-อาทิตย์ เท่านั้น ส่วนจันทร์-ศุกร์ รับจองแบบเป็นกรุ๊ป 10 ท่านขึ้นไป คอทุเรียน จะได้พบกับทุเรียนสารพัดสายพันธ์ละลานตา ชวนชิมอย่างยิ่ง อาทิ หมอนทอง ก้านยาว นกหยิบ พวงมณี นวลทองจันทร์ กบชายน้ำ มูซันคิง กบพิกุล ทองลินจง ฯลฯ แถมยังมีผลไมตามฤดูกาล อาหารและเครื่องดื่ม แกงเขียวหวานทุเรียน หมูชะมวง ก๋วยเตี๋ยวผัด น้ำฝาง น้ำชากุหลาบ และขนมอื่นๆ อีกมากมาย สถานที่ Shell ปั๊มเชลล์จุดพักรถตา-ยาย โทร. 089-9382662
การจองบุฟเฟ่ต์ บัตรราคาออนไลน์ • จองได้ถึง 7 เม.ย. 66 จำกัดเวลาทาน 2 ชม. (นับเวลาตั้งแต่เข้าทาน)
ยุติการตั้งครรภ์ไม่เกิน 12 สัปดาห์ รับยาฟรี ทุก รพ.สต.
ปัญหา
เนื่องจากการเข้าถึงการรักษาพยาบาลของประชาชนส่วนใหญ่กระจุกตัวอยู่ที่โรงพยาบาลใหญ่ เนื่องจากสถานบริการสาธารณสุขแบบปฐมภูมิขาดความพร้อม โดยเฉพาะด้านบุคลากร นอกจากนี้ประชาชนยังต้องมีภาระในการขอข้อมูลสุขภาพของตัวเองระหว่างโรงพยาบาล ในกรณีที่ต้องมีการส่งต่อผู้ป่วยไปรักษาต่อที่โรงพยาบาลอื่น และการเข้าถึงเตียงผู้ป่วยใน ที่ถึงเข้าได้ยาก เพราะเตียงมักจะเต็ม และต้องใช้เวลาในการส่งต่อผู้ป่วยไปโรงพยาบาลอื่นที่มีเตียงว่าง นอกจากนี้การเข้ารับรักษาในห้องฉุกเฉินมักมีกรณีที่ผู้ป่วยไม่ใช่ผู้ป่วยฉุกเฉินจริง ทำให้เป็นการลดศักยภาพในการรักษาผู้ป่วยฉุกเฉิน
ข้อเสนอ
- คุ้มครองสิทธิในการยุติการตั้งครรภ์ สำหรับบุคคลที่มีอายุครรภ์ไม่เกิน 12 สัปดาห์ ให้สามารถรับยายุติการตั้งครรภ์ได้ที่ รพ.สต. ทุกแห่งทั่วประเทศ
- โดยขั้นตอนของการขอรับยาคือ ให้ผู้หญิงซึ่งมีอายุครรภ์ไม่เกิน 12 สัปดาห์ และต้องการยุติการตั้งครรภ์ สามารถเข้ามาพบแพทย์ที่ รพ.สต. ใกล้บ้าน (ทั้งในรูปแบบ Telemedicine และพบแพทย์โดยตรง) เพื่อทำการซักประวัติและตรวจร่างกาย เพื่อจ่ายยายุติการตั้งครรภ์ต่อไป
- มีการให้คำปรึกษาหลังจากการยุติการตั้งครรภ์ฟรี เพื่อตรวจสอบและฟื้นฟูสภาพจิตใจของผู้หญิงที่เข้ารับการยุติการตั้งครรภ์
Kirikhan Spirits คีรีขาล จากพะเยา LINK
คีรีขาล เป็นผลิตภัณฑ์ตัวแรกที่ทางเพจจะนำมารีวิว ผลิตภัณฑ์สุรากลั่นชมชนของตำบลลอ อำเภอจุน จังหวัดพะเยา ซึ่งเป็นพื้นที่เกษตรกรรมอู่ข้าวอู่น้ำ และยังเป็นพื้นที่ทางประวัติศาสตร์ทางโบราณคดีที่สำคัญอีกแห่งหนึ่งของล้านนามาจนถึงปัจจุบัน วัตถุดิบหลักจะเป็นข้าวเหนียวพันธุ์พื้นเมืองที่ปลูกแบบอินทรีย์ในพื้นที่ กลั่นออกมาเป็นสุราขาว 35 ดีกรี โดยกลุ่มวิสาหกิจชุมชนกำนันเดชสุรากลั่น มีกลิ่นข้าวอ่อนๆ แต่ไม่แรงมาก ฉลากพิมพ์กราฟิกสีดำ เงิน ดูหรูหรา
ข้อมูลโดยเพจ
ชุมชนชุมใจ ภาพจาก
Local Spiritศูนย์ 20 ป้อมปราบฯ เปิดรับสมัครงาน LINK
ศูนย์บริการสาธารณสุข 20 ป้อมปราบฯ เปิดรับสมัครงาน
1.พนักงานช่วยงานด้านการเงินและบัญชี 1 อัตรา
2.พนักงานช่วยงานด้านสุขภาพ (ห้องทันตกรรม) 1 อัตรา
สมัครได้ด้วยตนเอง ที่ศูนย์ฯ 20 ป้อมปราบฯ
สอบถามโทร. 02-223-0004
โซเดียมกับคนป่วยเบาหวาน
โซเดียม ส่งผลมากกับคนป่วยเบาหวาน เพราะเมื่อมีโซเดียมมากเกินความต้องการของร่างกาย จะเร่งภาวะการเสื่อมของไตให้เร็วขึ้น เนื่องจากไตมีหน้าที่ขับโซเดียมส่วนเกินออกจากร่างกาย เมื่อไตเสื่อมจนไม่ สามารถขับโซเดียมส่วนเกินออกจากร่างกายได้จะทำให้มี การกักเก็บน้ำไว้ภายในร่างกาย ส่งผลให้เกิดอาการบวมขึ้น ผู้เป็นเบาหวานควรระมัดระวังในการเลือกกินอาหารเพื่อถนอมไตไว้ใช้ให้นานที่สุด โดยเลือกกินอาหารสดตามธรรมชาติ โดยไม่มีการปรุงแต่งรสใดๆ ซึ่งจะทำให้ ร่างกายได้รับโซเดียมเพียงพอกับความต้องการแล้ว [
ศูนย์เบาหวานมหิดล]
โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
ถนนริมคลองชลประทาน ต.สุเทพ อ.เมือง จ.เชียงใหม่ 50200
โทรศัพท์: 053-948-031, 053-948-032
เวลาทำการ เปิดทุกวัน 08:00-16:00
Facebook |
Website |
แผนที่
ข้อมูลสถิติ
ข้อมูลเดือนพฤษภาคม 2566 พบว่ามีเด็กจำนวน 2,297,969 คน ที่ได้รับเงินอุดหนุน 600 บาทต่อคนทุกเดือนคิดเป็นเงินจำนวน 1,437,844,800 บาท แม้จะไม่ครอบคลุมเด็กทุกคน แต่การดำเนินนโยบายเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดก็แสดงให้เห็นถึงความมุ่งมั่นของรัฐบาลที่จะลดปัญหาเด็กยากจนและลดความเหลื่อมล้ำทางสังคม รวมถึงเป็นการลงทุนเพื่ออนาคตของชาติ นโยบายเงินอุดหนุนฯ สอดคล้องกับแผนยุทธศาสตร์ชาติ 20 ปี (พ.ศ. 2561–2580) การมุ่งมั่นพัฒนานโยบายดังกล่าว โดยการขยายฐานอายุเด็ก และเพิ่มจำนวนเงินที่เด็กได้รับ ตลอดจนขยายเกณฑ์รายได้เฉลี่ยของพ่อแม่หรือผู้ปกครองเด็กผู้มีสิทธิ ช่วยเสริมให้โครงการเงินอุดหนุนฯ ดำเนินต่อไปอย่างเข้มแข็งขึ้น
แต่อย่างไรก็ตาม นโยบายโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดยังมีปัญหาและอุปสรรคบางประการที่ต้องมีการพัฒนาและปรับปรุงแก้ไขอีกมาก โดยพบว่ามีพ่อแม่หรือผู้ปกครองเด็กผู้มีสิทธิ ที่เป็นกลุ่มเป้าหมายที่ไม่ได้รับเงินอุดหนุนฯ มีมากถึงร้อยละ 30 หมายความว่าจะมีเด็ก 30 คน จาก 100 คนที่ควรจะได้รับเงินอุดหนุนฯ แต่กลับไม่ได้รับ เนื่องมาจากการคัดกรองกลุ่มเป้าหมายที่ไม่ครอบคลุมและละเอียดอย่างเพียงพอ โดยมีอุปสรรคในการเข้ารับสิทธิของโครงการ เช่น ความสับสนในขั้นตอนการรับสิทธิ และการลงทะเบียน ความซับซ้อนของกระบวนการรับรองสถานะความยากจน ครอบครัวที่ยากจนบางครอบครัวไม่มีบัญชีธนาคารหรือไม่สามารถเข้าถึงบริการเครื่องกดเงินอัตโนมัติ เอกสารทางราชการไม่ครบถ้วน และบางครอบครัวอยู่ห่างไกลประสบปัญหาในการเดินทางมาติดต่อ เป็นต้น
นโยบายโครงการเงินอุดหนุนเพื่อการเลี้ยงดูเด็กแรกเกิดเป็นโครงการที่ทุกรัฐบาลควรให้สนับสนุนด้านงบประมาณอย่างเพียงพอ เพื่อสร้างโอกาส และขยายสิทธิของเด็กที่ไปสู่เด็กไทยทุกคนที่อายุต่ำกว่า 6 ปี ให้ได้รับเงินอุดหนุนฯ ถ้วนหน้า เพื่อให้เด็กได้มีคุณภาพชีวิตที่ดีและอยู่ร่วมกันในสังคมโดยข้ามผ่านความเหลื่อมล้ำทางสังคมอีกด้วย
โรงพยาบาลธัญบุรี ทำฟันฟรี 20 ตุลาคม 2566
2-3 ธันวาคม 2566 โปรแกรมมนต์เสน่ห์ลุ่มแม่น้ำบางปะกง
ทริปที่ 7 และ 8 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 2 และวันอาทิตย์ที่ 3 ธันวาคม 2566) โปรแกรมมนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
6 คนไทยเตรียมเดินทางกลับไทย 3 ธ.ค. 66
เพจทางการของสถานเอกอัครราชทูตไทย รายงานว่า คนไทยที่ถูกจับเป็นตัวประกันและได้รับการปล่อยตัวจากฉนวนกาซา ชุดที่สอง จำนวน 6 ราย เตรียมเดินทางกลับประเทศไทย ในวันที่ 3 ธันวาคม 2566 นี้
ทั้ง 6 คนได้แก่ นายกง นายโอวาส นายไพบูลย์ นายจักรพันธ์ นายเฉลิมชัย และนายพัฒนายุทธ
ทั้งหมดได้ออกจากโรงพยาบาล Shamir Medical Center (Assaf Harofeh) ที่ได้เข้ารับการรักษาตัวตั้งแต่ได้รับการปล่อยตัว โดยมี ทีมบุคลากรทางการแพทย์ เจ้าหน้าที่โรงพยาบาล กองทัพอิสราเอล เจ้าหน้าที่กระทรวงการต่างประเทศอิสราเอล และนักสังคมสงเคราะห์ได้จัดพิธีอำลา โดยฝ่ายอิสราเอลได้กล่าวขอบคุณ เจ้าหน้าที่ฝ่ายไทย ที่ร่วมกันทำงานอย่างแข็งขันเป็นตัวแทนครอบครัวของอดีตตัวประกันจนทุกคนมีสุขภาพกายและจิตที่ดี
ในวันเดียวกัน นาย Avi Dichter รัฐมนตรีว่าการกระทรวงเกษตร ได้เข้าเยี่ยมกลุ่มคนไทยจำนวน 6 คน ที่โรงพยาบาล Shamir Medical Center โดยมีนางสาวพรรณนภา จันทรารมย์ เอกอัครราชทูตและคณะข้าราชการสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟและจากกระทรวงการต่างประเทศรอต้อนรับ นาย Dichter ได้กล่าวต้อนรับและให้กำลังใจกลุ่มคนไทยดังกล่าวคืนสู่อิสราเอล พร้อมกล่าวแสดงความชื่นชมแรงงานไทยในภาคการเกษตรซึ่งเป็นส่วนสำคัญอย่างยิ่งสำหรับอิสราเอลและพร้อมต้อนรับแรงงานไทยกลับมา
2 ธันวาคม 2566) พลตรี Lior Carmeli ผู้บัญชาการศูนย์ช่วยเหลือพลเรือนที่ถูกควบคุมตัวและผู้สูญหาย และพลจัตวา Amir Vadmani รองผู้บัญชาการศูนย์ฯ ได้เดินทางมาเยี่ยมชมศูนย์พักฟื้นตัวประกันชาวต่างชาติที่โรงพยาบาล Shamir Medical Center (Assaf Harofeh) โดยมีนายจุลวัจน์ นรินทรางกูร ณ อยุธยา พร้อมด้วยข้าราชการสถานเอกอัครราชทูตฯ ให้การต้อนรับ โดยนายทหารระดับสูงทั้งสองได้เข้าเยี่ยมและพบปะหารือกับตัวประกันชาวไทย 6 รายที่พักฟื้นที่โรงพยาบาล รวมทั้งรับฟังการบรรยายสรุปเกี่ยวกับการปฏิบัติงานของศูนย์ฯ จากผู้ประสานงานของกองทัพอิสราเอล และผู้บริหารของโรงพยาบาลฯ
โรงพยาบาลมหาวิทยาลัยบูรพา ฉีดฟรี วันศุกร์ที่ 15 ธันวาคม พ.ศ. 2566 เวลา 08.30 - 11.30 น.
โรงพยาบาลมหาวิทยาลัยบูรพา เปิดให้บริการฉีดวัคซีนป้องกันมะเร็งปากมดลูก ชนิด 2 สายพันธ์ุ ฟรี!!!สำหรับผู้หญิงไทย อายุ 11 - 20 ปี ฉีดฟรี วันศุกร์ที่ 15 ธันวาคม พ.ศ. 2566 เวลา 08.30 - 11.30 น. ณ อาคารวิจัยทางการแพทย์ ชั้น 5 โรงพยาบาลมหาวิทยาลัยบูรพา
สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกเวชศาสตร์ชุมชน โทร 038-390580 ต่อ 1526, 1800
หมายเหตุ
- กรุณานำบัตรประชาชนตัวจริงมาในวันที่รับบริการ
- หากอายุต่ำกว่า 18 ปี ต้องได้รับการยินยอมจากผู้ปกครองพร้อมเซ็นใบยินยอมการรับวัคซีน
- กรุณานำสมุดวัคซีนมาด้วย (ถ้ามี)
ยุทธศาสตร์ที่ 3 : ด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 561,954.2 ล้านบาท คิดเป็นร้อยละ 16.1 ของวงเงินงบประมาณ เพื่อให้ประชาชนทุกช่วงวัยมีคุณภาพชีวิตที่ดี การศึกษาได้รับการปฏิรูปให้ตอบสนองต่อนวัตกรรมและการเปลี่ยนแปลง สร้างสังคมการเรียนรู้ตลอดชีวิตทั้งในและนอกระบบการศึกษา สนับสนุนการอนุรักษ์และพัฒนามรดกทางศิลปวัฒนธรรมและอุตสาหกรรมสร้างสรรค์ พัฒนาระบบบริการสาธารณสุขที่ได้มาตรฐาน ครอบคลุม ทั่วถึง มีประสิทธิภาพ และเสริมสร้างศักยภาพทางการกีฬา รวมทั้ง ผลิตกำลังคนและพัฒนาทักษะฝีมือแรงงานเพื่อรองรับอุตสาหกรรมเป้าหมาย และวางรากฐานเศรษฐกิจในอนาคต จำแนกตามแผนงานสำคัญ ดังนี้
1) การเสริมสร้างศักยภาพการกีฬา งบประมาณ 2,539.8 ล้านบาท เพื่อให้ประชาชนมีสุขภาพแข็งแรง มีน้ำใจนักกีฬา และตระหนักถึงประโยชน์ของการออกกำลังกาย โดยส่งเสริมให้ประชาชนทุกกลุ่มทุกวัย ออกกำลังกาย เล่นกีฬาและนันทนาการอย่างสม่ำเสมอ ผ่านอาสาสมัครทางการกีฬาและผู้นำการออกกำลังกาย 700 หมู่บ้าน พัฒนาทักษะและศักยภาพนักกีฬามุ่งสู่ความเป็นเลิศในระดับนานาชาติ ตลอดจน พัฒนาโครงสร้างพื้นฐาน อุปกรณ์ สถานที่ และสิ่งอำนวยความสะดวกด้านการออกกำลังกาย
2) การปรับเปลี่ยนค่านิยมและวัฒนธรรม งบประมาณ 3,145.8 ล้านบาท เพื่อให้ประชาชนมีคุณธรรม จริยธรรม และความภูมิใจในความเป็นไทย โดยสนับสนุนให้ประชาชนมีส่วนร่วมในกิจกรรมการเทิดพระเกียรติและเผยแพร่เกียรติคุณทั้งด้านศาสนา ศิลปะ และวัฒนธรรม รวมทั้ง ส่งเสริมค่านิยมที่ดีงาม คุณธรรม จริยธรรม และการอนุรักษ์ฟื้นฟูขนบธรรมเนียมประเพณีวัฒนธรรมท้องถิ่น ไม่น้อยกว่า 11.2 ล้านคน รวมทั้ง ให้มีการประกาศขึ้นบัญชีมรดกภูมิปัญญาทางวัฒนธรรมของชาติ และจัดทำฐานข้อมูลด้านมรดกศิลปวัฒนธรรมในรูปแบบดิจิทัล เพื่อให้ประชาชนสามารถเข้าถึงองค์ความรู้ และพัฒนาต่อยอดเป็นพลังสร้างสรรค์ อันจะนำไปสู่การเพิ่มมูลค่าและเสริมสร้างภาพลักษณ์ความเป็นไทยสู่สากล
3) การพัฒนาคุณภาพการศึกษาและการเรียนรู้ งบประมาณ 24,932.7 ล้านบาท เพื่อส่งเสริมการเข้าถึงการศึกษาที่มีคุณภาพ ได้มาตรฐาน และทั่วถึง พัฒนาระบบการเรียนรู้และหลักสูตรให้ตอบสนองต่อการเปลี่ยนแปลงและความต้องการของตลาดแรงงาน ส่งเสริมการเรียนรู้ทุกที่ทุกเวลาด้วยดิจิทัลแพลตฟอร์มระบบการจัดการเรียนรู้ พัฒนาครูและบุคลากรทางการศึกษาให้เป็นครูยุคใหม่ ไม่น้อยกว่า 175,696 คน สนับสนุนการคืนครูให้นักเรียน ไม่น้อยกว่า 68,000 คน เพื่อลดปัญหาการขาดแคลนครู พัฒนาการเรียนการสอนหลักสูตรสะเต็มศึกษา (STEM) แก่นักเรียน 200,000 คน ในโรงเรียน 15,000 แห่ง ส่งเสริมผู้มีความสามารถพิเศษทางวิทยาศาสตร์ คณิตศาสตร์ และเทคโนโลยี 15,000 คน สนับสนุนโครงสร้างพื้นฐานให้กับสถานศึกษาเพื่อพัฒนาเป็นโรงเรียนคุณภาพประจำตำบล 8,217 แห่ง สนับสนุนอาหารเสริม (นม) และอาหารกลางวัน ส่งเสริมการขับเคลื่อนการผลิตและพัฒนากำลังคนอาชีวศึกษาสมรรถนะสูง 455 แห่ง แก้ปัญหาเด็กที่อยู่นอกระบบการศึกษาและเด็กออกกลางคันให้เข้าสู่ระบบการศึกษา รวมทั้ง พัฒนาทักษะวิชาชีพและอบรมอาชีพระยะสั้นให้กับกลุ่มเป้าหมาย 1,299,500 คน เพื่อเตรียมพร้อมเข้าสู่ตลาดแรงงานและต่อยอดอาชีพให้กับประชาชน
4) การพัฒนาศักยภาพคนตลอดช่วงชีวิต งบประมาณ 33,372.8 ล้านบาท เพื่อให้ประชาชนทุกช่วงวัยมีคุณภาพ ครอบครัวเข้มแข็ง สามารถพึ่งพาตนเองได้ โดยเสริมสร้างให้เด็กมีพัฒนาการสมวัย มีทักษะและความรู้ที่สอดรับกับการเปลี่ยนแปลงในศตวรรษที่ 21 ผลิตและพัฒนากำลังคน อุดมศึกษาเพื่อเพิ่มขีดความสามารถในการแข่งขันของประเทศ จัดรูปแบบและหลักสูตรต่อเนื่องเพื่อเชื่อมโยงการศึกษาขั้นพื้นฐานกับอาชีวศึกษาและอุดมศึกษา ให้สามารถสะสมหน่วยการเรียนรู้ (Credit Bank) 120 หลักสูตร ส่งเสริมโครงการบัณฑิตพันธุ์ใหม่ให้มีทักษะที่สามารถตอบโจทย์อุตสาหกรรม ไม่น้อยกว่า 13,520 คน รวมทั้ง พัฒนาแรงงานให้มีทักษะและสมรรถนะสูงและมีงานทำ ไม่น้อยกว่า 1,002,690 คน ดึงดูดผู้เชี่ยวชาญจากต่างประเทศในตำแหน่งงานที่ขาดแคลน 20,000 คน และพัฒนาทักษะอาชีพผู้สูงอายุไม่น้อยกว่า 179,600 คน ให้สามารถประกอบอาชีพและพึ่งพาตนเองได้
5) การเสริมสร้างให้คนมีสุขภาวะที่ดี งบประมาณ 64,670.1 ล้านบาท เพื่อให้ประชาชนมีสุขภาวะที่ดีทั้งกาย ใจ และสติปัญญา สามารถเข้าถึงบริการสาธารณสุขที่ได้มาตรฐานและเป็นธรรม โดยส่งเสริมกลไก สร้างเสริมสุขภาพและการป้องกันโรค เพิ่มศักยภาพการให้บริการด้านสาธารณสุข สามารถรองรับสถานการณ์ฉุกเฉินจากโรคอุบัติใหม่ โรคอุบัติซ้ำ และโรคระบาดที่อาจเกิดขึ้นในอนาคต พัฒนาระบบการแพทย์ปฐมภูมิ และเครือข่ายระบบสุขภาพระดับอำเภอ ตลอดจนพัฒนาระบบระวัง ป้องกัน ควบคุมโรคและภัยสุขภาพ ผ่านกลไกระดับชุมชน ด้วยการพัฒนาศักยภาพอาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) ไม่น้อยกว่า 1,075,100 คน และภาคีเครือข่ายในการจัดการสุขภาพ ส่งเสริมความรอบรู้ด้านการรักษาและฟื้นฟูสุขภาพที่ถูกต้องแก่ประชาชนและบุคลากรทางการแพทย์ เสริมสร้างความเป็นเลิศทางการแพทย์แผนไทย การแพทย์ทางเลือก และสมุนไพร พัฒนาและยกระดับสมุนไพรเพื่อเพิ่มมูลค่าและการดูแลสุขภาพประชาชน เร่งรัดการผลิตและพัฒนากำลังคนด้านสุขภาพ ไม่น้อยกว่า 30,580 คน และกระจายแพทย์ไปสู่ชนบทไม่น้อยกว่า 900 คนต่อปี พัฒนาระบบบริการการแพทย์ฉุกเฉินครบวงจรและระบบการส่งต่อ ให้ครอบคลุมทุกพื้นที่ เพื่อให้ประชาชนสามารถเข้าถึงได้อย่างทันท่วงที ตลอดจนเสริมสร้างความรอบรู้ด้านสุขภาพจิตผ่านช่องทางที่หลากหลาย
6) การดำเนินงานภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 29,109.8 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 404,183.2 ล้านบาท เพื่อสนับสนุนยุทธศาสตร์ด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์ ให้ประชาชนมีคุณภาพชีวิตที่ดี ยกระดับการศึกษาและการเรียนรู้ที่มีคุณภาพทั่วถึง ครูและบุคลากรทางการศึกษาได้รับสวัสดิการและคุณภาพชีวิตที่เหมาะสม 1,350,000 คน สนับสนุนบริการวิชาการด้านพลศึกษา กีฬาและนันทนาการ 3,628,800 คน พัฒนาศักยภาพวัยแรงงานให้สอดคล้องกับความต้องการของตลาดแรงงาน ตลอดจน สนับสนุนให้สถาบันการศึกษาน้อมนำแนวพระราชดำริมาบูรณาการแก้ไขปัญหาในการพัฒนาท้องถิ่นให้มีความเข้มแข็งและยั่งยืน
ประเทศสิงคโปร์
SINGAPORE
1. Duke-NUS Medical School, NUS, Singapore
หลักสูตร 4 ปี ปริญญา Doctor of Medicine
(MD) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศสิงค์โปร์ และรับรองโรงพยาบาลหลักที่ใช้
ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตรและอยู่ในประเทศสิงคโปร์ ดังนี้
1.Singapore General Hospital
2. KK Women’s and Children’s Hospital
3. Changi General Hospital
ว/ด/ป ที่ รับรอง 12 ก.ย. 62
ว/ด/ป ครบอายุ การรับรอง 11 ก.ย. 67
ข้อควรปฏิบัติ
ข้อควรปฏิบัติ มีดังนี้
- ฉีดวัคซีน โรคพิษสุนัขบ้า สัตว์เลี้ยงจะต้องมีสุขภาพแข็งแรง ไม่ป่วย มีอายุ 3 เดือนขึ้นไป
- ผ่าตัดทำหมันคุมกำเนิดถาวร ให้บริการสำหรับสุนัขและแมวไทยเท่านั้น งดรับสุนัขแมวพันธุ์หรือผสม และต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง ไม่ป่วย โดยงดน้ำ งดอาหาร พร้อมกักบริเวณ หรือขังกรง เป็นเวลา 8 - 12 ชั่วโมง (ให้สิทธิ์ครัวเรือนละไม่เกิน 2 ตัว) ระหว่างรอขอความร่วมมือ ล่ามโซ่หรือขังโกรงห้ามปล่อยสุนัขและแมวเพื่อป้องกันน้องแอบทานอาหาร)
- ผู้เข้ารับบริการจะต้องนำบัตรประชาชนมาลงทะเบียน
- หากผู้เข้ารับบริการไม่มีทะเบียนบ้านอยู่ในเขตพื้นที่ ให้แจ้งที่อยู่ที่อาศัย ที่อยู่ปัจจุบันในเขตพื้นที่ได้
สำหรับประชาชนที่สนใจนำสุนัขและแมวเข้ารับบริการ ควรปฏิบัติตามรายละเอียดดังกล่าวอย่างเคร่งครัด สามารถสอบถามเพิ่มเติมได้ที่ กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา หมายเลขโทรศัพท์ 038 – 111826 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
ผู้ว่าฯ ชัชชาติ ชวนคนกรุงตรวจสุขภาพฟรี
ผู้ว่าฯ ชัชชาติ ชวนคนกรุงตรวจสุขภาพฟรี Kick off ตรวจสุขภาพ 1 ล้านคน ยกคาราวานบริการสุขภาพรวมไว้ที่เดียว @ลานคนเมือง
นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร เปิดเผยว่า งานตลาดนัดสุขภาพ Bangkok Health Market ครั้งที่ 3 และ Kick off Health Screenings 1,000,000 คน ในวันที่ 24 ธันวาคม 2566 เวลา 07.00 - 14.00 น. ณ ลานคนเมือง เป็นการยกคาราวานการบริการและดูแลสุขภาพมารวมไว้ครบเป็นที่แรก และจัดโปรแกรม Health Screenings ตรวจคัดกรองสุขภาพใกล้บ้าน ฟรี 1,000,000 คน เพื่อเป็นของขวัญปีใหม่ให้กับคนกรุงเทพฯ โดยประชาชนสามารถมารับบริการตรวจคัดกรองโรคยอดฮิตของคนเมือง เช่น โรคเบาหวาน หัวใจ หลอดเลือดสมอง ภาวะสมองเสื่อม ตรวจวัณโรคปอด มะเร็งปากมดลูก จอประสาทตา ตรวจหาการติดเชื้อ HIV ด้วยตนเอง ประเมินสุขภาพจิต
สำหรับคนพิการ มีบริการพิเศษ โดยการประเมินความพิการและออกบัตรให้ได้เลย หรือจะมาลงทะเบียนรับเบี้ยผู้พิการ และเปลี่ยนสิทธิผู้พิการก็ทำได้ นอกจากนี้ยังมีโซน Entertainment การแสดงบนเวที และการแสดงชมรมผู้สูงอายุ เล่นเกมตอบคำถามสุขภาพ แจกของ สินค้าสุขภาพ อาหาร เครื่องดื่ม ของดี 50 เขตด้วย
โดยงานนี้นอกจากการตรวจคัดกรองสุขภาพประชาชนแล้วยังจะได้เห็นถึงความเข้มแข็งของการทำงานในการดูแลสุขภาพไร้รอยต่อ ตั้งแต่ที่บ้าน โรงพยาบาล จนกลับสู่ชุมชน โดยใช้นวัตกรรมและเทคโนโลยีที่ทันสมัย เช่น Motorlance, Commulance แอปพลิเคชัน หมอ กทม. UMSC และอื่น ๆ โดยความร่วมมือจากภาคีเครือข่ายทุกภาคส่วน
นโยบายนี้ช่วยเปิดโอกาสให้แรงงานนอกระบบเข้าถึงสิทธิ 30 บาทได้ - พญ.อรวรรณ ตะเวทิพงศ์
พญ.อรวรรณ ตะเวทิพงศ์ แพทย์ประจำคลินิกเวชกรรมแพทย์อรวรรณ อ.เขาย้อย จ.เพชรบุรี กล่าวถึงโครงการนี้ว่า
"นโยบายดังกล่าวได้ช่วยเปิดโอกาสให้แรงงานนอกระบบในพื้นที่ที่ใช้สิทธิหลักประกันสุขภาพแห่งชาติ (บัตรทอง 30 บาท) และผู้ใช้สิทธิบัตรทอง 30 บาททั้งในพื้นที่และไม่ว่าจะอยู่จังหวัดไหน เมื่อเดินทางมาที่ จ.เพชรบุรี สามารถรับบริการการดูแลรักษาอาการเจ็บป่วยนอกเวลาราชการได้ที่คลินิกฯ โดยไม่เสียค่าใช้จ่าย เพียงแค่พกบัตรประชาชนใบเดียวเท่านั้น
รวมถึงยังเป็นการทำให้คลินิกฯ ซึ่งเป็นภาคเอกชน ได้เข้ามามีส่วนร่วมเป็นเครือข่ายการให้บริการในระดับปฐมภูมิในชุมชน เป็นการลดความแออัดในสถานพยาบาลปฐมภูมิของรัฐอย่าง โรงพยาบาลส่งเสริมสุขภาพประจำตำบล (รพ.สต.) และที่สำคัญคือในโรงพยาบาลรัฐขนาดใหญ่ที่ประชาชนมักเลือกไปรับบริการ ทั้งที่อาการอาจจะไม่ได้หนักหรือร้ายแรงมาก
ส่วนการส่งต่อทางคลินิกฯ ก็สามารถที่จะส่งต่อผู้ป่วยไปยังโรงพยาบาลตามสิทธิการรักษาได้ โดยไม่จำเป็นต้องใช้ใบส่งตัว เพราะจะเป็นแบบอิเล็กทรอนิกส์อยู่ในแอปพลิเคชัน หรือส่งผ่านระบบข้อมูลให้คนไข้สามารถไปที่โรงพยาบาลรับส่งต่อได้เลยก็ได้เช่นกัน" [
hfocus]
การทดลองออกแบบพื้นที่สาธารณะขนาดเล็ก (Public Space) ‘Puppup Space’ (ปุ๊บปั๊บสเปซ)
การทดลองออกแบบพื้นที่สาธารณะขนาดเล็กบนพื้นที่จอดรถ 2 - 3 ช่อง ภายใต้แนวคิด ‘การคืนพื้นที่สำหรับคนเดินเท้า’ โดยการเปลี่ยนพื้นที่ของรถให้กลายเป็นพื้นที่กิจกรรมของชุมชน หรือพื้นที่สาธารณะชั่วคราวสำหรับการพักผ่อน โครงการนี้ต่อยอดมาจากงานทดลองปรับปรุงพื้นที่ให้เอื้อต่อการเดินและการใช้จักรยาน โดยเพิ่มพื้นที่ทางเดิน กำหนดช่องจราจรให้ชัดเจน ช่วยลดความเร็วจราจรเพื่อความปลอดภัย ในชุมชนย่านเขตพระนคร
สปสช.เขต 13 กรุงเทพมหานคร
สำนักงานหลักประกันสุขภาพแห่งชาติ เขต 13 กรุงเทพมหานคร
- สำนักงานหลักประกันสุขภาพแห่งชาติ สาขาเขตพื้นที่(กรุงเทพมหานคร) 120 ม. 3 อาคารรัฐประศาสนภักดี (อาคารบี) โซนทิศใต้ ชั้น 5 (ฝั่งลานจอดรถ) ศูนย์ราชการเฉลิมพระเกียรติ 80 พรรษา 5 ธันวาคม 2550 ถนนแจ้งวัฒนะ แขวงทุ่งสองห้อง เขตหลักสี่ กรุงเทพมหานคร ฯ 10210
- โทรศัพท์ เบอร์กลาง 02-142-1000 (เวลาราชการ)
- โทรสาร 02-143-8772-3
- แผนที่ google map
- website
- facebook
ศูนย์ตรวจสุขภาพและวัคซีนทางเลือก
ศูนย์ตรวจสุขภาพและวัคซีนทางเลือก โทร 02-4326167-8 ต่อ 1112 หรือ 061-409-3495
ศูนย์ตรวจสุขภาพ โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี ให้บริการตรวจสุขภาพประจำปี สำหรับผู้รับบริการตั้งแต่อายุ 15 ปี ขึ้นไป โดยเน้นการตรวจสุขภาพให้เหมาะสมกับภาวะสุขภาพและปัจจัยเสี่ยงด้านสุขภาพกับผู้รับบริการแต่ละราย โดยผู้รับบริการจะได้รับคำแนะนำก่อนการตัดสินใจเลือกโปรแกรมการตรวจสุขภาพ และผู้รับบริการจะได้รับการตรวจและให้คำแนะนำเรื่องสุขภาพโดยทีมแพทย์ และ พยาบาลที่มีความเชี่ยวชาญโดยเฉพาะ ทำให้ผู้รับบริการเข้าใจในการปฏิบัติตัวได้อย่างเหมาะสมกับภาวะสุขภาพของผู้รับบริการแต่ละราย เพื่อให้ผู้รับบริการทุกคนมีสุขภาพดีโดยให้บริการ ดังต่อไปนี้
- ให้คำแนะนำการตรวจสุขภาพเหมาะสมกับผู้รับบริการแต่ละบุคคล
- ตรวจร่างกายโดยแพทย์ผู้เชี่ยวชาญ
- ตรวจทางห้องปฏิบัติการที่ได้รับการรับรองตามมาตรฐานสากล
- ตรวจทางรังสีวิทยา
- ตรวจกระดูกพรูน
- อัลตราซาวนด์
- เอ็กซเรย์ปอด
- ให้คำแนะนำด้านวัคซีนป้องกันโรค โดยแพทย์ผู้เชี่ยวชาญ
[27/10/2023] รับสมัคร พนักงานธุรการ (บุคคล)
คลินิกความผิดปกติของการสื่อความหมาย
คลินิกความผิดปกติของการสื่อความหมาย
**กรุณานัดหมายล่วงหน้า**
คลินิกในเวลาราชการ :
วันจันทร์-ศุกร์ 08.00-16.00 น.
คลินิกพิเศษ (พรีเมียม)
บริการแก้ไขการพูด : จันทร์ อังคาร และพฤหัสบดี
เวลา 16.30-19.30 น.
บริการตรวจการได้ยิน : จันทร์-อังคาร
เวลา 16.30-19.30 น.
วันเสาร์ 09.00-12.00 น.
*เปิดตรวจทั้งหมด*
*การพบแพทย์จะต้องทำนัดหมายล่วงหน้า เท่านั้น
สอบถามบริการหรือโทรศัพท์นัดหมายได้ที่ 02-8396380 เวลา 13.00-15.00 น. (เว้นวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์)
*การนัดหมายเพื่อฝึกพูดจำเป็นต้องพบกุมารแพทย์ (อายุต่ำกว่า 15 ปี) หรือจิตแพทย์เด็กและวัยรุ่น (อายุ 15-17 ปี) เพื่อให้แพทย์ประเมินและส่งฝึกพูด
ให้บริการ
บริการแก้ไขการพูด
โดยนักแก้ไขการพูดมีหน้าที่ให้บริการ ดังนี้
• ประเมินและกระตุ้นพัฒนาการทางภาษาและการพูดในผู้ป่วยที่มีพัฒนาการทางภาษาและการพูดล่าช้าจากสาเหตุต่าง ๆ เช่น ภาวะความบกพร่องทางปัญญา (Intellectual Disabilities ; ID ), ออทิสซึม (Autism) และปากแหว่งเพดานโหว่ (Cleft Lip & Palate) เป็นต้น
• ประเมินและแก้ไขปัญหาการพูดไม่ชัด (Articulation & Phonological Disorders) และเสียงผิดปกติ (Voice Disorders)
• ประเมินและแก้ไขภาษาและการพูดเนื่องจากความบกพร่องของระบบประสาท เช่น ภาวะความบกพร่องทางการสื่อความ (Aphasia), ภาวะสมองพิการ (Cerebral Palsy ; CP) และความผิดปกติของการพูดเนื่องจากความบกพร่องของระบบประสาทควบคุมการพูด (Dysarthria, Apraxia)
คลินิกในเวลาราชการ :
วันจันทร์–ศุกร์ เวลา 08.00–16.00 น.
คลินิกพิเศษ (พรีเมียม) :
วันจันทร์ อังคาร พฤหัสบดี เวลา 16.30–19.30 น.
วันเสาร์ เวลา 08.00-12.00 น.
*ยกเว้นวันหยุดนักขัตฤกษ์*
#####
บริการแก้ไขการได้ยิน
โดยนักแก้ไขการได้ยินมีหน้าที่ให้บริการตรวจการได้ยินประเภทต่าง ๆ ดังนี้
• การตรวจคัดกรองการได้ยินในทารกแรกเกิด (Newborn hearing screening) • การตรวจวัดเสียงสะท้อนจากหูชั้นใน (Otoacoustic emissions)
• การตรวจการได้ยินแบบวินิจฉัย (Diagnostic audiometry) • การตรวจสมรรถภาพการทำงานของหูชั้นกลาง (Tympanometry)
• การให้บริการเครื่องช่วยฟังในผู้ใหญ่ (Hearing aids Fitting)
• การให้บริการตรวจคลื่นไฟฟ้าของระบบประสาทในผู้ใหญ่ (Auditory Evoked Potential)
คลินิกในเวลาราชการ :
• สำหรับเด็กอายุ 6 เดือน – 15 ปี
วันจันทร์ เวลา 13.00-15.00 น. และ
วันพุธ เวลา 08.00–15.00 น.
• สำหรับเด็กแรกเกิดและผู้ป่วยอายุ 15 ปีขึ้นไป
วันจันทร์-ศุกร์ เวลา 08.00–16.00 น.
คลินิกพิเศษ (พรีเมียม) :
• สำหรับผู้ป่วยอายุ 15 ปีขึ้นไป
วันจันทร์-อังคาร เวลา 16.30– 9.30 น.
*ยกเว้นวันหยุดนักขัตฤกษ์*
• สำหรับเด็กแรกเกิด และผู้ป่วยอายุ 15 ปีขึ้นไป
วันเสาร์ เวลา 08.00–12.00 น. และ
วันอาทิตย์ สัปดาห์ที่ 1 3 และ 5 เวลา 08.00–12.00 น.
*ยกเว้นวันหยุดนักขัตฤกษ์*
คลินิคพิเศษนอกเวลาราชการเวชกรรมฟื้นฟู โรงพยาบาลชลบุรี ให้บริการ วันจันทร์ - พฤหัสบดี
โรงพยาบาลชลบุรี เปิดให้บริการ "คลินิคพิเศษนอกเวลาราชการเวชกรรมฟื้นฟู" ให้บริการ วันจันทร์ - พฤหัสบดี เวลา 16.00 น. -20.00 น.
ให้บริการลดปวดและฟื้นฟูในผู้ป่วยที่มีปัญหาด้าน
▶️ ปวดคอ บ่า ไหล่ สะบัก ออฟฟิศซินโดรม
▶️ มือชา ปวดข้อศอก ไหล่ติด
▶️ ปวดเข่า ปวดหลัง ปวดร้าวลงขา
▶️ ปวดส้นเท้า รองช้ำ
ค่าบริการเบิกได้ตามสิทธิการรักษา
1️⃣”พบแพทย์” เริ่มต้นที่ 400 บาท
2️⃣”ไม่พบแพทย์” 350-400 บาท
สอบถามรายละเอียดเพิ่มเติม หรือนัดหมายล่วงหน้า เบอร์ 038-931591
ผศ.(พิเศษ) นพ.สุรินทร์ อัศววิทูรทิพย์ ผู้ช่วยคณบดีฝ่ายบริการวิชาการ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
“E-cigarettes, heated tobacco products and nicotine pouches are only for adult smokers who cannot quit any other way” - "บุหรี่ไฟฟ้า ผลิตภัณฑ์ยาสูบที่ใช้ความร้อน และนิโคติน กระเป๋า เหมาะกับผู้ใหญ่ที่ติดบุหรี่แล้วเลิกไม่ได้"
บริษัทยาสูบและบริษัทที่เกี่ยวข้องมักยืนกรานว่า ผลิตภัณฑ์ใหม่ๆ มีจุดประสงค์เพื่อลดอันตราย เหล่านี้ ไม่ได้ออกแบบมาสำหรับเยาวชน หรือโฆษณาให้กับเยาวชน
ในความเป็นจริง:
- หลักฐานที่เพิ่มขึ้น แสดงให้เห็นว่าผลิตภัณฑ์เหล่านี้ วางตลาดเป็นสินค้าอุปโภคบริโภค และพุ่งเป้าไปที่คนหนุ่มสาว
- ผลิตภัณฑ์เหล่านี้ออกแบบเพื่อดึงดูดเด็กและเยาวชน ด้วยการใช้กลิ่นผลไม้และลูกกวาด และทำการตลาดผ่านสื่อสังคมออนไลน์ เพื่อดึงดูดเยาวชนทั่วโลก และ
- ข้อมูลทั่วโลก แสดงให้เห็นว่าอัตราการใช้บุหรี่ไฟฟ้าสูงขึ้นในกลุ่มอายุน้อยกว่ามากกว่าผู้สูงอายุ และเยาวชนที่ใช้บุหรี่ไฟฟ้า สูงเป็นสามเท่า ของผู้ใหญ่ที่สูบบุหรี่แบบดั้งเดิม [11]
เลือกเสื้อผ้าสวยๆ ที่ BKK Food Bank สำนักงานเขตพระโขนง
ขยะเสื้อผ้า กำลังเป็นปัญหาใหญ่ที่หลายหน่วยงานกำลังให้ความสำคัญ สำนักงานเขตพระโขนงก็เป็นอีกหนึ่งหน่วยงานที่ตระหนักถึงปัญหานี้ โดยได้รับความอนุเคราะห์จาก บริษัท ยัสปาล จำกัด (มหาชน) บริจาคเสื้อผ้าบางส่วนเพื่อร่วมโครงการ BKK Food Bank ที่คราวนี้ ไม่ได้มาเพื่อแก้ปัญหาอาหารเหลือทิ้งอย่างเดียว แต่ยังช่วยแก้ปัญหาขยะจากเสื้อผ้าอีกด้วย
บรรยากาศการเลือกเสื้อผ้าที่สำนักงานเขตพระโขนง แม้จะไม่ได้มีผู้มารับบริการจำนวนมากนัก แต่มีหลายท่านที่เลือกหยิบเสื้อผ้ามือสองกลับไปใช้ เจ้าหน้าที่ระบุว่า "แม้จะไม่คึกคักมากนัก แต่ก็มีคนมาเลือกเสื้อผ้าบ้างเป็นระยะ ๆ ส่วนใหญ่ก็พอใจกับเสื้อผ้าที่เราคัดสรรไว้"
เมื่อสัมภาษณ์เจ้าหน้าที่ที่ดูแลส่วนของเสื้อผ้า ท่านบอกว่า "ที่ BKK Food Bank แห่งนี้ นอกจากจะมีอาหารและสิ่งของที่จำเป็นแล้ว เรายังมีจุดรับบริจาคเสื้อผ้าด้วย พวกเราจะจัดเก็บเสื้อผ้าที่ยังสามารถใช้งานได้ไว้ เพื่อให้ผู้เข้าร่วมโครงการได้มีโอกาสเลือกหยิบไปใช้ฟรี ๆ"
"จริง ๆ แล้วการรับบริจาคเสื้อผ้าช่วยลดปัญหาขยะเสื้อผ้าได้เยอะมาก ถ้าเสื้อผ้าเหล่านี้ต้องทิ้งเป็นขยะก็จะเป็นภาระต่อสิ่งแวดล้อม การนำมาบริจาคจึงเป็นวิธีการหนึ่งในการช่วยลดปัญหาได้ พวกเราได้ร่วมมือกับหลายหน่วยงานทั้งภาครัฐและเอกชนในการรับบริจาคเสื้อผ้า ผู้มาใช้บริการที่สำนักงานเขตก็มีสิทธิ์เลือกหยิบเสื้อผ้าเหล่านี้กลับไปใช้ฟรี ซึ่งก็มีผู้มาใช้บริการส่วนใหญ่พอใจมากเลยทีเดียว" เจ้าหน้าที่กล่าว
- หากท่านมีเสื้อผ้ามือสองที่ยังอยู่ในสภาพดี สามารถนำมาบริจาคได้ที่สำนักงานเขตพระโขนง ติดต่อ ฝ่ายพัฒนาชุมชนและสวัสดิการสังคม เขตพระโขนง โทร. 0 2332 9453
- หรือหากท่านกำลังมองหาเสื้อผ้าราคาประหยัด สามารถมารับได้ที่สำนักงานเขตพระโขนงเช่นกัน
13. CLIMATE ACTION การดำเนินการด้านสภาพภูมิอากาศ
ไม่มีประเทศใดที่ไม่ได้รับผลกระทบจากการเปลี่ยนแปลงสภาพภูมิอากาศอย่างรุนแรง การปล่อยก๊าซเรือนกระจกเพิ่มขึ้นมากกว่า 50 เปอร์เซ็นต์เมื่อเทียบกับปี 1990 ภาวะโลกร้อนทำให้ระบบภูมิอากาศของเราเกิดการเปลี่ยนแปลงอย่างยาวนาน ซึ่งคุกคามผลที่ไม่อาจย้อนกลับได้หากเราไม่ดำเนินการ
ความสูญเสียทางเศรษฐกิจเฉลี่ยต่อปีจากภัยพิบัติที่เกี่ยวข้องกับสภาพภูมิอากาศอยู่ที่หลายร้อยพันล้านดอลลาร์ นี่ยังไม่รวมถึงผลกระทบต่อมนุษย์จากภัยพิบัติทางธรณีฟิสิกส์ ซึ่งเกี่ยวข้องกับสภาพภูมิอากาศถึง 91 เปอร์เซ็นต์ และระหว่างปี 1998 ถึง 2017 คร่าชีวิตผู้คนไป 1.3 ล้านคน และบาดเจ็บอีก 4.4 พันล้านคน เป้าหมายดังกล่าวมีเป้าหมายเพื่อระดมเงิน 100 พันล้านดอลลาร์สหรัฐต่อปีภายในปี 2020 เพื่อตอบสนองความต้องการของประเทศกำลังพัฒนาในการปรับตัวให้เข้ากับการเปลี่ยนแปลงสภาพภูมิอากาศและลงทุนในการพัฒนาคาร์บอนต่ำ
การสนับสนุนภูมิภาคที่เปราะบางจะส่งผลโดยตรงต่อเป้าหมายที่ 13 ไม่เพียงเท่านั้น แต่ยังรวมถึงเป้าหมายการพัฒนาที่ยั่งยืนอื่นๆ อีกด้วย การดำเนินการเหล่านี้จะต้องดำเนินไปควบคู่กับความพยายามในการบูรณาการมาตรการป้องกันภัยพิบัติ การจัดการทรัพยากรธรรมชาติอย่างยั่งยืน และความมั่นคงของมนุษย์เข้ากับกลยุทธ์การพัฒนาประเทศ ยังคงมีความเป็นไปได้ที่จะจำกัดการเพิ่มขึ้นของอุณหภูมิเฉลี่ยทั่วโลกให้สูงกว่าระดับก่อนยุคอุตสาหกรรม 2 องศาเซลเซียส ซึ่งตั้งเป้าไว้ที่ 1.5 องศาเซลเซียส โดยต้องมีการดำเนินการร่วมกันอย่างเร่งด่วนและทะเยอทะยาน
สร้างบัญชี - กำหนดชื่อและกำหนดเลขรหัส
คำถาม : โดยเฉลี่ย คุณมีค่าใช้จ่าย/มีงบประมาณในการใช้บริการหัตถการเสริมความงามเฉลี่ยต่อครั้งเท่าไร?
คำถาม : โดยเฉลี่ย คุณมีค่าใช้จ่าย/มีงบประมาณในการใช้บริการหัตถการเสริมความงามเฉลี่ยต่อครั้งเท่าไร?
ผู้ที่ใช้บริการหัตถการความงามราว 69% ใช้จ่ายไม่เกิน 5,000 บาทต่อครั้ง โดยโรงพยาบาลรัฐ เป็นสถานบริการที่ผู้บริโภคสามารถใช้บริการในงบประมาณที่เข้าถึงได้ง่าย
13.Future of space technologies - อนาคตของเทคโนโลยีอวกาศ
เทคโนโลยีอวกาศครอบคลุมถึงดาวเทียม ยานปล่อย และเทคโนโลยีที่อยู่อาศัย ซึ่งช่วยให้สามารถปฏิบัติการและบริการอวกาศได้อย่างสร้างสรรค์
3. โอกาสในการพบปะผู้คน
จากข้อมูลการสำรวจภาวะการทำงานของประชากรของสำนักงานสถิติแห่งชาติ ในปี 2566 พบว่า คนโสดมีชั่วโมงการทำงานเฉลี่ยอยู่ที่ 43.2 ชั่วโมงต่อสัปดาห์ สูงกว่าชั่วโมงการทำงานเฉลี่ยรวมของทั้งประเทศ ที่อยู่ที่ 42.3 ชั่วโมงต่อสัปดาห์ ขณะที่คนมีคู่ (แต่งงานแล้ว) มีชั่วโมงการทำงานเฉลี่ย 40.9 ชั่วโมงต่อสัปดาห์
นอกจากนี้ จากผลการจัดอันดับ Best and Worst Cities for Work - Life Balance ปี 2565 ของบริษัท Kisi37 พบว่า กรุงเทพฯ อยู่ในอันดับที่ 5 ของเมืองที่แรงงานทำงานหนักที่สุดในโลก ซึ่งสภาพการณ์ดังกล่าว ชี้ให้เห็นว่า การที่คนโสดต้องใช้เวลา ส่วนใหญ่ไปกับการทำงาน ทำให้ไม่มีโอกาสในการมองหาคู่อย่างจริงจัง จึงเลือกที่จะอยู่เป็นโสดและมองหาเป้าหมายอื่น
สอดคล้องกับทิพวรรณ ศิริสัมพันธ์ (2562) ที่ระบุว่า สาเหตุที่ผู้หญิงเลือกครองตัวเป็นโสดมากขึ้นมาจากความไม่สมดุลระหว่างเวลาการทำงานและการสร้างครอบครัวซึ่งไม่สามารถให้ความสำคัญไปพร้อมกันได้งานสังคมสงเคราะห์ จันทร์ - ศุกร์ เวลา 08.00 - 16.00 น.
งานสังคมสงเคราะห์
วัน เวลาทำการ : จันทร์ - ศุกร์ เวลา 08.00 - 16.00 น.
เบอร์ติดต่อ : 02 2842331 ต่อ 306
งานสังคมสงเคราะห์ตั้งอยู่บริเวณชั้น 3 (ห้องเบอร์ 1)
งานสังคมสงเคราะห์ของศูนย์บริการสาธารณสุข เป็นการปฏิบัติงานครอบคลุมบริการ 4 ด้าน
คือการป้องกันปัญหา การแก้ไข การบำบัดฟื้นฟู และการพัฒนาให้กับผู้รับบริการในกลุ่มเป้าหมาย 5 กลุ่มด้วยกัน คือกลุ่มเด็ก สตรี ผู้สูงอายุ คนพิการ และประชาชนทั่วไป โดยให้บริการทั้งในเชิงรับ และเชิงรุก
เชิงรับ เป็นการให้ความช่วยเหลือผู้รับบริการในการแก้ปัญหา ฟื้นฟูสมรรถภาพ โดยรับการส่งต่อจากแพทย์ คลินิกต่างๆ ชุมชน และจากหน่วยงานอื่นๆ
เชิงรุก เป็นการให้บริการด้านการป้องกันปัญหาสังคมและการพัฒนา โดยจัดกิจกรรมเพื่อป้องกันปัญหาสังคมต่างๆ ที่อาจเกิดขึ้นกับกลุ่มเป้าหมายทางสังคมสงเคราะห์ โดยอาศัยแนวคิดและกระบวนการทางสังคมสงเคราะห์ในการปฏิบัติงาน และยึดผู้รับบริการเป็นศูนย์กลางในการจัดบริการเพื่อความเป็นอยู่ที่ดีขึ้นของประชาชน
ขอบเขตการให้บริการ
1. การให้ความช่วยเหลือ
- ช่วยเหลือเด็กที่มีปัญหาโภชนาการ
- ช่วยเหลืออาหารเสริมแก่สตรีมีครรภ์ มารดาติดเชื้อเอดส์ หรือผู้สูงอายุที่มีปัญหาสุขภาพ
- พิจารณาส่งต่อเพื่อรับการบำบัดรักษา กรณีต้องรักษาต่อเนื่องในกลุ่มผู้ด้อยโอกาส
- ส่งต่อเพื่อขอรับการช่วยเหลือกายอุปกรณ์ สำหรับคนพิการ
- ส่งต่อเพื่อรับบริการ ลดภาวะเครียดหรือความวิตกกังวล ที่มีผลต่อการดำเนินชีวิตประจำวัน
- จัดหาสถานที่และบริการที่เหมาะสมสำหรับเด็ก สตรี ผู้สูงอายุที่ขาดผู้ดูแล ถูกทอดทิ้ง ถูกกระทำทารุณหรือถูกล่วงเกินทางเพศ
- จัดหาแหล่งสนับสนุนการประกอบอาชีพ และการเสริมรายได้ให้แก่ผู้มีปัญหาเศรษฐกิจ
- ส่งต่อหน่วยงานที่จัดหางานกรณีว่างงาน
- ช่วยเหลือนักเรียนที่มีปัญหาการศึกษาให้สามารถศึกษาต่อไปได้ตามความสามารถ
- ช่วยเหลือครอบครัวที่มีปัญหา ให้สามารถดำรงชีวิตได้ตามอัตภาพ
- ช่วยให้ผู้ที่ขาดสิทธิทางกฎหมาย เข้าถึงบริการของรัฐได้ตามสิทธิพึงได้รับ เช่น การขึ้นทะเบียนคนพิการ เป็นต้น
- จัดกิจกรรม/โครงการเพื่อป้องกันและแก้ไขปัญหา
2. บริการให้คำปรึกษา
- ด้านสุขภาพ เช่น การขาดสารอาหาร ความพิการ เจ็บป่วยเรื้อรัง ติดยาเสพติด โรคเอดส์ เป็นต้น
- ด้านจิตใจ เช่น มีภาวะเครียด หรือมีความวิตกกังวล เป็นต้น
- ด้านปัญหาขาดการดูแล ถูกทอดทิ้ง หรือถูกกระทำทารุณ
- ด้านปัญหาความสัมพันธ์ในครอบครัว หรือความสัมพันธ์กับผู้อื่นในสังคม
- ด้านปัญหาครอบครัว เศรษฐกิจ การงาน และอาชีพ ด้านปัญหาการใช้สิทธิทางกฎหมายในการใช้บริการของรัฐ เช่น การเข้าเรียนในโรงเรียน การขึ้นทะเบียนคนพิการ การใช้สิทธิด้านการรักษาพยาบาล เป็นต้น
ศูนย์บริการสาธารณสุข 23 สี่พระยา วันที่ 2-13 กันยายน 2567
สำนักงานเขตบางรัก ร่วมกับ ศูนย์บริการสาธารณสุข 23 สี่พระยา และ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับน้องหมา-แมว ในพื้นที่เขตบางรัก ระหว่างวันที่ 2-13 กันยายน 2567 งานนี้ฟรีไม่มีค่าใช้จ่าย! ตั้งแต่เวลา 10.00 - 12.00 น.
2 ก.ย. 67 ชุมชนศรีเวียง
3 ก.ย. 67 ชุมชนซอยสองพระ
4 ก.ย. 67 ชุมชนตรอกขุนนาวา
5 ก.ย. 67 ชุมชนซอยพระนคเรศ
6 ก.ย. 67 ชุมชนตรอกห้านาย
9 ก.ย. 67 ชุมชนซอยหลังวัดแก้วแจ่มฟ้า
10 ก.ย. 67 ซอยสมบูรณ์ปัญญา
11 ก.ย. 67 ชุมชนซอยพิพัฒน์ 2
12 ก.ย. 67 ชุมชนซอยสันติภาพ
13 ก.ย. 67 ชุมชนซอยหลังวัดหัวลำโพง
สอบถามเพิ่มเติม: ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02 236 1395 ต่อ 6215
หากหลีกเลี่ยงการโฆษณาเกินจริงที่ไม่จำเป็น เราก็สามารถเตรียมสังคมให้พร้อมสำหรับเทคโนโลยีอันน่าทึ่งเหล่านี้ได้ โดยที่เราไม่สร้างแรงกดดันที่มากเกินไปให้กับนักประดิษฐ์และบริษัทต่างๆ
นอกจากนี้ เราต้องมองเทคโนโลยีที่ก้าวล้ำอย่างสมจริงด้วย ซึ่งอาจเป็นเรื่องยากที่สุด เนื่องจากข่าวคราวเกี่ยวกับโซลูชันด้านการดูแลสุขภาพที่ยอดเยี่ยมสามารถทำให้เราประหลาดใจได้ทุกวัน หากไม่อยากใช้ชีวิตอยู่ในนิยายวิทยาศาสตร์ เราจำเป็นต้องมีความระมัดระวังและมีสติสัมปชัญญะ
สนับสนุนยาและเวชภัณฑ์ ให้กับอุทยานแห่งชาติเขาคิชฌกูฏ
“Green Health Care&Share” 2023.01.06 โรงพยาบาลกรุงเทพจันทบุรี สนับสนุนยาและเวชภัณฑ์ ให้กับอุทยานแห่งชาติเขาคิชฌกูฏ จ.จันทบุรีและคิวรถขึ้นนมัสการรอยพระพุทธบาท เพื่อใช้สำหรับดูแลผู้แสวงบุญที่เดินทางมางานประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ประจำปี 2556 ที่จะจัดขึ้นระหว่างวันที่ 22 มกราคม ถึง 22 มีนาคม 2566
ส่งมอบอุปกรณ์ทางการแพทย์ ให้ รพ.สต. 2 แห่ง
Green Health Care&Share 2023.02.08 โรงพยาบาลกรุงเทพจันทบุรี โดย นายแพทย์สมชาย ภูนวกุล ผู้อำนวยการ คุณวิรัช สุรจิต ผู้อำนวยการฝ่ายบริหาร, คุณลัคณา เจริญรูป ผู้จัดการฝ่ายการตลาด เป็นตัวแทนส่งมอบอุปกรณ์ทางการแพทย์ อาทิ โต๊ะคร่อมเตียง (OVER BED) 8 คัน, เตียงผู้ป่วย 3 เตียง, เสาน้ำเกลือ 4 ต้น ให้กับ 1. โรงพยาบาลส่งเสริมสุขภาพตำบลโขมง 2. โรงพยาบาลส่งเสริมสุขภาพตำบลทุ่งเบญจา เพื่อสนับสนุนและร่วมมือในการดูแลด้านสาธารณสุขให้แก่หมู่บ้านสามารถนำไปใช้ดูแลประชาชนในพื้นที่ให้เกิดประโยชน์สูงสุด โรงพยาบาลกรุงเทพจันทบุรีหวังว่าอุปกรณ์เหล่านี้จะเป็นประโยชน์ในการดูแลรักษาผู้ป่วยให้กับทางโรงพยาบาลต่อไป เมื่อวันที่ 8 กุมภาพันธ์ 2566
ส่งมอบอุปกรณ์ทางการแพทย์ โรงพยาบาลส่งเสริมสุขภาพตำบลรำพัน ท่าใหม่ จันทบุรี
Green Health Care&Share 2023.02.14 โรงพยาบาลกรุงเทพจันทบุรี โดย คุณวิรัช สุรจิต ผู้อำนวยการฝ่ายบริหาร เป็นตัวแทนส่งมอบอุปกรณ์ทางการแพทย์ ได้แก่ โต๊ะคร่อมเตียง (OVER BED) 2 คัน, เตียงผู้ป่วย 4 เตียง, เสาน้ำเกลือ 1 ต้น ให้กับ
โรงพยาบาลส่งเสริมสุขภาพตำบลรำพัน ท่าใหม่ จันทบุรี เพื่อสนับสนุนและร่วมมือในการดูแลด้านสาธารณสุขให้แก่หมู่บ้านสามารถนำไปใช้ดูแลประชาชนในพื้นที่ให้เกิดประโยชน์สูงสุดต่อไป เมื่อวันที่ 14 กุมภาพันธ์ 2566
23 มิถุนายน 2565 ให้บริการที่ : โรงเรียนผู้สูงอายุ จังหวัดศรีสะเกษ
แจ้งข่าวประชาสัมพันธ์ สำหรับชาวศรีสะเกษ เตรียมพบกับหน่วยเคลื่อนที่ตรวจสุขภาพตา ของโรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ ในวันพฤหัสบดี ที่ 23 มิถุนายน 2565
ให้บริการที่ : โรงเรียนผู้สูงอายุ จังหวัดศรีสะเกษได้เลยนะคะ ตั้งแต่เวลา 09:00-16:00น. #ข้าราชการทุกๆหน่วยงาน ประชาชนที่อยู่บริเวรใกล้เคียง สามารถเดินทางเข้ารับการตรวจได้ที่หน่วยบริการได้เลยค่ะ สอบถามข้อมูลเพิ่มเติมโทร : 063-8722461 หรือ 043-811-757Day2 : 23 สิงหาคม 2565 เปิดประชุมคณะทำงานด้านสุขภาพภายใต้ APEC Health Week
ปลัดกระทรวงสาธารณสุขเปิดการประชุมคณะทำงานด้านสุขภาพ ภายใต้ APEC Health Week เผยเป็นการประชุมด้านสุขภาพนานาชาติครั้งแรกในไทย หลังโควิดระบาด ครอบคลุมทั้งประเด็นสุขภาพ เศรษฐกิจและนวัตกรรม ช่วยสมาชิกเขตเศรษฐกิจเพิ่มความพร้อมรับมือวิกฤตสุขภาพและฟื้นฟูเศรษฐกิจ
นพ.เกียรติภูมิ วงศ์รจิต ปลัดกระทรวงสาธารณสุข เป็นประธานเปิดการประชุมคณะทำงานด้านสุขภาพ (Health Working Group: HWG) SOM3/2022 ซึ่งเป็นหนึ่งในกิจกรรมการจัดประชุม APEC Health Week ระหว่างวันที่ 22-26 สิงหาคม 2565 ที่กระทรวงสาธารณสุขเป็นเจ้าภาพในการจัดประชุมระดับรัฐมนตรีสาธารณสุขของเขตเศรษฐกิจเอเปค ภายใต้หัวข้อ “Open to Partnership. Connect with the World. Balance Health and the Economy” หรือเปิดกว้างสร้างสัมพันธ์กับภาคี เชื่อมโยงกันกับโลก สู่สมดุลระหว่างสาธารณสุขและเศรษฐกิจ
นพ.เกียรติภูมิกล่าวว่า การประชุมคณะทำงานด้านสุขภาพ (Health Working Group: HWG) SOM 3/2022 ถือเป็นการประชุมด้านสุขภาพระดับนานาชาติครั้งแรกในประเทศไทย หลังจากการระบาดของโรคโควิด 19 โดยมีเป้าหมายคือการช่วยสร้างความตื่นตัวในระดับสากลทั่วภูมิภาคเอเปค เพื่อฟื้นฟูเศรษฐกิจและสุขภาพหลังวิกฤตโควิด 19 และช่วยเพิ่มระดับความพร้อมในการรับมือความท้าทายใหม่ๆ ไปพร้อมกัน เปิดรับทุกโอกาสจากการเรียนรู้และแบ่งปันประสบการณ์จากสมาชิกเขตเศรษฐกิจทั่วทุกมุมโลก ทั้งหมดนี้เพื่อส่งเสริมและสนับสนุนการทำงานร่วมกันระหว่างแต่ละเขตเศรษฐกิจ เพื่อเพิ่มมูลค่าด้านสุขภาพ ซึ่งนำไปสู่การเติบโตทางเศรษฐกิจในที่สุด
นพ.เกียรติภูมิกล่าวว่า รายละเอียดของการประชุมมีความครอบคลุมทั้งเรื่องสุขภาพ เศรษฐกิจ และนวัตกรรมที่จะพัฒนาระบบสุขภาพโลกในอนาคต รวมถึงเสริมสร้างการวางแผนทางด้านสุขภาพ โดยทุกคนที่เข้าร่วมประชุมมีความสำคัญในการมาร่วมกันวิเคราะห์และแบ่งปันความคิดเห็นเกี่ยวกับประเด็นต่างๆ ที่มีความท้าทาย โดยเฉพาะด้านการดำเนินงานเพื่อให้มั่นใจว่าสมาชิกของเอเปคสามารถบรรลุเป้าหมายที่ตั้งไว้ได้ และเชื่อว่าผู้เข้าร่วมประชุมจะได้รับแรงบันดาลใจจากประสบการณ์ที่ได้รับการแบ่งปันจากสมาชิกเขตเศรษฐกิจ เพลิดเพลินกับบรรยากาศของประเทศไทย และการประชุมมีประสิทธิผลและประสบความสำเร็จตามเป้าหมาย
Day2 : 23 สิงหาคม 2565 - ประชุมคณะทำงาน "สุขภาพหนึ่งเดียว" หรือ One Health
ที่ประชุมคณะทำงานสุขภาพ APEC ถกเข้ม การใช้แนวคิด “สุขภาพหนึ่งเดียว” หรือ One Health ช่วยสร้างเศรษฐกิจ การเข้าถึงวัคซีนตลอดช่วงชีวิต จ่อร่างข้อตกลงร่วมสร้างแนวทางดำเนินการให้บรรลุเป้าหมาย “ปุตราจายา 2040” ให้เป็นทิศทางเดียวกันเน้นนวัตกรรม เทคโนโลยีดิจิทัล รับมือภาวะฉุกเฉินและโรคอุบัติใหม่
นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข กล่าวว่า วันนี้เป็นวันที่สองของการประชุม APEC Health Week ซึ่งเป็นการประชุมของคณะทำงานด้านสุขภาพ (Health Working Group : HWG) APEC ที่เป็นเจ้าหน้าที่ระดับสูงด้านการแพทย์และสาธารณสุข โดยมีการทบทวนยุทธศาสตร์และแผนปฏิบัติการว่าจะดำเนินการอย่างไร เพื่อให้บรรลุตามข้อตกลงวิสัยทัศน์ปุตราจายาของเอเปค ค.ศ.2040 การปรับปรุงแผนยุทธศาสตร์ปี 2021-2024 และยุทธศาสตร์ The North Star : A 2030 ที่เน้นเรื่องของนวัตกรรมและเทคโนโลยีดิจิทัลในการดูแลด้านสุขภาพและเศรษฐกิจเพิ่มคุณภาพชีวิตของประชากรในภูมิภาค การเตรียมตัวรับมือภาวะฉุกเฉินด้านสาธารณสุขและโรคอุบัติใหม่การตอบสนอง ป้องกัน ควบคุมโรคติดต่อ และการฟื้นฟู การดูแลสุขภาพวัยชรา โภชนาการเด็ก และนวัตกรรมทางการแพทย์ เพื่อสร้างความเข้มแข็งระบบสุขภาพ และให้ประชากรในภูมิภาคมีสุขภาพที่ดี โดยแต่ละสมาชิกเขตเศรษฐกิจได้มาแสดงความคืบหน้าของแผนการดำเนินงาน โดยจะมีการร่างข้อตกลงร่วมเพื่อให้การดำเนินงาน
ของสมาชิกเขตเศรษฐกิจเป็นไปในทิศทางเดียวกัน
นายอนุทินกล่าวว่า นอกจากนี้ ยังมีการประชุมโต๊ะกลมพิจารณาช่องว่างและความท้าทายของการดำเนินงานให้บรรลุเป้าหมายแผนปฏิบัติงาน และแบ่งปันแนวทางการดำเนินงานที่ประสบมีความสำเร็จ หารือเรื่องการจัดลำดับการเข้าถึงวัคซีนตลอดช่วงชีวิตของคนทั่วไป การสร้างภูมิคุ้มกันด้านการเงินเพื่อสุขภาพ, การสร้างสมดุลสุขภาพและเศรษฐกิจในเรื่องของ “สุขภาพหนึ่งเดียว” หรือ One Health ว่าจะมาช่วยทำให้ระบบเศรษฐกิจเข้มแข็งขึ้นได้อย่างไร หรือการลดปัจจัยเสี่ยงด้านสุขภาพที่จะกระทบเศรษฐกิจ รวมถึงการเดินทางที่ปลอดภัยและการใช้ใบรับรองวัคซีนประกอบการเดินทางทำอย่างไรให้ทั้งรัฐบาลและภาคเอกชนดำเนินการและเข้าถึงอย่างไร้รอยต่อ
สำหรับบูธนิทรรศการต่างๆ ที่กระทรวงสาธารณสุขจัดเตรียมไว้ ก็แสดงถึงการนำสุขภาพมาช่วยสร้างหรือฟื้นตัวด้านเศรษฐกิจภายหลังพ้นการระบาดของโรคโควิด 19 ทั้งเรื่องของเมดิคัล ฮับ การบริการสุขภาพและทางการแพทย์ระดับสูง ผลิตภัณฑ์สุขภาพต่างๆ การนวดไทยและสปา ซึ่งได้รับความสนใจจากผู้เข้าร่วมประชุมเป็นอย่างมาก
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบึงกุ่ม
Cafe Amazon for Chance สาขา 5 โรงพยาบาลแหลมฉบัง
Cafe Amazon for Chance สาขา 5 โรงพยาบาลแหลมฉบัง
ร่วมสนับสนุนโดยบริษัท ThaiOil
ดำเนินการโดย ผู้พิการทางการได้ยิน
ตั้งอยู่ที่ โรงพยาบาลแหลมฉบัง ซอย ทุ่งสุขลา ตำบลทุ่งสุขลา อำเภอศรีราชา ชลบุรี 20230
+66659298127
ระบบขึ้นทะเบียนผู้ประกันตนตามมาตรา 40 LINK
การสมัครและขึ้นทะเบียนเป็นผู้ประกันตนตามมาตรา 40
สมัครขึ้นทะเบียน
ตามพระราชกฤษฎีกากำหนดหลักเกณฑ์และอัตราการจ่ายเงินสมทบ ประเภทของประโยชน์ทดแทน ตลอดจนหลักเกณฑ์และเงื่อนไขแห่งสิทธิในการรับประโยชน์ทดแทนของบุคคลซึ่งสมัครเป็นผู้ประกันตน พ.ศ. 2561 และพระราชกฤษฎีกากำหนดคุณสมบัติของบุคคลซึ่งอาจสมัครเข้าเป็นผู้ประกันตน พ.ศ. 2561 มีผลใช้บังคับตั้งแต่วันที่ 28 มีนาคม 2561 นั้น
1. คุณสมบัติของผู้สมัคร
1.1 มีสัญชาติไทย
1.2 เป็นชนกลุ่มน้อยซึ่งอพยพเข้ามาอาศัยในประเทศไทย โดยมีมติคณะรัฐมนตรีผ่อนผันให้อาศัยอยู่ในประเทศไทยได้เป็นการชั่วคราวเป็นกรณีพิเศษ ที่มีบัตรประจำตัวคนซึ่งไม่มีสัญชาติไทย โดยเลขประจำตัวหลักแรกเป็นเลข 6 หรือ เลข 7
1.3 เป็นบุคคลซึ่งไม่มีสัญชาติไทยที่ได้รับการผ่อนผันให้อยู่ในประเทศไทยได้เป็นการชั่วคราว เพื่อรอการส่งกลับ ที่มีบัตรประจำตัวคนซึ่งไม่มีสัญชาติไทย โดยเลขประจำตัวหลักแรกเป็นเลข 0 ทั้งนี้ ไม่รวมถึงกรณีที่มีบัตรประจำตัวคนซึ่งไม่มีสัญชาติไทยแต่มีเลขประจำตัวหลักแรกและหลักที่สองเป็นเลข 0 (00)
1.4 ผู้สมัครต้องมีอายุไม่ต่ำกว่า 15 ปีบริบูรณ์ และไม่เกิน 65 ปีบริบุูรณ์
1.5 ไม่เป็นผู้ประกันตนตามมาตรา 33 และมาตรา 39
1.6 ไม่เป็นสมาชิกของกองทุนบำเหน็จบำนาญข้าราชการ กองทุนบำเหน็จบำนาญข้าราชการกรุงเทพมหานคร กองทุนบำเหน็จบำนาญข้าราชการท้องถิ่น หรือไม่เป็นสมาชิกกองทุนของรัฐวิสาหกิจหรือหน่วยงานอื่นของรัฐที่มีลักษณะอย่างเดียวกับกองทุนบำเหน็จบำนาญของส่วนราชการ รวมทั้งไม่เป็นเจ้าหน้าที่ของรัฐที่อยู่ภายใต้บังคับตามกฎหมายว่าด้วยบำเหน็จบำนาญข้าราชการ กฎหมายว่าด้วยบำเหน็จบำนาญข้าราชการกรุงเทพมหานคร หรือกฎหมายว่าด้วยบำเหน็จบำนาญข้าราชการท้องถิ่น
1.7 หากเป็นบุคคลซึ่งเป็นผู้พิการ ให้ระบุลักษณะหรืออาการของผู้พิการโดยละเอียด (ยกเว้น ผู้พิการทางสติปัญญาและผู้พิการที่ไม่อาจรับรู้สิทธิที่พึงจะได้รับจากการเป็นผู้ประกันตนตามมาตรา 40 ไม่สามารถสมัครและขึ้นทะเบียนเป็นผู้ประกันตนตามมาตรา 40 ได้)
2. หลักฐานการสมัคร
2.1 บัตรประจำตัวประชาชน หรือบัตรอื่นที่ทางราชการออกให้แทนบัตรประจำตัวประชาชน
2.2 แบบคำขอสมัครเป็นผู้ประกันตนตามมาตรา 40 (สปส.1-40) กรณีไม่สามารถลงลายมือชื่อได้ ให้ใช้การประทับลายนิ้วมือแทนการลงชื่อและให้มีผู้รับรองลายมือชื่อจำนวน 2 คน
3. สถานที่ในการสมัคร
3.1 สำนักงานประกันสังคมกรุงเทพมหานครพื้นที่ สำนักงานประกันสังคมจังหวัด/สาขา ทุกแห่งทั่วประเทศ (ยกเว้นสำนักงานใหญ่ในบริเวณกระทรวงสาธารณสุข)
3.2 อินเตอร์เน็ต WWW.sso.go.th/section40_regist
3.3 บริษัทเคาน์เตอร์เซอร์วิส เซเว่น อีเลฟเว่น (7-11)
4. ทางเลือกในการจ่ายเงินสมทบประกันสังคมมาตรา 40
มี 3 ทางเลือก ดังนี้
- ทางเลือกที่ 1 จ่ายเงินสมทบ 70 บาท/เดือน
สิทธิประโยชน์พื้นฐานคุ้มครอง 3 กรณี คือ กรณีประสบอันตรายหรือเจ็บป่วย กรณีทุพพลภาพ กรณีตาย
- ทางเลือกที่ 2 จ่ายเงินสมทบ 100 บาท/เดือน
สิทธิประโยชน์พื้นฐานคุ้มครอง 4 กรณี คือ กรณีประสบอันตรายหรือเจ็บป่วย กรณีทุพพลภาพ กรณีตาย และกรณีชราภาพ
- ทางเลือกที่ 3 จ่ายเงินสมทบ 300 บาท/เดือน
สิทธิประโยชน์พื้นฐานคุ้มครอง 5 กรณี คือ กรณีประสบอันตรายหรือเจ็บป่วย กรณีทุพพลภาพ กรณีตาย กรณีชราภาพ และกรณีสงเคราะห์บุตร
หมายเหตุ :
1) ผู้ประกันตนทางเลือกที่ 2 และทางเลือกที่ 3 สามารถจ่ายเงินสมทบเพิ่มเติม (ออมเพิ่ม) ได้ไม่เกิน 1,000 บาท ต่อเดือน
2) กำหนดให้รัฐบาลร่วมจ่ายเงินสมทบให้ผู้ประกันตนตามมาตรา 40 ไม่เกินกึ่งหนึ่งของเงินสมทบที่ได้รับจากผู้ประกันตน
5. ช่องทางการชำระเงินสมทบประกันสังคมมาตรา 40
5.1 เคาน์เตอร์บริการ
5.2 หักผ่านบัญชีเงินฝากธนาคาร
ชำระงวดปัจจุบัน ได้ที่
1. ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร (ธ.ก.ส.)
2. ธนาคารกรุงไทย จำกัด (มหาชน)
3. ธนาคารกรุงศรีอยุธยา (มหาชน)
4. ธนาคารออมสิน
5. ธนาคารไทยพาณิชย์ จำกัด (มหาชน)
6. ธนาคารกสิกรไทย จำกัด (มหาชน)
7. ธนาคารธนชาต จำกัด (มหาชน)
8. ธนาคารกรุงเทพ จำกัด (มหาชน)
9. ธนาคารทหารไทย จำกัด (มหาชน)
5.3 ช่องทางอื่น
ชำระงวดปัจจุบัน งวดล่วงหน้า 12 เดือน และออมเพิ่มไม่เกิน 1,000 บาท/เดือน ได้ที่ ไปรษณีย์ (ธนาณัติ)
เสียค่าธรรมเนียมตามที่ไปรษณีย์กำหนด
หมายเหตุ
1. การจ่ายเงินสมทบผ่านทางเคาน์เตอร์เซอร์วิส โปรดแจ้งพนักงานให้ชัดเจนว่าจะจ่ายเงินสมทบล่วงหน้าหรือจ่ายเงินออมเพิ่ม เพื่อไม่ให้จ่ายเงินผิดพลาด
2. จ่ายเงินสมทบผ่านการหักบัญชีธนาคาร ธนาคารจะหักเงินในบัญชีของผู้ประกันตน ทุกวันที่ 20 ของเดือน
3. ลืมหรือขาดส่งเงินสมทบ ไม่สามารถส่งเงินสมทบย้อนหลังได้ แต่ไม่ถือเป็นการสิ้นสุดความเป็นผู้ประกันตน สามารถส่งเงินสมทบงวดปัจจุบันและส่งเงินล่วงหน้าได้ไม่เกิน 12 เดือน
4. เงินสมทบที่ผู้ประกันตนตามมาตรา 40 จ่าย สามารถนำมาลดหย่อนภาษีได้
5. ผู้ประกันตนตามมาตรา 40 ไม่ถูกตัดสิทธิรับเงินเบี้ยยังชีพผู้สูงอายุ
6. การแจ้งเปลี่ยนแปลงข้อมูล
6.1 เมื่อเป็นผู้ประกันตนแล้ว หากมีการเปลี่ยนแปลงข้อมูล เช่น เปลี่ยนคำนำหน้านามชื่อ - สกุล ที่อยู่ที่ติดต่อ เปลี่ยนแปลงสำนักงานประกันสังคมรับผิดชอบ หรือเปลี่ยนทางเลือกจ่ายเงินสมทบ เป็นต้น ให้ยื่นแบบแจ้งการเปลี่ยนแปลงข้อเท็จจริงหรือทางเลือกการจ่ายเงินสมทบผู้ประกันตนตามมาตรา 40 (สปส.1-40/1) พร้อมเอกสารที่เกี่ยวข้อง
6.2 กรณีขอเปลี่ยนทางเลือกการจ่ายเงินสมทบจะทำได้ปีละ 1 ครั้ง โดยเมื่อยื่นขอเปลี่ยนแปลงทางเลือกแล้ว จะมีผลในเดือนถัดไป
6.3 หากไม่ประสงค์เป็นผู้ประกันตนมาตรา 40 ต่อไป (ลาออก) ให้ยื่นแบบแจ้งความจำนงไม่ประสงค์เป็นผู้ประกันตนตามมาตรา 40 (สปส.1-40/2)
บริจาคโลหิต รพ.นครพนม LINK
บริจาคโลหิตสำหรับโรงพยาบาลนครพนม
บริจาคได้ที่ธนาคารเลือด ชั้น 3 อาคารอำนวยการฯ
ทุกวันไม่เว้นวันหยุดราชการ เช้า 08.30-11.40 น. บ่าย 13.00-15.30 น.
สอบถามเพิ่มเติมโทรศัพท์ 0-4219-9222 ต่อ 1060
และที่โรงพยาบาลประจำอำเภอทุกแห่ง เพื่อไว้ช่วยผู้ป่วยและภาวะวิกฤต [
กรมประชาสัมพันธ์]
หน่วยรับบริจาค มค 64
6 มค อ.ท่าอุเทน
13 มค อ.ธาตุพนม
20 มค อ.โพนสวรรค์
27 ตค อ.นาทม
4. กรอกหมายเลขอ้างอิง (Reference ID) และหมายเลข COE (COE ID) ลงไปตามรูปภาพ
หมายเหตุ:
- หมายเลขอ้างอิง (Reference ID) มีจำนวน 6 หลัก และเป็นหมายเลขเดียวกันกับที่ระบบสร้างขึ้นมาเมื่อตอนที่ผู้เดินทางขอ COE
- หากกรอกข้อมูลผิด 3 ครั้ง บัญชีจะถูกล็อกเป็นเวลา 5 นาที หลังจากนั้นจะสามารถกลับมากรอกข้อมูลได้อีกครั้ง
ต้องมีคำแนะนำกับลูกค้าสำหรับเมนูกัญชาด้วยหรือไม่
มีค่ะ เราจะมีคำเตือนต่างๆ อยู่ในเมนูว่ามีอะไรบ้าง ส่วนใครที่ถามเราก็จะบอกตามรายละเอียดที่ทางเราได้ศึกษาและได้ข้อมูลมา
ลำปาง เทศกาลปี๋ใหม่เมืองกับจ๊างไทย (เทศกาลสงกรานต์กับช้างไทย) 11-15 เมษายน 2564
เทศกาลปี๋ใหม่เมืองกับจ๊างไทย (เทศกาลสงกรานต์กับช้างไทย)
11-15 เมษายน 2564
place สถาบันคชบาลแห่งชาติ ศูนย์อนุรักษ์ช้างไทย อ.ห้างฉัตร จังหวัดลำปาง
เทศกาลปี๋ใหม่เมืองกับจ๊างไทย (เทศกาลสงกรานต์กับช้างไทย)
กิจกรรมสืบสานประเพณีสงกรานต์แบบล้านนา ได้แก่ ทำบุญกับช้าง เพลิดเพลินและสนุกสนานและความฉลาดของช้าง
ภูมิภาค : ภาคเหนือ
จังหวัด : ลำปาง
ติดต่อสอบถาม : สถาบันคชบาลแห่งชาติ (ศูนย์อนุรักษ์ช้างไทย)
เบอร์โทร : 054-829322, 054-829333
สุราษฎร์ธานี - ไม่ต้องกักตัว LINK
8 เมษายน 2564
มติคณะกรรมการโรคติดต่อจังหวัดสุราษฎร์ธานี
มีมติให้เดินทางเข้าสุราษฎร์ธานีไม่ต้องกักตัว แต่ให้ปฏิบัติตามมาตรการกระทรวงสาธารณสุขและ ศบค.อย่างเคร่งครัด
1. เดินทางเข้าสุราษฎร์ธานี ไม่ต้องกักตัว
สำหรับผู้มาจาก กรุงเทพฯ ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม ให้รายการตัว
QR Code Save Surat
2. งด
งดรวมกลุ่มสาดน้ำ จัดคอนเสิร์ต งดเล่นสงกรานต์ปะแป้ง งดเล่นปาร์ตี้โฟม หลีกเลี่ยงการเลี้ยงสังสรรค์
ยึดหลัก D-M-H-T-T อย่างเคร่งครัด
D-เว้นระยะห่าง- M-สวมหน้ากากอนามัย H-ล้างมือบ่อยๆ
รพ.สุราษฎร์ธานี โทร 077-915600
การฉีดวัคซีนโควิดของไทย
ในเรื่องการฉีดวัคซีนโควิดของไทย ช่วงเดือนแรก เราได้วัคซีนล็อตแรก 200,000 โดสและต้องรอระยะเวล า21วันหลังการฉีดวัคซีนเข็มแรก จึงจะฉีดวัคซีนเข็มสองได้ครับ เลยทำให้ฉีดได้น้อย
ส่วนเดือนเมษายนเราได้วัคซีนล็อตสอง อีก 800,000โดส เริ่มฉีดวันที่01/04/64 และทางเจ้าหน้าที่เร่งวัคซีนล็อตสามที่ตามปกติต้องเข้ามาในเดือน พ.ค.64 แต่เร่งให้เข้ามาก่อน ในวันที่10/04/64 อีก 1,000,000 โดส เพื่อให้ การฉีดวัคซีนทำได้มากกว่าเดิมและเร็วกว่าเดิม และสั่งซื้อวัคซีนซิโนแวคอีก500,000โดสจะเข้ามาปลายเดือน เม.ย.64
โดยในเดือน มี.ค.64 ในวัคซีนล็อตแรก200,000โดส มีอัตราการฉีดวัคซีนเข็มแรก(วันที่28/02/64-22/03/64) เฉลี่ย 4,639โดสต่อวัน แต่วัคซีนเข็มสอง(วันที่23-31/03/64) ฉีดได้ เฉลี่ย 9,966โดสต่อวัน
ในปัจจุบัน เดือน เม.ษ.64 ข้อมูล ณ
-วันที่01/04/64 เราฉีดวัคซีนได้ 12,897โดสต่อวัน
-วันที่02/04/64 เราฉีดวัคซีนได้ 27,240โดสต่อวัน
-วันที่03/04/64 เราฉีดวัคซีนได้ 12,372โดสต่อวัน
-วันที่04/04/64 เราฉีดวัคซีนได้ 13,230โดสต่อวัน
-วันที่05/04/64 เราฉีดวัคซีนได้ 37,397โดสต่อวัน
-วันที่06/04/64 เราฉีดวัคซีนได้ 29,108โดสต่อวัน
-วันที่07/04/64 เราฉีดวัคซีนได้ 67,763โดสต่อวัน
-วันที่08/04/64 เราฉีดวัคซีนได้ 74,622โดสต่อวัน
-วันที่09/04/64 เราฉีดวัคซีนได้ 71,006โดสต่อวัน
-วันที่10/04/64 เราฉีดวัคซีนได้ 18,016โดสต่อวัน
-วันที่11/04/64 เราฉีดวัคซีนได้ 14,656โดสต่อวัน
Mix Jeeravat
ประกันภัยแพ้วัคซีนโควิด-19 กรุงเทพประกันภัย LINK
คุ้มครองการแพ้วัคซีนโควิด-19 เมื่อเจอ แพ้ แล้วจ่ายค่ารักษาพยาบาล พร้อมรับเงินปลอบขวัญเมื่อเข้าพักรักษาตัวในโรงพยาบาล รองรับประชาชนและบุคคากรทางการแพทย์ที่ได้รับการฉีดวัคซีน เบี้ยเริ่มเพียง 99 บาท
มิตซู ช.เอราวัณ คลับ นครปฐม ฉีดวัคซีนแล้ว ออกรถใหม่ ให้ส่วนลด 5,000 บาท LINK
มิตซู ช.เอราวัณ คลับ - Mitsu Ch.Erawan Club นครปฐม
ฉีดนี้...เพื่อครอบครัว คนรอบตัว และคนที่คุณรัก
- ลูกค้าเข้าศูนย์บริการหรือศูนย์สี หากฉีดวัคซีนแล้วได้ ส่วนลด100 บาท
- ลูกค้าออกรถใหม่ ให้ส่วนลด 5,000 บาท
เพียงโชว์หลักฐานอะไรก็ได้ที่แสดงว่าคุณได้รับวัค
ซีน ให้กับทีมงาน มิตซู ช.เอราวัณ นครปฐม
สนใจคลิ๊ก Inbox : m.me/mitsuch.erawan
หรือ Line : https://lin.ee/8b5s4e9
ข้อแนะนำสำหรับผู้ป่วยจิตเวช LINK
1. รับประทานยาต่อเนื่องและดูแลสุขภาพจิตของตัวเองให้คงที่โดยเฉพาะในช่วง 2 สัปดาห์ก่อน และ 2 สัปดาห์หลังฉีดวัคซีน
2. พักผ่อนให้เพียงพอ ไม่อดนอน ออกกำลังกาย ดูแลสุขภาพร่างกายให้แข็งแรง
3. ไม่ควรลดยา เพิ่มยา หรือปรับยาเอง เพราะอาจทำให้เกิดอาการข้างเคียงหรือถอนยาได้
4. ยาจิตเวชส่วนใหญ่ปลอดภัยต่อการฉีดวัคซีน
ยังไม่พบรายงานถึงปฏิกิริยาระหว่างยาจิตเวชกับวัคซีนโควิด 19 (ข้อมูล ณ วันที่ 28 wค 2564)
5. หากผู้ป่วยรู้สึกกังวลใจเกี่ยวกับการรักษา การรับประทานยาและการฉีดวัคซีน ควรปรึกษาจิตแพทย์ที่ดูแลรักษา
ผู้ป่วยจิตเวชและผู้มีความบกพร่องทางจิต เช่น เชาวน์ปัญญาบกพร่อง ออทิซึม โรคจิตเภท
และโรคทางอารมณ์ เป็นต้น อาจมีความยากลำบาก ในการเข้าถึงวัคซีนและมีความเสี่ยงจากอาการทางจิตที่ก่อให้เกิดอุปสรรคในการป้องกันการติดเชื้อของตนเอง ครอบครัวและชุมชนควรมีส่วนช่วยผู้ป่วยจิตเวชในการเข้าถึงวัคซีน
อ้างอิงจาก คำแนะนำเที่ยวกับการรับวัคซีนโควิด 19 สำหรับผู้ป่วยจิตเวชและญาติ และคำแนะนำการบริหารยาทางจิตเวช และวัคซีนโควิด 19 สำหรับจิตแพทย์และบุคลากรการแพทย์
สมุทรปราการ ลงทะเบียนรับเข็ม2 ในจังหวัด LINK
แบบลงทะเบียนฉีดวัคซีนป้องกันโควิด-19 เข็ม 2 ในจังหวัดสมุทรปราการ สำหรับผู้ที่เคยได้รับเข็ม 1 นอกจังหวัดสมุทรปราการ ท่านสามารถกรอกข้อมูล ผ่านลิงค์นี้ โดยกดตรงคำว่า ‼️Click‼️ เพื่อเข้ารับการฉีดวัคซีนโควิด - 19 เข็ม 2 ได้ที่ โรบินสัน จังหวัดสมุทรปราการ
สำนักงานเขตจตุจักร จัดหน่วยเคลื่อนที่ให้บริการ 10-16 กันยายน 2564 LINK
สำนักงานเขตจตุจักร ร่วมศูนย์บริการสาธารณสุข 17 (ประชานิเวศน์) และศูนย์บริการสาธารณสุข 51 (วัดไผ่ตัน) จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในพื้นที่เขตจตุจักร
จึงขอเชิญชวนประชาชนนำสัตว์เลี้ยง สุนัขและแมวที่มีสุขภาพแข็งแรง อายุ 3 เดือนขึ้นไป ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯ เคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่าย ตั้งแต่วันที่ 10-16 กันยายน 2564
หมายเหตุ วันที่ 14 ก.ย.64 และวันที่ 16 กันยายน กรณีวันที่มีสถานที่ฉีดวัคซีน 2 จุด จุดที่ 1 เวลา 09.00-10.00 น. และจุดที่ 2 เวลา 10.30– 11.30น.
ศูนย์บริการวิชาการ สถาบันเทคโนโลยีจิตรลดา LINK
ศูนย์บริการวิชาการ สถาบันเทคโนโลยีจิตรลดา สถาบันที่จัดการศึกษาตามแนวพระราชดำริ "เรียนคู่งาน งานคู่เรียน" สร้างคนดี มีฝีมือ มีวินัยและจรรยาบรรณวิชาชีพ หลักสูตรอบรม และบริการวิชาการ จากสถาบันเทคโนโลยีจิตรลดา
พันธกิจ
- สอนในระดับประกาศนียบัตรวิชาชีพและปริญญาตรีแบบ "เรียนคู่งาน งานคู่เรียน"
- วิจัยและพัฒนาเทคโนโลยีและนวัตกรรมด้านวิชาชีพ
- บริการวิชาการและวิชาชีพแก่ชุมชนและสังคม
- อนุรักษ์และส่งเสริมศิลปวัฒนธรรมไทย และเข้าใจวัฒนธรรมที่หลากหลาย
--------------
[1] พยาบาลชุมชนของประเทศสหราชอาณาจักรคือ พยาบาลวิชาชีพที่ต้องเรียนเพิ่มอีกประมาณ 1 ถึง 1½ ปี
[2] the germ of the primary/secondary/tertiary care distinction (The Dawson Report; London: HMSO, 1920)
[3] กฎหมายฉบับนี้ส่วนหนึ่งได้รับอิทธิพลมาจาก “Bismarck model” (ประกันสุขภาพเชิงบังคับที่อยู่ในภาครัฐและเก็บเบี้ยประกันสุขภาพจากประชาชน: Insurance based) ซึ่งเกิดขึ้นอย่างเป็นทางการครั้งแรกที่ประเทศเยอรมัน ตั้งแต่ปีค.ศ.1853 ในสมัยที่นายกรัฐมนตรีชื่อ Bismarck และค่อยๆ ถูกนำไปใช้ตามประเทศต่างๆ ในแถบทวีปยุโรป
[4] ในสมัยนั้นมีผู้เสียชีวิตจำนวนมากจากสงคราม ผู้ที่เป็นหม้ายในที่นี้จึงหมายถึง หญิงหม้าย เป็นหลัก
[5] แรงผลักดันสำคัญมาจากความรู้สึกที่ว่า ชาวอังกฤษมีความแน่วแน่เด็ดเดี่ยว และร่วมกันเสียสละ จนกระทั่งชนะสงครามโลกครั้งที่ 2 รัฐจึงพยายามออกกฎหมายที่จะทำให้เกิดประโยชน์สูงสุดต่อประชาชน โดยให้ความสำคัญเป็นอย่างยิ่งต่อผู้ด้อยโอกาส
[6] จากการขอความเห็น (plebiscite) จากกลุ่มแพทย์ของ British Medical Association (BMA) ในเดือนมกราคม 2548 พบว่า 84% ของแพทย์ ลงคะแนน (vote) ว่าไม่เห็นด้วยหรือต่อต้านการเกิดขึ้นของ National Health Service (NHS) แต่ด้วยทักษะทางการเมืองของ Aneurin Bevan ทำให้กฎหมาย NHS ประกาศใช้ในเดือนกรกฎาคม ค.ศ.1948
[7] ในที่สุดจึงเรียกรูปแบบการนำภาษีมาใช้ในลักษณะนี้ว่า “Beveridge model” แต่ผู้ที่มีบทบาทในการออกแบบทีสำคัญคือ Aneurin Bevan ซึ่งเป็นรัฐมนตรีว่าการกระทรวงสาธารณสุขในขณะนั้น
[8] Micheal Balint เป็นจิตแพทย์ชาวฮังการีแต่ย้ายถิ่นมาเปิดคลินิกส่วนตัว ทำหน้าที่เป็นแพทย์เวชปฏิบัติทั่วไปอยู่ในกรุง London ประเทศอังกฤษ
[9] โรงเรียนแพทย์ที่โน้มน้าวยากที่สุดคือโรงเรียนแพทย์ที่มีโรงพยาบาลขนาดใหญ่และมีการพัฒนาเทคโนโลยีทางการแพทย์ในระดับสูง
[10] พยาบาลวิชาชีพที่ประเทศสหราชอาณาจักรมีหลักสูตรการเรียนการสอน 3 ปีสำหรับผู้ที่มาเรียนเป็นพยาบาลเวชปฏิบัติมักมีประสบการณ์การทำงานเป็น Practice nurse มาก่อน
ทอม เบรดี้
กุมภาพันธ์ ควอเตอร์แบ็คตำนานวัย 44 ของ NFL แห่งทีมแทมป้าเบย์ บัคคาเนียร์ เผยในการให้สัมภาษณ์ว่าเขาติดโควิดในช่วงฉลองแชมป์ซุปเปอร์โบล์
ศูนย์โควิดกาฬสินธุ์ ออกประกาศสถานที่และเวลา เสี่ยง อ.เมือง กาฬสินธุ์ LINK
22 ธันวาคม 64 สื่อสารความเสี่ยง COVID-19 ในจังหวัดกาฬสินธ์ุ เริ่มออกประกาศ แจ้ง สถานที่ที่มีความเสี่ยงต่อการแพร่ระบาด ในพื้นที่ โดยแจ้งผู้ที่เดินทางไปยังสถานที่ เวลา ตามประกาศ ให้รายงานตัวต่อจนท.สธ.ที่รพ.สต. หรือ หน่วยบริการปฐมภูมิ รพ.กาฬสินธ์ุ หรือ รพ.ชุมชนใกล้บ้าน เพื่อประเมินความเสี่ยงจากการสัมผัสผู้ป่วยยืนยันรายที่ 10063 และ 10064 สายพันธุ์โอมิครอน ของจ.กาฬสินธ์ุ
สถานที่เสี่ยง
ร้านสวิกบาร์ ร้านคิกคาปู้บาร์ (ตลาดโรงสี)
สำนักงานที่ดินกาฬสินธ์ุ
สำนักงานบังคับคดีกาฬสินธ์ุ
ธ.กสิกรไทย สาขาบิ๊กซี กาฬสินธ์ุ
ทีมสอบสวนโรค สสจ.กาฬสินธ์ุ ร่วมกับ CDCU อ.เมือง กาฬสินธ์ุ ดำเนินการ
1.ค้นหาผู้สัมผัสเสี่ยงสูง พบจำนวน 9 ราย เป็นคนในครอบครัวและญาติ
2. SAT สสจ.กาฬสินธ์ุ ประสานทีม SAT ขอนแก่น
2.1 แจ้งสถานที่เสี่ยง ผู้่ป่วยยืนยันมีประวัติเดินทางไปศาลากลางขอนแก่น วันที่ 13 ธ.ค. 8-16.30 น.
2.2 ติดตามผู้มีประวัติเดินทางจากสนามบินสุวรรณภูมิ โดย Thai Smile เที่ยวบิน WE046 เวลา 18.15 น. มาลงสนามบินขอนแก่น
2.3 ติดตามผู้มีประวัติเดินทางด้วยรถตู้โดยสารสาธารณะ ขอนแก่น-มุกดาหาร เวลา 16.30 น. จากต้นทาง สถานีขนส่งจ.ขอนแก่นแห่งที่ 3
ขั้น 4: เตรียมเอกสารสำหรับการเดินทาง
สำหรับผู้ที่เดินทางเข้าโครงการ TEST & GO (ไม่กักตัว)
ที่ได้รับ QR Code ก่อนวันที่ 22 ธันวาคม 2564 ต้องใช้เอกสารดังนี้
- QR Code ที่ได้รับจากระบบ Thailand Pass
- หลักฐานยืนยันการจอง รร. SHA+ หรือ AQ 1 คืน ที่ระบุว่าได้จ่ายเต็มจำนวนแล้ว หรือจ่ายมัดจำอย่างน้อย 15,000 บาท และรวมค่าตรวจ RT-PCR 1 ครั้ง
- หลักฐานการฉีดวัคซีนครบโดส (เด็กอายุต่ำว่า 18 ปี ไม่ต้องใช้หลักฐานการฉีดวัคซีน หากเดินทางพร้อมผู้ปกครอง)
- ผลตรวจโควิด-19 แบบ RT-PCR อายุไม่เกิน 72 ชม. ก่อนเดินทาง (ยกเว้นเด็กอายุต่ำกว่า 6 ปี เดินทางพร้อมผู้ปกครอง)
- ไม่ต้องใช้ประกันสุขภาพ (ยกเว้นชาวต่างชาติ)
สำหรับผู้ที่เดินทางเข้าโครงการ SANDBOX (ไม่กักตัว แต่ต้องอยู่ในพื้นที่ ๆ กำหนด 7 วัน)
ต้องใช้เอกสารดังนี้
- QR Code ที่ได้รับจากระบบ Thailand Pass
- หลักฐานยืนยันการจอง รร. ที่ผ่านมาตรฐาน SHA Extra+ อย่างน้อย 7 วัน และหลักฐานการชำระค่าตรวจโควิด-19 ตามที่รัฐบาลกำหนด
- หลักฐานการฉีดวัคซีนครบโดส (เด็กอายุต่ำว่า 18 ปี ไม่ต้องใช้หลักฐานการฉีดวัคซีน หากเดินทางพร้อมผู้ปกครอง)
- ผลตรวจโควิด-19 แบบ RT-PCR อายุไม่เกิน 72 ชม. (ยกเว้นเด็กอายุต่ำกว่า 6 ปี เดินทางพร้อมผู้ปกครอง)
- ไม่ต้องใช้ประกันสุขภาพ (ยกเว้นชาวต่างชาติ)
สำหรับผู้ที่เดินทางเข้าโครงการ ALTERNATIVE QUARANTINE (กักตัวใน รร. 7 หรือ 10 วัน)
ต้องใช้เอกสารดังนี้
- QR Code ที่ได้รับจากระบบ Thailand Pass
- หลักฐานยืนยันการจอง รร. AQ 7 หรือ 10 วัน ที่ระบุว่าได้จ่ายเต็มจำนวนแล้ว หรือจ่ายมัดจำอย่างน้อย 15,000 บาท และรวมค่าตรวจโควิด-19 แบบ RT-PCR 2 ครั้ง
- หลักฐานการฉีดวัคซีนครบโดส เฉพาะสำหรับผู้ที่ประสงค์กักตัว 7 วัน (หากไม่มีหลักฐานการฉีดวัคซีนจะต้องกักตัว 10 วัน ยกเว้นเด็กอายุต่ำกว่า 18 ปี เดินทางพร้อมผู้ปกครอง)
- ผลตรวจโควิด-19 แบบ RT-PCR อายุไม่เกิน 72 ชม. (ยกเว้นสำหรับคนไทย และเด็กอายุต่ำกว่า 6 ปี เดินทางพร้อมผู้ปกครอง ไม่ต้องใช้ผลจตรวจฯ) อย่างไรก็ดี สถานเอกอัครราชทูตฯ ขอแนะนำให้คนไทยทุกคนตรวจ RT-PCR ก่อนขึ้นเครื่อง
- ไม่ต้องใช้ประกันสุขภาพ (ยกเว้นชาวต่างชาติ)
เขตดอนเมือง เตรียมความพร้อมศูนย์พักคอย ณ ศูนย์สร้างสุขทุกวัย ดอนเมือง LINK
ดอนเมือง เตรียมความพร้อมศูนย์พักคอยเพื่อส่งต่อ (Community Isolation)
5 ม.ค.65 นายนันทพงศ์ แก้วศรี ผู้อำนวยการเขตดอนเมือง พร้อมด้วยคณะผู้บริหารเขต ลงพื้นที่ตรวจการเตรียมความพร้อมศูนย์พักคอยเพื่อส่งต่อ (Community Isolation) ในด้านต่างๆ ให้อยู่ในสถานะ Standby Mode ซึ่งสามารถพร้อมเปิดให้บริการรองรับผู้โควิดได้ทันทีหากเกิดการแพร่ระบาดระลอกใหม่ ณ ศูนย์สร้างสุขทุกวัย เขตดอนเมือง ในการนี้ คณะผู้บริหารได้ตรวจเยี่ยมให้กำลังใจเจ้าหน้าในการปฏิบัติงานด้วย
บริจาคโลหิตกับกลุ่มเซ็นทรัล ห้างในพื้นที่ภาคใต้ 4 จุด
โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช กำหนดฉีดวันอังคารที่ 8 กุมภาพันธ์ 2565 LINK
โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช เปิดแผนฉีดวัคซีนป้องกันโควิด-19 เข็มแรก ไฟเซอร์ (ฝาสีส้ม) กลุ่มเป้าหมายเด็กนักเรียนอายุ 5-11 ปี ในพื้นที่อำเภอเมืองตาก จังหวัดตาก
วัน อังคาร ที่ 8 กุมภาพันธ์ 2565 เวลา 13.00 - 15.00 น. ณ บริเวณโดมหน้าเสาธง โรงเรียนอนุบาลตาก
สิ่งที่ต้องเตรียมมาด้วย
1. เอกสารแสดงความประสงค์ผู้ปกครองให้เด็กได้รับการฉีดวัคซีน
2. แบบคัดกรองก่อนรับบริการฉีดวัคซีน
หมายเหตุ
- ตามรายชื่อที่แจ้งประสงค์ฉีดกับโรงเรียนอนุบาลตาก รอบแรก 240 คน
- สำหรับนักเรียนอายุ 5-11 ปี ในพื้นที่อำเภอเมืองตาก ที่ประสงค์ฉีดวัคซีนสามารถแจ้งประสงค์ได้ที่โรงเรียนที่เรียนอยู่ และรอการนัดหมายฉีด
- ทางโรงพยาบาลฯ จะประกาศแผนฉีดวัคซีนรอบต่อไป ให้ทราบล่วงหน้าทันทีที่ได้รับการจัดสรรวัคซีนเพิ่มเติม
น้ำมันกัญชา (สูตร อ.เดชา) LINK
น้ำมันกัญชา (สูตร อ.เดชา) DTAM GANJA OIL (DEJA FORMULA) ผลิตโดยกรมการแพทย์แผนไทยและการแพทย์ทางเลือก เป็นตำรับยาที่ได้รับอนุญาตให้ผลิตในประเทศภายใต้การรักษาโรค กรณีจำเป็นสำหรับผู้ป่วยเฉพาะราย (Special Access Scheme)
ขนาดและวิธีใช้ - รับประทานขนาด 1 หยด ทางปาก แล้วปรับขนาดใช้ตามคำสั่งของแพทย์แผนไทยและแพทย์แผนปัจจุบัน
1) องค์กรแห่งนวัตกรรม (Innovation)
องค์กรแห่งนวัตกรรม (Innovation) บำรุงราษฎร์เป็นองค์กรที่เปิดรับนวัตกรรมเทคโนโลยีทางการแพทย์ใหม่ ๆ รวมถึงเทคนิคการรักษาแนวใหม่ โดยคำนึงถึงประสิทธิภาพในการวินิจฉัยและการรักษาโรคเพื่อให้เกิดผลลัพธ์ที่ดีที่สุด ยกตัวอย่างเทคโนโลยีการรักษา Minimally Invasive ที่มีความแม่นยำมากขึ้น แผลเล็ก ฟื้นตัวเร็ว และลดความเสี่ยงจากการติดเชื้อ อาทิ การรักษาโรคต่อมลูกหมากโตด้วยไอน้ำ (Water Vapor Therapy), การรักษาก้อนเนื้องอกชนิดปกติด้วยการจัดความเย็นจัด (Cryoablation) หรือ AI Lunit ที่ช่วยแพทย์ในการวินิจฉัยและวางแผนการรักษาได้แม่นยำและเหมาะสมมากขึ้น หรือหุ่นยนต์ดาวินซีที่เข้ามาช่วยศัลยแพทย์ในการผ่าตัดรักษาผู้ป่วยหลายระบบอวัยวะ (Robotic Assisted Surgery) รวมถึงการตรวจหาความผิดปกติทางพันธุกรรม (Genomics) เป็นต้น รศ. (พิเศษ) นพ.ทวี โชติพิทยสุนนท์ กล่าวเพิ่มเติมถึงการวิจัยว่า “ปัจจุบันยังมีการวิจัยของประเทศบราซิลที่ศึกษาถึงความสัมพันธ์ของการฉีดวัคซีนป้องกันไข้หวัดใหญ่ และอัตราความรุนแรงของโควิด-19 โดยเปรียบเทียบใน 2 กลุ่ม คือ
1. กลุ่มผู้ป่วยโควิด-19 ที่ได้ฉีดวัคซีนไข้หวัดใหญ่ในระยะ 1-3 เดือนที่ผ่านมา และ
2. กลุ่มผู้ป่วยโควิด-19 ที่ไม่ได้ฉีดวัคซีนไข้หวัดใหญ่
ผลปรากฎว่าการฉีดวัคซีนไข้หวัดใหญ่ในผู้ป่วยโควิด-19 จะช่วยลดอัตราการนอนในแผนกผู้ป่วยหนักได้ 7% ช่วยลดอัตราของผู้ป่วยต้องใช้เครื่องช่วยหายใจได้ถึง 17% ซึ่งสอดคล้องกับการศึกษาวิจัยต่างประเทศอีกหลายแห่ง ทั้งในสหรัฐอเมริกา และบราซิล ที่ระบุว่าการฉีดวัคซีนไข้หวัดใหญ่ส่งผลในเชิงบวกต่อการเจ็บป่วยของโควิด-19 สามารถลดอัตราการเสียชีวิตลงจากการติดเชื้อโควิด-19 ได้ถึง 10% ด้วยเช่นกัน”
ปัจจุบันวัคซีนป้องกันไข้หวัดใหญ่มี 2 ชนิด คือ ชนิด 3 สายพันธุ์ และชนิด 4 สายพันธุ์ ซึ่งได้ผลที่ดีทั้ง 2 ชนิด อย่างไรก็ตามด้วยความก้าวหน้าทางการแพทย์ จึงแนะนำให้ประชาชนฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ชนิด 4 สายพันธุ์ ซึ่งจะครอบคลุมเชื้อไข้หวัดใหญ่ได้กว้างกว่าชนิด 3 สายพันธุ์ โดยวัคซีนจะมีการเปลี่ยนชนิดสายพันธุ์ย่อยไปทุกปีตามที่องค์การอนามัยโลก (WHO) คาดว่าจะระบาดในปีนั้นๆ จึงมีความจำเป็นที่จะต้องฉีดเป็นประจำทุกปี เพื่อกระตุ้นระบบภูมิคุ้มกันในร่างกายให้พร้อมรับมือกับเชื้อในแต่ละปี ซึ่งสามารถเข้ารับฉีดวัคซีนได้ตามคลินิกเอกชน หรือโรงพยาบาลเอกชนทั่วประเทศ โดยจะเริ่มให้บริการวัคซีนไข้หวัดใหญ่ในฤดูกาลปี 2565 ชนิด 4 สายพันธุ์ ตั้งแต่ปลายเดือนมีนาคม - ธันวาคม 2565 ขณะที่วัคซีนไข้หวัดใหญ่ชนิด 3 สายพันธุ์ของภาครัฐบาล จะเริ่มให้บริการฉีดฟรีได้ที่หน่วยบริการสาธารณสุขหรือโรงพยาบาลในระบบบัตรทอง ประมาณเดือนพฤษภาคม 2565 เป็นต้นไป
ผู้สนใจสามารถศึกษาข้อมูลเกี่ยวกับโรคไข้หวัดใหญ่ และโรคติดเชื้อต่างๆ เพิ่มเติมได้ที่เว็บไซต์มูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่
http://www.ift2004.org/ หรือทางทางเพจของมูลนิธิส่งเสริมการศึกษาไข้หวัดใหญ่
แพ็กเกจคลอดแบบเหมาจ่าย ศูนย์สุขภาพสตรี จุฬารัตน์ 9 แอร์พอร์ต LINK
ศูนย์สุขภาพสตรี โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต ได้จัดแพ็กเกจการดูแลสุขภาพครรภ์และแพ็กเกจคลอดให้คุณแม่อย่างเหมาะสม
• คลอดปกติ 3 วัน 2 คืน เริ่มต้น 30,000 ห้อง VIP 38,000
• ผ่าตัดคลอด 4 วัน 3 คืน เริ่มต้น 40,000 ห้อง VIP 49,800
พร้อมของรับขวัญลูกน้อยฟรี หลายรายการ
สอบถามเพิ่มเติมได้ที่ ศูนย์สุขภาพสตรี โทร. 081-811-1236 หรือ 02-115-2111 ต่อ 1140
* รายการอาจมีการเปลี่ยนแปลงหรือแก้ไขโดยไม่ต้องแจ้งให้ทราบล่วงหน้า ท่านสามารถสอบถามได้ที่ศูนย์สุขภาพสตรี โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต
แนะนำ 14 สวนผลไม้จังหวัดตราด LINK
ททท.ตราด แนะนำ 14 สวนผลไม้ของจังหวัด ที่พร้อมรับนักท่องเที่ยวในฤดูแห่งผลไม้ที่มาถึงแล้ว อุดมด้วยผลไม้ อย่างทุเรียน เงาะ มะไฟ มังคุด ลองกอง สับประรด และอีกมากมาย ที่ตั้งสวนก็มีทั้งในฝั่งจังหวัดตราดและเกาะช้าง บริการก็มีทั้งบุฟเฟ่ต์หรือแบบซื้อทานสดๆ ในสวน และยังซื้อกลับบ้านเป็นของขวัญของฝาก แต่ละสวนอยู่ตรงไหนบ้าง คลิกไปดูข้อมูลที่เพจ ททท.ตราดได้เลย แต่ละสวนมีบริการอะไรบ้างระบุไว้แล้ว รวมทั้งที่อยู่ เบอร์ติดต่อ ลิงค์แผนที่ ครบหมด ใครวางแผนไปตราด ต้องแวะสักสวน สองสวนสิน่า
รพ.วิมุต ตรวจโควิดถึงเที่ยงคืน PCR - Drive Thru - Rapid Antigen
รพ.วิมุต ขยายเวลาการให้บริการ RT-PCR และ Rapid Antigen Test ถึงเที่ยงคืน ด้วยบริการหลายแบบ
• ตรวจ RT-PCR ไม่พบแพทย์ ทราบผล 24 -48 ชั่วโมง ทาง E-mail ราคา 2,500 บาท (ไม่รวมค่าแพทย์และใบรับรองแพทย์ รวมค่าบริการรพ.)
• ตรวจ RT-PCR แบบ Drive Thru ราคาปกติ 2,500 บาท
• ตรวจ RT-PCR พร้อมใบรับรองแพทย์ (Fit-to- Fly Health Certificate) ทราบผล 24 -48 ชั่วโมง ราคา 3,200 บาท (รวมค่าแพทย์และค่าบริการรพ.)
• ตรวจ RT-PCR พร้อมใบรับรองแพทย์ (Fit-to- Fly Health Certificate) ทราบผลภายใน 3 ชั่วโมง ราคา 4,500 บาท (รวมค่าแพทย์และค่าบริการรพ.)
• ตรวจ Rapid Antigen Test ไม่พบแพทย์ ราคา 500 บาท (ไม่รวมค่าแพทย์และใบรับรองแพทย์ รวมค่าบริการรพ.)
• ตรวจ Rapid Antigen Test พร้อมใบรับรองแพทย์ ราคา 800 บาท (รวมค่าแพทย์และค่าบริการรพ.)
จำกัดจำนวนผู้รับบริการต่อวัน กรุณาทำนัดหมายล่วงหน้าอย่างน้อย 24 ชั่วโมง ติดต่อสอบถามรายละเอียดเพิ่มเติม โทร 02-079-0292
เข้าร่วมโครงการ Home Isolation รพ.มิชชั่น โทร 02-2821100 ไลน์ @missionhospitalbkk
โรงพยาบาลมิชชั่น โทร 02-2821100 ไลน์ @missionhospitalbkk
ผู้ป่วยที่มีสิทธิประกันสังคม ผู้ที่ตรวจพบเชื้อโควิด-19 สามารถเข้าร่วมโครงการ Home Isolation ไม่มีค่่าใช้จ่าย ได้ตั้งแต่วันนี้ - 30 เมษายน 2565 ตั้งแต่เวลา 8.00-15.00 น. เงื่อนไขคือ
มีผล ATK หรือ PCR เป็นบวก - อาการไม่รุนแรง - ไม่มีโรคประจำตัวที่ควบคุมไม่ได้ - ไม่ตั้งครรภ์
นนท์ kids Back to School 2 สูตร ไฟเซอร์ หรือ ซิโนแวค (ลงทะเบียนล่วงหน้า) LINK
นนท์ kids Back to School
เดือนเมษายน /พฤษภาคม 2565
หลังสงกรานต์ การติดเชื้อในครอบครัวเพิ่มสูงขึ้นมาก
รีบๆให้เด็กๆ มารับวัคซีนก่อนเปิดเทอมกันนะคะ
เวลา 10.00-15.00 น.
ทุกสัญชาติ
ทุกพื้นที่
เด็กเล็กอายุ 5-11 ปี
ไม่จำกัดสัญชาติและพื้นที่อยู่อาศัย
เปิดบริการฉีดวัคซีน Pfizer ฝาส้ม เข็ม 1
เด็กอายุ 6-11 ปี
สูตร Sinovac เข็ม 1 / Pfizer สัม เข็ม 2
พิเศษ!!Walk in ได้ทั้ง 2 สูตร สำหรับท่านที่ไม่สะดวกลงทะเบียน
สนามฉีด เซ็นทรัล รัตนาธิเบศร์
รับบัตรคิว ลานจอดรถชั้น 3
วันที่ 29 เม.ย. , 5, 20, 27 พ.ค. 2565 เซ็นทรัล แจ้งวัฒนะ
รับบัตรคิว อาคารจอดรถ B ชั้น 3 ครึ่ง
วันที่ 26 เม.ย., 3,17,24 พ.ค. 2565
สำหรับในเข็ม 2 จะได้รับใบนัดหมายจากสนามฉีด ในลำดับต่อไป
Ep.2.4 “หน้าที่ตามกฎหมาย Legal Obligations” LINK
กรณีเก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลส่วนบุคคล
จำเป็นต่อการปฏิบัติหน้าที่ตามกฎหมายกำหนด
ไม่ว่าจะเป็นตามบทบัญญัติแห่งกฎหมาย
หรือตามคำสั่งของหน่วยงานรัฐที่มีอำนาจ
หากผู้ควบคุมข้อมูลส่วนบุคคลสามารถอธิบาย
การปฏิบัติตามหน้าที่นั้นได้อย่างชัดเจน
ว่าปฏิบัติหน้าที่ตามบทบัญญัติใดหรือ
ปฏิบัติตามคำสั่งของหน่วยงานใดของรัฐ
การประมวลผลเพื่อการดังกล่าว
ไม่ต้องขอความยินยอมอีก
(มาตรา 24(6))
.
อย่างไรก็ตาม แม้ผู้ควบคุมจะประมวลผลตามกฎหมาย
ผู้ควบคุมยังคงมีหน้าที่จัดทำบันทึกรายการกิจกรรม
(Record of Processing Activities: ROP)
.
ตัวอย่าง
-เก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลเงินเดือนลูกจ้าง
เพื่อคำนวณจ่ายค่าประกันสังคม
ส่งให้กับสำนักงานประกันสังคม
Hospitel โรงพยาบาลเพชรเวช
เกณฑ์การเข้ารับการตรวจ และรักษาเข้า Hospitel
1. ผู้ป่วยยืนยันโควิด อายุน้อยกว่า 60 ปีที่ไม่มีอาการ หรือไม่มีภาวะเสี่ยง หรือภาวะอื่นร่วม (ไม่มีโรคประจำตัว) หรือผู้ที่สามารถช่วยเหลือตนเองได้ (กลุ่มสีเขียว)
2. สัญชาติไทยเท่านั้น ยกเว้นสิทธิบัตรทอง, ต่างด้าวไร้สิทธิ์, คนไทยที่มีปัญหาเรื่องสิทธิ์ (จะมีการแจ้งเตือนในระบบ) แนะนำติดต่อเข้ารับการตรวจโรงพยาบาลภาครัฐ
3. อายุตั้งแต่ 15 - 60 ปี
4. ท่านที่มีผลตรวจ RT-PCR หรือ ATK กรณีในรูปแบบเอกสารยืนยันจากทางห้องปฎิบัติการ (Lab) หรือ โรงพยาบาลอื่น ๆ ไม่เกิน 24 ชั่วโมง นับจากเวลาผลตรวจออก
5. น้ำหนักไม่เกิน 90 กิโลกรัม หรือค่า BMI ไม่เกิน 30
เพื่อลดการกระจายเชื้อและป้องกันความเสี่ยงในการเปลี่ยนแปลงของอาการผู้ป่วยโควิด-19 ที่กำลังหาเตียงรักษา ทั้งผู้ป่วยมีสิทธิประกันสังคมของโรงพยาบาลเพชรเวช หรือไม่ใช่สิทธิผู้ประกันตนโรงพยาบาลเพชรเวชก็ตาม สามารถเข้ารับบริการได้เช่นกัน (สิทธิประกันสังคมไม่มีค่าใช้จ่าย)
ติดต่อเข้ารับบริการที่อาคาร C บริเวณทางออกโรงพยาบาลเพชรเวช เต็นท์ที่ 2 สีขาว เวลา 08.00 - 16.00 น. เพื่อรับบัตรคิว (หากคิวเต็มจะปิดรับทันทีเนื่องจากมีผู้ติดเชื้อเป็นจำนวนมาก)
สอบถามข้อมูลเพิ่มเติม โทร 1390
คลังปัญญาผู้สูงอายุ [เศรษฐกิจดี]
ประโยชน์คนกรุงฯ
- ผู้สูงอายุที่ยังอยากทำงานหรือมีกำลังและพลังความคิดที่มีคุณค่าอยู่ก็สามารถสร้างประโยชน์ให้กับสังคมได้
- สังคมได้รับการถ่ายทอดประสบการณ์หรือคลังปัญญาที่น่าสนใจจากผู้สูงอายุ
รายละเอียดนโยบาย
ผู้สูงอายุตอนต้นหลายคนยังอยากทำงานหรือถ่ายทอดความรู้สู่สังคมหรือประสบการณ์ที่มีคุณค่า
ดังนั้น กทม.จะจัดหางานที่เหมาะสมให้กับผู้สูงอายุ เพื่อให้เกิดประโยชน์ต่อสังคมส่วนรวมและสร้างความภาคภูมิใจให้ผู้สูงอายุด้วย เช่น การช่วยดูแลเด็กอ่อน-เด็กเล็กแก่คุณแม่มือใหม่ในศูนย์ การคัดแยกขยะ หรือการเป็นอาสาสมัครดูแลสังคมในชุมชนเพื่อเฝ้าระวังปัญหาในระดับบ้านและชุมชน เช่น ความรุนแรงในครอบครัว ช่วยดูแลผู้ป่วยติดเตียง เพราะและทำกล้าไม้สนับสนุนการปลูกต้นไม้ในเมือง
Hospitel Isolation Package โรงพยาบาลพริ้นซ์ สุวรรณภูมิ
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ จัดเตรียม Hospitel Isolation Package เป็นทางเลือก
แบบ 1 ท่าน หรือ 2 ท่าน
แพคเกจ 7 วัน
โรงแรมหลายแห่ง อาทิ Lasantel Bangkok, Grand Parazo สุวรรณภูมิ Clef hotel, Theorie Hotel, Blue sky, Nasa Vegas, Gold Airport suite, 5-Eleven Court
สอบถามเพิ่มเติม 02-080-5999
ข้อมูล/ราคา เครื่องดื่ม คุ๊กกี้ มีให้เลือกซื้อ ลองชิมกัญ
ไวน์กัญชา ก็ทำกันหลายแห่ง อาจาโร เฮิร์ป West Land Herb คอไวน์ที่มีประสบการณ์มีความรู้ ซื้อหาไปลองชิม แนะนำติดชมกัน ก็เป็นการช่วยพัฒนาสินค้าให้ดีขึ้นได้ทางหนึ่ง
UBCH Easy App โรงพยาบาลมะเร็ง อุบลราชธานี
UBCH EASY เป็นแอพพลิเคชั่นที่นำเสนอประสบการณ์ที่ดีในการให้บริการแก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลมะเร็งอุบลราชธานี ซึ่งจะสามารถเรียกดูข้อมูลทั่วไป ข้อมูลสิทธิในการรับบริการ ข้อมูลการนัดหมาย คิวการรับบริการ ผลการตรวจ ประวัติการใช้ยา และประวัติการรักษา ผ่านทางโทรศัพท์มือถือ หรืออุปกรณ์พกพาต่างๆ เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัย และสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับผู้ที่มารับบริการที่โรงพยาบาลมะเร็งอุบลราชธานี เป็นแอพพลิเคชั่นที่นำเสนอประสบการณ์ที่ดีในการให้บริการแก่ผู้เข้ารับบริการต่างๆ ของโรงพยาบาลมะเร็งอุบลราชธานี ซึ่งจะสามารถเรียกดูข้อมูลทั่วไป ข้อมูลสิทธิในการรับบริการ ข้อมูลการนัดหมาย คิวการรับบริการ ผลการตรวจ ประวัติการใช้ยา และประวัติการรักษา ผ่านทางโทรศัพท์มือถือ หรืออุปกรณ์พกพาต่างๆ เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัย และสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับผู้ที่มารับบริการที่โรงพยาบาลมะเร็งอุบลราชธานี
ดาวน์โหลดได้ที่
iOS และ
AndroidGreenHead Cannabis Clinic ข้าวสาร
ภาษาไทยระบุ "กรีนเฮลคลินิกการแพทย์แผนไทย สาขาถนนข้าวสาร" โลโก้คุ้นๆ คล้ายๆ ที่ภูเก็ต ชะโงกมองไปในร้าน มีทั้งดอก หลายสกุล น่าเข้าไปศึกษา ขนมหรือผลิตภัณฑ์แปรรูป ก็มีบ้าง
มิติที่ 5 เพิ่มประสิทธิภาพการบริการและแก้ไขปัญหา
ในเดือน ก.ค. 65 มีผู้ใช้ Traffy Fondue รายงานปัญหา 113,881 เรื่อง โดย 5 ปัญหาร้องเรียนมากที่สุด (ไม่รวมปัญหาอื่น ๆ) ได้แก่ ถนน 19.1% น้ำท่วม 6.8% ทางเท้า 5.7% แสงสว่าง 5.6% และความปลอดภัย 4.9% ความคืบหน้าการแก้ไขปัญหา สำเร็จ 47% กำลังแก้ไข 19% ส่งต่อหน่วยงานแล้ว 30% รอรับเรื่อง 1% ที่สำคัญมีหัวข้อกรุงเทพฯ โปร่งใส สำหรับร้องเรียนเรื่องทุจริต
นอกจากนี้ ยังได้ขยายศูนย์ One Stop service 50 เขต ปัจจุบันมี 16 สำนักงานเขตที่มีศูนย์บริหารราชการฉับไวใสสะอาด (BANGKOK FAST & CLEAR ) หรือศูนย์ BFC ซึ่งเป็นหลักการเดียวกันกับศูนย์บริการจุดเดียวเบ็ดเสร็จ (One Stop Service : OSS) ที่ให้ประชาชนมารับบริการที่เขตแล้วจบที่จุดเดียวได้ ผู้ว่าราชการกรุงเทพมหานครได้สั่งการไปแล้วว่า ให้อีก 34 เขตที่เหลือดำเนินการแล้วเสร็จภายใน 1 ปี รวมทั้งให้ปรับการบริการเป็นดิจิทัลมากที่สุด ทั้งการยื่นเอกสารและการขออนุญาต ซึ่งจะทำให้เกิดประสิทธิภาพและเกิดความโปร่งใสมากขึ้น
สำหรับผู้ว่าฯ สัญจร 50 เขต ในช่วงเดือนกรกฎาคมที่ผ่านมา ผู้ว่าฯ สัญจร รวม 3 ครั้ง ในเขตจตุจักร เขตบางบอน เขตปทุมวัน ในทุกครั้งจะให้ความสำคัญกับลูกจ้างซึ่งเปรียบเสมือนโซ่ข้อสุดท้ายที่เชื่อม กทม. เข้ากับประชาชน เช่น คนงานกวาด คนงานเก็บขนมูลฝอย คนงานสวน คนงานเก็บสิ่งปฏิกูล ฯลฯ โดยชวนมานั่งร่วมโต๊ะมื้อกลางวัน เพื่อรับฟังสารทุกข์สุกดิบเกี่ยวกับการทำงาน การใช้ชีวิต เป็นการรับฟังปัญหาจากคนงานที่อยู่ใกล้ชิดพื้นที่โดยตรง
สายไหม ลงพื้นที่ตรวจสอบด้านความปลอดภัย สถานประกอบการที่ให้บริการในลักษณะคล้ายสถานบริการ LINK
5 สิงหาคม 2565 นายอนุชิต พิพิธกุล ผู้อำนวยการเขตสายไหม มอบหมายฝ่ายสิ่งแวดล้อมและสุขาภิบาล ฝ่ายโยธา ฝ่ายเทศกิจ ร่วมกับเจ้าหน้าที่สถานีดับเพลิงและกู้ภัยบางเขน และจ้าหน้าที่ตำรวจสถานีตำรวจนครบาลสายไหม ลงพื้นที่ตรวจสอบด้านความปลอดภัยสถานประกอบการที่ให้บริการในลักษณะคล้ายสถานบริการ ป้องกันเหตุอัคคีภัย เพื่อความปลอดภัยของนักท่องเที่ยวหรือผู้เข้าใช้บริการ รวมถึงความปลอดภัยของพนักงานผู้ให้บริการด้วย ตามนโยบายด้านความปลอดภัยของผู้บริหารกรุงเทพมหานคร
14.ไทยผลิตยาเลิกบุหรี่จาก เมล็ดจามจุรีสีทอง
ประเทศไทยประสบความสำเร็จในการวิจัยเพื่อพัฒนายาเลิกบุหรี่ที่ชื่อ "ไซทิซีน (cytisine)" เป็นสารสกัดธรรมชาติ จาก เมล็ดจามจุรีสีทอง มีสรรพคุณช่วยบรรเทาอาการถอนนิโคติด ทำให้ผ่อนคลายไม่หงุดหงิดในขณะที่เข้าสู่กระบวนการเลิกบุหรี่ โดยความร่วมมือของคณะแพทยศาสตร์ มศว. ศูนย์วิจัยและจัดการความรู้เพื่อการควบคุมยาสูบ (ศจย.) สสส. และองค์การเภสัชกรรม โดยยาชนิดนี้ใช้มาก่อนหน้านี้แล้วในยุโรป ถือเป็นยาเลิกบุหรี่ที่มีประสิทธิภาพดีและปลอดภัย ที่องค์การอนามัยโลกให้การรับรองและสนับสนุน ในประเทศไทย ขณะนี้อยู่ในขั้นตอนการวิเคราะห์ข้อมูลของกลุ่มตัวอย่างที่เข้ารับบริการ เมื่อได้รับผลวิจัยที่สมบูรณ์แล้ว อภ.จะทำการขึ้นทะเบียนยากับสำนักงาน อย. และผลักดันให้เข้าสู่บัญชียาหลักแห่งชาติต่อไป
E.Dependants
Dependants - Spouse and children under 20 years old of LTR visa holders (Maximum 4 dependants in total per one LTR visa holder)
Health insurance with at least USD 50,000 coverage or social security benefits insuring treatment in Thailand or at least USD 25,000 deposit
Must be the legal dependants (spouse and children). (Same-sex marriage or partnerships are not yet currently recognized by the law of Thailand.)
นพ.สมิทธิ์ ศรีสนธิ์ ชี้ การปิดสุญญากาศ ทำได้ง่ายมาก
ผมขออนุญาตอธิบายความว่า ข่าวนี้หมายถึงสภาผู้แทนราษฎรเห็นว่าร่าง พ.ร.บ.กัญชา กัญชง ของภูมิใจไทยที่ผ่าน กมธ. มันยังใช้คุมกัญชาได้ไม่ดีพอ จึงให้ กมธ. ไปพิจารณาใหม่ เพื่อให้มีกฎหมายที่ดีพอในการควบคุม ผมขอขอบคุณที่สมาชิกสภาผู้แทนราษฎรหลายคนมีมติแบบนี้ครับ โดยเฉพาะพรรคประชาธิปัตย์ เพื่อไทย และประชาชาติ
แต่อย่างไงก็ตาม กฎหมายยังอยู่เหมือนเดิม ยังไม่ยกเลิกครับ อย่าพึ่งเข้าใจผิดนะครับว่า กัญชากลับไปเป็นยาเสพติดแล้ว
หรืออาจกล่าวได้ว่าตอนนี้กัญชายังใช้กันได้อย่างเสรี กฎหมายที่อ้างว่าออกมาเพื่อควบคุมก็ไม่สามารถบังคับใช้ได้ จึงเป็นช่วงสุญญากาศในการควบคุมการใช้กัญชาเหมือนเดิมครับ
ดังนั้นพวกเราต้องเรียกร้องกันให้มีการปิดสุญญากาศนี้ กระทรวงสาธารณสุขทำได้ง่ายมากครับ แค่ยกเลิกประกาศกระทรวงที่ทำให้กัญชาไม่ใช่ยาเสพติดที่บังคับใช้ไปในวันที่ 9 มิถุนายน 2565 เพราะตอนนี้ พ.ร.บ.กัญชากัญชง ไม่สามารถออกได้ทันภายในปีนี้แน่นอนครับ และพ.ร.บ. นี้ เผลอๆ ออกไม่ทัน รัฐบาลสมัยนี้ครับ ทั้งนี้การยกเลิกก็ยังทำให้กัญชาใช้ทางการแพทย์ได้แน่นอนครับ
Smith Fa Srisont
นพ.สมิทธิ์ ศรีสนธิ์
นายกสมาคมแพทย์นิติเวชแห่งประเทศไทย
กรรมการแพทยสภา
บริหารจัดการขยะอย่างเป็นระบบ
ความเจริญเติบโตอย่างรวดเร็ว กิจกรรมทางเศรษฐกิจที่หลากหลาย และจำนวนประชากรที่มากที่สุด ล้วนเป็นสาเหตุที่ทำให้กรุงเทพฯ กลายเป็นแหล่งผลิต "ขยะ" ที่ใหญ่ที่สุดในประเทศโดยปัจจุบันมีปริมาณมูลฝอยที่กว่า 10,000 ตันต่อวัน (หรือเทียบเท่ารถสิบล้อ 400 คัน) คิดเป็นขยะมูลฝอยที่ต้องจัดเก็บประมาณ 3.6 ล้านตันต่อปี หรือประมาณ 20% ของปริมาณมูลฝอยทั้งประเทศ และมีแนวโน้มเพิ่มขึ้นเรื่อยๆ ซึ่งที่ผ่านมากรุงเทพมหานครได้มุ่งมั่นบริหารจัดการขยะมูลฝอยและสิ่งปฏิกูลอย่างมีประสิทธิภาพ โดยมีการบริหารจัดการขยะอย่างเป็นระบบ ตั้งแต่ต้นทางจนถึงปลายทาง
"ต้นทาง" เน้นการลดและควบคุมปริมาณขยะมูลฝอยที่แหล่งกำเนิด รวมถึงคัดแยกขยะและใช้ประโยชน์จากขยะ
ที่ต้นทาง
"กลางทาง" จัดรถเก็บขนมูลฝอยให้ทุกสำนักงานเขตเข้าบริการจัดเก็บขยะเพื่อนำเข้าสู่ระบบกำจัดอย่างทั่วถึงโดยส่วนใหญ่เป็นขยะทั่วไป และบางส่วนได้จัดเก็บแยกประเภทได้แก่ 1. ขยะทั่วไป 2. ขยะอินทรีย์ 3. ขยะอันตราย 4. ขยะติดเชื้อ พร้อมทั้งกำหนดระยะเวลาการทิ้งและการจัดเก็บที่แน่นอน
และ "ปลายทาง" ขยะที่จัดเก็บได้จาก 50 เขต จะถูกขนส่งไปยังศูนย์กำจัดมูลฝอยอ่อนนุช ตูนย์กำจัดมูลฝอยหนองแขม และศูนย์กำจัดมูลฝอยสายไหม โดยนำไปกำจัดด้วยวิธีการที่มีประสิทธิภาพเหมาะสมกับชนิดของขยะ
24-25 กันยายน BKK-เรนเจอร์ @ ศูนย์เยาวชนกรุงเทพมหานคร (ไทย-ญี่ปุ่น)
ระเบิดพลังเหล่าเรนเจอร์ส่งท้ายเทศกาลเด็กและเยาวชน เสาร์อาทิตย์ 24-25 กันยายนนี้ ในมหกรรม “ถนนเด็กเดิน ตอน กรุงเทพฯ มหานครของเด็กและเยาวชน” โดย #บางกอกกำลังดี กรุงเทพYoungไง และองค์กรเครือข่ายจากทั่วกรุงเทพ!
สุดสัปดาห์นี้รวมมัดจัดเต็มทั้งเสาร์และอาทิตย์ พบกับกิจกรรมที่สุดของความหลากหลายในพื้นที่ 3 โซน ทั้ง FREE ART ● FREE PLAY ● FREE MUSIC ● FREE WORKSHOP ● MINI EXHIBITION ● MINIWORKSHOP ● ART PERFORMANCE ● YOUTH x TALK และอีกมากมาย มาร่วมสนุก-ร่วมจริงจัง-และร่วมปลดปล่อยพลังเรนเจอร์ในตัวคุณไปพร้อมกัน! และที่สำคัญ *เข้าร่วมกิจกรรมฟรี* ตลอดงาน
+++
เสาร์ 24 กันยา
13.30 - 17.40 | ภายในอาคารกีฬาเวสน์ 2
1.STAGE กิจกรรมบนเวที
· YOUTH x TALK : รวมพลังเด็ก(ส่งเสียง)เปลี่ยนเมือง ในเรื่องราว 10 ประเด็นน่าจับตา เกี่ยวกับการพัฒนาเมืองกรุงเทพฯ ไปข้างหน้า ในความคิดเห็นของเยาวชน
· การแสดง Performance Art จากเครือข่าย Urban Street Bangkok
· ภาพยนตร์สารคดี “Dekumentary” เด็กสนใจอะไร เด็กมองความเป็นเมืองยังไง ให้ภาพเคลื่อนไหวในภาพยนตร์เรื่องนี้ช่วยสื่อสาร
· การแสดง Share DAY โดยศิลปิน Imhavingabadday.
2. MINI EXHIBITION ● MINIWORKSHOP
นิทรรศการ 11 เรื่องเกี่ยวกับเมืองกรุงเทพฯ
พบกับประสบการณ์แปลกใหม่ในบูธนิทรรศการสุดสร้างสรรค์โดยเด็กและเยาวชน 10 กลุ่ม ร่วมกับสภาเด็กและเยาวชนกรุงเทพมหานคร
+++
อาทิตย์ 25 กันยา
10.00 - 21.00 | จัดเต็มกิจกรรม 3 โซน
1. อาคารกีฬาเวสน์ 2 | 10.00 - 18.00
· การแสดงดนตรีคนรุ่นใหม่ไฟแรง วง Papercup, วง Hit And Run, วง GOODMOOD, วง ปั้นเอง และ วง LANDOKMAI
· กิจกรรม Bangkok Foresight กิจกรรม โต้วาที Battle for Better by dtac
· ตัวแทนเยาวชนเสนอข้อเสนอเชิงนโยบายต่อผู้ว่าราชการกรุงเทพมหานคร และคณะผู้บริหาร สู่การพัฒนา “สภาเมืองคนรุ่นใหม่”
· MINI EXHIBITION & MINIWORKSHOP นิทรรศการ 11 เรื่องเกี่ยวกับเมืองกรุงเทพฯ พบกับประสบการณ์แปลกใหม่ในบูธนิทรรศการสุดสร้างสรรค์โดยเด็กและเยาวชน 10 กลุ่ม ร่วมกับ สภาเด็กและเยาวชนกรุงเทพมหานคร : Children and Youth Council of Bangkok
· ประติมากรรม Center Piece
· WORKSHOP: Discover A Personal Brand | มาค้นศักยภาพและตัวตนแห่งความสำเร็จ เติมเต็มความมั่นใจไปกับครูเจน เจนรบ ชัยเลิศ แห่ง The jen studio
2. โซนสนามหญ้า | 16.00 - 19.30
· การแสดงดนตรีจากวง Smile เครือข่ายบางกอกนี้ดีจัง, วง So Shine Band, แพร ชนาภรณ์ Feat. คริสต้า ชิม IG: shimkrista The Voice All Stars, วง Yes Indeed Band, SPRITE และ DON KIDS จากค่าย HYPE TRAIN
· FREE ART FREE PLAY กิจกรรมจากเครือข่าย อาทิ สำรวจธรรมชาติ Nature Plearn Club, บันไดงูลดปัจจัยเสี่ยง, ตัวต่อบล๊อกไม้ และอื่น ๆ มากมาย
3. โซนลานปูน | 16.30 - 21.00
· การแสดงดนตรีจากศูนย์เยาวชนไทย-ญี่ปุ่น (ดินแดง), โรงเรียนศรีอยุธยา SA Band, วงโบวินี่ Bovini Official, BNK48 และวง Playground Band
· Cover Dance ดาวเสาร์หรรษา Show จาก Saturday School
· Dance Performance by หมีพูห์ & Friends
· บูธองค์กรเครือข่ายด้านเด็กและเยาวชนจากภาครัฐและภาคเอกชน
อ๋อ.. บางอ้อ เริ่มตั้งแต่ 12 พ.ย.65 LINK
อ๋อ.. บางอ้อ
เริ่มตั้งแต่ 12 พฤศจิกายน 2565
สถานที่จัดงาน สำนักงานเขตบางพลัด l มัสยิดบางอ้อ l บ้านศิลปะ whenlifegibesyoulemons, เขตบางพลัด
.
‘อ๋อ.. บางอ้อ’ หนึ่งในกิจกรรมภายใต้เทศกาล ‘บางกอกบานฉ่ำ’ เทศกาลที่สนับสนุนโดยกรุงเทพมหานคร เป็นการจัดเทศกาลศิลปะชุมชน เพื่อเพื่อส่งเสริมอัตลักษณ์ชุมชน ในการพัฒนาเป็นย่านสร้างสรรค์ และส่งเสริมกิจกรรมการท่องเที่ยวในพื้นที่กรุงเทพมหานครให้เป็นที่รู้จักในวงกว้าง
‘อ๋อ.. บางอ้อ’ เป็นการรวมพล คนบางอ้อ เปิดบ้าน เปิดร้าน เปิดวัด เปิดมัสยิด ให้ทุกคนได้มาช่วยกันตามหาเสน่ห์บางอ้อ ในชื่องาน “บางอ้อ…อ๋อแบบนี้นี่เอง”
.
โดยมีกิจกรรมมากมายตลอดทั้งวัน ตั้งแต่ลองเรือเจ้าพระยามาชมบางอ้อ เดินตลาดวัดบางพลัด ไหว้พระวัดสามัคคี วัดอาวุธ เปิดมัสยิด ชื่นชม สถาปัตยกรรม เปิดคอกม้า ชมการแสดงขี่ม้ายิงธนู เปิดลาน skate ริมแม่น้ำชมวิวรัฐสภา เปิดบ้านศิลปะ ชมการแสดง รำโขน อังกะลุง ฯลฯ ตลอดจนชวนร่วมทริปเดินถ่ายภาพ
เขตคลองเตยดูแลอย่างดี แจกฟรียากันยุง และน้ำดื่ม ได้ใจแฟนเพลงสุนทราภรณ์แบบเต็มๆ
24 พ.ย. 65 ประกาศคุมช่อดอกกัญชา เสวนากัญชาเสรี
1.ประกาศคุมช่อดอกกัญชา
- ราชกิจจานุเบกษา ประกาศกระทรวงสาธารณสุข เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 กำหนดให้ “ช่อดอกกัญชา” เป็นสมุนไพรควบคุม ต้องขออนุญาตจำหน่าย ห้ามขายผ่านตู้-โฆษณา-เด็กต่ำกว่า 20 ปี รวมถึงนักเรียน นิสิต นักศึกษา มีผล ตั้งแต่24 พ.ย.65 เป็นต้นไป
- นายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. ระบุ ประกาศคุมช่อดอกกัญชาจะมีผลบังคับใช้ในวันที่ 24 พ.ย.นี้ เรียบร้อยดี ไม่มีปัญหาอะไรแล้ว ส่วนร่าง พ.ร.บ.กัญชา เป็นเรื่องของการพิจารณาจากสภาผู้แทนราษฎร ซึ่งเป็นเอกสิทธิ์ของ แต่ละคน หากร่างฯ ไม่ผ่านก็รอสมัยหน้าจะเสนอร่างฯ อีกครั้ง ส่วนกรณีศาลปกครองรับฟ้องเพิกถอนปลดกัญชาจากยาเสพ ติด ต้องเตรียมข้อมูลไปตอบคำถามต่อศาล สธ.ก็สนับสนุนข้อมูลทางการแพทย์
-นายวิษณุ เครืองาม รองนายกรัฐมนตรี กล่าวว่า ณ ปัจจุบัน ต้นกัญชา ราก ลำต้น เมล็ด ช่อ ดอก ไม่ถือว่าเป็นยาเสพติด ประเภทที่ 5 แต่ยังคงมีการนำพืชกัญชาไปดัดแปลง หรือแปรรูปเพื่อใช้ในทางที่ผิด ซึ่ง สธ. พบว่า ช่อ ดอก ยังคงเป็นอันตราย อยู่ โดยสามารถนำมาสกัดเพื่อเสพ และอาจก่อให้เกิดอันตรายได้ จึงเป็นที่มาในการนำกฎหมายแพทย์โบราณมาควบคุม และ กำหนดให้กัญชาเป็นสมุนไพรควบคุม (ประกาศกระทรวงสาธารณสุข เรื่องสมุนไพรควบคุม (กัญชา) พ.ศ. 2565) ซึ่งในบาง ข้อกำหนดเป็นผลในทางบวก หากใครนำไป ศึกษา วิจัย ส่งออก ต้องขออนุญาตจากปลัด สธ. ในขณะเดียวกันก็มีการกำหนด มาตรการ เช่น ห้ามจำหน่ายให้นักเรียน นิสิต นักศึกษา หญิงตั้งครรภ์ เป็นต้น รวมถึงห้ามโฆษณา ห้ามจำหน่ายผ่านเครื่อง จำหน่ายสินค้าอัตโนมัติ วัด สวนสาธารณะ หอพัก สนามกีฬา อย่างไรก็ตาม ถ้ายังมีการฝ่าฝืนก็จะมีการตำหนิ ติเตียน หรือ ห้ามปราม เพราะการดำเนินการบางอย่างมีข้อจำกัด เช่น โรงเรียน เพราะไม่สามารถนำเด็กเข้าเรือนจำได้ แต่ถ้าฝ่าฝืนหนักก็ ต้องมีบทลงโทษตามกฎหมาย ทั้งนี้ หากยังมีช่องว่างเกิดขึ้นอีก ก็ต้องนำกฎหมายอื่น ๆ มาอุดช่องว่างไปก่อน ซึ่งแต่เดิม ประกาศกระทรวงก็มีการควบคุมที่ดีอยู่แล้ว แต่เพื่อเป็นการเพิ่มความเข้มข้นในการควบคุม จึงจำเป็นต้องมีการประกาศฉบับนี้ ออกมาเพื่ออุดช่องว่างต่าง ๆ ให้ดียิ่งขึ้น จนกว่า ร่าง พรบ.กัญชา กัญชง จะผ่านการพิจารณาจากสภาผู้แทนราษฎร ซึ่งหาก ผ่านการพิจารณาแล้ว จะสามารถควบคุมได้ครบทุกมิติ
2.กัญชาทางการแพทย์
- นพ.โอภาส การย์กวินพงศ์ ปลัด สธ. พร้อมด้วย อธิบดีกรมการแพทย์ ผอ.สถาบันสุขภาพเด็กฯ ผอ.สถาบันประสาท วิทยา ผอ.สถาบันมะเร็งแห่งชาติ ผอ.สบยช. และ ผอ.สถาบันโรคผิวหนัง ร่วมแถลงข่าวความก้าวหน้าในการใช้กัญชาทาง การแพทย์ โดยสถาบันประสาทวิทยา วิจัยการรักษาโรคลมชักรักษายากในเด็ก สถาบันมะเร็งแห่งชาติ วิจัยสารสกัดกัญชา เพื่อรักษาโรคมะเร็งในหนูทดลอง สถาบันโรคผิวหนัง กำลังวิจัยกัญชารักษาโรคผิว และค้นคว้าวิจัยสูตรเวชสำอางต้นแบบ แล้ว 18 สูตรตำรับ สถานบำบัดรักษาและฟื้นฟูผู้ติดยาเสพติดแห่งชาติบรมราชชนนี เตรียมวิจัยนำสารสกัด CBD ชนิดหยอด ใต้ลิ้น มาใช้ร่วมกับยาต้านอาการทางจิตในผู้ป่วยเสพติดเมทแอมเฟตามีนที่มีอาการทางจิตเวช นอกจากนี้ รพ.นพรัตนราชธานี ได้เปิดศูนย์ห้องปฏิบัติการทดสอบคุณภาพผลิตภัณฑ์กัญชา สมารถวิเคราะห์ปริมาณสารสำคัญในน้ำมันกัญชา 11 ชนิด และ ตรวจวิเคราะห์หาสารเทอร์ปีนส์ในน้ำมันกัญชา 28 ชนิด
- เภสัชกร กลุ่มงานคุ้มครองผู้บริโภคและแพทย์แผนไทย สสจ.กาญจนบุรี จัดทีมเชิงรุกลงพื้นที่เป็นวิทยากรให้ความรู้เรื่อง กัญชาทางการแพทย์ การใช้อย่างปลอดภัย ข้อควรระวังและผลข้างเคียงจากการใช้ผิดวัตถุประสงค์ให้แก่กลุ่มนักเรียนและ เยาวชนโรงเรียนกาญจนานุเคราะห์ อ.เมือง จ.กาญจนบุรี ประจำวันที่ 24 พฤศจิกายน 2565 2 ประเด็นข่าว
3.เสวนากัญชาเสรี
- พรรคเพื่อไทยจัดงานเสวนา “กัญชาเสรี บาปใหญ่รัฐบาลประยุทธ์?” แสดงความเห็นเชิงลบเกี่ยวกับร่าง พ.ร.บ.กัญชาฯ ว่าใช้ทางการแพทย์เป็นเพียงข้ออ้าง สอดไส้ผลประโยชน์ เหมือนเปิดช่องให้กลุ่มทุน เอื้อผู้ประกอบการรายใหญ่ ไม่คำนึงถึง ผลกระทบต่อเยาวชน จึงต้องทบทวนหาทางออก ต้องให้กัญชากลับไปเป็นยาเสพติดเหมือนเดิม
4.เข้มธุรกิจกัญชา
- นายสุนทร สุนทรชาติ ผอ.สำนักอนามัย กทม. กล่าวถึง กรณีมีข้อกังวลการจำหน่ายกัญชาในลักษณะไม่เหมาะสมย่าน ถนนข้าวสารและสุขุมวิท มีการเชิญผู้แทนกรมการแพทย์แผนไทยฯ เพื่อชี้แจงข้อกฎหมายและแนวทางบังคับใช้ตาม พ.ร.บ. คุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย พ.ศ.2552 และประกาศ สธ.เรื่อง สมุนไพรควบคุม (กัญชา) พ.ศ.2565 และได้ร่วมกับหน่วยงานเกี่ยวข้อง ตำรวจในท้องที่ เข้าไปตรวจสอบเข้มการจำหน่ายกัญชาในลักษณะไม่เหมาะสม ประสาน จัดทำแผนตรวจผู้ประกอบการร้านค้า หรือบริเวณที่อาจมีผู้เสพหรือสูบในที่ไม่เหมาะสมจนก่อเหตุรำคาญในพื้นที่วิทยาลัยแพทย์ฉุกเฉินแห่งประเทศไทย The Royal College of Emergency Physicians
วิทยาลัยแพทย์ฉุกเฉินแห่งประเทศไทย
The Royal College of Emergency Physicians
88/40 หมู่ที่4 อาคารเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว 84 พรรษา ซอยสาธารณสุข ซอย6 ถนนติวานนท์ ตำบลตลาดขวัญ อำเภอเมือง จังหวัดนนทบุรี 11000
โทรศัพท์ 094-9396767
E-mail:tcep.tmc@gmail.com
นักข่าวตุรกี Ibrahim Haskologlu เผยกับ BBC ว่าเขาได้รับคลิปวิดีโอจำนวนมากจากผู้ที่ติดอยู่ได้ซากอาคารที่พังถล่มลง เพื่อร้องขอความช่วยเหลือเร่งด่วน แต่เขาไม่สามารถจะให้ช่วยอะไรได้มากกว่านี้ นอกจากส่งต่อการร้องขอนี้สู่สื่อและนานาชาติ
เลิฟไม่แบด รักไม่แซด@บางซื่อ LINK
สำนักงานเขตบางซื่อ จัดกิจกรรม เลิฟไม่แบด รักไม่แซด @บางซื่อ จดทะเบียนสมรสในวันวาเลนไทน์ ณ ฝ่ายทะเบียน สำนักงานเขตบางซื่อ ในวันที่ 14 กุมภาพันธ์ 2566 เวลา 08.00-16.00 น. รับสติ๊กเกอร์กุญแจคู่รัก พร้อมถ่ายภาพคู่ ฟ รี ‼️
พบกิจกรรมออกบูธจากหน่วยงาน อาทิ โครงการซื่อสัตย์เพื่อชาติ ● ธนาคารออมสิน ● ไปรษณีย์ไทย ● รพ.เกษมราษฎร์ ● รพ.บางโพ เพื่อรับของที่ระลึก และ กิจกรรมไฮไลท์!!!!!
....เปิดรับจองคิวออนไลน์....
โดยการสแกน QR Code ได้ตั้งแต่วันนี้ - 13 ก.พ. 66
*ทั้งนี้ คู่ที่จดทะเบียนสมรสกับต่างชาติ ไม่รับจองคิวออนไลน์ ให้ยื่นเอกสารด้วยตนเอง ได้ที่ ชั้น 1 ฝ่ายทะเบียน สำนักงานเขตบางซื่อ เท่านั้น
เรื่องราวแห่งรักที่หลักสี่ Story of Love @ Laski LINK
14 กุมภาพันธ์ 2566 จูงมือคนรักมาสร้างเรื่องราวความรักในวันวาเลนไทน์ พร้อมรับของที่ระลึกในงาน "เรื่องราวแห่งรักที่หลักสี่" Story of Love @ Laski ในวันอังคารที่ 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00 - 16.00 น. ณ ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตหลักสี่
รักไม่จาง ที่บางแค LINK
รักไม่จาง ที่บางแค 14 กุมภาพันธ์ วันวาเลนไทน์ หากคุณและคู่รัก กำลังมองหาสถานที่จดทะเบียนสมรส ที่ดีและมีความหมาย เราขอแนะนำ...."สำนักงานเขตบางแค" ชื่อก็ได้ความหมายก็ดี #บางแคแคร์ทุกคน
ขอเชิญชวนคู่รักมาร่วมจดทะเบียนสมรส ภายในงาน "รักไม่จาง ที่บางแค" พร้อมรับของที่ระลึกสุดพิเศษ ลุ้นรับของรางวัลมากมาย บริการจุดถ่ายภาพที่ระลึก ทั้งยังมีกิจกรรมเสริมสุข สร้างสีสัน ในวันอังคารที่ 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 8.00 น. ถึง 16.00 น.
สอบถามข้อมูลและสำรองคิวล่วงหน้า ได้ที่ ฝ่ายทะเบียน โทร. 024545847
สำหรับคู่รักชาวไทยที่ประสงค์จดทะเบียนสมรสกับชาวต่างชาติ ต้องยื่นเอกสารด้วยตนเองที่สำนักงานเขต เท่านั้น‼️
รักดีๆ ใครๆก็ต้องการ รักจนแต่งงานใครๆ ก็อยากมี ....แต่งงานกันนะ
Rolling Loud Thailand 2023 เมืองพัทยา 13-15 เมษายน LINK
เทศกาลเพลงฮิปฮอประดับโลก ยกทัพบุกไทยสงกรานต์ปีนี้เลย ด้วยกองทัพแร็ปเปอร์ที่สาวกต้องคลั่ง Travis Scott, Wiz Khalifa, Kanye West, Post Malone และ Kendrick Lamar การเปิดโชว์ Rolling Loud Thailand 2023 ในไทยที่วอร์มอัพกันมาตั้งแตปลายปีก่อน กระชากความสนใจได้ไม่น้อย เมื่อใกล้เทศกาลเข้าไป ยิ่งต้องจับตาใกล้ชิด จะมีเทพแร็ปเปอร์คนไหนมาจริงบ้างหรือเซอร์ไพรส์เพิ่มเข้ามาอีกบ้าง
Rolling Loud จัดขึ้นครั้งแรกที่ Florida ในปี 2015 ปัจจุบันมีประเทศที่ถือลิขสิทธิ์ 5 ประเทศ คือ USA / California Netherlands / Rotterdam Germany Potugal Thailand / Pattaya โดยประเทศไทย เป็นประเทศเดียวในเอเชีย ถือลิขสิทธิ์ 5 ปี คือ 2023 – 2028 เป็นไปได้ว่าเราอาจจะได้เห็นกองทัพศิลปินระดับ A-List ตบเท้าเข้าไทยในทุกๆปี
งานนี้จัดที่ LEGEND SIAM • PATTAYA, THAILAND วันที่ 13-15 APRIL 2023 สงกรานต์แรปไงเล่าา
สวนละไม อ.วังจันทร์ ระยอง เปิดบุฟเฟต์ทุเรียน ตั้งแต่ 28 เม.ย. 66
สวนละไม อ.วังจันทร์ จ.ระยอง ประกาศเปิดสวนบุฟเฟต์ทุเรียน บุฟเฟ่ต์ผลไม้ ปี 2566 ตั้งแต่ 28 เม.ย. - 18 มิ.ย. พร้อมราคาโปรบุฟเฟ่ต์ทุเรียน จองบัตรล่วงหน้า 699 บาท (จากราคาปกติ 850 บาท) จองได้ถึง 17 เม.ย. นี้ วันสุดท้าย สอบถามรายละเอียดเพิ่มเติมได้ที่ Call Center 098-737-4983 และ 098-737-4984
ลดความแออัดในโรงพยาบาล - ห้องฉุกเฉิน (ER) กันไว้สำหรับกรณีฉุกเฉิน
ปัญหา
ปัจจุบัน ผู้ป่วยประสบปัญหาความล่าช้าและยุ่งยากในการส่งต่อผู้ป่วยไปสถานพยาบาลที่มีความพร้อมในการรักษา และการหาเตียงในโรงพยาบาลของรัฐ เนื่องจากโรงพยาบาลรัฐหลาย ๆ แห่งมักเตียงเต็ม ปัญหาดังกล่าวเกิดจากการเชื่อมต่อข้อมูลการรักษาของผู้ป่วย และจำนวนเตียงของโรงพยาบาล ที่ขาดการเชื่อมโยงข้อมูลระหว่างกัน
นอกจากนี้การบริจาคอวัยวะของคนไทยยังอยู่ในระดับต่ำ ซึ่งเป็นข้อจำกัดในการเปลี่ยนถ่ายอวัยวะกับผู้ป่วยที่ต้องการเปลี่ยนอวัยวะเพื่อต่อชีวิตของตัวเอง
ข้อเสนอ
การสงวนการตรวจในห้องฉุกเฉิน (ER) ไว้สำหรับอาการฉุกเฉิน ในกรณีผู้ป่วยอาการไม่ฉุกเฉินต้องรับบัตรคิว เพื่อมาตรวจในวันพรุ่งนี้
Nasan (นาสาร) สุราชุมชน จากสุราษฎร์ธานี
จุดเริ่มต้นของ นาสาร เกิดจากกลุ่มบาร์เทนเดอร์กลุ่มหนึงที่มีความตั้งใจอยากจะผลิตสุราที่ชูวัตถุดิบของท้องถิ่น ไทย และยกระดับความเป็นสุราท้องถิ่น ที่มีคาแรคเตอร์เฉพาะตัวและตอบสนองการใช้งานของบาร์เทนเดอร์ สามารถ นำไปใช้ผสมเครื่องดื่มได้หลากหลายและสามารถดื่มเพียวๆ หรือ แค่ใส่น้ำแข็งและคนให้เย็นได้อีกด้วย ดังนั้นทีมงานจึง เฟันหาแหล่งวัตถุดิบและแร่น้ำที่อุดมไปด้วยแร่ธาตุ จนมาพบว่าตำบลนาสาร จังหวัดสุราษฎร์ธานี ซึ่งหนึ่งในทีมงานนั้น เป็นคนดั้งเดิมที่นั่น มีแน้ำที่สมบูรณ์ไปด้วยแร่ธาตุธรมชาติเนื่องจากบริเวณแถวนั้นเป็นแหล่งเหมืองแร่และยังเป็นอีกที่ ที่ ผลิตมะพร้าวจำนวนมากเป็นอันดับที่ 3 ของประเทศไทย นาสาร จึงเป็นสุราที่มีคาแรคเตอร์เฉพาะตัว ดื่มกับอะไรก็อร่อย และเป็นธรรมชาติล้วนเกือบ 100%
สวนมะพร้าวที่ทางทีมงานเลือกใช้เป็นสวนที่ทำมะพร้าวสืบทอดกันมายาวนานหลายรุ่น คนดูแลสวนมี ประสบการณ์การทำงานไม่ต่ำกว่า 50 ปี ส่วนผสมสำคัญที่นำมาใช้จะเป็นน้ำช่อดอกมะพร้าว เนื่องจากน้ำช่อดอกมะพร้าว จะให้ความหวานที่นุ่ม ละมุมลิ้น ไม่บาดคอ มีแคลอรีต่ำ ช่วยแก้เจ็บคอและแก้อาการร้อนในได้ การเก็บน้ำช่อดอกมะพร้าว จะเก็บด้วยความพิดีพิถันด้วยมือเท่านั้น ทำให้นอกจากทีมจะอยากชูความเป็นสุราท้องถิ่นแล้ว ยังสนับสนุนการจ้างงานใน ห้องถิ่นอีกด้วย เพราะเราใส่ใจในการผลิตตั้งแต่ต้นน้ำยันปลายน้ำ นาสาร ไม่มีส่วนผสมของน้ำตาลทรายเลย เราใช้น้ำช่อ ดอกมะพร้าวหมักกับไม้เคี่ยม เป็นต้นไม้ยืนต้น ไม้มงคลประจำจังหวัดสุราษร์ธานี ซึ่งให้รสฝาด มีสรรพคุณในการฆ่าเชื้อ และมียีสต์ในตัวเอง ทำให้มีความเป็นธรรมชาติมากๆ หลังจากนั้นทำการกลั่นแบบเครื่องกลั่นรีฟลัส (Reflux) ใช้ไอน้ำกลั่น ไหลย้อนหอกลั่นขึ้นไป 12 ชั้น เพื่อให้ได้แอลกอฮอล์ที่บริสุทธิ์ และเราใช้การกลั่นและผลิตในตอนกลางคืนเพื่อให้ได้อุณ ภูมิที่ดีที่สุดโดยใช้สภาพแวดล้อมจากธรรมชาติเป็นตัวช่วยในการควบคุม รสสัมผัสจากการดื่มเพียวๆ จะมีความหอม น้ำตาลมะพร้าวจางๆ นุ่ม ละมุนไม่บาดคอ หวานปลายลิ้น และยังได้รสสัมผัสจากแร่ธาตุจากแร่น้ำที่เราเลือกใช้ หลังจาก ดื่มเสร็จยังมีความหอมจากน้ำตาลมะพร้าวเหลือไว้อยู่อ่อนๆ
ข้อมูลและภาพจาก
ทวิตเตอร์
ศูนย์ 31 เอิบ-จิตร ทังสุบุตร ประกาศรับสมัครงาน LINK
ศูนย์บริการสาธารณสุข31 เอิบ-จิตร ทังสุบุตร ประกาศรับสมัครสอบคัดเลือกบุคคลภายนอกที่ช่วยปฏิบัติราชการ สำนักอนามัย
- พนักงานช่วยงานด้านประชาสัมพันธ์ 1 อัตรา
- พนักงานช่วยงานด้านสุขภาพ 2 อัตรา
- พนักงานช่วยงานด้านสาธารณสุข 3 อัตรา (วุฒิปวส. ป.ตรี)
- นักกายภาพบำบัด 1 อัตรา
- นักจิตวิทยา 1 อัตรา
สอบถามโทร. 02-4347304
การกำจัดโซเดียมส่วนเกินออกจากร่างกายได้ 3 ทาง
การกำจัดโซเดียมส่วนเกินนั้นจะถูกขับออกจากร่างกายได้ 3 ทาง คือ
1. การขับโซเดียมผ่านทางไต
การขับโซเดียมไอออน (Na+) ออกทางไตเป็นทางสำคัญและร่างกายมีกลไกควบคุมการขับถ่ายอย่างมีประสิทธิภาพดีที่สุด โดยจะขับโซเดียมไอออน (Na+) ออกในรูปของปัสสาวะ ซึ่งโซเดียมไอออน (Na+) ประมาณร้อยละ 50 ของโซเดียมไอออน (Na+) ส่วนเกินจะถูกขับถ่ายออกทางปัสสาวะในวันแรก ส่วนที่เหลือจะถูกขับถ่ายออกหมดใน 3-4 วันต่อมา ในทางตรงข้ามถ้าร่างกายไม่ได้รับ โซเดียมไอออน (Na+) ไตจะสงวนโซเดียมไอออน (Na+) ไว้ จนปริมาณที่ออกมาทางปัสสาวะลดลงเหลือวันละ 5-10 มิลลิโมลได้ ถ้าขาด ติดต่อกันนานถึง 7 วัน
ในคนปกติทั่วไปจะมีปริมาณโซเดียมไอออน (Na+) ในร่างกายคงที่ การกินเกลือ Na+ระหว่าง 0-23 g จะทำให้น้ำหนักตัวเปลี่ยนแปลงได้เล็กน้อย ประมาณไม่เกินร้อยละ 10 และในทุก 140 มิลลิโมล ของโซเดียมไอออน (Na+) ที่เพิ่มขึ้น ร่างกายจะเก็บน้ำไว้ได้ประมาณ 1 ลิตร ดังนั้นการไตจึงเป็นอวัยวะที่มีสำคัญมากต่อการรักษาสถานภาพปกติของโซเดียมไอออน (Na+) ในร่างกาย
2. การขับโซเดียมผ่านทางเหงื่อ
ร่างกายจะสูญเสียโซเดียมไอออน (Na+) ทางเหงื่อวันละประมาณ 25 มิลลิโมล การขับโซเดียมไอออน (Na+) ออกทางเหงื่อนั้น เป็นผลจากร่างกายต้องการขับความร้อนออกมา (โดยใช้น้ำเป็นตัวนำความร้อน) เพื่อรักษาอุณหภูมิร่างกายให้ปกติ การที่โซเดียมถูกขับออกมากับเหงื่อจึงไม่มีผลต่อการควบคุมจำนวนโซเดียมในร่างกาย
3. การขับโซเดียมผ่านทางอุจจาระ
ปกติร่างกายขับโซเดียมไอออน (Na+) ออกทางอุจจาระน้อยมาก ประมาณวันละ 5-10 มิลลิโมล แต่การเสียโซเดียมไอออน (Na+) ผ่านทางนี้ในจำนวนมากนั้น อาจเกิดได้ในรายที่มีอาการท้องเดินหรืออาเจียนอย่างรุนแรง เนื่องจากน้ำในระบบทางเดินอาหารมีความเข้มข้นของอิเล็คโตรไลท์ (electrolyte) สูงมากกว่าในพลาสม่าและยังถูกขับออกมาจำนวนมากประมาณ 8 ลิตรต่อวัน ซึ่งการสูญเสียน้ำในทางเดินจำนวนมาก จะส่งผลให้มีการขับโซเดียมไอออน (Na+) เพิ่มขึ้นด้วย
ดังนั้นการได้รับโซเดียมไอออน (Na+) ในปริมาณที่ไม่เหมาะสมนั้น ล้วนเป็นผลเสียต่อร่างกายทั้งสิ้น แต่จากผลการสำรวจของกระทรวงสาธารณสุขร่วมกับสถาบันโภชนศาสตร์ มหาวิทยาลัยมหิดล พบว่าคนไทยส่วนใหญ่ได้รับโซเดียมมากกว่าสองเท่า ของปริมาณที่แนะนำต่อวัน ซึ่งมีผลให้เกิดภาวะโซเดียมไอออน(Na+) เกิน [
กรมควบคุมโรค]
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยขอนแก่น
เลขที่ 123 หมู่ที่ 16 ถนนมิตรภาพ ตำบลในเมือง อำเภอเมือง จังหวัดขอนแก่น 40002
หน่วยสัตว์ป่วยฉุกเฉินและวิกฤต: จันทร์ - ศุกร์ 08.30 - 16.30 น.
โทร.0-4320-2283
โทรศัพท์: 043-009700 ต่อ ห้องยา 44382 มือถือห้องยา 089-861 2277 ห้องการเงิน 44381 ศัลยกรรม 44383 สัตว์ป่วยใน 089-863-4322
รถพยาบาลสัตว์ฉุกเฉิน 0-4320-2283
เวลาทำการ
จันทร์ - ศุกร์ 08.30 - 16.30 น. (ไม่พักเที่ยง) ปิดรับบัตร 16.00 น.-
พฤหัสบดี 08.30 - 11.30 น. ปิดรับบัตร 11.30 น. ตั้งแต่เวลา 12.00 น. งดให้บริการ
เสาร์ - อาทิตย์ 09.00 - 20.00 น.(พักเที่ยง) ปิดรับบัตร รอบเช้า 11.30 น. รอบเย็น 19.30 น.
วันหยุดนักขัตฤกษ์ 09.00 - 16.00 น. (พักเที่ยง) ปิดรับบัตร 15.30 น.
Facebook |
Website |
แผนที่
Dashboard รายงานข้อมูลโครงการ LINK
ข้อมูลของโครงการที่น่าสนใจ ณ เดือนพฤษภาคม 2566 (รายงานวันที่ 5 กันยายน 2566) เช่น
จำนวนผู้ลงทะเบียนทั้งหมด 3.15 ล้านคน
ผู้ที่ได้รับเงินอุดหนุน 2.29 ล้านคน
จำนวนเงินที่จ่ายไป 1,437 ล้านบาท
แม่เลี้ยงเดี่ยว 113,285 คน
แม่วัยใส 309,639 คน
แม่วัยใสที่เป็นแม่เลี้ยงเดี่ยว 18,774 คน
เด็กที่รับเงินอุดหนุน รวม ประมาณ 2.29 ล้านคน (ชาย 1.18 ล้านคน หญิง 1.11 ล้านคน)
เด็กอายุเกิน 6 ขวบ 686,451 คน
ภูมิภาคที่ลงทะเบียน อีสาน 1.17 ล้านคน ภาคกลาง 7.41 แสนคน ภาคใต้ 6.8 แสนคน ภาคเหนือ 5.65 แสนคน
5 จังหวัดลงทะเบียนมากสุด ได้แก่ นครราชสีมา (1.26 แสนคน) อุบลราชธานี (1.12 แสนคน) นครศรีธรรมราช (9.6 หมื่นคน) บุรีรัมย์ (9.2 หมื่นคน) สงขลา (8.8 หมื่นคน) ส่วนกรุงเทพ มาในลำดับ 7 8.2 หมื่นคน
5 จังหวัดที่มีผู้ลงทะเบียนน้อยที่สุด ได้แก่ สมุทรสงคราม 6.3 พันคน สิงห์บุรี 7.8 พันคน ตราด 1 หมื่นคน ระนอง 1.1 หมื่นคน อ่างทอง 1.1 หมื่นคน
จำนวนนักท่องเที่ยวสะสม ณ วันที่ 1 มกราคม - 22 ตุลาคม 2566
งานลอยกระทงประจำปี 2566 ประเทศสิงคโปร์ จัดโดยชมรมสามัคคีไทยไกลบ้าน
งานลอยกระทงประจำปี 2566 จัดโดยชมรมสามัคคีไทยไกลบ้าน วัดอานันทเมตยาราม วันอาทิตย์ 26 พฤศจิกายน 4 โมงเย็น เป็นต้นไป สนุกสนาน ครึกครื้น แบบคนไทยไกลบ้าน ร่วมลอยกระทง ชมการสาธิตการทำกระทง แกะสลัก อิ่มกับซุ้มอาหาร ขนม ไทย หลากหลาย พร้อมการแสดงบนเวที และพิเศษสุดที่นี่ ที่เดียว กับประกวดนางนพมาศประจำปี 2566 ขอเชิญสาวไทย และผู้สนใจไม่จำกัดสัญชาติ อายุ 16 ปีขึ้นไป เข้าร่วมประกวดนางนพมาศ ชิงรางวัลเงินสด 900$ พร้อมถ้วยรางวัล มงกุฎ และสายสะพาย ปิดรับสมัคร 25 พฤศจิกายน 2566 นี้
โรงพยาบาลบางละมุง อาคารแสงเดือน ตั้งแต่วันนี้ - 22 ธันวาคม 2566
เชิญชวนหญิงไทย อายุ 11 - 20 ปี ฉีดวัคซีน HPV ภายใต้สโลแกน Woman Power No! Cancer “สวย เริด เชิด สู้มะเร็ง” และ “รู้เท่าทัน ป้องกันได้ ตรวจพบรักษาไว ปลอดภัยจากมะเร็ง” มะเร็งปากมดลูกป้องกันได้ด้วยการฉีดวัคซีนHPV
สำหรับโรงพยาบาลบางละมุง เปิดบริการฉีดวัคซีน HPV โดยท่านสามารถติดต่อ Walk in รับบริการฉีดวัคซีนได้ที่โรงพยาบาลบางละมุง อาคารแสงเดือน เปิดให้บริการตั้งแต่วันนี้ - 22 ธันวาคม 2566(ยกเว้นวันหยุดเสาร์-อาทิตย์)เวลา 08.00น. - 15.00น.
หมายเหตุ : กรุณานำบัตรประจำตัวประชาชนมาด้วยทุกครั้ง
#วัคซีนมะเร็งปากมดลูก #โรงพยาบาลบางละมุง
หากมีข้อสงสัย-สอบถามเพิ่มเติม ติดต่องานป้องกันควบคุมโรคและระบาดวิทยา โรงพยาบาลบางละมุง โทร.038-411551-2 ต่อ 228
ยุทธศาสตร์ที่ 4 : ด้านการสร้างโอกาสและความเสมอภาคทางสังคม
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 834,240.6 ล้านบาท หรือคิดเป็นร้อยละ 24.0 ของวงเงินงบประมาณ เพื่อให้คนไทยได้รับสวัสดิการพื้นฐานอย่างทั่วถึง เป็นธรรม และลดความเหลื่อมล้ำในทุกมิติ ส่งเสริมสภาพแวดล้อมและกลไกที่ส่งเสริมการพัฒนาเศรษฐกิจฐานราก เร่งดำเนินการให้ประชาชนมีสิทธิในที่ดินทำกิน พัฒนาระบบสาธารณสุข ยกระดับ 30 บาทรักษาทุกโรค และการศึกษาที่ได้คุณภาพและมาตรฐาน รวมทั้งสร้างหลักประกันสวัสดิการ สำหรับแรงงานทั้งในระบบและนอกระบบ และสนับสนุนการเตรียมความพร้อมสังคมไทยในการรองรับสังคมสูงวัย จำแนกตามแผนงานสำคัญ ดังนี้
1) การเตรียมความพร้อมเพื่อรองรับสังคมสูงวัย งบประมาณ 820.1 ล้านบาท เพื่อเตรียมความพร้อมประชากรเข้าสู่สังคมสูงวัยอย่างมีคุณภาพ โดยเผยแพร่ความรู้และยกระดับคุณภาพชีวิตของผู้สูงอายุให้มีความมั่นคงทางเศรษฐกิจ สุขภาพ สังคม และสภาพแวดล้อมที่เหมาะสม อาทิ ผู้สูงอายุมีงานทำและมีรายได้ ไม่น้อยกว่า 2,720 คน สามารถเข้าถึงความคุ้มครองทางสังคมและมีส่วนร่วมในกิจกรรมทางสังคม ไม่น้อยกว่า 331,220 คน อยู่ภายใต้สภาพแวดล้อมที่เหมาะสม ไม่น้อยกว่า 11,000 แห่ง และเข้าถึงระบบบริการสุขภาพตามมาตรฐานและได้รับการดูแลที่เหมาะสม ไม่น้อยกว่า 1,393,195 คน ตลอดจน เพิ่มศักยภาพบุคลากรด้านสุขภาพขององค์กรปกครองส่วนท้องถิ่นและอาสาสมัครบริบาลท้องถิ่น ไม่น้อยกว่า 23,390 คน เพื่อเป็นกลไกในการดูแลผู้สูงอายุที่มีภาวะพึ่งพิง 62,320 คน ให้ได้รับบริการด้านสุขภาพและสังคมอย่างทั่วถึงและมีคุณภาพชีวิตที่ดีขึ้น
2) การพัฒนาและส่งเสริมเศรษฐกิจฐานราก งบประมาณ 2,302.7 ล้านบาท เพื่อเพิ่มศักยภาพและเสริมสร้างความเข้มแข็งของเศรษฐกิจฐานรากภายในประเทศให้สามารถสร้างรายได้เพิ่มขึ้น และกระจายรายได้สู่ชุมชน ลดช่องว่างความเหลื่อมล้ำของรายได้ประชาชน พัฒนาและสร้างโอกาสประชาชนกลุ่มเป้าหมายให้มีอาชีพ สนับสนุนเกษตรกรรุ่นใหม่ไปสู่เกษตรกรปราดเปรื่อง จำนวนเกษตรกรได้รับการพัฒนาเป็นผู้ประกอบการเกษตร 23,095 ราย เกษตรกรได้รับสิทธิในที่ดินทำกิน ยกระดับศักยภาพผู้ประกอบการธุรกิจ สนับสนุนศูนย์เรียนรู้การเพิ่มประสิทธิภาพการผลิตสินค้าเกษตร ส่งเสริมและสร้างทักษะในการประกอบอาชีพทั้งในและนอกภาคการเกษตร สนับสนุนการปลูกไม้มีค่าเป็นพืชเศรษฐกิจ พัฒนาผลิตภัณฑ์และการให้บริการชุมชน โดยพัฒนาความเข้มแข็งของสถาบันเกษตรกร วิสาหกิจชุมชน รวมทั้งพัฒนาศักยภาพผู้ประกอบการชุมชน ส่งเสริมการแปรรูปสินค้าเกษตรในชุมชน พัฒนาผลิตภัณฑ์สินค้าชุมชน สนับสนุนการพัฒนากลไกการตลาดและระบบการบริหารจัดการเพื่อเพิ่มรายได้จากการจำหน่ายสินค้าชุมชน โดยพัฒนาศักยภาพการดำเนินธุรกิจของสหกรณ์ กลุ่มเกษตรกร และวิสาหกิจชุมชน ส่งเสริมช่องทางการตลาดสินค้าชุมชนให้ครอบคลุมทุกช่องทาง รวมทั้งส่งเสริมการพัฒนากลไกและโครงสร้างดูดซับมูลค่าทางเศรษฐกิจ และการกระจายรายได้กลับสู่ท้องถิ่น
3) การสนับสนุนด้านการสร้างโอกาสและความเสมอภาคทางสังคม งบประมาณ 5,053.0 ล้านบาท เพื่อยกระดับคุณภาพชีวิตของผู้มีรายได้น้อยและเกษตรกร โดยการจัดสรรที่ดินทำกินของตนเอง เพื่อใช้สำหรับประกอบอาชีพเกษตรกรรม และที่อยู่อาศัย ให้มีคุณภาพชีวิตที่ดีขึ้น สามารถเข้าถึงปัจจัยพื้นฐานที่จำเป็นต่อการดำรงชีพ รวมทั้งการแก้ไขปัญหาหนี้สินของเกษตรกรผ่านกองทุนฟื้นฟูและพัฒนาเกษตรกร 591 ราย ส่งเสริมการร่วมมือทางการค้าเพื่อพัฒนาเศรษฐกิจชุมชนและสนับสนุนการเสริมสร้างความเข้มแข็งทางเศรษฐกิจฐานรากในแต่ละภูมิภาค ส่งเสริมกองทุนหมู่บ้านและชุมชนเมืองแห่งชาติรวมทั้งสนับสนุนผู้มีรายได้น้อยให้เข้าถึงสินเชื่อเพื่อที่อยู่อาศัยเป็นของตนเองในระดับราคาที่เหมาะสม โดยรัฐบาลสนับสนุนสินเชื่อที่อยู่อาศัยในอัตราดอกเบี้ยที่ผ่อนปรน ตลอดจนสนับสนุนงานพิธีศพที่ได้รับพระราชทาน ตามพระบรมราโชบายอย่างเหมาะสม
4) การเสริมสร้างพลังทางสังคม งบประมาณ 6,842.0 ล้านบาท เพื่อส่งเสริมให้ทุกภาคส่วนมีส่วนร่วมในการสร้างพลังในชุมชนให้เกิดเป็นพลังทางสังคม สร้างครอบครัวอบอุ่นเข้มแข็ง สนับสนุนบทบาทและพัฒนาศักยภาพองค์การสวัสดิการสังคม อาสาสมัคร เครือข่าย และภาคประชาชน พัฒนากลไกและระบบสนับสนุนการบริหารจัดการเครือข่ายในระดับจังหวัด อำเภอ ตำบล และชุมชน ส่งเสริมศักยภาพบทบาทสตรีและสิทธิมนุษยชน ส่งเสริมและพัฒนาให้เกิดวิสาหกิจเพื่อสังคม 160 กิจการ สนับสนุนทุกเพศสภาพเป็นพลังในการขับเคลื่อนการพัฒนาสังคม ส่งเสริมชุมชนให้มีการสร้างงาน สร้างรายได้และพึ่งตนเองได้ ประชาชนมีที่อยู่อาศัยและที่ดินทำกิน ส่งเสริมและพัฒนาศักยภาพเกษตรกรในพื้นที่โครงการหลวง และโครงการอันเนื่องมาจากพระราชดำริ สนับสนุนการอนุรักษ์และฟื้นฟูศิลปวัฒนธรรมของแต่ละชุมชนโดยพัฒนาแหล่งเรียนรู้ทางการศึกษาด้านศิลปวัฒนธรรม นำองค์ความรู้ เทคโนโลยี นวัตกรรม และน้อมนำแนวทางพระราชดำริสู่การปฏิบัติ เพื่อส่งเสริมทุนทางสังคมและวัฒนธรรมของท้องถิ่นให้สามารถนำไปต่อยอดพัฒนาสู่การเพิ่มคุณค่า และมูลค่าทางเศรษฐกิจและสังคม
5) มาตรการแบบเจาะจงกลุ่มเป้าหมายเพื่อแก้ปัญหาเฉพาะกลุ่ม งบประมาณ 22,867.0 ล้านบาท เพื่อสนับสนุนและจัดหาโครงสร้างพื้นฐานที่เหมาะสมให้ประชากรกลุ่มต่าง ๆ ไม่ว่าจะเป็นการพิสูจน์สิทธิของบุคคลในเขตที่ดินของรัฐที่มีข้อพิพาทให้ยุติ ช่วยเหลือกลุ่มเป้าหมายที่ต้องการความช่วยเหลือเป็นพิเศษโดยเฉพาะกลุ่มเด็ก เยาวชน สตรี คนพิการ ผู้สูงอายุ และผู้ด้อยโอกาสทางสังคม เพื่อให้สามารถเข้าถึงบริการขั้นพื้นฐานของรัฐอย่างทั่วถึง และเป็นธรรม สร้างความเชื่อมั่น และเพิ่มคุณภาพการให้บริการสาธารณะให้มีความปลอดภัย รวมทั้งสร้างพลังความร่วมมือและการมีส่วนร่วมของประชาชน เพื่อนำไปสู่การยกระดับการคุ้มครองทางสังคม โดยสนับสนุนเบี้ยเด็กแรกเกิดถึง 6 ปี ไม่น้อยกว่า 2,556,723 คน สนับสนุนการจัดการศพผู้สูงอายุตามประเพณี 115,281 ราย สนับสนุนการพัฒนาและปรับปรุงบ้านมั่นคง 3,900 ครัวเรือน บ้านพอเพียง 26,348 ครัวเรือน พัฒนาที่อยู่อาศัยชุมชนริมคลองเปรมประชากร 70 ครัวเรือน รวมทั้งผู้มีรายได้น้อยสามารถเข้าถึงแหล่งสินเชื่อเพื่อซื้อที่อยู่อาศัยเป็นของตนเอง ส่งเสริมการจัดสิ่งอำนวยความสะดวกและบริการสาธารณะสำหรับคนพิการ ช่วยเหลือคุ้มครองผู้ประสบปัญหาทางสังคม พัฒนาคุณภาพชีวิตประชาชนกลุ่มเป้าหมายพิเศษในพื้นที่ ปรับปรุงและจัดหาอาคารเช่าสำหรับผู้มีรายได้น้อย รวมถึงสนับสนุนบริการสาธารณะให้แก่ประชาชน
6) การพัฒนาจังหวัดและกลุ่มจังหวัดแบบบูรณาการ งบประมาณ 23,076.0 ล้านบาท เพื่อสนับสนุนการดำเนินการแบบบูรณาการครอบคลุมทุกมิติการพัฒนาของจังหวัดและกลุ่มจังหวัด ที่มีความสอดคล้องกับทิศทางการพัฒนาของประเทศ โดยให้ความสำคัญกับกระบวนการมีส่วนร่วมของประชาชน เพื่อให้สามารถตอบสนองความต้องการและแก้ไขปัญหาในพื้นที่ผ่านโครงการภายใต้แผนพัฒนาจังหวัดและแผนพัฒนากลุ่มจังหวัดที่มีการบูรณาการร่วมกันทุกภาคส่วน ได้แก่ ส่วนราชการ รัฐวิสาหกิจ องค์กรปกครองส่วนท้องถิ่น หน่วยงานของรัฐ ภาคเอกชน และประชาชน เชื่อมโยงยุทธศาสตร์การพัฒนาประเทศไปสู่การขับเคลื่อนในระดับพื้นที่ ครอบคลุมทุกมิติ ทั้งด้านเศรษฐกิจ สังคม ความมั่นคง ทรัพยากรธรรมชาติและสิ่งแวดล้อม นำไปสู่การยกระดับคุณภาพชีวิตของประชาชน
7) การสร้างความเสมอภาคทางการศึกษา งบประมาณ 85,853.3 ล้านบาท เพื่อลดความเหลื่อมล้ำทางการศึกษาและสร้างโอกาสในการเข้าถึงการศึกษาที่มีคุณภาพและมีมาตรฐานอย่างเท่าเทียมและทั่วถึง ทั้งในระบบและนอกระบบตามสิทธิที่กำหนดไว้ โดยสนับสนุนค่าใช้จ่ายในการจัดการศึกษาตั้งแต่ระดับอนุบาลจนจบการศึกษาขั้นพื้นฐาน ไม่น้อยกว่า 9,085,400 คน ประกอบด้วยค่าจัดการเรียนการสอน ค่าหนังสือเรียน ค่าอุปกรณ์การเรียน ค่าเครื่องแบบนักเรียน และค่ากิจกรรมพัฒนาคุณภาพผู้เรียน รวมทั้งส่งเสริมและสนับสนุนกองทุนเพื่อความเสมอภาคทางการศึกษาในการช่วยเหลือผู้ขาดแคลนทุนทรัพย์และด้อยโอกาส ไม่น้อยกว่า 1.3 ล้านคน ให้ได้รับโอกาสทางการศึกษาหรือการเรียนรู้เพื่อพัฒนาศักยภาพให้เหมาะสมสอดคล้องกับความจำเป็นรายบุคคล ควบคู่ไปกับการพัฒนาคุณภาพการศึกษาของหน่วยจัดการเรียนรู้ทั้งในระบบและนอกระบบหรือกลไกความร่วมมือในพื้นที่ รวมทั้งเสริมสร้างและพัฒนาศักยภาพครู อาจารย์ และบุคลากรทางการศึกษาให้มีคุณภาพ และสนับสนุนทุนเพื่อสร้างโอกาสทางการศึกษาระดับอุดมศึกษาและสายอาชีพ จำนวน 25,000 คน
8) การสร้างหลักประกันทางสังคม งบประมาณ 339,007.2 ล้านบาท เพื่อให้ประชาชนได้รับความสะดวกจากบริการพื้นฐานทางการแพทย์ใกล้บ้าน มีสุขภาวะที่ดี โดยพัฒนาระบบสาธารณสุข ยกระดับ 30 บาทรักษาทุกโรคให้มีสิทธิประโยชน์เพิ่มขึ้น ประชาชนที่ได้รับสิทธิ์ ไม่น้อยกว่า 47.67 ล้านคน สามารถเข้าถึงบริการทางการแพทย์และสาธารณสุขภายใต้ระบบประกันสุขภาพที่ทั่วถึง ได้มาตรฐานและเป็นธรรม ด้วยบัตรประชาชนใบเดียว โดยเชื่อมโยงข้อมูลบนฐานข้อมูลที่มีความปลอดภัย พัฒนาคลินิกหมอครอบครัว ส่งเสริมกลไกการสร้างเสริมสุขภาพและป้องกันโรค โดยเฉพาะการให้วัคซีนเพื่อป้องกันโรค อาทิ วัคซีนป้องกันมะเร็งปากมดลูก มีสถานส่งเสริมสุขภาพ สถานชีวาภิบาลประจำท้องถิ่นเพื่อดูแลผู้ป่วยระยะสุดท้าย รวมทั้งเพิ่มประสิทธิภาพด้านการคุ้มครองผู้บริโภคเพื่อดูแลประชาชนให้ได้รับความเป็นธรรมในราคาสินค้าและบริการอย่างเหมาะสม ส่งเสริมการสร้างหลักประกันสังคมและสวัสดิการสำหรับแรงงานในระบบและนอกระบบ รวมถึงสร้างความปลอดภัยและอนามัยสุขภาพในการทำงานให้เหมาะสม ส่งเสริมและพัฒนาศักยภาพคนไร้ที่พึ่ง และคนขอทานได้รับการคุ้มครองช่วยเหลือที่ครอบคลุม ตลอดจนสนับสนุนและช่วยเหลือผู้มีรายได้น้อยในการลดภาระค่าครองชีพผ่านบัตรสวัสดิการแห่งรัฐ ไม่น้อยกว่า 15 ล้านคน และส่งเสริมการออมเพื่อเป็นหลักประกันการจ่ายบำนาญและประโยชน์ตอบแทนแก่สมาชิกเมื่อสิ้นสภาพ 2.55 ล้านคน ผ่านกองทุนการออมแห่งชาติ
9) การกระจายอำนาจให้แก่องค์กรปกครองส่วนท้องถิ่น งบประมาณ 339,124.9 ล้านบาท เพื่อให้องค์กรปกครองส่วนท้องถิ่นสามารถดำเนินงานและจัดบริการสาธารณะได้อย่างมีมาตรฐานและประสิทธิภาพ สามารถพึ่งตนเองได้ในทุกมิติและประชาชนได้รับบริการสาธารณะอย่างมีคุณภาพ ทั่วถึง และเป็นธรรม โดยมีการดำเนินงานที่สำคัญ คือ สนับสนุนการจัดการศึกษาขั้นพื้นฐานให้แก่นักเรียนโรงเรียนในสังกัดองค์กรปกครองส่วนท้องถิ่น ไม่น้อยกว่า 0.96 ล้านคน สนับสนุนอาหารกลางวันนักเรียน ไม่น้อยกว่า 5.19 ล้านคน สนับสนุนอาหารเสริม (นม) ไม่น้อยกว่า 5.2 ล้านคน สนับสนุนเบี้ยยังชีพผู้สูงอายุ ไม่น้อยกว่า 11.83 ล้านคน เบี้ยยังชีพคนพิการ ไม่น้อยกว่า 2.14 ล้านคน รวมถึงสนับสนุนการมีส่วนร่วมของประชาชนในการแสดงความสามารถและร่วมพัฒนาศักยภาพในพื้นที่ของตนเอง เพื่อยกระดับคุณภาพชีวิตของประชาชนในท้องถิ่นให้ดียิ่งขึ้น เสริมสร้างความเข้มแข็งให้แก่ชุมชนและประเทศอย่างมั่นคง และยั่งยืน
10) การดำเนินภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 837.9 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 8,456.5 ล้านบาท เพื่อสนับสนุนยุทธศาสตร์ด้านการสร้างโอกาสและความเสมอทางสังคมให้ประชาชนได้รับโอกาสในการเข้าถึงการบริการสาธารณะอย่างเท่าเทียม เป็นธรรม และทั่วถึง รวมทั้งพัฒนาคุณภาพชีวิตของแรงงานในระบบและนอกระบบ
ประเทศตุรกี
TURKEY
1. Faculty of Medicine, Ondokuz Mayis University, Samsun, Turkey
หลักสูตร 6 ปี
ปริญญา Doctor of Medicine (MD) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศตุรกี
และรับรองโรงพยาบาลที่ใช้ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ใน
ประเทศตุรกีได้แก่ Ondokuz Mayis University Hospital
ว/ด/ป ที่ รับรอง 12 ธ.ค. 62
ว/ด/ป ครบอายุ การรับรอง 11 ธ.ค.67
หมวด 9 พนักงานเจ้าหน้าที่
อัณฑะเหมียวครองเมือง โดย จรจัดสรร นิทรรศการงานศิลปะเพื่อจัดการปัญหาน้องแมวจร ที่นอกจากจะสร้างการรับรู้ถึงความจำเป็นในการทำหมันเพื่อคุมกำเนิดจำนวนประชากรเหมียวแล้ว ยังสามารถระดมทุนและช่วยหาบ้านอุปการะให้กับน้องแมวได้อีกหลายตัว นับเป็นรูปแบบกิจกรรมที่กรุงเทพมหานครสามารถนำไปส่งเสริมให้เกิดขึ้นในพื้นที่อื่น ๆ ได้อีกหลายพื้นที่
ศูนย์ทันตกรรม
ศูนย์ทันตกรรม โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี ชั้น4
ติดต่อสอบถามและนัดหมาย 0-2432-6167-8 ต่อ 4020 (สามารถเบิกค่ารักษาพยาบาลได้ตามสิทธิการรักษา)
ศูนยทันตกรรมโรงพยาบาลศูนย์บริการการแพทย์นนทบุรี มุ่งเน้นความปลอดภัยของผู้ป่วยเป็นสำคัญ วิวัฒนาการทางทันตกรรมในแต่ละสาขามีการพัฒนาไปอย่างรวดเร็วการดูแลสุขภาพช่องปากครอบคลุมทั้ง การป้องกัน และการรักษาที่ทันสมัย มีการพัฒนาคุณภาพและความรู้ของทันตแพทย์อย่างสม่ำเสมอ ศูนย์ทันตกรรมโรงพยาบาลศูนย์บริการการแพทย์นนทบุรี จึงจัดให้มีความพร้อมของทีมทันตกรรมที่มีความเชี่ยวชาญและพร้อมที่จะให้บริการดังต่อไปนี้ ตรวจฟัน อุดฟัน ถอนฟัน ขูดหินปูน ทันตกรรมสำหรับเด็ก รากฟันเทียม จัดฟัน ศัลยกรรมภายในช่องปาก รักษาโรคเหงือก ฟันปลอม ครอบฟัน ฯลฯ
เปิดให้บริการ
ในเวลาราชการ
จันทร์-พฤหัสบดี เวลา 08.00-16.00 น.
ศุกร์ เวลา 08.00 -12.00 น.
นอกเวลาราชการ เวลา 16.00-20.00 น.
เสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์ เวลา 08.00-12.00 น.
คลินิกพิเศษนอกเวลาราชการเวชกรรมฟื้นฟู จันทร์-พฤหัสบดี เวลา 16.00 น. - 20.00 น.
คลินิกพิเศษนอกเวลาราชการเวชกรรมฟื้นฟู
เริ่ม 22 ส.ค. 65 จันทร์-พฤหัสบดี เวลา 16.00 น. - 20.00 น.
ให้บริการ ลดปวดและฟื้นฟูในผู้ป่วยที่มีปัญหา
- ปวดคอ บ่า ไหล่ สะบัก ออฟฟิศซินโด
- มือชา ปวดข้อศอก ไหล่ติด
- ปวดเข่า ปวดหลัง ปวดกล้ามเนื้อ
- ปวดส้นเท้า รองช้ำ
ค่าบริการ เบิกได้ตามสิทธิการรักษา ค่าบริการส่วนเกิน เริ่มต้นที่ 900 บาท
สอบถามเพิ่มเติม จองคิวล่วงหน้า โทร 038-931591 วันเวลาราชการ
ผู้บริหารมูลนิธิคณะแพทยศาสตร์ จุฬาลงกรณ์มอบของที่ระลึกแก่วิทยากร
ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง บ่อนเซาะวิทยาศาสตร์แท้ และอุดหนุนวิทยาศาสตร์เทียม (pseudo-science)
ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง ให้การสนับสนุนทั้งทางตรงและทางอ้อมแก่นักวิทยาศาสตร์ นักวิจัย ล็อบบี้ยิสต์ และอดีตคนวงใน เพื่อโต้แย้งหลักฐานทางวิทยาศาสตร์ที่แสดงให้เห็นว่าผลิตภัณฑ์ของตนเป็นอันตราย
เป็นเวลาหลายทศวรรษ ที่อุตสาหกรรมยาสูบ จงใจโกหกและปลอมแปลงหลักฐานที่เกี่ยวข้องกับอันตรายจากยาสูบ อันตรายจากควันบุหรี่มือสอง และ "คุณประโยชน์" ของนวัตกรรมผลิตภัณฑ์ต่างๆ เช่น "น้ำมันดินต่ำ" และบุหรี่มีก้นกรอง พวกเขายังได้จ่ายเงินสนับสนุนวารสาร การศึกษาทางการแพทย์ และ กิจกรรมต่างๆ สำหรับผู้สนใจด้านสุขภาพและวิทยาศาสตร์
ในปี 2024 PMI ได้ให้ทุนสนับสนุนหลักสูตรต่างๆ ของ Medscape เกี่ยวกับการเลิกบุหรี่ ที่แสดงให้เห็นว่า "ผลิตภัณฑ์นิโคติน ค่อนข้างไม่เป็นอันตราย” ซีรีส์นี้ถูกยกเลิกในเวลาต่อมาหลังจากเสียงประณามจากนักวิทยาศาสตร์และนักการแพทย์ชุมชน
พวกเขาทำทั้งหมดนี้เพื่อบรรเทาความกังวลในหมู่ผู้กำหนดนโยบายและสาธารณชน เกี่ยวกับอันตรายที่จะเกิดจากจากผลิตภัณฑ์ของตน ก็เพื่อจะทำให้มีการควบคุมน้อยลง กฎระเบียบที่เข้มงวดน้อยลง จะทำให้ผลิตภัณฑ์เข้าถึงซื้อหาได้ง่ายขึ้น เพราะราคาไม่แพงและหาได้ทั่วไป รวมถึงเยาวชนด้วย
บริษัทยาสูบยังผลิตหรือสนับสนุน การสร้างข้อมูลที่ทำให้เข้าใจผิด เกี่ยวกับความสำคัญทางเศรษฐกิจของตนเอง ความต่างระหว่างรายได้จากภาษี เทียบกับอันตรายต่อสุขภาพและสังคมจากผลิตภัณฑ์ของพวกเขา หรือ ความเชื่อมโยงระหว่างภาษียาสูบ กับการค้าที่ผิดกฎหมาย
การวิจัยและข้อมูลบิดเบือนมักถูกส่งไปยังชุมชนวิชาการและสาธารณสุข ผู้กำหนดนโยบายและสื่อ ผ่านกลุ่มแนวหน้าและพันธมิตร
ยาสูบและอุตสาหกรรมที่เกี่ยวข้อง ใช้ผู้ส่งข้อความหลอกลวง เพื่อเผยแพร่ข้อความที่ทำให้เข้าใจผิดเหล่านี้ เนื่องจากอุตสาหกรรม ถูกกีดกันออกไปจากช่องทางภาครัฐและเอกชนมากขึ้นเรื่อยๆ ซ้ำยังไม่ได้รับความเห็นอกเห็นใจและการสนับสนุนจากสาธารณชน นั่นทำให้กลุ่มยาสูบและอุตสาหกรรมที่เกี่ยวข้อง จำเป็นต้องสร้าง กลุ่มแนวร่วมของตนเองขึ้น และบ่มเพาะการเป็นพันธมิตร ก็เพื่อให้กระทำการใดๆ เพื่อผลประโยชน์ของตนนั่นเอง
กลุ่มเหล่านี้ ถูกจัดเป็นกลุ่มบุคคลที่สาม กลุ่มแนวหน้า หรือกลุ่มรากหญ้าเทียม (Astroturf Group)* (41)
*(Astroturf Group กลุ่มองค์กรทางการเมือง ที่แสร้ง/ตบตา/ปลอมแปลงให้ดูเสมือนเป็นตัวแทน/สนับสนุนจากชนชั้นรากหญ้า แต่จริงๆแล้วไม่ใช่)
Medical Wellness คืออะไร
เวลเนสทางการแพทย์ (Medical Wellness) เป็นแนวทางการให้บริการด้านสุขภาพโดยคำนึงถึงปัจจัยหลายประการที่มี อิทธิพลต่อสุขภาพของบุคคล จึงก่อให้เกิดทางเลือกมากมายในการเข้าถึงการรักษาพยาบาล ป้องกันโรค ส่งเสริมสุขภาพ และฟื้นฟูสุขภาพ เพื่อความสมบูรณ์ของร่างกายที่ดีที่สุดของบุคคล
นอกจากนี้ เวลเนสทางการแพทย์ ยังหมายถึง
- การประยุกต์ใช้หลักปฏิบัติทางการแพทย์และสุขภาพ ที่มีมาตรฐานอย่างสมดุลและเหมาะสมภายในสถานพยาบาล
- การส่งเสริมแนวทางการดูแลผู้ป่วยแบบสหวิทยาการ (multi-disciplinary) โดยอาศัยความยินยอมและการตัดสินใจที่ได้รับการบอกกล่าว (informed consent) ที่สนับสนุนให้การให้บริการระหว่างผู้ปฏิบัติงานและ ผู้ป่วยเป็นไปอย่างถูกต้อง ราบรื่นและต่อเนื่อง
- การเสริมสร้างความต่อเนื่องเชื่อมโยงระหว่างผู้ประกอบวิชาชีพทางการแพทย์ที่เป็นผู้ให้บริการหลักและผู้ที่ไม่ใช่ผู้ประกอบวิชาชีพทางการแพทย์ที่ให้บริการสนับสนุน
- การปฏิบัติโดยมีเป้าหมายหลักในการส่งเสริมสุขภาพ (Health Promotion) และความเป็นอยู่ที่ดีที่สุด (Well-being) รายบุคคล (Personalized Care)
- ส่งเสริม พัฒนาการประยุกต์ใช้มาตรฐานวิชาชีพสำหรับ การจัดบริการเวลเนสทางการแพทย์ในปฏิบัติการทางคลินิก
บริการในกลุ่ม Medical Wellness
จากรายงานการสำรวจตลาดบริการด้านเวลเนสทางการแพทย์ พบว่า กลุ่มบริการที่ได้รับความนิยมและ มีส่วนแบ่งการตลาดขนาดใหญ่ ได้แก่
- การแพทย์ผสมผสานและการแพทย์ทางเลือก (Complementary and Alternative Medicine)
- บริการด้านความงามและการชะลอวัย (Beauty Care and Anti-Aging)
- การแพทย์เชิงป้องกันและการแพทย์เฉพาะบุคคล (Preventative, Personalized Medicine)
- การกินเพื่อสุขภาพ โภชนาการและการควบคุมน้ำ หนัก (Healthy Eating, Nutrition and Weight Loss)
- การฟื้นฟูความอ่อนเยาว์ (Rejuvenation)
- ผลิตภัณฑ์และบริการด้านการส่งเสริม ป้องกันและ ฟื้นฟูสุขภาพเพื่อมุ่งสู่การมีสุขภาพองค์รวม
โดยแนวคิดและวิธีปฏิบัติเกี่ยวกับสุขภาพแบบองค์รวม (Holistic Health) เป็นแนวคิดที่เติบโตอย่างมีพลวัตรและได้รับความสนใจอย่างมากในอุตสาหกรรมสุขภาพทางการแพทย์ในช่วงไม่กี่ปีที่ผ่านมา แนวทางนี้เน้นการบูรณาการความรู้ทางการแพทย์เพื่อเสริมสร้างความเป็นอยู่ที่ดีทางร่างกาย จิตใจ และอารมณ์ เพื่อให้ได้ภาวะสุขภาพที่มีความสมบูรณ์นอกเหนือไปจากการรักษาพยาบาลเมื่อยามเจ็บป่วย ครอบคลุมถึงพฤติกรรมสุขภาพการเลือกวิถีชีวิต การจัดการความเครียด โภชนาการ และการฟื้นฟูสภาพจิตใจ (mental health) ท่ามกลางปัจจัยต่างๆ
ซึ่งการเปลี่ยนแปลงกระบวนทัศน์นี้ ได้กระตุ้นให้เกิดบริการและแนวปฏิบัติที่เป็นนวัตกรรมใหม่ๆ มากมาย เพื่อรองรับความต้องการดูแลสุขภาพแบบองค์รวมที่มีมากขึ้นอย่างหลากหลายของบุคคล
การขยายตัวอย่างกว้างขวางของอุตสาหกรรมทางการแพทย์และบริการสุขภาพ แสดงให้เห็นถึงการผสมผสานระหว่างการปฏิบัติทางการแพทย์แบบดั้งเดิม กับการรักษาทางเลือก ซึ่งส่งเสริมการดำรงชีวิตอยู่อย่างสมดุลและกลมกลืน แนวทางนี้แสดงให้เห็นถึงการยอมรับ ถึงความสัมพันธ์อันซับซ้อนระหว่างจิตใจและร่างกาย และ พยายามค้นหาสาเหตุที่แท้จริงของปัญหาสุขภาพ ไม่ใช่แค่เพียงการรักษาอาการตามความเจ็บป่วยหรือไม่สุขสบายเท่านั้น
ในขณะที่ผู้คนมองหาวิธีจัดการสุขภาพของตนเองในเชิงรุกมากขึ้น อุตสาหกรรมทางการแพทย์และบริการสุขภาพก็ตอบสนอง ด้วยการนำเสนอบริการที่หลากหลาย
ตั้งแต่แผนสุขภาพ ส่วนบุคคลและโปรแกรมส่งเสริมพัฒนาปัญญาและความรู้แจ้ง (mindfulness) ไปจนถึงการแพทย์บูรณาการ รูปแบบการดูแลสุขภาพนี้แสดงให้เห็นถึงการเปลี่ยนแปลงทางวัฒนธรรมในวงกว้างที่ตระหนักว่า สุขภาพเป็นเส้นทางของการประพฤติปฏิบัติที่ต่อเนื่อง (health continuum) และมุ่งเน้นสู่ความเป็นอยู่ที่ดีอย่างยั่งยืน (Sustainable Well-being)
จากรายงานการสำรวจตลาดสุขภาพทางการแพทย์ ทั่วโลกในปี พ.ศ.2566 พบว่าในปีพ.ศ.2565 มีมูลค่า ประมาณ 1,309.1 พันล้านดอลลาร์สหรัฐ โดยคาดประมาณว่ายอดขายของตลาดจะเติบโตที่ CAGR ที่ร้อยละ 14.0% และมีมูลค่าประมาณ 5,524.3 พันล้านดอลลาร์สหรัฐภาย ในปีพ.ศ. 2576 ซึ่งตลาดบริการทางการแพทย์และสุขภาพทั่วโลกได้รับการคาดหมายว่าจะเติบโตในอัตราที่สำ คัญ ในปีต่อๆ ไป ครอบคลุมผลิตภัณฑ์และบริการต่างๆหลาก หลายที่มุ่งส่งเสริมทั้งสุขภาพกายและสุขภาพจิต ประกอบ ด้วยหมวดหมู่ต่างๆ เช่น การแพทย์ผสมผสาน และการแพทย์ทางเลือก การท่องเที่ยวเพื่อสุขภาพ การแพทย์เชิงป้องกันและเฉพาะบุคคล โดยภูมิภาคเอเชียแปซิฟิกจะมีอัตราการเติบโตสูงสุดในช่วงระยะเวลาคาดการณ์
เนื่องจากได้แรงหนุนจากปัจจัยต่างๆ เช่น การใช้จ่ายด้านการรักษาพยาบาลที่เพิ่มขึ้น ความตระหนักที่เพิ่มขึ้นของผู้คนเกี่ยวกับการดูแลสุขภาพเชิงป้องกัน ความก้าวหน้าของเทคโนโลยีและวิทยาการทางการแพทย์ ความชุกของโรคเรื้อรังที่เพิ่มขึ้น การให้ความสำคัญกับสุขภาพจิตและความพยายามในการจัดการกับความเครียดของผู้คนด้วยตนเอง เช่น การฝึกสติ และการบำบัดพฤติกรรม
แม้ว่าในปัจจุบัน ภูมิภาคอเมริกาเหนือครองตลาด ด้านสุขภาพทางการแพทย์ของโลกโดยมีส่วนแบ่งตลาดขนาดใหญ่ที่สุด เนื่องจากมีสถานพยาบาลจำนวนมากและ เทคโนโลยีทางการแพทย์ที่ก้าวหน้า รวมทั้งอุตสาหกรรมยาขนาดใหญ่ แต่ก็มีค่าใช้จ่ายด้านการรักษาพยาบาลที่สูงมาก
ดังนั้น จึงเป็นโอกาสของภูมิภาคเอเชียแปซิฟิกที่จะสามารถแข่งขันและมีอัตราการเติบโตของอุตสาหกรรมการแพทย์และบริการสุขภาพสูงสุดในอนาคตอันใกล้
14.LIFE BELOW WATER ชีวิตใต้ผืนน้ำ
มหาสมุทรของโลก อุณหภูมิ เคมี กระแสน้ำ และชีวิต ขับเคลื่อนระบบโลกที่ทำให้โลกอยู่อาศัยได้สำหรับมนุษย์ วิธีที่เราจัดการทรัพยากรที่สำคัญนี้มีความสำคัญต่อมนุษยชาติโดยรวม และเพื่อชดเชยผลกระทบจากการเปลี่ยนแปลงสภาพภูมิอากาศ
ผู้คนมากกว่าสามพันล้านคนต้องพึ่งพาความหลากหลายทางชีวภาพทางทะเลและชายฝั่งเพื่อดำรงชีพ อย่างไรก็ตาม ในปัจจุบัน เราพบว่าปลาทั่วโลกร้อยละ 30 ถูกใช้ประโยชน์เกินควร จนเหลือต่ำกว่าระดับที่ปลาสามารถผลิตผลผลิตอย่างยั่งยืนได้
มหาสมุทรยังดูดซับคาร์บอนไดออกไซด์ที่มนุษย์ผลิตได้ประมาณร้อยละ 30 และเราพบว่าระดับกรดในมหาสมุทรเพิ่มขึ้นร้อยละ 26 นับตั้งแต่การปฏิวัติอุตสาหกรรมเริ่มต้น มลพิษทางทะเล ซึ่งส่วนใหญ่มาจากแหล่งบนบก กำลังเพิ่มสูงขึ้นอย่างน่าตกใจ โดยพบขยะพลาสติกเฉลี่ย 13,000 ชิ้นต่อตารางกิโลเมตรของมหาสมุทร
เป้าหมายการพัฒนาอย่างยั่งยืนมีจุดมุ่งหมายเพื่อจัดการและปกป้องระบบนิเวศทางทะเลและชายฝั่งจากมลภาวะอย่างยั่งยืน ตลอดจนแก้ไขผลกระทบจากภาวะกรดในมหาสมุทร การส่งเสริมการอนุรักษ์และการใช้ทรัพยากรในมหาสมุทรอย่างยั่งยืนผ่านกฎหมายระหว่างประเทศจะช่วยบรรเทาความท้าทายบางประการที่มหาสมุทรของเรากำลังเผชิญอยู่
เปิดใช้งานสแกนใบหน้า หรือนิ้วมือ
คำถาม : ปัจจัยในการเลือกใช้สถานบริการศัลยกรรมเสริมความงามดังกล่าว?
ในการเลือกสถานบริการศัลยกรรม ปัจจัยที่เกี่ยวข้องกับมาตรฐานความปลอดภัยเป็นสิ่งที่ผู้บริโภค ให้ความสำคัญสูงสุดตามด้วยปัจจัยด้านราคา โดย Gen Z มีแนวโน้มเลือกสถานที่ใช้บริการตามรีวิว สูงกว่ากลุ่มอื่น
12.Electrification and renewables - การใช้ไฟฟ้าและพลังงานหมุนเวียน
แนวโน้มการใช้ไฟฟ้าและพลังงานหมุนเวียนครอบคลุมห่วงโซ่คุณค่าการผลิต การจัดเก็บ และการจำหน่ายพลังงานทั้งหมด เทคโนโลยีต่างๆ ได้แก่ แหล่งพลังงานหมุนเวียน เช่น พลังงานแสงอาทิตย์และพลังงานลม แหล่งพลังงานสะอาด เช่น พลังงานนิวเคลียร์และไฮโดรเจน เชื้อเพลิงที่ยั่งยืน และพลังงานชีวภาพ และโซลูชันการจัดเก็บและจำหน่ายพลังงาน เช่น ระบบแบตเตอรี่อายุการใช้งานยาวนานและโครงข่ายไฟฟ้าอัจฉริยะ
4. นโยบายส่งเสริมการมีคู่ของภาครัฐยังไม่ต่อเนื่องและครอบคลุมความต้องการของคนโสด
โดยการดำเนินกิจกรรมในช่วงที่ผ่านมา อาทิ ในปี 2564 กระทรวงสาธารณสุข ได้มีการจัดกิจกรรม “โสดมีตติ้ง” เพื่อเปิดโอกาสให้คนโสดได้เรียนรู้และพัฒนาความสัมพันธ์กัน และในปี 2566 จัดกิจกรรม “Sod Smart” เพื่อพัฒนาศักยภาพคนโสดรุ่นใหม่ สร้างทัศนคติเชิงบวกต่อการใช้ชีวิตคู่และการมีลูก ซึ่งผลการจัดกิจกรรมส่วนหนึ่งพบว่า คนโสดที่เข้าร่วมกิจกรรมกว่าร้อยละ 87.0 อยากมีคู่ แต่เหตุผลที่ยังเป็นโสด คือ ยังไม่เจอคนที่ใช่ ไม่มีเวลา ไม่มีโอกาสได้พบเพื่อนใหม่และมีภาระมาก
ขณะที่ในปี 2563 และปี 2566 การท่องเที่ยวแห่งประเทศไทย ร่วมกับ Tinder และบริษัท ไดร์ฟ ดิจิทัล จำกัด ได้จัดทำโครงการ “เส้นทางคนโสด Single Journey” เพื่อกระตุ้นเศรษฐกิจ การท่องเที่ยวในประเทศและเปิดโอกาสให้คนโสดได้มีโอกาสพบกัน ขณะที่ในต่างประเทศมีแนวทางการส่งเสริมการมีคู่ที่ครอบคลุมไปถึงการบรรเทาภาระค่าใช้จ่ายและการสร้างโอกาสในการมีคู่ อาทิ
สิงคโปร์ ในปี 2561 มีการจัดทำโครงการลดคนโสด โดยสนับสนุนเงินอย่างน้อย 2,500 บาท เพื่อให้ประชาชนนำไปใช้ในกิจกรรมออกเดท/ บริการหาคู่ เพื่อส่งเสริมให้คนโสดได้มีโอกาสพบรักกัน
ขณะที่จีน ในปี 2566 รัฐบาลท้องถิ่นของมณฑลเจียงซี ให้การสนับสนุนแอปพลิเคชันหาคู่ โดยใช้ฐานข้อมูลของคนโสดที่อาศัยอยู่ในเมืองมาพัฒนาจัดทำแพลตฟอร์มบริการจัดหาคู่ ที่เรียกว่า Palm Guixi
เช่นเดียวกับญี่ปุ่นที่ในปี 2567 จัดทำแอปพลิเคชันหาคู่สำหรับคนโสดที่อายุมากกว่า 18 ปี ที่อาศัย ทำงาน หรือเรียนอยู่ในกรุงโตเกียว โดยใช้ระบบ AI เพื่อช่วยวิเคราะห์หาคนที่มีความชอบใกล้เคียงกัน รวมทั้งยังมีระบบการยืนยันตัวตนเพื่อเพิ่มความปลอดภัยให้แก่ผู้ใช้งานอีกด้วย
ทั้งนี้ จากนโยบายส่งเสริมการมีคู่ของไทยในช่วงที่ผ่านมา จะเห็นได้ว่าเน้นไปที่กลุ่มคนโสดที่มีความพร้อม อย่างไรก็ตาม เมื่อพิจารณาจากจำนวนคนโสดในไทยที่เพิ่มขึ้นสูงร่วมกับปัจจัยต่อการเป็นโสดข้างต้น สะท้อนให้เห็นว่า ยังมีคนโสดอีกมากที่อาจอยากมีคู่ แต่มีอุปสรรคและข้อจำกัดที่ทำให้ต้องเป็นโสด ซึ่งไทยยังมีโอกาสในการดำเนินการสนับสนุนให้คนมีคู่ได้ อาทิ
1) การสนับสนุนเครื่องมือการ Matching คนโสด โดยภาครัฐอาจร่วมมือกับผู้ให้บริการ/พัฒนาแพลตฟอร์ม เพื่อส่งเสริมให้คนโสดสามารถเข้าถึงได้มากขึ้น เนื่องจากแอปพลิเคชัน หาคู่ในตลาดมีต้นทุน ขึ้นอยู่กับฟังก์ชันและความปลอดภัยที่ตอบโจทย์ความต้องการของผู้ใช้งาน
2) การส่งเสริม การมี Work - Life Balance ทั้งในภาครัฐและเอกชน ซึ่งจะช่วยให้คนโสดมีคุณภาพชีวิตที่ดีขึ้น อีกทั้งยังช่วยเพิ่ม โอกาสให้คนโสดมีเวลาทำกิจกรรมที่ชอบและพบเจอคนที่มีความชอบลักษณะเดียวกันมากขึ้น [คิดส์ for คิดส์ ร่วมกับศูนย์ความรู้นโยบายสาธารณะเพื่อการเปลี่ยนแปลง (101 PUB) และ สสส. สำรวจความคิดเห็นของเยาวชนอายุระหว่าง 15 – 25 ปี ในพื้นที่กรุงเทพฯ และปริมณฑล จ านวน 2,709 คน ]
3) การยกระดับทักษะ ที่จำเป็นในการทำงาน เพิ่มโอกาสความก้าวหน้าในอาชีพการงานและรายได้ อาทิ คอร์สเรียนเพิ่มทักษะ Soft & Hard Skills นอกจากนี้ จากผลสำรวจคิด for คิดส์ ปี 202238 พบว่า ร้อยละ 58.9 ของคนโสดยังมีโอกาส พบรักจากสถานศึกษาได้อีกด้วย และ
4) การส่งเสริมกิจกรรมและการมีส่วนร่วมทางสังคมอย่างต่อเนื่อง อาทิ กิจกรรมทำอาหาร ออกกำลังกาย อาสาสมัคร ทำงานศิลปะ ทำบุญ เพื่อส่งเสริมให้คนโสดได้มีโอกาสพบปะพูดคุย และสร้างความสัมพันธ์ใหม่ ๆ ผ่านกิจกรรมที่หลากหลาย
ศูนย์บริการสาธารณสุข 24 บางเขน ออกหน่วยฉีดวัคซีนสุนัขบ้า ฟรี
สำนักงานเขตบางเขน ร่วมกับศูนย์บริการสาธารณสุข 24 บางเขน ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ตั้งแต่เวลา 09.00 ถึง 11.00 น. กำหนดการฉีดวัคซีน
• 2 ก.ย. ชุมชนอยู่รวย บริเวณที่ทำการชุมชน
• 3 ก.ย. ชุมชนเสนาวิลล่า 1 บริเวณที่ทำการชุมชน
• 4 ก.ย. ชุมชนบางบัว บริเวณที่ทำการชุมชน
• 5 ก.ย. ชุมชนวัชรปราณี บริเวณที่ทำการชุมชน
• 6 ก.ย. ชุมชนหมู่บ้านธันธวัช 5 บริเวณศาลาอเนกประสงค์
• 9 ก.ย. ชุมชนหมู่บ้านพัชรัฐ ณ ศูนย์สุขภาพชุมชน ซ.คู้บอน 27 แยก 31
• 10 ก.ย. ชุมชนปั้นทอง 3 บริเวณที่ทำการชุมชน
• 11 ก.ย. ชุมชนแจ้งวัฒนะ 4
• 12 ก.ย. ชุมชนหมู่บ้านไปรษณีย์ 65 บริเวณลานอเนกประสงค์
• 13 ก.ย. ชุมชนร้อยกรอง บริเวณที่ทำการชุมชน
สอบถามข้อมูลเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล 02-552-8062 หรือศูนย์บริการสาธารณสุข 24 บางเขน 02-579-1342 ต่อ 15
ประวัติงานย่าโม
งานฉลองวันแห่งชัยชนะของท้าวสุรนารี หรือ งานย่าโม จัดขึ้นเพื่อเป็นการสักการะเทิดทูนวีรกรรมท่านท้าวสุรนารี หรือ คุณหญิงโม (ย่าโม) วีรสตรีไทย และปลุกจิตสำนึกให้เยาวชนไทยรุ่นหลังตระหนักถึงวีรกรรมอันกล้าหาญเสียสละและดำรงไว้ซึ่งความรักชาติ ผู้นำชาวบ้านเข้าต่อสู้กับกองทัพเจ้าอนุวงศ์แห่งนครเวียงจันทน์ที่ยกทัพมายึดเมืองนครราชสีมา จนเจ้าอนุวงศ์ถอนทัพออกจากเมือง เมื่อวันที่ 23 มีนาคม พ.ศ. 2369
งานย่าโมจัดขึ้นเป็นครั้งแรกหลังจากมีการบูรณะอนุสาวรีย์ท้าวสุรนารี ครั้งใหญ่เมื่อ พ.ศ. 2510 ระหว่างวันที่ 23 มีนาคม-3 เมษายน ของทุกปี ณ บริเวณลานอนุสาวรีย์ท้าวสุรนารี และสนามหน้าศาลากลางจังหวัดนครราชสีมา รวม 12 วัน 12 คืน
การบวงสรวงท้าวสุรนารี
เครื่องบวงสรวงประกอบด้วย
ผลไม้ 6 อย่าง พวงมาลัย 7 สี ดอกไม้ 16 ชุด ธูป 16 ดอก หมายถึง 16 ชั้นฟ้า 15 ชั้นดิน เพื่อให้คุณย่ารับรู้ แผ่นทอง 16 แผ่น และมีดดาบ โดยมีพราหมณ์นำประกอบพิธีท่องบทคาถาสักการะให้ว่าตามพร้อมกัน พร้อมทั้งยกพานผลไม้ พานดอกไม้ โดยเฉพาะได้ยกดาบซึ่งเป็นสัญลักษณ์อาวุธประจำกายคู่บารมีท้าวสุรนารีที่ถือดาบตลอดเวลาขึ้นถวาย พร้อมชักดาบออกจากฝักซึ่งมีความหมายจะได้ไม่มีอุปสรรคและทำให้มีชัยชนะด้วยคมดาบคุณย่าโม ก่อนชูปลายดาบขึ้นสู่ท้องฟ้าและเก็บเข้าฝักตามเดิม
การวางดอกไม้ โดยการคล้องพวงมาลัย และมาลัย 7 สี ปิดแผ่นทองรูปหล่อท้าวสุรนารีด้านล่าง โดยเริ่มปิดแผ่นแรกที่ หน้าผาก ปาก ไหล่ และเท้า รวมทั้งแผ่นศิลาจารึกประวัติการกอบกู้บ้านเมือง และถวายดาบ เป็นเสร็จพิธี
24 มิถุนายน 2565 ให้บริการที่ วัดศรีภูเวียง จ.ขอนแก่น
ขอเชิญชวนข้าราชการทุกหน่วยงาน ประชาชนชวนจังหวัดขอนแก่น และจังหวัดใกล้เคียง ในวันศุกร์ ที่ 24 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา จากทางโรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ สำหรับท่านใดที่มีปัญหาทางด้าน #สายตา #การมองเห็นไม่ชัด #สายตาพร่ามัว #มีภาพซ้อน สามารถเดินทางไปตรวจเช็คที่หน่วยบริการได้เลยค่ะ สถานที่ให้บริการ : วัดศรีภูเวียง จ.ขอนแก่น ตั้งแต่เวลา 08:30 - 16:.00 น. มาตรวจสุขภาพตากันเยอะๆ นะคะDay3 : 24 สิงหาคม 2565 คณะผู้เข้าร่วมประชุม APEC ศึกษาดูงานเทคโนโลยีการแพทย์-สาธารณสุข รพ.จุฬาฯ
รองปลัดกระทรวงสาธารณสุขนำทีมผู้เข้าร่วมประชุม APEC Health Week ศึกษาดูงานเทคโนโลยีและนวัตกรรมด้านการแพทย์และสาธารณสุข ที่สอดคล้องกับนโยบาย BCG 4 เรื่อง ทั้งศูนย์โปรตอนสมเด็จพระเทพฯ รักษามะเร็งด้วยอนุภาคโปรตอนอย่างแม่นยำ ผลข้างเคียงน้อย, ศูนย์สมเด็จพระเทพรัตนฯ แก้ไขความพิการบนใบหน้า, สำนักงานบรรเทาทุกข์และประชานามัยพิทักษ์ สภากาชาดไทย และ “หมอพร้อม” ดิจิทัลแพลตฟอร์มสุขภาพที่ใหญ่ที่สุดของประเทศไทย
24 สิงหาคม 2565 ที่โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย นพ.สุระ วิเศษศักดิ์ รองปลัดกระทรวงสาธารณสุข นำทีมผู้บริหารและผู้แทนสมาชิกเขตเศรษฐกิจ APEC จำนวนกว่า 80 คน เข้าศึกษาดูงานที่โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ประเด็นการขับเคลื่อนด้านการแพทย์และสาธารณสุขในรูปแบบเทคโนโลยีและนวัตกรรมที่ก้าวหน้าทันสมัย สอดคล้องกับนโยบายเศรษฐกิจชีวภาพ เศรษฐกิจหมุนเวียน และเศรษฐกิจสีเขียว (Bio-Circular-Green Economy model : BCG) ซึ่งเป็นหนึ่งในกิจกรรมระหว่างการจัดประชุม APEC Health Week ระหว่างวันที่ 22-26 สิงหาคม 2565
นพ.สุระ กล่าวว่า การแพร่ระบาดของโรคโควิด 19 ส่งผลกระทบต่อเศรษฐกิจของหลายประเทศ รวมถึงสมาชิกของเขตเศรษฐกิจเอเปค ดังนั้น ในการประชุม APEC 2022 จึงมีการนำนโยบาย BCG มาใช้ขับเคลื่อนเพื่อการฟื้นฟูเศรษฐกิจที่ยั่งยืน ครอบคลุม และสมดุล ภายใต้การเปลี่ยนแปลงที่รวดเร็ว จึงเน้นการนำเทคโนโลยีและนวัตกรรมมาช่วยเหลือผู้ประกอบธุรกิจ เพิ่มมูลค่า ลดความสูญเสีย คำนึงต่อสิ่งแวดล้อมมากขึ้น การศึกษาดูงานในวันนี้จึงได้นำเสนอนวัตกรรมทางการแพทย์และสาธารณสุขของประเทศไทยที่มีความสอดคล้องกับนโยบาย BCG ใน 4 ประเด็นหลัก ดังนี้
1.ศูนย์โปรตอนสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย เป็นอาคารใต้ดินลึก 15 เมตร ให้บริการรักษาผู้ป่วยโรคมะเร็งทางรังสีด้วยอนุภาคโปรตอน นับเป็นแห่งแรกในภาคพื้นเอเชียตะวันออกเฉียงใต้ ซึ่งการรักษาจะใช้เครื่องเร่งอนุภาคไซโคลตรอน ซึ่งจะเร่งอนุภาคโปรตอนไปทำลายก้อนมะเร็ง โดยเนื้อเยื่อปกติที่อยู่หน้าก้อนมะเร็งจะได้รับปริมาณรังสีน้อย และเนื้อเยื่อที่อยู่หลังก้อนมะเร็งแทบไม่ได้รับรังสีเลย ทำให้การรักษามีความแม่นยำสูง ช่วยลดผลข้างเคียง เพิ่มประสิทธิภาพการรักษา ผู้ป่วยโรคมะเร็งมีคุณภาพชีวิตที่ดีและยาวนานขึ้น
2.ศูนย์สมเด็จพระเทพรัตนฯ แก้ไขความพิการบนใบหน้าและกะโหลกศีรษะ นับเป็นศูนย์กลางการแก้ไขความพิการบนใบหน้าและกะโหลกศีรษะที่ใหญ่ที่สุดในเอเชียตะวันออกเฉียงใต้ ให้การดูแลช่วยเหลือผู้ที่มีความผิดปกติบนใบหน้าตั้งแต่กำเนิดหรือเกิดจากอุบัติเหตุ ให้สามารถกลับมาใช้ชีวิตที่มีคุณภาพในสังคมได้ โดยมีผู้ป่วยส่งต่อมาจากสถาบันทางการแพทย์ทั่วประเทศ ให้การดูแลรักษาผ่าตัดผู้ป่วยที่มีความผิดปกติบนใบหน้าและศีรษะหลากหลายประเภทมากกว่า 3,000 ราย จึงเป็นแหล่งเรียนรู้ของบุคลากรทางการแพทย์ทั่วประเทศและต่างประเทศ นอกจากนี้ ยังเป็นศูนย์กลางการรักษาผู้ป่วยโรคงวงช้าง โดยมีเทคนิคการผ่าตัดแก้ไขความพิการด้วยวิธี “จุฬาเทคนิค” และถูกนำไปใช้ทั่วโลก
3.สำนักงานบรรเทาทุกข์และประชานามัยพิทักษ์ สภากาชาดไทย ให้การช่วยเหลือบรรเทาทุกข์ผู้ประสบภัยอย่างครบวงจร ทั้งการเตรียมพร้อมก่อนเกิดภัย การจัดการขณะเกิดภัย และการฟื้นฟูบูรณะสู่ภาวะปกติ บรรเทาทุกข์ผู้ด้อยโอกาส ตลอดจนการประชานามัยพิทักษ์ เพื่อส่งเสริมคุณภาพชีวิตให้มั่นคง ทัดเทียม อย่างยั่งยืน สอดคลองกับยุทธศาสตร์สภากาชาดไทยในด้านบริการทางการแพทย์และสาธารณสุขที่เป็นเลิศครบวงจร โดยให้บริการทางการแพทย์ผ่านทางสถานีกาชาด 13 แห่ง ให้บริการด้านรักษาพยาบาล ฟื้นฟูสภาพ ส่งเสริมสุขภาพ และป้องกันโรคแก่ประชาชน อีกทั้งการจัดหน่วยแพทย์เคลื่อนที่ด้านจักษุศัลยกรรมฯ ศัลยกรรมตกแต่งแก้ไขปากแหว่งเพดานโหว่ และความพิการอื่นๆ รวมถึงหน่วยทันตกรรมเคลื่อนที่ เป็นต้น
4.หมอพร้อม แอปพลิเคชัน เป็นการพัฒนาด้านสาธารณสุขดิจิทัลที่เกิดขึ้นในช่วงการระบาดของโรคโควิด 19 ในช่วงแรกเพื่อเป็นช่องทางการสื่อสารกับประชาชนในช่วงการระบาด ให้ประชาชนสามารถเข้าถึงข้อมูลวัคซีนของตนเองได้ พร้อมประเมินติดตามอาการภายหลังการรับวัคซีน โดยปัจจุบัน “หมอพร้อม” ถือว่าเป็นดิจิทัลแพลตฟอร์มที่ใหญ่ที่สุดในด้านสาธารณสุขของประเทศไทย มีประชาชนมากกว่า 32 ล้านคน เข้าถึงแพลตฟอร์มนี้ทั้งแอปพลิเคชันและ Line OA และมีการพัฒนาต่อยอดอย่างไม่สิ้นสุด
Day3 : 24 สิงหาคม 2565 หารือทวิภาคีร่วมกันระหว่าง รัฐมนตรีสาธารณสุขไทย และรัฐมนตรีช่วยสาธารณสุข สหรัฐฯ
สหรัฐฯ ชื่นชมไทยที่บริหารจัดการวิกฤต “โควิด” ได้ดี ประชาชนให้ความร่วมมือสูง ย้ำไทยพร้อมสนับสนุน GHSA วาระความมั่นคงสุขภาพโลก ทั้งระบบแล็บและการพัฒนากำลังคน สนับสนุนฉีดวัคซีนพื้นฐานให้แก่เด็กเมียนมาตามตะเข็บชายแดนเพื่อป้องกันโรคติดต่อ ยินดีสหรัฐฯ เจ้าภาพจัดประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจในปีหน้า
กระทรวงสาธารณสุข จ.นนทบุรี นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข และนางแอนเดรีย ปาล์ม (Ms.Andrea Palm) รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุขและบริการมนุษย์ สหรัฐอเมริกา ได้หารือแบบทวิภาคี ระหว่างการจัดประชุม APEC Health Week ระหว่างวันที่ 22-26 สิงหาคม 2565 เกี่ยวกับความร่วมมือด้านสาธารณสุขระหว่างไทยและสหรัฐอเมริกา โดยมีผู้บริหารระดับสูงกระทรวงสาธารณสุขของไทยและสหรัฐอเมริกาเข้าร่วม
นายอนุทินกล่าวว่า ในการหารือทางสหรัฐอเมริกาได้แสดงความยินดีกับประเทศไทยที่เป็นเจ้าภาพในการจัดประชุม APEC ในครั้งนี้ ซึ่งการหารือโต๊ะกลม หัวข้อ “การลงทุนด้านหลักประกันสุขภาพเพื่อรองรับการระบาดในอนาคต” วันที่ 26 สิงหาคม 2565 ทางรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุขของสหรัฐฯ จะเข้าร่วมและเป็นผู้ร่วมอภิปรายในช่วงการสนทนาเรื่องการสร้างสมดุลระหว่างสุขภาพและเศรษฐกิจ พร้อมกันนี้ยังได้เชิญตนเข้าร่วมประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจในปี 2566 ด้วย ซึ่งทางสหรัฐอเมริกาเป็นเจ้าภาพในการจัดประชุมครั้งต่อไป นอกจากนี้ ยังได้ชื่นชมประเทศไทยที่รับมือสถานการณ์โรคโควิด 19 ได้เป็นอย่างดี ประชาชนให้ความร่วมมือกับนโยบายของรัฐบาล ทั้งการสวมหน้ากากอนามัย เว้นระยะห่าง สามารถดูแลรักษาผู้ติดเชื้อได้อย่างเต็มที่ทั้งเรื่องของยา การดูแลแบบ Home Isolation ฮอสปิเทล ระบบหลักประกันสุขภาพแห่งชาติ การฉีดวัคซีนโควิด 19 และขอบคุณประเทศไทยที่ส่งข้อมูลตัวอย่างเชื้อให้แก่สหรัฐฯ ในช่วงที่เริ่มมีการระบาด ในการนำไปศึกษาวิจัยยาและวัคซีน ส่วนไทยเองก็ขอบคุณสหรัฐฯ ที่ให้ความช่วยเหลือเราในช่วงวิกฤต ในการบริจาควัคซีน mRNA หลายล้านโดส สนับสนุนยาและเวชภัณฑ์ต่างๆ
นายอนุทินกล่าวว่า สหรัฐฯ ยังชื่นชมบทบาทของประเทศไทยในเรื่องความมั่นคงด้านสุขภาพระดับโลก โดยเฉพาะการเป็นที่ตั้งของสำนักงานเลขาธิการศูนย์อาเซียนด้านการรับมือกับภาวะฉุกเฉินทางสาธารณสุขและโรคอุบัติใหม่ (ASEAN Centre for Public Health Emergencies and Emerging Diseases: ACPHEED) โดยไทยก็ขอบคุณสหรัฐฯ ที่แสดงการสนับสนุนการจัดตั้ง ACPHEED ซึ่งเป็นศูนย์ระดับภูมิภาคที่จะช่วยเสริมความแข็งแกร่งให้ภูมิภาคอาเซียน ในการเตรียมความพร้อมและตอบสนองต่อภาวะฉุกเฉินด้านสาธารณสุขและโรคอุบัติใหม่ได้ดียิ่งขึ้น โดยประเทศไทยได้เตรียมการและพร้อมที่จะดำเนินการเปิดตัวสำนักเลขาธิการในวันที่ 26 สิงหาคม 2565 ซึ่งได้เชิญรัฐมนตรีสาธารณสุขอาเซียนและเอเปคเข้าร่วมด้วย
นายอนุทินกล่าวว่า ไทยและสหรัฐฯ มีความสัมพันธ์ที่ดีมาอย่างยาวนาน มีความร่วมมือด้านสาธารณสุขระหว่างกันอย่างต่อเนื่อง โดยสหรัฐฯ ได้ขอให้ไทยสนับสนุนโครงการของสหรัฐฯ ที่ดำเนินการภายใต้คณะทำงานด้านสุขภาพเอเปค (APEC Health Working Group) รวมถึงหารือเรื่องการดำเนินงานภายใต้ความร่วมมือวาระความมั่นคงด้านสุขภาพโลก (Global Health Security Agenda :GHSA) ซึ่งประเทศไทยได้เข้าร่วมเป็นสมาชิก GHSA ตั้งแต่แรกที่มีก่อตั้งขึ้นในปี 2014 หลังการระบาดของอีโบลาในทวีปแอฟริกา โดยมีกรมควบคุมโรค ประเทศไทย เป็นประธาน Steering Group ของ GHSA ในปี 2564 ขณะนี้มีสมาชิกเข้าร่วม 70 ประเทศทั่วโลก สะท้อนถึงความสำคัญของ GHSA ในการทำให้โลกปลอดภัยยิ่งขึ้นจากภัยคุกคามด้านสุขภาพจากโรคติดเชื้อ ซึ่งไทยพร้อมสนับสนุนงานของ GHSA อย่างเต็มที่ โดยเฉพาะในเรื่องของระบบห้องปฏิบัติการ (Lab System) และการพัฒนากำลังคน (Workforce Development) ซึ่งเป็น 2 ใน 9 ด้านของแผนงาน GHSA
นอกจากนี้ สหรัฐฯ ยังขอให้ไทยสนับสนุนการฉีดวัคซีนพื้นฐานป้องกันโรคติดต่อให้แก่เด็กตามตะเข็บชายแดนไทย-เมียนมา เนื่องจากมีเด็กจำนวนมากในเมียนมาไม่ได้รับการฉีดวัคซีนพื้นฐานที่ป้องกันโรคติดต่อ เช่น วัณโรค คอตีบ ไอกรน บาดทะยัก เป็นต้น กระทรวงสาธารณสุขไทยร่วมกับองค์กรความร่วมมือระหว่างประเทศ (TICA) จัดทำแผนความร่วมมือด้านสาธารณสุขกับเมียนมา ซึ่งสามารถผนวกความร่วมมือกับสหรัฐฯ ในประเด็นนี้ในแผนได้ โดยต้องแจ้งฝ่ายเมียนมาและกระทรวงการต่างประเทศของไทยด้วย
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตห้วยขวาง
Cafe Amazon for Chance สาขา 6 ปตท. สำนักงานใหญ่
Cafe Amazon for Chance สาขาที่ 6
ดำเนินการโดย ผู้พิการทางการได้ยิน
ตั้งอยู่ที่อาคารสำนักงานใหญ่ ปตท
555 ถนน วิภาวดีรังสิต แขวง จตุจักร เขตจตุจักร กรุงเทพมหานคร 10900
+66866234700
รพ.มหาราชนครราชสีมา ขอเชิญบริจาคโลหิต - หนึ่งคนให้ หลายคนรับ LINK
ห้องรับบริจาคโลหิต รพ.มหาราชนครราชสีมา และ
สำนักงานเหล่ากาชาดจังหวัดนครราชสีมา เปิดให้บริการตามปกติ ทุกวัน
สถานที่
1. ห้องรับบริจาคโลหิต อาคารรักษา รพ.มหาราชนครราชสีมา
จันทร์-ศุกร์ 8.30-19 น.
วันหยุดราชการ 8.30-16 น.
2. สำนักงานเหล่ากาชาดจังหวัดนครราชสีมา
เฉพาะวันเวลา ราชการ 8.30-16 น.
สอบถามโทร 044-259750
3. ห้องบริจาคโลหิร ห้างเดอะมอลล์นครราชสีมา ชั้น 2
เปิดบริการทุกวัน 10.30-19.45 น.
สอบถามโทร 044-231555
ตารางหน่วยเคลื่อนที่ ของเหล่ากาชาดนครราชสีมา ร่วมกับรพ.มหาราชนครราชสีมา
7 มค 9-12 น. หอประชุม อ. คง
8 มค 9-12 น. สำนักงานเทศบาล ต.โคกกรวด
13 มค 9-12 น. หอประชุม อ.ปากช่อง
14 มค 9-12 น. หอประชุม อ.บัวใหญ่
15 มค 9-12 น. หอประชุม อ.ปักธงชัย
18 มค 9-12 น. หอประชุม อ.จักราช
19 มค 9-12 น. หอประชุม อ.ขามสะแกแสง
22 มค 9-12 น. หอประชุม อ.สีดา
25 มค 9-12 น. หอประชุม อ.โนนไทย
26 มค 9-12 น. หอประชุม อ.โนนไทย
27 มค 9-12 น. ม.เทคโนฯราชมงคลวิทยาเขตอีสาน
28 มค 9-12 น. หอประชุม อ.ลำทะเมนชัย
29 มค 9-12 น. หอประชุม อ.วังน้ำเขียว
ไวน์กัญชา
ผลิตภัณฑ์ของวิสาหกิจกาชัญ จากทองผาภูมิ กาญจนบุรี
เมนูกัญชา กำหนดอายุลูกค้าไว้ต้อง 25 ปี ขึ้นไปด้วยใช่มั๊ย
กฎหมายไม่ได้ห้ามนะคะแต่บอกว่าไม่ควรจำหน่ายแก่คนอายุต่ำกว่า 25 ซึ่งทางร้านเราไม่จำหน่ายกับกลุ่มนี้อยู่แล้วค่ะ
15 มีนาคม 2564 พ่อค้า - แม่ค้า คลัสเตอร์ตลาดบางแค ติดโควิด 30 คน
สธ.เปิดเผยว่า คลัสเตอร์ "ตลาดบางแค" 4 วัน ตรวจเชิงรุกแล้ว 3,767 คน พบในจำนวนผู้ติดเชื้อ COVID-19 เป็นพ่อค้า - แม่ค้า 30 คน ชี้การคัดกรองเข้าตลาดยังไม่รัดกุม บางพื้นที่อากาศไม่ถ่ายเท ผู้เช่าแผง - ลูกจ้างแรงงานต่างชาติพูดคุยโดยเปิดแมสก์ไว้ใต้คาง
วันนี้ (15 มี.ค.2564) นพ.เฉวตสรร นามวาท รักษาราชการแทน ผอ.กองควบคุมโรคและภัยสุขภาพในภาวะฉุกเฉิน กรมควบคุมโรค แถลงสถานการณ์ COVID-19 ในประเทศไทย โดยระบุว่า สำหรับการแพร่ระบาดของเชื้อไวรัส COVID-19 กรณีตลาดบางแค ย่านฝั่งธนบุรีใต้นั้น พบเป็นตลาดสดขนาดใหญ่ริมถนนเพชรเกษม จุดเริ่มต้นอยู่ที่ ซ.เพชรเกษม 39/1 เขตภาษีเจริญ ไปสิ้นสุดที่เขตบางแค มีตลาดแยกย่อย และมีห้างฯ ภายในตลาด แบ่งเป็น ตลาดใหม่บางแค ตลาดแสงฟ้า ตลาดศิริเศรษฐนนท์ ตลาดวันเดอร์ ตลาดกิตติ และตลาดบางแค รวม 6 แห่ง
“ในตลาด 6 แห่ง มีทางเข้าหลายทาง มาตรการคัดกรอง COVID-19 ไม่รัดกุม เข้าทางไหนก็ได้ พื้นที่บางส่วนตลาดอากาศไม่ถ่ายเท หลังคาต่ำ ผู้เช่าแผง - ลูกจ้างแรงงานต่างชาติ มีพฤติกรรมพูดคุยกันโดยเปิดแมสก์ไว้ใต้คาง ทำให้มีความเสี่ยงในการแพร่ระบาด”
จากการตรวจเชิงรุกในวันที่ 11 มี.ค. 64 พบผู้ติดเชื้อ 85 คน แยกเป็นคนไทย 46 คน คนเมียนมา 39 คน แยกตามอายุ พบ 20-59 ปี 92.9% รองลงมาคือ 0-19 ปี 4.7% และ 60 ปีขึ้นไป 2.4% เมื่อแยกตามภูมิลำเนานอกเขต กทม. 15 คน ได้แก่ จ.สุพรรณบุรี 5 คน นครปฐม 3 คน เพชรบุรี 6 คน และสมุทรสาคร 1 คน
วันที่ 12 มี.ค. เพชรเกษม 39 เก็บตัวอย่าง 311 คน มีผลบวก 12 คน ตลาด เก็บตัวอย่าง 684 คน มีผลบวก 85 คน
วันที่ 13 มี.ค. ตลาด เก็บน้ำลาย 1,476 คน รอผล
วันที่ 14 มี.ค. ตลาด เก็บน้ำลาย 1,296 คน รอผล
รวม 3,767 คน มีผลบวก 97 คน รอผล 2,772 คน
นพ.เฉวตสรร ระบุว่า ข้อสังเกตจากจำนวนผู้ติดเชื้อ เป็นผู้ค้าขายในตลาดบางแค 30 คน เจ้าของร้านส่วนใหญ่เป็นคนไทย มีลูกจ้างแรงงานข้ามชาติ เจ้าของตลาดไม่ทราบข้อมูลของแรงงานข้ามชาติ และเจ้าของแผงคนไทยบางคนให้ต่างชาติเช่าแผงค้าต่อ
ทั้งนี้ สำหรับผู้ที่มีประวัติเดินทางไปตลาดพื้นที่เขตบางแค ตั้งแต่วันที่ 27 ก.พ. - 13 มี.ค. 64 หากมีอาการป่วย ไข้ ไอ เจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่รับรส ให้ขอรับการตรวจโรค COVID-19 ได้ที่โรงพยาบาลทุกแห่ง ส่วนผู้ที่ยังไม่มีอาการและไม่ใช่ผู้สัมผัสเสี่ยงสูง ให้ปฏิบัติตามแนวทางการป้องกันควบคุมโรคสวมหน้ากาก ล้างมือ เว้นระยะห่าง และสังเกตอาการ 14 วันด้วย
ส่วนสถานการณ์การฉีดวัคซีนป้องกัน COVID-19 เปรียบเทียบกับจำนวนประชากร เป้าหมายในระยะปัจจุบัน ตั้งแต่วันที่ 28 ก.พ. - 14 มี.ค. 64 เป้าหมายฉีดเข็มแรก 92,600 คน ฉีดแล้ว 46,598 คน (50%) โดยคิดว่าช่วงถัดจากนี้จะเร่งความเร็วในการฉีดวัคซีนได้ทันตามเป้าหมาย โดยการฉีดวันที่ 14 มี.ค.ที่ผ่านมา ฉีดไปแล้ว 1,635 คน ส่วนอาการไม่พึงประสงค์รุนแรงยังไม่มีรายงานใดๆ ที่ต้องเข้าคณะกรรมการผู้เชี่ยวชาญวินิจฉัย
สงกรานต์อีสานหนองคาย วันที่ 12-18 เมษายนนี้
ททท.สำนักงานอุดรธานี เชิญเที่ยวงานประเพณีมหาสงกรานต์อีสานหนองคาย ประจำปี 2564 ภายใต้แนวคิด "ม่วนกุ๊บ...สงกรานต์อีสานหนองคาย ตอน ม่วนซื่นนุ่งซิ่น เยือนถิ่นนคราธานี" วันที่ 12-18 เมษายน 2564 ณ บริเวณพระอุโบสถวัดโพธิ์ชัย พระอารามหลวง และลานวัฒนธรรมริมโขงหน้าวัดลำดวน แลนด์มาร์คพญานาคคู่
ไฮไลท์ในวันที่ 12 เมษายน 2564 คือ พิธีบวงสรวงพระธาตุอรหันต์ กิจกรรมฟ้อนถวายหลวงพ่อพระใส ณ บริเวณพระอุโบสถวัดโพธิ์ชัย พระอารามหลวง และวันที่ 13 เมษายน 2564 พิธีทำบุญตักบาตร พิธีอัญเชิญหลวงพ่อพระใสลงจากพระอุโบสถเพื่อให้ประชาชนสรงน้ำ
13-15 เมษายน 2564 ตั้งแต่เวลา 17.00 - 22.00 น. ณ ลานวัฒนธรรม ริมโขงหน้าวัดลำดวน (แลนด์มาร์คพญานาคคู่) สรงน้ำพระ 9 ส. ก่อเจดีย์ทราย การแสดงดนตรีศิลปวัฒนธรรมพื้นบ้าน กิจกรรมสอยดาว ตลาดแลงย้อนยุค และกิจกรรมอื่นๆ ที่น่าสนใจอีกมากมาย
สอบถามรายละเอียดเพิ่มเติมได้ ที่ ททท.สำนักงานอุดรธานี โทรศัพท์หมายเลข 0-4232-5407 หรือ Feacbook แฟนเพจ ททท.สำนักงานอุดรธานี หรือ ศูนย์บริการข้อมูลข่าวสารการท่องเที่ยวจังหวัดหนองคาย โทรศัพท์หมายเลข 0-4242-1326 เทศบาลเมืองหนองคาย โทรศัพท์หมายเลข 0-4241-2956
ตาก - มาจาก 47 จังหวัด กักตัว 14 วัน (ปรับปรุง 23 เมย 64) LINK
ทุกคนที่เดินทางเข้ามาในจังหวัดตาก สแกน
QR Code ตากชนะ
- ติดตั้งแอป ไทยชนะ
- มาจาก 47 จังหวัด รายงานตัวกับผู้นำชุมชน / อสม พร้อมกักตัวที่บ้าน 14 วัน (Home Quarantine) ตั้งแต่วันที่มา หรือจนกว่าเดินทางกลับ
- มาจากจังหวัดอื่น
- สังเกตอาการเอง หากมีผิดปกติ ไปพบแพทย์ รพ.ใกล้บ้าน
- ปฏิบัติตามมาตรการ D-H-M-T-T อย่างเคร่งครัด
ผุ้ประสานงานแต่ละอำเภอ
เมืองตาก 061-414-6365, 085-771-7704
บ้านตาก 089-6394222
ตามเดา 081-5804382
ลังเจ้า 089-8589066
แม่สอด 081-7408046
แประบาต 086-5007236
ท่าสองยาง 064-0922503
พบพระ 081-9625603
อุ้มผาง 098-1145325
ตอนที่ 5 การเดินทางอันเหลือเชื่อ
ตอนสุดท้ายละ ?
#วิถีคนแฟนไกล #บันทึกคนกักตัว2020
The incredible journey ????
โควิดเข้ามาเมืองไทยตั้งแต่ต้นปี ถ้ายังจำกันได้ ไทยเป็นประเทศที่สองที่เจอผู้ติดเชื้อต่อจากจีน จำได้ว่าเดือนกุมภายังต้องไปทำงานที่ฟิลิปปินส์ ด้วยความประหวั่นพรั่นพรึง ? เราติดยังวะ
สถานการณ์เริ่มเลวร้ายลง จนกรุงเทพถูกล็อคดาวน์ ช่วงเมษา ? ตอนนั้นก็ว่า surreal แล้ว กับการที่ห้างร้าน ธุรกิจต่างๆ ต้องปิดก่อน เพื่อตั้งหลัก การไปซื้อของที่ซูเปอร์ในห้างกลายเป็นอะไรที่ลุ้นระทึกตึกตัก ? แต่มาพีคเอาจริงๆ คือตอนที่ประกาศปิดสนามบิน ? ใครจะเชื่อว่าจะได้เห็นทั้งวันที่กรุงเทพร้างไร้ผู้คน จนถึงวันที่เครื่องบินต้องจอดนิ่งอยู่กับที่ คนในห้ามออก คนนอกห้ามเข้า สนามบินมืดตึ๊ดตื๋อ ? ตอนนั้นคือแพลนไว้แล้วว่าจะไปหาคุณฝรั่ง แต่ทุกอย่างถูกระงับ ทำได้แค่รออย่างมีความหวัง
สถานการณ์เหมือนจะเริ่มดีขึ้น โดยเฉพาะในเมืองไทย เริ่มคุมได้ สนามบินเริ่มเปิดแบบมีเงื่อนไข สถานทูตเริ่มให้บริการวีซ่าอีกครั้ง และนั่นคือสัญญาณของการเดินทางอันเหลือเชื่อครั้งนี้ ☺
สุดท้ายก็มาถึงวันที่การเดินทางครั้งนี้จบสิ้นลง ไม่ง่าย ไม่สนุก แต่ต้องทำ ? จนทจัดรถส่งทุกคนกลับถึงภูมิลำเนาทุกจังหวัดทั่วประเทศ โดยจะส่งที่ศาลากลางของแต่ละจังหวัด ไม่มีการแวะส่งข้างทาง กรุงเทพส่งจุดเดียวคือที่กรมขนส่งทางบก ส่วนคนที่มีญาติมารับหรือสะดวกกลับเอง ก็ทางใครทางมันจ้ะ ? เช็คเอาท์ตามสะดวก
ทุกคนได้ใบรับรองการกักตัวพร้อมด้วยผลตรวจโควิดทั้งสองครั้ง เอาไปใส่กรอบประดับฝาบ้านได้ ? ไม่ใช่สิ บางคนต้องใช้ในการแสดงตัวกลับอำเภอ ไรงี้ แต่เขารับรองเฉพาะสิบสี่วันนี้นะ หลังจากนี้ก็ รักษาตัวให้รอดนะ ?
กักตัวจริงๆ นับแล้วคือ 16 วัน เพราะวันแรกที่ถึงสนามบินไม่นับ และวันที่ 14 คือยังกลับไม่ได้ ต้องกลับวันรุ่งขึ้น ทุกคน ตื่นเต้น ดีใจ ไม่ติดโควิดและได้กลับบ้านไปหาครอบครัว หลายคนก็เริ่มเตรียมที่จะกลับไปที่นู่นอีก ไม่ว่าจะเป็นประเทศไหน เพราะหลายคน มีอีกครอบครัวหนึ่ง ทางนู้น ที่รอให้กลับไปหาเหมือนกัน ?
จนกว่าเราจะพบกันใหม่
Till we meet again
ขอบคุณเพื่อนที่ชวนให้เขียน ทำให้ได้ย้อนคิด ตกผลึกไอเดียอะไรมากมายและทำให้การอยู่ในห้องสี่เหลี่ยมเล็กๆ 14 วันที่ไม่มีแม้แต่วิวท้องฟ้า ไม่แย่จนเกินไป ??
อุดรธานี ปรับ 20,000 มีผล 23 เมย 64 LINK
คำสั่งจังหวัดอุดรธานี คณะกรรมการโรคติดต่อจังหวัดอุดรธานี มีมติที่ประชุมครั้งที่ 9/2564 วันที่ 22 เมษายน 2564
- ให้ประชาชนในพื้นที่จังหวัดอุดรธานี สวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้ง ตลอดเวลาที่ออกนอกเคหสถานหรือสถานที่พำนักของตน และมีกิจกรรมที่ต้องสัมผัสหรือเกี่ยวข้องกับบุคคลอื่น
- ให้ประชาชนในพื้นที่จังหวัดอุดรรานี สวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้งที่มี กิจกรรมที่ต้องส้มพัสหรือเกี่ยวข้องกับบุคคลอื่น
- ผู้ฝ่าฝืนไม่ปฏิบัติตามคำสั่งนี้ เป็นความผิดตามมาตรา 51 แห่งพระราชบัญญัติโรคติดต่อ พ.ศ.2558 ต้องระวางโทษปรับไม่เกินสองหมื่นบาท
มีผล 23 เมษายน 64 เป็นต้นไป
ประกันแพ้วัคซีนโควิด-19 - TQM LINK
วัคซีนโควิด-19 ใครแพ้เราจ่าย เบี้ยไม่ถึงร้อย คุ้มครองเกินล้าน
- คุ้มครองผลกระทบจากการฉีดวัคซีนโควิด-19
- แพ้วัคซีน ต้องนอนโรงพยาบาล คุ้มครองค่ารักษาพยาบาลสูงสุด 100,000 บาท
- สบายใจ รับเงินปลอบขวัญเมื่อเป็นผู้ป่วยใน (ไม่น้อยกว่า 5 วัน) สูงสุด 50,000 บาท
- รับสูงสุด 1,000,000 บาท กรณีโคม่า และ/หรือ สมองตาย
- เริ่มต้นเพียง 79 บาท/ปี สำหรับคนมีประกันโควิด-19 อยู่แล้ว ถ้าหากไม่มีประกันโควิด-19 ก็เริ่มแค่ 99 บาท/ปี เท่านั้น
ความคุ้มครอง เงื่อนไขการรับประกันภัยดินส์ ทุกสาขา รับฟรี‼️ เกี๊ยวกุ้งไต้หวัน LINK
ดินส์ ร่วมกับร้านอาหารในเครือเซ็นกรุ๊ป ทั้ง Zen , On the Table , AKA , *ตำมั่ว , *ลาวญวณ และ *เขียง (*เฉพาะสาขาที่ร่วมรายการ) มอบสิทธิพิเศษให้แก่คนไทยที่พร้อมใจกันไปฉีดวัคซีนเพื่อต้านโรคโควิค 19
เพียงแสดงหลักฐานการฉีดวัคซีนของตัวท่านเอง และซื้อเซ็ตเมนูอะไรก็ได้ 1 เซ็ท รับฟรี‼️ ??? เกี๊ยวกุ้งไต้หวัน (มูลค่า 95 บาท) ทันที
สิทธิพิเศษนี้ระหว่างวันที่ 18 พ.ค. 2564 - 30 มิ.ย. 2564
ดินส์ ทุกสาขา
อุทัยธานี ลงทะเบียนออนไลน์ ล่วงหน้าอย่างน้อย 2 สัปดาห์ LINK
สสจ.อุทัยธานี ช่องทางแจ้งความประสงค์ขอรับการฉีดวัคซีนเข็มที่ 2 ในพื้นที่จังหวัดอุทัยธานี
#เงื่อนไขการลงทะเบียนรีบวัคซีน COVID-19 เข็มที่ 2
ต้องได้รับการฉีดวัคซีน COVID-19 เข็มที่ 1 จากหน่วยฉีดนอกจังหวัดอุทัยธานี
มีใบนัดเข้ารับการฉีดวัคซีน COVID-19 เข็มที่ 2
ปัจจุบันพักอาศัยอยู่ในพื้นที่จังหวัดอุทัยธานี
ต้องลงทะเบียนแจ้งความประสงค์ขอรับการฉีดวัคซีน COVID-19 เข็มที่ 2 ก่อนถึงกำหนดนัดอย่างน้อย 2 สัปดาห์
** หมายเหตุ วัน เวลา การฉีดวัคซีน COVID-19 เข็มที่ 2 อาจมีการเปลี่ยนแปลงจากวันนัดเดิม เนื่องจาก ต้องรอการจัดส่ง วัคซีน COVID-19 จากส่วนกลาง หากหน่วยฉีดได้รับวัคซีน COVID-19 ตามที่ท่านแจ้งความประสงค์แล้ว จะมีเจ้าหน้าที่ ติดต่อกลับ หรือ ท่านสามารถติดตามประกาศทางหน้าเว็บหมออุทัยฯ
บางบอน ร่วมกับศูนย์ฯ 65 จัดหน่วยเคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 8-20 ก.ย. LINK
บางบอน ร่วมกับศูนย์ฯ 65 จัดหน่วยเคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
นายบวรสิน นิยมตรง ผู้อำนวยการเขตบางบอน แจ้งว่า สำนักงานเขตบางบอนร่วมกับศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ดำเนินการออกให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมว ระหว่างเวลา 09.00 – 11.00 น. และได้ดำเนินการให้บริการตามชุมชนและหมู่บ้าน ดังนี้
วันที่ 8 ก.ย.64 ชุมชนหนทางใหม่ปิ่นทอง
วันที่ 9 ก.ย.64 ชุมชนพระปิ่น 5
วันที่ 10 ก.ย.64 ชุมชนรางโพธิ์
วันที่ 13 ก.ย.64 ชุมชนคลองบางพราน
วันที่ 14 ก.ย.64 ชุมชนวัดนินสุขาราม
วันที่ 15 ก.ย.64 ชุมชนกานดาการ์เด้นท์
วันที่ 16 ก.ย.64 ชุมชนมั่นคงวิมานทอง
วันที่ 17 ก.ย.64 ชุมชนบางบอน 5 ซอย 6
วันที่ 20 ก.ย.64 ชุมชนสวนผัก
โดยให้บริการฉีดวัคซีน "ฟรี" ไม่เสียค่าใช้จ่ายแต่อย่างใด สำหรับท่านที่สนใจสามารถลงทะเบียนผ่าน QR code เพื่อลดการสัมผัส สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2450 3272 และศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน โทร. 0 2453 0526 จึงขอประชาสัมพันธ์ให้ทราบโดยทั่วกัน
รพ.พระนารายณ์มหาราช ลงทะเบียน ลพบุรีพร้อม เพื่อรับเข็ม 3 (แอสตร้า) LINK
โรงพยาบาลพระนารายณ์มหาราช ประกาศจาก "ลพบุรีพร้อม" สำหรับ "การลงทะเบียนฉีดกระตุ้นเข็ม 3" ของจังหวัดลพบุรี สำหรับผู้ที่ได้รับ "ซิโนแวค 2 เข็ม"
1. การลงทะเบียน ลงทะเบียนผ่านเวปไซด์ ลพบุรีพร้อม ถ้ามีชื่อในระบบอยู่แล้วขอให้เข้าไปตรวจสอบประวัติการฉีดวัคซีน
1.1. กรณีที่รับวัคซีนที่สถานพยาบาลในจังหวัด ให้ตรวจสอบว่ามีประวัติการได้รับซิโนแวค 2 เข็ม ในระบบหรือไม่ ถ้ามีข้อมูลไม่ครบให้ติดต่อทาง รพ. ขอให้ลงประวัติวัคซีนให้ถูกต้อง
1.2. กรณีต่างจังหวัดลงทะเบียนในระบบลพบุรีพร้อม ระบบจะเลือก รพ.ให้ตาม อำเภอ ที่ลงทะเบียน และ ต้องมีประวัติการได้รับซิโนแวค 2 เข็ม ในระบบ ถ้าหากข้อมูลไม่ครบให้ติดต่อทาง รพ. ที่ท่านไปฉีดมา ให้ลงประวัติวัคซีนให้ถูกต้อง ครบถ้วน
2. ให้ท่านติดตั้ง App หมอพร้อม (ไม่ใช่ Line หมอพร้อม) เพื่อรับข้อความนัดหมาย
มีหลายท่านสอบถามเรื่องลงทะเบียนเข็ม 3 มาว่าลงทะเบียนอย่างไร รายละเอียดดังนี้
1. ต้องมีชื่อในระบบลพบุรีพร้อม
2. ระบบจะตรวจสอบเองว่าท่านได้รับซิโนแวคมา 2 เข็ม และยังไม่ได้รับวัคซีนเข็ม 3
3. จากนั้นทางสำนักงานสาธารณสุขจังหวัดจะขอชื่อจากระบบไปขอเบิกวัคซีนจากส่วนกลาง
4. เมื่อได้วัคซีนกลับมาทาง รพ.จะระบุวันนัด และ ระบบส่งข้อความแจ้งเตือนผ่านแอพหมอพร้อมครับ
ทางทีมงานปรับระบบให้แสดงผลการลงทะเบียนไว้ที่ประวัติเข็ม 3 แล้ว
ประกาศจากรพ.โรงเรียนฝึกอาชีพกรุงเทพมหานคร LINK
โรงเรียนฝึกอาชีพกรุงเทพมหานคร มีโรงเรียนในเครือมากถึง 10 โรงเรียน
มีหลักสูตรการสอนมากกว่า 200 หลักสูตร ให้เลือกเรียนตามความต้องการ
มีบุคคลากรด้านการศึกษา ครู อาจารย์ประจำหลักสูตรต่าง ๆ พร้อมกว่า 200 คน
ทุกหลักสูตรเรียนจบมีใบประกาศรับรอง เพื่อใช้ประกอบการสมัครทำงานได้ทันที
ทอม แฮงส์
6 กรกฏาคม ดารารุ่นใหญ่วัย 63 เจ้าของ 2 รางวัลออสการ์ ตรวจพบว่าติดโควิดขณะถ่ายทำภาพยนตร์ในออสเตรเลีย เขาเปิดเผยว่าเขาและภรรยาติดเชื้อ มีอาการไข้ และรู้สึกเหนื่อย ปวดตามร่างกาย หลังจากกักตัวไป 1 สัปดาห์อาการก็ดีขึ้น
เบียร์ ยังคงเป็นแค่ต้นแบบเหมือนเดิม
แต่สูตรรากแช่ในวิสกี้ หรือวอดก้า ก็น่าสนใจ
ตลาด ตลาดนัด ร้านอาหาร จุดเสี่ยงติดเชื้อกลุ่มก้อน
หยุดยาวช่วงเทศกาสนี้
อาจพบการติดเชื้อเป็นกลุ่มก้อนมากขึ้น
ตลาด ตลาดนัด
ช่วงวันหยุดมีการจับจ่ายใช้สอยมากขึ้น
ขอให้เคร่งมาตรการ COVID Free Setting
พ่อค้า แม่ค้า ลูกจ้าง พนักงาน
รับวัคซีนให้ครบโดส
จัดสถานที่ไม่ให้แออัด อากาศถ่ายเทดี
เคร่งครัดมาตรการส่วนบุคคล
ใส่หน้ากากอนามัย ล้างมือบ่อยๆ
กลับบ้าน ทำความสะอาดร่างกายทันที
ร้านอาหาร
ร้านชาบู หมูกระทะ
การรับประทานอาหาร
ร่วมกัน และใช้เวลานาน
เสี่ยงติดเชื้อมากขึ้น
ชัยนาท ขอตรวจได้ที่ รพ.สต / สาธารณสุขเทศบาล LINK
มาตรการเดินทางเข้า-ออกจังหวัดชัยนาท เพื่อกำหนดมาตรการเฝ้าระวัง ป้องกัน และควบคุมโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) ช่วงเทศการปีใหม่ ฉบับที่ 20 แพลทฟอร์มลงทะเบียนเข้า-ออกพื้นที่จังหวัดชัยนาท
บริจาคโลหิตกับกลุ่มเซ็นทรัล ห้างในพื้นที่ภาคเหนือ 6 จุด
ยาจันทลีลา บรรเทาไข้ตัวร้อน ไข้เปลี่ยนฤดู แก้ลมวิงเวียน คลื่นไส้ อาเจียน แก้ลมปลายไข้ LINK
ตำรับยาจันทน์สีลามีฤทธิ์ทางเภสัชวิทยาคือ แก้ไข้ แก้ปวด และต้านการอักเสบ และมีความปลอดภัยสูงซึ่งทำให้เกิดความมั่นใจในประสิทธิภาพ และความปลอดภัยของตำรับยาที่จะนำมาใช้ทดแทนยาแผนปัจจุบันได้ และเป็นการสนับสนุนและเผยแพร่ตำรับยาที่มีการใช้ตามองค์ความรู้ดั้งเดิมให้เป็นที่ยอมรับของบุคลากรทางการแพทย์และประชาชน
มีทั้ง ชนิดผง ชนิดเม็ด และชนิดแคปซูล
ข้อควรระวัง ไม่แนะนำให้ใช้ในผู้ที่สงสัยว่าเป็นไข้เลือดออกเนื่องจากอาจบดบังอาการของไข้เลือดออก
แนะนำให้ใช้ยาจันทน์ลีลาได้ในหญิงที่มีไข้ทับระดูหรือไข้ระหว่างมีประจำเดือน
ความมาเป็น กัญชาทางการแพทย์ โรงพยาบาลเจ้าพระยาอภัยภูเบศร LINK
ในเดือนมิถุนายน 2562 โรงพยาบาลเจ้าพระยาอภัยภูเบศร ได้รับมอบหมายจากกระทรวงสาธารณสุขให้ปลูกและผลิตยากัญชา จึงจัดทำโครงการ “กัญชาอภัยภูเบศรโมเดล” เพื่อถ่ายทอดองค์ความรู้ให้กับเกษตกร ผู้ประกอบการรายย่อย และสถาบันการแพทย์ที่สนใจทั่วประเทศ เพื่อให้ประชาชนสามารถเข้าถึงยากัญชาที่มีคุณภาพอย่างเท่าเทียม โดยโรงพยาบาลได้ทำความร่วมมือกับหลายภาคส่วน ทั้งหน่วยงานในสังกัดกระทรวงสาธารณสุข เช่น สำนักงานคณะกรรมการอาหารและยา กรมวิทยาศาสตร์การแพทย์ กรมการแพทย์แผนไทยและการแพทย์ทางเลือก วิสาหกิจชุมชนและ มหาวิทยาลัยต่างๆ
พญ.หญิงโศรยา ธรรมรักษ์ ผู้อำนวยการโรงพยาบาลเจ้าพระยาภัยภูเบศร กล่าวว่า โรงพยาบาลฯ ได้ตั้งคณะทำงานซึ่งประกอบด้วยแพทย์ เภสัชกร แพทย์แผนไทยและพยาบาล ดำเนินการศึกษาและวิจัยต่อยอดกัญชาเพื่อใช้ในทางการแพทย์ ตั้งแต่ต้นทาง กลางทางและปลายทาง จากการทำงานมากว่า 1 ปี เราพบว่า ปัจจุบันมีงานศึกษาวิจัยเกี่ยวกับกัญชานับหมื่นชิ้นทั่วโลก ดังนั้นการหาแนวทางที่จะใช้กัญชาอย่างเหมาะสมและปลอดภัยในบริบทของประเทศไทย จึงเป็นสิ่งที่โรงพยาบาลฯ คำนึงถึงเป็นอย่างแรก ด้วยข้อจำกัดทางกฏหมายที่กัญชายังอยู่ในบัญชียาเสพติดการลงไปทำโดยโดยไม่มีระบบควบคุมที่ดีพออาจนำมาซึ่งปัญหาที่แก้ยาก ดังนั้นจึงเป็นจุดเริ่มต้นของการศึกษาวิจัยเรื่องการใช้ประโยชน์ โดยได้ลงมือปลูกกัญชาเอง และทำอย่างครบวงจร เพื่อให้รู้ว่ากัญชาจะจะใช้ประโยชน์อะไร กับผู้ป่วยกลุ่มไหน และการใช้ต้องมีความรู้อะไรทั้งในส่วนของบุคลากรทางการแพทย์และประชาชน
วัตถุดิบ กระบวนการสกัดและผลิต
ในส่วนต้นน้ำ คือ วัตถุดิบกัญชาที่มีคุณภาพ ด้วยความต้องการของผู้ป่วยในขณะนั้น ทางโรงพยาบาลจึงได้ทำงานร่วมกับกรมวิทยาศาสตร์การแพทย์และสำนักงานคณะกรรมการปราบรามยาเสพติด นำกัญชาของกลางที่ผ่านเกณฑ์คุณภาพมาสกัดด้วยเทคนิค supercritical fluid extraction โดยผลิตภัณฑ์ผ่านการตรวจสอบคุณภาพจากกรมวิทยาศาสตร์การแพทย์ ได้ยาล๊อตแรกเดือนสิงหาคม 2562 ในขณะเดียวกันก็ทำงานร่วมกับวิสาหกิจเพื่อสังคม มูลนิธิโรงพยาบาลเจ้าพระยาอภัยภูเบศรและวิสาหกิจชุมชนในพื้นที่ปลูกกัญชา 3 ระบบ ได้แก่ ระบบปิด กึ่งปิด และเปิด เพื่อศึกษาสภาวะการปลูก และความคุ้มค่า ในปัจจุบันเราพบว่าระบบปิดน่าจะไม่มีความคุ้มค่าสำหรับเกษตรกรประเทศไทย เนื่องจากค่าใช้จ่ายสูงมาก เพราะต้องลงทุนโรงเรือนและวัสดุต่างๆในราคาสูง อีกทั้งระบบยังใช้ไฟฟ้าตลอด 24 ชั่วโมง ในขณะนี้กำลังศึกษาการปลูกในสภาวะกลางแจ้ง หากประสบความสำเร็จก็จะบดต้นทุนการปลูกได้มาก
ในส่วนกลางน้ำ ได้พัฒนากระบวนการสกัด และผลิต ปัจจุบันเรามียา 4 ตำรับที่ได้รับอนุญาตให้ผลิต และกระจายไปในโรงพยาบาลทั่วประเทศ เกือบ 300 แห่ง ได้แก่ ยาสารสกัด THC 1.7% (สั่งจ่ายโดยแพทย์แผนปัจจุบัน) ยาแคปซูลศุขไสยาศน์ (สั่งจ่ายโดยแพทย์แผนไทย) ยาน้ำมันกัญชาทั้ง 5 ชนิดรับประทาน และชนิดทาภายนอก (สั่งจ่ายโดยแพทย์แผนไทย)
ในส่วนปลายน้ำ เป็นการใช้ในผู้ป่วย เราเป็นโรงพยาบาลแรกของประเทศที่เปิดคลินิกกัญชาทางการแพทย์ ต่อมาเมื่อมียากัญชาทางการแพทย์แผนไทย เราก็พัฒนาเป็นคลินิกกัญชาการแพทย์ผสมผสาน มีแพทย์แผนปัจจุบันและแพทย์แผนไทยทำงานด้วยกัน ในการส่งต่อผู้ป่วยของกันและกัน มีเภสัชกรคัดกรองผู้ป่วย ให้ยาและติดตามความปลอดภัยและผลการรักษา และพยาบาลมีหน้าที่ประเมินสัญญาณชีพและสนับสนุนการตรวจรักษาของแพทย์
ในส่วนปลายน้ำ มีการประเมินผลการรักษาผู้ป่วยอย่างเป็นระบบ และนำผลกลับมาพัฒนาคุณภาพการบริการ เช่น แพทย์แผนไทยร่วมกับเภสัชกรได้วิเคราะห์ข้อมูล พบว่า ยาผงศุขไสยาศน์ที่เรารับมาจากกรมการแพทย์แผนไทยและการแพทย์ทางเลือก ทำให้เกิดผลข้างเคียงทางเดินอาหารในผู้ป่วยสูงถึง 60% ดังนั้นเมื่อเราได้รับมอบหมายให้ผลิตยาตำรับนี้ เราจึงเปลี่ยนรูปแบบเป็นแคปซูลเพื่อลดผลข้างเคียง จากการติดตามมการใช้อย่างเป็นระบบ เราพบว่า ยาสารสกัดกัญชา THC 1.7% มีแนวโน้มเพิ่มคุณภาพชีวิตในผู้ป่วยมะเร็งระยะท้ายกว่า 100 ราย และช่วยลดปวดในผู้ป่วยที่ปวดปลายประสาทที่ล้มเหลวจากการรักษามาตรฐานอย่างมีนัยสำคัญ ส่วนยาศุขไสยาศน์มีผลเพิ่มคุณภาพการนอนหลับในผู้ป่วยที่นอนไม่หลับมานานกว่า 1 เดือนและใช้ยาหรือผลิตภัณฑ์อื่นแล้วไม่ได้ผล ในส่วนยากัญชาทั้ง 5 เราเพิ่งอบรมผู้สั่งใช้ยาเสร็จ คาดว่าภายในธันวาคมนี้จะมีโรงพยาบาล 100 แห่งที่ให้บริการยานี้
เป้าหมาย กัญชาอภัยภูเบศร ในปี 2564
พญ.โศรยา กล่าวว่า แผนงานที่โรงพยาบาลเจ้าพระยาอภัยภูเบศรจะดำเนินการในปี 2564 คือ ร่วมมือกับสำนักงานคณะกรรมการอาหารและยา (อย.) พัฒนา chatbot เพื่อให้ผู้ป่วย นักวิชาการ ผู้ประกอบการ และเกษตรกร สามารถเข้าถึงข้อมูลกัญชาที่ถูกต้องอย่างรวดเร็ว โดยแบ่งเป็นฐานข้อมูลทางวิชาการ เพื่อให้นักวิชาการ ผู้ประกอบการ และฐานข้อมูลสำหรับเกษตรกรสามารถเข้าถึงข้อมูลแบบเรียลไทม์
นอกจากนี้ยังร่วมมือกับ อย. อบรมเกษตรกรทั่วประเทศ เพื่อรองรับกฎหมายฉบับใหม่ พร้อมทำคู่มือการปลูก เก็บเกี่ยวและแปรูปกัญชาเบื้องต้น รวมถึงพัฒนาหลักฐานทางวิชาการที่หลากหลาย ทั้งการวิเคราะห์ข้อมูลผู้ป่วยย้อนหลัง การวิจัยทางคลินิกแบบควบคุมตัวแปร เพื่อสนับสนุนให้เกิดการใช้ โดยจะระบุทั้งข้อดีและข้อเสีย เพื่อให้รู้ข้อจำกัดของการใช้ นำไปสู่การใช้อย่างยั่งยืน
ขณะเดียวกัน ก็จะร่วมกับกรมการแพทย์แผนไทยฯ พัฒนาแนวทางการเก็บข้อมูลยาศุขไสยาศน์และยาน้ำมันกัญชาทั้ง 5 เพื่อเสนอต่อคณะผู้เชี่ยวชาญสมุนไพร ในบัญชียาหลักแห่งชาติ เพื่อนำไปสู่ การพัฒนาหลักฐานเพื่อผลักดันเข้าสู่ยาหลักแห่งชาติ
ผู้จัดการออนไลน์
สุขภาพดี บางมด ช่วยได้ LINK
เริ่มแล้ว วันนี้ - 31 มีนาคม ประกันสังคม ปี 2565 เปลี่ยนสิทธิการรักษาพยาบาล มาเป็น ร.พ.บางมด ท่านสามารถเปลี่ยนด้วยตนเองเพียงโหลด แอปพิเคชั่น ของสำนักงานประกันสังคม ( Application SSO Connect ) หรือ แจ้งฝ่ายบุคคล เพื่อทำเรืองเปลี่ยนฯ หรือติดต่อเรา 089-6669556 , 063-9014647 , 061-3876460 สุขภาพดี บางมด ช่วยได้
โปรแกรม ฝากครรภ์ คุณภาพ โรงพยาบาลเกษมราษฎร์บางแค LINK
โปรแกรม ฝากครรภ์ คุณภาพ – โรงพยาบาลเกษมราษฎร์บางแค สำหรับคุณแม่ทุกท่าน เพื่อเตรียมความพร้อมในการให้กำเนิดลูกน้อยอย่างอบอุ่นใจ ในการ ฝากครรภ์
สอบถามข้อมูลเพิ่มเติม โรงพยาบาลเกษมราษฎร์ บางแค Kasemrad Call Center 1218 กด 3 ต่อ 5104 , 5105 (ศูนย์สูตินรีเวช)
เกาะขายหัวเราะ เกาะหมาก ตราด LINK
เกาะขายหัวเราะ ฮอตมากตั้งแต่เปิดตัว ททท. ตราด เลยเขียนแนะนำ วิธีไปเกาะขายหัวเราะ ไปยังไง ไปช่วงไหน นอนไหนดี พร้อมข้อมูลอื่นๆ อีกครบ คลิกไปอ่านกันเลย
กรุงสยามเซนต์คาร์ลอส บริการตรวจ RT-PCR ราคา 2,200 บาท
โรงพยาบาลกรุงสยามเซนต์คาร์ลอส บริการตรวจหาเชื้อโควิด-19 RT-PCR ราคา 2,200 บาท ต้องการใบรับรองแพทย์ เพิ่ม 300 บาท (รอผลประมาณ 48 ชม.) เปิดให้บริการทุกวัน วันจันทร์ - วันศุกร์ เวลา 8.00-20.00 น. วันเสาร์ - วันอาทิตย์ เวลา 8.00-17.00 น. สามารถ Walk-in ได้ โดยไม่ต้องนัดหมายล่วงหน้า ตั้งแต่วันที่ 1 เมษายน 2565 เป็นต้นไป *หรือจนจะมีการเปลี่ยนแปลง สอบถามรายละเอียดเพิ่มเติมได้ที่ โทร : 02 975 6700 ถึง 05
มิตรประชา รับดูแลคนไข้ covid-19 Home isolation และ เจอแจกจบ
โรงพยาบาลมิตรประชา รับดูแลคนไข้ covid-19 Home isolation และ เจอแจกจบ ลงทะเบียนได้ที่ QR Code หรือโทร 02 455 5085
นนท์ student booster เข็ม 3 pfizer อายุ 12-17 ปี ยืนยันภายใน 4 พ.ค.2565 LINK
นนท์ student booster เข็ม 3 pfizer สำหรับนักเรียน ไม่จำกัดพื้นที่อาศัย และไม่จำกัดสัญชาติ
อายุ 12-17 ปี
ผู้ที่เคยได้รับ PZ ฝาสีม่วง
มาแล้ว 2 เข็ม ที่สนามฉีดนนท์student เมืองทองธานี
ขอเชิญยืนยัน เพื่อรับวัน เวลาการฉีด
ทางลิงค์
ภายในวันที่ 4 พ.ค.2565
สนามฉีด lmpact Hall 5-7 เมืองทองธานี
วันที่ 7-8 พ.ค. 2565 08.00-16.00 น.
เพื่อความสะดวกและรวดเร็ว
สำหรับนักเรียน ลงทะเบียน เข็ม 3 booster shots
กรุณาเตรียม หลักฐานการลงทะเบียน วันและรอบฉีด (แสดงหน้าจอโทร หรือ พิมพ์ใส่กระดาษ)
เพื่อแสดงหน้างาน
ในปีนี้มูลนิธิฯ มีความภูมิใจที่ได้เป็นส่วนหนึ่งในการการผลักดันให้เกิดโครงการนวัตกรรมการแพทย์เพื่อผู้สูงวัยและผู้ป่วยระยะ เพื่อรองรับสังคมแห่งผู้สูงวัย โดยโครงการนี้ได้มีการพัฒนานวัตกรรมในการสร้างศูนย์ต้นแบบการดูแลสุขภาวะผู้สูงอายุอย่างครบวงจร หวังว่าจะดูแลผู้คนในทุกช่วงวัยให้มีสุขภาพและคุณภาพชีวิตที่ดีจวบจนนาทีสุดท้าย โดยจะผลักดันให้เป็นศูนย์ต้นแบบการเรียนรู้ต่อไป ซึ่งโครงการต่างๆ ของรามาธิบดีที่กล่าวมานี้จะไม่สามารถขับเคลื่อนต่อไปได้หากไม่ได้รับการสนับสนุนจากภาคประชาชน ในนามของมูลนิธิเราจึงมุ่งมั่นทำงานเพื่อสานต่อการให้ที่ยิ่งใหญ่นี้ให้คงอยู่ในสังคมสืบต่อไป” นางสาวพรรณสิรี กล่าวทิ้งท้าย
เนื่องในวันรามาธิบดี จึงขอเรียนเชิญผู้มีจิตศรัทธาร่วมเป็นส่วนหนึ่งของการให้ ด้วยการซื้อเสื้อ “หัวใจอินฟินิตี้” ราคา 199 บาท ทางช่องทางต่าง ๆ เช่น LINE @ramafoundation, www.ramafoundation.or.th, มูลนิธิรามาธิบดีฯ หรือบริจาคเงินสมทบทุนมูลนิธิรามาธิบดีฯ สอบถามโทร 02-201-1111
Ep.2.5 “ประโยชน์อันชอบธรรม Legitimate Interest” LINK
การประมวลผลข้อมูลที่จำเป็นเพื่อประโยชน์อันชอบธรรม
ของผู้ควบคุมข้อมูลหรือบุคคลอื่น
สาระสำคัญคือประโยชน์อันชอบธรรมนั้น
‘ต้องไม่เกินไปกว่าความคาดหมายของเจ้าของข้อมูล’
เช่น การติด CCTV หน้าประตูทางเข้าบริษัท
ย่อมคาดหมายได้ว่าเป็นไปเพื่อการรักษาความปลอดภัย
ผู้ควบคุมข้อมูลสามารถทำให้เจ้าของข้อมูล
มีความคาดหมายที่ถูกต้องเพิ่มเติมได้โดยการแปะป้าย
“ CCTV กำลังทำงาน ”
.
ผู้ควบคุมข้อมูลส่วนบุคคลต้องใช้ดุลยพินิจ
ชั่งน้ำหนักระหว่างประโยชน์อันชอบธรรม
ไม่ให้ขัดกับสิทธิและประโยชน์เจ้าของข้อมูลส่วนบุคคล
ดังนั้น ผู้ควบคุมข้อมูลส่วนบุคคลต้องระบุได้ว่า
อะไรคือประโยชน์อันชอบธรรมที่จะได้รับ
และความจำเป็นในการประมวลผลข้อมูล
ทั้งยังมีหน้าที่ปกป้องสิทธิเสรีภาพและประโยชน์
ของเจ้าของข้อมูลส่วนบุคคลให้สมดุลกับ
ประโยชน์อันชอบธรรมที่จะได้รับด้วย
(มาตรา 24(5))
.
ตัวอย่างคือ หากติดกล้อง CCTV ในสถานที่
เช่น ภายในห้องน้ำ นอกจากเกินกว่าที่บุคคลทั่วไป
จะคาดหมายได้แล้ว ยังก้าวล่วงความเป็นส่วนตัว
และสร้างความเสี่ยงต่อเจ้าของข้อมูลมากเกินสมควร
กรณีนี้ก็จะไม่สามารถอ้างประโยชน์อันชอบธรรมได้
.
นอกจากนี้ ในการปกป้องสิทธิเสรีภาพ
และประโยชน์ของเจ้าของข้อมูล
ผู้ควบคุมข้อมูลควรจะมีระบบรักษาความปลอดภัย
ในการใช้ข้อมูลจากกล้องให้อยู่ในขอบเขตที่เหมาะสม
ไม่เปิดเผยให้ผู้อื่นเข้าถึงได้โดยง่าย ก็จะเป็นมาตรการ
ที่ช่วยคุ้มครองเจ้าของข้อมูลได้อีกทางหนึ่ง (Safeguard)
25.ข้อมูลส่วนบุคคลที่เก็บรวบรวมไว้ก่อนวันที่ พรบ.ใช้บังคับ
1. ผุ้ควบคุมข้อมูลส่วนบุคคลสามารถเก็บรวบรวมและใช้ข้อมูลส่วนบุคคลต่อไปได้ตามวัตถุประสงค์เดิม
2.ต้องกำหนดวิธีการยกเลิกความยินยอมและเผยแพร่ประชาสัมพันธ์ให้เจ้าของข้อมูลส่วนบุคคลที่ไม่ประสงค์ให้เก็บรวบรวมและใช้ข้อมูลส่วนบุคคลดังกล่าว สามารถแจ้งยกเลิกความยินยอมได้โดยง่าย
3.การเปิดเผยและการดำเนินกการอื่นที่มิใช่การเก็บรวบรวมและการใช้ข้อมูลส่วนบุคคล ให้เป็นไปตามกฏหมายนี้
กรุงเทพฯ มั่นใจ ปลอดภัยโควิด [เศรษฐกิจดีสุขภาพดี]
ประโยชน์คนกรุงฯ
- คนกรุงเทพฯ และนักท่องเที่ยวมั่นใจได้ว่า กทม.มีมาตรการจัดการโควิดที่ดี ลดความเสี่ยงจากการแพร่ระบาด
- ภาคธุรกิจได้ความมั่นใจและความเชื่อมั่นกลับมา ไม่ต้องกังวลกับความไม่แน่นอนของสถานการณ์โควิด 19
รายละเอียดนโยบาย
ความเชื่อมั่นคือสิ่งสำคัญที่จะทำให้เศรษฐกิจขับเคลื่อนต่อไปได้ รวมถึงสร้างความมั่นคงให้กับธุรกิจต่าง ๆ ในกรุงเทพฯ เนื่องจากการระบาดของโรคทำให้กิจกรรมทางเศรษฐกิจหยุดชะงัก
ดังนั้น กทม.จะสร้างความเชื่อมั่นให้กับนักท่องเที่ยวที่จะเข้ามายังพื้นที่กรุงเทพฯ ผ่านศักยภาพในการตรวจ คัดกรอง และติดตามกลุ่มเสี่ยง นอกจากนี้ กทม.จะส่งเสริมให้ภาคธุรกิจตรวจ ATK ให้กับทั้งพนักงานและลูกค้า พร้อมกับนำผลการตรวจขึ้นแสดงบนแอพพลิเคชั่นและส่งให้กับ กทม.เพื่อเก็บสถิติและควบคุมการระบาดในกรณีที่พบผู้ติดเชื้อ
การให้ยืมอุปกรณ์ทางการแพทย์ เทศบาลตำบลเจ้าพระยาสุรศักดิ์ จ.ชลบุรี LINK
เทศบาลตำบลเจ้าพระยาสุรศักดิ์ มีหลักเกณฑ์/เงื่อนไขการให้ยืมอุปกรณ์ทางการแพทย์แก่ผู้พิการ ผู้สูงอายุ ผู้ป่วย ที่ช่วยเหลือตัวเองไม่ได้ ดังนี้
1. ผู้พิการ ผู้สูงอายุ ผู้ป่วย ต้องเป็นผู้ที่มีสำเนาทะเบียนบ้านอยู่ในเขตเทศบาลตำบลเจ้าพระยาสุรศักดิ์ หรือในกรณีที่ไม่มีสำเนาทะเบียนบ้านต้องมีผู้รับรองว่าอยู่ในพื้นที่จริง
2. พยาธิสภาพเริ่มตั้งแต่ระดับความรู้สึกการรับรู้ได้น้อย การเคลื่อนไหวได้เป็นบางส่วน ไม่สามารถช่วยเหลือตนเองต้องมีญาติดูแล
3. ยื่นใบคำร้องขอยืมเตียงพร้อมเอกสารหลักฐาน
4. เมื่อหมดความจำเป็นต้องส่งคืนเทศบาล
หลักฐานเอกสารประกอบในการขอยืมเตียง
1. บันทึกข้อตกลงการขอรับการสนับสนุนให้ยืมครุภัณฑ์ทางการแพทย์ 2 ชุด ต่อการยืมเตียง
2. แบบคำร้องการขอยืมเตียง 1 ชุด ต่อการยืมเตียง
3. สำเนาทะเบียนบ้านหรือใบรับรองการเข้าอยู่อาศัยในพื้นที่
4. สำเนาบัตรประชาชน
5. สำเนาบัตรคนพิการ (กรณีพิการ)
6. รูปถ่ายขนาด 4 นิ้ว * 6 นิ้ว และ ขนาด 1 นิ้ว จำนวนอย่างละ 1 รูป
สำนักงานเทศบาลนครเจ้าพระยาสุรศักดิ์
เลขที่ 8 หมู่ 1 ถนนสายท่อน้ำ ตำบลหนองขาม อำเภอศรีราชา จังหวัดชลบุรี 20230
โทรศัพท์ : 038-348205 038-348206
Left: Dr. Patcharee Prasitvoranant Center : Dr. Alongkorn Kiatdilokrath Right: Dr. Kuruwin Limsamutpetch โรงพยาบาลกล้วยน้ำไท Hospitel
โรงพยาบาลกล้วยน้ำไท บริการดูแลผู้ป่วยที่ตรวจพบเชื้อเฉพาะผู้ป่วยที่มีผลตรวจ ATK 2ขีด(เป็นบวก) หรือผลตรวจ RT-PCR พบเชื้อเท่านั้น โดยไม่เสียค่าใช้จ่าย ตามเงื่อนไขของสิทธิ์
การดูแลรักษาผู้ป่วย แบ่งเป็น 3แบบ (ตามเงื่อนไขของสิทธิ์ที่มี) ✅ Home Isolation (HI) ✅ Self Isolation (SI) เจอแจกจบ ✅ Hospitel
โทรตามเบอร์ที่ให้ไว้ เพื่อเข้าระบบการรักษา
โทร. 064-5590454 (นัท) คุณสิทธิพล โกเมนทร์
โทร. 064-5699098 (โอม) คุณธนพัฒน์ พุทธจง
โทร. 061-3870823( ตั้ม ) คุณจักรกฤช
โทร. 091-5039106 (นุช) คุณปภาดา ประดิษฐวรคุณ
โทร. 097-0248220 (แพรว) คุณแพรวไพลิน ลิ้มปฏิมา
** ทุกวัน เวลา 8.00-19.00 น.**
เงื่อนไขการเข้าพักรักษา ในความดูแลของ รพ.กล้วยน้ำไท
- ทุกสิทธิ์การรักษาที่มี
- ผู้ป่วยต้องมีผลตรวจ ATK เป็นบวก หรือมีผลตรวจ Rt-PCR พบเชื้อ
- เริ่มตั้งแต่ 7 เม.ย. 2565 หรือจนกว่าจะเปลี่ยนแปลง
สอบถามเพิ่มเติม โทร.02-3812071-5 ให้บริการทุกวัน เวลา 8.00-17.00น.
ลิงค์
บริการรพ.กรุงเทพจันทบุรี เปิดรับสมัครงานหลายหน้าที่ หลายตำแหน่ง LINK
แผนกบริหารทรัพยากรบุคคล คุณศิริวรรณ สมบัติ bchhr@bch.co.th โทร. 039-319888 ต่อ 1508 สมัครงานด้วยตนเอง ทุกวันทำการ 08.00-16.00น.
รพ.กรุงเทพจันทบุรี เปิดรับตำแหน่งต่างๆ ดังนี้
เจ้าหน้าที่ลงทะเบียนต้อนรับ
ผู้ช่วยนักรังสีเทคนิค
พยาบาลวิชาชีพ (หลายอัตรา)
เจ้าหน้าที่การตลาดต่างประเทศ
ผู้ช่วยพยาบาล/ผู้ช่วยเหลือผู้ป่วย
พยาบาลวิชาชีพ ER
พยาบาลวิชาชีพ Part Time
วิสัญญีพยาบาล
เจ้าหน้าที่ EMT
เจ้าหน้าที่ซ่อมบำรุง
ตำแหน่งอื่นๆ
พนักงาน PART TIME
ผู้ช่วยแม่ครัว
เจ้าหน้าที่บริการทางการแพทย์ต่างประเทศ (ล่าม)
ผู้ช่วยผู้จัดการฝ่ายสนับสนุนการบริการ
Nurse Educator
พนักงานขับรถกอล์ฟ Part Time
Quality Management HOD
วิทยาศาสตร์การกีฬา(Sports Science)
Quality improvement officer
HRD Nurse
เสริฟอาหาร
Marketing Data Analyst
บางกอกน้อย ป้องกันอัคคีภัย LINK
8 สิงหาคม 2565 นางธราพร อำนวยสาร ผู้อำนวยการเขตบางกอกน้อย พร้อมเจ้าหน้าที่ฝ่ายโยธา ฝ่ายเทศกิจ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ฝ่ายปกครองและสถานีดับเพลิงและกู้ภัยบางขุนนนท์ ตรวจตามมาตรการด้านความปลอดภัยของอาคารและระบบป้องกันอัคคีภัยของสถานประกอบการที่มีลักษณะคล้ายสถานบริการ (ริมน้ำหมูกะทะ here u are , ฟูลมูน , น้ำเย็น , นิวชิตี้วอล , คัมปาย , บ้านเพื่อน)
โครงการที่อยู่ระหว่างดำเนินการ นโยบายบริหารจัดการขยะ
โครงการและนโยบายสำคัญที่อยู่ระหว่างดำเนินการและกำลังจะดำเนินการ
ㆍ เพิ่มประสิทธิภาพการจัดเก็บขยะด้วยการออกแบบ ศึกษาเก็บขนาดเล็ก ควบคู่กับอุปกรณ์และพัฒนาโมเดลรถจัดและรถช่วยลากขยะ เพื่อเข้าถึงตรอกซอกซอยขนาดเล็กและชุมชนริมคลองที่หลายแห่งมีความกว้างเพียงทางเดินเท้า และทางมอเตอร์ไซค์ผ่าน (กว้างน้อยกว่า 1-1.5 เมตร)
ㆍ ส่งเสริมและสนับสนุนการจัดการขยะตั้งแต่ต้นทาง ทั้งการคัดแยกอย่างถูกวิธีและการลดปริมาณขยะ (zero waste to landfill) โดยร่วมมือกับภาคีหน่วยงานที่ดำเนินการอยู่เดิมและสร้างภาคีเครือข่ายใหม่ให้มีจำนวนมากขึ้น ทั้งรูปแบบธนาคารขยะ ธุรกิจเพื่อสังคม ตลอดจนโครงการความร่วมมือระหว่างสมาคมผู้ประกอบการภาคเอกชนที่ให้ความสนใจและร่วมผลักดันแนวคิด Sustainable Development Growth (SDGs) และ BCG Bio-Circular-Green Economy)
การจัดการปัญหาขยะมูลฝอยไม่อาจสำเร็จได้ด้วยกำลังของกรุงเทพมหานครเพียงลำพัง จำเป็นต้องอาศัยความร่วมมือร่วมใจจากประชาชนและหน่วยงานที่เกี่ยวข้องทุกภาคส่วน ซึ่งจะช่วยให้การบริหารจัดการขยะเป็นไปอย่างมีประสิทธิภาพ กรุงเทพมหานครจึงดำเนินการเสริมสร้างความรู้ความเข้าใจ ควบคู่ไปกับการสร้างการมีส่วนร่วมกับประชาชนเกี่ยวกับการบริหารจัดการขยะอย่างถูกวิธี นอกจากนี้ยังสนับสนุนให้บุคลากรออกไปให้ความรู้แก่ประชาชนชนเพื่อให้เกิดความตระหนักรู้และสร้างจิตสำนึกรับผิดชอบต่อตนเองและส่วนรวมในการดูแลรักษาความสะอาดการจัดการขยะและสิ่งแวดล้อม เพื่อสร้างกรุงเทพฯ ให้เป็นเมืองที่สวยงามและน่าอยู่ของทุกคน
25 กันยายน BKK-เรนเจอร์ @TK Park เปิดโลกแห่งจินตนาการกับอาชีพใหม่ใน Metaverse
วันอาทิตย์ที่ 25 กันยายน 2565 เวลา 13.00 - 17.00 น. พบกับงานเปิดโลกแห่งจินตนาการกับอาชีพใหม่ใน Metaverse ชวนน้องๆ อายุ 11 - 15 ปี มาเปิดโลกใหม่ เพื่อรู้จักและเข้าใจเมทาเวิร์สอย่างถูกต้องให้มากขึ้น ที่ อุทยานการเรียนรู้ TK Park
5. แนวทางการดำเนินการ
ส่วนราชการและหน่วยงานของรัฐสามารถพิจารณาดำเนินการตามแนวทางดังต่อไปนี้ เพื่อให้หน่วยงานมีรูปแบบการปฏิบัติราชการวิถีใหม่ที่สอดคล้องและเหมาะสมกับรูปแบบและขั้นตอนวิธีการในการให้บริการประชาชนที่ทันสมัย ลักษณะงานและภารกิจของหน่วยงาน ประกอบกับการนำเทคโนโลยีมาใช้ในการปฏิบัติงานเพื่อเพิ่มประสิทธิภาพและคุณภาพในการให้บริการประชาชน ตลอดจนการปรับปรุงกลไกการบริหารงานบุคคลที่ทันสมัยและคล่องตัวซึ่งสามารถใช้เป็นแนวทางดำเนินการสำหรับสถานการณ์ในภาวะปรกติ และสถานการณ์ในภาวะไม่ปรกติ ดังนี้
5.1 รูปแบบและขั้นตอนวิธีการทำงานและรูปแบบการให้บริการประชาชนส่วนราชการและหน่วยงานของรัฐสามารถปรับปรุงกระบวนงาน (Work Procedure) ระบบและขั้นตอนการทำงาน (Work System/Process) และการให้บริการประชาชนที่หน่วยงานได้ดำเนินการ ดังนี้
5.1.1 การปรับรูปแบบและขั้นตอนวิธีการทำงาน
โดยหน่วยงานมีการยกระดับมาตรฐานการทำงานภายในให้สอดคล้องกับสถานการณ์และความคาดหวังของผู้รับบริการและผู้มีส่วนได้ส่วนเสีย มีการลดขั้นตอนและกระบวนงานที่ไม่จำเป็น เพื่อให้การทำงานมีประสิทธิภาพสูงสุด
5.1.2 การปรับรูปแบบการให้บริการประชาชน
โดยหน่วยงานมีการปรับปรุงรูปแบบการให้บริการประชาชนโดยใช้เทคโนโลยีดิจิทัลทดแทนการใช้กำลังคนปรกติเพื่อเพิ่มประสิทธิภาพและคุณภาพในการให้บริการประชาชน หรือการให้บริการประชาชนได้ตลอด24 ชั่วโมง 7 วัน รวมวันเสาร์ – อาทิตย์ เพื่ออำนวยความสะดวกให้ประชาชนสามารถติดต่อราชการได้ทุกวัน
5.2 ลักษณะงานและภารกิจ
ส่วนราชการและหน่วยงานของรัฐพิจารณาว่าภารกิจใดหรือลักษณะงานใด มีความเหมาะสมที่จะปฏิบัติงานในรูปแบบใด จึงจะสามารถตอบสนองต่อความต้องการของประชาชนผู้รับบริการและสอดคล้องกับการดำเนินงานตามภารกิจให้ดีที่สุด และต้องไม่ให้กระทบต่อประสิทธิภาพในการปฏิบัติงาน โดยอาจพิจารณาจากภารกิจของหน่วยงานตามที่เห็นว่าเหมาะสมและสอดคล้องกับบริบทการปฏิบัติราชการของหน่วยงาน ดังนี้
5.2.1 การพิจารณาภารกิจของส่วนราชการและหน่วยงานของรัฐ
ส่วนราชการและหน่วยงานของรัฐพิจารณาภารกิจในภาพรวมโดยพิจารณาว่าหน่วยงานมีภารกิจลักษณะใด ควรต้องกำหนดรูปแบบการปฏิบัติงานให้เป็นอย่างไรจึงจะสามารถตอบสนองและสอดคล้องกับการดำเนินการตามภารกิจได้ดีที่สุด และต้องไม่ให้กระทบต่อประสิทธิภาพในการปฏิบัติงานตามภารกิจ โดยภารกิจสามารถจำแนกออกได้เป็น 3 แบบ ดังนี้
(1) ภารกิจการให้บริการหรืออำนวยความสะดวกประชาชน
หมายถึง หน่วยงานมีภารกิจในการให้บริการประชาชนโดยตรงในรูปแบบต่าง ๆ มีลักษณะงานที่ต้องติดต่อกับประชาชน หรือประชาชนจำเป็นต้องติดต่อกับหน่วยงาน
(2) ภารกิจการจัดทำนโยบายหรือสนับสนุนการดำเนินการภาครัฐ
หมายถึง หน่วยงานที่ไม่มีภารกิจในการให้บริการประชาชน หรือไม่ได้ให้บริการประชาชนโดยตรงแต่มีลักษณะงานเชิงนโยบายซึ่งเป็นภารกิจของหน่วยงานตามกฎหมายการจัดตั้งหน่วยงานหรือลักษณะงานที่เป็นการสนับสนุนการปฏิบัติงานภายในหน่วยงาน
(3) ภารกิจที่มีลักษณะเฉพาะ
หมายถึง หน่วยงานที่มีภารกิจนอกเหนือจากข้อ (1) และข้อ (2) โดยมีลักษณะภารกิจเฉพาะเป็นของตนเอง ซึ่งมีความจำเป็นต้องปฏิบัติงานในพื้นที่เฉพาะไม่ได้ปฏิบัติงานในสถานที่ตั้งของหน่วยงาน หรือมีการใช้อุปกรณ์ เครื่องมือ เครื่องใช้เฉพาะ โดยหากไม่มีเงื่อนไขความเฉพาะเจาะจงดังกล่าว ก็อาจจะไม่สามารถปฏิบัติงานได้
5.2.2 การพิจารณาชื่อตำแหน่งงาน
ส่วนราชการและหน่วยงานของรัฐพิจารณาว่าชื่อตำแหน่งงานภายในหน่วยงานมีลักษณะการปฏิบัติงานเช่นใด และวิเคราะห์งานที่ผู้ปฏิบัติงานในชื่อตำแหน่งงานดังกล่าวได้รับมอบหมายว่ามีความเหมาะสมที่จะกำหนดให้ปฏิบัติงานในรูปแบบการปฏิบัติงานใดจึงจะตอบสนองและสอดคล้องกับภารกิจได้มากที่สุด โดยอาจจำแนกชื่อตำแหน่งงานออกได้เป็น 5 ลักษณะ ดังนี้
(1) ตำแหน่งงานที่ต้องติดต่อกับประชาชน หรือมีผู้รับบริการภายนอกหน่วยงาน อาทิแพทย์และนักตรวจสอบภาษี
(2) ตำแหน่งงานที่สนับสนุนการปฏิบัติงานของหน่วยงานหรือมีผู้รับบริการภายในหน่วยงาน อาทินักวิชาการเงินและบัญชี และนักวิชาการพัสดุ
(3) ตำแหน่งงานที่ต้องศึกษา วิเคราะห์ วิจัย อาทินักวิเคราะห์นโยบายและแผน และสถาปนิก
(4) ตำแหน่งงานที่ต้องปฏิบัติงานในพื้นที่เฉพาะ หรือใช้อุปกรณ์และเครื่องมือเฉพาะ เช่น นักวิทยาศาสตร์ และนักทัณฑวิทยา
(5) ตำแหน่งงานที่ต้องปฏิบัติงานกำกับ ติดตามงาน และบังคับบัญชา อาทิผู้อำนวยการ
เกาหลีใต้ ยกเลิกกิจกรรมฮาโลวีนและงานรื่นเริงต่างๆ ทั้งหมด
Korea Times รายงานว่ากิจกรรมที่มีแผนจะจัดในวันฮาโลวีนถูกยกเลิกหมดแล้ว จากเหตุโศกนาฏกรรมเมื่อคืนวันที่ 29 ตุลาคม เพื่อเป็นการป้องกันเหตุที่อาจเกิดซ้ำเนื่องจากยังไม่มีมาตรการความปลอดภัยที่เพียงพอ และเพื่อเป็นการไว้อาลัยกับการสูญเสียที่เกิดขึ้นด้วย หลังจากที่ประธานาธิบดีได้ประกาศไว้อาลัยทั่วประเทศไปจนถึง 5 พฤศจิกายน
สวนสนุกเอเวอร์แลนด์ ในจังหวัดคย็องกี (Gyeonggi Province) ประกาศยุติการจัดงานฮาโลวีนและกิจกรรมทุกอย่าง ที่เริ่มมาตั้งแต่วันที่ 2 กันยายน ไปจนถึงวันที่ 20 พฤศจิกายน งานฮาโลวีนเป็นกิจกรรมประจำปีของสวนสนุกแห่งนี้
ล็อตเต้เวิร์ด สวนสนุกชื่อดังอีกแห่งทางตะวันออกเฉียงใต้ของกรุงโซล ได้ประกาศยุติการจัดงานฮาโลวีนและกิจกรรมทุกอย่างเช่นกัน
นอกจากนั้น จุดอื่นๆ ทั่วประเทศเกาหลีใต้ ที่มีแผนการจัดงานฮาโลวีนและงานกิจกรรมรื่นเริงต่างๆ ได้ยกเลิกการจัดงานแล้วทั้งสิ้น เพื่อแสดงความไว้อาลัยต่อเหตุการณ์ อาทิ งานฮาโลวีนในฮองแด เทศกาลเต้นรำในมาโป งาน Busan One Asia Festival เค-ป๊อปคอนเสิร์ตในปูซาน งาน SMTOWN WONDERLAND 2022 เป็นต้น นอกจากนั้น รายการทีวีด้านบันเทิงหลายรายการ ก็ยกเลิกออกอากาศ เช่นกัน และถูกทดแทนด้วยรายการข่าว
ลอยกระทงบัว นครนายก
วันที่ 7-8 พฤศจิกายน 2565 ณ โบสถ์กลางน้ำวัดป่ากระทุ่ม ชุมชนบ้านวังต้น ต.พรหมณี อ.เมือง จ.นครนายก
AS If it Never Existed เริ่มตั้งแต่ 12 พ.ย.65 - 15 ม.ค.66 LINK
AS If it Never Existed
เริ่มตั้งแต่ 12 พฤศจิกายน 65 - 15 มกราคม 2566
จัดแสดงที่ Manycuts Artspace ARI ซอยอารีย์ 3, เขตพญาไท
ผลงานชุด As If It Never Existed, 2022 หรือถ้าสิ่งนี้ไม่เคยมีอยู่ โดย อาจิณโจนาธาน อาจิณกิจ
ซึ่งเป็นผลงานที่สร้างสรรค์ด้วยโทนสีจัดจ้านและสดใส โดยศิลปินใช้ความพยายามอย่างสูงในการสร้างภาพลวงตาขึ้นมาผ่านการซ้อนทับของรูปทรง พื้นผิว ที่ว่าง จุด เส้น คู่สี และองค์ประกอบต่างๆ สิ่งเหล่านั้นถูกบรรจงสร้างด้วยความพิถีพิถัน ไม่ใช่เพื่อสร้างความสมบูรณ์แบบ แต่ในทางกลับกัน เป็นความพยายามในการสร้างความผิดเพี้ยนหรือความไม่สมบูรณ์
25 พ.ย. 65 ประกาศคุมช่อดอกกัญชา
1.พ.ร.บ.กัญชาฯ
- นายศุภชัย โพธิ์สุ รองประธานสภาผู้แทนราษฎร พิจารณากระทู้ถามสดของนายศุภชัย ใจสมุทร ส.ส.พรรคภูมิใจไทย ถามนายอนุทิน ชาญวีรกูล รองนายกฯ และรมว.สธ. เรื่อง ปัญหาการพิจารณาร่าง พ.ร.บ.กัญชา กัญชง พ.ศ.... โดยนายอนุทิน ชี้แจงว่า รัฐบาลมีนโยบายกัญชาเสรีจริง แบบเสรีมีการควบคุม คืนกัญชาให้ประชาชนใช้ประโยชน์ทางการแพทย์ การ เสริมสร้างรายได้ทางเศรษฐกิจ มี กม.กำกับ มีกลไกดำเนินการรัดกุม ไม่เกิดผลกระทบต่อสังคม และสามารถควบคุมได้ ไม่ต่าง จากเหล้าบุหรี่ ส่วนแนวทางป้องกันผลกระทบจากการใช้กัญชาในกลุ่มเปราะบางนั้น การมีร่าง พ.ร.บ.กัญชา กัญชง จะควบคุม การใช้กัญชาได้อย่างสมบูรณ์ ไม่เกิดปัญหาต่อสังคม รวมถึงยังมี กม.ระดับรองอย่างประกาศ สธ. ห้ามสูบ ห้ามจำหน่ายให้เด็ก การคุมเข้มการใช้ช่อดอก ฝ่าฝืนมีโทษทั้งจำคุกและปรับ ยืนยันตั้งแต่ดำเนินนโยบายให้ประชาชนเข้าถึงกัญชาเพื่อประโยชน์ ทางการแพทย์ ยังไม่มีปัญหาใดที่ควบคุมไม่ได้ ส่วนคนที่แอบขายแอบสูบ คือจงใจทำผิด กม.ต้องถูกดำเนินคดี
2.ประกาศคุมช่อดอกกัญชา
- นพ.ธงชัย เลิศวิไลรัตนพงศ์ อธิบดีกรมการแพทย์แผนไทยฯ กล่าวว่า กรมจะชี้แจงกับผู้ประกอบการอีกครั้ง ทำหนังสือ แจ้งเงื่อนไขระเบียบตามการประกาศ สธ. เรื่องสมุนไพรควบคุม (กัญชา) ฉบับที่ 2 ให้ทราบโดยทั่วกัน และอีก 2-3 สัปดาห์ จะ ลงพื้นที่ตรวจสอบผู้ประกอบการรายต่างๆ เพื่อดูว่ามีผู้กระทำผิดเงื่อนไขที่ขออนุญาตหรือไม่ นอกจากนี้สิ่งสำคัญคือห้าม จำหน่ายให้เด็ก สตรีมีครรภ์และให้นมบุตร นักเรียน นักศึกษา ห้ามสูบในร้านที่จำหน่าย ห้ามขายผ่านเครื่องอัตโนมัติ รวมถึง ระบบออนไลน์ห้ามโฆษณาขายทุกรูปแบบ และห้ามกระทำในพื้นที่ที่กำหนด เช่น วัด สวนสาธารณะ สวนสัตว์และสวนสนุก ต้องขออนุญาตทั้งหมด พร้อมทำรายงานและตรวจสอบผู้ซื้อด้วย ย้ำห้ามนำเข้าผลิตภัณฑ์จากต่างประเทศ
- นายปานเทพ พัวพงษ์พันธ์ โฆษก คกก.สื่อสารและประชาสัมพันธ์การใช้กัญชาอย่างเข้าใจ สธ. โพสต์ถึงความคืบหน้าใน เรื่องกัญชา ยืนยันว่าจะไม่กลับไปเป็นยาเสพติดอีก ตลอดจนรับทราบและมีท่าทีสนับสนุนประกาศ สธ.ในการให้กัญชาเป็น สมุนไพรควบคุมฉบับใหม่ ชัยชนะครึ่งที่เกิดขึ้น ขอขอบคุณภาคประชาชนที่เคลื่อนไหวอย่างต่อเนื่องจนมีส่วนทำให้บรรลุ วัตถุประสงค์ได้จนมาถึงวันนี้ และขอขอบคุณรัฐบาล และ คกก.ป.ป.ส. ที่ได้ฟังเสียงทักท้วงจากประชาชนที่ไม่เห็นด้วยที่จะนำ กัญชาเป็นยาเสพติดอีก และเรียกร้องขอให้ออกกฎหมายเพื่อควบคุมกัญชาให้ได้อย่างเหมาะสมแทน การเดินทางของกัญชา เพื่อการแพทย์ สุขภาพ และเศรษฐกิจ ยังเหลืออีกครึ่งทาง คือ จะต้องมีกฎหมายมาควบคุมการใช้กัญชาอย่างเหมาะสม ไม่ใช่ การคว่ำกฎหมายทิ้ง
3.ตลาดกัญชง
- นายยิ่งยศ จารุบุษปายน ผู้บริหาร บ.ไทยลีฟฯ บริษัทลงทุนธุรกิจกัญชง กัญชา กล่าวว่า ขณะนี้ประเทศโซนยุโรปเริ่มเปิด กว้างเรื่องกัญชงทั้งการผลิตและการแปรรูปผลิตภัณฑ์ ในสหรัฐฯ หรือแคนาดา ผลตอบรับการจำหน่ายผลิตภัณฑ์ที่ใช้สารสกัด CBD จากกัญชงดีมาก ผลิตภัณฑ์มีคุณภาพและมีการควบคุมอย่างชัดเจนจากหน่วยงานโดยตรง มีการประชาสัมพันธ์ข้อมูลผล วิจัยเกี่ยวกับสารสกัด CBD ให้ประชาชนเข้าใจอย่างชัดเจน ทั้งนี้ ไทยลีฟได้ดำเนินการปลูกกัญชงและสร้างโรงงานกัญชงที่ จ. นครนายก คาดแล้วเสร็จภายในปลายเดือน พ.ย.65 ได้เข้าไปพูดคุยกับหน่วยงานที่เกี่ยวข้องตั้งแต่เริ่มต้น ทุกภาคส่วนเข้าใจ และยินดีให้ความร่วมมือยุทธศาสตร์ที่ 1 ด้านความมั่นคง
ยุทธศาสตร์ที่ 1 ด้านความมั่นคง เกี่ยวข้องกับในด้านยาเสพติด แรงงานการค้ามนุษย์ และการจัดการภัยพิบัติ
ด้านยาเสพติด
เป็นประเด็นปัญหาสำคัญของประเทศไทย ที่รัฐต้องจัดสรรงบประมาณ 4,187.5 ล้านบาท เพื่อมาดูแลทุกมิติ ตั้งแต่
1. การป้องกันและแก้ไขปัญหา งบประมาณ 1,405.36 ล้านบาท จำแนกเป็น
1.1 แก้ปัญหาในประชากรเป้าหมายที่มีการแพร่ระบาดของยาเสพติด 80,000 คน ใช้งบประมาณ 596.55 ล้านบาท
- จัดตั้งหมู่บ้านเข้มแข็ง 1,240 หมู่บ้าน ใช้งบประมาณ 145.7 ล้านบาท
- รณรงค์ป้องกันยาเสพติดในเรือนจำ 142 แห่ง ใช้งบประมาณ 43.32 ล้านบาท
1.2 การเฝ้าระวัง สร้างภูมิคุ้มกันใกับวัยเสี่ยง 3-29 ปี 493,500 คน ใช้งบประมาณ 254.85 ล้านบาท และกลุ่มวัยรุ่นเยาวชน 120,000 คน ใช้งบประมาณ 95 ล้านบาท
2. การปราบปราม ใช้งบประมาณ 1,631.79 ล้านบาท ไปในกระบวนการ
- ยุติบทบาทการค้ายาฯ จับกุม ยึด อายัดทรัพย์ เป้าหมายร้อยละ 50 ของเครือข่ายยาเสพติด ใช้งบประมาณ 1,518.63 ล้านบาท
- ศึกษา ค้นคว้า ตัวอย่างการตรวจวิเคราะห์ทางห้องแลป จำนวน 80,000 ตัวอย่าง ใช้งบประมาณ 83.96 ล้านบาท
- ตรวจสอบตัวยา เคมีภัณฑ์และสารตั้งต้นที่เป็นวัตถุเสพติดในสถานประกอบการ จำนวน 27,020 ราย ใช้งบประมาณ 29.2 ล้านบาท
3. การบำบัด รักษา ฟื้นฟู ผู้ติดยาเสพติด
งบประมาณ 1,150.39 ล้านบาท
3.1 การนำผู้ป่วยเข้าสู่กระบวนการบำบัดและติดตาม ร้อยละ 60 ใช้งบประมาณ 422.09 ล้านบาท
สิ่งที่ประชาชนจะได้รับ
- พื้นที่แพร่ระบาดยาเสพติดจะได้รับการเสริมสร้างเป็นพื้นที่ปลอดภัย
- เด็ก เยาวชน ผู้ใช้แรงงาน ประชาชน มีความรู้ มีภูมิคุ้มกันยาเสพติด
- ผู้ติดยาเสพติดเข้าถึงบริการการแพทย์และการบำบัดรักษา
- ผู้ผ่านการบำบัดได้รับการติดตาม ช่วยเหลืออย่างใกล้ชิด ได้รับโอกาสในการดำรงชีวิตในสังคมได้อย่างปกติสุข
สายการบินตุรกี ระดมอากาศยาน 80 เที่ยวบิน พร้อมลำเลียงอาสาสมัคร 11,780 ชีวิตลงพื้นที่ประสบภัยของตุรกีเร่งระดมความช่วยเหลือทุกพื้นที่ ตั้งแต่ Adana, Gaziantep, Adiyaman และ Urfa ทั้งนี้ผอ.สายการบินระบุจะไม่กระทบการบินปกติ
พระนคร นครแห่งความรัก@เขตพระนคร LINK
สำนักงานเขตพระนคร จัดงาน "พระนคร นครแห่งความรัก" วาเลนไทน์ปีนี้ จูงมือคนรัก มาจดทะเบียนสมรส กันนะคะ
สำนักงานเขตพระนคร ขอเชิญคู่รักร่วมจดทะเบียนสมรส พร้อมรับของที่ระลึก และลุ้นรับรางวัลใหญ่ อาทิ แหวนเพชร บัตรกำนัล และรางวัลอีกมากมาย ในวันอังคารที่ 14 กุมภาพันธ์ 2566 เวลา 08.00 -16.00 น. ณ ศูนย์บริหารราชการ ฉับไวใสสะอาด (Bangkok Fast & Clear : BFC) ชั้น 1 อาคาร 2 สำนักงานเขตพระนคร
นอกจากนี้ สำนักงานเขตพระนครได้จัดกิจกรรมพาคู่สมรสกราบสิ่งศักดิ์สิทธิ์ในพื้นที่ อาทิ วัดพระแก้ว ศาลหลักเมือง วัดอินทรวิหาร (รอบเวลา 09.00 น.) พร้อมจัดซุ้มดอกไม้ไว้ให้คู่รักได้ถ่ายภาพคู่เก็บไว้เป็นที่ระลึกกันอีกด้วย คนไม่มีคู่ก็มาถ่ายรูปได้นะคะ
สอบถามเพิ่มเติมและลงทะเบียนล่วงหน้าได้ที่ฝ่ายทะเบียน สำนักงานเขตพระนคร โทร. 02-2818124 ถึง 25, 02-2815370 ต่อ 6592 หรือสแกน QR Code
อรุณ...รัก ณ บางกอกใหญ่@วัดอรุณฯ LINK
สำนักงานเขตบางกอกใหญ่เชิญชวนคู่รักจดทะเบียนสมรส วันแห่งความรัก @วัดอรุณฯ
"อรุณ...รัก ณ บางกอกใหญ่"
สำนักงานเขตบางกอกใหญ่ ขอเรียนเชิญคู่รักแต่งกายในชุดไทยย้อนยุค จดทะเบียนสมรสเนื่องในวาระโอกาสพิเศษ เทศกาลวันแห่งความรัก 14 กุมภาพันธ์ 2566 ที่วัดอรุณราชวรารามราชวรมหาวิหาร... 1 ใน 10 แลนด์มาร์คของประเทศไทย ในชื่อธีมงาน "อรุณ...รัก ณ บางกอกใหญ่"
ในวันดังกล่าว คู่สมรส จะได้เริ่มต้นความเป็นสิริมงคลในพิธีเจริญพระพุทธมนต์พร้อมถวายเครื่องไทยธรรมแด่พระภิกษุสงฆ์ในพระอุโบสถ ซึ่งจะเปิดให้เข้าเฉพาะในวาระพิเศษ...ก่อนเข้าสู่พิธีการจดทะเบียนสมรส ณ เบื้องหน้าองค์พญายักษ์อันศักดิ์สิทธิ์ที่ซุ้มประตูยอดมงกุฎ
โดยผู้อำนวยการเขตบางกอกใหญ่เป็นนายทะเบียนลงนามอนุมัติพร้อมถ่ายภาพที่ระลึกร่วมกับกับคู่สมรส ซึ่งในงานนี้ คู่สมรสจะได้รับภาพถ่ายหน้าองค์พระปรางค์วัดอรุณฯ โดยช่างภาพมืออาชีพ พร้อมใส่กรอบมอบเป็นของขวัญที่ระลึกอันทรงคุณค่าในวาระพิเศษ รวมทั้งของที่ระลึกอีกมากมาย
คู่รัก ท่านใดที่สนใจ สามารถสแกน QR code เพื่อจองคิวลงทะเบียน หรือสอบถามรายละเอียดได้ที่ ฝ่ายทะเบียน สำนักงานเขตบางกอกใหญ่ โทร.02-4570069 ต่อ 5709 หรือ 02-8682513
“รังสิตสาด” 19-22 เมษายน 2023
สงกรานต์รังสิตที่ยิ่งใหญ่ที่สุด “รังสิตสาด” 19-22 เมษายน 2023 ที่ ESC Park Rangsit พบกับ 12 ศิลปิน 8 ดีเจ Safeplanet Lomosonic Mean YOUNGOHM Gavin.d x FIIXD Anatomy Rabbit Dept Cocktail THE TOYS SLAPKISS Patrickananda Paper Planes
สวนลุงทองใบ บุฟเฟ่ต์ชะนี - บุฟเฟ่ต์หมอนทอง ตะพง ระยอง LINK
สวนลุงทองใบ สวนผลไม้ท่องเที่ยวเชิงเกษตร จังหวัดระยอง เปิดจำหน่ายและเปิดจองทานบุฟเฟ่ต์แล้วนะคะ หิวเมื่อไหร่ก็แวะมา ติดต่อสอบถาม 091-6970047
• บุฟเฟ่ต์ชะนี ตั้งแต่สงกรานต์ถึงสิ้นเมษายน รับจองล่วงหน้าอย่างน้อย 7 วัน อิ่มไม่อั้นเพียง 600 บาท เท่านั้น
• สำหรับบุฟเฟ่ต์หมอนทอง จะเริ่มตั้งแต่พฤษภาคม เป็นต้นไป รับจองล่วงหน้าอย่างน้อย 7 วัน อิ่มไม่อั้นเพียง 600 บาท เท่านั้น
• สวนลุงทองใบ 96/1 หมู่11 ตำบลตะพง อำเภอเมือง จังหวัดระยอง
ส่งต่อ-หาเตียงแบบไร้รอยต่อ ด้วยศูนย์รวมเตียง-ระบบเชื่อมข้อมูลสุขภาพ
ปัญหา
ปัจจุบัน ผู้ป่วยประสบปัญหาความล่าช้าและยุ่งยากในการส่งต่อผู้ป่วยไปสถานพยาบาลที่มีความพร้อมในการรักษา และการหาเตียงในโรงพยาบาลของรัฐ เนื่องจากโรงพยาบาลรัฐหลาย ๆ แห่งมักเตียงเต็ม ปัญหาดังกล่าวเกิดจากการเชื่อมต่อข้อมูลการรักษาของผู้ป่วย และจำนวนเตียงของโรงพยาบาล ที่ขาดการเชื่อมโยงข้อมูลระหว่างกัน
นอกจากนี้การบริจาคอวัยวะของคนไทยยังอยู่ในระดับต่ำ ซึ่งเป็นข้อจำกัดในการเปลี่ยนถ่ายอวัยวะกับผู้ป่วยที่ต้องการเปลี่ยนอวัยวะเพื่อต่อชีวิตของตัวเอง
ข้อเสนอ
- เชื่อมต่อข้อมูลด้านสาธารณสุขของแต่ละโรงพยาบาล ให้สามารถเรียกดูเวชระเบียนคนไข้ได้จากทุกที่เมื่อได้รับอนุญาตจากคนไข้ในฐานะเจ้าของข้อมูล เพื่อความสะดวกในการส่งต่อผู้ป่วย
- ทำระบบรวมเตียงส่วนกลาง / Central Referral Centre โดยอาจเริ่มจากการนำเอาจำนวนเตียงว่าง 10-20% ของแต่ละโรงพยาบาลมาแชร์ข้อมูลกับส่วนกลางเพื่อให้รู้ว่าโรงพยาบาลไหนมีเตียงว่างบ้าง
ศูนย์จักษุยังให้บริการครอบคลุมในด้านศัลยกรรมตกแต่งและเสริมสร้างด้วย - นพ. ณัฐวุฒิ วะน้ำค้าง
นพ. ณัฐวุฒิ วะน้ำค้าง จักษุแพทย์เฉพาะทางด้านศัลยกรรมตกแต่งและเสริมสร้าง ด้านเปลือกตา ท่อน้ำตา และเบ้าตา โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมว่า ศูนย์จักษุยังให้บริการครอบคลุมในด้านศัลยกรรมตกแต่งและเสริมสร้างด้วย โดยแพทย์จะดูแลรักษาผู้ป่วยเกี่ยวกับโรคเบ้าตาและศัลยกรรมตกแต่งรอบดวงตา อาทิ ไทรอยด์ขึ้นตา ตาโปน ท่อน้ำตาอุดตัน หนังตาตก หนังตาม้วนเข้าใน/ม้วนออกนอก รวมถึงอุบัติเหตุทางตา เป็นต้น
ที่ผ่านมา มีผู้ป่วยหลายรายที่ประสบอุบัติเหตุและกระทบต่อเบ้าตาอย่างรุนแรง ซึ่งต้องอาศัยความร่วมมือกับทีมแพทย์สาขาอื่น ๆ ทั้งภายในศูนย์จักษุเอง รวมถึงแพทย์เฉพาะทางในแผนกอื่นๆ ยกตัวอย่างหญิงชาวยูเครนได้รับอุบัติเหตุจากมอเตอร์ไซค์พลิกคว่ำ หน้ากระแทกค่อนข้างรุนแรง จนใบหน้าหักทั้งหน้า ผู้ป่วยรายนี้ถือว่ามีความซับซ้อนและเป็นอีกรายที่ยาก ต้องมีการปรึกษาแพทย์ที่มีความชำนาญการสูงในหลายแขนง ทั้งจักษุแพทย์เฉพาะทางกล้ามเนื้อตา แพทย์ศัลยกรรมตกแต่งทางตา แพทย์ศัลยกรรมพลาสติก และต้องอาศัยทีมแพทย์ที่มีความชำนาญการและมีประสบการณ์สูงมาก โดยครั้งแรกเข้าผ่าตัดถึง 11 ชั่วโมง และดูแลรักษาต่อเนื่องอีกประมาณ 4-6 เดือน จากนั้นก็เข้ารักษากับจักษุแพทย์เฉพาะทางกล้ามเนื้อตา เพื่อผ่าตัดให้ตาตรง ปัจจุบันคนไข้รายนี้ มีใบหน้าและดวงตากลับมาใกล้เคียงปกติดี ส่วนอีกรายเป็นผู้ป่วยไทรอยด์ในผู้ใหญ่ มีปัญหาตาโปนมากจนตาใกล้จะบอด ทำให้ต้องรับการผ่าตัดแก้ไขเบ้าตา เปลือกตา ซึ่งต้อง consult แพทย์ชำนาญการที่เกี่ยวข้อง อาทิ แพทย์ผู้ชำนาญการด้านต่อมไร้ท่อ, จักษุแพทย์ผู้ชำนาญการถึง 3 ด้าน (กล้ามเนื้อ, เส้นประสาทตา และแก้ไขเบ้าตา เปลือกตา), แพทย์ผู้ชำนาญการด้านรังสีวิทยาเพื่อการฉายแสงและการให้ยาชีววัตถุร่วมด้วย ซึ่งจะช่วยให้ตาที่โปนยุบได้ ซึ่งผู้ป่วยไทรอยด์ส่วนใหญ่จำเป็นต้องได้รับการติดตามอาการอย่างต่อเนื่องตลอดระยะเวลาอย่างน้อย 2 ปี จนกว่าโรคจะสงบ
หมาใจดำ สุราพื้นบ้านเชียงใหม่ LINK
"หมาใจดำ" อีกหนึ่งสุราพื้นบ้านของจังหวัดเชียงใหม่ สุราหมาใจดำ คือ วอดก้า 40 ดีกรี หรือ เหล้าขาวพื้นบ้าน มีความละเมียดในเรื่องกลิ่่น และรสสัมผัสมากกว่าเหล้าขาวทั่วๆ ไป มีหลายรส ได้แก่
• หมาใจดำ Flowery 40 ดีกรี: เป็นสุรากลั่นจากน้ำหวานดอกมะพร้าว
• หมาใจดำ Banana 40 ดีกรี: เป็นสุรากลั่นจากกล้วย เค้าจะมีกลิ่นกล้วยเบาๆ
• หมาใจดำ มะขามป้อม 40 ดีกรี: เป็นสุรากลั่นจากมะขามป้อม
ปริมาณโซเดียมในเครื่องปรุงรสชนิดต่างๆ และอาหารจานเดียว
ปริมาณโซเดียมในเครื่องปรุงรสชนิดต่างๆ
เกลือป่น 1 ช้อนชา 2,000 มิลลิกรัม
น้ำปลา 1 ช้อนโต๊ะ 1,350 มิลลิกรัม
ซีอิ๊วขาว 1 ช้อนโต๊ะ 1,190 มิลลิกรัม
ซอสถั่วเหลือง 1 ช้อนโต๊ะ 1,187 มิลลิกรัม
ซอสหอยนางรม 1 ช้อนโต๊ะ 518 มิลลิกรัม
น้ำจิ้มไก่ 1 ช้อนโต๊ะ 385 มิลลิกรัม
ซอสพริก 1 ช้อนโต๊ะ 231 มิลลิกรัม
ซอสมะเขือเทศ 1 ช้อนโต๊ะ 149 มิลลิกรัม
ตัวอย่างปริมาณโซเดียมในอาหารจานเดียว (ต่อ 1 จาน/ชาม)
บะหมี่น้ำหมูแดง 1,480 มิลลิกรัม
ผัดซีอิ๊ว 1,352 มิลลิกรัม
แกงส้มผักรวม 1 ชาม 1,130 มิลลิกรัม
ส้มตำอีสาน 1,006 มิลลิกรัม
บะหมี่กึ่งสำเร็จรูป 1 ห่อ 977 มิลลิกรัม
ผัดผักบุ้งไฟแดง 894 มิลลิกรัม
ปอเปี๊ยะสด 562 มิลลิกรัม
ข้าวไข่เจียว 362 มิลลิกรัม
สุกี้น้ำ 1,560 มิลลิกรัม
เส้นใหญ่เย็นตาโฟ 1 ชาม 1,417 มิลลิกรัม
ข้าวหมูกรอบ 700 มิลลิกรัม
โรงพยาบาลสัตว์ มหาวิทยาลัยสงขลานครินทร์
อาคารจุฬาภรณการุณยรักษ์ (ชั้น 1 และ 2) ถนนปุณกัณฑ์ ตำบลคอหงส์ อำเภอหาดใหญ่ จังหวัดสงขลา 90110
โรงพยาบาลสัตว์เล็ก โทร 07428-9607
โรงพยาบาลสัตว์ใหญ่ โทร 07458-9530 095-0209889
จันทร์-ศุกร์ 8.30-16.30 น. (ปิดรับบัตรคิดเช้า 11.30-12.30 บ่าย 15.30)
เสาร์-อาทิตย์ 9.00-12.00 น. (ปิดรับบัตรช่วงเช้า 11.30 น.) บ่าย 13.00-16.30 น. (รับเฉพาะเคสฉุกเฉิน)
Facebook |
Website |
แผนที่ 21 สิงหาคม 2566 จังหวัดร้อยเอ็ด จัดกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี 2566 มีประชาชนนำสุนัข-แมว มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 76 ตัว ผ่าตัดทำหมันสุนัข-แมว จำนวน 71 ตัว
6 กันยายน 2566 จังหวัดขอนแก่น อำเภอบ้านฝาง จังหวัดขอนแก่น จัดงานวันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี 2566 (World Rabies Day 2023) โดยมีรองผู้ว่าราชการจังหวัดขอนแก่น กิจกรรมเป็นการประชาสัมพันธ์โครงการต่างๆ ที่มีความเชื่อมโยงกับการควบคุมโรคพิษสุนัขบ้า เช่น โครงการควบคุมประชากรสัตว์โดยวิธีผ่าตัดทำหมันสุนัขแมวของกรมปศุสัตว์ เพื่อลดจำนวนประชากรสุนัข – แมว ทั้งที่มีเจ้าของและไม่มีเจ้าของ โดยจำนวนประชากรของสัตว์ไม่มีเจ้าของ ทั้งนี้ จังหวัดขอนแก่น มีนโยบายให้จังหวัดได้รับการรับรองเป็นพื้นที่ปลอดโรคพิษสุนัขบ้าระดับจังหวัด โดยกำหนดให้อำเภอบ้านฝาง เป็นอำเภอต้นแบบ ในการสร้างพื้นที่ ปลอดโรคพิษสุนัขบ้าซึ่งองค์กรปกครองส่วนท้องถิ่นทุกแห่งในอำเภอบ้านฝาง ได้รับการรับรองเป็นพื้นที่ปลอดโรคพิษสุนัขบ้า นอกจากนี้องค์กรปกครองส่วนท้องถิ่นทุกแห่งในอำเภออุบลรัตน์ และอำเภอมัญจาคีรี ได้รับการรับรองเป็นพื้นที่ปลอดโรคพิษสุนัขบ้า ซึ่งทั้ง 3 อำเภอ อยู่ระหว่างการดำเนินการขอรับการประเมิน และรับรองเป็นอำเภอปลอดโรคพิษสุนัขบ้า ต่อไป
12 กันยายน 2566 จังหวัดสตูล ปศุสัตว์จังหวัดสตูล ดำเนินกิจกรรม วันป้องกันโ
รคพิษสุนัขบ้า ปี 2566 ณ อาคารอเนกประสงค์ หมู่ที่ 1 ตำบลปากน้ำ อำเภอละงู จ.สตูล ฉีดวัคซีนสุนัขแมว 68 ตัว ผ่าตัดทำหมัน 37 ตัว
21 กันยายน 2566 จังหวัดสมุทรปราการ จัดกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี พ.ศ. 2566 โดยมีผู้ว่าราชการจังหวัดสมุทรปราการ เป็นประธานเปิดกิจกรรม ณ อาคารศูนย์พักรักษาใจ เทศบาลตำบลบางเมือง อำเภอเมืองฯ จังหวัดสมุทรปราการ ภายในงานมีการออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และผ่าตัดทำหมันถาวรสุนัขและแมว มีการประชาสัมพันธ์ให้ความรู้ สร้างความเข้าใจเกี่ยวกับโรคพิษสุนัขบ้าและการดูแลสัตว์เลี้ยง การจัดโครงการดังกล่าว เพื่อเป็นการควบคุมประชากร สุนัข-แมว และให้สัตว์กลุ่มเสี่ยงได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าอย่างครอบคลุมทั่วถึง และให้ความรู้เรื่องโรคพิษสุนัขบ้าและกฎหมายที่เกี่ยวกับโรคพิษสุนัขบ้า การดูแลสุนัขและแมวเพื่อลดพาหะและการกระจายของโรคพิษสุนัขบ้า สามารถระวังป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงและดูแลตนเองให้ปลอดภัยจากโรคได้ และยังเป็นการปลูกจิตสำนึก “เลี้ยงสัตว์อย่างรับผิดชอบ” ให้กับให้เจ้าของสัตว์เลี้ยงและประชาชน
15 กันยายน 2566 จังหวัดชลบุรี ปศุสัตว์จังหวัดชลบุรี เปิดโครงการวันป้องโรคพิษสุนัขบ้าโลก ปี พ.ศ. 2566 (world Rabies Day 2023) ภายใต้แผนยุทธศาสตร์การดำเนินโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามปณิธานฯ ณ โรงเรียนเทศบาล 3 วัดเกาะแก้วนครสวรรค์ อ.พนัสนิคม จ.ชลบุรี
15 กันยายน 2566 จังหวัดสุพรรณบุรี ปศุสัตว์จังหวัดสุพรรณบุรี ร่วมปฏิบัติงานโครงการวันป้องกันโรคพิษสุนัขบ้า ประจำปีงบประมาณ พ.ศ. 2566 โดยให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าและผ่าตัดทำหมันสุนัข - แมวไม่มีเจ้าของ ณ วัดอู่ยา ตำบลดอนกำยาน อำเภอเมืองสุพรรณบุรี จังหวัดสุพรรณบุรี ดังนี้ 1. ให้บริการผ่าทำหมันสุนัข-แมว แบ่งเป็น - สุนัข จำนวน 7 ตัว - แมวจำนวน 13 ตัว รวมทั้งสิ้น 20 ตัว 2. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัข-แมว - สุนัข จำนวน 7 ตัว - แมว จำนวน 13 ตัว รวมทั้งสิ้น 20 ตัว
7 กันยายน 2566 จังหวัดภูเก็ต ปศุสัตว์จังหวัดภูเก็ต พร้อมด้วย ปศุสัตว์อำเภอเมืองภูเก็ต ปศุสัตว์อำเภอถลาง ด่านกักกันสัตว์ภูเก็ต และเจ้าหน้าที่สำนักงานปศุสัตว์จังหวัดภูเก็ต ร่วมด้วย องค์การบริหารส่วนตำบลสาคู ดำเนินการจัดกิจกรรม วันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี พ.ศ.๒๕๖๖ (World Rabies Day 2023) ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร. สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี โดยมีกิจกรรมออกหน่วยบริการผ่าตัดทำหมัน สุนัข–แมว จำนวน 36 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 52 ตัว พร้อมทั้งให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าและการเลี้ยงสัตว์อย่างถูกวิธี แก่เจ้าของสัตว์ และประชาชนทั่วไป ณ องค์การบริหารส่วนตำบลสาคู ตำบลสาคู อำเภอถลาง จังหวัดภูเก็ต
25 กันยายน 2566 วันแรกมาตรการวีซ่าฟรี จีน-คาซัคสถาน นายกต้อนรับนักท่องเที่ยวชุดแรก ณ ท่าอากาศยานสุวรรณภูมิ LINK
ท่าอากาศยานสุวรรณภูมิ (ทสภ.) ร่วมกับการท่องเที่ยวแห่งประเทศไทย (ททท.) จัดกิจกรรมต้อนรับผู้โดยสารที่เดินทางมาจากสาธารณรัฐประชาชนจีน ตามมาตรการ VISA Free เพื่อกระตุ้นการท่องเที่ยวของรัฐบาล ซึ่งเริ่มตั้งแต่วันที่ 25 กันยายน 2566 - 29 กุมภาพันธ์ 2567 รวมระยะเวลา 5 เดือน โดยในโอกาสต้อนรับเที่ยวบินในวันเริ่มต้นมาตรการนี้ได้มีการมอบของที่ระลึกเพื่อสร้างความประทับใจให้กับผู้โดยสารด้วย
และในวันที่ 25 กันยายน 2566 เวลา 10.15 น. นายเศรษฐา ทวีสิน นายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงการคลัง เป็นประธานในพิธีต้อนรับนักท่องเที่ยวชาวจีนตามมาตรการ VISA Free โดยมี นายหาน จื้อเฉียง เอกอัครราชทูตสาธารณรัฐประชาชนจีน ประจำประเทศไทย พร้อมด้วยผู้บริหารหน่วยงานที่เกี่ยวข้อง ร่วมมอบพวงมาลัยและของที่ระลึกให้กับนักท่องเที่ยวที่เดินทางมาจากนครเซี่ยงไฮ้ ด้วยสายการบินไทยแอร์เอเชียเอ็กซ์ เที่ยวบินที่ XJ 761 จำนวน 341 คน ประกอบด้วย นักท่องเที่ยวสัญชาติจีน 306 คน และสัญชาติอื่นๆ 35 คน ณ บริเวณทางออกจากเครื่องบิน Gate D4 ชั้น 2 อาคารเทียบเครื่องบิน D อาคารผู้โดยสาร ทสภ. ..
อ่านต่อ
รัฐบาลคาดว่ากิจกรรมฟรีวิซ่านักเดินทางจีนนี้ จะช่วยกระตุ้นการเดินทางเข้าประเทศไทยของชาวจีนมากขึ้น ต้อนรับช่วงเทศกาลโกลเด้นวีค ที่เป็นวันหยุดยาวของชาวจีน ช่วงวันที่ 29 ก.ย.-6 ต.ค. 2566 นี้
9-10 ธันวาคม 2566 ชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์
ทริปที่ 9 และ 10 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 9 และวันอาทิตย์ที่ 10 ธันวาคม 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
ยุทธศาสตร์ที่ 5 : ด้านการสร้างการเติบโตบนคุณภาพชีวิตที่เป็นมิตรต่อสิ่งแวดล้อม
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 131,292.3 ล้านบาท หรือคิดเป็นร้อยละ 3.8 ของวงเงินงบประมาณ เพื่ออนุรักษ์ ฟื้นฟู และใช้ประโยชน์จากทรัพยากรธรรมชาติและสิ่งแวดล้อมอย่างสมดุล เพื่อสร้างการเติบโตอย่างยั่งยืน สร้างการเติบโตบนสังคมเศรษฐกิจสีเขียว และบูรณาการความร่วมมือกับภาคีเครือข่ายในการบริหารจัดการทรัพยากรธรรมชาติและสิ่งแวดล้อม จำแนกตามแผนงานสำคัญ ดังนี้
1) การสร้างการเติบโตอย่างยั่งยืนบนสังคมเศรษฐกิจภาคทะเล งบประมาณ 415.4 ล้านบาท เพื่อให้ทรัพยากรทางทะเลและชายฝั่งได้รับการปรับปรุง ฟื้นฟู และสร้างใหม่ โดยจัดการคุณภาพน้ำทะเล รักษาระบบนิเวศและสัตว์ทะเลหายากใกล้สูญพันธุ์ ตลอดจนคุ้มครอง อนุรักษ์ และฟื้นฟูระบบนิเวศทางทะเลและชายฝั่งให้คงความสมบูรณ์ ควบคู่กับการบริหารจัดการเพื่อใช้ประโยชน์อย่างยั่งยืน รวมทั้งพัฒนาและเพิ่มประสิทธิภาพระบบติดตามเฝ้าระวัง คาดการณ์ และประเมินผลกระทบจากคราบน้ำมันในทะเล โดยมีค่าเป้าหมายดัชนีคุณภาพมหาสมุทร 72 คะแนน
2) การจัดการมลพิษและสิ่งแวดล้อม งบประมาณ 868.0 ล้านบาท เพื่อให้ประเทศมีการบริหารจัดการคุณภาพสิ่งแวดล้อมที่มีประสิทธิภาพและเอื้อต่อการมีคุณภาพชีวิตที่ดีของประชาชน โดยแก้ไขปัญหาขยะทุกประเภทอย่างเป็นระบบและมีประสิทธิภาพมากขึ้น มีการบริหารจัดการมลพิษจากแหล่งกำเนิด และสนับสนุนการจัดการขยะแบบมีส่วนร่วมของทุกภาคส่วน ส่งเสริมการบริหารจัดการที่ดินในพื้นที่เกษตรกรรมเพื่อเข้าสู่ความเป็นกลางทางคาร์บอน และความสมดุลของการจัดการทรัพยากรที่ดิน ส่งเสริมการหยุดเผาในพื้นที่การเกษตร จัดการคุณภาพอากาศของแต่ละพื้นที่ให้อยู่ในเกณฑ์มาตรฐานที่กำหนด และปริมาณน้ำเสียได้รับการบำบัดได้ตามมาตรฐานน้ำทิ้งจากระบบบำบัดน้ำเสียชุมชน ไม่น้อยกว่า 90.0 ล้านลูกบาศก์เมตร รวมถึงการส่งเสริมให้โรงพยาบาล มีการพัฒนาอนามัยสิ่งแวดล้อมได้ตามเกณฑ์
3) การจัดการผลกระทบจากการเปลี่ยนแปลงสภาวะภูมิอากาศ งบประมาณ 1,788.2 ล้านบาท เพื่อให้ประเทศสามารถลดการปล่อยก๊าซเรือนกระจก และลดผลกระทบจากภัยธรรมชาติและการเปลี่ยนแปลงสภาพภูมิอากาศ โดยมีเป้าหมายการปล่อยก๊าซเรือนกระจกโดยรวมลดลง 45 ล้านตันคาร์บอนไดออกไซด์เทียบเท่า หรือคิดเป็นร้อยละ 8 จากกรณีปกติ ด้วยการเสริมสร้างความตระหนักรู้ด้านการเปลี่ยนแปลงสภาพภูมิอากาศ สร้างความร่วมมือของภาคีต่าง ๆ เสริมสร้างขีดความสามารถในการลดมลพิษ และลดก๊าซเรือนกระจกจากภาคอุตสาหกรรม ส่งเสริมการลงทุนเทคโนโลยีคาร์บอนต่ำ เพิ่มการกักเก็บคาร์บอนในพื้นที่ป่าเพื่อพัฒนาประเทศมุ่งสู่สังคมคาร์บอนต่ำ ตลอดจนเพิ่มประสิทธิภาพระบบตรวจวัดและการแจ้งเตือนภัยสภาพอากาศ รวมทั้งประเมินการกักเก็บคาร์บอนในภาคป่าไม้ และการใช้ประโยชน์ที่ดิน เพื่อใช้กำหนดนโยบายลดการปล่อยก๊าซเรือนกระจก
4) การสนับสนุนด้านการสร้างการเติบโตบนคุณภาพชีวิตที่เป็นมิตรต่อสิ่งแวดล้อม งบประมาณ 2,333.5 ล้านบาท เพื่ออนุรักษ์ รักษาและใช้ประโยชน์ทรัพยากรธรรมชาติและสิ่งแวดล้อมอย่างสมดุลและยั่งยืน สนับสนุนการบริหารจัดการทรัพยากรน้ำ สนับสนุนการปฏิบัติการฝนหลวง บริหารจัดการเทคโนโลยีสารสนเทศ เพื่อการบริหารจัดการทรัพยากร รวมทั้งเพิ่มศักยภาพการบริหารจัดการทรัพยากรน้ำบาดาล
5) การสร้างการเติบโตอย่างยั่งยืน อนุรักษ์ ฟื้นฟู และป้องกันการทำลายทรัพยากรธรรมชาติ งบประมาณ 5,655.8 ล้านบาท เพื่อให้ความหลากหลายทางชีวภาพได้รับการอนุรักษ์และฟื้นฟู โดยพัฒนากลไกและมาตรการในการอนุรักษ์ ปกป้องคุ้มครอง ฟื้นฟูและใช้ประโยชน์ความหลากหลายทางชีวภาพอย่างยั่งยืน รักษาพื้นที่ป่าในความดูแล 98.94 ล้านไร่ และส่งเสริมการปลูกไม้เศรษฐกิจแบบครบวงจร 36,300 ไร่ จัดระเบียบการใช้ที่ดินด้วยการสำรวจการถือครองที่ดินและจัดทำแผนการจัดการทรัพยากรที่ดินและป่าไม้ระดับพื้นที่ 3,731 หมู่บ้าน เพื่อลดปัญหาความขัดแย้งการใช้ประโยชน์ทรัพยากรที่ดินและป่าไม้ในพื้นที่เขตป่าสงวนแห่งชาติ รวมทั้งการขับเคลื่อนการพัฒนาประเทศด้วยโมเดลเศรษฐกิจ BCG เพื่อเสริมสร้างคุณภาพชีวิตและเศรษฐกิจในพื้นที่ ส่งเสริมการใช้ประโยชน์โครงสร้างพื้นฐานและเพิ่มขีดความสามารถในการแข่งขันอย่างเป็นมิตรกับสิ่งแวดล้อม
6) การบริหารจัดการทรัพยากรน้ำ งบประมาณ 92,003.6 ล้านบาท เพื่อให้ประเทศมีความมั่นคงด้านน้ำเพิ่มขึ้น มีการบริหารจัดการทรัพยากรน้ำอย่างเป็นระบบและยั่งยืน รวมทั้งช่วยเหลือและแก้ปัญหาภัยแล้ง โดยการจัดการน้ำอุปโภคบริโภคผ่านการจัดหาแหล่งน้ำสำรองเพื่อระบบประปา 56,434 ครัวเรือน สร้างความมั่นคงด้านน้ำทั้งภาคการผลิต การเกษตร และอุตสาหกรรมให้มีต้นทุนน้ำใช้อย่างสมดุล มีพื้นที่รับประโยชน์จากแหล่งน้ำเพิ่มขึ้น 335,501 ไร่ การจัดการน้ำท่วมและบรรเทาสถานการณ์อุทกภัยในพื้นที่ชุมชนและพื้นที่เศรษฐกิจ 298,646 ไร่ พัฒนาและเพิ่มประสิทธิภาพการจัดการน้ำเสีย 120 แห่ง อนุรักษ์ฟื้นฟูสภาพป่าต้นน้ำ ป้องกันการชะล้างพังทลายของดินและฟื้นฟูป่าต้นน้ำ 37,194 ไร่ และปลูกป่าฟื้นฟู 7,450 ไร่ พื้นที่ชลประทานเดิมได้รับการปรับปรุง 1 ล้านไร่ เกษตรกรและราษฎรได้รับประโยชน์จากศูนย์ศึกษาการพัฒนาอันเนื่องมาจากพระราชดำริ 20,000 คน ตลอดจนบริหารจัดการเทคโนโลยีสารสนเทศอย่างมีประสิทธิภาพ
7) การดำเนินงานภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 10,013.5 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 18,214.3 ล้านบาท เพื่อสนับสนุนยุทธศาสตร์ด้านการสร้างการเติบโตบนคุณภาพชีวิตที่เป็นมิตรต่อสิ่งแวดล้อม โดยการบริหารจัดการพื้นที่ป่าอนุรักษ์ ชายฝั่งและระบบนิเวศทางทะเล ทรัพยากรธรรมชาติ จัดการมลพิษและสิ่งแวดล้อม ส่งเสริมและพัฒนาสวนสัตว์เพื่อการท่องเที่ยว และการพัฒนาแหล่งเรียนรู้และแหล่งอนุรักษ์พันธุ์พืช
สหราชอาณาจักร
UNITED KINGDOM OF GREAT BRITAIN AND NORTHEN IRELAND
1. University of Leicester Medical School, University of Leicester, U.K
หลักสูตร 5 ปี
ปริญญา Bachelor of Medicine and Bachelor of Surgery (MBChB) ที่มีการเรียนการสอน
ตลอดหลักสูตร ณ สหราชอาณาจักร และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับ
คลินิกที่ระบุมาในหลักสูตรและอยู่ในสหราชอาณาจักร ดังนี้
1. University Hospital of Leicester
1.1 Leicester General Hospital
1.2 Leicester Glenfield Hospital
1.3 Leicester Royal Infirmary Hospital
2. Lincoln Hospital
3. Northampton General Hospital
4. Ketterine district Hospital
5. Peterborough Hospital
6. Burton Hospital
7. Bedford Hospital
ว/ด/ป ที่ รับรอง 13 มิ.ย 62
ว/ด/ป ครบอายุ การรับรอง 12 มิ.ย 67
2. University of Norwich Medical School, University of East Anglia, UK
หลักสูตร 5 ปี
ปริญญา Bachelor of Medicine, Bachelor of Surgery (MBBS) ที่มีการเรียนการสอนตลอด
หลักสูตร ณ สหราชอาณาจักร และรับรองโรงพยาบาลหลักที่ใช้ในการเรียนการสอนระดับคลินิกที่
ระบุมาในหลักสูตรและอยู่ในสหราชอาณาจักร ดังนี้
1.Norfolk and Norwich University Hospital
2.James Paget University Hospital
3.The Queen Elizabeth Hospital Kings Linn
4. Norfolk and Suffolk (Mental Health)
ว/ด/ป ที่ รับรอง 12 ก.ย. 62
ว/ด/ป ครบอายุ การรับรอง 11 ก.ย. 67
3. School of Medicine, Faculty of Clinical and Biomedical Sciences, University of Central Lancashire, UK
หลักสูตร 5 ปี ปริญญา Bachelor of Medicine and Surgery
(MBBS) ที่มีการเรียนการสอนตลอดหลักสูตร ณ ประเทศอังกฤษ และรับรองโรงพยาบาลหลักที่ใช้
ในการเรียนการสอนระดับคลินิกที่ระบุมาในหลักสูตร และอยู่ในประเทศอังกฤษ คือ Royal
Blackburn Hospital
ว/ด/ป ที่ รับรอง 14 ม.ค. 64
ว/ด/ป ครบอายุ การรับรอง 13 ม.ค. 69
++ ข่าวสาร ++
สิ่งที่จะเกิดต่อไป จากเครือข่ายสถานพยาบาล-ร้านยาที่จะร่วมโครงการ
โครงการ 30 บาท รักษาทุกที่ รอบนี้ ไม่เพียงจำกัดการให้บริการด้านสาธารณสุข ไว้กับเฉพาะโรงพยาบาลรัฐเท่านั้น แต่ได้ขยายขอบเขตเครือข่าย ออกไปยังคลินิกและร้านยา โดยสปสช. ได้ทำข้อตกลงร่วมกับ 4 สภาวิชาชีพ ได้แก่ สภาเภสัชกรรม สภาการพยาบาล สภาเทคนิคการแพทย์ และ ทันตแพทยสภา เพื่อให้สถานพยาบาลแต่ละวิชาชีพ มาร่วมให้บริการกับประชาชน ทำให้กระจายบริการออกไปทั่วประเทศได้อย่างกว้างขวางและครอบคลุมมากขึ้นอย่างรวดเร็วนั่นเอง
4 สภาวิชาชีพ จะมีส่วนร่วมและพัฒนาระบบ 30 ในทิศทางอย่างไร ดังนี้ [
hfocus]
สภาเภสัชกรรม
- ปัจจุบันมีร้านยา 2,200 แห่งเข้าร่วมเป็นร้านยาคุณภาพ ให้บริการดูแลประชาชนเจ็บป่วยเล็กน้อย 16 อาการ รับยาได้ที่ร้านยา เป็นด่านหน้าดูแลประชาชน ลดความแออัด และร้านยายังเป็นหน่วยจ่ายยา สำหรับการรับยานอกโรงพยาบาล ประชาชนไม่ต้องเดินทางไปโรงพยาบาลเพื่อรับยาแบบเดิม
- ร้านยาจะทยอยขึ้นทะเบียนร่วมโครงการมากขึ้น ผ่านระบบหมอพร้อม ที่เป็นศูนย์กลางข้อมูลประวัติคนไข้ ซึ่งคือหัวใจที่จะทำให้เข้าถึงข้อมูลและซักประวัติเบื้องต้น เพื่อจ่ายยาได้
- ระบบออนไลน์ เชื่อมโยงนี้ จะทำให้เชื่อมต่อกับการทำงานของแพทย์ได้ แพทย์วินิจฉัยโรคมา มีใบสั่งยาเข้าระบบ ทางเภสัชกรร้านยาก็สามารถจัดยาตามแพทย์สั่งได้
สภาการพยาบาล
- คลินิกพยาบาลเป็นงานการบริการตามขอบเขตวิชาชีพโดยตรง และสอดคล้องกับการทำงานโครงการ 30 บาทรักษาทุกที่ อยู่แล้ว หน้าที่หลักของคลินิกพยาบาล คือ ปฏิบัติตามแผนการรักษาของแพทย์ ดูแลคนไข้ตามที่แพทย์กำหนด แต่จะไม่สามารถวินิจฉัยและออกแผนการรักษาได้ การจ่ายยาก็เป็นจ่ายยาเบื้องต้น ตามข้อกำหนดของการรักษาโรคเบื้องต้น
- อุปสรรคเล็กน้อย คือประเด็นเรื่องคีย์ข้อมูล หากลดขั้นตอนตรงนี้ได้จะดีมาก (ต้องทำ 2 อย่างทั้ง ให้บริการและคีย์ข้อมูลการบริการ)
สภาเทคนิคการแพทย์
- คลินิกเทคนิคการแพทย์ จะให้บริการเกี่ยวกับ เจาะเลือด ตรวจเลือด สารคัดหลั่งต่างๆ ปัสสาวะ เสมหะ ฯลฯ ที่แพทย์กำหนดเพื่อใช้ในการตรวจวินิจฉัย การมีคลินิกเทคนิคการแพทย์เข้าร่วมโครงการ จัดว่ามีความสำคัญเพราะปกติประชาชนจะต้องเดินทางไปยังโรงพยาบาลเท่านั้น ทำให้เกิดความแออัดและเสียเวลาเสียค่าใช้จ่ายมาก จนบางครั้งประชาชนละเลย คลินิกเทคนิคการแพทย์จะมาช่วยลดความแออัดในโรงพยาบาลได้โดยตรง ประชาชนเข้าถึงได้ง่ายกว่า ต้นทุนลดลงอย่างชัดเจน
- ปัจจุบันคลินิกที่เข้าร่วมประมาณ 100 แห่ง และจะเพิ่มขึ้นเรื่อยๆ
-
- ความมั่นใจด้านมาตรฐาน เป็นสิ่งสำคัญ สภาฯ กำกับดูแลเรื่องมาตรฐานของผลแล็ป ให้ถูกต้องแม่นยำตามมาตรฐาน มีการรับรอง สร้างความเชื่อมั่นว่าเป็นมาตรฐานเดียวกันทั่วประเทศ ไม่ว่าจะตรวจจากคลินิกใด
- การร่วมโครงการเป็นโอกาสสร้างการรับรู้ให้กับประชาชนถึงการมีอยู่และความสำคัญของคลินิกเทคนิคการแพทย์ ทำให้ประชาชนรู้จักมากขึ้น และโอกาสที่สิทธิ์สุขภาพอื่นๆ จะเข้ามาเพิ่มขึ้นด้วย
ทันตแพทยสภา
- งานบริการทันตกรรม จะมาปรับปรุงให้เหมาะสมมากขึ้นเพื่อให้เป็นมาตรฐานเดียว โดยการเรียงลำดับความสำคัญใหม่ในการบริการทันตกรรม
- "เดนท์คลาวด์" ที่จะให้คลินิกคีย์ข้อมูลขึ้นเดนคลาวด์ทั้งหมด จะทำให้มีข้อมูลการรักษาส่งถึงกัน ทั้ง รพ.และคลินิกทันตกรรม และเพื่อเบิกจ่ายเงินจากแพลทฟอร์ม
การออกแบบบ้านนกบ้านกระรอก ถนนในกรุงเทพฯ ที่มีต้นไม้สองข้างทางมักเป็นที่อยู่ของนก กระรอก หรือสัตว์ขนาดเล็กอื่น ๆ ซึ่งเป็นส่วนหนึ่งของระบบนิเวศในเมือง A49 & Friends เล็งเห็นความสำคัญของวัฏจักรแห่งสิ่งมีชีวิตตัวเล็กดังกล่าว จึงออกแบบบ้านหลังเล็กที่ห้อยอยู่ตามต้นไม้ เพื่อให้เป็นที่อยู่ของสัตว์ตัวน้อย ทั้งยังสร้างความรื่นรมย์ให้กับผู้เดินเท้าผ่านงานออกแบบสร้างสรรค์ของพวกเขา ในซอยสุขุมวิท 26 ซึ่งสามารถนำไปปรับใช้ในพื้นที่อื่นได้เช่นกัน
ศูนย์เวชศาสตร์ฟื้นฟู และกายภาพบำบัด
ศูนย์เวชศาสตร์ฟื้นฟูและกายภาพบำบัด โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี ชั้น4
ติดต่อสอบถามและนัดหมาย โทร. 0-2432-6167 0-2432-6168 ต่อ 4010
(สามารถเบิกค่ารักษาพยาบาลได้ตามสิทธิการรักษา)
ศูนย์เวชศาสตร์ฟื้นฟู โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี พร้อมให้บริการการดูแลรักษาและวางแผนการรักษาโดยแพทย์ผู้เชี่ยวชาญ นักกายบำบัด บริการด้านการรักษา ดังนี้:
• โปรแกรมเวชศาสตร์ฟื้นฟู
• เวชศาสตร์ฟื้นฟูระบบประสาท บริการด้านการฟื้นฟู ปัญหาทางระบบประสาท อัมพฤกษ์ อัมพาต
• เวชศาสตร์ฟื้นฟูระบบกระดูก ข้อ และกล้ามเนื้อ
• โปรแกรมการดูแลต่อเนื่องหลังจากผู้ป่วยกลับบ้าน
ศูนย์เวชศาสตร์ฟื้นฟู ให้การฟื้นฟูบำบัดด้วยทีมสหสาขาวิชาชีพที่ครบถ้วนตามมาตรฐานสากล เพื่อให้การบำบัด บรรเทาความรุนแรงของโรคและกลุ่มอาการให้ผู้ป่วย
• การบำบัดด้วยการดึงหลัง ดึงคอ ด้วยเครื่องมือทางไฟฟ้า
• การบำบัดด้วยความร้อนประเภทต่างๆ เช่น การวางแผ่นประคบ เครื่องมือให้ความร้อนลึกด้วยคลื่นเสียง (Ultrasound) หรือคลื่นแม่เหล็กไฟฟ้า เครื่องลดปวดด้วยเลเซอร์
• การฟื้นฟูอาการปวดคอ ปวดหลัง
• การฟื้นฟูสมรรถภาพโรคหัวใจ และหลอดเลือด
• กิจกรรมบำบัดผู้ป่วยที่มีอาการ Stroke
• กิจกรรมบำบัดในเด็ก
• การนวดเพื่อรักษา เป็นการนวดเพื่อลดจุดกดเจ็บของร่างกาย
• กิจกรรมบำบัด ฝึกการทำงานของมือ นิ้วมือ ไหล่ การฝึกกิจกรรมต่างๆ ในชีวิตประจำวัน
• แก้ไขความผิดปกติการพูด การกลืน
• กายภาพบำบัดด้านการฟื้นฟูผู้ป่วยที่มีปัญหาด้วยเครื่องกายอุปกรณ์เสริมช่วยการเดิน เครื่องออกกำลังกายขาและแขนแบบ Passive และ Active
สถานที่ให้บริการ
โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี ชั้น4
วันเวลาให้บริการ
วันจันทร์ – ศุกร์
ในเวลาราชการ 08.00-16.00 น.
นอกเวลาราชการ 16.00-20.00 น.
อาการแบบไหนรักษาด้วยการฝังเข็มได้บ้าง
สนใจรักษาอาการเหล่านี้ ติดต่อสอบถามได้ที่โรงพยาบาลปากเกร็ดถนน 345
การฝังเข็มเปิดบริการในคลินิกแพทย์แผนจีน ที่โรงพยาบาลปากเกร็ดถนน345 แพทย์แผนจีน เปิดบริการทุกวันอังคารและวันพุธ เวลา 8.00 น -15.00 น.
สามารถสอบถามรายละเอียดเพิ่มเติมหรือแอดไลน์ได้
โทร 02-1573070 ต่อ 2203
การฝังเข็ม รักษา อาการปวดหัวไมเกรนได้
การฝังเข็ม ศาสตร์ของแพทย์แผนจีน ในอาการไมเกรน จะช่วยเรื่อง
1. กระตุ้นการไหลเวียนของเลือด
2. ผ่อนคลายกล้ามเนื้อ
3. บรรเทาอาการปวด
สนใจรักษาด้วยการฝังเข็ม ติดต่อสอบถามได้ที่โรงพยาบาลปากเกร็ดถนน 345
การฝังเข็มเปิดบริการในคลินิกแพทย์แผนจีน ที่โรงพยาบาลปากเกร็ดถนน345 แพทย์แผนจีน เปิดบริการทุกวันอังคารและวันพุธ เวลา 8.00 น -15.00 น.
บริการผ่าตัดต่อหมัน ที่คลินิกนอกเวลา SMC รพ.ชลบุรี
รพ.ชลบุรี เปิดให้บริการผ่าตัดต่อหมัน ที่คลินิกนอกเวลา SMC
✅ลดเวลารอคอย
✅บริการโดยแพทย์เฉพาะทาง
✅ใช้สิทธิ์การรักษาได้ (จ่ายส่วนเกินสิทธิ)
สอบถามรายละเอียดได้ที่เบอร์ 038-931377 และ 038-931974 (โทรในเวลาราชการ)
15. LIFE ON LAND ชีวิตบนผืนดิน
ชีวิตของมนุษย์ขึ้นอยู่กับโลกมากพอๆ กับมหาสมุทรในการดำรงชีพและหาเลี้ยงชีพ พืชพรรณต่างๆ เป็นแหล่งอาหารของมนุษย์ถึง 80 เปอร์เซ็นต์ และเราพึ่งพาการเกษตรกรรมเป็นทรัพยากรทางเศรษฐกิจที่สำคัญ ป่าไม้ปกคลุมพื้นผิวโลก 30 เปอร์เซ็นต์ เป็นแหล่งที่อยู่อาศัยที่สำคัญของสิ่งมีชีวิตนับล้านสายพันธุ์ และเป็นแหล่งสำคัญของอากาศและน้ำที่สะอาด นอกจากนี้ยังมีความสำคัญต่อการต่อสู้กับการเปลี่ยนแปลงสภาพภูมิอากาศอีกด้วย
ทุกปี ป่าไม้สูญเสียพื้นที่ไป 13 ล้านเฮกตาร์ ในขณะที่พื้นที่แห้งแล้งเสื่อมโทรมลงอย่างต่อเนื่องทำให้พื้นที่ 3.6 พันล้านเฮกตาร์กลายเป็นทะเลทราย ซึ่งส่งผลกระทบต่อชุมชนยากจนอย่างไม่สมส่วน
แม้ว่าพื้นที่ 15 เปอร์เซ็นต์จะได้รับการคุ้มครอง แต่ความหลากหลายทางชีวภาพก็ยังคงมีความเสี่ยง สัตว์และพืชเกือบ 7,000 สายพันธุ์ถูกค้าขายอย่างผิดกฎหมาย การค้าสัตว์ป่าไม่เพียงทำลายความหลากหลายทางชีวภาพเท่านั้น แต่ยังสร้างความไม่มั่นคง ก่อให้เกิดความขัดแย้ง และก่อให้เกิดการทุจริตอีกด้วย
จำเป็นต้องดำเนินการอย่างเร่งด่วนเพื่อลดการสูญเสียถิ่นที่อยู่อาศัยตามธรรมชาติและความหลากหลายทางชีวภาพซึ่งเป็นส่วนหนึ่งของมรดกร่วมกันของเรา และสนับสนุนความมั่นคงด้านอาหารและน้ำระดับโลก การบรรเทาและปรับตัวต่อการเปลี่ยนแปลงสภาพภูมิอากาศ ตลอดจนสันติภาพและความมั่นคง
ระบบยืนยันสมัครเสร็จเรียบร้อย (ไปสแกนหน้าต่อ)
15.Climate tech beyond electrification and renewables - เทคโนโลยีด้านภูมิอากาศที่ก้าวข้ามการใช้ไฟฟ้าและพลังงานหมุนเวียน
เทคโนโลยีด้านภูมิอากาศ (นอกเหนือจากการใช้ไฟฟ้าและพลังงานหมุนเวียน) มุ่งเน้นไปที่โซลูชันที่บรรเทาผลกระทบเชิงลบของการใช้ทรัพยากรต่อภูมิอากาศ ไม่ว่าจะเป็นการกำจัด CO2 ออกจากชั้นบรรยากาศหรือการผลิตวัสดุและอินพุตที่มีอยู่ด้วยปริมาณคาร์บอนเทียบเท่าที่ต่ำกว่า
25-26 มิถุนายน 2565 ให้บริการที่ จ.นครราชสีมา
#โครงการรักบ้านเกิด ครั้งที่ 2 โดยโรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ ขอเชิญชวนทุกท่านที่มีปัญหาทางด้านสายตา การมองเห็นไม่ชัด มีภาพซ้อน มีอาการตาพร่ามัว เตรียมพบกับหน่วยตรวจสุขภาพตาเคลื่อนที่ โรงพยาบาลธีรวัฒน์
วันเสาร์ที่ 25 มิถุนายน 2565 หน่วยเคลื่อนที่ตรวจสุขภาพตาจะออกตรวจให้กับพี่น้องชาวโคราช และข้าราชการทุกหน่วยงาน เชิญพบกันได้ที่ สหกรณ์ออมทรัพย์ครูนครราชสีมา ตั้งแต่เวลา 08:30 - 16:00 น.
ในวันอาทิตย์ที่ 26 มิถุนายน 2565 ณ ศาลาบ้านบึงแสนสุข ม.7 บ้านบึงแสนสุข ต.โพธิ์กลาง อ.เมือง จ.นครราชสีมา ตั้งแต่เวลา 09:00 - 16:00 น.
สอบถามพิ่มเติมได้ที่ 063-872-2461 หรือ 043-811-757 คุณวิไลวรรณ วิจิตรพรรณ ผู้ประสานงานDay4 : 25 สิงหาคม 2565 เปิดการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ (HLM) ครั้งที่ 12
เปิดการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ วันที่ 25-26 สิงหาคม 2565 หารือสร้างสมดุลสุขภาพและเศรษฐกิจ โดยไทยแลกเปลี่ยนประสบการณ์การรับมือโรคโควิด 19 พร้อมชูนโยบายกัญชาทางการแพทย์ ส่งเสริมทั้งการดูแลสุขภาพและการสร้างเศรษฐกิจ ส่วนวันพรุ่งนี้จะหารือโต๊ะกลมการลงทุนด้านหลักประกันสุขภาพรองรับการระบาดในอนาคต เพื่อออกแถลงการณ์เป็นแนวทางดำเนินการร่วมกันต่อไป
25 สิงหาคม 2565 ที่โรงแรมมิลเลนเนียม ฮิลตัน กทม. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธานเปิดการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ (HLM) ครั้งที่ 12 โดยมีรัฐมนตรีกระทรวงสาธารณสุขจาก 15 เขตเศรษฐกิจเอเปคเข้าร่วมประชุมแบบออนไซต์ ได้แก่ ออสเตรเลีย บรูไนดารุสซาลาม แคนาดา ชิลี อินโดนีเซีย ญี่ปุ่น มาเลเซีย เม็กซิโก เปรู ฟิลิปปินส์ สิงคโปร์ จีนไทเป ไทย สหรัฐอเมริกา และเวียดนาม เข้าร่วมประชุมผ่านออนไลน์ 5 เขตเศรษฐกิจ ได้แก่ จีน จีนฮ่องกง เกาหลีใต้ นิวซีแลนด์ และรัสเซีย รวมถึงผู้นำระดับสูงจากหน่วยงานระหว่างประเทศ 2 คน คือ ดร.รีเบคกา ฟาติมา สตา มาเรีย ผู้อำนวยการบริหารสำนักงานเลขาธิการเอเปค และ ดาโต๊ะ ปาดูกา ลิม จ๊อก ฮอย เลขาธิการอาเซียน
นายอนุทินกล่าวว่า การประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจครั้งที่ 12 ระหว่างวันที่ 25-26 สิงหาคม 2565 จัดขึ้นภายใต้หัวข้อหลัก “เปิดกว้างสร้างสัมพันธ์ เชื่อมโยงกัน สู่สมดุล” โดยเน้นเรื่องการสร้างความสมดุลระหว่างสุขภาพและเศรษฐกิจ เนื่องจากช่วงที่ผ่านมาเรามีปัญหาทางสาธารณสุข คือ การระบาดของโรคโควิด 19 ทำให้หลายประเทศมีการล็อกดาวน์ ส่งผลกระทบทางเศรษฐกิจอย่างมาก หรือบางประเทศมีการผ่อนคลายอย่างมากจนทำให้เกิดความสูญเสียเช่นกัน ดังนั้น โควิดสอนให้เราสร้างสมดุลที่ดีระหว่างสุขภาพกับเศรษฐกิจ โดยเรื่องการดูแลรักษาทั้งวัคซีนและมาตรการทางการแพทย์จะต้องมีความเท่าเทียมทั้งภายในประเทศและระหว่างประเทศ เพราะเป็นความจริงที่ว่า “ไม่มีใครปลอดภัยจนกว่าทุกคนจะปลอดภัย” อย่างไรก็ตาม เรื่องสุขภาพสามารถสร้างความมั่นคงและมั่งคั่งทางเศรษฐกิจได้ ประเทศไทยมีตัวอย่างการดำเนินงานเรื่องนโยบายกัญชาทางการแพทย์ ในการนำมาดูแลสุขภาพประชาชน และเกิดโอกาสทางอุตสาหกรรมและเศรษฐกิจ
นายอนุทินกล่าวอีกว่า ในการประชุมได้มีการเสวนาเรื่องการสร้างสมดุลระหว่างสุขภาพและเศรษฐกิจ (Balancing Health and the Economy) โดยตนเป็นหนึ่งในผู้ร่วมอภิปรายกับอีก 5 ท่าน ได้แก่ รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข อินโดนีเซีย , รัฐมนตรีว่าการกระทรวงสาธารณสุข สิงคโปร์ , รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุขและบริการมนุษย์ สหรัฐอเมริกา , เลขาธิการอาเซียน และผู้อำนวยการบริหารสำนักงานเลขาธิการเอเปค ทำให้เกิดการแลกเปลี่ยนวิสัยทัศน์ ข้อมูลเชิงลึก และประสบการณ์จริงในการตอบสนองต่อโควิด มีการหารือถึงการส่งเสริมความร่วมมือระหว่างเศรษฐกิจและการพัฒนาเพื่อปรับปรุงคุณภาพชีวิตที่ดี การตั้งเป้าส่งเสริมการค้า ความมั่นคง การเติบโตและการพัฒนาที่ครอบคลุมในภูมิภาคเอเชียแปซิฟิก
สำหรับการเสวนาเรื่องการสร้างสมดุลระหว่างสุขภาพและเศรษฐกิจ ทางอินโดนีเซียได้แลกเปลี่ยนเรื่องการบริหารจัดการเพื่อรับมือโรคโควิด 19 โดยมีการปรับเปลี่ยนรูปแบบของระบบบริการสุขภาพปฐมภูมิ มีการลงทุนด้านสุขภาพ ระบบการเงินการคลังสุขภาพ การพัฒนากำลังคนด้านสุขภาพ และการใช้เทคโนโลยีด้านสุขภาพ สิ่งที่ยังเป็นความท้าทาย ได้แก่ ระบบบริการสุขภาพปฐมภูมิที่ยังมีบุคลากรไม่เพียงพอ โดยเฉพาะอย่างยิ่งในพื้นที่ทุรกันดาร และมีผู้มารับบริการวัคซีนโควิด 19 เพื่อสร้างภูมิคุ้มกันลดลงในช่วงโควิด ขณะที่สิงคโปร์แลกเปลี่ยนเรื่องของการตัดสินใจเลือกใช้มาตรการระหว่างด้านสุขภาพและเศรษฐกิจ ซึ่งช่วงแรกเลือกมาตรการปิดประเทศ เพื่อสกัดกั้นการแพร่กระจายของโควิด แต่ประชาชนก็ได้รับผลกระทบด้านเศรษฐกิจ จึงต้องให้วัคซีนโควิดเพื่อเสริมสร้างภูมิคุ้มกัน แต่ก็มีความท้าทายเรื่องการเข้าถึงวัคซีน ความมั่นใจในวัคซีนของประชาชน และศักยภาพการผลิตวัคซีนของประเทศ ส่วนทางสหรัฐอเมริกาได้เน้นย้ำความสำคัญของการพัฒนาระบบบริการสุขภาพ ความเท่าเทียมของการเข้าถึงบริการ การลงทุนด้านสุขภาพ รวมถึงการพัฒนากำลังคนให้เพียงพอและการสร้างงานให้กับบุคลากรด้านสาธารณสุข เน้นการรับมือกับผลกระทบด้านพฤติกรรมของประชาชน เช่น สุขภาพจิต การใช้สารเสพติด เป็นต้น
ขณะที่เลขาธิการอาเซียนแลกเปลี่ยนข้อมูลว่า การระบาดของโควิด 19 ส่งผลกระทบต่อสุขภาพของกลุ่มเปราะบาง ทั้งเด็ก ผู้หญิง และแรงงานต่างด้าว รวมถึงการดำเนินงานด้านสาธารณสุขและเศรษฐกิจ โดยเฉพาะการท่องเที่ยว บทบาทของอาเซียนในการสนับสนุนแต่ละประเทศ คือ การลดผลกระทบของโควิด สร้างความร่วมมือแลกเปลี่ยนองค์ความรู้ เทคโนโลยี และประสบการณ์ด้านสาธารณสุขในการรับมือโรคระบาด เพิ่มการลงทุนด้านสาธารณสุข เพื่อพัฒนาศักยภาพของประเทศในอาเซียนร่วมกัน ซึ่งมีความท้าทายเรื่องความเพียงพอของทรัพยากรด้านสาธารณสุข ทั้งบุคลากรด้านสุขภาพ งบประมาณ จึงควรมีการเพิ่มการทำงานร่วมกับกระทรวงการคลังส่วนสำนักงานเลขาธิการเอเปคเสนอเรื่องการทำงานเพื่อฟื้นเศรษฐกิจของเขตสุขภาพต่างๆ ได้แก่ 1) Trade Facilitation เพื่อให้วัคซีนและเวชภัณฑ์ต่างๆสามารถผ่านเข้าสู่ประเทศต่างๆ ได้ และ 2) Safe Passage เพื่อให้เกิดการเดินทางระหว่างประเทศและลดผลกระทบด้านเศรษฐกิจ
Day4 : 25 สิงหาคม 2565 รมว.สธ.ไทย หารือทวิภาคีร่วมกับ ADB รมว.สธ.อินโดนีเซีย และ สิงคโปร์
การหารือทวิภาคีร่วมกับ 1 หน่วยงานและ 2 เขตเศรษฐกิจ ก่อนการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ ทั้งความร่วมมือโครงการ SECURE ร่วมกับธนาคารพัฒนาเอเชีย การดำเนินงานศูนย์ ACPHEED ร่วมกับอินโดนีเซีย และความร่วมมือด้าน Genomics กับสิงคโปร์
ที่โรงแรมมิลเลนเนียม ฮิลตัน กทม. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข ให้สัมภาษณ์ว่า ช่วงก่อนการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ (HLM) ครั้งที่ 12 ตนและผู้บริหารระดับสูงของกระทรวงสาธารณสุขได้หารือทวิภาคีร่วมกับ 1 หน่วยงาน และ 2 เขตเศรษฐกิจเอเปค คือ ธนาคารพัฒนาเอเชีย (Asian Development Bank : ADB) โดยหารือร่วมกับ Dr. Wan Farisan Bin Wan Sulaiman Executive Director, ADB และคณะ ถึงความร่วมมือด้านสาธารณสุขระหว่างกระทรวงสาธารณสุขและ ADB ทั้งการสนับสนุนงบประมาณของ ADB ในการดำเนินงานศูนย์ความเป็นเลิศทางการแพทย์ (Medical Excellent Center) ของกระทรวงสาธารณสุข และความคืบหน้าของโครงการ SECURE เพื่อสนับสนุนการใช้วัคซีนและการบริหารจัดการวัคซีนอย่างมีประสิทธิผลและประสิทธิภาพ และส่งเสริมมาตรการความมั่นคงด้านสุขภาพหลังการแพร่ระบาดของโควิด 19 ซึ่ง ADB ดำเนินงานใน 7 ประเทศ ได้แก่ กัมพูชา อินโดนีเซีย ลาว ฟิลิปปินส์ ติมอร์เลสเต เวียดนาม และไทย ซึ่งไทยพร้อมทำงานร่วมกับ ADB เพื่อเสริมสร้างระบบสุขภาพของไทยและความมั่นคงด้านสุขภาพ
ส่วนอีก 2 เขตเศรษฐกิจ คือ การหารือทวิภาคีร่วมกับ Dr. Dante Saksono Harbuwono รัฐมนตรีช่วยว่าการกระทรวงสาธารณสุขอินโดนีเซียและคณะ เกี่ยวกับความร่วมมือด้านสาธารณสุขระหว่าง 2 เขตเศรษฐกิจ โดยเฉพาะเรื่องการจัดตั้งศูนย์อาเซียนด้านการรับมือภาวะฉุกเฉินทางด้านสาธารณสุขและโรคอุบัติใหม่ (ACPHEED) ที่ตั้งอยู่ใน 3 ประเทศ คือ อินโดนีเซีย ไทย และเวียดนาม โดยมีสำนักงานเลขาธิการของ ACPHEED ตั้งอยู่ในประเทศไทย โดยอยู่ระหว่างการจัดทำข้อตกลงการจัดตั้ง (Establishment Agreement : EA) ให้แล้วเสร็จภายในเดือนกันยายน 2565 ซึ่งไทยได้ยืนยันความมุ่งมั่นที่จะร่วมมือกับอินโดนีเซียและเวียดนามในการดำเนินงานอย่างใกล้ชิด หลังจากที่ข้อตกลงการจัดตั้ง ACPHEED ได้รับการสรุปโดยประเทศสมาชิกอาเซียน เพื่อทำให้ APCHEED เป็นศูนย์ระดับภูมิภาคที่ยั่งยืน และไทยยังแสดงความเต็มใจที่จะส่งเสริมความร่วมมือด้านสุขภาพกับอินโดนีเซียในทุกระดับ ทั้งทวิภาคี ภูมิภาค และระดับโลก
ส่วนการหารือทวิภาคีกับ Mr. Ong Ye Kung รัฐมนตรีว่าการกระทรวงสาธารณสุข สิงคโปร์ ไทยได้แสดงความยินดีกับสิงคโปร์ในการแสดงบทบาทนำจนบรรลุมติสมัชชาสุขภาพแห่งชาติ “Strengthening health emergency preparedness and response in cities and urban settings” ที่เป็นการยืนยันเจตนารมณ์ทางการเมือง การมีทรัพยากรที่เพียงพอ การมีส่วนร่วมของภาคส่วนที่เกี่ยวข้อง การพัฒนาและดำเนินการแผนงาน การซักซ้อมการปฏิบัติ และการร่วมมือและสนับสนุนการแลกเปลี่ยนการปฏิบัติที่ดีกับพันธมิตรระหว่างประเทศ และหารือความร่วมมือด้าน Genomics ทั้งด้านการศึกษาวิจัยและการศึกษาดูงานที่สิงคโปร์
Day4 : 25 สิงหาคม 2565 รมว.สธ.มาเลเซีย ดูงานจิตเวช สถาบันจิตเวชศาสตร์สมเด็จเจ้าพระยา
อธิบดีกรมสุขภาพจิต นำรัฐมนตรีสาธารณสุขมาเลเซีย ศึกษาดูงานจิตเวช สถาบันจิตเวชศาสตร์สมเด็จเจ้าพระยา นำเสนอการบริการ คลินิกประสาทวิทยาและความจำสำหรับภาวะสมองเสื่อม สุขภาพจิตเด็กและวัยรุ่น ศูนย์สมองจิตใจและโปรแกรมฟื้นฟู ซึ่งไทย-มาเลเซีย พร้อมแลกเปลี่ยนและสนับสนุนข้อมูลวิชาการด้านสุขภาพจิตระหว่างกัน
ที่ สถาบันจิตเวชศาสตร์สมเด็จเจ้าพระยา กรุงเทพมหานคร พญ.อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต นำ นาย Khairy Jamaluddin ABU BAKAR รัฐมนตรีว่าการกระทรวงสาธารณสุข ประเทศมาเลเซีย และคณะ เยี่ยมชมการดำเนินงานศูนย์สุขภาพจิต และกิจกรรมต่างๆ
พญ.อัมพร กล่าวว่า ประเทศไทยกับประเทศมาเลเซียมีความสัมพันธ์ที่ดีในการดำเนินงานด้านสุขภาพจิตมาอย่างต่อเนื่อง มีกิจกรรมทางวิชาการราวมกัน ทั้งการศึกษา การประชุม และการฝึกอบรม นอกจากนี้ กรมสุขภาพจิตยังร่วมมือกับโรงพยาบาลเปอร์ไม ยะโฮร์บาห์รู ประเทศมาเลเซีย (Permai Hospital, Johor Bahru, Malaysia) ดำเนินงานด้านจิตเวช บริการสุขภาพชุมชน ศูนย์ฟื้นฟู และงานสุขภาพจิตชุมชน ซึ่งตอกย้ำคุณภาพการบริการสุขภาพจิตของทั้งสองประเทศอย่างมีนัยสำคัญ สำหรับประเทศไทย ได้ขับเคลื่อนยุทธศาสตร์สุขภาพจิตในการส่งเสริมและป้องกัน ควบคู่กับการปรับปรุงคุณภาพและมาตรฐานระบบการบริการ โดยกรมสุขภาพจิตมีโรงพยาบาลจิตเวชทั่วไปในสังกัด 14 แห่ง และสถาบันสุขภาพจิตเด็กและวัยรุ่น 6 แห่ง ขณะนี้บางแห่งกำลังพัฒนาสู่การเป็นศูนย์กลางความเป็นเลิศเฉพาะทางและด้านวิชาการ เพื่อตอบสนองการเปลี่ยนแปลง และรองรับผลกระทบจากการแพร่ระบาดในเชิงรุก
พญ.อัมพร กล่าวต่อว่า ในวันนี้ได้นำเสนอข้อมูลต่อรัฐมนตรีสาธารณสุขมาเลเซีย และคณะ เกี่ยวกับการบริการสุขภาพจิตของไทย อาทิ โรคที่พบมาก ได้แก่ การใช้สารเสพติด จิตเภท ภาวะซึมเศร้า โรคสมาธิสั้น และการรักษาช่วยเหลือผู้ที่มีความเสี่ยงต่อภาวะฆ่าตัวตาย การให้บริการผู้ป่วยนอก ซึ่งในปี 2565 มีการระบาดของ Covid-19 ทำให้มีอัตราการเข้ารับบริการลดลง เป็นต้น นอกจากนี้ ได้นำเสนอการดำเนินงานของ คลินิกประสาทวิทยาและความจำสำหรับภาวะสมองเสื่อมที่มีพฤติกรรมและอาการทางจิตวิทยาของภาวะสมองเสื่อม สุขภาพจิตเด็กและวัยรุ่น ศูนย์สมอง จิตใจ และโปรแกรมฟื้นฟู และกิจการร้านกาแฟหลังคาแดงและร้านเพื่อน ที่ให้ผู้ป่วยจิตเวชได้ปฏิบัติ เรียนรู้ สร้างทักษะทางสังคม สามารถกลับคืนสู่สังคม โดยมีคุณภาพชีวิตที่ดีและมีศักดิ์ศรีในความเป็นมนุษย์ รวมถึงเป็นต้นแบบธุรกิจเพื่อสังคมสำหรับผู้ป่วยจิตเวชแห่งแรกของประเทศ ซึ่งการนำเสนอและแลกเปลี่ยนข้อมูลในครั้งนี้ เป็นส่วนหนึ่งในการกระชับความสัมพันธ์และสร้างความร่วมมือในการดำเนินงานด้านจิตเวชระหว่างไทยและมาเลเซียให้มีประสิทธิผลมากขึ้น และเป็นประตูสู่การพัฒนาขีดความสามารถของบุคลากรสาธารณสุขด้านจิตเวชของทั้ง 2 ประเทศต่อไปในอนาคต
The Reporter ย้อนกระทู้สด ส.ก.ลาดกระบัง ความคืบการก่อสร้างเมื่อ มกราคม 66
The Reporter UPDATE: ย้อนกระทู้ถามสด ส.ก.ลาดกระบัง ทวงถามความคืบหน้าการก่อสร้างสะพานยกระดับอ่อนนุช-ลาดกระบังเมื่อมกราคม 66 ตั้งข้อสังเกตไร้ชื่อบุคลากรเขตเป็นผู้คุมงาน พบก่อสร้างช้ากว่ากำหนด วางอุปกรณ์ขวางบนถนน กระทบความปลอดภัยประชาชน
ผู้สื่อข่าวรายงานว่า จากเหตุคานสะพานข้ามแยก บริเวณหน้าโลตัส ลาดกระบัง กรุงเทพมหานคร ที่กำลังทำการก่อสร้าง เกิดการทรุดตัวพังถล่มลงมา เป็นเหตุให้มีผู้บาดเจ็บ 13 ราย หากย้อนกลับไปในวันที่ 18 มกราคม 2566 ในการประชุมสภากรุงเทพมหานคร สมัยประชุมสามัญ สมัยแรก (ครั้งที่ 3) ประจำปีพุทธศักราช 2566 ณ ห้องประชุมสภากรุงเทพมหานคร อาคารไอราวัตพัฒนา ศาลาว่าการกรุงเทพมหานคร ดินแดง นายสุรจิตต์ พงษ์สิงห์วิทยา ส.ก.เขตลาดกระบัง ได้เคยตั้งกระทู้ถามสดไว้ เรื่องความคืบหน้าโครงการก่อสร้างทางยกระดับถนนอ่อนนุช-ลาดกระบัง
นายสุรจิตต์ ระบุว่าตามที่กรุงเทพมหานคร โดยสำนักการโยธาได้ดำเนินโครงการก่อสร้างทางยกระดับถนนอ่อนนุช-ลาดกระบัง โดยมีวัตถุประสงค์เพื่อให้การสัญจรมีความรวดเร็วและเพื่อรองรับการเจริญเติบโตของชุมชน ซึ่งจะเพิ่มศักยภาพและรองรับปริมาณการจราจรบนถนนอ่อนนุช-ลาดกระบัง ระยะเวลาดำเนินการ 900 วัน เริ่มสัญญาวันที่ 22 กุมภาพันธ์ 2564 และสิ้นสุดสัญญาวันที่ 11 สิงหาคม 2566 ปัจจุบันการก่อสร้างไม่มีความคืบหน้า รวมทั้งมีการตั้งวางวัสดุอุปกรณ์ในการก่อสร้างบนถนนกีดขวางการจราจร ทำให้การจราจรติดขัดเพิ่มมากขึ้น ส่งผลกระทบต่อประชาชนที่สัญจรผ่านถนนสายนี้ได้รับความเดือดร้อนและไม่ปลอดภัย
ถนนลาดกระบัง 54 ระยะทาง 600-700 ม. พื้นที่ส่วนหนึ่งอยู่ในความรับผิดชอบของสำนักงานเขตลาดกระบัง และอีกส่วนอยู่ในความรับผิดชอบของจังหวัดใกล้เคียง โครงการนี้มีวงเงินก่อสร้าง กว่า 1,600 ล้านบาท แต่จะเห็นได้ว่ารายชื่อของผู้ควบคุมงานไม่มีบุคลากรของสำนักงานเขตพื้นที่หรือผู้อำนวยการเขตร่วมเป็นเจ้าหน้าที่โครงการด้วย นอกจากนี้ความก้าวหน้าของโครงการยังช้ากว่าที่กำหนดถึง 45.69% ส่งผลให้เกิดปัญหาการจราจรในพื้นที่ ซึ่งเมื่อลงพื้นที่โครงการจริงพบมีคนงานเพียงไม่กี่คน และคาดว่าจะเสร็จไม่ทันตามสัญญาในวันที่ 16 ธันวาคม 2567
“โครงการนี้ไม่ได้เกิดขึ้นในสมัยผู้ว่าฯ ชัชชาติ แต่ปัญหานี้ส่งผลกระทบต่อประชาชนคนกรุงเทพมหานคร เราจึงต้องร่วมกันแก้ไขปัญหาจึงขอสอบถามผู้ว่าราชการกรุงเทพมหานครเกี่ยวกับความคืบหน้าโครงการก่อสร้างทางยกระดับถนนอ่อนนุช-ลาดกระบัง และการที่หน่วยงานในพื้นที่ไม่ได้เข้าร่วมในโครงการจะทำให้ปัญหาแก้ไขได้ถูกจุดหรือไม่ มีความคุ้มค่าในการลงทุนอย่างไร” นายสุรจิตต์ กล่าว
ในที่ประชุมนายวิศณุ ทรัพย์สมพล รองผู้ว่าราชการกรุงเทพมหานคร กล่าวว่า สำนักการโยธาและสำนักงานเขต จะนำข้อร้องเรียนไปปรับปรุง เพื่อลดผลกระทบที่เกิดขึ้นกับประชาชน นอกจากนี้จะส่งข้อมูลความก้าวหน้าของโครงการให้สำนักงานเขตประชาสัมพันธ์ให้ประชาชนในพื้นที่รับทราบเป็นระยะ ส่วนการก่อสร้างได้ปรับเปลี่ยนรูปแบบการก่อสร้างเป็นการหล่อแผ่นคอนกรีตจากโรงงานและนำมาติดตั้งในพื้นที่ โดยจะเร่งรัดให้ผู้รับจ้างดำเนินการโดยเร่งด่วน ด้านการจราจรจะกั้นพื้นที่ก่อสร้างเกาะกลางถนนให้เหลือช่องจราจร 2 เลน เพื่อลดปัญหาการจราจร รวมทั้งจะติดตั้งป้ายเตือน ไฟฟ้าส่องสว่าง และขีดสีตีเส้นทางม้าลายให้ชัดเจน ปัญหาฝุ่นจะใช้รถบรรทุกน้ำฉีดพ่นในพื้นที่วัดค่าฝุ่นละอองขนาดเล็ก PM2.5 และตรวจวัดควันดำเป็นระยะ รวมถึงงดการก่อสร้างที่ทำให้เกิดเสียงดังในช่วงเวลากลางคืน เพื่อลดผลกระทบที่จะเกิดกับประชาชนในพื้นที่ให้ได้มากที่สุด
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตดินแดง
Cafe Amazon for Chance สาขา 7 กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์
Cafe Amazon for Chance สาขาที่ 7 ดำเนินการโดย กลุ่มผู้สูงอายุ
ตั้งอยู่ที่ สาขากระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์
- แผนที่ Google map
- Credit ภาพ cafe-amazon.com
ข่าว
การบริจาคโลหิต รพ.ศูนย์สกลนคร LINK
วัน เวลาทำการบริจาคโลหิต
วันจันทร์ - ศุกร์ (ไม่หยุดพักกลางวัน) เวลา 08.30-15.30 น.
วันเสาร์ – อาทิตย์และวันหยุดราชการ (หยุดพักกลางวัน) เวลา 08.30-15.30 น.
สามารถสอบถามรายละเอียดเพิ่มเติมได้ในเวลาราชการที่ ห้องรับบริจาคโลหิต โรงพยาบาลศูนย์สกลนครโทร.042-711615 ต่อ 1070
6. อนุญาตให้เปิดการใช้งาน GPS และ Bluetooth เป็นอันเสร็จสิ้นการลงทะเบียน
กรณีน้องๆ ที่อายุไม่ถึงแต่อยากชิม แนะนำเค้ายังไง
แนะนำเมนูอื่นที่ร้านให้ค่ะ ซึ่งน้องๆ ก็จะเข้าใจเหตุผล14 มีนาคม 2564 รมว.สธ. ลงพื้นที่ ตลาดบางแค
วันนี้ (14 มีนาคม 2564) ที่ตลาดบางแค กรุงเทพมหานคร นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข พร้อมด้วยนพ.ธงชัย กีรติหัตถยากร รองปลัดกระทรวงสาธารณสุข นพ.โอกาส การย์กวินพงศ์ อธิบดีกรมควบคุมโรค นพ.ณรงค์ อภิกุลวณิชย์ ผู้ตรวจราชการเขตสุขภาพที่ 6 ลงพื้นที่ตรวจเยี่ยมให้กำลังใจเจ้าหน้าที่และผู้ค้าในตลาด โดยนายอนุทินให้สัมภาษณ์ว่า จากการหารือกับเจ้าของตลาด และผู้อำนวยการเขตบางแค พบว่า ตลาดบางแคเป็นตลาดขนาดใหญ่ มีตลาดย่อยในพื้นที่ 6 แห่งติดกัน อาจมีผู้ที่มาจากพื้นที่มีการแพร่ระบาดเข้ามา ทำให้เกิดการติดเชื้อ แม้ว่ามีการทำความสะอาดตลาดและฆ่าเชื้อเป็นประจำก็ตาม ซึ่งกระทรวงสาธารณสุข โดยกรมควบคุมโรค ได้ร่วมมือกับกรุงเทพมหานครที่เป็นผู้รับผิดชอบหลักในการควบคุมโรค แก้ไขสถานการณ์และเร่งตรวจเชิงรุกค้นหาผู้ติดเชื้อให้ได้มากที่สุด ควบคุมโรคให้เร็วที่สุด พบผู้ติดเชื้อส่วนใหญ่เป็นผู้ที่ไม่แสดงอาการ ได้ส่งไปรักษาที่โรงพยาบาลบางขุนเทียนแล้ว จะค้นหาเชิงรุกต่อเนื่อง โดยในวันนี้ได้ส่งรถตรวจหาเชื้อชีวนิรภัยพระราชทาน จำนวน 2 คัน ลงพื้นที่หมู่บ้านวังทอง ถนนเพชรเกษม 77 เขตหนองแขม พร้อมทั้งให้ความรู้ความเข้าใจกับประชาชนในชุมชนแล้ว
นายอนุทินกล่าวต่อว่า ขอความร่วมมือผู้ที่เคยเดินทางมาไปตลาด 6 แห่งในเขตบางแค ตั้งแต่วันที่ 20 กุมภาพันธ์ – 13 มีนาคม 2564 ได้แก่ ตลาดสิริเศรษฐนนท์ (แสงฟ้าเก่า) ตลาดศูนย์การค้าบางแค ตลาดกิตติ ตลาดภาสม ตลาดใหม่บางแค และตลาดวันเดอร์ จำกัดการเดินทางไปยังพื้นที่อื่น แจ้งความเสี่ยงให้คนในครอบครัวทราบ แยกตัวเอง รักษาระยะห่าง เลี่ยงการรับประทานอาหารและของใช้ส่วนตัวร่วมกัน ให้ครบ 14 วันนับตั้งแต่วันที่ไปตลาด และไปขอรับการตรวจหาเชื้อที่โรงพยาบาลรัฐ หรือรถตรวจหาเชื้อชีวนิรภัยพระราชทาน ซึ่งจะออกให้บริการที่สวนสาธารณะข้างเดอะมอลล์บางแค โดยไม่เสียค่าใช้จ่ายให้ผู้ที่มีประวัติเดินทางไปตลาดบางแคในช่วงวันดังกล่าว ตั้งแต่วันพรุ่งนี้เป็นต้นไป นอกจากนี้ จะจัดสรรวัคซีนป้องกันโรคโควิด 19 ให้กับประชาชนในเขตบางแคซึ่งเป็นพื้นที่เสี่ยงหนึ่งให้มากขึ้น
ลำปาง สลุงหลวง กลองใหญ่ ปี๋ใหม่เมือง นครลำปาง 10-13 เมษายน 64 LINK
จังหวัดลำปาง "นครแห่งความสุข ที่ไม่หมุนตามกาลเวลา" ประกาศเปิดประตูบ้านยาวต่อเนื่อง จากวันรำลึกประวัติศาสตร์รถไฟ-รถม้าลำปาง จัดงานสืบสานประเพณีครั้งยิ่งใหญ่ประจำปี 2564 "สลุงหลวง กลองใหญ่ ปี๋ใหม่เมือง นครลำปาง" เตรียมจัดเต็มการแสดงศิลปวัฒนธรรมประเพณีไทยล้านนา
งาน "สลุงหลวง กลองใหญ่ ปี๋ใหม่เมือง นครลำปาง" ภายใต้แนวคิด "สุขก๋าย ม่วนใจ๋ ปลอดภัย ไร้โควิด-19" ตั้งแต่วันที่ 10 - 13 เมษายน 2564 ที่บริเวณข่วงแก้วเวียงละกอน หน้าอาคารพิพิธภัณฑ์การเรียนรู้เมืองลำปาง (มิวเซียมลำปาง) และศาลหลักเมืองลำปาง
- วันที่ 10 เมษายน 2564 เป็นต้นไป ณ ที่บริเวณข่วงแก้วเวียงละกอน โดยจะมีการจัดพิธีเปิดงานอย่างยิ่งใหญ่ตระการตาในช่วงเย็นของวัน ด้วยการแสดงแสง สี เสียง ชุด "สลุงหลวง กลองใหญ่ ปี๋ใหม่เมือง" และต่อด้วยการแสดงศิลปวัฒนธรรมต่างๆ อีกมากมาย ซึ่งกิจกรรมจะมียาวต่อเนื่องไปจนถึงวันที่ 13 เมษายน
- วันที่ 11 เมษายน 2564 การจัดแสดงศิลปวัฒนธรรมพื้นบ้านล้านนา, การแสดงดนตรีพื้นเมืองสะล้อ ซอ ซึง, การประกวดทำแกงฮังเลดั้งเดิม และการประกวดตกแต่งขันโตกอัตลักษณ์พื้นถิ่นลำปาง, การประกวดบ่าวน้อย สาวน้อย ปี๋ใหม่เมืองเวียงละกอน
- วันที่ 12 เมษายน 2564 จะมีการจัดขบวนแห่อัญเชิญพระเจ้าแก้วมรกตดอนเต้า จากวัดพระธาตุลำปางหลวง มาสู่ในใจกลางนครลำปาง พร้อมกับขบวนแห่งานบุญสลุงหลวงของชาวเมืองลำปาง ซึ่งจะเคลื่อนขบวนจากวัดปงสนุกมายังพิพิธภัณฑ์การเรียนรู้เมืองลำปาง (มิวเซียมลำปาง) โดยจะมีการประกอบพิธีเจริญพระพุทธมนต์เย็น และสรงน้ำพระเจ้าแก้วมรกตดอนเต้า ณ ศาลหลักเมืองลำปาง
- วันที่ 13 เมษายน 2564 ด้วยการทำบุญตักบาตรในช่วงเช้าตรู่ และชมขบวนแห่ปี๋ใหม่เมืองในช่วงบ่าย โดยขบวนแห่จะได้มีการอัญเชิญพระพุทธรูปศักดิ์สิทธิคู่บ้านคู่เมือง และพระพุทธรูปศักดิ์สิทธิประจำอำเภอจากทั้ง 13 อำเภอ ของจังหวัดลำปาง มาร่วมขบวนแห่ให้ประชาชนและนักท่องเที่ยวได้ร่วมกันสรงน้ำสักการะเพื่อความเป็นสิริมงคลด้วย
ททท ลำปาง โทร 054222214
แพร่ - มาจากพื้นที่แดง กักตัว 14 วัน LINK
9 เมย 64
ผู้เดินทางมาจากทุกจังหวัด
- 10 จังหวัดที่ต้องกักตัวเมื่อเดินทางเข้าจังหวัดแพร่ ได้แก่ กรุงเทพฯ นนทบุรี นครปฐม ปทุมธานี สมุทรสาคร สมุทรปราการ ชลบุรี ประจวบคีรีขันธ์ สระแก้ว และ เชียงใหม่
- สแกน QR แพร่ชนะ
- รายงานตัวต่อกำนัน ผู้ใหญ่บ้าน อสม จนท.สธ.ในพื้นที่
- หากมีอาการไข้ ไอเจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่รับรส ถ่ายเหลว ให้ไปรับการตรวจที่รพ.ใกล้บ้าน
- ผู้ที่เดินทางมาจากจังหวัดอื่น รายงานตัว สแกน QR แพร่ชนะ เฝ้าระวังสังเกตอาการ 14 วัน
สอบถามโทร 054-511-145 ต่อ 207 (เวลาราชการ) และ 064-579-5738
รพ.แพร่ โทร 054-511-096
เพจ
สสจ แพร่ โทร 054-511-145
ประกันภัยแพ้วัคซีนโควิด-19 SILKSPAN LINK
ประกันภัยแพ้วัคซีนโควิด-19 คุ้มครองกรณีได้รับผลกระทบจากการฉีดวัคซีนป้องกันเชื้อไวรัสโควิด-19
- ค่ารักษาพยาบาล คุ้มครอง ค่ารักษาพยาบาลผู้ป่วยใน สูงสุด 100,000 บาท
- รับเงินปลอบขวัญ เมื่อเข้ารักษาตัวเป็นผู้ป่วยในในโรงพยาบาล สูงสุด 50,000 บาท
- รับประกันทุกอาชีพ ที่มีสัญชาติไทยที่อาศัยอยู่ในประเทศไทย
On the Table, Tokyo Cafe รับฟรี‼️ สลัดไส้กรอกอาราบิกิ 1 ที่ LINK
On the Table, Tokyo Cafe สนับสนุนคนไทย ฉีดวัคซีนช่วยชาติ ??
รับฟรี‼️ ?สลัดไส้กรอกอาราบิกิ? 1 ที่ (มูลค่า 140 บาท)
เพียงแสดงหลักฐานการฉีดวัคชีน ? และซื้อสินค้าเมนูใดๆ ก็ได้อย่างน้อย 1 เมนู ที่ร้าน On the Table, Tokyo Café ทุกสาขา
ตั้งแต่วันที่ 18 พ.ค. 64 - 30 มิ.ย. 64 นี้เท่านั้น
เขตบางนา บริการวันที่ 13-30 ก.ย. 64 LINK
สำนักงานเขตบางนา ร่วมกับศูนย์บริการสาธารณสุข 8 และศูนย์บริการสาธารณสุข 32 กำหนดออกหน่วยเคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี !!! ไม่เสียค่าใช้จ่าย
ตั้งแต่เวลา 09.00 - 11.00 น.
13 ก.ย. 64 - เคหะบางนา (แฟลต 6) - ลานกีฬาหมู่บ้านไพโรจน์
14 ก.ย. 64 - ศูนย์สขภาพ ชุมชนพึ่งทรัพย์ - ที่ทำการชุมชนทิมเรืองเวช
16 ก.ย. 64 - ที่ทำการชุมชนเรวัตินิเวศน์ - ที่ทำการชุมชนทองใบ + อยู่เย็น
20 ก.ย. 64 - ที่ทำการชุมชนเจริญรุ่งเรือง
21 ก.ย. 64 - ที่ทำการชุมชนร่วมพัฒนา
28 ก.ย. 64 - ที่ทำการชุมชนริมทางด่วน
30 ก.ย. 64 - ที่ทำการชุมชนรุ่งสว่าง
สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 0 2173 5270
รพ.ยุวประสาทฯ เปิดลงทะเบียนฉีดเข็ม 1 และเข็ม 3 ผ่าน QR Code
พิงค์
2 เมษายน ร๊อคสตาร์สาวสุดพั๊งค์วัย 41 เจ้าของรางวัลแกรมมี่ ประกาศทางอินตาแกรมว่าเธอและลูกชาย 3 ขวบ ติดโควิด เธอเปิดเผยว่า โรคนี้มันรุนแรงและหนักมาก จนหวั่นใจว่าจะไม่รอด หลังจากหายแล้ว เธอได้บริจาคเงิน 1 ล้านเหรียญเข้ากองทุนฟื้นฟูโควิด เพื่อเป็นการสนับสนุนเหล่าบุคลากรการแพทย์ที่ทุ่มเทเพื่อช่วยเหลือผู้ป่วยโควิด ที่เธอยกย่องว่าเป็น "ฮีโร่"
โหลยาดองสไตล์ไทยดั้งเดิมขาดไม่ได้แน่นอน
แคปซูลกระท่อมสกัด สรรพคุณ ตื่นตัวในการทำงาน
ชิมฟรี ยอดยามะเร็ง น้ำสาบาน น้ำสมานฉันท์ เป็นอย่างไร เดินเข้าในสุด แล้วขอชิมสักเป๊ก
ติดเชื้อจากคลัสเตอร์ระบาดต่อเนื่อง 25 ราย
สำนักงานสาธารณสุขจังหวัดกาฬสินธุ์ รายงานจำนวนผู้ติดเชื้อใหม่ข้อมูล
23 ธันวาคม 2564 จำนวนผู้ติดเชื้อจากคลัสเตอร์ระบาดต่อเนื่อง 25 ราย เป็นเชื่อมโยงตลาดโรงสี 19 ราย จากจำนวนทั้งหมดที่พบทั้งจังหวัด 29 ราย
อยากให้ความสุขอยู่คู่กับสุขภาพ - Cheevit Cheeva (ชีวิตชีวา)
"ร้านชีวิตชีวา เติบโตมาได้จากการที่แพรไปคุยกับลูกค้าในช่องทางออนไลน์ต่างๆ ด้วยตัวเอง เพื่อให้เราเข้าใจความต้องการของลูกค้าที่แท้จริงและแก้ไขปัญหาให้เขาได้ทันท่วงที ตรงนั้นคือสิ่งที่แพรเชื่อ การได้เข้าร่วมแคมเปญตรงนี้จึงถือเป็นความภูมิใจ ที่เราส่งได้มอบความสุขในรูปแบบขนมที่เราเชื่อมั่นให้กับลูกค้า โดยเฉพาะอย่างยิ่งลูกค้าผู้ป่วยเบาหวานที่ปกติเขาอาจจะ Enjoy กับขนมขนาดนี้ไม่ได้ รวมถึงลูกค้าที่อาจจะไม่ได้เป็นโรคเบาหวานแต่ต้องการดูแลสุขภาพด้วย ก็ขอให้มีความสุขเมนูของเรา มีความสุขกับการทานและดูแลสุขภาพไปพร้อมๆ กันนะคะ"
แพร-กันติชา สมศักดิ์ ผู้บริหารร้าน Cheevit Cheeva (ชีวิตชีวา) กล่าวถึงความรู้สึกที่ได้เข้าร่วมแคมเปญและฝากความในใจถึงผู้บริโภค
เปาโล โชคชัย 4 - เปาโล เกษตร จัดโปรแกรมตรวจสุขภาพ LINK
- โปรแกรมตรวจสุขภาพ Chinese New Year 21 รายการ
- โปรแกรมตรวจโรคหัวใจ
- โปรแกรมตรวจหาภูมิคุ้มกัน Covid-19
สั่งซื้อได้วันที่ 25 มกราคม - 2 กุมภาพันธ์ 2565 เข้ารับบริการได้ถึง 31 มีนาคม 2565 โรงพยาบาลเปาโล โชคชัย 4 โทร.02-514-4141
บริจาคโลหิตกับกลุ่มเซ็นทรัล ห้างในพื้นที่ภาคอีสาน 3 จุด
คลอดเหมาจ่าย โรงพยาบาลเกษมราษฎร์ ประชาชื่น LINK
คลอดเหมาจ่าย โรงพยาบาลเกษมราษฎร์ ประชาชื่น คลอดธรรมชาติ 3 วัน 2 คืน 34,500 ผ่าตัดคลอด 4 วัน 3 คืน 49,500 ผ่าคลอดแฝด คิดเพิ่มจากผ่าคลอด 19,000 (4 วัน 3 คืน) ราคานี้ได้ถึง 31 ธันวาคม 65 สอบถามข้อมูลเพิ่มเติมได้ที่แผนกประชาสัมพันธ์ โทร 02-910-1600 ต่อ 1835 เวลา 09.00 – 17.00 น.
โรงพยาบาลเวิลด์เมดิคอล บริการตรวจ Drive Thru Test (RT-PCR) 2,000 บาท
โรงพยาบาลเวิลด์เมดิคอล เปิดบริการตรวจโควิด-19 รูปแบบ Drive Thru Test (RT-PCR ) #ค่าบริการตรวจหาเชื้อ 2,000 บาท/คน (*ราคาสำหรับคนไทย)
✅ เปิดรับคิวตรวจ เวลา 05.00 น. เป็นต้นไป
✅ รับตรวจ วันละ 300 คน
✅ เปิดตรวจทุกวัน (จันทร์-อาทิตย์) : เวลา 09.00-22.00 น.
✅ ใบรับรองแพทย์ กรณีตรวจพบเชื้อ 500 บาท ( ** กรณีติดเชื้อ‼ แพทย์จะทำการออกใบรับรองว่า "พบเชื้อและมาตรวจจริง" เท่านั้น (ไม่ระบุรูปแบบการรักษาหรือระบุสถานะการรักษาในปัจจุบัน แม้จะเป็นการตรวจหาเชื้อหลังการรักษาก็ตาม)
✅ รู้ผลตรวจภายใน 24 ชั่วโมง
✅ ค่าบริการตรวจหาเชื้อ Covid-19 รูปแบบ Drive thru Test
▪️ ค่าบริการตรวจหาเชื้อ ราคา 2,000 บาท (ราคาสำหรับคนไทย)
วิภาราม ดูแลผู้ประกันตนสิทธิประกันสังคมทุกโรงพยาบาล หากมีผล ATK ขึ้น 2 ขีด
โรงพยาบาลวิภาราม สำหรับผู้ประกันตนสิทธิประกันสังคมทุกโรงพยาบาล กรณีที่ท่านมีผลการตรวจแบบ ATK (Antigen Test Kit) เป็น positive ขึ้น 2 ขีด
• ท่านสามารถเข้ารับการตรวจด้วยวิธี ATK ซ้ำเพื่อยืนยันผล และเข้ารับการรักษาที่โรงพยาบาล หรือ โรงแรม Hospitel (ไม่เสียค่าใช้จ่าย)
• โดยท่านสามารถติดต่อได้ที่ ARI Clinic ชั้น 4B ทุกวันตั้งแต่เวลา 8.00-16.00 น. ไม่ต้องนัดหมายล่วงหน้า (คิวจำนวนจำกัด)
• หลักฐานที่ต้องนำมาด้วย ผลตรวจหรือชุดตรวจ Antigen Test Kit (ผลตรวจไม่เกิน 5 วัน ก่อนเข้ามารับบริการที่โรงพยาบาล) และบัตรประจำตัวประชาชน หรือสอบถามข้อมูลเพิ่มเติมได้ที่ 0-2032-2550 ARI Clinic อาคารจอดรถ ชั้น 4B ต่อ 2344,2345 (**หมายเหตุ ประกาศ ณ วันที่ 18/02/2565)
สำหรับผู้ป่วยที่ไม่สะดวกทำ Hotel Isolation (สำหรับผู้ที่ไม่มีสิทธิ์ประกันสังคม) สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกรับผู้ป่วยใน (Admission) โทร. 0-2032-2550, 0-2722-2500 ต่อ 2010, 2165
เจอ แจก แต่ดูแลไม่จบ แพ็กเกจผู้ป่วยนอกที่กลับไปรักษาตัวที่บ้าน (สำหรับผู้ที่ไม่มีสิทธิ์ประกันสังคม) Package A = 3,800 Package B = 5,800 Package C = 3,200 Package D = 5,200 สอบถามข้อมูลเพิ่มเติมได้ที่ 0-2032-2550 สำหรับผู้ใหญ่ ติดต่อ ARI Clinic ชั้น2 เบอร์ต่อ 3213, 3215 สำหรับเด็ก ติดต่อ ARI Clinic เด็ก ชั้น4 เบอร์ต่อ 2438, 2439
เสื้อหัวใจอินฟินิตี้
เนื่องในวันรามาธิบดี จึงขอเรียนเชิญผู้มีจิตศรัทธาร่วมเป็นส่วนหนึ่งของการให้ ด้วยการซื้อเสื้อ “หัวใจอินฟินิตี้” ราคา 199 บาท ทางช่องทางต่าง ๆ เช่น
LINE @ramafoundation
www.ramafoundation.or.th, มูลนิธิรามาธิบดีฯ
หรือบริจาคเงินสมทบทุนมูลนิธิรามาธิบดีฯ
สอบถามโทร 02-201-1111
Ep 2.6 “ความยินยอม Consent” LINK
ขอความยินยอมอย่างไร? ให้ถูกต้องตามกฎหมาย PDPA
•
กรณีมีความจำเป็นต้องเก็บรวบรวมข้อมูลส่วนบุคคล
โดยไม่มีฐานการประมวลผลอื่นตามมาตรา 24
ผู้ควบคุมต้องได้รับความยินยอมจากเจ้าของข้อมูล
ก่อนหรือขณะเก็บรวบรวม ใช้ หรือเปิดเผยข้อมูลนั้น
โดยใช้แบบหรือข้อความที่เข้าใจง่าย แยกเป็นสัดส่วน ทำเป็นหนังสือหรือระบบอิเล็กทรอนิกส์ก็ได้
ต้องไม่เป็นการหลอกลวงหรือมีเงื่อนไขแอบแฝง
เพื่อประมวลผลข้อมูลที่ไม่จำเป็นหรือไม่เกี่ยวข้อง
•
สำคัญคือ เจ้าของข้อมูลต้องมีอิสระและทำโดยสมัครใจ สามารถเลือกได้ว่าจะให้ความยินยอมหรือปฎิเสธ
ทั้งนี้ แม้ให้ความยินยอมไปแล้ว เจ้าของข้อมูลก็สามารถถอนความยินยอมได้ เว้นแต่มีข้อจำกัดตามกฎหมาย โดยการถอนความยินยอมต้องสามารถทำได้ง่าย (เรียกได้ว่าง่ายเหมือนกับตอนให้ความยินยอม)
•
ดังนั้น จึงไม่ควรขอความยินยอมโดยไม่จำเป็น
ซึ่งจริง ๆ แล้ว การทำกิจกรรมส่วนใหญ่สามารถทำได้
โดยไม่ต้องขอความยินยอม เพราะมีเหตุอื่นให้ใช้ได้
เช่น การปฏิบัติตามสัญญา การปฏิบัติตามกฎหมาย
เพียงแต่ผู้ควบคุมข้อมูลมีหน้าที่ต้องแจ้ง ให้เจ้าของข้อมูลทราบถึงวัตถุประสงค์นั้น
•
ตัวอย่าง
การประมวลผลข้อมูลเพื่อซื้อขายสินค้า สามารถทำได้ตามฐานสัญญาโดยไม่ต้องขอความยินยอม แต่หากเสนอบริการเสริมเพิ่มเติม ที่ไม่เกี่ยวข้องกับสัญญาซื้อขายนั้น ต้องขอความยินยอมจากเจ้าของข้อมูลส่วนบุคคล
•
และการขอความยินยอมจะต้องไม่แสร้งว่า
เป็นส่วนหนึ่งของสัญญาหรือเงื่อนไขในการให้บริการ
หรือทำให้เข้าใจผิดว่าหากไม่ให้ความยินยอมแล้ว
เจ้าของข้อมูลจะไม่ได้รับบริการนั้น ๆ
•
กรณีผู้ควบคุมมีการประมวลผลข้อมูลส่วนบุคคล หลายอย่างเพื่อวัตถุประสงค์เดียวกัน สามารถรวมอยู่ในความยินยอมครั้งเดียวได้ แต่หากใช้ข้อมูลส่วนบุคคลชุดเดียวกัน เพื่อประมวลผลหลายวัตถุประสงค์
ต้องให้เจ้าของข้อมูลมีทางเลือกได้ว่า ยินยอมสำหรับวัตถุประสงค์ใดบ้าง
•
เนื่องจากแต่ละองค์กรมีรูปแบบและลักษณะที่แตกต่างกัน รูปแบบการขอความยินยอมของแต่ละองค์กร จึงสามารถออกแบบและปรับให้เหมาะสมกับกิจกรรมการประมวลผลของตนได้
•
‼️ย้ำอีกครั้งว่าตามกฎหมาย PDPA ไม่ได้กำหนดให้ต้องขอความยินยอมในทุกกรณี หากวัตถุประสงค์การประมวลผลข้อมูล เข้าหลักการข้ออื่นโดยชอบด้วยกฎหมายแล้ว ก็ไม่ต้องนำเรื่องความยินยอมมาใช้
(แต่ยังมีหน้าที่ในการแจ้งเจ้าของข้อมูลส่วนบุคคลอยู่)
โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช จ.ตาก LINK
งานการพยาบาลที่บ้านและชุมชน กลุ่มงานพยาบาลชุมชน รพ.สมเด็จพระเจ้าตากสินมหาราช ให้บริการยืมอุปกรณ์การแพทย์ที่จำเป็นแก่ผู้ป่วยเรื้อรัง โดยอุปกรณ์ที่ได้รับการสนับสนุนจากผู้มีจิตศรัทธา เพื่อนำไปใช้ดูแลต่อเนื่องเพื่อฟื้นฟูสมรรถภาพที่บ้าน
เงื่อนไข : เฉพาะผู้อาศัยอยู่จริงใน อ.เมืองตาก
อุปกรณ์ที่มีให้ยืม
- ที่นอนลมไฟฟ้า
- เครื่องผลิตออกซิเจน
- เครื่องดูดเสมหะ
- เครื่องพ่นยา
- เครื่องช่วยหายใจ
- เครื่องวัดออกซิเจนปลายนิ้ว
- เครื่องวัดความดันโลหิต
- ปรอทดิจิตอล
ติดต่อ โรงพยาบาลสมเด็จพระเจ้าตากสินมหาราช จ.ตาก
โทร. 064-8617083 , 055-511024 ต่อ 1053
กัญชากับโลกเทคฯ ล้ำๆ กับการเปิดตัว NFT
โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต เปิดรับสมัครงาน หลายตำแหน่ง LINK
ตำแหน่งงานด่วน
เจ้าหน้าที่ตรวจสอบภายใน
เจ้าหน้าที่ขับรถฉุกเฉิน (รพ.จุฬารัตน์ 9อินเตอร์)
เจ้าหน้าที่การเงินผู้ป่วย
เจ้าหน้าที่ช่างซ่อมบำรุง
เจ้าหน้าที่จัดซื้อ (โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต)
เจ้าหน้าที่เวชระเบียน,ประชาสัมพันธ์ โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต
พนักงานผู้ช่วยวิชาชีพแผนกอุบัติและฉุกเฉิน /ห้องผ่าตัดฯ /ผู้ป่วยหนัก /WARD /ผู้ป่วยนอก /แผนก X-Ray/Lab
โรงพยาบาลจุฬารัตน์ 9 แอร์พอร์ต
สนใจติดต่อ แผนกทรัพยากรบุคคล (ตึกด้านหลัง รพ.)
โทร. 02-017-0602 หรือ 02-738-9900 ต่อ 2225
มือถือ 081-370-9963
หรือส่งประวัติมาทาง E-mail: recruit.ch9@gmail.com
ติดต่อสมัครงาน วันจันทร์-ศุกร์ เวลา 08.00-16.00 (หยุด เสาร์-อาทิตย์ และนักขัตฤกษ์)
**โปรดแต่งกายสุภาพมาสมัครงาน ไม่สวมรองเท้าแตะ**
ขนมวันวารอีกชุดนึง LINK
บ่าวดรีม ฟิชชิ่งฮันเตอร์ ผมทันทุกอันเลยความจริงที่ไม่อยากยอมรับ #ผมจะไม่ยอมรับความจริงเด็ดขาดผมยังไม่แก่ถึงใกล้จะ25แล้วก็เถอะ
5.3 เทคโนโลยีที่ใช้สนับสนุนการปฏิบัติงาน
ส่วนราชการและหน่วยงานของรัฐอาจพิจารณานำเทคโนโลยีมาใช้สนับสนุนการให้บริการประชาชนและผู้รับบริการ และปรับรูปแบบการบริการบางลักษณะให้อยู่ในรูปแบบอิเล็กทรอนิกส์ (e-Service) หรือพัฒนานวัตกรรมเพื่อสนับสนุนการให้บริการและการปฏิบัติงานเพื่ออำนวยความสะดวกให้ประชาชนสามารถติดต่อและรับบริการจากหน่วยงานภาครัฐได้ทุกที่ทุกเวลา อีกทั้งเป็นการลดภาระค่าใช้จ่ายในการเดินทางและค่าใช้จ่ายต่าง ๆ ของผู้รับบริการรวมถึงอาจพิจารณานำเทคโนโลยีสารสนเทศเข้ามาใช้สนับสนุนการปฏิบัติงานภายในหน่วยงานให้สามารถดำเนินการได้โดยไม่ติดขัด และสามารถติดตามขั้นตอนการปฏิบัติงานได้อย่างมีประสิทธิภาพ โดยอาจพิจารณาดำเนินการได้ดังนี้
5.3.1 การปรับเปลี่ยนงานบริการภาครัฐที่สำคัญเป็นรูปแบบดิจิทัลแบบเบ็ดเสร็จ (End-to-End Digital Services) โดยหน่วยงานอาจพิจารณาปรับกระบวนการให้บริการประชาชนโดยใช้เทคโนโลยีดิจิทัล ตลอดจนพิจารณาดำเนินการผ่านแพลตฟอร์มกลางของงานบริการภาครัฐที่สำนักงานพัฒนารัฐบาลดิจิทัลพัฒนาขึ้น เพื่อให้การบริการประชาชนมีความสะดวก รวดเร็ว เป็นไปอย่างต่อเนื่องและปลอดภัย ลดข้อจำกัดด้านเวลา สถานที่ การเดินทาง และลดความแออัดในการรับบริการ อีกทั้งยังช่วยลดภาระประชาชนและผู้มาติดต่อราชการได้อย่างมีนัยสำคัญอีกด้วย
5.3.2 การนำเทคโนโลยีดิจิทัลมาสนับสนุนการปฏิบัติงานภายในหน่วยงาน โดยหน่วยงานอาจปรับเปลี่ยนกระบวนการบริหารจัดการภายในและพัฒนากระบวนงานให้สามารถทำงานผ่านระบบดิจิทัลได้อย่างเต็มประสิทธิภาพ ดังนี้
(1) ระบบเอกสารอิเล็กทรอนิกส์โดยเป็นระบบที่สามารถจัดเก็บเอกสารในรูปแบบอิเล็กทรอนิกส์อย่างเป็นระเบียบ ช่วยประหยัดเวลาและสถานที่จัดเก็บมีความสะดวกและรวดเร็วในการเข้าถึงเอกสารได้ทุกที่ ทุกเวลา
(2) ระบบสารบรรณอิเล็กทรอนิกส์ โดยเป็นระบบที่สามารถสนับสนุนการปฏิบัติงานตามกระบวนงานสารบรรณได้ครบทุกขั้นตอน
(3) ระบบการปฏิบัติงานภายในอิเล็กทรอนิกส์ โดยเป็นระบบที่มีการบูรณาการกระบวนงานของหน่วยงานให้อยู่ในรูปแบบดิจิทัล เพื่ออำนวยความสะดวกในการปฏิบัติงานภายในหน่วยงานตามระบบหรือขั้นตอนการปฏิบัติงานที่กำหนดภายในหน่วยงาน
(4) ระบบการบริหารงานบุคคลอิเล็กทรอนิกส์ โดยเป็นระบบที่ออกแบบเพื่อสนับสนุนการบริหารงานบุคคลภายในหน่วยงาน โดยสามารถกระทำได้อย่างครอบคลุมในทุกขั้นตอน และสามารถดำเนินการได้ทั้งในสถานที่ตั้งและนอกสถานที่ตั้ง
(5) ระบบการสื่อสารและการประชุมอิเล็กทรอนิกส์โดยเป็นระบบที่ใช้สำหรับการสนับสนุนการประชุมอย่างมีประสิทธิภาพ เพื่อประโยชน์ในการติดต่อสื่อสารและ
การประชุมร่วมกัน
(6) ระบบความมั่นคงปลอดภัยของข้อมูล (Data Security) โดยเป็นระบบที่ออกแบบเพื่อการบริหารจัดการความมั่นคงปลอดภัยของสารสนเทศของหน่วยงาน โดยที่ข้อมูลในระบบควรมีความถูกต้อง เชื่อถือได้ และเป็นมาตรฐานเดียวกัน โดยหน่วยงานควรมีการกำหนดระบบความปลอดภัยของข้อมูล รวมถึงการบริหารจัดการความเสี่ยงต่อการปฏิบัติงานจากภายนอก
(7) ระบบความช่วยเหลือทางเทคนิค โดยหน่วยงานมีการพัฒนาช่องทางในการช่วยแก้ปัญหากรณีระบบหรือโปรแกรมของผู้ปฏิบัติงานเกิดขัดข้อง หรือช่วยให้คำปรึกษา หรือช่วยสนับสนุนการทำงานของผู้ปฏิบัติงานได้ทุกที่ ทุกเวลา
5.4 การบริหารจัดการภายในหน่วยงาน
การที่ส่วนราชการและหน่วยงานของรัฐจะสามารถดำเนินการตามแนวทางการปฏิบัติราชการที่รองรับชีวิตและการทำงานวิถีใหม่ได้อย่างมีประสิทธิภาพ นั้น ควรต้องปรับรูปแบบและวิธีการในการปฏิบัติงานที่แตกต่างจากเดิม ตลอดจนมีการกำหนดทิศทางในการบริหารจัดการภายในหน่วยงานให้สอดคล้องกับบริบททางสังคมวิถีใหม่และสภาพแวดล้อมที่เปลี่ยนแปลงไป ดังนี้
5.4.1 การบริหารแผนงาน หน่วยงานควรกำหนดนโยบายและเป้าหมาย
การปรับเปลี่ยนองค์กรที่ชัดเจน เพื่อให้สามารถวางแผนในการพัฒนาปรับปรุงกระบวนงาน วิธีการทำงานกระบวนการให้บริการประชาชน และการปฏิบัติราชการภายในหน่วยงานให้มีประสิทธิภาพยิ่งขึ้น โดยมีการนำเทคโนโลยีมาสนับสนุนการปฏิบัติงานอย่างเต็มที่ มีการวางแผนงานให้สอดคล้องกับทิศทางการปรับตัวของหน่วยงาน เพื่อรองรับบริบททางเศรษฐกิจและสังคมวิถีใหม่ที่เปลี่ยนแปลงขึ้นอย่างรวดเร็ว
5.4.2 การบริหารงบประมาณ หน่วยงานควรพิจารณาจัดสรรงบประมาณ
เพื่อจัดเตรียมความพร้อมทั้งด้านอุปกรณ์และระบบโครงสร้างพื้นฐานเพื่อรองรับการปรับกระบวนงานและการนำเทคโนโลยีมาใช้ในการให้บริการประชาชนและการปฏิบัติงานอย่างเต็มประสิทธิภาพ โดยควรพิจารณาจัดสรรงบประมาณรายจ่ายประจำปีของหน่วยงานให้สอดคล้องกับทิศทางการปรับปรุงประสิทธิภาพของหน่วยงาน เพื่อให้การให้บริการประชาชนและการปฏิบัติงานภายในหน่วยงานมีประสิทธิภาพสูงสุด นอกจากนี้ ยังควรพิจารณาทบทวนเหตุผลความจำเป็นในการขยายพื้นที่ตั้งของหน่วยงาน หรือการก่อสร้างอาคารสำนักงานเพิ่มเติม ซึ่งสามารถทดแทนโดยการจัดให้มีพื้นที่ทำงานร่วม (Co-working Space) ให้แก่ผู้ปฏิบัติงาน
5.4.3 การบริหารงานบุคคล หน่วยงานควรออกแบบและปรับปรุงกลไก
การบริหารงานบุคคลภายในให้สอดคล้องชีวิตและการทำงานวิถีใหม่ โดยมีการมอบหมายงานตรวจสอบกำกับติดตามงานและบริหารผลการปฏิบัติราชการอย่างมีประสิทธิภาพ สามารถมอบหมายและติดตามงานได้โดยไม่จำกัดรูปแบบและสถานที่ในการปฏิบัติงาน มีการพัฒนาทักษะและสมรรถนะของผู้ปฏิบัติงานทุกระดับให้มีความเข้าใจและความพร้อมในการปฏิบัติราชการภายใต้บริบทฐานวิถีชีวิตใหม่ มีการพัฒนาคุณภาพชีวิตและส่งเสริมความผูกพันในองค์กร โดยการออกแบบกิจกรรมที่เหมาะสมและสอดคล้องกับรูปแบบการปฏิบัติราชการที่เปลี่ยนแปลงไปและมีการรักษาวินัยและเสริมสร้างจริยธรรมที่เหมาะสมและสอดคล้องกับวิถีชีวิตและการทำงานรูปแบบใหม่ เพื่อให้บุคลากรยังคงสามารถปฏิบัติงานได้อย่างมีประสิทธิภาพ ตอบสนองต่อภารกิจของหน่วยงานได้อย่างเต็มที่ และดำรงตนให้สมเกียรติและหน้าที่ของการเป็นเจ้าหน้าที่ของรัฐ โดยเจ้าหน้าที่ที่ปฏิบัติงานนอกสถานที่ตั้งพึงต้องอุทิศเวลาในการทำงานให้แก่หน่วยงาน รักษาภาพลักษณ์ความเป็นเจ้าหน้าที่ของรัฐ การเลือกปฏิบัติงานในสถานที่ที่มีความเหมาะสม ไม่ละทิ้งหรือทอดทิ้งหน้าที่ราชการ และรักษาความลับของทางราชการ
VIVID CHAO PHRAYA เริ่มตั้งแต่ 12 - 27 พ.ย. - 5 ธ.ค.65 LINK
VIVID CHAO PHRAYA
เริ่มตั้งแต่ 12 - 27 พฤศจิกายน - 5 ธันวาคม 2565
สถานที่ สะพานพระราม 8 l ป้อมวิไชยประสิทธิ์ l วัดกัลยาณมิตรฯ l สะพานพระพุทธยอดฟ้า l RIVER CITY l ICON SIAM
.
การท่องเที่ยวแห่งประเทศไทย ร่วมกับหน่วยงานพันธมิตรทั้งภาครัฐและภาคเอกชน อาทิ กรุงเทพมหานคร, กองทัพเรือ, มูลนิธิอนุรักษ์โบราณสถานในพระราชวังเดิม, กรมทางหลวงชนบท, วัดกัลยาณมิตร วรมหาวิหาร, ศูนย์การค้าริเวอร์ ซิตี้ แบงค็อก, ไอคอนสยาม จัดกิจกรรม “VIVID CHAO PHRAYA”
.
ซึ่ง “VIVID CHAO PHRAYA” เป็นปรากฎการณ์แห่งแสงสีสุดยิ่งใหญ่ริมแม่น้ำเจ้าพระยา เพื่อส่งเสริมการท่องเที่ยวในพื้นที่กรุงเทพมหานคร และสร้างบรรยากาศและสีสันให้กับแม่น้ำเจ้าพระยาด้วยแสงไฟและการแสดงทางวัฒนธรรมในยามค่ำคืน เพื่อต้อนรับนักท่องเที่ยวชาวต่างประเทศที่เข้ามาท่องเที่ยวในช่วง High Season และผู้เข้าร่วมการประชุมผู้นำเขตเศรษฐกิจเอเปก ซึ่งจะเป็นการสร้างภาพลักษณ์ที่ดีให้กับประเทศพร้อมทั้งขยายเวลาการท่องเที่ยวในช่วงเวลากลางคืน โดยจะเป็นการสร้างโอกาสทางธุรกิจให้กับผู้ประกอบการท่องเที่ยวและธุรกิจเกี่ยวเนื่องที่ตั้งอยู่ในพื้นที่การจัดกิจกรรม โดยกิจกรรมจะจัดขึ้นระหว่างวันที่ 12-27 พฤศจิกายน 2565 บริเวณริมแม่น้ำเจ้าพระยา
*ทีมแพทย์สาธิตการดูแลผู้ป่วยวิกฤตร่วมกับทีมสหสาขาวิชาชีพ ปธน.ตุรกี ประกาศภาวะฉุกเฉินใน 10 จังหวัด LINK
ปธน.ตุรกี ใช้อำนาจตามมาตรา 119 ของรัฐธรรมนูญตุรกี ประกาศภาวะฉุกเฉินใน 10 จังหวัดที่ประสบเหตุแผ่นดินไหว เป็นเวลา 3 เดือน โดยรัฐบาลจะเร่งดำเนินกระบวนการทางรัฐสภาเพื่อให้คำสั่งมีผลสมบูรณ์โดยเร็วที่สุด
ปธน.ระบุในแถลงการณ์ ถึงจำนวนผุ้เสียชีวิตไม่ต่ำกว่า 3,549 ราย บาดเจ็บ 22,168 ราย มีประชาชนได้รับความช่วยเหลือกว่า 8,000 ราย
เมืองมีนถิ่นทอง เราสองรักนิรันดร์@สำนักงานเขตมีนบุรี LINK
"เมืองมีนถิ่นทอง เราสองรักนิรันดร์" สำนักงานเขตมีนบุรี ชวนคู่รักจดทะเบียนสมรส วันวาเลนไทน์ แม้ไม่ใช่คู่สมรส ก็ขอเชิญมาแวะถ่ายรูปได้จร้า ในวันที่ 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00 -16.00 น. กับบรรยากาศไทยย้อนยุค จดทะเบียนสมรส บนอาคารเรือนไม้ศาลาว่าการจังหวัดมีนบุรีเก่า (พิพิธภัณฑ์ท้องถิ่นเมืองมีนบุรี)
-รับสิทธิ์จับสลากลุ้นรางวัลใหญ่ และของขวัญของที่ระลึกมากมาย (จับรางวัลใหญ่เวลา 10.00 น. และ 14.00 น.)
-เชิญชวนสวมชุดไทย ถ่ายรูปในบรรยากาศเรือนไม้โบราณ มีจุดเช็คอิน และมุมสวยๆ เพียบ
-บริการถ่ายรูปคู่สมรส และปริ้นให้ฟรี (คู่ละ 1 ภาพ)
เปิดจองคิวออนไลน์ตั้งแต่วันนี้ - 12 ก.พ.2566 (หากครบตามจำนวนจะปิดรับลงทะเบียน) ในช่องทาง QR Code หรือตามลิงค์นี้ https://forms.gle/v338stKujb13xN6C6
หมายเหตุ : คู่สมรสที่จองคิวผ่านแอพพลิเคชั่น BMAQ ไว้แล้ว ไม่ต้องจองคิวซ้ำนะจ๊ะ เจ้าหน้าที่รับจองเรียบร้อยแล้วจ่ะ
สำนักงานเขตมีนบุรี จัดกิจกรรมจดทะเบียนสมรสวันที่ 14 กุมภาพันธ์ 2566 ในชื่องาน "เมืองมีนถิ่นทอง เราสองรักนิรันดร์" ทั้งนี้ เพื่อเป็นการส่งเสริมสถาบันครอบครัว ซึ่งเป็นพื้นฐานของความมั่นคงในชีวิต และส่งเสริมให้ประชาชนตระหนักถึงความสำคัญของการจดทะเบียนสมรสให้ถูกต้องตามกฎหมาย
โดยในปีนี้กำหนดจัดกิจกรรม จดทะเบียนสมรส บริเวณพิพิธภัณฑ์ท้องถิ่นเมืองมีนบุรี (อาคารไม้ศาลาว่าการจังหวัดมีนบุรีเก่า) ตั้งแต่เวลา 08.00-16.00 น.
คู่รักที่มาจดทะเบียนสมรสภายในงาน มีสิทธิ์ร่วมลุ้นจับสลาก รับของรางวัลใหญ่ โดยจับรางวัล 2 รอบ คือ เวลา 10.00 น. และ 14.00 น. ทั้งนี้ คู่รักทุกคู่จะได้รับของที่ระลึกมากมาย มีบริการนำชมพิพิธภัณฑ์ท้องถิ่นเมืองมีนบุรี มีการจัดมุมถ่ายรูป ให้ทุกคู่รักได้เก็บบรรยากาศสวยๆหลายจุด
ที่สำคัญ มีบริการถ่ายรูปคู่รักและปริ้นให้ฟรี คู่ละ 1 รูป ด้วยนร้า
สำหรับคู่รักที่สนใจจดทะเบียนสมรสภายในงาน “เมืองมีนถิ่นทอง เราสองรักนิรันดร์” สามารถจองคิวล่วงหน้าผ่านระบบออนไลน์ ด้วยการสแกน QR Code ได้ตั้งแต่วันนี้ -12 กุมภาพันธ์ 2566 (จำนวนจำกัด) หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตมีนบุรี โทร. 02-5407155
รักหวานชื่น...ยั่งยืนที่ลาดพร้าว LINK
เขตลาดพร้าว เชิญชวนคู่รัก จดทะเบียนสมรสในวันแห่งความรัก "รักหวานชื่น...ยั่งยืนที่ลาดพร้าว" วันที่ 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00 – 16.00 น. ณ ฝ่ายทะเบียน ชั้น 1 สำนักงานเขตลาดพร้าว
งานนี้รับของขวัญ ฟรี! แถมมีมุมถ่ายภาพสวยๆ รอให้คู่รักมาถ่ายภาพประทับใจในวันสำคัญกันอีกด้วย สอบถามรายละเอียดเพิ่มเติม ได้ที่ฝ่ายทะเบียน โทรศัพท์หมายเลข 02-5386702
เพิ่มยอดบริจาคอวัยวะเชิงรุก ถามทุกครั้งที่ทำบัตรประจำตัวประชาชน
ปัญหา
ปัจจุบัน ผู้ป่วยประสบปัญหาความล่าช้าและยุ่งยากในการส่งต่อผู้ป่วยไปสถานพยาบาลที่มีความพร้อมในการรักษา และการหาเตียงในโรงพยาบาลของรัฐ เนื่องจากโรงพยาบาลรัฐหลาย ๆ แห่งมักเตียงเต็ม ปัญหาดังกล่าวเกิดจากการเชื่อมต่อข้อมูลการรักษาของผู้ป่วย และจำนวนเตียงของโรงพยาบาล ที่ขาดการเชื่อมโยงข้อมูลระหว่างกัน
นอกจากนี้การบริจาคอวัยวะของคนไทยยังอยู่ในระดับต่ำ ซึ่งเป็นข้อจำกัดในการเปลี่ยนถ่ายอวัยวะกับผู้ป่วยที่ต้องการเปลี่ยนอวัยวะเพื่อต่อชีวิตของตัวเอง
ข้อเสนอ
กำหนดให้เพิ่มคำถามเรื่อง “การบริจาคอวัยวะ” ทุกครั้งที่ทำบัตรประจำตัวประชาชน และบันทึกข้อมูลลงในชิปบัตรประจำตัวประชาชน เพื่อให้ง่ายต่อการตรวจสอบเมื่อผู้บริจาคอวัยวะเสียชีวิต
บำรุงราษฎร์สามารถให้บริการปลูกถ่ายกระจกตาได้ - รศ. พญ. งามจิตต์ เกษตรสุวรรณ


รศ. พญ. งามจิตต์ เกษตรสุวรรณ ประธานชมรมกระจกตาและการแก้ไขสายตาแห่งประเทศไทย และจักษุแพทย์เฉพาะทางโรคกระจกตา โรงพยาบาลบำรุงราษฎร์ ให้ข้อมูลเพิ่มเติมว่าการที่บำรุงราษฎร์สามารถให้บริการปลูกถ่ายกระจกตาได้ ถือเป็นอีกบทพิสูจน์ถึงความพร้อมในทุกมิติของศูนย์จักษุ เพราะก่อนที่คนไข้จะปลูกถ่ายกระจกตาได้นั้น แพทย์ต้องมีการซักประวัติและตรวจสุขภาพผู้ป่วยอย่างละเอียด ตรวจสุขภาพตาเพื่อเตรียมความพร้อมก่อนปลูกถ่ายกระจกตา เช่น ต้องดูว่ามีภาวะต้อหิน ดูประสาทตาและจอตา ความดันลูกตา มีตาแดง มีการติดเชื้อหรือไม่ ต้องเตรียมสภาพผิวตาให้มีความพร้อมที่จะปลูกถ่ายกระจกตา เนื่องจากการอักเสบต่าง ๆ จะกระตุ้นให้เกิดการต่อต้านของเนื้อเยื่อได้ ซึ่งต้องอาศัยการทำงานที่สอดประสานกันของจักษุแพทย์เกือบทุกแขนง และต้องปรึกษาร่วมกันในแต่ละรายว่าสามารถผ่าตัดปลูกถ่ายกระจกตาได้หรือไม่ ที่สำคัญ บำรุงราษฎร์มีการทำงานร่วมกับศูนย์ดวงตาสภากาชาดไทย และศูนย์ดวงตานำเข้าจากต่างประเทศที่ได้การรับรองมาตรฐานขั้นสูง โดยมีการตรวจสอบคุณภาพกระจกตาที่จะนำมาเปลี่ยนให้กับผู้ป่วย มีความใส คุณภาพดี ไม่มีโรคที่อาจเกิดขึ้นกับดวงตาภายหลังการผ่าตัด
ศูนย์จักษุ โรงพยาบาลบำรุงราษฎร์ สามารถทำการรักษาโรคกระจกตาเสื่อมและต้อกระจกได้ในการผ่าตัดครั้งเดียวกัน ซึ่งผู้ป่วยลักษณะนี้ถ้าทำการรักษาแบบผู้ป่วยต้อกระจกทั่วไป อาจจะทำให้กระจกตาเสียได้ ดังนั้น ก่อนการรักษาแพทย์จะวางแผนร่วมกันและวิเคราะห์ผู้ป่วยแต่ละรายว่าเหมาะสมกับการรักษาพร้อมกันหรือไม่ โดยแพทย์จะอธิบายถึงวิธีการรักษาและให้ผู้ป่วยเป็นผู้ตัดสินใจว่าต้องการรักษาแบบใด ปัจจุบันมีโรงพยาบาลเอกชนเพียงไม่กี่แห่งที่สามารถทำหัตถการได้พร้อมกันถึง 2 โรค ซึ่งต้องอาศัยความชำนาญการและประสบการณ์ของแพทย์อย่างมาก ทั้งนี้แพทย์แต่ละแขนงต้องทำงานร่วมกันได้แบบไร้รอยต่อจริงๆ
สุราขุมชนลุงนิด เชียงราย LINK
สุราขุมชนลุงนิด จังหวัดเชียงราย ปัจจุบันพี่ตั้มเป็นผู้รับช่วงต่อการดำเนินการครับ โดยใช้ชื่อแบรนด์ลุงนิดไว้ เพื่อระลึกถึงพ่อแฟนที่เสียไปเลยตั้งแบรนด์เป็นชื่อของพ่อ “ลุงนิด” มีด้วยการ 3 แบบ อนาคตจะพัฒนา เป็นตัวพรีเมี่ยม
ข้อมูลและภาพจาก
Local Spiritเรื่องจากผู้ประสบเหตุเมื่อปี 2019
Dhanapat Koomsalud รู้สึกผิดหวังที่ Donmuang International Airport สนามบินดอนเมือง
มีเรื่องมาเล่า มาเตือนฮะ...
เมื่อวันที่ 30 กรกฎาคม 2562 ที่ผ่านมา ผมได้บินกลับมาจากโอซาก้า ไฟล์ทกลางคืน กลับมากับครอบครัว โดยบินมาลงที่สนามบินดอนเมืองประมาณ 3.50 น. พอเครื่องจอดก็เดินลงมาปกติ (จำไม่ได้แน่ชัดว่าลงมาที่เกทไหน) หลังจากเดินออกมาจากงวงแล้ว ก็เดินตามทางมาเรื่อยๆ ซึ่งระหว่างทางก็จะมีทางเลื่อนเป็นระยะๆ ก็เดินตามทางเลื่อนปกติคับ
จนเดินมาถึงทางเลื่อนอันหนึ่ง ผมก็เดินเข้าไปปกติ แต่พอสุดทาง กำลังจะก้าวเดินออกไป ก็รู้สึกว่ามีแรงดึงรองเท้าจากพื้นทางเลื่อนให้ติดอยู่กับทางเลื่อน ดึงขนาดว่าไม่สามารถยกเท้าออกมาได้ ไอ้เราก็พยายามดึงอยู่อึดใจนึง ไม่รู้ว่ารองเท้าติดอะไร จนคนเดินตามมาเริ่มมอง ว่าไอ้นี่หยุดเดินทำไม พี่สาวผมก็หันมามองว่า ทำไมผมไม่เดินต่อ ตอนนั้นผมเห็นท่าไม่ดีแล้ว เพราะดึงเท้าไม่ขึ้นจริงๆ จึงตัดสินใจถอดรองเท้าเลย ซึ่งจังหวะที่ถอดรองเท้านั่นเอง รองเท้าก็ถูกทางเลื่อนดูดหายวับไปกับตาเข้าไปด้านในทันที!! คือตกใจมากคับ พอสติกลับมา ผมก็มามองดู ก็พบว่าตัวป้องกันที่เป็นซี่ๆ ตรงปลายทางเลื่อนนั้นชำรุดอยู่ จึงเป็นเหตุให้รองเท้าผมโดนทางเลื่อนดูดเข้าไป
หลังจากนั้นพี่สาวผมก็รีบไปตามเจ้าหน้าที่มาเพื่อทำการปิดการทำงานของทางเลื่อน และเปิดฝาทางเลื่อนออก เพื่อดูว่ารองเท้าผมเข้าไปติดอยู่ข้างใต้อย่างไร สภาพก็เป็นอย่างที่เห็น... เละครับ ไม่อยากจะคิดว่า ถ้าผมดึงเท้าออกช้าเพียงเสี้ยววินาที หรือ ใส่รองเท้าที่ไม่สามารถถอดได้ง่ายๆ เท้าผม ขาผม อาจจะโดนดูดเข้าไปในทางเลื่อนเรียบร้อยแล้วก็ได้ครับ
หลังจากเจ้าหน้าที่เอารองเท้าขึ้นมาให้แล้ว เจ้าหน้าที่ก็บอกว่าให้ผมไปแจ้งกับประชาสัมพันธ์ว่าเกิดเหตุนี้ เพื่อจะให้ทางสนามบินรับผิดชอบสิ่งที่เกิดขึ้น พอไปถึงประชาสัมพันธ์ เค้าก็แจ้งว่าให้เขียนสิ่งที่เกิดขึ้นในใบรับความคิดเห็น นี่คือวิธีคอมเพลนวิธีเดียว (พนักงานก็ดูเต็มใจมากกก.. พอเข้าใจนะ มันประมาณตี 4 น้องอาจจะมึนๆ เบลอๆ อยู่) ก็เขียนบรรยายเรื่องราว พร้อมทิ้งชื่อ และเบอร์ติดต่อไว้ครับ
ซึ่งหลังจากเกิดเหตุขึ้นในวันที่ 30 กรกฎาคม 62 นั้น ทางดอนเมืองก็มีส่ง SMS มา 1 ครั้งถ้วนในวันที่ 6 สิงหาคม 62 ว่าขออภัย จะตรวจสอบ และแจ้งกลับอีกที จนวันนี้ 27 สิงหาคม 62 เกือบเดือนละครับ ทุกอย่างก็ยังเงียบเชียบ... สงสัย ผมคงต้องทำใจละมั้งคับ
ก็เลยมาขอเตือนทุกคนไว้ด้วยละกันนะครับว่า เวลาเดินๆ ก็ระวังกันหน่อย ดูให้ดีๆ บางทีความผิดพลาดที่เกิดจากคนอื่น ก็อาจจะทำให้เราซวยได้เหมือนกัน
#สนามบินดอนเมือง #อุบัติเหตุ #ความซวยยามเช้า
====================
ขออัพเดตเพิ่มเติมครับ เนื่องจากมีเหตุการณ์คล้ายๆ กันเกิดขึ้นในวันที่ 29/6/66 ครับ
หลังจากโพสต์นี้ออกไป วันที่ 27/8/62 ผมได้รับการติดต่อจากทางดอนเมือง และมีการนัดคุยกัน วันที่ 29/8/62 ครับ
ซึ่งสิ่งที่ผมได้แจ้งทางดอนเมืองไปคือ เหตุที่เกิดขึ้น ส่วนนึงก็มาจากรองเท้าที่ผมใส่ด้วย ด้วยความที่รองเท้าเป็นยาง จึงมีโอกาสถูกดูดเข้าไปสูงครับ แต่สิ่งที่ผมอยากให้ปรับปรุงคือ ผมอยากให้มีการดูแลและปรับปรุงอุปกรณ์ต่างๆ ให้ดีขึ้น เพิ่มความปลอดภัยมากขึ้น และ ขอให้เพิ่มความรวดเร็วในการช่วยเหลือ ช่องทางการดูแล การร้องเรียน ต้องดีกว่านี้ ทันท่วงทีกว่านี้ครับ
ในส่วนของการเยียวยา ทางดอนเมืองได้ให้กระเช้าผลไม้กระเช้าซุปไก่ และ ชุด souvenir ผ้าห่มดอนเมือง และจ่ายเงินชดเชยค่ารองเท้าที่เสียหายมาให้ครับ
อย่างไรในครั้งนี้ผมขอแสดงความเสียใจกับผู้ประสบเหตุด้วยนะครับ และหวังว่าจะไม่มีครั้งต่อไปครับผม
Starbucks Coffee workshop #1 #2 #3 LINK
WORKSHOP #1 Espresso Deconstruction
ระยะเวลาในการทำกิจกรรม: 1.30 ชั่วโมง (2,500 บาท)
เรียนรู้และเข้าใจหัวใจหลักของการทำเครื่องดื่มเอสเพรสโซ่ รสชาติอันเป็นเอกลักษณ์ของสตาร์บัคส์ โดยผู้เชี่ยวชาญ ด้านกาแฟของเรา ในคอร์สนี้ลูกค้าจะได้เรียนรู้ :
- องค์ประกอบหลักสำคัญของการรังสรรค์เครื่องดื่มเอสเพรสโซ่ เช่น เมล็ดกาแฟ เครื่องชง และอุปกรณ์ที่ใช้
- เข้าใจเทคนิคสูตรเฉพาะและความแตกต่างของการทำเครื่องดื่ม Latte และ Cappuccino เพื่อรังสรรค์เครื่องดื่มเอสเพรสโซ่แก้วโปรด ให้ได้รสชาติที่ชื่นชอบ
WORKSHOP #2 Aroma Flavor and Perfect Pairing
ระยะเวลาในการทำกิจกรรม : 1.30 ชั่วโมง (3,000 บาท)
ผู้เชี่ยวชาญด้านกาแฟของสตาร์บัคส์จะนำทุกท่านเดินทาง เข้าสู่โลกของกาแฟสตาร์บัคส์ผ่านการใช้ประสาทสัมผัส ทั้ง 5 ในคอร์สนี้ลูกค้าจะได้เรียนรู้ :
- Aroma Lab เรียนรู้การแยกกลิ่นอันเป็นเอกลักษณ์ต่าง ๆ ที่จะพบได้ในกาแฟ
- ฝึกการชิมและแยกรสชาติของกาแฟจากภูมิภาคต่าง ๆ ทั้งจากละตินอเมริกา แอฟริกา อาระเบีย และเอเชีย แปซิฟิก
- เข้าใจวิธีการเลือกรสชาติของขนมที่มีส่วนในการส่งเสริมรสชาติของกาแฟจากแต่ละภูมิภาค
WORKSHOP #3 Hand Brew
ระยะเวลาในการทำกิจกรรม: 2.30 ชั่วโมง (3,500 บาท)
ผู้เชี่ยวชาญด้านกาแฟของเราจะนำทุกท่านเรียนรู้เรื่องราว ของกาแฟจากแหล่งเพาะปลูกต่าง ๆ รวมถึงเทคนิควิธี การชง และการชิมกาแฟจากเครื่องชงหลากหลายประเภท ในคอร์สนี้ลูกค้าจะได้เรียนรู้ :
- เรื่องราวและรสชาติอันเป็นเอกลักษณ์ของกาแฟจากหลากหลายพื้นที่แหล่งเพาะปลูก
- หลักสำคัญ และเทคนิคการชงกาแฟให้ได้รสชาติเยี่ยม
- ฝึกชงกาแฟจากเครื่องชงประเภทต่าง ๆ ทั้ง Pour Over Cone Brew, Chemex และ Syphon
- ชิมและแยกแยะรสชาติกาแฟที่ชงจากเครื่องชงประเภทต่าง ๆ
For more information and reservation, please contact Starbucks
Central World, 5th floor (Atrium Zone)
reachable at 065-521-3418
Starbucks ReserveTM Chao Phraya Riverfront
ICONSIAM 7th FL at 065-526-2819
8 สิงหาคม 2566 จังหวัดชลบุรี เทศบาลเมืองศรีราชา ร่วมกับ ปศุสัตว์อำเภอศรีราชา จัดกิจกรรมบริการทำหมันสุนัขและแมว ประจำปี 2566 โดยมีนายประภัส เจริญสันติสุข รองนายกเทศมนตรีเมืองศรีราชา เจ้าหน้าที่กองสาธารณสุขและสิ่งแวดล้อมเทศบาลเมืองศรีราชา และเจ้าหน้าที่ปศุสัตว์อำเภอศรีราชา เข้าร่วมกิจกรรมให้บริการทำหมันสุนัขและแมว ให้แก่ประชาชนในเขตเทศบาล ซึ่งมีประชาชนนำสัตว์เลี้ยง เข้ามารับบริการเป็นจำนวนมาก ณ บริเวณด้านหน้าอนุสาวรีย์ท่านจอมพลและมหาอำมาตย์เอกเจ้าพระยาสุรศักดิ์มนตรี
29 พฤษภาคม 2566 จังหวัดชลบุรีเทศบาลเมืองอ่างศิลา ร่วมกับ คณะสัตวแพทย์ศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย พร้อมด้วยเครือข่ายป้องกันและควบคุมโรค กองสาธารณสุข อบจ.ชลบุรี ให้ความรู้แก่ประชาชนในเขตเทศบาลเมืองอ่างศิลา ที่ลงทะเบียนเข้าร่วมโครงการเฝ้าระวังและป้องกันแก้ไขปัญหาสุนัขและแมว ประจำปี 2566 (รุ่นที่ 2) ที่อาคารอเนกประสงค์เทศบาลเมืองอ่างศิลา (วัดอ่างศิลา) ซึ่งมีการประชุมเชิงปฏิบัติการ กิจกรรมผ่าตัดทำหมันให้กับสุนัขและแมว โดยไม่คิดค่าใช้จ่าย เพื่อควบคุมจำนวนประชากรสุนัขและแมว และกำจัดโรคพิษสุนัขบ้าให้หมดไปอย่างยั่งยืน โดยมีนายมนูญ วิวรรณ ปลัดเทศบาลเมืองอ่างศิลา พร้อมด้วยนายสมาน นภาโชติ ประธานสภาเทศบาลเมืองอ่างศิลา สมาชิกสภาเทศบาลเมืองอ่างศิลา และหัวหน้าส่วนราชการ ร่วมอำนวยความสะดวกให้กับประชาชน โครงการเฝ้าระวังและป้องกันแก้ไขปัญหาสุนัขและแมว ประจำปี 2566 (รุ่นที่ 2) กำหนดจัดขึ้นระหว่างวันที่ 29 – 30 พฤษภาคม 2566 ซึ่งทางคณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ได้นำบุคลากรผู้เชี่ยวชาญและเครื่องมืออุปกรณ์ที่ทันสมัยให้บริการผ่าตัดทำหมันสุนัขและแมวในเขตพื้นที่เทศบาลเมืองอ่างศิลา พร้อมทั้งให้ความรู้แก่เจ้าของสุนัขและแมว การสาธิตการดูแลควบคุมจำนวนประชากรสุนัขและแมว
7 กันยายน 2566 จังหวัดแพร่ ปศุสัตว์จังหวัดแพร่ นำทีมเจ้าหน้าที่สำนักงานปศุสัตว์จังหวัดแพร่ และสำนักงานปศุสัตว์อำเภอเมืองแพร่ ดำเนินการบริการผ่าตัดทำหมัน โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระราชปณิธานฯ ร่วมให้บริการผ่าตัดทำหมัน ให้คำปรึกษาเกี่ยวกับการเลี้ยงสัตว์ พร้อมด้วยเจ้าหน้าที่ทุกอำเภอ บูรณาการร่วมกับเทศบาลตำบลป่าแมต นายสุภวัฒน์ ศุภศิริ นายกเทศมนตรีตำบลป่าแมต พร้อมนำพนักงานเจ้าหน้าที่ ร่วมบูรณาการผ่าตัดทำหมัน สุนัขและแมวในพื้นที่เทศบาลตำบลป่าแมต รวมจำนวน 56 ตัว ณ เทศบาลตำบลป่าแมต อำเภอเมืองแพร่ จังหวัดแพร่
7 กันยายน 2566 จังหวัดลำพูน เปิดโครงการวันป้องกันโรคพิษสุนัขบ้าโลก ปี พ.ศ.2566 ณ ห้องประชุมศาลาประชาคม เทศบาลตำบลบ้านกลาง อำเภอเมือง จังหวัดลำพูน จัดโดยสำนักงานปศุสัตว์จังหวัดลำพูน ร่วมกับ เทศบาลตำบลบ้านกลาง ภายใต้หัวข้อ “All for 1 - One Health for all” ภายใต้แผนยุทธศาสตร์การดำเนินโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าตามพระปณิธานฯ กิจกรรมประกอบด้วย การมอบประกาศนียบัตรการรับรองพื้นที่ปลอดโรคพิษสุนัขบ้า ระดับอำเภอ ให้แก่ นายอำเภอแม่ทา และองค์กรปกครองส่วนท้องถิ่นในพื้นที่อำเภอแม่ทาจำนวน 8 แห่ง ร่วมรับมอบ, การมอบประกาศนียบัตรให้แก่หน่วยงานระดับท้องถิ่นที่มีผลงานดีเด่นเป็นที่ประจักษ์ด้านการป้องกันควบคุมโรคพิษสุนัขบ้า ประจำปี พ.ศ.2566 (Thailand Rabies Awards 2023) ระดับเขต ดังนี้ รางวัลชนะเลิศระดับองค์การบริหารส่วนตำบล ได้แก่ องค์การบริหารส่วนตำบลทาแม่ลอบ อำเภอแม่ทา จังหวัดลำพูน และรางวัลรองชนะเลิศระดับเทศบาล ได้แก่ เทศบาลตำบลทาสบเส้า อำเภอแม่ทา จังหวัดลำพูน นอกจากนี้ยังมีการให้บริการผ่าตัดทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สุนัขและแมว ไปจนถึงการประชาสัมพันธ์ให้ความรู้เรื่องโรคพิษสุนัขบ้าให้กับนักเรียน และส่งเสริมให้ประชาชนเลี้ยงสุนัขและแมวอย่างถูกวิธีและมีความรับผิดชอบ โดยมีหัวหน้าส่วนราชการจังหวัดลำพูน พนักงานเจ้าหน้าที่เทศบาล คณะครูและนักเรียนโรงเรียนเทศบาล 1 บ้านกลาง ปศุสัตว์จังหวัดลำพูน และผู้แทนจากองค์กรปกครองส่วนท้องถิ่นในจังหวัดลำพูน เข้าร่วมโครงการในครั้งนี้
จำนวนนักท่องเที่ยวสะสม ณ วันที่ 1 มกราคม - 24 กันยายน 2566
ทำอย่างไรดี เมื่อมีเหตุจรวดโจมตีจากทางเหนือของอิสราเอล
ตามที่ได้เกิดเหตุการณ์การโจมตีจากทางภาคเหนือของอิสราเอล นั้น สถานเอกอัครราชทูตฯ ขอแนะนำแนวทางปฏิบัติตน ดังนี้
1. ดาวน์โหลดแอพ Pikud Haoref ของกองทัพในโทรศัพท์มือถือ เปิดโลเคชั่น เปลี่ยนเป็นภาษาอังกฤษ
2. เตรียมหาที่หลบภัยใกล้บ้าน ทดลองจับเวลาจากบ้านไปยังที่หลบภัย
3. เมื่อเสียงไซเรนดังขึ้น ให้รีบไปยังที่หลบภัยทันที และรอจนเสียงไซเรนหยุดลงจึงออกจากที่หลบภัย
4. หากเสียงไซเรนดังขณะที่อยู่นอกบ้าน ให้รีบไปยังบ้านใกล้เคียงเพื่อขอเข้าที่หลบภัย หรือหลบใกล้กำแพง หรือนอนราบบนพื้นโดยใช้มือป้องกันศีรษะ
5. หากอยู่ในอาคาร ให้ทำตามข้อแนะนำของเจ้าหน้าที่
6. หากอยู่ในรถ ให้หยุดรถและออกจากรถทันทีเพื่อไปยังที่หลบภัยที่ใกล้ที่สุด หรือหมอบราบบนพื้นหญ้าข้างทาง (อย่าหมอบราบบนถนน)
7. หากเสียงไซเรนดังขณะอยู่บ้าน ให้เข้าห้องหลบภัยโดยด่วน หรือหากไม่มีให้ไปขอใช้ห้องหลบภัยของเพื่อนบ้าน หรือหลบหลังบันได หากอยู่ชั้นสูงในอาคารที่พัก ให้ลงมาชั้นที่ต่ำกว่า
8. ในห้องหลบภัยควรเตรียมน้ำ ยา ที่ชาร์จโทรศัพท์ ฟูก และสิ่งจำเป็นอื่นๆ ให้พร้อม และเมื่อเสียงไซเรนดังขึ้น ให้รีบเข้าห้องหลบภัยโดยนำโทรศัพท์ติดตัวไปด้วย ปิดหน้าต่างเหล็กห้องนิรภัย และล็อคประตูให้เรียบร้อย
ด้วยความห่วงใย จากสถานเอกอัครราชทูต ณ กรุงเทลอาวีฟ
ยุทธศาสตร์ที่ 6 : ด้านการปรับสมดุลและพัฒนาระบบการบริหารจัดการภาครัฐ
รัฐบาลได้จัดสรรงบประมาณรายจ่าย จำนวน 604,804.5 ล้านบาท คิดเป็นร้อยละ 17.4 ของวงเงินงบประมาณ เพื่อให้ระบบการบริหารราชการมีประสิทธิภาพและประสิทธิผล มุ่งผลสัมฤทธิ์และผลประโยชน์ส่วนรวม จำแนกตามแผนงานสำคัญ ดังนี้
1) การต่อต้านการทุจริตและประพฤติมิชอบ งบประมาณ 754.0 ล้านบาท เพื่อลดปัญหาการทุจริตในสังคมไทย โดยมีค่าเป้าหมายค่าดัชนีการรับรู้การทุจริต (Corruption Perceptions index : CPI) อยู่ในอันดับ 1 ใน 51 และ/หรือได้คะแนนไม่ต่ำกว่า 53 คะแนน และคะแนนเฉลี่ยการประเมินคุณธรรมและความโปร่งใส (Integrity and Transparency Assessment : ITA) ของหน่วยงานภาครัฐทุกหน่วยงานในประเทศไทย ไม่น้อยกว่า 89 คะแนน ผ่านการปลูกจิตสำนึก และสร้างค่านิยมให้ทุกภาคส่วนตระหนักรู้ในเรื่องความซื่อสัตย์สุจริต คุณธรรม จริยธรรม และใช้หลักธรรมาภิบาลในการบริหารองค์กร ปรับปรุงกฎหมายและการบังคับใช้กฎหมายอย่างเข้มงวดและเป็นธรรม รวมทั้งให้ประชาชนมีส่วนร่วมในการป้องกัน ปราบปรามการทุจริตและประพฤติมิชอบ เพื่อให้สังคมไทยมีภาพลักษณ์ความซื่อสัตย์สุจริตดีขึ้น มีความโปร่งใสและตรวจสอบได้
2) รัฐบาลดิจิทัล งบประมาณ 3,029.6 ล้านบาท เพื่อพัฒนารูปแบบการให้บริการภาครัฐผ่านการนําเทคโนโลยีดิจิทัลมาประยุกต์ใช้อย่างคุ้มค่า โดยยกระดับการเปลี่ยนผ่านดิจิทัลภาครัฐให้ยืดหยุ่นคล่องตัว มีการบริหารงานอย่างมีประสิทธิภาพด้วยการพัฒนาทักษะบุคลากรภาครัฐ ไม่น้อยกว่า 100,000 คน พัฒนาโครงสร้างพื้นฐานด้านดิจิทัลโดยให้บริการระบบคลาวด์กลางภาครัฐ ไม่น้อยกว่า 40,000 VM (Virtual Machine) สนับสนุนการพัฒนาแพลตฟอร์มหรือเครื่องมือดิจิทัลกลางภาครัฐเพื่อเชื่อมโยงและแบ่งปันข้อมูลระหว่างหน่วยงานของรัฐ อย่างน้อย 16 แพลตฟอร์ม ให้เป็นไปตามความต้องการของประชาชน ภาคธุรกิจ และผู้ใช้บริการ ตลอดจนจัดตั้งทีมรับมือเหตุฉุกเฉินทางคอมพิวเตอร์ในด้านบริการภาครัฐ ด้านพลังงานสาธารณูปโภค และด้านสาธารณสุข เพื่อป้องกันและลดความเสี่ยงจากภัยคุกคามทางไซเบอร์อย่างมีประสิทธิภาพ ปรับปรุงระบบการอนุมัติและอนุญาตของภาครัฐ พัฒนาระบบจัดเก็บและเปิดเผยข้อมูลภาครัฐ เพื่อยกระดับการพัฒนาภาครัฐสู่การเป็นรัฐบาลดิจิทัล
3) การพัฒนากฎหมายและกระบวนการยุติธรรม งบประมาณ 17,774.2 ล้านบาท เพื่อทบทวน ปรับปรุง หรือยกเลิกกฎหมายที่หมดความจำเป็นหรือเป็นอุปสรรคในการพัฒนาประเทศ ให้สอดคล้องกับบริบทที่เปลี่ยนแปลงไป พัฒนากฎหมายและกระบวนการยุติธรรม และมาตรฐานและกลไกกำกับดูแลด้านดิจิทัลและปัญญาประดิษฐ์ เพื่อให้ประชาชนได้รับความยุติธรรมและคุ้มครองสิทธิและเสรีภาพ รวมทั้ง ควบคุมและพัฒนาพฤตินิสัยผู้ต้องขังอย่างมีประสิทธิภาพ เพื่อคืนคนดีสู่สังคม
4) การพัฒนาบริการประชาชนและการพัฒนาประสิทธิภาพภาครัฐ งบประมาณ 28,420.2 ล้านบาท เพื่อพัฒนาระบบอำนวยความสะดวกในการบริการภาครัฐให้สามารถติดต่อราชการโดยสะดวก รวดเร็ว โปร่งใส ลดค่าใช้จ่าย และตรวจสอบได้ รวมทั้งการบริหารจัดการด้านการเงิน การคลัง โดยเพิ่มประสิทธิภาพการจัดเก็บรายได้ ขยายฐานภาษี และการปรับปรุงระบบภาษีที่เหมาะสมกับสถานการณ์ทางเศรษฐกิจของประเทศ เพิ่มประสิทธิภาพในการบริหารจัดการหนี้สาธารณะให้เกิดความยั่งยืนทางการคลังในระยะยาว มีการปรับสมดุลภาครัฐโดยการปรับขนาดของภาครัฐให้เหมาะสมกับภารกิจ เสริมสร้างบทบาทของภาคส่วนอื่นๆ ตลอดจนสร้างบุคลากรภาครัฐให้เป็นคนดี มีคุณธรรม จริยธรรม มีจิตสำนึก และเป็นคนเก่ง มีความรู้ความสามารถ ควบคู่ไปกับการเสริมสร้างประสิทธิภาพและคุณภาพภายใต้หลักระบบคุณธรรม
5) การสนับสนุนด้านการปรับสมดุลและพัฒนาระบบการบริหารจัดการภาครัฐ งบประมาณ 425,212.6 ล้านบาท เพื่อสนับสนุนเป้าหมายยุทธศาสตร์ด้านการปรับสมดุลและพัฒนาระบบการบริหารจัดการภาครัฐ ตอบสนองความต้องการของประชาชนได้อย่างสะดวก รวดเร็ว โปร่งใส ปลอดการทุจริตและประพฤติมิชอบ สนับสนุนการดำเนินงานด้านนิติบัญญัติ รวมทั้ง ค่าใช้จ่ายตามสิทธิและประโยชน์ต่างๆ ของบุคลากรภาครัฐที่กำหนดไว้ในงบกลาง อาทิ เงินเบี้ยหวัด บำเหน็จ บำนาญ เงินเลื่อนเงินเดือนและเงินปรับวุฒิข้าราชการ เงินสำรอง เงินสมทบ เงินชดเชย และเงินช่วยเหลือของข้าราชการ ลูกจ้าง และพนักงานของรัฐ
6) การดำเนินงานภารกิจพื้นฐานและภารกิจอื่น งบประมาณ 21,241.5 ล้านบาท และค่าใช้จ่ายบุคลากรภาครัฐ งบประมาณ 108,372.4 ล้านบาท เพื่อสนับสนุนยุทธศาสตร์ด้านการปรับสมดุลและพัฒนาระบบการบริหารจัดการภาครัฐให้มีประสิทธิภาพและเกิดความคุ้มค่า ประชาชนได้รับความสะดวกและรวดเร็ว
ทั้งหมดนี้คือสิ่งที่เทศกาลงานออกแบบกรุงเทพฯ หรือ Bangkok Design Week พยายามขับเคลื่อนมาโดยตลอด ทุกภาคส่วนมาร่วมกันประกอบสร้างกรุงเทพฯ ให้เป็น ‘เมืองที่น่าอยู่’ กว่าที่เคย พร้อมกับกลุ่มผู้ขับเคลื่อนทั้ง 15 ย่าน 1) เจริญกรุง - ตลาดน้อย นักออกแบบ/นักสร้างสรรค์ และชุมชนคนในพื้นที่ 2) พระนคร โดยผู้ขับเคลื่อน ศูนย์มิตรเมือง (Urban Ally) กลุ่มนักออกแบบนักสร้างสรรค์ และชุมชนคนในพื้นที่ 3) ปากคลองตลาด โดยผู้ขับเคลื่อน Human of Flower Market by Arch SU และมนุษย์ปากคลองฯ 4) นางเลิ้ง โดยผู้ขับเคลื่อน Urban Studies lab และ Community Lab ชุมชนในย่านนางเลิ้ง 5) เยาวราช โดยผู้ขับเคลื่อน SATARANA (สาธารณะ) และชุมชนคนในพื้นที่ 6) หัวลำโพง โดยผู้ขับเคลื่อน RTUS-Bangkok (ริทัศน์บางกอก) 7) อารีย์ - ประดิพัทธ์ โดยผู้ขับเคลื่อน AriAround 8) บางโพ - เกียกกาย โดยผู้ขับเคลื่อน Bangpho Wood Street และ Creative Soul Studio 9) วงเวียนใหญ่ - ตลาดพลู โดยผู้ขับเคลื่อน คณะการออกแบบและสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศรีปทุม 10) เกษตรฯ - บางบัว โดยผู้ขับเคลื่อน คณะก่อการย่านเกษตร SC ASSET และมหาวิทยาลัยศรีปทุม (SPU) 11) พร้อมพงษ์ โดยผู้ขับเคลื่อน A49 & Friends 12) สยาม - ราชเทวี โดยผู้ขับเคลื่อน สถาบันอาศรมศิลป์ เครือข่ายนักพัฒนาเมือง และชุมชนบ้านครัว 13) บางกอกใหญ่ - วังเดิม โดยผู้ขับเคลื่อน บริษัท ครอส แอนด์ เฟรนด์ จำกัด และยังธน 14) พระโขนง - บางนา โดยผู้ขับเคลื่อน South Sukhumvit และ 15) บางมด โดยกลุ่มผู้ขับเคลื่อนย่านบางมด
ศูนย์การแพทย์แผนไทย
ศูนย์การแพทย์แผนไทย โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี พร้อมให้บริการการตรวจรักษาโรคด้วยศาสตร์แพทย์แผนไทย รักษาโรค
• กลุ่มอาการโรคปวดกล้ามเนื้อ
• กลุ่มอาการไอ เจ็บคอ
• ท้องอืด ท้องเฟ้อ ท้องผูก
• ไมเกรน หวัด ภูมิแพ้
• ปวดเข่า
• นิ้วล้อก
• หัวไหล่ติด
• อัมพฤกษ์ อัมพาต
• ปวดท้องประจำเดือน
สถานที่ให้บริการ (แพทย์แผนไทย)
โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี ชั้น5
ติดต่อสอบถามและนัดหมาย
02-4326167-8 ต่อ 5010
064-6758391
(สามารถเบิกค่ารักษาพยาบาลได้ตามสิทธิการรักษา)
16.PEACE, JUSTICE AND STRONG INSTITUTIONS สันติภาพ ความยุติธรรม และสถาบันที่เข้มแข็ง
เราไม่สามารถหวังการพัฒนาอย่างยั่งยืนได้หากไม่มีสันติภาพ ความมั่นคง สิทธิมนุษยชน และการปกครองที่มีประสิทธิภาพ ซึ่งยึดหลักนิติธรรม แต่โลกของเรากลับแบ่งแยกกันมากขึ้น บางภูมิภาคมีสันติภาพ ความปลอดภัย และความเจริญรุ่งเรือง ในขณะที่บางภูมิภาคกลับตกอยู่ในวังวนแห่งความขัดแย้งและความรุนแรงที่ไม่มีวันสิ้นสุด ซึ่งสิ่งนี้ไม่ใช่สิ่งที่หลีกเลี่ยงไม่ได้และต้องได้รับการแก้ไข
ความรุนแรงและความไม่ปลอดภัยจากอาวุธส่งผลกระทบเชิงลบต่อการพัฒนาประเทศ ส่งผลต่อการเติบโตทางเศรษฐกิจ และมักส่งผลให้เกิดความไม่พอใจที่กินเวลานานหลายชั่วอายุคน ความรุนแรงทางเพศ อาชญากรรม การแสวงประโยชน์ และการทรมานยังเกิดขึ้นอย่างแพร่หลายในพื้นที่ที่มีความขัดแย้งหรือไม่มีหลักนิติธรรม และประเทศต่างๆ ต้องใช้มาตรการเพื่อปกป้องผู้ที่มีความเสี่ยงสูงสุด
เป้าหมายการพัฒนาที่ยั่งยืนมีเป้าหมายเพื่อลดความรุนแรงในทุกรูปแบบอย่างมีนัยสำคัญ และทำงานร่วมกับรัฐบาลและชุมชนเพื่อยุติความขัดแย้งและความไม่ปลอดภัย การส่งเสริมหลักนิติธรรมและสิทธิมนุษยชนเป็นกุญแจสำคัญของกระบวนการนี้ เช่นเดียวกับการลดการไหลเวียนของอาวุธผิดกฎหมายและการเสริมสร้างการมีส่วนร่วมของประเทศกำลังพัฒนาในสถาบันการปกครองระดับโลก
จะเห็นได้ว่าปัญหาและภาระที่คน Sandwich Generation ต้องเผชิญค่อนข้างหนักเมื่อเทียบกับ คนกลุ่มอื่น นอกจากจะส่งผลต่อตนเองแล้ว ยังอาจส่งผลกระทบต่อสังคมภาพรวมได้ จึงต้องมีแนวทางในการลดภาระ ที่จะเกิดขึ้นกับครัวเรือน Sandwich ดังนี้
1. การส่งเสริมทักษะทางการเงิน (Financial Literacy) ตั้งแต่ก่อนวัยเกษียณ ทั้งการมีทักษะความรู้ และการบริหารจัดการทางการเงิน รวมถึงการป้องกันความเสี่ยง อาทิ การออมเงินเพื่อยามเกษียณ ที่ควรเริ่มเก็บออม ตั้งแต่เนิ่น ๆ และในทุกช่วงวัย โดยเฉพาะแรงงานนอกระบบ ซึ่งอาจจูงใจให้เข้าร่วมกองทุนการออมแห่งชาติ ส่วนแรงงานในระบบ ควรมีรูปแบบการออมเพิ่มเติมนอกเหนือจากภาคบังคับ เพื่อลดปัญหาทางการเงินจากรุ่นสู่รุ่น รวมทั้งต้องส่งเสริมทักษะ การบริหารจัดการเมื่อมีหนี้สิน เพื่อให้สามารถปลดหนี้ได้เร็วหรือไม่ติดกับดักหนี้ และ การซื้อประกันสุขภาพและประกันชีวิต ส าหรับวางแผนเตรียมการดูแลคนในครอบครัวต่อไป และป้องกันเหตุฉุกเฉิน ไม่ว่าจากโรคภัยหรือจากอุบัติเหตุ ซึ่งการด าเนินการข้างต้น จะช่วยลดความกดดัน/ความตึงเครียดภายในครัวเรือน และน าไปสู่การมีความมั่นคงทางการเงินในระยะยาว
2. การส่งเสริมให้ผู้สูงอายุมีงานท า โดยเฉพาะผู้สูงอายุที่ต้องการท างาน โดยมีกลไกส าคัญ คือ การส่งเสริมการฝึกอบรมทักษะแรงงานผู้สูงอายุพร้อมกับการจับคู่งานเชิงรุก เพื่อให้ตรงกับความต้องการของนายจ้าง รวมถึงการส่งเสริมการเข้าถึงแหล่งทุนหรือสินเชื่อเพื่อการประกอบอาชีพ43 ด้าน นายจ้าง ภาครัฐอาจให้สิทธิประโยชน์ เพิ่มเติมเพื่อกระตุ้นให้นายจ้างเข้าร่วมมาตรการจูงใจทางภาษีเพื่อส่งเสริมการจ้างงานผู้สูงอายุ44 ให้มีเพิ่มขึ้น
3. การใช้บริการผู้ช่วยดูแล (Care Assistant) และเทคโนโลยีในการดูแลสมาชิกในครัวเรือน ส าหรับ ครัวเรือนที่ไม่มีปัญหาทางการเงิน อาจเลือกใช้บริการจ้างผู้ช่วยดูแล ทั้งผู้ที่ผ่านการฝึกอบรม และผู้ดูแลทั่วไป มาช่วยดูแลบางหน้าที่ เช่น ดูแลเรื่องอาหารและยา ช่วยพาไปหาหมอตามเวลานัด พาไปท ากิจกรรม เป็นต้น รวมถึง การใช้เทคโนโลยี อาทิ หุ่นยนต์อัตโนมัติ อุปกรณ์ Smart Home ต่าง ๆ ที่ช่วยดูแลผู้สูงอายุที่บ้าน หรือกล้องอัจฉริยะ Wi-Fi (Smart Camera) และเครื่องเซนเซอร์ตรวจจับความเคลื่อนไหว (Motion Sensor) ที่เชื่อมต่อกับโทรศัพท์ เพื่อช่วยอ านวยความสะดวก แบ่งเบาความกังวล และลดภาระการดูแล โดยเฉพาะในกลุ่มเด็กและผู้สูงอายุ อีกทั้ง ยังช่วยสร้างสมดุลระหว่างชีวิตครอบครัวและการท างานให้กับแรงงาน
4. การสนับสนุนศูนย์ดูแลเด็กและผู้สูงอายุ โดยเน้นที่การปรับปรุงศูนย์พัฒนาเด็กและศูนย์บริการ ผู้สูงอายุของภาครัฐหรือการสนับสนุนภาคธุรกิจส าหรับการด าเนินกิจการ เพื่อลดค่าใช้จ่ายของภาครัฐ โดยอาจให้ สิทธิประโยชน์ทางด้านกฎหมาย เพื่อกระตุ้นให้เกิดขยายตัวของธุรกิจรับดูแลเด็กและผู้สูงอายุในพื้นที่เดียวกันมากขึ้น โดยการดูแลในลักษณะการรับฝากดูแลผู้สูงอายุและเด็กชั่วคราวในช่วงระหว่างเวลาท างานของวัยแรงงาน กลุ่ม Sandwich Generation
ศูนย์บริการสาธารณสุข 26, 27, 36
26 มิถุนายน 2565 ให้บริการประชาชนชวนจังหวัดมุกดาหาร
ขอเชิญชวนข้าราชการทุกหน่วยงาน ประชาชนชวนจังหวัดมุกดาหาร และจังหวัดใกล้เคียง ในวันอาทิตย์ที่ 26 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา จากทางโรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ สำหรับท่านใดที่มีปัญหาทางด้าน #สายตา #การมองเห็นไม่ชัด #สายตาพร่ามัว #มีภาพซ้อน สามารถเดินทางไปตรวจเช็คที่หน่วยบริการได้เลยค่ะ
สถานที่ให้บริการ : ห้องประชุมอเนกประสงค์โรงเรียนบ้านคำสร้อย อำเภอคำสร้อย จังหวัดมุกดาหาร ตั้งแต่เวลา 08:30 - 16:.00 น. Day5 : 26 สิงหาคม 2565 เปิดตัวสำนักงาน ACPHEED ณ ศูนย์การแพทย์บางรัก ถ.สาทร
เปิดตัวสำนักงานเลขาธิการศูนย์ ACPHEED แสดงความพร้อมดำเนินการทันที เป็นศูนย์กลางการประสานงานให้ทุกประเทศอาเซียนเฝ้าระวังป้องกัน ตรวจจับ และตอบโต้ภาวะฉุกเฉินด้านสาธารณสุขและโรคอุบัติใหม่ได้ทันสถานการณ์
ที่อาคารศูนย์การแพทย์บางรัก ถนนสาทร กทม. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข พร้อมด้วยดาโต๊ะ ปาดูกา ลิม จ็อก ฮอย เลขาธิการอาเซียน, รัฐมนตรีสาธารณสุขประเทศอาเซียน ได้แก่ มาเลเซีย สิงคโปร์ ลาว เมียนมา กัมพูชา ฟิลิปปินส์ และบรูไนดารุสซาลาม และรัฐมนตรีเขตเศรษฐกิจเอเปค ได้แก่ ญี่ปุ่น เม็กซิโก เปรู สหรัฐอเมริกา และชิลี ร่วมกันทำพิธีเปิดตัว (Soft Launching) สำนักงานเลขาธิการศูนย์อาเซียนด้านการรับมือกับภาวะฉุกเฉินทางสาธารณสุขและโรคอุบัติใหม่ (ASEAN Centre for Public Health Emergencies and Emerging Diseases: ACPHEED) โดยมีผู้บริหารกระทรวงสาธารณสุขและกระทรวงการต่างประเทศ และองค์กรความร่วมมือระหว่างประเทศเข้าร่วมในงาน จากนั้นได้หารือร่วมกับเลขาธิการอาเซียน
นายอนุทินกล่าวว่า การระบาดใหญ่ของโรคโควิด 19 ส่งผลกระทบต่อความมั่นคงด้านสุขภาพ ตลอดจนความเสียหายทางเศรษฐกิจและสังคมอย่างมหาศาล ประเทศทั่วโลกเห็นพร้องเพิ่มความร่วมมือกันยกระดับขีดความสามารถทั้งระดับชาติและระดับภูมิภาครับมือกับโรคติดต่ออุบัติใหม่ ซึ่งในภูมิภาคอาเซียน 10 ประเทศได้ให้ความสำคัญกับเรื่องนี้ โดยมีประกาศจัดตั้งศูนย์อาเซียนสำหรับภาวะฉุกเฉินด้านสาธารณสุขและโรคอุบัติใหม่ (ACPHEED) ในการประชุมสุดยอดอาเซียนครั้งที่ 37 เมื่อปี 2563 และล่าสุดในการประชุมรัฐมนตรีสาธารณสุขอาเซียนครั้งที่ 15 เมื่อวันที่ 11-15 พฤษภาคม 2565 ที่บาหลี ประเทศอินโดนีเซีย มีฉันทามติให้จัดตั้งสำนักงานเลขาธิการ ACPHEED ที่ประเทศไทย และในระยะแรกมี 3 ประเทศ คือ เวียดนาม อินโดนีเซีย ไทยที่รับเป็นแกนนำดำเนินการด้านการป้องกัน (Prevention) การตรวจจับ (Detection) และการตอบโต้ (Response) ตามลำดับโดยประเทศไทยได้รับการยอมรับในระดับนานาชาติ และเป็นตัวอย่างในการถอดบทเรียนแลกเปลี่ยนเรียนรู้การบริหารจัดการและควบคุมสถานการณ์การระบาดของโรคโควิด 19 โดยองค์การอนามัยโลกเมื่อเดือนเมษายน 2565ที่ผ่านมา
นายอนุทินกล่าวว่า บทบาทและหน้าที่ตามข้อตกลงที่ทำขึ้นในการประชุมไตรภาคีเรื่อง ACPHEED ลงวันที่ 13 พฤษภาคม 2565 สำนักงานเลขาธิการจะทำหน้าที่เป็นศูนย์กลางความเป็นเลิศและศูนย์ทรัพยากรระดับภูมิภาคอาเซียน เพื่อเสริมสร้างสมรรถนะและขีดความสามารถในการป้องกัน ตรวจจับ และตอบสนองต่อภาวะฉุกเฉินทางสาธารณสุขและโรคอุบัติใหม่ และประสานการทำงานร่วมกับหน่วยงานพันธมิตรและประเทศต่างๆ นอกภูมิภาคอาเซียน
สำหรับสำนักงานเลขาธิการ ACPHEED ตั้งอยู่ที่ชั้น 15 ของอาคารศูนย์การแพทย์บางรัก 17 ชั้น ถนนสาทร ใจกลางย่านธุรกิจของกรุงเทพฯ โดยอาคารแห่งนี้ก่อสร้างแล้วเสร็จและเปิดทำการเมื่อต้นปี 2564 มีการติดตั้งระบบอำนวยความสะดวกและเครือข่ายคอมพิวเตอร์ พร้อมสิ่งอำนวยความสะดวกจำนวนมาก เช่น พื้นที่ส่วนกลางขนาดใหญ่สำหรับผู้รับบริการ ศูนย์ปฏิบัติตรวจการวิเคราะห์ ศูนย์ฉีดวัคซีน ศูนย์วิจัยและฝึกอบรม ที่พัก ห้องประชุมที่ทันสมัย เหมาะสมกับการใช้เป็นสำนักงานเลขาธิการ และพร้อมดำเนินการทันทีเมื่อประเทศสมาชิกอาเซียนบรรลุข้อตกลงการจัดตั้ง (Establishment Agreement: EA) ภายในเดือนกันยายนนี้
Day5 : 26 สิงหาคม 2565 ปิดฉากประชุมเอเปคสุขภาพ APEC Health Week บรรลุข้อมติ 12 ข้อ
ปิดฉากประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ บรรลุข้อมติ 12 ข้อ สร้างสมดุลสุขภาพและเศรษฐกิจ เน้นลงทุนสร้างความเข้มแข็งของระบบสุขภาพ ความมั่นคงด้านสุขภาพ รวมทั้งหลักประกันสุขภาพถ้วนหน้าเพื่อรองรับโรคระบาดในอนาคต ตามวิสัยทัศน์ปุตราจายา 2040 เล็งเปิดพรมแดนสร้างการเดินทางที่ปลอดภัยไม่กระทบต่อการป้องกันโควิด พร้อมแบ่งปันและถ่ายทอดเทคโนโลยีวัคซีนโควิด และอำนวยความสะดวกทางการค้า
ที่โรงแรมมิลเลนเนียม ฮิลตัน กทม. นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข เป็นประธานเปิดการประชุมโต๊ะกลมหัวข้อการลงทุนในด้านความมั่นคงด้านสุขภาพโลกเพื่อเตรียมความพร้อมรับมือโรคระบาดในอนาคต ซึ่งเป็นการหารือที่สำคัญของรัฐมนตรีสาธารณสุขของเขตเศรษฐกิจเอเปค ในวันที่ 2 ของการประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจ (HLM) ครั้งที่ 12 “เปิดกว้างสร้างสัมพันธ์กับภาคี เชื่อมโยงกันกับโลก สู่สมดุลระหว่างสาธารณสุขและเศรษฐกิจ” ระหว่างวันที่ 25-26สิงหาคม 2565
นายอนุทินกล่าวว่า จากการระบาดของโควิด 19 ทำให้เห็นว่าโลกยังเตรียมพร้อมในการรับมือการระบาดไม่เพียงพอ และเขตเศรษฐกิจต่างๆ เห็นความสำคัญของการรองรับการระบาดใหญ่ในอนาคต และการลงทุนที่จะทำให้เกิดความมั่นคงด้านสุขภาพ ความมั่งคั่งในประชาชนและคนรุ่นต่อไป ตามที่กำหนดไว้ในวิสัยทัศน์ปุตราจายา 2040 ที่ให้ส่งเสริมการเติบโตที่มีคุณภาพ อันนำมาซึ่งประโยชน์ที่เห็นได้ชัดเจน การมีสุขภาพที่ดีขึ้น และความเป็นอยู่ที่ดีแก่ทุกคน การหารือในรอบนี้จึงเน้นการสร้างความมั่นคงด้านสุขภาพ เพื่อเตรียมพร้อมสำหรับการระบาดใหญ่ครั้งต่อไปผ่านการลงทุนเรื่องระบบสุขภาพ การสร้างหลักประกันสุขภาพถ้วนหน้า รวมทั้งการเร่งพัฒนาและผลิตวัคซีน และการพัฒนาระบบสุขภาพดิจิทัล
นายอนุทินกล่าวว่า ผลลัพธ์ที่สำคัญจากการประชุมครั้งนี้คือ ข้อมติ 12 ข้อ ในถ้อยแถลงของประธาน (Chair’s Statement) ที่มุ่งสร้างสมดุลด้านสุขภาพและเศรษฐกิจ และสนับสนุนการลงทุน เพื่อสร้างความเข้มแข็งของระบบสุขภาพและหลักประกันสุขภาพ ซึ่งปัจจัยสำคัญในการสร้างความมั่นคงด้านสุขภาพ การเปิดพรมแดนสร้างการเดินทางที่ปลอดภัย ไม่กระทบต่อการป้องกันโควิด นอกจากนี้ยังสนับสนุนให้เขตเศรษฐกิจของเอเปคร่วมมือกับภาคเอกชนให้มากยิ่งขึ้น เพื่อส่งเสริมสุขภาพและความเป็นอยู่ที่ดีของประชาชนในภูมิภาคเอเชีย-แปซิฟิก โดยเฉพาะการแบ่งปันและถ่ายทอดเทคโนโลยีวัคซีนโควิด และอำนวยความสะดวกทางการค้า
“การประชุมครั้งนี้ถือว่าประสบความสำเร็จเป็นอย่างมาก มีรัฐมนตรี และเจ้าหน้าที่ระดับสูงจากเขตเศรษฐกิจเอเปคมาร่วมประชุม On-site ถึง 15 เขตเศรษฐกิจ และ อีก 5 เขตเศรษฐกิจเข้าร่วมประชุมออนไลน์ รวมผู้เข้าร่วมประชุมทั้งสิ้นกว่า 150 คนซึ่งมากกว่าทุกครั้งที่เคยจัดมา นอกจากนี้ที่ประชุมยังได้บรรลุข้อมติถึง 12 ข้อ ที่สามารถนำมาดำเนินการในการสร้างสมดุลระหว่างสาธารณสุขและเศรษฐกิจของภูมิภาคเอเชีย-แปซิฟิก และในตอนท้ายของการประชุม ได้แสดงความยินดีและส่งมอบการเป็นเจ้าภาพจัดประชุมระดับสูงเอเปคว่าด้วยสาธารณสุขและเศรษฐกิจครั้งต่อไปให้แก่ผู้แทนของสหรัฐอเมริกา ซึ่งจะเป็นเจ้าภาพในปี 2566” นายอนุทินกล่าว
UPDATE: นายกรัฐมนตรีกำชับหน่วยงานเกี่ยวข้องเร่งดูแลผู้บาดเจ็บและเสียชีวิตกรณีเหตสะพานข้ามแยกย่านลาดกระบังทรุดตัว แนะทุกหน่วยงานอยู่ระหว่างการก่อสร้างคุมเข้มความปลอดภัย
10 ก.ค. 66 น.ส.ไตรศุลี ไตรสรณกุล รองโฆษกประจำสำนักนายกรัฐมนตรี กล่าวว่า พล.อ.ประยุทธ์ จันทร์โอชา นายกรัฐมนตรีและรมว.กลาโหม มีความห่วงใยผู้ประสบเหตุสะพานข้ามแยก บนถนนหลวงแพ่ง เขตลาดกระบัง เกิดการทรุดตัวและถล่มเป็นเหตุให้มีผู้เสียชีวิต และบาดเจ็บหลายราย
นายกรัฐมนตรีแสดงความเสียใจต่อครอบครัวของผู้เสียชีวิต และกำชับให้หน่วยงานที่เกี่ยวข้องกับโครงการเร่งดำเนินการให้ความช่วยเหลือเยียวยาครอบครัวผู้เสียชีวิตตามกฎหมาย และดูแลรักษา เยียวยาผู้ได้รับบาดเจ็บให้เร็วที่สุด
อย่างไรก็ตาม เนื่องจากเหตุการณ์อุบัติเหตุจากการก่อสร้างได้เกิดขึ้นหลายครั้ง ขอให้หน่วยงานเกี่ยวข้องตรวจสอบสาเหตุของอุบัติเหตุโดยละเอียดว่ามีสาเหตุจากอะไร เกิดจากสิ่งแวดล้อมของพื้นที่ก่อสร้าง หรือความประมาทระหว่างการปฏิบัติงาน หากเกิดจากความประมาทขอให้มีการดำเนินการทางกฎหมายให้ถึงที่สุด
"นายกรัฐมนตรีเห็นว่าได้เกิดเหตุลักษณะนี้แล้วหลายครั้งและทุกครั้งก็เกิดความสูญเสียต่อชีวิตและทรัพย์สินของประชาชน และคนงาน ขอให้ทุกหน่วยงานที่อยู่ระหว่างดำเนินโครงการก่อสร้างกำชับผู้รับเหมา ผู้ดำเนินโครงการใช้ความระมัดระวัง ปฏิบัติตามมาตรฐานการก่อสร้างอย่างเข้มงวดด้วย" น.ส.ไตรศุลี กล่าว
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตพญาไท
Cafe Amazon for Chance สาขา 8 หน่วยบัญชาการนาวิกโยธิน สัตหีบ
Cafe Amazon for Chance สาขาที่ 8 ดำเนินการโดย ทหารผ่านศึกและครอบครัว
ตั้งอยู่ที่ หน่วยบัญชาการนาวิกโยธิน หาดเตยงาม อ.สัตหีบ จ.ชลบุรี
ข่าวที่เกี่ยวข้อง
เปิดรับบริจาคโลหิตที่งานธนาคารเลือด รพ.มุกดาหาร LINK
ขอเชิญทำบุญต้อนรับเทศกาลปีใหม่โดยการบริจาคโลหิตวันนี้เปิดรับบริจาคโลหิตที่งานธนาคารเลือดโรงพยาบาลมุกดาหารนะคะ เชิญชวนทุกท่าน
หน่วยรับบริจาคโลหิตเคลื่อนทีมกราคม 64
- วันที่ 6 มกราคม อำเภอเมือง
- วันที่ 20 มค.64 วิทยาลัยการอาชีพนิคมคำสร้อย
- วันที่ 27 มกราคม 64 ห้างบิ๊กซีมุกดาหาร
- ทุกหน่วยเวลา 09.00-12.00 น.เชิญชวนทุกท่านร่วมบริจาคโลหิต ตามวันเวลาและสถานที่ตามที่แจ้งด้วยค่ะ
ประกาศจากสถานเอกอัครราชทูตไทยทั่วโลก เรื่อง ThailandPlus
- สถานเอกอัครราชทูต ณ กรุงปักกิ่ง Royal Thai Embassy, Beijing
- สถานกงสุลใหญ่ ณ นครกว่างโจว Royal Thai Consulate-General, Guangzhou
- สถานเอกอัครราชทูต ณ กรุงออตตาวา Royal Thai Embassy, Ottawa
- Royal Thai Consulate-General, Frankfurt
- Royal Thai Embassy, Pretoria, Republic of South Africa สถานเอกอัครราชทูต ณ กรุงพริทอเรีย
- สถานกงสุลใหญ่ ณ นครซิดนีย์ Royal Thai Consulate-General, Sydney, Australia
- สถานกงสุลใหญ่ ณ นครคุนหมิง Royal Thai Consulate-General, Kunming, China
- สถานกงสุลใหญ่ ณ นครมิวนิก Royal Thai Consulate-General in Munich, Germany
- สถานเอกอัครราชฑูต ณ กรุงแคนเบอร์รา Royal Thai Embassy Canberra
ไอศครีม ติมกัญนะ
ไอศครีม ติมกัญนะ เสิร์ฟความอร่อยและรอยยิ้ม ขายดีมาก
เมนูไหนที่เป็น signature เรียกว่ามาแล้วต้องลอง
เป็นอะไรกัญ ตัวนี้ใครมาต้องลองและขายดีมาก เป็นชากัญชา ใส่วุ้นใบเตยกัญชา
กทม เปิด ผลการตรวจคัดกรองเชิงรุก ตลาดในพื้นที่เขตบางแค
ผลการตรวจคัดกรองเชิงรุกกลุ่มก้อนผู้ติดเชื้อตลาดในพื้นที่เขตบางแค ระหว่าง 11 - 14 มี.ค. 64
น่าน - มาจาก 5+5 จว. กักตัว 14 วัน LINK
10 เมย 64
จังหวัดน่านออกประกาศ
แจ้งเพิ่มจังหวัดที่ต้องกักตัวเป็นเวลา 14 วัน ได้แก่ 1.จังหวัดชลบุรี 2.จังหวัดเชียงใหม่ 3.จังหวัดประจวบคีรีขันธ์ 4.จังหวัดสมุทรสาคร 5.จังหวัดสระแก้ว (รวม 5 จังหวัดเดิมตามประกาศ ฉบับที่ 7 ได้แก่ กรุงเทพมหานคร จังหวัดปทุมธานี จังหวัดนนทบุรี จังหวัดสมุทรปราการ จังหวัดนครปฐม) ทั้งนี้ ตั้งแต่วันที่ 11 เมษายน พ.ศ.2564 เวลา 08.00 น. เป็นต้นไป จนกว่าจะมีประกาศเปลี่ยนแปลง
ต้องกักตัวที่บ้านหรือที่พักแรม 14 วัน โดยมีผลตั้งแต่วันที่ 9 เม.ย. 64 เป็นต้นไป
ต้องกักตัวไม่ว่าจะพักอยุ่ที่บ้าน หรือที่ โรงแรม ก็ตาม
ส่วนผู้ที่มาจากจังหวัดอื่น (รวมทั้งจังหวัดสมุทรสาคร) และประเมินแล้วไม่เสี่ยง ให้เฝ้าสังเกตอาการตนเอง(Self monitoring) เป็นเวลา 14 วัน
เพจ
สสจ น่าน โทร 054-600-070, 054-600-075
รพ.น่าน โทร 054-719-000
อุบลราชธานี ต่ออายุมาตรการตั้งแต่ 1 พค 64 ไปจนกว่าจะมีคำสั่งเปลี่ยนแปลง LINK
อุบลราชธานีเข้มมาตรการสวมหน้ากากเต็มร้อย เพื่อป้องกันและควบคุมการแพร่ระบาดของโรค COVID-19 ขยายระยะเวลาบังคับใช้มาตรการต่อไป ตั้งแต่ 1 พค 64 จนกว่าจะมีคำสั่งเปลี่ยนแปลง
มาตรการกำหนดให้ใส่หน้ากากอนามัยทุกครั้งก่อนออกจากเคหสถานและต้องติดต่อกับผู้อื่น
หรือเดินทางไปในสถานที่สาธารณ หรือสถานที่ใดๆ ที่มีคนอื่นอยู่จำนวนมาก
ทั้งนี้ บุคคลที่อยุ่ในเคหสถาน ร้านค้า หรือสถานที่ใดๆ ที่ต้องติดต่อกับบุคคลอื่น ต้องสวมหน้ากากด้วย
ฝ่าฝืน/ไม่ปฏิบัติตาม และกระทำการในลักษณะเสี่ยงต่อการแพร่ระบาด ระวางโทษ ปรับไม่เกิน 20,000 บาท และผิดตามมาตรา 18 แห่งพรก.สถานการณ์ฉุกเฉิน ระวางโทษจำคุกไม่เกิน 2 ปี ปรับไม่เกิน 40,000 บาท หรือทั้งจำทั้งปรับ
สั่ง 23 เมย 64
ราชประชาสมาสัย เปิด walk in ฉีดเข็ม 1 และเข็ม 3 วันที่ 15,16,29 พ.ย.
สถาบันราชประชาสมาสัย เปิด walk in ฉีดเข็ม 1 และเข็ม 3 วันที่ 15,16,29 พ.ย.
1. เข็ม 1 ซิโนแวค 65 คน
2. เข็มกระตุ้น เข็ม 3 หลังติดเชื้อ 3 เดือน สำหรับกลุ่มที่ไม่เคยได้วัคซีนมาก่อน และรับมาแล้ว 1 เข็ม
3. เข็มกระตุ้น ด้วยแอสตร้าเซเนก้า หลังรับเข็ม 2 ซิโนแวค หรือซิโนฟาร์มไปแล้วอย่างน้อย 3 เดือน
เมล กิ๊บสัน
เมษายน ดารารุ่นใหญ่วัย 64 เจ้าของรางวัลออสการ์ผู้กำกับยอดเยี่ยม มีผลตรวจติดโควิดและเข้ารักษาในโรงพยาบาลในแคลิฟอร์เนียทันที เขาได้รับยาสูตรเรดิซิเวียร์และยาต้านไวรัส สูตรเดียวกันกับปธน.ทรัมป์
เน้นย้ำ! เทศกาลปีใหม่ ตรวจคัดกรองด้วย ATK
เน้นย้ำ! เทศกาลปีใหม่ ทุกจังหวัดเฝ้าระวังคัดกรองประชาชน เดินทางกลับบ้านอย่างเข้มงวด และเมื่อกลับมาทำงาน ให้นายจ้าง/สถานประกอบการ ตรวจคัดกรองด้วย ATK ลดความเสี่ยงการแพร่ระบาดโควิด 19
รพ. พญาไท นวมินทร์ พร้อมดูแลผู้ป่วยประกันสังคมอย่างทั่วถึง LINK
รพ. พญาไท นวมินทร์ ตอกย้ำความเป็นผู้นำด้านสุขภาพ พร้อมดูแลผู้ป่วยประกันสังคมอย่างทั่วถึง ภายใต้คุณภาพมาตรฐานและความปลอดภัย แผนกผู้ป่วยนอกประกันสังคม ถูกออกแบบใหม่ให้กว้างขวาง สะดวกสบาย สำหรับรองรับผู้มาใช้บริการโดยเฉพาะ อำนวยความสะดวกด้วยบริการแบบ One Stop Service บริการครบ จบในที่เดียว โรงพยาบาลพญาไท นวมินทร์ โทร. 02-944-7111
คลอดธรรมชาติหรือคลอดแบบผ่าตัด พญาไท นวมินทร์ LINK
เพราะลูกคือของขวัญสุดล้ำค่า ไม่ว่าจะคลอดธรรมชาติหรือคลอดแบบผ่าตัด เราพร้อมดูแลอย่างเต็มที่ ด้วยแพ็กเกจคลอดเหมาจ่ายคลอดอุ่นใจ
แพ็กเกจเริ่มต้น 35,000 บาท มีอะไรที่มากกว่า
✅ รูปถ่ายพร้องกรอบ + ปั๊มรอยเท้า ✅ นวดกระตุ้นน้ำนม ✅ ปรึกษาแพทย์ TeleMedicine ✅ ชุดห่อตัวเด็ก ✅ และอื่นๆ
ศูนย์สุขภาพผู้หญิง โรงพยาบาลพญาไท นวมินทร์ โทร. 02-944-7111 ต่อ 2201
วันเดียว เที่ยวสามเกาะ - เกาะมัน จ.ระยอง LINK
สามเกาะ ที่ว่าคือเกาะมันใน ที่ตั้งของศูนย์วิจัยทรัพยากรทางทะเลและชายฝั่งอ่าวไทยฝั่งตะวันออก กรมทรัพยากรทางทะเลและชายฝั่ง เป็นศูนย์เพาะเลี้ยงเต่า 2 สายพันธุ์คือ เต่ากระและเต่าตนุ มีฟาร์มอนุบาลลูกเต่าจำนวน 200-300 ตัว เป็นศูนย์อนุรักษ์เต่าสำคัญของไทยเลยทีเดียว
อีกสองเกาะคือ เกาะมันกลาง เหมาะกับดำน้ำดูปะการัง และเกาะมันนอก มีไฮไลท์คือสะพานไม้ทอดไปในทะเลใส มุมโดนใจคนชอบถ่ายภาพ สนใจเดินทาง ติดต่อ ททท.สำนักงานระยอง โทร. 038 655 420 ติดต่อ เจ้าหน้าที่ศูนย์วิจัยทรัพยากรทางทะเลและชายฝั่งอ่าวไทยฝั่งตะวันออก โทร. 061 234 2457 (พี่สมชาย)
บางปะกอก 8 เปิดให้บริการ ตรวจ PCR Drive-Thru ค่าบริการ 2,500 บาท
โรงพยาบาลบางปะกอก 8 เปิดให้บริการ Drive-Thru ตรวจหาเชื้อ COVID-19 โดยให้บริการตรงอาคาร 3 ขับรถเข้าไปโดยไม่ต้องลงจากรถ (One Stop Service) ทราบผลภายใน 48 ชั่วโมง ค่าบริการ 2,500 บาท 100 ท่าน/วัน เวลา 08.00-16.00 น. ผลสามารถใช้ได้เฉพาะภายในประเทศเท่านั้น เริ่มวันนี้ - 30 เมษายน 2565 สแกน QR code ลงทะเบียนล่วงหน้า หรือ โทร 080-9607095 ติดต่อ drive thru
สุขสวัสดิ์ เปิดลงทะเบียน จองเตียงผู้ป่วย COVID19 สัญชาติไทย ไม่มีค่าใช้จ่าย LINK
โรงพยาบาลสุขสวัสดิ์ เปิดลงทะเบียน จองเตียงสำหรับเข้าพักกักตัวกรณีผู้ป่วย COVID19 สัญชาติไทย ไม่มีค่าใช้จ่ายใดๆ
- สิทธิประกันสังคม, สิทธิข้าราชการ และสิทธิบัตรทองทุกโรงพยาบาล โดยสามารถเลือกรูปแบบการกักตัว หรือพักรักษาตัวได้ดังนี้
- ที่โรงพยาบาลสุขสวัสดิ์ (Cohort ward) (เขตราษฎร์บูรณะ)
- พักรักษาตัว (Hospitel) ที่โรงแรมแซฟฟรอน ฮิล ( มีนบุรี )
- กักตัว (Hotel Isolation) ที่โรงแรมสมาร์ท สวีท (สุขุมวิท 11)
- กักตัวเองที่บ้าน (Self-isolation) **เฉพาะสิทธิประกันสังคมทุกโรงพยาบาล
สนใจสอบถามข้อมูลเพิ่มเติมได้ที่
02-8746766-70 ต่อ1106
คุณพรพิมล 098-020-9935
คุณกาญจนา 092-859-9601
คุณณัฏฐ์รมิดา 082-358-5511
คุณต้น 06-1561-9755
คุณฟ้า 081-090-2030
คุณสุชาติ 086-272-0481
คุณเจษฎาภรณ์ 063-969-5666
Inbox : Facebook Page โรงพยาบาลสุขสวัสดิ์
Line : @sshospital
บัญชีบริจาค มูลนิธิรามาธิบดี
ชื่อบัญชี มูลนิธิรามาธิบดี
- ธนาคารกสิกรไทย เลขที่ 879-2-00448-3 ธนาคารกรุงเทพ เลขที่ 090-3-50015-5
- ธนาคารไทยพาณิชย์ เลขที่ 026-3-05216-3 ธนาคารกรุงศรีอยุธยา เลขที่ 072-1-35991-0
- บริจาคออนไลน์ www.ramafoundation.or.th สอบถามโทร 02-201-1111
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ เปิดรับสมัครงานหลายตำแหน่ง LINK
ตำแหน่งที่เปิดรับสมัคร
ผู้จัดการ : Manager
ผู้ตรวจการ : Supervisor
หัวหน้าแผนก : Department head
เลขานุการ : Secretary
วิศวกรเครื่องมือแพทย์ : Biomedical Engineering
พนักงานซ่อมบำรุง : Maintenance
เวรเปล : Porter
ยานพาหนะ : Transportation
เจ้าหน้าที่ลูกค้าสัมพันธ์และลงทะเบียน : Officer , Customer service
เจ้าหน้าที่เวชระเบียนและเวชสถิติ : Officer , Medical Record
เจ้าหน้าที่ประกันและสิทธิประโยชน์ : Officer , Utilization Review
เจ้าหน้าที่รับผู้ป่วยใน : Officer , Admission
เจ้าหน้าที่การเงิน : Finance officer
เจ้าหน้าที่ศูนย์คุณภาพ : Quality center staff
เจ้าหน้าที่ธุรการ :
เจ้าหน้าที่ Call Center :
เจ้าหน้าที่งานขายและการตลาด : Sale Marketing
Call center 02 080 5999
โดมิโน่ LINK
Supap Rodklongtan
เมื่อก่อนชอบเล่น เดี๋ยวนี้ลืมไปแล้วว่าเล่นอย่างไร?
5.5 รูปแบบการปฏิบัติงาน
ส่วนราชการและหน่วยงานของรัฐสามารถพิจารณากำหนดรูปแบบการปฏิบัติงานของเจ้าหน้าที่ให้เหมาะสมกับภารกิจ ลักษณะงานของหน่วยงาน รูปแบบการให้บริการประชาชน รวมถึงเทคโนโลยีที่นำมาใช้เพื่อพัฒนาระบบงาน เพื่อให้การปฏิบัติงานและการให้บริการประชาชนมีประสิทธิภาพ และหน่วยงานสามารถปรับตัวเพื่อตอบสนองต่อการเปลี่ยนแปลงทั้งทางเศรษฐกิจและสังคมได้อย่างทันการณ์ โดยสามารถพิจารณาจากรูปแบบการปฏิบัติงาน จำนวน 3 รูปแบบ ดังนี้
รูปแบบที่ 1 การปฏิบัติงานในสถานที่ตั้งโดยการเหลื่อมเวลาทำงาน โดยมี
รายละเอียด ดังนี้
(1) ปฏิบัติงาน 5 วันต่อสัปดาห์โดยมีวันหยุด 2 วันต่อสัปดาห์
(2) ปฏิบัติงานภายในช่วงวันจันทร์ – วันอาทิตย์
(3) ปฏิบัติงานไม่น้อยกว่า 8 ชั่วโมงต่อวัน รวมเวลาพักกลางวัน 1 ชั่วโมงต่อวัน
(4) ช่วงเวลาการเข้างาน - เลิกงาน กำหนดได้มากกว่า 1 ช่วงเวลา อาทิ
07.00 น. - 15.00 น., 07.30 น. - 15.30 น., 08.00 น. - 16.00 น., 08.30 น. - 16.30 น.,
09.00 น. - 17.00 น., 09.30 น. - 17.30 น. หรือ 10.00 น. - 18.00 น.
(5) ในการกำหนดช่วงเวลาการเข้างาน - เลิกงาน ตามข้อ (4) หน่วยงานอาจพิจารณาให้ผู้ปฏิบัติงานเข้างาน – เลิกงานในช่วงเวลาเดียวกันทุกวัน หรือให้ผู้ปฏิบัติงานเข้างาน – เลิกงานในแต่ละวันให้แตกต่างช่วงเวลาได้
(6) การปฏิบัติงานในสถานที่ตั้ง หมายรวมถึง การปฏิบัติงานในสถานที่ ภายนอกที่เจ้าหน้าที่ปฏิบัติงานตามภารกิจของหน่วยงาน อาทิ พื้นที่ลาดตระเวน พื้นที่ตั้งหน่วยบริการ พื้นที่ปฏิบัติการ
รูปแบบที่ 2 การปฏิบัติงานในสถานที่ตั้งโดยการนับชั่วโมงทำงาน โดยมีรายละเอียด ดังนี้
(1) ปฏิบัติงาน 5 วันต่อสัปดาห์โดยมีวันหยุด 2 วันต่อสัปดาห์
(2) ปฏิบัติงานภายในช่วงวันจันทร์ – วันอาทิตย์
(3) ปฏิบัติงานไม่น้อยกว่า 40 ชั่วโมงต่อสัปดาห์ รวมเวลาพักกลางวัน 5 ชั่วโมงต่อสัปดาห์
(4) นับเวลาเข้างานไม่ก่อนเวลา 07.30 น.
(5) นับเวลาเลิกงานไม่เกินเวลา 18.30 น.
(6) มีช่วงเวลาหลักในการทำงาน (Core Time) จำนวน 5 ชั่วโมงต่อวัน ตั้งแต่เวลา 09.30 น. - 15.30 น. (ไม่รวมเวลาพักกลางวัน 1 ชั่วโมง) โดยเป็นช่วงเวลาที่ผู้ปฏิบัติงานจะต้องอยู่ปฏิบัติงานในสถานที่ตั้ง และสามารถเข้างานก่อนหรือเลิกงานหลังช่วงเวลาหลักได้อย่างยืดหยุ่น แต่ต้องมีจำนวนชั่วโมงการทำงานรวมกันแล้วไม่น้อยกว่า 40 ชั่วโมงต่อสัปดาห์ รวมเวลาพักกลางวัน 5 ชั่วโมงต่อสัปดาห์
(7) ทั้งนี้ หน่วยงานอาจกำหนดเวลาเข้างาน – เลิกงานและช่วงเวลาหลักในการทำงาน (Core Time) แตกต่างไปจากข้อ (4) (5) และ (6) ได้ตามเหตุผลความจำเป็นและลักษณะการปฏิบัติงาน
(8) การปฏิบัติงานในสถานที่ตั้ง หมายรวมถึง การปฏิบัติงานในสถานที่ภายนอกที่เจ้าหน้าที่ปฏิบัติงานตามภารกิจของหน่วยงาน อาทิ พื้นที่ลาดตระเวน พื้นที่ตั้งหน่วยบริการ พื้นที่ปฏิบัติการ
รูปแบบที่ 3 การปฏิบัติงานนอกสถานที่ตั้งโดยมีรายละเอียด ดังนี้
(1) ปฏิบัติงาน 5 วันต่อสัปดาห์โดยมีวันหยุด 2 วันต่อสัปดาห์
(2) ปฏิบัติงานภายในช่วงวันจันทร์ – วันอาทิตย์
(3) ปฏิบัติงานไม่น้อยกว่า 8 ชั่วโมงต่อวัน รวมเวลาพักกลางวัน 1 ชั่วโมงต่อวัน
(4) ปฏิบัติงานตั้งแต่เวลา 08.30 น. - 16.30 น หรือช่วงเวลาอื่นตามที่หน่วยงานเห็นสมควร
(5) การปฏิบัติงานนอกสถานที่ตั้ง หมายถึง การปฏิบัติงานของเจ้าหน้าที่นอกสถานที่ตั้งของหน่วยงาน หรือในพื้นที่ที่หน่วยงานจัดไว้เป็นที่ทำงานร่วม (Co-Working Space) หรือที่พักของเจ้าหน้าที่ หรือสถานที่อื่นใดที่หน่วยงานกำหนด
(6) การปฏิบัติงานนอกสถานที่ตั้ง ไม่ได้หมายรวมถึงกรณี ดังต่อไปนี้
(6.1) การได้รับอนุมัติให้เดินทางไปราชการ การได้รับอนุมัติให้เดินทางไปราชการและการจัดการประชุมของส่วนราชการ ตามระเบียบสำนักนายกรัฐมนตรีว่าด้วยการอนุมัติให้เดินทางไปราชการและการจัดการประชุมของทางราชการ พ.ศ. 2524 และที่แก้ไขเพิ่มเติม
(6.2) การได้รับอนุมัติให้เดินทางไปรับราชการประจำในต่างประเทศ
(6.3) การได้รับอนุมัติให้เดินทางไปศึกษา ฝึกอบรม ปฏิบัติการวิจัยหรือดูงาน ณ ต่างประเทศ ตามระเบียบสำนักนายกรัฐมนตรี ว่าด้วยการให้ข้าราชการไปศึกษา ฝึกอบรม ปฏิบัติการวิจัย และดูงาน ณ ต่างประเทศ พ.ศ. 2549
(6.4) การได้รับคำสั่งให้ไปปฏิบัติงานหรือทำการใด ๆตามพระราชกฤษฎีกา กำหนดหลักเกณฑ์การสั่งให้ข้าราชการไปทำการซึ่งให้นับเวลาระหว่างนั้นเหมือนเต็มเวลาราชการ พ.ศ. 2550
(6.5) การได้รับคำสั่งให้ไปปฏิบัติงานที่หน่วยงานอื่นในประเทศตามระเบียบ ก.พ. ว่าด้วยการเพิ่มพูนประสิทธิภาพของข้าราชการโดยการให้ไปปฏิบัติงานที่หน่วยงานอื่นในประเทศ พ.ศ. 2554
(6.6) การปฏิบัติหน้าที่ราชการนอกสถานที่ตั้งของหน่วยงานซึ่งเป็นภารกิจปรกติของหน่วยงานนั้น
(6.7) กรณีอื่นตามที่มีกฎหมาย กฎ ระเบียบ ข้อบังคับ คำสั่ง หรือมติคณะรัฐมนตรีกำหนด
(7) ระหว่างการปฏิบัติงานนอกสถานที่ตั้ง หน่วยงานจะต้องสามารถติดต่อผู้ปฏิบัติงานได้ตลอดช่วงระยะเวลาการปฏิบัติงาน และกรณีมีเหตุผลความจำเป็นเพื่อประโยชน์ของทางราชการ หน่วยงานอาจสั่งให้ผู้ปฏิบัติงานมาปฏิบัติงานในสถานที่ตั้งได้ในบางวันหรือบางช่วงเวลาได้
อย่างไรก็ดีหากส่วนราชการและหน่วยงานของรัฐมีการกำหนดรูปแบบการปฏิบัติงานไว้เป็นพิเศษหรือเป็นการเฉพาะ เช่น การปฏิบัติงานเป็นตารางเวลาหรือตารางเวรการปฏิบัติงานในวันหยุดราชการ ส่วนราชการและหน่วยงานของรัฐก็สามารถพิจารณาดำเนินการตามรูปแบบการปฏิบัติงานที่ปฏิบัติอยู่เดิมต่อไปได้ หรือดำเนินการประกอบกับรูปแบบการปฏิบัติงานข้างต้นตามที่เห็นสมควรได้เช่นกัน
UNFOLDING BANGKOK HIDDEN TEMPLE เริ่มตั้งแต่ 12 พ.ย. - 31 ธ.ค.65
UNFOLDING BANGKOK
HIDDEN TEMPLE
เริ่มตั้งแต่ 12 พฤศจิกายน - 31 ธันวาคม 65
สถานที่จัดงาน 5 วัด, ย่านฝั่งธนบุรี
.
‘Unfolding Bangkok เปิดประสบการณ์ใหม่กรุงเทพมหานคร’ เป็นกิจกรรมที่จัดขึ้นโดยสำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน) หรือ CEA ร่วมกับ Urban Ally และศูนย์ข้อมูลสถาปัตยกรรมไทย คณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศิลปากร ร่วมกับมิตรเมือง ภาคีเครือข่ายย่านบางยี่เรือ-ตลาดพลู
เป็นการแสดงศิลปะในรูปแบบ Projection Mapping และ Architectural Lighting ภายใต้ธีมหลัก Hidden Temple โดยใช้พื้นที่ของ 8 วัดย่านฝั่งธนฯ เป็นพื้นที่จัดแสดง เริ่มตั้งแต่วันเสาร์นี้และจะจัดเป็นช่วงๆ ไปจนถึงสิ้นปี
.
ธีมแรก “HIDDEN TEMPLE” จะเป็นการชวนเปิดประสบการณ์ท่อง 5 วัดลับย่านฝั่งธนฯ ซึ่งเป็นส่วนหนึ่งภายใต้เทศกาล “Colorful Bangkok” ออกสตาร์ทวันเสาร์ที่ 12 พฤศจิกายนนี้ เป็นธีม “HIDDEN TEMPLE” เปิดประสบการณ์ท่อง 5 วัดลับย่านฝั่งธนฯ
.
โดย Hidden Temple ภายใต้แนวคิด “จาริกแสวงบุญ” จัดขึ้นระหว่างวันที่ 12 - 20 พฤศจิกายน 2565 จะชวนสัมผัสประสบการณ์ที่วัดอินทาราม I วัดจันทาราม-วัดราชคฤห์ ย่านตลาดพลู
เขตบางกอกน้อย
สำนักงานเขตบางกอกน้อยร่วมกับศูนย์บริการสาธารณสุข 30 วัดเจ้าอามมีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 13 -17 มีนาคม 2566 เวลา 9.00 - 12.00 น.ประชาชนผู้ที่สนใจ โปรดนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ได้ตาม สถานที่ วันและเวลาที่ระบุ
กองทุนดูแลผู้สูงอายุ-ผู้ป่วยติดเตียง งบประมาณเฉลี่ย 9,000 บาท/คน/เดือน
ปัญหา
ปัจจุบัน คนไทยส่วนใหญ่ยังไม่รู้จักหรือเข้าไม่ถึงการดูแลฟื้นฟูผู้ป่วยในระยะปานกลาง ระยะยาว ระยะประคับประคอง ทำให้ผู้ป่วยที่ต้องได้รับการดูแล ที่ส่วนใหญ่เป็นผู้ป่วยสูงอายุและไม่สามารถพึ่งพาตัวเอง ไม่สามารถเข้าถึงการรักษาในระยะนี้อย่างมีคุณภาพ หากจะเข้าการรักษาก็ต้องเป็นภาระของบุตรหลานหรือญาติในการดูแล เนื่องในระดับองค์กรปกครองส่วนท้องถิ่นหรือชุมชุนยังไม่มีโครงสร้างพื้นฐานและบุคลากรในการรักษาระยะปานกลาง ระยะยาว และระยะประคับประคอง
โดยเฉพาะอย่างยิ่งการรักษาในระยะประคับประคอง (Palliative Care) ที่ยังไม่เข้าถึงในสถานบริการแบบปฐมภูมิ ทำให้ผู้ป่วยระยะสุดท้ายหรือระยะประคับประคองเข้าไม่ถึงการรักษาแบบประคับประคอง ที่จะทำให้ตัวเองไม่ทรมานจากความเจ็บปวดจากอาการป่วยระยะสุดท้าย นอกจากยังขาดแคลนบุคลากรที่มีความสามารถในการรักษาในระยะประคับประคอง เนื่องจากบุคลากรทางการแพทย์ทั่วไปไม่ได้มีความรู้ในด้านนี้ ส่วนแพทย์เฉพาะทางก็มีจำนวนน้อยและไม่ได้มีเส้นทางการเติบโตในสายอาชีพที่ดี อีกทั้งยังขาดโครงพื้นฐานและความรู้ความเข้าใจของประชาชนเกี่ยวกับการรักษาแบบประคับประคอง
นอกจากการรักษาแบบประคับประคอง สิทธิที่ผู้ป่วยระยะสุดท้ายที่มีความเจ็บป่วยทางกายแบบรักษาไม่ได้ที่จะตายอย่างมีศักดิ์ศรี หรือการทำการุณยฆาตเป็นสิ่งที่ยังไม่ถูกกฎหมายในประเทศไทย ทำให้ผู้ป่วยบางคนต้องทนทุกข์ทรมานก่อนเสียชีวิต
ข้อเสนอ
- พัฒนาให้ระบบสุขภาพสุขภาพปฐมภูมิดูแลเรื่องการฟื้นฟูที่บ้าน/ชุมชนได้ ผ่านการดำเนินการร่วมกับองค์กรปกครองส่วนท้องถิ่น
- พัฒนาระบบกองทุนดูแลผู้สูงอายุในระยะยาว งบประมาณ 9,000 บาท/คน/เดือน (นโยบายสวัสดิการ) ผ่านการดำเนินการร่วมกับองค์กรปกครองส่วนท้องถิ่น
หากพบเชื้อต้องเข้ารับการตรวจเพิ่มเติม รักษาได้ ลดเสี่ยงเป็นมะเร็งปากมดลูก
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า เมื่อพบเชื้อ สิ่งที่สำคัญมากคือต้องตรวจต่อด้วยการส่องกล้องเข้าไปดู แบบขยายสี่สิบเท่า (Colposcopy) แล้วชโลมน้ำยาบางอย่างเข้าไป ทําให้เห็นรอยโรคชัดขึ้น และตัดเอาเนื้อชิ้นเล็ก ๆ ไปตรวจ ผลชิ้นเนื้อเล็กๆ นี้ จะบอกได้ว่าเป็นระยะอะไรนั่นเอง ระยะก่อนเป็นมะเร็ง ระยะหนึ่ง ระยะสองพอบอกได้
ส่วนการรักษา ขึ้นอยู่กับว่าเราเป็นระยะไหน เช่นสมมุติว่าเป็นระยะศูนย์ จะตัดแค่บริเวณเนื้อแค่ปากมดลูก ไม่ต้องถึงขั้นตัดมดลูก ไม่ต้องนอนโรงพยาบาล ใช้วิธีฉีดยาชาที่ปากมดลูก แล้วก็ใช้ขดลวดไฟฟ้าตัด เสร็จแล้วกลับบ้านได้เลย กลับกัน หากสมมุติว่าเป็นระยะที่มากกว่านั้น ในบางคนยังสามารถผ่าตัดเอามดลูกออกได้ แต่บางคนก้อนใหญ่มาก ผ่าตัดไม่ได้ การรักษาคือใช้วิธีฉายแสง และให้ยาเคมีบําบัด ซึ่งภาวะแทรกซ้อนมันก็จะมากขึ้น อาจจะมีอาการปัสสาวะเป็นเลือด ถ่ายเป็นเลือดเพราะว่าโดนรังสี หรือบางคนได้ยาเคมี ก็จะมีภาวะแทรกซ้อนเยอะ เม็ดเลือดขาวต่ำมีภาวะซีดเป็นต้น
ตอกย้ำแนวคิดมะเร็งปากมดลูก หากตรวจพบเชื้อเอชพีวีตั้งแต่เนิ่นๆ รักษาได้ ลดความเสี่ยงการเกิดมะเร็งปากมดลูก
นพ. โอฬาริก มุสิกวงศ์ แพทย์ผู้เชี่ยวชาญสูติศาสตร์ นรีเวชวิทยา สำนักส่งเสริมสุขภาพ กรมอนามัย และโฆษกรัฐมนตรีช่วยว่าการกระทรวงสาธารณสุข กล่าวว่า โดยหลักการคือ เมื่อเริ่มเป็นน้อยๆ การรักษาก็จะง่าย สะดวก หายเร็ว และหายได้ ดังนั้น นี่คือความสําคัญที่อยากจะบอกคนไข้ทุกคนว่าหากตรวจแล้วผลเป็นบวกให้รีบมาพบแพทย์ บางคนอาจจะไม่เป็นอะไรเลยก็ได้ หรือหากพบเชื้อเอชพีวี จะได้ทําการรักษาแต่เนิ่นๆ อย่าลืมว่ามะเร็งในระยะแรกเริ่มแม้จะมีอาการผิดปกติ แต่ก็อาจจะเหมือนปกติ กว่าจะไปรู้อีกทีก็เป็นจนกระทั่งเราเป็นมากแล้ว และแม้ว่าโรคนี้ไม่ถึงกับรักษาไม่ได้ แต่มันต้องเสียทรัพยากรในการรักษา ซึ่งในเมื่อหลีกเลี่ยงได้ด้วยการเข้ารับการตรวจคัดกรองโดยไม่เสียค่าใช้จ่ายด้วยแล้ว จึงอยากรณรงค์ให้ผู้หญิงกลุ่มเสี่ยงเข้ารับการตรวจคัดกรอง HPV DNA จะแบบคุณหมอตรวจให้ หรือจะเก็บตัวอย่างด้วยตนเองแบบ HPV DNA Self-Sampling ก็ได้ เพราะเชื้อ HPV ยิ่งตรวจพบไวยิ่งดีจะได้ทำการรักษาก่อนเชื้อพัฒนาไปเป็นมะเร็ง
กันไว้ดีกว่าแก้ มดลูกแย่จะแก้ไม่ทัน!!
ศูนย์บริการสาธารณสุข 38 จี๊ด - ทองคำ บำเพ็ญ ประกาศรับสมัคร LINK
พนักงานช่วยงานด้านสาธารณสุข 4 ตำแหน่ง
-จบการศึกษา วุฒิ ปวส. ทุกสาขา (ปวส. 3 ตำแหน่ง)
-อัตราค่าตอบแทนรายวัน วันละ 620 บาท
----------------
-จบการศึกษา วุฒิ ปวช. (ปวช. 1 ตำแหน่ง)
-อัตราค่าตอบแทนรายวัน วันละ 500 บาท
--------------------------
- พนักงานช่วยงานทั่วไป
- จบการศึกษา วุฒิ ม.3
- อัตราค่าตอบแทนรายวัน วันละ 320 บาท
--------------------------
คุณสมบัติทั่วไป
-มีสัญญาติไทย
-อายุไม่ตำกว่า 18 ปี
----------
หลักฐานประกอบการสมัคร
-รูปถ่ายหน้าตรงไม่สวมหมวก ไม่สวมแว่นตาดำ
ถ่ายมาแล้วไม่เกิน 1 ปี ขนาด 1 นิ้ว จำนวน 1 รูป
-สำเนาบัตรประจำตัวประชาชน จำนวน 1 ฉบับ
-สำเนาทะเบียนบ้าน จำนวน 1 ฉบับ
-ใบสำคัญทางการศึกษา ฉบับจริงนำมาแสดงเป็นหลักฐาน
และยื่นสำเนาไว้ 1 ฉบับ
-ใบรับรองแพทย์ ซึ่งออกให้ไม่เกิน 1 เดือน จำนวน 1 ฉบับ
-หากเป็นเพศชาย แนบหลักฐานการผ่านการเกณฑ์ทหาร
----------
วันเวลาและสถานที่รับสมัคร
-สามารถสมัครได้ด้วยตนเองที่ ห้องธุรการ ชั้น 4
อาคารศูนย์บริการสาธารณสุข 38 จี๊ด - ทองคำ บำเพ็ญ
เลขที่ 23 ศูนย์ราชการกรุงเทพมหานคร (เกียกกาย)
ถนนทหาร แขวงถนนนครไชยศรี เขตดุสิต กทม.
--------------------
**(สมัครด้วยตนเองเท่านั้น
ไม่รับสมัครทางช่องทางอื่น)**
--------------------
-สมัครได้ตั้งแต่วันที่ 3 กรกฎาคม 2566
ถึงวันที่ 14 กรกฎาคม 2566
ในวันและเวลาราชการ
-หากมีข้อสงสัยสามารถโทรสอบถามได้ที่
เบอร์โทรศัพท์ 0 2241 8378 , 0 2243 3157
โซเดียมกับผลเสียต่อไต
จากการที่มีการคั่งของน้ำและระดับความดันโลหิตสูง ทำให้ไตทำงานหนักขึ้น เพื่อเพิ่มการกรองโซเดียมและน้ำส่วนเกินของร่างกาย ผลที่ตามมาคือเกิดความดันในหน่วยไตสูงขึ้น และการรั่วของโปรตีนในปัสสาวะมากขึ้น นอกจากนี้ยังกระตุ้นให้ร่างกายสร้างสารบางอย่าง ซึ่งทำให้ไตเสื่อมเร็วขึ้น
ไตเป็นอวัยวะที่ช่วยในการปรับระดับโซเดียมในร่างกายคนเรา เมื่อปริมาณโซเดียมสูงเกินไป ไตจะขับถ่ายออกมา ในทางกลับกันถ้าร่างกายต้องการโซเดียม ไตจะทำงานโดยดูดสสารนั้นกลับสู่เลือด แต่เมื่อใดที่ไตทำงานผิดปกติไม่สามารถขับโซเดียมได้ในปริมาณที่เหมาะสม จนร่างกายมีปริมาณโซเดียมสะสมสูง น้ำในร่างกายก็จะเพิ่มปริมาณมากขึ้น นั่นหมายถึงว่าระดับเลือดก็จะสูงขึ้นด้วย เมื่อปริมาณเลือดสูงขึ้น เลือดต้องวิ่งผ่านไปยังเส้นเลือดมากขึ้น เป็นผลให้เกิดความดันโลหิตสูงขึ้น ซึ่งหัวใจก็ต้องสูบฉีดหนักขึ้น เพราะปริมาณเลือดที่เพิ่มสูงขึ้น ทำให้หัวใจต้องเต้นเร็วขึ้น
การได้โซเดียมมากเกิน เป็นสาเหตุทำให้ระดับความดันโลหิตเพิ่มขึ้น โดยเฉพาะในกลุ่มผู้สูงอายุ ผู้ป่วยโรคไตเรื้อรัง คนอ้วน และผู้ป่วยโรคเบาหวาน ภาวะความดันโลหิตสูงทำให้เกิดผลเสียต่อหลอดเลือดในอวัยวะต่างๆ เช่น หัวใจ และสมอง เกิดโรคหลอดเลือดหัวใจตีบตัน โรคอัมพฤกษ์ อัมพาตตามมา พบว่าในผู้ที่เป็นโรคความดันโลหิตสูงอยู่แล้วหากรับประทานโซเดียมในปริมาณที่เหมาะสม ควบคู่กับยาลดความดันโลหิต สามารถลดความดันโลหิตได้ดีกว่าผู้ที่รับประทานยาลดความดันโลหิต แต่ได้รับโซเดียมเกินกำหนด
น้ำพริกกะปิ 1 ถ้วย มีโซเดียมเฉลี่ย 2,250 มก.
เพจ
ลดพุง ลดโรค สำนักงานปศุสัตว์จังหวัดเลย บริการทำหมันฉีดวัคซีนกรกฎาคม-กันยายน
สำนักงานปศุสัตว์จังหวัดเลย กำหนดการผ่าตัดทำหมันสุนัข-แมว/ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่จังหวัดเลย (สอบถามโทร. 042-811572 ต่อ 25)
ประจำเดือนกันยายน 2566
- 1 กันยายน 2566 รับจำนวนจำกัด 50 ตัว ณ สำนักงานปศุสัตว์จังหวัดเลย
- 22 กันยายน 2566 เวลา 8.00 น. ณ โรงเรียนบ้านน้ำกระโทม หมู่ 8 ต.ท่าลี่ อ.ท่าลี่
ประจำเดือนสิงหาคม 2566
- 22 สิงหาคม 2566 ณ ศูนย์พัฒนาเด็กเล็กเก่า บ้านเลยตาวตาด หมู่ 2 ตำบลเลยวังไสย์ อำเภอภูหลวง - ผลการดำเนินการ ดังนี้ 1. ให้บริการผ่าตัดทำหมันสุนัขและแมว ทั้งหมด 17 ตัว แบ่งเป็น - สุนัขเพศเมีย 8 ตัว - แมวเพศเมีย 2 ตัว - แมวเพศผู้ 7 ตัว 2. ฉีดวัคซีนป้องกันโรคพิษสุนัขนัขบ้า ให้แก่สุนัขจำนวน 7 ตัว
- 22 สิงหาคม 2566 ณ หอประชุมองค์การบริหารส่วนตำบลปากหมัน หมู่ที่ 3 ตำบลปากหมัน อำเภอด่านซ้าย - ผลการดำเนินการ ดังนี้ 1. ให้บริการผ่าทำหมันสุนัข-แมว แบ่งเป็น - สุนัขเพศผู้ จำนวน - ตัว - สุนัขเพศเมีย จำนวน 9 ตัว - แมวเพศผู้ จำนวน 5 ตัว - แมวเพศเมีย จำนวน 19 ตัว รวมทั้งสิ้น 33 ตัว 2. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัข-แมว - สุนัข 2 ตัว - แมว 6 ตัวรวมทั้งสิ้น 8 ตัว ประชาชนผู้เข้ารับบริการ 25 ราย รวมทั้งให้ความรู้และความเข้าใจเกี่ยวกับการป้องกันโรคพิษสุนัขบ้า และการดูแลสุนัขและแมวในกำกับดูแลให้เป็นไปตามระเบียบกฎหมายและปลอดภัยจากโรคพิษสุนัขบ้า
- 18 สิงหาคม 2566 ณ วัดอุโมงค์ บ้านยาง หมู่ 5 ต.ท่าลี่ บริการผ่าตัดทำหมันสุนัข 12 ตัว แมว 10 ตัว รวม 22 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า (เก็บตก) สุนัข 16 ตัว แมว 14 ตัว รวม 30 ตัว
- 14 กรกฎาคม 2566 ณ ศาลากลางบ้านป่าไม้งาม ตำบลโคกขมิ้น อำเภอวังสะพุง บริการผ่าทำหมันสุนัข-แมว แบ่งเป็น สุนัขเพศเมีย จำนวน 17ตัว สุนัขเพศผู้ จำนวน 6 ตัว - แมวเพศเมีย จำนวน 8ตัว แมวเพศผู้ จำนวน 3 ตัว รวมทั้งสิ้น 34 ตัว ประชาชนผู้เข้ารับบริการ 19 ราย รวมทั้งให้ความรู้และความเข้าใจเกี่ยวกับการป้องกันโรคพิษสุนัขบ้า และการดูแลสุนัขและแมวในกำกับดูแลให้เป็นไปตามระเบียบกฎหมาย และปลอดภัยจากโรคพิษสุนัขบ้า
สัปดาห์ที่ 39 (15 กันยายน - 1 ตุลาคม 2566)
ต่างชาติ 552,419 คน
เฉลี่ยวันละ 78,917 คน
นักท่องเที่ยวต่างชาติสะสม 20,051,535 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 839,409 ล้านบาท
5 ประเทศ แรก
จีน 106,472 คน
มาเลเซีย 96,060 คน
เกาหลีใต้ 41,981 คน
อินเดีย 37,067 คน
ลาว 24,311 คน
*****
สัปดาห์ที่ 38 (18-24 กันยายน 2566)
ต่างชาติ 481,404 คน
เฉลี่ยวันละ 68,772 คน
นักท่องเที่ยวต่างชาติสะสม 19,499,116 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 815,597 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 78,042 คน
จีน 61,728 คน
อินเดีย 30,679 คน
เกาหลีใต้ 29,856 คน
ญี่ปุ่น 24,470 คน
*****
สัปดาห์ที่ 37 (11-17 กันยายน 2566)
ต่างชาติ 470,708 คน
เฉลี่ยวันละ 67,244 คน
นักท่องเที่ยวต่างชาติสะสม 19,000,988 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 795,114 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 84,981 คน
จีน 56,779 คน
อินเดีย 30,853 คน
เกาหลีใต้ 25,954 คน
ญี่ปุ่น 23,760 คน
*****
สัปดาห์ที่ 36 (4-10 กันยายน 2566)
ต่างชาติ 454,205 คน
เฉลี่ยวันละ 64,887 คน
นักท่องเที่ยวต่างชาติสะสม 18,530,280 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 775,295 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 70,490 คน
จีน 53,574คน
อินเดีย 32,960 คน
เกาหลีใต้ 26,757 คน
ลาว 22,220 คน
*****
สัปดาห์ที่ 35 (29 สิงหาคม - 3 กันยายน 2566)
ต่างชาติ 505,006 คน
เฉลี่ยวันละ 72,229 คน
นักท่องเที่ยวต่างชาติสะสม 18,076,075 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 755,720 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 123,341 คน
จีน 48,669 คน
อินเดีย 29,896 คน
เกาหลีใต้ 26,728 คน
ลาว 24,951 คน
*****
สัปดาห์ที่ 34 (21-27 สิงหาคม 2566)
ต่างชาติ 528,428 คน
เฉลี่ยวันละ 75,490 คน
นักท่องเที่ยวต่างชาติสะสม 17,571,069 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 735,956 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 106,779 คน
จีน 66,747 คน
เกาหลีใต้ 29,896 คน
อินเดีย 28,157 คน
เวียดนาม 25,248 คน
*****
16-17 ธันวาคม 2566 ชมทุ่งดอกเก๊กฮวย เที่ยวค่ายบางระจัน Check-in งาน ยอยศยิ่งฟ้า อยุธยามรดกโลก
ทริปที่ 11 และ 12 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 16 และวันอาทิตย์ที่ 17 ธันวาคม 2566) โปรแกรม แต่งชุดไทย นั่ง KIHA 183 ชมทุ่งดอกเก๊กฮวย เที่ยวค่ายบางระจัน Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
นอกจากนี้ ที่ขาดไม่ได้คือผู้สนับสนุนเทศกาลฯ ไม่ว่าจะเป็นเอพี ไทยแลนด์ (AP Thailand), เซ็นทรัลพัฒนา x เซ็นทรัลเวิลด์ (CPN x centralwOrld), ธนาคารกรุงศรีอยุธยา จำกัด (มหาชน) (KRUNGSRI), แอล.พี.เอ็น. (LPN), วัน แบงค็อก (One Bangkok), เอสซี แอสเสท (SC ASSET), เอปสัน (ประเทศไทย) (EPSON), ไปรษณีย์ไทย, ห้างสรรพสินค้าเซ็นทรัล (CENTRAL), ฮาตาริ (HATARI), กลุ่มสยามพิวรรธน์ (SIAM PIWAT), การท่องเที่ยวแห่งประเทศไทย, สำนักงานส่งเสริมการจัดประชุมและนิทรรศการ (องค์การมหาชน) (TCEB) และซีแพค กรีน โซลูชั่น (CPAC) และพันธมิตรของ CEA ได้แก่ กรุงเทพมหานคร (Bangkok Metropolitan Administration: BMA),บริษัท อรุณพลัส จำกัด, ศูนย์การค้าซีคอนสแควร์, บจก. ทีวีบูรพา และ Media Partner ของ CEA
ศูนย์แพทย์แผนจีน
ศูนย์การแพทย์แผนจีน โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี พร้อมให้บริการการตรวจรักษาโรคด้วยศาสตร์แพทย์แผนจีน รักษาโรค ปวดเมื่อยคอ บ่าไหล่ หลัง ท้องเสียเรื้อรัง ท้องผูก ปวดศรีษะ ไมเกรน เวียนศีรษะ โรคกระเพาะอาหาร กรดไหลย้อน ปรับสมดุลฮอร์โมน นอนไม่หลับ มีอาการชา ภูมิแพ้ ประจำเดือนมาไม่ปรกติ มีบุตรยาก ปวดตามข้อ เอว หัวเข่า นิ้วล็อก โรคหลอดเลือดสมอง อัมพาตใบหน้า อ่อนเพลียเรื้อรัง บริการด้านความงาม เช่น ลดริ้วรอย ลดน้ำหนัก รักษาสิว ฝ้า กระ
สถานที่ให้บริการ (แพทย์แผนจีน)
โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี
ติดต่อสอบถามและนัดหมาย 0-2432-6167-8 ต่อ 6000 (สามารถเบิกค่ารักษาพยาบาลได้ตามสิทธิการรักษา)
พญ. กอบกุลยา จึงประเสริฐศรี พิธีกรงาน
ความสำคัญของการดูแลสุขภาพแบบเวลเนส
ตามที่ทราบกันโดยทั่วไปแล้วว่า เวลเนสเป็นการดูแลสุขภาพแบบองค์รวมทั้งร่างกาย จิตใจ อารมณ์ สังคม และในมิติทางจิตวิญญาณ โดยมุ่งเน้นการป้องกันก่อนการเกิดโรคและมีการปรับวิถีชีวิต (lifestyle) และพฤติกรรมสุขภาพด้วยเทคโนโลยีทางการแพทย์สมัยใหม่ควบคู่กันไป เพื่อนำไปสู่ผลลัพธ์ของการมีสุขภาพดีแบบองค์รวม (Holistic Health) รวมถึงนำไปสู่การมีความเป็นอยู่ที่ดี (Well-being) และช่วยลดความเสี่ยงต่อการเกิดโรคไม่ติดต่อเรื้อรัง (NCDs) ได้อีกด้วยการดูแลสุขภาพแบบเวลเนสทางการแพทย์ เป็นวิธีการปฏิบัติทางการแพทย์ที่เน้นการป้องกันมากกว่าการรักษา ส่งเสริมการมี Healthy Lifestyle หรือการใช้ชีวิตประจำวันที่ดีต่อสุขภาพอย่างต่อเนื่องและมีความสุขอย่างยั่งยืน ผนวกการดูแลสุขภาพเข้าสู่ชีวิตประจำวันเพื่อให้มีสุขภาพที่ดีขึ้น
การจัดบริการเวลเนสในปัจจุบัน มีการนำ เสนอ บริการที่ใช้วิทยาการทางการแพทย์เป็นหลักการในการดูแลสุขภาพองค์รวมที่เหมาะสมกับคนทุกเพศทุกวัย เพราะในแต่ละวัยย่อมมีปัญหาสุขภาพที่แตกต่างกันออกไป เช่น
- วัยเด็ก มีปัญหาเกี่ยวกับภูมิแพ้ การขาดวิตามิน หรือสมาธิสั้น
- วัยทำงาน มีปัญหาด้านความเจ็บป่วยจากการทำงาน ภาวะซึมเศร้า ปัญหาสุขภาพจิต การดูแล สมองและความสดชื่นกระปรี้กระเปร่า การเสริมความงาม
- วัยผู้สูงอายุ มีปัญหาด้านการเสื่อมสมรรถภาพของร่างกาย ปัญหาการนอนไม่หลับ ความอยากอาหาร รวมทั้งความต้องการชะลอวัย เป็นต้น
17.PARTNERSHIPS FOR THE GOALS ความร่วมมือเพื่อเป้าหมาย
เป้าหมายการพัฒนาอย่างยั่งยืนสามารถบรรลุผลได้ก็ต่อเมื่อมีความร่วมมือและความร่วมมือระดับโลกที่แข็งแกร่งเท่านั้น ความช่วยเหลือด้านการพัฒนาอย่างเป็นทางการยังคงมั่นคงแต่ต่ำกว่าเป้าหมายที่ 147 พันล้านดอลลาร์สหรัฐในปี 2560 ในขณะที่วิกฤตด้านมนุษยธรรมที่เกิดจากความขัดแย้งหรือภัยพิบัติทางธรรมชาติยังคงต้องการทรัพยากรทางการเงินและความช่วยเหลือเพิ่มเติม ประเทศต่างๆ จำนวนมากยังต้องการความช่วยเหลือด้านการพัฒนาอย่างเป็นทางการเพื่อส่งเสริมการเติบโตและการค้า
โลกเชื่อมโยงกันมากกว่าที่เคย การปรับปรุงการเข้าถึงเทคโนโลยีและความรู้เป็นหนทางสำคัญในการแบ่งปันแนวคิดและส่งเสริมนวัตกรรม การประสานนโยบายเพื่อช่วยให้ประเทศกำลังพัฒนาจัดการหนี้สินของตน รวมถึงส่งเสริมการลงทุนสำหรับประเทศที่พัฒนาน้อยที่สุดถือเป็นสิ่งสำคัญสำหรับการเติบโตและการพัฒนาอย่างยั่งยืน
เป้าหมายดังกล่าวมีจุดมุ่งหมายเพื่อเสริมสร้างความร่วมมือระหว่างภาคเหนือ-ใต้และภาคใต้-ใต้โดยสนับสนุนแผนระดับชาติเพื่อบรรลุเป้าหมายทั้งหมด การส่งเสริมการค้าระหว่างประเทศและการช่วยเหลือประเทศกำลังพัฒนาในการเพิ่มการส่งออกเป็นส่วนหนึ่งของการบรรลุระบบการค้าที่เป็นธรรมและอิงตามกฎสากลซึ่งยุติธรรมและเปิดกว้างและให้ประโยชน์แก่ทุกคน
โปรแกรมคลินิก KKSEHR มาพร้อมกับความสามารถข้างต้น และพร้อมแล้วสำหรับการใช้งานในคลินิกคุณ ติตต่อทดลองใช้ หรือนัด demo-online เราได้ที่ www.kongkasoft.com หรือ 066 150 2487
27 มิถุนายน 2565 ออกให้บริการประชาชนชวนจังหวัดอุดรธานี
ขอเชิญชวนข้าราชการทุกหน่วยงาน ประชาชนชวนจังหวัดอุดรธานี และจังหวัดใกล้เคียง ในวันจันทร์ที่ 27 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา จากทางโรงพยาบาลธีรวัฒน์ จ.กาฬสินธุ์ สำหรับท่านใดที่มีปัญหาทางด้าน #สายตา #การมองเห็นไม่ชัด #สายตาพร่ามัว #มีภาพซ้อน สามารถเดินทางไปตรวจเช็คที่หน่วยบริการได้เลย
สถานที่ให้บริการ : สหกรณ์ออมทรัพย์ครู จ.อุดรธานี ตั้งแต่เวลา 08:30 - 16:00 น. บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางซื่อ
Cafe Amazon for Chance สาขา 9 สำนักงาน ก.ล.ต. ถนนวิภาวดีรังสิต
Cafe Amazon for Chance สาขาที่ 9 ให้บริการโดยผู้พิการทางการได้ยิน
เปิดเมื่อ 30 มิ.ย. 63
ตั้งอยู่ที่ คณะกรรมการกำกับหลักทรัพย์และตลาดหลักทรัพย์ (ก.ล.ต.)
333, 3 ซอย วิภาวดีรังสิต แขวง จอมพล เขตจตุจักร กรุงเทพมหานคร 10900
+6620339999
ข่าวที่เกี่ยวข้อง
ศูนย์คลังเลือดกลาง รพ.ขอนแก่น ขอรับบริจาคโลหิตหมู่โอ (O) LINK
ศูนย์คลังเลือดกลาง โรงพยาบาลขอนแก่น ขอรับบริจาคโลหิตหมู่โอ (O)
เนื่องด้วยสถานการณ์โลหิตโรงพยาบาลขอนแก่น อยู่ในภาวะวิกฤติ จึงขอเชิญชวนประชาชนผู้มีจิตอันเป็นกุศล สุขภาพร่างกายแข็งแรง บริจาคโลหิตเพื่อช่วยชีวิตผู้ป่วย และรองรับสถานการณ์ช่วงเทศกาลปีใหม่
- ผู้ที่สนใจ สามารถบริจาคได้ที่ ห้องรับบริจาคโลหิต โรงพยาบาลขอนแก่น อาคารคุณากรปิยชาติ ชั้น 3
- วันจันทร์-ศุกร์ เวลา 08.30-19.30 น.
- วันเสาร์ อาทิตย์และวันหยุดนักขัตฤกษ์ เวลา 08.30-15.30 น.
- โทรศัพท์ 043-009900 ต่อ 4544
- ประกาศ ณ วันที่ 25 ธ.ค. 63
ประกาศกระทรวงสาธารณสุข ให้กลุ่มเสี่ยงไปตรวจโรคที่โรงพยาบาลทุกแห่ง
ประกาศกระทรวงสาธารณสุข ให้กลุ่มเสี่ยงไปตรวจโรคที่โรงพยาบาลทุกแห่ง
แพร่ แอ่วเวียงโกศัยม่วนใจ๋ใส่ผ้าหม้อห้อม ตลอดเทศกาลสงกรานต์ 2564
จ.แพร่ รณรงค์สวมใส่ผ้าไทย ผ้าพื้นเมืองแพร่ ภายใต้แนวคิด “แอ่วเวียงโกศัยม่วนใจ๋ใส่ผ้าหม้อห้อม” ตลอดเทศกาลสงกรานต์ 2564
พะเยา - สแกน QR พะเยาชนะ LINK
8 เมย 64
ประกาศจังหวัดพะเยา
- สแกน QR พะเยาชนะ + ขอความร่วมมื่อ ติดตั้ง หมอชนะ
- มาจาก 5 จว.แดง รายงานตัวต่อจนท. /อสม/กำนัน/ผู้ใหญ่บ้าน ประเมินความเสี่ยง
- เสี่ยงต่ำ สังเกตตนเอง
- เสี่ยงสูง ให้กักตัวที่บ้าน 14 วัน นับแต่วันที่เดินทางมาถึงพะเยา
เว้นแต่กรณีนี้ ให้ผู้เดินทางสังเกตอาการตนเอง
- ผู้เดินทางมีผลตรวจ RT-PCR หรือตรวจน้ำลาย (Pooled Saliva Samples) โดยแสดงใบรับรองแพทย์ อายุไม่เกิน 72 ชม. ก่อนเข้าจังหวัด ที่มีข้อความระบุว่า "ผลการตรวจทางห้องปฏิบัติการไม่พบการติดเชื้อ COVID 19 และไม่ป่วยช่วง 14 วัน ก่อนเดินทาง หรือ
- ผู้เดินทางที่ได้รับวัคซีนโควิด ครบตามเกณฑ์ที่ผู้ผลิตวัคซีนกำหนด โดยแสดงเอกสารรับรองการได้รับวัคซีน ซึ่งออกโดยหน่วยงานรัฐ ต้องเป็นวัคซีนที่ขึ้นทะเบียนตามกฏหมายไทย หรือรับรองจาก อนามัยโลก หรือ ตามที่สธ.กำหนด
หากมีอาการไข้ ไอ เจ็บคอ มีน้ำมูก อ่อนเพลียน หายใจหอบเหนื่อย จมุกไม่ได้กลิ่น ลิ้นไม่รับรส ให้รีบไปพบแพทย์ ณ รพ.ใกล้บ้าน
การเข้าจังหวัดที่มาจากพื้นที่ นอกเหนือจาก สีแดง ให้
- รายงานตัวต่อจนท.
- สังเกตอาการตนเอง
รพ.พะเยา โทร 054-409-300
เพจ
สสจ พะเยา โทร 054-409-199
สุโขทัย
จังหวัดสุโขทัย มีคำสั่งกำหนดมาตรการ ให้ประชาชนใส่หน้ากากอนามัย/หน้ากากผ้า เมื่ออยู่นอกบ้าน ตามมาตรการฯ ฉบับที่ 32
คำแนะนำสำหรับผู้ป่วยโรคระบบประสาท LINK
คำแนะนำการฉีดวัคซีนโควิด-19 สำหรับผู้ป่วยโรคระบบประสาท
ผู้ป่วยโรคสมองและระบบประสาทไขสันหลัง ถือเป็นกลุ่มที่มีความเสี่ยงสูง หากติดเชื้อไวรัสโคโรน่า จึงควรได้รับการฉีดวัคซีนป้องกันการติดเชื้อไวรัสเป็นกลุ่มแรกๆ โดยผู้ป่วยต้องมีอาการทางระบบประสาทคงที่ หรือไม่อยู่ในภาวะอันตรายต่อชีวิต อย่างน้อย 4 สัปดาห์
โรคหลอดเลือดสมอง
ใช้เข็มเล็กกว่า 23G
กิน Warfarin ค่า INR <3
ยาเหล่านี้ฉีดได้
- Aspirin
- Clopidogrel
- Cilostazol
- NOAC
โรคลมชัก
ฉีดได้ แต่ระวังไข้หลังฉีดวัคซีนอาจจะกระตุ้นอาการชักได้
โรคอื่น ๆ
พาร์กินสัน สมองเสื่อม โรคเส้นประสาท โรคเซลล์สั่งการเสื่อมตัว หรืออื่น ๆ ฉีดได้ตามปกติ
โรคภูมิคุ้มกันระบบประสาทหรือผู้ป่วยกินยากดภูมิคุ้มกัน
ห้าม ฉีดวัคซีนชนิดเชื้อเป็น (Live-attenuated vaccine) ถ้ายังไม่เริ่มยา เข็มแรก ฉีดได้เลย เข็มที่2 ฉีดก่อนเริ่มยา 4 สัปดาห์
ผู้ป่วยที่กินยากดภูมิคุ้มกันอยู่แล้ว
ยาขนาดน้อย: ฉีดวัคซีนได้เลย
ยาขนาดสูง: วางแผนฉีดวัคซีนหลัง 4-12 สัปดาห์
ยา Cladibine หรือ Alemtuzumab: ฉีดวัคชีนหลังให้ยาครั้งสุดท้าย 12-24 สัปดาห์
รพ.กรุงเทพขอนแก่น มอบส่วนลดค่าห้อง 50% ลด20% โปรแกรมตรวจสุขภาพ LINK
เพียงแสดงประวัติการรับวัคซีนป้องกัน COVID-19 ใน หมอพร้อม รับสิทธิพิเศษ
ส่วนลดค่าห้อง Standard Room 50%
ห้องพักขนาดมาตรฐาน (4 เมตร x 9 เมตร)
โทรทัศน์ LCD 32"
เตียงปรับระดับอัตโนมัติด้วยไฟฟ้า
ตู้เย็น, เตาอบไมโครเวฟ, กระติกน้ำร้อนและชุดรับประทานอาหาร
ตู้เก็บของนิรภัยส่วนตัว
ระบบ Internet WiFi
Sofa bed ขนาดใหญ่
ส่วนลดค่าโปรแกรมตรวจสุขภาพ 20%
Absolute Check Up
Executive Check Up
Advanced Check Up
วันนี้ถึง 31 ธันวาคม 2564
โรงพยาบาลขอสงวนสิทธิ์ในการเปลี่ยนแปลงรายละเอียดเงื่อนไขโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
ศูนย์บริการสาธารณสุข 64 คลองสามวา ออกหน่วยฉีด 15-27 กันยายน 2564
ศูนย์บริการสาธารณสุข 64 คลองสามวา ร่วมกับฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคลองสามวา
เชิญชวนให้ประชาชนพื้นที่ใกล้เคียงนำสัตว์เลี้ยง สุนัข แมว มาฉีดได้ ณ จุดบริการ - เอกสารที่ต้องเตรียมบัตรประชาชนเจ้าของสัตว์เลี้ยง ใบเหลืองเก่า (ถ้ามี)
>>กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2564<< ระหว่างวันที่ 15 – 27 กันยายน 2564 เวลา 09.00 - 11.30 น.
[เต็มแล้ว] อบจ.ปทุมเปิดจองโมเดอร์นา ตั้งแต่ 22 พ.ย. 64
ประชาสัมพันธ์ องค์การบริหารส่วนจังหวัดปทุมธานี? - อบจ.ปทุมธานี เปิดรับลงทะเบียนวัคซีนโมเดอร์นา ตั้งแต่วันนี้ (22 พ.ย. 64) เวลา 11.00 น. เป็นต้นไป - สามารถลงทะเบียนเพื่อขอรับวัคซีนได้ ผ่านทาง Line Official Account ของ อบจ.ปทุมธานี ***วัคซีนโดย อบจ.ปทุมธานี ฉีดให้กับทุกท่าน โดยไม่มีการเสียค่าใช้จ่ายใดๆ ทั้งสิ้น***
ฮิวจ์ แกรนท์
พระเอกสุดหล่อ จากเรื่องนอตติ้งฮิลล์ และอีกมากมาย ตรวจพบว่าติดโควิดเมื่อเดือนกุมภาพันธ์ เขามีอาการจมูกไม่ได้กลิ่น
เขตบางกอกใหญ่ เตรียมพร้อมศูนย์พักคอย ณ ศูนย์สร้างสุขทุกวัยบางกอกใหญ่ LINK
บางกอกใหญ่เตรียมพร้อมศูนย์พักคอยเพื่อส่งต่อ รองรับผู้ป่วยโควิด-19
วันที่ 5 มกราคม 2565 นายสุเมธ อมรศรีวรากุล ผู้อำนวยการเขตบางกอกใหญ่ พร้อมด้วยนางเยาวะสกุล ทองธัญวีรัตน์ นายเกียรติวิสุทธิ์ เพ็ชรหมื่นไวย ผู้ช่วยผู้อำนวยการเขตบางกอกใหญ่ หัวหน้าฝ่ายสิ่งแวดล้อมฯ เจ้าหน้าที่ฝ่ายที่เกี่ยวข้อง ตรวจสถานที่เตรียมการจัดตั้งศูนย์พักคอยเพื่อส่งต่อ (Community Isolation) เพื่อรองรับการแยกผู้ป่วยโควิด-19 ในพื้นที่เขตบางกอกใหญ่ เพื่อลดการสูญเสีย ณ ศูนย์สร้างสุขทุกวัยบางกอกใหญ่
2) สถาบันด้านวิชาการทางการแพทย์ (Academic Hospital)
สถาบันด้านวิชาการทางการแพทย์ (Academic Hospital) บำรุงราษฎร์มีฝ่ายวิจัยและศึกษาที่มีบทบาทมุ่งส่งเสริมสนับสนุนการเรียนรู้อย่างต่อเนื่องของแพทย์ ทันตแพทย์ และบุคคลากรทางการแพทย์ของโรงพยาบาล ตลอดจนสร้างองค์ความรู้ใหม่ รวมทั้งนวัตกรรมในทางการแพทย์และบริการที่เกี่ยวข้อง มีการดำเนินความร่วมมือกับสถาบันทางวิชาการ/มหาวิทยาลัยในระดับประเทศ อาทิ สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง (สจล.) มหาวิทยาลัย CMKL, วิทยาลัยแพทยศาสตร์นานาชาติ จุฬาภรณ์ มหาวิทยาลัยธรรมศาสตร์, การส่งเสริมสนับสนุนงานวิจัยทั้งงานวิจัยที่เน้นความก้าวหน้าทางการแพทย์, การจัดประชุมทางวิชาการและการอบรมฝึกปฏิบัติ (Workshop) โดยมีแพทย์ของบำรุงราษฎร์เป็นผู้ถ่ายทอดความรู้และประสบการณ์ให้กับแพทย์ที่เข้าร่วมอบรม อาทิ การจัดประชุมนานาชาติในการผ่าตัดกระดูกสันหลังผ่านกล้องเอ็นโดสโคป ที่จัดต่อเนื่องมาตั้งแต่ปี 2555 และการจัดประชุมนานาชาติด้านโรคหัวใจ (International Cardiology Annual Meeting) ต่อเนื่องมาตั้งแต่ปี 2558 ในด้านการวินิจฉัยและรักษาภาวะหัวใจเต้นผิดปกติที่ทำให้เกิดการตายเฉียบพลัน เป็นต้นรพ.บี.แคร์ฯ ต้อนรับสมาชิกใหม่ กับโปรแกรมคลอดเหมาจ่าย LINK
รพ.บี.แคร์ฯ ต้อนรับสมาชิกใหม่ กับโปรแกรมคลอดเหมาจ่าย พร้อมรับสิทธิประโยชน์มากมาย สำหรับคุณแม่และลูกน้อย เราดูแลทุกชีวิตที่เกิดใหม่อย่างมีคุณภาพด้วยประสบการณ์และความชำนาญ ของทีมสูติ-นรีแพทย์ และกุมารแพทย์ วางใจให้มืออาชีพดูแลสุขภาพคุณแม่และลูกน้อยให้เติบโตสมบูรณ์
คลอดปกติ 37,900บาท 3วัน 2คืน
ผ่าตัดคลอด 49,900บาท 4วัน 3คืน
รับสิทธิ์ผ่อนชำระ 0% นาน 3 เดือน กับบัตรเครดิตที่เข้าร่วมรายการ
สอบถามรายละเอียดและนัดหมายแพทย์ได้ที่ ศูนย์สุขภาพสตรี ชั้น 1 อาคารปานปิติ โทร. 02 532 4444 ต่อ 2103, 2104
ทุ่งโปรงทอง ไประยอง ต้องไม่พลาด LINK
สัมผัสความอุดมสมบูรณ์ของผืนป่าชายเลนที่หนาแน่นและเต็มไปด้วยพันธุ์ไม้หลายชนิด เช่น แสม ตะบูนดำ ลำพูน โกงกาง โปรงแดง ฯลฯ บนเส้นทางเดินศึกษาธรรมชาติที่มีสะพานไม้ทอดยาวผ่านป่าชายเลนราว 2 กิโลเมตร และที่นี่ยังเป็นแหล่งอาศัยของสัตว์น้ำนานาชนิด อย่างปูแสม ปูก้ามดาบ (พบได้ช่วงน้ำลด) รวมไปถึงนกชนิดต่างๆ และค้างคาวแม่ไก่อีกด้วย ติดต่อ เทศบาลตำบลปากน้ำประแส : 038-661-720 ????ติดต่อ ททท.สำนักงานระยอง : 038-655-420
โรงพยาบาลสมุทรปราการ พร้อมบริการฉีดวัคซีน ตลอดเดือนสงกรานต์ LINK
Walk in ฉีดวัคซีน เดือนสงกรานต์ ครอบครัวพร้อมหน้า ลดความเสี่ยง กับเทศกาลสงกรานต์ ในเดือน เมษายน นี้
ขอเชิญชวนทุกท่านที่มีอายุตั้งแต่ 12 ปีขึ้นไป (ไทย และ ต่างชาติ) ฉีดวัคซีน Pfizer , astrazeneca เข็ม 1-4 (ตามเงื่อนไขที่แนบมาใต้โพส)
และลูกๆหลานๆ ของท่านที่มีอายุ 5 -11 ปี สัญชาติไทย (ไม่จำกัดภูมิลำเนา) ฉีด Pfizer เด็ก เข็ม 1
Walk in ไม่จำกัดจำนวน ตลอดทั้งเดือน
ณ จุดบริการฉีดวัคซีน ลานจอดรถชั้น 3 Big C สมุทรปราการ (ตรงข้ามโรบินสัน)
เปิดบริการตั้งแต่วันจันทร์ - เสาร์
ยกเว้นวันหยุดราชการ และวันหยุดสงกรานต์ คือวันที่ 6,13,14,15,16 เม.ย 65 ไม่เปิดบริการ
รับคิวได้ตั้งแต่เวลา 07.00 -15.00 น.
หลักฐานที่ต้องนำมา ....
1️⃣ บัตรประชาชน ทะเบียนบ้าน หรือ สูติบัตร
2️⃣ กรณีเคยติดโควิด ขอให้นำใบรับรองแพทย์ หรือ ผลการตรวจมาด้วย
3️⃣ หลักฐานที่เคยฉีดวัคซีนเข็มที่ผ่านมา
4️⃣ ปากกาส่วนตัว
ที่จุดบริการจะไม่ออกใบรับรอง(Certificate)การฉีดวัคซีนให้ ขอให้ทุกท่านตรวจสอบการฉีดวัคซีนผ่าน app หมอพร้อมค่
หลักสูตรฉุกเฉินการแพทย์ - อ.นพ.สุขสันต์ กนกศิลป์
อาจารย์ นายแพทย์สุขสันต์ กนกศิลป์ อาจารย์ประจำหลักสูตรฉุกเฉินการแพทย์ โรงเรียนวิทยาศาสตร์การแพทย์ ได้บรรยายและจำกัดความถึงนักฉุกเฉินการแพทย์ไว้ว่า
"นักฉุกเฉินการแพทย์มืออาชีพ เชี่ยวชาญพร้อมช่วยเหลือสังคม”
ทางหลักสูตรมุ่งเน้นผลิตบัณฑิตให้มีความรู้ความชำนาญ และทักษะด้านฉุกเฉินการแพทย์ เพื่อให้ผู้ป่วยฉุกเฉินโดยเฉพาะผู้ป่วยฉุกเฉินวิกฤตนั้นได้รับการผดุงชีวิต รวมทั้งป้องกันการเสียชีวิตหรือการรุนแรงขึ้นของการบาดเจ็บหรืออาการป่วยนั้นได้อย่างถูกต้อง มีประสิทธิภาพ มีคุณธรรม จริยธรรม จรรยาบรรณและเจตคติที่ดีตามมาตรฐานการแพทย์ฉุกเฉิน สามารถทำงานเป็นทีมร่วมกับสหวิชาชีพในงานฉุกเฉินการแพทย์ได้อย่างถูกต้อง เพื่อลดอัตราความเสี่ยงและความสูญเสียของผู้ป่วยกรณีฉุกเฉินให้ได้รับการปฏิบัติการฉุกเฉินก่อนถึงมือผู้ประกอบวิชาชีพในสถานพยาบาลที่รับผู้ป่วยไว้ค้างคืน มีความทันสมัยเข้ากับบริบทของประเทศและนานาชาติ นำไปสู่การวิจัย ช่วยเหลือ และการถ่ายทอดความรู้ให้กับบุคคลอื่นได้
ปัจจุบัน เปิดการเรียนการสอนในสาขาวิชาฉุกเฉินการแพทย์ (ต่อเนื่อง) เป็นสาขาของการประกอบโรคศิลปะด้านสุขภาพที่กระทำต่อผู้ป่วยฉุกเฉินนอกสถานพยาบาลเป็นหลัก รวมทั้งสามารถดูแลเบื้องต้นในห้องฉุกเฉิน เพื่อให้ผู้ป่วยฉุกเฉินนั้นได้รับการช่วยชีวิตและป้องกันการเสียชีวิต โดยกิจกรรมเยี่ยมชมยังจำลองสถานการณ์การช่วยเหลือผู้บาดเจ็บจากอุบัติเหตุพลัดตกจากที่สูง มีการปวดเจ็บต้นคอและแผ่นหลังเคลื่อนย้ายขึ้นรถพยาบาล (Ambulance) ตลอดจนสาธิตเครื่องมือและอุปกรณ์เทคโนโลยีที่ทัน สมัยภายในรถก่อนนำผู้บาดเจ็บหรือผู้ป่วยส่งโรงพยาบาลต่อไป
กลุ่มสมุนไพรอื่นๆ ที่ไม่ใช่กัญชา ก็มานะ แม้จะบางตาไปมากก็ตาม
มิติที่ 6 การปลูกต้นไม้
โครงการปลูกต้นไม้ 1 ล้านต้น สร้างการมีส่วนร่วมกับภาครัฐ เอกชน และประชาชน เพิ่มพื้นที่สีเขียว เริ่มเป็นกำแพงกรองฝุ่นแล้ววันนี้ โดย ณ วันที่ 3 ส.ค. 65 มีการปลูกต้นไม้ตามโครงการฯ ไปแล้วทั้งหมด 82,248 ต้น แบ่งเป็น ไม้ยืนต้น 27,186 ต้น ไม้พุ่ม 45,818 ต้น ไม้เลื้อย 9,244 ต้น ยอดจองปลูกต้นไม้ 1,641,360 ต้น ขณะนี้ประชาชนสามารถบันทึกการปลูกต้นไม้ที่ตนเองปลูกและติดตามการเติบโตของต้นไม้ได้ด้วยตนเอง ผ่านแอปพลิเคชันไลน์ “ปลูกอนาคต” (Line @tomorrowtree)
นอกจากนี้ ในเดือน ก.ค. ที่ผ่านมา กทม.ได้ประสานความร่วมมือด้านการพัฒนากรุงเทพมหานครในมิติต่าง ๆ กับหน่วยงานภายนอกจากหลายภาคส่วน รวมทั้งหมด 31 ครั้ง โดยเป็นหน่วยงานรัฐ 10 ครั้ง หน่วยงานต่างประเทศ 10 ครั้ง ภาคประชาสังคม 5 ครั้ง เอกชน 3 ครั้ง และการศึกษาวิจัย 3 ครั้ง
● การเตรียมรับมือสถานการณ์น้ำในกรุงเทพมหานคร:
ด้าน นายวิศณุ ทรัพย์สมพล รองผู้ว่าราชการกรุงเทพมหานคร แถลงถึงสถานการณ์น้ำและการแก้ปัญหาน้ำท่วมพื้นที่ กทม. ว่า ปัจจุบัน กทม.มีท่อระบายน้ำยาว 6,564 กิโลเมตร ตั้งเป้าลอกท่อไว้ที่ 4,630 กิโลเมตร ดำเนินการแล้วเสร็จ 2,400 กิโลเมตร ส่วนการขุดลอกคลอง 1,980 คลอง ความยาว 2,745 กิโลเมตร ได้ดำเนินการลอกคลองเอาเลนออก 27 กิโลเมตร และจะทำทั้งหมดอีก 98 กิโลเมตร ตามแผนของสำนักการระบายน้ำ ขณะที่การลอกคลองเปิดทางน้ำไหลโดยสำนักงานเขต ดำเนินการไปแล้วประมาณ 1,500 กิโลเมตร
สำหรับอุโมงค์ระบายน้ำใน กทม. มี 4 แห่ง ความยาว 19 กิโลเมตร ได้แก่ อุโมงค์ประชาราษฎร์ สาย 2 อุโมงค์คลองบางซื่อ อุโมงค์คลองแสนแสบ และอุโมงค์บึงมักกะสัน ยังอยู่ระหว่างการก่อสร้างอีก 4 แห่ง ได้แก่ อุโมงค์คลองเปรมประชากร อุโมงค์คลองทวีวัฒนา อุโมงค์คลองแสนแสบส่วนต่อขยาย และอุโมงค์บึงหนองบอน คาดว่าจะมีประสิทธิภาพการระบายน้ำรวม 152 ลูกบาศก์เมตรต่อวินาที ส่วนสถานีสูบน้ำมี 190 แห่ง ประตูระบายน้ำ 244 แห่ง และบ่อสูบน้ำ 316 แห่ง ซึ่งเป็นหัวใจสำคัญในการระบายน้ำ ป้องกันน้ำท่วมขังใน กทม. สำหรับการระบายน้ำในถนนสายหลัก จะมีเซนเซอร์รายงานน้ำท่วม แต่ในซอยย่อยจะไม่มี จึงต้องอาศัยข้อมูลจากการรายงานเหตุของประชาชนผ่าน Traffy Fondue ทั้งนี้ สำนักระบายน้ำได้ปรับจุดเสี่ยงน้ำท่วมในพื้นที่ กทม.จาก 9 จุด เหลือ 7 จุดแล้ว ปัญหาที่พบคือ การปรับปรุงสถานีสูบน้ำ ทำให้ไม่สามารถระบายน้ำได้อย่างเต็มที่รวมถึงการเฝ้าระวังจุดน้ำท่วมซ้ำซากในถนนสายรอง
Visa Application and Issuance
4 steps as following;
- Register and submit online an application for qualification endorsement for LTR Visa and supporting documents.
- Within 20 working days after having received complete documents, applicants will be notified of the result.
- Qualified applicants may proceed with applying for LTR Visa issuance at the Royal Thai Embassies/the Royal Thai Consulate Generals overseas or Immigration offices in Thailand within 60 days from the issuance date of the endorsement letter. The processing fee for the 10-year visa with multiple entry is 50,000 Baht per person.
- Applicants who work in Thailand, may collect digital work permits at the Department of Employment at One Stop Service Center for Visa and Work Permit, Chamchuri Square Building, Bangkok or provincial labour offices. The processing fee is 3,000 Baht per year to maintain digital work permit.
ในบทความวิชาการของคุณหมอ Perlman และคณะ จาก Mayo Clinic ได้กล่าวถึงความหมายของ Health and wellness coaching (HWCs) ไว้ว่า เป็นการดูแลโดยมีผู้ป่วยเป็นศูนย์กลาง ช่วยให้ผู้ป่วยกำหนดเป้าหมายของตัวเอง ร่วมกับกระบวนการเรียนรู้ร่วมกัน และติดตามการเปลี่ยนแปลงของพฤติกรรม ทั้งหมดนี้อาศัยความสัมพันธ์อันดี ระหว่างผู้ป่วยกับทีมสหวิชาชีพ โดยทีมสหวิชาชีพเป็นทีมวิชาชีพทางด้านสาธารณสุขที่ได้รับการอบรมเกี่ยวกับทฤษฎีการปรับเปลี่ยนพฤติกรรม การสร้างแรงจูงใจ และเทคนิคการสื่อสาร เพื่อช่วยให้ผู้ป่วยมีการเปลี่ยนแปลงทางสุขภาพอย่างยั่งยืน เรียกได้ว่า เป็น Personalised Care
แตกต่างจากการพบแพทย์แบบทั่วไป การดูแลในรูปแบบ Health and wellness coaching อาจใช้เวลาเฉลี่ย 45-60 นาทีต่อสัปดาห์ เป็นเวลาอย่างน้อย 3 เดือน เพื่อให้เกิดการปรับเปลี่ยนวิถีชีวิตที่สอดคล้องกับผู้ป่วยมากที่สุด
บทความวิชาการในวารสาร American Journal of Lifestyle Medicine ที่รวบรวมงานวิจัยเกี่ยวกับ Health and wellness coaching ได้สรุปผลการวิจัยว่า วิธีการ Health and wellness coaching มีส่วนช่วยลดน้ำหนัก ลดค่าความดันโลหิต ลดความเสี่ยงของการเกิดโรคหัวใจและโรคเบาหวานได้
5.6 การดำเนินการของหน่วยงาน ส่วนราชการและหน่วยงานของรัฐ อาจพิจารณาดำเนินการตามแนวทางและขั้นตอน ดังนี้
5.6.1 หน่วยงานพิจารณาเหตุผลความจำเป็นในการดำเนินการ โดยพิจารณาภารกิจและลักษณะงานของหน่วยงานในภาพรวม รูปแบบและขั้นตอนวิธีการทำงานและรูปแบบการให้บริการประชาชน และเทคโนโลยีที่ใช้สนับสนุนการปฏิบัติงาน ว่ามีความพร้อมและเหมาะสมในการจัดรูปแบบการปฏิบัติงานที่เหมาะสมอย่างไรบ้าง จากนั้นจึงพิจารณาเลือกรูปแบบการปฏิบัติงานที่เหมาะสมต่อไป ทั้งนี้ รูปแบบการปฏิบัติงานที่หน่วยงานเลือกจะต้องไม่กระทบต่อประสิทธิภาพและคุณภาพการให้บริการประชาชน รวมถึงการปฏิบัติงานตามภารกิจของหน่วยงาน
5.6.2 ผู้บริหารหน่วยงานพิจารณามอบนโยบายหรือมีข้อสั่งการในการปฏิบัติงานตามรูปแบบการปฏิบัติงานที่กำหนด โดยเมื่อพิจารณาแล้วควรแจ้งให้ผู้ปฏิบัติงานทราบและถือปฏิบัติซึ่งอาจกระทำได้หลายวิธี เช่น การออกคำสั่งหรือประกาศ การจัดทำบันทึกข้อความแจ้งเวียนภายในหน่วยงาน การแจ้งให้ผู้ปฏิบัติงานทราบผ่านช่องทางออนไลน์ เพื่อสร้างความเข้าใจกับบุคลากรภายในหน่วยงาน ทั้งนี้หน่วยงานควรสร้างการรับรู้และความเข้าใจให้แก่ประชาชนผู้รับบริการ หรือผู้มีส่วนเกี่ยวข้องอื่นภายนอกหน่วยงาน โดยอาจประชาสัมพันธ์ผ่านช่องทางต่าง ๆ เพื่อให้ทราบวัน - เวลา หรือตารางการปฏิบัติงานที่แตกต่างไปจากเดิม หรือช่องทางการขอรับบริการ เพื่อป้องกันปัญหาในการขอรับบริการ หรือการติดต่อประสานงานที่อาจเกิดขึ้นได้
5.6.3 ผู้บังคับบัญชาหารือและตกลงร่วมกับผู้ใต้บังคับบัญชา เพื่อกำหนดรูปแบบการปฏิบัติงานที่เหมาะสมตามที่หน่วยงานกำหนด และพิจารณามอบหมายงานให้กับผู้ปฏิบัติงานอย่างเหมาะสมและสอดคล้องกับภารกิจและเหตุผลความจำเป็นของงาน นอกจากนี้ยังควรต้องคำนึงถึงความพร้อมในการปฏิบัติงานรูปแบบต่าง ๆ ของเจ้าหน้าที่ผู้ปฏิบัติงานด้วยซึ่งจะต้องไม่ส่งผลกระทบต่อประสิทธิภาพและคุณภาพในการปฏิบัติงานของหน่วยงาน5.6.4 หน่วยงานติดตามและประเมินผลการดำเนินการ เพื่อทบทวนการดำเนินการตามแนวทางการปฏิบัติราชการที่รองรับชีวิตและการทำงานวิถีใหม่ว่าส่งผลกระทบต่อประสิทธิภาพและคุณภาพการปฏิบัติงานตามภารกิจของหน่วยงานอย่างไรบ้าง และพิจารณาปรับปรุงองค์ประกอบต่าง ๆ ที่เกี่ยวข้องให้มีความเหมาะสมต่อไป อาทิการปรับรูปแบบและขั้นตอนวิธีการทำงานและรูปแบบการให้บริการประชาชน การนำเทคโนโลยีมาใช้ในการให้บริการประชาชนและการปฏิบัติงานภายใน การปรับระบบการบริหารงานภายในให้สอดคล้องกับชีวิตและการทำงานวิถีใหม่และการปรับรูปแบบการปฏิบัติงานให้เหมาะสมยิ่งขึ้นต่อไป
บำรุงราษฎร์มีแนวทางการรักษาด้วยวิธีอื่น ๆ นอกจากวิธีการผ่าตัด - ศ. พญ. ศิรินธรา สิงหรา ณ อยุธยา


ศ. พญ. ศิรินธรา สิงหรา ณ อยุธยา แพทย์ชำนาญการเฉพาะทางด้านรังสีร่วมรักษาระบบประสาทและไขสันหลัง โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมว่าบำรุงราษฎร์มีแนวทางการรักษาด้วยวิธีอื่น ๆ นอกจากวิธีการผ่าตัด เนื่องจากมีผู้ป่วยในหลายกรณีที่ไม่เหมาะกับการผ่าตัด เช่น ข้อจำกัดเรื่องอายุ หรือมีโรคประจำตัวบางโรค ซึ่งการรักษาแบบรังสีร่วมรักษาระบบประสาท (Neuro Intervention) จึงเข้ามาตอบโจทย์ผู้ป่วยกลุ่มนี้ โดยเป็นการทำงานร่วมกับทีมแพทย์อายุรกรรมและทีมแพทย์ด้านประสาทศัลยกรรม โดยการรักษาวิธีนี้จะเป็นการผ่าตัดแบบไม่เปิดกะโหลก ซึ่งเป็นศาสตร์ทางการแพทย์เฉพาะทางรังสีวิทยาเพื่อการตรวจวินิจฉัยและการรักษาโรคด้านโรคหลอดเลือดสมองและไขสันหลังโดยเทคโนโลยี Minimally Invasive Surgery (MIS) เน้นการเปิดแผลเล็ก โดยเจาะรูบริเวณเส้นเลือดต้นแขนหรือต้นขา ประมาณ 1-2 มิลลิเมตร ร่วมกับการใช้เทคโนโลยี Bi-plane เครื่องมือเอกซเรย์ 2 ระนาบ ทำให้เห็นความชัดเจนของเส้นเลือดเพื่อสอดอุปกรณ์ขนาดเล็กเท่าเส้นผมเข้าไปรักษาหลอดเลือดในสมองและไขสันหลังได้อย่างถูกต้องแม่นยำ โดยสามารถรักษาได้ทั้งโรคหลอดเลือดสมองตีบหรืออุดตันในระยะเฉียบพลัน โรคหลอดเลือดโป่งพองในสมอง หรือเป็นปานหลอดเลือดแดงต่อดำ ตั้งแต่กำเนิดหรือเกิดภายหลัง รวมถึงโรคหลอดเลือดไขสันหลัง อีกทั้งยังช่วยลดระยะเวลาพักรักษาในห้อง ICU และลดอาการแทรกซ้อนได้
SIAM Songkran Music Festival 2023: SIAMYSTIQUE 4 วันเต็ม ที่ RCA 12-15 เมษายน 2566
SIAM Songkran Music Festival 2023: SIAMYSTIQUE หวนคืนมาอีกครั้ง ปีนี้ 4 วันเต็ม ความฝัน • เวทมนตร์ • จิตวิญญาณ ปลดปล่อยมนต์สเน่ห์ของ "สัตว์ในตำนาน" แห่งสยามสู่คนทั้งโลก ที่จะถูกจารึกไว้ในประวัติศาสตร์ชาติเรา กลับมาสร้างตำนานเนรมิตในชีวิตจริง ผสม Vibe ของ SIAM Culture ผสานเข้ากับ World-Class Music Watering Festival ปลุกพลังแห่งจิตวิญญาณ SIAMYSTIQUE ด้วย Line-up ระดับโลก! ปลุกสัญชาตญาณ Party Animals ในตัวคุณ 4 วันเต็ม กับมหกรรมดนตรี EDM ผ่านสายน้ำที่ยิ่งใหญ่ที่สุดในเอเชีย กับพื้นที่ 15 ไร่ ใจกลางกรุงเทพมหานคร
SIAM Songkran Music Festival 2023: SIAMYSTIQUE Date: 12-15 APR 2023 Venue: Urban Yard RCA, Bangkok
ศูนย์ดูแลผู้ป่วยแบบประคับประคองในชุมชน อย่างน้อยอำเภอละหนึ่งแห่ง
ปัญหา
ปัจจุบัน คนไทยส่วนใหญ่ยังไม่รู้จักหรือเข้าไม่ถึงการดูแลฟื้นฟูผู้ป่วยในระยะปานกลาง ระยะยาว ระยะประคับประคอง ทำให้ผู้ป่วยที่ต้องได้รับการดูแล ที่ส่วนใหญ่เป็นผู้ป่วยสูงอายุและไม่สามารถพึ่งพาตัวเอง ไม่สามารถเข้าถึงการรักษาในระยะนี้อย่างมีคุณภาพ หากจะเข้าการรักษาก็ต้องเป็นภาระของบุตรหลานหรือญาติในการดูแล เนื่องในระดับองค์กรปกครองส่วนท้องถิ่นหรือชุมชุนยังไม่มีโครงสร้างพื้นฐานและบุคลากรในการรักษาระยะปานกลาง ระยะยาว และระยะประคับประคอง
โดยเฉพาะอย่างยิ่งการรักษาในระยะประคับประคอง (Palliative Care) ที่ยังไม่เข้าถึงในสถานบริการแบบปฐมภูมิ ทำให้ผู้ป่วยระยะสุดท้ายหรือระยะประคับประคองเข้าไม่ถึงการรักษาแบบประคับประคอง ที่จะทำให้ตัวเองไม่ทรมานจากความเจ็บปวดจากอาการป่วยระยะสุดท้าย นอกจากยังขาดแคลนบุคลากรที่มีความสามารถในการรักษาในระยะประคับประคอง เนื่องจากบุคลากรทางการแพทย์ทั่วไปไม่ได้มีความรู้ในด้านนี้ ส่วนแพทย์เฉพาะทางก็มีจำนวนน้อยและไม่ได้มีเส้นทางการเติบโตในสายอาชีพที่ดี อีกทั้งยังขาดโครงพื้นฐานและความรู้ความเข้าใจของประชาชนเกี่ยวกับการรักษาแบบประคับประคอง
นอกจากการรักษาแบบประคับประคอง สิทธิที่ผู้ป่วยระยะสุดท้ายที่มีความเจ็บป่วยทางกายแบบรักษาไม่ได้ที่จะตายอย่างมีศักดิ์ศรี หรือการทำการุณยฆาตเป็นสิ่งที่ยังไม่ถูกกฎหมายในประเทศไทย ทำให้ผู้ป่วยบางคนต้องทนทุกข์ทรมานก่อนเสียชีวิต
ข้อเสนอ
- พัฒนาศูนย์ดูแลผู้ป่วยแบบประคับประคองในชุมชน อย่างน้อยอำเภอละหนึ่งแห่ง
- พัฒนาหลักสูตรการดูแลผู้ป่วยแบบประคับประคอง ทั้งสำหรับบุคลากรทางการแพทย์ สำหรับผู้ดูแลมืออาชีพ สำหรับอาสาสมัครในชุมชน และสำหรับครอบครัวของผู้ป่วย
- ยกระดับสถานบริการสาธารณสุขแบบปฐมภูมิ พัฒนา อสม. ให้ทำหน้าที่บางอย่าง (เช่น ดูแลผู้ป่วย NCD ได้) โดยมีค่าตอบแทนเพิ่มขึ้น
- เปิดให้ประชาชนวางแผนล่วงหน้า (Advanced Care Plan) เพื่อยินยอมเข้ารับการรักษาแบบประคับประคอง
สวนส้มไร่ยอดดอย จากเชียงใหม่ LINK
"สวนส้มไร่ยอดดอย" เชียงใหม่ สาเหตุที่เรามาทำเหล้าส้มเนื่องจากส้มบางลูกที่ผิวเสียผิวลายไม่สามารถนำบรรจุกล่องส่งลูกค้าได้ทั้งหมด ทางสวนจึงมีแนวคิดที่จะเริ่มทำการแปรรูปหลายๆ อย่างอาทิเช่น ส้มแห้ง ส้มอบ หรือแม้กระทั่งน้ำส้ม
ข้อมูลและภาพจาก
Local Spiritโซเดียมสูง เป็นสาเหตุหลักของการเกิดโรคความดันโลหิตสูง
ปัจจัยที่เชื่อว่าเป็นสาเหตุของความดันโลหิตสูงนั้น มีหลายปัจจัย ได้แก่ กรรมพันธุ์, ความอ้วน, ระดับไขมันในเส้นเลือด, ความเครียดทางจิตใจ รวมทั้งพฤติกรรมและวิถีชีวิตที่เคยชินเช่น การรับประทานอาหารรสเค็มโดยในภาวะปกติร่างกายมีกลไกการปรับความดันโลหิตให้มีค่าอยู่ในระดับปกติและคงที่อยู่เสมอ ด้วยกลไกดังนี้
1. กลไกการปรับความดันโลหิตที่เกิดขึ้นโดยรวดเร็ว หมายถึง กลไกที่ใช้เวลาเพียงเล็กน้อยในการปรับ ได้แก่
1.1 กลไกทางระบบประสาท ซึ่งได้แก่ปฏิกิริยา Reflex โดย Reflex ที่มีบทบาทสำคัญในการควบคุมความดันโลหิตคือ baroreceptor reflex, chemoreceptor reflex และ central nervous system, ischemic mechanism โดยอาศัยตัวรับรู้ (receptor) ที่ไวต่อการเปลี่ยนแปลงความดันโลหิต ซึ่งอยู่บริเวณผนังของหลอดเลือดแดงขนาดใหญ่ เมื่อตัวรับรู้ (receptor) ของ Reflex ถูกกระตุ้น โดยการเปลี่ยนแปลงของระดับความดันโลหิต จะเกิดการเปลี่ยนแปลงความถี่ของสัญญาณคลื่นประสาทที่ไปยังสมองส่งผลให้เกิดการเปลี่ยนแปลงขนาดของหลอดเลือด การเต้นของหัวใจ และความแรงของการบีบตัวของหัวใจ และทำให้ความดันโลหิตกลับเข้าสู่สภาวะปกติ
1.2 กลไกทางฮอร์โมนและสารเคมี เป็นกลไกควบคุมความดันโลหิตที่เกิดขึ้นในเวลาอันรวดเร็วโดยอาศัยบทบาทของฮอร์โมนและสารเคมีด้วยซึ่งได้แก่ nor epinephrine- epinephrine system, rennin-angiotensin system และ vasopressin(ADH)
1.2.1 ฮอร์โมน nor epinephrine และ epinephrine ซึ่งมีผลต่อระบบไหลเวียน คือ ทำให้หัวใจทำงานเพิ่มขึ้น หลอดเลือดส่วนใหญ่ในร่างกายหดตัวทั้งหลอดเลือดแดงและหลอดเลือดดำ ความดันโลหิตสูงขึ้นซึ่งเป็นการเพิ่มcardiacoutput และความต้านทานส่วนปลาย
1.2.2 ระบบเรนิน-แองจิโอเทนซิน (renin-angiotensin system) เป็นกลไกของการปรับความดันโลหิตที่เกิดขึ้นอย่างรวดเร็วอีกชนิดหนึ่งและยังสามารถควบคุมในระยะยาวได้อีกด้วยถือเป็นระบบที่มีความสำคัญมาก โดยถูกกระตุ้นเมื่อมีระดับความดันโลหิตเปลี่ยนแปลง โดยระบบเรนิน-แองจิโอเทนซินนั้น มีผลต่อการปรับเปลี่ยนระดับความดันโลหิตสูง, มีอิทธิพลต่อหลอดเลือดเป็นอย่างมากมากและมีฤทธิ์ในการกระตุ้นมากกว่านอร์อิพิเนฟรินประมาณ 200 เท่า โดยการทำให้หลอดเลือดแดงหดตัวและยับยั้งการขับออกของเกลือและน้ำที่ไตจึงมีผลกระตุ้นการผลิตและหลั่งฮอร์โมนอันโดสเตอโรนซึ่งไปยับยั้งการขับเกลือและน้ำ
2. กลไกการปรับความดันโลหิตที่ต้องใช้เวลานาน หมายถึง กลไกที่ใช้เวลานานในการปรับระดับความดันโลหิต ซึ่งเกิดขึ้นช้ากว่ากลไกของระบบประสาท ได้แก่ การควบคุมปริมาตรของเลือดโดยกลไกทางหลอดเลือดฝอยและกลไกทางไต
2.1 กลไกทางหลอดเลือดฝอย (capillary fluid shift) โดยเมื่อความดันโลหิตเปลี่ยนแปลง จะมีผลไปถึงความดันในหลอดเลือดฝอยด้วย ทำให้สมดุลของการแลกเปลี่ยนสารน้ำผ่านผนังหลอดเลือดฝอยถูกรบกวนไปด้วย
2.2 กลไกทางไต (Renal body fluid mechanism) การปรับความดันโลหิตโดยบทบาททางไตเป็นกลไกที่ต้องใช้เวลานานหลายชั่วโมงกว่าจะมีประสิทธิภาพสูงสุด ซึ่งในช่วงแรกของการปรับต้องอาศัยกลไกอื่นๆ ที่ตอบสนองภายในเวลาอันรวดเร็วกว่าร่วมด้วยกลไกทางไตทำได้โดยอาศัยบทบาทการทำงานของระบบเรนิน-แองจิโอเทนซิน ทำให้เพิ่มการหลั่งฮอร์โมนที่เกี่ยวข้องกับการดูดกลับของโซเดียมและน้ำ คือ aldosterone และโดยการออกฤทธิ์ของ vasopressin ทำให้มีการดูดกลับของน้ำที่หลอดฝอยของไตเพิ่มขึ้น กลไกทางไตในการปรับความดันโลหิตเมื่อมีการเปลี่ยนแปลงของความดันของหลอดเลือดดังแผนผัง
เทศบาลนครเชียงใหม่ ประกาศมาตรการควบคุมป้องกันโรคพิษสุนัขบ้าระบาด
ประชาสัมพันธ์จากงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครเชียงใหม่ เนื่องจากปัจจุบันเทศบาลนครเชียงใหม่ได้รับการแจ้งว่าพบสุนัขจรจัดป่วยเป็นโรคพิษสุนัขบ้าในพื้นที่ตำบลวัดเกต เพื่อเป็นการป้องกันโรคพิษสุนัขบ้าไม่ให้มีการระบาดเป็นวงกว้าง จึงขอความร่วมมือประชาชนในพื้นที่ ดังนี้
- งดปล่อยสุนัข/แมวของท่าน โดยแนะนำให้อยู่ในบ้าน หากกรณีต้องปล่อยต้องมีสายจูง หรืออยู่ในการควบคุมดูแลของเจ้าของตลอดเวลา
- สุนัข/แมวที่ไม่ได้รับวัคซีนป้องกันโรคพิษสุนัขบ้า หรือทำแล้วแต่ไม่มีเอกสารหรือเอกสารยืนยันการทำวัคซีนสูญหาย ให้นำสัตว์ไปรับวัคซีน ณ สถานพยาบาลสัตว์ ทันที
- หากพบสุนัข/แมวของท่านมีอาการผิดปกติ ซึม ชักเกรง หรือดุร้ายผิดปกติ ให้แจ้งงานสัตวแพทย์เทศบาลนครเชียงใหม่ โทร. 0 5325 9136 หรือปศุสัตว์อำเภอเมือง/จังหวัดเชียงใหม่ ทันที
- หากถูกสุนัข/แมวกัด หรือข่วน ให้ล้างแผลด้วยสบู่ ใส่ยาฆ่าเชื้อและรีบไปโรงพยาบาลทันที
ทั้งนี้ หากมีข้อสงสัยเพิ่มเติม หรือต้องการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าโดยไม่เสียค่าบริการท่านสามารถติดต่อ ศูนย์บริการสุขภาพสัตว์เลี้ยงเทศบาลนครเชียงใหม่ ถนนเชียงใหม่-ลำพูน ได้ในวันและเวลาราชการ
ในฐานะแพลตฟอร์มทางความคิดสร้างสรรค์และการสร้างประสบการณ์ใหม่ ๆ เทศกาลงานออกแบบกรุงเทพฯ จะทำหน้าที่เป็นสื่อกลางในการเชื่อมโยงผู้คนและหน่วยงานต่าง ๆ ที่มีความสนใจ มาร่วมพัฒนาและขับเคลื่อน “กรุงเทพฯ” ให้เป็นเมืองในแบบที่เราต้องการใช้ชีวิตไปด้วยกัน ทั้งยังหวังว่าวลีคุ้นหู ‘กรุงเทพฯ ชีวิตดี ๆ ที่ลงตัว’ จะกลายเป็นจริงได้สักวันหนึ่งในอนาคต
คลินิกศัลยกรรม
เปิดให้บริการ วันจันทร์ – วันศุกร์ ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120คลินิกเบาหวาน
คลินิกเบาหวาน เปิดให้บริการ วันจันทร์ ,วันอังคาร , วันพฤหัสบดี ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120
ศูนย์บริการสาธารณสุข 28 กรุงธนบุรี วันที่ 2-13 กันยายน 2567
ศูนย์บริการสาธารณสุข 28 กรุงธนบุรี หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วันที่ 2-13 กันยายน 2567 เวลา 10.00 - 12.00 น. สอบถามโทร 02-8631664
28 มิถุนายน 2565 ให้บริการประชาชนชวนจังหวัดหนองคาย
ขอเชิญชวนข้าราชการทุกหน่วยงาน ประชาชนชวนจังหวัดหนองคาย และจังหวัดใกล้เคียง ในวันอังคารที่ 28 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา จากทางโรงพยาบาล ธีรวัฒน์ จ.กาฬสินธุ์ สำหรับท่านใดที่มีปัญหาทางด้าน #สายตา #การมองเห็นไม่ชัด #สายตาพร่ามัว #มีภาพซ้อน สามารถเดินทางไปตรวจเช็คที่หน่วยบริการได้เลย
สถานที่ให้บริการ : ชมรมข้าราชการบำนาญ อ.ท่าบ่อ จ.หนองคายตั้งแต่เวลา 08:30 - 15:00 น. บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตดุสิต
รพ.ประโคนชัย เปิดรับบริจาคโลหิตตามปกติ LINK
ผู้ป่วยยังต้องการโลหิต โรงพยาบาลประโคนชัย เปิดรับบริจาคโลหิตตามปกติ
ทุกวัน เวลา 9.00-15.00 น.
ท่านที่มาบริจาคโลหิต ให้ผ่านจุดคัดกรองของ รพ.
และมาติดต่อที่ห้องเจาะเลือด ชั้น 2 ตึกอุบัติเหตุ
ข้อปฏิบัติสำหรับผู้มาบริจาคโลหิต ในรพ.ประโคนชัย (ในช่วงสถานการณ์โควิด-19)
- ใส่ Mask ทุกครั้งเมื่อเข้าเขตโรงพยาบาล
- การเข้า- อออกโรงพยาบาล ผู้บริจาคโลหิตเข้าประตูหลักด้านหน้า (ฝั่งร้าน7-11)เพื่อคัดกรองก่อนเข้ารพ.ทุกราย
- รถเข้าออก เป็นระบบ One.- way.เข้าด้านหน้า ออกประตูด้านหลัง รพ.
- ที่จอดรถ ห้าม!!จอดรถในพื้นที่ตึกอุบัติเหติเก่า สำหรับใต้ตึกอุบัติเหตุใหม่จอดเฉพาะรถเจ้าหน้าที่เท่านั้น
กราบขอบพระคุณพระใบฎีกาอธิพงษ์ แสงมาศ เจ้าอาวาสวัดบ้านพิณทองได้เมตตามอบพระเครื่อง #หลวงปู่ทวด สำหรับมอบให้ผู้บริจาคโลหิตในโรงพยาบาลประโคนชัยเพื่อเป็นขวัญและสิริมงคลในชีวิต
ซีอิ้วหมักใบกัญชา โดย รพ.อภัยภูเบศร
14 มีนาคม 2564 กทม.เผยผลตรวจเขตบางแค ติด 96 คน
กรุงเทพมหานคร เผยผลการตรวจเชิงรุก COVID-19 ตลาดในพื้นที่เขตบางแค ตั้งแต่วันที่ 7-13 มี.ค.ที่ผ่านมา จาการตรวจทั้งหมด 4,046 คนผลติดเชื้อ 96 คน รอผลตรวจ 3,186 คน รายละเอียดการตรวจเชิงรุกในตลาด ตลาดวันเดอร์ ตรวจทั้งหมด 2,335 คน พบผู้ติดเชื้อ 96 ราย ไม่ติดเชื้อ 764 คน รอผล 1,475 คน
ส่วนตลาดใกล้เคียงกับตลาดวันเดอร์ ทั้งหมด 1,711 คน รอผลตรวจทั้ง 1,711 คนแบ่งเป็น ตลาดสิริเศรษฐนนท์ ตลาดศูนย์การค้าบางแค ตลาดกิตติ ตลาดภาสม ตลาดใหม่บางแค ตรวจทั้งหมด 1,400 คน รอผลตรวจทั้ง 1,400 คน ตลาดคลองขวาง ตรวจทั้งหมด 311 คน รอผลตรวจทั้ง 311 ราย
ไทยพีบีเอสพิจิตร งานสมโภชเมือง ไหลเรือไฟประทีปนาวาบูชาหลวงพ่อเพชร 5 - 15 เมษายน 2564
งานนมัสการหลวงพ่อเพชรและสมโภชเมืองพิจิตร จัดขึ้นในระหว่าง 5 - 15 เมษายน 2564 ไฮไลท์อยู่ที่พิธีไหลเรือไฟประทีปนาวาบูชาหลวงพ่อเพชร ซึ่งจะทำการไหลเรือไฟใน วันที่ 6, 9,12 และ 15 เมษายน 2564 บริเวณแม่น้ำน่านหน้าวัดท่าหลวง
นอกจากนี้ ภายในงานยังมีเวทีเวลาการแสดงกลางน้ำ ของนักร้องชื่อดังมากมาย รวมทั้งมีการออกบูธ ของหน่วยงานต่างๆ การจัดนิทรรศการ จำหน่ายสินค้า OTOP และของกินของใช้หลากหลายชนิด ทั้งนี้ทางคณะกรรมผู้จัดงาน ตั้งได้จุดคัดกรองบริเวณทางเข้า-ออก พร้อมขอความร่วมมือประชาชนที่มาเที่ยวงานสวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้ง เพื่อป้องกันโควิด-19 ส.ปชส.พิจิตร 05-04-64 #ประชาสัมพันธ์จังหวัดพิจิตร
เชียงใหม่ - เข้าพื้นที่ไม่ปลอดภัย ไม่สวมหน้ากาก ปรับ 20,000 บาท (25 เม.ย. 64) LINK
เชียงใหม่มีมติ ออกคำสั่งให้ทุกคน ต้องสวมหน้ากากอนามัยหรือหน้ากากผ้า เมื่อเข้าไปยัง “พื้นที่ไม่ปลอดภัย” เพื่อป้องกันมิให้เกิดสภาวะที่ไม่ถูกสุขลักษณะซึ่งอาจเป็นสาเหตุให้โรคแพร่ออกไป จนเกิดการระบาดเป็นวงกว้างในพื้นที่
โดย คำสั่งที่ 43/2564 ได้นิยาม “พื้นที่ไม่ปลอดภัย” หมายถึง พื้นที่ที่มีการพบปะผู้คน หรือ มีการรวมกลุ่มของผู้คน อันได้แก่ ตลาด ห้างสรรพสินค้า ยานพาหนะสาธารณะ อาคารขนส่งผู้โดยสาร สถานีรถไฟ สนามบิน สถานที่ทำงาน และสถานที่สาธารณะต่างๆ
ส่วนบทกำหนดโทษ ระบุไว้ว่า “ผู้ใดฝ่าฝืนไม่ปฏิบัติตามคำสั่งนี้ และคำสั่งเจ้าพนักงานควบคุมโรคติดต่อ ต้องระวางโทษปรับไม่เกิน 20,000 บาท”
โดยให้มีผลบังคับใช้ตั้งแต่วันที่ 26 เมษายน 2564 ถึงวันที่ 9 พฤษภาคม 2564
ฟรี! ประกันผลกระทบในการฉีดวัคซีนโควิด-19 AIA LINK
ฟรี! ประกันผลกระทบในการฉีดวัคซีนโควิด-19
ความคุ้มครอง/จำนวนเงินเอาประกันภัย
- ค่าชดเชยรายวันเมื่อเข้ารับการรักษาพยาบาลเป็นผู้ป่วยในตามความจำเป็นทางการแพทย์ เนื่องจากอาการแพ้หรือผลกระทบข้างเคียงจากการฉีดวัคซีนป้องกันโควิด-19 (ภายใน 60 วันนับจากวันที่ได้รับการฉีดวัคซีน) สูงสุดไม่เกิน 14 วัน ต่อการฉีดวัคซีน 1 ครั้ง และไม่เกิน 2 ครั้งต่อรายชีวิต 1,000 บาทต่อวัน
- จ่ายผลประโยชน์กรณีเสียชีวิตเนื่องจากอาการแพ้วัคซีนป้องกันโควิด-19 (เสียชีวิตภายใน 60 วันนับจากวันที่ได้รับการฉีดวัคซีน) โดยจ่ายครั้งเดียวต่อรายชีวิต 200,000 บาท
คำแนะนำในผู้ป่วยมะเร็ง LINK
คำแนะนำการให้วัคซีนป้องกันโรคโควิด-19 ในผู้ป่วยมะเร็ง
หลักการ
1. ผู้ป่วยมะเร็งเป็นกลุ่มเสี่ยงที่มีความจำเป็นต้องได้รับวัคซีนโควิด-19 เป็นกลุ่มแรกๆ
2. แนะนำให้ฉีดวัคซีนในผู้ป่วยมะเร็งทุกคนที่กำลังเข้ารับการรักษา โดยคำนึงถึงปัจจัยด้านความปลอดภัยและประสิทธิภาพของวัคซีนเท่าที่มีการศึกษาวิจัยในกลุ่มผู้ป่วยที่มีลักษณะคล้ายคลึงหรือเทียบเคียงได้กับผู้ป่วยเหล่านี้
3. ควรให้วัคซีนแก่ผู้ที่ให้การดูแลผู้ป่วยหรือญาติใกล้ชิดด้วย
การให้วัคซีนแก่ผู้ป่วยมะเร็งในกรณีจำเพาะ
1. ผู้ป่วยที่ได้รับการรักษาโดยการปลูกถ่ายเซลล์เม็ดเลือดหรือภูมิคุ้มกันบำบัดโดยวิธี CAR T CELLS ให้เว้นระยะการให้วัคซีนโควิด-19 อย่างน้อย 3 เดือน
2. ผู้ป่วยกลุ่มโรคเลือดที่เป็นมะเร็ง
- หากได้รับยาเคมีบำบัดที่มีฤทธิ์ทำลายเซลล์ เช่น CYTARABINE/ANTHRACYCLINE-BASED INDUCTION REGIMEN ในผู้ป่วยมะเร็งเม็ดเลือดขาวเฉียบพลันชนิดมัยอิลอยด์ (AML) ให้วัคซีนโควิด-19 เมื่อจำนวนเม็ดเลือดขาวชนิดนิวโทรฟิลมีระดับปกติ ( >1,500 เซลล์ต่อมิลลิลิตร)
- หากผู้ป่วยมีภาวะไขกระดูกบกพร่องหรือได้รับการรักษามาเป็นระยะเวลานาน สามารถให้วัคซีน
โควิด-19 ได้เมื่อมีความพร้อมของวัคซีน
3. ผู้ป่วยมะเร็งชนิดเป็นก้อน
- ผู้ที่ได้รับยาเคมีบำบัดที่มีฤทธิ์ทำลายเซลล์ ยามะเร็งชนิดมุ่งเป้า ยามะเร็งชนิดภูมิคุ้มกันบำบัดหรือได้รับการฉายรังสี สามารถให้วัคซีนโควิด-19 ได้เมื่อมีความพร้อมของวัคซีน
- ผู้ที่ได้รับการผ่าตัด ให้วัคซีนห่างจากวันผ่าตัดอย่างน้อย 3 วัน
หมายเหตุ
ผู้ที่ให้การดูแลผู้ป่วยหรือญาติใกล้ชิด (อายุ 16 ปี ขึ้นไป) สามารถรับวัคซีนได้ตลอดเวลาเมื่อมีความพร้อมของวัคซีน และแม้จะได้รับวัคซีนแล้ว ผู้ที่ให้การดูแลผู้ป่วยหรือญาติใกล้ชิดควรสวมใส่หน้ากากรักษาระยะห่าง และปฏิบัติตนตามคำแนะนำในการป้องกันโรคโควิด-19
ศูนย์บริการสาธารณสุขสอง วัดมักกะสัน ออกฉีด 6-30 กันยายน
รพ.แม่สอด เปิดให้บริการฉีดวัคซีนป้องกันโรคโควิด 19 ทั้งชาวเข็มแรก เข็ม 2 และเข็ม 3 LINK
ต่อเนื่องกับวัคซีนโควิดของพี่น้องชาวแม่สอดผู้มีสัญชาติไทย สัปดาห์นี้ รพ.แม่สอด เปิดให้บริการฉีดวัคซีนป้องกันโรคโควิด 19 ทั้งชาวเข็มแรก เข็ม 2 และเข็ม 3 ดังนี้
- เข็มแรก วันที่ 27, 29-30 ก.ย. 64 และ 1 ต.ค. 64
สำหรับผู้มีอายุ 18 ปีขึ้นไป ที่ยังไม่เคยได้รับวัคซีนมาก่อน ฉีดสลับชนิด เข็มแรก ซิโนแวค + เข็ม 2 แอสตร้า เซเนกา
(ท่านใดที่มีภูมิลำเนานอกเขต อ.แม่สอด แต่ทำงานหรือพักอาศัยในแม่สอด ต้องมีเอกสารรับรองจากที่ทำงานหรือเจ้าบ้าน สแกน QR Code ดาวน์โหลดแบบฟอร์มจากเว็บไซต์ รพ.แม่สอด หัวข้อ "เอกสารดาวน์โหลด")
- เข็ม 2 ตามนัด
- เข็ม 3 วัคซีนแอสตร้า เซเนกา
วันที่ 27, 29 ก.ย. 64 และ 1 ต.ค. 64 สำหรับประชาชนทั่วไป
วันที่ 30 ก.ย. 64 สำหรับบุคลากรทางการศึกษาเท่านั้น
โดยช่วงแรกของการฉีดเข็ม 3 ขอสงวนให้เฉพาะผู้ที่ได้รับวัคซีนซิโนแวค ครบ 2 เข็ม ในช่วงเดือนมีนาคม - พฤษภาคม 2564
หลังจากนี้ รพ.แม่สอด ยังคงให้บริการทั้งเข็มแรก เข็ม 2 และเข็ม 3 ไปอย่างต่อเนื่อง กรุณาติดตามข่าวสารจากหน้าเพจ รพ.แม่สอด
(รพ.แม่สอด ให้บริการฉีดวัคซีน รอบเช้า 08.30 - 11.30 น. และรอบบ่าย 13.00 - 15.30 น.)
หากท่านใดเพิ่งเดินทางมาจากพื้นที่สีแดงเข้มหรือสีแดงต้องกักตัวให้ครบ 14 วันก่อนมารับบริการ เพื่อลดความเสี่ยงในการแพร่กระจายเชื้อ
อย่าลืม!! พกบัตร ปชช. ตัวจริง และปากกามาด้วยนะคะ
สอบถามรายละเอียดเพิ่มเติม ได้ที่งานวัคซีน รพ.แม่สอด ในวันจันทร์ - ศุกร์ เวลา 14.00 - 16.00 น. โทร. 062-3107163, 062-3108850
Cafe Amazon for Chance สาขา 10 The Offices@Central World
ร้านกาแฟ Cafe Amazon for chance สาขา 10 ตั้งอยู่ที่สำนักงาน The Offices @ Central World สาขานี้ เป็นความร่วมมือ บริษัท ปตท.น้ำมันและการค้าปลีก บ.สานพลัง วิสาหกิจเพื่อสังคม และ อโกด้า
เรื่องและภาพ
RYT9แลรี่ คิง
พีธีกรคนดังระดับอมตะของสหรัฐ กับรายการทาง CNN ที่ออกอากาศยาวนานเป็นประวัติศาสตร์ "Larry King Live" รายงานว่าเขาติดโควิดเมื่อเดือนมกราคม 2021 ขณะอายุ 87 ปี และต่อมาได้จากไปด้วยภาวะติดเชื้อที่ไม่ใช่โควิด
โรงพยาบาลพระนครศรีอยุธยา จัดฉีด วันที่ 8 และ 10 กุมภาพันธ์ LINK
โรงพยาบาลพระนครศรีอยุธยา จัดฉีดวัคซีนไฟเซอร์เด็ก 5-11 ปี วันที่ 8 และ 10 กุมภาพันธ์ เป็นระยะที่ 1 ณ จุดฉีดรพ.พระนครศรีอยุธยา และ รพ.เสนา
ส่วน ระยะที่ 2 จะเริ่มฉีด วันที่ 14 กุมภาพันธ์ เป็นต้นไป สำหรับเด็กอายุ 5-11 ปี กลุ่มปกติ (ตรวจสอบรายชื่อและสถานที่เข้ารับการฉีดได้ที่โรงเรียนหรือสถานพยาบาลใกล้บ้าน)
การฉีดต้องได้รับการยินยอมจากผู้ปกครอง เท่านั้น
ยาศุขไสยาสน์ แก้อาการนอนไม่หลับ อาการอารมณ์เปลี่ยนแปลง LINK
ยาศุขไสยาสน์ สำหรับ
- สำหรับผู้ที่มีอาการนอนไม่หลับเรื้อรัง มากกว่า 1 เดือน เคยใช้ยาช่วยนอนหลับแล้วไม่ได้ผล ผ่านเกณฑ์ประเมินคะแนนคุณภาพการนอนหลับ คือ PSQI มากกว่า 5 ขึ้นไป
- สำหรับผู้มีภาวะเบื่ออาหาร หรือรับประทานลดลงในช่วง 1 เดือนและอาจมีน้ำหนักตัวลดลงอย่างรวดเร็ว เคยใช้ยาช่วยเจริญอาหารแล้วไม่ได้ผล
Thailand Digital Health Pass และ EU DCC นี้ จะเป็นการอำนวยความสะดวกให้กับประชชนและหน่วยงานระหว่างประเทศของกลุ่มประเทศในสหภาพยุโรปเอง และประเทศอื่นๆ นอกสหภาพยุโรป ตรวจสอบข้อมูลระหว่างกันได้อย่างราบรื่น จะส่งผลดีต่อการฟื้นตัว การเดินทาง และด้านอื่นๆที่จะเกิดขึ้นต่อไป
ศ. คลินิก นพ. อนุศักดิ์ เยี่ยงพฤกษาวัลย์ ผู้อำนวยการศูนย์หุ่นยนต์ช่วยผ่าตัดบำรุงราษฎร์ รพ.เปาโล โชคชัย 4 รับผู้ประกันตนเพิ่ม 26,000 คน LINK
เลือกเปลี่ยนสถานพยาบาลประกันสังคมได้แล้ววันนี้ !!! รพ.เปาโล โชคชัย 4 รับผู้ประกันตนเพิ่ม 26,000 คน เปลี่ยนสถานพยาบาลประกันสังคมเป็น รพ.เปาโล โชคชัย 4 และผู้ที่มีสิทธิ์ประกันสังคมที่รพ.เปาโล โชคชัย 4 สามารถใช้สิทธิ์รักษาที่ รพ.เปาโล โชคชัย 4 และ รพ.พญาไท นวมินทร์ (กรณีผู้ป่วยนอกเท่านั้น ) สอบถามข้อมูลเพิ่มเติม โรงพยาบาลเปาโล โชคชัย 4 02-514-4141
จุดหมายแห่งการปรับสมดุลสุขภาพและการพักผ่อน BDMS Wellness Clinic Retreat @ Celes Samui เชิญทุกท่านมาเปิดประสบการณ์ในการปรับสมดุลแล้วพักผ่อนอย่างมีไลฟ์สไตล์ สามารถติดต่อสอบถามได้ที่ 077-900-999 หรือ www.celesresorts.com
“ก็ต้องยอมรับว่า ที่ผ่านมาความล่าช้าจากการปรับปรุงพื้นที่ต่าง ๆ ไม่ว่าจะเป็นสถานีสูบน้ำ บ่อสูบน้ำ หรือจุดเฝ้าระวัง เป็นสิ่งหนึ่งที่เราต้องไขน็อตในการเร่งรัด ที่จะทำให้แต่ละโครงการเสร็จให้เร็วกว่านี้ ตอนนี้ล่าช้ามาพอสมควรแล้ว จะเป็นมาตรการที่เราต้องทำเพิ่มเติมเข้าไป สำหรับข้อมูลจุดน้ำท่วมในถนนสายรอง เราก็นำข้อมูลที่พี่น้องประชาชนแจ้งเข้ามา นำมาอยู่ในฐานข้อมูล และส่งทีมงานเข้าไปสำรวจเพื่อหาสาเหตุที่แท้จริงว่าเกิดจากอะไร เช่น เป็นที่ลุ่มต่ำ ระดับน้ำในคลองสูง พอเรารู้ปัญหาแต่ละที่ เราจะได้หาทางแก้ไขทั้งในระยะสั้นและระยะยาวได้อย่างถูกต้องและเหมาะสมกับงบประมาณที่มีอยู่ และขอความร่วมมือประชาชนทุกท่าน พยายามลดการทิ้งขยะให้น้อยลง ถ้าขยะอยู่หน้าบ้านอาจจะเก็บเข้าไปไว้ในบ้านก่อนเพื่อรอให้ฝนหาย ซึ่งหากมัดปากถุงไม่แน่น ขยะอาจจะปลิวไปอุดตันท่อระบายน้ำได้ และจะทำให้ประสิทธิภาพการระบายน้ำทั้งในระดับเส้นเลือดฝอยรวมถึงเส้นเลือดหลักลดลง” รองผู้ว่าฯ วิศณุ กล่าว
Watch the video LINK
This video will help you get the quick ideas of LTR of privilege, benefits and eligible category. File your application if you are qualified. Thailand is waiting.
เคล็ดลับง่ายๆในการเริ่มต้นดูแลสุขภาพ คุณหมอแอมป์
ดังนั้นคุณหมอแอมป์ จึงมีเคล็ดลับง่ายๆในการเริ่มต้นดูแลสุขภาพ ดังนี้
1.การรับประทานอาหารที่ดีต่อสุขภาพ เหมาะสมกับความต้องการของร่างกาย
2.การออกกำลังกาย เสริมสร้างสมรรถภาพทางกายและการใช้ชีวิต
3. การนอนหลับที่มีคุณภาพ ลดกิจกรรมที่ทำให้นอนหลับไม่สนิท เข้าใจธรรมชาติการนอนหลับของร่างกาย
4. การจัดการกับความเครียด สร้างสภาวะทางอารมณ์ที่ดี มองโลกในเชิงบวก
5.การหลีกเลี่ยงพฤติกรรมอันตรายต่างๆ เช่น การสูบบุหรี่ การดื่มเครื่องดื่มแอลกอฮอล์
เพราะการมีสุขภาพที่ดี มีอายุยืนยาวอย่างมีคุณภาพ ลดความเสี่ยงการเกิดโรคไม่ติดต่อเรื้อรังต่างๆ ต้องอาศัยการดูแลสุขภาพอย่างครอบคลุมทุกมิติและเหมาะสมกับแต่ละบุคคล เพื่อสุขภาพกาย สุขภาพใจที่แข็งแรง
คุณหมอแอมป์ฝากทิ้งท้ายไว้ว่า “เพราะสุขภาพดี คือ สมบัติที่สำคัญที่สุด” นั่นเอง
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญสุขภาพแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
สอบถามข้อมูลเพิ่มเติมได้ที่ บีดีเอ็มเอส เวลเนส คลินิก (BDMS Wellness Clinic)
เว็บไซต์ : www.bdmswellness.com
ข้อดีของการรักษาแบบรังสีร่วมรักษาระบบประสาท คือสามารถรักษาได้อย่างตรงจุด แม่นยำ และช่วยให้ผู้ป่วยมีโอกาสกลับมาใช้ชีวิตได้ตามปกติหรือใกล้เคียงกับปกติได้มากขึ้น ทั้งนี้แพทย์จะต้องตรวจวินิจฉัยด้วยคลื่นแม่เหล็กไฟฟ้า (MRI) เพื่อพิจารณาถึงตำแหน่ง ขนาดและรูปร่างของก้อนลิ่มเลือด/หลอดเลือดที่โป่งพอง อายุ และสุขภาพของผู้ป่วย เพื่อประเมินแนวทางการรักษาที่เหมาะสมกับผู้ป่วยแต่ละรายเพื่อให้เกิดผลลัพธ์ที่ดีที่สุด
ธนาคารอุปกรณ์ดูแลผู้ป่วยที่บ้าน
ปัญหา
ปัจจุบัน คนไทยส่วนใหญ่ยังไม่รู้จักหรือเข้าไม่ถึงการดูแลฟื้นฟูผู้ป่วยในระยะปานกลาง ระยะยาว ระยะประคับประคอง ทำให้ผู้ป่วยที่ต้องได้รับการดูแล ที่ส่วนใหญ่เป็นผู้ป่วยสูงอายุและไม่สามารถพึ่งพาตัวเอง ไม่สามารถเข้าถึงการรักษาในระยะนี้อย่างมีคุณภาพ หากจะเข้าการรักษาก็ต้องเป็นภาระของบุตรหลานหรือญาติในการดูแล เนื่องในระดับองค์กรปกครองส่วนท้องถิ่นหรือชุมชุนยังไม่มีโครงสร้างพื้นฐานและบุคลากรในการรักษาระยะปานกลาง ระยะยาว และระยะประคับประคอง
โดยเฉพาะอย่างยิ่งการรักษาในระยะประคับประคอง (Palliative Care) ที่ยังไม่เข้าถึงในสถานบริการแบบปฐมภูมิ ทำให้ผู้ป่วยระยะสุดท้ายหรือระยะประคับประคองเข้าไม่ถึงการรักษาแบบประคับประคอง ที่จะทำให้ตัวเองไม่ทรมานจากความเจ็บปวดจากอาการป่วยระยะสุดท้าย นอกจากยังขาดแคลนบุคลากรที่มีความสามารถในการรักษาในระยะประคับประคอง เนื่องจากบุคลากรทางการแพทย์ทั่วไปไม่ได้มีความรู้ในด้านนี้ ส่วนแพทย์เฉพาะทางก็มีจำนวนน้อยและไม่ได้มีเส้นทางการเติบโตในสายอาชีพที่ดี อีกทั้งยังขาดโครงพื้นฐานและความรู้ความเข้าใจของประชาชนเกี่ยวกับการรักษาแบบประคับประคอง
นอกจากการรักษาแบบประคับประคอง สิทธิที่ผู้ป่วยระยะสุดท้ายที่มีความเจ็บป่วยทางกายแบบรักษาไม่ได้ที่จะตายอย่างมีศักดิ์ศรี หรือการทำการุณยฆาตเป็นสิ่งที่ยังไม่ถูกกฎหมายในประเทศไทย ทำให้ผู้ป่วยบางคนต้องทนทุกข์ทรมานก่อนเสียชีวิต
ข้อเสนอ
จัดตั้งธนาคารอุปกรณ์ให้ยืมอุปกรณ์ดูแลผู้ป่วยที่บ้าน (เช่น เครื่องปั๊มออกซิเจน เครื่องให้ยาชั่วคราว) โดยให้เทศบาลหรืออบต. เป็นผู้บริหารจัดการธนาคารอุปกรณ์ โดยเป็นผู้จัดซื้ออุปกรณ์ให้ประชาชนยืม หรือรับบริจาคจากประชาชนหรือภาคเอกชนที่ประสงค์จะสนับสนุนอุปกรณ์
โซเดียม ส่งผลให้เกิดการบวมน้ำ (การคั่งของเกลือและน้ำในอวัยวะต่างๆ)
เมื่อมีปริมาณโซเดียมไอออน (Na+) มากเกินในร่างกาย จะมีผลทำให้น้ำภายนอกเซลล์ (ECF) เพิ่มมากขึ้น เนื่องจาก โซเดียมไอออน (Na+) มีผลทำให้ osmolality ในพลาสมาเพิ่มมากขึ้น จึงดึงน้ำออกจากเซลล์และกระตุ้นให้มีการกระหายน้ำและดื่มน้ำเพิ่มขึ้นมาก และการที่น้ำออกจากเซลล์เข้ามาในพลาสมาจึงทำให้ น้ำในหลอดเลือด (intravascular fluid, IVF) เพิ่มขึ้น และถ้าเพิ่มขึ้นมากจะทำให้เกิดการคั่งของเกลือและน้ำในอวัยวะต่างๆ ซึ่งเป็นอันตรายต่อหัวใจ ทำให้มีน้ำคั่งในปอดและเกิดการบวมน้ำได้ ร่างกายจึงต้องแก้ไขด้วยการเพิ่มการขับโซเดียมไอออน (Na+) ออกทางไต ให้มากขึ้นและปรับให้มีการดูดกลับของ Na+ ลดลง
ในผู้ที่มีสุขภาพแข็งแรง ไตยังสามารถกำจัดเกลือและน้ำส่วนเกินได้ทัน แต่ในผู้ป่วยโรคไตเรื้อรัง ซึ่งมักจะไม่สามารถกำจัดเกลือและน้ำส่วนเกินในร่างกายได้ เกิดภาวะคั่งของเกลือและน้ำในอวัยวะต่างๆเช่น แขนขา หัวใจ และปอด ผลคือทำให้แขนขาบวม เหนื่อยง่าย แน่นหน้าอก นอนราบไม่ได้ ในผู้ป่วยโรคหัวใจ น้ำที่คั่งในร่างกายจะทำให้เกิดภาวะหัวใจวายมากขึ้น
- จากอาการเจ็บป่วย หรือ การแพ้ยาบางชนิด
- พฤติกรรมการรับประทานอาหารที่มีรสจัดหรือมีส่วนผสมของโซเดียมมากเกินไป โดยเฉพาะรสเค็มจัดและเผ็ดจัด เพราะเกลือมีส่วนในการเพิ่มปริมาณของเหลวในร่างกาย จึงส่งผลทำให้เกิดอาการบวมน้ำได้
- การนั่งหรือยืนในท่าเดิมเป็นเวลานาน โดยเฉพาะเมื่ออยู่ในสภาพอากาศร้อน
- การตั้งครรภ์
- สำหรับสุภาพสตรีมักจะเกิดขึ้นในช่วงก่อนมีประจำเดือน หรือมีการเปลี่ยนเเปลงของฮอร์โมน
สัปดาห์ที่ 33 (14-20 สิงหาคม 2566)
ต่างชาติ 555,854 คน
เฉลี่ยวันละ 79,408 คน
นักท่องเที่ยวต่างชาติสะสม 17,028,411 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 714,421 ล้านบาท
5 ประเทศ แรก
จีน 86,484 คน
มาเลเซีย 79,468 คน
เกาหลีใต้ 33,680 คน
อินเดีย 30,315 คน
เวียดนาม 25,204 คน
*****
สัปดาห์ที่ 32 (7-13 สิงหาคม 2566)
ต่างชาติ 577,136 คน
เฉลี่ยวันละ 82,448 คน
นักท่องเที่ยวต่างชาติสะสม 16,472,557 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 689,883 ล้านบาท
5 ประเทศ แรก
จีน 92,582 คน
มาเลเซีย 67,731 คน
เกาหลีใต้ 37,111 คน
อินเดีย 33,952 คน
เวียดนาม 32,838 คน
*****
สัปดาห์ที่ 31 (31 กรกฎาคม - 6 สิงหาคม 2566)
ต่างชาติ 573,246 คน
เฉลี่ยวันละ 81,893 คน
นักท่องเที่ยวต่างชาติสะสม 15,895,421 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 663,862 ล้านบาท
5 ประเทศ แรก
จีน 95,581 คน
มาเลเซีย 73,810 คน
เกาหลีใต้ 37,754 คน
อินเดีย 27,707 คน
เวียดนาม 25,717 คน
23-24 ธันวาคม 2566 ชมทุ่งดอกคอสมอส เที่ยววังนารายณ์ Check-in งานยอยศยิ่งฟ้า อยุธยามรดกโลก
ทริปที่ 13 และ 14 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 23 และวันอาทิตย์ที่ 24 ธันวาคม 2566 โปรแกรม แต่งชุดไทย นั่ง KIHA183 ชมทุ่งดอกคอสมอส เที่ยววังนารายณ์ Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
เกี่ยวกับเทศกาลงานออกแบบกรุงเทพฯ
เกี่ยวกับเทศกาลงานออกแบบกรุงเทพฯ
เทศกาลงานออกแบบกรุงเทพฯ หรือ Bangkok Design Week จัดขึ้นเป็นครั้งแรกตั้งแต่ปี พ.ศ. 2561 โดยเป็นเทศกาลสำคัญที่ได้รับการบรรจุไว้ในปฏิทินกิจกรรมของกรุงเทพมหานคร และเป็นส่วนหนึ่งของการขับเคลื่อนเศรษฐกิจสร้างสรรค์ รวมทั้งร่วมผลักดันกรุงเทพมหานครให้เติบโตและโดดเด่นในฐานะเครือข่ายเมืองสร้างสรรค์ยูเนสโก (UNESCO Creative City Network: UCCN) สาขาการออกแบบ (Bangkok City of Design) อีกด้วย
เทศกาลงานออกแบบกรุงเทพฯ ดำเนินการโดยสำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน) หรือ CEA ร่วมกับผู้ร่วมจัดเทศกาลฯ ทั้งภาครัฐและเอกชน สถาบันการศึกษา และองค์กรระหว่างประเทศกว่า 60 หน่วยงาน รวมถึงนักออกแบบและธุรกิจสร้างสรรค์กว่า 2,000 ราย โดยมียอดผู้เข้าชมงานทั้งไทยและต่างประเทศรวมแล้วมากกว่า 400,000 คนในแต่ละปี โดยตลอด 6 ปีของการจัดงาน (พ.ศ. 2561 - 2566) เทศกาลฯ สร้างมูลค่าทางเศรษฐกิจได้ไม่น้อยกว่า 1,948 ล้านบาท เทศกาลงานออกแบบกรุงเทพฯ ไม่เพียงส่งผลดีต่ออุตสาหกรรมสร้างสรรค์ไทย ทั้งในแง่ของการเป็นเวทีแสดงผลงานของนักออกแบบและธุรกิจสร้างสรรค์ การกระตุ้นให้เกิดการแข่งขัน ตลอดจนการสร้างเครือข่ายทางธุรกิจทั้งในและต่างประเทศ แต่ยังส่งผลกระทบเชิงบวกที่ขยายผลสู่ธุรกิจแวดล้อมต่าง ๆ เช่น การตลาด การพิมพ์ สื่อออนไลน์ แกลเลอรี ร้านกาแฟ ร้านอาหาร ธุรกิจของฝาก-ของที่ระลึก โลจิสติกส์ การท่องเที่ยว ที่พักโรงแรม บริการขนส่งมวลชน ฯลฯ
เกี่ยวกับสำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน)
สำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน): สศส. หรือ Creative Economy Agency (Public Organization): CEA เป็นหน่วยงานเฉพาะด้านที่ทำหน้าที่ส่งเสริมความคิดสร้างสรรค์ให้เป็นกลไกสำคัญในการขับเคลื่อนเศรษฐกิจสร้างสรรค์ โดยให้ความสำคัญกับการพัฒนาอุตสาหกรรมสร้างสรรค์สาขาต่าง ๆ ให้เติบโต และส่งเสริมให้ภาคการผลิตนำความคิดสร้างสรรค์ไปประยุกต์ใช้ในการเพิ่มมูลค่าสินค้าและบริการ นำไปสู่การยกระดับศักยภาพการแข่งขันของธุรกิจและประเทศในระดับสากล
ทำบุญบริจาค ลดหย่อนภาษีได้ 2 เท่า
ทำบุญบริจาคสมทบทุนเพื่อช่วยเหลือผู้ป่วยอวัยวะ และดวงตาเสื่อมสภาพ กับสภากาชาดไทย.... สแกนบริจาคเลย ตั้งแต่วันนี้ - 31 ธันวาคม 2567
ร่วมบริจาคเงินสนับสนุนได้หลายช่องทาง :
- ลดหย่อนภาษีได้ 2 เท่า ผ่านระบบ e-Donation โดย Scan QR Code ด้วย Mobile Banking Application ที่ www.letthemseelove.com/donate
- บัญชีศูนย์รับบริจาคอวัยวะสภากาชาดไทย ธ.กรุงไทย 023-1-25888-7
- บัญชีศูนย์ดวงตาสภากาชาดไทย ธ.ไทยพาณิชย์ 045-231-390-2
- ช่องทาง TrueMoney Wallet https://l.sustainablelife.co/rc3
ศูนย์บริการสาธารณสุข29 (ช่วง นุชเนตร) เขตจอมทอง ฉีดวัคซีน ฟรี 2-13 กันยายน 2567
สำนักงานเขตจอมทอง ร่วมกับ ศูนย์บริการสาธารณสุข29 (ช่วง นุชเนตร) สำนักอนามัย จัดหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง เพื่อเสริมสร้างภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยงประจำปี 2567 (รอบที่ 2 ) ระหว่างวันที่ 2-13 กันยายน 2567 ตั้งแต่เวลา 10.00- 12.00 น. สามารถเข้ารับบริการได้ฟรี!! สอบถามเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ชั้น 4 สำนักงานเขตจอมทอง โทร 02-4276671
29 มิถุนายน 2565 ออกให้บริการประชาชนชวนจังหวัดมหาสารคาม
ขอเชิญชวนข้าราชการทุกหน่วยงาน ประชาชนชวนจังหวัดมหาสารคาม และจังหวัดใกล้เคียง ในวันพุธที่ 29 มิถุนายน 2565 เตรียมพบกับหน่วยตรวจสุขภาพตา จากทางโรงพยาบาล ธีรวัฒน์ จ.กาฬสินธุ์ สำหรับท่านใดที่มีปัญหาทางด้าน #สายตา #การมองเห็นไม่ชัด #สายตาพร่ามัว #มีภาพซ้อน สามารถเดินทางไปตรวจเช็คที่หน่วยบริการได้เลย
สถานที่ให้บริการ : อิงกมลเพลส (ตรงข้ามแจ่วฮ้อนท่าขอนยาง ) ตำบลท่าขอนยาง อำเภอกันทรวิชัย จังหวัดมหาสารคาม ตั้งแต่เวลา 08:30 - 16:00 น.โรงพยาบาลวิภาราม สมุทรสาคร รับสมัครงานหลายอัตรา
โรงพยาบาลวิภาราม สมุทรสาคร ประกาศ รับสมัครงาน สำหรับผู้ที่สนใจจะร่วมงานกับเรา สนใจติดต่อสมัครงานได้ที่... แผนกบุคคลและพัฒนาบุคคล โรงพยาบาลวิภาราม สมุทรสาคร ชั้น 4 เวลา 9:00 - 16.00 น. โทรสอบถามเพิ่มเติมได้ที่ 034-116-999 ต่อ 2407, 2408
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตราชเทวี
แถลงข่าวร่วมจัดงาน LINK
กรมปศุสัตว์เจ้าภาพหลักจับมือหน่วยงานภาคีเครือข่ายแถลงข่าวร่วมจัดกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day 2020) กำหนดจัดงานในวันที่ 28 กันยายน 2563 ภายใต้แนวคิด “End Rabies: Collaborate, Vaccinate (ร่วมกันกำจัดโรคพิษสุนัขบ้า ด้วยการพาสัตว์เลี้ยงมาทำวัคซีน)”
นายสัตวแพทย์สรวิศ ธานีโต อธิบดีกรมปศุสัตว์ พร้อมด้วยนายแพทย์อนุพงค์ สุจริยากุล ผู้ทรงคุณวุฒิกรมควบคุมโรค นายทวี เสริมภักดีกุล รองอธิบดีกรมส่งเสริมการปกครองท้องถิ่น ผศ.น.สพ.ดร.คงศักดิ์ เที่ยงธรรม คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ รศ.ดร.สพ.ญ.วลาสินี ศักดิ์คำดวง คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล ร่วมแถลงข่าวการจัดกิจกรรมในวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day 2020) ที่กำหนดจัดขึ้นในวันที่ 28 กันยายน 2563 โดย ดร.เฉลิมชัย ศรีอ่อน รมว.กษ. เป็นประธานเปิดงาน ณ โรงแรมพลูแมน วัตถุประสงค์เพื่อเป็นการกระตุ้นปลูกจิตสำนึกของประชาชนให้ป้องกันตนเอง ลดความเสี่ยงต่อการติดเชื้อโรคพิษสุนัขบ้า และสร้างความรับผิดชอบต่อสัตว์เลี้ยง “เลี้ยง รัก รับผิดชอบ”
นายสัตวแพทย์สรวิศ ธานีโต อธิบดีกรมปศุสัตว์ กล่าวว่า การดำเนินงานของกรมปศุสัตว์จะมุ่งเน้นการเฝ้าระวัง ป้องกัน และควบคุมโรคพิษสุนัขบ้าในสัตว์ ปี 2563 นี้พบโรคพิษสุนัขบ้าในสัตว์จำนวน 173 ตัวอย่าง คิดเป็นร้อยละ 2.94 ของตัวอย่างทั้งหมด 5,884 ตัวอย่าง จากข้อมูล
Thairabies.net พบว่าสถานการณ์การเกิดโรคในสัตว์ย้อนหลังสามปีลดลงอย่างต่อเนื่อง กรมปศุสัตว์มีเป้าหมายสำคัญคือ การสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าทั่วประเทศ ซึ่งปัจจุบันมีจังหวัดที่สามารถสร้างพื้นที่ปลอดโรคได้ทั้งหมด 17 จังหวัด (แพร่, แม่ฮ่องสอน, ชุมพร, ตราด, นครนายก, นครปฐม, นราธิวาส, บึงกาฬ, พังงา, ลำปาง, ลำพูน, สกลนคร, สิงห์บุรี, สุโขทัย, หนองบัวลำภู, อ่างทอง และอุตรดิตถ์) และในปีนี้กรมปศุสัตว์ได้รับเกียรติให้เป็นเป็นเจ้าภาพในการจัดงานวันป้องกันโรคพิษสุนัขบ้าโลก โดยเน้นการมีส่วนร่วมของผู้เข้าชม และการส่งต่อองค์ความรู้ไปสู่บุคคลรอบข้าง เพื่อเป็นการกระตุ้นปลูกจิตสำนึกของประชาชนให้ป้องกันตนเอง ลดความเสี่ยงต่อการติดเชื้อโรคพิษสุนัขบ้า และสร้างความรับผิดชอบต่อสัตว์เลี้ยง นอกจากนี้ กรมปศุสัตว์ร่วมกับสัตวแพทยสภา สมาคมสัตวแพทย์ผู้ประกอบการบำบัดโรคสัตว์ สัตวแพทยสมาคมแห่งประเทศไทยได้จัดทำคู่มือเวชปฏิบัติเรื่องโรคพิษสุนัขบ้าสำหรับคลินิกและโรงพยาบาลสัตว์อีกด้วย
นายแพทย์อนุพงค์ สุจริยากุล ผู้ทรงคุณวุฒิกรมควบคุมโรค กล่าวว่า ภารกิจหลักของกรมควบคุมโรค จะรับผิดชอบในการเฝ้าระวัง ป้องกัน ควบคุมโรคและดูแลรักษาโรคพิษสุนัขบ้าในคน โดยมีเป้าหมายที่สำคัญคือ การป้องกันไม่ให้มีผู้เสียชีวิตด้วยโรคพิษสุนัขบ้าอย่างยังยืน ซึ่งโรคพิษสุนัขบ้าเป็นโรคที่สามารถป้องกันได้ด้วยการฉีดวัคซีนหลังสัมผัสโรค ดังนั้นจึงผลักดันให้ผู้ถูกสัตว์กัดหรือข่วนทุกราย เข้ารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้ครบชุดตามที่แพทย์นัด โดยประชาชนทุกคนสามารถเข้าถึงการฉีดวัคซีนและมีวัคซีนเพียงพอต่อความต้องการ ด้วยหลักการ “ฉีดได้ทุกเข็ม เข้าถึงทุกสิทธิ์”นายทวี เสริมภักดีกุล รองอธิบดีกรมส่งเสริมการปกครองท้องถิ่น กรมส่งเสริมการปกครองท้องถิ่น มีภารกิจในการขับเคลื่อน 3 กิจกรรมหลัก ประกอบด้วย การพัฒนาศักยภาพบุคลากรท้องถิ่นในการป้องกันควบคุมโรคพิษสุนัขบ้า, การประกวดตามโครงการ Thailand Rabies Awards 2020 เพื่อเชิดชูเกียรติ อปท. ที่มีผลการปฏิบัติงานดีเด่นในการควบคุมโรคพิษสุนัขบ้า และการตรวจติดตามการดำเนินงานของ อปท. ในพื้นที่ต่างๆ ที่มีผลงานเป็นที่ประจักษ์ในการควบคุมโรคพิษสุนัขบ้าผศ.น.สพ.ดร.คงศักดิ์ เที่ยงธรรม คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารีฯ มีแผนการดำเนินการต่อในปี 2564-2568 เน้นการบรูณาการทุกภาคส่วนที่เกี่ยวข้องกับการควบคุมป้องกันโรคพิษสุนัขบ้า โดยมีเป้าหมายให้ประเทศไทยปลอดโรคพิษสุนัขบ้าทั้งในคนและในสัตว์
รศ.ดร.สพ.ญ.วลาสินี ศักดิ์คำดวง คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล มหาวิทยาลัยได้ให้ความสำคัญในการป้องกันและควบคุมโรคพิษสุนัขบ้า โดยได้ดำเนินการศึกษาวิจัยและประชาสัมพันธ์ความรู้เกี่ยวกับโรคพิษสุนัขบ้าให้กับประชาชน อีกทั้ง ในปี 2564 มหาวิทยาลัยมหิดล ได้รับเกียรติให้เป็นเจ้าภาพการจัดงานวันป้องกันโรคพิษสุนัขบ้าโลกต่อจากกรมปศุสัตว์ด้วย กรมปศุสัตว์จึงขอเชิญชวนประชาชน ร่วมกิจกรรมในวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day) ผ่านระบบออนไลน์ ได้ตลอดเดือนกันยายน ซึ่งการจัดงานครั้งนี้ มีการถ่ายทอดสดออนไลน์ Live Streaming ภายใต้แนวคิด “End Rabies: Collaborate, Vaccinate" “ร่วมกันกำจัดโรคพิษสุนัขบ้า ด้วยการพาสัตว์เลี้ยงมาทำวัคซีน” กำหนดจัดงานในวันจันทร์ที่ 28 กันยายน 2563 ระหว่างเวลา 9.30 - 17.00 น. ผ่าน 3 ช่องทาง คือ แฟนเพจ : วันป้องกันโรคพิษสุนัขบ้าโลก : World Rabies Day 2020, Youtube : WRDThai2020 และ
www.WRD2020Thailand.com ณ ตึกอำนวยการ กรมปศุสัตว์
ภาคบริการโลหิตแห่งชาติที่ 5 จ.นครราชสีมา LINK
ภาคบริการโลหิตแห่งชาติที่ 5 จ.นครราชสีมา สภากาชาดไทย
ณ ห้องบริจาคทั้ง 3 ห้อง
- ศูนย์การค้าเทอร์มินอล 21 โคราช ชั้น LG
จ-ศ 10-18.30 น.
ส-อ และ นักขัตฤกษ์ 11-17.30 น.
- อาคารภาคบริการโลหิตแห่งชาติที่ 5 ต.หนองบัวศาลา
จ-ศ 8.30-16 น.
ส-อ และ นักขัตฤกษ์ 9-15.30 น.
- ภายในมหาวิทยาลัยราชภัฏนครราชสีมา
จ-ศ 8.3-16 น.
สอบถามโทร 044-938938 ต่อ 1303 , 090-0909470
Step by Step installing the ThailandPlus app
ทราบว่ามีพี่ๆ จนท.รัฐมาเยี่ยมเยียนแล้ว เค้ามีคำแนะนำอะไรบ้างไหม
ก็มีให้คำแนะนำทุกหน่วยงานที่เข้ามานะคะ เพราะธุรกิจตัวนี้ยังถือว่าใหม่มาก แล้วเราเป็นที่แรกในราชบุรีด้วย เจ้าหน้าที่ทุกคนน่ารักมากค่ะ ให้คำแนะนำเป็นอย่างดี
13 มีนาคม 64 ประกาศด่วน จาก 3 จังหวัด - กรุงเทพ นครปฐม นนทบุรี กรณีคลัสเตอร์บางแค
13 มีนาคม 64 ประกาศด่วน จาก 3 จังหวัด - กรุงเทพ นครปฐม นนทบุรี กรณีคลัสเตอร์บางแค
กรุงเทพมหานคร
13 มีนาคม 64 21.27 น.
สำนักงานประชาสัมพันธ์ กรุงเทพมหานคร ออกประกาศ ให้ผู้ที่เดินทางไป ตลาด 6 แห่งในย่านบางแค ได้แก่
- ตลาดสิริเศรษฐนนท์ (แสงฟ้าเก่า)
- ตลาดศูนย์การค้าบางแค
- ตลาดกิตติ, ตลาดภาสม
- ตลาดใหม่บางแค
- ตลาดวันเดอร์ เขตบางแค กรุงเทพมหานคร
ระหว่างวันที่ 20 ก.พ. - 13 มี.ค. 64
ให้ติดต่อรายงานตัวกับสำนักอนามัย กรุงเทพมหานคร ด่วน!!!
ผ่านระบบ ออนไลน์ BKKcovid19
หากระบบแจ้งว่าเป็นกลุ่มเสี่ยงสูง กทม. จะจัดเจ้าหน้าที่ติดต่อไปโดยเร็วที่สุด
หรือติดต่อสายด่วน สำนักอนามัย กทม.ได้ที่เบอร์ 02-203-2393 และ 02-203-2396
นครปฐม
13 มีนาคม 64 22.44 น.
สำนักงานสาธารณสุขจังหวัดนครปฐม ออกประกาศผ่านเพจ ระบุ
- ชาวนครปฐม ที่เดินทางไป กรุงเทพมหานคร(ตลาดบางแค) ตั้งแต่ 27 กพ. ถึง 13 มีค. 64 ให้ไปตรวจ covid-19 ได้ที่โรงพยาบาลของรัฐใกล้บ้าน
- ระบุสาเหตุ "ตลาดบางแคขณะนี้เกิดการระบาดพบผู้ติดชเื้อ Covid-19 ที่ไม่มีอาการ 80 ราย ขณะนี้ กทม. ทำการตรวจเพิ่มอีก 1,000 ราย เพื่อหาผู้ติดเชื้อเพิ่มเติม
- แจ้งเหตุสาธารณสุข โทร 06-5904-2374
นนทบุรี
13 มีนาคม 64 21.22 น.
ศูนย์ข้อมูล COVID-19 นนทบุรี โพสต์ประกาศ
- สำนักงานสาธารณสุขจังหวัดนนทบุรี ขอความร่วมมือให้ประชาชนที่เดินทางไปตลาดบางแค (กทม.) ในช่วงระหว่างวันที่ 27 กุมภาพันธ์ - 13 มีนาคม 2564 ลงทะเบียนด้วยข้อมูลที่แท้จริง ตาม QR Code เพื่อเฝ้าระวังและสอบสวนโรคท่านที่สงสัยว่าสัมผัสเสี่ยงสูง เช่น สัมผัสกับผู้ป่วยยืนยัน ไปซื้อสินค้า-อาหารในตลาดเป็นประจำ ไม่ได้ป้องกันตัวอย่างเหมาะสม หรือ มีอาการติดเชื้อ เช่น ไข้ ไอ น้ำมูล เจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่ได้รับรส หรือ ถ่ายเหลว อย่างใดอย่างหนึ่ง สามารถเข้ารับการตรวจโควิด19 ที่โรงพยาบาลใกล้บ้านสอบถามเพิ่มเติม สำนักงานสาธารณสุขจังหวัดนนทบุรี โทร 061-3945402, 061-3945403, 061-1722534, 061-1742260
กทม. ถนนคนเดินคลองโอ่งอ่าง เทศกาลสงกรานต์ 9-14 เม.ย. LINK
กรุงเทพมหานคร กำหนดจัดกิจกรรมถนนคนเดินคลองโอ่งอ่าง ในช่วงวันหยุดเทศกาลสงกรานต์ระหว่างวันที่ 9-14 เม.ย. นี้ ตั้งแต่เวลา 16.00–22.00 น. พร้อมเชิญชวนพ่อค้าแม่ค้าและนักท่องเที่ยว สวมใส่เสื้อลายดอก เพื่อสร้างสีสันให้กับ “ถนนคนเดินคลองโอ่งอ่าง” พร้อมกับชม ชิม ช้อป ผลิตภัณฑ์ของดีกรุงเทพฯ 50 เขต ภายในงาน
นครพนม มหาสงกรานต์ สรงน้ำพระธาตุประจำวันเกิด 8 พระธาตุ 7 อำเภอ LINK
นครพนม มหาสงกรานต์ สรงน้ำพระธาตุประจำวันเกิด ได้ตลอดทั้งเดือนเมษายน เสริมสิริมงคลด้วยการสรงน้ำพระธาตุประจำวันเกิด 8 พระธาตุ 7 อำเภอในจังหวัดนครพนม ได้แก่ 1.พระธาตุพนม (อาทิตย์) อำเภอธาตุพนม 2.พระธาตุเรณู (จันทร์) อำเภอเรณูนคร 3.พระธาตุศรีคุณ (อังคาร) อำเภอนาแก 4.พระธาตุมหาชัย (พุธ) อำเภอปลาปาก 5.พระธาตุมรุกขนคร (พุธ กลางคืน) อำเภอธาตุพนม 6.พระธาตุประสิทธิ์ (พฤหัสบดี) อำเภอนาหว้า 7.พระธาตุท่าอุเทน (ศุกร์) อำเภอท่าอุเทน และ 8.พระธาตุนคร (เสาร์) เขตเทศบาลเมืองนครพนม เพื่อให้สาธุชนกราบไหว้ขอพร เสริมสิริมงคลด้วยการสรงน้ำพระธาตุประจำวันเกิด 8 พระธาตุ 7 อำเภอ
ทั้งนี้ทาง ททท.สำนักงานนครพนม ได้ประสานพระเทพวรมุนี เจ้าคณะจังหวัดนครพนม แจ้งไปยังวัดพระธาตุประจำวันเกิดทั้ง 8 แห่ง ให้จัดกิจกรรมต้อนรับนักท่องเที่ยวตลอดทั้งเดือนเมษายนนี้ ส่วนในตัวจังหวัดนครพนม กรณีนักท่องเที่ยวไม่สะดวกในการเดินทางไปยังที่ตั้งองค์พระธาตุทั้ง 8 แห่ง ทางจังหวัดได้มีกิจกรรมเทศกาลไหว้พระธาตุประจำวันเกิดองค์จำลองไว้ ณ หมู่บ้าน 8 ชนเผ่า ถนนสวรรค์ชายโขง จุดเช็คอินแห่งใหม่ อีกทั้งยังมีกิจกรรมเทศกาลไหว้พระธาตุประจำวันเกิดองค์จำลอง ณ หมู่บ้าน 8 ขนเผ่า ถนนสวรรค์ชายโขง และการแข่งขันกีฬาชายหาด ณ หาดทรายทองศรีโคตรบูร อำเภอเมืองนครพนม ระหว่างวันที่ 13-15 เมษายน 2564 ประกอบด้วย ระหว่างวันที่ 13-15 เมษายน 2564 ประกอบด้วย วอลเล่ย์บอลชายหาด ประเภทชายคู่ และ หญิงคู่,เปตองชายหาด ประเภท ชายเดี่ยว,ทีมชาย,ฟุตบอลชายหาด ประเภท ประชาชนทั่วไปชาย และเซปักตะกร้อ
หนองคาย - จาก 5 จว. กักตัว 14 วัน+รายงานตัว LINK
คำสั่งคณะกรรมการโรคติดต่อจังหวัดหนองคายที่ 8/64 ลงวันที่ 8 เมษายน 2564
ให้ผู้เดินทางจากพื้นที่ควบคุม 5 จังหวัด - กทม นครปฐม นนทบุรี ปทุมธานี สมุทรปราการ รวมถึงพื้นท่/กลุ่มจังหวัดที่ สธ.ประกาศ ให้เป็นพ้นที่เสี่ยงหรือระบาด
1. รายงานตัวกับ กำนัน ผญบ อสม
2. ต้องกักตัว 14 วัน
เว้นแต่เป็นบุคคล
1. ได้รับการฉีดวัคซีนป้องกันโควิด ครบ 2 เข็ม มาแล้วไม่ตำกว่า 14 วัน และมีใบรับรองการฉีด
2. มีผลการตรวจโควิดที่แสดงว่าไม่พบเชื้อ ภายใน 72 ชม
ให้เฝ้าสังเกตอาการตนเองและปฏิบัติตามมาตรการควบคุม (Self Quarantine) อย่างน้อย 14 วัน
- สสจ หนองคาย โทร 042-41-3354 042-421-438 042-422-923
- รพ หนองคาย โทร 042-413-456
คำแนะนำ วัดซีน และ คนไข้มะเร็ง LINK
คำแนะนำ "วัดซีน" และ "คนไข้มะเร็ง"
เรียบเรียงจากคำแนะนำของสมาคมมะเร็งแห่งสหรัฐอเมริก Version 2.0 วันที่ 10 มีนาคม 2564
เรียบเรียงโดย ผศ.พญ.เอื้อมแข สุขประเสริฐ
ภาควิชาอายุรศาสตร์ คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่น
1. คนไข้มะเร็งกลุ่มไหนที่ควรได้รับการฉีดวัคซีนป้องกันโควิด 19 ?
คนไข้มะเร็งทุกคน ไม่ว่าจะเพิ่งเป็น กำลังรักษา หรือหายแล้ว ควรได้รับ
2. ทำไมถึงต้องได้รับ ?
ผู้ป่วยมะเร็งมีภาวะภูมิต้านทานที่ต่ำกว่าคนทั่วไป ดังนั้นจึงเป็นกลุ่มเสี่ยงที่ถ้าติดเชื้อไวรัสแล้วมีโอกาสเป็นโรคที่รุนแรงมากกว่าคนทั่วไป นอกจากนั้นยังมีโอกาสจะมีเชื้อค้างในร่างกายนานและอาจก่อให้เกิดไวรัสที่มีการกลายพันธ์ ดังนั้นคนไข้มะเร็งจึงถือเป็นกลุ่มที่ควรได้รับวัดซีนให้เร็วที่สุดเท่าที่จะเป็นไปได้
3. ควรฉีดเมื่อไหร่
3.1 คนไข้มะเร็งที่ไม่ใช่ระบบเลือด เช่นมะเร็งเต้านม มะเร็งปอด มะเร็งลำไส้ et
- ผู้ป่วยทุกคนที่ไม่ว่าจะได้รับการรักษาด้วยยาเคมี ,ยามุ่งเป้า (targeted therapy) , ยากลุ่มภูมิคุ้มกันบำบัด (immunotherapy) : ควรฉีดทันทีที่มีวัคซีน
- ผู้ป่วยที่กำลังได้รับการผ่าตัด ; ควรฉีดเมื่อร่างกายฟื้นตัวจากการผ่าตัด
3.2 คนไข้มะเร็งระบบเลือดที่ได้รับการรักษาด้วยการปลูกถ่ายไขกระดูกควรฉีดหลังจากรักษาครบ 3 เดือนไปแล้ว
4. ถ้ากำลังได้รับยาเคมีบำบัดหรือภูมิคุ้มกัน ควรฉีดช่วงไหน ?
ควรฉีดทันทีที่มีวัคซีน และจะฉีดวันเดียวกับที่ให้ยาเคมี หรือยาภูมิคุ้มกันบำบัด และจะฉีดวันไหนก็ได้ที่ได้รับการรักษาด้วยยามุ่งเป้า ไม่มีความจำเป็นต้องรอระยะเวลาหรือรอเช็คเม็ดเลือดขาว เนื่องจากผู้ป่วยมะเร็งกลุ่มนี้โอกาสที่จะมีเม็ดเลือดขาวต่ำที่ทำให้กังวลว่าจะทำให้ประสิทธิภาพของวัคชีน
5. ควรฉีดวัคซึนตัวไหน หรือวัคซีนที่ผลิตด้วยเทคโนโลยีใด ?
วัดซีนทุกยี่ห้อ ไม่ว่าจะผลิตด้วยเทคโน โลยี่แบบ ใด ที่ได้รับอนุมัติจาก อย.ไทยสามารถใช้ได้ทุกชนิด ไม่ว่าจะเป็น Sinovac, AstraZeneca ต่อไปถ้าอนุมัติ Moderna, Pizer , Sputnik V ,Sinopharm สามารถใช้ได้ทุกยี่ห้อ
อบจ.อุทัยธานี จัดวัคซีนโมเดอร์นาไว้สำหรับกลุ่มคนพิการ
เป็นคนพิการ อายุ 18 ปีขึ้น มีบัตรประจำตัวคนพิการ อาศัยอยู่ในอุทัยธานี ไม่เคยรับวัคซีนมาก่อน อยู่ในภาวะยากจน ไม่มีรายได้ เข้าไม่ถึงสิทธิ หรือเป็นคนพิการที่ต้องสัมผัสประชาชน
ขณะนี้ยังเปิดเผยกำหนดการแผนการฉีด
สมาคมโรคเบาหวานแห่งประเทศไทย LINK
สมาคมโรคเบาหวานแห่งประเทศไทย ในพระราชูปถัมภ์ สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี
- อาคารเฉลิมพระบารมี ๕๐ ปี ชั้น 11 โซน A เลขที่ 2 ซอยเพชรบุรี 47 (ศูนย์วิจัย) ถนนเพชรบุรีตัดใหม่ แขวงบางกะปิ เขตห้วยขวาง กรุงเทพฯ 10310
- โทรศัพท์:- 0-2716-5412
- มือถือ:- 084-468-0711
- แฟกซ์:- 0-2716-5411
- อีเมล:- info@dmthai.org
- Facebook
ขอหนังสือรับรองฉีดวัคซีน - จะเดินทางไปต่างประเทศ LINK
การขอหนังสือรับรองการสร้างเสริมภูมิคุ้มกันโรค COVID-19 สำหรับการเดินทางระหว่างประเทศ สำนักงานสาธารณสุขจังหวัดอุบลราชธานี
1. กรุณาตรวจสอบข้อมูล ให้ครบถ้วน ถูกต้อง
2. ผู้ร้องขอฯ ต้องนำเอกสารตัวจริงทั้ง 3 ฉบับ มาแสดงในวันรับเอกสาร
3. กรณีที่ไม่สามารถมารับเอกสารได้ด้วยตัวเอง ต้องมีหนังสือมอบอำนาจฉบับตัวจริงมามอบให้ในวันรับเอกสาร
4. มีค่าบริการออกเอกสารรับรองฯ เล่มละ 50 บาท
5. สำนักงานสาธารณสุขจังหวัดอุบลราชธานี จะแจ้งนัดหมายการรับเอกสารทางหมายเลขโทรศัพท์ที่แจ้งในระบบ
5. ติดต่อรับเอกสารได้ที่กลุ่มงานพัฒนายุทธศาสตร์สาธารณสุข สำนักงานสาธารณสุขจังหวัดอุบลราชธานี หมายเลขโทรศัพท์ 082-648-9270
นี่เป็นเพียงส่วนหนึ่ง สนใจไปลองเดินชม ทดลองชิม คุยกับผู้ประกอบการเพื่อแลกเปลี่ยนข้อมูลและโอกาส ในธุรกิจกัญชา กัญชา กระท่อม ที่กำลังจะเดินทางไปอีกไกลนับจากนี้
มีข้อคิดเห็นอย่างไร เชิญร่วมสนทนาผ่อนกล่องคอมเม้นต์ได้เลย
24 ธ.ค.2564 ศบค.แถลงยืนยัน 2 สามีภรรยาติดเชื้อโอมิครอน LINK
24 ธ.ค.2564 ศบค. โดย พญ.อภิสมัย ศรีรังสรรค์ แถลงสถานการณ์ผู้ติดเชื้อโอมิครอนในประเทศไทยมีจำนวน 205 ราย และระบุถึงคู่สามี-ภรรยา ที่กาฬสินธุ์ ที่เดินทางกลับจากประเทศเบลเยียม ยืนยันว่าติดเชื้อโอมิครอน จริง
"EOC รายงานพบผู้ป่วย 2 ท่าน พบที่จังหวัดกาฬสินธุ์ เป็นคู่ สามี-ภรรยา เดินทางมาจากประเทศเบลเยียม ทั้ง 2 ท่าน อายุ 47 ปี จากข้อกำหนดของไทยที่จะต้องตรวจ RT-PCR ซึ่งทั้งสองได้ตรวจเมื่อวันที่ 9 ธันวาคม มีผลเป็นลบ เมื่อเข้ามาถึงประเทศไทยวันที่ 10 ธันวาคม วันแรก ได้ตรวจ PCR อีกครั้ง (ตามข้อกำหนดมาตรการ Test and Go) และพักรอ 1 คืน ผลออกมาเป็นลบ ในวันที่ 11 ธันวาคม จึงเดินทางไปจังหวัดกาฬสินธุ์บ้านเกิด วันที่ 12 ธันวาคม ไปรับประทานอาหารกับครอบครัว พบว่าร้านอาหารที่ใช้บริการมีลักษณะเป็นพื้นที่ปิด"
"เริ่มมีอาการเมื่อวันที่ 13 และ15 ธันวาคม ระหว่างนั้น ทั้งสอง เดินทางไปธนาคาร สถานที่ราชการหลายแห่ง โดยสารรถตู้ประจำทาง และเดินทางข้ามพื้นที่ไปขอนแก่น มีการพบปะผู้คน กลายเป็นมีผู้สัมผัสเสี่ยงสูง วันที่ 15 ธันวาคม เมื่อพบว่ามีอาการ ได้ไปตรวจ ATK ซ้ำ จากนั้นเข้ารับการรักษาในโรงพยาบาลวันที่ 17 ธันวาคม ยืนยันจากการตรวจ RT-PCR ซ้ำ เป็นบวก และตรวจสายพันธุ์ ยืนยัน ยืนยันสายพันธุ์ในวันที่ 21 ธันวาคมว่าเป็น "โอมิครอน" ทั้งสองคน"
จากคลัสเตอร์นี้ทำให้มีรายงาน ผู้ติดเชื้อเพิ่มขึ้นแล้ว 21 คน นอกจากนี้ ยังมีบางจังหวัด ที่อยู่ระหว่างการสอบสวนโรค โดยกรมวิทยาศาสตร์การแพทย์จะติดตามสอบสวนทุกรายอย่างใกล้ชิด
รับสิทธิ์ ได้ง่ายๆ แค่ add line @VIMUTHOSPITAL
จากความตั้งใจของผู้บริหารทั้งสี่ร้านที่พร้อมให้บริการส่งต่อความสุขในรูปแบบความหวานให้แก่ลูกค้าแม้ว่าจะป่วย บวกรวมกับความเชี่ยวชาญในการดูแลผู้ป่วยเบาหวานแบบครบวงจรของศูนย์โรคเบาหวาน โรงพยาบาลวิมุต เราพร้อมแล้วที่จะให้ทุกคนได้ลิ้มลองความหวานที่รับประทานแล้วไม่อันตราย อย่าลืมไปลองกันได้ที่ Casa Lapin, Rolling Roasters, Cheevit Cheeva, White Story (เฉพาะสาขาที่เข้าร่วม) รับสิทธิ์ เพียงแค่ add line @VIMUTHOSPITAL ตลอดเดือนธันวาคมนี้ พิเศษ พร้อมรับ Promotion เช็กความเสี่ยงเบาหวานโดยศูนย์โรคเบาหวาน โรงพยาบาลวิมุต ฟรีรพ.แม่สอด จะเปิดรับลงทะเบียน คนไข้ที่ตรวจ ATK+
COVID CALL CENTER รพ.แม่สอด 065-4611428 กด 1
เวลา 08.30-12.00 น. และ 13.00-16.00 น. ทุกวัน (ไม่เว้นวันหยุด)
(ไม่ต้องลงทะเบียนผ่าน QR code อีกต่อไป)
? สะดวก ง่าย ไม่ยุ่งยาก
เพียงแจ้งชื่อ-สกุล, เลข HN : Hospital Number รพ.แม่สอด (ถ้ามี) หรือแจ้งเลข ปชช. 13 หลัก
จากนั้นนัดหมาย X-ray+พบแพทย์ One stop service
(ในวันที่มาตรวจ จนท.จะขอดูรูปประกอบ เพื่อยืนยันผลตรวจ ATK ขึ้น 2 ขีดจากที่บ้าน)
?️ วันธรรมดา (จันทร์-ศุกร์) ถ้าโทรมาก่อน 12.00 น. -> มาตรวจ One stop service 13.00 วันนั้น
?️ วันหยุด ถ้าโทรมาก่อน 09.30 น. -> ได้ตรวจ One stop service 10.00 น. วันนั้น
?️ หากเกินเวลาที่กำหนด จะได้คิววันรุ่งขึ้น วันธรรมดา 13.00 น. วันหยุด 10.00 น.
? เมื่อโทรแจ้งและได้รับการยืนยันแล้ว สามารถมาที่ รพ. ด้วยตนเองได้เลย
มาถึง รพ. ให้นั่งรอที่บริเวณศาลาพักญาติ หน้า ARI Clinic เวลา 13.00 น. เป็นต้นไป
"พบแพทย์ไวขึ้น ได้ X-ray ทุกคน"
ท่านใดแพทย์สั่งจ่ายยา จะได้รับยากลับบ้านทันที
หากผล X-ray ผิดปกติ จะได้เข้านอน รพ.ในวันนั้น
? หากมีอาการหอบเหนื่อยมาก พูดไม่จบประโยค ออกซิเจนในเลือดน้อยกว่า 96% ให้โทร.ติดต่อ 1669
โรงพยาบาลสุราษฎร์ธานี จัดฉีดในวันที่ 7 และ 14 กุมภาพันธ์ 65 LINK
โรงพยาบาลสุราษฎร์ธานี จัดฉีดวัคซีนโควิดไฟเซอร์ ฝาสีส้ม สำหรับเด็ก 5-11 ปี ที่มีโรคประจำตัว 7 กลุ่มโรค สำหรับน้องๆ ในเขตอำเภอเมือง สุราษฏร์ธานี จะเริ่มฉีดเข็ม 1 ในวันจันทร์ที่ 7 และ วันจันทร์ ที่ 14 กุมภาพันธ์ เวลา 08.00 - 12.00 น. น้องๆ จะได้รับการนัดหมายจากคุณหมอที่ดูแลประจำ และคุณพ่อคุณแม่สามารถสอบถามหรือนัดหมายเพิ่มเติมได้ผ่านห้องตรวจเด็กในเวลา 08.30 -15.30น ในวันราชการ นะคะ แล้วมาพบกันนะจ๊ะ
กลุ่มประเทศที่เข้าร่วมระบบ EU DCC
รายชื่อประเทศที่เข้าร่วมระบบ EU DCC จำแนกตามทวีปต่างๆ ดังนี้
ทวีปเอเซีย
- สิงคโปร์
- ไทย
- อิสราเอล
- เลบานอน
- สหรัฐอาหรับเอมิเรตส์
- ไต้หวัน
- อาร์เมเนีย
อเมริกาใต้
- เอลซัลวาดอร์
- ปานามา
- อุรุกวัย
แอฟริกา
- เคปเวิร์ด
- โมรอคโค
- โตโก
- ตูนิเซีย
ออสเตรเลีย
สหภาพยุโรป 45 ประเทศ
- อัลแบเนีย
- อันดอร่า
- ออสเตรีย
- เบลเยี่ยม
- บัลแกเรีย
- โครเอเชีย
- ไซปรัส
- เชคเนีย
- เดนมาร์ค
- เอสโตเนีย
- หมู่เกาะแฟโรห์
- ฟินแลนด์
- ฝรั่งเศส
- จอร์เจีย
- เยอรมนี
- กรีซ
- ฮังการี
- ไอซ์แลนด์
- ไอร์แลนด์
- อิตาลี
- ลัตเวีย
- ลิคเทนสไตน์
- ลิธัวเนีย
- ลักเซ็มเบอร์ก
- มัลตา
- มอลโดวา
- มอนเตเนโกร
- โมนาโก
- เนเธอร์แลนด์
- นอร์ธ มาซิโดเนีย
- นอร์เวย์
- โปแลนด์
- โปรตุเกส
- โรเมเนีย
- ซาน มาริโน
- เซอร์เบีย
- สโลวาเกีย
- สโลเวเนีย
- สเปน
- สวีเดน
- สวิตเซอร์แลนด์
- ตุรกี
- วาติกัน
- ยูเครน
- สหราชอาณาจักร
*ข้อมูลรายชื่อประเทศ ณ 10 กุมภาพันธ์ 2565
ปัจจัยเสี่ยงของการเกิดสมองเสื่อม
1. น้ำหนักตัวเกิน
จากการศึกษาของ Whitmer RA และ คณะในผู้ป่วยวัยกลางคนอายุ 40-45 ปี จำนวน 10,276 คน นาน 27 ปี ซึ่งส่วนใหญ่เป็นคนผิวขาว แต่ก็มีคนผิวดำและคนเอเซียส่วนหนึ่ง พบว่า ผู้ที่มีดรรชนีมวลกาย (body mass index: BMI) ตั้งแต่ 30 ขึ้นไป จะเพิ่มความเสี่ยง 2.1 -2.54 เท่า และ BMI ที่เหมาะสมที่สุด สำหรับการป้องกันภาวะสมองเสื่อมในอนาคตคือ 20-22.5 และความเสี่ยงของการเกิดภาวะสมองเสื่อมเพิ่มขึ้นตาม BMI คือ BMI 22.50-24.99 มีความเสี่ยง 1.73 เท่า BMI 25.00-27.49 มีความเสี่ยง 1.93 เท่า BMI 27.50-29.99 มีความเสี่ยง 2.30 เท่า และBMI ตั้งแต่ 30 ขึ้นไป มีความเสี่ยง 2.54 เท่า โดยความเสี่ยงที่เกิดขึ้นไม่ได้ขึ้นกับโรคที่อาจเกิดร่วมในผู้ป่วยที่น้ำหนักเกิน
2. การสูบบุหรี่
ผู้สูงอายุไทยยังสูบบุหรี่ร้อยละ 27.3 โดยผู้สูงอายุชายสูบบุหรี่มากกว่าผู้สูงอายุหญิง 5 เท่า (อัตราส่วนชายต่อหญิงที่ยังสูบบุหรี่ ร้อยละ 35.5 ต่อ 7.3 ในเขตเมือง และร้อยละ 58.6 ต่อ 11 ในเขตชนบท) การศึกษาที่ผ่านมาแสดงให้เห็นถึงผลดีและผลเสียของการสูบบุหรี่ต่อการเกิดภาวะสมองเสื่อม สำหรับด้านดี ซึ่งมีผู้ศึกษาไม่มากนักคือ ผู้ป่วยอัลไซเมอร์มี nicotinic receptor ชนิด α4 ลดลง ซึ่งพบว่ามีความสัมพันธ์กับการเกิด Amyloid – β 1-42 plaques และความรุนแรงของอาการสมองเสื่อม ผู้ที่มี Apolipoprotein E4 genotype ซึ่งเป็นปัจจัยเสี่ยงทางพันธุกรรมของอัลไซเมอร์พบว่า มี nicotinic receptor ลดลง สารนิโคตินในบุหรี่อาจช่วยเพิ่มปริมาณหรือกระตุ้นให้มีการหลั่งสารสื่อประสาทได้มากขึ้น ทำให้มีสมาธิจดจ่อ และกระบวนการคิดรวบรวมข้อมูลดีขึ้น และอาจยับยั้งการเกิด apoptosis ของเซลล์ประสาทได้ อย่างไรก็ตามการศึกษาอื่นๆ พบว่า ผลของการสูบบุหรี่กับโรคอัลไซเมอร์ไม่ชัดเจน มีทั้งได้ผลดี ผลเสีย หรือไม่มีผลต่อการเกิดโรค และผลดีที่เกิดขึ้นจะหมดไปเมื่อพิจารณาถึงผลเสียที่เกิดจากโรคหลอดเลือดสมองและผลต่ออวัยวะอื่นๆ ที่เกิดร่วมด้วย การสูบบุหรี่เพิ่มอุบัติการการเกิดโรคหลอดเลือดถึง 2 เท่า และเพิ่มความเสี่ยงต่อการเกิดภาวะสมองเสื่อม 2.28 เท่า แต่ความเสี่ยงต่อภาวะสมองเสื่อมค่อนข้างๆ ไม่ชัดเจนเท่าผลต่อการเกิดโรคหลอดเลือดสมองเนื่องจากการศึกษาไม่พบว่าการสูบบุหรี่จะเพิ่มอุบัติการณ์การเกิดภาวะสมองเสื่อม การงดสูบบุหรี่ตั้งแต่ 5 ปีขึ้นไปจะลดปัจจัยเสี่ยงของการเกิดโรคหลอดเลือดสมองลงได้เท่าคนที่ไม่เคยสูบบุหรี่ คือลดลงร้อยละ 50 ซึ่งนับว่าได้ผลดีกว่าการควบคุมไขมัน หรือความดันโลหิตสูงอีก การสูบบุหรี่จะทำให้การไหลเวียนเลือดไปที่สมองทั้งส่วน cortex และ subcortex ลดลง ทำให้สมองฝ่อเร็วขึ้น ทำให้ผู้ป่วยมี cognitive performance ไม่ดีและเสีย cognitive flexibility US Preventive Services Task Force (USPSTF) ได้แนะนำให้แพทย์แนะนำผู้ป่วยให้เลิกบุหรี่ โดยการใช้เวลาเพียง 3 นาทีก็ได้ประโยชน์ในการทำให้ผู้ป่วยสามารถเลิกบุหรี่ได้
3. แอลกอฮอล์
การดื่มแอลกอฮอล์ขนาดน้อยๆ ในปริมาณไม่เกิน 3 แก้วต่อวัน สามารถลดโอกาสเกิดภาวะสมองเสื่อมได้ร้อยละ 42 และลดโอกาสเกิดภาวะสมองเสื่อมจากโรคหลอดเลือดสมองได้ร้อยละ 71 โดยไม่ขึ้นกับชนิดของแอลกอฮอล์ อย่างไรก็ตามบางการศึกษาของพบว่าชนิดของแอลกอฮอล์ที่สามารถลดโอกาสการเกิดโรคอัลไซเมอร์ได้คือไวน์เท่านั้น แต่การศึกษาในประเทศญี่ปุ่นพบว่าการดื่มแอลกอฮอล์เป็นปัจจัยเสี่ยงที่สำคัญของการเกิดภาวะสมองเสื่อมจากโรคหลอดเลือดสมอง ผลกระทบของแอลกอฮอล์ต่อร่างกายไม่ควรพิจารณาเฉพาะเรื่องภาวะสมองเสื่อมเท่านั้น เนื่องจากแอลกอฮอล์ยังมีผลต่อระบบต่างของร่างกาย ผู้ป่วยที่ดื่มแอลกอฮอล์ที่มีปัญหาเรื่องภาวะสมองเสื่อม ยังอาจเกิดจากการขาดสารอาหาร อุบัติเหตุต่อสมอง และอื่นๆ
4. สารอาหาร
เนื่องจากสาเหตุหนึ่งของการเกิดโรคอัลไซเมอร์คือ การเกิด oxygen free radicals จากoxidative stress จึงมีการศึกษาถึงประโยชน์ของการให้ antioxidants เพื่อป้องกันภาวะสมองเสื่อม ซึ่งสารอาหารที่ได้รับการศึกษามากที่สุดใน antioxidants คือ วิตามินซีและวิตามินอี สารอาหารที่สำคัญตัวอื่นได้แก่ กรดโฟลิกและวิตามินบีสิบสอง เนื่องจากการขาดสาร 2 ชนิดนี้จะทำให้มีระดับ homocysteine สูงขึ้น และเพิ่มความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจ ภาวะสมองเสื่อม และโรคอัลไซเมอร์ได้ การรับประทานกรดโฟลิก และวิตามินบีสิบสองสามารถลดระดับ homocysteine ได้จริง แต่ไม่พบว่าจะทำให้ cognitive function ในผู้ป่วยที่มี mild moderate และ cognitive decline และผู้ป่วยที่มีภาวะสมองเสื่อมแล้วดีขึ้น และในปัจจุบันยังไม่มีหลักฐานยืนยันเช่นกันว่าการให้วิตามินบีแก่ผู้ป่วยที่มี cognitive deterioration หรือภาวะสมองเสื่อมแล้วจะสามารถทำให้ความสามารถของสมองกลับคืนเป็นปกติ
วิตามินที่ผู้สูงอายุไทยยังได้รับไม่เพียงพอ ได้แก่ วิตามินบีหนึ่ง วิตามินบีสอง เบต้าคาร์โรทีน กรดโฟลิก วิตามินอี และไนอะซิน ส่วนวิตามินเอ และวิตามินซีนั้นมักได้รับเพียงพอกับความต้องการแล้ว
5. การขาดการออกกำลังกาย
ทราบกันดีว่า การออกกำลังกายจะก่อให้เกิดประโยชน์ต่อผู้สูงอายุ อย่างไรก็ตาม การศึกษาที่แสดงให้เห็นถึงผลจากการออกกำลังกายเพื่อป้องกันภาวะสมองเสื่อมยังอยู่ในระหว่างการศึกษา จึงคงต้องรอดูผลต่อไปว่าการออกกำลังกายจะได้ผลในการป้องกันภาวะสมองเสื่อมหรือไม่ อย่างไรก็ตามในทางทฤษฎี การออกกำลังกายอาจป้องกันภาวะสมองเสื่อมได้จากการกระตุ้นที่ neurotrophic factors และปรับเปลี่ยนกระบวนการ apoptosis85,86 นอกจากนั้นการออกกำลังกายยังทำให้ระบบการไหลเวียนเลือดดี เพิ่มการไหลเวียนเลือดที่สมองและลดโอกาสของการเกิดโรคหลอดเลือดสมอง ผลอื่นๆ ที่อาจเกิดขึ้นคือ การออกกำลังกายทำให้กล้ามเนื้อและข้อต่อแข็งแรง การทรงตัวดีขึ้น ลดโอกาสการล้มได้ ซึ่งเป็นการลดการเกิดการกระทบกระเทือนต่อสมอง
การศึกษาที่เป็น population-based cohort ในผู้ที่มีอายุเฉลี่ย 50 ปี ติดตามเฉลี่ย 21 ปี ในประเทศฟินแลนด์ โดยใช้คำถามถามความถี่ของการออกกำลังกายที่ใช้เวลาอย่างน้อย 20-30 นาที และทำให้เหนื่อยหรือสูญเสียเหงื่อ พบว่าผู้ที่ออกกำลังกายอย่างน้อย 2 ครั้งต่อสัปดาห์ขึ้นไป ในวัยกลางคนมีความเสี่ยงต่อการเกิดภาวะสมองเสื่อมและโรคอัลไซเมอร์ลดลงร้อยละ 52 และ 62 ตามลำดับเมื่อเข้าสู่วัยสูงอายุ
6. ความดันโลหิตสูง
จากรายงานทางระบาดวิทยาพบความสัมพันธ์ระหว่างโรคความดันโลหิตสูงและภาวะสมองเสื่อม ดังการศึกษา Honolulu Asia Aging Study ซึ่งทำในประชากรชายเชื้อชาติญี่ปุ่นอเมริกัน พบว่า ความเสี่ยงของการเกิด intermediate cognitive function และ poor cognitive function เพิ่มขึ้นร้อยละ 7 และ9 ตามลำดับในแต่ละช่วงความดันซิสโตลิกที่เพิ่มขึ้นทุก 10 มิลลิเมตรปรอท และการที่มีความดันโลหิตสูงในวัยกลางคนเพิ่มความเสี่ยงของการเกิดภาวะสมองเสื่อมในวัยสูงอายุ การศึกษาในประเทศฝรั่งเศสในผู้ป่วยชายและหญิงที่มีอายุเฉลี่ย 65 ปีที่มีความดันโลหิตมากกว่า 160/95 มิลลิเมตรปรอท พบว่า เมื่อติดตาม 4 ปีผู้ป่วยที่มีความดันโลหิตสูงมีความเสี่ยง 2.8 เท่าที่จะเกิดการลดลงของคะแนน Mini Mental State Examination(MMSE) นอกจากนั้นผู้ป่วยโรคความดันโลหิตสูงที่ไม่ได้รับการรักษามีความเสี่ยง 4.3 เท่าที่จะมีความสามารถของสมองลดลง (cognitive decline) สำหรับผู้ป่วยที่ได้รับการรักษามีความเสี่ยง 1.9 เท่าเมื่อเทียบกับผู้ที่ไม่มีความดันโลหิตสูง89 โดยความดันโลหิตสูงมีผลกระทบทั้งทางตรงและทางอ้อมต่อการลดลงของความสามารถของสมอง สำหรับผลทางตรงคือ ผู้ป่วยที่มีความดันโลหิตสูงมีการลดลงของปริมาตรสมอง น้ำหนักสมอง และมีการเพิ่มขึ้นของ neurofibrillary tangles ที่ neocortex และ hippocampus สำหรับผลทางอ้อมเกิดจากการที่เกิด atherosclerosis และโรคหลอดเลือสมองจากการที่มีความดันโลหิตสูงเป็นเวลานาน90
7. โรคเบาหวานและภาวะดื้อต่ออินซูลิน
ผลของการที่มีระดับอินซูลินในเลือดสูง(peripheral hyperinsulinemia) จะยับยั้ง peripheral Aβ degradation ลดปริมาณของ insulin receptor ใน blood brain barrier ลดความเข้มข้นของอินซูลินในสมองและลดการขนย้ายของ carrier protein ส่วนการที่มีระดับของอินซูลินในสมองต่ำทำให้ Aβ release ออกจากเซลล์สมองน้อยลงเกิดการคั่งของ Aβ และลดปริมาณของ insulin degrading enzyme ซึ่งเชื่อว่าเป็นเอนไซม์ที่มีส่วนช่วยในการกำจัด Aβ และยังมีผลทำให้เกิด tau hyperphosphorylation ซึ่งทำให้เกิด tangles ในผู้ป่วยโรคอัลไซเมอร์ นอกจากนั้นยังส่งผลให้ cortical glucose utilization ในสมองส่วน hippocampus และ entorrhinal cortex ยังลดลงและมี oxidative stress มากขึ้น
ภาวะดื้อต่ออินซูลินและการที่มีระดับอินซูลินในเลือดสูง เป็นปัจจัยเสี่ยงของโรคหลอดเลือดอุดตัน โดยทำให้เกิด endothelial dysfunction โรคเบาหวานชนิดที่ 2 และภาวะดื้อต่ออินซูลินยังเพิ่มโอกาสเกิดโรคหลอดเลือดสมอง ผู้ป่วยโรคเบาหวานมีโอกาสเกิดปัญหาแทรกซ้อนทางด้านหลอดเลือดเพิ่มขึ้น 4 เท่า และจากรายงานการศึกษาวิจัยทางระบาดวิทยาได้พบความสัมพันธ์ของการเกิดภาวะสมองเสื่อมจากโรคหลอดเลือดสมองสูงขึ้นในผู้ป่วยที่เป็นโรคเบาหวานชนิดที่ 2 หรือความดันโลหิตสูง โดยพบอุบัติการณ์ภาวะสมองเสื่อมสูงขึ้น 2 เท่า ในผู้ป่วยโรคเบาหวานและพบว่าเป็นภาวะสมองเสื่อมจากโรคหลอดเลือดสมองมากกว่า
โรคอัลไซเมอร์ ดังนั้นจึงพบว่า โรคเบาหวานและการที่มีระดับอินซูลินในเลือดสูงเป็นปัจจัยเสี่ยงของโรค
อัลไซเมอร์และภาวะสมองเสื่อมจากโรคหลอดเลือดสมอง
8. ภาวะไขมันในเลือดสูง
การที่มีระดับโคเลสเตอรอลในเลือดสูงมีความสัมพันธ์กับการเกิดโรคหลอดเลือดสมองซึ่งนำไปสู่การเกิดภาวะสมองเสื่อมจากโรคหลอดเลือดสมองมากขึ้น นอกจากนั้นการที่มีไขมันในเลือดสูงยังมีอาจทำให้เกิดโรคอัลไซเมอร์อีกด้วย
9. โรคหัวใจ
ผู้ป่วยโรคหัวใจชนิดต่างๆ มีโอกาสทำเกิดหลอดเลือดสมองอุดตันจากลิ่มเลือดที่เกิดขึ้นในหัวใจ
10. ระดับโฮโมซีสเตอีนที่สูง (Hyperhomocysteinemia)
ผลกระทบต่อสมองจากการที่มีระดับโฮโมซีสเตอีนเพิ่มขึ้นเกิดจาก 2 สาเหตุหลักคือ จากการเกิดพิษต่อเซลล์สมองและจากการที่มีผลเสียต่อหลอดเลือดสมอง การเปลี่ยนแปลงของโฮโมซีสเตอีนในร่างกายเราเกิดขึ้น 2 วิธี โดยต้องอาศัยวิตามินบีหก วิตามินบีสิบสองและกรดโฟลิกเป็นตัวช่วย การขาดวิตามินเหล่านี้จะทำให้เกิดการเพิ่มขึ้นของโฮโมซีสเตอีน
11. ฮอร์โมนเพศหญิงทดแทน (Hormone replacement therapy: HRT)
จากการศึกษาในอดีตพบว่า ฮอร์โมนเพศหญิงทดแทน สามารถช่วย cognitive function ในผู้หญิงที่มีและไม่มีภาวะสมองเสื่อม ยิ่งไปกว่านั้นผู้หญิงวัยหมดประจำเดือนที่รับประทานยา HRT จะมี verbal memory, vigilance, reasoning และmotor speed ที่ดีกว่าผู้หญิงวัยหมดประจำเดือนที่ไม่ได้รับประทาน
ในปัจจุบันพบว่าฮอร์โมนเพศหญิงทดแทน ทำให้เกิดโรคมะเร็งเต้านม โรคหลอดเลือดหัวใจตีบ โรคหลอดเลือดสมองตีบ การอุดตันหลอดเลือดดำ แม้ว่าจะมีผลดีกับเรื่องมะเร็งลำไส้ใหญ่และทวารหนัก และการเกิดกระดูกหัก นอกจากนั้นยังพบอุบัติการณ์โรคหลอดเลือดสมองสูงขึ้น และผู้ป่วยที่ได้ฮอร์โมนเพศหญิงทดแทนชนิดรวมเกิดภาวะสมองเสื่อมเพิ่มขึ้นประมาณ 2 เท่า
12. อุบัติเหตุที่ศีรษะ
มีหลายรายงานการศึกษาทางระบาดวิทยาพบว่าผู้ป่วยที่เป็นโรคอัลไซเมอร์และภาวะสมองเสื่อมจากสาเหตุอื่นๆ มีประวัติเคยได้รับอุบัติเหตุที่ศีรษะมากกว่าคนที่ไม่มีสมองเสื่อม อย่างไรก็ตามบางการศึกษา ไม่พบว่าการได้รับอุบัติเหตุที่ศีรษะมาก่อนเป็นปัจจัยเสี่ยงของการเกิดภาวะสมองเสื่อม
13. อาการซึม สับสนเฉียบพลัน
ผู้ป่วยที่มีอาการนี้เกิดขึ้นเมื่อติดตามไปแล้วมีโอกาสเกิดภาวะสมองเสื่อมสูงขึ้นกว่าคนที่ไม่เคยเป็น โดยการศึกษาของ Rockwood และคณะซึ่งติดตามผู้ป่วยอายุเฉลี่ย 65 ปีจำนวน 203 คนเป็นเวลา 3 ปี หลังเกิดอาการซึม สับสนเฉียบพลัน พบว่า ผู้ป่วยที่ไม่เคยมีอาการซึม สับสนเฉียบพลันเกิดภาวะสมองเสื่อมร้อยละ 5.6 ในขณะที่ผู้ที่เคยมีอาการซึม สับสนเฉียบพลันเกิดภาวะสมองเสื่อมร้อยละ 18.1105 สาเหตุอาจเกิดจากการที่ผู้ป่วยอาจมี cognitive impairment ที่ไม่ได้รับการวินิจฉัยหรือเป็น subclinical dementia ตั้งแต่ก่อนผ่าตัดหรือก่อนเกิดอาการซึม สับสนเฉียบพลันอยู่แล้ว หรืออาจเกิดภาวะสมองเสื่อมจากผลของอาการซึม สับสนเฉียบพลันทำให้เกิดการเปลี่ยนแปลงพยาธิวิทยาของสมองตามมา
14. โรคหลอดเลือดสมอง
การป้องกันการเป็นซ้ำของโรคหลอดเลือดสมองด้วยการแก้ไขปัจจัยเสี่ยงต่าง เช่น ความดันโลหิตสูง โรคเบาหวาน สูบบุหรี่ เป็นต้น รวมถึงการรับประทานยาต้านเกร็ดเลือด เช่น แอสไพริน หรือยากันเลือดแข็งตัว เช่น วาร์ฟาริน ในกรณีที่มีโรคหัวใจบางชนิด เป็นการป้องกันการเป็นซ้ำของโรคหลอดเลือดสมอง ดังนั้นจึงสามารถป้องกันภาวะสมองเสื่อมด้วย
15. โรคซึมเศร้า
จากการศึกษาวิจัยจำนวนมาก พบว่าอาการซึมเศร้ามีความสัมพันธ์กับภาวะสมองเสื่อม อาจเป็นไปได้จากการที่อาการซึมเศร้าเป็นสาเหตุที่ทำให้มีปัญหาความจำ หรืออาการซึมเศร้าเป็นอาการหนึ่งของภาวะสมองเสื่อมเอง โดยเกิดก่อนที่จะมีอาการสมองเสื่อมที่ชัดเจน ถึงแม้ในปัจจุบันยังไม่ทราบชัดเจนว่าอาการซึมเศร้ามีส่วนทำให้เกิดภาวะสมองเสื่อมหรือแท้จริงแล้วเป็นอาการหนึ่งของภาวะสมองเสื่อม การป้องกันและแก้ไขอาการซึมเศร้าจึงยังนับว่าเป็นการป้องกันภาวะสมองเสื่อมวิธีหนึ่ง
16. สารพิษในสิ่งแวดล้อมรอบตัว
ถึงแม้จะไม่มีข้อสรุปที่ชัดเจนถึงผลเสียของสารพิษต่างๆ ต่อการเกิดภาวะสมองเสื่อม แต่มีหลายรายงานที่พบว่าการได้รับสารพิษต่างๆ
โรงพยาบาลหัวเฉียว เปิดรับผู้ประกันตนเพิ่ม จำนวน 10,000 ราย LINK
ปี 2565 โรงพยาบาลหัวเฉียว เปิดรับผู้ประกันตนเพิ่ม จำนวน 10,000 ราย พร้อมสิทธิพิเศษสำหรับครอบครัวผู้ประกันตน ให้บริการตรวจรักษาโดยทีมแพทย์ผู้ชำนาญการทุกสาขา ด้วยคุณภาพมาตรฐานพร้อมขยายพื้นที่บริการทั้งคลินิกผู้ป่วยนอกและหอผู้ป่วยใน เพื่ออำนวยความสะดวก ด้วยบริการแบบ One Stop Service อีกทั้งเพื่อเพิ่มคุณภาพชีวิตที่ดีให้กับทุกท่าน สามารถเริ่มเปลี่ยนสถานพยาบาลได้ตั้งแต่วันนี้ - 31 มีนาคม 2565
แพ็กเกจ #คลอดบุตร เหมาจ่าย โรงพยาบาลพีเอ็มจี LINK
แพ็กเกจ คลอดบุตร เหมาจ่าย พิเศษเฉพาะประกันสังคมรพ.พีเอ็มจี เหมาจ่ายเริ่มต้นที่ 20,000.- (3 วัน 2 คืน)
คลอดธรรมชาติ เหมาจ่าย ราคาเริ่มต้น 28,000 บาท (3 วัน 2 คืน)
ผ่าตัดคลอด เหมาจ่าย ราคาเริ่มต้น 38,000 บาท (4 วัน 3 คืน)
**พิเศษสำหรับคุณพ่ออยากเข้าไปให้กำลังใจคุณแม่ในช่วงเวลาพิเศษ ราคา 5,000 บาท (เฉพาะคลอดธรรมชาติเท่านั้น)**
หมายเหตุ 1.กรณีกำหนดฤกษ์ผ่าคลอด มีค่าใช้จ่ายเพิ่มเติม 5,000 บาท 2.ราคาดังกล่าว ไม่รวมภาวะเทรกซ้อนมารดา และทารก แผนกสูตินรีเวชกรรม ต่อ 1112 . โรงพยาบาลพีเอ็มจี ยินดีให้บริการทุกท่าน สอบถามเพิ่มเติม โทร 02-4514920 ถึง 4
Ep. 3 “สิทธิของเจ้าของข้อมูลส่วนบุคคล” LINK
“รู้เรื่องสิทธิ ง่ายนิดเดียว” EP. 3 สิทธิของเจ้าของข้อมูลส่วนบุคคล
รู้หรือไม่?
ตาม พ.ร.บ. #คุ้มครองข้อมูลส่วนบุคคล พ.ศ. 2562
มีการรับรองสิทธิของเจ้าของ #ข้อมูลส่วนบุคคล ทั้งหมด 8 สิทธิ
มาทำความรู้จักและเข้าใจการได้รับสิทธิตามกฎหมาย
มีอะไรบ้างไปดูกัน...
1. สิทธิการได้รับแจ้ง (Right to be Informed) - มาตรา 23
*เป็นสิทธิที่เจ้าของข้อมูลส่วนบุคคล ทุกคน ได้รับโดยไม่ต้องมีการร้องขอ*
2. สิทธิในการเพิกถอนความยินยอม (Right to Withdraw Consent) - มาตรา 19
3. สิทธิในการเข้าถึงข้อมูลส่วนบุคคล (Right of Access) - มาตรา 30
4. สิทธิในการแก้ไขข้อมูลส่วนบุคคลให้ถูกต้อง (Right to Rectification) มาตรา 35, มาตรา 36
5. สิทธิในการลบข้อมูลส่วนบุคคล (Right to be Forgotten) - มาตรา 33
6. สิทธิในการห้ามมิให้ประมวลผลข้อมูลส่วนบุคคล (Right to Restrict of Processing) - มาตรา 34
7. สิทธิในการให้โอนย้ายข้อมูลส่วนบุคคล (Right of Data Portability) - มาตรา 31
8. สิทธิในการคัดค้านการประมวลผลข้อมูลส่วนบุคคล (Right to Object) – มาตรา 32
*** วิธีการใช้สิทธิข้อ 2-8 เป็นไปตามกฎหมายกำหนด***
ห้องฉุกเฉินอัจฉริยะ Smart ER 4.0 คุณประโยชน์ต่อเนื่องจากค่าไฟฟ้าที่ประหยัดได้
วันที่ 7 ธันวาคม 2563 ที่ห้องอุบัติเหตุฉุกเฉิน อาคารไชยกุล โรงพยาบาลบ้านตาก อำเภอบ้านตาก จังหวัดตาก นายพงศ์รัตน์ ภิรมย์รัตน์ ผู้ว่าราชการจังหวัดตาก เป็นประธานเปิดห้องฉุกเฉินอัจฉริยะ Smart ER 4.0 เพื่อสร้างความปลอดภัยอย่างเป็นระบบ ในการให้บริการทางการแพทย์แก่ประชาชน โดยมี นายจรัญ จันทมัตตุการ นายแพทย์สาธารณสุขจังหวัดตาก นายอรรถวุฒิ พึ่งเนียม นายอำเภอบ้านตาก แพทย์หญิงธัญญารัตน์ สิทธิวงศ์ ผู้อำนวยการโรงพยาบาลบ้านตาก บุคลากรทางการแพทย์และสาธารณสุข และผู้เกี่ยวข้อง เข้าร่วมพิธีเปิดงาน
สำหรับห้องฉุกเฉินอัจฉริยะ Smart ER 4.0 เป็นการปรับปรุงพัฒนาห้องฉุกเฉินให้เป็นห้องฉุกเฉินอัจฉริยะ เพื่อสร้างความปลอดภัยอย่างเป็นระบบในการให้บริการ โดยยึดหลัก 2 P safety คือ ผู้ดูแลผู้ป่วยผู้รับบริการปลอดภัย (Patient safety) และบุคลากรสาธารณสุขปลอดภัย (Personnel safety) โดยการนำระบบเทคโนโลยีสารสนเทศที่ทันสมัยมาใช้ให้เข้ากับยุค Digital disruption ภายใต้สถานการณ์ที่มีการระบาดของโรคติดเชื้อไวรัสโควิด-19 จึงได้พัฒนาระบบให้เกิดความเกิดความปลอดภัยสูงสุด ลดการแพร่กระจายเชื้อในสถานบริการ อีกทั้งได้พัฒนาสิ่งแวดล้อมภายในห้องฉุกเฉินให้เอื้อต่อการเยียวยา (Healing environment) บรรยากาศที่ผ่อนคลายและเป็นมิตร ซึ่งเป็นผลดีต่อทั้งผู้ป่วยและผู้ปฏิบัติงานด้วย
โอกาสนี้ ผู้ว่าราชการจังหวัดตาก และแขกผู้มีเกียรติได้เยี่ยมชมการให้บริการห้องฉุกเฉินอัจฉริยะ (Smart ER 4.0) การพัฒนาภูมิสถาปัตย์ สิ่งแวดล้อมเพื่อการเยียวยาของหอผู้ป่วยใน ระบบไฟฟ้าด้วยพลังงานแสงอาทิตย์ ขนาด 137.76 kW งานแผนแพทย์และผลิตภัณฑ์สมุนไพรโรงพยาบาลบ้านตาก และคลินิกโรคติดเชื้อทางเดินหายใจ (ARI clinic)
ทั้งนี้ โรงพยาบาลบ้านตากได้พัฒนาคุณภาพการให้บริการมาอย่างต่อเนื่อง อาทิ ผ่านการประเมินเพื่อรับรองคุณภาพสถานบริการและต่ออายุการรับรอง 6 ครั้งผ่านการประเมินพัฒนาด้านอนามัยสิ่งแวดล้อม GREEN & CLEAN HOSPITAL ระดับดีมาก PLUS ปี 2563 และเป็นโรงพยาบาลที่มีผลการประเมินการดำเนินงานสาธารณสุขตามคำรับรองการปฏิบัติราชการ (Performance Agreement : PA) ปี 2563 ระดับโรงพยาบาลสูงสุดในจังหวัดตากและปัจจุบันได้พัฒนาสู่การเป็น Smart hospital โดยประยุกต์ใช้เทคโนโลยีดิจิทัล เพื่อสนับสนุนการจัดบริการภายในโรงพยาบาลลดขั้นตอนการปฏิบัติงาน เพิ่มความสะดวกสบายความรวดเร็วในการรับบริการที่มีคุณภาพ ปลอดภัย และทันสมัยอีกด้วย
ข่าวจาก สำนักงานประชาสัมพันธ์จังหวัดตาก
7 ธ.ค.63ปัญหาฝุ่น PM 2.5 ที่คุกคามกทม. (และประเทศไทย)
ทุกคนรู้และผู้ว่าคนใหม่ก็ตระหนักถึงปัญหานี้ จึงได้เห็นหลายนโยบายที่มุ่งจัดการปัญหาฝุ่น มลพิษในกรุงเทพ ทั้งไม้อ่อน ไม้นวมและไม้หนัก อาทิเช่น
นโยบายจัดทีม นักสืบฝุ่น ศึกษาต้นตอ PM2.5 - ได้รู้ถึงที่มาและต้นกำเนิดของฝุ่นในพื้นที่กรุงเทพฯ เพื่อการจัดการอย่างตรงจุด กทม.จะเป็นเจ้าภาพในการทำบัญชีที่มาของฝุ่นภายในกรุงเทพฯ โดยจะร่วมมือกับสถาบันอุดมศึกษาในการสืบทราบต้นตอของฝุ่น ทั้งการเก็บตัวอย่าง การวิเคราะห์องค์ประกอบ เช่น คุณสมบัติทางเคมี อิออน โลหะหนัก เพื่อเก็บสถิติและระบุถึงต้นตอนของฝุ่น เพื่อนำไปเป็นข้อมูลสำหรับการแก้ปัญหาได้อย่างตรงจุด ทั้งในแง่การป้องกันการปล่อยมลพิษ และในแง่การเอาผิดจากผู้ปล่อยมลพิษเกินค่ามาตรฐาน
นโยบายพยากรณ์ แจ้งเตือน ป้องกันฝุ่น PM2.5 กทม.จะต้องดำเนินการเรื่องฝุ่น PM2.5 ตั้งแต่พยากรณ์ แจ้งเตือน และป้องกัน ดังนี้ 1. จัดเตรียมอุปกรณ์ป้องกันฝุ่นรูปแบบต่างๆ ที่เหมาะสม เช่น หน้ากากป้องกันฝุ่นพิษ การตรวจเครื่องฟอกอากาศ 2. ประสานงานกับหน่วยงานต่างๆ นำข้อมูลเหล่านี้มาพัฒนาเป็นรูปแบบการพยากรณ์เพื่อแจ้งเตือนให้กับประชาชน 3. พัฒนาจุดการแจ้งเตือนฝุ่นในสถานที่ที่มีประชาชนอยู่หนาแน่นโดยเฉพาะประชาชนกลุ่มเปราะบาง เช่น โรงเรียน โรงพยาบาล สถานที่สาธารณะ ป้ายรถเมล์ และสี่แยก 4. ปรับการแจ้งเตือนให้ค่าการแสดงผลเป็นแบบเรียลไทม์เพื่อให้ประชาชนทราบถึงสถานการณ์ฝุ่นอยู่เสมอและสามารถเลี่ยงการดำเนินกิจกรรมกลางแจ้งได้ในช่วงเวลาที่ฝุ่นหนาแน่น
นโยบายตรวจสอบคุณภาพอากาศเชิงรุกในโรงงาน - โรงงานที่อยู่ในกรุงเทพฯ มีประมาณ 6,200 แห่ง เป็นจังหวัดที่มีโรงงานมากที่สุดเป็นอันดับที่ 3 รองจากจังหวัดสมุทรปราการและสมุทรสาคร และยังมีกิจการที่มีการผลิตส่วนหนึ่งที่อยู่นอกระบบการตรวจสอบของกรมโรงงานอีกด้วย ดังนั้นเพื่อรักษาคุณภาพอากาศที่ดีให้กับประชาชน กทม.เป็นเจ้าภาพในการเข้าไปตรวจสอบการปล่อยมลพิษเชิงรุกของโรงงานดังนี้ 1. เข้าไปตรวจสอบการปล่อยมลพิษของโรงงาน 2. ออกคำแนะนำและคำสั่งให้แก้ไขการปล่อยมลพิษ 3. ดำเนินการทางกฎหมาย หรือ ประสานงานเพื่อเพิกถอนใบอนุญาต 4. ประสานงานกับภาครัฐและเอกชนที่เกี่ยวข้องเพื่อรวบรวมข้อมูลและพัฒนาฐานข้อมูลการปล่อยมลพิษภายใน กทม.เพื่อติดตามข้อมูลการจัดการมลพิษในพื้นที่อย่างต่อเนื่อง 5. แสดงผลข้อมูลมลพิษของโรงงานเพื่อให้ประชาชนในพื้นที่ได้รับรู้ถึงสถานการณ์ปัจจุบันแล้วความคืบหน้าในการดำเนินการปรับปรุงคุณภาพอากาศของผู้ประกอบการ
นโยบายดำเนินการทางกฎหมายกับผู้ที่ปล่อยมลพิษ จากนโยบาย นักสืบฝุ่น และ การตรวจสอบมลพิษในโรงงาน จะทำให้ กทม.ตรวจสอบพบผู้กระทำความผิดปล่อยมลพิษเกินค่ามาตรฐานได้ ดังนั้น กทม.จะดำเนินมาตรการจากเบาไปหาหนักเพื่อให้ผู้ประกอบการต่างๆ ลดการปล่อยมลพิษให้มาอยู่ในระดับที่มาตรฐานกำหนด เช่น การตักเตือนและกำหนดแนวทางร่วมกันในการแก้ไขปัญหา (มาตรการเบา) การสั่งให้หยุดประกอบกิจการ การก่อสร้าง หรือเพิกถอนใบอนุญาตที่เกี่ยวข้อง (มาตรการหนัก)
นโยบายตรวจจับรถควันดำจากต้นตอ กทม.จะร่วมมือกับตำรวจจราจร และกรมการขนส่งทางบก ในการดำเนินการดังนี้ 1. ตรวจสอบรถบรรทุกเชิงรุกจากต้นทางพร้อมกับออกใบรับรองให้กับรถบรรทุกว่าได้ผ่านการตรวจมาตรฐานเรียบร้อยแล้ว ส่วนรถบรรทุกที่ถูกตรวจสอบและไม่ผ่านมาตรฐานจะมีการจำกัดการใช้งานจนกว่าผู้ประกอบการจะดำเนินการแก้ไขแล้วเสร็จ 2. ตรวจสอบพื้นที่ก่อสร้างและรถบรรทุกที่เข้ามาในพื้นที่ว่าได้มาตรฐานการปล่อยมลพิษหรือไม่ ซึ่งหากตรวจพบเจอผู้กระทำความผิดจะมีการพิจารณากำหนดโทษในรูปแบบต่าง ๆ ตั้งแต่การตักเตือน ไป
รายชื่อรพ.เอกชนที่ให้บริการ Hospitel - Home Isolation - Private Hospital
บางแห่ง ฟรี บางแห่ง มีค่าใช้จ่าย ตามที่ปรากฏ (โปรดตรวจสอบกับแต่ละรพ.อีกครั้ง เพื่อให้ได้ข้อมูลที่อัพเดตที่สุด)
SNMRI Easy สถาบันสิรินธรเพื่อการฟื้นฟูฯ LINK
SNMRI Easy สำรองคิว เช็คอินง่ายๆ ครบ จบ ในแอปเดียว สถาบันสิรินธรเพื่อการฟื้นฟูฯ มีแอปพลิเคชั่นแล้วนะ SNMRI Easy สำรองคิว เช็คอินง่ายๆ ครบ จบ ในแอปเดียว ท่านสามารถทำการขอนัดพบแพทย์ล่วงหน้าผ่านทางแอปพลิเคชั่นได้ง่ายๆ
Check-In(ลงทะเบียนยืนยันการรักษา) ล่วงหน้าก็ได้!!
ตรวจสอบประวัติการรักษา ดูข้อมูลการใช้ยา และบริการอื่นๆ
สามารถดาวน์โหลดผ่าน
App Store จุฬารัตน์สไมล์คลินิก ทันตกรรม @รพ.จุฬารัตน์ 3 LINK
จุฬารัตน์สไมล์คลินิก ทันตกรรม รพ.จุฬารัตน์ 3 เปิดทำการ 1 ต.ค. 64
บริการหัตถการทุกชนิด ภายใต้นโยบาย
- อุปกรณ์ป้องกันเต็มที่
- ใช้เครื่องลดละอองฝอยและฟอกอากาศระดับโรงพยาบาล
- เวียนห้องตรวจหลังงานฟุ้งกระจาย
- ทันตแพทย์ และเจ้าหน้าที่ได้รับวัคซีนครบทุกคน
ผู้ป่วยทั่วไป/คนไข้ต่อเนื่อง ต้องการทำนัดล่วงหน้า
สอบถามข้อมูลเพิ่มเติม หรือติดต่อได้ที่
โทร 096-794-3834 หรือ 02-0332900 ต่อ 1067
หรือ ไลน์ dent1067
ไม้ขีดไฟในสยาม Pa Tedee LINK
ไม้ขีดไฟในสยาม เริ่มมีใช้ครั้งแรกสมัยรัชกาลที่ 4
“ไม้ขีดไฟ” เป็นของใช้จำเป็นที่ต้องมีติดบ้านเสมอ มันทำให้เราติดไฟ, จุดไฟได้ง่าย เร็ว และสะดวกทันใจกว่าการใช้เหล็กไฟชุดเหลือเกิน ไม่รู้เหมือนกันว่าเมื่อแรกมีไม้ขีดไฟใช้กันผู้คนจะตื่นเต้นกับมันมากน้อยแค่ไหน
อ่านต่อที่โพสต์ Pa Tedee จ้า
โปรแกรมกิจกรรมเด่น จากหน่วยงานในสธ.ใน APEC Health Week
รพ.สิรินาถ บึงกุ่ม ประกาศยุติการให้บริการ LINK
รพ.สิรินาถ บึงกุ่ม ได้ประกาศยุติการให้บริการผ่านเพจของรพ. ไปก่อนหน้านั้นแล้ว (วันที่ 31 สิงหาคม 2565) โดยระบุว่า "ขอยุติการให้บริการผู้ป่วยสิทธิหลักประกันสุขภาพถ้วนหน้า (บัตรทอง) ตั้งแต่วันที่ 1 ตุลาคม 2565 เป็นต้นไป"
กรุงเทพฯ ในวันนี้ ไม่ใช่แค่เมืองหลวงหรือศูนย์กลางความเจริญทุกด้านของประเทศเท่านั้น หากแต่คือ "หน้าตา" หรือ "ตัวแทนประเทศไทย" และที่สำคัญที่สุดคือเป็น "บ้านหลังใหญ่" ที่มีคนกว่า 10 ล้านคนอาศัยอยู่อาศัยร่วมกัน เราทุกคนจึงต้องร่วมมือร่วมใจกันดูแลบ้านหลังนี้ให้เป็นระเบียบเรียบร้อยสวยงาม สะอาด สดใส มีสิ่งแวตล้อมดี เพื่อให้ที่นี่ เป็นบ้านที่ผู้อยู่สุขกายสบายใจ เป็นเมืองที่ผู้มาเยือนต่างประทับใจ เป็นมหานครที่เป็นหน้าเป็นตา และความภาคภูมิใจของประเทศไทยและได้รับการยอมรับในระตับนานาชาติทัดเทียมมหานครชั้นนำระดับโลก
สถิติจำนวนประชากร ปี 2565
ยอดรวมทั้งหมด
- ชาย 32,286,841
- หญิง 33,817,263
- รวม 66,104,104
รายเดือน
- มกราคม 2565 ชาย 32,333,451 หญิง 33,831,810 รวม 66,165,261
- กุมภาพันธ์ 2565 ชาย 32,328,659 หญิง 33,831,020 รวม 66,159,679
- มีนาคม 2565 ชาย 32,319,924 หญิง 33,827,430 รวม 66,147,354
- เมษายน 2565 ชาย 32,308,380 หญิง 33,820,954 รวม 66,129,334
- พฤษภาคม 2565 ชาย 32,300,190 หญิง 33,817,702 รวม 66,117,892
- มิถุนายน 2565 ชาย 32,295,019 หญิง 33,816,786 รวม 66,111,805
- กรกฎาคม 2565 ชาย 32,291,150 หญิง 33,817,014 รวม 66,108,164
- สิงหาคม 2565 ชาย 32,286,841 หญิง 33,817,263 รวม 66,104,104
- กันยายน 2565 ชาย 32,286,628 หญิง 33,821,264 รวม 66,107,892
- ตุลาคม 2565 ชาย 32,282,718 หญิง 33,821,933 รวม 66,104,651
- พฤศจิกายน 2565 ชาย 32,278,115 หญิง 33,821,860 รวม 66,099,975
- ธันวาคม 2565 ชาย 32,270,615 หญิง 33,819,860 รวม 66,090,475
11:56 น.รายงานมีคนไทย 1 คนเสียชีวิต LINK
สถานเอกอัครราชทูต ณ กรุงโซล ขอเรียนว่า เมื่อคืนวันเสาร์ที่ 29 ตุลาคม 2565 ได้เกิดเหตุการณ์โศกนาฏกรรมในงานเทศกาลคืนวัน Halloween ที่จัดขึ้นในย่านถนน Itaewon กรุงโซล ทำให้มีผู้คนจำนวนมากเบียดกันแน่น ล้ม และเหยียบกัน รวมทั้งขาดอากาศหายใจ (stampede) โดยเฉพาะบริเวณซอยแคบทางลงถนนหลักบริเวณโรงแรม Hamilton ซึ่งล่าสุดเช้าวันที่ 30 ตุลาคม 2565 มีรายงานยืนยันว่า มีผู้เสียชีวิตจากเหตุการณ์ดังกล่าวอย่างน้อย 151 คน และได้รับบาดเจ็บ 82 คน
ล่าสุด สถานเอกอัครราชทูตฯ ได้รับรายงานจากตำรวจเกาหลีใต้ด้วยความเสียใจเป็นอย่างยิ่งว่า มีคนไทย 1 คน เสียชีวิตจากเหตุการณ์ดังกล่าว ซึ่งสถานเอกอัครราชทูตฯ อยู่ระหว่างการประสานงานกับทางการเกาหลีใต้เพื่อสอบถามรายละเอียด และแจ้งให้ญาติของผู้เสียชีวิตรับทราบ พร้อมทั้งให้ความช่วยเหลือในการจัดการศพผู้เสียชีวิตต่อไป
ในการนี้ สถานเอกอัครราชทูตฯ ขอแนะนำให้คนไทยในเกาหลีใต้หลีกเลี่ยงการเดินทางไปท่องเที่ยวในงานเฉลิมฉลองที่อาจจะมีความหนาแน่นในช่วงนี้
ทั้งนี้ สามารถติดต่อ/สอบถาม/ตรวจสอบเกี่ยวกับคนสูญหายได้ที่ช่องทางของทางการเกาหลีใต้ เบอร์โทรศัพท์ 02 2199 8660 โดยหากคนไทยท่านใดต้องการความช่วยเหลือจากสถานเอกอัครราชทูตฯ สามารถติดต่อมายังเบอร์โทรศัพท์ฉุกเฉิน 010-6747-0095 หรือ
010-3099-2955 ได้ตลอดเวลา
บุฟเฟต์ทุเรียนในจันทบุรี
ลาไปบอกลา - เพิ่มสิทธิวันลาดูแลพ่อ-แม่ที่ป่วยระยะสุดท้าย
ปัญหา
ปัจจุบัน คนไทยส่วนใหญ่ยังไม่รู้จักหรือเข้าไม่ถึงการดูแลฟื้นฟูผู้ป่วยในระยะปานกลาง ระยะยาว ระยะประคับประคอง ทำให้ผู้ป่วยที่ต้องได้รับการดูแล ที่ส่วนใหญ่เป็นผู้ป่วยสูงอายุและไม่สามารถพึ่งพาตัวเอง ไม่สามารถเข้าถึงการรักษาในระยะนี้อย่างมีคุณภาพ หากจะเข้าการรักษาก็ต้องเป็นภาระของบุตรหลานหรือญาติในการดูแล เนื่องในระดับองค์กรปกครองส่วนท้องถิ่นหรือชุมชุนยังไม่มีโครงสร้างพื้นฐานและบุคลากรในการรักษาระยะปานกลาง ระยะยาว และระยะประคับประคอง
โดยเฉพาะอย่างยิ่งการรักษาในระยะประคับประคอง (Palliative Care) ที่ยังไม่เข้าถึงในสถานบริการแบบปฐมภูมิ ทำให้ผู้ป่วยระยะสุดท้ายหรือระยะประคับประคองเข้าไม่ถึงการรักษาแบบประคับประคอง ที่จะทำให้ตัวเองไม่ทรมานจากความเจ็บปวดจากอาการป่วยระยะสุดท้าย นอกจากยังขาดแคลนบุคลากรที่มีความสามารถในการรักษาในระยะประคับประคอง เนื่องจากบุคลากรทางการแพทย์ทั่วไปไม่ได้มีความรู้ในด้านนี้ ส่วนแพทย์เฉพาะทางก็มีจำนวนน้อยและไม่ได้มีเส้นทางการเติบโตในสายอาชีพที่ดี อีกทั้งยังขาดโครงพื้นฐานและความรู้ความเข้าใจของประชาชนเกี่ยวกับการรักษาแบบประคับประคอง
นอกจากการรักษาแบบประคับประคอง สิทธิที่ผู้ป่วยระยะสุดท้ายที่มีความเจ็บป่วยทางกายแบบรักษาไม่ได้ที่จะตายอย่างมีศักดิ์ศรี หรือการทำการุณยฆาตเป็นสิ่งที่ยังไม่ถูกกฎหมายในประเทศไทย ทำให้ผู้ป่วยบางคนต้องทนทุกข์ทรมานก่อนเสียชีวิต
ข้อเสนอ
เพิ่มสวัสดิการวันลาสำหรับแรงงาน เพื่อดูแลพ่อแม่ที่ป่วยที่ได้รับการวินิจฉัยจากแพทย์ว่าเป็นผู้ป่วยระยะสุดท้าย โดยการเพิ่มไปในกฎหมายคุ้มครองแรงงาน
เว็บไซต์หน่วยงานในสังกัดกรมปศุสัตว์
ตามดูเรื่องทำหมันหมาแมว วัคซีนพิษสุนัขบ้า
เว็บไซต์ที่เกี่ยวข้องในสังกัด
หน้าที่ความรับผิดชอบ สำนักป้องกันและบรรเทาสาธารณภัย
สำนักป้องกันและบรรเทาสาธารณภัย เป็นหน่วยงานที่มีหน้าที่ความรับผิดชอบในการป้องกันและบรรเทาสาธารณภัยในพื้นที่กรุงเทพมหานคร ได้กำหนดมาตรการดูแลด้านการป้องกันและบรรเทาอัคคีภัยให้กับประชาชนในเขตชุมชนต่าง ๆ ทั้งในระยะสั้นและระยะยาว ซึ่งจะต้องดำเนินภารกิจด้านการป้องกัน ระงับเหตุ และฟื้นฟูให้การสงเคราะห์
1.ด้านการป้องกันก่อนเกิดเหตุ โดยได้ดำเนินการตามโครงการต่าง ๆ เพื่อป้องกันอัคคีภัยให้กับประชาชนในชุมชน ดังนี้
1.1 การตรวจสอบอาคารและพื้นที่เสี่ยงภัย ในพื้นที่กรุงเทพมหานคร ได้แก่ อาคารสูง อาคารขนาดใหญ่พิเศษ อาคารชุมนุมคน รวมทั้งพื้นที่ย่านที่มีความเสี่ยง เช่น บริเวณเชียงกง ถนนสายไม้ สถานีจำหน่ายและสะสมแก๊ส เป็นต้น โดยในปีงบประมาณ 2565 ได้ดำเนินการตรวจสอบอาคารสูง อาคารขนาดใหญ่พิเศษ และอาคารชุมนุมคนจำนวน 1,568 แห่ง
1.2 โครงการชุมชนปลอดภัย (ประปาหัวแดง) กรุงเทพมหานคร กับ การประปานครหลวงร่วมกันติดตั้งหัวจ่ายน้ำดับเพลิงในชุมชน จำนวน 2,000 จุด ระหว่างปี 2554-2556 กรุงเทพมหานครโดยสถานีดับเพลิงและกู้ภัยและสำนักงานเขต และการประปานครหลวงโดยสำนักงานการประปาสาขาพื้นที่ จึงได้ร่วมกันดำเนินการตรวจสอบและพิจารณาหาจุดติดตั้งหัวจ่ายน้ำดับเพลิง (ประปาหัวแดง) ในพื้นที่กรุงเทพมหานคร ที่มีความเหมาะสมตามหลักเกณฑ์ของการประปานครหลวง ตั้งแต่ช่วงเดือนกรกฎาคมถึงเดือนธันวาคม พ.ศ. ๒๕๖๕ พบว่ามีจุดติดตั้งหัวจ่ายน้ำดับเพลิงที่มีความเหมาะสมและเป็นไปตามหลักเกณฑ์การติดตั้งหัวจ่ายน้ำดับเพลิงของการประปานครหลวง จำนวน ๒๘๔ จุด ซึ่งอยู่ระหว่างประสานการประปานครหลวง เพื่อดำเนินการติดตั้ง
1.3 โครงการอบรมให้ความรู้การอพยพหนีไฟ การประชาสัมพันธ์สร้างความตระหนักรู้ ในการป้องกันและบรรเทาสาธารณภัยแก่เด็กนักเรียน เยาวชน และบุคลากร ในสถานศึกษา
1.4 การอบรมฝึกซ้อมการอพยพหนีไฟ ได้แก่ การฝึกซ้อมตามแผนเผชิญเหตุให้กับชุมชน การฝึกอบรมฝึกซ้อมอพยพหนีไฟให้แก่ภาครัฐ และภาคเอกชน และร่วมดำเนินการฝึกซ้อมอพยพหนีไฟให้กับหน่วยงานระดับสำนัก และสำนักงานเขต ทั้ง 77 หน่วยงาน
1.5 การรณรงค์ประชาสัมพันธ์ ให้ประชาชนได้รับทราบแนวทางปฏิบัติในกรณีที่เกิดอัคคีภัยและวิธีการปฏิบัติตนเมื่อเกิดอัคคีภัย ผ่านสื่อต่าง ๆ และดำเนินการแจกจ่ายแผ่นพับแผ่นปลิวให้ประชาชนได้รับความรู้
1.6 การฝึกอบรมเจ้าหน้าที่ในสังกัด เพื่อเพิ่มความรู้ความสามารถในการปฏิบัติงาน รวมทั้งการศึกษาดูงานทั้งในและนอกประเทศ
1.7 โครงการพัฒนาศักยภาพ อปพร. เพื่อให้กลุ่มพลังมวลชนเข้ามามีส่วนร่วมในการสนับสนุนในการปฏิบัติงานของเจ้าหน้าที่ โดยทำการฝึกอบรมให้ความรู้ สนับสนุนอุปกรณ์เครื่องมือเครื่องใช้ต่าง ๆ
1.8 โครงการจัดตั้งสถานีดับเพลิงและกู้ภัยเพิ่มเติม โดยมีวัตถุประสงค์เพื่อขยายการให้บริการให้ครอบคลุมพื้นที่กรุงเทพมหานคร และมีประสิทธิภาพตามมาตรฐานที่กำหนดไว้
การดำเนินการเตรียมการป้องกันอัคคีภัย จะบรรลุเป้าหมายและวัตถุประสงค์จำเป็นที่จะต้องได้รับความร่วมมือจากทุกภาคส่วน โดยเฉพาะอย่างยิ่งภาคประชาชน ซึ่งถือว่าเป็นความสำคัญเป็นอย่างยิ่งในการมีส่วนร่วมในการป้องกันอัคคีภัยที่อาจเกิดขึ้น ดังนั้นการอบรมให้ความรู้แก่ประชาชนถือว่าเป็นสิ่งสำคัญที่จะต้องดำเนินการอย่างเร่งด่วนและต่อเนื่อง สำหรับมาตรการระยะยาวจะพัฒนาศักยภาพเจ้าหน้าที่โดยการจัดตั้งโรงเรียนดับเพลิงของกรุงเทพมหานคร เพื่ออบรมให้ความรู้แก่เจ้าหน้าที่ประชาชนทั่วไป ให้มีความชำนาญและทักษะในการปฏิบัติงานด้านการระงับเหตุให้เกิดประสิทธิภาพ ซึ่งกระทรวงมหาดไทยได้สั่งการให้จังหวัดในแต่ละจังหวัดรวมทั้งกรุงเทพมหานคร จัดทำแผนการป้องกันและระงับอัคคีภัย รวมทั้งกำหนดการฝึกซ้อมแผนอย่างน้อยปีละ 1 ครั้ง
2.ด้านการระงับเหตุ สำนักป้องกันและบรรเทาสาธารณภัยเป็นหน่วยงานที่มีหน้าที่ในการดำเนินภารกิจดังกล่าว จึงได้จัดทำแผนเผชิญเหตุ โดยสนธิกำลังระหว่างหน่วยงานในสังกัดและหน่วยงานภายนอก เพื่อให้การเข้าทำการดับเพลิงเป็นไปอย่างมีประสิทธิภาพและรวดเร็ว รวมทั้งร่วมกับชุมชนต่าง ๆ ในการจัดทำแผนอพยพหนีไฟ นอกจากนี้ยังได้กำหนดมาตรการเพื่อป้องกันและบรรเทาภัยพิบัติของกรุงเทพมหานคร โดยการจัดตั้งศูนย์ป้องกันและควบคุมภัยพิบัติ โดยเป็นศูนย์ควบคุมสั่งการ ศูนย์ข้อมูลข่าวสารและประสานงานระหว่างหน่วยงานต่าง ๆ
3.ด้านฟื้นฟูและสงเคราะห์ โดยให้การสงเคราะห์ผู้ประสบภัยในพื้นที่กรุงเทพมหานคร 50 เขต โดยมอบถุงยังชีพ เครื่องอุปโภคบริโภค เงินค่าที่พักอาศัยชั่วคราวหรือค่าเช่าบ้าน เงินค่าวัสดุสมทบสร้างหรือซ่อมแซมบ้านเรือนที่พักอาศัย เงินทุนประกอบอาชีพ ค่าจัดการศพผู้เสียชีวิต ค่ารักษาพยาบาล เงินปลอบขวัญ ค่าครองชีพ เงินสมทบจัดซื้อสัตว์เลี้ยงหรือพืชพันธุ์ต่างๆ รวมทั้งให้คำแนะนำปรึกษาในการขอรับความช่วยเหลือจากหน่วยงานต่างๆ ที่เกี่ยวข้อง เช่น สำนักงานเขต กรมป้องกันและบรรเทาสาธารณภัย มูลนิธิราชประชานุเคราะห์ สภากาชาดไทย มูลนิธิป่อเต็กตึ๊ง มูลนิธิร่มกตัญญู ฯลฯ
4. Customize marketing - content partnership
HealthServ.net เปิดกว้างสำหรับธุรกิจ/องค์ ที่มีแนวคิด/แนวทางในการทำการตลาด ประชาสัมพันธ์ กิจกรรม ฯลฯ เปิดกว้างสำหรับรูปแบบการตลาดที่ต้องการ ที่จะตอบโจทย์ความต้องการของธุรกิจ/องค์กรของท่านได้ และเรายินดี เป็นพันธมิตรกับท่าน เพื่อประโยชน์สูงสุดต่อธุรกิจและกลุ่มเป้าหมายคาดหวัง - อีเมล์มาที่ healthserv.net@gmail.com หรือ โทร. 081-6969454 (คุณธนพรรณ Sale MKT)
สัปดาห์ที่ 30 (24-30 กรกฎาคม 2566)
ต่างชาติ 563,882 คน
เฉลี่ยวันละ 80,555 คน
นักท่องเที่ยวต่างชาติสะสม 15,322,175 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 638,161 ล้านบาท
5 ประเทศ แรก
จีน 90,851 คน
มาเลเซีย 75,064 คน
เกาหลีใต้ 40,716 คน
เวียดนาม 27,200 คน
อินเดีย 26,929 คน
*****
สัปดาห์ที่ 29 (17-23 กรกฎาคม 2566)
ต่างชาติ 566,611 คน
เฉลี่ยวันละ 80,945 คน
นักท่องเที่ยวต่างชาติสะสม 14,758,293 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 613,030 ล้านบาท
5 ประเทศ แรก
จีน 94,252 คน
มาเลเซีย 81,185 คน
เกาหลีใต้ 35,691 คน
เวียดนาม 28,714 คน
อินเดีย 28,601 คน
*****
สัปดาห์ที่ 28 (10-16 กรกฎาคม 2566)
ต่างชาติ 562,467 คน
เฉลี่ยวันละ 80,353 คน
นักท่องเที่ยวต่างชาติสะสม 14,151,990 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 587,828 ล้านบาท
5 ประเทศ แรก
จีน 94,691 คน
มาเลเซีย 76,165 คน
เกาหลีใต้ 30,932 คน
อินเดีย 30,074 คน
เวียดนาม 28,538 คน
*****
สัปดาห์ที่ 27 (3-9 กรกฎาคม 2566)
ต่างชาติ 555,644 คน
เฉลี่ยวันละ 79,378 คน
นักท่องเที่ยวต่างชาติสะสม 13,589,520 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 562,635 ล้านบาท
5 ประเทศ แรก
จีน 91,900 คน
มาเลเซีย 80,823 คน
อินเดีย 29,885 คน
เกาหลีใต้ 28,809 คน
เวียดนาม 27,074 คน
*****
สัปดาห์ที่ 26 (26 มิถุนายน - 2 กรกฎาคม 2566)
ต่างชาติ 569,064 คน
เฉลี่ยวันละ 81,295 คน
นักท่องเที่ยวต่างชาติสะสม 13,033,876 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 538,159 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 104,991 คน
จีน 82,561 คน
อินเดีย 33,908 คน
เกาหลีใต้ 28,926 คน
เวียดนาม 26,021 คน
*****
สัปดาห์ที่ 25 (19-25 มิถุนายน 2566)
ต่างชาติ 523,794 คน
เฉลี่ยวันละ 74,828 คน
นักท่องเที่ยวต่างชาติสะสม 12,464,812 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 514,237 ล้านบาท
5 ประเทศ แรก
จีน 85,065 คน
มาเลเซีย 67,082 คน
อินเดีย 36,653 คน
เกาหลีใต้ 28,857 คน
เวียดนาม 26,798 คน
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์ข้อมูลสุขภาพ
ผู้ช่วยศาสตราจารย์ นายสัตวแพทย์ ดร.พีรุทย์ เชียรวิชัย ประธานหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์ข้อมูลสุขภาพ วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน
“สาขาวิชาวิทยาศาสตร์ข้อมูลสุขภาพ พัฒนาการแพทย์ด้วย Data Science รองรับความต้องการนักวิทยาศาสตร์ข้อมูล เป็นสาขาใหม่และมีความสำคัญอย่างยิ่ง เพื่อตอบสนองต่อการขยายตัวอย่างรวดเร็วของข้อมูลทางด้านวิทยาศาสตร์สุขภาพ เป็นหลักสูตรที่เกิดจากความร่วมมือระหว่าง วิทยาลัยแพทยศาสตร์ศรีสวางควัฒน ราชวิทยาลัยจุฬาภรณ์ ร่วมกับ คณะวิศวกรรมศาสตร์ มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี (มจธ.) หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์ข้อมูลสุขภาพ เหมาะสำหรับนักเรียนที่มีความสนใจด้านวิทยาศาสตร์สุขภาพและมีความสามารถทางด้านการใช้คอมพิวเตอร์ เมื่อจบการศึกษาแล้วบัณฑิตของหลักสูตรจะมีส่วนช่วยในการบริหารจัดการ วิเคราะห์ฐานข้อมูลสุขภาพขนาดใหญ่ จากแหล่งต่างๆ และนำมาใช้ในการแก้ไขปัญหาทางการแพทย์และการสาธารณสุข เพื่อตอบโจทย์ของทั้งการรักษาและการวิจัยได้อย่างถูกต้อง รวดเร็ว ตลอดการเรียนในหลักสูตร 4 ปี มีทั้งภาคทฤษฎี คือ การเรียนรู้พื้นฐานที่จำเป็นทั้งในด้านวิทยาศาสตร์ข้อมูล (Data science) เช่นการเขียนโปรแกรม สถิติ และระบบฐานข้อมูล ร่วมกับวิทยาศาสตร์สุขภาพ (Health science) เช่นระบบสุขภาพ การวินิจฉัยและอณูชีววิทยา และจะได้เรียนรู้ผ่านการลงมือทำด้วยตัวเองในภาคปฏิบัติ รวมถึงฝึกงานกับสถานที่ประกอบการจริง นักศึกษาจะได้นำความรู้ทั้งสองด้านมาประยุกต์รวมกันให้เกิดเป็นความรู้ใหม่เพื่อนำไปประกอบวิชาชีพต่อไป ภายหลังจากจบหลักสูตรแล้วนักศึกษาสามารถศึกษาต่อได้ในสาขาวิศวกรรมข้อมูล วิทยาศาสตร์ข้อมูลและวิทยาศาสตร์ข้อมูลสุขภาพ ชีวสารสนเทศและชีววิทยาเชิงระบบระบาดวิทยา ซึ่งเป็นสาขาที่ได้รับความนิยมทั้งในและต่างประเทศ”
5 ประเภทสินเชื่อ ของธนาคารออมสิน
5 ประเภทสินเชื่อ ของธนาคารออมสิน ตามแผนงานความมั่นคงปลอดภัยทางการเงิน
รายละเอียดแต่ละโปรแกรมเดือนกรกฎาคม 2567
ขบวนภาคอีสาน 2565
ขบวนภาคอีสาน
เดือนมีนาคม 2565
- 1-2 มี.ค. ที่ว่าการอ.ปทุมราชวงศา จ.อำนาจเจริญ
- 3-4 มี.ค. โรงพยาบาลม่วงสามสิบ อ.ม่วงสามสิบ จ.อุบลราชธานี
- 7-9 มี.ค. โรงพยาบาลเขมราฐ อ.เขมราฐ จ.อุบลราชธานี
- 10-11, 14-15 มี.ค. หอประชุมที่ว่าการอ.สว่างวีระวงศ์ จ.อุบลราชธานี
- 16-18 มี.ค. หอประชุมที่ว่าการอ.น้ำยืน จ.อุบลราชธานี
- 21 มี.ค. ที่ว่าการอ.กันทรลักษ์ จ.ศรีสะเกษ
- 22 มี.ค. โรงเรียนขุนหาญวิทยาสรรค์ อ.ขุนหาญ จ.ศรีสะเกษ
- 23 มี.ค. ที่ว่าการอ.ภูสิงห์ จ.ศรีสะเกษ
- 24 มี.ค. โรงพยาบาลขุขันธ์ อ.ขุขันธ์ จ.ศรีสะเกษ
- 25 มี.ค. อบต.โพนเขวา อ.เมือง จ.ศรีสะเกษ
- 28 มี.ค. โรงเรียนสำโรงทาบวิทยาคม อ.สำโรงทาบ จ.สุรินทร์
- 29-30 มี.ค. หอประชุมที่ว่าการอ.ท่าตูม จ.สุรินทร์
- 31 มี.ค. ที่ว่าการอ.สังขะ จ.สุรินทร์
เดือนเมษายน 2565
- 1 เม.ย. หอประชุมที่ว่าการอ.พนมดงรัก จ.สุรินทร์
- 4-5 เม.ย. โรงเรียนสุรวิทยาคาร อ.เมือง จ.สุรินทร์
- 7 เม.ย. โดมสวนเฉลิมพระเกียรติ อ.สตึก จ.บุรีรัมย์
- 8 เม.ย. หอประชุมที่ว่าการอ.แคนดง จ.บุรีรัมย์
- 11 เม.ย. หอประชุมที่ว่าการอ.โนนดินแดง จ.บุรีรัมย์
- 12 เม.ย. หอประชุมที่ว่าการอ.ละหานทราย จ.บุรีรัมย์
- 18 เม.ย. หอประชุมที่ว่าการอ.บ้านกรวด จ.บุรีรัมย์
- 19 เม.ย. หอประชุมที่ว่าการอ.ประโคนชัย จ.บุรีรัมย์
- 20 เม.ย. โรงเรียนวัดอัมภาราม อ.เฉลิมพระเกียรติ จ.บุรีรัมย์
- 21-22 เม.ย. อ.เสาไห้ จ.สระบุรี
- 25-26 เม.ย. อ.เมือง จ.สระบุรี
- 27-28 เม.ย. อ.เฉลิมพระเกียรติ จ.สระบุรี
- 29 เม.ย. อ.หนองแซง จ.สระบุรี
* ข้อมูลจาก
เพจมูลนิธิกาญจนบารมี
ศูนย์ตรวจการได้ยิน
ศูนย์ตรวจการได้ยินและแก้ไขการได้ยิน ให้บริการ ทุกวันพฤหัสบดี ที่ 2 และ 4 ของเดือน ณ ห้องตรวจการได้ยิน ชั้น 4 โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี. โทร 02-4326167, 02-4326168
บริการตรวจสมรรถภาพการได้ยิน ตรวจประเมินการทำงานของหูชั้นกลาง และ บริการเครื่องช่วยฟัง รองรับสิทธิรักษา ได้แก่ สิทธิข้าราชการ สิทธิสวัสดิการรัฐวิสาหกิจ สิทธิชำระเงิน สิทธิบัตรทอง (ไม่รวมบริการเครื่องช่วยฟัง)
++ กิจกรรมในปีที่ผ่านมา ++
++ เขตดุสิต ++
โรงพยาบาลสัตว์ คลินิครักษาสัตว์ ในเขตดุสิต มีหลายแห่งดังนี้
Reference
1. WHO global report on trends in prevalence of tobacco use 2000–2030. Geneva: World Health Organization; 2024 (
Link).
2. Health Behaviour in School-aged Children (HBSC) study [website]. World Health
Organization; 2024 (
link).
3. Tobacco: e-cigarettes [website]. World Health Organization; 2024 (
link).
4. Pettigrew S, Santos JA, Pinho-Gomes A, Li Y, Jones A. Exposure to e-cigarette advertising and young people’s use of e-cigarettes: a four-country study. Tob. Induc. Dis. 2023;21:141. (
link).
5. Bach L. Flavored tobacco products attract kids. Washington (DC): Campaign for
Tobacco-Free Kids; 2023 (
link).
6. Flavors (including menthol) in tobacco products [issue brief]. New York: STOP; 2022 (
link).
7. Kyriakos CN, Zatoński MZ, Filippidis FT. Flavour capsule cigarette use and perceptions: a systematic review. Tob Control. 2023;32:e83-e94 (
link).
8. Results from the Annual National Youth Tobacco Survey. Silver Spring (MD): US Food
and Drug Administration; 2023 (
link).
9. Jongenelis MI. E-cigarette product preferences of Australian adolescent and adult users: a 2022 study. BMC Public Health. 2023;23(1):220. doi:10.1186/s12889-023-15142-8.
10. Nearly two thirds of youth would stop vaping with no added sweet flavors, menthol or cooling agents. The James. 10 July 2023. (
link)
11. Urgent action needed to protect children and prevent the uptake of e-cigarettes [news release]. World Health Organization; 14 December 2023 (
link).
12. Harris E. Most young adults who use e-cigarettes have never smoked. JAMA. 2023;330(21):2045. doi:10.1001/jama.2023.22357.
13. Tobacco industry ads generate billions of views and reach millions of kids on Instagram, Facebook, X and TikTok [news release]. Campaign for Tobacco-Free Kids; 8 December 2023 (
link).
14. Lin SY, Cheng X, Rossheim ME, Gress D, Cuellar AE, Cheskin L et al. Associations between use of specific social media sites and electronic cigarette use among college students. J Am Coll Health. 2023;71(7):2217-2224. doi:10.1080/07448481.2021.1965149.
15. Lights, camera, tobacco? Washington (DC): Truth Initiative; 2024 (
link).
16. Played: this year’s video games glamorize tobacco use to youth [news release]. Truth Initiative; 19 December 2017 (
link).
17. Loud and clear: Big Tobacco’s music sponsorship motives [blog]. In: STOP; 13 July2022 (
link).
18. Driving addiction: F1, Netflix and cigarette company advertising. New York: STOP; 2023 (
link).
19. Azad A. Juul went into a ninth-grade classroom and called its device ‘totally safe,’ teens testify. CNN; 25 July 2019 (
link).
20. CSR: education. Bath: Tobacco Tactics; 2021 (
link).
21. Battle of minds [website]. British American Tobacco; 2024 (
link).
22. Single sticks fact sheet. New York: STOP; 2023 (
link).
23. United Kingdom Department for Education. Disposable vape ban and what it means
for young people [blog]. In: Education Hub; 29 January 2024 (
link).
24. Pods [website]. Uber Technology Inc.; 2024 (
link).
25. Global tobacco surveillance system data (GTSSData) [database].
Atlanta (GA): Centers for Disease Control and Prevention; 2024 (
link).
26. Africa tobacco industry interference index 2023, second edition. Lomé: African Tobacco Control Alliance; 2023 (
link).
27. Fang J, Yang G, Wan X. ‘Pro-tobacco propaganda’: a case study of tobacco industrysponsored elementary schools in China. Tob Control. 2019;0:1-5. doi:10.1136/ tobaccocontrol-2018-054646.
28. China National Tobacco Corporation’s global expansion. New York: STOP; 2022 (
link).
29. Grant CA. The 2023 Carreras Scholarship categories and application process [website]. Scholarship Jamaica; 2023 (
link).
บริการด้าน Medical Wellness
บริการในกลุ่มเวลเนสทางการแพทย์มีความ หลากหลายไปตามความต้องการดูแลสุขภาพเฉพาะบุคคล (personalize wellness) อย่างไรก็ตาม โดยทั่วไปอาจ จัดแบ่งหมวดหมู่บริการเวลเนสตามลักษณะการให้บริการ ที่ต้องกระทำ โดยผู้ประกอบวิชาชีพทางการแพทย์ ออกได้ เป็น 2 กลุ่ม ดังนี้
ข้อมูลทางวิทยาศาสตร์
Part 3 : ศัลยกรรม... ความงามทันตา ความสวยทันใจ
ปศุสัตว์สมุทรปราการ จัดทำหมันหมาแมว ฟรี
สำนักงานปศุสัตว์จังหวัดสมุทรปราการ จัดงานโครงการคลินิกเกษตรเคลื่อนที่ฯ ในพระราชานุเคราะห์ สมเด็จพระบรมโอรสาธิราช สยามกุฏราชกุมาร โดยให้บริการทำหมันสุนัขแมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
- 12 มกราคม 2567 ณ สำนักงานปศุสัตว์สมุทรปราการ ถ.ปู่เจ้าสมิงพราย ต.สำโรงกลาง อ.พระประแดง สมุทรปราการ
- 12 มิถุนายน 2567 ณ วัดใหญ่ ต.ในคลองบางปลากด อ.พระสมุทรเจดีย์ สมุทรปราการ
- 18 กรกฎาคม 2567 ณ อาคารอเนกประสงค์ เทศบาลเมืองแพรกษา ต.แพรกษา อ.เมือง สมุทรปราการ
เงื่อนไขดังนี้
• จำกัดบ้านละไม่เกิน 2 ตัว • ทำหมันสุนัขอายุ 6 เดือนขึ้นไป ยกเว้น สุนัขพันธุ์หน้าสั้น หรือพันธุ์เล็ก • บริการทำหมันแมวเพศเมีย อายุ 5 เดือนขึ้นไป เพศผู้ อายุ 7 เดือนขึ้นไป • งดอาหารน้ำ 12 ชั่วโมง • สัตว์ต้องมีสุขภาพดี ไม่ป่วย • ลงทะเบียนรับคิวที่หน้างาน เริ่มลงทะเบียนตั้งแต่เวลา 8.30 - 11.30 น. สอบถามโทร 02-3847530
1.สินเชื่อเคหะแก่ข้าราชการและพนักงานรัฐวิสาหกิจ
คลีนิคสัตว์ราชวัตร เขตดุสิต
คลีนิคสัตว์ราชวัตร ตรวจรักษาสัตว์ป่วย ฉีดวัคซีน ผ่าตัดทำหมัน ตรวจเลือด อาบน้ำ ตัดขน ฯลฯ เปิดบริการเวลา 9.00-18.00 น. ที่อยู่ 955/9 ถ.นครไชยศรี นครไชยศรี ดุสิต Tel 091-0137641
Facebook |
@healthserv.net
*ภาพจากเพจคลีนิคสัตว์ราชวัตร 30. Betancourt A. ¿Cómo obtener boletas gratis para el Festival Estéreo Picnic 2023? [How to get free tickets to Estéreo Picnic 2023?]. Enter; 3 March 2023 (
link) (in Spanish).
31. Vital strategies. The next frontier in tobacco marketing: the Metaverse, NFTs, advergames and more. New York; 2023 (
link).
32. #SponsoredByBigTobacco. Tobacco & Nicotine Marketing on Social Media. Washington (DC): Campaign for Tobacco-Free Kids; n.d. (
link).
33. The many faces of modern addiction. New York: STOP; 2022 (
link).
34. Vital Strategies. Tobacco Marketing and Football: A Losing Game. New York, NY; 2023. Available from: termcommunity.com/TobaccoMarketingandFootballALosingGame.
35. GeekVape Indonesia. Naruto aja ngejar Aegis Solo 2, masa kamu ngga [Naruto just chased Aegis Solo 2, why don’t you] [post]. Facebook; 6 October 2021 (
link/) (in Indonesian).
36. An inherent contradiction: the tobacco industry’s environmental, social & governance
(ESG) activities. New York: STOP; 2022 (
link).
37. Unsustainable: Big Tobacco’s use of the UN SDGs. Bath: Tobacco Tactics; 2023 (
link).
38. Goodchild M, Nargis N, Tursan d’Espaignet E. Global economic cost of smokingattributable diseases. Tob Control. 2018;27:58-6 (
link).
39. Philip Morris International: its smoke-free rhetoric doesn’t reflect its behavior. In: Addiction at any cost: Philip Morris International uncovered. New York: STOP; n.d. (
link).
40. Vape law a win for public health, opens door to science-based innovation — PMFTC exec. Inquirer. 23 August 2023 (
link).
41. Shining the light on tobacco industry allies. New York: STOP; 2024 (
link).
42. Litigation relevant to regulation of novel and emerging nicotine and tobacco products: case summaries. Geneva: World Health Organization; 2021 (
link).
43. Pending litigation brought by multinational tobacco companies against governments. Washington (DC): Campaign for Tobacco-Free Kids; 2024 (
link).
44. Philip Morris joins challenge to EU ban on heated flavoured tobacco products. Irish Times. 22 March 2023 (
link).
45. Kramer E, Masduki RR, Maryani E, Nurhajati L, Redjeki AMS. How do national laws filter down to the local? Tobacco control regulations and smoke free areas in a decentralised Indonesia. J Curr Southeast Asian Aff. 2023;42(2):216-41 (
link).
46. Ciurcanu A, Cerantola A. ‘Smoke-free’ cities and islands — sponsored by Philip Morris. Organized Crime and Corruption Reporting Project; 5 May 2022 (
link).
47. Smoke-free destinations. Bath: Tobacco Tactics; 23 February 2022 (
link).
48. Industry brief: Eliminating Child Labour in Tobacco Growing (ECLT) Foundation. New York: STOP; 2019 (
link).
49. COP10 adopted historic decisions to protect the environment from the harms of tobacco and to address cross-border tobacco advertising, promotion and sponsorship and the depiction of tobacco in entertainment media [news release]. Geneva: WHO FCTC; 10 February 2024 (
link).
50. Misleadingly labeled e-liquids that appeal to youth. Silver Spring (MD): United States Food and Drug Administration; 2020 (
link).
51. Tenth session of the Conference of the Parties to the WHO FCTC (Panama City, Panama, 5–10 February 2024): global youth voices statement. Bangkok: Global Center for Good Governance in Tobacco Control; 2023 (
link).
52. Ojina E. Kenyan parents fight sale of Lyft, BAT’s new nicotine product. Nation Media Group; 26 August 2020 (Wednesday, August 26, 2020
link).
1) บริการเวลเนสเฉพาะบุคคล (Individual Consultations)
1) บริการเวลเนสเฉพาะบุคคล (Individual Consultations) ประกอบด้วยบริการดูแลให้คำปรึกษา รวมทั้งการปฏิบัติด้านสุขภาพเฉพาะบุคคล ดังนี้
- การฝังเข็ม
- อายุรเวท
- การดูแลจังหวะการเต้นของหัวใจเพื่อเสริม สร้างสรีรวิทยาทางอารมณ์ (Heartmath)
- การใช้สมุนไพรทางการแพทย์
- การดูแลสุขภาพแบบผสมผสาน
- ธรรมชาติบำบัด
- โภชนาการและการกินเพื่อสุขภาพ
- กายภาพบำบัด
- การจัดกระดูกเพื่อเสริมสร้างสมรรถนะของร่างกาย
- การให้คำ ปรึกษาด้านจิตวิทยาและการจัดการความเครียด
- การตรวจทางห้องปฏิบัติการเพื่อเสริมสร้างสมดุลของชีวเคมีในร่างกาย
- การนอนหลับอย่างเป็นสุข
- การปรับเปลี่ยนพฤติกรรมเสพติด
- เสริมความงามและการชะลอวัย เป็นต้น
1.คลินิกสัตวแพทย์ กทม.1 สี่พระยา เขตบางรัก
คลินิกสัตวแพทย์ 1 สี่พระยา
ถ.สี่พระยา ตรงข้ามวัดแก้วแจ่ม- ฟ้า เขตบางรัก
โทร. 02-2364055 กด 213
[
แผนที่]
street view |
Facebook |
Website
3.คลินิกสัตวแพทย์ กทม.3 วัดธาตุทอง เขตวัฒนา
คลินิกสัตวแพทย์ 3 วัดธาตุทอง
โทร. 02-3916082 โทร. 02-3929277 , 02-3929278 กด 118
4.คลินิกสัตวแพทย์ กทม.4 บางเขน เขตจตุจักร
คลินิกสัตวแพทย์ 4 บางเขน
ถ.พหลโยธิน แขวงลาดยาว เขตจตุจักร
โทร. 02-5791342 กด 15
[
แผนที่]
street view |
Facebook |
Website
5.คลินิกสัตวแพทย์ กทม.5 วัดหงส์รัตนาราม เขตบางกอกใหญ่
คลินิกสัตวแพทย์ 5 วัดหงส์รัตนาราม
ถ.อิสรภาพ แขวงวัดอรุณ เขตบางกอกใหญ่
โทร. 02-4725896 กด 109
[
แผนที่]
street view |
Facebook |
Website
7.คลินิกสัตวแพทย์ กทม.7 บางกอกน้อย เขตบางกอกน้อย
คลินิกสัตวแพทย์ 7 บางกอกน้อย
อาคารคลินิกสัตวแพทย์กรุงเทพมหานคร 7 บางกอกน้อย
527/78 ถ.จรัญสนิทวงศ์ เขตบางกอกน้อย
โทร. 02-4112432
[
แผนที่]
street view
8.คลินิกสัตว์แพทย์ กทม.8 ดินแดง กลุ่มควบคุมโรคพิษสุนัขบ้า ถ.มิตรไมตรี เขตดินแดง
คลินิกสัตว์แพทย์ 8 ดินแดง
กลุ่มควบคุมโรคพิษสุนัขบ้า ดินแดง
ถนนมิตรไมตรี เขตดินแดง
โทร. 02-2453311 , 02-2487417
[
แผนที่]
street view |
Facebookซีจีเอช ลำลูกกา ซีจีเอช สายไหม รับสมัครงาน
ซีจีเอช ลำลูกกา
พนักงานนิติการ
พนักงานขับรถ
พนักงานรับส่งเอกสาร ด่วน!!!
พนักงานธุรการ (คนพิการ)
ข้อมูลสมัครงานติดต่อ
โทร: 02 991 8999 ต่อ 1239
ซีจีเอช สายไหม
โทร: 02 991 8999 ต่อ 1239
พนักงานประสานงานลูกค้าองค์กร (การตลาด)
พนักงานธุรการ (คนพิการ) (ปฎิบัคิงานที่ โรงพยาบาล CGH ลำลูกกา)
ช่างซ่อมบำรุง
SYSTEM ENGINEER
พนักงานธุรการ
2. สินเชื่อสวัสดิการสำหรับข้าราชการและพนักงานรัฐวิสาหกิจ
2) บริการเวลเนสแบบกลุ่ม (Group Consultations)
2) บริการเวลเนสแบบกลุ่ม (Group Consultations) ประกอบด้วยบริการดูแลให้คำปรึกษารวมทั้งการปฏิบัติด้าน สุขภาพโดยผู้ประกอบวิชาชีพทางการแพทย์ ในกลุ่มบุคคลที่มี เป้าหมายหรือความประสงค์ที่จะปรับปรุง ปรับเปลี่ยนหรือแก้ไข ปัญหาสุขภาพแบบเดียวกัน ได้แก่
- การทำสมาธิแบบกลุ่ม
- การส่งเสริมสุขภาพผู้สูงอายุ
- การรับประทานอาหารอย่างมีสติ
- การอยู่อย่างเป็นสุขร่วมกับโรคเบาหวาน
- ชี่กง
- เวชศาสตร์วิถีชีวิต
- ห้องเรียนเลิกบุหรี่
- โยคะ
- กิจกรรมบำบัด
- การฝึกจิตใจเพื่อก้าวผ่านความสูญเสีย (Moving Through Grief) เป็นต้น
3. สินเชื่อ Salary Pay เพื่อบุคลากรภาครัฐ
4.สินเชื่อสวัสดิการสำหรับข้าราชการบำนาญและลูกจ้างประจำโดยใช้บำเหน็จตกทอดเป็นหลักประกัน
จองคิวทำหมัน สุนัข - แมว ศบส.46 กันตารัติอุทิศ
ศูนย์บริการสาธารณสุข (ศบส.) 46 กันตารัติอุทิศ ร่วมกับกลุ่มควบคุมและพักพิงสุนัข ประเวศ เชิญชวนประชาชนนำสัตว์เลี้ยงมารับบริการ ฟรี
- ทำหมันสุนัขแมว
- ฝังไมโครชิพ (ในสุนัข)
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
ตารางบริการ และติดต่อจองคิว
ทุกวันพุธ สัปดาห์ที่ 1 และ 3 ของเดือน ณ ศูนย์สาขาลำปลาทิว - ซอยวัดทิพพาวาส
ทุกวันพุธ สัปดาห์ที่ 2 และ 4 ของเดือน
ณ ศูนย์บริการสาธารณสุข 46 กันตารัติอุทิศ [แผนที่ - เพจ]
คำแนะนำ
- เอกสารที่ต้องเตรียมสำหรับเจ้าของสัตว์เลี้ยง คือ สำเนาบัตรประชาชน สำเนาทะเบียนบ้าน อย่างละ 1 ฉบับ เพื่อนำมาลงทะเบียนในวันรับบริการ
- นำมารับบริการได้ตามวัน/เวลาที่ได้คิว ตั้งแต่ 8.30 น. เป็นต้นไป
- สัตว์ที่จะนำมารับบริการ ต้องงดน้ำ/งดอาหาร อย่างน้อย 6-12 ชั่วโมง
- จับขังกรงไว้
- สัตว์จะต้องมีอายุ 6 เดือนขึ้นไป ไม่ป่วย ไม่ให้นมลูก
สอบถามเพิ่มเติม โทร. 02-329-0320 ต่อ 21 หรือ 098-273-2446 (ในวัน-เวลาราชการ)
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตวัฒนา
UCEP เจ็บป่วยฉุกเฉินวิกฤต มีสิทธิทุกที่ โทร 1669
Our Facility 6th Floor (Operation / Laboratory)
Reception Area
Warm welcoming environment
Sperm Collection Room
Built-in toilet from your conveniences.
Recovery Area
4 beds and 1 private room for recovery after operation, closely monitored by nurse, separated toilet inside recovery area.
Laboratory
Oocyte & Embryo Lab
Controlled environment by Clean room class 10,000, Air pressure and temporary controlled by powerful air filtration system.
Sperm Lab
For sperm analysis and sperm preparation procedure.
ภาคบริการโลหิตแห่งชาติที่ 6 จังหวัดขอนแก่น LINK
10-13 ธันวาคม นี้ กาชาดชวนบริจาคโลหิตสำรอง ช่วงวันหยุดยาว เนื่องจากโรงพยาบาลมีการเบิกใช้โลหิต จำนวนมาก
@ขอนแก่น บริจาคได้ที่ :
- ภาคบริการโลหิตแห่งชาติที่ 6 จังหวัดขอนแก่น ต.สำราญ
- ห้องรับบริจาคโลหิตสภากาชาดไทย ชั้น 2 โรงแรมโฆษะ
@หน่วยรับบริจาคโลหิตเคลื่อนที่
- งานไหมขอนแก่น 10 ธ.ค.63 เวลา 16.30-20.30 น.
- คริสตจักรชีวิตสุขสันต์ขอนแก่น 13 ธ.ค.63 เวลา 12.30-16.00 น.
โทร. 06 3474 0844, 0 4342 4630-1
1. Download ThailandPlus App
Visitors download ThailandPlus and install on their mobile phone before
the departure to Thailand. Check availability now these store
13 มีนาคม 64 ประกาศด่วน จาก นนทบุรี กรณีคลัสเตอร์บางแค
สกลนคร เสริมสิริมงคลยุค New Normal กับงานมหาสงกรานต์ สรงน้ำพระธาตุเชิงชุม และหลวงพ่อพระองค์แสน
สกลนคร เสริมสิริมงคลยุค New Normal กับงานมหาสงกรานต์ สรงน้ำพระธาตุเชิงชุม และหลวงพ่อพระองค์แสน พระธาตุคู่บ้านคู่เมืองของชาวจังหวัดสกลนคร และกิจกรรมลอดอุโมงค์บุญ ซึ่งนักท่องเที่ยวจะได้ประพรมน้ำมนต์จากการลอดอุโมงค์บุญเมื่อเดินทางมาถึงสกลนคร ระหว่างวันที่ 13-15 เมษายน 2564 ณ วัดพระธาตุเชิงชุมวรวิหาร เขตเทศบาลเมืองสกลนครรายงานวัคซีนประเทศสวิตเซอร์แลนด์ LINK
รายงานตัวเลขการบริหารจัดการวัคซีนของประเทศสวิตเซอร์แลนด์
- จำนวนวัคซีนที่ได้รับ 3,908,500 โดส
- วัคซีนที่ได้บริหารจัดการ 3,689,909 โดส (การกระจายไปยังรัฐ/จุดฉีดต่างๆ)
- จำนวนผู้ที่ไดรับวัคซีนแล้ว 1,242,631 ราย
รายละเอียดทั้งหมด
คลิกที่นี่คำแนะนำสำหรับผู้ป่วยกลุ่มเสี่ยง 7 โรค ผู้สูงอายุ และประชาชน LINK
คำแนะนำการรับวัคซีนป้องกันโควิด-19 สำหรับผู้ป่วยกลุ่มเสี่ยง 7 โรค ผู้สูงอายุ และประชาชนทั่วไป โดยมีข้อควรระวัง ตามแต่ละกลุ่มโรค ดังนี้
- สำหรับผู้ที่มีประวัติแพ้ยา ความดันโลหิตสูง 160 มม.ปรอท
- ไม่ควรมีไข้ 37.5 องศา ขึ้นไป
คำแนะนำสำหรับแต่ละกลุ่มโรค มีดังนี้
1. กลุ่มโรคมะเร็ง
ผู้ป่วยมะเร็งทุกชนิดสามารถรับวัคซีนโควิด-19 ได้
- ผู้ป่วยรักษาโดยการปลูกถ่ายเซลล์เม็ดเลือด ให้เว้นระยะการให้วัคซีนโควิด-19 อย่างน้อย 3 เดือน
- ผู้ป่วยที่ได้รับการผ่าตัด ให้วัคซีนห่างจากวันผ่าตัดอย่างน้อย 3 วัน
2. กลุ่มโรคหัวใจและหลอดเลือด
ผู้ป่วยโรคหัวใจและหลอดเลือดสามารถรับวัคซีนโควิด-19 ได้
- กรณีผู้ป่วยมีอาการหัวใจกำเริบเฉียบพลันที่อาการยังไม่คงที่ และอาจเป็นอันตรายถึงแก่ชีวิต ให้รอจนกว่าอาการดีขึ้นและคงที่
- กรณีผู้ป่วยมีความดันโลหิตสูงชนิดรุนแรง SEP> 160 mmHg ควรควบคุมความดันโลหิตให้ดีก่อนรับวัคซีน
- หากรับประทานยาละลายลิ่มเลือดควรแจ้งเจ้าหน้าที่ เพื่อพิจารณาเพิ่มความระมัดระวัง
3.กลุ่มโรคทางเดินหายใจเรื้อรัง (โรคปอดอุดกั้น โรคหอบหืดที่ควบคุมได้ไม่ดี)
ผู้ป่วยโรคทางเดินหายใจเรื้อรังสามารถรับวัคซีนโควิด-19 ได้
ฉีดหลังอาการกำเริบ 2-4 สัปดาห์
4.กลุ่มโรคไตเรื้อรัง
ผู้ป่วยไตวายเรื้อรัง รวมทั้งผู้ที่ได้รับการฟอกเลือด ล้างไตทางช่องท้อง หรือปลูกถ่ายไต สามารถรับวัคซีนโควิด-19 ได้
ในกรณีกินยากดภูมิกันขนาดสูง ให้ปรึกษาแพทย์ที่ดูแลก่อน
5. กลุ่มโรคระบบประสาท (โรคหลอดเลือดแดง โรคลมชัก โรคภูมิคุ้มกันระบบประสาท)
ผู้ป่วยโรคระบบประสาท สามารถรับวัคซีนโควิด-19 ได้
- ผู้ป่วยต้องมีอาการทางระบบประสาทคงที่ หรือไม่อยู่ในภาวะอันตรายต่อชีวิตอย่างน้อย 4 สัปดาห์
- ในกรณีที่ใช้ยาต้านการแข็งตัวของเลือดหรือยากดภูมิคุ้มกัน ให้ปรึกษาแพทย์ก่อนการรับวัคซีน
6.กลุ่มโรคเบาหวานและโรคอ้วน
ผู้ป่วยโรคเบาหวานที่ควบคุมได้ และโรคอ้วน สามารถรับวัคซีนโควิด-19 ได้
ผู้ป่วยโรคเบาหวานที่ขาดยาหรือควบคุมระดับน้ำตาลได้ไม่ดี และผู้ป่วยเบาหวานชนิดที่ 1 ที่ต้องฉีดอินซูลิน ให้บรึกษาแพทย์ก่อนรับวัคซีน
7.กลุ่มผู้สูงอายุ
ผู้สูงอายุ 60 ปีขึ้นไป ถ้าไม่มีข้อห้ามและข้อพึงระวัง สามารถรับวัคซีนโควิด-19 ของแอสตร้าเซนเนก้าได้
8. ประชาชนทั่วไป
ถ้าไม่มีข้อห้ามและข้อพึงระวัง สามารถรับวัคซีนโควิด-19 ได้
อบต.อุตรดิตถ์ เปิดแคมเปญ "คนอุตรดิตถ์ไม่ทิ้งกัน" รับกลับมารักษา ในกรณีที่ได้รับความเดือนร้อนและจำเป็นเท่านั้น LINK
อบต.อุตรดิตถ์ เปิดแคมเปญ "คนอุตรดิตถ์ไม่ทิ้งกัน" รับกลับมารักษา ในกรณีที่ได้รับความเดือนร้อนและจำเป็นเท่านั้น
สำหรับผู้สงสัยติดเชื้อและผู้ป่วยที่ต้องการกลับมารักษาตัวในอุตรดิตถ์ จะมีระยะรอคอย ไม่น้อยกว่า 24 ชั่วโมง
การเดินทาง มี 2 วิธี
1. รถยนต์ของอบจ.
2.เดินทางกลับมาเอง
ทั้งสองวิธี มีขั้นตอนที่ต้องปฏิบัติแนวทางเดียวกันดังนี้
1.ต้องลงทะเบียนซักประวัติ
2.ตรวจหาเชื้อ ATK/Rapid
- หากผลเป็นลบ ไม่ติดเชื้อ จะส่งต่อเพื่อกักตัวตามภูมิลำเนา 14 วัน
- หากผลตรวจเป็นบวก ติดเชื้อ จะส่งตรวจ RT-PCR อีกครั้ง หากผลเป็นบวก จะส่งศูนย์พักคอย ประเมินอาการ และขึ้นทะเบียนผู้ป่วย หากอาการรุนแรง จะเข้ารักษาในรพ.
ติดต่อสาธารณสุขอุตรดิตถ์ 06 1270 5588
สายด่วน 095-3092692, 095-6155939
อบจ.กระบี่ นัดฉีด 19 พ.ย.จำนวน 1260 ราย LINK
17 พ.ย.64 อบจ.กระบี่ ประกาศนัดหมายการฉีดวัคซีน Moderna เฉพาะเขตอำเภอเมืองกระบี่ ท่านที่ลงทะเบียนฉีด ณ โรงพยาบาลกระบี่ นัดฉีดวันที่ 19 พฤศจิกายน 2564 เวลา 11.00-14.00 น. ณ จุดฉีดวัคซีนโรงพยาบาลกระบี่ **สำหรับท่านที่ลงทะเบียนอำเภออื่นๆ อยู่ระหว่างการพิจารณากำหนดวันฉีด** ติดตามข่าวสารได้ที่หน้า เพจองค์การบริหารส่วนจังหวัดกระบี่ สอบถามเพิ่มเติม 075-600297
.....
10 พ.ย.64 อบจ.กระบี่
ประกาศรายชื่อผู้ที่ผ่านการพิจารณารับวัคซีน กำหนดจะได้รับวัคซีน ในวันที่ 17 พ.ย. จำนวน 2,520 โดส = 1,260 คน (สำหรับ 2 เข็ม/คน) เมื่อวัคซีนมาถึง ณ สถานที่จัดเก็บคือโรงพยาบาลกระบี่ และโรงพยาบาลชุมชนแต่ละแห่งตามที่ลงทะเบียนไว้ จะทำการนัดหมายวันฉีดให้ทราบอีกครั้ง ผ่านระบบหมอพร้อมและหน้าเฟส
อบจ.กระบี่
สอบถามเพิ่มเติมได้ที่ Line @ https://page.line.me/905aixzt หรือ 075-600297
....
อบจ.กระบี่ เปิดให้ตรวจสอบรายชื่อผู้ลงทะเบียนฉีดวัคซีน Moderna ที่ลงทะเบียนรอบวันที่ 23-26 กันยายน และ 1-5 ตุลาคม 2564
หมายเหตุ การแจ้งรายชื่อครั้งนี้ อบจ. แจ้งรายชื่อผู้ที่มีคุณสมบัติตามเงื่อนไข 5 กลุ่ม เพื่อส่งไปยังสภากาชาดไทยตรวจสอบว่าเป็นผู้ไม่เคยได้รับวัคซีนมาก่อน ส่วนรายชื่อจริง จะรอยืนยันจากสภากาชาดไทยอีกครั้ง
ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ.2563 สาขาการแพทย์
ศาสตราจารย์ ดร. นายแพทย์ วาเลนติน ฟัสเตอร์ (Valentin Fuster, M.D., Ph.D.)
ศาสตราจารย์ ดร. นายแพทย์ วาเลนติน ฟัสเตอร์ (Valentin Fuster, M.D., Ph.D.)
ผู้อำนวยการศูนย์โรคหัวใจ และนายแพทย์ใหญ่โรงพยาบาลเม้าท์ไซนาย นครนิวยอร์ค สหรัฐอเมริกา
ผู้อำนวยการศูนย์วิจัยโรคหัวใจและหลอดเลือดแห่งชาติ กรุงมาดริด ประเทศสเปน
หัวหน้ากองบรรณาธิการ วารสารวิทยาลัยโรคหัวใจแห่งอเมริกา
สหรัฐอเมริกา
3) การมีวัฒนธรรมที่โดดเด่น (Unique Culture)
การมีวัฒนธรรมที่โดดเด่น (Unique Culture) ที่ถ่ายทอดและปฏิบัติสืบต่อกันมาเข้าสู่ปีที่ 42 อันเป็น Rich Heritage อันทรงคุณค่าของบำรุงราษฎร์ ได้แก่
1. Agility ความสามารถในการปรับตัวให้ทันต่อสถานการณ์อย่างรวดเร็ว
2. Un-complacency คือ การที่ไม่หยุดอยู่กับความพึงพอใจที่เกิดขึ้น ทุกคนมีความม่งมั่นในการพัฒนาพัฒนาผลงานให้ดีขึ้นได้เรื่อยๆ และตั้งใจทำให้ดีกว่าผลงานครั้งที่ผ่านมา ซึ่งจะเห็นได้จากการนำเทคโนโลยีใหม่ ๆ เข้ามาช่วยเสริมประสิทธิภาพในการรักษา (adaptive to technology) และการ reaccreditation เรื่องของคุณภาพมาตรฐานความปลอดภัยตลอดเวลา เพื่อประโยชน์สูงสุดของผู้มาใช้บริการ และ
3. Compassionate Caring เป็นการส่งมอบการบริบาลด้วยความเอื้ออาทร ดูแลผู้ป่วยและบุคลากรทุกคนเสมือนญาติมิตร
บทที่ 3 แผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19)
แผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic
Approach to COVID-19) เป็นกรอบแนวทางการดําเนินงานเพื่อให้ประชาชนเกิดความเชื่อมั่นและสร้างความสมดุลทางสุขภาพ สังคม และเศรษฐกิจของประเทศ โดยการจะดําเนินการให้สําเร็จลุล่วงได้นั้น ต้องอาศัยความร่วมมือจากทุกภาคส่วน รวมทั้งต้องมีการควบคุม กํากับ มาตรการอย่างมีประสิทธิภาพ
3.1 เป้าหมาย
การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น มีเป้าหมายในการดําเนินงานที่สําคัญ 2 ประการ หรือเรียกว่า 2U ได้แก่ Universal Prevention คือ การป้องกันตนเองแบบครอบจักรวาล และ Universal Vaccination คือ การฉีดวัคซีนป้องกันโรคโควิด 19 ในทุกกลุ่ม โดยเฉพาะกลุ่มผู้สูงวัย และกลุ่ม โรคเรื้อรัง ให้ได้รับวัคซีนครบตามเกณฑ์ และได้รับเข็มกระตุ้นตามระยะเวลาที่กําหนด แผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) มีเป้าหมาย ดังนี้
3.1.1 การเข้าถึงการดูแลรักษาได้อย่างรวดเร็ว มีคุณภาพ อัตราป่วยตาย ไม่เกิน ร้อยละ 0.1
3.1.2 ความครอบคลุมวัคซีนเข็มกระตุ้น ≥ ร้อยละ 60
3.1.3 สร้างความรู้ ความเข้าใจที่ถูกต้องและความร่วมมือของประชาชน ในการรับมือ และปรับตัวเพื่ออยู่ร่วมกับโควิด 19 จาก Pandemic สู่ Endemic อย่างปลอดภัย
3.2 ระยะดําเนินการ
ระยะดําเนินการ แบ่งเป็น 4 ระยะ ได้แก่
3.2.1 ระยะ Combatting (12 มีนาคม – ต้น เมษายน 2565) เป็นระยะต่อสู้ เพื่อลดการระบาด ลดความรุนแรงลง จะมีมาตรการต่างๆ ออกไป การดําเนินการให้กักตัวลดลง
3.2.2 ระยะ Plateau (เมษายน – พฤษภาคม 2565) เป็นการคงระดับผู้ติดเชื้อไม่ให้สูงขึ้น ให้เป็นระนาบจนลดลงเรื่อย ๆ
3.2.3 ระยะ Declining (ปลาย พฤษภาคม – 30 มิถุนายน 2565) เป็นการลดจํานวนผู้ติดเชื้อลงให้เหลือ 1,000-2,000 คน
3.2.4 ระยะ Post-pandemic 1 กรกฎาคม 2565 เป็นต้นไป คือ ออกจากโรคระบาด เข้าสู่โรค
ประจําถิ่น
3.3 ยุทธศาสตร์
3.3.1 ยุทธศาสตร์การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านสาธารณสุข
3.3.2 ยุทธศาสตร์การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านการแพทย์
3.3.3 ยุทธศาสตร์การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านกฎหมายและสังคม
3.3.4 ยุทธศาสตร์การบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านการสื่อสารและประชาสัมพันธ์
ภาพที่ 7 แสดงระยะดําเนินการแผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19)
โดยมีรายละเอียด แผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ดังนี้
EP. 3.1 สิทธิการได้รับแจ้ง Right to be Informed - มาตรา 23 LINK
•
เจ้าของข้อมูลส่วนบุคคลมีสิทธิได้รับแจ้งรายละเอียดอะไรบ้าง?
และหากผู้ควบคุมข้อมูลส่วนบุคคลไม่ดำเนินการจะมีผลอย่างไร?
•
หลักสำคัญของสิทธินี้คือ เป็นสิทธิที่เจ้าของข้อมูลส่วนบุคคล ทุกคน ได้รับโดยไม่ต้องมีการร้องขอ
•
ตามกฎหมายแล้วผู้ควบคุมข้อมูลส่วนบุคคล จะต้อง แจ้งวัตถุประสงค์และรายละเอียดของการประมวลผลข้อมูลส่วนบุคคล
ให้เจ้าของข้อมูลส่วนบุคคลทราบ ไม่ว่าจะด้วยวิธีการใดก็ตาม
เพื่อให้เจ้าของข้อมูลส่วนบุคคลรู้ว่าข้อมูลของตนจะถูกนำไปใช้ทำอะไร?
*การประมวลผล หมายถึง การเก็บรวบรวม ใช้หรือเปิดเผยข้อมูลส่วนบุคคลส่วนบุคคล
•
รายละเอียดการแจ้งให้ทราบ ต้องมีอย่างน้อย
- เก็บข้อมูลอะไรบ้าง
- เก็บไปทำไม
- เก็บนานแค่ไหน
- ส่งต่อข้อมูลให้ใคร
- ช่องทางติดต่อผู้ควบคุมข้อมูล
•
* หากเก็บรวบรวมข้อมูลจากแหล่งอื่นก็ต้องแจ้งเจ้าของข้อมูลทราบด้วย (มาตรา 25)
•
*กรณีมีการแก้ไขวัตถุประสงค์ในภายหลัง
จะต้องแจ้งให้ทราบหากวัตถุประสงค์ที่แก้ไขนั้นมีความแตกต่างไปจากวัตถุประสงค์เดิม
•
หากผู้ควบคุมข้อมูลส่วนบุคคลไม่ปฏิบัติตามกฎหมายแจ้งรายละเอียดให้เจ้าของข้อมูลทราบ
ถือเป็นความผิดตามพระราชบัญญัติฉบับนี้ โดยมีบทลงโทษเป็นโทษปรับทางปกครองไม่เกิน 1,000,000 บาท
(มาตรา 82)
•
ติดตามรายละเอียดของสิทธิได้ในครั้งต่อไป
เพื่อความเข้าใจในเรื่องสิทธิและเตรียมพร้อมในการปฏิบัติตามข้อกำหนดของ่กฎหมาย
ได้อย่างถูกต้อง
วัณโรคกระดูกสันหลัง (Pott Disease)
วัณโรคกระดูกสันหลัง (Pott Disease) เป็นการติดเชื้อวัณโรคที่บริเวณกระดูกสันหลัง ทำให้เกิดภาวะแทรกซ้อนทางระบบประสาท หากเกิดในเด็กจะเกิดปัญหาเกี่ยวกับการเจริญเติบโตของกระดูกสันหลัง ทำให้หลังโก่ง พบในผู้ชายมากกว่าผู้หญิง
ไม่ออกกำลังกายร่างกายยิ่งเสื่อม
เช่นเดียวกับ ผศ.ดร.นพ. ประวีร์ สิริเธียรทรรศน์ ผู้อำนวยการคลินิกสร้างเสริม และฟื้นฟูระบบกล้ามเนื้อและกระดูก “บีดีเอ็มเอส เวลเนส คลินิก” กล่าวว่า เมื่อเราอายุมากขึ้นมีการเคลื่อนไหวน้อยลง นอกจากร่างกายจะสูญเสียมวลกล้ามเนื้อ รวมถึงความแข็งแรงและความยืดหยุ่นของกล้ามเนื้อ ยังเกิดการสะสมของไขมันตามส่วนต่างๆ ของร่างกาย
ภาวะที่ร่างกายมีไขมันมากเกินไปร่วมกับมีมวลกล้ามเนื้อและความแข็งแกร่งของกล้ามเนื้อน้อย เรียกว่า ‘Sarcopenic Obesity’ เป็นปัญหาที่พบมากในผู้สูงอายุ ส่งผลให้รู้สึกอ่อนแรง เคลื่อนไหวร่างกายลำบาก เสี่ยงต่อการหกล้มมากกว่า 3 เท่า เมื่อเทียบกับกลุ่มที่มีมวลกล้ามเนื้อปกติ
ปัจจัยที่ทำให้เกิดภาวะ Sarcopenic Obesity
คือ
1. ภาวะโภชนาการไม่เหมาะสม ผู้สูงอายุส่วนใหญ่มักรับประทานโปรตีนไม่เพียงพอ จากภาวะเบื่ออาหารหรือปัญหาเกี่ยวกับเหงือกและฟัน ผู้สูงอายุที่ไม่มีโรคไตเรื้อรัง ควรบริโภคโปรตีนประมาณ 1-1.2 กรัมต่อน้ำหนักตัวหนึ่งกิโลกรัมต่อวัน จากแหล่งโปรตีนที่ย่อยง่าย เช่น เนื้อปลา เต้าหู้ ธัญพืช และถั่วต่าง ๆ
2. ขาดการออกกำลังกาย ผู้สูงอายุควรออกกำลังกายแบบบริหารหัวใจง่ายๆ เช่น การเดินเร็ว แกว่งแขน ย่ำเท้าอยู่กับที่ เพื่อให้ร่างกายเกิดการใช้ไขมันส่วนเกิน และออกกำลังกายแบบใช้แรงต้าน เช่น ยกน้ำหนักเบาๆ เพื่อเสริมสร้างกล้ามเนื้อให้แข็งแรง
เส้นทางสู่ The Best Local Chef Contest 2022
เส้นทางสู่ The Best Local Chef Contest 2022
กรมการท่องเที่ยว จัดกิจกรรมส่งเสริมศักยภาพชุมชน โฮมสเตย์ เพื่อพัฒนาองค์ความรู้ให้แก่ชุมชนท่องเที่ยวที่มีความสนใจในการพัฒนาเมนูอาหารสุขภาพ ภายใต้แนวคิด "อาหารถิ่น กินปลอดภัย ห่างไกล NCDs" (Yummy & Healthy Dish) ด้วยการสร้างเสริมความรู้การประกอบอาหารสุขภาพให้กับชุมชนท่องเที่ยว ให้ใส่ใจถึงความปลอดภัยและสุขภาพของนักท่องเที่ยว โดยเฉพาะโรคในกลุ่ม NCDs ที่เป็นภัยใกล้ตัวอย่างยิ่ง จะช่วยสร้างภาพลักษณ์และความเชื่อมั่นให้กลุ่มนักท่องเที่ยว และเป็นการผลักดันชุมชนท่องเที่ยว ในการเตรียมความพร้อมเพื่อรองรับการเติบโตด้านการท่องเที่ยวเชิงสุขภาพและการเติบโตของตลาดอาหารสุขภาพในอนาคต
เส้นทางสู่การเป็น The Best Local Chef Contest 2022 กรมการท่องเที่ยวกำหนดแผนสำหรับชุมชนที่เข้าร่วมการอบรม 4 ก้าว ได้แก่
ก้าวที่ 1 เข้าร่วมอบรมการพัฒนาเมนูอาหารสร้างสรรค์เพื่อสุขภาพเฉพาะกลุ่ม (ผ่าน Zoom) 18-19 พ.ค.65
ก้าวที่ 2 ชุมชนที่สนใจสมัครเข้าร่วมรับการคัดเลือก โดยนำเสนอเมนูอาหารสร้างสรรค์ เป็นอาหารคาว 1 เมนู เครื่องดื่ม 1 เมนู ภายใต้แนวคิด "อาหารถิ่น กินปลอดภัย ห่างไกล NCDs (Yummy & Healthy Dish)" เพื่อคัดเหลือ 10 ชุมชน
ก้าวที่ 3 อบรมเชิงปฏิบัติการร่วมกับเชฟที่มีชื่อเสียงให้กับชุมชนที่ผ่านการคัดเลือก 10 ชุมชน
ก้าวที่ 4 การแข่งขัน The Best Local Chef Contest 2022 เพื่อค้นหาสุดยอดเมนูอาหารสร้างสรรค์ เพื่อสุขภาพเฉพาะกลุ่ม ภายใต้แนวคิด "อาหารถิ่น กินปลอดภัย ห่างไกล NCDs (Yummy & Healthy Dish)"
หัวข้อเสวนา : กินอย่างไร ให้ห่างไกล NCDs
หัวข้อบรรยาย : สร้างมูลค่าเพิ่มให้สินค้า บริการ ด้วยแนวคิดเศรษฐกิจสร้างสรรค์ เจาะลึกโภชนาการ กินปลอดภัย ห่างไกล NCDs
ไอเดียสร้างเมนูสุขภาพ ด้วยวัตถุดิบท้องถิ่น
เทคนิคการปรุงอาหารให้อร่อยง่าย ดีต่อสุขภาพ
เคล็ดไม่ลับการออกแบบอาหารและจัดจานสุขภาพ อย่างสร้างสรรค์
บริการการแพทย์ ภูมิปัญญาไทย กรมแพทย์แผนไทย จัดสินค้ามาโชว์เต็มๆ เช่นกัน
กรมแพทย์แผนไทย อีกหนึ่งหน่วยงานหลักของการชูกัญชาทางการแพทย์แผนไทย จนเป็นที่ยอมรับในปัจจุบัน ในงานได้จัดผลิตภัณฑ์กัญชา เวชภัณฑ์กัญชา มาแสดงแบบเต็มๆ พร้อมกับจัดทีมแพทย์ให้คำปรึกษาและจ่ายยาให้ในงานด้วย
NAH Smart Health รพ.ค่ายสมเด็จพระนเรศวรมหาราช LINK
NAH Smart Health รพ.ค่ายสมเด็จพระนเรศวรมหาราช แอพลิเคชั่นเพื่อความสุขของผู้รับบริการโรงพยาบาลค่ายสมเด็จพระนเรศวรมหาราช คุณสามารถดาวน์โหลด Application NAH Smart Health ได้แล้ววันนี้ ทั้งระบบปฏิบัติการ
Android และระบบปฏิบัติการ
iOS พร้อมเปิดให้ใช้งานแล้ววันนี้
การให้บริการ ✦ ข้อมูล+แจ้งเตือนเวลาพบแพทย์ ✦ ข้อมูล+แจ้งเตือนเมื่อผลตรวจออกครบ ✦ ข้อมูล+แจ้งเตือนผลตรวจร่างกายประจำปี ✦ รายการแพ้ยา ✦ ข่าวสาร/กิจกรรมจากทางโรงพยาบาล
NAH Smart Health
nah-smart-healthGreenhead Clinic กรีนเฮดคลินิกการแพทย์แผนไทย
คลินิกแพทย์แผนไทย แห่งเกาะภูเก็ต ที่นำกัญชา กัญชงมาใช้ดูแลสุขภาพ คลินิกเปิดบริการ พร้อมแพทย์ประจำคลินิก ที่ผ่านการอบรมหลักสูตรกัญชา ที่สามารถให้คำแนะนำเกี่ยวกับ การใช้
✔️กัญชาทางการแพทย์แบบบูรณาการ
✔️การใช้กัญชาในการแพทย์แผนไทย
✔️การใช้กัญชารักษาผู้ป่วยทางโรคประสาท
สาขาหลักที่ถ.เยาวราช ภูเก็ต สาขา 2 ที่เชิงทะเล เพิ่งเปิดไม่นาน
กรุงเทพมหานคร


นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร ได้กล่าวถึงบทบาทและการขับเคลื่อนระบบบริการปฐมภูมิ และการเชื่อมโยงข้อมูลสุขภาพในพื้นที่กรุงเทพฯ ว่า ไม่มีเวลาไหนที่เหมาะเท่าเวลานี้กับการปฏิรูปเรื่องสาธารณสุข เรามีบทเรียนที่สำคัญมากจากเรื่องโควิด-19 กรุงเทพมหานครมีบทเรียนที่หนักมาก ตรงกับ 2 เรื่องสำคัญ คือ การบูรณาการด้านข้อมูลและเรื่องทรัพยากร กรุงเทพมหานครมีเตียงมาก สุดท้ายแล้วการจัดสรรทรัพยากรต่าง ๆ ยังมีปัญหา การร่วมมือกันระหว่างหน่วยงานเราอาจจะเป็นจังหวัดที่ไม่มีสาธารณะสุขจังหวัด ไม่มีคนที่สั่งการทั้งจังหวัดได้ แต่ละส่วนมีหน้าที่ดูแลตัวเอง กรุงเทพมหานครมีเตียงอยู่แค่ 11% ของเตียงทั้งหมดในกรุงเทพฯ เรื่องแรกก็คือเรื่องการบูรณาการด้านข้อมูลความร่วมมือ เรื่องที่สองเรื่องปฐมภูมิเป็นจุดอ่อนของกรุงเทพมหานคร เราไม่มีหน่วยปะทะ หน่วยหน้า จะเห็นได้ว่าเรามีแต่หน่วยปะทะหลักก็คือศูนย์บริการสาธารณสุขของกรุงเทพมหานคร ซึ่งมีอยู่ 69 แห่ง ถามว่ารับไหวไหม อย่างศูนย์บริการสาธารณสุข 41 คลองเตย มีบุคลากรอยู่ 82 คน ดูแลประชากรในคลองเตยประมาณ 1 แสนคน ไม่มีทางรับไหว พอปฐมภูมิอ่อนแอ ทุกอย่างไหลไปที่ทุติยภูมิ ตติยภูมิหมด เมื่อคนไม่มาศูนย์บริการสาธารณสุขแต่ไปที่โรงพยาบาลหลัก โรงพยาบาลหลักก็แน่นเพราะคนไม่ไว้ใจปฐมภูมิ การแก้ไขปฐมภูมิเป็นเรื่องสำคัญมาก ๆ ที่จะแก้ไขปัญหาของระบบสาธารณสุขของกรุงเทพมหานคร
จริง ๆ แล้วกรุงเทพมหานครไม่สามารถทำคนเดียวได้ เพราะมันต้องมีทั้งเทคโนโลยี ทั้งข้อมูลต่าง ๆ เป็นมิติที่ดีที่ทุกคนมาร่วมมือกัน ต่างจังหวัดมีอาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) ส่วนกรุงเทพมหานครมีอาสาสมัครสาธารณสุขกรุงเทพมหานคร (อสส.) ในอัตราส่วนที่น้อยมากเมื่อเทียบกับต่างจังหวัด ต้องเพิ่ม อสส. มากขึ้น และกรุงเทพมหานครจะมีอีกส่วนหนึ่งที่มาเป็นบทบาทสำคัญ คือ อาสาสมัครเทคโนโลยี (อสท.) ประจำชุมชน ถ้าลองไปดู อสส. จะเป็นผู้สูงอายุเยอะ ไม่ค่อยเชี่ยวชาญด้านเทคโนโลยี อสท. เป็นเด็กรุ่นใหม่ในชุมชนที่ใช้เทคโนโลยีเป็น สามารถเข้าใจการใช้ Application แล้วไปสอนคนในชุมชนให้เข้าใจการเข้าถึง Telemedicine การใช้ Application การเอาข้อมูลอัพเดทมาถึงส่วนกลางก็จะทำให้ภาพรวมของการดูแลปฐมภูมิเข้มข้น วันนี้เป็นมิติที่ดีมาก ๆ ที่ทุกคนมาร่วมมือกัน การจัดงานในวันนี้ ผมคิดว่าจะเห็นการเปลี่ยนแปลงที่เกิดกับคุณภาพชีวิตของคนทั้งประเทศได้อย่างชัดเจน
ผู้ว่าราชการกรุงเทพมหานคร กล่าวเพิ่มเติมว่า ตอนทำนโยบายของ กทม. ได้มีการศึกษาแนวคิดของนักการปฏิรูปเรื่องสาธารณสุข ซึ่งเห็นตรงกันว่านโยบาย 216 ข้อ เรื่องสาธารณะสุขสอดคล้องกับแนวคิดของ ศ.คลินิก เกียรติคุณ นพ.อุดม คชินทร ประธานกรรมการในคณะกรรมการปฏิรูปประเทศด้านการสาธารณสุข ทั้งสิ้น คือเน้นเรื่องเส้นเลือดฝอยปฐมภูมิ เพราะเชื่อว่า กทม. ไม่มีหน้าที่ไปสร้างเตียงอีกจำนวนมาก สร้างปฐมภูมิให้ดีแล้วเชื่อว่าการใช้เตียงทุกเตียงทุติยภูมิ ตติยภูมิคงจะมีประสิทธิภาพมากขึ้น เป็นนโยบายที่ดูแลเส้นเลือดฝอยปรับปรุงสาธารณะสุข ใช้เทคโนโลยี Telemedicine มาช่วยในการเข้าถึงชุมชน ดีใจที่จะพัฒนาและมีแนวร่วมมากขึ้น กรุงเทพมหานครทำ Sandbox 2 ที่ คือ ที่ดุสิต กับ ที่ราชพิพัฒน์
Sandbox คือ แบบทดลอง กรุงเทพมหานครแบ่งเขตสาธารณสุขออกเป็น 6 โซน แล้วทำแต่ละโซนโดยทดสอบก่อน ถ้ามันมีความสำเร็จเอาขยายไปที่อื่นได้ Sandbox ต้องมีตั้งแต่โรงพยาบาลที่แม่ข่ายสามารถดูแลเคสที่หนัก Complicate (ซับซ้อน) ได้ อาจใช้วชิรพยาบาลเป็นตัวแม่ ศูนย์บริการสาธารณสุขเป็นปฐมภูมิลำดับแรก แล้วก็จะมีเครือข่ายคลีนิค ชุมชนอบอุ่น ร้านขายยา มันก็จะเป็นเครือข่ายที่ครบสมบูรณ์แบบ ถ้าปะทะได้จบ อยู่ที่คลีนิคหรือศูนย์สาธารณสุข จากนั้นมีโรงพยาบาลคอย Consultant (ที่ปรึกษา) อาจจะมีหน่วย Telemedicine ลงไป ตอนนี้ Sandbox เริ่มจะสำเร็จ ของราชพิพัฒน์น่าจะเสร็จสิงหาคมนี้ น่าจะเป็นตัวอย่างที่ Completed (สมบูรณ์) ขยายผลได้ ทุกอย่างเดินไปอย่างเต็ม ข้อดีของปฐมภูมิคือไม่ต้องลงทุนมากมายเพียงแค่เปลี่ยน Mindset หาแนวร่วม ใช้ Regulation (ระเบียบ/ข้อบังคับ) ใช้การตรวจสอบ มากำกับควบคุม ถ้าโรงพยาบาล 1 โรงอาจใช้เวลา 3 ปี แล้วได้ที่เป็น Location และเปลี่ยนวิธีคิดเรื่อง ปฐมภูมิ คิดว่า Impact เร็ว หาแนวร่วมได้เร็ว หัวใจของคำว่าการปฏิรูป คิดว่า 2 คำ คือ Disrupt เปลี่ยนวิธีคิดแบบเดิม และต้อง Scale คือขยายผลได้เร็ว ถึงมี sandbox ถ้าสำเร็จ 1 โมเดล เอาขยายไปทุกเขต ในทุกสาธารณสุขได้คิดว่าน่าจะเห็นผลตั้งแต่เดือนหน้า เพราะเริ่มทำมาระยะหนึ่งแล้ว ซึ่งในการดำเนินการสามารถร่วมกับหน่วยงานอื่นได้ อีกปัญหาที่เจอคือความเป็นเนื้อเดียวกัน มีการตั้งคณะกรรมการของระบบสาธารณสุขทั้งหมดเพื่อให้เกิดการประสานงานด้านความรู้ เทคโนโลยี ทรัพยากรต่าง ๆ บูรณาการการทำงานร่วมกัน
ประกาศหน่วยบริการใหม่ ทดแทน รพ.สิรินาถ บึงกุ่ม LINK
ประกาศ!!! กรณีโรงพยาบาลสิรินาถ บึงกุ่ม ยกเลิกการขึ้นทะเบียนเป็นหน่วยบริการ ในระบบหลักประกันสุขภาพแห่งชาติ เขตพื้นที่กรุงเทพมหานคร สปสช. จัดหน่วยบริการรับส่งต่อแห่งใหม่มารอบรับ รพ.รับส่งต่อแห่งเดิมให้แก่ผู้รับบริการที่มีหน่วยบริการปฐมภูมิส่งต่อ รพ.จำนวน 3 แห่ง มีผลตั้งแต่ วันที่ 1 ตุลาคม 2565 เป็นต้นไป
1. หน่วยบริการปฐมภูมิ คือ พรหมธาดาคลินิกเวชกรรม สาขาบึงกุ่ม หน่วยบริการประจำ คือ ศูนย์บริการสาธารณสุข 50 บึงกุ่ม รพ.รับส่งต่อแห่งใหม่คือ รพ.นพรัตนราชธานี
2. หน่วยบริการปฐมภูมิ คือ คลินิกเวชกรรมเสนา 88 หน่วยบริการประจำ คือ ศูนย์บริการสาธารณสุข 56 ทับเจริญ รพ.รับส่งต่อแห่งใหม่คือ รพ.นพรัตนราชธานี
3. หน่วยบริการปฐมภูมิ คือ คลินิกเวชกรรมบ้านอัมรินทร์ หน่วยบริการประจำ คือ ศูนย์บริการสาธารณสุข 50 บึงกุ่ม รพ.รับส่งต่อแห่งใหม่คือ รพ.นพรัตนราชธานี
ท่านสามารถตรวจสอบสิทธิด้วยตนเองผ่านทาง
1. ไลน์ สปสช. @nhso
2. แอปพลิเคชัน สปสช.
3. โทร 1330 กด 2 กดเลขบัตรประชาชน 13 หลัก
ค่ำแล้ว แต่แฟนเพลงไม่ถอยเลย กลับคึกครื้นเสียยิ่งกว่าเดิมซะอีก
ของขวัญปีใหม่ จากกระทรวงการคลัง กลุ่มที่ 3 มาตรการ/โครงการอื่น
มาตรการ/โครงการอื่น จำนวน 7 มาตรการ/โครงการ
ได้แก่
3.1 โครงการเที่ยวปีใหม่สุขใจไปกับพิพิธภัณฑ์ธนารักษ์ เพื่อมอบเป็นของขวัญปีใหม่ พ.ศ. 2566 ให้แก่ประชาชน
กรมธนารักษ์เปิดให้ประชาชนทั่วไปได้เข้าชมพิพิธภัณฑ์เหรียญกษาปณานุรักษ์ พิพิธบางลำพู พิพิธภัณฑ์ธนารักษ์ จังหวัดเชียงใหม่ พิพิธภัณฑ์ธนารักษ์ จังหวัดสงขลา และพิพิธภัณฑ์ธนารักษ์ จังหวัดขอนแก่น โดยไม่เก็บค่าเข้าชม ระหว่างวันที่ 30 ธันวาคม 2565 ถึงวันที่ 15 มกราคม 2566
3.2 โครงการสนับสนุนตลาดทุนและเศรษฐกิจของประเทศให้เติบโตอย่างยั่งยืนลดภาระแก่ผู้ประกอบธุรกิจเพื่อความสุขที่มั่นคงของทุกภาคส่วน
สำนักงานคณะกรรมการกำกับหลักทรัพย์และตลาดหลักทรัพย์ (สำนักงาน ก.ล.ต.) ดำเนินโครงการสนับสนุนตลาดทุนและเศรษฐกิจของประเทศให้เติบโต อย่างยั่งยืน รวมทั้งลดภาระแก่ผู้ประกอบธุรกิจ รวมถึงโครงการที่จะช่วยลดภาระต้นทุน ที่เกินความจำเป็นให้แก่ผู้ประกอบธุรกิจในสภาพแวดล้อมการแข่งขันที่รุนแรงขึ้น และเศรษฐกิจที่ชะลอตัวในปัจจุบัน เพื่อให้สามารถเติบโตได้อย่างยั่งยืน ดังนี้
(1) การยกเว้นค่าธรรมเนียมเพื่อส่งเสริมการจัดตั้งและบริหารจัดการกองทุนรวมเพื่อความยั่งยืน (SRI Fund) โดยยกเว้นค่าธรรมเนียมการจัดตั้งกองทุนรวม 100,000 บาทต่อกองทุนรวม และยกเว้นค่าธรรมเนียมการแก้ไขโครงการจัดการกองทุนรวม ไม่เกิน 5,000 บาท ต่อกองทุนรวม โดยจะมีผลตั้งแต่วันที่ 1 มกราคม 2566
(2) การยกเว้นค่าธรรมเนียมการประกอบธุรกิจสำหรับผู้ประกอบธุรกิจที่แจ้งยุติการประกอบธุรกิจ 50,000 บาทต่อราย โดยจะมีผลตั้งแต่วันที่ 1 มกราคม 2566
(3) การยกเว้นค่าธรรมเนียมเพื่อสนับสนุนการออกตราสารหนี้กลุ่มความยั่งยืน โดยจะขยายเวลาเพิ่มเติม 3 ปี เริ่มตั้งแต่วันที่ 1 มิถุนายน 2565 ถึงวันที่ 31 พฤษภาคม 2568
(4) การยกเว้นค่าธรรมเนียมเพื่อสนับสนุนค่าใช้จ่ายในการจ้างผู้ทวนสอบ/ผู้ให้การรับรองข้อมูลก๊าซเรือนกระจก ตามที่ชำระจริงแต่ไม่เกิน 50,000 บาท ซึ่งเป็นโครงการต่อเนื่อง มีผลจนถึงสิ้นปี 2566 และอยู่ระหว่างเตรียมขยายระยะเวลาต่อไปอีก 3 ปี
3.3 โครงการส่งเสริมให้ประชาชนและผู้ลงทุนมีศักยภาพในการสร้างสุขภาพทางการเงินที่ดีและมีภูมิคุ้มกัน ไม่ถูกหลอกลวง
สำนักงาน ก.ล.ต. ให้ความสำคัญและมีการดำเนินการเพื่อส่งเสริมความรู้ด้านการเงิน (Financial Literacy) เพื่อส่งเสริมให้ประชาชนและผู้ลงทุนมีศักยภาพในการสร้างสุขภาพทางการเงินที่ดี และมีภูมิคุ้มกัน ไม่ถูกหลอกลวง ในยุคที่การหลอกลวงมีมากขึ้นและมีรูปแบบที่หลากหลาย ดังนี้
(1) สำนักงาน ก.ล.ต. เดินสายติดอาวุธคนไทย ระวังภัยกลโกง โดยจัดให้ปี 2566 เป็นปีแห่งการรณรงค์ให้ความรู้ผู้ลงทุนในการระวังภัยกลโกงการลงทุน เผยแพร่ความรู้ให้กระจายเข้าถึงประชาชนทั่วทุกภูมิภาค โดยเริ่มจากการจัดทำศูนย์รวมความรู้ภัยกลโกงการลงทุนบนเว็บไซต์ของสำนักงาน ก.ล.ต. ภายใต้ชื่อโครงการ “SCAM CENTER รู้ทันภัยกลโกง” (จะเริ่มให้บริการตั้งแต่วันที่ 1 มกราคม 2566 เป็นต้นไป)
(2) โครงการหลักสูตรเรียนรู้ออนไลน์ e-learning “ก.ล.ต. Crypto Academy” (www.seccryptoacademy.com) เพื่อเป็นแหล่งความรู้เกี่ยวกับสินทรัพย์ดิจิทัล รวมถึงความเสี่ยงและข้อควรระวังที่เกี่ยวข้องแบบครบวงจร โดยจะเริ่มให้บริการตั้งแต่วันที่ 1 มกราคม 2566 เป็นต้นไป
(3) โครงการเครื่องมือเปรียบเทียบกองทุนรวม “SEC Fund Check” เพื่อให้ประชาชนมีเครื่องมือที่สามารถค้นหาข้อมูลเกี่ยวกับกองทุนรวมได้อย่างครบถ้วนเป็นกลางพร้อมคุณสมบัติที่ง่ายต่อการใช้งาน สามารถเปรียบเทียบกองทุนในหลายมิติ โดยจะเริ่มให้บริการในเดือนพฤศจิกายน 2565
(4) โครงการ “แนวทางวางแผนการเงินและการจัดการเงินกองทุนสำรองเลี้ยงชีพหลังเกษียณ” โดยจะจัดทำเป็นการเสวนาผ่านสื่ออิเล็กทรอนิกส์เกี่ยวกับแนวทางวางแผนการเงินและการจัดการเงินทุนสำรองเลี้ยงชีพหลังเกษียณ รวมถึงเรื่องภาษีที่เกี่ยวข้อง โดยมีระยะเวลาดำเนินการช่วงประมาณปลายเดือนพฤศจิกายนถึงช่วงครึ่งแรกของเดือนธันวาคม 2565
3.4 โครงการกรมธรรม์ประกันภัยรายย่อย (ไมโครอินชัวรันส์) สำหรับเทศกาลปีใหม่ 2566
สำนักงานคณะกรรมการกำกับและส่งเสริมการประกอบธุรกิจประกันภัย (สำนักงาน คปภ.) ได้จัดทำกรมธรรม์ประกันภัยรายย่อย (ไมโครอินชัวรันส์) สำหรับเทศกาลปีใหม่ 2566 เพื่อส่งเสริมให้ประชาชนใช้ระบบประกันภัยเป็นเครื่องมือในการบริหารความเสี่ยง และสร้างคุณภาพชีวิตที่ดีให้กับประชาชนได้อย่างทั่วถึงโดยเฉพาะผู้มีรายได้น้อย ด้วยเบี้ยประกันภัยที่เหมาะสมกับความเสี่ยงของผู้เอาประกันภัย ในการเดินทางท่องเที่ยวหรือกลับภูมิลำเนาในช่วงเทศกาลสำคัญที่มีวันหยุดต่อเนื่อง เช่น เทศกาลปีใหม่ สงกรานต์ เป็นต้น จึงได้มีการพัฒนาผลิตภัณฑ์ประกันภัยที่ให้การคุ้มครองในระยะเวลาสั้น 30 วัน ด้วยเบี้ยประกันภัย 10 บาท
3.5 มาตรการช่วยเหลือผู้กู้ยืมเงินเพื่อเป็นของขวัญปีใหม่ พ.ศ. 2566
กองทุนเงินให้กู้ยืมเพื่อการศึกษา (กยศ.) ได้จัดเตรียมมาตรการของขวัญปีใหม่ปี 2566 ให้กับผู้กู้ยืมเงินกองทุนเงินให้กู้ยืมเพื่อการศึกษา ดังนี้
(1) ขยายระยะเวลามาตรการลดหย่อนหนี้ จากเดิมสิ้นสุดวันที่ 31 ธันวาคม 2565 เป็นสิ้นสุดวันที่ 30 มิถุนายน 2566 รวมระยะเวลา 6 เดือน ดังนี้
- ลดเงินเพิ่มร้อยละ 100 กรณีผู้กู้ยืมเงินทุกกลุ่มชำระหนี้ปิดบัญชีในคราวเดียว
- ลดเงินเพิ่มร้อยละ 80 กรณีผู้กู้ยืมเงินกลุ่มก่อนฟ้องคดีมาชำระหนี้ค้างทั้งหมดให้มีสถานะปกติ (ไม่ค้างชำระ)
- ลดหย่อนเงินต้น ร้อยละ 5 กรณีชำระหนี้ปิดบัญชีในคราวเดียว สำหรับผู้กู้ยืมเงินที่อยู่ระหว่างการชำระเงินคืนกองทุนและมิได้เป็นผู้ผิดนัดชำระหนี้หรือเคยเป็นผู้ผิดนัดชำระหนี้
- ลดอัตราดอกเบี้ย จากเดิมร้อยละ 1 ต่อปี เป็นร้อยละ 0.01 ต่อปี ให้กับผู้กู้ยืมเงินที่อยู่ระหว่างการชำระเงินคืนกองทุนและมิได้เป็นผู้ผิดนัดชำระหนี้หรือเคยเป็นผู้ผิดนัดชำระหนี้ และ
- ลดเบี้ยปรับเหลือร้อยละ 0.5 ต่อปี กรณีผู้กู้ยืมเงินที่ยังไม่ถูกดำเนินคดีและไม่สามารถชำระหนี้ได้ตามกำหนด
(2) ชะลอการฟ้องร้องดำเนินคดีกับผู้กู้ยืมเงินและผู้ค้ำประกันที่ผิดนัดชำระหนี้ ประจำปี 2563 ปี 2564 และปี 2565 จากเดิมภายในวันที่ 31 มีนาคม 2566 เป็นภายในวันที่ 5 กรกฎาคม 2566 เว้นแต่คดีที่จะขาดอายุความ
(3) ชะลอการบังคับคดีสำหรับผู้กู้ยืมเงินที่ผิดนัดไม่ชำระหนี้ตามคำพิพากษาไปจนถึงวันที่
31 ธันวาคม 2566 เว้นแต่คดีที่ใกล้สิ้นสุดระยะเวลาการบังคับคดี
(4) งดการขายทอดตลาดทรัพย์สินของผู้กู้ยืมเงิน และผู้ค้ำประกันที่กองทุนได้ยึดทรัพย์ไว้ จนถึงวันที่ 31 ธันวาคม 2566 โดยผู้กู้ยืมเงินและผู้ค้ำประกันจะต้องร่วมกับกองทุนของดการขายทอดตลาดต่อกรมบังคับคดี
(5) มาตรการลดอัตราดอกเบี้ยให้ผู้กู้ยืมเงินที่อยู่ระหว่างการชำระเงินคืนกองทุนกลุ่มก่อนฟ้องคดี ที่มีสถานะปัจจุบันไม่เป็นผู้ผิดนัดชำระหนี้ โดยลดอัตราดอกเบี้ยจากเดิมร้อยละ 1 ต่อปี เป็นร้อยละ 0.5 ต่อปี เริ่มมีผลตั้งแต่วันที่ 1 มกราคม 2566 ถึงวันที่ 30 มิถุนายน 2566
3.6 มาตรการของขวัญปีใหม่ปี 2566 ให้กับลูกค้ารายย่อยที่ไม่มีหลักประกัน/ผู้ค้ำประกัน
บริษัท บริหารสินทรัพย์ ธนาคารอิสลามแห่งประเทศไทย จำกัด (บสอ.) จัดทำมาตรการของขวัญปีใหม่ปี 2566 ให้กับลูกค้ารายย่อยที่ไม่มีหลักประกัน/ผู้ค้ำประกัน เพื่อช่วยเหลือลูกค้าและผู้ค้ำประกันให้ปลดหนี้ได้ ดังนี้ (1) ลดเบี้ยปรับ ร้อยละ 100 ชำระเพียงเงินต้น กรณีปิดบัญชี (2) ลดเบี้ยปรับ ร้อยละ 100 ชำระเงินต้นพร้อมดอกเบี้ย 3 เดือน กรณีผ่อนชำระไม่เกิน 6 เดือน (3) พิจารณาผ่อนปรนตามความสามารถของลูกค้า/ผู้ค้ำประกัน กรณีผ่อนชำระเกิน 6 เดือน
3.7 โครงการ “ชม ชิม ช็อป ยาสูบเชียงราย”
การยาสูบแห่งประเทศไทย (ยสท.) จัดทำโครงการ “ชม ชิม ช็อป ยาสูบเชียงราย” เพื่อมอบเป็นของขวัญปีใหม่ให้ประชาชนชาวเชียงรายได้มีพื้นที่ค้าขายสินค้า/พืชผลทางการเกษตร และกระตุ้นเศรษฐกิจของจังหวัดเชียงราย ระหว่างวันที่ 29 ธันวาคม 2565 ถึงวันที่ 29 มกราคม 2566 ณ สวนตุงและโคมนครเชียงราย จังหวัดเชียงราย
นายจักกพันธุ์ ผิวงาม - ดูแลด้านโครงสร้างพื้นฐานและการจราจร
"ผู้ว่าราชการกรุงเทพมหานครได้ให้ความสำคัญกับปัญหาฝุ่น PM 2.5 โดยกำหนด 16 มาตรการ
ให้หน่วยงานที่เกี่ยวข้องนำไปปฏิบัติ สิ่งที่เราดำเนินการ คือ ตรวจ ติดตาม และแก้ไข ลงพื้นที่สำรวจหาสาเหตุ ปัญหาของฝุ่นว่าเกิดจากอะไร รวมทั้งบูรณาการความร่วมมือภาครัฐ/ภาคเอกชน เพื่อแก้ไขปัญหา ให้นโยบายสามารถเดินหน้าต่อไปได้ในอนาคต"
นายจักกพันธุ์ ผิวงาม
รองผู้ว่าราชการกรุงเทพมหานคร
ดูแลด้านโครงสร้างพื้นฐานและการจราจร
กล่าวในงานอัพเดทความคืบหน้านโยนาย 9 ด้าน 9 ดี ก้าวสูปี 66 กรุงเทพฯ เมืองน่าอยู่
21 ธันวาคม 2565
เขตจอมทอง
ป้องกันคุณจากสัตว์เลี้ยง ด้วยวัคซีนป้องกันโรคพิษสุนัขบ้า สำหรับผู้มีสัตว์เลี้ยง น้องหมา น้องแมว สามารถขอรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วันที่ 13 -24 มีนาคม 2566 ตั้งแต่เวลา 10.00 - 12.00 น. ทั้งนี้ รับบริการได้ฟรี ไม่มีค่าใช้จ่าย
สวนเคพี การ์เด้น จันทบุรี เปิดสวน 29 เมษายน 2566 LINK
สวนเคพี การ์เด้น จันทบุรี KP Garden Chanthaburi ต.ท่าหลวง อ.มะขาม ประกาศจะเปิดให้บริการสวนผลไม้ ตั้งแต่ 29 เมษายน 2566 ถึงกลางเดือนกรกฎาคม เปิดเฉพาะวันเสาร์-อาทิตย์ และวันหยุดนักขัตฤกษ์เท่านั้น (วันธรรมดา รับเฉพาะหมู่คณะ 20 คนขึ้นไป) เวลาทำการ 10-17 น. เปิดบริการวันละ 3 รอบ คือ 10.00 13.00 และ 15.00 น
ค่าบริการ คนละ 650 บาท กินทุเรียนไม่อั้น เด็ก 5-10 ขวบ 300 บาท * โปรดจองล่วงหน้า 1 อาทิตย์ และมาตรงเวลานะคะ
สำหรับกิจกรรม ได้แก่ เดินชมสวนพร้อมเกร็ดความรู้เกี่ยวกับผลไม้จากวิทยากรของสวน ชมผลไม้สดๆ จากต้น เต็มอิ่มกับขบวนผลไม้ ทุเรียน เงาะ มังคุด ลองกอง และของว่าง ปั่นจักรยานชมสวน ให้อาหารแพะ ชมบ้านน้องเดือน
ตายดี - สิทธิยุติชีวิตตนเองอย่างมีศักดิ์ศรี สำหรับคนที่ป่วยจากโรคทางกายที่รักษาไม่ได้
ปัญหา
ปัจจุบัน คนไทยส่วนใหญ่ยังไม่รู้จักหรือเข้าไม่ถึงการดูแลฟื้นฟูผู้ป่วยในระยะปานกลาง ระยะยาว ระยะประคับประคอง ทำให้ผู้ป่วยที่ต้องได้รับการดูแล ที่ส่วนใหญ่เป็นผู้ป่วยสูงอายุและไม่สามารถพึ่งพาตัวเอง ไม่สามารถเข้าถึงการรักษาในระยะนี้อย่างมีคุณภาพ หากจะเข้าการรักษาก็ต้องเป็นภาระของบุตรหลานหรือญาติในการดูแล เนื่องในระดับองค์กรปกครองส่วนท้องถิ่นหรือชุมชุนยังไม่มีโครงสร้างพื้นฐานและบุคลากรในการรักษาระยะปานกลาง ระยะยาว และระยะประคับประคอง
โดยเฉพาะอย่างยิ่งการรักษาในระยะประคับประคอง (Palliative Care) ที่ยังไม่เข้าถึงในสถานบริการแบบปฐมภูมิ ทำให้ผู้ป่วยระยะสุดท้ายหรือระยะประคับประคองเข้าไม่ถึงการรักษาแบบประคับประคอง ที่จะทำให้ตัวเองไม่ทรมานจากความเจ็บปวดจากอาการป่วยระยะสุดท้าย นอกจากยังขาดแคลนบุคลากรที่มีความสามารถในการรักษาในระยะประคับประคอง เนื่องจากบุคลากรทางการแพทย์ทั่วไปไม่ได้มีความรู้ในด้านนี้ ส่วนแพทย์เฉพาะทางก็มีจำนวนน้อยและไม่ได้มีเส้นทางการเติบโตในสายอาชีพที่ดี อีกทั้งยังขาดโครงพื้นฐานและความรู้ความเข้าใจของประชาชนเกี่ยวกับการรักษาแบบประคับประคอง
นอกจากการรักษาแบบประคับประคอง สิทธิที่ผู้ป่วยระยะสุดท้ายที่มีความเจ็บป่วยทางกายแบบรักษาไม่ได้ที่จะตายอย่างมีศักดิ์ศรี หรือการทำการุณยฆาตเป็นสิ่งที่ยังไม่ถูกกฎหมายในประเทศไทย ทำให้ผู้ป่วยบางคนต้องทนทุกข์ทรมานก่อนเสียชีวิต
ข้อเสนอ
อนุญาตให้บุคคลที่ป่วยจากโรคทางกายที่รักษาไม่ได้ มีสิทธิเข้าสู่กระบวนการยุติชีวิตตนเองอย่างมีศักดิ์ศรีโดยความช่วยเหลือจากแพทย์ โดยผู้ทำต้องมีสติและได้รับการรับรองโดยจิตแพทย์ว่าไม่มีอาการป่วยทางสุขภาพจิต
R-Rit (อาริท) สุราชุมชนหัวหิน ประจวบคีรีขันธ์ LINK
"R-Rit" (อาริท) สุราชุมชนจากจังหวัดประจวบคีรีขันธ์ อำเภอหัวหิน ก่อตั้งโดยคุณบุญฤทธิ์ ผู้ชื่นชอบการทดลองทำเหล้าโดยใช้ข้าวไทยหลากหลายชนิดมากว่า 10 ปี จนได้พันธุ์ข้าวที่มีกลิ่นและรสชาติตามที่ต้องการจากข้าวเหนียวของจังหวัดชัยภูมิ
โรงนี้ใช้น้ำฝนที่ตั้งใจเก็บจากบริเวณเทือกเขาตะนาวศรี และใช้ข้าวเหนียวที่ยังไม่ได้สีจาก จ.ชัยภูมิ นำมาขัดสีภายในโรงเหล้าของตัวเอง หมักโดยใช้ลูกแป้งที่ผสมสมุนไพรไทยประมาณ 16 ชนิดหมักกับข้าวเหนียวเป็นระยะเวลาประมาณ 1 เดือน โดยเฉลี่ยใช้ข้าวเหนียวประมาณ 1 กก ต่อสุรา 1 ขวด โดยไม่มีการเติมสารเร่งหรือแต่งเติมใดๆ เทคนิคการหมักบางส่วนได้ซึมซับมาจากสุราโบราณของไทยและสุราข้าวจากประเทศญี่ปุ่น
ข้อมูลและภาพจากเพจประชาชนเบียร์
Trip 4 : วันที่ 26 - 27 สิงหาคม 66 (แบบพักค้างคืน) เที่ยวสบายๆ@กาญจนบุรี
Trip 4 : วันที่ 26 - 27 สิงหาคม 66 (แบบพักค้างคืน) โปรแกรม “พิรุณโปรยปราย เที่ยวสบายๆ @ กาญจนบุรี ราคา 3,999 บาท
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก (เกษตรบางพระ)
43 ม.6 ตำบลบางพระ อำเภอศรีราชา จังหวัดชลบุรี 20110
โทร 033-136099 ต่อ 1484, 1485 062-7875199
เวลาทำการ : จันทร์-ศุกร์ 08:30-16:30 น. หยุดนักขัตฤกษ์
บริการตรวจวินิจฉัยโรค และรักษาโรคทั่วไป ฉีดวัคซีน อัลตร้าซาวด์ ผ่าตัดทำหมัน ศัลกรรมกระดูกและเนื้อเยื่ออ่อน เอ็กซ์เรย์ กาย
แผนกของโรงพยาบาล และเวลาการทำการ อายุรกรรมทั่วไป ศัลยกรรม ทันตกรรม สัตว์น้ำและสัตว์พิเศษ การตรวจวินิจฉัย ห้องปฏิบัติการ หน่วยปศุสัตว์ สัตว์ป่า และม้า อายุรกรรมทั่วไป ศัลยกรรม
Facebook |
Website |
แผนที่
สัปดาห์ที่ 24 (12-18 มิถุนายน 2566)
ต่างชาติ 489,781 คน
เฉลี่ยวันละ 69,969 คน
นักท่องเที่ยวต่างชาติสะสม 11,899,199 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 493,754 ล้านบาท
5 ประเทศ แรก
จีน 73,750 คน
มาเลเซีย 71,849 คน
อินเดีย 36,234 คน
สิงคโปร์ 27,654 คน
เกาหลีใต้ 25,203 คน
*****
สัปดาห์ที่ 23 (5-11 มิถุนายน 2566)
ต่างชาติ 460,527 คน
เฉลี่ยวันละ 65,790 คน
นักท่องเที่ยวต่างชาติสะสม 11,409,418 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 472,355 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 69,158 คน
จีน 60,438 คน
อินเดีย 34,581 คน
เกาหลีใต้ 27,654 คน
เวียดนาม 25,203 คน
*****
สัปดาห์ที่ 22 (29 พฤษภาคม - 4 มิถุนายน 2566)
ต่างชาติ 500,410 คน
เฉลี่ยวันละ 71,488 คน
นักท่องเที่ยวต่างชาติสะสม 10,948,891 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 452,248 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 117,791 คน
จีน 57,479 คน
อินเดีย 32,748 คน
เกาหลีใต้ 29,957 คน
เวียดนาม 24,977 คน
*****
cms_detail_row
สัปดาห์ที่ 21 (22-28 พฤษภาคม 2566)
ต่างชาติ 492,030 คน
เฉลี่ยวันละ 70,290 คน
นักท่องเที่ยวต่างชาติสะสม 10,448,481 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 431,599 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 98,759 คน
จีน 71,112 คน
อินเดีย 34,602 คน
เกาหลีใต้ 28,636 คน
เวียดนาม 26,392 คน
*****
สัปดาห์ที่ 20 (15-21 พฤษภาคม 2566)
ต่างชาติ 434,568 คน
เฉลี่ยวันละ 62,082 คน
นักท่องเที่ยวต่างชาติสะสม 9,905,066 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 410,818 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 65,935 คน
จีน 64,650 คน
อินเดีย 34,473 คน
เกาหลีใต้ 22,426 คน
เวียดนาม 21,199 คน
*****
สัปดาห์ที่ 19 (8-14 พฤษภาคม 2566)
ต่างชาติ 415,309 คน
เฉลี่ยวันละ 59,329 คน
นักท่องเที่ยวต่างชาติสะสม 9,470,498 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 391,778 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 62,396 คน
จีน 61,482 คน
อินเดีย 32,168 คน
ลาว 20,651 คน
เกาหลีใต้ 20,523 คน
*****
สัปดาห์ที่ 17 (24-30 เมษายน 2566)
ต่างชาติ 567,361 คน
เฉลี่ยวันละ 81,052 คน
นักท่องเที่ยวต่างชาติสะสม 8,608,331 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 353,331 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 117,181 คน
จีน 98,893 คน
อินเดีย 33,576 คน
เวียดนาม 26,690 คน
เกาหลีใต้ 26,077 คน
*****
สัปดาห์ที่ 15 (10-16 เมษายน 2566)
ต่างชาติ 463,459 คน
เฉลี่ยวันละ 66,209 คน
นักท่องเที่ยวต่างชาติสะสม 7,526,412 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 224,018 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 80,239 คน
จีน 77,178 คน
อินเดีย 31,997 คน
เวียดนาม 28,873 คน
เกาหลีใต้ 21,089 คน
ผู้ช่วยศาสตราจารย์ นายสัตวแพทย์ ดร.พีรุทย์ เชียรวิชัย วท.บ โรงพยาบาลพหลพลพยุหเสนา กาญจนบุรี จัดฉีดที่ โรบินสันกาญจนบุรี ชั้น 2 ข้าง ธ.ไทยพาณิชย์
โรงพยาบาลพหลพลพยุหเสนา ขอเชิญชวน หญิงไทย อายุ 11-20 ปี (เกิด 1 มค 2546-31 ธค 2555) ฉีดวัคซีนป้องกันมะเร็งปากมดลูก (HPV) ฟรี ที่ โรบินสันกาญจนบุรี ชั้น 2 ข้าง ธ.ไทยพาณิชย์
ขบวนภาคกลางและภาคใต้ 2565
ตารางออกหน่วยเคลื่อนที่
ขบวนภาคกลางและภาคใต้
เดือนมีนาคม 2565
- 1-4 มี.ค. อ.บางเลน นครปฐม
- 7-11 มี.ค. อ.สามพราน นครปฐม
- 14-18 มี.ค. อ.บ้านคา ราชบุรี
- 21-23 มี.ค. อ.เมือง ราชบุรี
- 24-25 มี.ค. อ.ปากท่อ ราชบุรี
- 28-30 มี.ค. อ.บางสะพาน ประจวบคีรีขันธ์
เดือนเมษายน 65
- 31 มี.ค. - 1 เม.ย. อ.สามร้อยยอด ประจวบคีรีขันธ์
- 4 เม.ย. โรงเรียนบ้านเขาย้อย อ.เขาย้อย เพชรบุรี
- 5 เม.ย. โรงเรียนหนองหญ้าปล้อง อ.หนองหญ้าปล้อง เพชรบุรี
- 7-8 เม.ย. ที่ว่าการอ.บ้านแหลม อ.หนองบ้านแหลม เพชรบุรี
- 11-12 เม.ย. ที่ว่าการอ.แก่งกระจาน อ.หแก่งกระจาน เพชรบุรี
- 19-20 เม.ย. สนามฟุตซอลเทศบาลตำบลท่ายาง อ.เมือง ชุมพร
- 21-22 เม.ย. ที่ว่าการอ.หลังสวน อ.หลังสวน ชุมพร
- 25-26 เม.ย. เทศบาลตำบลน้ำจืด อ.กระบุรี ระนอง
- 27 เม.ย. องค์การบริหารส่วนจังหวัดระนอง อ.เมือง ระนอง
- 28 เม.ย. อ.กะเปอร์ ระนอง
- 29 เม.ย. ที่ว่าการอ.สุขสำราญ อ.สุขสำราญ ระนอง
* ข้อมูลตารางออกหน่วย จาก
เว็บมูลนิธิกาญจนบารมี
ประชาชนในพื้นที่ ติดตามข้อมูล/ประกาศ ได้จากที่ว่าการอำเภอที่ท่านอาศัย ผ่านเพจหรือโทร หรือช่องทางติดต่ออื่นใดของอำเภอนั้นๆ
3. บริการ Home care
บริการ Home care คือ
- บริการเยี่ยมดูแลที่บ้านโดยทีมสุขภาพจากหน่วยบริการ โดยรายละเอียดการดูแลแตกต่างกันไป ตามแผนการดูแล ซึ่งเป็นไปตามสภาวะผู้ป่วย ประกอบด้วย การดูแลที่บ้านกรณีผู้ป่วย LTC และ กรณี ผู้ป่วย PC ตามมาตรฐานบริการ
- มีการเบิกค่าชดเชยบริการ จาก สปสช. ได้ตามเกณฑ์
เวชศาสตร์ฟื้นฟู และกายภาพบำบัด
ให้บริการการดูแลรักษา บริการด้านการรักษา ดังนี้ : เวชศาสตร์ฟื้นฟูระบบประสาท บริการด้านการฟื้นฟู ปัญหาทางระบบประสาท อัมพฤกษ์ อัมพาต เวชศาสตร์ฟื้นฟูระบบกระดูก ข้อ และกล้ามเนื้อ อุปกรณ์เครื่องช่วยผู้พิการ โปรแกรมการดูแลต่อเนื่องหลังจากผู้ป่วยกลับบ้าน เปิดให้บริการ วันจันทร์-ศุกร์ เวลา 08.00-16.00 น.
ติดต่อสอบถามข้อมูลเพิ่มเติม 02-4475582-3Trip 3 : เสาร์ที่ 15 และอาทิตย์ที่ 16 กรกฎาคม ตามรอยลิซ่า นุ่งซิ่น@พระนครศรีอยุธยา (ไปเช้ากลับเย็น)
โรงพยาบาลสัตว์สุโขทัย - กรุงเทพฯ
โรงพยาบาลสัตว์สุโขทัย โรงพยาบาลสัตว์ที่เปิดให้บริการมานาน ประสบการณ์มากกว่า 30 ปี บริการ ฉีดวัคซีน ผ่าตัดเล็ก อัลตร้าซาวด์ ดมยาสลบ ทำหมันสุนัขแมว ฝากเลี้ยง อื่นๆ ร้านเปิดให้บริการ จ.-ส. 10.00-18.00 น. อา. เฉพาะเคสนัดล่วงหน้า (โทรมาสอบถาม) 260/1 ถ.พระรามที่ 5 แขวงสวนจิตรลดา เขตดุสิต Tel 02-2430587
Facebook |
@healthserv.net บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตสวนหลวง
6 อาการฉุกเฉินวิกฤต
6 อาการฉุกเฉินวิกฤต
- หมดสติ ไม่รู้สึกตัว ไม่หายใจ
- ซึมลง เหงื่อแตก ตัวเย็น หรือมีอาการชักร่วม
- เจ็บหน้าอกเฉียบพลัน รุนแรง
- หายใจเร็ว หอบเหนื่อยรุนแรง หายใจติดขัด มีเสียงดัง
- แขนขาอ่อนแรงครึ่งซีก พูดไม่ชัด แบบปัจจุบันทันด่วน หรือชักต่อเนื่องไม่หยุด
- มีอาการอื่นร่วม ที่มีผลต่อการหายใจ ระบบการไหลเวียนโลหิต และ ระบบสมองที่อาจเป็นอันตรายต่อชีวิต
ความเป็นมาร้านกาแฟ Cafe Amazon
คาเฟ่ อเมซอน
ร้านกาแฟ Cafe Amazon ถือกำเนิดขึ้นครั้งแรกในปี 2545 จากวิสัยทัศน์ของผู้บริหาร บริษัท ปตท. จำกัด (มหาชน) ที่เล็งเห็นถึงโอกาสในการเพิ่มศักยภาพทางการตลาดของสถานีบริการน้ำมัน ปตท. จึงได้วางแนวคิดให้เป็นธุรกิจหนึ่งในสถานีบริการน้ำมัน ปตท. ที่สร้างรายได้ให้กับสถานีฯ และตอบสนองต่อไลฟ์สไตร์ของผู้บริโภคและคนเดินทางได้มากขึ้น
การสร้างแบรนด์ "CafeAmazon" เริ่มต้นจากแนวความคิดที่ว่า ประเทศบราซิลซึ่งเป็นต้นตำรับกาแฟและดินแดนแห่งนี้มีป่า Amazon อันเป็นสุดยอดแห่งป่าดงดิบธรรมชาติของโลก ที่อุดมไปด้วยเสน่ห์ของธรรมชาติอันยิ่งใหญ่ ทั้งพืชพรรณแมกไม้ สายน้ำ สัตว์ป่านานาชนิด และยังเป็นแหล่งผลิตอากาศอันบริสุทธิ์ แนวความคิดนี้จึงถูกนำมาเพื่อสร้างสรรค์เป็นร้านกาแฟที่มีบรรยากาศร่มรื่นเย็นสบายด้วยร่มไม้และน้ำล้อมรอบ
โดยตลอดระยะเวลาที่ผ่านมา ร้าน CafeAmazon ถูกพัฒนาให้เป็นจุดนัดพบ แหล่งพักผ่อน สำหรับคนเดินทาง ตกแต่งด้วยโทนสีเขียว นำเสนอภาพลักษณ์แนวธรรมชาติ โดยใช้สวนหย่อมและน้ำพุเพื่อสร้างบรรยากาศ ร่มรื่น เย็นสบาย ความรู้สึกผ่อนคลาย ซึ่งถือเป็นเอกลักษณ์ของร้าน Cafe Amazon เสมือนเป็นโอเอซิสของคนเดินทาง และด้วยเอกลักษณ์รสชาติเครื่องดื่มกาแฟที่เข้มข้น จึงกลายมาเป็นสโลแกนที่ว่า "Taste of Nature"
Our Services
Our Services
Fertility consultation
Infertility check up
Women check up
-Ultrasound scan
-Pep smear + HPV test
-Blood test for Chromosomes study
-Hormone blood test
-Fallopian tube checking (Femvue)
-Hysteroscope
Male check up
-Sperm analysis
-Sperm DNA Fragmentation
-Blood test for Chromosomes study
Fertility treatment
-Timing Sexual intercross
-IUI (IntraUterine Insemination)
-IVF (In-Vitro Fertilization)
-minimal stimulation
-conventional stimulation
-ICSI (Intracytoplasmic Sperm Injection)
-Embryo Culture
-Sperm preparation
-Macs Sperm preparation
-PESA/TESA
-PGS (Preimplantation Genetic Screening before Embryo Transfer)
-Embryo transfer
-SEET / 2Stage Technique for Embryo Transfer
Oocyte / Embryo / Sperm Freezing
NIPT test
Our Special Technique
- SEET (Stimulation of Endometrium –Embryo Transfer) is Our inhouse development technique by Dr.Masahide Shiotani to stimulate the endometrium to prepare for Embryo implantation.
- 2 Stage Embryo Transfer, to increase a chance of implantation.
- MACS (Magnetic- activated cell sorting) Sperm preparation is the method used in the sperm preparation process to reduce apoptotic sperm and Improved acrosome reaction.
- Time Lapse System Incubation, Built-in camera and microscopy incubator for 24 hrs. monitoring Embryo development inside the incubator, to reduce the risk from uncontrolled environments outside the incubator during Embryo culture duration.
Treatment matching
For new marriage couples who prepare to have a baby.
- Fertility consultation
- Infertility check up
For couples who have tried conceiving moreover 6-12 months, age less than 35 years old.
- Infertility check up
- Fertility consultation
- Timing SI by Stimulation cycle or IUI
For couples who have failed IUI more than 3times, assume the fallopian tube is blocked.
- Infertility check up
- Femvue to check the fallopian tube
- Fertility consultation
- IVF / ICSI
For couples who have experience in implantation failure.
- Infertility check up
- Fertility consultation
- ICSI + PGS
For couples who have problems with male infertile, low fertilization rate, less number of Blastocyst Embryo.
- Infertility check up
- Fertility consultation
- Sperm fragmentation test
- MACS Sperm preparation
- ICSI + PGS
For couples who have low levels of AMH hormones.
- IVF/ICSI with minimal stimulation
For single women who plan for having a baby/ age more than 30 years old.
2. Terms & Conditions policy
Visitors are recommended to read the privacy policy caretully belore usage.
Terms and conditions are apart of Thailand COVID-19 preventive measure. Furthemnore this application is a monitoring system that support contingency management for Thailand; served as a COVID-19 spreading tracing tool.
When visitors read throughly and mark on Iaccept these terms and conditions on box, they have accepted the personal data protection set forth by this policy.
หากท่านพัฒนาสินค้าหรือมีสินค้าจากสูตรกัญชา พร้อมจะนำเสนอ เรายินดีเผยแพร่ โปรดส่งข้อมูลมาที่ healthserv.net@gmail.com
Recommended vaccine for travelers : วัคซีนสำหรับผู้เดินทางระหว่างประเทศ
การสร้างเสริมภูมิคุ้มกันสำหรับผู้เดินทางไปต่างประเทศนับเป็นเรื่องสำคัญ เพราะประเทศจุดหมายที่เรา จะเดินทางไปอาจเกิดโรคระบาดหรือมีโรคติดต่อบางอย่างเป็นโรคประจำถิ่น ซึ่งผู้เดินทางเข้าไปในประเทศหรือ พื้นที่นั้นๆ อาจจะไม่มีภูมิคุ้มกันโรคนั้นๆ อยู่ทำให้มีความเสี่ยงในการติดโรค และบ่อยครั้งที่ประเทศจุดหมายปลายทาง กำหนดกฎหมายหรือระเบียบในการสร้างเสริมภูมิคุ้มกันของผู้เดินทางเข้าประเทศตามความเหมาะสมของตนเอง ดังนั้นผู้เดินทางจึงควรสร้างเสริมภูมิคุ้มกันโรคก่อนการเดินทาง โดยควรปรึกษาแพทย์อย่างน้อย 4-6 สัปดาห์ก่อน การเดินทาง เนื่องจากร่างกายต้องใช้เวลาในการสร้างภูมิคุ้มกันหลังการให้วัคซีน และวัคซีนบางชนิดต้องให้หลายครั้ง ก่อนที่ร่างกายจะสร้างภูมิคุ้มกันในระดับที่สามารถป้องกันโรคได้
อย่างไรก็ตาม แม้จะมีการเสริมสร้างภูมิคุ้มกันโดยวัคซีนก่อนออกเดินทางแล้ว ไม่ได้หมายความว่า ผู้เดินทางจะปลอดภัยจากโรคติดต่อดังกล่าว ความปลอดภัยของผู้เดินทางจะต้องระวังตัวป้องกันไม่ให้เกิดโอกาสเสี่ยง ต่อการเกิดโรคโดยไม่จำเป็น เช่น การเลือกบริโภคอาหารหรือน้ำที่สะอาดถูกอนามัย
ผู้เดินทางกลุ่มพิเศษ
ทารกและเด็ก
ทารกและเด็กควรได้รับวัคซีนตามแผนการสร้างเสริมภูมิคุ้มกันโรคของกระทรวงสาธารณสุขให้ครบถ้วน ตามอายุ โดยทั่วไปไม่แนะนำให้เด็กอายุต่ำกว่า 9 เดือน เข้าไปในพื้นที่ที่มีการระบาดของไข้เหลือง เนื่องจากวัคซีน ป้องกันโรคไข้เหลืองจะไม่ให้แก่เด็กก่อนอายุ 9 เดอื น อย่างไรก็ดีในเด็กอายุ 6-8 เดือน ถ้าจำเป็น ต้องเดินทางเข้าไป ในพื้นที่เสี่ยงและไม่สามารถป้องกันไม่ให้ยุงกัดได้ดี อาจพิจารณาให้วัคซีนไข้เหลืองได้ แต่ต้องพิจารณาเป็นรายๆ ไป ส่วนเด็กอายุน้อยกว่า 6 เดือนถือเป็นข้อห้ามในการรับวัคซีนไข้เหลือง
วัยรุ่นและวัยหนุ่มสาว
วัยรุ่นและวัยหนุ่มสาวเป็นกลุ่มที่มีความเสี่ยงสูงต่อการติดเชื้อมากเพราะส่วนใหญ่เดินทางอย่างประหยัด ดังนั้นจึงอาจพักอาศัยในสถานที่ที่มีระบบสุขาภิบาลต่ำกว่ามาตรฐาน (โดยเฉพาะอย่างยิ่งกลุ่มเดินทางที่มีกระเป๋า สัมภาระสะพายหลัง) รวมถึงพฤติกรรมทางเพศและความเสี่ยงอื่นๆ ที่เกิดขึ้นจากฤทธิ์ของแอลกอฮอล์หรือยา คนกลุ่มนี้จึงควรได้รับคำแนะนำให้รับวัคซีนป้องกันโรคที่เหมาะสมก่อนออกเดินทางและระมัดระวังหลีกเลี่ยงโอกาส ติดเชื้อโรคต่างๆ ไปพร้อมกันด้วย
ผู้เดินทางเป็นประจำ
ผู้ที่เดินทางเป็นประจำโดยเฉพาะทางเครื่องบินอาจละเลยการดูแลสุขภาพตนเอง การเดินทางที่นับจำนวน ไม่ถ้วนและไม่เคยเกิดปัญหาด้านสุขภาพมาก่อนจึงอาจทำให้ไม่ได้ตรวจตราว่าตัวเองได้รับ การสร้างภูมิคุ้มกันครบถ้วน หรือยัง
ผู้เดินทางนาทีสุดท้ายหรือเดินทางกะทันหัน
ผู้เดินทางหลายต่อหลายคนต้องเดินทางกะทันหัน ดังนั้นจึงเป็นการยากที่จะได้รับวัคซีนหลายชนิดในเวลา อันสั้น ถ้าไม่อาจได้รับวัคซีนก่อนจะเดินทางได้ครบถ้วน อาจจะขอรับวัคซีนโด๊สที่เหลือในประเทศปลายทางหลังช่วง เวลาที่เหมาะสมได้
หญิงตั้งครรภ์
การตั้งครรภ์ไม่ใช่ข้อห้ามไม่ให้รับวัคซีน ถ้าวัคซีนชนิดนั้นปลอดภัยและมีผลในการป้องกันโรคทั้งมารดา และทารกในครรภ์ แต่ต้องใช้ความระมัดระวังอยู่บ้างในการหลีกเลี่ยงวัคซีนบางชนิดที่อาจเกิดอันตรายต่อทารกใน ครรภ์ได้ วัคซีนทำจากเชื้อตาย, toxoids, polysaccharide และวัคซีน IPV ถือว่ามีความปลอดภัยสำหรับหญิง มีครรภ์ ส่วนวัคซีนเชื้อมีชีวิตอ่อนฤทธิ์ เช่น วัคซีน MMR, BCG, Varicella, วัคซีนป้องกันโรคไข้เหลือง วัคซีน ไทฟอยด์ชนิดกิน, วัคซีนเจอี จะเป็นวัคซีนต้องห้ามเพราะตามทฤษฎีแล้วจะเสี่ยงต่อทารกในครรภ์ และเป็นวัคซีนที่ต้อง หลีกเลี่ยง แต่ความเสี่ยงและประโยชน์ที่จะได้จากวัคซีนเชื้อยังมีชีวิตต้องแยกพิจารณาเป็นรายๆ เช่น หญิงตั้งครรภ์ ถ้าจำเป็นต้องเดินทางเข้าไปในพื้นที่เสี่ยงต่อการติดโรคไข้เหลืองอย่างหลีกเลี่ยงไม่ได้ อาจพิจารณาให้วัคซีนไข้เหลือง
ผู้เดินทางสูงอายุ
- ผู้สูงอายุอาจไม่เคยได้รับวัคซีนที่แนะนำให้ตามปกติ หรือภูมิคุ้มกันที่เคยมีอาจตกต่ำลง ทำให้ไวต่อ การติดเชื้อโรคได้ง่าย เช่น คอตีบ ไอกรน บาดทะยัก และโปลิโอ เช่นเดียวกับโรคติดเชื้อประจำถิ่นอื่นๆ ในประเทศ จุดหมายปลายทาง
- ผู้เดินทางที่สูงอายุที่ไม่เคยได้รับการสร้างเสริมภูมิคุ้มกันโรคควรได้รับการสร้างเสริมภูมิคุ้มกันพื้นฐานครบชุด ตั้งแต่ Tdap, IPV และ HB และสำหรับผู้ไม่มีภูมิคุ้มกันโรคตับอักเสบเอ ควรได้รับวัคซีนดังกล่าวก่อนออกเดินทาง ไปยังประเทศที่กำลังพัฒนา
- ผู้เดินทางสูงอายุมีความเสี่ยงต่อการเกิดอาการแทรกซ้อนที่รุนแรงของโรคไข้หวัดใหญ่ จึงควรได้รับวัคซีน ไข้หวัดใหญ่อย่างสม่ำเสมอทุกปี และควรพิจารณารับการฉีดวัคซีน Pnc ด้วย
ผู้เดินทางที่มีปัญหาการเจ็บป่วยเรื้อรัง
ผู้เดินทางที่มีปัญหาการเจ็บป่วยเรื้อรัง เช่น ภูมิคุ้มกันบกพร่องเป็นโรคมะเร็ง โรคเบาหวาน หรือกำลัง รับรักษาด้วยยากดภูมิคุ้มกันจะมีโอกาสเสี่ยงจากอาการแทรกซ้อนเมื่อได้รับวัคซีนที่เชื้อยังมีชีวิต ดังนั้นจึงต้องแนะนำ ให้หลีกเลี่ยงวัคซีน MMR, OPV, BCG, Varicella, วัคซีนไข้เหลือง และวัคซีนทัยฟอยด์ (ชนิดกิน) ถ้าจำเป็นต้อง เดินทางไปยังประเทศที่ต้องการเอกสารรับรองการฉีดวัคซีนโรคไข้เหลือง ผู้เดินทางต้องขอหนังสือรับรองจากแพทย์ เพื่อขอยกเว้นการฉีดวัคซีนดังกล่าว
ผู้เดินทางที่มีปัญหาหัวใจและระบบการไหลเวียนของเลือด และ/หรือ โรคทางเดินหายใจ หรือ โรคเบาหวาน เป็นกลุ่มเสี่ยงสูงที่จะติดเชื้อไข้หวัดใหญ่รุนแรงและเกิดอาการแทรกซ้อนของโรคดังกล่าวด้วย จึงแนะนำให้รับ การฉีดวัคซีนป้องกันโรคไข้หวัดใหญ่ทุกปี และ วัคซีน Pnc ด้วย สำหรับผู้ที่ไม่มีม้าม หรือม้ามไม่ปกติ จะแนะนำให้ รับวัคซีนเพิ่มได้แก่ วัคซีน Hib, Mnc และ Pnc
ผู้ที่ติดเชื้อเอชไอวี ควรได้รับวัคซีนให้ครบถ้วนเช่นเดียวกับคนปกติ รวมทั้งควรได้รับวัคซีนไข้หวัดใหญ่ Pnc โดยมีข้อยกเว้นดังต่อไปนี้ :
- วัคซีน MMR ให้ได้ตามปกติ ยกเว้นถ้าผู้เดินทางมีภาวะภูมิคุ้มกันบกพร่องมาก (เช่น เป็น HIV ที่มีระดับ CD 4 < 200 เซลล์/มม.3 หรือ < 15% ในเด็ก) ถือเป็นข้อห้ามในการรับวัคซีน
- วัคซีน BCG ให้ได้เฉพาะผู้ที่ยังไม่มีอาการของโรค (แต่สำหรับคนไทยไม่จำเป็นต้องรับ BCG เพราะมีการให้เป็นวัคซีนพื้นฐานตั้งแต่แรกเกิด เนื่องจากมีความชุกของโรคสูงในประเทศไทย)
- วัคซีนไข้เหลือง เป็นข้อห้ามในกลุ่มผู้ป่วยโรคภูมิคุ้มกันบกพร่องที่มี CD4 น้อยกว่า 200 เซลล์/ตร.มม. ส่วนผู้ที่มี CD4 200-499 เซลล์/ตร.มม. สามารถพิจารณาให้วัคซีนไข้เหลืองได้ถ้าจำเป็นต้องเดินทางเข้าไปในพื้นที่เสี่ยง
มุกดาหาร มหาสงกรานต์ สรงน้ำพระใหญ่และสรงน้ำรอยพระพุทธบาท เสริมสิริมงคลปีใหม่ไทย
มุกดาหาร มหาสงกรานต์ สรงน้ำพระใหญ่และสรงน้ำรอยพระพุทธบาท เสริมสิริมงคลปีใหม่ไทยอีกทั้งไหว้ขอพรพญาศรีมุกดามหามุนีนีลปานนาคราช พญานาคที่คอยปกปักรักษาพระเจ้าใหญ่แก้วมุกดาศรีไตรรัตน์ ณ วัดรอยพระพุทธบาทภูมโนรมย์ อำเภอเมือง จังหวัดมุกดาหารมหาสารคาม - กักตัว 14 วัน+scan QR-code LINK
7 เมย 64
[ประกาศ] มหาสารคาม ขอให้ประชาชนที่เดินทางมาจาก 5 จังหวัด
กรุงเทพมหานคร นครปฐม นนทบุรี ปทุมธานี และสมุทรปรากร
ขอความร่วมมือให้ไปรายงานตัวกับเจ้าหน้าที่สาธารณสุข ณ สถานบริการสาธารณสุขใกล้บ้าน หรือ
scan QR-code เพื่อประเมินอาการและความเสี่ยงในการติดเชื้อโควิด-19 และสังเกตอาการตัวเองที่บ้าน 14 วัน
และขอให้ปฏิบัติตามมาตรการด้านสาธารณสุข D-M-H-T-T
เพจ
สสจ.มหาสารคาม
โทร สายด่วนโควิดมหาสารคาม 095-180-7712 (24 ชม)
รพ.มหาสารคาม 043-711750
เมื่อไหร่? ต้องไปตรวจโควิด-19
ตาก - สวมหน้ากากออกจากบ้าน ฝ่าฝืนปรับ 20,000 (เริ่ม 22 เมย 64) LINK
มาตรการป้องกัน ควบคุมโรคติดเชื้อไวรัสโคโรนา 2019 จังหวัดตาก(เพิ่มเติม) ตามคำสั่งจังหวัดตากที่ 1287/2564 ลงวันที่ 22 เมษายน 2564 ให้ประชาชนในพื้นที่จังหวัดตากสวมหน้ากากอนามัยหรือหน้ากากผ้าทุกครั้งตลอดเวลาที่ออกนอกเคหสถาน(บ้านเรือนหรือที่อยู่อาศัย) ทั้งนี้ ตั้งแต่วันที่ 22 เมษายน 2564 เป็นต้นไป จนกว่าจะมีคำสั่งเปลี่ยนแปลง
ประกันแพ้วัคซีน COVID-19 V-Care LINK
V-Care ประกันแพ้วัคซีน COVID-19
เบี้ยเริ่มต้นเพียง 95 บาท
คุ้มครองสูงสุด 1,000,000 บาท
รับเงินชดเชยรายได้รายวันกรณีนอนโรงพยาบาลจากการแพ้วัคซีน COVID-19 สูงสุด 3,000 บาท/วัน
คำแนะนำในผู้ป่วยโรคทางโลหิตวิทยา LINK
คำแนะนำทั่วไป ผู้ป่วยโรคโลหิตวิทยารวมทั้งผู้ดูแลผู้ป่วยทุกคนควรได้รับการฉีดวัคซีนโควิด-19 โดยสามารถรับชนิดใดก็ได้ที่มีในประเทศไทย
ถาม: ผู้ป่วยที่มีปัญหาเลือดออกง่าย เกล็ดเลือดต่ำหรือเกล็ดเลือดทำงานผิดปกติ รับประทานยาต้านเกล็ดเลือดหรือยาต้านการแข็งตัวของเลือด สามารถรับการฉีดวัคซีนโควิด-19 ได้หรือไม่
ตอบ: ได้แนะนำให้รับการฉีดวัคซีน โดยใช้เข็มฉีดยาขนาดเล็ก (25 หรือ 27) ที่กล้ามเนื้อต้นแขน หลังฉีดวัคซีนให้กดนานประมาณ 5 นาทีด้วยตนเอง จากนั้นอาจใช้น้ำแข็งหรือเจลประคบเย็นช่วยประคบหลังฉีดวัคซีนได้
ถาม: ผู้ป่วยที่รับประทานยาต้านการแข็งตัวของเลือดวอร์ฟาริน มีข้อแนะนำอย่างไรในการฉีดวัคซีน
ตอบ: รับวัคซีนได้แนะนำให้ตรวจ INR ภายใน 1 สัปดาห์ก่อนฉีดวัคซีน หาก INR < 4 สามารถรับการฉีดวัคซีนได้โดยไม่จำเป็นต้องหยุดหรือปรับขนาดยา หากไม่มีผล INR แต่ระดับ INR ก่อนหน้านี้อยู่ในระดับ 2-3 มาโดยตลอด สามารถรับการฉีดวัคซีนได้
ถาม: ผู้ป่วยมะเร็งทางโลหิตวิทยา ได้แก่โรคมะเร็งต่อมน้ำเหลือง ผู้ป่วยโรคมะเร็งเม็ดเลือดขาวมัยอีโลมา (MM) และมะเร็งเม็ดเลือดขาวลิวคีเมีย ควรรับการฉีดวัคซีนโควิด-19 หรือไม่
ตอบ: ควร เนื่องจากผู้ป่วยกลุ่มนี้มีภูมิต้านทานต่ำ หากติดเชื้อไวรัสจะทำให้มีโอกาสเกิดอาการรุนแรงได้
ถาม: ผู้ป่วยมะเร็งทางโลหิตวิทยา ควรได้รับวัคซีนโควิด-19 เมื่อใด
ตอบ: สามารถรับวัคซีนได้ตั้งแต่แรกวินิจฉัย ระหว่างรับการรักษา หรือเมื่อรักษาครบแล้ว
* ในระหว่างรับการรักษาให้ขึ้นกับการพิจารณาของแพทย์ผู้ดูแล โดยหลีกเลี่ยงการรับวัคซีนในช่วงที่มีเม็ด เลือดขาวต่ำรุนแรง
** ในผู้ที่ได้รับการรักษาด้วยยามุ่งเป้า การสร้างภูมิคุ้มกันหลังจากการฉีดวัคซีนโควิด-19 อาจต่ำกว่าใน คนปกติ
ถาม: ผู้ป่วยโรคไขกระดูกฝ่อ หรือ ไขกระดูกทำงานผิดปกติ(MDS หรือ MPN) ควรรับการฉีดวัคซีนโควิด-19 หรือไม่
ตอบ: ควร เนื่องจากผู้ป่วยมีภูมิต้านทานต่ำ หากติดเชื้อไวรัสจะทำให้มีโอกาสเกิดอาการรุนแรงได้
ถาม: ผู้ป่วยโรคทางโลหิตวิทยา ที่รับการรักษาด้วยการปลูกถ่ายสเต็มเซลล์หรือภูมิคุ้นกันบำบัด CAR-T cell ควรรับวัคซีนโควิด-19 หรือไม่
ตอบ: ควร โดยรับวัคซีนหลังปลูกถ่ายสเต็มเซลล์หรือภูมิคุ้มกันบำบัด CAR-T cell 3 เดือน เพื่อให้วัคซีนสามารถกระตุ้นภูมิต้านทานได้ดี
*ช่วงเวลาที่เหมาะสม ขึ้นกับการพิจารณาของแพทย์ผู้ดูแล
ถาม: ผู้ป่วยโรคเลือดจางธาลัสซีเมีย ควรรับการฉีดวัคซีนโควิด-19 หรือไม่
ตอบ: ควร โดยขึ้นกับการอนุมัติให้ใช้วัคซีนตามกลุ่มอายุของผู้ป่วย
* วัคซีนโควิด-19 ทุกชนิดในประเทศไทย สามารถฉีดให้แก่ผู้ที่มีอายุ 18 ปีขึ้นไป สำหรับผู้ที่อายุน้อยกว่า 18 ปี ขึ้นกับชนิดของวัคซีนที่ได้รับอนุมัติให้ใช้ได้
ถาม: ผู้ดูแลใกล้ชิดผู้ป่วยโรคทางโลหิตวิทยา ควรรับการฉีดวัคซีนโควิด-19 หรือไม่
ตอบ: ควร เมื่อมีความพร้อมของวัคซีน เพื่อลดโอกาสติดเชื้อของผู้ดูแล ซึ่งอาจแพร่เชื้อให้แก่ผู้ป่วยได้
ศาสตราจารย์ ดร. นายแพทย์ วาเลนติน ฟัสเตอร์ สำเร็จการศึกษาแพทยศาสตร์บัณฑิต จากมหาวิทยาลัยบาเซโลน่า ประเทศสเปน และดุษฎีบัณฑิต จากมหาวิทยาลัยเอดินเบอระ สหราชอาณาจักร
ตั้งแต่ปี พ.ศ.2513 เป็นต้นมา ศาสตราจารย์ ดร. นายแพทย์วาเลนติน ฟัสเตอร์ ได้ทำการศึกษาวิจัยถึงบทบาทของเกล็ดเลือดในกระบวนการเกิดการอุดตันของหลอดเลือดหัวใจ รวมถึงประโยชน์ของการให้ยาต้านเกล็ดเลือดในการป้องกันการอุดตันของหลอดเลือดที่นำมาใช้เป็นทางเบี่ยงภายหลังจากการผ่าตัดทำทางเบี่ยงหลอดเลือดหัวใจ โดยเริ่มในสัตว์ทดลอง และต่อมาได้ต่อยอดมาเป็นการศึกษาวิจัยในผู้ป่วย ได้แสดงให้เห็นเป็นครั้งแรกถึงประโยชน์ของการให้ยาต้านเกล็ดเลือดในการป้องกันการอุดตันของหลอดเลือดที่นำมาใช้เป็นทางเบี่ยงภายหลังจากการผ่าตัดทำทางเบี่ยงหลอดเลือดหัวใจในผู้ป่วย อีกทั้งองค์ความรู้ที่ได้นี้มีส่วนทำให้เกิดการพัฒนาแนวคิดในการสร้างขดลวดค้ำยันชนิดเคลือบยา เพื่อนำมาใช้ในผู้ป่วยกล้ามเนื้อหัวใจขาดเลือดเฉียบพลันที่จำเป็นต้องได้รับการรักษาด้วยการขยายหลอดเลือดหัวใจด้วยบอลลูนและใส่ขดลวด องค์ความรู้ที่ได้จากงานวิจัยของ ศาสตราจารย์ ดร. นายแพทย์ฟัสเตอร์ ได้ช่วยทำให้อัตราการเจ็บป่วยและการเสียชีวิตในผู้ป่วยลดลงอย่างมาก และยังช่วยปรับปรุงให้การดูแลผู้ป่วยโรคหลอดเลือดหัวใจอุดตันดีมากยิ่งขึ้นอีกด้วย
จากผลงานของศาสตราจารย์ ดร.นายแพทย์ วาเลนติน ฟัสเตอร์ ที่เชื่อมโยงนำเอาองค์ความรู้ที่ได้จากงานวิจัยพื้นฐาน ไปต่อยอดจนกระทั่งเกิดเป็นองค์ความรู้ใหม่ที่ถูกนำไปใช้ในการรักษาผู้ป่วยที่มีหลอดเลือดหัวใจตีบตัน โดยเฉพาะอย่างยิ่งประโยชน์ของการให้ยาต้านเกล็ดเลือดในการป้องกันการอุดตันของหลอดเลือดที่นำมาใช้เป็นทางเบี่ยงภายหลังจากการผ่าตัดทำทางเบี่ยงหลอดเลือดที่ตีบตัน ผลงานนี้ได้ช่วยชีวิตผู้ป่วยโรคหลอดเลือดหัวใจตีบตันนับล้านคนทั่วโลก
ผศ. นพ. พลกฤต ทีฆคีรีกุล แพทย์ผู้ชำนาญการด้านอายุรศาสตร์โรคหัวใจ และเวชพันธุศาสตร์ โรงพยาบาลเพชรเวช รับผู้ประกันตนเพิ่มได้อีก 5,000 สิทธิ์ LINK
นับถอยหลัง 7 วัน กับการเปลี่ยนสิทธิประกันสังคมมาที่โรงพยาบาลเพชรเวช ด้วยความพร้อมทีมแพทย์เฉพาะทาง และเทคโนโลยีมาตรฐานชั้นนํา โรงพยาบาลเพชรเวชสามารถรับผู้ประกันตนเพิ่มได้อีก 5,000 สิทธิ์ ติดต่อสอบถามเพิ่มเติม Line official
✅ สิทธิการรักษา Hospitel โดยไม่เสียค่าใช้จ่าย
✅ ตรวจ ATK โดยไม่เสียค่าใช้จ่าย
ยุทธศาสตร์ที่ 1 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านสาธารณสุข
ยุทธศาสตร์ที่ 1 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านสาธารณสุข
กลยุทธ์
1. เร่งการฉีดวัคซีนเข็มกระตุ้น ≥60%
2. ปรับระบบการเฝ้าระวัง เน้นการระบาดเป็นกลุ่มก้อนและผู้ป่วยปอดอักเสบ
3. ผ่อนคลายมาตรการสําหรับผู้เดินทางจากต่างประเทศ
4. ปรับแนวทางแยกกักผู้ป่วย และกักกันผู้สัมผัส
โดยมีรายละเอียดมาตรการแบ่งตามระยะดําเนินการ ดังนี้
EP. 3.2 สิทธิในการเพิกถอนความยินยอม Right to Withdraw Consent - มาตรา 19 LINK
EP. 3.2 สิทธิในการเพิกถอนความยินยอม Right to Withdraw Consent - มาตรา 19
.
หากเราเคยตกลงยินยอมเกี่ยวกับบริการเสริม และกังวลว่าจะถูกเก็บข้อมูลส่วนบุคคลมากจนเกินไป
สามารถของเพิกถอนความยินยอมนั้นได้หรือไม่???
.
หลักการสำคัญคือ เจ้าของข้อมูลส่วนบุคคลมีสิทธิที่จะเพิกถอนความยินยอมเมื่อใดก็ได้ (มาตรา19)
* ในกรณีที่เป็นการเก็บรวบรวมข้อมูลจากการให้ความยินยอม (Consent)
.
การเพิกถอนความยินยอมจะอยู่ในรูปแบบใดก็ได้ เช่น ทางอิเล็กทรอนิกส์ หรือทำเป็นเอกสารที่เป็นลายลักษณ์อักษร โดยการเพิกถอนจะต้อง มีความชัดเจน เข้าใจง่าย และไม่ยากไปกว่าการขอความยินยอม
.
เมื่อผู้ควบคุมข้อมูลส่วนบุคคลส่วนบุคคลได้รับคำขอการเพิกถอนจากเจ้าของข้อมูลแล้ว
จะต้อง “แจ้งถึงผลกระทบ” จากการถอนความยินยอมและ “หยุดการประมวลผล”
*กรณีการขอถอนความยินยอมโดยผู้เยาว์ให้เป็นไปตามหลักเกณฑ์ในการขอความยินยอม
และ การถอนความยินยอมไม่ส่งผลกระทบต่อการประมวลผลที่ให้ความยินยอมไปแล้ว
.
* การประมวลผล หมายถึง การเก็บรวบรวม ใช้หรือเปิดเผยข้อมูลส่วนบุคคล
.
หากผู้ควบคุมข้อมูลส่วนบุคคลไม่แจ้งถึงผลกระทบจากการถอนความยินยอม
ต้องระวางโทษปรับทางปกครองไม่เกิน 1,000,000 บาท (มาตรา 82)
.
ติดตามประเด็นเกี่ยวกับสิทธิได้ในครั้งต่อไป
เพื่อที่คุณจะไม่พลาดสิทธิของคุณ และเตรียมพร้อมรับมือได้อย่างถูกต้อง...
วัณโรคเยื่อหุ้มสมองอับเสบ (TB Meningitis)
วัณโรคเยื่อหุ้มสมองอับเสบ (TB Meningitis) เป็นวัณโรคชนิดรุนแรงของเยื่อหุ้มสมอง มีความสัมพันธ์กับอัตราการเสียชีวิต และความพิการสูง สำหรับการรักษา ผู้เชี่ยวชาญแนะนำให้รักษานานอย่างน้อย 9-12 เดือน เพื่อป้องกันการกลับมาเป็นซ้ำ
เพราะการมีสุขภาพที่ดีนำมาซึ่งความสุข บีดีเอ็มเอส เวลเนส คลินิก จึงสนับสนุนให้ทุกคนหันมาดูแลสุขภาพ เพื่อให้มีชีวิตที่ยืนยาวอย่างมีคุณภาพ แม้กระทั่งสูงวัยถ้ารู้จักดูแลและป้องกันแต่เนิ่นๆ อายุก็เป็นเพียงแค่ตัวเลข
BDMS Wellness Clinic มุ่งมั่นพัฒนาและวิจัยเรื่องสุขภาพ เพื่อมอบเป็นของขวัญแก่คนไทยทุกคน เพราะสุขภาพที่ดี คือของขวัญที่ดีที่สุด Live longer, Healthier and Happier
สอบถามข้อมูลเพิ่มเติมได้ที่ บีดีเอ็มเอส เวลเนส คลินิก (BDMS Wellness Clinic)
เว็บไซต์ www.bdmswellness.com
หลักสูตรบริหารจัดการสถานพยาบาล - อ.รดา เพ็ชรขัน
ท้ายสุด
อาจารย์รดา เพ็ชรขัน ผู้อำนวยการโรงเรียนนวัตกรรมการบริหารจัดการสถานพยาบาล ได้บรรยายถึงการจัดทำหลักสูตรมาจากปัจจุบันสถานพยาบาลและโรงพยาบาลเพิ่มจำนวนมากขึ้น มีการแข่งขันเพื่อสร้างคุณภาพและมาตรฐานในการให้บริการ ในขณะที่ผู้รับบริการต่างก็มีความต้องการและคาดหวังที่จะได้รับการบริการอย่างทั่วถึง รวดเร็ว มีคุณภาพและมาตรฐานมากยิ่งขึ้น
ซึ่งสวนทางกับปัญหาการให้บริการด้านสุขภาพของสถานพยาบาลในประเทศไทย จากการที่บุคลากรทางการแพทย์ต้องรับภาระงานที่ได้รับมอบหมายนอกเหนือจากการปฏิบัติวิชาชีพคือ งานสนับสนุนที่ได้รับมอบหมายให้ปฏิบัติควบคู่ไปกับการให้บริการรักษาพยาบาล และการบริการทางการแพทย์ ซึ่งการปฏิบัติงานดังกล่าวนี้ส่งผลต่อการทำงานของบุคลากรทางการแพทย์ และส่งผลกระทบโดยตรงต่อคุณภาพในการให้บริการผู้ป่วยที่มารับบริการ
ด้วยเหตุผลดังกล่าวนี้ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ เห็นเป็นโอกาสอันดียิ่งที่จะได้มีส่วนช่วยในการแก้ไขปัญหาการใช้บุคลากรวิชาชีพไม่ตรงตามมาตรฐานวิชาชีพ หรือภาระงานที่ไม่ใช่ภาระงานโดยตรง จึงได้จัดตั้งโรงเรียนนวัตกรรมการบริหารจัดการสถานพยาบาล และพัฒนาหลักสูตรประกาศนียบัตร สาขาวิชานวัตกรรมการจัดการงานธุรการสถานพยาบาล หลักสูตร 1 ปี เป็นหลักสูตรแรกและหลักสูตรเดียวในประเทศไทย จัดการศึกษาที่มุ่งเน้นการฟื้นฟู และพัฒนาทักษะ (Re-skills and Up-skills) ด้วยกระบวนการเรียนการสอนแบบบูรณาการความรู้ควบคู่กับการปฏิบัติงาน (WIL: Work Integrate Learning) เพื่อผลิตผู้สำเร็จการศึกษาที่มีองค์ความรู้ มีทักษะและมีคุณลักษณะเฉพาะที่เหมาะสม มีความพร้อมปฏิบัติงานในการสนับสนุนการดำเนินงานของสถานพยาบาล ตามความชำนาญเฉพาะที่ผู้เรียนเลือกศึกษาอย่างมีคุณภาพ
หัวเฉียว บริการ Hospitel รักษาฟรี ไม่มีค่าใช้จ่าย LINK
โรงพยาบาลหัวเฉียว ร่วมกับ The Chateau Palace Hotel ปิ่นเกล้า (มาตรฐานบริการโดยโรงแรมโอ๊ควู๊ด) เปิดให้บริการ Hospitel รองรับการดูแลรักษาผู้ป่วยติดเชื้อ COVID-19
ผู้ที่มีผลตรวจ ATK หรือ RT-PCR เป็นบวก รักษาฟรี ไม่มีค่าใช้จ่าย
ห้องผู้ป่วยพิเศษรับส่งต่อผู้ติดเชื้อ ด้วยมาตรฐานการดูแลรักษาผู้ป่วย COVID-19 ภายใต้การดูแลของทีมแพทย์ พยาบาล โรงพยาบาลหัวเฉียว
ผู้ป่วยสามารถใช้สิทธิประกันสุขภาพ ประกันโควิด ประกันสังคม หรือสิทธิบัตรทอง *โดยไม่เสียค่าใช้จ่าย
ดูแลโดยทีมบุคลากรทางการแพทย์ ตลอด 24 ชั่วโมง สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกรับผู้ป่วยใน โทร. 0-2223-1351 ต่อ 3122, 3123 : ตลอด 24 ชั่วโมง
อาจาโร เฮิร์ป ก้าวที่มั่นคงของสินค้าสมุนไพรไทย
อาจาโร เฮิร์ป เป็นแบรนด์สินค้าสมุนไพรไทย ของโรงพยาบาลพระอาจารย์ฝั้น อาจาโร จ.สกลนคร ที่กำเนิดโดยสืบสานศาสตร์แพทย์แผนไทย เภสัชสมุนไพรไทย สืบทอดสู่ปัจจุบันด้วยศาสตร์การแพทย์และเภสัชศาสตร์ระดับสากล มีผลงานค้นคว้าวิจัยสนับสนุน ผลิตภัณฑ์ออกแบบ ผลิตและพัฒนาบนข้อมูลวิทยาศาสตร์การแพทย์ การผลิตที่ได้มาตรฐาน คุณภาพ GMP และรับรองโดยอย. เป็นหนึ่งในต้นแบบห่วงโซ่ที่ครบถ้วนทั้งการผลิตวัตถุดิบโดยการผสานความร่วมมือกับชุมชนและเกษตรกร การสกัดสารสกัด และผลิตเป็นสินค้า ดังนั้น รายได้และผลประโยชน์ จากการสนับสนุนของผู้บริโภค จะส่งต่อไปยังเกษตรกรต้นน้ำ และสนับสนุนงานวิชาการ นับว่าได้ประโยชน์สูงยิ่งนัก
SRK Touch โรงพยาบาลสมเด็จพระนางเจ้าสิริกิติ์ LINK
แอพพลิเคชั่น SRK Touch โรงพยาบาลสมเด็จพระนางเจ้าสิริกิติ์ สำหรับผู้ป่วยของ รพ.สมเด็จพระนางเจ้าสิริกิติ์ ท่านจะสามารถตรวจสอบคิว , การนัดหมาย , ประวัติการรักษา, ประวัติแพ้ยา, ผล Lab , X-Ray และติดตามสถานะคิว จาก Application นี้ และในคนไข้ที่มาตรงนัด สิทธิ์สวัสดิการข้าราชการ สามารถลงทะเบียนผ่านตู้ Kiosk เพื่อไปยังห้องตรวจต่างๆ ซึ่งจะได้บัตรคิว และใบรับรองสิทธิ์อยู่ในใบเดียวกัน หรือกรณีมาเจาะเลือดล่วงหน้าภายใน 7 วัน สามารถออกใบรับรองสิทธิ์ได้ที่ตู้นี้ โดยไม่ต้องไปที่ห้องรับรองเพื่อออกสิทธิ์ แต่สำหรับท่านที่มาตรงนัด แต่ไม่ได้ทำการนัดในระบบ EMR จะไม่สามารถใช้งานผ่านตู้ได้ค่ะ สิทธิ์ที่ใช้งานผ่านตู้ได้คือ สิทธิ์สวัสดิการข้าราชการ, พลเรือนชำระเงินสด ส่วนสิทธิ์อื่นยังต้องไปออกสิทธิ์ห้องเดิมก่อน
ดาวน์โหลดได้ทั้ง
Play Store และ
App Storeโรงพยาบาลสินแพทย์ ลำลูกกา รับสมัครพนักงานผู้ช่วยพยาบาล LINK
ตำแหน่งพนักงานผู้ช่วย NA (พนักงานผู้ช่วยพยาบาล)
แผนกหอผู้ป่วยใน (IPD Cohort / IPD ทั่วไป)
พนักงานผู้ช่วย Full Time = 6 อัตรา
พนักงานผู้ช่วย Part Time = 6 อัตรา
คุณสมบัติผู้สมัคร
1. เพศหญิง
2. วุฒิ ม.3-6 ขึ้นไป
3. ใบประกาศนียบัตรผู้ช่วย
4. หากมีประสบการณ์จะพิจารณาเป็นพิเศษ
***มีค่าตอบแทนพิเศษเพิ่มให้ เฉพาะคนที่สนใจทำงาน Ward สาขาลำลูกกา เท่านั้น
รพ.สินแพทย์ ลำลูกกา
37/29 หมู่ที่ 3 ต.คูคต อ.ลำลูกกา จ.ปทุมธานี 12130
สอบถามเพิ่มเติมโทร. 02-006-9999 ต่อ 10231,10237


รศ.ดร.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร ได้กล่าวเกี่ยวกับความก้าวหน้าประเด็นการปฏิรูปประเทศด้านสาธารณสุขของกรุงเทพมหานครว่า ในฐานะที่เป็นคนทำและในฐานะของพื้นที่ที่ทำ การเริ่มต้นที่เป็นทางการสามารถทำต่อไปได้อย่างที่เราตั้งใจ ซึ่งกรุงเทพมหานครจะเปิด Sandbox จะทำพื้นที่การทดลองเพื่อใช้ ไอเดียนี้มีไหม ดีเพราะมันต้องลองว่าทำได้จริงไหม แต่มันจะยั่งยืนไหมคงไม่ เพราะ Sandbox เป็นการใช้การออกแบบพิเศษจากคนกลุ่มหนึ่งในการที่จะขับเคลื่อนการเปลี่ยนแปลง ในฐานะประชาชนในสถานการณ์โควิด-19 ช่วง 2 ปีกว่าที่ผ่านมา ส่วนตัวมีความเชื่อมั่นในวงการแพทย์สูงมาก และเชื่อว่านโยบายสาธารณะหรือการบริการสาธารณะควรมี 2 สิ่งนี้อยู่ คือ 1. ความเป็นมืออาชีพ เมื่อไหร่ที่การบริการสาธารณะใดก็ตามที่มีความเป็นมืออาชีพในตัว หมายถึงคนที่เคยอยู่บนยอดสูงสุดของบริการสาธารณะ เป็นคนที่มีความรู้มากๆ มีความเป็นมืออาชีพ ยึดถือในจริยธรรม ความเชื่อเกิดขึ้นได้ ดังนั้นการยืดหยุ่นให้ระบบสามารถบริการคนได้มากขึ้นมันเกิดขึ้นได้บนการตัดสินใจที่เป็นมืออาชีพของบริการสาธารณะ 2. ความเป็นเทคนิคในทุกเรื่องที่สืบเนื่องความเป็นมืออาชีพ เป็นคำตอบที่ตอบได้ว่าเช่นนี้ทำได้ เป็นการตัดสินใจบนข้อมูลความรู้ที่มีมากที่สุดของวงการ
รองผู้ว่าฯ ทวิดา กล่าวต่อว่า โดยปกติแล้วเรื่องสุขภาพขายถ้าเราตอบได้ว่าเป็นเรื่องที่จะต้องขับเคลื่อนทางด้านสุขภาพให้กับภาคประชาชน สำหรับความสูญเสีย 2 ปีครึ่งที่ผ่านมา ในฐานะผู้ใช้บริการสาธารณสุขมันไม่ใช่แค่ความสูญเสียทางสภาพเศรษฐกิจ บางคนสูญเสียชีวิต และบางคนไปต่อไม่ได้ กรุงเทพมหานครมีความตั้งใจอยากจะเพิ่มเติมใน 2 ประเด็น คือ 1. ทดลองนำร่องปฐมภูมิ เพิ่งเปิดตัวดุสิตโมเดลไปวันที่ 28 ก.ค. 65 และ 2. ราชพิพัฒน์แซนด์บ็อกซ์ ที่ตั้งใจจะทำให้ได้และเปิดตัวภายในปลายเดือนนี้ การขยับเขยื้อนในการทำให้การสาธารณสุขปฐมภูมิเป็นการแพทย์ใกล้บ้านใกล้ใจเกิดขึ้น การดำเนินการมีการส่งผลกระทบ หน่วยงานมีการปรับตัวมากขึ้น ความร่วมมือเป็นสิ่งสำคัญ ต่อไปต้องมีความร่วมมือจากทุกภาคส่วนในทุกระดับ สถานพยาบาลต้องร่วมมือกัน การเปลี่ยนแปลงที่ตั้งใจทำให้เกิดขึ้นเริ่มมีสัญญาณว่าสามารถทำได้และเปลี่ยนแปลงได้
สุดท้ายอีกเรื่องที่สำคัญมีอีกหนึ่งกลไกที่กรุงเทพมหานครกำลังรื้ออยู่คือการปฏิรูประบบราชการ เพราะจริงๆ แล้ว คนที่ดูแลพื้นที่และเชื่อมโยงกันอาจไม่ใช่คนที่ดูแลบริหารจัดการเรื่องพื้นที่สุขภาพ ซึ่งเราไม่ค่อยพูดถึงสำนักงานเขตมากนักทั้งที่เป็นคนที่ใกล้ชิดกับประชาชน 2. ทำอย่างไรให้ประชาชนเข้าใจระบบสุขภาพปฐมภูมิว่าทำอะไรได้บ้าง ซึ่งเป็นหน้าที่กรุงเทพมหานครที่ทำให้กลไกปลายทางเสริมไปกับกลไกสุขภาพที่กรุงเทพมหานครทำ และภายในอาทิตย์นี้คาดว่ากรุงเทพมหานครจะมีกลไกในการช่วยกันคิดช่วยกันทำข้อเสนอแนะว่า ที่คิดหรือทำกันอยู่เป็นอย่างไร ซึ่งมั่นใจว่าจะต้องมีช่องว่าง เมื่อเจอช่องว่างก็มาหาวิธีการปิดช่องว่างให้เร็ว พอมีการรื้อระบบบางอย่างให้เกิดความเข้าใจในการทำงานรวมถึงการสนับสนุนจากหน่วยงานที่เกี่ยวข้องจะสามารถทลายอุปสรรคในการทำงานและขับเคลื่อนงานให้ไปได้ สามารถสร้างความเปลี่ยนแปลงที่เป็นประโยชน์กับภาคประชาชนปลายทางได้เร็วที่สุดเท่าที่จะทำได้ หวังว่าแซนด์บ็อกซ์ที่จะเปิดในอนาคตจะสามารถโชว์อะไรบางอย่างให้รู้ว่าจะทำอย่างไรต่อ และทำเรื่องนี้ให้สำเร็จจนถึงที่สุด สามารถขยายผลไปทั่วพื้นที่กรุงเทพฯ และอาจรวมถึงปริมณฑลด้วย
ประกาศจาก รพ.กล้วยน้ำไท LINK
ประกาศ!! ตามที่สปสช. ได้แจ้งยกเลิกสัญญากับรพ.เอกชนทั้ง 9 แห่งนั้นเป็นการยกเลิก *กรณีหน่วยรับส่งต่อ*
ทั้งนี้ ผู้ที่มีบัตรทองยังสามารถใช้บริการได้ที่
คลินิกเวชกรรมกล้วยน้ำไท เคสหคลินิก และเคคลินิกได้ทุกสาขา รวมถึงผู้ที่เป็นสิทธิ์ว่าง
สอบถามแอดมินคลินิกกล้วยน้ำไท
โทร.080-3270304
กรณี หน่วยรับส่งต่อทาง สปสช. จะจัดหน่วยบริการให้ใหม่ภายใน 1 ตค. 65
ยุทธศาสตร์ที่ 2 ด้านการสร้างความสามารถในการแข่งขัน
ยุทธศาสตร์ที่ 2 ด้านการสร้างความสามารถในการแข่งขัน
ภาพรวมคือการพัฒนาด้านคมนาคมและระบบโลจิสติกส์ โครงสร้างพื้นฐานของประเทศ การส่งเสริมระบบอุตสาหกรรมและบริการที่เป็นระดับประเทศ ตั้งแต่โครงสร้างระบบถนน ระบบราง ระบบโลจิสติกส์ ทางน้ำ ทางอากาศ เขตพัฒนาพิเศษภาคตะวันออก (EEC) การพัฒนาอุตสาหกรรมและบริการแห่งอนาคต และการส่งเสริมวิสาหกิจ
สำหรับระดับประชาชน ด้านที่ยุทธศาสตร์ตอบโจทย์ได้โดยตรงคือการพัฒนาด้านการท่องเที่ยว และด้านการเกษตร
ด้านการท่องเที่ยว งบประมาณ 5,125.1 ล้านบาท
มุ่งไปที่ประเด็นการพัฒนาที่ตอบคำถามว่า "ประชาชนได้อะไร" ดังนี้
ได้รับความสะดวก ปลอดภัยแหล่งท่องเที่ยวธรรมชาติได้รับการฟื้นฟู
• เพิ่มศักยภาพด้านการท่องเที่ยวเชิงอนุรักษ์ 10 แห่ง
• เสริมชายหาดป้องกันการกัดเซาะ 3 แห่ง
• ติดตั้งทุ่นแพลอยน้ าฝั่งอ่าวไทย 2 จังหวัด / อันดามัน 2 จังหวัด / ทุ่นผูกเรือเพื่ออนุรักษ์แนวปะการัง 5 จังหวัด
• มีระบบปฏิบัติการฉุกเฉินที่ครบวงจรทั้งทางบก ทางน้ำและทางอากาศ 1 ระบบ
การท่องเที่ยววิถีชุมชนได้รับการพัฒนา
• จำนวนชุมชนที่ได้รับการผลักดันให้เข้าสู่ตลาดอุตสาหกรรม
การท่องเที่ยว เพิ่มขึ้น 20 ชุมชน
• พัฒนาเส้นทางชุมชนท่องเที่ยว OTOP นวัตวิถี 50 ชุมชน
• ชุมชนท่องเที่ยวได้รับการพัฒนาศักยภาพ 50 ชุมชน
• พัฒนาและยกระดับชุมชนเข้าสู่มาตรฐานการท่องเที่ยวไทย
50 ชุมชน มีผู้ประกอบการเข้าสู่มาตรฐาน 160 คน
• มีสินค้าและบริการที่สร้างสรรค์ใหม่ พร้อมเสนอขาย
25 รายการ
• สร้างชุมชนท่องเที่ยวในพื้นที่เมืองรองที่มีศักยภาพ
1 ชุมชน / 2 นวัตกรรม / ผู้ประกอบการเข้าเป็นสมาชิก
เพิ่มขึ้น 15 ราย
มีแหล่งท่องเที่ยวหลากหลายกระจายตัวทั้งเมืองหลักและเมืองรอง
• ก่อสร้างทางหลวงชนบทเพื่อการท่องเที่ยว 231.771 กม.
• เตรียมความพร้อมเข้าเป็นสมาชิกเครือข่ายเมืองสร้างสรรค์ 2 เมือง ได้แก่ น่าน และสุพรรณบุรี
• เมืองในพื้นที่พิเศษได้รับการพัฒนาตามแนวทาง UNESCO 5 เมือง ได้แก่ สุโขทัย เลย ชลบุรี เชียงราย และเพชรบุรี
• แหล่งธรณีวิทยาได้รับการพัฒนาเป็นแหล่งท่องเที่ยว 9 แห่ง มีเป้าหมายผู้เยี่ยมชมไม่น้อยกว่า 70,000 ราย
• เพิ่มศักยภาพสวนพฤกษศาสตร์ระยอง ให้เป็นแหล่งท่องเที่ยวเชิงคุณภาพ
นักท่องเที่ยวมีจำนวนเพิ่มมากขึ้น
• การพัฒนาผลิตภัณฑ์ไมซ์ภายใต้รูปแบบกิจกรรม
7 Themes และยกระดับการมีส่วนร่วมของชุมชนสู่ Product MICE Premium 2 เมือง
• ส่งเสริมการตลาดทั้งในและต่างประเทศโดยสร้างการรับรู้ประเทศไทย มีจ านวนการรับรู้แคมเปญ 1,080 ล้านคน/ครั้ง
• ส่งเสริมการท่องเที่ยวเชื่อมโยงกลุ่มอาเซียน งานสัมมนาระดับนานาชาติ 4 งาน / งานที่กลุ่ม GMS เข้ามาจัดงานในไทย 8 งาน
ประชาชนและผู้ประกอบการมีรายได้เพิ่มขึ้น
• ผู้ประกอบการท่องเที่ยวได้รับการถ่ายทอดความรู้ด้านการแพทย์แผนไทยและการแพทย์ทางเลือก มีรายได้เพิ่มขึ้น 500 ราย
• พัฒนาเมืองท่องเที่ยว 10 เมือง รองรับการจัดงานท่องเที่ยวเชิงธุรกิจได้แก่ กรุงเทพมหานคร เชียงใหม่ ขอนแก่น ภูเก็ต พัทยา ชุมพร กระบี่ สุราษฎร์ธานี สงขลา และเมืองรองที่มีศักยภาพ
ประเทศได้อะไร
1. รายได้จากการท่องเที่ยวไม่น้อยกว่า 2.4 ล้านล้านบาท
2. ขีดความสามารถทางการแข่งขันด้านการท่องเที่ยวของไทยอยู่ในอันดับไม่ต่ ากว่า 1 ใน 30 ของโลก
ฝุ่น PM 2.5
ตรวจ : สถานที่ต้นทางรถยนต์ รถประจำทาง รถบรรทุก 58,711 คัน
โรงงาน แพลนท์ปูน ไซต์ก่อสร้าง ถมดิน 1,900 แห่ง
ติดตาม : BKK Clean Air Area ตรวจสอบแหล่งกำเนิดทุกแห่งอย่างน้อย 2 ครั้งต่อเดือน
จุดวัดค่าฝุ่นในพื้นที่ กทม. 70 จุด ผ่าน App AirBKK Traffy Fondue
แก้ไข : สั่งแก้ไข-ห้ามใช้รถยนต์ รถประจำทางรถบรรทุก 1,020 คัน
สั่งปรับปรุงโรงงาน แพลน์ท์ปูน ไซต์ก่อสร้าง ถมดิน 41 ครั้ง
สวน 15 นาที
ยืนยันแล้ว 98 แห่ง
- ที่ดินกทม. 39 แห่ง หน่วยงานรัฐ 34 แห่ง เอกชน 24 แห่ง
- เปิดให้บริการแล้ว 13 แห่ง
หาบเร่แผงลอย
จุดผ่อนผัน 95 จุด
- เสร็จแล้ว 55 จุด
- กำลังดำเนินการ 31 จุด
- ขอทบทวน 9 จุด
นอกจุดผ่อนผัน 618 จุด
- สำรวจนอกจุดผ่อนผัน 50 เขต
- จำนวนผู้ค้า 13,964 ราย
ศูนย์อาหาร Hawker Center
- สำรวจพื้นที่ 125 จุด เพื่อพัฒนาเป็นศูนย์อาหาร Hawker Center เอกชน 109 จุด ราชการ 9 จุด วัด 7 จุด
- พื้นที่นำร่อง 2 จุด เขตมีนบุรี และสวนลุมพินีประตู 5 (อยู่ระหว่างดำเนินการ)
ก.ล.ต. มอบของขวัญปีใหม่ 2566 (2 โครงการใหญ่ 8 รายการย่อย)
ก.ล.ต. มอบของขวัญปีใหม่ 2566 (2 โครงการใหญ่ 8 รายการย่อย)
- โครงการสนับสนุนตลาดทุนและเศรษฐกิจของประเทศให้เติบโตอย่างยั่งยืน ลดภาระแก่ผู้ประกอบธุรกิจเพื่อความสุขที่มั่นคงของทุกภาคส่วน
- โครงการส่งเสริมให้ประชาชนและผู้ลงทุน มีศักยภาพในการสร้างสุขภาพทางการเงินที่ดี และมีภูมิคุ้มกัน ไม่ถูกหลอกลวง
จัดให้ 2566 เป็นปีแห่งการรณรงค์ให้ความรู้ระวังภัยกลโกงการลงทุน ส่งเสริมความรู้ผ่านหลักสูตรออนไลน์ และงานเสวนา มอบเว็บแอปพลิเคชัน "SEC Fund Check" ค้นหาข้อมูลเปรียบเทียบกองทุนรวม เป็นกลาง ใช้งานง่าย
ผังขบวนอัญเชิญพระอุปคุต
งานนมัสการองค์พระธาตุพนม ๒๕๖๖ ผังขบวนอัญเชิญพระอุปคุต พิธีอัญเชิญพระอุปคุต ประจำปี ๒๕๖๖ ในวันที่ ๒๙ มกราคม ขึ้น ๘ ค่ำ เดือน ๓ ร่วมถวายเป็นพุทธบูชาองค์พระธาตุพนม ขอเชิญทุกท่านร่วมพิธีในครั้งนี้
ลดชั่วโมงการทำงานบุคลากรทางการแพทย์
ปัญหา
ปัจจุบัน บุคลากรทางการแพทย์มีชั่วโมงการทำงานที่สูงเกินไป อย่างเช่นแพทย์ ต้องทำงานสัปดาห์ละ 80 ชั่วโมง หรือเฉลี่ยวันละ 14 ชั่วโมง ซึ่งระยะเวลาการทำงานที่มากเกินไปส่งผลต่อความสามารถต่อการให้บริการกับประชาชน เช่น ความแม่นยำในการตรวจวินิจฉัยโรค การทำหัตถการ ทำให้ประชาชนอยู่ในความเสี่ยงในการรักษาที่ผิดพลาด
ภาระงานของบุคลากรทางการแพทย์ ที่มีชั่วโมงการทำงานสูง แต่ค่าตอบแทนนอกเวลากลับได้รับอย่างไม่เหมาะสม และบางกรณีก็ไม่ได้รับค่าตอบแทนนอกเวลา ทำให้บุคลากรทางการแพทย์หมดกำลังใจในการทำงานในระบบสาธารณสุขของรัฐ และนำไปสู่การลาออกเข้าไปอยู่ในระบบเอกชนที่ผลตอบแทนดีกว่า (กรณีแพทย์ลาออกปีละ 500 - 600 คน)
นอกจากนั้น บุคลากรที่ทำงานเกี่ยวกับการกู้ชีพฉุกเฉิน ส่วนใหญ่มาจากอาสาสมัครตามมูลนิธิต่าง ๆ ซึ่งการดำเนินงานไม่ได้มีระบบและหลักเกณฑ์ที่เป็นมาตรฐานทางวิชาการ หรือไม่ได้สำเร็จการศึกษาในด้าน paramedic และยังไม่ได้รับการกำกับดูแลด้านมาตรฐานการปฏิบัติงานจากภาครัฐ เพราะว่าอาสาสมัครเหล่านี้ถือเป็นคนแรกที่เข้าไปในที่เกิดเหตุ อีกทั้งหน่วยงานรัฐ โดยเฉพาะองค์กรปกครองส่วนท้องถิ่น มีบุคลากรด้านการกู้ชีพฉุกเฉินไม่เพียงพอ
ข้อเสนอ
- กำหนดชั่วโมงการทำงานของแพทย์ไม่เกิน 60 ชั่วโมง/สัปดาห์
- กำหนดให้ได้พัก 8 ชั่วโมง หลังจากทำงานมาแล้วติดกัน 24 ชั่วโมง
- กำหนดให้ได้พัก หากทำงาน 24.00-08.00 น. (เวรดึก)
- ควบคุมมาตรฐานที่พักบุคลากรทางการแพทย์ (ปลอดภัย อยู่ในรั้วโรงพยาบาล)
- ลดภาระงานที่ไม่เกี่ยวกับการแพทย์ (เช่น เอกสารที่ไม่จำเป็น)
- เปิดข้อมูลการทำงานของบุคลากรทางการแพทย์ เพื่อการจัดตารางการทำงานที่เหมาะสม และเพื่อการตรวจสอบ
มีข้าวมีนา เหล้าบ๊วยแห่งเมืองเหนือ แม่สรวย เชียงราย LINK
มีข้าวมีนาใช้บ๊วยสุกพันธุ์ยูมิ ซึ่งเกษตรกรชาวสวนบ๊วยที่บ้านลอจอ อ.แม่สรวย จ.เชียงราย นิยมปลูกกันมาก ซึ่งทางร้านมีข้าว มีนาได้สั่งซื้อมาทุกปี ส่วนผสม มีน้ำตาลกรวด (ชนิดเกร็ดแบบฟอกสี) เหล้าอ้อย (Sugarcane Spirit) 40 ดีกรี ที่เป็นสุราชุมชน ผลิตโดยญาติของมิตรสหายในกลุ่มดองเหล้าบ๊วยที่แนะนำกันมา เหตุที่ทำเหล้าบ๊วยเพราะประทับใจวัฒนธรรมการกินดื่มแบบไต้หวันที่เคยไปสัมผัส การเอาวัตถุดิบผลไม้ในท้องถิ่นตามฤดูกาลมาทำ ได้ช่วยเกษตรกรโดยตรงเป็นรูปธรรม
ข้อมูลและภาพจากเพจประชาชนเบียร์
ศูนย์บริการสาธารณสุขห้าสิบ บึงกุ่ม ประกาศรับสมัครพนักงานสาธารณสุข LINK
ศูนย์บริการสาธารณสุขห้าสิบ บึงกุ่ม ประกาศรับสมัครพนักงานสาธารณสุข
ตำแหน่ง : พนักงานช่วยงานด้านสาธารณสุข
สาขา : สาธารณสุข หรือสาขาที่เกี่ยวข้อง
จำนวน : 1 อัตรา
วุฒิการศึกษา : ป.ตรี
อัตราค่าตอบแทน : 750 บาท /วัน
เวลาทำงาน : 08.00 - 16.00 น. วันจันทร์ - วันศุกร์
#สมัครด้วยตนเอง ตั้งแต่วันที่ 6 มิ.ย. 66 – 23 มิ.ย. 66 นัดสัมภาษณ์วันที่ 26 มิ.ย. 66
ที่ศูนย์บริการสาธารณสุข 50 บึงกุ่ม ณ ห้องธุรการ ชั้น 2
สอบถามเพิ่มเติมโทร. 02-3752897 ต่อ 21 ในวันและเวลาทำการ
#เอกสารที่ใช้ในการสมัคร
1. สำเนาบัตรประชาชน 1 ฉบับ
2. สำเนาทะเบียนบ้าน 1 ฉบับ
3. สำเนาวุฒิการศึกษา 1 ฉบับ
4. รูปถ่ายขนาด 1 นิ้ว 1 รูป
5. ใบรับรองแพทย์ 1 ฉบับ
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเทคโนโลยีราชมงคลศรีวิชัย วิทยาเขตนครศรีธรรมราช
133 หมู่ 5 ต.ทุ่งใหญ่ อ.ทุ่งใหญ่ จ.นครศรีธรรมราช 80240
โทร 075-489611(สำนักงานคณบดี) 075489614 (สำนักงานวิชาการ)
โทรสาร 075-489611
แผนกอายุรกรรม แผนกศัลยกรรม แผนกสูติกรรม แผนกอุบัติเหตุ ฉุกเฉินและผู้ป่วยวิกฤติ บริการรักษาและพักฟื้นสัตว์ป่วยภาวะฉุกเฉิน รับพักฟื้นและดูแลสัตว์ป่วยจากแผนกอื่นๆ ดูแลและรักษาสัตว์ป่วยต่อจากหน่วยอายุรกรรมที่ได้รับการกู้ชีพ หรือสัตว์ป่วยที่ต้องการดูแลอย่างใกล้ชิด
การบริการ
- รักษาสัตว์ป่วยหลังจากการศัลยกรรม
- รักษาสัตว์ป่วยฉุกเฉิน เช่น อุบัติเหตุ ภาวะชักอย่างต่อเนื่อง ภาวะไตวายเฉียบพลัน ฯลฯ
สัปดาห์ที่ 13 (27 มีนาคม - 2 เมษายน 2566)
ต่างชาติ 455,152 คน
เฉลี่ยวันละ 65,022 คน
นักท่องเที่ยวต่างชาติสะสม 6,605,943 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 256,194 ล้านบาท
5 ประเทศ แรก
จีน 68,199 คน
มาเลเซีย 40,146 คน
รัสเซีย 34,415 คน
สหราชอาณาจักร 25,487 คน
อินเดีย 23,991 คน
*****
สัปดาห์ที่ 11 (13-19 มีนาคม 2566)
ต่างชาติ 432,917 คน
เฉลี่ยวันละ 72,152 คน
นักท่องเที่ยวต่างชาติสะสม 5,578,721 คน
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 215,025 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 777,978 คน
รัสเซีย 496,106 คน
เกาหลีใต้ 398,136 คน
จีน 393,993 คน
อินเดีย 275,512 คน
cms_detail_row
สัปดาห์ที่ 10 (6-12 มีนาคม 2566)
ต่างชาติ 537,937 คน
เฉลี่ยวันละ 76,849 คน
นักท่องเที่ยวต่างชาติสะสม 5,145,804 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 339,535 ล้านบาท
5 ประเทศ แรก
มาเลเซีย 712,550 คน
รัสเซีย 461,533 คน
เกาหลีใต้ 375,249 คน
จีน 341,934 คน
อินเดีย 251,192 คน
*****
สัปดาห์ที่ 9 (27 กุมภาพันธ์ - 5 มีนาคม 2566)
ต่างชาติ 460,237 คน
เฉลี่ยวันละ 76,706 คน
นักท่องเที่ยวต่างชาติสะสม 4,533,264 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1.61 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 610,597 คน
รัสเซีย 413,525 คน
เกาหลีใต้ 344,355 คน
จีน 277,969 คน
อินเดีย 217,140 คน
*****
สัปดาห์ที่ 8 (20-26 กุมภาพันธ์ 2566)
ต่างชาติ 472,374 คน
เฉลี่ยวันละ 78,729 คน
นักท่องเที่ยวต่างชาติสะสม 3,945,254 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1.42 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 493,671 คน
รัสเซีย 368,724 คน
เกาหลีใต้ 312,132 คน
จีน 225,888 คน
อินเดีย 188,712 คน
*****
สัปดาห์ที่ 7 (13-19 กุมภาพันธ์ 2566)
ต่างชาติ 445,063 คน
เฉลี่ยวันละ 74,177 คน
นักท่องเที่ยวต่างชาติสะสม 3,400,439 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1.22 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 413,186 คน
รัสเซีย 320,890 คน
เกาหลีใต้ 273,037 คน
จีน 180,734 คน
อินเดีย 161,942 คน
4. บริการคลินิกผู้สูงอายุ
บริการคลินิกผู้สูงอายุ
- จัดบริการคลินิกผู้สูงอายุตามมาตรฐาน
- การให้บริการในโรงพยาบาล มีการประเมินสุขภาพผู้สูงอายุแบบครบวงจร (Compressive Geriatric Assessment; CGA)
- การวินิจฉัยเพื่อการดูแลบำบัดรักษาในกลุ่มอาการและปัญหาสุขภาพที่สำคัญในผู้สูงอายุ
- การจัดทำแผนการดูแลต่อเนื่องในชุมชน
- รองรับการส่งต่อเพื่อการดูแลบำบัดรักษาจากการคัดกรองสุขภาพในชุมชน
Drama-addict โดยปรกติแล้ว ชายและหญิง จะมีโครงสร้างอนาโตมี่พวกมวลกล้ามเนื้อแตกต่างกัน
โดยปรกติแล้ว ชายและหญิง จะมีโครงสร้างอนาโตมี่พวกมวลกล้ามเนื้อแตกต่างกัน ชาย จะมีมวลกล้ามเนื้อมากกว่าหญิงในขนาดเท่าๆกัน เกือบสองเท่า และชายจะมีปริมาณกล้ามเนื้อในร่างกายส่วนบนมากกว่าหญิง (ของผู้หญิงจะไปเยอะแถวๆร่างกายส่วนล่าง แถวๆสะโพกต้นขา ทำให้ผู้หญิงหลายๆคนเล่นท่าพวก hip thrust ได้หนักโคตรๆ บางคนหนักกว่าผู้ชายอีก) ดังนั้นกล้ามเนื้อที่ใช้ในกีฬาที่เน้นแรงปะทะ และใช้ร่างกายส่วนบนเยอะมาก เช่น การต่อยมวย ฝ่ายชายจึงได้เปรียบเหนือกว่าหญิงเกือบสองเท่า
มีงานวิจัยหลายๆงานวิจัย ที่เอาชายและหญิง ขนาดเท่าๆกันมาทดสอบต่อยและวัดพลังหมัด พบว่าแรงหมัดของผู้ชาย มากกว่าหญิงอย่างน้อย 1 เท่าตัว ถ้าคนตัวใหญ่ๆหน่อยก็ 2-2.6 เท่าตัวกันไปเลย ซึ่งความได้เปรียบนี้ไม่ใช่แค่การเอาชนะ แต่ถ้าหนักๆ คือ ถึงตายได้เลย
ดังนั้นในการแข่งขันของผู้หญิงจึงควรต้องมีการตรวจยืนยันเพศอย่างชัดเจน เพื่อลดความได้เปรียบเสียเปรียบของผู้เข้าแข่งขัน เพราะหากมีนักกีฬาที่มีความได้เปรียบจากสรีระของความเป็นชาย หรือฮอร์โมนเพศชายเข้าร่วมแข่ง มันก็แทบจะสู้กันไม่ได้แล้ว ซึ่งการตรวจที่จำเป็นก็ได้แก่ การตรวจระดับฮอร์โมนเพศชาย และการตรวจโครโมโซมเพศ
Drama-addict 1 สิงหาคม 2567 บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตประเวศ
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา กายอุปกรณ์ LINK
คู่มือส าหรับประชาชน : การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะ สาขากายอุปกรณ์ หน่วยงานที่ให้บริการ : ส ำนักสถำนพยำบำลและกำรประกอบโรคศิลปะ กระทรวงสำธำรณสุข หลักเกณฑ์ วิธีการ เงื่อนไข (ถ้ามี) ในการยื่นค าขอ และในการพิจารณาอนุญาต
1. ระยะเวลำด ำเนินกำรของงำนบริกำรนี้ก ำหนดไว้ 45 วันท ำกำร ให้นับตั้งแต่วันที่คณะอนุกรรมกำรวิชำชีพพิจำรณำรำยชื่อ ผู้มีสิทธิสอบเป็นต้นไป ทั้งนี้ ยกเว้นกรณีที่เกิดภำวะวิกฤตหรือเหตุกำรณ์ฉุกเฉินต่ำงๆ ไม่ว่ำจะเกิดจำกภัยธรรมชำติ อุบัติเหตุ หรือ กำรมุ่งร้ำยต่อองค์กร เช่น อุทกภัย อัคคีภัย กำรก่อกำรประท้วง กำรก่อกำรจลำจล กำรก่อวินำศกรรม เป็นต้น
2. คุณสมบัติของผู้ยื่นค ำขอต้องเป็นไปตำมที่กฎหมำยก ำหนด คือ 2.1 อำยุไม่ต่ ำกว่ำ 20 ปีบริบูรณ์ 2.2 เป็นผู้มีควำมรู้ในวิชำชีพตำมมำตรำ 33 (6) แห่งพระรำชบัญญัติกำรประกอบโรคศิลปะ พ.ศ. 2542 ซึ่งแก้ไขเพิ่มเติมโดย พระรำชบัญญัติกำรประกอบโรคศิลปะ (ฉบับที่ 4) พ.ศ. 2556 ดังนี้ ต้องมีควำมรู้ในวิชำชีพ คือ เป็นผู้ได้รับปริญญำ หรือ ประกำศนียบัตรเทียบเท่ำปริญญำสำขำกำยอุปกรณ์ จำกสถำบันกำรศึกษำที่คณะกรรมกำรวิชำชีพสำขำกำยอุปกรณ์รับรอง 2.3 ไม่เป็นผู้มีควำมประพฤติเสียหำย 2.4 ไม่เคยต้องโทษจ ำคุกโดยค ำพิพำกษำถึงที่สุดในคดีที่คณะกรรมกำรวิชำชีพเห็นว่ำอำจจะน ำมำซึ่งควำมเสื่อมเสียเกียรติ ศักดิ์แห่งวิชำชีพ 2.5 ไม่เป็นผู้ติดยำเสพติดให้โทษ 2.6 ไม่เป็นโรคที่คณะกรรมกำรวิชำชีพประกำศก ำหนดว่ำไม่สมควรให้ประกอบโรคศิลปะ ได้แก่ โรคเรื้อนในระยะติดต่อหรือ ในระยะที่ปรำกฎอำกำรเป็นที่รังเกียจต่อสังคม วัณโรคในระยะอันตรำย โรคเท้ำช้ำงในระยะที่ปรำกฎอำกำรเป็นที่รังเกียจต่อสังคม โรคพิษสุรำเรื้อรัง และโรคอื่นซึ่งคณะกรรมกำรวิชำชีพพิจำรณำเห็นว่ำเป็นอุปสรรคต่อกำรประกอบวิชำชีพกำยอุปกรณ์ 2.7 ไม่เป็นคนวิกลจริตหรือจิตฟั่นเฟือนไม่สมประกอบ
3. ผู้ยื่นค ำขอต้องตรวจสอบคุณสมบัติให้ครบถ้วนก่อนยื่นค ำขอ ในกรณีที่มีกำรยื่นค ำขอและช ำระค่ำธรรมเนียมกำรสอบเรียบร้อย แต่คณะอนุกรรมกำรวิชำชีพมีกำรพิจำรณำว่ำไม่มีสิทธิสอบหรือมีคุณสมบัติไม่ครบถ้วนในกำรขอขึ้นทะเบียน จะไม่มีกำรคืนเงิน ค่ำธรรมเนียมให้ไม่ว่ำกรณีใดๆ
4. หนังสือรับรองกำรตรวจสุขภำพ ต้องเป็นไปตำมแบบที่ก ำหนด หรือกรณีที่เป็นใบรับรองแพทย์ทั่วไป ต้องมีสำระส ำคัญให้ครบ ตำมแบบที่ก ำหนด พร้อมประทับตรำสถำนพยำบำลที่ออกหนังสือรับรอง ทั้งนี้ ระยะเวลำกำรรับรอง ต้องไม่เกิน 90 วันนับแต่วันที่ ออกหนังสือรับรอง
5. หลักเกณฑ์ วิธีกำรและเงื่อนไขกำรรับสมัครและกำรสอบแต่ละครั้งอ้ำงอิงตำมประกำศคณะกรรมกำรวิชำชีพสำขำกำยอุปกรณ์ ในกำรสอบครั้งนั้นๆ ซึ่งต้องมีกำรประกำศเพื่อประชำสัมพันธ์ทำงเว็บไซต์ของส ำนักสถำนพยำบำลและกำรประกอบโรคศิลปะ และแจ้งเป็นหนังสือไปยังส ำนักงำนสำธำรณสุขจังหวัดทุกจังหวัดเพื่อขอควำมร่วมมือในกำรรับสมัครสอบ ก่อนถึงก ำหนดกำร รับสมัครสอบ
6. กรณีจบกำรศึกษำจำกต่ำงประเทศต้องมีหนังสือแจ้งว่ำสถำบันกำรศึกษำได้รับกำรรับรองจำกคณะกรรมกำรวิชำชีพสำขำกำย อุปกรณ์แล้ว
7. กรณีของผู้ที่สอบไม่ผ่ำนสำมำรถยื่นค ำร้องขอทรำบผลคะแนนสอบได้ ภำยใน 30 วัน นับแต่วันที่ประกำศผลกำรสอบ โดยต้อง มำยื่นควำมประสงค์ขอดูคะแนนด้วยตนเอง ณ กลุ่มกำรประกอบโรคศิลปะสำขำกำรแพทย์แผนปัจจุบัน
8. กำรยื่นค ำขอขึ้นทะเบียน ผู้ขอต้องมำยื่นด้วยตนเอง ณ สถำนที่รับสมัคร 30 การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะ สาขากายอุปกรณ์
9. กำรรับใบอนุญำตให้เป็นผู้ประกอบโรคศิลปะ กรณีที่ไม่สำมำรถมำรับด้วยตนเองได้ ต้องมอบอ ำนำจให้บุคคลอื่นมำรับแทน โดยท ำเป็นหนังสือมอบอ ำนำจให้บุคคลอื่นมำรับแทน ซึ่งต้องติดอำกรแสตมป์พร้อมแนบส ำเนำบัตรประจ ำตัวประชำชนของ ผู้มอบอ ำนำจและผู้รับมอบอ ำนำจ หำกมีกำรแก้ไขเอกสำรต้องนับวันหลังจำกหน่วยงำนได้รับเอกสำรแก้ไขครบถ้วนแล้ว
10. กรณีที่มีเหตุสุดวิสัยที่มีผลให้ด ำเนินกำรในขั้นตอนใดๆ ของกำรจัดสอบไม่เป็นตำมที่ประกำศก ำหนด ต้องมีกำรประกำศ ก ำหนดให้ทรำบถึงกำรเปลี่ยนแปลงก ำหนดกำรอย่ำงเป็นทำงกำร
11. ในกรณีที่คณะกรรมกำรวิชำชีพมีค ำสั่งไม่รับขึ้นทะเบียนและออกใบอนุญำตให้แก่ผู้ขอเป็นผู้ประกอบโรคศิลปะ ผู้ยื่นค ำขอนั้น มีสิทธิอุทธรณ์เป็นหนังสือต่อคณะกรรมกำรกำรประกอบโรคศิลปะภำยใน 30 วันนับแต่วันที่ได้รับหนังสือแจ้งกำรไม่รับขึ้นทะเบียน และออกใบอนุญำต
12. ในกรณีที่ค ำขอหรือเอกสำรหลักฐำนไม่ครบถ้วน และ/หรือ มีควำมบกพร่องไม่สมบูรณ์เป็นต้นเหตุให้ไม่สำมำรถพิจำรณำได้ เจ้ำหน้ำที่จะจัดท ำบันทึกควำมบกพร่องของรำยกำรเอกสำรหรือหลักฐำนที่ต้องยื่นเพิ่มเติม โดยผู้รับบริกำรจะต้องด ำเนินกำร แก้ไข หรือยื่นเอกสำรเพิ่มเติมภำยในระยะเวลำที่ก ำหนดในบันทึก มิเช่นนั้นจะถือว่ำผู้รับบริกำรละทิ้งค ำขอ
หมำยเหตุ: ขั้นตอนกำรด ำเนินงำนตำมคู่มือจะเริ่มนับระยะเวลำตั้งแต่เจ้ำหน้ำที่ได้รับเอกสำรครบถ้วนตำมที่ระบุไว้ในคู่มือ ประชำชนเรียบร้อยแล้ว
ช่องทางการให้บริการ
สถานที่ให้บริการ ศนย์บริกำรธุรกิจสุขภำพ ชั้น 1 อำคำรกรมสนับสนุนบริกำรสุขภำพ ถนนสำธำรณสุข 8 กระทรวงสำธำรณสุข เบอร์โทรศัพท์ 02 1937059 และส ำนักงำนสำธำรณสุขจังหวัด ทุกจังหวัด /ติดต่อด้วยตนเอง ณ หน่วยงำน ระยะเวลาเปิดให้บริการ เปิดให้บริกำรวันจันทร์ ถึง วันศุกร์ (ยกเว้นวันหยุดที่ทำง รำชกำรก ำหนด) ตั้งแต่เวลำ 08:30 - 16:30 น. (มีพักเที่ยง)
ชื่อกระบวนงาน: กำรขอขึ้นทะเบียนเพื่อรับใบอนุญำตเป็นผู้ประกอบโรคศิลปะสำขำกำยอุปกรณ์ หน่วยงานกลางเจ้าของกระบวนงาน: ส ำนักสถำนพยำบำลและกำรประกอบโรคศิลปะ กรมสนับสนุนบริกำรสุขภำพ ประเภทของงานบริการ: กระบวนงำนบริกำรที่เบ็ดเสร็จในหน่วยเดียว หมวดหมู่ของงานบริการ: อนุญำต/ออกใบอนุญำต/รับรอง กฎหมายที่ให้อ านาจการอนุญาต หรือที่เกี่ยวข้อง:
1)พ.ร.บ.กำรประกอบโรคศิลปะ พ.ศ.2542 และฉบับแก้ไขเพิ่มเติม
=== สารบัญ ============
ประกาศกรมสนับสนุนบริการสุขภาพ
เรื่อง คู่มือส าหรับประชาชน กรมสนับสนุนบริการสุขภาพ พ.ศ. 2558
1
คู่มือส าหรับประชาชน : งานการประกอบโรคศิลปะ (1)
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขารังสีเทคนิค 2
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขากิจกรรมบ าบัด 7
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา
เทคโนโลยีหัวใจและทรวงอก
13
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา
จิตวิทยาคลินิก
19
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา
การแก้ไขความผิดปกติของการสื่อความหมาย
24
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา
กายอุปกรณ์
29
การขอขึ้นทะเบียนเพื่อรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะสาขา
การแพทย์แผนจีน
34
การขอแก้ไขหรือเพิ่มเติมรายการในทะเบียนและใบอนุญาตประกอบโรคศิลปะ 39
การขอใบแทนใบอนุญาตเป็นผู้ประกอบโรคศิลปะ 42
การขอใบแปลใบอนุญาตประกอบโรคศิลปะเป็นภาษาอังกฤษ 45
คู่มือส าหรับประชาชน : งานการประกอบโรคศิลปะ (2)
การขอขึ้นทะเบียนเพื่อรับหนังสืออนุญาตให้บุคคลประกอบโรคศิลปะ
โดยอาศัยศาสตร์ไคโรแพรคติก
48
การขอขึ้นทะเบียนเพื่อรับหนังสืออนุญาตให้บุคคลประกอบโรคศิลปะ
โดยอาศัยทัศนมาตรศาสตร์
53
การขอต่ออายุหนังสืออนุญาตให้บุคคลประกอบโรคศิลปะ
โดยอาศัยศาสตร์ไคโรแพรคติก
58
การขอต่ออายุหนังสืออนุญาตให้บุคคลประกอบโรคศิลปะ
โดยอาศัยทัศนมาตรศาสตร์
63
คู่มือส าหรับประชาชน : งานการประกอบโรคศิลปะ (3)
การขอรับรองสถาบันการศึกษาสาขารังสีเทคนิค 68
การขอรับรองสถาบันการศึกษาสาขากิจกรรมบ าบัด 71
การขอรับรองสถาบันการศึกษาสาขาเทคโนโลยีหัวใจและทรวงอก 76
การขอรับรองสถาบันการศึกษาสาขาจิตวิทยาคลินิก 80
การขอรับรองสถาบันการศึกษาสาขาการแก้ไขความผิดปกติของ
การสื่อความหมาย
84
การขอรับรองสถาบันการศึกษาสาขากายอุปกรณ์ 88
การขอรับรองสถาบันการศึกษาสาขาการแพทย์แผนจีน 92
ภาคผนวก :
(1) ค าสั่งกรมสนับสนุนบริการสุขภาพ ที่ 531/2558 เรื่อง แต่งตั้งคณะกรรมการ และ
คณะท างานจัดท าคู่มือส าหรับประชาชน ตามพระราชบัญญัติการอ านวยความ
สะดวกในการพิจารณาอนุญาตของทางราชการ พ.ศ. 2558
97
(2) ข้อมูลการเผยแพร่คู่มือส าหรับประชาชน กรมสนับสนุนบริการสุขภาพ 102
(3) สรุปภาพรวมคู่มือส าหรับประชาชน กรมสนับสนุนบริการสุขภาพ :
งานการประกอบโรคศิลปะ
103
3. Setup Photo profile
Caution
2 ways available for your profile photo
- Browsing Profile photo from photo gallery, it is recommend that you choose recent photo taken within one month.
- Taking a new photo
In both cases, full face look strainght forward into the camera without cap or sun glasses on are requested. (eyeglasses are acceptable)
พิษณุโลก เชิญร่วมงานประเพณีสงกรานต์ ประจำปี 2564
เทศบาลนครพิษณุโลกเชิญร่วมงานประเพณีสงกรานต์ ประจำปี 2564 ขึ้นในวันอังคารที่ 13 เมษายน 2564 ณ บริเวณวัดพระศรีรัตนมหาธาตุวรมหาวิหาร จังหวัดพิษณุโลก โดยมีวัตถุประสงค์เพื่อส่งเสริมและทำนุบำรุงศิลปะ จารีตประเพณี ภูมิปัญญาท้องถิ่นและขนบธรรมเนียมประเพณีอันดีงามของท้องถิ่น อันเป็นเอกลักษณ์สำคัญประจำชาติ ทั้งยังเป็นการให้ความรู้เกี่ยวกับประเพณีของท้องถิ่น ให้เยาวชนและประชาชนได้เกิดความรักและเห็นความสำคัญของจารีตประเพณีของท้องถิ่น อันควรรักษาไว้ให้สืบทอดกันต่อไป โดยกำหนดให้มีการจัดกิจกรรมต่างๆ ดังนี้
การจัดงานประเพณีสงกรานต์ ประจำปี 2564 ในครั้งนี้ได้จัดให้มีกิจกรรมหลากหลาย ได้แก่ พิธีทำบุญตักบาตรข้าวสารอาหารแห้งเนื่องในวันสงกรานต์ การปล่อยพันธุ์ปลา การถวายผ้าห่มพระพุทธชินราช และถวายผ้าห่มพระปรางค์ สรงน้ำพระบรมสารีริกธาตุและสรงน้ำพระพุทธชินราชจำลอง เทศบาลนครพิษณุโลกจึงขอเชิญชวนพี่น้องประชาชนร่วมงานประเพณีสงกรานต์ ประจำปี 2564 ในวันที่ 13 เมษายน 2564 ตั้งแต่เวลา 07.00 น. เป็นต้นไป ณ บริเวณหน้าวัดพระศรีรัตนมหาธาตุวรมหาวิหารโดยพร้อมเพรียงกัน
วันนี้ติดเชื้อ 1,543 ราย (ในประเทศ 1540 ราย)
วันนี้ติดเชื้อ 1,543 ราย
ในประเทศ 1,540 ราย
- ในระบบบริการ 1,161 ราย
- คัดกรองเชิงรุก 379 ราย
ต่างประเทศ 3 ราย
กระจายใน 62 จังหวัด
ใช้เครื่องช่วยหายใจ 11 คน - กทม 5 ขอนแก่น 1 ระยอง 1 ตาก 1 นครปฐม 1 สมุทปราการ 2
เขตบางเขน ลงพื้นที่ส่งมอบยาเวชภัณฑ์ ให้ผู้ป่วยโควิดที่แยกกักตัวที่บ้าน LINK
เขตบางเขน : ลงพื้นที่อย่างเร่งด่วนส่งมอบยาและเวชภัณฑ์ ให้กับผู้ป่วยโควิดที่แยกกักรักษาตัวที่บ้าน (Home Isolation) เพื่อดูแลประชาชนให้รอดปลอดภัย ด้วยความห่วงใย ตามนโยบายของผู้ว่าฯ กทม.
วันพุธที่ 5 มกราคม 2565 เวลา 09.30 น. -11.30 น. นางสาวพิศมัย เรืองศิลป์ ผู้อำนวยการเขตบางเขน มอบหมายให้ นางสาวนวลน้อย เพิ่มผล หัวหน้าฝ่ายพัฒนาชุมชนและสวัสดิการสังคม จัดอาสาสมัครลานกีฬากรุงเทพมหานคร ลงพื้นที่อย่างเร่งด่วนตามโครงการหน่วยเคลื่อนที่เร็วจัดรถรับยาและเวชภัณฑ์จากศูนย์บริการสาธารณสุข 24 บางเขน ส่งมอบให้กับผู้ป่วยโควิดที่แยกกักรักษาตัวที่บ้าน (Home Isolation) จำนวน 3 ราย เพื่อให้ได้รับยาและเวชภัณฑ์อย่างเร็วขึ้น ลดความเสี่ยงที่จะเกิดอาการหนักขึ้น เพื่อบรรเทาความเดือดร้อนแก่ผู้ป่วยฯ ในพื้นที่เขตบางเขนจากสถานการณ์การเเพร่ระบาดของโรคติดเชื้อไวรัสโควิด – 19
EP. 3.3 สิทธิในการเข้าถึงข้อมูลส่วนบุคคล (Right of Access) - มาตรา 30 LINK
เจ้าของข้อมูลสามารถขอเข้าถึงข้อมูลของตนได้ทุกกรณีหรือไม่ ???
และเมื่อผู้ควบคุมข้อมูลได้รับคำขอเข้าถึงข้อมูลแล้วจะต้องดำเนินการตามคำขอนั้น ภายในกี่วัน???
หลักการสำคัญคือ เจ้าของข้อมูลมีสิทธิที่จะขอเข้าถึงข้อมูลที่เกี่ยวกับตนได้ดังนี้
1. ขอเข้าถึงและขอรับสำเนาข้อมูลที่เกี่ยวกับตน
2. ขอให้เปิดเผยถึงการได้มาซึ่งข้อมูลที่ตนไม่ได้ให้ความยินยอม
เมื่อได้รับคำขอแล้ว ผู้ควบคุมข้อมูลส่วนบุคคลต้องจัดเตรียมข้อมูลที่เกี่ยวข้องตามคำขอให้เจ้าของข้อมูลโดยไม่ชักช้า (ไม่เกิน 30 วัน นับแต่ที่ได้รับคำขอ)
อย่างไรก็ตาม ผู้ควบคุมข้อมูลสามารถปฏิเสธคำขอได้ในกรณีดังต่อไปนี้
1. เป็นการปฏิเสธตามกฎหมายหรือคำสั่งศาล
2. คำขอจากเจ้าของข้อมูลส่วนบุคคลนั้นส่งผลกระทบต่อสิทธิและเสรีภาพของบุคคลอื่น
*หากมีการปฏิเสธคำขอจะต้องทำบันทึกรายการเกี่ยวกับการปฏิเสธด้วย ซึ่งมีรายละเอียดตามมาตรา 39
.
หากปรากฏว่าผู้ควบคุมข้อมูลส่วนบุคคลไม่ปฏิบัติตามคำขอ ต้องระวางโทษปรับทางปกครองไม่เกิน 1,000,000 บาท (มาตรา 82)
.
สามารถติดตามประเด็นเกี่ยวกับสิทธิอื่นได้ในครั้งต่อไป
เพื่อเตรียมความพร้อมสำหรับองค์กรและหน่วยงานของท่านอย่างถูกต้อง
Hospital Isolation โรงพยาบาลวัฒนแพทย์ ตรัง
ใกล้หมออุ่นใจ คนที่บ้านปลอดภัย ห่างไกล Covid-19 โรงพยาบาลวัฒนแพทย์ ตรัง มอบความห่วงใย พร้อมรักษาผู้ที่ได้รับเชื้อโควิด-19 และมีผลตรวจเป็นบวก ด้วยแพ็กเกจอุ่นใจ เริ่มต้นที่ 6,800 บาท (แบบผู้ป่วยนอก)
แพทย์ตรวจรักษา
ตรวจโควิด-19 แบบ Antigen test kit (ATK)
ชุดยารักษาตามอาการ 5-10 วัน
ชุดเวชภัณฑ์และอุปกรณ์
ตรวจเอกซเรย์ทรวงอก (Chest X-Ray)
ตรวจความสมบูรณ์ของเม็ดเลือด (CBC)
ราคาดังกล่าวรวมค่าแพทย์ ค่าบริการโรงพยาบาลเวชภัณฑ์ และชุดอุปกรณ์ป้องกันแล้ว
การให้ยารักษาตามอาการ ขึ้นอยู่กับดุลยพินิจของแพทย์
รับสิทธิ์ห้องพักสำหรับกักตัวที่โรงพยาบาล 1,500 บาท/คืน (พร้อมอาหาร 3 มื้อ) เมื่อซื้อแพ็กเกจอุ่นใจ เริ่มต้นที่ 6,800 บาท (แบบผู้ป่วยนอก)
สอบถาม โทร 075-205555
ลิงค์
บริการวัณโรคต่อมน้ำเหลือง
วัณโรคต่อมน้ำเหลือง เป็นวัณโรคนอกปอดที่พบได้บ่อยที่สุด มักมีอาการต่อมน้ำเหลืองโต ผู้ป่วยส่วนมาก จะมาพบแพทย์ด้วยมีก้อนที่บริเวณลำคอ อาจเป็นก้อนใหญ่ร่วมกับไข้เรื้อรัง หรือเป็นก้อนโตต่อกันเป็นสายยาวเรียกว่า "ฝีประคำร้อย"
Royal Thai Embassy around the world
อโรคยาศาล วัดคำประมง สกลนคร ช่วยเหลือดูแลผู้ป่วยมะเร็ง มายาวนาน
อโรคยาศาล วัดคำประมง สกลนคร ช่วยเหลือดูแลผู้ป่วยมะเร็ง มายาวนาน
MDKKU CARE แพทย์ฯ ม.ขอนแก่น LINK
MDKKU CARE แอปฯ แพทย์ฯ ม.ขอนแก่น แอพเดียวจบ ครบทุกบริการ
แอป MDKKU CARE จะช่วยลดภาระงานของบุคลากรทางการแพทย์และสามารถที่ดูแลผู้ป่วยได้อย่างเต็มที่ โดยต้องการที่จะให้ผู้ป่วยใช้ระยะเวลาภายในโรงพยาบาลน้อยที่สุดแต่เกิดประโยชน์สูงสุด
แอปพลิเคชัน MDKKU CARE เป็นแอปพลิเคชันที่เกิดขึ้นจากความร่วมมือระหว่างโรงพยาบาลศรีนครินทร์ คณะแพทยศาสตร์ และธนาคารไทยพาณิชย์จำกัด (มหาชน) โดยเป็นการดำเนินการพัฒนาแอปพลิเคชันร่วมกัน เพื่อยกระดับการให้บริการของโรงพยาบาลศรีนครินทร์ เนื่องจากเป็นโรงพยาบาลที่มีผู้ป่วยเข้ามาติดต่อและใช้บริการเป็นจำนวนมาก ทำให้ผู้ป่วยบางส่วนอาจได้รับการบริการที่มีความล่าช้า ดังนั้น จึงได้มีการพัฒนาแอปพลิเคชันเพื่อตอบสนองการบริการที่สามารถทำให้ผู้ป่วยเข้าถึงและได้รับการรักษาที่รวดเร็วมากยิ่งขึ้น
แหล่งอ้างอิง
Noncommunicable diseases progress monitor 2022. Geneva: World Health Organization; 2022
Bloom, D.E., Cafiero, E.T., Jané-Llopis, E., Abrahams-Gessel, S., Bloom, L.R., Fathima, S., Feigl, A.B., Gaziano, T., Mowafi, M., Pandya, A., Prettner, K., Rosenberg, L., Seligman, B., Stein, A.Z., & Weinstein, C. (2011). The Global Economic Burden of Noncommunicable Diseases. Geneva: World Economic Forum.
Lobo V, Patil A, Phatak A, Chandra N. Free radicals, antioxidants and functional foods: Impact on human health. Pharmacognosy reviews. 2010 Jul;4(8):118.
Cleveland Clinic medical professional. Hormones: What They Are, Function & Types [Internet]. Cleveland Clinic. 2022 [cited 30 June 2022]. Available from: https://my.clevelandclinic.org/health/articles/22464-hormones
Vinall M. Your Hormones May Be the Key to Getting a Solid Night’s Sleep. Here’s How [Internet]. Healthline. 2021 [cited 30 June 2022]. Available from: https://www.healthline.com/health/sleep/how-sleep-can-affect-your-hormone-levels#hormones-and-sleep
Rutkowski, K., Sowa, P., Rutkowska-Talipska, J., Kuryliszyn-Moskal, A., & Rutkowski, R. (2014). Dehydroepiandrosterone (DHEA): hypes and hopes. Drugs, 74(11), 1195-1207.
Alhadi EDOO M, Chutturghoon V, WUSU-ANSAH G, ZHU H, Yang ZHEN T, Yang XIE H et al. Serum Biomarkers AFP, CEA And CA19-9 Combined Detection for Early Diagnosis of Hepatocellular Carcinoma. Iranian Journal of Public Health. 2019;.
Johns Hopkins Medicine. Common Liver Tests [Internet]. Hopkinsmedicine.org. 2022 [cited 30 June 2022]. Available from: https://www.hopkinsmedicine.org/health/treatment-tests-and-therapies/common-liver-tests
Virginia A. Moyer, MD, MPH. Screening for Chronic Kidney Disease: U.S. Preventive Services Task Force Recommendation Statement. Annals of Internal Medicine. 2012;157(8):I.
Harvard Health Publishing. Blue light has a dark side - Harvard Health [Internet]. Harvard Health. 2020 [cited 2 August 2022]. Available from: https://www.health.harvard.edu/staying-healthy/blue-light-has-a-dark-side
Perlman A, Abu Dabrh A. Health and Wellness Coaching in Serving the Needs of Today’s Patients: A Primer for Healthcare Professionals. Global Advances in Health and Medicine. 2020;9:216495612095927.
Sforzo G, Kaye M, Harenberg S, Costello K, Cobus-Kuo L, Rauff E et al. Compendium of Health and Wellness Coaching: 2019 Addendum. American Journal of Lifestyle Medicine. 2019;14(2):155-168.
สนับสนุนมูลนิธิ
เกี่ยวกับมูลนิธิเพื่อสุนัขในซอย (ซอยด๊อก)
ก่อตั้งขึ้นในปีพ.ศ. 2546 ที่จังหวัดภูเก็ต ช่วยเหลือสุนัขและแมวจรจัดที่ประสบอุบัติเหตุ บาดเจ็บ ถูกทารุณกรรม มีเป้าหมายเพื่อพัฒนาคุณภาพชีวิตของสัตว์จรจัดในประเทศไทยและทวีปเอเชียให้ดียิ่งขึ้น โครงการหลักของมูลนิธิฯ คือการควบคุมประชากรสุนัขและแมวจรจัดด้วยการทำหมันและฉีดวัคซีน
โดยปัจจุบันได้ทำหมันสุนัขและแมวแล้วกว่า 750,000 ตัว ซึ่งเป็นจำนวนที่มากที่สุดเท่าที่มีบันทึกการทำหมันในสถิติโลก มูลนิธิฯ ออกหน่วยทำหมันเคลื่อนที่ในภาคใต้ กรุงเทพฯ และปริมณฑล รวมถึงพื้นที่อื่น ๆ โดยไม่คิดค่าใช้จ่าย
นอกจากช่วยชีวิตและรักษาอาการป่วย บาดเจ็บแล้ว ซอยด๊อกยังหาบ้านใหม่ให้แก่สุนัขและแมวจรจัดที่ได้รับการตรวจสุขภาพ ฉีดวัคซีน ทำหมันแล้วโดยไม่มีค่าใช้จ่ายในการรับเลี้ยงแต่อย่างใด
การดำเนินงานของมูลนิธิฯ มาจากการสนับสนุนและบริจาคจากผู้ที่ต้องการสร้างความเปลี่ยนแปลงให้กับชีวิตสัตว์จรจัด สามารถดูรายละเอียดการทำงานของมูลนิธิฯ เพิ่มเติมได้ที่ www.soidog.org/th Facebook facebook.com/SoiDogInThai/
ร่วมสนับสนุนการดำเนินงานของหน่วยทำหมันเคลื่อนที่ได้ที่
- https://links.soidog.org/support-cnvr-today
- พร้อมเพย์ 0993-0000-63503 7-Eleven ระบุ Soidog Foundation
- แอพมือถือ "TrueMoney Wallet" ได้ที่ https://bit.ly/2ZbrbON
- บัตรเครดิต/Paypal ในระบบออนไลน์ได้ที่ https://bit.ly/3fSbIsM
- ธ.ไทยพาณิชย์ ชื่อบัญชี : Soi Dog Foundation เลขบัญชี : 403-109-8541 หรือ 706-2-28385-8
- ธ.กสิกรไทย ชื่อบัญชี มูลนิธิเพื่อสุนัขในซอย เลขบัญชี 486-2-14221-2
- ธ. กรุงเทพ ชื่อบัญชี มูลนิธิเพื่อสุนัขในซอย เลขบัญชี 573-0-42837-1
ขอขอบคุณทุกท่านสำหรับการสนับสนุนโครงการ CNVR มูลนิธิเพื่อสุนัขในซอย เพื่อควบคุมจำนวนสุนัขจรจัดและลดการแพร่ระบาดของโรคพิษสุนัขบ้าในประเทศไทย
ทั้งนี้ แพทย์ผู้ชำนาญการจะเป็นผู้ตัดสินใจเลือกเทคโนโลยีที่นำมาตรวจวินิจฉัยให้เหมาะสมกับผู้ป่วยแต่ละราย เพื่อให้มีความแม่นยำและให้การรักษาได้อย่างตรงจุด เช่น เทคโนโลยีเพื่อตรวจการบีบตัวของหลอดอาหาร กระเพาะอาหาร ลำไส้เล็ก และการตรวจการทำงานของทวารหนักและหูรูดทวารหนัก, การวัดปริมาณน้ำลาย เพื่อดูการทำงานของต่อมน้ำลาย, การทดสอบไฮโดรเจนทางลมหายใจ, การตรวจวัดความเป็นกรดในหลอดอาหาร 24 ชั่วโมง หรือการรักษาโดยการฝึกขับถ่ายให้เป็นธรรมชาติ สำหรับผู้ป่วยที่มีภาวะท้องผูกและกลั้นอุจจาระไม่ได้ โดยผู้ป่วยท้องผูกที่รับประทานยาระบายแล้วอาการไม่ดีขึ้น ประมาณ 40% เกิดจากการเบ่งถ่ายที่ผิดวิธี แพทย์และพยาบาลจะช่วยสอนให้ผู้ป่วยเรียนรู้ที่จะเบ่งและคลาย นำไปสู่การรักษาให้หายขาดได้
*ในภาพเป็นการตรวจวัดการทำงานของทางเดินอาหารส่วนต้น
HealthServ.net เริ่มต้นตั้งแต่สิงหาคม 2563 และเติบโตขึ้นเป็นลำดับจนถึงปัจจุบัน ด้วยบทบาทการเป็นแพลตฟอร์มที่ให้ข้อมูลด้านสุขภาพมากมายในหลายมิติ ไม่ว่าจะเป็นด้านข้อมูล ความรู้สุขภาพ สำหรับการดูแลตนเองและครอบครัว คนที่รัก อัพเดตด้วยข่าวสารในด้านสุขภาพทั้งจากภาครัฐ องค์กรสุขภาพ หรือเอกชน บทความ บทวิเคราะห์ ที่เป็นประโยชน์ต่อการอ้างอิง ค้นคว้า รวมไปถึงข้อมูลการบริการสุขภาพด้านต่างๆ จากผู้ให้บริการสุขภาพที่มีมากมายในประเทศไทย โดยข้อมูลในหลากหลายมิติเหล่านี้ สามารถเข้าถึงได้โดยกลุ่มผู้ชมในทุกๆ กลุ่ม ทุกระดับ ซึ่ง HealthServ.net ตอบสนองความต้องการข้อมูลที่เป็นที่ต้องการเหล่านั้นได้อย่างชัดเจน ตรงเป้าหมาย
ด้วยประสิทธิภาพเหล่านั้น HealthServ.net จึงมั่นใจว่า สามารถส่งต่อคุณค่าและคุณภาพของธุรกิจ/องค์กรของท่าน ตรงสู่ส่งกลุ่มผู้ชมเป้าหมายได้อย่างมีประสิทธิภาพและสัมฤทธิ์ผล
ข้อมูลผู้ชมเว็บถึง ปัจจุบัน ดูได้ที่หน้าสถิติเว็บไซต์
Generation ของกลุ่มผู้บริจาคในปีที่ผ่านมาและแผนความร่วมมือกับหน่วยงานอื่น ๆ ภายในปี 2566


- สัดส่วนกลุ่มผู้บริจาคบุคคลธรรมดากว่า 40% ของมูลนิธิรามาธิบดีฯ มาจากผู้บริจาคกลุ่ม Gen X ที่มีช่วงอายุตั้งแต่ 45 ปีขึ้นไป โดยมีสัดส่วนของผู้บริจาคที่อยู่ในช่วงอายุ 45-60 ปี และ 60 ปีขึ้นไปใกล้เคียงกัน ซึ่งเป็นกลุ่มผู้บริจาคที่มียอดบริจาคต่อรายสูงที่สุดเมื่อเทียบกับผู้บริจาคบุคคลธรรมดาในช่วงอายุอื่น ๆ
- จากช่วงวิกฤตโควิด-19 ที่ผ่านมาระหว่างปีพ.ศ. 2563-2564 มูลนิธิฯ มียอดบริจาคจากกลุ่ม Gen Z (9-24 ปี) สูงขึ้น 2 เท่าจากช่วงก่อนวิกฤตโควิด-19 จากการระดมทุนเพื่อโครงการเร่งด่วน และเห็นผลลัพธ์จากการให้อย่างชัดเจนเป็นรูปธรรมในระยะเวลาอันสั้น โดยในปีพ.ศ. 2565 ยอดบริจาคจากผู้บริจาคกลุ่มนี้ลดลงเล็กน้อยแต่ยังคงมียอดบริจาคสูงกว่าช่วงก่อนวิกฤตโควิด-19
- ในแง่ของการสื่อสารกับกลุ่มคนรุ่นใหม่มูลนิธิรามาธิบดีฯ ได้นำเอาความชื่นชอบของคนกลุ่มนี้มาพัฒนาการทำงานมากขึ้น เช่น การจัดทำของที่ระลึกโดยใช้การ์ตูนคาแรคเตอร์ที่ได้รับความนิยม เช่น ไลน์เฟรนด์ (LINE Friends), เฮลโล คิตตี้ (Hello Kitty), สนูปี้ (Snoopy) ฯลฯ หรือ การใช้อินฟลูเอนเซอร์ที่เป็นศิลปินกลุ่มคนรุ่นใหม่มาช่วยโปรโมทแคมเปญต่างๆ เช่น การเปิดตัวของที่ระลึกการกุศล Power of Giving เมื่อช่วงปลายปีที่ผ่านมาก็ได้ตัวแทนจากแบรนด์แฟชั่นชั้นนำของไทย เช่น PAINKILLER Atelier, Kloset & Etcetera, DISAYA, Greyhound Original, SMILEYHOUND มาร่วมงาน นอกจากนี้ในหน้า Facebook แฟนเพจของมูลนิธิรามาธิบดีฯ ยังมีการทำคอนเทนต์เพื่อดึงดูดความสนใจของกลุ่มคนรุ่นใหม่โดยเฉพาะ เช่น คอนเทนต์วอลเปเปอร์เสริมความสุข...ไม่สิ้นสุด 12 ราศี พร้อมเลขมงคล จากอาจารย์ไวท์ หมอดูโอปป้า เพื่อสร้างความหลากหลายของคอนเทนต์ที่เราสื่อสารออกไป
- ในส่วนของแผนความร่วมมือกับหน่วยงานอื่นๆ ในปีนี้มูลนิธิยังคงมีการร่วมมือกับแบรนด์ลิขสิทธิ์แท้ Peter Rabbit และ My Melody ถือเป็นความพิเศษที่มูลนิธิมีความตั้งใจเพิ่มความหลายหลาย ผ่านของใช้ในชีวิตประจำวัน ให้ทุกท่านได้เข้าถึงการทำบุญได้มากยิ่งขึ้น
UD TOWN Songkran Festival 2023 - 12-16 เมษายน 2566 LINK
UD TOWN Songkran Festival 2023 งานสงกรานต์อุดรปี 2566 นี้ จัดที่ UD TOWN 12 - 16 เมษายน 2566 เตรียมตัวมันส์ 5 วัน 5 คืนเต็ม!! ไฟ แสง สี เสียง เลเซอร์ สุดตระการตา พร้อมอุโมงค์น้ำที่ใหญ่ และยาวขึ้น 2 เท่า พื้นที่ความสนุกที่สามารถจุคนได้กว่า 20,000 คน อิ่มอร่อยกับอาหารกว่า 100 เมนู รายชื่อศิลปิน
- เบอร์ใหญ่จากยุโรป Mike Williams ดีเจ จากประเทศเนเธอร์แลนด์ ที่ยังเป็นโปรดิวเซอร์ และนักดนตรี ที่เป็นที่รู้จัก และเคยร่วมงานกับ Tiësto มาแล้ว
- 22Bullets ดีเจสายเลือดไทย ที่ดังระดับโลก เคยได้ร่วมแสดงบนเวทีเดียวกับดีเจหัวแถวของวงการ อาทิ Afrojack (แอฟโฟรแจ็ค), KSHMR (แคชเมียร์) มาแล้ว
- unmonkey BearBeer Boakyzzz GodSend Thankert Mirinda Riviere James Cozmo Ohm DMC MIU KAHU SPICYZ DopeHearHear IVY Rocky DJ FIFA JANICE NTU ENjoy APPLE
ค่าตอบแทนบุคลากรทางการแพทย์เป็นธรรม
ปัญหา
ปัจจุบัน บุคลากรทางการแพทย์มีชั่วโมงการทำงานที่สูงเกินไป อย่างเช่นแพทย์ ต้องทำงานสัปดาห์ละ 80 ชั่วโมง หรือเฉลี่ยวันละ 14 ชั่วโมง ซึ่งระยะเวลาการทำงานที่มากเกินไปส่งผลต่อความสามารถต่อการให้บริการกับประชาชน เช่น ความแม่นยำในการตรวจวินิจฉัยโรค การทำหัตถการ ทำให้ประชาชนอยู่ในความเสี่ยงในการรักษาที่ผิดพลาด
ภาระงานของบุคลากรทางการแพทย์ ที่มีชั่วโมงการทำงานสูง แต่ค่าตอบแทนนอกเวลากลับได้รับอย่างไม่เหมาะสม และบางกรณีก็ไม่ได้รับค่าตอบแทนนอกเวลา ทำให้บุคลากรทางการแพทย์หมดกำลังใจในการทำงานในระบบสาธารณสุขของรัฐ และนำไปสู่การลาออกเข้าไปอยู่ในระบบเอกชนที่ผลตอบแทนดีกว่า (กรณีแพทย์ลาออกปีละ 500 - 600 คน)
นอกจากนั้น บุคลากรที่ทำงานเกี่ยวกับการกู้ชีพฉุกเฉิน ส่วนใหญ่มาจากอาสาสมัครตามมูลนิธิต่าง ๆ ซึ่งการดำเนินงานไม่ได้มีระบบและหลักเกณฑ์ที่เป็นมาตรฐานทางวิชาการ หรือไม่ได้สำเร็จการศึกษาในด้าน paramedic และยังไม่ได้รับการกำกับดูแลด้านมาตรฐานการปฏิบัติงานจากภาครัฐ เพราะว่าอาสาสมัครเหล่านี้ถือเป็นคนแรกที่เข้าไปในที่เกิดเหตุ อีกทั้งหน่วยงานรัฐ โดยเฉพาะองค์กรปกครองส่วนท้องถิ่น มีบุคลากรด้านการกู้ชีพฉุกเฉินไม่เพียงพอ
ข้อเสนอ
ปรับอัตราค่าตอบแทนสำหรับการทำงานในช่วงนอกเวลา
วางเกณฑ์ที่คำนึงถึงหลัก “ทำมากได้มาก” - ค่าตอบแทนแปรผันตามชิ้นงาน
สิงห์นาคา สุราชุมชนอุตรดิตถ์ LINK
“สิงห์นาคา” สุราชุมชนจากอุตรดิตถ์ เริ่มต้นจากคุณปู่และคุณย่าก่อตั้งโรงงานเมื่อปี พ.ศ.2549 โดยเริ่มจากชักชวนญาติพี่น้องมาร่วมกลุ่ม และเพื่อต้องการให้ลูกหลานได้กลับมาทำอาชีพที่ถิ่นฐานบ้านเกิดตัวเอง โดยได้เริ่มทำสุราจากข้าวเหนียว และได้รับการแนะนำ พัฒนา ปรับปรุงจากผู้เชียวชาญ จนเกิดเป็นสุราจากมะม่วงหิมพานต์เพิ่มมาอีก 1 ทางเลือก
คุณพ่อเป็นคนตั้งชื่อแบรนด์นี้ขึ้นมาโดยอิงจากรูปภาพของสัตว์ในป่าหิมพานต์ คือ “ตัวไกรษรปักษา” แล้วนำมาปรับแต่งชื่อขึ้นใหม่เป็น “สิงห์นาคา” โดยความหมายคือเป็นการรวมพลังสองสิ่งอยู่ในหนึ่งเดียวกัน ซึ่ง สิงห์ เป็นเจ้าป่าที่ทรงพลัง และ นาคา หมายถึง เทพที่มีทรัพย์สมบัติ
ข้อมูลและภาพจากเพจประชาชนเบียร์
Trip 3 : วันที่ 16 และ 17 กันยายน 66 (ไปเช้ากลับเย็น) ทริปอิ่มบุญ@ราชบุรี
วันที่ 16 และ 17 กันยายน 66 (ไปเช้ากลับเย็น) โปรแกรม “ทริปอิ่มบุญ ปันรอยยิ้มให้น้อง @ราชบุรี ราคา 1,499 บาท
ประเพณียี่เป็งล้านนา
ในช่วงเวลาเทศกาลลอยกระทงของภาคกลาง เป็นช่วงเวลาเดียวกันกับเทศกาลประเพณียี่เป็งของทางภาคเหนือ สำหรับชาวเหนือถือเป็นงานสำคัญอีกช่วงหนึ่งของปี มีการประดับประดาดวงโคมตามบ้านเรือนวัดวา จุดผางประทีป ประเพณียี่เป็ง หรือประเพณีเดือนยี่ เป็นประเพณีเก่าแก่ของล้านนที่สืบทอดมานาน โดยคำว่า "ยี่" แปลว่า สอง ส่วน "เป็ง" แปลว่า เพ็ญ หรือ คืนพระจันทร์เต็มดวง ซึ่งหมายถึงประเพณีในวันเพ็ญเดือนสองของชาวล้านนา งานประเพณีจะมีทั้งหมด 3 วัน คือ
- วันขึ้นสิบสามค่ำ หรือ ชาวพื้นถิ่นเรียกว่า "วันดา" จะเป็นวันสำหรับการซื้อของตระเตรียมสิ่งต่างๆ ไปทำบุญที่วัด (ในปีนี้ตรงกับวันที่ ๒๙ ต.ค. ๒๕๖๓)
- วันขึ้นสิบสี่ค่ำ จะไปทำบุญกันที่วัด พร้อมทำกระทงใหญ่ไว้ที่วัดและนำของกินมาใส่กระทงเพื่อทำทานให้แก่คนยากจน (ในปีนี้ตรงกับวันที่ ๓๐ ต.ค. ๒๕๖๓)
- วันขึ้นสิบห้าค่ำ จะนำกระทงใหญ่ที่วัดและกระทงเล็กส่วนตัวไปลอยในลำน้ำ (ในปีนี้ตรงกับวันที่ ๓๑ ต.ค. ๒๕๖๓)
กิจกรรมที่ชาวล้านนานิยมกระทำในประเพณียี่เป็ง คือ การจุดผางประทีปและโคมไฟบูชาพระเจ้าห้าพระองค์ การปล่อยว่าว จุดบอกไฟชนิดต่างๆ วัด การไปทำบุญที่วัดในวันยี่เป็ง การฟังเทศน์ใหญ่ ที่เรียกว่า เทศมหาชาติ และการทำซุ้มประตูป่า
ประเพณีเดือนยี่เป็ง จังหวัดในภาคเหนือที่สำคัญและเป็นที่รู้จัก ในปีที่ผ่านมา (2565)
- ประเพณีเดือนยี่เป็งเชียงใหม่ 2565 ในปีที่ผ่านมา จัดระหว่างวันที่ 7-9 พฤศจิกายน 2565 จัดโดย เทศบาลนครเชียงใหม่ ด้วยแนวคิด "ความสุขแห่งสายน้ำ ปิงนครามหานที" เป็นการกลับมาจัดครั้งยิ่งใหญ่หลังจากพ้นยุคโควิด เป็นงานที่ได้สัมผัสบรรยากาศความงดงาม สืบสานงานประเพณีและวัฒนธรรมที่ยิ่งใหญ่ อย่างอลังการแบบสุดๆ จริงๆ
- ประเพณียี่เป็งลอยกระทง เชียงราย หรือชื่องาน "ป๋าเวณียี่เป็งนครเชียงราย" จัดขึ้น วันที่ 9 พฤศจิกายน 2565 ณ สวนตุงและโคมนครเชียงราย โดย เทศบาลนครเชียงราย มีกิจกรรมลอยกระทง การประกวดหนูน้อยนพมาศ ขบวนแห่กระทงที่ยิ่งใหญ่จากสวนตุง และโคมฯ ถนนธนาลัย สู่สถานที่จัดงาน และ มีการประกวดนางนพมาศ ประกวดโคม ประกวดกระทง พร้อมการแสดงบนเวทีอย่างตระการตา
- ประเพณียี่เป็งจังหวัดลำพูน ปี2565 จัดเมื่อวันที่ 8 พฤศจิกายน 2565 ณ ศาลากลางจังหวัดลำพูน (หลังเก่า) อำเภอเมือง จังหวัดลำพูน โดย อบจ.ลำพูน ร่วมกับ เทศบาลเมืองลำพูน ใช้ชื่อเทศกาล” โคมแสนดวงที่เมืองลำพูน ” จัดขึ้นเพื่อถวายเป็นพุทธบูชาต่อองค์พระธาตุเจ้าหริภุญชัย และการถวาย ซึ่งโคมล้านนา พิธีถวายโคมหลากสี แด่พระนางจามเทวี ปฐมกษัตรีย์แห่งนครหริภุญชัย มีการจัดการประกวดปล่อยโคมลอย ประเภทนักเรียนนักศึกษา และ ประเภทประชาชนทั่วไป (รูปเเบบเเฟนซี) ทำให้เป็นปีที่มีโคมลอยเเฟนซี ในรูปเเบบที่เเฟนซีที่เเปลกตา บรรยากาศสีสันในการจัดกิจกรรมที่สนุกสนาน ในลำพูน
- ประเพณียี่เป็ง ลอยกระทงที่กว๊านพะเยา ประจำปี 2565 วันที่ 7-8 พฤศจิกายน 2565 ณ บริเวณลานอนุสาวรีย์พ่อขุนงำเมือง และถนนชายกว๊านพะเยา โดย เทศบาลเมืองพะเยา เพื่อส่งเสริมสนับสนุนให้ประชาชนและเยาวชนได้เรียนรู้และมีส่วนร่วมในการอนุรักษ์สืบสานวัฒนธรรมประเพณีที่ดีงาม และเพื่อเป็นการกระตุ้นเศรษฐกิจชุมชน และส่งเสริมการท่องเที่ยวของจังหวัดพะเยาโดยไฮไลท์ภายในงานชมการประกวดนางนพมาศกว๊านพะเยา การแสดง แสง สี เสียง ขบวนแห่กระทง 15 ชุมชนในเขตเทศบาลเมืองพะเยา
- ป๋าเวณียี่เป็งละกอนลำปาง หรือประเพณียี่เป็งแห่ง จ.ลำปาง ในวันที่ 8 พฤศจิกายน 2565 ณ สวนสาธารณะหนองกระทิง อำเภอเมือง จังหวัดลำปาง จัดโดย อบจ.ลำปาง ภายในงานพบกับความตระการตาของข่วงโคม 3,500 ดวง ประกวดซุ้มประตูป่า ประกวดบอกไฟดอก (พลุโอ่ง) การแสดงซอ ปุยฝ้าย มะลิวัลย์ (เวลา 10.00 น.) การแสดงศิลปะ วัฒนธรรม การประชันวงปี่พาทย์ การแสดงวงแสนละเมา-ธวัชเมืองเถิน (เวลา 21.00 น.) กิจกรรม work shop อาทิ ทำผางประทีป ระบายสีโคม ประดิษฐ์กระทงใบตอง บายศรี สวยกาบ ตำข้าวใหม่ด้วยครกมอง ทำโคมยี่เป็ง และวัฒนธรรมทางอาหารที่ใช้ใบตอง ประกอบด้วย อาหาร 1 อย่าง ขนม 1 อย่าง เช่น ข้าวต้มมัดกล้วย แหนบต่างๆ พร้อมชมเครื่องแต่งกายชุดไทยล้านนา และนิทรรศการประเพณีลอยกระทง
สัปดาห์ที่ 6 (6-12 กุมภาพันธ์ 2566)
ต่างชาติ 473,798 คน
เฉลี่ยวันละ 72,966 คน
นักท่องเที่ยวต่างชาติสะสม 2,885,761 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 1.04 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 353,001 คน
รัสเซีย 274,895 คน
เกาหลีใต้ 232,331 คน
จีน 140,970 คน
อินเดีย 136,411 คน
*****
สัปดาห์ที่ 5 (30 มกราคม - 5 กุมภาพันธ์ 2566)
ต่างชาติ 412,493 คน
เฉลี่ยวันละ 68,748 คน
นักท่องเที่ยวต่างชาติสะสม 2,378,830 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 0.85 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 293,069 คน
รัสเซีย 229,591 คน
เกาหลีใต้ 191,827 คน
อินเดีย 112,984 คน
จีน 107,856 คน
*****
สัปดาห์ที่ 4 (23-29 มกราคม 2566)
ต่างชาติ 474,682 คน
เฉลี่ยวันละ 79,113 คน
นักท่องเที่ยวต่างชาติสะสม 1,905,560 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 0.68 แสนล้านบาท
5 ประเทศ แรก
มาเลเซีย 241,379 คน
รัสเซีย 184,088 คน
เกาหลีใต้ 152,325 คน
อินเดีย 93,093 คน
จีน 80,204 คน
*****
สัปดาห์ที่ 3 (16-22 มกราคม 2566)
ต่างชาติ 429,352 คน
เฉลี่ยวันละ 71,558 คน
นักท่องเที่ยวต่างชาติสะสม 1,342,365 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 0.48 แสนล้านบาท
5 ประเทศ แรก
รัสเซีย 143,580 คน
มาเลเซีย 138,737 คน
เกาหลีใต้ 111,522 คน
อินเดีย 68,609 คน
ลาว 56,517 คน
*****
สัปดาห์ที่ 2 (9-15 มกราคม 2566)
ต่างชาติ 375,883 คน (9-14 ม.ค.)
เฉลี่ยวันละ 62,647 คน
นักท่องเที่ยวต่างชาติสะสม 854,485 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 0.30 แสนล้านบาท
5 ประเทศ แรก
รัสเซีย 92,628 คน
มาเลเซีย 85,560 คน
เกาหลีใต้71,432 คน
อินเดีย 44,534 คน
ลาว 38,505 คน
*****
สัปดาห์ที่ 1 (2-8 มกราคม 2566)
ต่างชาติ 366,762 คน (2-7 ม.ค.)
เฉลี่ยวันละ 61,127 คน
นักท่องเที่ยวต่างชาติสะสม 419,516 คน (ตั้งแต่ 1 ม.ค.)
รายได้จากการใช้จ่ายนักท่องเที่ยวต่างชาติ 0.15 แสนล้านบาท
5 ประเทศ แรก
รัสเซีย 46,128 คน
มาเลเซีย 45,517 คน
เกาหลีใต้ 32,977 คน
อินเดีย 22,393 คน
ลาว 19,674 คน
5. บริการ Home ward / Hospital at home โดยทีมสุขภาพ
บริการ Home ward / Hospital at home โดยทีมสุขภาพ
- คือ บริการดูแลผู้ป่วยที่บ้านเหมือนเป็นหอผู้ป่วย โดยจัดบริการโดยโรงพยาบาล ร่วมกับทีมปฐมภูมิ ทั้งนี้รายละเอียดบริการเป็นไปตามคู่มือการดูแล Home ward กรมการแพทย์(Home ward สำหรับ ผู้ป่วยระยะท้าย ได้แก่ Home ward for active dying patients)
- มีการเบิกค่าชดเชยบริการ จาก สปสช. ได้ตามเกณฑ์
คลินิกความดันโลหิตสูง
ความดันโลหิตสูง เปิดให้บริการ วันพุธ, วันศุกร์ ในเวลาทำการ 08.30 – 12.00 น. / วันจันทร์ – ศุกร์ ในเวลาทำการ 13.00 – 16.30 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120คลินิกเลิกบุหรี่/สุรา
คลินิกเลิกบุหรี่/สุรา เปิดให้บริการ วันพุธ ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120เจาะประเด็นเพศสภาพและกฎกีฬาแบบชัดเจน - หมอหิว ไม่อยากตรวจแล้วอะ
2 สิงหาคม 2567 - หมอหิว ไม่อยากตรวจแล้วอะ
#เจาะประเด็นเพศสภาพและกฎกีฬาแบบชัดเจน จากนักมวยหญิงโอลิมปิคปี 2024 ที่ผ่านมา Imane Khelif ไม่ผ่านเกณฑ์ chromosome test และ hormone test เป็นอย่างไร ไปฟังดูกันจ้า (ยาวมาก แนะนำให้พกยาดมมาดมด้วย)
จากแหล่งข่าวหลายสำนักเปิดเผยว่า Khelif เป็นกลุ่มอาการ Swyer syndrome เอาล่ะ ตั้งสติแล้วทำความเข้าใจไปด้วยกันนะ
Swyer syndrome
เป็นภาวะทางพันธุกรรมผิดปกติตั้งแต่เกิด จะเกิดโรคในผู้ที่เป็น XY (chromosome XY เป็น Chromosome เพศชาย ส่วน XX เป็น Chromosome เพศหญิง)
เกริ่นก่อนว่าในคนทุกคนจะมีฮอร์โมนทั้งชายและหญิงอยู่ในตัว การกำหนดเพศจะเริ่มจากมีโครโมโซมเป็น XX หรือ XY ตั้งแต่เริ่มการแบ่งตัวในท้อง ซึ่งโครโมโซมจะมีผลสร้างอวัยวะสืบพันธุ์ที่สร้างฮอร์โมนต่อไป การเจริญพันธุ์และรูปร่างก็จะเปลี่ยนไปตามฮอร์โมนที่เด่นกว่า
ประเด็นสำคัญคือใน Swyer เนี่ย Y ตัวนี้ในรหัสพันธุกรรมไม่สามารถเข้ากระบวนการสร้างอัณฑะได้เลยโดยสิ้นเชิง ( pure gonadal dysgenesis) เนื่องจากขาด testis determinig factors ซึ่งอัณฑะเป็นตัวสร้างฮอร์โมนเพศชาย testosterone ส่วนใหญ่ เมื่อไม่มีอัณฑะทำให้ฮอร์โมนเพศหญิง estrogen เด่นกว่าและเกิดการพัฒนารูปร่างทางเพศเป็นผู้หญิงตั้งแต่เป็นทารกในครรภ์ กล่าวง่ายๆคือ มีช่องคลอด มีมดลูก มีรังไข่ได้ แต่ด้วยความที่ chromosome มีเพียง X เดียวก็ไม่สามารถสร้างฮอร์โมน estrogen ได้เพียงพอเช่นกัน ทำให้รังไข่นั้นฝ่อและไม่สามารถตกไข่ได้ตามปกติ ไม่สามารถมีประจำเดือนเพราะขาด estrogen และอาจไม่พัฒนาหน้าอกเมื่อเข้าวัยเจริญพันธุ์
แต่อิทธิพล chromosome Y นอกจากเครื่องเพศจะมีผลกับกายภาพทางร่างกายอื่นๆทั้งกล้ามเนื้อ กระดูกจะเหมือนผู้ชาย มักตัวสูงใหญ่หรือแขนขายาวกว่าผู้หญิงด้วย
แปลง่ายๆ Swyer syndrome ทำให้ฮอร์โมนไม่สุดทุกทางต่ำทั้งคู่ เป็น XY (ชาย) ที่ไม่มีองคชาติและอัณฑะ แต่มีช่องคลอด มดลูก รังไข่นั่นเอง เคสส่วนใหญ่จึงถูกเลี้ยงดูมาแบบเด็กหญิงเพราะดูภายนอกเป็นผู้หญิง มักมาพบแพทย์ด้วยไม่มีประจำเดือน หรือไม่มีหน้าอกเมื่อเข้าวัยรุ่น
ในท้ายที่สุดการรักษาคือการให้ฮอร์โมนเพศหญิง estrogen เข้าไปเพื่อให้สามารถพัฒนาเต้านม และมีประจำเดือนได้ จะได้ใช้ชีวิตแบบผู้หญิงต่อไปค่ะ
ในส่วนการกีฬานั้นมีการ test เบื้องต้นเท่าที่แอดรู้คือ testosterone test และ chromosome test คือการเปิดโอกาสให้ DSD (differences sex development คือการมีอวัยวะและเพศกำกวม) ได้เข้ามาแข่งต้องมีระดับ testosterone ไม่สูงจนเกินเกณฑ์เพื่อให้อยู่ในระดับเพศหญิงและแข่งกับเพศหญิง
มีตัวอย่าง Caster Semenya นักวิ่งอเมริกาใต้เจ้าของเหรียญทองโอลิมปิคปี 2012 และ 2016 และเหรียญอีกมากมายที่มีรูปร่างหน้าตาคล้ายผู้ชาย แต่มีสูติบัตรเป็นเพศหญิง ถูกเลี้ยงมาแบบเพศหญิง เมื่อได้มีการเทสแล้วพบว่าโครโมโซมเป็น XY แต่เกิดมาด้วยอวัยวะเพศกำกวม องคชาติไม่พัฒนา ไม่มีรังไข่ในท้องแต่เป็นอัณฑะที่ยังไม่ลงมาแทน มีช่องคลอดแต่ไม่มีมดลูก (คนละโรคกับ khelif นะ) ทำให้เกิดประเด็นทางสังคมมากมายและมีการโต้เถียงในวงการกีฬาอย่างมาก ในปี 2023 World athletics ได้ออกมาประกาศว่า DSD ต้องมีปริมาณฮอร์โมน testosterone ตัดเกณฑ์ไม่เกิน 2.5 mmol/L ตราบเท่าที่จะลงแข่งกีฬาหญิง เพื่อความเสมอภาคในการแข่งกีฬา (มีรายละเอียดอื่นๆอีกมาก) โดย Caster Semenya เองก็ต้องเข้ารับการรักษากดฮอร์โมนเพศชายเพื่อจะเข้าร่วมการแข่งกีฬาในอนาคตด้วยเช่นกัน
ทั้งนี้ประเด็นร้อนของ Lin กับ Khelif คือการเป็น XY DSD นั้นไม่ผิด แต่ผิดกฎ world athletics ที่ไม่ตรงตามกฎควบคุม testosterone เพื่อให้ลดการแสดงออกถึงลักษณะรูปร่าง ความแข็งแรงกล้ามเนื้อแบบผู้ชายนั่นเอง จึงถูก International Boxing Association (IBA) ตัดสิทธิจากการแข่งขันชิงแชมป์โลกที่กรุงนิวเดลีเมื่อปีที่แล้ว ทั้งนี้ตัว Khelif ยังไม่เคยเปิดเผยว่าตรวจร่างกายแล้วมีอวัยวะเพศ/ภายในเป็นแบบใด ซึ่งในโรคเกี่ยวกับเพศนั้น แม้เป็นโรคเดียวกันก็อาจมีความรุนแรงในการแสดงออกที่แตกต่างกันได้ เช่น Swyer บางคนอาจมดลูกแย่กว่าอีกคน บางคนอาจรูปร่างเหมือนผู้หญิงจริงมากกว่า บลาๆ
เรื่องนี้อาจต้องดูกันต่อไปว่าสิ้นสุดอย่างไร ในส่วนตัวของแอด รายที่เพศกำกวมมากๆแบบ Swyer syndrome แข่งชายก็ไม่ได้ แข่งหญิงก็ไม่ได้ก็น่าสงสาร แต่สุดท้ายการผิดกฎเรื่องฮอร์โมนที่ยืดหยุ่นให้ transgender หรือ DSD มาแข่งได้ แบบนี้ก็ไม่ดีเหมือนกันเนอะ เหมือนต่อยกับคนแอบฉีดสเตียรอยด์เร่งกล้ามอ่ะ เรื่องนี้ละเอียดอ่อนมากๆเลย
Khelif อาจต้องมาเจอนักชกทีมชาติไทยในรอบรองชนะเลิศ คุณจันทร์แจ่ง สุวรรณเพ็ง เราก็คงต้องรอลุ้นกันนะคะ
อ้างอิง
ศูนย์บริการสาธารณสุข 33 วัดหงส์รัตนาราม ฉีดวัคซีนฟรี 2-13 กันยายน 2567
ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตบางกอกใหญ่ ร่วมกับสำนักงานสัตวแพทย์สาธารณสุข และศูนย์บริการสาธารณสุข 33 (วัดหงส์รัตนาราม) เชิญชวน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!! ระหว่างวันที่ 2 - 13 กันยายน 2567 เวลา 10.00 - 12.00 น.
กิจกรรมทำหมันสัญจร ปี 2567
วันเสาร์ที่ 24 ส.ค. 67 เวลา 10.00-13.00 น. วัดใหญ่ศรีสุพรรณ วงเวียนใหญ่ กทม
วันอาทิตย์ที่ 25 ส.ค. 67 เวลา 13.00-15.00 น. วัดคลองมะเดื่อ ดอนไก่ดี อ.กระทุ่มแบน จ.สมุทรสาคร
วันเสาร์ที่ 31 ส.ค. 67 เวลา 13.00-15.00 น. วัดแพะโคก ต.ดาวเรือง อ.เฉลิมพระเกียรติ จ.สระบุรี
วันอาทิตย์ที่ 1 ก.ย. 67 เวลา 13.00-15.00 น. อาคารอเนกประสงค์ ม.6 ต.ศรีนาวา อ.เมือง จ.นครนายก
วันเสาร์ที่ 14 ก.ย. 67 เวลา 13.00-15.00 น. วัดเสนาสนาราม อ.พระนครศรีอยุธยา จ.อยุธยา
วันอาทิตย์ที่ 15 ก.ย. 67 เวลา 13.00-15.00 น. วัดท่ากุ่ม ต.หนองสาหร่าย อ.ดอนเจดีย์ จ.สุพรรณบุรี
วันเสาร์ที่ 21 ก.ย. 67 เวลา 13.00-15.00 น. ชะอำ จ.เพชรบุรี
วันอาทิตย์ที่ 22 ก.ย. 67 เวลา 13.00-15.00 น. วัดบึงทองหลาง ลาดพร้าว 101 บางกะปิ กทม
วันเสาร์ที่ 28 ก.ย. 67 เวลา 13.00-15.00 น. วัด ต.เมืองเก่า อ.กบินทร์บุรี จ.ปราจีนบุรี-ยังไม่ระบุชื่อวัด
วันอาทิตย์ที่ 29 ก.ย. 67 เวลา 13.00-15.00 น. วัดอัยยิการาม คลอง 9 ปทุมธานี
วันเสาร์ที่ 12 ต.ค. 67 เวลา 9.00-14.00 น. วัดเชียงทอง อ.วังเจ้า จ.ตาก
วันอาทิตย์ที่ 13 ต.ค. 67 เวลา 9.00-14.00 น. วัดพร้าว อ.เมือง จ.ตาก
วันจันทร์ที่ 14 ต.ค. 67 เวลา 9.00-12.00 น. สำนักงานเทศบาลตำบลบ้านตาก อ.บ้านตาก จ.ตาก
วันเสาร์ที่ 19 ต.ค. 67 เวลา 13.00-15.00 น. วัดกระดังงา อ.เมือง จ.สิงห์บุรี
วันอาทิตย์ 20 ต.ค. 67 เวลา 13.00-15.00 น. วัดป่าสะแก ต.ป่าสะแก อ.เดิมบางนางบวช จ.สุพรรณบุรี
วันเสาร์ที่ 26 ต.ค. 67 เวลา 13.00-15.00 น. วัดบางเลน บางเลน จ.นครปฐม
วันอาทิตย์ที่ 27 ต.ค. 67 เวลา 13.00-15.00 น. วัดแสงสรรค์ คลอง 2 ปทุมธานี
วันเสาร์ที่ 9 พ.ย.67 เวลา 13.00-15.00 น. วัด ณ จ.อยุธยา -ยังไม่ระบุสถานที่
วันอาทิตย์ที่ 10 พ.ย. 67 เวลา 13.00-15.00 น. วัด ณ อ.สองพี่น้อง จ.สุพรรณบุรี -ยังไม่ระบุสถานที่
วันเสาร์ที่ 16 พ.ย.67 วัด ณ ต.หนองกลางดง อ.ทัพทัน จ.อุทัยธานี -ยังไม่ระบุสถานที่
วันอาทิตย์ที่ 17 พ.ย. 67 วัด ณ ต.หนองกลางดง อ.ทัพทัน จ.อุทัยธานี -ยังไม่ระบุสถานที่
วันเสาร์ที่ 23 พ.ย.67 เวลา 13.00-15.00 น. วัดบางกะดี ปทุมธานี
วันอาทิตย์ที่ 24 พ.ย.67 เวลา 13.00-15.00 น. วัดบางกะดี ปทุมธานี
วันเสาร์ที่ 7 ธ.ค. 67 สระบุรี -ยังไม่ระบุสถานที่
วันอาทิตย์ 8 ธ.ค. 67 นครนายก -ยังไม่ระบุสถานที่
วันเสาร์ที่ 14 ธ.ค. 67 วัด ณ จ.อยุธยา -ยังไม่ระบุสถานที่
วันอาทิตย์ 15 ธ.ค. 67 จ.สุพรรณบุรี -ยังไม่ระบุสถานที่
วันเสาร์ที่ 21 ธ.ค. 67 วัด ณ จ.ราชบุรี -ยังไม่ระบุสถานที่
วันอาทิตย์ 22 ธ.ค. 67 วัดธรรมสุขใจซอยสามัคคี คลอง 1 ปทุมธานี
ลงทะเบียนทำหมันแมว&สุนัขได้ที่ลิงก์นี้
https://bit.ly/2URyB3Z
ข้อมูลจาก
https://www.rakmaw.com/
ร่วมสมทบทุน สนับสนุน กิจกรรม
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร สิทธิประโยชน์ทันตกรรม
สิทธิประโยชน์ทันตกรรมในระบบหลักประกันสุขภาพแห่งชาติ (สิทธิบัตรทอง หรือ 30 บาทรักษาทุกโรค) ครอบคลุมทันตกรรม 3 ด้าน คือ ทันตกรรมส่งเสริมป้องกัน ทันตกรรมรักษา และ ทันตกรรมฟื้นฟู
1. ทันตกรรมส่งเสริมป้องกัน
มีรายการสิทธิประโยชน์ สำหรับคนไทยทุกสิทธิการรักษา ดังนี้
1. ตรวจสุขภาพช่องปาก ขัด และทำความสะอาดฟัน (ทุกกลุ่มวัย)
2. การทาฟลูออไรด์วาร์นิช (ตามดุลยพินิจทันตแพทย์)
3. การเคลือบฟันด้วยฟลูออไรด์ความเข้มข้นสูงเฉพาะที่ (ตามดุลยพินิจทันตแพทย์)
4. เคลือบหลุมร่องฟันในฟันกรามถาวรและฟันกรามน้อย (ตามดุลยพินิจทันตแพทย์)
5. คัดกรองรอยโรคเสี่ยงมะเร็งและมะเร็งช่องปากโดยการตัดเนื้อเยื่อบริเวณรอยโรค (Biopsy) และตรวจทางพยาธิวิทยา (ผู้มีอายุ 40 ปีขึ้นไปที่มีความเสี่ยง)
2. ทันตกรรมรักษา (สิทธิบัตรทอง 30 บาท)
มีรายการสิทธิประโยชน์ ดังนี้
1. ถอนฟัน
2. อุดฟัน อุดคอฟัน
3. ขูดหินปูน
4. รักษาโพรงประสาทฟันน้ำนม (รากฟันน้ำนม)
5. ใส่เพดานเทียมในเด็กปากแหว่งเพดานโหว่
6. ผ่าฟันคุด (ตามข้อบ่งชี้ของทันตแพทย์)
7. รักษาโรคปริทันต์อักเสบ
8. รักษารากฟันแท้
9. การรักษาอื่นๆ ทางทันตกรรมที่จำเป็นต่อผู้ป่วย
3. ทันตกรรมฟื้นฟู
มีรายการสิทธิประโยชน์ ดังนี้
1. ฟันปลอมฐานพลาสติก (ฟันเทียม) ทั้งแบบซี่ถอดได้และแบบทั้งปากถอดได้
2. ใส่รากฟันเทียมทุกกลุ่มอายุที่มีปัญหาการใส่ฟันเทียมทั้งปากแล้วฟันเทียมหลวมไม่แน่น ไม่กระชับหรือไม่สามารถใส่ฟันเทียมได้ที่ทันตแพทย์วินิจฉัยแล้วว่า จำเป็นต้องได้รับการใส่รากฟันเทียม
3. จัดฟันในผู้มีภาวะปากแหว่งเพดานโหว่หรือปากแหว่ง หรือเพดานโหว่ (ตามดุลยพินิจของทันตแพทย์)
ทันตกรรมอะไรบ้างที่บัตรทองไม่คุ้มครอง
- การทำเพื่อความสวยงามโดยไม่มีข้อบ่งชี้ทางการแพทย์
- การตรวจวินิจฉัยและการรักษาที่เกินความจำเป็นจากข้อบ่งชี้ทางการแพทย์
ขั้นตอนการรับบริการ เข้ารับบริการทันตกรรมได้ทันที แค่มีบัตรประชาชนใบเดียว
- ผู้ที่มีสิทธิบัตรทองหรือสิทธิ 30 บาท สามารถเข้ารับบริการทันตกรรมที่หน่วยบริการประจำตามสิทธิหรือหน่วยบริการปฐมภูมิได้ทุกแห่งเพียงแสดงบัตรประชาชนทุกครั้งเมื่อเข้ารับบริการ
- นอกจากนั้นยังเข้ารักษาได้ที่คลินิกทันตกรรมชุมชนอบอุ่น ในจังหวัดนำร่อง 30 บาทรักษาทุกที่ด้วยบัตรประชาชนใบเดียว โดยจะได้รับบริการ 5 รายการที่คลินิกทันตกรรมชุมชนอบอุ่น ปีละ 3 ครั้ง ดังนี้ การขูดหินปูน การอุดฟัน การถอนฟัน การเคลือบหลุมร่องฟัน และการเคลือบฟลูออไรด์ เพื่อช่วยลดความแออัดในโรงพยาบาล เมื่อครบ 3 ครั้งแล้ว หากยังจำเป็นต้องรักษาต่อก็สามารถใช้สิทธิได้ที่หน่วยบริการประจำตามสิทธิได้โดยไม่เสียค่าใช้จ่าย
ข้อมูลจาก สปสช.
เชิญชวนผู้มีประกันสังคม อายุ 50 ปีขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ (4 สายพันธุ์) ฟรี LINK
โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล
ขอเชิญชวนผู้มีประกันสังคมตามมาตรา 33, 39
ที่มีอายุ 50 ปีขึ้นไป ฉีดวัคซีนไข้หวัดใหญ่ (4 สายพันธุ์)
ฟรี ไม่เสียค่าใช้จ่าย
เริ่มให้บริการตังแต่วันนี้ - 31 สิงหาคม 2565
สามารถติดต่อขอรับบริการได้ที่
ศูนย์ตรวจสุขภาพ โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล
08.00 - 17.00 น. หรือโทร 035-356-888 ต่อ 1301
สอบถามเพิ่มเติม โทร 035-356-888 หรือ 081 – 631 – 5853
คำถามที่พบบ่อยเกี่ยวกับการรักษาโควิด-19 ถ้าสิทธิประกันสังคม LINK
คำถามที่พบบ่อยเกี่ยวกับการรักษาโควิด-19 ถ้าสิทธิประกันสังคมอยู่ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล"
Q 1 : ถ้าเรามีสิทธิประกันสังคม ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล” สามารถตรวจหาเชื้อโควิด แบบ ATK หรือแบบ RT- PCR เสียค่าใช้จ่ายหรือไม่ ?
A 1 : เบื้องต้นต้องเข้ามาให้แพทย์ประเมินอาการ เพื่อให้แพทย์พิจารณาการทำ ATK หรือ RT-PCR ในขั้นตอนถัดไป
-------
Q 2 : ถ้าเรามีสิทธิประกันสังคม ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล” เมื่อตรวจ ATK มีผลเบื้องต้นเป็นบวก สามารถรักษาโควิดได้ที่โรงพยาบาลได้หรือไม่ (มีเงื่อนไขอย่างไรในการรับรักษา )
A 2 : หลังจากที่มีผล ATK Positive ต้องเข้ามาพบแพทย์ที่ Clinic ARI บริเวณชั้นที่ 1 เพื่อให้แพทย์ประเมินอาการและพิจารณาการรักษาในลำดับถัดไป
-------
Q 3 : ถ้าเรามีสิทธิประกันสังคม ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล” เมื่อตรวจพบเชื้อโควิด ทางโรงพยาบาลรับรักษาด้วยหรือไม่ ( มีเงื่อนไขอย่างไรในการรับรักษา )
A 3 : ทางโรงพยาบาลมีความพร้อมในการดูแลผู้ป่วย COVID-19 ทั้งในด้านของบุคลากรทางการแพทย์และจำนวนเตียง ดังนั้น หากมีประกันสังคมที่โรงพยาบาลเอเชียอินเตอร์เนชั่นแนลสามารถติดต่อเข้ามาที่โรงพยาบาลเพี่อให้แพทย์ประเมินอาการผู้ป่วยเบื้องต้น และวางแผนการรักษาในลำดับถัดไป โดยไม่เรียกเก็บค่าใช้จ่ายเพิ่มเติม หากมีสิทธิประกันสังคมที่โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล
-------
Q 4 : ถ้าเรามีสิทธิประกันสังคม ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล” เมื่อมารักษาโควิดที่โรงพยาบาล ต้องเสียค่าใช้จ่ายหรือไม่ ?
A 4 : ทางโรงพยาบาลให้บริการดูแลรักษาผู้ป่วย COVID-19 ที่มีสิทธิประกันสังคมที่โรงพยาบาลเอเชียอินเตอร์เนชั่นโดยไม่เก็บค่าใช้จ่ายเพิ่มเติม
-------
Q 5 : ถ้าเรามีสิทธิประกันสังคม ที่ “โรงพยาบาลเอเชียอินเตอร์เนชั่นแนล” สามารถตรวจหาเชื้อโควิด แบบ ATK หรือ แบบ RT- PCR แบบไม่เสียค่าใช้จ่ายได้กี่ครั้ง และมีสิทธิรักษาโควิดแบบไม่มีค่าใช้จ่ายได้กี่ครั้ง
A 5 : อ้างอิงจากประกาศของกระทรวงสาธารณสุขฉบับล่าสุดที่มีผลบังคับใช้ในวันที่ 16/03/2565 กล่าวคือเมื่อมีการตรวจ ATK ผลเป็น Positive ให้เข้ามาติดต่อที่โรงพยาบาลที่คลินิก ARI เพื่อให้แพทย์ประเมินอาการ และวางแผนการรักษาต่อไป
-------
สอบถามการย้ายสิทธิประกันสังคม โทร 035-356888 หรือ 081-6315853
6-7 กรกฎาคม 2567 แบบ 2 วัน 1 คืน เส้นทางราชบุรี
ทริปที่ 1 วันที่ 6 และ 7 กรกฎาคม 2567 แบบ 2 วัน 1 คืน [ราคา 3,999 บาท]
ตามรอยวัฒนธรรมสัมผัสธรรมชาติใกล้กรุง กิจกรรมพิเศษเส้นทางราชบุรี First Time แฟชั่นโชว์ ผ้าขาวม้า ครั้งแรกบนรถไฟไทย สุขทันที ที่เที่ยวกับรถไฟไทย เดินทางครั้งนี้ไม่เหมือนเดิม โชว์การเดินแฟชั่นโชว์ผ้าขาวม้า ของดีประจำเมืองราชบุรี ถ่ายทอดรูปแบบของการเดินแฟชั่นโชว์จากผ้าขาวม้า ที่นำมาประยุกตีให้ทันสมัย ผ่านการออกแบบจาก ช่างออกแบบสมัยใหม่ พบกับ... SURPRISE นายแบบ นักแสดงซีรีส์ ขวัญใจสายวายมากฝีมือ ร่วมเดินแบบแฟชั่นโชว์ผ้าขาวม้า ของดีประจำเมืองราชบุรี คุณเจ ชลัช ตันติจิบูรณ์ บนขบวนรถ KIHA 183 ครั้งแรก และกิจกรรมอื่นๆ อีกมากมาย
13-14 กรกฎาคม 2567 แบบ 2 วัน 1 คืน เส้นทางหาดสวย-ฟ้าใส สวนสนประดิพัทธ์
13-14 กรกฎาคม 2567 แบบ 2 วัน 1 คืน เส้นทางหาดสวย-ฟ้าใส สวนสนประดิพัทธ์ [ราคา 3,999 บาท]
พบกับกิจกรรมพิเศษ เปิดประสบการณ์ ฟัง SAXOPHONE บรรเลง ผ่านบทเพลงของพ่อ บนขบวนรถ KIHA 183 เส้นทางประจวบคีรีขันธ์ อันแสนโรแมนติก พบกับ... อาจารย์อัส มนต์คเนศวร์ สิริปภัสสรา นำบทเพลงพระราชนิพนธ์ ของในหลวงรัชกาลที่ 7 และในหลวงรัชกาลที่ 9 สองพระมหากษัตริย์ไทย ที่ทรงมีความผูกพันกับเมืองหัวหิน มาบรรเลงเพื่อรำลึกและระลึกถึง พระอัจฉริยภาพทางดนตรีของทั้ง 2 พระองค์ บรรเลงโดย SAXOPHONE เครื่องดนตรีวง JAZZ ที่ผสานความคลาสสิก และบอกเล่าตัวตน ของเมืองหัวหินได้เป็นอย่างดี...
20-21 กรกฎาคม 2567 แบบ 2 วัน 1 คืน มหัศจรรย์เมืองสุพรรณ แหล่งอารยธรรมีทวารวดี
20-21 กรกฎาคม 2567 แบบ 2 วัน 1 คืน มหัศวรรย์เมืองสุพรรณ แหล่งอารยธรรมีทวารวดี [ราคา 3,999 บาท]
พบกับกิจกรรมพิเศษ "เส้นทางสุพรรณบุรี" พบกับปรมาจารย์เพลงฉ่อย "น้าโย่ง" จะมา "ฉ่อย" ครั้งแรก บนขบวนรถ KIHA 183 พร้อมฉ่อยเรื่องราว "กำเนิดเมืองอู่ทอง" เล่าเรื่องความรุ่งเรืองของผืนแผ่นดินสุวรรณภูมิ ที่รุ่งเรือง ในยุคสมัยทวารวดี อันเป็นต้นกำเนิดอู่ทอง ผ่านการเล่นเพลงพื้นบ้าน ที่เป็นเอกลักษณ์ของจังหวัดสุพรรณบุรี และในแถบภูมิภาคกลาง อย่างฉ่อย ตลอดการเดินทาง
27-28 กรกฎาคม 2567 แบบ 2 วัน 1 คืน สัมผัสมนต์เสน่ห์ปราจีนบูรพา
27-28 กรกฎาคม 2567 แบบ 2 วัน 1 คืน สัมผัสมนต์เสน่ห์ปราจีนบูรพา [ราคา 3,999 บาท]
พบกับกิจกรรมพิเศษ "เส้นทางปราจีนบุรี" เคล็ดลับสายมู ON THE TRAIN กับ อาจารย์เป็นหนึ่ง วงษ์ภูดร มูอย่างไรให้ปัง พาไปมู กูรด้านศาสตร์ฮวงจุ้ย พาไหว้ ขอพร แนะเคล็ดลับการไหว้ ท้าวเวสสุวรรณปางพ่อแก่ แห่งเดียวในประเทศไทย "วัดปทุมบูชา" ขอพรด้านโชคลาภ เงินทอง เคล็ดลับการบูชาของขลัง ของหลวงปู่โสฬส เกิจิอาจารย์ชื่อดังสายเครื่องรางของขลัง วัดโคกอู่ทอง
พิเศษ 28 กรกฎาคม 2567 รถจักรไอน้ำเฉลิมพระเกียรติ 72 พรรษา เส้นทางประวัติศาสตร์ กรุงเทพ-อยุธยา LINK
เนื่องในโอกาสมหามงคลวันเฉลิมพระชนมพรรษา พระบาทสมเด็จพระเจ้าอยู่หัว 72 พรรษา 28 กรกฎาคม 2567 การรถไฟฯ การรถไฟแห่งประเทศไทย ได้จัดขบวนรถพิเศษนำเที่ยวรถจักรไอน้ำเส้นทางประวัติศาสตร์ กรุงเทพ-พระนครศรีอยุธยา เพื่อร่วมเฉลิมพระเกียรติฯ พร้อมกับเปิดโอกาสให้ประชาชนได้ร่วมเดินทางเป็นส่วนหนึ่งในการแสดงออกถึงความจงรักภักดี และสำนึกในพระมหากรุณาธิคุณ ที่พระองค์ได้ทรงปฏิบัติพระราชกรณียกิจนานัปการเพื่อประโยชน์สุขแห่งอาณาราษฎร
ทั้งนี้ ผู้ร่วมเดินทางจะได้เดินทางย้อนอดีตไปบนเส้นทางรถไฟสายประวัติศาสตร์ กรุงเทพ-อยุธยา-กรุงเทพ ขบวนที่ 901/902 ด้วยรถจักรไอน้ำแบบแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลก ครั้งที่ 2 ผลิตโดยบริษัท นิปปอน ชาร์เรียว จำกัด เริ่มออกเดินทางจากสถานีกรุงเทพ (หัวลำโพง) เวลา 08.10 น. ถึงสถานีอยุธยา เวลา 10.20 น. จากนั้นนักท่องเที่ยวจะมีเวลาเดินทางท่องเที่ยวโบราณสถานที่ทรงคุณค่าทางประวัติศาสตร์ ไหว้พระขอพรสิ่งศักดิ์สิทธิ์หรือร้านอาหารแบบผสมผสานกับบรรยากาศความเป็นเมืองเก่าของจังหวัดพระนครศรีอยุธยา ประมาณ 6 ชั่วโมง และเดินทางกลับออกจากสถานีอยุธยา เวลา 16.40 น. ถึงกรุงเทพ เวลา 18.50 น.
สำหรับอัตราค่าโดยสาร
- รถธรรมดาชั้น 3 ไป - กลับ ผู้ใหญ่/เด็ก ราคา 329 บาท
- ตู้โดยสารปรับอากาศ (รถโอทอป) ราคา 799 บาท
- บริการอาหารว่างและน้ำดื่มทั้งเที่ยวไป – กลับ
และพิเศษสุดสำหรับผู้โดยสารที่เดินทางในทริปนี้ การรถไฟฯ และบริษัท เรกคิทท์ เบนคีเซอร์ (ประเทศไทย) จำกัด ได้ร่วมมือกันมอบผลิตภัณฑ์เดทตอล เพื่อส่งมอบความห่วงใยในการดูแลพี่น้องประชาชน นักท่องเที่ยวสำหรับทุกท่านอีกด้วย
การรถไฟฯ เริ่มเปิดจำหน่ายตั๋วโดยสารพร้อมกันทั่วประเทศในวันที่ 28 มิถุนายน 2567 ตั้งแต่เวลา 08.30 น. เป็นต้นไป ผู้สนใจสามารถติดต่อซื้อตั๋วโดยสารและสำรองที่นั่งล่วงหน้า (สูงสุด 30 วัน) ด้วยระบบ D-Ticket หรือที่สถานีรถไฟทุกแห่งทั่วประเทศ
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตพระโขนง
1. หมดสติ ไม่รู้สึกตัว ไม่หายใจ
2. ซึมลง เหงื่อแตก ตัวเย็น หรือมีอาการชักร่วม
แจงรับใบอนุญาตประกอบโรคศิลปะ สาขากายอุปกรณประจําป 2563
แจงรับใบอนุญาตประกอบโรคศิลปะ
สาขากายอุปกรณประจําป 2563
ตามประกาศคณะกรรมการวิชาชีพสาขากายอุปกรณ เรื่อง ผลการพิจารณาผูสอบผานเพื่อ
ขึ้นทะเบียนและรับใบอนุญาตเปนผูประกอบโรคศิลปะสาขากายอุปกรณประจําป 2563 และการอนุมัติ
ขึ้นทะเบียนเปนผูประกอบโรคศิลปะสาขากายอุปกรณไดประกาศรายชื่อผูสอบผานและไดรับการขึ้นทะเบียน
เปนผูประกอบโรคศิลปะสาขากายอุปกรณจํานวน 22 คน นั้น
ในการนี้ กองสถานพยาบาลและการประกอบโรคศิลปะไดจัดทําใบอนุญาตประกอบโรคศิลปะฯ
ใหแกผูสอบผานและไดรับการขึ้นทะเบียนเปนผูประกอบโรคศิลปะสาขากายอุปกรณเสร็จเรียบรอยแลว
จึงขอแจงใหผูสอบผาน มารับใบอนุญาตประกอบโรคศิลปะสาขากายอุปกรณไดตั้งแต
วันอังคารที่ 15 กันยายน 2563 เปนตนไป ในวันและเวลาราชการ ณ ศูนยบริการแบบเบ็ดเสร็จ ชั้น 1
อาคารกรมสนับสนุนบริการสุขภาพ ถนนสาธารณสุข 8 กระทรวงสาธารณสุข อําเภอเมือง จังหวัดนนทบุรี
กรณีที่ทานมารับใบอนุญาตดวยตนเอง
สิ่งที่ตองเตรียมไดแก
1. บัตรประจําตัวประชาชน
2. คาธรรมเนียมใบอนุญาต 1000 บาท
กรณีที่ทานมอบฉันทะใหผูอื่นมารับแทน
สิ่งที่ตองเตรียมไดแก
1. หนังสือมอบอํานาจ (ตามแบบฟอรมที่แนบทายประกาศนี้)
2. สําเนาบัตรประชาชนของผูมอบอํานาจ และผูรับมอบอํานาจ
3. คาธรรมเนียมใบอนุญาต 1000 บาท
source 4.Fill COE Code
Fill in 6 digit COE Code
Remark
- The Reference ID (6 digits) is the same number generated from COE online System
- COE: Certificate Of Entry is a document certified the person the permission to enter into The Kingdom of Thailand.
- False input for 3 times will result in registration locking for 5 minutes. After that, start again at Step 6.
ร้อยเอ็ด - มาจาก 5 จว.ให้รายงานตัว เพื่อสอบสวน หากเสี่ยงต้องกักตัว 14 วัน LINK
9 เมย 64
ผู้ที่เดินทางเข้ามาในจังหวัดร้อยเอ็ด ตั้งแต่วันที่ 9 เมษายน 2564 เป็นต้นไป ให้ปฏิบัติตัวดังนี้
- ผู้ที่เดินทางมาจากพื้นที่ควบคุม 5 จังหวัด และมีประวัติเสี่ยง ให้กักตัว 14 วัน
- ผู้ที่เดินทางมาจากพื้นที่ควบคุม 5 จังหวัด คือ กรุงเทพฯ สมุทรปราการ นนทบุรี นครปฐม และปทุมธานี ให้สังเกตอาการตนเอง 14 วัน (ออกจากบ้านได้บ้าง แต่รีบไป รีบกลับ /งดงานเลี้ยงสังสรรค์ ไม่ตั้งวงดื่มสุรา /ปฏิบัติตามมาตรการ D M H T T อย่างเคร่งครัด)
- ผู้ที่เดินทางมาจากพื้นที่ควบคุม 5 จังหวัด ให้รายงานตัวต่อผู้นำชุมชน หรือเจ้าหน้าที่สาธารณสุข เพื่อคัดกรองความเสี่ยง (เพื่อพิจารณาดำเนินการตามข้อที่ 1)
- หากมีอาการอย่างใดอย่างหนึ่ง คือ ไข้ ไอ เจ็บคอ มีน้ำมูก จมูกไม่ได้กลิ่น ลิ้นไม่รับรส ให้ไปพบแพทย์ที่โรงพยาบาลใกล้บ้านพร้อมแจ้งประวัติเสี่ยง
- ขอความร่วมมือประชาชนทุกท่านปฏิบัติตามมาตรการป้องกันโรคโควิด 19 D M H T T ได้แก่ ล้างมือบ่อยๆ สวมหน้ากากอนามัยหรือหน้ากากผ้า อยู่ห่างกัน 2 เมตร ตรวจวัดอุณหภูมิร่างกาย สแกน "ไทยชนะ" และ ติดตั้งแอปพลิเคชั่น "หมอชนะ"
โรงพยาบาลพญาไท อัพโหลรายชื่อแล้ว เช็คสิทธิ์พร้อมลงทะเบียนการรับวัคซีนได้ที่ Line และ app หมอพร้อม LINK
หลายท่านอาจมีความกังวลใจในการจองสิทธิ์วัคซีนโควิดของรัฐ เนื่องจากเกรงว่าจำนวนวัคซีนนั้นจะเต็มจำนวน ทางโรงพยาบาลพญาไท ขอเรียนให้ทุกท่านทราบว่า การฉีดวัคซีนรอบแรก ตั้งแต่ เดือน มิถุนายน ถึง กรกฎาคม 2564 นี้ มีวัคซีนที่รัฐบาลได้จัดหาไว้เพียงพอแก่การฉีดวัคซีนให้กับกลุ่มเป้าหมายในรอบนี้ และกระทรวงสาธารณสุขได้วางแผนจัดหาวัคซีนให้ครอบคลุมกลุ่มเป้าหมายทั้งหมดภายในสิ้นปีนี้
โรงพยาบาลพญาไท ได้ทำการอัพโหลดรายชื่อผู้รับบริการที่มีอายุ 60 ปี ขึ้นไป และกลุ่มเสี่ยง 7 โรคเรื้อรัง ที่มีประวัติการรักษากับโรงพยาบาลเข้าระบบหมอพร้อมเรียบร้อยแล้ว ท่านสามารถเช็คสิทธิ์พร้อมลงทะเบียนการรับวัคซีนได้ที่ Line และ app หมอพร้อม
หากไม่พบรายชื่อของท่านหรือไม่สามารถทำการนัดหมายได้ สามารถสอบถามเพิ่มเติมได้ที่
Call center 1772
@LINE : https://bit.ly/3idUabu
สอบถามเกี่ยวกับการลงทะเบียนรับวัคซีน COVID-19 : https://bit.ly/3vRnL0J
อบจ.น่าน รับผู้ป่วยโควิด-19 กลับบ้าน LINK
ช่องทางติดต่อสอบถาม โควิด19 จ.น่าน
• รับผู้ป่วยโควิด-19 กลับบ้าน ไอดีไลน์ @876vtsfm โทร 0842128070
• วัคซีนป้องกันโควิด-19 โทร 0623321073
• สอบถามเรื่องอื่นๆเกี่ยวกับโควิด-19 โทร 054-600070 ต่อ 311,312,313
ศูนย์ปฏิบัติการภาวะฉุกเฉินกรณี โรคโควิด -19 สำนักงานสาธารณสุขจังหวัดน่าน
เพจ
อบจ.น่านเขตภาษีเจริญ ตรวจความพร้อมศูนย์พักคอย วัดกำแพง (บางแวก 32) LINK
เขตภาษีเจริญ ตรวจความพร้อมศูนย์พักคอยในพื้นที่ รับมือการแพร่ระบาดของโรคโควิด-19 อย่างทันท่วงที
5 ม.ค. 65 นายยุทธนา ป่าไม้ ผู้อำนวยการเขตภาษีเจริญ นำหัวหน้าฝ่ายสิ่งแวดล้อมฯ และเจ้าหน้าที่ฝ่ายสิ่งแวดล้อมฯ ลงพื้นที่ตรวจความเรียบร้อยศูนย์พักคอยเพื่อส่งต่อ เขตภาษีเจริญ (Community Isolation) วัดกำแพง (บางแวก 32) เพื่อเตรียมความพร้อมรับมือการแพร่ระบาดของโรคโควิด-19 ในพื้นที่ภาษีเจริญ ณ วัดกำแพง (บางแวก 32) เขตภาษีเจริญ
4) การมีเครือข่ายพันธมิตรที่เข้มแข็ง (Partnership)
การมีเครือข่ายพันธมิตรที่เข้มแข็ง (Partnership) บำรุงราษฎร์มีนโยบายอย่างชัดเจนในการแสวงหาพันธมิตรทางธุรกิจใหม่ ๆ เพื่อความร่วมมือในการตอบสนองความต้องการของลูกค้าที่มีการกระจายอยู่ในเซกเมนต์ต่าง ๆ มากขึ้น ที่ผ่านมา บำรุงราษฎร์ได้ร่วมมือกับมั่นคงเคหะการและไมเนอร์ ภายใต้การดำเนินงานของศูนย์ส่งเสริมสุขภาพไวทัลไลฟ์ ร่วมเปิดตัวโครงการ RAKxa Wellness ที่บางกระเจ้า ซึ่งเป็นศูนย์บูรณาการสุขภาพและการแพทย์แบบองค์รวม Fully Integrative Wellness & Medical Retreat แห่งแรกในเอเชียที่รวม Advanced Medical Science และ Holistic Wellness ไว้ด้วยกัน
นอกจากนี้ยังมีการดำเนินการภายใต้โมเดลธุรกิจ Bumrungrad Health Network เพื่อขยายการให้บริการทางการแพทย์ด้วยมาตรฐานบำรุงราษฎร์ไปยังกลุ่มเซกเมนต์ใหม่ๆ ของโรงพยาบาลพันธมิตร อาทิ ศูนย์กระดูกสันหลังและศูนย์ข้อ ร่วมกับโรงพยาบาลพริ้นซ์ สุวรรณภูมิ, ศูนย์กระดูกสันหลัง ร่วมกับโรงพยาบาลนครธน, ศูนย์มะเร็งฮอไรซัน ร่วมกับโรงพยาบาลพิษณุเวช จังหวัดพิษณุโลก, และล่าสุดได้เปิดบริการด้านพันธุศาสตร์ เพื่อยกระดับการตรวจหาความผิดปกติทางพันธุกรรม ร่วมกับสวัสดีราษฎร์คลินิกเวชกรรม จังหวัดนครราชสีมา เพื่อขยายโอกาสให้ประชาชนสามารถเข้าถึงการบริการทางการแพทย์ในระดับที่หลากหลายขึ้นในโรงพยาบาลพันธมิตรที่กระจายอยู่ในภูมิภาคต่างๆ รวมถึงยังขยายความร่วมมือกับพันธมิตรในอุตสาหกรรมอื่นๆ อาทิ สยามพิวรรธน์, เซ็นทรัล, เดอะ มอลล์, อนันดา และแสนสิริ เพื่อการแนะนำโปรแกรมดูแลสุขภาพที่ออกแบบเพื่อให้เหมาะกับลูกค้าแต่ละกลุ่มอีกด้วย โรงพยาบาลศิครินทร์ เปิดรับเพิ่มได้อีกกว่า 110,000 คน LINK
เลือกประกันสังคมปี 65 เลือก โรงพยาบาลศิครินทร์ เปิดรับเพิ่มได้อีกกว่า 110,000 คน ผู้ประกันตนสามารถเข้ารับบริการที่โรงพยาบาลศิครินทร์ได้ทุกสาขา (โดยไม่มีเงื่อนไข) โดยยื่นบัตรประชาชนเพื่อการเข้ารับบริการ
#รอพบแพทย์ไม่นาน #ปรึกษาพบแพทย์เฉพาะทางได้ #รักษาและผ่าตัดด้วยมาตรฐานโรงพยาบาลสากลระดับโลก
ติดต่อสอบถามรายละเอียดเพิ่มเติม โรงพยาบาลศิครินทร์ โทร.1728 โรงพยาบาลศิครินทร์ สมุทรปราการ โทร 02-323-2995 โรงพยาบาลศิครินทร์ หาดใหญ่ โทร 074-310310
EP. 3.4 สิทธิในการแก้ไขข้อมูลส่วนบุคคลให้ถูกต้อง (Right to Rectification) - มาตรา 35 และมาตรา 36 LINK
.
การแก้ไขข้อมูลส่วนบุคคลให้ถูกต้อง สมบูรณ์ เป็นหน้าที่ของใคร???
เจ้าของข้อมูลส่วนบุคคลจะต้องเป็นผู้ร้องขอแก้ไขทุกกรณีหรือไม่???
รู้ไปพร้อมกัน...
.
หลักการสำคัญคือ เจ้าของข้อมูลส่วนบุคคลสามารถยื่นคำร้องขอแก้ไขข้อมูลส่วนบุคคลที่เกี่ยวกับตนได้ เมื่อเห็นว่าข้อมูลส่วนบุคคลของตนไม่ถูกต้องหรือไม่สมบูรณ์
.
เมื่อผู้ควบคุมข้อมูลได้รับคำร้องขอแก้ไขข้อมูลส่วนบุคคลจะต้องดำเนินการแก้ไขให้ ‘ถูกต้อง เป็นปัจจุบัน สมบูรณ์ และไม่ก่อให้เกิดความเข้าใจผิด’
*ถึงแม้ว่าไม่มีการร้องขอจากเจ้าของข้อมูลก็ตาม
แต่การแก้ไขข้อมูลส่วนบุคคลก็เป็นหน้าที่ตามกฎหมายของผู้ควบคุมข้อมูล
.
หากผู้ควบคุมข้อมูลปฏิเสธคำร้องขอแก้ไขข้อมูลจะต้องบันทึกรายการและเหตุผลการปฏิเสธไว้ด้วย
ตามมาตรา 39
และเจ้าของข้อมูลมีสิทธิร้องเรียนต่อคณะกรรมการผู้เชี่ยวชาญเพื่อสั่งให้ผู้ควบคุมข้อมูลส่วนบุคคลดำเนินการได้ ตามมาตรา 34 วรรคสอง
.
ติดตามประเด็นเรื่องสิทธิของเจ้าของข้อมูลได้ในครั้งต่อไป
เพื่อสร้างความเข้าใจที่ชัดเจนต่อการใช้กฎหมายคุ้มครองข้อมูลส่วนบุคคล
Home Isolation ที่โรงพยาบาลสิริเวช โดยไม่มีค่าใช้จ่าย
โรงพยาบาลสิริเวช จันทบุรี พร้อมให้บริการผู้ป่วยโควิด-19
ตั้งแต่ขั้นตอนการตรวจหาเชื้อ จนถึงการรักษาที่โรงพยาบาล 5 วัน 7 วัน 10 วัน
สอบถามโทร 097-0415366, 097-0416966, 082-9640463
ลิงค์บริการวิมุต เปิดให้บริการ Hotel Isolation อีกครั้งเริ่ม 1 กรกฎาคมนี้! LINK
โรงพยาบาลวิมุตเปิดให้บริการ Hotel Isolation อีกครั้งเริ่ม 1 กรกฎาคมนี้! พร้อมดูแลรักษาผู้ป่วยติดเชื้อ COVID-19 โดยเปิดให้บริการ 3 ประเภท (ทุกสิทธิการรักษา)
1. Hospital รับการรักษาที่โรงพยาบาลวิมุต
2. Hotel Isolation เข้าพักที่โรงแรม Elegant Airport Hotel
3. Home Isolation
ท่านที่ต้องการเข้ารับบริการ สามารถกรอกแบบฟอร์มลงทะเบียน Waiting list ในลิงก์ด้านล่าง
เมื่อกรอกข้อมูลแล้วจะมีเจ้าหน้าที่ติดต่อกลับตามลำดับคิว โดยการรับตัวเข้ารักษาประเภทใดนั้น จะอยู่ขึ้นกับความเหมาะสมตามดุลยพินิจของแพทย์
ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่
ViMUT Covid Hotline 02-079-0101
สุขสวัสดิ์อินเตอร์ จัดแพคเกจเหมาจ่าย 7 วัน เริ่ม 15,000 LINK
โรงพยาบาลสุขสวัสดิ์อินเตอร์ ทางเลือกสำหรับผู้ติดเชื้อทั้งชาวไทยและต่างชาติ ที่ต้องการกักตัวในโรงพยาบาลสุขสวัสดิ์อินเตอร์ มีทีมแพทย์ พยาบาลวิชาชีพและทีมสหสาขวิชาชีพดูแลตลอด 24 ชั่วโมงแบบครบวงจร มั่นใจในความปลอดภัยตามมาตรฐานวิชาชีพ พร้อมห้องทุกประเภทให้เลือกหลากหลาย ตอบโจทย์ทุกความต้องการและงบประมาณของครอบครัว ด้วยโปรแกรมแบบเหมาจ่าย
สอบถามลายละเอียดได้ที่เบอร์
คุณธงชัย 092-268-7289
คุณเจษฎาภรณ์ 063-969-5666
คุณสุภาพร 081-090-2030
คุณเยาวภา 093-551-4452
วัดภูพร้าว อุบลราชธานี ผลิตภัณฑ์ อคิลานัง เภสัชภิรมย์
วัดสิรินธรวรารามภูพร้าว วัดดังแห่ง ช่องเม็ก อ.สิรินธร จ.อุบลราชธานี วัดที่มีรูปประดับต้นกัลปพฤกษ์เรืองแสง ที่รู้จักกันดีทั่วประเทศ นอกจากนั้นแล้ว วัดภูพร้าวแห่งนี้ ยังเป็นศูนย์รวมองค์ความรู้ด้านผลิตภัณฑ์สมุนไพร มาเนิ่นนานอีกด้วย โดยการริเริ่มของพระครูปัญญาวโรบล รวมทั้งสูตร "น้ำมันกัญชาภูพร้าว" ที่ปัจจุบันได้มอบสูตรให้กับกระทรวงสาธารณสุขแล้ว 2 ตำรับ คือ น้ำมันกัญชาวัดภูพร้าว และพรายพร่างพระธมนี เพื่อให้ใช้สำหรับผลิตเป็นยาแจกจ่ายให้กับประชาชนไทย ทางวัดเองได้ร่วมดำเนินการด้านสมุนไพรและผลิตภัณฑ์กับกลุ่มชุมชนในพื้นที่ และสร้างสรรค์ ตำรับยาพื้นบ้าน ภายใต้ชื่อ "อคิลานัง เภสัชภิรมย์"
สถาบันโรคผิวหนัง (IndermSkin)
เป็นสถาบันโรคผิวหนังรวบรวมและเผยแพร่ข่าวสารด้านโรคผิวหนังรวมถึงการดูแลด้านผิวพรรณความงาม นวัตกรรมในการดูแลผิวหนัง โดยนำเสนอข้อมูลที่ถูกต้อง ทันสมัย ผ่านทางบทความอินโฟกราฟิก และสื่อคลิปวีดีโอ โดยแพทย์ผู้เชี่ยวชาญด้านโรคผิวหนังจากสถาบันโรคผิวหนัง เพื่อส่งเสริมความเข้าใจที่ถูกต้อง และป้องกันการเกิดปัญหาด้านผิวหนัง
ดาวน์โหลดได้ที่
iOS และ
Androidนิทรรศการ Thailand Global Healthcare Destination
กรมสนับสนุนบริการสุขภาพได้จัดนิทรรศการภายใต้แนวคิด “Thailand Global Healthcare Destination” นำเสนอถึงการขับเคลื่อนสู่การเป็นศูนย์กลางด้านสุขภาพ (Medical Hub) ของไทย ศักยภาพของอุตสาหกรรมการแพทย์เพื่อสร้างเศรษฐกิจไทยภายหลังการระบาดของโรคโควิด 19 ได้แก่ การให้บริการทางการแพทย์ที่มีศักยภาพสูง มีชื่อเสียงและดึงดูดชาวต่างชาติ (Magnets) และอุตสาหกรรมที่ส่งเสริมการท่องเที่ยวทางการแพทย์ ได้แก่ การดูแลรักษาสุขภาพบริการชั้นเลิศ (Wellness & Medical Retreat) เช่น การนวดรักษา การนวดกดจุด สปา เป็นต้น
นอกจากนี้ ยังมีการนำเสนอผลิตภัณฑ์คุณภาพสูงเพื่อการดูแลสุขภาพ (High Products Hub) จากองค์การเภสัชกรรม โรงพยาบาลเจ้าพระยาอภัยภูเบศร และบริษัทขาวลออ เป็นต้น ข้อเสนอแพ็กเกจตรวจสุขภาพพิเศษ จากโรงพยาบาลเอกชนชั้นนำของประเทศ บทบาทของอาสาสมัครสาธารณสุขไทย (อสม.) ในการรับมือสถานการณ์การแพร่ระบาดของโรคโควิด 19 ในช่วงที่ผ่านมา ซึ่งได้รับคำชื่นชมจาก WHO รวมถึงการเตรียมความพร้อมของประเทศไทยในการเป็นเจ้าภาพจัดงาน Specialised Expo 2028 Phuket โดยมีสำนักงานส่งเสริมการจัดประชุมและนิทรรศการ (Thailand Convention and Exhibition Bureau) หรือ TCEB ร่วมจัดนิทรรศการด้วย
ตลอดระยะเวลาการจัดประชุม กระทรวงสาธารณสุขร่วมกับหน่วยงานต่างๆ ในการส่งเสริมสนับสนุนการวางจําหน่ายผลิตภัณฑ์เพื่อสุขภาพ ผลิตภัณฑ์สมุนไพรไทย และผลิตภัณฑ์โอทอป 4 - 5 ดาว (OTOP) ณ ลานพลาซ่า King Power รางน้ำ และเปิดช่องทางการวางจำหน่ายสินค้าและผลิตภัณฑ์สุขภาพออนไลน์ ผ่านทางเว็บไซต์
thailandmedicalhub.net/ ซึ่งผู้เข้าร่วมประชุมเอเปคสามารถซื้อสินค้าและผลิตภัณฑ์สุขภาพในพื้นที่จัดแสดงนิทรรศการและขอคืนภาษีได้โดยได้รับความร่วมมือในการเตรียมระบบ Vat Refund/Tax Refund และการเปิดใช้ช่องทางพิเศษ (Fast Track Lane) จากการท่าอากาศยานสุวรรณภูมิ กรมสรรพากร กรมศุลกากร สำนักงานตรวจคนเข้าเมือง และหน่วยงานอื่นๆ ที่เกี่ยวข้อง เพื่ออำนวยความสะดวกให้แก่ผู้เข้าประชุมการประชุมระดับสูงว่าด้วยสาธารณสุขและเศรษฐกิจครั้งนี้ด้วย
มูลนิธิรามาธิบดีฯ
มูลนิธิรามาธิบดี ในพระราชูปถัมภ์สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ทำหน้าที่เป็นศูนย์กลางในการระดมทุนเพื่อสนับสนุนการดำเนินงานของคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี ดูแลให้คนไทยทุกคน ทุกระดับชั้น มีสุขภาพที่ดีอย่างยั่งยืนมาเกือบครึ่งศตวรรษ ซึ่งการระดมทุนที่ผ่านมานั้น สามารถช่วยเหลือผู้ป่วยยากไร้ได้หลายหมื่นรายต่อปี รวมถึงการจัดซื้อเครื่องมือแพทย์ที่จำเป็นในการช่วยชีวิตผู้ป่วย ซึ่งเป็นไปตามหลักปณิธานของมูลนิธิรามาธิบดีฯที่ว่า "การให้สุขภาพที่ดีอย่างยั่งยืนคือการให้อันยิ่งใหญ่และไม่สิ้นสุด"
• โทร. 022012222
เลือกชมของที่ระลึกจุดจำหน่ายของที่ระลึกของมูลนิธิรามาธิบดีฯ
• Robinhood Mart
สงกรานต์เย็นฉ่ำวิถีไทย สุขใจอุทัยธานี 13 - 15 เมษายน 2566
SONGKRAN FESTIVAL UTHAITHANI 13 - 15 เมษายน นี้ ณ บริเวณหอนาฬิกา เย็นฉ่ำวิถีไทย สุขใจอุทัยธานี
พัฒนา อสม. เฉพาะทาง
ปัญหา
ปัจจุบัน บุคลากรทางการแพทย์มีชั่วโมงการทำงานที่สูงเกินไป อย่างเช่นแพทย์ ต้องทำงานสัปดาห์ละ 80 ชั่วโมง หรือเฉลี่ยวันละ 14 ชั่วโมง ซึ่งระยะเวลาการทำงานที่มากเกินไปส่งผลต่อความสามารถต่อการให้บริการกับประชาชน เช่น ความแม่นยำในการตรวจวินิจฉัยโรค การทำหัตถการ ทำให้ประชาชนอยู่ในความเสี่ยงในการรักษาที่ผิดพลาด
ภาระงานของบุคลากรทางการแพทย์ ที่มีชั่วโมงการทำงานสูง แต่ค่าตอบแทนนอกเวลากลับได้รับอย่างไม่เหมาะสม และบางกรณีก็ไม่ได้รับค่าตอบแทนนอกเวลา ทำให้บุคลากรทางการแพทย์หมดกำลังใจในการทำงานในระบบสาธารณสุขของรัฐ และนำไปสู่การลาออกเข้าไปอยู่ในระบบเอกชนที่ผลตอบแทนดีกว่า (กรณีแพทย์ลาออกปีละ 500 - 600 คน)
นอกจากนั้น บุคลากรที่ทำงานเกี่ยวกับการกู้ชีพฉุกเฉิน ส่วนใหญ่มาจากอาสาสมัครตามมูลนิธิต่าง ๆ ซึ่งการดำเนินงานไม่ได้มีระบบและหลักเกณฑ์ที่เป็นมาตรฐานทางวิชาการ หรือไม่ได้สำเร็จการศึกษาในด้าน paramedic และยังไม่ได้รับการกำกับดูแลด้านมาตรฐานการปฏิบัติงานจากภาครัฐ เพราะว่าอาสาสมัครเหล่านี้ถือเป็นคนแรกที่เข้าไปในที่เกิดเหตุ อีกทั้งหน่วยงานรัฐ โดยเฉพาะองค์กรปกครองส่วนท้องถิ่น มีบุคลากรด้านการกู้ชีพฉุกเฉินไม่เพียงพอ
ข้อเสนอ
- พัฒนาระบบแนวหน้าสุขภาพ (ผู้ปฏิบัติงานด้านสุขภาพแบบเฉพาะงาน) โดยการจ้างงานแบบ part-time ให้ค่าตอบแทนตามชิ้นงาน (เช่น นักโภชนาการ นักจิตวิทยา นักกายภาพบำบัด นักรังสีวิทยา นักพยาธิวิทยา) และแนวหน้าสุขภาพท้องถิ่น (หรือ Local Health Vanguard) ที่พัฒนาต่อยอดมาจาก อสม. ผ่านการฝึกอบรมและได้รับมาตรฐาน เพื่อช่วยภารกิจต่างๆ ของระบบสุขภาพในชุมชน
- จัดระบบผลตอบแทนที่เป็นธรรมตามรายชิ้นงาน-ตามผลงาน (ไม่ใช่เงินเดือน แต่จูงใจ/มั่นคงพอที่จะดำเนินการ เป็นอาชีพได้)
ยอดข้าวสุราทิพย์ สุราชุมชนจากตรัง LINK
"ยอดข้าวสุราทิพย์" สุราชุมชนจากตรัง เกิดขึ้นจากการที่ชอบทดลอง อยากทำ อยากส่งเสริมแรงงานในชุมชน อยากสร้างอาชีพให้กับกลุ่มวัยรุ่นภายในระแวกบ้านให้มีอาชีพ ดีกว่าไปมั่วสุมกับสารเสพติด และอยากสนับสนุนวัตถุดิบพื้นบ้านของเกษตรกร จึงได้จัดตั้งโรงกลั่นสุราขึ้นมา ภายใต้ชื่อ ยอดข้าวสุราทิพย์ พร้อมกับมีความคิดว่าถ้าเราทำวัตถุดิบพื้นบ้านนี้ให้มันดีเทียบเท่ากับ Vodka ของต่างประเทศ ทำให้กลิ่นฉุนน้อยลงถึงขั้นไม่มีกลิ่น และเอกลักษณ์เฉพาะตัวสามารถนำไปแข่งกับของต่างประเทศได้ จึงคิดค้นสูตรต่างๆ โดยใช้วัตถุดิบพื้นบ้านของเกษตรกรอย่างเช่นข้าว และวัตถุดิบเพื่อนบ้านอย่างเช่นน้ำตาลโตนด ทดลองจนได้มาเป็น vodka ภายใต้แบรนด์ยอดข้าวสุราทิพย์
ข้อมูลและภาพจากเพจประชาชนเบียร์
ข้อกังวล จากหน่วยบริการ
จากการดึงเอาคลินิกและร้านยามาเข้าร่วมโครงการ ทำให้การบริการขยายไปได้กว้างและเร็ว ครอบคลุมพื้นที่ทั่วประเทศได้มากขึ้นตามเป้าหมาย แต่กระนั้น มีข้อห่วงใยข้อกังวลบางประการ สะท้อนออกมา ในหลายประเด็น
- การต้องวางเงินมัดจำ สำหรับคลินิกและร้านยา มีผลต่อการตัดสินใจเข้าร่วมโครงการ
- กรณีร้านยา มีประเด็นเรื่องภาษีเข้ามาเป็นปัจจัย เพราะในการบริการมีทั้งค่าบริการ และ ค่ายา (ค่าสินค้า) แตกต่างจากสถานพยาบาล ที่จะมีเพียงค่าบริการ
- การบันทึกข้อมูล ทำให้คลินิกมีงานมากขึ้น นอกเหนือจากการให้บริการอย่างเดียว ทำให้ต้องใช้เวลามากขึ้น เสนอให้ลดขั้นตอนตรงนี้
- ความกังวลเรื่องการเบิกจ่าย ในเรื่องทั้งวิธีการและจำนวน
คลินิกโรคหอบหืด
คลินิกโรคหอบหืด เปิดให้บริการ วันพฤหัสบดี ในเวลาทำการ 13.00 – 16.30 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120ครบรอบ 34 ปี โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ
วันที่ 19 พ.ค. 2566 เวลา 09.00 น. : รศ.ทวิดา กมลเวชช รองผู้ว่าราชการกรุงเทพมหานคร เป็นประธานเปิดงานวันคล้ายวันสถาปนาโรงพยาบาลโรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ ครบรอบ 34 ปี พร้อมมอบของที่ระลึกแก่ผู้มีอุปการคุณและจิตอาสา มอบโล่แก่บุคลากรดีเด่นและมอบทุนการศึกษาแก่นักเรียนเรียนดี โดยมี นายแพทย์สุขสันต์ กิตติศุภกร รองปลัดกรุงเทพมหานคร ผู้บริหารกรุงเทพมหานคร ผู้บริหารสำนักการแพทย์ ผู้บริหารโรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ และผู้ที่เกี่ยวข้อง ร่วมพิธี ณ ห้องประชุม ชั้น 7 อาคารเมตตาธรรม โรงพยาบาลหลวงพ่อทวีศักดิ์ ชุตินฺธโร อุทิศ เขตหนองแขม
รองผู้ว่าฯ ทวิดา กล่าวชื่นชมการดำเนินงานของโรงพยาบาลที่ได้มีความเจริญก้าวหน้า ตามลำดับโดยเฉพาะอย่างยิ่งความมุ่งมั่นที่จะพัฒนาเพิ่มศักยภาพการให้บริการในด้านการรักษาผู้ป่วย รวมทั้งผลการดำเนินงานของโรงพยาบาลที่ได้มีการพัฒนาขยายการให้บริการในการรักษาพยาบาลผู้ป่วยที่มีจำนวนเพิ่มมากขึ้น เพื่อรองรับการเจริญเติบโตของเมืองในย่านฝั่งธนบุรีและพื้นที่ใกล้เคียง โดยได้มีการระดมทุนจากทุกภาคส่วนต่าง ๆ เพื่อให้การดำเนินการบรรลุตามวัตถุประสงค์ที่ตั้งไว้ พร้อมทั้งขอบคุณผู้มีจิตศรัทธาที่ร่วมบริจาคเงินและสนับสนุนกิจกรรมของโรงพยาบาลด้วยดีตลอดมา
Timeline โครงการ BKK Food Bank
โครงการ BKK Food Bank กรุงเทพมหานคร เริ่มต้น เมื่อปี 2565 (2022) มีไทม์ไลน์เส้นทางการดำเนินงาน ดังนี้
ปี 2565
22 มิถุนายน 2565 กรุงเทพมหานคร เปิดกิจกรรมนำร่องโครงการ Food Bank
1 กรกฎาคม 2565 ประชุมหารือการจัดทำ Model โครงการ BKK Food Bank การนำเสนอข้อคิดเห็น ปัญหา และอุปสรรคจากการดำเนินโครงการ “BKK Food Bank” ของเขตต้นแบบที่เริ่มดำเนินการไปแล้ว 3 เขต ได้แก่ เขตบางขุนเทียน เขตพระนคร และเขตคลองเตย นำเสนอ 3 รูปแบบ ทั้งหมดจะนำเสนอเข้าสู่ที่ประชุมหัวหน้าหน่วยงานกรุงเทพมหานครในวันที่ 7 ก.ค.65 เพื่อเดินหน้าแนวทางการดำเนินการ BKK Food Bank 50 เขต
20 ธันวาคม 2565 นายศานนท์ หวังสร้างบุญ รองผู้ว่าราชการกรุงเทพมหานครเป็นประธานการประชุมชี้แจงโครงการพัฒนาต้นแบบ BKK Food Bank ครั้งที่ 1/2565 โดยมีผู้บริหารสำนักพัฒนาสังคม ผู้บริหารเขตนำร่อง 10 เขต ผู้แทนมูลนิธิสโกลารส์ ออฟ ซัสทีแนนซ์ ประเทศไทย (Scholars of Sustenance Thailand: SOS Thailand) ผู้แทนมูลนิธิวีวี แชร์ (VV Share Foundation) และผู้ที่เกี่ยวข้อง ร่วมประชุม ณ ห้องสุทัศน์ ศาลาว่าการกรุงเทพมหานคร เขตพระนคร ที่ประชุมได้มีมติสรุปแนวทางการดำเนินงานโครงการพัฒนาต้นแบบ BKK Food Bank ระบบส่งต่ออาหารให้กลุ่มเปราะบางอย่างเป็นรูปธรรม ปี 2566 โดยดำเนินการร่วมกับมูลนิธิสโกลารส์ ออฟ ซัสทีแนนซ์ และมูลนิธิวีวี แชร์ ร่วมกับผู้เข้าร่วมดำเนินการนำร่อง จำนวน 10 สำนักงานเขต ประกอบด้วย เขตบางแค เขตภาษีเจริญ เขตบางกอกน้อย เขตบางขุนเทียน เขตบางพลัด เขตคลองสาน เขตพระโขนง เขตคลองเตย เขตลาดกระบัง และเขตประเวศ โดยสำนักงานเขตนำร่องดำเนินการ ดังนี้ 1. แต่งตั้งคณะทำงานดำเนินโครงการพัฒนาต้นแบบ BKK Food Bank ระบบส่งต่ออาหารให้กลุ่มเปราะบางอย่างเป็นรูปธรรม 2. ดำเนินงานตามโครงการฯ โดยมูลนิธิสโกลารส์ ออฟ ซัสทีแนนซ์ ดำเนินงานร่วมกับ 6 สำนักงานเขต คือ เขตภาษีเจริญ เขตบางแค เขตบางกอกน้อย เขตคลองสาน เขตบางขุนเทียน และเขตบางพลัด ส่วนมูลนิธิวีวี แชร์ ดำเนินการร่วมกับ 4 สำนักงานเขต คือ เขตลาดกระบัง เขตพระโขนง เขตประเวศ และเขตคลองเตย
ปี 2566
8 สิงหาคม 2566 นายพรพรหม ณ.ส. วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร ติดตามโครงการ BKK Food Bank แจก passport จัดการอาหารส่วนเกิน (surplus) ส่งมอบข้าวสารอาหารแห้งให้แก่ประชาชนกลุ่มเปราะบาง ตามนโยบายผู้ว่าราชการกรุงเทพมหานคร ครั้งที่ 3 พร้อมกับภาคีเครือข่าย LINE MAN จัดส่งอาหารให้กลุ่มเปราะบาง ผู้พิการ ผู้ป่วยติดเตียง ที่ไม่สามารถเดินทางมารับด้วยตนเอง โดยมี ดร.ไพฑูรย์ งามมุข ผู้อำนวยการเขตห้วยขวาง นางสายทิพย์ สุคนธ์มณี และนายอุกฤษฏ์ องตระกูล ผู้ช่วยผู้อำนวยการเขตห้วยขวาง คณะผู้บริหารและเจ้าหน้าที่เขตห้วยขวาง เข้าร่วมให้การต้อนรับและนำเสนอข้อมูล ณ ศูนย์ BKK FOOD BANK เขตห้วยขวาง
11 กันยายน 2566 รองผู้ว่าฯศานนท์ เป็นประธานการประชุมตามโครงการพัฒนาต้นแบบ BKK Food Bank โดยมีนายพรพรหม ณ.ส. วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร นพ.สุขสันต์ กิตติศุภกร รองปลัดกรุงเทพมหานคร ผู้บริหารสำนักพัฒนาสังคมและสำนักงานเขต ผู้แทน SOS, VV Share, Lotus, โครงการพัฒนาแห่งสหประชาชาติ (United Nations Development Programme : UNDP) ร่วมประชุม ณ ห้องนพรัตน์ ชั้น 5 ศาลาว่าการกรุงเทพมหานคร เขตพระนคร
รองผู้ว่าฯศานนท์ กล่าวว่า โครงการ BKK Food Bank เป็นนโยบายที่ดำเนินการมา 1 ปี โดยใช้วิธีการในรูปแบบ Sandbox ทดลองก่อน สรุปเป็น 2 แบบ ส่วนที่ 1 คือ Food Surplus หรืออาหารส่วนเกิน ส่วนที่ 2 คือ Food Donation คือการบริจาคอาหาร สถิติการดำเนินงาน BKK Food Bank วันที่ 28 ก.พ.66 - 31 ส.ค.66 นํ้าหนักอาหารบริจาค 6,033.74 กิโลกรัม ปริมาณคาร์บอนที่ลดได้ 15,265.36 kgCO2e และรวมได้จํานวน 25,341.7 มื้อ ผู้รับมอบอาหารส่วนเกิน ประกอบด้วย ผู้พิการ 781 คน ผู้สูงอายุ 3,626 คน เด็ก1,375 คน ผู้ป่วยติดเตียง 457 คน คนไร้บ้าน 141 คน ผู้ด้อยโอกาส 912 คน ประชาชน 2,220 คน อื่นๆ 52 คน ประเภทอาหารเป็น อาหารปรุงสุกพร้อมทานมากที่สุด 1,880.58 กก. เบเกอรี่ 1,741.05 กก. ผักและผลไม้ 778.14 กก. ตามลำดับ
18 ตุลาคม 2566 ผู้ว่าชัชชาติ ตรวจเยี่ยม BKK Food Bank ณ สำนักงานเขตห้วยขวาง โดยมีนายประพฤทธ์ หาญกิจจะกุล สมาชิกสภากรุงเทพมหานคร เขตห้วยขวาง นายพรพรหม ณ.ส. วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร ผู้บริหารกรุงเทพมหานคร ผู้บริหารเขตห้วยขวาง และผู้ที่เกี่ยวข้อง ร่วมกิจกรรม ผู้ว่าชี้แจงว่า "โครงการนี้ไม่ใช้งบประมาณของหลวง แต่ขอความร่วมมือคนที่มีส่วนเกิน ต่อไปก็จะขยายไปถึงซูเปอร์มาร์เก็ตต่างๆ อาหารที่ใกล้หมดอายุ ยังบริโภคได้ แต่ขายไม่ได้แล้ว แทนที่จะทิ้งเป็นอาหารเสีย ก็จะมาอยู่ที่ Food Bank คนที่มีความต้องการก็สามารถนำไปบริโภคได้ ต่อไปร้านอาหารที่เข้าโครงการ Food Bank อาจจะมีป้ายขอบคุณที่เข้าร่วมโครงการ โมเดลนี้จะเป็นโมเดลหนึ่งที่ทำที่นี่ และจะขยายผลต่อไปทั่วทั้งกรุงเทพมหานคร"
19 ตุลาคม 2566 รองผู้ว่าฯศานนท์ เป็นประธานเปิดการประชุมเชิงปฏิบัติการโครงการพัฒนาต้นแบบ BKK Food Bank ส่งต่ออาหารให้กลุ่มเปราะบางอย่างเป็นรูปธรรม โดยมี นายเรอโน เมเยอร์ ผู้แทนโครงการพัฒนาแห่งสหประชาชาติ (United Nations Development Programme : UNDP) ผู้บริหารกรุงเทพมหานคร ผู้บริหารสำนักพัฒนาสังคม สำนักอนามัย ผู้บริหารเขตบางกอกน้อย ผู้แทนสำนักงานเขตนำร่องโครงการ BKK Food Bank และ BKK Food Center เจ้าหน้าที่โครงการพัฒนาแห่งสหประชาชาติ (United Nations Development Programme : UNDP) ผู้แทนหน่วยงานภาคเอกชน และผู้ที่เกี่ยวข้อง ร่วมประชุม ณ ห้องประชุมสุพรรณหงส์ ชั้น 3 สำนักงานเขตบางกอกน้อย
ประเด็นการประชุม 2 ประเด็นสำคัญคือ การส่งของถึงกลุ่มเปราะบางที่ทำให้สิ้นเปลืองในการดำเนินการในบางครั้ง ให้หาโมเดลใหม่ที่เหมาะสมเกี่ยวกับสถานที่ในการส่ง อีกประเด็นคือ โมเดลที่ให้กลุ่มเปราะบางมารับของเองที่ศูนย์ Food Bank อาจจะเป็นที่สำนักงานเขต วัด หรือสถานที่ต่างๆ ทั้งสองประเด็นต้องสรุปหาแนวทางที่เหมาะสมให้ได้ "เพื่อไม่ต้องเหนื่อยทั้งเขตที่นำของมาส่ง และไม่ต้องเหนื่อยทั้งผู้ให้ที่ต้องมาเลือกว่าจะต้องไปให้ที่ไหน"
27 – 29 พฤศจิกายน 2566 กรุงเทพมหานครจัดกิจกรรมการ ณ โรงแรมรอยัล ออร์คิด เชอราตัน เขตบางรัก เปิดตัวยุทธศาสตร์ City of Food นโยบายอาหารกรุงเทพมหานคร พ.ศ. 2566-2570 ตามเครือข่ายกติกาสัญญานโยบายอาหารในเมืองมิลาน โดยมีบุคคลสำคัญร่วมงาน ได้แก่ นายเดวิด เดลี (Mr. David Daly) เอกอัครราชทูตสหภาพยุโรปประจำประเทศไทย นายเปาโล ดิโอนิซี (Mr. Paolo Dionisi) เอกอัครราชทูตสาธารณรัฐอิตาลีประจำประเทศไทย นางสาวอันนา สคาวุซโซ (Ms. Anna Scavuzzo) รองนายกเทศมนตรีนครมิลาน นายพาโบล กานดารา (Mr. Pablo Gandara) หัวหน้าโครงการความร่วมมือระหว่างเมืองและภูมิภาคนานาชาติประจำภูมิภาคเอเชียและออสตราเลเชีย (โครงการ IURC Asia and Australasia) นายฟิลิปโป กาวาสเซนี (Mr. Filippo Gavazzeni) หัวหน้าสำนักงานเลขานุการเครือข่ายกติกาสัญญานโยบายอาหารในเมืองมิลาน (MUFPP) นายวิศณุ ทรัพย์สมพล รองผู้ว่าราชการกรุงเทพมหานคร พญ.วันทนีย์ วัฒนะ รองปลัดกรุงเทพมหานคร รักษาราชการแทนปลัดกรุงเทพมหานคร นายพรพรหม ณ.ส. วิกิตเศรษฐ์ ที่ปรึกษาของผู้ว่าราชการกรุงเทพมหานคร และผู้บริหารด้านความยั่งยืนของกรุงเทพมหานคร (Chief Sustainability Officer: CSO) และผู้เกี่ยวข้องร่วมพิธีเปิด กิจกรรมประกอบด้วย 1. การนำเสนอนโยบายอาหารของกรุงเทพมหานคร 2. การเสวนา และการประชุมเชิงปฏิบัติการ (Workshop) 3. การศึกษาดูงานการดำเนินงาน District Food Management Sandbox
ปี 2567
8 มีนาคม 2567 ผู้ว่าชัชชาติ ตรวจเยี่ยมโครงการ BKK Food Bank เขตพระโขนง โดยมี นายแสนยากร อุ่นมีศรี ผู้อำนวยการสำนักพัฒนาสังคม นางสายทิพย์ สุคนธ์มณี ผู้อำนวยการเขตพระโขนง ผู้บริหารสำนักพัฒนาสังคม ผู้บริหารเขตพระโขนง ร่วมตรวจเยี่ยมและรายงานผลการดำเนินการ ณ ศูนย์ BKK Food Center เขตพระโขนง ชั้น 1 สำนักงานเขตพระโขนง.
BKK Food Bank เขตพระโขนง ประกอบด้วย 1. อาหารส่วนเกิน (food Surplus) ดำเนินการร่วมกับมูลนิธิ สโกลารส์ ออฟซัสทีแนนซ์ (Scholars Of Sustenance : SOS Thailand) ตั้งแต่วันที่ 22 สิงหาคม 2566 ดำเนินการสัปดาห์ละ 3 วัน (อังคาร พุธ และพฤหัสบดี) ส่งต่ออาหารแก่กลุ่มเปราะบางในพื้นที่ชุมชนที่จัดตั้งตามระเบียบกรุงเทพมหานคร 45 ชุมชน และอีก 15 ชุมชนที่ไม่ได้จดทะเบียน, เจ้าหน้าที่ภาคสนามของสำนักงานเขตพระโขนง และเด็กนักเรียนด้อยโอกาส โดยปี 2566 เริ่มดำเนินการ 22 ส.ค. 66 – 30 ก.ย. 66 มีเป้าหมายดำเนินการ 18 ครั้ง ดำเนินการ 18 ครั้ง (คิดเป็น 100 %) ปี 2567 เริ่มดำเนินการ 1 ต.ค. 66 – 30 ก.ย. 67 มีเป้าหมายการดำเนินงาน 139 ครั้ง ดำเนินการแล้ว 60 ครั้ง (คิดเป็น 43.17 %) ซึ่งจากผลการดำเนินการตั้งแต่ 22 ส.ค. 66 – 29 ก.พ. 2567 รวมส่งต่ออาหารแล้ว 3,411 ราย คิดเป็น 13,295.06 มื้ออาหาร รวมน้ำหนักอาหารส่วนเกิน 3,165.49 กิโลกรัม สามารถลดปริมาณคาร์บอน 8,008.69 คาร์บอนไดออกไซค์ (TCO2e)
2. อาหารบริจาค (Food Donation) ส่งมอบอาหารแก่กลุ่มเปราะบาง ดำเนินการร่วมกับเครือข่ายผู้ประกอบการในพื้นที่ เช่น วัดวชิรธรรมสาธิตวรวิหาร วัดธรรมมงคลเถาบุญญนนท์พระวิหาร และบริษัท จัสปาล จำกัด (มหาชน) เป็นต้น โดยมีกลุ่มเป้าหมายเป็นกลุ่มเปราะบางในชุมชนจดทะเบียน 45 ชุมชน ในชุมชนไม่จดทะเบียน 15 ชุมชน กลุ่มคนงานภาคสนามของสำนักงานเขตพระโขนง กลุ่มนักเรียนผู้ด้อยโอกาส รวมถึงเด็กในศูนย์พัฒนาเด็กก่อนวัยเรียนชุมชนหมู่บ้านนิรันดร์วิลล่า ดำเนินการตั้งแต่มีนาคม 2566 เป็นต้นมา ทั้งในรูปแบบอาหารปรุงสุก ข้าวสารอาหารแห้ง ถุงยังชีพ ฯลฯ ตั้งแต่เริ่มดำเนินการมีผู้ได้รับความช่วยหลือรวม 794 ราย
23 มีนาคม 2567 ผู้ว่าชัชชาติ ตรวจเยี่ยมโครงการ BKK Food Bank ชั้น 1 สำนักงานเขตบางพลัด โครงการ BKK Food Bank เขตบางพลัด เริ่มต้นโครงการตั้งแต่วันที่ 22 กุมภาพันธ์ 2566 โดยมีเจ้าหน้าที่ฝ่ายพัฒนาชุมชนฯ และฝ่ายสิ่งแวดล้อมฯ ลงพื้นที่ไปรับของจาก 7-11 ในพื้นที่ จำนวน 7 แห่ง เพื่อนำมาแจกจ่ายให้กับกลุ่มเป้าหมายในชุมชน จำนวน 48 ชุมชนในพื้นที่เขตบางพลัด โดยสับเปลี่ยนหมุนเวียนไปตามชุมชนต่าง ๆ รวมกลุ่มเป้าหมายทั้งสิ้น 738 คน มีแผนดำเนินการส่งมอบอาหาร 3 วัน/สัปดาห์ ได้แก่ วันอังคาร วันพุธ และวันพฤหัสบดี
สำหรับการดำเนินงานที่ผ่านมา สำนักงานเขตบางพลัดได้ส่งมอบอาหารแล้ว 164 ครั้ง น้ำหนักอาหารบริจาค จำนวนทั้งสิ้น 2,259.43 กิโลกรัม หรือ 9,489.61 มื้อ มีปริมาณ Carbon Footprint หรือปริมาณก๊าซเรือนกระจกลดลง เท่ากับ 5,716.36 กิโลกรัมคาร์บอนไดออกไซด์เทียบเท่า (kgCO2e)
27 เมษายน 2567 ผู้ว่าชัชชาติ ตรวจเยี่ยมโครงการ BKK Food Bank เขตบางขุนเทียน ซึ่งเริ่มดำเนินโครงการเมื่อวันที่ 22 มิ.ย. 65 ซึ่งเป็น 1 ใน 4 เขตนําร่องของกรุงเทพมหานคร ปัจจุบันมีผู้ได้รับความช่วยเหลือกลุ่มเปราะบางจากโครงการ จำนวน 3,448 ราย โดยเปิดบริการทุกวันศุกร์ให้แก่ลูกจ้างที่มีรายได้น้อยและกลุ่มเปราะบาง
7 พฤษภาคม 2567 ผู้ว่าชัชชาติ ตรวจเยี่ยมและเป็นประธานการส่งต่อความช่วยเหลือผ่านศูนย์ BKK Food Bank Center เขตพระโขนง ณ ห้อง BKK Food Bank Center ชั้น 1 สำนักงานเขตพระโขนง โดยมี นางสายทิพย์ สุคนธ์มณี ผู้อำนวยการเขตพระโขนง ผู้บริหารสำนักพัฒนาสังคม ผู้บริหารกลุ่มเขตกรุงเทพใต้ ผู้บริหารเขตพระโขนง ร่วมตรวจเยี่ยมและรายงานผลการดำเนินการ
ผู้ว่าชัชชาติ ตรวจเยี่ยมศูนย์ BKK Food Bang ณ
ชุมชนรุ่งมณีพัฒนา เขตวังทองหลาง โครงการ BKK Food Bank เขตวังทองหลาง
เริ่ม KICK OFF เมื่อ วันที่ 18 กุมภาพันธ์ 2567 นำโดยนายโครงการ เจียมจีรกุล ผู้อำนวยการเขตวังทองหลาง พร้อมเจ้าหน้าที่ฝ่ายพัฒนาชุมชนฯ ลงพื้นที่ดำเนินการส่งต่ออาหารให้กลุ่มเปราะบางอย่างเป็นรูปธรรม ร่วมกับสภาองค์กรชุมชนสนับสนุนโดยมูลนิธิ SOS และผู้ประกอบต่างๆ ณ ชุมชนรุ่งมณีพัฒนา เขตวังทองหลาง กทม. ทั้งนี้ เพื่อเป็นการสงเคราะห์และช่วยเหลือกลุ่มเปราะบางในชุมชนพื้นที่เขตวังทองหลางอย่างเป็นรูปธรรม
การแพทย์แม่นยำกับการดูแลสุขภาพส่วนบุคคล (Precision Medicine for Well-being)
การแพทย์แม่นยำ หรืออาจเรียกว่า การแพทย์เฉพาะบุคคล (Personalize Medicine)
วิทยาการทางการแพทย์ที่ก้าวหน้าทำให้ทราบว่า ยีนพฤติกรรม (เช่น พันธุกรรม การออกกำลังกาย นิสัย การกิน การนอน การขับถ่าย ฯลฯ) และสภาพแวดล้อมต่างๆ ล้วนเป็นปัจจัยที่ส่งผลต่อสุขภาพของบุคคล ดังนั้น
การแพทย์แม่นยำ (Precision Medicine) จึงเข้ามามีบทบาท ในการป้องกัน ส่งเสริม รักษาและฟื้นฟูสุขภาพของผู้คน ในรูปแบบที่สามารถปรับวิธีการให้เหมาะสมกับแต่ละบุคคล แทนที่จะใช้แนวทางเดียวกันสำหรับทุกคน
การแพทย์แม่นยำ หรืออาจเรียกว่า การแพทย์ เฉพาะบุคคล (Personalized Medicine) เป็นวิทยาการที่ช่วยให้แพทย์สามารถค้นหาความเสี่ยงของโรคเฉพาะและการรักษาที่จะได้ผลดีที่สุดสำหรับแต่ละบุคคล การแพทย์แม่นยำยังรวมถึงแนวทางปฏิบัติหรือกิจกรรมในรูปแบบต่างๆ ที่เกิดขึ้นนอกสถานพยาบาล เช่น กิจกรรมการป้องกัน โรคและการส่งเสริมสุขภาพ โดยวิธีการทางการแพทย์แม่นยำ สามารถทำนาย ป้องกัน รักษา และจัดการโรคสำหรับบุคคล และครอบครัวได้ดีขึ้น โดยการแพทย์แม่นยำมีวิธีการสืบค้น ตรวจวัด ติดตาม หรือทำนายความเสี่ยงของการเกิดโรคหรืออาการเจ็บป่วยได้จาก
- ประวัติส่วนบุคคล
- ประวัติการเจ็บป่วยในครอบครัว
- การตรวจวัดเพื่อจัดลำดับจีโนม (Genome Sequencing) ที่บ่งชี้สารพันธุกรรมของเชื้อโรค สามารถช่วยค้นหา ติดตาม และควบคุมการระบาดของโรคติดเชื้อได้ รวมทั้ง
- การตรวจจีโนม เพื่อวิเคราะห์การกลายพันธุ์ของยีน BRCA1 หรือBRCA2 มีแนวโน้มที่จะเป็นมะเร็งเต้านม หรือมะเร็งรังไข่ในเพศหญิง และการกลายพันธุ์ของยีน BRCA1 หรือ BRCA2 จะมีความเสี่ยงเพิ่มขึ้นสำหรับมะเร็งบางชนิดในเพศชาย
- การตรวจจีโนม เพื่อวิเคราะห์ความเสี่ยงของการเกิดมะเร็งลำ ไส้ใหญ่และทวารหนักและมะเร็งอื่นๆในผู้ป่วย โรคลินช์ ซึ่งเป็นโรคมะเร็งที่ถ่ายทอดทางพันธุกรรมที่พบได้บ่อยที่สุดในประชากรอายุน้อย อันเกิดจากความผิดปกติของ MMR gene (MLH1, MSH2, MSH6, PMH2 and EPCAM) แบบ second HIT phenomenon
- การตรวจวิเคราะห์พันธุกรรมของเนื้องอก (Biomarker Testing) เพื่อจำแนกชนิดของเนื้องอก รวมทั้ง คาดการณ์ว่ามะเร็งมีแนวโน้มที่จะกลับมาเป็นอีกหรือไม่ ซึ่งสามารถช่วยให้ผู้คนตัดสินใจได้ว่าจะต้องรับการรักษา เช่น เคมีบำบัด หรือการฉายรังสี
- การวิเคราะห์การตอบสนองต่อยา (Pharmacogenetics) ซึ่งมีความแตกต่างกันไปตามพันธุกรรมของแต่ละบุคคล ซึ่งจะช่วยให้แพทย์เลือกยาและขนาดยาที่น่าจะปลอดภัย และมีประสิทธิภาพมากที่สุดสำหรับผู้ป่วยแต่ละคน
- การตรวจสอบปริมาณกลูโคสอย่างต่อเนื่องเพื่อปรับปรุงการให้อินซูลินในผู้ป่วยโรคเบาหวาน (Continuous Glucose Monitoring System) ด้วยการใช้อุปกรณ์ตรวจวัด (sensor) ที่แขนหรือท้องเพื่อติดตามระดับน้ำตาล ในเลือดอย่างต่อเนื่อง เพื่อให้แพทย์ปรับปรุงปริมาณอินซูลินที่ให้แก่ผู้ป่วยและติดตามภาวะแทรกซ้อนอันอาจเกิดขึ้นได้
- อุปกรณ์สุขภาพติดตามตัว (Wearable/Smart device) ที่สามารถวัดปริมาณแคลอรีจากการบริโภคอาหาร กิจกรรมทางกาย ความดันโลหิต ค่าออกซิเจนในเลือด ชีพจร อัตราการเต้นของหัวใจ ดัชนีมวลกาย เป็นต้น อุปกรณ์เหล่านี้พกพาได้สะดวก สามารถรองรับการใช้ชีวิตอย่างมีสุขภาพดีและช่วยส่งเสริมสุขภาพให้อาการ จ็บป่วยด้วยโรคเรื้อรังดีขึ้นได้ เช่น การรับประทานอาหาร การปรับปรุงนิสัยการนอนหลับ การฝึกการหายใจและ สมาธิ นอกจากนี้ยังสามารถช่วยเตือนให้รับประทานยา ได้อย่างตรงเวลาและสม่ำเสมออีกด้วย
46 XY DSD .. เมื่อโครโมโซมเป็นผู้ชาย แต่ร่างกายพัฒนาเป็นผู้หญิง - Jessada Denduangboripant
วันนี้เต็มหน้าฟีดเฟซบุ๊ก มีแต่เรื่องข่าวกีฬาชกมวยหญิงโอลิมปิก 2024 ที่เกิดดม่ากันกับผลการชกระหว่าง "อิมาน เคลิฟ" นักมวยหญิงชาวแอลจีเรีย เอาชนะนักมวยหญิงอิตาลี ไปได้อย่างง่ายดาย โดยขอยอมแพ้ตั้งแต่ยกแรกผ่านไปแค่ 46 วินาที พร้อมกับความกังขาที่ว่า เธอเคยตรวจว่าเป็นหญิงแท้หรือไม่ และตรวจไม่ผ่าน (โดยพบว่า เธอมีระดับฮอร์โมนเพศชายสูง)
"ข้อกล่าวหา" หนึ่ง ที่ยังไม่มีการแถลงยืนยันชัดเจนจากทาง เคลิฟ คือการบอกว่า แม้ในเอกสารทางการ จะระบุว่าเธอเป็นเพศหญิง มีอวัยวะร่างกายไปทางเพศหญิง แต่จริงๆ เธอเป็น “เพศชายทางชีวภาพ (biological male)" คือมีโครโมโซมเป็น XY เป็นเพศชายตั้งแต่กำเนิด เลยทำให้มีฮอร์โมนเทสโทสเตอโรน (testosterone) สูง เลยมีกล้ามเนื้อที่แข็งแรงกว่าผู้หญิงทั่วไป
(เน้นว่า เป็นข้อกล่าวหา ที่ "ยังไม่ถูกยืนยัน" )
คำถามที่ทำให้คนทั่วไปงงงวยคือ ถ้ามีโครโมโซมเป็น XY แล้วเธอจะมีร่างกายเป็นผู้หญิง (ซึ่งควรจะต้องมีโครโมโซม XX) ได้อย่างไร ? ไม่เห็นตรงกับที่เรียนมา
คำตอบคือ มันก็มีกรณีพิเศษ ที่หาได้ยาก เกิดขึ้นได้จากความผิดปรกติของพัฒนาการทางเพศ (disorders of sexual development หรือ DSD) และระดับฮอร์โมนเพศ (sex hormones) ในคนบางคนได้จริงๆ ครับ
ลองจินตนาการถึงเด็กผู้หญิงสักคนหนึ่ง ที่พออายุสัก 13 ปี แล้วพ่อแม่เริ่มสังเกตว่าเธอดูมีลักษณะที่ "แมน" ขึ้น ดูคล้ายเด็กชายมากขึ้น เช่น เสียงทุ้มลง มีขนขึ้นมากตามร่างกาย ฯลฯ พอพาไปหาหมอ ตรวจเลือดวัดระดับฮอร์โมนเทสโทสเตอโรน ก็พบว่ามีสูงขึ้น จนทำให้แพทย์ตัดสินใจส่งตรวจหารูปแบบของโครโมโซม (เรียก คาริโอไทป์ karyotype) ก็พบว่าเธอมีโครโมโซม 46 แท่ง โดยเป็นโครโมโซมเอ็กซ์ 1 แท่งและโครโมโซมวาย 1 แท่ง !?
หรือในทางตรงข้าม เด็กผู้ชายอีกคน มาหาหมอเพราะมีพัฒนาการของร่างกายที่แตกต่างจากเพื่อนๆ แม้จะอายุ 17 ปีแล้ว เช่น หน้าเกลี้ยงเกลา ไม่มีขนหนวดเคราขึ้น มีอวัยวะเพศขนาดเล็กและไม่พัฒนารูปร่างตามอายุ พอแพทย์ตรวจเลือดวัดระดับฮอร์โมนเพศชาย ก็มีระดับต่ำ พอตรวจวัดปริมาณของตัวอสุจิ ก็มีระดับน้อย !?
เด็กทั้งสองคนนี้ มีแนวโน้มที่อาจจะเป็นภาวะ DSD "disorder of sexual development" หรือมีความผิดปรกติในการพัฒนาทางเพศของร่างกาย แม้จะมีจำนวนโครโมโซมเป็น 46 แท่งตามปรกติก็ตาม ... ซึ่งมีได้ทั้งแบบ 46, XY DSD (ผู้หญิง แต่เป็นเพศชายทางชีวภาพ) และแบบ 46, XX DSD (ผู้ชาย แต่เป็นเพศหญิงทางชีวภาพ)
เคสนักชกมวยหญิง ที่เราสนใจกัน จะเข้ากรณี 46,XY DSD ซึ่งหมายถึง จริงๆ เป็นเด็กผู้ชายที่มีโครโมโซมเพศ เป็น XY แต่กลับมีอวัยวะเพศภายนอก "กำกวม" มีพัฒนาการของอวัยวะเพศชายไม่สมบูรณ์ และในบางกรณี อวัยวะเพศ อาจเป็นของเพศหญิงเลยก็ได้
สาเหตุของภาวะ 46,XY DSD เกิดจากความผิดปกติ ในขั้นตอนใดขั้นตอนหนึ่งของพัฒนาการทางเพศของร่างกาย เช่น เกิดความผิดปกติในพัฒนาการของอัณฑะ , เกิดความผิดปกติของกระบวนการสร้างฮอร์โมนแอนโดรเจน (androgen) หรือการทำหน้าที่ของฮอร์โมนแอนโดรเจน ผิดปกติไป , หรือความผิดปกติอื่นๆ ได้แก่ cloacal exstrophy , persistent Mullerian duct syndrome , vanishing testes syndrome , severe hypospadias , congenital hypogonadotropic hypogonadism , cryptorchidism (INSL3) ตลอดจนผลกระทบจากสิ่งแวดล้อม
ผลที่ตามมาคือ เกิดภาวะอวัยวะเพศกำกวม ตั้งแต่ระดับที่ไม่สามารถแยกได้ชัดเจนว่าเป็นเพศหญิงหรือเพศชาย , หรือแม้จะดูเหมือนหญิงหรือชาย แต่ก็มีลักษณะไม่สมบูรณ์ , และรวมถึงมีลักษณะเพศเป็นเพศหญิงชัดเจน แต่ไม่ตรงกับโครโมโซม
คำสรุปของเรื่องนี้คือ แม้ว่าเราจะเรียนกันมาตลอดว่า โครโมโซม X และ Y เป็นตัวกำหนดเพศของคนเราตั้งแต่เกิด (คือ ถ้าเป็น XX ก็เป็นผู้หญิง และถ้า XY ก็เป็นผู้ชาย) ก็ตาม
แต่ในโลกความจริง มันก็มีข้อยกเว้นเกิดขึ้นได้ ที่บางคนจะมีสภาพร่างกายแตกต่างจากโครโมโซม ซึ่งเป็นความผิดปกติที่เรียกว่า DSD เกิดขึ้นตามธรรมชาติ และส่งผลกระทบต่อชีวิตของคนๆ นั้นอย่างมาก ในการอยู่ร่วมในสังคมแบบทึ่ "มีแค่ 2 เพศ" ครับ
การตรวจวัดความเป็นกรดในหลอดอาหาร 24 ชั่วโมง
5.สินเชื่อรายได้ประจำสุขใจ
การตรวจวัดการทำงานของทวารหนักและหูรูดทวารหนัก
แพทย์กำลังวิเคราะห์การตรวจวัดการทำงานของทวารหนักและหูรูดทวารหนัก
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางนา
3. เจ็บหน้าอกเฉียบพลัน รุนแรง
4. หายใจเร็ว หอบเหนื่อยรุนแรง หายใจติดขัด มีเสียงดัง
5.Find COE Code
To retrieve the COE Code go to
COE Online System then
- Click "Forget 6-digit code, Click hear"
- Fill in the passport number, given name, family name and date of birth
อนาคตอาจมีร้านเปิดขึ้นอีกเยอะ คู่แข่งคงมากขึ้น มีมุมมองอย่างไร
ดีค่ะ เราไม่ได้มองว่าเป็นคู่แข่งเลยเพราะเชื่อว่าทุกผู้ประกอบการจะต้องพัฒนาและหาจุดเด่นของแต่ละร้านที่แตกต่างกันออกไป ยิ่งแพร่หลายผลประโยชน์ก็จะได้ตกทุกคนไม่ใช่ผูกมัดกับแค่นายทุนเจ้าใหญ่ๆเพียงเจ้าเดียว
โรงพยาบาลคามิลเลียนเตรียมพร้อมรับลงทะเบียนฉีดวัคซีน Covid-19 LINK
โรงพยาบาลคามิลเลียนเตรียมพร้อมรับลงทะเบียนฉีดวัคซีน Covid-19 (6 พฤษภาคม 64)
✔ กลุ่มผู้สูงอายุ 60 ปี ขึ้นไป
✔ กลุ่มผู้ป่วย 7 โรคเรื้อรัง
- โรคทางเดินหายใจ
- โรคหัวใจและหลอดเลือด
- โรคหลอดเลือดสมอง
- โรคมะเร็งอยู่ระหว่างบำบัดเคมี
- โรคไตเรื้อรังระยะ 5
- โรคเบาหวาน
- โรคอ้วน
✔ เมื่อระบบรับลงทะบียนจองฉีดวัคซีนCOVID-19 พร้อมแล้ว *จะแจ้งให้ท่านทราบโดยเร็วที่สุด
พาคนอุดรกลับบ้านเฮา!!! ไม่มีค่าใช้จ่าย!!! LINK
พาคนอุดรกลับบ้านเฮา!!! ผู้ติดเชื้อโควิด-19 และผู้สัมผัสเสี่ยงสูง สามารถติตต่อให้ไปรับ เพื่อกลับมารักษาที่อุดรได้เลย ไม่มีค่าใช้จ่าย!!!
วันนี้ (11 สิงหาคม 2564) สาธารณสุขจังหวัดอุดรธานี ประกาศรับคนอุดรที่ติดเชื้อโควิด-19 หรือเป็นผู้สัมผัสเสี่ยงสูง กลับอุดรบ้านเฮา โดยจะมีรถไปรับถึงบ้าน และพากลับมารักษาในโรงพยาบาล หากเป็นผู้ติดเชื้อโควิด-19 แต่หากเป็นผู้สัมผัสเสี่ยงสูง จะพาไปกักตัวในสถานกักกันที่ทางอำเภอจัดเตรียมไว้
ติดต่อประสาน หากมีความประสงค์จะกลับบ้าน
เบอร์โทร. 064-7896153
ไลน์ แอดเบอร์ 0812611616
ผู้ติดเชื้อโยงตลาดโรงสีเพิ่มเป็น 45 รอบสอบสวนโรคอีก 10
25 ธันวาคม 64 ศูนย์สื่อสารความเสี่ยง รายงาน จำนวนผู้ติดเชื้อใหม่ 61 ราย ผู้ติดเชื้อโยงตลาดโรงสีเพิ่มเป็น 45 ราย รอบสอบสวนโรคอีก 10 ราย Cluster ระบาดต่อเนื่อง 5 ราย ติดจากนอกพื้นที่และอยู่ระหว่างกักตัว 1 ราย
ข้อมูลข้างต้นอาจมีการเปลี่ยนแปลงได้โดยไม่แจ้งล่วงหน้า กรุณาติดตามข้อมูลข่าวสารเกี่ยวกับการเดินทางเข้าประเทศไทยอย่างใกล้ชิดจากเว็บไซต์และ Facebook ของหน่วยราชการไทยที่เกี่ยวข้อง
เขตยานนาวา ลงพื้นที่เตรียมความพร้อมศูนย์ CI ณ โรงเรียนวัดดอกไม้ ถนนพระรามที่ 3 LINK
ยานนาวา ลงพื้นที่สำรวจศูนย์ CI เตรียมความพร้อม หากมีสถานการณ์เร่งด่วนให้สามารถเปิดบริการได้ภายใน 48 ชม.
…วันที่ 5 มกราคม 2565 นายสุนิติ บุณยมหาศาล ผู้อำนวยการเขตยานนาวา พร้อมผู้บริหารเขต ศูนย์บริการสาธารณสุขในพื้นที่ และเจ้าหน้าที่ผู้เกี่ยวข้อง ลงพื้นที่สำรวจศูนย์พักคอยเพื่อส่งต่อเขตยานนาวา (CI) ณ โรงเรียนวัดดอกไม้ ถนนพระรามที่ 3 เขตยานนาวา เตรียมความพร้อมเร่งด่วนให้สามารถเปิดบริการได้ภายใน 48 ชั่วโมง หากสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา-2019 ในพื้นที่กรุงเทพมหานครมีแนวโน้มการระบาดเพิ่มขึ้น เพื่อรองรับผู้ติดเชื้อเข้าสู่ระบบและการรักษา
ผู้ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ.2563 สาขาการสาธารณสุข
การป้องกันภาวะสมองเสื่อมตลอดทุกช่วงอายุ (Life time course of prevention)
การรณรงค์ป้องกันภาวะสมองเสื่อมต้องทำตลอดตั้งแต่วัยเด็กจนวัยสูงอายุจึงจะได้ผลสูงสุด การป้องกันภาวะสมองเสื่อมในอดีตมักเน้นไปในด้านการป้องกันโรคเมื่อประชากรมีอายุวัยกลางคนหรือวัยสูงอายุเป็นต้นไป อย่างไรก็ตามการทำงานของสมองต้องมีการพัฒนามาตั้งแต่ช่วงที่อยู่ในครรภ์มารดา การที่สมองมีระดับของศักยภาพการทำงาน (cognitive reserve) ที่สูงตั้งแต่แรกเริ่ม เมื่อเกิดพยาธิสภาพขึ้นก็จะถึงขีด (threshold) ที่ทำให้เกิดอาการจากภาวะสมองเสื่อมช้าลง10 มุมมองของการป้องกันโรคตลอดทุกช่วงอายุ สามารถแบ่งแนวทางการป้องกันออกได้เป็น 4 ระดับ11
- ปัจจัยด้านพันธุกรรม ได้แก่ ความผิดปกติ Mutation ของยีน amyloid precursor protein, Presenilin 1 และ Presenilin 2 เป็นต้น โดยเน้นในการป้องกันในด้านการตรวจทางพันธุกรรมเพื่อหาความผิดปกติในญาติของผู้ป่วย ส่วน Genotype epsilon 4/4 มีผลให้มีการสร้างสาร amyloid และทำให้ผู้ที่มี genotype ดังกล่าว เกิดโรคอัลไซเมอร์เร็วขึ้น และผู้ป่วย MCI ที่มี Apo-lipoprotein epsilon 4/4 (APOE e4) จะมีโอกาสดำเนินโรคเป็นโรคอัลไซเมอร์สูงขึ้น
- ปัจจัยเสี่ยงในวัยเด็ก ได้แก่ การดูแลช่วงตั้งครรภ์และคลอด เพื่อลดปัญหาภาวะขาดสารอาหาร การติดเชื้อในครรภ์ การขาดออกซิเจนในช่วงคลอด นอกจากนั้นสถานภาพของครอบครัวในด้านเศรษฐานะ ขนาดของครอบครัว อาชีพของบิดามารดา การศึกษา ตลอดจนการเจริญเติบโตของแขนขาและศีรษะในวัยเด็ก ยังมีผลต่อระดับของศักยภาพการทำงานของสมองอีกด้วย12
- ปัจจัยเสี่ยงในวัยผู้ใหญ่ ปัจจัยเสี่ยงในวัยผู้ใหญ่ที่สำคัญแบ่งออกเป็น 2 ปัจจัยหลัก คือ
3.1 ปัจจัยเสี่ยงด้านพฤติกรรม เช่น การรับประทานอาหารบางชนิด และไม่รับประทานอาหารบางชนิด น้ำหนักตัวเกิน สูบบุหรี่ ดื่มแอลกอฮอล์ปริมาณมาก ขาดการออกกำลังกาย การร่วมกิจกรรมที่พัฒนาการรู้คิด การเกิดอุบัติเหตุ ตลอดจนการได้รับสารพิษต่างๆ เป็นต้น
3.2 ปัจจัยเสี่ยงที่มีผลต่อหลอดเลือด เช่น ความดันโลหิตสูง โรคเบาหวาน ไขมันในเลือดสูง โรคหัวใจเต้นผิดจังหวะ หรือโรคลิ้นหัวใจพิการ เป็นต้น
- ปัจจัยเสี่ยงในวัยสูงอายุ ได้แก่ การใช้ยาบางชนิดที่มีผลต่อการทำงานของสมอง ความผิดปกติทางเมตาบอลิกและเกลือแร่ อารมณ์ซึมเศร้า ภาวะซึมสับสนเฉียบพลัน และโรคหลอดเลือดสมอง เป็นต้น การควบคุมแก้ไข midlife risk factors ในวัยสูงอายุมักได้ผลไม่มาก เนื่องจากมีปัจจัยด้านอายุซึ่งเป็นปัจจัยเสี่ยงของภาวะสมองเสื่อมที่สำคัญที่เลี่ยงไม่ได้ ตลอดจนผู้สูงอายุมักมีปัจจัยเสี่ยงหลายอย่างร่วมกัน และการแก้ไขปัจจัยเสี่ยงของ midlife risk factors มักต้องอาศัยระยะเวลาในการเห็นประสิทธิผล
ประกันสังคม รพ.ลาดพร้าว มีโปรเด็ด LINK
คลินิกประกันสังคม รวมโปรเด็ด จัดแรงส์รับปีใหม่ 2565 พร้อมสรรพสำหรับดูแลผู้ประกันตน ตามสิทธิประกันสังคม โรงพยาบาลลาดพร้าว สามารถสอบถามรายละเอียดเพิ่มเติมที่ คลินิกประกันสังคม โรงพยาบาลลาดพร้าว อาคาร 1 ☎️ 02 530 2556 ต่อ 1280 , 1285 ฝ่ายตรวจสุขภาพ
EP. 3.5 สิทธิในการลบข้อมูลส่วนบุคคล (Right to be Forgotten) - มาตรา 33 LINK
.
เจ้าของข้อมูลสามารถยื่นคำร้องขอลบหรือทำลายข้อมูลได้ในกรณีใดบ้าง
และผู้ควบคุมข้อมูลจะต้องดำเนินการอย่างไร??
.
หลักการสำคัญ เจ้าของข้อมูลส่วนบุคคลมีสิทธิยื่นคำร้องขอลบหรือทำลาย หรือทำให้ข้อมูลส่วนบุคคลไม่สามารถระบุถึงตนได้ ตามเงื่อนไขที่กฎหมายกำหนด
.
กรณีที่เจ้าของข้อมูลส่วนบุคคลขอใช้สิทธิได้
1. ข้อมูลหมดความจำเป็นในการประมวลผลตามวัตถุประสงค์
2. ถอนความยินยอมในการใช้ข้อมูล (ในกรณีนี้ต้องปรากฏว่ามีการเก็บข้อมูลตามฐานความยินยอม มาตรา 24)
3. ข้อมูลถูกใช้ประมวลผลโดยไม่ถูกกฎหมาย
.
กรณีที่กฎหมายยกเว้นการใช้สิทธิ
1. เป็นข้อมูลที่เกี่ยวกับเสรีภาพในการแสดงความคิดเห็น
2. เป็นข้อมูลที่เกี่ยวกับการทำวิจัย หรือสถิติ (มาตรา 24(1)) หรือเพื่อสาธารณะประโยชน์ (มาตรา 24(4))
3. เป็นข้อมูลที่กฎหมายระบุให้เก็บ
.
ในกรณีที่มีการส่งต่อหรือเปิดเผยข้อมูลนั้นต่อสาธารณะแล้ว ผู้ควบคุมข้อมูลต้องดำเนินการแจ้งให้ลบข้อมูลดังกล่าวด้วย
.
หากผู้ควบคุมข้อมูลไม่ดำเนินการตามคำร้องขอ
เจ้าของข้อมูลมีสิทธิร้องเรียนต่อคณะกรรมการผู้เชี่ยวชาญเพื่อสั่งให้ผู้ควบคุมข้อมูลดำเนินการได้
.
สามารถติดตามสิทธิของเจ้าของข้อมูลส่วนบุคคลได้ในครั้งต่อไป
เพื่อสร้างความเข้าใจที่ถูกต้องในประเด็นเรื่องสิทธิไปด้วยกัน...
โรงพยาบาลธนบุรี เปิดให้บริการ Hospitel
โรงพยาบาลธนบุรี เปิดให้บริการ Hospitel รวมกับ JC Kevin Hotel สาทร รับอายุ 15-60 ปี หรือเด็ก อายุ 3-14 ปี และ Grand Howard Hotel บางคอแหลม รับอายุ 15-50 ปี หรือเด็กอายุ 3-14 ปี
เหมาะกับผู้ป่วยอาการน้อย สีเขียว ไม่แสดงอาการ ไม่มีโรคประจำตัว
เด็กอายุ 3-14 ปี พักร่วมกับผู้ปกครอง
สอบถาม Tel : 0-2487-2000
BAH Connect ของ รพ.ภูมิพลอดุลยเดช LINK
BAH Connect ของ รพ.ภูมิพลอดุลยเดช กรมแพทย์ทหารอากาศ เป็นแอปพลิเคชันที่อำนวยความสะดวกให้กับประชาชน สำหรับการเข้าถึงบริการต่างๆ ของโรงพยาบาลภูมิพลอดุลยเดช รวมทั้งข้อมูลนัดหมายและการดูข้อมูลการรักษาผ่านทางมือถือ และอุปกรณ์พกพา เป็นการเพิ่มช่องทางในการสื่อสารไปยังประชาชน เป็นการเสริมสร้างภาพลักษณ์ที่ดูทันสมัยและสะดวกสบาย รวมทั้งสร้างความพึงพอใจให้กับประชาชนที่มาใช้บริการ
แอปพลิเคชันนี้พัฒนาโดยความร่วมมือระหว่างโรงพยาบาลภูมิพลอดุลยเดช กรมการแพทย์ทหารอากาศ ร่วมกับสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ศูนย์เทคโนโลยีอิเล็กทรอนิกส์และคอมพิวเตอร์แห่งชาติ และสำนักงานพัฒนารัฐบาลดิจิทัล (องค์การมหาชน) ภายใต้การกำกับดูแลของสำนักนายกรัฐมนตรี ซึ่งเป็นหน่วยงานกลางของระบบรัฐบาลดิจิทัล
ดาวน์โหลดได้ที่
iOS และ
Androidกรมการแพทย์แผนไทย โชว์นวดไทย
กรมการแพทย์แผนไทยและการแพทย์ทางเลือกได้รับมอบหมายในการจัดบูธนิทรรศการเกี่ยวกับการแพทย์แผนไทย การนำสมุนไพรมาใช้ทางการแพทย์ และการสาธิตการนวดแผนไทยภายในงาน ซึ่งจัดให้บริการนวดคอ บ่า ไหล่ และนวดเท้าให้แก่ผู้เข้าร่วมประชุม จำนวน 10 เตียง ได้แก่ นวดคอ บ่า ไหล่ จำนวน 5 เตียง รองรับได้ 40 คนต่อวัน และนวดเท้า 5 เตียง รองรับได้ 40 คนต่อวัน โดยมีการจัดสถานที่นวดเป็นสัดส่วน มีฉากกั้นระหว่างเตียง และจัดบริการบนมาตรฐานความปลอดภัยจากโรคโควิด 19 โดยผู้ให้บริการและผู้รับบริการจะสวมหน้ากากอนามัย มีการทำความสะอาดก่อนและหลังรับบริการ เป็นต้น
การเลือกนำเอา นวดไทย มานำเสนอและให้บริการครั้งนี้ เพื่อต้องการสื่อถึงศักยภาพการนำเอาบริการการแพทย์แผนไทยและสมุนไพร มาใช้ในการดูแลสุขภาพของประเทศไทย ซึ่งไม่เพียงประโยชน์ด้านการดูแลสุขภาพแล้ว ยังเป็นบริการที่จะสร้างมูลค่าด้านเศรษฐกิจสูงให้กับประเทศได้
นวดไทยได้รับการขึ้นทะเบียนเป็นรายการตัวแทนมรดกวัฒนธรรมที่จับต้องไม่ได้ของมนุษยชาติ จากองค์การยูเนสโกตั้งแต่วันที่ 12 ธันวาคม 2562 ถือเป็นเอกลักษณ์ของประเทศไทยที่ต่างชาติให้ความสนใจและนิยมมารับบริการ โดยเฉพาะการท่องเที่ยวเชิงสุขภาพ
การนวดไทยเพื่อการส่งเสริมสุขภาพ และการนวดไทย เพื่อการรักษาโรค เช่น โรคกลุ่มอาการปวดกล้ามเนื้อหรือโรคออฟฟิศซินโดรม ซึ่งในทางแพทย์แผนไทยเรียกว่า โรคลมปลายปัตฆาต เป็นโรคลมชนิดหนึ่งที่ทำให้เลือดลมไหลเวียนไม่สะดวก เลือดคั่งและแข็งตัวบริเวณกล้ามเนื้อ เส้นเอ็นและริมหัวต่อกระดูก ทำให้เกิดอาการปวดตึงกล้ามเนื้อ แข็งเป็นก้อนเป็นลำตามแนวมัดกล้ามเนื้อ ซึ่งการนวดจะช่วยบรรเทาอาการ
ประเทศไทยมีการผลักดันสมุนไพร 12 รายการเป็น Herbal Champion มา ตั้งแต่ปี 2560 ได้แก่ กวาวเครือขาว กระชายดำ ขมิ้นชัน บัวบก มะขามป้อม กระชายขาว พริก ฟ้าทะลายโจร กระเจี๊ยบแดง หญ้าหวาน ว่านหางจระเข้ และไพล และมุ่งหวังว่าไทยจะก้าวขึ้นมาเป็นศูนย์กลางนวัตกรรมสมุนไพรของโลก คาดว่าปี 2565 จะเกิดการสร้างรายได้จากการพัฒนาสมุนไพร การแพทย์แผนไทยและการแพทย์ทางเลือก ประมาณเกือบ 78,000 ล้านบาท
เปลี่ยนอาสากู้ชีพเป็นอาชีพ มีทุนพัฒนาทักษะ-สวัสดิการ
ปัญหา
ปัจจุบัน บุคลากรทางการแพทย์มีชั่วโมงการทำงานที่สูงเกินไป อย่างเช่นแพทย์ ต้องทำงานสัปดาห์ละ 80 ชั่วโมง หรือเฉลี่ยวันละ 14 ชั่วโมง ซึ่งระยะเวลาการทำงานที่มากเกินไปส่งผลต่อความสามารถต่อการให้บริการกับประชาชน เช่น ความแม่นยำในการตรวจวินิจฉัยโรค การทำหัตถการ ทำให้ประชาชนอยู่ในความเสี่ยงในการรักษาที่ผิดพลาด
ภาระงานของบุคลากรทางการแพทย์ ที่มีชั่วโมงการทำงานสูง แต่ค่าตอบแทนนอกเวลากลับได้รับอย่างไม่เหมาะสม และบางกรณีก็ไม่ได้รับค่าตอบแทนนอกเวลา ทำให้บุคลากรทางการแพทย์หมดกำลังใจในการทำงานในระบบสาธารณสุขของรัฐ และนำไปสู่การลาออกเข้าไปอยู่ในระบบเอกชนที่ผลตอบแทนดีกว่า (กรณีแพทย์ลาออกปีละ 500 - 600 คน)
นอกจากนั้น บุคลากรที่ทำงานเกี่ยวกับการกู้ชีพฉุกเฉิน ส่วนใหญ่มาจากอาสาสมัครตามมูลนิธิต่าง ๆ ซึ่งการดำเนินงานไม่ได้มีระบบและหลักเกณฑ์ที่เป็นมาตรฐานทางวิชาการ หรือไม่ได้สำเร็จการศึกษาในด้าน paramedic และยังไม่ได้รับการกำกับดูแลด้านมาตรฐานการปฏิบัติงานจากภาครัฐ เพราะว่าอาสาสมัครเหล่านี้ถือเป็นคนแรกที่เข้าไปในที่เกิดเหตุ อีกทั้งหน่วยงานรัฐ โดยเฉพาะองค์กรปกครองส่วนท้องถิ่น มีบุคลากรด้านการกู้ชีพฉุกเฉินไม่เพียงพอ
ข้อเสนอ
- เพิ่มศักยภาพของระบบอาสากู้ชีพให้ได้รับประกาศนียบัตรเฉพาะด้าน
- ตั้งเป้าให้มี Paramedic หรือนักปฏิบัติการฉุกเฉินการแพทย์
- ระดับปริญญาตรี อย่างน้อยทุกตำบล
- ระดับประกาศนียบัตร อย่างน้อย 1 คน ในทุกทีมอาสากู้ชีพ
- ภาครัฐอุดหนุนเงินให้กับมูลนิธิเพื่อเป็นทุนการศึกษาด้านการแพทย์ฉุกเฉินให้กับอาสาสมัคร
- เพิ่มงบประมาณ/ข้อกำหนดของท้องถิ่นในการจ้างนักปฏิบัติการฉุกเฉินการแพทย์ในรูปแบบต่างๆ ที่ได้รับค่าตอบแทนที่เป็นธรรมและมั่นคง (เช่น จ้างเป็นบุคลากรประจำ จ้างเป็นหน่วยงานรับผิดชอบในพื้นที่) โดยมีข้อตกลงการปฏิบัติงานชัดเจน
ด้านตัวแทนอาสาสมัคร อาทิ นางนันทวัน สุวัฒนา ตัวแทนชุมชนเคหะหลักสี่ รุ่นที่ 1 นายฉัฐณัฐ วิมลธีรโชค ตัวแทนชุมชนเคหะหลักสี่ รุ่นที่ 2 และ นางบุญเยี่ยม บุญเลิศ ตัวแทนชุมชนหมู่บ้านบัวบาน รุ่นที่ 3 กล่าวให้สัมภาษณ์ถึงความรู้สึกว่า “การก้าวเข้ามาเป็นอาสาจุฬาภรณ์ ได้รับความรู้ทางด้านสุขภาพที่หลากหลาย โดยพร้อมจะนำความรู้ที่ได้ทั้งหมดไปเผยแพร่ให้กับชุมชนอย่างถูกวิธี ขอบคุณทางโครงการฯ ที่เปิดโอกาสให้มีส่วนเข้าร่วม เพราะคนที่จะดูแลกันได้ดีที่สุดในเบื้องต้นก็คือคนในชุมชน วันนี้ได้รับความรู้ที่ถูกต้องจากอาจารย์ แพทย์ นักศึกษาแพทย์ เกิดความประทับใจ สุดท้ายอยากเชิญชวนให้ทุกคนในชุมชนเข้าร่วมกิจกรรม เพื่อตระหนักถึงการดูแลสุขภาพและสิ่งแวดล้อมในชุมชนให้ขยายวงกว้างต่อไป”
คลินิกผิวหนัง
ผิวหนัง เปิดให้บริการ วันจันทร์ – วันศุกร์ ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120จิตเวช
จิตเวช เปิดให้บริการ วันพุธ ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120คลินิกโรคหัวใจ
คลินิกโรคหัวใจ เปิดให้บริการ วันจันทร์ ช่วงบ่าย เวลา 13.00 – 16.30 น. (จันทร์แรกของเดือน) วันพุธ ช่วงบ่าย เวลา 13.00 – 16.30 น. (พุธที่ 4 ของเดือน) สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120การให้คำปรึกษาด้านสุขภาพและเวลเนส (Health and Wellness Coach)
ปัจจุบันการให้คำปรึกษาด้านสุขภาพและเวลเนส ได้รับความนิยมจากผู้ใช้บริการมากขึ้นเรื่อยๆ ผู้ทำหน้าที่ให้คำปรึกษา มักถูกเรียกว่า “เวลเนสโค้ช (Wellness Coach)” ซึ่งมีวิธีการทำงานโดยการให้ความรู้ด้านสุขภาพ โดยไม่ก้าวล่วงวิชาชีพด้านการแพทย์ หากเวลเนสโค้ชผู้นั้น ไม่ใช่ผู้ประกอบวิชาชีพทางการแพทย์ โดยมีศิลปะในการกระตุ้นและโน้มน้าวให้บุคคลหรือกลุ่มบุคคลมีส่วนร่วมในกระบวนการตามหลักฐานเชิงประจักษ์ อำนวยความสะดวก และยึดผู้รับบริการเป็นศูนย์กลางในการพัฒนาและบรรลุเป้า หมายด้านสุขภาพและความเป็นอยู่ที่ดีที่ตัดสินใจด้วยตนเอง ช่วยให้ผู้ขอรับคำปรึกษาใช้ข้อมูลเชิงลึก จุดแข็งส่วนบุคคล และทรัพยากรหรือต้นทุนด้านสุขภาพที่มีอยู่ของตนเองในการกำหนดเป้าหมายอย่างมุ่งมั่นในการประพฤติ ปฏิบัติ และสร้างความรับผิดชอบในการเสริมสร้างวิถีชีวิตที่มีสุขภาพดีตามที่ปรารถนา ซึ่งด้วยศาสตร์และศิลปะเหล่านี้ เวลเนส โค้ชจะต้องทำความรู้จักและสำรวจข้อมูลผู้ขอรับบริการ เพื่อเลือกใช้วิธีการเสริมแรง ให้กำลังใจแก่ผู้ขอรับคำปรึกษา และเลือกใช้ทรัพยากรภายนอกในการเสริมสร้างสุขภาวะที่ดี และสุขภาพองค์รวมด้วยกลยุทธ์การจัดการตนเองเพื่อดำเนินการเปลี่ยนแปลงวิถีชีวิตที่ดีต่อสุขภาพอย่างยั่งยืนของผู้ขอรับคำปรึกษา
บทบาทของเวลเนสโค้ชที่สำคัญอีกประการหนึ่ง คือ การเป็นหุ้นส่วนที่รับผิดชอบต่อการมีสุขภาวะที่ดีของผู้ขอรับคำปรึกษาและมองหาโอกาสในการการเติบโตและพัฒนาความเป็นอยู่ที่ดีและการมีสุขภาพองค์รวมอย่างต่อ เนื่อง ไม่ใช่ผู้กำหนดหรือตัดสินการเปลี่ยนแปลงพฤติกรรม โดยในบทบาทของผู้อำนวยความสะดวก (facilitator) ในกระบวนการเปลี่ยนแปลงพฤติกรรมของผู้ขอรับคำ ปรึกษา เวลเนสโค้ชจะสนับสนุนให้ผู้ขอรับคำปรึกษาบรรลุเป้าหมายที่กำกับตนเองให้เกิดการเปลี่ยนแปลงพฤติกรรมที่สอดคล้องกับความปรารถนาส่วนบุคคลด้านสุขภาพ และความเป็นอยู่ที่ดีอย่างมีสุขภาพองค์รวม โดยอาศัยข้อมูลสำคัญจากแผนการดูแลสุขภาพที่เป็นการวินิจิฉัย หรือผลจากการดูแลรักษาโดยผู้ประกอบวิชาชีพทางการแพทย์ ซึ่งเมื่อกระบวนการให้คำปรึกษาดำเนินการไปอย่างเหมาะสม
นอกจากนี้ หากเวลเนสโค้ชทำงานร่วมกับหรืออยู่ภายใต้การควบคุมกำกับของผู้ประกอบวิชาชีพทางการแพทย์หรือผู้ประกอบโรคศิลปะ (เช่น แพทย์ นักจิตวิทยา นักกายภาพบำ บัดนักกิจกรรมบำ บัด แพทย์แผนไทย แพทย์แผนจีน ฯลฯ)
เวลเนสโค้ชก็จะมีบทบาทสำคัญในการสนับสนุนการดำเนินการตามแผนการรักษาของผู้ประกอบวิชาชีพทางการแพทย์เหล่านั้น โดยไม่วินิจฉัย ตีความข้อมูลทางการแพทย์ สั่งหรือยกเลิกการสั่งยา แนะนำอาหารเสริม ให้คำปรึกษาด้านโภชนาการ หรือวางแผนมื้ออาหาร ให้คำแนะนำ หรือสั่งการฟื้นฟูสมรรถภาพด้วยวิธีการทางการแพทย์ รวมให้คำปรึกษาและให้คำแนะนำ หรือจัดให้มีการแทรกแซงทางจิตวิทยา อันเป็นการก้าวล่วงการประกอบวิชาชีพทางการแพทย์ โดยเฉพาะอย่างยิ่ง การทำจิตบำบัด ด้วยการปรับความคิดและพฤติกรรม (Cognitive Behavioral Therapy; CBT), การลดความไวต่อการเคลื่อนไหวของดวงตา และการประมวลผลซ้ำ (Eye Movement Desensitization and Reprocessing; EMDR), การบำบัดที่มุ่งเน้นการหาทางออกหรือแก้ไขปัญหา (Solution Focused Therapy), จิตบำบัดเพื่อเปลี่ยนรูปแบบพฤติกรรมที่ไร้ประโยชน์ หรือ พฤติกรรมบำบัดวิภาษวิธี (Dialectical Behavior Therapy; DBT), การบำบัดระบบครอบครัวภายใน (Internal Family Systems Therapy; IFS), การบำบัดที่เกี่ยวข้องกับการรักษาทางจิตวิทยาที่ได้รับการวินิจฉัยทางการแพทย์ เป็นต้น
ในกลุ่มบริการทางการแพทย์ของประเทศไทย ที่มีหลักสูตรฝึกอบรมผู้ให้คำปรึกษาทางการแพทย์เพื่อเสริมสร้างความรู้ ความเข้าใจและการปฏิบัติตัวที่ถูกต้อง ในการวางแผนดูแลสุขภาพส่วนบุคคล ได้แก่ การแพทย์แม่นยำกลุ่มจีโนมิกส์ (Genomics Counselor) และ เวชศาสตร์วิถีชีวิต (Lifestyle Medicine)
ในประเทศไทย แม้จะยังไม่มีกฎหมายรองรับการประกอบอาชีพเวลเนสโค้ช แต่ด้วยการเปลี่ยนแปลงเป้าหมายในชีวิตของผู้คนที่ให้ความสำคัญด้านสุขภาพมากขึ้น ทำให้เวลเนสโค้ชมีบทบาทมากขึ้นเรื่อยๆในการค้นหาแหล่งความรู้ หรือ การเข้าถึงข้อมูลสุขภาพที่ถูกต้องของผู้คน ดังนั้น เวลเนสโค้ชจึงต้องทำหน้าที่ของตนเองอย่างมี ความสำนึกรับผิดชอบ สั่งสมความรู้ ความสามารถ ความ เชี่ยวชาญในสาขาความรู้ของตนอย่างเคารพในกฎหมายและ มาตรฐานด้านวิชาชีพทางการแพทย์ คำนึงถึงขีดจำกัดของความรู้และทักษะที่เกี่ยวข้องในการให้คำปรึกษาด้านสุขภาพ และให้ความสำคัญต่อหลักการทางจริยธรรม โดยไม่ใช่ช่องว่างแห่งความรู้ (Gap of Knowledge) หรือความเชื่อด้านสุขภาพของบุคคล (Personal Health Believes) มาฉวยโอกาสสร้างกระแสบริการและการโฆษณาชวนเชื่อที่ไม่ถูกต้องให้แก่ประชาชน
#GDRT_Topic Genderation
#GDRT_Topic : Imane Khelif ไม่ใช่หญิงข้ามเพศ (เกิดมามีอวัยวะเพศหญิง มีคำนำหน้าในเอกสารราชการเป็นหญิง ถูกปฏิบัติด้วยในฐานะผู้หญิง และไม่เคยเข้ารับการผ่าตัดเปลี่ยนแปลงเพศ)
แต่เธอเป็นนักมวยหญิงที่มีภาวะพัฒนาการทางเพศที่แตกต่าง (Disorder of Sex Development หรือ DSD) ซึ่งทำให้เธอกลายเป็นศูนย์กลางของการถกเถียงในวงการกีฬาโอลิมปิกขณะนี้
Khelif เกิดและเติบโตในเมือง Tiaret ประเทศแอลจีเรีย เธอเริ่มต้นอาชีพนักมวยและประสบความสำเร็จมากมาย แต่ใช่ว่าจะไม่เคยชกแพ้
ในโอลิมปิกฤดูร้อนปี 2020 เธอแข่งขันในรุ่นไลต์เวท แต่พ่ายแพ้ในรอบก่อนรองชนะเลิศให้กับ Kellie Harrington จากไอร์แลนด์
ใน IBA Women’s World Boxing Championships ปี 2022 เธอเป็นนักมวยหญิงชาวแอลจีเรียคนแรกที่เข้าถึงรอบชิงชนะเลิศ และได้รับเหรียญเงินหลังจากแพ้ให้กับ Amy Broadhurst
อย่างไรก็ตาม ในเดือนมีนาคม 2023 Khelif ถูกตัดสิทธิ์จากการแข่งขันชิงแชมป์โลก IBA Women’s World Boxing Championships เนื่องจากไม่ผ่านการทดสอบความเหมาะสมทางเพศ ประธาน IBA อ้างว่าผลการทดสอบแสดงว่าเธอมีโครโมโซม XY และระดับฮอร์โมนเทสโทสเตอโรนสูงกว่าปกติ ซึ่งเป็นลักษณะที่พบในผู้ชาย แต่ไม่มีการเปิดเผยผลการทดสอบอย่างเป็นทางการ
แม้จะมีข้อขัดแย้ง แต่คณะกรรมการโอลิมปิกสากล (IOC) ได้อนุญาตให้ Khelif เข้าร่วมการแข่งขันในโอลิมปิกปารีส 2024 โดยยืนยันว่าเธอปฏิบัติตามกฎระเบียบและข้อกำหนดทางการแพทย์ที่จำเป็นทั้งหมด
ในการแข่งขันรอบแรกที่ปารีส Khelif ชนะการแข่งขันในแมทช์ที่ขึ้นชกกับ Angela Carini จากอิตาลี Carini ถอนตัวออกจากการแข่งขันหลังจากเริ่มไปได้เพียง 46 วินาที
โดย Angela Carini ได้ออกมากล่าวกับผู้สื่อข่าวทั้งน้ำตาว่า "ฉันไม่เคยโดนหมัดแบบนี้มาก่อน มันเป็นไปไม่ได้ที่จะสู้ต่อ ฉันก็ไม่ใช่คนที่จะพูดได้ว่าสิ่งนี้มันผิดหรอกนะ ฉันเข้ามาในเวทีเพื่อสู้ ฉันไม่ยอมแพ้ แต่หมัดหนึ่งมันเจ็บมากจนฉันต้องบอกว่าพอแล้ว ฉันจะออกไปด้วยความภาคภูมิใจ"
เหตุการณ์นี้ได้สร้างความสนใจและการถกเถียงเพิ่มเติมเกี่ยวกับความเหมาะสมในการแข่งขันของ Khelif
การเข้าร่วมแข่งขันของ Khelif ได้รับการสนับสนุนจากคณะกรรมการโอลิมปิกแอลจีเรีย (COA) ซึ่งได้ออกมาปกป้องเธอและประณามการวิพากษ์วิจารณ์ที่ไม่เป็นธรรม อย่างไรก็ตาม มีการวิพากษ์วิจารณ์จากบุคคลสำคัญและสื่อมวลชนบางส่วนที่มองว่าเธอไม่ควรเข้าร่วมแข่งขันในประเภทหญิงเนื่องจากมีลักษณะทางพันธุกรรมที่เป็นชาย
กรณีของ Imane Khelif เป็นตัวอย่างที่ชัดเจนของความท้าทายและความขัดแย้งที่เกิดขึ้นในวงการกีฬาที่เกี่ยวข้องกับการทดสอบความเหมาะสมทางเพศ เหตุการณ์นี้ได้เปิดประเด็นการถกเถียงเกี่ยวกับความยุติธรรม ความเท่าเทียม และการยอมรับความหลากหลายในวงการกีฬา
ในขณะที่บางคนมองว่าการอนุญาตให้ Khelif แข่งขันเป็นการละเมิดความยุติธรรมและความปลอดภัยของนักกีฬาหญิงคนอื่นๆ อีกฝ่ายก็มองว่าเป็นการยอมรับ เคารพสิทธิของนักกีฬาทุกคน
อย่างไรก็ตาม สิ่งสำคัญที่ต้องตระหนักคือ เราไม่ควรนำกรณีของ Khelif มาใช้เป็นเครื่องมือในการโจมตีหรือลดทอนความสำคัญของความหลากหลายทางเพศ กรณีนี้คือความซับซ้อนของร่างกายมนุษย์และความหลากหลายทางชีววิทยา ซึ่งไม่ได้เกี่ยวข้องโดยตรงกับประเด็นของบุคคลข้ามเพศหรือความหลากหลายทางเพศสภาพอื่นๆ
การถกเถียงเกี่ยวกับความเหมาะสมในการแข่งขันกีฬาควรมุ่งเน้นไปที่การสร้างกฎเกณฑ์ที่เป็นธรรมและปลอดภัยสำหรับนักกีฬาทุกคน โดยคำนึงถึงหลักฐานทางวิทยาศาสตร์และการเคารพสิทธิมนุษยชน แทนที่จะใช้เป็นเครื่องมือในการสร้างความเกลียดชังหรือการเลือกปฏิบัติต่อกลุ่มคนที่มีความหลากหลายทางเพศ
ในท้ายที่สุด กรณีของ Khelif ควรกลายเป็นโอกาสให้สังคมได้เรียนรู้และเข้าใจความซับซ้อนของเพศสภาพและเพศสรีระมากขึ้น รวมถึงการพัฒนานโยบายและแนวปฏิบัติที่ครอบคลุมและเป็นธรรมสำหรับทุกคนในวงการกีฬา โดยไม่ละเลยประเด็นความปลอดภัยและความยุติธรรมในการแข่งขัน
ศูนย์บริการสาธารณสุข 35 หัวหมาก ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 2- 13 กันยายน 2567
ศูนย์บริการสาธารณสุข 35 หัวหมาก หน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสัตว์เลี้ยง (บริการฟรี) ระหว่างวันที่ 2- 13 กันยายน 2567 (เวลา 09.00-11.00น) สถานที่จุดตั้งหน่วยบริการตามประกาศที่แนบมาด้านล่างนี้นะคะ **หากท่านใดมีความประสงค์ สามารถนำสัตว์เลี้ยงของท่านเข้ารับบริการได้ ตามจุดที่ใกล้บ้านของท่านหรือตามสถานที่ ตั้งหน่วยบริการได้เลย สอบถามโทร 02-3775494 ต่อ 5771
เงื่อนไขการใช้อัตราดอกเบี้ยและวิธีเปิดบัญชีเงินเดือนกับธนาคาร
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตคลองเตย
5. แขนขาอ่อนแรงครึ่งซีก พูดไม่ชัด แบบปัจจุบันทันด่วน หรือชักต่อเนื่องไม่หยุด
6. มีอาการอื่นร่วม ที่มีผลต่อการหายใจ ระบบการไหลเวียนโลหิต และ ระบบสมองที่อาจเป็นอันตรายต่อชีวิต
6.Allow App request features and run
App requests to allow GPS and Bluetooth then done.
มองโอกาสและตลาดผลิตภัณฑ์กัญชาในบ้านเราในอนาคตอย่างไร
ตลาดยังไปได้อีกไกลค่ะ กัญชาน่าจะแปรรูปเป็นผลิตภัณฑ์ได้อีกหลายอย่าง ถ้าภาครัฐช่วยส่งเสริมให้ความรู้แก่ประชาชนในอนาคต น่าจะได้เห็นเทคโนโลยีที่ทำให้กัญชาเป็นมากกว่าอาหารและยา21 เมย 64 ประกาศเรื่องวัคซีนเข็มที่สอง (spa)
เฉพาะผู้ที่ได้รับการฉีดวัคซีนเข็มที่ 1 และไม่พบรายชื่อนัดรับวัคซีนเข็มที่ 2 บน
www.ภูเก็ตต้องชนะ.com เท่านั้น. ให้ท่านนำบัตรประชาชนตัวจริงและใบนัดรับวัคซีนเดิมที่เคยได้รับ ไปรับวัคซีนเข็มที่สองที่จุดรับวัคซีนเข็มแรกในวันที่ 30 เมษายน 2564 เท่านั้น ตามเวลาดังนี้
1. สนามบินภูเก็ต : เวลา 14.00-16.00 น.
2. โรงแรมอังสนาลากูนา : เวลา 13.00-16.00 น.
3. ห้างจังซีลอน : เวลา 16.00 น.
4. สนามกีฬาสะพานหิน : เวลา 14.00 น.
5. โรงแรมภูเก็ตออร์คิดรีสอร์ท : เวลา 16.00 น.
โรงพยาบาลในเครือบางปะกอกและปิยะเวท เปิดให้ลงทะเบียนรับวัคซีนฟรี‼️ LINK
เปิดให้ลงทะเบียนรับวัคซีนฟรี‼️
---------------------------------
โรงพยาบาลในเครือบางปะกอกและปิยะเวท ได้ร่วมมือกับทางกรุงเทพมหานครและห้างสรรพสินค้าชั้นนำในการควบคุมและป้องกันการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) โดยมีการจัดทีมแพทย์และพยาบาลช่วยปฏิบัติงานในการฉีดวัคซีนให้กับประชาชนทั่วไปฟรี ตามจุดให้บริการต่างๆดังนี้
---------------------------------
1. ธัญญาพาร์ค ศรีนครินทร์
2. โรบินสัน ไลฟ์สไตล์ ลาดกระบัง
3. เซ็นทรัลเวิลด์
4. เซ็นทรัล เฟสติวัล อีสต์วิลล์
5. บิ๊กซีบางบอน
6. โลตัสมีนบุรี
7. เอเชียทีค เดอะ ริเวอร์ฟร้อนท์
---------------------------------
เริ่มฉีดวันที่ 7 มิถุนายน 2564
เวลาในการให้บริการ ตามเวลาเปิดปิด ของสถานที่นั้น
ผู้ที่สนใจสามารถลงทะเบียนรับการฉีดวัคซีนฟรีได้ที่ https://bit.ly/3tN6bsZ
หรือโทร 1745 ติดต่อขอรับบริการได้ที่โรงพยาบาลในเครือบางปะกอกและปิยะเวท??
สอบถามเพิ่มเติมได้ที่
LINE : https://lin.ee/gDBGCme
เข้าสู่เว็บไซต์ : http://piyavate.com
อุบลฯ พร้อมรับผู้ป่วยกลับรักษา LINK
ผู้ป่วยโควิด-19 ที่ต้องการกลับมารับการรักษาในพื้นที่จังหวัดอุบลราชธานี ติดต่อโทร
082-6489270 , 096-6932139 , 096-9371783 ทุกวัน 8.30-19 น.
ผู้ป่วยจะต้อง
1.แจ้งชื่อ-สกุล พร้อมแนบผลการตรวจยืนยันโควิด ให้เจ้าหน้าที่ก่อนเดินทางทุกคน
2. ติดต่อนัดหมายกับรพ.ที่จะรับรักษาในแต่ละอำเภอ ก่อนเดินทางกลับ ห้ามเดินทางก่อน
เมื่อมาถึงให้เข้ารพ.ทันที ห้ามแวะเข้าหมู่บ้าน/ที่พักของตนเอง หรือห้ามพบญาติในพื้นที่
ให้โทรแจ้งนัดหมายเจ้าหน้าที่ ก่อนถึงรพ. ที่รับไว้รักษา 3-4 ชม.
* ไม่รับตรวจหาเชื้อในรายที่สงสัยหรืออยากมาขอรับการตรวจจากพื้นที่จังหวัดอื่นๆ
** หากต้องการต้องติดต่อจังหวัดภูมิลำเนาของท่านโดยตรง
*** รับเฉพาะคนอุบลฯ ที่มีผลตรวจยืนยันโควิด และยังไม่มีเตียง/ไม่มีรพ.ว่างรับการรักษา
นพ.สสจ.กาฬสินธุ์ กล่าวถึงเคสโอไมครอน จ.กาฬสินธุ์
นพ.อภิชัย ลิมานนท์ นพ.สสจ.กาฬสินธุ์
กล่าวถึงเคสโอไมครอน จ.กาฬสินธุ์ "เบื้องต้น พบระบาดเฉพาะร้านอาหาร เพราะมีการถอดแมสเพื่อทานอาหาร ส่วนสถานที่อื่นๆยังไม่พบการติดเชื้อ การสวมแมสจึงเป็นการป้องกันที่ดี ขอให้ชาวกาฬสินธุ์ ยึดมาตรการ DMHTTA อย่างเคร่งครัด"
เขตหลักสี่พร้อมเสมอ เตรียมพร้อมศูนย์พักคอยฯ ณ โรงเรียนการไปรษณีย์-เขตหลักสี่ LINK
#หลักสี่พร้อมเสมอ "เตรียมพร้อมศูนย์พักคอยฯรองรับผู้ป่วยโควิด-19 กรณีเร่งด่วน"
(5 ม.ค. 65) เวลา 08.30 น. นายสมบัติ กนกทิพย์วรรณ ผู้อำนวยการเขตหลักสี่ นำผู้บริหารเขต เจ้าหน้าที่ฝ่ายรักษาความสะอาดฯ ฝ่ายเทศกิจ ฝ่ายโยธา และฝ่ายสิ่งแวดล้อมฯ จัดกิจกรรม Big Cleaning ศูนย์พักคอยโรงเรียนการไปรษณีย์-เขตหลักสี่ โดยทำความสะอาดภายในอาคารและบริเวณโดยรอบ ตรวจสอบระบบไฟ ตรวจสอบความพร้อมอุปกรณ์ อาทิ กล้องวงจรปิด อินเตอร์คอม เตียงนอน และสิ่งของจำเป็นต่างๆ เพื่อเตรียมความพร้อมของศูนย์พักคอย ให้สามารถรองรับผู้ป่วยโควิด-19 กรณีที่ต้องเปิดใช้เร่งด่วน
นายแพทย์เบอนาร์ด พีคูล (Bernard Pécoul, M.D., MPH.)
นายแพทย์เบอนาร์ด พีคูล (Bernard Pécoul, M.D., MPH.)
ผู้ก่อตั้งและผู้อำนวยการบริหาร องค์กรจัดหายาสำหรับโรคที่ถูกละเลย
Drugs for Neglected Diseases initiative (DNDi)
สาธารณรัฐฝรั่งเศส
โรงพยาบาลพระปกเกล้า เชิญเด็กฉีดวัคซีนวันที่ 9 กุมภาพันธ์ 65 LINK
โรงพยาบาลพระปกเกล้า ขอเชิญเด็กที่มีโรคประจำตัว อายุ 5-11 ปี และเด็กนักเรียน ชั้น ป.5-ป.6 ขอเชิญเด็กที่มีโรคประจำตัว อายุ 5-11 ปี และเด็กนักเรียน ชั้น ป.5-ป.6 ที่ศึกษาอยู่ในโรงเรียน เขตอำเภอเมืองจันทบุรี มารับการฉีดวัคซีน ไฟเซอร์ วันพุธที่ 9 กุมภาพันธ์ 65 ณ ลานค้าชุมชน (ตรงข้ามจวนผู้ว่า) ตั้งแต่ 7-12 น.
การฉีดเชิงรุกที่โรงเรียน กำหนดการดังนี้
7 กุมภาพันธ์ 65 โรงเรียนอนุบาลจันทบุรี และโรงเรียนสฤษดิเดช
8 กุมภาพันธ์ 65 โรงเรียนอำนวยวิทย์ และโรงเรียนสตรีมารดาพิทักษ์
การป้องกันภาวะสมองเสื่อมตามระดับ
การป้องกันโรคทุกโรคแบ่งออกเป็น 3 ระดับ คือระดับปฐมภูมิ(primary prevention) ทุติยภูมิ(secondary prevention) และตติยภูมิ (tertiary prevention) สำหรับการป้องกันภาวะสมองเสื่อมก็เช่นเดียวกันคือ
- การป้องกันโรคระดับปฐมภูมิ (primary prevention) คือ การป้องกันโรคก่อนที่จะเริ่มมีการเปลี่ยนแปลงระดับชีวภาพ หรือการป้องกันปัจจัยเสี่ยงของโรค
- การป้องกันโรคระดับทุติยภูมิ (secondary prevention) ได้แก่ การตรวจคัดกรองโรคตั้งแต่ผู้ป่วยยังไม่แสดงอาการ เพื่อที่จะได้แก้ไขตั้งแต่ระยะแรก แม้ในปัจจุบันมีความพยายามที่จะตรวจคัดกรองหาผู้ป่วยที่เป็น mind cognitive impairment (MCI) เพื่อที่จะชะลอการเกิดโรคอัลไซเมอร์ออกไป โดยผู้ป่วย MCI มีโอกาสเกิดภาวะสมองเสื่อมโดยเฉพาะโรคอัลไซเมอร์สูงกว่าประชากรทั่วไป คือ โอกาสเปลี่ยนเป็นโรคอัลไซเมอร์ร้อยละ 6-25 ต่อปี เทียบกับร้อยละ 1-2 ต่อปีในประชากรทั่วไป แต่ผลจากการใช้ยาเพื่อชะลอการเกิดโรคอัลไซเมอร์ได้ผลเฉพาะในปีแรกเท่านั้น นอกจากนั้นในปัจจุบันยังมีความพยายามที่จะใช้ตัวทำนายต่างๆ ไม่ว่าจะเป็นภาพเอ็กเรย์คลื่นแม่เหล็กไฟฟ้า หรือการตรวจน้ำไขสันหลังดังกล่าวข้างต้น เพื่อทำนายว่ามีโอกาสเกิดภาวะสมองเสื่อมในอนาคต แต่ยังอยู่ในระหว่างการศึกษา และโดยทั่วไปค่อนข้างยากที่จะบอกให้รู้ว่าผู้ป่วยรายใดมีโอกาสเกิดภาวะสมองเสื่อมในอนาคต ยกเว้นว่า เป็นผู้ที่มีความเสี่ยงทางพันธุกรรมหรืออยู่ในสภาพแวดล้อมที่อาจเป็นสาเหตุของภาวะสมองเสื่อมได้
- การป้องกันสมองเสื่อมระดับตติยภูมิ (Tertiary prevention) ได้แก่ การชะลอการดำเนินโรคเมื่อผู้ป่วยมีอาการแสดงของโรคแล้ว ซึ่งพบว่าในปัจจุบันมียาหลายชนิดที่สามารถชะลออาการของโรคได้ เช่น cholinesterase inhibitors, vitamin E และ memantine เป็นต้น การป้องกันการเกิดโรคหลอดเลือดสมองซ้ำหรือปัจจัยต่างๆ ที่อาจซ้ำเติมให้การทำงานของสมองของผู้ป่วยแย่ลงก็เป็นกลวิธีของการป้องกันโรคระดับนี้ นอกจากนั้นยังรวมถึงการแก้ไขปัญหาทางจิตเวชและพฤติกรรมที่เกิดในผู้ป่วยที่มีสมองเสื่อม รวมถึงการทำกายภาพบำบัดผู้ป่วย ซึ่งจะช่วยผู้ป่วยและผู้ดูแลผู้ป่วยให้ดีขึ้นได้ระดับหนึ่ง การเพิ่มคุณภาพของระบบการดูแลผู้ป่วยไม่ว่าระดับครอบครัวหรือประเทศชาติ เช่น การตั้นสมาคมผู้ดูแลผู้ป่วยสมองเสื่อม การฝึกทักษะการดูแลผู้ป่วย เหล่านี้เป็นต้น ก็เป็นการช่วยชะลอปัญหาของผู้ป่วยที่เกิดจากสมองเสื่อมวิธีหนึ่ง
อย่างไรก็ตาม ปัญหาที่พบในการแปลผลผลของการศึกษาด้านปัจจัยเสี่ยงและการป้องกันภาวะสมองเสื่อม มีหลายประเด็น ตัวอย่างเช่น
1. การแยกระหว่างการที่ปัจจัยและผลลัพธ์ของการศึกษาเป็นแค่ความสัมพันธ์ หรือจริงๆ แล้วเป็นสาเหตุ (association or causality) ซึ่งโดยทั่วไปต้องพิจารณาโอกาสการเป็นสาเหตุ โดยอาจพิจารณาจาก
- ดูความสัมพันธ์ด้านเวลาในการได้รับปัจจัยเกิดก่อนการเกิดโรค (temporal relationship) แต่ปัจจัยด้านการดำรงชีพ เช่น สารอาหาร การออกกำลังกาย การเข้าร่วมกิจกรรมที่กระตุ้นการรู้คิด เป็นต้น หรือแม้แต่ปัจจัยเสี่ยงที่มีผลต่อหลอดเลือด เช่น ความดันโลหิตสูง เป็นต้น โดยทั่วไปผู้ป่วยควรได้รับก่อนเกิดภาวะสมองเสื่อมเป็นเวลานานอย่างน้อยหลายปี ตัวอย่างเช่น การพบว่าภาวะซึมเศร้ามีความสัมพันธ์กับการเกิดโรคอัลไซเมอร์นั้น อาจเกิดจากภาวะซึมเศร้าเป็นสาเหตุจริง หรือเป็นอาการในระยะเริ่มแรกของผู้ป่วยโรคอัลไซเมอร์ก็ได้
- ขนาดของความสัมพันธ์ (strength of association) หากปัจจัยที่สงสัยเป็นสาเหตุจริง น่าจะมีความสัมพันธ์กับผลลัพธ์คือการเกิดสมองเสื่อมหลายเท่าตัว แต่โดยส่วนใหญ่ปัจจัยด้านต่างๆ นอกจากอายุและพันธุกรรมแล้ว จะพบว่ามีความสัมพันธ์กับการเกิดภาวะสมองเสื่อมเพียง 2-3 เท่า
- การเกิดโรคเพิ่มมากขึ้นหรือลดลงตามขนาดของปัจจัยที่เปลี่ยนแปลงไป (dose-response relationship) ตัวอย่างเช่น การศึกษาโดย Morris MC และคณะพบว่าอุบัติการณ์ของโรคอัลไซเมอร์ลดลงตามการรับประทานปริมาณกรด docosahexaenoic (DHA) ที่เพิ่มขึ้น และตามความถี่ของการรับประทานปลาที่มากขึ้น15 อย่างไรก็ตามการศึกษาส่วนใหญ่มักไม่ได้แสดงถึงความสัมพันธ์ประเภทนี้
- ผลของการศึกษาควรเหมือนเดิมหากทำการศึกษาซ้ำ (replication of the findings) ไม่ว่าจะในประชากรกลุ่มเดิม กลุ่มย่อยของประชากรเดิม (subgroup ) หรือกลุ่มใหม่ ซึ่งสิ่งนี้เป็นข้อจำกัดหนึ่งของการความสัมพันธ์ที่พบในภาวะสมองเสื่อม เพราะมักจะมีความแตกต่างไปในผลที่ได้จากการศึกษาที่ทำซ้ำคล้ายเดิม ดังเช่น การศึกษาเรื่องบทบาทของยา statins ต่อการเกิดภาวะสมองเสื่อม พบว่าการศึกษาที่เป็นชนิด case-control studies และการศึกษาที่มีคุณภาพของการวิจัยต่ำกว่า รายงานถึงการลดลงของการเกิดภาวะสมองเสื่อมโดยรวมและชนิดอัลไซเมอร์ แต่การศึกษาระยะหลังที่ตามมาที่มีคุณภาพการศึกษาสูงกว่า ไม่พบความสัมพันธ์ดังกล่าว16
- ผลที่ได้ ควรสอดคล้องกับองค์ความรู้ที่มีอยู่เดิม สามารถอธิบายได้ (Biological plausibility) อย่างไรก็ตาม บางครั้งเราพบความสัมพันธ์ก่อนที่จะอธิบายด้วยองค์ความรู้ที่มีได้ แต่ในอนาคตถึงจะอธิบายได้ และขณะเดียวกันสิ่งที่ควรพบตามหลักพื้นฐานที่ทราบอยู่แล้ว อาจไม่เป็นไปตามทฤษฎีเสมอไป
- เมื่อหยุดปัจจัยที่สงสัยว่าเป็นสาเหตุ โอกาสการเกิดโรคก็ลดลงตามลงมา (cessation of exposure) ดังเช่น หากการสูบบุหรี่เป็นสาเหตุของภาวะสมองเสื่อมแล้ว เมื่อหยุดสูบ โอกาสเกิดสมองเสื่อมควรลดลง อย่างไรก็ตามพยาธิสภาพหลายอย่างอาจเกิดความผิดปกติอย่างถาวร ถึงแม้หยุดสาเหตุ การเกิดโรคก็อาจไม่ลดลง
- ความจำเพาะระหว่างปัจจัยเสี่ยงและโรค (Specificity of the association) เนื่องจากภาวะสมองเสื่อมเกิดจากหลายสาเหตุร่วมกัน และปัจจัยเสี่ยงของโรคนี้โดยเฉพาะปัจจัยเสี่ยงด้านหลอดเลือด และปัจจัยเสี่ยงด้านพฤติกรรมมักไม่จำเพาะทำให้เกิดแต่ภาวะสมองเสื่อมเท่านั้น ยังคงทำให้เกิดโรคอื่นได้อีก ดังนั้นจึงไม่พบความจำเพาะของความสัมพันธ์นี้ในการพิจารณาการเป็นสาเหตุของโรค
2. การแยกระหว่างปัจจัยบางอย่างที่ทำให้เกิดโรคอัลไซเมอร์เองโดยตรง หรือแท้จริงแล้วปัจจัยเหล่านั้นอาจมีผลต่อการหลอดเลือดและการไหลเวียนเลือดในสมองของผู้ป่วยสมองเสื่อม อาจแยกได้ยาก
3. ข้อมูลที่มีอยู่ในปัจจุบันส่วนใหญ่มาจากข้อมูลการศึกษาที่ไม่ได้ถูกวางแผนมาศึกษาด้านสมองเสี่อมโดยตรง แต่ผลลัพธ์หลักของการศึกษาเป็นภาวะอื่น เช่น โรคหัวใจและระบบไหลเวียนเลือด และโรคมะเร็งเป็นต้น ดังนั้นจึงมีข้อจำกัดในการประเมินวัดทั้งปัจจัยเสี่ยง (exposure) และการรู้คิดบกพร่องหรือสมองเสื่อม (outcome)
4. การประเมินวินิจฉัยภาวะสมองเสื่อมในการศึกษาในประชากรปริมาณมาก มักขาดความถูกต้องแม่นยำในด้านการวินิจฉัย เช่น ไม่มีคำนิยามที่ชัดเจนของการวินิจฉัย เกณฑ์ที่ใช้ไม่ได้รับการเทียบด้านมาตรฐาน ตลอดจนเครื่องมือที่ใช้ในการประเมินแต่ละการศึกษามีความแตกต่างกัน ทำให้การเปรียบเทียบผลระหว่างการศึกษาต่างๆ ทำได้ลำบาก นอกจากนั้นบางครั้งการวินิจฉัยโดยการประเมินผู้ป่วยเพียงหนึ่งครั้งอาจทำได้ลำบาก จึงทำให้หลายๆ การศึกษาทางด้านระบาดวิทยาของภาวะนี้อาจมีการวินิจฉัยโรคที่คลาดเคลื่อนได้ และถึงแม้หลายการศึกษามีการติดตามผู้ป่วย แต่ระยะเวลาที่ติดตามส่วนใหญ่มักจะไม่นานพอในด้านการบอกการเป็นสาเหตุของการเกิดโรคได้
5. การระบุปัจจัยเสี่ยงในหลายการศึกษายังขาดคุณภาพในด้านการวัดประเมินปัจจัยเสี่ยง เช่น ปัจจัยด้านอาหาร การดำรงชีพ สุขภาพ เศรษฐานะสังคม ยาที่ใช้ ตลอดจนการเข้าร่วมกิจกรรมที่กระตุ้นการรู้คิด เป็นต้น ดังตัวอย่างเช่น การศึกษาด้านวิตะมินเสริมกับการป้องกันการลดลงของการรู้คิด พบว่าการศึกษาต่างๆ มีความแตกต่างกันทั้งในขนาดของวิตะมินที่ผู้ป่วยได้ การติดตามและประเมินการรู้คิดของผู้ป่วย การประเมินภาวะโภชนาการเดิมของผู้ป่วย ระยะเวลาการติดตาม และการศึกษาส่วนใหญ่ยังมักไม่ได้ใช้การลดลงของการรู้คิดเป็นผลลัพธ์หลักของการศึกษา
จากรายงาน National Institutes of Health State-of-the-Science Conference Statement ในปีพ.ศ. 255317 โดยเป็นการทบทวนรายงานงานวิจัยอย่างเป็นระบบ (systematic review) ถึงตุลาคม พ.ศ.2552 หรืองานวิจัยต้นฉบับตั้งแต่ปีพ.ศ. 2527 ถึงตุลาคม พ.ศ.2552 โดยสืบค้นในวารสารที่ตีพิมพ์เป็นภาษาอังกฤษ และจำกัดจำนวนผู้เข้าร่วมวิจัยอย่างน้อย 50 คนถ้าเป็นการวิจัยแบบ randomized control trials และอย่างน้อย 300 คน ถ้าเป็นงานวิจัยแบบ observational studies โดยรายงานดังกล่าวได้แสดงความสัมพันธ์ระหว่างปัจจัยและการเกิดโรคเป็นดังนี้
ยุทธศาสตร์ที่ 2 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านการแพทย์
ยุทธศาสตร์ที่ 2 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านการแพทย์
กลยุทธ์
1. ปรับแนวทางการดูแลรักษาแบบผู้ป่วยนอก (OPD)
2. ดูแลผู้ป่วยที่เสี่ยงอาการรุนแรง และมีอาการรุนแรงรวมทั้งภาวะ Long COVID
โดยมีรายละเอียดมาตรการแบ่งตามระยะดําเนินการ ดังนี้
6. สถานชีวาภิบาลในชุมชน
สถานชีวาภิบาลในชุมชน
- สถานชีวาภิบาลในชุมชน เป็นสถานที่ให้บริการดูแลผู้มีภาวะพึ่งพิง และการดูแลประคับประคอง/ ระยะท้าย (Long-Term Care and Palliative Care facility) นอกสถานพยาบาล ให้การดูแลในระดับ ชุมชน แบ่งเป็นประเภทต่างๆ ดังนี้
1) สถานชีวาภิบาล สำหรับองค์กรพระพุทธศาสนา (กุฏิชีวาภิบาล กุฏิชีวาบาล กุฏิสงฆ์อาพาธ-สถาน ชีวาภิบาล ฯลฯ)
2) สถานชีวาภิบาล ที่ดำเนินการโดยองค์กรศาสนาอื่นๆ ท้องถิ่น ภาคประชาสังคม องค์กรเอกชน ที่ไม่แสวงหากำไร
3) สถานชีวาภิบาล ในสังกัดกระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์
4) สถานชีวาภิบาลเอกชน ได้แก่ สถานประกอบการดูแลผู้สูงอายุ (nursing home เป็นต้น)
- เป็นเครือข่ายเชื่อมโยงบริการชีวาภิบาลกับหน่วยบริการของรัฐ
- มาตรฐานด้านสถานที่ ความปลอดภัย การบริการ และบุคลากร เป็นไปตามมาตรฐานโดยองค์กรที่มี หน้าที่ในการกำกับดูแล
คลินิกจิตเวช
จิตเวช เปิดให้บริการ วันพุธ ในเวลาทำการ 08.30 – 12.00 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120รายละเอียดแต่ละโปรแกรมเดือนสิงหาคม 2567
เดือนสิงหาคม: เดือนแห่งความรัก ความอบอุ่น รถไฟไทยชวน "คุณแม่พาลูกเที่ยว" กับ 2 ทริป สุดพิเศษ คุณแม่รับฟรี บัตรกำนัลเท่ากับราคาตั๋วโดยสาร พร้อมจับมือเที่ยว เกี่ยวหัวใจให้อบอุ่นทั้งครอบครัว
โปรแกรมเที่ยว KIHA 183 เดือนสิงหาคม 2567 ในคอนเซ็ปต์ พิรุณโปรยปราย เที่ยวสบาย ๆ กลางสายฝน มีทั้งหมด 8 ทริป 5 สัปดาห์
ศูนย์บริการสาธารณสุข 36 บุคคโล ฉีดวัคซีนพิษสุนัขบ้า (เฉพาะสุนัขและแมว) 2-5 และ 9-10 กันยายน 2567
ศูนย์บริการสาธารณสุข 36 บุคคโล จัดกิจกรรมฉีดวัคซีนพิษสุนัขบ้า (เฉพาะสุนัขและแมว) เวลา 09.00 - 11.30 น. บริการฟรี ไม่มีค่าใช้จ่าย ระหว่างวันที่ 2-5 และ 9-10 กันยายน 2567 ตามสถานที่ให้บริการตามภาพ
3-4 และ 24- 25 สิงหาคม 2567 แบบพักค้างคืน โปรแกรม พิรุณโปรย ชมทุ่งกระเจียวงาม ณ ผาสุดแผ่นดิน ถิ่นชัยภูมิ
วันที่ 3-4 และ 24-25 สิงหาคม 2567 แบบพักค้างคืน โปรแกรม “พิรุณโปรย ชมทุ่งกระเจียวงาม ณ ผาสุดแผ่นดิน ถิ่นชัยภูมิ จังหวัดชัยภูมิ” พาชมอุทยานแห่งชาติป่าหินงาม มีทั้งทุ่งดอกกระเจียว ลานหินงาม ผาสุดแผ่นดิน จุดชมวิวผาหัวนาค แวะเช็กอินที่ มอหินขาว สโตนเฮนจ์เมืองไทย และนมัสการพระธาตุชัยภูมิ ราคาท่านละ 3,999 บาท
10 และ 11 สิงหาคม 67 โปรแกรม ล่องแพแควน้อย พิรุณโปรยที่เมืองกาญจน์
วันที่ 10 และ 11 สิงหาคม 67 แบบไปเช้ากลับเย็น โปรแกรม “ล่องแพแควน้อย พิรุณโปรยที่เมืองกาญจน์ จังหวัดกาญจนบุรี” ชวนชมวิวทิวทัศน์บนสะพานข้ามแม่น้ำแคว นั่งรถไฟผ่านโค้งประวัติศาสตร์ เยี่ยมชมถ้ำกระแซ กราบขอพรพระโพธิสัตว์กวนอิมพันมือที่วัดเมตตาธรรมโพธิญาณ เยี่ยมชมวัดถ้ำพุหว้า และล่องแพชมธรรมชาติสองฝั่งแม่น้ำแควน้อย - แควใหญ่ ราคาท่านละ 1,499 บาท
12 สิงหาคม 67 แบบวันเดียวกลับ ชวนนั่งรถจักรไอน้ำประวัติศาสตร์
ทริปที่ 1 แม่พาลูกเที่ยว ชวนนั่งรถจักรไอน้ำประวัติศาสตร์ วันที่ 12 สิงหาคม 2567 (ONE DAY TRIP) กรุงเทพ - ฉะเชิงเทรา แวะเที่ยวตัวเมืองฉะเชิงเทรา ด้วยรถสองแถว หรือตุ๊กๆ หน้าสถานีชุมทางฉะเชิงเทราได้ตามอัธยาศัย หมายเหตุ : ไม่มีปริการนำเที่ยว
อัตราค่าโดยสาร รถธรรมดา ชั้น 3 ราคา 329 บาท รถปรับอากาศ ชั้น 2 ราคา 799 บาท
17 สิงหาคม 2567 แบบวันเดียวกลับ Royal Blossom กรุงเทพ-กาญจนบุรี
ทริปที่ 2 วันที่ 17 สิงหาคม 67 แม่ชวนลูกเที่ยว Royal Blossom รถไฟสายแห่งความสุข แบบวันเดียวกลับ กรุงเทพ-กาญจนบุรี [ราคา 1,799 บาท]
คลิกดูโปรแกรมตลอดวันได้เลย
- ชม สะพานข้ามแม่น้ำแคว สะพานประวัติศาสตร์ที่ สร้างขึ้นในระหว่างสงครามโลกครั้งที่ 2 ชมวิวทิวทัศน์บนสะพานข้ามแม่น้ำแคว อนุสรณ์สถานสำคัญทางประวัติศาสตร์ที่โด่งดังไปทั่วโลก
- แวะชม จุดจอดรถไฟถ้ำกระแซ นั่งรถไฟผ่านโค้งประวัติศาสตร์สำคัญเป็นเส้นทางที่สวยที่สุดเส้นหนึ่ง ลัดเลาะไปตามหน้าผาและป่าโปร่ง ย้อนมิติกลับไปสู่อดีตสมัยสงครามโลกครั้งที่ 2
- เยี่ยมชม ถ้ำกระแซ อดีตที่พักของเซลยศึกเมื่อครั้งก่อสร้างเส้นทางรถไฟสายมรณะ และภายในถ้ำยังมี พระพุทธรูปศักดิ์สิทธิ์ประดิษฐานอยู่ภายในถ้ำ
- ไหว้พระที่ วัดเมตตาธรรมโพธิญาณ วัดมหายานจีนนิกาย สร้างด้วยไม้ทั้งหลัง แกะสลักลงสีแบบสถาปัตยกรรมจีนสวยงาม กราบขอพรพระโพธิสัตว์กวนอิมพันมือองค์ใหญ่
- แวะชมวัดถ้ำพุหว้า นำชมมหัศจรรย์ถ้ำกลางป่า หน้าถ้ำจะมีปราสาทหินทราย เป็นรูปแบบของศิลปะขอมโบราณประยุกต์ขนาดใหญ่สีน้ำตาลแดง มีลวดลายประณีตที่สวยงามมาก
17-18 สิงหาคม 2567 โปรแกรม มูเตลู เปิดโชครับทรัพย์ สายฝนโปรยปราย จังหวัดฉะเชิงเทรา
วันที่ 17 และ 18 สิงหาคม 67 แบบไปเช้ากลับเย็น โปรแกรม “มูเตลู เปิดโชครับทรัพย์ สายฝนโปรยปราย จังหวัดฉะเชิงเทรา” พาสักการะหลวงพ่อโสธร ที่วัดโสธรวรารามวรวิหาร เสริมบารมีวาสนา ที่วิหารแปดเซียนแปดริ้ว แวะซื้อของฝากจากตลาดบ้านใหม่ กราบขอพรพระพิฆเนศองค์ยืน ล่องเรือสัมผัสความงดงามสองฟากฝั่งแม่น้ำบางปะกง พร้อมชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
31 สิงหาคม และ 1 กันยายน 2567 ไปเช้ากลับเย็น เส้นทางปันสุข สายลมพลังบวก จังหวัดสระบุรี
วันที่ 31 สิงหาคม และวันที่ 1 กันยายน 67 แบบไปเช้ากลับเย็น โปรแกรม “เส้นทางปันสุข สายลมพลังบวก จังหวัดสระบุรี” พาชม “ผาเสด็จพัก” ที่มีความสำคัญทางประวัติศาสตร์ของการก่อสร้างทางรถไฟสายแรก กรุงเทพ - นครราชสีมา และสักการะพระอนุสาวรีย์พระบาทสมเด็จพระเจ้าจุลจอมเกล้าเจ้าอยู่หัว รัชกาลที่ 5 พาเที่ยว ตลาดหัวปลี ตลาดสร้างสุขชุมชนร่วมสร้าง เยี่ยมเยือนหอนมสิการ สร้างที่ท่องเที่ยวเชิงวัฒนธรรม ชวนร่วมเติมฝัน ปันสุขให้กับน้องที่โรงเรียนธรรมิกวิทยา ราคาท่านละ 1,499 บาท
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตปทุมวัน
มีโอกาสผ่านไปราชบุรี แวะชิมเครื่องดื่มกัญ ที่
Framsook Lek Lek CAFE
ซอย แม้นรำลึก 1 ตำบล หน้าเมือง อำเภอเมืองราชบุรี ราชบุรี 70000
โทร 0866673429
แผนที่
Facebook
ไลน์ framsook
สุรินทร์ - มาจาก.จ.สีแดง กักกันตัว 14 วัน LINK
8 เมย 64
ประกาศ จ. สุรินทร์
1. ผู้ที่เดินทางมาจากจังหวัดพื้นที่ควบคุมสูงสุด (พื้นที่สีแดง) ทุกคนต้องกักกันตัว 14 วัน
2. การกักกันตัว 14 วัน ให้กักกันตัวในที่พักอาศัย หรือสถานที่ที่ทางอำเภอ หรือคณะกรรมการโรคติดต่อจังหวัดกำหนด โดยห้ามออกจากพื้นที่กักกันตัว และหากมีอาการป่วยต้องแจ้งกับ อาสาสมัครสาธารณสุขประจำหมู่บ้าน (อสม.) หรือผู้ใหญ่บ้าน/กำนัน ทันที
3. สำหรับผู้ที่เดินทางมาจากจังหวัดพื้นที่ควบคุม (พื้นที่สีส้ม) ทุกคนต้องรายงานตัว ภายใน 24 ชั่วโมง
4. สำหรับผู้ที่เดินทางมาจากจังหวัดอื่น ให้ทุกคนเฝ้าระวังตัวเองโดยเคร่งครัด
=====
จูน วิถีคนแฟนไกล
สาวอักษรศาสตร์ ละแวกสามย่าน ชีวิตและงานมีแต่หนังสือ หนังสือและหนังสือ ประสบการณ์ทำงานกับสำนักพิมพ์ ทั้งไทยและต่างประเทศ 20 กว่าปี ยาวนานเพียงพอสำหรับการเดินทางไปบนเส้นทางใหม่ยุคหลังโควิด ยุคที่โลกอาจไม่เหมือนเดิม
=====
20 เมย 64
วันนี้(20 เมษายน 2564) ทาง
ภูเก็ตต้องชนะ.com จะเปิดให้ลงทะเบียนขอรับวัคซีนแก่บุคคลสัญชาติไทยประเภทมีทะเบียนบ้านอยู่ในจังหวัดภูเก็ตและประเภทองค์กรซึ่งจดทะเบียนในจังหวัดภูเก็ต เวลา 11.00 น.
หลังจากการลงทะเบียนให้รอการนัดหมายรับวัคซีนอีกครั้ง เนื่องจากรอยืนยันกำหนดการส่งมอบวัคซีนจากกระทรวงสาธารณสุข
หากระบบขึ้นว่าเลขบัตรประชาชนซ้ำแสดงว่าท่านได้เคยลงทะเบียนไว้แล้ว ให้รอนัดหมายอีกครั้ง
คนสตูลไม่ทิ้งกัน LINK
คนสตูลไม่ทิ้งกัน ยินดีต้อนรับคนสตูล ที่ป่วยด้วยโรค โควิด-19 กลับมารักษาตัวที่สตูล ติดต่อศูนย์ประสานงาน "คนสตูลไม่ทิ้งกัน" 074-723375 ศูนย์บริการส่งต่อโรงพยาบาลสตูล
ข้อมูล ณ วันที่ 12 ส.ค.64
มีผู้ป่วยกลับบ้านรวม 88 ราย โดยแยกประเภทผู้ป่วยตามอาการ ดังนี้
สีเขียว (เล็กน้อย) 50 ราย
สีเหลือง (ไม่รุนแรง เหนื่อยหอบ) 38 ราย
สีแดง (รุนแรง ปอดอักเสบ) ไม่มี
แพลตฟอร์มคอร์สเรียนออนไลน์โดย Google (Google Digital Garage) LINK
Google Digital Garage ถูกพัฒนาขึ้นโดย Google ออกแบบมาเพื่อคนที่ต้องการพัฒนาทักษะที่กำลังเป็นที่ต้องการในยุคปัจจุบัน ทั้งหมดเรียนเป็นภาษาอังกฤษ มีคอร์สเรียนในสามหมวดหลักได้แก่ Data and Tech (ข้อมูลและเทคโนโลยี), Digital Marketing (การตลาดออนไลน์) และ Career Development (การพัฒนาอาชีพ) มีทั้งบทเรียนที่ใช้เวลาเรียนน้อยกว่า 2 ชั่วโมง ไปจนถึงบทเรียนที่ต้องใช้เวลาเรียนมากว่า 20 ชั่วโมง เลือกระดับความยากง่ายของคอร์สเรียนได้ จะเรียนแบบมีใบประกาศนียบัตรหรือแบบที่ไม่มีก็ได้ การเข้าเรียน ผู้เรียนจะต้องล็อกอินเข้าเรียนด้วย Gmail โดยหลังจากล็อกอินเข้าไปแล้ว ระบบจะให้กรอกชื่อ สกุล (นำไปใช้ในใบประกาศนียบัตร) และรายละเอียดอีกเล็กน้อย จากนั้นก็เริ่มเรียนได้เลย
นายแพทย์เบอนาร์ด พีคูล สำเร็จการศึกษาแพทยศาสตร์บัณฑิตจากมหาวิทยาลัยเคลมองท์ เฟอร่องด์ (Clermont-Ferrand University) สาธารณรัฐฝรั่งเศส และสาธารณสุขศาสตร์มหาบัณฑิตจากมหาวิทยาลัยทูเลน สหรัฐอเมริกา
ก่อนที่ นายแพทย์พีคูล จะเข้ามามีบทบาทในการจัดตั้งองค์กรจัดหายาสำหรับโรคที่ถูกละเลย (Drugs for Neglected Diseases initiative, DNDi) นั้น นายแพทย์พีคูล เป็นผู้อำนวยการบริหารในองค์กรแพทย์ไร้พรมแดน (Médecins Sans Frontières) ซึ่งเป็นองค์กรสาธารณประโยชน์ที่ก่อตั้งเพื่อให้ความช่วยเหลือในการเข้าถึงยาจำเป็นของกลุ่มประเทศในแอฟริกา ลาตินอเมริกา และเอเซีย
ในขณะที่ทำงานในประเทศยูกันดา นายแพทย์พีคูล พบมีการใช้ยา เมลาโซพรอล (Melarsoprol) ซึ่งเป็นอนุพันธ์ของสารหนู ในการรักษาผู้ป่วยที่เป็น โรคแอฟริกัน ทริปาโนโซมิเอซิส (African trypanosomiasis) หรือ โรคเหงาหลับ (Sleeping sickness) และพบผู้ป่วย 1 ราย ใน 20 รายที่ได้รับอนุพันธ์นี้เสียชีวิต จากเหตุการณ์ที่มีการขาดยารักษาที่มีประสิทธิภาพและมีผลข้างเคียงที่รุนแรงนี้ ทำให้ นายแพทย์พีคูล ตัดสินใจจัดทำ โครงการจัดหายาสำหรับโรคที่ถูกละเลย (Drugs for Neglected Diseases initiative – DNDi) ขึ้นในปี พ.ศ.2546 โดยมีเป้าหมายเพื่อพัฒนาการรักษาที่ปลอดภัย มีประสิทธิภาพ ราคาไม่แพง สำหรับผู้ป่วยที่เป็นโรคที่ถูกละเลย
ภายใต้การบริหารของ นายแพทย์พีคูล โครงการจัดหายาสำหรับโรคที่ถูกละเลย ได้ขยายเป็นองค์กรวิจัยและพัฒนาที่ไม่แสวงหาผลกำไร สร้างความร่วมมือกับองค์กรพันธมิตรทั้งภาครัฐและเอกชนหลากหลายองค์กร อาทิ มูลนิธิบิลเกตส์, เวลคัม ทรัส, หน่วยงานในยุโรปและบริษัทยาหลายแห่ง จนถึงปัจจุบันก่อให้เกิดวิธีการรักษาที่มีประสิทธิภาพในการรักษาโรคที่ถูกละเลย รวม 8 ชนิด รักษาโรคมาลาเรีย โรคเหงาหลับ โรค Visceral leishmaniasis และโรค Chagas disease
ยาเหล่านี้ถูกบรรจุให้เป็นแนวทางในการรักษาโรค ที่องค์การอนามัยโลกแนะนำให้เป็นยารักษาตัวแรกสำหรับโรคที่ถูกละเลย (Neglected tropical diseases) ในหลายประเทศ ขณะนี้มีการพัฒนาสารใหม่มากกว่า 20 ชนิด และมีการศึกษาทดลองทางคลินิกมากกว่า 20 การศึกษา
ในฐานะผู้อำนวยการ นายแพทย์พีคูล ได้ประสานงานวิจัยและร่วมมือพัฒนา ริเริ่มและบริหารจัดโครงการวิจัย ซึ่งประกอบ ด้วยทีมงานและนักวิทยาศาสตร์ที่ดำเนินโครงการในส่วนต่างๆ ของโลก โดยเฉพาะอย่างยิ่งในแอฟริกาและลาตินอเมริกา โดยมีจุดมุ่งหมายเพื่อส่งมอบการรักษาใหม่ที่มีประสิทธิภาพจำนวน 16 ชนิดจาก 18 ชนิด สำหรับโรคที่ถูกละเลยให้แก่ผู้ป่วย ภายในปี พ.ศ.2566 จนถึงปัจจุบัน DNDi ได้ส่งมอบยาใหม่ถึง 8 ชนิด ซึ่งช่วยรักษาชีวิตของผู้ป่วยเป็นจำนวนมาก
ผลงานของนายแพทย์เบอนาร์ด พีคูล ได้มีส่วนสำคัญในการลดอัตราการเสียชีวิตและยกระดับคุณภาพชีวิตให้กับประชากรนับล้านคนทั่วโลก โดยเฉพาะอย่างยิ่งประชากรในประเทศกลุ่มกำลังพัฒนาหรือประเทศที่มีรายได้น้อย ที่เจ็บป่วยด้วยโรคที่ถูกละเลย
กรมการแพทย์ โชว์ นวัตกรรมทางการแพทย์ ในงาน APEC Health Week
กรมการแพทย์ กระทรวงสาธารณสุข จัดเต็ม! ขนทัพ “นวัตกรรมทางการแพทย์” แสดงภายในงานประชุม APEC Health Week ทั้งเครื่องตรวจโควิดจากลมหายใจ ไม่ต้องแยงจมูก เจาะเลือด หรือใช้น้ำลาย รู้ผลใน 5 นาที แม่นยำสูง เครื่องตรวจชนิดเบาหวานจากลมหายใจ ระบบบันทึกทางการแพทย์ด้วยเสียงภาษาไทย เวชสำอางจากกัญชา ชูตอบโจทย์การดูแลรักษา แก้ไขปัญหาบริการ ต่อยอดเชิงพาณิชย์ได้
นพ.สมศักดิ์ อรรฆศิลป์ อธิบดีกรมการแพทย์ กล่าวว่า กรมการแพทย์เตรียมการนำเสนอนิทรรศการนวัตกรรมทางการแพทย์ที่ได้มาตรฐาน ล้ำสมัย และเกิดประโยชน์ตามความต้องการของประชาชน โดยเฉพาะเรื่องการฟื้นฟูสุขภาพและเศรษฐกิจภายหลังการระบาดของโรคโควิด 19 ซึ่งมีตัวอย่างได้แก่
- นวัตกรรมตรวจคัดกรองโควิด 19 จากลมหายใจ (Volatile Exhale Breath Analysis: VEBA)
- เครื่องตรวจระดับน้ำตาลในเลือดจากอะซิโตนในลมหายใจ (G-Breath) ใช้ตรวจและบอกชนิดของเบาหวาน จากก๊าซ 4 ชนิดที่ออกมาพร้อมกับลมหายใจ
- การพิมพ์สามมิติเพื่อช่วยการรักษาทางการแพทย์ ช่วยทำให้การกำหนดตำแหน่งเพื่อผ่าตัดหรือฉายแสงมะเร็งมีความแม่นยำขึ้น
- Precision cutting guide ในโรคมะเร็งช่องปาก
- กะโหลกเทียม (Cranioplasty) และ การทำเฝือกเฉพาะบุคคล
- การใช้ระบบปัญญาประดิษฐ์เพื่อวินิจฉัยการตีบของหลอดเลือดหัวใจจากภาพถ่ายสแกนภาวะเลือดเลี้ยงกล้ามเนื้อหัวใจ
- ระบบอำนวยความสะดวกในการจดบันทึกทางการแพทย์ เทคโนโลยีการรู้จำเสียงพูดแล้วแปลงเสียงให้เป็นข้อความอักษรอัตโนมัติ
- นวัตกรรมเวชสำอางกัญชาจากสถาบันโรคผิวหนัง
นวัตกรรมเหล่านี้เป็นนวัตกรรมเด่นของกรมการแพทย์ ที่มีการออกแบบแนวทางการแก้ไขปัญหาการทำงาน การบริการ และการดูแลรักษาผู้ป่วยรูปแบบใหม่ที่มีประสิทธิภาพและดีขึ้นกว่าเดิม ที่สำคัญคือลดการนำเข้าและสามารถต่อยอดในเชิงพาณิชย์ต่อไปได้ จึงเป็นนวัตกรรมที่นำมาจัดแสดงภายในงานประชุม APEC Health Week ให้เห็นถึงศักยภาพของประเทศไทยและเพื่อให้เกิดการแลกเปลี่ยนเรียนรู้กับสมาชิกเขตเศรษฐกิจเอเปค
7. ผู้ดูแล (caregiver/ care community)
ผู้ดูแล (caregiver/ care community)
- ผู้ดูแลในระบบชีวาภิบาล หมายถึง ผู้ที่ให้การดูแลผู้มีภาวะพึ่งพิง หรือผู้ป่วยระยะท้าย ในสถานชีวาภิบาล ในชุมชน หรือ บ้าน
- ผู้ดูแลต้องได้รับการอบรมให้มีศักยภาพตามมาตรฐานและหลักเกณฑ์ของกรมอนามัย หรือ กรมสนับสนุนบริการสุขภาพ หรือ กระทรวงพัฒนาสังคมและความมั่นคงของมนุษย์
รูปแบบบริการ
1. บริการผู้ป่วยใน (Inpatient service)
- In-patient palliative care services: ระบบรับปรึกษา Palliative Care หอผู้ป่วย Palliative Care ในโรงพยาบาล
- In-patient elderly care services
2. บริการผู้ป่วยนอก (Outpatient service) และบริการการแพทย์ทางไกล (Telemedicine)
- คลินิก Palliative Care
- คลินิกผู้สูงอายุ
- คลินิกหมอครอบครัว
3. บริการดูแลที่บ้าน หรือที่สถานชีวาภิบาลในชุมชน
- LTC Home care (บริการที่บ้าน หรือ สถานชีวาภิบาลในชุมชน)
- PC Home care และ PC Home ward (บริการที่บ้าน หรือ สถานชีวาภิบาลในชุมชน)
โปรแกรมท่องเที่ยว Royal Blossom กรุงเทพ–กาญจนบุรี แบบ One Day Trip สิงหาคม 2567
โปรแกรมท่องเที่ยว ROYAL BLOSSOM เส้นทางรถไฟสายแห่งความสุข กรุงเทพ – กาญจนบุรี แบบ One Day Trip ในวันเสาร์ที่ 24 และ 31 สิงหาคม 2567 จะพาทุกท่านไปสัมผัสกับสถานที่ท่องเที่ยวอันทรงคุณค่าทางประวัติศาสตร์มากมาย อาทิ การชมวิวทิวทัศน์บน “สะพานข้ามแม่น้ำแคว” ซึ่งเป็นอนุสรณ์สถานสำคัญทางประวัติศาสตร์ที่โด่งดังไปทั่วโลก แวะชม “สะพานถ้ำกระแซ” สะพานไม้ ที่สร้างเลียบไปตามหน้าผาริมแม่น้ำแควน้อย ผ่านโค้งน้ำที่สวยงามที่สุดแห่งหนึ่งของเส้นทางรถไฟ พร้อมขอพรพระพุทธรูปศักดิ์สิทธิ์ที่ประดิษฐานอยู่ภายใน “ถ้ำกระแซ” อดีตที่พักของเชลยศึกขณะที่ก่อสร้างเส้นทางรถไฟสายมรณะแห่งนี้ ดื่มด่ำสัมผัสกับบรรยากาศธรรมชาติสองฝั่งแม่น้ำแควน้อย – แควใหญ่ที่ร้านอาหาร “แพธาราบุรี” ตลอดจนไหว้พระขอพรที่ “วัดเมตตาธรรมโพธิญาณ” ชมความงดงามของสถาปัตยกรรมจีน และถ้ำสวยกลางป่า “วัดถ้ำพุหว้า” ที่มีหินงอกหินย้อยภายในถ้ำ พร้อมกับชมสถาปัตยกรรมขอมโบราณอันสวยงามของวัดอีกด้วย ----
เช็คโปรแกรมรถไฟหรู Royal Blossom ตลอดปีนี้ บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางรัก
Useful link
“ถือเป็นโครงการแรกของประเทศไทยที่ดูแลผู้สูงวัยแบบครบจร เพราะอยู่ใกล้สถานพยาบาล โดยบริษัท ธนารักษ์พัฒนาสินทรัพย์ จำกัด (ธพส.) จะเริ่มก่อสร้างกลางปี 64 และเสร็จสิ้นปลายปี 2565 วงเงินก่อสร้าง 1,400 ล้านบาท ซึ่งจะสามารถเปิดให้ผู้สูงอายุที่เข้าร่วมโครงการเข้าพักได้ทันที โดยห้องพักที่ผู้สูงวัยอาศัยจะมีขนาด 31-50 ตารางเมตร ส่วนถ้าหากโครงการระยะแรกมีผู้จองสิทธิเกินกว่าที่กรมวางไว้ กรมจะใช้วิธีจับสลากรายชื่อและตั้งรายชื่อสำรองไว้เพื่อจัดสรรสิทธิให้ตามลำดับ”
ซึ่งในเรื่องดอกเบี้ยของสินเชื่อที่ปล่อยกู้นั้น ขณะนี้กำลังหารือกับธนาคารอยู่ แต่คาดว่าจะต่ำกว่าโครงการบ้านพักข้าราชการ ที่คิดดอกเบี้ยเฉลี่ย 3.12% ต่อปี ส่วนถ้าหากโครงการระยะแรกคนจองเต็มแล้ว กรมจะพิจารณาเปิดโครงการก่อสร้างระยะที่สองต่อไป
--
ประชาชาติธุรกิจ --
ศรีสะเกษ - รายงานตัว LINK
12 เมษายน 2564
แจ้งผู้เดินทางเข้าพื้นที่จังหวัดศรีสะเกษ
- ผู้เดินทางมาจากพื้นที่เสี่ยงสูง 8 จังหวัด ประกอบด้วย กรุงเทพมหานคร ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม ชลบุรี เชียงใหม่และประจวบคีรีขันธ์ ให้รายงานตัวและปฏิบัติตามมาตรการนี้อย่างเคร่งครัด
-ผู้ที่เดินทางมาจากพื้นท่ีเสี่ยงสูง 8 จังหวัด ต้องได้รับการตรวจวัดอุณหภูมิร่างกาย และเฝ้าระวัง สังเกตอาการโดยเจ้าหน้าที่สาธารณสุข/อสม.ทุกวัน ตลอดระยะเวลาที่อยู่ในพื้นที่จังหวัดศรีสะเกษ ยกเว้นอยู่เกิน 14 วันต้องได้รับการตรวจวัดอุณหภูมิร่างกาย และเฝ้าระวัง สังเกตอาการโดยเจ้าหน้าที่สาธารณสุข/อสม.เป็นเวลา 14 วัน
- ส่วนผู้ที่เดินทางมาจากจังหวัดอื่นให้รายงานตัวและปฏิบัติตามมาตรการ DMHTT อย่างเคร่งครัด
(พื้นที่เสี่ยงสูงสามารถปรับได้ตามสถานการณ์การระบาด)
รพ. ศรีสะเกษ โทร 045-611-389
เพจ
รพ.ศรีสะเกษ โทร 045-616-040-6
เพจ
ศูนย์ข่าวโควิด 19 ศรีสะเกษ
ข้อมูล
ศูนย์ข่าวโควิด ศรีษะเกษ19 เมย 64 ประกาศเรื่องการรับวัคซีนเข็มที่สอง
หากท่านได้รับการฉีดวัคซีนเข็มที่ 1 แล้วแต่ยังไม่มีรายชื่อในระบบ
หมอพร้อม หรือ นัดรับวัคซีนเข็มที่ 2 บน
ภูเก็ตต้องชนะ.com
ให้ท่านส่งเลขที่บัตรประชาชน ชื่อ สกุล และใบนัดฉีดวัคซีนที่ท่านได้รับไป
- จุดฉีดสนามบิน และ โรงแรมอังสนา กรุณาส่งที่ LineID : @784hmzeq
- จุดฉีดโรงแรมภูเก็ตออคิด กรุณาส่งที่ Line ID : chay_m หรือ Email : its.chalonghospital@gmail.com
- จุดฉีดสะพานหินและจังซีลอน กรุณาส่งที่ LineID : @phuketwin
คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
วิทยาลัยวิทยาศาสตร์การแพทย์เจ้าฟ้าจุฬาภรณ์ ราชวิทยาลัยจุฬาภรณ์
ที่ตั้ง 906 ถนนกำแพงเพชร 6 แขวงทุ่งสองห้อง เขตหลักสี่ กรุงเทพฯ 10210
โทร.0-2576-6000 ต่อ 8753
อีเมล์ healthsciences@pccms.ac.th
กรมสนับสนุนบริการสุขภาพ นำเสนอการขับเคลื่อน Medical Hub
กรมสนับสนุนบริการสุขภาพ กระทรวงสาธารณสุข นำเสนอการขับเคลื่อน Medical Hub ของไทยผ่านการจัดบูธนิทรรศการในงานประชุม APEC Health Week ระหว่างวันที่ 22-26 สิงหาคม 2565 โรงแรมมิลเลนเนียม ฮิลตัน กรุงเทพฯ โชว์ศักยภาพด้านการแพทย์และสาธารณสุขไทย บริการสุขภาพชั้นเลิศ ผลิตภัณฑ์สุขภาพคุณภาพสูง ตอบโจทย์การสร้างสมดุลสุขภาพและเศรษฐกิจ ชูบทบาท อสม. กับการควบคุมป้องกันโควิด 19 ในชุมชน
โดยกรม สบส. ได้จัดนิทรรศการภายใต้แนวคิด “Thailand Global Healthcare Destination” นำเสนอถึงการขับเคลื่อนสู่การเป็นศูนย์กลางด้านสุขภาพ (Medical Hub) ของไทย ศักยภาพของอุตสาหกรรมการแพทย์เพื่อสร้างเศรษฐกิจไทยภายหลังการระบาดของโรคโควิด 19 ได้แก่ การให้บริการทางการแพทย์ที่มีศักยภาพสูง มีชื่อเสียงและดึงดูดชาวต่างชาติ (Magnets) และอุตสาหกรรมที่ส่งเสริมการท่องเที่ยวทางการแพทย์ ได้แก่ การดูแลรักษาสุขภาพบริการชั้นเลิศ (Wellness and Medical Retreat) นอกจากนี้ ยังมีการนำเสนอผลิตภัณฑ์คุณภาพสูงเพื่อการดูแลสุขภาพ (High Products Hub) จากองค์การเภสัชกรรม โรงพยาบาลเจ้าพระยาอภัยภูเบศร และบริษัทขาวลออ เป็นต้น ข้อเสนอแพ็กเกจตรวจสุขภาพพิเศษ จากโรงพยาบาลเอกชนชั้นนำของประเทศ บทบาทของอาสาสมัครสาธารณสุขไทย (อสม.) ในการรับมือสถานการณ์การแพร่ระบาดของโรคโควิด 19 ในช่วงที่ผ่านมา ซึ่งได้รับคำชื่นชมจาก WHO รวมถึงการเตรียมความพร้อมของประเทศไทยในการเป็นเจ้าภาพจัดงาน Specialised Expo 2028 Phuket โดยมีสำนักงานส่งเสริมการจัดประชุมและนิทรรศการ (Thailand Convention and Exhibition Bureau) หรือ TCEB ร่วมจัดนิทรรศการด้วย
ตลอดระยะเวลาการจัดประชุม กระทรวงสาธารณสุขร่วมกับหน่วยงานต่างๆ ในการส่งเสริมสนับสนุนการวางจําหน่ายผลิตภัณฑ์เพื่อสุขภาพ ผลิตภัณฑ์สมุนไพรไทย และผลิตภัณฑ์โอทอป 4 - 5 ดาว (OTOP) ณ ลานพลาซ่า King Power รางน้ำ และเปิดช่องทางการวางจำหน่ายสินค้าและผลิตภัณฑ์สุขภาพออนไลน์ ผ่านทางเว็บไซต์ https://www.thailandmedicalhub.net/ ซึ่งผู้เข้าร่วมประชุมเอเปคสามารถซื้อสินค้าและผลิตภัณฑ์สุขภาพในพื้นที่จัดแสดงนิทรรศการและขอคืนภาษีได้โดยได้รับความร่วมมือในการเตรียมระบบ Vat Refund/Tax Refund และการเปิดใช้ช่องทางพิเศษ (Fast Track Lane) จากการท่าอากาศยานสุวรรณภูมิ กรมสรรพากร กรมศุลกากร สำนักงานตรวจคนเข้าเมือง และหน่วยงานอื่นๆ ที่เกี่ยวข้อง เพื่ออำนวยความสะดวกให้แก่ผู้เข้าประชุมการประชุมระดับสูงว่าด้วยสาธารณสุขและเศรษฐกิจครั้งนี้ด้วย
สรุป
การดูแลสุขภาพองค์รวมด้วยเวลเนสทางการแพทย์ เป็นการเสริมสร้างปัจจัยที่มีผลต่อการเปลี่ยนแปลงพฤติกรรมสุขภาพสู่การมีสุขภาพองค์รวมที่ดีอย่างยั่งยืน เริ่มต้นจากความตระหนักรู้ในตนเองของบุคคล ที่ให้ความสำคัญต่อการมีสุขภาพดีของตนเองและครอบครัวหรือคนใกล้ชิด ด้วยวิธีการ ประสบการณ์ ความรู้เดิมและความรู้ใหม่ที่ถูกต้องตามหลักวิชาการ ประพฤติปฏิบัติต่อเนื่องเป็นกระบวนการดูแลสุขภาพที่ครบครันทั้งในด้านการส่งเสริม ป้องกัน รักษา และการฟื้นฟูสุขภาพ ตลอดจนแสวงหาคำแนะนำปรึกษา รับบริการตรวจวินิจฉัยหรือเข้าสู่กระบวนการทางการแพทย์ที่แม่นยำ ด้วยวิทยาการและเทคโนโลยีทางการแพทย์จากผู้ประกอบวิชาชีพทางการแพทย์
เพื่อเติมเต็มความต้องการมีอายุขัยที่ยืนยาวอย่างมีสุขภาวะ และความสามารถในการดำรงชีวิตอย่างมีความเป็นอยู่ที่ดีในสภาพแวดล้อมของตน บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตสาทร
พังงา - กักตัว 14 วัน มาจาก 18 จังหวัด LINK
ให้ผู้ที่เดินทางเข้ามาพำนักในจังหวัดพังงา จำนวน 18 จังหวัด คือ กรุงเทพ ชลบุรี เชียงใหม่ นราธิวาส สมุทรปราการ สมุทรสาคร ประจวบคีรีขันธ์ สระแก้ว นนทบุรี ปทุมธานี นครปฐม ภูเก็ต สุพรรณบุรี สระบุรี ระยอง อุดรธานี ขอนแก่น สงขลา ปฎิบัติดังนี้
1.รายงานตัว ที่ รพ.สต.หรือเทศบาล
2.ทำแบบประเมินความเสี่ยงและลงนามในเอกสาร หากมีความเสี่ยงดังนี้
- มีประวัติไปในผับ บาร์ คาราโอเกะหรือสถานบันเทิงที่มีผู้ติดเชื้อ
- มีประวัติสัมผัสกับผู้ติดเชื้อโควิด
หากมีความเสี่ยง ข้อใดข้อหนึ่ง จะ ต้องกักตัว 14 วัน หรือตามเวลาที่อยู่ในพังงา หากไม่มีความเสี่ยง ไม่ต้องกักตัว แต่ต้องปฏิบัติตัว แบบ DMHTT
สำหรับจังหวัดอื่นๆ ไม่ต้องรายงานตัว แต่ให้ ดูแลตัวเอง แบบ DMHTTA
ศุนย์สื่อสารความเสี่ยง สสจ.พังงา 098-131-3422
รพ. พังงา โทร 076-411-616
18 เมย 64 ประกาศเรื่องการรับวัคซีนเข็มที่สอง
ท่านสามารถตรวจสอบนัดรับวัคซีนเข็มที่สองได้แล้วทาง www.ภูเก็ตต้องชนะ.com เฉพาะการรับวัคซีนที่สะพานหิน, ห้างจังซีลอนและโรงแรมภูเก็ตออคิดรีสอร์ท
สำหรับการนัดรับวัคซีนเข็มที่สองที่สนามบินและโรงแรมอังสนากรุณารออีก 1-2 วันครับ
กรุณาไปตามนัดในระบบ ท่านไม่สามารถเปลี่ยนแปลงสถานที่นัดรับวัคซีนต่างจากเข็มแรกได้
คนตากไม่ทิ้งกัน อบจ.ตาก LINK
อบจ.ตาก และคณะกรรมการโรคติดต่อจ.ตาก ตั้งศูนย์ "คนตากไม่ทิ้งกัน จ.ตาก" รับ
- กรณี ติดเชื้อโควิด ต้องการรักษาที่จ.ตาก
- กรณีต้องการกลับบ้าน โดยไม่เสี่ยงแพร่เชื้อ
โดยจะต้องเป็นผู้ที่มีภูมิลำเนาในจ.ตากเท่านั้น
สอบถามโทร 061-0240676 (วันเวลาราชการ)
061-0240677 (นอกเวลาราชการ)
สายด่วนโทร 1567
โรงพยาบาลธนบุรี บำรุงเมือง เปิดลงทะเบียนฉีดวัคซีนไฟเซอร์ เข็มที่ 1 สำหรับเด็ก อายุ 5-11 ปี LINK
โรงพยาบาลธนบุรี บำรุงเมือง เปิดลงทะเบียนฉีดวัคซีนไฟเซอร์ เข็มที่ 1
สำหรับเด็ก อายุ 5-11 ปี
สถานที่ให้บริการ : ศูนย์กุมารเวชกรรม ชั้น B1 โรงพยาบาลธนบุรี บำรุงเมือง
สแกน QR CODE เพื่อลงทะเบียน
เอกสารที่ต้องนำมาแสดงในวันฉีดวัคซีน
1. สำเนาสูติบัตร หรือ สำเนาทะเบียนบ้าน
2. บัตรประชาชนของผู้ปกครอง
เข้ารับบริการได้ตั้งแต่ 7 -10 กุมภาพันธ์ 2565 ทุกวันจันทร์ - พฤหัสบดี เวลา 9.00-12.00 น.
หมายเหตุ
1. หากท่านนัดหมายวันเข้ารับบริการแล้วไม่สามารถยกเลิกและเลื่อนนัดได้ทุกกรณี
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตยานนาวา
/// NEWS ////////
กรมธนารักษ์เดินหน้าพัฒนาโครงการ “ที่พักอาศัยผู้สูงอายุ รามา-ธนารักษ์ บ้านสวัสดิการกรมธนารักษ์ และบ้านพักข้าราชการ”
กรมธนารักษ์จัดพิธีลงนามบันทึกข้อตกลง (MOU : Memorandum of Understanding) โครงการบูรณาการสวัสดิการที่พักอาศัยผู้สูงอายุ รามา - ธนารักษ์ และบ้านพักข้าราชการ ประจำปีงบประมาณ พ.ศ. 2563
กรมธนารักษ์จัดพิธีลงนามบันทึกข้อตกลง (MOU : Memorandum of Understanding) การบริหารจัดการที่ราชพัสดุ โครงการ “ที่พักอาศัยผู้สูงอายุ รามา-ธนารักษ์” โครงการ “บ้านสวัสดิการกรมธนารักษ์บนที่ราชพัสดุแปลงหมายเลขทะเบียนที่ นม.2612 (บางส่วน) ตำบลหนองสาหร่าย อำเภอปากช่อง จังหวัดนครราชสีมา” โครงการ “บูรณาการสวัสดิการที่พักอาศัยกับสถานที่ทำงานและศูนย์บริการของข้าราชการพลเรือนสามัญ” เพื่อรองรับการเข้าสู่สังคมผู้สูงอายุ (Ageing Society) ของประเทศ และเพื่อตอบสนองนโยบายของรัฐบาลในการพัฒนาเศรษฐกิจฐานรากจากโครงการพัฒนาอสังหาริมทรัพย์บนที่ราชพัสดุที่มีศักยภาพ รวมทั้งยกระดับคุณภาพชีวิตของประชาชน เจ้าหน้าที่ และบุคลากรของรัฐ
วันนี้ (14 สิงหาคม 2563) ณ กรมธนารักษ์ นายยุทธนา หยิมการุณ อธิบดีกรมธนารักษ์ ลงนามบันทึกข้อตกลง (MOU : Memorandum of Understanding) โครงการบูรณาการสวัสดิการที่พักอาศัยผู้สูงอายุ รามา - ธนารักษ์ และบ้านพักข้าราชการ ประจำปีงบประมาณ พ.ศ. 2563 โดยเป็นความร่วมมือระหว่าง กรมธนารักษ์ คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี สำนักงานคณะกรรมการข้าราชการพลเรือน ธนาคารอาคารสงเคราะห์ ธนาคารออมสิน ธนาคารกรุงไทย จำกัด (มหาชน) และบริษัท ธนารักษ์พัฒนาสินทรัพย์ จำกัด โดยมีนายสันติ พร้อมพัฒน์ รัฐมนตรีช่วยว่าการกระทรวงการคลัง ให้เกียรติเป็นประธานพิธีลงนาม ซึ่งมีรายละเอียดของโครงการ ดังนี้
1. โครงการ “ที่พักอาศัยผู้สูงอายุ รามา-ธนารักษ์” บนที่ราชพัสดุ จังหวัดสมุทรปราการ
กรมธนารักษ์ได้ร่วมมือกับคณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล ดำเนินโครงการฯ บนที่ราชพัสดุแปลงหมายเลขทะเบียนที่ สป.623 ตำบลบางปลา อำเภอบางพลี จังหวัดสมุทรปราการ เนื้อที่ประมาณ 20-0-00 ไร่ และยังได้มีการขยายโครงการดังกล่าวในระยะที่ 2 อีก 50 ไร่ ทั้งนี้ เพื่อให้ผู้สูงอายุมีระบบการดูแลสุขภาพและสวัสดิการอื่นๆ แบบครบวงจร รวมทั้งให้ผู้สูงอายุมีคุณภาพชีวิตที่ดีขึ้น โดยโครงการดังกล่าวถือว่าเป็นโครงการนำร่องของกรมธนารักษ์และจะนำไปประยุกต์ใช้เป็นแนวทางในจังหวัดอื่นต่อไป
2. โครงการ “บ้านสวัสดิการกรมธนารักษ์บนที่ราชพัสดุ” จังหวัดนครราชสีมา
กรมธนารักษ์ได้ร่วมมือกับส่วนราชการต่างๆ ดำเนินโครงการฯ บนที่ราชพัสดุแปลงหมายเลขทะเบียนที่ นม.2612 (บางส่วน) ตำบลหนองสาหร่าย อำเภอปากช่อง จังหวัดนครราชสีมา เนื้อที่ประมาณ 31-1-89 ไร่ ทั้งนี้ เพื่อเป็นการจัดสวัสดิการด้านที่พักอาศัยให้แก่ข้าราชการและลูกจ้างของหน่วยงานภาครัฐ รวมทั้งเป็นการพัฒนาคุณภาพชีวิตและเสริมสร้างขวัญและกำลังใจของข้าราชการและลูกจ้างตามความจำเป็นขั้นพื้นฐาน ซึ่งจะเปิดจองพร้อมกันในวันที่ 14 สิงหาคม 2563 เป็นต้นไป
3. โครงการ “บูรณาการสวัสดิการที่พักอาศัยกับสถานที่ทำงานและศูนย์บริการของข้าราชการพลเรือนสามัญ”
กรมธนารักษ์ได้ร่วมมือกับสำนักงานคณะกรรมการข้าราชการพลเรือน (สำนักงาน ก.พ.) เพื่อพัฒนาแนวคิดในการจัดสวัสดิการและเสริมสร้างคุณภาพงาน คุณภาพชีวิตให้แก่ข้าราชการพลเรือน โดยได้บูรณาการเรื่องของสถานที่พักอาศัย สถานที่ทำงาน และศูนย์บริการประชาชนให้อยู่ในพื้นที่เดียวกัน โดยนำ ที่ราชพัสดุมาดำเนินโครงการบูรณาการสวัสดิการที่พักอาศัยกับสถานที่ทำงาน และศูนย์บริการของข้าราชการพลเรือนสามัญ
นอกจากนี้ กรมธนารักษ์ยังได้มีการเปิดให้จองโครงการบ้านสวัสดิการในพื้นที่จังหวัดชลบุรี บนที่ราชพัสดุแปลงหมายเลขทะเบียนที่ ชบ.633 ตำบลพลูตาหลวง อำเภอสัตหีบ จังหวัดชลบุรี เนื้อที่ประมาณ 46-2-88 ไร่ เพื่อเป็นสวัสดิการด้านที่พักอาศัยให้กับข้าราชการและลูกจ้างของหน่วยงานภาครัฐ ภายในงานแถลงข่าวครั้งนี้ด้วย
สำหรับโครงการพัฒนาที่ราชพัสดุทั้ง 4 โครงการดังกล่าว กรมธนารักษ์ได้ตอบสนองนโยบายของรัฐบาลในการพัฒนาเศรษฐกิจฐานรากผ่านโครงการพัฒนาอสังหาริมทรัพย์บนที่ราชพัสดุที่มีศักยภาพเพื่อกระตุ้นเศรษฐกิจของประเทศ อีกทั้ง ยังช่วยยกระดับคุณภาพชีวิตของประชาชน เจ้าหน้าที่และบุคลากรของรัฐอีกด้วย
ThaiGov News
IUI
IUI (IntraUterine Insemination) is generally commonly known as simply step of assisted reproductive technology (ART) which is suitable for patients who have normal fallopian tube and no effect from male infertile factor.
The procedure will start by using mind stimulation to recruit a few eggs and inject sperm into the uterus. This process is close to natural as the egg and sperm will be fertilized by themselves inside the body.
ตรัง - 5 จังหวัดเสี่ยง กักตัว 14 วัน ลงทะเบียน Trang Healthy Passport LINK
9 เมษายน 2564 ตามคำสั่ง 1534/2564
เดินทางมาจาก กรุงเทพฯ (เฉพาะเขตวัฒนา ห้วยขวาง ลาดพร้าว วังทองหลาง)
ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม
- รายงานตัวต่อ อสม/กำนัน/ผู้ใหญ่บ้าน หรือผู้นำชุมชนในเขตพื้นที่
- โหลดแอปพลิเคชั่น "หมอชนะ" และลงทะเบียน QR Code "Trang Healthy Passport" เพื่อแสดงตัวเมื่อเจ้าหน้าที่เรียกตรวจ
- กักตนเองในที่พัก 14 วัน หรือเท่าที่อยู่ในพื้นที่จังหวัดตรัง โดยมีเจ้าหน้าที่ติดตามดูแลสุขภาพ
ยกเว้น ไม่ต้องกักตัวในที่พัก ต้องมีเอกสารแสดง
- ใบแสดงผลตรวจโควิท-19 โดยวิธี RT-PCR ที่ออกก่อนเดินทางไม่เกิน 72 ชั่วโมง (3 วัน) ว่าไม่พบเชื้อ
- ผู้ที่รับการตรวจหาเชื้อโควิท-19 โดยวิธี RT-PCR ณ โรงพยาบาลตรัง โรงพยาบาลประจำอำเภอ หรือโรงพยาบาลเอกชนในจังหวัดตรัง
- ผู้ที่มีใบแสดงผลการฉีดวัคซีนโควิท-19 ครบ 2 เข็ม
- ปฎิบัติตามมาตราการโรคอย่างเคร่งครัด D-M-H-T-T
สายด่วน ตรัง Covid-19 085-888-9497, 075-205-615 - 22
16 เมย 64 สสจ.ภูเก็ต ขอเลื่อนนัดรับวัคซีนเข็มที่สองวันที่ 22-30 เมย 64
เนื่องจากจังหวัดภูเก็ตได้รับมอบวัคซีนเข็มที่สองเร็วกว่ากำหนด ทาง สสจ.ขอเลื่อนนัดการรับวัคซีนเข็มที่สองของผู้ที่เคยได้รับวัคซีนเมื่อวันที่ 1-10 เมษายน โดยให้มารับเข็มที่สองวันที่ 22-30 เมษายน และต้องเข้ามารับที่สถานที่ฉีดเดิมเท่านั้น
ประกาศหยุดให้บริการจองคิวผ่านหมอพร้อมชั่วคราว ตั้งแต่ 31 พค 64
หน่วยบริการตรวจเชิงรุก ช่วงวันที่ 19-25 กค 64
หน่วยบริการตรวจเชิงรุก กทม. ช่วงวันที่ 19-25 กรกฏาคม 64
ม.ราชภัฏจันทรเกษม จตุจักร
วันที่ตรวจ 19-25 กค 64
แจกคิวล่วงหน้า 16-18 กค
รวม 5,600 คิว/วัน
โทร 02-5139947, 025133444 ต่อ 5217
สนามกีฬาเฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วันที่ตรวจ 19-25 กค 64
แจกคิววันต่อวัน ตั้งแต่ 6 โมงเช้า
รวม 1,000 คิว/วัน
โทร 02-8369999 ต่อ 3621, 3622
ไลน์ @wmcgi
สวนป่าใต้สะพานตากสิน คลองสาน
วันที่ตรวจ 19-25 กค 64
แจกคิวล่วงหน้า 1 วัน จองผ่าน 1) แอปคิวคิว QueQ 2) โทร 02-4387190 3) รับคิวที่ ฝ่ายทะเบียน 9-16 น.
รวม 1,000 คิว/วัน
โทร 02-4375279 ต่อ 5058 02-4387190, 02-4375486
วัดปากน้ำภาษีเจริญ
วันที่ตรวจ 19-22 กค 64
แจกคิวล่วงหน้า ที่สำนักงานเชต วันที 19-24 กค เวลา 8-16 น.
จนกว่าบัตรคิวหมด
โทร 02-4132724
ลานวัฒนธรรม ห้วยขวาง
วันที่ตรวจ 19-21 กค 64
แจกคิววันต่อวัน 6-8 น.
จำนวน 500 คิว/วัน
โทร 02-2769959
วัดวชิรธรรมสาธิต พระโขนง
วันที่ตรวจ 19-20 กค 64
แจกคิววันต่อวัน จองผ่านแอปคิวคิว QueQ ตั้งแต่เที่ยงคืน
จำนวน 600 คิว/วัน
โทร 02-3113538
เอกสารที่ต้องใช้
1. บัตรประชาชนตัวจริง พร้อมสำเนา
2. ปากกาส่วนตัว ไว้ลงทะเบียน
สายด่วน รับคนลำปางกลับบ้าน
รวมเบอร์สายด่วน "รับคนลำปางกลับบ้าน"
• ศูนย์ข้อมูลโควิด-19 จังหวัดลำปาง โทร. 093-1408023
• ศูนย์ประสานงานรับคนลำปางกลับบ้าน โทร. 090-3311493
• ศูนย์ประสานงานโรงพยาบาลมะเร็งลำปาง LPCH โทร. 1668
• สมาคมกู้ภัยนครลำปาง โดย ท๊อปพันธ์ทิพย์ โทร. 062-4272199
• มณฑลทหารบกที่ 32 โทร. 095-6761623, 054-225946 (ตลอด 24 ชั่วโมง)
...ปิ๊กมาฮักษาเนื้อฮักษาตั๋ว ตี้ลำปางบ้านเฮาเน้อเจ้า...
ผู้ประกอบการสถานพยาบาลและสถานประกอบการเพื่อสุขภาพ สามารถรับบริการผ่านระบบออนไลน์ ได้ที่เว็บไซต์
www.bizportal.go.th และ
www.esta.hss.moph.go.th ตามงานบริการในรูปภาพ
หรือจองคิวออนไลน์ก่อนมาใช้บริการ ได้ทางเว็บไซต์ www.queue.hss.moph.go.th จำกัดจำนวน 30 คิว/วัน
คกก.ควบคุมโรคติดต่อ จ.กาฬสินธุ์ ประชุมรับมือโควิดคลัสเตอร์โอไมครอน
25 ธ.ค.2564 คกก.ควบคุมโรคติดต่อ จ.กาฬสินธุ์ ประชุมด่วน นำโดยนายทรงพล ใจกริ่ม ผู้ว่าราชการจังหวัดกาฬสินธุ์ เพื่อรับมือโควิดคลัสเตอร์โอไมครอน หลังให้ทีมเก็บข้อมูลชัด ๆ เพื่อเสนอต่อกรรมการให้พิจารณาลงมติเป็นคำสั่งถือปฏิบัติ
วงระบาดเริ่มแคบลงแล้ว แต่ข้อสั่งการก็จำเป็นต้องใช้ยาแรงเฉพาะจุด ไม่สุ่มกว้างให้ประชาชนเดือดร้อน เช่น โรงเรียนในเขตเทศบาลเมืองให้เรียนออนไลน์ งานประเพณีห้ามรวมตัวเกิน 100 คน ร้านอาหารห้ามดื่มเครื่องดื่มแอลกอฮอล์ สั่งปิดบาร์ที่เป็นแหล่งระบาดเพิ่มอีก 14 วัน ค้นหาตรวจเชิงรุก 1,000 รายต่อวัน แล้วมาประเมินกันอีกครั้งวันที่ 30 ธ.ค.64
ปัจจัยที่เพิ่ม-ลด-ไม่มีความสัมพันธ์ ต่อความเสี่ยงต่อการเกิดภาวะสมองเสื่อมชนิดอัลไซเมอร์
ปัจจัยที่เพิ่มความเสี่ยงต่อการเกิดภาวะสมองเสื่อมชนิดอัลไซเมอร์
ความน่าเชื่อมั่นของหลักฐานระดับปานกลาง
- APOE e4 genotype
- การใช้ฮอร์โมนเพศเอสโทรเจนร่วมกับเมทธิวโปรเจสเตอโรน
ความน่าเชื่อมั่นของหลักฐานระดับต่ำ
- การใช้ยาต้านการอักเสบสเตียรอยด์ (non-steroidal anti-inflammatory drugs)บางชนิด
- โรคซึมเศร้า
- เบาหวาน
- ไขมันในเลือดสูงในวัยกลางคน
- อุบัติเหตุต่อสมองในเพศชาย
- การได้รับยาฆ่าแมลง
- คนโสด ได้รับการสนับสนุนทางสังคมน้อย
- กำลังสูบบุหรี่
ปัจจัยที่ลดความเสี่ยงต่อการเกิดภาวะสมองเสื่อมชนิดอัลไซเมอร์
ความน่าเชื่อมั่นของหลักฐานระดับต่ำ
- อาหารเมดิเตอเรเนี่ยน
- กรดโฟลิก
- ยาลดไขมัน statins
- การศึกษาสูง
- ดื่มอัลกอฮอล์ระดับน้อยถึงปานกลาง
- เข้าร่วมกิจกรรมที่กระตุ้นการรู้คิด
- การออกกำลังกาย
ปัจจัยที่ไม่มีความสัมพันธ์ต่อการเกิดภาวะสมองเสื่อมชนิดอัลไซเมอร์
ความน่าเชื่อมั่นของหลักฐานระดับสูง
- สารสกัดใบแปะก๊วย
ความน่าเชื่อมั่นของหลักฐานระดับปานกลาง
- วิตะมินอี
- ยากลุ่ม cholinesterase inhibitors
ความน่าเชื่อมั่นของหลักฐานระดับต่ำ
- ยาลดความดันโลหิต
- การได้รับฮอร์โมนเอสโตรเจน
- กรดไขมันโอเมก้า-3
- วิตะมินบี 12 วิตะมินซี เบต้าคาโรทีน
- โฮโมซิสเตอีน
- ความดันโลหิตสูง
- อ้วน
- กลุ่มอาการทางเมตะโบลิก
- ปัจจัยเสี่ยงในวัยเด็ก
- ระดับของอาชีพ
- สารตะกั่ว
ปัจจัยที่ยังไม่มีข้อมูลเพียงพอที่จะบอกถึงความสัมพันธ์ได้
- การรับประทานไขมันอิ่มตัวสูง
- การรับประทานผักและผลไม้
- แร่ธาตุ
- การรับประทานพลังงานสูง
- Memantine
- การหยุดหายใจในขณะหลับ
- โรควิตกกังวล
- การเข้าร่วมกิจกรรมที่ไม่ได้กระตุ้นการรู้คิดหรืออกกำลังกาย
- สารทำละลาย อลูมิเนี่ยม
- ปัจจัยทางพันธุกรรมอื่นๆ นอกจาก APOE
ถึงแม้ว่าส่วนใหญ่แล้วจะยังไม่มีหลักฐานทางวิชาการที่ชัดเจนในเรื่องปัจจัยที่ส่งเสริมหรือป้องกันการเกิดภาวะสมองเสื่อม แต่ไม่ได้แปลว่าปัจจัยที่ศึกษามานั้นไม่ได้เป็นปัจจัยของการเกิดโรคจริงๆ เพียงแต่ยังขาดข้อมูลที่มีน้ำหนักทางวิชาการที่เพียงพอ ซึ่งโดยส่วนใหญ่เกิดจากการที่มีการศึกษาถึงแต่ละปัจจัยไม่มากนัก มีความแตกต่างของการศึกษาเป็นอันมาก การวัดประเมินปัจจัยและผลลัพธ์ไม่มีความแม่นยำ การศึกษาวิจัยให้ผลแตกต่างออกไปในการศึกษาอื่น และถึงแม้จะพบความสัมพันธ์จริงๆ ก็มักเป็นความสัมพันธ์ที่ไม่สูงมากนัก การวิจัยที่เหมาะสมอาจต้องเป็นการศึกษาวิจัยที่เป็น observational studies ที่มีการวางแผนในการวิจัยที่ดี และอาจจำเป็นต้องศึกษาถึงปัจจัยของโรคหลายๆ ปัจจัยพร้อมๆ กัน และการให้การแก้ไขปัจจัยต่างๆ เหล่านี้ไปพร้อมๆ กัน เพราะการศึกษาแยกแต่ละปัจจัยเสี่ยงอาจไม่เป็นผลต่อการเปลี่ยนแปลงการเกิดภาวะสมองเสื่อม
บทบาทองค์กรแพทย์ เสริมความแข็งแกร่งองค์กร
รศ.นพ. ทวีสิน ตันประยูร ประธานปฏิบัติการด้านการแพทย์ โรงพยาบาลบำรุงราษฎร์ กล่าวเสริมว่า ในส่วนของ
"แพทย์" ถือว่ามีบทบาทสำคัญอย่างมากในการสร้างวัฒนธรรมองค์กรให้แข็งแกร่งยิ่งขึ้น อาทิ บทบาทองค์กรแพทย์ของบำรุงราษฎร์ในการรักษามาตรฐานทางการแพทย์และจรรยาบรรณ กระบวนการสรรหาแพทย์ใหม่ ๆ ที่มีความชำนาญการและประสบการณ์สูงในแต่ละด้าน เพื่อมาผนึกกำลังกับแพทย์ปัจจุบันของโรงพยาบาล เพื่อให้ครอบคลุมในทุกด้านและส่งมอบประสบการณ์ที่ดีและผลของการรักษาที่ดีที่สุดให้แก่ผู้ป่วยแต่ละราย
Hemp House
H.E.M.P : Healthy Everyday Multi Plants ชั้น M ห้าง เอ็มควอเทียร์ มีเครื่องดื่ม ขนม สแนค ไอติม ให้ลองชิมกัน นั่งรับประทานที่ร้าน หรือ สั่งกลับบ้านได้
Bloomร้านค้าผลิตภัณฑ์กัญชา และ CBD - Cannabis & CBD Shop
Organic Village Siam Square Soi 5 สินค้ากัญชา CBD น่าสนใจหลายอย่าง สินค้ากลิ่นเทอร์ปีน น้ำมัน CBD สบู่ เทียนหอม เยลลี่ น้ำผึ้ง ไอติม
*ภาพทีมแพทย์โรงพยาบาลบำรุงราษฎร์ และ ศูนย์เชี่ยวชาญเฉพาะทางด้านระบบประสาทและการเคลื่อนไหวของระบบทางเดินอาหาร คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
สอบถามรายละเอียดเพิ่มเติมได้ที่ศูนย์เฉพาะทางด้านการทำงานระบบทางเดินอาหาร โรงพยาบาลบำรุงราษฎร์ ชั้น 2 อาคาร B (อาคารโรงพยาบาล) หรือโทร. 063 190 3152 หรือโทร. 1378
ดูแลติดตามผลผู้ป่วยหลังการรักษาอย่างใกล้ชิด
ที่สำคัญ หลังการรักษาผู้ป่วยวิกฤต แผนกผู้ป่วยวิกฤตระบบประสาทและไขสันหลัง จะดูแลติดตามผลผู้ป่วยหลังการรักษาอย่างใกล้ชิดเพื่อให้มั่นใจว่าปลอดภัย โดยห้องพักผู้ป่วยวิฤตระบบประสาท ถูกออกแบบโดยเน้นการจัดสิ่งแวดล้อมเพื่อให้เกิดความปลอดภัยสูงสุด พร้อมด้วยเครื่องติดตามการทำงานของหัวใจและระบบไหลเวียนโลหิตของผู้ป่วยแต่ละรายที่เชื่อมโยงกับเครื่องศูนย์กลางเพื่อติดตามสัญญาณชีพ (central vital sign monitoring) เพื่อให้พยาบาลประจำแผนกผู้ป่วยวิกฤตสามารถเฝ้าระวังอาการของผู้ป่วยหนักได้อย่างทั่วถึง ทั้งนี้ แผนก NCCU ได้เข้ามาเติมเต็มให้ ICU มีความแข็งแกร่งและมีประสิทธิภาพในการส่งมอบคุณภาพชีวิตที่ดีขึ้นให้กับผู้ป่วย
ยุทธศาสตร์ที่ 3 ด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์
ยุทธศาสตร์ที่ 3 ด้านการพัฒนาและเสริมสร้างศักยภาพทรัพยากรมนุษย์ 2 ประเด็นหลัก
1. เสริมสร้างให้คนมีสุขภาวะที่ดี
2. พัฒนาศักยภาพคนตลอดช่วงชีวิต พัฒนาคุณภาพการศึกษาและการเรียนรู้
1. เสริมสร้างให้คนมีสุขภาวะที่ดี
งบประมาณ 51,831.8 ล้านบาท
ประกอบด้วย
1.1 การพัฒนาระบบการแพทย์ปฐมภูมิ และเครือข่ายระบบสุขภาพ
ได้แก่
1.1.1 คลินิกหมอครอบครัว งบประมาณ 161 ล้านบาท - เพื่อเพิ่มจำนวนคลินิกหมอครอบครัว จากเดิม 3,000 ทีม เป็น 3,500 ทีม
1.1.2 สนับสนุนค่าป่วยการและพัฒนาศักยภาพ อสม. หมอประจำบ้าน รวม 1.05 ล้านคน งบประมาณ 12,613.74 ล้านบาท
1.1.3 โรงพยาบาลส่งเสริมสุขภาพตำบล (รพ.สต.) งบประมาณ 2,109.29 ล้านบาท เพื่อการพัฒนาด้านสุขภาพเชิงรุก พัฒนา รพ.สต.ติดดาว
1.2 พัฒนาบุคลากรทางการแพทย์
1.2.1 ผลิตบุคลากรด้านสาธารณสุข ใน 2 กระทรวงหลัก ได้แก่กระทรวงสาธารณสุขและกระทรวงอุดมศึกษา
กระทรวงสาธารณสุข งบประมาณ 479.6 ล้านบาท สำหรับการ พัฒนาพยาบาลและบุคลากรทางการแพทย์ เป้าหมายไม่น้อยกว่า 25,900 คน
กระทรวงอุดมศึกษา งบประมาณ 2,379.19 ล้านบาท สำหรับการ พัฒนาแพทย์และพยาบาล เป้าหมายไม่น้อยกว่า 4,900 คน
1.2.2 การกระจายแพทย์ไปสู่ชนบท ให้เพียงพอในพื้นที่ห่างไกล
ไม่น้อยกว่า 7,490 คน ด้วยงบประมาณ 1,889.64 ล้านบาท
1.3 เสริมสร้างความมั่นคงทางสุขภาพและบริการทางการแพทย์ครบวงจร
1.3.1 พัฒนาศักยภาพด้านวิทยาศาสตร์ การแพทย์ในการวินิจฉัยและป้องกันโรค งบประมาณ 329.47 ล้านบาท ในการ
- พัฒนาและยกระดับ การบริหารจัดการข้อมูลอ้างอิงทางห้องปฏิบัติการ
- บูรณาการฐานข้อมูลด้านวิทยาศาสตร์การแพทย์ และเครือข่ายห้องปฏิบัติการเพื่อความมั่นคงด้านสุขภาพ
1.3.2 พัฒนาระบบบริการการแพทย์ฉุกเฉิน ครบวงจรและระบบการส่งต่อ
- พัฒนาระบบบริหารจัดการภาวะฉุกเฉินและภัยสุขภาพ ระบบบริการ
- พัฒนาคุณภาพบริการการส่งต่อผู้ป่วยประสานกันเป็นเครือข่ายอย่างมีประสิทธิภาพและต่อเนื่อง
1.4 พัฒนาเทคโนโลยีและนวัตกรรมทางการแพทย์และสาธารณสุข
1.4.1 สมุนไพร กัญชา กัญชง
ส่งเสริมการผลิตน้ำมันกัญชา สำหรับใช้ในโรงพยาบาลสังกัด กระทรวงสาธารณสุขทั่วประเทศ และขับเคลื่อนกัญชา กัญชง กระท่อม ทางการแพทย์แผนไทยและการแพทย์ทางเลือก
1.4.2 เพิ่มประสิทธิภาพการวินิจฉัยและรักษา
- พัฒนาระบบเทคโนโลยีดิจิตัลด้านสุขภาพทางการแพทย์เฉพาะทาง
- พัฒนาระบบรักษาพยาบาลทางไกล Telemedicine Telepharmacy Telenursing
2. พัฒนาศักยภาพคนตลอดช่วงชีวิต พัฒนาคุณภาพการศึกษาและเรียนรู้
งบประมาณ 51,153.5 ล้านบาท
พัฒนาใน ด้าน
2.1 ส่งเสริมศักยภาพและพัฒนาทักษะทุกช่วงวัย
2.2 พัฒนาการเรียนรู้และวิทยาการ
ที่ท่องเที่ยว
เขตพญาไท LINK
สำนักงานเขตพญาไท ร่วมกับ ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์ ออกหน่วยบริการฉีดวัคซีนป้องกันพิษสุนัขบ้า ฟรี ระหว่างวันที่ 13-24 มีนาคม 2566 เช็คสถานที่ให้บริการและวันที่ได้จากสอบถาม
โทร. 02-2794141 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพญาไท
โทร 02-2711122 ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์
บุฟเฟต์ทุเรียน ในจังหวัดอื่นๆ
พญ. เมทินี ศิริมหาราช หัวหน้าศูนย์จักษุและจักษุแพทย์เฉพาะทางโรคจอตาและน้ำวุ้นตา โรงพยาบาลบำรุงราษฎร์ กล่าวปิดท้ายว่า ทุกวันนี้ ต้องยอมรับว่าแพทย์ไทยเก่งและมีความสามารถมาก แต่สิ่งที่จะทำให้วงการแพทย์พัฒนาก้าวไปไกลมากขึ้น คือ การหยิบเอาความรู้ความชำนาญการของแพทย์แต่ละท่าน รวมถึงจุดแข็งของแพทย์ในแต่ละสาขามาไว้รวมกันและทำงานร่วมกันได้ ซึ่งจะทำให้กระบวนการการรักษาเกิดประสิทธิภาพและผลลัพธ์หลังการรักษาได้อย่างดีที่สุด ส่วนนี้จะช่วยเอื้อประโยชน์สูงสุดให้แก่ผู้ป่วย โดยเฉพาะอย่างยิ่งโรคยาก หรือโรคที่ซับซ้อน โดยสถิติการรักษาในปี 2565 ได้แสดงถึงอัตราความสำเร็จของการผ่าตัดเกี่ยวกับโรคตาโดยเฉลี่ยสูงกว่า 90% ซึ่งสูงกว่าเกณฑ์มาตรฐานในระดับสากล สะท้อนถึงศักยภาพและความพร้อมในทุกมิติของศูนย์จักษุ โรงพยาบาลบำรุงราษฎร์
เศรษฐกิจการท่องเที่ยวไทย ในช่วง 3 เดือนแรกของปี 2566
“เศรษฐกิจการท่องเที่ยวไทย ในช่วง 3 เดือนแรกของปี 2566 ประเทศไทยมีจำนวนนักท่องเที่ยวชาวต่างชาติ 6,477,538 คน และนักท่องเที่ยวไทยเที่ยวไทย 45.41 ล้านคน - ครั้ง ส่งผลให้เกิดมูลค่าการใช้จ่ายของนักท่องเที่ยวทั้งหมด 481,841 ล้านบาท”
มูลค่าผลิตภัณฑ์มวลรวมภายในประเทศด้านการท่องเที่ยว (Tourism GDP) ในไตรมาสแรกของปี 2566 มีมูลค่า 496,054 ล้านบาท ขยายตัวร้อยละ 51.28 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 181.57 �เมื่อเทียบกับไตรมาสแรกของปี 2565 (%YoY) ซึ่งคิดเป็นสัดส่วนร้อยละ 10.95 ของเศรษฐกิจประเทศ
มูลค่าการใช้จ่ายของนักท่องเที่ยวทั้งหมดในไตรมาสแรกของปี 2566 มีมูลค่า 481,841 ล้านบาท ขยายตัวร้อยละ 43.99 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 157.99 เมื่อเทียบกับไตรมาสแรกของปี 2565 (%YoY)
มูลค่าผลผลิตรวมของอุตสาหกรรมการท่องเที่ยว ในไตรมาสแรกของปี 2566 มีมูลค่า 207,564 ล้านบาท ขยายตัวร้อยละ 51.85 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 193.94 เมื่อเทียบกับไตรมาสแรกของปี 2565 (%YoY) โดยสาขาอุตสาหกรรมการท่องเที่ยวที่มีมูลค่าผลผลิตมากที่สุด 5 อันดับแรก ได้แก่ (1) การบริการโรงแรมและที่พัก (2) การบริการอาหารและเครื่องดื่ม (3) การจำหน่ายปลีกสินค้าท่องเที่ยวของประเทศ (4) การขนส่งผู้โดยสารทางอากาศ และ (5) การขนส่งผู้โดยสารทางรถยนต์
งานเทสกาลนมัสการองค์พระปฐมเจดีย์ประจำปี 2566
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชารังสีเทคนิค คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
ผู้ช่วยศาสตราจารย์ ดร.สัมฤทธิ์ กิตติพยัคฆ์ อาจารย์ประจำหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชารังสีเทคนิค คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
“ปัจจุบัน นักรังสีเทคนิค ถือเป็นบุคลากรการแพทย์สาขาที่ขาดแคลนระดับประเทศ หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชารังสีเทคนิค มีวัตถุประสงค์ผลิตบัณฑิตรังสีเทคนิคที่ตอบสนองความต้องการของประเทศ ดำเนินการเรียนการสอนโดยอาจารย์ผู้เชี่ยวชาญในแต่ละสาขา ทั้งรังสีวินิจฉัย รังสีรักษา และเวชศาสตร์นิวเคลียร์ นักศึกษามีโอกาสได้เรียนภาคทฤษฎีและภาคปฏิบัติกับเครื่องมือและเทคโนโลยีที่ทันสมัย โรงเรียนรังสีเทคนิคได้นำ Virtual Environment in Radiotherapy Training (VERT) มาใช้ในการเรียนการสอนรายวิชารังสีรักษาเป็นแห่งแรกในประเทศไทย โดยจุดเด่นของเครื่องมือนี้คือ เป็นการจำลองห้องฉายรังสีรักษาเสมือนจริง โดยไม่ต้องเสี่ยงกับอุบัติเหตุที่อาจเกิดขึ้นกับผู้ป่วย เครื่องมือ หรือผู้ปฏิบัติงาน ซึ่งจะช่วยให้การเรียนการสอนภาคทฤษฎีเห็นภาพมากยิ่งขึ้น ช่วยเพิ่มความน่าสนใจ กระตุ้นการเรียนรู้ในห้องเรียน และเพิ่มประสิทธิภาพในการเรียนรู้เมื่อนักศึกษาได้ออกไปฝึกงานภาคปฏิบัติ ทั้งหมดนี้การเรียนการสอนจะมีอาจารย์ดูแลการเรียนการสอนอย่างใกล้ชิด”
++ ปริมณฑล ++
เบอร์โทรติดต่อภายใน โรงพยาบาลศูนย์บริการการแพทย์นนทบุรี
คลินิกวัณโรค
คลินิกวัณโรค เปิดให้บริการ วันอังคาร ช่วงเช้า เวลา 08.30 – 12.00 น. – ช่วงบ่าย เวลา 13.00 – 16.30 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120คลินิกไต CKD
คลินิกไต CKD เปิดให้บริการ วันอังคาร ช่วงเช้า เวลา 08.30 – 12.00 น. – ช่วงบ่าย เวลา 13.00 – 16.30 น. สถานที่ให้บริการ โรงพยาบาลบางกรวย สอบถามรายละเอียดเพิ่มเติม หรือ ติดต่อเพื่อนัดหมายแพทย์ได้ที่ โทร. 0-2447-5582 – 3 ต่อ 120ประเภทศูนย์พักพิงสุนัขจรจัด บ้านพักพิง
อ้างอิง
Amanpuri resort, Phuket
Breuleux, C., (2004) Medical Wellness Journal, The Medical Wellness Association, Volume 1-2, p.1-3. (C) 2004 Christopher Breuleux, PhD, The Medical Wellness Association
Center for Disease Control and Prevention retrieved from Precision health: Improving health for each of us and all of us | CDC. January 2024.
Christopher Breuleux., (2004) Integrating Medical Wellness Programs. ANTI-AGING MEDICAL NEWS Winter 2009
Edwin Lim Medical Aesthetic Clinic, Singapore
GLOBE NEWSWIRE. New York. March 20, 2023.
Global Wellness Institute. 2020-2023
Medical Wellness Association. 2020
Persistence Market Research. Adoption of Wellness Services by Employers and General Population will drive the Global Market over Forecast Duration (2023-2033). March 20.2023
The Health Coaches Australia and New Zealand Association (HCANZA).2022
World Health Organization. 2023
สร้อยเพชร ประเทืองเศรษฐ์.(2566) ผู้ช่วยผู้อำ นวยการ BDMS Wellness Clinicรายละเอียดแต่ละโปรแกรมเดือนกันยายน 2567
โปรแกรมเที่ยว KIHA 183 เดือนกันยายน 2567 เป็นธีม
เติมฝันปันสุข มี 8 ทริป 4 สัปดาห์
ข้อเขียนความเห็นผ่านสื่อ
Main takeaways ข้อสรุปที่มีนัยต่อธุรกิจบริการ หัตถการและศัลยกรรมเสริมความงาม
1. กลุ่มคนรุ่นใหม่จะเป็นฐานผู้ใช้บริการส าคัญในธุรกิจเวชศาสตร์ความงามในระยะข้างหน้า โดยกลุ่ม Gen Y และ Gen Z เป็นกลุ่มที่ให้ความส าคัญ กับการท าหัตถการและการท าศัลยกรรมเพิ่มขึ้นอย่างเห็นได้ชัด นอกจากนี้ กลุ่มผู้ชายยังเป็นอีกกลุ่มที่มีโอกาสเติบโตสูงเนื่องจากผู้ชายในยุคปัจจุบัน หันมาดูแลผิวและใส่ใจภาพลักษณ์ของตัวเองกันมากขึ้น จึงส่งผลให้บริการเวชศาสตร์ความงามได้รับความสนใจจากผู้บริโภคในหลากหลายกลุ่มและ เริ่มแพร่หลายในวงกว้าง อีกทั้ง สถานบริการทั้งคลินิกและโรงพยาบาลต่างเปิดให้บริการด้านความงามแบบครบวงจรมากขึ้นทั้งการดูแลผิวพรรณ รูปร่าง รวมถึงการท าศัลยกรรมเสริมความงามจึงท าให้ผู้บริโภคสามารถเข้าถึงบริการได้ง่ายในงบประมาณที่ไม่สูงมากนัก
2. การตั้งราคาที่เหมาะสมเข้าถึงได้ง่ายยังคงเป็นกลยุทธ์หลักของธุรกิจหัตถการเสริมความงามในการเพิ่มโอกาสให้ผู้ใช้บริการเดิมกลับมาใช้บริการซ ้า รวมถึงการเจาะกลุ่มผู้ใช้บริการใหม่ เช่น การมอบส่วนลดส าหรับการใช้บริการครั้งต่อไปหรือแพ็กเกจทดลองใช้บริการหัตถการรูปแบบอื่น ๆ เนื่องจากพฤติกรรมผู้บริโภคส่วนใหญ่นิยมใช้บริการหัตถการเสริมความงามมากกว่า 1 ประเภท และยังมีผู้บริโภคไม่น้อยที่สนใจใช้บริการหัตถการ เสริมความงาม นอกจากนี้ การพัฒนาแพ็กเกจการบริการที่สามารถตอบโจทย์ความต้องการเฉพาะบุคคลควบคู่ไปด้วย อย่างการน าเสนอแพ็กเกจ หัตถการความงามแบบครบวงจรทั้งการแก้ปัญหาผิวและการบ ารุงผิว จะสามารถดึงดูดผู้ใช้บริการได้ตรงกลุ่มเป้าหมายมากขึ้นเพราะผู้บริโภค ในแต่ละกลุ่มมีปัญหาผิวและรูปร่างที่แตกต่างกัน
3. การสร้างความน่าเชื่อถือในการให้บริการทั้งชื่อเสียงของสถานบริการ ความเชี่ยวชาญของทีมแพทย์ และความปลอดภัยของอุปกรณ์/เครื่องมือ ที่ให้บริการจะสามารถดึงดูดผู้ที่สนใจท าศัลยกรรมได้มากขึ้น แม้ทุกวันนี้มุมมองของสังคมในยุคปัจจุบันจะเปิดกว้างต่อการท าศัลยกรรมเสริมความงาม แต่มาตรฐานด้านความปลอดภัยยังคงเป็นปัจจัยส าคัญต่อการตัดสินใจท าศัลยกรรมเสริมความงามและการเลือกสถานบริการของผู้บริโภค ซึ่งการ ได้รับรองมาตฐานความปลอดภัยในระดับสากลนอกจากจะช่วยเพิ่มความมั่นใจให้กับผู้บริโภคแล้ว ยังช่วยเพิ่มความสามารถในการแข่งขันจากบริการ ศัลยกรรมในต่างประเทศที่ปัจจุบันสามารถเข้าถึงผู้บริโภคได้ง่ายขึ้นผ่านธุรกิจให้ค าปรึกษาและบริการศัลยกรรม (เอเจนซี่) อีกด้วย นอกจากนี้ การแชร์ประสบการณ์และผลลัพธ์ที่ดีจากผู้ใช้บริการจริงจะเป็นอีกวิธีหนึ่งที่สามารถสร้างแรงจูงใจในการท าศัลยกรรมเสริมความงามได้โดยเฉพาะ กลุ่ม Gen Z และ Gen Y ที่ได้รับอิทธิพลจากการรีวิว/โฆษณาเกี่ยวกับ McKinsey Technology Council
เทคโนโลยีเป็นตัวเร่งปฏิกิริยาสำหรับโอกาสใหม่ๆ ตั้งแต่การคิดค้นผลิตภัณฑ์และบริการใหม่ๆ การขยายขอบเขตของผลผลิต และการจับมูลค่าเพิ่มในงานประจำวันของเรา
McKinsey Technology Council ช่วยให้ผู้นำทางธุรกิจเข้าใจเทคโนโลยีแนวหน้าและการประยุกต์ใช้ที่เป็นไปได้ในธุรกิจของตน
เราพิจารณาเทคโนโลยีต่างๆ ตั้งแต่ AI เชิงสร้างสรรค์ การเรียนรู้ของเครื่องจักร และการคำนวณควอนตัม ไปจนถึงเทคโนโลยีอวกาศที่กำลังสร้างโอกาสและการประยุกต์ใช้ใหม่ๆ McKinsey
Technology Council รวบรวมนักวิทยาศาสตร์ ผู้ประกอบการ นักวิจัย และผู้นำทางธุรกิจมากกว่า 100 คนจากทั่วโลก เราวิจัย ถกเถียง และให้คำแนะนำแก่ผู้บริหารจากทุกอุตสาหกรรมในขณะที่พวกเขาเดินตามภูมิทัศน์เทคโนโลยีที่เปลี่ยนแปลงอย่างรวดเร็ว
—Lareina Yee หุ้นส่วนอาวุโส McKinsey ประธาน McKinsey Technology Council
ทำหมันหมาแมว โดยมูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร เป็นองค์กรที่ทำโครงการทำหมันแมวสัญจรกับมูลนิธิรักษ์แมว มายาวนานกว่า 10 ปี โดยออกเดินทางไปบริการทำหมันให้กับหมาแมวจรจัดในพื้นที่จังหวัดต่างๆ รวมถึงการรักษาแมวจรที่ป่วย หาบ้านให้เจ้าเหมียว เป็นภารกิจที่ทำโดยไม่คิดค่าบริการทำหรือค่าบริการ แต่มูลนิธิประสงค์จะขอรับการสนับสนุน เพื่อเป็นทุนสนับสนุนการดำเนินการ ค่าใช้จ่าย ค่าเดินทาง โปรแกรมการออกทำหมัน มูลนิธิรักษ์แมว ในพื้นที่จังหวัดต่างๆ
ร่วมสนับสนุนและดูรายละเอียดโครงการได้ที่ taejai.com (การบริจาคนำไปลดหย่อนภาษีได้) สนับสนุนโดยโอนเงินบริจาคเข้าบัญชี มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร”
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางคอแหลม
IVF - In Vitro Fertilization
IVF - In Vitro Fertilization
รายงานวัคซีนประเทศอังกฤษ LINK
รายงานวัคซีนประเทศอังกฤษ 20 May 2021
- จำนวนผู้ที่ได้รับวัคซีนโดสแรกแล้ว 37,250,363 ราย
- จำนวนผู้ที่ได้รับวัคซีนโดสที่สองแล้ว 21,239,471 ราย
- รวมวัคซีนที่ฉีดไปแล้ว 58,489,834 โดส
อังกฤษใช้วัคซีน 3 ราย คือ Pfizer/BioNTech, AstraZeneca and Moderna
(
Summary)
มติ คกก.โรคติดต่อ ปิดสถานที่เสี่ยง + ค้นหาเชิงรุกปชช.กลุ่มเสี่ยง (พนักงาน/แรงงาน)
สำนักงานสาธารณสุขจังหวัดกาฬสินธุ์ ร่วมประชุมคณะกรรมการโรคติดต่อจังหวัดกาฬสินธุ์ ครั้งที่ 32/2564
25 ธันวาคม 2564 เวลา 09.30 น. คณะกรรมการโรคติดต่อจังหวัดกาฬสินธุ์ ส่วนราชการที่เกี่ยวข้อง และกองระบาด กรมควบคุมโรค กระทรวงสาธารณสุข ประชุม และมีมติเห็นชอบ 2 วาระ สำคัญ คือ
1. มติเห็นชอบร่างคำสั่งจังหวัดกาฬสินธุ์ ฉบับที่ 39 ให้สอดคล้องกับสถานการณ์การแพร่ระบาดโรคติดเชื้อไวรัสโคโรนา 2019 (COVID - 19) สายพันธุ์โอมิครอน (Potentially B.1.1.529 : Omicron) ในเขตพื้นที่จังหวัดกาฬสินธุ์ ดังนี้
: มติเห็นชอบการปิดสถานที่ที่มีความเสี่ยงต่อการระบาดของโรคและมีการพบผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 จำนวน 2 ร้าน
- ร้านคิกคาปู้บาร์ เป็นเวลา 14 วัน นับตั้งแต่วันที่ 21 ธันวาคม 2564
- ร้านครัวพารวย นับตั้งแต่วันที่ 25 ธันวาคม 2564
: มติเห็นชอบให้ปิดสถานศึกษาในเขตเทศบาลเมืองกาฬสินธุ์
: มติเห็นชอบห้ามดื่มในร้านอาหาร
: มติเห็นชอบห้ามจัดกิจกรรมรวมกลุ่มของบุคคลที่มีจำนวนรวมกันมากกว่า 100 คน หากเกินจำนวนที่กำหนดต้องได้รับอนุญาตจากนายอำเภอท้องที่
2. มติเห็นชอบมอบ สำนักงานสาธารณสุขจังหวัดกาฬสินธุ์และหน่วยงานที่เกี่ยวข้อง ดำเนินการค้นหาเชิงรุก โดยเฉพาะในกลุ่มพนักงานร้านอาหาร สถานบริการ และแรงงานต่างด้าว เป้าหมาย อย่างน้อย 1000 ราย/วัน (อำเภอเมือง 500 ราย/วัน อำเภออื่น 500 ราย/วัน) ต่อเนื่อง 7 วันนับตั้งแต่ 24 ธ.ค 2564
ติดตามรายละเอียดเพิ่มเติมได้ทาง
ด้วยความปรารถนาดีจาก โรงพยาบาลวิมุต
อีกระดับของการรักษาด้วยความใส่ใจ
โรงพยาบาลหนองบัวลำภู กำหนดฉีดวันที่ 7-11 กุมภาพันธ์ 2565 LINK
การให้บริการวัคซีนไฟเซอร์เด็กอายุ 5-11 ปี โรงพยาบาลหนองบัวลำภู ให้บริการวัคซีนไฟเซอร์สำหรับเด็ก อายุ 5-11 ปี ระหว่างวันที่ 7-11 กุมภาพันธ์ 2565 เวลา 08.00 น. - 14.00 น. ณ ศูนย์ฉีดวัคซีนโรงพยาบาลหนองบัวลำภู หมายเหตุ : 1. สถานศึกษาที่มีน้องๆอายุตามเกณฑ์การรับวัคซีน สามารถนำน้องๆเข้ารับวัคซีนเป็นสถานศึกษาตามวันและเวลาที่กำหนด 2. น้องๆที่ไม่ได้อยู่ในระบบการศึกษา ต้องมีผู้ปกครองมาด้วยทุกครั้ง
อาหารและยากัญชา ภูมิปัญญาไทยในการใช้กัญชา
กัญชาในอาหารและยา คู่กันมาในประเทศไทยแสนนาน ในงานจัดให้มีโชว์อาหาร การทำอาหาร การทำยา การทำน้ำมันกัญชาสูตรหมอเดชา เช็คตารางกิจกรรมปรุงยาเพื่อการดูแลสุขภาพได้จากตารางได้เลย และจัดเวลาไปชม
ควรเริ่มจัดฟัน ตั้งแต่อายุเท่าไหร่
ช่วงอายุ 12-13 ปี เป็นช่วงที่สามารถเริ่มจัดฟันได้ เพราะเป็นช่วงอายุที่ฟันแท้เริ่มขึ้นครบ และขากรรไกรเริ่มมีการเจริญเติบโต ทำให้การขยายหรือลดรูปร่างขากรรไกรเป็นไปได้ง่าย
ทั้งนี้แนะนำให้ผู้ปกครองพาเด็กๆ ไปพบทันตแพทย์ เพื่อตรวจหาการสบฟันที่ผิดปกติ เมื่ออายุ 7 ปีขึ้นไป เนื่องจากการสบฟันที่ผิดปกติบางอย่าง สามารถแก้ไขได้ หากตรวจพบเมื่อเด็กอายุยังน้อย นะคะ
นายศานนท์ หวังสร้างบุญ - ดูแลด้านพัฒนาสังคมและการศึกษา
"เปลี่ยนวิธีการทำงาน เน้น "คน" เป็นที่ตั้ง"
นายศานนท์ หวังสร้างบุญ
รองผู้ว่าราชการกรุงเทพมหานคร
ดูแลด้านพัฒนาสังคมและการศึกษา
กล่าวในงานอัพเดทความคืบหน้านโยบาย 9 ด้าน 9 ดี ก้าวสูปี 66 กรุงเทพฯ เมืองน่าอยู่
21 ธันวาคม 2565
หอเฉลิมรัฐสีมาคุณากร
หอเฉลิมรัฐสีมาคุณากร เป็นหอเฉลิมพระเกียรติ ซึ่ง รร.จปร. น้อมเกล้าฯ จัดถวายเพื่อเฉลิมพระเกียรติ พลเอกหญิง สมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี เนื่องในวโรกาสทรงเจริญพระชนมายุ 48 พรรษา 2 เมษายน 2546
ประวัติความเป็นมา
หอเฉลิมรัฐสีมาคุณากรแต่เดิมเป็นห้องนิทรรศการชั่วคราวสำหรับจัดแสดงพระรูปพระราชกรณียกิจใน "ทูลกระหม่อมอาจารย์" พลเอกหญิง สมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี ที่ทรงปฏิบัติ ณ รร.จปร. และพื้นที่นครนายก ซึ่งบางส่วนเคยจัดแสดงแล้ว เมื่อครั้งเสด็จฯ ทรงเปิดอาคารกองวิชาประวัติศาสตร์ 26 ธันวาคม 2536 ต่อมาในปี 2544 พลโทสมชาย อุบลเดชประชารักษ์ ผู้บัญชาการ รร.จปร. ขณะนั้น ให้ปรับปรุงเป็นหอเฉลิมพระเกียรติสำหรับจัดแสดงพระรูปและสิ่งของต่างๆ เกี่ยวกับพระราชกรณียกิจ เพื่อเทิดพระเกียรติและเผยแพร่พระมหากรุณาธิคุณที่มีต่อ รร.จปร. และพสกนิกรจังหวัดนครนายก การปรับปรุงและการจัดแสดงมาแล้วเสร็จในขณะที่พลโทชาตรี ศิรศรัณย์ ดำรงตำแหน่งผู้บัญชาการ รร.จปร.
พระราชทานนาม และเสด็จฯ ทรงเปิด "หอเฉลิมรัฐสีมาคุณากร"
ในระหว่างดำเนินการปรับปรุง ทูลกระหม่อมอาจารย์ทรงพระกรุณาโปรดเกล้าฯ พระราชทานชื่อหอเฉลิมพระเกียรตินี้ว่า "หอเฉลิมรัฐสีมาคุณากร" ซึ่งประกอบขึ้นจากสร้อยพระนาม โดยมีความหมายว่า "หอแห่งการสรรเสริญผู้สร้างคุณความดีแก่ประเทศชาติ" และพระราชทานพระราชานุญาตให้อัญเชิญพระนามาภิไธย "สธ" ประดิษฐานที่ป้ายชื่อ อีกทั้งทรงพระมหากรุณาธิคุณเสด็จฯ ทรงเปิดหอเฉลิมรัฐสีมาคุณากรเมื่อ 5 สิงหาคม 2545
แนวคิดหลักของการจัดแสดง
หอเฉลิมรัฐสีมาคุณากรมุ่งสื่อแสดงว่า พระราชกรณียกิจที่ทูลกระหม่อมอาจารย์ทรงปฏิบัติ ณ รร.จปร. นับแต่พุทธศักราช 2523 สืบมาจนถึงปัจจุบันได้มีส่วนก่อให้เกิดการเปลี่ยนแปลงและการพัฒนา รร.จปร. ด้านต่างๆ ไม่โดยทางตรงก็ทางอ้อม เปรียบเสมือนทรงรับช่วงพระราชกรณียกิจที่พระมหากษัตริย์และพระบรมวงศานุวงศ์พระองค์ต่างๆ เคยทรงปฏิบัติไว้ ประดุจทรงเป็นสะพานเชื่อมอดีตกับปัจจุบัน เพื่อทอดยาวสู่อนาคตต่อไป นอกจากนั้นยังมุ่งแสดงพระราชกรณียกิจด้านการพัฒนาในพื้นที่จังหวัดนครนายกอีกด้วย
เนื้อหาการจัดแสดง
การจัดแสดงภายในหอเฉลิมรัฐสีมาคุณากรนั้น แบ่งเป็น 3 ส่วน ส่วนที่หนึ่ง (ส่วน A) เน้นพระราชกรณียกิจที่ทูลกระหม่อมอาจารย์ทรงปฏิบัติตลอดระยะเวลากว่า 20 ปี ณ รร.จปร. เช่น การทรงสอนและบริหาร โดยอัญเชิญพระรูป และสิ่งของส่วนพระองค์มาจัดแสดงส่วนหนึ่ง อีกส่วนหนึ่งเป็นผลงานทางวิชาการต่างๆ ของกองวิชาประวัติศาสตร์ที่ทรงส่งเสริมและสนับสนุนให้ดำเนินการ
ส่วนที่สอง (ส่วน B) จัดแสดงสิ่งของ ซึ่งแยกเป็น 2 ประเภท ประเภทแรกคือ สิ่งของที่ทูลกระหม่อมอาจารย์พระราชทานแก่กองวิชาประวัติศาสตร์ ประกอบด้วยสิ่งของบางรายการที่มีทูลเกล้าฯ ถวายในการเสด็จฯ นำ นนร. ทัศนศึกษา และสิ่งของที่มีผู้ทูลเกล้าฯ ถวายในวาระอื่นๆ ประเภทที่สองคือ สิ่งของบางรายการที่มีผู้มอบให้กองวิชาประวัติศาสตร์
ส่วนที่สาม (ส่วน C) แสดงพระรูปและสิ่งของเพื่อแสดงให้เห็นว่า พระราชดำริที่กว้างไกล และพระราชกรณียกิจที่ไม่ได้ขีดวงจำกัดเพียงภายในรั้ว รร.จปร. ก่อให้เกิดการศึกษาวิจัยพื้นที่จังหวัดนครนายกอย่างเป็นระบบ และมีส่วนช่วยขยายการพัฒนาออกไปยังชุมชนภายนอก และก่อให้เกิดโครงการพัฒนาพื้นที่จังหวัดนครนายกด้านต่างๆ โดยเฉพาะอย่างยิ่งด้านการศึกษา
เขตธนบุรี LINK
สำนักงานเขตธนบุรี ร่วมกับศูนย์บริการสาธารณสุข 26 ศูนย์บริการสาธารณสุข 27 และศูนย์บริการสาธารณสุข 36 บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง สุนัขและแมว บริการฟรีไม่มีค่าใช้จ่าย สอบถามโทร. 02-4650025 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เขตธนบุรี
เหล้าอสุรา สุราชุมชนเชียงใหม่ มันฝรั่งวัตถุดิบหลัก
"ASURA" เหล้าอสุรา สุราชุมชนจากจังหวัดเชียงใหม่ วัตถุดิบหลักเป็นมันฝรั่งของจังหวัดเชียงใหม่กับแม่ฮ่องสอน ที่ถือว่าเป็นแหล่งปลูกมันฝรั่งชั้นดีของประเทศไทย เขาใช้หัวมันฝรั่งมาผสมกับยีสต์สายพันธุ์เชียงใหม่เพาะเลี้ยงด้วยสมุนไพรไทย เช่น ม้ากระทืบโรง ทำให้เหล้าอสุรามีรสชาติ ความซ่าในลำคอ ที่เป็นเอกลักษณ์เฉพาะตัวของเหล้าอสุรา
ขวดแสตนเลสอสุราถูกสั่งทำขึ้นมาแบบพิเศษ โดยใช้เกรดแสตนเลส 304 ที่จัดอยู่ในระดับฟู้ดเกรด มีคุณสมบัติทนต่อการกัดกร่อน จึงไม่ทำปฏิกริยากับน้ำสุรา ผ่านการตรวจสอบอย่างละเอียดจากกลุ่มวิเคราะห์ของกรมสรรพสามิตแล้ว มั่นใจได้ว่าไม่อันตรายต่อสุขภาพ เป็นความพยายามที่จะฉีกภาพจำของสุรากลั่นทั่วไปของไทยมีระดับขึ้นไปอีกขั้นหนึ่ง
Trip 4 : วันที่ 23 และ 24 กันยายน 66 (ไปเช้ากลับเย็น) ทริปอิ่มบุญ@ฉะเชิงเทรา
วันที่ 23 และ 24 กันยายน 66 (ไปเช้ากลับเย็น) โปรแกรม “ทริปอิ่มบุญ ปันรอยยิ้มให้น้อง @ฉะเชิงเทรา ราคา 1,499 บาท
โครงการเพื่อสังคมเกี่ยวกับสัตว์เลี้ยง
บ้านรักหมาศาลายา
ชื่อหน่วยงาน : โครงการรณรงค์เพื่อสวัสดิภาพสุนัขจรจัด มหาวิทยาลัยมหิดล ศาลายา และพัฒนาต้นแบบสาธิตการจัดการสุนัขจรจัดในชุมชนอย่างยั่งยืน
ที่อยู่ :คณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล 999 ถนนพุทธมณฑล สาย 4 ต.ศาลายา อ.พุทธมณฑล จ.นครปฐม 73170
โทรศัพท์ 02-441-5242 คุณเมธาวี (เจ้าหน้าที่ประชาสัมพันธ์คณะฯ)
โทรศัพท์ 063-241-1048 คุณปรเมศ (เจ้าหน้าที่โครงการ)
โทรสาร 02-441-0773 (โปรดระบุ บ้านรักหมา) สามารถติดต่อได้ในวันและเวลาราชการ
facebook :
บ้านรักหมาศาลายา มหาวิทยาลัยมหิดล - Salaya Dog Shelter Mahidol University
แผนที่
หมายเหตุ : หากข้อมูลไม่ถูกต้อง/ไม่อัพเดต หรือต้องการเพิ่มเติมข้อมูลในเพจนี้ แจ้งมาได้ที่ healthserv.net@gmail.com
สาขาวิชารังสีเทคนิค ในห้องแล็บ ศูนย์พักพิงสุนัขจรจัด อบต.ไร่รถ อำเภอดอนเจดีย์
ศูนย์พักพิงสุนัขจรจัด ขององค์การบริหารส่วนตำบลไร่รถ อำเภอดอนเจดีย์ เป็นศูนย์พักพิงสุนัขจรจัด บนที่ดินสาธารณะ หมู่ที่ 7 บ้านสำนักโก ตำบลไร่รถ อำเภอเดอนเจดีย์ จังหวัดสุพรรณบุรี ก่อสร้างโดย นายวรภพ ฉิมพันธ์ นายกองค์การบริหารส่วนตำบลไร่รถ พร้อมด้วยครอบครัวฉิมพันธ์ และร่วมกับ ผู้มีจิตศรัทธา และงบส่วนตัว เพื่อเป็นการดูแลสุนัขที่ถูกทอดทิ้ง
ที่ผ่านมา ปลัดจังหวัดสุพรรณบุรี พร้อมด้วยทีมจิตอาสา ได้เดินทางมาเยี่ยมศูนย์พักพิงสุนัขจรจัด เพื่อทำการฉีดยาป้องกันโรคพิษสุนัขบ้า และฉีดวัคซีนรวมป้องกันโรคต่างๆ ให้กับสุนัข ปัจจุบันนี้ มีสุนัขที่จะต้องดูแลจำนวน 87 ตัว
นายวรภพ ฉิมพันธ์ นายก อบต.ไร่รถ กล่าวว่า สืบเนื่องจากมีข่าวออกมาจากสื่อ ทางโซเชียลว่า รัฐบาลจะเก็บภาษีในการเลี้ยงสัตว์สุนัขและแมว จึงทำให้ประชาชนเกิดการปล่อยทิ้งสุนัขและแมว ตามวัด โรงเรียน และสถานที่ต่างๆ ทำให้เกิดสุนัขและแมวจรจัดไร้ที่อยู่อาศัย และคนดูแล จึงปรึกษาหารือกับชาวบ้าน หมู่ที่ 7 สำนักโก จะขอแบ่งพื้นที่สาธารณะ จำนวน 1 ไร่ เพื่อจัดสร้างเป็นที่อยู่อาศัยให้กับสุนัขจรจัดที่ถูกทอดทิ้ง ซึ่งทาง นายนิมิต วันไชยธนวงศ์ ผู้ว่าราชการจังหวัดสุพรรณบุรี และปลัดจังหวัด ได้จัดตั้งกองทุนและรับบริจาคจากผู้ใจบุญมาสร้างที่อยู่อาศัยชั่วคราวไปก่อน และซื้ออาหารให้กับสุนัขจรจัดที่ถูกทอดทิ้ง อีกด้วย
- ไม่ได้เป็นผู้ชายที่แปลงเพศมาเพื่อลงแข่งในกีฬาของสุภาพสตรี แต่เป็นคนที่มีสภาวะที่เรียกว่ามีลักษณะทางกายภาพที่แตกต่างจากคนทั่วไปจนไม่สามารถระบุเพศที่ชัดเจนได้ว่าจริงๆ แล้วควรเป็นชายหรือหญิง (Intersex)
- ตั้งแต่เกิดถูกครอบครัวเลี้ยงดูมาในฐานะผู้หญิง โดยทั้งในใบเกิด พาสปอร์ต รวมไปถึงเอกสารทางราชการต่างๆ ก็ระบุเพศสภาพว่าเป็นผู้หญิง
- ก่อนจะเป็นนักมวย เธอชื่นชอบกีฬาฟุตบอล ซึ่งครอบครัวเธอไม่สนับสนุนให้ชกมวย เพราะคิดว่าเป็นกีฬาของผู้ชาย
- ทุกรายการที่ลงแข่งขันเป็นการแข่งในฐานะผู้หญิงทั้งหมดนับตั้งแต่ปี 2018 จนมาถึง โอลิมปิก 2024 จะมีเพียงแค่ในปี 2023 ในรายการที่จัดขึ้นโดย IBA (รายการ Women’s World Boxing Championship) เท่านั้นที่ตัดสิทธิ์การแข่งขันหลังตรวจพบว่ามีฮอร์โมนเพศชายมากกว่าเพศหญิง (เทสโทสเตอโรน) ในตอนนั้นเธอคิดว่าตัวเองตกเป็นเหยื่อของคนที่ไม่ตัองการให้แอลจีเรียได้แชมป์
- สาเหตุที่สามารถลงแข่งขันในโอลิมปิกได้เพราะหน่วยงานที่จัดการแข่งขันครั้งนี้ไม่ใช่ IBA แต่เป็น คณะกรรมการโอลิมปิกสากล (IOC) ที่มีกฏกติกาการรับสมัครนักกีฬาคนละแบบกับทาง IBA (สำหรับสาเหตุที่ IBA ไม่ได้จัดการแข่งขันในปีนี้เนื่องจากมีมติไม่ไว้วางใจจากปัญหาความโปร่งใสในองค์กรที่ให้สิทธิพิเศษแก่รัสเซีย)
- ทั้งนี้ในปี 2020 ก็เคยเข้าร่วมโอลิมปิก แต่ตกรอบก่อนรองชนะเลิศ ในตอนนั้นก็ไม่ได้ถูกพูดถึง และเป็นประเด็นมากขนาดนี้ ซึ่งจากการได้ลงแข่งในโอลิมปิก 2020 ทำให้ IOC ตัดสินใจให้เธอสามารถลงแข่งขันในครั้งนี้ได้
- อีกหนึ่งเหตุผลที่รองรับการเป็นผู้หญิงของเธอคือ ในประเทศแอลจีเรียการแปลงเพศเป็นเรื่องผิดกฏหมาย ซึ่งหลังจากมีประเด็นร้อนแรง คณะกรรมการโอลิมปิกของแอลจีเรียได้ออกมาปกป้องเธอ และประนามบุคคลที่ต่อว่า และด้อยค่าความเป็นผู้หญิงของเธอ
24 ก.พ. - 31 มี.ค. 2565 อบต.บางน้ำจืด ทำหมันสุนัขฟรี กับ (Soidog)
องค์การบริหารส่วนตำบลบางน้ำจืด จังหวัดสมุทรสาคร ประชาสัมพันธ์ ทำหมันสุนัขฟรี กับ (Soidog) ตั้งแต่วันที่ 24 ก.พ. - 31 มี.ค. 2565 (วันจันทร์ - วันศุกร์ เวลา 09.00 - 16.00 น.) บริเวณหลังคาโค้ง สนามกีฬา อบต.บางน้ำจืด (ให้บริการวันละ 40 ตัว) ท่านที่จะนำสุนัขมาเข้ารับบริการ กรุณา ติดต่อ จองคิวล่วงหน้าที่เบอร์ 063-038-9879 และ 094-932-9698 หรือ สามารถสอบถามข้อมูลเพิ่มเติมได้ที่ 063-038-9879 และ 094-932-9698
22 กรกฎาคม 2567 ทีมอาสาหมาแมวเมืองเหน่อ @เดิมบาง ทำหมันหมาฟรี
ทีมอาสาหมาแมวเมืองเหน่อ @เดิมบาง จัดกิจกรรมทำหมันหมาฟรี! วันจันทร์ที่ 22 กรกฎาคม 2567 ณ สมาคมจีน ตลาดท่าช้าง ให้บริการกับประชาชนในพื้นที่ ต.เขาพระ ม.1. และ 3-9 มีรถรับส่งให้ฟรี ฉีดยาพิษสุนัข ยากำจัดเห็บหมัดให้ ฟรี! แจ้ง อสม. ใกล้บ้าน สอบถามโทร 096-2428926 คุณดา ร้านนายฮั่นการไฟฟ้า (กิจกรรมนี้เป็นหน่วยสัญจรที่ทำหมันเฉพาะสุนัข ทำสัญญากับมูลนิธิเพื่อสุนัขในซอย แค่ 3 ตำบลในอำเภอเดิมบางบางนางบวช (เขาพระ หัวเขา และยางนอน) 3 ตำบล ในอำเภอสองพี่น้อง (หนองบ่อ บ่อสุพรรณ และทุ่งคอก) ไม่อกหน่วยนอกเขตพื้นที่ทำสัญญา)
Trip 4 : เสาร์ที่ 22 และอาทิตย์ที่ 23 กรกฎาคม @เขาชะงุ้ม เที่ยวเมืองโอ่งราชบุรี (พักค้างคืน)
7 และ 8 กันยายน 2567 แบบไปเช้ากลับเย็น โปรแกรม เติมฝันให้น้อง ล่องเรือดำเนิน เพลิดเพลินที่ราชบุรี
วันที่ 7 และ 8 กันยายน 67 แบบไปเช้ากลับเย็น โปรแกรม “เติมฝันให้น้อง ล่องเรือดำเนิน เพลิดเพลินที่ราชบุรี จังหวัดราชบุรี” ร่วมเติมฝัน ปันสุขให้น้อง ที่ศูนย์การศึกษาพิเศษ ชวนล่องเรือสัมผัสวิถีชุมชน ผ่านตลาดน้ำเหล่าตั๊กลัก ตลาดน้ำดำเนิน และร่วมกิจกรรมเพ้นท์โอ่งที่โรงโอ่งรัตนโกสินทร์ ราคาท่านละ 1,499 บาท
14 และ 15 กันยายน 2567 แบบไปเช้าเย็นกลับ โปรแกรม ปันสุข เสริมบุญ ที่วัดพระบาทน้ำพุ ลพบุรี
วันที่ 14 และ 15 กันยายน 67 แบบไปเช้าเย็นกลับ โปรแกรม “ปันสุข เสริมบุญ ที่วัดพระบาทน้ำพุ จังหวัดลพบุรี” พาเช็กอินวัลลภาฟาร์ม ร่วมเติมฝัน ปันสุข สร้างกำลังใจที่ดีให้แก่กัน ที่วัดพระบาทน้ำพุ และเยี่ยมชมวัดพระศรีรัตนมหาธาตุ ราคาท่านละ 1,499 บาท
21 และ 22 กันยายน 2567 แบบไปเช้ากลับเย็น โปรแกรม ของเด็ดสวนตาล กับเส้นทางปันสุข เพชรบุรี
วันที่ 21 และ 22 กันยายน 67แบบไปเช้ากลับเย็น โปรแกรม “ของเด็ดสวนตาล กับเส้นทางปันสุข จังหวัดเพชรบุรี” พาเพลิดเพลินสวนตาลลุงถนอม แวะชมไร่เพชรมาลัยกุล ชม ชิม ชอปสินค้า พื้นเมือง พร้อมชวนร่วมเติมฝัน ปันสุขให้กับน้องที่โรงเรียนธรรมิกวิทยา ราคาท่านละ 1,499 บาท
28 และ 29 กันยายน 2567 แบบไปเช้าเย็นกลับ โปรแกรม เติมฝันกับ Influencer ณ เมืองแปดริ้ว ฉะเชิงเทรา
วันที่ 28 และ 29 กันยายน 67 แบบไปเช้าเย็นกลับ โปรแกรม “เติมฝันกับ Influencer ณ เมืองแปดริ้ว จังหวัดฉะเชิงเทรา” พาผ่อนคลายเติมพลังจากธรรมชาติ ที่แสนภูดาษ เฮลท์ แอนด์ เวลเนส คลับแวะตั้งเซ่งจั้วแสนภูดาษ เฉินเตี้ยนคาเฟ่ เยี่ยมชมตลาดเก่าคลองสวน 100 ปี สักการะหลวงพ่อโสธร วัดวีระโชติธรรมาราม พร้อมเติมฝัน ปันสุขให้แก่น้อง ๆ และชมวิวยามเย็นกลางสะพานแม่น้ำบางปะกง โดยมี Influencer ร่วมเดินทางและทำกิจกรรมตลอดทริป ราคาท่านละ 1,499 บาท
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตป้อมปราบศัตรูพ่าย
Preliminary Screening List
สตูล - กักตัว 14 วัน LINK
10 เมย 64
เดินทางมาจากพื้นที่ติดเชื้อตามสธ.ประกาศ
รายงานตัวกับจนท.ทันที
กักตัวในที่พัก (Home quarantine) และแยกจากผู้อื่นในการดูแลของจพง. 14 วัน
หากมาจากพื้นที่อื่น ลงทะเบียนผ่าน
QR Code
ทุกคนต้องโหลดแอป หมอชนะ พร้อมปฏิบัติตามมาตรการอย่างเคร่งครัด
สายด่วน
สตูลCovid-19 061-1733317 082-3962085
สถาณการณ์โควิดสตูล สอบถามเพิ่มเติมที่
093-634-3357, 093-639-4113, 098-723-8362, 098-681-2742, 093-635-1182, 086-396-2085
ผู้ว่าฯ ขอความร่วมมือและกำชับ มาตรการความปลอดภัยในการจัดงานเทศกาลปีใหม่
ผู้ว่าราชการจังหวัดกาฬสินธุ์ นายทรงพล ใจกริ่ม ขอความร่วมมือและกำชับเกี่ยวมาตรการความปลอดภัยในการจัดงานเทศกาลปีใหม่ สำหรับกิจกรรม/กิจการที่มีความเสี่ยง ดังนี้
1.ให้ทุกส่วนราชการ หน่วยงานของรัฐ รัฐวิสาหกิจ และองค์กรปกครองส่วนท้องถิ่นงดจัดกิจกรรมและการเฉลิมฉลองเทศกาลปีใหม่ประจำปี พ.ศ.2565 เพื่อเป็นการป้องกันการแพร่ระบาดโรคติดเชื้อไวรัสโควิด – 19
2.ขอความร่วมมือประชาชน และภาคเอกชนงดจัดกิจกรรมและการเฉลิมฉลองเทศกาลปีใหม่ประจำปี พ.ศ.2565 เพื่อเป็นการป้องกันการแพร่ระบาดโรคติดเชื้อไวรัสโควิด – 19
3.ขอความร่วมมือข้าราชการ เจ้าหน้าที่ ลูกจ้าง พนักงาน และประชาชนที่เดินทางออกนอกพื้นที่จังหวัดกาฬสินธุ์ในช่วงเทศกาลปีใหม่ ขอให้ตรวจคัดกรองโรคติดเชื้อโควิด – 19 ด้วยวิธี ATK ด้วยตนเองและแสดงผลการตรวจต่อหน่วยงานต้นสังกัด หากผลการตรวจเป็นบวกให้แจ้งเจ้าหน้าที่สาธารณสุขทันที
4.ให้บุคคลที่เดินทางเข้ามาในราชอาณาจักร ตั้งแต่วันที่ 12 ธันวาคม 2564 รายงานตัวต่อเจ้าพนักงานควบคุมโรคติดต่อในพื้นที่ เมื่อเข้ามาพักอาศัย หรือปฏิบัติงานในพื้นที่จังหวัดกาฬสินธุ์
โดยยึดมาตรการของกระทรวงสาธารณสุข และมาตรการจังหวัดกาฬสินธุ์ ในการป้องกันควบคุมโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ในช่วงที่มีการเเพร่ระบาดของโรคโควิด-19 เราสามารถป้องกันตนเองได้โดยยึดหลัก D-M-H-T-T-A ให้ใช้แอปพลิเคชัน “หมอชนะ” สวมหน้ากากอนามัย หรือหน้ากากผ้าอย่างถูกวิธีตามเมื่ออยู่นอกเคหสถานหรือเมื่ออยู่ในที่สาธารณะ เพื่อลดความเสี่ยงในการแพร่ หรือรับเชื้อเว้นระยะห่างทางสังคมอย่างน้อย 1 - 2 เมตร ล้างมือบ่อย ๆ ตรวจ ATK เป็นระยะเมื่อมีความเสี่ยง ไม่ใช้ของร่วมกับผู้อื่น เลี่ยงการสัมผัสหน้ากาก ทานอาหารร้อน ปรุงสุก และสังเกตอาการตนเอง หากมีไข้ หรือมีอาการระบบทางเดินหายใจให้เข้ารับการรักษาที่สถานพยาบาลทันที และขอความร่วมมือให้หน่วยงานที่เกี่ยวข้องเร่งรัดการขับเคลื่อนภารกิจในการกระจายและแจกจ่ายวัคซีนการลงทะเบียนรับวัคซีน การฉีดวัคซีน รวมทั้งการอื่นใดที่เกี่ยวข้องให้เป็นไปอย่างรวดเร็วและมีประสิทธิภาพ เพื่อสร้างความเชื่อมั่นแก่ประชาชนให้เข้ารับการฉีดวัคซีนเพื่อมุ่งลดจำนวนผู้ป่วยและให้เกิดภูมิคุ้มกันหมู่ต่อไป
โรงพยาบาลหนองคาย ฉีดวันที่ 7-11 กุมภาพันธ์ LINK
โรงพยาบาลหนองคาย ฉีดเด็ก 5-11 ปี 7 กลุ่มโรค วันที่ 7-11 กุมภาพันธ์ 9-15 น. ที่ชั้น 4 อาคารเฉลิมพระเกียรติ รพ.หนองคาย สิ่งที่ต้องนำมาด้วย
1. บัตรประชาชนเด็ก 2.ซองยาโรคประจำตัว
เข็ม 2 ห่างกัน 8 สัปดาห์
ยุทธศาสตร์ที่ 3 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านกฎหมายและสังคม
กลยุทธ์
1. บริหารจัดการด้านกฎหมายในทุกหน่วยงาน ให้สอดคล้องกับการปรับตัวเข้าสู่ Post - pandemic
2. ผ่อนคลายมาตรการทางสังคม ลดการ “จํากัดการเดินทางและการรวมตัวของคนหมู่มาก”
3. ทุกภาคส่วนส่งเสริมมาตรการ UP, COVID Free Setting
โดยมีรายละเอียดมาตรการแบ่งตามระยะดําเนินการ ดังนี้
เกษมราษฎร์ รัตนาธิเบศร์ แพ็คเกจดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน LINK
โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ แพ็คเกจดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน
อุ่นใจ ปลอดภัย ภายใต้การดูแลของโรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ (การุญเวชเดิม)
- Package A ราคา 2,900 บาท
- Package B ราคา 3,000 บาท
- Package C ราคา 4,000 บาท
- Package D ราคา 6,500 บาท
เหมาะสำหรับ
- ผู้ที่มีผลตรวจ ATK หรือ RT-PCR พบเชื้อ
- ผู้ป่วยอายุ 5-60 ปี
- ผู้ป่วยที่มีอาการไม่รุนแรง สามารถดูแลตัวเองได้
- อยู่คนเดียว หรือมีที่พักอาศัยที่มีห้องแยก
- ผู้ป่วยไม่มีโรคประจำตัวรุนแรง
สอบถามเพิ่มเติม : 1218 กด 11 ต่อ แผนกประชาสัมพันธ์ และการตลาด
อาหาร เครื่องดื่ม อื่นๆ จากผู้ประกอบการหน้าใหม่ๆ
สอบถามข้อมูลเพิ่มเติม
ข้อ 1.1 ติดต่อ สำนักงานเศรษฐกิจการคลัง โทร. 02 273 9020 ต่อ 3525 3509 3529 หรือกรมสรรพากร โทร. 1161
ข้อ 1.2 - 1.3 ติดต่อ สำนักงานเศรษฐกิจการคลัง โทร 02 273 9020 ต่อ 3521 3508 3548 3526
ข้อ 1.4 - 1.5 ติดต่อ กรมสรรพสามิต โทร. 1713
ข้อ 2 ติดต่อ ธนาคารออมสิน โทร. 02 299 8000 หรือ 1115 ธนาคารเพื่อการเกษตรและสหกรณ์การเกษตร โทร. 02 555 0555 ธนาคารอาคารสงเคราะห์ โทร. 02 645 9000 ธนาคารพัฒนาวิสาหกิจขนาดกลางและขนาดย่อมแห่งประเทศไทย โทร. 02 265 3000 หรือ 1357 ธนาคารเพื่อการส่งออกและนำเข้าแห่งประเทศไทย โทร. 02 169 9999 หรือสายด่วน Hotline 02 037 6099 ธนาคารอิสลามแห่งประเทศไทย โทร. 02 264 3345 หรือ 1302 บรรษัทประกันสินเชื่ออุตสาหกรรมขนาดย่อม โทร. 02 890 9999
ข้อ 3.1 ติดต่อ กรมธนารักษ์ โทร. 02 282 0818
ข้อ 3.2 – 3.3 ติดต่อ สำนักงานคณะกรรมการกำกับหลักทรัพย์และตลาดหลักทรัพย์ โทร. 1207 กด 5
ข้อ 3.4 ติดต่อ สำนักงานคณะกรรมการกำกับและส่งเสริมการประกอบธุรกิจประกันภัย โทร. 02 515 3999 ต่อ 8202 หรือสายด่วน คปภ. โทร. 1186
ข้อ 3.5 ติดต่อ กองทุนเงินให้กู้ยืมเพื่อการศึกษา โทร. 02 016 2695
ข้อ 3.6 ติดต่อ บริษัท บริหารสินทรัพย์ ธนาคารอิสลามแห่งประเทศไทย จำกัด โทร. 0 2055 5999 ต่อ 2266
ข้อ 3.7 ติดต่อ การยาสูบแห่งประเทศไทย โทร. 02 229 1000
พิพิธภัณฑ์ รร.จปร. ณ อาคาร รร.จปร. ๑๐๐ ปี อนุสรณ์สถาน แห่งเกียรติประวัติ
ประวัติ โรงเรียนนายร้อยพระจุลจอมเกล้า และพิพิธภัณฑ์ รร.จปร.
พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัวพระราชทานกำเนิดโรงเรียนนายร้อยชั้นประถมเมื่อวันที่ ๕ สิงหาคม ๒๔๓๐ ทั้งนี้เพื่อให้การศึกษาวิชาการและวิชาทหารแก่พระบรมวงศานุวงศ์และบุตรข้าราชการ โดยพระราชทานนามว่า “โรงเรียนทหารสราญรมย์” หลังจากนั้นมีการ
ปรับปรุงหลักสูตรและเปลี่ยนนามโรงเรียนนายร้อย ดังนี้ ใน พ.ศ. ๒๔๔๐ นาม “โรงเรียนสอนวิชาทหารบก” และใน พ.ศ. ๒๔๔๑ นาม“โรงเรียนทหารบก” ต่อมาใน พ.ศ. ๒๔๔๕ โปรดเกล้าฯให้สร้างโรงเรียนนายร้อยชั้นมัธยมที่ถนนราชดำเนินนอก และเสด็จฯไปทรงประกอบพิธีเปิดในวันที่ ๒๖ ธันวาคม ๒๔๕๒ ครั้นถึงรัชกาลพระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว โปรดเกล้าฯ ให้รวมโรงเรียนชั้นประถมและชั้นมัธยม และเปลี่ยนนามโรงเรียนเป็น "โรงเรียนนาย-ร้อยทหารบก" ต่อมาเพื่อเป็นการเฉลิมพระเกียรติพระบาทสมเด็จ
พระจุลจอมเกล้าเจ้าอยู่หัว พระบาทสมเด็จพระเจ้าอยู่หัวภูมิพลอดุลยเดชโปรดเกล้าฯ พระราชทานนามใหม่ว่า “โรงเรียนนายร้อยพระ-จุลจอมเกล้า” ในวันที่ ๑ มกราคม ๒๔๙๑
โรงเรียนนายร้อยพระจุลจอมเกล้าย้ายจากถนนราชดำเนินนอกมา ณ ที่ตั้งปัจจุบัน อำเภอเมือง จังหวัดนครนายก เมื่อวันที่ ๒๙ กรกฎาคม ๒๕๒๙
พิพิธภัณฑ์ รร.จปร. แห่งนี้ พลเอกหญิงสมเด็จพระเทพ-รัตนราชสุดาฯสยามบรมราชกุมารี เสด็จฯมาทรงวางศิลาฤกษ์ เมื่อวันที่ ๕ สิงหาคม ๒๕๓๐ ซึ่งเป็นวันครบรอบ ๑๐๐ ปี แห่งการสถาปนาโรงเรียนนายร้อยพระจุลจอมแกล้าและ เสด็จฯมาทรงเปิดอาคาร เมื่อวันที่ ๕ สิงหาคม ๒๕๓๓
วัตถุประสงค์ เพื่อเป็นพระบรมราชานุสรณ์แห่งพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว องค์พระผู้พระราชทานกำเนิดโรงเรียนนายร้อยพระจุลจอมเกล้าและเป็นที่จัดแสดงเกียรติประวัติศิษย์เก่า ที่ได้สร้างคุณงามความดี และเสียสละเพื่อประเทศชาติราชบัลลังก์
ชั้นที่ ๑ ประกอบด้วย
ห้องบรรยายสรุปกิจการของโรงเรียนนายร้อยพระจุลจอม
เกล้าด้วยระบบสื่อสารสนเทศ ความจุ ๑๒๐ ที่นั่ง
แสดงวัตถุพิพิธภัณฑ์ของ จอมพล ป.พิบูลสงคราม
แสดงอนุสรณ์แห่งโรงเรียนเท็ฆนิคทหารบก
นักเรียนนายร้อยหญิงรุ่นแรกและรุ่นเดียวของไทย
จัดแสดงเครื่องแบบนักเรียนทหารนานาชาติ
ชุดรับประทานอาหารสำหรับนักเรียนนายร้อยในอดีต
ชั้นที่ ๒ จัดแสดง
เกียรติประวัติของศิษย์เก่าโรงเรียนนายร้อยพระ
จุลจอมเกล้า ในฐานะผู้นำฝ่ายบริหารและฝ่ายนิติ-บัญญัติ
เชิดชูเกียรติประวัติของศิษย์เก่าที่ปฏิบัติราชการสนามในสงครามต่างๆ ซึ่งเป็นภารกิจในการรักษาอธิปไตยและความสงบภายในอันเป็นหน้าที่ของทหารไทยนับตั้งแต่สงครามโลกครั้งที่ ๑ กรณี-พิพาทอินโดจีน สงครามมหาเอเชียบูรพา สงครามเกาหลี และสงครามเวียดนาม การต่อสู้เพื่อเอาชนะผู้ก่อความไม่สงบ
ชั้นที่ ๓ จัดแสดง
พระบรมรูปหล่อหุ่นเรซิ่นรัชกาลที่ ๕ ในฉลองพระองค์ชุดจอมพลทหารบก พร้อมพระราชประวัติย่อ
เรื่องราวเกี่ยวกับกำเนิดและวิวัฒนาการของโรงเรียนนายร้อยพระจุลจอมเกล้า
วัตถุพิพิธภัณฑ์ซึ่งเป็นสิ่งของพระราชทานจากพระบาทสมเด็จพระเจ้าอยู่หัว ภูมิพลอดุลยเดชมหาราช
เขตลาดกระบัง LINK
เขตลาดกระบัง ขอเชิญชวน ประชาชนที่อยู่ในพื้นที่ดังกล่าว นำสัตว์เลี้ยงของท่านมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยเจ้าหน้าที่จะเข้าดำเนินการ ลงพื้นที่แบบ หน่วยเคลื่อนที่ไปยังชุมชนของท่าน ตามวันและเวลาที่ประกาศ
สีแก้ว สุรากลั่นชุมชนนครศรีธรรมราช น้ำตาลต้นจาก100%
"สีแก้ว" สุรากลั่นชุมชนจากจังหวัดนครศรีธรรมราช ใช้วัตถุดิบหลักเป็นน้ำตาลของต้นจาก 100% น้ำตาลจากมีความแปลกตรงที่มีความเค็มในตัวน้ำตาลโดยธรรมชาติ เพราะ "ต้นจาก" อาศัยอยู่ในน้ำเค็มและน้ำกร่อย
สมัยก่อนปู่ย่าตายายนิยมเอาน้ำหวานจาก หรือ น้ำตาลจาก มาหมักในไห ในโอ่ง แอบทำกันในป่า เพราะผิดกฏหมายพอมารุ่นลูกรุ่นหลาน ก็ทำให้ถูกต้องตามกฏหมาย จนกระทั่งเป็นงานและอาชีพสืบต่อๆกันมาจนถึงปัจจุบัน
คำว่า "สีแก้ว" ชื่อนี้มาจากชื่อคนในหมู่บ้านที่คิดค้นวิธีทำเหล้าเป็นคนแรกและตรงกับชื่อตัวหนังตะลุงของทางภาคใต้ เด็กๆจะเรียกลุงสีแก้วหรือตาสีแก้ว เลยเป็นที่มาของ"สุรากลั่นชุมชนสีแก้ว"
ตัวเจ้าของแบรนด์ คุณภิญโญ โบศรี ผู้ริเริ่มก่อตั้ง วิสาหกิจชุมชนแปรรูปน้ำตาลเป็นน้ำตาลผง รวบรวมสมาชิกในหมู่บ้านจำนวน 10 คน ซึ่งทุกๆคนทำไร่จาก-ทำน้ำตาลจากเป็นอาชีพหลักและทำอาชีพนี้กันทั้งหมู่บ้านพื้นที่ประมาณ5,000 กว่าไร่ ในหมู่บ้าน ต.ขนาบนาก อ.ปากพนัง จ.นครศรีธรรมราช
บ้านพักพิงสุนัขจรจัดภูเก็ต
บ้านพักพิงสุนัขจรจัดภูเก็ต เปิดให้อุปการะสุนัข เปิดวันเวลาราชการ จ-ศ 08:30-16:30 น. เอกสารที่ท่านต้องเตรียม ✅ สำเนาบัตรประชาชน หรือพาสปอร์ต ✅ ภาพถ่ายสถานที่เลี้ยง ✅ Map ✅ เอกสารที่ทางบ้านพักพิงสุนัขจรจัด เตรียมให้
บ้านพักพิงสุนัขจรจัดภูเก็ต เปิดรับบริจาคอาหารและสิ่งของเครื่องใช้นะคะ สามารถเข้ามาบริจาคอาหารได้ หรือสามารถติดต่อ โทรมาสอบถาม 095-2765252 และ
ทักมาทางเพจ #ไม่รับเงิน
บ้านพักพิงสุนัขจรจัดภูเก็ต มีช่องทางให้ติดต่อสอบถามปัญหาสุนัขจรจัด หรือต้องการบริจาคอาหารให้กับน้องๆ หากไม่สะดวกเดินทางเข้ามาทางเรามีที่อยู่ในการจัดส่งอาหาร ได้ ติดต่อ โทรมาสอบถาม 095-2765252
ศูนย์ฯ 42 ถนอม ทองสิมา ฉีดวัคซีน วันที่ 2 - 13 กันยายน 2567
ศูนย์ฯสี่สิบสอง ถนอม ทองสิมาขอเชิญชวน ประชาชนนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า วันที่ 2 - 13 กันยายน 2567 เวลา 09.30 - 11.30 น. ตามชุมชนดังนี้ ฟรี หมายเหตุ : น้องหมา น้องแมว อายุตั้งแต่ 3 เดือนขึ้นไป น้องหมา น้องแมวต้องไม่ตั้งครรภ์หรือให้นมลูก น้องหมา น้องแมวต้องสุขภาพดี ***ท่านใดต้องการนำวัคซีนไปฉีดที่บ้านให้เตรียมกระติกใส่น้ำแข็งมารับได้
มิถุนายน 67 โครงการทำหมันให้สุนัขและแมวฟรีครั้งที่ 14 จ.สุพรรณบุรี และ สุโขทัย
โครงการทำหมันให้สุนัขและแมวฟรีครั้งที่ 14 โครงการ "สมาร์ทฮาร์ท ห่วงใยเพื่อนสัตว์เลี้ยง"
• จังหวัดสุพรรณบุรี จะจัดขึ้นในวันที่ 13-14 มิถุนายน ณ สถานพักพิงสุนัขจรจัด แห่งที่ 1 ต.พิหารแดง อ.เมือง ลงทะเบียนได้ที่ จังหวัดสุพรรณบุรี โทรฯ 035-511-021
• จังหวัดสุโขทัย จะจัดขึ้นในวันที่ 17-19 มิถุนายน ณ องค์การบริหารส่วนจังหวัดสุโขทัย ติดต่อลงทะเบียนได้ที่ จังหวัดสุโขทัย โทรฯ 0-5501-9611
10 กรกฎาคม 2567 ศูนย์พักพิงสุนัขจังหวัดสุพรรณบุรี แห่งที่ 1 ทำหมันสุนัขและแมว
ศูนย์พักพิงสุนัขฯ ได้จัดกิจกรรมร่วมกับปศุสัตว์จังหวัดสุพรรณบุรี ปศุสัตว์อำเภอเมืองสุพรรณบุรีในการผ่าตัดทำหมันสุนัขและแมวให้กับประชาชนในเขตเทศบาลเมืองสุพรรณบุรี • เพื่อควบคุมจำนวนประชากรของสุนัขและแมว • เพื่อรองรับการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าในเขตเทศบาลเมืองสุพรรณบุรี • เพื่อลดพฤติกรรมก้าวร้าว • ลดความเสี่ยงในการเกิดโรคมะเร็งบางชนิด
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตสัมพันธวงศ์
สถาบันวัคซีนแห่งชาติ
อาคาร 4 ชั้น 5 ตึกสถาบันบำราศนราดูร เลขที่ 38 ซอยติวานนท์ 14 ต.ตลาดขวัญ อ.เมืองนนทบุรี จ.นนทบุรี 11000
02-580-9729-31
อำนาจเจริญ - กักตัว 14 วัน LINK
11 เมษายน 2564
ประกาศ ด่วน ผู้ที่เดินทางมาจาก เขต/อำเภอ เสี่ยงดังต่อไปนี้ เมื่อมาถึงอำนาจเจริญ ต้องรายงานตัวต่อเจ้าพนักงานควบคุมโรคติดต่อ ได้แก่ กำนัน ผู้ใหญ่บ้าน เจ้าหน้าที่สาธารณสุข หรือ อสม. ในพื้นที่ทันที่ และต้องกักกันตัวที่บ้าน 14 วัน สอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนโควิดอำนาจเจริญ โทร 08 6651 5424 , 09 0241 0098 , 09 3323 4686 และ 09 5192 4903
รพ อํานาจเจริญ โทร 045-511-948
ประกาศสถานที่ เวลา จุดเสี่ยงเพิ่มเติม
25 ธันวาคม 64 สื่อสารความเสี่ยง จ.กาฬสินธุ์ ประกาศสถานที่ เวลา จุดเสี่ยงเพิ่มเติม ให้ประชาชนที่มีประวัติไปสถานที่/เวลาดังกล่าว รายงานตัวต่อจนท.เพื่อตรวจประเมินความเสี่ยง
รพ.น่าน จัดฉีดในวันศุกร์ที่ 4 กุมภาพันธ์ LINK
รพ.น่าน ขอเชิญชวน ลูกหลานที่เป็นกลุ่มเสี่ยง 7 กลุ่มโรค ที่อาศัยในเขตอำเภอเมืองน่าน หรือ ต่างอำเภอที่ได้รับการรักษาที่รพ.น่าน
...รับการฉีดวัคซีนไฟเซอร์ สูตรสำหรับเด็ก (ขวดฝาส้ม)
...ในวันศุกร์ที่ 4 กุมภาพันธ์ เวลา 9.00 - 15.00 น. ที่ห้องประชุมพุทธมนต์โชติคุณ ชั้น 5 อาคารสิริเวชรักษ์ รพ.น่าน
กลุ่มเสี่ยงได้แก่
1.โรคอ้วน ที่มีภาวะทางเดินหายใจอุดกั้น
2.โรคทางเดินหายใจเรื้อรัง รวมทั้งหอบหืดที่มีอาการปานกลางหรือรุนแรง
3.โรคหัวใจและหลอดเลือดสมอง
4.โรคไตวายเรื้อรัง
5.โรคมะเร็งและภาวะภูมิคุ้มกันต่ำ
6.โรคเบาหวาน
7.กลุ่มโรคพันธุกรรม รวมทั้งกลุ่มอาการดาวน์ เด็กที่มีภาวะบกพร่องทางระบบประสาทอย่างรุนแรง และเด็กที่มีพัฒนาการล่าช้า
...ทั้งนี้หากผู้ป่วยเด็กที่อาศัยอยู่ต่างอำเภอ มีความลำบากในการเดินทาง จะมีบริการฉีดวัคซีน ที่รพ.ชุมชน ใกล้บ้านท่านทุกแห่งต่อไป.
เปาโล สมุทรปราการ เปิดให้บริการ Privilege With Hospitel LINK
โรงพยาบาลเปาโล สมุทรปราการ ร่วมกับ โรงแรม O2 Luxury เปิดให้บริการ Privilege With Hospitel
ห้องเดี่ยว เหมาจ่าย (5 วัน) ราคา 19,000.-/คน
ห้องคู่ เหมาจ่าย (5 วัน) ราคา 14,000.-/คน
ห้องเดี่ยว เหมาจ่าย (7 วัน) ราคา 25,000.-/คน
ห้องคู่ เหมาจ่าย (7 วัน) ราคา 18,000.-/คน
สอบถามรายละเอียดเพิ่มเติม 061-7957490 , 094-8386477 (ให้บริการ จันทร์-ศุกร์ เวลา 08.00-17.00 น.)
กล้วยน้ำไท บริการดูแลผู้ป่วย Home Isolation (HI) Self Isolation (SI) Hospitel LINK
โรงพยาบาลกล้วยน้ำไท บริการดูแลผู้ป่วยที่ตรวจพบเชื้อ
เฉพาะผู้ป่วยที่มีผลตรวจ ATK 2ขีด(เป็นบวก) หรือผลตรวจ RT-PCR พบเชื้อเท่านั้น โดยไม่เสียค่าใช้จ่าย ตามเงื่อนไขของสิทธิ์
การดูแลรักษาผู้ป่วย แบ่งเป็น 3แบบ (ตามเงื่อนไขของสิทธิ์ที่มี)
- Home Isolation (HI)
- Self Isolation (SI) เจอแจกจบ
- Hospitel
ขั้นตอนการเข้าพักรักษา
1. โทรตามเบอร์ที่ให้ไว้ เพื่อเข้าระบบการรักษาหรือสอบถาม
โทร. 064-5590454 (นัท) คุณสิทธิพล โกเมนทร์
โทร. 064-5699098 (โอม) คุณธนพัฒน์ พุทธจง
** ทุกวัน เวลา 8.00-19.00 น.**
เงื่อนไขการเข้าพักรักษา ในความดูแลของ รพ.กล้วยน้ำไท
- ทุกสิทธิ์การรักษาที่มี
- ผู้ป่วยต้องมีผลตรวจ ATK เป็นบวก หรือมีผลตรวจ Rt-PCR พบเชื้อ
- เริ่มตั้งแต่ 7 เม.ย. 2565 หรือจนกว่าจะเปลี่ยนแปลง
สอบถามเพิ่มเติมโทร.02-3812071-5
ให้บริการทุกวัน เวลา 8.00-17.00น.
420 Cannabis Bar Bangkok Nature is not a crime
420 Cannabis Bar Bangkok Nature is not a crime
แสงเรืองนีออนใบไม้เจ็ด แฉกแหวกความมืดมาเชื้อเชิญ พร้อมกับยื่นเครื่องดื่มน่าชื่นใจ ชวนลอง ศรีนครินทร์-บางนา
สวัสดิการทั่วถึงสำหรับเด็ก
- เพิ่มค่าอาหาร จาก 20 บาท เป็น 32 บาทและอุปกรณ์ศูนย์เด็กเล็ก จาก 100 บาท เป็น 600 บาท
- อาหารเช้า/กลางวัน ฟรี
- ชุดนักเรียนฟรี ลดการใส่เครื่องแบบ
- ผ้าอนามัยฟรี
สวัสดิการทั่วถึงสำหรับคนไร้บ้าน
- จัดจุด drop-in 4 จุด ตัดผม ซัก อบ อาบ ตรวจสอบสิทธิสวัสดิการ ตรวจสุขภาพ ลงทะเบียนจ้างงาน
- จัดระเบียบการแจกอาหาร
- จัดที่อยู่อาศัย อยู่อาศัยระยะยาว อยู่อาศัยชั่วคราว (บ้านพักคนละครึ่ง)
สวัสดิการทั่วถึงสำหรับคนพิการ
- จ้างงานคนพิการ 323 คน
- พัฒนาระบU LIVE CHAT AGENT
- โรงเรียนเรียนร่วม 158 โรงเรียน
- นำร่องอบรมครูเรียนรวม 2 โรงเรียน
- LINE OA กรุงเทพเพื่อทุกคน : ฐานข้อมูล และสิทธิประโยชน์ สำหรับคนพิการ
- รถรับส่งคนพิการ โดยกรุงเทพธนาคม
อาสาสมัครเทคโนโลยีประจำชุมชน
266 คน จาก 31 เขต
Food bank
ส่งต่ออาหารส่วนเกินจากผู้ให้สู่กลุ่มคนเปราะบางใน 10 เขตนำร่อง
คลองสาน บางกอกน้อย บางพลัด บางขุนเทียน บางแค ภาษีเจริญ
ส่งเสริมอาชีพ
- สร้างแรงงานตอบโจทย์ตลาดแรงงาน
- สร้างผู้ประกอบการ
การเรียนรู้
- คัดกรองเด็กยากจนพิเศษเพื่อขอรับทุนการศึกษาจากกสศ. 6,159 คน
- ปลดล็อกครู เพิ่มเจ้าหน้าที่ธุรการและการเงิน ลดภาระงานเอกสารครู ปรับเกณฑ์การเลื่อนวิทยฐานะให้เป็นมาตรฐานสากล
- เปิดโรงเรียนสู่การเรียนรู้ (Saturday School) 85 โรงเรียน
- พื้นที่นวัตกรรมการศึกษา (Education Sandbox) 54 โรงเรียน
- พัฒนาเทคโนโลยีการศึกษา เช่าระบบคอมผิวเตอร์ใหม่ทุกโรงเรียน
- พื้นที่เรียนรู้นอกห้องเรียน
34 ห้องสมุด / 140 บ้านหนังสือ 1 970 ลานกีฬา / 12 ศูนย์กีฬา / 2 พิพิธภัณฑ์เด็ก / 24 พิพิธภัณฑ์ท้องถิ่น / 35 ศูนย์เยาวชน / 103 สวนสารารณะ
- กิจกรรมในพื้นที่ มากกว่า 200 ครั้ง ใน 6 เดือน
เฉลี่ย 4 - 5 กิจกรรมต่อสัปดาห์ มีผู้เข้าร่วมมากกว่า 500,000 คน
เศรษฐกิจสร้างสรรค์
- ส่งเสริมผลิตภัณฑ์ชุมชน
ONLINE 93 ร้าน ยอดขาย 1.85 ล้าน
OFFLINE ตลาดชุมชน / พื้นที่ออกร้านตามกิจกรรม / เทศกาล
- ย่านสร้างสรรค์
กลุ่มผ่านประวัติศาสตร์และวัฒนธรรมสร้างสรรค์
กลุ่มผ่านพาณิชยกรรมสร้างสรรค์
กลุ่มย่านชุมชนและวิถีชีวิตสร้างสรรค์
- จัดตั้งคณะทำงาน 27 คณะ อาทิ กรุงเทพฯ กลางแปลง BKK Ranger ดิปาวาลี ดนตรีในสวน
สุราเทวะ สุราชุมชนเขาคิชฌกูฏ
"สุราเทวะ" สุราชุมชนจากอำเภอเขาคิชฌกูฏ จังหวัดจันทบุรีที่มีต้นกำเนิดจากชนเผ่าชอง ชนเผ่าพื้นบ้านของจันทบุรี ซึ่งต่อยอดมาจากแบรนด์สุรา "ต้นทองหลาง" ที่เป็นหนึ่งในสุราชุมชนผลิตจากข้าวกล้อง เป็นภูมิปัญญาส่งต่อมาและรักษาไว้โดย พ่อทุย ศรีเมือง ตั้งแต่สมัยที่ต้องลักลอบต้มในป่า จนได้เป็นวิสาหกิจชุมชน เป็นเจ้าเดียวที่หมักในโอ่งดิน และลูกแป้งสูตรเฉพาะ จึงมีเอกลักษณ์แบบท้องถิ่น
ตอนนี้ผลิตสืบทอดกันมาเป็นรุ่นที่ 3 กำลังมีการต่อยอดเป็นเหล้าจินและวอดก้า โดยนำผลไม้พื้นถิ่นเข้ามาผสมผสาน กำลังจะออกมาให้พวกเราได้ยลโฉมเร็วๆ นี้
ปราย พันแสง
ฟาดกันดุเดือดไปทั้งโลก เลยเอามาเล่าต่อ ลองฟังความจากอีกมุม เขาบอกว่า : อีเมน เคลีฟ (Imane Khelif) น่ะนิยามตัวเองว่าเป็นผู้หญิงมาโดยตลอด ผ่านการตรวจสอบตามกฎเกณฑ์และมีสิทธิ์ทุกอย่างในการแข่งขัน WIRED Italia ของประเทศอิตาลี ระบุว่า ไม่ว่า เจ.เค.โรว์ลิง, อีลอน มัสค์ หรือชาวโลกจะพูดถึงเรื่องนี้อย่างไรก็ไม่สามารถลบล้างข้อเท็จจริงว่าเธอเป็นหญิง
ที่สำคัญ ในโอลิมปิกโตเกียว
เธอเคยชกแพ้ผู้หญิง
นักมวยชาวแอลจีเรีย อีเมน เคลีฟ ชนะการแข่งขันกีฬาโอลิมปิกที่ปารีสปี 2024 เมื่อคู่ต่อสู้ของเธอ แองเจลา คารินิ (Angela Carini) จากอิตาลี ยกธงขาวยอมแพ้หลังจากโดนชกหนักหน่วงเข้าที่ใบหน้าหลายครั้งในวินาทีแรกของการแข่งขัน
ชัยชนะดังกล่าวทําให้เกิดการโต้เถียงเกี่ยวกับ อีเมน เคลีฟ ซึ่งตกเป็นเป้าหมายของนักวิจารณ์เรื่องเพศของเธอตลอดการแข่งขัน
เว็บไซต์ WIRED Italia ของประเทศอิตาลีเผยแพร่บทความเรื่อง The Shameful Controversy Over Olympic Boxer Imane Khelif ในภาษาอิตาเลียน ระบุว่า อีเมน เคลีฟ เกิดในปี 1999 ที่เมืองเทียเรต์ ประเทศแอลจีเรีย เคลิฟชกมวยมาตั้งแต่เธอยังเป็นเด็กและเคยแข่งขันในประเภทหญิงมาโดยตลอด (ลิงค์บทความอยู่ในคอมเมนต์)
#ปารีสเกมส์2024 #โอลิมปิก2024 #ImaneKhelif #Genderation
ในอาชีพการงานของเธอ เธอเข้าแข่งขัน Women’s World Boxing Championships ที่กรุงนิวเดลีในปี 2018 จากนั้นเข้าแข่งขันที่รัสเซียในปีต่อมา
อีเมน เคลีฟ เข้าแข่งขันในกีฬาโอลิมปิกที่โตเกียวจนถึงรอบก่อนรองชนะเลิศ โดยพ่ายแพ้แก่นักมวยหญิง เคลลี่ แฮร์ริงตัน (Kellie Harrington)
การแข่งขันนี้เกิดขึ้นในรอบชิงเหรียญทองของกีฬามวยสากลหญิง รุ่นไลท์เวท (60 กิโลกรัม) ในโอลิมปิกฤดูร้อน 2020 ที่โตเกียว
เคลลี่ แฮร์ริงตัน เป็นนักชกจากไอร์แลนด์ ส่วน อีเมน เคลีฟเป็นตัวแทนจากแอลจีเรีย ทั้งสองคนต่างผ่านเข้ามาถึงรอบชิงชนะเลิศด้วยฟอร์มการชกที่ยอดเยี่ยม
ในการแข่งขัน แฮร์ริงตันใช้ประสบการณ์และทักษะการเคลื่อนไหวที่ดีกว่าเอาชนะไปได้ โดยชนะคะแนนเอกฉันท์จากกรรมการทั้ง 5 คน
เคลลี่ แฮร์ริงตัน สามารถควบคุมจังหวะการชกได้ดีกว่า ใช้ความเร็วและการเคลื่อนไหวที่แม่นยำในการหลบหลีกและโจมตี ในขณะที่เคลีฟพยายามใช้พลังและความดุดันในการต่อสู้
แม้เคลีฟจะพ่ายแพ้ แต่การได้เหรียญเงินในการแข่งขันครั้งนี้ถือเป็นความสำเร็จครั้งสำคัญของเธอและวงการกีฬาของแอลจีเรีย
นอกจากนี้ อีเมน เคลีฟ ได้อันดับสองในการแข่งขันชิงแชมป์โลกหญิงปี 2022 ที่อิสตันบูล
ทุกอย่างดูเหมือนจะดําเนินไปอย่างราบรื่นจนถึงเวิร์ลคัพ 2023 ซึ่งจัดโดยสมาคมมวยนานาชาติ IBA ที่นําโดยรัสเซีย ซึ่งไม่ได้รับการยอมรับจากคณะกรรมการโอลิมปิกสากล ตัดสิทธิ์เคลีฟหลังจากการทดสอบคุณสมบัติทางเพศที่ถูกกล่าวหาว่าพบว่าเธอมีโครโมโซม XY
Umar Kremlev ประธาน IBA กล่าวว่าทั้งเคลีฟและนักมวยชาวไต้หวัน หลิน หยู ถิง (Lin Yu-ting)ซึ่งถูกกล่าวหาว่ามีผลการทดสอบที่คล้ายคลึงกัน "กําลังพยายามหลอกลวงเพื่อนร่วมงานและแสร้งทําเป็นผู้หญิง" คราวนั้น อีเมน เคลีฟได้โต้แย้งข้อกล่าวหา
การโต้เถียงโอลิมปิก
ทั้งเคลีฟและหลินได้รับการยอมรับในการแข่งขันชกมวยโอลิมปิก กฎการรับในกรณีนี้ได้รับการจัดการโดยสิ่งที่เรียกว่า Boxing Unit ซึ่งรับรองว่านักกีฬาทุกคนที่เข้าร่วมการแข่งขันชกมวยของเกมจะปฏิบัติตามกฎคุณสมบัติและการลงทะเบียนสําหรับการแข่งขันตลอดจนข้อบังคับทางการแพทย์ทั้งหมด ซึ่งรวมถึงใบรับรองแพทย์ที่เหมาะสม ประทับตราและยืนยันอย่างน้อยสามเดือนก่อนเริ่มการแข่งขัน
“นักมวยเหล่านี้มีสิทธิ์อย่างสมบูรณ์ พวกเธอเป็นผู้หญิงในหนังสือเดินทาง เป็นผู้หญิงที่แข่งขันในโอลิมปิกที่โตเกียวและแข่งขันในฐานะนักกีฬาหญิงมาหลายปีแล้ว ผมคิดว่าเราทุกคนมีความรับผิดชอบที่จะเพลาๆ ลงบ้างและไม่เปลี่ยนเป็นการล่าแม่มด” มาร์ค อดัมส์ โฆษกของ IOC กล่าวในการแถลงข่าวเมื่อวันอังคารที่ผ่านมา
ถึงกระนั้น บุคคลสําคัญบนโซเชียลมีเดียก็ประณามการมีส่วนร่วมของเคลีฟในเกมโอลิมปิก อาทิ เจ้าของ X อย่าง อีลอน มัสค์ (Elon Musk)ขยายทวีตจากนักว่ายน้ำไรลีย์ เกนส์ (Riley Gaines) ว่า "ผู้ชายไม่ได้อยู่ในกีฬาของผู้หญิง"
ในขณะที่ผู้เขียนแฮร์รี่ พอตเตอร์ เจ.เค.โรวลิง (J.K. Rowling) อ้างถึงเคลีฟว่า"เป็นผู้ชายที่รู้ว่าเขาได้รับการคุ้มครองโดยสถาบันกีฬาที่เกลียดผู้หญิง คนพวกนี้เพลิดเพลินกับความทุกข์ของผู้หญิงที่เพิ่งโดนชกต่อยเข้าที่หัว"
ความจริงก็คือเคลีฟเข้าร่วมการแข่งขันเพราะเธอได้รับอนุญาตตามกฎและผ่านมาตรฐานของ IOC แล้ว “ความโกรธเกรี้ยวของทุกคนที่มีต่อนักกีฬาสองคนนี้เป็นเรื่องเข้าใจผิดทั้งหมด ” Boxing Unit และ IOC กล่าวในแถลงการณ์เมื่อวันพฤหัสบดี โดยอ้างถึงการแบนของ IBA ที่“ไม่มีขั้นตอนที่เหมาะสม โดยเฉพาะอย่างยิ่งการพิจารณาว่านักกีฬาเหล่านี้แข่งขันในการแข่งขันระดับบนสุดมาหลายปีแล้ว และแนวทางดังกล่าวขัดต่อธรรมาภิบาล”
การโต้เถียงในช่วงสองสามวันที่ผ่านมาทําให้เกิดปัญหาร้ายแรง เช่น hyperandrogynism—การผลิตฮอร์โมนเทสโทสเตอโรนมากเกินไปโดยร่างกายของผู้หญิงและการมีเพศสัมพันธ์ ซึ่งบางคนเกิดมาพร้อมกับลักษณะทางเพศที่ไม่เข้ากับคําจํากัดความดั้งเดิมของชายและหญิงที่มีอยู่ ทําให้เกิดการดูหมิ่นดูแคลน จากนั้นก็มีการวางยาพิษการถกเถียงเรื่องที่ละเอียดอ่อนมากอยู่แล้วเกี่ยวกับการมีส่วนร่วมของผู้หญิงข้ามเพศในโอลิมปิกและการแข่งขันกีฬาโดยทั่วไป
อย่างไรก็ตาม นอกเหนือจากทุกสิ่งแล้ว ความจริงก็คือ อีเมน คาลีฟได้นิยามตัวเองว่าเป็นผู้หญิงมาโดยตลอด และ IOC ก็อนุญาตให้เธอเข้าร่วมการแข่งขันกีฬาโอลิมปิกเช่นนี้ แม้จะต้องเผชิญกับความคิดเห็นอย่างรุนแรงของสาธารณชน
“ฉันไม่ต้องการที่จะอยู่ต่อหน้าเธอต่อหน้าโลกที่ไม่ยุติธรรมกับผู้หญิง คณะกรรมการการแพทย์โอลิมปิกได้ตรวจสอบนักกีฬาและยืนยันว่าเธอเป็นผู้หญิงโดยธรรมชาติและปัญหาเดียวคือระดับฮอร์โมนเทสโทสเตอโรนสูง แล้วฉันก็ไม่เห็นปัญหาใด ๆ เราอยู่ในการแข่งขันนะและคนที่แข็งแกร่งที่สุดคือคนที่ชนะ เธอมีลักษณะที่ทําให้เธอแข็งแกร่งกว่าคนอื่นๆ นอกเหนือจากความจริงที่ว่าระดับเทสโทสเทอโรนของเธอ ไม่สามารถปล้นความเป็นผู้หญิงของเธอได้”
“อีเมน เคลีฟ เป็นผู้หญิงที่แข็งแกร่ง ในอดีต เธอต้องพ่ายแพ้การแข่งขันเมื่อตอนที่เธอยังเป็นมือใหม่ แต่ตอนนั้นไม่มีใครพูดถึงเรื่องนี้ ตอนนี้เพราะเธอเปล่งประกายเจิดจรัสจากการทุ่มเทอย่างหนักเพื่อตัวเอง ทุกคนจึงดูเหมือนจะมีความคิดเห็นต่อเรื่องนี้ หยุดเผยแพร่ข้อมูลเท็จ เธอสมควรได้รับการยอมรับสําหรับความทุ่มเทและความสําเร็จของเธอ ไม่ใช่ข่าวลือที่ไร้เหตุผล”
ส่วนหนึ่งในท้อปคอมเมนต์
ของหนังสือพิมพ์นิวยอร์คไทม์
ศูนย์บริการสาธารณสุข 43 มีนบุรี วันที่ 2- 13 กันยายน 2567
ศูนย์บริการสาธารณสุข 43 มีนบุรี ประชาสัมพันธ์ หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 2 ประจำปี 2567 ระหว่างวันที่ 2- 13 กันยายน 2567 ***ผู้ที่จะมารับบริการ โปรดนำบัตรประชาชนมาด้วย และสัตว์เลี้ยงที่มาฉีดวัคซีนป้องกันพิษสุนัขบ้าต้องมีอายุ 3 เดือนขึ้นไป ไม่มีอาการป่วย และไม่ท้อง
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตพระนคร
เขตในฝั่งธนบุรี
ไทยพีบีเอส รายงานสรุปสถานการณ์ จ.กาฬสินธุ์ LINK
25 ธันวาคม ไทยพีบีเอส รายงานสรุปสถานการณ์ จ.กาฬสินธุ์
คลัสเตอร์โควิดสายพันธุ์โอมิคอรน จากคลัสเตอร์สองสามีภรรยากลับจากเบลเยียม จนไปลามตลาดโรงสี ทำให้มีผู้ติดเชื้อจากคลัสเตอร์นี้แล้วกว่า 60 คน /ล่าสุดคณะกรรมการควบคุมโรคติดต่อสั่งปิดร้านอาหารกึ่งผับในตลาดโรงสี รวมไปถึงสถานศึกษาในเขตเทศบาลเมืองไปจนถึงวันที่ 30 ธันวาคม ห้ามนั่งดื่มเหล้าในร้าน รวมทั้งงดจัดกิจกรรมสังสรรค์ที่มีผู้คนเกิน 100 คน ขึ้นไป
ร้านคิกคาปู้ ซึ่งเป็นร้านอาหารกึ่งผับ ภายในตลาดโรงสี เขตเทศบาลเมืองกาฬสินธุ์ เป็นหนึ่งในร้านอาหารที่คณะกรรมการควบคุมโรคติดต่อจังหวัดกาฬสินธุ์ มีคำสั่งปิดเป็นเวลา 14 วัน
หลังพบเป็นจุดที่สองสามีภรรยา ซึ่งกลับจากเบลเยียมมาใช้บริการ จนทำให้นักดนตรี พนักงานร้าน ตลอดจนลูกค้าติดเชื้อโควิด-19 สายพันธุ์โอมิครอนจำนวนมาก ซึ่งยอดผู้ติดเชื้อจากคลัสเตอร์โรงสีขณะนี้ 66 คนแล้ว
นอกจากนี้ยังได้สั่งปิดและสถานศึกษาทุกแห่งในเขตเทศบาลเมืองกาฬสินธุ์ โดยให้จัดการเรียนการสอนแบบออนไลน์ไปจนถึงวันที่ 30 ธันวาคม หลังพบว่ามีกลุ่มนักเรียน นักศึกษาเข้าไปนั่งทานอาหารที่ตลาดโรงสี
มติของจังหวัด ยังสั่งห้ามนั่งดื่มแอลกอฮอล์ภายในร้านอาหาร หน่วยงานภาครัฐงดจัดงานปีใหม่ ส่วนภาคเอกชนก็ขอความร่วมมือ ถ้าจะจัดกิจกรรมในช่วงเทศบาลปีใหม่ต้องมีผู้ร่วมงานไม่ให้เกิน 100 คน และต้องขออนุญาตจากนายอำเภอ ซึ่งถือเป็นมาตรการควบคุมโรคสูงสุด หลังจากพบผู้ติดเชื้อจากคลัสเตอร์ตลาดโรงสีที่กระจายไปในหลายพื้นที่อย่างรวดเร็ว
เขตลาดพร้าว เตรียมความพร้อมในการเปิดศูนย์พักคอยเพื่อส่งต่อ ณ บริเวณบริษัท อาร์ บี เอส โลจิสติกส์ จำกัด ซอยประเสริฐมนูกิจ 29 แยก 4 เขตลาดพร้าว LINK
#เขตลาดพร้าว "เตรียมความพร้อมในการเปิดศูนย์พักคอยเพื่อส่งต่อ เขตลาดพร้าว"
วันพุธที่ 5 มกราคม 2565 เวลา 09.00 น. นางสุภาพร ศรีศาสนวงศ์ ผู้อำนวยการเขตลาดพร้าว พร้อมด้วยนางสาวเสาวลักษณ์ วยะนันทน์ นายเจษฎา ประภาสะวัต ผู้ช่วยผู้อำนวยการเขตลาดพร้าว คณะผู้บริหารเขตฯ และเจ้าหน้าที่เขตฯ ลงพื้นที่เตรียมความพร้อมในการเปิดศูนย์พักคอยเพื่อส่งต่อ เขตลาดพร้าว เพื่อดูแลผู้ป่วยติดเชื้อโควิด-19 โดยได้มอบหมายเจ้าหน้าที่ฝ่ายรักษาความสะอาดฯ เข้าทำความสะอาดศูนย์พักคอยฯ และมอบหมายเจ้าหน้าที่ฝ่ายโยธา เข้าตรวจเช็คอุปกรณ์เครื่องมือสื่อสารภายในศูนย์พักคอยฯ ให้พร้อมต่อการใช้งาน เพื่อเตรียมความพร้อมในการเปิดศูนย์พักคอยฯ ณ บริเวณบริษัท อาร์ บี เอส โลจิสติกส์ จำกัด ซอยประเสริฐมนูกิจ 29 แยก 4 เขตลาดพร้าว เป็นการคัดแยกผู้ติดเชื้อออกจากชุมชน และป้องกันการแพร่ระบาดของโรคติดเชื้อไวรัสโคโรน่า 2019 (COVID-19)
ในการนี้ ผู้อำนวยการเขตลาดพร้าว พร้อมด้วยคณะผู้บริหารเขตฯ ร่วมกับนายนพพล ชูกลิ่น ประธานเจ้าหน้าที่บริหาร กลุ่มบริษัท อาร์บีเอส กรุ๊ป ร่วมประชุมหารือการเตรียมความพร้อมในการเปิดศูนย์พักคอยเพื่อส่งต่อ เขตลาดพร้าว เพื่อดูแลผู้ป่วยติดเชื้อโควิด-19
กรุงสยามเซนต์คาร์ลอส บริการดูแลผู้ป่วยโควิดเข้ารักษา ในโรงพยาบาล LINK
โรงพยาบาลกรุงสยามเซนต์คาร์ลอส ให้บริการดูแลรักษาผู้ป่วยโควิด
ที่มีความประสงค์เข้ารักษาโควิด ในโรงพยาบาล "ราคาเริ่มต้น 1,840.- บาท/วัน"
แพ็กเกจรักษาตัวสำหรับผู้ป่วย โควิด-19
ห้องเดี่ยว (1 คน/ห้อง)
- ราคา 3,200.- บาท (สำหรับเข้ารักษาตัว 1 วัน)
- ราคา 16,000.- บาท (สำหรับเข้ารักษาตัว 5 วัน)
- ราคา 22,400.- บาท (สำหรับเข้ารักษาตัว 7 วัน)
* ราคาดังกล่าว รวมค่าห้อง , ค่าบริการพยาบาล , ค่า Hospital Free , ค่าอาหาร 3 มื้อ
ห้องคู่ (2 คน/ห้อง)
- ราคา 1,840.- บาท (สำหรับเข้ารักษาตัว 1 วัน)
- ราคา 9,200.- บาท (สำหรับเข้ารักษาตัว 5 วัน)
- ราคา 12,880.- บาท (สำหรับเข้ารักษาตัว 7 วัน)
* ราคาดังกล่าว รวมค่าห้อง , ค่าบริการพยาบาล ค่า Hospital Fee , ค่าอาหาร 3 มื้อ
‼‼ไม่รวมค่าแพทย์ ค่าตรวจวินิจฉัยทางเทคนิคการเเพทย์ ค่ายา ค่าเวชภัณฑ์ และ อื่นๆ‼‼
ตั้งแต่ 4 ก.ค. ถึง 31 ก.ค. 2565 หรือจนกว่าจะมีการเปลี่ยนแปลง
สอบถามรายละเอียดเพิ่มเติม 06-2780-3111
+++ ต่างจังหวัด +++
Iron Balls (ไอรอน บอล) เป็น Craft Spirits ณ กรุงเทพ
Iron Balls (ไอรอน บอล) เป็น Craft Spirits โดย Ashley Sutton สถาปนิกชาว Australia ที่เคยฝากผลงานการออกแบบ Bar หลาย ๆ แห่งในกรุงเทพ รวมไปถึงบาร์อีก 2 แห่งของเขาเอง โดยหนึ่งในนั้นเป็น Distillery & Bar ที่เอกมัย ซึ่งใช้สำหรับการผลิต Spirits ของ Iron Balls เอง
Gin Iron balls ถูกผลิตขึ้นอย่างพิถีพิถันใจกลางกรุงเทพมหานครที่ A R. Sutton & Co Engineers โดยผู้ผลิตได้บอกว่า“เราเลือกที่จะผลิตสิ่งที่มีคุณภาพมากกว่าปริมาณ เราทำทุกขั้นตอนด้วยมือตั้งแต่การหมัก Coconut palm, Juniper, Hillside ginger และ Lemongrass ไปจนถึงการกลั่น”
ปล.เคยได้ยินมาว่าเจ้าของแบรนด์ชอบแล่นเรือ เลยออกแบบขวดให้ฐานกว้างไม่ล้มง่ายตอนอยู่บนเรือ
#MainStand
#MainStand : นักมวยไอร์แลนด์ ที่เคยชนะ นักชกแอลจีเรียที่เป็นประเด็น ออกมาตอบโต้ประเด็นและสนับสนุน ให้เธอชกต่อไป
#MainStand : คณะกรรมการโอลิมปิกแอลจีเรีย ประณาม การโจมตีต่อนักมวยที่เคยถูกตัดสิทธิ์เพราะฮอร์โมนเพศชายเกิน
คณะกรรมการโอลิมปิกของแอลจีเรีย (COA) ออกแถลงการณ์ประณามการโจมตี "อย่างไม่มีมูลความจริง" ต่อไอมาน คาลิฟ นักชกแอลจีเรีย หลังจากที่มีการตั้งคำถามเกี่ยวกับการการเข้าร่วมการแข่งขันในโอลิมปิก หลังจากที่โดนกล่าวหาว่า มีความเป็นชายสูงจากการตรวจฮอร์โมนเพศจากทาง IBA (สหพันธ์มวยสากลนานาชาติ) แล้วได้สิทธิ์แข่งขันโอลิมปิก
แถลงการณ์ระบุว่า "COA ขอประณามอย่างรุนแรงต่อการกำหนดเป้าหมายและใส่ร้ายนักกีฬาที่มีชื่อเสียงของเราอย่าง ไอมาน คาลิฟ โดยปราศจากเหตุผลอันสมควร พร้อมทั้งสิ่งที่ทำให้เข้าใจผิดผ่านทางสื่อต่างประเทศ"
"การโจมตีบุคลิกภาพและศักดิ์ศรีของเธอในลักษณะดังกล่าวถือว่าไม่ยุติธรรมอย่างยิ่ง โดยเฉพาะอย่างยิ่งในขณะที่เธอกำลังเตรียมตัวสำหรับจุดสูงสุดของอาชีพของเธอในการแข่งขันโอลิมปิก"
สำหรับ คาลิฟ จะลงนวมรอบ 8 คนสุดท้าย เจอกับนักชกจากฮังการี หากชนะจะรอเจอผู้ชนะ ระหว่างจันทร์แจ่ม สุวรรณเพ็ง และนักชกจากตุรกี
#MainStand : โอลิมปิก ฟาดกลับ "ไอบ้า" ตัดสิทธิ์นักมวยที่ฮอร์โมนเพศเกินอย่างไม่ยุติธรรม ยืนยันจะปกป้องนักมวยทั้งสอง
#ทุกคนมีสิทธิที่จะเล่นกีฬาได้โดยไม่เลือกปฏิบัติ
- นักกีฬาทุกคนที่เข้าร่วมการแข่งขันชกมวยในโอลิมปิกเกมส์ ปารีส 2024 ได้ปฏิบัติตามกฎการแข่งขันและกฎเกณฑ์ทางการแพทย์ที่เกี่ยวข้องทั้งหมดที่กำหนดโดยหน่วยงานกำกับดูแลการจัดมวยสากล ปารีส 2024 (PBU)
- เราพบว่ามีการให้ข้อมูลที่ทำให้เข้าใจผิดเกี่ยวกับนักกีฬาหญิงสองคนที่แข่งขันในโอลิมปิกที่ปารีสในปี 2024 นักกีฬาทั้งสองคนแข่งขันมวยสากลระดับนานาชาติในประเภทหญิงมาหลายปีแล้ว รวมถึงโอลิมปิกที่โตเกียว 2020 การแข่งขันชิงแชมป์โลกของสมาคมมวยสากลนานาชาติ (IBA) และการแข่งขันที่ได้รับการอนุมัติจาก IBA
- แต่นักกีฬาทั้งสองคนนี้ตกเป็นเหยื่อของการตัดสินใจที่ทำตามอำเภอใจของ "ไอบ้า" ในการแข่งขันมวยสากลชิงแชมป์โลกในปี 2023 พวกเธอถูกตัดสิทธิ์โดยไม่มีกระบวนการทางกฎหมายใดๆ
- ตามบันทึกการประชุมของ IBA ที่เผยแพร่ในเว็บไซต์ การตัดสินใจครั้งนี้เริ่มต้นโดยเลขาธิการและซีอีโอของ IBA เพียงคนเดียว ก่อนคณะกรรมการ IBA ลงมติรับรองในภายหลังและขอให้กำหนดขั้นตอนสำหรับกรณีที่คล้ายกันในอนาคต
- บันทึกการประชุมยังระบุด้วยว่า IBA ควร "กำหนดขั้นตอนที่ชัดเจนเกี่ยวกับการทดสอบเพศ" ดังนั้น ไอโอซีจึงถือว่า #แนวทางดังกล่าวขัดต่อหลักธรรมาภิบาลที่ดี
- IOC มุ่งมั่นที่จะปกป้องสิทธิมนุษยชนของนักกีฬาทุกคนที่เข้าร่วมการแข่งขันกีฬาโอลิมปิกตามกฎบัตรโอลิมปิก และรู้สึกเสียใจกับการละเมิดที่นักกีฬาทั้งสองคนได้รับอยู่ในขณะนี้
#MainStand : "อิมาน เคลิฟ" กลายเป็นที่รู้จักของวงการมวยทั่วโลก หลังคว้าชัยชนะแบบเต็มไปด้วยข้อกังขาในศึกมวย โอลิมปิก 2024 ที่กรุงปารีส ฝรั่งเศส
เคลิฟ ใช้เวลาแค่ 46 วินาที เอาชนะ แองเจล่า คารินี่ คู่แข่งจากอิตาลีในรอบแรกของมวยหญิงรุ่น 66 กก. ซึ่งอีกฝ่ายถึงกับร้องไห้โฮออกมา และสารภาพว่าโดน เคลิฟ ที่มีเพศสภาพไม่ตรงกับเธอ ต่อยจมูกอย่างแรงจนชกต่อไม่ได้ พละกำลังต่างกันมากไป
ส่วน เคลิฟ ที่ถูกมองว่ามีเพศสภาพเป็น "เพศชายทางชีวภาพ" ให้สัมภาษณ์สั้นๆ หลังคว้าชัยชนะ แบบไม่พูดถึงเรื่องเพศสภาพที่เป็นดราม่าว่า "เป็นเรื่องน่าพอใจเสมอเมื่อคว้าชัยชนะในการแข่งขันที่สำคัญ กระนั้น ฉันขอโฟกัสอยู่ที่เป้าหมายของตัวเอง ก็คือการคว้าเหรียญรางวัล"
สิ่งที่เกิดขึ้นทำให้คณะกรรมการโอลิมปิกสากล (IOC) ที่เป็นผู้รับผิดชอบดูแลการแข่งขันมวยสากลสมัครเล่นครั้งนี้ ถูกโจมตีอย่างหนักหน่วงจากการให้ เคลิฟ ขึ้นชกทั้งที่ IBA ยืนยันว่านักมวยคนนี้ไม่ผ่านการตรวจเพศสภาพในฐานะนักมวยหญิง แม้ว่าพาสปอร์ตและเอกสารต่างๆ จะระบุว่ากำปั้นของแอลจีเรียคนนี้ เป็นผู้หญิงก็ตาม
ทั้งนี้หลังเกิดเรื่องดราม่า IOC ยังคงให้ อิมาน เคลิฟ ขึ้นชก PARIS 2024 ได้ต่อไป ซึ่งตอนนี้เข้าถึงรอบ 8 คนสุดท้ายแล้ว หากเข้ารอบรองชนะเลิศก็จะมีเหรียญทองแดงติดมือ และเป็นคู่แข่งที่ จันทร์แจ่ม สุวรรณเพ็ง กำปั้นหญิงไทย มีสิทธิ์ได้ชกกันหากเข้ามาเจอกันในรอบรองชนะเลิศครั้งนี้
#MainStand : IBA ยืนยันไม่เกี่ยวข้อง เรื่องที่สองนักมวยเพศสภาพไม่ตรง ได้ขึ้นชกมวยหญิงโอลิมปิก ยกให้ IOC เป็นคนตอบ
สหพันธ์มวยสากลนานาชาติ (IBA) ออกแถลงการณ์ยืนยันเกี่ยวกับสองนักมวยชาวแอลจีเรียกับไต้หวัน ว่ามีเพศสภาพไม่ตรงตามกฏเกณฑ์ที่จะให้ขึ้นชกมวยในประเภทหญิง ก่อนยกให้ IOC เป็นผู้ชี้แจงต่อสาธารณะในเรื่องนี้
แถลงการณ์จาก IBA มีเนื้อหาสำคัญระบุว่าพวกเขาได้เคยตัดสิทธิ์ไม่ให้ อิมาน เคลิฟ จากแอลจีเรีย กับ หลิน ยู่-ติง จากไต้หวัน ขึ้นชกมวยหญิงในรายการชิงแชมป์ที่ นิว เดลี เมื่อปี 2023 เนื่องจากพบว่าเพศสภาพไม่ตรงตามกฏเกณฑ์ที่จะให้ขึ้นชกในรุ่นผู้หญิง
แม้จะไม่ได้ชี้แจงเรื่องการตรวจเพศโดยละเอียด ทว่า IBA ยืนยันว่าทั้ง เคลิฟ กับ ยู่-ติง ไม่ผ่านเกณฑ์การทดสอบก่อนขึ้นชกมวยหญิง ซึ่งหากปล่อยให้ทั้งคู่ขึ้นชกมวยหญิงตามเดิม อาจทำให้พวกเขาได้เปรียบนักมวยที่เป็นผู้หญิง และไม่ยุติธรรมต่อนักกีฬาคนอื่นๆ ที่ลงแข่งเวทีเดียวกัน
IBA ระบุต่อว่า ยู่-ติง ยอมรับคำตัดสินของทางองค์กร ไม่ได้โต้แย้งเรื่องนี้ ขณะที่ เคลิฟ แม้ทีแรกจะมีการยื่นอุทธรณ์ต่อศาลอนุญาโตตุลาการกีฬา แต่สุดท้ายก็ได้ถอนคำร้องดังกล่าวและยอมรับคำตัดสินเช่นเดียวกัน
ทั้งนี้ IBA ได้ทิ้งท้ายว่าพวกเขาขอให้ IOC ผู้จัดการแข่งขัน โอลิมปิก 2024 ที่ปารีส ฝรั่งเศส เป็นผู้ตอบคำถามเรื่องนี้ต่อสาธารณชน และยืนยันว่า IBA ไม่ได้มีส่วนเกี่ยวข้องใดๆ ในการอนุญาตให้นักมวยทั้งสองที่ถูกตั้งคำถามเรื่องเพศสภาพ ขึ้นชกในโอลิมปิก 2024
"สำหรับคำชี้แจงที่ว่า IOC ทำไมถึงให้นักกีฬาที่มีข้อได้เปรียบในการแข่งขันลงแข่งรายการของพวกเขา เราขอแนะนำให้ผู้ที่สนใจ ค้นหาคำตอบจากทาง IOC โดยตรง ขอแสดงความนับถือ" IBA ระบุ
#MainStandSTORY : พาสปอร์ตเป็นหญิง โอลิมปิกเผยสาเหตุ ให้นักมวยหญิงที่โดนตัดสิทธิ์จากไอบ้า เพราะมีความเป็นชาย เข้าแข่งโอลิมปิก
ทั่วโลกแสดงความเห็น หลังจากโอลิมปิก อนุญาตให้นักมวยหญิงสองคน ที่ไม่ผ่านการตรวจเพศจากการแข่งขันมวยสากลชิงแชมป์โลก 2023 เนื่องจากถูกระบุว่ามีความเป็นชายสูงกว่ากำหนด เข้าแข่งขันในโอลิมปิก 2024 ประกอบด้วย ไอมาน คาลิฟ จากแอลจีเรีย (รุ่น 66 กก.หญิง) และ หลิน ยู่-ติง จากไต้หวัน (รุ่น 57 กกหญิง) ซึ่งนักชกแอลจีเรียมีโอกาสจะเจอกับจันทร์แจ่ม สุวรรณเพ็ง นักชกไทยในรอบรองชนะเลิศด้วยถ้ามาถึง
มาร์ค อดัมส์ โฆษกคณะกรรมการโอลิมปิกสากล หรือ ไอโอซี ออกมาแถลงถึงเรื่องนี้ว่าทุกอย่างเป็นไปตามข้อบังคับ
“พาสปอร์ตของทั้งสองคนระบุว่าทั้งคู่เป็นผู้หญิง เพราะฉะนั้นถือว่าทั้งสองคนเป็นผู้หญิง”
“ทั้งสองคนมีสิทธิ์เข้าร่วมการแข่งขันเพราะไม่ได้มีการฝ่าฝืนกฎเกณฑ์ที่โอลิมปิกระบุไว้ นี่คือสิ่งที่พวกเธอเป็น และเราสนับสนุนให้พวกเธอได้แข่งเต็มที่ มันจะเป็นไม่ให้เกียรติที่เราจะมาเถียงกันถึงรายละเอียดของนักกีฬาแต่ละคน"
“นักกีฬาผ่านทัวร์นาเม้นท์ที่โอลิมปิกจัดมาหลายรายการ พวกเธอไม่ได้เพิ่งมาแข่ง”
แม้จะมีการชี้แจงจากคณะกรรมการโอลิมปิกแต่สื่อระดับโลกอย่าง THE TELEGRAPH มีการระบุว่าในการประชุมสรุปนักกีฬาไม่มีการนำประเด็นเรื่องนี้เข้ามาพูดคุยหรือแม้แต่ความกังวลเรื่องความปลอดภัย แม้แต่น้อย ซึ่งบางชาติมีความพยายามจะสอบถามแต่ไม่ได้รับความชัดเจนในประเด็นนี้
ขณะที่รายงานวิจัยบอกว่า นักมวยชายจะมีความแข็งแกร่งของกล้ามเนื้อมากกว่าหญิงถึง 90% และหมัดหนักกว่าผู้หญิงถึง 2.6 เท่า ดังนั้นจึงไม่ควรให้นักมวยหญิงต่อยกับนักมวยชายเด็ดขาด
ต้องรอดูว่าในรายของนักชกแอลจีเรีย ที่เคยเอาชนะจันทร์แจ่มในชิงแชมป์โลก 2023 ไป 5-0 เสียง จะมีประเด็นให้พูดถึงขนาดไหน จากนี้
21 กันยายน 2567 ทำหมันสุนัขและแมว คณะสัตวแพทยศาสตร์ ม.เกษตรศาสตร์ กำแพงแสน
โครงการจิตอาสาชาวเกษตรเพื่อคุณภาพชีวิตที่ดี ของคน สัตว์ และสิ่งแวดล้อม ประจำปีงบประมาณ 2567 ทำหมันสุนัขและแมว ครั้งที่ 4 ในวันเสาร์ที่ 21 กันยายน 2567 ณ ห้อง 4-113 อาคารเรียนและปฏิบัติการ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสน สนใจ
สมัครได้ตามลิ้งค์ศูนย์บริการสาธารณสุข 44 ลำผักชี เขตหนองจอก ออกหน่วยฉีดวัคซีน วันที่ 2- 13 กันยายน 2567
สำนักงานเขตหนองจอก ร่วมกับ ศูนย์บริการสาธารณสุข 44 ลำผักชี มีกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ครั้งที่ 2 ระหว่างวันที่ 2-13 กันยายน 2567 เวลา 10.00 - 12.00 น.
✅ ประชาชนผู้ที่สนใจ โปรดนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยสามารถนำสัตว์เลี้ยงเข้ารับบริการได้ตาม สถานที่ วันและเวลาดังกล่าว ทั้งนี้ให้บริการฉีดวัคซีนฟรี ไม่มีค่าใช้จ่าย
✅ ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตหนองจอก โทร. 02-5431477 หรือศูนย์บริการสาธารณสุข 44 ลำผักชี โทร. 02-9881633 - 6
12 มกราคม 67 ปศุสัตว์สมุทรปราการ ทำหมันหมาแมว ฟรี
สำนักงานปศุสัตว์จังหวัดสมุทรปราการ บริการทำหมันสุนัข-แมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี วันศุกร์ที่ 12 มกราคม 2567 ณ สำนักงานปศุสัตว์จังหวัดสมุทรปราการ ถ.ปู่เจ้าสมิงพราย ต.สำโรงกลาง อ.พระประแดง เงื่อนไขดังนี้
• ให้สิทธิ์ท่านละ 2 ตัว
• ทำหมันน้องหมา 6 เดือนขึ้นไป ยกเว้น สุนัขพันธุ์หน้าสั้น /พันธุ์เล็ก
• ทำหมันแมว เพศเมีย 5 เดือนขึ้นไป เพศผู้ 7 เดือนขึ้นไป
• งดน้ำอาหาร 12 ชั่วโมง
• ลงทะเบียนรับบัตรคิวหน้างาน ตั้งแต่เวลา 8.30-12.00 น.
สอบถามโทร. กลุ่มพัฒนาสุขภาพสัตว์ 02-3847530
โรงพยาบาลสัตว์ มทร.ตะวันออก ขยายเวลาบริการวัคซีนพิษสุนัขบ้าในสัตว์เลี้ยง ฟรี LINK
โรงพยาบาลสัตว์ มทร.ตะวันออก ขยายเวลาบริการวัคซีนพิษสุนัขบ้าในสัตว์เลี้ยง ฟรี เปิดฉีดวัคซีนพิษสุนัขบ้าให้กับสัตว์เลี้ยง ฟรี ทุกวันจันทร์ - ศุกร์ เวลา 09.00-12.00 น. และ 13.00-16.00 น. (เว้นวันหยุดราชการ) ผู้สนใจเข้ารับวัคซีน สามารถนำสัตว์เลี้ยงที่จะเข้ารับบริการมายังโรงพยาบาลสัตว์ มทร.บางพระ เพื่อลงทะเบียน สอบถามโทร. 062-7875199
เทศบาลนครรังสิต ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ถึง 25 ก.ค.66 LINK
เทศบาลนครรังสิต ขอเชิญชวนชาวนครรังสิตร่วมสร้างพื้นที่ปลอดโรคพิษสุนัขบ้า โดยการนำสุนัข แมว มารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในระหว่างวันที่ 30 พฤษภาคม - 25 กรกฎาคม 2566 ณ สถานที่ใกล้บ้าน (เวลาและสถานที่ ตามที่กำหนดในตาราง) สอบถามรายละเอียดเพิ่มเติมได้ที่ : งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม โทร. 02-5670941
28 ก.ย.66 เทศบาลอ่างศิลา จัดฉีดวัคซีน
เทศบาลเมืองอ่างศิลา เชิญชวนประชาชนนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า (ฟรี!!!) ในวันที่ 28 กันยายน 2566 เวลา 09.00 - 11.30 น. ณ อาคารอเนกประสงค์เทศบาลเมืองอ่างศิลา (วัดอ่างศิลา) **โปรดนำบัตรประชาชนมาในวันดังกล่าวด้วย** สอบถามข้อมูลเพิ่มเติมได้ที่กองสาธารณสุขและสิ่งแวดล้อม 038 142 100 ถึง 104 ต่อ 111
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางพลัด
Treatment Time Line chart
ระยอง - ไม่มีกักตัว LINK
8 เมษายน
วันนี้ได้มีการประชุมคณะกรรมการโรคติดต่อจังหวัดระยอง ซึ่งจังหวัดยังไม่มีการกำหนดมาตรการกักตัวคนที่เดินทางเข้าพื้นที่ระยอง แต่ขอความร่วมมือท่านที่เดินมาจากพื้นที่เสี่ยง รายงานตัวต่อเจ้าหน้าที่สาธารณสุข เพื่อเป็นข้อมูลการเฝ้าระวังแต่ติดตามหากเกิดกรณีการติดเชื้อ - ชาญนะ เอี่ยมแสง - ผู้ว่าราชการจ.ระยอง
รพ.ระยอง 094-6847832
รพ.บ้านฉาง 088-7719391
รพ.นิคมพัฒนา 038-038050 ถึง 1 ต่อ 305
รพ.ปลวกแดง 033-650413 ต่อ 233
รพ.เขาชะเมา 098-8838766
รพ.บ้านค่าย 091-0509914,081-3840526
รพ.แกลง 081-9404218
รพ.วังจันทร์ 084-8654124
รพ.เฉลิมพระเกียรติฯ 081-3708248
ให้บริการในเวลาราชการ เวลา 08.30 - 20.00 น.
สำนักงานสาธารณสขจังหวัดระยอง
ให้บริการ เวลา 08.30- 16.30 น.
064-9456689 เฉพาะจันทร์ถึง ศุกร์
064-9458669 เฉพาะ วันหยุดและวันหยุดนักขัตฤกษ์
2 เทคโนโลยีเด่นของบำรุงราษฎร์ปีนี้
โดยในปีนี้ บำรุงราษฎร์จะให้น้ำหนักด้านการแพทย์ใน 2 ส่วนสำคัญคือ
1. Robotic Surgery Center การนำเทคโนโลยีหุ่นยนต์ช่วยผ่าตัดระบบดาวินซีเข้ามาช่วยศัลยแพทย์ในการผ่าตัดรักษาผู้ป่วยหลายระบบอวัยวะให้ครอบคลุมมากยิ่งขึ้น และ
2. Genetic มุ่งเน้นการตรวจหาความผิดปกติทางพันธุกรรม (Genomics) ซึ่งจะช่วยระบุความเสี่ยงในการเกิดโรคบางชนิด ทำให้สามารถป้องกันโรคเชิงรุกได้ อาทิ โรคมะเร็ง โรคหัวใจและหลอดเลือด วางแผนการมีบุตรและป้องกันกลุ่มโรคเสี่ยงทางพันธุกรรมอื่นๆ ในอนาคต รวมถึงตรวจพันธุกรรมเพื่อป้องกันการแพ้ยา ซึ่งจะช่วยให้แพทย์สามารถเลือกใช้ยาหรือวิธีการรักษาที่มีประสิทธิภาพสูงสุดสำหรับผู้ป่วยแต่ละราย
บำรุงราษฎร์เชื่อมั่นว่า ทั้ง 2 เทคโนโลยี ที่นำมาใช้นี้ จะมาเสริมการรักษาให้มีประสิทธิภาพมากยิ่งขึ้น และเป็นเทรนด์การแพทย์ที่บำรุงราษฎร์ให้ความสำคัญนับจากนี้ต่อไป
เคารพและรักษาคุณค่าภูมิปัญญาท้องถิ่นดั้งเดิม
พ่อครู พ่อแก่ แม่เฒ่า ตำรับตำรา สรรพคุณ สรรพยา ดั้งเดิมแบบไทย ในแต่ละท้องถิ่นภาคกลาง ภาคเหนือ ภาคใต้ ภาคอีสาน ล้วนมีคุณค่าให้บันทึกไว้
หมอกมุงเมือง สุราชุมชนเมืองสามหมอก แม่ฮ่องสอน
สุรากลั่น "หมอกมุงเมือง" สุราชุมชนแม่ฮ่องสอนเมืองสามหมอก 1864 โค้งที่ว่าเมากันหนักมาก ยังแพ้พ่ายดีกรีสุราตัวนี้ ที่มาของชื่อ "หมอกมุงเมือง" คือ ฤดูหนาวของแม่ฮ่องสอน จะมีหมอกมาปกคลุม ทั้งเมือง เมื่อมองลงมาจากพระธาตุดอยกองมู จะเห็นเป็นวิว "หมอกมุงเมือง" หรือหมอกปกคลุมเมือง จึงกลายมาเป็นชื่อวิสาหกิจชุมชน หมอกมุงเมืองนั่นเอง ชื่อนี้ถ้าใครดื่มหมดแบนยังเรียกชื่อสุราตัวนี้ถูกต้องคุณคือระดับเทพเซียน
สุรากลั่น"หมอกมุงเมือง"ได้รับคัดเลือกให้เป็นผลิตภัณฑ์ OTOP 5 ดาว ของจังหวัดแม่ฮ่องสอน ตลอดระยะเวลา กว่า 10ปี เราได้มีการพัฒนาอย่างต่อเนื่องเพื่อสร้างสรรค์สิ่งที่ดีที่สุดเพื่อความยั่งยืนของวิถีสุรา เพื่อคนไทยและต่อยอดเป็นสินค้าส่งออกต่อไปในอนาคต
เช็คอินจุดบริการ ตรวจสุขภาพฟรี กับคาราวานตรวจสุขภาพ ทั่วกทม. 1 ล้านคน ได้เลย
เทศบาลนครปฐม ทำหมันหมาแมว ฟรี ปี 2567
โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้าฯ จ.นครปฐม ประจำปี 2567 เริ่มแล้ว โดย เทศบาลนครนครปฐม ร่วมกับ กรมปศุสัตว์ ให้บริการทําหมันสุนัขและแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในเขตเทศบาลนครนครปฐม ฟรี ‼ (ให้บริการเฉพาะสำหรับผู้มีทะเบียนบ้านอยู่ในเขตเทศบาลนครนครปฐมเท่านั้น)
เช็คกำหนดการให้บริการ เงื่อนไขและช่องทางการลงทะเบียนได้แล้ว (ทำหมันจำกัดจำนวน และลงทะเบียนล่วงหน้า / ฉีดวัคซีนฟรี ไม่จำกัดจำนวน)
- วันจันทร์ที่ 9 กันยายน 2567 เวลา 09.00 - 10.30 น. ณ สมาคมตระกูลแซ่ลิ้มแห่งประเทศไทย จังหวัดนครปฐม เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 28 สิงหาคม - 5 กันยายน 2567 ฟรี ‼ (จำกัดจำนวน 100 ตัว) สามารถลงทะเบียนได้ 2 ช่องทาง 1. ลงทะเบียนได้ที่เบอร์โทรศัพท์ 034-242199 และ 034-966441 ถึง 4 ต่อ 22 เวลา 09.00 - 15.00 น. เว้นวันหยุดราชการ 2. ลงทะเบียนผ่าน QR - Code ในภาพ
ศูนย์บริการสาธารณสุข 45 ร่มเกล้า ลาดกระบัง ริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 2-13 กันยายน 2567
ศูนย์บริการสาธารณสุข 45 ร่มเกล้า ลาดกระบัง กำหนดการออกหน่วยรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 นี้ค่ะ ท่านที่มีสัตว์เลี้ยงในชุมชนตามประกาศ สามารถพาสัตว์เลี้ยงเข้ารับบริการได้ตามวันและเวลาดังกล่าว อย่าลืมนำบัตรประชาชนของเจ้าของมาด้วยนะคะ
17 พฤษภาคม 2567 ศูนย์พักพิงสุนัขฯ สุพรรณบุรี ทำหมันสุนัขและแมว ฟรี
17 พฤษภาคม 2567 ศูนย์พักพิงสุนัขฯ ได้จัดกิจกรรมร่วมกับปศุสัตว์จังหวัดสุพรรณบุรี ปศุสัตว์อำเภอเมืองสุพรรณบุรี ผ่าตัดทำหมันสุนัขและแมวให้กับประชาชนในเขตเทศบาลเมืองสุพรรณบุรี • เพื่อควบคุมจำนวนประชากรของสุนัขและแมว • เพื่อรองรับการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าในเขตเทศบาลเมืองสุพรรณบุรี • เพื่อลดพฤติกรรมก้าวร้าว • ลดความเสี่ยงในการเกิดโรคมะเร็งบางชนิด ศูนย์พักพิงสุนัขจังหวัดสุพรรณบุรี แห่งที่ 1
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางกอกน้อย
ประกาศ 10 เมย 64
เฉพาะวันนี้ ( 10เมษายน ) ทางศูนย์รับวัคซีนสะพานหิน สามารถเก็บตกรับผู้ที่มีนัดรับวัคซีนวันที่ 3-10 เมษายนจากทุกศูนย์ ในเวลา 14.00 - 19.00 น.
ให้นำบัตรประชาชนตัวจริงพร้อมทั้งแสดงนัดเดิมของตัวเองบน check.ภูเก็ตต้องชนะ.com แก่เจ้าหน้าที่
** ไม่รับ walk in ทุกกรณี **
ยุทธศาสตร์ที่ 4 บริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19) ด้านการสื่อสารและประชาสัมพันธ์
กลยุทธ์
1. ทุกภาคส่วนร่วมสร้างความรู้ความเข้าใจ และพฤติกรรม ให้ประชาชนสามารถดําเนินชีวิตร่วมกับโควิด 19 อย่างปลอดภัย (Living with COVID-19)
2. สื่อสารประชาสัมพันธ์ เชิงรุก อย่างครอบคลุม ให้เกิดความเข้าใจที่ถูกต้อง และสร้างความร่วมมือของประชาชนในแต่ละช่วงเวลา
โดยมีรายละเอียดมาตรการแบ่งตามระยะดําเนินการ ดังนี้
สรุปแผนและมาตรการการบริหารจัดการสถานการณ์โรคโควิด 19 สู่โรคประจําถิ่น (Endemic Approach to COVID-19)
นวดไทยแท้ หลายขนาน จาก 4 ภาค ที่นับวันจะหาใช้บริการยากยิ่ง
ตลอดหลายๆ ปีที่ผ่านมาของงานสมุนไพรแห่งชาติ การนวดขนานต่างๆ ถือเป็นอีกไฮไลท์ของงานเสมอมา การนวดที่ไม่ใช่แค่นวดไทย นวดเท้า นวดคอบ่าไหล่ ที่เราคุ้นเคยในการบริการมาตรฐานทั่วไป แต่การนวดอย่างนวดสัปปายะ นวดราชสำนัก นวดโต๊ะบีแด จากจะแน๊ะ นราธิวาส ด้วยน้ำมันนวดลังกาสุกะ เอกลักษณ์แห่งภาคใต้ที่ไม่มีที่อื่นอีกแล้ว นวดเหยียบเหล็กแดง ที่ตื่นตะลึงทุกครั้งที่มีการนวดโชว์ในงาน เอกลักษณ์ที่ไม่เหมือนใครสไตล์ภาคกลาง การตอกเส้น และนวดสัปปายะ แห่งดินแดนล้านนา คืออีกเอกลัษณ์ที่ต้องไปถึงเชียงใหม่เท่านั้นถึงจะได้รับบริการ (ไม่มีในกรุงเทพ นะจ๊ะ) และ นวดยองเส้น แดนอีสาน ที่ใช้บริการได้ที่เชียงคาน ริมน้ำโขง เท่านั้น
เพราะความพิเศษ และจำนวนจำกัดมาก หากอยากใช้บริการต้องไปจองในงานเท่านั้นจ้า
เขตสะพานสูง LINK
สำนักงานเขตสะพานสูง ร่วมกับศูนย์บริการสาธารณสุข 68 สะพานสูง รณรงค์ฉีดวัคซีนพิษสุนัขบ้า ครั้งที่ 1 ประจำปี 2566 กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 13 - 24 มีนาคม 2566 ตั้งแต่เวลา 10.00 -12.00 น.
เชิญชวนประชาชน นำสัตว์เลี้ยงสุนัขหรือแมวอายุ 3 เดือนขึ้นไป มารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนเคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่ายใดๆ (ฟรี)
***และหากมีข้อสงสัย สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสะพานสูง ชั้น 3 โทรศัพท์. 0 2372 2918-23 ต่อ 7118 และ 7119 หรือ ศูนย์บริการสาธารณสุข 68 สะพานสูง โทรศัพท์ 0 2372 2225 ต่อ 7
รัชนาการณ์ เหล้าเครียะจากน้ำตาลโตนด สงขลา
เหล้าเครียะ "รัชนาการณ์" สุราชุมชนจากน้ำตาลโตนด ตำบลตะเครียะ อำเภอระโนด จังหวัดสงขลา ภูมิปัญญาของบรรพบุรุษ ที่สืบทอดมาจนถึงรุ่นลูกรุ่นหลาน
เหล้าเครียะ ที่ใครๆก็รู้จักกันดีจากสำนวนที่ว่า "ดีเหมือนเหล้าเครียะ" ด้วยความแรงของดีกรีเหล้าที่สามารถจุดไฟติด และรสชาติของเหล้าที่ได้จากน้ำตาลโตนดซึ่งเป็นวัตถุดิบหลัก ที่ทำให้หลายคนชื่นชอบในรสชาติตั้งแต่อดีตจนถึงปัจจุบัน
ดราม่าเรื่องมวยสากลหญิงในโอลิมปิก มีความซับซ้อนกว่าที่เราเห็น - วิเคราะห์บอลจริงจัง
อิมาน เคลิฟ นักมวยแอลจีเรีย ที่ตกเป็นข่าว เธอเกิดมาด้วยโครโมโซม XY แต่ทำไม IOC ถึงอนุญาตให้แข่งได้ในประเภทหญิง? เราจะไปลำดับเหตุการณ์ตั้งแต่แรก
เมื่อวานนี้ (1 สิงหาคม) มวยสากลรุ่นเวลเตอร์เวท ไม่เกิน 66 กิโลกรัมหญิง เป็นการชกในรอบ 16 คนสุดท้าย
รุ่นนี้ มีนักกีฬาไทย 1 คนที่ยังเหลืออยู่ ได้แก่ จันทร์แจ่ม สุวรรณเพ็ง เธอเอาชนะคู่แข่งจากคองโก ทะลุไปถึงรอบควอเตอร์ไฟนอลได้สำเร็จ โดยจะไปเจอกับนักชกตุรกี
อีกหนึ่งคู่ในรอบ 16 คนสุดท้าย อิมาน เคลิฟ จากแอลจีเรีย เจอกับ แองเจล่า คารินี่ จากอิตาลี
พอระฆังดัง อิมาน เคลิฟ ก็เดินหน้าไล่ต่อยทันที แล้วปล่อยหมัดจะแจ้งเข้าจมูกของคารินี่ไปสองครั้ง
หลังจากชกไปได้แค่ 46 วินาที คารินี่เดินเข้าที่มุม แล้วบอกสตาฟฟ์ว่า "มันเจ็บจนทนไม่ไหว ฉันไม่อยากจะชกต่ออีกแล้ว"
เอ็มมานูเอเล่ เรนซินี่ หัวหน้าทีมมวยสากลอิตาลี ถามคารินี่ว่า "ลองชกให้จบยกแรกก่อนไหม" แต่คารินี่ส่ายหน้า และขอยอมแพ้
ระหว่างเดินออกจากมุมมาที่กลางเวที เพื่อชูมือให้ผู้ชนะ คารินี่พูดประโยคเดียวซ้ำๆ คือ "มันไม่แฟร์ มันไม่แฟร์ มันไม่แฟร์" และสุดท้ายก็ร้องไห้ แล้วไม่ยอมจับมือกับอิมาน เคลิฟด้วย
หลังจบการชก คารินี่ให้สัมภาษณ์ว่า "พอโดนต่อยเข้าจมูกหมัดที่สอง ฉันหายใจไม่ออก เลยเดินไปหาโค้ชแล้วบอกว่าขอยอมแพ้ ฉันไม่อยากจะสู้อีกแล้ว ฉันเคยชินกับความเจ็บนะ แต่ไม่เคยเจอหมัดอะไรแบบนี้ มันสู้ไมไหวแล้ว"
การยกธงขาวยอมแพ้ในโอลิมปิกเป็นเรื่องเกิดขึ้นได้ แต่ที่มันกลายเป็นประเด็น เพราะอิมาน เคลิฟ คนที่ชนะในไฟต์นี้ เป็นนักมวยหญิงไม่กี่คนในโลก ที่มีโครโมโซม XY
ในร่างกายมนุษย์เรา จะมีโครโมโซมทั้งหมด 23 คู่ โดยแบ่งเป็นออโต้โซม ที่ควบคุมลักษณะพันธุกรรมต่างๆ จำนวน 22 คู่ และโครโมโซมเพศ จำนวน 1 คู่
โดยโครโมโซมเพศ ถ้าเป็น XX จะหมายถึงเพศหญิง ถ้าเป็น XY จะหมายถึงเพศชาย
เมื่ออิมาน เคลิฟ ถูกเปิดเผยว่า มีโครโมโซม XY ทำให้สื่อหลายสำนักโจมตีว่า "โอลิมปิกเถื่อน ปล่อยผู้ชายมาไล่ต่อยผู้หญิง"
สำนักข่าวเดลีเมลของอังกฤษ ใช้คำว่า Biological male who destroyed female rival in 46 seconds (คนที่เกิดมาเป็นเพศชาย ทำลายคู่แข่งนักมวยหญิงจนราบคาบใน 46 วินาที)
เมื่อมีดราม่าเกิดขึ้น บวกกับรูปลักษณ์ของอิมาน เคลิฟ ที่ดูมีความแมนมากๆ หลายคนจึงเข้าใจกันไปว่า เธอเป็นผู้ชายที่แปลงเพศมา แล้วมาไล่ต่อยนักมวยหญิง
แต่ในข้อเท็จจริงของเรื่องนี้ คือ อิมาน เคลิฟ ไม่ได้เป็น Transgender เธอไม่ได้แปลงเพศอะไรเลย
อิมาน เคลิฟ มีสภาพร่างกายที่เรียกว่า DSD (Disorder of Sexual Development) อธิบายคือ เป็นเด็กที่เกิดมาโดยมีโครโมโซม XY แต่มีปัญหาบกพร่องในการแสดงออกของยีนเพศชาย ทำให้รูปลักษณ์ภายนอก เกิดมามีความเป็นหญิง มีอวัยวะเพศเป็นหญิง และก็จะนำมาสู่ การถูกเลี้ยงในฐานะเพศหญิงแบบปกติตั้งแต่เกิดด้วย
ถ้าเราไปดูรูปถ่ายของอิมาน เคลิฟ ตั้งแต่เป็นเยาวชน เราจะเข้าใจว่าเธอเป็นเด็กผู้หญิงปกติ โตขึ้นมาทำพาสปอร์ต เธอก็ถูกระบุว่าเป็น Female
เมื่อโตขึ้น รูปลักษณ์ของเธอ เริ่มดูคล้ายผู้ชายมากขึ้น แต่ผู้คนก็ไม่ได้สงสัยอะไร เพราะผู้หญิงแบบแนวแมนๆ ก็มีเยอะแยะไปในยุคนี้
อิมาน เคลิฟ ต่อยมวยหญิงมาตลอด แต่เธอตกเป็นข่าวใหญ่ ในเดือนมีนาคม 2023 เมื่อ IBA (สมาคมมวยนานาชาติ) แบนเธอจากการแข่งขันมวยสากลสมัครเล่นชิงแชมป์โลก โดยให้เหตุผลว่า คนมีโครโมโซม XY ไม่สามารถต่อยกับโครโมโซม XX ได้
การแข่งขันมวยที่ IBA เป็นคนจัด จะใช้เกณฑ์ XX or XY ในการแยกแยะ ว่าใครจะลงชกมวยหญิง หรือ มวยชาย ดังนั้นอิมาน เคลิฟ ก็เลยลงแข่งขันศึกมวยหญิงชิงแชมป์โลกไม่ได้
เกร็ดสำคัญที่เราควรรู้คือ ในมวยสากลโอลิมปิก ผู้จัดการแข่งขันไม่ใช่ IBA แต่เป็นทาง IOC (คณะกรรมการโอลิมปิกสากล) เป็นคนจัดการแข่งขันทั้งหมดเอง กฎต่างๆ IOC ก็จะยึดของตัวเอง
ในอดีต IOC เคยใช้เกณฑ์ XX or XY ในการแยกนักกีฬาชาย-หญิงมาตลอด แต่ในโอลิมปิกเกมส์ 1996 ที่แอตแลนต้า ก็มีดราม่าเพราะ มีนักกีฬาหญิง 8 คน ที่รูปลักษณ์ภายนอกเป็นหญิงทุกอย่าง แต่มีโครโมโซม XY จึงถูกแบนจากการแข่งขันทั้งหมด
จุดนั้นทำให้ IOC มองว่า การแยกเพศนักกีฬาที่ลงแข่งด้วยโครโมโซม อาจไม่ใช่ทางเลือกที่ถูกต้องที่สุด คนที่ถูกเลี้ยงดูเป็นหญิงมาตลอด แม้จะมีโครโมโซม XY ก็ควรลงแข่งในกีฬาหญิงได้หรือเปล่า?
ดังนั้นนับจากโอลิมปิกที่ซิดนีย์ในปี 2000 IOC จึงมีการเปลี่ยนแนวทางใหม่ มาใช้กฎที่ชื่อว่า "เทสโทสเทอโรน ลิมิต"
อธิบายคือ IOC จะไม่สนใจ ว่าคุณเป็น XX หรือ XY ถ้าหากมีค่าเทสโทสเทอโรน อยู่ต่ำกว่า 10 นาโมโมลต่อลิตร ในช่วง 12 เดือนหลังสุดก่อนแข่งโอลิมปิก ก็จะสามารถลงแข่งขันได้ในประเภทหญิง
ดังนั้น อิมาน เคลิฟ ที่โดนแบนจากรายการของ IBA จึงสามารถลงแข่งในโอลิมปิกได้ เพราะแม้เธอจะเป็น XY แต่เธอมีค่าเทสโทสเทอโรนต่ำกว่าเกณฑ์ที่กำหนด
ผู้คนจะชอบใจหรือไม่ ก็ไม่รู้ แต่อย่างน้อยที่สุด เธอก็เข้ามาเล่นโอลิมปิกได้อย่างถูกต้อง ตามกฎที่ IOC วางเอาไว้เอง
ถามว่าแฟร์ไหม? ก็ตอบยาก เพราะท้ายที่สุดแล้วเธอก็เป็น XY กล้ามเนื้อและพลัง ก็มีข้อได้เปรียบมากกว่า XX คนอื่นๆ อยู่แล้ว
ถ้าดู 46 วินาที ที่อยู่บนสังเวียน อิมาน เคลิฟ ดูแข็งแรงกว่าคู่แข่งมาก หมัดเธอพุ่งแรงเหมือนผู้ชาย คือใครดูไฟต์นี้ก็ต้องเห็นใจฝั่งคารินี่ ว่าจะเอาอะไรไปสู้
แต่จะบอกว่าอิมาน เคลิฟ ทำผิดกฎก็ไม่ได้อีก ก็ค่าเทสโทสเทอโรนของเธอ มันก็ไม่เกินลิมิต
ในเรื่องนี้ บางคนยอมรับได้ แต่บางคนก็ยอมไม่ได้ ตัวอย่างเช่น ซูซาน มัวร์ คอลัมนิสต์จากหนังสือพิมพ์ เดลี่ เทเลกราฟ เขียนว่า "คนที่เกิดมาด้วยอาการ DSD พวกเขาเลือกเกิดไม่ได้ แต่พวกเขาเลือกได้ที่จะไม่โกง ด้วยการพรากเอาเหรียญรางวัลไปจากนักกีฬาหญิงปกติคนอื่นๆ พวกเขาเลือกได้ ที่จะไม่ลงแข่ง แล้วทำให้ผู้อื่นได้รับบาดเจ็บ"
โดยบทความนี้ ถูกแชร์ต่อโดยเจ เค โรว์ลิ่ง นักเขียนคนดัง เจ้าของผลงานแฮร์รี่ พอตเตอร์ด้วย
ขณะที่อีลอน มัสก์ ก็รีทวีตข้อความ ที่บอกว่า "ผู้ชายไม่ควรมาอยูในกีฬาของผู้หญิง" คือมีคนดังหลายคน ที่มองว่าอิมาน เคลิฟ เอาเปรียบนักกีฬาหญิงคนอื่นๆ อยู่
แต่คนที่มองว่าเรื่องนี้ ไม่ได้ใหญ่ขนาดนั้นก็มีเช่นกัน ตัวอย่างเช่น เอมี่ บอร์ดเฮิร์ส นักมวยหญิงแชมป์โลกชาวไอร์แลนด์ ที่เคยต่อยชนะอิมาน เคลิฟมาแล้ว เธอทวีตว่า "ฉันไม่คิดว่าเธอทำสิ่งที่เรียกว่า โกง คือเธอเกิดมาเป็นแบบนี้ และเราก็ทำอะไรไม่ได้ ที่สำคัญ เธอก็เคยแพ้นักมวยหญิงมาก่อนหน้านี้ถึง 9 คนเลยนะ"
ต่างคน ต่างความคิด นำมาสู่การถกเถียงกันอย่างหนักในโลกออนไลน์เวลานี้
สำหรับจุดยืนของ IOC กับดราม่านี้คือ "ปกป้อง อิมาน เคลิฟ" โดยบอกว่า เธอเข้าร่วมแข่งขันตามกฎ และไม่มีทางที่จะเปลี่ยนกฎระหว่างการแข่งขันได้ นอกจากนั้นยังแสดงความผิดหวัง ที่คนในสังคม ทำการโจมตีใส่เคลิฟ และ หลิน ยู่-ติง นักมวยอีกคนจากไต้หวัน ที่มีสภาพร่างกายแบบเดียวกันด้วย
หมายความว่า ต่อให้สังคมจะว่ายังไง แต่ อิมาน เคลิฟ ก็จะได้แข่งขันต่อในรอบ 8 คนสุดท้าย ซึ่งถ้าหากเธอชนะได้ และอีกคู่ จันทร์แจ่มของเราก็ชนะได้เหมือนกัน สองคนนี้จะมาปะทะกันตรงๆ ในรอบรองชนะเลิศ
ไม่อยากนึกเลยนะครับ ว่าถ้าทั้งคู่ได้เจอกันจริงๆ ในไฟต์สำคัญขนาดนั้นล่ะก็ คอมเมนต์ของชาวเน็ตไทย จะดุเดือดขนาดไหน
บทสรุปของเรื่องนี้ ขอย้ำอีกครั้ง ว่าไม่เกี่ยวอะไรกับคนแปลงเพศ (Transgender) นี่ไม่ใช่เคสเดียวกับลีอา โทมัส นักว่ายน้ำที่เป็นผู้ชายมาถึงมัธยม แล้วตัดสินใจแปลงเพศในสมัยมหาวิทยาลัย คือมันเป็นคนละเคสกันเลย
สิ่งที่ดีเบทกันอยู่ตอนนี้คือ ถ้ามีกรณีอย่างอิมาน เคลิฟอีกจะทำอย่างไร
คนที่เกิดมาด้วย XY เป็นผู้ชายในเชิงชีววิทยา แต่ถ้ามีอาการ DSD มีอวัยวะเพศหญิง และถูกเลี้ยงดูแบบเป็นหญิงมาตลอด มีสิทธิ์ได้แข่งโอลิมปิกกับเขาหรือไม่ มันจะแฟร์ไหม ในเมื่อคุณเป็น XY ท้ายที่สุดกล้ามเนื้อก็ได้เปรียบเพศหญิงปกติคนอื่นอยู่ดี
แล้วอนาคต คณะกรรมการโอลิมปิกสากล ควรจะเปลี่ยนกลับไปใช้ เกณฑ์ XX or XY ในการคัดเลือกนักกีฬาแบบยุคอดีตหรือเปล่า จะได้ตัดดราม่าตรงนี้ทิ้งไปเลย
ถ้าดีไซน์กฎมาแบบนั้น นักกีฬาคนไหนที่เกิดมาเป็น XY ก็ต้องยอมรับ ว่าคุณไม่มีสิทธิ์ร่วมแข่งขันกีฬาร่วมกับผู้หญิงคนอื่น จงยอมทำใจ แล้วไปประกอบอาชีพอื่นแทนเอา แบบนั้นยุติธรรมที่สุดหรือเปล่า?
แต่เอาล่ะครับ ในโอลิมปิกคราวนี้ มันเปลี่ยนแปลงอะไรไม่ได้แล้ว เราก็ต้องดูอิมาน เคลิฟ ลงแข่งขันกันต่อไป
ถ้าเธอได้เหรียญทองโอลิมปิกจริงๆ ทุกคนก็ต้องยอมตามนั้น แม้ในใจจะรู้สึกว่ามันแปลกประหลาดแค่ไหนก็ตามที
วิเคราะห์บอลจริงจัง (ภาพจากเพจด้วยเช่นกัน)
ศูนย์บริการสาธารณสุข 46 กันตารัติอุทิศ
ศบส.สี่สิบหก กันตารัติอุทิศ ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 ระหว่างวันที่ 2-13 กันยายน 2567 เวลา 9-12.00 น. ท่านที่มีสัตว์เลี้ยง สามารถพาสัตว์เลี้ยงเข้ารับบริการได้ตามวันและเวลาดังกล่าว อย่าลืม!! นำบัตรประชาชนของเจ้าของมาด้วยนะ
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางกอกใหญ่
ปัตตานี ปฏิบัติตัวตามมาตรการป้องกันโรค D-M-H-T-T LINK
ผู้เดินทางมาจากพื้นที่เสี่ยง 9 จังหวัด
(กรุงเทพฯ สมุทรสาคร สมุทรสงคราม นนทบุรี นครปฐม ปทุมธานี ตาก และราชบุรี)
- รายงานตัวกับเจ้าหน้าที่สาธารณสุข โรงพยาบาลส่งเสริมสุขภาพตำบล (ในเวลาราชการ), โรงพยาบาลใกล้บ้าน, อสม, ผู้นำชุมชน เมื่อเดินทางมาถึง
- ให้เจ้าหน้าที่ควบคุมโรคติดต่อ พิจารณาการกักตัวตามความเสี่ยงและความเหมาะสมในการป้องกันโรค
- หากมีไข้และอาการทางเดินหายใจ จมูกไม่ได้กลิ่น ให้รีบพบแพทย์
- ปฏิบัติตัวตามมาตรการป้องกันโรค D-M-H-T-T และติดตั้งแอปพลิเคชั่น ไทยชนะ
ฉะเชิงเทรา - จาก 5 จว. รายงานตัว LINK
ผู้ที่เข้าพำนัก ในพื้นที่จ. ฉะเชิงเทรา สแกน
QR Code เพื่อรายงาน
ผู้ที่เดินทางจาก กทม ปทุมธานี นนทบุรี นครปฐม สมุทรปราการ ให้รายงานต่อจนท.ควบคุมโรคติดต่อท้องที่
เทศบาลเมือง ฉะเชิงเทรา 092-664-9655
เขตอำเภอเมือง ฉะเชิงเทรา 082-919-3205
สำนักงานสาธารณสุขจังหวัดฉะเชิงเทรา 094-792-2525
รพ. พุทธโสธร โทร 038-814-375
ประกาศ 9 เมย 64
ประกาศ 9 เมย 64 05:03
ภูเก็ตต้องชนะ
1. ศูนย์วัคซีนภูเก็ต ทั้ง 5 ศูนย์เปิดให้บริการจะให้บริการเฉพาะผู้ที่ได้รับการจัดสรรเวลาและในศูนย์ที่ระบุบนเวปไซด์ check.ภูเก็ตต้องชนะ.com เท่านั้นในวันที่ 9 เมษายน 2564 (ไม่รับ walk in)
2. ผู้ที่ได้รับจัดสรรเวลาในวันที่ 10 เมษายน 2564 ณ ศูนย์สะพานหิน ให้มารับวัคซีนก่อนเวลา 18.00 น. ในวันที่ 10 เมษายน 2564 (งดรับผู้ได้รับจัดสรรในวันอื่น หรือมาจากศูนย์วัคซีนอื่น หรือไม่ได้ลงทะเบียนล่วงหน้าโดยเด็ดขาด)
3. ผู้ได้รับจัดสรรเวลารับวัคซีนตั้งแต่วันที่ 1-8 เมษายนที่ผ่านมาแล้วยังไม่ได้รับวัคซีน ให้รอนัดใหม่ในรอบเดือนพฤษภาคม 2564
4. ศูนย์สะพานหินให้บริการรับวัคซีนรอบนี้ถึงวันที่ 10 เมษายน 2564 ผู้ที่ได้รับจัดสรรเวลารับวัคซีนในวันที่ 11-12 เมษายน 2564 กรุณารอ sms ในการจัดสรรเวลาใหม่ โดยรายชื่อท่านจะถูกจัดเป็นผู้ได้รับวัคซีนเป็นกลุ่มแรกในการฉีดวัคซีนรอบเดือนถัดไป
5. ผู้ที่ประสงค์จะลงทะเบียนรับวัคซีนในรอบเดือนพฤษภาคม 2564 สามารถลงทะเบียนใน www.ภูเก็ตต้องชนะ.com ได้ตั้งแต่วันที่ 20 เมษายน 2564 เป็นต้นไป
13 กค 64 LINK
หน่วยบริการตรวจเชิงรุก COVID-19 ในพื้นที่กรุงเทพมหานคร
วันที่ 13 ก.ค. 64 ตั้งแต่เวลา 08.00 น. เป็นต้นไป
กำหนดการแจกบัตรคิว ดังนี้
1. เขตดินแดง - แจกวันต่อวัน เริ่มแจก 07.00 น. (400 คน)
2. เขตลาดพร้าว - แจกล่วงหน้า 1 วัน เริ่มแจก 06.00 น. (900 คน)
3. เขตมีนบุรี - แจกวันต่อวัน เริ่มแจก 06.00 น. (1,000 คน)
4. เขตสวนหลวง - แจกล่วงหน้า 1 วัน เริ่มแจก 06.00 น. (200 คน)
5. เขตบางพลัด - แจกล่วงหน้า 1 วัน เริ่มแจก 08.00 น. (900 คน)
6. เขตราษฎร์บูรณะ - แจกวันต่อวัน เริ่มแจก 04.00 น. (900 คน)
เอกสารและอุปกรณ์ที่ต้องใช้:
- บัตรประจําตัวประชาชนตัวจริง พร้อมสำเนา 2 ใบ
- ปากกาสีน้ำเงินส่วนตัว เพื่อใช้ลงทะเบียน (เลี่ยงการสัมผัสหรือส่งต่อ)
เขตหลักสี่ LINK
เจ้าของสัตว์เลี้ยง เตรียมพร้อม หลักสี่ ออกหน่วยให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
วันที่ 13-24 มี.ค. 2566 นี้ ฟรี ตั้งแต่เวลา 09.30 - 11.30 น. ที่สำคัญ‼....นำบัตรประจำตัวประชาชนเจ้าของสัตว์เลี้ยงมาลงทะเบียน เพื่อขอรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าได้ฟรี
บุฟเฟต์ทุเรียน @Durian Master แห่งเดียวในภูเก็ต LINK
บุฟเฟต์ทุเรียน @Durian Master แห่งแรก แห่งเดียวในภูเก็ต มีครบทุกพันธุ์อร่อย หมอนทอง/ ก้านยาว/ พวงมณี/ กระดุม / ชะนี
• ราคา 599บาท /1คน (รวมเมนูอาหารหวาน โดยใช้วัตถุดิบหลักจากทุเรียนร้านเราเอง)
• ราคา 899บาท /1คน (รวบรวมไว้ทั้ง เมนูอาหารคาว และอาหารหวานกว่า 10เมนูแบบจุกๆ)
นอกจากเมนูบุฟเฟต์ ลูกค้าสามารถเลือกทุเรียนหน้าร้านซื้อปลีกได้นะคะ มีให้ลูกค้าเลือกสรรตามชอบเลยย ติดต่อสอบถาม 098-568-6533
White Shark และ Summer Beach ชลบุรี
White Shark เหล้าไวต์ชาร์คสุรากลั่นชุมชนจากบางแสนจังหวัดชลบุรี จากบาร์เล็กๆ อยู่ริมหาดวอนนภา บางแสน ชลบุรี ความรู้เรื่องเหล้าเป็นศูนย์ มีแต่ passion ที่อยากทำเหล้าแบรนด์ตัวเองเพื่อเอามาใช้ในบาร์ของเรา หาข้อมูลจากอินเตอร์เน็ต จนได้เจอกลุ่มคนที่สนใจเรื่องสุราชุมชนเหมือนๆ กันจากนั้นก็ได้เรียนรู้ ทดลองด้วยตัวเอง แบบลองผิดลองถูกมาเรื่อยๆ จนผลลัพธ์เป็นที่น่าพอใจ ในที่สุดก็จัดตั้งโรงกลั่นได้สำเร็จในปี 2019 เกิดแบรนด์ Summer Beach ขึ้นมาเพื่อการทำค็อกเทลโดยเฉพาะ เปิดตัวครั้งแรกที่งาน Khaokho craft festival เมื่อเดือนตุลาปี 2022 ทั้ง 2 แบรนด์ใช้วัตถุดิบหลักคืออ้อย ถ้าทำมาจากอ้อยเหมือนกัน เหล้า2ตัวต่างกันยังไง? White Shark กลั่นด้วยหอกลั่นแบบคอลัมน์ต่อเนื่อง Summer Beach กลั่นด้วยหม้อทองแดง ทำให้เหล้าทั้งสองแบรนด์มีความแตกต่าง ที่มาของชื่อแบรนด์? ไม่มีอะไรซับซ้อน นึกถึงชลบุรี บางแสน ก็คือทะเลชายหาด ทีมฟุตบอลฉลามชล จึงเป็นที่มาของแบรนด์ทั้ง 2 ตัว ชลบุรีเป็นเมืองทะเล เลยยึด Concept นี้ในการสร้างแบรนด์อื่นๆ ในอนาคตอีกด้วย
"วิจารณ์-สายลม" โค้ชกำปั้นไทย มองการชกกับ "เคลิฟ" เหมือนชกกับผู้ชาย - PPTV
2 สตาฟฟ์โค้ชที่พานักกีฬามวยหญิงไทยไปแข่งขันในโอลิมปิก 2024 บอกว่าการต้องพบ อีมาน เคลิฟ นักชกแอลจีเรีย เหมือนเป็นการชกกับผู้ชาย เพราะรูปร่างหน้าตาแข็งแกร่ง และมองว่าไม่ควรมาขึ้นชกกับผู้หญิง
โดยความเห็นของ พ.ต.ท.วิจารณ์ พลฤทธิ์ ฮีโร่เหรียญทองโอลิมปิก ปี 2000 ที่ซิดนีย์ ปัจจุบันเป็นหัวหน้าผู้ฝึกสอนมวยสากลหญิง ได้พูดคุยกับทีมข่าวพีพีทีวี บอกว่า หากทางคณะกรรมการโอลิมปิก (IOC) เห็นว่า อีมาน เคลิฟ เป็นผู้หญิงเพราะดูตามพาสปอร์ต ระบุ เพศเป็นเพศหญิง แต่หากมองตามระดับฮอร์โมนเพศ "เคลิฟ" มีระดับฮอร์โมน ผู้ชายมากกว่าผู้หญิง แน่นอนว่าต้องมีความแข็งแรงมากกว่าผู้หญิงปกติ แต่เมื่อ IOC ยึดตามพาสปอร์ต ไทยเราต้องว่าตาม แต่เชื่อว่าเราสู้ได้ ไทยเราเตรียมตัวมาดี หากจะต้องโคจรมาเจอกับนักชกไทย
ซึ่งก่อนหน้านี้ได้พูดคุยกับ จันทร์แจ่ม สุวรรณเพ็ง นักชกที่ชกในรุ่นเดียวกับกับนักชกแอลจีเรีย นั้นยังกำลังใจดีพร้อมสู้ศึก แม้เหตุการณ์ที่เกิดขึ้นจะสร้างความกังวล เรื่องความปลอดภัยของนักชกที่จะขึ้นเวทีสู้กับ"เคลิฟ" แต่ทีมสตาฟฟ์โค้ช ได้มีการปรับแผนรับมือต่อสู้กันอย่างหนักหน่วง เพราะศึกนี้เหมือนขึ้นชกกับผู้ชาย ที่มีความแข็งแกร่งและว่องไว พร้อมออกอาวุธจัดการคู่ต่อสู้ตลอดเวลา
นอกจากนี้โค้ชวิจารณ์ ยังบอกอีกว่า ความจริง "จันทร์แจ่ม" เคยเจอกับ "เคลิฟ" มาแล้วบนเวทีมวยสากลชิงแชมป์โลกเมื่อปี 2023 ที่ประเทศอินเดีย ซึ่งในครั้งนั้น "เคลิฟ" เป็นฝ่ายชนะไปได้ แต่หลังการแข่งขันทางไอบ้า (ตรวจพบโครโมโซม xy ซึ่งพบในเพศชาย ไม่ใช่ xx ตามปกติของเพศหญิง กรรมการจึงเปลี่ยนคำตัดสินให้ "จันทร์แจ่ม" เป็นฝ่ายชนะ /
ซึ่งการชกบนเวทีในครั้งนั้นยอมรับว่า "เคลิฟ" มีความแข็งแกร่งว่องไว ออกอาวุธเหมือนผู้ชาย แต่เมื่อย้อนกลับไปตอนที่เจอ "เคลิฟ" ครั้งแรกในปี 2018 นักชกรายนี้ก็มีชกแพ้เหมือนกัน แต่กลับมาปีนี้กลับชกเหมือนผู้ชายไม่มีผิด //
อนาคตโอลิมปิกในอีก 4 ปีข้างหน้าคาดหวังว่า ทางผู้จัดจะมีการระบุกติกาการลงแข่งให้ชัดเจน// หมายความว่าต้องมีการระบุรดับฮอร์โมนในเกณฑ์ที่เหมาะสม ว่า ควรอยู่ที่เท่าไหร่ จึงจะสามารถลงแข่งในเวทีมวยหญิงได้ เพราะหากปล่อยให้เป็นเหมือนปีนี้จะเกิดความได้เปรียบขึ้น
อย่างไรก็ตาม โอลิมปิก 2028 จะจัดที่ลอสแองเจลิส สหรัฐอเมริกา ยังไม่ได้บรรจุมวยสากลเข้าแข่งขัน
ด้าน ร.ต.สายลม อาดี หนึ่งในทีมสตาฟฟ์โค้ช บอกว่า เคลิฟ" มีระดับฮอร์โมนผู้ชายมากผิดปกติ ก็เปรียบเหมือนผู้ชาย การที่ผู้ชายไปชกกับผู้หญิง ก็ต้องมีความได้เปรียบ เพราะผู้หญิงไม่แข็งแรงเท่าผู้ชายอยู่แล้ว และส่วนตัวเคยสัมผัสกับ "เคลิฟ" ตอนฝึกซ้อมที่ฝรั่งเศส ซึ่งคือผู้ชายดีๆ นี่เอง มีความแข็งแรง เร็ว สามารถเร่งเครื่องทำลายคู่ต่อสู้ได้ตลอดเวลา
นอกจากนี้โค้ชสายลม บอกอีกว่า หลังเกิดเหตุการณ์นี้ เหล่าสตาฟฟ์โค้ชประเทศต่างๆ ล้วนไม่อยากให้นักกีฬาของตัวเองขึ้นชกกับ "เคลิฟ" เพราะเสี่ยงอันตราย ที่จะเกิดการบาดเจ็บระหว่างขึ้นชก แต่เมื่อ IOC อนุญาตให้ "เคลิฟ" ชกต่อได้ ไทยเราเองก็พร้อมสู้เต็มที่ นักชกกำลังใจเต็มร้อย มีโอกาสชนะแน่นอน
PPTV 2 สิงหาคม 2567 ศูนย์บริการสาธารณสุข 47 คลองขวาง
ศูนย์บริการสาธารณสุข 47 คลองขวาง เขตภาษีเจริญ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 2-6 กันยายนนี้ ตั้งแต่เวลา 09.00-11.00 น.
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตคลองสาน
ประกาศ 8 เมย 64 ตรวจสอบนัดได้ที่ เว็บภูเก็ตต้องชนะ.com LINK
สามารถเปลี่ยนเวลาได้ในวันและสถานที่เดิม
หากเปลี่ยนวันหรือเปลี่ยนสถานที่ จะถือว่าเป็นการ walk in แล้วแต่เจ้าหน้าที่ว่าจะให้เข้าไหม แนะนำให้เข้าลงทะเบียนใหม่รอบหน้า
สำหรับบุคคลทั่วไปที่มีทะเบียนบ้านในจังหวัดภูเก็ต ลงทะเบียนบนเวปได้เลย ส่วนทะเบียนบ้านต่างจังหวัด ลงทะเบียนได้ที่ ผู้ใหญ่บ้าน กำนัน อบต. เทศบาล
ปิดปรับปรุงระบบลงทะเบียนบริษัท
เรื่องโรคประจำตัว ติดต่อ สสจ.ภูเก็ตโทร 094-5938876 หรือ 094-5935342
ผู้ที่ไปร่วมงานคัลเลอร์บีชไซด์วันที่ 2-3 เมษายน และมีนัดมารับวัคซีนในเดือนเมษายน ให้งดมารับวัคซีน
ให้บุคคลที่เข้าร่วมงานดังกล่าวทุกคน รีบไปตรวจหาเชื้อที่ รพ.ใกล้บ้านฟรี รวมถึงให้แยกกักตัวเองที่บ้านเป็นเวลา 14 วันนับจากวันงาน
โดยให้เลื่อนการรับวัคซีน (หากตรวจไม่พบเชื้อ) เป็นรอบเดือน พฤษภาคม
ท่านสามารถเปลี่ยนเวลาในวันและสถานที่เดิมได้
หากเปลี่ยนวันหรือเปลี่ยนสถานที่ จะถือว่าเป็นการ walk in แล้วแต่เจ้าหน้าที่ว่าจะให้เข้าไหม ซึ่งตอนนี้เจ้าหน้าที่เข้มงวดมากครับ
เนื่องจากมีผู้ลงทะเบียนเกินกว่าจำนวนวัคซีนรอบเดือนเมษายน เราจึงขอปิดระบบลงทะเบียนบริษัทและบุคคลทั่วไป จนกว่าเราจะทราบกำหนดการของวัคซีนในเดือนพฤษภาคม โดยท่านที่ไม่มีนัดหมายในระบบจะไม่ได้รับวัคซีนรอบนี้ครับ
ยะลา เดินทางได้ปกติ LINK
1. มาตราการเดินทางเข้ามาจังหวัดยะลา สำหรับผู้มาจากต่างจังหวัด
- รายงานตัวและประเมินความเสี่ยง กับ เจ้าหน้าที่สาธารณสุขใกล้บ้าน หรือลงทะเบียน QR Code : YALA SAFE ALERT
- ปฏิบัติตามมาตรการ D-M-H-T-T อย่างเคร่งครัด
2. ร้านอาหาร สถานบันเทิง ยังไม่ปิด แต่ให้มีการจัดการตามรูปแบบที่เคยปฏิบัติ มีแอลกอฮอลล้างมือ เว้นระยะห่างในการเข้าใช้บริการ
3. การจัดงานแต่งงาน ต้องจัดให้มีแอลกอฮอลล้างมือ/จุดล้างมือ เว้นระยะห่างในการนั่ง สวมแมสตลอดยกเว้นช่วงทานอาหาร
สอบถามเพิ่มเติม
สายด่วน ยะลาCovid-19
093-359-1300, 098-563-3488, 098-563-3496, 098-563-3499
12-18 กค 64 LINK
12 กค 64
ลานจอดรถ ศบส.38 จี๊ด-ทองคำ บำเพ็ญ เขตดุสิต
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดยาง ถนนอ่อนนุช เขตสวนหลวง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
13 กค 64
ลานกีฬาชุมชนดินแดง ถนนประชาสงเคราะห์ เขตดินแดง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดยาง ถนนอ่อนนุช เขตสวนหลวง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
14 กค 64
ลานกีฬาชุมชนดินแดง ถนนประชาสงเคราะห์ เขตดินแดง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดยาง ถนนอ่อนนุช เขตสวนหลวง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
15 กค 64
ลานกีฬาชุมชนดินแดง ถนนประชาสงเคราะห์ เขตดินแดง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดยาง ถนนอ่อนนุช เขตสวนหลวง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
16 กค 64
วัดสามัคคีธรรม เขตวังทองหลาง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดวชิรรรรมสาธิตวรวิหาร เขตพระโขนง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
17 กค 64
วัดสามัคคีธรรม เขตวังทองหลาง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดวชิรรรรมสาธิตวรวิหาร เขตพระโขนง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
18 กค 64
วัดสามัคคีธรรม เขตวังทองหลาง
โลตัส สาขาเลียบทางด่วน เอกมัย-รามอินทรา เขตลาดพร้าว
เฉลิมพระเกียรติ 72 พรรษา มีนบุรี
วัดวชิรรรรมสาธิตวรวิหาร เขตพระโขนง
ลานใต้สะพานพระราม 8 เขตบางพลัด
วัดราษฎร์บูรณะ เขตราษฎร์บูรณะ
กำหนดการแจกบัตรคิว ดังนี้
1. เขตดินแดง - แจกวันต่อวัน เริ่มแจก 07.00 น. (400 คน)
2. เขตลาดพร้าว - แจกล่วงหน้า 1 วัน เริ่มแจก 06.00 น. (900 คน)
3. เขตมีนบุรี - แจกวันต่อวัน เริ่มแจก 06.00 น. (1,000 คน)
4. เขตสวนหลวง - แจกล่วงหน้า 1 วัน เริ่มแจก 06.00 น. (200 คน)
5. เขตบางพลัด - แจกล่วงหน้า 1 วัน เริ่มแจก 08.00 น. (900 คน)
6. เขตราษฎร์บูรณะ - แจกวันต่อวัน เริ่มแจก 04.00 น. (900 คน)
เขตป้อมปราบศัตรูพ่าย
ศูนย์บริการสาธารณสุข20 ร่วมกับสำนักงานเขตป้อมปราบศัตรูพ่ายจัดหน่วยบริการฉีดวัตซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์ โดยมีวันเวลาสถานที่
Chalong Bay Pure Series สุราชุมชนภูเก็ต
Chalong Bay Pure Series (ในกล่องสีขาว) ฉลองเบย์สุราชุมชนจากภูเก็ต สุราตัวนี้เคยได้รับรางวัลระดับนานาชาติ เหรียญทอง ปี 2015 จาก San Francisco World Spirits Competition ผลิตจากอ้อยไทยสด 100% จัดอยู่ในกลุ่มรัม 3% ของโลกที่ผลิตจากอ้อยแท้ๆ กับกลั่นโดยเครื่องกลั่นทองแดงนำเข้าจากประเทศฝรั่งเศส และฉลองเบย์ยังให้ความสำคัญกับการทำธุรกิจที่ยั่งยืนโดยร่วมมือกับชาวนาท้องถิ่นมาอย่างยาวนานถึง 12 ปี เพื่อเพาะปลูกอ้อยโดยไร้สารเคมีและใช้วิธีการเก็บเกี่ยวโดยไม่มีการเผา
ขวดสีดำคือ SANEHA "เสน่ห์หา" เป็นสุราที่ใช้วัตถุดิบธรรมชาติจากประเทศไทย 100% มีสมุนไพรธรรมชาติ 6 ชนิด และมะแขว่นวัตถุดิบหายากจากป่าธรรมชาติของไทย กลั่นโดยเครื่องกลั่นทองแดงนำเข้าจากประเทศฝรั่งเศสแบบดั่งเดิม
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตธนบุรี
ประกาศ 8 เมย 64 - ผู้ที่ไปร่วมงานคัลเลอร์บีชไซด์วันที่ 2-3 เมย และมีนัดมารับวัคซีนในเดือนเมษายน ให้งดมารับวัคซีน
ผู้ที่ไปร่วมงานคัลเลอร์บีชไซด์วันที่ 2-3 เมษายน และมีนัดมารับวัคซีนในเดือนเมษายน ให้งดมารับวัคซีน ให้บุคคลที่เข้าร่วมงานดังกล่าวทุกคน รีบไปตรวจหาเชื้อที่ รพ.ใกล้บ้านฟรี รวมถึงให้แยกกักตัวเองที่บ้านเป็นเวลา 14 วันนับจากวันงาน โดยให้เลื่อนการรับวัคซีน (หากตรวจไม่พบเชื้อ) เป็นรอบเดือน พฤษภาคม
สระบุรี - กักตัว 14 วัน ถ้ามาจาก 5 จว. LINK
เข้าจังหวัด
ลงทะเบียน QR
- มาจาก ลงทะเบียน QR หรือบันทึกข้อมูลผ่านจุดตรวจ และเฝ้าสังเกตอาการ 14 วัน หรือ จนกว่าจะออกจากสระบุรี
- ผู้เดินทางเข้าสระบุรี ลงทะเบียน "ไทยชน"
ผู้ที่เดินทางไปใน 5 จว. - กทม ปทุม นนทบุรี สมุทรปราการ นครปฐม - ตั้งแต่ 1 เมย 64 รายงานตัวต่อจนท.และ
กักตัว 14 วัน หรือจนกว่าจะออกจากสระบุรี หากอยู่ไม่ครบ 14 วัน แต่ถ้า จนท.เห็นว่าไม่สามารถกักตัวในที่พักอาศัยได้ กักตัวในสถานที่ที่จังหวัดจัดให้ (Local quarantine)
เพจ
สสจ.สระบุรี สายด่วนโควิด สระบุรี 096-909-9179
โทร 036-211-015
รพ.สระบุรี โทร 036-343-500
11 กค 64 รวม 5 จุด ตั้งแต่เวลา 08.00 น. เป็นต้นไป LINK
หน่วยบริการตรวจเชิงรุก COVID-19 ในพื้นที่กรุงเทพมหานคร
วันที่ 11 ก.ค. 64 ตั้งแต่เวลา 08.00 น. เป็นต้นไป
- วัดพระศรีมหาธาตุ บางเขน
- สนามกีฬาเฉลิมพระเกียรติ มีนบุรี
- วัดยาง อ่อนนุช
- วัดบางขุนเทียนนอก พระราม 2 ซอย 28 (จอมทอง 19)
- ตลาดบางแคภิรมย์
เอกสารและอุปกรณ์ที่ต้องใช้:
- บัตรประจําตัวประชาชนตัวจริง พร้อมสำเนา 2 ใบ
- ปากกาสีน้ำเงินส่วนตัว เพื่อใช้ลงทะเบียน (เลี่ยงการสัมผัสหรือส่งต่อ)
เขตคลองสามวา LINK
กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 13-24 มีนาคม 2566 เวลา 9.00 - 11.30 น. (ตามสถานที่ดังกล่าว)
สำนักงานเขตตลิ่งชัน ศูนย์ฯ 49 วัดชัยพฤกษมาลา ฉีดวัคซีน 2-12 กันยายน
สำนักงานเขตตลิ่งชัน ศูนย์ฯ 49 วัดชัยพฤกษมาลา ฉีดวัคซีน 2-12 กันยายน เวลา 9.30 - 11.30 น. สอบถามโทร 02-4241561 ฝ่ายสิ่งแวดล้อมฯ สำนักงานเขตตลิ่งชัน
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตราษฎร์บูรณะ
กายอุปกรณ์ Wiki
กายอุปกรณ์ หมายถึง อุปกรณ์ทางการแพทย์ต่างๆที่ใช้กับร่างกาย ในความหมายที่ใช้ในปัจจุบัน มักจะหมายถึงอุปกรณ์ที่ใช้กับร่างกายเพื่อช่วยเหลือการเคลื่อนไหว เช่น แขนเทียม ขาเทียม อุปกรณ์ประคองหรือดามหลัง อุปกรณ์ดามมือ เป็นต้น แต่โดยทั่วไป ขอบเขตที่แท้จริงของกายอุปกรณ์ ยังรวมไปถึงอุปกรณ์อื่นๆที่ใช้กับร่างกายด้วย เช่น ลูกตาเทียม ข้อเข่าเทียมที่ใช้สำหรับผ่าตัดทดแทนเข่าเดิมในผู้ป่วยข้อเข่าเสื่อม เป็นต้น และอุปกรณ์ช่วยเหลือการเคลื่อนไหวต่างๆ เช่น รถล้อเข็น (Wheelchair) ไม้เท้า เป็นต้น
ส่วน งานกายอุปกรณ์ หมายถึงการตรวจวัดขนาด ออกแบบ ประดิษฐ์ ผลิต ดัดแปลง แก้ไข ซ่อมแซม อุปกรณ์ต่างๆที่ใช้กับร่างกายให้เหมาะสมกับผู้ป่วยแต่ละราย เพื่อช่วยเหลือการเคลื่อนไหวเท่านั้น งานกายอุปกรณ์ต้องอาศัยทักษะฝีมือและความเชี่ยวชาญชำนาญเฉพาะบุคคลค่อนข้างสูง (ร่วมกับความรู้ความเข้าใจในเรื่องวัสดุศาสตร์ วิศวกรรมศาสตร์ ศิลปะ และเรื่องวิทยาศาสตร์การแพทย์ด้านกายวิภาคประยุกต์ ด้านชีวกลศาสตร์และการเคลื่อนไหวประยุกต์พอสมควร)
และ งานกายอุปกรณ์ จัดเป็นส่วนหนึ่งของทีมงานด้านเวชศาสตร์ฟื้นฟู อีกด้วย
ในภาษาอังกฤษคำว่า กายอุปกรณ์ ใช้ใน US ว่า Orthosis and Prosthesis (ตัวย่อว่า O&P) ส่วนในประเทศไทยนิยมเรียกว่า Prosthesis and Orthosis (ตัวย่อ PO) อนึ่งคำว่า Prosthesis อาจเขียนว่า Prostheses ก็ได้เมื่อมีความหมายเป็นพหูพจน์ และคำว่า Orthosis สามารถเขียนให้อยู่ในรูปพหูพจน์ได้ว่า Orthoses
ส่วนคำว่า งานกายอุปกรณ์ ใช้ว่า Prosthetics and Orthotics (ตัวย่อ P&O) หรือ Orthotics and Prosthetics (ตัวย่อ O&P) ก็ได้เช่นกัน
บุคลากรด้านกายอุปกรณ์ในประเทศไทย
บุคลากรที่ทำหน้าที่ตรวจวัดขนาด ออกแบบ ประดิษฐ์ ผลิตและดัดแปลงซ่อมแซมกายอุปกรณ์เสริม-เทียมให้เหมาะสมกับผู้ป่วยและผู้พิการ มีชื่อเรียกตามที่ ก.พ.ระบุ ซึ่งเรียกชื่อตำแหน่งบรรจุตามวุฒิการศึกษาคือ หากสำเร็จการศึกษาระดับประกาศนียบัตรจากโรงพยาบาลเลิดสิน หรือ สำเร็จการศึกษาประกาศนียบัตรชั้นสูงจากสถาบันเทคโนโลยีพระจอมเกล้าพระนครเหนือ (พ.ศ. 2536-2542) เรียกว่า ช่างกายอุปกรณ์ (PO technician) แต่หากสำเร็จการศึกษาระดับปริญญาจะเรียกว่า นักกายอุปกรณ์ (Prosthetist/Orthotist) ซึ่งโรงเรียนกายอุปกรณ์สิรินธร คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล[1] ถือเป็นสถาบันการศึกษาแห่งแรกและแห่งเดียวในภูมิภาคเอเชียตะวันออกเฉียงใต้ที่ผลิตบัณฑิตในสาขากายอุปกรณ์หรือนักกายอุปกรณ์ออกมา
(ในอดีต หลักสูตรด้านกายอุปกรณ์ในประเทศไทยยังไม่มีการจัดเป็นหลักสูตรปริญญา ซึ่งเหมือนกับอีกหลายๆหลักสูตร เช่น พยาบาล (เทคนิค) , ครู (ประกาศนียบัตรชั้นสูง) เป็นต้น แต่ในปัจจุบันได้ปรับหลักสูตรเป็นระดับปริญญาแล้ว ในหลายๆประเทศ เช่น ญี่ปุ่น ปัจจุบันยังมีหลักสูตรกายอุปกรณ์ทั้งระดับปริญญา (เรียน 4 ปี) และระดับอนุปริญญา (เรียน3 ปี) เช่นกัน)
ช่างกายอุปกรณ์หรือนักกายอุปกรณ์ จะปฏิบัติงานในทีมของเวชศาสตร์ฟื้นฟู ซึ่งจะประกอบด้วยสหสาขาวิชา เช่น แพทย์เวชศาสตร์ฟื้นฟู นักกายภาพบำบัด นักกิจกรรมบำบัด นักอรรถบำบัด นักจิตวิทยา พยาบาลทางเวชศาสตร์ฟื้นฟู
ผู้ที่ทำหน้าที่ส่งต่อการรักษาและร่วมตรวจสอบกายอุปกรณ์กับผู้ป่วยคือ แพทย์ ซึ่งมักเป็น แพทย์เวชศาสตร์ฟื้นฟู หรือ ศัลยแพทย์ออร์โธปิดิกส์
ประเภทของกายอุปกรณ์
กายอุปกรณ์แบ่งเป็น 2 ประเภท ได้แก่
กายอุปกรณ์เทียม (prosthesis) กายอุปกรณ์ต่างๆ ที่ใช้ทดแทนอวัยวะหรือชิ้นส่วนของอวัยวะที่ขาดหายไป เช่น ขาเทียม แขนเทียม นิ้วมือเทียม เป็นต้น
ในทางกายอุปกรณ์สำหรับแขนขา หมายถึง อุปกรณ์ใดๆก็ตามภายนอกร่างกาย ที่นำมาทดแทนส่วนของระยางค์ (แขน-ขา) ทั้งหมดหรือบางส่วนซึ่งไม่เคยมีอยู่เลยหรือขาดหายไป
Prosthesis; Prosthetic device: Externally applied device used to replace wholly, or in part, an absent or deficient limb segment. (จากข้อ 2.1.1 ใน ISO 8549-1 : 1989)
กายอุปกรณ์เสริม (orthosis) คือ กายอุปกรณ์ต่างๆที่ใช้เพื่อเสริมการทำหน้าที่ของอวัยวะที่มีปัญหาในการทำงาน (เช่น อ่อนแรง, เจ็บปวด, เสื่อมสมรรถภาพ เป็นต้น) อาจเรียกชื่อสามัญว่า อุปกรณ์เสริม, อุปกรณ์ดาม หรือที่ประคอง (Splint หรือ Brace) ก็ได้
ในทางกายอุปกรณ์สำหรับแขนขา หมายถึง อุปกรณ์ใดๆก็ตามภายนอกร่างกาย ที่นำมาดัดแปลงลักษณะโครงสร้างหรือการทำหน้าที่ของระบบประสาท-กล้ามเนื้อและระบบค้ำจุนร่างกาย (กระดูก-กล้ามเนื้อ) ของร่างกาย
Orthosis; Orthotic device: Externally applied device used to modify the structural and functional characteristics of the neuro-muscular and skeletal systems. (จากข้อ 2.1.2 ใน ISO 8549-1 : 1989)
เมื่อดูจากคำจำกัดความตาม ISO อุปกรณ์ช่วยเหลือการเคลื่อนไหว (Mobility aids) ชนิดต่างๆ เช่น รถล้อเข็น (Wheelchair) , ไม้เท้า (Cane) , ไม้ค้ำยัน (Crutches) ก็จัดได้ว่าเป็นกายอุปกรณ์เสริมชนิดหนึ่งเช่นกัน แต่ตามปรกติในทางปฏิบัติ มักไม่ถูกรวมอยู่ในกายอุปกรณ์เสริม มักจัดเป็นอีกกลุ่มซึ่งแยกออกมา
กายอุปกรณ์เทียม
ในงานกายอุปกรณ์ แบ่งเป็นกลุ่มใหญ่ๆคือ
กายอุปกรณ์สำหรับระยางค์ล่าง หรือเรียกง่ายๆว่า ขาเทียม
กายอุปกรณ์เทียมสำหรับระยางค์บน หรือเรียกแบบง่ายว่า แขนเทียม
หมายเหตุ
รยางค์ล่าง (Lower extremity) หมายถึง ขา (ตั้งแต่ปลายนิ้วเท้าจนถึงข้อสะโพก) และกระดูกเชิงกราน (ทำหน้าที่เป็นโครงให้ขายึดกับแกนกลางร่างกายที่กระดูกสันหลัง)
รยางค์บน (Upper extremity) หมายถึง แขน (ตั้งแต่ปลายนิ้วมือจนถึงข้อไหล่) กระดูกไหปลาร้าและกระดูกสะบัก (ทำหน้าที่เป็นโครงให้ขายึดกับแกนกลางร่างกายที่กระดูกซี่โครง)
การเรียกชื่อชนิดต่างๆของแขนเทียมและขาเทียม สามารถทำได้ 2 แบบคือ
เรียกตามตำแหน่งที่ระยางค์ล่างโดนตัด แบ่งได้เป็น (จากด้านล่างขึ้นมาด้านบน)
สำหรับระยางค์ล่าง แบ่งได้เป็น
กายอุปกรณ์เทียมทดแทนนิ้วเท้า (Toe prosthesis)
กายอุปกรณ์เทียมทดแทนบางส่วนของเท้า (Partial foot prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาผ่านข้อเท้า (Ankle disarticulation (AD) prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาผ่านกระดูกหน้าแข้ง (Transtibial (TT) prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาผ่านข้อเข่า (Knee disarticulation (KD) prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาผ่านกระดูกต้นขา (Transfemoral (TF) prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาผ่านข้อสะโพก (Hip disarticulation (HD) prosthesis)
ขาเทียมสำหรับผู้ถูกตัดขาและเอากระดูกเชิงกรานออกไปด้วย 1 ข้าง (Hemipelvectomy prosthesis)
สำหรับระยางค์บน แบ่งได้เป็น
กายอุปกรณ์เทียมทดแทนนิ้วมือ (Finger prosthesis)
กายอุปกรณ์เทียมทดแทนบางส่วนของมือ (Partial hand prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านข้อมือ (Wrist disarticulation (WD) prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านกระดูกปลายแขน (Transradial (TR) prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านข้อศอก (Elbow disarticulation (ED) prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านกระดูกต้นแขน (Transhumeral (TH) prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านกระดูกต้นแขนที่คอกระดูกต้นแขน (Humeral-neck amputation prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนผ่านข้อไหล่ ("True" shoulder disarticulation prosthesis)
แขนเทียมสำหรับผู้ถูกตัดแขนร่วมกับเอากระดูกสะบักและกระดูกไหปลาร้าออกไปด้วย 1 ข้าง (Forequater amputation prosthesis)
เรียกโดยอ้างอิงจากตำแหน่งของข้อต่อ เป็นการแบ่งง่ายๆและเป็นระบบเดิมที่นิยมใช้กันมา ได้แก่
ขาเทียม มักใช้ข้อเข่าเป็นจุดอ้างอิง โดย
ใช้ ขาเทียมระดับใต้เข่า (Below-knee (BK) prosthesis) แทน ขาเทียมสำหรับผู้ถูกตัดขาผ่านกระดูกหน้าแข้ง
ใช้ ขาเทียมระดับข้อเข่า (Through-knee (TK) prosthesis) แทน ขาเทียมสำหรับผู้ถูกตัดขาผ่านข้อเข่า
ใช้ ขาเทียมระดับเหนือเข่า (Above-knee (AK) prosthesis) แทน ขาเทียมสำหรับผู้ถูกตัดขาผ่านกระดูกต้นขา
แขนเทียม มักใช้ข้อศอกเป็นจุดอ้างอิง โดย
ใช้ แขนเทียมระดับใต้ศอก (Below-elbow (BE) prosthesis) แทน แขนเทียมสำหรับผู้ถูกตัดแขนผ่านกระดูกปลายแขน
ใช้ แขนเทียมระดับข้อศอก (Through-elbow (TE) prosthesis) แทน แขนเทียมสำหรับผู้ถูกตัดแขนผ่านข้อศอก
ใช้ แขนเทียมระดับเหนือศอก (Above-elbow (AE) prosthesis) แทน แขนเทียมสำหรับผู้ถูกตัดแขนผ่านกระดูกต้นแขน
นอกจากนี้ สำหรับแขนเทียม ยังสามารถแบ่งตามคุณสมบัติได้แก่
ประเภทสวยงาม (Cosmetic type) ประเภทนี้ไม่สามารถเคลื่อนไหวมือเทียม/ข้อมือ/ข้อศอก/ข้อไหล่ได้
ประเภทใช้งานได้ (Functional type) สามารถเคลื่อนไหวส่วนต่างๆของแขนเทียมได้ตามความต้องการของผู้พิการ โดยยังสามารถแบ่งลงไปได้ตามประเภทของการควบคุมการเคลื่อนไหวเป็น
ควบคุมโดยการใช้การเคลื่อนไหวของร่างกาย (Body controlled)
ควบคุมโดยใช้พลังงานภายนอก (External-power controlled) ซึ่งควบคุมการจ่ายไฟฟ้าด้วยปุ่มสวิตช์กด (Switch controlled) หรือ ตัวรับสัญญาณไฟฟ้าในกล้ามเนื้อ (Myoelectric)
กายอุปกรณ์เสริม
มีหน้าที่ต่างๆ เช่น
จำกัดการเคลื่อนไหวของอวัยวะ
ช่วยให้มีการเคลื่อนไหวของอวัยวะ
บรรเทาอาการเจ็บปวด
ช่วยส่งเสริมให้กระดูกที่หักติดเป็นปรกติ
ป้องกันภาวะแทรกซ้อนต่างๆ เช่น ข้อเคลื่อนหลุด เอ็นฉีกขาด เป็นต้น
ฯลฯ
กายอุปกรณ์เสริม มักแบ่งประเภทใหญ่ๆตามอวัยวะที่ใช้เป็น 4 ประเภทได้แก่
กายอุปกรณ์สำหรับศีรษะ (Head orthosis)
กายอุปกรณ์สำหรับกระดูกสันหลัง (Spinal orthosis)
กายอุปกรณ์สำหรับระยางค์บน (Upper-extremity orthosis)
กายอุปกรณ์สำหรับระยางค์ล่าง (Lower-extremity orthosis) รวมถึงกายอุปกรณ์เสริมสำหรับเท้า (Foot orthosis) และการดัดแปลงรองเท้า (Shoe modification) อีกด้วย
โดยการเรียกชื่อสำหรับกายอุปกรณ์เสริมแต่ละชนิด สามารถเรียกชื่อได้หลายแบบตามแต่ละระบบมาตรฐานทางการแพทย์ โดยแบ่งเป็นกลุ่มย่อยๆตามข้อด่อที่กายอุปกรณ์เสริมพาดผ่าน เช่น กายอุปกรณ์เสริมสำหรับมือ-ข้อมือ (Wrist-hand orthosis: WHO) , กายอุปกรณ์เสริมสำหรับเท้า-ข้อเท้า (Ankle-foot orthosis: AFO) หรือ กายอุปกรณ์เสริมสำหรับกระดูกสันหลังส่วนอก-ส่วนหลัง-ส่วนกระเบนเหน็บ (Thoracolumbosacaral spinal orthosis: TLSO) เป็นต้น
และมักเพิ่มเติมชื่อกายอุปกรณ์เสริมแต่ละชนิดเพื่อให้จำเพาะเจาะจงไปมากกว่านี้ โดยอาจเรียกตามหน้าที่การทำงาน เช่น ป้องกันการเหยียด (Extension-stopped) , ช่วยการงอ (Flexion-assisted) หรือตามตำแหน่ง"ด้าน"ที่อยู่บนร่างกาย เช่น ด้านหลังมือ (Dorsal) , ด้านฝ่ามือ (Volar) เป็นต้น
นอกจากนี้ อาจเรียกตามชื่อสามัญ ซึ่งเป็นชื่อเดิมที่มีมาก่อนจะจัดระบบ เช่น อุปกรณ์เสริมชนิดจีเว็ตต์ เบรซ (Jewette brace) , อุปกรณ์เสริมชนิดไนท์เบรซ (Knight brace) หรือ ยูนิเวอร์ซัล คัฟฟ์ (Universal cuff) เป็นต้น
อุปกรณ์ช่วยเหลือการเคลื่อนไหว
อุปกรณ์ช่วยเหลือการเคลื่อนไหว (Mobility aids) ต่างๆ เช่น รถล้อเข็น (Wheelchair) , ไม้เท้า (Cane) , ไม้ค้ำยัน (Crutches) เป็นต้น มีหลากหลายชนิด ซึ่งต้องอาศัยความรู้ในการเลือกชนิดและส่วนประกอบของอุปกรณ์เหล่านี้เป็นอย่างมาก โดยเฉพาะแผ่นรองนั่งของรถล้อหมุน
สำหรับรถล้อเข็น สามารถแบ่งจำพวกเป็น
รถล้อเข็นมือหมุน
รถล้อเข็นมือหมุนใช้งานทั่วไป
รถล้อเข็นมือหมุนใช้งานพิเศษ (เช่น สำหรับใช้แข่งขันกีฬา เป็นต้น)
รถล้อเข็นไฟฟ้า
Source
Wikiประกาศ 7 เมย 16.04 น.
ประกาศ
ผู้ที่มาฉีดวัคซีนในวันที่ 2 เมษายน ที่โรงยิมเนเซี่ยม 4000 ที่นั่ง สะพานหิน ให้กักตัวสังเกตุอาการในบ้านอย่างน้อย 7 วัน
ถ้ามีอาหารไข้ ไอ เหนื่อย มีน้ำมูก เจ็บคอ จมูกไม่ได้กลิ่น ลิ้นไม่รับรส ให้รีบมาตรวจหาเชื้อ covid-19 ที่ รพ.วชิระ ครับอุทัยธานี - ผู้ที่มาจาก 9 จว.พื้นที่ควบคุม ให้รายงานตัว LINK
กำหนดให้ผู้ที่เดินทางมาจากจังหวัดที่กำหนดเป็นพื้นที่ควบคุม (9 จังหวัด - กทม ตาก นครปฐม ปทุมธานี นนทบุรี ราชบุรี สมุทรปราการ สมุทรสาคร สมุทรสงคราม) รายงานตัวกับ จนท. อสม. ผู้นำชุมชน และต้องเข้าสู่มาตรการคัดกรอง หรือสอบสวนโรค หากพบมีเหตุอันควรสงสัยว่าเป็นโรคหรือสัมผัสโรค หรือพาหะที่เสี่ยงต่อการกระจายโรค ให้เจ้าพนักงานควบคุมโรคติดต่อในพื้นที่ ออกคำสั่งกักกันไว้สังเกตอาการ ณ เคหสถาน กำหนด 14 วัน นับแต่วันที่เดินทางเข้ามาในพื้นที่จังหวัดอุทัยธานี
29 พฤษภาคม 64 เวลา 14.00 น.
การป้องกันภาวะสมองเสื่อมในชีวิตประจำวัน
ถึงแม้ว่ายังต้องอาศัยการศึกษาวิจัยที่ยืนยันมากกว่านี้ในด้านการป้องกันภาวะสมองเสื่อม แต่แนวทางการปฏิบัติตัวโดยทั่วไปมีดังนี้
1. รับประทานอาหารครบหมู่ หลีกเลี่ยงอาหารที่มีไขมันอิ่มตัวและโคเลสเตอรอลสูง ใช้น้ำมันพืช เช่น น้ำมันจากดอกทานตะวัน ถั่วเมล็ดแห้ง เมล็ดฟักทอง ถั่วเหลือง เป็นต้น รับประทานปลาทะเลให้มาก รับประทานอาหารที่มีวิตามินซี วิตามินอีและกรดโฟลิกสูง
2. รักษาน้ำหนักตัวไม่ให้เกินเกณฑ์โดยไม่ให้ดรรชนีมวลกายเกิน 25
3. หลีกเลี่ยงยาหรือสารที่จะทำให้เกิดอันตรายแก่สมอง เช่น การดื่มเหล้าจัดหรือการรับประทานยาโดยไม่จำเป็น
4. ไม่สูบบุหรี่หรืออยู่ในที่ๆ มีควันบุหรี่
5. การฝึกฝนสมอง ได้แก่ การพยายามฝึกให้สมองได้คิดบ่อยๆ เช่น อ่านหนังสือ เขียนหนังสือบ่อยๆ คิดเลข ดูเกมส์ตอบปัญหา ฝึกหัดการใช้อุปกรณ์ใหม่ๆ เป็นต้น
6. ออกกำลังกายสม่ำเสมอ สัปดาห์ละ 3-5 ครั้ง เช่น วิ่งเหยาะ ปั่นจักรยาน เดินเล่น รำมวยจีน เป็นต้น
7. การพูดคุย พบปะผู้อื่นบ่อยๆ เช่น ไปวัด ไปงานเลี้ยงต่างๆ หรือเข้าชมรมผู้สูงอายุ เป็นต้น
8. ตรวจสุขภาพประจำปี หรือถ้ามีโรคประจำตัวอยู่เดิมก็ต้องติดตามการรักษาเป็นระยะ เช่น การตรวจหา ดูแลและรักษาโรคความดันโลหิตสูง โรคเบาหวาน โรคไขมันในเลือดสูง โรคหัวใจ เป็นต้น
9. ถ้ามีอาการเจ็บป่วยควรปรึกษาแพทย์แต่เนิ่น โดยเฉพาะในผู้สูงอายุ เพื่อลดโอกาสเกิดอาการสับสนเฉียบพลัน
10. ระมัดระวังเรื่องอุบัติเหตุต่อสมอง ระวังการหกล้ม เป็นต้น
11. พยายามมีสติในสิ่งต่างๆ ที่กำลังทำและฝึกสมาธิอยู่ตลอดเวลา
พยากรณ์อากาศประจำวัน ประจำวันที่ 2 เมษายน 2565 LINK
พยากรณ์อากาศสำหรับประเทศไทยตั้งแต่เวลา 23:00 วันนี้ (2 เม.ย.) ถึง 23:00 วันพรุ่งนี้ (3 เม.ย.) ระบุว่า ลักษณะอากาศทั่วไป - พยากรณ์อากาศ 24 ชั่วโมงข้างหน้า หย่อมความกดอากาศต่ำปกคลุมบริเวณอ่าวไทย ประกอบกับลมตะวันออกและลมตะวันออกเฉียงเหนือที่พัดปกคลุมอ่าวไทย และภาคใต้มีกำลังแรง ทำให้ภาคใต้มีฝนเพิ่มขึ้นและมีฝนตกหนักบางแห่ง ขอให้ประชาชนบริเวณภาคใต้ระวังอันตรายจากฝนที่ตกหนัก ซึ่งอาจให้เกิดน้ำท่วมฉับพลันและน้ำป่าไหลหลากที่จะเกิดขึ้นไว้ด้วย
ส่วนคลื่นลมบริเวณอ่าวไทยมีกำลังปานกลาง โดยอ่าวไทยตอนบนมีคลื่นสูงประมาณ 2 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงมากกว่า 2 เมตร ส่วนอ่าวไทยตอนล่างคลื่นสูง 1-2 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงประมาณ 2 เมตร ส่วนชาวเรือบริเวณอ่าวไทยควรเดินเรือด้วยความระมัดระวัง และหลีกเลี่ยงการเดินเรือบริเวณที่มีฝนฟ้าคะนองไว้ด้วย
สำหรับบริเวณความกดอากาศสูงกำลังค่อนข้างแรงจากประเทศจีนแผ่ปกคลุมบริเวณประเทศไทยตอนบน ทำให้บริเวณดังกล่าวอุณหภูมิจะลดลงกับมีลมแรง โดยภาคเหนือ ภาคกลาง ภาคตะวันออก รวมทั้งกรุงเทพมหานครและปริมณฑล อุณหภูมิจะลดลง 2-4 องศาเซลเซียส ส่วนภาคตะวันออกเฉียงเหนือ อุณหภูมิจะลดลงอีก 1-3 องศาเซลเซียส แต่ยังคงมีฝนฟ้าคะนองเกิดขึ้นได้บางพื้นที่บริเวณภาคเหนือตอนบน ภาคตะวันออกเฉียงเหนือตอนล่าง และภาคตะวันออก ขอให้ประชาชนบริเวณประเทศไทยตอนบนดูแลรักษาสุขภาพเนื่องจากสภาพอากาศที่เปลี่ยนแปลงไว้ด้วย
ฝุ่นละอองขนาดเล็ก
ประเทศไทยตอนบนมีแนวโน้มการสะสมของฝุ่นละออง/หมอกควันลดลง เนื่องจากบริเวณดังกล่าวมีลมแรงขึ้น
พยากรณ์อากาศสำหรับประเทศไทยตั้งแต่เวลา 23:00 วันนี้ ถึง 23:00 วันพรุ่งนี้.
ภาคเหนือ อากาศเย็นกับมีลมแรง และอุณหภูมิจะลดลง 2-4 องศาเซลเซียส
โดยมีฝนฟ้าคะนองร้อยละ 20 ของพื้นที่ ส่วนมากบริเวณจังหวัดแม่ฮ่องสอน
เชียงใหม่ เชียงราย ลำพูน ลำปาง พะเยา และน่าน
อุณหภูมิต่ำสุด 18-23 องศาเซลเซียส
อุณหภูมิสูงสุด 26-28 องศาเซลเซียส
ลมตะวันออกเฉียงใต้ ความเร็ว 10-20 กม./ชม.
ภาคตะวันออกเฉียงเหนือ อากาศเย็นกับมีลมแรง และอุณหภูมิจะลดลง 1-3 องศาเซลเซียส
โดยมีฝนฟ้าคะนองร้อยละ 40 ของพื้นที่ ส่วนมากบริเวณจังหวัดชัยภูมิ ขอนแก่น มหาสารคาม
ร้อยเอ็ด ยโสธร อำนาจเจริญ นครราชสีมา บุรีรัมย์ สุรินทร์ ศรีสะเกษ และอุบลราชธานี
อุณหภูมิต่ำสุด 15-19 องศาเซลเซียส
อุณหภูมิสูงสุด 25-26 องศาเซลเซียส
ลมตะวันออกเฉียงเหนือ ความเร็ว 10-30 กม./ชม.
ภาคกลาง อากาศเย็นกับมีลมแรง และอุณหภูมิจะลดลง 1–3 องศาเซลเซียส
อุณหภูมิต่ำสุด 22-23 องศาเซลเซียส
อุณหภูมิสูงสุด 29-30 องศาเซลเซียส
ลมตะวันออกเฉียงเหนือ ความเร็ว 10-25 กม./ชม.
ภาคตะวันออก อากาศเย็นกับมีลมแรง และอุณหภูมิจะลดลง 1–3 องศาเซลเซียส
โดยมีฝนฟ้าคะนองร้อยละ 10 ของพื้นที่ ส่วนมากบริเวณจังหวัดจันทบุรี และตราด
อุณหภูมิต่ำสุด 20-23 องศาเซลเซียส
อุณหภูมิสูงสุด 27-29 องศาเซลเซียส
ลมตะวันออกเฉียงเหนือ ความเร็ว 20-35 กม./ชม.
ทะเลมีคลื่นสูงประมาณ 2 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงมากกว่า 2 เมตร
ภาคใต้ (ฝั่งตะวันออก) มีฝนฟ้าคะนองร้อยละ 70 ของพื้นที่ และมีฝนตกหนักบางแห่ง
บริเวณจังหวัดชุมพร สุราษฎร์ธานี นครศรีธรรมราช พัทลุง สงขลา ปัตตานี ยะลา และนราธิวาส
อุณหภูมิต่ำสุด 22-25 องศาเซลเซียส อุณหภูมิสูงสุด 27-31 องศาเซลเซียส
ตั้งแต่จังหวัดสุราษฎร์ธานีขึ้นมา : ลมตะวันออกเฉียงเหนือ ความเร็ว 20-35 กม./ชม.
ทะเลมีคลื่นสูงประมาณ 2 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงมากกว่า 2 เมตร
ตั้งแต่จังหวัดนครศรีธรรมราชลงไป : ลมตะวันออกเฉียงเหนือ ความเร็ว 15-35 กม./ชม.
ทะเลมีคลื่นสูง 1-2 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงประมาณ 2 เมตร
ภาคใต้ (ฝั่งตะวันตก) มีฝนฟ้าคะนองร้อยละ 70 ของพื้นที่ และมีฝนตกหนักบางแห่ง
บริเวณจังหวัดระนอง พังงา ภูเก็ต กระบี่ ตรัง และสตูล
อุณหภูมิต่ำสุด 22-25 องศาเซลเซียส
อุณหภูมิสูงสุด 30-32 องศาเซลเซียส
ลมตะวันออกเฉียงเหนือ ความเร็ว 15-30 กม./ชม.
ทะเลมีคลื่นสูงประมาณ 1 เมตร บริเวณที่มีฝนฟ้าคะนองคลื่นสูงมากกว่า 1 เมตร
กรุงเทพมหานครและปริมณฑล อากาศเย็น กับมีลมแรง และอุณหภูมิจะลดลง 1–3 องศาเซลเซียส
โดยมีฝนฟ้าคะนองร้อยละ 10 ของพื้นที่
อุณหภูมิต่ำสุด 21-22 องศาเซลเซียส อุณหภูมิสูงสุด 28-29 องศาเซลเซียส
ลมตะวันออกเฉียงเหนือ ความเร็ว 10-25 กม./ชม.
เวิลด์เมดิคอล เปิดให้บริการเข้าระบบรักษาที่บ้าน WMC HOME ISOLATION แบบชำระเงิน
โรงพยาบาลเวิลด์เมดิคอล เปิดให้บริการเข้าระบบรักษาที่บ้าน WMC HOME ISOLATION (** แบบชำระเงิน**) บริการส่งยาถึงบ้าน...!!! ลงทะเบียนผ่านช่องทาง Online
** คิดค่าบริการส่งยา 100 บาท/ท่าน
*** เฉพาะกรุงเทพฯ นนทบุรี และปทุมธานี
เปิดให้บริการทุกวัน : จันทร์-อาทิตย์ เวลา 8.30 – 15.00 น.
บริการรับยาที่โรงพยาบาล
เปิดให้บริการทุกวัน : จันทร์-อาทิตย์ เวลา 8.00 – 17.00 น. (ท่านสามารถ Walk in เข้ารับบริการได้ที่ ณ จุดบริการ Drive Thru Test ของโรงพยาบาล)
theworldmedicalhospital.com
สอบถามข้อมูลเพิ่มเติม 02-836-9999
ขบวนรถไฟ สายใยแห่งรัก Station of Love @Maeklong LINK
อำเภอเมืองสมุทรสงคราม จัดกิจกรรมรับเทศกาลวาเลนไทน์ ชื่องาน "ขบวนรถไฟ สายใยแห่งรัก Station of Love @Maeklong " ให้บริการจดทะเบียนสมรสนอกสำนักทะเบียน ณ สถานีรถไฟแม่กลอง (สุธา คาเฟ่) คู่รักที่สนใจ ลงทะเบียนได้ถึง 10 กุมภาพันธ์ 2566 ลงทะเบียนผ่านทาง
เพจที่ว่าการอำเภอสมุทรสงคราม หรือ สแกน QR Code หรือ สมัครด้วยตนเองที่ที่ว่าการอำเภอ
รับสิทธิพิเศษ
1. รับของที่ระลึกสุดน่ารัก
2. 20 คู่แรก รับวัตถุมงคล
เขตตลิ่งชัน LINK
เขตตลิ่งชัน ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัควีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1 ประจำปีงบประมาณ 2566 วันที่ 7 มีนาคม 2566 นางชดาวรรณ ป่าไม้ ผู้อำนวยการเขตตลิ่งชัน นายสมพร มีหาดทราย ผู้ช่วยผู้อำนวยการเขตตลิ่งชัน มอบหมายนายยุทธนา ศรีแย้มวงษ์ หัวหน้าฝ่ายสิ่งแวดล้อมและสุขาภิบาล จัดเจ้าหน้าที่ติดป้ายประชาสัมพันธ์การออกหน่วยเคลื่อนที่รณรงค์ฉีดวัควีนป้องกันโรคพิษสุนัขบ้าร่วมกับเจ้าหน้าที่ศูนย์บริการสาธารณสุข 49 วัดชัยพฤกษมาลา ครั้งที่ 1 (วันที่ 13 มีนาคม 2566 ถึงวันที่ 24 มีนาคม 2566) ประจำปีงบประมาณ 2566
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ
อาจารย์ฉัตรพร เรืองทอง อาจารย์ประจำหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
“หลักสูตรที่มีความพร้อมด้านการผลิตบุคลากร “ผู้เชี่ยวชาญด้านวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ” ในการทำงานด้านบริการสุขภาพรองรับสังคมสูงวัย มุ่งสร้างบุคลากรด้านวิทยาศาสตร์การเคลื่อนไหวและสุขภาพที่เป็นทั้งนักวิชาการที่มีความรู้ ความสามารถ และนักปฏิบัติการที่มีทักษะสามารถประยุกต์องค์ความรู้ด้านวิชาวิทยาศาสตร์การเคลื่อนไหวและสุขภาพที่มีคุณภาพ ใช้เวลาศึกษา 4 ปี ทั้งภาคทฤษฎีและปฏิบัติ ในภาคทฤษฎีประกอบด้วยวิชาหลักที่เกี่ยวข้องกับการเคลื่อนไหว เช่น กายวิภาคศาสตร์ ชีวกลศาสตร์ สรีรวิทยาการออกกำลังกาย จิตวิทยา โภชนาการ นักศึกษาที่จบหลักสูตรฯ นี้ไปสามารถประกอบอาชีพในหน่วยงานภาครัฐและเอกชน โรงพยาบาล ศูนย์เวชศาสตร์ฟื้นฟู ศูนย์สุขภาพ และสโมสรกีฬา และเพื่อตอบรับกับโจทย์แห่งอนาคตของประเทศไทย โรงเรียนวิทยาศาสตร์การเคลื่อนไหวและสุขภาพสอนให้วิเคราะห์การเคลื่อนไหวและออกแบบโปรแกรมการเคลื่อนไหวเพื่อสร้างเสริมสุขภาพให้เหมาะสมได้สำหรับทุกช่วงอายุ”
++ ต่างจังหวัด ++
ศูนย์บริการสาธารณสุข 50 และ 56 เขตบึงกุ่ม และทับเจริญ
เขตบึงกุ่ม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 2-13 กันยายน 2567 สำนักงานเขตบึงกุ่ม โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 50 บึงกุ่ม และศูนย์บริการสาธารณสุข 56 ทับเจริญ ดำเนินการรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในพื้นที่เขตบึงกุ่ม ‼️ฟรี‼️
รายละเอียดในการลงทะเบียนทำหมันดังนี้
- ผู้ลงทะเบียนจะต้องเป็นผู้ที่สามารถดูแลแมวก่อนและหลังทำหมันได้
- แมวจะต้องได้รับการอดน้ำอดอาหาร 10-12 ชั่วโมงก่อนการพามาทำหมัน
- อุปกรณ์ที่ใส่แมวมาทำหมันกำหนดให้ใช้ - กรง หรือ - ตะกร้าแบบมีฝาเปิดแบบฝาเดียว หรือ - บล็อกใส่แมวเท่านั้น
- แมวทุกตัวที่มาทำหมันกับทางมูลนิธิฯ จะได้รับการสักหูทุกตัว เพื่อเป็นสัญลักษณ์ว่าแมวได้รับการทำหมันมาแล้ว
- แมวที่จะทำหมันได้ เพศเมียทำได้ที่่อายุ 4 เดือนหรือน้ำหนักได้ 2 กิโลกรัม เพศผู้ทำได้ที่่อายุ 5 เดือนหรือมองเห็นไข่แล้ว แม่แมวทำหมันได้เมื่อลูกแมวกินอาหารเองได้แล้ว ประมาณ 45-60 วันหลังคลอด
- เปิดให้ลงทะเบียนทำหมันได้คนละไม่เกิน 2 ตัว(กรณีต้องการทำมากกว่า 2 ตัว ให้ระบุจำนวนที่ต้องการและความจำเป็นในการขอเพิ่มจำนวนที่เมลล์ catpantip@gmail.com)
- ลงทะเบียนทำหมันออนไลน์ได้ที่ลิ้งค์ https://bit.ly/2URyB3Z คิวเต็มจะปิดรับทันที
- ลงทะเบียนทำหมันเสร็จเรียบร้อยแล้ว สามารถโอนเงินเข้าบัญชีมูลนิธิฯ ชื่อบัญชี มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร” ธนาคารกสิกรไทย สาขาเซ็นทรัล ปิ่นเกล้า เลขที่ 036-1-50346-5
- ส่งรูปใบโอนเงินภายใน 5 วันมาที่เมลล์ catpantip@gmail.com เพื่อรับลำดับคิวทำหมันต่อไป
- เมื่อโอนเงินแล้ว จะไม่สามารถเรียกคืนหรือยกยอดรอบต่อไปได้ ดังนั้นขอให้แน่ใจว่าจะพาแมวไปทำหมันแน่ ๆ นะคะ
หมายเหตุ : ต้องการสอบถามข้อมูลเพิ่มเติม ติดต่อได้ที่ช่องทางเดียวคือเมลล์ catpantip@gmail.com ไม่เกิน 3 วันตอบกลับเมลล์ทุกฉบับ
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตจอมทอง
โรงเรียนกายอุปรณ์สิรินธร LINK
หลักสูตรวิทยาศาสตรบัณฑิตสาขาวิชากายอุปกรณ์ แห่งแรกในอาเซียน
โรงเรียนกายอุปรณ์สิรินธร
เป็นหน่วยงานที่มีฐานะเทียบเท่าภาควิชา คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล
การศึกษามี 5 หลักสูตร ได้แก่
1. หลักสูตรกายอุปกรณศาสตรบัณฑิต
2.หลักสูตรกายอุปกรณศาสตรบัณฑิต (นานาชาติ)
3.หลักสูตรกายอุปกรณศาสตรบัณฑิต (นานาชาติแบบเรียนทางไกลผสมผสาน)
4.หลักสูตรกายอุปกรณศาสตรบัณฑิต (ทางไกลผสมผสาน)
5.หลักสูตรวิทยาศาสตรมหาบัณฑิต สาขาวิชากายอุปกรณ์ (หลักสูตรนานาชาติ)
การบริการ มีคลินิกที่เปิดทำการอยู่ 2 คลินิก
1.คลินิกหน่วยกายอุปกรณ์
2.ศูนย์ความเป็นเลิศด้านกายอุปกรณ์
โรงเรียนฯ ได้รับการรับรองมาตรฐานสากล ISPO category 1 institution และ ISO 9001:2008 certification.
SSPO
โรงเรียนกายอุปกรณ์สิรินธร คณะแพทยศาสตร์ศิริราชพยาบาล, มหาวิทยาลัยมหิดล เลขที่ 14
ถนนอรุณอมรินทร์, แขวงอรุณอมรินทร์,
เขตบางกอกน้อย กรุงเทพฯ 10700
สำนักงานโรงเรียนโทรศัพท์ 02-419-3452
คลินิกกายอุปกรณ์โทรศัพท์ 02-419-3448
SSPO
Faculty of Medicine Siriraj Hospital, Mahidol University
14 Arun-Aumarin Road, Arun-Aumarin, Bangkoknoi, Bangkok, 10700 Thailand
นครสวรรค์ - กักตัว 14 วัน LINK
11 เมย 64 จังหวัดนครสวรรค์ แจ้งให้ผู้เดินทางเข้ามาในพื้นที่ จากทุกจังหวัด ต้องกักตัว 14 วัน หรือกักตัวตามจำนวนวันที่อยู่ในพื้นที่
1. ให้ผู้เดินทางเข้ามาในพื้นที่จังหวัดนครสวรรค์จากทุกพื้นที่ ให้รายงานตัวกับกำนัน ผู้ใหญ่บ้าน ประธานชุมชน อสม.หรือเจ้าหน้าที่สาธารณสุข เพื่อดำเนินการเฝ้าระวังกักตัวที่เคหะสถานจนกว่าจะเดินทางออกจากจังหวัดนครสวรรค์ หรือจนกว่าจะพ้นกำหนด 14 วัน ตามมาตราการป้องกันฯของสาธารณสุข
2. การจัดงานต่างๆ หากไม่เกิน 100 คน สามารถจัดได้ แต่ต้องปฏิบัติตามมาตราการสาธารณสุข หากเกิน100คน แต่ไม่ถึง 500 คน ให้ขออนุญาตจัดงานที่อำเภอนั้นๆ และหากเกิน 500 คนขึ้นไป ให้ขออนุญาตจากคณะกรรมการโรคติดต่อจังหวัดนครสวรรค์
3.สอบถามรายละเอียดเพิ่มเติมได้ที่สำนักงานสาธารณสุขจังหวัดนครสวรรค์ 061-6255166 หรือ 056-232-001 ต่อ 132-133
Hotline covid 081-352-7696 , สคร 3 จ.นครสวรรค์ 063-104-1850 , 056-229-716
รพ.สวรรค์ประชารักษ์ โทร 056-219-888
28 พฤษภาคม 64 เวลา 20.00 น.
ลำดับ 1-50
1 ชื่อผู้รับอนุญาต : องค์การเภสัชกรรม นาง นันทกาญจน์ สุวรรณปิฏกกุล
ชื่อสถานที่ : องค์การเภสัชกรรม
ที่ตั้ง : 138 4 รังสิต-นครนายก บึงสนั่น ธัญบุรี ปทุมธานี 0 2546 1955 12110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 1/2562 (ปลูก)
2 ชื่อผู้รับอนุญาต : มหาวิทยาลัยรังสิต นาย ธนภัทร ทรงศักดิ์
ชื่อสถานที่ : คณะนวัตกรรมการเกษตร วิทยาลัยนวัตกรรมการเกษตร เทคโนโลยีชีวภาพและอาหาร มหาวิทยาลัยรังสิต
ที่ตั้ง : 52/347 พหลโยธิน 87 7 พหลโยธิน หลักหก เมืองปทุมธานี ปทุมธานี 0 2997 2222 12000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 2/2562 (ปลูก)
3 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน นาย โฆษิต ศรีภูธร
ชื่อสถานที่ : คณะทรัพยากรธรรมชาติ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสกลนคร
ที่ตั้ง : 205 10 แร่ พังโคน สกลนคร 042 771 460 47160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 4/2562 (ปลูก)
4 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข และ วิสาหกิจชุมชนศูนย์กลางการพัฒนาสมุนไพร เพ ลา เพลิน เพื่อชุมชน นาย กิตติ โล่สุวรรณรักษ์
ชื่อสถานที่ : วิสาหกิจชุมชนศูนย์กลางการพัฒนาสมุนไพร เพ ลา เพลิน เพื่อชุมชน
ที่ตั้ง : 252 7 หนองขมาร คูเมือง บุรีรัมย์ 44634736 - 31190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 5/2562(ปลูก)
5 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเกษตรศาสตร์ นาย วัชรพงษ์ อินทรวงศ์
ชื่อสถานที่ : มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตเฉลิมพระเกียรติ จังหวัดสกลนคร
ที่ตั้ง : 59 1 วปรอ.366 เชียงเครือ เมืองสกลนคร สกลนคร 0 4272 5042 47000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 6/2562(ปลูก)
6 ชื่อผู้รับอนุญาต : มหาวิทยาลัยแม่โจ้ นาย วีระพล ทองมา
ชื่อสถานที่ : โรงเรือนปลูกกัญชาระบบปิด สาขาพืชผัก คณะผลิตกรรมการเกษตร
ที่ตั้ง : 63 4 หนองหาร สันทราย เชียงใหม่ 0 5387 3000 50210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 7/2562 (ปลูก)
7 ชื่อผู้รับอนุญาต : มหาวิทยาลัยแม่โจ้ นาย วีระพล ทองมา
ชื่อสถานที่ : โรงเรือนของศูนย์วิจัยและพัฒนาไส้เดือนดิน พื้นที่สำนักฟาร์ม มหาวิทยาลัยแม่โจ้
ที่ตั้ง : 151 7 ป่าไผ่ สันทราย เชียงใหม่ 0 5387 3000 50210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 8/2562 (ปลูก)
8 ชื่อผู้รับอนุญาต : มหาวิทยาลัยมหาสารคาม นาย สมชาย แก้ววังชัย
ชื่อสถานที่ : อาคารเรียนรู้การเกษตรและอุตสาหกรรม คณะเทคโนโลยี มหาวิทยาลัยมหาสารคาม
ที่ตั้ง : 162 17 นาสีนวน กันทรวิชัย มหาสารคาม 0 4375 4333 44150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 10/2562 (ปลูก)
9 ชื่อผู้รับอนุญาต : มหาวิทยาลัยมหาสารคาม นาย สมชาย แก้ววังชัย
ชื่อสถานที่ : อาคารวิทยาศาสตร์ชีวภาพ คณะวิทยาศาสตร์ มหาวิทยาลัยมหาสารคาม
ที่ตั้ง : 245 7 ขามเรียง กันทรวิชัย มหาสารคาม 04 3754 2246 44150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 11/2562 (ปลูก)
10 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์เพชรลานนา นาง มาลา สร้อยสำโรง
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์เพชรลานนา
ที่ตั้ง : 176 6 แจ้ห่ม-วังเหนือ แม่สุก แจ้ห่ม ลำปาง 08 1888 6079 52120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 12/2562 (ปลูก)
11 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มรักจังฟาร์ม วังน้ำเขียว นาง โศรยา ธรรมรักษ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มรักจังฟาร์ม วังน้ำเขียว
ที่ตั้ง : 105 1 ไทยสามัคคี วังน้ำเขียว นครราชสีมา 08 1348 4444 30370
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 2/2563 (ปลูก)
12 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลพระนคร นาย จิระศักดิ์ ธาระจักร์
ชื่อสถานที่ : คณะวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยเทคโนโลยีราชมงคลพระนคร
ที่ตั้ง : 1381 ประชาราษฎร์ 1 วงศ์สว่าง บางซื่อ กรุงเทพมหานคร 028363000 ต่อ 4194 10800
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 3/2563 (ปลูก)
13 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลพระนคร นาย จิระศักดิ์ ธาระจักร์
ชื่อสถานที่ : โรงพยาบาล สูงเนิน
ที่ตั้ง : 280 8 มิตรสัมพันธ์ สูงเนิน สูงเนิน นครราชสีมา 0 4441 9712 30170
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 4/2563 (ปลูก)
14 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา นาย สุรพล ใจวงศ์ษา
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มปลูกและแปรรูปบุกเกษตรอินทรีย์บ้านทุ่งแพม
ที่ตั้ง : 222/1 3 แม่ยวม แม่สะเรียง แม่ฮ่องสอน 58110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 5/2563 (ปลูก)
15 ชื่อผู้รับอนุญาต : สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ นาย ศรีเมฆ ชาวโพงพาง
ชื่อสถานที่ : อาคารกลุ่มนวัตกรรม 2 ทาวเวอร์ A สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ
ที่ตั้ง : 144 9 พหลโยธิน คลองหนึ่ง คลองหลวง ปทุมธานี 0 2564 7100 ต่อ 71453 12120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 6/2563 (ปลูก)
16 ชื่อผู้รับอนุญาต : มูลนิธิโรงพยาบาลเจ้าพระยาอภัยภูเบศร ในพระอุปถัมภ์สมเด็จพระเจ้าภคินีเธอ เจ้าฟ้าเพชรรัตนราชสุดา สิริโสภาพัณณวดี นาง โศรยา ธรรมรักษ์
ชื่อสถานที่ : มูลนิธิโรงพยาบาลเจ้าพระยาอภัยภูเบศร ในพระอุปถัมภ์สมเด็จพระเจ้าภคินีเธอ เจ้าฟ้าเพชรรัตนราชสุดา สิริโสภาพัณณวดี
ที่ตั้ง : 32/7 12 ปราจีนอนุสรณ์ ท่างาม เมืองปราจีนบุรี ปราจีนบุรี 0 3721 1088 25000
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 8/2563 (ปลูก)
17 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข นาย สามิตร รมยาคม
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลคลองม่วง
ที่ตั้ง : 17 4 คลองม่วง ปากช่อง นครราชสีมา 0 4408 1456 30130
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 9/2563 (ปลูก)
18 ชื่อผู้รับอนุญาต : มหาวิทยาลัยขอนแก่น นาย มนต์ชัย ดวงจินดา
ชื่อสถานที่ : หมวดพืชผัก สาขาพืชสวน คณะเกษตรศาสตร์ มหาวิทยาลัยขอนแก่น
ที่ตั้ง : 123 16 ในเมือง เมืองขอนแก่น ขอนแก่น 0 4300 9700 40000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 12/2563 (ปลูก)
19 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีสุรนารี นาย หนึ่ง เตียอำรุง
ชื่อสถานที่ : สวนเฉลิมพระเกียรติ 50 พรรษา บรมราชกุมารี มหาวิทยาลัยเทคโนโลยีสุรนารี
ที่ตั้ง : 111 6 มหาวิทยาลัย สุรนารี เมืองนครราชสีมา นครราชสีมา 0 4422 5097 30000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 13/2563 (ปลูก)
20 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข นาง อมร คำทะริ
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลเชียงพิณ
ที่ตั้ง : 745 9 เชียงพิณ เมืองอุดรธานี อุดรธานี 0 4226 3307 41000
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 14/2563 (ปลูก)
21 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข นาย ปัญญา โสรมรรค
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านหนองแซง
ที่ตั้ง : 250 อุดร-หนองบัวลำภู หนองบัวบาน หนองวัวซอ อุดรธานี 0 4212 5098 41360
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 15/2563 (ปลูก)
22 ชื่อผู้รับอนุญาต : จุฬาลงกรณ์มหาวิทยาลัย นาย สถิรกร พงศ์พานิช
ชื่อสถานที่ : ศูนย์เครือข่ายการเรียนรู้เพื่อภูมิภาค จุฬาลงกรณ์มหาวิทยาลัย จ.สระบุรี
ที่ตั้ง : 158 2 ห้วยแห้ง แก่งคอย สระบุรี 0 2218 8152 18110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 18/2563 (ปลูก)
23 ชื่อผู้รับอนุญาต : มหาวิทยาลัยราชภัฏนครราชสีมา นาย ธนากร เปลื้องกลาง
ชื่อสถานที่ : วิสาหกิจชุมชน กลุ่มเกษตรกรทฤษฎีใหม่ตำบลเสมา
ที่ตั้ง : 59 1 เสมา สูงเนิน นครราชสีมา 08 4417 9950 30170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 19/2563 (ปลูก)
24 ชื่อผู้รับอนุญาต : มหาวิทยาลัยราชภัฏนครราชสีมา นาย ธนากร เปลื้องกลาง
ชื่อสถานที่ : ศูนย์วิทยาศาสตร์ คณะวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยราชภัฏนครราชสีมา
ที่ตั้ง : 340 สุรนารายณ์ ในเมือง เมืองนครราชสีมา นครราชสีมา 0 4400 9009 ต่อ 1302 และ 1316 30000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 20/2563 (ปลูก)
25 ชื่อผู้รับอนุญาต : มหาวิทยาลัยราชภัฏสวนสุนันทา นาย ธวัชชัย กมลธรรม
ชื่อสถานที่ : วิทยาลัยสหเวชศาสตร์ มหาวิทยาลัยราชภัฏสวนสุนันทา ศูนย์การศึกษาจังหวัดสมุทรสงคราม
ที่ตั้ง : 111/2 7 พระรามที่ 2 บางแก้ว เมืองสมุทรสงคราม สมุทรสงคราม 0 3477 3905 75000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 22/2563 (ปลูก)
26 ชื่อผู้รับอนุญาต : กรมการแพทย์ ร่วมกับ วิสาหกิจชุมชนเจริญศรีเกษตรอินทรีย์ครบวงจร เรืออากาศเอก สมชาย ธนะสิทธิชัย
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 51570
ที่ตั้ง : 6 กุดสระ เมืองอุดรธานี อุดรธานี 09 7924 5196 41000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 23/2563 (ปลูก)
27 ชื่อผู้รับอนุญาต : กรมการแพทย์ เรืออากาศเอก สมชาย ธนะสิทธิชัย
ชื่อสถานที่ : โรงพยาบาลมะเร็งอุดรธานี
ที่ตั้ง : 36 1 มิตรภาพ หนองไผ่ เมืองอุดรธานี อุดรธานี 0 4220 7375 41000
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 24/2563 (ปลูก)
28 ชื่อผู้รับอนุญาต : องค์การเภสัชกรรม นาง นันทกาญจน์ สุวรรณปิฎกกุล
ชื่อสถานที่ : องค์การเภสัชกรรม
ที่ตั้ง : 999 6 หนองใหญ่ หนองใหญ่ ชลบุรี 20190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 26/2563 (ปลูก)
29 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์ตำบลบ้านพระ นาง โศรยา ธรรมรักษ์
ชื่อสถานที่ : โฉนดที่ดิน เลขที่ 18150
ที่ตั้ง : บุฝ้าย ประจันตคาม ปราจีนบุรี 09 5552 4165 25130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 27/2563 (ปลูก)
30 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเกษตรศาสตร์ นาย ธานี ศรีวงศ์ชัย
ชื่อสถานที่ : คณะเกษตร มหาวิทยาลัยเกษตรศาสตร์
ที่ตั้ง : 50 งามวงศ์วาน ลาดยาว จตุจักร กรุงเทพมหานคร 0 2579 0588 10900
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 30/2563 (ปลูก)
31 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรอื่น ๆ ทุกชนิด อัจฉริยะส่งออกการนำเข้า นาย สามารถ ขันทกสิกรรม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 15404
ที่ตั้ง : 9 14 หนองบัว หนองบัว นครสวรรค์ 09 7997 4654 60110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 32/2563 (ปลูก)
32 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนโรงสีข้าวตำบลเขาทอง นาย พิสิฏฐ์ โมกขศักดิ์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านเขาทอง
ที่ตั้ง : 90 3 เขาทอง พยุหะคีรี นครสวรรค์ 0 5638 2092 60130
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 33/2563 (ปลูก)
33 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผักพืชสมุนไพรและพืชพลังงาน ตำบลพนมรอก นาย ต่อลาภ ไร่นุ่น
ชื่อสถานที่ : วิสาหกิจชุมชนผักพืชสมุนไพรและพืชพลังงาน ตำบลพนมรอก
ที่ตั้ง : 40/2 4 พนมรอก ท่าตะโก นครสวรรค์ 081 972 6923 60160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 34/2563 (ปลูก)
34 ชื่อผู้รับอนุญาต : มหาวิทยาลัย ราชภัฏเทพสตรี นาย ฑัชวงษ์ จุลสวัสดิ์
ชื่อสถานที่ : อุทยานวิทยาศาสตร์สมเด็จพระนารายณ์ คณะวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยราชภัฏเทพสตรี
ที่ตั้ง : นิคมสร้างตนเอง เมืองลพบุรี ลพบุรี 0 3642 2605 15000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 35/2563 (ปลูก)
35 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรอินทรีย์เพื่อสุขภาพละหานทราย นางสาว สลักจิต วรรณโกษิตย์
ชื่อสถานที่ : ตาม น.ส.3 เล่ม 2 หน้า 87 เลขที่ 316
ที่ตั้ง : สำโรงใหม่ ละหานทราย บุรีรัมย์ 0 4464 9037 31170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 36/2563 (ปลูก)
36 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มออมทรัพย์ปลูกผักสวนครัวพืชสมุนไพรบ้านวังคาง นาย อนิรุทธ์ วินิจสร
ชื่อสถานที่ : ตาม น.ส.3 เล่ม 10(18) หน้า 144 เลขที่ 223
ที่ตั้ง : สำโรงชัย ไพศาลี นครสวรรค์ 09 5575 1267 60220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 37/2563 (ปลูก)
37 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนรวมพลคนสร้างงานตำบลดอนชะเอม นาย ชนะศักดิ์ จิตต์น่วม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 20541
ที่ตั้ง : 3 ดอนชะเอม ท่ามะกา กาญจนบุรี 063 909 8795 71130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 38/2563 (ปลูก)
38 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรสมุนไพร พัฒนาก้าวหน้า นาย ไกรลาศ ครองรักษ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรสมุนไพร พัฒนาก้าวหน้า
ที่ตั้ง : 101 5 มิตรภาพ มวกเหล็ก สระบุรี 06 1553 9465 18180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 41/2563 (ปลูก)
39 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มยางพาราห้วยทมน้อย ม.11 นาย ธนากร คนเพียร
ชื่อสถานที่ : โรงพยาบาล ชานุมาน
ที่ตั้ง : 4 8 หนองผือ-มุกดาหาร ชานุมาน ชานุมาน อำนาจเจริญ 0 4546 6009 37210
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 42/2563 (ปลูก)
40 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนภูมิใจไทอำนาจเจริญพืชเศรษฐกิจสมุนไพร นาง ศิรินุช ฉายแสง
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลโนนดู่
ที่ตั้ง : 120 14 อรุณประเสริฐ สร้างนกทา เมืองอำนาจเจริญ อำนาจเจริญ 0 4598 9740 37000
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 43/2563 (ปลูก)
41 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรภูอ่าง นาย สุรพล สิมมะลี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 37298
ที่ตั้ง : ผาน้อย วังสะพุง เลย 08 6450 3655 42130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 44/2563 (ปลูก)
42 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผลิตพืชปลอดสารพิษ นาง ปารณีย์ กิจไพบูลย์รัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3536
ที่ตั้ง : 6 สวนพริก พระนครศรีอยุธยา พระนครศรีอยุธยา 08 9688 5842 13000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 45/2563 (ปลูก)
43 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนตำบลคลองจิก นาย ธีรภัทร มารอด
ชื่อสถานที่ : วิสาหกิจชุมชนตำบลคลองจิก
ที่ตั้ง : 36/12 3 คลองจิก บางปะอิน พระนครศรีอยุธยา 08 1355 6195 13160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 46/2563 (ปลูก)
44 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพื่อเศรษฐกิจทางเลือกจังหวัดสตูล นาย ประชา หนูหมาด
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 2544
ที่ตั้ง : ป่าแก่บ่อหิน ทุ่งหว้า สตูล 08 1898 2486 91120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 48/2563 (ปลูก)
45 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านโตนปาหนัน นาย บุญยืน ทองเงิน
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1954 เล่ม 20 ข หน้า 54
ที่ตั้ง : 154 5 ทุ่งนุ้ย ควนกาหลง สตูล 06 1243 3212 91130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 49/2563 (ปลูก)
46 ชื่อผู้รับอนุญาต : สถาบันเทคโนโลยีนิวเคลียร์แห่งชาติ (องค์การมหาชน) นางสาว พิริยาธร สุวรรณมาลา
ชื่อสถานที่ : สถาบันเทคโนโลยีนิวเคลียร์แห่งชาติ (องค์การมหาชน)
ที่ตั้ง : 9/9 7 ทรายมูล องครักษ์ นครนายก 0 2401 9889 26120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 50/2563 (ปลูก)
47 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก นาย อนันต์ พงศ์ธรกุลพานิช
ชื่อสถานที่ : อาคารพิรุณรักษ์ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก
ที่ตั้ง : 43 6 บางพระ ศรีราชา ชลบุรี 0 3313 6099 ต่อ 1180 20110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 52/2563 (ปลูก)
48 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสุขฤทัยเกษตรปลอดภัย นาย วัฒนะ ปานดวงแก้ว
ชื่อสถานที่ : วิสาหกิจชุมชนสุขฤทัยเกษตรปลอดภัย
ที่ตั้ง : 199/9 6 สุขฤทัย ห้วยคต อุทัยธานี 09 6753 2226 61170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 53/2563 (ปลูก)
49 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกและแปรรูปพืชสมุนไพรปลอดสารพิษ นาย สมเจตน์ เจียมเจือจันทร์
ชื่อสถานที่ : วิสาหกิจชุมชนปลูกและแปรรูปพืชสมุนไพรปลอดสารพิษ
ที่ตั้ง : 149 6 บ้านบึง บ้านไร่ อุทัยธานี 08 0111 9944 และ 08 0111 8844 61140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 54/2563 (ปลูก)
50 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรพอเพียงเลี้ยงแพะแกะอำเภอบ้านไร่
ชื่่อผู้ดำเนินกิจการ : นาย สมเจตน์ เจียมเจือจันทร์
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1149 เล่ม 12ก หน้า 49 (อุทัยธานี)
ที่ตั้ง : 7 บ้านบึง บ้านไร่ อุทัยธานี
เลขที่ใบอนุญาต : 56/2563 (ปลูก)
ปริมณฑล
เขตบางเขน เตรียมความพร้อมเปิดศูนย์พักคอย บริเวณอาคารศูนย์กีฬารามอินทรา ซ.รามอินทรา 5 บางเขน LINK
#บางเขน #เตรียมความพร้อมเปิดศูนย์พักคอยเพื่อส่งต่อผู้ป่วยโควิด19ระลอกใหม่ >>สำนักงานเขตบางเขน เตรียมความพร้อมด้านอาคารสถานที่ศูนย์พักคอยกรุงเทพมหานคร เพื่อรอการส่งต่อผู้ป่วยที่มีผลตรวจรับรองว่าติดเชื้อโควิด-19 ในพื้นที่เขตบางเขน ระลอกใหม่ที่เกิดขึ้นที่เกิดจากสายพันธุ์โอไมครอน และสายพันธุ์เดลต้า ณ บริเวณอาคารศูนย์กีฬารามอินทรา ซอยรามอินทรา 5 เขตบางเขน โดยมีเป้าหมายรองรับผู้ป่วยติดเชื้อโควิด-19 ประมาณ 120 เตียง และสามารถขยายได้ถึง 150 เตียง หากมีผู้ป่วยจำนวนมาก นอกจากนี้ ยังได้เตรียมความพร้อมของสายด่วน 20 คู่สาย ของศูนย์ EOC เขต เพื่อรองรับการติดต่อสอบถามความช่วยเหลือจากประชาชนตลอด 24 ชม. โทร.0 2026 3166
โรงพยาบาลจุฬารัตน์ ชลเวช เปิดรับสมัครงาน
เปิดรับสมัครงานโรงพยาบาลจุฬารัตน์ ชลเวช สำหรับผู้ที่สนใจ สามารถเข้ามากรอกใบสมัครได้ในเวลาทำการ วันจันทร์-วันศุกร์ เวลา 08.00 - 16.00 น.
สนใจสอบถามเพิ่มเติมได้ที่ : แผนกบุคคล
038-284355 ต่อ 5501
081-4567553 (คุณริ)
087-5849104 (คุณกวาง)
หรือ ส่งข้อมูลสมัครงานมาที่ : rattima@chularat.com
รักเรานิรันดร์ ที่เขื่อนป่าสักชลสิทธิ์@อำเภอพัฒนานิคม
สำนักทะเบียนอำเภอพัฒนานิคม
ขอเชิญชวนคู่รักร่วมสร้างความทรงจำที่งดงามไปด้วยกัน
ขอเชิญชวน คู่รักชายหญิง และ คู่รัก LGBTQI+
จดทะเบียนสมรสและจดบันทึกใบสำคัญคู่ชีวิต นอกสถานที่ ในวันแห่งความรัก 14 กุมภาพันธ์ 2566 วันวาเลนไทน์ ณ เขื่อนป่าสักชลสิทธิ์ อ.พัฒนานิคม จ.ลพบุรี (ฟรีไม่มีค่าใช้จ่าย)
กิจกรรมครั้งนี้ จัดขึ้นภายใต้ชื่อ “รักเรานิรันดร์ ที่เขื่อนป่าสักชลสิทธิ์”
ภายในงานมีกิจกรรม
- ขบวนกลองยาว
- จดทะเบียนสมรสและจดบันทึกใบสำคัญคู่ชีวิต
- รับพรจากพระเกจิ และรับของที่ระลึก เพื่อความเป็นสิริมงคล พร้อมปะพรมน้ำมนต์
- มีจุดถ่ายรูปสวยงาม (แบคดรอป)
- นั่งรถไฟลากชมเขื่อน ข้ามฟากไหว้พระใหญ่
- มอบใบสำคัญการสมรสและใบสำคัญคู่ชีวิตโดยนายอำเภอพัฒนานิคม
- คู่รักทุกคู่ลุ้นรับของรางวัลภายในงาน
- พักฟรีที่โสมาภารีสอร์ท 1 คืน (ภายใน 1 เดือน)
รับสมัครตั้งแต่บัดนี้เป็นต้นไป ถึงวันที่ 13 กุมภาพันธ์ 2566
โดยสามารถสมัครได้ด้วยตนเองที่ สำนักทะเบียนอำเภอพัฒนานิคม
สอบถามเพิ่มเติมที่เบอร์โทรศัพท์ 036-491726/063-9031502
หมายเหตุ: ใบสำคัญคู่ชีวิต มีลักษณะเช่นเดียวกับ ใบสำคัญการสมรส(ทะเบียนสมรส) คือ มีชื่อ สกุล ของทั้งสองฝ่าย ระบุวันที่จดบันทึกและลายเซ็นของนายทะเบียน(นายอำเภอ)
เป็นกิจกรรมของสำนักทะเบียนอำเภอพัฒนานิคม โดยไม่มีผลผูกพันทางกฎหมายใดๆ”
เขตสายไหม
สำนักงานเขตสายไหม เชิญชวนชาวสายไหมนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันพิษสุนัขบ้า ประจำปี 2566 ในระหว่างวันที่ 13 - 24 มีนาคม 2566 รายละเอียดตามภาพ
วิทยาศาสตร์การเคลื่อนไหวและสุขภาพ บรรยาย
หมายเหตุ
ปี 2566 มีโรงพยาบาลประกันสังคม เพิ่มเข้ามาใหม่ 6 แห่ง ได้แก่ รพ.ลาดกระบังกรุงเทพมหานคร , รพ.กรุงไทย เวสเทิร์น นนทบุรี , รพ.เชียงราย ราม, รพ.ศูนย์การแพทย์มหาวิทยาลัยวลัยลักษณ์ นครศรีธรรมราช , รพ.กรุงเทพสุราษฎร์ และ รพ.เฉลิมพระเกียรติสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ระยอง และโรงพยาบาลเอกชน 1 แห่ง ที่ยุติการรับผู้ประกันตน คือ
โรงพยาบาลไอเอ็มเอช ธนบุรี (ประชาพัฒน์)
ปี 2565 มีโรงพยาบาลประกันสังคม เพิ่มเข้ามาใหม่ 9 แห่ง ทั่วประเทศ ได้แก่ รพ.พญาไท นวมินทร์ กรุงเทพ, รพ.เอเชียอินเตอร์เนชั่นแนล พระนครศรีอยุธยา, รพ.ดีบุก ภูเก็ต, รพ.ลำพูนใกล้หมอ ลำพูน, รพ.สมเด็จพระยุพราชเดชอุดม อุบลราชธานี, รพ.เกษมราษฏร์ ปราจีนบุรี, รพ.ซีจีเอช ลำลูกกา ปทุมธานี, รพ.ทีอาร์พีเอช ตรัง และ รพ.ลานนา 3 เชียงใหม่
อ่านเพิ่มเติม
ศูนย์บริการสาธารณสุข 51 จตุจักร วันที่ 2-3 กันยายน และ 9-13 กันยายน 2567
สำนักงานเขตจตุจักร ร่วมกับศูนย์บริการสาธารณสุข 51 จตุจักร และ ศูนย์บริการสาธารณสุข 17 ประชานิเวศน์ จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในพื้นที่เขตจตุจักร จึงขอเชิญชวนประชาชนนำสัตว์เลี้ยง ที่มีสุขภาพแข็งแรง ไม่อยู่ระหว่างตั้งท้อง และมีอายุมากกว่า 3 เดือนขึ้นไป เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯ เคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่าย ตั้งแต่วันที่ 2-3 กันยายน และ 9-13 กันยายน 2567 ตามเวลาที่กำหนด สามารถติดต่อสอบถามได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล 02 513 9947
เมืองพัทยา หน่วยบริการทำหมันสุนัขแมว เดือนเมษายน-พฤษภาคม 2567
กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา ได้จัดทำแผนปฏิบัติงานโครงการรณรงค์ควบคุมและป้องกันโรคพิษสุนัขบ้าในเขตเมืองพัทยา ครอบคลุมพื้นที่ ตำบลนาเกลือ หมู่ 1 – 7 ตำบลหนองปรือ หมู่ 5, 6, 9, 10, 11, 12, 13 ตำบลหนองปลาไหล หมู่ 6 – 8 ตำบลห้วยใหญ่ หมู่ 4 เพื่อให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดป้องกันเห็บหมัดในสุนัข และผ่าตัดทำหมันคุมกำเนิดถาวร รับหน่วยละ 50 ตัว โดยเริ่มให้บริการตั้งแต่วัน 09.00 – 12.00 น.
กำหนดการเดือนมีนาคม-เมษายน 2567 เวลา 9.00 - 12.00 น. ทุกจุด
- 1 มีนาคม 2567 สำนักสงข์หนองอ้อ
- 4 มีนาคม 2567 เกาะล้าน
- 6 มีนาคม 2567 วัดหนองใหญ่
- 13 มีนาคม 2567 วัดหนองใหญ่
- 15 มีนาคม 2567 วัดโพธิสัมพันธ์
- 18 มีนาคม 2567 วัดโพธิสัมพันธ์
- 20 มีนาคม 2567 วัดสว่างฟ้าพฤฒาราม
- 27 มีนาคม 2567 วัดสว่างฟ้าพฤฒาราม
- 29 มีนาคม 2567 วัดป่าสุทธิภาวัน
- 1 เมษายน 2567 วัดป่าสุทธิภาวัน
- 3 เมษายน 2567 วัดช่องลมนาเกลือ
- 10 เมษายน 2567 วัดช่องลมนาเกลือ
- 22 เมษายน 2567 วัดกระทิงราย
- 24 เมษายน 2567 วัดกระทิงราย
- 1 พฤษภาคม 2567 วัดจิตตภาวัน
- 3 พฤษภาคม 2567 วัดจิตตภาวัน
- 6 พฤษภาคม 2567 เกาะล้าน
- ฉีดวัคซีน โรคพิษสุนัขบ้า สัตว์เลี้ยงจะต้องมีสุขภาพแข็งแรง ไม่ป่วย มีอายุ 3 เดือนขึ้นไป
- ผ่าตัดทำหมันคุมกำเนิดถาวร ให้บริการสำหรับสุนัขและแมวไทยเท่านั้น งดรับสุนัขแมวพันธุ์หรือผสม และต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง ไม่ป่วย โดยงดน้ำ งดอาหาร พร้อมกักบริเวณ หรือขังกรง เป็นเวลา 8 - 12 ชั่วโมง (ให้สิทธิ์ครัวเรือนละไม่เกิน 2 ตัว) ระหว่างรอขอความร่วมมือ ล่ามโซ่หรือขังโกรงห้ามปล่อยสุนัขและแมวเพื่อป้องกันน้องแอบทานอาหาร)
- ผู้เข้ารับบริการจะต้องนำบัตรประชาชนมาลงทะเบียน
- หากผู้เข้ารับบริการไม่มีทะเบียนบ้านอยู่ในเขตพื้นที่ ให้แจ้งที่อยู่ที่อาศัย ที่อยู่ปัจจุบันในเขตพื้นที่ได้
สำหรับประชาชนที่สนใจนำสุนัขและแมวเข้ารับบริการ ควรปฏิบัติตามรายละเอียดดังกล่าวอย่างเคร่งครัด สามารถสอบถามเพิ่มเติมได้ที่ กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา หมายเลขโทรศัพท์ 038 – 111826 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
12 มิถุนายน 2567 เทศบาลนครเจ้าพระยาสุรศักดิ์ ผ่าตัดทำหมันถาวรสุนัขและแมวจรจัดและด้อยโอกาส จำนวน 100 ตัว
โครงการควบคุมจำนวนประชากรสัตว์จรจัดและสัตว์ด้อยโอกาสใน เขตเทศบาล ประจำปีงบประมาณ พ.ศ. 2567
เทศบาลนครเจ้าพระยาสุรศักดิ์ ร่วมกับ สำนักงานปศุสัตว์อำเภอศรีราชา กิจกรรมบริการฟรี ไม่มีค่าใช้จ่าย ในวันที่ 12 มิถุนายน 2567 เวลา 08.30 น.
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าประจำปี ฟรี!ไม่จำกัดจำนวน
- ผ่าตัดทำหมันถาวรสุนัขและแมวจรจัดและด้อยโอกาส จำนวน 100 ตัว
o จำกัดจำนวนสัตว์ไม่เกิน 3 ตัว/ผู้รับบริการ
o ผู้รับบริการอยู่ในเขตเทศบาลนครเจ้าพระยาสุรศักดิ์
o สัตว์ต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง
o สัตว์กลุ่มเสี่ยงในพื้นที่ ที่มีประวัติการเกิดโรคพิษสุนัขบ้า
o งดน้ำงดอาหารอย่างน้อย 8 - 12 ชั่วโมง
o ไม่รับสุนัขและแมวที่มีสายพันธุ์แท้
***ลงทะเบียนรับคิว ***
ดำเนินการ ณ วัดหนองขาม ตำบลหนองขาม อำเภอศรีราชา จังหวัดชลบุรี สอบถามข้อมูลเพิ่มเติม งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม 038-348253 ต่อ 219
ปศุสัตว์ชลบุรี ตารางออกหน่วยทำหมันฉีดวัคซีน มิถุนายน-สิงหาคม 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว สำนักงานปศุสัตว์จังหวัดชลบุรี ปี 2567 (ร่วมกับอปท.) รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) เวลาออกหน่วยบริการทุกจุด 8.30 - 11.00 น. **เท่านั้น** พื้นที่อื่นๆ รอ Update หรือโทรสอบถาม อบต./เทศบาล ในพื้นที่
- 4 มิ.ย. 67 เทศบาลตำบลคลองตำหรุ อ.เมือง
- 5 มิ.ย. 67 เทศบาลตำบลเกาะจันทร์ อ.เกาะจันทร์
- 7 มิ.ย. 67 เทศบาลตำบลเขาไม้แก้ว อ.บางละมุง
- 11 มิ.ย. 67 เทศบาลเมืองชลบุรี อ.เมือง
- 12 มิ.ย. 67 เทศบานครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- 13 มิ.ย. 67 เทศบาลเมืองบ้านสวน อ.เมือง
- 14 มิ.ย. 67 เทศบาลเมืองบ้านบึง อ.บ้านบึง
- 18 มิ.ย. 67 เทศบาลเมืองหนองปรือ อ.บางละมุง
- 19 มิ.ย. 67 เทศบาลเมืองเมืองชลบุรี
- 20 มิ.ย. 67 เทศบาลตำบลเสม็ด อ.เมือง
- 21 มิ.ย. 67 เทศบาลเมืองแสนสุข อ.เมือง
- 25 มิ.ย. 67 เทศบาลเมืองเมือง
- 27 มิ.ย. 67 เทศบาลเมืองบ้านสวน อ.เมือง
- 12 ก.ค. 67 เทศบาลตำบลเกาะสีชัง อ.เกาะสีชัง
- 17 ก.ค. 67 วัดบ่อวิน เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- 25 ก.ค. 67 เทศบาลเมืองบ้านสวน อ.เมือง
- 16 สิงหาคม ณ วัดหนองปรือ เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- 21 สิงหาคม ณ เทศบาลเมืองหนองปรือ อ.บางละมุง
ปศุสัตว์ ชลบุรี ตารางออกหน่วยทำหมันฉีดวัคซีน เดือนตุลาคม ปี 2567
กำหนดการออกหน่วยเดือนตุลาคม 2567
ติดตามข้อมูล
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว สำนักงานปศุสัตว์จังหวัดชลบุรี ปี 2567 (ร่วมกับอปท.) รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) เวลาออกหน่วยบริการทุกจุด 8.30 - 11.00 น. **เท่านั้น** พื้นที่อื่นๆ รอ Update หรือโทรสอบถาม อบต./เทศบาล ในพื้นที่
Trip 5 : เสาร์ที่ 29 และอาทิตย์ที่ 30 กรกฎาคม โครงการพระราชดำริ@ฉะเชิงเทรา ชมวิวกลางสะพานข้ามแม่น้ำบางปะกง (ไปเช้ากลับเย็น)
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตทุ่งครุ
แนวทางปฏิบัติงานของรถ EMS ช่วงสถานการณ์ Covid-19
คลินิกกายอุปกรณ์ LINK
กายอุปกรณ์ กายอุปกรณ์ คือ อุปกรณ์ทางการแพทย์ที่กระทำกับอวัยวะภายนอกของร่างกายเพื่อช่วยในการฟื้นฟูสมรรถภาพทางกายและการเคลื่อนไหวของร่างกายในส่วนที่สูญหายหรือบกพร่องเกี่ยวกับระบบประสาท กล้ามเนื้อและกระดูก หน่วยงานกายอุปกรณ์ สถาบันสิรินธรเพื่อการฟื้นฟูฯ เป็นหน่วยงานที่ให้บริการด้านวิชาการและบริการการฟื้นฟูสมรรถภาพทางกายและการเคลื่อนไหว ด้านวิชาการได้มีการจัดทำผลงานวิจัยอย่างต่อเนื่องเพื่อพัฒนารูปแบบ นวัตกรรมและระบบบริการ ฟื้นฟูสมรรถภาพทางกายและการเคลื่อนไหวเคลื่อนที่ 4 ภูมิภาค เพื่อให้ผู้ป่วยและคนพิการได้เข้าถึงบริการอย่างสะดวกและรวดเร็ว สำหรับงานบริการหน่วยงานกายอุปกรณ์มีหน้าที่ให้บริการในด้านการตรวจประเมิน ออกแบบ ผลิต ดัดแปลง ซ่อมแซมและแก้ไขกายอุปกรณ์ประเภทต่าง ควบคุมไปทั้งกายอุปกรณ์เทียม กายอุปกรณ์เสริม รวมไปถึงรองเท้าสำหรับแก้ไขความพิการ แผ่นเสริมในรองเท้า และ นิ้วมือนิ้วเท้าเทียมชนิดซิลิโคน
การจองคิวนัดหมาย
1. ผู้รับบริการรายใหม่ ติดต่อห้องเวชระเบียนเพื่อทำประวัติใหม่และรอรับแฟ้มประวัติ/ ผู้รับบริการรายเก่า ติดต่อห้องเวชระเบียนเพื่อรับแฟ้มประวัติที่ตึกอำนวยการ
สถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพทางการแพทย์แห่งชาติ
2. พบแพทย์เวชศาสตร์ฟื้นฟูเพื่อตรวจวินิจฉัยโรค
3. ยื่นแฟ้มที่งานธุรการ อาคารกายอุปกรณ์ เพื่อรับใบนัดหมายการเข้าตรวจคลินิกกายอุปกรณ์
การเข้าตรวจคลินิกกายอุปกรณ์ (วันจันทร์ เวลา 08.30 น. - 12.00 น.)
1. ผู้รับบริการรับแฟ้มประวัติที่เวชระเบียนตึกอำนวยการ สถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพทางการแพทย์แห่งชาติ
2. ยื่นแฟ้มประวัติพร้อมใบนัดหมายที่งานธุรการ อาคารกายอุปกรณ์
3. พบแพทย์เวชศาสตร์ฟื้นฟูประจำงานกายอุปกรณ์เพื่อตรวจประเมิน วินิจฉัยโรค และรับใบสั่งกายอุปกรณ์
4. พบนักกายอุปกรณ์เพื่อตรวจประเมิน หล่อแบบ และออกแบบกายอุปกรณ์
5. รับใบนัดหมายเพื่อมาทดลองใช้กายอุปกรณ์ และยื่นแฟ้มประวัติคืนที่งานธุรการ อาคารกายอุปกรณ์
*** หมายเหตุ : อย่าลืมนำรองเท้าที่เหมาะสมจะใช้ในการทดลองกายอุปกรณ์มาด้วย ***
การเข้าตรวจคลินิกกายอุปกรณ์ (วันพุธ เวลา 08.30 น. - 16.30 น.)
1. ผู้รับบริการรับแฟ้มประวัติที่เวชระเบียนตึกอำนวยการ สถาบันสิรินธรเพื่อการฟื้นฟูสมรรถภาพทางการแพทย์แห่งชาติ
2. ยื่นแฟ้มประวัติพร้อมใบนัดหมายที่งานธุรการ อาคารกายอุปกรณ์
3. พบนักกายอุปกรณ์เพื่อทดลองใช้กายอุปกรณ์
4. พบแพทย์เวชศาสตร์ฟื้นฟูเพื่อตรวจสอบกายอุปกรณ์
5. หากมีการนัดตรวจสอบกายอุปกรณ์เป็นระยะ ๆ หรือนัดรับกายอุปกรณ์ รับใบนัดหมายครั้งต่อไปและยื่นแฟ้มประวัติคืนที่งานธุรการ อาคารกายอุปกรณ์
พิษณุโลก - กักตัว 14 วัน LINK
สรุปมาตรการสำหรับประชาชนที่จะเดินทางเข้าจังหวัดพิษณุโลก
1) วิธีปฏิบัติตน ให้ดำเนินการตามแนวทางประกาศวันที่ 27 มกราคม 2564
2) สีของพื้นที่จังหวัดให้ยึดตามที่ ศบค.กำหนด (วันที่ 7 เมษายน 64)
3) ยกเว้น พื้นที่กรุงเทพมหานคร, นนทบุรี, ปทุมธานี, สมุทรปราการ และนครปฐม จังหวัดพิษณุโลก ยกระดับให้เป็นพื้นที่ควบคุมสูงสุด
4) ประชาชนทุกคนที่จะเดินทางเข้ามาจังหวัดพิษณุโลก จึงให้สแกน QR code โปรแกรม
save phitsanulok5) ประชาชนที่มาจาก 5 จังหวัดพื้นที่ควบคุมสูงสุด ให้สแกน QR code โปรแกรม save phitsanulok เช่นกัน และ จนท.จะเข้าไปคัดกรองเพื่อพิจารณาความเสี่ยงของบุคคลนั้นๆ โดยที่
- กลุ่มเสี่ยงสูงจะมีคำสั่งให้ "คุมไว้สังเกต" ที่บ้านพัก (ตามกรอบสีส้ม)
- กลุ่มเสี่ยงต่ำให้ปฏิบัติตนตามพื้นที่เฝ้าระวังสูง (DMHTT) (ตามกรอบสีเหลือง)
เพจ
สสจ.พิษณุโลก โทร 055-252-052
รพ.พุทธชินราช พิษณุโลก 055 270 300
รพ.มหาวิทยาลัยนเรศวร 055 965 666
27 พฤษภาคม 64 เวลา 20.00 น.
8 ล้านในที่สุด
ลำดับ 51-100
51 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนคนหนามเข้ นาย สมเจตน์ เจียมเจือจันทร์
ชื่อสถานที่ : วิสาหกิจชุมชนคนหนามเข้
ที่ตั้ง : 55/1 10 บ้านไร่ บ้านไร่ อุทัยธานี 08 5604 0080 61140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 57/2563 (ปลูก)
52 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพัฒนาการเกษตรบ้านเขาผาลาด นาย จตุรงค์ ดิษผล
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3832
ที่ตั้ง : พลวงสองนาง สว่างอารมณ์ อุทัยธานี 08 9825 5067 61150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 58/2563 (ปลูก)
53 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มแปรรูปผลผลิตทางการเกษตรบ้านหนองหิน นาง จารุวรรณ พลแสน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 44087
ที่ตั้ง : ทุ่งจังหัน โนนสุวรรณ บุรีรัมย์ 31110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 59/2563 (ปลูก)
54 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรอำเภอกระสัง นาย อิธิรัตน์ ศรีนาคา
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรอำเภอกระสัง
ที่ตั้ง : 679 19 กระสัง-ประโคนชัย กระสัง กระสัง บุรีรัมย์ 08 9420 5555 31160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 60/2563 (ปลูก)
55 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพร ตำบลบางยอ นาย สายชล แสงแดงชาติ
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพร ตำบลบางยอ
ที่ตั้ง : 89/13 9 เพชรหึงษ์ บางยอ พระประแดง สมุทรปราการ 814413028 10130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 2/2564 (ปลูก)
56 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรสวนดงเย็น นาย ยอด คุณยศยิ่ง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 45784
ที่ตั้ง : ป่าเมี่ยง ดอยสะเก็ด เชียงใหม่ 08 7195 1551 50220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 3/2564 (ปลูก)
57 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์บ้านสหกรณ์ นาย สมบัติชนก์ หัตถะปนิตร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 6604
ที่ตั้ง : เชียงใหม่-แม่ออน ออนกลาง แม่ออน เชียงใหม่ 09 9858 3585 50130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 4/2564 (ปลูก)
58 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรพื้นบ้านและพืชกินผลตะวันออก นาย เฉลิมพล ฉิมพา
ชื่อสถานที่ : วิสาหกิจชุมชนพืชสมุนไพรพื้นบ้านและพืชกินผลตะวันออก
ที่ตั้ง : 99 6 โคกสะอาด เมืองอุดรธานี อุดรธานี 09 5695 4951 41000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 5/2564 (ปลูก)
59 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรเพื่อสุขภาพ ตำบลปากทาง นาง อักษร กล่อมจิตต์
ชื่อสถานที่ : องค์การบริหารส่วนตำบลปากทาง
ที่ตั้ง : ปากทาง เมืองพิจิตร พิจิตร 08 6440 0304 66000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 6/2564 (ปลูก)
60 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรไทภูเขียว นาย สุภาพ สำราญวงษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 53486
ที่ตั้ง : ผักปัง ภูเขียว ชัยภูมิ 08 9717 3816 และ 08 1949 4210 36110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 7/2564 (ปลูก)
61 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มแปรรูปผลผลิตทางการเกษตรบ้านโสกจาน นาย กุญช์กฤษฏิ์ พันทา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 39061
ที่ตั้ง : 1/1 7 ในเมือง บ้านไผ่ ขอนแก่น 08 9819 5840 40110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 8/2564 (ปลูก)
62 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรไทด่านบ้านโป่งชี นาง ศรีสุดา อุ่นแก้ว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 14498
ที่ตั้ง : โป่ง ด่านซ้าย เลย 08 1822 9426 42120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 9/2564 (ปลูก)
63 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์วิถีไทบ้าน นาย สุทิน แสงชมภู
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านเมี่ยง
ที่ตั้ง : 150 9 ท่าลี่-หนองผือ หนองผือ ท่าลี่ เลย 08 9840 9997 42140
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 11/2564 (ปลูก)
64 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพัฒนาเกษตรกรพัฒนาธุรกิจภาคเอกชน นาย ไพรัช จันทร์แสง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 19686
ที่ตั้ง : ศรีสองรัก เมืองเลย เลย 08 7978 7955 42100
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 12/2564 (ปลูก)
65 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสารภีกรีนแอนด์คลีน นาย ศุภพร บุญศรีตัน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 4066
ที่ตั้ง : ไชยสถาน สารภี เชียงใหม่ 08 9566 7669 และ 0856240055 50140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 13/2564 (ปลูก)
66 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสภาชุมชนบ้านห้วยลาด นางสาว มนต์จันทร์ พิมใจ
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1126 เล่ม 12ก หน้า 26 เลขที่ดิน 405
ที่ตั้ง : หนองบัว ภูเรือ เลย 08 3016 1694 42160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 14/2564 (ปลูก)
67 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนแปรรูปสมุนไพรปลูกรัก นาย บุญฤทธิ์ วงศ์เชวงทรัพย์
ชื่อสถานที่ : วิสาหกิจชุมชนแปรรูปสมุนไพรปลูกรัก
ที่ตั้ง : 348 แม่สอด-แม่ระมาด พระธาตุ แม่ระมาด ตาก 087-8443362 63140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 15/2564 (ปลูก)
68 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนท่องเที่ยวเชิงเกษตรแบบผสมผสานตำบลเหล่ายาว นาย คะนอง ถนอมสัตย์
ชื่อสถานที่ : โรงพยาบาล บ้านโฮ่ง
ที่ตั้ง : 308 7 ลำพูน-ลี้ บ้านโฮ่ง บ้านโฮ่ง ลำพูน 0 5398 0377 0 53098 0504 51130
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 16/2564 (ปลูก)
69 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพัฒนาสมุุนไพรครบวงจรอำเภอแกลง นางสาว นวลพรรณค์ เมตตา
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลกร่ำ
ที่ตั้ง : 55 3 เพ-แกลง-กร่ำ กร่ำ แกลง ระยอง 0 3865 7457 21190
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 17/2564 (ปลูก)
70 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มรามยม นาง ปรานอม ทองม่วง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13798
ที่ตั้ง : ทัพทัน ทัพทัน อุทัยธานี 08 1888 3142 61120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 18/2564 (ปลูก)
71 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรตำบลหนองขาหย่าง นาย ชาญวิทย์ สุระดม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 7753
ที่ตั้ง : เขากวางทอง หนองฉาง อุทัยธานี 09 5986 5456 61110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 19/2564 (ปลูก)
72 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรไทย นาง กาญจนา มากวงษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 6421
ที่ตั้ง : สว่างอารมณ์ สว่างอารมณ์ อุทัยธานี 09 8787 3252 61150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 20/2564 (ปลูก)
73 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนฅนท้องถิ่นบ้านสมุนไพรเขากวางทอง นาย สมเจตน์ ไวสาริกิจ
ชื่อสถานที่ : ส.ป.ก. เลขที่ 164 เล่ม 2 หน้า 64
ที่ตั้ง : เขากวางทอง หนองฉาง อุทัยธานี 931383393 61110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 21/2564 (ปลูก)
74 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรทางการแพทย์บ้านหนองมะกอก นาง ศญามล น้ำแก้ว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 18397
ที่ตั้ง : หนองนางนวล หนองฉาง อุทัยธานี 08 4491 6189 61110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 22/2564 (ปลูก)
75 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรบ้านดอนหมี ม.8 ต.เวียงสะอาด นาง อรทัย ญาติปราโมทย์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 74563
ที่ตั้ง : เวียงสะอาด พยัคฆภูมิพิสัย มหาสารคาม 909293544 44110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 23/2564 (ปลูก)
76 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรช่วยชีวิตพิชิตโรคแปรรูปและจำหน่ายครบวงจร นาย บัญชา ดวงทิพย์จันทร์
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรช่วยชีวิตพิชิตโรคแปรรูปและจำหน่ายครบวงจร
ที่ตั้ง : 10 9 หนองซอน เชียงยืน มหาสารคาม 885719909 44160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 24/2564 (ปลูก)
77 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรเกษตรผสมผสานบ้านนาปะขอ นาย เกรียงไกร ไชยวรรณ
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านนาปะขอ
ที่ตั้ง : 111/1 5 นาปะขอ บางแก้ว พัทลุง 93140
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 25/2564 (ปลูก)
78 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนคนกระบี่เพื่อปลูกสมุนไพร นาง อัมพา เพ็ชรสุก
ชื่อสถานที่ : วิสาหกิจชุมชนคนกระบี่เพื่อปลูกสมุนไพร
ที่ตั้ง : 222 ปากน้ำ เมืองกระบี่ กระบี่ 08 6275 3636 81000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 26/2564 (ปลูก)
79 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรไทยโนนมาลัย นาย บดินทร์ ที่รักษ์
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - บุรีรัมย์ -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 28/2564 (ปลูก)
80 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรวิถีท่องเที่ยวเพื่อสุขภาพบ้านแก่งหลวง นาง นวพรรษ พงษ์เผือก
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 30871
ที่ตั้ง : เกาะสำโรง เมืองกาญจนบุรี กาญจนบุรี 08 7155 8425 71000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 29/2564 (ปลูก)
81 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรวิถีท่องเที่ยวเพื่อสุขภาพบ้านวังเย็น นาง บุบผา สิริชุมแสง
ชื่อสถานที่ : ตาม น.ส.3ก เล่มที่ 3ข หน้า 2 เลขที่ 252
ที่ตั้ง : วังเย็น เมืองกาญจนบุรี กาญจนบุรี 08 7169 4934 71000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 30/2564 (ปลูก)
82 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรบ้านอดุลกาญจนกิจ นาง พรชื่น วรพิสุทธิวงศ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มสมุนไพรบ้านอดุลกาญจนกิจ
ที่ตั้ง : 84 1 หนองปรือ หนองปรือ กาญจนบุรี 09 2785 6195 71220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 31/2564 (ปลูก)
83 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรบ้านท่าโป่ง นาย อุกฤษฎ์ บุษบงค์
ชื่อสถานที่ : พื้นที่วิสาหกิจชุมชนปลูกพืชสมุนไพรบ้านท่าโป่ง
ที่ตั้ง : 85/8 3 จรเข้เผือก ด่านมะขามเตี้ย กาญจนบุรี 08 7000 5411 71260
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 32/2564 (ปลูก)
84 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรวิถีท่องเที่ยวเพื่อสุขภาพบ้านหนองหญ้า นาง จารุวรรณ จันโทสถ
ชื่อสถานที่ : ตาม น.ส.3 เล่มที่ 14 หน้า 187
ที่ตั้ง : 5 หนองหญ้า เมืองกาญจนบุรี กาญจนบุรี 71000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 33/2564 (ปลูก)
85 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนวิสาหกิจเกษตรวิถีท่องเที่ยวเพื่อสุขภาพบ้านยางเกาะ นาย สุขชัย ประเสริฐสุข
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 11954 เล่ม 120 หน้า 54
ที่ตั้ง : กลอนโด ด่านมะขามเตี้ย กาญจนบุรี 926162991 71260
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 34/2564 (ปลูก)
86 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรวิถีท่องเที่ยวเพื่อสุขภาพบ้านลาดหญ้า นาง สงวน จันทร์สว่าง
ชื่อสถานที่ : ตาม น.ส.3 เลขที่ 10 เล่มที่ 5 หน้าที่ 38
ที่ตั้ง : ลาดหญ้า เมืองกาญจนบุรี กาญจนบุรี 08 7090 3163 71190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 35/2564 (ปลูก)
87 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรและปศุสัตว์บ้านท่ามะเดื่อ นางสาว เกสร เรืองศรี
ชื่อสถานที่ : ตาม น.ส.3 เล่ม 10 หน้า 11 เลขที่ 52
ที่ตั้ง : ศรีมงคล ไทรโยค กาญจนบุรี 71150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 36/2564 (ปลูก)
88 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรเพื่อเศรษฐกิจใหม่ นาย พงศกร กรโสภา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 4630
ที่ตั้ง : หนองกุง เมืองกาฬสินธุ์ กาฬสินธุ์ 09 6569 8892 46000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 37/2564 (ปลูก)
89 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรไทยยางตลาด นาง ประภัสสร ใจศิริ
ชื่อสถานที่ : วิสาหกิจชุมชนปลูกพืชสมุนไพรไทยยางตลาด
ที่ตั้ง : 179 18 ยางตลาด ยางตลาด กาฬสินธุ์ 09 1054 1242 46120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 38/2564 (ปลูก)
90 ชื่อผู้รับอนุญาต : มหาวิทยาลัยนเรศวร นางสาว กรกนก อิงคนินันท์
ชื่อสถานที่ : คณะเภสัชศาสตร์ มหาวิทยาลัยนเรศวร
ที่ตั้ง : 99 9 ท่าโพธิ์ เมืองพิษณุโลก พิษณุโลก 0 5596 3730 65000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 39/2564 (ปลูก)
91 ชื่อผู้รับอนุญาต : สถาบันพระบรมราชชนก นาย ชัยวัฒน์ พันธ์รัศมี
ชื่อสถานที่ : วิทยาลัยการสาธารณสุขสิรินธร จังหวัดพิษณุโลก
ที่ตั้ง : 653 8 พิษณุโลก-หล่มสัก วังทอง วังทอง พิษณุโลก 0 55311025 65130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 40/2564 (ปลูก)
92 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเมืองดงคอน นาย ชนาภัทร อุดมทรัพย์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 24144
ที่ตั้ง : 14 ดงคอน สรรคบุรี ชัยนาท 06 5547 5554 17140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 41/2564 (ปลูก)
93 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้เลี้ยงและพัฒนาพันธุ์กระบือลุ่มน้ำลำปาว นาง พนมวรรณ์ ศรีคิรินทร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 37240
ที่ตั้ง : ลำคลอง เมืองกาฬสินธุ์ กาฬสินธุ์ 08 1053 9159 46000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 42/2564 (ปลูก)
94 ชื่อผู้รับอนุญาต : มหาวิทยาลัยศิลปากร นาย ธนะเศรษฐ์ ง้าวหิรัญพัฒน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 92882
ที่ตั้ง : พญาเย็น ปากช่อง นครราชสีมา 30320
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 43/2564 (ปลูก)
95 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์จังหวัดบุรีรัมย์ นาย ธวัชชัย มากมน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 27623
ที่ตั้ง : พุทไธสง พุทไธสง บุรีรัมย์ 08 1068 0770 31120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 44/2564 (ปลูก)
96 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการค้า นาย ปฏิภาณ เกียรติลือไกล
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรเพื่อการค้า
ที่ตั้ง : 35/1 8 โนนขวาง บ้านด่าน บุรีรัมย์ 09 8102 6375 31000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 47/2564 (ปลูก)
97 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรพื้นบ้านเฮือนฝั่งมูล นาย สุทัศน์ สิมพราช
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 986
ที่ตั้ง : สตึกสำราญ สตึก สตึก บุรีรัมย์ 06 1038 7988 31150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 48/2564 (ปลูก)
98 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนห้างนาโมเดลกัญชารักษาโรค นาย ปิยะพร อ่อนศรี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 711
ที่ตั้ง : หนองแก เมืองอุทัยธานี อุทัยธานี 08 7842 1372 61000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 49/2564 (ปลูก)
99 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรทางการแพทย์ตำบลหนองฉาง นาย อำนาจ บุญมีศรี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 15068
ที่ตั้ง : หนองนางนวล หนองฉาง อุทัยธานี 08 6924 1789 61110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 50/2564 (ปลูก)
100 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ผลิตพืชพลังงานทดแทนเพื่อโรงไฟฟ้าชีวมวลตำบลระบำ นาย นพดล ขยันการนาวี
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มผู้ผลิตพืชพลังงานทดแทนเพื่อโรงไฟฟ้าชีวมวลตำบลระบำ (อุทัยธานี)
ที่ตั้ง : 19 8 ระบำ ลานสัก อุทัยธานี
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 51/2564 (ปลูก)เขตบางกะปิ เปิดศูนย์พักคอยฯ (CI) ณ ศูนย์สร้างสุขทุกวัยบางกะปิ ซอยรามคำแหง 60 LINK
เปิดแล้ววันนี้!! ศูนย์พักคอยฯ บางกะปิ (CI) รับโควิด-19 ระลอกใหม่ (7 มกราคม 2565)
นายนพ ชูสอน ผู้อำนวยการเขตบางกะปิ นางสาวศิริพร รัตนคันทรง ผู้ช่วยผู้อำนวยการเขตบางกะปิ พร้อมด้วยผู้บริหารเขตบางกะปิ และเจ้าหน้าที่เกี่ยวข้อง ตรวจความเรียบร้อย ณ ศูนย์พักคอยฯ บางกะปิ (Community Isolation) ได้แก่ ตรวจสอบการจัดวางที่นอน การติดตั้งระบบไฟฟ้า ระบบเสียงตามสาย ระบบรักษาความปลอดภัย CCTV ระบบอินเตอร์เน็ต ห้องน้ำและห้องสุขา ความพร้อมของระบบบำบัดน้ำเสีย ระบบกำจัดขยะทั่วไปและขยะติดเชื้อ ตลอดจนสร้างความเข้าใจแก่เจ้าหน้าที่และบุคลากรทางการแพทย์ ศูนย์พักคอยเพื่อส่งต่อเขตบางกะปิ (Community Isolation) เปิดเพื่อรองรับผู้ป่วยโควิด-19 ระลอกใหม่ รองรับการแยกผู้ป่วยโควิด-19 ที่มีอาการไม่มากหรือไม่แสดงอาการ ออกจากครอบครัวหรือชุมชนมาอยู่ในความดูแลของเจ้าหน้าที่ เพื่อดูแลเบื้องต้นระหว่างรอนำส่งเข้ารับการรักษาต่อในโรงพยาบาล สำหรับศูนย์พักคอยเพื่อส่งต่อ เขตบางกะปิ ตั้งอยู่ที่ศูนย์สร้างสุขทุกวัยบางกะปิ ซอยรามคำแหง 60 รองรับผู้ป่วยโควิด-19 ได้ 133 เตียง อยู่ภายใต้การดูแลของโรงพยาบาลนวมินทร์ และศูนย์บริการสาธารณสุข 35 หัวหมาก
ข้อมูลควรรู้สำหรับผู้ประกันตน
ควรรู้สำหรับผู้ประกันตน
สอบถามข้อมูลเกี่ยวกับประกันสังคม
บางปะกอก-รังสิต2 จัดแพคเกจ Private Hospital รองรับ 5 วัน 15,000 / 30,000 LINK
รพ. บางปะกอก-รังสิต2 บริการรักษาผู้ป่วยติดเชื้อโควิดกลุ่มสีเขียวที่โรงพยาบาล อาการไม่รุนแรง หรือไม่มีอาการใดๆ ตามเงื่อนไขหรือเกณฑ์พิจารณา จำนวน 5 วัน เหมาจ่ายจำนวน 5 วัน ราคารวม
- ห้องพักเดี่ยว / ห้องพักคู่
- ติดตามอาการโดยแพทย์และพยาบาลทางออนไลน์ 1 ครั้ง/วัน
- ตรวจ X-Ray ปอดแรกรับเข้ารักษาในโรงพยาบาล 1 ครั้ง
- ยารักษาพื้นฐาน และยา Favipiravia ตามดุลยพินิจของแพทย์
- สิ่งอำนวยความสะดวกในห้องพัก และบริการอาหารสำหรับ 5 วัน
สอบถามรายละเอียดข้อมูลเพิ่มเติม และเงื่อนไขยกเว้น ที่ 02-028-1111
เขตบางรัก LINK
สำนักงานเขตบางรัก ร่วมกับ ศูนย์บริการสาธารณสุข 23 สี่พระยา สำนักอนามัย ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่เขตบางรัก ประจำปี 2566 ระหว่างวันที่ 13-24 มีนาคม 2566
ทั้งนี้ให้บริการฉีดวัคซีนฟรี! ไม่มีค่าใช้จ่ายแต่อย่างใด สามารถนำลูกหลานสุดรักมาฉีดวัคซีนกันได้ตามตารางนี้ ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02 236 1395 ต่อ 6215 หรือ ศูนย์บริการสาธารณสุข 23 สี่พระยา โทร. 02 236 4055 , 080 552 3539
Trip 5 : วันที่ 30 กันยายน 66 (ไปเช้ากลับเย็น) ทริปอิ่มบุญ@เพชรบุรี
วันที่ 30 กันยายน 66 (ไปเช้ากลับเย็น) โปรแกรม “ทริปอิ่มบุญ ปันรอยยิ้มให้น้อง @เพชรบุรี ราคา 1,499 บาท
สาธิตการเรียนการสอน คณะวิทยาศาสตร์การเคลื่อนไหวและสุขภาพ
ปศุสัตว์จังหวัดชลบุรี ออกหน่วยทำหมัน เดือนมีนาคม 2567 LINK
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน มีนาคม 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่ก่อนได้จ้า
ปศุสัตว์จังหวัดชลบุรี ออกหน่วยทำหมัน เดือนเมษายน 2567 LINK
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน เมษายน 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ โทรสอบถาม อบต./เทศบาล ในพื้นที่
17 พฤษภาคม 2567 เทศบาลนครเจ้าพระยาสุรศักดิ์ ทำหมันหมาแมว ฉีดวัคซีน ฟรี
เทศบาลนครเจ้าพระยาสุรศักดิ์ ร่วมกับ สำนักงานปศุสัตว์อำเภอศรีราชา ดำเนินโครงการควบคุมจำนวนประชากรสัตว์จรจัดและสัตว์ด้อยโอกาสใน เขตเทศบาล ประจำปีงบประมาณ พ.ศ. 2567 กิจกรรมบริการฟรี ไม่มีค่าใช้จ่าย
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าประจำปี ฟรี!ไม่จำกัดจำนวน
- ผ่าตัดทำหมันถาวรสุนัขและแมวจรจัดและด้อยโอกาส จำนวน 100 ตัว
o จำกัดจำนวนสัตว์ไม่เกิน 3 ตัว/ผู้รับบริการ
o ผู้รับบริการอยู่ในเขตเทศบาลนครเจ้าพระยาสุรศักดิ์
o สัตว์ต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง
o สัตว์กลุ่มเสี่ยงในพื้นที่ ที่มีประวัติการเกิดโรคพิษสุนัขบ้า
o งดน้ำงดอาหารอย่างน้อย 8 - 12 ชั่วโมง
o ไม่รับสุนัขและแมวที่มีสายพันธุ์แท้
***ลงทะเบียนรับคิว ***
ในวันที่ 17 พฤษภาคม 2567 เวลา 08.30 น.
ดำเนินการ ณ วัดนาพร้าว ตำบลสุรศักดิ์ อำเภอศรีราชา จังหวัดชลบุรี
สอบถามข้อมูลเพิ่มเติม งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม 038-348253 ต่อ 219
21 มิถุนายน 2567 เทศบาลเมืองแสนสุข ทําหมันสุนัข แมว ทำหมันฟรี
เทศบาลเมืองแสนสุข ขอเชิญทําหมันสุนัข แมว ตามโครงการป้องกัน และควบคุมโรคติดต่อจากสัตว์สู่คนแบบบูรณาการ(ทำหมันฟรี) ประจําปีงบประมาณ 2567 กำหนดทำหมันในวันที่ 21 มิถุนายน 2567 ตั้งแต่เวลา 09.00 - 16.00 น. โดยให้บริการ ณ อาคารอเนกประสงค์ เทศบาลเมืองแสนสุข
ขอรับการขึ้นทะเบียนได้ที่
https://shorturl.asia/6C4Mr หรือ สแกน QR CODE ด้านล่าง หรือ ลงทะเบียนด้วยตนเอง งานสัตวแพทย์ (อาคารใหม่ ชั้น1) เทศบาลเมืองแสนสุขตั้งแต่บัดนี้ -21 กรกฎาคม 2567 (ในวันและเวลาราชการ)
ผู้เข้าร่วมโครงการต้องมีทะเบียนบ้านอยู่ในเขตเทศบาลเมืองแสนสุข จำกัดท่านละไม่เกิน 3 ตัว (รับจำนวน 100 ตัวเท่านั้น)
ด้วยเทศบาลเมืองแสนสุขร่วมกับสำนักงานปศุสัตว์ จังหวัดชลบุรี และชมรมอาสาสมัครสัตวแพทย์ เทศบาลเมืองแสนสุข จะดําเนินการตามโครงการป้องกันและควบคุมโรคติดต่อจากสัตว์สู่คนแบบบูรณาการ ประจําปีงบประมาณ 2567 โดยจัดให้มีการคุมกําเนิดสัตว์ ด้วยการผ่าตัดทําหมันถาวรให้กับสุนัข แมว ในเขตเทศบาลเมืองแสนสุข ทั้งสุนัข แมว ที่เลี้ยงอยู่ตามชุมชน และสุนัข แมว ที่อยู่ตามที่ทางสาธารณะ วัด สถานศึกษา และสถานที่ท่องเที่ยว เพื่อเป็นการลดเหตุ เดือดร้อนรําคาญ ลดภัยคุกคามจากสัตว์จรจัด ป้องกันการแพร่ระบาด และระงับโรคติดต่อจากสัตว์สู่คน
- ดังนั้น เพื่อให้การดําเนินการเป็นไปตามวัตถุประสงค์ของโครงการ และเป็นการเตรียมการ จึงขอเชิญท่าน เจ้าของสัตว์เลี้ยงสุนัข แมว ที่มีอายุตั้งแต่ 6 เดือน ขึ้นไป มีสุขภาพสมบูรณ์ และมีความประสงค์ จะขอรับบริการตามโครงการนี้
- ขอให้เจ้าของนําสัตว์เลี้ยงเข้ารับบริการ ตามกําหนดการข้างต้น โดยท่านเจ้าของต้องเตรียมตัว สัตว์เลี้ยงให้สะอาด พร้อมทั้งงดน้ำและอาหาร ก่อนนํามาผ่าตัดอย่างน้อย 12 ชั่วโมง
- สอบถามข้อมูลเพิ่มเติมได้ที่ : งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม หมายเลขโทรศัพท์ 038-385100 (ในวันและเวลาราชการ)
กำหนดบริการทำหมันหมาแมว เทศบาลเมืองอ่างศิลา กรกฎาคม 2567
เทศบาลเมืองอ่างศิลา ออกหน่วยบริการทำหมันสุนัขและแมวให้กับประชาชนในเขตเทศบาลเมืองอ่างศิลา ครอบคลุมพื้นที่ ตำบลบ้านปึก หมู่ 1 – 7 ตำบลเสม็ด หมู่ 3 – 8 ตำบลห้วยกะปิ หมู่ 4 – 5 ตำบลอ่างศิลา หมู่ 1 – 5 (ฟรี!!!) Scan QR Code ด้านล่างเพื่อลงทะเบียนตามวันเวลาและสถานที่ดังกล่าว โดยเริ่มให้บริการตั้งแต่เวลา 9.30 – 15.30 น. ตามกำหนดการดังต่อไปนี้ (*หากไม่สามารถสแกน QR Code ในช่องที่ต้องการได้ แสดงว่ามีผู้ลงทะเบียนเต็มจำนวนแล้ว)
- เดือน เมษายน 2567. วันที่ 4 , 11 , 18 และ 25 สถานที่ วัดเตาปูน วันที่ 5 , 12 , 19 และ 26 สถานที่ บริเวณด้านหลังปั๊มเชลล์(วงษ์ทรายทอง)
- เดือน พฤษภาคม 2567 วันที่ 2 , 9 , 16 และ 23 สถานที่ ลานจอดรถไทวัสดุ(แยกอ่างศิลา) วันที่ 3 , 17 , 24 และ 31 สถานที่ ตลาดนัดวัดบางเป้ง
- เดือน มิถุนายน 2567 วันที่ 6 , 13 , 20 และ 27 สถานที่ ศาลาพระพรหม หมู่ 5 ต.ห้วยกะปิ วันที่ 7 , 14 , 21 และ 28 สถานที่ ลานตรงข้ามอู่เพชรการาจ
- เดือน กรกฎาคม 2567 วันที่ 4 , 5 , 11 , 12 , 18 , 19 , 25 และ 26 สถานที่ อาคารอเนกประสงค์เทศบาลเมืองอ่างศิลา(วัดอ่างศิลา)
15 กรกฎาคม 2567 เมืองพัทยา เปิดบริการผ่าตัดทำหมันสุนัขและแมว
กลุ่มงานสัตวแพทย์ เมืองพัทยา เปิดบริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ใน 7 ชุมชนดังต่อไปนี้เท่านั้น ได้แก่ วัดชัยมงคล ชุมชนกอไผ่ ชุมชนทัพพระยา ชุมชนพัทยาใต้พัฒนา ชุมชนชุมสาย ชุมชนอรุโณทัย และชุมชนหนองอ้อ ในวันจันทร์ที่ 15 กรกฎาคม 2567 ตั้งแต่เวลา 09.00 - 12.00 น.
ณ วัดชัยมงคล (พระอารามหลวง)
ชอเชิญประชาชนในชุมชนดังกล่าว นำบัตรประชาชนมาลงทะเบียน เพื่อนำสัตว์เลี้ยงเข้ารับบริการด้านต่างๆ ดังนี้
- การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
- การผ่าตัดทำหมันสุนัขและแมว
- การให้คำแนะนำด้านสุขภาพสัตว์เลี้ยง
หมายเหตุ : ให้บริการในสุนัขและแมว ที่มีอายุ 6 เดือน ขึ้นไป ควรงดน้ำ งดอาหารสัตว์เลี้ยง อย่างน้อย 12 ชั่วโมง และรับเฉพาะสุนัขพันธุ์ไทยและแมวพันธู์ไทย เท่านั้น กรณีทำหมันตัวเมีย ให้บริการบ้านละไม่เกิน 2 ตัว ตัวผู้ไม่จำกัด
สอบถามรายละเอียดเพิ่มเติมที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
17 กรกฎาคม 2567 ทำหมันสุนัขและแมว ฟรี ณ วัดหนองใหญ่
17 กรกฎาคม 2567 ทำหมันสุนัขและแมว ฟรี ณ วัดหนองใหญ่ เวลา 9-12.00 น. งดน้ำงดอาหาร กักบริเวณ 8-12 ชม. รับเฉพาะหมาไทย แมวไทย ตัวเมียบ้านละไม่เกิน 2 ตัว ตัวผู้ไม่จำกัด พกบัตรประชาชนมาด้วยนะ
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางขุนเทียน
กำแพงเพชร - มาจากพื้นที่ 5 จว.สีแดง กักตัว 14 วัน LINK
สแกน
QR Code เพื่อรายงานตัว
1. มาจากพื้นที่ 5 จว.สีแดง (กทม ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม)
รายงานตัวต่อจนท.
สแกน QR Code
กักตัวเอง 14 วัน
เฝ้าระวังอาการตนเอง 14 วัน
2. มาจากพื้นที่สีส้ม 9 จว (สมุทรสาคร สมุทรสงคราม ชุมพร ตาก ราชบุรี ชลบุรี สุพรรณบุรี นราธิวาส กาญจนบุรี)
รายงานตัวกับจนท.
สแกน QR Code
คุมสังเกตตัวเอง 14 วัน
เพจ
สสอ.กำแพงเพชร โทร 055-713-167
รพ.กำแพงเพชร โทร 055-022-000
รพ.ธนบุรี เปิดลงทะเบียนรับฉีดวัคซีน เพื่อเข้าจองผ่าน หมอพร้อม LINK
แจ้งขอรับการฉีดวัคซีนโควิด-19 ผ่านแบบ
ฟอร์มแจ้งความประสงค์ในการขอรับการฉีดวัคซีน Covid-19 ที่โรงพยาบาลธนบุรี ที่ได้รับการจัดสรรโดยรัฐบาล
หมายเหตุ :
- การลงทะเบียนไม่ได้ยืนยันว่าท่านจะได้รับการฉีดวัคซีน
- ผู้ที่มีอายุน้อยกว่า 18 ปี ห้ามลงทะเบียน
- แบบฟอร์มลงทะเบียนแสดงความจำนงค์ ให้รพ.นำข้อมูลส่วนบุคคลบางส่วนของท่าน. เพิ่มเข้าไปในฐานข้อมูลใน "หมอพร้อม". ที่อาจมีข้อมูลของท่านไม่ครบถ้วน เพื่อท่านจะสามารถลงทะเบียนใน "หมอพร้อม" เพื่อจองการฉีดวัคซีน COVID-19 โดยรพ.จะใช้เวลาประมาณ 24 ชม.ในการส่งข้อมูลเข้า "หมอพร้อม" หลังจากที่ท่านลงทะเบียนเรียบร้อย. จากนั้นอีก 24 ชม.ข้างหน้า ขอให้ท่านเข้าระบบ "หมอพร้อม" เพื่อจองวันเวลาการฉีดวัคซีนที่แน่นอนในรพ.ธนบุรี จึงจะเสร็จสมบูรณ์
26 พฤษภาคม 64 เวลา 14.00 น.
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 101-150
101 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนฅนรักษ์บ้านไร่ นาย สมเจตน์ เจียมเจือจันทร์
ชื่อสถานที่ : วิสาหกิจชุมชนฅนรักษ์บ้านไร่
ที่ตั้ง : 199 7 บ้านไร่ บ้านไร่ อุทัยธานี 08 7015 1796 61140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 52/2564 (ปลูก)
102 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มทำการเกษตรบ้านห้วยใหญ่อ่าวตง นาย ปรพล สุขาทิพย์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มทำการเกษตรบ้านห้วยใหญ่อ่าวตง
ที่ตั้ง : 20 12 อ่าวตง วังวิเศษ ตรัง 08 9289 3900 92220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 53/2564 (ปลูก)
103 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านหลังควน นาง ยุวดี ลื่อเท่ง
ชื่อสถานที่ : วิสาหกิจชุมชนบ้านหลังควน
ที่ตั้ง : 311 21 เขาวิเศษ วังวิเศษ ตรัง 06 2203 7159 92220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 54/2564 (ปลูก)
104 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านควนสุขภาวะ นาง นภาภรณ์ ขวัญแก้ว
ชื่อสถานที่ : วิสาหกิจชุมชนบ้านควนสุขภาวะ
ที่ตั้ง : 19 4 บ้านควน เมืองตรัง ตรัง 08 9157 8115 92000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 55/2564 (ปลูก)
105 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผลิตปุ๋ยอินทรีย์จังหวัดตรัง นาย สุรศักดิ์ ราชพาลี
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1165 เล่มที่ 12 ข หน้าที่ 15
ที่ตั้ง : 8 น้ำผุด เมืองตรัง ตรัง 08 6945 5093 92000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 56/2564 (ปลูก)
106 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรพัฒนา 2563 นาย อนันต์ รับบุญ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 57331
ที่ตั้ง : เขากะลา พยุหะคีรี นครสวรรค์ 08 8956 1305 60130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 58/2564 (ปลูก)
107 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรและการแปรรูป นาย สุวัฒน์ ชมชื่น
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 14475
ที่ตั้ง : เนินขี้เหล็ก ลาดยาว นครสวรรค์ 08 6680 8206 60150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 59/2564 (ปลูก)
108 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนตลาดน่าชมชุมชนบ้านหนองขอน นาย เรืองยศ ศรีอุดม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 35448
ที่ตั้ง : วังเมือง ลาดยาว นครสวรรค์ 08 2479 6561 60150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 60/2564 (ปลูก)
109 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนทำไร่อ้อยและทอพรมเช็ดเท้าหมู่ 7 บ้านพุตานวล นาย ทองสุก ขวัญใจ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 114931
ที่ตั้ง : 8 พระนอน เมืองนครสวรรค์ นครสวรรค์ 60000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 61/2564 (ปลูก)
110 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ เครือข่ายวิสาหกิจชุมชนต้นเจ้าพระยา นาย อรรถฤทธิ์ บดีรัฐ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 57848
ที่ตั้ง : 4 เขากะลา พยุหะคีรี นครสวรรค์ 864458589 60130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 62/2564 (ปลูก)
111 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรอินทรีย์อำเภอแก่งหางแมว นาย รัฐวุฒิ สมบูรณ์ธรรม
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรอินทรีย์อำเภอแก่งหางแมว
ที่ตั้ง : 135/2 4 เขาวงกต แก่งหางแมว จันทบุรี 08 9245 9979 22160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 63/2564 (ปลูก)
112 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์ ชอง-มู-แฮง นาย อดิศร จินดามณีกรกุล
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8658
ที่ตั้ง : 1 คลองพลู เขาคิชฌกูฏ จันทบุรี 08 1295 3149 22210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 64/2564 (ปลูก)
113 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้เลี้ยงแพะอำเภอจังหาร นาย เชวง บุริวัฒน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 30173
ที่ตั้ง : 9 ปาฝา จังหาร ร้อยเอ็ด 09 4542 7401 45000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 65/2564 (ปลูก)
114 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรชุมชนหินกอง นาง พาฝัน ทาสระคู
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพืชสมุนไพรชุมชนหินกอง
ที่ตั้ง : 100 1 หินกอง สุวรรณภูมิ ร้อยเอ็ด 08 4428 1009 45130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 66/2564 (ปลูก)
115 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรเพื่อประโยชน์ทางการแพทย์ ต.ชอนม่วง นาง วัชรินทร์ รีวงษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 26670
ที่ตั้ง : ชอนม่วง บ้านหมี่ ลพบุรี 08 1456 9599 15110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 67/2564 (ปลูก)
116 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเลี้ยงไก่ไข่อารมณ์ดีบ้านหนองปลาไหล นาย ชัยพร กลิ่นจันทร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 975
ที่ตั้ง : ชัยนารายณ์ ชัยบาดาล ลพบุรี 09 5759 7575 15130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 68/2564 (ปลูก)
117 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร นาย วัชระ เอี่ยมรัศมีกุล
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร
ที่ตั้ง : 95 12 พนมไพร-มหาชนะชัย พนมไพร พนมไพร ร้อยเอ็ด 08 9019 5666 45140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 69/2564 (ปลูก)
118 ชื่อผู้รับอนุญาต : มหาวิทยาลัยแม่โจ้ นาย วีระพล ทองมา
ชื่อสถานที่ : โรงเรือนปลูกกัญชา ศูนย์วิจัยเกษตรสมัยใหม่
ที่ตั้ง : 151 สำนักฟาร์มมหาวิทยาลัยแม่โจ้ 7 ป่าไผ่ สันทราย เชียงใหม่ 0 5387 3000 50210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 70/2564 (ปลูก)
119 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนฮักจังโนนศิลา นาง นรินทิพย์ ฤทธิ์ฐิติ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 36840 36841
ที่ตั้ง : วัดหลวง โพนพิสัย หนองคาย 06 2265 9554 43120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 71/2564 (ปลูก)
120 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนนาฮีเกษตรรุ่งเรือง นาย อุดมศักดิ์ มหาชัย
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 83976 83977 83978
ที่ตั้ง : ค่ายบกหวาน เมืองหนองคาย หนองคาย 43100
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 72/2564 (ปลูก)
121 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรรวมใจโคกถ้ำเทพนิมิตร นาย ณธกร จุมพลักษณ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 22134
ที่ตั้ง : กองนาง ท่าบ่อ หนองคาย 43110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 73/2564 (ปลูก)
122 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรผสมผสานภูมิบ้านแป้น นาย สมศักดิ์ นาโควงศ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรผสมผสานภูมิบ้านแป้น
ที่ตั้ง : 324 10 บ้านแป้น โพนนาแก้ว สกลนคร 934869519 47230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 74/2564 (ปลูก)
123 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนไพรสกลบ้านดงยอ นาง สมพร อาจหาญ
ชื่อสถานที่ : วิสาหกิจชุมชนไพรสกลบ้านดงยอ
ที่ตั้ง : 404 6 พังขว้าง เมืองสกลนคร สกลนคร 08 3281 5533 47000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 75/2564 (ปลูก)
124 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรและเลี้ยงโคขุน ตำบลแวงน่าง นาย สุเทพ แก้วสีขาว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 75846
ที่ตั้ง : แวงน่าง เมืองมหาสารคาม มหาสารคาม 08 1873 0322 44000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 76/2564 (ปลูก)
125 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพฤกษเวช บ้านโพนงาม หมู่ 5 อำเภอกุดบาก นาย แสงจันทร์ อัตรสาร
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 43 เล่ม 1ก หน้าที่ 43
ที่ตั้ง : 5 นาม่อง กุดบาก สกลนคร 933278397 47180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 77/2564 (ปลูก)
126 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชน พฤษาเวช นาง จินตนา คำสวาสดิ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 31474
ที่ตั้ง : 1 นาตงวัฒนา โพนนาแก้ว สกลนคร 08 7865 2958 47230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 78/2564 (ปลูก)
127 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรตำบลบ่อใหญ่ นาย ณัฐวัฒน์ ธนาเกียรติเมธิน
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านบ่อใหญ่
ที่ตั้ง : 399 3 บ่อใหญ่ บรบือ มหาสารคาม 44130
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 79/2564 (ปลูก)
128 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพชรสมุนไพรชุมพร นาย พันเลิศ ปวัฒพันธ์
ชื่อสถานที่ : วิสาหกิจชุมชนเพชรสมุนไพรชุมพร
ที่ตั้ง : 178 9 ท่ามะพลา หลังสวน ชุมพร 08 9673 8866 86110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 80/2564 (ปลูก)
129 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรกรปลูกพืชปลอดสารพิษ ต.บ้านด่าน นาง วัชราภรณ์ บำรุงธรรม
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรกรปลูกพืชปลอดสารพิษ ต.บ้านด่าน
ที่ตั้ง : 69 2 บ้านด่าน บ้านด่าน บุรีรัมย์ 091 264 7772 31000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 81/2564 (ปลูก)
130 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนหนองหม้องพารวย นาย ทิพากร ดีแดง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 59174
ที่ตั้ง : แก่งเลิงจาน เมืองมหาสารคาม มหาสารคาม 44000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 82/2564 (ปลูก)
131 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผลิตภัณฑ์ดาวอินคา-ไดมอนด์ ภูพาน นางสาว พิมลรัตน์ วงค์สีดา
ชื่อสถานที่ : ตาม น.ส.3ก เลขที่ 110 เล่มที่ 2 ก หน้าที่ 10
ที่ตั้ง : 13 โคกภู ภูพาน สกลนคร 08 5758 6159 47180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 83/2564 (ปลูก)
132 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรผสมผสานตำบลม่วง นาย เอกชัย พลศักดิ์ขวา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 6293
ที่ตั้ง : 4 ม่วง บ้านม่วง สกลนคร 098326 9823 47140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 84/2564 (ปลูก)
133 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรผสมผสาน เพื่อคุณภาพชีวิตยั่งยืน อ.กุสุมาลย์ นาง ดารารัตน์ กุณสิทธิ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 25662
ที่ตั้ง : 6 กุสุมาลย์ กุสุมาลย์ สกลนคร 969034218 47210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 85/2564 (ปลูก)
134 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผักผลไม้สมุนไพรอินทรีย์หนองไผ่ครบวงจร นาย เทา ทิพจร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 129907
ที่ตั้ง : 7 ดงมะไฟ เมืองสกลนคร สกลนคร 06 3912 2206 47000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 86/2564 (ปลูก)
135 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชน Best forests best for life นาย กิตติพงษ์ มณีเติม
ชื่อสถานที่ : วิสาหกิจชุมชน Best forests best for life
ที่ตั้ง : 124 16 สวายจีก เมืองบุรีรัมย์ บุรีรัมย์ 06 1694 4924 และ 08 9848 7486 44000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 87/2564 (ปลูก)
136 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกรีนแมน นาย เสกสรร มีธรรม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13134
ที่ตั้ง : 9 บัวสลี แม่ลาว เชียงราย 887985701 57250
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 88/2564 (ปลูก)
137 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนหม่อนผลแปรรูปกลุ่มใต้ร่มบุญ นางสาว ดวงฤดี สุระสังวาลย์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 108476
ที่ตั้ง : 6 พะตง หาดใหญ่ สงขลา 09 3685 1502 90230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 89/2564 (ปลูก)
138 ชื่อผู้รับอนุญาต : กรมวิทยาศาสตร์การแพทย์ นาง ศิริวรรณ ชัยสมบูรณ์พันธ์
ชื่อสถานที่ : สถาบันวิจัยสมุนไพร กรมวิทยาศาสตร์การแพทย์
ที่ตั้ง : 88/7 บำราศนราดูร ติวานนท์ ตลาดขวัญ เมืองนนทบุรี นนทบุรี 0 2951 0000 11000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 90/2564 (ปลูก)
139 ชื่อผู้รับอนุญาต : กรมสุขภาพจิต นาย ศิริศักดิ์ ธิติดิลกรัตน์
ชื่อสถานที่ : โรงพยาบาลศรีธัญญา
ที่ตั้ง : 47 4 ติวานนท์ ตลาดขวัญ เมืองนนทบุรี นนทบุรี 0 2528 7800 0 2528 7874 11000
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 91/2564 (ปลูก)
140 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข นาย พนา พงศ์ชำนะภัย
ชื่อสถานที่ : โรงพยาบาล สมเด็จพระยุพราชหล่มเก่า
ที่ตั้ง : 180 1 นาแซง หล่มเก่า เพชรบูรณ์ 848955352 67120
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 92/2564 (ปลูก)
141 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรและแปรรูป โคกภู ๔ นาง กนกอร จันทะวงศ์
ชื่อสถานที่ : ตาม น.ส.3ก เลขที่ 110 เล่มที่ 2 ก หน้าที่ 10
ที่ตั้ง : 13 โคกภู ภูพาน สกลนคร 06 1046 9284 47180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 93/2564 (ปลูก)
142 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพฤกษเวช หลุบเลา 2 นาง จิตลัดดา พาพรมฤทธิ์
ชื่อสถานที่ : ตาม น.ส.3ก เลขที่ 110 เล่มที่ 2 ก หน้าที่ 10
ที่ตั้ง : 98 13 โคกภู ภูพาน สกลนคร 06 5243 2397 47180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 94/2564 (ปลูก)
143 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพร ตำบลดงเหนือ นาย กิตติศักดิ์ มานิสสรณ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8724
ที่ตั้ง : 11 ดงเหนือ บ้านม่วง สกลนคร 08 7994 9894 47140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 95/2564 (ปลูก)
144 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มวัวพูนทรัพย์บ้านม่วงไข่ นาง ปริศนา บุญสร้อย
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 20887
ที่ตั้ง : 5 ด่านม่วงคำ โคกศรีสุพรรณ สกลนคร 06 2446 8577 47280
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 96/2564 (ปลูก)
145 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์ริมสีม่วงและผลิตภัณฑ์แปรรูป นาย ศุภสิทธิ์ สุขี
ชื่อสถานที่ : โรงพยาบาล เขาค้อ
ที่ตั้ง : 75 1 เขาค้อ เขาค้อ เพชรบูรณ์ 0 5672 8075-7 67270
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 97/2564 (ปลูก)
146 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรนครบางยาง นาย ศิษฏิคม เบ็ญจขันธ์
ชื่อสถานที่ : โรงพยาบาล สมเด็จพระยุพราชนครไทย
ที่ตั้ง : 111 7 นครไทย นครไทย พิษณุโลก 0 5538 9060 ต่อ 151 65120
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 98/2564 (ปลูก)
147 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตสมุนไพรเพื่อการแพทย์ตำบลคลองห้า นาย สุเทพ สินทอง
ชื่อสถานที่ : วิสาหกิจชุมชนผลิตสมุนไพรเพื่อการแพทย์ตำบลคลองห้า
ที่ตั้ง : 6 13 คลองห้า คลองหลวง ปทุมธานี 08 7065 1525 12120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 99/2564 (ปลูก)
148 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรเพื่อสุขภาพและแปรรูปตำบลสว่างแดนดิน นาง วิยดารัตน์ กุลแก้ว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 90170
ที่ตั้ง : สงฆ์ธรรม 20 สว่างแดนดิน สว่างแดนดิน สกลนคร 08 5223 9242 47110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 100/2564 (ปลูก)
149 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนไร่สวนดอกปลอดสาร นางสาว จันทิราพรรณ์ เพาะบุญ
ชื่อสถานที่ : วิสาหกิจชุมชนไร่สวนดอกปลอดสาร
ที่ตั้ง : 39/9 7 ดอนฉิมพลี บางน้ำเปรี้ยว ฉะเชิงเทรา 09 6128 4799 24170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 101/2564 (ปลูก)
150 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมาชิก อสม.สู่สมาชิกฟาร์มเมอร์ ตำบลคำเลาะ นาง ศุภลักษณ์ อันไชยศรี
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลคำเลาะ (อุดรธานี)
ที่ตั้ง : 155 1 คำเลาะ ไชยวาน อุดรธานี
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 102/2564 (ปลูก)
เขตหนองจอก ตรวจความพร้อมศูนย์พักคอย ณ บริเวณศูนย์สร้างสุขทุกวัย สวนสาธารณะหนองจอก LINK
วันที่ 8 มกราคม 2565 นายวุฒิภัทร คำประกอบ ผู้อำนวยการเขตหนองจอก มอบหมายให้นายภูวนาถ นนทรีย์ ผู้ช่วยผู้อำนวยการเขตหนองจอก ลงพื้นที่ตรวจความพร้อมศูนย์พักคอยเพื่อส่งต่อ เขตหนองจอก ณ บริเวณศูนย์สร้างสุขทุกวัย สวนสาธารณะหนองจอก เพื่อเตรียมความพร้อมสถานที่ในการใช้รองรับผู้ป่วยติดเชื้อโควิด-19 ระลอกใหม่ที่กำลังมีแนวโน้มระบาดเพิ่มมากขึ้นในพื้นที่กรุงเทพมหานครต่อไป
เขตสวนหลวง
เขตสวนหลวง เชิญชวนนำ สุนัข แมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่ ฟรี สำนักงานเขตสวนหลวง โดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 37 (ประสงค์ - สุดสาคร ตู้จินดา) ออกให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่เขตสวนหลวง ตลอดเดือนมีนาคมนี้ อย่าลืมนำสัตว์เลี้ยงของท่านมาฉีดวัคซีน ตามวันเวลา และสถานที่ตามที่แจ้งนี้นะคะ ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสวนหลวง โทร 0 2322 4668 ในวันเวลาราชการ
เทศบาลนครแหลมฉบัง จัดหน่วยเคลื่อนที่ฉีดวัคซีนพิษสุนัขบ้า เดือนมิถุนายน 2566 LINK
เทศบาลนครแหลมฉบัง ห่วงใยพี่น้องประชาชนในเขตเทศบาล จากโรคพิษสุนัขบ้าซึ่งมีสุนัขและแมวเป็นสัตว์เลี้ยงนำโรค เพื่อเป็นการป้องกันการแพร่ระบาดของโรคพิษสุนัขบ้า เทศบาลนครแหลมฉบัง ได้จัดทำโครงการป้องกันและควบคุมโรคพิษสุนัขบ้าในเขตเทศบาลนครแหลมฉบังประจำปี 2566 โดยมีกิจกรรมออกหน่วยเคลื่อนที่วัคซีนป้องกันโรคพิษสุนัขบ้าใน 23 ชุมชน
ศูนย์บริการสาธารณสุข 53 ทุ่งสองห้อง
เขตหลักสี่ โดยศูนย์บริการสาธารณสุข 53 ทุ่งสองห้อง แจ้งประชาชนนำสัตว์เลี้ยงมารับวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 2-13 กันยายน 2567 ฟรี ไม่มีค่าใช้จ่าย
กำหนดการ ปศุสัตว์จังหวัดปราจีนบุรี ทำหมันหมาแมว ฟรี มีนาคม-สิงหาคม 2567
สำนักงาน
ปศุสัตว์จังหวัดปราจีนบุรี ได้เปิดให้บริการทำหมันฟรี (และฉีดวัคซีน) สำหรับประชาชนในพื้นที่จ.ปราจีนบุรี ประจำปี 2567 กำหนดการดังนี้
- 5 มี.ค. ที่ทำการ อบต.ดงขี้เหล็ก อ.เมืองปราจีนบุรี
- 7 มี.ค. อบต.บ้านพระ อ.เมืองปราจีนบุรี
- 20 มี.ค. วัดโนนสะอาด ต.โพธิ์งาม อ.ประจันตคาม จ.ปราจีนบุรี
- 22 มี.ค. ที่ทำการเทศบาลประจันตคาม อ.ประจันตคาม
- 26 มี.ค. เทศบาลตำบลโคกมะกอก ต.โนนห้อม อ.เมืองปราจีนบุรี ในวันอังคารที่
- 9 เม.ย. ณ อาคารสำนักงานปศุสัตว์จังหวัดปราจีนบุรี รับบัตรคิว เวลา 9.00-10.00 น. รับหมา 10 ตัว รับแมว 20-30 ตัว
- 24 เม.ย ทีมสัตวแพทย์ไปออกหน่วยทำหมัน ณ วัดบางกระเบา อ.บ้านสร้าง จ.ปราจีนบุรี
- 26 เม.ย. ทีมสัตวแพทย์ไปออกหน่วยทำหมัน ณ เทศบาลนาปรือ ต.เนินหอม อ.เมืองปราจีนบุรี จ.ปราจีนบุรี
- 6 มิ.ย. โรงงาน Destar ต.ท่าตูม อ.ศรีมหาโพธิ (งานปิดภายใน)
- 19 มิ.ย. วัดสระข่อย อ.ศรีมโหสถ จ.ปราจีนบุรี
- 25 มิ.ย. อบต.บุฝ้าย อ.ประจันตคาม จ.ปราจีนบุรี
- 27 มิ.ย. อาคารที่ทำการเทศบาลกบินทร์ อ.กบินทร์บุรี จ.ปราจีนบุรี
- 4 ก.ค. อบต.ท่าตูม ต.ท่าตูม อ.ศรีมหาโพธิ จ.ปราจีนบุรี คนที่มีรายชื่อตามประกาศ ให้มารับคิวเวลา 9.00 น. เป็นต้นไป
- 17 ก.ค. วัดราษฎร์เจริญศรัทาธรรม ม.7 ต.กรอกสมบูรณ์ อ.ศรีมหาโพธิ จ.ปราจีนบุรี เวลา 9.00-12.00 น.
- 26 ก.ค. กิจกรรม Happy Friday ที่ สนง.ปศุสัตว์จังหวัด ฉีดวัคซีนหมาแมว ทำหมันแมว และรักษาพื้นฐาน เวลา 9.00-12.00
- 14 ส.ค. โรงเรียนวัดพรหมรังษีมิตรภาพที่ 1 ต.โพธิ์งาม อ.ประจันตคาม เวลา 9.00-12.00 น.
- 15 ส.ค. เทศบาลตำบลโพธิงาม อ.ปราะจันตคาม
กำหนดการ ปศุสัตว์จังหวัดปราจีนบุรี ทำหมันหมาแมว ฟรี ปี 2567
สำนักงาน
ปศุสัตว์จังหวัดปราจีนบุรี ได้เปิดให้บริการทำหมันฟรี (และฉีดวัคซีน) สำหรับประชาชนในพื้นที่จ.ปราจีนบุรี ประจำปี 2567 กำหนดการดังนี้
- กิจกรรมทำหมันฟรี ออกหน่วยวันที่ 10 ก.ย. 2567 ณ ที่ทำการ อบต.นนทรีย์ อ.กบินทร์บุรี จ.ปราจีนบุรี เวลา 9.00-12.00 น. โดยกิจกรรมนี้ เราจะเปิดให้คนนอกเขต ต.นนทรีย์ เข้ามาจองทางโทรศัพท์ที่เบอร์ 082-2163021 วันเวลาที่เปิดโทรจอง เปิดสายวันที่ 3 ก.ย. 67 เวลา 10.00-12.00 น. รับ 30 คิว (ตัว) บัตรประชาชนปราจีนบุรีเท่านั้น รับทั้งหมาและแมว ไม่รับพันธุ์หน้าสั้น เช่น หมาชิสุ ปั๊ก แมวเปอร์เซียและลูกผสมเหล่านั้น
- กิจกรรมทำหมันวันศุกร์นี้ Happy Friday วันศุกร์ที่ 13 ก.ย. 2567 ทำที่ สนง.ปศุสัตว์จังหวัดปราจีนบุรี อ.เมืองปราจีนบุรี เวลา 9.00 - 12.00 น. ทำหมันแมว หมา ฉีดวัคซีนป้องกันโรค ถ่ายพยาธิ มีค่าใช้จ่ายเล็กน้อย
- กิจกรรมทำหมันวันศุกร์ Happy Friday วันศุกร์ที่ 20 ก.ย. 2567 ทำที่ สนง.ปศุสัตว์จังหวัดปราจีนบุรี อ.เมืองปราจีนบุรี เวลา 9.00 - 12.00 น. ทำหมันแมว หมา ฉีดวัคซีนป้องกันโรค ถ่ายพยาธิ มีค่าใช้จ่ายเล็กน้อย
- กิจกรรม Happy Friday วันศุกร์นี้ วันที่ 4 ต.ค. 2567 ทำหมันแมว หมา รักษาเบื้องต้น ฉีดวัคซีนถ่ายพยาธิ มีค่าใช้จ่ายเล็กน้อย ช่วยคนเลี้ยงสัตว์ในภาวะเศรษฐกิจไม่ดีแบบนี้ ทำที่ สนง.ปศุสัตว์จังหวัดปราจีนบุรี อ.เมืองปราจีนบุรี เวลา 9.00 - 12.00 น.
- กิจกรรมทำหมันสุนัขแมว 8 ต.ค. 2567 ทีมสัตวแพทย์สำนักงานปศุสัตว์จังหวัดปราจีนบุรี ได้ออกทำหมันเคลื่อนที่สุนัขแมว ที่วัดป่าสวนพฤกษชาติ ต.ทุ่งโพธิ์ อ.นาดี จ.ปราจีนบุรี
- กิจกรรม Happy Friday ทำหมันสุนัข แมว รักษาเบื้องต้น ฉีดวัคซีน ถ่ายพยาธิ ที่มีค่าใช้จ่ายประหยัดช่วยคนเลี้ยงสัตว์ วันศุกร์ ที่ 11 ต.ค. 2567 ณ ปศุสัตว์จังหวัดปราจีนบุรี ต.หน้าเมือง อ.เมืองปราจีนบุรี เวลา 9.00-12.00 น. ผู้ที่ประสงค์จะนำ หมา แมว มาทำหมัน ให้แจ้งชื่อจองผ่านแอทมิน
- กิจกรรม Happy Friday ทำหมันสุนัข แมว รักษาเบื้องต้น ฉีดวัคซีน ถ่ายพยาธิ ที่มีค่าใช้จ่ายประหยัดช่วยคนเลี้ยงสัตว์ วันศุกร์ ที่ 18 ต.ค. 2567 ณ ปศุสัตว์จังหวัดปราจีนบุรี ต.หน้าเมือง อ.เมืองปราจีนบุรี เวลา 9.00-12.00 น. ผู้ที่ประสงค์จะนำ หมา แมว มาทำหมัน ให้แจ้งชื่อจองผ่านแอทมิน
- กิจกรรมทำหมันฟรี วันที่ 29 ต.ค. 2567 เวลา 9.00-12.00 น. ที่ทำการ อบต.วังดาล อ.กบินทร์บุรี จ.ปราจีนบุรี กิจกรรมนี้ เราจะเปิดให้ประชาชนนอกเขตพื้นที่จองผ่านทีมปศุสัตว์ที่เบอร์โทร 082-2163021 โดยโทรมาจองในวันพฤหัส ที่ 24 ต.ค. นี้ เวลาเปิดสาย 10.30-12.00 น. รับจำกัด 30 สาย (ราย/ตัว) ไม่รับพันธุ์หน้าสั้น เช่นหมาชิสุ ปั๊ก แมวเปอร์เซียหรือลูกผสมเหล่านั้น สัตว์ที่ทำต้องอายุ 6 เดือนขึ้นไปสุขภาพดี
มีนาคม-เมษายน 2567 ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง มีบริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี LINK
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ขอเชิญชาวเขตเทศบาลนครระยอง นำสุนัขและแมวของท่านเข้ารับบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่1) ประจำปีงบประมาณ 2567 ในโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ โดยงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม. บริการตามแต่ละชุมชนเวลา 13.30 - 16.00 น.
เงื่อนไขการเข้ารับบริการ
1. เตรียมบัตรประชาชน และต้องอาศัยอยู่ในเขตเทศบาลนครระยอง
2. สุนัขและแมวต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี
3. สุนัขและแมวไม่อยู่ในช่วงตั้งท้อง และให้นมลูก
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการ จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305
25-26 , 29-30 เมษายน จุดฉีดวัคซีน โดย ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศตั้งจุดออกให้บริการวัคซีนป้องกันโรคพิษสุนัขบ้า
เริ่มให้บริการตั้งแต่ 17.00 น. - 19.00 น.
- กรุณาเตรียมบัตร ปชช. ก่อนเข้ารับบริการ
- สุนัขและแมวตั้งมีอายุมากกว่า 3 เดือนขึ้นไป ไม่ป่วย และอยู่ช่วงระหว่างตั้งท้อง
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศจุดฉีดวัคซีน พฤษภาคม
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศตั้งจุดออกให้บริการวัคซีนป้องกันโรคพิษสุนัขบ้า เริ่มให้บริการตั้งแต่ 17.00 น. - 19.00 น. - กรุณาเตรียมบัตร ปชช. ก่อนเข้ารับบริการ - สุนัขและแมวตั้งมีอายุมากกว่า 3 เดือนขึ้นไป ไม่ป่วย และอยู่ช่วงระหว่างตั้งท้อง
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางบอน
*HealthServ.net เป็นสื่อกลางในการเผยแพร่ข้อมูลนี้ไปสู่ผู้ชมเท่านั้น ไม่ได้เป็นไปเพื่อการค้า และไม่ได้เป็นเจ้าลิขสิทธิ์ของเนื้อหา 25 พฤษภาคม 64 เวลา 08.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมา 57,000 ราย
ส่วนกรุงเทพเพิ่ม ประมาณ 8,000 ราย
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 151-200
151 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตภัณฑ์สมุนไพรบ้านเมืองใหม่ นาย สุรศักดิ์ เตียงงา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 12259
ที่ตั้ง : 4 ชุมเห็ด เมืองบุรีรัมย์ บุรีรัมย์ 086 460 4839 31000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 103/2564 (ปลูก)
152 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรไทยบ้านจาน นาง ไพรวรรณ มูลสาระ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 4245
ที่ตั้ง : โนนนาจาน นาคู กาฬสินธุ์ 46160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 104/2564 (ปลูก)
153 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปลอดภัยหัวงิ้ว นาย ไชยา ใจว่อง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 22941
ที่ตั้ง : 2 โพตลาดแก้ว ท่าวุ้ง ลพบุรี 08 1847 3469 15150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 105/2564 (ปลูก)
154 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ผลิตยางพารา นาย อาทิตย์ เหลาสุภาพ
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลนาโก
ที่ตั้ง : 245 1 นาโก กุฉินารายณ์ กาฬสินธุ์ 0 4385 1916 และ 0 4384 0248 46110
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 106/2564 (ปลูก)
155 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์ชุมชนคนบ้านเรา นาย มนพ ยกฉวี
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรอินทรีย์ชุมชนคนบ้านเรา
ที่ตั้ง : 124 5 ท่ามิหรำ เมืองพัทลุง พัทลุง 09 8001 7183 และ 08 2832 5660 93000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 107/2564 (ปลูก)
156 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์บ้านเขาไม้แก้ว นาง โศรยา ธรรมรักษ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์บ้านเขาไม้แก้ว
ที่ตั้ง : 69 4 เขาไม้แก้ว กบินทร์บุรี ปราจีนบุรี 08 9895 7978 25110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 108/2564 (ปลูก)
157 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรออร์แกนิคเขาฉกรรจ์ นาย ภาษิต รวดเร็ว
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลซับมะนาว
ที่ตั้ง : 333 18 หนองหว้า เขาฉกรรจ์ สระแก้ว 0 3755 0430 27000
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 109/2564 (ปลูก)
158 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปลอดภัยบ้านต้าย นาย อุดมพร ศรีวรสาร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 5167
ที่ตั้ง : โพนจาน โพนสวรรค์ นครพนม 48190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 110/2564 (ปลูก)
159 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรบ้านคลองหว้าใหม่ นาย วิชิต คำไกร
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลทับพริก
ที่ตั้ง : 354 2 ทับพริก อรัญประเทศ สระแก้ว 0 3754 3430 27120
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 111/2564 (ปลูก)
160 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านสวนสมุนไพร ผักปลอดสาร นาย อุดมศักดิ์ ช่วยสงเคราะห์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านคลองมะนาว
ที่ตั้ง : 216 9 ท่าเกวียน วัฒนานคร สระแก้ว 08 5286 8370 27160
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 112/2564 (ปลูก)
161 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชผักสมุนไพรและไม้ดอกไม้ประดับตำบลชุมเห็ด นาย ธีระ ภาพยนตร์
ชื่อสถานที่ : วิสาหกิจชุมชนผู้ปลูกพืชผักสมุนไพรและไม้ดอกไม้ประดับตำบลชุมเห็ด
ที่ตั้ง : 270 3 ชุมเห็ด เมืองบุรีรัมย์ บุรีรัมย์ 08 4356 7428 31000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 113/2564 (ปลูก)
162 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์บ้านเขาไม้แก้ว นาย ธรรมนูญ ภักดิ์นิลรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์บ้านเขาไม้แก้ว
ที่ตั้ง : 69 4 เขาไม้แก้ว กบินทร์บุรี ปราจีนบุรี 08 9895 7978 25110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 114/2564 (ปลูก)
163 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรกรรายย่อยตำบลสลกบาตร นาย พิน สุริพัฒน์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลสลกบาตร
ที่ตั้ง : 802 1 พหลโยธิน สลกบาตร ขาณุวรลักษบุรี กำแพงเพชร 0 5577 1535 62140
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 115/2564 (ปลูก)
164 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนศูนย์เพาะชำไม้ผลไม้ยืนต้นและพืชสมุนไพร นาย พิน สุริพัฒน์
ชื่อสถานที่ : วิสาหกิจชุมชนศูนย์เพาะชำไม้ผลไม้ยืนต้นและพืชสมุนไพร
ที่ตั้ง : 124 3 วังชะพลู ขาณุวรลักษบุรี กำแพงเพชร 09 3132 6370 62140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 116/2564 (ปลูก)
165 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเซาะกราวเมืองบุรีรัมย์ นาย สถาปนา พานนนท์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 22404
ที่ตั้ง : อิสาณ เมืองบุรีรัมย์ บุรีรัมย์ 09 5612 7467 31000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 117/2564 (ปลูก)
166 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อสุขภาพตำบลค้อใต้ นาย วีรพล เพริศแก้ว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 21150
ที่ตั้ง : ค้อใต้ สว่างแดนดิน สกลนคร 08 3340 0025 47110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 118/2564 (ปลูก)
167 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์และการแปรรูป นาย นิกร แสนบุญมา
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรอินทรีย์และการแปรรูป
ที่ตั้ง : 136 5 ป่าพุทรา ขาณุวรลักษบุรี กำแพงเพชร 09 7397 5545 62130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 119/2564 (ปลูก)
168 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรทางเลือกบ้านมาบลำบิด นาย ไพโรจน์ แสนจันทร์
ชื่อสถานที่ : สถานีอนามัยเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว ฉลองสิริราชสมบัติ ครบ 50 ปี บ้านมาบลำบิด
ที่ตั้ง : 2/2 7 คลองกิ่ว บ้านบึง ชลบุรี 0 3815 8881 20220
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 120/2564 (ปลูก)
169 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนไทยทวีกิจ นางสาว รัติยา สาทรสวัสดิ์
ชื่อสถานที่ : วิสาหกิจชุมชนไทยทวีกิจ
ที่ตั้ง : 159 6 คลองกิ่ว บ้านบึง ชลบุรี 08 1654 8185 20220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 121/2564 (ปลูก)
170 ชื่อผู้รับอนุญาต : กรมวิชาการเกษตร นาย สมบัติ ตงเต๊า
ชื่อสถานที่ : โรงเรือนความปลอดภัยทางชีวภาพ อาคารปฏิบัติการสำนักวิจัยพัฒนาเทคโนโลยีชีวภาพ กรมวิชาการเกษตร กรุงเทพฯ
ที่ตั้ง : 50 พหลโยธิน ลาดยาว จตุจักร กรุงเทพมหานคร 0 2579 0151-8 10900
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 122/2564 (ปลูก)
171 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มแม่บ้านเกษตรกรหนองผักตบ นางสาว ใฝ่ปอง บุรีขันธ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 25680
ที่ตั้ง : 4 นาหัวบ่อ โพนสวรรค์ นครพนม 48190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 123/2564 (ปลูก)
172 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนชุมชนเกษตรผสมผสานบ้านดงยาง นาง หนูพร ชรินทร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 6845
ที่ตั้ง : 6 ม่วง บ้านม่วง สกลนคร 08 9046 7896 47140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 124/2564 (ปลูก)
173 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนอคิลานัง เภสัชภิรมย์ นาย วันชัย พิลาพันธ์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านช่องเม็ก
ที่ตั้ง : 55 13 ช่องเม็ก สิรินธร อุบลราชธานี 34350
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 125/2564 (ปลูก)
174 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนม่วงสามสิบเกษตรสมาร์ทฟาร์ม นาย ธงศักดิ์ เกิดสุข
ชื่อสถานที่ : วิสาหกิจชุมชนม่วงสามสิบเกษตรสมาร์ทฟาร์ม
ที่ตั้ง : 77 1 หนองเมือง ม่วงสามสิบ อุบลราชธานี 08 7569 9519 34140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 126/2564 (ปลูก)
175 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเกษตรในเมือง นาย ปรีชา หนูทิม
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรในเมือง
ที่ตั้ง : 6/54 ลาดยาว จตุจักร กรุงเทพมหานคร 08 4644 3969 10900
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 127/2564 (ปลูก)
176 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์ นาง บุษบง ไชยวงค์
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 4780 เล่มที่ 48 หน้าที่ 30
ที่ตั้ง : 9 ป่าสัก เชียงแสน เชียงราย 57150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 128/2564 (ปลูก)
177 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนฟาร์มครูหวัด นาง สมหญิง สุคนธ์
ชื่อสถานที่ : วิสาหกิจชุมชนฟาร์มครูหวัด
ที่ตั้ง : 157 7 ปรางหมู่ เมืองพัทลุง พัทลุง 08 8298 5695 และ 08 82988508 93000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 130/2564 (ปลูก)
178 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนภูผาฟาร์ม นาย สุรชัย พฤกษาพิสิฐ
ชื่อสถานที่ : วิสาหกิจชุมชนภูผาฟาร์ม
ที่ตั้ง : 18 2 โคกสูง-ขามทะเลสอ พุดซา เมืองนครราชสีมา นครราชสีมา 09 4364 5557 และ 06 5347 0577 30000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 131/2564 (ปลูก)
179 ชื่อผู้รับอนุญาต : (โคราชเฮิรฟ-ไวลเนสต์ ทุ่งสว่าง) นาย ไพศาล ลินนะเลิง
ชื่อสถานที่ : วิสาหกิจชุมชนผลิตสมุนไพรเพื่อเวชศาสตร์และท่องเที่ยวเชิงสุขภาพ (โคราชเฮิรฟ-ไวลเนสต์ ทุ่งสว่าง)
ที่ตั้ง : 159 เจนจบทิศ ทุ่งสว่าง ประทาย นครราชสีมา 08 1838 7401 และ 08 8362 5723 30180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 132/2564 (ปลูก)
180 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกและสกัดสมุนไพรไทยครบวงจร นาย บุญภพ ทาธิจันทร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 28146
ที่ตั้ง : เวียง ฝาง เชียงใหม่ 08 9755 2435 50110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 133/2564 (ปลูก)
181 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนคนร้องกวางเพื่อปลูกสมุนไพร นาย ไพรวัลย์ สายศร
ชื่อสถานที่ : วิสาหกิจชุมชนคนร้องกวางเพื่อปลูกสมุนไพร
ที่ตั้ง : 182 ยันตรกิจโกศล ร้องเข็ม ร้องกวาง แพร่ 08 1998 8926 54140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 134/2564 (ปลูก)
182 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้เลี้ยงโคบ้านโนนภิบาลบ้านหนองพลวงน้อย นาย พิเชษฐ์ เมืองแสน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 39027
ที่ตั้ง : 5 วังไม้แดง ประทาย นครราชสีมา 091 831 3350 30180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 135/2564 (ปลูก)
183 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชทางเลือกอำเภอครบุรี นาย นที ศุภลักษณ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 29597
ที่ตั้ง : 8 เฉลียง ครบุรี นครราชสีมา 09 4539 5651 และ 08 1073 7748 30250
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 136/2564 (ปลูก)
184 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเวชศาสตร์สมุนไพรเครือข่ายพัฒนาชีวิตครู อ.ครบุรี กลุ่มที่ 1 จ.นครราชสีมา นาย สุเทพ เกษรครบุรี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 29597
ที่ตั้ง : 8 เฉลียง ครบุรี นครราชสีมา 09 4539 5651 และ 08 1073 7748 30250
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 137/2564 (ปลูก)
185 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนภูมิใจ ไทยขอนแก่น นาย ชลวิทย์ บุญศรี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 45325
ที่ตั้ง : พระลับ เมืองขอนแก่น ขอนแก่น 08 5009 9914 40000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 138/2564 (ปลูก)
186 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรหนองโนใต้ นาย วิเชียร โทอินทร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 14676
ที่ตั้ง : นาดูน นาดูน มหาสารคาม 06 2914 4219 44180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 139/2564 (ปลูก)
187 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเหล่าราษฎร์พัฒนาฟาร์ม ม.11 ต.ประชาพัฒนา นาง เตือนใจ ภวภูตานนท์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 69336
ที่ตั้ง : ประชาพัฒนา วาปีปทุม มหาสารคาม 09 8625 1995 44120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 140/2564 (ปลูก)
188 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนวิชาชีพเกษตรอินทรีย์ไร่ทหารสานประชา นาย ศักดิ์ชัย พอกขุนทด
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 68149
ที่ตั้ง : 6 นิคมสร้างตนเอง เมืองลพบุรี ลพบุรี 09 8825 3034 และ 09 5557 8381 15000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 141/2564 (ปลูก)
189 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพฤกษเวช หมู่ 5 บ้านค้อน้อย พันจ่าตรี สำรอง วงค์ละคร
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 523 เล่มที่ 6 ก หน้าที่ 23
ที่ตั้ง : 2 กุดบาก กุดบาก สกลนคร 08 6373 3583 47180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 142/2564 (ปลูก)
190 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรโพหักเข้มแข็ง นาง จรรยา บัวพึ่ง
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรโพหักเข้มแข็ง
ที่ตั้ง : 38 4 โพหัก บางแพ ราชบุรี 08 1299 1710 70160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 143/2564 (ปลูก)
191 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเชียงใหม่ นาย สัญชัย จตุรสิทธา
ชื่อสถานที่ : คณะเกษตรศาสตร์ มหาวิทยาลัยเชียงใหม่
ที่ตั้ง : 239 ห้วยแก้ว สุเทพ เมืองเชียงใหม่ เชียงใหม่ 0 5394 1300 50200
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 144/2564 (ปลูก)
192 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านสมุนไพรแขวงเมืองวิเศษไชยชาญ นาง ราตรี ครองราษฎร์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลไผ่จำศีล
ที่ตั้ง : 3 ไผ่จำศิล วิเศษชัยชาญ อ่างทอง 0 3563 1654 14110
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 145/2564 (ปลูก)
193 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนตำบลบะหว้าพัฒนาสมุนไพรครบวงจร นาย เอกธนา ทิพม้อม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 47603
ที่ตั้ง : 6 บ้านนายอ อากาศ อากาศอำนวย สกลนคร 0 4209 9951 47170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 146/2564 (ปลูก)
194 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรกรผสมผสานและพืชสมุนไพร นาย ชนินทร์ งามแสง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 16390
ที่ตั้ง : 2 โนนนาจาน นาคู กาฬสินธุ์ 08 7852 3270 46160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 147/2564 (ปลูก)
195 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรออแกนิคอำเภอเลิงนกทา นาย คมสันต์ กาลจักร
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรออแกนิคอำเภอเลิงนกทา
ที่ตั้ง : 161 5 สามแยก เลิงนกทา ยโสธร 06 1923 6999 35120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 148/2564 (ปลูก)
196 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มรักษ์สมุนไพรไทย บ้านสร้างแก้ว ท่าคันโท นาย ศิริชัย ไกรเสน
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1520 เล่มที่ 16 หน้าที่ 20
ที่ตั้ง : 2 กุงเก่า ท่าคันโท กาฬสินธุ์ 08 0462 5161 และ 09 9363 5845 46190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 149/2564 (ปลูก)
197 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรแม่จั๊วะ นาง ศิราภรณ์ ภิญโญชูโต
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรแม่จั๊วะ
ที่ตั้ง : 33 8 แม่จั๊วะ เด่นชัย แพร่ 0 5461 3395 54110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 150/2564 (ปลูก)
198 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรอินทรีย์เพื่อสุขภาพฟากคลอง นาง ปาริฉัตร ตองติดรัมย์
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรอินทรีย์เพื่อสุขภาพฟากคลอง
ที่ตั้ง : 103 6 ลำไทรโยง นางรอง บุรีรัมย์ 08 1669 4844 31110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 151/2564 (ปลูก)
199 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนน้ำรักพัฒนา นาย ประกิต สุทธิธรรม
ชื่อสถานที่ : วิสาหกิจชุมชนน้ำรักพัฒนา (จันทบุรี)
ที่ตั้ง : 46/4 2 ท่าหลวง มะขาม จันทบุรี
เลขที่ใบอนุญาต : 153/2564 (ปลูก)
200 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนน้ำรักพัฒนา นาย ประกิต สุทธิธรรม
ชื่อสถานที่ : วิสาหกิจชุมชนน้ำรักพัฒนา (จันทบุรี)
ที่ตั้ง : 46/4 2 ท่าหลวง มะขาม จันทบุรี
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 153/2564 (ปลูก)
เขตสาทร ตรวจความพร้อมศูนย์พักคอยฯ ณ ศูนย์กีฬาเขตสาทร LINK
สาทร ตรวจความพร้อมศูนย์พักคอยฯ เขตสาทร เตรียมรับผู้ป่วยโควิด‐19 (8 ม.ค. 65) นายชาติชาย กุละนำพล ผู้อำนวยการเขตสาทร พร้อมทีมงานเจ้าหน้าที่ที่เกี่ยวข้อง ลงพื้นที่สำรวจความพร้อมของศูนย์พักคอยเพื่อส่งต่อ ศูนย์กีฬาเขตสาทร ซึ่งเตรียมกลับมาเปิดรองรับผู้ป่วยที่มีผลตรวจติดเชื้อโควิด 19 ที่กำลังกลับมาแพร่ระบาดอีกครั้ง
เขตบางซื่อ
เขตบางซื่อ "ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า" ฟรี‼️ ตั้งแต่วันที่ 13 - 17 มีนาคม เวลา 09.00 - 11.00 น. สอบถามข้อมูลเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ชั้น 5 สำนักงานเขตบางซื่อ หมายเหตุ เตรียมบัตรประชาชนมาทำประวัติน้องด้วยน๊า
ศูนย์บริการสาธารณสุข 54 ทัศน์เอี่ยม วันที่ 9-13 กันยายน 2567
ศูนย์บริการสาธารณสุข54 ทัศน์เอี่ยม ประชาสัมพันธ์รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง สุนัขและแมวในชุมชนแขวงบางมด เขตทุ่งครุ กทม. วันที่ 9-13 กันยายน 2567 สอบถามได้ที่ 024263514 ต่อ 214
กิจกรรมทำหมันสุนัขและแมวจรจัด เทศบาลนครระยอง 2567
- ครั้งที่ 1 ณ ลานจอดรถหลังตลาดสตาร์ ในวันที่ 14 พฤษภาคม 2567 เวลา 13.00 - 16.00 น. เริ่มลงทะเบียน เวลา 13.00 - 15.00 น.
- ครั้งที่ 2 ณ ที่ทำการชุมชนพูนไฉ่ ในวันที่ 21 พฤษภาคม 2567 เวลา 8.30 - 12.00 น.
- ครั้งที่ 3 ณ ศาลาริมน้ำ - ท่าเกตุ ในวันที่ 11 มิถุนายน 2567 เวลา 8.30 - 12.00 น. เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 4 ณ วัดตรีรัตนาราม วันที่ 24 มิถุนายน 2567 เวลา 8.30 - 12.00 น. เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 5 ณ วัดตโขดใต้ วันที่ 16 กรกฎาคม 2567 เวลา 8.30 - 12.00 น. เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 6 ณ สวนสาธารณโขดปอ วันที่ 23 กรกฎาคม 2567 เวลา 8.30 - 12.00 น.
- ครั้งที่ 7 ณ วัดปากน้ำ วันที่ 13 สิงหาคม 2567 เวลา 8.30 - 12.00 น.
- ครั้งที่ 8 ณ ลานจอดรถเนินอุไร (หน้าสวนศรีเมือง) วันที่ 20 สิงหาคม 2567 เวลา 8.30 - 12.00 น.
เงื่อนไขบริการ
- จำกัดบ้านละ 1 ตัว เฉพาะผู้่อยู๋ในเขต ทน.ระยอง เท่านั้น
- สุนัขและแมวที่เข้าผ่าตัดจะต้องมีสุขภาพดี ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
- ต้องงดน้ำและอาหาร อย่างน้อย 8 ชม. ก่อนผ่าตัด
- สำหรับสุนัขและแมวขนาดเล็กหรือพันธุ์หน้าสั้น แนะนำให้ทำหมันที่สถานพยาบาลสัตว์ เนื่องจากมีความเสี่ยงในเรื่องการวางยาสลบ
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ยินดีต้อนรับผู้ประสงค์จะรับอนุเคราะห์สุนัขไปดูแลต่อ หรือร่วมบริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการ จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305
กิจกรรมบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่1) เทศบาลนครระยอง
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ขอเชิญชาวเขตเทศบาลนครระยอง นำสุนัขและแมวของท่านเข้ารับบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่1) ประจำปีงบประมาณ 2568 ในโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ โดยงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม
- 1, 4-8 พฤศจิกายน 2567 ชุมชนปากน้ำ
- 11-13 พฤศจิกายน 2567 ชุมชนสมุทรเจดีย์
- 14-15, 18-20 พฤศจิกายน 2567 มุสลิม-ปากคลอง บ้านปากคลอง ก้นปึก-ปากคลอง
- 21-22 พฤศจิกายน 2567 ชุมชนสัมฤทธิ์
- 25-27 พฤศจิกายน 2567 ชุมชนสนามเป้า
- 28-29 พฤศจิกายน 2567 ชุมชนบางจาก
- 2-3 ธันวาคม 2567 ชุมชนบางจาก
*บริการตามแต่ละชุมชนเวลา 13.30 - 16.00 น.
เงื่อนไขบริการ
เงื่อนไขการเข้ารับบริการ
1. เตรียมบัตรประชาชน และต้องอาศัยอยู่ในเขตเทศบาลนครระยอง
2. สุนัขและแมวต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี
3. สุนัขและแมวไม่อยู่ในช่วงตั้งท้อง และให้นมลูก
สำหรับในเขตชุมชนอื่นๆในเทศบาล จะมีประกาศอีกครั้ง
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง [
พิกัด] ยินดีต้อนรับผู้ประสงค์จะรับอนุเคราะห์สุนัขไปดูแลต่อ หรือร่วมบริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการ จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตหนองแขม
สถต ิ ผ ิ ู ้ประกอบโรคศ ิ ลปะ ข ้ อม ู ล ณ วันท ี่30 กันยายน 2562
สำขำกำรประกอบโรคศิลปะ
จ ำนวนผู้ประกอบโรค
ศิลปะ
กิจกรรมบ ำบัด 1376
กำยอุปกรณ์ 283
กำรแก้ไขควำมผิดปกติของกำรสื่อ
ควำมหมำย 384
จิตวิทยำคลินิก 954
เทคโนโลยีหัวใจและทรวงอก 728
รังสีเทคนิค 4960
กำรแพทย์แผนจีน 1469
รวม 10154
หมำยเหตุ เป็นข้อมูลตำมปีงบประมำณ 2562 ณ วันที่ 30 กันยำยน 25622. การสอบขน
ึ
้
ทะเบย
ี
น
http://mrd-hss.moph.go.th/roksil/registration.html
การสอบขึ้นทะเบียน
http://mrd-hss.moph.go.th/roksil/registration.html
ผลการสอบขึ้นทะเบียนและรับใบอนุญาตเป็นผู้ประกอบโรคศิลปะโดยคณะกรรมการวิชาชีพสาขาต่างๆ
ประจ าปี 2562
สาขาการประกอบโรคศิลปะ จ านวน
ผู้เข้าสอบ
จ านวนผู้สอบผ่านตาม
หลักเกณฑ์ที่ก าหนด
ร้อยละ
กิจกรรมบ ำบัด 123 102 82.92
กำยอุปกรณ์ 23 22 95.65
กำรแก้ไขควำมผิดปกติของกำรสื่อ
ควำมหมำย
25 17 68.00
จิตวิทยำคลินิก 249 101 40.56
เทคโนโลยีหัวใจและทรวงอก 63 60 95.23
รังสีเทคนิค 369 286 77.50
กำรแพทย์แผนจีน 299 184 61.53
ทัศนมำตร 112 64 57
ไคโรแพรคติก สอบ ธค62
source
นราธิวาส เดินทางเข้าออกได้ปกติ ปฏิบัติตามมาตรการ D-M-H-T-T เคร่งครัด LINK
การเดินทางเข้า-ออกพื้นที่ ยังคงเดินทางได้ปกติ และยืนยันยังไม่มีมาตรการปิดจังหวัด ขณะที่จังหวัดนราธิวาสยังคงมีด่านโควิดตรวจคัดกรองโรคโควิด-19-และด่านความมั่นคง บริเวณรอยต่อจังหวัด เพื่อสกัดกั้นการแพร่ระบาดของโรคติดเชื้อไวรัสโควิด-19
ผู้เดินทางมาจากพื้นที่เสี่ยง 5 จังหวัด (กรุงเทพฯ ปทุมธานี นนทบุรี สมุทรปราการ นครปฐม)
- รายการตัวกับสาธารณสุขอำเภอ
- รับการกักตัวตามแนวทางที่จังหวัดนราธิวาสกำหนด โดยพิจารณาจากผลการตรวจคัดกรองโรค
หมอราม พร้อม LINK
(1 พค 64) โรงพยาบาลรามคำแหงให้ความร่วมมือเป็นสถานพยาบาลที่จะให้บริการวัคซีนโควิด-19 แก่ประชาชน (เฉพาะผู้ป่วยโรงพยาบาลรามคำแหง)
เราจะเปิดระบบรับลงทะเบียนจองฉีดวัคซีนโควิด-19 ในเร็วๆ นี้ เพื่อให้ประชาชนได้รับวัคซีนครบตามลำดับที่ภาครัฐกำหนด
เริ่มจากผู้ป่วยของโรงพยาบาลรามคำแหงทุกท่านที่เข้าเกณฑ์ กลุ่มผู้มีอายุ 60 ปีขึ้นไป และกลุ่มผู้มีโรคประจำตัวเรื้อรังก่อนเป็นอันดับแรก ตามด้วยกลุ่มผู้มีอายุ 18-59 ปี ตามที่รัฐกำหนด
ท่านไม่จำเป็นต้องรีบจองคิวในขณะนี้ ทันทีระบบรับลงทะเบียนจองฉีดวัคซีนโควิด-19 พร้อมแล้ว เราจะแจ้งให้ท่านทราบทันที และจะมีการกำหนดเวลานัดหมายวันที่ท่านจะได้รับบริการอีกครั้ง
ขอให้ทุกท่านโปรดมั่นใจว่าจะได้รับการฉีดวัคซีนครบอย่างแน่นอน
24 พฤษภาคม 64 เวลา 14.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมา 72,000 ราย
ส่วนกรุงเทพเพิ่ม ประมาณ 12,000 ราย ถอยลงเช่นกัน
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 201-250
201 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพาะปลูกพืชสมุนไพรเพื่อสุขภาพ บ้านหนองน้ำใส นาย สมชาย พสุธาดลอนันต์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 14340
ที่ตั้ง : 2 หนองน้ำใส วัฒนานคร สระแก้ว 08 1865 9374 27160
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 154/2564 (ปลูก)
202 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรเพื่อทางการแพทย์หนองแคนใหญ่ นาย ศิระ หล้าธรรม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3768
ที่ตั้ง : 12 เมืองจันทร์ เมืองจันทร์ ศรีสะเกษ 09 8597 2150 33120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 155/2564 (ปลูก)
203 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกสมุนไพรทางการแพทย์บ้านอะลาง นาย ธีรวิชญ์ ศรชัย
ชื่อสถานที่ : วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรทางการแพทย์บ้านอะลาง
ที่ตั้ง : 115 3 หนองใหญ่ เมืองจันทร์ ศรีสะเกษ 065 761 3082 33120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 156/2564 (ปลูก)
204 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพอเพียง (สีเขียว) นาย ณรงค์ นามวงษ์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพอเพียง (สีเขียว)
ที่ตั้ง : 126 12 สำโรง อุทุมพรพิสัย ศรีสะเกษ 08 6879 5359 33120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 157/2564 (ปลูก)
205 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา นาย สุรพล ใจวงศ์ษา
ชื่อสถานที่ : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา พิษณุโลก
ที่ตั้ง : 52 7 บ้านกร่าง เมืองพิษณุโลก พิษณุโลก 0 5529 8438 65000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 158/2564 (ปลูก)
206 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา นาย สุรพล ใจวงศ์ษา
ชื่อสถานที่ : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา น่าน
ที่ตั้ง : 59 13 ฝายแก้ว ภูเพียง น่าน 0 5434 2547-8 55000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 159/2564 (ปลูก)
207 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ผลิตลูกพันธุ์ปลาประทาย นาย ชูชีพ ประสาทไทย
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 55930
ที่ตั้ง : กระทุ่มราย ประทาย นครราชสีมา 08 1074 0630 30180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 160/2564 (ปลูก)
208 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนนาแปลงใหญ่ตำบลโนนเพ็ด นาย เทพวิทย์ เทพวงษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3872
ที่ตั้ง : 9 โนนเพ็ด ประทาย นครราชสีมา 08 7452 1978 30180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 161/2564 (ปลูก)
209 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชผักสมุนไพรวังทรายพูน นางสาว พัลลภา กุลเทศ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 2069
ที่ตั้ง : หนองปลาไหล วังทรายพูน พิจิตร 08 1785 5471 66180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 162/2564 (ปลูก)
210 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้เลี้ยงไก่พื้นเมือง ลำน้ำห้วยเสนง นาง ฉวีวรรณ ชุ่มชื่นดี
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มผู้เลี้ยงไก่พื้นเมือง ลำน้ำห้วยเสนง
ที่ตั้ง : 32 1 ตาเบา ปราสาท สุรินทร์ 08 1202 8500 32140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 163/2564 (ปลูก)
211 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพราะรักสุรินทร์ นาง โฉมศรี ถุนาพรรณ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 12374
ที่ตั้ง : เชื้อเพลิง ปราสาท สุรินทร์ 09 1758 0993 32140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 164/2564 (ปลูก)
212 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพราะรักสุรินทร์ นาย อนันต์ โชติสิรินันท์
ชื่อสถานที่ : วิสาหกิจชุมชนเพราะรักสุรินทร์
ที่ตั้ง : 131 2 โชคชัยเดชอุดม กันตวจระมวล ปราสาท สุรินทร์ 08 1593 8718 32140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 165/2564 (ปลูก)
213 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ผลิตและแปรรูปอาหารปลอดภัย นาง นวลจันทร์ เจือวงษ์
ชื่อสถานที่ : วิสาหกิจชุมชนผู้ผลิตและแปรรูปอาหารปลอดภัย
ที่ตั้ง : 81 1 ชยางกูร โชคชัย นิคมคำสร้อย มุกดาหาร 08 1745 1743 49130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 166/2564 (ปลูก)
214 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มทอผ้าบ้านหนองนกเขียน นาง เทียมจันทร์ มนต์ดี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 7297
ที่ตั้ง : 4 ร่มเกล้า นิคมคำสร้อย มุกดาหาร 06 1062 1274 49130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 167/2564 (ปลูก)
215 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ สหกรณ์ปลูกพืชปลอดภัยมุกดาหาร จำกัด นาง อ้อมทิพย์ บุญแฝง
ชื่อสถานที่ : ตาม น.ส.3 ก. เลขที่ 5199 เล่ม 52 ข. หน้า 49
ที่ตั้ง : มุกดาหาร เมืองมุกดาหาร มุกดาหาร 08 1054 3345 49000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 168/2564 (ปลูก)
216 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสู้ไปด้วยกัญ นาง ฉวีวรรณ จันทรักษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 70150
ที่ตั้ง : ท่าสองคอน เมืองมหาสารคาม มหาสารคาม 09 0252 9393 44000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 169/2564 (ปลูก)
217 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนชมรมแพทย์แผนไทย ต.บ่อสวก นาย วรินทร์เทพ เชื้อสำราญ
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ่อสวก
ที่ตั้ง : 98 3 บ่อสวก เมืองน่าน น่าน 0 5468 1089 55000
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 170/2564 (ปลูก)
218 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มศูนย์ข้าวชุมชนตำบลคอรุม นาย พงษ์ศักดิ์ สมประสงค์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 47907
ที่ตั้ง : คอรุม พิชัย อุตรดิตถ์ 08 2410 4895 53120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 171/2564 (ปลูก)
219 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปลูกพืชสมุนไพรตำบลพะทาย นาย ทวี สุวรรณมาโจ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 23276
ที่ตั้ง : พะทาย ท่าอุเทน นครพนม 09 7193 2823 48120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 172/2564 (ปลูก)
220 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชผักอินทรีย์ (ปลอดสารพิษ) ตำบลท่าขุนราม นาย ภูเบศ ชัยพิทักษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 67030
ที่ตั้ง : 11 ท่าขุนราม เมืองกำแพงเพชร กำแพงเพชร 06 2294 5498 และ 08 8282 1148 62000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 173/2564 (ปลูก)
221 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรนอกกรอบเพื่อรอยยิ้มที่ยั่งยืน นาง บัวลอย ชุ่มกระโทก
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรนอกกรอบเพื่อรอยยิ้มที่ยั่งยืน
ที่ตั้ง : 112 9 เมืองแฝก ลำปลายมาศ บุรีรัมย์ 09 2989 9898 31130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 174/2564 (ปลูก)
222 ชื่อผู้รับอนุญาต : มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา นาย สุรพล ใจวงศ์ษา
ชื่อสถานที่ : สถาบันวิจัยเทคโนโลยีเกษตร มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา ลำปาง
ที่ตั้ง : 202 17 พหลโยธิน พิชัย เมืองลำปาง ลำปาง 0 5434 2547-8 52000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 175/2564 (ปลูก)
223 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสามสวนสมุนไพร นาง หทัยกาญจน์ ภิญโญทรัพย์
ชื่อสถานที่ : วิสาหกิจชุมชนสามสวนสมุนไพร
ที่ตั้ง : 396 9 สามสวน บ้านแท่น ชัยภูมิ 098 6396894 36190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 176/2564 (ปลูก)
224 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเกษตรอินทรีย์เพื่อสังคม นาง อุทุมพร ภักดีศิริวงษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 58124
ที่ตั้ง : หนองโดน จัตุรัส ชัยภูมิ 06 3826 4239 36130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 177/2564 (ปลูก)
225 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรครบวงจรบ้านนาตุ้ม นาย จรัญเดช เมืองแก้ว
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรครบวงจรบ้านนาตุ้ม
ที่ตั้ง : 118 2 บ่อเหล็กลอง ลอง แพร่ 09 1140 3001 54150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 178/2564 (ปลูก)
226 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชเศรษฐกิจใหม่ ต.บึงวิชัย นาย วรพล คนใจบุญ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 32861
ที่ตั้ง : 2 ลำคลอง เมืองกาฬสินธุ์ กาฬสินธุ์ 08 3345 7755 46000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 179/2564 (ปลูก)
227 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตสมุนไพรเพื่อการแพทย์อำเภอคูเมือง นาย เวฬุวัน อินทอง
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 909 เล่ม 10 ก
ที่ตั้ง : คูเมือง คูเมือง บุรีรัมย์ 08 9474 8322 31190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 180/2564 (ปลูก)
228 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรสมุนไพรไทยภูเก็ต นาย อนุ ยกทอง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 50341 เลขที่ 60457 เลขที่ 60456 เลขที่ 60455 และ เลขที่ 60454
ที่ตั้ง : ศรีสุนทร เชิงทะเล ถลาง ภูเก็ต 09 6639 3666 83110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 181/2564 (ปลูก)
229 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร นาย เดช ผลไม้
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร
ที่ตั้ง : 95 12 พนมไพร-มหาชนะชัย พนมไพร พนมไพร ร้อยเอ็ด 08 9019 5666 45140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 182/2564 (ปลูก)
230 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเลี้ยงโคพื้นบ้าน บ้านหัวดอนชาด หมู่ที่ 4 ตำบลบ้านฝาง อำเภอเกษตรวิสัย จังหวัดร้อยเอ็ด นาย พงษ์เฉลย พลอยวิเลิศ
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเลี้ยงโคพื้นบ้าน บ้านหัวดอนชาด
ที่ตั้ง : 4 บ้านฝาง เกษตรวิสัย ร้อยเอ็ด 08 1314 3747 45150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 183/2564 (ปลูก)
231 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชผสมผสานบ้านโคกกลาง นาย พงษ์เฉลย พลอยวิเลิศ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 25771
ที่ตั้ง : หนองแคน ปทุมรัตต์ ร้อยเอ็ด 06 5727 8585 45190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 184/2564 (ปลูก)
232 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรเพื่อการแพทย์ไทย นาย พงษ์เฉลย พลอยวิเลิศ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 64972 และ 64971
ที่ตั้ง : 3 จตุร-บ้านหนองห่าง หัวช้าง จตุรพักตรพิมาน ร้อยเอ็ด 08 4789 0789 45180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 185/2564 (ปลูก)
233 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรบ้านโคกกุง หมู่ 5 นาย สุพัตร บุรณะเวช
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 7982
ที่ตั้ง : - - - - 5 - ขามเปี้ย โพธิ์ชัย ร้อยเอ็ด 08 3355 1221 45230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 186/2564 (ปลูก)
234 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรทางเลือก นาย วิเชียร โพธิจักร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 10340
ที่ตั้ง : 12 ขอนแก่น-โพนทอง นาอุดม โพนทอง ร้อยเอ็ด 08 9574 5621 45110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 187/2564 (ปลูก)
235 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรทุ่งกุลาทอง นาย คำพันธ์ บุตรพรม
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรทุ่งกุลาทอง
ที่ตั้ง : 8 1 สระคู สุวรรณภูมิ ร้อยเอ็ด 06 5952 4699 45130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 188/2564 (ปลูก)
236 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรบ้านหนองน้ำลึก หมู่ 4 นาย สัมฤทธิ์ ศรีประทุม
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพืชสมุนไพรบ้านหนองน้ำลึก หมู่ 4
ที่ตั้ง : 110 4 หนองตาไก้ โพธิ์ชัย ร้อยเอ็ด 08 1872 8232 45230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 189/2564 (ปลูก)
237 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกสมุนไพรบ้านยางเลิง นาย ชูชัย เต็มธนะกิจไพศาล
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มปลูกสมุนไพรบ้านยางเลิง
ที่ตั้ง : 248 12 ดอกไม้ สุวรรณภูมิ ร้อยเอ็ด 06 5294 0647 45130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 190/2564 (ปลูก)
238 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเครือข่ายนาแปลงใหญ่ อ.พุทไธสง นาง นารี เทพบัณฑิตย์
ชื่อสถานที่ : กลุ่มวิสาหกิจชุมชนเครือข่ายนาแปลงใหญ่ อ.พุทไธสง
ที่ตั้ง : 77 12 บ้านจาน พุทไธสง บุรีรัมย์ 08 1879 1527 31120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 191/2564 (ปลูก)
239 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรทางการแพทย์เชียงอาด นาย วุฒิภิวัตน์ คำหงษ์ษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 32072
ที่ตั้ง : เหล่าต่างคำ โพนพิสัย หนองคาย 06 3516 5041 43120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 192/2564 (ปลูก)
240 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสวนสมุนไพรชายทุ่ง นาย อัครวัฒน์ เพียวพงภควัต
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 920 เล่ม 10 ก หน้า 20
ที่ตั้ง : หนองกี่ หนองกี่ บุรีรัมย์ 08 1296 2385 31210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 193/2564 (ปลูก)
241 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรชุมชนยิ้ม นาย อัครวัฒน์ เพียวพงภควัต
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 105 เล่ม 2 ก หน้า 5
ที่ตั้ง : ทุ่งกระเต็น หนองกี่ บุรีรัมย์ 09 8964 1519 31210
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 194/2564 (ปลูก)
242 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนแผ่นดินเงินแผ่นดินทอง นาย กิตติ โล่สุวรรณรักษ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 9107
ที่ตั้ง : 2 ไทรม้า เมืองนนทบุรี นนทบุรี 08 9651 5456 11000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 195/2564 (ปลูก)
243 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเฮอร์บริสต้า (Herbristra) SMEs นาง จันทนา มงคล
ชื่อสถานที่ : วิสาหกิจชุมชนเฮอร์บริสต้า (Herbristra) SMEs
ที่ตั้ง : 12/2 เลียบคลองบางไทร บางไผ่-หนองเพรางาย บางคูรัด บางบัวทอง นนทบุรี 08 6105 0320 11110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 196/2564 (ปลูก)
244 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนที่นี่ น้ำใส นาย วิจิตร พิมพ์บุญ
ชื่อสถานที่ : สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านน้ำใส
ที่ตั้ง : 277 2 น้ำเป็น เขาชะเมา ระยอง 09 4484 8618 และ 0 3899 6214 21110
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 197/2564 (ปลูก)
245 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนลุ่มไทรเกษตรวิถีใหม่ นาง ยุพเยาว์ ภูศรี
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 1402 เล่มที่ 15 ก หน้า 2
ที่ตั้ง : 2 ป่าคลอก ถลาง ภูเก็ต 08 8751 1962 83110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 199/2564 (ปลูก)
246 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตพืชสมุนไพรไทยตำบลปากล่อ นาย ธีรชัย มะโนมะยา
ชื่อสถานที่ : วิสาหกิจชุมชนผลิตพืชสมุนไพรตำบลปากล่อ
ที่ตั้ง : 1/1 3 ปากล่อ โคกโพธิ์ ปัตตานี 08 6689 9601 94180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 200/2564 (ปลูก)
247 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์บ้านมะกรูด นาง เสาวลี จันทร์งาม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 2022
ที่ตั้ง : 5 มะกรูด โคกโพธิ์ ปัตตานี 08 6967 3729 94120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 201/2564 (ปลูก)
248 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผักปลอดสารพิษและสมุนไพรทางการแพทย์ นาย โยธิน นันทวิสุทธิ์
ชื่อสถานที่ : วิสาหกิจชุมชนผักปลอดสารพิษและสมุนไพรทางการแพทย์
ที่ตั้ง : 126 1 นาประดู่ โคกโพธิ์ ปัตตานี 08 9295 9760 94180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 202/2564 (ปลูก)
249 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์ ต.คอกกระบือ นาง สุจินต์ มัจฉาชาญ
ชื่อสถานที่ : ตาม น.ส.3 เล่ม (1) 46 หน้า 88 (ปัตตานี)
ที่ตั้ง : 1 คอกกระบือ ปะนาเระ ปัตตานี
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 203/2564 (ปลูก)
250 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรทางเลือกและการแปรรูปนาง บุญธิญา สุทธิโคตร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 19401 (หนองบัวลำภู)
ที่ตั้ง : หนองบัว เมืองหนองบัวลำภู หนองบัวลำภู
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 204/2564 (ปลูก)
การดำเนินโรคของภาวะสมองเสื่อม
ลำดับการดำเนินโรคของภาวะสมองเสื่อมแบ่งออกเป็น 4 ระยะ ได้แก่
- ระยะก่อนสมองเสื่อม
ในระยะก่อนสมองเสื่อม (Predementia) อาการแรกสุดมักจะเข้าใจผิดว่าเกิดขึ้นเองจากความชรา หรือเกิดจากภาวะเครียด การทดสอบทางจิตประสาทวิทยาแสดงความบกพร่องทางการรู้เล็กน้อยซึ่งกินเวลาถึง 8 ปีกว่าที่ผู้ป่วยจะมีลักษณะครบตามเกณฑ์การวินิจฉัยโรคอัลไซเมอร์ อาการเริ่มแรกจะมีผลกระทบต่อชีวิตประจำวันที่ซับซ้อนส่วนใหญ่3 ความบกพร่องที่เห็นชัดคือการสูญเสียความจำ คือพยายามจำข้อมูลที่เรียนรู้เมื่อไม่นานมานี้ไม่ได้และไม่สามารถรับข้อมูลใหม่ๆ ได้ ปัญหาเกี่ยวกับหน้าที่การบริหารจัดการ อาทิความใส่ใจต่อสิ่งหนึ่งๆ การวางแผน, ความยืดหยุ่น และความคิดเชิงนามธรรม หรือความบกพร่องของความจำเชิงอรรถศาสตร์ (การจำความหมายและความสัมพันธ์เชิงแนวคิด เช่น ปลาวาฬเป็นสัตว์เลี้ยงลูกด้วยนม แอปเปิลมีสีแดง เป็นต้น) อาจปรากฏอาการได้ในโรคอัลไซเมอร์ระยะแรก อาจพบภาวะไร้อารมณ์ (apathy) ได้ในระยะนี้และจะเป็นอาการที่คงปรากฏอยู่ตลอดทุกระยะเวลาการดำเนินโรค ในระยะก่อนแสดงอาการทางคลินิกนี้อาจเรียกอีกอย่างว่า ความบกพร่องทางการรู้เล็กน้อย (mild cognitive impairment) แต่ก็ยังคงเป็นที่ถกเถียงกันว่าชื่อดังกล่าวเป็นโรคหนึ่งซึ่งได้รับการวินิจฉัยต่างหากหรือเป็นเพียงระยะแรกของโรค
อัลไซเมอร์
สมองเสื่อมระยะแรก
ระยะสมองเสื่อมระยะแรก (Early dementia) ผู้ป่วยโรคอัลไซเมอร์จะมีความบกพร่องของความจำและการเรียนรู้จนสามารถวินิจฉัยอย่างแน่นอนได้ ผู้ป่วยบางส่วนมีอาการบกพร่องทางภาษา การบริหาร การกำหนดรู้ (ภาวะเสียการระลึกรู้ (agnosia)) หรือการจัดการเคลื่อนไหว (ภาวะเสียการรู้ปฏิบัติ (apraxia)) เด่นกว่าการสูญเสียความทรงจำ โรคอัลไซเมอร์ไม่ได้มีผลกระทบต่อความจำทั้งหมดเท่าๆ กัน แต่ความทรงจำระยะยาวที่เป็นเหตุการณ์ที่เกิดขึ้นเฉพาะตัวของผู้ป่วย (ความจำเชิงเหตุการณ์ (episodic memory)) ความรู้ทั่วไป (ความจำเชิงอรรถศาสตร์ (semantic memory)) และความจำโดยปริยาย (implicit memory; ความจำของร่างกายว่าทำสิ่งต่างๆ อย่างไร เช่น การใช้ช้อนส้อมรับประทานอาหาร) ทั้งสามอย่างนี้จะได้รับผลกระทบน้อยกว่าความจำหรือความรู้ใหม่ ปัญหาทางภาษามีลักษณะเด่นคือการรวบคำให้สั้นและพูดหรือใช้ศัพท์ไม่ฉะฉานหรือคล่องเหมือนเดิม ซึ่งทำให้พูดหรือเขียนภาษาได้น้อยลง ในระยะนี้ผู้ป่วยโรคอัลไซเมอร์ยังสามารถสื่อสารบอกความคิดพื้นฐานของตนได้ เมื่อผู้ป่วยมีการเคลื่อนไหวโดยละเอียด เช่น การเขียน การวาดภาพ หรือการแต่งตัว อาจพบความบกพร่องของการประสานการเคลื่อนไหวและการวางแผน (ภาวะเสียการรู้ปฏิบัติ) ทำให้ผู้ป่วยดูเงอะงะหรือซุ่มซ่าม19 เมื่อโรคดำเนินต่อไปผู้ป่วยโรคอัลไซเมอร์มักสามารถทำงานหลายอย่างได้ด้วยตัวเองแต่อาจต้องอาศัยผู้ช่วยหรือผู้ดูแลในกิจกรรมที่ต้องอาศัยกระบวนการคิดหรือการรู้อย่างมาก
สมองเสื่อมระยะกลาง
ระยะสมองเสื่อมระยะปานกลาง (Moderate dementia) จะพบความเสื่อมของสมองจนไม่สามารถทำกิจกรรมต่างๆ ได้ด้วยตนเอง มีความบกพร่องด้านการพูดปรากฏชัดเจนเนื่องจากไม่สามารถนึกหาคำศัพท์ได้ ทำให้ใช้ศัพท์ผิดหรือใช้คำอื่นมาแทน (paraphasia) ทักษะการอ่านและการเขียนค่อยๆ เสียไปเรื่อยๆ เมื่อเวลาผ่านไปการประสานงานเพื่อการเคลื่อนไหวที่ซับซ้อนจะลดลง ทำให้ไม่สามารถทำกิจกรรมในชีวิตประจำวันส่วนใหญ่ได้อย่างปกติ ในระยะนี้ปัญหาความจำของผู้ป่วยจะแย่ลงเรื่อยๆ และผู้ป่วยไม่สามารถจำญาติสนิทของตนเองได้ ความทรงจำระยะยาวซึ่งแต่เดิมยังคงอยู่ก็จะค่อยๆ บกพร่องไป และมีพฤติกรรมเปลี่ยนแปลง อาการแสดงที่พบบ่อยคือการหนีออกจากบ้าน ความรู้สึกผิดปกติ สับสนหรือเห็นภาพหลอนในเวลาโพล้เพล้หรือกลางคืน (sundowning) หงุดหงิดโมโหง่าย และอารมณ์แปรปรวน เช่นร้องไห้ ก้าวร้าวอย่างไม่มีเหตุผล หรือดื้อต่อผู้ดูแล ประมาณร้อยละ 30 ของผู้ป่วยอาจมีอาการเชื่อว่าบุคคล สิ่งของ หรือสถานที่เปลี่ยนแปลงไป (เรียกว่ากลุ่มอาการ Delusional misidentification syndrome) และอาจมีอาการหลงผิดอื่นๆ อาจมีอาการกลั้นปัสสาวะไม่ได้ อาการดังกล่าวทำให้เกิดความเครียดต่อผู้ดูแลหรือญาติ ซึ่งต้องตัดสินใจส่งผู้ป่วยไปยังสถานรับดูแลผู้ป่วยระยะยาวอื่นๆ เพื่อลดความเครียด
สมองเสื่อมระยะสุดท้าย
ในระยะสมองเสื่อมระยะสุดท้าย (Advanced dementia) ผู้ป่วยต้องพึ่งพาผู้ดูแลตลอดเวลา ทักษะทางภาษาของผู้ป่วยลดลงแม้เพียงการพูดวลีง่ายๆ หรือคำเดี่ยวๆ จนกระทั่งไม่สามารถพูดได้เลย แม้ว่าผู้ป่วยจะไม่สามารถพูดจาตอบโต้เป็นภาษาได้ แต่ผู้ป่วยมักสามารถเข้าใจคำพูดและตอบสนองกลับมาด้วยการแสดงอารมณ์ ถึงแม้ผู้ป่วยจะยังมีลักษณะก้าวร้าว แต่ลักษณะของภาวะไร้อารมณ์และอ่อนเพลียจะเด่นกว่า ในที่สุดผู้ป่วยจะไม่สามารถทำกิจกรรมใดได้เลยหากขาดผู้ช่วยเหลือ มวลกล้ามเนื้อและการเคลื่อนไหวร่างกายลดลงจนผู้ป่วยต้องนอนนิ่งอยู่เฉยๆ และไม่สามารถป้อนอาหารด้วยตนเองได้ และสุดท้ายผู้ป่วยจะเสียชีวิตจากปัจจัยภายนอกอื่นๆ โดยตรง อาทิ แผลกดทับหรือโรคปอดบวม แต่ไม่ได้เสียชีวิตจากตัวโรคโดยตรง
อบต.บางขันแตก อ.เมือง สมุทรสงคราม บริการวัคซีนป้องกันโรคพิษสุนัขบ้าในปี 2566 LINK
กองสาธารณสุขและสิ่งแวดล้อม องค์การบริหารส่วนตำบลบางขันแตก จะดำเนินการให้บริการวัคซีนป้องกันโรคพิษสุนัขบ้าในปี 2566 จึงขอเชิญชวนประชาชนที่เป็นเจ้าของสุนัขและแมวในพื้นที่ตำบลบางขันแตก ลงทะเบียนแจ้งความประสงค์ขอรับวัคซีนป้องกันโรคพิษสุนัขบ้าได้ ตั้งแต่วันที่ 16 มกราคม - 16 มีนาคม 2566 ในวันและเวลาราชการ
สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่ หมายเลขโทรศัพท์ 034-765758 กองสาธารณสุขและสิ่งแวดล้อม องค์การบริหารส่วนตำบลบางขันแตก
เขตยานนาวา
สำนักงานเขตยานนาวา ร่วมกับ ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์ และศูนย์บริการสาธารณสุข 55 เตชะสัมพันธ์ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง ฟรี‼️ ระหว่างวันที่ 13 - 24 มีนาคม 2566 ตั้งแต่เวลา 09.00 น. ถึงเวลา12.00 น.
ลูกสุนัขควรได้รับการฉีดวัคซีนพิษสุนัขบ้าในสุนัขเข็มแรก เมื่อมีอายุประมาณ 16 – 18 สัปดาห์ ฉีดวัคซีนตามนัดหมายทุกครั้ง โดยสุนัขโตต้องได้รับวัคซีนกระตุ้นซ้ำทุกปี
++ กิจกรรมที่ผ่านไปปีก่อน ++
++ กิจกรรมที่ผ่านไป ++
++ กิจกรรมที่ผ่านไป ปี 2566 ++
++ กิจกรรมที่ผ่านไป ++
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตบางแค
ลำพูน - กักตัว 14 วัน มาหรือไปพื้นที่เสี่ยงก็ตาม LINK
ประกาศ 7 เมย 64
- ผู้เดินทางจากพื้นที่เสี่ยง ให้ลงทะเบียนใน Safe Lamphun และตรวจเชื้อโควิด และกักตัว 14 วัน
- หากพำนักในหมู่บ้าน/ชุมชน ให้แจ้งต่อกำนัน/ผู้ใหญ่บ้าน แพทย์ประจำตำบาล สารวัตรกำนัน ผู้ช่วยผู้ใหญ่บ้าน สำหรับในพื้นที่เขต อ.เมือง แจ้งต่อประธานชุมชน รายงานต่อจนท.ควบคุมโรคเป็นรายวัน
- หากพักค้างในโรงแรม ให้แจ้งต่อโรงแรม/เจ้าของ/ผู้รับผิดชอบ เพื่อแจ้งให้เจ้าพนักงานควบคุมโรคติดต่อทันที
- ผู้พำนักในลำพูนที่เดินทางไปในพื้นที่เสี่ยง ให้แจ้งข้อมูลการเดินทางและลงทะเบียน ใน Safe Lamphun และตรวจเชื้อโควิด และกักตัว 14 วัน
23 พฤษภาคม 64 เวลา 14.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมาเพียง 63,000 ราย ถอยจากเมื่อวาน สองหมื่น
ส่วนกรุงเทพเพิ่ม ประมาณ 16,000 ราย ถอยลงเช่นกัน
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 251-300
251 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านไร่สะบายดีบ้านสบคำ นาย กฤษกร หมั่นกิจ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17388
ที่ตั้ง : เวียง เชียงแสน เชียงราย 09 1956 6564 57150
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 205/2564 (ปลูก)
252 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเวชศาสตร์สมุนไพรศึกษาเพื่อพัฒนาชีวิตครูแห่งประเทศไทยกลุ่มที่ 1 อำเภอธาตุพนม จังหวัดนครพนม นาง เทพนม อินทรีย์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 49416
ที่ตั้ง : 14 ทช.นพ.3013 นาถ่อน ธาตุพนม นครพนม 06 1089 5009 48110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 206/2564 (ปลูก)
253 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรเพื่อแปรรูปเป็นอาหารและยา นาย ทนงศิลป์ ลี้พล
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 14941
ที่ตั้ง : 3 ยอดชาด วังยาง นครพนม 09 5596 6417 48130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 207/2564 (ปลูก)
254 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนไร่เพื่อนคุณ นาง นันทวัน วัฒนราช
ชื่อสถานที่ : วิสาหกิจชุมชนไร่เพื่อนคุณ
ที่ตั้ง : 229 14 ประโคนชัย ประโคนชัย บุรีรัมย์ 08 9924 9927 31140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 208/2564 (ปลูก)
255 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนแปรรูปผลผลิตทางการเกษตรและพืชสมุนไพรตำบลริมปิง นาย บัญชา ประสานสิน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 39154
ที่ตั้ง : 7 จามเทวี ริมปิง เมืองลำพูน ลำพูน 08 0241 9626 51000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 209/2564 (ปลูก)
256 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนภูมิภักดิ์ไผท นาย สุพจน์ เฉยแสง
ชื่อสถานที่ : วิสาหกิจชุมชนภูมิภักดิ์ไผท
ที่ตั้ง : 12/12 12 ทรายขาว สอยดาว จันทบุรี 08 1663 3996 22180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 210/2564 (ปลูก)
257 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรทางการแพทย์โปร่งเย็น นาง นรินทิพย์ ฤทธิ์ฐิติ
ชื่อสถานที่ : วิสาหกิจชุมชนผู้ปลูกพืชสมุรไพรทางการแพทย์โปร่งเย็น
ที่ตั้ง : 64 17 จุมพล โพนพิสัย หนองคาย 09 0030 6666 43120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 211/2564 (ปลูก)
258 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรอินทรีย์และแปรรูปพืชสมุนไพร นาย กมล แซ่ปึง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17305
ที่ตั้ง : พังโคน-บึงกาฬ โนนสมบูรณ์ เมืองบึงกาฬ บึงกาฬ 38000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 212/2564 (ปลูก)
259 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชผักและสมุนไพรปลอดสารพิษบ้านนาโนน นาง เตือนใจ ไกรรัตน์
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 213/2564 (ปลูก)
260 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตปุ๋ยชีวภาพอัดเม็ดบ้านท่าไคร้ นาง เตือนใจ ไกรรัตน์
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 214/2564 (ปลูก)
261 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนแปรรูปสมุนไพรหนองสมออำเภอคง นาย เทอดพงศ์ พันธวิศิษฏ์
ชื่อสถานที่ : วิสาหกิจชุมชนแปรรูปสมุนไพรหนองสมออำเภอคง
ที่ตั้ง : 171 14 เมืองคง คง นครราชสีมา 09 7935 6282 30260
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 215/2564 (ปลูก)
262 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตปุ๋ยชีวภาพอัดเม็ดบ้านท่าไคร้ นาง เตือนใจ ไกรรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 35050
ที่ตั้ง : 5 บึงกาฬ เมืองบึงกาฬ บึงกาฬ 08 1749 9311 38000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 217/2564 (ปลูก)
263 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตเมล็ดพันธุ์ข้าวและพืชสมุนไพรบ้านหนองปรือ นาย เอกภพ ด้วงชื่น
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3575
ที่ตั้ง : หนองกรด บรรพตพิสัย นครสวรรค์ 08 4820 5189 60180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 219/2564 (ปลูก)
264 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชผักผลไม้และนวัตกรรมกล้วยบรรพตพิสัย นาง สุมณฑา บุนนาค
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3576
ที่ตั้ง : 9 หนองกรด บรรพตพิสัย นครสวรรค์ 09 6881 3006 60180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 220/2564 (ปลูก)
265 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรอำเภอกะปง นาย กษิต วิริยะนรอนันต์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มสมุนไพรอำเภอกะปง
ที่ตั้ง : 33/4 4 ท่านา กะปง พังงา 09 9109 2807 82170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 221/2564 (ปลูก)
266 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรภูเก็ต นางสาว เหมือนแพร บุญล้อม
ชื่อสถานที่ : ตาม น.ส.3ก เลขที่ 4515 เล่ม 45 ก หน้า 15
ที่ตั้ง : 7 กะทู้ กะทู้ ภูเก็ต 09 2365 5165 83120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 222/2564 (ปลูก)
267 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชใบเขียว นางสาว เหมือนแพร บุญล้อม
ชื่อสถานที่ : ตาม น.ส.3ก เลขที่ 3600 เล่ม 36 ข หน้า 50
ที่ตั้ง : กะทู้ กะทู้ ภูเก็ต 08 1535 6636 83120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 223/2564 (ปลูก)
268 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรอำเภอประโคนชัย นาง วารินทร์ สุขสำโรง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8799
ที่ตั้ง : ประโคนชัย ประโคนชัย บุรีรัมย์ 093 7892654 31140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 224/2564 (ปลูก)
269 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มผู้ปลูกพืชสมุนไพรอำเภอปะคำ นาง เมลดา แพทย์กระโทก
ชื่อสถานที่ : ตาม น.ส.3 เลขที่ 66/608 เล่ม 1 หน้า 113
ที่ตั้ง : 1 โคกมะม่วง ปะคำ บุรีรัมย์ 916612582 31220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 225/2564 (ปลูก)
270 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนศูนย์กลางสมุนไพรพนาสวรรค์ นาย ประยงค์ ชุมวรฐายี
ชื่อสถานที่ : วิสาหกิจชุมชนศูนย์กลางสมุนไพรพนาสวรรค์
ที่ตั้ง : 23 7 ท่าข้าม ท่าแซะ ชุมพร 09 1819 6263 86140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 226/2564 (ปลูก)
271 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเพียงกัญ นาย กสิณพจน์ ฟูเจริญกัลยา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 52241
ที่ตั้ง : ป่าซาง แม่จัน เชียงราย 08 0256 4252 57110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 227/2564 (ปลูก)
272 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกพืชสมุนไพรทางการแพทย์ปทุมรัตต์ นาย ธวัชชัย อินธิสาร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 22160
ที่ตั้ง : หนองแคน ปทุมรัตต์ ร้อยเอ็ด 081 9544703 45190
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 228/2564 (ปลูก)
273 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรสาเกตนคร นาย ชอบ จิตรไทย
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรสาเกตนคร
ที่ตั้ง : 88 8 เหนือเมือง เมืองร้อยเอ็ด ร้อยเอ็ด 09 8662 6711 45000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 229/2564 (ปลูก)
274 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพัฒนาการเกษตรบ้านเมืองแก้ว นาง เพ็ญศรี สุดชา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 9986
ที่ตั้ง : 4 หนองหิน เมืองสรวง ร้อยเอ็ด 08 6016 4118 45220
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 230/2564 (ปลูก)
275 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร นาย เดช ผลไม้
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มพืชสมุนไพรทางเลือกบ้านไทยสมบูรณ์ หมู่ที่ 12 ตำบลพนมไพร
ที่ตั้ง : 95 12 พนมไพร-มหาชนะชัย พนมไพร พนมไพร ร้อยเอ็ด 08 9019 5666 45140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 231/2564 (ปลูก)
276 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข นาย ปรีชา สุมาลัย
ชื่อสถานที่ : โรงพยาบาลสมเด็จพระยุพราชเวียงสระ
ที่ตั้ง : 204/16 10 บ้านส้อง เวียงสระ สุราษฎร์ธานี 0 7736 1283 84190
ประเภทสถานที่ : รพ. รัฐ
เลขที่ใบอนุญาต : 232/2564 (ปลูก)
277 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรสมุนไพรก้าวหน้า นาย ภูวดล กิตติวัฒนาสาร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 29030
ที่ตั้ง : 29031 78432 78431 77355 หนองยายพิมพ์ นางรอง
ประเภทสถานที่ : บุรีรัมย์
เลขที่ใบอนุญาต : 06 5515 8289
278 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรสมุนไพรก้าวหน้า นาย วัชรพงษ์ ชอบสุข
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 29030
ที่ตั้ง : 29031 78432 78431 77355 หนองยายพิมพ์ นางรอง
ประเภทสถานที่ : บุรีรัมย์
เลขที่ใบอนุญาต : 06 5515 8289
279 ชื่อผู้รับอนุญาต : กรมการแพทย์ ร่วมกับ วิสาหกิจชุมชนเกษตรสมุนไพรก้าวหน้า นาง มิ่งขวัญ วิชัยดิษฐ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 29030
ที่ตั้ง : 29031 78432 78431 77355 9 หนองยายพิมพ์ นางรอง
ประเภทสถานที่ : บุรีรัมย์
เลขที่ใบอนุญาต : 06 5515 8289
280 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรกรดงลานปลูกพืชสมุนไพร นาง เพ็ญประภา วิเศษสัตย์
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเกษตรกรดงลานปลูกพืชสมุนไพร
ที่ตั้ง : 151 3 ดงลาน เมืองร้อยเอ็ด ร้อยเอ็ด 08 1769 7959 45000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 236/2564 (ปลูก)
281 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนออร์แกนิกเกษมสุข นาย ทินเทวัญ พุทธลา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8724
ที่ตั้ง : พลับพลา เชียงขวัญ ร้อยเอ็ด 09 6874 6195 และ 06 3829 6994 45170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 237/2564 (ปลูก)
282 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ผลิตและแปรรูปผลิตภัณฑ์เกษตรอินทรีย์ อำเภอจตุรพักตรพิมาน นาย พงษ์เฉลย พลอยวิเลิศ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 26127
ที่ตั้ง : 11 ดู่น้อย จตุรพักตรพิมาน ร้อยเอ็ด 08 2840 8451 45180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 238/2564 (ปลูก)
283 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มพืชเศรษฐกิจใหม่บ้านนาชม หมู่ที่ 16 ตำบลแสนสุข อ.พนมไพร นาย วัชระ เอี่ยมรัศมีกุล
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 30370
ที่ตั้ง : 13 แสนสุข พนมไพร ร้อยเอ็ด 08 2357 2499 45140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 239/2564 (ปลูก)
284 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเกษตรทางเลือกใหม่ไทยสมบูรณ์ หมู่ 12 ต.พนมไพร อ.พนมไพร นาย วัชระ เอี่ยมรัศมีกุล
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13968
ที่ตั้ง : 12 พนมไพร พนมไพร ร้อยเอ็ด 08 0198 8515 45140
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 240/2564 (ปลูก)
285 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนอาชีวะรักษ์สมุนไพร นาย วัชระบพิตร บังพิมาย
ชื่อสถานที่ : วิสาหกิจชุมชนอาชีวะรักษ์สมุนไพร
ที่ตั้ง : 17/17 17 นาอุดม โพนทอง ร้อยเอ็ด 08 1208 5882 45110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 241/2564 (ปลูก)
286 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนทับทิมพิลาฟาร์ม นาย อัศราวุธ ใจหาญ
ชื่อสถานที่ : วิสาหกิจชุมชนทับทิมพิลาฟาร์ม
ที่ตั้ง : 208 10 รอบเมือง เมืองร้อยเอ็ด ร้อยเอ็ด 08 1294 2560 45000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 242/2564 (ปลูก)
287 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรชุมชนดอกไม้ นาง รัตนากร อาจหาญ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 26664
ที่ตั้ง : 2 ดอกไม้ สุวรรณภูมิ ร้อยเอ็ด 08 7545 4634 45130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 243/2564 (ปลูก)
288 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มเลี้ยงไส้เดือนดินดี ตำบลคำพอุง นางสาว ทองหลาง ประชาโชติ
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มเลี้ยงไส้เดือนดินดี ตำบลคำพอุง
ที่ตั้ง : 144 3 คำพอุง โพธิ์ชัย ร้อยเอ็ด 08 2858 1558 45230
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 244/2564 (ปลูก)
289 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์เสลภูมิพอเพียงตามศาสตร์พระราชา บ้านดงประเสริฐ นาย บุญมี โพธิ์สนาม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 53798
ที่ตั้ง : 19 10 ขวัญเมือง เสลภูมิ ร้อยเอ็ด 08 8569 9989 45120
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 245/2564 (ปลูก)
290 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์อำเภอทุ่งเขาหลวง นาย ครรชิต นามไพรสันต์
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรอินทรีย์อำเภอทุ่งเขาหลวง
ที่ตั้ง : 13 9 มะบ้า ทุ่งเขาหลวง ร้อยเอ็ด 09 0192 7900 45170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 246/2564 (ปลูก)
291 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มภูมิปัญญาไทย ม.8 ต.เขาปู่ นาง อุไร คงแสง
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลเขาปู่
ที่ตั้ง : 20 11 เขาปู่ ศรีบรรพต พัทลุง 0 7468 9340 93190
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 247/2564 (ปลูก)
292 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผู้ปลูกข้าว ม.5 ต.นาสนุ่น อ.ศรีเทพ นาย บรรเจิด ปานเงิน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 4216 และ 4218
ที่ตั้ง : ศรีเทพ ศรีเทพ เพชรบูรณ์ 09 3141 5234 67170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 248/2564 (ปลูก)
293 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบริษัทนาดอนฟาร์ม นาย สมมาตร สุขดำ
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลหานโพธิ์
ที่ตั้ง : 34 10 หานโพธิ์ เขาชัยสน พัทลุง 0 7467 3879 93130
ประเภทสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบล (รพสต.)
เลขที่ใบอนุญาต : 249/2564 (ปลูก)
294 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรรักป่าดงขวาง นาย วิจิตร สุวรรณไตรย์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17268
ที่ตั้ง : 9 อาจสามารถ เมืองนครพนม นครพนม 08 7772 7380 48000
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 250/2564 (ปลูก)
295 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกสมุนไพรเพื่อการแปรรูปในชุมชนบ้านท่าควาย นาย วิจิตร สุวรรณไตรย์
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 251/2564 (ปลูก)
296 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับวิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรบ้านนางเลิศ หมู่ที่ 6 นาย ภาณุวัฒน์ ธันยพงศ์พันธุ์
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 252/2564 (ปลูก)
297 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับวิสาหกิจชุมชนปลูกพืชสมุนไพรพึ่งพาตนเองและชุมชน นางสาว พัชรา ดีพรหม
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 253/2564 (ปลูก)
298 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรแบบผสมผสานบ้านศาลา นาย บุญรส พ่อค้าช้าง
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ
ที่ตั้ง : - - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 254/2564 (ปลูก)
299 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนอุดมสมุนไพร นาง สุภัตรา ศรีวรสาร
ชื่อสถานที่ : รายละเอียดระบุตามหมายเหตุ (-)
ที่ตั้ง : - - - - - - -
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 255/2564 (ปลูก)
300 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพัฒนาสมุนไพรครบวงจรอำเภอเวียงหนองล่อง นาย สุเทพ สมบูรณ์ชัย
ที่ตั้ง : 371 6 วังผาง เวียงหนองล่อง ลำพูน
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 256/2564 (ปลูก)เขตคันนายาว
เขตคันนายาว ขอเรียนเชิญชวนนำสัตว์เลี้ยง เข้ารับบริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้บริการฟรี ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว ร่วมกับ ศูนย์บริการสาธารณสุข 69 คันนายาว สำนักอนามัย ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสัตว์เลี้ยง ให้บริการฟรี (free) สอบถามข้อมูลเพิ่มเติม ▫️ศูนย์บริการสาธารณสุข 69 คันนายาว โทร 02 379 8911-2 ▫️ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว โทร 02-3799945
Green Heaven Dispensary
ร้านตั้งอยู่ ลาดพร้าว128 ติดริมถนนใหญ่ ร้านมีใบอนุญาต เจ้าของร้านเป็นแพทย์แผนไทยให้คำแนะนำได้
เทศบาลนครระยอง กิจกรรมทำหมันสุนัขและแมวจรจัด ฟรี LINK
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง และสำนักงานปศุสัตว์จังหวัดระยอง จัดกิจกรรมบริการผ่าตัดทำหมัน สุนัขและแมว ฟรี โดยไม่เสียค่าใช้จ่าย ในพื้นที่เทศบาลระยอง ดังนี้
- ครั้งที่ 1 วันที่ 14 พฤษภาคม 2567 เวลา 13.00 - 16.00 น. ณ ลานจอดรถหลังตลาดสตาร์ เริ่มลงทะเบียน เวลา 13.00 - 15.00 น.
- ครั้งที่ 2 วันที่ 21 พฤษภาคม 2567 เวลา 8.30 - 12.00 น. ณ ที่ทำการชุมชนพูนไฉ่ เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 3 วันที่ 11 มิถุนายน 2567 เวลา 8.30 - 12.00 น. ณ ศาลาริมน้ำ - ท่าเกตุ เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 4 วันที่ 24 มิถุนายน 2567 เวลา 8.30 - 12.00 น. ณ วัดตรีรัตนาราม เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
เงื่อนไขควรทราบ
- จำกัดบ้านละ 1 ตัว เฉพาะผู้่อยู๋ในเขต ทน.ระยอง เท่านั้น
- สุนัขและแมวที่เข้าผ่าตัดจะต้องมีสุขภาพดี ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
- ต้องงดน้ำและอาหาร อย่างน้อย 8 ชม. ก่อนผ่าตัด
- สำหรับสุนัขและแมวขนาดเล็กหรือพันธุ์หน้าสั้น แนะนำให้ทำหมันที่สถานพยาบาลสัตว์ เนื่องจากมีความเสี่ยงในเรื่องการวางยาสลบ
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการ จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305
เทศบาลตำบลพลา ระยอง เปิดลงทะเบียนทำหมันสุนัขและแมว
9 พฤษภาคม 2567 เทศบาลตำบลพลา จ.ระยอง บริการฉีดวัคซีนและทำหมันสุนัข-แมว (ฟรี) จำนวน 50 ตัว
เทศบาลตำบลพลา โดยกองสาธารณสุขและสิ่งแวดล้อม แจ้งให้บริการฉีดวัคซีนและทำหมันสุนัข-แมว (ฟรี) จำนวน 50 ตัว สำหรับการทำหมัน ในวันพฤหัสบดีที่ 9 พฤษภาคม 2567 ตั้งแต่เวลา 8.30-12.00 น. ณ บริเวณด้านหน้าสำนักงานเทศบาลตำบลพลา ลงทะเบียนเพื่อขอรับบริการได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลพลา ตั้งแต่บัดนี้ จนถึงวันที่ 3 พฤษภาคม 2567 สอบถามรายละเอียดเพิ่มเติมได้ที่หมายเลขโทรศัพท์ 038-630998
11 มิถุนายน 2567 เทศบาลนครระยอง ทำหมันหมาแมว ฟรี ณ ศาลาริมน้ำ - ท่าเกตุ
กิจกรรมทำหมันสุนัขและแมวจรจัด เทศบาลนครระยอง (ครั้งที่ 3) เทศบาลนครระยองและสำนักงานปศุสัตว์จังหวัดระยอง
ขอเชิญชวนนำสุนัขและแมวเข้ารับบริการผ่าตัดทำหมัน โดยไม่เสียค่าใช้จ่าย ณ ศาลาริมน้ำ - ท่าเกตุในวันที่ 11 มิถุนายน 2567 เวลา 8.30 - 12.00 น.เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- จำกัดบ้านละ 1 ตัว เฉพาะผู้่อยู๋ในเขต ทน.ระยอง เท่านั้น
- สุนัขและแมวที่เข้าผ่าตัดจะต้องมีสุขภาพดี ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
- ต้องงดน้ำและอาหาร อย่างน้อย 8 ชม. ก่อนผ่าตัด
- สำหรับสุนัขและแมวขนาดเล็กหรือพันธุ์หน้าสั้น แนะนำให้ทำหมันที่สถานพยาบาลสัตว์ เนื่องจากมีความเสี่ยงในเรื่องการวางยาสลบ
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข สามารถติดต่อได้ในวันและเวลาราชการจ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น. เบอร์ติดต่อ 038-612305 (
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง)
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตภาษีเจริญ
*HealthServ.net เป็นสื่อกลางในการเผยแพร่ข้อมูลนี้ไปสู่ผู้ชมเท่านั้น ไม่ได้เป็นไปเพื่อการค้า และไม่ได้เป็นเจ้าลิขสิทธิ์ของเนื้อหา 22 พฤษภาคม 64 เวลา 14.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมา 83,000 ราย ขยับจากเมื่อวานนิดเดียว
ส่วนกรุงเทพเพิ่ม ประมาณ 19,000 ราย เพิ่มนิดเดียวเช่นกัน
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 301-350
301 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเรณูใต้ นาง สุภาณี สารทอง
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 38810
ที่ตั้ง : เรณูใต้ เรณูนคร นครพนม 09 3424 1765 48170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 257/2564 (ปลูก)
302 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกไม้ไผ่และแปรรูป นาย กิตติเชษฐ์ ธีรกุลพงศ์เวช
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 38056
ที่ตั้ง : 4 นาหว้า นาหว้า นครพนม 09 4804 0360 48180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 258/2564 (ปลูก)
303 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์ท่าอยู่ นาย พิเชฐ เจ๊ะโส๊ะ
ชื่อสถานที่ : โฉนดตราจอง เลขที่ 9 เล่มที่ 1 หน้าที่ 9
ที่ตั้ง : ท่าอยู่ ตะกั่วทุ่ง พังงา 08 8167 5170 82130
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 259/2564 (ปลูก)
304 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรรุ่นใหม่อำเภอเมืองเชียงราย นาย พิภพ ดวงมา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 6050
ที่ตั้ง : 9 บ้านดู่ เมืองเชียงราย เชียงราย 08 6516 5433 57100
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 260/2564 (ปลูก)
305 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปราการ นาย นเรศฤทธิ์ ขัดธะสีมา
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรปราการ
ที่ตั้ง : 200/31 1 สุขุมวิท บางปูใหม่ เมืองสมุทรปราการ สมุทรปราการ 09 2626 2659 10280
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 261/2564 (ปลูก)
306 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปราการ นาย นเรศฤทธิ์ ขัดธะสีมา
ชื่อสถานที่ : สำนักงานสาธารณสุขจังหวัดสมุทรปราการ
ที่ตั้ง : 19 35 อัศวนนท์ 2 สุขุมวิท ปากน้ำ เมืองสมุทรปราการ สมุทรปราการ 0 2389 5980 ต่อ 232 10270
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 262/2564 (ปลูก)
307 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนแปรรูปสมุนไพรไทย (ไทยสปา) นาย อัศราวุธ ใจหาญ
ชื่อสถานที่ : วิสาหกิจชุมชนแปรรูปสมุนไพรไทย (ไทยสปา)
ที่ตั้ง : 199 6 โคกล่าม จตุรพักตรพิมาน ร้อยเอ็ด 08 5199 5140 45180
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 263/2564 (ปลูก)
308 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรผสมผสานและการเกษตรเพื่อชุมชนบ้านโพธิ์เงิน นาย กัมปนาท โกวิทางกูร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 9399
ที่ตั้ง : โพธิ์ศรีสว่าง โพนทอง ร้อยเอ็ด 08 4030 3599 45110
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 264/2564 (ปลูก)
309 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนหมอยาฟาร์ม นาย กัมปนาท โกวิทางกูร
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 30502
ที่ตั้ง : 16 นิเวศน์ ธวัชบุรี ร้อยเอ็ด 08 6596 1789 45170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 265/2564 (ปลูก)
310 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนหมอยาฟาร์ม นาย ประกาศ เจริญราษฎร์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 30502
ที่ตั้ง : 16 นิเวศน์ ธวัชบุรี ร้อยเอ็ด 08 6596 1789 45170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 266/2564 (ปลูก)
311 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์และสุขภาพวังน้อยเมืองใหม่ นาย สุนทร โรจน์สุริยาวงศ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17943
ที่ตั้ง : ลำตาเสา วังน้อย พระนครศรีอยุธยา 06 4515 9559 13170
ประเภทสถานที่ : หน่วยงานของรัฐ
เลขที่ใบอนุญาต : 1/2565 (ปลูก)
312 ชื่อผู้รับอนุญาต : มหาวิทยาลัยวลัยลักษณ์ นางสาว พจมาลย์ สุรนิลพงศ์
ชื่อสถานที่ : มหาวิทยาลัยวลัยลักษณ์
ที่ตั้ง : 222 10 ไทยบุรี ท่าศาลา นครศรีธรรมราช 0 7567 2303 80160
ประเภทสถานที่ :
เลขที่ใบอนุญาต : นศ 1/2565 (ป-ว)
313 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรอินทรีย์ นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 55841
ที่ตั้ง : บ้านกิ่ว แม่ทะ ลำปาง 08 9126 7289 52150
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ลป 1/2565 (ป)
314 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก วิสาหกิจชุมชนนงนุชพัทยาการ์เด้นดีไซน์ นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนนงนุชพัทยาการ์เด้นดีไซน์
ที่ตั้ง : 82/8 8 นาจอมเทียน สัตหีบ ชลบุรี 08 9747 5978 20250
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ชบ 1/2565 (ป)
315 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชน NYNO SAMUI นาง ดวงพร บุญมี
ชื่อสถานที่ : วิสาหกิจชุมชน NYNO SAMUI
ที่ตั้ง : 123 3 บ่อผุด เกาะสมุย สุราษฎร์ธานี 892142999 84320
ประเภทสถานที่ :
เลขที่ใบอนุญาต : สฎ 1/2565 (ป)
316 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนท่าขอนยางรักษ์ไพร นางสาว จิรพรรณ ช่อประพันธ์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 60469
ที่ตั้ง : 1 ท่าขอนยาง กันทรวิชัย มหาสารคาม 816702467 44150
ประเภทสถานที่ :
เลขที่ใบอนุญาต : มค 1/2565 (ป)
317 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชน พืชสมุนไพรหาดเล็ก นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3133
ที่ตั้ง : 2 หาดเล็ก คลองใหญ่ ตราด 06 1662 9929 23110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ตร 1/2565 (ป)
318 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มคลองปูนรักษ์สมุนไพร นาย ยอดรัก รัตนคุณ
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มคลองปูนรักษ์สมุนไพร
ที่ตั้ง : 222 2 คลองปูน แกลง ระยอง 08 0093 3288 21170
ประเภทสถานที่ :
เลขที่ใบอนุญาต : รย 1/2565 (ป)
319 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนรักษ์สมุนไพรตำบลสีแก้ว นาย อินทนนท์ อินทนพ
ชื่อสถานที่ : สถานีอนามัยเฉลิมพระเกียรติ 60 พรรษา นวมินทราชินี บ้านสีแก้ว
ที่ตั้ง : 222 5 สีแก้ว เมืองร้อยเอ็ด ร้อยเอ็ด 0 4365 4723 45000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : รอ 1/2565 (ป)
320 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนคนรักบ้านโพธิ์ นาย เอนก ล้อมวงษ์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านโพธิ์
ที่ตั้ง : 9/9 1 บ้านโพธิ์ เมืองสุพรรณบุรี สุพรรณบุรี 0 3545 1225 72000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : สพ 1/2565 (ป)
321 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพรทางการแพทย์และท่องเที่ยวท่าบ่อ นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนปลูกพืชสมุนไพรทางการแพทย์และท่องเที่ยวท่าบ่อ
ที่ตั้ง : 182 2 บ้านถ่อน ท่าบ่อ หนองคาย 09 8615 1996 43110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : นค 1/2565 (ป)
322 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรและท่องเที่ยวเชิงสุขภาพ (ภูเก็ต) นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรและท่องเที่ยวเชิงสุขภาพ (ภูเก็ต)
ที่ตั้ง : 266 เดชาณรงค์ เยาวราช ตลาดใหญ่ เมืองภูเก็ต ภูเก็ต 09 3640 5554 83000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ภก 1/2565 (ป)
323 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนคนรักหนองหมากฝ้าย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17399
ที่ตั้ง : 3 หนองหมากฝ้าย วัฒนานคร สระแก้ว 06 1878 2951 และ 06 4879 5495 27160
ประเภทสถานที่ :
เลขที่ใบอนุญาต : สก 1/2565 (ป)
324 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 386 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
325 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 179 4 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
326 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 168 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
327 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 3 4 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
328 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 92 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
329 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 287 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
330 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 187 6 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
331 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 288 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
332 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 58 7 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
333 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502
ที่ตั้ง : 124 2 บ้านจีต กู่แก้ว อุดรธานี - 41130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อด 1/2565 (ป)
334 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 97 2 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
335 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 2 7 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
336 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 309 7 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
337 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 31 5 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
338 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 117 6 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
339 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี)
ที่ตั้ง : 240 7 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
340 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกู่แก้วพาเจริญ นาย ชินวัฒน์ เดชวงษา
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 8502 (อุดรธานี )
ที่ตั้ง : 16 4 บ้านจีต กู่แก้ว อุดรธานี
เลขที่ใบอนุญาต : อด 1/2565 (ป)
341 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนบ้านแก่งแหล่งเรียนรู้การผลิตพริกไทยดำและปุ๋ยอินทรีย์ นาย ฑีรพล แว่นแก้ว
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 4249 (นครสวรรค์)
ที่ตั้ง : 10 บ้านแก่ง เมืองนครสวรรค์ นครสวรรค์
เลขที่ใบอนุญาต : นว 1/2565 (ป)
342 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนศูนย์ผลิตเมล็ดพันธุ์ข้าวชุมชนบ้านไร่เจริญ นาย วิรัตน์ ยิ้มมี
ชื่อสถานที่ : วิสาหกิจชุมชนศูนย์ผลิตเมล็ดพันธ์ข้าวชุมชนบ้านไร่เจริญ (อุตรดิตถ์)
ที่ตั้ง : 171 7 บ้านโคน พิชัย อุตรดิตถ์
เลขที่ใบอนุญาต : อต 1/2565 (ป)
343 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเครือนอนนา นาย วิโรจน์ กอบางยาง
ชื่อสถานที่ : วิสาหกิจชุมชนเครือนอนนา (กาฬสินธุ์)
ที่ตั้ง : 275 13 กุดสิมคุ้มใหม่ เขาวง กาฬสินธุ์
เลขที่ใบอนุญาต : กส 1/2565 (ป)
344 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชสมุนไพรและผลไม้ปลอดสารพิษบ้านน้ำตก นาง ญาพณิดา แย้มวัตร
ชื่อสถานที่ : ตามโฉนดที่ดินเลขที่ 23557 (อุทัยธานี)
ที่ตั้ง : 1 สะแกกรัง เมืองอุทัยธานี อุทัยธานี
เลขที่ใบอนุญาต : อน 1/2565 (ป)
345 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรนาคาทิพย์ นาย เทวัญ ธานีรัตน์ ประเภทคำขอ : เพื่อใช้ทางการแพทย์ ชื่อสถานที่ : ตามโฉนดที่ดิน นค.3 12116 (บึงกาฬ) ที่ตั้ง : 7 โนนศิลา ปากคาด บึงกาฬ เลขที่ใบอนุญาต : บก 1/2565 (ป)
346 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนโยโกะ ฟาร์มเกษตร สมุนไพร นาย เทวัญ ธานีรัตน์ ประเภทคำขอ : เพื่อใช้ทางการแพทย์ ชื่อสถานที่ : วิสาหกิจชุมชนโยโกะฟาร์มเกษตรสมุนไพร (กาญจนบุรี) ที่ตั้ง : 148 1 ลุ่มสุ่ม ไทรโยค กาญจนบุรี เลขที่ใบอนุญาต : กจ 1/2565 (ป)
347 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรไทยทีเอ็นเฮช (TNH) นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 57418 (นครราชสีมา)
ที่ตั้ง : ในเมือง เมืองนครราชสีมา นครราชสีมา
เลขที่ใบอนุญาต : นม 1/2565 (ป)
348 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก วิสาหกิจชุมชนนิวไฮมุกดาหาร นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 5199 เล่มที่ 52 หน้า 49 (มุกดาหาร)
ที่ตั้ง : ตาดแคน มุกดาหาร เมืองมุกดาหาร มุกดาหาร
เลขที่ใบอนุญาต : มห 1/2565 (ป)
349 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนนวตกรรมเกษตรแกมบิส นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนนวตกรรมเกษตรแกมบิส (ประจวบคีรีขันธ์)
ที่ตั้ง : 37/48 หินเหล็กไฟ หัวหิน ประจวบคีรีขันธ์
เลขที่ใบอนุญาต : ปข 1/2565 (ป)
350 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรทางการแพทย์กุดชุม นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรทางการแพทย์กุดชุม (ยโสธร)
ที่ตั้ง : 222 7 กุดชุม กุดชุม ยโสธร
เลขที่ใบอนุญาต : ยส 1/2565 (ป)
เขตบางแค LINK
เขตบางแค เปิดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า น้องหมา น้องแมว ฟรี
สำนักงานเขตบางแค ร่วมกับ ศูนย์บริการสาธารณสุข 40 บางแค สำนักอนามัย กรุงเทพมหานคร ออกหน่วยรณรงค์บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สัตว์เลี้ยง เช่น สุนัข แมวอายุตั้งแต่ 3 เดือนขึ้นไป ในพื้นที่เขตบางแค โดยไม่เสียค่าใช้จ่าย ตามชุมชนต่างๆ ในพื้นที่เขตบางแค
ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ
ศูนย์บริการสาธารณสุข ห้าสิบเจ็ด บุญเรือง ล้ำเลิศ ขอประชาสัมพันธ์การให้บริการฉีดวัคซีนพิษสุนัขบ้า ประจำเดือนกันยายน 2567
รายละเอียดตามตาราง
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตตลิ่งชัน
ชัยนาท - มาจาก 8 จว. ทำบันทึกเข้าออก ประเมินความเสี่ยง กัก/ไม่กัก 14 วัน LINK
12 เมษายน 2564
ประกาศพื้นที่ควบคุมสูงสุด พื้นที่ควบคุม และพื้นที่ที่มีการระบาดต่อเนื่อง เพื่อกำหนดมาตรการเฝ้าระวัง ป้องกัน และควบคุมโรคติดเชื้อไวรัสโคโรน่า 2019 (โควิด-19)
มาจาก 8 จังหวัดควบคุมและระบาดต่อเนื่อง - กทม ปทุมธานี นนทบุรี นครปฐม สมุทรสาคร สมุทรปราการ เชียงใหม่ ชลบุรี
1. ทำบันทึกเข้าออกพื้นที่ ผ่าน
Chainat to go ก่อนเดินทางทุกครั้ง
2. ทำแบบประเมินความเสี่ยง
3. หากผลประเมินเสี่ยงสูง ต้องตรวจหาภูมิคุ้มกัน หรือ ตรวจหาเชื้อโควิดก่อนเข้าที่พำนัก หรือ กักตัวที่บ้าน (Self quarantine) 14 วัน หรือเท่าจำนวนวันพักในจังหวัด
4. หากผลประเมินไม่เสี่ยง ให้คงมาตรการ D-M-H-T-T
สสจ.ชัยนาท 056 405 518
21 พฤษภาคม 64 เวลา 14.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมา 79,000 ราย วูบมากมาย
ส่วนกรุงเทพเพิ่ม ประมาณ 14,000 ราย วูบกว่าครึ่งเช่นกัน
ตัวเลขแบบนี้ ไม่ต่างอะไรกับหยุดนิ่ง
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ลำดับ 351-400
351 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนกลุ่มข้าวหอมมะลิบ้านหนองโดน นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17085
ที่ตั้ง : 5 หนองโดน ลำปลายมาศ บุรีรัมย์ 08 8595 9297 31130
ประเภทสถานที่ :
เลขที่ใบอนุญาต : บร 1/2565 (ป)
352 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเกษตรดอนชาดพืชปลอดภัย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรดอนชาดพืชปลอดภัย
ที่ตั้ง : 208 3 บุ่งหวาย วารินชำราบ อุบลราชธานี 08 4960 4448 34310
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อบ 1/2565 (ป)
353 ชื่อผู้รับอนุญาต : กรมวิทยาศาสตร์การแพทย์ นาง มธุรส ทาทอง
ชื่อสถานที่ : ศูนย์วิทยาศาสตร์การแพทย์ที่ 10 อุบลราชธานี
ที่ตั้ง : 82 11 คลังอาวุธ ขามใหญ่ เมืองอุบลราชธานี อุบลราชธานี 0 4531 2232 34000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อบ 1/2565 (ป-ว)
354 ชื่อผู้รับอนุญาต : วิสาหกิจชุมชน เกษตรกรยุคใหม่บ้านหาดตุ่น นาง อรุวรรณ แสงพยับ
ชื่อสถานที่ : น.ส.3 ก. เลขที่ 105 เล่ม 2ก หน้า 5
ที่ตั้ง : 28 10 ปากจั่น กระบุรี ระนอง 936357456 85110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : รน 1/2565 (ป)
355 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์ตำบลรูสะมิแล นาย แวอารีเฟ็น และมะลี
ชื่อสถานที่ : วิสาหกิจชุมชนสมุนไพรเพื่อการแพทย์ตำบลรูสะมิแล
ที่ตั้ง : 99 1 รูสะมิแล เมืองปัตตานี ปัตตานี 081-8964323 94000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ปน 1/2565 (ป)
356 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนผลิตผลจากธรรมชาติ นาง สมยงค์ ทุ่งสาร
ชื่อสถานที่ : วิสาหกิจชุมชนผลิตผลจากธรรมชาติ
ที่ตั้ง : 31/23 3 ศาลายา-นครชัยศรี มหาสวัสดิ์ พุทธมณฑล นครปฐม 08 6600 9686 73170
ประเภทสถานที่ :
เลขที่ใบอนุญาต : นฐ 1/2565 (ป)
357 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพัฒนาสมุนไพรลำพูน นาง มณีรัตน์ กัณธิยะ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 138117
ที่ตั้ง : 138118 138119 138120 หนองช้างคืน เมืองลำพูน ลำพูน
ประเภทสถานที่ : 841704047
เลขที่ใบอนุญาต :
358 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรเพื่อสุขภาพนาไม้ไผ่ นาย ปราโมทย์ เดชะราช
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 15248
ที่ตั้ง : นาไม้ไผ่ ทุ่งสง นครศรีธรรมราช 08 1326 4881 80110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : นศ 1/2565 (ป)
359 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสมุนไพรต้นบุญ นาง สุภาวดี นันทะเสน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 2428
ที่ตั้ง : หนองครก เมืองศรีสะเกษ ศรีสะเกษ 0 8173 9039-2 33000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ศก 1/2565 (ป)
360 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชเศรษฐกิจและพลังงาน ต.ยี่ล้น นางสาว สุรินทร์ ประมวลสุข
ชื่อสถานที่ : วิสาหกิจชุมชนพืชเศรษฐกิจและพลังงาน ต.ยี่ล้น
ที่ตั้ง : 125/10 2 ยี่ล้น วิเศษชัยชาญ อ่างทอง 09 1892 6635 14110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : อท 1/2565 (ป)
361 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนสามภู นาง บุญรวม ใจกล้า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 44331
ที่ตั้ง : หนองศาลา ชะอำ เพชรบุรี 08 4911 5616 76120
ประเภทสถานที่ :
เลขที่ใบอนุญาต : พบ 1/2565 (ป)
362 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนชีววิถีตำบลน้ำเกี๋ยน นางสาว ศิรินันท์ สารมณฐี
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 9201
ที่ตั้ง : น้ำแก่น เมืองน่าน น่าน 0 5471 9420 55000
ประเภทสถานที่ :
เลขที่ใบอนุญาต : นน 1/2565 (ป)
363 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนใบตองคลองกระจง นาย สังวร ทองงาม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 12589
ที่ตั้ง : คลองกระจง สวรรคโลก สุโขทัย 08 9641 5319 64110
ประเภทสถานที่ :
เลขที่ใบอนุญาต : สท 1/2565 (ป)
364 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรก้าวหน้า ว่าที่ร้อยตรี พีระ สีปานเงิน
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 27587
ที่ตั้ง : ตาลเตี้ย เมืองสุโขทัย สุโขทัย 06 1901 9675 64220
ประเภทสถานที่ :
เลขที่ใบอนุญาต : สท 2/2565 (ป)
365 ชื่อผู้รับอนุญาต : วิสาหกิจชุมชน กะทู้เกษตรผสมผสาน นาย ภานุวัฒน์ จันทรวิภาดา
ชื่อสถานที่ : วิสาหกิจชุมชนกะทู้เกษตรผสมผสาน
ที่ตั้ง : 18/241 สี่กอ 6 วิชิตสงคราม กะทู้ กะทู้ ภูเก็ต 818356310 83120
ประเภทสถานที่ :
เลขที่ใบอนุญาต : ภก 2/2565 (ป)
366 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนพืชเศรษฐกิจพลังงานตำบลบางจักและคลองขนาก นาง สมจิตร์ ขุนสุข
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 801 เล่มที่ 9 หน้า 444 (อ่างทอง)
ที่ตั้ง : 88/2 5 บางจัก วิเศษชัยชาญ อ่างทอง
เลขที่ใบอนุญาต : อท 2/2565 (ป)
367 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเงินยวงสมุย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 39175 (สุราษฎร์ธานี)
ที่ตั้ง : 4 แม่น้ำ เกาะสมุย สุราษฎร์ธานี
เลขที่ใบอนุญาต : สฎ 2/2565 (ป)
368 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนแปรรูปผลผลิตทางการเกษตรและพืชสมุนไพรตำบลริมปิง นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนแปรรูปผลผลิตทางการเกษตรและพืชสมุนไพรตำบลริมปิง (ลำพูน)
ที่ตั้ง : 66 จามเทวี 7 ริมปิง เมืองลำพูน ลำพูน
เลขที่ใบอนุญาต : ลพ 2/2565 (ป)
369 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพร ม.2 ต.กำแพง นาย ณรงค์ วราพุฒ
ชื่อสถานที่ : วิสาหกิจชุมชนปลูกพืชสมุนไพร ม.2 ต.กำแพง (ศรีสะเกษ)
ที่ตั้ง : 123 2 กำแพง อุทุมพรพิสัย ศรีสะเกษ
เลขที่ใบอนุญาต : ศก 2/2565 (ป)
370 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเรือนไทยเมล่อนและพืชปลอดภัย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 17088 และ 17089 (อุบลราชธานี)
ที่ตั้ง : 11 หัวดอน เขื่องใน อุบลราชธานี
เลขที่ใบอนุญาต : อบ 2/2565 (ป)
371 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนวังโพธิ์พัฒนา นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตาม น.ส.3 ก เลขที่ 702 เล่มที่ 8ก. หน้า 2 (กาญจนบุรี)
ที่ตั้ง : 1 ลุ่มสุ่ม ไทรโยค กาญจนบุรี
เลขที่ใบอนุญาต : กจ 2/2565 (ป)
วันที่อนุมัติ : 25 กุมภาพันธ์ 2565
372 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนบ้านทิพสมุนไพรไทยเพื่อการแปรรูป นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนบ้านทิพสมุนไพรไทยเพื่อการแปรรูป (บุรีรัมย์)
ที่ตั้ง : 95 21 ชุมเห็ด เมืองบุรีรัมย์ บุรีรัมย์
เลขที่ใบอนุญาต : บร 2/2565 (ป)
373 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเกษตรอินทรีย์เพื่อสุขภาพทุ่งแต้ นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนเกษตรอินทรีย์เพื่อสุขภาพทุ่งแต้ (ยโสธร)
ที่ตั้ง : 157 1 ทุ่งแต้ เมืองยโสธร ยโสธร
เลขที่ใบอนุญาต : ยส 2/2565 (ป)
374 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก วิสาหกิจชุมชนสมุนไพร Herb tone ภูมโนรมย์ นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชน สมุนไพร Herb tone ภูมโนรมย์ (มุกดาหาร)
ที่ตั้ง : 99/9 6 คำอาฮวน เมืองมุกดาหาร มุกดาหาร
เลขที่ใบอนุญาต : มห 2/2565 (ป)
375 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรไทยทุ่งทะเลโคราช นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 57418 (นครราชสีมา)
ที่ตั้ง : ในเมือง เมืองนครราชสีมา นครราชสีมา
เลขที่ใบอนุญาต : นม 2/2565 (ป)
376 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนดอนขวางพัฒนา " นางสาว ณฐมน ชูศักดิ์
ชื่อสถานที่ : วิสาหกิจชุมชนดอนขวางพัฒนา (อุทัยธานี)
ที่ตั้ง : 80 3 ดอนขวาง เมืองอุทัยธานี อุทัยธานี
เลขที่ใบอนุญาต : อน 2/2565 (ป)
377 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนยางพาราเหล่าทอง นาง ปิยะรัตน์ ระดาฤทธิ์
ชื่อสถานที่ : วิสาหกิจชุมชนยางพาราเหล่าทอง (บึงกาฬ)
ที่ตั้ง : 65 10 เหล่าทอง โซ่พิสัย บึงกาฬ
เลขที่ใบอนุญาต : บก 2/2565 (ป)
378 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนไร่พญาน้อย นาย เฉลิมพล นิมิตรพรชัย
ชื่อสถานที่ : วิสาหกิจชุมชนไร่พญาน้อย (นครสวรรค์)
ที่ตั้ง : 142 12 หนองกรด เมืองนครสวรรค์ นครสวรรค์
เลขที่ใบอนุญาต : นว 2/2565 (ป)
379 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนคนรักหนองหมากฝ้าย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 22732 (สระแก้ว)
ที่ตั้ง : 7 หนองหมากฝ้าย วัฒนานคร สระแก้ว
เลขที่ใบอนุญาต : สก 2/2565 (ป)
380 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนนาคาเกษตรริมโขงหนองคาย นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 15538 (หนองคาย)
ที่ตั้ง : 2 หาดคำ เมืองหนองคาย หนองคาย
เลขที่ใบอนุญาต : นค 2/2565 (ป)
381 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มสมุนไพรเกษตรอินทรีย์ตำบลหนองฮี นาง รจนา หลวงสนาม
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 9506 (ร้อยเอ็ด)
ที่ตั้ง : 16 หนองฮี หนองฮี ร้อยเอ็ด
เลขที่ใบอนุญาต : รอ 2/2565 (ป)
382 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรบ้านนาซา นาย บุญเริ่ม โอทาน
ชื่อสถานที่ : วิสาหกิจชุมชนกลุ่มปลูกพืชสมุนไพรบ้านนาซา (ระยอง)
ที่ตั้ง : 888 4 ปากน้ำกระแส แกลง ระยอง
เลขที่ใบอนุญาต : รย 2/2565 (ป)
383 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนเกษตรปลอดภัยจังหวัดตราด นางสาว ชนันรัตน์ ฉิมผกา
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลหนองเสม็ด (ตราด)
ที่ตั้ง : 149 4 หนองเสม็ด เมืองตราด ตราด
เลขที่ใบอนุญาต : ตร 2/2565 (ป)
384 ชื่อผู้รับอนุญาต : มหาวิทยาลัย เทคโนโลยีราชมงคลสุวรรณภูมิ นาย ปิติชน เปี่ยมบริบูรณ์
ชื่อสถานที่ : ศูนย์เทคโนโลยีเกษตรและนวัตกรรม (AIC) จังหวัดสุพรรณบุรี มหาวิทยาลัย เทคโนโลยีราชมงคลสุวรรณภูมิ ศูนย์สุพรรณบุรี (สุพรรณบุรี)
ที่ตั้ง : 450 สุพรรณบุรี-ชัยนาท ย่านยาว สามชุก สุพรรณบุรี
เลขที่ใบอนุญาต : สพ 2/2565 (ป)
385 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 36 11 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
386 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 36 11 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
387 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 19 11 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
388 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 73 6 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
389 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 222 3 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
390 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 105 6 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
391 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 319 13 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
392 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 189 13 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
393 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 121 6 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
394 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนกลุ่มปลูกผักปลอดสารพิษบ้านเชียง นาย จันทร์ โฮมป่า
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 13852 (อุดรธานี)
ที่ตั้ง : 10 13 บ้านเชียง หนองหาน อุดรธานี
เลขที่ใบอนุญาต : อด 2/2565 (ป)
395 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชเศรษฐกิจและสมุนไพรบ้านดอนข่า นาง รัชนีกร คำนวนอินทร์์
ชื่อสถานที่ : โรงพยาบาลส่งเสริมสุขภาพตำบลบ้านโคกประสิทธิ์ (กาฬสินธุ์)
ที่ตั้ง : - - - 12 โคกสะอาด ฆ้องชัย กาฬสินธุ์
เลขที่ใบอนุญาต : กส 2/2565 (ป)
396 ชื่อผู้รับอนุญาต : สำนักงานปลัดกระทรวงสาธารณสุข ร่วมกับ วิสาหกิจชุมชนปลูกพืชสมุนไพร และพืชเศรษฐกิจดูนลำพัน พันจ่าโท คุณากร เจียมใจ
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 42601 (มหาสารคาม)
ที่ตั้ง : นาเชือก นาเชือก มหาสารคาม
เลขที่ใบอนุญาต : มค 2/2565 (ป)
397 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนเหมืองทอง นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : วิสาหกิจชุมชนเหมืองทอง (ชลบุรี)
ที่ตั้ง : 44/44 4 เหมือง เมืองชลบุรี ชลบุรี
เลขที่ใบอนุญาต : ชบ 2/2565 (ป)
398 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อสุขภาพคลองนกกระทุง นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 3701 , 3702 , 3703 (นครปฐม)
ที่ตั้ง : 11 คลองนกกระทุง บางเลน นครปฐม
เลขที่ใบอนุญาต : นฐ 2/2565 (ป)
399 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรออร์แกนิค สปา นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 43652 (สุพรรณบุรี)
ที่ตั้ง : 10 เดิมบาง เดิมบางนางบวช สุพรรณบุรี
เลขที่ใบอนุญาต : สพ 3/2565 (ป)
400 ชื่อผู้รับอนุญาต : กรมการแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับ วิสาหกิจชุมชนสมุนไพรเพื่อการแปรรูป นาย เทวัญ ธานีรัตน์
ชื่อสถานที่ : ตามโฉนดที่ดิน เลขที่ 1401 (ชลบุรี)
ที่ตั้ง : 1 บ่อทอง บ่อทอง ชลบุรี
เลขที่ใบอนุญาต : ชบ 3/2565 (ป)
เขตจตุจักร
สำนักงานเขตจตุจักร ร่วมศูนย์บริการสาธารณสุข 51 จตุจักร จัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยงในพื้นที่เขตจตุจักร จึงขอเชิญชวนประชาชนนำสัตว์เลี้ยงลูกด้วยนม ได้แก่ สุนัข แมว และกระต่าย ที่มีสุขภาพแข็งแรง อายุ 3 เดือนขึ้นไป ไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนฯ เคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่าย ตั้งแต่วันที่ 13 -17 มีนาคม และ 20-24 มีนาคม 2566 ตามวันและเวลาดังตาราง
สามารถสอบถามรายละเอียดเพิ่มเติม
ได้ที่ศูนย์บริการสาธารณสุข 51 จตุจักร
เบอร์ 022798972, 0955264096
บัญชีเครือข่าย หน่วยบริการในกทม. เขต เขตทวีวัฒนา
พิจิตร - จาก 15 จว. กักตัว+สแกน QR LINK
12 เม.ย.64
คกก.โรคติดต่อจังหวัดพิจิตร เห็นชอบปรับมาตรการป้องกันโควิด-19 ให้สอดคล้องกับการแพร่ระบาดที่มีแนวโน้มสูงขึ้น มาตรการสำหรับผู้เดินทางเข้าจังหวัดพิจิตร ดังนี้
1. กรณีประชาชนทั่วไปทุกคนจากทุกจังหวัดที่เดินทางเข้าพิจิตร ต้องลงทะเบียนผ่านลิงค์
ปกป้องพิจิตร และติดตั้งใช้งานแอป หมอชนะ และ Home Quarantine
2. ผู้เดินทางจาก15 จังหวัด ได้แก่ กรุงเทพ เชียงใหม่ ชลบุรี สมุทรปราการ ประจวบคีรีขันธ์ สมุทรสาคร ปทุมธานี สระแก้ว นนทบุรี นครปฐม ภูเก็ต ระยอง สุพรรณบุรี นครสวรรค์ และจังหวัดพิษณุโลก ปฏิบัติ ดังนี้
- ลงทะเบียนผ่านลิงค์ ปกป้องพิจิตร
- โหลดใช้งานแอป หมอชนะ และ Home Quarantine
- รายงานตัวกับกำนัน ผญบ.อสม.ในพื้นที่กักตัวอยู่บ้านตามวันเวลาที่อยู่จริง
- หากมาจากสถานที่เสี่ยง เช่น สถานบันเทิง ติดต่อขอตรวจได้ที่โรงพยาบาลทุกแห่ง
สสจ.พิจิตร 056-990-354-7
20 พฤษภาคม 64 เวลา 14.00 น.
รายงานตัวเลขโดยรวมวันนี้ เพิ่มมา 166,000 ราย เพิ่มจากเมื่อวานเล็กน้อย
การขยับเข้าใกล้ 50% ของยอดรวมผู้มีสิทธิในระยะที่ 2 นี้ ที่ 16 ล้านคน ก็เข้าไปอีกนิด
ส่วนกรุงเทพเพิ่ม ประมาณ 32,000 ราย ดีกว่าเมื่อวานพอสมควร น่ายินดี
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เขตหนองแขม
สำนักงานเขตหนองแขมร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ "กำหนดแผนการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 13 - 24 มีนาคม 2566 ฟรีให้กับประชาชนที่เลี้ยงสุนัขและแมวที่มีอายุตั้งแต่ 3 เดือนขึ้นไป โดยสามารถขอรับบริการ ณ จุดให้บริการหน่วยเคลื่อนที่ได้ ตั้งแต่เวลา 10.00 - 12.00 น.
เทศกาลออกพรรษา (ต่อจากด้านบน)
ดังนั้น ในทุกวันแรม ๑ ค่ำเดือน ๑๑ ของทุกปี ชาวพุทธจึงพร้อมใจกันจัดให้มีการทำบุญตักบาตรให้เหมือนครั้งพุทธกาล เรียกว่า ตักบาตรเทโวโรหณะ โดยทางวัดต่างๆ จะนิมนต์พระภิกษุสงฆ์ขึ้นไปพำนักบนที่สูงของวัดก่อน แล้วเมื่อถึงเวลามงคลฤกษ์จึงค่อยนิมนต์ให้เดินเรียงแถวลงมาจากที่สูงให้ประชาชนทั้งหลายได้มองเห็นและตั้งใจใส่บาตรกันทางเบื้องล่างเลียนแบบภาพการเสด็จลงจากดาวดึงส์ของพระพุทธองค์ สำหรับในประเทศไทย เป็นที่ยอมรับกันว่า งานเทศกาลตักบาตรเทโว ของจังหวัดอุทัยธานี ณ ยอดเขาเล็กๆ ใจกลางวัดสังกัสรัตนคีรีนั้น บรรยากาศทั้งหลายใกล้เคียงดูน่าพิศวง จนชวนให้คิดไปได้ว่าเป็น วันตักบาตรเทโวโรหณะ ในสมัยพุทธกาลนั้นจริงๆ
พิธีกรรมประกอบเทศกาล ออกพรรษา
และนอกจาก การประกอบพิธีมหาปวารณา และการตักบาตรเทโวโรหณะแล้ว ยังมีพิธีกรรมซึ่งวัดและประชาชนนิยมจะประกอบขึ้นเนื่องในโอกาสเทศกาลออกพรรษา หรือใช้โอกาสเทศกาลออกพรรษานี้ เป็นช่วงเริ่มต้นของพิธีกรรมอื่นๆ อีกหลากหลายรายการด้วยกัน อาทิ
ประเพณีถวายกฐิน หรือทอดกฐิน เป็นประเพณีที่สำคัญยิ่งของพุทธศาสนิกชนอีกอย่างหนึ่ง จัดขึ้นทั้งฝ่ายเจ้านายคือ การพระราชพิธีถวายผ้าพระกฐินขององค์พระมหากษัตริย์ไปจนการทอดกฐินของประชาชนคนธรรมดา โดยจะนิยมทำกันตั้งแต่วันแรม ๑ ค่ำเดือน ๑๑ ไปจนถึงกลางเดือน ๑๒ (วันขึ้น ๑๕ ค่ำ เดือน ๑๒ - วันลอยกระทง)
คำว่า กฐิน แปลว่า ไม้สะดึง คือกรอบไม้ชนิดหนึ่งสำหรับขึงผ้าให้ตึง ในสมัยโบราณการทำจีวรต้องเอาไม้สะดึงมาขึงผ้าให้ตึงเสียก่อนแล้วจึงเย็บ เพราะช่างยังไม่มีความชำนาญเหมือนสมัยปัจจุบันนี้ และเครื่องมือในการเย็บก็ยังไม่ดีพอเหมือนจักรเย็บผ้าในปัจจุบัน การทำจีวรในสมัยโบราณจะเป็นผ้ากฐินหรือแม้แต่จีวรอันมิใช่ผ้ากฐิน ถ้าภิกษุทำเอง ก็จะจัดเป็นงานอย่างเอิกเกริก
ประเพณีเทศน์มหาชาติเวสสันดรชาดก หรือ การเทศน์มหาชาติ คือการจัดให้มีธรรมเทศนาเรื่องเวสสันดรชาดก อันเป็นพระชาติสุดท้ายขององค์พระสัมมาสัมพุทธเจ้า ซึ่งได้ทรงบำเพ็ญบารมีธรรมครบทั้ง ๑๐ บารมี จึงเป็น มหาชาติ คือชาติที่ยิ่งใหญ่ งานบุญพิธีจึงยิ่งใหญ่ตามกันไปด้วย อุบาสก อุบาสิกา มัคทายกวัดนิยมร่วมกันจัดให้มีขึ้นเป็นพิเศษ ส่วนมากจะตั้งใจจัดให้เป็นการหาทุนทรัพย์เข้าวัดครั้งสำคัญ แต่จะมียกเว้นไม่เหมือนใครอยู่ในภาคอีสาน ซึ่งถือเป็นหนึ่งในฮีตสิบสองต้องปฏิบัติ จะนิยมทำกันในเดือน ๔ เรียกว่า "งานบุญผะเหวด” ซึ่งเป็นช่วงที่เสร็จถัดไปจากการทำบุญคูนลาน หรือบุญเอาข้าวเข้ายุ้ง นั้นเอง
ประเพณีทอดผ้าป่า การทอดผ้าป่า เป็นประเพณีและเป็นมรดกตกทอดมาแต่สมัยพุทธกาลเมื่อครั้งที่องค์พระสัมมาสัมพุทธเจ้าไม่ทรงอนุญาตให้ภิกษุรับผ้าจากคฤหัสถ์ ให้ใช้แต่ผ้าบังสุกุล (ผ้าเปื้อนฝุ่น) เท่านั้น ชาวบ้านมักเรียกว่า ผ้าป่า เนื่องจากเป็นผ้าที่ไม่มีเจ้าของ ทิ้งอยู่ตามที่ต่างๆ ตามกองขยะ หรือพันห่อศพไว้ และต้องนำมาซัก เย็บ ย้อมเป็นสบง จีวรหรือสังฆาฏิ นับเป็นความยากลำบากแก่ภิกษุสงฆ์เป็นอย่างยิ่ง ชาวบ้านที่มีศรัทธาเห็นความยากลำบากของพระจึงหาทางช่วย โดยนำผ้าไปทิ้งไว้ตามทางที่พระท่านผ่านไปมาเป็นประจำ หรือทิ้งตามกองขยะ หรือนำไปห่อศพไว้ เพราะถ้าไม่ทำเช่นนี้พระภิกษุจะไม่ยอมรับผ้านั้น จึงมีผู้นิยมทำตามกันมาจนเป็นประเพณี
ฤดูของการทอดผ้าป่า จริงๆ แล้วก็ไม่ได้มีการกำหนดกฏเกณฑ์ใดๆ สุดแต่ชาวบ้านจะศรัทธาเลื่อมใส ส่วนใหญ่มักจะทำในระยะจวนจะออกพรรษาหรือช่วงออกพรรษาแล้ว อีกอย่างหนึ่งก็จะนิยมทำรวมกันกับขบวนกฐิน คือ เมื่อทอดกฐิน เสร็จแล้ว ก็ทอดผ้าป่าหรือทอดไปตามรายทางที่ไปทอดกฐินนับเป็นหลายสิบวัดรวมๆ กันทีเดียวก็ได้
จากทั้งหมดนี้จึงสามารถสรุปได้ว่า ในวันออกพรรษานี้ พุทธศาสนิกชนไทยถือเป็นโอกาสอันดีที่จะกระทำการบำเพ็ญกุศลเป็นพิเศษ เช่น ทำบุญตักบาตร จัดดอกไม้ ธูป เทียนไปบูชาพระที่วัด และฟังพระธรรมเทศนา และสิ่งที่ชาวพุทธนิยมจัดทำไปใส่บาตรในวันนี้จนเป็นเอกลักษณ์เฉพาะงานก็คือ ข้าวต้มลูกโยน นั้นเอง
และไม่เพียงเท่านั้น เนื่องจากช่วงเวลาออกพรรษา ยังเป็นช่วงเวลาที่เสมือนการปิดภาคการศึกษา สิ้นสุดการที่พระภิกษุ และ สามเณร จะไปไหนไม่ได้ในช่วงค่ำคืน ต้องขยันหมั่นเพียรเรียนอรรถแปลบาลีทั้งหลาย ดังนั้น จึงเปรียบเสมือนเชือกที่ถูกบิดเป็นเกลียวแน่นเขม็ง ถึงเวลาคลายออกก็จะมีกำลังเหวี่ยงแรงสักหน่อย ช่วงโอกาสนี้ในแต่ละวัด ในแต่ละชุมชน จึงจะพร้อมใจกันจัดงานเฉลิมฉลองในลักษณะต่างๆ ขึ้นอย่างพร้อมเพรียงโดยมิได้นัดหมาย ช่วยกันทำให้ช่วงเวลาออกพรรษา กลายเป็นช่วงเวลาที่มีการจัดงานเทศกาลประเพณีมากที่สุดในรอบปี
และไม่เพียงแต่เฉพาะประเทศไทยเท่านั้น แม้ในบรรดาประเทศแถบอุษาคเนย์ที่ยังคงมีพระพุทธศาสนาเป็นหลักอยู่ในประเทศ เช่น ประเทศเมียนมา ประเทศสปป.ลาว ประเทศกัมพูชา ก็จะมีช่วงเวลาแห่งการจัดงานเทศกาลประเพณีเป็นพิเศษ เช่นนี้ คล้ายคลึงกับประเทศไทยเช่นกัน
ไทใหญ่ จุดประทีปโคมไฟ ปอยเหลินสิบเอ็ด และออกหว่า
ชาวไต หรือชาวไทใหญ่ จะมีอยู่จำนวนมากในประเทศไทยที่จังหวัดเชียงราย เชียงใหม่ และแม่ฮ่องสอน โดยเฉพาะที่จังหวัดแม่ฮ่องสอนที่ประชากรมากกว่า ๗๐ เปอร์เซ็นต์ เป็นชาวเชื้อสายไทใหญ่นั้น จะมีการจัดงานในเทศกาลออกพรรษาที่แปลกตาเป็นพิเศษกว่าที่อื่นๆ ชาวเมืองแม่ฮ่องสอนเรียกชื่องานประเพณีนี้อย่างง่ายๆ ว่า ปอยเหลินสิบเอ็ด หรือ ปอยเดือนสิบเอ็ด เป็นงานประเพณีเดียวของประเทศไทยที่มีช่วงระยะเวลาการจัดงานยาวที่สุดคือ ตลอด ๑ เดือนเต็มๆ เลยทีเดียว
และจุดเด่นที่สุดของงานประเพณีนี้ คือ มีขบวนแห่จองพารา หรือ ปราสาทกระดาษที่ตกแต่งอย่างสวยงาม ซึ่งจะแห่กันในช่วงกลางคืน และมีการฟ้อนรูปสัตว์ โต หรือ จามรี นกกิงกาหล่า หรือ กินรี กินรา กาเบ้อ หรือผีเสื้อ ไปพร้อมกับขบวนแห่ ส่วนในช่วงกลางวันพิธีกรรมจะเน้นเรื่องราว การเสด็จนิวัติสู่โลกมนุษย์ขององค์พระสัมมาสัมพุทธเจ้า ชาวไต หรือ ชาวไทใหญ่จะพร้อมใจกันจัดทำ จองเข่งต่างส่างปุ๊ด หรือ จองพารา แปลว่า ซุ้มปราสาทรับเสด็จ ซึ่งทำจากโครงไม้ไผ่ ประดับลวดลายด้วยกระดาษสาสีต่างๆ บรรจุหน่อกล้วย อ้อย และโคมไฟ ตกแต่งสวยงาม สมมุติเป็นปราสาทรับเสด็จพระพุทธองค์ จากนั้นก็จะยกจองพาราขึ้นไว้นอกชายคา นอกรั้ว หรือบริเวณกลางลาน ทั้งที่บ้านและที่วัด
ช่วงท้ายๆ ของประเพณีปอยเหลินสิบเอ็ด ก่อนวันแรม ๘ ค่ำ จะมีงาน "หลู่เตนเหง” หรือการถวายเทียนพันเล่ม จนมาถึงวันแรม ๘ ค่ำ หรือวันกอยจ้อด เป็นวันสุดท้ายของเทศกาลจะมีพิธี "ถวายไม้เกี๊ยะ” โดยนำฟืนจากไม้เกี๊ยะ (สนภูเขา) มามัดรวมกันเป็นต้นสูงประมาณไม่ต่ำกว่า ๒.๕ เมตร เส้นผ่าศูนย์กลางประมาณไม่ต่ำกว่า ๓๐ เซนติเมตร แล้วนำเข้าขบวนแห่ จุดเด่นของงานวันนี้อยู่ที่การประกวดศิลปะและวัฒนธรรมไทใหญ่ เช่น การประกวดนางสาวไต ประกวดชุดไต ประกวดฟ้อนดาบและ ประกวดจองพารา เป็นต้น ขณะที่ตามถนนหนทางและบ้านเรือนจะพร้อมใจกันเล่นฟ้อนรำรูปสัตว์ต่างๆ จากความเชื่อว่าสัตว์โลกและสัตว์หิมพานต์จะพากันออกมาแสดงความชื่นชม ยินดี ออกมาร่ายรำเป็นพุทธบูชารับเสด็จ
อีกแห่งหนึ่ง ที่เมืองแม่สะเรียง จังหวัดแม่ฮ่องสอน ที่นี่แม้จะมีชาวไทใหญ่เป็นคนส่วนใหญ่ของเมืองเหมือนกับแม่ฮ่องสอน แต่ด้วยความที่เมืองอยู่ห่างจากแม่ฮ่องสอนนับร้อยกิโลเมตร และมีภูเขากั้นขวางมากมายทำให้การไปมาหาสู่กันยากลำบาก จึงทำให้งานเทศกาลออกพรรษาของที่นี่มีความแตกต่างออกไป
คำว่า "ออกหว่า” หมายถึง การออกจากฤดูฝน เป็นงานประเพณีออกพรรษาตามความเชื่อเฉพาะของชาวอำเภอแม่สะเรียงโดยงานจะเน้นที่ "การตักบาตรตีสี่” บริเวณหน้าบ้านของตนเอง ตลอดทั้ง ๓ วันเทศกาล และจะตักบาตรอาหารสดในวันแรก เนื่องจากชาวอำเภอแม่สะเรียงเชื่อว่า การตักบาตรที่หน้าบ้านของตนเองจะเป็นสิริมงคลต่อบ้านและคนในครอบครัว นอกจากนั้นยังมีการจัดทำโคมและซุ้มราชวัติตกแต่งบ้านเรือน ตลอดจนมีขบวนแห่เทียนเหง หรือเทียนพันเล่ม ซึ่งประกอบด้วยขบวนแห่ต้นโคม เครื่องไทยทาน และการแสดงศิลปะรำฟ้อนต่างๆ เพื่อร่วมเฉลิมฉลองการกลับจากสวรรค์ขององค์สัมมาสัมพุทธเจ้า เช่นเดียวกัน
อีสานริมโขง เรือไฟ บั้งไฟ ผาสาด
เรือไฟ ในภาคอีสาน มีความหมายทั้งการนำพาเอาเคราะห์ร้ายออกไป และการนำเครื่องบูชาออกไปสักการะสิ่งศักดิ์สิทธิ์ที่เคารพนับถือ แต่ทั้งสองประการที่กล่าวถึงนี้ ต่างใช้ช่วงเทศกาลออกพรรษาเป็นฤกษ์ดี และใช้สายน้ำในการนำพาไปสู่เป้าหมายทั้งสองรายการ
ประเพณีไหลเรือไฟ จังหวัดนครพนม เป็นพิธีกรรมทางพุทธศาสนา จัดในวันขึ้น ๑๕ ค่ำ เดือน ๑๑ คือ วันออกพรรษา เป็นประเพณีโบราณของชาวอีสาน โดยเฉพาะผู้อยู่อาศัยในแถบลุ่มแม่น้ำโขง โดยมาจากคติความเชื่อว่า เป็นการลอยเครื่องสักการะไปกับเรือไฟเพื่อบูชารอยพระพุทธบาท ที่ริมฝั่งแม่น้ำนัมมทานที ในชมพูทวีปไกลโพ้น
ในวันนี้ งานประเพณีไหลเรือไฟ จังหวัดนครพนม เป็นงานใหญ่ระดับประเทศที่ เรือไฟ แต่ละลำมีโครงสร้างมหึมา มีการประกวดประขันกันตกแต่งออกแบบไฟประดับไฟแก่เรือลำใหญ่ให้สวยงามอลังการด้วยกระป๋องไฟนับพันนับหมื่นดวง ทั้งยังมีการยิง พลุ ตะไล ไฟพะเนียง เป็นเทคนิคพิเศษออกจากเรือไฟได้อย่างสวยงามตระการตา สว่างไสวไปทั่วทั้งท้องน้ำหน้าเมืองนครพนม
การลอยเรือไฟ ในช่วงเทศกาลออกพรรษา เช่นเดียวกับเมืองนครพนมนี้ ยังมีเหมือนกันในอีกหลากหลายพื้นที่ริมฝั่งแม่น้ำโขง โดยเฉพาะที่เมืองหลายเมืองริมฝั่งแม่น้ำโขงฟากประเทศ สปป. ลาว เมืองหลวงพระบาง เมืองเวียงจันทน์ก็มีการลอยเรือไฟ ด้วยคติเช่นเดียวกันนี้ไม่แตกต่างกัน เรือไฟ ของประชาชนใน สปป.ลาว ยังมีเรือไฟโคก คือ เรือไฟบนบก และมี เรือไฟน้อย ส่วนบุคคล ซึ่งจัดทำรูปร่างใกล้เคียงกับกระทงในเทศกาลลอยกระทงของภาคกลางภาคเหนือประเทศไทยอีกด้วย
ที่เมืองเชียงคาน จังหวัดเลย ในเทศกาลนี้ ก็มีกระบวนการ ลอยเรือไฟ เช่นกัน หากแต่ความไม่เหมือนกันคือ สิ่งที่ลอยเรียกว่า ผาสาด เป็น ปราสาท ไม่ใช่เรือ และความหมายในการประดับไฟ คือ ธูปและเทียน ก็แตกต่างจากไหลเรือไฟ นครพนม และ ไหลเรือไฟที่อื่นๆ เพราะนอกจากผาสาดนี้จะมีดอกไม้ธูปเทียนแล้ว ยังจะมี ผม หรือ เล็บ ของผู้ลอยใส่ลงไปในผาสาดด้วย ดังนั้นการลอยผาสาดออกไป จึงมิใช่เป็นการลอยไปบูชาสิ่งศักดิ์สิทธิ์แล้ว หากแต่เป็นการอธิษฐานขอต่อสิ่งศักดิ์สิทธิ์ให้นำเคราะห์ร้าย หรือ ทุกข์โศกโรคภัยทิ้งออกไปให้ไกลจากตัวผู้ลอยนั้นเอง
บั้งไฟพญานาค ไม่ใช่ทั้งเรือไฟและผาสาด หากแต่เป็นดวงไฟสว่าง ซึ่งพวยพุ่งขึ้นจากลำแม่น้ำโขงพุ่งตรงดิ่งขึ้นสู่ท้องฟ้า ในเขตจังหวัดริมแม่น้ำโขงไล่เรียงตั้งแต่เมืองเลย หนองคาย บึงกาฬ นครพนม มุกดาหาร อำนาจเจริญ จนถึงอุบลราชธานี และจะมีกำหนดพุ่งขึ้นไปอย่างแน่นอนในโอกาสเทศกาลออกพรรษา ๑๕ ค่ำเดือน ๑๑ พอดี
ตำนานเก่าเล่าว่า พญานาคครอบครองนครบาดาล ครั้นพระพุทธเจ้าเสด็จมาโปรดสัตว์ก็เกิดความเลื่อมใสหมายใจจะขอบวช แต่ไม่สามารถบวชได้ เนื่องจากยังเป็นสัตว์เดรัจฉาน พญานาคจึงปวารณาตนเป็นพุทธมามกะ เมื่อพระพุทธเจ้าเสด็จขึ้นไปโปรดพระมารดาที่สวรรค์ชั้นดาวดึงส์ และเสด็จกลับยังโลกมนุษย์ในวันขึ้น ๑๕ ค่ำ เดือน ๑๑ พญานาค ซึ่งอยู่เมืองบาดาล จึงบันดาลให้เกิดบั้งไฟพญานาค พุ่งขึ้นเป็นการแสดงความชื่นชมยินดีต่อการเสด็จนิวัตกลับสู่มนุษยโลกขององค์สัมมาสัมพุทธเจ้า
ส่วนเรื่องราวใหม่ๆ ในเทศกาลนี้ก็มีอยู่อย่างหลากหลาย ทั้งกล่าวว่าเป็นปรากฏการณ์ธรรมชาติของก๊าซในแม่น้ำโขง เป็นการกระทำโดยมนุษย์ด้วยกันเองด้วยเจตนาเร้นลับบางอย่าง ทั้งหมดนี้ ก็ยังเป็นเรื่องที่จะต้องแสวงหาความจริงกันต่อไป แต่ที่แน่ๆ เทศกาลบั้งไฟพญานาค ได้จัดเป็นงานเทศกาลประเพณีหนึ่งของจังหวัดหนองคายไปแล้ว
แห่ปราสาทผึ้ง และ แห่กระธูปออกพรรษาเหมือนกัน แต่จุดหลักต่างกัน
ประเพณีแห่ปราสาทผึ้ง จังหวัดสกลนคร มีจุดสำคัญอยู่ที่การจัดสร้างปราสาทจากขี้ผึ้งขึ้นอย่างสวยงามและยิ่งใหญ่ ด้วยจุดมุ่งหมายให้เป็นปราสาทเพื่อรับเสด็จการกลับมาขององค์พระสัมมาสัมพุทธเจ้า ถือเป็นประเพณีงานบุญสำคัญและเป็นเอกลักษณ์ของจังหวัดสกลนคร ตัวปราสาทขี้ผึ้งที่เป็นศูนย์กลางของงานนี้ ได้มีการพัฒนารูปแบบการสร้างซึ่งมีพื้นฐานมาจากการจัดทำหอผึ้งในสมัยก่อนให้มีความวิจิตรตระการและสวยงามมากขึ้น และสิ่งอื่นๆ ที่เข้ามามีส่วนร่วมในเทศกาลประเพณีอันยิ่งใหญ่นี้ ก็คือความเป็นตัวของตัวเองของจังหวัดสกลนครอีกหลากหลายสิ่ง นั้นเอง
และใกล้เคียงมากกับงานแห่ปราสาทผึ้ง จังหวัดสกลนคร ที่อำเภอหนองบัวแดง จังหวัดชัยภูมิ ก็เปลี่ยนจากขี้ผึ้ง ที่นำไปถวายวัดเพื่อจัดทำเทียน มาเป็นกระดาษที่นำไปถวายวัดเพื่อจัดทำธูป ซึ่งเป็นเครื่องใช้จำเป็นของพระสงฆ์ เช่นเดียวกัน พร้อมๆ กันก็ยังมีฝีมือจัดทำปราสาทด้วยธูปสีต่างๆ ให้เป็นปราสาทไว้รอต้อนรับการเสด็จกลับของพระพุทธองค์ดังเรื่องราวในตำนานโบราณของเทศกาลออกพรรษาอีกด้วย
ทั้งปราสาทผึ้ง และปราสาทกระธูป เป็นอีกแนวทางหนึ่งของงานเทศกาลประเพณีที่จัดขึ้นเนื่องในเทศกาลออกพรรษาโดยการนำเอาสิ่งที่เป็นเอกลักษณ์ของพื้นที่ ซึ่งเป็นเครื่องประกอบพิธีกรรมทางศาสนาเฉพาะถิ่น ขึ้นมาขยายเป็นจุดเด่นของงาน จนทำให้ปรากฏชัดแก่สาธารณะทำให้พิธีกรรมทางศาสนาแปรเปลี่ยนไปกลายเป็นจุดรองของภาพรวมงานเทศกาลทั้งหมด ซึ่งในปัจจุบันมีงานเทศกาลประเพณีออกพรรษาเช่นนี้อยู่ไม่ใช่น้อยด้วยกัน
แห่พระ แข่งเรือ ออกพรรษา หน้าน้ำของชาวลุ่มเจ้าพระยา แม่น้ำเจ้าพระยา
เกิดขึ้นจากแม่น้ำสี่สายในภาคเหนือ คือ แม่น้ำปิง วัง ยม และ น่าน สายน้ำทั้งห้าสายนี้คือกระดูกสันหลังแกนกลางของประเทศไทย การทำมาหากินของคนไทย นับแต่อดีตจนปัจจุบันผูกพันกับสายน้ำทั้งห้าสายนี้อย่างแนบแน่น และงานเทศกาลประเพณีของพื้นที่ต่างๆ จึงมีความผูกพันใกล้ชิดกับสายน้ำ และคงดำรงอยู่ แม้ชีวิตการเดินทางในวันนี้จะมุ่งหน้าเข้าสู่เส้นทางถนนสายต่างๆ เป็นหลักแล้วก็ตาม
ประเพณีแข่งเรือ เป็นประเพณีหน้าน้ำของคนไทย เป็นการละเล่นในยามน้ำหลากที่สืบทอดมาแต่โบราณ และการมาของน้ำหลากก็มักจะมาในช่วงฤดูฝน ครั้นปลายฝนต้นหนาว น้ำเริ่มไหลช้าลงจนพอที่จะขวางเรือกับสายน้ำหันเหได้ตามใจ ก็เป็นช่วงเทศกาลออกพรรษาพอดี ดังนั้น อุบาสก อุบาสิกา มรรคทายกวัดจึงตั้งใจจัดให้สองความสำคัญนี้เข้ามาอยู่ร่วมรวมในงานเทศกาลประเพณีเดียวกัน ส่วนการคลี่คลายของชื่องานจะเป็นชื่ออะไรก็สุดแล้วแต่คณะผู้จัดงานจะตั้งชื่อกันไปตามความเหมาะสม ประเพณีแข่งเรือจังหวัดพิจิตร แห่งลุ่มน้ำยม ประเพณีแข่งเรือเมืองน่านที่มีเรือหัวนาคราชเป็นเอกลักษณ์ ของลุ่มน้ำน่าน ต่างเป็นตัวอย่างสำคัญของสองลุ่มน้ำดังว่านี้ ส่วนประเพณีโยนบัว บางพลี จังหวัดสมุทรปราการ และประเพณี แห่พระแข่งเรือ ในอีกหลากหลายลุ่มน้ำในภาคกลางก็ล้วนเป็นสิ่งซึ่งแสดงให้เห็นได้ชัดเจนถึงการดำรงอยู่ร่วมกันของ การแห่พระ และการแข่งเรือ ในเทศกาลออกพรรษา ของลุ่มน้ำเจ้าพระยา และ ปิง วัง ยม น่าน กระดูกสันหลังหลักของประเทศไทยในวันนี้
ภาคใต้ ลากพระบก ชักพระน้ำและเอกลักษณ์แข่งเรือ ขึ้นโขน ชิงธง
การเกิดประเพณีลากพระ และชักพระขึ้นในภาคใต้ นอกจากจะสืบเนื่องด้วยพุทธตำนาน เช่นเดียวกับเทศกาลออกพรรษาในภูมิภาคอื่นๆ แล้ว ยังสันนิษฐานว่า น่าจะมี คตินิยมดั้งเดิมอย่างอื่นเป็นพื้นฐานอยู่ด้วย กล่าวคือ ในเดือน ๑๑ นั้น พื้นที่ภาคใต้ เข้าสู่ฤดูฝนช้ากว่าภูมิภาคอื่นๆ ประชาชนส่วนมากประกอบอาชีพการเกษตร สิ่งปรารถนาที่พ้องกัน จึงได้แก่การขอให้ฝนตกต้องตามฤดูกาล งานลากพระ จึงมุ่งขอฝน เพื่อการเกษตร จนเกิดเป็นคติความเชื่อว่า การลากพระจะทำให้ฝนตกต้องตามฤดูกาล
ประเพณีลากพระของชาวภาคใต้มีอยู่ ๒ ประการ คือ ลากพระทางบก กับ ชักพระทางน้ำ ลากพระทางบก คือการอัญเชิญพระพุทธรูปปางอุ้มบาตร ซึ่งเป็นปางพระพุทธรูปสำหรับการขอฝนโดยเฉพาะขึ้นประดิษฐาน บนพนมพระ หรือบุษบก แล้วแห่แหน โดยการลากไปบนบก วัดส่วนใหญ่ ที่ดำเนินการประเพณีลากพระวิธีนี้ มักตั้งอยู่ในที่ไกลแม่น้ำลำคลอง
ส่วนชักพระทางน้ำ เป็นการอัญเชิญพระพุทธรูปปางอุ้มบาตรขึ้นประดิษฐาน บนบุษบก ในเรือ แล้วแห่แหนโดยการชักลากเรือที่ตกแต่งตามแบบประเพณีท้องถิ่นให้สวยงามแล้วลากเรือพระไปทางน้ำ ประเพณีลากพระที่มักกระทำด้วยวิธีนี้เป็นของวัด ที่ส่วนใหญ่อยู่ใกล้แม่น้ำลำคลอง
ก่อนถึงวันชักลากพระคือ วันแรม ๑ ค่ำ เดือน ๑๑ จะมี "การคุมพระ” ที่วัด การคุมพระ คือการตีตะโพนประโคมก่อนจะถึงวันลากพระประมาณ ๑๐ - ๑๕ วัน เพื่อเป็นการเตือนให้ชาวบ้าน ทราบว่า จะมีการลากพระ เพื่อปลุกใจชาวบ้านให้กระตือรือร้นร่วมพิธีชักลากพระ การคุมพระนี้เองที่จะเป็นต้นเหตุให้เกิดการ แข่งขันประชันโพน กลายเป็นประเพณี แข่งโพนลากพระ จังหวัดพัทลุง และการชักพระ ลากพระ ก็กลายเป็นประเพณีสำคัญในเทศกาลออกพรรษาต่อไปในหลายๆ พื้นที่ภาคใต้ นั้นเอง
นอกจากประเพณีการลากพระบก ชักพระน้ำแล้ว ในภาคใต้ที่จังหวัดชุมพร ยังมีกรณีพิเศษไม่เหมือนที่ไหนจนงานประเพณีมีชื่อเสียงขึ้นเป็นเอกลักษณ์เฉพาะตัวไม่เหมือนที่อื่นๆ แต่ก็เป็นงาน เทศกาลประเพณีที่มีที่มาหลักคือ เทศกาลออกพรรษา เช่นเดียวกัน คือ งานประเพณีแข่งเรือ ขึ้นโขนชิงธง แม่น้ำหลังสวน จังหวัดชุมพร นั้นเอง
สุดท้าย ประเพณีการลากพระน้ำ ที่มีชื่อเสียงอย่างยิ่งจนเป็นที่รู้จักไปทั่วโลก ก็คือประเพณีการลากเรือพระทางน้ำของประเทศเพื่อนบ้านอุษาคเนย์ นั่นคือ ประเพณีแห่พระพุทธรูปบัวเข็ม พระพองต่ออู ของพี่น้องชาวอินทา ทะเลสาบอินเล รัฐฉาน สาธารณรัฐแห่งสหภาพเมียนม่า ดินแดนที่ชาวบ้านในทะเลสาบพายเรือกันด้วยการใช้เท้านั้นเอง งานนี้เป็นงานในเทศกาลออกพรรษาของชาวพุทธในเมียนมา ซึ่งมีภาพหลักคือการนำองค์พระพุทธรูปศักดิ์สิทธิ์ลงประดิษฐานในเรือการเวกที่ตกแต่งประดับประดาอย่างเมียนมาที่สวยงามอลังการยิ่ง แล้วแต่ละวันก็จะลากเรือพระออกไปประดิษฐานให้ชาวบ้านในทะเลสาบทั้งหลาย ณ วัดในพื้นที่ต่างๆ รอบทะเลสาบได้กราบไหว้บูชา และเรือพระ เมื่อจอดลงที่วัดแห่งใดแห่งหนึ่งริมทะเลสาบแล้วตามวันที่กำหนด ก็จะได้เวลานำออกแห่แหนไปที่วัดอื่นๆ ริมทะเลสาบต่อไปอีก จนครบถ้วน ๑ เดือนแห่งเทศกาลแห่พระ ก็จะจบสิ้นพิธีกรรมนั้นเองอย่างสวยงาม
จากทั้งหมดที่เล่าให้ฟังมาแล้วมากมาย ข้อสรุปจึงอยู่ที่ว่า เทศกาลออกพรรษา ก็คือช่วงเวลาทางพุทธศาสนา ที่ชาวไทยและชาวอุษาคเนย์ได้ช่วยกันใช้ให้เป็นช่วงเวลาแห่งการเฉลิมฉลองให้แก่การเข้าพรรรษา ที่พระภิกษุและสามเณรทั้งหลายต้องหยุดยั้งการเดินทางจาริกไปยังที่ต่างๆ และหันกลับเข้าวัดมุ่งหน้าศึกษาพระธรรมคำสั่งสอนขององค์พระสัมมาสัมพุทธเจ้าอย่างมุ่งมั่นเคร่งครัด และรวมทั้งเมื่อมีการจัดงานบุญเฉลิมฉลองแล้ว ก็ควรมีสิ่งซึ่งจะเป็นสารัตถประโยชน์แก่ชุมชนต่างๆ อย่างหลากหลาย เช่น ในด้านธรรมศึกษา ด้านความบันเทิง การสืบสานวัฒนธรรมประเพณี รวมทั้ง เรื่องใหม่เรื่องล่าที่มาแรงที่สุดก็คือ การท่องเที่ยวด้วย และทั้งหมดนี้ก็คือ เทศกาลออกพรรษา ช่วงเวลาแห่งการเฉลิมฉลองของคนไทย และชาวพุทธอุษาคเนย์ทั้งหลายนั้นเอง
เทศกาลออกพรรษา ช่วงเวลาแห่งการเฉลิมฉลอง เรื่อง : อภินันท์ บัวหภักดี
กรมส่งเสริมวัฒนธรรม
ศูนย์บริการสาธารณสุข 59 ทุ่งครุ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สัตว์เลี้ยง...ฟรี 2-6 กันยายน 2567
ศูนย์บริการสาธารณสุข 59 ทุ่งครุ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สัตว์เลี้ยง...ฟรี 2-6 กันยายน 2567
1 ตุลาคม วันกาแฟสากล
วันกาแฟสากล (1 ตุลาคม) เป็นโอกาสที่ใช้เพื่อส่งเสริมและเฉลิมฉลองกาแฟในฐานะเครื่องดื่ม โดยมีกิจกรรมต่างๆ เกิดขึ้นในสถานที่ต่างๆ ทั่วโลก วันที่เป็นทางการครั้งแรกคือ 3 ตุลาคม 2015 ตามที่ตกลงกันโดยองค์กรกาแฟสากล ในขณะนั้น และเปิดตัวในมิลานวันนี้ยังใช้เพื่อส่งเสริมการค้ากาแฟที่เป็นธรรมและเพื่อสร้างความตระหนักรู้ถึงความทุกข์ยากของผู้ปลูกกาแฟในวันนี้ ธุรกิจหลายแห่งเสนอกาแฟฟรีหรือลดราคา ธุรกิจบางแห่งแบ่งปันคูปองและข้อเสนอพิเศษกับผู้ติดตามที่ภักดีผ่านเครือข่ายโซเชียล บริษัท การ์ดอวยพรบางแห่งขายการ์ดอวยพรวันกาแฟสากลเช่นเดียวกับอีการ์ดฟรี ประเทศต่างๆ ทั่วโลกเฉลิมฉลองวันกาแฟแห่งชาติของตนเองในวันที่ต่างๆ ตลอดทั้งปี ในเดือนมีนาคม 2014 รัฐสมาชิกของ ICO (องค์กรกาแฟสากล) ตกลงที่จะจัดวันกาแฟสากลในวันที่ 1 ตุลาคมเพื่อสร้างวันเฉลิมฉลองเพียงวันเดียวสำหรับคนรักกาแฟทั่วโลก -
wikipedia |
websiteไขข้อสงสัย?หลัง สปสช. ยกเลิกสัญญา 64 คลินิก ผู้ใช้สิทธิบัตรทองต้องทำอย่างไร
ปทุมธานี - สังเกตตนเอง LINK
9 เมย 64 ม
าตรการเดินทางข้ามจังหวัด
เดินทางเข้า
1. รายงานตัวต่อจนท. อสม หรือผู้ประกอบการโรงงาน/หน่วยงานต้นสังกัด
2. สังเกตตนเอง 14 วัน หากมีอาการ ให้พบแพทย์รพ.ใกล้บ้าน
3. ร่วมมือติดตั้งแอปหมอชนะ หรือ ไทยชนะ และปฏิบัติตามมาตรการอย่างเคร่งครัด
เพจ สสจ.ปทุมธานี 02 581 6454
19 พฤษภาคม 64 เวลา 14.00 น.
วันนี้เพิ่มจากเมื่อวาน เพียง 1.44 แสนคน วูบหนักแบบน่าใจหาย
ส่วนกรุงเทพเพิ่ม ประมาณ 21,000 วูบหนักเช่นกัน
หรือว่าไหลไปลงช่องทางอื่นกัน
น่าเป็นห่วง แต่หวังว่าจะดีขึ้น
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เขตบางขุนเทียน LINK
ศูนย์บริการสาธารณสุข 42 ถนอม ทองสิมา ร่วมกับสำนักงานเขตบางขุนเทียน จัดกิจกรรมรณรงค์ฉีดวัคซีนพิษสุนัขบ้าตั้งแต่วันที่ 13- 24 มีนาคม 2566 ตามวัน/เวลา และสถานที่ให้บริการ
เงื่อนไขการฉีดวัคซีน
- สุนัขและแมว อายุตั้งแต่ 3 เดือนขึ้นไป
- สุนัขและแมวไม่อยู่ในช่วงที่ให้นมลูก
- สุนัขและแมวไม่อยู่ในช่วงที่ตั้งครรภ์
หมายเหตุ : หากต้องการนำวัคซีนพิษสุนัขบ้าไปฉีดเอง ให้นำกระติกใส่น้ำแข็งมาด้วย
กิจกรรมรถไฟคิฮะ ปี 2566 ที่ผ่านไปแล้ว
++ งานปีที่ผ่านมา (2565-2566) ++
หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาฉุกเฉินการแพทย์ (4 ปี)
นางสาวชัชชญา สุนทรอาคเนย์ อาจารย์ประจำหลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาฉุกเฉินการแพทย์ (4 ปี) คณะเทคโนโลยีวิทยาศาสตร์สุขภาพ
“คณะเทคโนโลยีวิทยาศาสตร์สุขภาพเปิดรับสมัครบุคคลเข้าศึกษา หลักสูตรวิทยาศาสตรบัณฑิต สาขาวิชาฉุกเฉินการแพทย์ (หลักสูตร 4 ปี) ประจำปีการศึกษา 2567 จำนวน 40 คน คุณสมบัติจบชั้นมัธยมศึกษาตอนปลาย (ม.6) หรือ เทียบเท่า จากสาขาวิทยาศาสตร์ เป้าหมายเพื่อผลิต “นักฉุกเฉินการแพทย์ ความช่วยเหลือแรกก่อนถึงมือแพทย์” รองรับอาชีพสาขาขาดแคลน การเรียนการสอนเน้นความรู้เชิงทฤษฎีและข้อเท็จจริงเป็นหลัก เช่น ความรู้ทางกฎหมายที่เกี่ยวข้องกับการปฏิบัติงานฉุกเฉิน ระบบสุขภาพของประเทศไทย ระบบการแพทย์ฉุกเฉินของประเทศไทยและนานาชาติหลักการพื้นฐานด้านระบบคุณภาพและความปลอดภัยของผู้ป่วย รวมทั้งมาตรฐานการปฏิบัติการฉุกเฉิน เป็นสาขาของการประกอบวิชาชีพด้านสุขภาพที่กระทำต่อผู้ป่วยฉุกเฉินนอกสถานพยาบาลเป็นหลัก รวมทั้งสามารถดูแลเบื้องต้นในห้องฉุกเฉิน เพื่อให้ผู้ป่วยฉุกเฉินนั้นได้รับการช่วยชีวิตและป้องกันการเสียชีวิต ภายหลังจากจบการศึกษาแล้ว นักศึกษาจะมีความเชี่ยวชาญในการทำงานของนักฉุกเฉินการแพทย์ คือการบริบาลและดูแลรักษาผู้ป่วยนอกสถานพยาบาล และในห้องฉุกเฉินของโรงพยาบาล เป็นการกู้ชีพชั้นสูง การทำหัตถการและการบริหารยาฉุกเฉิน การรักษาและส่งต่อไปยังสถานพยาบาลฉุกเฉิน เพื่อให้ผู้ป่วยพ้นจากภาวะวิกฤติ นอกจากนี้ ยังมีบทบาทในการพัฒนาระบบการแพทย์ฉุกเฉินไทย เพื่อประโยชน์สูงสุดของผู้ป่วย”
ทุ่งสง ลากพระ ประจำปี ๒๕๖๖
อบจ.นครศรีธรรมราช ร่วมกับอำเภอทุ่งสง และองค์กรปกครองส่วนท้องถิ่นอำเภอทุ่งสง ขอเชิญชวนประชาชนและนักท่องเที่ยว เที่ยวงาน #โครงการส่งเสริมการท่องเที่ยวอำเภอทุ่งสง "ลากพระ ประจำปี ๒๕๖๖" ๓๐ ตุลาคม - ๕ พฤศจิกายน ๒๕๖๖ ณ หน้าที่ว่าการอำเภอทุ่งสง จังหวัดนครศรีธรรมราช
กิจกรรมในงาน
พิธีเปิดงาน ๓๐ ตุลาคม ๒๕๖๖
ร้านสาธิตและจำหน่ายผลิตภัณฑ์ชุมชน/ผลิตภัณฑ์ OTOP
การประกวดนางสาวทุ่งสง
ประกวดแม่หม้าย
กิจกรรมศิลปวัฒนธรรมพื้นถิ่น อาทิ การแทงต้ม การแข่งขันรำวงเวียนครก การแสดงขับร้องบทเพลงพระราชนิพนธ์
การแสดงคอนเสิร์ตและจากการแสดงบนเวที ฯลฯ
รายงานข่าว เกี่ยวกับสถานการณ์โรคพิษสุนัขบ้า ในไทยปี 2567
อัพเดตจาก
กรมปศุสัตว์ สรุปภาพรวมสถานการณ์โรคพิษสุนัขบ้าระหว่างปี 2566-2567 ตั้งแต่ 1 ตุลาคม 2566 ถึงปัจจุบัน
- 25 มิถุนายน 2567 มีพื้นที่ที่พบการเกิดโรค 8 จังหวัด 11 จุด ได้แก่ จังหวัดจันทบุรี บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ มหาสารคาม ตาก และสุพรรณบุรี
- 15 มิถุนายน 2567 มีพื้นที่ที่พบการเกิดโรค 11 จังหวัด 22 จุด ได้แก่ จังหวัดชลบุรี ฉะเชิงเทรา สมุทรปราการ อำนาจเจริญ อุบลราชธานี ศรีสะเกษ มหาสารคาม กาฬสินธุ์ มุกดาหาร ตาก และพิจิตร
- 1 มิถุนายน 2567 มีพื้นที่ที่พบการเกิดโรค 12 จังหวัด 22 จุด ได้แก่ จังหวัดชลบุรี ฉะเชิงเทรา สมุทรปราการ อำนาจเจริญ อุบลราชธานี ศรีสะเกษ กาฬสินธุ์ มุกดาหาร ตาก พิจิตร สมุทรสงคราม และสงขลา
- 15 พฤษภาคม 2567 มีพื้นที่ที่พบการเกิดโรค 12 จังหวัด 19 จุด ได้แก่ จังหวัดสระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา สมุทรปราการ อุบลราชธานี นครพนม กาฬสินธุ์ มุกดาหาร ตาก สมุทรสงคราม และสงขลา
- 1 พฤษภาคม 2567 มีพื้นที่ที่พบการเกิดโรค 9 จังหวัด 19 จุด ได้แก่ จังหวัดสระแก้ว ปราจีนบุรี ชลบุรี ระยอง อำนาจเจริญ สุรินทร์ อุบลราชธานี นครพนม และสงขลา
- 29 เมษายน 2567 มีพื้นที่ที่พบการเกิดโรค 26 จังหวัด 157 จุด คือ ลพบุรี จันทบุรี สระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง สมุทรปราการ นครนายก อำนาจเจริญ ชัยภูมิ บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ ยโสธร นครราชสีมา เลย มหาสารคาม นครพนม กาฬสินธุ์ อุตรดิตถ์ สมุทรสงคราม นครศรีธรรมราช พัทลุง และสงขลา
- 15 เมษายน 2567 มีพื้นที่ที่พบการเกิดโรค 11 จังหวัด 31 จุด ได้แก่ จังหวัดจันทบุรี ปราจีนบุรี ชลบุรี ระยอง อำนาจเจริญ บุรีรัมย์ สุรินทร์ อุบลราชธานี กาฬสินธุ์ พัทลุง และสงขลา
- 1 เมษายน 2567 ทั้งหมด 26 จังหวัด 142 จุด
- 15 มีนาคม 2567 ทั้งหมด 26 จังหวัด 126 จุด
- 1 มีนาคม 2567 ทั้งหมด 24 จังหวัด 121 จุด
- 15 กุมภาพันธ์ 2567 ทั้งหมด 24 จังหวัด 106 จุด
- 1 กุมภาพันธ์ 2567 ทั้งหมด 24 จังหวัด 95 จุด
- 15 มกราคม 2567 ทั้งหมด 21 จังหวัด 79 จุด
- 1 มกราคม 2567 ทั้งหมด 18 จังหวัด 69 จุด
- 15 ธันวาคม 2566 ทั้งหมด 18 จังหวัด 60 จุด
- 1 ธันวาคม 2566 มี 10 จังหวัดพื้นที่ที่พบการเกิดโรคพิษสุนัขบ้าสูงสุด 30 วันย้อนหลัง ได้แก่ จังหวัดสงขลา สุรินทร์ อุบลราชธานี ชลบุรี อำนาจเจริญ ปราจีนบุรี ยโสธร ชัยภูมิ ศรีสะเกษ และสตูล ซึ่งข้อมูลระหว่างวันที่ 1 ตุลาคม 2566 - 1 ธันวาคม 2566 มีพื้นที่ 8 จังหวัด 24 จุด ที่พบการเกิดโรค ได้แก่ ปราจีนบุรี ชลบุรี อำนาจเจริญ ชัยภูมิ สุรินทร์ อุบลราชธานี ยโสธร และสงขลา
++ กิจกรรมที่ผ่านไป ++
5 กิจกรรมต้องไม่พลาดเมื่อมาลพบุรี
ททท. สำนักงานลพบุรี ชวนเที่ยวชวนทำกิจกรรมน่าสนุกเมื่อมาเที่ยวลพบุรี 5 Must ที่ต้องไม่พลาด
1 Must taste จานเด็ดต้องลองของลพบุรี
2 Must try กีฬาท้าทายที่ต้องลอง
3 Must buy ของดีน่าซื้อฝาก
4 Must seek แหล่งเที่ยว unseen ต้องไปค้นหา
5 Must see ประเพณีต้องชมวัฒนธรรมลพบุรี
สอบถามข้อมูลเพิ่มเติมได้ที่ : ททท.สำนักงานลพบุรี โทร. 036-770096-7 หรือ Facebook Fanpage : ททท.สำนักงานลพบุรี : Tat Lopburi
กิจกรรมต้องไม่พลาดเมื่อมาชัยนาท
ททท.แนะนำนักท่องเที่ยวเมื่อมาเที่ยวจ.ชัยนาท ต้องไม่พลาด เที่ยวชมและทำกิจกรรม ดังต่อไปนี้
1 Must taste อาหารอร่อยอาหารถิ่นจานเด็ด เมืองชัยนาท
2 Must try กีฬาท้าทายในเมืองชัยนาท
3 Must buy หัตถกรรมน่าซื้อฝาก
4 Must seek แหล่งท่องเที่ยว unseen น่าค้นหา
5 Must see ประเพณีวัฒนธรรมเอกลักษณ์ชัยนาท
++ กิจกรรมที่ผ่านไป 2567 ++
6 และ 15 กุมภาพันธ์ 2567 ปศุสัตว์จังหวัดชลบุรี ทำหมันและฉีดวัคซีน
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กุมภาพันธ์ 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
18 พฤษภาคม 64 เวลา 20.00 น.
วันนี้ยอดเพิ่มเพียง 2.96 แสนเท่านั้น มาอยู่ 7,199,462 ราย
เรียกว่าชะลอตัวอย่างรุนแรง
ส่วนกรุงเทพ เพิ่มประมาณ 35,000 ราย ลดลงพอสมควรจากเมื่อวาน
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เขตทวีวัฒนา LINK
ฝ่ายสิ่งแวดล้อมและสุขาภิบาลร่วมกับศูนย์บริการสาธารณสุข 67 (ทวีวัฒนา) เชิญชวนประชาชนนำสัตว์เลี้ยง สุนัข แมว นำไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2566 โดยจัดหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง เพื่ออำนวยความสะดวกให้กับประชาชน ผู้ที่สนใจสามารถนำสัตว์เลี้ยงลูกด้วยนมทุกชนิด มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในวันและเวลา 10.00 - 12.00 น. สามารถนำมาฉีดได้ "ฟรี " ตามจุดรับบริการดังกล่าว
สอนเบื้องต้นให้มีความรู้พื้นฐาน
เมืองพัทยา จัดหน่วยบริการทำหมันสุนัขแมว มกราคม 2567 LINK
เมืองพัทยาพร้อมส่งมอบความสุข...ต้อนรับปีใหม่ “ออกหน่วยให้บริการทำหมันสุนัขแมว ประจำเดือน มกราคม 2567 โดยกลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา ได้เตรียมจัดทำแผนปฏิบัติงานโครงการรณรงค์ควบคุมและป้องกันโรคพิษสุนัขบ้าในเขตเมืองพัทยา ครอบคลุมพื้นที่ตำบลนาเกลือ หมู่ 1 – 7 ตำบลหนองปรือ หมู่ 5, 6, 9, 10, 11, 12, 13 ตำบลหนองปลาไหล หมู่ 6 – 8 ตำบลห้วยใหญ่ หมู่ 4 เพื่อให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดป้องกันเห็บหมัดในสุนัข และผ่าตัดทำหมันคุมกำเนิดถาวร ประจำเดือน มกราคม 2567 รับหน่วยละ 50 ตัว โดยเริ่มให้บริการตั้งแต่วัน 09.00 – 12.00 น. ดังนี้
- วันที่ 8 มกราคม 2567 วัดทองพัฒนาราม
- วันที่ 10 มกราคม 2567 วัดทองพัฒนาราม
- วันที่ 17 มกราคม 2567 วัดใหม่หาดกระทึงทอง
- วันที่ 19 มกราคม 2567 วัดใหม่หาดกระทึงทอง
- วันที่ 22 มกราคม 2567 วัดบุณย์กัญจนาราม
- วันที่ 24 มกราคม 2567 วัดบุณย์กัญจนาราม
- วันที่ 31 มกราคม 2567 วัดเขาพระใหญ่
- ฉีดวัคซีน โรคพิษสุนัขบ้า สัตว์เลี้ยงจะต้องมีสุขภาพแข็งแรง ไม่ป่วย มีอายุ 3 เดือนขึ้นไป
- ผ่าตัดทำหมันคุมกำเนิดถาวร ให้บริการสำหรับสุนัขและแมวไทยเท่านั้น งดรับสุนัขแมวพันธุ์หรือผสม และต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง ไม่ป่วย โดยงดน้ำ งดอาหาร พร้อมกักบริเวณ หรือขังกรง เป็นเวลา 8 - 12 ชั่วโมง (ให้สิทธิ์ครัวเรือนละไม่เกิน 2 ตัว) ระหว่างรอขอความร่วมมือ ล่ามโซ่หรือขังโกรงห้ามปล่อยสุนัขและแมวเพื่อป้องกันน้องแอบทานอาหาร)
- ผู้เข้ารับบริการจะต้องนำบัตรประชาชนมาลงทะเบียน
- หากผู้เข้ารับบริการไม่มีทะเบียนบ้านอยู่ในเขตพื้นที่ ให้แจ้งที่อยู่ที่อาศัย ที่อยู่ปัจจุบันในเขตพื้นที่ได้
สำหรับประชาชนที่สนใจนำสุนัขและแมวเข้ารับบริการ ควรปฏิบัติตามรายละเอียดดังกล่าวอย่างเคร่งครัด สามารถสอบถามเพิ่มเติมได้ที่ กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา หมายเลขโทรศัพท์ 038 – 111826 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
เมืองพัทยา จัดหน่วยบริการทำหมันสุนัขแมว กุมภาพันธ์ 2567
เมืองพัทยา กำหนดออกหน่วยให้บริการทำหมันสุนัขแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดป้องกันเห็บหมัดในสุนัข ประจำเดือน กุมภาพันธ์2567 โดยเริ่มให้บริการตั้งแต่วัน 09.00 – 12.00 น. ดังนี้
- 2 กุมภาพันธ์ 2567 วัดเขาพระใหญ่
- 5 กุมภาพันธ์ 2567 วัดเขาพระบาท บริเวณหน้าโบสถ์
- 7 กุมภาพันธ์ 2567 วัดเขาพระบาท บริเวณหน้าโบสถ์
- 14 กุมภาพันธ์ 2567 วัดชัยมงคล
- 16 กุมภาพันธ์ 2567 วัดชัยมงคล
- 19 กุมภาพันธ์ 2567 วัดธรรมสามัคคี
- 21 กุมภาพันธ์ 2567 วัดธรรมสามัคคี
- 28 กุมภาพันธ์ 2567 สำนักสงฆ์หนองอ้อ
- ฉีดวัคซีน โรคพิษสุนัขบ้า สัตว์เลี้ยงจะต้องมีสุขภาพแข็งแรง ไม่ป่วย มีอายุ 3 เดือนขึ้นไป
- ผ่าตัดทำหมันคุมกำเนิดถาวร ให้บริการสำหรับสุนัขและแมวไทยเท่านั้น งดรับสุนัขแมวพันธุ์หรือผสม และต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง ไม่ป่วย โดยงดน้ำ งดอาหาร พร้อมกักบริเวณ หรือขังกรง เป็นเวลา 8 - 12 ชั่วโมง (ให้สิทธิ์ครัวเรือนละไม่เกิน 2 ตัว) ระหว่างรอขอความร่วมมือ ล่ามโซ่หรือขังโกรงห้ามปล่อยสุนัขและแมวเพื่อป้องกันน้องแอบทานอาหาร)
- ผู้เข้ารับบริการจะต้องนำบัตรประชาชนมาลงทะเบียน
- หากผู้เข้ารับบริการไม่มีทะเบียนบ้านอยู่ในเขตพื้นที่ ให้แจ้งที่อยู่ที่อาศัย ที่อยู่ปัจจุบันในเขตพื้นที่ได้
สำหรับประชาชนที่สนใจนำสุนัขและแมวเข้ารับบริการ ควรปฏิบัติตามรายละเอียดดังกล่าวอย่างเคร่งครัด สามารถสอบถามเพิ่มเติมได้ที่ กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา หมายเลขโทรศัพท์ 038 – 111826 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
28 มีนาคม - 10 เมษายน 2561
ราชบุรี -สแกน QR code LINK
ขอความร่วมมือประชาชนต่างจังหวัดที่เดินทางเข้ามาในพื้นที่จังหวัดราชบุรี ขอความร่วมมือลงทะเบียน ด้วยการสแกน
QR code ณ จุดคัดกรอง หรือด่านตรวจของจังหวัดราชบุรี เพื่อเป็นประโยชน์ในการควบคุมโรคติดเชื้อไวรัสโควิด 19 ด้วยความปรารถนาดีจากจังหวัดราชบุรี
เพจ
สสจ.ราชบุรี โทร 032 328 101
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ พร้อมเปิดจองวันและเวลา ผ่านระบบหมอพร้อม LINK
โรงพยาบาลพริ้นซ์ สุวรรณภูมิ พร้อมเปิดจองวันและเวลาเพื่อเข้ารับการฉีดวัคซีนที่โรงพยาบาล พริ้นซ์ สุวรรณภูมิผ่านระบบหมอพร้อม
ท่านสามารถทำการจองได้ตั้งแต่วันที่ 5 - 31 พ.ค. 64
เลือกรับวัคซีนในวันที่ 7 มิ.ย. 64 - 31 ก.ค. 64
โดยเบื้องต้น เปิดให้จองเฉพาะกลุ่มเป้าหมายเท่านั้น
ติดต่อสอบถามเกี่ยวกับการรักษาหรือทำการนัดหมาย Call center 02 080 5999
17 พฤษภาคม 64 เวลา 20.00 น.
ยอดรวมเพิ่มขึ้นเป็น 6,903,736 ราย
เพิ่มแบบก้าวกระโดดอีกครั้งวันเดียว 9.3 แสนราย
ขยับขึ้นมาเป็น 43% (จากยอดรวม 2 กลุ่ม 16 ล้านราย) ใกล้ครึ่งทางละ Good Good job!
กรุงเทพบวกเพิ่มมาอีก 42,000 ราย/วัน เริ่มดูดีขึ้นเรื่อยๆ
หลังจากมีประกาศว่ารอบฉีดเดือนมิถุนายน เต็มแล้ว น่าจะเป็นปัจจัยสำคัญอันนึง ที่กระตุ้นให้เข้ามาจองคิวกันคึกคักขึ้น ก้าวผ่านครึ่งเดือนแล้ว ลุ้นกันต่อไปว่าจบสัปดาห์นี้จะอยู่ที่เท่าไหร่
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เดือนพฤษภาคม-มิถุนายน 2566
เดือนพฤษภาคม 2566 เอาใจนักท่องเที่ยวลุย มาร่วมผจญภัยกับคอนเซ็ปต์ "ผจญภัยเหนือสายน้ำ"
เดือนมิถุนายน 2566 เอาใจนักท่องเที่ยวสายอนุรักษ์สิ่งแวดล้อมกับคอนเซ็ปต์ "Save The World กับ KIHA 183"
31 มกราคม 2567 ทำหมัน สุนัข และแมว เทศบาลเมืองวารินชำราบ
งานสัตว์แพทย์ กองสาธารณสุขฯ
เทศบาลเมืองวารินชำราบ ร่วมกับ สำนักงานปศุสัตว์จังหวัดอุบลราชธานี จัดกิจกรรมควบคุมประชากรสุนัขและแมวโดยให้บริการ ผ่าตัดทำหมัน สุนัข และแมว ในวันที่ 31 มกราคม 2567 เวลา 09.00 - 15.30 น. ณ หอประชุมประชาวาริน
เป้าหมายการดำเนินงาน
1.สุนัขเพศผู้ จำนวน 30 ตัว
2.สุนัขเพศเมีย จำนวน 25 ตัว
3.แมวเพศผู้ จำนวน 30 ตัว
4.แมวเพศเมีย จำนวน 40 ตัว
ให้บริการสัตว์เลี้ยงที่มีเจ้าของพักอาศัยอยู่ในเขตเทศบาลเมืองวารินชำราบ
เจ้าของสัตว์เลี้ยงที่สนใจนำบัตรประาชนมาลงทะเบียนได้ที่กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองวารินชำราบ
วันที่ 22 มกราคม 2567 เป็นต้นไป (ในวัน-เวลาราชการ) จนกว่าครบตามจำนวน
ไม่รับลงทะเบียนทางโทรศัพท์ จำกัดครัวเรือนละไม่เกิน 2 ตัว
สอบถามข้อมูลเพิ่มเติม โทร. 045-269680 ต่อ 130
6 กุมภาพันธ์ 2567 เทศบาลเมืองหนองปรือ บริการทำหมันและฉีดวัคซีน
เทศบาลเมืองหนองปรือ บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวในเขตเทศบาลเมืองหนองปรือ ตามโครงการแก้ไขปัญหาผลกระทบของประชาชนจากสัตว์จรจัด
• บริการทำหมัน เพศผู้ จำนวน 150 ตัว เพศเมีย จำนวน 100 ตัว / บ้านละไม่เกิน 2 ตัว
• บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ไม่จำกัดจำนวน
วันที่ 6 กุมภาพันธ์ 2567 เวลา 09.00 - 12.00 น. ณ อาคารอเนกประสงค์สวนสุขภาพฯ เทศบาลเมืองหนองปรือ เริ่มรับลงทะเบียน เวลา 07.30 น. สิ่งที่ต้องเตรียมสุนัขและแมวก่อนทำหมัน
1. ให้สุนัข แมว งดอาหารและน้ำ อย่างน้อย 8 ชั่วโมง ก่อนทำหมัน
2. นำบัตรประชาชนและทะเบียนบ้านของเจ้าของสุนัข แมว มายื่นในวันดำเนินการ
รับเฉพาะผู้ที่มีทะเบียนบ้านอยู่ในเขตเทศบาลเมืองหนองปรือเท่านั้น
กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองหนองปรือ หมายเลขโทรศัพท์ 038-933110
ทำหมันหมาแมวฟรี ณ วัดใหม่สำราญ เกาะล้าน 7 กุมภาพันธ์ 2566 LINK
7 กุมภาพันธ์ 2566 เมืองพัทยาจัดหน่วยเคลื่อนที่ให้ทำกิจกรรมและให้บริการด้านสุขภาพกว่า 20 รายการ ทำหมันหมาแมวฟรี เชิญชวนผู้สนใจเข้ารับบริการได้ที่ ณ วัดใหม่สำราญ (เกาะล้าน) สอบถามโทร. 038250562 ต่อ 122 ในวันและเวลาราชการ หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
16 พฤษภาคม 64 เวลา 14.00 น.
16 พค 64 เวลา 14.00 น.
ยอดรวมเพิ่มขึ้นเป็น 6,066,850 ราย
เพิ่มแบบก้าวกระโดดอีกครั้งวันเดียว 8 แสนราย
คิดเป็นประมาณ 37.5% (จากยอดรวม 2 กลุ่ม 16 ล้านราย) Good job!
กรุงเทพวันนี้กระชากขึ้นมาที่ 30,000 ราย/วัน เริ่มดูดี
หวังว่าจะแรงขึ้นเรื่อยๆเมื่อใกล้ๆสิ้นเดือน
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
โครงการ จุฬาอารี - 88 ปี สัตวแพทย์ จุฬาฯ 23 - 26 พฤษภาคม 2567 ณ เกาะสีชัง จังหวัดชลบุรี
ฝ่ายประชาสัมพันธ์และภาพลักษณ์องค์กร คณะสัตวแพทยศาสตร์ ร่วมกับ วิทยาลัยประชากรศาสตร์ โดยความร่วมมือกับ สำนักบริหารศิลปวัฒนธรรม จุฬาลงกรณ์มหาวิทยาลัย จัดทำกิจกรรมทำหมัน ฉีดวัคซีนและดูแลสุขภาพให้สุนัขและแมวในพื้นที่โดยไม่มีค่าใช้จ่าย ใน
โครงการ จุฬาอารี - 88 ปี สัตวแพทย์ จุฬาฯ (CHULA ARi - 88" CUVET)
ในวันที่ 23 - 26 พฤษภาคม 2567 ณ เกาะสีชัง จังหวัดชลบุรี
หนึ่งในโครงการ 88 CUVET ผู้นำความรู้และนวัตกรรมเพื่อสังคม (88th yr CUVET: Bridging knowledge and innovation for a better society)
3 กรกฎาคม 2563
โครงการปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า ประจำปีงบประมาณ ๒๕๖๓ กำหนดจัดโครงการฯ วันที่ 3 กรกฎาคม 2563 เวลา 9.00-14.00 น. ณ สวนสาธารณะ ลานกีฬา@อำเภอกะทู้
26 ตุลาคม – 6 พฤศจิกายน 2563
เทศบาลเมืองกะทู้ ร่วมกับ มูลนิธิเพื่อสุนัขในซอย กำหนดแผนการผ่าตัดทำหมันสุนัข–แมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โครงการเพิ่มศักยภาพการควบคุมดูแลและติดตามสุนัขและแมว ในพื้นที่เทศบาลเมืองกะทู้ ปีงบประมาณ 2564 ระหว่างวันที่ 26 ตุลาคม – 6 พฤศจิกายน 2563 (จันทร์-ศุกร์) ตั้งแต่ เวลา 08.00-16.00 น. ณ สวนสาธารณะลานกีฬา @ อำเภอกะทู้ หมายเหตุ : - ให้สุนัขและแมว งดน้ำ งดอาหาร ก่อนรับบริการผ่าตัดทำหมัน อย่างน้อย 8 ชั่วโมง - เปิดรับลงทะเบียนจองคิวตั้งแต่บัดนี้เป็นต้นไป ที่กองสาธารณสุขและสิ่งแวดล้อม - เตรียมบัตรประชาชนมาติดต่อเพื่อขอรับบริการฯ ติดต่อสอบถามเพิ่มเติมได้ที่ งานสัตวแพทย์ 07632 3856
ไขข้อสงสัย? ผู้ป่วยที่ admit อยู่ในรพ.7แห่ง ขณะนี้ จะต้องทำอย่างไร LINK
ถาม ผู้ป่วยที่ admit อยู่ในรพ.7แห่ง ขณะนี้ จะต้องทำอย่างไร
ตอบ
ผู้ป่วยที่ admit อยู่ในรพ.7แห่ง สามารถใช้สิทธิได้จนกว่าแพทย์ จะอนุญาตให้กลับบ้าน
รพ.ทั้ง 7 แห่ง คือ
- เขต 13 โรงพยาบาลบางไผ่ โรงพยาบาลทั่วไปขนาดใหญ่
- เขต 13 โรงพยาบาลปิยะเวท โรงพยาบาลทั่วไปขนาดใหญ่
- เขต 13 โรงพยาบาลทั่วไปขนาดเล็กนันอา
- เขต 13 โรงพยาบาลทั่วไปขนาดกลาง โรงพยาบาลวิชัยเวช แยกไฟฉาย
- เขต 13 โรงพยาบาลทั่วไปขนาดใหญ่ พระราม 2
- เขต 13 โรงพยาบาลสุขสวัสดิ์ โรงพยาบาลทั่วไปขนาดใหญ่
- เขต 13 โรงพยาบาลทั่วไปขนาดเล็กบางขุนเทียน 1
วิภารามแหลมฉบัง Package รักษาผู้ป่วย Covid-19 แบบ A-B-C LINK
วิภารามแหลมฉบัง Package รักษาผู้ป่วยCovid-19
บริการรักษาผู้ป่วยCovid-19 ที่โรงพยาบาล (กลุ่มสีเขียว)
- Package A กักตัว 5 วัน 4 คืน ราคา 25,000 บาท
- Package B กักตัว 7 วัน 6 คืน ราคา 35,000 บาท
- Package C กักตัว 10 วัน 9 คืน ราคา 50,000 บาท
สอบถามข้อมูลเพิ่มเติมได้ที่
โทรศัพท์ 033-009800 แผนก Admission ต่อ 1116
แผนกการตลาด ต่อ 2023-2025
ศูนย์บริการสาธารณสุข 64 คลองสามวา 2-13 กันยายน 2567 เวลา 08.00-12.00 น.
ศูนย์บริการสาธารณสุข64 คลองสามวา ร่วมกับสำนักงานเขตคลองสามวา จัดบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ระหว่างวันที่ 2-13 กันยายน 2567 เวลา08.00-12.00 น. วันและสถานที่ตามตารางการให้บริการ ผู้เข้ารับบริการสามารถwalk in เข้ามารับบริการได้ตามวันและเวลาดังกล่าว
หมายเหตุ ผู้รับบริการทุกท่านสามารถนำสัตว์เลี้ยงมารับบริการฉีดวัคซีนได้ตามวัน เวลา และสถานที่ตามตารางการรับบริการข้างต้น ผู้ที่นำสัตว์เลี้ยงเข้ารับบริการทุกท่าน ให้นำบัตรประชาชนหรือเอกสารที่แสดงเลขบัตรประชาชน13หลัก เพื่อลงทะเบียนเข้ารับบริการ
16 กันยายน 2564 เนื่องในวันป้องกันโรคพิษสุนัขบ้าโลก
เทศบาลเมืองกะทู้ ร่วมกับ ปศุสัตว์จังหวัดภูก็ต จัดโครงการเฝ้าระวังและป้องกันโรคพิษสุนัขบ้า ในพื้นที่เทศบาลเมืองกะทู้ เนื่องในวันป้องกันโรคพิษสุนัขบ้าโลก ปี พ.ศ. 2564 “World Rabies Day 2021” ในวันพฤหัสบดีที่ 16 กันยายน 2564 เวลา 09.00-16.00 น.
ณ สวนสาธารณะลานกีฬา@อ.กะทู้ โดยออกหน่วยให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และการผ่าตัดทำหมันสุนัข-แมว สามารถ จองคิวผ่าตัดทำหมัน ได้ตั้งแต่วันนี้เป็นต้นไป ผ่าน QR-Code หรือ ลิงค์
15 พฤษภาคม 64 เวลา 14.00 น.
15 พค 64 เวลา 14.00 น.
ยอดรวมเพิ่มขึ้นเป็น 5,9207,001 ราย
เพิ่มจากช่วงเช้าเล็กน้อย ราวๆ 2.8 แสนราย
กรุงเทพ เพิ่ม ประมาณ 12,000 ราย น้อยลงพอสมควร อาจเพราะเป็นช่วงสุดสัปดาห์
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
รายงานผู้ติดเชื้อ 4 กพ 2564
- ศบค. ผู้ป่วยรายใหม่ 809 ราย ในประเทศ 45 ราย เชิงรุก 751 ราย ต่างประเทศ 13 ราย รวมผู้ป่วยยืนยันสะสม 22,058 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 3 ราย สมุทรสาคร 786 ราย ตาก 5 ราย สมุทรสงคราม 1 ราย ราชบุรี 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 13 ราย อิสราเอล 1 ราย มาเลเซีย 1 ราย ปากีสถาน 1 ราย สหราชอาณาจักร 1 ราย เอมิเรตส์ 1 ราย สหรัฐอเมริกา 2 ราย รัสเซีย 1 ราย เอธิโอเปีย 1 ราย เยอรมนี 1 ราย เบลเยียม 1 ราย สเปน 1 ราย ฝรั่งเศส 1 ราย
รายงานผู้ติดเชื้อ 3 กพ 2564
- ศบค. ผู้ป่วยรายใหม่ 795 ราย ในประเทศ 24 ราย เชิงรุก 759 ราย ต่างประเทศ 12 ราย รวมผู้ป่วยยืนยันสะสม 21,249 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 4 ราย สมุทรสาคร 777 ราย ตาก 1 ราย มหาสารคาม 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 12 รายสหรัฐอเมริกา 1 ราย สหราชอาณาจักร 1 ราย แคนาดา 1 ราย มาเลเซีย 2 ราย คูเวต 1 ราย รัสเซีย 1 ราย ตุรกี 1 ราย เอมิเรตส์ 4 ราย
รายงานผู้ติดเชื้อ 2 กพ 2564
- ศบค. ผู้ป่วยรายใหม่ 836 ราย ในประเทศ 109 ราย เชิงรุก 710 ราย ต่างประเทศ 17 ราย รวมผู้ป่วยยืนยันสะสม 20,454 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 29 ราย สมุทรสาคร 787 ราย นนทบุรี 1 ราย สมุทรสงคราม 2 ราย
- ศบค. ติดเชื้อต่างประเทศ 17 ราย สวิตเซอร์แลนด์ 3 ราย อินเดีย 1 ราย ไนจีเรีย 1 ราย สหรัฐอเมริกา 2 ราย ฝรั่งเศส 1 ราย สหราชอาณาจักร 3 ราย เดนมาร์ก 1 ราย แคนาดา 2 ราย มาเลเซีย 3 ราย
รายงานผู้ติดเชื้อ 1 กพ 2564
- ศบค. ผู้ป่วยรายใหม่ 836 ราย ในประเทศ 39 ราย เชิงรุก 793 ราย ต่างประเทศ 4 ราย รวมผู้ป่วยยืนยันสะสม 19,618 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 10 ราย สมุทรสาคร 814 ราย ราชบุรี 2 ราย
- ศบค. ติดเชื้อต่างประเทศ 4 ราย สหรัฐอเมริกา 1 ราย เบลเยี่ยม 1 ราย สหราชอาณาจักร 1 ราย มาเลเซีย 1 ราย
14 พฤษภาคม 64 เวลา 14.00 น.
14 พค 64 เวลา 14.00 น.
ยอดรวมเพิ่มขึ้นเป็น 4,422,974 ราย
เพิ่มจาก ช่วงเช้า อีกเกือบๆ 6 แสนราย
กรุงเทพ เพิ่มในอัตราเดิม คือ ประมาณ 16,000 ราย
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เกษมราษฎร์ ปราจีนบุรี เตรียม BCH HOME ISOLATION ดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน LINK
โรงพยาบาลเกษมราษฎร์ ปราจีนบุรี เตรียม BCH HOME ISOLATION
ดูแลรักษาผู้ป่วยโควิด-19 ที่บ้าน อุ่นใจ ปลอดภัย
ภายใต้การดูแลของโรงพยาบาลเกษมราษฎร์ ปราจีนบุรี
- แพ็คเกจ Standard ราคา 2,000.-
- แพ็คเกจ Package 1 ราคา 3,500.-
- แพ็คเกจ Package 2 ราคา 3,500.-
- แพ็คเกจ Package 3 ราคา 4,000.-
- แพ็คเกจ Package 4 ราคา 6,500.-
เหมาะสำหรับ
- ผู้ที่มีผลตรวจ ATK หรือ RT-PCR พบเชื้อ
- ผู้ป่วยอายุ 5-60 ปี
- ผู้ป่วยมีอาการไม่รุนแรง สามารถดูแลตนเองได้
- อยู่คนเดียว หรือมีที่พักอาศัยที่มีห้องแยก
- ผู้ป่วยไม่มีโรคประจำตัวรุนแรง
ติดต่อซื้อแพ็กเกจและเข้ารับบริการได้ที่ ARI Clinic
ทุกวัน เวลา 08.00 - 17.00 น.
ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ฉีดวัคซีนสัตว์เลี้ยง ฟรี 2-13 กันยายน 2567
ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ฉีดวัคซีนป้องกันพิษสุนัขบ้าให้กับสัตว์เลี้ยง ฟรี วันที่ 2-13 กันยายน 2567 เวลา 09.00 - 11.00 น. สถานที่ ตามรายละเอียดด้านล่างนี้
2 ก.ย. ชุมชนสสวนผัก
3 ก.ย. ชุมชนคลองบางพรานพัฒนา
4 ก.ย. ชุมชนหนทางใหม่ปิ่นทอง
5 ก.ย. ศบส.65 (สาขาม่วงศิริ)
6 ก.ย. ซอยเอกชัย 82,84,86
9 ก.ย. ชุมชนมั่นคงวิมานทอง
10 ก.ย. หมู่บ้านกานดาการ์เด้น
11 ก.ย. ซอยบางบอน 5 ซอย 6
12 ก.ย. หมู่บ้านพระปิ่น 5
13 ก.ย. ชุมชนสถานีรางโพธิ์
14-18 มีนาคม 2565 โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ
โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ ประจำปีงบประมาณ 2565 วันที่
14 มีนาคม 2565 เวลา 09.00 – 16.00 น. ณ โรงเรียนอบจ.บ้านไม้เรียบ
15 มีนาคม 2565 เวลา 09.00 – 16.00 น. ณ สวนสาธารณะลานกีฬา@อำเภอกะทู้
16 มีนาคม 2565 เวลา 09.00 – 16.00 น. ณ วัดกะทู้
17 มีนาคม 2565 เวลา 09.00 – 16.00 น. ณ ศาลเจ้าทุ่งทอง
18 มีนาคม 2565 เวลา 09.00 – 16.00 น. ณ วัดเก็ตโฮ่
แผนการออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
แผนการผ่าตัดทำหมันสุนัข – แมว
15 มีนาคม 2565 เวลา 09.00 - 12.00 น. ณ สวนสาธารณะ ลานกีฬา @อำเภอกะทู้ จำนวน 45 ตัว
* เปิดรับลงทะเบียนจองคิวผ่าตัดทำหมันสุนัข-แมว โดยวิธี Scan QR code และกรอกข้อมูลให้ครบถ้วน เพียงช่องทางเดียวเท่านั้น
* หมายเหตุ กรุณาเตรียมบัตรประชาชนมาแสดงต่อเจ้าหน้าที่ในวันที่มารับบริการฯ
* จำกัดเฉพาะผู้ที่พักอาศัยอยู่ในพื้นที่เทศบาลเมืองกะทู้ จำนวน 1 สิทธ์/ครัวเรือน
* ผู้ที่ลงทะเบียนสำเร็จ ให้งดน้ำงดอาหารสุนัข และแมว 8 ชั่วโมง ก่อนที่จะนำไปรับบริการผ่าตัดตอนทำหมัน
4-8 และ 11-15 เมษายน 2565
เทศบาลเมืองกะทู้ ประชาสัมพันธ์
โครงการเพิ่มศักยภาพการควบคุมดูแลและติดตามสุนัขและแมวในพื้นที่เทศบาลเมืองกะทู้ ปีงบประมาณ พ.ศ. 2565
กำหนดจัดกิจกรรมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า , ทำหมันแมวชุมชน จำนวน 30 ตัว / วัน , ทำหมันแมวมีเจ้าของ จำนวน 20 ตัว / วัน
ระหว่างวันที่ 4-8 และระหว่างวันที่ 11-15 เมษายน 2565 เวลา 08.00 น.-16.00 น. ณ สวนสาธารณะลานกีฬา@ อ.กะทู้
20-22 พฤษภาคม 2565 เจ้าฟ้าจุฬาภรณ์ เสด็จทรงปฏิบัติพระกรณียกิจ ในพื้นที่จังหวัดภูเก็ต
สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารีกรมพระศรีสวางควัฒน วรขัตติยราชนาวี เสด็จทรงปฏิบัติพระกรณียกิจ ในพื้นที่จังหวัดภูเก็ต ในวันที่ 20-22 พฤษภาคม 2565 เสด็จทรงออกหน่วยแพทย์ พระราชทาน โรงพยาบาลจุฬาภรณ์และออกหน่วยสัตวแพทย์อาสาจุฬาภรณ์ เพื่อฉีดวัคซีนและทำหมันให้กับสุนัขและแมว ณ ศูนย์กีฬาสะพานหิน อำเภอเมืองภูเก็ต จังหวัดภูเก็ต
1 กรกฎาคม 2565
โครงการปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯกรมพระศรีสวางควัฒน วรขัตติยราชนารี ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธานศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี ปีงบประมาณ 2565 กิจกรรม ทำหมัน สุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฯ (สามารถ walk in ได้เลย) วันศุกร์ที่ 1 กรกฎาคม 2565 ณ สวนสาธารณะลานกีฬา @อำเภอกะทู้ เวลา 8.30-16.30 น. ฟรี !!!
Festival ออนซอนชัยภูมิ ครั้งที่ 2
"Festival ออนซอนชัยภูมิ ครั้งที่ 2 " ‼ สัปดาห์ที่ 3 ‼ สีสันยามค่ำคืน ความสนุกครึกครื้น วันเสาร์ที่ 24 และอาทิตย์ 25 ธ.ค 65 เวลา 17.00- 22.00 น. ต่อเนื่องทุกวันเสาร์และวันอาทิตย์ ไปจนถึงวันที่ 1 มกราคม 2566 บริเวณลานหน้าศาลากลางจังหวัดชัยภูมิ (หลังเก่า) . พบกับกิจกรรมการแสดง หนังกลางแปลง โซนสินค้าและอาหารมากมาย .
ไขข้อสงสัย? กรณีที่ 64 คลินิก ถูกยกเลิกสัญญา จะต้องดำเนินการอย่างไร LINK
ถาม กรณีที่ 64 คลินิก ถูกยกเลิกสัญญา จะต้องดำเนินการอย่างไร
ตอบ
แนะนำให้ลงทะเบียนทำบัตรทองใหม่ กรณีมีเครือข่ายใกล้บ้านที่สามารถลงทะเบียนเพิ่มเติมได้ ซึ่งในระหว่างนี้ สปสช. ได้รับสมัครหน่วยบริการทดแทน กรณีที่ท่านเจ็บป่วย ต้องเข้ารับบริการ สามารถใช้สิทธิที่คลินิก ศูนย์บริการสาธารณสุข รพ.รัฐและเอกชนที่เข้าร่วมโครงการได้
รายงานผู้ติดเชื้อ 31 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 829 ราย ในประเทศ 91 ราย เชิงรุก 731 ราย ต่างประเทศ 7 ราย รวมผู้ป่วยยืนยันสะสม 18,782 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 7 ราย สมุทรสาคร 801 ราย นครปฐม 1 ราย นนทบุรี 1 ราย ขอนแก่น 1 ราย ราชบุรี 1 ราย ลพบุรี 1 ราย สมุทรสงคราม 2 ราย มหาสารคาม 4 ราย ชลบุรี 1 ราย ปทุมธานี 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 7 ราย บาห์เรน 1 ราย เอมิเรตส์ 1 ราย สหรัฐอเมริกา 1 ราย ไอร์แลนด์ 2 ราย สหราชอาณาจักร 1 ราย อียิปต์ 2 ราย
รายงานผู้ติดเชื้อ 30 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 930 ราย ในประเทศ 28 ราย เชิงรุก 889 ราย ต่างประเทศ 14 ราย รวมผู้ป่วยยืนยันสะสม 17,953 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 4 ราย สมุทรสาคร 883 ราย สมุทรปราการ 19 ราย นนทบุรี 2 ราย มหาสารคาม 6 ราย ตาก 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 14 รายอิหร่าน 1 ราย เกาหลีใต้ 1 ราย สหรัฐอเมริกา 2 ราย ไนจีเรีย 2 ราย รัสเซีย 1 ราย สหราชอาณาจักร 2 ราย มาเลเซีย 1 ราย เยอรมนี 2 ราย
รายงานผู้ติดเชื้อ 29 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 802 ราย ในประเทศ 89 ราย เชิงรุก 692 ราย ต่างประเทศ 21 ราย รวมผู้ป่วยยืนยันสะสม 17,023 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 10 ราย สมุทรสาคร 765 ราย นนทบุรี 1 ราย อยุธยา 2 ราย สระแก้ว 1 ราย อ่างทอง 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 21 ราย อินเดีย 2 ราย เยอรมนี 2 ราย บาห์เรน 1 ราย อินโดนีเซีย 1 ราย เอธิโอเปีย 1 ราย สหรัฐอเมริกา 3 ราย สวีเดน 1 ราย สวิตเซอร์แลนด์ 1 ราย แอฟริกาใต้ 1 ราย เนเธอร์แลนด์ 2 ราย ซาอุดิอาระเบีย 2 ราย สหราชอาณาจักร 1 ราย ออสเตรีย 1 ราย มาเลเซีย 2 ราย เมียนมา 1 ราย
รายงานผู้ติดเชื้อ 28 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 756 ราย ในประเทศ 22 ราย เชิงรุก 724 ราย ต่างประเทศ 10 ราย รวมผู้ป่วยยืนยันสะสม 16,221 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 8 ราย สมุทรสาคร 733 (9+724) ราย นนทบุรี 1 ราย อยุธยา 1 ราย สมุทรปรากร 3 ราย จันทบุรี 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 10 ราย โปรตุเกส 1 ราย รัสเซีย 2 ราย อินโดนีเซีย 1 ราย กาตาร์ 1 ราย สหรัฐอเมริกา 5 ราย
รายงานผู้ติดเชื้อ 27 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 819 ราย ในประเทศ 92 ราย เชิงรุก 716 ราย ต่างประเทศ 11 ราย รวมผู้ป่วยยืนยันสะสม 15,465 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 6 ราย สมุทรสาคร 714 ราย สมุทรสงคราม 1 ราย เพชรบุรี 1 ราย นนทบุรี 1 นราธิวาส 1 ราย ปทุมธานี 1 ราย อ่างทอง 1 ราย สมุทรปรากร 2 (1+1) ราย จันทบุรี 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 11 ราย สหราชอาณาจักร 3 ราย อเอมิเรตส์ 1 ราย อิหร่าน 1 ราย โปแลนด์ 1 ราย โมซัมบิก 1 ราย บาห์เรน 1 ราย สวีเดน 2 ราย อินโดนีเซีย 1 ราย
รายงานผู้ติดเชื้อ 26 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 959 ราย ในประเทศ 89 ราย เชิงรุก 848 ราย ต่างประเทศ 22 ราย รวมผู้ป่วยยืนยันสะสม 14,646 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 21 ราย สมุทรสาคร 914 (70+844) ราย สมุทรสงคราม 1 ราย อุบลราชธานี 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 21 ราย อินโดนีเซีย 1 ราย ปากีสถาน 1 ราย อินเดีย 2 ราย เมียนมา 3 ราย ซูดาน 2 ราย สหราชอาณาจักร 6 ราย เนปาล 1 ราย จีน 1 ราย สหรัฐอเมริกา 3 ราย เดนมาร์ก 1 ราย รัสเซีย 1 ราย
รายงานผู้ติดเชื้อ 25 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 187 ราย ในประเทศ 61 ราย เชิงรุก 116 ราย ต่างประเทศ 10 ราย รวมผู้ป่วยยืนยันสะสม 13,687 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 22 ราย สมุทรสาคร 148 (35+113) ราย สมุทรสงคราม 3 ราย ระยอง 2 ราย สมุทรปราการ 2 ราย
- ศบค. ติดเชื้อต่างประเทศ 10 ราย สหราชอาณาจักร 6 ราย รัสเซีย 1 ราย มาเลเซีย 1 ราย บาห์เรน 1 ราย เยอรมนี 1 ราย
รายงานผู้ติดเชื้อ 24 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 198 ราย ในประเทศ 118 ราย เชิงรุก 73 ราย ต่างประเทศ 7 ราย รวมผู้ป่วยยืนยันสะสม 13,500 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 21 ราย สมุทรสาคร 148 (76+72) ราย นนทบุรี 1 ราย สมุทรสงคราม 7 ราย ราชบุรี 1 ราย สมุทรปราการ 12 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 6 ราย เบลเยียม 1 ราย มาเลเซีย 1 ราย บาห์เรน 1 ราย ฝรั่งเศส 2 ราย เอมิเรตส์ 1 ราย เมียนมา 1 ราย
รายงานผู้ติดเชื้อ 23 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 198 ราย ในประเทศ 69 ราย เชิงรุก 111 ราย ต่างประเทศ 18 ราย รวมผู้ป่วยยืนยันสะสม 13,302 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 9 (5+4) ราย สมุทรสาคร 163 (56+107) ราย อ่างทอง 1 ราย สมุทรสงคราม 5 ราย สมุทรปราการ 1 ราย ระยอง 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 18 ราย สวีเดน 1 ราย อินเดีย 1 ราย อิตาลี 1 ราย เอมิเรตส์ 2 ราย อียิปต์ 1 ราย รัสเซีย 1 ราย สหรัฐอเมริกา 1 ราย บาห์เรน 4 ราย สหราชอาณาจักร 5 ราย สวิตเซอร์แลนด์ 1 ราย
รายงานผู้ติดเชื้อ 22 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 309 ราย ในประเทศ 80 ราย เชิงรุก 217 ราย ต่างประเทศ 12 ราย รวมผู้ป่วยยืนยันสะสม 13,104 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 13 (8+5) ราย สมุทรสาคร 261 (49+212) ราย ตาก 5 ราย ปทุมธานี 6 (1+3) ราย นนทบุรี 1 ราย อยุธยา 2 ราย กาญจนบุรี 2 ราย เพชรบุรี 2 ราย ราชบุรี 3 ราย สมุทรปราการ 2 ราย
- ศบค. ติดเชื้อต่างประเทศ 12 ราย เลบานอน 1 ราย สหราชอาณาจักร 2 ราย เอสโตเนีย 1 ราย สหรัฐอาหรับเอมิเรตส์ 1 ราย อิตาลี 2 ราย ซูดาน 2 ราย สวิตเซอร์แลนด์ 1 ราย ศรีลังกา 1 ราย เยอรมนี 1 ราย
รายงานผู้ติดเชื้อ 21 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 142 ราย ในประเทศ 88 ราย เชิงรุก 37 ราย ต่างประเทศ 17ราย รวมผู้ป่วยยืนยันสะสม 12,795 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 16 (14+2) ราย สมุทรสาคร 92 (63+29) ราย เชียงราย 1 ราย อ่างทอง 4 ราย นนทบุรี 2 ราย ปทุมธานี 4 (1+3) ราย ระยอง 1 ราย ชลบุรี 1 ราย จันทบุรี 4 (1+3) ราย
- ศบค. ติดเชื้อต่างประเทศ 17 ราย เมียนมา 2 ราย สวิตเซอร์แลนดื 1 ราย สวีเดน 1 ราย ตุรกี 3 ราย ญี่ปุ่น 1 ราย อินเดีย 3 ราย สหรัฐอเมริกา 3 ราย มาเลเซีย 3 ราย
รายงานผู้ติดเชื้อ 20 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 59 ราย ในประเทศ 28 ราย เชิงรุก 23 ราย ต่างประเทศ 8 ราย รวมผู้ป่วยยืนยันสะสม 12,653 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 13 (10+3) ราย สมุทรสาคร 27 (7+20) ราย ราชบุรี 1 ราย สมุทรปราการ 3 ราย นครพนม 1 อยุธยา 1 ราย ระยอง 1 ราย ตาก 1 ราย ปทุมธานี 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 10 ราย ไอร์แลนด์ 1 ราย ปากีสถาน 1 ราย สหรัฐอเมริกา 2 ราย มาเลเซีย 1 ราย ญี่ปุ่น 1 ราย อินเดีย 1 ราย เยอรมนี 1 ราย
รายงานผู้ติดเชื้อ 19 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 171 ราย ในประเทศ 33 ราย เชิงรุก 125 ราย ต่างประเทศ 13 ราย รวมผู้ป่วยยืนยันสะสม 12,594 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด สมุทรสาคร 138 (18+120) ราย กรุงเทพ 13 (9+4) ราย ราชบุรี 1 ราย สมุทรปราการ 1 ราย ระยอง 3 ราย นนทบุรี 2 (1+1) ราย
- ศบค. ติดเชื้อต่างประเทศ 13 ราย ไต้หวัน 1 ราย ตุรกี 1 ราย เบลเยี่ยม 1 ราย สหราชอาณาจักร 1 ราย ฝรั่งเศส 2 ราย สาธารณรัฐเช็ค 1 ราย สหรัฐอเมริกา 1 ราย ญี่ปุ่น 2 ราย มาเลเซีย 2 ราย เอมิเรตส์ 1 ราย
รายงานผู้ติดเชื้อ 18 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 357 ราย ในประเทศ 82 ราย เชิงรุก 275 ราย ต่างประเทศ 12 ราย รวมผู้ป่วยยืนยันสะสม 12,423 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด เลย 1 ราย กรุงเทพ 18 (13+5) ราย ตรัง 1 ราย นนทบุรี 2 ราย พระนครศรีอยุธยา 1 ราย สมุทรสาคร 310 (51+259) ราย อ่างทอง 8 ราย สมุทรปราการ 2 ราย ชลบุรี 2 (1+1) ราย ระยอง 2 ราย
- ศบค. ติดเชื้อต่างประเทศ 10 ราย โอมาน 1 ราย สหราชอาณาจักร 1 ราย ฝรั่งเศส 1 ราย สหรัฐอเมริกา 2 ราย เยอรมนี 1 ราย มาเลเซีย 5 ราย บาห์เรน 1 ราย
รายงานผู้ติดเชื้อ 17 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 364 ราย ในประเทศ 43 ราย เชิงรุก 321 ราย ต่างประเทศ 10 ราย รวมผู้ป่วยยืนยันสะสม 12,054 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 10 ราย ขอนแก่น 2 ราย ตาก 1 ราย นนทบุรี 2 ราย พระนครศรีอยุธยา 1 ราย สมุทรสาคร 335 (24+311) ราย สุพรรณบุรี 1 ราย อ่างทอง 2 ราย ชลบุรี 1 ราย ตรัง 2 ราย ปราจีนบุรี 1 ราย พัทลุง 3 ราย ระยอง 2 ราย สมุทรปราการ 1 ราย
- ศบค. ติดเชื้อต่างประเทศ 10 ราย สหรัฐอเมริกา 2 ราย เยอรมนี 3 ราย อินเดีย 2 ราย เดนมาร์ก 1 ราย กาตาร์ 1 ราย มาเลเซีย 1 ราย
รายงานผู้ติดเชื้อ 16 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 230 ราย ในประเทศ 83 ราย เชิงรุก 126 ราย ต่างประเทศ 21 ราย รวมผู้ป่วยยืนยันสะสม 11,680 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 12 ราย ขอนแก่น 2 ราย จันทบุรี 1 ราย ชัยภูมิ 1 ราย ปทุมธานี 1 ราย สมุทรสาคร 55 ราย อ่างทอง 6 ราย ชลบุรี 5 ราย
- ศบค. ติดเชื้อต่างประเทศ 21 ราย เยอรมันี 3 ราย กาตาร์ 1 ราย เอธิโอเปีย 1 ราย รัสเซีย 1 ราย สหรัฐอเมริกา 1 ราย มาเลเซีย 1 ราย สหราชอาณาจักร 7 ราย ตุรกี 6 ราย
การตรวจที่ รพ ต่างๆขณะนี้ ผลเป็นบวกเยอะมาก แบบมีเชื้อ - 6 เมษายน 64 LINK
การตรวจที่ รพ ต่างๆขณะนี้ ผลเป็นบวกเยอะมาก แบบมีเชื้อ
และที่แยงจมูกครั้งแรกไม่เจอ ก็สรุปไม่ได้ ต้องแยงต่ออีก 2-3 ครั้ง ใน 10 วัน และผลอีก 2-3 วันจึงจะทราบ
ทางที่ดี ถ้ามีความเสี่ยง แยกตัว ดีที่สุด ที่บ้าน และมาตรวจที่ 7-10 วัน
คนที่พบมีเชื้อไปแล้ว ถ้าไม่มีอาการ และเอกซเรย์ปอดไม่มีปอดบวม (เพราะโควิดมีปอดบวมโดยไม่มีอาการได้)
แยกตัวต่อ และกลับมา รพ ทันทีที่อาการเปลี่ยน
ไม่เช่นนั้น รพ ล้นหลาม
เทศบาลนครเชียงใหม่ กับกิจกรรมทำหมันสุนัขและฉีดวัคซีนสุนัขบ้า ประจำปี 2566 LINK
เทศบาลนครเชียงใหม่ มอบหมายให้หน่วยงานสัตวแพทย์ ฝ่ายบริการสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม ดำเนินการให้บริการทำหมันสัตว์เลี้ยง ณ ศูนย์บริการสุขภาพสัตว์บ้านเด่นฯ
ศูนย์บริการสุขภาพสัตว์บ้านเด่นฯ เป็นศูนย์บริการสุขภาพสัตว์เลี้ยง ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดยากำจัดเห็บ หมัด และเป็นสถานที่ผลิตน้ำจุลินทรีย์ชีวภาพ (อี.เอ็ม.) รวมทั้งเป็นสถานที่จัดกิจกรรมชมรม ทู บี นัมเบอร์วันของเทศบาลนครเชียงใหม่ ตั้งอยู่ถนนเชียงใหม่ - ลำพูน โดยเปิดให้บริการวันจันทร์ - วันศุกร์ ตั้งแต่เวลา 09.00 - 15.00 น.
++ กิจกรรมที่ผ่านไป 2566 ++
งานนมัสการพระแท่นดงรัง 2566 วันที่ 27 ก.พ. - 7 มี.ค. 2566
งานนมัสการพระแท่นดงรัง 2566 ปีนี้จัดระหว่างวันที่ 27 ก.พ. - 7 มี.ค. 2566 ณ วัดพระแท่นดงรังวรวิหาร อ.ท่ามะกา จ.กาญจนบุรี ตารางการแสดงศิลปิน 9 วัน 9 คืน 27 ก.พ. นพคุณ อรุณรุ่ง จอมขัวญ กัลยา 28 ก.พ. ใบเฟิร์น สุทธิยา เบ๋บี๋ บาร์บี้ 1 มี.ค. ไรอัล กาจบัณฑิต 2 มี.ค. ปุยปรียานุช อุ้ม อนัญญา 3 มี.ค. เนย จิตรเลขา ฟอร์ม ชลพ์พรรธน์ 4 มี.ค. เชน คเชนทร์ หมิวเขมจิรา 5 มี.ค. จ่อย รวมมิตร 6 มี.ค. อิงอิง คอมโบ้ 7 มี.ค. อ๊อด
เทศบาลนครนครปฐม ทำหมันฟรี 2565-2566
ปี 2566 เทศบาลนครนครปฐม ร่วมกับ ปศุสัตว์จังหวัดนครปฐม และ ปศุสัตว์อำเภอเมืองนครปฐม จัดทำโครงการ ทําหมันสุนัขและแมวฟรี ดังนี้
- วันพฤหัสบดีที่ 15 ธันวาคม 2565 เวลา 09.00 - 12.00 น. ณ ลานโดมอเนกประสงค์ ศูนย์เยาวชนเทศบาลนครนครปฐม (สนามจันทร์) ทำหมันจํานวนจำกัด 70 ตัว เท่านั้น ลงทะเบียนจองคิว ระหว่างวันที่ 7 - 14 ธันวาคม 2565 เวลา 08.30 - 16.30 น.
- วันอังคารที่ 7 มีนาคม 2566 เวลา 09.00 - 12.00 น. ณ สมาคมหวังศรีนครปฐม ถนนมาลัยแมน ลงทะเบียนจองคิววันที่ 22 กุมภาพันธ์ ถึง 3 มีนาคม 2566
- วันอังคารที่ 20 มิถุนายน 2566 เวลา 09.00 - 12.00 น. ณ ศาลาเทพเจติยาจารย์ วัดเสนหา พระอารามหลวง ทําหมันสุนัขและแมวฟรี จำนวน 100 ตัว และให้บริการ #ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยง (ไม่จำกัดจำนวน)
- วันอังคารที่ 18 กรกฎาคม 2566 เวลา 09.00 - 12.00 น. ณ ศาลามั่นสุข วัดไร่เกาะต้นสำโรง เปิดให้ลงทะเบียนจองรับบริการทำหมัน ในวันที่ 5 – 14 กรกฎาคม 2566
- วันที่ 31 สิงหาคม 2566 ณ อาคารอเนกประสงค์ วิทยาลัยอาชีวศึกษาเทศบาลนครปฐม เปิดให้ลงทะเบียนทําหมันสัตว์ ตั้งแต่วันที่ 21 - 30 สิงหาคม 2566
- วันพุธที่ 20 กันยายน 2566 เวลา 09.00 - 11.00 น. เรือนกระดังงา ฝั่งวัดไร่เกาะต้นสำโรง หน้าพระสังกัจจาย
- วันพฤหัสบดีที่ 14 ธันวาคม 2566 เวลา 09.00 - 11.00 น. ณ สมาคมหวังศรี สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลนครนครปฐม หมายเลขโทรศัพท์ 034-242199 และ 034-966440 ถึง 4 ต่อ 21
++ กิจกรรมที่ผ่านไป ++
เทศบาลนครอุดรธานี ออกให้บริการผ่าตัดทำหมัน ฉีดวัคซีนสุนัขและแมว ฟรี‼️ วันที่ 11-22 สิงหาคม เวลา 08.30-16.30 น. พี่น้องประชาชนที่อาศัยอยู่ภายในเขตเทศบาลนครอุดรธานี นำสุนัขและแมวของท่านมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และทำหมันได้ตามกำหนดการ
ตามตารางกำหนดการ พิกัดเขต 1-4 ดังนี้
- วันที่ 10 สิงหาคม 2566 พื้นที่เขต 1 ณ ชุมชนโพธิ์สว่าง 1 (วัดทองคายนิมิต)
- วันที่ 11 สิงหาคม 2566 พื้นที่เขต 2 ณ ชุมชนบ้านเดื่อ 1 (วัดบ้านเดื่อ)
- วันที่ 17 สิงหาคม 2566 พื้นที่เขต 3 ณ ชุมชนเก่าจาน 4 (บ้าน ที่ทำการกรรมการชุมชน)
- วันที่ 18 สิงหาคม 2566 พื้นที่เขต 3 ณ ชุมชนโพธิวราราม (วัดโพธิวราราม)
- วันที่ 22 สิงหาคม 2566 พื้นที่เขต 4 ณ ชุมชนดอนอุดม 1 (ศาลาชุมชน)
โดยก่อนที่จะนำสุนัขหรือแมว มารับบริการทำหมัน จะต้องปฏิบัติ ดังต่อไปนี้
1) งดน้ำและอาหารก่อนผ่าตัดอย่างน้อย 12 ชั่วโมง
2) สุนัขต้องไม่มีอาการผิดปกติหรือกำลังป่วย
3) อายุต้องมากกว่า 4 เดือนขึ้นไป
4) สุนัขที่กำลังมีประจำเดือน หรือเพิ่งคลอดลูกไม่เกิน 2 เดือนไม่ควรทำหมัน
ติดต่อสอบถามรายละเอียดเพิ่มเติม ได้ที่ กลุ่มงานบริการสาธารณสุข สำนักสาธารณสุขและสิ่งแวดล้อม โทร. 042-325176 ถึง 85 ต่อ 2107 วันและเวลาราชการ
++ กิจกรรมที่ผ่านไป ++
ศูนย์บริการสาธารณสุข 66 ตำหนักพระแม่กวนอิม โชคชัย 4
ศูนย์บริการสาธารณสุข 66 ตำหนักพระแม่กวนอิม โชคชัย 4
2 กันยายน 2567 หมู่บ้านเลิศอุบล 4
3 กันยายน 2567 หมู่บ้านเสนานิเวศน์โครงการ 1
4 กันยายน 2567 หมู่บ้านต.รวมโชค
5 กันยายน 2567 หมู่บ้านราณี 5
6 กันยายน 2567 หมู่บ้านพัฒนา หมู่ 1,5
9 กันยายน 2567 วัดสาครสุ่นประชาสรรค์
10 กันยายน 2567 หมู่บ้านจิรัฐติกร
11 กันยายน 2567 วัดสิริกมลาวาส
12 กันยายน 2567 วัดลาดปลาเค้า
13 กันยายน 2567 ชุมชนเนียมกล่ำสามัคคี
ติดต่อโทร 02-5394895 02-5394828
++ กิจกรรมที่ผ่านไป 2566 ++
ปี 2566
ถ่ายโอน ปี 2566
ถ่ายโอน ปี 2566 จำนวน 3,263 แห่ง(33.03%)
- ถ่ายโอนไป อบจ. 3,263 แห่ง
- อบจ.รับถ่ายโอน 49 อบจ.
- ไม่รับถ่ายโอน 27 อบจ
- รับถ่ายโอน 100% 6 อบจ. (มุกดาหาร, หนองบัวลำภู, ร้อยเอ็ด, ขอนแก่น, ปราจีนบุรี, สุพรรณบุรี)
Kilo Run มหัศจรรย์ครอสคันทรี 8 ม.ค. 2566
Kilo Run มหัศจรรย์ครอสคันทรี : วิ่งหลงมนต์เสน่ห์แดนดงตาล (กินเที่ยวครบ) @เพชรบุรี หมวดกิจกรรม : หมวดกีฬา Kilo Run-มหัศจรรย์ครอสคันทรี :วิ่งหลงมนต์เสน่ห์แดนดงตาล (กินเที่ยวครบ)@เพชรบุรี” 8 ม.ค. 2566
เที่ยวงานถนนต้นตาล ครั้งที่ 2 วันที่ 6 - 8 มกราคม 2566
เที่ยวงานถนนต้นตาล ครั้งที่ 2 วันที่ 6 - 8 มกราคม 2566 ติดไฟอร่าม ยามค่ำคืน “หนมโหนด" - ประกวดกินหนมโหนด - ประกวดลูกตาลยักษ์ - ประกวดหนูน้อยทองกวาว - ประกวดเงาเสียงไมค์ทองม้วน - ประกวดวัว/วัวลาน/ไก่ชน - รำวงย้อนยุค - ชมควายสวยงามราคาแพงที่สุดในประเทศไทย ณ ถนนต้นตาล ต.ไร่สะท้อน อ.บ้านลาด จ.เพชรบุรี
งาน Pattaya Countdown 2023
ชมพลุปีใหม่ พร้อมโปรดักชั่น แสง สี เสียง จัดเต็มอย่างยิ่งใหญ่ ในงาน Pattaya Countdown 2023 ณ ท่าเทียบเรือท่องเที่ยวพัทยา (แหลมบาลีฮาย) จุดพลุคืน 31 ธ.ค. 65 จุดพลุ วันที่ 31 ธันวาคม 2565 (พัทยา) - ชมคอนเสิร์ต พร้อมนับถอยหลังสู่ศักราชใหม่ ส่งท้ายปีเก่าต้อนรับปีใหม่ 2566 และชมพลุสุดอลังการระดับประเทศ จุดพลุ วันที่ 31 ธันวาคม 2565 (เกาะล้าน) - ชมคอนเสิร์ต พร้อมนับถอยหลังสู่ศักราชใหม่ ส่งท้ายปีเก่าต้อนรับปีใหม่ 2566 และชมพลุสุดอลังการระดับประเทศ
Runway Camping @Terminal21 Pattaya 27 ม.ค. – 1 ก.พ. 66
Runway Camping เทศกาลอาหารสไตล์แคมป์ปิ้ง ชมหนังกลางแปลง บนลานเครื่องบินครั้งแรกในพัทยา ครั้งแรกในพัทยา! เทศกาลอาหารสไตล์แคมป์ปิ้ง ชมหนังกลางแปลง บนลานเครื่องบิน ใจกลางเมืองพัทยา ยกขบวนร้านอาหารเมนู คาว หวาน และ คาราวาน Food Truck ภายใต้บรรยากาศการตกแต่งสไตล์แคมป์ปิ้งสุดชิลล์ เอาใจสาย camper มุมถ่ายรูปเพียบ! รับชม ฟรีคอนเสิร์ต จากศิลปินวง Hers ฟังเพลงเพลินทุกวัน พบกับโซน Runway Cinema ชมหนังกลางแปลงบนลานบิน ริมชายหาดทะเลเทียม ฟรี ไม่มีค่าใช้จ่าย แล้วมาอิ่ม บรรยากาศฟินๆ กันได้ที่ลานเครื่องบิน ทุกวัน ตั้งแต่วันที่ 27 ม.ค. – 1 ก.พ. 66 เวลา 17.00 – 22.00 น.
เปอรานากันแหลมสัก 13 - 15 มกราคม 66
Go Local Meet Local Eat Local ในงาน “Peranakan Laemsak 2023 เปอรานากันแหลมสัก” สัมผัสเสน่ห์แหล่งท่องเที่ยวชิมอาหารเลิศรส ช็อปของฝากจากชุมชน ชมกิจกรรมและศิลปะวัฒนธรรมท้องถิ่น ณ สามแยกวัฒนธรรม ต. แหลมสัก 13 - 15 มกราคม 66
งานกาชาดกระบี่ ประจำปี 2566
จังหวัดกระบี่ ร่วมกับ เหล่ากาชาดจังหวัดกระบี่ ขอเชิญเที่ยวงาน ปีใหม่ และ งานกาชาดกระบี่ ประจำปี 2566 จัดระหว่างวันที่ 29 ธันวาคม 2565 ถึง 7 มกราคม 2566 ณ บริเวณสนามศาลากลาง จังหวัดกระบี่
ชมหมอกส่องดาว ที่...แม่กาษา จังหวัดตาก
ชมหมอกส่องดาว ที่...แม่กาษา จังหวัดตาก | Beauty beyond words at Mae Kasa มกราคม 2566 แม่สอด เป็นอำเภอเล็ก ๆ ในจังหวัดตาก แม้จะเป็นอำเภอเล็ก ๆ หลายคนอาจจะรู้จักในฐานะอำเภอติดกับชายแดนเมียนมาแต่วันนี้เราจะมาพาทุกคนไปรู้จักแม่สอดในมุมมองอื่น ๆ มาดูกันสิว่าแม่สอดมีอะไรน่าค้นหาบ้าง
สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 2 จัดทุกวันเสาร์-อาทิตย์ ตั้งแต่วันที่ 17 ธันวาคม 2565 – 26 กุมภาพันธ์ 2566 LINK
ททท. สำนักงานราชบุรี ร่วมกับ วัดขนอน จังหวัดราชบุรี เชิญนักท่องเที่ยวร่วมกิจกรรม “สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 2 ” เพื่อร่วมอนุรักษ์และเผยแพร่ศิลปวัฒนธรรมหนังใหญ่วัดขนอนอันเป็นเอกลักษณ์ของจังหวัดราชบุรี พร้อมทั้งส่งเสริมให้นักท่องเที่ยวได้เรียนรู้และเปิดประสบการณ์ใหม่ด้านการท่องเที่ยวจากการทำกิจกรรม DIY.
จัดทุกวันเสาร์-อาทิตย์ เวลา 09.00-16.00 น. เริ่มตั้งแต่วันที่ 17 ธันวาคม 2565 – 26 กุมภาพันธ์ 2566 ณ วัดขนอน อ.โพธาราม จังหวัดราชบุรี นักท่องเที่ยวสามารถร่วมกิจกรรมได้ฟรี ดังนี้
1. ชมการแสดงหนังใหญ่ วันเสาร์ เวลา 10.00 น. วันอาทิตย์ เวลา 11.00 น.
2. กิจกรรม DIY กิจกรรมตอกหนังใหญ่และระบายสี กิจกรรมเพ้นท์ผ้าบาติก
3. ชมพิพิธภัณฑ์หนังใหญ่ (เปิดให้เข้าชมทุกวัน)
The Rhythm Balloon Festival 2023 (31 ม.ค. - 5 ก.พ. 66)
เริ่มแล้ว! #เทศกาลบอลลูน #กาญจนบุรี ปีนี้จัดใหญ่มันส์ไม่ยั้ง พบกันในงาน The Rhythm Balloon Festival 2023 ขึ้นบอลลูนชมวิว ดูคอนเสิร์ต เต็มอิ่มกับโชว์พิเศษจัดแน่นทุกวัน 1 ปีมีครั้งเดียวกับงานโชว์บอลลูนสุดยิ่งใหญ่อลังการที่ ปีนี้จัดเต็ม! ขนกองทัพบอลลูนแบบตระการตามาให้ถ่ายรูปสุดปัง Exclusive Night Concert จากศิลปินและดีเจชื่อดัง งานนี้มันส์สะเทือนกาญจนบุรีแน่นอน
DJ Night Party 31 ม.ค. - 3 ก.พ. Exclusive Night Concert 4 ก.พ.- 5 ก.พ. พบโชว์สุดพิเศษทุกวัน จัดเต็มอย่างต่อเนื่อง ! • Hot Air Balloon ขึ้นชมวิวสุดตระการตา • Balloon Dance ตามจังหวะเพลงสุดมันส์ • Fly Board Show เอ็กซ์ตรีมทางน้ำ • Fire Performance Show ควงกระบองไฟสุดเร้าใจ • Farm Chill Live Music อย่างชิลล์
งาน KANCHANABURI FUN TIME FESTIVAL เทศกาลแห่งความสนุกสุดอบอุ่น 19-22 ม.ค. 2566
อบจ.กาญจนบุรี ขอเชิญร่วมเติมเต็มความสุขในงาน KANCHANABURI FUN TIME FESTIVAL เทศกาลแห่งความสนุกสุดอบอุ่น วันที่ 19-22 ม.ค. 2566 ตั้งแต่ 17.00 น. เป็นต้นไป ณ บริเวณด้านหน้าโรงงานกระดาษไทยกาญจนบุรี ในงานพบกับ... อุปกรณ์แคมป์ปิ้ง กิจกรรมสาย CRAFT สายกาแฟ หนังดังกลางแปลง จุดถ่ายภาพสุดเก๋ ชมดนตรีจากศิลปินดัง พร้อมช้อป ชิม สุดยอดอาหารอร่อยในจังหวัดกาญจนบุรี กันแบบจุใจ เข้าชมฟรี ‼️ ตลอดงาน จุดจอดรถ บริเวณโรงเรียนเทศบาล 5
หนาวนี้ที่ ชะแล ครั้งที่ 6 วันที่ 21 - 23 มกราคม 2566
ชวนมากิน เที่ยว นอนเต็นท์ ดูดาว สัมผัสอากาศหนาว ที่ตำบลชะแล องค์การบริหารส่วนตำบลชะแล ขอเชิญเที่ยวงาน "หนาวนี้ที่ ชะแล" ครั้งที่ 6 เพื่อเป็นการส่งเสริมการท่องเที่ยวเชิงอนุรักษ์ของตำบลชะแล ระหว่างวันที่ 21 - 23 มกราคม 2566 ณ ไร่ปราถนา บ้านทุ่งนางครวญ หมู่ที่ 6
ตำบลชะแล อำเภอทองผาภูมิ จังหวัดกาญจนบุรี สอบถามข้อมูลเพิ่มเติมได้ที่ อบต.ชะแล โทร. 034 510770 หรือ 092 880 0959 (คุณกุ๊ก)
ตรุษจีนสุพรรณบุรี มหัศจรรย์ 15 ปี มังกรสวรรค์ 21-31 มกราคม 2566
จังหวัดสุพรรณบุรี ร่วมกับ การท่องเที่ยวแห่งประเทศไทย และคณะกรรมการศาลเจ้าพ่อหลักเมืองสุพรรณบุรี กำหนดจัดงานตรุษจีนสุพรรณบุรี ระหว่างวันที่ 21-31 มกราคม 2566 ณ อุทยานมังกรสวรรค์ พิพิธภัณฑ์ลูกหลานพันธุ์มังกรศาลเจ้าพ่อหลักเมืองสุพรรณบุรี อ.เมืองสุพรรณบุรี จ.สุพรรณบุรี เพื่อรำลึกถึงความสัมพันธ์ทางการทูต ระหว่างไทย – จีน และเฉลิมฉลองครบรอบ 15 ปี มังกรสวรรค์ ในเทศกาลตรุษจีน ตลอดจนเพื่อเป็นการอนุรักษ์ สืบสานเทศกาลประเพณีสำคัญในพื้นที่ ส่งเสริมการท่องเที่ยวในช่วงเทศกาลตรุษจีน นำไปสู่การท่องเที่ยวตามแหล่งท่องเที่ยวต่างๆในพื้นจังหวัดสุพรรณบุรี
กิจกรรมภายในงาน. ชมแสง สี เสียง สุดตระการตาตลอดงาน ชมการแสดงโดยเยาวชนสุพรรณบุรีที่ถอดแบบมาจากจีน...การแสดงชุดลูกหลานพันธุ์มังกร อาทิ สิงโตปีนเสาดอกเหมย กลองศึก มังกร 9 เซียน กังฟู เอ็งกอบู๊ กวนอิมพันมือ งิ้วเปลี่ยนหน้ากาก การแสดงชุดพิเศษ การแสดงระบำแบบจีน ชมการแสดงคอนเสิร์ตของศิลปินดารานักร้องชื่อดัง อาทิ น้องฮาย ชุติมา แกรมมี่โกลด์ /พร์อกซี่ /หนูมิเตอร์ /ศรราม อเนกลาภ / นิวคันทรี่ แกรมมี่โกลด์/มีนตรา อินธิรา ตื่นตาตื่นใจกับการประดับตกแต่งด้วยระบบ แสง สี ดอกไม้ ให้เป็นสวน แสง สีสัน สวรรค์ เมืองสุพรรณฯ
งานเกษตรและของดีเมืองอ่างทอง ประจำปี 2566
“งานเกษตรและของดีเมืองอ่างทอง ประจำปี 2566” ระหว่างวันที่ 20 – 29 มกราคม 2566 ณ วัดขุนอินทประมูล ผู้เข้าร่วมงานจะได้รับชมการแสดงแสง สี เสียง อย่างสวยงามและยิ่งใหญ่ตระการตากับการแสดงศิลปวัฒนธรรม จากวิทยาลัยนาฎศิลป์อ่างทอง
งานอนุสรณ์ดอนเจดีย์ ประจำปี 2566
จังหวัดสุพรรณบุรี ร่วมกับการท่องเที่ยวแห่งประเทศไทย (ททท.) รวมทั้งหน่วยงานในภาครัฐและภาคเอกชน กำหนดจัดงานอนุสรณ์ดอนเจดีย์ และงานกาชาดจังหวัดสุพรรณบุรี ประจำปี 2566 วันที่ 18 มกราคม – 1 กุมภาพันธ์ 2566
ณ พระบรมราชานุสรณ์ดอนเจดีย์ อำเภอดอนเจดีย์ จังหวัดสุพรรณบุรี เพื่อเชิดชูวีรกรรมอันยิ่งใหญ่ของสมเด็จพระนเรศวรมหาราช โดยนำเสนอเรื่องราวเกี่ยวกับประวัติศาสตร์ชาติไทย และร่วมรำลึกถึงสมเด็จพระนเรศวรมหาราช ที่สามารถกอบกู้เอกราชให้ชาติไทยมีความเป็นอิสระมาจนทุกวันนี้ ตลอดจนเป็นการส่งเสริมการท่องเที่ยวในจังหวัดสุพรรณบุรี
กิจกรรมภายในงาน การแสดง แสง สี เสียง สงครามยุทธหัตถีอันยิ่งใหญ่ตระการตาด้วยช้างจริง ม้าจริง ในสถานที่จริง เพื่อเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช • การแสดงศิลปวัฒนธรรม และมหรสพต่างๆ อาทิ การแสดงโขน การแสดงวงโปงลาง การแสดงลิเก การแสดงวงปี่พาทย์ การแสดงวงดนตรี การประกวดขับร้องเพลงลูกทุ่ง ฯลฯ • การเดินแบบผ้าไทย การประกวดธิดาดอนเจดีย์ ซึ่งแต่งกายด้วยชุดตะเบงมานเหมือนวีรสตรีไทยในอดีต • การออกร้านธารากาชาด/เฮฮาพาโชค การจัดแสดงและจำหน่ายสินค้าผลิตภัณฑ์ของจังหวัดสุพรรณบุรี “ของดีวิถีคนเมืองเหน่อ” และการจัดจำหน่ายสินค้าอุปโภคบริโภค
งานวันเกษตรภาคอีสาน ประจำปี 2566 วันที่ 27 มกราคม – 5 กุมภาพันธ์ 2566
งานวันเกษตรภาคอีสาน ประจำปี 2566 ระหว่างวันที่ 27 มกราคม – 5 กุมภาพันธ์ 2566 ณ อุทยานเทคโนโลยีการเกษตร มหาวิทยาลัยขอนแก่น อำเภอเมือง จังหวัดขอนแก่น ภายใต้แนวคิด “นวัตกรรมเกษตรอีสาน มุ่งสู่การพัฒนาที่ยั่งยืน” สามารถดูรายละเอียดกิจกรรม และติดต่อสอบถามเพิ่มเติมได้ที่ Facebook : งานวันเกษตรภาคอีสาน ประจำปี 2566 หรือโทรศัพท์ โทร. 043-009-700 ต่อ 45312 , 42489 , 44753
ปฏิทินกิจกรรมท่องเที่ยว เดือนมกราคม 2566
งานเทศกาลตรุษจีนหาดใหญ่ไชน่าทาวน์ ประจำปี 2566
งานเทศกาลตรุษจีน ประจำปี 2566 “Hatyai Chinese New Year 2023” เทศกาลตรุษจีนหาดใหญ่ไชน่าทาวน์ ประจำปี 2566 ระหว่างวันที่ 20 – 24 มกราคม 2566 ณ บริเวณถนนเสน่หานุสรณ์ อ.หาดใหญ่ จ.สงขลาPhuket Festival 2566
Phuket Festival เทศกาลเดือนสามบ้านเรา 27-29 มกราคม 2566 ย่านเมืองเก่าภูเก็ต
107 ปี เทศกาลตรุษจีนปากน้ำโพ นครสวรรค์ 2566 วันที่ 15-26 มกราคม 2566
เที่ยวตรุษจีนปากน้ำโพ ขอเชิญชวนเที่ยวงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2566 อย่างยิ่งใหญ่ กำหนดจัดขึ้นระหว่างวันที่ 15-26 มกราคม 2566 รวม 12 วัน 12 คืน Highlight - ชมขบวนแห่กลางคืน(ชิวซา) วันที่ 24 มกราคม 2566 - ขบวนแห่กลางวัน(ชิวสี่) วันที่ 25 มกราคม 2566 ตรุษจีนนครสวรรค์ปีนี้จัดงานอย่างยิ่งใหญ่ ภายใต้แนวคิด “สืบสานพลังแห่งศรัทธา รักษาประเพณี 107ปี ตรุษจีนปากน้ำโพ” ชมขบวนแห่ที่ยาวที่สุดในประเทศไทย ทั้งกลางวันและกลางคืน การแสดงขบวนนางฟ้าจากโรงเรียนและมหาวิทยาลัยต่าง ๆ การแสดงคณะมังกรทอง การแสดงสิงโต 5 ชาติพันธุ์ 5 คณะ สิงโตปักกิ่ง สิงโตกว๋องสิว สิงโตไหหนำ สิงโตฮกเกี๊ยน สิงโตฮากกา ดนตรีจีนล่อโก้ว รำถ้วยไหหนำ เอ็งกอ-พะบู๊ องค์สมมติเจ้าแม่กวนอิม และลูกศิษย์ กิมท้ง-เง็กนึ่ง
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดกำแพงเพชร ประจำปี พ.ศ. 2566
International Performance Meeting 14 มกราคม 2566
International Performance Meeting In-salt-a(x)tion ณ เฮือนแม่คำแปง บ้านน้ำครกใหม่เกาะสวรรค์ Asiatopia House, Nan 14 มกราคม 2566 เวลา 16.00 น.
เทศกาลกาแฟน่าน เชื่อมสัมพันธ์คนรักกาแฟ 7-8 มกราคม 2566


งาน "เทศกาลกาแฟน่าน เชื่อมสัมพันธ์คนรักกาแฟ" ระหว่างวันที่ 7-8 มกราคม 2566 ณ บริเวณข่วงเมืองน่าน มีกิจกรรมต่างๆ มากมาย เช่น การแข่งขันคัดเมล็ดกาแฟ การ Cupping กาแฟ การสาธิตและแข่งขันดริปกาแฟ การเสวนา "โอกาสกาแฟน่าน" โดย วิทยากรผู้ทรงคุณวุฒิและมีความรู้เกี่ยวกับกาแฟ เช่น นายเคเลป จอร์แดน ผู้ใหญ่เจริญศักดิ์ เลิศวรยุทธ นายวิชัย กำเนิดมงคล และนายสันติ หาญสงคราม ในงานมีการออกร้านจำหน่ายกาแฟจากแหล่งปลูกต่างๆ ในจังหวัดน่าน ร้านกาแฟชั้นนำในจังหวัดน่าน และกลุ่มเกษตรกรผู้ปลูกกาแฟ นิทรรศการเกี่ยวกับกาแฟ กิจกรรม "กูรูสิงห์เหนือ เสือใต้ โรบัสต้า" นิทรรศการจากมหาวิทยาลัยแม่โจ้ มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนาน่าน วิทยาลัยชุมชนน่าน และศูนย์การเรียนรู้และบริการวิชาการเครือข่ายแห่งจุฬาลงกรณ์มหาวิทยาลัย ทั้งนี้ห้ามพลาดการประมูลกาแฟจากแหล่งผลิตที่ขึ้นชื่อของจังหวัดน่าน ในงานยังมีการจำหน่ายกล้าพันธุ์กาแฟสายพันธุ์ต่างๆ ให้กับผู้ที่สนใจทั่วไป สำหรับกาแฟน่านเป็นกาแฟที่ขึ้นชื่อระดับประเทศ กาแฟน่านชนะเลิศการแข่งขันระดับประเทศติดต่อกันหลายปี และได้ถูกเลือกให้เป็นเครื่องดื่ม ต้อนรับผู้นำประเทศสมาชิกเอเปคทั่วโลก ในการประชุมผู้นำเอเปค ครั้งที่ผ่านมาที่กรุงเทพมหานคร
งาน อนุสรณ์ดอนเจดีย์ และงานกาชาดจังหวัดสุพรรณบุรี ประจำปี 2567 (18 มกราคม - 1 กุมภาพันธ์ 2567)
งานอนุสรณ์ดอนเจดีย์ และงานกาชาดจังหวัดสุพรรณบุรี ประจำปี 2567 วันที่ 18 มกราคม - 1 กุมภาพันธ์ 2567 ณ บริเวณพระบรมราชานุสรณ์ดอนเจดีย์ อำเภอดอนเจดีย์ จังหวัดสุพรรณบุรี เพื่อเชิดชูวีรกรรมอันยิ่งใหญ่ของสมเด็จพระนเรศวรมหาราช โดยนำเสนอเรื่องราวเกี่ยวกับประวัติศาสตร์ชาติไทย และร่วมรำลึกถึงสมเด็จพระนเรศวรมหาราชที่สามารถกอบกู้เอกราชให้ชาติไทยมีความเป็นอิสระมาจนทุกวันนี้ และที่พลาดไม่ได้ ชมการต่อสู้บนหลังช้างสุดยิ่งใหญ่สมจริงช้างชนช้างวีรกรรมยุทธหัตถีกู้ชาติเกียรติยศไว้ในแผ่นดิน ยิ่งใหญ่ตระการตา....แสง สี เสียง ช้าง ม้า นักแสดงหลายร้อยชีวิตที่ร่วมแสดงมหาวีรกรรมยุทธหัตถีครั้งนี้
กิจกรรมภายในงานที่น่าสนใจ
ชมการต่อสู้บนหลังช้างสมจริงช้างชนช้าง การแสดง แสง สี เสียง ที่ยิ่งใหญ่ในศึกยุทธหัตถี....โดยทำการแสดงรวม 10 วัน ๆ ละ 1 รอบ โดยเริ่มแสดงตั้งแต่เวลา 19.30 น. ทุกรอบ
รอบการแสดงยุทธหัตถี ได้แก่ วันที่ 18, 19, 20, 21 ,26,27,28,30,31 มกราคม และ 1 กุมภาพันธ์ 2567
นอกจากนี้ยังมีการแสดงเวทีกลาง การแสดงดนตรี 5 สายธาร การประกวดร้องเพลงลูกทุ่ง การแสดงศิลปวัฒนธรรม การประกวดธิดาดอนเจดีย์ การเดินแบบผ้าไทย การประกวดรำวงสุพรรณบุรี และรำวงมหาดไทย การออกร้านธารากาชาด/เฮฮาพาโชค การแสดงดนตรีคอนเสิร์ตจากศิลปินชื่อดัง การออกร้านจำหน่ายสินค้าต่างๆ มากมาย
ติดต่อ-สอบถามรายละเอียดได้ที่ สำนักงานมูลนิธิพระบรมราชานุสรณ์ดอนเจดีย์ 035-535377 สำนักงานจังหวัดสุพรรณบุรี โทร. 035-535377 ที่ทำการปกครองจังหวัดสุพรรณบุรี โทร 035-535380
ปฎิทินเที่ยวจ.นนทบุรี มกราคม 2567
งาน นครพนม Winter Festival 2023 วันที่ 29 - 31 ธ.ค. 2565
งาน นครพนม Winter Festival 2023 ตอนสายลมแห่งความสุข ตลอดวันที่ 29 - 31 ธ.ค. 2565 นี้ ฟรีคอนเสิร์ตจากศิลปินดังมากมาย ไม่ว่าจะเป็น Season Five, เล็ก Greasy Café และ ครูเต้ย อภิวัฒน์ พบกับอุโมงค์ไฟประดับสุดอลังการยาวกว่า 300 เมตรตลอดริมน้ำโขง อิ่มหนำกับร้านค้าเจ้าเด็ดและของพื้นบ้านมากมาย พร้อมกิจกรรมสุดพิเศษอีกเพียบรอมอบความสุขให้กับคุณ
ใครกำลังมองหาสถานที่เคาท์ดาวน์ดีๆ กิจกรรมแน่นๆ พลาดไม่ได้ มาเจอกับเราได้เลยที่งาน นครพนม Winter Festival 2023
งานนครพนม Winter Festival 2023 ตอนสายลมแห่งความสุข
สนับสนุนโดย จังหวัดนครพนม, เทศบาลเมืองนครพนม และการท่องเที่ยวแห่งประเทศไทย
วันที่ 29 – 30 ธันวาคม 2565 เวลา 16.00 – 23.00น. และ 31 ธันวาคม 2565 เวลา 16.00 - 01.00น. ณ ถนนสุนทรวิจิตร ริมฝั่งแม่น้ำโขง นครพนม
6 มกราคม 2567 อบต.หาดพันไกร จัดทำโครงการทำหมันสุนัข
กลุ่มจิตอาสา Love Dog ร่วมกับ อบต.หาดพันไกร จัดทำโครงการทำหมันสุนัขในตำบลหาดพันไกร อำเภอเมืองชุมพร จังหวัดชุมพร ..ฟรี ทำกิจกรรมทำหมันสุนัข ฟรี ในวันเสาร์ที่ 6 มกราคม 2567 ตั้งแต่เวลา 09.00 น.เป็นต้นไป สถานที่ : อาคารจอดรถ ที่ทำการองค์การบริหารตำบลหาดพันไกร อำเภอเมืองชุมพร จังหวัดชุมพร ** หลักเกณฑ์ ดังนี้ ** ทำหมันสุนัข สุนัขเพศเมีย ฟรี สุนัขเพศ ผู้ อายุ ไม่เกิน 6 เดือน .... ฟรี (อายุเกิน 6 เดือน มีค่าเวชภัณฑ์ตัวละ 500.- บาท) ทำหมันแมว ทุกตัวมีค่าเวชภัณฑ์ ตัวละ 500.- บาท
Ladkacher Coffee Camp 2023 ฟาร์มปลูกกาแฟบ้านลาดกะเฌอ สกลนคร 17-18 มกราคม 2566
Ladkacher Coffee Camp วันที่ 17-18 มกราคม 2566 มหกรรมกาแฟครั้งแรกของจังหวัดสกลนคร กับกิจกรรมแคมป์ปิ้ง คั่วกาแฟ และดื่มด่ำกับการจิบกาแฟจากผลผลิตฟาร์มปลูกกาแฟบ้านลาดกะเฌอ สกลนคร ท่ามกลางบรรยากาศสุดแสนโรแมนติก ริมอ่างเก็บน้ำลาดกะเฌอ เทือกภูพาน พบกับกิจกรรมอื่นๆอีกมากมายจาก Barista และโรงคั่วกาแฟ ที่ยก Slow Bar มารังสรรค์ความละมุนละไมให้ทุกท่านได้สัมผัสภายในงาน การจัดกิจกรรมในครั้งนี้เป็นการส่งเสริมการท่องเที่ยวในพื้นที่เทือกเขาภูพานและจังหวัดสกลนคร และเป็นการส่งเสริมภาคเกษตรกรรมแก่เกษตรกรและผู้มีความสนใจในการปลูกกาแฟ
17, 24, 31 มกราคม 2567 เทศบาลตำบลเชิงเนิน ผ่าตัดทำหมันสุนัข พร้อมจัดวัคซีนป้องต้น
เทศบาลตำบลเชิงเนิน ร่วมกับ Vetvan THAILAND จัดกิจกรรม ผ่าตัดทำหมันสุนัข พร้อมจัดวัคซีนป้องต้น โรคพิษสุนัขบ้า ณ วัดบ้านดอน หมู่ที่ 4 ต.เชิงเนิน อ.เมืองระยอง จ.ระยอง22 มกราคม 2567 เทศบาลนครนครปฐม ร่วมกับ กรมปศุสัตว์ ให้บริการทําหมันสุนัขและแมว ฟรี
เทศบาลนครนครปฐม ร่วมกับ กรมปศุสัตว์ ให้บริการทําหมันสุนัขและแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในเขตเทศบาลนครนครปฐม ฟรี (*สำหรับผู้มีทะเบียนบ้านอยู่ในเขตเทศบาลนครนครปฐม) ตามโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้าฯ
- วันจันทร์ที่ 22 มกราคม 2567 เวลา 09.00 - 11.00 น. ณ ลานโดมอเนกประสงค์ ศูนย์เยาวชนเทศบาลนครนครปฐม (พระราชวังสนามจันทร์) [แผนที่]
- เปิดให้ลงทะเบียนทำหมันสัตว์ ตั้งแต่วันที่ 12 - 19 มกราคม 2567 ‼ (จำนวนจำกัด 100 ตัว)
สามารถลงทะเบียนได้ 2 ช่องทาง
1. ลงทะเบียนได้ที่เบอร์โทรศัพท์ 034-242199 และ 034-966440 ถึง 4 ต่อ 21 เวลา 09.00 - 15.00 น. เว้นวันหยุดราชการ
2. ลงทะเบียนผ่าน QR - Code ในภาพ
***เงื่อนไขการรับบริการเป็นไปตามที่กำหนด***
(นำบัตรประจำตัวประชาชนมาด้วยทุกครั้งที่รับบริการ)
23 มกราคม 2567 เทศบาลตำบลท่าข้าม ร่วมกับ ปศุสัตว์จังหวัดฉะเชิงเทรา ทำหมันหมาแมว ฉีดวัคซีน ฟรี
กองสาธารณสุขและสิ่งแวดล้อม
เทศบาลตำบลท่าข้าม ร่วมกับ ปศุสัตว์จังหวัดฉะเชิงเทรา ปศุสัตว์อำเภอบางปะกง และโรงพยาบาลสัตว์รุ่งสวัสดิ์ อำเภอพนัสนิคม จังหวัดชลบุรี เชิญชวนร่วมกิจกรรมรณรงค์ โครงการป้องกันและควบคุมโรคพิษสุนัขบ้า ประจำปี พ.ศ.2567 ในวันอังคารที่ 23 มกราคม 2567 ณ สำนักงานเทศบาลตำบลท่าข้าม (ทำการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ทำหมันสุนัขและแมว)
23 มกราคม 2567 เทศบาลตำบลท่าข้าม ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ทำหมันสุนัขและแมว
กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลท่าข้าม ร่วมกับ ปศุสัตว์จังหวัดฉะเชิงเทรา ปศุสัตว์อำเภอบางปะกง และโรงพยาบาลสัตว์รุ่งสวัสดิ์ อำเภอพนัสนิคม จังหวัดชลบุรี เชิญชวนร่วมกิจกรรมรณรงค์ โครงการป้องกันและควบคุมโรคพิษสุนัขบ้า ประจำปี พ.ศ.2567 ในวันอังคารที่ 23 มกราคม 2567 ณ สำนักงานเทศบาลตำบลท่าข้าม (ทำการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ทำหมันสุนัขและแมว)KKU SMART FLOWER FARM 2023 เปิดให้เข้าชมตั้งแต่วันที่ 27 มกราคม 2566 เป็นต้นไป
“KKU SMART FLOWER FARM 2023” เปิดให้เข้าชมตั้งแต่วันที่ 27 มกราคม 2566 เป็นต้นไป ณ แปลงเกษตรเชิงท่องเที่ยว บริเวณทิศใต้ อุทยานเทคโนโลยีการเกษตร มหาวิทยาลัยขอนแก่น ราคาค่าเข้าชม 30 บาท เวลา เปิด-ปิด 07:30 น.-21:00 น. เปิดบริการทุกวัน
Finding the Soul of Molam วันที่ 28 มกราคม 2566
Finding the Soul of Molam วันที่ 28 มกราคม 2566 ไปม่วนๆ จอยๆ โจ๊ะๆ กันได้ทั้งวัน ช่วงเช้ากิจกรรมแลกเปลี่ยนเรียนรู้ “เรื่องหมอลำ” ช่วงเย็น เปิดปาร์ตี้หมอลำ โดย คณะสะเวินใจ
Sunset Coffee Fest 2023 เทศกาลกาแฟแห่งภาคตะวันตก ครั้งที่ 2 วันที่ 10 -12 ก.พ.66 LINK
งาน Sunset Coffee Fest 2023 เทศกาลกาแฟแห่งภาคตะวันตก ครั้งที่ 2 “Milky Way, the Way of Coffee” ณ ร้าน MAS. Stay-at-Café อ.เมืองกาญจนบุรี กำหนดจัดงานขึ้นในวันที่ 10 -12 ก.พ.66 ณ The Zeit River Kwai Resort อ.เมือง จ.กาญจนบุรี ภายในงานมีร้านกาแฟที่มีเอกลักษณ์พิเศษและเป็นที่นิยมเข้าร่วมออกบูธ 60 ร้าน ทั้งในส่วนของกาญจนบุรี และจากต่างจังหวัด ไฮไลท์ของงาน คือ ผู้เข้าร่วมงานจะได้เรียนรู้เทคนิคการชงกาแฟจากบาริสต้าที่ได้รับรางวัลระดับประเทศและระดับโลก อาทิ คุณแซน จาก Santa Café เจ้าของรางวัล CP Meiji Speed Latte Art Championship 2019-2022 และคุณต้อม จาก MAS. Stay-at-Café เจ้าของรางวัล SANREMO Thailand x BONSOY Latte Art Smackdown 2022 โดยในปีนี้เพิ่มเติมกิจกรรมพิเศษการแข่งขันชง Latte Art ซึ่งเป็นที่มาของคอนเซ็ปต์ “Milky Way, the Way of Coffee” นอกจากนี้ยังมี Bakery and Coffee Workshop งาน craft เก๋ไก๋ และฟรีคอนเสิร์ต
งานนมัสการพระแท่นดงรัง ระหว่างวันที่ 27 ก.พ. - 7 มี.ค. 2566 LINK
งานนมัสการพระแท่นดงรัง งานประจำปีที่ขึ้นชื่อของจังหวัดกาญจนบุรี ปีนี้จัดขึ้น ระหว่างวันที่ 27 ก.พ. - 7 มี.ค. 2566 ณ วัดพระแท่นดงรังวรวิหาร อ.ท่ามะกา จ.กาญจนบุรี ขอเชิญร่วมนมัสการแท่นหินขนาดใหญ่ที่ชาวบ้านเชื่อกันว่าเป็นพระแท่นศักดิ์สิทธิ์ พระพุทธเจ้าเสด็จดับขันธปรินิพพาน ณ ที่แห่งนี้ นมัสการรอยพระพุทธบาทจำลองที่ทำจากไม้ขนาดใหญ่ที่มีเพียงแห่งเดียวในประเทศไทย กราบขอพรพระสังกัจจายน์ (หลวงพ่อโต) ชมโบราณสถานที่เกี่ยวข้องกับพุทธประวัติ อาทิ เขาถวายพระเพลิง บ่อบ้วนพระโอษฐ์ วิหารพระอานนท์ ฯลฯ และพิพิธภัณฑ์พื้นบ้านภายในวัด พร้อมเลือกซื้อสินค้าราคาถูกจากโรงงาน เที่ยวชมมหรสพ ฟรี การแสดงดนตรี ตลอด 9 วัน 9 คืน
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช 16 - 25 ก.พ. 66
จังหวัดกาญจนบุรีกำหนดจัดงานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2566 ระหว่างวันที่ 17-22 กุมภาพันธ์ 2566 ระยะเวลา 6 วัน 6 คืน ที่บริเวณลานพระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช ตำบลดอนเจดีย์ อำเภอพนมทวน จังหวัดกาญจนบุรี เพื่อเทิดพระเกียรติและให้ประชาชนชาวจังหวัดกาญจนบุรีและนักท่องเที่ยวได้รำลึกถึงพระมหากรุณาธิคุณของสมเด็จพระนเรศวรมหาราชที่ทรงเป็นผู้กอบกู้เอกราชของไทย รวมทั้งเป็นการอนุรักษ์และสืบทอดวัฒนธรรมของท้องถิ่นนำทุนทางวัฒนธรรมของจังหวัดกาญจนบุรีมาส่งเสริมการท่องเที่ยวให้เป็นที่รู้จักอย่างแพร่หลาย กระตุ้นเศรษฐกิจสร้างรายได้ให้กับประชาชนในพื้นที่ ภายในงานจะมีการแสดง แสง เสียง ย้อนรอยประวัติศาสตร์สมเด็จพระนเรศวรมหาราช พระมหากษัตริย์ผู้กอบกู้เอกราชของชาติไทย จำนวน 6 รอบ แสดงเวลา 19.00 น. รองรับที่นั่งชมการแสดงบริเวณภายในอัฒจันทร์ จำนวน 1,000 ที่นั่ง เปิดให้เข้าชมฟรี และกิจกรรมการแสดงศิลปะวัฒนธรรมพื้นบ้าน การจำหน่ายสินค้าและผลิตภัณฑ์ของชุมชน และการแสดงมหรสพสร้างความบันเทิงให้กับประชาชนและนักท่องเที่ยวที่เข้ามาเที่ยวชมงาน
พิธีจดทะเบียนสมรส@ต้นจามจุรียักษ์
พิธีจดทะเบียนสมรส@ต้นจามจุรียักษ์ 14 ก.พ. 66 ณ ต้นจามจุรียักษ์ อ.เมืองกาญจนบุรี โทร. 034 511 040
ท่าม่วงบ้านฉันชวนชิม 3 - 5 ก.พ. 66
ท่าม่วงบ้านฉันชวนชิม 3 - 5 ก.พ. 66 ณ ตลาดนางลอย อ.ท่าม่วง (facebook
ท่าม่วงบ้านฉัน ดีและงาม) สัมผัสเรื่องราวการพัฒนาชุมชนในเขตเทศบาลตำบลท่าม่วง เพื่อนำไปสู่ความสุขที่ยั่งยืนของทุกคน ความเป็นท่าม่วงที่สืบทอดมายาวนาน อัตลักษณ์ที่ต้องหลงไหล กับกิจกรรมที่คัดมา
วันที่ 3 ก.พ. สาธิตอาหารพื้นบ้าน ประกวดยำขนมจีน
วันที่ 4 ก.พ. พบกับน้องอิงค์ นักแสดงน้องใหม่ซีรีย์ Love song รักเราเท่าเพลงไหนจ้า
วันที่ 5 ก.พ.การแสดงจากกลุ่มแม่บ้านท่าม่วงนะคะ
กิจกรรม เที่ยวเขาวังสุดปัง กินกาแฟสุดฟิน 1-28 กุมภาพันธ์ 2566 LINK
ททท. สำนักงานเพชรบุรี ขอชวนกันไปเที่ยวเขาวัง จ.เพชรบุรีกันจ้า จะมาคู่ หรือมาเดี่ยว ได้หมดเบย กับกิจกรรม “เที่ยวเขาวังสุดปัง กินกาแฟสุดฟิน” เพียงเที่ยวเขาวัง เข้าชมพิพิธภัณฑสถานแห่งชาติ พระนครคีรี จ.เพชรบุรี ก็สามารถแลกซื้อกาแฟฟินๆ ได้ในราคา 29 บาท กติกา : เพียงนำบัตรเข้าชมพิพิธภัณฑสถานแห่งชาติ พระนครคีรี จังหวัดเพชรบุรี มาแลกซื้อกาแฟ Cappucino / Espresso / Americano / Latte ได้ในราคาเพียง 29 บาทเท่านั้น (จากราคาปกติ 75 บาท) ที่ร้าน Cosmic Cafe (สาขาหน้าเคเบิ้ลคาร์เขาวัง หรือสาขา Old Town จ.เพชรบุรี) ระยะเวลา : 1-28 กุมภาพันธ์ 2566 เท่านั้นน้าาา (จำกัด 200 สิทธิ์แรกเท่านั้น)
หนังกลางแปลง คลาสสิคไทย “สันติ-วีณา” ที่นาบุญข้าวหอม 3-4 กุมภาพันธ์ LINK
“สันติ-วีณา” เป็นภาพยนตร์ไทยที่สร้างเมื่อปี 2497 โดยใช้ฉากถ่ายทำในจังหวัดเพชรบุรีตลอดทั้งเรื่อง และฟิล์มของภาพยนตร์เรื่องนี้ได้หายจากประเทศไทยไปกว่า 60 ปี กระจัดกระจายอยู่ในหลายประเทศ จนกระทั่งหอภาพยนตร์ ได้ติดตามรวบรวมกลับคืนมาและได้บูรณะฟิล์มใหม่จนได้เป็นภาพยนตร์ที่สมบูรณ์แบบกลับมาฉายใหม่ได้อีกครั้ง
ในวันศุกร์ที่ 3 กุมภาพันธ์ 2566 นี้ นา บุญข้าวหอม และเพื่อนเครือข่าย ร่วมมือกับหอภาพยนตร์ (องค์การมหาชน) องค์การบริหารส่วนตำบลธงชัย เทศบาลเมืองเพชรบุรี การท่องเที่ยวแห่งประเทศไทย สำนักงานเพชรบุรี สำนักงานวัฒนธรรมจังหวัดเพชรบุรีจัดฉายภาพยนตร์ไทยเรื่อง “สันติ-วีณา” แบบกลางแปลง พร้อมกิจกรรมต่าง ๆ เริ่ม 16.00 น. เป็นต้นไป **ภาพยนตร์จะเริ่มฉายเวลา 19.00 น.
วันเสาร์ที่ 4 กุมภาพันธ์ มีตักบาตรเช้าที่ ตลาดนาพาเพลิน นาบุญข้าวหอม แล้วนั่งรถรางไปตามรอยหนังกัน โดยจะเริ่มต้นทางที่สถานีดีจัง เขาวังเคเบิลคาร์
ผู้ที่สนใจร่วมเดินทางไปกับทริปนี้ สามารถติดต่อได้ที่คุณเอ๋ โทรศัพท์ 0968915139 (รับได้จำนวนจำกัด)
เส้นทางไปนาบุญข้าวหอมวิถีชาวเล เสน่ห์บางตะบูน 10-11 กุมภาพันธ์ 2566 LINK
สภาวัฒนธรรมอำเภอบ้านแหลม โดย สภาวัฒนธรรมเทศบาลตำบลบางตะบูน และสภาวัฒนธรรมตำบลของอำเภอบ้านแหลมทุกแห่ง ขอเชิญร่วมงาน วิถีชาวเลเสน่ห์บางตะบูน พบกับกิจกรรมมากมาย การแสดงนิทรรศการภูมิปัญญาพื้นบ้าน และอาหารพื้นถิ่น สนับสนุนโดยองค์การบริหารส่วนจังหวัดเพชรบุรี สภาวัฒนธรรมจังหวัดเพชรบุรี สำนักงานวัฒนธรรมจังหวัดเพชรบุรี ในวันที่ 10-11 กุมภาพันธ์ 2566 ณ เทศบาลตำบลบางตะบูน อำเภอบ้านแหลม จังหวัดเพชรบุรี ตั้งแต่เวลา 16.00 น. เป็นต้นไป
ท่ายางดีจัง ตอน ท่ายางที่รัก 18 - 19 ก.พ. 2566
ท่ายางดีจัง ตอน ท่ายางที่รัก 18 - 19 ก.พ. 2566 เชิญชมศิลปะ วัฒนธรรมชุมชน สภาวัฒนธรรม 12 ตำบล ฟังเพลง ชมแกลอรี่ภาพถ่าย และสนุกสนานไปกับเกมส์ตักไข่พาเพลิน
งาน Burapa Pattaya Bike Week 9-13 ก.พ.66 LINK
กลับมาอีกครั้ง 9 – 13 ก.พ. นี้ การรวมตัวของชาวไบค์เกอร์ ในงาน Burapa Pattaya Bike Week & Back To The Culture 2023 ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก เมืองพัทยา ร่วมกับสมาคมบูรพามอเตอร์ไซค์เคิลคลับ กำหนดจัดงานสัปดาห์มอเตอร์ไซค์และเสียงเพลงแห่งเสรีภาพ ครั้งที่ 26 “BURAPA PATTAYA BIKE WEEK & BACK TO THE CULTURE 2023” โดยจัดขึ้นระหว่างวันที่ 9 – 13 กุมภาพันธ์ 2566 ณ บริเวณสวนสาธารณะศูนย์กีฬาแห่งชาติภาคตะวันออก ซอยชัยพฤกษ์ 2
ไทยแลนด์โอเพ่น มาสเตอร์เกมส์ ครั้งที่ 3 กีฬาอาวุโส 4-12 ก.พ.66
จังหวัดชลบุรีพร้อมเป็นเจ้าภาพจัดการแข่งขันกีฬาสูงอายุ “ไทยแลนด์โอเพ่น มาสเตอร์เกมส์” ครั้งที่ 3 (“3rd THAILAND OPEN MASTER GAMES”) ที่ จ. ชลบุรี เปิดโอเพ่นให้ชาวต่างชาติเดินทางเข้าประเทศไทยสามารถเข้าแข่งขันได้แบบโอเพ่นทุกชาติ เพื่อให้เป็นการชิงชัยในระดับนานาชาติเต็มรูปแบบครั้งแรก จัดขึ้นระหว่างวันที่ 4 – 12 กุมภาพันธ์ 2566 จังหวัดชลบุรี มีการแข่งขันทั้งหมด 15 ชนิดกีฬา 2 กีฬาสาธิต
การแสดง Art Fire Show ศิลป์แห่งไฟ ทุกวัน เสาร์ และ อาทิตย์ ที่ ArtVenture NFT
การแสดง Art Fire Show ศิลป์แห่งไฟ ทุกวัน เสาร์ และ อาทิตย์ เวลา 19.00 ที่ ArtVenture NFT
ระหว่างรอชมการแสดง...ก็มาเดิม ชิม ชอป กันที่ ArtVenture Fair พร้อมให้คุณได้เลือกซื้อสินค้าสุดฮิปและอาหารมากมาย เริ่มตั้งแต่ เวลา 15.00 น. ถึง 21.00 น. แวะมาฟังเพลงเพลิน ๆ และชมโชว์พิเศษ เป่าแซกโซโฟนและโฟล์คซองในสวน และที่สำคัญ ArtVenture NFT ยังจัดแสดงผลงานศิลปะ CharacterMob ให้ชมกันยาว ๆ จนถึงสิ้นเดือนกุมภาพันธ์นี้ ใครที่ยังไม่มีโอกาสได้แวะมาเยี่ยมชม สุดสัปดาห์นี้ ห้ามพลาดนะ!!!! งานจัดตั้งแต่ 23 ธันวาคม 65 ยาวไปถึง 23 กุมภาพันธ์ 2566 เลย
สถานีความสุข กาลครั้งหก หนีกรุง FM Festival of Music 18 ก.พ.66
สถานีความสุข กาลครั้งหก หนีกรุง FM Festival of Music แล้วมาพบกับศิลปินที่คุณรัก ไม่ว่าจะเป็น Tilly Birds, Three Man Down, Ink Waruntorn, NONT TANONT, Joey Boy และ Jjetrin วันที่ 18 กุมภาพันธ์ 2566 @Wisdom Valley เขาไม้แก้วพัทยา สอบถามข้อมูลเพิ่มเติม 0847140000
งานมหกรรมเกษตรธรรมชาติครั้งที่ 22 วันที่ 10-14 ก.พ.66
งานมหกรรมเกษตรธรรมชาติครั้งที่ 22 “สืบสานศาสตร์พระราชา พัฒนาเทคโนโลยี สู่วิถีพอเพียง” ระหว่างวันที่ 10 - 14 กุมภาพันธ์ 2566 เวลา 8.00 - 20.00 น. ณศูนย์ฝึกและพัฒนาอาชีพเกษตรกรรมวัดญาณสังวรารามวรมหาวิหาร ตำบลห้วยใหญ่ อำเภอบางละมุง จังหวัดชลบุรี
จดทะเบียนสมรส ณ เกาะสีชัง วันวาเลนไทน์
อำเภอเกาะสีชัง รับสมัครคู่รักจดทะเบียนสมรส ในวันที่ 14 กุมภาพันธ์ 2566 โดยจะมีพิธีจดทะเบียนสมรส ณ สะพานอัษฎางค์ (สะพานแห่งความรัก) โดยลงทะเบียนหรือติดต่อสอบถามเพิ่มเติมได้ที่ โทร.038-216201 เวลาทำการ 08:00 - 16:30 น. ตั้งเเต่วันนี้เป็นต้นไป
CENTRAL PATTAYA DESTINATION OF LOVE 9-14 ก.พ 66
วาเลนไทน์ปีนี้ ศูนย์การค้าเซ็นทรัล พัทยา ชวนคุณมาอินเลิฟ หอมละมุนกลิ่นไอความรัก ช้อปดอกกุหลาบ เช็คอินถ่ายรูปกับคาเฟ่ดอกไม้แสนหวาน พร้อมชวนมาสัมผัส ลิ้มรสและใบชากลิ่นดอกไม้ จากร้าน Bianca Moment ช้อปดอกกุหลาบ ดอกไม้แห่งความรัก และบอลลูนน่ารัก จาก ร้าน G Flower,Valentine’s Flower,Honey Dew Flower,ตาหวาน Flower,และ The Balloon Shop
9-14 ก.พ 66 ลานกิจกรรมชั้น 1 ศูนย์การค้าเซ็นทรัล พัทยา
13-14 ก.พ. 66 สนุกกับกิจกรรม Love Photobooth ถ่ายภาพฟรี! พร้อมรับรูปทันที สำหรับสมาชิก Central Life X
14 ก.พ. 66 สายเลิฟ สายแซด มาอินกับคอนเสิร์ตจาก Only Monday เวลา 19.00 น. ณ ลาน Sunken ถ่ายรูปอวดโซเชียล แชร์ความหวานท่ามกลางสวนดอกกุหลาบ
สวนนงนุชพัทยา ใจดี ให้เด็กไทยเข้าฟรี ทุกวัน ตลอดปี LINK
สวนนงนุชพัทยา ใจดี ให้เด็กไทยเข้าฟรี ทุกวัน ตลอดปี (เสาร์ - อาทิตย์ และนักขัตฤกษ์ก็เที่ยวได้)
เงื่อนไข เด็กที่มากับผู้ปกครองและความสูงไม่เกิน 140 cm เท่านั้น
สามารถชมสวนสวย ได้มากกว่า 50 โซน ในเนื้อที่ 1,400 ไร่ รวมโซนไดโนเสาร์แล้ว
การแข่งขันกีฬาเทควันโด ประจำปี 2566 วันที่ 11-12 ก.พ.66
เชิญชวนทุกท่านร่วมชม เชียร์ และเป็นกำลังใจให้ทัพนักกีฬาที่เข้าร่วมการแข่งขันกีฬาเทควันโดในรายการ 10th NSDF PATTAYA CHOI YOUNG SEOK CUP INTERNATIONAL TAEKWONDO CHAMPIONSHIP ประจำปี 2566 ได้ ระหว่างวันที่ 11-12 กุมภาพันธ์ 2566 ณ อาคารกรีฑาในร่ม ศูนย์กีฬาแห่งชาติภาคตะวันออก เมืองพัทยา จังหวัดชลบุรี ตั้งแต่เวลา 08.30 น.
ครัวคุณต๋อยยกทัพ บุก เซ็นทรัล ศรีราชา 3-12 ก.พ. 66
ครัวคุณต๋อยยกทัพ บุก เซ็นทรัล ศรีราชา เสิร์ฟเมนูสุดฟิน อร่อยถูกปาก รสชาติถูกใจ ห้ามพลาดเลยของอร่อย ชาวศรีราชาเตรียมฟิน! จัดเต็มกับ 3 โซนแห่งความอร่อยที่รวมร้านเด็ด กว่า 70 ร้านดัง ทั้งเมนูคาว หวาน และ ของว่าง ให้ได้เลือกช้อปอย่างจุใจ การันตีความอร่อยทุกร้าน โดยรายการครัวคุณต๋อย รับรองไม่ผิดหวังแน่นอน วันที่ 3-12 ก.พ. 66 ลานกิจกรรมหน้าร้าน LYN, หน้าร้าน Playboy และ โซนหน้า TOPS MARKET ศูนย์การค้าเซ็นทรัล ศรีราชา
Eco Community Market at Spirit mountain เขาโต๊ะหลวง อ่าวนาง วันที่ 25 ก.พ. 66
Eco Community Market at Spirit mountain เขาโต๊ะหลวง อ่าวนาง วันที่ 25 ก.พ. 66 เวลา 10 AM - 5 PM กิจกรรมสุขภาพดีๆ ได้แก่ นวดไทย หมากขุม/หมากเก็บ แกะสลักผลไม้ ร้อยมาลัยดอกรัก นวดน้ำมันอโรมา Plant based green smoothie workshop ฟังดนตรีเพลนิ โดยครูฟาส ฝึกโยคะ Permaculture and circularity, sharing hands experience about designing a sustainable lifestyle
เทศกาลท่องเที่ยวทุ่งหยีเพ็ง The Mangrove Love Festival 2023 - 15 กุมภาพันธ์ 66
เทศกาลท่องเที่ยวทุ่งหยีเพ็ง "The Mangrove Love Festival 2023" 15 กุมภาพันธ์ 2566 ณ ท่าเรือท่องเที่ยวบ้านทุ่งหยีเพ็ง เสวนา "ศาลาด่านโมเดล สู่การพัฒนาตำบลอย่างยั่งยืน"
KRABI International JAZZ 2023 - 21 กุมภาพันธ์ 66
ททท. สำนักงานกระบี่ ขอเชิญชมการแสดงดนตรี KRABI International JAZZ 2023 จากวง Biggles Big Band Amsterdam ประเทศเนเธอร์แลนด์ ???????? ที่จะมาบรรเลงเพลงแจ๊สคลาสสิคท่ามกลางบรรยากาศพระอาทิตย์ตกที่สุดแสนจะโรแมนติกหาดนพรัตน์ธารา
21 กุมภาพันธ์ 2566 เวลา 18.00 น. ณ อ่าวนางแลนด์มาร์ค ฟรีไม่มีค่าใช้จ่าย จัดโดย…ททท. สำนักงานกระบี่ ร่วมกับสมาคมไทยท่องเที่ยวเชิงอนุรักษ์และผจญภัย (TEATA) สมาคมโรงแรมจังหวัดกระบี่ บริษัทอ่าวนางแลนด์มาร์คจำกัด ร่วมผนึกพันธมิตรเครือข่ายด้านการท่องเที่ยวในพื้นที่
งานฮอมปอยบุปผชาติแม่ข่างาม ครั้งที่ 5 ประจำปี พ.ศ. 2566
งาน "ฮอมปอยบุปผชาติแม่ข่างาม" ครั้งที่ 5 ประจำปี พ.ศ. 2566 ณ ท่าน้ำแม่ข่าบ้านพระนอน-บ้านป่ารวก ต.ดอนแก้ว อ.แม่ริม จ.เชียงใหม่
โครงการดนตรีในสวน เพื่อสุนทรียะและนันทนาการของชาวเชียงใหม่ ประจำปี 2566
14 กุมภาพันธ์นี้ คอนเสิร์ตดีๆ เที่ยวฟรี!! ชมฟรี!! ไม่มีค่าใช้จ่าย โครงการดนตรีในสวน เพื่อสุนทรียะและนันทนาการของชาวเชียงใหม่ ประจำปี 2566 MUSICAL FLOWER BloomingFest เพลินเพลง เดินชมสวน กับมวลดอกไม้ วันที่ 14 กุมภาพันธ์ 2566 17.00-21.00 น ณ สวนเฉลิมพระเกียรติ 82 พรรษา (ด้านหลังศาลากลางจังหวัดเชียงใหม่) 二な家でり学県大県系理学业 เทศกาลแห่งเสียงดนตรีและบทเพลงอันไพเราะ ในบรรยากาศมวลบุปผชาติผลิบาน ในสวนสวย ที่เชิญชวนทุกท่านมาร่วมสัมผัสความงดงามไปพร้อมกับเสียงเพลง จาก ศิลปินชื่อดัง พร้อมส่งมอบความสุขให้ชาวเชียงใหม่ กบ ทรงสิทธิ์ ปุยฝ้าย มะลิวัลย์ ไก่ พรรณนิภา โดย องค์การบริหารส่วนจังหวัดเชียงใหม่
Chiang Mai Crafts Week#7 งานคราฟท์ที่ใหญ่ที่สุดในภาคเหนือ 16-20 กุมภาพันธ์ 66
งานคราฟท์ที่ใหญ่ที่สุดในภาคเหนือ ททท.สำนักงานเชียงใหม่ เชิญทุกท่านร่วมสัมผัสประสบการณ์ คร๊าฟท์ คราฟท์…กับ Chiang Mai Crafts Week#7 ในวันที่ 16-20 กุมภาพันธ์ 2566 นี้ @Central Chiangmai Airport ปีนี้มาในธีม ????t H i N k gReeN???? กับงานประดิษฐ์สุด Create รักษ์โลก เพื่อสิ่งแวดล้อมที่ดีขึ้น ???? ช้อป...สุดเพลิน กับสินค้า craftและ อุปกรณ์เพื่องาน Craft ในราคาเพื่อนพ้องน้องพี่ กว่า 150 บูธ เดินกันแบบตาลาย ???? ใกล้ชิด Diva ผู้สร้างสรรค์งาน Craft ฝีมือคนไทยเล่าถึงแรงบันดาลใจในการสร้างผลงานระดับเทพ ????***และพิเศษสุด Workshop ที่รวบรวมกันมากว่า 100 คลาส กับกูรูตัวจริงอย่างใกล้ชิด
งาน ฮอมปอยบุปผชาติแม่ข่างาม ครั้งที่ 5 ประจำปี 2566
งาน "ฮอมปอยบุปผชาติแม่ข่างาม" ครั้งที่ 5 ประจำปี 2566 กิจกรรมรณรงค์ฟื้นฟูคลองแม่ข่า สายน้ำชุมชนชาวเชียงใหม่ ชมขบวนเรือบุปผชาติ ตลอดสองฝั่งคลองท่าน้ำแม่ข่าบ้านพระนอน –บ้านป่ารวด ต.ดอนแก้ว อ.แม่ริม ระหว่างวันที่ 17 -19 กุมภาพันธ์ 2566
Chiang Mai Blooms 2023 กุมภาพันธ์ - มีนาคม 2566 LINK
งาน “Chiang Mai Blooms 2023” Magic Moment เทศกาลเชียงใหม่เบิกบาน ที่จะมาเปิดประสบการณ์สร้างความทรงจำดีด้วยดอกไม้ทั่วเมืองเชียงใหม่ ให้มากินหอม อยู่หอม ตลอดเดือน กุมภาพันธ์ - มีนาคม 2566 กับ 14 กิจกรรมสุดเพลิดเพลิน
บินปุ๊บ พักปั๊บ รับครกไปเลย 15 กุมภาพันธ์ – 31 มีนาคม 2566
ททท.ตาก ร่วมกับ สายการบินนกแอร์ และพันธมิตร ด้านท่องเที่ยวในจ.ตาก จัดกิจกรรมส่งเสริมการตลาดท่องเที่ยว ในวันธรรมดา Joint Promotion “บินปุ๊บ พักปั๊บ รับครกไปเลย” ตั้งแต่วันที่ 15 กุมภาพันธ์ – 31 มีนาคม 2566 นี้ - โรงแรมที่ร่วมรายการได้แก่ โรงแรมเดอะทิค โรงแรมเซนทรา เซนทารา บายเซ็นทาราแม่สอด โรงแรมมอนเต้ -
รายละเอียด -
ดูคลิปShop Chic Chill @เกาะลอย สินค้าอัตลักษณ์เมืองตาก 13-15 กุมภาพันธ์ 2566 LINK
เชิญชวนเที่ยวงาน “Shop Chic Chill @เกาะลอย สินค้าอัตลักษณ์เมืองตาก” ระหว่างวันที่ 13-15 กุมภาพันธ์ 2566 ณ บริเวณลานอเนกประสงค์หนองน้ำมณีบรรพต (เกาะลอย) อำเภอเมืองตากโดยภายในงานท่านจะได้พบกับ ???? การเดินแบบ แฟชั่นโชว์ สินค้าอัตลักษณ์เมืองตาก นำโดยท่านผู้ว่าราชการจังหวัดตาก (พิธีเปิดงาน) ???? ร้านค้าจำหน่ายกว่า 30 ร้านค้า ???? การจัดนิทรรศการ ???? สินค้าเกษตร ???? สินค้าอัตลักษณ์จังหวัดตาก ???? สินค้าราคาประหยัด (ธงฟ้า)
วิถีชาวเลเสน่ห์บางตะบูน 10-11 กุมภาพันธ์ 66
ขอเชิญร่วมงาน วิถีชาวเลเสน่ห์บางตะบูน พบกับกิจกรรมมากมาย การแสดงนิทรรศการภูมิปัญญาพื้นบ้าน และอาหารพื้นถิ่นบางตะบูน ในวันที่ 10-11 กุมภาพันธ์ 2566 ตั้งแต่เวลา 16.00 น. เป็นต้นไป ณ เทศบาลตำบลบางตะบูน อำเภอบ้านแหลม จังหวัดเพชรบุรี สนับสนุนโดยองค์การบริหารส่วนจังหวัดเพชรบุรี สภาวัฒนธรรมจังหวัดเพชรบุรี สำนักงานวัฒนธรรมจังหวัดเพชรบุรี
สวดมนตร์และร่วมเวียนเทียนรอบพระอุโบสถ วัดแหลมใต้
วันที่6เป็นวันพระขึ้น15ค่ำเดือน4 ขอชวนญาติโยมมาร่วมสร้างบุญสร้างกุศลสร้างบารมีสวดมนตร์และร่วมเวียนเทียนรอบพระอุโบสถ วัดแหลมใต้ ต.หน้าเมือง อ.เมือง จ.ฉะเชิงเทรา ขอเชิญญาติโยมสวดมนตร์พระพุทธมนตร์ เวลา 17:00 ที่วิหารพระนอนตาหวานวัดแหลมใต้ หลังจากสวดพระพุทธมนตร์เสร็จ ☺️☺️ ขอเชิญ ร่วมทำกิจกรรมเวียนเทียนรอบพระอุโบสถวัดแหลมใต้ พร้อมกับคณะสงฆ์วัดแหลมใต้ นำโดยท่านพระครูธรรมธรจำลอง โรจนธมฺโม เจ้าอาวาสวัดแหลมใต้
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2566 กาญจนบุรี 16 - 25 กุมภาพันธ์ 66
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2566 กาญจนบุรี 16 - 25 กุมภาพันธ์ 2566 ณ พระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช ต.ดอนเจดีย์ อ.พนมทวน จ.กาญจนบุรี ชมฟรี!! การแสดง แสง เสียง เทิดพระเกียรติฯ สุดอลังการ 6 รอบการแสดง ในระหว่างวันที่ 17 - 22 กุมภาพันธ์ 2566 ตั้งแต่เวลา 19.00 น. เป็นต้นไป เที่ยวชมตลาดย้อนยุค และร่วมสนุกกับรำวงย้อนยุค ชมการแสดงมหรสพ 10 คืน ชิม ช้อป สินค้าของดีมากมาย สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักงานการท่องเที่ยวและกีฬาจังหวัดกาญจนบุรี โทร. 034-520335 ต่อ 202
Big Cleaning Day ชวนพายเรือเก็บขยะในแม่น้ำ 15 ก.พ.66
ชมรมชาวเรือชาวแพ ต.ท่ากระดาน อ.ศรีสวัสดิ์ จ.กาญจนบุรี ขอเชิญร่วมงาน สืบสานประเพณีทำบุญแม่น้ำเขื่อนศรีนครินทร์ ประจำปี 2566 ณ ท่าน้ำท่ากระดาน จุดประสงค์เพื่อสร้างความสามัคคี และส่งเสริมการท่องเที่ยว โดยงานนี้จะจัดขึ้น วันที่ 15 กุมภาพันธ์ 2566 เริ่มเวลา 6:30 - 17:00 น. ณ ท่าน้ำท่ากระดาน ท่าน้ำหม่องกระแทะ เขื่อนศรีนครินทร์ กิจกรรมภายในงาน - พิธีทำบุญบวงสรวงแม่น้ำ Big Cleaning พิธีปล่อยพันธ์ปลาลงสู่แม่น้ำ การแข่งขันกีฬาพื้นบ้าน พายเรือหัวใบ้ท้ายบอด พายแพเปียกชิงธง แข่งพายเรือคายัค สอบถามโทร : 092-279-4965
ปฏิทินกิจกรรมท่องเที่ยวกาญจนบุรีเดือนกุมภาพันธ์ เดือนแห่งความรัก
งานมหกรรมของดีเมืองอ่างทอง “มหกรรมกินปลาใหญ่ กินไข่นกกระทา กินผักปลอดภัย” ประจำปี 2566 วันที่ 23-26 กุมภาพันธ์ 66
จังหวัดอ่างทองขอเชิญเที่ยวงานมหกรรมของดีเมืองอ่างทอง “มหกรรมกินปลาใหญ่ กินไข่นกกระทา กินผักปลอดภัย” ประจำปี 2566 ระหว่างวันที่ 23-26 กุมภาพันธ์ 2566 ณ บริเวณสนามหน้าศาลากลางจังหวัดอ่างทอง (หลังเก่า)
✨ มาร่วมชิม ช้อป การจำหน่ายผลิตภัณฑ์สินค้าที่มีคุณภาพจากผู้ผลิตสินค้าเกษตร/อาหารปลอดภัย ผลิตภัณฑ์ชุมชนสินค้า OTOP สินค้าทางวัฒนธรรม สินค้าธงฟ้า และของดีจังหวัดอ่างทองอีกมากมายจากร้านค้าคุณภาพที่ผ่านการคัดสรรมาจากทั้ง 7 อำเภอ
✨ รับชมการแสดง “รำวงมหาดไทย” การประกวดร้องเพลง และการแสดงศิลปวัฒนธรรม จากวิทยาลัยนาฏศิลปอ่างทอง ที่มีความงดงามตระการตา
✨ ร่วมซื้อสลากกาชาด ประจำปี 2566 ได้ภายในงาน ????ราคาฉบับละ 50 บาท ????ได้บุญ ลุ้นโชค โดยจะประกาศรางวัลในวันที่ 26 กุมภาพันธ์นี้ เวลา 18.00 น.เป็นต้นไป ณ เวทีหน้าศาลากลางจังหวัดอ่างทอง (หลังเก่า)
กิจกรรมของงาน
วันที่ 23 กุมภาพันธ์ 2566
เวลา 16.30 น. พบกับ ความสนุกสนานจากกิจกรรมการแข่งขันกินปลาใหญ่ กินไข่นกกระทา กินผักปลอดภัย
เวลา 18.30 น. พิธีเปิดงานมหกรรมของดีเมืองอ่างทอง “มหกรรมกินปลาใหญ่ กินไข่นกกระทา กินผักปลอดภัย ประจำปี 2566” พร้อมรับฟังการบรรเลงวงเครื่องสาย รับชมการแสดง “รำวงมหาดไทย” และการแสดงศิลปวัฒนธรรม จากวิทยาลัยนาฏศิลปอ่างทอง ที่มีความงดงามตระการตา
วันที่ 24 กุมภาพันธ์ 2556
เวลา 18.00 -18.30 น. การแสดง “รำวงมหาดไทย”
เวลา 18.30 – 22.00 น. การประกวดร้องเพลงของนักร้องกลุ่มองค์กรปกครองส่วนท้องถิ่น
วันที่ 25 กุมภาพันธ์ 2556
เวลา 18.00 -18.30 น. การแสดง “รำวงมหาดไทย”
เวลา 18.30 – 22.00 น. การประกวดร้องเพลงของกำนันผู้ใหญ่บ้าน
วันที่ 26 กุมภาพันธ์ 2566 ตั้งแต่เวลา 18.00 น. เป็นต้นไป รับชมการออกรางวัลสลากกาชาด จังหวัดอ่างทอง ประจำปี 2566 ลุ้นรับรถยนต์ TOYOTA Hilux Revo Double Cab Z Edition รถจักรยานยนต์ สร้อยคอทองคำ น้ำหนัก 1 บาท และของรางวัลอีกมากมาย
งานบอลลูนยักษ์ รักโลก ณ ห้างเสริมไทย 28 ก.พ. - 6 มี.ค.2566
งานบอลลูนยักษ์ รักโลก ณ ห้างเสริมไทย จังหวัดมหาสารคาม งานนี้ชมฟรี 28 ก.พ. - 6 มี.ค.2566
งาน KHON KAEN INTERNATIONAL JAZZ FESTIVAL 2023 ในวันที่ 13-14 กุมภาพันธ์ 2566


การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานขอนแก่น ร่วมกับสมาคมไทยท่องเที่ยวเชิงอนุรักษ์และผจญภัย (Thai Ecotourism and Adventure Travel Association : TEATA) พิพิธภัณฑ์ธนารักษ์จังหวัดขอนแก่น มหาวิทยาลัยขอนแก่น หอการค้าจังหวัดขอนแก่น สภาอุตสาหกรรมจังหวัดขอนแก่น และสมาคมธุรกิจการท่องเที่ยวจังหวัดขอนแก่น กำหนดจัดงาน KHON KAEN INTERNATIONAL JAZZ FESTIVAL 2023 ในวันที่ 13-14 กุมภาพันธ์ 2566 ณ พิพิธภัณฑ์ธนารักษ์ จังหวัดขอนแก่น ภายใต้บรรยากาศ “Swing Night Jazz @ The Museum” เพื่อให้เยาวชนและผู้ที่สนใจดนตรีแจ๊ส เข้าร่วมกิจกรรมโดยจัดงานเทศกาลดนตรีแจ๊ส โดยใช้ชื่อ KHON KAEN INTERNATIONAL JAZZ FESTIVAL 2023 ในช่วงเย็นของวันที่ 14 กุมภาพันธ์ 2566 ณ พิพิธภัณฑ์ธนารักษ์ จังหวัดขอนแก่น โดยได้รับเกียรติจากคณะดนตรีออร์เคสตร้าแจ๊สในนาม The Biggles Big Band Amsterdam จากประเทศเนเธอร์แลนด์ ซึ่งได้รับการสนับสนุนจาก สถานเอกอัครราชทูตเนเธอร์แลนด์ ประจำประเทศไทย ซึ่งกำหนดจัดการแสดงดนตรีออร์เคสตร้าแจ๊สในประเทศไทย ระหว่างวันที่ 9-24 กุมภาพันธ์ 2566 เพื่อการแลกเปลี่ยนวัฒนธรรมระหว่าง 2 ราชอาณาจักร คือ ราชอาณาจักรไทยและเนเธอร์แลนด์ ซึ่งจะเป็นการประชาสัมพันธ์จังหวัดขอนแก่นและภาคตะวันออกเฉียงเหนือของประเทศไทยในประเทศเนเธอร์แลนด์ และประเทศในกลุ่มยุโรปซึ่งจะสามารถดึงดูดนักท่องเที่ยวกลุ่ม Expatriates ในจังหวัดขอนแก่นและจังหวัดใกล้เคียง รวมทั้งประเทศเพื่อนบ้านให้เข้ามาชมการแสดงดนตรี ซึ่งเป็นการส่งเสริมให้เกิดการพักค้างและสามารถกระตุ้นการใช้จ่ายในพื้นที่จัดงาน
ปฏิทินกิจกรรมท่องเที่ยว เดือนกุมภาพันธ์ 2566
สมุทรสาคร พันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 22 วันอาทิตย์ที่ 19 ก.พ.66
สมุทรสาคร พันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 22 วันอาทิตย์ที่ 19 ก.พ นี้ ที่อำเภอพันท้ายนรสิงห์ จังหวัดสมุทรสาคร
กิจกรรมแรลลี่การกุศล “แรลลี่รวมใจ ต้านภัยมะเร็ง” 11-12 กุมภาพันธ์ 2566
กิจกรรมแรลลี่การกุศล “แรลลี่รวมใจ ต้านภัยมะเร็ง” ณ ปั๊ม Esso (ก่อนถึง Porto chino) ต.มหาชัย อ.เมืองฯ จ.สมุทรสาคร จัดโดย สมาคมกีฬาแห่งจังหวัดสมุทรสาคร และชมรมสวนกุหลาบวิทยาลัย สมุทรสาคร (สวน’สาคร) กำหนดจัดขึ้นในระหว่างวันที่ 11-12 กุมภาพันธ์ 2566 เส้นทางสมุทรสาคร-กาญจนบุรี โดยมีวัตถุประสงค์เพื่อจัดหารายได้สมทบทุนจัดซื้อเครื่องมือแพทย์ศูนย์เชี่ยวชาญมะเร็งครบวงจร เขตสุขภาพที่ 5 โรงพยาบาลนครท่าฉลอม ต.ท่าฉลอม อ.เมืองฯ จังหวัดสมุทรสาคร รวมถึงเพื่อรับรองผู้ป่วยที่อยู่ในจังหวัดสมุทรสาครและจังหวัดใกล้เคียงให้ได้รับการรักษาโรคมะเร็งแบบครบวงจร อีกทั้งยัง เป็นการส่งเสริมการท่องเที่ยวเชื่อมโยง จ.สมุทรสาครและกาญจนบุรี สร้างการรับรู้แหล่งท่องเที่ยวให้เป็นที่รู้จัก ก่อให้เกิดการหมุนเวียนทางเศรษฐกิจ กระจายรายได้สู่ธุรกิจโรงแรมที่พัก ร้านอาหารและการท่องเที่ยวงาน “Rasada Music Festival 2023” วันที่ 17-19 กุมภาพันธ์ 2566
งาน “Rasada Music Festival 2023” งานแสดงดนตรีและอาหารทะเลเกาะสิเหร่ ระหว่างวันที่ 17-19 กุมภาพันธ์ 2566 ตั้งแต่เวลา 17.00-24.00 น. จัดโดยเทศบาลตำบลรัษฎา จังหวัดภูเก็ต เพื่อส่งเสริมการท่องเที่ยวเกาะสิเหร่ ตำบลรัษฎา ให้เป็นที่รู้จักของคนภูเก็ตและนักท่องเที่ยวทั่วไปมากยิ่งขึ้น และเป็นการกระตุ้นเศรษฐกิจในพื้นที่ พร้อมเปิดโอกาสให้ผู้ประกอบการในพื้นที่มีรายได้เพิ่มขึ้น จากการออกร้านจำหน่ายอาหารทะเล อาหารพื้นเมืองภูเก็ต จากโรงแรม ร้านอาหาร ร้านอาหารนานาชาติ และมีการแสดงวิถีชีวิตท้องถิ่นของชาวอูลักลาโว้ย หรือชาวไทยใหม่ เกาะสิเหร่ ศิลปะวัฒนธรรมประจำถิ่น และการแสดงดนตรี “ROCK ON THE BEACH” เสก โลโซ ไก่กะละมัง และ วง หิน เหล็ก ไฟ
กิจกรรมสานสัมพันธ์รัก สักการะเทพเจ้าจันทรา 14 กุมภาพันธ์ 2566
เชิญชวนคู่รักร่วมจดทะเบียนสมรส ในงาน มหัศจรรย์วันวาเลนไทน์ ร่วมกิจกรรม "สานสัมพันธ์รัก" สักการะ "เทพเจ้าจันทรา" เทพเจ้าแห่งความรัก เพื่อความเป็นสิริมงคล คู่รัก ในวันที่ 14 กุมภาพันธ์ 2566 ณ คลองญวนชวนรักษ์ จังหวัดนครสวรรค์
งานวันคล้ายวันเกิดเจ้าพ่อเจ้าแม่ชุมแสง ปี 2566 วันที่ 4-7 กุมภาพันธ์ 2566
ขอเชิญเที่ยวงานวันคล้ายวันเกิดเจ้าพ่อเจ้าแม่ชุมแสง ปี 2566 วันที่ 4-7 กุมภาพันธ์ 2566 ณ ศาลเจ้าชั่วคราว (หลังสถานีรถไฟ) ชมการแสดงขบวนประเพณี การแสดงลิเก งิ้ว ชมคอนเสิร์ตจาก ศิลปินมากมาย
เทศกาลความรักแห่งชาติ คพอ. FAST FOOD FIN IN LOVE 2023 10 -14 กุมภาพันธ์ 2566
Chef table พร้อมสูตร เมนูอาหารฟรีจำนวนจำกัดเท่านั้น !!! เทศกาลความรักแห่งชาติ "คพอ. FAST FOOD FIN IN LOVE 2023" ระหว่างวันที่ 10 -14 กุมภาพันธ์ 2566 ณ ลานหน้าศูนย์การค้าเซ็นทรัลพิษณุโลก งานนี้รวบรวม ของกินเด็ดๆ ร้านดังกว่า 70 ร้าน ของช้อปเก๋ๆ มาให้สายกินได้ฟินกันสุดๆ ได้เจอกันแน่นอน พร้อมมันส์ไปกับ ฟรี!!! คอนเสิร์ตสุดฟิน จากศิลปินสุดคูลลลล
ตลาด เฟี้ยว ฟิน อินฟาร์ม ep. 2 @สองแควออร์กานิค
สองแควออร์กานิค จัด ตลาด เฟี้ยว ฟิน อินฟาร์ม ep. 2 วันอาทิตย์ที่ 12 กพ. 2566 นี้ ที่สวนเกษตรอินทรีย์ บ้านสวนเพชรนภัทร ปากโทก อ.เมือง พิษณุโลก บ้านสวนเพชรนภัทร สวนเกษตรอินทรีย์ 083 212 0033
ปฏิทินกิจกรรมเดือนกุมภาพันธ์ 2566
วันที่ 10-14 ก.พ. 66
ชื่องาน : คพอ. FEST FOOD FIN IN LOVE 2023 "เทศกาลอาหารกิน ถิ่นสองแคว"
สถานที่จัด : Cental Phitsanulok
วันที่ 11 ก.พ. 66
ชื่องาน : Chang Music Connection presents Rock Mountain 2023
สถานที่จัด Jolly Land อ.เขาค้อ จ.เพชรบูรณ์
วันที่ 12 ก.พ. 66
ชื่องาน : เฟี้ยว ฟิน อินฟาร์ม
สถานที่จัด : บ้านสวนเพชรนภัทร สวนเกษตรอินทรีย์
วันที่ 17-18 ก.พ. 66
ชื่องาน : เพชรบูรณ์กลางแปลง
สถานที่จัด : อ.เมือง จ.เพชรบูรณ์
วันที่ 17-18 ก.พ. 66
ชื่องาน : เขาค้อเฟสติวัล ครั้งที่ 1 เทศกาลดนตรีแคมป์ส่งท้ายลมหนาว
สถานที่จัด : ไร่บีเอ็นฟาร์ม อ.เขาค้อ จ.เพชรบูรณ์
วันที่ 27 ม.ค. - 2 ก.พ. 66
ชื่องาน : มะขามหวานนครบาลเพชรบูรณ์ ประจำปี 2566
สถานที่จัด : ศูนย์ราชการจังหวัดเพชรบูรณ์
วันที่ 27 ม.ค. - 2 ก.พ. 66
ชื่องาน : สมโภชพระพุทธชินราช ประจำปี 2566
สถานที่จัด : วัดพระศรีรัตนมหาธาตุวรมหาวิหาร
ปฏิทินกิจกรรมท่องเที่ยว จ.กำแพงเพชร เดือนกุมภาพันธ์ 2566
“ชวนปักหมุด แต่งชุดย้อนวันวาน” อินทยงยศ ถนนสายวัฒนธรรม จังหวัดลำพูน ตั้งแต่วันที่ 25 ก.พ. จนถึง 16 เม.ย. 2566
ททท.สำนักงานลำปาง ขอเชิญชวนร่วมกิจกรรม . “ชวนปักหมุด แต่งชุดย้อนวันวาน” อินทยงยศ ถนนสายวัฒนธรรม จังหวัดลำพูน . ทุกวันเสาร์-อาทิตย์ ตั้งแต่วันที่ 25 ก.พ. จนถึง 16 เม.ย. 2566 ณ ถนนอินทยงยศช่วงบริเวณด้านหลังวัดพระธาตุหริภุญชัยฯ จังหวัดลำพูน
ปฏิทินท่องเที่ยว เดือนกุมภาพันธ์ - มีนาคม 2566
ตามรอยบูรพกษัตริย์ไทย 15-19 กุมภาพันธ์ 2566
“ตามรอยบูรพกษัตริย์ไทย” การแสดง แสง สี เสียง เทิดพระเกียรติบูรพกษัตริย์ไทย ด้วยเอฟเฟคตระการตา แสงสีต่อยอดเจดีย์วัดวิหารทองให้สมบูรณ์เหมือนอดีตกาล การแสดงนิทรรศการผ่านสื่อนวัตกรรมและเทคโนโลยีที่ทันสมัยด้วยระบบจอสัมผัส ร้อยเรียงประวัติศาสตร์พระเครื่องพระบูชา และการจัดจำหน่ายสินค้า ผลิตภัณฑ์และของดีของชุมชน การแสดงศิลปวัฒนธรรมของกลุ่มจังหวัดภาคเหนือตอนล่าง 1 โดยจัดกิจกรรม จำนวน 5 วัน ตั้งแต่วันที่ 15 - 19 กุมภาพันธ์ 2566 ณ พระราชวังจันทน์ อำเภอเมือง จังหวัดพิษณุโลก
ทั้งนี้ ผู้สนใจเข้ารับชมฟรี!! พ
PATTAYA INTERNATION KITE ON THE BEACH 2023 วันที่ 24-28 ก.พ. 2566
ศูนย์การค้าเซ็นทรัล พัทยา จัดงาน “PATTAYA INTERNATION KITE ON THE BEACH 2023” ระหว่างวันที่ 24-28 ก.พ. 2566 ณ ริมชายหาดเมืองพัทยา และ ชั้น 1 ศูนย์การค้าเซ็นทรัล พัทยา เทศกาลว่าวยักษ์ริมชายหาดเมืองพัทยา ความยาวกว่า 500 เมตร
- อลังการกับการแสดงโชว์ว่าวขนาดยักษ์ หลายรูปแบบ หลากสีสัน บนท้องฟ้า ชายหาดพัทยา โดย Thaitan Kite Team Thailand พร้อมการแสดงโชว์ว่าวจากสหรัฐอเมริกา (ตั้งแต่ 12.00น. เป็นต้นไป)
- ชมการแสดงโชว์ว่าว LED (ตั้งแต่เวลา 18.00 น. เป็นต้นไป)
- สนุกตื่นเต้นกับ Sport Kite Show ริมบีช
- ตื่นตากับ Sport Kite Display & Exhibition กลางศูนย์การค้าฯกว่า 1,000 ตัว
ช้อปสนุกกับ Kite-Craft Market ทั้งว่าวนานาชนิด งานคราฟท์สุดชิคมากมาย
Hand Brew Coffee Fest 17-19 กุมภาพันธ์ 2023
ททท.พัทยา ชวนเที่ยวงานกาแฟแถวบางเสร่ เพราะนอกจากคุณจะได้สัมผัสบรรยากาศสุดชิลของชุมชนชาวประมงเล็กๆ ทะเลสงบๆ คาเฟ่สวยๆ ที่ไม่ไกลจากพัทยามากแล้ว ในวันที่ 17-19 กุมภาพันธ์ 2023 ยังมีเทศกาลคูลๆ อย่าง Hand Brew Coffee Fest ที่จะจัดขึ้นที่ wonderfarm บางเสร่ จ.ชลบุรี อีกด้วย
เทศกาลกาแฟที่จะทำให้คุณรู้สึกว่าเหมือนอยู่ในร้านกาแฟใหญ่มากๆร้านนึง ที่ "บาร์กาแฟบาร์เดียว" ของร้านมีเมล็ดดีๆให้ได้ลองชิมกว่า 50 ตัว ทั้ง Filter และ Espresso ที่คั่วจากโรสเตอร์เก่งๆในแบบที่เราต้องคอยตามกด F ให้ทัน ที่สำคัญบาริสต้าที่ยืนหลังบาร์ทุกคนคือตัวจริง ของจริง เรียกว่าเป็นระดับชื่อที่ใครก็ปฏิเสธไม่ได้ พบกันที่ Hand Brew Coffee Fest 17-19 กุมภาพันธ์ 2023 10.00-18.00 ที่ wonderfarm บางเสร่ จ.ชลบุรี
การประกวดนางสาวน่าน
การประกวดนางสาวน่าน จะจัดขึ้นในวันที่ 18 กุมภาพันธ์ 2566 เวลา 17.00 น.เป็นต้นไป ณ เวทีกลางริมแม่น้ำน่าน เชิงสะพานพัฒนาภาคเหนือ เพื่อคัดเลือกสาวงามที่เหมาะสมให้ดำรงตำแหน่งนางสาวน่าน ประจำปี 2566 และทำหน้าที่เป็นทูตสายสัมพันธ์ ประชาสัมพันธ์ศิลปะ วัฒนธรรม ประเพณี และการท่องเที่ยวของจังหวัดน่าน
ต่อล้อต่อเสียง 18-19 กุมภาพันธ์ 2566
“ต่อล้อต่อเสียง” ตอน สุ่มเสียงแห่งชาติพันธ์ุ เสาร์ที่ 18 กุมภาพันธ์ 2566 ตั้งแต่เวลา 16.00-21.00 น. ณ เฮือนแม่คำแปง บ้านน้ำครกใหม่ และอาทิตย์ที่ 19 กุมภาพันธ์ 2566 ณ กำแพงเมืองเก่าน่าน
NAN FEST เทศกาลน่าน : นั่งเล่น on the road 11 กุมภาพันธ์ 2566
NAN FEST / เทศกาลน่าน ร่วมกับ วงนั่งเล่น เสนอ " นั่งเล่น on the road " ขอเชิญทุกท่านมาล้อมวงนั่งฟังวงนั่งเล่นด้วยกันท่ามกลางบรรยากาศเป็นกันเองสบายๆกลางธรรมชาติ ในวันเสาร์ที่ 11 กุมภาพันธ์ 2566 15:30 เปิดให้เริ่มเข้างาน / 16:00 วงดนตรีเปิดงาน / 16:30ผู้ว่าราชการฯเปิดงาน / 17:00-19:00 วงนั่งเล่น ณ สถานที่ ป่าทำมา ต.เมืองจัง อ.ภูเพียง จ.น่าน
งานวันตาลโตนด ของดีวัดโบสถ์ และงานกาชาดประจำปี 2566
งานวันตาลโตนด ของดีวัดโบสถ์ และงานกาชาดประจำปี 2566 ณ บริเวณ ที่ว่าการอำเภอหลังเก่า อ.วัดโบสถ์ จ.พิษณุโลก วันที่ 17 - 26 กุมภาพันธ์ 2566
1 กุมภาพันธ์ 2567 เทศบาลเมืองบ้านสวน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า , ทำหมันสุนัขและแมว **(จรจัด)
สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองบ้านสวน เตรียมลงพื้นที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า , ทำหมันสุนัขและแมว **(จรจัด) วันพฤหัสบดีที่ 1 กุมภาพันธ์ 2567 ณ ศาลเจ้าเตียวเทียนซือ หมู่ 9
เวลา 09.00 น. - 12.00 น. อย่าลืมเตรียมบัตรประชาชนมาด้วย **เฉพาะในเขตเทศบาลเมืองบ้านสวนเท่านั้น (จำนวนจำกัด) สำหรับประชาชนที่จะนำสุนัขและแมวมาทำหมัน ให้จับสุนัขหรือแมวขังไว้ในกรง เพื่องดน้ำงดอาหารอย่างน้อย 8-12 ชั่วโมง เพื่อความปลอดภัยสำหรับสัตว์เลี้ยงของท่าน
งานแสงสว่างที่ปลายราง (รถไฟแม่กลอง) ครั้งที่ 2
ททท.สมุทรสงครามชวนเดินชิลล์ เที่ยวชม “งานแสงสว่างที่ปลายราง (รถไฟแม่กลอง) ครั้งที่ 2” ระหว่างวันที่ 11-14 กุมภาพันธ์ นี้ ตั้งแต่เวลา 15:00 เป็นต้นไป ณ บริเวณริมเขื่อนท่าน้ำวัดเพชรสมุทรวรวิหาร (ใกล้กับสุธา คาเฟ่) ต.แม่กลอง อ.เมืองฯ จ.สมุทรสงคราม พบปะ พูดคุย แลกเปลี่ยน ซื้อขาย สินค้าของคนแม่กลอง กว่า 100 ร้านค้า รวมทั้ง พบกับกิจกรรมพิเศษในงานมากมาย เช่น ✨การแสดงศิลปะและดนตรี เวทีของเยาวชน ✨ชมการสาธิตการกวนกาละแมรามัญ ✨การสนทนาภาษาตะเกียง จุดตะเกียงเจ้าพายุ 1000 ดวง ✨โชว์เพลงเพราะจากศิลปินชื่อดัง สุรชัย สมบัติเจริญ และ ดาจิม แรพเปอร์ไทย ✨สืบสานดนตรีไทย บรรเลงเพลงด้วยเครื่องดนตรีอังกะลุง ✨กิจกรรมสาระริมเขื่อน และกิจกรรอื่นๆ อื่นมากมาย ✨ชวนร่วมกิจกรรมยามเย็น แข่งขันตกกุ้งริมแม่น้ำแม่กลอง ✨และไฮไลท์คำคัญ คือ การจดทะเบียนสมรสบนรถไฟในวันแห่งความรัก 14 กุมภาพันธ์ 2566 ตั้งแต่เวลา 09:00 เป็นต้นไป
พิธีสมรสหมู่แบบคาทอลิกที่โบสถคริสต์บ้านซ่งแย้ (วัดอัครเทวดามิคาแอล)
พิธีสมรสหมู่แบบคาทอลิกที่โบสถคริสต์บ้านซ่งแย้ (วัดอัครเทวดามิคาแอล)
ในช่วงวันวาเลนไทน์ (14 กุมภาพันธ์ ของทุกปี) ที่โบสถ์คริสต์บ้านซ่งแย้ ตำบลคำเตย อำเภอไทยเจริญ จะจัดพิธีสมรสหมู่แบบคาทอลิกให้กับคู่บ่าวสาวที่ปรารถนาจะใช้ชีวิตคู่ร่วมกัน โดยการจัดพิธีดังกล่าวจัดขึ้นอย่างสมเกียรติของคู่บ่าวสาวและแขกเหรื่อที่มาร่วมงาน มีขบวนแห่ขันหมาก พิธีมิสซาบูชาขอบพระคุณพิธีสมรสแบบคาทอลิก พิธีอวยพร และการแสดงศิลปวัฒนธรรมเพื่อแสดงความยินดีกับคู่สมรส
กิจกรรมจดทะเบียนสมรสที่หินสามวาฬ วันวาเลนไทน์ 14 ก.พ.66
กิจกรรมจดทะเบียนสมรสที่หินสามวาฬ ณ เขตป่านันทนาการหินสามวาฬ ตำบลโคกก่อง อำเภอเมืองบึงกาฬ จังหวัดบึงกาฬ
งานมหกรรมมูนมังอีสาน ครั้งที่ 14 สกลม่วนซื่น ประจำปี 2566 วันที่ 22-24 กุมภาพันธ์ 2566
ขอเชิญสัมผัสวิถีอีสาน งานมหกรรมมูนมังอีสาน ครั้งที่ 14 “สกลม่วนซื่น” ประจำปี 2566 บริเวณริมห้วยทราย มหาวิทยาลัยราชภัฏสกลนคร วันที่ 22-24 กุมภาพันธ์ 2566
เทศบาลตำบลบ้านตาก ริการทำหมันสุนัข-แมว ฟรี!! 22 กุมภาพันธ์ 2567
เทศบาลตำบลบ้านตาก ขอเชิญชวนเจ้าของสัตว์เลี้ยง
ในเขตพื้นที่เทศบาลตำบลบ้านตาก
ลงทะเบียนเข้ารับบริการทำหมันสุนัข-แมว ฟรี!!
เปิดรับลงทะเบียน 5-9 กุมภาพันธ์ 2567
ทำหมันวันที่ 22 กุมภาพันธ์ 2567
เจ้าของสุนัขและแมวติดต่อลงทะเบียน ด้วยตนเองได้ที่
กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลบ้านตาก
รีบด่วน จำนวนจำกัดเพียง 50 ตัวเท่านั้น
กรุณานำบัตรประชาชนมาเพื่อใช้ในการกรอกข้อมูลด้วยนะคะ
มลายูเดย์ 24-26 กุมภาพันธ์ 2566
มลายูเดย์ 24-26 กุมภาพันธ์ 2566 เทศบาลนครยะลา ร่วมกับ สถานกงสุลใหญ่มาเลเซีย ประจำจังหวัดสงขลา สถานกงสุลใหญ่สาธารณรัฐอินโดนีเซีย ประจำจังหวัดสงขลา สำนักงานวัฒนธรรมจังหวัดยะลา กำหนดจัดงานมลายูเดย์@ยะลา ปีที่ ๘ วันที่ ๒๔ - ๒๖ กุมภาพันธ์ ๒๕๖๖ ณ สนามช้างเผือก ในงานประกอบด้วยหลากหลายกิจกรรม เช่น ~ การสัมมนาวิชาการ ~ การแข่งขันทักษะทางวิชาการ ~ การจัดขบวนแห่ส่งเสริมประเพณีศิลปวัฒนธรรม ~ การแสดงแลกเปลี่ยนระหว่างประเทศ ~ การแสดงบนเวที จากประเทศไทย มาเลเซีย อินโดนีเซีย ~ นิทรรศการศิลปกรรมร่วมสมัย ~ การสาธิตทำขนมพื้นบ้าน ~ การออกร้านจำหน่ายอาหารฮาลาล และเครื่องแต่งกายมลายู ฯลฯ ~ ชมสุดยอดการแสดงจาก มาเลเซีย อินโดนีเซีย และชายแดนใต้ของไทย
งานเฉลิมพระเกียรติพระบาทสมเด็จพระพุทธเลิศหล้านภาลัย 2566
ททท.สำนักงานสมุทรสงคราม ขอเชิญเที่ยวชม “งานเฉลิมพระเกียรติพระบาทสมเด็จพระพุทธเลิศหล้านภาลัย” ประจำปี ๒๕๖๖ ณ อุทยาน ร.๒ อำเภออัมพวา จังหวัดสมุทรสงคราม ระหว่างวันที่ ๒๕-๒๖ กุมภาพันธ์ นี้ เพื่อเป็นการเฉลิมพระเกียรติ ฯ และสนองในพระมหากรุณาธิคุณของพระองค์ท่านที่ทรงพระราชทานศิลปวัฒนธรรมไว้เป็นมรดกแก่ชาติจนได้รับยกย่องให้เป็นบุคคลสำคัญของโลกจากองค์การศึกษาวิทยาศาสตร์และวัฒนธรรมแห่งสหประชาชาติ (UNESCO) และในวันเสาร์ที่ ๒๕ กุมภาพันธ์ ๒๕๖๖ เวลา ๑๕.๐๐ น. สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี ทรงพระกรุณาเสด็จพระราชดำเนินทรงเป็นประธานในงานดังกล่าว จึงขอเรียนเชิญทุกท่านเฝ้าทูลละอองพระบาท โดยพร้อมเพียงกัน ตลอดจนขอเชิญรับชมการถ่ายทอดสดทางช่อง MCOT HD หมายเลย ๓๐
งานแห่พระลุยไฟ ประจำปี 2566 จังหวัดยะลา 28 ก.พ. 66
มูลนิธิแม่กอเหนียวยะลา (ฉือเซี่ยงตึ้ง) ถนนพุทธภูมิวิถี อำเภอเมือง จังหวัดยะลา พิธีสวดพระพุทธมนต์เปิดมณฑลพิธี อันศักดิ์สิทธิ์ การแสดง โหล่วโก้ว ป่วงเซียง ของมูลนิธิแม่กอเหนี่ยว ยะลา การแสดงโชว์สิงโต มังกรทอง ศิษย์ท้าวมหาพรหม กรุงเทพฯ การแสดงอุปรากรณ์ จีน งิ้ว พิธีเปิดประตูศาลเจ้าอัญเชิญองค์พระจำลองออกแห่รอบเมืองยะลา ชมขบวนเองกอ ศิษย์เจ้าแม่ลิ้มกอเหนี่ยวยะลา คณะสิงโต มังกรทอง ศิษย์ท้าวมหาพรหม กทมSunset Beach Music Festival 2023 หาดบางเก่า 4 มี.ค.66 LINK
Sunset Beach Music Festival 2023 เทศกาลดนตรี Reggae & Ska Beachlife Festival ที่ใหญ่ที่สุดในประเทศไทย 13ศิลปิน 9 DJ ไทยและต่างชาติ เสาร์ที่ 4 มีนาคม 2566 ณ หาดบางเก่า / บ้าน ไม้บนหาด อ.ชะอำ จ.เพชรบุรี นำทีมโดย BIGMOUNTAIN QUINO / JOB 2 DO / KAI-JO BROTHERS / สิงโต นำโชค / T-BONE / ศรีราชาร็อคเกอร์ / MOCCAGARDEN / GOLDRED / จุลโหฬาร / คณะขวัญใจ / RASTAFAH / DEEP "O" SEA / THE SUPERGLASSES SKA EMSEMBLE / DJ PEACHY / DJ DOGGA ZONE DJ KING KONG KILLA(GJHF) / STICKY KEYS(GJHF) / SISTA2INE / BRAD-ROC / ORAWAN / DAPOOKSTER AKA.THE STICKY RICE / PAPA STEVE
ชราชวนวิ่งเพชรบุรี Cross Country ครั้งที่1 วันที่ 26 มี.ค.66
ชราชวนวิ่งเพชรบุรี cross country ครั้งที่ 1 วันที่ 26 มีนาคม 2566 ณ.ไร่ชัยราชพฤกษ์ อำเภอแก่งกระจาน จังหวัดเพชรบุรี ชมรมกีฬาและนันทนาการผู้สูงอายุ จังหวัดเพชรบุรี จัดจำหน่วยเสื้อวิ่งชราชวนวิ่งเพชรบุรี cross country ครั้งที่ 1 เพื่อนำรายได้หลังหักค่าใช้จ่ายเป็นทุนในการบริหารจัดการในการส่งนักกีฬาตัวแทนจังหวัดเพชรบุรีเข้าร่วมการแข่งขันกีฬาผู้สูงอายุ ณ.จังหวัดพิษณุโลก เดือนพฤษภาคม 2566 โดยท่านที่ซื้อเสื้อจะได้รับสิทธิ์ประโยชน์ทุกอย่างในกิจกรรม ชราชวนวิ่งเพชรบุรี cross country ครั้งที่ 1 เบอร์โทร 08065548761
ชะอำ บิกินี่ บีชรัน 2023 วันอาทิตย์ที่ 19 มีนาคม 2566
หาดชะอำ บิกินีบีชรัน 2023 วันอาทิตย์ที่ 19 มีนาคม 2566 จุดเริ่มต้นและเส้นชัย ณ หาดทรายหน้าโรงแรมลองบีช ชะอำ อำเภอชะอำ จังหวัดเพชรบุรี
งาน Pattaya Music Festival 2023 มี.ค.66 LINK
งาน Pattaya Music Festival 2023 ทุกศุกร์-เสาร์ ตลอดมีนาคม 66 อัพเดต! งานเทศกาลดนตรีเมืองพัทยา PATTAYA MUSIC FESTIVAL 2023 ครั้งแรกของปี กำหนดการแสดงทุกวัน ศุกร์ - เสาร์ ตลอดเดือนมีนาคม 2566 ติดตามอัพเดต
PELUPO MUSIC FESTIVAL 2023 (เพลูโป้) เทศกาลดนตรี inter พัทยา 11 มี.ค.66 LINK
PELUPO MUSIC FESTIVAL 2023 (เพลูโป้) เทศกาลดนตรี Inter หลีกหนีความวุ่นวาย เตรียมตัวเดินทางสู่ PELUPO (เพลูโป้) เทศกาลดนตรี International ที่พาศิลปินจากทั่วทุกมุมโลกมารวมไว้ในงานเดียวกัน ณ เดอะฟิลด์ แอท สยามคันทรีคลับ จังหวัดชลบุรี วันที่ 11 มีนาคม 2566 ณ PELUPO คอนเสิร์ตของศิลปินระดับโลก Activity ความสนุกสนานมากมาย ร่วมเฉลิมฉลองความงดงามของดนตรี ศิลปะ ชีวิต งาน PELUPO จะมีทั้งหมด 2 เวที Line up : Phoenix Kings of Convenience Summer Salt Men I trust Ezra Collective H I N A N O Ginger Root George BCNR AUTTA
งานเฉลิมฉลองวันนักบุญแพททริค 17 มี.ค.66
งานเฉลิมฉลองวันนักบุญแพททริค (St.Patrick’s Day Parade Pattaya) 17 มีนาคม 2023 ถนนสายชายหาดพัทยา หน่วยงานที่จัดกิจกรรม : มูลนิธิคุณพ่อเรย์ ติดต่อสำนักงาน : 038-716628
งานเมาว์ลิดกลางจังหวัดกระบี่ 1 - 5 มี. ค. 66
งานเมาว์ลิดกลางจังหวัดกระบี่ | The 42nd Maulidur Rasul Krabi Province
วันที่ 1 - 5 มี. ค. 66
มัสยิดกลางจังหวัดกระบี่ งานวันเฉลิมฉลองวันคล้ายวันประสูติของท่านศาสดามูฮัมหมัด เมาว์ลีดินนบี สดุดีบรมศาสดา ฟังการบรรยายธรรม พร้อมกับช้อปปิ้ง กินอาหารฮาลาล ให้ฮาหร่อยกันไปเลย
งานดนตรี Song by The River @Krabi เดือนมีนาคม ณ ลานปูดำ และ ถนนคนเดิน
ชวนเชิญเดินเที่ยว ฟังเพลง ในงาน Song by The River @Krabi วันที่ 3-4 , 10-11, 17 – 18 มี.ค. 66 ณ 2 เวที 17.00 – 21.00 น. ลานปูดำ 19.00 – 21.00 น. ถนนคนเดิน ช็อปสินค้า กินอาหารอร่อย ๆ เดินกันชิลๆ ให้ตัวปลิวตามสายลม ท่ามกลางหมู่ดาว ที่พร่างพราวเหนือเขาขนาบน้ำ [
Location map]
งาน ลานตาลันตา ครั้งที่ 18 วันที่ 3-5 มี.ค. 66 ณ เมืองเก่าลันตาบ้านศรีรายา
งาน ลานตาลันตา ครั้งที่ 18 วันที่ 3-5 มี.ค. 66 ณ
เมืองเก่าลันตาบ้านศรีรายา ร่วมนั่ง ไทม์แมชชีน เจาะเวลา หาอดีตไปแลลันตาผ่านกาลเวลามาปัจจุบัน พบวิถี ผู้คน – การเดินทาง – การดำรงอยู่ – วัฒนธรรม ที่จะมาร้อยเรียงเป็นเรื่องราว ชมพิธี “เปิดเล เขเรือ” (เปิดทะเล นั่งเรือ), การแสดงทางอัตลักษณ์ของแต่ละชุมชน, เสน่ห์ของความหลากหลายทางชาติพันธุ์บนลันตาที่อยู่ร่วมกันอย่างกลมเกลียว ประเพณี พิธีกรรมต่างๆ " ช๊อปสนุกกับสินค้าชุมชนท่องเที่ยว 11 แห่ง การออกบูธของโรงแรมและร้านอาหาร ย้อนอดีตที่ถนนคนเดินศรีรายา ละลานตาราตรีการแสดงดนตรี และการแสดงวัฒนธรรม อิ่มอร่อยกับการประกวดเมนูพื้นบ้าน อาหารพื้นถิ่น ของคนลันตา "แกงแพะ/ ข้าวยำ งาน Craft, DIY, กิจกรรมเพื่อสิ่งแวดล้อม" โอ๊ย…ละลานตาจริงๆ แล้วเจอกันนะ....ที่ลันตา
นาตีนกรีนวิลเลจ 10 - 12 มีนาคม 66 ณ หลาดประตีน
ททท. ชวนท่องเที่ยวเชิงวัฒนธรรมในงาน “นาตีนกรีนวิลเลจ” 10 - 12 มีนาคม ณ
หลาดประตีน งานตลาดแนวรักษ์โลกแบบสุด Green 100% กิ๊ปเก๋แค่ไหน ภายในงานเค้าใช้วัสดุและภาชนะจากธรรมชาติที่มีในท้องถิ่น มาบรรจุอาหารและเครื่องดื่ม เช่น กะลา ใบตอง ใบจาก ใบกะพ้อ กระบอกไม้ไผ่ มาดูการทำขนมทุ่มโพล้ง!! อ่ะอ๋า มันคือ อาราย? กินข้าวเหนียวกับปลาย่าง ขนมครก ชมการขูดมะพร้าว การสาธิตการทำอาหารถิ่น วิธีบีบน้ำอ้อยแบบโบราณ การออกร้านจำหน่ายสินค้า พร้อมกับชมวิถีชีวิตแบบมุสลิมที่เรียบง่าย
นาตีนกรีนวิลเลจ เฟสติวัล : ตลาดท้องถิ่น อนุรักษ์วัฒนธรรมวิถีชีวิตชุมชนแบบดั้งเดิมของพี่น้องมุสลิม รวมของกินแสนอร่อย ส่งเสริมการท่องเที่ยวเชิงวัฒธรรมและวิถีชิวิตชุมชน ภายใต้การอนุรักษ์สิ่งแวดล้อมโดยการใช้วัสดุและภาชนะจากวัสดุธรรมชาติในการบรรจุอาหารเพื่ออนุรักษ์สิ่งแวดล้อม สนับสนุนให้ประชาชนและชุมชนเข้ามามีส่วนร่วมในการอนุรักษ์ และพัฒนาแหล่งท่องเที่ยวท้องถิ่นของตนเอง ผ่านกิจกรรมหลากหลาย ทั้ง สาธิตการทำอาหาร แบบโบราณ การทำน้ำอ้อยสด ฯลฯ การแสดงย้อนรอยนาตีนจาก นักเรียนโรงรียนบ้านช่องพลี
ตะลอน…ตลาด @กระบี่ Krabi Flea Market
จ.กระบี่มีตลาดนัดแบบ Green Green หลายที่ให้ต้องไปเดินชม
- ตลาดปูดำ : Poodum Night Market
- ถนนคนเดินจังหวัดกระบี่ : ดื่มด่ำบรรยากาศยามเย็นที่หน้าเมืองกระบี่แล้วต่อด้วยช้อปปิ้งเพลินๆ ที่ถนนคนเดินกระบี่
- Chill Chill Market : ตลาดชิลชิลมาเก็ต ตลาดเล็กๆ แต่ชิลล์สมชื่อ
- หลาดประตีน : Prateen Market ตลาดแนวรักษ์โลก ย้อนยุคนิดๆ ชมวิถีถิ่น กินในกะลา / ใบตอง เปิดความ Green พลัส x ความปัง ในงาน “นาตีนกรีนวิลเลจ” 10-12 มีนาคม
- ตลาดโต้รุ่งเจ้าฟ้า ... ซีฟู๊ด อาหารถิ่น น้ำพืชผักผลไม้ แนวสมูทตี้ ที่สามารถกินกันยันรุ่ง
- ตลาดสดมหาราช ใจกลางเมืองกระบี่ ของคาว หวาน อาหาร แห้ง-สด มีครบพบได้ที่ ตะ หลาด มะ หา ราด
- ตลาดสดเหนือคลอง มาส่องดูวิถีของคนพื้นเมืองที่นี่ ว่ากินอะไรขายอะไร อย่างใกล้ชิด
Workshop อาหารเป็นยา กับป้านิด และ คุณปูเป้ ณ สุข เวลเนส รีสอร์ท กระบี่
Workshop อาหารเป็นยา กับป้านิด และ คุณปูเป้ ณ สุข เวลเนส รีสอร์ท กระบี่ วันที่ 5 มีนาคม 2566 นี้ 9.00-15.00 น พบกับ 2 กิจกรรม สุดพิเศษ จาก 2 อินฟลูเอ็นเซอร์สายสุขภาพชื่อดัง“ป้านิดดา”แห่งแสงแดดเฮลท์มาร์ท และ“คุณปูเป้”จากเพจปูเป้ทำเอง มาเจอกันที่กระบี่ เพื่อพบปะพูดคุยแบ่งปันเคล็ดลับการดูแลสุขภาพด้วยโพรไบโอติกส์ ร่วมสนุกสนานกับ workshop "กิมจิผักพื้นบ้าน" เครื่องดื่มเพื่อสุขภาพ"ไซเดอร์" และ "คอมบูชา" รับประทานอาหารเพื่อสุขภาพมื้อกลางวันและเย็นร่วมกัน ในราคาสุด
15.00-18.00น. เปิดตลาด(เข้าฟรีไม่มีค่าใช้จ่าย) ชม ชิม ช้อป สินค้าและบริการสุขภาพ ดูแลทั้งใจและกาย เพลิดเพลินกับวงดนตรีพื้นบ้าน “รองเง็ง” ชม การสาธิต งานฝีมือ "เมคราเม่" พร้อมรับคำแนะนำในการดูแลสุขภาพจากผู้เชี่ยวชาญสาขาต่างๆ ฟรี! ตรวจหลอดเลือดฝอยเพื่อประเมินความเสี่ยงโรคหลอดเลือด โยคะ และ คลื่นเสียงบำบัด(รับจำนวนจำกัด). แล้วพบกันที่ ณ สุข เวลเนส รีสอร์ท กระบี่ สนใจสอบถามเพิ่มเติม โทร : 088 5919296, 075 680411
เดินวิ่งครบรอบ 40 ปีสมาคมมุสลิมสัมพันธ์จังหวัดกระบี่ 5 มีนาคม 66
เดินวิ่งครบรอบ 40 ปีสมาคมมุสลิมสัมพันธ์จังหวัดกระบี่ วันที่ 5 มีนาคม 2566 ณ องค์การบริหารส่วนจังหวัดกระบี่
งานมหกรรมสุดยอดกระเที่ยมและของดี OTOP อำเภอเวียงแหง 17 - 26 มีนาคม 66
งานมหกรรมสุดยอดกระเที่ยมและของดี OTOP อำเภอเวียงแหง ระหว่างวันที่ 17 - 26 มีนาคม 2566 ณ ทางเข้าที่ว่าการอำเภอเวียงแหง จังหวัดเชียงใหม่
งานเทพเสด็จเมืองกาแฟ ครั้งที่ 9 วันที่ 4 – 5 มีนาคม 2566
งานเทพเสด็จเมืองกาแฟ ครั้งที่ 9 ประจำปี 2566 ระหว่างวันที่ 4 – 5 มีนาคม 2566 ณ ลานอเนกประสงค์ บ้านปางไฮ ต.เทพเสด็จ อ.ดอยสะเก็ด จ.เชียงใหม่
กิจกรรม Art & Craft 1 มีนาคม 2566 โครงการไนท์บาซาร์ เชียงใหม่
กิจกรรม Art & Craft ณ โครงการไนท์บาซาร์ เชียงใหม่ ร่วมกับ สำนักงานพาณิชย์จังหวัดเชียงใหม่ เปิดพื้นที่ให้ผู้ประกอบการ เกษตรกร ผู้ผลิตสินค้าชุมชน ของในกลุ่ม สำนักงานพาณิชย์จังหวัดเชียงใหม่ นำสินค้ามาจำหน่ายตรงผู้บริโภค อาทิ เสื้อผ้า สินค้าแปรรูป ได้แก่ เครื่องดื่ม กาแฟ โกโก้ กระเป๋า และอื่นๆ มากมาย พบกันวันที่ 1 มีนาคม 2566 เป็นต้นไป เวลา 18.00-23.00 น. ณ บริเวณชั้น 2 ใกล้ทางขึ้นโครงการไนท์บาซาร์ เชียงใหม่
งานมหัศจรรย์กาแฟดี จังหวัดตาก ครั้งที่ 2 วันที่ 25-26 มีนาคม 2566 LINK
งานมหัศจรรย์กาแฟดี จังหวัดตาก ครั้งที่ 2 วันที่ 25-26 มีนาคม นี้ ณ สวนริมแม่น้ำปิง เทศบาลเมืองตาก มาสัมผัสอัตลักษณ์กาแฟดีจังหวัดตาก การแข่งขัน Drip coffee (Drip/Pour-Over) ด้วยรุปแบบ slow bar สกัดรสชาติ รสหอมกรุ่นกลิ่นกาแฟตาก การแข่งขัน Moka pot เย็น เนรมิตเมนูกาแฟ Es Yen เมนูกาแฟยอดนิยม สร้างสรรค์ไอเดียกาแฟรูปแบบ Espresso Signature Drink การเสวนาหัวข้อ "โอกาสและอนาคตของกาแฟตาก" และชิมเมนูกาแฟมากมายในงาน
งานวันชางไทย ณ บ้านพะยอ (บ้านเพราะช้าง) อ.พบพระ จ.ตาก 12-13 มีนาคม 66
งานวันชางไทย ณ บ้านพะยอ (บ้านเพราะช้าง) อ.พบพระ จ.ตาก 12-13 มีนาคม 66 ประกวดธิดาช้าง (คืน 17 มีนาคม) นิทรรศกาลช้างไทยและวัฒนธรรม พิธีมัดมือช้าง การแสดงช้างแสนรู้ กิจกรรมป้อนอาหารช้าง ถ่ายภาพกับช้างแสนรู้ เที่ยวชิม ชม ช็อปในงานอีกเพียบ
HUT-เล่น : เป็นสมุนไพร 18-19 มีค.2566 LINK
HUT-เล่น : เป็นสมุนไพร งานเทศกวน ที่ทดลองกวนรวมเรื่องราว สุขภาพและสมุนไพรในบรรยากาศสบายๆ คลายร้อนริมลำธารและน้ำตกของชาว จ.ตาก ที่อยากชวนทุกคนมาลอง มาเล่น มารู้ งานมีวันที่ 18-19 มีค. 2566 เวลา 10.00 - 17.00 น ณ
น้ำตกผาแดง สวนพฤกษศาสตร์ เหมืองผาแดง
ชวนเที่ยวงาน แม่สอด ลดสนั่น ลั่นเมือง วันที่ 1 มี.ค. - 30 เม.ย. 66 LINK
ชวนเที่ยวงาน “แม่สอด ลดสนั่น ลั่นเมือง” วันที่ 1-7 มี.ค. 66 ณ โรบินสัน ไลฟ์สไตล์ แม่สอด พบกับร้านค้ามากกว่า 80 ร้านค้าและ วันที่ 1 มี.ค. - 30 เม.ย. 66 ณ สถานประกอบการที่เข้าร่วมโครงการ
พบกับ.. พาณิชย์ลดราคาช่วยประชาชน ภายใต้โครงการธงฟ้าราคาประหยัดลดค่าครองชีพประชาชน ปีงบประมาณ 2566 และผู้ประกอบการในพื้นที่อำเภอแม่สอดร่วมกันลดราคาสินค้า และบริการ ลดสูงสุด 70% ได้แก่ ร้านอาหาร/คาเฟ่ โรงแรม/ที่พัก สินค้าเกษตร สินค้าอุปโภคบริโภค เครื่องใช้ไฟฟ้า วัสดุก่อสร้าง บริการขนส่ง เครื่องมือการเกษตร/ปุ๋ยเคมี/ยากำจัดศัตรูพืช สินค้าเบ็ดเตล็ด และบริการอื่นๆ
อบจ.ตาก หลักสูตร การทำเบเกอรี่ 30 มีนาคม พ.ศ. 2566 ฟรี LINK
องค์การบริหารส่วนจังหวัดตาก ประชาสัมพันธ์ โครงการส่งเสริมการประกอบอาชีพสู้วิกฤติ COVID-19 รุ่นที่ 4 หลักสูตร “การทำเบเกอรี่” จัดอบรม วันพฤหัสบดี ที่ 30 มีนาคม พ.ศ. 2566
ณ ห้องประชุมแม่ปิง ชั้น 2 วิทยาลัยเทคนิคตาก อำเภอเมืองตาก จังหวัดตาก
โดย วิทยากรจากวิทยาลัยเทคนิคตาก ... ให้ความรู้ หัวข้อเรื่อง ความรู้ทั่วไป หลักการทำ และเคล็ดลับการทำเบเกอรี่ การทำคุกกี้นม การทำเค้กกล้วยหอม การทำชิฟฟ่อนน้ำมะพร้าวอ่อน
**กิจกรรมครั้งนี้ไม่มีค่าใช้จ่ายใดๆทั้งสิ้น จำกัดผู้เข้าอบรม จำนวน 50 ท่าน เท่านั้น แต่งกายด้วยชุดสุภาพเรียบร้อย ระหว่างการเข้าร่วมโครงการ ต้องปฏิบัติตามมาตรการป้องกันการแพร่ระบาดของโรคระบาดโควิด 19 โดยเคร่งครัด กิจกรรมครั้งนี้ ฟรีตลอดงาน !!!
งานหวานชีวา พาเที่ยวเกาะ 11-12 มีนาคม 2566 ณ ไร่แสนรักษ์ สามพราน จ.นครปฐม
"งานหวานชีวา พาเที่ยวเกาะ" วันเสาร์-อาทิตย์ 11-12 มีนาคม 2566 ณ ไร่แสนรักษ์ เกาะลัดอีแท่น อ.สามพราน จ.นครปฐม ครั้งนี้เรามีสินค้าเกษตรปลอดสารจากชาวสวน งานแฮนเมดสุดเจ๋ง แบบชิ้นเดียวในโลก...ส่งตรงถึง นทท. ทุกท่าน และกิจกรรมสุดมันส์ส์ "งมหอย"... อ้าวววงง..มั้ยล่ะจ๊ะงั้นตามมานะ...มีรางวัลสำหรับนักงมที่ชนะด้วยนะ และมีรถรางบริการฟรี....ฟรี...ฟรี...ที่ "วัดไร่ขิง" เวลา 10.00- 16.00 น. ไร่เเสนรักษ์ 089 441 1414
Cha-am Under The Sea เทศกาลอาบแดด รับลม ชมดนตรี ริมชายหาดชะอำเหนือ 31 มี.ค. - 2 เม.ย.66
เตรียมพบกับ Cha-am Under The Sea เทศกาลอาบแดด รับลม ชมดนตรี ริมชายหาดชะอำเหนือ ตลอดวันที่ 31 มี.ค. - 2 เม.ย. 2566 จัดเต็มซุ้มถ่ายรูป มุมนั่งชิล และบูธช้อปชิมที่ขนอาหารทะเลมาให้คุณแบบจุกๆ พิเศษ ฟรีคอนเสิร์ตที่จะเพิ่มดีกรีความร้อนแรงริมชายหาด
31 มี.ค. 2566 Burin และ Only Monday
1 เม.ย. 2566 Your Mood
2 เม.ย. 2566 Getsunova
เทศกาลชิมปูชัก@ชะอำ ครั้งที่ 8 วันที่ 11-18 มี.ค.66
เทศกาลชิมปูชัก@ชะอำ ครั้งที่ 8 วันที่ 11-18 มีนาคม 2566 ณ จุดชมวิวชายหาดชะอำ อำเภอชะอำ จังหวัดเพชรบุรี งานเริ่มในช่วงเย็นเป็นต้นไป ของทุกวัน ในงานพบกับอาหารทะเลสดๆ และซุ้มอาหารต่างๆภายในงาน จากร้านในพื้นที่ ทุกคืนพบกับนักร้อง ศิลปิน มหกรรมสินค้าถนนคนเดิน อาหารของใช้ สวนสนุกเด็ก ตั้งแต่จุดจอดรถ จนถึงทางเข้างานจุดชมวิว
Phrachomklao run 2023 ตอน วิ่งกระชากใจ ใครๆก็วิ่งได้ 12 มี.ค.66
Phrachomklao run 2023 ตอน วิ่งกระชากใจ ใครๆก็วิ่งได้ วันที่ 12 มีนาคม 2566 ณ บริเวณหน้าสนามโรงเรียนเบญจมเทพอุทิศ จังหวัดเพชรบุรี ประเภทการแข่ง มินิมาราธอน 10 / 4.4 / 3 / Family 4.4 / VIP - ชมภาพกิจกรรมนักวิ่งและบรรยากาศที่เพจ
facebook.com/pckrunตลาดกาแฟสัญจร Sun Coff and Moon Craft 17-19 มี.ค.66 LINK
ตลาดกาแฟสัญจร Sun Coff and Moon Craft 17 – 19 มีนาคม 2566 ที่
Thew Talay World ชะอำ ฟินกับการจิบกาแฟพร้อมดนตรีสดตลอดทั้งวัน งานนี้ไม่ได้มีแค่กาแฟและเครื่องดื่มแน่นอน มาช้อป ชิม ชิว ครบจบที่งานเดียวกันค่ะ - เบเกอรี่ - อาหาร - เสื้อผ้า / กิ๊ปชอป - งานแฮนด์เมด - งานวินเทจ - Workshop ศิลปะ - Workshop กาแฟ - Food Truck - Coffee Truck - Coffee Camp พิเศษสุด พบกับกิจกรรม Free Workshop เก๋ๆ ภายในบูธ ททท. วาดภาพจากสีกาแฟ สุดเก๋ D.I.Y. วาดภาพบนแก้วพลาสติกใบเก่า กลายเป็นแก้วเท่ๆ ไม่ซ้ำใคร (กิจกรรมนี้ผู้ร่วมกิจกรรมสามารถนำแก้วมาเองได้) (โดยศิลปิน : ครูหมิว กานต์ชนก อินทรปรุง)
ยลศิลป์ ถิ่นอาหาร ย่านต้นม่วง วันที่ 10-11 มี.ค.66
ขอเชิญเที่ยวงานตลาดนัดภูมิปัญญาสภาวัฒนธรรมอำเภอเมืองเพชรบุรี ยลศิลป์ ถิ่นอาหาร ย่านต้นม่วง วันที่ 10-11 มีนาคม 2566 ณ ถนนหน้าที่ทำการ อบต.ต้นมะม่วง เวลาแดดร่มลมตก 16.00-21.00 น. พบกับกิจกรรมมากมายภายในงาน อาทิ • สาธิตงานสกุลช่างเมืองเพชร • สาธิตอาหารคาวหวานท้องถิ่นและอาหารสร้างสรรค์ • การแสดงศิลปวัฒธรรมไทยและชาติพันธุ์ • การแสดงจากชมรมผู้สูงอายุและเยาวชนเพชรบุรี • เรียนรู้งานฝีมือ 108 อาชีพ • นิทรรศการหน่วยงานและภาคีเครือข่ายวัฒนธรรม • ชิม-ช้อป อาหารคาว-หวาน ของที่ระลึกจากตลาดชุมชนและตลาดอิ่มสุข
กิจกรรมนั่งรถรางชมเมืองเพชร
กิจกรรมนั่งรถรางชมเมืองเพชรได้รับความสนใจเป็นอย่างมาก เราจึงขอเปิดรับจองที่นั่งล่วงหน้า เพื่อให้ทุกท่านสามารถสำรองที่นั่งได้ง่ายๆ และไม่พลาดรถรางเที่ยวพิเศษ วันที่ 11 มีนาคมนี้ รอบที่ 1 เวลา 10.00 น. รอบที่ 2 เวลา 11.30 น. (รอบละ 35 ที่นั่งเท่านั้น) สามารถสำรองที่นั่งรถรางได้ที่ช่องทาง QR Code
Beach Boys & Girls Music Fest 25 มี.ค.66
Beach Boys & Girls Music Fest วันเสาร์ที่ 25 มีนาคม 2566 TRIPLE TREE BEACH RESORT (ใกล้ครัวเม็ดทราย) อำเภอชะอำ เพชรบุรี รวมศิลปินตัวตึงแห่งชาร์ต • NONTTANONT • Bowkylion • TheToys • VioletteWautier • TILLYBIRDS • THREEMANDOWN • ZomMarie • PROXIEth
บิกินีบีชรัน 2023 วันอาทิตย์ที่ 19 มี.ค.66
บิกินีบีชรัน 2023 วันอาทิตย์ที่ 19 มีนาคม 2566 จุดเริ่มต้นและเส้นชัย ณ หาดทรายหน้าโรงแรมลองบีช ชะอำ อำเภอชะอำ จังหวัดเพชรบุรี
Art of Salt เทศกาลประติมากรรมเกลือ ครั้งที่ 8 วันที่ 31 มี.ค. - 2 เม.ย.66
Art Of Salt เทศกาลประติมากรรมเกลือ ครั้งที่ 8 "หลงเกลือหวาน..จนเกินต้าน" ระหว่างวันที่ 31 มีนาคม ถึงวันที่ 2 เมษายน 2566 ณ จุดชมวิวบางแก้ว บ้านแหลม เพชรบุรี งานเกลือที่จะพลิกโฉม เม็ดเกลือ มาปั้น ประติมากรรมเกลือ นับเป็นการต่อยอดภูมิปัญญา เส้นทางสายเกลือและยังช่วยส่งเสริมการท่องเที่ยวโดยชุมชน จากชาวบ้านในท้องถิ่น ชิมเกลือหวาน มากิน กุ้ง หอย ปู ปลา ดื่มด่ำรสชาติอาหารหลากชนิด และสัมผัสความสุขจากวงดนตรี แสง สีเสียง
Dusit Thani Hua Hin Local Feast 18-19 มี.ค.66 LINK
Dusit Thani Hua Hin’s Local Feast วันที่ 18 - 19 มีนาคม นี้ในเวลา 17:00 น.- เที่ยงคืน พาเหรดอาหารหลากหลายท่ามกลางบรรยากาศของสีสันและความบันเทิงจากดนตรีสด ดีเจมาร์ติน หนังกลางแปลง และโมเม้นท์ดีๆ กับเพื่อนฝูงและครอบครัว ลิ้มรสขนมกุยช่ายอันขึ้นชื่อ รวมถึงผัดไทยรสเด็ด และของหวานที่คุณหนู ๆ ชื่นชอบ ไม่ว่าจะเป็นสายไหม ขนมน้ำตาลปั้น หรือเครื่องดื่มที่ใช้มะนาวเมืองเพชรเป็นส่วนผสมหลัก และยังมีอาหารนานาชาติที่คุณชื่นชอบอีกด้วย *มีค่าเข้าชม
ชมนิทรรศการ มุมลุงหมวด 17 – 26 มี.ค.66
ชมนิทรรศการ "มุมลุงหมวด" ร.ต.ต.ไพบูลย์ แก้วมุกดา ช่างภาพอาวุโสที่มีฝีมือการถ่ายภาพท่านหนึ่งของเมืองเพชรบุรี ถ่ายไว้เมื่อราว ๆ 40 – 50 ปีก่อน และที่สำคัญมีภาพถ่ายพลุ ในงานพระนครคีรียุคต้น ๆ จัดแสดงที่เขาวังเคเบิลคาร์ ช่วงระหว่างการจัดงานพระนครคีรี วันที่ 17 – 26 มีนาคม 2566 ณ เขาวังเคเบิลคาร์ จัดโดยกลุ่มลูกหว้า ททท.เพชรบุรี และ สำนักงานวัฒนธรรมจังหวัดเพชรบุรี
งานเกษตรแฟร์ฉะเชิงเทรา ครั้งที่ 12 วันที่ 17-26 มี.ค.66
งานเกษตรแฟร์ฉะเชิงเทรา ครั้งที่ 12 วันที่ 17-26 มีนาคม 2566 ณ บริเวณมหาวิทยาลัยราชภัฏราชนครินทร์ อำเภอเมือง จังหวัดฉะเชิงเทรา
งานเทศกาลขนมหวานอาหารอร่อย 6-12 มีนาคม 2566
ฉะเชิงเทราหวานเจี๊ยบ เชิญทุกคนมากัน กินให้พุงแตก แล้วพรุ่งนี้ค่อยลด 6-12 มีนาคม 2566 ณ สนามยิงปืน ช.พัน2 อ.เมือง จ.ฉะเชิงเทรา เวลา 10.00 - 22.00 น. มาเที่ยวงานใส่สไบ หรือจะใส่กระโจงก็ย่อมได้ แปลงร่างเป็นออเจ้า ก็เก๋ จัดเต็มร้านเด็ด รวมของกิน ขนมหวาน อาหารรสแซ่บ ของอร่อยสตรีทฟู๊ด พร้อมที่นั่งทาน จิบน้ำเพลินๆ เคล้าเสียงเพลงแบบชิวๆ ตั้งแต่เช้ายันค่ำ
วันมะม่วงและของดีเมืองแปดริ้ว ครั้งที่ 52 ประจำปี 2566 วันที่ 31 มีนาคม - 9 เมษายน 2566
ขอเชิญเที่ยวงาน "วันมะม่วงและของดีเมืองแปดริ้ว ครั้งที่ 52 ประจำปี 2566" ระหว่างวันที่ 31 มีนาคม - 9 เมษายน 2566 เวลา 09.00 - 21.00 น. ณ โรงเรียนวัดโสธรวรารามวรวิหาร อำเภอเมืองฉะเชิงเทรา จังหวัดฉะเชิงเทรา
Calligraphy Workshop เขียน สร้าง สุข ด้วยอักษรวิจิตร 24 มีนาคม 66
Calligraphy Workshop เขียน สร้าง สุข ด้วยอักษรวิจิตร เรียนรู้ศาสตร์การเขียนด้วย Calligraphy หรืออักษรวิจิตร ด้วยพู่กันสีน้ำ 24 มีนาคม 66 13.30 -15.30 น. รับจำนวนจำกัด เรียนฟรี สอนโดย อ.ดร.จินดา เนื่องจำนงค์
ท่าม่วงบ้านฉันชวนชิม 24 - 26 มี.ค.66
ททท.กาญจนบุรี ขอชวนไปย้อนยุคสนุกสนาน ในบรรยากาศเทศกาลปีใหม่ไทยที่กำลังใกล้จะมาถึง กับงาน "ท่าม่วงบ้านฉันชวนชิม" วันที่ 24 - 26 มีนาคม 2566 ตั้งแต่ 4 โมงเย็น ถึง 3 ทุ่ม ณ ตลาดนางลอย ซอยเทศบาล 12 อ.ท่าม่วง จ.กาญจนบุรี
The Route 97 ทริปพาย SUP แม่น้ำแควน้อย 18-19 มีนาคม 66 LINK
The Route 97 ทริปพาย SUP แม่น้ำแควน้อย จ.กาญจนบุรี 2 วัน 1 คืน วันที่ 18-19 มีนาคม 66 กับระยะทางวัดใจ 97km.(พายตามน้ำวันละ 50 กม.) ทริปนี้คุณจะได้สัมผัสธรรมชาติตลอดเส้นทาง • ผ่านเส้นทางรถไฟสายมรณะ ถ้ำกระเเซ/ ปางช้าง • พูดคุยปาร์ตี้สังสรรค์เเลกเปลี่ยนประสบการณ์ • ทริปนี้เป็นการร่วมงานกันของ 3 เพจ SUP Thailand Trips , SUP2SIS , SUPGUN
SUP THAILAND TRIPS ทริปพาย SUP ล่องแม่น้ำป่าสัก 11-12, 25-26 มี.ค.66 LINK
SUP THAILAND TRIPS เปิดรูทใหม่ พายแม่น้ำป่าสักช่วงท้ายเขื่อน ให้นักพายได้ต่อจิ๊กซอว์อีกชิ้นเติมเต็มมิติแม่น้ำป่าสักให้สมบูรณ์แบบ ทริปพาย SUP ล่องแม่น้ำป่าสัก เชื่อมการพายล่องแม่น้ำป่า ทั้ง 2ช่วง2มนต์สเน่ห์เข้าหากัน รูทA : ไฮไลต์ค้างคาวแม่ไก่ฝูงใหญ่ - เสาร์ที่ 11 มีนาคม 2566 - เสาร์ 25 มีนาคม 2566 รูทB : ไฮไลต์ผาหมีเหนือเสือใต้ - อาทิตย์ที่ 12 มีนาคม 2566 - อาทิตย์ที่ 26 มีนาคม 2566 *ค่าใช้จ่าย สอบถามเพิ่มเติมติดต่อ : 061-7929299
ปฏิทินกิจกรรมท่องเที่ยวกาญจนบุรีเดือนมีนาคม
สอบถามข้อมูลเพิ่มเติม ททท.กาญจนบุรี โทร. 034-511200 034-512500
งาน “รำลึกวีรชนแขวงเมืองวิเศษไชยชาญ ประจำปี 2566” 24 - 26 มีนาคม 66
งาน “รำลึกวีรชนแขวงเมืองวิเศษไชยชาญ ประจำปี 2566” 24 - 26 มีนาคม 2566 ณ บริเวณอนุสาวรีย์นายดอก นายทองแก้ว ต.ไผ่จำศีล อ.วิเศษชัยชาญ จ.อ่างทอง เพื่อเป็นการรำลึกและยกย่องวีรกรรม ความกล้าหาญ และความเสียสละของวีรชนแขวงเมืองวิเศษไชยชาญ นายดอก นายทองแก้ว ตลอดจนวีรชนแขวงเมืองวิเศษไชยชาญในสมัยกรุงศรีอยุธยาตอนปลาย ที่ได้ร่วมกันปกป้องรักษาเอกราชของประเทศไทยไว้
กิจกรรมภายในงาน - ชมการแสดงศิลปวัฒนธรรม - การแสดงดนตรี - การแสดงจินตภาพประกอบแสง สี เสียง ชุด “วิเศษไชยชาญถิ่นวีรชน สถิตย์ฟ้าจารึกดิน” และกิจกรรมอื่นอีกมากมาย - การออกร้านจำหน่ายสินค้าดีสินค้าเด่น ของจังหวัดอ่างทอง
งาน ตลาดเกษตรกร 28 มีนาคม 2566
สำนักงานเกษตรจังหวัดสุพรรณบุรี ขอเชิญเที่ยวงาน "ตลาดเกษตรกร" วันที่ 28 มีนาคม 2566 เริ่มเวลา 07.00 - 12.00 น. ณ บริเวณหน้าสำนักงานเกษตรจังหวัดสุพรรณบุรี เชิญช้อปสินค้าเกษตรปลอดภัย ข้าว (หอมมะลิ, กข 43, ไรซ์เบอร์รี่) ผักสลัดและผักพื้นบ้าน ผลไม้ตามฤดูกาล ไข่สดจากฟาร์ม นมวัว นมแพะ อาหารและเครื่องดื่ม ผลิตภัณฑ์แปรรูป เครื่องจักสาน (กระเป๋า) สินค้าประมง Fisher man shop โปรโมชั่นเปิดตลาด ช้อปครบ 99 บาท รับคูปองจับฉลากลุ้นของรางวัล
ตลาดวัฒนธรรมจังหวัดสุพรรณบุรี 11 - 12 มีนาคม 2566
สำนักงานวัฒนธรรมจังหวัดสุพรรณบุรี ขอเชิญร่วมกิจกรรมส่งเสริมตลาดวัฒนธรรมจังหวัดสุพรรณบุรี ระหว่างวันที่ 11 - 12 มีนาคม 2566 ตั้งแต่เวลา 11.00 น. เป็นต้นไป ณ ตลาดร่มไม้ชายน้ำ วัดพระลอย ตำบลรั้วใหญ่ อำเภอเมืองสุพรรณบุรี จังหวัดสุพรรณบุรี
เปิดรับสมัครประกวดเทพีสงกรานต์ สุพรรณบุรี ประจำปี 2566
องค์การบริหารส่วนจังหวัดสุพรรณบุรี เปิดรับสมัครสาวงามอายุระหว่าง 17 - 25 ปี ประกวดเทพีสงกรานต์ สุพรรณบุรี ประจำปี 2566 - รับสมัครตั้งแต่บัดนี้ - 3 เมษายน 2566 - รายงานตัวจับหมายเลข 5 เมษายน 2566 สอบถามโทร : 035-525500
เสวนาทางวิชาการ เนื่องในวาระครบ 130 ปี ห้ามเจ้านายมิให้ไปเมืองสุพรรณบุรี 17 มีนาคม พ.ศ. 2566
กิจกรรมบรรยายและเสวนาทางวิชาการ เนื่องในวาระครบ 130 ปี ห้ามเจ้านายมิให้ไปเมืองสุพรรณบุรี เรื่อง เทศาภิบาล : ศาสตร์การปกครองของไทยสมัยรัชกาลที่ 5 โดย หอสมุดแห่งชาติจังหวัดสุพรรณบุรี เฉลิมพระเกียรติ ร่วมกับ ชมรมนักโบราณคดี (สมัครเล่น) เมืองสุพรรณ วันศุกร์ ที่ 17 มีนาคม พ.ศ. 2566 เวลา 08.30 – 15.30 น. ณ หอสมุดแห่งชาติจังหวัดสุพรรณบุรี เฉลิมพระเกียรติ
ตรุษไทยภูผาม่าน 2566 วันที่ 21-23 มีนาคม 2566
ตรุษไทยภูผาม่าน 2566 วันที่ 21-23 มีนาคม 2566 สนามหน้าที่ว่าการอำเภอภูผาม่าน อ.ภูผาม่าน จ.ขอนแก่น ร่วมชมพิธีขอขมาผู้สูงอายุ การประกวดเทพีตรุษไทย การแข่งขันกีฬาพื้นบ้าน การแสดงแสงสีเสียง ชมการสาธิตและจำหน่ายผลิตภัณฑ์ OTOP
ปฏิทินกิจกรรมท่องเที่ยว เดือนมีนาคม 2566 ร้อยแก่นสารสินธุ์
มหกรรมเปิดโลกอุทยานธรณีเพื่อการท่องเที่ยว ครั้งที่ 10 วันที่ 10-14 มีนาคม 2566
กรมทรัพยากรธรณี ชวนเที่ยวงานมหกรรมเปิดโลกอุทยานธรณีเพื่อการท่องเที่ยว ครั้งที่ 10 จังหวัดขอนแก่น ตอน Dinosaur in Love Festival 2023 @ Khon Kaen Geopark วันที่ 10-14 มีนาคม 2566 ณ ตลาดต้นตาล ภายในงานทุกท่านจะได้พบกับกิจกรรมมากมาย อาทิ
•ไดโนเสาร์จำลอง
• นิทรรศการ ‘Dino-Trail’ เส้นทางท่องเที่ยวอุทยายธรณีขอนแก่น
• นิทรรศการหุ่นฟางไดโนเสาร์
• นิทรรศการหุ่นฟางไดโนเสาร์จำลอง
• นิทรรศการแสดงผลงานศิลปะและผลิตภัณฑ์
• นิทรรศการให้ความรู้ด้านธรณีวิทยาและไดโนเสาร์/ส่องกล้องดูดาว
• ร้านค้าจำหน่ายสินค้าผลิตภัณฑ์ชุมชนกว่า 20 ร้านค้า
ON THE ROCK ร็อกบอกรัก 25 มีนาคม 2566
ON THE ROCK ร็อกบอกรัก 25 มีนาคม 2566 ลานเนินนุ่ม จ. เชียงใหม่ 6 ศิลปินร็อกขึ้นเหนือมาบอกฮัก พบกับ สงกรานต์ รังสรรค์, แบงค์ ปรีติ, Dax Rock Rider, MODERNDOG , SLOTMACHINE และ COCKTAIL
งาน “Songkhla Signature" เทศกาลอาหารคู่เมืองสงขลา 10-12 มีนาคม 2566
งาน “Songkhla Signature" เทศกาลอาหารคู่เมืองสงขลา เพื่อส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจในท้องถิ่น ประเดิมวันแรกด้วยความมันส์กับการแข่งขันชกมวยไทยโบราณ "สยามคาดเชือก ตำนานไชยา” พร้อมกิจกรรมหลาหลาย ของกินขึ้นชื่อมากมาย 10-12 มีนาคม 2566 ณ หาดสมิหลา อำเภอเมือง จังหวัดสงขลา
วันสงขลา (โครงการสืบสานอัตลักษณ์ เมืองสงขลา) วันที่ 9 - 11 มีนาคม 2566


องค์การบริหารส่วนจังหวัดสงขลา ร่วมกับ จังหวัดสงขลา สำนักงานวัฒนธรรมจังหวัดสงขลา จัดโครงการวันสงขลา (โครงการสืบสานอัตลักษณ์ เมืองสงขลา) วันที่ 9 - 11 มีนาคม 2566 ณ พิพิธภัณฑ์ฑสถานแห่งชาติ สงขลา พบกับกิจกรรม วันที่ 9 มีนาคม 256 - เสวนาทางทางวิชาการ “สงขลาตำนานอาหารร้อยปี สู่เมืองสร้างสรรค์ด้านอาหาร” ณ พิพิธภัณฑสถานแห่งชาติสงขลาพิธีทางศาสนา ณ ศาลาวิหารแดงบนเขาตังกวน -พิธีเวียนเทียน ณ พระธาตุเจดีย์หลวงบนเขาตังกวน (การแต่งกายชุดสุภาพสีขาว) วันที่ 10 มีนาคม 2566 - พิธีทำบุญตักบาตรบรรพชนคนสงขลา 15 อำเภอและอำเภอเมืองสงขลา บริเวณถนนนางงาม - พิธีสมโภชเสาหลักเมือง/พิธีเจริญพระพุทธมนต์เพื่อความเป็นสิริมงคลเมืองสงขลา (การแต่งกายชุดสุภาพสีขาว) - พิธีเปิดงานโครงการวันสงขลา (สืบสานอัตลักษณ์เมืองสงขลา) ประจำปี 2566 ณ พิพิธภัณฑสถานแห่งชาติสงขลา - มอบโล่รางวัลเชิดชูเกียรติ “คนดีศรีสงขลา” ประจำปี 2565 และมอบเกียรติบัตรคนสงขลาคนต้นแบบ - เสวนาทางวิชาการ หัวข้อ “สงขลาเมืองสร้างสรรค์ของยูเนสโก (UNESCO)” ณ พิพิธภัณฑสถานแห่งชาติสงขลา วันที่ ๑๑ มีนาคม ๒๕๖๖ - เสวนาทางวิชาการ “สงขลาสู่เมืองมรดกโลก” ณ พิพิธภัณฑสถานแห่งชาติสงขลา - มอบเกียรติบัตรคนสงขลาคนต้นแบบ
มหัศจรรย์แห่งวิถีลุ่มน้ำทะเลสาบสงขลา สู่การเป็นพื้นที่พิเศษเพื่อการท่องเที่ยวอย่างยั่งยืน วันที่ 17 - 19 มีนาคม 2566
กิจกรรมเวิร์คช็อป แม่พิมพ์แกะไม้ลวดลายเมืองเก่าสงขลา ภายในงาน "มหัศจรรย์แห่งวิถีลุ่มน้ำทะเลสาบสงขลา สู่การเป็นพื้นที่พิเศษเพื่อการท่องเที่ยวอย่างยั่งยืน" ในระหว่างวันที่ 17 - 19 มีนาคม 2566 ณ ถนนนครนอก ย่านเมืองเก่าสงขลา จังหวัดสงขลา
ท่องเที่ยวสายมู หาดใหญ่มูเตลู 17-18 มีนาคม 2566
ท่องเที่ยวสายมู หาดใหญ่มูเตลู 17-18 มีนาคม 2566 ณ ใจกลางเมืองหาดใหญ่ ถ.ธรรมนูญวิถี 16-22 น.
พุ่งใต้เฟส 18 มีนาคม 2566
พุ่งใต้เฟส เทศกาลดนตรี The Pirated Park หาดใหญ่ 18 มีนาคม 2566
คอนเสิร์ตนั่งเล่น On the Road หอศิลป์ สงขลา 19 มีนาคม 2023
คอนเสิร์ตนั่งเล่น On the Road หอศิลป์ สงขลา 19 มีนาคม 2023 ลงทะเบียนเข้างาน 16.00 น. เป็นต้นไป เริ่มงาน 17.00 น. ณ หอศิลป์ สงขลา ถ.นครนอก
OTOP ทั่วไทยร่วมใจสู่ชายแดนใต้ 26 มีนาคม 2566
OTOP ทั่วไทยร่วมใจสู่ชายแดนใต้ 26 มีนาคม 2566 หอประชุมนานาชาติ มอ.หาดใหญ่
ปฏิทินกิจกรรมประจำเดือนมีนาคม 2566 @เซ็นทรัล หาดใหญ่
ปฏิทินกิจกรรมประจำเดือนมีนาคม - เมษายน 2566 ที่ไดอาน่า หาดใหญ่
ปฏิทินกิจกรรมประจำเดือนมีนาคม - เมษายน 2566 ที่ไดอาน่า หาดใหญ่
MOTOR_SHOW_HATYAI_2023 ครั้งที่ 12 วันที่ 29 มี.ค. - 2 เม.ย. 66
งานมอเตอร์โชว์ หาดใหญ่ 2023 วันที่ 29 มีนาคม – 2 เมษายน 2566 ณ หาดใหญ่ฮอลล์ชั้น 5 และลานโปรโมชั่นชั้น 1 ศูนย์การค้า เซ็นทรัลหาดใหญ่
งานเทศกาล(นั่งชิม2)ผลไม้ และของฝากจากบ้านแพ้ว 24-26 มีนาคม 2566
งานเทศกาล(นั่งชิม2)ผลไม้ และของฝากจากบ้านแพ้ว สดจากสวน..ดีต่อใจ..ใกล้เมืองกรุง ระหว่างวันที่ 24-26 มีนาคม 2566 ณ อาคารสหกรณ์การเกษตรบ้านแพ้ว ต.บ้านแพ้ว อ.บ้านแพ้ว จ.สมุทรสาคร
Fin Food Festival เทศกาลอาหารสุดฟิน มหาชัย 29 มี.ค. - 2 เม.ย.66
Fin Food Festival เทศกาลอาหารสุดฟิน 29 มี.ค. - 2 เม.ย.66 ตั้งแต่ 16:00 น. ณ เซ็นทรัล มหาชัย พบกับ 60 ร้านอร่อยชื่อดังทั่วประเทศ
เทศกาลอาหารทะเล สมุทรสาคร ครั้งที่ 20 วันที่ 1-5 มีนาคม 2566
เทศกาลอาหารทะเล สมุทรสาคร ครั้งที่ 20 วันที่ 1-5 มีนาคม 2566 ณ ศูนย์การค้าแลนด์มาร์ค มหาชัย เริ่มเวลา 16.00 น. จัดโดยชมรมร้านอาหารจังหวัดสมุทรสาคร
อบรม SLEEP WITH NATURE ... EMPOWER YOUR LIFE 27 - 28 มีนาคม 2566
กรมการท่องเที่ยว ขอเชิญผู้ประกอบการโรงแรม ที่พัก ชุมชน และผู้สนใจ เข้าร่วมอบรม การส่งเสริมและพัฒนาที่พัก Eco Lodge ที่พักรักษ์ธรรมขาติ รักษ์นิเวศ (ไม่มีค่าใช้จ่าย มีประกาศนียบัตรให้ และโอกาสต่อยอดจับคู่ธุรกิจ (สำหรับท่านที่ได้รับการคัดเลือก) รวมถึงรับคำแนะนำจากผู้เชี่ยวชาญ ด้าน Eco Lodge ชั้นนำของประเทศไทย
“SLEEP WITH NATURE ... EMPOWER YOUR LIFE เติมพลังให้ชีวิต พักใกล้ชิดธรรมชาติ” การอบรมมาตรฐานกิจกรรม "Eco Lodge เพื่อการท่องเที่ยว (Eco Lodging Standard)”
การอบรมออนไลน์ ผ่าน Zoom วันที่ 27 - 28 มีนาคม 2566 เวลา 09.00 – 16.00 น. จับคู่ธุรกิจออนไลน์ (เฉพาะผู้ผ่านการอบรมที่ได้ลงทะเบียนและผ่านการคัดเลือก) 24 เม.ย. 2566
Summer Food Fest ระหว่างวันที่ 17-19 มีนาคม 2566
Summer Food Fest ระหว่างวันที่ 17-19 มีนาคม 2566 นี้ ตั้งแต่เวลา 16.00 น. เป็นต้นไป ณ ลานกิจกรมด้านหน้า @เซ็นทรัล มหาชัย
งาน “สืบสาน…สีสัน…สายเส้น เบญจรงค์ดอนไก่ดี ” ครั้งที่ 13 วันที่ 10-12 มีนาคม 2566
งาน “สืบสาน…สีสัน…สายเส้น เบญจรงค์ดอนไก่ดี ” ครั้งที่ 13 วันที่ 10-12 มีนาคม 2566 ตั้งแต่เวลา 10.00-20.00 น. ณ หมู่บ้านเบญจรงค์ดอนไก่ดี อ.กระทุ่มแบน จ.สมุทรสาคร เพื่อเป็นการส่งเสริมหมู่บ้านทำมาค้าขาย และประชาสัมพันธ์ส่งเสริมการตลาดและวัฒนธรรมภายในชุมชน โดยในงานมีกิจกรรมมากมาย อาทิ การสอนวาดลวดลายลงบนเครื่องเบญจรงค์, กิจกรรม Work Shop, การแสดงและจำหน่ายสินค้าเกษตร, เกษตรแปรรูป, สินค้า OTOP และสินค้าธงฟ้าราคาประหยัด กว่า 30 ร้านค้า, การแสดงทางวัฒนธรรม และดนตรีโฟล์คซอง สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานพาณิชย์จังหวัดสมุทรสาคร โทร 034-426092 , หมู่บ้านเบญจรงค์ดอนไก่ดี โทร. 0 3447 3480 หรือ ททท.สำนักงานสมุทรสงคราม โทร.034-752847-8 Inbox Facebook : ททท.สำนักงานสมุทรสงคราม : TAT Samut Songkhram Office
เดินวิ่ง ศูนย์ผู้สูงอายุศิริราช - สมุทรสาคร 12 มีนาคม 2566
เดินวิ่ง ศูนย์ผู้สูงอายุศิริราช - สมุทรสาคร 12 มีนาคม 2566 สนามกีฬากลางจังหวัดสมุทรสาคร ติดต่อสอบถาม Facebook Page : งานเดินวิ่ง ศูนย์ผู้สูงอายุศิริราช สมุทรสาคร
Dinosaurs Fest 2023 วันที่ 18 มี.ค. - 9 เม.ย. 2566
Dinosaurs Fest 2023 วันที่ 18 มี.ค. - 9 เม.ย. 2566 • จันทร์ - ศุกร์ เวลา 15.00 - 21.00 น. • เสาร์ - อาทิตย์ เวลา 10.00 - 21.00 น. เซ็นทรัล ภูเก็ต ฟลอเรสต้า * มีค่าเข้าชม
KILORUN 2023 ASEAN LIFESTYLE JOURNEY พบกัน 25 มีนาคม 2566
มิติใหม่แห่งการวิ่ง-กิน KILORUN 2023 ASEAN LIFESTYLE JOURNEY พบกัน 25 มีนาคมที่ภูเก็ต สมาคมธุรกิจการท่องเที่ยวจังหวัดภูเก็ต ร่วมกับ Index Creative Village จัด KILORUN 2023 ASEAN LIFESTYLE JOURNEY กลับมาจัดอีกครั้งหลังโควิด พบกันลานมังกร ภูเก็ต วันเสาร์ที่ 25 มีนาคม 2566 5.30-11.00 บกิจกรรม KG RUN เดินไปกินไป พบ 10 เมนูอร่อย และร้านอาหารเด็ดระดับมิชลิน ให้สมกับเป็นเมือง Phuket Gastronomy พร้อมถ่ายภาพสวยกับสภาปัตยกรรมโดดเด่นของเมืองเก่าภูเก็ตตลอดเส้นทาง ปะทะน้องจุ้ง และน้องเบาหวิว อิ่มสุด อร่อยสุด ฟินสุด พิชิตเหรียญและรางวัลใหญ่
งาน ภูเก็ตเด็ดทั้งเกาะ @หาดใหญ่ 31 มีนาคม-2 เมษายน 2566
งาน "ภูเก็ตเด็ดทั้งเกาะ" @หาดใหญ่ วันที่ 31 มีนาคม-2 เมษายน 2566 ณ ลานโปรโมชั่นชั้น 1 เซนทรัลเฟสติวัล หาดใหญ่ (หน้าสตาร์บัค)
น้องหมีพี่เสือ Tono & The Gang : Run For Charity 2023 เดิน – วิ่งการกุศล
สมาคมส่งเสริมการท่องเที่ยวนครนายก ร่วมกับ การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครนายก ชมรมฅนรักษ์สัตว์ป่า จัดกิจกรรม “น้องหมีพี่เสือ Tono & The Gang : Run For Charity 2023” เดิน – วิ่งการกุศล “5 KM” วันที่ 26 มีนาคม 2566 ณ เส้นทางอ่างเก็บน้ำห้วยปรือ – ศูนย์ช่วยเหลือสัตว์ที่ 1 นครนายก – อ่างเก็บน้ำห้วยปรือ ตำบลเขาพระ อำเภอเมืองนครนายก จังหวัดนครนายก เพื่อสนับสนุนการดำเนินงานของศูนย์ช่วยเหลือสัตว์ป่าที่ 1 นครนายก และสร้างสรรค์กิจกรรมดีๆ เส้นทางใหม่ของจังหวัดนครนายก
งาน Fruits & Food Fest 2023 มะยงชิด มะปรางหวานและของดีนครนายก
งาน Fruits & Food Fest 2023 มะยงชิด มะปรางหวานและของดีนครนายกกำหนดการคร่าว ๆ (ที่คาดว่าศิลปินตอบรับมา บางกิจกรรมอาจมีการเปลี่ยนแปลง) 9 - 13 มีนาคม 2566 นี้ 10.00 -20.00 น.
งานมหกรรมสินค้าดี สี่แคว สี่จังหวัด 24-28 มีนาคม 2566
เชิญชวนนักท่องเที่ยว ชิม ชม ช๊อป ของดี งานมหกรรมสินค้าดี สี่แคว สี่จังหวัด นครสวรรค์ กำแพงเพชร พิจิตร อุทัยธานี ระหว่างวันที่ 24-28 มีนาคม 2566 เวลา 11.00-21.00 น. ณ คลองญวนชวนรักษ์ (เกาะญวน) จ.นครสวรรค์
งานประเพณีแห่เจ้าพ่อเจ้าแม่ ฤาษีนารายณ์หนองบัว ประจำปี 2566 วันที่ 23 - 27 มีนาคม 2566
งานประเพณีแห่เจ้าพ่อเจ้าแม่ ฤาษีนารายณ์หนองบัว ประจำปี 2566 ชมขบวนแห่เจ้าพ่อเจ้าแม่ ฤาษีนารายณ์หนองบัว งิ้วโรงใหญ่ มังกรทอง สิงโตทอง เอ็งกอ ล่อโก้ว มวย ลิเก มหกรรมคอนเสิร์ต ศิลปินดังมากมาย พบกับสินค้าOTOP อาหารดี 4 ภาค ให้เลือกซื้อเลือกกินกลับไป
กำหนดการ
23 มี.ค.66 - คอนเสิร์ต ศรสุพรรณโชว์/หลี่ซัง ไหทองคำ
24 มี.ค.66 - คาราบาว
25 มี.ค.66 - ปีเตอร์ โฟดิฟาย ดาด้า 4G
26 มี.ค.66 - บังนัสฟิวเจอร์แบนด์/บัว กมลทิพย์
27 มี.ค.66 - ลิเกคณะศรราม น้ำเพชร วงเก๋าซึม
5 วัน 5 คืน 23 - 27 มีนาคม 2566
แห่รอบนอก 23 มีนาคม 2566
แห่กลางวัน 25 มีนาคม 2566
นมัสการรอยพระพุทธบาทเมืองพระบาง วัดวรนาถบรรพต (ยอดเขากบ) อำเภอเมืองฯ นครสวรรค์ วันที่ 4-6 มีนาคม 2566
เชิญชวนเที่ยวงาน "นมัสการรอยพระพุทธบาทเมืองพระบาง" ในวันที่ 4-6 มีนาคม 2566 ณ วัดวรนาถบรรพต (ยอดเขากบ) อำเภอเมืองฯ จังหวัดนครสวรรค์ พบกับกิจกรรม
- สักการะรอยพระพุทธบาท
- ตลาดวัฒนธรรม
- การแสดงทางวัฒนธรรม
- การสาธิตภูมิปัญญาทางวัฒนธรรม
- ไม่มีเก็บค่าใช้จ่าย
- เชิญชวนการแต่งกายชุดไทยตามความชอบ
*บางรายการอาจมีการปรับเปลี่ยน ตามความเหมาะสม
ข้อมูล : สำนักงานวัฒนธรรมจังหวัดนครสวรรค์
เบอร์โทรติดต่อ ๐๕๖-๒๕๗๒๐๑
การแข่งขันกีฬาเยาวชนแห่งชาติ ครั้งที่ 38 “นครสวรรค์เกมส์” 25 มี.ค. - 3 เม.ย. 66
การแข่งขันกีฬาเยาวชนแห่งชาติ ครั้งที่ 38 “นครสวรรค์เกมส์” ระหว่างวันที่ 25 มี.ค. - 3 เม.ย. 66
ปฏิทินกิจกรรม พิษณุโลก เดือนมีนาคม 2566
งานมะม่วงครั้งที่ 3 ของจังหวัดพิษณุโลก 17-21 มีนาคม 2566 LINK
งานมะม่วงครั้งที่ 3 ของจังหวัดพิษณุโลก (Phitsanulok Mango Festival 2023) จัดระหว่างวันที่ 17-21 มีนาคม 2566 ณ ศูนย์การค้าเซ็นทรัล พิษณุโลก ได้รวบรวมมะม่วงน้ำดอกไม้สีทองพรีเมียม เกรดส่งออกของดีจังหวัดพิษณุโลก และเพิ่มช่องทางการจัดจำหน่ายให้แก่เกษตรกร จังหวัดพิษณุโลก
งานประเพณีนบพระ เล่นเพลงและงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2566 วันที่ 3 -12 มีนาคม 2566
จังหวัดกำแพงเพชร ขอเชิญเที่ยวงานประเพณีนบพระ เล่นเพลงและงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2566 ณ สนามหน้าเมืองหน้าที่ว่าการอำเภอเมือง จ.กำแพงเพชร และ บริเวณวัดพระบรมธาตุพระอารามหลวง จ.กำแพงเพชร วันที่ 3 -12 มีนาคม 2566
666 ปี พระยาลิไทได้อัญเชิญพระบรมสารีลิกธาตุมาประดิษฐาน ณ วัดพระบรมธาตุ เมืองนครชุม งานประเพณีนบพระ เล่นเพลง ถือเป็นประเพณีโบราณ ทางจังหวัดกำแพงเพชร รื้อฟื้นประเพณีนี้มาจัดขึ้นตั้งแต่ปี 2526
การละเล่นสนุกสนานพื้นบ้าน โดยมีการร้องเพลงพื้นบ้าน มีชายหญิงร่วมร้องและร่ายรำเป็นที่สนุกภายหลังจากได้ทำบุญทำกุศลแล้ว
กิจกรรมภายในงาน .
- พิธีบวงสรวงอดีตกษัตริยาธิราช
- ชมขบวนแห่พยุหยาตราจำลอง พระยาลิไทย และเจ้าเมือง เสด็จนบพระบรมธาตุเจดีย์ และสักการะต้นพระศรีมหาโพธิ์
- พิธีทำบุญตักบาตร เนื่องในวันมาฆบูชา
- ชมนิทรรศการ “งานเสน่ห์วิถีถิ่นดินแดนมรดกโลกทางวัฒนธรรมกำแพงเพชร”
- กิจกรรมมัจฉากาชาด
- เลือกซื้อสินค้าอุปโภค บริโภค สินค้าของดีเมืองกำแพงเพชร สินค้า OTOP อาหารพื้นบ้าน สินค้าภาครัฐ ภาคเอกชน
จังหวัดกำแพงเพชร ร่วมกับ แพลตฟอร์มเพลินไทย ร่วมยกระดับช่องทางเผยแพร่ข้อมูล
การจัดกิจกรรม “ งานประเพณีนบพระ เล่นเพลง และงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2566 ”
ผ่านระบบดิจิทัล Smart Map Smart Event อำนวยความสะดวกต่อนักท่องเที่ยวผู้มาเยือนในพื้นการจัดงานและสถานที่ท่องเที่ยวที่น่าสนใจภายในงาน แสดงตำแหน่งปัจจุบันของผู้ใช้งานแบบ Real Time สะดวก เข้าถึงง่าย และไม่มีค่าใช้จ่ายในการใช้บริการ
✅Beyond KamphaengPhet
✅SMART EVENT
✅SMART MAP
กำแพงเพชร เมืองนี้มีมากกว่าที่รู้จัก
ขอแนะนำ .. เครื่องมือที่เปรียบเสมือนผู้ช่วยในการเดินทาง เที่ยวสนุก สะดวก ปลอดภัย
⬇️ Scan QR.Code หรือ กดลิงค์เข้าสู่ข้อมูลการจัดงาน
ปฏิทินกิจกรรมเดือนมีนาคม จ.กำแพงเพชร
เดือนมีนาคมของกำแพงเพชร
- งานบุญผะเหวด 1 - 5 มีนาคม 2566
- งานประเพณีนบพระเล่นเพลง 3 - 12 มีนาคม 2566
- ถนนสายวัฒนธรรม อำเภอคลองลาน ทุก ศ ส อา สุดท้ายของเดือน
งานบาติกงามพร้อม มัดย้อมงามตา งานผ้ากองงาม อ.ป่าซาง จ.ลำพูน 31 มี.ค. – 2 เม.ย. 66
งานบาติกงามพร้อม มัดย้อมงามตา งานผ้ากองงาม
31 มี.ค. – 2 เม.ย. 66 ณ หมู่บ้านกองงาม
????ภายในงานพบกับการเปิดร้านจำหน่ายผ้าบาติกและผ้ามัดย้อม เปิดตลาด DIY สามารถลองทำสินค้าด้วยตนเองแถมยังได้กลับบ้าน ชมการสาธิตขั้นตอนกระบวนการผลิตจากผ้าบาติกและผ้ามัดย้อม, การประกวดธิดาบาติกมัดย้อม, การประกวดธิดาบาติกมัดย้อม จำแลง, ชมการแสดงแฟชั่นโชว์หนูน้อยบาติกและการแสดงของศิลปินล้านนา อิ่ม อร่อยกับโซนอาหาร กว่า 80 บูธ
*ค้นหาในแผนที่ ว่า : วัดป่าเหียง / โรงเรียนบ้านกองงาม
เชิญชวนมาแอ่ว ถนนคนเดิน กาดดีพร้อม (Kad DIProm) อ.เกาะคา วันที่ 29 มีนาคม 2566
ททท.สำนักงานลำปาง ของประชาสัมพันธ์เชิญชวนทุกท่านมาแอ่ว ถนนคนเดิน "กาดดีพร้อม" (Kad DIProm) กรมส่งเสริมอุตสาหกรรม โดย ศูนย์วิจัยและพัฒนาวัสดุอุตสาหกรรมสร้างสรรค์ อ.เกาะคา จ.ลำปาง ถนนคนเดิน "กาดดีพร้อม ครั้งที่ 1" เริ่มครั้งแรก ในวันที่ 29 มีนาคม 2566 เวลา 16.00-21.00 น. ณ ศูนย์ประชุมและแสดงสินค้าอุตสาหกรรมภาคเหนือ ถนนพหลโยธิน (ตรงข้ามโรงพยาบาลเกาะคา )
ภายในงานพบกับสินค้าอุตสาหกรรมและสินค้าหัตถกรรม อาหาร สมุนไพร โอทอป ที่ได้รับการส่งเสริมจากหน่วยงานภาครัฐ มาร่วมออกร้าน และยังมีการแสดง ดนตรี ในระหว่างจัดงาน โดย "กาดดีพร้อม" มีกำหนด ในวันพุธที่ 1 และพุธที่ 3 ของทุกเดือน
ย้อนวันวาน ลำปาง เรอเนซองส์ 24-26 มีนาคม 2566
ย้อนวันวาน ลำปาง เรอเนซองส์ เทศบาลนครลำปาง กำหนดจัดงานรำลึกประวัติศาสตร์ "ขัวหลวง รัษฎา 106 ปี" ระหว่างวันที่ 24-26 มีนาคม 2566 เวลา 17.30 น. เป็นต้นไป ณ สะพานรัษฎาภิเศก อ.เมืองลำปาง จ.ลำปาง เพื่อประชาสัมพันธ์แหล่งท่องเที่ยวทางประวัติศาสตร์ให้เป็นที่รู้จัก และอนุรักษ์สืบสานวัฒนธรรม ประวัติศาสตร์จังหวัดลำปาง ททท.สำนักงานลำปาง ขอเชิญร่วมย้อนวันวาน เล่าขานสะพานรัษฎาฯ ตั้งแต่วันนี้จนถึงวันที่ 31 มีนาคม 2566
ปฏิทินท่องเที่ยวจังหวัดลำปาง มีนาคม ถึง พฤษภาคม 2566
ปฏิทินท่องเที่ยวจังหวัดลำปาง เดือน มีนาคม ถึง พฤษภาคม 2566
ปฏิทินท่องเที่ยวจังหวัดลำพูน มีนาคม ถึง พฤษภาคม 2566
ปฏิทินท่องเที่ยวจังหวัดลำพูน มีนาคม ถึง พฤษภาคม 2566
Home for Child 66 เดิน-วิ่งการกุศล คนหละปูนแป๋งบ้านหื้อน้อง 26 มีนาคม 2566 LINK
งานวิ่งสมทบทุนสร้างบ้านให้นักเรียนที่ยากจน “Home for Child 66 เดิน-วิ่งการกุศล คนหละปูนแป๋งบ้านหื้อน้อง”
วันที่ 26 มีนาคม 2566 สำนักงานเขตพื้นที่การศึกษาประถมศึกษาลำพูน เขต 1 จัดแข่งขันกิจกรรมการเดิน-วิ่งการกุศล เพื่อหารายได้สมทบทุนสร้างบ้านให้นักเรียนที่ยากจน “Home for Child 66 เดิน-วิ่งการกุศล คนหละปูนแป๋งบ้านหื้อน้อง” ณ สำนักงานเขตพื้นที่การศึกษาประถมศึกษาลำพูน เขต 1 ต.ต้นธง อ.เมืองลำพูน จ.ลำพูน โดยการแข่งขันเป็นระยะ Fun Run 5 Km และ ระยะ Mini Marathon 10 Km
ทั้งนี้รายได้ทั้งหมดจะถูกนำไปสนับสนุนสร้างบ้านตามโครงการ “ธารน้ำใจ สร้างบ้านใหม่ ให้นักเรียน” เพื่อช่วยเหลือนักเรียนที่อยู่ในสภาวะลำบาก และเสริมสร้างความปลอดภัยให้นักเรียนมีคุณภาพชีวิตที่ดี อยู่ในสังคมอย่างมีความสุข ได้รับการศึกษาเต็มตามศักยภาพ
การแข่งขัน LAMPHUN DUATHLON ลำพูนทวิกีฬา 2023 วันที่ 26 มีนาคม 2566
จ.ลำพูน จัดการแข่งขัน LAMPHUN DUATHLON ลำพูนทวิกีฬา 2023 วิ่งปั่นวิ่ง ส่งเสริมการท่องเที่ยว ผลักดันเศรษฐกิจในพื้นที่ 26 มีนาคม 2566 ณ บริเวณสะพานขาวทาชมภู อ.แม่ทา จ.ลำพูน ระยะการแข่งขันแบบวิ่งสลับปั่น วิ่ง 5 กิโลเมตร/ปั่น 22 กิโลเมตร/วิ่ง 5 กิโลเมตร จัดโดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดลำพูน ภายใต้โครงการส่งเสริมการท่องเที่ยวเชิงกีฬาจังหวัดลำพูน 1 จังหวัด 1 Sport Event วันที่ 25 มีนาคม 2566 มีกิจกรรมพิเศษ Lamphun Camping (ลำพูนแคมป์ปิ้ง) ดนตรีโฟล์คซอง การแสดงเรียกนกแสนรู้ และการจำหน่ายผลิตภัณฑ์สินค้าชุมชน
Light Show & Sound " งานรำลึกประวัติศาสตร์สะพานรัษฎาภิเศก “ขัวหลวงรัษฎา 106 ปี” 24 มีนาคม 2566
การแสดง Light Show & Sound " งานรำลึกประวัติศาสตร์สะพานรัษฎาภิเศก “ขัวหลวงรัษฎา 106 ปี” วันที่ 24 มีนาคม 2566 ณ บริเวณถนนเลียบริมแม่น้ำวังฝั่งกาดกองต้า (กองฮิมวัง) และฝั่งหลังจวนผู้ว่าฯ สะพานรัษฎาภิเศก อ.เมือง จ.ลำปาง
กิจกรรมการประกวดวาดภาพ “เสน่ห์ขัวหลวง” การแสดงดนตรีร่วมสมัย พิธีทำบุญตักบาตรบนสะพานรัษฎาภิเศก กิจกรรมเสวนา “เล่าเรื่องขัวหลวงรัษฎา” การแสดงดนตรีเพลงแจ๊สยุคเก่า
วันศุกร์ที่ 24 มีนาคม 2566
08.30 น. ผู้เข้าร่วมประกวดวาดภาพลงทะเบียนเข้าร่วมงาน
– “กิจกรรมการประกวดวาดภาพจากเรื่องเล่าสะพานรัษฎาภิเศก
ณ ห้องมัลติมีเดีย ชั้น 1 พิพิธภัณฑ์การเรียนรู้เมืองลำปาง (มิวเซียมลำปาง)”
09.00 น. วิทยากรบรรยายให้ความรู้เล่าเรื่องประวัติความเป็นมาของสะพานรัษฎาภิเศก
10.00 น. ผู้เข้าร่วมประกวดวาดภาพลงมือสร้างสรรค์ผลงาน
16.00 น. ปิดรับผลงานการวาดภาพของผู้เข้าร่วมประกวด
16.15 น. คณะกรรมการตัดสินการประกวดวาดภาพจากเรื่องเล่าสะพานรัษฎาภิเศก
17.30 น. กิจกรรมงาน “ขัวหลวงรัษฎา 106 ปี”
19.30 น. การแสดง Light Show & Sound “ขัวหลวงรัษฎา 106 ปี และสีสันแม่น้ำวัง”
วันเสาร์ที่ 25 มีนาคม 2566
17.30 น. กิจกรรมงาน “ขัวหลวงรัษฎา 106 ปี”
18.00 น. ชมการแสดงดนตรีร่วมสมัย
18.30 น. พิธีเปิดงาน การแสดงศิลปวัฒนธรรม และกิจกรรมมอบรางวัลให้กับผู้ประกวดวาดภาพฯ
19.30 น. การแสดง Light Show & Sound “ขัวหลวงรัษฎา 106 ปีและสีสันแม่น้ำวัง” รอบที่ 1
20.30 น. การแสดง Light Show & Sound “ขัวหลวงรัษฎา 106 ปี และสีสันแม่น้ำวัง”
วันอาทิตย์ที่ 26 มีนาคม 2566
07.00 น. พิธีทำบุญตักบาตรข้าวสารอาหารแห้งบนสะพานรัษฎาภิเศกแบบล้านนา
17.30 น. กิจกรรมงาน “ขัวหลวงรัษฎา 106 ปี”
18.00 น. ชมการแสดงดนตรีร่วมสมัย
19.30 น. การแสดง Light Show & Sound “ขัวหลวงรัษฎา 106 ปีและสีสันแม่น้ำวัง” รอบที่ 1
20.30 น. การแสดง Light Show & Sound “ขัวหลวงรัษฎา 106 ปี และสีสันแม่น้ำวัง” รอบที่ 2
งานวันช้างไทย 11-13 มีนาคม 2566
ททท.สำนักงานลำปางขอเชิญชวนนักท่องเที่ยวร่วมงานวันช้างไทย - ️ระหว่างวันที่ 11-13 มีนาคม 2566 เพื่อให้คนไทยได้ตระหนักถึงความสำคัญของช้างไทย และร่วมอนุรักษ์ช้างไทยซึ่งเป็นสัตว์สัญลักษณ์ของชาติมิให้สูญพันธุ์และเป็นสมบัติของชาติสืบไป ณ สถาบันคชบาลแห่งชาติ ในพระอุปถัมภ์ฯ (ศูนย์อนุรักษ์ช้างไทย) องค์การอุตสาหกรรมป่าไม้ จ.ลำปาง เริ่มตั้งแต่เวลา 08.00น. เป็นต้นไป
กิจกรรมไฮไลท์ภายในงานประกอบด้วย
วันที่ 12 มีนาคม 2566
- ประกอบพิธีฮ้องขวัญช้าง
- พิธีบำเพ็ญกุศลอุทิศให้กับช้าง
- การประกวดจัดซุ้มอาหารช้างของหน่วยงานต่างๆ
(งดการกิจกรรมการแสดงช้างและกิจกรรมนั่งหลังช้าง)
วันที่ 13 มีนาคม 2566
- ประกอบพิธีทำบุญตักบาตรข้าวสารอาหารแห้ง พระสงฆ์จำนวน 16 รูป
- ชมการจัดแสดงการประกวดซุ้มอาหารช้างและนิทรรศการของแต่ละหน่วยงาน
- เยี่ยมชมกิจกรรมต่างๆ และร่วมทำบุญเลี้ยงอาหารช้าง
สอบถามเพิ่มเติม ศูนย์อนุรักษ์ช้างไทย จ.ลำปาง The Thai Elephant Conservation Center Lampang หรือโทร 054 829 333
รถม้าปาแอ่วเวียง 18 - 31 มีนาคม 2566 LINK
ททท.สำนักงานลำปาง จัดกิจกรรม "รถม้าปาแอ่วเวียง" ขอเชิญนักท่องเที่ยวทุกท่าน ร่วมย้อนวันวาน-ชมบ้านเก่า-เล่าเรื่องอดีตเมืองลำปาง เริ่มตั้งแต่วันที่ 18 - 31 มีนาคม 2566
งานนมัสกาลปิดทองหลวงพ่อพุทธสิทธิ วัดสว่างอารมณ์ (บ้านคลองแขก) 31 มีนาคม - 2 เมษายน 66
งานนมัสกาลปิดทองหลวงพ่อพุทธสิทธิ วัดสว่างอารมณ์ (บ้านคลองแขก) ทอดผ้าป่าสามัคคี ร้านค้า ชมภาพยนตร์ ล้วงไหการกุศล ศิลปินดังก็มา ห้ามพลาด‼️ 31 มี.ค. อ๊อดโฟร์เอส 1 เม.ย. จันทร์จวง ดวงจันทร์, เต้ย อภิวัฒน์ 2 เม.ย. พิมพ์พา พรศิริ, ตั๊กเเตน ชลดา ณ วัดสว่างอารมณ์ (บ้านคลองแขก) อำเภอบางเลน จังหวัดนครปฐม วันที่ 31 มีนาคม ถึง 2 เมษายน 2566
Sunset Beach Music Festival 2023 เทศกาลดนตรีเร็กเก้ เสาร์ที่ 4 มีนาคม 2566
Sunset Beach Music Festival 2023 เทศกาลดนตรี Reggae & Ska Beachlife Festival ที่ใหญ่ที่สุดในประเทศไทย เสาร์ที่ 4 มีนาคม 2566 ณ หาดบางเก่า / บ้าน ไม้บนหาด อ.ชะอำ จ.เพชรบุรี
งานปลาทู Festival 31 มี.ค. - 2 เม.ย. 66
งานปลาทู Festival 31 มี.ค. - 2 เม.ย. 66 ณ ริมเขื่อนหน้าศาลเจ้าพ่อหลักเมืองสมุทรสาคร
งานสีสันเมืองเลย “Mask Festival 2023” 17-19 มีนาคม 2566
งานสีสันเมืองเลย “Mask Festival 2023” ณ ลานพญานาคปู่ไหลคำมา ต.กุดป่อง อ.เมืองเลย จ.เลย ระหว่างวันที่ 17-19 มีนาคม 2566 ชมการแสดงน้ำพุเต้นระบำ ประกอบแสง สี เสียง ม่านน้ำ พร้อมกิจกรรมมากมายภายในงาน รวมถึงบูทจำหน่ายสินค้า และผลิตภัณฑ์ทางวัฒนธรรม ขบวนพาเหรด หน้ากากนานาชาติ มีเฉพาะ วันศุกร์ที่ 17 มีนาคม วันเดียวเท่านั้น
ปฏิทินเท่องเที่ยวช่วง เดือน มีนาคม - เมษายน 2566
เดือน มีนาคม 2566
ชมต้นดอกจานบาน (ทองกวาว) ณ บ้านห้วยไผ่ใต้ อ.วังสะพุง จ.เลย
วันที่ 14 มีนาคม 2566
งาน เดิน-วิ่ง เพื่อสุขภาพ เดือนหงายริมโขง ครั้งที่ 3 อ.เชียงคาน จ.เลย
วันที่ 17-19 มีนาคม 2566
งานสีสันเมืองเลย และงานหน้ากากนานชาติ "Mask Festival 2023"ณ ลานพญานาคปู่ไหลคำมา อ.เมือง จ.เลย
วันที่ 6 เมษายน 2566
งานตุ้มโฮมปี้น้องไต บ้านนาป่าหนาด อ.เชียงคาน จ.เลย
วันที่ 14 เมษายน 2566
งานประเพณีสงกรานต์และแห่ต้นดอกไม้ บ้านแสงภา ต.แสงภา อ.นาแห้ว จ.เลย
วันที่ 16 เมษายน 2566
งานประเพณีสงกรานต์และแห่ต้นดอกไม้ บ้านอาฮี อ.ท่าลี่ จ.เลย
วันที่ 16 เมษายน 2566
ประเพณีวัฒนธรรม "แห่ข้าวพันก้อนเพื่อถวายแด่องค์พระธาตุศรีสองรัก" อ.ด่านซ้าย จ.เลย
วันที่ 17-18 เมษายน 2566
งานประเพณีสงกรานต์ และสรงน้ำพระพุทธเมตตา อุทยานแห่งชาติภูกระดึง อ.ภูกระดึง จ.เลย
ตารางกิจกรรม บุญเดือน 4 นมัสการไหว้พระธาตุ จังหวัดนครพนม
งาน สระบุรี Summer Day 31 มี.ค. - 2 เม.ย. 66
งาน "สระบุรี Summer Day" 31 มี.ค. - 2 เม.ย. 66 31 มีนาคม พบกับ / Taitosmith Lomosonic 1 เมษายน พบกับ / Only Monday Three Man Down 2 เมษายน พบกับ / LAIM Silly Fools ตลาดพงษ์ศิริโคกสว่าง ติดกับโรงเรียนเกตุพิชัย ก่อน 20:00 น.เข้าฟรี หลัง 20:00 น. บัตรราคา 199 บาท ต่อ 1 ท่าน
งานแห่ผ้าห่มพระธาตุศรีสุราษฎร์ แลธรรมชาติเขาท่าเพชร ครั้งที่ 13 ประจำปี 2566
งานแห่ผ้าห่มพระธาตุศรีสุราษฎร์ แลธรรมชาติเขาท่าเพชร ครั้งที่ 13 ประจำปี 2566 กำหนดการดังนี้
วันที่ 26 มีนาคม 2566
07.00 น. พิธีบวงสรวงศาลหลักเมือง
10.00 น. พิธีบวงสรวงพระธาตุศรีสุราษฎร์
18.00 น. พิธีสมโภชผ้าห่มพระธาตุศรีสุราษฎร์ ณ บริเวณศาลหลักเมืองสุราษฎร์ธานี
วันที่ 27 มีนาคม 2566
พิธีเชิญผ้าขึ้นห่มพระธาตุศรีสุราษฎร์
12.00 น. ขบวนแห่เริ่มลงทะเบียน และพร้อมกัน ณ บริเวณศาลหลักเมืองสุราษฎร์ธานี
13.19น. พิธีปล่อยขบวนแห่พระบฏและผ้าห่มพระธาตุศรีสุราษฎร์ออกจากบริเวณศาลหลักเมืองไปยังพระธาตุศรีสุราษฎร์
การแต่งกาย : การแต่งกายชุดสุภาพ โทนสีขาว หรือสีครีม
งาน “Summer Coffee Craft” 17-19 มีนาคม 2566
งาน "Summer Coffee Craft " 17-19 มีนาคม 2566 ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล สุราษฎร์ธานี คอกาแฟ ห้ามพลาด ในบรรยากาศชิลเอาท์ ชวนคุณมานั่งฟังเพลงเพลินๆ จิบกาแฟเบาๆ ชิม Specialty Coffee เมนูซิกเนเจอร์จากร้านดัง อาทิ AP SLOW BAR, 10/29 COFFEE CAMP, KCEG กลุ่มวิสาหกิจบ้านขุนช่างเคี่ยน จ.เชียงใหม่, อร่อยชิปหายการคั่ว ,CRAFT HOME BREWING ,ROAM COFFEE, PAKTAI CANEPHORA ,POMPA COFFEE SLOWBAR ,COACOLOW ,บ้านแงว HOME CAFÉ & SPECIALTY COFFEE
วันที่ 18 มีนาคม ชมการแข่งขัน Summer Drip Smackdown และสาธิตการ Drip การแฟจาก Barista ชื่อดัง
งาน “Walk N’ Torque by Amazing Thailand" 11 มีนาคม 2566
งาน “Walk N’ Torque by Amazing Thailand" การท่องเที่ยวแห่งประเทศไทย (ททท.) ขอเชิญชวนผู้ชื่นชอบการตกแต่งรถยนต์ทั้งสายสวยงาม และสาย Retro ร่วมงาน “Walk N’ Torque by Amazing Thailand" ในวันเสาร์ที่ 11 มีนาคมนี้ บริเวณถนนสาย 2 หลังโรงแรม The Heritage หรือสามารถ Scan ดูเส้นทางด้านล่างขวาใน Poster งาน ประตูเปิดให้รถเข้าตั้งแต่ 16.00 น. เป็นต้นไป ในงานมีดนตรีจากวง Gorealla
PATTAYA MUSIC FESTIVAL 2023
งานเทศกาลดนตรี "PATTAYA MUSIC FESTIVAL 2023" โดยเมืองพัทยา จัดให้แบบไม่กั๊ก ชมฟรี!! ตลอดศุกร์เสาร์ เดือนมีนาคม 2566
WESTKOFF 2023 : The Art of Asadong เทศกาลกาแฟและศิลปะของจังหวัดราชบุรี
WESTKOFF 2023 : The Art of Asadong เทศกาลกาแฟและศิลปะของจังหวัดราชบุรี 24-26 มีนาคม 2566 เวลา 10.00-20.00 น. ณ 155-Camp อ.เมือง จ.ราชบุรี กิจกรรมเชื่อมโยงผู้คน วัฒนธรรม ศิลปะที่หลากหลาย เข้าด้วยกัน โดยมีกาแฟเป็นจุดเชื่อมโยงที่เข้าถึงและเข้าใจง่ายในบริบทปัจจุบัน โดยการเล่าเรื่องผ่านอัตลักษณ์ในฉบับชาวราชบุรี ประกอบด้วย กาแฟ งานศิลปะหัตถกรรม งานศิลปะร่วมสมัย แหล่งท่องเที่ยว ดนตรีและธรรมชาติ ภายใต้คอนเซ็ปท์ The Art of Asadong : เมื่ออาทิตย์ อัสดง ลงปัจฉิม สนธยา ส่องแสงพริ้ม...ก่อนลับดวงตะวัน"
ประเพณีการแห่มาลัยข้าวตอก 1 -5 มีนาคม 2566
ประเพณีการแห่มาลัยข้าวตอก จัดขึ้นระหว่างวันที่ 1 -5 มีนาคม 2566 ณ บริเวณหน้าที่ว่าการอำเภอมหาชนะชัย จังหวัดยโสธร ชาวอำเภอมหาชนะชัยมีความเชื่อเรื่องใช้ข้าวถวายเป็นพุทธบูชาอยู่แล้ว เป็นประเพณีที่เกิดจากการแพร่กระจายของการใช้ข้าวเป็นเครื่องบูชา ได้จัดประเพณีการแห่มาลัยขึ้นเพื่อฟื้นฟูวัฒนธรรมของชุมชน ปรับเปลี่ยนมาจนเป็นมาลัยที่ใช้แขวนเป็นเครื่องบูชานั้นได้เกิดกระบวนการสั่งสมประสมการและภูมิปัญญา ตลอดจนเกิดเป็นวัฒนธรรมซึ่งมีคติในพิธีกรรม ที่มาที่แฝงเร้นในการจัดพิธีกรรมการแห่ข้าวดอก โดยจะมีชุมชนที่เข้าร่วมจัดทำเป็นมาลัยขนาดใหญ่เพื่อเป็นตัวแทนชุมชนเข้าร่วมการประกวด ชุมชนที่เข้าร่วมในการแห่มาลัยมากที่สุดคือ หมู่ 2 หมู่ 4 และหมู่ 8 ตำบลฟ้าหยาด ในตำบลอื่นก็มีทำบ้างแต่ไม่มากนัก
“ตลาดร่มเย็น” กราบรอยพระบาท “มาฆปูรมี” เที่ยวตลาดย้อนยุค วันที่ 2-6 มีนาคม 2566
“ตลาดร่มเย็น” กราบรอยพระบาท “มาฆปูรมี” เที่ยวตลาดย้อนยุค ชิมอาหารอร่อย…เมนูของศรีมโหสถ วันที่ 2-6 มีนาคม 2566 ในงานเทศกาลมาฆปูรมีศรีปราจีนบุรี ครั้งที่ 37 ณ บริเวณโบราณสถานสระมรกต อ.ศรีมโหสถ จ.ปราจีนบุรีเทศกาลอาหารสะอาด รสชาติอร่อย อาหารจานเด็ด ครั้งที่ 22 วันที่ 3 - 5 มี.ค. 2566
เทศกาลอาหารสะอาด รสชาติอร่อย อาหารจานเด็ด ครั้งที่ 22 วันที่ 3 - 5 มี.ค. 2566 สนามช้างเผือก อำเภอเมืองยะลา จังหวัดยะลา พบกับร้านหรอยกว่า 100 ร้าน ทั่วจังหวัดชายแดนภาคใต้ พร้อมการแสดงจากศิลปิน "แพท Power" วง FIN และ วุฒิ ป่าบอน ชิมช้อปกาแฟกับโซน Coffee Park ที่รังสรรค์กาแฟหลากหลายเำำื่อคอกาแฟโดยเฉพาะและรับชมการแสดงแสงสีเสียงจากสถานบันการศึกษาต่างๆ มากมายตลอดงาน
งานบุญมหาชาติ ประจำปี พ.ศ. 2566 (งานกินข้าวปุ้น เอาบุญผะเหวด ฟังเทศน์มหาชาติ) 6-9 มีนาคม 2566
วัดศรีทัศน์ เทศบาลตำบลดงมะไฟ อำเภอเมือง จังหวัดสกลนคร วันจันทร์ที่ 6 มีนาคม 2566 (ขึ้น 15 ค่ำ เดือน 4) งานกินข้าวปุ้น
วิ่งเปิดเมือง ที่ท่าอุเทน 11 - 12 มีนาคม 2566
"วิ่งเปิดเมือง" ที่ท่าอุเทน เดิน วิ่ง เลาะริมโขง กับบรรยากาศยามเช้า ปลุกเพื่อน ๆ ชาวนักวิ่งทั้งหลาย มาวิ่งกับ ททท. สำนักงานนครพนม และชาวท่าอุเทน เเละ ททท. ยังมีบูธให้สายวิ่งมาร่วมกิจกรรม รับของที่ระลึก จุก ๆ ไปเล้ยยย... พบกันวันที่ 11 - 12 มีนาคม 2566 นี้ ณ ลานกิจกรรมสถานีตำรวจภูธรท่าอุเทน อ.ท่าอุเทน จ.นครพนม
บึงกาฬ AMAZING BUENG KAN FESTIVAL 16-19 มีนาคม 2566 LINK
งาน "AMAZING BUENG KAN FESTIVAL" 16 - 19 มีนาคม 2566 place ถนนข้าวเม่าริมโขง เขตเทศบาลเมืองบึงกาฬ จังหวัดบึงกาฬ กิจกรรมเพื่อส่งเสริมการท่องเที่ยวเส้นทางท่องเที่ยว สายมูและความเชื่อของผู้คนลุ่มน้ำแม่โขง ภายในงานจะรวบรวมกิจกรรมในรูปแบบการท่องเที่ยวเชิงวัฒนธรรมและความเชื่อ อาทิ กิจกรรม ทริปท่องเที่ยวเสริมสิริมงคล เสริมดวง เสริมโชค ให้รวยให้ปังตามรอยเส้นทางสายมู โดยอาจารย์คฑา ชินบัญชรและนิทรรศการแนะนำเส้นทางท่องเที่ยวสายมู กิจกรรมโชว์การแสดงม่านน้ำแสง สี เสียง ที่บอกเรื่องราวของสถานที่ท่องเที่ยวที่สำคัญของจังหวัดบึงกาฬ ชิม ช็อปอาหารและเครื่องดื่มหลากหลายร้านค้า ขบวนรถFood Trucks รวมถึงการออกบูธสินค้า OTOP ชมไฟประดับที่จัดขึ้นอย่างสวยงาม ได้แก่ จุดถ่ายภาพอุโมงค์ไฟจุดถ่ายภาพการจัดสวนไฟประดับ และจุดถ่ายภาพกล่องไฟประดับ และการแสดงฟรีคอนเสิร์ตจากศิลปิน ได้แก่หนิง The Voice, วง Paradox, MONICA, ดิว อรุณพงศ์, สงกรานต์ รังสรรค์, วง Fool Step, Yes sir Days,MAN R x OWEN และ วง ONLY MONDAY ขอเชิญชาวทุกท่านมาท่องเที่ยวเสริมสิริมงคล เสริมดวง เสริมโชค ให้รวยให้ปังตามรอยเส้นทางสายมู พร้อมมาร่วมชมความสวยงามตลอดการจัดงานในบรรยากาศของการจัดงาน "AMAZING BUENG KANFESTVAL " เข้าร่วมงานฟรี ไม่มีค่าใช้จ่าย
งานมะม่วงหลากชนิด มะยงชิดหวานอร่อยและของดีอำเภอลานสัก ประจำปี 2566 วันที่ 18-19 มีนาคม 2566
ททท.สำนักงานอุทัยธานี ×อบต.ทุ่งนางาม ขอเชิญทุกท่านร่วมงานมะม่วงหลากชนิด มะยงชิดหวานอร่อยและของดีอำเภอลานสัก ประจำปี 2566 ระหว่างวันที่ 18-19 มีนาคม 2566 ณ หุบป่าตาด อ.ลานสัก จ.อุทัยธานี ชมกิจกรรมต่างๆมากมายภายในงาน
✅การประกวดหนูน้อยชาวสวน ✅การประกวดธิดาจำแลง ✅การแข่งขันกินข้าวเหนียวมะม่วง ✅การแข่งขันตำมะม่วงลีลา ✅การจัดจำหน่ายสินค้าของดีของเด็ดอำเภอลานสัก
โกงกางรัน 2 LINK
โกงกางรัน 2 ตอน "บุญคุณ ปูแสม" วันอาทิตย์ ที่ 19 มีนาคม 2566 ณ มหาวิทยาลัยราชภัฏสวนสุนันทา วิทยาเขตสมุทรสงคราม
กิจกรรม เดินวิ่ง 12 ปี วันสถาปนาจังหวัดบึงกาฬ 22 มีนาคม 2566
จังหวัดบึงกาฬ ขอเชิญทุกท่านเข้าร่วมกิจกรรม เดินวิ่ง “12 ปี วันสถาปนาจังหวัดบึงกาฬ” ในงานวันสถาปนาและงานกาชาดจังหวัดบึงกาฬ ประจำปี 2566 วันพุธที่ 22 มีนาคม 2566 เริ่มลงทะเบียน เวลา 04.00 น. ณ ศูนย์ราชการจังหวัดบึงกาฬ อ.เมืองบึงกาฬ จ.บึงกาฬ แบ่งเป็นประเภท ระยะทาง 5 และ 10 กิโลเมตร สอบถามข้อมูลเพิ่มเติม โทร : 042-492471
งานสถาปนาจังหวัดบึงกาฬ และกาชาดจังหวัดบึงกาฬประจำปี 2566
งานสถาปนาจังหวัดบึงกาฬ และกาชาดจังหวัดบึงกาฬประจำปี 2566 ระหว่าง 22-26 มีนาคม 2566 ณ ศูนย์ราชการจังหวัดบึงกาฬ ฉลองครบรอบ 12 นักษัตรจักรราศี 12 ปี จ.บึงกาฬ เมืองศักดิ์สิทธิ์ ดินแดนมหัศจรรย์ ชมศิลปินบนเวทีทุกวัน การแสดงแสงสีเสียงสุดยิ่งใหญ่ งานสินค้าโอท็อปของดีเด่นบึงกาฬ
งานวัฒนธรรมสองฝั่งเจ้าพระยา มหาเจษฎาบดินทร์ 30 มีนาคม - 3 เมษายน 2566
งานวัฒนธรรมสองฝั่งเจ้าพระยา มหาเจษฎาบดินทร์ ประจำปีประมาณพ.ศ. 2566 ระหว่างวันที่ 30 มีนาคม - 3 เมษายน 2566 ณ อุทยานเฉลิมกาญจนาภิเษก และท่าน้ำเมืองนนท์ อ.เมือง จ.นนทบุรี
31 มีนาคม พิธีเปิดงาน ชมขบวนแห่งชาติพันธุ์ ขบวนเรือทางน้ำ รำเทิดพระเกียรติ การแสดงแสงสีเสียง พระราชประวัติรัชกาลที่ 3 กิจกรรมอื่นๆ - การแสดงสุดยอดศิลปวัฒนธรรม โขน ลิเก หุ่นละครเล็ก สาธิตการทำอาหารพื้นเมือง ชิม ช็อป ผลิตภัณฑ์ชุมชนตลาดย้อนยุค แชะแชร์ อุโมงค์ประดับไฟ street art ร่วมแต่งกายผ้าไทย
Walking Street @Rangsit 31 มีนาคม - 2 เมษายน 2566
Walking Street @Rangsit "เดิน กิน ชิม เที่ยว" วันที่ 31 มีนาคม - 2 เมษายน 2566 เวลา 17.00 - 23.00 น. ณ ริมเขื่อนหน้าโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร ???? พบกับ สินค้ามากมาย อาทิ ???? ️มหกรรมอาหาร ???? ️สินค้า OTOP สนุกไปกับศิลปินดารารับเชิญ... 31 มีนาคม ปูแดง จอนนี่มิวสิค 1 เมษายน แช่ม แช่มรัมย์ 2 เมษายน THE BOY SUPTAR INDY
งานมหกรรมแข่งขันนกเขาชวาเสียงอาเซียน ประจำปี 2566
31 มี.ค. 2566 สนามสวนขวัญเมือง จังหวัดยะลา การแข่งขันนกเขาชวาเสียงอาเซียนประเภท เสียงเล็ก เสียงกลาง เสียงใหญ่ ประเภทรวมเสียง ประเภทดาวรุ่ง และนกเขาใหญ่ กิจกรรมเสริม คือ การแข่งขันนกกรงหัวจุก ณ สนามศูนย์เยาวชนเทศบาลนครยะลา การจำหน่ายอาหารจานเด็ดจาก 3 จังหวัดชายแดนภาคใต้ การแสดงบนเวทีของหน่วยงานต่างๆ ทั้งภาครัฐและเอกชนททท.เพชรบุรี ขอชวนมาปลูกป่า
ททท. ขอชวนมาปลูกป่า ยิงกระสุนเมล็ดพันธุ์แห่งความดี ให้การเดินทางท่องเที่ยวในแต่ละทริปมีคุณค่า มีความหมาย มากกว่าเดิม
ชวนเพื่อน ชวนครอบครัว คนรู้ใจ ไปค้นหาและสร้างประสบการณ์ ที่มีความหมาย Meaningful Travel ด้วยกิจกรรม "เที่ยวด้วย...ช่วยได้" โดย ททท.สำนักงานเพชรบุรี มีส่วนช่วยให้นักท่องเที่ยวได้คืนประโยชน์สู่สังคม ชุมชน สิ่งแวดล้อมและผืนป่า
ททท.สำนักงานเพชรบุรี ด้วยความร่วมมือจากทางวนอุทยานเขานางพันธุรัต อ.ชะอำ จ.เพชรบุรี
ขอเชิญนักท่องเที่ยวที่สนใจทำกิจกรรมบำเพ็ญประโยชน์ หรือกลุ่มบริษัทที่ต้องการเสริมกิจกรรม Team building
ร่วมกิจกรรม CSR ปลูกป่า Seed Bomb เพื่อสร้างประสบการณ์ดีๆ
ททท. ร่วมด้วยช่วยจัดหาอุปกรณ์ปลูกป่า Seed Bomb
ระยะเวลา : ธ.ค 65 – พ.ค.66
สนใจรายละเอียดกรุณาติดต่อ : ททท.สำนักงานเพชรบุรี
โทร. 032-471005-6
FB: TATPhetchaburi
Line :@tat_phet
งานประเพณีวันไหลพัทยา ประจำปี 2566 วันที่ 19 เม.ย.66
งานประเพณีวันไหลพัทยา ประจำปี 2566 วันที่ 19 เมษายน 2566 งานประเพณีวันไหลพัทยา ประจำปี 2566 วันที่ 19 เมษายน 2566 ณ วัดชัยมงคล (พระอารามหลวง), สอบถาม เมืองพัทยา โทร. 0-3825-3100 ต่อ 4091
งานประเพณีวันไหลนาเกลือ ประจำปี 2566 วันที่ 18 เม.ย.66
งานประเพณีวันไหลนาเกลือ ประจำปี 2566 วันที่ 18 เม.ย. 66 ณ ลานโพธิ์นาเกลือ สอบถาม เมืองพัทยา โทร. 03825-3100 ต่อ 4091
Fun Flow Fest by Rave สนุก มันส์ วันไหลพัทยา 17-19 เม.ย.66
สนุก มันส์ กันให้เต็มที่ในวันไหลพัทยา ไปกับงาน Fun Flow Fest by RAVE พบกับเหล่าศิลปินที่รวมทัพจัดเต็ม พร้อมความบันเทิงเต็มรูปแบบ Festival ที่เป็นสีสันในยามค่ำคืนวันไหลพัทยาไปกับศิลปินที่คุณชื่นชอบ บัตร Standard & VIP 17 เม.ย. LAZYLOXY X SAMBLACK & URBOYTJ / 18 เม.ย. PALMY & COCKTAIL / 19 เม.ย.POLYCAT & SLOT MACHINE 15:00 - 23:59 น. ลานข้าง 7-11 เรือ (พัทยาใต้)
ชีวาสมุทร Sea You Strong ว่ายน้ำข้าม 3 จังหวัด กระบี่ พังงา ภูเก็ต 28 - 30 เมษายน 66 LINK
งาน "ชีวาสมุทร" โครงการ SEA YOU STRONG วันที่ 28 - 30 เมษายน 2566 เป็นการว่ายน้ำเชิงอนุรักษ์ข้าม 3 จังหวัด (กระบี่ พังงา และภูเก็ต) ระยะทางโดยประมาณ 70 กิโลเมตร วัตถุประสงค์เพื่อให้คนหันมาสนใจและให้ความสำคัญต่อทะเล สัตว์ทะเล แนวปะการัง และชุมชนชายฝั่งแถบอันดามัน เป็นกิจกรรม ว่ายน้ำเพื่อระดมทุนสำหรับงานอนุรักษ์ เส้นทางการว่ายน้ำเริ่มจาก หาดยาว อ. เหนือคลอง จ. กระบี่ ไปเกาะ ปอดะ อ่าวนาง, เกาะห้อง, เกาะยาวน้อย, เกาะยาวใหญ่ จนจบที่อ่าวปอ จ.ภูเก็ต
นำรถโดยสารขึ้นจอดด้านบนถ้ำเขาหลวงได้
ตั้งแต่วันที่ 17 มีนาคม พ.ศ. 2566 นักท่องเที่ยวสามารถนำรถโดยสารขึ้นจอดด้านบนถ้ำเขาหลวงได้
COOL Summer Fest 2023 เทศกาลดนตรีปลุกเพลงแดนซ์ท้าแดด 22 เม.ย.66
สาดสีสันมันส์ลั่นหาด เร่าร้อน on the beach ที่ COOL SUMMER BEACH, CHAAM ไปกับเทศกาลดนตรีริมทะเลที่รวมเทรนด์สุดป็อป Up ดีกรีความ Hot ไปกับ STAMP / URBOYTJ / TWOPEE / WAII NO ONE ELSE / PIXXIE / BAMM และ SLAPKISS
สงกรานต์ เฟสติวัล 2023 @กาญจนบุรี 13 - 14 เม.ย.66
องค์การบริหารส่วนจังหวัดกาญจนบุรี ขอเชิญเที่ยวงาน สงกรานต์ เฟสติวัล 2023 @กาญจนบุรี 13 - 14 เมษายน 2566 ณ บริเวณถนนสองแควริมน้ำหน้าเมือง (สกายวอร์คสองแควกาญจนบุรี) ชุ่มฉ่ำกับอุโมงค์น้ำ ยาว 40 เมตร ชมการแสดงคอนเสิร์ตศิลปินชื่อดัง กิจกรรมสืบสานประเพณีไทย ชิมอาหารอร่อยในมหกรรมอาหารร้านเด็ด กว่า 600 ร้านค้า ร่วมสืบสานความสนุก ปลุกความครื้นเครงที่กาญจนบุรี
งานรำลึกวันทหารผ่านศึกออสเตรเลีย-นิวซีแลนด์ (Anzac Day) ประจำปี 2023 วันที่ 25 เม.ย.66 LINK
ศูนย์ประวัติศาสตร์ช่องเขาขาด ต.ท่าเสา อ.ไทรโยค จ.กาญจนบุรี แจ้งประชาสัมพันธ์การจัดงานรำลึกวันทหารผ่านศึกออสเตรเลีย-นิวซีแลนด์ (Anzac Day) ประจำปี 2023 ในวันที่ 25 เมษายน 2566 เวลา 05.30 น. โดยในปีนี้ ประตูทางเข้าด้านหน้ากองการเกษตรและสหกรณ์ฯ (ที่ตั้งของศูนย์ประวัติศาสตร์ฯ) จะเปิดพื้นที่ให้ประชาชนเข้าได้ตั้งแต่เวลา 03.00 น. และอาคารศูนย์ฯก็จะเปิดให้เข้าชมได้ตั้งแต่เวลา 03.00 น. เช่นกัน เพื่อรองรับผู้เข้าร่วมพิธีในวันดังกล่าว
นักท่องเที่ยวและผู้สนใจ สามารถศึกษากำหนดการ รายละเอียด และข้อควรทราบของกิจกรรมในวันรำลึกแอนแซค 2023 ได้จากภาพในโพสต์นี้ (มีทั้งภาษาไทย และอังกฤษ)
งานพิธีรำลึกวันแอนแซค ณ ช่องเขาขาด จ.กาญจนบุรี กำหนดจัดขึ้นในวันที่ 25 เมษายนของทุกปี โดยชาวออสเตรเลียและชาวนิวซีแลนด์ทั่วโลกจะร่วมกันรำลึกถึงวันแอนแซค ซึ่งเป็นวันครบรอบการปฏิบัติการทางทหารครั้งใหญ่ ครั้งแรกที่กองกำลังออสเตรเลียและนิวซีแลนด์ได้ต่อสู้ระหว่างสงครามโลกครั้งที่ 1 เมื่อวันที่ 25 เมษายน พ.ศ. 2458
สงกรานต์ @สังขละบุรี 12-17 เม.ย.66
สงกรานต์พหุวัฒนธรรม สังขละบุรี 12-17 เม.ย. 2566 ที่ เจดีย์พุทธคยา วัดวังก์วิเวการาม - ชมประเพณีการก่อพระเจดีย์ทราย การขนน้ำไปอาบน้ำผู้สูงอายุที่วัด การสรงน้ำพระ ผ่านรางกระบอกไม้ไผ่ที่นำมามัดรวมต่อกันความยาวนับกิโล ตื่นตากับแรงศรัทธาของผู้คนที่พร้อมใจกันนอนเรียงรายต่อ ๆ กันให้พระสงฆ์เดินเหยียบไปบนหลัง (มีเฉพาะวันที่ 17 เมษายน เวลาประมาณ 15.00 น. เป็นต้นไป) ชมพิธีแห่กองผ้าป่า และยกฉัตรเจดีย์ทราย ในเช้าวันที่ 18 เมษายน เริ่มเวลาประมาณ 09.00 น.
เทศกาลอีสานสร้างสรรค์ 2566 Isan Creative Festival 2023 วันที่ 1-9 เมษายน 2566
มหาวิทยาลัยขอนแก่น ขอเชิญร่วมงานมหกรรม “เทศกาลอีสานสร้างสรรค์ 2566 หรือ Isan Creative Festival 2023” มหกรรมแสดงศักยภาพด้านความคิดสร้างสรรค์ของภาคอีสาน… เติมเต็มถิ่นฐาน ตื่มบ้านตื่มเมือง ระหว่างวันที่ 1-9 เมษายน 2566 ณ TCDC Khon Kaen, สถานีขนส่งปรับอากาศจังหวัดขอนแก่น และพิพิธภัณฑ์ธนารักษ์
- การจัดแสดงผลงานและนิทรรศการ (Showcase & Exhibition)
- เสวนา และเวิร์กช็อป (Talk & Workshop)
- อีเวนต์และโปรแกรมบันเทิง (Event & Entertainment Program)
- ย่านเศรษฐกิจสร้างสรรค์ (Creative District Project)
- ตลาดสร้างสรรค์ (D-KAK Market)
- ทัวร์สร้างสรรค์ (Creative Tour)
"แลน เบิ่ง ดู๊" งานวิ่งในเมืองขอนแก่น 1-9 เมษายน 2566
"แลน เบิ่ง ดู๊" งานวิ่งในเมืองขอนแก่น วิ่งท่ามกลางเมือง ตลอดเส้นทาง 5 กิโลเมตร ซึมซับบรรยากาศในเมืองยามเช้า ผ่านตรอก ซอกซอย มุมเมืองร้านค้าที่คุณไม่เคยได้เห็นมาก่อน มีจุด Checkpoint ให้สำรวจและให้คุณได้มารู้จักกับเมืองขอนแก่นมากขึ้น
วันแข่งขัน : 1-9 เมษายน 2566 เวลา 06:00-10:00 น.
เปิดรับสมัคร : 9-29 มีนาคม 2566
งานกาชาดจังหวัดสงขลา 2566 วันที่ 21- 30 เมษายน 2566
งานกาชาดจังหวัดสงขลา 2566 จากเดิม 28 เมษายน - 7 พฤษภาคม 2566 เป็นวันที่ 21- 30 เมษายน 2566 ณ บริเวณสระบัว แหลมสมิหลา อ.เมือง จ.สงขลา ลุ้นของรางวัลสลากกาชาด และ รับชมการแสดงจากศิลปินทุกคืน
รวมน้ำใจช่วยกาชาด 2566
รวมน้ำใจช่วยกาชาด 2566 ขอเชิญร่วมบริจาคของรางวัลรวมน้ำใจช่วยกาชาด ประจำปี พ.ศ. 2566 ในวันที่ 7 เมษายน 2566 ตั้งแต่เวลา 09.00 น. เป็นต้นไป ณ จวนผู้ว่าราชการจังหวัดสงขลา ( ตำหนักเขาน้อย )
Drumcode x Blue Tree Songkran 14-15 เมษายน 2566
กิจกรรม Drumcode x Blue Tree Songkran (ดรัมโค้ท แอนด์ บลูทรีสงกรานต์) วันที่จัดงาน 14-15 เมษายน 2566 สนามหญ้าบลูทรีภูเก็ต ดีเจสายเทคโนชื่อดังระดับโลก 9 ท่าน รวมถึงดีเจสาวชาวไทยชื่อดังบนเวทีโลก NAKADIA และดีเจชาวไทยอีกมากมาย ร่วมระเบิดความมันส์ในครั้งนี้ - มีค่าเข้าชม
PPAO MiniMarathon 2023
PPAO MiniMarathon 2023 งานวิ่งอบจ.ภูเก็ต วันที่ 2 เมษายน 2566 ณ. โครงการอ่างเก็บน้ำบางเหนียวดำ ต.ศรีสุนทร อ.ถลาง จ.ภูเก็ต
งานวันไหลคลองพระสะทึง2566 วันที่ 13 เมษายน 2566
งานวันไหลคลองพระสะทึง2566 จังหวัดสระแก้ว 13 เมษายน 2566 อ่างเก็บน้ำคลองพระสะทึง หมู่ที่ 5 บ้านทุ่งกบินทร์ ตำบลวังใหม่ อำเภอวังสมบูรณ์ จังหวัดสระแก้ว พบกับ ขบวนรถแห่พระพุทธรูป รถแห่นางสงกรานต์ 14 หมู่บ้าน พิธีสรงน้ำพระ รดน้ำดำหัวขอพรผู้สูงอายุ ชมการประกวดเทพีสงกรานต์ตำบลวังใหม่ สนุกสุดมันส์กับวงดนตรี #หัวกะทิแบนด์ ร่วมชิมอาหารที่ขนความอร่อยมาออกร้านตลอดงาน งานนี้เต็มคาราเบลเเน่นอน
เดิน -วิ่งการกุศล "เมืองฉะ อีเกี้ลรัน" ซูเปอร์ฮาล์ฟ มาราธอน 2023 วันอาทิตย์ที่ 23 เมษายน 2566
เดิน -วิ่งการกุศล "เมืองฉะ อีเกี้ลรัน" ซูเปอร์ฮาล์ฟ มาราธอน 2023 ณ องค์การบริหารสวนตำบลดงน้อย อำเภอราซสาส์น จังหวัดฉะเชิงเทรา วันอาทิตย์ที่ 23 เมษายน 2566 เวลา 05.00 - 09.30 น.
เที่ยวงานสมโภชศาลหลักเมืองนครสวรรค์ ปีที่ 49 วันที่ 12-14 เมษายน 2566
เที่ยวงานสมโภชศาลหลักเมืองนครสวรรค์ ปีที่ 49 ระหว่างวันที่ 12-14 เมษายน 2566 ณ ศาลหลักเมืองจังหวัดนครสวรรค์ ภายในงาน
- ร่วมกราบไหว้สิ่งศักดิ์สิทธิ์คู่บ้าน คู่เมือง เพื่อความเป็นสิริมงคลต่อชาวจังหวัดนครสวรรค์ และความเจริญรุ่งเรืองก้าวหน้าในชีวิต
- ถ่ายภาพกับจุดเช็คอินในบรรยากาศแบบไทยล้านนา (โคมยี่เป็ง)
- กิจกรรมก่อเจดีย์ทราย
- แต่งกายสุภาพ เสื้อผ้าหลากสีสัน
- ช้อปและชิมกับบูธจำหน่ายอาหารพื้นเมือง
- ชมหนังกลางแปลง
- ฟังเพลงโฟล์คซอง
- ร่วมประมูลวัตถุมงคลต่อหน้าเจ้า
- กิจกรรมอื่นๆในงานอีกมากมาย
กิจกรรมจ.กำแพงเพชร เดือนเมษายน 2566
กิจกรรมดีๆ มากมาย - งานประเพณีสงกรานต์ - มหาสงกรานต์@เกาะกลางน้ำ - การแข่งขันจักรยานชิงแชมป์แห่งประเทศไทย
การแข่งขันจักรยานชิงแชมป์ประเทศไทย 27-30 เมษายน 2566 ณ สนามกำแพงเพชร
การแข่งขันจักรยานชิงแชมป์ประเทศไทย ชิงถ้วยพระราชทาน “คิงส์ภูมิพล” และการแข่งขันจักรยานประเภทเสือภูเขาชิงแชมป์ประเทศไทย ชิงถ้วยพระราชทาน พระบาทสมเด็จพระเจ้าอยู่หัว พร้อมด้วยกิจกรรมขี่จักรยานเพื่อสุขภาพ ประจำปี 2566 สนามที่ 4 ระหว่างวันที่ 27-30 เมษายน 2566 ณ สนามกำแพงเพชร
ปั่นสร้างสุข ปั่นเพื่อสุขภาพ@กำแพงเพชร วันเสาร์ที่ 29 เมษายน 66
ปั่นเพื่อสุขภาพ “ปั่นสร้างสุข” ร่วมในรายการแข่งขันจักรยานชิงแชมป์ประเทศไทย ชิงถ้วยพระราชทานฯ วันเสาร์ที่ 29 เมษายน เวลา 15.00 น. ณ เทศบาลเมืองหนองปลิง ฟรี มี อาหาร และ เสื้อแจก 300 ตัว สนับสนุนโดยองค์การบริหารส่วนจังหวัดกำแพงเพชร [
สมาคมกีฬาจักรยานชากังราว จังหวัดกำแพงเพชร]
งานประเพณี บุญเดือน5 มหาสงกรานต์บ้านทุ่งสนุ่น อ.บึงสามัคคี วันที่ 13 - 16 เมษายน 2566 LINK
ขอเชิญเที่ยวงานประเพณี บุญเดือน5 มหาสงกรานต์บ้านทุ่งสนุ่น ต.ระหาน อ.บึงสามัคคี จ.กำแพงเพชร ประจำปี 2566 วันที่ 13 - 16 เมษายน 2566 กิจกรรมตลอดทั้ง 4 วัน - ทำบุญตักบาตรทุกวัน - บังสุกุล อุทิศให้วิญญาณบรรพบุรุษ - อาบน้ำมนต์ประจำปี - พิธีแต่งแก้เสียเคราะห์ - สรงน้ำพระพุทธรูป สรงน้ำพระธาตุ - สรงน้ำท้าวเวสสุวรรณ พญาเศรษฐีเมืองกำแพงเพชร - สรงน้ำ พระภิกษุสามเณร (15 เม.ย.66 ) - ก่อเจดีย์ทราย ถวายเจดีย์ทราย - แห่ธง ผ้าป่า ปิดท้ายวันสงกรานต์ (16 เม.ย.66) หากจะพูดถึง Highlight ที่สำคัญของงานสงกรานต์บ้านทุ่งสนุ่น นั้นก็คือ การแห่ธงผ้าป่าสงกรานต์ ประเพณีของชาวบ้านทุ่งสนุ่น ซึ่งจัดมาเป็นประจำเกือบ 100 ปีมาแล้ว ขบวนแห่ธงผ้าป่า และแคนวง ดนตรีเล่นสด แห่ผ้าป่าทั้งวันจาก 6 หมู่บ้าน ทะยอยแห่มารอกันที่หน้าวัด ผู้คนหลั่งไหลมาเที่ยว เล่นน้ำและมาเต้นมารำ จากทั่วทุกสารทิศ จนมีชื่อเรียกอีกชื่อหนึ่งว่า วันไหลไทยบ้านทุ่งสนุ่น
งานแต่งสีอวดลาย ผ้าฝ้ายดอนหลวง 7 – 11 เม.ย. 66
งานแต่งสีอวดลาย ผ้าฝ้ายดอนหลวง 7 – 11 เม.ย. 66 ณ หมู่บ้านดอนหลวง
????ลักษณะของการจัดงานเป็นแบบ “กาดปื้นเฮือน” จะเป็นช่วงเวลาของการลดราคาสินค้าประจำปี (สินค้าหัตถกรรมผ้าฝ้ายทอมือ) เพื่อดึงดูดนักท่องเที่ยวรวมทั้งผู้ที่สนใจผลิตภัณฑ์ผ้าฝ้ายทอมือ ภายในงานมีกิจกรรมต่าง ๆ มากมาย เช่น การสาธิตการทอผ้าฝ้ายพื้นเมืองโดยนักท่องเที่ยวสามารถทดลองทอผ้าฝ้ายตามวิถีของชุมชน ได้แก่ ทดลองอีดฝ้าย ปั่นฝ้าย กวักฝ้าย อีกทั้งสัมผัสวัฒนธรรมอันดีงามในการต้อนรับแขกผู้มาเยือน คือการผูกข้อไม้ข้อมือรับศีลรับพรปีใหม่จากผู้เฒ่าผู้แก่บ้านดอนหลวง มีการจำหน่ายอาหารพื้นเมือง (กาดมั้ว) ลานขันโตก ชมการแสดงพื้นเมืองของชาวบ้านและนักเรียนในตำบลแม่แรง รวมถึงการจำหน่ายผ้าฝ้าย ผ้าทอ ซึ่งเป็นสินค้า OTOP ที่ขึ้นชื่อ เป็นของฝากของที่ระลึกในราคาย่อมเยา ท่ามกลางบรรยากาศกลิ่นอายแห่งมนต์เสน่ห์แห่งล้านนา ด้วยเสียงเพลงสะล้อ ซอ ซึง ที่บรรเลงขับกล่อมตลอดการจัดงาน
* ค้นหาในแผนที่ ว่า : วัดดอนหลวง
“ชวนแอ่วเมืองรถม้า พาเรียนรู้ 3 ประสบการณ์” รับส่วนลดมูลค่า 100 บาท
ททท.สำนักงานลำปาง “ชวนแอ่วเมืองรถม้า พาเรียนรู้ 3 ประสบการณ์” รับส่วนลดมูลค่า 100 บาท ตั้งแต่วันที่ 1 เมษายน - 31 พฤษภาคม 2566 สิทธิ์มีจำนวนจำกัด (First Come First Serve)
• DIY วาดชามไก่ เล่าเรื่องราวเซรามิกลำปาง หรือ ช้อปสินค้าครบ 500 บาท ณ ธนบดีมิวเซียมลำปาง รับส่วนลดทันที 100 บาทโทร.083-483-2892
• DIY ปิ่นปักผมจากขนแผงคอม้า ทำเกือกม้า หรือร่วมสัมผัสวิถีชีวิตของม้ากับบ้านม้าท่าน้ำ โทร.086-658-6198
• DIY ทำสร้อยเซรามิก ณ อารีเซรามิก โทร.093-138-9662
เที่ยวลำปางช่วงเทศกาลสงกรานต์ สนุกมากมายเกินคาด
งานประเพณีแปดเป็ง "สรงน้ำพระธาตุหริภุญชัย" 28 เม.ย.- 4 พ.ค.66
วัดพระธาตุหริภุญชัย ลำพูน แจ้งกำหนดการจัดงานประเพณีแปดเป็ง "สรงน้ำพระธาตุหริภุญชัย" วันที่ 28 เมษายน - 4 พฤษภาคม 2566 วิถีความเชื่อ ความศรัทธา ต่อพระพุทธศาสนาที่สืบทอดกันมายาวนานกว่าพันปี สนับสนุนโดย อบจ ลำพูน เทศบาลเมืองลำพูน สภาวัฒนธรรมและวัดพระธาตุหริภุญชัย
กิจกรรมประเพณีช่วงสงกรานต์ จ.ลำพูน
กิจกรรมประเพณี ช่วงเทศกาลสงกรานต์ใน จ.ลำพูน ประจำเดือน เมษายน 2566 สอบถามข้อมูลเพิ่มเติมได้ที่ ททท.สำนักงานลำปาง โทร.054-222214 หรือ Inbox Page Facebook : ททท.สำนักงานลำปาง
งานสลุงหลวง กลองใหญ่ ปีใหม่เมืองนครลำปาง ประจำปี 2566 วันที่ 8-13 เมษายน 2566
งานสลุงหลวง กลองใหญ่ ปีใหม่เมืองนครลำปาง ประจำปี 2566 งานประเพณีที่ยิ่งใหญ่ที่สุดของจังหวัดลำปาง ระหว่าง 8-13 เมษายน 2566 ณ บริเวณลานหน้าพระธาตุศรีจอมไคล วัดปงสนุก บริเวณถนนปงสนุก และข่วงนคร ห้าแยกหอนาฬิกาโดยมีกิจกรรมมากมาย อาทิ
- การแข่งขันตีก๋องปู่จา ชิงถ้วยพระราชทานฯ
- พิธีเปิดงาน และการแสดงแสง สี เสียง อันตระการตา
- การประกวดเทพบุตร - เทพธิดา สลุงหลวง
- ขบวนแห่น้ำทิพย์ 13 อำเภอ ขบวนแห่สลุงหลวง
- การประกวด บ่าวน้อย - สาวน้อย ปีใหม่เมืองเวียงละกอน
- ขบวนแห่จุมพระ และขบวนแห่ป๋าเวณีปีใหม่เมืองนครลำปาง
- กิจกรรมข่วงแก้วเวียงละกอน และลานภูมิผญา
พร้อมงานออกร้านถนนสายวัฒนธรรมกว่า 50 ร้านค้า
และ ศิลปิน ตู่ ดารณี และ อ้อม รัตนัง ที่จะมาสร้างความบันเทิงให้พี่น้องชาวลำปางและนักท่องเที่ยว
ติดตามรายละเอียดเพิ่มเติมได้ที่ :
เฟซบุ๊ก : SALUNGLUANG.LAMPANG
งานปิดทองพระพุทธไสยาสน์ หลวงพ่อโต กลางเดือน 5 ประจำปี 2566
งานปิดทองพระพุทธไสยาสน์ หลวงพ่อโต กลางเดือน 5 ประจำปี 2566 วันที่ 3-5 เมษายน 2566 ณ วัดสะตือ ตำบลท่าหลวง อำเภอท่าเรือ จังหวัดพระนครศรีอยุธยา
ย้อนวันวาน เสน่ห์กาญจน์ - บ้านเรา 12-17 เมษายน 2566 เข้างานฟรี
"ย้อนวันวาน เสน่ห์กาญจน์ - บ้านเรา" ร้านอาหารคีรีมันตรา และ The Village Farm To Cafe วันที่ 12-17 เมษายน 2566 เวลา15:00-22:00 น. เข้างานฟรี สงกรานต์นี้ชวนทุกคนมารื้อฟื้นความทรงจำในวันวาน ตะลุยเที่ยวงานวัดสุดคลาสสิค มาสนุกไปกับรำวงย้อนยุคโจ๊ะๆ จัดเต็มแสงสีเสียง ท้าความกล้ากับบ้านผีสิงสุดหลอน ชวนกันเล่นชิงช้าสวรรค์ นั่งม้าหมุน ถ่ายรูปคู่กับพระเจดีย์ทราย ของกินของทานเล่นมากมาย 16 เม.ย. พบกับมินิคอนเสิร์ตจากพลพล พลกองเส็ง สอบถามเพิ่มเติม : 034-540-889 / 034-540-599เทศกาลโขนกรุงศรี ปีที่ 4 : รามายณะนานาชาติ LINK
เทศกาลโขนกรุงศรี ปีที่ ๔ : รามายณะนานาชาติ จัดระหว่างวันที่ 30 มีนาคม 2566 - 3 เมษายน 2566 เวลา 16.30-22.00 น. บริเวณ ลานหลังวัดมหาธาตุ อุทยานประวัติศาสตร์พระนครศรีอยุธยา เข้าชมฟรีทุกกิจกรรม
สงกรานต์เฟสติวัล 12-18 เมษายน
ซัมเมอร์ festival 12-18 เมษายน 66
เทศกาลดนตรีที่ชวนมาสาดความันส์ไม่รู้จบ ที่ ริมทะเลนครปฐม สยามชัยหาดทรายขาว ศิลปิน ทั้ง 7 วัน L.ก.ฮ. Sprite x guygeegee Donkids โชค โชคมงคล อาม ชุติมา ปลื้ม 5G มิตร อินทิรา พัทลุง และอีกมากมาย
งานประเพณีสงกรานต์ องค์พระปฐมเจดีย์ ประจำปี 2566
งานประเพณีสงกรานต์ องค์พระปฐมเจดีย์ ประจำปี 2566 สรงน้ำพระบรมสารีริกธาตุ พระร่วงจำลอง เเห่ผ้าห่มองค์พระปฐมเจดีย์ ก่อพระเจดีย์ทราย การเเสดงวัฒนธรรมไทย ประเพณีตำเเป้งขนมจีนวัดพะเนียงเเตก ระหว่างวันที่ 13-16 เม.ย.2566 ที่วัดพระปฐมเจดีย์ จ.นครปฐมสงกรานต์นี้ที่ เมืองมัลลิกา ร.ศ. 124 วันที่ 13 -16 เมษายน 2566
สงกรานต์นี้ที่ เมืองมัลลิกา ร.ศ. 124 วันที่ 13 -16 เมษายน 2566 พบกับกิจกรรมมากมายภายในงาน - ก่อเจดีย์ทราย - ขบวนกลองยาว - ลั่นกลองชัย - การแสดงนาฏศิลป์ไทย และศิลปะพื้นบ้านมากมาย เช่น กระตั้วแทงเสือ ฟันดาบ ระบำตีไก่ และตำนานมหาสงกรานต์ เป็นต้น มุมถ่ายรูปสวยๆ ไม่ว่าจะเป็น - ️พระบรมธาตุเจดีย์ - ️ย่านเยาวราช ย่านบางรัก - ️หอคอยชมเมือง - ️ต้นเมเปิ้ล - ️และซุ้มกืจกรรมร่วมสนุก อย่างซุ้มสอยดาวและปากระป๋อง เมืองมัลลิกา ร.ศ.124 ตั้งอยู่ใน อ.ไทรโยค จ.กาญจนบุรี โทร.093-6610101, 063-0326060, 063-2214564, 034-540884
Locating The Locals วันที่ 1 - 9 เมษายน 2566 @พิพิธภัณฑ์ธนารักษ์ ขอนแก่น
Locating The Locals นิทรรศการศิลปะรูปแบบใหม่ ผสานศิลปะความเป็นไทยเข้ากับเทคโนโลยีสุดล้ำ! สนุกไปกับการเดินชมงานศิลป์ฟิน ๆ อินไปกับ Virtual Exhibition! นิทรรศการศิลปะผ่านระบบ VR เสมือนจริง! พร้อมไปเจอทุกท่านแล้วที่งาน อีสานสร้างสรรค์ วันที่ 1 - 9 เมษายน 2566 นี้! พิพิธภัณฑ์ธนารักษ์
ปฏิทินท่องเที่ยวกาญจนบุรี เดือนเมษายน
งานสงกรานต์นครพนม สรงน้ำพระธาตุประจำวันเกิด 8 ธาตุ LINK
งานสงกรานต์นครพนม มีกิจกรรมบุญประเพณีเสริมสิริมงคลที่สำคัญ สำหรับชาวนครพนมและจากจังหวัดอื่นๆ นั่น คือ การสรงน้ำพระธาตุประจำวันเกิด 8 ธาตุ แห่งนครพนม
จัดโดย ททท.นครพนม วัดทั้ง 8 พระธาตุ 7 อำเภอ ของ จ.นครพนม ได้แก่
- กิจกรรมสรงน้ำพระธาตุพนม อ.ธาตุพนม พระธาตุประจำวันอาทิตย์
- กิจกรรมสรงน้ำพระธาตุเรณู อ.เรณูนคร พระธาตุประจำวันจันทร์
- กิจกรรมสรงน้ำพระธาตุศรีคุณ อ.นาแก พระธาตุประจำวันอังคาร
- กิจกรรมสรงน้ำพระธาตุมหาชัย อ.ปลาปาก พระธาตุประจำวันพุธ
- กิจกรรมสรงน้ำพระธาตุมรุกขนคร อ.ธาตุพนม พระธาตุประจำวันพุธ
- กิจกรรมสรงน้ำพระธาตุประสิทธิ์ อ.นาหว้า พระธาตุประจำวันพฤหัสบดี
- กิจกรรมสรงน้ำพระธาตุท่าอุเทน อ.ท่าอุเทน พระธาตุประจำวันศุกร์
- กิจกรรมสรงน้ำพระธาตุนคร อ.เมือง พระธาตุประจำวันเสาร์
โขนพระราชทาน สระบุรี ตอน "หนุมานชาญกำแหง" 8-9 เมษายน 2566
โขนพระราชทาน ตอน "หนุมานชาญกำแหง" เชิญชวนชาวจังหวัดสระบุรีและจังหวัดใกล้เคียง ร่วมอนุรักษ์ศิลปวัฒนธรรมอันหาชมยาก ในระหว่างวันเสาร์ที่ 8 - วันอาทิตย์ที่ 9 เมษายน 2566 ณ วัดพระพุทธบาท ราชวรมหาวิหาร สระบุรี เปิดให้ชมโดยไม่เสียค่าใช้จ่าย ณ บริเวณลานด้านหน้าวงเวียนธรรมจักร วัดพระพุทธบาทราชวรมหาวิหาร ตั้งแต่เวลา 19.00 น. เป็นต้นไป และร่วมสักการะรอยพระพุทธบาทสิ่งศักดิ์สิทธิ์ คู่บ้านคู่เมือง ของจังหวัดสระบุรี
เที่ยวตลาดหัวปลี เปิดรับวันหยุดยาว 6-9 เมษายน 2566
6-9 เมษายน 2566 นี้ ตลาดหัวปลี เปิดรับวันหยุดยาว ให้ได้ไปท่องเที่ยวพักผ่อน เต็มเติมความสุข สุขภาพที่ดี ผ่านอาหารปลอดภัย มาทานอาหารเป็นยากันได้ ระหว่างวันที่ ตลาดเปิด
การแข่งขันจักรยานทางไกลนานาชาติ ทัวร์ ออฟ ไทยแลนด์ 1 – 10 เมษายน 2566
การแข่งขันจักรยานทางไกลนานาชาติ ทัวร์ ออฟ ไทยแลนด์ รายการ “The Princess Maha Chakri Sirindhorn’s cup Tour of Thailand 2023” ระหว่างวันที่ 1 – 10 เมษายน 2566 ใช้เส้นทางการแข่งขันจังหวัดกาญจนบุรี – ผ่านจังหวัดสุพรรณบุรี - พระนครศรีอยุธยา – ลพบุรี - สระบุรี - นครราชสีมา – ปราจีนบุรี - สระแก้ว – จันทบุรี – ระยอง
รวมระยะทาง 1,032.90 กิโลเมตร
Saraburi International Jazz Day #2 LINK
กิจกรรมครั้งนี้มีชื่อว่า “Swing & Wine” จัดขึ้นในวันอาทิตย์ที่ 30 เมษายน 2566 ฉลองวาระ “วันแจ๊สโลก” ร้าน ณ Hobby Log สระบุรี วงดนตรีที่แสดง อาทิ Sea’n Gun Brothers Siam Cubano (สยามคิวบาโน่) Jazz Big Band จากมหาวิทยาลัยราชภัฏวไลยอลงกรณ์ และพิเศษสุดคือ Project Saraburi All Stars รวบรวมวงดนตรีนักดนตรีที่ชื่นชอบดนตรีแจ๊ส ของสระบุรีเข้าไว้ด้วยกัน ไปสัมผัสความอบอุ่นกระชุ่มกระชวย ณ ชุมชนดนตรีแจ๊สแห่งสระบุรีด้วยกัน
งานบวงสรวงและสมโภชศาลหลักเมืองจังหวัดพิษณุโลก ประจำปี 2566 วันที่ 6 เมษายน 2566
เทศบาลนครพิษณุโลกจัดงานบวงสรวงและสมโภชศาลหลักเมืองจังหวัดพิษณุโลก ประจำปี 2566 ครบรอบ 27 ปี อย่างยิ่งใหญ่ เพื่อเป็นการอนุรักษ์และสืบสานประเพณีพร้อมทั้งเป็นการส่งเสริมการท่องเที่ยวเมืองพิษณุโลก วันที่ 6 เมษายน 2566 เวลา 18.00 น. ที่บริเวณศาลหลักเมืองจังหวัดพิษณุโลก
งานมหกรรมอาหารและของที่ลึก งานประเพณีสงกรานต์ พิษณุโลก ประจำปี 2566 วันที่ 9 – 15 เมษายน 2566
งานมหกรรมอาหารและของที่ลึก งานประเพณีสงกรานต์ จังหวัดพิษณุโลก ประจำปี 2566 เริ่มตั้งแต่วันที่ 9 – 15 เมษายน 2566 ณ บริเวณสวนชมน่านเฉลิมพระเกียรติ และ บริเวณสวนกลางเมือง กิจกรรมภายในงาน การจำหน่ายอาหาร และการจำหน่ายสินค้านานาชนิด ร้านอาหารที่มีชื่อเสียงในจังหวัดพิษณุโลก และได้รับป้ายรับรองอาหารสะอาด รสชาติอร่อย (Clean Food Good Taste) ตลาดย้อนยุคเมืองพิษณุโลก การแสดงดนตรีของเยาวชนในจังหวัดพิษณุโลก ระหว่างวันที่ 9 - 15 เมษายน 2566 เวลา 19.00 น. เป็นต้นไป ณ เวทีสวนกลางเมืองเทศบาลนครพิษณุโลกงานประเพณีสงกรานต์ ประจำปี 2566 วันที่ 12-15 เมษายน 2566
งานประเพณีสงกรานต์ ประจำปี 2566 มีการสาธิตการก่อเจดีย์ทราย สรงน้ำพระพุทธรูป เล่นน้ำสงกรานต์แบบไทย การละเล่นเด็กไทย รำมังคละ และกลองยาว ณ สวนกลางเมือง เทศบาลนครพิษณุโลก ในวันที่ 12 เมษายน 2566 เวลา 17.30 น. พิธีสรงน้ำพระสงฆ์ทรงสมณศักดิ์ ณ พระวิหารพระอัฏฐารส วัดพระศรีรัตนมหาธาตุวรมหาวิหาร วันที่ 13 เมษายน เวลา 07.30 น. เนื่องในวันสงกรานต์ มีพิธีทำบุญตักบาตรข้าวสารและอาหารแห้ง การปล่อยนกปล่อยปลาและการถวายผ้าห่มและสรงน้ำพระพุทธชินราช ณ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร การเล่นน้ำตามประเพณีสงกรานต์ ในกิจกรรม “ถนนเล่นน้ำสงกรานต์วิถีไทยสองแคว” ณ บริเวณสวนกลางเมืองพิษณุโลก และถนนสายต่างๆ ในเขตเทศบาลนครพิษณุโลก จัดน้ำพลุลีลา บริเวณวงเวียนสถานีรถไฟ ขบวนแห่อัญเชิญพระพุทธชินราชจำลอง และขบวนแห่นางสงกรานต์ ของการท่องเที่ยวแห่งประเทศไทย สำนักงานพิษณุโลก เทศบาลนครพิษณุโลก สภาวัฒนธรรม-เทศบาลนครพิษณุโลก และเครือข่ายชุมชนในเขตเทศบาลนครพิษณุโลก ช่วงค่ำมีพิธีเปิดงานประเพณีสงกรานต์ ประจำปี 2566 ณ เวทีสวนชมน่านเฉลิมพระเกียรติภายในงานมี การประกวดนางสงกรานต์ ช่วงกลางวันถึงช่วงค่ำระหว่างวันที่ 13-15 เมษายน มีกิจกรรมถนนเล่นน้ำสงกรานต์วิถีไทยสองแคว น้ำพุอุโมงค์น้ำตก และน้ำพลุลีลา บริเวณวงเวียนสถานีรถไฟ และบริเวณถนนสายต่าง ๆ ภายในเขตเทศบาลนครพิษณุโลก ซึ่งปีนี้ทางเทศบาลจัดเตรียมน้ำให้ประชาชนได้เล่นน้ำคลายร้อนกันอย่างชุ่มฉ่ำ หลังจากงดการเล่นน้ำสงกรานต์เนื่องสถานการณ์โควิดที่ผ่านมา Night Tram Tour นั่งรถรางชมเมืองพิษณุโลกยามค่ำ เดือนเมษายน 66 ฟรี
Night Tram Tour นั่งรถรางชมเมืองพิษณุโลกยามค่ำ ตลอดทั้งเดือนเมษายน ฟรี !
รอบรถรางมีกำหนดวิ่งในวันที่ 1-2 / 6 / 8-9 / 13-16 / 22-23 / 29-30 เมษายน 2566 วันละ 1 รอบ เวลา 18.00น. เท่านั้น จุดจอดรถราง จะอยู่ในวัดพระศรีรัตนมหาธาตุวรมหาวิหาร
พิเศษ ! สำหรับนักท่องเที่ยวที่เข้าพักในจังหวัดพิษณุโลก โชว์สลีปใบเสร็จที่พักในจังหวัดพิษณุโลก เพื่อรับ Set อาหารถิ่น พร้อมเครื่องดื่ม ฟรี
สนใจสำรองที่นั่งทักแชท Line@ : tatphitlok ได้เลย สอบถามข้อมูลเพิ่มเติมโทร. 055252742-3
HUT-เล่น : Green Market 20 วันที่ 29-30 เมย. 2566
HUT-เล่น : Green Market 20 งานเทศกวนท้าลมร้อน ที่ทดลอง กวนรวมสินค้าน่าลุ้นน่าลองเกือบ ครึ่งร้อยกว่าร้านค้า ในบรรยากาศ สวนป่าใต้ร่มไม้ที่ร่มรื่นณ์ พร้อมกิจกรรมและนิทรรศการศิลป่วน สุดสร้างสรรค์มาให้ได้รู้ ได้ลอง ได้เล่น ร่วมกันแบบ "Interactive Doodle Art" งานมีวันที่ 29-30 เมย. 2566 นี้ เวลา 10.00 - 17.00 น ณ พื้นที่สวนป่าในเมือง สวนพฤกษศาสตร์ เหมืองผาแดง
กิจกรรมเปิดสวนมะยงชิด ต้อนรับสงกรานต์ 5-17 เม.ย.66
กิจกรรมเปิดสวนมะยงชิดครั้งแรก ต้อนรับสงกรานต์ 5-17 เม.ย.66 นี้ กิจกรรมน่ารักๆ ไปเที่ยวกันครับ มาชิมมะยงชิดสดจากต้น เลือกเก็บตามใจชอบทุกไซส์ทุกขนาด ก.ก. ละ 49 บาท บ้านคลองห้วยทรายใกล้ๆ นี่เองครับ
ประเพณี ปอยส่างลอง อำเภอแม่สอด วันที่ 3-5 เมษายน 2566
เทศบาลตำบลท่าสายลวดร่วมกับวัดไทยวัฒนารามเเละชมรมเครือไตท่าสายลวด ขอเชิญร่วมสืบสานประเพณี ปอยส่างลอง บรรพชาสามเณร ภาคฤดูร้อน ณ วัดไทยวัฒนาราม หมู่ที่ 1 ตำบลท่าสายลวด อำเภอแม่สอด จังหวัดตาก ระหว่างวันที่ 3-5 เมษายน 2566
อยากชวนเธอ...มาเที่ยวสงกรานต์เมืองตาก 13-15 เมษายน 2566


ททท. สำนักงานตาก "อยากชวนเธอ...มาเที่ยวสงกรานต์เมืองตาก" #เที่ยวตาก ชวนร่วมสรงน้ำหลวงพ่อแสนทอง พร้อมขบวนแห่ สรงน้ำพระพุทธรูปประจำชุมชน ทั้ง 16 ชุมชน วนรอบเมือง เพื่อความเป็นสิริมงคลให้กับชาวเมืองตาก #สงกราต์แบบเต็มคาราเบล #ครั้งนี้ยิ่งใหญ่แน่นอน #สงกรานต์เมืองตาก #ปาร์ตี้สงกรานต์เมืองตาก สำหรับกิจกรรมสงกรานต์ ปีนี้ ชาวเมืองตากได้มีเฮ แบบเต็มคาราเบลไปเลย อัดอั้นกันมานานแล้ว ปีนี้เป็นมหาสงกรานต์ที่ยิ่งใหญ่กันแน่ๆ #สงกรานต์เมืองตาก "ไม่มาไม่ได้แล้ว" มาสนุก มามันส์ กับกิจกรรมมากมาย อาทิเช่น 13 เม.ย.66 กิจกรรม ดังนี้ #ทำบุญตักบาตรในวันสงกรานต์ ณ วัดมณีบรรพตวรวิหาร (วัดเขาแก้ว เริ่มตัังแต่เวลา 06.00 - 08.00 น.) #พิธีอัญเชิญหลวงพ่อแสนทอง #ขบวนแห่อัญเชิญหลวงพ่อแสนทองรอบเมืองตาก #ปาร์ตี้โฟม #อุโมงค์น้ำ #สวนสนุกบ้านลมและบ้านบอล #กิจกรรมการประกวดหนูน้อยสงกรานต์Smart Kids รุ่นอายุ 3-6 ปี เวลา 17.00-19.00 น. ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก #กิจกรรมการประกวดแข่งขันTak Cover Dance Contest 2023 เวลา 19.30 น. เป็นต้นไป ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก 14 เม.ย.66 กิจกรรม ดังนี้ #กิจกรรมการประกวดหนูน้อยสงกรานต์Smart Kids รุ่นอายุ 7-10 ปี เวลา 17.00-19.00 น. ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก #กิจกรรมการประกวดธิดามหาสงกรานต์ "นางฟ้าจำแลง"(รับสมัครสาวประเภทสอง) เวลา 18.00 น. เป็นต้นไป ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก #ปาร์ตี้โฟม #อุโมงค์น้ำ #สวนสนุกบ้านลมและบ้านบอล 15 เม.ย.66 กิจกรรม ดังนี้ #ปาร์ตี้โฟม #อุโมงค์น้ำ #สวนสนุกบ้านลมและบ้านบอล #กิจกรรม "ปาร์ตี้สงกรานต์เมืองตาก 2023" #ชมคอนเสิร์ตสุดมันส์ "นักดนตรีในเมืองตากที่มารวมตัวกัน ร่วมส่งความสุขและความสนุกสนาน ให้กลับมากันอีกครั้งที่ยิ่งใหญ่... เริ่มตั้งแต่เวลา 15.00 น. - 22.00 น.. ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก
กิจกรรม ปาร์ตี้สงกรานต์เมืองตาก 2023 - 15 เม.ย.66
15 เม.ย.66 กิจกรรม "ปาร์ตี้สงกรานต์เมืองตาก 2023" ชมคอนเสิร์ตสุดมันส์ "นักดนตรีในเมืองตากที่มารวมตัวกัน ร่วมส่งความสุขและความสนุกสนาน ให้กลับมากันอีกครั้งที่ยิ่งใหญ่... ปาร์ตี้โฟม #อุโมงค์น้ำ #สวนสนุกบ้านลมและบ้านบอล เริ่มตั้งแต่เวลา 15.00 น. - 22.00 น.. ณ ลานเวทีด้านเหนืออาคารกิตติคุณ อำเภอเมืองตาก จังหวัดตาก
เย็นทั่วหล้า มหาสงกรานต์ สุพรรณบุรี” ประจำปี 2566 (ครั้งที่ 12) 13 - 15 เมษายน 2566


13 - 15 เมษายน 2566 เวลา 10.00 - 18.00 น. ณ บริเวณถนนอาทิวราห์ อำเภอเมืองสุพรรณบุรี จังหวัดสุพรรณบุรี กิจกรรมต่าง ๆ ภายในงาน ในวันที่ 13 เมษายน 2566 เวลาประมาณ 15.00 น.เป็นต้นไป ชมขบวนแห่หลวงพ่อโตทองคำและสิ่งศักดิ์สิทธิ์ของจังหวัดสุพรรณบุรี ขบวนแห่สงกรานต์ รถบุปผชาติ ของส่วนราชการจังหวัด และอำเภอ 10 อำเภอ ที่สอดแทรกวิถีชีวิต วัฒนธรรม ประเพณี ที่แสดงถึงเอกลักษณ์ของแต่ละอำเภอ เส้นทางขบวน ปล่อยขบวนแห่ ณ จุดตั้งขบวนบริเวณวัดไชนาวาส อำเภอเมืองสุพรรณบุรี เคลื่อนขบวนตรงไปถนนพระพันวษา ผ่านสถานีตำรวจภูธรเมืองสุพรรณบุรี สี่แยกนางพิม ผ่านจุดชมขบวนถึงสี่แยกเทศบาลเมืองสุพรรณบุรี เลี้ยวซ้ายเข้าถนนหมื่นหาญ ตรงไปถึงสี่แยกไฟแดงถนนเณรแก้ว เลี้ยวขวาเข้าถนนอาทิวราห์ ฝั่งสี่ช่องจราจร และสิ้นสุดขบวนแห่ ณ เวทีกลาง บริเวณลานกว้าง ใกล้กับสำนักงานคณะกรรมการการเลือกตั้งประจำจังหวัดสุพรรณบุรี และในวัน 14 - 15 เมษายน 2566 ยังมีการประกวดเทพีสงกรานต์ ประจำปี 2566 การแสดงคอนเสิร์ตวงดนตรีลูกทุ่ง “ในปีนี้ จังหวัดสุพรรณบุรีได้มีการจัดถนนเล่นน้ำและอุโมงค์น้ำบนถนนอาทิวราห์ “
สงกรานต์วิถีใหม่ แต่งไทย เที่ยวหลาดย้อนยุค สนุกกับการละเล่น วันที่ 11-12 เมษายน 2566
"สงกรานต์วิถีใหม่ แต่งไทย เที่ยวหลาดย้อนยุค สนุกกับการละเล่น" ในสไตล์คลาสสิคแบบไทยๆ ที่จะพาทุกท่านย้อนวันวานไปสัมผัสบรรยากาศ สบายๆ เป็นกันเอง วันที่ 11-12 เมษายน 2566 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ บริเวณสะพานนริศ อ.เมืองจ.สุราษฎร์ธานี มีกิจกรรมที่น่าสนใจมากมาย อาทิ ✅ชม ชิม ช๊อป เที่ยวตลาดย้อนยุค ✅ อิ่มเอมกับอาหารท้องถิ่นทั้งคาวหวาน ✅ก่อเจดีย์ทราย ✅ การรำวงเวียนครก ที่เป็นสิ่งไม่ควรพลาดสำหรับคนที่รักในเสียงเพลง
กิจกรรมในชลบุรี เมษายน 66
Songkran fun for Kids (สงกรานต์ฟันน้ำนม) ที่แรกในพัทยา 15 เมษายน 2566
สงกรานต์นี้ อาร์ทเวนเจอร์มีจัดกิจกรรม Songkran fun for Kids (สงกรานต์ฟันน้ำนม) ที่แรกในพัทยา ถนนสงกรานต์สำหรับเด็ก ซึ่งในงานมีกิจกรรมให้เข้าร่วมมากมาย ได้แก่
- กิจกรรมวาดภาพ Street Art by Sand
- ศิลปะ ติด ศิลปินน้อย
- Stromp Percussion and Drum (หนุกหนาน)
- ฉีดน้ำ Gun
- Face Paint
โชว์พิเศษ Art Fire Show ศิลปะแห่งไฟ ในเวลา 19.00-19.30 น.
การแสดงดนตรีสด mini concert 19.30-21.00 น.
แล้วพบกันนะคะ 15 เมษายนนี้ เวลา 15.00-21.00 น.
Koh Tao’s SPOTLIGHT FEST 7-9 เมษายน 2566 LINK
Koh Tao’s SPOTLIGHT FEST เทศกาลท่องเที่ยวเกาะเต่าหัวใจยั่งยืน 2023 วันที่ 7-9 เมษายน 2566 @ Sairee Beach O chai Bungalow เทศกาลท่องเที่ยวเกาะเต่าหัวใจยั่งยืน 2023 สัมผัส … แสงแห่งความรู้รักษ์ธรรมชาติ แสงแห่งเศรษฐกิจสีเขียว แสงแห่งพลังชุมชน แสงแห่งการจัดการการท่องเที่ยวอย่างรับผิดชอบและมุ่งเป้าความยั่งยืน และ 12 กิจกรรม เพื่อสิ่งแวดล้อม ที่แฝงไว้ด้วยความสนุก และเอกลักษณ์ในแบบเกาะเต่า
Suratthani Songkran Festival 2023 เซ็นทรัล สุราษฎร์ธานี
สงกรานต์นี้ห้ามพลาด!! มาสาดความสนุกสุดมันส์ไปกับงาน Suratthani Songkran Festival 2023 ปาร์ตี้สงกรานต์ที่ยิ่งใหญ่ที่สุดในจ.สุราษฎร์ธานี ชมฟรี!! คอนเสิร์ตจากศิลปินชื่อดัง DJs พร้อมพริตตี้สาวสวย ตลอด 2 วันเต็ม
12 เม.ย. : พบกับ LazyLoxy & SamBlack และมันส์ไปกับ DJ Spin
13 เม.ย. : พบกับ MEAN และ DJ สาวสวยสุดเซ็กซี่ Joy Lila
ร่วมฉลองสงกรานต์มหาบันเทิงไปด้วยกัน 12-13 เม.ย. 66 ณ ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล สุราษฎร์ธานี
การแสดงโชว์ว่าวนานาชาติจากแชมป์โลก 14-17 เม.ย. 2566
ตื่นตา ตื่นใจ กับการแสดงโชว์ว่าวนานาชาติจากแชมป์โลก และว่าวหลากหลายรูปแบบ หลากสีสัน บนท้องฟ้า กว่า 50 ตัว สนุกกับการถ่ายรูปเช็คอินกับบอลลูนยักษ์สุดว้าว เตรียมตัว พกกล้องให้พร้อมแล้วมาเที่ยวกัน วันที่ 14-17 เม.ย. 2566 ณ ลานกิจกรรมหน้า ศูนย์การค้าเซ็นทรัล สุราษฎร์ธานี
ปลุกตำนาน สงกรานต์ กาดสวนแก้ว 11-15 เมษายน 2566
ปลุกตำนาน สงกรานต์ กาดสวนแก้ว 11-15 เมษายน 2566 ณ กาดสวนแก้ว เชียงใหม่
คืนชีพอีกครั้ง กับงานสงกรานต์ที่เป็นระดับตำนาน ของชาวเชียงใหม่ พบกับ ดนตรี แสง สี เสียง และ DJ MC สุดจ๊าบ สวนอาหาร สวนสนุก เครื่องดื่มจัดเต็ม
11 เม.ย. DJ CHINGCHAR & DJ CAEAMEL
12 เม.ย. DJ CHINGCHAR & DJ CAEAMEL
13 เม.ย. DJ CAEAMEL & DJ BANK MX
14 เม.ย. DJ หมวย & DJ SWAGMOY
15 เม.ย. DJ KIKKII & DJ KOALA
เชิญแอ่วและเล่นน้ำสงกรานต์ ณ ถนนข้าวแต๋น ปลอดเหล้าเบียร์ @ น่าน 2566
เทศบาลเมืองน่าน ร่วมกับ เครือข่ายองค์กรงดเหล้าจังหวัดน่าน สสส. ธนาคารกสิกรไทยและหน่วยงานภาคี เชิญแอ่วและเล่นน้ำสงกรานต์ ณ ถนนข้าวแต๋น ปลอดเหล้าเบียร์ @ น่าน 2566 (ถนนสุมนเทวราช ช่วงวันที่ 13-16 เมษายน 2566 ตั้งแต่สี่แยกประตูน้ำเข็มถึงสี่แยกหัวเวียงใต้) ภายใต้แนวคิด “SONGKRAN 4 RETURN 2023 คุณค่า ความสุข ความสนุก ความปลอดภัย กำลังจะกลับมา” จุ่มอกเย็นใจสุขสลีปี๋ใหม่เมือง2566
งานการะวะ บรวงสรวงพญาผานอง อ.ปัว 12 เมษายน 2566
งานการะวะ บรวงสรวงพญาผานอง ในวันที่ 12 เมษายน 2566 ณ อนุสาวรีย์พญาผานอง หน้าที่ว่าการอำเภอปัว ขบวนแห่เริ่มเวลา 09.00 น. และเชิญเที่ยวงานสงกรานต์ ณ สวนสาธารณะอ่างเก็บน้ำ ร.ศ. 200 เริ่มงานตั้งแต่วันที่ 12 - 14 เมษายน 2566 ในงานพบกับขบวนสรงน้ำพระ เวทีน้ำ ปาร์ตี้โฟม ดีเจ Music Festival ดนตรีสด Cover Danceงานประเพณีสงกรานต์และสมโภชพระหลักเมืองน่าน วัดมิ่งเมือง
ขอเชิญร่วมงานประเพณีสงกรานต์และสมโภชพระหลักเมืองน่าน วัดมิ่งเมือง สระสรง ไหว้สา ปูจาพระหลักเมืองน่าน ประจำปี 2566 ระหว่างวันที่ 11 - 15 เมษายน 2566 ณ มณฑลพิธีศาลพระหลักเมืองน่าน
งานประเพณีสงกรานต์ (ปี๋ใหม่เมือง) อำเภอเชียงกลาง
เทศบาลตำบลเชียงกลาง ขอเชิญชวนเที่ยวงานประเพณีสงกรานต์ (ปี๋ใหม่เมือง) ระหว่างวันที่ 12-15 เมษายน 2566 ณ ลานศาลเจ้าพ่อพญาไมย ตำบลเชียงกลาง อำเภอเชียงกลาง จังหวัดน่าน มีการจัดกิจกรรมมากมาย
สระสรง ไหว้สา ปูชาพระหลักเมืองน่าน ประจำปี 2566
งานประเพณีสมโภชสรงน้ำพระราชทานพระหลักเมืองน่าน และสืบชาตาหลวงเมืองน่าน ในเทศกาลสงกรานต์ 2566 ระหว่างวันที่ 11-15 เมษายน 2566 ณ มณฑลพิธีศาลพระหลักเมืองน่าน
-วันที่ 11 เมษายน 2566 ขบวนแห่น้ำสรงพระราชทานของพระบาทสมเด็จพระเจ้าอยู่หัว พระบรมสารีริกธาตุ และพระพุทธรูปสำคัญ จาก 11 วัด พิธีเจริญพระพุทธมนต์ และพิธีสวดเบิก สมโภชน้ำสรงพระราชทาน
-วันที่ 12-14 เมษายน 2566 สรงน้ำพระหลักเมืองน่าน ถวายบูชาสักการะพระบรมสารีริกธาตุ ร่วมทอดผ้าป่าสามัคคี ชมการประกวดร้องเพลง และกลองพื้นบ้าน
-วันที่ 15 เมษายน 2566 พิธีสรงน้ำพระราชทานของพระบาทสมเด็จพระเจ้าอยู่หัว พระหลักเมืองน่าน บวงสรวงบูชาพระหลักเมืองน่าน และพิธีสืบชาตาหลวงเมืองน่าน
งานแข่งเรือเชื่อมความสัมพันธ์ ระหว่างตำบล ผาตอ-แสนทอง
งานแข่งเรือเชื่อมความสัมพันธ์ ระหว่างตำบล ผาตอ-แสนทอง วันที่ 13 เมษายน พ.ศ. 2566 ณ. บริเวณลำน้ำยาว ท่าน้ำสวนสาธารณะบ้านนาหนุน 1,2,3 ตำบลผาตอ-แสนทอง อำเภอท่าวังผา จ.น่าน โดย องค์การบริหารส่วนตำบลผาตอ / องค์การบริหารส่วนตำบลแสนทอง สภาวัฒนธรรมตำบลผาตอ / สภาวัฒนธธรมตำบลแสนทอง
งานเลี้ยงป่างเจ้าป่อ อ.เวียงสา จ.น่าน วันที่ 11 - 12 เมษายน 2566
ขอเชิญเที่ยวงาน "เลี้ยงป่างเจ้าป่อ" วันที่ 11 - 12 เมษายน 2566 ในงานมีพิธีพุทธาภิเษกรูปเหมือนเจ้าป้อ พิธีบวงสรวง (พิธีขึ้นเจ้าตี่ เลี้ยงเจ้าป่อ) ชมการแข่งข้นเปตองผู้สูงอายุและประเภทบุคคลทั่วไป, การแข่งข้นกีฬาพื้นบ้าน, การแบ่งข้นยิงก๋ง, การแข่งข้นกีฬาทางน้ำอีกหลายรายการ, การจำหน่ายสินค้าชุมชน และสนุกสนานกับรำวงย้อนยุคคณะดวงเดือนมิวสิค ณ ลานศาลเจ้าพ่อช้างงาแดง ต.น้ำมวบ อ.เวียงสา จ.น่าน
วงาน "ฮอดสะหลี๋ ปี๋ใหม่ ม่วนใจ๋ ตี้ล้องปูทา" 2566 อำเภอสันติสุข 11 - 12 เมษายน 66
ขอเชิญเที่ยวงาน "ฮอดสะหลี๋ ปี๋ใหม่ ม่วนใจ๋ ตี้ล้องปูทา" 66 วันที่ 11 - 12 เมษายน 66 ณ ที่ว่าการอำเภอสันติสุข จ.น่าน พบกิจกรรมภายในงาน การแข่งเรือยาว, การแข่งเรือยาง, การประกวดร้องเพลงไทยลูกทุ่ง, การประกวดคนงามสันติสุข, การประกวดรำวงประยุกต์และร่าวงย้อนยุค, การแข่งขันกีฬา อาทิเช่น ฟุดบอล เซปักตระกร้อ, การจำหน่ายสินค้า 0TOP, ตลาดนัด และกิจกรรมอื่น ๆ อีกมากมาย
กิจกรรม "กาดมะเก่าแลกเบี้ย" ภายในเทศกาลน่านบันดาลใจ ครั้งที่ 3 Nan Art and Craft Festival 2023
ขอชวนนักท่องเที่ยวทุกคนมาร่วมสนุกกับกิจกรรม "กาดมะเก่าแลกเบี้ย" ภายในเทศกาลน่านบันดาลใจ ครั้งที่ 3 Nan Art and Craft Festival 2023 พื้นที่สร้างสรรค์น่าน ร่วมกิจกรรมด้วยการแต่งกายด้วยชุดพื้นเมืองล้านนา (น่าน) แอ่วกาดมะเก่า แลกเบี้ย (ใช้หอยเบี้ยแทนเงินสด)ใช้จ่ายใน โซนกาดหมั้วคัวศิลป์ และโซนกาดหมั้วครัวล่องน่าน ภายใน "งานวันพระเจ้าน่าน มรดกน่าน มรดกไทย" ระหว่างวันที่ 2 - 5 เมษายน 2566 ตั้งแต่เวลา 15.00 น. - 21.00 น. ณ พื้นที่ลานกิจกรรมข่วงน้อย เทศบาลเมืองน่าน ตำบลในเวียง อำเภอเมืองน่าน จังหวัดน่าน เทศกาลน่านบันดาลใจ เทศการแห่งแรงบันดาลใจ การต่อยอด สานต่อ งานหัตถกรรม และศิลปะพื้นบ้าน จังหวัดน่าน
งาน วันมรดกน่าน สืบสานมรดกไทย และวันรำลึกพระเจ้าน่าน สืบสานตำนานนันทบุรี 2-5 เมษายน 2566
ขอเชิญเที่ยวงาน "วันมรดกน่าน สืบสานมรดกไทย และวันรำลึกพระเจ้าน่าน สืบสานตำนานนันทบุรี" เทิดพระเกียรติสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ในโครงการเพิ่มขีดความสามารถด้านการแข่งขันและยกระดับการท่องเที่ยวน่านสู่ท่องเที่ยวคุณภาพสูง ระหว่างวันที่ 2-5 เมษายน 2566 ณ ข่วงเมืองน่าน และพิพิธภัณฑสถานแห่งชาติ น่าน
งานตลาดมหัศจรรย์ ของดีเมืองน่าน ครั้งที่ 1 วันที่ 28 เมษายน - 1 พฤษภาคม 2566
งานตลาด "มหัศจรรย์ ของดีเมืองน่าน" ครั้งที่ 1 จัดระหว่างวันที่ 28 เมษายน - 1 พฤษภาคม 2566 ณ ห้างสรรพสินค้า Lotus สาขาน่าน เวลา 10.00-18.00 น. โดยโครงการนี้ เป็นโครงการต่อเนื่องตลอดปี 2566 จัดขึ้นโดย สำนักงานพัฒนาชุมชนจังหวัดน่าน สำนักงานเกษตรจังหวัดน่าน ร่วมกับ สำนักงานด้านความยั่งยืนและพัฒนาชุมชน จ.น่าน เครือเจริญโภคภัณฑ์ และห้างสรรพสินค้า Lotus สาขาน่าน เพื่อเปิดพื้นที่ให้ร้านค้าชุมชนได้มีโอกาสพบปะกับผู้ซื้อโดยตรง
งาน ลอง หละ ปูน ซิมโฟนีคีตล้านนา เมืองรอง...ที่ต้องลอง 14-16 เมษายน 2566
งาน ลอง หละ ปูน ซิมโฟนีคีตล้านนา เมืองรอง...ที่ต้องลอง มหกรรมไฟประดับหละปูนวิจิตร Synchronized Music Fountain นํ้าพุดนตรี ประกอบแสง สี เสียง ขับขานประวัติศาสตร์ผ่านน่านน้ำบนดิน ครั้งแรกของเมืองไทย ชิมโฟนีคีตล้านนา จากศิลปินล้านนาร่วมสมัย 14-16 เมษายน 2566 ณ ศาลากลางจังหวัดลำพูน (หลังเก่า) พบกับ กาดเก่าเล่าเรื่อง เมืองหละปูน ตลาดต้องชม..ต้องชิม กับสารพัดอาหารและสินค้า ณ ศาลากลาง จังหวัดลำพูน (หลังเก่า) อินทยงยศถนนสายวัฒนธรรม เล่าขานตำนาน ร่วมสมัยร้อยปีลำพูน ณ ถนนอินทยงยศ
พิธีบวงสรวงและพิธีพุทธาภิเษก ท้าวเวสสุวรรณโณ ยักษ์วัดใต้
เชิญร่วมงานบุญประจำปี พิธีบวงสรวงและพิธีพุทธาภิเษก วันที่ 14-15-16 เมษายน พ.ศ. 2566 ณ วัดปากข้าวสารใต้ จ.สระบุรี กราบไหว้ขอพรปู่ท้าวเวสสุวรรณโณ ไพศรณ์อำนวยทรัพย์ ( ยักษ์วัดใต้ ) ให้เกิดความเป็นสิริมงคล พร้อมทั้งสนุกกับ หนังกลางแปลง รำวงย้อนยุค ตักไข่ปลาการกุศลทุกคืนกับของรางวัลอีกมากมาย
กินปลาหน้าเขื่อนชวนเพื่อนเที่ยว @ห้วยหนองโรง 25 เมษายน - 1 พฤษภาคม 66
กินปลาหน้าเขื่อนชวนเพื่อนเที่ยว @ห้วยหนองโรง 25 เมษายน - 1 พฤษภาคม 66 ฟรีคอนเสิร์ตทุกค่ำคืน จัดโดยอบต.กะบกเตี้ย อ.เนินขาม จ.ชัยนาท
งานมหกรรมกลองนานาชาติ พิธีไหว้ครูกลอง ครั้งที่ 12 วันที่ 18-23 เมษายน 2566
งานมหกรรมกลองนานาชาติ พิธีไหว้ครูกลอง ครั้งที่ 12 วันที่ 18-23 เมษายน 2566 บริเวณหมู่บ้านทำกลอง ตำบลเอกราช อำเภอป่าโมก จังหวัดอ่างทอง 18 เม.ย. ST BAND 19 เม.ย. เจน ไทรถแห่ 20 เม.ย. SB BAND 21 เม.ย. บรรพต ไหทองคำ 22 เม.ย. วงเก๋าซึม 23 เม.ย. เนสกาแฟ ศรีนคร
งาน พาณิชย์ BIG SALE ฉะเชิงเทรา 28-30 เมษายน 2566
งาน พาณิชย์ BIG SALE ชม ชิม ช้อป สินค้าราคาประหยัด พาณิชย์ On Tour จังหวัดฉะเชิงเทรา
28-30 เมษายน 2566 บริเวณลานพื้นที่สนามยิงปืน อำเภอเมือง จังหวัดฉะเชิงเทรา
พบกับ มินิคอนเสิร์ต ของดีราคาโดนใจ และ โปรโมชั่นดีๆอีกมากมาย เชิญชวนประชาชนจังหวัดฉะเชิงเทราและพื้นที่ใกล้เคียง เลือกชื้อสินค้าอุปโภค บริโภคราคาประหยัด ในงาน “พาณิชย์...ลดราคา! ออนทัวร์ ทั่วไทย จังหวัดฉะเชิงเทรา" จำหน่ายสินค้าที่จำเป็นต่อการครองชีพแก่ประชาชน ในราคาประหยัดกว่าท้องตลาด และสินค้าอื่น ๆ กว่า 100 บูธ งานเริ่ม เวลา 10-19 น. หรือจนกว่าสินค้าจะหมด ชื้อสินค้าภายในงานครบ 200 บาท รับคูปอง ลุ้นทองคำ เครื่องใช้ไฟฟ้า
เทศกาลกินกุ้งและของดี อำเภอบางแพ วันที่ 27-30 เมษายน 2566
โอกาสไปกินกุ้งอร่อยมาแล้ว ในงานเทศกาลกินกุ้งและของดี อ.บางแพ ณ ที่ว่าการอำเภอบางแพ จ.ราชบุรี วันที่ 27-30 เมษายน 2566 จัดโดยอ.บางแพ ในงานจะได้พบกับกุ้งสดคุณภาพ ราคาถูก จากเกษตรกรโดยตรง สินค้า otop สินค้าเกษตร สินค้าชุมชน การแสดงศิลปวัฒนธรรมชุมชน และเยาวชน อ.บางแพ
ชวนเที่ยวตลาดคลองผีเสื้อ อ.สามพราน 23 เมษายน 2566
ตลาดคลองผีเสื้อ ร้าน MADi ณ ลัดอีแท่น ชุมชนเกาะลัดอีแท่น อ.สามพราน จ.นครปฐม
วันอาทิตย์ที่ 23 เมษายน 2566 เวลา 10.00-15.00 น.
MADi ณ ลัดอีแท่น หวนคืนวันวานคลองผีเสื้อในความทรงจำ ผสมผสาน ตลาดน่ารัก พร้อมแม่ค้าพ่อค้าที่จะส่งตรงสินค้าสดๆ จากสวน จากไร่ ที่ดูแลด้วยหัวใจ ให้นักท่องเที่ยวทุกท่านได้ลิ้มลองกันเลย ของดี ๆ ที่นาน ๆ จะรวบรวมตัวกันสักครั้ง
- เลือกซื้อส้มโอมลฑลนครไชยศรีของแท้ แห่งเกาะลัดอีแท่น
- ผักปลอดสาร น้ำอ้อยออแกนิคที่หวานหอม ชื่นใจ
- ขนมทองม้วน ที่ใช้กระทิคั้นสดๆ จากมะพร้าวแห่ง ต.ท่าตลาด
- กล้วยหอมทองสด ๆ ฝานบาง ๆ ทอดร้อน ๆ หวานกรอบใน 3 โลก
- มะพร้าวน้ำห๊อมหอม ชาวสามพรานคอนเฟริม
- สินค้าสุขภาพจากส้มโอหนึ่งเดียวที่ผสานระหว่างภูมิปัญญาและนวัตรกรรม แบบน่าหลงไหล
- นิทรรศกาลภาพถ่ายวิถีชีวิตชุมชน
- กิจกรรมล่องแพ เข้าสวนเก็บส้มโอ
เทศกาลฤดูร้อน Nasatta Summer Flower Carnival ครั้งที่ 2 วันที่ 12 เมษายน – 30 กรกฎาคม 2566
เทศกาลฤดูร้อน Nasatta Summer Flower Carnival ครั้งที่ 2 ที่ ณ สัทธา อุทยานไทย อ.บางแพ จ.ราชบุรี วันที่ 12 เมษายน – 30 กรกฎาคม 2566 ทุกวันพุธ ถึง วันอาทิตย์ร่วมถึงวันนักขัตฤกษ์
งานเปิด 09:00-17:30 น. (วันพุธ ถึง วันศุกร์) 09:00-18:00 น. (วันเสาร์ อาทิตย์ และนักขัตกฤษ์)
สามารถซื้อบัตรได้ที่หน้างาน
Ratchaburi Sunset Cruise ล่องเรือชมวิถีชีวิตสองฝั่งริมน้ำแม่กลอง สงกรานต์นี้ 13-16 เมษายน 66
Ratchaburi Sunset Cruise ล่องเรือชมวิถีชีวิตสองฝั่งริมน้ำแม่กลอง และชมบรรยากาศพระอาทิตย์ตกดินสุดโรแมนติก บริเวณสะพาน 3 ยุค - สะพานธนะรัชต์ - สะพานจุฬาลงกรณ์ - สะพานรถไฟคานขึงแห่งแรกของประเทศไทย สงกรานต์นี้ 13-16 เมษายน 66 เปิดให้บริการทุกวันศุกร์ เสาร์ และอาทิตย์ ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ ท่าเรือตลาดโคยกี๊ อำเภอเมือง จังหวัดราชบุรี สอบถามเพิ่มเติมและจองที่นั่ง : โทร. 096 – 1404 457
งานวิ่ง Night Run Suphanburi 2023 - 29 เมษายน 2566
งานวิ่ง "Night Run Suphanburi 2023" ณ สวนเฉลิมภัทรราชินี และหอคอยบรรหาร-แจ่มใส ในวันเสาร์ที่ 29 เมษายน 2566 นี้ ระยะวิ่ง 6.6 KM. / 10 KM. (Chip Time)
งาน ประเพณีบุญเดือน 6 ประจำปี 2566
งาน ประเพณีบุญเดือน 6 ประจำปี 2566 ระหว่างวันที่ 24 เมษายน - 2 พฤษภาคม 2566 บริเวณ ศาลเจ้าพ่อพญาแล ตำบลในเมือง อำเภอเมือง จังหวัดชัยภูมิ
สืบสานประเพณี วันสงกรานต์ ชัยภูมิ ประจำปี 2566
เทศบาลเมืองชัยภูมิ ขอเชิญร่วมสืบสานประเพณี วันสงกรานต์ ประจำปี 2566 ในวันพฤหัสบดี ที่ 13 เมษายน 2566 เริ่มตั้งแต่เวลา 06.00 น เป็นต้นไป หน้าอนุสาวรีย์พระยาภักดีชุมพล(แล) จังหวัดชัยภูมิ ร่วมกิจกรรม
- ทำบุญตักบาตร : ข้าวสาร อาหารแห้ง
- สรงน้ำพระพุทธรูป
- สรงน้ำรูปหล่อเหมือนหลวงปู่หลักคำ
- สรงน้ำรูปหล่อเหมือนเจ้าพ่อพญาแล
- รดน้ำขอพรผู้ใหญ่ เพื่อเป็นสิริมงคล
- ขบวนแห่สงกรานต์รอบเมือง
งานหาบน้ำเขื่อนฮดธาตุ ปี 2566 สงกรานต์ วันที่ 12-16 เมษายนนี้ เจอกันที่
การท่องเที่ยวแห่งประเทศไทย จับมือ จังหวัดชัยภูมิ ชวนร่วมงานเทศกาลประเพณีหาบน้ำเขื่อนฮดธาตุ ณ พระธาตุชัยภูมิ ระหว่างวันที่ 12 –16 เมษายน 2566 ณ อรุณธรรมสถาน หรือที่รู้จักกันในชื่อของพระธาตุชัยภูมิ อ. แก้งคร้อ จ. ชัยภูมิ พบกับพิธีโบราณอันศักดิ์สิทธิ์และขบวนแห่น้ำเขื่อนฮดธาตุ การออกร้านจำหน่ายสินค้าชุมชนกว่า 30 ร้าน การแสดงวัฒนธรรมพื้นถิ่น ทั้งการฟ้อนรำ วงโปงลาน และวงแคน รวมถึงคอนเสิร์ตจากศิลปินมากมาย อาทิ แตงโม, ไข่มุก, หมู จากเวที The Voice Thailand และเป่า กิ่งกาญจน์ สำหรับผู้สนใจเดินทางท่องเที่ยวชมงานในช่วงเวลาดังกล่าว สามารถดูรายละเอียดสถานที่พักและสถานที่ท่องเที่ยวอื่นๆ เพิ่มเติมได้ที่ ททท. สำนักงานนครราชสีมา โทรศัพท์ 044 21366, 044 213030 Facebook : ททท. สำนักงานนครราชสีมา ส้นทางการเดินทางไปที่ พระธาตุชัยภูมิ
งานสมโภชศาลหลักเมืองกาญจนบุรีประจำปี 2566 วันที่ 23 เมษายน - 4 พฤษภาคม 2566 LINK
งานสมโภชศาลหลักเมืองกาญจนบุรีประจำปี 2566 เริ่มตั้งแต่วันที่ 23 เมษายน - 4 พฤษภาคม 2566 ณ ถนนหลักเมือง อ.เมือง จ.กาญจนบุรี ช็อป ชิม อาหารและสินค้ามากมาย สวนสนุกชุดใหญ่ ชมการแสดงตลอด 12 วัน 12 คืนเต็ม ศิลปินชื่อดัง วันที่ 25 เมษายน มีพิธีสมโภชศาลหลักเมืองกาญจนบุรี ถวายเครื่องสักการะบูชาพระบรมราชานุเสาวรีย์ พระบาทสมเด็จพระนั่งเกล้าเจ้าอยู่หัว รัชกาลที่ 3 พิธีเจริญพระพุทธมนต์และถวายภัตตาหารเพลแด่พระภิกษุสงฆ์ จำนวน 9 รูป และ พิธีเวียนเทียนสมโภชศาลหลักเมืองกาญจนบุรี เพื่อความเป็นสิริมงคลและเป็นธรรมเนียมประเพณีที่ปฏิบัติกันเป็นประจำทุกปี
งานสมุทรปราการ ประตูสู่ฮาลาลไทย 28-30 เม.ย.2566
หอการค้าจังหวัดสมุทรปราการ จัดงาน “สมุทรปราการ ประตูสู่ฮาลาลไทย” ระหว่างวันที่ 28-30 เม.ย.2566 อุทยานการเรียนรู้และหอชมเมืองสมุทรปราการ ตำบลปากน้ำ อำเภอเมือง จังหวัดสมุทรปราการ ภายในงานมีกิจกรรม การแสดงศิลปวัฒนธรรม การออกร้านจำหน่ายผลิตภัณฑ์ฮาลาล งานนี้ หอการค้าจังหวัดสมุทรปราการ ร่วมกับ สำนักงานคณะกรรมการอิสลามประจำจังหวัดสมุทรปราการ จัดขึ้นเพื่อส่งเสริมอุตสาหกรรมอาหารฮาลาล และบริการฮาลาลของจังหวัดสมุทรปราการ เพิ่มความเข้าใจในมิติของฮาลาลในด้านต่างๆ สู่การสร้างอาชีพ สร้างรายได้ สร้างความตระหนักต่อผู้บริโภค ในการใช้ชีวิต การดูแลสุขภาพอนามัยผ่านผลิตภัณฑ์สินค้าฮาลาล สร้างรายได้แก่ประชาชนในท้องถิ่น และกระตุ้นเศรษฐกิจในภาพรวมของจังหวัดสมุทรปราการ
งานเทศกาลชลบุรี ของดีเมืองชล มนต์เสน่ห์ตะวันออก Taste of Chonburi 2023
งานเทศกาลชลบุรี ของดีเมืองชล มนต์เสน่ห์ตะวันออก Taste of Chonburi 2023 "รวมของดี ของดัง ตัวมัม ต้องชอบ!" ตั้งแต่วันที่ 28 เมษายน - 4 พฤษภาคม 2566 เพลิดเพลินกับ มินิคอนเสิร์ต ศิลปิน #เขียนไขและวานิช ในวันที่ 1 พฤษภาคม 2566 เวลา 15.00 น. ณ ลานกิจกรรม ชั้น 1 เซ็นทรัล ชลบุรี
ปฏิทินนนทบุรีเดือนเมษายน 2566
เทศกาลงานประเพณีสงกรานต์ จังหวัดยะลา
13 - 15 เม.ย. 2566 ถนนข้าวยำ อำเภอเมือง จังหวัดยะลา ร่วมทำบุญตักบาตร รดน้ำดำหัวผู้ใหญ่ และการละเล่นสาดน้ำ วิ่งเยือนถิ่นนที ริมโขง ม่วนซื่นของดี สบายดีนครพนม 1-2 เมษายน 66
กิจกรรมวิ่ง Nakhonphanom Night Run บนเส้นทางริมฝั่งแม่น้ำโขง ชมความงามพระอาทิตย์ตกช่วงเวลายามเย็น บริเวณติดลำแม่น้ำโขง ณ ลานพญาศรีสัตตนาคราช เมืองนครพนม
วิ่งแลโขงนครพนม แซ่บนัวของอร่อยเมืองนครพนม นักวิ่งที่ได้เข้าร่วมกิจกรรมยังได้สัมผัสกับเส้นทางการแข่งขันที่ยังคงไว้ซึ่งวัฒนธรรมและประเพณี 3 ชนชาติ นมัสการ “ พญาศรีสัตตนาคราช “ แหล่งท่องเที่ยวของจังหวัดนครพนม วันจัดกิจกรรม : วันเสาร์ที่ 1 เมษายน 2566 สถานที่ : ณ ลานพญาศรีสัตตนาคราช อ.เมือง จ.นครพนม ระยะวิ่ง : 7 Km
งานเทิดพระเกียรติสมเด็จพระปฐมบรมมหาชนก อุทัยธานี วันที่ 1 - 9 เมษายน 2566
งานเทิดพระเกียรติสมเด็จพระปฐมบรมมหาชนก จังหวัดอุทัยธานี ประจำปี 2566 วันที่ 1 - 9 เมษายน 2566 ณ สวนน้ำเฉลิมพระเกียรติ (บึงพระชนกฯ) ชมช็อปชิมสินค้าเด่นจ.อุทัยธานี ชมการแสดงวัฒนธรรม จากเยาวชนและประชาชนชาวอุทัยธานี การแสดงมินิคอนเสิร์ตจากเหล่าศิลปินนักร้องดัง 9 วัน 9 คืน ชมอุโมงค์ไฟตระการตา คาราวานสินค้าราคาถูก
พิธีเจริญพระพุทธมนต์ น้ำมนต์ 3 พระอารามหลวง 5,7,10 เมษายน 2566 LINK
พิธีเจริญพระพุทธมนต์ น้ำมนต์ 3 พระอารามหลวง
• วันที่ 5 เมษายน 2566 ณ วัดพระธาตุเชิงชุมวรวิหาร อ.เมือง จ.สกลนคร
• วันที่ 7 เมษายน 2566 ณ วัดศรีมงคลใต้ อ.เมือง จ.มุกดาหาร
• วันที่ 10 เมษายน 2566 ณ วัดพระธาตุพนมวรมหาวิหาร อ.ธาตุพนม จ.นครพนม
นักท่องเที่ยวสามารถมารับน้ำมนต์มงคลได้ตั้งแต่วันที่ 13 เมษายนนี้ เพียงแค่เข้าพักในโรงแรมที่ได้มาตรฐาน SHA ในกลุ่มจังหวัดสนุก “สกลนคร นครพนม มุกดาหาร”
ปล. น้ำมนต์มีจำนวนจำกัด หากนักท่องเที่ยวสนใจ สามารถตามรอยน้ำมนต์มงคลได้ที่ 3 พระอารามหลวง
งานประเพณีสงกรานต์นครพนม ประจำปี 2566 สนุกเต็มที่ นครพนมบ้านเฮา LINK
ปีนี้กำหนดสถานที่จัดงานประเพณีสงกรานต์ ประจำปี 2566 ณ บริเวณหาดทรายทองศรีโคตรบูรณ์ ริมฝั่งแม่น้ำโขง ถนนสวรรค์ชายโขง ตำบลในเมือง อำเภอเมืองนครพนม จังหวัดนครพนม
กิจกรรมการประกวดโขงนทีลีลาส
วันที่ 10-11 เมษายน เป็นการจัดการแข่งขันกีฬาลีลาส (เฉพาะนักกีฬาในประเทศ) ณ บริเวณลานหน้าพญาศรีสัตตนาคราช เขตเทศบาลเมืองนครพนม
งานสงกรานต์ ถนนข้าวปุ้น
13-15 เมษายน 2566
กิจกรรมสนุกสนานมากมาย
ขบวนรถบุพชาติ และขบวน 9 ชนเผ่า
กิจกรรมส่งเสริมเทศกาลอาหารถิ่นไทนคร 9 ชนเผ่า 2 เชื้อชาติ
ทำประติมากรรมทราย
การแสดงสินค้า อาหารและศิลปวัฒนธรรม
พิธีเจริญพระพุทธมนต์ น้ำมนต์ 3 พระอารามหลวง
• วันที่ 7 เมษายน 2566 ณ วัดศรีมงคลใต้ อ.เมือง จ.มุกดาหาร
กิจกรรมสรงน้ำพระธาตุนคร อ.เมือง พระธาตุประจำวันเสาร์
งานสืบสานตำนาน ฝ้ายงามหนองเงือก 9 – 12 เม.ย. 66 ณ หมู่บ้านหนองเงือก อ.ป่าซาง
งานสืบสานตำนาน ฝ้ายงามหนองเงือก 9 – 12 เม.ย. 66 ณ หมู่บ้านหนองเงือก
????หมู่บ้านหนองเงือกได้รับคัดเลือกเป็นแกนนำหลักของเครือข่ายกลุ่มผ้าทอของจังหวัดลำพูนร่วมกับบ้านดอนหลวง ผลิตภัณฑ์ผ้าฝ้ายทอมือของหมู่บ้านหนองเงือก ยังคงเอกลักษณ์ดั้งเดิม โดยเฉพาะความโดดเด่นทางศิลปหัตถกรรมการทอผ้าฝ้ายที่ได้รับการถ่ายทอดภูมิปัญญาจากบรรพบุรุษมานานนับ 200 กว่าปี ซึ่งชาวบ้านหนองเงือก ได้สืบทอดการทอผ้าฝ้ายและกรรมวิธี พัฒนารูปแบบสีสัน ลวดลายให้ทันยุคทันสมัยเป็นสินค้าหัตถกรรมพื้นบ้านที่ทำจากผ้าฝ้ายย้อมด้วยสีธรรมชาติ และยังผลิตส่งไปจำหน่ายยังแหล่งขายของที่ระลึกต่างๆ หลายแห่ง
ค้นหาในแผนที่ ว่า : วัดหนองเงือก ตำบลแม่แรง อำเภอป่าซาง จังหวัดลำพูน
กิจกรรมปี๋ใหม่เมือง ที่ วัดพระธาตุหริภุญชัย ลำพูน 12-16 เม.ย.66
กิจกรรมปี๋ใหม่เมือง ที่ วัดพระธาตุหริภุญชัย ลำพูน วันที่ 12-16 เมษายน 2566 กิจกรรมมากมาย มีพิธี สืบชะตา ตามวิถีล้านนา วันละ สองรอบ ตานตุงค่าคิง สรงน้ำพระ ตานเจดีย์ทราย
สงกรานต์เชียงใหม่ 2566 ปาเว๋ณี เชียงใหม่ 12-16 เมษายน 2566 LINK
เทศบาลนครเชียงใหม่ ชวนเที่ยวเทศกาลงานประเพณีสงกรานต์เชียงใหม่ “ป๋าเวณีปี๋ใหม่เมืองเจียงใหม่ ประจำปี 2566” ตั้งแต่วันที่ 12-16 เมษายน 2566 ณ ข่วงประตูท่าแพ ลานอนุสาวรีย์สามกษัตริย์ จังหวัดเชียงใหม่ - พิธีทำบุญตักบาตร เมืองเจียงใหม่ งานประเพณีสมโภชพระพุทธสิงหิงค์ ขบวนแห่การประกวดแม่หญิงขี่รถถีบกางจ้อง พิธีหุงน้ำศักดิ์สิทธิ์ สวดพุทธมนต์ กิจกรรมตานตุงไชย 726 ปีเมืองเชียงใหม่ การแสดงศิลปะพื้นบ้านล้านนา กิจกรรมสืบสานฮีตฮอย ย้อนรอยปี๋ใหม่เมือง
สืบสานประเพณีสงกรานต์ บึงยี่โถ 13 เมษายน 2566
สืบสานประเพณีสงกรานต์ วันที่ 13 เมษายน 2566 ร่วมสรงน้ำพระ รดน้ำดำหัวผู้สูงอายุ เล่นอุโมงค์น้ำ ร่วมชมรำวงย้อนยุค ร่วมสมัย พร้อมประกวดเทพีสงกรานต์ เริ่มงาน 09.00 น. ณ สนามกีฬาเฉลิมพระเกิยรติฯ คลอง 4 มีที่จอดรถรับรองพี่น้องที่มาร่วมงานในครั้งนี้
21-27 เมษายน 2566
เทศบาลเมืองกะทู้ ร่วมกับ กรมปศุสัตว์ และมูลนิธิเพื่อสุนัขในซอย (Soi Dog) #ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ️ตั้งแต่เวลา 09.00 - 16.00 น.
21 เมษายน 2566 ณ สวนสาธารณะลานกีฬา @อำเภอกะทู้
24 เมษายน 2566 ณ วัดกะทู้
25 เมษายน 2566 ณ โรงเรียน อบจ.บ้านไม้เรียบ
26 เมษายน 2566 ณ ศาลเจ้าทุ่งทอง
27 เมษายน 2566 ณ วัดเก็ตโฮ่
บุญบั้งไฟกุดชุม 23-30 เมษายน 2566
บุญบั้งไฟกุดชุม 23-30 เมษายน 2566 บริเวณหน้าที่ว่าการอำเภอกุดชุม ยโสธร ชมพิธีเปิดสุดยิ่งใหญ่ ประกวดบั้งไฟสวยงาม ประกวดบั้งไฟโก้ ประกวดขบวนเซิ้งสวยงาม ประกวดแข่งขันจุดบั้งไฟขึ้นสูง ชมคอนเสิร์ต 28 เม.ย. ยูิก ไหทองคำ เต็มวง 29 เม.ย. ใบปอ รัตติยา เต็มวง
FESTAL LIFE ART EXHIBITION SPACE 24 เม.ย.– 30 มิ.ย.66 LINK
FESTAL LIFE ART EXHIBITION SPACE
วันที่ 24 เม.ย.- 30 มิ.ย. 66 และ 3 ก.ค. – 30 ก.ย. 66 ที่ FESTAL LIFE ART EXHIBITION SPACE ชั้น G โซนเซ็นทรัล สเปลล์
ฟิวเจอร์พาร์ค และสเปลล์ ปลุกกระแสคนรักงานอาร์ต เสริฟไลฟ์สไตล์ให้ชีวิตคุณสนุกมากขึ้นกับประสบการณ์ใหม่แบบไร้ขีดจำกัดด้วยไลฟ์สไตล์ที่แตกต่าง กับFUTURE ART LAND พื้นที่ศิลปะแห่งใหม่ของกรุงเทพตอนเหนือ พร้อม Line Up งานศิลปะที่มีชื่อเสียงอย่างต่อเนื่อง เปิดตัว FUTURE ART LAND อย่างยิ่งใหญ่ด้วย FESTAL LIFE ART EXHIBITION SPACE ที่รวมศิลปินที่มีชื่อเสียงระดับประเทศกว่า 30 คน ร่วมสร้างความสนุกผ่านผลงานศิลปะตามสไตล์ในแบบของตัวเอง ภายใต้ Concept Festal Life ให้คุณใช้ชีวิตได้แบบไร้ขีดจำกัด สนุกไปกับความหลากหลายที่เต็มไปด้วยสีสันแห่งความเฟสทีฟของการใช้ชีวิต โดยมีผลงานที่จะนำมาแสดงกว่า 80 ชิ้นงาน โดยจะแบ่งการนำเสนอผลงานออกเป็น 2 ช่วง
Artist Line Up
Phase 1 (24 เม.ย.– 30 มิ.ย. 66) 17 ศิลปิน
Phase 2 (3 ก.ค.– 30 ก.ย. 66) 13 ศิลปิน
Walking Street @Rangsit "เดิน กิน ชิม เที่ยว" 28 - 30 เมษายน 2566 LINK
เทศบาลนครรังสิต ขอเชิญร่วมงาน Walking Street @Rangsit " เดิน กิน ชิม เที่ยว " วันที่ 28 - 30 เมษายน 2566 เวลา 17.00 - 23.00 น. ณ ริมเขื่อนหน้าโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร พบกับ สินค้ามากมาย ???? ️มหกรรมอาหาร ???? ️สินค้า OTOP ชมการแสดงดนตรีทุกวัน ร่วมสนุกสนาน กับกิจกรรม "ย้อนวัย ยุควันวาน วัยโจ๋ วัยเก๋า"
งานมหกรรมมหัศจรรย์อาหารทะเลพัทยา พฤษภาคม 2566
งานมหกรรมมหัศจรรย์อาหารทะเลพัทยา 2566 เดือนพฤษภาคม 2566 ณ ชายหาดพัทยา สมาคมนักธุรกิจและการท่องเที่ยว ร่วมกับ เมืองพัทยา และท่องเที่ยวและกีฬาจังหวัดชลบุรี โทร.03848-8000 , 03827-4284
Prachan Ultra 100 ประจันต์อัลตร้าร้อย ครั้งที่ 2 วันที่ 5-6-7 พ.ค.66
Prachan Ultra 100 ประจันต์อัลตร้าร้อย ครั้งที่ 2 วันที่ 5-6-7 พฤษภาคม 2566 งานวิ่งอัลตร้า รอบอ่างเก็บน้ำห้วยแม่ประจันต์ อำเภอหนองหญ้าปล้อง 1 รอบ 35 กิโลเมตร ถนน 70% ครอสคันทรี่ 20% แถมเทรลเบาๆ ให้อีก 10% วิ่งสนุก ท้าทายแต่ไม่อันตราย และพบกับประสบการณ์วิ่งใหม่ "วิ่งกลางคืน" ไม่ร้อน ไม่แดด ไม่ไหม้ วิ่งชมแสงจันทร์กับแสงไฟฉายคาดหัวตลอดทั้งคืน เลือกได้เลยว่าจะกี่รอบ กับ 4 ระยะให้เลือก 35 / 70 / 105 / 140 กม. ข้อมูลเพิ่มเติม
facebook.com/PrachanUltra100งานวิ่ง Khon kaen21 วันที่ 28 พ.ค. 66 LINK
งานวิ่ง "Khon kaen21" 4 เส้นทางเอาใจสายบุญ ได้วิ่งแล้วยังได้บุญ ได้มองมุมสวยๆ เส้นทาง วัดหนองแวง พระอารามหลวง - พุทธมณฑลอีสาน - วัดกลาง - วัดธาตุ พระอารามหลวง วันที่วิ่ง 28 พฤษภามคม 2566 เริ่ม Start 04:00 น. เป็นต้นไป สถานที่วิ่ง Start - Finish ที่ประตูเมืองขอนแก่น และเส้นทางวิ่งรอบอำเภอเมืองขอนแก่น ระยะวิ่ง 21.10 KM
มหกรรมชาติพันธุ์ลำพูน 1 – 3 พฤษภาคม 2566 LINK
วัฒนธรรมลำพูน เชิญร่วมงาน “มหกรรมชาติพันธุ์ลำพูน” ส่งเสริมการท่องเที่ยวเชิงวัฒนธรรมและอัตลักษณ์วิถีชาติพันธุ์
จังหวัดลำพูน โดยสำนักงานวัฒนธรรมจังหวัดลำพูน ร่วมกับหน่วยงานภาคีเครือข่าย และพี่น้องกลุ่มชาติพันธุ์ในจังหวัดลำพูน เชิญร่วมงาน "มหกรรมชาติพันธุ์ลำพูน" ประจำปี 2566 ระหว่างวันที่ 1 – 3 พฤษภาคม 2566 เวลา 10.00 น. - 21.00 น.ณ ศูนย์บริการนักท่องเที่ยว (เชิงสะพานท่าขาม) อำเภอเมืองลำพูน จังหวัดลำพูน
โดยงานนี้จัดขึ้นภายใต้แนวคิด "อุ่นงันวัฒนธรรม งามล้ำวิถีชาติพันธุ์ มหัศจรรย์นครลำพูน" ความมหัศจรรย์แห่งวิถีชาติพันธุ์ ไทยอง, ไทลื้อ, ไทยวน, มอญ, และกะเหรี่ยง
พบกับกิจกรรมทางวัฒนธรรม สุดตระการตา
วันที่ 1 พฤษภาคม 2566 : ขบวนแห่ “วิถีชาติพันธุ์ มหัศจรรย์นครลำพูน” / พิธีเปิดงานที่ยิ่งใหญ่
วันที่ 2 พฤษภาคม 2566 : การแสดงแบบแฟชั่นโชว์ LAMPHUN CREATIVE ETHNIC FASHION สรรสร้าง อย่าง สร้างสรรค์”
วันที่ 3 พฤษภาคม 2566 : การเสวนา “ชาติพันธุ์ สรรค์สร้าง สู่เมืองเก่าที่ Smart” / การแสดง Light & Sound ชุด “อุ่นงันวัฒนธรรม งามล้ำวิถีชาติพันธุ์ มหัศจรรย์นครลำพูน"
นอกจากนี้ยังมีกิจกรรมการแสดงและจำหน่ายสินค้าทางวัฒนธรรม / นิทรรศการอัตลักษณ์วัฒนธรรมประเพณี / บ้านกลุ่มชาติพันธุ์จำลอง / นิทรรศการผ้า “ภูมิพัสตรานครลำพูน”/ “ข่วงกาดชาติพันธุ์” อาหาร และสินค้าทางวัฒนธรรม / การแข่งขันทำอาหาร / การแสดงศิลปวัฒนธรรม / การละเล่น / และดนตรีชาติพันธุ์
จึงขอเชิญชวนร่วมผลักดันจังหวัดลำพูนให้เป็นเมืองแห่งการท่องเที่ยวเชิงวัฒนธรรมและอัตลักษณ์วิถีชาติพันธุ์ และสร้างเมืองลำพูนให้เป็นเมืองเก่าที่ Smart อย่างยั่งยืน ติดตามรายละเอียดการจัดงานได้ที่
https://www.facebook.com/Lamphunethnicityfair งานเกษตรและของดีอำเภอท่ายาง Thayang Agri Festival ครั้งที่ 30 วันที่ 16-24 พ.ค.66
อำเภอท่ายาง จ.เพชรบุรี เชิญชวนเที่ยวงานเกษตรประจำปี "งานเกษตรและของดีอำเภอท่ายาง Thayang Agri Festival ครั้งที่ 30 วันที่" 16-24 พ.ค.66 บริเวณ ถนนโตและสนามฟุตบอล อ.ท่ายาง งานพิธีเปิดยิ่งใหญ่ เลือกซื้อสินค้าเกษตร พืชผักผลไม้จากสวนท่ายางคุณภาพ ชมประกวดวัวลาน การชนวัวลาน การแสดงวัฒนธรรมพื้นบ้านชาวสวนท่ายาง การแสดงศิลปินดังทุกคืน 9 คืนเต็ม ศิลปินบิ๊กเนมวันแรก ปู พงษ์สิทธิ์ ตามด้วย เก๋ กรกต TN Band แบม แบม แก้ใส ฝ้าย พรชนก วง L.ก.ฮ. เฟิร์ส พรชิตา แนนซี่ ท็อปไลน์
ท่องเที่ยวสุราษฎร์ธานีวิถีฮาลาล SURATTHANI HALAL TOURISM 5-8 พฤษภาคม 2566
“ท่องเที่ยวสุราษฎร์ธานีวิถีฮาลาล SURATTHANI HALAL TOURISM” ในวันที่ 5-8 พฤษภาคม 2566 ณ ศูนย์การเรียนรู้ปรัชญาเศรฐกิจพอเพียงฯภาคใต้ จ.สุราษฎร์ธานี กิจกรรมน่าสนใจมากมาย
- ชมนิทรรศการท่องเที่ยววิถีฮาลาลจังหวัดสุราษฎร์ธานี
- การออกร้านค้าอาหารฮาลาล บริการ ที่พัก โรงแรม ผลิตภัณฑ์สินค้าฮาลาล กว่า 50 ร้านค้า
- สาธิตการทำข้าวหมกมีรยานีทะเล กะทะใหญ่ที่สุด
- เสวนา ฮาลาลเพื่อการท่องเที่ยว
-การอันเชิญพระมหาคำภีร์อัลกุรอาน / การขับร้องอนาซีด / การแสดงลิเกฮลู
-ชมการแสดงวัฒนธรรมการแต่งการแบบมุสลิม ในชุดมาลายู และอาราเบียน
- ชมการขับร้องนาเสดอาหรับมาเล
- และกิจกรรมอื่นๆ
International Tour: Indonesia, Singapore, Thailand
International Tour: Indonesia, Singapore, Thailand ซึ่งน่านเป็นหนึ่งเวทีในการเดินสายนานาชาติของคอนเสิร์ทนี้ - อินโดนีเซีย, สิงคโปร์, ประเทศไทย/น่าน-เชียงใหม่ วันที่ 12 พฤษภาคม 2566 พบกับ จัดแสดง ณ เฮือนแม่คำแปง บ้านน้ำครกใหม่ ตำบลกองควาย อำเภอเมือง จังหวัดน่าน ตั้งแต่เวลา 18.00-20.00 น.
งาน "ประเพณีงานบุญกลางบ้านและเผยแพร่เครื่องจักสานพนัสนิคม" ครั้งที่ 26วันที่ 5-7 พฤษภาคม 2566
งาน "ประเพณีงานบุญกลางบ้านและเผยแพร่เครื่องจักสานพนัสนิคม" ครั้งที่ 26 วันที่ 5-7 พฤษภาคม 2566 พบกับ มหกรรมจักสาน 4 ภาค มหกรรมเอ็งกอ ครั้งแรกในไทย กับการพบกันของสุดยอดเอ็งกอ 3 คณะ 3 จังหวัด สัมผัสวิถีชีวิตผสมผสาน วัฒนธรรม ภูมิปัญญา อาหารถิ่น ไทย ลาว จีน ร่วมสนุกกับการละเล่นพื้นบ้าน ชมการแข่งขันการแสดง และดนตรีท้องถิ่น มากมาย ทั้งเวทีไทย เวทีลาว เวทีจีน ณ สวนสาธารณะเทศบาลเมืองพนัสนิคม
ปฏิทินกิจกรรมเดือนพฤษภาคม 2566
งานมหัศจรรย์อาหารทะเลพัทยา 2566
การแสดงทักษาผสมเครื่องดื่มเมืองพัทยา 2566
เดินวิ่งวิสาขะพุทธบูชา ถือศีล 5 ลดละอบายมุข
กิจกรรมปั่นปันรักษ์ ณ ป่าสิริเจริญวรรษอันเนื่องมาจากพระราชดำริ
การแข่งขันวิ่งฮาล์ฟมาราธอน รัชชโลทร
การแข่งขันคอร์ฟบอล (KORFBALL THAILAND CHAMPIONSHIP 2022)
การแข่งขันคอร์ฟบอล (KORFBALL THAILAND CHAMPIONSHIP 2022) 27 พฤษภาคม 2022 ถึง 30 พฤษภาคม 2022 14:30 น. ถึง 18:00 น. ชายหาดจอมเทียน หน่วยงานที่จัดกิจกรรม : สมาคมกีฬาฟุตบอลแห่งประเทศไทย/เมืองพัทยา
เทศกาลรถม้าคาร์นิวัลนครลำปาง 5-7 พฤษภาคม 2566
สำหรับงานเทศกาลรถม้าคาร์นิวัลนครลำปาง กำหนดจัดขึ้นระหว่างวันที่ 5-7 พฤษภาคม 2566 โดยวันนี้ได้มีการปล่อยขบวนพาเหรดรถม้าคาร์นิวัล กว่า 13 ขบวน โดยขบวนเริ่มจากหน้าสถานีรถไฟนครลำปาง ไปตามเส้นทางถนนฉัตรไชย ห้าแยกหอนาฬิกา และไปตามเส้นทางถนนบุญวาทย์ สิ้นสุดขบวน ณ มิวเซียมลำปาง ประกอบด้วย ????ขบวนรถม้าเทิดพระเกียรติ ฯ ????ขบวนรถม้านานาชาติ ????ขบวนรถม้าลำปางเรอเนซองส์ ????ขบวนรถม้าแฟนซีโลกสร้างสรรค์ ????ขบวนรถม้ากลุ่มคาวบอย 1800 ย้อนยุคตะวันตก ????ขบวนรถม้าแฟนซี แบบต่างๆ จากหน่วยงานในจังหวัดลำปาง ????สุดตระการตาด้วยระบบแสง สี เสียง เอฟเฟ็คที่ยิ่งใหญ่ และอื่นๆ อีกมากมายตลอด 3 วัน
แม่แจ๋ม แจ่มแต้หนา 2566
แม่แจ๋ม แจ่มแต้หนา 13 – 15 พฤษภาคม 2566 ณ ลานกิจกรรมบ้านแม่แจ๋ม จ.ลำปาง Expo เอ็กซ์โปอ้อมน้อย ครั้งที่ 1 วันที่ 18-27 พ.ค. 66
Expo เอ็กซ์โปอ้อมน้อย ครั้งที่ 1 กระตุ้นเศรษฐกิจ 18-27 พฤษภาคม 2566 บริเวณลาดตลาดนัดข้างวัดอ้อมน้อย ต.อ้อมน้อย อ.กระทุ่มแบน สมุทรสาคร มหกรรมสินค้าราคาถูก อาหารเครื่องดื่มนานาชนิด สวนสนุกชุดใหญ่ คอนเสริ์ตศิลปินดังทุกคืน ตลอด 10 คืนเต็ม อาทิเช่น เฟิร์ส พรชิตา อาม ชุติมา พลอย พุ่มพวง เนสกาแฟ ศรีบุตร ใบปอ รัตติยา โดนัท พีอาร์ เรคคอร์ด โซดา สตรีศิลป์ และอีกเพียบ
เทศกาลอาหารไทย 4 ภาค ครั้งที่ 1 วันที่ 12-21 พ.ค.66
เทศกาลอาหารไทย 4 ภาค ครั้งที่ 1 แลนด์มาร์คมหาชัย อ.เมือง สมุทรสาคร วันที่ 12-21 พ.ค.66 งานออกร้านของพี่น้องผู้ประกอบการใหญ่น้อยในพื้นที่มหาชัยและทุกพื้นที่ มหกรรมสินค้าที่ยิ่งใหญ่ บิ๊กแบรนด์ แกรนด์ เซลล์ ลดกระหน่ำ 40-70% เพื่อพี่น้องสมุทรสาคร อาหารอร่อยมากมาย เครื่องดื่ม ขนม จัดมาเต็ม ชมดนตรีโฟล์คซองสบายๆ ตลอดงาน นักร้องเสียงดีมีคุณภาพ
มหกรรมคอนเสิร์ตเปิดตลาดนัด ชุมชนคลองสี่วา 19-28 พ.ค. 66
มหกรรมคอนเสิร์ตเปิดตลาดนัด ชุมชนคลองสี่วา ต.นาดี อ.เมือง สมุทรสาคร ตรงข้ามบ้านเอื้ออาทร วันที่ 19-28 พ.ค. 66 ช็อปสินค้าราคาถูก ชิมอาหาร 4 ภาค สวนสนุกชุดใหญ่ คอนเสิร์ตศิลปินดัง ชมฟรีทุกวัน
งานสมโภชศาลหลักเมืองราชบุรี ประจำปี 2566 วันที่ 25 พฤษภาคม - 4 มิถุนายน 2566
งานสมโภชศาลหลักเมืองราชบุรี ประจำปี 2566 วันที่ 25 พฤษภาคม - 4 มิถุนายน 2566 ณ ศาลหลักเมืองราชบุรี จ.ราชบุรี ชมพิธีสักการะศาลเจ้าพ่อหลักเมือง พบกับมหกรรมสินค้าราคาถูกจากโรงงาน สินค้าพื้นบ้าน สินค้าโอท็อป ไม้ดอกไม้ประดับ มหกรรมอาหาร เครื่องดื่ม สวนสนุกเครื่องเล่น ชมคอนเสิร์ตทุกค่ำคืน 11 คืนเต็ม ศิลปินดัง อย่าง ปู พงษ์สิทธิ์ (2 มิย) L.ก.ฮ. เอมหาหิงส์ เอสบีแบนด์ วงพัทลุง ปูจ๋าน ลองไมค์ และอีกเพียบ
ปฏิทินท่องเที่ยวลำพูน พฤษภาคม-มิถุนายน
15-17 พฤษภาคม ประเพณีเปลี่ยนผ้าครูบาชัยยะวงศาพัฒนา วัดพระพุทธบาทห้วยต้ม อ.ลี้
16-22 พฤษภาคม ประเพณีใส่ขันดอก วัดอินทขิล อ.ป่าซาง
11 มิถุนายน วันชาตกาล ครูบาเจ้าศรีวิชัย วัดดอยติ วัดบ้านปาง วัดจามเทวี
23-25 มิถุนายน เส้นทางสายไหม อัตลักษณ์ผ้าไทยล้านนา สถาบันผ้าทอมือหริภุญชัย อ.เมืองลำพูน
กิจกรรม Check In อินกรีน @ลำปาง & ลำพูน
ททท.สำนักงานลำปาง ชวนนักท่องเที่ยว Check In อินกรีน @ลำปาง & ลำพูน ระหว่างวันที่ 15 พฤษภาคม - 31 สิงหาคม 2566 พัก 1 จังหวัด รีวิวแหล่งท่องเที่ยว 1 แหล่ง พร้อมติด #เที่ยวฟินInGreenSeasonลำปางลำพูน รับฟรี!!! กระเป๋าใบไม้ (Leaf Bag) 1ใบ (มีให้เลือกถึง 3 แบบ3 สไตล์) ที่ได้รับรางวัลนวัตกรรมแห่งชาติ Thai Star Awards *** First Come First Serve*** สอบถามเพิ่มเติม เพจเฟซบุ๊ก ททท.สำนักงานลำปาง หรือ โทร. 054-222214
กิจกรรม Check In อินกรีน @ลำปาง & ลำพูน
ททท.สำนักงานลำปาง ชวนนักท่องเที่ยว Check In อินกรีน @ลำปาง & ลำพูน ระหว่างวันที่ 15 พฤษภาคม - 31 สิงหาคม 2566 พัก 1 จังหวัด รีวิวแหล่งท่องเที่ยว 1 แหล่ง พร้อมติด #เที่ยวฟินInGreenSeasonลำปางลำพูน รับฟรี!!! กระเป๋าใบไม้ (Leaf Bag) 1ใบ (มีให้เลือกถึง 3 แบบ3 สไตล์) ที่ได้รับรางวัลนวัตกรรมแห่งชาติ Thai Star Awards *** First Come First Serve*** สอบถามเพิ่มเติม เพจเฟซบุ๊ก ททท.สำนักงานลำปาง หรือ โทร. 054-222214
ปฏิทินนนทบุรีเดือนพฤษภาคม 2566
ปฏิทินกิจกรรมท่องเที่ยวบุรีรัมย์ พฤษภาคม 2566
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดบุรีรัมย์ ต้อนรับเดือนพฤษภาคม 2566
• บุรีรัมย์ ยูไนเต็ด vs นครราชสีมา มาสด้า เอฟซี วันที่ 12 พฤษภาคม 2566 ณ สนามช้าง อารีนา จังหวัดบุรีรัมย์
• มหกรรมเกษตรแฟร์ ครั้งที่ 7
วันที่ 12-21 พฤษภาคม 2566
ณ วิทยาลัยเกษตรและเทคโนโลยีบุรีรัมย์
• GT World Challenge Asia สนาม 1 พิเศษสุดกับการชมรถซูเปอร์คาร์ชั้นนำของโลกที่จะมาประลองความเร็ว วันที่ 13-14 พฤษภาคม 2566 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• Idemitsu Super Turbo Thailand 2023 สนามที่ 3-4 ศึกการแข่งขันรถยนต์ทางเรียบ วันที่ 19-21 พฤษภาคม 2566 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• B-Quik Thailand Super Series 2023 EVENT 2 รถยนต์ทางเรียบระดับนานาชาติ วันที่ 26-28 พฤษภาคม 2566 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• ชมนกกระเรียนกระเรียนพันธุ์ไทย ตลอดทั้งปี ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำ และนกกระเรียนพันธุ์ไทย อ.เมืองบุรีรัมย์ จังหวัดบุรีรัมย์
งาน SME FESTIVAL 2023 วันที่ 1-7 พฤษภาคม 2566
งาน SME FESTIVAL 2023 ณ องค์พระปฐมเจดีย์ อ.เมือง จ.นครปฐม วันที่ 1-7 พฤษภาคม 2566
- พบกับกิจกรรมการแสดง ของ 7 อำเภอในย่านนครปฐมที่จัดเต็มภายในงาน!!
- บี้เดอะสกา, Success.tall , มินิคอนเสิร์ต แจสแด้นท์
- ของกินอร่อยๆมากมายภายในงาน
- การแสดง Cover Dance จาก Arts Dance Club
- ตัวตลกอ้วนผอม
- การแสดงดนตรีสากล (โฟลค์ซอง)
- การแสดงโขน just dance วงT29, วงThe gift
งานฟังเพลงพ่อคลอเสียงน้ำ ครั้งที่ 4 Rhythm of life 2-5 ธันวาคม 2566
"งานฟังเพลงพ่อคลอเสียงน้ำ ครั้งที่ 4" Rhythm of life 2-5 ธันวาคม 2566 เขื่อนขุนด่านปราการชล นครนายก มาฟังเสียงเพลง คลอไปกับเสียงน้ำตกยักษ์ที่ยิ่งใหญ่ พร้อมชิลกับรรยากาศ สบายๆ คลอเสียงเพลง และละอองน้ำ พบกับร้านอาหารเครื่องดื่ม ของอร่อยของดีนครนายกเพียบ อากาศดีๆ เพลงเพราะ การแสดงมายากล กิจกรรม และจุดถ่ายรูปสุดสวย - สุดพิเศษสำหรับนักท่องเที่ยวที่แสดงใบเสร็จค่าใช้จ่ายเดินทางท่องเที่ยวหรือพักค้าง ช่วงวันที่ 2,3 และ 5 ธันวาคม 2566 รับสิทธิ์นั่งรถรางชมเขื่อน ฟรี จำกัดจำนวน 300 สิทธิ์ต่อวัน
1 พฤษภาคม 2567 อบต.ท่าหินโงม ทำหมันฟรี
องค์การบริหารส่วนตำบลท่าหินโงม ขอประชาสัมพันธ์เชิญชวนประชาชนผู้เลี้ยงสุนัขและแมวที่มีความประสงค์จะผ่าตัดทำหมัน สามารถเข้ารับบริการได้ใน วันพุธที่ 1 พฤษภาคม 2567 ตั้งแต่เวลา 09.00 น. ณ อาคารเอนกประสงค์องค์การบริหารส่วนตำบลท่าหินโงม สามารถติดต่อสอบถามเพิ่มเติมได้ที่ หมายเลขโทรศัพท์ 0-4413-2038
3 พฤษภาคม 2566 - 30 กรกฎาคม 2566
เทศบาลเมืองกะทู้ ร่วมกับ มูลนิธิเพื่อสุนัขในซอย ขอเชิญชวนประชาชนชาวเมืองกะทู้ นำสัตว์เลี้ยง (สุนัข-แมว) เข้าร่วมผ่าตัดทำหมัน ฟรี! ทุกวันพุธ-วันอาทิตย์ (ระหว่างวันที่ 3 พฤษภาคม 2566 - 30 กรกฎาคม 2566) ผ่าตัดทำหมันฟรี_ไม่มีค่าใช้จ่าย จำกัดการให้บริการต่อวัน #สุนัขจำนวน 5 ตัว #แมวจำนวน 20 ตัว เวลา 08.00 - 17.00 น. ณ สวนสาธารณะลานกีฬา @อำเภอกะทู้ สอบถามรายละเอียดเพิ่มเติม โทร 076-321500 ต่อ 7 (กองสาธารณสุขและสิ่งแวดล้อม)
7 พฤษภาคม 2567 ทำหมันหมาแมวฟรี อบต.ชะแมบ
องค์การบริหารส่วนตำบลชะแมบ ร่วมกับปศุสัตว์จังหวัดพระนครศรีอยุธยา ขอเชิญชวนประชาชนนำสัตว์เลี้ยงมารับบริการทำหมัน และฉีดวัคซีนสุนัข-แมว ฟรี‼️ ในวันที่ 7 พฤษภาคม 2567 ณ โดมวัดศรีประชา 08.30 - 12.00 น สอบถามเพิ่มเติม 08-9900-4640 สำนักปลัดองค์การบริหารส่วนตำบลชะแมบบุญบั้งไฟ ค้อวัง ยโสธร 8-14 พ.ค. 66
บุญบั้งไฟ ค้อวัง ยโสธร 8-14 พ.ค. 66 ที่หน้าที่ว่าการอ.ค้อวัง ยโสธร สินค้าราคาถูก อาหารอร่อย สินค้าโอท็อปเพียบ ชมคอนเสิร์ต 5 คืน - 8 พ.ค. GPS Music ยกค่าย 10 พ.ค. บุ๊ค ศุภกาญจน์ เต็มวง 12 พ.ค. ข้าวฟ่าง เบียร์ พร้อมพงษ์ เต็มวง 13 พ.ค. เม้ก อภิสิทธิ์ 14 พ.ค. บิ๊กวัน กันทรลักษณ์ เต็มวง
โครงการ เพื่อพัฒนาสินค้าและส่งเสริมอาชีพ 10-14 พฤษภาคม 2566
อบจ.ปทุมธานี เชิญชวนชาวจังหวัดปทุมธานีและจังหวัดใกล้เคียง ร่วมเที่ยวชมงาน มนต์เสน่ห์ ถิ่นบัวหลวง เมืองรวงข้าว เชื้อชาวมอญ ในโครงการเพื่อพัฒนาสินค้าและส่งเสริมอาชีพ โดยจัดขึ้นระหว่างวันที่ 10-14 พฤษภาคม 2566 ณ Alive Park Hall ชั้น G ศูนย์การค้าฟิวเจอร์พาร์ค อำเภอธัญบุรี จังหวัดปทุมธานี เลือกซื้อผลิตภัณฑ์ สินค้าพื้นบ้านของปทุมธานี เพื่อเป็นการกระตุ้นเศรษฐกิจ ยกระดับสินค้าท้องถิ่นให้เป็นที่รู้จักมากยิ่งขึ้น อีกทั้งยังเป็นการอนุรักษ์ภูมิปัญญาของชาวบ้าน ให้อยู่คู่กับจังหวัดปทุมธานีต่อไป
ประเพณีบุญบั้งไฟ ยโสธร วันที่ 17 ถึง 21 พฤษภาคม 2566
งานประเพณีบุญบั้งไฟยโสธร ประจำปีพุทธศักราช 2566 ระหว่างวันที่ 17 ถึง 21 พฤษภาคม 2566 - บุญบั้งไฟ เป็นประเพณีหนึ่งของภาคอีสานของประเทศไทย ตลอดจนประเทศลาว[ต้องการอ้างอิง] โดยมีที่มาจากนิทานพื้นบ้านเรื่องพญาคันคาก เรื่องผาแดงนางไอ่ ซึ่งในนิทานพื้นบ้านดังกล่าวได้กล่าวถึง การที่ชาวบ้านได้จัดงานบุญบั้งไฟขึ้นเพื่อเป็นการบูชา พญาแถน หรือเทพวัสสกาลเทพบุตร ซึ่ง ชาวบ้านมีความเชื่อว่า พระยาแถนมีหน้าที่คอยดูแลให้ฝนตกถูกต้องตามฤดูกาล และมีความชื่นชอบไฟเป็นอย่างมาก หากหมู่บ้านใดไม่จัดทำการจัดงานบุญบั้งไฟบูชา ฝนก็จะไม่ตกถูกต้องตามฤดูกาล อาจก่อให้เกิดภัยพิบัติกับหมู่บ้านได้
บุญบั้งไฟ เลิงนกทา 22-29 พฤษภาคม 66
บุญบั้งไฟ เลิงนกทา 22-29 พฤษภาคม 66 บริเวณหน้าที่ว่าการอำเภอเลิงนกทา จ.ยโสธร วันที่ 26 พ.ค. ชมพิธีเปิดและขบวนแห่งบั้งไฟ วันที่ 27 พ.ค. คอนเสิร์ต เวียง นฤมล เต็มวง วันที่ 28 พ.ค. ชมการจุดบั้งไฟ
งานสมโภชหลักเมือง และกาชาดจังหวัดยะลา ประจำปี2566
งานสมโภชหลักเมือง และกาชาดจังหวัดยะลา ประจำปี2566 วันที่ 25 พ.ค. - 4 มิ.ย. 2566 ศาลหลักเมืองยะลา อำเภอเมือง จังหวัดยะลา พิธีสงฆ์ พิธีพราหมณ์บนศาลหลักเมือง ขบวนแห่หลักเมืองจำลอง ขบวนแห่งานกาชาดจังหวัดยะลา (วัฒนธรรมและของดีเมืองยะลา) กิจกรรมเปิดงานกาชาดจังหวัดยะลา สำหรับกิจกรรมตลอดระยะเวลา 11 วัน 11 คืน ประกอบด้วย การออกร้านนาวากาชาด การแสดง การออกรางวัลสลากกาชาดเพื่อการกุศล ศิลปวัฒธรรม การประกวดธิดานิบง การประกวดร้องเพลงลูกทุ่งไทย ขวัญใจมหาชน การจัดนิทรรศการ การแสดงผลงานวิชาการของหน่วยราชการ สถานศึกษาและภาคเอกชน การแสดงมหรสพ และการแสดงของศิลปินดารานักแสดงอีกมากมาย
Change the future night run 2023 (27 พฤษภาคม 66)
Change the future night run 2023 วันเสาร์ที่ 27 พฤษภาคม 2566 เวลา 18:00 – 22:00 น. ณ Riverdale Marina ตำบลบางกะดี อำเภอเมือง จังหวัดปทุมธานี สภาอุตสาหกรรมจังหวัดปทุมธานี ร่วมกับภาคีเครือข่ายฯ จัดโครงการการแข่งขันวิ่งมินิมาราธอน Change The Future 2023 รูปแบบ Night Run โดยมี 3 ระยะทาง ได้แก่ 3 กิโลเมตร 5 กิโลเมตร และ 10 กิโลเมตร
.
ซูเปอร์สปอร์ต ลากูน่า ภูเก็ต มาราธอน 2566
ซูเปอร์สปอร์ต ลากูน่า ภูเก็ต มาราธอน 2566 วิ่งทางเรียบ ลากูน่า โกรฟ, ภูเก็ต 10-11 มิถุนายน 2566 สปอร์ตอีเว้นท์ที่ใหญ่ที่สุดในจังหวัดภูเก็ตและเป็นงานวิ่งมาราธอนชั้นนำของประเทศไทย โดยได้รับการการันตีมาตรฐานสนามวิ่งมาราธอนระดับสากลจากสมาคมวิ่งมาราธอนนานาชาติและการแข่งขันทางเรียบ (IAAF AIMS) ตั้งแต่เริ่มจัดงานในปีแรกจนถึงปัจจุบันและเป็นงานที่นักวิ่งสามารถนำไปควอลิฟายเพื่อเข้าแข่งขันวิ่งระดับโลก อาทิ บอสตัน มาราธอน ได้อีกด้วย
งานประเพณีบุญเดือนหก บวชนาคหมู่-บุญบั้งไฟ วัดทุ่งสนุ่นรัตนาราม 3-4 มิถุนายน 2566
งานประเพณีบุญเดือนหก บวชนาคหมู่-บุญบั้งไฟ วัดทุ่งสนุ่นรัตนาราม
กำหนดการ(คร่าวๆ)
วันที่ 3 มิถุนายน 2566 รับนาค
วันที่ 4 มิถุนายน 2566 เช้า ทำขวัญนาค บ่าย แห่นาค แห่บั้งไฟ จุดบั้งไฟ บวชนาค เป็นเสร็จพิธี
ฉลองเจดีย์ร้อยยอด ประดิษฐานพระบรมสารีริกธาตุ 3-11 มิถุนายน 2566 วัดไผ่โรงวัว
สัปดาห์ส่งเสริมพระพุทธศาสนา วิสาขบูชา ฉลองเจดีย์ร้อยยอด ประดิษฐานพระบรมสารีริกธาตุ
3-11 มิถุนายน 2566 ณ วัดไผ่โรงวัว (หลวงพ่อขอม) อำเภอสองพี่น้อง จังหวัดสุพรรณบุรี
ช้อป มหกรรมสินค้าราคาถูก สินค้า OTOP ผลิตภัณฑ์พื้นบ้าน สินค้าจากโรงงานผู้ผลิต ชิม อาหารอร่อย ผลไม้ตามฤดูกาล ขนมหวานท้องถิ่นหลากหลาย ชม สวนสนุกชุดใหญ่ระดับประเทศ คอนเสิร์ตจากศิลปินดัง 3 มิ.ย. เสรี รุ่งสว่าง 4 มิ.ย. แอ้ม ชลธิชา 5 มิ.ย. บังนัส ฟิวเจอร์แบนด์ 6 มิ.ย. นัน ไมค์ทองคำ 7 มิ.ย. ไรอัล ไมค์หมดหนี้ 8 มิ.ย. วงดนตรี 9 มิ.ย. ไผ่ พงศธร 10 มิ.ย. เฟิร์ส พรชิตา 11 มิ.ย. ต่าย อรทัย
งานวันรำลึก พุ่มพวง ดวงจันทร์ ปี 2566 ครบรอบปีที่ 31 วันที่ 10-18 มิถุนายน 2566 LINK
งานวันรำลึก พุ่มพวง ดวงจันทร์ ปี 2566 นี้ ครบรอบปีที่ 31 วันที่ 10-18 มิถุนายน 2566 ณ วัดทับกระดาน ตำบลบ่อสุพรรณ อำเภอสองพี่น้อง จังหวัดสุพรรณบุรี เช่นเดิม พิธีทำบุญตักบาตร และพิธีทอดผ้าป่าเพื่ออุทิศส่วนบุญกุศลให้กับพุ่มพวง ดวงจันทร์ การแสดงของเหล่าศิลปินนักร้องที่มีชื่อเสียงกว่า 300 คน และการจัดจำหน่ายคาราวานสินค้าต่างๆ การแสดงคอนเสิร์ต 9 วัน 9 คืน จัดยิ่งใหญ่กว่าทุกปี พบกับ อภิมหาคอนเสิร์ตลูกทุ่ง ดารา นักร้อง ศิลปินรับเชิญชื่อดัง ตลก ลิเก ภาพยนตร์ มิตรรัก แฟนเพลง พุ่มพวง ดวงจันทร์ พร้อมกันทั่วประเทศ
งานรำลึกประจำปี องค์เจ้าพ่อกวนอู ศาลเจ้าพ่อสำเร็จ 18-20 มิ.ย.66
งานรำลึกประจำปี องค์เจ้าพ่อกวนอู ศาลเจ้าพ่อสำเร็จ อ.บ้านแพ้ว สมุทรสาคร วันที่ 18-20 มิถุนายน 2566 ชิมงิ้ว 3 วัน 3 คืน คณะแซลั่งเล่าชุน และมายากล อลังการระดับประเทศ มีเลี้ยงอาหารฟรีทุกคืน แจกรางวัลผู้ร่วมงานเพียบ
งาน Amazing Film Festival Experience 2-4 มิถุนายน 2566 เขาไม้แก้ว ชลบุรี
งาน "Amazing Film Festival Experience" 2-4 มิถุนายน 2566 เวลา 16.00 – 23.00 น. สถานที่จัดงาน Wisdom Valley ต. เขาไม้แก้ว อ.บางละมุง จ.ชลบุรี เทศกาลภาพยนตร์ระดับประเทศ กับ 4 โรงภาพยนตร์ ท่ามกลางหุบเขาพื้นที่สีเขียวกว่า 1,400 ไร่
กิจกรรมไฮไลท์มากมาย
- การฉายภาพยนตร์ทั้งไทยและต่างประเทศกว่า 20 เรื่อง กับจอกลางแจ้ง 4 รูปแบบ
- โรงภาพยนตร์จอยักษ์ริมทะเลสาบกับภาพยนตร์ The Beach, พี่มาก...พระโขนง, Top Gun, Elvis และ La La Land
- โรงภาพยนตร์แนวตั้งกับซีรีส์ Blackout บาร์ลับ ไม่มีในโลก จากค่ายนาดาว บางกอก
- โรงภาพยนตร์กลางแปลง พาย้อนรำลึกวันวานกับชุมแพ, ฟ้าทะลายโจร, คนเล็กหมัดเทวดา, คู่กรรม, ไอ้หนุ่มหมูหิน และเส้าหลิน สองใหญ่
- โรงภาพยนตร์ลับในป่ากับภาพยนตร์พร้อมเขย่าขวัญกับ It Follows, The Lure, The Witch 2
- จุดไฮไลท์ถ่ายภาพเช็คอินในงานจากซีนหนังดัง
- การแสดงจากศิลปินยอดนิยมตลอด 3 วัน / 2 มิถุนายน 2566 พลอยชมพู และ PROXIE / 3 มิถุนายน 2566 Dept และ Lomosonic / 4 มิถุนายน 2566 นุนิว และ เป้ อารักษ์
- การเสวนาโดยบุคลากรภาพยนตร์ อาทิ สมาพันธ์สมาคมภาพยนตร์แห่งชาติ และคุณวิทยา ปานศรีงาม ‘นักแสดงไทยขวัญใจต่างชาติ’ ในซีรีส์ Netflix เรื่อง Hurts Like Hell เจ็บ เจียน ตาย
- การประกวดหนังสั้นผลงานจากนักศึกษา กับผลงานชนะเลิศ อาทิ In the Same Dream, the Flowers Upside Down, Hairdresser, Midnight Reminiscence และดาววิกาล
- ร้านจำหน่ายอาหารเด่นเมนูเด็ดจากกลุ่มจังหวัดในภาคตะวันออก
ททท. ได้จัดบริการรถรับ-ส่ง ใน 4 เส้นทาง ได้แก่ เทอมินอล 21 เซ็นทรัล พัทยา แยกวัดชัย และ Wisdom Valley ตั้งแต่เวลา 15.00 – 02.00 น. ตลอดระยะเวลาจัดงาน
❗️เข้าชมฟรีตลอด 3 วัน
เทศกาลภาพยนตร์ของเมืองพัทยา (Pattaya Film Festival 2023) 15 - 19 มิถุนายน 2566
งานเทศกาลภาพยนตร์ของเมืองพัทยา จัดขึ้นระหว่างวันที่ 15 - 19 มิถุนายน 2566 ศูนย์การค้าเซ็นทรัล มารีน่าพัทยา พบกับโปรแกรมฉายภาพยนตร์ ทั้งภาพยนตร์ไทยและต่างประเทศ นำความสนุกสนานและสาระของเรื่องเล่าจากทั่วโลกมาให้ผู้ชมทั้งในโรงภาพยนตร์และกลางแปลงริมหาด เสริมสร้างวัฒนธรรมการดูหนังอันหลากหลายสำหรับผู้ชมทุกกลุ่มวัย รวมทั้งยังเป็นก้าวแรกของการโปรโมทพัทยาเป็น City of Film ชมฟรีทุกเรื่อง! สอบถามรายละเอียดที่ Pattaya Contact Center 1337
PATTAYA WellFest 2023 วันที่ 9-11 มิถุนายน 2566
สมาคมสปาและเวลเนสภาคตะวันออก ร่วมกับ เทวารัณย์เวลเนส พัทยา และพันธมิตรธุรกิจสุขภาพ จึงได้จัดกิจกรรม “PATTAYA WellFest 2023” ในระหว่างวันที่ 9-11 มิถุนายน พ.ศ.2566 ณ บริเวณริมชายหาดด้านหน้าโรงแรมดุสิตธานี พัทยา โดยการสนับสนุนจากสำนักงานท่องเที่ยวและกีฬาจังหวัดชลบุรี การท่องเที่ยวแห่งประเทศไทยสำนักงานพัทยา และเมืองพัทยา ปีนี้ องค์กร Global Wellness Day ได้กำหนดธีมกิจกรรมเป็น “Dance Magenta” ซึ่งสีชมพูนี้เป็นสีประจำที่ใช้ในทุกปี และในปีนี้ได้กำหนดให้เป็นปีของการเต้น เพราะการเต้นเป็นกิจกรรมที่ทำได้ทุกเพศทุกวัย มีความสนุกสนาน และมีในหลากหลายวัฒนธรรม สมาคมฯ และพันธมิตร จึงมีแนวความคิดที่จะนำวัฒนธรรมไทยมาผสมผสานกับการออกกำลังกายเพื่อสุขภาพท่ามกลางชายหาดของเมืองพัทยา เข้าร่วมกิจกรรมได้โดยไม่มีค่าใช้จ่าย พร้อมด้วยกิจกรรมลุ้นรับของรางวัลสำหรับ 500 ท่านแรกที่สแกรน QR Code ลงทะเบียนแอพพริเคชั่นนำมาแสดงเพื่อรับเสื้อและหมวกที่ระลึกงาน
อบรม The Next Wave Muslim Tourism 14-15 มิถุนายน 66
กรมการท่องเที่ยวขอประชาสัมพันธ์เชิญชวนผู้ประกอบการโรงแรมที่พัก ร้านอาหารฮาลาล เข้าร่วมการอบรมเสริมความรู้ เพื่อพัฒนาศักยภาพผู้ประกอบการด้านการบริการเพื่อการท่องเที่ยวในการรองรับนักท่องเที่ยวมุสลิมในวันพฤหัสบดีที่ 15 มิถุนายน 2566 เวลา 08.30 – 16.00 น. ณ โรงแรมแกรนด์ เบลล่า พัทยา จังหวัดชลบุรี สำนักงานการท่องเที่ยวและกีฬาจังหวัดชลบุรี จึงขอความอนุเคราะห์ท่านประชาสัมพันธ์ เชิญชวนผู้ประกอบการโรงแรมที่พัก ร้านอาหารฮาลาล ที่สนใจสมัครเข้ารับการอบรมดังกล่าว รายละเอียดตาม Brochure ประชาสัมพันธ์ ภายในวันที่ 10 มิถุนายน 2566
เทศกาลพัทยา (PATTAYA FESTIVAL) ระหว่างวันที่ 23 – 24 มิถุนายน 2566
เมืองพัทยาร่วมกับภาคเอกชนกำหนดจัดโครงการงานเทศกาลพัทยา (PATTAYA FESTIVAL) ระหว่างวันที่ 23 – 24 มิถุนายน 2566 ตั้งแต่เวลา 15.00 น. ณ บริเวณชายหาดพัทยาเพื่อส่งเสริมและกระตุ้นเศรษฐกิจการท่องเที่ยวของเมืองพัทยาและเป็นการกระจายรายได้ให้กับประชาชนในพื้นที่ โดยภายในงานพบกับการออกร้านค้าจำหน่ายอาหารทะเลแปรรูปจากร้านที่มีชื่อเสียงและได้รับความนิยมจากเพจ หมีทะเล Sea Bear การสาธิตเล่นกีฬา Sport on The Beach วอลเลย์บอลชายหาด เทนนิสชายหาด พร้อมฟังเพลงเพลิดเพลินจากการแสดงดนตรีอะคูสติก DJ. จากสมาคมอุตสาหกรรมบันเทิงและการท่องเที่ยวเมืองพัทยาที่สลับปรับเปลี่ยนกับศิลปินชื่อดังของไทย
Pattaya Beach Game 2023 วันที่ 30 มิถุนายน - 9 กรฎาคม 2566
Pattaya Beach Game 2023 ระหว่างวันที่ 30 มิถุนายน - 9 กรฎาคม 2566 ณ ชายหาดพัทยากลาง สอบถามรายละเอียดที่ Pattaya Contact Center 1337
ถนนคนเดิน 24-28 มิ.ย. 2566 ณ สวนสาธารณะ ข้างศาลเจ้าพ่อหลักเมืองสมุทรสาคร
ถนนคนเดิน 24-28 มิ.ย. 2566 ตั้งแต่ 16.00 น. เป็นต้นไป ณ สวนสาธารณะ ข้างศาลเจ้าพ่อหลักเมืองสมุทรสาคร สินค้ามากมาย ร้านค้ากว่า 100 ร้าน ชมคอนเสิร์ตศิลปินดังเพียบ ดังนี้
24 มิย หมู มูซู และ นัท นวภัสร์ (ไมค์ทองคำ 2) และการแสดงโรงเรียนเทศบาลบ้านมหาชัย (อนุกูลราษฎร์)
25 มิย ไทรถแห่ และการแสดงดนตรีโรงเรียนสมุทรสาครบูรณะ
26 มิย สลัมบอมเบย์ และ วงไอโอดีน และการแสดงดนตรีดุริยางค์มณฑลทหารบกที่ 16
27 มิย วง FC Band และการแสดงดนตรีโรงเรียนสมุทรสาครวิทยาลัย
เทศกาลกินกุ้งสมุทรสาคร ครั้งที่ 3 @ตลาดทะเลไทย ระหว่างวันที่ 22-25 มิถุนายน 2566
เทศกาลกินกุ้งสมุทรสาคร" ครั้งที่ 3 @ตลาดทะเลไทย ระหว่างวันที่ 22-25 มิถุนายน 2566 ตั้วแต่เวลา 10.30 - 20.00 น. งานเดียวที่จะได้พบกับเมนูอาหารทะเล กุ้ง หมึก แมงดา กั้ง ปลา หอย ปู กว่า 40 เมนู จากร้านอาหารทะเลชื่อดังแห่งเมืองสมุทรสาคร The metropolis of seafood ในราคายิ่งกว่ายุติธรรม เริ่มต้น 15 บาท หรือมาเป็นแก๊งจัดไปชุดใหญ่ จุใจจนเบื่อกุ้งไปนาน แค่ 599 เท่านั้น* (เมนูจานใหญ่ยักษ์ กุ้งเนื้อเน้นๆ เต็มๆ คำ แบบภาพหน้าปก)
Samut Sakhon Pride 2023 เสาร์ที่ 24 มิ.ย.66 LINK
งาน Samut Sakhon Pride 2023 เสรีภาพ ความหลากหลาย และความเท่าเทียม จัดขึ้นครั้งแรกในจังหวัดสมุทรสาคร เสาร์ที่ 24 มิ.ย.นี้ ณ บริเวณหอนาฬิกา-ชุมชนเก่าริมน้ำตลาดกระทุ่มแบน ตั้งแต่เวลา 4 โมงเย็น-2 ทุ่มครึ่ง ภายในงานพบกับ ขบวนคาร์นิวัลทางบก ขบวนแห่ทางน้ำหนึ่งเดียวในไทย กิจกรรมโยนดอกกุหลาบ ถ้อยแถลงจากเจ้าเมือง ดนตรีสด คราฟต์เบียร์จาก 3 อำเภอ วงเสวนาจากตัวแทน LGBTQ+ สมุทรสาคร
งาน Home made มหาชัย 29 มิ.ย.- 3 ก.ค. 66
เซ็นทรัลมหาชัย จัดงาน Home made มหาชัย 29 มิ.ย.- 3 ก.ค. 66 งานผลิตภัณฑ์ งานฝีมือ ของฝาก ของที่ระลึก อาหาร เครื่องดื่ม จากผู้ประกอบการโอท็อปและ SME ในสมุทรสาคร บริเวณลานกิจกรรมชั้น 1 จัดโดย อบจ.สมุทรสาคร
เส้นทางสายไหม อัตลักษณ์ผ้าไทยล้านนา เมืองลำพูน 23-25 มิถุนายน 66
23-25 มิถุนายน เส้นทางสายไหม อัตลักษณ์ผ้าไทยล้านนา สถาบันผ้าทอมือหริภุญชัย อ.เมืองลำพูน วันที่ 24 มิถุนายน 2566 มีการประกวดผ้าพื้นถิ่น 17 จังหวัดภาคเหนือ อาทิ การประกวดผ้ายกดอก การประกวดผ้าจก การประกวดผ้าล้านนาประยุกต์ จึงขอเชิญชวนผู้ที่สนใจสมัครเข้าร่วมประกวดผ้าพื้นถิ่นฯ ได้ตั้งแต่วันนี้ไปจนถึงวันที่ 21 มิถุนายน 2566 นี้
งาน PHUKET SURF CONTEST 2023 วันที่ 23-25 มิถุนายน 2566 LINK
“PHUKET SURF CONTEST 2023” จัดขึ้นในวันที่ 23-25 มิถุนายน 2566 ณ หาดกะตะ ชวนแข่งขันเซิร์ฟแบบเท่ๆ ชิงเงินรางวัลรวมกว่า 220,000 บาท ส่งต่อ FEEL GOOD ไปกับคอนเสิร์ตจาก ATOM / TWOPEE SOUTHSIDE/ ZOM MARIE/ WHAL & DOLPH / TONTRAKUL / PIXXIE พร้อมศิลปินและดีเจอีกมากมาย ผู้ที่สนใจเข้าร่วมงานได้ฟรี ไม่มีค่าใช้จ่าย
KHAOLAK SURF FESTIVAL 2023 วันที่ 16-18 มิถุนายน 2566 LINK
“KHAOLAK SURF FESTIVAL 2023” จัดขึ้นในวันที่ 16-18 มิถุนายน 2566 ณ MEMORIES BEACH เขาหลัก ชวนผู้ที่ชื่นชอบกิจกรรมกระดานโต้คลื่นออกมาสัมผัสคลื่นลมและแสงแดด พร้อมแข่งขันเซิร์ฟชิงเงินรางวัลรวมกว่า 220,000 บาท ก่อนจะไปสนุกเต็มสตรีมกับคอนเสิร์ตจากศิลปินมากมาย เช่น KHAN THAITANIUM / TWOPEE SOUTHSIDE / VALENTINA PLOY / LAZYLOXY & SAMBLACK / TONTRAKUL / MAIYARAP ที่จะมาปลดปล่อยเอเนอจี้ดีๆ ผ่านบทเพลง ท่ามกลางบรรยากาศริมทะเลสวยๆ ที่แฟนตัวจริงต้องตามมาเชียร์ที่หน้าเวทีแล้ว!!!
Amazing Muay Thai Experience มวยไชยา 30 มิถุนายน – 2 กรกฎาคม 2566
Amazing Muay Thai Experience มวยไชยา จัดขึ้น ณ สะพานนริศ ริมแม่น้ำตาปี จังหวัดสุราษฎร์ธานี วันที่ 30 มิถุนายน – 2 กรกฎาคม 2566
ภายในงานมีกิจกรรมที่หลากหลายและน่าสนใจสำหรับนักท่องเที่ยวที่หลงใหลในศิลปะมวยไทย อาทิ การสอนมวยให้กับบุคคลทั่วไปที่สนใจเรียนมวย โดยมวยทั้ง 4 สาย มีความโดดเด่นแตกต่างกันไป ได้แก่ หมัดหนัก: มวยโคราช ฉลาด: มวยลพบุรี ท่าดี: มวยไชยา ไวกว่า: มวยท่าเสา หรือมวยพระยาพิชัย และยังมีการแข่งขันมวยไทย การสักยันต์ การจําหน่ายวัตถุมงคล และเครื่องรางของขลัง ผู้ที่สนใจสามารถติดตามรายละเอียดเพิ่มเติมได้ที่ TAT Contact Center โทร.1672 Travel buddy
งาน "อุตสาหกรรมแฟร์" จ.ลำปาง 23 - 30 มิถุนายน 2566
งาน "อุตสาหกรรมแฟร์" อุตสาหกรรมสร้างสรรค์ ปั้นแต่งโตไว ด้วยดีพร้อม พบกับกิจกรรมมากมายทั้ง เทคโนโลยี ชิม ช๊อป ฟินเวอร์ จัดโดยศูนย์วิจัยและพัฒนาวัสดุอุตสาหกรรมสร้างสรรค์ กรมส่งเสริมอุตสาหกรรม ระหว่างวันที่ 23 - 30 มิถุนายน 2566 ณ ศูนย์ประชุมและแสดงสินค้าอุตสาหกรรมภาคเหนือ ถนนพหลโยธิน อำเภอเกาะคา จังหวัดลำปาง ภายในงานพบกับ
• โซน OTOP/DIY Zone
• นิทรรศการ/สาธิต วัสดุอุตสาหกรรมสร้างสรรค์
• นิทรรศการ/สาธิต โตโยต้า Karakuri Kaizen for DIPROM Community
• การจำหน่ายสินค้า SMEs
• การให้คำแนะนำปรึกษาการส่งเสริมอุตสาหกรรม
• ประชุมสัมมนาเชิงวิชาการ และอื่นๆ อีกมากมาย
สอบถามเพิ่มเติม โทร. 054-281884, 054-019942
อุทยานแห่งชาติดอยขุนตาล เปิดการท่องเที่ยวและพักแรม และเส้นทางศึกษาธรรมชาติ LINK
อุทยานแห่งชาติดอยขุนตาล เปิดการท่องเที่ยวและพักแรม และเส้นทางศึกษาธรรมชาติ ตั้งแต่วันที่ 21 มิถุนายน 2566 นี้เป็นต้นไป หนีร้อนมาสัมผัสกับธรรมชาติ กับเส้นทางเดินป่า ย.1 - ย.4 และถ่ายรูปชิล ชิลกับอุโมงค์ขุนตาน อุโมงค์รถไฟที่ยาวที่สุดในประเทศไทย
สอบถามข้อมูลเพิ่มเติมได้ที่ 081-0326341 ศูนย์บริการนักท่องเที่ยวอุทยานแห่งชาติดอยขุนตาล
10 - 11 มิถุนายน 2566 เทศกาลปลาหมึก และอาหารทะเลริมชายหาด 2566
เทศกาลปลาหมึก และอาหารทะเลริมชายหาด 2566 Pattaya Squid Fair Golden Hour 2023 วันที่ 10 - 11 มิถุนายน 2566 งานเปิดตั้งแต่ 17.00 น. - 22.00 น. เป็นต้นไป ณ ริมชายหาดจอมเทียนพัทยา (หน้าโรงแรม The NOW)
- ช็อป อาหารทะเลสด ๆ พร้อมปรุงที่งาน จากเรือประมงที่ยกขึ้นริมชายฝั่ง
- เมนูสุดพิเศษ จากเชฟโรงแรมและร้านอาหารชื่อดัง พร้อมสาธิตเมนู Sea Food ซาชิมิ ปลาตัวใหญ่ ให้ผู้เข้าร่วมงานได้ลิ้มลองฟรีในวันเปิดงาน
- อร่อยกับอาหารร้านดังทั่วชลบุรี และพัทยา
- นั่งชิลริมหาด พร้อมฟังดนตรีสด อะคูสติกแบนด์
- ชมการแสดงกระบองไฟ ระบำฮาวายชาวเลทุกวัน
งานกระท้อนหวานของดีลพบุรี ปี66 วันที่ 21 มิถุนายน - 5 กรกฎาคม 2566
งานกระท้อนหวานของดีลพบุรี ปี66 (15 วัน 15 คืน ) ปีนี้ร้านดังร่วมงานคึกคัก ของอร่อยเพียบ งานนี้พลาดไม่ได้ วันที่ 21 มิถุนายน - 5 กรกฎาคม 2566 ณ บริเวณหน้าที่ว่าการอำเภอเมืองลพบุรี จังหวัดลพบุรี
เทศกาลอาหารอร่อย จังหวัดชัยนาท 23-25 มิถุนายน 2566
"เทศกาลอาหารอร่อย จังหวัดชัยนาท” ณ วิสาหกิจชุมชนสวนยางกลางนา ตำบลนางลือ อำเภอเมือง จังหวัดชัยนาท จัดขึ้นระหว่างวันที่ 23-25 มิถุนายน 2566 (3 วัน) ตั้งแต่เวลา 11.00-20.00 น. ณ บริเวณเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท ภายในงานพบกับ การสาธิตทำอาหารจากวัตถุดิบท้องถิ่น ทั้งคาวและหวาน โดยทีมเชฟยอดฝีมือ ผู้ช่วยศาสตราจารย์ธนวิทย์ ลายิ้ม กับเมนู “สำรับชัยนาท” บูธจำหน่ายสินค้า ร้านอาหารชื่อดัง เมนูเด็ด ของดี จังหวัดชัยนาท กว่า 140 ร้านค้า การเดินแบบแฟชั่นโชว์ชุดผ้าไทย การแสดงศิลปวัฒนธรรม ดนตรีโฟล์คซอง และการแสดงของศิลปินชื่อดัง
- 23 มิ.ย.66 กานต์ ทศน (20.00 น.)
- 24 มิ.ย.66 พั้นซ์ วรกาญจน์ (19.00 น.)
- 25 มิ.ย.66 ลุลา กันยารัตน์ (19.00 น.)
สอบถามข้อมูลด้านการท่องเที่ยวเพิ่มเติมได้ที่ : ททท.สำนักงานลพบุรี โทร. 036-770096-7 หรือ Facebook Fanpage : ททท.สำนักงานลพบุรี : Tat Lopburi Office
ปฏิทินนนทบุรีเดือนมิถุนายน 2566
งานโครงการตลาดสินค้าราคาประหยัด ลดค่าครองชีพ 28-30 มิถุนายน 66
ลดกระหน่ำ เพื่อชาวสมุทรปราการในงานโครงการตลาดสินค้าราคาประหยัด ลดค่าครองชีพ
เพื่อประชาชนจังหวัดสมุทรปราการ 28-30 มิถุนายน 66 ณ ศูนย์การค้าเยสบางพลี พลาซ่า อําเภอบางเสาธง จงัหวัดสมุทรปราการ เลือกซื้อสินค้า อุปโภคบริโภค คุณภาพดี ราคาประหยัด อาทิ ไข่ไก่สดคุณภาพ น้ำมันพืช น้ำตาลทราย ข้าวหอมมะลิ ราคาถูกกว่าท้องตลาด สินค้า OTOP ผลิตภัณฑ์ชุมชน สินค้าอุตสาหกรรม ของดีของเด่น ของชาวสมุทรปราการ ที่ยกกันมากว่า 80 ร้านค้า ให้เลือกซื้อกันอย่างจุใจเพื่อชาวสมุทรปราการ ลดแล้วลดอีกกับสินค้านาทีทอง นาทีถูก ทุกวัน และร่วมสนุกกับกิจกรรมภายในงานเพื่อรับของแจกติดมือกลับบ้านฟรี ตลอดการจัดงาน
พลาดแล้วจะเสียใจไม่ไปไม่ได้ 28-30 มิถุนายน 66 เวลา 09.00-19.00น.
ณ ศูนย์การค้าเยสบางพลี พลาซ่า อําเภอบางเสาธง จงัหวัดสมุทรปราการ
งานดีๆ โดย สำนักงานพาณิชย์จังหวัดสมุทรปราการ
Central and Eastern Thailand Local BCG Plus Fair 2023วันที่ 14-18 มิถุนายน 2566
Mission For The Earth ภารกิจรักษ์โลก รักษ์สิ่งแวดล้อม ภายในงาน “Central and Eastern Thailand Local BCG Plus Fair 2023” วันที่ 14-18 มิถุนายน พ.ศ. 2566 ณ บริเวณลานกิจกรรม ชั้น 1
หน้า H&M ศูนย์การค้าเซ็นทรัล บางนา กรุงเทพมหานคร
พบกับสินค้ารักษ์โลก รักษ์สิ่งแวดล้อม Bio-Circular-Green Economy ของภาคกลางและภาคตะวันออกสินค้าที่มีคุณภาพที่อยู่ในโครงการ Local+ 3 กลุ่ม ได้แก่ สินค้าอัตลักษณ์ สินค้า BCG เป็นกลุ่มสินค้าที่เน้นการผลิตโดยมุ่งรักษาทรัพยากรธรรมชาติ และสินค้านวัตกรรม
กิจกรรมภายในงานครั้งนี้ ประกอบด้วย การจัดงานแสดงและจําหน่ายสินค้า จำนวน 50 ร้านค้า
พร้อมจัดกิจกรรมเจรจาธุรกิจ ทั้งแบบ Offline/Online ระหว่างผู้ประกอบการ เพื่อเป็นการเพิ่มโอกาสทางการตลาดให้กับผู้ประกอบการ
สมุทรปราการเกมส์ การแข่งขันกีฬา แห่งชาติครั้งที่ 48 วันที่ 9-19 มิถุนายน 2566
จ.สมุทรปราการ เป็นเจ้าภาพการแข่งขันกีฬา แห่งชาติครั้งที่ 48 “สมุทรปราการเกมส์” และ กีฬาคนพิการแห่งชาติ ครั้งที่ 48 “เมืองปราการเกมส์” รอบคัดเลือกตัวแทนภาค 1 ณ ตลาดเชิงท่องเที่ยวศูนย์กลางจำหน่ายผลผลิตทางการประมงและศูนย์ส่งพัฒนาเศรษฐกิจจังหวัดสมุทรปราการ ตำบลท้ายบ้าน อำเภอเมืองสมุทรปราการ ระหว่างวันที่ 9-19 มิถุนายน 2566 โดยมีนักกีฬาจากจังหวัดในสังกัดภาค 1 จำนวน 14 จังหวัดเข้าร่วมการแข่งขันในครั้งนี้งานมหกรรมประกวดพระเครื่อง พระบูชา เหรียญคณาจารณ์ และเครื่องรางของขลัง 10 - 11 มิถุนายน 2566
งานมหกรรมประกวดพระเครื่อง พระบูชา เหรียญคณาจารณ์ และเครื่องรางของขลัง ตลาดพระโรงสี ประจำปี 2566 ในวันเสาร์และอาทิตย์ ที่ 10 - 11 มิถุนายน 2566 นี้ ที่ตลาดพระโรงสี ตำบลบางสมัคร อำเภอบางปะกง จังหวัดฉะเชิงเทรา
ขบวน Samut Sakhon Pride LGBTQ+ Pride Parade @กระทุ่มแบน 24 มิ.ย. 66 LINK
งาน Samut Sakhon Pride เสาร์นี้ 24 มิ.ย. 66 นี้ ชวนมาสัมผัสและร่วมขบวน LGBTQ+ Pride Parade ครั้งแรกของสมุทรสาคร บริเวณหอนาฬิกากระทุ่มแบน ตั้งแต่ 4 โมงเย็นเป็นต้นไป เตรียมพบกับหลากหลายกิจกรรมสร้างสรรรค์ภายในงาน ไม่ว่าจะเป็น… • ขบวนคาร์นิวัลทางบก • ขบวนแห่ทางน้ำ หนึ่งเดียวในไทย • กิจกรรมโยนดอกกุหลาบลงเรือ ส่งความรักถึง LGBTQ+ • น้องตุ้ม-ปริญญา นักมวยข้ามเพศคนแรกของไทย • ดาว TikTok สไปร์ทซี่ x เอิร์ทตี้ • แฟชั่นโชว์บนธงสีรุ้ง • ถ้อยแถลงจากเจ้าเมืองในการโอบอุ้มชุมชน LGBTQ+ • ดนตรีสด LGBTQ+ Playlist • คราฟต์เบียร์จาก 3 อำเภอ + แม่กลอง • วงเสวนาจากตัวแทน LGBTQ+ สมุทรสาครในหัวข้อ “ความหลากหลายทางเพศในเมืองเล็ก สู่ฝันใหญ่ในโลก Beyond Gender” ชวนเพื่อนมาร่วมบันทึกประวัติศาสตร์งาน Pride ครั้งแรกของสมุทรสาครกันเยอะๆ นะ
งาน พาณิชย์ FRUIT FESTIVAL 2023 - 27 มิ.ย.-5 ก.ค.66
เมืองพัทยาจึงขอเชิญผู้สนใจ ร่วมชม ช้อปผลไม้และผลิตภัณฑ์จากเกษตรกรได้ ในงาน “พาณิชย์ FRUIT FESTIVAL 2023" ระหว่างวันที่ 27 มิถุนายน - 5 กรกฎาคมนี้ ณ ลานกิจกรรมศูนย์การค้าเซ็นทรัล พัทยา งานจัดโดย กรมการค้าภายใน เป็นการดำเนินมาตรการบริหารจัดการผลไม้เชิงรุก ปี 2566 เพื่อช่วยเหลือเกษตรกรกระจายผลผลิต รณรงค์การบริโภคผลไม้ ในช่วงผลผลิตผลไม้ภาคใต้ออกสู่ตลาด ในปี 2566 ซึ่งภายในงานจะมีการออกร้านจำหน่ายผลไม้ และผลิตภัณฑ์ต่างๆ จากเกษตรกร ให้ประชาชนและนักท่องเที่ยวได้เลือกสรรมากมาย สอบถามเพิ่มเติมได้ที่ กองส่งเสริมและบริหารระบบการตลาด กรมการค้าภายใน โทร.02-5075899 หรือที่ศูนย์การค้าเซ็นทรัล พัทยา โทร.038-930999
ปฏิทินกิจกรรมท่องเที่ยวบุรีรัมย์ มิถุนายน 2566
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดบุรีรัมย์ ต้อนรับเดือนมิถุนายน 2566
• OR BRIC Superbike สนาม 2
วันที่ 2-4 มิถุนายน 2566 ณ สนามช้าง
อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• PT Maxnitron Racing Series 2023
เข้าชมแบบติดขอบสนามฟรีตลอดงาน
วันที่ 9-11 มิถุนายน 2566 ณ สนามช้าง
อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• Idemitsu Super Turbo Thailand 2023
สนามที่ 3-4 ศึกการแข่งขันรถยนต์ทางเรียบ
วันที่ 16-18 มิถุนายน 2566 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
• ชมนกกระเรียนกระเรียนพันธุ์ไทย ตลอดทั้งปี ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำ และนกกระเรียนพันธุ์ไทย อ.เมืองบุรีรัมย์ จังหวัดบุรีรัมย์
OR BRIC Superbike สนาม 2 วันที่ 2-4 มิถุนายน 2566 LINK
OR BRIC Superbike สนาม 2 วันที่ 2-4 มิถุนายน 2566 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต จังหวัดบุรีรัมย์
OR BRIC Superbike 4 สนาม ปี 2566 ดังนี้
สนาม 1 วันที่ 7-9 เมษายน 66
สนาม 2 วันที่ 2-4 มิถุนายน 66
สนาม 3 วันที่ 28-30 กรกฎาคม 66
สนาม 4 วันที่ 21-24 กันายน 66
Amazing Chiang Mai Pride 2023
Amazing Chiang Mai Pride 2023 ขบวนพาเหรด "Chiang Mai Pride Parade 2023" เริ่มตั้งขบวนตั้งแต่ พุทธสถาน เคลื่อนขบวนไปยังถนนไนท์บาร์ซาร์ เข้าถนนลอยเคราะห์และสิ้นสุดที่ ประตูท่าแพ บริเวณข่วงประตูมีกิจกรรมงานวัด(ปาเป้า โยนห่วง รถไฟราง) พร้อมทั้งฉายหนังกลางแปลงตลอดคืน และกิจกรรมบันเทิงอีกมากมาย "เชียงใหม่" เมืองแห่งสีสันและความสุขที่หลากหลาย
Suphanburi Music Craft & Folk Art Festival 2023 วันที่ 9-13 มิถุนายน 2566
Suphanburi Music Craft & Folk Art Festival 2023 ???? วันที่ 9-13 มิถุนายน 2566 ณ วัดป่าเลไลยก์วรวิหาร จ.สุพรรณบุรี ภายในงานพบกับ ♥️ งานเสวนา ♥️ creative workshops ♥️ ดนตรี ♥️ และสินค้าชุมชน ????พร้อมเปิดพื้นที่ music open space ให้กับทุกคนได้ร่วมสนุก
งาน “ไหว้ครูดนตรี Suphanburi Thailand" 7- 8 มิถุนายน 2566
งาน “ไหว้ครูดนตรี Suphanburi Thailand" เพื่อเป็นการส่งเสริมความร่วมมือด้านวัฒนธรรมของทุกภาคส่วน และสืบสาน รักษา ต่อยอด และเผยแพร่ภูมิปัญญาทางวัฒนธรรม “พิธีไหว้ครู” ซึ่งได้รับการขึ้นทะเบียนเป็นมรดกภูมิปัญญาทางวัฒนธรรมของชาติ ประจำปี พ.ศ. 2554 อีกทั้งยังเป็นการส่งเสริมการเตรียมความพร้อมเพื่อเข้ารับการพิจารณาเข้าสู่เครือข่ายเมืองสร้างสรรค์ (ด้านดนตรี) ขององค์การยูเนสโก เป็นการเชื่อมต่อกิจกรรมให้กับกลุ่มศิลปินในประเทศที่จะเข้าร่วมในปีต่อ ๆ ไป รวมถึงการดึงดูดศิลปินต่างชาติได้เข้าร่วมงานในอนาคต ให้จังหวัดสุพรรณบุรีเป็นศูนย์กลางการไหว้ครูดนตรีโลก
กิจกรรมภายในงาน นอกจากมีพิธีไหว้ครูแล้วยังมีกิจกรรม Suphanburi City of Music และการจัดขบวนแห่ Suphanburi Misic Festival การแสดง 5 เวที อาทิ เวทีการแสดงเพลงพื้นบ้านและการแสดงชาติพันธ เวทีการบรรเลงวงปี่พาทย์ เวทีการแสดงลิเกรวมดาว และการจัดตลาดนัดดนตรี วิถีไทยวิถีโลก การประชันดนตรี วิถีคนเพลง อีกด้วย
7- 8 มิถุนายน 2566
ณ โรงละครแห่งชาติภาคตะวันตกจังหวัดสุพรรณบุรีและศูนย์ราชการกรมศิลปากร อำเภอเมือง จังหวัดสุพรรณบุรี
เสียงใหม่ พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ วง Thai Symphony Orchestra ในวันศุกร์ที่ 2 มิถุนายน 2566
ครั้งแรกใจกลางเมืองตรัง “เสียงใหม่” ณ หอนาฬิกาจังหวัดตรัง พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ วง Thai Symphony Orchestra ในวันศุกร์ที่ 2 มิถุนายน 2566เวลา 19.00 - 20.30 น. บริเวณหอนาฬิกา ถนนวิเศษกุล อำเภอเมืองตรัง จังหวัดตรัง บรรเลงโดย วงไทยซิมโฟนีออร์เคสตร้า (Thai Symphony Orchestra) อำนวยเพลง โดย ดร.ธีรนัย จิระสิริกุล สร้างสรรค์ภาพจิตรกรรมประกอบบทเพลง โดย ดร. สุชาติ วงษ์ทอง อาจารย์เนาวรัตน์ พงศ์ไพบูลย์ ศิลปินแห่งชาติร่วมอ่านบทกวี
การแสดงซิมโฟนีออร์เคสตร้า โดยวง Thai Symphony Orchestra 2 มิถุนายน 2566
การแสดงซิมโฟนีออร์เคสตร้า โดยวง Thai Symphony Orchestra ชมฟรี “เสียงใหม่” พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ ณ โรงยิม 4,000 ที่นั่ง สนามกีฬาเทศบาลนครตรัง 2 (ทุ่งแจ้ง) วันศุกร์ที่ 2 มิถุนายน 2566 เวลา 19.00 - 21.30 น.
บรรเลงโดย วงไทยซิมโฟนีออร์เคสตร้า (Thai Symphony Orchestra) อำนวยการเพลง โดย ดร.ธีรนัย จิระสิริกุล สร้างสรรค์ภาพจิตรกรรมประกอบบทเพลง โดย ดร. สุชาติ วงษ์ทอง อ.เนาวรัตน์ พงศ์ไพบูลย์ ศิลปินแห่งชาติ ร่วมอ่านบทกวี ศิลปินรับเชิญ
- วงรองเง็งเสียงใหม่
- วงปล่อยแก่ยะลา
- จ๊อบ บรรจบ พลอินทร์
เทศบาลเมืองสุรินทร์ ทำหมันให้กับสุนัขและแมว 29 มิถุนายน 2566
เทศบาลเมืองสุรินทร์ ร่วมกับ ปศุสัตว์จังหวัดสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว "ในเขตเทศบาลเมืองสุรินทร์ รับ จำนวนจำกัด" ในวันที่ 29 มิถุนายน 2566 เวลา 08.30-163.0 น. ณ วัดพรหมสุรินทร์
PATTAYA WellFest 2023 วันที่ 9-11 มิ.ย.66
สมาคมสปาและเวลเนสภาคตะวันออก ร่วมกับ เทวารัณย์เวลเนส พัทยา และพันธมิตรธุรกิจสุขภาพ จึงได้จัดกิจกรรม “PATTAYA WellFest 2023” ในระหว่างวันที่ 9-11 มิถุนายน พ.ศ.2566 ณ บริเวณริมชายหาดด้านหน้าโรงแรมดุสิตธานี พัทยา โดยการสนับสนุนจากสำนักงานท่องเที่ยวและกีฬาจังหวัดชลบุรี การท่องเที่ยวแห่งประเทศไทยสำนักงานพัทยา และเมืองพัทยา
งานมหกรรมท่องเที่ยวมนต์เสน่ห์ชายแดนใต้ 2023 ในวันที่ 15-18 มิถุนายน 2566
งานมหกรรมท่องเที่ยวมนต์เสน่ห์ชายแดนใต้ 2023 งานดี งานเด่น งานดังของ 3 จังหวัดชายแดนใต้ ยะลา ปัตตานี นราธิวาส ในงานพบกับจุดเช็คอินท่องเที่ยว สินค้า OTOP สินค้า sme สินค้าชุมชนท่องเที่ยวมากมาย ณ บริเวณหน้ากองร้อย ตชด. 445 อำเภอเบตง จังหวัดยะลา พบกับศิลปินดังและการประกวดร้องเพลงลูกทุ่ง กิจกรรมส่งเสริมการขาย จับ แจก คูปอง และช่วงนาทีทอง ศิลปินที่มาสร้างความสนุกอาทิ กล้วยสแตมป์ เปา กิ่งกาญจย์ วุฒิ ป่าบอน ตรี ชัยณรงค์ ไก่ กะละมัง ในวันที่ 15-18 มิถุนายน 2566 หน้ากองร้อย ตชด. 445 อำเภอเบตง จังหวัดยะลา
งานตลาดยามเย็น ถิ่นทุเรียนนนท์ คนไทรม้า 17-25 มิถุนายน 2566
เทศบาลเมืองไทรม้า ขอเชิญชวนทุกท่าน เที่ยวชมงาน “ตลาดยามเย็น ถิ่นทุเรียนนนท์ คนไทรม้า” ระหว่างวันที่ 17-25 มิถุนายน 2566 ตั้งแต่เวลา 15.00-20.00 น. ณ ลานวัดบางนา หมู่ที่ 6 ตำบลไทรม้า ช้อปของดี ชิมของอร่อย ชิลด์บรรยากาศพื้นบ้าน กับทุเรียนเมืองนนท์แท้ๆจากชาวสวนเมืองนนท์ ตลอด 9 วัน 9 คืน‼️ ✅️การันตีคุณภาพลูกต่อลูก ✅️ราคาจับต้องได้ ✅️บรรยากาศชาวสวนพื้นบ้านดั้งเดิม ????️ ภายในงาน ลุ้นนาทีทอง ทุเรียนเมืองนนท์ในราคาพิเศษ ☎️ สอบถามเพิ่มเติม 0 2926 1350-2 ต่อ 220 ในวันและเวลาราชการ ????️อย่าลืม 17-25 มิถุนายน 2566 เที่ยวงาน “ตลาดยามเย็น ถิ่นทุเรียนนนท์ คนไทรม้า” ณ วัดบางนา
20-26 มิถุนายน 2566 งาน Nonthaburi fruit fest เซ็นทรัล เวสต์เกต
งาน Nonthaburi fruit fest 20 – 26 มิ.ย. 66 ที่ลานโปรโมชั่น ชั้น 1 หน้าร้าน MINISO เซ็นทรัล เวสต์เกต ยกขบวนผลไม้เมืองนนท์นานาชนิดส่งตรงจากเกษตรกรชาวสวนนนทบุรีมาเสิร์ฟ ขบวนผลไม้เมืองนานาชนิดตามฤดูกาลส่งตรงจากเกษตรกรชาวสวนนนทบุรี และกลุ่มเกษตรกรชาวสวนรายย่อย
- ทุเรียนจากชาวสวนการันตีเครื่องหมาย GI
- ผลไม้แปรรูปรสเลิศ
- 24 มิถุนายน สาธิตการทำขนมจากผลไม้โดยเชฟบีม Top Chef Thailand ขนมหวาน คนแรกของประเทศไทย
25 มิถุนายน สาธิตวิธีการทำสมูทตี้สูตรพิเศษจากร้าน D-Chan Premium Milk
งาน IP LOCAL MARKET 20-25 มิถุนายน 2566
กรมทรัพย์สินทางปัญญา ชวนเที่ยวชมงาน “IP LOCAL MARKET” ชอป ชิม ชม สินค้าภูมิปัญญาท้องถิ่น คุณค่าทรัพย์สินทางปัญญาชุมชน วันที่ 20-25 มิถุนายน 2566 ณ ชั้น 1 โซนโปรโมชั่น P1F
ภายในงานจะได้สัมผัสกับ 4 โซนประสบการณ์พิเศษ
• IP SHOWCASE พื้นที่จัดแสดงสินค้าที่ผ่านการพัฒนา และขอรับความคุ้มครองทรัพย์สินทางปัญญา
• IP SHOW ชมกิจกรรมสาธิตแสดงคุณค่าทางภูมิปัญญาชุมชน
• IP WORKSHOP พื้นที่สร้างงานคราฟต์ & DIY ด้วยตนเอง
• IP SELECTED งานแสดงและจำหน่ายสินค้าเด่น 20 ชุมชน ที่ขอรับความคุ้มครองทรัพย์สินทางปัญญา
• ร่วมสนุกกับการทำ Workshop เวลา 16.00 น. ทุกวัน ฟรี...
• พิเศษ! สำหรับผู้เข้าชมงาน ลุ้นรับบัตรกำนัลเงินสด นำไปรับส่วนลดแลกซื้อสินค้าภายในงานได้ทุกวัน
กรมทรัพย์สินทางปัญญา ยกระดับสินค้าชุมชน สร้างโอกาสการค้าอย่างยั่งยืน
งาน “The Sound of Illumination” (siren)เสียงจากใจ คิดถึงจากแดนใต้
งาน “The Sound of Illumination” (siren)เสียงจากใจ คิดถึงจากแดนใต้ พบกับการแสดงแสง สี เสียง ตระการตาใน Illumination Lighting Show สนุกกับการแสดงศิลปวัฒนธรรม เพลิดเพลินกับดนตรีพื้นบ้านชายแดนใต้ เต็มอิ่มกับสินค้า อาหารพื้นถิ่น
ร่วมสนุกในช่วงเวลาแห่งความสุขของเสียงดนตรี เลือกซื้อ เลือกชิมสินค้าพื้นเมืองเอกลักษณ์ชายแดนใต้ ในงาน The Sound of Illumination กับเสียงจากใจ คิดถึงจากแดนใต้
- วันที่ 25 -26 มิถุนายน ณ บริเวณสวนเจ้าทะเล (ปัตตานีซีเก็ต) อ.เมือง จังหวัดปัตตานี กับคอนเสิร์ต วงอานัส และ วง พัทลุง
- วันที่ 27 -28 มิถุนายน ณ สวนสาธารณะสิรินธร อ.สุไหงโก-ลก จ.นราธิวาส กับคอนเสิร์ต วง L. ก.ฮ. และวงแฮมเมอร์
- วันที่ 28 -29 มิถุนายน ณ สวนสาธารณะสนามช้างเผือก อำเภอเมืองยะลา จังหวัดยะลา กับคอนเสิร์ต วงกางเกง และวงแทมมะริน
ภายในงาน The Sound of Illumination เดินชิมชิลๆ กับอาหารพื้นบ้าน รสชาติต้นตำหรับ กับเมนูในความทรงจำของชาวปัตตานี ยะลา นราธิวาส กับเสียงสะท้อนแห่งความสุข ที่เตรียมเช็คอินกันได้ภายในงาน เชคอิน Illumination Lighting ใจกลางเมืองปัตตานี ยะลา นราธิวาส ชมการแสดง ศิลปวัฒนธรรม และดนตรีพื้นบ้านจากแดนใต้ให้หายคิดถึง ว่าครั้งหนึ่งเคยได้มาเยือน มาร่วมกันส่งเสียงแห่งความคิดถึงจากแดนใต้ในงาน The Sound of Illumination “เสียงจากใจ คิดถึงจากแดนใต้”
เทศกาลหนังสือ เชียงใหม่บุ๊คแฟร์ ครั้งที่ 8
เทศกาลหนังสือ เชียงใหม่บุ๊คแฟร์ ครั้งที่ 8 ระหว่างวันที่ 30 มิถุนายน - 9 กรกฎาคม 2566 เวลา 10.00 - 21.00 น. ณ เชียงใหม่ ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต
การแข่งขันกีฬาโรงเรียนกีฬาแห่งประเทศไทย ครั้งที่ 24 “นครลำปางเกมส์”
จ.ลำปาง เตรียมความพร้อมเป็นเจ้าภาพจัดการแข่งขันกีฬาโรงเรียนกีฬาแห่งประเทศไทย ครั้งที่ 24 “นครลำปางเกมส์” ระหว่างวันที่ 22-31 กรกฎาคม 2566
Pattaya Marathon 2023 วันที่ 22-23 กรกฎาคม 2566
SONGKLA BEACH LIFE 2023 วันที่ 7-9 กรกฎาคม 2566 LINK
“SONGKLA BEACH LIFE 2023” จัดขึ้นในวันที่ 7-9 กรกฎาคม 2566 ณ หาดชลาทัศน์ จังหวัดสงขลา เอาใจนักท่องเที่ยวสายอินดี้มาสนุกกับกิจกรรมบนชายหาด ใต้ป่าสน ชวนมาเรียนรู้การพายซับบอร์ดเวิร์คช้อปสนุกๆ กับ SUP พร้อมชมคอนเสิร์ตจากศิลปินชื่อดัง ได้แก่ SAFEPLANET / MUSKETEERS / HYBS / DEPT / LOSERPOP / YOURMOOD กิจกรรม Workshop และเรียนรู้การพายซับบอร์ด Beach Activities และ Street Art
Amazing Muay Thai Experience มวยโคราช 14-16 กรกฎาคม 2566
Amazing Muay Thai Experience มวยโคราช จัดขึ้น ณ เซ็นทรัลพลาซา จังหวัดนครราชสีมา วันที่ 14-16 กรกฎาคม 2566
ภายในงานมีกิจกรรมที่หลากหลายและน่าสนใจสำหรับนักท่องเที่ยวที่หลงใหลในศิลปะมวยไทย อาทิ การสอนมวยให้กับบุคคลทั่วไปที่สนใจเรียนมวย โดยมวยทั้ง 4 สาย มีความโดดเด่นแตกต่างกันไป ได้แก่ หมัดหนัก: มวยโคราช ฉลาด: มวยลพบุรี ท่าดี: มวยไชยา ไวกว่า: มวยท่าเสา หรือมวยพระยาพิชัย และยังมีการแข่งขันมวยไทย การสักยันต์ การจําหน่ายวัตถุมงคล และเครื่องรางของขลัง ผู้ที่สนใจสามารถติดตามรายละเอียดเพิ่มเติมได้ที่ TAT Contact Center โทร.1672 Travel buddy
งาน Amazing Thai Taste Festival 2023 วันที่ 28-30 กรกฎาคม 2566
ชาวเชียงใหม่เตรียมตัวให้พร้อม กับงานที่รวบรวมสุดยอดร้านดัง สวรรค์ของคนรักการกิน ที่งาน Amazing Thai Taste Festival 2023 ทั้งอาหารเอกลักษณ์ 5 ภูมิภาค อาหารนานาชาติ อาหารสุขภาพ และยกขบวนร้านดัง มิชลิน และสตรีทฟู้ดเจ้าอร่อยมากมายที่งาน ให้ได้อิ่มอร่อยตลอดงาน จัดเต็มด้วยศิลปินนักร้องชื่อดังระดับประเทศ ให้ได้ชมฟรีในงาน! วันที่ 28-30 กรกฎาคม 2566 ณ ศูนย์การค้าเซ็นทรัลเฟสติวัลเชียงใหม่ จัดงานโดยการท่องเที่ยวแห่งประเทศไทย (ททท.)
• วันที่ 28 ก.ค. 2566 พบกับ Seasonfive และ Yourmood
• วันที่ 29 ก.ค. 2566 พบกับ Playground และ อะตอม ชนกันต์
• วันที่ 30 ก.ค. 2566 พบกับ Musketeers และ No one else
สราญรมย์ ชมวิถีลุ่มเจ้าพระยา-ป่าสัก ประจำปี 2566 วันที่ 5-9 กรกฎาคม 2566
"สราญรมย์ ชมวิถีลุ่มเจ้าพระยา-ป่าสัก” ประจำปี 2566 กำหนดจัดขึ้นระหว่างวันที่ 5-9 กรกฎาคม 2566 (5 วัน) ตั้งแต่เวลา 11.00-21.00 น. ณ บริเวณเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท
เปิดอาณาจักร 6 จังหวัด ภาคกลางตอนบน รวมไว้เป็นหนึ่งเดียว ยิ่งใหญ่ที่สุดในภาคกลาง ศูนย์รวมสินค้าดี เด็ด ดัง เอาใจขาช้อปกว่า 120 ร้านค้า สัมผัสบรรยากาศแห่งความสุขบนผืนน้ำ กับกิจกรรม “ล่องเรือนำเที่ยว ชมวิถีชีวิตริมแม่น้ำเจ้าพระยา” ตระการตากับ “การแสดงน้ำพุประกอบเสียงเพลง” และ “ม่านน้ำสุดอลังการ” พร้อมร่วมกิจกรรมสนุกๆ ลุ้นรับของรางวัลพรีเมี่ยมตลอดงาน จัดเต็มกับการแสดงของศิลปินดังแนวหน้าระดับประเทศ
งาน Chachoengsao Job Fair 2023 วันที่ 14 กรกฏาคม 2566
งาน Chachoengsao Job Fair 2023 “นัดพบแรงงาน” ครั้งที่ 2 ปี 2566 วันที่ 14 กรกฏาคม 2566 ณ ศูนย์การค้าโรบินสันไลฟ์สไตล์ ฉะเชิงเทรา ลานกิจกรรมชั้น 1 หน้าร้าน BONCHON ภายในงานมีบริษัทชั้นนำมากมาย กับตำแหน่งงานที่หลากหลาย มากกว่า 1,500 อัตรา มีบริษัทฯ ทั้งในจังหวัด และต่างจังหวัด
งาน “ผลไม้และของดีเสิงสาง” เริ่ม 11-17 ก.ค 66
เตรียมเที่ยว งาน “ผลไม้และของดีเสิงสาง” เริ่ม 11-17 ก.ค 66 ณ สนามหน้าที่ว่าการอำเภอเสิงสาง 14 ก.ค. เนสกาแฟ 16 ก.ค. คาราบาว 17 ก.ค. ใบปอ รัตติยา ชมแข่งขันปอกและกินทุเรียน เลือกซื้อผลไม้ราคาถูก จากชาวสวนโดยตรง พร้อมสวนสนุกชุดใหญ่
ถนนคนเดินเทศบาลเมืองปู่เจ้าสมิงพราย ครั้งที่ 5 วันที่ 3-7 ก.ค. 66
ถนนคนเดินเทศบาลเมืองปู่เจ้าสมิงพราย ครั้งที่ 5 วันที่ 3-7 ก.ค. 66 ตั้งแต่ 12.00 -21.00 น. บริเวณเทศบาลเมืองปู่เจ้าสมิงพราย ตรงข้ามรพ.เมืองสมุทรปู่เจ้าฯ ข้างโรงงานโฟร์โมสต์ สำโรงใต้
งานหมากไม้รสหวาน สืบสานประเพณี นวัตวิถีโนนสุวรรณ 6-12 ก.ค.66 LINK
อ.โนนสุวรรณ จ.บุรีรัมย์ เชิญชวนเที่ยวงาน งานหมากไม้รสหวาน สืบสานประเพณี นวัตวิถีโนนสุวรรณ และงานส่งเสริมการท่องเที่ยวแบบ Life Style วิถีเกษตรโนนสุวรรณ จัดระหว่างวันที่ 6-12 ก.ค.66 บริเวณ หน้าอำเภอโนนสุวรรณ เชิญชิม เลือกซื้อทุเรียนน้ำแร่ภูเขาไฟ ของอำเภอโนนสุวรรณ รสชาติระดับชาติ ชมคอนเสิร์ตศิลปินดัง ตลอดงาน
6 ก.ค. แบมแบม ไหทองคำ
7 ก.ค. แอน อรดี ปะทะ บอย ศิริชัย
8 ก.ค. พลอย พุ่มพวง
9 ก.ค. โชค รถแห่
10 ก.ค. บังนัส ฟิวเจอร์แบนด์
11 ก.ค. บัว กมลทิพย์
12 ก.ค. เอ มหาหิงค์ เต็มวง
เทศกาลอาหารและเกษตรแฟร์ ครั้งที่ 1 วันที่ 14-23 ก.ค.66
เทศกาลอาหารและเกษตรแฟร์ ครั้งที่ 1 วันที่ 14-23 ก.ค.66 มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน (สุรนารายณ์) นครราชสีมา คอนเสิร์ตดีศิลปินดัง วง L.กฮ. Big Ass เต็มวง เฟิร์ส พรชิตา
ฉลองชัยชนะครั้งยิ่งใหญ่ ของจังหวัดสระบุรี หอมนสิการ สุดยอด UNSEEN
ขอเชิญร่วมงาน ฉลองชัยชนะครั้งยิ่งใหญ่ ของจังหวัดสระบุรี หอมนสิการ สุดยอด UNSEEN ประเทศไทย ๑ ∽ ๒ กรกฎาคม ๒๕๖๖ ณ บริเวณหอมนสิการ ตำบลสองคอน อำเภอแก่งคอย จังหวัดสระบุรี ชิงช้าสวรรค์ ม้าหมุน ไลฟ์แจ๊ส โรงละครโจ หลุยส์
7-9 ก.ค. 66 งานไทรโยคเมืองไม้ผล มนต์เสน่ห์แห่งขุนเขา
มหาวิทยาลัยราชภัฏกาญจนบุรี ร่วมกับภาคีเครือข่าย จัดงาน"ไทรโยคเมืองไม้ผล มนต์เสน่ห์แห่งขุนเขา"
ปฏิทินเที่ยวหยุดยาว ลำปาง-ลำพูน (28 กรกฎาคม - 2 สิงหาคม 2566)
ปฏิทินเที่ยวหยุดยาว ลำปาง-ลำพูน (28 กรกฎาคม - 2 สิงหาคม 2566)
กิจกรรมในพื้นที่จังหวัดลำปาง ในช่วงหยุดยาว 6 วัน
1. กิจกรรม "กาดริมวัง คนฮิมตาง" เกษตรปลอดภัย ท่องเที่ยวปันสุขวิถีใหม่ ครั้งที่ 2 ระหว่างวันที่ 28 - 30 กรกฎาคม 2566 ตั้งแต่เวลา 10.00-21.00น. ณ บริเวณริมน้ำวัง หลังจวนผู้ว่าราชการ อ.เมือง จ.ลำปาง
2.“กอเอ๋ยกอไก่ ขอไข่ในเล้า ” งานวันภาษาไทยแห่งชาติ ประจำปี 2566 Central Lampang x ลำลอง - lamlong ร่วมกันจัดงาน “กอเอ๋ยกอไก่ ขอไข่ในเล้า” เนื่องในโอกาสวันภาษาไทยแห่งชาติ 2566
วันศุกร์ที่ 28 กรกฎาคม 2566 เวลา 15.00 - 20.00 น. ณ ลานร่ำเปิง หน้าศูนย์การค้าเซ็นทรัล ลำปาง
3.กิจกรรม ส่งเสริมพระพุทธศาสนา เนื่องในวันอาสฬหบูชา และวันเข้าพรรษา จังหวัดลำปาง ประจำปี 2566 พิธีแสดงตนพุทธมามกะ และพิธีเวียนเทียน
วันอังคารที่ 1 สิงหาคม 2566 เวลา 18.00 น. เป็นต้นไป ณ วัดพระแก้วดอนเต้าสุชาดาราม อ.เมือง จ.ลำปาง
4.กิจกรรม การแข่งขันนกบินอิสระ Call back ชิงแชมป์ประเทศไทย Grand Flight Tour Thailand สนามที่ 3 จังหวัดลำปาง
วันเสาร์ที่ 5 สิงหาคม 2566 ณ สวนสาธารณะหนองกระทิง อ.เมือง จ.ลำปาง
กิจกรรมในพื้นที่จังหวัดลำพูน ในช่วงหยุดยาว 6 วัน
1.กิจกรรม หล่อเทียนพรรษา และแห่เทียนถวายเทียนพรรษา
วันที่ 24 และ 31 กรกฎาคม 2566 ณ วัดพระธาตุหริภุญชัยฯ อ.เมือง จ.ลำพูน
2. กิจกรรม ขึ้นรถไฟไปทำบุญ ผสานวัฒนธรรมบ้านพี่เมืองน้อง ร่วมถวายเทียนพรรษา "ลำปาง-ลำพูน" ครั้งที่ 13
วันที่ 30 กรกฎาคม 2566 ณ วัดดอยแม่ทา อ.แม่ทา จ.ลำพูน
สอบถามรายละเอียดเพิ่มเติมได้ที่ ททท.สำนักงานลำปาง เบอร์โทร.054-222214 ทุกวันจันทร์-ศุกร์ หรือสอบถามได้ที่ INBOX Fanpage ททท.สำนักงานลำปาง
งาน "วิจิตร@เชียงใหม่ สีสันแห่งเส้นแสง น้ำพุร้อนสันกำแพง 24 - 30 ก.ค. 2566
งาน "วิจิตร@เชียงใหม่ สีสันแห่งเส้นแสง น้ำพุร้อนสันกำแพง โครงการตามพระราชดำริ" ภายใต้คอนเซปต์ "Springs of Life น้ำพุแห่งชีวิต" ที่จะพาทุกคนย้อนดูความเป็นมา และความสัมพันธ์ระหว่างคนกับธรรมชาติ บรรยากาศตอนกลางคืนงามขนาด Highlight ที่ไม่ควรพลาดนั่นก็คือ เลเซอร์ผ่านม่านน้ำพุร้อน ที่บอกเล่าเรื่องราววิถีชีวิตจากอดีต สู่ปัจจุบัน ของกิจการน้ำพุร้อนสันกำแพง ตั้งแต่วันที่ 24 - 30 ก.ค. 2566 เวลา 17:00 - 22:00 น. น้ำพุร้อนสันกำแพง โครงการตามพระราชดำริ อ.แม่ออน จ.เชียงใหม่
สักการะสิ่งศักดิ์สิทธิ์ คู่บ้านคู่เมือง อุดรธานี ช่วงหยุดราชการยาวต่อเนื่องตั้งแต่ 28 ก.ค. - 2 ส.ค. 66
สำนักงานประชาสัมพันธ์จังหวัดอุดรธานี เชิญชวนประชาชนและนักท่องเที่ยวสักการะสิ่งศักดิ์สิทธิ์ คู่บ้านคู่เมือง อุดรธานี ขอพรเพื่อความเป็นสิริมงคล 1 พระอนุสาวรีย์พลตรี พระเจ้าบรมวงศ์เธอ กรมหลวงประจักษ์ศิลปาคม 2 พระบรมธาตุธรรมเจดีย์ วัดโพธิสมภรณ์ พระอารามหลวง 3 หลวงพ่อนาค วัดมัชฌิมาวาส พระอารามหลวง 4 ศาลหลักเมือง 5 ท้าวเวสสุวรรณ หน้าศาลหลักเมือง 6 พระพุทธโพธิ์ทอง อยู่บริเวณศาลหลักเมืองทางด้านทิศตะวันตก ใกล้กันกับท้าวเวสสุวรรณ 7 ศาลเทพารักษ์ 8 ศาลเจ้าปู่-ย่า 9 พระพุทธไสยาสน์โลกนาถศาสดามหามุนี วัดป่าภูก้อน อำเภอนายูง 10 พิพิธภัณฑ์ธรรมเจดีย์พระธรรมวิสุทธิมงคล วัดป่าบ้านตาด 11 วัดภูตะเภาทอง อ.หนองวัวซอ 12 อุทยานประวัติศาสตร์ภูพระบาท 13 พระธาตุเทพจินดา วัดมหาธาตุเทพจินดา อำเภอกุมภวาปี 14 วัดสระมณี บ้านผักตบ ตำบลผักตบ อำเภอหนองหาน 15 คำชะโนด อำเภอบ้านดุง 16 วัดป่าไชยวาน อำเภอไชยวาน 17 วัดภูทองเทพนิมิต อำเภอหนองแสง
งาน "ร่มโพธิ์ทอง ห่มผ้าพระนอน เกษตรและของดีเมืองอ่างทอง" 27 กรกฎาคม - 6 สิงหาคม 2566
งาน "ร่มโพธิ์ทอง ห่มผ้าพระนอน เกษตรและของดีเมืองอ่างทอง"
ภายในงานพบกับ..
✅ ไฟประดับ แสง สี สวยงามตระการตา
✅ การแสดงศิลปวัฒนธรรม การแสดงพื้นบ้าน การบรรเลงเพลงร่วมสมัย
✅ ร่วมสักการะพระพุทธไสยาสน์ เยี่ยมชมโบราณสถาน ภายในวัดขุนอินทประมูล ลอดอุโบสถเสริมสิริมงคล
✅ พิธีทำขวัญข้าว เดินเที่ยวชมการจัดแสดงนิทรรศการด้านข้าว ????
✅ พิธีห่มผ้าพระนอน ในวันที่ 1 สิงหาคม 2566
✅ การจำหน่ายสินค้า/อาหารเกษตรปลอดภัย และ สินค้าผลิตภัณฑ์ชุมชนของดีเมืองอ่างทอง (OTOP) ทั้งประเภท เสื้อผ้าและเครื่องแต่งกาย ของใช้ของประดับตกแต่ง สมุนไพรอาหารและยา
✅ ร้านอาหารปรุงสุก รสดี รสเด็ด ของจังหวัดอ่างทอง
✅ ตลาดต้นไม้ พันธุ์ไม้นานาชนิด ผลิตภัณฑ์การเกษตร เฟอร์นิเจอร์ไม้ และของใช้เบ็ดเตล็ด ฯลฯ
✅ การจัดประกวดชิงเงินรางวัล อาทิ ประกวดไก่พื้นเมือง การเรียงเมล็ดข้าวเป็นภาพ การแข่งขันจับปลาไหล หุงข้าวหม้อดิน สานสุ่มไก่ และกิจกรรมที่น่าสนใจอื่น ๆ อีกมากมาย
???? ระหว่างวันที่ 27 กรกฎาคม - 6 สิงหาคม 2566 ณ วัดขุนอินทประมูล อำเภอโพธิ์ทอง จังหวัดอ่างทอง
งานประเพณีทิ้งกระจาดประจำปี พ.ศ. 2566 มูลนิธิป่อเต็กตึ๊ง 24 กรกฎาคม - 11 กันยายน 2566 LINK
มูลนิธิป่อเต็กตึ๊ง ขอเชิญทำบุญบริจาคซื้อข้าวสาร กำหนดแจกเครื่องอุปโภคบริโภค ในโอกาสงานประเพณีทิ้งกระจาดประจำปี พ.ศ. 2566 "ทำบุญให้ผู้ล่วงลับ ทำทานให้ผู้ยากไร้" ระหว่างวันที่ 24 กรกฎาคม - 11 กันยายน พ.ศ. 2566 กำหนดการดังนี้
• 19 สิงหาคม พ.ศ. 2566 ณ สุสานมูลนิธิป่อเต็กตึ๊ง อำเภอบ้านแพ้ว จังหวัดสมุทรสาคร
• 24 สิงหาคม พ.ศ. 2566 ณ คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีนหัวเฉียว สาขาโคราช จังหวัดนครราชสีมา
• 1 กันยายน พ.ศ. 2566 ณ คลินิกการประกอบโรคศิลปะ สาขาการแพทย์แผนจีนหัวเฉียว สาขาศรีราชา จังหวัดชลบุรี
• 12 กันยายน พ.ศ. 2566 ณ มูลนิธิป่อเต็กตึ๊ง พลับพลาไชย กรุงเทพฯ
มูลนิธิร่วมกุศลสมุทรปราการ ประเพณีทิ้งกระจาด ประจำปี 2566 ตั้งแต่ 26 กรกฎาคม - 21 สิงหาคม 2566
มูลนิธิร่วมกุศลสมุทรปราการ ขอเชิญผู้มีจิตศรัทธาร่วมงานบุญมหากุศลครั้งยิ่งใหญ่ ใน #ประเพณีทิ้งกระจาด ประจำปี 2566 “ทำบุญอุทิศส่วนกุศลให้ผู้ล่วงลับ พร้อมทำทานให้แก่ผู้ยากไร้
ณ มูลนิธิร่วมกุศลสมุทรปราการ ถนนท้ายบ้านซอย17 ต.ปากน้ำ อ.เมือง จ.สมุทรปราการ
ตั้งแต่วันนี้ 26 กรกฎาคม 2566 - 21 สิงหาคม 2566 โดยผู้มีจิตศรัทธา สามารถร่วมทำบุญได้ 2 ช่องทาง ดังนี้
สักการะหลวงปู่ไต้ฮงกง และทำบุญบริจาคเงิน สิ่งของ ข้าวสาร อาหารแห้ง ได้ที่มูลนิธิร่วมกุศลสมุทรปราการ ถนนท้ายบ้าน ซอย17 ต.ปากน้ำ อ.เมือง จ.สมุทรปราการ โทร.021758789,021758668,0822242932
โอนเงินทำบุญผ่านบัญชีธนาคารกสิกรไทยสาขาสมุทรปราการ เลขที่ 224-2-22221-5 ชื่อบัญชี มูลนิธิร่วมกุศลสมุทรปราการ
****กรุณาตรวจสอบชื่อบัญชีก่อนกดยืนยันทุกครั้ง****
งานมหกรรมเกษตรและกล้วยไม้นครปฐม 66
งานมหกรรมเกษตรและกล้วยไม้นครปฐม 66 ระหว่างวันที่ 27 กรกฎาคม – 2 สิงหาคม 2566 ตั้งแต่เวลา 15.00 น. – 21.00 น. ณ อุทยานการอาชีพชัยพัฒนา ตำบลบ่อพลับ อำเภอเมือง จังหวัดนครปฐม โดยภายในงานจะประกอบไปด้วยการจัดแสดงกล้วยไม้ ไม้ดอก ไม้ประดับ พืชผล พืชผัก อย่างสวยงามตระการตา พร้อมจุด Check In ถ่ายภาพ อีกทั้งมีการประกวดกล้วยไม้ ไม้ดอก ไม้ประดับ จัดสวนพืชผัก ผลไม้ กิจกรรมฝึกอบรมระยะสั้น ได้แก่ การทำขนมเค้กส้มโอ ชาส้มโอ เครื่องดื่มจากมะพร้าว ขนมจากมะพร้าว การเพาะต้นอ่อนทานตะวัน ผักบุ้ง ถั่วงอก ถั่วลันเตา การปลูกผักสลัดในดิน การทำสลัดผัก กิมจิ ผักดอง การร้อยมาลัยกล้วยไม้ จัดดอกไม้สด จัดกระเช้า จัดสวนถาด กิจกรรมส่งเสริมการขาย และการเชื่อมโยงธุรกิจกลุ่มจากผู้ประกอบการรุ่นใหม่
นอกจากนี้ยังมีการแสดงของชมรม To Be Number One จังหวัดนครปฐม การแข่งขันกีฬาอีสปอร์ต (ROV) และการแสดงดนตรีพร้อม Influencer ที่มีชื่อเสียงการแสดงดนตรีของผู้ที่บกพร่องทางการได้ยิน ตลอดจนการจำหน่ายสินค้าเกษตร สินค้าเกษตรนาทีทองในราคาพิเศษ ร้านอาหารฟู้ดทรัค สามารถเลือกซื้อ เลือกกิน เลือกช้อป ทุกสรรพสิ่งในราคาย่อมเยา และการจัดนิทรรศการแสดงผลผลิตทางการเกษตรของอำเภอต่างๆ ทั้ง 7 อำเภอ ที่ผ่านการรับรองในนาม “นครปฐมการันตี” อีกด้วย
ปฏิทินการท่องเที่ยวจังหวัดนครปฐมประจำเดือนกรกฎาคม
ททท.สำนักงานตาก ขอแนะนำ 10 แหล่งท่องเที่ยวในช่วงวันหยุดยาว 28 กรกฎาคม – 2 สิงหาคม 2566
ททท.สำนักงานตาก ขอแนะนำ 10 แหล่งท่องเที่ยวในช่วงวันหยุดยาว ระหว่างวันที่ 28 กรกฎาคม – 2 สิงหาคม 2566
1. สักการะเพื่อเป็นสิริมงคล ณ ศาลสมเด็จพระเจ้าตากสินมหาราช อ.เมือง จ.ตาก
เวลาทำการ เปิดทุกวัน 09.00 – 17.00 น. [
พิกัด]
2. ชมความสวยงามของบรรยากาศริมน้ำปิงเมืองตาก ณ สะพานสมโภชกรุงรัตนโกสินทร์ 200 ปี (สะพานแขวน) อ.เมือง จ.ตาก
เวลาทำการ สามารถไปชมได้ตลอดทั้งวัน [
พิกัด]
3. สักการะและชมความสวยงามของวัดพระบรมธาตุบ้านตาก อ.บ้านตาก จ.ตาก
เวลาทำการ เปิดทุกวัน 07.00 – 17.00 น. [
พิกัด]
4. ชมความ UNSEEN ของไม้กลายเป็นหินที่ยาวที่สุดในโลก ณ อุทยานแห่งชาติดอยสอบมาลัย-ไม้กลายเป็นหิน อ.บ้านตาก จ.ตาก
เวลาทำการ เปิดทุกวัน 09.00 – 17.00 น. [
พิกัด]
5. ล่องแพชมวิวในเขื่อน แวะรับประทานเมนูปลาแม่น้ำ หรือเลือกนอนพักบรรยากาศสุดฟิน ณ เขื่อนภูมิพล อ.สามเงา จ.ตาก
เวลาทำการ เปิดทุกวัน 08.30 – 17.00 น. [
พิกัด]
6. ชมความสวยงามของวัดพม่า ณ วัดไทยสามัคคี อ.แม่สอด จ.ตาก
เวลาทำการ เปิดทุกวัน 08.30 – 17.00 น. [
พิกัด]
7. ชมความสวยงามของถ้ำที่มีลวดลายชั้นหินธรรมชาติสีฟ้า ณ ถ้ำสีฟ้า อ.แม่สอด จ.ตาก
เวลาทำการ เปิดทุกวัน 08.30 – 17.00 น. [
พิกัด]
8. เลือกซื้อสินค้าของฝากชาวบ้าน ที่ริมฝั่งชายแดน ไทย-เมียนมา ณ ตลาดริมเมย อ.แม่สอด จ.ตาก
เวลาทำการ เปิดทุกวัน 08.00 – 18.00 น. [
พิกัด]
9. ชมน้ำตกหินปูน มีชั้นจำนวนมาก ถึง 97 ชั้น มีน้ำตลอดปี และชมความสวยงามของทุ่งดอกกระเจียวสีส้ม ณ น้ำตกพาเจริญ อ.พบพระ จ.ตาก เวลาทำการ 08.00 – 17.00 น. [
พิกัด]
10. ชมวิวทะเลหมอก และทุ่งดอกไม้บนยอดดอย มีความสูง 1,100 เมตรที่มีอากาศเย็นทั้งปี ณ ม่อนหมอกตะวัน อ.พบพระ จ.ตาก
เวลาทำการ เปิดทุกวัน [
พิกัด]
ชิม ช็อป ใช้ ช่วยเศรษฐกิจไทย บ้านโฮ่ง ลำพูน 1-8 ก.ค.66
ร่วมงาน ชิม ช็อป ใช้ ช่วยเศรษฐกิจไทย บ้านโฮ่ง ลำพูน 1-8 ก.ค.66 บริเวณ กาดใหม่ชัยมงคล ตรงข้ามโลตัส ห้วยการ อ.บ้านโฮ่ง ลำพูน อิ่มอร่อยตลอดงาน ของใช้มากมาย
เทศกาลลำไย อำเภอลี้ 14-25 ก.ค.66
เทศกาลลำไย อำเภอลี้ 14-25 ก.ค.66 ณ สนามโรงเรียนเวียงเจดีย์ (เก่า) อ.ลี้ จ.ลำพูน จัดโดยชมรมกำนันผู้ใหญ่บ้าน อ.ลี้ จ.ลำพูน สินค้ามากมาย อาหารขนมน่าชิม สวนสนุกชุดใหญ่ กิจกรรม คอนเสิร์ต 12 วันเต็มๆ สนุกกันแบบจุกๆ ศิลปินบิ๊กเนมมากมาย นัน ไมค์ทองคำ ต่าย อรทัย ปูแดง วงมหาหิงค์ เอ็ดดี้ ตลาดแตก 1 MILL ครูเต้ย อภิวัฒน์ วง L.กฮ.
เทศกาลไทลื้อ “โฮ่มฮีต โตยฮอย ร้อยใจไทลื้อ” สืบสานตำนานไทลื้อ ครั้งที่ 20 วันที่ 15-16 กรกฎาคม 2566
สำนักงานวัฒนธรรมจังหวัดพะเยา ขอเชิญร่วมงาน เทศกาลไทลื้อ “โฮ่มฮีต โตยฮอย ร้อยใจไทลื้อ” สืบสานตำนานไทลื้อ ครั้งที่ 20 มาร่วมสัมผัส "วิถีวัฒนธรรมไทลื้อ" ภาคเหนือ ระหว่างวันที่ 15-16 กรกฎาคม 2566 ณ วัดพระธาตุสบแวน อำเภอเชียงคำ จังหวัดพะเยา
ชม ชิม ช้อป ภายในงานกันแบบจัดเต็ม!
-ชม...ขบวนแห่ทางศิลปวัฒนธรรมของกลุ่มชาติพันธุ์ไทลื้อภาคเหนือ หน่วยงาน/สถานศึกษา และการแสดงทางศิลปวัฒนธรรม
-ชิม...อาหารพื้นถิ่น อาหารชาติพันธุ์ไทลื้อ
-ช้อป...ผลิตภัณฑ์ชุมชน สินค้า ของฝากผลิตภัณฑ์ผ้าทอไทลื้อ ผลิตภัณฑ์ (CPOT)
สอบถามรายละเอียดเพิ่มเติมได้ที่ : สำนักงานวัฒนธรรมจังหวัดพะเยา
โทร. 054-485781-2
ททท.สำนักงานเชียงราย
โทร. 053-744674-5
ชมหนังกลางแปลง และแอ่ว"กาดพะเยาว์ คราฟท์" 25 ก.ค 2566
Wow WOW Wow สายชิว...In love ห้ามพลาด ไปชมหนังกลางแปลง และแอ่ว"กาดพะเยาว์ คราฟท์" 25 ก.ค 2566.นี้ ที่ลานอเนกประสงค์ เทศบาลเมืองพะเยา
ปฏิทินเที่ยวหยุดยาว ลำปาง-ลำพูน (28 กรกฎาคม - 2 สิงหาคม 2566)
ปฏิทินเที่ยวหยุดยาว ลำปาง-ลำพูน (28 กรกฎาคม - 2 สิงหาคม 2566)
กิจกรรมในพื้นที่จังหวัดลำปาง ในช่วงหยุดยาว 6 วัน
1. กิจกรรม "กาดริมวัง คนฮิมตาง" เกษตรปลอดภัย ท่องเที่ยวปันสุขวิถีใหม่ ครั้งที่ 2 ระหว่างวันที่ 28 - 30 กรกฎาคม 2566 ตั้งแต่เวลา 10.00-21.00น. ณ บริเวณริมน้ำวัง หลังจวนผู้ว่าราชการ อ.เมือง จ.ลำปาง
2.“กอเอ๋ยกอไก่ ขอไข่ในเล้า ” งานวันภาษาไทยแห่งชาติ ประจำปี 2566 Central Lampang x ลำลอง - lamlong ร่วมกันจัดงาน “กอเอ๋ยกอไก่ ขอไข่ในเล้า” เนื่องในโอกาสวันภาษาไทยแห่งชาติ 2566
วันศุกร์ที่ 28 กรกฎาคม 2566 เวลา 15.00 - 20.00 น. ณ ลานร่ำเปิง หน้าศูนย์การค้าเซ็นทรัล ลำปาง
3.กิจกรรม ส่งเสริมพระพุทธศาสนา เนื่องในวันอาสฬหบูชา และวันเข้าพรรษา จังหวัดลำปาง ประจำปี 2566 พิธีแสดงตนพุทธมามกะ และพิธีเวียนเทียน
วันอังคารที่ 1 สิงหาคม 2566 เวลา 18.00 น. เป็นต้นไป ณ วัดพระแก้วดอนเต้าสุชาดาราม อ.เมือง จ.ลำปาง
4.กิจกรรม การแข่งขันนกบินอิสระ Call back ชิงแชมป์ประเทศไทย Grand Flight Tour Thailand สนามที่ 3 จังหวัดลำปาง
วันเสาร์ที่ 5 สิงหาคม 2566 ณ สวนสาธารณะหนองกระทิง อ.เมือง จ.ลำปาง
กิจกรรมในพื้นที่จังหวัดลำพูน ในช่วงหยุดยาว 6 วัน
1.กิจกรรม หล่อเทียนพรรษา และแห่เทียนถวายเทียนพรรษา
วันที่ 24 และ 31 กรกฎาคม 2566 ณ วัดพระธาตุหริภุญชัยฯ อ.เมือง จ.ลำพูน
2. กิจกรรม ขึ้นรถไฟไปทำบุญ ผสานวัฒนธรรมบ้านพี่เมืองน้อง ร่วมถวายเทียนพรรษา "ลำปาง-ลำพูน" ครั้งที่ 13
วันที่ 30 กรกฎาคม 2566 ณ วัดดอยแม่ทา อ.แม่ทา จ.ลำพูน
สอบถามรายละเอียดเพิ่มเติมได้ที่ ททท.สำนักงานลำปาง เบอร์โทร.054-222214 ทุกวันจันทร์-ศุกร์ หรือสอบถามได้ที่ INBOX Fanpage ททท.สำนักงานลำปาง
งาน YALA MARATHON 2023
งาน YALA MARATHON 2023 กำหนดจัดวันที่ 30 ก.ค. 2566 งานวิ่งยะลา มาราธอน แบ่งเป็น 4 ระยะ คือ ฟันรัน (Fun Run) 4.32 กิโลเมตร, มินิมาราธอน (Mini Marathon) 10.5 กิโลเมตร, ฮาล์ฟมาราธอน (Half Marathon) 21.1 กิโลเมตร และฟูลมาราธอน (Full Marathon) 42.195 กิโลเมตร ใช้เส้นทางการวิ่ง ภายในเขตเทศบาลนครยะลา ตามที่กำหนด ผ่านวงเวียนศาลหลักเมือง แยกมลายูบางกอก ถนนสาย 15 แยกบ้านร่ม สะพานท่าสาป วงเวียนบ่อเจ็ดลูก ศูนย์ฮอนด้า โคลีเซียม วัดพุทธภูมิ ถนนเลียบแม่น้ำตลอดสาย วงเวียนหอนาฬิกา โดยมี จุด START – FINISH ณ สนามโรงพิธีช้างเผือก
วิ่ง ม.อ. หาดใหญ่สู่ธรรมชาติ ครั้งที่ 23 วันอาทิตย์ที่ 13 สิงหาคม 2566
วิ่ง ม.อ. หาดใหญ่สู่ธรรมชาติ ครั้งที่ 23 ชิงถ้วยพระราชทานจากสมเด็จพระเจ้าอยู่หัวและสมเด็จพระนางเจ้าฯ พระบรมราชินี มหาวิทยาลัยสงขลานครินทร์ ขอเชิญชวนนักศึกษา บุคลากร และผู้สนใจ เข้าร่วมงานวิ่ง ม.อ. หาดใหญ่สู่ธรรมชาติ ครั้งที่ 23 ในวันอาทิตย์ที่ 13 สิงหาคม 2566 เพื่อเฉลิมฉลองเนื่องในโอกาสครบรอบ 55 ปี แห่งการสถาปนามหาวิทยาลัยสงขลานครินทร์ เพื่อหารายได้จัดซื้อรถพยาบาลให้กับศูนย์บริการฉุกเฉินและบรรเทาสาธารณภัย มหาวิทยาลัยสงขลานครินทร์ และส่งเสริมให้นักศึกษา บุคลากร และประชาชนทั่วไปได้ใช้เวลาว่างให้เป็นประโยชน์ด้วยการเดิน–วิ่งออกกำลังกายเพื่อสุขภาพ
Amazing Muay Thai Experience มวยลพบุรี 18-20 สิงหาคม 2566 LINK
Amazing Muay Thai Experience มวยลพบุรี จัดขึ้น ณ พระราชวังนารายณ์ราชนิเวศน์ จังหวัดลพบุรี วันที่ 18-20 สิงหาคม 2566
งานดีๆ ที่ตั้งใจมาจัดให้พี่น้องชาวลพบุรีได้ไปร่วมสนุกกัน
- เปิดประสบการณ์เรียนรู้ต้นตำรับมวยไทย 4 สาย พบกับ ความฉลาดมีเชิงชั้นของมวยลพบุรีบ้านเรา ความว่องไวของมวยท่าเสา มวยท่าดี ของมวยไชยา และ ทึ่ง...กับหมัดหนักของมวยโคราช เปิดรับสมัครให้เรียนฟรี วันละ 4 รอบ
- ชมการสาธิตมวยไทยโบราณ 4 สาย และสาธิตการเปรียบมวยไทยแบบโบราณ
- เสริมความเชื่อความศรัทธาด้วยกิจกรรมการสักยันต์ เช่าบูชาวัตถุมงคล และเครื่องรางของขลัง
- ทันยุคสุดมันกับเกม Interactive มาช้อปสินค้าเกี่ยวกับมวยไทย และอร่อยไปกับอาหารและเครื่องดื่มกว่า 30 ร้าน
- มาร่วมลุ้นและเชียร์การแข่งขันชกมวยไทย ใน “ศึกมหัศจรรย์มวยไทย” ตั้งแต่ 6 โมงเย็นเป็นต้นไป
- 2 ทุ่มครึ่งของทุกวัน สนุกกับ Mini Concert จากศิลปินชื่อดัง ศุกร์ที่ 18 สิงหาคม พบกับ โต้ง ทูพี เสาร์ที่ 19 สิงหาคม พบกับ Sarah Salola อาทิตย์ 20 สิงหาคม เพลิดเพลินกับ มีนตรา อินทิรา
- และกิจกรรมอื่นๆ อีกมากมาย
ชมฟรีตลอดงาน!!
18 – 20 สิงหาคม นี้
บ่าย 3 โมงเย็น ถึง 4 ทุ่ม ณ สนามกีฬาโรงเรียนพิบูลวิทยาลัย
ผู้ที่สนใจสามารถติดตามรายละเอียดเพิ่มเติมได้ที่ TAT Contact Center โทร.1672 Travel buddy
งาน วิ่งกับหมอ ไม่หงอมะเร็ง 20 สิงหาคม 2566 LINK
ชวนไปวิ่งที่แปดริ้วกันในงาน วิ่งกับหมอ ไม่หงอมะเร็ง Eastern Cancer Network Run @ฉะเชิงเทรา “We beat cancer" วันอาทิตย์ที่ 20 สิงหาคม 2566 จุดเริ่มต้นและเส้นชัย ณ โรงเรียนวัดโสธรวรารามวรวิหารจังหวัดฉะเชิงเทรา รายได้หลังหักค่าใช้จ่าย มอบให้โรงพยาบาลพุทธโสธร เพื่อนำไปดูแลรักษาผู้ป่วยมะเร็ง จัดโดย Eastern Cancer Network เครือข่ายการรักษาผู้ป่วยมะเร็งในภาคตะวันออกของประเทศไทย
เทศกาลกุ้งมังกร ภูเก็ต 2023 วันที่ 1-31 สิงหาคม 2566 LINK
เทศกาลกุ้งมังกร จังหวัดภูเก็ต ประจำปี 2566 (PHUKET LOBSTER FESTIVAL 2023) กลับมาอีกครั้ง กับร้านอาหารทั่วจังหวัดภูเก็ต กว่า 200 ร้าน พร้อมกับโปรโมชั่น จากททท. สุดพิเศษ ททท. สำนักงานภูเก็ต มอบคูปองส่วนลด 300 บาท สำหรับนักท่องเที่ยวที่รับประทานเมนู กุ้งมังกร ในร้านอาหารที่ร่วมรายการ โดยมียอดค่าบริการขั้นต่ำ 1,000 บาทขึ้นไป (คูปองมีจำนวนจำกัด) ใช้คูปองได้ระหว่างวันที่ 1-31 สิงหาคม 2566. งานเทศกาลกุ้งมังกร ภูเก็ต จัดใหญ่ทั่วทั้งเกาะ ครอบคลุมร้านอาหารใน 3 อำเภอ
เช็ครายชื่อโรงแรม/ร้านที่ร่วมรายการทั้ง 3 จังหวัดได้ที่นี่แรลลี่ด๊อกก้า Rally Dogkar ปีที่ 14 อาทิตย์ที่ 12-13 สิงหาคม 2566
การเตรียมตัวไปแรลลี่ด๊อกก้า
Rally Dogkar ปีที่ 14 อาทิตย์ที่ 12-13 สิงหาคม 2566 เริ่ม 12.00 จบกิจกรรม 19.00 น.กิจกรรมจบ นอนโรงแรมที่นั่นเลย สตาร์ท : Limelihgt – บ้านพักพิงสุนัขจรจัด สวนป่าบางขนุน - บลูทรี ปลายทาง : โรงแรม Cassia Phuket
งานเวียนเทียนทางน้ำกลางกว๊านพะเยา ครั้งที่ 49 วันอาสาฬหบูชา ในวันที่ 1 สิงหาคม 2566
เชิญชวนพุทธศาสนิกชนทุกท่านออกไปทำบุญแสวงประสบการณ์แห่งความสุขทันใจใน “โมเม้นต์ที่ใช่สร้างได้ไม่ต้องรอ” ในงานเวียนเทียนทางน้ำกลางกว๊านพะเยา ครั้งที่ 49 เนื่องในวันอาสาฬหบูชา ในวันที่ 1 สิงหาคม 2566 เวลา 07.00-20.30 น. ณ วัดติโลกอาราม อ.เมือง จ.พะเยา
ปฏิทินท่องเที่ยวจังหวัดพะเยา เดือนกรกฎาคม-สิงหาคม 2566
สิงหาพาแม่เที่ยว ที่สวนพฤกษศาสตร์สมเด็จพระนางเจ้าสิริกิติ์ จังหวัดเชียงใหม่ LINK
ตลอดเดือนสิงหาคมที่จะถึงนี้ มาส่งมอบความรักแด่คุณแม่ ในกิจกรรม “Mother’s month” สิงหาพาแม่เที่ยว ที่สวนพฤกษศาสตร์สมเด็จพระนางเจ้าสิริกิติ์ จังหวัดเชียงใหม่ สวนพฤกษศาสตร์สมเด็จพระนางเจ้าสิริกิติ์ จังหวัดเชียงใหม่ ส่งมอบสิทธิพิเศษ
ฟรี ค่าบัตรเข้าชมสวนสำหรับคุณแม่และคุณลูก 1 ท่าน (ค่ายานพาหนะจ่ายปกติ) และยังสามารถนำสลิปชำระเงิน รับส่วนลดพิเศษสำหรับเครื่องดื่มที่ร่วมรายการ ได้ตั้งแต่วันที่ 1 – 31 สิงหาคม 2566
หากจะแพลนพาคุณแม่เที่ยว ส่งมอบความรัก กระชับความสัมพันธ์ในครอบครัว กับช่วงเวลาดีๆ ต้องที่นี่ สวนพฤกษศาสตร์สมเด็จพระนางเจ้าสิริกิติ์
ปฏิทินกิจกรรม จังหวัดอุดรธานี เดือนสิงหาคม 2566
กิจกรรมสัปดาห์วิทยาศาสตร์แห่งชาติ ”วิทยาศาสตร์เพื่อชีวิต สิ่งแวดล้อม และสังคม BCG” 16 - 18 สิงหาคม 2566 LINK
กิจกรรมสัปดาห์วิทยาศาสตร์แห่งชาติ ”วิทยาศาสตร์เพื่อชีวิต สิ่งแวดล้อม และสังคม BCG” ในวันที่ 16 - 18 สิงหาคม 2566 ณ อาคารหอประชุม100ปี และอาคาร SCB 1-2-3 คณะวิทยาศาสตร์ มหาวิทยาลัยราชภัฎอุดรธานี (
สามพร้าว) โดยมีกิจกรรมต่างๆ อาทิ เช่น ประกวดโครงงานวิทยาศาสตร์ และคณิตศาสตร์ ประกวดนวัตกรรมวิทยาศาสตร์ การแข่งขันจรวดขวดน้ำประเภทแม่นยำ การแข่งขันตอบปัญหาวิทยาศาสตร์ ไอที และสิ่งแวดล้อม ประกวดวาดภาพทางวิทยาศาสตร์ science show นิทรรศการวิทยาศาสตร์เพื่อท้องถิ่น กิจกรรมจากสาขาวิชาต่างๆ กิจกรรมอื่นๆ มากมาย และของรางวัลอีกมากมายรอให้ทุกท่านมาร่วมสนุก
ปฏิทินกิจกรรม สิงหาคม 2566
● งานฉลองท้าวเวสสุวรรณ ในสัปดาห์แห่เทียนเข้าพรรษา วันที่ 24 ก.ค. - 1 ส.ค. 2566 ณ วัดป่าเลไลยก์วรวิหาร จ.สุพรรณบุรี
● งานสืบสานประเพณี ช่วงเทศกาลเข้าพรรษา หนึ่งเดียวของจังหวัดสุพรรณบุรี พิธีอุ้มหลวงพ่อดำลงสรงแม่น้ำท่าจีน วันที่ 30 ก.ค. - 1 ส.ค. 2566 ณ วัดเถรพลาย อ.ศรีประจันต์ จ.สุพรรณบุรี
● ประเพณีแห่เทียนพรรษา จังหวัดสุพรรณบุรี ประจำปี 2566 วันที่ 1 - 2 ส.ค. 2566 ณ วัดป่าเลไลยก์วรวิหาร อำเภอเมือง จังหวัดสุพรรณบุรี
● งานประเพณีทิ้งกระจาด จังหวัดสุพรรณบุรี ประจำปี 2566 วันที่ 2 - 14 กันยายน 2566 ณ ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี
งานเทศกาลสารทจีนและประณีทิ้งกระจาด 2566 ณ ศาลเจ้าแม่ (หน้าผา) ปากน้ำโพ 26-31 สิงหาคม 2566 LINK
งานเทศกาลสารทจีนและประณีทิ้งกระจาด ประจำปี 2566 วันที่ 26-31 สิงหาคม 2566 ณ ศาลเจ้าแม่ (หน้าผา) เชิญชวนผู้มีจิตศรัทธา ร่วมบริจาคเครื่องอุปโภคบริโภค แก่ผู้มีรายได้น้อย กำหนดการมีดังนี้
• 26 สค. ลงทะเบียนรับบัตรคิว
• 27 สค. ประเพณีทิ้งกระจาด ศาลเจ้าแม่หน้าผา
• 28 สค. ประเพณีทิ้งกระจาด ศาลเจ้าพ่อเทพารักษ์
• 30 สค. เทศกาลสารทจีน วันไหว้บรรพบุรุษ
จะต้องเตรียมตัวมาดังนี้
1.ประตูเปิด วันที่ 26 สิงหาคม เวลา 10.00 น. เป็นต้นไป
2.สิ่งที่ท่านต้องเตรียมมาคือ บัตรประชาชนตัวจริง 1 ใบ รับได้บ้านละ 1 ถัง
(บัตรประชาชน 1 ใบ รับได้บ้านละ 1 ถังเท่านั้น โดยอ้างอิงจากเลขที่ทะเบียนบ้านในระบบ)
3.คณะกรรมการจัดงานฯ ยังคงให้ความสำคัญต่อการควบคุมการแพร่ระบาดของเชื้อไวรัสทุกสายพันธุ์ ขอความกรุณาสวมหน้ากากอนามัย มิเช่นนั้น จะถือว่าท่านสละสิทธิ์ จัดงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2566-2567 เถ่านั้งปีที่ 108
ประเพณีทิ้งกระจาด (ซิโกว) มูลนิธิชุมพรการกุศลสงเคราะห์ หน่วยกู้ชีพ - กู้ภัยสายชล ประจำปี 2566 วันที่ 25 - 27 สิงหาคม 2566 LINK
มูลนิธิชุมพรการกุศลสงเคราะห์ หน่วยกู้ชีพ - กู้ภัยสายชล ประจำปี 2566 วันที่ 25-27 สิงหาคม 2566 เรียนเชิญร่วมบริจาค ข้าวสาร อาหารแห้ง เครื่องนุ่งห่ม หรือปัจจัยแก่ผู้ยากไร้ ได้ทุกวัน ที่สำนักงานมูลนิธิชุมพรการกุศลสงเคราะห์ หรือ โอนบริจาคผ่านบัญชีธนาคารหมายเลข 654-26500-8 ชืื่ิอบัญชี มูลนิธิชุมพรการกุศลสงเคราะห์ ประเภท ออมทรัพย์ ธนาคารไทยพาณิชย์ สาขาชุมพร #ประเพณีทิ้งกระจาด2566 #ปณิธานยิ่งใหญ่ตามแบบอย่างองค์หลวงปุ่ไต่ฮงโจวซือ
เริ่มงาน วันที่ 25 - 27 สิงหาคม 2566 (รวม 3 วัน 3 คืน) กำหนดการ
วันศุกร์ ที่ 25 สิงหาคม 2566 เวลา 18.00 น. พิธีสวดพระพุทธมนต์ เปิด ณ มณฑลพิธี
วันเสาร์ ที่ 26 สิงหาคม 2566
เวลา 16.00 น.พิธีลอยกระทง ออกเชิญวิญญาณทางน้ำทั้ง 10 ทิศ
เวลา 19.00 น.พิธีสวดพระพุทธมนต์ นิมนต์พระสงฆ์สวดอุทิศส่วนบุญส่วนกุศล แก่ดวงวิญญาณผู้ล่วงลับ
เวลา 20.00 น.พิธีเวียนธูป อุทิศส่วนบุญแก่วิญญาณบรรพบุรุษ
วันอาทิตย์ ที่ 27 สิงหาคน 2566
เวลา 11.00 น.พิธีเคารพดวงวิญญาณผู้ล่วงลับไปแล้ว
เวลา 12.00 น. นิมนต์พระอาจารย์จีนวินยานุกร สุนทรธรรมภูษิต ปริยัติกิจโกศลเจ้าอาวาสวัดฉื่อฉาง อ.หาดใหญ่ จ.สงขลา เป็นประธานประกอบ
พิธีบวงสรวงดวงวิญญาณ
เวลา 16.00 น.แจกทาน ข้าวสาร อาหารแห้ง แก่ผู้ยากไร้
เวลา 19.00 น. พิธีสวดพระพุทธมนต์ เผาเครื่องกระดาษสักการะ ปิดงาน
ร่วมบริจาคข้าวสาร อาหารแห้ง แก่ผู้ยากไร้ ที่มูลนิธิชุมพรการกุศลสงเคราะห์ได้ทุกวัน
ติดต่อสอบถาม สำนักงานมูลนิธิชุมพรการกุศลสงเคราะห์
โทร 077-511451,093-5816887
บรรเทาสาธารณภัย โทร 077-502861
ชื่อบัญสี มูสนิอิฐมพรการกูศลสิงเคราะหั
ธนาตารไทยพาณิชย์ สายาชุมพร เลขที่ 654-265500-8
งานเทศกาลทิ้งกระจาด (ซิโกว) ศาลเจ้าอ่างทอง วันที่ 15-17 และ 19 สิงหาคม 2566 LINK
งานบุญเดือนเจ็ด (จีน) เปิดประตูนรก อุทิศให้ผีไร้ญาติ งานเทศกาลทิ้งกระจาด (ซิโกว) ศาลเจ้าพ่อกวนอูเทศบาลเมืองอ่างทอง วันที่ 15-17 และ 19 สิงหาคม 2566 เชิญชวนร่วมบุญบริจาคทรัพย์ ข้าวสาร-น้ำดื่ม-สิ่งของเครื่องใช้ เพื่อสร้างมหาบารมี อุทิศให้ผีไร้ญาติ เป็นมหากุศลยิ่งใหญ่พ้นจากภัยอันตราย แจ้งความจำนงทำบุญได้ที่ ศาลเจ้าอ่างทอง 035-611603 กำหนดการกิจกรรม ดังนี้
15 ส.ค. 8.00 น. พิธีอัญเชิญองค์เทพเจ้าฯ
16 ส.ค. 8.30 น. พิธีไหว้เทพเจ้าฯ (ชิวอิก ซิวว่อย)
17 ส.ค. 8.30 น. พิธีสวดเสริมสิริมงคล โดยพระจีนอนันมนิกาย 13.30 น. พิธีไหว้ฮงเฮียตี๋ อุทิศให้ผู้ล่วงลับ ผีไร้ญาติ 15.30 พิธีทิ้งกระจาด (ซิโกว) บริเวณด้านหลังศาลเจ้าอ่างทอง
19 ส.ค. 8.30 น. พิธีเพี่ยงเพ้าเทพเจ้า ส่งองค์เทพเจ้าฯ
ชมอุปรากรจีนงิ้ว พร้อมบรรยาย 5 คืน (15-19 สิงหาคม)
มหกรรมการท่องเที่ยวโดยชุมชนจังหวัดภูเก็ต Explore New Phuket, Explore Into The Local ในวันอาทิตย์ที่ 27 สิงหาคม 2566
ขอเชิญเที่ยวงาน “มหกรรมการท่องเที่ยวโดยชุมชนจังหวัดภูเก็ต” Explore New Phuket, Explore Into The Local ในวันอาทิตย์ที่ 27 สิงหาคม 2566 เวลา 16.00 - 22.00 น.
ณ ถนนถลาง จังหวัดภูเก็ต กิจกรรมภายในงาน
- ชมนิทรรศการชุมชนท่องเที่ยว
- การแสดงของชุมชนท่องเที่ยว
- ช้อปสินค้า ผลิตภัณฑ์ และของที่ระลึกของชุมชน
- ลุ้นของรางวัลมากมาย
ประเพณีพ้อต่อจังหวัดภูเก็ต ประจำปี 2566
เทศบาลนครภูเก็ตขอเชิญชวนประชาชนชาวจังหวัดภูเก็ต ร่วมสืบสานประเพณีพ้อต่อจังหวัดภูเก็ต ประจำปี 2566 ระหว่างวันที่ 28 สิงหาคม – 14 กันยายน 2566
“พ้อต่อ” คือชื่อเรียกประเพณีวันสารทจีน ของชาวไทยเชื้อสายจีนภูเก็ต ซึ่งจะจัดขึ้นในช่วงเดือน 7 ตามปฏิทินจันทรคติของจีน เชื่อกันว่าเป็นช่วงเวลาที่ประตูนรกเปิดออก เพื่อปลดปล่อยดวงวิญญาณให้กลับมาเยี่ยมและรับส่วนกุศลจากลูกหลานบนโลกมนุษย์TRAMS MOVE KORAT 18 - 20 สิงหาคม 2566
TRAMS MOVE KORAT @Mayfair Market ในโครงการ City Link 18 - 20 สิงหาคม 2566 ศิลปินจัดเต็ม มาเที่ยว ชิม ช้อป ชิล ในงานสนุกกับศิลปินสุดปังตลอด 3 วันเต็ม มูให้สุดในซุ้มแม่หมอดูดวงแม่นเวอร์ คนรักงานอาร์ตห้ามพลาดกับมุมศิลปะคิวท์ ๆ พร้อมกิจกรรมรับของรางวัลเพียบ! ดูฟรี คอนเสิร์ตของศิลปินจัดเต็ม!!!
18 สิงหาคม “LANDOKMAI” และ “Pop Pongkool”
19 สิงหาคม “PRETZELLE” และ “Safeplanet”
20 สิงหาคม “YourMood” และ “Big Ass”
งานแข่งเรือยาวประเพณี จ.สมุทรสาคร ครั้งที่ 17 วันที่ 26-27 สิงหาคม 66
งานแข่งเรือยาวประเพณี จ.สมุทรสาคร ครั้งที่ 17 วันที่ 26-27 สิงหาคม 66 ณ คลองชลประทาน D7 คลองตำขำ ต.ชัยมงคล อ.เมือง สมุทรสาคร ประเภทเรือ 7 ฝีพาย เรือมาด 12 ฝีพาย เรือยาว 30 ฝีพาย ถ่ายทอดสด TLB ไทยลองโบท
งานชมชิมช็อป ของดีวังม่วง 17-26 ส.ค.2566
งาน มหกรรมเจ้าพระยาป่าสัก UP EXPO 2023 @สระบุรี 28 สิงหาคม - 3 กันยายน 2566
งาน มหกรรมเจ้าพระยาป่าสัก UP EXPO 2023 @สระบุรี 28 สิงหาคม - 3 กันยายน 2566 บริเวณลานตรงข้ามศูนย์ราชการจังหวัดสระบุรี
พบกับสินค้าเด่นจาก 6 จังหวัดภาคกลางตอนบน (สระบุรี อยุธยา ลพบุรี สิงห์บุรี อ่างทอง ชัยนาท) อาทิเช่น สินค้าแปรรูป สินค้า BCG สินค้าอัตลักษณ์ สินค้านวัตกรรม สินค้าขุมชน และ ผลิตภัณฑ์ OTOP SMEs การแสดงมินิคอนเสิร์ต สาธิตการแปรรูปอาหารจากวัตถุดิบท้องถิ่น (แจกชิมฟรี) Workshop การตลาดออนไลน์ และกิจกรรมส่งเสริมการขายอีกมากมาย อาทิ แจกคูปองส่วนลด สําหรับซื้อสินค้าในงาน เกมชิงรางวัล
ชมการแสดง แน่นเวทีทุกคืน อาทิ วงดนตรีนักศึกษา & JOKER FAMILY ปู่จ๋าน ลองไมค์ & เคนน้อย ร้อยลีลา เฟิร์ส พรชิตา & ธัญญ่า อาร์สยาม กานต์ ทศน & แบงค์ โซจู
เปาวลี พรพิมล & นุ้ย สุวีณา วง L.กฮ. & อ๊อฟ ดอกฟ้า อาร์สยาม เบลล์ นิภาดา & ลำเพลิน วงศกร
กิน เล่น Beach Festival @ ริเช่ ฟาร์ม ชัยนาท 25-27 สิงหาคม 2566
กิน เล่น Beach Festival @ ริเช่ ฟาร์ม ชัยนาท การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานลพบุรี ชวนเที่ยวชายหาดที่ครบจบทั้ง กิน ช้อป นอน เล่น ในงานเดียว กับ เทศกาล “กิน เล่น Beach Festival” วันที่ 25-27 สิงหาคมนี้ เวลา 11.00 - 20.00 น. ณ วิสาหกิจชุมชนริเช่ฟาร์ม อำเภอมโนรมย์ จังหวัดชัยนาท เต็มอิ่มกับกิจกรรม กิน ช้อป นอน เล่น อาทิ • ลานกางเต้นท์ นอนฟังดนตรี ริมหาดทราย • ประกวดดนตรี beach music challenge • การแสดงโคเวอร์แดนซ์จากนักเรียน • การแสดงไวโอลีนโดยนักดนตรีระดับชาติ • เรียนรู้ศิลปะสีน้ำ • เข้าคอร์ส D.I.Y หมวกลายหินอ่อน • สาธิตเสื้อพิมพ์ลาย อีโคพริ้นท์ • สาธิตการทำพวงมโหตร • ดนตรีเปิดหมวก • ช้อปสินค้าใหม่ล่าสุดจาก โครงการ พัฒนาผู้ประกอบการราชภัฎจันทรเกษม สินค้าชุมชน สินค้าสุขภาพ และSMEs คัดสรรคุณภาพ
ปฏิทินการท่องเที่ยวจังหวัดนครปฐมประจำเดือนสิงหาคม
งานเเข่งขันเเรลลี่ 2 วัน 1 คืน ฉลองครบรอบ 80 ปี มหาวิทยาลัยศิลปากร
งานเเข่งขันเเรลลี่ 2 วัน 1 คืน ฉลองครบรอบ 80 ปี มหาวิทยาลัยศิลปากร 5-6 สิงหาคม 2566 เส้นทางพระราชวังสนามจันทร์ นครปฐม - เเก่งกระจาน เพชรบุรีพร้อมกิจกรรมดูดวงกับกูรูสายมูชื่อดัง ฟรี! (มูลค่า 2,500 บาท) อาหารเย็นมื้อพิเศษและปาร์ตี้กลางคืนสุดสนุก สัมผัสธรรมชาติเเละผู้เข้าแข่งขันทุกคนมีสิทธิ์ร่วมลุ้นของรางวัลในงานมากมาย ห้ามพลาด!
เทศกาลดนตรีวิถีเมือง นครปฐมเมืองดนตรี 17-18 ส.ค. 66 LINK
17-18 ส.ค. 66 พบกับเทศกาลดนตรีวิถีเมือง ร่วมสนับสนุน ร่วมขับเคลื่อน นครปฐมเมืองดนตรี สู่เครือข่ายเมืองสร้างสรรค์ของ UNESCO พบนิทรรศการ ร้านค้าของดีนครปฐม กิจกรรมฝึกอบรม และการแสดงดนตรี
17 ส.ค. 66 I hate Monday 17.00-18.00 น.
18 ส.ค. 66 KISSCODE 17.00-18.00 น.
ปฏิทินท่องเที่ยวจังหวัดพะเยา เดือนสิงหาคม-กันยายน 2566
งานแข่งขันเรือยาวประเพณี จังหวัดพระนครศรีอยุธยา ประจำปี 2566
งานแข่งขันเรือยาวประเพณี จังหวัดพระนครศรีอยุธยา ประจำปี 2566 Ayutthaya Long Boat Racing 2023 การแข่งขันช่วงชิงความเป็นหนึ่งแห่งลุ่มน้ำเจ้าพระยา-ป่าสัก ร่วมสืบสานประเพณีที่มีมาอย่างช้านานของจังหวัดพระนครศรีอยุธยา 19-20 สิงหาคม 2566 ณ วัดพนัญเชิงวรมหาวิหาร
จักรยานเสือหมอบ เสือภูเขา สิงหาพาแม่เที่ยว เขื่อนภูมิพล จ.ตาก
กฟผ.จัดกิจกรรม EGAT Bike & RUN Series 2023 Healthy For All ร่วมปั่นจักรยานและวิ่งไปบน 8 เส้นทางของกฟผ.ทั่วประเทศ รอบ 19 สิงหาคมนี้ ไปปั่นวิ่ง ณ เขื่อนภูมิพล
เทศกาลอาหาร ผลไม้ของหรอยกงหรา 1-3 กันยายน 2566
สายผลไม้ สายชิวๆหาของทานยามเย็นเชิญจ้าาา "เทศกาลอาหาร ผลไม้ของหรอยกงหรา" 1-3 กันยายน 2566 เวลา 11 โมงเป็นต้นไป ณ ทางเข้าน้ำตกนกรำ ต.คลองทรายขาว อ.กงหรา จ.พัทลุง พบกับกิจกรรมน่าสนใจมากมาย อาทิ การประกวดการทำอาหาร การประกวดผลไม้ ชิม ช๊อบ แชร์ พร้อมกิจกรรมนาทีทอง แล้วพบกันนะจ๊ะ สนับสนุนงานดีๆโดยกระทรวงการท่องเที่ยวและกีฬา
ประเพณียายดอกไม้ (ตักบาตรดอกไม้) บ้านแป้ง จังหวัดสิงห์บุรี 2 สิงหาคม 2566 LINK
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานลพบุรี เชิญชวนพุทธศาสนิกชนร่วมบุญใหญ่ สืบสานประเพณียายดอกไม้ (ตักบาตรดอกไม้) เนื่องในงานเทศกาลเข้าพรรษาตำบลบ้านแป้ง จังหวัดสิงห์บุรี
ระหว่างวันที่ 1-2 สิงหาคม 2566 ณ วัดจินดามณี และพระบรมธาตุเจดีย์บ้านแป้ง อำเภอพรหมบุรี จังหวัดสิงห์บุรี
กิจกรรมภายในงาน…
- พิธีตักบาตรยายดอกไม้ คำว่า “ยาย” (ยายดอกไม้) นั้น เป็นสำเนียงที่เพี้ยนมาจาก คำว่า “หย่าย” ภาษาลาว ซึ่งแปลว่า การแจกจ่าย หรือการให้ ดังนั้นคำว่า “ยายดอกไม้” จึงหมายถึง การให้ หรือการถวายดอกไม้แด่พระสงฆ์ เพื่อนำไปบูชาพระพุทธเจ้า
- พิธีทำบุญตักบาตรข้าวสารอาหารแห้ง
- พิธีถวายผ้าอาบน้ำฝน และเทียนพรรษา 7 วัด 7 ต้น
- พิธีเวียนเทียน พระบรมธาตุเจดีย์บ้านแป้ง
- กิจกรรมคั่วข้าวตอก ถั่ว งา เครื่องปรุงกระยาสารท ทำกระทง ร้อยดอกไม้ของผู้สูงอายุ
- ชมสาธิตการกวนข้าวกระยาสารท และขนมมงคล
- ชมภูมิปัญญาการทำน้ำปลาแท้ วิถีชาวบ้าน
- ชมสาธิตการทำอาหารพื้นบ้าน อาทิ ลาบมะเขือ ขนมเบื้องญวน ยำญวน ข้าวเกรียบงา บัวลอยญวน และข้าวประดับดิน
- ชมเครื่องมือประกอบอาชีพของชาวลาวเวียงจันทร์ในอดีต อาทิ เครื่องมือทำทอง เครื่องมือปั้นหม้อ
- ชมการแสดงรำวงเมืองสิงห์ และเต้นบาสโลป
☎️ สอบถามข้อมูลด้านการท่องเที่ยวเพิ่มเติมได้ที่ : ททท.สำนักงานลพบุรี โทร. 036-770096-7 หรือ Facebook Fanpage : Tat Lopburi
Craft Cuisine & Cosmetics 2023 วันที่ 4-5 สิงหาคม 2566
งาน Craft Cuisine & Cosmetics 2023 พบกับงานคราฟท์ที่ดีที่สุดของพัทลุง และ ครั้งแรกกับแหล่งรวมร้านเด็ด งานคราฟท์ในพัทลุง ณ มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง
พบกับของหรอยพัทลุง และของสวย ๆ งาม ๆ จากเบรนเครื่องสำอางมากมาย มากับ Concept งาน “ชิมของหรอย joy งานคราฟท์ อิ่มอารมณ์ ชมดนตรี” วันที่ 4-5 สิงหาคม 2566 ณ หลาดริมชล มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง ตั้งแต่ 10.00 น. - 22.00 น. ของทุกวัน
#ภายในงานพบกับบูธต่างๆ กว่า 100 ราย และกิจกรรมมากมายให้เพลิดเพลิน
????ร้านอาหารและเครื่องดื่ม จากร้านดังทั่วทั้งจังหวัดพัทลุง
????ร้านเครื่องสำอางที่หลากหลาย
????งานคราฟท์
????ดนตรีในสวนที่จะสร้างบรรยากาศตลอดทั้งงาน
????การประกวดแข่งขันอาหารพื้นบ้าน และเชฟรุ่นเยาว์
????นวัตกรรมสุดล้ำและผลงานวิจัยสุดเจ๋ง ด้านอาหารและเครื่องสำอาง ของดีพัทลุง
แล้วมา joy กันนะครับ กับงานคราฟท์พัทลุง ณ มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง
Amazing Muay Thai Experience มวยท่าเสา 11-13 สิงหาคม 2566
Amazing Muay Thai Experience มวยท่าเสา จัดขึ้น ณ วัดใหญ่ท่าเสา จังหวัดอุตรดิตถ์ วันที่ 11-13 สิงหาคม 2566
ภายในงานมีกิจกรรมที่หลากหลายและน่าสนใจสำหรับนักท่องเที่ยวที่หลงใหลในศิลปะมวยไทย อาทิ การสอนมวยให้กับบุคคลทั่วไปที่สนใจเรียนมวย โดยมวยทั้ง 4 สาย มีความโดดเด่นแตกต่างกันไป ได้แก่ หมัดหนัก: มวยโคราช ฉลาด: มวยลพบุรี ท่าดี: มวยไชยา ไวกว่า: มวยท่าเสา หรือมวยพระยาพิชัย และยังมีการแข่งขันมวยไทย การสักยันต์ การจําหน่ายวัตถุมงคล และเครื่องรางของขลัง ผู้ที่สนใจสามารถติดตามรายละเอียดเพิ่มเติมได้ที่ TAT Contact Center โทร.1672 Travel buddy
งานมหกรรมผลไม้ และของดีเมืองยะลา ประจำปี 15-17 ส.ค.2566
งาน "มหกรรมผลไม้ และของดีเมืองยะลา" ประจำปี 2566 วันที่ 15 - 17 สิงหาคม 2566 ณ สนามโรงพิธีช้างเผือก เทศบาลนครยะลา
เทศกาล แสง สี สิงห์ 18-27 ส.ค.66 LINK
เทศกาล แสง สี สิงห์ ถ้าหามุมที่ถูกใจได้แล้ว อย่าลืมแวะมาเที่ยวกันต่อที่งานเทศกาลแสง สี สิงห์ 18-27 ส.ค. 2566 นี้ 5 จุดน่าสนใจ ลองแวะไปถ่ายรูปกันดูนะคะ
- ถ่ายภาพงานแสง สี สิงห์ อันนี้พลาดไม่ได้ไม่ว่าจะเป็นงาน Neon Light Art หรือ เครื่องเล่นต่างๆ ช่วยย้อนวัยกันไป
- แนวเขื่อนถนนวิไลจิตต์ เมืองสิงห์บุรี ออกจากหน้ามิวเซียวมสิงห์บุรีมานิดหน่อย จะเป็นงาน Street Art แถวเขื่อน ทอดยาวไป มุมฮิปๆเพียบ
- Crosswalk Art ที่เดินเลยมานิดๆจะเจอ ลายสีสันสดใสตัดกับเมืองและตึกมากเสน่ห์
- ต่อที่ ‘ห้องอาหารวรินทรา’ ที่ปกติ วง ‘The Improviser’ มาเล่น บรรยากาศวินเทจให้ไปดื่มด่ำเก็บภาพเอาไว้ก็สวยไม่หยอก
- แต่ถ้าอยากมาถ่ายภาพบรรยากาศดนตรีสดโดย The Improviser ต้องไปถ่ายที่เมืองทองรามา ก็จะได้ภาพไฟนีออนคู่กับวงดนตรีไป
เทศกาลกุ้งสามน้ำ กินร้อย ปล่อยล้าน 22 - 24 กันยายน 2566
ขอเชิญเที่ยวงาน “เทศกาลกุ้งสามน้ำ กินร้อย ปล่อยล้าน“ ระหว่างวันที่ 22 - 24 กันยายน 2566 ณ ตลาดน้ำทะเลน้อย อำเภอควนขนุน จังหวัดพัทลุง
กิจกรรม "กิน-เที่ยว วิถีเท่" งานมหกรรมเมืองลุงเท่ ครั้งที่ 2 (Phatthalung Festival) 24 - 28 สิงหาคม 2566
จังหวัดพัทลุง โดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดพัทลุง ร่วมกับหอการค้าจังหวัดพัทลุง และ YEC จังหวัดพัทลุง ขอเชิญเที่ยวชมงาน “ เมืองลุงเท่ ครั้งที่ 2 กิจกรรม กิน -เที่ยว วิถีเท่” ในระหว่างวันที่ 24 - 28 สิงหาคม 2566 เริ่มตั้งแต่เวลา 16.00 น.– 21.00 น. ณ บริเวณลานจอดรถลานนา ถนนบายพาส อำเภอเมือง จังหวัดพัทลุง ภายในงานท่านจะได้พบกับ บูธอาหารของดีเมืองลุง ทั้ง 11 อำเภอ สินค้าพื้นบ้าน สินค้า OTOP นิทรรศการการท่องเที่ยว จากหน่วยงานภาครัฐ และเอกชน ทริปเส้นทางการท่องเที่ยว เขา ป่า นา เล ลิ้มรสอาหารอร่อยหลากหลายเมนูเลิศรส ดื่มด่ำบรรยากาศที่อบอวลไปด้วยกลิ่นไอของธรรมชาติ และวัฒนธรรม ชมการแสดงศิลปะวัฒนธรรม
งาน บั้งไฟเฟสติวัล สีสันยโสธร 2023 (25-27 สิงหาคม 2566)
งาน บั้งไฟเฟสติวัล สีสันยโสธร 2023 ระหว่างวันที่ 25-27 สิงหาคม 2566 วิมานพญาแถน จังหวัดยโสธร พบกับ การจําหน่ายอาหารถนนคนลาบ และ ผลิตภัณฑ์จากกลุ่มอาชีพ ยกขบวนมากว่า 30 ร้านค้า ของดีจังหวัดยโสธร ตื่นตากับ แฟชั่นโชว์ผ้าพื้นเมือง เช็คอิน ซุ้มผ้าขาวม้ายาว 31 เมตร และ อุโมงค์รินน้ำยาว 150 เมตร ชมการแสดงศิลปวัฒนธรรม ประเพณี และ มินิคอนเสิร์ต จากศิลปินดังที่ท่านชื่นชอบ ฟรี!
งานประเพณีอัญเชิญเทพเจ้า จังหวัดสิงห์บุรี ประจำปี 25-31 สิงหาคม 2566
งานประเพณีอัญเชิญเทพเจ้า จังหวัดสิงห์บุรี ประจำปี 2566
ระหว่างวันที่ 25-31 สิงหาคม 2566 ณ บริเวณหน้าโรงหนังเมืองทองรามา ถนนวิไลจิตต์ อำเภอเมือง จังหวัดสิงห์บุรี (เวลา 19.00 น. ชมการแสดงงิ้วเปลี่ยนหน้า และ การแสดงมายากล ทุกค่ำคืน)
25 สิงหาคม 2566
ช่วงเช้า : นำขบวนมังกร-สิงโต ทำความเคารพ สิ่งศักดิ์สิทธิ์ภายในตลาดสิงห์บุรี และขบวนจะเดินทางไปโดยรอบ เพื่อความเป็นสิริมงคลของคนไทยเชื้อสายจีน
ช่วงเย็น : เวลา 17.30 น. ชมขบวนมังกร-สิงโต โดยมีไฮไลท์ “งิ้วเปลี่ยนหน้ากาก” พร้อมการแสดงของมังกร-สิงโต ซึ่งจะแห่เคลื่อนออกจากปั๊มเชลล์(เดิม) ผ่านถนนขุนสรรค์ไปยังถนนวิไลจิตต์ เพื่อทำการแสดง ณ บริเวณหน้าโรงหนังเมืองทองรามา
26 สิงหาคม 2566
ช่วงเช้า : อัญเชิญองค์เทพเจ้าแห่รอบตลาดสิงห์บุรี
ช่วงเย็น : อัญเชิญองค์เทพเจ้าเข้าประทับที่
28 สิงหาคม 2566
ช่วงเย็น : ประมูลของของมงคล เพื่อความเป็นสิริมงคล ความเจริญรุ่งเรือง ความร่มเย็นเป็นสุข ในการร่วมทำบุญให้องค์เทพเจ้า
30 สิงหาคม 2566 (วันสารทจีน) ตั้งแต่ช่วงเช้า เปิดโอกาสให้ประชาชนชาวไทยเชื้อสายจีน มาร่วมไหว้องค์เทพเจ้า
31 สิงหาคม 2566 (วันซิโกว) แจกจ่ายของให้แก่ผู้ยากไร้
เทศกาลไก่เบตง 26 ส.ค.- 1 ก.ย.66
งาน เทศกาล ไก่เบตง ปีนี้ จัดระหว่างวันที่ 26 สิงหาคม - 1 กันยายน 2566 ณ บริเวณลานวัฒนธรรมสัมพันธ์เทศบาลเมืองเบตง อำเภอเบตง จังหวัดยะลา (บริเวณปากอุโมงค์เบตงมงคลฤทธิ์ สวนน้ำเทศบาลเมืองเบตง) การประกวดพันธุ์ "ไก่เบตง การจัดแสดงนิทรรศการ “ไก่เบตง” ตลาดนัด “ไก่เบตง” การประกวดทุเรียนพันธุ์พื้นบ้าน และทุเรียนพันธุ์ชื่อดังเบตง การสาธิตทําอาหาร ของดีเมืองเบตง อาทิ กาแฟเบตง อาหารพื้นเมืองเบตง การออกบูธ ตลาดนัดอาหาร ของดีเมืองเบตง การประกวดวงดนตรี การแสดงศิลปวัฒนธรรม อาทิ ดีเกฮูลู มโนราห์ การแสดงของศิลปินนักร้องและนักแสดง อาทิ วงพัทลุง วงกางเกง บ่าววี การประกวดธิดาไก่เบตง ประกวด Miss Tourism (สาวประเภทสอง) การแข่งขันกินไก่เบตง แข่งขันกินหมี่เหลืองเบตง
งาน ทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี 2-14 กันยายน 66 LINK
เชิญชวนคนไทยเที่ยวงานประจำปีสุดยิ่งใหญ่ ของจ.สุพรรณบุรี ที่มีชื่อเสียงไปทั่วประเทศ นั่นคือ งาน ทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี ที่ปีนี้ กลับมาจัดอย่างยิ่งใหญ่ อีกครั้ง ณ บริเวณศาลเจ้าพ่อหลักเมือง มังกรสวรรค์ กำหนดจัดงานวันที่ 2-14 กันยายน 2566
งานประเพณีทิ้งกระจาดศาลเจ้าพ่อหลักเมือง สุพรรณบุรี ปี 2566 วันที่ 2-4 และ 14 ก.ย.66
งานประเพณีทิ้งกระจาดศาลเจ้าพ่อหลักเมือง จังหวัดสุพรรณบุรี ประจำปี 2566 วันที่ 2-14 กันยายน 2566 ณ ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี กำหนดการดังนี้
• 2 ก.ย. 2566 เวลา 08.00 น. พิธีขบวนอัญเชิญเจ้าพ่อหลักเมือง ให้ชาวสุพรรณสักการะ รอบตลาดในเมืองสุพรรณบุรี เวลา 19.00 น. ชมการแสดงมังกร ชมการแสดงสิงโตถวายเจ้าพ่อ หน้าบริเวณงาน
• 3 ก.ย. 2566 เวลา 18.00 น. พิธีลอยกระทง บริเวณแม่น้ำท่าจีน สี่แยกนางพิม
• 4 ก.ย. 2566 เวลา 15.00 น. พิธีแจกทานข้าวสารกระจาดฟ้า
• 14 ก.ย. 2566 เวลา 15.00 น. พิธีแจกทานข้าวสารกระจาดดิน
พิธีเปิดงาน
เริ่มตั้งแต่เวลา 06.00 น. เป็นต้นไป พิธีอัญเชิญเจ้าพ่อหลักเมืองสุพรรณบุรี ณ ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี ชมพิธีเปิดอย่างยิ่งใหญ่ ปล่อยขบวนแห่อัญเชิญเจ้าพ่อหลักเมืองอย่างยิ่งใหญ่ จากศาลเจ้าพ่อหลักเมืองสุพรรณบุรี แห่ไปตามเส้นทางรอบตัวเมืองสุพรรณบุรี ไปยังสมาคมตง ฮั้ว ฮ่วย ก้วง ขบวนแห่จำนวน 40 อย่างขบวนยิ่งใหญ่ตระการตา ประกอบด้วย ขบวนกลองศึก ขบวนสิงโต วูซู ขบวนมังกร 9 เชียน ขบวนเอ็งกอบู๊ ขบวนเชิญธง 16 ธง เชิญตะเกียง 2 ดวง (เต็งรั้ง) ขบวนเกี้ยวอัญเชิญเจ้าพ่อ ขบวนรถลากอัญเชิญเจ้าพ่อหลักเมืองจำลอง ฯลฯ
เวลา 18.00 น. พิธีลอยกระทง จะมีขบวนแห่โคมไฟจากสมาคมตง ฮั้ว ฮ่วย ก้วง เพื่อไปลอยกระทง ปล่อยนก ปล่อยปลา และทำพิธีกรรมทางศาสนาจีน ณ ท่าน้ำถนนนางพิม ริมแม่น้ำท่าจีน ชมขบวนแห่โคมไฟ จากสมาคมตง ฮั้ว ฮ่วย ก้วง ไปยังท่าน้ำถนนนางพิม ริมแม่น้ำท่าจีน ซึ่งเป็นสถานที่จัดพิธีลอยกระทง ประกอบด้วย 16 ขบวน ได้แก่ ขบวนเชิญธง 16 ธง เชิญตะเกียง 2 ดวง (เต็งรั้ง, ขบวนอัญเชิญพระสงฆ์จีน, ขบวนลูกหลานเจ้าพ่อ, ขบวนตั่วล่อโก้ว, ขบวนมิตรสัมพันธ์ ไทย-จีน, สาวงามถือโคมไฟ และมังกรทองนครสวรรค์
เวลา 15.00 น.พิธีทิ้งกระจาด ณ ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี
งานวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาด ประจำปี 2566 วันที่ 8 - 14 กันยายน 2566 LINK
ศาลเจ้าเล่งจูเกียง - ศาลเจ้าแม่ลิ้มกอเหนี่ยว จังหวัดปัตตานี ขอเชิญ ร่วมงานวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาด ประจำปี 2566 ระหว่างวันที่ 8 - 14 กันยายน 2566 ณ ศาลเจ้าเล่งจูเกียงปัตตานี ทำบุญสุขใจ บริจาคทานเป็นบุญกุศล ร่วมสักการะองค์เจ้าแม่ลิ้มกอเหนี่ยวและองค์พระต่างๆในศาลเจ้าเพื่อความเป็นสิริมงคล มีการแสดงงิ้วตลอดงาน กำหนดการปี 2566 ดังนี้
วันจันทร์ที่ 11 กันยายน 2566 เป็นวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว
เวลา 09.00 น - 12.00 น.
• พระสังฆาธิการในจังหวัดปัตตานี สวดพุทธมนต์และให้พร
• ร่วมพิธีไหว้เทวดาฟ้าดิน และพิธีไหว้องค์พระในศาลเจ้า
• มอบทุนการศึกษา
• มอบข้าวสาร น้ำตาลทรายให้กับวัดในจังหวัดปัตตานี
วันอังคารที่ 12 กันยายน 2566
เวลา 14.00 น. มอบข้าวสารให้กับโรงเรียนและหน่วยงานที่ขาดแคลนในจังหวัดปัตตานี
วันพุธที่ 13 กันยายน 2566
เวลา 15.00 น. ประเพณีทำบุญเทกระจาด
ร่วมทำบุญกับเจ้าแม่ฯ ติดต่อได้ที่
ศาลเจ้าเล่งจูเกียงปัตตานี (ศาลเจ้าแม่ลิ้มกอเหนี่ยว)
เปิดทำการทุกวัน เวลา 06.00 - 17.00 น.
โทรศัพท์ 073-332851
มูลนิธิเทพปูชนียสถาน (เจ้าแม่ลิ้มกอเหนี่ยว)
เปิดทำการวันจันทร์ - เสาร์ เวลา 09.00 - 16.00 น.
โทรศัพท์ 073-333316
โทรสาร 073-311860
ทิ้งกระจาด วัดอุภัยภาติการาม หลวงพ่อโต ซำปอกง แปดริ้ว ฉะเชิงเทรา 2-3 กันยายน 66 LINK
วัดอุภัยภาติการาม หลวงพ่อโต ซำปอกง ขอเชิญร่วมเป็นเจ้าภาพ ทิ้งกระจาด ประจำปี 2566 วันที่ 2-3 กันยายน 2566 ร่วมลงชื่อเป็นเจ้าภาพงานทิ้งกระจาด ลงชื่อเป็นเจ้าภาพ ร่วมบุญตามกำลังศรัทธา เจ้าภาพข้าวสารอาหารแห้งและของใช้ต่างๆ ข้าวสาร อาหารแห้ง น้ำดื่มลัง เจ้าภาพเครื่องกระดาษ ภูเขาเงินทอง ชุดเสื้อผ้าผู้ล่วงลับ ก้อนเงินก้อนทอง ร่วมบุญผ่านบัญชีธนาคารได้ที่ ธ.กรุงไทย เลขที่บัญชี : 269-0-18971-2 ชื่อบัญชี : วัดอุภัยภาติการาม ติดต่อสอบถามโทร 061-0429955 ณ วัดอุภัยภาติการาม (ซำปอกง) แปดริ้ว ฉะเชิงเทรา
สาครซีฟู้ดส์ เฟสติวัล @สมุทรสาคร 8-10 ก.ย.66 LINK
มหกรรมอาหารทะเลแห่งมหาชัย กลับมาอีกครั้ง ในวันที่ 8-10 กันยายน 2566 ตั้งแต่เวลา เวลา 16.00 น. - 22.00 ที่ริมเขื่อนหน้าศาลเจ้าพ่อหลักเมืองสมุทรสาคร รับประกันคุณภาพควาสดอร่อยอาหารทะเลไทยสมุทรสาคร โดยสำนักงานจังหวัดสมุทรสาคร
เจริญสินธานี Expo 2023 วันที่ 1-10 ก.ย.66
เจริญสินธานี Expo 2023 วันที่ 1-10 ก.ย.66 บริเวณ โครงการสินเจริญธานี โคกขาม อ.เมือง สมุทรสาคร
งานประกวด miss queen jumbo บ้านแพ้ว 2023 LGBTQ+ ในงานแลนด์ ออฟ บ้านแพ้ว
งานนัดพบแรงงาน Skill Expo 2023 - 4 ก.ย.66
งานนัดพบแรงงาน Skill Expo 2023 - 4 ก.ย.2566 ณ ลานเอนกประสงค์ วิทยาลัยเทคนิคสมุทรสาคร
การแข่งขันจักรยานแห่งสมุทรสาคร มหาชัยเกมส์ 2023 วันที่ 3 ก.ย.66
งานสืบสานประเพณีสารทเดือนสิบ ครั้งที่ 6 วันที่ 22 ก.ย.- 1 ต.ค. 66
งานสืบสานประเพณีสารทเดือนสิบ ครั้งที่ 6 วันที่ 22 ก.ย.- 1 ต.ค. 66 บริเวณสี่แยกตลาดบางปะอิน จังหวัดพระนครศรีอยุธยา
วันส้มโอขาวแตงกวา และของดีศรีท้องถิ่น ชัยนาท 7 - 17 กันยายน 2566
งาน “วันส้มโอขาวแตงกวา และของดีศรีท้องถิ่น จังหวัดชัยนาท” ครั้งที่ 39 ประจำปี 2566 กำหนดจัดขึ้นระหว่างวันที่ 7 - 17 กันยายน 2566 (11 วัน 11 คืน) ณ บริเวณเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท ภายใต้แนวคิด “เทคโนโลยีก้าวล้ำ นวัตกรรมนำสมัย GI ส้มโอขาวแตงกวาชัยนาท” ทังนี้ มีวัตถุประสงค์เพื่อสนับสนุน เผยเแพร่ และส่งเสริมการปลูกส้มโอขาวแตงกวา (GI) ซึ่งเป็นผลไม้ท้องถิ่นที่มีชื่อเสียงของจังหวัดชัยนาท การจำหน่ายส้มโอขาวแตงกวา ผลิตภัณฑ์ด้านการเกษตร ไม้ผล กิ่งพันธุ์ การจำหน่ายสินค้าหนึ่งตำบล หนึ่งผลิตภัณฑ์ (OTOP) ตลอดจนเป็นการส่งเสริมการท่องเที่ยวของจังหวัดชัยนาท ภายในงานประกอบด้วยกิจกรรมที่น่าสนใจ อาทิ 1) การประกวดส้มโอขาวแตงกวาชัยนาท 2) การประกอบอาหารจากส้มโอขาวแตงกวาชัยนาท 3) ขบวนแห่ส้มโอขาวแตงกวาชัยนาท กว่า 10 ขบวน 4) การประกวดธิดาส้มโอขาวแตงกวาชัยนาท 5) การจำหน่ายผลิตภัณฑ์แปรรูปจากส้มโอขาวแตงกวา
กิจกรรม โปรแกรม เด็กเลี้ยงวัว ฟาร์มโคนม ไทย-เดนมาร์ค อ.มวกเหล็ก จ.สระบุรี 9-10 กันยายน 2566 LINK
ฟาร์มโคนม ไทย-เดนมาร์ค อ.มวกเหล็ก จ.สระบุรี โปรแกรม “เด็กเลี้ยงวัว” เราจะพาน้องๆหนูๆไปเปิดประสบการณ์ ทดลองเป็น "เกษตรกรผู้เลี้ยงโคนม" เด็กๆจะได้เรียนรู้และลงมือฝึกปฏิบัติเป็นการเกษตรกรผู้เลี้ยงโคนมตัวน้อย ได้สัมผัสพี่วัวอย่างใกล้ชิด พาพี่วัวอาบน้ำ แปรงขน ก่อนพาพี่วัวไปรีดนม อีกทั้งยังได้ทดลองรีดนมแม่โคด้วยมือ สัมผัสเต้านมนุ่มๆของแม่โค ชมการรีดนมโคด้วยเครื่อง ชม Thai-Denmark Smart Dairy Farm หรือฟาร์มที่ใช้เทคโนโลยีเข้ามาช่วยการเลี้ยงวัว ชมโรงงานผลิตนมตั้งแต่ขั้นตอนรับน้ำนมดิบจนถึงขบวนการบรรจุนมลงกล่อง พร้อมทั้งมีกิจกรรมทำอาหารจากน้ำนมโค อาทิ เช่น สมูตตี้, Fresh Mozzarella, Panna cotta, Yogurt อีกทั้งยังมีโชว์การแสดงคาวบอย เล่นรอบกองไฟ ดื่มด่ำบรรยากาศธรรมชาติ นอนดูดาว ฟังเสียงน้ำตก วันเสาร์ที่ 9 และ วันอาทิตย์ที่ 10 กันยายน 2566 (2 วัน 1 คืน) ????แนะนำเด็กตั้งแต่อายุ 3 ปีขึ้นไป ห้องพัก 1 ห้อง แนะนำ 1 ครอบครัวไม่ควรเกิน 4 คน ฟรี อาหาร 4 มื้อ รับจำนวนจำกัด หรือจนกว่าห้องพักจะเต็ม สอบถามเพิ่มเติม/จอง โทร.091-890-6335
หอการค้าแฟร์ 2023 ราชบุรี วันที่ 3-11 กันยายน 2566
ขอเชิญเที่ยวงาน หอการค้าแฟร์ 2023 จังหวัดราชบุรี วันที่ 3-11 กันยายน 2566 ณ บริเวณตลาดเก่าโคยกี้ ริมน้ำแม่กลอง อ.เมืองจ.ราชบุรี
ตารางผ่าตัดทำหมัน 2566
ตารางผ่าตัดทำหมัน กันยายน - ธันวาคม 2566
- 3 กันยายน 2566 ณ เทศบาลตำบลยางเนิ้ง อำเภอสารภี ผ่าตัดทำหมันแมว ฟรี (ทำหมันแมว พื้นที่สันกำแพง เมือง สารภี หางดง) เวลา 08.30-11.00 น.
- 17 กันยายน 2566 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ ฉีดวัคซีนสุนัขรวม 6 โรค สถานที่ วัดแม่ย่อย ต.สันทรายน้อย อ.สันทราย
- 23 กันยายน 2566 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ สถานที่ อบต.โป่งแยง ต.โป่งแยง อ.แม่ริม
- 30 กันยายน 2566 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ สถานที่ อบต.สันป่ายาง ต.สันป่ายาง อ.แม่แตง
- 28 ตุลาคม 2566 เทศบาลตำบลเจดีย์ดีแม่ครัว ต.แม่แฝกใหม่ อ.สันทราย ผ่าตัดทำหมันสุนัขฟรี สุนัขเพศเมียและเพศผู้ อายุ 4 เดือน - 8 ปี
- 21 ตุลาคม 2566 วัดพระนอนขอนม่วง อ.แม่ริม สำหรับสุนัขเพศเมียและเพศผู้ อายุ 4 เดือน - 8 ปี เป็นสุนัขในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด
- 15 ตุลาคม 2566 ทำหมันแมว เทศบาลเมืองต้นเปา รับบัตรคิว 08.30 -11.00 น.
- 12 พฤศจิกายน 2566 เทศบาลตำบลตลาดใหญ่ ต.ตลาดใหญ่ อ.ดอยสะเก็ด ผ่าตัดทำหมันสุนัขฟรี สุนัขเพศเมียและเพศผุ้ อายุ 4 เดือน - 8 ปี น้ำหนัก 10 -20 กิโลกรัม
- 19 พฤศจิกายน 2566 ผ่าตัดทำหมันสุนัขฟรี เพศผู้และเพศเมีย น้ำหนัก 10-20 กิโลกรัม เทศบาลตำบลสันนาเม็ง ฉึดวัคซีน5 โรคสุนัข+พิษสุนัขบ้า ฟรี จำนวน 150 โดส สุนัข อายุ 3 เดือน ขึ้นไป
- 9 ธันวาคม 2566 เทศบาลตำบลป่าไผ่ อ.สันทราย ทำหมันสุนัขฟรี น้ำหนัก 10-20 กิโลกรัม เฉพาะ สุนัขในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด
- 24 ธันวาคม 2566 เทศบาลตำบลแม่ริม อ.แม่ริม ผ่าตัดทำหมันสุนัขฟรี น้ำหนัก 10-20 กิโลกรัม เฉพาะสุนัขในพื้นที่แม่ริม สันทราย ดอยสะเก็ด
งานเยือนวังเก่า เล่าวันวาน ผ่านสำรับอาหาร 23 - 27 กันยายน 2566
งานเยือนวังเก่า เล่าวันวาน ผ่านสำรับอาหาร วันที่ 23 - 27 กันยายน 2566 เวลา 14.00 - 21.00 น. ณ ศูนย์ศิลปวัฒนธรรมเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา มหาวิทยาลัยศิลปากร วิทยาเขตพระราชวังสนามจันทร์ (ข้างพระราชวังสนามจันทร์) เพื่อการเดินทางที่สะดวกแนะนำให้จอดรถที่ ลานจอดรถ ตลาดโต้รุ่ง องค์พระปฐมเจดีย์ มีรถรับ - ส่ง ถึงหน้างาน
maps.app.goo.gl
จุดจอดรถ
- ลานจอดรถข้างทับเจริญ
- ข้างสะพานรามประเวศน์
- ลานจอดรถพระปฐมเจดีย์ (แนะนำให้จอดรถที่นี่)
ปฏิทินการท่องเที่ยวประจำเดือนกันยายน
25 ส.ค. - 3 ก.ย. เทศกาลอาหาร พรรณไม้ ม.เกษตรกำแพงแสน
30 ส.ค. - 3 ก.ย. เทศกาลกลางเดือน 9 วัดละมุด นครชัยศรี
1-10 ก.ย. งานส้มโอนครชัยศรี วัดไทยาวาส นครชัยศรี
15-17 ก.ย. งานปิดทองปู่พักสกกธมโม วัดลานตากฟ้า นครชัยศรี
23-27 ก.ย. งานเยือนวังเก่า เล่าวันวาน ผ่านสำรับอาหาร ม.ศิลปากร พระราชวังสนามจันทร์
นครปฐมเมืองดนตรี Creative city of music Nakhon Prathom 22-23 กันยายน 66
นครปฐมเมืองดนตรี Creative city of music Nakhon Prathom
วันที่ 22 กันยายน 2566 เวลา 17.00 น. ณ บริเวณลานอาจารย์ศิลป์ พีระศรี หน้าสำนักงานอธิการบดี มหาวิทยาลัยศิลปากร วิทยาเขตพระราชวังสนามจันทร์ จังหวัดนครปฐม
วันที่ 23 กันยายน 2566 เวลา 18.00 น. ณ บริเวณลานจอดรถร้านค้ากลางคืน (สนามลี้คุนกี่) องค์พระปฐมเจดีย์
ปฏิทินท่องเที่ยวจังหวัดเลย กันยายน - ตุลาคม 2566
ปฏิทินท่องเที่ยวจังหวัดเลย - หนองบัวลำภู ช่วงเดือน กันยายน - ตุลาคม 2566
- วันที่ 14-16 กันยายน 2566 งานมหกรรมผ้าไทเลย ณ สนามหน้าศาลากลางจังหวัดเลย
- วันที่ 20-30 กันยายน 2566 งานหอการค้าแฟร์ 2566 เทศกาลแห่งความสุขสนุกแบบ very much ตอนมหัศจรรย์หน่อไม้ไทเลย ณ สนามหน้าศาลากลางจังหวัดเลย
- วันที่ 22-30 ตุลาคม 2566 งานประเพณีออกพรรษาและลอยผาสาดอำเภอเชียงคาน ประจำปี 2566 ณ อ.เชียงคาน / วันออกพรรษาและกิจกรรมลอยผาสาด (15 ค่ำ เดือน 11) คือ 29ต.ค. 66 ขบวนแห่ปราสาทผึ้ง, การแข่งขันเรือยาว ไทย –ลาว การออกร้านของส่วนราชการและเอกชน, การแสดงและจำหน่ายสินค้า OTOP, การจำหน่ายสินค้าราคาถูกมากมาย เสื้อผ้าแฟชั่นทันสมัย ของกิน ของใช้ เฟอนิเจอร์จากโรงงาน, การแสดงดนตรี - หมอลำ, การประกวดนางงามและปราสาทผึ้ง, การไหลเรือไฟ , การลอยผาสาด, งานพาแลง พร้อมสวนสนุกชุดใหญ่สุดอลังการ สอบถามเพิ่มเติมได้ที่ - อำเภอเชียงคานโทร. 0-4282-1597 - เทศบาล ต.เชียงคาน โทร. 0-4282-1914
- วันเสาร์ที่ 28 ต.ค. 66 เชียงคานฮาโลวีน 2023 ขบวนแห่เหล่าผีในเทศกาลฮาโลวีน ที่สนุกสนานที่ชุมชนบ้านไม้โบราณ 100 ปี และถนนคนเดินเชียงคาน จากบริเวณวัดศรีคุนเมือง ไปจนถึงลานวัฒนธรรมวัดท่าคก จุดตั้งขบวน บริเวณหน้าวัดศรีคุนเมือง (ซ.6-7 ล่าง) ถนนคนเดินเชียงคาน สอบถามเพิ่มเติมได้ที่ ททท.สำนักงานเลย โทร. 042812812
- วันอาทิตย์ที่ 29 ต.ค. 66 งานออกพรรษาประเพณีไหลเรือไฟโบราณ อำเภอด่านซ้าย ประจำปี 2566 ชมขบวนไหลเรือไฟโบราณที่สวยงามตระการตา ที่ชาวเมืองด่านซ้าย ได้ร่วมสืบทอดกันมากว่า 400 ปี เพื่อบูชาองค์พระสัมมาสัมพุทธเจ้า และสิ่งศักดิ์สิทธิ์ ในค่ำคืนวันเพ็ญออกพรรษา 15 ค่ำ เดือน 11 ณ บริเวณริมฝั่งแม่น้ำหมัน เขตเทศบาลด่านซ้าย จนถึงท่าน้ำวัดโพธิ์ศรีบ้านนาเวียงใหญ่ สอบถามเพิ่มเติมได้ที่ ททท.สำนักงานเลย โทร. 0 4281 2812
งาน SME ONE FEST 2023 by สสว.น้องมะเฟือง ชวนช้อปของดี SME ทั่วไทย 22-24 กันยายน 2566
ขอเชิญเที่ยวงาน SME ONE FEST 2023 by สสว. “น้องมะเฟือง ชวนช้อปของดี SME ทั่วไทย” ณ ถนนนเรศวร ระหว่างวัดมหาธาตุและวัดราชบูรณะ จังหวัดพระนครศรีอยุธยา ระหว่างวันที่ 22-24 กันยายน 2566 ตั้งแต่เวลา 16.00 – 22.00 น.
????️ เลือกซื้อ อุดหนุนสินค้าดี สินค้าเด่น จากผู้ประกอบการรายย่อยและวิสาหกิจชุนชน อาทิ สินค้าชุมชน ผลผลิตทางการเกษตร พืช ผัก ผลไม้ ผลิตภัณฑ์แปรรูปทางการเกษตร อาหารสด อาหารทะเล อาหารแปรรูป สินค้าหัตกรรมพื้นบ้าน ของใช้ เสื้อผ้าเครื่องแต่งกายฝีมือชาวบ้าน สินค้าของฝากของที่ระลึกของจังหวัดระยอง และสินค้าจากผู้ประกอบการไมโครเอสเอ็มอีทั่วไทยกว่า 200 ร้านค้า⭐️
ภายในงานพบกับสินค้าราคาพิเศษ กิจกรรมแจกของรางวัล การแสดงศิลปวัฒนธรรมพื้นบ้าน การแสดงจากศิลปินนักร้องมากมาย✨
จัดโดย สำนักงานส่งเสริมวิสาหกิจขนาดกลางและขนาดย่อม (สสว.) ร่วมกับสมาคมสมาพันธ์เอสเอ็มอีไทย
กิจกรรมปั่นจักรยาน พบพระ SEZ mor fun 8 กันยายน 2566
กิจกรรมปั่นจักรยานประชาสัมพันธ์สร้างการรับรู้เขตพัฒนาเศรษฐกิจพิเศษ และส่งเสริมการท่องเที่ยววิถีใหม่สไตล์ SEZ ณ ม่อนหมอกตะวัน บ้านป่าหวาย หมู่ที่ 3 ตำบลคีรีราษฎร์ อำเภอพบพระ จังหวัดตาก ในวันศุกร์ที่ 8 กันยายน 2566
ถนนคนเดิน ท่องเที่ยววิถีชุมชนคนตราด 5-7 กันยายน 2566
งาน “ถนนคนเดิน ท่องเที่ยววิถีชุมชนคนตราด” เริ่มตั้งแต่วันที่ 5-7 กันยายน 2566 สัมผัสวิถีและอัตลักษณ์จังหวัดตราด ณ วัดโยธานิมิต พระอารามหลวง (วัดโบสถ์) ตำบลวังกระแจะ อำเภอเมืองตราด จังหวัดตราด กิจกรรมภายในงานพบกับ
• นั่งรถรางเที่ยวชมเมืองตราด (พิธีเปิด)
• สินค้าOTOP ของดีเมืองตราดและชมดนตรีสด
• ถ่ายภาพแลนด์มาร์คศิลปะกำแพงสถานกักขังกลางจ.ตราด
• พร้อมสักการะอนุสาวรีย์พระเจ้าตากสินฯ
• พร้อมสักการะศาลเจ้าพ่อหลักเมืองสิ่งศักดิ์สิทธิ์คู่เมืองตราด
ตราดสีทองเมนูที่ต้องลองซีซั่น2
ททท. สำนักงานตราด ขอเรียนเชิญสื่อมวลชนทุกท่านร่วมเป็นเกียรติในการจัดการแข่งขัน “ตราดสีทอง...เมนูที่ต้องลอง” ซีซั่น 2 การแข่งขันการทำขนมหวานและเครื่องดื่มจากสับปะรดตราดสีทอง “Trat Si Thong Pineapple’s Desserts & Drinks Contest 2022” และร่วมทำข่าวประชาสัมพันธ์ให้การจัดงานครั้งนี้เป็นที่ทราบอย่างกว้างขวาง ในวันศุกร์ที่ 8 กันยายน 2566 เวลา 08.30 น. ณ ห้องประชุมโรงแรมตราดซิตี้
วิถีเกษตร แค้มป์ คร๊าฟ ศิลปะ ดนตรี กีฬาและอาหาร 8-10 กันยายน 2566
"วิถีเกษตร แค้มป์ คร๊าฟ ศิลปะ ดนตรี กีฬาและอาหาร" วิถีแห่งความสุก ที่มีความสุข ที่ บ้านนาบ้าน 8-10 กันยายน 2566 ชวนมาเที่ยวของดีบ้านนา"ฟาร์มสุกที่บ้านนา" ณ จุดชมวิวบ้านนาบ้านเรา เทศบาลตำบลบ้านนา อ.ศรีนครินทร์ จ.พัทลุง
งาน “เทศกาลทุเรียนเมืองลุง” และ “เทศกาลแคมป์ปิ้ง” 8 - 10 กันยายน 2566
งาน “เทศกาลทุเรียนเมืองลุง” และ “เทศกาลแคมป์ปิ้ง”
ภายใต้โครงการส่งเสริมศักยภาพการท่องเที่ยวชุมชนอย่างรับผิดชอบบนฐานนิเวศน์และวัฒนธรรม
เพื่อการพัฒนาอย่างยั่งยืน (Phatthalung Go Green Festival)
ในระหว่างวันที่ 8 - 10 กันยายน 2566 ณ จุดชมวิวบ้านนาบ้านเรา อำเภอศรีนครินทร์ จังหวัดพัทลุง
โดยสำนักงานท่องเที่ยวและกีฬาจังหวัดพัทลุงร่วม สำนักงานเทศบาลตำบลบ้านนา อำเภอศรีนครินทร์ จังหวัดพัทลุง
งานหอการค้าแฟร์ 2566 ตอน มหัศจรรย์หน่อไม้ไทเลย วันที่ 20-30 กันยายน 2566
งานหอการค้าแฟร์ 2566 "เทศกาลแห่งความสุขสนุกแบบ Very much" ตอน มหัศจรรย์หน่อไม้ไทเลย วันที่ 20-30 กันยายน 2566 ณ ลานหน้าศาลากลางจังหวัดเลย
รักนี้ที่หอโหวด ๑๐๑
ต้อนรับเทศกาลแห่งความรักที่ใกล้จะมาถึง หอโหวดร้อยเอ็ด ชวนคู่รักมาสัมผัสประสบการณ์พิเศษ “ รักนี้ที่หอโหวด ๑๐๑ “ จดทะเบียนสมรสความสูง 101 เมตร 360 องศา สิทธิพิเศษสำหรับคู่รักทุกคู่
จดทะเบียนสมรส ณ พุทธพิมานมงคล ชั้น 35
ถ่ายภาพคู่รักบนหอโหวดกับเวลาพิเศษ
รับบัตรขึ้นชมหอโหวด ๑๐๑ จำนวน 10 ใบ
รับของที่ระลึกจากการท่องเที่ยวแห่งประเทศไทย
ฟรีค่าธรรมเนียมถ่ายภาพ wedding ที่หอโหวด
สอบถามรายละเอียดเพิ่มเติม : Facebook : สำนักการศึกษา เทศบาลเมืองร้อยเอ็ด
โทร 043 - 511222 ต่อ 131-132
กิจกรรมชมพระอาทิตย์ลอดซุ้มประตูปราสาทสด๊กก๊อกธม 18 - 19 มีนาคม 2566
ร่วมเป็นส่วนหนึ่งของงานกิจกรรมท่องเที่ยวแหล่งอารยธรรมขอมโบราณตามรอยปราสาทศิลา “ปราสาทสด๊กก๊อกธม” ประจำปี 2566 วันที่ 18 - 19 มีนาคม 2566 และวันที่ 22 มีนาคม 2566 ณ อุทยานประวัติศาสตร์สด๊กก๊อกธม ตำบลโคกสูง อำเภอโคกสูง จังหวัดสระแก้ว
งานประเพณีบุญหลวงและการละเล่นผีตาโขน ในปี 2566 วันที่ 23-25 มิถุนายน 2566
งานประเพณีบุญหลวงและการละเล่นผีตาโขน ในปี 2566 อำเภอด่านซ้าย จ.เลย วันที่ 23-25 มิถุนายน 2566 งานบุญประเพณีที่สืบกันมายาวนานของชาวด่านซ้าย ปีนี้ ททท.เลย ดันงานผีตาโขนโกอินเตอร์ ด้วยการจัดทำเอกสารเผยแพร่ในภาษาญี่ปุ่น เกาหลี มาเลเซีย จีน และอังกฤษ กระจายยัง ททท.ในแต่ละประเทศเป้าหมายด้วย ปีนี้ ด่านซ้าย น่าจะได้ต้อนรับนักท่องเที่ยวนานาชาติล้นหลามแน่ๆ
ปัวม่วนมาก งานประเพณีสงกรานต์ อ.ปัว 12-14 เมษายน พ.ศ. 2566
เทศบาลตำบลปัว ร่วมกับ สมาคมส่งเสริมการท่องเที่ยวอำเภอปัว และชมรมผู้ประกอบการอำเภอปัว ขอเชิญเที่ยวงานประเพณีสงกรานต์ (ปัวม่วนมาก) รดน้ำดำหัวผู้สูงอายุ ประจำปี 2566 จัดขึ้นระหว่างวันที่ 12-14 เมษายน พ.ศ. 2566 ณ บริเวณสวนสาธารณะอ่างเก็บน้ำ รศ. 200 ภายในงานท่านจะได้รับชมขบวนแห่สงกรานต์ที่ตื่นตาตื่นใจ พร้อมร่วมทำบุญในขบวนแห่สรงน้ำพระ เพื่อความเป็นสิริมงคล และทีเด็ดสำหรับใครที่เป็นสายเฮฮา ท่านจะได้พบกับความสนุกสนานในเวทีน้ำ ปาร์ตี้โฟม ครั้งแรกในอำเภอปัว และเพลิดเพลินไปกับดีเจมิวสิคเฟสติวัล เคล้าคลอเสียงเพลงจากดนตรีสด ที่สำคัญพลาดไม่ได้กับกิจกรรมการแสดงโคเวอร์แดนซ์ ที่เปิดโอกาสให้เยาวชนในเขตอำเภอปัว ได้แสดงความสามารถ มาร่วมเชียร์ ร่วมสนุกสนานกันได้ในงาน #ปัวม่วนมาก แล้วท่านจะม่วนใจ๋ไม่ผิดหวัง
เดิน-วิ่ง WALK RUN BIKE FIGHTING STROKE 9 แสงนำใจ ไทยทั้งชาติ เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 9 เฉลิมพระเกียรติ 29 ตุลาคม 66
จังหวัดชลบุรี ขอเชิญชวนสมัครเดิน-วิ่ง “WALK RUN BIKE FIGHTING STROKE 9”
ภายใต้โครงการ "แสงนำใจ ไทยทั้งชาติ เดิน วิ่ง ปั่น ป้องกันอัมพาต" ครั้งที่ 9 เฉลิมพระเกียรติ หัวข้อ "คนรุ่นใหม่ ขับเคลื่อนไทยไร้สโตรค" จังหวัดชลบุรี เพื่อนำรายได้มอบให้มูลนิธิโรงพยาบาลสมเด็จพระยุพราช (party popper) กำหนดจัดงานในเช้าวันเสาร์ที่ 29 ตุลาคม 2566 เวลา 05.30 น. เป็นต้นไป ณ สวนเฉลิมพระเกียรติราชินี 60 พรรษา จ.ชลบุรี (ถนนหน้า อบจ.) ไปบนสะพานชลมารควิถี 84 พรรษา เดิน 5.8 กม. / วิ่ง 10.2 กม. สมัครได้แล้ววันนี้ถึงวันที่ 31 กรกฎาคม 2566 ติดต่อสอบถาม : กลุ่มงานพัฒนาคุณภาพและรูปแบบบริการ สำนักงานสาธารณสุขจังหวัดชลบุรี 038 932 450 ต่อ 2458
งานประจำปีวัดท่ากระบือ สมุทรสาคร ปีนี้ 2566 ระหว่างวันที่ 16-22 ต.ค.66 LINK
งานประจำปีปิดทองวัดท่ากระบือ อ.กระทุ่มแบน ประจำปี พ.ศ.2566 จัดระหว่างวันที่ วันที่ 16-22 ตุลาคม 2566 เชิญชวนร่วมงานบุญใหญ่ประจำปี ทำบุญปิดทองไหว้พระ ทำบุญคล้ายวันมรณภาพและปิดทองรูปหล่อ หลวงพ่อรุ่ง ทำบุญยกช่อฟ้าวิหารจตุรมุข สนุกรื่นเริง 7 วัน 7 คืน ช็อป ชิม ชิลล์ ชมคอนเสิร์ตและการแสดงทุกคืน อาหารอร่อย ร้านค้าเพียบ สินค้ามากมายราคาประหยัดให้เลือกซื้อ ศิลปินใหญ่ ปู พงษ์สิทธิ์ วงโปเตโต้ แจ็ส ชวนชื่น ลำไย ไหทองคำ ยูกิ ไหทองคำ งานใหญ่ระดับนี้ รอมาทั้งปี ไม่ควรพลาดด้วยประการทั้งปวง
งาน 100 ปี ชาตกาล พระอุบาลีคุณูปมาจารย์ วันบูรพาจารย์ วัดไร่ขิง 4-12 ต.ค.66
งาน 100 ปี ชาตกาล พระอุบาลีคุณูปมาจารย์ วันบูรพาจารย์ วัดไร่ขิง 4-12 ต.ค.66
งานพิธีไหว้ครู ครอบครูบูชาครูประจำปี วัดท่ากระบือ 16 ต.ค.66
งานพิธีไหว้ครู ครอบครูบูชาครูประจำปี วัดท่ากระบือ 16 ตุลาคม 2566
มหกรรมประกวดพระเครื่อง หลวงพ่อรุ่ง วัดท่ากระบือ สมุทรสาคร ครั้งที่ 4 วันที่ 22 ต.ค.66
มหกรรมประกวดพระเครื่อง หลวงพ่อรุ่ง วัดท่ากระบือ สมุทรสาคร ครั้งที่ 4 วันที่ 22 ต.ค.66 ณ วัดท่ากระบือ อ.กระทุ่มแบน สมุทรสาคร ลุ้นรางวัลจับฉลาก เลขหางบัตรลุ้น พระบูชาหลวงพ่อรุ่ง วัดท่ากระบือ ขนาดหน้าตัก 9 นิ้ว รางวัลชนะเลิศ แต่ละรายการ เหรียญหลวงพ่อรุ่งวัดท่ากระบือ
งานวันรำลึกพระปิยมหาราช 17-26 ต.ค.66
งานวันรำลึกพระปิยมหาราช 17-26 ต.ค.66 บริเวณ รร.บ้านโคกตูม ถนนวงเวียนโคกตูม ลพบุรี พิธีบวงสรวงเสด็จพ่อร.5 กิจกรรมสอยดาวโรงเรียน (21-23 ตค) ศิลปินตลอด 10 คืน อาทิ เจน ไทรถแห่ เฟิร์ส พรชิตา วงเนสกาแฟ
ปฏิทินกิจกรรมในพัทยา เดือนตุลาคม 2566
6 - 7 ตุลาคม 2566 INTERNATIONAL BEACH TENNIS TOURNAMENT PATTAYAOPEN ณ ชายหาดพัทยา หน้าโรงแรมฮาร์ด ร็อค พัทยา
14 - 24 ตุลาคม 2566 มหากุศล อิ่มบุญอิ่มใจ เทศกาลกินเจเมืองพัทยา ณ โรงเจนาเกลือ
19 - 22 ตุลาคม 2566 การแข่งขันกีฬาซอฟท์บอลนานาชาติรายการ MASTER’S FASTPITCH SOFTBALL TOURNAMENT ณ ฮอร์สชู พอยท์ รีสอร์ท แอนด์ คันทรีคลับ
28 ตุลาคม 2566 งานวิ่งริมบีชที่ยิ่งใหญ่ และ เซ็กซี่ที่สุดในประเทศไทย
The Sexiest Running Event In Thailand @ Pattaya Beach
ณ ชายหาดพัทยา
สอบถามรายละเอียดเพิ่มเติมได้ที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
ปฏิทินท่องเที่ยวเชียงใหม่ เดือนตุลาคม
พัทยาบิกีนี่ รัน 28 ต.ค.66
PATTAYA INTERNATIONAL BIKINI BEACH RACE 2023 วันที่ 28 ตุลาคม 2566 งานวิ่งสุดหวามและแสนงามแห่งปี ณ ชายหาดพัทยา ที่มาพร้อมความเซ็กซี่ และใหญ่ที่สุดในประเทศไทย ระยะทางวิ่ง 5 Km. ณ ชายหาดเมืองพัทยา หน้าศูนย์การค้าเซ็นทรัลพัทยา
เปิดเมืองกินฟรี วิถีธรรม ชักพระสุราษฎร์ธานี 30 ตุลาคม 2566
เปิดเมืองกินฟรี วิถีธรรม วันแรมค่ำ เดือน 11 ในกิจกรรม “งานประเพณีชักพระ-ทอดผ้าป่า และแข่งเรือยาว จังหวัดสุราษฎร์ธานี” ประจำปี 2566 วันที่ 30 ตุลาคม 2566 ตั้งแต่เวลา 09.30 น. ณ บริเวณหน้าศูนย์ราชการจังหวัดสุราษฎร์ธานี (ถนนดอนนก) พบกับอาหารมากมายกว่า 20 เมนู โดย องค์การบริหารส่วนจังหวัดสุราษฎร์ธานี และหน่วยงานพันธมิตรผู้ร่วมให้การสนับสนุน
เชียงคานฮาโลวีน2023 วันเสาร์ที่ 28 ตุลาคม 2566
ททท.สำนักงานเลย ร่วมกับอำเภอเชียงคาน และสมาคมธุรกิจการท่องเที่ยวจังหวัดเลย จัดกิจกรรม “เชียงคานฮาโลวีน 2023” ในวันเสาร์ที่ 28 ตุลาคม 2566 ณ ถนนคนเดินเชียงคาน ปีนี้เตรียมจอย มาปล่อยผีที่ เชียงคานฮาโลวีน เตรียมเสื้อผ้าหน้าผมไว้เลย ชวนเพื่อนๆ มาหลอก มากระตุกต่อมหลอน ไม่ว่าจะเป็นผีไทย จีน ญี่ปุ่น ฝรั่ง ก็แต่งได้ตามจินตนาการเลย เราจะมาหลอกหลอนทุกคนไปพร้อมกัน เริ่มตั้งขบวนตั้งแต่ 18.00 น. บริเวณถนนคนเดินหน้าวัดศรีคุนเมือง
ตักบาตรเทโว วัดพระปฐมเจดีย์ 30 ต.ค. 2566
ตักบาตรเทโว วัดพระปฐมเจดีย์ 30 ต.ค. 2566 เวลา 7.00 น. ทำบุญไหว้พระ องค์หลวงพ่อพระร่วง
โปรแกรมชมวัดไชยวัฒนาราม ยามราตรี 13 ตุลาคม ถึง 31 ธันวาคม 2566
ราตรีนี้...ที่วัดไชยวัฒนาราม โดยกรมศิลปากร เปิดให้ทุกท่านเข้าชม วัดไชยวัฒนาราม ผ่าน แสง สี จากการประดับไฟ ตั้งแต่เวลา 18.00 - 22.00 น. (ซื้อบัตรเข้าชมได้ถึงเวลา 21.00 น.) ทุกวันศุกร์ เสาร์ อาทิตย์ วันหยุดนักขัตฤกษ์ และเทศกาลสำคัญ เริ่มตั้งแต่วันที่ 13 ตุลาคม ถึงวันที่ 31 ธันวาคม พ.ศ. 2566 สอบถามรายละเอียดเพิ่มเติมสำนักงานอุทยานประวัติศาสตร์พระนครศรีอยุธยา โทร 035-242286 ต่อ 101
ปฏิทินท่องเที่ยวจังหวัดพระนครศรีอยุธยา 3 เดือนส่งท้ายปี 2566
ปฏิทินท่องเที่ยวจังหวัดพระนครศรีอยุธยา 3 เดือนส่งท้ายปี 2566 นี้ สอบถามรายละเอียดเพิ่มเติมได้ที่ ททท.สำนักงานพระนครศรีอยุธยา 035 246 076-7 หรือทาง Inbox เพจ : ททท.สำนักงานพระนครศรีอยุธยา : TAT Ayutthaya Office
ตุลาพาเพลินเดินงานกาแฟซีซั่น3 วันที่ 21-22 ต.ค.66
งาน ตุลาพาเพลินเดินงานกาแฟซีซั่น3 วันที่ 21-22 ต.ค.66 เวลา 09.00-17.00 น.
บริเวณ โรงแรมเดอะพาร์ค โฮเต็ล กิจกรรมงานกาแฟเด็ดในพิษณุโลก มีกาแฟให้เลือกชิมมากกว่า 66 ร้าน พิเศษ Special Guest ที่จะมาสร้างประสบการณ์ด้านกาแฟแก่ทุกท่าน พร้อมกับการแข่งขันสุดเข้มข้น ใครจะเข้มกว่ากาแฟต้องไปเชียร์กันแล้ว
ปฏิทินกิจกรรมเดือนตุลาคม 2566 ในพื้นที่จังหวัดพิษณุโลก - เพชรบูรณ์
งานท่องเที่ยวกัญชงพบพระ ระหว่างวันที่ 26 - 29 ตุลาคม 66
ชวนเชิญมาท่องเที่ยวงานกัญชงพบพระ ระหว่างวันที่ 26 - 29 ตุลาคม 2566 ชม ช็อป และร่วมกิจกรรมต่างๆมากมายภายในงาน มีกิจกรรมตลอดทั้งกลางวันและกลางคืน เพื่อเป็นการกระตุ้นส่งเสริมและสนับสนุนต่อยอดภูมิปัญญาชาวบ้าน และเปิดโอกาสเปิดตลาดเพื่อเชื่อมโยงสินค้าผลิตภัณฑ์ของกัญชง จากชุมชนสู่ตลาดทั้งในประเทศและต่างประเทศ กิจกรรมภายในงาน
✅ชมขบวนนางรำพิธีเปิด กว่า 200 คน ✅ชม ช็อป ผลิตภัณฑ์ชนเผ่า ✅ชมการแสดงของนักร้อง นักแสดง ✅ประกวดธิดากัญชง ✅ประกวดแม่บ้านงามใยกัญชง ✅แข่งขันนักร้องพร้อมหางเครื่อง(กลุ่มแม่บ้าน) ✅แข่งขันทอผ้าใยกัญชง ✅แข่งขันเขียนเทียนบนผ้า ✅แข่งขันกีฬาเปตอง -รุ่นประชาชน -รุ่นเยาวชน สอบถามเพิ่มเติม 055805555
งานประเพณี ต่างซอมต่อโหลง ปอยออกหว่าพาราลงเมิง 28-29 ตุลาคม 2566
งานประเพณี " ต่างซอมต่อโหลง ปอยออกหว่าพาราลงเมิง " หรือวันพาลาลงเมิง ถือเป็นวันสำคัญทางพระพุทธศาสนา เป็นวันที่พระสัมมาสัมพุทธเจ้า เสด็จสู่โลก หลังจากขึ้นไปจำพรรษาอยู่ในสวรรค์ชั้นดาวดึงส์พิภพ ถ้วนไตรมาส และตรัสอภิธรรมเทศนา เป็นวันบุญกุศล ที่สำคัญของพุทธบริษัท โบราณเรียกกันอีกอย่างหนึ่งว่า วันพระเจ้าเปิดโลก กำหนดการจัดงาน วันเสาร์ ที่ 28-29 ตุลาคม 2566 วัดไทยวัฒนาราม
ปศุสัตว์สุรินทร์ออกหน่วยทำหมัน ควบคุมประชากรสัตว์นำโรคพิษสุนัขบ้า ในพื้นที่เกิดโรคพิษสุนัขบ้า
ปศุสัตว์สุรินทร์ออกหน่วยทำหมัน ควบคุมประชากรสัตว์นำโรคพิษสุนัขบ้า ในพื้นที่เกิดโรคพิษสุนัขบ้า
- 25 ตุลาคม 2566 ตำบลนารุ่ง อำเภอศีขรภูมิ นายสัตวแพทย์อภิชัย นาคีสังข์ ปศุสัตว์จังหวัดสุรินทร์ มอบหมายให้นายสัตวแพทย์จรูญวิทย์ นะพรรัมย์ หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ นายสัตวแพทย์และเจ้าหน้าที่กลุ่มพัฒนาสุขภาพสัตว์ นายปรัชญา เรืองอมรวิวัฒน์ ปศุสัตว์อำเภอศรีณรงค์รักษาราชการแทนปศุสัตว์อำเภอศีขรภูมิ นายสัตวแพทย์และเจ้าหน้าที่สำนักงานปศุสัตว์อำเภอศีขรภูมิ นายประพันธ์ โพธิ์เงิน ปศุสัตว์อำเภอโนนนารายณ์ ร่วมกับสัตวแพทย์หญิงปนัดดา เนตรพุดซา และเจ้าหน้าที่จากสำนักงานปศุสัตว์เขต 3 โดยบูรณาการร่วมกับองค์การบริหารส่วนตำบลนารุ่ง กำนัน ผู้ใหญ่บ้าน ในพื้นที่ตำบลนารุ่ง อำเภอศีขรภูมิ จังหวัดสุรินทร์ ดำเนินโครงการคุมกำเนิดสุนัขและแมวอย่างถาวร ในพื้นที่เกิดโรคพิษสุนัขบ้า ณ ศาลากลางหมู่บ้าน หมู่ที่ 1 ตำบลนารุ่ง อำเภอศีขรภูมิ จังหวัดสุรินทร์ โดยมีกิจกรรมให้ความรู้เรื่องโรคพิษสุนัขบ้าแก่ประชาชน บริการผ่าตัดทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมวทั้งที่มีเจ้าของและด้อยโอกาส โดยมีสุนัขและแมวมารับบริการจำนวนมาก
งานเทศกาลอาหารเกษตรแฟร์ ร้อยเอ็ด ครั้งที่1 วันที่ 1-9 ตุลาคม 2566
งานเทศกาลอาหารเกษตรแฟร์ ครั้งที่1 วันที่ 1-9 ตุลาคม 2566 ณ ถนนคนเดินสาเกตนคร ชมคอนเสิร์ตฟรีทุกคืน
วิ่งเปิดภู ดูเขา รักกัน 1 ตุลาคม 2566
เนื่องในโอกาสที่อุทยานแห่งชาติภูกระดึงได้รับการโหวตให้เป็น "อุทยานมรดกอาเซียน" ในกิจกรรม " วิ่งเปิดภู ดูเขา รักกัน " (PKTS) วัตถุประสงค์ เพื่อส่งเสริมการท่องเที่ยวในจังหวัดเลยและอุทยานแห่งชาติภูกระดึงในฤดูเปิดการท่องเที่ยว ส่งเสริมการสร้างรายได้ให้กับชุมชน เตรียมความพร้อมพัฒนาพื้นที่ให้พร้อมรับนักท่องเที่ยวชาวไทยและชาวต่างชาติ และมอบรายได้หลังหักค่าใช้จ่ายเข้ากองทุนสวัสดิการของกรมอุทยานแห่งขาติภูกระดึงอีกด้วย
จัดการแข่งขันในวันที่ 1 ตุลาคม 2566 โดยการแข่งขันแบ่งออกเป็น 2 ระยะ ได้แก่ 9 กิโลเมตร และ 25 กิโลเมตร จุดสตาร์ทอยู่ที่ศูนย์บริการนักท่องเที่ยวศรีฐาน (ด้านล่างอุทยานแห่งชาติภูกระดึง) และเส้นชัยจะอยู่ที่ ศูนย์บริการนักท่องเที่ยววังกวาง (ยอดภูกระดึง) เส้นทางวิ่งจะอยู่บนเส้นทางศึกษาธรรมชาติ ภายใต้คอนเซ็ป “วิ่งโหด โคตร อีโค้” Low Carbon Net Zero ลดโลกร้อน ลดโลกเลอะ น้ำดื่มและอาหาร ตลอดการแข่งขัน ใช้เป้น้ำ ลดการใช้พลาสติก แยกขยะประเภทต่างและนำไปแปรรูปต่อไป เพิ่มการแข่งขันรุ่นเยาวชน ให้เด็กๆรักสิ่งแวดล้อม และอยู่กับต้นไม้ และรักต้นไม้ ปลูกฝังให้รักสิ่งแวดล้อมตั้งแต่เด็ก Zero Food.Waste. ให้นักวิ่งใช้คูปองอาหารเพื่อลดอาหารที่เหลือจากการรับประทาน ร่วมรักษ์สิ่งแวดล้อม Responsible.Tourism เพื่อให้เรามีป่า ได้วิ่งกันต่อไป....
เพียรยินดี...ที่คิดถึง 12 ตุลาคม 2566
เพียรยินดี...ที่คิดถึง
บทกวี บรรเลงเพลง แลงานศิลป์ ชมสารคดีสั้น ฟังเสวนาเมืองสร้างสรรค์
กิจกรรม เพียรยินดี...ที่คิดถึง เพื่อผลักดันให้เกิด “เมืองเศรษฐกิจสร้างสรรค์”
โดยจะเริ่มต้นขึ้นในย่านตลาดเพียรยินดี ใจกลางเมืองพัทลุง
ในวันพฤหัสบดีที่ 12 ตุลาคม 2566 เวลา 16.00 – 20.30 น.
บริเวณถนนซอยตลาดเพียรยินดี
“เราเชื่อว่าการพัฒนาเมืองที่นำเอาความคิดสร้างสรรค์มาเป็นกลไกขับเคลื่อนเศรษฐกิจ จะนำไปสู่การเกิดย่านสร้างสรรค์ได้ ถือว่าเป็นการพัฒนาเมืองและเศรษฐกิจผ่านมิติการพัฒนาพื้นที่
ด้วยความคิดสร้างสรรค์และสร้างระบบนิเวศสร้างสรรค์เชิงพื้นที่ขึ้น
ถือว่าเป็นกลไกหนึ่งของการขับเคลื่อนเศรษฐกิจและการท่องเที่ยวภายในจังหวัดด้วย”
ภายในงานมีกิจกรรม ประกอบไปด้วย
-กิจกรรมเสวนา เรื่อง “พัทลุงสู่การเป็นเมืองเศรษฐกิจสร้างสรรค์”
โดยผู้ประกอบการชุมชนเสกัก โซนตลาดเพียรยินดี หน่วยงานภาครัฐในจังหวัดพัทลุง
ถ่ายทอดสดช่องทางเพจแลต๊ะแลใต้ Thai PBS
-อ่านบทกวีจากศิลปินในจังหวัดพัทลุง
-การแสดงดนตรีจากบาส หลานยายอิ่ม และบ้านบุญดำรมย์
-การจัดแสดงภาพถ่ายบอกเล่าเรื่องราวตลาดเพียรยินดี
-ชมสารคดีสั้น “วิถีคนตลาดเพียร”
งานวันสัตตนาคารำลึก ประจำปี 2566 วันที่ 18-19 ตุลาคม 2566
งานวันสัตตนาคารำลึก ประจำปี 2566 วันที่ 18-19 ตุลาคม ร่วมห่มขาวปฏิบัติธรรมขอพร 7 เทพ พญานาคราชอุรังคพิทักษ์ งานบุญวันสัตตนาคารำลึก ตามตำนานพญานาคราช 7 องค์ที่ช่วยพิทักษ์รักษาพระธาตุพนมมาแต่โบราณ ณ ลานเจดีย์ภายในกำแพงแก้ว องค์พระธาตุพนม วัดพระธาตุพนมวรมหาวิหาร กำหนดการคร่าวๆ
18 ต.ค. วันขึ้น 4 คำ เดือน 11 เวลา 16.00น. เป็นต้นไป คณะโอรสธิดา และพุทธศาสนิกชน ร่วมประกอบพิธีบวงสรวง องค์สัตตนาคา เจริญศีล เจริญภาวนา ฟังพระธรรมเทศนาโดยพระราชสิริวัฒน์ เจ้าคณะจังหวัดนครพนม จากนั้นร่วมปฏิบัติธรรมบูชาพระธาตุพนม ตลอดคืน
19 ต.ค. วันขึ้น 5 ค่ำ เดือน 11 เวลา 02.00น. สวดสดุดีองค์สัตตนาคา จากนั้น 6.00น. ทำบุญตักบาตรเช้า และ 11.00น. ร่วมถวายเพล เสร็จพิธี
ไหลเรือไฟ งานเทศกาลออกพรรษา ประจำปี 2566 - 20-30 ตุลาคม 2566
งานไหลเรือไฟ จังหวัดนครพนม ประจำปี 2566 กำหนดจัดขึ้นระหว่างวันที่ 20-30 ตุลาคม 2566 (รวม 11 วัน 11 คืน) โดยมีกิจกรรมไฮไลท์ในคืนวันออกพรรษา วันที่ 29 ตุลาคม 2566 ขึ้น 15 ค่ำเดือน 11 ไหลเรือไฟจาก 12 อำเภอ จำนวน 12 ลำ กำหนดให้มีกิจกรรมในทุกค่ำคืน ได้แก่ การไหลเรือไฟโชว์คืนละ 1-2 ลำ การปล่อยกระทงสายวันละ 25,000 ดวง การแสดงศิลปวัฒนธรรมท้องถิ่น การจัดทำเรือไฟโบราณ การแสดงซุ้มวิถีคนทำเรือไฟของ 12 อำเภอ และมหกรรมสินค้า OTOP คาราวานสินค้า การแสดงมหรสพตามประเพณี
เชียงคานฮาโลวีน 2023 เสาร์ที่ 28 ตุลาคม 2566
เชียงคานฮาโลวีน 2023 ในวันเสาร์ที่ 28 ตุลาคม 2566 ณ ถนนคนเดินเชียงคาน ปีนี้เตรียมจอย มาปล่อยผีที่ เชียงคานฮาโลวีน เตรียมเสื้อผ้าหน้าผมไว้เลย ชวนเพื่อนๆ มาหลอก มากระตุกต่อมหลอน ไม่ว่าจะเป็นผีไทย จีน ญี่ปุ่น ฝรั่ง ก็แต่งได้ตามจินตนาการเลย เราจะมาหลอกหลอนทุกคนไปพร้อมกัน เริ่มตั้งขบวนตั้งแต่ 18.00 น. บริเวณถนนคนเดินหน้าวัดศรีคุนเมือง
ประเพณีชักพระ ยะลา ประจำปี วันที่ 29 ต.ค.2566
ประเพณีชักพระ ประจำปี วันที่ 29 ต.ค.2566 ศูนย์เยาวชนเทศบาลนครยะลา จังหวัดยะลา กิจกรรมส่งเสริมและอนุรักษ์ประเพณีวัฒนธรรม ชุมนุมเรือพระ การแสดงธรรมเทศนา การประกวดเรือพระ การประกวดขบวนแห่เรือพระ การสาธิตทำขนมพื้นบ้าน การสแดงบนเวทีกลาง ส่งเสริมประเพณีศิลปวัฒนธรรม การแสดงมโนราห์และหนังตะลุง การฉายหนังกลางแปลงย้อนยุค การแข่งขันตีโพน การแข่งขันขูดมะพร้าว การแข่งขันซัดต้ม งานประเพณี “แห่ข้าวพันก้อนบูชาพระธาตุศรีสองรัก” 16 เม.ย.66
ททท.เลย ขอเชิญชวนนักท่องเที่ยว พี่น้องชุมชนเมืองด่านซ้าย และชาว จ.เลย เข้าร่วมงานประเพณี “แห่ข้าวพันก้อนบูชาพระธาตุศรีสองรัก” ประเพณีโบราณที่สืบทอดกันมาอย่างยาวนานของชาวด่านซ้าย วันที่ 16 เมษายน 2566 ณ อ.ด่านซ้าย อันเป็นช่วงเวลาเทศกาลสงกรานต์ โอกาสที่จะได้รับรู้เรื่องราวของประเพณีที่ดีงาม โดยสืบทอดต่อๆ กันมาอย่างยาวนาน และควรค่าแก่การอนุรักษ์ไว้ ททท.สำนักงานเลย จึงขอเชิญชวนทุกท่านเขาร่วมงานแห่ข้าวพันก้อน ณ บริเวณหน้าวัดโพนชัย และร่วมเดินในขบวนเพื่อไปสักการะบูชาองค์พระธาตุศรีสองรัก สนใจร่วมขบวนขอความร่วมมือแต่งกายสุภาพเสื้อขาวนะคะ
งานถนนคนเดินท่าวังผา วันที่ 2-4 กุมภาพันธ์ 2566
งานถนนคนเดินท่าวังผา วันที่ 2-4 กุมภาพันธ์ 2566 ณ ลานสาธารณะบ้านท่าวังผา หมู่ 2 ตั้งแต่ 16.00 น. เป็นต้นไป กิจกรรมในงาน ➡️ของกินหลากหลาย ➡️เครื่องเล่นสไลเดอร์ บ้านลม ➡️โชว์ ฟ้อนดาบ ตีกลองสะบัดชัย แมงโต ต้อนรับ ➡️การแสดงจากน้องๆเยาวชน อ.ท่าวังผา ➡️ขับกล่อม ดนตรีพื้นเมืองและ ดนตรีโฟล์คซอง ตลอดทั้งงาน
กิจกรรมเดือน มกราคม-มิถุนายน 2566
กิจกรรมเดือน มกราคม 2566
วันเสาร์ที่ 7 ม.ค.66 กิจกรรมทำหมันสัญจรวัด ณ ปทุมธานี
วันเสาร์ที่ 14 ม.ค. 66 กิจกรรมทำหมันสัญจร วัด ณ จ.นครปฐม
วันอาทิตย์ที่ 15 ม.ค.66 กิจกรรมทำหมันสัญจร วัด ณ เทเวศร์ กทม.
วันเสาร์ที่ 28 ม.ค.66 กิจกรรมทำหมันสัญจรวัด ณ ต.ไผ่ลิง อ.พระนครศรีอยุธยา จ.พระนครศรีอยุธยา
วันอาทิตย์ที่ 29 ม.ค.66 กิจกรรมทำหมันสัญจรวัด ณ ต.สามชุก อ.สามชุก จ.สุพรรณบุรี
กิจกรรมเดือนกุมภาพันธ์ 2566
วันเสาร์และอาทิตย์ที่ 4-5 ก.พ.66 กิจกรรมทำหมันสัญจรวัด ณ ต.หนองไข่น้ำ อ.หนองแค จ.สระบุรี
วันเสาร์ที่ 11 ก.พ.66 กิจกรรมทำหมันสัญจรวัด ณ ต.เกาะโพธิ์ อ.ปากพลี จ.นครนายก
วันอาทิตย์ที่ 12 ก.พ.66 กิจกรรมทำหมันสัญจรแถวท่าพระจันทร์ กทม
วันเสาร์ที่ 18 ก.พ.66 กิจกรรมทำหมันสัญจร ณ ต.คลองหนึ่ง อ.คลองหลวง จ.ปทุมธานี
วันอาทิตย์ที่ 19 ก.พ.66 กิจกรรมทำหมันสัญจรวัด ณ ต.บ้านใหม่ อ.เมืองปทุมธานี จ.ปทุมธานี
กิจกรรมเดือน มีนาคม 2566
วันเสาร์และอาทิตย์ที่ 4-5 มี.ค.66 กิจกรรมทำหมันสัญจร ณ ห้องทำหมัน หน้า BCC Hall เซ็นทรัลลาดพร้าว
วันเสาร์ที่ 25 มี.ค.66 กิจกรรมทำหมันสัญจรวัด ณ ต.บางนมโค อ.เสนา จ.อยุธยา
วันอาทิตย์ที่ 26 มี.ค.66 กิจกรรมทำหมันสัญจรวัด ณ อ.สามชุก จ.สุพรรณบุรี
กิจกรรมเดือน เมษายน 2566
วันเสาร์ที่ 1 เม.ย.66 กิจกรรมทำหมันสัญจรวัด ณ จรัญ 8
วันอาทิตย์ที่ 2 เม.ย.66 กิจกรรมทำหมันสัญจรวัด ณ ต.บ้านใหม่ อ.เมือง จ.ปทุมธานี
วันเสาร์ที่ 22 เม.ย.66 กิจกรรมทำหมันสัญจรวัด ณ ต.ตะกุด อ.เมือง จ.สระบุรี
วันอาทิตย์ที่ 23 เม.ย.66 กิจกรรมทำหมันสัญจร วัด ณ ต.หัวโพธิ์ อ.สองพี่น้อง จ.สุพรรณบุรี
วันเสาร์ที่ 29 เม.ย.66 กิจกรรมทำหมันสัญจร วัด ณ ต.เจ็ดเสมียน อ.โพธาราม จ.ราชบุรี
วันอาทิตย์ที่ 30 เม.ย.66 กิจกรรมทำหมันสัญจร วัด ณ อ่อนนุช สวนหลวง กทม.
กิจกรรมเดือน พฤษภาคม 2566
วันเสาร์ที่ 6 พ.ค.66 กิจกรรมทำหมันสัญจร วัด ณ ต.เขาพระ อ.เดิมบางนางบวช จ.สุพรรณบุรี
วันอาทิตย์ที่ 7 พ.ค. 2566 กิจกรรมทำหมันสัญจร วัด ณ ต.วัดโบสถ์ อ.บางปลาม้า จ.สุพรรณบุรี
วันเสาร์ที่ 27 พ.ค.66 กิจกรรมทำหมันสัญจรวัด ณ ต.ศรีนาวา อ.เมือง จ.นครนายก
วันอาทิตย์ที่ 28 พ.ค. 66 กิจกรรมทำหมันสัญจร วัด ณ คลอง 2 อ.ธัญบุรี จ.ปทุมธานี
กิจกรรมเดือน มิถุนายน 2566
วันเสาร์ที่ 3 มิ.ย. 66 กิจกรรมทำหมันสัญจรวัด ณ คลองจั่น บึงกุ่ม กทม.
วันอาทิตย์ที่ 4 มิ.ย. 66 กิจกรรมทำหมันสัญจรวัด ณ ต.สำโรงเหนือ อ.เมือง จ.สมุทรปราการ
วันจันทร์ที่ 5 มิ.ย. 66 กิจกรรมทำหมันสัญจรโรงเรียน ณ ถ.วิภาวดีรังสิต เขตดินแดง กทม.
วันอาทิตย์ที่ 11 มิ.ย. 66 กิจกรรมทำหมันสัญจรโรงเรียน ณ แถวท่าพระจันทร์ กทม.
วันเสาร์ที่ 24 มิ.ย. 66 กิจกรรมทำหมันสัญจรวัด ณ ต.มหาราช อ.มหาราช จ.อยุธยา
วันอาทิตย์ที่ 25 มิ.ย. 66 กิจกรรมทำหมันสัญจรเคหะชุมชนร่มเกล้า เขตลาดกระบัง กทม.
ลอยกระทง วัดบางหญ้าแพรก 26-28 พ.ย.66
เทศกาลประจำปีสืบสานประเพณีลอยกระทง ปิดทองหลวงปู่ใหญ่ หลวงปู่ล่าย วัดบางหญ้าแพรก สมุทรสาคร วันที่ 26-28 พ.ย.66 มหรสพเต็มเวที 3 คืนเต็ม ชมฟรี
งานดนตรีในสวน SINGING IN THE GARDEN 4 พฤศจิกายน 2566
งานดนตรีในสวน SINGING IN THE GARDEN ชวนเพื่อนชวนฝูงมากันให้พร้อม แล้วไปจิบเบียร์ นั่งฟาง ฟังดนตรี ในบรรยาศกาศแคมป์ปิ้ง ต้อนรับหน้าหนาว ที่ร้าน 123 Histoire de café ในวันที่ 04 พฤศจิกายน 2566 เปิดจองบัตรตั้งแต่วันที่ 1 กันยายน 2566 เวลา 09:00 น. เป็นต้นไป (บัตรมีจำนวน 200 ใบเท่านั้น)
งานประเพณีเดือนยี่เป็งเชียงใหม่ ประจำปี 2566 วันที่ 26-28 พ.ย.66
"นครเชียงใหม่" ร่วมกับภาคีเครือข่าย จัดเต็ม งานประเพณีเดือนยี่เป็งเชียงใหม่ ประจำปี 2566 แบบยิ่งใหญ่ ระหว่าง 26-28 พ.ย.นี้ ชูความ "ล้านนาย้อนยุค" เพื่ออนุรักษ์วัฒนธรรมดั้งเดิม หวังส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจ
เดิน-วิ่งการกุศล Jamjuree Charity Run 2023 อาทิตย์ที่ 19 พฤศจิกายน 2566
ททท.กาญจนบุรี ขอเชิญนักวิ่ง และนักท่องเที่ยวที่รักการออกกำลังกาย ร่วมงาน เดิน-วิ่งการกุศล Jamjuree Charity Run 2023 ร่วมเป็นส่วนหนึ่งของงานวิ่งบรรยากาศดี เที่ยวชมบรรยากาศยามเช้า ที่ "ต้นจามจุรียักษ์" แลนด์มาร์คท่องเที่ยวสำคัญของจังหวัด และยังได้ร่วมทำบุญ โดยรายได้เพื่อซื้อเครื่องมือแพทย์มอบให้กับโรงพยาบาล และมอบเป็นทุนการศึกษาให้กับเด็กนักเรียนที่เรียนดีแต่ขาดแคลนในจังหวัดกาญจนบุรี กิจกรรมจัดขึ้นในวันอาทิตย์ที่ 19 พฤศจิกายน 2566 สามารถสมัครร่วมกิจกรรมได้ตั้งแต่วันนี้ - 25 ต.ค. 66 นี้
กิจกรรมดีๆ สุดฟิน..สุดชิล พัทยา เดือนพฤศจิกายน
15-19 พ.ย.66 การแข่งขันบอร์ดยืนพายชิงแชมป์โลก ICF SUP WORLD CHAMPIONSHIPS ณ ศูนย์ฝึกกีฬาเรือพายราชนาวี และชายหาดจอมเทียน
17-21 พ.ย.66 การแข่งขันบาสเกตบอลประชาชนเมืองพัทยา ณ ลานกีฬาชุมชนเมืองพัทยา ซ.หนองเกตุใหญ่ จ.ชลบุรี
18-24 พ.ย.66 การแข่งขันเทนนิสระดับนานาชาติ ITF ASSETWISE TENNIS MASTER CHAMPIONSHIP ณ สนามเทนนิส ฟิตช์ คลับ รอยัลคลิฟ
24-26 พ.ย.66 การแข่งขันสตรีทบาสเกตบอล 3x3 ณ ลานเครื่องบินหน้าศูนย์การค้าเทอร์มินอล 21 พัทยา
27 พ.ย.66 งานประเพณีลอยกระทงเมืองพัทยา ประจำปี 2566 ณ ชายหาดพัทยากลาง
27 พ.ย.- 9 ธ.ค.66 การแข่งขันยิงปืนลูกซองรณยุทธชิงแชมป์โลก IPSC SHOTGUN WORLDSHOOT 2023 PATTAYA THAILAND ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก
ชม Kenny G ในเทศกาลดนตรีแจ๊สเมืองพัทยา 10-11 พฤศจิกายน
เทศกาลดนตรีแจ๊สระดับโลก กลับมาจัด ณ พัทยาอีกครั้งปีนี้ ในงาน Pattaya International Jazz Festival 2023 “เทศกาลดนตรีแจ๊สเมืองพัทยา” วันศุกร์ที่ 10 และเสาร์ที่ 11 พฤศจิกายนนี้ ตั้งแต่ 17.00 น. เป็นต้นไป ริมชายหาดพัทยากลาง จังหวัดชลบุรี
ตารางการแสดงลั้ลลาเฟส 2023 Party and Rhythm on The Beach 17-19 พฤศจิกายน 2566
กิจกรรม “ลั้ลลาเฟส 2023 Party and Rhythm on The Beach” กำหนดจัดขึ้นในวันที่ 17-19 พฤศจิกายน 2566 ณ บริเวณชายหาดจอมเทียนพัทยา จังหวัดชลบุรี โดยเป็นการแข่งขันวิ่งบนชายหาด ระยะทาง 2.5 กม. พร้อมกับความสนุกสนานไปกับเสียงดนตรี ซึ่งคาดว่าจะมีนักวิ่งทั้งชาวไทยและต่างชาติมากกว่า 30,000 คน เข้าร่วมการแข่งขัน โดยภายในงานจะมีกิจกรรมการประกวดมิสลั้ลลา พร้อมเทศกาลอาหาร และการแสดงดนตรี
Chonburi Coffee on The Beach 2023 วันที่ 25-26 พฤศจิกายน 2566
งาน “Chonburi Coffee on The Beach 2023″ กำหนดจัดขึ้นในวันที่ 25-26 พฤศจิกายน 2566 ณ บริเวณชายหาดจอมเทียนพัทยา จังหวัดชลบุรี โดยเป็นงานที่รวบรวมคาเฟ่ร้านดังทั้งพัทยา-ชลบุรี และจากต่างประเทศ ที่มีทั้งชา กาแฟ ขนม ฯลฯ ที่มีเอกลักษณ์เฉพาะตัว พร้อมเวิร์คช็อปพูดคุยกับบาริสต้าชื่อดัง เพื่อให้เหล่าคอกาแฟได้มีการแลกเปลี่ยนประสบการณ์ด้านกาแฟร่วมกันที่เมืองพัทยา จ.ชลบุรี
เทศกาลพลุนานาชาติเมืองพัทยา 24-25 พ.ย.66
งาน เทศกาลพลุนานาชาติ เมืองพัทยา 2023 (Pattaya International Fireworks Festival 2023) ซึ่งเมืองพัทยา โดยสำนักการท่องเที่ยวและกีฬา จัดขึ้นเป็นประจำทุกปีในวันศุกร์และวันเสาร์สัปดาห์สุดท้ายของเดือนพฤศจิกายน บริเวณชายหาดพัทยากลาง จ.ชลบุรี สำหรับปีนี้ตรงกับวันที่ 24 - 25 พ.ย. 2566
บางแสน42 ชลบุรีมาราธอน 2023 วันที่ 5 พ.ย.66
บางแสน42 ชลบุรีมาราธอน 2023 วันอาทิตย์ที่ 5 พฤศจิกายน 2566 สถานที่จัดกิจกรรม หาดบางแสน ชลบุรี จัดวิ่งระยะ 42.195 km ระยะเดียว
มาวิ่งเชียงคานกันนะ KhanXC : Chiang Khan Cross Country 12 พฤศจิกายน 2566
เปิดรับสมัครถึงวันที่ 30 ตุลาคม 2566 โค้งสุดท้ายของการเปิดรับสมัครแล้วกับงานเชียงคานครอสคันทรี งานวิ่งถนน+ทางดินงานแรกและงานเดียวของเชียงคานแล้วคุณจะหลงรักเชียงคานมากขึ้น
ระยะการแข่งขัน 5K,10K,21K,42K วันแข่งขัน 12 พฤศจิกายน 2566
งานเทศกาลนมัสการองค์พระปฐมเจดีย์ ปิดทองพระร่วงโรจนฤทธิ์ บูชาพระบรมสารีริกธาตุ 3 แผ่นดิน
งานเทศกาลนมัสการองค์พระปฐมเจดีย์ ปิดทองพระร่วงโรจนฤทธิ์ บูชาพระบรมสารีริกธาตุ 3 แผ่นดิน 24 พฤศจิกายน ~ 2 ธันวาคม 2566 ณ วัดพระปฐมเจดีย์ ราชวรมหาวิหาร ตำบลพระปฐมเจดีย์ อำเภอเมืองนครปฐม จังหวัดนครปฐม
อยุธยา พาเที่ยว 22-29 พฤศจิกายน 2566 เซ็นทรัลอยุธยา
อยุธยา พาเที่ยว กับคอนเซปต์ "ปลายปีนี้ เที่ยวไหนดี ?" พบกับโปรโมชั่นมากมายภายในงาน กว่า 30 บูธ จากหลากหลายจังหวัดทุกภูมิภาค อาทิ เชียงใหม่ ตราด กระบี่ สตูล พังงา พัทยา กาญจนบุรี และจังหวัดอื่นๆอีกมากมาย ทั้งโรงแรม แพ็คเกจทัวร์ ดำน้ำดูปะการัง ระหว่างวันที่ 22-29 พฤศจิกายน 2566 ณ ลานกิจกรรม ชั้น G บริเวณเคาน์เตอร์ประชาสัมพันธ์ ศูนย์การค้าเซ็นทรัลอยุธยา
ตะลุยกินตะลุยช็อป @ตลาดนัดพาณิชย์ ครั้งที่ 2 วันที่ 3-5 พฤศจิกายน 2566
สำนักงานพาณิชย์จังหวัดฉะเชิงเทรา ร่วมกับ เครือข่ายธุรกิจบิสคลับจังหวัดฉะเชิงเทรา
ขอเชิญชวนทุกท่าน เที่ยวงาน " ตะลุยกินตะลุยช็อป @ตลาดนัดพาณิชย์ " ครั้งที่ 2 ในโครงการสร้างทีม Salesman จังหวัดและส่งเสริมสินค้าอัตลักษณ์ท้องถิ่นไทยโกอินเตอร์
กิจกรรม จัดจุดจำหน่ายสินค้า Local+ จังหวัดฉะเชิงเทรา เพื่อกระตุ้นระบบเศรษฐกิจฐานราก ขยายโอกาสส่งเสริมผู้ประกอบการชุมชน ซึ่งจัดขึ้นระหว่างวันที่ 3-5 พฤศจิกายน 2566 ณ ริมน้ำหลังวิทยาลัยอาชีวศึกษาฉะเชิงเทรา ต.หน้าเมือง อ.เมือง จ.ฉะเชิงเทรา ตั้งแต่เวลา 15.00 น. เป็นต้นไป ‼️ ภายในงานท่านจะได้พบกับสินค้าต่างๆมากมาย จำนวนมากกว่า 80 ร้านค้า อาทิเช่น สินค้าเกษตร เกษตรแปรรูป ผลิตภัณฑ์ชุมชน ฯลฯ และยังมีกิจกรรมลด แลก แจก แถม นาทีทอง ‼️ อีกด้วย
////
งาน " ตะลุยกินตะลุยช็อป @ตลาดนัดพาณิชย์ "ครั้งที่ 1 ระหว่างวันที่ 27-29 ตุลาคม 2566 ณ โดมองค์พระพิฆเนศ วัดสมานรัตนาราม ต.บางแก้ว อ.เมือง จ.ฉะเชิงเทรา
ประเพณีปักธงชัย ไหว้พ่อขุนบางกลางท่าว อ.นครไทย 13-27 พ.ย.66
ประเพณีปักธงชัย ไหว้พ่อขุนบางกลางท่าว ประจำปี 2566
จันทร์ 13 พ.ย.66 - พิธี ทอธงทอใจ ลงด้ายเส้นแรก
เสาร์ 18 พ.ย.66 - พิธีบวงสรวงพ่อขุนศรีอินทราทิตย์ นางรำ 1299 คน , ขบวนแห่ 14.00 น. , พิธีเปิดงาน
อาทิตย์ 19 พ.ย.66 - เดินแบบผ้าไทย
จันทร์ 20 พ.ย.66 - กิจกรรม ทูบีนัมเบอร์วัน
อังคาร 21 พ.ย.66 - กิจกรรม ทูบีนัมเบอร์วัน
พุธ 22 พ.ย.66 - ประกวดร้องเพลงผู้นำท้องที่ท้องถิ่น
พฤหัส 23 พ.ย.66 - ประกวดร้องเพลงผู้นำท้องที่ท้องถิ่น
ศุกร์ 24 พ.ย.66 - ประกวดส้มตำลีลา
เสาร์ 25 พ.ย.66 - ประกวดธิดาพ่อขุน
อาทิตย์ 26 พ.ย.66 - พิธีบวงสรวงพ่อขุนฯ (วัดกลาง) , ซ้อมใหญ่ การแสดงแสงสีเสียง
จันทร์ 27 พ.ย.66 - ขึ้นเขาปักธง , การแสดงแสงสีเสียง , ออกรางวัลสลากกาชาด , ลอยกระทง
(ทุกวันภายในงานมี สวนสนุก สินค้า และวงดนตรี)
งานประเพณีลอยกระทงสองแควในอดีต พรหมลิขิต แห่งสายน้ำน่าน 23-27 พ.ย.66
เทศบาลนครพิษณุโลกจัดงานประเพณีลอยกระทงสองแควในอดีต จังหวัดพิษณุโลก ประจำปี 2566 "พรหมลิขิต แห่งสายน้ำน่าน" โดยกำหนดจัดขึ้นระหว่างวันที่ 23-27 พฤศจิกายน 2566 บริเวณหน้าวัดพระศรีรัตนมหาธาตุวรมหาวิหาร และบริเวณสวนชมน่านเฉลิมพระเกียรติ ภายในงานกิจกรรมประกอบไปด้วย กิจกรรมวังกระทงเทศบาลนครพิษณุโลก ซึ่งปีนี้จัดตกแต่งสวยงามแสงสีอลังการ บริเวณ ย้อนวันวานในอดีตโดยกำหนดเป็นโซนแต่งกายชุดไทย 4 ภาคให้ผู้เข้าร่วมชมกระทงได้ถ่ายรูปกับบรรยากาศเป็นที่ระลึก ณ บริเวณพลับพลาพระที่นั่งสีตลาภิรมย์สวนกลางเมือง พิษณุโลก นอกจากนี้ มีพิธีสักการะอธิษฐานจิตขอพรองค์หลวงพ่อพุทธชินราช กิจกรรมถนนสองแควแลอดีต เที่ยวงานวัดใหญ่ในอดีต รำวงย้อนยุค และการละเล่นเด็กไทยตลาดย้อนยุค การประกวดหนูน้อยนพมาศ ขบวนแห่กระทงใหญ่ และการประกวดนางนพมาศ นอกจากนี้ยังมีการจำหน่ายอาหารอร่อยไร้แอลกอฮอล์ การประกวดร้องเพลงไทยลูกทุ่ง และวงดนตรีสากล ต้านยาเสพติด การประกวดประดิษฐ์กระทงฝีมือระดับประถมศึกษา และระดับมัธยมศึกษา และประเภทประชาชนทั่วไป เป็นต้น
ยลถิ่นภูมิปัญญา ชลาธารราชนก ระหว่างวันที่ 23 - 27 พฤศจิกายน พ.ศ. 2566
งานใหญ่ช่วงเทศกาลลอยกระทง ทางองค์การบริหารส่วนจังหวัดพิษณุโลก เชิญเที่ยวงาน "ยลถิ่นภูมิปัญญา ชลาธารราชนก" ระหว่างวันที่ 23 - 27 พฤศจิกายน พ.ศ. 2566 ณ สวนสาธารณะบึงราชนก อำเภอวังทอง จังหวัดพิษณุโลก
เดิน-วิ่งการกุศล มทร.ล้านนา ตาก มินิมาราธอน ครั้งที่ 2 วันอาทิตย์ที่ 19 พฤศจิกายน 2566
เดิน-วิ่งการกุศล โครงการ "มทร.ล้านนา ตาก มินิมาราธอน ครั้งที่ 2 (RMUTL Tak Mini Marathon 2th 2023)" วันอาทิตย์ที่ 19 พฤศจิกายน 2566 ณ บริเวณศาลสมเด็จพระเจ้าตากสินมหาราช อำเภอเมือง จังหวัดตาก รับสมัครตั้งแต่วันนี้ - 15 พฤศจิกายน 2566
งานประเพณีลอยกระทงสายไหลประทีป 1000 ดวง ประจำปี 2566 วันที่ 24-27 พฤศจิกายน 2566
งานประเพณีลอยกระทงสายไหลประทีป 1000 ดวง ประจำปี 2566 วันที่ 24-27 พฤศจิกายน 2566 ณ บริเวณริมสายธารลานกระทงสาย เชิงสะพานสมโภชกรุงรัตนโกสินทร์ 200 ปี อ.เมืองตาก จ.ตาก
ลอย ลอย กระทง สีสันแห่งสายน้ำประเพณี ลอยกระทงดอกบัว ปี 2566
ลอย ลอย กระทง วันเพ็ญเดือน 12 ชวนออเจ้ามาลอยกระท การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครนายก …. เชิญชวนนุ่งโจงห่มสไบ แต่งไทยเที่ยวงานตลาดย้อนยุค ในงาน “สีสันแห่งสายน้ำประเพณี ลอยกระทงดอกบัว ปี 2566” ในวันที่ 26-27 พฤศจิกายน 2566 พิเศษ!! การแข่งขันเรือพายในวันที่ 25 พฤศจิกายน และพบกับกิจกรรมมากมาย ณ โบสถ์กลางน้ำวัดป่ากระทุ่ม ชุมชนบ้านวังต้น ต.พรหมณี อ.เมือง จ.นครนายก พิกัด : โบสถ์เก่าวัดป่ากระทุ่ม 200 กว่าปี
Amazing Seafood Festival 2023
Amazing Seafood Festival 2023 วันที่ 25 - 27 พฤศจิกายนนี้ ณ สวนสุขภาพเทศบาลเมืองศรีราชา จังหวัดชลบุรี จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดชลบุรี
พบกับซีฟู้ดสดๆ รสชาติจัดจ้าน แซ่บซี๊ดดทุกเมนู
ยกมาเสิร์ฟแบบเต็มพื้นที่ ให้ทุกคนได้ชิม ช้อป พร้อมลุ้นรับของรางวัลภายในงาน
และยังมีเหล่าศิลปินชื่อดังที่จะมาสร้างความสนุกให้ได้กรี๊ดกันสนั่น
ลอยกระทง ปีนี้ รับรองไม่มีเหงา เพราะเรารวมทุกแมนูแซ่บ ซี๊ดด..มาฮีลใจให้แล้ว
งาน Alive up x คุ้มกลางเวียง (11 – 12 พฤศจิกายน 2566)
งาน Alive up x คุ้มกลางเวียง วันที่ 11 – 12 พฤศจิกายน 2566 พาผองเพื่อนมาแอ่ว กิจกรรมย้อนวันวาน ใจถวินหา คุ้มเจ้าบุรีรัตน์ มหาอินทร์ หรือ คุ้มกลางเวียง ที่จะพาทุกท่านย้อนกลับไปสู่ความเป็นล้านนา ภายในงานจะมีกิจกรรมปลีกย่อยอีกหลายอย่าง
ALIVE UP SANPAKOI ส่อง / สร้าง / สันป่าข่อย " วันที่ 16 - 17 กันยายนนี้ ณ ลานอาคารอนุสาร สันป่าข่อย ชวนมาเดิน มาแอ่ว มาชิม มาชม มาทำขนม มาถ่ายภาพ
Tak morning drip 24 พย 66
Tak morning drip 24 พย 66 เวลา 07:00-10:00 น. บริเวณหน้าอนุสาวรีย์จอมพลถนอม ริมแม่น้ำปิง อ.เมือง จ.ตาก อาจจะทุกวันเสาร์และอาทิตย์
พฤศจิกายน 2566 รายงาน 10 จังหวัดพบการเกิดโรคพิษสุนัขบ้า
30 พฤศจิกายน 2566 นายสัตวแพทย์สมชวน รัตนมังคลานนท์ อธิบดีกรมปศุสัตว์ เปิดเผยถึงสถานการณ์โรคพิษสุนัขบ้า ประจำวันที่ 29 พฤศจิกายน 2566 ว่ามี 10 จังหวัดพื้นที่ที่พบการเกิดโรคพิษสุนัขบ้าสูงสุด 30 วันย้อนหลัง ได้แก่ จังหวัดสงขลา สุรินทร์ อุบลราชธานี ชลบุรี อำนาจเจริญ ปราจีนบุรี ยโสธร ชัยภูมิ ศรีสะเกษ และสตูล
ซึ่งข้อมูลระหว่างวันที่ 1 ตุลาคม 2566 - 29 พฤศจิกายน 2566 มีพื้นที่ 9 จังหวัด 27 จุด ที่พบการเกิดโรค ได้แก่ ปราจีนบุรี ชลบุรี ระยอง อำนาจเจริญ ชัยภูมิ สุรินทร์ อุบลราชธานี ยโสธร และสงขลา
ปัจจุบันยังคงมีประกาศเขตโรคระบาดสัตว์ 49 จุด ในพื้นที่ 14 จังหวัด คือ ลพบุรี ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง อำนาจเจริญ ชัยภูมิ สุรินทร์ อุบลราชธานี ยโสธร อุตรดิตถ์ สมุทรสงคราม นครศรีธรรมราช และสงขลา ซึ่งขณะนี้ กรมปศุสัตว์ยังได้เร่งรัดควบคุมโรคทุกจุดเกิดโรค โดยฉีดวัคซีนรอบจุดเกิดโรค (ring vaccination) ร่วมในการเฝ้าระวัง ป้องกัน และควบคุมโรคได้ หากพบสัตว์แสดงอาการสงสัยเป็นโรคพิษสุนัขบ้าสามารถแจ้งเจ้าหน้าที่ปศุสัตว์อำเภอหรือปศุสัตว์จังหวัดได้ทุกพื้นที่ หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนกรมปศุสัตว์ เบอร์โทรศัพท์ 06 3225 6888 ตลอด 24 ชั่วโมง
ปศุสัตว์จังหวัดสุรินทร์ ทำหมันหมาแมว ฟรี 27 พฤศจิกายน 2566
สำนักงานปศุสัตว์จังหวัดสุรินทร์ ขอประชาสัมพันธ์ เชิญชวนเจ้าของสุนัขและแมว เข้ารับบริการตามโครงการหน่วยสัตวแพทย์อาสาจุฬาภรณ์ จังหวัดสุรินทร์ ภายใต้โครงการสัตว์ปลอดโรคคนปลอดภัย จากโรคพิษสุนัขบ้า เพื่อฉีดวัคซีนและผ่าตัดทำหมันสุนัขและแมว ในพื้นที่จังหวัดสุรินทร์
วันจันทร์ที่ 27 พฤศจิกายน 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์
เปิดลงทะเบียน (ปิดรับเมื่อเต็มจำนวน)
วันจันทร์ที่ 20 พฤศจิกายน 2566 เวลา 9.00 น.
ประกาศรายชื่อผู้ที่ผ่านตามหลักเกณฑ์
วันพุธที่ 22 พฤศจิกายน 2566 เวลา 10.00 น.
ผ่าน Facebook สำนักงานปศุสัตว์จังหวัดสุรินทร์
ซึ่งผู้ที่ผ่านตามหลักเกณฑ์ได้รับการประกาศรายชื่อ ต้องเดินทางมาตรวจ ATK หน้างานก่อนเวลา 06.30 น.
จำกัด จำนวนสุนัขและแมว 100 ตัว
- ประกาศรายชื่อผู้ที่ผ่านตามหลักเกณฑ์ เพื่อฉีดวัคซีนและผ่าตัดทำหมันสุนัขและแมว ในวันจันทร์ที่ 27 พฤศจิกายน 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์
เทศกาลแจ๊ส เมืองพัทยา ณ ชายหาดพัทยา 10-11 พ.ย.66
เทศกาลแจ๊ส เมืองพัทยา (Pattaya Jazz Festival) ณ ชายหาดพัทยา 10-11 พ.ย.66 Call center 1337
มหัศจรรย์งานช้างสุรินทร์ 2566
งานประจำปีสุดยิ่งใหญ่แห่งจ.สุรินทร์ "มหัศจรรย์งานช้างสุรินทร์ 2566" จัดขึ้นระหว่างวันที่ 16-27 พฤศจิกายน 2566 ชมขบวนแห่ช้าง การแสดงแสงสีเสียง กิจกรรมความบันเทิงตลอด 12 วัน 12 คืน พิธีต้อนรับและเลี้ยงอาหารช้างที่ใหญ่ที่สุดในโลก ชมขบวนแห่ช้างเข้าเมืองบริเวณสถานีรถไฟสุรินทร์ และ บริเวณอนุสาวรีย์พระยาสุรินทร์ภัคดีศรีณรงค์จางวาง อำเภอเมืองสุรินทร์ จังหวัดสุรินทร์
“มาแต่ตรัง” Trang Renown เทศกาลท่องเที่ยวสร้างสรรค์ 22-26 พฤศจิกายน 2566
มาแต่ตรัง ไม่หนังก็โนรา…เทศกาลท่องเที่ยวสร้างสรรค์ ที่จะชวนทุกคนมาทำความรู้จักเมืองตรัง พามองย้อนจากสำนวนที่รู้จักกันในอดีต จนถึงปัจจุบันที่เมืองตรังมีอะไรมากกว่าที่ทุกคนคิด
เทศกาลท่องเที่ยวสร้างสรรค์ “มาแต่ตรัง Trang Renown” มุ่งพัฒนาสินทรัพย์เดิมของเมืองตรังทั้งประวัติศาสตร์ วัฒนธรรม อาหาร สถาปัตยกรรม และผู้คน ที่มีพื้นที่ธรรมชาติกลางเมืองที่ถูกหลงลืมอย่างคลองห้วยยาง ย่านเมืองเก่าทับเที่ยง เป็นพื้นที่หัวใจสำคัญที่จะกระตุ้นเมืองเก่าตรัง ภายใต้โครงการกิจกรรมส่งเสริมการท่องเที่ยวภายใต้โครงการยกระดับและพัฒนาด้านการท่องเที่ยวคุณภาพสูงฝั่งอันดามัน (Premium Tourism Andaman) ดำเนินการโดยสำนักงานท่องเที่ยวและกีฬาจังหวัดและความร่วมมือจากภาคประชาสังคมและภาคเอกชน มีกิจกรรมสำคัญ 3 ด้าน ดังนี้
Renowned Place
พื้นที่สร้างสรรค์โดดเด่นในมุมใหม่
????งานออกแบบแสงสีในพื้นที่แลนด์มาร์คสำคัญของย่านเมืองเก่าทับเที่ยง อาทิ คริสตจักรตรัง โรงหนังเก่าเพชรรามา มูลนิธิกุศลสถานตรัง และคลองห้วยยาง
????พื้นที่นั่งเล่นสร้างสรรค์ (Pocket park) ตลอดริมคลองห้วยยาง
????เส้นทางท่องเที่ยวเมืองเก่า (Old town Tour) ร่วมเยี่ยมชมสถานที่สำคัญและสถาปัตยกรรมโดดเด่นในย่านเมืองเก่าทับเที่ยง
Renowned People
????ไอเดียของศิลปินและนักสร้างสรรค์ที่จะมาแต่งแต้มสีสันให้เมืองตรัง
????พื้นที่สร้างสรรค์แลกเปลี่ยนเรียนรู้ (Creative space) ณ ตรังชาตะ และโรงหนังเพชรรามา
????นิทรรศการและศิลปะจัดวาง (Exhibition & Art installation) ที่จะสะท้อนแนวคิดของนักสร้างสรรค์ที่มีต่อย่านเมืองเก่าทับเที่ยง
Renowned Local Product and Service
????ยกระดับสินค้าและบริการสร้างสรรค์เมืองตรัง
????ตลาดจำหน่ายอาหาร งานสร้างสรรค์และผลิตภัณฑ์พื้นถิ่น (Creative market) ณ มูลนิธิกุศลสถาน
ขอเชิญชวนร่วมงาน “มาแต่ตรัง...” เทศกาลท่องเที่ยวสร้างสรรค์ Creative tourism Festival ระหว่างวันที่ 22-26 พฤศจิกายน 2566 เวลา 10.00- 21.00 น. ณ คลองห้วยยาง ย่านเมืองเก่าทับเที่ยง ตำบลทับเที่ยง อำเภอเมืองตรัง จังหวัดตรัง
เทศกาลพลุนานาชาติ พัทยา 2566 วันที่ 24-25 พ.ย.66
เมืองพัทยา โดยสำนักการท่องเที่ยวและกีฬา กำหนดจัดโครงการเทศกาลพลุนานาชาติเมืองพัทยา เชิญชวนมาร่วมชม เทศกาลพลุนานาชาติ พัทยา 2566 (Internation Fireworks Festival 2023) 2 วันเต็ม คือวันที่ 24-25 พ.ย.66 บริเวณชายหาดพัทยา สอบถาม Pattaya Contact Center 1337
Thailand tropical downhill race 25-26 พฤศจิกายน 2566
การแข่งขัน Thailand tropical downhill race การแข่งขันกีฬา extreme สเก็ตบอร์ด ดาวน์ ฮิลล์ นานาชาติ จาก 12 ประเทศ ซึ่งจะแข่งขันรอบชิงชนะเลิศในวันพรุ่งนี้ 26 พฤศจิกายน 2566 ณ ป่านันทนาการน้ำตกเขาอีโต้ ตั้งแต่ 09.00 น. เช้าเป็นต้นไป
ประเพณีลอยกระทงพัทยา 2566 ชายหาดพัทยากลาง 27 พ.ย.66
งาน ประเพณีลอยกระทงพัทยา 2566 ณ ชายหาดพัทยากลาง ค่ำคืนวันเพ็ญ 27 พ.ย.66 นี้ด้วยกันนะ รายละเอียดสอบถาม Pattaya Contact Center 1337
PATTAYA COFFEE ON THE BEACH 2022


กลับมาอีกครั้ง PATTAYA COFFEE ON THE BEACH 2022 พบกันต้นเดือนธันวาคม นี้ ที่ชายหาดพัทยา องค์การบริหารส่วนจังหวัดชลบุรี ร่วมกับ เมืองพัทยา, การท่องเที่ยวแห่งประเทศไทย สำนักงานพัทยา , สมาคมนักธุรกิจและการท่องเที่ยวเมืองพัทยา, สำนักงานส่งเสริมการจัดประชุมและนิทรรศการ (องค์การมหาชน) หรือ สสปน , ชมรมคาเฟ่แอนด์บิสโทรคลับ พัทยา เตรียมจัดงาน PATTAYA COFFEE ON THE BEACH 2022 ขึ้น เป็นปีที่ 2 ระหว่างวันที่ 10-11 ธันวาคม 2565 บริเวณริมชายหาดพัทยาเหนือ สุดพิเศษปีนี้ด้วยธีมงาน “Coffee & Friend” เพื่อเป็นการเพิ่มสีสันให้ภายในงานมากยิ่งขึ้น ซึ่งจะแตกต่างจากปีที่แล้วที่จัดขึ้นภายธีม “Beach Camp” เพื่อเป็นการกระตุ้นการท่องเที่ยวในจังหวัดชลบุรีมีความน่าสนใจ ด้วยการสร้างภาพลักษณ์และกิจกรรมใหม่ๆ อีกทั้งยังเป็นการเปิดโอกาสให้ผู้ประกอบการร้านกาแฟและคาเฟ่ในชลบุรี ได้นำเสนอผลงาน และเปิดประสบการณ์ แลกเปลี่ยนความรู้ใหม่แก่ผู้ที่สนใจในการดื่มการกาแฟ โดยภายในงานได้เชิญกูรูชื่อดังในแวดวงกาแฟ มาร่วม Workshopให้ความรู้ที่เกี่ยวข้องกับกาแฟ นอกจากนี้ยังมีโซนต่าง ๆ ให้ร่วมสัมผัส ชม ชิม แชะมากมาย อาทิ โซนสำหรับจำหน่ายกาแฟและร้านคาเฟ่, โซนสำหรับจำหน่ายอาหารและเครื่องดื่ม, โซนสำหรับพักผ่อน รับประทานอาหาร ชมการแสดง ภายใต้บรรยากาศ “Coffee & Friend” อีกด้วย
งานสัปดาห์สะพาน ข้ามแม่น้ำแคว และงานกาชาด จังหวัดกาญจนบุรี
การแสดงแสงเสียง รำลึกความโหดร้ายของการสร้างสะพานข้ามแม่น้ำแคว และทางรถไฟสายมรณะ การออกร้านกาชาด นิทรรศการของหน่วยงาน ห้างร้าน สวนสนุก และมหรสพบันเทิงต่าง ๆ
เทศกาลหุ่นโคมไฟนครสวรรค์ ครั้งที่ 5
เทศกาลหุ่นโคมไฟนครสวรรค์ ครั้งที่ 5 จัดขึ้นในระหว่างวันที่ 24 ธันวาคม 2565 ถึง 2 มกราคม 2566 ณ เกาะกลางอุทยานสวรรค์ (หนองสมบุญ) แนวคิด “เกาะสวรรรค์ มหัศจรรย์แห่งแสง” ภายในงานท่านจะได้พบกับประติมากรรมหุ่นโคมไฟที่สวยงานและหาชมได้ยาก เช่น ประติมากรรมหุ่นโคมไฟน้ำตกหิมพานต์ , ประติมากรรมเขาวงกตช้างเอราวัณ , ประติมากรรมวาฬยักษ์สีน้ำเงิน และประติมากรรมที่น่ารัก เป็นศิริมงคลมากมาย
งานสัปดาห์สะพานข้ามแม่น้ำแควและงานกาชาดจังหวัดกาญจนบุรี 8-17 ธันวาคม 2566
งานสัปดาห์สะพานข้ามแม่น้ำแคว และงานกาชาดจังหวัดกาญจนบุรี 2566 10 วันเต็ม ตั้งแต่ 8-17 ธันวาคม 2566 บริเวณสะพานข้ามแม่น้ำแคว จังหวัดกาญจนบุรี มาเดินเที่ยวชมงาน แสงสีเสียง ย้อนรอยประวัติศาสตร์ อลังการ ท่ามกลางสัมผัสลมหนาวเดือนธันวาคม ร่วมสนุกกับคอนเสริ์ตศิลปินดัง 10 คืนเต็ม กับศิลปินบิ๊กเนม อย่าง เสกโลโซ ค๊อกเทล วงโกปี้ คาราบาว มหาหิงค์ และอีกเพียบ ชมเชียร์การประกวดนางงามสันติภาพ ประกวดร้องเพลงลูกทุ่งไทย ชิมชอมช็อปสินค้าราคาถูก อาหารอร่อย เครื่องดื่มขนมเพียบตลอดงาน พาแฟนพาครอบครัวไปเดินชมงานกันนะ กิจกรรมการแสดงคอนเสิร์ต
8 ธ.ค. บอล เชิญยิ้ม & นัน อนันต์ & รำวงย้อนยุค ศรสุพรรณ 9 ธ.ค. SARAN 10 ธ.ค. GUNNER & DIAMOND 11 ธ.ค. SEK LOSO 12 ธ.ค. วงโกปี้ คาราบาว 13 ธ.ค. เนสกาแฟ ศรีนคร 14 ธ.ค. มหาหิงค์ 15 ธ.ค. COCKTAIL 16 ธ.ค. ทรงไทย 17 ธ.ค. OG BOBBY & DON KINS & SPRITE
มหกรรมงาน เดิน-วิ่ง Olympic Day ครั้งแรกในกาญจนบุรี 2 ธ.ค. 66
มหกรรมงาน เดิน-วิ่ง Olympic Day ครั้งแรกในกาญจนบุรี พร้อมแลนด์มาร์คใหม่ ความภาคภูมิใจของคนกาญจน์ คณะกรรมการจัดกิจกรรมเดิน-วิ่ง Olympic Day2023 จังหวัดกาญจนบุรี และสมาคมกีฬาแห่งจังหวัดกาญจนบุรี ร่วมกับกองทุนพัฒนาการกีฬาแห่งชาติ การกีฬาแห่งประเทศไทย ชวนวิ่งยามเย็นชมสกาย วอล์ค ในวันเสาร์ ที่ 2 ธ.ค. 66 ณ สกายวอล์ค อ.เมือง จ.กาญจนบุรี กับเส้นทางสวยงาม 2 ระยะ 13 กม. (Start:16.30 น.) และ 4.7 กม. (Start:16.50 น.)
ค่าสมัครเพียง!! 380 บาท (ราคารวมค่าระบบสมัคร30บาท)
พร้อมสนุกกับกิจกรรมแข่งขันกีฬา และกีฬาเยาวชน
เช่น Futsal, Basketball 3x3, Extreme, Air Badminton, Sup Board, เจ้าหนูหมัดเหล็ก, ปีนผาคว้าดาว, จั๊มทูปารีสสมัครกิจกรรมเดิน-วิ่ง ได้ตั้งแต่วันนี้ - 20 พ.ย. 66
งานเกษตรกำแพงแสน ครั้งที่ 26 วันที่ 1-11 ธันวาคม 2566
งานเกษตรกำแพงแสน ครั้งที่ 26 กำหนดจัดงาน 1-11 ธันวาคม 2566
งานยอยศยิ่งฟ้าอยุธยามรดกโลก ประจำปี 2566 วันที่ 16 - 24 ธันวาคม 2566
ชมความงดงามตระการตาของการแสดงแสง-เสียง ในงาน "ยอยศยิ่งฟ้าอยุธยามรดกโลก" เรื่อง "อโยธยา ยศเกริกฟ้า วีรกษัตรา ศิลป์เรืองรุจี วิเทศไมตรี ศรีอโยธยา" จัดแสดง ณ บริเวณวัดมหาธาตุ รอบการแสดง
- วันเสาร์ - วันอาทิตย์ ที่ 16 - 17 ธันวาคม 2566 เวลาแสดง 19.00 - 20.00 น. และ 20.45 - 21.45 น.
- วันจันทร์-พฤหัสบดี ที่ 18 - 21 ธันวาคม 2566 เวลาแสดง 19.30 - 20.30 น.
- วันศุกร์ - อาทิตย์ ที่ 22 - 24 ธันวาคม 2566 เวลาแสดง 19.00 - 20.00 น. และ 20.45 - 21.45 น.
ติดต่อข้อมูลข่าวสารที่ทำการปกครองจังหวัดพระนครศรีอยุธยา กลุ่มงานการเงิน โทร. 0-3533 -6563 หรือ 0-3533-5244
งานเดินกิน ถิ่นนาเกลือ 2-24 ธ.ค. 2566 และ 6-14 ม.ค.2567
“งานเดินกิน ถิ่นนาเกลือ” ปีที่ 15 พบกับของอร่อยๆ เดินชิม ช๊อป แบบชิวๆ ฟังดนตรีแบบเพลินๆ วันที่ 2-24 ธ.ค. 2566 และ 6-14 ม.ค.2567
ปฏิทินท่องเที่ยวเชียงใหม่ เดือนธันวาคม 2566
งาน Phangnga Coffee Journey #Season 2 จัดทุกวันเสาร์ของเดือนธันวาคม 2566
คอกาแฟห้ามพลาด งาน Phangnga Coffee Journey #Season 2 จัดทุกวันเสาร์ของเดือนธันวาคม 2566 เช็กอิน 4 สถานที่ 4 บรรยากาศสุดฟิน มาในรูปแบบ Coffee & Camping โดยมีผู้ประกอบการร้านกาแฟชื่อดังในพื้นที่จังหวัดพังงา ร่วมออกบูธในแบบสโลว์บาร์ นำเสนอเมนูกาแฟและเครื่องดื่มที่มีชื่อเสียงของแต่ละร้าน ภายในงานมีเสียงดนตรีจากวงโฟล์คซองคอยบรรเลงเพลงเพราะๆ ได้อารมณ์เข้ากับการจิบกาแฟ พร้อมกับมีกิจกรรมดีๆ โดยการเที่ยวงาน Phangnga Coffee Journey ครบ 4 พื้นที่ รับคูปองเงินสด 300 บาท ทันที (คูปองมีจำนวนจำกัด) สามารถนำไปใช้เป็นส่วนลดแทนเงินสดกับอาหารในร้าน Michelin หรือร้าน Thai Select ที่ร่วมรายการกับ ททท. พังงา
งาน Phangnga Coffee Journey #Season 2 จัด 4 ครั้งใน 4 พื้นที่ ทุกวันเสาร์ในเดือนธันวาคม 2566 ระหว่างเวลา 09.00-16.00 น.
- ครั้งที่ 1 วันเสาร์ที่ 2 ณ บริเวณหาดท้ายเหมือง อุทยานแห่งชาติเขาลำปี-หาดท้ายเหมือง อำเภอท้ายเหมือง
- ครั้งที่ 2 วันเสาร์ที่ 9 ณ หาดนางทอง เขาหลัก อำเภอตะกั่วป่า
- ครั้งที่ 3 วันเสาร์ที่ 16 ณ บริเวณสวนสาธารณะเฉลิมพระเกียรติสมเด็จพระศรีนครินทร์ทราบรมราชชนนี 80 พรรษา อำเภอเมืองพังงา
- ครั้งที่ 4 วันเสาร์ที่ 23 ณ บริเวณย่านเมืองเก่า อำเภอตะกั่วป่า
ททท.สำนักงานพังงา : TAT Phangnga Office 076-413400
Kanchanaburi Countdown Festival 2024 อุโมงไฟกาญจนบุรี ส่งท้ายปีเก่ารับปีใหม่ 2567
องค์การบริหารส่วนจังหวัดกาญจนบุรี ชวนมาสนุกส่งท้ายปีที่เมืองกาญจน์ ในงาน “Kanchanaburi Countdown Festival 2024” ตั้งแต่ 28 - 31 ธันวาคม 2566 ชมอุโมงค์ไฟยาวกว่า 80 เมตร ถ่ายภาพสวยสุดสะดุดตา แลนด์มาร์คเด่นสง่าถ่ายรูปสวยทุกรูป สถานที่ลานหน้าองค์การบริหารส่วนจังหวัดกาญจนบุรี
จริงใจ ม่วนม่วนมาร์เก็ต ครั้งที่ 2 วันที่ 14-17 ธันวาคม 2566
งาน “จริงใจ ม่วนม่วนมาร์เก็ต ครั้งที่ 2” วันที่ 14-17 ธันวาคม 2566 นี้ ณ โครงการจริงใจมาร์เก็ต ในย่านจริงใจเซ็นทรัล Creative District จ.เชียงใหม่ งานแฟร์สุดยิ่งใหญ่ของกลุ่มเซ็นทรัล หนึ่งปีมีเพียงครั้งเดียว!! จริงใจเปิดบ้านต้อนรับพี่ ๆ น้อง ๆ จากทั่วทุกสารทิศ ไม่ว่าจะอยู่ภาคเหนือ กลาง อีสาน ใต้ ก็มาขายของตวยกั๋นได้ จัดเต็ม 4 วัน 4 คืน ม่วนใจ๋กันได้มากกว่าเดิม
เขื่อนขุนด่านปราการชล เปิดการระบายน้ำผ่าน Spillway 2-5 ธันวาคม 2566
น้ำตกยักษ์กลับมาแล้ว เขื่อนขุนด่านปราการชล เปิดการระบายน้ำผ่าน Spillway ในวันที่ 2-5 ธันวาคม 2566 ตามช่วงเวลาดังนี้
วันที่ 2 ธ.ค.2566 เวลา 16.30-19.30 น.
วันที่ 3 ธ.ค. 2566 เวลา 16.00-18.00 น.
วันที่ 4 ธ.ค. 2566 เวลา 16.00-18.00 น.
วันที่ 5 ธ.ค. 2566 เวลา 16.30-19.30 น.
หมายเหตุ ขอสงวนสิทธิ์ การเปลี่ยนแปลงการระบายน้ำตามสถานการณ์
ปฏิทินกิจกรรมพัทยาเดือนธันวาคม 66
เที่ยวงาน สันกำแพง FinFunFest 22–28 ธันวาคม 2566 อ.สันกำแพง
เชิญเที่ยวงาน “#สันกำแพงFinFunFest” งานฤดูหนาวและงานของดี ผลิตภัณฑ์ชุมชน อ.สันกำแพง ครั้งที่ 15 ประจำปี 2566 “สันกำแพง Fin Fun Fest” ระหว่างวันที่ 22–28 ธันวาคม 2566 ณ ศูนย์ราชการเฉลิมพระเกียรติ อ.สันกำแพง จ.เชียงใหม่
เทศกาลในจังหวัดสุรินทร์ช่วงเดือนธันวาคม 2566
เทศกาลในจังหวัดสุรินทร์ช่วงเดือนธันวาคม 2566
- 5 ธ.ค. 66 งานเสาหลักเมือง ณ อนุสาวรีย์พระยาสุรินทร์ภักดีฯ
- 8 - 12 ธ.ค. 66 งานของดีอำเภอปราสาทและงานกาชาดอำเภอปราสาทประจำปี 2566 ณ ที่ว่าการอำเภอปราสาท
- 6 - 7 ธ.ค. 66 งานศาลเจ้าตังสี่ อ.เมืองสุรินทร์
- 8 - 10 ธ.ค. 66 งานศาลเจ้าเมืองที อ.เมืองสุรินทร์
- 15 - 24 ธ.ค. 66 เทศกาลงานงิ้วสุรินทร์ ณ หลังสถานีรถไฟสุรินทร์
- 15 - 19 ธ.ค. 66 เทศกาลปลาไหล ข้าวใหม่หอมมะลิ และงานกาชาดชุมพลบุรีประจำปี 2566 ณ ที่ว่าการอำเภอชุมพลบุรี
- 20 - 26 ธ.ค. 66 สมโภชศาลเจ้าพ่อปึงเถ่ากงม่า หนองไผ่ล้อม อ.สำโรงทาบ
- 22 ธ.ค. 66 งานศาลหลักเมืองลำดวน อ.ลำดวน
สวดมนต์ข้ามปี ณ วัดชัยมงคล พระอารามหลวง พัทยาจังหวัดชลบุรี
สวดมนต์ข้ามปี ณ วัดชัยมงคล พระอารามหลวง พัทยาจังหวัดชลบุรีและวัดหรือสถานปฏิบัติธรรมใกล้บ้านท่าน
เคาท์ดาวน์@หนองคาย รับปีใหม่ 2024
เคาท์ดาวน์@หนองคาย รับปีใหม่ 2024
สวดมนต์ข้ามปีที่ #วัดโพธิ์ชัย พระอารามหลวง อ.เมือง จ.หนองคาย
สวดมนต์ข้ามปีที่ #วัดหลวงพ่อองค์ตื้อ อ.ท่าบ่อ จ.หนองคาย
กิจกรรมCount Down ที่ CHIC CHIC Market Chic Chic Market
กิจกรรมCount Down ที่ลานวัฒนธรรมริมโขงวัดลำดวน(พญานาคคู่) เทศบาลเมืองหนองคาย
31ธันวาคม 2566 ตั้งแต่เวลา 18.00 น. เป็นต้นไป
พิพิธภัณฑสถานแห่งชาติ เจ้าสามพระยา เข้าฟรี เป็นของขวัญปีใหม่
พิพิธภัณฑสถานแห่งชาติ เจ้าสามพระยา และ
โบราณสถานสำคัญ 5 แห่ง ได้แก่ 1. วัดพระศรีสรรเพชญ์ 2. วัดราชบูรณะ 3. วัดมหาธาตุ 4. วัดพระราม 5. วัดไชยวัฒนาราม 6. วัดมเหยงคณ์ งดเก็บค่าเข้าชม ระหว่างวันที่ 20 ธันวาคม 2566 – 5 มกราคม 2567 ตั้งแต่เวลา 09.00-16.00 น. สอบถามข้อมูลเพิ่มเติมที่ 035-241587
Creative Lanna Festival 2023 (8-10 ธันวาคม 2566)
งาน Creative Lanna Festival 2023 วันที่ 8 - 10 ธันวาคม 2566 ระหว่างเวลา 10.00 - 21.00 น. ณ พิพิธภัณฑ์เรือนโบราณล้านนา สำนักส่งเสริมศิลปวัฒนธรรมล้านนาสร้างสรรค์ มหาวิทยาลัยเชียงใหม่ เข้าชมฟรีตลอดงาน งานเทศกาลล้านนาสร้างสรรค์ ที่ย้อนอดีตสู่ปัจจุบัน วิถีชีวิต วัฒนธรรม ผ่านนวัตกรรมเเสง สี เสียง เปิดพื้นที่แห่งสีสัน ยามค่ำคืน Night Museum รวมทั้งนิทรรศการ งานเสวนา การแสดงร่วมสมัย นวัตกรรมแสง สี เสียง Projection Mapping บนเรือนสถาปัตยกรรม กิจกรรม Workshop และร้านค้า อาหาร ผลิตภัณฑ์งานคราฟต์ จากนักศึกษา บุคลากร เเละศิษย์เก่ามหาวิทยาลัยเชียงใหม่ ไว้ใน "กาดแลงมาจอย" และตลาด Alive Up ซึ่งมีบูธร้านค้ามากกว่า 40 ร้านค้า
กิจกรรมส่งเสริมวัฒนธรรมฅนเมืองแขวงกาวิละ 21 - 22 ธันวาคม 2566
ขอเชิญร่วมกิจกรรมส่งเสริมวัฒนธรรมฅนเมืองแขวงกาวิละ ในวันที่ 21 - 22 ธันวาคม 2566 ตั้งแต่เวลา 18.00 น. เป็นต้นไป ณ พื้นที่สาธารณะริมน้ำปิง (ติดสะพานเม็งราย)
21 ธันวาคม 2566 18.00 น. - พิธีบายศรีสู่ขวัญ ส่งท้ายปี รับมงคลปีใหม่ 18.30 น.
- พิธีเปิดงาน "ส่งเสริมวัฒนธรรมฅนเมืองแขวงกาวิละ" ร่วมเปิดไฟต้นคริสต์มาสฅนเมืองแขวงกาวิละ
21 - 22 ธันวาคม 2566 ร่วมสนุกกับ กาดหมั้วฅนเมืองแขวงกาวิละ ของดีฅนกาวิละ กิจกรรมสาธิตภูมิปัญญา กิจกรรมการแสดงศิลปวัฒนธรรม
AONANG COUNT DOWN 2024
AONANG COUNT DOWN 2024 ณ ลานเวทีอ่าวนาง แลนด์มาร์ค หมู่ที่ 3 หาดนพรัตน์ธารา ตำบลอ่าวนาง อำเภอเมืองกระบี่ พบกับการแสดงดนตรี โชว์ศิลปวัฒนธรรมประเพณีท้องถิ่น โชว์มวยไทย โชว์ควงไฟ การแสดงพลุสุดอลังการ ต้อนรับปีใหม่ 2567 คืนวันที่ 31 ธันวาคม 2566 เวลา 19.00 น. เป็นต้นไป
Eco-community Market 16 ธันวาคม 2566
Eco-community Market. Variety of activities for the whole day. Please come and join us at Spirit mountain, chong pli soi 6, aonang, Krabi มาสนุกไปกับกิจกรรม Green green ดีๆ ปังๆ ตลอดวัน ที่ ตลาดนัดรักษ์โลก Eco Market เขาโต๊ะหลวง ช่องพลีซอย 6 วันดีวันนี้วันเดียว 16 ธันวาคม 2566
UDONTHANI COUNTDOWN 2024
เทศบาลนครอุดรธานี ชวนทุกท่าน มาร่วมนับถอยหลังสู่ปี 2024 UDONTHANI COUNTDOWN 2024 วันที่ 31 ธันวาคม 2566 มาร่วมมอบความสุข สร้างความสนุกสนาน ส่งท้ายปีไปพร้อมกันกับชาวอุดรธานี ณ ลานดับเพลิง สวนสาธารณะหนองประจักษ์ศิลปาคม ชมฟรี ‼️ คอนเสิร์ตจากศิลปินชื่อดัง เต็มอิ่ม กับความบันเทิง บูธจำหน่ายสินค้าและอาหารนานาชนิด เวลา 17.00 น. เป็นต้นไป
สวดมนต์ข้ามปี ต้อนรับปีใหม่ 2567 วัดมหาวนาราม พระอารามหลวง จังหวัดอุบลราชธานี
สวดมนต์ข้ามปี ต้อนรับปีใหม่ 2567 วัดมหาวนาราม พระอารามหลวง ขอเชิญชวนพุทธศาสนิกชน สวดมนต์ข้ามปี สวดสะเดาะเคราะห์ ต่อชะตา เสริมบุญบารมี เริ่มสิ่งดี ๆ ต้อนรับปีใหม่ 2567 ในวันอาทิตย์ที่ 31 ธันวาคม พุทธศักราช 2566 เวลา 19.39 น. เป็นต้นไป ณ พระวิหารพระเจ้าใหญ่อินทร์แปลง วัดมหาวนาราม พระอารามหลวง อำเภอเมืองอุบลราชธานี จังหวัดอุบลราชธานี
Phuket countdown 2024
นับถอยหลังข้ามปีกันที่หาดกะรน 29-31 ธันวาคม 2566 Phuket countdown 2024 by อบจ. สวนสาธารณะหนองหาน หาดกะรน อาหาร การแสดง ศิลปิน ฯลฯ
กินลม ชมเล เเลหาดสุรินทร์ 29 - 31 ธันวาคม 2566
งาน กินลม ชมเล เเลหาดสุรินทร์ 29 - 31 ธันวาคม 2566 ณ หาดสุรินทร์ จ.ภูเก็ต การแสดงโชว์ว่าวยักษ์ริมหาด การแสดงแปลอักษรเหนือท้องฟ้าหาดสุรินทร์ การแสดงพลุสุดอลังการ ศิลปินและนักร้องชื่อดัง
ดูดาวข้ามปี Countdown 2024 ณ หอดูดาวเฉลิมพระเกียรติ สงขลา
ดูดาวข้ามปี Countdown 2024 31 ธันวาคม 2566 (เวลา 18:30 เป็นต้นไป) ณ หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา สงขลา ชวนไปดื่มด่ำบรรยากาศใต้แสงดาวเคล้าเสียงเพลง ในค่ำคืนสุดท้ายของปี ณ จุดชมวิวสามทะเล Highlight ภายในงาน… ชมพลุมุมสูงเมืองสงขลา สังเกตการณ์วัตถุท้องฟ้าผ่านกล้องโทรทรรศน์ ชมดวงจันทร์ ดาวเสาร์ ดาวพฤหัสบดี ถ่ายรูปเช็คอินกับบอลลูนดวงจันทร์ขนาดใหญ่ ชิลไปกับเสียงเพลงจากวงดนตรี อิ่มอร่อยกับอาหาร Food Truck
ใจFull Market นครนายก
ใจFull Market นครนายก ตลาดในสวนแห่งใหม่ของจังหวัดนครนายก จุดเช็คอินและแหล่งท่องเที่ยวแห่งใหม่ ที่ขายตั้งแต่ 7 โมงเช้าถึง5ทุ่ม ดื่มกาแฟ ทานข้าวเที่ยง ซื้ออาหารเย็นเข้าที่พัก ครบจบในที่เดียว อบอุ่น สบายใจ และมีดนตรีขับกล่อม เปิดรับสมัครพ่อค้าแม่ค้าพร้อมเข้ามาเป็นส่วนหนึ่งในพื้นที่ความสุขและลอยยิ้มของเรา - ร้านอาหาร - ร้านขนม - ร้านกาแฟ - ร้านเสื้อผ้า - ร้านของฝาก >> ตลาดเปิด 30 ธค 2023 นี้ !! เวลาขาย วันเสาร์ - วันอาทิตย์ และ วันหยุดนักขัตฤกษ์
เทศกาล Tak Tourism Festival 2024
เทศกาล Tak Tourism Festival 2024 เที่ยว "ตาก" แสนสุขใจ ชมสวน ฟังเสียง เพลินแสง รับลมหนาว 9 อำเภอ ระหว่างวันที่ 25 ธันวาคม 2566 ถึง วันที่ 3 มกราคม 2567 เวลา 17.00 - 21.00 น. ณ องค์การบริหารส่วนจังหวัดตาก
Canival คานิว๊าว เทศกาลส่งท้ายปีเก่าต้อนรับปีใหม่
เทศกาลส่งท้ายปีเก่าต้อนรับปีใหม่กำลังจะกลับมาอีกครั้ง กับ Canival คานิว๊าว ที่สุโขทัยเทรเชอร์ไลท์การ์เด้น เริ่มวันที่ 22-31 ธันวาคม 2566 เวลา 18.00-23.00
มหกรรมว่าวอีสานบุรีรัมย์ นอนดูดาว ชมว่าวกลางคืน ประจำปี 2566 อำเภอห้วยราช
"มหกรรมว่าวอีสานบุรีรัมย์ นอนดูดาว ชมว่าวกลางคืน" ประจำปี 2566 ครั้งที่ 34 ณ สนามแข่งว่าวอำเภอห้วยราช จังหวัดบุรีรัมย์ (ข้างมหาวิทยาลัยรามคำแหงฯ จังหวัดบุรีรัมย์) ระหว่างวันที่ 22-24 ธันวาคม 2566 เตรียมความพร้อมในการพัฒนาการแข่งขันว่าวแอกโบราณและว่าวแอกพัฒนาให้เป็นกีฬาทางอากาศที่ได้มาตรฐาน พบกับกิจกรรมสืบทอดภูมิปัญญาและอนุรักษ์ขนบธรรมเนียมประเพณีอันดีงาม กิจกรรมภายในงาน
- การแข่งขันว่าว แอกโบราณและว่าวแอกพัฒนา
- การแข่งขันแกว่งแอก
- การประดิษย์ว่าวยุวชน
- การสาธิตการทำว่าว
- การประกวดว่าวยักษ์
- การแสดงศิลปวัฒนธรรมพื้นบ้านของลูกหลานชาวอำเภอห้วยราช
- การแสดงดนตรีศิลปะพื้นบ้าน พร้อมเลือกซื้อสินค้าของดีและ OTOP ประจำตำบลอำเภอห้วยราช จังหวัดบุรีรัมย์ ????
สอบถามข้อมูลเพิ่มเติมได้ที่ : มหกรรมว่าวอีสานบุรีรัมย์ โทร : 086 249 6763
ปฎิทินเที่ยวจ.นนทบุรี ธันวาคม 2566
ส่งสุขปีใหม่ ปศุสัตว์จันทบุรี ร่วมกับเทศบาลตำบลบางกะจะ จัดกิจกรรมป้องกัน โรคพิษสุนัขบ้า ส่งความสุขปีใหม่ 2567 ให้แก่ประชาชน
20 ธันวาคม 2566 เวลา 09.00 น.น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับ นายสิทธิรัตน์ ศรีจันทร์ นายกเทศมนตรีตำบลบางกะจะ นางสาวจีรวรรณ สาระทัศนานันท์ ปศุสัตว์อำเภอเมือง จันทบุรี น.สพ.มนัสกิจ พลศรี หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ และผู้นำชุมชน ลงพื้นที่ บริเวณสวนสาธารณะ เฉลิมพระเกียรติ ร.9 ท่าแฉลบ ต.บางกะจะ อ.เมืองจันทบุรี แหล่งร้านอาหารทะเลที่มีชื่อเสียงของจันทบุรี จัดกิจกรรมส่งความสุขปีใหม่ 2567 ให้แก่ประชาชน และนักท่องเที่ยว โครงการบวร ร่วมใจกัน เมืองจันท์ ปลอดโรคพิษสุนัขบ้า ตามโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางวัฒน วรชัตติยราชนารี ออกหน่วยบริการเคลื่อนที่ ผ่าตัดทำหมัน ฉีดวัคนป้องกันโรคพิษสุนัขบ้าแก่สุนัข แมวจรจัด และสุนัข แมว ของชุมชน เพื่อสร้างพื้นที่ ปลอดโรคพิษสุนัขข้าในระดับท้องถิ่น ผลการปฏิบัติงานฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สุนัข แมว รวม 42 ตัว ผ่าตัดทำหมันเพื่อควบคุมป ระชากรสัตว์ รวม 50 ตัว และให้คำปรึกษาการดูแลสุขภาพสัตว์ การปฏิบัติตัว แก่ประชาชนที่ถูกต้องหากถูกสุนัขกัด 4 ข้อ เพื่อไม่ให้เสียชีวิตด้วยโรคพิษสุนัขบ้า ด้วยการล้างแผลด้วยน้ำสบู่ ใส่ยาทาแผล กักสุนัขหรือเฝ้าสังเกตอาการอย่างน้อย 10 วัน แล้วรีบไปพบแพทย์ทันที ทั้งนี้ ขอความร่วมมือ เจ้าของสัตว์ นำสุนัข แมวที่มีอายุตั้งแต่ 24 เดือนขึ้นไป ไปรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จากสถานพยาบาลสัตว์ หรือตามที่เทศบาล , อบต.ในพื้นที่นัดหมายเมืองเลยฮาล์ฟมาราธอน MUANG LOEI21 2023 วันที่ 10 ธ.ค. 66
เมืองเลยฮาล์ฟมาราธอน MUANG LOEI21 2023 วันวิ่ง อาทิตย์ที่ 10 ธ.ค. 66 ระยะการแข่งขัน 10 / 21 กม. เปิดรับสมัครแล้ว
มหกรรมกล้วยไม้และของดีสมุทรสาคร 15 - 19 ธันวาคม 2566
ขอเชิญเที่ยวชมงาน "มหกรรมกล้วยไม้และของดีสมุทรสาคร" 15 - 19 ธันวาคม 2566 ณ ศูนย์การค้าเซ็นทรัล มหาชัย จังหวัดสมุทรสาคร จังหวัดสมุทรสาคร โดยสำนักงานเกษตรจังหวัดสมุทรสาคร และสหกรณ์ผู้ประกอบการกล้วยไม้ไทย จำกัด กำหนดจัดงานมหกรรมกล้วยไม้และของดีสมุทรสาครขึ้นระหว่างวันที่ 15 - 19 ธันวาคม 2566 ศูนย์การค้าเซ็นทรัล มหาชัย เพื่อเป็นการส่งเสริมอาชีพ เพิ่มรายได้ เพิ่มโอกาสและช่องทางการตลาดให้กับเกษตรกร กลุ่มองค์กรเกษตรกร และวิสาหกิจชุมชน ส่งเสริมภาพลักษณ์การท่องเที่ยวและกระตุ้นเศรษฐกิจในพื้นที่จังหวัดสมุทรสาคร โดยภายในงานมหกรรมกล้วยไม้และของดีสมุทรสาคร แบ่งเป็น 2 โซนได้แก่ โซนแสดงพันธุ์กล้วยไม้ นิทรรศการเกี่ยวกับกล้วยไม้ และจัดเช็คอินสำหรับถ่ายภาพ ซึ่งทุกท่านเข้ามาเยี่ยมชมและถ่ายภาพความสวยงามได้ และ โซนที่ 2 การจำหน่ายสินค้ากล้วยไม้ ไม้ดอกไม้ประดับ ผัก ผลไม้ สินค้าแปรรูป และสินค้าหัตถกรรม ที่เป็นของดีของจังหวัดสมุทรสาครจากผู้ผลิตโดยตรง ของทั้ง 3 อำเภอในจังหวัดสมุทรสาคร จำนวน 40 บูธ สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานเกษตรจังหวัดสมุทรสาคร โทร. 0 3442 6995 หรือ สหกรณ์ผู้ประกอบการกล้วยไม้ไทย จำกัด โทร. 0 3449 9388, 08 6383 3714 Facebook : สหกรณ์ผู้ประกอบการกล้วยไม้ไทย จำกัดงานประเพณี "ตีคลีไฟ" 15 - 16 ธันวาคม 2566
ขอเชิญเที่ยวงานประเพณี "ตีคลีไฟ" ประเพณี 1 เดียวในโลก เป็นประเพณีจากภูมิปัญญาท้องถิ่น ที่มีขึ้นมาแต่โบราณ การตีคลีไฟเป็นวิธีการคลายหนาวอย่างหนึ่งของชนบทในแถบบริเวณนี้ ภายในงานมีการเเข่งขันกีฬาพื้นบ้าน เช่น เเข่งเรือยาว ตีคลีโหลน ตีคลีไกล ชมการแสดง แสง สี เสียง และพบกับไฮไลท์การแข่งขันตีคลีไฟสุดอลังการที่นี่ที่เดียว วันที่ 15 - 16 ธันวาคม 2566 ณ วัดแจ้งสว่าง บ้านหนองเขื่อง ตำบลกุดตุ้ม อำเภอเมืองชัยภูมิ จังหวัดชัยภูมิ
เชียงคานเฟสติวัล #1 วันที่ 22 – 23 ธันวาคม 2566
เชียงคานเฟสติวัล #1 จัดขึ้นระหว่างวันที่ 22 – 23 ธันวาคม 2566 ณ บ้านติดดิน อ.เชียงคาน
สมุทรสาคร ฟู้ดส์ เฟสติวัล Food Fun Fest 22 - 24 ธันวาคม 2566
งาน "Food Fun Fest" สมุทรสาคร ฟู้ดส์ เฟสติวัล วันที่ 22 - 24 ธันวาคม 2566 เวลา 16.00 - 22.00 น. ณ ริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร ภายในงาน พบกับ 80 ร้านดัง มาให้ ชิม ช๊อป แชะ ในบรรยากาศสุดฟิน นั่งฟังดนตรีชิลๆ ต้อนรับลมหนาว พร้อมชมพระอาทิตย์ตกยามเย็นสุดโรแมนติก
งานนิทรรศการมะพร้าวและวิถีชีวิตพื้นถิ่น Baanrimklong of Art #3 (22-24 ธันวาคม 2566)
ททท.สำนักงานสมุทรสงคราม ชวนสัมผัสวิถีชีวิตชุมชน พร้อมเรียนรู้กิจกรรมมะพร้าวแห่งชีวิต ณ ชุมชนบ้านริมคลองโฮมสเตย์ ในงานนิทรรศการมะพร้าวและวิถีชีวิตพื้นถิ่น Baanrimklong of Art #3 วันที่ 22-24 ธันวาคมนี้ ณ บ้านริมคลองโฮมสเตย์ ต.บ้านปรก อ.เมืองฯ จ.สมุทรสงคราม ภายในงานมีการจัดนิทรรศการต่างๆ รวมถึงกิจกรรมภายใต้แนวคิด “จากมะพร้าว 1 ต้น ทำอะไรได้บ้าง” Work Shop ทำน้ำตาลป๊อบ , ขนมต้ม , ทำลูกชุบ , อาหารพื้นถิ่น , จักสานใบมะพร้าว , ผ้ามัดย้อมจากเปลือกมะพร้าว , พวงกุญแจจากขลุยมะพร้าว , กิจกรรมท่องเที่ยวเชิงเกษตร ตามแนวคิด BCG และ STGs , เลือกซื้อสินค้า ผลิตภัณฑ์ Art &Craft เป็นต้น สอบถามรายละเอียดเพิ่มเติมได้ที่ บ้านริมคลองโฮมสเตย์ โทร. 08 9170 2904
ประเพณีกินข้าวใหม่ชาวกะเหรี่ยง "อั่ง บึ่ง ซั่ง" วันที่ 23-24 ธันวาคม 2566
ขอเชิญร่วมสืบสานประเพณีกินข้าวใหม่ชาวกะเหรี่ยง "อั่ง บึ่ง ซั่ง" วันที่ 23-24 ธันวาคม 2566 ณ บ้านบางกะม่า ต.บ้านบึง อ.บ้านคา จ.ราชบุรี ร่วมกิจกรรมฟรี 23 ธ.ค.65 เริ่มเวลาประมาณ 13.00 - 21.00 น. ???? การละเล่น การแสดงดนตรี รำกะเหรี่ยง ???? สาธิตการทำขนมหมี่สิ ????การละเล่นสะบ้า ???? กิจกรรมสาธิตฟาด ฝัด ตำ ข้าว 24 ธ.ค.65 ช่วงเช้า ???? ทำบุญตักบาตรข้าวใหม่ ???? กินข้าวใหม่
Night At The Museum พิพิธภัณฑ์ยามค่ำคืน ณ อุทยาน ร.2 (23-25 ธันวาคม 2566)
Night At The Museum พิพิธภัณฑ์ยามค่ำคืน ณ อุทยาน ร.2 (23-25 ธันวาคม 2566) ตอน “ณ บางช้าง” วันที่ 22-24 ธันวาคม 2566 เวลา 16.00 – 20.00 น.
มหานครแห่งความสุข สีสันวัฒนธรรมยโสธร 2023
ยโสธรวินเทอร์ หนาวนี้ที่ยโสธร "มหานครแห่งความสุข สีสันวัฒนธรรมยโสธร 2023" วันที่ 26-29 ธันวาคม 2566 พบกับกิจกรรมต่างๆมากมาย... พบดาราศิลปินมากมาย พบอุโมงค์ไฟแห่งรักยาวที่สุดริมชี พบเมืองเกษตรอินทรีย์วิถียโสธร พบทางเดินอุโมงค์โคมแห่งความสุข พบยโซล~ยโสจุดถ่ายรูปสไตล์เกาหลี พบถนนคนลาบ มหานครแห่งของกิน พบของฝาก ขวัญปีใหม่ พบร้านอาหารเมนูสไตล์ชิค พบขบวนจำหน่ายอาหารฟู๊ดทรัค พบดนตรีหลากหลายด้านวัฒนธรรม พบร้านค้าจำหน่ายสินค้าเกษตรอินทรีย์ ชมการแสดงมินิคอนเสิร์ตจากศิลปินดัง พบการแสดงดนตรีสีสันสุดเซอร์ไพรส์ ณ บริเวณวิมานพญาแถน จังหวัดยโสธร
งานวันน้อมรำลึกก่อตั้งโครงการฯและงานวันดินโลก ปี 2566 (27 ธ.ค. 66 - 5 มกราคม 67)
งานวันน้อมรำลึกก่อตั้งโครงการฯและงานวันดินโลก ปี 2566 “ผืนป่าและแผ่นดินที่พ่อสร้าง” ณ ศูนย์ศึกษาวิธีการฟื้นฟูที่ดินเสื่อมโทรมเขาชะงุ้ม อันเนื่องมาจากพระราชดำริ อ.โพธาราม จ.ราชบุรี วันที่ 27 ธ.ค. 66 - 5 มกราคม 67
งานเทศกาลโคมไฟนานาชาติ@หนองใหญ่ ชุมพร
งานเทศกาลโคมไฟนานาชาติ@หนองใหญ่ ชุมพร ตั้งแต่ 29 ธ.ค. 66 - 4 ม.ค. 67 ภายในงานมีซุ้มโคมไฟถ่ายรูปหลากหลายประเทศ มีร้านค้ามากกว่า100 ร้านค้า มีกิจกรรมให้ร่วมสนุก
สวนผึ้ง Moon & Lake Music Festival 30-31 ธันวาคม 2566
เคาท์ดาวน์ปีนี้ไปเที่ยวเทศกาลดนตรี “สวนผึ้ง Moon & Lake Music Festival วันที่ 30-31 ธันวาคม 2566 เวลา 16.00 - 24.00 น. ณ อ่างเก็บน้ำชัฏป่าหวาน อ.สวนผึ้ง จ.ราชบุรี พบกับศิลปินและวงดนตรีสุดมันส์ ชมฟรีตลอดงาน !! วันที่ 30 ธันวาคม 2566 : Joy Tiktok มิตรภาพ , ซานิ , Wanyai FT. Mon Monik , แสตมป์ , และอะตอม วันที่ 31 ธันวาคม 2566 : วงวานร ราชบุรี , Fellow Fellow , Moderndog , และจ๊ะ นงผณี
เดิ่น CRAFT MARKET #2 งานคร๊าฟ สุดฟินที่ ภูเขียว LINK
งาน " เดิ่น คร๊าฟ มาเก็ต " ครั้งที่ 2 วันที่ 30 ธันวาคม 2566 งานรวบรวมร้านค้างานทำมือต่างๆมาให้เพื่อนๆ ได้เลือกช๊อปส่งท้ายปีกัน มีทั้งอาหารคร๊าฟ เสื้อผ้านารักๆ และสินค้ามือสองเจ๋งๆ และที่เด็ดไปกว่านั้นคือ เราจะเชิญ home brew craft beer มาออกบูธให้เพื่อนๆได้ชิมเบียร์คร๊าฟที่ทำโดยฝีมือคนในท้องถิ้นเรา ว่าเด็ดสุดยอดขนาดไหน
กิจกรรมภายในงาน งาน เสวนา และ work shop bakery ไว้ให้ท่านที่สนใจร่วมฟังและwork shop กันตลอดทั้งวัน กิจกรรม " แจกของขวัญปีใหม่ให้กับผู้ร่วมงาน " ที่ทุกคนรอคอย โดยเฉพาะ สมาชิกร้านเดิ่น ของเรา มีสิทธิ์ร่วมลุ้นรางวัลใหญ่จากทางร้านด้วยถือว่าเป็นการขอบคุณลูกค้าที่สนับสนุนเรามาโดยตลอด กิจกรรมเล่นเกมเพื่อแลกของขวัญ กิจกรรมดนตรี และเปิดแผ่น DJ งานนี้เราเริ่มจัดตั้งแต่ง 12.00 น. ยาวไปถึง 22.00 น.
Amazing Maeklong Countdown 2024
งาน Amazing Maeklong Countdown 2024 ณ สะพานแขวนแควอ้อม วัดปากน้ำ อำเภออัมพวา จังหวัดสมุทรสงครามกิจกรรมดนตรี AMPHAWA BLACKHOUSE COUNTDOWN 2024 - 31 ธ.ค.2566
สำนักงานเทศบาลตำบลอัมพวา ร่วมกับ BLACKHOUSE จัดกิจกรรมดนตรี "AMPHAWA BLACKHOUSE COUNTDOWN 2024" จัดเต็มความมันส์และความสนุกส่งท้ายปี ฟรี !! คอนเสิร์ต กับศิลปินดัง OG-ANIC&34PANATA , Qwerty , Cat Water , THE AUK และเด็กๆ นักดนตรีชาว จ.สมุทรสงคราม พบกัน 31 ธ.ค.2566 ตั้งแต่เวลา 18.00 น. เป็นต้นไป หน้าที่ว่าการอำเภออัมพวา ริมแม่น้ำแม่กลอง ตลาดน้ำอัมพวา
กิจกรรมเดือน กรกฎาคม-กันยายน 2566
กิจกรรมเดือน กรกฎาคม 2566
วันเสาร์และอาทิตย์ที่ 1-2 ก.ค กิจกรรมทำหมันสัญจร ณ ห้องทำหมันหน้า WestGate Hall เซ็นทรัล WestGate
วันเสาร์ที่ 15 ก.ค. 66 กิจกรรมทำหมันสัญจรวัด ณ อ.เมือง จ.สระบุรี
วันอาทิตย์ที่ 16 ก.ค. 66 กิจกรรมทำหมันสัญจรวัด ณ ต.พรหมณี อ.เมือง จ.นครนายก
วันศุกร์-อาทิตย์ที่ 28-30 ก.ค.66 กิจกรรมทำหมันสัญจรวัด ณ สมอโคน จ.ตาก
กิจกรรมเดือน สิงหาคม 2566
วันเสาร์ที่ 5 สิงหาคม 2566 เวลา 13.00-15.00 น. วัต ณ อ.เมือง จ.อยุ
วันอาทิตย์ที่ 6 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ ต.เขาพระ อ.เดิมบางนางบวช จ.สุพรรณบุรี
วันเสาร์ที่ 19 สิงหาคม 2566 เวลา 13.00-15.00 น. วัต ณ ต.โคกขาม อ.เมือง จ. สมุทรสาคร
วันอาทิตย์ที่ 20 สิงหาคม 2566 เวลา 13.00-15.00 น. วัต ณ อ.ซะอำ อ.เพชรบุรี
วันเสาร์ที่ 26 สิงหาคม 2566 เวลา 13.00-15.00 น. โรงเรียน ณ สำาตะคอง อ.ปากช่อง จ.นครราชสีมา
วันอาทิตย์ที่ 27 สิงหาคม 2566 เวลา 13.00-15.00 น. วัต ณ ต.มวกเหล็ก อ.มวกเหล็ก จ.สระบุรี
กิจกรรมเดือน กันยายน 2566
วันเสาร์ที่ 9 กันยายน 2566 เวลา 13.00-15.00 น. วัต ณ อ่อนนุช กทม.
วันอาทิตย์ที่ 10 กันยายน 2566 เวลา 13.00-15.00 น. ณ ต.วังเย็น อ.แปลงยาว จ.ฉะเช็งเทรา
รพ. ตรวจคนไข้ drive through ตั้งแต่ 1 เมย 64 ประมาณ 1,000 + ราย พบผู้ติดโควิด -19 ถึงเมื่อวาน 106 ราย ( ประมาณ 9%) ส่วนใหญ่ไปเที่ยว สถานบันเทิง
13 พฤษภาคม 64 เวลา 14.00 น.
จำนวนรวมเพิ่มขึ้นแบบก้าวกระโดดอีกครั้งระดับ 6 แสนรายต่อวัน เป็นแนวโน้มที่ดี
ส่วนใหญ่มาจากจังหวัดต่างๆ
กรุงเทพ เพิ่มจำนวน 20,000 ราย
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
ที่เที่ยวแนะนำ ตลาดชุมชนจีนโบราณบ้านชากแง้ว
ชวนเที่ยวตลาดชุมชนจีนโบราณบ้านชากแง้ว ตลาดจีนโบราณอายุมากกว่า 100 ปี เดินหาของกินอร่อยๆ เคล้าบรรยากาศสไตล์จีน ถ่ายรูปเล่นหน้า โรงหนังโบราณ โรงฝิ่นโบราณ (ตรอกโรงยา) สักการะ ศาลเจ้าแม่ทับทิม ศาลเจ้าของชาวจีน เปิดเฉพาะวันเสาร์ เวลา 15.00-21.00 น. [
พิกัด]
แนะนำวิธีเดินทาง ++ กิจกรรมที่ผ่านไป 2567 ++
โครงการคลินิกเกษตรเคลื่อนที่ฯ 2567 ปศุสัตว์จังหวัดสมุทรปราการ
สำนักงานปศุสัตว์จังหวัดสมุทรปราการ จัดงานโครงการคลินิกเกษตรเคลื่อนที่ฯ ในพระราชานุเคราะห์ สมเด็จพระบรมโอรสาธิราช สยามกุฏราชกุมาร โดยให้บริการทำหมันสุนัขแมวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
- วันศุกร์ที่ 12 มกราคม 2567 ณ สำนักงานปศุสัตว์สมุทรปราการ ถ.ปู่เจ้าสมิงพราย ต.สำโรงกลาง อ.พระประแดง สมุทรปราการ
- ครั้งที่ 3/2567 วันพุธที่ 12 มิถุนายน 2567 ณ วัดใหญ่ ต.ในคลองบางปลากด อ.พระสมุทรเจดีย์ สมุทรปราการ
- ครั้งที่ 4/2567 วันพฤหัสบดีที่ 18 กรกฎาคม 2567 ณ อาคารอเนกประสงค์ เทศบาลเมืองแพรกษา ต.แพรกษา อ.เมือง สมุทรปราการ
เงื่อนไขดังนี้
• จำกัดบ้านละไม่เกิน 2 ตัว • ทำหมันสุนัขอายุ 6 เดือนขึ้นไป ยกเว้น สุนัขพันธุ์หน้าสั้น หรือพันธุ์เล็ก • บริการทำหมันแมวเพศเมีย อายุ 5 เดือนขึ้นไป เพศผู้ อายุ 7 เดือนขึ้นไป • งดอาหารน้ำ 12 ชั่วโมง • สัตว์ต้องมีสุขภาพดี ไม่ป่วย • ลงทะเบียนรับคิวที่หน้างาน เริ่มลงทะเบียนตั้งแต่เวลา 8.30 - 11.30 น. สอบถามโทร 02-3847530
++ กิจกรรมที่ผ่านไป 2567 ++
//// กิจกรรมปี 2567 ที่ผ่านไป ///
ปี 2567
สรุปถ่ายโอน 2567 (ณ 5 ตค. 2567)
สรุปถ่ายโอน ณ 5 ตค. 2567
จำนวน สอน./รพ.สต.ทั้งหมด 9,878 แห่ง
- ยังไม่ถ่ายโอน 5,341 (54.07%)
- ถ่ายโอนแล้ว 4,537 (45.93%)
- ถ่ายโอน 100% จำนวน 15 อบจ.
สังกัดที่ถ่ายโอนไป
- อบจ. 4,453 แห่ง (98.15%)
- เทศบาลตำบล 33 แห่ง (0.73%)
- องค์การบริหารส่วนตำบล 31 แห่ง (0.68%)
- เทศบาลเมือง 11 แห่ง (0.24%)
งานนมัสการพระแท่นดงรัง 2567 วันที่ 17-25 มี.ค. 2567


ททท.กาญจนบุรี ขอเชิญเที่ยว งานนมัสการพระแท่นดงรัง 2567 ปีนี้จัดระหว่างวันที่ 17-25 มี.ค. 2567 ณ วัดพระแท่นดงรังวรวิหาร อ.ท่ามะกา จ.กาญจนบุรี ททท.กาญจนบุรี ขอเชิญเที่ยว งานนมัสการพระแท่นดงรัง 2567 ปีนี้จัดระหว่างวันที่ 17-25 มี.ค. 2567 ณ วัดพระแท่นดงรังวรวิหาร อ.ท่ามะกา จ.กาญจนบุรี กลับมาอีกครั้งกับงานประจำปีที่ขึ้นชื่อของจังหวัดกาญจนบุรี ขอเชิญร่วมนมัสการแท่นหินขนาดใหญ่ที่ชาวบ้านเชื่อกันว่าเป็นพระแท่นศักดิ์สิทธิ์ที่พระพุทธเจ้าเสด็จดับขันธปรินิพพาน ณ ที่แห่งนี้ นมัสการรอยพระพุทธบาทจำลองที่ทำจากไม้ขนาดใหญ่ที่มีเพียงแห่งเดียวในประเทศไทย กราบขอพรพระสังกัจจายน์ (หลวงพ่อโต) ชมโบราณสถานที่เกี่ยวข้องกับพุทธประวัติ อาทิ เขาถวายพระเพลิง บ่อบ้วนพระโอษฐ์ วิหารพระอานนท์ ฯลฯ และพิพิธภัณฑ์พื้นบ้านภายในวัด พร้อมเลือกซื้อสินค้าราคาถูกจากโรงงาน เที่ยวชมมหรสพ ฟรี ตารางการแสดงศิลปิน 9 วัน 9 คืน 17 มี.ค. ณกรณ์ น้ำอ้อย พรวิเชียร ภคพร พรสุพรรณ 18 มี.ค. นัท ณวภัสร์ ไมค์ทองคำ 19 มี.ค. ดวงตา คงทอง 20 มี.ค. กนกวรรณ เกิดกาญจน์ ดำรง วงศ์ทอง 21 มี.ค. แอ้ม ชลธิชา นพคุณ รุ่งอรุณ 22 มี.ค. ยิ่งรัก สลักใจ 23 มี.ค. เต้ย จักรรินทร์ ปะแป้ง พลอยชมพู 24 มี.ค. ไรอัล กาจบัณฑิต ต้นข้าว 25 มี.ค. อ๊อด โฟร์เอส สอบถามข้อมูลเพิ่มเติม : ผู้อำนวยการศูนย์ท่องเที่ยว วัดพระแท่นดงรังวรวิหาร โทร. 089-8200992
ตารางเที่ยวบินจังหวัดระนอง
- สิงหาคม 2567 Air Asia FD3140 ดอนเมือง - ระนอง : 11.40 - 12.55 น. FD3141 ระนอง - ดอนเมือง : 13.25 - 14.35 น. ทำการบินทุกวัน ***(ยกเลิกเที่ยวบิน วันที่ 14, 21, 28)
- กรกฎาคม 2567 Air Asia FD3140 ดอนเมือง - ระนอง : 11.40 - 12.55 น. FD3141 ระนอง - ดอนเมือง : 13.25 - 14.35 น. ทำการบินทุกวัน
- มิถุนายน 2567 Air Asia FD3140 ดอนเมือง - ระนอง : 11.40 - 12.55 น. FD3141 ระนอง - ดอนเมือง : 13.25 - 14.35 น. ทำการบินทุกวัน
ตารางเที่ยวบินอาจมีการเปลี่ยนแปลงได้ตามความเหมาะสม
ติดต่อสอบถาม : 077 880527 สายการบินไทยแอร์เอเชีย. 077 862253 ท่าอากาศยานระนอง
ที่ต้องเที่ยว : เมืองระนอง แหล่งมหานครน้ำแร่ 13 พิกัดแช่น้ำแร่ร้อนระนอง LINK
เมืองระนอง แหล่งมหานครน้ำแร่ 13 พิกัดแช่น้ำแร่ร้อนระนอง 1. บ่อน้ำร้อนรักษะวาริน 2. บ่อน้ำแร่ร้อนพรรั้ง อุทยานแห่งชาติน้ำตกหงาว 3. น้ำนอง ฮอทสปา 4. ธาริน ฮอทสปริง 5. ราชาวดีสปาและน้ำแร่ 6. ทินิดี ฮอทสปริง 7. น้ำใสเขาสวย รีสอร์ท 8. บ้านในหมง 9. โรงแรมกาญจน์ญาภา ฮอทสปริง 10. Wellness Sports Club Ranong@Tinidee Ranong 11. รัก ระนอง ฮอทสปริง สปา 12. บ่อน้ำร้อนพรุหลุมพี 13. บ่อน้ำร้อนบ้านหาดยาย อุทยานแห่งชาติลำน้ำกระบุรี อำเภอละอุ่น จ.ระนอง [
ข้อมูลเต็มพร้อมโทร]
SkyWalk สองแคว กาญจนบุรี เปิดให้บริการทุกวัน (ไม่มีวันหยุด) ตั้งแต่เวลา 08.00 - 19.00 น.
SkyWalk สองแคว กาญจนบุรี เปิดให้บริการทุกวัน (ไม่มีวันหยุด) ตั้งแต่เวลา 08.00 - 19.00 น. จำกัดจำนวนผู้ใช้บริการ 150 คน ต่อช่วงเวลา ** ค่าบริการขึ้นชม : ท่านละ 60 บาท (หากนำรองเท้าเดิมกลับมาใช้ซ้ำ ลดเหลือ 30 บาท) เด็กสูงไม่เกิน 120 ซม. ขึ้นฟรี สอบถามข้อมูลเพิ่มเติม / ติดต่อจองเข้าชมเป็นหมู่คณะ โทร. 098-9520628
ถนนคนเดินสองแคว ริมแม่น้ำแคว Sky Walk แลนด์มาร์คยอดนิยม
ถนนคนเดินสองแคว อ.เมือง จ.กาญจนบุรี ชวนเดินชิลสูดอากาศริมแม่น้ำแควที่ถนนคนเดินสองแควซึ่งอยู่เคียงกับ Sky Walk แลนด์มาร์คยอดนิยมคนมาไม่ขาดสายเมื่อมาอำเภอเมืองกาญจนบุรี ถนนคนเดินสองแถว บรรยากาศน่าเดิน น่าช้อป เสื้อผ้า ของกินเพียบเรียงรายตลอดความยาวถนนเกือบ 500 เมตร ด้านติดริมน้ำยังมีลานกิจกรรม บางสัปดาห์มีการแสดงให้ชมฟรี เป็นถนนที่น่าเดิน เปิด เย็นวันเสาร์ ประมาณ 17.00 – 21.30 น. พิกัด : ติดกับ Sky Walk อ.เมือง จ.กาญจนบุรี
Ramayana Run 2024 ครั้งที่ 2 ปล่อยตัววิ่ง 7 มกราคม 2567
Ramayana Run 2024 ครั้งที่ 2 ได้ทั้งวิ่ง ได้ทั้งเล่นสวนน้ำ คุ้มกว่านี้ไม่มีอีกแล้ว‼️
ปล่อยตัววิ่ง 7 มกราคม 2567 ณ สวนน้ำรามายณะ จ.ชลบุรี
ระยะทางวิ่ง 3 KM./ 6 KM./ 10 KM./ 21 KM.
รับจำนวนจำกัด 1,000 คนเท่านั้น
เดินกิน ถิ่นนาเกลือ พัทยา 2 ธ.ค 2566 - 14 ม.ค.2567 LINK
งาน "เดินกินถิ่นนาเกลือ" ณ เมืองพัทยา ปีที่ 15 กำหนดจัดงานทุกวันเสาร์และวันอาทิตย์ ตั้งแต่วันที่ 2 - 24 ธันวาคม 2566 และวันที่ 6 -14 มกราคม 2567 จำนวน 12 วัน สถานที่จัดงานตั้งแต่ที่ทำการตำรวจชุมชนเขตงานที่ 8 (ป้อมตำรวจนาเกลือ) ถึงสะพานยาวนาเกลือ เป็นงานที่คนพัทยา แม่ค้าพ่อค้า ผู้ประกอบการ นักท่องเที่ยวต่างก็รอคอย และคาดว่างานปีนี้จะคึกคักกว่าปีที่ผ่านมาแน่นอน
การแข่งขันเจ็ตสกีและเรือเร็วท้องถิ่นเมืองพัทยา ประจำปี 2567 (5-7 มกราคม 2567)
เมืองพัทยา โดยสำนักการท่องเที่ยวและกีฬา กำหนดจัดโครงการแข่งขันเจ็ตสกีและเรือเร็วท้องถิ่นเมืองพัทยา ประจำปี 2567 ระหว่างวันที่ 5-7 มกราคม 2567 ตั้งแต่เวลา 09.00 - 17.00 น. ณ บริเวณลานกีฬาอเนกประสงค์หาดจอมเทียน เมืองพัทยา อำเภอบางละมุง จังหวัดชลบุรี เพื่อสร้างความสามัคคี ส่งเสริมพลานามัยที่ดี สร้างโอกาสให้แก่เยาวชน และประชาชนทั่วไปได้ประสบการณ์จากการแข่งขันรวมทั้งส่งเสริมให้เมืองพัทยา มีภาพลักษณ์ที่ดีในด้านการเป็นเมืองกีฬา (Sports City) และการท่องเที่ยวเชิงกีฬา (Sports Tourism)
งานวันสมเด็จพระเจ้าตากสินมหาราชรำลึกและงานกาชาดจังหวัดจันทบุรีประจำปี 2567 ระหว่างวันที่ 28 ธ.ค.66 - 5 ม.ค.67
เชิญเที่ยวงาน วันสมเด็จพระเจ้าตากสินมหาราชรำลึกและงานกาชาดจังหวัดจันทบุรีประจำปี 2567 ระหว่างวันที่ 28 ธ.ค.66 - 5 ม.ค.67 ที่สนามทุ่งนาเชย เทศบาลเมืองจันทบุรี อำเภอเมือง จังหวัดจันทบุรีพบกับความสนุกพร้อมวงดนตรีมากมาย 9 วัน 9 คืน ภายในงานมีสินค้าหลากหลายพร้อมทั้งร้านเด็ดและร้านดังใน TikTok มารวมกันแล้วที่งานวันสมเด็จพระเจ้าตากสินมหาราชรำลึกและงานกาชาดจังหวัดจันทบุรี 
งานลงแขก Ontour บุกจันทบุรี ครั้งที่ 2 วันที่ 11 ม.ค. 2567
งานลงแขก Ontour บุกจันทบุรี ครั้งที่ 2!! . ร่วมพูดคุยสังสรรค์ แลกเปลี่ยนประสบการณ์กัน สร้าง Community ผู้ประกอบการร้านอาหาร (งานนี้ใครที่ไม่ได้มีธุรกิจหรือทำธุรกิจอื่น ๆ นอกจากร้านอาหาร ก็สามารถมาเข้าร่วมได้นะ) วันที่ 11 ม.ค. 2567 เวลา 17.30 - ร้านปิด ????ร้าน ครัวกระต่าย จันทบุรี
ปฏิทินท่องเที่ยวจ.สระแก้ว ปี 2567
ปฏิทินกิจกรรมเด่นๆของจังหวัดกำแพงเพชร ตลอดปี 2567
"เที่ยงทั้งปีที่นี่...กำแพงเพชร" เช็คตารางกิจกรรมโดดเด่นน่าเที่ยวในจ.กำแพงเพชร ในรอบปี 2567 นี้ งานใหญ่ประจำปีมีทุกเดือนตั้งกุมภาพันธ์ ถึง พฤษภาคม เริ่มจาก งานบพระเล่นเพลง และกาชาดประจำปี คืองานที่หลายคนรอคอย ในเดือนกุมภาพันธ์ ต่อด้วยงานบุญผะเหวดฟังเทศน์มหาชาติ เดือนมีนาคม งานประเพณีสงกรานต์ เดือนเมษายน และประเพณีบุญบั้งไฟ เดือนพฤษภาคม ดีงามไหมล่ะ ไปเที่ยวกันนะ กำแพงเพชรรอต้อนรับทุกท่านจากทั่วไทยอยู่นะ สอบถาม
ข้อมูลเรื่องท่องเที่ยว จ.กำแพงเพชร โทร. 055-714029 , 055-714817
ปฏิทินท่องเที่ยวนครสวรรค์ มกราคม 2567
ปฏิทินท่องเที่ยวนครสวรรค์ มกราคม 2567
1.กองเสบียงเฟสติวัล คิตตี้แลนด์ แดนมหัศจรรย์ 5-14 ม.ค.67 กองเสบียงฟาร์ม
2.ประเพณีก่อพระทรายข้าวเปลือก 13-14 ม.ค.67 วัดเขาล้อ อ.ท่าตะโก
3.Belief Fest 13 ม.ค.67 เขากะลา อ.พยุหะคีรี
4.บึงบอระเพ็ด Contest Festival 26-30 ม.ค.67 บึงบอระเพ็ด
งานแสดงบอลลูนนครสวรรค์ 26-30 มกราคม 2567
งานแสดงบอลลูนครั้งแรกของจังหวัดนครสวรรค์ 26-30 มกราคม 2567 ณ แหล่งท่องเที่ยวบึงบอระเพ็ด จังหวัดนครสวรรค์ ขึ้น & ชม บอลลูน หุ่นโคมไฟ ฟังดนตรี ลานแคมป์ปิ้ง ลานอาหาร & เครื่องดื่ม ชมอควาเรียม อุโมงค์ปลา จระเข้หวาดเสียว Cafe Fisica เรียนรู้จักรวาลวิทยา BIKE WEEK ประกวดร้องเพลง วงดนตรี COVER DANCE MISS QUEEN ฟรีทุกกิจกรรมตลอดงาน
ปฏิทินกิจกรรมเดือนมกราคม 2567 จังหวัดพิษณุโลก
ปฏิทินกิจกรรมเดือนมกราคม 2567 จังหวัดพิษณุโลก
ปฏิทินท่องเที่ยวสระบุรี มกราคม-กุมภาพันธ์-มีนาคม 2567
มกราคม 2567
งานต้นกล้าเกษตรแฟร์ วันที่ 5 - 15 ม.ค. 67
เทศกาลโคนมแห่งชาติ วันที่ 5-14 ม.ค. 67
งานเขาเขียว มิวสิคเฟสติวัล 2 วันที่ 12 ม.ค. 67
Saraburi Jazz Festival วันที่ 20-21 ม.ค. 67
Muuji Festival 2024 เทศกาลดนตรีแบบฉบับญี่ปุ่น วันที่ 27 ม.ค. 67
กุมภาพันธ์ 2567
งานวิ่งดูดนม OMEGA RUN 2024 วันที่ 3-4 ก.พ. 67 ณ ฟาร์มโคนมไทย-เดนมาร์ค อ.มวกเหล็ก
งานวิ่งโกรกอีดก มินิ-ฮาร์ฟ มาราธอน 2024 วันที่ 3-4 ก.พ. 67
เทศกาลขึ้นเขา ไหว้พระธาตุเชิงเขา วันที่ 9-25 ก.พ.67
งานตรุษจีนปากเพรียว วันที่ 9-11 ก.พ. 67
งานเทศกาลนมัสการ รอยพระพุทธบาท วันที่ 10-25 ก.พ. 67
มีนาคม 2567
Rotary Saraburi Charity Run#6 17 มี.ค.67
ปฏิทินท่องเที่ยวจังหวัดพระนครศรีอยุธยา มกราคม-มีนาคม ปี 2567
การแข่งขันตกปลาในอ่าวเมืองพัทยา 29-30 มกราคม 2567
เมืองพัทยากำหนดจัดการแข่งขันตกปลาในอ่าวเมืองพัทยา (PATTAYA FISHING GIMES 2024) ระหว่างวันที่ 29-30 มกราคม 2567 ณ ลานกีฬาอเนกประสงค์ หาดจอมเทียน เมืองพัทยา
การแข่งขันกีฬาทางน้ำเมืองพัทยา ประจําปี 2567 วันที่ 27-28 มกราคม 2567
เมืองพัทยากำหนดจัดการแข่งขันกีฬาทางน้ำเมืองพัทยา ประจําปี 2567 (SUP PATTAYA CHAMPIONSHIPS 2024) ระหว่างวันที่ 27-28 มกราคม 2567 ณ ลานกีฬาอเนกประสงค์ หาดจอมเทียน เมืองพัทยา
ย้อนวันวาน เที่ยวตลาดย้อนยุค ณ หมู่บ้านอนุรักษ์ควายไทย อ.ศรีประจันต์ จ.สุพรรณบุรี ตลอดเดือนมกราคม-กุมภาพันธ์ 2567
ททท. สำนักงานสุพรรณบุรี ร่วมกับหมู่บ้านอนุรักษ์ควายไทย จัดกิจกรรม “ย้อนวันวาน เที่ยวตลาดย้อนยุค” ณ หมู่บ้านอนุรักษ์ควายไทย อ.ศรีประจันต์ จ.สุพรรณบุรี ทุกวันเสาร์-อาทิตย์ ตลอดเดือนมกราคม-กุมภาพันธ์ 2567 (เริ่มวันที่ 13-14 มกราคม)ตั้งแต่เวลา 10.00 น.-20.00 น. พิเศษสำหรับนักท่องเที่ยวที่เข้าพักในช่วงวันจัดกิจกรรม(เสาร์-อาทิตย์) เพียงแสดงหลักฐานเข้าพักรับฟรีทันที คูปอง 50 บาท (จำกัด 50 สิทธิ์ | วัน) กิจกรรมน่าสนใจ • เที่ยวตลาดย้อนยุค • ชิมอาหารคาวหวาน • การแสดงดนตรีไทยจากน้อง ๆ นักเรียนในพื้นที่ • เช่าชุดย้อนวันวานกับมุมถ่ายภาพสุดเก๋ สไตล์มนต์รักลูกทุ่ง • ชมการแสดงควาย ที่หาชมได้ยากในปัจจุบัน • ประดับไฟ Light Up บ้านทรงไทย สอบถามข้อมูลเพิ่มเติม ททท.สำนักงานสุพรรณบุรี 035-525867
ปฏิทินท่องเที่ยวจังหวัดนครปฐม ประจำเดือน มกราคม 2567
ปฏิทินท่องเที่ยวประจวบคีรีขันธ์ เดือนมกราคม 2567
ปฏิทินท่องเที่ยว มกราคม 2567
กิจกรรมที่เที่ยวในเมืองพะเยา
• อุทยานการเรียนรู้พะเยา TK Park Phayao (หยุดทุกวันจันทร์)
• บริการรถไฟฟ้านำเที่ยวและ Free WiFi (ให้บริการทุกวัน)
• ศูนย์จำหน่ายสินค้าและผลิตภัณฑ์ชุมชนเทศบาลเมืองพะเยา (ใกล้กับสวนสมเด็จย่า ๙๐)
ตลาดนัด ของกิน ของใช้ ตลอดสัปดาห์
• วันจันทร์ และวันพฤหัสบดี (ช่วงเช้า) กาดต้นสัก ศาลากลางจังหวัดพะเยา
• วันอังคาร (ช่วงเย็น) กาดพาเยาว์คราฟ ณ ลานอเนกประสงค์เทศบาลเมืองพะเยา
• วันพุธ (ช่วงเย็น) กาดหล่ายต้า ณ ภูมินทร์ ซอย 2
• วันพุธ (ช่วงเย็น) กาด SMEs ริมกว๊านพะเยา
• วันศุกร์ – เสาร์ (ช่วงเย็น) กาดสุขใจฮิมกว๊าน ณ ลานอเนกประสงค์เทศบาลเมืองพะเยา
• วันเสาร์ – อาทิตย์ และวันหยุดนักขัตฤกษ์ (ช่วงเช้า) ระเบียงสุข ริมกว๊านพะเยา
• วันอาทิตย์ (ช่วงเย็น) หอการค้าแฟร์ ณ บริเวณศาลหลักเมืองจังหวัดพะเยา
กิจกรรม “วิถีศรัทธา ผ้าป่าทางน้ำ แม่น้ำแคว กาญจนบุรี” และ “ซุปตาร์ พาทำบุญ”
ททท.สำนักงานกาญจนบุรี ขอเชิญร่วมกิจกรรม “วิถีศรัทธา ผ้าป่าทางน้ำ แม่น้ำแคว กาญจนบุรี” และ “ซุปตาร์ พาทำบุญ” วันเสาร์ที่ 20 และวันอาทิตย์ที่ 21 มกราคม นี้ กิจกรรมดี ๆ เพื่อส่งเสริมการท่องเที่ยวเพื่อสังคม พร้อมทั้งระดมทุนทรัพย์จัดซื้ออุปกรณ์การแพทย์ และเป็นกองทุนไว้ดูแลผู้ป่วย ให้กับศูนย์สุขภาพพระสงฆ์ สมเด็จพระสังฆราชองค์ที่ 19 รพ.สต.บ้านวังด้ง อ.เมือง จ.กาญจนบุรี --
รายละเอียดกิจกรรมปฎิทินกิจกรรมกระบี่ มกราคม 2567
KRABI EVENT CALENDAR January 2024 มกราคม 2567
- 29 ธันวาคม 66- 7 มกราคม 67 งานปีใหม่และงานกาชาดจังหวัดกระบี่ บริเวณศาลากลางกระบี่ ไปร่วมลุ้นรับโชคใหญ่ จากร้านมัจฉากาชาดตลอดทั้ง 10 วัน 10 คืน ไปช็อปของขวัญผลิตภัณฑ์จากชุมชนและสินค้าราคาถูกจากทั่วประเทศ ไปสนุกสนานกับการแสดงศิลปวัฒนธรรมพื้นบ้าน และการแสดงของศิลปินชื่อดัง
- 20 มกราคม 67 International Run at Krabi 2024 21/10/5 km สวนสาธารณะธารา กระบี่
- 21 มกราคม 67 ปั่นเปิดฟ้า ท่องเที่ยวกระบี่ Andaman Cycling at Krabi สวนสาธารณะธารา กระบี่ ติดต่อ : มหาวิทยาลัยการกีฬาแห่งชาติ วิทยาเขตกระบี่ 075663638
- 22-30 มกราคม 67 กระบี่เกมส์ การแข่งขันกีฬานักเรียนนักศึกษา ครั้งที่ 43 ประจำปี 2567 สำนักงานการท่องเที่ยวและกีฬาจังหวัดกระบี่ - 075 663 246
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดสุรินทร์ เดือนมกราคม – มีนาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดสุรินทร์เดือนมกราคม – มีนาคม 2567
- 19-20 มกราคม 2567 SURIN WAGYU FESTIVAL ลานจอดรถโรบินสัน สุรินทร์
- 4-14 กุมภาพันธ์ 2567 งานศิลปวัฒนธรรมนานาชาติ มหาวิทยาลัยราชภัฏสุรินทร์
- 14 กุมภาพันธ์ 2567 งานแต่งงานและจดทะเบียนสมรสบนหลังช้าง ณ ศูนย์คชศึกษา บ้านตากลาง อำเภอท่าตูม
- 15-17 กุมภาพันธ์ 2567 นุ่งผ้าไหม ใส่ประเกือบ เรือมกันตรึม สนามหน้าที่ว่าการอำเภอเขวาสินรินทร์
- 16-25 กุมภาพันธ์ 2567 งานวันเกษตรและเทคโนโลยีอีสาน มหาวืยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์
- 13 มีนาคม 2567 เทศกาลงานวันช้างไทย หมู่บ้านช้าง บ้านตากลาง อำเภอท่าตูม
สอบถามข้อมูลเพิ่มเติม :
ททท. สำนักงานสุรินทร์ โทร. 044-514447 044-514448
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดศรีสะเกษ เดือนมกราคม – มีนาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดศรีสะเกษ เดือนมกราคม – มีนาคม 2567
- 26 - 4 มกราคม 2567 เทศกาลปีใหม่สี่เผ่าไทย ศรีสะเกษ บริเวณสนามหญ้าศาลากลาง อ.เมืองศรีสะเกษ จ.ศรีสะเกษ
- 18 - 22 มกราคม 2567 งานเทศกาลหอมแดงกระเทียมดี ที่ยางชุมน้อ สนามหน้าที่ว่าการอำเภอยางชุมน้อย จ.ศรีสะเกษ
- 2 - 6 กุมภาพันธ์ 2567 งานประเพณีบุญข้าวจี้ มหัศจรรย์ของดี โพธิ์ศรีสุวรรณ สนามหน้าที่ว่าการอำเภอโพธิ์ศรีสุวรรณ จ.ศรีสะเกษ
- 11 - 12 กุมภาพันธ์ 2567 งานประเพณี "หฺวัวบุญเบิกฟ้า ขึ้น 3 ค่ำ มหัศจรรย์ เดือน 3":ปราสาทปรางค์กู่ ต.กู่ อ.ปรางค์กู่ จ.ศรีสะเกษ
- 19 - 23 กุมภาพันธ์ 2567 งานประเพณีบุญเดือน 3 ประจำปี 2567 วัดสระกำแพงใหญ่ ต.สระกำแพงใหญ่ อ.อุทุมพรพิสัยจ.ศรีสะเกษ
- 6 - 10 มีนาคม 2567 เทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทย ศรีสะเกษ สวนสมเด็จพระศรีนครินทร์ศรีสะเกษ อ.เมืองศรีสะเกษ จ.ศรีสะเกษ
ปฏิทินกิจกรรมในจังหวัดภูเก็ต ประจำเดือน มกราคม 2567
ปฏิทินกิจกรรมในจังหวัดภูเก็ต ประจำเดือน มกราคม 2567
หรอยหนัดหยัดได้ กินดีย์ภูเก็จ วันที่ 19-21 มกราคม 2567
องค์การบริหารส่วนจังหวัดภูเก็ต ขอเชิญร่วมงาน “หรอยหนัดหยัดได้ “กินดีย์ภูเก็จ” วันที่ 19-21 มกราคม 2567 ณ สวนเฉลิมพระเกียรติ ร.10 ปลายแหลมสะพานหิน
ดูหนังกลางแปลงฟรี ลานเครื่องบิน ศูนย์การค้าเทอร์มินอล21
ดูหนังกลางแปลงฟรี! ณ ลานเครื่องบิน ศูนย์การค้าเทอร์มินอล21 พัทยา ส่วนหนึ่งของงานเทศกาล FOOD FUN FEST #RUNWAYCAMPING วันอาทิตย์ที่ 28 ม.ค. 2567 •เวลา 18.00 น. ชมหนังกลางแปลงเรื่อง Aladin •เวลา 20.00 น. ชมหนังกลางแปลงเรื่อง Big Hero
Rayong Walking Street งานแรกของปี 2567 (24-28 ม.ค. 2567)
Rayong Walking Street งานแรกของปี 2567 วันที่ 24-28 ม.ค. 2567 (14.00 - 22.00 น.) สนามกีฬากลางจังหวัดระยอง ❕ ร้านอาหาร Street Food มากกว่า100ร้านค้า หลากหลายเมนูให้ได้ลองเลือกชิมพร้อมฟังดนตรีสดชิลๆและขุดเช็คอินถ่ายรูปสวยๆเป็นที่ระลึก
สตรีทฟู๊ดอาหารอร่อยบ้านฉางบ้านฉัน 18-22 มกราคม 2567
สตรีทฟู๊ดอาหารอร่อยบ้านฉางบ้านฉัน ครั้งที่ 1 วันที่ 18-22 มกราคม 2567 เวลา 16.00 - 24.00 น. ณ ลานจอดรถศูนย์การค้าโรบินสันไลฟ์สไตล์ บ้านฉาง ที่สาย Food Lover พลาดไม่ได้เด็ดขาด จัดเต็มร้านอาหาร เครื่องดื่ม ขนมหวาน มาแบบจัดเต็มตลอด 5 วัน มีดนตรีสดให้ได้นั่งฟังชิวๆ พิเศษกับกิจกรรม - แสดงก๊อปปี้โชว์ เสกโลโซ ติ๊กชีโร่ อ่างเถิดเทิง และนางแมวยั่วสวาท - การแสดงกายกรรมจากรายการชิงร้อย ชิงล้าน และรายการเกมพันหน้า - พบกับร้านค้าแบกะดิน ขายของมือสอง
งาน "มัจฉา หาคู่ ครั้งที่2 Rayong Fishing Cup 2024" (14 มกราคม 2567)
งาน "มัจฉา หาคู่ ครั้งที่2 Rayong Fishing Cup 2024" โครงการจัดการแข่งขันกีฬาตกปลาทะเลระยอง วันที่ 14 มกราคม 2567 บริเวณหาดแหลมรุ่งเรือง ชิม ช้อป เที่ยว อาหารและสินค้าโอท็อปจากกลุ่มประมงพื้นบ้านแหลมรุ่งเรือง และแข่งขันตกปลาชิงเงินรางวัลรวมสูงสุด 120,000 บาท พร้อมถ้วยรางวัลผู้ว่าราชการจังหวัดระยอง ร่วมจัดโดย เทศบาลนครระยอง กรมประมง ททท.สำนักงานระยองและบริษัท SPRC
วันเด็กเที่ยวตลาดอยู่สบาย พนมสารคาม
ตลาดอยู่สบาย วันอาทิตย์ที่ 14 มกราคม 2567
พบกันครั้งแรกในศักราชใหม่ และร่วมฉลองวันแด็ก
พาหนูน้อยมาจับฉลากรับของขวัญกันนะคะ
เมนูขนมและอาหารอร่อยยังมีมาให้ช้อปกันเช่นเคย
สนุกสานกับงานศิลปะมัดย้อมผ้า และป้อนนมแพะสุดคิวท์
พืชผัก ผลไม้จากสวนหลังบ้าน ก็ยังแสนอร่อยและปลอดภัย
ตลาดเราไม่ใหญ่โต
เน้นของอร่อยมีคุณภาพ ราคาไม่แพง
มุ่งส่งมอบความสุข อิ่มท้อง อิ่มใจ
สร้างรอยยิ้มเพิ่มพลังบวกให้กันและกันนะคะ
ตลาดอยู่สบาย วันอาทิตย์
ริมถนนหลวงสาย 331 ตรงข้ามปั๊มน้ำมันพีที
ห่างจากสี่แยกนาน้อยเพียง 300 เมตร
ณ ศูนย์เรียนรู้เศรษฐกิจพอเพียงด้านวนเกษตร
(ร้านอยู่สวน อยู่ป่า บ้านดิน) ริมถนนหลวงสาย 331
สี่แยกนาน้อย ต.เกาะขนุน อ.พนมสารคาม จ.ฉะเชิงเทรา
โทร. 062 4262565 Line: wanakaset
ปฏิทินท่องเที่ยวสมุทรสาคร เดือนมกราคม-กุมภาพันธ์ 2567
ปฏิทินท่องเที่ยวจังหวัดสมุทรสงคราม และสมุทรสาคร ประจำเดือนมกราคม-กุมภาพันธ์ 2567
ปฏิทินท่องเที่ยวจังหวัดสมุทรสงคราม มกราคม-กุมภาพันธ์ 2567
ปฏิทินท่องเที่ยวจังหวัดสมุทรสงคราม และสมุทรสาคร ประจำเดือนมกราคม-กุมภาพันธ์ 2567
ปฏิทินกิจกรรมสงขลา หาดใหญ่ มกราคม-มีนาคม 2567
กิจกรรม Work Shop แฮมโรลทอดกรอบ@อุทยานการเรียนรู้ยะลา (TKpark Yala)
กิจกรรม Work Shop แฮมโรลทอดกรอบ สำหรับน้อง ๆ หนู ๆ ในวันอาทิตย์ ที่ 28 มกราคม 2567 เวลา14.00-15.30 น. เข้าร่วมกิจกรรมฟรี (ให้สิทธิ์น้องๆ ที่มีบัตรสมาชิกก่อน) ลงทะเบียนหน้างาน รับ 20 คนแรกเท่านั้น !!
ปฏิทินกิจกรรม 3 จังหวัดใต้ นราธิวาส ปัตตานี ยะลา มกราคม 2567
กิจกรรมท่องเที่ยวของจังหวัดชุมพร มกราคม 2567
Surat Music Festival #2 LIFESTYLE 13 มกราคม 2567
Surat Music Festival #2 LIFESTYLE วันเสาร์ที่ 13 มกราคม 2567 ประตูเปิดเวลา 15:30 น คอนเสิร์ตเริ่มเวลา 18:00 - 00.00น. ณ ลานข้างห้างสหไทย การ์เด้น พลาซ่า จ.สุราษฎร์ธานี พบศิลปิน วง Slotmachine วง Safeplanet ศิลปินหญิง violette wautier และ 2วง ดนตรีสุดมันส์ ในจังหวัดสุราษฎร์ธานี วง คณะหลานป้าโจ๊ก วง Ziw(สิว) และ กิจกรรมความสนุกภายในงานมากมาย - ดนตรีบำบัด จากBuhlan Mandala - กิจกรรมBody Paint - กิจกรรม หุ่นนิ่ง Living Statue - กิจกรรม Canival Magic Show - กิจกรรม บอลลูนสีสัน
งาน ปลายฝนต้นหนาว สุราษฎร์ธานี วันที่ 27-30 มกราคม 2567
งาน “ปลายฝนต้นหนาว” สุราษฎร์ธานี วันที่ 27-30 มกราคม 2567 ณ บริเวณจุดชมวิวเขื่อนรัชชประภา และลานอเนกประสงค์หน้าเทศบาลตำบลบ้านเชี่ยวหลาน อ.บ้านตาขุน จ.สุราษฎร์ธานี
การแข่งขันรถจักรยานยนต์แอนดูโร่ครอส Bridgestone Silver Rock 3-2-1 ครั้งที่ 1
การแข่งขันรถจักรยานยนต์แอนดูโร่ครอส “Bridgestone Silver Rock 3-2-1 ครั้งที่ 1 ระหว่างวันที่ 20-21 มกราคม 2567 ณ สนาม Silver Rock Bike Park (ซอยวัดถ้ำพญานาค หลังมหาวิทยาลัยราชภัฏเลย) ตำบลเมือง อำเภอเมือง จังหวัดเลย
ปฏิทินกิจกรรม เพชรบูรณ์ เดือนมกราคม 2567
กิจกรรมจ.บุรีรัมย์ เดือนมกราคม 2567
วันที่ 23 ธันวาคม 2566 -1 มกราคม 2567
“Yippee New year 2024”
ณ บุรีรัมย์คาสเซิล
สอบถามเพิ่มเติมโทร : 098 103 5331
(บุรีรัมย์คาสเซิล)
วันที่ 30 ธันวาคม 2566 -1 มกราคม 2567
“งานรับอรุณเบิกฟ้า วันปีใหม่ 2567”
ณ อุทยานประวัติศาสตร์พนมรุ้ง
สอบถามเพิ่มเติมโทร : 044 666 251
(อุทยานประวัติศาสตร์พนมรุ้ง)
วันที่ 30 ธันวาคม 2566 -1 มกราคม 2567
“งานบุรีรัมย์ ราตรี แสงสี พนมรุ้ง - วนัมรุง LIGHT UP”
ณ อุทยานประวัติศาสตร์พนมรุ้ง
สอบถามเพิ่มเติมโทร : 044 666 251
(อุทยานประวัติศาสตร์พนมรุ้ง)
วันที่ 30 ธันวาคม 2566 -1 ธันวาคม 2567
“งานประเพณีเทศกาล ข้าวมะลิหอม
ปลาจ่อมกุ้ง ชมทุ่งนก กาชาดประโคนชัย ประจำปี 2566”
ณ บริเวณหน้าสำนักงานเทศบาล ตำบลประโคนชัย จังหวัดบุรีรัมย์
สอบถามเพิ่มเติมโทร : 044 671 368 (เทศบาลตำบลประโคนชัย)
วันที่ 12 มกราคม 2567
“งานบุญคูณลาน (บุญกุ้มข้าวใหญ่)”
ณ วัดตาไก้พลวง อำเภอนางรอง จังหวัดบุรีรัมย์
สอบถามเพิ่มเติมโทร : 081 548 8256
(วัดตาไก้พลวง)
วันที่ 13 มกราคม 2567
"วันเด็กแห่งชาติ 2567"
ณ ปราสาทเมืองต่ำ
สอบถามเพิ่มเติมโทร : 044 666 251
(อุทยานประวัติศาสตร์พนมรุ้ง)
วันที่ 18-20 มกราคม 2567
“งานประเพณีบุญหัวมันใหญ่”
ณ บ้านปลื้มพัฒนา อำเภอปะคำ จังหวัดบุรีรัมย์
สอบถามเพิ่มเติมโทร : 092-2926873
(ประธานฝ่ายประชาสัมพันธ์การจัดงาน)
วันที่ 27 มกราคม 2567
“BURIRAM MARATHON 2024”
ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต
สอบถามเพิ่มเติมโทร : 062 235 6768
(สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต)
ตลอดเดือน พฤศจิกายน 2566 - มกราคม 2567
“ชมนกกระเรียนพันธุ์ไทย และ ฤดูนกอพยพ
หนีหนาวจากจีน-ไซบีเรีย-ญี่ปุ่น”
ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำและนกกระเรียนพันธุ์ไทย
สอบถามเพิ่มเติม: ศูนย์เรียนรู้พื้นที่ชุ่มน้ำและนกกระเรียนพันธุ์ไทย
โทร : 081 760 5339
ปฎิทินเที่ยวจ.นนทบุรี ธันวาคม 2566 - มกราคม 2567
Pet market by หมาติดเที่ยว ×ssktmmee @emsphere 24-31 มกราคม 2024
ครั้งแรกกับ emsphere เปิดบ้านต้อนรับน้องๆสี่ขา ให้เข้าไปเช็คอินกันครั้งแรกกับงาน Pet market by หมาติดเที่ยว ×ssktmmee พร้อมกับกิจกรรมสนุกๆตลอดงานทั้ง 8 วัน วันที่ 24-31 มกราคม 2024 เวลส 10.00-21.00 ณ Emtower,Emyard สนาม playground ในร่ม (ฟรี)
petmarket by หมาติดเที่ยว @เซ็นทรัลอีสวิลล์ 19-21 มกราคม 2567
petmarket by หมาติดเที่ยว วันที่ 19-21 มกราคม 2567 เวลา 10.00-22.00 ตรงบริเวณ ตรอกหมาใหญ่ ใกล้บ่อทราย ห้างเซ็นทรัลอีสวิลล์ พิเศษในงาน โรงพยาบาลสัตว์แอทโมส : Utmost Pet Hospital ตรวจสุขภาพ ฟรี ถ่ายพยาธิ ฟรียาป้องกันเห็บหมัดลด 15%
PetMarket โดย หมาติดเที่ยว @SC Plaza สายใต้ใหม่ 11-14 มกราคม 2567
PetMarket โดย หมาติดเที่ยว วันที่ 11-14 มค เวลา 10.30-19.00 บริเวณ SC Plaza สายใต้ใหม่ ชั้น 1 โซนกิจกรรม พบกับความน่ารักของน้องๆ สี่ขา และกิจกรรม เกมส์ บูธร้านค้ามากมาย พร้อมเอาใจคุณหนูๆ เพลิดเพลินกันในโซนป้อนอาหาร มีบริการตรวจสุขภาพ และฉีดวัคซีนน้องๆ จาก โรงพยาบาลสัตว์ตลิ่งชัน มาให้บริการฉีดวัคซีนพิษสุนัขบ้าฟรี ผลิตภัณฑ์ยาราคาพิเศษ
Giant Dog Play Out กองทัพหมายักษ์บุกศรีราชา 19-22 มกราคม 2567
Giant Dog Play Out กองทัพหมายักษ์บุกศรีราชา 19-22 มกราคม 2567 ลานกิจกรรม ชั้น G เซ็นทรัล ศรีราชา ชวนคุณมาใกล้ชิดน้องหมาสายพันธ์ยักษ์ใหญ่ 4 สายพันธุ์หาชมยาก • Cane Corso (เคน คอร์โซ่) • Neapolitan Mastiff (นโปเลียน มาสทิฟฟ์) • Boerboe (บัวโบว์) • Ban dog (แบนด๊อก) ภายในงานพบกับกิจกรรมสำหรับคนรักสุนัขมากมายย Giant Dog Play Out สนามวิ่งเล่นน้องหมาพร้อมจุดถ่ายภาพสุดน่ารัก Dog Café คาเฟ่น้องหมาปอมเมอเรเนียนกว่า 50 ตัว Dog Talent การแสดงโชว์ความสามารถของสุนัขแสนรู้ Giant Dog ID Card ทำบัตรประชาชนน้องหมา
ประกวดสุนัข ชิงถ้วยพระราชทาน งานเกษตรสุรนารี 67
ประกวดสุนัข ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ในงานเกษตรสุรนารี 67 ณ มหาวิทยาลัยเทคโนโลยีสุรนารี นคราชสีมา
วันเสาร์ที่ 13 ม.ค 67 (วันเด็กแห่งชาติ) การประกวดสุนัขแฟนตาซี (ธีมอิสระ) -การแสดงสุนัขโกลเด้นแสนรู้ จากเพจสามข้าวแฟ่มิลี่ และการประกวดสุนัขพิทบลูและบลูลี่ ประเภทสวยงาม
วันอาทิตย์ที่ 14 ม.ค 67 การประกวดสุนัขลากนำ้หนักชิงแชมป์แห่งประเทศไทย
สอบถามรายละเอียดเพิ่มเติมได้ที่ 087-246-0202
Trang Food FestiWOW : เบิกฟ้าหาดสำราญ อากาศดี ซีฟู้ดเด็ด 11-14 มกราคม 2567
ชวนเที่ยวตรัง กับ Trang Food FestiWOW : เบิกฟ้าหาดสำราญ อากาศดี ซีฟู้ดเด็ด อาหารอร่อย จุดเช็คอินเก๋ๆมาเที่ยว มาชม มาชิม มาช๊อป ตั้งแต่วันที่ 11-14 มกราคม 2567 ณ บริเวณสวนสน 100 ปี หาดสำราญ อำเภอหาดสำราญ จังหวัดตรังงาน Palm Street Art ถนนต้นตาล 26-28 ม.ค. 67
งาน Palm Street Art ถนนต้นตาล ครั้งที่ 3 ตอน เด็กเลี้ยงวัว 26-28 ม.ค. 67 ต.ไร่สะท้อน บ้านลาด เพชรบุรี
++ กิจกรรมปี 2567 ++
เสาร์ที่ 13 มค 67 สามพราน นครปฐม
วันอาทิตย์ที่ 14 มค 67อยุธยา
วันเสาร์ที่ 27 มค 67 นครนายก
วันอาทิตย์ที่ 28 มค 67 คลอง 9 ปทุมธานี
วันเสาร์ที่ 3 กพ 67 ท่าพระจันทร์ กทม
วันอาทิตย์ที่ 4 กพ 67 สองพี่น้อง สุพรรณบุรี
วันเสาร์ที่ 17 กพ 67 สิงห์บุรี
วันอาทิตย์ที่ 18 กพ 67 ศรีประจันต์ สุพรรณบุรี
วันที่ 25 -26 กพ 67 แถวสะพานพุทธ กทม
วันที่ 9-10 มีค 67 เซ็นทรัลลาดพร้าว
วันเสาร์ที่ 16 มีนาคม 67 สระบุรี
วันอาทิตย์ที่ 17 มีนาคม 67 ปทุมธานี
วันเสาร์ที่ 30 มีนาคม 67 ฉะเชิงเทรา
วันอาทิตย์ที่ 31 มีนาคม 67 เจริญนคร กทม
วันจันทร์ที่ 8 เม.ย. 67 เวลา 10.00-12.00 น. วัดอัมพวัน อ. เมือง จ.ตาก
วันเสาร์ที่ 20 เม.ย. 67 เวลา 13.00-15.00 น. วัด ณ ต.บ้านเกาะ อ.เมือง จ. อยุธยา
วันอาทิตย์ที่ 21 เม.ย. 67 เวลา 13.00-15.00 น. วัด ณ ต.สามชุก อ.สามชุก จ.สุพรรณบุรี
วันเสาร์ที่ 27 เม.ย. 2567 เวลา 13.00-15.00 น. วัด ณ จ.สระบุรี
วันอาทิตย์ที่ 28 เม.ย. 67 เวลา 13.00-15.00 น. วัด ณ ต.มวกเหล็ก อ.มวกเหล็ก จ.สระบุรีโรงพยาบาลสุราษฎร์ธานี รับบริจาคอวัยวะ
โรงพยาบาลสุราษฎร์ธานี รายงานการรับบริจาคอวัยวะ ดังนี้
27 เมษายน มอบพวงหรีดแก่ครอบครัวจุ้ยทองคำ ผู้เสียชีวิตบริจาคดวงตา 2 ข้าง
15 สิงหาคม มอบพวงหรีด แก่ครอบครัวคุณจิณณวัตร ยาหอม ผู้บริจาคดวงตา
ตะลอนเที่ยวชมหนองคาย ด้วยสามล้อเรืองแสง
การท่องเที่ยว จ.หนองคาย ชวนนักท่องเที่ยวผู้มาเยือนหนองคาย ลองนั่งรถสามล้อเรืองแสง เที่ยวชมเมืองหนองคาย รถจอดบริการรอรับนักท่องเที่ยว ที่ด้านหน้าลานน้ำพุพญานาค(หน้าอนุสาวรีย์ปราบฮ่อ) มีบริการทุกวัน เวลา 18.30-21.00 น. ค่าบริการท่านละ 100 บาท เหมารอบเที่ยวละ400 บาท(ไม่เกิน4คน)
จุดแวะ ลานน้ำพุพญานาค วัดโพธิ์ชัย พระธาตุหล้าหนอง พญานาคคู่ วัดลำดวน จวนผู้ว่าราชการจังหวัดหนองคายหลังเดิม
ติดต่อสอบถามเพิ่มเติม :
- สมาคมส่งเสริมการท่องเที่ยว จ.หนองคาย โทร. 091-0606781
- สภาอุตสาหกรรมการท่องเที่ยว จ.หนองคาย โทร. 089-4184393
- ศูนย์บริการข้อมูลข่าวสารการท่องเที่ยว จ.หนองคาย โทร. 042-421326
มหกรรมศิลปะร่วมสมัยนานาชาติ Thailand Biennale, Chiang Rai 2023 (9 ธันวาคม 2566 - 30 เมษายน 2567)
มหกรรมศิลปะร่วมสมัยนานาชาติ Thailand Biennale, Chiang Rai 2023 - 9 ธันวาคม 2566 - 30 เมษายน 2567 ณ จังหวัดเชียงราย แนวคิดหลักของเบียนนาเล่ครั้งนี้ คือ "The Open World" หรือ "เปิดโลก" การจัดเบียนนาเล่ครั้งนี้ ถือเป็นอีกหนึ่งความร่วมมือจากทุกภาคส่วนที่จะช่วยกันขับเคลื่อนเมืองเชียงรายให้มีสีสัน มีชีวิตชีวาไปด้วยผลงานศิลปะหลากหลายสาขา ในงานปีนี้จะได้พบกับ 20 ศิลปินกลุ่มแรกของงาน Thailand Biennale, Chiang Rai 2023 ประกอบด้วยศิลปินชาวไทยและต่างประเทศจากทั่วโลก ติดตามรายละเอียดและข้อมูลเพิ่มเติมได้ที่
www.thailandbiennale.org เพจ
facebook.com/thailandbiennale และสายด่วนวัฒนธรรม 1765
ปฏิทินท่องเที่ยวช่วงเดือน มกราคม- กุมภาพันธ์ 2567
งาน Charming Chiang Mai Flower Festival มนต์เสน่ห์เชียงใหม่ เมืองดอกไม้งาม 15 ธันวาคม 2566 - 21 มกราคม 2567 LINK
เทศกาลแห่งดอกไม้ที่บานสะพรั่งสวยงาม Charming Chiang Mai Flower Festival “มนต์เสน่ห์เชียงใหม่ เมืองดอกไม้งาม” 15 ธันวาคม 2566 - 21 มกราคม 2567 ตั้งแต่เวลา 08.00 - 23.00 น. ณ สวนเฉลิมพระเกียรติ 82 พรรษา บริเวณหลังศาลากลางจังหวัดเชียงใหม่ จัดเต็มทั้ง ดอกไม้ประดับนับล้านดอก ที่พร้อมผลิบานตลอดทั้งปีใหม่นี้ ไฟประดับนับล้านดวง พร้อมมุมถ่ายรูปลงโซเชียลเพียบ การแสดงน้ำพุประกอบ แสง สี เสียง สุดตระการตา จุใจ 4 รอบต่อวัน 19.00 น., 20.00 น., 21.00 น. และ 22.00 น. Light of Glory การแสดงผสมผสานศิลปะล้านนาและความเป็นสากล ที่พร้อมอวดความงามสู่สายตาโลก 2 รอบการแสดงต่อวัน 19.30 น. และ 21.30 น.
เทศกาลชมสวน (Flora Festival) แอ่วสุขใจ..I wanna be (e) 1 ธันวาคม 2566 – 29 กุมภาพันธ์ 2567
เทศกาลชมสวน (Flora Festival) นับเป็นเทศกาลยิ่งใหญ่ประจำปีที่นักท่องเที่ยวต่างให้การรอคอยที่จะได้ชื่นชมความงามของไม้ดอกเมืองหนาวนานาพรรณจากเกษตรกรบนพื้นที่สูง สำหรับเทศกาลชมสวนปีนี้จัดขึ้นภายใต้แนวคิด “แอ่วสุขใจ..I wanna be (e)” ระหว่างวันที่ 1 ธันวาคม 2566 – 29 กุมภาพันธ์ 2567 เวลา 08.00 – 18.00 น. ณ อุทยานหลวงราชพฤกษ์ จังหวัดเชียงใหม่ เพื่อเป็นการส่งเสริมการท่องเที่ยวรักษ์สิ่งแวดล้อมอย่างยั่งยืน
31 ธันวาคม 2566 รพ.เชียงราย ประชานุเคราะห์ รับบริจาคอวัยวะและดวงตา
วันอาทิตย์ที่
31 ธันวาคม 2566 เวลา 15.15 น. คุณเพ็ญจันทร์ กุลสิทธิ และคุณจิราภรณ์ สุพลมาตย์ เป็นตัวแทนผู้บริหารโรงพยาบาลเชียงรายประชานุเคราะห์ มอบพวงหรีด ให้กับญาติผู้บริจาคอวัยวะและดวงตา ให้กับสภากาชาดไทย อวัยวะที่ได้รับบริจาคในครั้งนี้ ได้แก่ ไต จำนวน 2 ข้าง ดวงตา จำนวน 2 ดวง และ ตับ ทั้งนี้ เพื่อนำไปปลูกถ่ายให้กับผู้ที่รอคอยการรักษา ด้วยการปลูกถ่ายอวัยวะ โดยการตัดสินใจบริจาคอวัยวะและดวงตาของมารดาผู้ป่วยในครั้งนี้ ถือเป็นการทำบุญครั้งยิ่งใหญ่ให้กับผู้ป่วยในวาระสุดท้ายของชีวิต ขอกุศลผลบุญในครั้งนี้ ส่งผลให้ดวงวิญาณของผู้บริจาค ไปอยู่ในภพภูมิที่ดี ครอบครัวพบแต่ความสุขความเจริญ ยิ่งๆ ขึ้นไป
12 ธันวาคม 2566 รพ.เชียงราย ประชานุเคราะห์ รับบริจาคอวัยวะและดวงตา
วันอังคารที่ 12 ธันวาคม 2566 เวลา 14.00 น. คุณสว่างจิตต์ จันทร, คุณสุวิมล ขัตติยะ และ คุณมยุรฉัตร ด้วงนคร เป็นตัวแทนผู้บริหารโรงพยาบาลเชียงรายประชานุเคราะห์ มอบพวงหรีด ให้กับญาติผู้บริจาคอวัยวะและดวงตา ให้กับสภากาชาดไทย อวัยวะที่ได้รับบริจาคในครั้งนี้ ได้แก่ ไต จำนวน 2 ข้าง ดวงตา จำนวน 2 ดวง และ ลิ้นหัวใจ ทั้งนี้ เพื่อนำไปปลูกถ่ายให้กับผู้ที่รอคอยการรักษา ด้วยการปลูกถ่ายอวัยวะ การตัดสินใจบริจาคอวัยวะและดวงตาของมารดาผู้ป่วยในครั้งนี้ ถือเป็นการทำบุญครั้งยิ่งใหญ่ให้กับผู้ป่วยในวาระสุดท้ายของชีวิต ขอกุศลผลบุญในครั้งนี้ ส่งผลให้ดวงวิญาณของผู้บริจาค ไปอยู่ในภพภูมิที่ดี ครอบครัวพบแต่ความสุขความเจริญ ยิ่งๆ ขึ้นไป
Flora Exhibition Hall ชมสวนทิวลิปและไฮเดรนเยีย อาคารนิทรรศน์พรรณพฤกษา
Flora Exhibition Hall อาคารนิทรรศน์พรรณพฤกษา [
แผนที่] ชมสวนทิวลิปและไฮเดรนเยีย สุดอลังที่บานพร้อมกันกว่า 30,000 ดอก เปิดให้เข้าชมวันจันทร์-วันเสาร์ ตั้งแต่เวลา 09.30-16.30 น. (ประตูปิด 16.00) ปิดวันอาทิตย์ และวันหยุดนักขัตฤกษ์ เข้าเยี่ยมชมฟรีไม่มีค่าใช้จ่าย (กรุ๊ปทัวร์และบุคคลที่ต้องการถ่ายรูปเชิงพาณิชย์กรุณาติดต่อแอดมินก่อนนะคะ). สอบถามโทร 038978400
งานฤดูหนาว นางสาวเชียงใหม่ และงาน OTOP ของดีเมืองเชียงใหม่ ประจำปี 2567 (3-17 มกราคม 2567)
งานฤดูหนาว นางสาวเชียงใหม่ และงาน OTOP ของดีเมืองเชียงใหม่ ประจำปี 2567 พร้อมเปิดให้ประชาชนเข้างานฟรีและเที่ยวงานกันอย่างจุใจตลอด 15 วันเต็ม ตั้งแต่ 3 - 17 มกราคม 2567 เวทีกลางภายในงานฤดูหนาวฯ บริเวณด้านหลังศาลากลางจังหวัดเชียงใหม่ เพื่อเป็นการส่งเสริมการท่องเที่ยวในช่วงส่งท้ายปีเก่า ต้อนรับปีใหม่ และเป็นการกระตุ้นเศรษฐกิจในพื้นที่ ภายในงานมีกิจกรรมที่น่าสนใจมากมาย อาทิ การแสดงนิทรรศการของส่วนราชการและหน่วยงานต่างๆ การจัดการประกวดนางสาวเชียงใหม่ การออกสลากกาชาด ตลอดจนการออกร้านค้ากาชาด และผลิตภัณฑ์ชุมชน หนึ่งตำบล หนึ่งผลิตภัณฑ์ (OTOP) สินค้าตลาดประชารัฐ และการออกร้านจำหน่ายสินค้า เพื่อกระตุ้นเศรษฐกิจ และการท่องเที่ยวภายในจังหวัดเชียงใหม่ รวมถึงมีการ อีกมากมายแสดงมหรสพอีกมากมาย โดยเปิดโอกาสให้พี่น้องประชาชนและผู้เข้าเที่ยวชมงาน ได้ร่วมสนุกสนานเพลิดเพลินไปกับกิจกรรมที่จัดขึ้นตลอดทั้ง 15 วันเต็ม
งานแผ่นดินสมเด็จพระนเรศวรมหาราชพิษณุโลก ประจำปี 2567 (6-20 มกราคม 2567)
งานแผ่นดินสมเด็จพระนเรศวรมหาราชพิษณุโลก ประจำปี 2567 วันที่ 6-20 มกราคม 2567 ณ บริเวณหน้าศาลากลางจังหวัดพิษณุโลกและบริเวณพระราชวังจันทน์ งานแผ่นดินสมเด็จพระนเรศวรมหาราช ประจำปี 2567 เหล่ากาชาดจังหวัดพร้อมด้วยจังหวัดพิษณุโลกและหน่วยงานทั้งภาครัฐ ภาคเอกชน ร่วมกันจัดขึ้นเพื่อเป็นการเทิดพระเกียรติและเผยแพร่พระเกียรติคุณของสมเด็จพระนเรศวรมหาราช อีกทั้งเพื่อส่งเสริมการท่องเที่ยว ส่งเสริมผลิตภัณฑ์ชุมชน OTOP และหารายได้ไว้ใช้จ่ายในกิจการสาธารณะประโยชน์และสาธารณกุศล
Coffee IN FARM สระแก้ว ครั้งที่ 1 วันที่ 6-7 มกราคม 2567
Coffee IN FARM สระแก้ว ครั้งที่ 1 วันที่ 6 - 7 มกราคม 2567 ณ S.K. Country Farm จ.สระแก้ว พบกับ - ออกร้านสุดยอดกาแฟสระแก้ว Barista S.K - การแสดงดนตรีในฟาร์ม - โคขุนไทยวากิว - อาหาร & เครื่องดื่ม S.K. Country Farm สระแก้ว Tel. 098-268-4076
AMAZING CHIANG RAI CAFE HOPPING เที่ยวคาเฟ่ลุ้นรับรางวัลใหญ่ทุกเดือน (8 มกราคม – 31 มีนาคม 2567)
ททท. สำนักงานเชียงราย จัดกิจกรรม AMAZING CHIANG RAI CAFE HOPPING เที่ยวคาเฟ่ลุ้นรับรางวัลใหญ่ทุกเดือน ตั้งแต่ 8 มกราคม – 31 มีนาคม 2567 นี้ ✅ เพียงใช้จ่ายในร้านคาเฟ่ที่ร่วมกิจกรรมครบ 100 บาท รับแสตมป์ 1 ดวง สะสมครบ 3 ดวง ลุ้นรับรางวัลใหญ่ทันทีทุกเดือน ติดตามรายละเอียดกิจกรรมได้ที่
cafehopping หรือสอบถามข้อมูลเพิ่มเติมได้ที่ ททท. สำนักงานเชียงราย 053-717433 หรือ 053-744674 053-744675
กิจกรรมชุมชน นา ดอน เล เฟสติวัล (Na Don Lay Festival) 9-10 มกราคม 2567
กิจกรรมชุมชน “นา ดอน เล เฟสติวัล (Na Don Lay Festival) “ จัดโดยชุมชนบ้านร่าหมาด - ขุนสมุทร เชื่อมโยงการท่องเที่ยวชุมชนอำเภอเกาะลันตา โดยกิจกรรมกำหนดจัด 2 วัน ระหว่างวันที่ 9-10 มกราคม 2567 ณ อาคารศูนย์การเรียนรู้ท่าเรือบ้านขุนสมุทร หมู่ที่ 10 ตำบลเกาะกลาง อำเภอเกาะลันตา จังหวัดกระบี่
ภายในงาน “นา ดอน เล เฟสติวัล “ครั้งที่ 1 มีการออกร้านและการละเล่นของชุมชน เที่ยวชมของดีวิถีชุมชน อาทิ กาแฟทำมือโบราณ ซึ่งเป็นภูมิปัญญาการทำกาแฟโบราณนั้นเป็นแบบดั้งเดิม ไม่มีเครื่องทุ่นแรงที่เป็น เครื่องจักรเข้ามาเกี่ยวข้องในกระบวนการผลิต มีการคั่วกาแฟโดยใช้ไม้ฟืนแทนแก๊ส การใช้น้ำตาลอ้อยแทนน้ำตาลทราย นอกจากนี้ยังมี ขนมพื้นถิ่น ผลิตภัณฑ์จักสานเตยปาหนัน แหล่งอนุรักษ์ทุ่งทะเล การเสวนาการท่องเที่ยว การแข่งขันเรือแจวพื้นบ้าน เป็นต้น
นักท่องเที่ยวที่สนใจสินค้าชุมชนหรือบริษัทนำเที่ยวที่ต้องการนำนักท่องเที่ยวทั้งคนไทยและคนต่างชาติได้ไปสัมผัสงานที่แสดงออกถึงแก่นแท้ของวิถีชีวิตชุมชนของคนบริเวณเกาะกลาง สามารถแนะนำให้นักท่องเที่ยวเดินทางเข้าไปเยี่ยมชมกิจกรรมได้ตลอดทั้งวัน สำหรับในวันที่ 10 มกราคม 2567 มีกิจกรรมแข่งขันเรือแจวพื้นบ้าน ขนาดเรือ 9 ตัวกง ตั้งแต่เวลา 10.00-16.00 น. และการออกร้านชุมชนท้องถิ่น ตั้งแต่เวลา 20.00-22.00 น
โปรแกรมภาพยนตร์วันที่ 9-14 มกราคม 67 หอภาพยนตร์ อ.พุทธมณฑล
โปรแกรมภาพยนตร์วันที่ 9-14 มกราคม 67 หอภาพยนตร์ อ.พุทธมณฑล จ.นครปฐม ไม่เสียค่าเข้าชม อ่านรายละเอียดและ
สำรองที่นั่ง สอบถามข้อมูลเพิ่มเติมโทร 02 482 2013
ยามค่ำอยุธยา 2567 Ayutthaya Sundown 2024 (ขยายเวลาจนถึงเดือนเมษายน 2567)
ข่าวดี ขยายเวลากิจกรรมเที่ยวชมโบราณสถานในยามค่ำคืน "ยามค่ำอยุธยา 2567 Ayutthaya Sundown 2024" ออกไปจนถึงเดือนเมษายน 2567 โดยการเที่ยวชม 2 โบราณสถานสำคัญ คือ วัดราชบูรณะ (ทุกวันศุกร์ เสาร์ อาทิตย์) และ วัดไชยวัฒนาราม (ทุกวันศุกร์ เสาร์ อาทิตย์ วันหยุดนักขัตฤกษ์ และเทศกาลสำคัญ) ทั้งสองแห่งสามารถเยี่ยมชมความสวยงามของโบราณสถานยามค่ำคืนได้ตั้งแต่ เวลา 18.00 - 22.00 น. (สามารถซื้อบัตรได้ถึง 21.00 น.)
ค่าธรรมเนียมเข้าชม ชาวไทย 10 บาท ชาวต่างชาติ 50 บาท ผู้พิการ และชาวไทยผู้มีอายุมากกว่า 60 ปี เข้าชมฟรี
สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานอุทยานประวัติศาสตร์พระนครศรีอยุธยา โทร 035-242286 ต่อ 101
เทศกาลโคมไฟ เฟสติวัล แสงสีแห่งเมืองปากน้ำ ครั้งที่ 11 (14-27 กุมภาพันธ์ 2567)
เที่ยวงานเทศกาลโคมไฟ เฟสติวัล แสงสีแห่งเมืองปากน้ำ ครั้งที่ 11 (11th Samutprakan Lantern Festival) จัดขึ้นตั้งแต่ 14-27 กุมภาพันธ์ 2567 ณ มูลนิธิธรรมกตัญญู (เสียนหลอไต้เทียนกง) บางปู กม.34 อ.เมือง จ.สมุทรปราการ
ทำบุญเมืองราชบุรี 11 มกราคม 2567
ขอเชิญร่วม "ทำบุญเมืองราชบุรี" วันพฤหัสบดีที่ 11 มกราคม 2567 ณ บริเวณโดยรอบศาลเจ้าพ่อหลักเมืองราชบุรี ค่ายภาณุรังษี กรมการทหารช่าง ต.พงสวาย อ.เมือง จ.ราชบุรี
• พิธีบวงสรวงสักการะเจ้าพ่อหลักเมืองราชบุรี • พิธีสวดพระพุทธมนต์ พิธีทำบุญตักบาตร • พิธีปล่อยพันธุ์สัตว์น้ำ • รำถวายสักการะเจ้าพ่อหลักเมืองราชบุรี
ณ บริเวณโรงยิมเนเชี่ยมจังหวัดราชบุรี ต.หน้าเมือง อ.เมือง จ.ราชบุรี
• การมอบสิ่งของให้แก่ผู้สูงอายุ ๑๐๐ ปี ขึ้นไป/คนยากจน/ผู้ยากไร้ • การมอบชุดลูกเสือ/ชุดเนตรนารี/ทุนการศึกษาแก่นักเรียน • การแสดงของเด็กเยาวชน/สมาชิก TO BE NUMBER ONE • การจำหน่ายสินค้าตลาดธงฟ้า/สินค้า OTOP • การเปิดโรงเลี้ยงโรงทาน • การไถ่ชีวิตโคกระบือ • กิจกรรมจิตอาสาและการแข่งขันกีฬาทางน้ำ
มาโฮมบุญบูชาคุณข้าว อ.นางรอง 11-12 มกราคม 2567
งานสืบสาน บุญคูณลาน (บุญกุ้มข้าวใหญ่) "มาโฮมบุญบูชาคุณข้าว" วันที่ 11-12 มกราคม 2567 ณ วัดตาไก้พลวง อำเภอนางรอง จังหวัดบุรีรัมย์ เริ่มตั้งแต่เวลา 09:00 น. เป็นต้นไป
งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท) 12-17 มกราคม 2567
ททท.อุบลฯ ชวนเที่ยวเส้นทางแห่งศรัทธาสักการะพระเถราจารย์(หลวงปู่ชา สุภัทโท) เนื่องในโอกาสเดือนแห่งการจัดงานสำคัญ “งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท)“ ระหว่างวันที่ 12-17 มกราคม 2567 นี้ ณ วัดหนองป่าพง อ.วารินชำราบ จ.อุบลราชธานี เพื่อแสดงออกถึงความกตัญญูกตเวทิตาคุณ แด่พระเดชพระคุณพระโพธิญาณเถร ผู้เป็นบูรพาจารย์ สอบถามข้อมูลเพิ่มเติมได้ที่ ททท.สำนักงานอุบลราชธานี 045-243770
งานเดินถนนชมศิลป์ กินขนมโบราณ กินอาหารในวรรณคดี ริมนทีเมืองแม่กลอง 2-14 มกราคม 2567
งานเดินถนนชมศิลป์ กินขนมโบราณ กินอาหารในวรรณคดี ริมนทีเมืองแม่กลอง วันที่ 12-14 มกราคม 2567 เวลาประมาณ 5 โมงเย็น เป็นต้นไป ณ บริเวณถนนริมแม่น้ำแม่กลอง (ท่าเรือแสงวณิชเก่า) อ.เมือง จ.สมุทรสงคราม ใกล้สถานีรถไฟแม่กลอง ภายในงานมีกิจกรรมมากมาย อาทิ การโชว์นกแก้วมาคอร์ การแข่งขันตกกุ้ง การแสดงศิลปวัฒนธรรมของเด็ก เยาวชน และศิลปินท้องถิ่น การสาธิตขนมโบราณ และอาหารในวรรณคดี เป็นต้น สำนักงานวัฒนธรรมจังหวัดสมุทรสงคราม โทร. 0 3471 8138
งานเจ้าพ่อพญาแล ประจำปี 2567 จังหวัดชัยภูมิ 12 - 20 มกราคม 2567
งาน เจ้าพ่อพญาแล ประจำปี 2567 จังหวัดชัยภูมิ ระหว่างวันที่ 12 - 20 มกราคม 2567 ณ สนามหน้าศาลากลางจังหวัดชัยภูมิ กิจกรรมภายในงาน อาทิ
- นิทรรศการบ้านไม้โบราณ ศิลปวัฒนธรรมและของดีจากทั้ง 16 อำเภอ
- นิทรรศการจากหน่วยงานภาครัฐ เอกชน
- การจำหน่ายสินค้า OTOP ลุ้นโชคกับร้านหรรษากาชาด และสลากบำรุงกาชาด
- การแสดงศิลปวัฒนธรรม
- ร้านเด็ด ร้านดี สินค้าราคาถูกมากมาย
- คอนเสิร์ตจากศิลปินดังมากมาย
รายละเอียดงานในแต่ละวัน ประกอบด้วย
12 ม.ค. 67 พิธีเปิดงาน + เวทีกลางประกวดธิดาพญาแล
- 04.30 น. พิธีถวายบายศรีเจ้าพ่อพญาแล
- 06.00 น. พิธีถวายช้างแด่เจ้าพ่อพญาแล
- 08.00 น. พิธีเปิดงานเจ้าพ่อพญาแล
13 ม.ค. 67 เดินแบบผ้าไทย
14 ม.ค. 67 ยูกิ ไหทองคำ + ยองบ่าง
15 ม.ค. 67 แอน อรดี
16 ม.ค. 67 ปู พงษ์สิทธิ์ คำภีร์ + วงเขากุย
17 ม.ค. 67 เนส กาแฟ ศรีนคร + วงเขากุย
18 ม.ค. 67 มนต์แคน แก่นคูณ
19 ม.ค. 67 ยังโอม + วงเขากุย
20 ม.ค. 67 เสก โลโซ + วงเขากุย
บอลลูน ทับทิมสยาม05 (12-14 มกราคม 2567)
บอลลูน หมู่บ้านทับทิมสยาม05 เขาตาง๊อกโฟล์กเฟสติวัล2024 วันที่ 12-14 มกราคม 2567 ที่ไร่รวมใจสตอเบอร์รี่ สระแก้ว (ด้านหลังทุ่งเก๊กฮวย) บ้านทับทิมสยาม05 ต.คลองไก่เถื่อน อ.คลองหาด จ.สระแก้ว ชมฟรี!!
เขาตาง๊อก โฟล์ก เฟสติวัล 2024 วันที่ 12-14 มกราคม 2567
เขาตาง๊อก โฟลก์ เฟสติวัล 2024 วันที่ 12-14 มกราคม 2567 ที่ ทับทิมสยาม05 อ.คลองหาด จังหวัดสระแก้ว เทศกาลดนตรีในสวน ทุ่งดอกไม้ ที่จะเนรมิตขุนเขา ทั้งบรรยากาศ Culture Lifestyle Fashion ผสานกับเสียงเพลงจากศิลปินชั้นนำทั่วไทย Festival รูปแบบใหม่ ถูกใจสายแคมป์
12 มกราคม โรงพยาบาลสุราษฎร์ธานี รับบริจาคอวัยวะ
12 มกราคม 2567 นายแพพย์ประกอบ ลือชาเกียรติศักดิ์ รองผู้อำนวยการฝ้ายการแพทย์ อาวุโส โรงพยาบาลสุราษฎร์ธานี มอบพวงหรืดศูนย์รับบริจาคอวัยวะสภากาชาดไทย ศูนย์รับบริจาค ตาสภากาชาดไทย และโรงพยาบาลสุราษฎร์ธานี โดยมีครอบครัวสกุลระสาโสมเป็นผู้รับม บุญกุศลในครั้งนี้ส่งผลให้ผู้เสียชีวิตไปสู่ภพภูมิที่ดี
งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท) 12-17 มกราคม 2567
“งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท)“ ระหว่างวันที่ 12-17 มกราคม 2567 นี้ ณ วัดหนองป่าพง อ.วารินชำราบ จ.อุบลราชธานี เพื่อแสดงออกถึงความกตัญญูกตเวทิตาคุณ แด่พระเดชพระคุณพระโพธิญาณเถร ผู้เป็นบูรพาจารย์
งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท) 12-17 มกราคม 2567
“งานปฏิบัติธรรมอาจริยบูชาพระโพธญาณเถร (ชา สุภฺทโท)“ ระหว่างวันที่ 12-17 มกราคม 2567 นี้ ณ วัดหนองป่าพง อ.วารินชำราบ จ.อุบลราชธานี เพื่อแสดงออกถึงความกตัญญูกตเวทิตาคุณ แด่พระเดชพระคุณพระโพธิญาณเถร ผู้เป็นบูรพาจารย์
วันเด็กแห่งชาติ ประจำปี 2567 มิวเซียมลำปาง
งาน “วันเด็กแห่งชาติ” ประจำปี 2567 ในวันเสาร์ที่ 13 มกราคม 2567 เวลา 08.00 – 12.00 น. ณ มิวเซียมลำปาง
เที่ยวงานวันเด็กแห่งชาติ 2567 ณ อุทยานการเรียนรู้และหอชมเมืองสมุทรปราการ
ขอเชิญชวนพี่น้องประชาชนทุกท่าน พาบุตรหลาน "เที่ยวงานวันเด็กแห่งชาติ 2567" ณ อุทยานการเรียนรู้และหอชมเมืองสมุทรปราการ วันเสาร์ที่ 13 มกราคม 2567 เริ่มตั้งแต่เวลา 07.00 น. เป็นต้นไป พร้อมซุ้มอาหารบริการฟรีมากกว่า 30 ซุ้ม ทั้งอาหารคาว หวาน น้ำดื่ม ฟรีตลอดงาน พบกับกิจกรรมมากมาย อาทิ กิจกรรมการแสดงของนักเรียนบนเวที การแสดงความสามารถของเด็กและเยาวชน ซุ้มเกมต่างๆ และที่ขาดไม่ได้เลยคือการแจกของขวัญวันเด็กจาก #คณะผู้บริหารเทศบาลนครสมุทรปราการ
สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 3 วัดขนอน 13 มกราคม – 7 เมษายน 2567
ททท. สำนักงานราชบุรี ร่วมกับ วัดขนอน จังหวัดราชบุรี เชิญนักท่องเที่ยวร่วมกิจกรรม “สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 3” เพื่อร่วมอนุรักษ์และเผยแพร่ศิลปวัฒนธรรมหนังใหญ่วัดขนอนอันเป็นเอกลักษณ์ของจังหวัดราชบุรี พร้อมทั้งส่งเสริมให้นักท่องเที่ยวได้เรียนรู้และเปิดประสบการณ์ใหม่ด้านการท่องเที่ยวจากการทำกิจกรรม DIY. จัดทุกวันเสาร์-อาทิตย์ เวลา 09.00-16.00 น. เริ่มตั้งแต่วันที่ 13 มกราคม – 7 เมษายน 2567 ณ วัดขนอน อ.โพธาราม จ.ราชบุรี นักท่องเที่ยวสามารถร่วมกิจกรรมได้ฟรี ดังนี้
1. ชมการแสดงหนังใหญ่ • วันเสาร์ เวลา 10.00 น.• วันอาทิตย์ เวลา 11.00 น
2. กิจกรรม DIY • กิจกรรมตอกพวงกุญแจหนังใหญ่จำลองและระบายสี
3. ชมพิพิธภัณฑ์หนังใหญ่ (เปิดให้เข้าชมทุกวัน)
งานมหกรรมดาราศาสตร์สุดยิ่งใหญ่ วันเด็กแห่งชาติ ประจำปี 2567 วันที่ 13 มกราคม 2567
งานมหกรรมดาราศาสตร์สุดยิ่งใหญ่ วันเด็กแห่งชาติ ประจำปี 2567 : NARIT AstroFest พบกับกิจกรรมร่วมสนุก ร่วมเรียนรู้ ผ่านวิชาดาราศาสตร์ตลอดทั้งวัน วันที่ 13 มกราคม 2567 ตั้งแต่เวลา 09:00 น. - 22:00 น. ณ หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา สงขลา
บ้านไร่มิวสิคเฟสติวัล2 เสาร์ที่ 13 มกราคม 67
บ้านไร่มิวสิคเฟสติวัล2 เสาร์ที่ 13 มกราคม 67 ประตูเปิด 16.00 น. เป็นต้นไป ที่ บอสเบสท์ฟาร์ม (บ้านห้วยหนามตะเข้) อ.บ้านไร่ จ.อุทัยธานี พบกับศิลปิน ✅ ฮิวโก้ & ใหม่ สิบล้อ (เต็มวง) ✅ ไววิทย์ ✅ iBossTeam ✅ Drunk Dog (Reggae Surf) ✅ ฉุกละหุก ✅ หาเรื่องออกจากบ้าน
งานเชียงรายดอกไม้งาม ครั้งที่ 20 - 28 ธ.ค. 66 -15 ม.ค. 67
งานเชียงรายดอกไม้งาม ครั้งที่ 20 ระหว่างวันที่ 28 ธันวาคม 66-15 มกราคม 67 ณ สวนตุงและโคมนครเชียงราย อ.เมือง ชมความงดงามของดอกไม้เมืองหนาวหลากสีสัน ใจกลางเมืองนครเชียงราย Music in the Park ดนตรีในสวน ทุกวันเสาร์ ไปจนถึงเสาร์ที่ 17 กุมภาพันธ์ 66 สอบถามข้อมูลเพิ่มเติมได้ที่ : เทศบาลนครเชียงราย 053-715952 ททท.สำนักงานเชียงราย 053-744674-5
UP BOOK FAIR 2024 มหาวิทยาลัยพะเยา (15-19 มกราคม 2567) LINK
โครงการ UP BOOK FAIR 2024 มหกรรมหนังสือเพื่อการเรียนรู้ ครั้งที่ 11 จัดขึ้นระหว่างวันที่ 15 – 19 มกราคม 2567 ณ อาคารสถาบันนวัตกรรมการเรียนรู้ ชั้น G บุคลากร ในงานจะได้พบกับ
✅ ร้านหนังสือและสำนักพิมพ์ชื่อดัง รวมสายวิชาการ สายสุขภาพ สายการ์ตูนญี่ปุ่น อนิเมะ รวมถึงแฟนนิยายสำนักพิมพ์ของไทย
✅ เวทีเสวนา พบกับ นักวิจัย
✅กิจกรรมส่งเสริมการอ่าน
✅ กิจกรรม Workshops สุดพิเศษ (ชวนทำแซนด์วิช, ประดิษฐ์สร้อยข้อมือ, สร้อยคอ, พวงกุญแจ) ฟรี!
✅ กิจกรรมการออกบูธ โดย ศูนย์เศรษฐกิจพอเพียง และสถาบันนวัตกรรมและถ่ายทอดเทคโนโลยี
✅ กิจกรรมสาธิตการปลูกผัก โฮโดรโปนิกส์ (Hydroponic) โดย ศูนย์เศรษฐกิจพอเพียง และร่วมกิจกรรมดี ๆ อีก 1 กิจกรรม (กิจกรรม กดไลค์ กดแชร์โพสต์ และติดแฮชแท็ก #UPBookFair2024 จำนวน 10 รางวัล) ลุ้นรับคูปองรับเครื่องดื่มฟรี!!! สำหรับผู้โชคดีที่ร่วมกิจกรรม
งานประเพณีบวงสรวงดวงวิญญาณ อำเภอสรรคบุรี ประจำปี 2567 (18 มกราคม 2567)
งานประเพณีบวงสรวงดวงวิญญาณ ประจำปี 2567 ณ บริเวณสนามหน้าที่ว่าการอำเภอสรรคบุรี ในวันที่ 18 มกราคม 2567 เวลา 18.00 น. การแข่งขันตระกร้อ ด้านภัยยาเสพติด เวลา ๒๐.๐๐ น. ชมการแสดงโขน จาก วิทยาลัยนาฏศิลปสุพรรณบุรี ในวันที่ ๑๙ มกราคม ๒๕๖๗ เวลา ๑๗.๓๐ น. เริ่มพิธีสงฆ์ เวลา ๑๔.๑๕ น. เริ่มพิธีพราหมณ์ เวลา ๑๙.๓๐ น. ขบวณแห่ขององค์กรปกครองส่วนท้องถิ่น เวลา ๒๐.๐๐ น. ชมการแสดงลิเกคอนเสิร์ต กุ้ง สุธิราช วงศ์เทวัญงาน บวงสรวงดวงวิญญาณขุนสรรค์ครั้งที่ 42 ประจำปี 2567 อำเภอสรรคบุรี
งาน บวงสรวงดวงวิญญาณขุนสรรค์ครั้งที่ 42 ประจำปี 2567 และงานเล่าขานตำนานเมืองแพรก วันที่ 18-21 มกราคม 2567 ณ สนามหน้าที่ว่าการอำเภอสรรคบุรี จ.ชัยนาท วันที่ 18 ม.ค. ชมโขนจาก วิทยาลัยนาฏศิลป์สุพรรณบุรี วันที่ 19 ม.ค. ชมลิเกคณะ กุ้งสุธิราชวงศ์เทวัญ ภายในงานมีของกิน ของอร่อย ของเล่น สวนสนุก ขนขบวนมาให้ความสุข ความสนุก มากมาย‼️
วันที่ระลึกการก่อตั้งเมืองอุดรธานี ปีที่ 131 (18 มกราคม 2567)
ททท.สำนักงานอุดรธานี ขอชวนร่วมรับพลังดีพร้อมชาวอุดรธานีนับหมื่นคน สัมผัสพลังแห่งศรัทธาที่มีมายาวนานพร้อมกัน ในวันพฤหัสบดีที่ 18 มกราคม 2567 เวลา 7:30 - 9:30 น. ณ บริเวณห้าแยกอนุสาวรีย์กรมหลวงประจักษ์ศิลปาคม อ.เมือง จ.อุดรธานี
เฉลิมฉลอง “วันที่ระลึกการก่อตั้งเมืองอุดรธานี ปีที่ 131” 18 มกราคมนี้ …. ร่วมกันสร้างประวัติศาสตร์ และประสบการณ์พลังแห่งศรัทธา นับจากปีฉลองเมืองครบ 100 ปี ที่พลังแห่งศรัทธาไม่เคยจางหาย กลับตอกย้ำให้ชาวเมืองอุดรธานี รวมตัวร่วมใจรำเทิดพระเกียรติระลึกถึงผู้ก่อตั้งเมืองอุดรธานี “กรมหลวงประจักษ์ศิลปาคม” หมั่นแก่นสู่ปีที่ 131 ในวันที่ 18 มกรา ของทุกปี ดังปรากฎในบทเพลงรำบวงสรวง
งานพฤกษาตะวันออกครั้งที่ 16 วันที่ 19 - 28 มกราคม 2567
งานพฤกษาตะวันออกครั้งที่ 16 ระหว่างวันที่ 19 - 28 มกราคม 2567 ณ สนามหน้าศาลากลางจังหวัดชลบุรี งานประกวดต้นไม้สุดยิ่งใหญ่แห่งภาคตะวันออก ประจำปี 2567 ชมการประกวดพันธ์ไม้มากมายหลากหลายชนิด ได้แก่ การจัดสวนญี่ป่น ประกวดกล้วยไม้ ประกวดกระบองเพชร ประกวดบอนไซ ประกวดบัว ประกวดสวนถาด ประกวดเฟิร์น ประกวดสับปะรดสี หลายรายการ เป็นการชิงถ้วยพระราชทานฯ และเชิญชวน ร่วมประมูลไม้บนเวที เพื่อเป็นเจ้าของพันธ์ไม้งามที่หาที่ไหนไม่ได้
งานประจำปี วัดโกรกกราก สมุทรสาคร 19-28 มกราคม 2567
งานประจำปี 2567 นมัสการ ปิดทององค์หลวงพ่อปู่ หลวงปู่กรับ หลวงพ่อแพ วัดโกรกกราก สมุทรสาคร 19-28 มกราคม 2567
งานเทศกาลร่มบ่อสร้าง และหัตถกรรมสันกำแพง 2567 (19 - 21 มกราคม 2567)
งานเทศกาลร่มบ่อสร้าง และหัตถกรรมสันกำแพง ครั้งที่ 39 และงานมหัศจรรย์ล้านนาเมืองกระดาษสาบ้านต้นเปา ครั้งที่ 18 วันที่ 19 - 21 มกราคม 2567 ณ หมู่บ้านบ่อสร้าง อำเภอสันกำแพง จังหวัดเชียงใหม่ กิจกรรมขบวนแห่รถร่มบ่อสร้าง ขบวนแห่แม่ญิงขี่รถถีบกางจ้องร่มบ่อสร้าง การประกวดธิดาร่มบ่อสร้าง การประกวดแข่งขันซุ้มประตูบ้านตกแต่งด้วยร่มบ่อสร้าง บูธอาหารและสินค้า ถนนคนเดิน การอนุรักษ์งานหัตถกรรมพื้นบ้านในการประดิษฐ์ร่มล้านนา และการประดิษฐ์กระดาษสาในรูปแบบต่างๆ สอดรับกับนโยบายของรัฐบาลและกระทรวงวัฒนธรรมที่มุ่งขับเคลื่อน Soft Power ในด้านเทศกาลประเพณีและการท่องเที่ยว ส่งเสริมหัตถกรรมของคนในชุมชน และเป็นการนำเสนอแหล่งท่องเที่ยวชุมชนที่บอกเล่าเรื่องราวประวัติศาสตร์ ผ่าน “การผลิตร่มบ่อสร้าง” ต้นกำเนิดการประดิษฐ์ร่มแห่งแรกของประเทศไทย โดยภายในงานมี การเดินขบวนแห่สืบสานศิลปวัฒนธรรมล้านนา ขบวนแม่ญิงขี่รถถีบก๋างจ้อง การเพ้นท์ร่มล้านนานานาชาติ รวมทั้งสัมผัสกับประสบการณ์ใกล้ชิดกับวิถีชุมชนในแง่มุมต่างๆ ของอำเภอสันกำแพง พร้อมทั้งเลือกชมและเลือกซื้อสินค้าหัตถกรรม ซึ่งเป็นงานศิลปะที่งดงาม ทั้งร่ม พัด ไม้แกะสลัก ผ้าฝ้าย ผ้าไหม เครื่องเงินเครื่องเขิน และผลิตภัณฑ์จากกระดาษสาที่ผลิตโดยพี่น้องชาวสันกำแพง
สุรินทร์วากิวเฟสติวัล2024 (19-20 มกราคม 2567)
สุรินทร์วากิวเฟสติวัล2024 งานรวมเนื้อวากิวที่ดีที่สุดในภาคอีสาน กับร้านค้ามากถึง 50 บูธ 19-20 มกราคม 2567 ณ ลานจอดรถโรบินสันไลฟ์สไตล์ สุรินทร์ แค่ 2 วันเท่านั้น สายเนื้อห้ามพลาด จัดโดย: หอการค้าสุรินทร์ สมาคมเลี้ยงวัว
สิ่งที่จะได้พบเจอในงานวากิวนี้ • พบกับการประกวดเนื้อจาก 18 ฟาร์มโคขุนไทย-วากิวระดับแนวหน้า เฟ้นหาเนื้อจากฟาร์มที่ดีที่สุดครั้งแรกในประเทศไทย • อิ่มอร่อยกับเนื้อไทย-วากิว และร้านค้ากว่า 50 ร้าน • สนุกกับฟรีมินิคอนเสิร์ต "ว่าน ธนกฤต" • นั่งลิ้มชิมรสเนื้อวากิวกับเครื่องดื่มเย็นๆในบรรยากาศชิลล์ - ครั้งแรกกับการประกวด เชฟ “โคตรกะเพรา” ของสุรินทร์ - พบกับเชฟ “กะปอม อิศรา” จากรายการ The Master Chef • เพลิดเพลินกับกิจกรรมบนเวที และฟังเพลงโฟล์คซองตลอดทั้งงาน
งานวัดโกรกกราก สมุทรสาคร 19-28 ม.ค. 67
งานวัดโกรกกราก สมุทรสาคร 19-28 ม.ค. 67 ไหว้หลวงปู่วัดโกรกกราก ดนตรี มหรสพ แสงสี เครื่องเล่น ของกินของใช้เพียบ
งานเทศกาลผักอินทรีย์ และของดีวังน้ำเขียว ปี 2567 (19 - 21 มกราคม 2567)
ททท. สำนักงานนครราชสีมา ขอเชิญชวนร่วมงาน "เทศกาลผักอินทรีย์ และของดีวังน้ำเขียว ปี 2567" ระหว่างวันที่ 19 - 21 มกราคม 2567 ณ นิคมเศรษฐกิจพอเพียง ตำบลวังน้ำเขียว อำเภอวังน้ำเขียว จังหวัดนครราชสีมา กิจกรรมภายในงานมีมากมาย ประกอบด้วย - ชมแปลงผักเกษตรอินทรีย์ พร้อมเลือกซื้อผลิตภัณฑ์จากเกษตรและสินค้าชุมชน - กิจกรรม Work Shop เช่น การทำผ้ามัดย้อม การเพ้นท์สี การระบายภาพ และกิจกรรมถ่ายรูป ฯลฯ และในวันที่ 21 มกราคม 2567 พบกับ "วิ่งสุดฟิน…กินผักกลางสวน" ระยะทาง 5 และ 10 กิโลเมตร
งาน "ไทใหญ่ เฟสติวัล ออนทัวร์" คอนเสิร์ตออนทัวร์ จากศิลปินชาว(ไต)ไทใหญ่ (19-20 มกราคม)
ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต ชวนมาสนุกสุดมันส์กับ ครั้งแรกของการแสดงคอนเสิร์ตออนทัวร์ จากศิลปินชาว(ไต)ไทใหญ่ ในงาน "ไทใหญ่ เฟสติวัล ออนทัวร์" ระหว่างวันที่ 19-20 ม.ค. 67 ณ ลานม่วนใจ๋ (Outdoor) ศูนย์การค้าเซ็นทรัลเชียงใหม่ แอร์พอร์ต ยกทัพศิลปินชื่อดังส่งมอบความสนุก 2 วันจุใจ / 19 ม.ค. 67 พบกับ The Sai, นางหมวยใส, จายอ่องเมือง, จายสายเหลิน, นางน้องนวล / 20 ม.ค.67 พบกับ จายหาญแลง, นางแสงอ่อน, จายจ๋อมเหลิน, หลาวหนุ่มหอม, จายล้อมวุน / จำหน่ายบัตรล่วงหน้าแล้ววันนี้ ที่ชั้น G โซน Aquarium
นิทรรศการ "Pushing P" 19 มกราคม - 28 กุมภาพันธ์ 2567
นิทรรศการ "Pushing P" ณ 14 อาร์ต เฮาส์ แกเลอรี่ โดยสามารถเข้าชมได้ตั้งแต่วันที่ 19 มกราคม - 28 กุมภาพันธ์ 2567
19 มกราคม โรงพยาบาลนครพิงค์ รับบริจาคอวัยวะ ผู้ป่วยหญิง อายุ 52 ปี
19 มกราคม 2567 โรงพยาบาลนครพิงค์ รายงานว่า เมื่อวันที่ 16 มกราคม 2567 คุณอาทิตยา อิ่นแก้ว อายุ 52 ปี ได้รับการวินิจฉัยว่ามีเส้นเลือดสมองแตกและมีภาวะสมองตาย เมื่อทีมแพทย์ได้แจ้งการวินิจฉัยกับญาติแล้ว ญาติจึงได้ตัดสินใจร่วมกันว่าประสงค์จะบริจาคอวัยวะทุกส่วนที่สามารถใช้ประโยชน์ได้ให้กับสภากาดชาดไทยเพื่อต่อลมหายใจของผู้อื่น เนื่องจากผู้ป่วยเป็นผู้ที่มีจิตใจดีงาม และชอบทำบุญด้วยการบริจาคโลหิตอยู่เสมอ จึงตั้งใจให้ผู้ป่วยได้มีโอกาสทำบุญกุศลครั้งยิ่งใหญ่เป็นครั้งสุดท้าย ทีมแพทย์ประเมินแล้วว่าสามารถบริจาคได้เฉพาะกระจกตา จึงได้ประสานงานให้ผู้ป่วยและญาติได้บริจาคกระจกตาตามเจตนารมณ์
ด้วยบุญกุศลที่ได้อุทิศดวงตาเพื่อมอบแสงสว่างแก่ผู้อื่นแล้วนั้น ขอให้ดวงวิญญาณของคุณอาทิตยา อิ่นแก้ว ไปสู่ภพภูมิที่ดีและได้รับรู้ว่าได้ช่วยเหลือผู้อื่นตามเจตนารมณ์แล้ว ขอขอบคุณผู้เกี่ยวข้องในภารกิจสะพานบุญในครั้งนี้ - หอผู้ป่วย ICU ศัลยกรรมประสาท - ศูนย์ดวงตาสภากาชาดไทย - ทีมจัดเก็บดวงตา รพ.นครพิงค์ - คุณพิทักษ์ เขื่อนคำ - คุณอารีวรรณ กิติธีรภัค ผู้ประสานงานการปลูกถ่ายอวัยวะ. ***ภาพและบทความนี้ ได้รับอนุญาตให้เผยแพร่จากญาติผู้เสียชีวิตแล้ว ภาพ/ข่าว - คณะทำงานภาพลักษณ์องค์กร สื่อสาธารณะและสังคม โรงพยาบาลนครพิงค์
Saraburi Jazz Festival วันที่ 20-21 ม.ค. 67
งาน Saraburi Jazz Festival จัดขึ้นในวันที่ 20-21 มกราคม 2567 หอมนสิการ อ.แก่งคอย จ.สระบุรี งานดนรีที่จะได้ดื่มด่ำกับความไพเราะของการแสดงดนตรีแจ๊สในบรรยากาศท่ามกลางเทือกเขาที่สวยที่สุดแห่งหนึ่งของจังหวัดสระบุรี ณ หอมนสิการ อ.แก่งคอย จ.สระบุรี ภายในงานพบกับศิลปินชื่อดังอย่างคับคั่ง ไม่ว่าจะเป็น อาจารย์เทวัญ ทรัพย์แสนยากร, คุณนรีกระจ่าง คันธมาส, คุณป้อม ออโต้บาห์น, ศิลปินจากเดอะโกลเด้นซอง และศิลปินรับเชิญสุดพิเศษ คุณวินัย พันธุรักษ์ ศิลปินแห่งชาติ ผู้ร่วมก่อตั้งวงดิอิมพอสซิเบิ้ล ตำนานหน้าหนึ่งของวงการดนตรีประเทศไทย
งานเบบี้บ็อกซ์ พะเยาครีเอทีฟครั้งที่ 1 (20-21 มกราคม 67)
"งานเบบี้บ็อกซ์ พะเยาครีเอทีฟครั้งที่ 1" วันที่ 20-21 มกราคม 67 เวลา 10.00 - 22.00 น. ณ ลานเอนกประสงค์เทศบาลเมืองพะเยา งานน่าสนใจ และกิจกรรมแน่นๆงานศิลป์ ร่วมชม และ ร่วมประมูลชิ้นงาน ตัวอย่าง กิจกรรม
✅แข่งขันดนตรีเยาวชน ครั้งที่ 1
✅ แข่งขัน..รูบิค ครั้งที่ 2
✅ แข่งขัน..เชฟกระทะเด็ก ครั้งที่ 1
✅ แข่งขัน..Baby Box Star ครั้งที่ 1
✅ แข่งขัน..การงัดข้อ ครั้งที่ 1
✅ กิจกรรม workshop งานคราฟท์ บัตรราคา 200 ทำได้ทุกอย่าง (จำนวนจำกัด) Painting Sand Art ปั้นดินเบา พับดาว เปเปอร์มาเช่ บ้านจิ๋ว เครื่องดนตรี DIY เครื่องประดับ DIY
✅ เสวนาการทำช่องออนไลน์จากอินฟลูเอนเซอร์เยาวชนพะเยา
✅ เดินกะลา เล่นไม้โก๋งเก๋ง โดดหนังยาง
✅โชว์ร้องเพลงประสานเสียง เบลล์ประสานเสียง กาดละอ่อน ..ลงทะเบียนขายของ ฟรี มินิเกมส์ หมากเก็บ รถทัวร์นายภัทร ประกวดการแต่งกาย ประกวด BabyBox Star หนูน้อยมหัศจรรย์ 9-12 ปี อินฟลูเอนเซอร์ เสวนาความรู้ ดนตรี อนิเมะ แก๊งเขียงไห้ งัดข้อ
งานประเพณีปอยต่างข้าวซ่อมต่อวัดศิลปะพม่าเมืองลำปาง 20 – 21 มกราคม 2567
จังหวัดลำปาง ร่วมกับมหาวิทยาลัยราชภัฏลำปาง ภาคีเครือข่ายภาครัฐและภาคเอกชน กำหนดจัด
งานประเพณีปอยต่างข้าวซ่อมต่อวัดศิลปะพม่าเมืองลำปาง ระหว่างวันที่ 20 – 21 มกราคม 2567 ณ วัดไชยมงคล (วัดจองคา) อำเภอเมือง จังหวัดลำปาง
ภายในงานพบกับ ขบวนประเพณีปอยต่างข้าวซ่อมต่อวัดศิลปะพม่าเมืองลำปาง จากบริเวณมิวเซียมลำปาง มายังวัดไชยมงคล (วัดจองคา) พิธีล้างหน้าพระมหามัยมุนีจำลอง ซึ่งเป็นครั้งแรกของนครลำปาง และพิธีถวายข้าวซ่อมต่อ โดยผู้เข้าร่วมงานมีโอกาสได้รับผ้าเช็ดหน้าของพระมหามัยมุนี จากวัดมหามัยมุนี เมืองมัณฑเลย์ ประเทศพม่า พร้อมมีกิจกรรมที่น่าสนใจ ดังนี้
- กิจกรรมประกวดการจัดหม้อดอก
- กิจกรรมการประกวดทำแกงฮังเล ต้นตำรับพม่า-ไทใหญ่
- กิจกรรมประจำฐานการเรียนรู้พิธีกรรมและศิลปวัฒนธรรมพม่าไทใหญ่
- กิจกรรมการกวนข้าวทิพย์ (ข้าวหย่ากู๊)
- กิจกรรมการจัดดาเครื่องพิธีกรรมสำหรับการถวายข้าวซ่อมต่อ
- การแสดงรำนกกิงกะหร่า
- การฟ้อนหุ่นกระบอกพม่า
- แฟชั่นโชว์ชุดพม่า ไทใหญ่ (ประยุกต์)
- การแสดงแฟชั่นโชว์ชุดพม่า ไทใหญ่ (ชุดราชสำนัก)
นอกจากนี้ ยังมีกิจกรรมการท่องเที่ยวบนเส้นทางวัดศิลปะพม่า-ไทใหญ่เมืองลำปางด้วยรถราง มีนิทรรศการภาพถ่ายและข้อมูลเกี่ยวกับประวัติศาสตร์เมืองลำปาง คนพม่า-ไทใหญ่ในเมืองลำปาง ธรณีวิทยา (Geopark) ลำปาง และกิจกรรมการถ่ายภาพมุม Vogue วัดไชยมงคล (จองคา) ให้ผู้ชมงานร่วมสนุกด้วย
“ปอยต่างข้าวซ่อมต่อ” เป็นประเพณีของชุมชนชาวพม่าไทใหญ่ที่เข้ามาตั้งถิ่นฐานอยู่ในเมืองลำปางในช่วงยุคสมัยการสัมปทานป่าไม้ พ.ศ. 2383 คำว่า “ปอย” ในภาษาล้านนามีรากศัพท์มาจากคำว่า “แปวว์” ในภาษาพม่าที่แปลว่า “งานบุญ” ส่วนคำว่า “ซ่อมต่อ” มาจากคำว่า “ซุน” ที่แปลว่า “ข้าวต่อ” แปลว่าการถวาย ปอยต่างข้าวซ่อมต่อจึงหมายความว่า การทำบุญด้วยการถวายข้าว ในขณะที่คนลำปางนำคำว่า “ซ่อมต่อ” ในภาษาพม่ามาตีความหมายแบบภาษาไทยท้องถิ่น คือการจัดงานบุญเพื่อซ่อมบำรุงข้าวของเครื่องใช้โดยเฉพาะหมวดเครื่องครัวที่ชำรุดเสียหาย โดยนำภาชนะใหม่ที่จะถวายมาใส่ข้าวสาร ตกแต่งประดับให้สวยงามถือเป็นกุศโลบายในการดูแลข้าวของเครื่องใช้ของวัด ที่ถือเป็นของสาธารณะหรือของชุมชนซึ่งชาวบ้านมักจะเข้ามาหยิบยืมใช้ ด้วยเหตุนี้งานปอยต่างข้าวซ่อมต่อจึงเริ่มแพร่หลายสู่คนเมืองโดยมีเป้าหมายในการจัดงานบุญเพื่อซ่อมแซมภาชนะหรือสร้างใหม่ เพื่อแทนที่ของเดิมที่ชำรุดเพื่อเป็นการสืบทอดพระพุทธศาสนาให้ยั่งยืนสืบไป
งาน Bangsaen Koff Fest 2024
งาน Bangsaen Koff Fest 2024 งานเทศกาลประจำปีของคนรักกาแฟ 20 - 21 มกราคม 2024 l 09.00 - 19.00 น. ณ หาดบางแสน บริเวณหลังศาลเจ้าพ่อแสน พบกับบูธร้านกาแฟ คาเฟ่ ชา โกโก้ เบเกอรี่ อุปกรณ์ร้านกาแฟครบวงจร เมล็ดหลากหลายสายพันธุ์ กว่า 80 ร้านค้า อัพเดตเทรนด์ใหม่ๆของปี 2024 ก่อนใคร กับ ผู้เชี่ยวชาญ สายกาแฟ กิจกรรม workshop สำหรับคนรักกาแฟ กิจกรรมการแข่งขันกาแฟ การแสดงดนตรีและดีเจภายในงาน การแสดงดนตรีและดีเจภายในงาน วันที่ 20 มกราคม 2567 พบกับ DJ Docg / Easy Daisy / Poorer / Catnip วันที่ 21 มกราคม 2567 พบกับ DJ Docg / Plutonium / WWJ / Mind be better / Jainoise
Bikinirun trang : RUN FUN EAT นที่ 20 มกราคม 2567
Bikinirun trang : RUN FUN EAT พบกับงานวิ่งของคนตรัง ที่อยากชวนเหล่านักวิ่ง มาพบกับบรรยากาศสวยๆริมทะเลตรัง มาร่วมเปิดประสบการณ์ใหม่ๆไปด้วยกัน เปลี่ยนงานวิ่งให้เป็นงานที่สนุกมากยิ่งขึ้น กับ Bikini Run Trang เพราะเราเชื่อว่า "วิ่งกับเที่ยวคือเรื่องเดียวกัน" แล้วมาสนุกกันกับการวิ่งในธีม "นีออนรัน" ใน Concept : RUN FUN EAT ใน วันที่ 20 มกราคม 2567 ณ หาดปากเมง อ.สิเกา จ.ตรัง ภายในงานจะได้พบกับกิจกรรมสุดพิเศษ สำหรับทุกคนที่เดินทางมาร่วมงาน กิจกรรมสนุกๆ มากมาย การเพ้นท์ตัว ควงไฟ กระทบไหล่มิสแกรนด์ตรัง พร้อมทั้งของกินขึ้นชื่อของ เมืองตรัง รวมไว้ที่นี่ Bikini Run Trang ครั้งที่ 5 ติดตามรายละเอียด ได้ที่ช่องทาง Facebook : Bikiniruntrangงานกระต่ายขาชง ชิมกาแฟและเครื่องดื่มจากฝีมือนักชงในจันทบุรี 21 มกราคม 2567
กิจกรรมชิมกาแฟและเครื่องดื่มจากฝีมือนักชงในจันทบุรี ให้ชาวจันทบุรีได้มาร่วมกันเรียนรู้ เปิดประสบการณ์สัมผัสรสชาติและความซับซ้อนในกลิ่นของกาแฟ #สายแคมป์ #สายสโลบาร์ พกอุปกรณ์ส่วนตัวมาให้พร้อมแล้วเจอกัน (ที่งานมีไฟฟ้าอำนวยความสะดวก) วันที่ 21 มกราคม 2567 เวลา 06.00-09.00 น สถานที่ : ลานแอโรบิค ทุ่งนาเชย จันทบุรี ฟรี ไม่มีค่าใช้จ่ายใดๆ
มิสแกรนด์ไทยแลนด์ มิสแกรนด์ประจวบคีรีขันธ์ 2024 Final Show (21 มกราคม 2567)
เตรียมพบกับการชิงมงกุฏแห่งท้องทะเล ที่จะหยุดทุกสายตาด้วยความงดงาม ราวกับเงือกสาวแห่งท้องทะเล จากเวที Miss Grand Prachuap Khiri Khan 2024 มิสแกรนด์ ประจวบคีรีขันธ์ 2567 กับงานประกวดที่จัดขึ้นที่ Bluport Huahin เตรียมพบกับ 12 เงือกสาวแห่งท้องทะเลประจวบคีรีขันธ์ ที่เข้ามาช่วงชิงตำแหน่ง “ควีนแห่งท้องทะเล” ใครจะเป็นคนได้มงกุฏแห่งท้องทะเลไปครอบครอง พบกันได้วันที่ 21 มกราคม 2567 ลาน The Square บลูพอร์ตหัวหิน
การแข่งขันกีฬานักเรียน นักศึกษาแห่งชาติ กระบี่เกมส์ 22-30 มกราคม 2567
การแข่งขันกีฬานักเรียน นักศึกษาแห่งชาติ ครั้งที่ ๔๓ ประจำปี ๒๕๖๗ "กระบี่เกมส์" วันที่ 22-30 มกราคม 2567 ณ สนามกีฬากลาง มหาวิทยาลัยการกีฬาแห่งชาติ วิทยาเขตกระบี่
ประเพณีตานข้าวใหม่ ใส่บาตรหลวง 2567 จ.พะเยา 24-27 มกราคม 2567
ขอเชิญชวนมาทำบุญ ให้ปีนี้เป็นปีที่ดีของทุกคนกันนะคะกับประเพณีตานข้าวใหม่ ใส่บาตรหลวง 2567 ประเพณีหนึ่งเดียวในโลก ที่จังหวัดพะเยา วันที่ 24-27 มกราคม 2567 รับรองว่าอิ่มบุญ อิ่มสุข อิ่มใจ อิ่มท้อง กลับบ้านแน่นอน สอบถามรายละเอียดเพิ่มเติมได้ที่
facebook.com/upili.official -มหาวิทยาลัยพะเยา 054 466 666 - 3806 --
คลิปกิจกรรมเพจพะเยาบ้านฉันเที่ยว LOPBURI ART FEST ครั้งที่2 x Mighty JAM 25 - 26 มกราคม 67 @อำเภอโคกสำโรง
เที่ยว LOPBURI ART FEST ครั้งที่2 x Mighty JAM จัดระหว่างวันที่ 25 - 26 มกราคม 2567 @อำเภอโคกสำโรง เวลา 10.00 - 17.00 น. ณ บริเวณสระน้ำข้างวัดตะวันเย็น สร้างสรรค์โดย กลุ่ม Lopburui ร่วมกับทีม MSV จากเชียงใหม่ และศิลปินอาสาทั้งในประเทศ และต่างประเทศกว่า 30 ชีวิต ตลอดจนอาสาเยาวชนลพบุรี ร่วมออกแบบสร้างสรรค์งานกราฟิตี้บนกำแพงการประปา ลพบุรี กว่า 500 เมตร ไปสัมผัสผลงานจาก หัวใจแห่งศิลปะที่แต่งแต้มเติมสี ที่ประจงสร้างเพื่อรังสรรค์เมืองรองอย่าง “ลพบุรี” ให้มีชีวิตชีวามากขึ้น ถือเป็นคุณค่าแห่งการสร้างสรรค์สังคมที่ยิ่งใหญ่ ศิลปิน street Art ทั้งไทยและต่างชาติขึ้นกำแพงพ่นพร้อมกัน 3 จุด ในอำเภอโคกสำโรง
งานมหกรรมแพทย์แผนไทยเขตสุขภาพที่ 3 กำแพงพิชัยอุทัยสวรรค์ (25-27 มกราคม 2567)
งานมหกรรมแพทย์แผนไทยเขตสุขภาพที่ 3 ปีงบประมาณ 2567 "กำแพงพิชัยอุทัยสวรรค์" จัดขึ้นระหว่างวันที่ 25-27 มกราคม 2567 ณ บริเวณเขื่อนเรียงหิน จังหวัดชัยนาท เปิดให้บริการเวลา 10.00-21.00 น. งานสุขภาพแผนไทยเพื่อเป็นการต่อยอด "ภูมิปัญญา พัฒนาสมุนไพร ใส่ใจเศรษฐกิจฐานรากสู่สากล" จัดโดยความร่วมมือของสาธารณสุขทั้ง 5 จังหวัด คือ จังหวัดกำแพงเพชร จังหวัดพิจิตร จังหวัดอุทัยธานี จังหวัดนครสวรรค์ และจังหวัดชัยนาท เพื่อเป็นการขับเคลื่อนนโยบายในการอนุรักษ์ ส่งเสริมและคุ้มครองภูมิปัญญาด้านการแพทย์แผนไทย การแพทย์พื้นบ้าน การแพทย์ทางเลือก และกัญชาทางการแพทย์ โดยนำภูมิปัญญาดังกล่าวมาเพื่อเป็นประโยชน์สูงสุดในการดูแลสุขภาพประชาชน โดยภายในงานมีกิจกรรมต่างๆ อาทิ -โซนคลินิกบริการด้วยสุขภาพ ด้านการแพทย์แผนไทย การแพทย์ทางเลือก - ด้านการแพทย์พื้นบ้าน - บูธนิทรรศการผลงานเด่น นวัตกรรม และคลินิกบริการด้านการแพทย์แผนไทย การแพทย์พื้นบ้าน การแพทย์ทางเลือก - บูธสินค้าและผลิตภัณฑ์สุขภาพ
กิจกรรมการขับเคลื่อนเมืองนครปฐม เป็นเครือข่าย UNESCO พัฒนาเมืองสร้างสรรค์ด้านดนตรี Creative City Of Music
25 มกราคม 2567 บริเวณสนามฟุตบอล มหาวิทยาลัยราชภัฏนครปฐม สำนักงานวัฒนธรรมจังหวัดนครปฐม ร่วมกับจังหวัดนครปฐม และสถานศึกษา จัดโครงการส่งเสริมการท่องเที่ยวเชิงอาหารและวัฒนธรรม การท่องเที่ยวที่หลากหลาย (Smart Tourism) กิจกรรมการขับเคลื่อนเมืองนครปฐมเป็นเครือข่ายเมืองสร้างสรรค์ของ UNESCO โดยมีนายสุรศักดิ์ เจริญศิริโชติ ผู้ว่าราชการจังหวัดนครปฐม เป็นประธานในพิธีเปิด พร้อมด้วยนางวราภรณ์ เจริญศิริโชติ นายกเหล่ากาชาดจังหวัดนครปฐม นางสาวอโรชา นันทมนตรี ผู้ช่วยปลัดกระทรวงมหาดไทย ช่วยราชการจังหวัดนครปฐม ปฏิบัติหน้าที่รองผู้ว่าราชการจังหวัดนครปฐม นายอรรถวุฒิ พึ่งเนียม รองผู้ว่าราชการจังหวัดนครปฐม ดร.วิรัตน์ ปิ่นแก้ว อธิการบดีมหาวิทยาลัยราชภัฏนครปฐม นายศราวุฒิ สุวรรณทัพ หัวหน้าสำนักงานจังหวัดนครปฐม หัวหน้าส่วนราชการ นักเรียน นักศึกษา และประชาชน เข้าร่วมพิธีเปิดโครงการในครั้งนี้
การจัดกิจกรรมในครั้งนี้ สำนักงานวัฒนธรรมจังหวัดนครปฐม ได้ร่วมกับ สถานศึกษา และหน่วยงานต่างๆ มีกำหนดจัดขึ้น ๗ ครั้ง ๗ อำเภอ เป็นดนตรีเพื่อสร้างสุขภาวะที่ดี สร้างคุณภาพชีวิตที่ดี ให้ชาวนครปฐมใช้ดนตรีเพื่อความสุขในการดำรงชีวิตที่เกิดขึ้น จากการสร้างสรรค์ของทุกภาคส่วนที่มีการบูรณาการ ผสมผสานศิลปะในสาขาต่างๆ มาสร้างสรรค์ให้เกิดผลงานที่ทรงคุณค่า ทั้งดนตรีไทย ดนตรีสากล ดนตรีลูกทุ่ง เพลงพื้นบ้าน การแสดงศิลปวัฒนธรรม นอกจากนี้ยังมีการออกร้านจำหน่ายสินค้า CCPOT ผลิตภัณฑ์ชุมชน การสาธิตผลิตภัณฑ์ ชุมชน/อาหาร อาทิเช่น การสาธิตวิธีการทำขนมฝอยทอง การสาธิตวิธีการทำยาหม่อง ของวิสาหกิจชุมชนศูนย์การเรียนรู้แพทย์แผนไทยและสมุนไพรตำบลบางแขม การสาธิตวิธีการทำผลิตภัณฑ์ จากเส้นพลาสติก ของชำร่วย การสาธิตวิธีการทำผลิตภัณฑ์สมุนไพรไล่ยุง การสาธิตวิธีการทำพวงมาลัยมะกรูดหอมใบเตย การสาธิตวิธีการทำผลิตภัณฑ์หมวกกุ้ยโล้ย เป็นต้น ที่แสดงถึงอัตลักษณ์และเอกลักษณ์ประจำท้องถิ่น ให้ผู้ที่สนใจร่วมชม และเลือกช็อบสินค้าของชุมชนอีกด้วย
ซึ่งโครงการส่งเสริมการท่องเที่ยวเชิงอาหารและวัฒนธรรม การท่องเที่ยวที่หลากหลาย (Smart Tourism) กิจกรรมการขับเคลื่อนเมืองนครปฐมเป็นเครือข่ายเมืองสร้างสรรค์ของ UNESCO ครั้งต่อไป จะจัดขึ้นในวันที่ ๒๗ มกราคม ๒๕๖๗ ณ วัดไร่ขิง พระอารามหลวง อำเภอสามพราน จังหวัดนครปฐม ตั้งแต่เวลา ๑๐.๐๐ น. เป็นต้นไป ประเพณี ตานข้าวใหม่ หิงไฟพระเจ้า วัดต้นเกว๋น อ.หางดง 25 มกราคม 2567
ประเพณี “ตานข้าวใหม่ หิงไฟพระเจ้า” โดยชาวบ้านชุมชนต้นเกว๋นร่วมกับกลุ่มหน่อศิลป์ คณะวิจิตรศิลป์ มหาวิทยาลัยเชียงใหม่ ในวันที่ วันที่ 25 มกราคม 2567 เวลา 7.00 น. และ 17.00 น. เป็นต้นไป ณ วัดต้นเกว๋น อ.หางดง จ.เชียงใหม่ โดยในเวลา 07:00 น. จะเป็นประเพณีตานข้าวใหม่ และ 17:00 น. จะเริ่มพิธีตานหลัวหิงไฟพระเจ้า ชาวล้านนามีความเชื่อว่า พระพุทธเจ้าหรือพระพุทธรูปในวิหารก็รู้สึกถึงความหนาวเย็นเช่นเดียวกับคนเรา จึงร่วมกันหาไม้ฟืนมาจุดเผาไฟผิงให้เกิดความอบอุ่น ประเพณีนี้เป็นประเพณีที่เกิดขึ้นสอดคล้องกับบริบททางสภาพแวดล้อม เนื่องจากในดินแดนล้านนาในอดีตเป็นพื้นที่ๆมีความหนาวเย็น รวมทั้งมีป่าไม้ที่อุดมสมบูรณ์ ต้นไม้ขึ้นหนาแน่นและมีความชื้นสูง - ภาพและข้อมูลจาก Event pass
งาน น้อมรำลึกสมเด็จพระนเรศวรมหาราช กู้แผ่นดิน ประจำปี 2567 (25-27 มกราคม 2567)
งาน น้อมรำลึกสมเด็จพระนเรศวรมหาราช กู้แผ่นดิน ประจำปี 2567 วันที่ 25-27 มกราคม 2567 ขอเชิญพี่น้องประชาชนชาวโคราชแต่งชุดไทยย้อนยุค ไปเที่ยวชมงานฯ โดย จังหวัดนครราชสีมา ร่วมกับกองทัพภาคที่ 2 จัดงานที่ทุกคนรอคอย งาน "น้อมรำลึกสมเด็จพระนเรศวรมหาราช กู้แผ่นดิน” ซึ่งเป็นโอกาสครบรอบ 5 ปี ของการจัดสร้างพระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช เพียงแห่งหนึ่งแห่งเดียวใหญ่ที่สุดในจังหวัดนครราชสีมา
ในงานมีไฮไลท์! การโชว์โขน ศิลปะมวยไทย การแสดงทางยุทธวิธี และการแสดงแสง สี เสียงชื่อชุด “อิสรภาพแห่งชาติ มหาราชนเรศวร” โดยได้รับเกียรติจากดารานักแสดง “เด่นคุณ งามเนตร” จาก ละคร “พรหมลิขิต” ทางช่อง 3 และ “ฟ้าใส” อรจิรา ศิริมงคล นายกเหล่ากาชาดจังหวัดนครราชสีมา ร่วมแสดง . ในงานมีธีมบรรยากาศย้อนยุคสมัยอยุธยา ขอเชิญชวนร่วมแต่งกายชุดไทยโบราณ ไปชิมช้อป ตลาดน้ำ ตลาดย้อนยุค และตลาดชุมชน และชมการแสดง แสง สี เสียงในยามค่ำคืน จัดทั้งหมด 3 วันเริ่มวันที่ 25 ถึง 27 มกราคม 2567 นี้ ณ ลานด้านหน้าพระบรมราชานุสาวรีย์สมเด็จพระนเรศวรมหาราช ค่ายสุรนารี กองทัพภาคที่ 2 จ.นครราชสีมา
Esan Bakery Chocolate & Tea Fest 2024
"Esan Bakery Chocolate & Tea Fest 2024" มหกรรมงานเบเกอรี่ ช็อกโกแลต เครื่องดื่มชา กาแฟ แบบครบครันที่สุดในภาคอีสาน พบเชฟทำขนมและศิลปินดารา ชื่อดังมากกมาย 4 วันเต็ม วันที่ 25 - 28 ม.ค. 2567 ณ ชั้น 4 Korat Hall เซ็นทรัล โคราช
ปฏิทินฟูลมูนปาร์ตี้ ปี 2024 เกาะพะงัน
กิจกรรมท่องเที่ยวที่ปฏิเสธไม่ได้ของสุราษฎร์ธานี คือ กิจกรรมฟูลมูนปาร์ตี้ (Full Moon Party Koh Phangan 2024) เกาะพะงันซึ่งในปี 2024 มีปฏิทินกำหนดการจัดงานไว้ชัดเจนตั้งแต่ต้นปี จำนวน 13 ครั้ง (รวม countdown ส่งท้ายปี 2024-2025) งานฟูลมูนปาร์ตี้เกาพะงัน ของแท้ มีกำหนดจัดขึ้นในทุกคืนวันพระจันทร์เต็มดวง ที่หาดริ้น เกาะพะงัน ประเทศไทย. ในกรณีที่วันพระจันทร์เต็มดวงรอบนั้นตรงกับวันพระใหญ่ (อันได้แก่ มาฆบูชา วิสาขบูชา อาสาฬหบูชา เข้าพรรษา ออกพรรษา) จะทำการเลื่อนไปจัดวันถัดไป สาเหตุที่เลื่อนเนื่องจากกฏหมายปัจจุบันกำหนดให้ห้ามจำหน่ายสุราในวันดังกล่าว
งานของดีสระบุรีและงานกาชาด สระบุรี 26 ม.ค. - 3 ก.พ. 67
งานของดีสระบุรีและงานกาชาด 26 ม.ค. - 3 ก.พ. 67 บริเวณศาลากลางหลังใหม่สระบุรี
งาน วันเกษตร ภาคอีสาน 67 (26 มกราคม - 4 กุมภาพันธ์ 2567)
ขอเชิญเที่ยวงาน วันเกษตร ภาคอีสาน 67 E-SAN AGRICULTURAL FAIR 2024 เกษตรอีสาน สรรค์สร้างนวัตกรรม นำคุณค่าสู่สากล วันที่ 26 มกราคม - 4 กุมภาพันธ์ 2567 ณ บริเวณอุทยานเทคโนโลยีการเกษตร มหาวิทยาลัยขอนแก่น
TRAMS MOVE Chiang Mai (26-28 ม.ค. 2567)
งาน TRAMS MOVE Chiang Mai วันที่ 26-28 ม.ค 2567 เวลา 16:00-24:00 น. บริเวณช้างโรงสี ดอยสะเก็ด เชียงใหม่ ลงทะเบียนเข้างานฟรี ฟรีคอนเสิร์ต จาก 9 ศิลปินดัง Workshop ศิลปะและมายากลแสนสนุก #ดูดวงฟรี จากเลขศาสตร์และไพ่ยิปซี และ ร้านอาหารและเครื่องดื่มจัดเต็ม นั่งชิลได้ตลอดทั้งคืนกลางบรรยายดนตรีเคล้าอารมณ์กลางทุ่งนา พร้อมกิจกรรมสนุกๆ แจกของรางวัลอีกเพียบ งานนี้ไม่มีกลับไปมือเปล่าแน่นอน
26 ม.ค. 67 พบกับ REINIZRA / MOVING AND CUT / WANYAI X MON MONIK
27 ม.ค. 67 พบกับ BEAN NAPASON / MEAN / SLUR
28 ม.ค. 67 พบกับ ANATOMY RABBIT / WHAL & DOLPH / SCRUBB
นั่งรถรางชมเมืองเชียงราย 26-30 มกราคม 2567
เปิดเส้นทาง “
นั่งรถรางชมเมืองเชียงราย” เฉลิมฉลองในโอกาสจังหวัดเชียงราย ครบรอบ 762 ปี วันที่ 26-30 มกราคม 2567 ณ เส้นทางรถรางชมเมืองเชียงราย 18 จุด อ.เมือง จ.เชียงราย เชิญชวนเปิดประสบการณ์นั่งรถรางชมเมืองที่จะพาทุกท่านย้อนเรื่องราวแห่งประวัติศาสตร์การสร้างเมืองเชียงราย และจุดสำคัญต่างๆ จำนวน 18 จุด (นั่งรถรางฟรี) ช่วงเวลาออกรถ 18:30-19:30 น. 19.00-20.00 น. 19.30-20.30 น. 20.00-21.00 น. จุดบริการขึ้นรถราง ณ สวนตุงและโคมนครเชียงราย (ขึ้น-ลง เพียงจุดเดียว) สอบถามข้อมูลเพิ่มเติมได้ที่ เทศบาลนครเชียงราย: 053-711333 ททท.สำนักงานเชียงราย: 053-744674-5
งานพ่อขุนเม็งรายมหาราชและงานกาชาดปี 2567 (26 มกราคม - 4 กุมภาพันธ์ 2567)
ททท.สำนักงานเชียงราย ขอเชิญชวนนักท่องเที่ยวทุกท่านร่วมเฉลิมฉลองเมืองเชียงรายครบรอบ762 ปี และงาน "พ่อขุนเม็งรายมหาราชและงานกาชาดปี 2567" วันที่ 26 มกราคม - 4 กุมภาพันธ์ 2567 ณ บริเวณสนามบินฝูงบิน 416 (สนามบินเก่า) จังหวัดเชียงราย ปีนี้จัดงานอย่างยิ่งใหญ่ เพื่อเป็นการรำลึกถึงพ่อขุนเม็งรายมหาราชที่ทรงสร้างเมืองเชียงราย เมื่อวันที่ 26 มกราคม 2567 ชมการประดับไฟ ตกแต่งบริเวณอาคารสถานที่ สวยงามทุกมุมเมือง โดยมีกำหนดพิธีเปิดงานวันที่ 26 มกราคม 2567 เปิดไฟสว่างไสวพร้อมกัน 3 จุด บริเวณเวทีกลางในงานพ่อขุนเม็งราย ฯ , วัดร่องเสือเต้น และบริเวณสวนตุงและโคมจังหวัดเชียงราย
เชิญชมการแสดงมหรสพ ความบันเทิง และชมคอนเสิร์ตจากศิลปินที่มีชื่อเสียงโด่งดังมากมาย อาทิเช่น แบงค์ ปริติ, Silly fools, L.ก.ฮ, Rachyo, 1 mill+fixed, Sek loso, Lomosomic, rachyo, mahahing และวงกางเกง ????ร่วมสนุกกับกิจกรรมที่มีความแตกต่างและหลากหลายจากแต่ละบูธของแต่ละอำเภอและหน่วยงานต่างๆ และชวนชิมอาหารและเครื่องดื่มอร่อยๆ ภายในตลอดงานทั้ง 10 วัน 10 คืน
สอบถามรายละเอียดเพิ่มเติมได้ที่ เทศบาลนครเชียงราย โทร.053 711 333 หรือ ททท.สำนักงานเชียงราย โทร. 053 744 674-5 พิธีเสี่ยงทายธิดาข้าวทิพย์ 2567 ตานข้าวใหม่ ใส่บาตรหลวง
เวียง มหาวิทยาลัยพะเยา ขอเชิญชวนบุคลากร นิสิต มหาวิทยาลัยพะเยา เข้าร่วมงาน… พิธีเสี่ยงทายธิดาข้าวทิพย์ 2567 “ตานข้าวใหม่ ใส่บาตรหลวง” วันที่ 26 มกราคม 2567 เวลา 17.00 เป็นต้นไป ณ ลานข่วงวัฒนธรรม อนุสาวรีย์พ่อขุนงำเมือง ริมกว๊านพะเยา
การจัดการแฟร์ครั้งที่19 : Under the lake 26-28 มกราคม 2567
การจัดการแฟร์ครั้งที่19 : Under the lake 26-28 มกราคม 2567 ณ ลานอเนกประสงค์ (บริเวณถนนคนเดินกว๊านพะเยา) โดยมีกิจกรรมมากมายอาทิ เช่น - การเสวนาทางธุรกิจ - การออกร้านของนิสิตชั้นปีที่ 2 - การออกร้านของนักเรียนโรงเรียนสาธิตฯ - การออกร้านของวิสาหกิจชุมชน และ OTOP พะเยา - การออกงานของพ่อค้าแม่ค้าทั่วไปจังหวัดพะเยา - การแสดงโชว์ความสามารถของนิสิตชั้นปีที่ 1 - การประกวด BM MUSIC CONTEST - การประกวด Cover Dance - การแข่งขันกินก๋วยเตี๋ยวอันเจริญ - การประกวดหนูน้อย Little Mermaid 2024 - การประกวด Miss Queen Paradise 2024
นัดพบแรงงานใหญ่ 26 - 27 มกราคม 2567
งาน “นัดพบแรงงานใหญ่” สำนักงานจัดหางานจังหวัดลำปาง ขอเชิญชวนนายจ้างและสถานประกอบการที่สนใจหรือต้องการรับสมัครงาน รวมถึงผู้ว่างงานที่สนใจอยากจะสมัครงาน เข้าร่วมงาน “นัดพบแรงงานใหญ่” ระหว่างวันที่ 26 - 27 มกราคม 2567 ณ อาคารบุญชูตรีทอง โรงเรียนบุญวาทย์วิทยาลัย
เกษตรแฟร์ 2024 (GMS Agri & Food 2024) 26 มกราคม – 4 กุมภาพันธ์ 2567
งาน “เกษตรแฟร์ 2024 (GMS Agri & Food 2024)” ระหว่างวันที่ 26 มกราคม – 4 กุมภาพันธ์ 2567 บริเวณสนามทุ่งศรีเมืองอุดรธานี
หอการค้าจังหวัดอุดรธานี บูรณาการร่วมกับจังหวัดอุดรธานี หน่วยงานสังกัดกระทรวงเกษตรและสหกรณ์ จังหวัดอุดรธานี องค์การบริหารส่วนจังหวัดอุดรธานี เทศบาลนครอุดรธานี ส่วนราชการ หน่วยงานภาครัฐและภาคเอกชน รวมถึงองค์กรพันธมิตรและเครือข่ายที่เกี่ยวข้อง จัดงาน“เกษตรแฟร์ 2024 (GMS Agri & Food 2024)” ระหว่างวันที่ 26 มกราคม – 4 กุมภาพันธ์ 2567 ณ สนามทุ่งศรีเมืองอุดรธานี โดยมีวัตถุประสงค์เพื่อสร้างโอกาสทางการตลาดให้กับสินค้าเกษตรคุณภาพ สอดคล้องกับนโยบายของรัฐบาล และขับเคลื่อน ภาคเกษตร เตรียมความพร้อมให้กับผู้ประกอบการรายย่อย ในงานพืชสวนโลกในปี 2569 เผยแพร่และสร้างโอกาสให้กับเกษตรกร สามารถพัฒนาระบบตลาดสินค้าเกษตรคุณภาพรวมถึงการส่งเสริมการท่องเที่ยว สร้างการรับรู้ให้กับจังหวัดอุดรธานี เป็นเมืองไมซ์ซิตี้ ภายในงานประกอบด้วยกิจกรรมต่างๆ อาทิ โซนของกระทรวงเกษตรและสหกรณ์ พบกับกิจกรรมของหน่วยงาน เกษตรและสหกรณ์จังหวัด, เกษตรจังหวัด, ประมงจังหวัด, ปศุสัตว์จังหวัด, ศูนย์หม่อนไหมเฉลิมพระเกียรติฯ อุดรธานี รวมถึงผลิตภัณฑ์เกษตรคุณภาพสูงจาก Young Smart Farmer และพืชสมุนไพรของสำนักงานสาธารณสุขจังหวัดอุดรธานี และกิจกรรมส่งเสริมอาชีพจากสถาบันพัฒนาฝีมือแรงงาน 18 อุดรธานี โซนการแสดงสินค้า และนวัตกรรมของผู้ให้การสนับสนุน โซนที่ 3 สินค้าจากของดี 4 ภาค และ Street food – Food tuck โซนวิถีคนวิถีควาย ผลิตภัณฑ์ผ้าขิดลายควาย “จากผืนนา สู่ผืนผ้า” ภูษาขิดกาษรอุดรธานี สินค้าของที่ระลึก กิจกรรมภายในงานตลอด 10 วัน อาทิเช่น กิจกรรมการรีดเส้นจากวดพลาสติก, ตู้หยอดเหรียญอัตโนมัติ, ชมการแสดงโชว์ปลาสวยงามและนิทรรศการ, Land mark พืชสวนโลก, งานประกวดกบพ่อพันธุ์ – แม่พันธุ์, การประกวดอาหารเมนูจากกบ “กบทอดกระเทียมพริกไทย” การการแข่งขันอาหาร Udonthani Beef และพบกับเชฟชื่อดัง เชฟชุมพล แจ้งไพร, แฟชั่นโชว์ผ้าไทยใส่ให้สนุก, ประกวดหนูน้อยเกษตรแฟร์, การแสดงคีตตะกวีมวยไทย, กิจกรรมการประกวดภาพถ่ายรับเงินรางวัล, กิจกรรมการประกวดเมนูเสืออุดรฟิวชั่น “เสืออุดรไม่ร้องไห้” การแสดงจากเยาวชน จากองค์การบริหารส่วนจังหวัดอุดรธานี และเทศบาลนครอุดรธานี, การแข่งขันกีฬา เพื่อส่งเสริมและพัฒนาการพลศึกษา สุขภาพ การกีฬา นันทนาการ กิจกรรมส่งเสริมการขาย (นาทีทอง) สินค้าอาทิ ไข่ไก่ จากธงฟ้าของกระทรวงพาณิชย์ น้ำมันพืช รวมทั้งสินค้าอุปโภค บริโภค ราคาต่ำกว่าท้องตลาดทุกวัน
งานสังคมสุขใจ ครั้งที่ 9 วันที่ 26 – 28 มกราคม 2567
งานสังคมสุขใจ ครั้งที่ 9 “รวมพลังขับเคลื่อนสังคมอินทรีย์” วันที่ 26 – 28 มกราคม 2567 ณ สวนสามพราน จ.นครปฐม เข้างานฟรี !! สอบถามข้อมูลเพิ่มเติม สวนสามพราน โทร. 034-322588
งานสืบสานวัฒนธรรมเบื้องบูรพา และงานกาชาดจังหวัดสระแก้ว ประจำปี 2567 วันที่ 26 มกราคม - 3 กุมภาพันธ์ 2567
งานสืบสานวัฒนธรรมเบื้องบูรพา และงานกาชาดจังหวัดสระแก้ว ประจำปี 2567
26 มกราคม - 3 กุมภาพันธ์ 2567 ณ บริเวณอุทยานพุทธมณฑลสระแก้ว ตำบลท่าเกษม อำเภอเมืองสระแก้ว จังหวัดสระแก้ว รวม 9 วัน 9 คืน ร่วมทำบุญพร้อมลุ้นรับของรางวัลมากมายทุกวันกับร้านมัจฉากาชาด และลุ้นรับรางวัลใหญ่ ทองคำแท่ง มูลค่า 1 ล้านบาท เพียงซื้อสลากกาชาดในราคา 50 บาทเท่านั้น ชม ชิม ช็อป ร้านค้าต่างๆ มากมายภายในงาน และชมการแสดงศิลปวัฒนธรรมและการแสดงดนตรี ฟรีตลอดงาน
- วันที่ 26 มกราคม 2567 พิธีเปิดงาน “สืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาดจังหวัดสระแก้ว ประจำปี 2567 และกิจกรรมการเดินแบบผ้าไทย เพื่อส่งเสริมและสนับสนุนการสวมใส่ผ้าไทย สร้างค่านิยม สืบสาน รักษามรดกและอัตลักษณ์ภูมิปัญญาไทย
- วันที่ 27 มกราคม 2567 เชิญชมการประกวด วงดนตรีของนักเรียน นักศึกษา ในจังหวัดสระแก้ว
- วันที่ 28 มกราคม 2567 พบกับการแสดงของศิลปิน มนต์แคน แก่นคูณ ได้รับการสนับสนุนจาก บริษัท น้ำตาลนิวกว้างสุ้นหลี จำกัด
- วันที่ 29 มกราคม 2567 เชิญชมการประกวดร้องเพลง กำนัน ผู้ใหญ่บ้าน และผู้บริหารองค์กรปกครองส่วนท้องถิ่น
- วันที่ 30 มกราคม 2567 เชิญชมการประกวดเต้น Cover dance
- วันที่ 31 มกราคม 2567 พบกับการแสดงของศิลปิน แอน อรดี ได้รับการสนับสนุนจาก บริษัท ฮอนด้า ประสิทธิ์มอเตอร์สระแก้ว 2554 จำกัด
- วันที่ 1 กุมภาพันธ์ 2567 พบกับการแสดงของศิลปิน จ๊ะ อาร์สยาม ได้รับการสนับสนุนจาก สมาคมสันนิบาตเทศบาลจังหวัดสระแก้ว
- วันที่ 2 กุมภาพันธ์ 2567 พบกับการแสดงของศิลปิน ครูเต้ย อภิวัฒน์ ได้รับการสนับสนุนจาก บริษัท น้ำตาลและอ้อยตะวันออก จำกัด (มหาชน)
- วันที่ 3 กุมภาพันธ์ 2567 ชมการออกรางวัลสลากกาชาด โดยรางวัลที่ 1 เป็นรางวัลทองคำแท่ง มูลค่า 1 ล้านบาท และเชิญชมการแสดงของศิลปิน เบิ้ล ปทุมราช ได้รับการสนับสนุนจาก คุณมนัส ตันเฮง
26 มกราคม - 3 กุมภาพันธ์ 2567 พบกันในงาน “สืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาดจังหวัดสระแก้ว ประจำปี 2567” ณ บริเวณอุทยานพุทธมณฑลสระแก้ว ตำบลท่าเกษม อำเภอเมืองสระแก้ว และลงทะเบียนจับจองร้านขายสินค้าฟรี ทั้ง 9 วัน
26 มกราคม โรงพยาบาลสุราษฎร์ธานี รับบริจาคอวัยวะ ชายอายุ 21 ปี
26 มกราคม 2567 โรงพยาบาลสุราษฎร์ธานี รายงานการรับบริจาคอวัยวะ นายวิชิตชัย ชอบประดิษฐ อายุ 21 ปี ได้มารักษาตัวในโรงพยาบาลสุราษฎร์ธานี และได้เสียชีวิตลง วันที่ 26 มกราคม 2567 ญาติได้ตัดสินใจทำบุญครั้งสุดท้ายให้กับผู้เสียชีวิตโดยการบริจาคอวัยวะ ได้แก่ หัวใจ ไต 2 ข้าง ดวงตา 2 ข้าง สามารถนำอวัยวะไปช่วยชีวิตผู้อื่นได้ เก็บอวัยวะโดยทีม ART โรงพยาบาล สุราษฎร์ธานี นายแพทย์ปณิธาน สื่อมโนธรรม ผู้อำนวยการโรงพยาบาลสุราษฎร์ธานี คณะผู้บริหาร เจ้าหน้าที่ พร้อมด้วยตัวแทนจากสภากาชาดไทย เป็นตัวแทนทำการเคารพศพผู้บริจาคอวัยวะ มอบพวงหรีด จากศูนย์รับบริจาคอวัยวะสภากาชาดไทย ศูนย์รับบริจาคดวงตาสภากาชาดไทย และ โรงพยาบาลสุราษฎร์ธานี โดยมีญาติเป็นผู้รับมอบ ขอให้บุญกุศลดังกล่าวจงส่งผลให้ผู้เสียชีวิตไปสู่ภพภูมิที่ดี
ดนตรีในสวน บึงพระราม 26 มกราคม 2567
ขอเชิญชม ดนตรีในสวน 26 มกราคม 2567 นี้ 16.30-21.00 น. ณ ลานน้ำพุช้าง บึงพระราม
งานวิ่ง Pong Mabprachan run 2024 ( 27 มกราคม 2567 )
Pong Mabprachan run 2024 วิ่งชิลล์…….วิวดี๊ดี ฟรีคอนเสิร์ต JoeyBoy ในวันเสาร์ที่ 27 มกราคม 2567 เวลา 16.00 เป็นต้นไป ณ สวนสาธารณะอ่างเก็บน้ำมาบประชัน ต.โป่ง อ.บางละมุง จ.ชลบุรี จัดและดำเนินงานโดย: เทศบาลตำบลโป่งร่วมกับชมรมวิ่งเพื่อสุขภาพเทศบาลตำบลโป่ง
เทศกาลอาหารนานาชาติเชียงใหม่ 27-28 มกราคม 2024
เทศกาลอาหารนานาชาติเชียงใหม่ วันที่ 27-28 มกราคม 2024 ณ โอลด์ เชียงใหม่ (ศูนย์วัฒนธรรมเชียงใหม่ ถ.วัวลาย) เวลา 10.00 - 22.00 น. สัมผัสกับรสชาติที่หลากหลายและร่วมเดินทางไปกับมรดกทางอาหาร จากหลากหลายวัฒนธรรม มาที่เดียวเหมือนได้เที่ยวทั่วเชียงใหม่ แบ่งเป็นโซน ดังนี้ โซน A กองกีดทัวร์ โซน B กินอาหารเมือง อาหารไทยทั่วทิศ โซน C อาหารนานาชาติและโรงแรมชั้นนำ โซน D อาหารจากชาติพันธุ์ โซน E ความรู้และนวัตกรรมอาหาร โซน F Chiang Mai Green Kitchen โซน G เวิร์คชอป โซน H Artisan Market โซน I Chefs Table
งานครบรอบ 15 ปี ถนนฅนเดิน ขอนแก่น วันเสาร์ที่ 27 มกราคม 2567
เทศบาลนครขอนแก่นขอเชิญชวนเที่ยวงานครบรอบ 15 ปี ถนนฅนเดิน ขอนแก่น วันเสาร์ที่ 27 มกราคม 2567 เวลา 16.30-22.00 น. ณ เวทีสวนรัชดานุสรณ์ ถนนฅนเดินขอนแก่น ในโครงการส่งเสริมแสดงสินค้าและผลิตภัณฑ์ชุมชน ประจำปีงบประมาณ 2567 และฉลองครบรอบ 15 ปี ถนนฅนเดินขอนแก่น พบกับ -สินค้าราคาถูก -กิจกรรมนาทีทอง -อาหารอร่อย -แห่กลองยาวและวงดนตรีสด จาก มหาวิทยาลัยขอนแก่น/โรงเรียนเทศบาลวัดกลาง/โรงเรียนเทศบาลบ้านศรีฐาน
งานเทนนิสไทยแลนด์ โอเพ่น 2024 วันที่ 27 มกราคม - 4 กุมภาพันธ์ 2024 อารีน่า หัวหิน สปอร์ตคลับ
งานเทนนิสไทยแลนด์ โอเพ่น 2024 จัดขึ้นระหว่างวันที่ 27 มกราคม - 4 กุมภาพันธ์ 2024 ณ อารีน่า หัวหิน สปอร์ตคลับ จังหวัดประจวบคีรีขันธ์ พบกับทัพนักกีฬาเทนนิสชื่อดังระดับโลกเข้าร่วมแข่งขัน นำโดย ‘จู หลิน’ ดีกรีแชมป์ปีที่แล้วที่จะมาป้องกันแชมป์ ‘แม็กด้า ลีเน็ตต์’ มือ 22 ของโลก และ ‘พอลล่า บาโดซ่า’ อดีตมือ 2 ของโลก นอกจากนี้ยังมีนักกีฬาเทนนิสฝีมือดีอีกหลายคน นี่แค่คร่าว ๆ ก็เรียกได้ว่าทั้งหมดเป็นนักกีฬาที่มีฝีมือโดดเด่นไม่แพ้กันเลยสักคน ทั้งนี้แฟนเทนนิสยังสามารถรับชมการถ่ายทอดสดได้ทางทรูสปอร์ต 2 และ ททบ.5 โดยรอบคัดเลือก แข่งขันระหว่างวันที่ 27 - 28 มกราคม 2024 และรอบเมนดรอว์ แข่งขันระหว่างวันที่ 29 มกราคม - 4 กุมภาพันธ์ 2024 รายการเทนนิส ไทยแลนด์ โอเพ่น 2024 ถือได้ว่าเป็นการจัดรายการระดับโลกที่ใหญ่ที่สุดในเอเชียตะวันออกเฉียงใต้ ซึ่งได้รับความสนใจจากนักเทนนิสอันดับต้น ๆ ของโลกและแฟนเทนนิสเป็นจำนวนมาก
hua hin tattoo festival 2024 (27 - 28 January 2024)
งาน hua hin tattoo festival 2024 งานที่รวมตัวช่างสักระดับประเทศหลายท่านไว้ในงานเดียว ทั้งช่างสักรุ่นเก๋า และ ช่างสักรุ่นใหม่ และประกวดงานสักอีกหลายๆ ประเภท ไม่ว่าจะเป็น - Realistic - Mandala - Minimal - Japanese - New School - Old School - Māori, Polynesian, Tribal และอื่นๆ อีกมากมาย ที่ Event Port 1 ชั้น 1 บลูพอร์ตหัวหิน 27 - 28 January 2024
รถโรงหนังเฉลิมทัศน์ ณ เชียงราย (27 ม.ค. – 7 ก.พ. 2567)
รถโรงหนังเฉลิมทัศน์ โดย หอภาพยนตร์ (องค์การมหาชน) ออกเดินทางสู่จังหวัดเชียงราย เพื่อจัดกิจกรรมรถโรงหนัง ฉายภาพยนตร์แก่เด็กนักเรียน-ครู ประชาชน และเข้าร่วมเป็นส่วนหนึ่งของงานมหกรรมศิลปะร่วมสมัยนานาชาติ Thailand Biennale, Chiang Rai 2023 จุดฉาย (จัดฉายภาพยนตร์โปรแกรมพิเศษ)* ศาลากลางจังหวัดเชียงรายหลังเก่า อ.เมืองเชียงราย วันที่ 27 ม.ค. – 7 ก.พ. 2567 (12 วัน) ไม่เสียค่าใช้จ่ายในการเข้าร่วมกิจกรรม รอบประชาชน จันทร์ - ศุกร์ เวลา 17.00 น. / เสาร์-อาทิตย์ ฉาย 2 รอบ เวลา 14.00 / 17.00 น. สามารถขอรับตั๋วได้ฟรี ก่อนเวลาฉาย 30 นาที
Amazing Thailand Wawee Festival 27-28 มกราคม 2567
งาน Amazing Thailand Wawee Festival วันที่ 27 - 28 มกราคม 2567 ลานกิจกรรมวาวีเฟสติวัล ดอยวาวี อ.แม่สรวย จ.เชียงราย (เข้าชมฟรี) เทศกาลสุดชิลล์ บนยอดดอยวาวี หมู่บ้านต้นชาระดับตำนานที่สืบสานการปลูกชามายาวนานกว่า 800 ปี บรรยากาศดอยวาวีไม่มีเหงา เพราะมี การประดับไฟบนยอดดอยวาวีสุดตระการตา ร้านอาหารและฟู๊ดทรัครสเด็ด ที่ขนความอร่อยมากันจนล้นดอย คอนเสิร์ตสุดมันส์จากหลากหลายศิลปินมากหน้าหลายตา ไปสัมผัสตำนานบนยอดดอยวาวีไปพร้อมกัน
งานเจี๊ยะ โม่ง โร่ง โม่น เดิง ราชบุรี : กินอยู่ดูมอญ เมืองราชบุรี ครั้งที่ 8 (27 - 28 มกราคม 2567)
งานสร้างสรรค์วัฒนธรรมชุมชนมอญ “ เจี๊ยะ โม่ง โร่ง โม่น เดิง ราชบุรี : กินอยู่ดูมอญ เมืองราชบุรี ครั้งที่ 8 ประจำปี 2567 ” มหกรรมอาหารและศิลปวัฒนธรรมมอญ ยิ่งใหญ่ระดับประเทศ ระหว่างวันที่ 27 - 28 มกราคม 2567 ตั้งแต่เวลา 10.00 - 20.00 น. ณ วัดมะขาม ตำบลคุ้งพยอม อำเภอบ้านโป่ง จังหวัดราชบุรี - พบกับกิจกรรมมากมาย - การประกวดสำรับอาหารมอญ (เปิดชิมฟรี) - แจกสูตรการทำอาหารจากผู้ชนะเลิศการแข่งขัน (เจี๊ยะโม่งฯ ครั้งที่ 7) - ร้านอาหารมอญสูตรโบราณ จากทั่วประเทศ - ตลาดสินค้าหัตถกรรม วีถีวัฒนธรรมมอญ - การแสดงศิลปวัฒนธรรม ทั้งแล่นทั้งรำ จากศิลปินระดับครูนาฏศิลป์ - และกิจกรรมอื่น ๆ พิเศษ ‼️ ครั้งแรกกับการร่วมห่มผ้าพระเจดีย์ทรงมอญ เก่าแก่กว่า 200 ปี เป็นอีกหนึ่งเจดีย์ที่สวยที่สุดในประเทศไทย มาชิม-ช้อป-เที่ยว-เช็คอิน-ถ่ายรูป-ทำบุญไปด้วยกัน
การแข่งขันอีสปอร์ตจังหวัดสมุทรสาคร 27 - 28 มกราคม 2567
การแข่งขันอีสปอร์ตจังหวัดสมุทรสาคร วันที่ 27 - 28 มกราคม 2567 ตั้งแต่เวลา 09.00 น. เป็นต้นไป ณ ศูนย์การค้า พอร์โต้ ชิโน่
การประมูลสุนัขทหารไม่ผ่านเกณฑ์ที่ศูนย์การสุนัขทหารที่ปากช่อง เสาร์ที่ 27 มกราคม 2567
การประมูลสุนัขทหารไม่ผ่านเกณฑ์ที่ศูนย์การสุนัขทหารที่ปากช่อง จ.นครราชสีมา เสาร์ที่ 27 มกราคม 2567 เวลา 08:00 น. รอบนี้มีสุนัขทหารไม่ผ่านเกณฎ์ทั้งหมด 54 ตัว มีพันธุ์ลาบราดอร์ เยอรมันเชฟเปิร์ด และมาลีนอยส์ ใครไปร่วมกันประมูลได้ไปนะคะ เด็กๆ นิสัยดีทุกตัวค่ะ
การแสดง มินิไลท์ แอนด์ ซาวน์ พิมาย ชุด วิมายะนาฏการ อุทยานประวัติศาสตร์พิมาย (27 มกราคม 2567)
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครราชสีมาร่วมกับอุทยานประวัติศาสตร์พิมาย ขอเชิญชวนนักท่องเที่ยวร่วมชมการแสดง มินิไลท์ แอนด์ ซาวน์ พิมาย ชุด "วิมายะนาฏการ" ในวันเสาร์ที่ 27 มกราคม 2567 ตั้งแต่เวลา 16.00 น. เป็นต้นไป ณ อุทยานประวัติศาสตร์พิมาย อำเภอพิมาย จังหวัดนครราชสีมา ภายในงานมีกิจกรรมที่น่าสนใจ อาทิ
- การเลือกซื้ออาหารถิ่น และอาหารมิชลินโคราช ในตลาดย้อนยุค พิมายพันปี
- บายศรีสู่ขวัญให้แก่นักท่องเที่ยว โดยผู้เฒ่าผู้แก่ในเมืองพิมาย
- การแสดงดนตรีไทย จากโรงเรียนพิมายวิทยา และกิจกรรมขยะให้โชค
สอบถามข้อมูลเพิ่มเติมได้ที่ ททท. สำนักงานนครราชสีมา โทร 044-213666, 044-213030
CRAFT BOX SAKAEO VOL.2 เสาร์-อาทิตย์ 27 – 28 มกราคม 2567
CRAFT BOX SAKAEO VOL.2 MUTELU MARKET ตลาดนัดสายมู เสาร์-อาทิตย์ 27 – 28 มกราคม 2567 ณ ลานเพลิน หลังบิ๊กซี สระแก้ว 16.00-23.00 น. เดินตลาดนัดแนวใหม่ ตลาดนัดแนวมงคลชีวิต มาดูดวง มาตามหาเนื้อคู่ มาเดินเล่น สอยดาวลุ้นโชค มาช็อปปิ้ง จูงมือบุตร ฉุดมือหลาน ประสานมือเพืัอนฝูง มาพักผ่อนหย่อนใจ พร้อมเครื่องดื่มเย็นๆ ฟังเพลงเพลินๆ อาหาร ขนม กับแกล้ม หลากหลาย ครบทุกสายเหมือนเดิม
งานประจำปี มะขามหวาน นครบาลเพชรบูรณ์ 27 ม.ค. - 4 ก.พ. 2567
จังหวัดเพชรบูรณ์ ร่วมกับ การท่องเที่ยวแห่งประเทศไทย องค์การบริหารส่วนจังหวัดเพชรบูรณ์ ขอเชิญเที่ยวงานประจำปี มะขามหวาน นครบาลเพชรบูรณ์ 27 ม.ค. 67 - 4 ก.พ. 67 ณ บริเวณหน้าศาลากลางจังหวัดเพชรบูรณ์. ชม ขบวนแห่รถบุปผชาติและธิดามะขามหวาน
การประกวดสาวนครบาลเพชรบูรณ์ ตลาดนัดมะขามหวานจากเกษตรกร การประกวดมะขามหวานชิงถ้วยพระราชทาน การแสดงสินค้า OTOP ผลิตภัณฑ์ชุมชน ชม ชิม ช็อป อาหารพื้นเมือง ลานวัฒนธรรม
27 ม.ค. 67 แบมแบม แก้มใส
28 ม.ค. 67 ดิว วิทวัส
29 ม.ค. 67 มินตรา อินทิรา
30 ม.ค. 67 แอน อรดี
31 ม.ค. 67 หมอลำ ระเบียบวาทะศิลป์
1 ก.พ. 67 พลอย พุ่มพวง
2 ก.พ. 67 เจทีแบนด์ เพชรบูรณ์
3 ก.พ. 67 เพชร สหรัตน์
4 ก.พ. แนนซี่ ท็อปไลน์
มหกรรมคอนเสิร์ต ชมฟรี
งานเทศกาลตรุษจีน แขวนโคม ขอพร ปีมังกร สุขสันต์ วิหารกวนอิม อี่ ทง เทียน ไท้ เครือสหพัฒน์ กบินทร์บุรี
ขอเชิญชวนร่วมงานเทศกาลตรุษจีน “ แขวนโคม ขอพร ปีมังกร สุขสันต์ ” วันที่ 27 มกราคม – 3 มีนาคม 2567 เวลา 8.00 น. – 20.00 น. (หลังจากสองทุ่มยังสามารถเข้ามาถ่ายรูปได้) ณ วิหารกวนอิม อี่ ทง เทียน ไท้ เครือสหพัฒน์กบินทร์บุรี จังหวัดปราจีนบุรี กิจกรรมในงาน - ถ่ายรูป + เช็คอิน รับฟรีของที่ระลึก - บูชาชุดเสริมเฮง - แขวนโคมขอพรพร้อมติดคำอธิษฐาน
นิทรรศการแฟชั่นและผ้าไทยโบราณ 28 มกราคม - 11 กุมภาพันธ์ 2567
นิทรรศการแฟชั่นและผ้าไทยโบราณ สะท้อนความอลังการแห่งความเป็นไทย จาก“อาจารย์โสภาส ณ ตะกั่วทุ่ง” สุดยอดศิลปินนักพันผ้าแนวหน้าเมืองไทย และ “อาจารย์สงคราม งามยิ่ง“ ครูศิลป์ของแผ่นดิน 2562 จากสถาบันส่งเสริมศิลปหัตถกรรมไทย (องค์การมหาชน) ตั้งแต่ 28 มกราคม - 11 กุมภาพันธ์ 2567 เวลา 11.00 - 21.00 ณ Proud Thai, B Floor, บลูพอร์ต หัวหิน
มหกรรมดนตรีแจ๊ส Bluport Jazz Concert Mr. Igor Butman (28 ม.ค 67)
บลูพอร์ต หัวหิน จัดให้ชมฟรีกับงาน " Bluport Jazz Concert Mr. Igor Butman " ศิลปินระดับโลกพร้อมมามอบความสุขและรอยยิ้มให้ทุกท่าน โดยวัตถุประสงค์ของการจัดงาน ได้จัดขึ้นเพื่อช่วยกระตุ้นการท่องเที่ยวในเมืองหัวหิน และสร้างความแน่นเฟ้นในโอกาสครบรอบ 125 ปี ความสัมพันธ์ทางการทูต ระหว่างไทยและรัสเซียโดยได้เชิญศิลปิน อิกอร์ บุตแมน (Mr. Igor Butman) เป็นศิลปินแห่งชาติรัสเซีย, นักดนตรีแจ๊สที่มีชื่อเสียงระดับโลก ผู้ควบคุมวง Moscow Jazz orchestra และได้รับรางวัลศิลปินแห่งชาติจากประธานาธิบดีรัสเซียในปี ค.ศ 2021 ที่ครั้งนี้มาพร้อมกับวงดนตรี Igor Butman Quintet ซึ่งเป็นวงที่รวบรวมนักดนตรีแจ๊สรุ่นใหม่มากความสามารถจากรัสเซียมาด้วย
Igor Butman Quintet เคยได้รับเชิญไปแสดงคอนเสิร์ตในสหรัฐอเมริกา และประเทศต่าง ๆ ในยุโรปและเอเชีย รวมทั้ง การร่วมแสดงในเทศกาลดนตรีแจ๊สนานาชาติที่มีชื่อเสียงทั่วโลก วงดนตรีนำโดย Igor Butman ศิลปินแห่งชาติและนักดนตรีแจ๊สที่มีชื่อเสียงมากที่สุดในรัสเซีย และนักดนตรีแจ๊สมากความสามารถ ได้แก่ Oleg Akkuratov (นักเปียโนและนักร้องนำ ผู้ได้รับรางวัลรองชนะเลิศ Sarah Vaughan International Jazz Vocal Competition 2018) Evgeny Pobozhiy (มือกีตาร์ ผู้ได้รับรางวัลชนะเลิศจาก Herbie Hancock International Institute of Jazz Guitar Competition 2019 ) Nikolay Zatolochnyy มือดับเบิลเบส และ Eduard Zizak มือกลอง และนอกจากนี้ ภายในงานยังมีไฮไลท์พิเศษที่สำคัญกับ โชว์วาดรูปศิลปะไทย-รัสเซีย โดยอาจารย์วรรณวิมล เกษางาม ผู้อำนวยการโรงเล่นศิลปะ หมู่บ้านศิลปิน หัวหิน ร่วมกับศิลปินชาวรัสเซีย และ ภายในงานมีการออกบู๊ทจำหน่ายอาหาร เครื่องดื่ม จากร้านดังมากมาย มาให้ชิม ช้อป และดื่มด่ำไปกับความกลมกล่อมของบรรยากาศดนตรีแจ๊สในยามค่ำคืน
ในโอกาสนี้ จึงขอเชิญชวนชาวหัวหิน นักท่องเที่ยวทั้งชาวไทยและชาวต่างชาติ ร่วมเฉลิมฉลองและดื่มด่ำกับดนตรีในงาน " Bluport Jazz Concert Mr. Igor Butman " ศิลปินแจ๊สระดับโลกและศิลปินแห่งชาติชาวรัสเซีย ในวันอาทิตย์ ที่ 28 ม.ค 67 เวลา 18.00 น. เป็นต้นไป ณ ลานเดอะสแควร์ บลูพอร์ตหัวหิน สอบถามข้อมูลเพิ่มเติมได้ที่ โทร.032-905-111
กิจกรรม Surasakmontri Army Run 2024 วิ่งนี้เพื่อน้องชายแดน 28 มกราคม 2567
กิจกรรม Surasakmontri Army Run 2024 วิ่งนี้เพื่อน้องชายแดน วันอาทิตย์ ที่ 28 มกราคม 2567 ณ ค่ายพระยาสุนทรธรรมธาดา (ค่ายรามสูร) ต.โนนสูง อ.เมืองอุดรธานี จ.อุดรธานี
เที่ยวเมืองนนท์ ยลวิถีเจ้าพระยา วันอาทิตย์ที่ 28 มกราคม 2567
กิจกรรมวันเดียว เที่ยวเมืองนนท์ ยลวิถีเจ้าพระยา ในวันอาทิตย์ที่ 28 มกราคม 2567 ลงเรือ ณ ท่าน้ำนนท์ เยี่ยมชม 1 วัดเฉลิมพระเกียรติวรวิหาร 2 วัดเขมาภิรตารามราชวรวิหาร 3 วัดใหญ่สว่างอารมณ์ 4 เกาะเกร็ด อีกทั้งภายในงานยังมีกิจกรรมให้ร่วมสนุกมากมาย อาทิเช่น แต่งกายชุดไทยมาล่องเรือและโพสภาพใส่ชุดไทยถ่ายคู่กับแหล่งท่องเที่ยวในวันงาน ลุ้นรับของที่ระลึก เป็นต้น สอบถามรายละเอียดเพิ่มเติมได้ที่ 094 896 4193 คุณรัชนก,096 981 5171 คุณณัฐชา
วิถีน่าน วิถีถิ่น วิถีไทย ประจำปี 2567 (31 มกราคม 2567 - 4 กุมภาพันธ์ 2567)
วิถีน่าน วิถีถิ่น วิถีไทย ประจำปี 2567 ชมรมผู้ประกอบการค้าอาหารจังหวัดน่าน ขอเชิญเที่ยว งานมหกรรมอาหาร "วิถีน่าน วิถีถิ่น วิถีไทย ประจำปี 2567" ครั้งที่ 15 วันที่ 31 มกราคม 2567 - 4 กุมภาพันธ์ 2567 ณ ลานจอดรถ ห้างสรรพสินค้านราไฮเปอร์มาร์ท ภายในงานพบกับ 1. การจำหน่ายอาหารกว่า 30 บูธ 2. การประกวดนักร้อง และหางเครื่อง 3. การแสดงดนตรีศิลปิน เดอะเพอะ 4. การแสดงวงตนตรี วงไดนามิก และ วงสมาย 5. การแสดงรำวงสาวงามไดนามิกแดนซ์ 6. การประกวดแข่งขัน"แกงแคไก่เมือง"
Sisaket Trade Fair 2024 (30 มกราคม - 3 กุมภาพันธ์ 2567)
Sisaket Trade Fair 2024 งานแสดงและจำหน่ายสินค้าเชื่อมโยงกับประเทศเพื่อนบ้าน Sisaket Trade Fair 2024 ระหว่างวันที่ 30 มกราคม - 3 กุมภาพันธ์ 2567 เวลา 10.00 - 20.00 น. เป็นต้นไป ณ สนามหน้าศาลากลางจังหวัดศรีสะเกษ ชมการแสดงดนตรีทุกคืน 30 มกราคม - เอิ้นขวัญ วรัญญา 31 มกราคม - ธัญญ่า อาร์สยาม 1 กุมภาพันธ์ - ไผ่ พงศธร 2 กุมภาพันธ์ - ศาล สานศิลป์ 3 กุมภาพันธ์ - เต๋า ภูศิลป์
เทศกาลส้มโอขาวใหญ่และของดีสมุทรสงคราม 31 ม.ค. – 4 ก.พ. 2567
งานเทศกาลส้มโอขาวใหญ่และของดีสมุทรสงคราม ระหว่างวันที่ 31 มกราคม – 4 กุมภาพันธ์ 2567 ณ บริเวณหน้าศาลากลางจังหวัดสมุทรสงคราม ภายในงานแต่ละวันจะเปิดตั้งแต่เวลา 09.00 -18.00 น. นักท่องเที่ยวจะได้ชิมและเลือกซื้อส้มโอพันธุ์ขาวใหญ่จากชาวสวนโดยตรงในราคาย่อมเยา การจำหน่ายผลิตภัณฑ์ชุมชน สินค้า OTOP จากทั้ง 3 อำเภอของสมุทรสงคราม
เทศกาลส้มโอขาวใหญ่และของดีสมุทรสงคราม 2567 วันที่ 31 มกราคม – 4 กุมภาพันธ์ 2567
งาน “เทศกาลส้มโอขาวใหญ่และของดีสมุทรสงคราม” ประจำปี 2567 ณ บริเวณศาลากลางจังหวัดสมุทรสงคราม อำเภอเมืองฯ จังหวัดสมุทรสงครามระหว่างวันที่ 31 มกราคม – 4 กุมภาพันธ์ 2567 ภายในงานมีกิจกรรมมากมาย อาทิ
• การออกร้านจำหน่ายส้มโอขาวใหญ่ และสินค้าเกษตร รวมทั้งสินค้ากลุ่มวิสาหกิจชุมชน OTOP , SMEs สินค้าปลอดภัย และสินค้าท้องถิ่นจากชุมชน กว่า 60 ร้าน
• กิจกรรมการประกวดคุณภาพส้มโอขาวใหญ่ และการประกวดเมนูจากส้มโอขาวใหญ่ลีลา
• การแสดงและนิทรรศการสินค้า GI ของ จังหวัดสมุทรสงคราม
• กิจกรรมการไลฟ์สดขายส้มโอในงาน ผ่านเพจ Facebook : สำนักงานพาณิชย์จังหวัดสมุทรสงคราม, ททท. สำนักงานสมุทรสงคราม และสำนักงานประชาสัมพันธ์จังหวัดสมุทรสงคราม พร้อมจัดส่งผ่านทาง บริษัท ไปรษณีย์ไทย จำกัด โดยเริ่มตั้งแต่เวลา 11.00 น. ตลอดทุกวันที่จัดงานฯ
• กิจกรรมจัดสรรสินค้านาทีทอง นาทีถูก อาทิ ส้มโอลูกละ 1 บาท เป็นต้น
จัดโดยจังหวัดสมุทรสงคราม ร่วมกับ สำนักงานพาณิชย์จังหวัดสมุทรสงคราม ททท. สำนักงานสมุทรสงคราม สำนักงานเกษตรจังหวัดสมุทรสงคราม ตลอดจนหน่วยงานภาครัฐ และเอกชน กำหนดจัดงาน “เทศกาลส้มโอขาวใหญ่และของดีสมุทรสงคราม” ประจำปี 2567 ระหว่างวันที่ 31 มกราคม – 4 กุมภาพันธ์ 2567 ณ บริเวณศาลากลางจังหวัดสมุทรสงคราม อำเภอเมืองฯ จังหวัดสมุทรสงคราม
ประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2566-2567
กำหนดการจัดงาน ประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2566-2567
ฉลองเทศกาลตรุษจีนปากน้ำโพ ปีที่108 จะจัดขึ้นระหว่างวันที่ 3-14 กุมภาพันธ์ 2567 (12 วัน 12คืน)
ถนนคนเดินอุ้มผาง ทุกวันศุกร์-เสาร์ ตั้งแต่ ตุลาคม 66 - กุมภาพันธ์ 67
ถนนคนเดินอุ้มผาง ทุกวันศุกร์-เสาร์ ตั้งแต่ ตุลาคม 66-กุมภาพันธ์ 67 พิชิต 1219 โค้ง มาลุยน้ำตกทีลอซู ล่องลำน้ำแม่กลอง ชิมอาหารถิ่น วิถีวัฒนธรรมชาวอุ้มผาง
ชมภาพบรรยากาศงานสักหน่อย บอกเลยว่าอาหารน่ากินสุดๆ สอบถามข้อมูลการเดินทาง การท่องเที่ยว สำนักงานตาก 055-514341-3 (เปิดจันทร์-ศุกร์ เวลา 08.30-16.30 น.)
โค้ง 33 จ.ตาก ก็มีนะ รู้ยัง
ไม่ใช่แค่น่านนะที่มีโค้ง 33 แต่จ.ตาก ก็มีเหมือนกัน สวยไม่แพ้กัน (บางมุมสวยกว่าอีก อิอิ) "โค้ง 33" จ.ตาก นี้ อยู่ที่
บ้านแม่โกนเกน เกาะมะนาว ต.มหาวัน อ.แม่สอด เป็นถนนคดโค้งสวยงาม คล้ายเลข 3 ซ้อนกันสองตัว เป็นเลข 33 สองข้างทางเป็นเนินหญ้าสลับกับไร่ข้าวโพดเขียวขจี *ภาพจากเพจ ททท.ตาก
งานประเพณีนบพระ–เล่นเพลง และงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2567 (22 กุมภาพันธ์ - 3 มีนาคม 2567)
งานประเพณีนบพระ–เล่นเพลง และงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2567 (22 กุมภาพันธ์ - 3 มีนาคม 2567) ขอเชิญเที่ยวงานประจำปี 2567 ทุกภาคทั่วประเทศไทยงานประเพณีนบพระ–เล่นเพลง และงานกาชาดจังหวัดกำแพงเพชร ประจำปี 2567 จัดระหว่างวันที่ 22 กุมภาพันธ์ - 3 มีนาคม 2567 ณ หน้าสนามที่ว่าการอำเภอเมือง จังหวัดกำแพงเพชร เพื่อเป็นการอนุรักษ์ขนบธรรมเนียม วัฒนธรรม และประเพณีอันดีงามของบรรพบุรุษไทยในอดีตกาล ให้อนุชนรุ่นหลังได้ยึดถือปฏิบัติเป็นแบบอย่าง ตลอดจนส่งเสริมการท่องเที่ยวภายในจังหวัด และร่วมสืบสานงานประเพณีอันเนื่องจากโบราณกาล เรื่องราวและตำนานประวัติศาสตร์ในแผ่นดินพระยาลิไทย ตอนเสด็จพระราชดำเนินมาถวายสักการบูชาพระบรมธาตุ อันเป็นจุดเริ่มต้นของงานประเพณี “นบพระ-เล่นเพลง” ในช่วงวันมาฆบูชา ขึ้น 15 ค่ำ เดือน 3 ชิมชมช็อปสินค้าภายในงาน ของดี ของเด็ด ของอร่อย มากมาย ชมการแสดง ดนตรี ความบันเทิงที่ขนมาเต็มเวทีทุกคืน สนุกสนานที่ร้านมัจฉากาชาด ลุ้นแจกรางวัลใหญ่ทุกวัน
งานแห่โคม ชมพระฉาย ครั้งที่ 10 (2 - 3 กุมภาพันธ์ 2567)
งาน แห่โคม ชมพระฉาย ครั้งที่ 10 วันที่ 2 - 3 กุมภาพันธ์ 2567 นี้ ณ มณฑลพิธีหน้าพระพุทธมหาวชิรอุตตโมภาสศาสดา พระพุทธรูปแกะสลักหน้าผาเขาชีจรรย์
BURAPA PATTAYA BIKE WEEK 2024 วันที่ 8-9-10 กุมภาพันธ์ 2567
"BURAPA PATAYA BIKE WEEK & SPIRIT OF HERO 2024" จัดขึ้นในวันที่ 8-9-10 ก.พ.2567 ณ สวนสาธารณะซอยชัยพฤกษ์ 2 เมืองพัทยา
วิ่งเทรลเกาะล้าน 3-4 กุมภาพันธ์ 2567
กิจกรรม วิ่งเทรลเกาะล้านครั้งที่ 2 ในวันที่ 3-4 กุมภาพันธ์ 2567
ตรุษจีนไชน่าทาวน์พัทยา 2567 การแสดงเชิดสิงโตในวันเสาร์ที่ 10 กุมภาพันธ์ 2567
ตรุษจีนไชน่าทาวน์พัทยา 2567 โซโหทาวน์พัทยา ไชน่าทาวน์แลนด์มาร์คของเมืองพัทยา ฉลองครบรอบ 12 ปี กับช่วงเทศกาล "ตรุษจีน..ไชน่าทาวน์พัทยา 2567" ไหว้ขอพรเจ้าแม่กวนอิมปางพันมือ และเรียกทรัพย์โชคลาภกับพิธี "ไป่กิมตุ้ง" ที่จัดเพียงปีละครั้งเฉพาะวันตรุษจีนเท่านั้น พร้อมรับชมการแสดงของมังกรจักรพรรดิ์ และการแสดงเชิดสิงโตในวันเสาร์ที่ 10 กุมภาพันธ์ 2567 เวลา 17.00 น. ถึง 24.00 น
เทศกาลว่าวนานาชาติบนชายหาดพัทยา 22- 26 ก.พ. 2567
เทศกาลว่าวนานาชาติบนชายหาด 22- 26 ก.พ. 2567 ณ ริมชายหาดเมืองพัทยา และ ชั้น 1 ศูนย์การค้าเซ็นทรัล พัทยา ชมว่าว หลายรูปแบบ หลากสีสัน โดย Thaitan Kite Team Thailand พร้อมการแสดงโชว์ว่าวจากประเทศฝรั่งเศส โคลัมเบีย เยอรมัน
ปฏิทินกิจกรรมท่องเที่ยวเดือนแห่งความรักและเทศกาลตรุษจีน กุมภาพันธ์ 2567
ตรุษจีนสุพรรณบุรี มหัศจรรย์ 16 ปี มังกรสวรรค์ ประจำปี 10 - 21 กุมภาพันธ์ 2567
ตรุษจีน สุพรรณบุรี มหัศจรรย์ 16 ปี มังกรสวรรค์ ประจำปี 2567 ระหว่างวันที่ 10 - 21 กุมภาพันธ์ 2567 บริเวณอุทยานมังกรสวรรค์ ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี กิจกรรมภายในงาน : - สักการะเจ้าพ่อหลักเมือง - จำหน่ายสินค้าและอาหารในราคาประหยัด - การแสดงชุด ลูกหลานพันธุ์มังกร ประกอบด้วย สิงโตวูซู กลองศึก มังกร 9 เซียน กังฟู เอ็งกอบู๊ กวนอิมพันมือ งิ้วเปลี่ยนหน้ากาก การแสดงจากศิลปินชื่อดัง
งานมหกรรมอาหารอร่อยและของดีเมืองสุพรรณ ครั้งที่ 22 (12 - 18 กุมภาพันธ์ 2567)
งานมหกรรมอาหารอร่อยและของดีเมืองสุพรรณ ครั้งที่22 วันที่ 12 - 18 กุมภาพันธ์ 2567 ณ สนามกังสดาลย์ปาร์ค ถนนพันศรโยธา (ถนนม้าสีหมอก) ก่อนถึงสามแยกสารพัดช่างบรรหาร-แจ่มใส
น่านกลางแปลง ทุกวันศุกร์-เสาร์ ตลอดเดือนกุมภาพันธ์ 2567 ชมฟรีทุกเรื่อง LINK
ทีมงานน่านเฟส ภูมิใจนำเสนอ งาน "น่านกลางแปลง" นำหนังดังในอดีต หนังหาชมได้ยาก จนกระทั่งหนังที่เป็นกระแส มาให้ชมกันทุกวันศุกร์-เสาร์ ตลอดเดือนกุมภาพันธ์ 2567 ตั้งแต่เวลา 1 ทุ่มเป็นต้นไป บริเวณ สวนสาธารณะริมแม่น้ำน่าน (ใต้สะพานพัฒนาภาคเหนือ) ชมฟรีทุกเรื่อง (ติดตามโปรแกรมฉายได้ ตั้งแต่วันที่ 1 กุมภาพันธ์ 2567 เป็นต้นไป ทาง
เพจ Nan Fest ) คละเคล้าบรรยาการศย้อนยุค ย้อนเวลา ไปหาความม่วนในอดีต กับร้านค้ารูปแบบย้อนยุค
โปรแกรมหนังกลางแปลง...เดือน กุมภาพันธ์ 2567
………………………………………………………………….
ศุกร์ที่ 2 ก.พ. 2567
18.30 น. Money Has Four Legs เงิน 4 ขา พี่จ๋า..ขออีกเทค (98 นาที)
20.15 น. สายสีมา นักสู้สามัญชน (100 นาที)
เสาร์ที่ 3 ก.พ. 2567
18.30 น. สันติวีนา (114 นาที)
20.30 น. Aftersun (96 นาที)
………………………………………………………………….
ศุกร์ที่ 9 ก.พ. 2567
18.30 น. กระเบนราหู (Manta Ray) (105 นาที)
20.20 น. The Long Walk (บ่มีวันจาก) (114 นาที)
เสาร์ที่ 10 ก.พ. 2567
18.30 น. โรงแรมนรก (138 นาที)
20.50 น. Burning (166 นาที)
………………………………………………………………….
ศุกร์ที่ 16 ก.พ. 2567
18.30 น. อานนเป็นนักเรียนตัวอย่าง (Arnold Is A Model Student) (85 นาที)
20.00 น. พระเจ้าช้างเผือก (99 นาที)
เสาร์ที่ 17 ก.พ. 2567
18.30 น. Voice of Borderland ชายแดนไม่เงียบ (62นาที)
20.00 น. CHILDREN OF THE MIST (92 นาที)
………………………………………………………………….
ศุกร์ที่ 23 ก.พ. 2567
18.30 น. สุดสาคร (87นาที)
20.00 น. Flee (88นาที)
เสาร์ที่ 24 ก.พ. 2567
18.30 น. สวรรค์มืด (98 นาที)
20.15 น. Drive My Car (179 นาที)
………………………………………………………………….
อาทิตย์ที่ 25 ก.พ. 2567
18.30 น.
โปรแกรมน่านวันวาน
1. Chang: A Drama of the Wilderness 1927 (69 นาที)
2.รัชกาลที่ 7 เสด็จฯ เลียบมณฑลฝ่ายเหนือ พ.ศ. 2469
(18 นาที)
3.น่าน 2511 (27 นาที)
4.ล่องแก่งแม่น้ำน่าน 2505 (25นาที)
21.00 น.
โปรแกรม Short film
1.The Misplaced Flower/ Saw Has Moo 11.57 นาที
2.Last Summer / ดาโพ มรดกพนา 19.10 นาที
4.Twilight of Ours / Teerapat Sriwichai
20.10 นาที
5.Twist of fate โชคชะตาเล่นตลก / Jirachaya Chaiyo 11.55 min
ปฎิทินกิจกรรมกระบี่ กุมภาพันธ์ 2567
Krabi Event Calendar February วางแผนเที่ยวกันได้เลยนะกุมภาพันธ์ month of love เดือนแห่งรัก
- 13 - 14 กุมภาพันธ์ 67 งาน “ศิลปะ ขยะ ดนตรี ” Joy Beach Cafe อ่าวน้ำเมา FB : Joy Beach Krabi
- 16-18 กุมภาพันธ์ 67 Peranakan Leamsak 2024 งานเปอรานากัน แหลมสัก ณ ชุมชนท่องเที่ยวแหลมสัก สัมผัสเสน่ห์แหล่งท่องเที่ยวที่แหลมสัก , ชิมอาหารพื้นถิ่นเลิศรส ช้อปของฝากจากชุมชน, ชมการแสดง ศิลปะ 3 วัฒนธรรม
- 18 กุมภาพันธ์ 67 Run For Local @ Laemsak ณ ชุมชนท่องเที่ยวแหลมสัก
- 20 -26 กุมภาพันธ์ 67 งานเกษตรแฟร์และ OTOP จังหวัดกระบี่ ครั้งที่ 11 ณ อบจ. กระบี่
- 23-26 กุมภาพันธ์ 67 Song by The River @ Krabi Season 2 พบดนตรีหลากหลายสไตล์ พิเศษ วันที่ 24 กุมภาพันธ์ พบกับ John Nuvo และกลุ่มศิลปิน Sounds Of Earth ใจศิลป์บำบัดโลก ที่จะมาเปลี่ยนโลกในโหมดของการแสดงดนตรีรูปแบบใหม่ด้วยหูฟัง ณ ลานประติมากรรมปูดำ ติดต่อ ททท.สำนักงานกระบี่ 0 7562 2163
DISCOVER PHUKET NIGHT RUN 2024 งานวิ่งมินิมาราธอน
เดิน-วิ่งไปด้วยกัน กับเทศบาลนครภูเก็ต DISCOVER PHUKET NIGHT RUN 2024 งานวิ่งมินิมาราธอน เพื่อสนับสนุนส่งเสริมให้ประชาชน ได้ออกกำลังกาย สร้างความใกล้ชิดความสัมพันธ์ที่ดีต่อกันในสังคม วันเสาร์ที่ 24 กุมภาพันธ์ 2567 เวลา 21.30 น. เป็นต้นไป ณ. สวนเฉลิมพระเกียรติ 72 พรรษา มหาราชินี (ลานมังกร) จังหวัดภูเก็ต
ปฏิทินกิจกรรมชลบุรี เดือนกุมภาพันธ์ 2567
ฉลองเทศกาลตรุษจีนต้อนรับปีมังกร ณ ศูนย์การค้าเทอร์มินอล21
ฉลองเทศกาลตรุษจีนต้อนรับปีมังกร ณ ศูนย์การค้าเทอร์มินอล21 พัทยา ชมฟรี !! การแสดงกายกรรมเชิดมังกรทอง ยาวกว่า 39 เมตรและสิงโต 9 สี 9 มงคล วันที่ 10 ก.พ. 2567 เวลา 15.00 เชิดมังกรทอง + สิงโต 9 สี 9 มงคล พร้อมแจกส้ม เสริมความมั่งคั่ง เวลา 18.00 กายกรรมเชิดมังกรทอง 39 เมตร ณ ลานเครื่องบิน
ปฏิทินท่องเที่ยวและกิจกรรม เดือนกุมภาพันธ์ จ.ระยอง
กุมภาพันธ์เดือนแห่งความรัก จ.ระยอง มีกิจกรรมอะไรฉ่ำๆ บ้างไหมนะ
1-4 ก.พ. : เขาน้อยออฟโรด ชาแลนจ์ 2024, สนามแข่งขันหมู่ที่3 ต.เขาน้อย อ.เขาชะเมา
7-8 ก.พ. : เสน่ห์วิถีถิ่น แผ่นดินระยอง ย้อนวันวานตลาดเก่าบ้านทางเกวียน ณ ตลาดสีเขียว สนามกีฬาเฉลิมพระเกียรติฯ อ.แกลง
9-11 ก.พ. : กินลม ชมทะเล ริมชายหาดสวนสน อ.แกลง
16-18 ก.พ. : Giant Kite Festival @ Rayong ท่าเทียบเรือเทศบาลบ้านเพ
17-18 ก.พ. : Somewhere in Klaeng Coffee Market @ Bake and More, Klaeng
17 ก.พ. : Star Party @ FarmSaengSuk, Klaeng
21-25 ก.พ. : โคตรมัน Food @ Robinsan LifeStlye BanChang (***ฟรีคอนเสิร์ต)
ติดต่อททท.สำนักงานระยอง : 038-655-420
Giant Kite festival @ Rayong เทศกาลว่าวนานาชาติ ระยอง 16 - 18 กุมภาพันธ์ 2567
เทศกาล "Giant Kite festival @ Rayong" เทศกาลว่าวนานาชาติครั้งแรกของปี 2567 เทศกาลรับลมทะเลและของดีบ้านเพเมืองระยอง ❕ วันที่ 16 - 18 กุมภาพันธ์ 2567 บริเวณท่าเทียบเรือเทศบาลตำบลบ้านเพ งานแสดงว่าวยักษ์สุดตระการตา ว่าวระดับนานาชาติครั้งแรกของปี 2567 ที่จังหวัดระยอง ขนกันมามากมายเต็มพื้นที่ ไปจนถึงกิจกรรมสนุกๆมากมายภายในงาน - โชว์กระบองไฟ - ฟังดนตรีสดบรรยากาศสบายๆริมทะเล - ร้านค้าจำหน่ายสินค้า - ถ่ายรูป 360 องศากับว่าวยักษ์สุดอลังการ - กิจกรรมเล่นว่าว - Show Giant Kite สนับสนุนพื้นที่จัดกิจกรรมโดยเทศบาลตำบลบ้านเพ ติดต่อสอบถามรายละเอียดงาน โทร 081-996-9979 / 081-8312538
การแข่งขัน "KHOA NOI OFF ROAD CHALLENGE 2024" (1-4 กุมภาพันธ์ 2567)
การแข่งขัน "KHOA NOI OFF ROAD CHALLENGE 2024" 1-4 กุมภาพันธ์ 2567ตั้งแต่เวลา 09.00 น.เป็นต้นไป ณ สนามออฟโรดองค์การบริหารส่วนตำบลเขาน้อย อ.เขาชะเมา จ.ระยอง กิจกรรมส่งเสริมการท่องเที่ยวในพื้นที่ ต.เขาน้อย และประชาสัมพันธ์แหล่งท่องเที่ยวชุมชน เสริมสร้างภาพลักษณ์การท่องเที่ยว รวมทั้งกระตุ้นเศรษฐกิจให้มีสภาพความคล่อง รวมทั้งเป็นการเชื่อมความสัมพันธ์ระหว่างชาวออฟโรดจากทั่วประเทศไทย และเพื่อนบ้านในภูมิภาคอาเซียน โดยการสนับสนุนและรับรองของสมาพันธ์ออฟโรดแห่งประเทศไทย ติดต่อททท.สำนักงานระยอง : 038-655-420
การประกวดวงดนตรี TK Music Contest Festival ตอน Fandom แฟนฉัน LINK
การประกวดวงดนตรี TK Music Contest Festival ตอน Fandom แฟนฉัน รับสมัครตั้งแต่บัดนี้ถึงวันที่ 9 กุมภาพันธ์ 2567 ประกวดในวันพุธที่ 14 กุมภาพันธ์ 2567 เวลา 13.00 -17.00 น. ณ หอประชุม Meeting Hall ชั้น 1 อุทยานการเรียนรู้ยะลา ประชุม ชี้แจง และจับฉลากลำดับการประกวดวันอังคารที่ 13 กุมภาพันธ์ 2567 เวลา 16.00 น. ณ ลานสานฝัน ชั้น 3 อุทยานการเรียนรู้ยะลา
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนกุมภาพันธ์ 2567
- 3/02/2567 คอนเสิร์ต จ๊ะ นงผณี ณ KK Riverside Resort อ.แก่งกระจาน
- 4/02/2567 Kaengkrachan Explorer Run ณ KRSC อ.แก่งกระจาน
- 9-14/02/2567 ประเพณีตรุษจีน ณ บริเวณถนนสุรินทรฦาชัย อ.เมือง
- 10/02/2567 JAZZ FOR DOG @ COCO&COFF อ.บ้านแหลม
- 17/02/2567 ฉายหนังกลางแปลง MAGIC SEEDS @ Camping Matket อ.แก่งกระจาน
- 23-24/02/2567 ลานวัฒนธรรมอำเภอแก่งกระจาน ณ วัดห้วยกวางจิง อ.แก่งกระจาน
- 25-26/02/2567 พระราชนิเวศมฤคทายวัน เปิดให้เยี่ยมชมเป็นกรณีพิเศษ อ.ชะอำ
งานประจำปีปิดทอง ฝังลูกนิมิตร วัดในจ.เพชรบุรี
งานประจำปี ปิดทอง ฝังลูกนิมิตร
- 6-8/02/2567 วัดนาพรม อ.เมือง
- 9-17/02/2567 วัดลาดศรัทธาราม อ.บ้านลาด
- 10-18/02/2567 วัดโพธุ์สุวรรณ อ.ชะอำ
- 10-18/02/2567 วัดชะอำ อ.ชะอำ
- 10-18/02/2567 วัดหุบเฉลา อ.ท่ายาง
- 10-18/02/2567 วัดสองพี่น้อง อ.แก่งกระจาน
- 21-25/02/2567 วัดในกลาง อ.บ้านแหลม
JAZZ For Dogs เสาร์ที่ 10 กุมภาพันธ์ 2567
อีเวนท์สุดชิลล์ ของเหล่า Dogs Lover ทั้งหลาย กับ “JAZZ For Dogs” ที่ ร้านกาแฟ Coco&Coff บ้านแหลม เพชรบุรี วันเสาร์ที่ 10 กุมภาพันธ์นี้ ตั้งแต่เวลา 9.00-17.30 น. . ในงานมีกิจกรรมน่ารักๆ นั่งฟังเพลง Jazz สบายๆ ในบรรยากาศชิลล์ๆ ท่ามกลางธรรมชาติ สวนสน ดงไผ่ ร่มรื่นริมบึง พร้อมได้ร่วมกันหยอดกระปุกสมทบทุน สำหรับโครงการช่วยสุนัขจรกันตามสะดวก พบกับศิลปิน วงดนตรี และ DJ ที่จะมาร่วมบรรเลงเล่นร้องเพลงสไตล์ JAZZ / SOUL / R&B - โอ Olarick X ว่านมหาเสน่ห์แบนด์ - Saint Cat - DJ Rujaya - และนักร้องรับเชิญจากเหล่า Dogs lover ทั้งหลาย
ปฏิทินกิจกรรมท่องเที่ยวนครราชสีมา-ชัยภูมิ กุมภาพันธ์ 2567
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดนครราชสีมา และจังหวัดชัยภูมิ ประจำเดือนกุมภาพันธ์ 2567 เทศกาลเดือนนี้มีทั้งสวนดอกไม้ คอนเสิร์ตเทศกาลตรุษจีน วาเลนไทน์
ปฏิทินกิจกรรมนครราชสีมา เดือนกุมภาพันธ์ 2567
ฤดูกาลกาแฟ ครั้งที่ 3 @อุทยานแห่งชาติน้ำตกพาเจริญ อ.พบพระ (3-4 กุมภาพันธ์ 2567)
“ฤดูกาลกาแฟ ครั้งที่ 3” วันที่ 3-4 กุมภาพันธ์ 2567 อุทยานแห่งชาติน้ำตกพาเจริญ อ.พบพระ จ.ตาก กิจกรรมและของที่น่าสนใจอีกมากมาย ในบรรยากาศชิวๆ ริมน้ำตกพาเจริญ
ชิงแชมป์ ROV (E-SPORTS) ปีที่ 1 แม่สอด 15 กุมภาพันธ์ 2567
ชิงแชมป์ ROV (E-SPORTS) ปีที่ 1 ประเภทในโรงเรียนสังกัดเทศบาลนครแม่สอด พร้อมโล่เกียรติยศและรางวัล จาก นายกเทศมนตรีนครแม่สอด ว่าที่ ร.ต.ประเสริฐ ปวงละคร โครงการจัดกิจกรรมลานคนเก่ง "การแข่งขันรายการ E-SPORTS (ROV)" จัดโดย กองการศึกษา เทศบาลนครแม่สอด วันพฤหัสบดีที่ 15 กุมภาพันธ์ 2567 เริ่มตั้งแต่เวลา 08.00 น. ณ พิพิธภัณฑ์นครแม่สอด (อาคารศูนย์การแสดงสินค้า OTOP ชั้น 1)
ปฏิทินงานพัทยา เดือนกุมภาพันธ์ 2567


- 4 ก.พ.67 การแข่งขันวิ่งเทรลเกาะล้าน (KOH LARN TRAIL 2024) ซึ่งปีนี้จัดขึ้นเป็นครั้งที่ 2 ณ หาดแสม เกาะล้าน @Samae Beach, KOH LARN
- 8-10 ก.พ.67 งาน "สัปดาห์มอเตอร์ไซค์และเสียงเพลงแห่งเสรีภาพ ครั้งที่ 27" (27th BURAPA PATTAYA BIKE WEEK) ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซ.ชัยพฤกษ์ 2 @Eastern National Spots Training Center Soi 2
- 10 ก.พ.67 งาน "เทศกาลตรุษจีนเมืองพัทยา" (CHINESE NEW YEARS PATTAYA FESTIVAL 2024) ณ ชายหาดพัทยากลาง @Central Pattaya Beach
- 16-25 ก.พ.67 การแข่งขันฟุตบอลชายหาดนานาชาติเมืองพัทยา (PATTAYA INTERNATIONAL BEACH FOOTBALL 2024) ณ ชายหาดจอมเทียน @Jomtien Beach
- 17-18 ก.พ.67 การประกวดวงโยธวาทิตแบบนั่งบรรเลง (PATTAYA CONCERT BAND 2024) ณ ศูนย์การค้ารอยัลการ์เค้นพลาซ่า พัทยา @Royal Garden Plaza Pattaya
- 22-25 ก.พ.67 การแข่งขันกอล์ฟหญิง HONDA LPGA THAILAND 2024 ณ สยามคันทรีคลับ โอลด์คอร์ส พัทยา จ.ชลบุรี @Siam Country Clup Pattaya Old Course
- 22-26 ก.พ.67 เทศกาลว่าวนานาชาติบนชายหาดพัทยา (PATTAYA INTERNATIONAL KITE ON THE BEACH 2024) ณ ริมชายหาดพัทยา @Pattaya Beach
- 24-25 ก.พ.67 การประกวดดนตรีเยาวชนเมืองพัทยา (PATTAYA MUSIC CONTEST 2024) ณ ศูนย์การค้ารอยัลการ์เค้นพลาซ่าพัทยา @Royal Garden Plaza Pattaya
ปฏิทินท่องเที่ยวจ.เลย กุมภาพันธ์ 2567
กิจกรรมท่องเที่ยว จ.สุโขทัย เดือนกุมภาพันธ์-มีนาคม 2567
กิจกรรมท่องเที่ยว จ.สุโขทัย เดือนกุมภาพันธ์-มีนาคม 2567
- กิจกรรม World Vibe Sukhothai Taste 2024 by Treasure Farm 8 - 11 กุมภาพันธ์ 2567 , โรงแรมสุโขทัยเทรเชอร์รีสอร์ท แอนด์ สปา จัดโดย โรงแรมสุโขทัยเทรเชอร์
- เฮือนพวนชวนคราฟต์ : 3 ทศวรรษ พวนสุนทรี วันที่ 9-11 กุมภาพันธ์ 2567 , ร้านสุนทรีผ้าไทย อ.ศรีสัชนาลัย จ.สุโขทัย จัดโดย ร้านสุนทรี ร่วมกับ ททท.สุโขทัย
- Sukhothai farm to table by ไร่ฟุ้งเฟื่อง & บิ้งนาเฟสติวัล 10 กุมภาพันธ์ 2567 , ไร่ฟุ้งเฟื่อง ต.เมืองบางขลัง อ.สวรรคโลก จ.สุโขทัย จัดโดย เครือข่ายตลาดมีเขียว และ ไร่ฟุ้งเฟื่อง
- สุขสราญผ่านเพลงพ่อ 14 กุมภาพันธ์ 2567 เวลา 17.30 น. , สวนสาธารณะ ริมแม่น้ำยม อ.เมือง จ.สุโขทัย จัดโดย วิทยาลัยนาฏศิลปสุโขทัย
- กิจกรรมชาวไทยเชื้อสายจีน (งานประเพณีแห่เจ้า) 20-24 กุมภาพันธ์ 2567 , อ.เมือง จ.สุโขทัย
- เวียนเทียนตะคันเมืองโบราณสุโขทัย 24 กุมภาพันธ์ 2567 , วัดราชธานี อ.เมือง สุโขทัย จัดโดย ททท.สำนักงานสุโขทัย
- ตลาดอำเภอด้ง ทุกวันศุกร์ เสาร์ อาทิตย์ เวลา 15:00-21:00 อนามัยตำบลบ้านตึก (เก่า) หัวสะพานยาวสี่แยกบ้านตึก อ.ศรีสัชนาลัย จ.สุโขทัย จัดโดย ชุมชนตำบลเมืองด้ง
- ตลาดเมืองเก่าอินดี้ ทุกวันจันทร์ เวลา 16.00 - 20.30 น. , ณ บริเวณบ้านปรีดาภิรมย์ ต.เมืองเก่า อ.เมือง จ.สุโขทัย จัดโดย ชุมชนเมืองเก่าสุโขทัย
- ตลาดท่าน้ำรับเสด็จ ทุกวันศุกร์ -เสาร์-อาทิตย์ เวลา 16.00-20.00 น. ณ บริเวณท่าน้ำรับเสด็จฯ อุทยานประวัติศาสตร์สุโขทัย
- ตลาดฮิมห้วยบ้านนาต้นจั่น ทุกวันศุกร์และวันเสาร์ เวลา 16.00น - 21.00 น. , บริเวณตลาดฮิมห้วย คลองหลังฝาย อ.ศรีสัชนาลัยจ.สุโขทัย จัดโดย ชุมชนบ้านนาต้นจั่น
- ศิลป์สุขใจ ทุกเสาร์ อาทิตย์ สิ้นเดือน , ART FARM โรงนาบ้านไร่ อ.สวรรคโลก จ.สุโขทัย จัดโดย โรงนาบ้านไร่
- BAN BAN FEST 1-3 มีนาคม 2567 ณ สวนน้ำเปรมสุข อ.เมือง จ.สุโขทัย จัดโดย อาสาพัฒนาเมือง และ บริษัทสุโขทัยพัฒนาเมือง
Somewhere in Klaeng Coffee Market @ Bake and More 17-18 กุมภาพันธ์ 2567
Coffee market งานที่รวมร้านกาแฟกว่า 14ร้าน พร้อมกิจกรรมให้ร่วมสนุกอีกมากมาย ในวันที่ 17-18 กุมภาพันธ์ 2567 ที่ Bake and more
งานปิดทองฝังลูกนิมิต ระยอง กุมภาพันธ์ 2024
งานปิดทองฝังลูกนิมิต ระยอง กุมภาพันธ์ 2024
- วัดมาบตาพุด ต.มาบตาพุด อ.เมือง จ.ระยอง เปิดงาน 10 ก.พ.67 เวลา 09.00 น. พิธีตัดหวาย ผูกสีมา 19 ก.พ.67 เวลา 09.00 น.
- วัดเขาช่องลม ตำบลชำฆ้อ อำเภอเขาชะเมา จังหวัดระยอง เปิดงาน 10 ก.พ.67 เวลา 08:00 น. พิธีตัดหวาย ผูกสีมา 18 ก.พ.67 เวลา 20:00 น.
- วัดห้วยทับมอญ ต.ห้วยทับมอญ อ.เขาชะเมา จ.ระยอง เปิดงาน 8 ก.พ.67 เวลา 09:00 น. พิธีตัดหวาย ผูกสีมา 18 ก.พ.67 เวลา 21:59 น.
- วัดหนองกะพ้อ ต.ทุ่งควายกิน อ.แกลง จ.ระยอง เปิดงาน 10 ก.พ.67 เวลา 08:00 น. พิธีตัดหวาย ผูกสีมา 19 ก.พ.67 เวลา 09:00 น
กิจกรรมวันตรุษจีน ณ ศูนย์คชศึกษา (โลกของช้าง) 9 กุมภาพันธ์ 2567
กิจกรรมวันตรุษจีน (ช้าง) โครงการคชอาณาจักร จังหวัดสุรินทร์ ร่วมกับศูนย์คชศึกษา (โลกของช้าง) องค์การบริหารส่วนจังหวัดสุรินทร์ จัดขึ้นในวันศุกร์ ที่ 9 กุมภาพันธ์ 2567 เวลา 11.00 น. - 12.00 น. เชิญชวนร่วมกิจกรรมวันตรุษจีน ณ ศูนย์คชศึกษา (โลกของช้าง) องค์การบริหารส่วนจังหวัดสุรินทร์
กิจกรรมจ.บุรีรัมย์ เดือนกุมภาพันธ์ 2567
วันที่ 1-5 กุมภาพันธ์ 2567
"งานสักการะเจ้าพ่อหลวงอุดม ของดีคูเมือง และงานกัญชาเพื่อประชาชน อำเภอคูเมือง ประจำปี 2567" ณ ลานหน้าตลาดสดเทศบาลอำเภอคูเมือง 2567 สอบถามเพิ่มเติมโทร : 044 699 063
วันที่ 2-4 กุมภาพันธ์ 2567
“เทศกาลนกกระเรียน” ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำและนกกระเรียนพันธุ์ไทย สอบถามเพิ่มเติมโทร : 09 0286 8327
วันที่ 16-18 กุมภาพันธ์ 2567
“กินปลาหน้าเขื่อนชวนเพื่อนวิ่ง@โนนดินแดง” ณ เขื่อนลำนางรอง อำเภอโนนดินแดง สอบถามเพิ่มเติมโทร : 044 606 241
วันที่ 23-25 กุมภาพันธ์ 2567
“D1 Grand Prix Thailand 2024 สนาม 1 และ 2” ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 23-29 กุมภาพันธ์ 2567
"งานปิดทองพระเจ้าใหญ่ ปีที่ 78" ณ วัดหงษ์ อำเภอพุทไธสง สอบถามเพิ่มเติมโทร : 08 1807 9665
วันที่ 27-29 กุมภาพันธ์ 2567
“นมัสการพระพุทธประโคนชัยมหามิ่งมงคล” ณ อุทยานพระพุทธประโคนชัยมหามิ่งมงคล
สอบถามเพิ่มเติมโทร : 08 0440 5655
เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท
(ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ณ ถนนคูเมือง / คลองละลม
ปฎิทินเที่ยวจ.นนทบุรี กุมภาพันธ์ 2567
Pet Pilot เชียงใหม่ 1-4 กุมภาพันธ์ 2567
งานมหกรรมสัตว์เลี้ยงคุณภาพจากกรุงเทพสู่ ที่จัดโดย IMPACT Exhibition Organizer (อิมแพ็ค เมืองทองธานี) 1 - 4 กุมภาพันธ์ 2567 เวลา 11.00 - 20.00 น. ณ เชียงใหม่ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต
งาน SmartHeartGold Toy Dog Show 2024 LINK
งาน SmartHeartGold Toy Dog Show 2024 วันที่ 17-18 กุมภาพันธ์ 2567 ณ ศูนย์การค้า เซ็นทรัล บางนา สอบถามรายละเอียดได้ที่ : ชมรมสุนัขพันธุ์เล็กแห่งประเทศไทย โทร. 081-869-9789, 02-949-7484 Fax: 02-949-7484 ** ปิดรับสมัครวันที่ 13 กุมภาพันธ์ 2567 **
งานประกวดแมวกับชมรม UCA Thailand by FFC 17-18 กุมภาพันธุ์ 2567
ประกวดแมวกับชมรม UCA Thailand by FFC ในงาน Cat Expo วันที่ 17-18 กุมภาพันธ์ 2567 ณ ศูนย์การค้า แฟชั่น ไอส์แลนด์ ฮอลล์ ชั้น 3 ภายในงานมีกิจกรรมต่างๆ
1.งานประกวด "The Prince & The Princess FFC Cat Show วันที่ 17-18 กุมภาพันธุ์ 2567 ณ ศูนย์การค้า Fashion Island
2.ประกวดแมว House Hold Cat Show
3.งานประกวดชุด Fancy Costume (ดีไซน์ ชุดเจ้าชาย ชุดเจ้าหญิง)
* ทุกการเข้าร่วมกิจกรรม เจ้าน้องแมวยังมีของรางวัลจาก sponsor ติดไม้ติดมือไปให้ลองกับน้องแมวที่บ้านอีกด้วยนะค้าบบ
ปฏิทินกิจกรรม จ.อุดรธานี เดือนกุมภาพันธ์ 2567
ปฏิทินกิจกรรม จ.อุดรธานี เดือนกุมภาพันธ์ 2567 นี้
1.งานเกษตรแฟร์ ณ สนามทุ่งศรีเมืองอุดรธานี
2.นิทรรศการผ้าอีสาน-ล้านช้าง ISAN LANXANG ณ มหาวิทยาลัยราชภัฏอุดรธานี
3.งาน Udon Craft Space ณ โรงแรมเพรสซิเดนท์ อุดรธานี
4.งานฉลองเทศกาลตรุษจีน ศาลเจ้าปู่-ย่า อุดรธานี
5.งานมรดกโลกบ้านเชียง
6.THE GREAT CHINESE NEW YEAR 2024 ศูนย์การค้าเซ็นทรัล อุดร Central Udon
7.Best of Luck Year of Dragon ศูนย์การค้ายูดี ทาวน์ UD TOWN
8.งานเทศกาลตรุษจีน ถนนอาหารเมืองอุดรธานี 2567
9.เทศกาลอีสานโซล ณ มหาวิทยาลัยราชภัฏอุดรธานี
10.UDON COFFEE FAMILY AT บุญถาวร
11.soontaree’s time ณ โรงแรม Blu Monkey Brown House อุดรธานี
12.งานสรงน้ำพระบรมสารีริกธาตุ ณ วัดป่าบ้านค้อ อ.บ้านผือ จ.อุดรธานี
13.Udonpit Run 2024
ปฏิทินกิจกรรม จ.บึงกาฬ เดือนกุมภาพันธ์ 2567
You are my valentine 14 กุมภาพันธ์ 2567
กิจกรรมความรักกับสัตว์เลี้ยงแสนรัก วันที่ 14 กุมภา 67 นี้ ศูนย์การค้าเซ็นทรัล เวสต์วิลล์ ร่วมกับ มูลนิธิบ้านสงเคราะห์สัตว์พิการ จัดงาน You are my valentine @Central Westville ชั้น G มีกิจกรรมมาให้ร่วมสนุกมากมาย อาทิ ก๊วน Pet Red Carpet ประชันลุคพรมแดง, Pet Talk แชร์เรื่องราวน่ารักของสมาชิกตัวแสบ , Pet Portraits วาดรูปสีน้ำจากศิลปิน,นวดสัมผัสรัก, D.I.Y จี้ปลอกคอสุดคิวต์, เพ้นต์ถ้วยชามเซรามิก, อาหารโฮมเมดสำหรับน้องหมา และพลาดไม่ได้กับมุม Photoshoot ถ่ายปกกับนิตยสารแพรว ปิดท้ายความสนุกด้วยมินิคอนเสิร์ต กระซิบดังๆ ว่ามีของขวัญมามอบให้ตลอดทั้งวัน
ททท.พังงา จัดทัวร์ เที่ยวรักษ์พังงา ในงานบุญมาฆบูชา 24 กุมภาพันธ์ 2567
“ครั้งหนึ่งในชีวิต...ต้องแห่ผ้าขึ้นธาตุ...ที่ตะกั่วป่า” ททท. สำนักงานพังงาจัดแพ็คเกจทัวร์ “เที่ยวรักษ์พังงา...ในงานบุญมาฆบูชา” สายบุญห้ามพลาดเชิญชวนทุกคนมาร่วมเป็นส่วนหนึ่งในกิจกรรมแห่พระบรมธาตุ ณ วัดพระธาตุคีรีเขตและแห่ผ้าขึ้นธาตุ ณ วัดราษฎร์อุปถัมภ์ (วัดบางเหรียง) ใน “วันมาฆบูชา” 24 กุมภาพันธ์ 2567 นอกจากนี้เติมเสบียงบุญด้วยการปล่อยปลากะพงทอง เสริมราศี เสริมโชค มั่งคั่ง ร่ำรวย อิ่มบุญ อิ่มใจไหว้พระขอพร ทำบุญไปด้วยกันในวันมาฆบูชา ค่าใช้จ่ายแพ็คเก็จ : 499. บาท (ราคานี้รวม อาหารว่าง 2 มื้อ อาหารกลางวัน 1 มื้อ / พันธ์ปลากะพงทอง /ค่าประกันอุบัติเหตุ)
ปฏิทินท่องเที่ยวประจำเดือนกุมภาพันธ์ 2567 ของจังหวัดพังงา
งานกาชาดจังหวัดพังงา ประจำปี 2567
สนามหน้าศาลากลาง (หลังเก่า)
FB: องค์การบริหารส่วนจังหวัดพังงา
26 มกราคม – 4 กุมภาพันธ์ 2567
ㅤ
เทศกาลอาหารซีฟู๊ด
ตลาดริมน้ำตะกั่วป่า อ.ตะกั่วป่า
FB: เทศบาลเมืองตะกั่วป่า
3 กุมภาพันธ์ 2567
ㅤ
เทศกาลงานตรุษจีน 2567
ถนนสายวัฒนธรรมเมืองเก่าตะกั่วป่า
FB: เทศบาลเมืองตะกั่วป่า
11 กุมภาพันธ์ 2567
ㅤ
งานเปิดโลกทะเลเกาะยาวจังหวัดพังงา
ท่าเรือคลองเหีย ต.เกาะยาวใหญ่ อ.เกาะยาว
FB: องค์การบริหารส่วนจังหวัดพังงา
9 – 11 กุมภาพันธ์ 2567
ㅤ
งานสานสัมพันธ์บ้านพี่เมืองน้อง
สะพานสารสิน บ้านท่านุ่น อ.ตะกั่วทุ่ง
FB: องค์การบริหารส่วนจังหวัดพังงา
16 – 18 กุมภาพันธ์ 2567
ㅤ
งานประเพณีแห่ผ้าขึ้นธาตุ
วัดราษฎร์อุปถัมภ์ (วัดบางเหรียง) อ.ทับปุด
FB: อบต.บางเหรียง อ.ทับปุด จ.พังงา
16 – 24 กุมภาพันธ์ 2567
ㅤ
Khaolak Brew Fest 2024
โวยวายพาร์ค ใกล้หาดบางเนียง, ตะกั่วป่า
FB: Khaolak Brew Master
17 กุมภาพันธ์ 2567
ㅤ
วันมาฆบูชา วัดพระธาตุคีรีเขต
วัดพระธาตุคีรีเขต อ.ตะกั่วป่า
FB: เทศบาลเมืองตะกั่วป่า
24 กุมภาพันธ์ 2567
TRANG Season of Love 10-14 กุมภาพันธ์ 2567
TRANG Season of Love มาบอกรัก กระซิบรัก กับบรรยากาศสุดโรแมนติก ในงาน "TRANG Food FestiWOW : Season of Love" Wow กับการตกแต่งบรรยากาศสุดโรแมนติก ในธีม Fairytale????♀️ กับโซนต่างๆ อาทิ Love Garden Way to Love Chinese Love Story Food Paradise Sweet Love Love Local Health&Care แล้วพบกัน 10-14 กุมภาพันธ์ 2567 นี้ เวลา 16.00-22.00 น. ณ สวนทับเที่ยง อำเภอเมือง จังหวัดตรัง
ปฏิทินกิจกรรม จ.ตรัง เดือน กุมภาพันธ์ 2567
เกษตรและของดีเมืองอ่างทอง ครั้งที่ 11 วันที่ 9 - 18 กุมภาพันธ์ 2567
งาน"เกษตรและของดีเมืองอ่างทอง ครั้งที่ 11" ประจำปี 2567 วันที่ 9 - 18 กุมภาพันธ์ 2567 ณ วัดขุนอินทประมูล อ.โพธิ์ทอง จ.อ่างทอง
ปฏิทินท่องเที่ยวจังหวัดสกลนคร กุมภาพันธ์ 67
ปฏิทินท่องเที่ยวจังหวัดนครพนม กุมภาพันธ์ 67
ปฏิทินท่องเที่ยวจังหวัดมุกดาหาร กุมภาพันธ์ 67
Rasada Music Festival 2024 ครั้งที่ 3 วันที่ 16 – 18 กุมภาพันธ์ 2567
เทศบาลตำบลรัษฎา จัดงาน Rasada Music Festival 2024 ครั้งที่ 3 ณ หาดสิเหร่ ระหว่างวันที่ 16 – 18 กุมภาพันธ์ 2567 ตั้งแต่เวลา 17.00 - 24.00 น. . พบกับร้านอาหาร ของดีร้านดัง มากกว่า 50 ร้าน ให้ได้ชิม ได้ช๊อป ความอร่อยกับบรรยากาศริมทะเลที่สวยงาม . Rasada Music Festival 2024 ครั้งที่ 3 เป็นการส่งเสริมและกระตุ้นการท่องเที่ยวพื้นที่ตำบลรัษฎา และฟื้นฟูเศษฐกิจฐานรากของจังหวัดภูเก็ต พร้อมต้อนรับนักท่องเที่ยวในช่วงวันหยุดสุดสัปดาห์กลางเดือนกุมภาพันธ์ 2557 . 16 ก.พ.67 พบกับศิลปิน มาลีฮวนน่า , Rock & Ride , การแสดงพื้นบ้าน และ DJ . วันที่ 17 ก.พ. 67 พบกับศิลปิน มีนตรา อินทิรา , นาวี , การแสดงพื้นบ้าน และ DJ วันที่ 18 ก.พ.67 พบกับศิลปิน แจ๊ส สปุ๊กนิค ปาปิยอง กุ๊กกุ๊ก , วงคอลั่ม , การแสดงพื้นบ้าน/ และ DJ . ทุกค่ำคืนเข้าชมฟรีตลอดงาน
Good coffee & Green Market HUT-เล่น ฉบับสัญจร วันที่ 17-18 กุมภาพันธ์ 2567
Good coffee & Green Market HUT-เล่น ฉบับสัญจร วันที่ 17-18 กุมภาพันธ์ 2567 เวลา 10.00-17.00 น ณ พื้นที่ลานร่มไม้ริมทะเลสาป ม.ราชภัฏกำแพงเพชร (แม่สอด) กิจกรรม Work shop กิจกรรมสนทนาแลกเปลี่ยนเรื่องกาแฟ บทเพลงชิวๆกับบรรยากาศริมทะเลสาปCat Expo 2024 วันที่ 17 - 18 กุมภาพันธ์ 2567
Cat Expo 2024 วันที่ 17 - 18 กุมภาพันธ์ 2567 ณ ไอส์แลนด์ ฮอลล์ ชั้น 3 ศูนย์การค้าแฟชั่นไอส์แลนด์ มหกรรมงานแมวสุดยิ่งใหญ่ประจำปี ที่คนรักแมวต้องไม่พลาด
ถนนคนเดินสองแคว ถนนคนเดินที่ยาวที่สุดของเมืองกาญจน์ ทุกเย็นวันเสาร์ เริ่มตั้งแต่ 16.00-22.00 น.
ชวนมา ชม ชิม ชอป บนถนนคนเดินที่ยาวที่สุดของเมืองกาญจน์ "ถนนคนเดินสองแคว" ระยะทางยาวกว่า 750 เมตร [
พิกัด] เลือกซื้อสินค้าของใช้-ของฝากหลากหลาย อาหารการกิน ทั้งแบบปรุงสดใหม่ และอาหารพร้อมทาน จาก 600 ร้านค้า พร้อมขึ้นชมแม่น้ำ 2 สีบนสกายวอล์คที่อยู่ในบริเวณเดียวกัน ถนนคนเดินจัดทุกเย็นวันเสาร์ เริ่มตั้งแต่ 16.00-22.00 น. [ภาพ ท
ทท กาญจนบุรี]
BURAPA PATTAYA BIKE WEEK & SPIRIT OF HEROES 2024
BURAPA PATTAYA BIKE WEEK & SPIRIT OF HEROES 2024 บริเวณสวนสาธารณะ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซอยชัยพฤกษ์ 2 เมืองพัทยา จังหวัดชลบุรี งาน สัปดาห์มอไซค์และเสียงเพลงแห่งเสรีภาพ ครั้งที่ 27 "BURAPA PATTAYA BIKE WEEK & SPIRIT OF HEROES 2024 ระหว่างวันที่ 8 - 10 กุมภาพันธ์ 2567 ณ บริเวณสวนสาธารณะ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซอยชัยพฤกษ์ 2 เมืองพัทยา จัดโดยเมืองพัทยา ร่วมกับสมาคมบูรพามอเตอร์ไซค์เคิลคลับ กิจกรรมภายในงาน วันที่ 8 กุมภาพันธ์ 2567 15.00 น. โชว์พารามอเตอร์ 16.00 น. โชว์ม้า 17.30 น. โชว์สตั๊น 18.00 น. เป็นต้นไป การแสดงดนตรี วันที่ 9 กุมภาพันธ์ 2567 16.00-18.00 น. กิจกรรมภาคสนาม-อากาศ 18.00 น. เป็นต้นไป การแสดงดนตรี วันที่ 10 กุมภาพันธ์ 2567 14.00 น. ขบวนแห่บิ๊กไบค์รอบเมืองพัทยา เพื่อแสดงออกถึงมิตรภาพที่ดีระหว่างคนขับมอเตอร์ไซค์ทั้งในและต่างประเทศ 15.00-16.00 น. กิจกรรมภาคสนาม-อากาศ 18.00 น. เป็นต้นไป การแสดงดนตรี
Samutsakhon bike week สมุทรสาครไบค์วีค 2567
งานสมุทรสาคร ไบค์วีค ครั้งที่ 8 ปี 2024 จะมีขึ้นในวันที่ 16 - 17 กุมภาพันธ์ 2567 ที่สวนน้ำพันท้ายนรสิงห์ ติดกับศาลพันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร โดยรูปแบบงานจะเป็นงานเลี้ยงพร้อมคอนเสิร์ตจากศิลปินมากมาย เช่น Joey ภูวศิษฐ์, Paradog, Mocca Garden, วงเพชรเกษม, ไทรถแห่ มีการออกร้านจำหน่ายสินค้าสุดพิเศษ อาหาร เครื่องดื่ม ของที่ระลึก รวมทั้งร่วมชมรถบิ๊กไบค์สวยๆจากเพื่อนสมาชิกหลายร้อยคัน ซึ่งผู้ที่สนใจสามารถร่วมกิจกรรมผ่านการซื้อเสื้อกับทางทีมงานสมุทรสาครไบค์วีคได้ในราคาตัวละ 400 บาท ซึ่งมีบริการจัดส่งทั่วประเทศ เสื้อสามารถเข้างานได้ทั้ง 2 วัน โดยทางทีมผู้จัดงานรับรองว่างานนี้สนุกแน่นนอน ที่สำคัญยังได้ร่วมกันทำประโยชน์ให้กับจังหวัดสมุทรสาครอีกด้วย
กิจกรรม Mothers Class โรงพยาบาลเกษมราษฎร์ศรีบุรินทร์ จ.เชียงราย LINK
โรงพยาบาลเกษมราษฎร์ศรีบุรินทร์ จ.เชียงราย จัดกิจกรรม Mothers Class เพื่อเป็นการช่วยเตรียมพร้อมให้กับคุณแม่ตั้งครรภ์และคุณพ่อ สู่การเป็นคุณแม่คุณพ่อคุณภาพ มีความรู้ รู้วิธีการดูแลลูกน้อยที่กำลังจะเป็นสมาชิกใหม่ของครอบครัว
- Mothers Class ครั้งที่ 1 วันเสาร์ ที่ 17 กุมภาพันธ์ 2567
- Mothers Class ครั้งที่ 2 วันเสาร์ ที่ 22 เมษายน 2566
- Mothers Class ครั้งที่ 3 วันอาทิตย์ ที่ 26 พฤษภาคม 2567
- Mothers Class ครั้งที่ 4 วันอาทิตย์ ที่ 23 มิถุนายน 2567
งานดอกฝ้ายบาน สืบสานวัฒนธรรมไทเลย ประจำปี 2567 (1-10 กุมภาพันธ์ 2567)
งานดอกฝ้ายบาน สืบสานวัฒนธรรมไทเลย ประจำปี 2567 ระหว่างวันที่ 1-10 กุมภาพันธ์ 2567 ณ สนามหน้าศาลากลางจังหวัดเลย
งานมหกรรมไม้ดอกไม้ประดับ เชียงใหม่ ครั้งที่ 47 (1-5 กุมภาพันธ์ 2567)
เทศกาลยิ่งใหญ่แห่งปี มหกรรมไม้ดอกไม้ประดับจังหวัดเชียงใหม่ ครั้งที่ 47 ประจำปี 2567 ระหว่างวันที่ 1-5 กุมภาพันธ์ 2567 ภายใต้แนวคิด "บุปผชาติล้านนา ภูษาเวียงพิงค์" Miracle of Precious Flora มหัศจรรย์แห่งพฤกษา ความงามเลอค่า นครเชียงใหม่ ชมขบวนแห่รถบุปผชาติที่สวยงาม กว่า 25 ขบวน จุดเริ่มเริ่มบริเวณเชิงสะพานนวรัฐ ถึง สวนสาธารณะหนองบวกหาด จังหวัดเชียงใหม่ ในวันเสาร์ที่ 3 กพ. 2567 เวลา 7.30 น. เป็นต้นไป กิจกรรมการแสดงชุด "เฟสติวัล ล้านนา” จินตนาการความงดงามจากทั้ง 3 ฤดูกาลของเชียงใหม่ ผสมผสานกับศิลปะล้านนาท่ามกลางทุ่งดอกไม้นานาพรรณ อาทิ ทุ่งดอกทิวลิป กุหลาบสเปรย์ ไฮเดรนเยีย ดอกกล้วยไม้ เป็นต้น ประกอบกับงานประติมากรรมน้อยใหญ่ อันงดงามอลังการในแบบฉบับที่เหนือจินตนาการ โดดเด่นไม่เหมือนใคร การแสดงน้ำพุเต้นระบำ การแสดงดนตรีในสวนดอกไม้ ผสมผสานนวัตกรรมร่วมสมัย กับประตูซุ้มทะลุมิติ การแสดง Mapping Baby Bear กิจกรรมอุโมงค์เรืองแสง ซุ้มอุโมงค์ไม้ไผ่ประดับดอกไม้และไฟ ชมสวนกล้วยไม้ และโซนกิจกรรมอื่นๆ อีกมากมาย
การแสดงน้ำพุดนตรี วันละ 3 รอบ เวลา 19.00 น. 20.00 น. และ 21.00 น.
การแสดง Mapping Baby Bear เวลา 19.00 - 22.00 น.
กิจกรรมอุโมงค์เรืองแสง เวลา 18.00 - 22.00 น.
สกายวอล์คแห่งใหม่ ณ วัดพระธาตุดอยสะเก็ด ต.เชิงดอย อ.ดอยสะเก็ด จ.เชียงใหม่
แลนด์มาร์คจุดชมวิวแห่งใหม่ของจ.เชียงใหม่ ณ วัดพระธาตุดอยสะเก็ด ต.เชิงดอย อ.ดอยสะเก็ด จ.เชียงใหม่ เปิดให้เยี่ยมชมเป็นทางการ 1 กุมภาพันธ์ 2567 นี้ จากจุดนี้ ผู้มาเยือนจะได้เพลิดเพลินกับวิวทิวทัศน์ธรรมชาติที่ล้อมรอบด้วยป่าเขาที่สวยงามของ อ.ดอยสะเก็ด กับมุมเช็คอินสวยๆ ที่สายถ่ายรูปไม่ควรพลาดกับจุดชมวิวสุดพิเศษ อาทิ ทิวเขาอำเภอดอยสะเก็ด ทางไปเชียงราย - หนองบัวพระเจ้าหลวง - สันเขื่อนแม่กวง - รูปหล่อครูบาศรีวิชัย วัดดอยกู่ สำหรับสายบุญ เป็นโอกาสนมัการเจดีย์ครอบรอยพระพุทธบาท ถือเป็นสิริมงคลแก่ชีวิตอย่างสูงยิ่งนัก (สอบถามเพิ่มเติม การท่องเที่ยวแห่งประเทศไทย สำนักงานเชียงใหม่ 053 248 604)
Thailand International Pet Variety Exhibition @ CNX ครั้งที่ 11 ( 1 – 4 กุมภาพันธ์ 2567)
Thailand International Pet Variety Exhibition @ CNX ครั้งที่ 11 วันที่ 1 – 4 กุมภาพันธ์ 2567 เวลา 11:00 น. – 20.00 น. เชียงใหม่ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต งานมหกรรมสัตว์เลี้ยง เพื่อชาวเชียงใหม่และชาวเหนือ กิจกรรมแน่นๆ 4 วันเต็ม อาทิ การแข่งขัน "ตูบนักบิน เหินเวหา" การแข่งขัน "หมาเลีย-แมวเลีย" การแข่งขันวิ่งแข่ง "มาหาแม่มา" การประกวดสุนัขพิทบูล บูลลี่ UDC Championship Dog Show ครั้งที่ 33 การแข่งขันพิทบลูลากน้ำหนักหาสุดยอดจอมพลัง ชิงถ้วยรางวัลเกียรติยศแชมป์ประเทศไทย การประกวด “คู่หู DUO แฟชั่นโชว์" คอนเซปต์ Pet Pilot การประกวดสุนัขสวยงามแบบทั่วไป (Open Show) ทุกสายพันธุ์
กินลม ชมดาว หาดชมดาว 1 กุมภาพันธ์ 2567
ขอเชิญชวนทุกท่าน ร่วมงานพาแลง หาดชมดาวชมกิจกรรมการแสดงศิลปวัฒนธรรมท้องถิ่นและการแสดงดนตรีสด ในวันพฤหัสบดีที่ 1 กุมภาพันธ์ 2567 ตั้งแต่ เวลา 17.00 - 24.00 น.
งานประจำปี ปิดทองขอพร วัดโรงเข้ 1-5 กุมภาพันธ์ 2567
งานประจำปี ปิดทองขอพร วัดโรงเข้ อ.บ้านแพ้ว สมุทรสาคร วันที่ 1-5 กุมภาพันธ์ 2567
THAILANDBEEF FEST 2024 ปรากฎการณ์เนื้อใหญ่ที่สุดในประเทศไทย 1 – 4 กุมภาพันธ์ 2567
ร่วมสร้างปรากฎการณ์เนื้อในงาน THAILANDBEEF FEST 2024 "Korat Beef Phenomenon" วันที่ 1 – 4 กุมภาพันธ์ 2567 ณ อุทยานวิทยาศาสตร์ภาคตะวันออกเฉียงเหนือตอนล่าง (จ.นครราชสีมา) มหาวิทยาลัยเทคโนโลยีสุรนารี เทศกาลเนื้อที่ใหญ่ที่สุดในประเทศไทย พร้อมรวบรวมเทคโนโลยีและนวัตกรรมเพื่ออุตสาหกรรมโคเนื้อครบวงจรที่ใหญ่ที่สุดในประเทศ
งานฉลองอนุสาวรีย์เจ้าพ่อพญาแล อำเภอบ้านเขว้า และงานบุญลอมข้าวใหญ่ 1-5 กุมภาพันธ์ 2567
อำเภอบ้านเขว้า ขอเชิญเที่ยวงานฉลองอนุสาวรีย์เจ้าพ่อพญาแล อำเภอบ้านเขว้า และงานบุญลอมข้าวใหญ่ ส่งเสริมการท่องเที่ยวและเทศกาลไหมของดีบ้านเขว้า ปี 2567 ระหว่างวันที่ 1-5 กุมภาพันธ์ 2567 นี้ ณ สนามหน้าที่ว่าการอำเภอบ้านเขว้า พบกับการประกวดสุดยอดบ้านเขว้า การแข่งขันทำอาหารพื้นบ้าน การเดินแบบผ้าไทยการกุศล มวยไทยมวยมันส์ และหมอลำคณะดังมากมาย
เชียงใหม่ม่วน 1-6 ก.พ. 67
เชียงใหม่ม่วน 1-6 ก.พ. 67 ที่ ศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส) กำหนดการแสดง 1 ก.พ. เเจ๊ส สปุ๊กนิค ปาปิยอง กุ๊กกุ๊ก 2 ก.พ. ตั๊กเเตน ชลดา 3 ก.พ. Dax Rock Rider , Greasy Cafe 4 ก.พ. Sarah Salola ft. JIXGO , DoubleBam 5 ก.พ. เจ เจตริน 6 ก.พ. Cocktail ประตูงานเปิด 16:30 น.เป็นต้นไป (ตรวจบัตรประชาชนตัวจริงเท่านั้น หรือใบขับขี่) เข้าได้ทุกวัย ไม่จำกัดอายุ อายุต่ำกว่า 12 ปี เข้าฟรี ! ภายในงานจะมี wristband สำหรับแบ่งโซนลูกค้า - ลูกค้าที่อายุไม่ถึง 20 ปี สามารถเดินลงมาซื้ออาหารลานล่างได้ ยืนดูคอนเสิร์ตได้ เเต่ไม่สามารถเข้าไปนั่งในลานเครื่องดื่มได้ - สำหรับลูกค้าที่มาเป็นครอบครัว สามารถนั่งได้ที่ลานด้านบน ด้านบนมีจอ LED ซัพพอร์ต - โซนลานเครื่องดื่ม สงวนโต๊ะสำหรับเปิดเครื่องดื่ม เงื่อนไขเป็นไปตามงานกำหนด
งานประเพณี บวงสรวงปราสาทเก่า เล่าขานประเพณี วิถีจอมพระ ประจำปี 2567 วันที่ 1-5 กุมภาพันธ์ 2567
งานประเพณี บวงสรวงปราสาทเก่า เล่าขานประเพณี วิถีจอมพระ ประจำปี 2567 เมื่อวันที่ 1-5 กุมภาพันธ์ 2567 ณ บริเวณสวนสาธารณะสระหนองคู อำเภอจอมพระ วันที่ 1 ก.พ. ชมขบวนแห่ งานประเพณี คืนวันที่ 3 ก.พ. ชมรายการมวยศึกรวมน้ำใจบวงสรวงปราสาทจอมพระ [
ชมภาพบรรยากาศงานและขบวนแห่ที่เพจจอมพระทันข่าว]
รักเบิกบาน อุทยานแห่งชาติ @มุกดาหาร
รักเบิกบาน ณ อุทยานแห่งชาติ @มุกดาหาร วาเลนไทน์นี้ชวนมา “แชะ Check แชร์” @ภูผาเทิบ & ภูสระดอกบัว
ททท. สำนักงานนครพนม ควงแขนมากับ อุทยานแห่งชาติภูผาเทิบ - Phu Pha Thoep National Park และ อุทยานแห่งชาติภูสระดอกบัว - Phu Sa Dok Bua National Park ขอเชิญชวนมาร่วมกิจกรรม เนื่องในวันวาเลนไทน์ ลุ้นรับของที่ระลึกฟรี!! มากกว่า 30 รางวัล กติกา
1. โพสต์ภาพถ่าย ณ แหล่งท่องเที่ยวใดก็ได้ภายในอุทยานแห่งชาติภูผาเทิบ หรือ อุทยานแห่งชาติภูสระดอกบัว ใต้โพสต์นี้ จะเป็นรูปคู่ รูปเดี่ยว หรือรูปหมู่ ได้หมดเลยน้าา…
2. ระบุแคปชั่นรักโดน ๆ
3. ติดแฮชแท็กตามสถานที่ #รักนะภูผาเทิบ หรือ #รักนะภูสระดอกบัว
ร่วมสนุกโพสต์รูปได้ตั้งแต่วันนี้จนถึงวันที่ 18 กุมภาพันธ์ 2567
ประกาศผลผู้โชคดี วันที่ 20 กุมภาพันธ์ 2567 ทางหน้าเพจเลยจ้า
เทศกาลสตรอว์เบอร์รี่ ตลอดเดือนกุมภาพันธ์
ต้อนรับเทศกาลวาเลนไทน์ พร้อมกับฤดูกาลสตรอว์เบอร์รี่ ชวนชม ชิม ชิลล์ แปลงสตรอว์เบอร์รี่ บ้านอีมาดอีทราย แก่นมะกรูด อุทัยธานี มีตลอดทั้งเดือนกุมภาพันธ์ นี้ ปลูกที่ภาคกลาง ชวนชิม ที่อำเภอบ้านไร่ สั่งจองได้แล้ว ตามพิกัด 6 พิกัด ส่งเสริมการท่องเที่ยวโดย สำนักปลัดองค์การบริหารส่วนจังหวัด องค์การบริหารส่วนจังหวัดอุทัยธานี พิกัดไร่สตรอว์เบอร์รี่ สั่งจองล่วงหน้าได้ ???? ไ ร่ สี ฟ้ า Tel 081 295 4866 ???? ไร่วินัย Tel 091 839 9376 ???? ไร่ป้าสา Tel 064 690 1874 ???? ไร่โชคชัย Tel 083 536 0445 ???? ไร่สุชาติ Tel 061 016 2340 ???? ไร่ลุงอุ๊ Tel 095 783 7393
Fruit Innovation Fair 2024 เสวนาความรู้เรื่องการปลูกทุเรียน 2-4 กุมภาพันธ์ 2567
" Fruit Innovation Fair 2024" เสวนา หัวข้อ ปลูกทุเรียน 1 ไร่ ได้ 4 ตัน จริงหรือ ? สวนผลไม้คุณภาพ สู่อนาคตชาติที่ยั่งยืน Better Fruit, Better Farm, Better Future วันที่ 2-4 กุมภาพันธ์ 2567 ศูนย์การค้าเซ็นทรัล จันทบุรี จัดโดยหอการค้าจังหวัดจันทบุรี โทร. 039-321551 089-8314779
เสวนา แลกเปลี่ยนเรียนรู้จากหลายกูรู ทำสวน และการบริหารจัดการน้ำ
พิเศษ! เยี่ยมชมสวนที่ประสบความสำเร็จ ในการจัดการผลผลิต บูธเทคโนโลยีและอุปกรณ์การเกษตร เพื่อคุณภาพผลไม้ที่ดีของไทย จับคู่เจรจาธุรกิจ ช่วยเติมสิ่งที่ขาดซึ่งกันและกัน ตรงจุดตรงเป้าของคู่ค้า ประหยัดเวลาในการสืบค้นให้ตรงตามความต้องการ พบกับกิจกรรมและนวัตกรรมทางการเกษตร ที่จะช่วยพัฒนาคุณภาพผลผลิตทางการเกษตร วันที่ 2-4 กุมภาพันธ์ 2567 ณ จันทบุรี ฮอลล์ ศูนย์การค้าเซ็นทรัล จันทบุรี
งาน กินอยู่อย่างเป็นสุข ย้อนยุคอาหารโบราณ ตำนานคนวัดสิงห์ ครั้งที่ 11 (2 - 3 กุมภาพันธ์ 2567)
งาน “กินอยู่อย่างเป็นสุข ย้อนยุคอาหารโบราณ ตำนานคนวัดสิงห์ ครั้งที่ 11” ในวันที่ 2 - 3 กุมภาพันธ์ 2567 ณ บริเวณอนุสรณ์สถานท่าเสด็จตลาดวัดสิงห์ อำเภอวัดสิงห์ จังหวัดชัยนาท ตั้งแต่เวลา 17.00 น. เป็นต้นไป
กิจกรรม Night at The Palace ย้อนเวลา ชมวัง 4 ศตวรรษ 2 กุมภาพันธ์ - 30 เมษายน 2567
กรมศิลปากร จัดกิจกรรมสุดพิเศษ
Night at The Palace ย้อนเวลา ชมวัง 4 ศตวรรษ พระราชวังจันทรเกษม จังหวัดพระนครศรีอยุธยา เริ่มวันที่ 2 กุมภาพันธ์ - 30 เมษายน 2567 ทุกวันศุกร์ เสาร์และอาทิตย์ ตั้งแต่เวลา 16.30 - 21.00 น. (ซื้อบัตรเข้าชมได้ถึงเวลา 20.30 น.)
โอกาสที่จะได้เที่ยวชมยลโฉมความงามของโบราณสถานสำคัญอันเป็นที่ประทับของพระมหาอุปราชในสมัยกรุงศรีอยุธยาช่วงเวลาค่ำคืน พร้อมด้วยกิจกรรมสุด Exclusive อีกมากมายรอต้อนรับทุกท่าน โดยเปิดให้ท่านเข้าชม พระราชวังจันทรเกษม
ค่าเข้าชม ชาวไทย 20 บาท ชาวต่างชาติ 100 บาท ผู้พิการ และชาวไทยผู้มีอายุมากกว่า 60 ปี เข้าชมฟรี
และในวันที่ 2 กุมภาพันธ์ 2567 มีกิจกรรมนำชมรอบเปิดวัง เวลา 18.30 น. เป็นต้นไป
สอบถามรายละเอียดเพิ่มเติม โทร. 035 251 586
ม่วนแต้ น่านเฟส 67
ขอเชิญชวนแอ่วงาน NAN FEST "ม่วนแต้ น่านเฟส 67 วันที่ 2-3 กุมภาพันธ์ 2567 ตั้งแต่เวลา 09.00 - 21.00 น. ณ ข่วงเมืองน่าน(ข่วงน้อย) ตำบลในเวียง อำเภอเมืองน่าน จังหวัดน่าน พบกับกิจกรรม Creative Space , กิจกรรมนิทรรศการศิลปะ , กิจกรรมเทศกาลดนตรี , การสาธิตและจำหน่ายสินค้าที่มีแนวคิดสร้างสรรค์
เทศกาล แห่โคม ชมพระฉาย สืบสายศิลป์ ถิ่นหนองจับเต่า เขาชีจรรย์ ครั้งที่ 10 (2 – 3 กุมภาพันธ์ 2567)
เชิญชวนร่วมสักการะบูชาพระบรมสารีริกธาตุ ประดิษฐาน ณ พระอุระของ “พระพุทธมหาวชิรอุตตโมภาสศาสดา” ซึ่งเป็นพระพุทธรูปแกะสลักหินประจำรัชกาลที่ 9 และพบกับการแสดงศิลปวัฒนธรรมสุดอลังการ ในงานเทศกาล “แห่โคม ชมพระฉาย สืบสายศิลป์ ถิ่นหนองจับเต่า เขาชีจรรย์” ครั้งที่ 10 วันที่ 2 – 3 กุมภาพันธ์ 2567 เวลา 16.30-20.00 น. ณ มณฑลพิธีด้านหน้าพระพุทธมหาวชิรอุตตโมภาสศาสดา พระพุทธรูปแกะสลักหน้าผาเขาชีจรรย์ อ.สัตหีบ จ.ชลบุรี
WESTKOFF2024 LocalBuri โลคอลบุรี 2-4 กุมภาพันธ์ 2567
WESTKOFF2024 LocalBuri โลคอลบุรี Back To The Origins @155 Camp หนองกลางนา อ.เมือง จ.ราชบุรี วันที่ 2-4 กุมภาพันธ์ 2567 เวลา 10.00-23.00 น. เทศกาลกาแฟและศิลปะ ครั้งที่ 2 ของ จ.ราชบุรี RATCHABURI COFFEE & ART FESTIVAL งานเทศกาลกาแฟและศิลปะ ครั้งที่ 2 ของจังหวัดราชบุรี ที่รวบรวมเรื่องราวมากมายของคนกาแฟทั่วภูมิภาคตะวันตก และเพื่อนๆที่มีใจรักในเรื่องของศิลปะ วัฒนธรรม และการใช้ชีวิต ผ่านตัวกลางที่เชื่อมโยงเราเข้าด้วยกันอย่าง ‘กาแฟ’พบกับงานศิลปะ-หัตถกรรมพื้นถิ่น ศิลปะรวมสมัย สไตล์โลคอล บูทร้านค้า กาแฟ ขนม และอาหารมากมายในบรรยากาศสวนสวยติดริมน้ำแม่กลอง ชมการแข่งขัน และกิจกรรมเวิร์คช้อปกาแฟ กระทบไหล่ Coffee Celebrity พูดคุย-เสวนา “ภาษากาแฟ...เข้าใจง่าย” ตกเย็นชมอาทิตย์ตกดิน ฟังดนตรีจาก ศิลปินโลคอล ตลอด 3 วัน
งาน หลงเข้าสวน ชวนมารักษ์บางสะแก ครั้งที่ 2 - 2-4 กุมภาพันธ์ 2567
ททท. สำนักงานสมุทรสงคราม ขอเชิญชวนเที่ยวงาน "
หลงเข้าสวน ชวนมารักษ์บางสะแก ครั้งที่ 2 " วันที่ 2-4 กุมภาพันธ์ 2567 เริ่มตั้งแต่เวลา 10.00-18.00 น. ณ ศูนย์เรียนรู้เศรษฐกิจพอเพียงตำบลบางสะแก อ.บางคนที จ.สมุทรสงคราม กิจกรรมดังกล่าว จัดขึ้นโดยวิสาหกิจชุมชนรักษ์บางสะแก ได้เชิญชวนภาคีเครือข่าย มาร่วมกิจกรรมมากขึ้น โดยบูรณาการการทำงานร่วมกันกับหลายภาคส่วน ได้แก่ • โครงการสมุทรสงครามอยู่ดี สนับสนุนให้เกิดงานดี มีคุณค่า แถมมีโขนเด็กมาให้ชม ดนตรีไทยมาให้ฟังในสวนส้มโอ • สถาบันพัฒนาองค์กรชุมชน สนับสนุน กิจกรรมให้กลุ่มผู้มีรายได้น้อยในชุมชน มาร่วมกิจกรรม • เครือข่ายกสิกรรมธรรมชาติจังหวัดสมุทรสงครามและภาคตะวันตก มาจัดงานวันดินโลกในงานด้วย ให้ความรู้และกิจกรรมต่างๆ • และอีกหลายหน่วยงานในชุมชน ยังมีของดีชุมชน เช่น แกงกระดองกรุบ ขนมรุม ขนมครก ขนมไทย ข้าวต้มมัด และเมนูต่างๆ กับบรรยากาศสวนส้มโอ ที่ออกแบบโดย มหาวิทลัยศิลปากร. สอบถามเพิ่มเติมได้ที่ Facebook : รักษ์บางสะแก คลิก รักษ์บางสะแก หรือ ททท.สำนักงานสมุทรสงคราม โทร. 0 3475 2847-8
มหกรรมหนังสือภาคใต้ ครั้งที่ 10 หาดใหญ่ ฮอลล์ 2 - 11 กุมภาพันธ์ 2567
มหกรรมหนังสือภาคใต้ ครั้งที่ 10 วันที่ 2 - 11 กุมภาพันธ์ 2567 เวลา 10:00 - 21:00 น. ณ หาดใหญ่ ฮอลล์ ชั้น 5 ศูนย์การค้าเซ็นทรัล หาดใหญ่ พบกับงานใหญ่ของปีที่นักอ่านทุกคนห้ามพลาด!!!
✱ กว่า 60 สำนักพิมพ์ ที่ยกขบวนขนหนังสือมาให้นักอ่านได้ช้อปเล่มโปรดในราคาพิเศษ
✱ สนุกไปกับกิจกรรมต่าง ๆ ที่จัดเตรียมไว้เพื่อทุกคน อาทิ กิจกรรมเสวนาจากนักคิด-นักเขียน, กิจกรรม workshop และกิจกรรม Mini concert
✱ สร้างวัฒนธรรมการอ่านกับกิจกรรมประกวดเล่านิทาน โดยมูลนิธิหนึ่งอ่านล้านตื่น
✱ เพลิดเพลินไปกับกิจกรรมแข่งขันตอบปัญหาวรรณกรรมไทย
✱ มาปล่อยพลังโชว์ Cosplay free stage
งานเทศกาลอาหารและเกษตรแฟร์ ครั้งที่ 2 (2-11 กุมภาพันธ์ 2567)
งานเทศกาลอาหารและเกษตรแฟร์ ครั้งที่ 2 มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน สุรนารายณ์ จ.นครราชสีมา วันที่ 2-11 กุมภาพันธ์ 2567
ถนนคนเดิน…ของดีโพธิ์กลาง 67 วันที่ 2 - 3 กุมภาพันธ์ 2567
เทศบาลตำบลโพธิ์กลาง ขอเชิญร่วมงาน "ถนนคนเดิน…ของดีโพธิ์กลาง 67" ระหว่างวันที่ 2 - 3 กุมภาพันธ์ 2567 ณ หน้ากองพัน สห. - ตลาด ช.2 ถนนศรีโพธิ์กลาง ต.โพธิ์กลาง อ.เมือง กิจกรรมภายในงาน - ชิม ช็อปร้านค้า OTOP จำนวนกว่า 400 ร้าน - ชมการประกวดแม่หม้ายโพธิ์กลาง - ชมการประกวดไอ้หนุ่มโพธิ์กลาง - ชมการประกวดหนูน้อยโพธิ์กลาง - สนุกสนานกับการประกวดส้มตำลีลา - ชม Cover Dance - การแสดงวัฒนธรรมพื้นบ้าน - หนังกลางแปลง - ดนตรีย้อนยุคสุดมัน - การละเล่นต่าง ๆ ติดต่อสอบถาม: เทศบาลตำบลโพธิ์กลาง อ.เมือง 044 - 930239
Mystic Festival Thailand 2024 เขาใหญ่ 2-3-4 กุมภาพันธ์ 2024
เทศกาลดนตรี แสงสี ดีเจ ลึกลับแห่งเขาใหญ่ อีกโลกล้ำที่รอคุณไปกล้ำกลาย ศิลปินกว่าครึ่งร้อยเวียนวนมาบันเทิงตั้งแต่พระอาทิตย์ตกจนพระอาทิตย์ขึ้น ตลอด 3 คืนอันลึกลับ หาคำตอบเพิ่มเติม
mysticthailandSIAM CARNIVAL FUNFAIR มหกรรมสวนสนุกนานาชาติ โรบินสัน ปราจีนบุรี 2-18 กุมภาพันธ์ 2567
SIAM CARNIVAL FUNFAIR มหกรรมสวนสนุกนานาชาติ วันที่ 2-18 กุมภาพันธ์ 2567 เวลา 17:00 - 22:00 น. บริเวณศูนย์การค้า โรบินสันไลฟ์สไตล์ ปราจีนบุรี อำเภอเมือง จังหวัดปราจีนบุรี
การแสดงในงานดอกฝ้ายบาน สืบสานวัฒนธรรมไทเลย ประจำปี 2567 (2 กุมภาพันธ์ 2567)
องค์การบริหารส่วนจังหวัดเลย ขอเชิญร่วมชมการแสดงในงานดอกฝ้ายบาน สืบสานวัฒนธรรมไทเลย ประจำปี 2567 จาก โรงเรียนในสังกัดองค์การบริหารส่วนจังหวัดเลย ในวันที่ 2 กุมภาพันธ์ 2567 ณ เวทีกลางสนามหน้าศาลากลาง จังหวัดเลย ตั้งแต่เวลา 18.00 น. เป็นต้นไป
เทศกาลนกกระเรียน 2567 (Thailand Sarus Crane Festival 2024) 2 - 4 กุมภาพันธ์ 2567 LINK
องค์การสวนสัตว์แห่งประเทศไทย ร่วมกับจังหวัดบุรีรัมย์ และองค์กรเครือข่าย ขอเชิญร่วมงาน “เทศกาลนกกระเรียน 2567 (Thailand Sarus Crane Festival 2024) วันที่ 2 - 4 กุมภาพันธ์ 2567 เวลา 14.00-19.00 น. ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำและนกกระเรียนพันธุ์ไทย จังหวัดบุรีรัมย์ เทศกาลสร้างสรรค์ที่ผสมงานวิชาการเข้ากับงานศิลปะเพื่อการอนุรักษ์และเหมาะกับทุกคนในครอบครัว ไม่ว่าจะเด็กหรือผู้ใหญ่ ด้วยกิจกรรมหลากหลายรูปแบบ ได้แก่
• กิจกรรมปล่อยนกกระเรียนพันธุ์ไทยจากการเพาะเลี้ยงของสวนสัตว์นครราชสีมากลับสู่พื้นที่ชุ่มน้ำธรรมชาติ จำนวน 10 ตัว ซึ่งจัดขึ้นเป็นครั้งที่ 12 แล้ว ในปีนี้เราขอเชิญทุกท่านมาร่วมส่งกำลังใจให้นกกระเรียนอยู่รอดปลอดภัยทุกตัว
• กิจกรรมพื้นที่เรียนรู้ ที่มีทั้งการเสวนา หัวข้อ “อดีตถึงปัจจุบัน นกกระเรียนพันธุ์ไทย” และ Workshop ทั้งภาควิชาการด้านความหลากหลายทางชีวภาพ และภาคงานศิลปะ เช่น การวาดรูปและทำกระเป๋าผ้านกกระเรียน
• นิทรรศการและกิจกรรม จากหน่วยงานเครือข่ายอนุรักษ์ ไฮไลท์อยู่ที่นิทรรศการ ”วันพื้นที่ชุ่มน้ำโลก“ นิทรรศการภาพถ่าย ”นกกระเรียนพันธุ์ไทยจากสวนสัตว์สู่ธรรมชาติ“ และกิจกรรม “ดูนกในพื้นที่ชุ่มน้ำ”
• การแสดงและดนตรี จากนักเรียน นักศึกษา และชุมชนเครือข่ายอนุรักษ์นกกระเรียนในจังหวัดบุรีรัมย์ มานั่งฟังนั่งชมในบรรยากาศสบายๆ พร้อมกัน
• ถนนศิลปะ ที่พร้อมให้คุณพ่อคุณแม่พาน้องๆ หนูๆ มาปล่อยพลังเลอะทรายเลอะสี เรียนรู้การสร้างสรรค์งานศิลปะเพื่อการอนุรักษ์ร่วมกันได้ทั้งครอบครัว
• สารคดีกลางแปลง ชวนหยิบเก้าอี้สนามมานั่งดูสารคดี ”A day in the Wild” สารคดีที่บอกเราว่า ธรรมชาติเชื่อมโยงทุกสรรพสิ่ง (ฝน/นา/ป่า/นก) สารคดีฝีมือคนไทยโดยไทยพีบีเอส
• ปั่นจักรยานหรือนั่งเรือชมธรรมชาติ พร้อมชมวิวอ่างเก็บน้ำช่วงพระอาทิตย์ตก โดยไม่ต้องจองล่วงหน้าเพราะกลุ่มพายเรือมาเตรียมพร้อมบริการทุกท่านแล้วในงานนี้เท่านั้น
• ตบท้ายด้วยการชิมอาหารพื้นบ้านและช้อปผลิตภัณฑ์ท้องถิ่นของชุมชนรอบพื้นที่ชุ่มน้ำอันเป็นแหล่งอาศัยของนกกระเรียนพันธุ์ไทย จะนั่งกินริมน้ำหรือซื้อเป็นของฝากกลับบ้านก็ได้
เจอกัน
ยังมีกิจกรรมอื่นๆ อีกมากมายให้ได้ร่วมสนุกกันภายในงาน และอย่าลืมพกกระบอกน้ำกันมาเพื่อลดขยะด้วยนะ
งานเกษียณมาร์เก็ต 3-4 กุมภาพันธ์ 2567
งาน "เกษียณมาร์เก็ต" ตลาดของหวานหายาก และงานฝีมือเก๋ ๆ สำหรับวัยเกษียณและทุกช่วงวัย พร้อมกิจกรรมเวิร์คช็อปและดนตรีสดในงาน วันที่ 3 - 4 กุมภาพันธ์ 2567 ตั้งแต่เวลา 8.00 น. ถึง 14.00 น. ณ ศูนย์วัฒนธรรมเชียงใหม่ ใกล้กับสนามบินเชียงใหม่
งานประกวดพระเครื่องมรดกไทยก้าวไกลสู่มรดกโลก นครนายก วันที่ 3-4 กุมภาพันธ์ 2567
งานประกวดพระเครื่องมรดกไทยก้าวไกลสู่มรดกโลก พระเครื่อง พระบูชา เครื่องราง ของขลัง พระท้องถิ่น ของเก่า ของสะสม และโบราณวัตถุ ชิงถ้วยรางวัลใหญ่ ถ้วยรางวัลลายครามเบญจรงค์ ในวันเสาร์ที่ 3 และวันอาทิตย์ที่ 4 กุมภาพันธ์ 2567 ตั้งแต่เวลา 08.00 - 16.00 น. ณ ตลาดแยกช้าง ต.พรหมณี อ.เมือง จ.นครนายก จัดโดยชมรมประกวดพระเครื่องอันดับ 1 แห่งประเทศไทย
ดนตรีในสวน#2 วันที่ 3 กุมภาพันธ์ 2567
ดนตรีในสวน#2 วันที่ 3 กุมภาพันธ์ 2567 พบกับ "บอม เบิ้ล บอย"3 พี่น้อง ครอบครัวสินเจริญ นาม "สินเจริญ บราเธอร์ส" ดนตรีเริ่มเวลา 17.00 น
วิ่งดูดนม OMEGA RUN 2024 ครั้งที่ 3 (4 กุมภาพันธ์ 2567) LINK
งานวิ่งบนเส้นทางทุ่งฟาร์มโคนมไทยเดนมาร์ค เส้นทางธรรมชาติเคล้าสายหมอก โอบรอบด้วยขุนเขา วิ่งสนุกอารมณ์ครอส คันทรี เพลินชมคอกวัว เเละได้วิ่งดื่มนมยามเช้า วันปล่อยตัววิ่ง 4 กุมภาพันธ์ 2567 ณ ฟาร์มโคนมไทยเดนมาร์ค จ.สระบุรี ระยะวิ่ง 3 KM./ 5 KM./ 12 KM./ 21 KM. รับจำนวนจำกัด 1,500 คนเท่านั้น
มหัศจรรย์ วันมวยไทย ดังไกลสู่ ชาวโลก ประจำปี 2567 (4-6 กุมภาพันธ์ 2567)
ขอเชิญร่วมงาน “มหัศจรรย์ วันมวยไทย ดังไกลสู่ ชาวโลก ประจำปี 2567” (Amazing Muay Thai World Festival 2024) วันที่ 4-6 กุมภาพันธ์ 2567 ณ อุทยานราชภักดิ์ อ.หัวหิน จ.ประจวบคีรีขันธ์ ทั้งนี้ ททท. ร่วมจัดกิจกรรมเพื่อส่งเสริมมวยไทยเป็นซอฟต์พาวเวอร์ของประเทศ โดยมีกิจกรรมที่สำคัญ เช่น ✨️พิธีบวงสรวงบูรพกษัตริย์ ๗ พระองค์ และสมเด็จพระสรรเพชญ์ที่ ๘ (สมเด็จพระเจ้าเสือ) ✨️ การจัดนิทรรศการประวัติศาสตร์มวยไทย ✨️กิจกรรมมวยไทย ๔ ภาค ✨️ กิจกรรมชกมวย "มวยไทยรากหญ้าสู่สากล" ✨️ กิจกรรมส่งเสริมอุตสาหกรรมมวยไทย ✨️ การจำหน่ายสินค้าและอาหารพื้นเมืองของจังหวัดประจวบคีรีขันธ์ ✨️กิจกรรมพิธีครอบครูมวยไทย กิจกรรมไหว้ครูมวยไทย ✨️ การแสดงแม่ไม้มวยไทย ✨️ การแสดงไฮไลต์ แสง สี เสียง ประกอบการแสดงแปรรูปขบวนด้วยพลุและโดรน
THAI FIGHT อุทยานราชภักดิ์ 4 กุมภาพันธ์ 2567
ประเดิมศักราชแห่งความมันกับ “THAI FIGHT อุทยานราชภักดิ์” มาร่วมเทิดทูนองค์พระมหากษัตริย์ สืบสานวันมวยไทย รักษาศิลปะไหว้ครูมวย สร้างความเร้าใจด้วยมวยคาดเชือกกับเหล่าขุนพลไทยไฟท์ แสนชัย, เต็งหนึ่ง, ป.ต.ท., น้องโอ, เวโร, ไลอ้อน, เขี้ยวเพชร, วรจักรเล็ก, ฟ้าลิขิต และยูเนส ในวันอาทิตย์ที่ 4 กุมภาพันธ์ 2567 ลานอุทยานราชภักดิ์ อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
งานเฉลิมพระเกียรติพระบาทสมเด็จพระพุทธเลิศหล้านภาลัย ปี 2567 (4 กุมภาพันธ์ 2567)


งานเฉลิมพระเกียรติพระบาทสมเด็จพระพุทธเลิศหล้านภาลัยในปี 2567 ระหว่างวันที่ 3-4 กุมภาพันธ์ 2567 ณ อุทยาน ร. 2 อำเภออัมพวา จังหวัดสมุทรสงคราม โดยปีนี้กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี องค์ประธานมูลนิธิฯ ทรงพระกรุณาโปรดเกล้า ฯ เสด็จพระราชดำเนินเป็นการส่วนพระองค์ ในวันที่ 3 กุมภาพันธ์ 2567 ในการนี้ บริษัท อสมท. จำกัด (มหาชน) จะถ่ายทอดสดให้พสกนิกรชาวไทยได้ชื่นชมพระบารมี ตั้งแต่สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จพระราชดำเนินมาถึงเวลา 15.00 น. จนเสด็จพระราชดำเนินกลับ ภายในงานจะมีการแสดง ประกอบด้วย นาฎศิลป์ตามบทพระราชนิพนธ์ในพระบาทสมเด็จพระพุทธเลิศหล้านภาลัย ได้แก่ รำอาศิรวาทราชสดุดี การแสดงละครใน เรื่องรามเกียรติ์ การแสดงโขน ทั้งนี้ ทางมูลนิธิฯ จะเปิดจำหน่ายบัตรเข้าชมรอบวันที่ 3 กุมภาพันธ์ 2567 ราคา 1,000 -2,000 บาท รวม 225 ใบ ทางเพจ Facebook : อุทยาน ร.2 ตั้งแต่บัดนี้เป็นต้นไป รายได้ทูลเกล้าทูลกระหม่อมถวายเงินโดยเสด็จพระราชกุศลสมทบทุนมูลนิธิฯ ส่วนในวันที่ 4 กุมภาพันธ์ 2567 จะเปิดให้ประชาชนทั่วไปเข้าชมการแสดงโขน โดยไม่เก็บค่าใช้จ่ายใด ๆ ระหว่าง เวลา 16.00-17.30 น.
ขอเชิญเข้าชมงาน ในวันที่ 4 กุมภาพันธ์ 2567 ตั้งแต่เวลา 10.00 น. เป็นต้นไป
พบกับกิจกรรม อาทิ
- การแสดงโขน เรื่องรามเกียรติ์ ชุดขาดเศียรขาดกร (รอบวันที่ ๔ กุมภาพันธ์ ๒๕๖๗ เวลา ๑๗.๐๐ - ๑๘.๓๐ น.)
- การแสดงศิลปวัฒนธรรม อาทิ ขับเสภาเทิดพระเกียรติ การแสดงหุ่นกระบอก การบรรเลงวงดนตรีไทยและวงดุริยางค์สากล
- สาธิตและจำหน่ายอาหารคาวหวานในบทพระราชนิพนธ์ ขนมพื้นบ้าน และขนมไทยโบราณ
- สาธิตงานหัตถศิลป์ อาทิ การขึ้นรูปเครื่องประดับ งานเครื่องแขวน งานดอกไม้ประดิษฐ์ การทำหัวโขน เครื่องเบญจรงค์ สินค้า OTOP สมุทรสงคราม
- นิทรรศการด้านการเกษตร
- นิทรรศการวัตถุดิบท้องถิ่นสมุทรสงคราม
- ตลาดน้ำ-ตลาดบก ร้านค้าชุมชนสมุทรสงคราม
สอบถามเพิ่มเติม โทร. 022821442
การประกวดหนูน้อยตี๋หมวย ตรุษจีน ประจำปี 2567 (วันประกวดอาทิตย์ที่ 4 กุมภาพันธ์ 2567) LINK
TK Park Yala จัดกิจกรรมต้อนรับเทศกาลตรุษจีน กับการประกวดหนูน้อยตี๋หมวย ตรุษจีน ประจำปี 2567 ชมการแสดงความสามารถพิเศษของเด็ก ๆ พร้อมชิงรางวัลทุนการศึกษาและของรางวัลอื่น ๆ อีกมากมาย รายละเอียดการรับสมัคร
▪︎ รับสมัครน้องๆ ทั้งชายและหญิง อายุระหว่าง 6 -8 ปี (ประกวดเป็นเดี่ยว)
▪︎ รับจำนวนจำกัด 20 คนเท่านั้น
▪︎ แต่งกายชุดที่สื่อถึงวันตรุษจีนสไตล์จีนอาตี๋ อาหมวย จีนทันสมัยหรือร่วมสมัยแบบใดก็ได้
▪︎ กิจกรรมการประกวด มีลักษณะดังนี้ การเดิน การแนะนำตัวเองบนเวที การแสดงความสามารถพิเศษ รวมทั้งการตอบคำถามจากคำถามที่จับสลากได้
▪︎ เตรียมการแสดงความสามารถพิเศษ 1 ชุด ความยาวไม่เกิน 3 นาที โดยการแสดงต้องมีความเกี่ยวข้องกับความเป็นจีนหรือเทศกาลตรุษจีน (กรณีมีเพลงประกอบ ให้เตรียมเพลงมาเอง)
▪︎ จับหมายเลข ซ้อมเดินและชี้แจงรายละเอียดการประกวด ในวันเสาร์ที่ 3 กุมภาพันธ์ 2567 เวลา 09.00-12.00 น. ณ ลานสานฝัน ชั้น 3 อุทยานการเรียนรู้ยะลา
▪︎ ประกวดวันอาทิตย์ที่ 4 กุมภาพันธ์ 2567 เวลา 13.00-16.00 น. (ลงทะเบียนเวลา 12.30-13.00 น.) ณ ลานสานฝัน ชั้น 3 อุทยานการเรียนรู้ยะลา
▪︎ รับสมัครตั้งแต่บัดนี้ถึงวันที่ 1 กุมภาพันธ์ 2567 (หรือจนกว่าจะเต็ม)
NINJABLACK CAMPING RUN 4 กุมภาพันธ์ 2567
NINJABLACK CAMPING RUN (Mountain Series) วันอาทิตย์ ที่ 4 กุมภาพันธ์ 2567 เวลา 03:30 - 09:30 น. สนามที่ 1 @ทับทิมสยาม 05 คลองหาด จ.สระแก้ว
Farang Market X Caravan Food Truck 2024 (2 กุมภาพันธ์ 2567)
Farang Market X Caravan Food Truck 2024 งานเทศกาลอาหารและคาราวานฟู้ดทรัค วันศุกร์ ที่ 2 กุมภาพันธ์ 2567 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ที่กาดฝรั่ง วิลเลจ บริเวณลานกิจกรรม ด้านหน้าโครงการ พบกับร้านอาหารนานาชนิด เครื่องดื่มเย็นชื่นใจ มีดนตรีตลอดทั้งคืน
RUN BIKE FOR LOVE UTHAITHANI ครั้งที่ 2 วันที่ 4 กุมภาพันธ์ 2567
RUN BIKE FOR LOVE UTHAITHANI ครั้งที่ 2 ในวันที่ 4 กุมภาพันธ์ 2567 เริ่ม start หน้าหุบป่าตาด ระยะวิ่ง 5 กม และ ปั่น 16 กม.จากจีนสู่ไทยสุขใจในแผ่นดินน่าน China Town of Nan (5 กุมภาพันธ์ 2567)
ขอเชิญเที่ยวงาน “จากจีนสู่ไทยสุขใจในแผ่นดินน่าน China Town of Nan” ในวันจันทร์ ที่ 5 กุมภาพันธ์ 2567 ตั้งแต่เวลา 17.00 น.เป็นต้นไป ณ บริเวณศาลเจ้าปึงเถ่ากง ถนนสุมนเทวราช บ้านหัวเวียงใต้ ตำบลในเวียง อำเภอเมืองน่าน จังหวัดน่าน เชิญชวนร่วมแต่งกายตามอย่างวัฒนธรรมชาวจีน ร่วมสัมผัสกลิ่นไอวัฒนธรรมชาวจีน พบกับกิจกรรมมากมายเช่น • กาดน่าน(โฮ๊ะ) คราฟท์ • กาดมะเก่าบ้านหัวเวียงใต้ • สาธิตอาหารคาวหวาน อาหารจีน อาหารพื้นเมือง • การแสดงเชิดสิงโต การแสดงรำไท้เก๊ก ฯลฯ • การเสวนา จากจีนสู่ไทยสุขใจในแผ่นดินน่าน China Town of Nan โดยวิทยากร ตัวแทนกลุ่มคนไทยเชื้อสายจีนในจังหวัดน่าน ประกอบด้วย นายวิทยา จงประสาธน์สุข ประธานพ่อค้าน่าน นายแสนสุข เหล่าอาภากุล ร้านแสนสุขอลูมิเนีย นางสาวสิริกาญน์ ตั้งจิตนุสรณ์ ตลาดตั้งจิตนุสรณ์
กิจกรรมรวมพลคนเรือมอันเร งานเทศกาลแลกเปลี่ยนวัฒนธรรมนานาชาติ (Thailand Cultural Exchange Festival : Thailand-CEF)
จังหวัดสุรินทร์ ขอเชิญชวนทุกท่านสมัครเข้าร่วมกิจกรรม "รวมพล คนเรือมอันเร" ในงานเทศกาล แลกเปลี่ยนวัฒนธรรมนานาชาติ (Thailand Cultural Exchange Festival : Thailand-CEF)” ๕ กุมภาพันธ์ ๒๕๖๗ ณ ลานกิจกรรมสวนเฉลิมพระเกียรติ ๘๐ พรรษา (สวนใหม่) จังหวัดสุรินทร์ เวลา ๑๗.๐๐ น. ผู้เข้าร่วมกิจกรรมรับเกียรติบัตรจากผู้ว่าราชการจังหวัดสุรินทร์ สอบถามรายละเอียดเพิ่มเติมทาง Facebook "สำนักงานวัฒนธรรมจังหวัดสุรินทร์" หรือโทร 044511963 ต่อ 22
ขบวนคาร์นิวัล Open World สีสันคัลเลอร์ฟูล ในงานเทศกาลการแลกเปลี่ยนวัฒนธรรมนานาชาติ
ร่วมชม ร่วมโชว์ ขบวนคาร์นิวัล Open World สีสันคัลเลอร์ฟูล ในงานเทศกาลการแลกเปลี่ยนวัฒนธรรมนานาชาติ จังหวัดสุรินทร์ ขอเชิญชวนจิตอาสา แต่งกายแฟนซี ร่วมขบวนคาร์นิวัล Open World สีสันคัลเลอร์ฟูล ในงานเทศกาล แลกเปลี่ยนวัฒนธรรมนานาชาติ (Thailand Cultural Exchange Festival : Thailand-CEF)” ๕ กุมภาพันธ์ ๒๕๖๗ นี้ ร่วมกับขบวนแฟนซีนานาชาติ ๑๐ ประเทศ ผู้เข้าร่วมกิจกรรมรับเกียรติบัตรจากผู้ว่าราชการจังหวัดสุรินทร์ สอบถามรายละเอียดเพิ่มเติมทาง Facebook "สำนักงานวัฒนธรรมจังหวัดสุรินทร์" หรือโทร 044511963 ต่อ 22
ฉลองตรุษจีน อุดรธานี ที่ศาลเจ้าปู่-ย่า กิจกรรมมงคล 5 วันเต็ม วันที่ 5-9 ก.พ.67
ฉลองตรุษจีน อุดรธานี ที่ศาลเจ้าปู่-ย่า กิจกรรมมงคล 5 วันเต็ม วันที่ 5-9 ก.พ.67 มารับพลังดี รับปีมังการทอง #มหัศจรรย์ปีมังกรทองอุดรธานี2567 กับ 4 พื้นที่ เฉลิมฉลองปีมังกรทองอุดรธานี [
รายละเอียดกิจกรรม]
Hightlights มังกรและอุโมงค์ไฟยิ่งใหญ่สุดตระการตามากที่สุด ความสูงถึง 3 เมตร ยาว 4 เมตร และยาวมากถึง 24 เมตร มังกรมหามงคลตัวนี้..ได้รับการประดิษฐ์อย่างปราณีต โดยช่างผู้เชี่ยวชาญ จากเยาวราช..กรุงเทพมหานคร ผู้ซึ่งสร้างประตูซุ้มทางเข้าของเทศกาลตรุษจีน ณ เยาวราช ปี 2566
4 จุดเที่ยวงานตรุษจีน อุดรธานี
- 5-9 ก.พ. 67 งานเทศกาลตรุษจีน’ 67 ณ ศาลเจ้าปู่ย่า อุดรธานี
- 10-12 ก.พ. 67 เทศกาลตรุษจีน ถนนอาหารอุดรธานี 2567 ณ บริเวณวงเวียนหอนาฬิกา อุดรธานี
- 10-11 ก.พ. 67 Best of Luck Year of Dragon ณ ศูนย์การค้า UD Town
- 6-11 ก.พ. 67 The Great Chinese New Year 2024 ศูนย์การค้า Central Udon
งานชนลาว - เผ่าเยอ 6-8 กุมภาพันธ์ 2567
เชิญชวนทุกท่าน เที่ยวงานชนลาว - เผ่าเยอ ระหว่างวันที่ 6-8 กุมภาพันธ์ 2567 ณ สวนสาธารณะริมลำน้ำเสียว เตรียมตัวพบกับ การแสดงวงดนตรีสุดมันส์ การประกวดไก่พื้นเมือง และกิจกรรมอื่นๆ อีกมากมาย
สืบสานงานประเพณีบุญคูณลาน ตำนานข้าวอินทรีย์ วิถีวัฒนธรรมยโสธร 6 - 9 กุมภาพันธ์ 2567
ขอเชิญร่วมสู่ขวัญข้าวชาวอีสาน "สืบสานงานประเพณีบุญคูณลาน ตำนานข้าวอินทรีย์ วิถีวัฒนธรรมยโสธร" ตั้งแต่วันที่ 6 - 9 กุมภาพันธ์ 2567 ณ บริเวณหน้าที่ว่าการอำเภอกุดชุม อำเภอกุดชุม จังหวัดยโสธร . กิจกรรมภายในงาน ประกอบด้วย การประดับตกแต่งปราสาทข้าว พิธีบายศรีสู่ขวัญข้าว การออกร้านจำหน่ายผลิตภัณฑ์ทางวัฒนธรรม CPOT , CCPOT ผลิตภัณฑ์ OTOP สินค้าตลาดประชารัฐ นิทรรศการองค์ความรู้ “ข้าวอินทรีย์ วิถีวัฒนธรรมยโสธร” การแสดงนิทรรศการองค์ความรู้ของส่วนราชการ หน่วยงาน การออกร้านมัจฉากุดชุม การประกวดขับร้องเพลงไทยลูกทุ่งพร้อมหางเครื่อง การประกวดกลองยาว การประกวดตีข้าว บีบข้าวปุ้น ส้มตำลีลา ตำข้าว หุงข้าว การแสดงศิลปวัฒนธรรมจากกลุ่มเด็กและเยาวชน และศิลปินพื้นบ้านที่มีชื่อเสียง
ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร ประจำปี 2567 (7-11 กุมภาพันธ์ 2567)
"ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร" ประจำปี 2567 ระหว่างวันที่ 7-11 กุมภาพันธ์ 2567 ณ บริเวณริมเขื่อนหน้าศาลเจ้าพ่อหลักเมืองสมุทรสาคร ภายในงานพบกับสินค้าวัฒนธรรม มรดกตกทอดแห่งภูมิปัญญาจากร้านค้ามากกว่า 50 ร้าน ช็อปสนุกร่วมลุ้นรางวัล ร่วมกราบไหว้เทพเจ้าไช้สิ่งเอี๊ย เสริมมงคลตามความเชื่อชาวไทยเชื้อสายจีน พร้อมด้วยนิทรรศการ และการประกวดเชิดสิงโต ชมพลุไฟตระกาลตา แสง สี เสียง สวยงาม สอยดาวจากต้นไม้มงคล
Travel Trend Talk 2024 โดย สมาพันธ์ท่องเที่ยวชลบุรี 7 ก.พ.2567
" Travel Trend Talk 2024 " มาอัพเดทเทรนด์ที่คนวงการท่องเที่ยวต้องรู้" จัดโดย สมาพันธ์ท่องเที่ยวชลบุรี วันที่ 7 ก.พ.2567 ณ โรงแรมเดอะซายน์ เวลา 14.00-17.30 น. โดย... วิทยากรชื่อดัง ระดับประเทศ ที่ประสบความสำเร็จในธุรกิจจริง ! ได้แก่ คุณต่อ เพนกวิ้น เพจ Tor Penguin คุณคิว ธีระทัต หนูดำ CEO จงทำคอมเมิร์ช คุณ CK Cheong CEO of Fastwork คุณแต๋ง After Yum เต็มอิ่มกับ ความรู้อัดแน่นแบบจุกๆ ทุกแง่ ทุกมุม สำหรับ ผู้ประกอบการ SMEs และคนวงการท่องเที่ยว !! มีค่าใช้จ่าย
สุรินทร์โฟล์คแคมป์ #1 เขียนไขและวานิช งานใหม่ปี 2567
สุรินทร์โฟล์คแคมป์ #1 เขียนไขและวานิช งานใหม่ปี 2567 เข้าฟรี‼️ชมฟรี‼️ วันที่ 8-9 ก.พ. 2567 "ตลาดไนท์ มหาเฮง พลาช่า" ขอเชิญทุกท่านออกเดินทาง ทิ้งความวุ่นวายต่างๆ มาพักผ่อน ฟังวงดนตรีที่คุณชื่นชอบ กับบรรยากาศสุดแสนพิเศษที่คุณไม่เคยได้สัมผัสที่ไหนมาก่อน พร้อมกิจกรรม ความสนุก อาหารอร่อย มากมาย ภายในงาน
งานเฉลิมฉลอง “มรดกโลกบ้านเชียง ประจำปี 2567” วันที่ 8 - 11 กุมภาพันธ์ 2567
ททท.สำนักงานอุดรธานี ขอเชิญร่วมงานเฉลิมฉลอง “มรดกโลกบ้านเชียง ประจำปี 2567”วันที่ 8 - 11 กุมภาพันธ์ 2567 ณ ชุมชนบ้านเชียง อำเภอหนองหาน จังหวัดอุดรธานี กิจกรรมไฮไลท์ ศุกร์ที่ 9 กุมภาพันธ์ 2567 ตั้งแต่เวลา 16:00 น. เป็นต้นไป • ชมขบวนแห่วิถีชีวิตและวัฒนธรรมประเพณี กว่า ๑๑ ขบวน จากชาวบ้านเชียงและชาวอุดรธานีณ ถนนสายวัฒนธรรมบ้านเชียง • ชมการแสดงแสง สี เสียง สื่อผสม ตอน "ตำนานวิถีชีวิต มรดกโลกบ้านเชียง" • ชมการแสดงวิถีชีวิต "วิถีคน วิถีควาย มรดกไทย มรดกโลก" • ชมนิทรรศการวิชาการ "สืบเส้นใยผ้า สานภูมิปัญญาบ้านเชียง" และกิจกรรมอื่น ๆ อีกมากมาย สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักงานวัฒนธรรมจังหวัดอุดรธานี - 042 247 802 เทศบาลตำบลบ้านเชียง - 042 235 001
เทศกาลตรุษจีน ประจำปี 2567 ราชบุรี ไชน่าทาวน์ 8-12 กุมภาพันธ์ 2567
งาน “เทศกาลตรุษจีน ราชบุรี ดินแดนมังกร ร่ำรวย เสริมบารมี ปีมังกรทอง” ประจำปี 2567 ที่จะจัดขึ้นในระหว่าง วันที่ 9-11 กุมภาพันธ์ 2567 เวลา 16.00 – 22.00 น. ณ ริมเขื่อนรัฐประชาพัฒนา-ตลาดโคยกี่ จังหวัดราชบุรี ภายในงานจะพบกับความสวยงามอลังการตระการตากับนำเสนอเอกลักษณ์ของเมืองมังกร ในการจำลองบรรยากาศแบบจีนของปีมังกรทอง ที่ทุกท่านจะพบกับ
การแสดงฟรีคอนเสิร์ตจากศิลปินชื่อดัง วันที่ 9 กุมภาพันธ์ 66 เวลา 21.00 น. วง The Pakinson วันที่ 10 กุมภาพันธ์ 66 เวลา 21.00 น. วง Better Weather วันที่ 11 กุมภาพันธ์ 66 เวลา 21.00 น. Sani. กิจกรรมอื่นๆ
- อุโมงค์มังกร ที่ชาวจีนเชื่อกันว่ามังกรจะนำมาซึ่งอายุยืนยาว ความเจริญรุ่งเรือง โชคลาภวาสนา และการเดินผ่านลอดท้องมังกรนั่นเชื่อว่าจะเสริมสร้างความเป็นสิริมงคล ที่จะให้โชคลาภตลอดทั้งปี
- อุโมงค์โคมจีน สัญลักษณ์มงคล ที่ช่วยเสริมสิริมงคลให้แสงสว่างแก่มนุษย์
- ประติมากรรมกับจุดถ่ายรูปต่างๆ เช่น จุดถ่ายรูปมังกรทอง, โคมไฟ 8 เซียน, โคมไฟกิเลน และการตกแต่งประดับไฟทั่วบริเวณงาน
- เสริมดวงด้วยโหราศาสตร์ชื่อดัง อาทิ ดูดวงศาสตร์ ไพ่ยิปซี, ดูดวงด้วยศาสตร์จากเส้นลายมือ,
- กิจกรรมการรังสรรค์ทำอาหารมงคลร่วมกับ เชฟบิ๊ก-ภูริพรรษ ใจวีระวัฒนากุล “ผู้ชนะ STARS CHEF THAILAND ดาวสร้างดาว”
- กิจกรรมการเพนท์พัดมงคล
- ชมการแสดงวัฒนธรรมจีนร่วมสมัย
- การแสดงเชิดสิงโต, การแสดงรำพัด, การแสดงงิ้วเปลี่ยนหน้า
- ชมขบวนแห่ตรุษจีนที่ยิ่งใหญ่อลังการ
- การออกร้านจำหน่ายอาหารและเครื่องดื่ม และขบวนรถ Food Truck
มหกรรมเครื่องปั้นดินเผาของดีด่านเกวียน 8-14 กุมภาพันธ์ 2567
งานมหกรรมเครื่องปั้นดินเผาของดีด่านเกวียน วันที่ 8-14 กุมภาพันธ์ 2567 บริเวณถนนหน้าเทศบาลด่านเกวียน อำเภอโชคชัย จังหวัดนครราชสีมา
World Vibe Sukhothai Taste 2024 by Treasure Farm 8-11 กุมภาพันธ์ 2567
World Vibe Sukhothai Taste 2024 by Treasure Farm 8-11 กุมภาพันธ์ 2567 กิจกรรมส่งเสริมกรท่องเที่ยว Sukh Festa ที่จะสร้างความ "สุขสำราญอาหารสุโขทัยที่ไม่เหมือนเดิม" ทุกเมนูคัดสรรวัตถุดิบที่มีคุณภาพ โดยเฉพาะ ผักและข้าวปลอดสารพิษจาก Treasure Farm มาปรุงเป็นสำรับสุโขทัยในรูปแบบใหม่ อาทิ มินิเบอร์เกอร์น้ำพริกกากหมู ปลาเห็ดยัดไส้ปูก้อน ผัดกระเพราหมูคุโบูตะ ซูชิขนมเบื้องสุโขทัย และอีกหลากหลายเมนู สายกินห้ามพลาดครับ
งานวัฒนธรรมไทยหล่ม ขนมเส้นหล่มเก่า และเทศกาลอาหารสะอาดรสชาติอร่อยครั้ที่ 25 ประจำปี2567 8-14 ก.พ. 67
ขอเชิญเที่ยวงาน วัฒนธรรมไทยหล่ม ขนมเส้นหล่มเก่า และเทศกาลอาหารสะอาดรสชาติอร่อยครั้ที่ 25 ประจำปี2567 8-14 ก.พ. 67 สินค้าและคอนเสิร์ต 10-14 ก.พ. 67 เริ่มงานเป็นทางการ สนามหน้าที่ว่าการอำเภอหล่มเก่า
การแข่งขันร่มร่อนบิมลงเป้าแม่นยำ ชิงแชมป์แห่งประเทศไทยและนานาชาติ สานสัมพันธ์อาเซียน ครั้งที่ 8 - เอเอฟเอ เนชั่นลีก วันที่ 8 - 12 ก.พ. 67
การแข่งขันร่มร่อนบิมลงเป้าแม่นยำ ชิงแชมป์แห่งประเทศไทยและนานาชาติ สานสัมพันธ์อาเซียน ครั้งที่ 8 - เอเอฟเอ เนชั่นลีก วันที่ 8 - 12 ก.พ. 67 ณ ผาตากเสื้อ จ.หนองคาย
การแข่งขันร่มร่อนบินลงเป้าแม่นยำเวิลด์คัพ ประจำปี 2567 วันที่ 15 - 18 ก.พ. 67 ณ ผาตากเสื้อ จ.หนองคาย
ได้ชม ได้เชียร์แล้ว ต้องได้เที่ยว เพราะแหล่งท่องเที่ยวบริเวณใกล้เคียงสวยมากก - ชมวิวโขงบนสกายวอล์ค วัดผาตากเสื้อ - ชมหมอก ภูห้วยอีสัน - สัมผัสถ้ำพญานาค “ถ้ำเพียงดิน” - ชมโขง ล่องเรือชมพันโขดแสนไคร้ และอีกมากมาย
งานเทศกาลตรุษจีน ซินจ่าวมุกดาหาร MUKDAHAN INDOCHINA FEST 2024
งานเทศกาลตรุษจีนมุก#4 “ซินจ่าวมุกดาหาร” MUKDAHAN INDOCHINA FEST 2024 ✨บรรยากาศของเมืองมุกที่ตกแต่งประดับประดาไปด้วยโคมไฟจีน โคมไฟเวียดนาม ถนนย่านเมืองเก่ามุกดาหาร มีมุมถ่ายรูปชิคๆ ให้ถ่ายรูปกันด้วยน๊าาาา เพลินเพลินกับอาหารการกิน #ของดีเมืองมุก และ ร้านค้าประจำเมืองมากกว่า 30 ร้านค้า เรียกได้ว่าเป็นถนนอาหารของดีเมืองมุกกันเลยทีเดียว วันที่ 8 - 11 ก.พ. 2567 เวลา 17:00-22:00 น. ณ เซนเตอร์พ้อย สี่แยกฮั่นนำ มุกดาหารการแข่งขันร่มร่อนบินลงเป้าแม่นยำชิงแชมป์แห่งประเทศไทยและนานาชาติ สานสัมพันธ์อาเซียน ครั้งที่ 8 - เอเอฟเอ เนชั่นลีก
ททท.สำนักงานอุดรธานี ชวนมาร่วมชม ร่วมเชียร์ ให้กำลังใจนักกีฬา ในกิจกรรม
การแข่งขันร่มร่อนบินลงเป้าแม่นยำชิงแชมป์แห่งประเทศไทยและนานาชาติ สานสัมพันธ์อาเซียน ครั้งที่ 8 - เอเอฟเอ เนชั่นลีก วันที่ 8 - 12 ก.พ. 67 ณ ผาตากเสื้อ จ.หนองคาย
การแข่งขันร่มร่อนบินลงเป้าแม่นยำเวิลด์คัพ ประจำปี 2567 วันที่ 15 - 18 ก.พ. 67 ณ ผาตากเสื้อ จ.หนองคาย ได้ชม ได้เชียร์แล้ว ต้องได้เที่ยว เพราะแหล่งท่องเที่ยวบริเวณใกล้เคียงสวยมากก -ชมวิวโขงบนสกายวอล์ค วัดผาตากเสื้อ -ชมหมอก ภูห้วยอีสัน -สัมผัสถ้ำพญานาค “ถ้ำเพียงดิน” -ชมโขง ล่องเรือชมพันโขดแสนไคร้ -และอีกมากมายมนต์ฮักเชียงคาน 9 – 10 กุมภาพันธ์ 2567
มนต์ฮักเชียงคาน จัดขึ้นระหว่างวันที่ 9 – 10 กุมภาพันธ์ 2567 ณ บ้านติดดิน อ.เชียงคาน
งานแผ่นดินสมเด็จพระนารายณ์ 2567 (9-18 กุมภาพันธ์ 2567)
เชิญชวนนักท่องเที่ยว นุ่งโจง ห่มสไบ แต่งไทย
งานแผ่นดินสมเด็จพระนารายณ์มหาราช ลพบุรี งานประจำปีลพบุรี ที่ 1 ปี มี 1 ครั้ง ชมงามเทวสถานปรางค์แขก พระนารายณ์ราชนิเวศน์ ปีนี้เปิดวังให้เที่ยว 10 วัน 10 คืน เต็ม สัมผัสมนต์เสน่ห์แห่งละโว้ บรรยากาศ ตลาดย้อนยุค และซาโม่นตลาดมอญเมืองละโว้ และการแสดงครั้งยิ่งใหญ่ในการแสดงประวัติศาสตร์จินตนาการ ชุด “King Narai มหาราชแห่งแผ่นดิน" ชมฟรี..ไม่มีค่าใช้จ่าย
เทศกาลขึ้นเขาไหว้พระสักการะพระบรมสารีริกธาตุ วัดเชิงเขา 9-25 กุมภาพันธ์ 2567
งานประจำปีเทศกาลขึ้นเขาไหว้พระสักการะพระบรมสารีริกธาตุ วัดเชิงเขา จังหวัดสระบุรี 9-25 กุมภาพันธ์ 2567 งาน 17 วัน 17 คืน ศิลปินดนตรีแน่นเวทีทุกคืน บิ๊กเนม เช่น ปู พงษ์สิทธิ์ แด็ก Rock Rider (บิ๊กแอส) มนต์แคน แก่นคูน สีเผือก คนด่านเกวียน เสรี รุ่งสว่าง เอ อนุชา และอีกเพียบ
งานตรุษจีนปากเพรียว 2567 วันที่ 9-11 กุมภาพันธ์ 2567
งานตรุษจีนปากเพรียว ประจำปี 2567 วันที่ 9-11 กุมภาพันธ์ 2567 กิจกรรมการแสดงนาฏศิลป์จีน แต่งตัวสไตล์จีน ไม่ว่าจะเป็นกี่เพ้า ชุดจีนโบราณ จีนประยุกต์ หรือ คอสเพย์สไตล์จีนถ่ายรูปภายในงาน ณ ถนนพิชัยรณรงค์สงคราม โรงเจบ้วนเฮงตั๊ว อ.เมืองสระบุรี จ.สระบุรี
เทศกาลริมน้ำโขง 9 - 10 กุมภาพันธ์ 2024
เทศกาลริมน้ำโขง 9 - 10 กุมภาพันธ์ 2024 สะพานมิตรภาพไทย-ลาว 3 นครพนม, ไทยแลนด์ มาพร้อมศิลปิน 8 วง ร่วมสนุกแบบไฟลุกกับราคาบัตรเพียง 699 เท่านั้น (บัตร 1 ใบเข้าได้ 2 วัน)
งานประจำปีและของดีเมืองน่าน ประจำปี 2567 (9-18 ก.พ. 2567)
จังหวัดน่าน และเหล่ากาชาดจังหวัดน่าน ร่วมกับภาคเอกชน กำหนดจัดงานประจำปีและของดีเมืองน่าน ประจำปี 2567 ระหว่างวันที่ 9-18 ก.พ. 2567 ณ ริมแม่น้ำน่าน เชิงสะพานพัฒนาภาคเหนือ เพื่อส่งเสริมพัฒนาการผลิตภาคเกษตรและผลิตภัณฑ์ชุมชน (OTOP) ของท้องถิ่น อนุรักษ์ศิลปวัฒนธรรมประเพณีของท้องถิ่นและชนเผ่าต่าง ๆ จัดแสดงนิทรรศการตามแนวคิดปรัชญาเศรษฐกิจพอเพียง ส่งเสริมการท่องเที่ยวของจังหวัดน่าน และจัดหารายได้เพื่อเป็นค่าใช้จ่ายด้านสาธารณกุศลของเหล่ากาชาดจังหวัดน่าน
สำหรับปีนี้บัตรสลากกาชาดการกุศล ใบละ 50 บาท โดยรางวัลที่ 1 รถยนต์โตโยต้า ฟอร์จูนเนอร์ รางวัลที่ 2 รถยนต์โตโยต้า รีโว่ และรางวัลต่าง ๆอีกมากมาย ซึ่งในปีนี้เตรียมจัดพื้นที่จัดแสดง และจำหน่าย ผลิตภัณฑ์ OTOP พื้นที่สร้างสรรค์ สินค้าหัตถกรรม และสินค้าชุมชนของดีจากแต่ละอำเภอมาวางจำหน่าย
พิเศษสุด ตื่นตาตื่นใจ การออกร้านของเหล่ากาชาด จ.น่าน ชมนิทรรศการของส่วนราชการ ไฟประดับงานที่สวยสดงดงามตา สินค้า OTOP ศิลปหัตถกรรม ของดีเมืองน่านเลือกซื้อสินค้าดีราคาถูก อาหารอร่อยหลากหลาย สวนสนุกสำหรับคุณน้องคุณหนู
กำหนดการจัดงาน เริ่มต้้งแต่เวลา 19.00 น.เป็นต้นไป
วันที่ 9 ก.พ. 67 พิธีเปิดงาน การแสดงวงดุริยางค์ มทบ.38 การเปิดตัวผู้ประกวดนางสาวน่าน
วันที่ 10 ก.พ. 67 การประกวดธิดาดอยและการแสดงวัฒนธรรมชนเผ่า
วันที่ 11 ก.พ. 67 การประกวดร้องเพลงไทยลูกทุ่งและหางเครื่อง ขององค์กรปกครองส่วนท้องถิ่น
วันที่ 12 ก.พ. 67 คอนเสิร์ตจากศิลปิน ครูแอ๊ด และวงเดอสะล้อ (ดนตรีล้านนาร่วมสมัย)
วันที่ 13 ก.พ. 67 การแสดงดนตรีเยาวชนจังหวัดน่าน และคอนเสิร์ต ศิลปินเต้ย เชน ไมค์ทองคำ
วันที่ 14 ก.พ. 67 การแสดงของนักเรียน เยาวชนจังหวัดน่าน และแสดงคอนเสิร์ตกีต้าร์ เดอะว๊อย และการแสดงบอลลูนโชว์
วันที่ 15 ก.พ. 67 การแสดงบอลลูนโชว์ การแสดงกิจกรรมเยาวชนต้นแบบ To Be Number One และคอนเสิร์ตหญิงลี ศรีจุมพล พร้อมแดนเซอร์สาวสวย
วันที่ 16 ก.พ. 67 คอนเสิร์ต รักชาติ ศาสน์ กษัตริย์ โดยหมวดดุริยางค์ มทบ.38 การแสดงของวง ท๊อปสตาร์แบนด์ มายากลเป็บซี่โชว์ คิวศรีธัญญา กายกรรมโชว์ เมจิกบับเบิล บอลลูนแมนโชว์ โชว์ของคนขายาว
วันที่ 17 ก.พ. 67 การประกวดนางสาวน่าน
วันที่ 18 ก.พ. 67 การประกวดร้องเพลงไทยลูกทุ่ง ประเภท กำนัน ผู้ใหญ่บ้านฯ และการออกรางวัลสลากกาชาดการกุศล ประจำปี 2567
ทั้งนี้ ขอเชิญสาวงาม สมัครเข้าประกวดธิดาดอย ในงานประจำปีและของดีเมืองน่าน ประจำปี 2567 เปิดรับสมัครตั้งแต่วันที่ 22 มกราคม - 2 กุมภาพันธ์ 2567
- สมัครออนไลน์ (ตลอด 24 ชั่วโมง) สแกนคิวอาร์โค๊ด
- สมัครด้วยตนเอง ณ ศูนย์พัฒนาราษฎรบนพื้นที่สูงจังหวัดน่าน ตำบลผาสิงห์ อำเภอเมือง จังหวัดน่าน โทร. 054 - 719 459 ( เฉพาะวัน เวลา ราชการ )
และขอเชิญสาวงาม สมัครเข้าประกวดนางสาวน่าน ในงานประจำปีและของดีเมืองน่าน ประจำปี 2567 ตั้งแต่วันที่ 22 มกราคม - 2 กุมภาพันธ์ 2567 ณ อาคารสำนักงานวัฒนธรรมจังหวัดน่าน
โดยเสียค่าธรรมเนียมการสมัครเข้าประกวด จำนวนเงิน 500 บาท
สอบถามการรับสมัคร เพจ : สำนักงานวัฒนธรรม จ.น่าน หรือ โทรศัพท์หมายเลข 0 6585 65163
ชายเรียง - เชียงราย หนังก๋างแปง 3 มิติ 9-10 กุมภาพันธ์ 2567
มาแหมเตื้อแล้ว ชายเรียง - เชียงราย หนังก๋างแปง 3 มิติ 9-10 กุมภาพันธ์ 2567 ร้าน The Terminal Stadium เชียงราย ตรงกันข้ามสนามบินแม่ฟ้าหลวง เปิดจองที่นั่งตั้งแต่ 17:00 น เป็นต้นไป พบกับหนังกลางแปลงยุคใหม่ในรูปแบบ 3มิติ คราวนี้เปิดให้ชมฟรี สามารถเข้าชมได้ทั้งเด็กและผู้ใหญ่ เกียมสาดเกียมเก้าอี้แคมป์ปิ้งฮื้อพร้อม แล้วไปม่วนตวยกัน
✅ศุกร์ที่ 9 กุมภาพันธ์ 2567 19.00 น Fending Nemo (นีโม่...ปลาเล็กหัวใจโต๊โต) 20.20 น กังฟูแพนด้า ภาค 1
✅เสาร์ที่ 10 กุมภาพันธ์ 2567 19.00 มินเนี่ยน 20.10 Pacific Rim (แปซิฟิค ริม สงครามอสูรเหล็ก)
OnceUponAtime2 เทศกาลดนตรี Musicfestival & Balloon จังหวัดสุรินทร์
เหลาเฟส OnceUponAtime2 เทศกาลดนตรี Musicfestival & Balloon วันที่ 9 กุมภาพันธ์ 2567 หมู่บ้านกัลปพฤกษ์2 อ.เมือง สุรินทร์ (ทางเข้าตรงข้ามไอคิวคอนกรีต ถนนเลี่ยงเมือง แสลงพันธ์) แนวคิดปีนี้ " Balloon in Wonderland " สนุกแน่นๆกับทั้ง 2 เวที สุดกระหึ่ม เครื่องเล่นสวนสนุก บอลลูนโชว์ ตลอดทั้งงาน ร้านค้า ร้านอาหาร มาร่วมออกบูท ร้านแฟชั่น อุปกรณ์แคมปิ้งป์ ลานกางเต๊นท์ สำหรับสายcamping
Line up เวที 1 - Yellow stoner , T-046 , YORKE, เรนิษรา SafePlanet. Musketeers. โชว์พาเหรดบอลลูน // เวที 2. - Sitta, เฟิร์ส ดอ, อิสญา , OSF & เรกเก้
งานประจำปีปิดทองวัดดอนไก่ดี 9-13 กุมภาพันธ์ 2567
งานเทศกาลตรุษจีนหาดใหญ่ ประจำปี 2567 วันที่ 9-13 กุมภาพันธ์ 2567
งานเทศกาลตรุษจีนหาดใหญ่ ประจำปี 2567 วันที่ 9-13 กุมภาพันธ์ 2567 ตั้งแต่เวลา 17.00-23.30 น. ณ โรงเรียนศรีนครมูลนิธิ ถนนเทพสงเคราะห์ และชีอุทิศ อำเภอหาดใหญ่ จังหวัดสงขลา นอกจากนี้มาเพลิดเพลินกับหุ่นโคมไฟที่อลังการงานสร้าง, ชมไฟแสงสีสวยงาม, ฟรีคอนเสิร์ตจากศิลปินดัง, มังกร-สิงโต, ประกวด Miss Chinese Hatyai, สวนสนุก, ไข่มังกร, อั่งเปาลุ้นโชค, โรงเตี๊ยม, ร้านค้า-ฟู้ดทรักอาหารอร่อยที่คัดสรรเพื่องานนี้
งานมหากุศลแห่พระสะเดาะเคราะห์ประจำปี ฉลองตรุษจีนหาดใหญ่ วันที่ 9 - 18 กุมภาพันธ์ 2567
งานมหากุศลแห่พระสะเดาะเคราะห์ประจำปี ฉลองตรุษจีนหาดใหญ่ วันที่ 9 - 18 กุมภาพันธ์ 2567 (10 วัน 10 คืน) มูลนิธิมิตรภาพสามัคคี (ท่งเซียเซี่ยงตึ๊ง)
งาน "เฮือนพวนชวนคราฟต์" : 3 ทษวรรษ พวนสุนทรี วันที่ 9-11 กุมภาพันธ์ 2567
งาน "เฮือนพวนชวนคราฟต์" : 3 ทษวรรษ พวนสุนทรี วันที่ 9-11 กุมภาพันธ์ 2567 นี้ ตั้งแต่เวลา 10.00 น. -17.00 น. ณ เฮือนไทยพวนโบราณบ้านหาดเสี้ยว , ร้านสุนทรีผ้าไทย อ.ศรีสัชนาลัย จ.สุโขทัย กิจกรรมในงาน (แบบสุขคราฟต์)
1. เล่าเรื่องผ้า “3 ทศวรรษ พวนสุนทรี” ผ่าน Gallery
2. เชิญขึ้นเฮือนไทยพวนโบราณบ้านหาดเสี้ยว พร้อมถ่ายภาพกับวิถีชีวิตบนเฮือน และรับภาพโปสการ์ดฟรี 30 ท่านแรก/ วัน
3. ร่วมทำกิจกรรม DIY สุดชิค ผลงานหนึ่งเดียวด้วยมือของเรา กับพันธมิตรของพวนสุนทรี พร้อมจำหน่ายสินค้างานคราฟต์ที่มีคุณค่าจากศิลปินโดยตรง “ไม่ซื้อไม่ได้”
4. อิ่มอร่อยกับ “ก๋วยเตี๋ยวเฮือนไทยพวน” เส้นข้าวกล้อง หนึ่งเดียวที่สุโขทัย และอิ่มอีก กับอาหารไทยพวนแบบดั้งเดิม และแบบพวนฟิวชั่น และเครื่องดื่มหลากหลายเมนูจากสุขเสมอ เฉพาะวันที่ 9 กพ มีกิจกรรม สาวไหม และคั่วใบชา จากกรมหม่อนไหม
พบกับร้านค้าที่น่าสนใจ
1. สุนทรีผ้าไทย
2. ร้านไปยาลใหญ่
3. จิตรกรภูธร
4. ไทยครั่ง
5. มนตรีเครื่องเงินสุโขทัย
6. PANAYA craft
7. สุขเสมอ
8. Mothanaceramic
9. PIPIT
10. USER THAI
**เฮือนพวนชวนคราฟต์ 1 ใน 12 กิจกรรม Sukh Festa ที่ผู้ประกอบการสุโขทัย ตั้งใจจัดงานต้อนรับนักท่องเที่ยว หมุนเวียนกันจัดตลอดเดือนกุมภาพันธ์ ถึงต้นเดือนมีนาคม จะมีกิจกรรมอะไรต่อจากนี้บ้าง? ติดตามได้ทางเพจ Facebook : ททท.สำนักงานสุโขทัย และ เพจ Facebook : Sukh Festa
เปิดโลกทะเลเกาะยาวจังหวัดพังงา 2567 วันที่ 9-11 ก.พ. 2567
เปิดโลกทะเลเกาะยาวจังหวัดพังงา 2567 จัดขึ้นระหว่างวันที่ 9-11 ก.พ. 2567 ท่าเทียบเรือคลองเหีย เกาะยาวใหญ่นที่ 10 กุมภาพันธ์นี้ เวลา 20.00 น. พิธีเปิดอย่างยิ่งใหญ่ พบกับศิลปินชื่อดัง • "ซี ดาหลา" • "พ็อก บิ้กอาย" พร้อมคณะเอวีรูม
งาน Art Lane Festival 2024 (9 - 11 กุมภาพันธ์ 2567)
งาน Art Lane Festival 2024 ครั้งที่ 21 9 - 11 กุมภาพันธ์ 2567 คณะศิลปกรรมศาสตร์ มหาวิทยาลัยขอนแก่น
9 กุมภาพันธ์ 2567 ปศุสัตว์ระยอง รายงานการระบาดในจังหวัดระยอง 3 เคส
9 ก.พ. 2567 พบ โรคพิษสุนัขบ้า ระบาดแล้ว ในเขต อ.เขาชะเมา อ.บ้านฉาง และ อ.นิคมพัฒนา จ.ระยอง
เดือนกุมภาพันธ์ 2567 พบรายงานการระบาดของโรคพิษสุนัขบ้าระบาดในจังหวัดระยองแล้ว 3 เคส ได้แก่
1. สุนัขจรจัด ม.4 ต.เขาน้อย อ.เขาชะเมา
2. สุนัขจรจัด ม.3 ต.สำนักท้อน อ.บ้านฉาง
3. สุนัขจรจัด ม.3 ต.นิคมพัฒนา อ.นิคมพัฒนา
ทั้งนี้ สำนักงานปศุสัตว์จังหวัดระยอง พร้อมด้วย สำนักงานปศุสัตว์อำเภอในพื้นที่เกิดโรค ร่วมกับ เจ้าหน้าที่องค์กรปกครองส่วนท้องถิ่น (อปท.) ที่พบโรค ได้แก่ อบต.เขาน้อย อบต.สำนักท้อน ทต.สำนักท้อน อบต.นิคมพัฒนา เจ้าหน้าที่สาธารณสุขอำเภอ ผู้นำท้องที่ และเจ้าหน้าที่อสม. ร่วมกันดำเนินการฉีดวัคซีนป้องกันโรคแก่สุนัขและแมวทุกตัวในพื้นที่เสี่ยงรัศมี 5 กม. รอบจุดเกิดโรค พร้อมสั่งกักโรคสัตว์ที่มีความเสี่ยงสูง เพื่อดูอาการอย่างเข้มงวด สำหรับคนที่มีความเสี่ยงสัมผัสสัตว์ติดเชื้อได้แจ้งให้รีบพบแพทย์แล้ว
จากการลงพื้นที่สอบสวนโรค พบว่า สุนัขทั้งหมดไม่เคยได้รับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้ามาก่อนคือปัจจัยเสี่ยงหลักที่ทำให้เกิดโรคระบาดดังกล่าว
จึงขอเน้นย้ำเจ้าของนำสุนัขและแมวของตนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าเป็นประจำทุกปี เนื่องจากโรคพิษสุนัขบ้าเป็นโรคติดต่อจากสัตว์สู่คน โดยมีสุนัขและแมวเป็นพาหะนำโรคหลัก หากมีอาการระบบประสาทแล้ว ไม่ว่าคนหรือสัตว์จะเสียชีวิตทุกราย แต่สามารถป้องกันได้โดยการฉีดวัคซีนให้สุนัขและแมวอย่างสม่ำเสมอ กรณีเริ่มฉีดครั้งแรก ควรได้รับเข็มกระตุ้นในอีก 2-4 สัปดาห์ถัดไป แล้วฉีดเข็มกระตุ้นเป็นประจำทุก 1 ปี ทั้งนี้ วัคซีนพิษสุนัขบ้าฟรีสามารถสอบถามได้ที่อปท.ในพื้นที่นั้น
เทศกาลตรุษจีนอุดรธานี ถนนอาหารเมืองอุดรธานี ประจำปี 2567
เทศบาลนครอุดรธานี กำหนดให้มีการจัดงานเทศกาลตรุษจีน (ถนนอาหารเมืองอุดรธานี) ประจำปี 2567 ขึ้นระหว่างวันที่ 10-12 กุมภาพันธ์ 2567 ณ บริเวณวงเวียนเฉลิมพระเกียรติ (หอนาฬิกา) ถนนประจักษ์ศิลปาคม ซึ่งปีนี้เป็นปีที่ 18 ของการจัดงานเทศกาลตรุษจีน เพื่อส่งเสริมการท่องเที่ยวของจังหวัดอุดรธานี บูรณาการทำงานร่วมกันระหว่างภาครัฐ ภาคเอกชน และภาคประชาชน เพื่อเป็นการกระตุ้นเศรษฐกิจ สร้างงาน สร้างรายได้ ให้กับประชาชนในท้องถิ่น และเพื่อประชาสัมพันธ์เอกลักษณ์อันมีชื่อเสียงของจังหวัดอุดรธานี เมืองพหุวัฒนธรรม หรือ เมืองหลากหลายวัฒนธรรมให้เป็นที่รับรู้ระดับประเทศ (ภาพกิจกรรมงานตรุษจีนอุดรธานี ปี 2566 จากเทศบาลนครอุดรธานี)
เทศกาลเที่ยวงานวัดเขาวงพระจันทร์ 3,790 ขั้น พิสูจน์ศรัทธา 10 - 25 กุมภาพันธ์ 2567
ททท.สำนักงานลพบุรี ชวนเที่ยว “เทศกาลเที่ยวงานวัดเขาวงพระจันทร์” 3,790 ขั้น พิสูจน์ศรัทธา นมัสการรอยพระพุทธบาท และหลวงพ่อพุทธโชค ใน
ระหว่างวันที่ 10 - 25 กุมภาพันธ์ 2567 (15 วัน 15 คืน) ณ วัดเขาวงพระจันทร์ ตำบลห้วยโป่ง อำเภอโคกสำโรง จังหวัดลพบุรี “เขาวงพระจันทร์” นับว่าเป็นภูเขาที่สูงที่สุดในจังหวัดลพบุรี โดยมีทางบันไดขึ้นสู่ยอดเขารวม 3,790 ขั้น มีความเชื่อว่าหากใครได้มานมัสการรอยพระพุทธบาทที่ประดิษฐานอยู่บนยอดเขาจะประสบความสุข สมหวังทุกประการ ซึ่งโดยปกติแล้วจะมีนักท่องเที่ยวหลั่งไหลเดินทางขึ้นเขาเพื่อไปกราบนมัสการรอยพระพุทธบาทกันอย่างต่อเนื่องตลอดทั้งปี โดยเฉพาะในช่วงการจัดงาน ซึ่งเป็นช่วงที่ทางวัดเขาวงพระจันทร์เปิดโอกาสให้นักท่องเที่ยวสามารถขึ้นเขาได้ตลอด 24 ชั่วโมง พร้อมทั้งมีการประดับไฟสวยงาม รวมถึงมีร้านค้าไว้คอยให้บริการตลอดเส้นทาง
งานเทศกาลนมัสการพระพุทธบาท ประจำปี 2567 (10-25 ก.พ. 2567)
งานเทศกาลนมัสการพระพุทธบาท ประจำปี 2567 ระหว่างวันที่ 10-25 ก.พ. 2567 เปิดนมัสการ24ชั่วโมง ณ วัดพระพุทธบาทราชวรมหาวิหาร จ.สระบุรี
งานประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) จันทบุรี ประจำปี 2567 วันที่ 10 กุมภาพันธ์ 2567 ถึงวันที่ 9 เมษายน 2567
งานประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) จันทบุรี ประจำปี 2567 จัดขึ้นระหว่างวันที่ 10 กุมภาพันธ์ 2567 ถึงวันที่ 9 เมษายน 2567 ซึ่งจะมีพิธีบวงสรวง วันที่ 8 กุมภาพันธ์ 2567 เขาคิชฌกูฏ ตั้งอยู่ในเขตอุทยานแห่งชาติเขาคิชฌกูฏ เป็นที่ประดิษฐานของ "พระบาทเขาคิชฌกูฏ" หรือ "พระบาทพลวง" รอยพระพุทธบาทที่อยู่สูงที่สุดในประเทศไทย สูงกว่า 1,050 เมตร จากระดับน้ำทะเล งานประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ เป็นงานใหญ่ประจำปีของจันทบุรีที่มีชาวไทยและชาวต่างประเทศที่มีมีความศรัทธาเดินทางมานมัสการนับล้านคนแต่ละปี เป็นมหกรรมใหญ่ที่ชาวจันทบุรีภาคภูมิใจที่ได้ต้อนรับผู้มาเยือน หากใครยังไม่เคยต้องหาโอกาสสัักครั้งในชีวิต
Art Night Run Chiangrai Biennale งานวิ่งผสมผสานงานศิลปะ หนึ่งเดียวในไทย 10 กุมภาพันธ์ 2567
Art Night Run Chiangrai Biennale เสาร์ที่ 10 กุมภาพันธ์ 2567 เวลา 19.00 น.ณ หอศิลป์ร่วมสมัยเมืองเชียงราย (CIAM) ร่วมกันสร้างสรรค์ผลงานศิลปะจากการวิ่ง หนึ่งเดียวในประเทศไทย กับเส้นทางการแข่งขัน 3 ระยะทาง 12km, 6km, และ 3km บอกเลยว่างานนี้ไม่ธรรมดากิจกรรม 3 วัน 3 คืน ที่อัดแน่นไปด้วยงานศิลปะ ดนตรีคอนเสิร์ตและการพบปะสังสรรค์สำหรับนักวิ่งทั่วประเทศ เหรียญรางวัล โล่ห์รางวัล และเสื้อที่ระลึก “Art Night Run Chiangrai Biennale ” ที่ถูกออกแบบพิเศษโดย อาจารย์เฉลิมชัย โฆษิตพิพัฒน์ และ อาจารย์สุวิทย์ ใจป้อม นายกขัวศิลปะเชียงราย เป็นผู้ร่วมออกแบบ เตรียมพบกับคอนเสิร์ตสุดมันส์ กับวงดนตรีระดับตำนาน ModernDog!! วันศุกร์ที่ 9 กุมภาพันธ์ 67 เวลา 16.00 น. เป็นต้นไป งานนี้นักวิ่งเข้าชม ฟรี
งานตรุษจีน ประจำปี 2567 มังกรทองนครลำปาง Chinatown@Lampang 2024
เทศบาลนครลำปาง กำหนดจัดงานเทศกาลตรุษจีน ประจำปี 2567 ขึ้น ภายใต้ชื่องาน “มังกรทองนครลำปาง Chinatown@Lampang 2024” ระหว่างวันที่ 10 – 11 กุมภาพันธ์ 2567 เวลา 17.00 น. เป็นต้นไป ณ บริเวณถนนประสานไมตรี เพื่อสืบสานประเพณีวันสำคัญของคนไทยเชื้อสายจีน ซึ่งจังหวัดลำปางมีคนไทยเชื้อสายจีนอาศัยอยู่เป็นจำนวนมากตั้งแต่อดีตจนถึงปัจจุบัน โดยเฉพาะในย่านชุมชนสบตุ๋ย บริเวณสถานีรถไฟนครลำปาง จึงได้จัดให้มีกิจกรรมส่งเสริมองค์ความรู้ ประเพณีและวัฒนธรรมของคนไทยเชื้อสายจีน เพื่อเป็นการอนุรักษ์ สืบสานและส่งเสริมศิลปวัฒนธรรมประเพณีของท้องถิ่นให้สืบทอดสู่คนรุ่นหลัง มีกำหนดการ ดังนี้
วันที่ 10 - 11 กุมภาพันธ์ 2567 (ปิดถนนเวลา 17.00 น. เป็นต้นไป)
17.00 น. เป็นต้นไป - ชมนิทรรศการองค์ความรู้ศิลปวัฒนธรรมจีน - กิจกรรม DIY สไตล์จีน - การจำหน่ายสินค้าและอาหารสไตล์จีน - กิจกรรมบันทึกภาพ เช็คอิน สีสัน โคมจีน มังกรทองนครลำปาง
วันที่ 10 กุมภาพันธ์ 2567
17.30 น. - การบรรเลงดนตรีจีน รร.ประชาวิทย์ลำปาง
18.00 น. - การแสดงชมรมไทเก๊กสวนหลวง ร.9
18.30 น. - พิธีเปิดงานเทศกาลตรุษจีน ประจำปี 2567 โดย นายกเทศมนตรีนครลำปาง
18.50 น. - การแสดง “งิ้วเปลี่ยนชุด”
19.30 น. - การประกวดหนูน้อย Chinese Nakhon Lampang 2024 (แนะนำตัว)
20.30 น. - การแสดงชุด “บทกลอนลำนำจีน” รร.ประชาวิทย์ลำปาง - การแสดงขับร้องเพลงหมู่จีน รร.ประชาวิทย์ลำปาง - ประกาศผู้เข้ารอบหนูน้อยฯ 10 คนสุดท้าย - การแสดงความสามารถหนูน้อยฯ (คนละไม่เกิน 3 นาที) - การแสดงชุด Chinese dancing “ซูมู่จือ” พาใจใช้ชีวิตให้ดี รร.เทศบาล 1 (บ้านแสนเมืองมูล) - การแสดงจาก BLOSSOM BLOSSZAA ACADEMY Studio - ประกาศผู้เข้ารอบหนูน้อยฯ 5 คนสุดท้าย (ตอบคำถาม) - การแสดงชุด “ฝากความคิดถึงไปกับแสงจันทร์” รร.เทศบาล 3 (บุญทวงค์อนุกูล) - การแสดงชุด 好运来 (ห่าวหยุนไหล) ขอให้โชคดี รร.เทศบาล 6 (วัดป่ารวก)
22.00 น. - ประกาศผลการประกวดหนูน้อยฯ และพิธีมอบรางวัล - ร่วมบันทึกภาพ
วันที่ 11 กุมภาพันธ์ 2567
17.30 น. - การบรรเลงดนตรีจีน รร.ประชาวิทย์ลำปาง
18.00 น. - การแสดงชุด “ผู้สูงอายุต้อนรับตรุษจีน” จากชมรมผู้สูงอายุ - การแสดงชุด “อังกะลุง” จากชมรมผู้สูงอายุ
19.00 น. - การแสดงชมรมไทเก๊กสวนเวียงละกอน
19.20 น. - การแสดงชมรมไทเก๊กสวนสาธารณะเขลางค์นคร
19.40 น. - การแสดงชุด “ช่วงเวลาแห่งความสุข” รร.มัธยมวิทยา - การแสดงจาก BLOSSOM BLOSSZAA ACADEMY Studio
20.00 น. - การแสดงชุด “เชิดสิงโต มังกร”
21.00 น. - การแสดงชุด “ฝากความคิดถึงไปกับแสงจันทร์” รร.เทศบาล 4 (บ้านเชียงราย) - การแสดงชุด “รำพัดมงคลจีน” รร.เทศบาล 5 (บ้านศรีบุญเรือง) - การแสดงชุด “สี่สาวงาม” รร.มัธยมวิทยา
21.30 น. - พิธีปิด
*** กำหนดการอาจเปลี่ยนแปลงได้ตามความเหมาะสม
*** การแต่งกายสไตล์ชุดจีน/โทนสีแดง
SISAKET COVER DANCE CONTEST 2024 แข่งขันวันที่ 10 กุมภาพันธ์ 2567
สายแดนซ์...ต้องมา SISAKET COVER DANCE CONTEST 2024 ชิงเงินรางวัล มูลค่า 50,000 บาท แข่งขันวันที่ 10 กุมภาพันธ์ 2567 ณ สวนสาธารณะกุดหวาย จังหวัดศรีสะเกษ รับสมัครตั้งแต่วันนี้ ถึง 31 มกราคม 2567
Dark Sky Star Party มหกรรมท่องเที่ยวดูดาวแห่งปี 10 กุมภาพันธ์ 2567
มหกรรมท่องเที่ยวดูดาวแห่งปี "Dark Sky Star Party" ณ ผาแต้ม เขตอุทยานท้องฟ้ามืดที่มีทัศนวิสัยท้องฟ้าดีที่สุดแห่งหนึ่งของไทย พบกันวันเสาร์ที่ 10 กุมภาพันธ์ 2567 เวลา 17:00 - 23:00 น. ณ อุทยานแห่งชาติผาแต้ม อ. โขงเจียม จ. อุบลราชธานี
NARIT ร่วมกับอุทยานแห่งชาติผาแต้ม องค์การบริการส่วนจังหวัดอุบลราชธานี และการท่องเที่ยวแห่งประเทศไทย ชวนมาร่วมงานมหกรรมท่องเที่ยวดูดาวครั้งยิ่งใหญ่ “Dark Sky Star Party” ณ อุทยานแห่งชาติผาแต้ม อ. โขงเจียม จ. อุบลราชธานี การรวมตัวอีกครั้งของคาราวานกล้องโทรทรรศน์จากนักดาราศาสตร์สมัครเล่น และเครือข่ายดาราศาสตร์ทั่วไทย พร้อมหลากหลายกิจกรรมทางดาราศาสตร์ ประวัติศาสตร์ และธรรมชาติ
ตรุษจีนไชน่าทาวน์พัทยา 2567 (10 กุมภาพันธ์ 2567)
โซโหทาวน์พัทยา ไชน่าทาวน์แลนด์มาร์คของเมืองพัทยา ฉลองครบรอบ 12 ปี กับช่วงเทศกาล "ตรุษจีน..ไชน่าทาวน์พัทยา 2567" ไหว้ขอพรเจ้าแม่กวนอิมปางพันมือ และเรียกทรัพย์โชคลาภกับพิธี "ไป่กิมตุ้ง" ที่จัดเพียงปีละครั้งเฉพาะวันตรุษจีนเท่านั้น พร้อมรับชมการแสดงของมังกรจักรพรรดิ์ และการแสดงเชิดสิงโตในวันเสาร์ที่ 10 กุมภาพันธ์ 2567 เวลา 17.00 น. ถึง 24.00 น
ตรุษจีน 2567 หอชมเมืองสมุทรปราการ เปิดให้เข้าชมฟรี
เทศกาลตรุษจีน 2567 หอชมเมืองสมุทรปราการ เปิดให้เข้าชมฟรี โอกาสขึ้นชมวิว 360 องศา เมืองสมุทรปราการ ชมความเป็นมาของเมืองสมุทรปราการ ผ่านเทคนิคจัดแสดง แสง สีเสียง สุดตระการตา ภายในนิทรรศการ “ร้อยเป็นเรื่องเมืองปากน้ำ” เปิดทำการ วันอังคาร - อาทิตย์ (ปิดวันจันทร์) เวลา 10.00 - 17.00 น. ติดต่อสอบถามข้อมูลเพิ่มเติม โทร. 098-2419495
งานปิดทองลูกนิมติ วัดป้อมวิเชียรโชติการาม 10-18 กุมภาพันธ์ 2567
งาน JAZZ IN KHAO YAI 10 กุมภาพันธ์ 2567
งาน JAZZ IN KHAO YAI TRIPLE HERITAGE OF KORAT, THAILAND นำเสนอวงดนตรีแจ็สออร์เคสตรา. BIGGLES BIG BAND & THAI BLIND ORCHESTRA & DR.ALONGKOT CHUKAEW วันที่ 10 กุมภาพันธ์ 2567 17:00 น. : ลงทะเบียน 18:15 น. : แฟชั่นโชว์ โดย CHAYANNA SILK 18:30 น. : เริ่มคารแสดง ณ ร้านเป็นลาว เขาใหญ่ ถ.ธนะรัชต์ อ.ปากช่อง จ.นครราชสีมา ❗️สแกนเพื่อลงทะเบียน ภายในวันที่ 7 กุมภาพันธ์ 2567 รายได้นำไปสมทบทุนบริจาคแค่วัดป่าศรีแสงธรรม จังหวัดอุบลราชธานี
วิถีชาวดิน ถิ่นงานปั้น ประจำปี 2567 (10 - 14 กุมภาพันธ์ 2567)
ททท. สำนักงานนครราชสีมา ขอเชิญเที่ยวงานเทศกาลเครื่องปั้นดินเผาด่านเกวียนกับงาน "วิถีชาวดิน ถิ่นงานปั้น" ประจำปี 2567 ระหว่างวันที่ 10 - 14 กุมภาพันธ์ 2567 ณ ลานกิจกรรมหน้าเทศบาลตำบลด่านเกวียน อำเภอโชคชัย จังหวัดนครราชสีมา กิจกรรมการแข่งขันมากมาย วงดนตรี ศิลปินเต็มวงแสงสีเสียง อลังการ ตลอดทั้ง 5 วัน 5 คืน - 10 ก.พ. 67 วงออร์เคสตรา ย่าโมซิมโฟนีออร์เคสตรา และ วงหนิงปัทมา - 11 ก.พ. 67 วงออนซอนแบนด์ - 12 ก.พ. 67 เจนเจ้าค่ะ ไทรถแห่ - 13 ก.พ. 67 วงเพลงไทยแบนด์ - 14 ก.พ. 67 ประกวดธิดาดิน และวง T-REX
กิจกรรมท่องเที่ยวหัวใจสีเขียว Pangsida Chill 2024 : Bike & Have FUN วันที่ 10-11 กุมภาพันธ์ 2567 LINK
กิจกรรมท่องเที่ยวหัวใจสีเขียว Pangsida Chill 2024 : Bike & Have FUN วันที่ 10-11 กุมภาพันธ์ 2567 เชิญทุกท่านมาเยือนเมืองรอง มาปิคนิก ณ ลานกางเต็นท์อุทยานแห่งชาติปางสีดา ฟังเพลงรัก.... ต้อนรับเช้าวันใหม่กับกิจกรรมจักรยานท่องเที่ยว ฉบับครอบครัว ปั่นรับลมหนาวเส้นทางอุทยานแห่งชาติปางสีดา อำเภอเมืองสระแก้ว จังหวัดสระแก้ว – อ่างเก็บน้ำนฤบดินทรจินดา อำเภอนาดี จังหวัดปราจีนบุรี แล้วรวมทำบุญปล่อยปลา ณ อ่างเก็บน้ำนฤบดินทรจินดา - ติดต่อสอบถาม ททท.สำนักงานนครนายก โทร.0-3731-2282,0-3731-2284 จันทร์-ศุกร์ เวลา 09.00-16.00 น.
Leaf&Rhyme II งานดนตรีสายธรรมชาติ วันที่ 10-11 FEB 2024 LINK
Leaf&Rhyme II งานดนตรีสายธรรมชาติ ที่อบอุ่น จัดโดยเพื่อน ๆ กลุ่มใบไม้ กลุ่มนักกิจกรรมอนุรักษ์ฯ ที่ตั้งใจจัดงานดนตรี & ศิลปะ เพื่อส่งต่อความปรารถนาดีต่อธรรมชาติ วันที่ 10-11 FEB 2024 ที่ Baimai Activity Space ต.ป่าจะ อ.บ้านนา จ.นครนายก ⭕ งานศิลปะ Exhibition ด้านธรรมชาติ การอนุรักษ์ฯ ⭕ Playground ลานเล่นอิสระ Van Play Project ชวนเด็ก ๆ มาด้วยได้เลยจ้า ⭕ กิจกรรม Workshop สาย Craft, Art, Healing, Food ⭕ มีกิจกรรมอื่น ๆ ให้ได้ร่วม ได้เล่น ได้แลกเปลี่ยน ⭕ ยามเช้าวันอาทิตย์ : Yoga, Bird Walk, Nature Trail, Art Workshop ⭕ มี Cafe บริการในพื้นที่ (The Tropical | Eco-Cafe) ⭕ โซน Camp Bar รอบกองไฟ เนื้อย่าง ปิ้งย่าง BBQ เครื่องดื่ม ตลอด 2 วัน ⭕ มีอาหาร เครื่องดื่ม บริการภายในงาน ⭕ มีลานกางเต็นท์ บริการ กว้างขวาง ไม่แออัด (จำกัดจำนวน) ⭕ จำกัดผู้ร่วมงาน 400 ท่าน เท่านั้น บนพื้นที่ 18 ไร่ ⭕ รายได้ทั้งหมด เพื่อขับเคลื่อนอาสาสมัครในด้านการอนุรักษ์ฯ กับกลุ่มใบไม้ ⭕ มีพื้นที่จอดรถในบริเวณงาน เดินได้เลย ใกล้ ๆ ⭕ สามารถเดินทางด้วยรถสาธารณะได้ (จากรังสิต รถตู้ทีนึง+พี่วินทีนึง ถึงงานเลย) ⭕ ห้องน้ำถาวร สะอาด จำนวน 20 ห้อง ทั่วบริเวณงาน (4 จุด)
โชว์มาเลย Season 3 วันเสาร์ ที่ 10 กุมภาพันธ์ 2567
“โชว์มาเลย Season 3” เวทีการประกวดสุดยิ่งใหญ่ประจำปีของจ.เลย กับโอกาสในการแสดงฝีมือ โชว์ความสามารถด้านการร้อง เล่น เต้น โชว์ บนเวทีกลางในงานดอกฝ้ายบาน 2567 ชิงเงินรางวัลรวมมูลค่ากว่า 20,000 บาท วันเสาร์ ที่ 10 กุมภาพันธ์ 2567 – เวลา 17:00 น. ณ เวทีกลาง บริเวณลานหน้าศาลากลางจังหวัดเลย จัดโดย หอการค้าจังหวัดเลยร่วมกับจังหวัดเลย และกลุ่มนักธุรกิจรุ่นใหม่ YEC Loei มาร่วมกันเชียร์และให้กำลังใจผู้เข้าร่วมประกวดกันนะ
Sukhothai farm to table จากแปลง ขึ้นจาน อาหาร ดนตรี ศิลป์ (10 กุมภาพันธ์ 2567)
Sukhothai farm to table จากแปลง ขึ้นจาน อาหาร ดนตรี ศิลป์ วันที่ 10 ก.พ. 2567 เวลา 16.00 - 21.00 น. ไร่ฟุ้งเฟื่อง ต.เมืองบางขลัง อ.สวรรคโลก จ.สุโขทัย ชวนไปเที่ยว แหล่งท่องเที่ยวเชิงเกษตร ชมเมืองโบราณบางขลัง ชิมเมนูอาหาร Farm to table เลือกชิมอาหารถิ่น เดินเที่ยวชมงานบิ้งนาเฟสติวัล ฟังดนตรี เลือกซื้อสินค้าจากร้านค้าชุมชน และร้านค้าเครือข่ายตลาดมีเขียว สินค้าปลอดสารพิษเป็นมิตรกับสิ่งแวดล้อม
ปฏิทินท่องเที่ยวเครือข่ายตลาดมีเชียว
เที่ยวตลาดในสวน ฉลองตรุษจีน เเละวาเลนไทน์ (ตรุษไทน์) ที่ Barisut cafe 10, 11 เเละ 14 ก.พ. 2567
ชวนเที่ยวตลาดในสวน ฉลองตรุษจีน เเละวาเลนไทน์ (ตรุษไทน์) ที่ Barisut cafe คาเฟ่ลับสไตล์เเคมปิ้ง ใกล้ชิดธรรมชาติ น้องเป็ดน่ารัก (ต.มาบแค อ.เมือง จ.นครปฐม) พายเรือชิลๆ ให้อาหารปลา พร้อมสนามเด็กเล่นให้น้องๆปล่อยพลังอย่างเต็มที่ ในงานพบกับ ร้านค้า อาหาร พิซซ่า รถไอศครีม ดนตรีในสวน กิจกรรม workshop ดินปั้น บาติก มาลัยทิชชู ♥️เเล้วพบกัน วันที่ 10, 11 เเละ 14 ก.พ. 2567 เวลา 9.00 - 20.00 น. เข้างานฟรี รับสมัครร้านค้า ขนม ของทานเล่น ของที่ระลึก มากมาย มาร่วมเป็นส่วนหนึ่งของงานกันจ้า สอบถาม 062 - 1259565
CRAFT BEER NAKHONNAYOK @ใจFULL MARKET 10 - 11 กุมภาพันธ์ 2567
CRAFT BEER NAKHONNAYOK @ใจFULL MARKET งานคราฟท์ ที่รวบรวม Brewer และสุราชุมชน หลากหลายแบรนด์ คนรักคราฟท์เบียร์ แวะมาพบปะพูดคุย ใช้ใจสัมผัสรสชาติที่แต่ละท่านตั้งใจทำออกมา แลกเปลี่ยน ประสบการณ์กัน วันที่ 10 - 11 กุมภาพันธ์ 2567 เวลา : 17.00 - 23.00 ออกมาเดินเล่น บรรยากาศดีๆ ฟังเพลงชิลล์ๆ ทานของกินอร่อยๆ และจิบคราฟท์ดีๆ หวังว่าจะเป็นวันที่อบอุ่น และทำให้ทุกคนใจfull ไปด้วยกัน
ประเพณีบุญเดือนสาม ไหว้ปู่อือลือ บวงสรวงพญานาค ประจำปี 2567 ณ อำเภอบึงโขงหลง จังหวัดบึงกาฬ
ประเพณีบุญเดือนสาม ไหว้ปู่อือลือ บวงสรวงพญานาค ประจำปี 2567 ณ อำเภอบึงโขงหลง จังหวัดบึงกาฬ ระหว่างวันที่ 10-12 กุมภาพันธ์ 2567 กิจกรรมไฮไลท์ส่งเสริมการท่องเที่ยวทั้ง 3 วัน ในประเพณีบุญเดือนสามไหว้ปู่อือลือบวงสรวงพญานาคประจำปี 2567
**** วันที่ 10 กพ 67
เวลา 07.30 น อัญเชิญพระอุปคุต และห่มผ้าพระธาตุศรีบุญเนาว์
**** วันที่ 11 กพ 67
เวลา 08.30 น พิธีไหว้ปู่อือลือ และบวงสรวงพญานาคทางน้ำ โดยขบวนเรือ
และ เวลา 17.00 น พิธีไหลเรือไฟและการบวงสรวงพญานาคประจำวันเกิด และการแสดงแสงสีเสียง ตำนานปู่อือลือ
*** วันที่ 12 กพ 67
เวลา 07.00 น พิธีบวงสรวงถวายเครื่องสักการะปู่อือลือ
พบกับกิจกรรมการแสดงแสงสีเสียง ถนนคนเดินบึงโขงหลง และการออกร้านจำหน่ายสินค้า OTOP ของกินของใช้ ขึ้นชื่อจังหวัดบึงกาฬ ตลอด 3 วัน ตั้งแต่ 6.00 – 21.00 น. โดยโซนสินค้าประเภทอาหารที่ทุกท่านสามารถเดินชิม ช้อป และนั่งพักผ่อนได้ ชมการแสดงรำบวงสรวงสุดประทับใจ ????????ที่สำคัญมีจุด Check in สำหรับบันทึกภาพเป็นที่ระลึกสวย ๆ มากมาย
งานตรุษไทสกล 10-12 กุมภาพันธ์ 2567@ลานคนเมือง จังหวัดสกลนคร
เชิญเที่ยวงาน"ตรุษไทสกล" ระหว่างวันที่ 10-12 กุมภาพันธ์ 2567 @ลานคนเมือง จังหวัดสกลนคร ศิลปะ วัฒธรรม และอาหาร ชมการแสดง แสง สี เสียง เลือกซื้อ เลือกทานอาหาร 3 เชื้อชาติ ไทสกล
Dragon Run 2024 วันที่ 11 กุมภาพันธ์ 2567
Dragon Run 2024 วันที่ 11 กุมภาพันธ์ 2567 เดินวิ่งการกุศล สนับสนุนโครงการสร้างห้องผ่าตัดหัวใจ รพ.มิตรภาพสามัคคีท่งเซียเซี่ยงตึ๊ง ระยะวิ่ง 4.5 km/ 10.5 km
กิจกรรม เกี่ยวก้อยร้อยรัก กระซิบฮักเมืองน่าน พิธีสมรสหมู่แบบโบราณล้านนาน่าน หนึ่งเดียวในโลก (13-15 กุมภาพันธ์ 2567)
เชิญชวนคู่รักทุกท่าน ร่วมกิจกรรม "เกี่ยวก้อยร้อยรัก กระซิบฮักเมืองน่าน" พิธีสมรสหมู่แบบโบราณล้านนาน่าน หนึ่งเดียวในโลก ในวันที่ 13-15 กุมภาพันธ์ 2567 จัดโดย ททท.สำนักงานน่าน และ ชมรมที่พักจังหวัดน่าน รายละเอียดเพิ่มเติม เพียงท่านสแกน QR Code หรือ โทรสอบถาม 099-219-8747, 061-264-9399
Hug Fest : ฮัก เฟสท์ เทศกาลดนตรีแห่งความสุข 13-14 กุมภาพันธ์ 67
Hug Fest : ฮัก เฟสท์ เทศกาลดนตรีแห่งความสุข 13-14 กุมภาพันธ์ 67 เวลา 19:00 - 22:30 น. เซ็นทรัลเชียงใหม่ (เฟสติวัล) รายชื่อศิลปิน
13 กุมภาพันธ์ 67 19:00 WET SHIRT 20:45 SLAPKISS 22:30 FREEHAND
14 กุมภาพันธ์ 67 19:00 NERD 20:45 LOWER MANSION 22:30 REINIZRA
งาน ศิลปะ ขยะ ดนตรี Joy Beach Cafe อ่าวน้ำเมา 13 - 14 กุมภาพันธ์ 2567
งาน “ศิลปะ ขยะ ดนตรี ” Joy Beach Cafe อ่าวน้ำเมา 13 - 14 กุมภาพันธ์ 2567
งานประเพณีสู่ขวัญข้าว ตำบลนนทรี จังหวัดปราจีนบุรี 13-14 กุมภาพันธ์ 2567
งานประเพณีสู่ขวัญข้าว ตำบลนนทรี จังหวัดปราจีนบุรี วันที่ 13-14 กุมภาพันธ์ 2567 เวลา 16.00 น.เป็นต้นไป ณ สนามกีฬาองค์การบริหารส่วนตำบลนนทรี จ.ปราจีนบุรี ภายในงานพบกับกิจกรรมมากมาย -กิจกรรมประกวดประดิษฐ์เรือนนอนจากฟางข้าว -การแข่งขันสตรีทฟุตบอล กองฟางสเตเดี๊ยม -ขบวนแห่ธิดาแม่โพสพ -พิธีกรรมสู่ขวัญข้าว
นิทรรศการแสดงภาพ One Love Art Exhibition ครั้งที่ 4 วันที่ 13-18 ก.พ.2567
นิทรรศการแสดงภาพ One Love Art Exhibition ครั้งที่ 4 โดยมูลนิธิหนึ่งน้ำใจ ร่วมชมจิตรกรรมร่วมสมัยจากศิลปินระดับประเทศ สนุกกับกิจกรรมเวิร์กชอป อิ่มอร่อยกับร้านอาหารขึ้นชื่อของจังหวัดเชียงใหม่ วันที่ 13-18 ก.พ.2567 ที่ One Nimman จ.เชียงใหม่ รายได้จากนิทรรศการ โดย มูลนิธิหนึ่งน้ำใจ (One Love) เพื่อใช้ในการสร้างอาคารเรียนในถิ่นทุรกันดาร
Singha Park Chiangrai International Balloon Fiesta 2024 (14-18 กุมภาพันธ์ 2567)


“Singha Park Chiangrai International Balloon Fiesta 2024” เทศกาลบอลลูนนานาชาติ ที่ทุกท่านจะได้พบกับบอลลูนสีสันสดใส สวยงาม ลอยเหนือน่านฟ้าจังหวัดเชียงราย 14 - 18 กุมภาพันธ์ 2567 ชมบอลลูนนานาชาติจาก 11 ประเทศทั่วโลก อาทิ สหรัฐอเมริกา, ฝรั่งเศส, อังกฤษ, ญี่ปุ่น, ลัตเวีย, เกาหลีใต้, ออสเตรเลีย,สวิตเซอร์แลนด์, ออสเตรีย เวียดนาม และไทย รวมทั้งสิ้นกว่า 28 ลูก และการแข่งขันบอลลูนนานาชาติ พร้อมการแสดงโชว์บอลลูน จัดเต็มแสง สี เสียง ยามค่ำคืน / พิเศษโรแมนติกให้วาเลนไทน์กับ กิจกรรม Balloon Love 2024 บอกรักบนฟ้า / ชมการแสดงโขนกลางแปลงแบบเต็มคณะ เรื่องรามเกียรติ์ ชุด "พระจักรีทรงกรดปฐมบทรามเกียรติ์" จาก “กลุ่มศิลปินวังหน้า” กว่า 100 ชีวิต / มหกรรมคอนเสิร์ตสุดโรแมนติก จากศิลปินชื่อดัง ตลอด 5 วัน 5 คืน อาทิ อะตอม, บุรินทร์, แหลม สมพล, ZEAL, นนท์ ธนนท์, PAUSE, น้อย วงพรู, ETC, แสตมป์, TIMETHAI, MAIYARAP, URBOYTJ และอีกมากมาย / กิจกรรมพิเศษ Balloon Tethering / ฟาร์มทัวร์ ชมความ สวยงามของดอกไม้ วิวไร่ชา / สกู๊ตเตอร์ / จักรยาน / กิจกรรมแอดเวนเจอร์ ATV บนเส้นทางธรรมชาติ เป็นต้น ที่สำคัญสายกินก็พลาดไม่ได้ งานนี้เรามีซุ้มอาหารกว่า 50 ร้านอร่อยชื่อดังจากทั่วประเทศอีกด้วย
*** โปรดระวังมิจฉาชีพ สิงห์ปาร์ค เชียงราย ไม่มีนโยบายจำหน่ายบัตรทางออนไลน์ ติดตามรายละเอียดกิจกรรมต่างๆ ได้ทาง FB : เพจ สิงห์ปาร์ค เชียงราย เท่านั้น ***
กิจกรรมจดทะเบียนสมรส Fall in love @ Phuluang 14 กุมภาพันธ์ 2567
อำเภอภูหลวง ร่วมกับ Banana Land จัดกิจกรรมจดทะเบียนสมรส “Fall in love @ Phuluang” ในวัน พุธ ที่ 14 กุมภาพันธ์ 2567 ณ ปราสาทฟาง Banana land ดินแดนกล้วยๆ ใน Theme (ธีม) เจ้าหญิง-เจ้าชาย ผู้ที่สนใจ (*) สมัครฟรี ไม่มีค่าใช้จ่าย (*) รับของที่ระลึกในวันลาเลนไทน์ (*) ลุ้นรับของที่ระลึกสุดพิเศษ (*) รับจำนวนจำกัด เพียง 9 คู่ เท่านั้น (*) แจ้งความประสงค์ได้ที่ สำนักทะเบียนอำเภอภูหลวง วันนี้ – 31 มกราคม 2567 สอบถามรายละเอียดเพิ่มเติม สำนักทะเบียนอำเภอภูหลวง 042-897-592
Chiang Mai Crafts Week วันที่ 14-18 ก.พ. 2567
งานเชียงใหม่คราฟท์วีค Chiang Mai Crafts Week วันที่ 14-18 ก.พ. 2567 นี้ ที่ ณ ศูนย์การค้าเซ็นทรัลเชียงใหม่ แอร์พอร์ต ในแนวคิด Infinity Crafts รัก(ษ์)นี้ไม่สิ้นสุด ค้นหาแรงบันดาลใจ พูดคุยกับกูรูและเพื่อนร่วมวงการ และ Workshop แบบเต็มที่ภายในงาน มากกว่า 200 บูธ และ 150 Workshop ภายในงานพบกับ 1. Craft & Workshop Zone 2. Glint & Glow เด็กเปล่งแสง 3. Caffe•in•Space คาเฟอีนสเปซ 4. so do ART อาร์ตเป็นเช่นไร 5. Slow Fashion คลีนิคซ่อมผ้า แต่ละโซนกิจกรรมเน้นๆ แน่นๆ
Singha Park Chiangrai International Balloon Fiesta 2024 (14 –18 กุมภาพันธ์ 2567)
เทศกาลบอลลูนนานาชาติสุดยิ่งใหญ่แห่งปี “Singha Park Chiangrai International Balloon Fiesta 2024” ระหว่างวันที่ 14 –18 กุมภาพันธ์ 2567 ณ สิงห์ปาร์ค เชียงราย กิจกรรมสุดพิเศษ… เทศกาลบอลลูนนานาชาติจาก 11 ประเทศทั่วโลก อาทิ สหรัฐอเมริกา, ฝรั่งเศส, อังกฤษ, ญี่ปุ่น, ลัตเวีย, เกาหลีใต้, ออสเตรเลีย,สวิตเซอร์แลนด์, ออสเตรีย เวียดนาม และไทย รวมทั้งสิ้นกว่า 28 ลูก และการแข่งขันบอลลูนนานาชาติ พร้อมการแสดงโชว์บอลลูน จัดเต็มแสง สี เสียง ยามค่ำคืน
กิจกรรม Balloon Love 2024 บอกรักบนฟ้า ดื่มด่ำกับการแสดงโขนกลางแปลงแบบเต็มคณะ เรื่องรามเกียรติ์ ชุด "พระจักรีทรงกรดปฐมบทรามเกียรติ์" จาก “กลุ่มศิลปินวังหน้า” กว่า 100 ชีวิต มหกรรมคอนเสิร์ตสุดโรแมนติก จากศิลปินชื่อดัง ตลอด 5 วัน 5 คืน อาทิ อะตอม, บุรินทร์, แหลม สมพล, ZEAL, นนท์ ธนนท์, PAUSE, น้อย วงพรู, ETC, แสตมป์, TIMETHAI, MAIYARAP, URBOYTJ และอีกมากมาย
ราคาบัตรเข้างาน วันละ 200 บาท / คน บัตรเหมารวม 5 วัน พิเศษ! 800 บาท
สอบถามข้อมูลเพิ่มเติมได้ที่ :สิงห์ปาร์คเชียงราย โทร.091-5760374
สมรสสมรัก❤ ฮักนี้...ที่ลำปาง 14 กุมภาพันธ์ 2567
สำนักงานการท่องเที่ยวและกีฬาจังหวัดลำปาง ร่วมกับ อำเภอเมืองลำปาง การท่องเที่ยวแห่งประเทศไทย สำนักงานลำปาง องค์การบริการส่วนจังหวัดลำปาง ศูนย์การค้าเซ็ลทรัลลำปาง สมาคมรถม้าจังหวัดลำปาง มหาวิทยาลัยเชียงใหม่ และสถานีรถไฟนครลำปาง ร่วมจัดกิจกรรม ส่งเสริมการท่องเที่ยว ฮักนี้...ที่ลำปาง
❤ ขอเชิญชวนคู่รัก จดทะเบียนสมรสในวันวาเลนไทน์ 14 กุมภาพันธ์ 2567 นี้ โดยทุกคู่จะได้รับกรอบทะเบียนสมรสที่สวยงามล้ำค่า ถ่ายรูปคู่กับรถม้าลำปาง ฟรี ณ ศูนย์การค้าเซ็นทรัลลำปาง
พิเศษ! รับสมัคร 10 คู่รัก ที่จะร่วมฉลองสมรสหมู่ในชุดล้านนาลำปาง พานั่งรถม้าพาชมเมืองลำปางและถ่ายรูปพรีเวดดิ้งสถานที่ท่องเที่ยวจริงของเมืองลำปาง พร้อมรับไฟล์รูปเป็นของขวัญพิเศษสำหรับคู่รัก จากนั้นร่วมพิธีฮ้องขวัญและฉลองมงคลสมรสแบบขันโตกล้านนา รับคำอวยพรและพยานรักจากผู้ว่าราชการจังหวัดลำปาง ในบรรยากาศแบบล้านนาที่โรแมนติกของเมืองลำปาง เมืองแห่งความสุขของคู่รัก (สำหรับคู่พิเศษ 10 คู่รัก มีค่าใช้จ่ายการแต่งกายตามเงื่อนไขที่กำหนด)
งาน Surin International Jazz Festival 2024 (14-15 กุมภาพันธ์ 2567)
งาน Surin International Jazz Festival 2024 ภายใต้บรรยากาศ “We love elephant” ในวันที่ 14-15 กุมภาพันธ์ 2567 ณ โรงแรมทองธารินทร์ จังหวัดสุรินทร์ ครั้งแรกของจังหวัดสุรินทร์ กับ ????วงดนตรีระดับโลก Biggles BIG BAND จาก Amsterdam ประเทศเนเธอร์แลนด์ โอกาสที่ลูกหลานชาวจังหวัดสุรินทร์ จะได้ร่วม Workshop กับวง Jazz ระดับโลก ได้แก่ วง Surawittayakarn Wind Symphony & Marching Band โรงเรียนสุรวิทยาคาร joy with..... เด็กๆ ต้นกล้ากันตรึม บ้านดงมัน ด็ก ๆ Cover dance โรงเรียนสิรินธร คีตลีลา โรงเรียน น้องโมน่า-นางสาวสุรินทร์ ร่วมนางอัปสรา เดี๋ยวซอกันตรึม และกิจกรรมอีกมากมาย
กำหนดการแสดงและค่าใช้จ่าย
14 ก.พ 2567 เวลา 17.00 น. เป็นต้นไป ลานเบียร์การ์เด้นท์ โรงแรมทองธารินทร์ (ชม Free) ใส่เสื้อ Brand ร่วมงาน สร้างพลังด้วยกัน
15 ก.พ 2567 เวลา 09.00-12.00 น. workshop ที่โรงเรียนสุรวิทยาคาร ร่วมกับคนรักดนตรี
15 ก.พ 2567 open door เวลา 18.00 น. เป็นต้นไป สถานที่จัดแสดง Hall ห้องโรงแรมทองธารินทร์ (บัตร 350 บ มีอาหารและเครื่องดื่ม)
ติดต่อซื้อบัตร ติดต่อจำหน่ายสินค้าในงานได้ที่ คุณแรฟ 092-6120222 คุณเฟิร์น 081-7607452
และภาคีเครือข่ายอีกหลายหน่วยงาน สำหรับกิจกรรมนี้จะจัดขึ้นที่สุรินทร์ให้โลกแห่งเสียงดนตรีศิลปะเป็นความรักแบ่งปันไปยังทุกท่านด้วยความสุข นำเสียงดนตรีเปิดโลกการท่องเที่ยวจากนักดนตรีชาวต่างชาติ สร้างบรรยากาศสุรินทร์ถิ่นอีสานใต้.
รายได้หักสบทบทุนเยาวชนดนตรีสุรินทร์ และช้างที่น่ารักของเรา
แต่งงานและจดทะเบียนสมรสบนหลังช้าง 14 กุมภาพันธ์ 2567 (วันวาเลนไทน์ ????)
ขอเชิญชวน ???? คู่สมรส???? สมัครเข้าร่วมงานแต่งงานและจดทะเบียนสมรสบนหลังช้าง การจดทะเบียนสมรสบนหลังช้างหนึ่งเดียวในโลก ในวันที่ 14 กุมภาพันธ์ 2567 (วันวาเลนไทน์ ????) ณ สวนเฉลิมพระเกียรติฯ 80 พรรษา (สวนใหม่) ต.นอกเมือง อ.เมือง จ.สุรินทร์ รับสมัครจำนวนจำกัด ‼️ สมัครได้ ตั้งแต่บัดนี้จนถึงวันที่ 7 กุมภาพันธ์ 2567 รับสมัครในวันและเวลาราชการ เวลา 08.30 - 16.30 น. (สแกน QR Code ในภาพเพื่อสมัคร)
งานประจำปีสมโภช 101 ปี วัดโพธิ์แจ้ 14-18 กุมภาพันธ์ 2567
งานประจำปีสมโภช 101 ปี วัดโพธิ์แจ้ ถ.เอกชัย ต.บางน้ำจืด อ.เมือง สมุทรสาคร วันที่ 14-18 กุมภาพันธ์ 2567
มหกรรมว่าวสุราษฎร์ธานี 14-18 กุมภาพันธ์ 2567
มหกรรมว่าวสุราษฎร์ธานี 14-18 กุมภาพันธ์ 2567 ณ หาดนายอำเภอ ตำบลตระกรบ อำเภอไชยา จังหวัดสุราษฎร์ธานี
ชม-ช็อป-ชิม ในงาน "ISAN SOUL Festival" สร้างสรรค์จากภูมิปัญญาอีสาน บูรณาการสู่สากล #SoftPower อีสานเบ่งบานสู่สากล (14-15 กุมภาพันธ์ 2567) LINK
มหาวิทยาลัยราชภัฏอุดรธานี ขอเชิญท่านมาชม-ช็อป-ชิม ในงาน "ISAN SOUL Festival" สร้างสรรค์จากภูมิปัญญาอีสาน บูรณาการสู่สากล #SoftPower อีสานเบ่งบานสู่สากล ระหว่างวันที่ 14-15 กุมภาพันธ์ 2567 ตั้งแต่ 12.00 - 21.00 น. ณ บริเวณลานสนามหญ้าหน้าศูนย์ออกแบบสร้างสรรค์ฯ FTCDC มหาวิทยาลัยราชภัฏอุดรธานี
วันที่ 14-15 ก.พ. 2567 พบ Arts&Craft&Music Street ถนนงานศิลปะ งานออกแบบ งานคราฟต์ ดนตรี ผลงานสร้างสรรค์ของศิลปินอินดี้ นักศึกษา ตั้งแต่เวลา 12.00 น. 21.00 น. กิจกรรมเด่นในงานทั้งสองวัน
- การเดินแบบแฟชั่นสิ่งทอ "ISAN SOUL" จากชุมชนโดยนักออกแบบระดับประเทศ
- การนำเสนอเมนูอาหารพื้นถิ่น Gastronomy โดย - อ.ขาบ สุทธิพงษ์ สุริยะ - เชฟหนุ่ม: วีระวัฒน์ ตริยเสนวรรธน์
- การเสวนาหัวข้อ "พลังสื่อ พลังสร้าง ISAN Soft Power" โดยเหล่ากูรูด้านสื่อ ภาพยนต์แถวหน้า
- มาย้อนยุค มาปูเสื่อ กินลูกชิ้น ฟินกับการดูหนังกลางแปลง ณ บริเวณลานสนามหญ้าหน้า ศูนย์สร้างสรรค์ผ้าและสิ่งทอ-ftcdc
วิ่งขึ้นภู ดู...หินสามวาฬ วันพุธที่ 14 กุมภาพันธ์ 2567
จังหวัดบึงกาฬ โดยเทศบาลตำบลโคกก่อง ร่วมกับ สำนักงานการท่องเที่ยวและกีฬาจังหวัดบึงกาฬ ที่ทำการปกครองอำเภอเมืองบึงกาฬ เชิญผู้สนใจเข้าร่วมกิจกรรมวิ่งขึ้นภู ดู...หินสามวาฬ ในวันพุธที่ 14 กุมภาพันธ์ 2567 เวลา 05.00 น ณ จุดทางขึ้นหินสามวาฬ รับสมัครผู้ร่วมกิจกรรมจำนวน 500 ท่าน สมัครฟรีได้รับเสื้อท่านละ 1 ตัว ***โดยงานนี้รับสมัครหน้างานเท่านั้น ไปก่อนมีสิทธิ์ก่อน ติดต่อสอบถามเทศบาลตำบลโคกก่อง 042 409804
UDON HUG MUSEUM #2 Art Eat Peak Music
UDON HUG MUSEUM #2 Art Eat Peak Music ณ ลานกิจกรรมด้านหลังพิพิธภัณฑ์เมืองอุดรธานี (ริมสวนสาธารณะหนองประจักษ์) ไฮไลท์การแสดงบอลลูนแฟนซี การแสดงพลุ และการแสดงจากศิลปินดัง
14 กุมภาพันธ์ 2567 ศิลปิน “ซานิ นิภาภรณ์”
15 กุมภาพันธ์ 2567 ศิลปิน “ปั่น ไพบูลย์เกียรติ”
16 กุมภาพันธ์ 2567 ศิลปิน “ไข่มุก รุ่งรัตน์“
Phatthalung Get Up Art&Music90 Fun Fate 16-17 กุมภาพันธ์ 2567
อนเสิร์ตศิลปะ&ดนตรี: การผสมผสานระหว่างความคิดสร้างสรรค์และท่วงทำนอง! มาร่วมสนุกสุดพิเศษแห่งศิลปะและดนตรีกับเราในคอนเสิร์ต Phatthalung Get Up Art&Music90 Fun Fate ครั้งแรกในจังหวัดพัทลุง ดื่มด่ำไปกับเสียงเพลงอันน่าหลงใหลและจังหวะความคิดสร้างสรรค์อันน่าหลงใหล ทั้งหมดนี้รวมอยู่ในประสบการณ์อันน่าประทับใจ เตรียมตื่นตาตื่นใจไปกับความกลมกลืนของศิลปะและท่วงทำนอง!
วันที่: 16-17 กุมภาพันธ์ 2567 เวลา: 15.00น.-24.00น. เรดบีฟเฮ้าส์ พัทลุง-red beef house (ถนนบายพาส) ไฮไลท์ของกิจกรรม
- การแสดงศิลปะ: ชมงานของศิลปินมากความสามารถที่นำเสนอในส่วนต่างๆของในงาน และสนุกกับการถ่ายภาพเช็คอินในจุดต่างๆ ของในงานมากมาย
- วงดนตรี: โซนเวที1 : เพลิดเพลินไปกับวงดนตรีโฟล์คซอง ที่คอยมาบรรณเลงขับกล่อมให้ทุกท่านที่เข้ามาในงาน ได้สนุกและผ่อนคลาย
- โซนเวที2 Main stage :สนุกสนานไปกับ ดีเจ แนวEDM และวงดนตรี ที่จะค่อยสร้างความสนุกให้กับทุกท่าน
- อาหารและเครื่องดื่ม : พบกับอาหารและเครื่องดื่มที่หลากหลายให้คุณได้มาลิ้มลองสัมผัสรสชาติ
มาร่วมร่วมสนุกกับความคิดสร้างสรรค์และท่วงทำนองกับเราที่ Phatthalung Get Up Art&Music90 Fun Fate มาสัมผัสความประทับใจต่อหน้าต่อตาและหูของคุณ ขณะที่ศิลปะและดนตรีผสมผสานกันอย่างลงตัว เป็นส่วนหนึ่งของประสบการณ์สุดพิเศษนี้
คพอ food fin in love 2024 (16-20 กพ.2567)
คพอ food fin in love จัดให้ สำหรับ สายกิน สายเปย์ อิ่ม อร่อย คุ้มค่า มางานนี้ 16-20 กพ. 2567 ที่ ลานหน้าศูนย์การค้าเซ็นทรัลพิษณุโลก
CHANTHABURI “Art & Camp Under The Moon Light” ตอน “ชวนกันมาลำไย” 16 -18 กุมภาพันธ์ 2567
CHANTHABURI “Art & Camp Under The Moon Light” ตอน “ชวนกันมาลำไย” 16 -18 กุมภาพันธ์ 2567 รีสอร์ท เขาสอยดาว จันทบุรี บรรยากาศแห่งความสุข มาสนุกที่จันทบุรี
งานเปอรานากัน แหลมสัก ณ ชุมชนท่องเที่ยวแหลมสัก (16-18 กุมภาพันธ์ 2567)
Peranakan Leamsak 2024 งานเปอรานากัน แหลมสัก ณ ชุมชนท่องเที่ยวแหลมสัก วันที่ 16-18 กุมภาพันธ์ 2567 สัมผัสเสน่ห์แหล่งท่องเที่ยวที่แหลมสัก ชิมอาหารพื้นถิ่นเลิศรส ช้อปของฝากจากชุมชน ชมการแสดง ศิลปะ 3 วัฒนธรรม
งานวันเกษตรและเทคโนโลยีอีสาน ครั้งที่ 11 (16-25 กุมภาพันธ์ 2567)
ขอเชิญเที่ยวงานยิ่งใหญ่ประจำปี "งานวันเกษตรและเทคโนโลยีอีสาน" ครั้งที่ 11 ระหว่างวันที่ 16-25 กุมภาพันธ์ 2567 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์
งาน Cafe in the Garden บุญถาวร (อุดรคอฟฟี่แฟมีลี่) 16-18 ก.พ 2567
ททท. สำนักงานอุดรธานี ชวนมาร่วมเป็นส่วนหนึ่งในกิจกรรม ครั้งแรก‼️ ของงาน Cafe in the Garden ในอุดรธานี ที่ต้องห้ามพลาด งาน “Udon Coffee Family” At บุญถาวร (อุดรคอฟฟี่แฟมีลี่) วันที่ 16-18 ก.พ 2567 เวลา 09:00-18:00 น. สถานที่ บุญถาวร สาขาอุดรธานี กิจกรรมในงาน จิบกาแฟ แลงานคราฟต์ เพลินงานศิลป์ ???? เคล้าเสียงดนตรี ตะลุยชิมเบเกอรี่ home maded จากร้านค้าทั้งในจังหวัดและจังหวัดข้างเคียง กิจกรรม workshop เท่ ๆ ให้ได้สนุกกันทั้งครอบครัว เมนูสุดเอ็กซ์คลูซีฟที่รังสรรค์ขึ้นเป็นพิเศษและจำหน่ายเฉพาะในงานนี้เท่านั้น ร่วมลุ้นของรางวัลได้ทุกวัน Save the date และเตรียมตัวให้พร้อมกับเทศกาลชิลๆ ของคนชิคๆ ที่ บึงบุญถาวร
งานศาลพันท้ายนรสิงห์ 16-19 กุมภาพันธ์ 2567
งานเค้ก เบเกอรี่ คุกกี้ และเครื่องดื่ม brew bliss 2 colors of love 16-18 กุมภาพันธ์ 2567
รับเดือนแห่งความรักไปงาน “brew bliss 2 colors of love” งานรวมร้านเค้ก เบเกอรี่ คุกกี้ และเครื่องดื่มจากโรงแรมชั้นนำ ร้านคาเฟ่ที่มีชื่อเสียงในจังหวัดเชียงใหม่ และร้าน Home Made มากมายกว่า 40 บูธ กิจกรรมเวิร์คช็อป สอนการทำขนม แต่งหน้าเค้ก การแสดงภาพวาด และการเวิร์คช็อป สอนการวาดภาพให้กับเด็กและผู้ที่สนใจ การแสดงดนตรีแบบเปิดหมวก และ มินิคอนเสิร์ตจากศิลปินของเชียงใหม่ วันที่ 16-18 กุมภาพันธ์ 2567 เวลา 9:00 - 19:00 น. ที่ โครงการบ้านโบราณเชียงใหม่ ถนนเจริญประเทศ
Ko Kret International Art and Craft Festival 2024 วันที่ 16-18 กุมภาพันธ์ 2567
คณะสถาปัตยกรรมและการออกแบบร่วมกับ จังหวัดนนทบุรี และสมาคมส่งเสริมการท่องเที่ยวนนทบุรี จับมือกันเพื่อเปิดมุมมองใหม่การท่องเที่ยวเกาะเกร็ด ด้วยภาพลักษณ์ เกาะแห่งศิลปะและงานคราฟท์ โดยได้รับการตอบรับจากคณะศิลปิน ทั้งชาวไทยและต่างชาติ รวม 80 คน จาก 7 ประเทศ ร่วมรังสรรค์งานศิลป์ บนเกาะเกร็ดให้เป็น แกลลอรี่ ที่มีชีวิต
ด้วยแนวคิด“จากตัวตนที่เรามี ให้โลกรู้ว่าเรามีตัวตน” ภายใต้ชื่อ Ko Kret International Art and Craft Festival 2024 ระหว่างวันที่ 16-18 กุมภาพันธ์ 2567 นี้ ณ วัดปรมัยยิกาวาส เกาะเกร็ด อำเภอปากเกร็ด จังหวัดนนทบุรี
โครงการนี้เป็นการพัฒนาต่อยอดศักยภาพด้านการท่องเที่ยวของจังหวัดนนทบุรี ที่เป็นเมืองแห่งวัฒนธรรมริมสายน้าเจ้าพระยา เพื่อกำหนดแนวทางการพัฒนามุ่งสู่การเป็น “เมืองน่าอยู่” ตามสโลแกน “วิถีน้ำ วิถีนนท์” ที่ยังคงวิถีไทย ชนบทคู่ขนานไปกับการพัฒนาเมือง ทั้งยังมีแหล่งท่องเที่ยวที่มีชื่อเสียงหลายแห่ง โดยเฉพาะอย่างยิ่ง “เกาะเกร็ด” ซึ่งเป็นแหล่งท่องเที่ยวที่มีทุนทางวัฒนธรรมของชาติพันธุ์ที่หลายหลาย มีประวัติศาสตร์ วิถีชีวิต และงานหัตถศิลป์ที่เป็นเอกลักษณ์และมีเสน่ห์ จึงได้ร่วมกันจัดงาน Ko Kret International Art and Craft Festival 2024 ขึ้น ซึ่งเป็นงานเดียวที่ระดมศิลปินที่มีชื่อเสียงทั้งของประเทศไทย และศิลปินจากต่างประเทศ ราว 80 คน จาก 7 ประเทศ เข้าร่วมสร้างสรรค์งานศิลปะรูปแบบต่างๆ บนเกาะเกร็ด โดยมีกิจกรรมหลักได้แก่ การจัดแสดงผลงานศิลปะและงานคราฟท์ในรูปแบบงานเซรามิค การจัดกิจกรรม Workshop เพื่อถ่ายทอดศาสตร์และองค์ความรู้จากศิลปินที่มาร่วมงาน สู่เยาวชนทั้งจาก มหาวิทยาลัยและนักเรียนในท้องถิ่น รวมทั้งการจัด Craft Clinic เพื่อเป็นการแลกเปลี่ยนเรียนรู้ ผสมผสานองค์ความรู้กับความชำนาญเข้ากับภูมิปัญญาท้องถิ่น เพื่อให้เกิดการพัฒนาในด้านศิลปะ และหัตถกรรมท้องถิ่นของเกาะเกร็ดมากยิ่งขึ้น ซึ่งจะช่วยสร้างมูลค่าเพิ่ม ต่อยอดไปให้เป็น Soft Power ในอนาคต ส่งผลดีต่อการกระจายรายได้สู่ฐานรากของประเทศได้อย่างยั่งยืน ภายใต้แนวคิด “จากตัวตนที่เรามี ให้โลกรู้ว่าเรามีตัวตน” (From Local To Global) กำหนดจัดขึ้นในระหว่างวันที่ 16-18 กุมภาพันธ์ 2567 ณ วัดปรมัยยิกาวาส เกาะเกร็ด อำเภอปากเกร็ด จังหวัดนนทบุรี
งานนมัสการพระบรมสารีริกธาตุ ปีที่ 69 ณ วัดเขมาภิรตาราม 16 - 24 กุมภาพันธ์ 2567
งานนมัสการพระบรมสารีริกธาตุ ปีที่ 69 ณ วัดเขมาภิรตาราม อ.เมืองนนทบุรี จ.นนทบุรี ระหว่างวันที่ 16 - 24 กุมภาพันธ์ 2567
วิ่งคลั่งรัก NONGPRUE CITY RUN 17 กุมภาพันธ์ 2567
เทศบาลเมืองหนองปรือ ได้กำหนดจัดโครงการแข่งขันวิ่งเพื่อสุขภาพ" NONGPRUE CITY RUN " ประจำปีงบประมาณ พ.ศ. 2567 ในวันเสาร์ที่ 17 กุมภาพันธ์ 2567 ณ อ่างเก็บน้ำมาบประชัน อำเภอบางละมุง จังหวัดชลบุรี โดยมีวัตถุประสงค์ เพื่อส่งเสริมให้การวิ่งเป็นกิจกรรมออกกำลังกายที่ทุกเพศทุกวัย สามารถทำได้ และรณรงค์ให้เด็ก เยาวชน และประชาชนหันมาใส่ใจการออกกำลังกายเพื่อป้องกันโรคภัยไข้เจ็บ ซึ่งการแข่งขันดังกล่าวประกอบด้วย การแข่งขันวิ่งฟันรัน 5 กิโลเมตร และ วิ่งมินิมาราธอน 10 กิโลเมตร
เปิดรับสมัครแล้ว ตั้งแต่บัดนี้ ถึงวันที่ 31 มกราคม 2567
ผู้ที่สนใจสามารถสอบถามรายละเอียดเพิ่มเติมได้ที่ กองการศึกษาฝ่ายส่งเสริมการศึกษาศาสนาและวัฒนธรรม ที่หมายเลขโทรศัพท์ 038-933107 ในวันและเวลาราชการ
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2567 (17 - 26 กุมภาพันธ์ 2567)
งานเทิดพระเกียรติสมเด็จพระนเรศวรมหาราช ประจำปี 2567 ในระหว่างวันที่ 17 - 26 กุมภาพันธ์ 2567 ระยะเวลา 10 วัน 10 คืน ที่ บริเวณลานพระบรมราชานุสาวรีย์ สมเด็จพระนเรศวรมหาราช ตำบลดอนเจดีย์ อำเภอพนมทวน จังหวัดกาญจนบุรี เพื่อเทิดพระเกียรติและรำลึกถึงพระมหากรุณาธิคุณของสมเด็จพระนเรศวรมหาราชที่ทรงกอบกู้เอกราชของชาติไทย ภายในงานจะมีการแสดง แสง เสียง ย้อนรอยประวัติศาสตร์สมเด็จพระนเรศวรมหาราช พระมหากษัตริย์ผู้กอบกู้เอกราชของชาติไทย ใช้เวลาในการแสดง 40 นาที จำนวน 7 รอบ ในระหว่างวันที่ 17 - 26 กุมภาพันธ์ 2567 รองรับที่นั่งชมการแสดงบริเวณภายในอัฒจันทร์ จำนวน 1,000 ที่นั่ง นอกจากนี้ภายในงาน ระหว่างวันที่ 17 - 26 กุมภาพันธ์ 2567 ยังมีกิจกรรมส่งเสริมการท่องเที่ยวเชิงวัฒนธรรม อาทิ รำวงย้อนยุค การละเล่นพื้นบ้าน และการแสดงศิลปะวัฒนธรรม เป็นต้น ตลาดย้อนยุค รวมทั้งการแสดงแสง เสียง เทิดพระเกียรติสมเด็จพระนเรศวรมหาราช และการแสดงมหรสพสร้างความบันเทิงให้กับประชาชน และนักท่องเที่ยวที่เข้ามาเที่ยวชมงานโดยเปิดให้เข้าชมฟรีตลอดงานเทศกาลเก็บเกี่ยว ที่ไร่องุ่นมอนซูน แวลลีย์ หัวหิน Harvest Festival 2024
1 ปีจะมีเพียงครั้งเดียว กับ "เทศกาลเก็บเกี่ยว ที่ไร่องุ่นมอนซูน แวลลีย์ หัวหิน Harvest Festival 2024” วันที่ 17-25 กุมภาพันธ์ 2567
ซาว สื่น Coffee and Music Fest. 2024 เทศกาลกาแฟและดนตรีครั้งแรกของศรีสะเกษ
เตรียมพบกับ...เทศกาลกาแฟและดนตรีครั้งแรกของศรีสะเกษ "ซาว สื่น Coffee and Music Fest. 2024" ในวันที่ 17 - 18 กุมภาพันธ์ 2567 ณ ลานกางเต๊นท์ เกาะกลางน้ำ ห้วยน้ำคำ จ.ศรีสะเกษ มาดื่มด่ำบรรยากาศ จิบกาแฟดีๆ ในสวนร่มๆ ฟังดนตรีเบาๆสบายๆ พร้อมร่วมกิจกรรมสำหรับคอกาแฟและศิลปะอีกมากมายกับพวกเรานะครับ แล้วมาสนุกด้วยกันนะครับ จัดโดย เทศบาลเมืองศรีสะเกษ หอการค้าศรีสะเกษ ศรีสะเกษ
งาน Ubon Solar night run 2024 (17 กุมภาพันธ์ 2567)
งาน "Ubon Solar night run 2024" เปิดประสบการณ์การวิ่ง ทั้ง แสง สี เสียง การสร้างสรรค์ศิลปะบนถนนเรืองแสง และบรรยากาศรอบเขื่อนสิรินธร 17 กุมภาพันธ์ 2567 นี้ มาวิ่งชมเขื่อนในยามราตรี 2 ระยะ 5KM / 12.75 KM
เทศกาลมาฆปูรมีศรีปราจีน ครั้งที่ 38 ประจำปี 2567 วันที่ 17 - 25 กุมภาพันธ์ 2567
เทศกาลมาฆปูรมีศรีปราจีน ครั้งที่ 38 ประจำปี พ.ศ. 2567 ระหว่างวันที่ 17 - 25 กุมภาพันธ์ 2567 ณ บริเวณรอยพระพุทธบาทคู่ โบราณสถานสระมรกต ตำบลโคกไทย อำเภอศรีมโหสถ จังหวัดปราจีนบุรี
ดีโอดี ณ คราฟท์ | Market Weekend 17-18 กุมภาพันธ์ 2567
ดีโอดี ณ คราฟท์ | Market Weekend 17-18 กุมภาพันธ์ 2567 ณ DOD Cafe & Bistro อ.สามพราน จ.นครปฐม พบกับตลาดงานคราฟท์ แฮนด์เมด สินค้าจากชุมชน พร้อมเพลิดเพลินไปกับ Workshop และ Passport Stamp ให้ทุกคนได้ร่วมรับสิทธิพิเศษมากมาย แล้วมาปลดปล่อยพลังความคิดสร้างสรรค์ไปด้วยกันในงาน "ดีโอดี ณ คราฟท์" ✨ กิจกรรม Workshop ทุบใบไม้ ย้อมผ้าด้วยสีธรรมชาติ ลิ้มรสชาติของน้ำผึ้งป่า ลงสีน้ำทองบนเซรามิก ✨ กิจกรรม PASSPORT STAMP ทำตาม Mission บน DOD PASSPORT รับสิทธิพิเศษเพียบ! สามารถพาน้อนๆ สัตว์เลี้ยงมาเที่ยวงานได้ด้วยนะ
งาน MU Charity. 2024 : Run for Fund 18 กุมภาพันธ์ 2567
งาน MU Charity. 2024 : Run for Fund เชิญชวนศิษย์เก่ามหาวิทยาลัยมหิดลเข้าร่วมงาน MU Charity. 2024 : Run for Fund งานเดินวิ่งการกุศล ชิงถ้วยพระราชทานสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา สยามบรมราชกุมารี รายได้สมทบทุนมูลนิธิมหาวิทยาลัยมหิดล และกองทุนสุขภาพนักศึกษามหาวิทยาลัยมหิดล
วิ่งเพื่อชุมชน 2024 วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567
Run for Local @Laemsak 2024 Sunday, 18 February 2024 ????วิ่งเพื่อชุมชน 2024 ณ ชุมชนท่องเที่ยวแหลมสัก อ.อ่าวลึก จ.กระบี่ วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567 ชุมชนท่องเที่ยวแหลมสัก ขอเชิญนักเดินนักวิ่งทั้งมืออาชีพและสมัครเล่นมาออกกำลังกายเพื่อสุขภาพพร้อมสัมผัสเสน่ห์แห่งดินแดนทะเลสามด้านวัฒนธรรมสามสาย เลือกทานอาหารอร่อยๆ จากบูธอาหารของชุมชนตามต้องการ วิ่งบนเส้นทางอันร่มรื่นผ่านความงดงามของธรรมชาติและวิถีชุมชน วิ่งเพื่อสุขภาพกายสุขภาพใจและอิ่มบุญจากการได้ช่วยเหลือสังคมไปด้วยกัน
อุบลอัมสเตอร์ดัม 18 ก.พ. 2567
อุบลอัมสเตอร์ดัม การแสดงดนตรีแห่งสองวัฒนธรรม วง Biggle Bigband Jazz Orchestra Thai-Esan Jazz Fusion Music เพื่อการแลกเปลี่ยนวัฒนธรรมระหว่าง 2 ราชอาณาจักร คือ ไทยและเนเธอร์แลนด์ พร้อมศิลปินรับเชิญหงา คาราวาน วันที่ 18 ก.พ.67 ลานร้อยพันธุ์บัวหน้าศูนย์การค้าเซ็นทรัล อุบล
กินปลาหน้าเขื่อนชวนเพื่อนวิ่ง @โนนดินแดง 18 ก.พ. 2567
งานวิ่งเพื่อการกุศล กินปลาหน้าเขื่อนชวนเพื่อนวิ่ง@โนนดินแดง 2024 วันวิ่ง 18 ก.พ.2567 ณ เขื่อนลำนางรอง อ.โนนดินแดง จ.บุรีรัมย์ ระยะวิ่ง 10/6 km
งานมหกรรมมูนมังอีสาน ครั้งที่ 15 สกลมาคราฟต์ ( Sakon - Ma - Craft) 19-22 กุมภาพันธ์ 2567
งานมหกรรมมูนมังอีสาน ครั้งที่ 15 "สกลมาคราฟต์ ( Sakon - Ma - Craft)" . เตรียมพบกับงานมหกรรมมูนมังอีสาน ครั้งที่ 15 ในแนวคิด “สกลมาคราฟต์” นำเสนอรูปแบบของชุมชนหัตถกรรม (Craft Village) เพื่อเป็นแนวทางในการยกระดับงานหัตถกรรมพื้นบ้านสู่หัตถกรรมร่วมสมัยที่สะท้อนอัตลักษณ์ทางวัฒนธรรมของสกลนครจากท้องถิ่นสู่สากล . มีกำหนดจัดขึ้น ระหว่างวันที่ 19-22 กุมภาพันธ์ 2567 ณ บริเวณริมห้วยทราย มหาวิทยาลัยราชภัฏสกลนคร
งานนมัสการ??ระบรมสารีริกธาตุองค์พระธาตุบังพวนประจำปี2567 (20 - 24 กุมภาพันธ์ 2567)
งานนมัสการพระบรมสารีริกธาตุองค์พระธาตุบังพวนประจำปี2567 ณ วัดพระธาตุบังพวน อ.เมือง จ.หนองคาย วันที่ 20 - 24 กุมภาพันธ์ 2567 มหรสพตลอด 5 วัน 5 คืน 20 ก.พ. 67 เชิญพระอุปคุต/พิธีเปิดงาน/พิธีบวชชีพราหมณ์ 21 ก.พ. 67 หมอลำใจเกินร้อย บอย ศิริชัย แอน อรดี 22 ก.พ. 67 ศึกมวยไทย 15 คู่ 23 ก.พ. 67 คอนเสิร์ตวาไรตี้ ต้อมมิวสิค 24 ก.พ. 67 (กลางวัน)ฟังลำกลอนประยุกต์ แม่บุญช่วง เด่นดวง 24 ก.พ. 67 (กลางคืน)ใหม่ พัชรี ไชยเลิศ
งานเกษตรแฟร์และ OTOP จังหวัดกระบี่ ครั้งที่ 11 (20 - 26 กุมภาพันธ์ 2567)
อบจ.กระบี่ ขอเชิญเที่ยวชมงาน เกษตรแฟร์และ OTOP จังหวัดกระบี่ ครั้งที่ 11 วันที่ 20 - 26 กุมภาพันธ์ 2567 ณ องค์การบริหารส่วนจังหวัดกระบี่
20 กุมภาพันธ์ 2567 เทศบาลตำบลป่าคลอก ภูเก็ต วัคซีนป้องกันโรคพิษสุนัขบ้าและทำหมัน ฟรี
เทศบาลตำบลป่าคลอก ขอเชิญชวนประชาชน ผู้เลี้ยงสุนัขและแมว นำสุนัขและแมว มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าและทำหมัน ฟรี !!! รับจำนวนจำกัด 30 ตัว เท่านั้น โดยมีกำหนดในวันที่ 20 กุมภาพันธ์ 2567 ตั้งแต่เวลา 09.00-14.00 น. ณ เทศบาลตำบลป่าคลอก
เจ้าของสนุัขและแมวสามารถนำบัตรประชาชน มาลงทะเบียนขอรับบริการได้ที่กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลป่าคลอก ได้ตั้งแต่บัดนี้ จนถึงวันที่ 15 กุมภาพันธ์ 2567 เวลา 08.30-16.00 น. ติดต่อสอบถามรายละเอียดเพิ่มเติมได้ที่ 076-529833 ข้อควรปฏิบัติก่อนการทำหมันสัตว์
- งดน้ำงดอาหารสัตว์ อย่างน้อย 6-8 ชั่วโมง ก่อนทำหมัน
- อายุสัตว์ที่สามารถทำหมันได้ คือตั้งแต่ 6 เดือนขึ้นไป
คอนเสิร์ต คิดถึง โจ้ (วงพอส) 20 กุมภาพันธ์ 67
20 กุมภาพันธ์ 2567 นี้ มาร่วมร้องเพลงพอสไปด้วยกัน กับ คอนเสิร์ต “คิดถึง โจ้ (วงพอส)” ณ ลานสะแกกรัง อ.เมือง จ.อุทัยธานี เข้าชมฟรี ‼️ ไม่มีค่าใช้จ่าย
งานบุญเดือนสาม สืบสานประเพณีวิถีชาวอู่ไท 21 กุมภาพันธ์ – 3 มีนาคม 2567
งานบุญเดือนสาม สืบสานประเพณีวิถีชาวอู่ไท ระหว่างวันที่ 21 กุมภาพันธ์ – 3 มีนาคม 2567 ณ วัดหนองขุนชาติ อ.หนองฉาง จ.อุทัยธานี
งานดนตรีในสวน Mill ไม่ Mute พุธนี้ไม่เงียบ 21 ก.พ. - 3 เม.ย.67
อบจ.กาญจนบุรี ขอเชิญเที่ยวงานดนตรีในสวน Mill ไม่ Mute พุธนี้ไม่เงียบ ณ โรงงานกระดาษไทยกาญจนบุรี ตั้งแต่เวลา 17.00 - 21.30 น. พบกับกิจกรรม ดนตรีในสวน ประกวดดนตรีโฟล์คซอง ดูหนังกลางแปลง ชิล ช้อป สินค้า vintage DIY
ประเพณีปอยหลวงสมโภช 650 ปี วัดผาลาด - สกทาคามี วันที่ 22-24 กุมภาพันธ์ 2567
ประเพณีปอยหลวงสมโภช ๖๕๐ ปี ที่วัดผาลาด - สกทาคามี วันที่ 22-24 กุมภาพันธ์ 2567 เวลา 8.00 น. พิธีเปิดประเพณี 6 เป็ง ร่วมเป็นเจ้าภาพกองบุญใหญ่บุญหลวง สมทบทุนสร้างหอประวัติศาสตร์, ถวายมูลนิธิโรงพยาบาลสงม์. บูรณะโรงพยาบาลมหาราช ตึกสุจิณโณ, สงเคราะห์โรงพยาบาลในถิ่นชนบท, ทุนการศึกษาพระสงฆ์-สามเณร และเยาวชน จำนวน 18 กอง ๆละ 100,000 บาท
ปอยหลวง วัดผาลาด ขอเชิญร่วมสร้าง พระเกสรดอกไม้ล้านนา บุปผาล้านดวง ในวันที่ 25 มกราคม 2567 เวลา 8.30 น.เป็นต้นไป
วันที่ 22-24 กุมภาพันธ์ 2567 เวลา 8.00 น. พิธีเปิดประเพณี 6 เป็ง ตวยฮอยครูบา บูชาพระธาตุ ลั่นฆ้องแห่น้ำสรง พระเกสรดอกไม้ฯ ตามเส้นทางธรรมชาติ พระสงฆ์เจริญชัยมงคลคาถา ถวายไทยทาน ถวายภัตตาหาร และรับประทานอาหารร่วมกัน เวลา 15.30 อาราธนาพระสงฆ์เจริญพระพุทธมนต์ พิธีหยาดน้ำหมายตานแบบล้านนา ถวายเสนาสนะ ถวายไทยทานแก่พระสงฆ์ พระสงฆ์อนุโมทนา สรงน้ำพระธาตุ เวียนเทียน จุดประทีปบูชาพระธาตุร่วมกัน แผ่เมตตาหยาดน้ำลงแผ่นดิน เป็นเสร็จพิธี
ติดต่อร่วมทำบุญประเพณีปอยหลวงสมโภช 650 ปี ที่วัดผาลาด โทร.0876454-390
เทศกาลว่าวนานาชาติบนชายหาดพัทยา 2024 (22- 26 ก.พ. 2567)
เทศกาลว่าวนานาชาติบนชายหาด หน้าเซ็นทรัล พัทยา วันที่ 22- 26 ก.พ. 2567 ณ ริมชายหาดเมืองพัทยา และ ชั้น 1 ศูนย์การค้าเซ็นทรัล พัทยา หลายรูปแบบ หลากสีสัน โดย Central Pattaya และ Thaitan Kite Team Thailand พร้อมการแสดงโชว์ว่าวจากประเทศฝรั่งเศส โคลัมเบีย เยอรมัน
Thailand Local BCG Plus Expo @ Udon Thani 22 - 26 กุมภาพันธ์ 2567
สำนักงานพาณิชย์จังหวัดอุดรธานี ขอเชิญชมงาน “Thailand Local BCG Plus Expo @ Udon Thani” 22 - 26 กุมภาพันธ์ 2567 ศูนย์การค้าเซ็นทรัลอุดร จังหวัดอุดรธานี จัดโดยสำนักงานพาณิชย์จังหวัดอุดรธานี
• พบผลิตภัณฑ์นวัตกรรมเป็นมิตรกับสิ่งแวดล้อม สินค้าและบริการที่โดดเด่น เสื้อผ้าเครื่องแต่งกาย ของใช้และตกแต่ง เครื่องประดับ สมุนไพร อาหารและเครื่องดื่ม
• ชมนิทรรศการ Local BCG Plus การเจรจาธุรกิจ และกิจกรรม Workshop ผลิตภัณฑ์เชิงสร้างสรรค์
• ม๋วนซื่น กับวงดนตรีหมอลำและแสดงศิลปวัฒนธรรมอีสาน
• ชมฟรีคอนเสิร์ตศิลปินดัง
• วันที่ 22 พบขวัญใจแม่ยกมาราธอน_ตรี ชัยณรงค์
• วันที่ 23 พบอิหล่า มหัศจรรย์_ เบลล์ นิภาดา
• วันที่ 24 พบสาวหมอลำซำน้อย _ข้าวทิพย์ ธิดาดิน
• วันที่ 25 พบลูกทุ่งสาวเสียงซอ_ ก้านตอง ทุ่งเงิน
• วันที่ 26 พบลูกทุ่งสาวมหาเสน่ห์ _ ธัญญ่า อาร์สยาม
• พบกับ Influencer DJ โจอี้ ศรีเมืองขอน ทุกวัน
• พิเศษ แจกคูปองเงินสด และซื้อสินค้าในงานครบทุก 300 บาท ลุ้นสร้อยคอทองคำและเครื่องใช้ไฟฟ้า ทุกวัน
งานประเพณีสมโภชพระธาตุหล้าหนอง ประจำปี 2567 วันที่ 22-24 กุมภาพันธ์ 2567
งานประเพณีสมโภชพระธาตุหล้าหนอง ประจำปี 2567 ระหว่างวันที่ 22-24 กุมภาพันธ์ 2567 ณ พระธาตุหล้าหนอง พระธาตุกลางน้ำ เทศบาลเมืองหนองคาย
วันที่ 22 กุมภาพันธ์ 2567 -พิธีบวงสรวงเจ้าพ่อพระธาตุกลางน้ำ -พิธีบวงสรวงพระธาตุกลางน้ำ -พิธีบายศรี/รำบวงสรวงพระธาตุหล้าหนอง -พิธีบวชชีพราหมณ์
วันที่ 23 กุมภาพันธ์ 2567 -เปิดรับบริจาคจตุปัจจัย ดอกไม้ ธูป เทียน ตักบาตรประจำวันเกิด ผ้าป่าลอยฟ้า ตักบาตร108 -ทำบุญผ้าห่มพระธาตุหล้าหนอง -ชมมหรสพ หมอลำย้อนยุค
วันที่ 24 กุมภาพันธ์ 2567 -พิธีทำบุญตักบาตรริมโขงหน้าพระธาตุหล้าหนอง พระสงฆ์ 73รูป -ร่วมแห่ผ้าขึ้นห่มพระธาตุหล้าหนอง -ร่วมเวียนเทียน - การแสดงมหรสพ วงนกยูงทอง
มหกรรมว่าวประเพณี และว่าวนานาชาติ และว่าว ไทย 4 ภาค วันที่ 23-25 กุมภาพันธ์ 2567
มหกรรมว่าวประเพณี และว่าวนานาชาติ และว่าว ไทย 4 ภาค วันที่ 23-25 กุมภาพันธ์ 2567 บริเวณสนามบินกองทัพอากาศ จังหวัดสตูล ชมการแข่งขันว่าวสวยงาม ความคิดสร้างสรรค์ ว่าวควาย ว่าวยักษ์ ว่าวแฟนซี ว่าวไฟ ว่าวประเพณีท้องถิ่น 4 ภาค ว่าวระดับโลก ไม่น้อยกว่า 30 ประเทส ศิลปินนักแสดงชื่อดัง ชิมอาหารอันดามันเลิศรสจากร้านดัง และอีกมากมาย การประกวด MISS SATUN
Song by The River@Krabi Season 2 (23-26 กุมภาพันธ์ 2567)
งานดนตรีชิลล์ๆ ริมน้ำ รับสายลม ชมพระจันทร์ "Song by The River@Krabi Season 2" วันที่ 23-26 กุมภาพันธ์ 2567 เวลา 17.30 – 21.30 น. ณ ลานปูดำ พบดนตรีหลากหลายสไตล์ พิเศษ วันที่ 24 ก.พ. พบกับ John Nuvo และกลุ่มศิลปิน Sounds Of Earth ใจศิลป์บำบัดโลก ที่จะมาเปลี่ยนโลกในโหมดของการแสดงดนตรีรูปแบบใหม่ด้วยหูฟัง
งาน งิ้วอุบลฯ ประจำปี 2567 (23 กุมภาพันธ์ 2567)
ร่วมฉลองสมโภช ศาลเจ้าพุทธก๋งอุบลราชธานี ฉลองครบรอบ 164 ปี พร้อมอัญเชิญเจ้าแห่รอบเมือง งาน " งิ้ว" อุบลฯ ประจำปี 2567 วันที่ 23 กุมภาพันธ์ 2567 ภาคเช้า เวลา 07.00 น. อัญเชิญเจ้าขึ้นประทับบนรถที่กำหนด โดยทีมประทับทรงมูลนิธิศิษย์พระจี้กงอุบลราชธานีจีหงี่เกาะ ภาคบ่าย หลังเสร็จพิธีแห่เจ้ารอบเมือง อัญเชิญเทวรูปทั้งหมดเข้าประทับ ณ ศาลเจ้าพุทธก๋งอุบลราชธานี ภาคกลางคืน เวลา 18.00 น. ชมการแสดงสิงโตดอกเหมย เชิญกราบไหว้สิ่งศักดิ์สิทธิ์ ในวันที่ 23 กุมภาพันธ์ 2567-3 มีนาคม 2567 ชมการแสดงงิ้วประเพณีและประมูลส้มเพื่อเป็นศิริมงคล รวม 10 วัน 10 คืน
เทศกาลภาพยนตร์ญี่ปุ่นประจำปี ณ สงขลา 23-25 กุมภาพันธ์ 2567
เทศกาลภาพยนตร์ญี่ปุ่นประจำปี Japanese Film Festival 2024 ปีนี้จัด 4 จังหวัด กทม. เหนือ อีสาน ใต้ ดังนี้ (ชมฟรี ทุกเรื่อง)
- House Samyan 2-18 กุมภาพันธ์ 2567
- Alliance Française de Chiang Maï สมาคมฝรั่งเศสเชียงใหม่ 9-11 กุมภาพันธ์ 2567
- Art lane เทศกาลถนนศิลปะ 9 กุมภาพันธ์ 2567
- CMUACC หอศิลปวัฒนธรรม มหาวิทยาลัยเชียงใหม่ 16-18 กุมภาพันธ์ 2567
- Khon Kaen University Science Park อุทยานวิทยาศาสตร์ มหาวิทยาลัยขอนแก่น 24-25 กุมภาพันธ์ 2567
- สงขลา @ลอเร็ม ยิปซัม 23-25 กุมภาพันธ์ 2567
มลายูเดย์@ยะลา 23-25 กุมภาพันธ์ 2567
งานมลายูเดย์@ยะลา ปีที่ 9 ซึ่งจะจัดงานระหว่างวันที่ 23-25 กุมภาพันธ์ 2567 ณ สนามโรงพิธีช้างเผือก เทศบาลนครยะลา เปิดรับสมัครผู้สนใจจำหน่ายอาหาร-เสื้อผ้า ยื่นเอกสารได้ วันที่ 5-7 กุมภาพันธ์ 2567 บูธเสื้อผ้ามลายู (สินค้ามือ 1 เท่านั้น) ยื่นที่ ห้องเทศกิจ เทศบาลนครยะลา บูธอาหารฮาลาล ยื่นที่ สาธารณสุขฯเทศบาล ชั้น 2 หลังปั๊ม ปตท.วงเวียนหอนาฬิกา สอบถามรายละเอียดเพิ่มเติม โทร.073-223666 ต่อ 1121 (งานเทศกิจ เทศบาลนครยะลา)
งานมหกรรมข้าวพันธุ์ดีฉลอง 30 ปีและของดีอำเภอสระใครประจำปี 2567 (23 กุมภาพันธ์ ถึง 1 มีนาคม 2567)
งานมหกรรมข้าวพันธุ์ดีฉลอง 30 ปีและของดีอำเภอสระใครประจำปี 2567 จัดขึ้นระหว่างวันที่ 23 กุมภาพันธ์ ถึง 1 มีนาคม 2567 ณ สนามหน้าที่ว่าการอำเภอสระใคร จังหวัดหนองคาย ไฮไลท์ของงาน เจดีย์รวงข้าวขนาดใหญ่ที่ถูกมัดรวมกันประดับตกแต่งไฟสวยงาม นอกจากจะได้ชมศิลปะจากรวงข้าวแล้ว กิจกรรมภายในงานประกอบด้วย - นิทรรศการหุ่นไม้ไผ่สานยักษ์ - นิทรรศการของหน่วยงานราชการ - การเวียนเทียนข้าวเปลือก - การประกวดธิดาข้าวหอม - การประกวดหนุ่มหล่อข้าวพันธุ์ดี - การประกวดร้องเพลง - การประกวดเต้นแอโรบิค - การประกวดเมล็ดข้าวพันธุ์ดี - การประกวดตำข้าวลีลา - การจัดจำหน่ายเมล็ดพันธุ์ข้าว - การจำหน่ายผลิตภัณฑ์ OTOP - การจำหน่ายสินค้าเกษตร และสินค้าจากโรงงาน
พิธีเปิดงานมีพิธีบวงสรวงสู่ขวัญข้าว และพิธีรำบวงสรวงพระเเม่โพสพ นางรำกว่า 600 คน มีมหรสพตลอดคืน 23 ก.พ. 67 ลำเพลิน วงศกร 24 ก.พ. 67 ฮันนี่ นิชาดา 25 ก.พ. 67 ดอกเหมย เพ็ญนภา สมสุข 26 ก.พ. 67 ยองบ่าง 27 ก.พ. 67 เนสกาแฟ ศรีนคร 28 ก.พ. 67 ตรี ชัยณรงค์ 1 มี.ค. 67 ประถมบันเทิงศิลป์
Happy Rally สุขทันที.... ที่เที่ยวพะเยา 24-26กุมภาพันธ์ 2567
ททท.สำนักงานเชียงรายร่วมกับ หอการค้า, YECจังหวัดพะเยาและผู้ประกอบการท่องเที่ยวจังหวัดพะเยา เชิญชวนนักท่องเที่ยวมาค้นหาความสุขและความทรงจำที่ดีในกิจกรรมHappy Rally สุขทันที... ที่เที่ยวพะเยา ระหว่างวันที่ 24-26กุมภาพันธ์ 2567 ในเดือนแห่งความรักเชิญชวนคู่รัก คู่เพื่อน คู่พี่น้อง คู่บุญ มาร่วมกิจกรรมแรลลี่มหาสนุก เติมเต็มความรัก ภายใต้แนวคิด Happy Model และสุขทันที.. ที่เที่ยวพะเยา :สุขกาย(Nature) : สุขใจ(Faith) : สุขในวิถี(Local) : สุขในอาหารที่อร่อย(Tasty) ในจังหวัดพะเยา กิจกรรม High light
- ทำบุญไหว้พระขอพรสิ่งศักดิ์สิทธิ์ 9 วัด เส้นทาง อ.เมือง.- อ. เชียงคำ จ.พะเยา
- ร่วมงานเวียนเทียนทางน้ำกลางกว๊านพะเยา" หนึ่งเดียวในโลก" เนื่องในวันมาฆบูชา
- ทำบุญตักบาตรเช้า พระบิณฑบาตทางเรือกว๊านพะเยา กิจกรรมUnseenจังหวัดพะเยา
- สนุกสนานกับกิจกรรม Happy Rally เก็บแต้ม ค้นหาRC ถ่ายรูปกับคู่รักแชะแชร์ในเส้นทางไหว้พระ 9 วัดลุ้นของรางวัลมากมาย
สุขเป็นคู่ เปิดประตูบุญ Happy Rally สุขทันที... ที่เที่ยวพะเยา การแข่งขัน KPOP Cover Dance@เชียงใหม่ 24 กุมภาพันธ์ 2567
การแข่งขัน KPOP Cover Dance ที่จัดขึ้นโดย KTO (Korea Tourism Organization) หรือ องค์การส่งเสริมการท่องเที่ยวเกาหลีประจำประเทศไทย ที่กลับมาอย่างยิ่งใหญ่ในปี 2024 นี้จะมีความพิเศษตรงที่ เราจัดการแข่งขันทั้งหมด 3 จังหวัด เชียงใหม่ กรุงเทพฯ ภูเก็ต
สำหรับงานที่จังหวัดเชียงใหม่ 24 กุมภาพันธ์ 2567 ที่ Central Festival Chiangmai ณ ลาน Promotion 2 มาในคอนเซปต์ Kpop Cover Dance Tournament Roadshow เป็นการแข่งขันรูปแบบ Tournament โดยทางทีมงานจะทำการเปิดรับสมัครทีมที่จะเข้าแข่งขัน (โดยจะไม่ได้มีการออดิชั่นใดๆ) • ทุกทีมที่สมัครเข้ามาจะมีสิทธิ์ทำการแข่งขันทั้งหมด และจะประกาศผู้ชนะและรางวัลอื่นๆ ตามลำดับทันทีที่โชว์ครบทุกทีม ณ วันที่ทำการแข่งขัน • แต่ปีนี้! จะพิเศษที่ เราเปิดโอกาสให้กับน้องๆรุ่นจูเนียร์ ที่อายุตั้งแต่ 3 ปี จนถึง 12 ปี สามารถสมัครเข้ามาร่วมการแข่งขันได้ และยังมีรางวัลพิเศษThe Best Junior ให้กับน้องๆที่ทำการแสดงได้ถูกใจกรรมการอีกด้วย
กิจกรรม Tak Morning Drip ครั้งที่ 3 วันเสาร์ที่ 24 กุมภาพันธ์ 2567
ขอเชิญร่วมกิจกรรม Tak Morning Drip ครั้งที่ 3 วันเสาร์ ที่ 24 กุมภาพันธ์ 2567 เวลา 07:00 น. บริเวณเกาะทานตะวัน อ.บ้านตาก จ.ตาก ณ เกาะทานตะวันตากตก บ้านตาก กิจกรรมครั่งนี้ ไม่มีค่าใช้จ่าย พบกับกิจกรรมกาแฟดริป กาแฟยามเช้า จากแหล่งปลูกจังหวัดตาก ชมทัศนียภาพแม่น้ำปิง ที่บ้านตาก ความสวยงามและบรรยากาศที่สวยงาม ร่วมพูดคุย แลกเปลี่ยนประสบการณ์ และแบ่งปันกาแฟดีๆ นำเมล็ด หรืออุปกรณ์มาให้กัน พบกับ กาแฟจังหวัดตากจากหลายเขตอำเภอ : อาทิเช่น (เมืองตาก) ห้วยเหลือง (บ้านตาก) ห้วยทู่ (แม่สอด) ห้วยปลาปลาหลด (อุ้งผาง) แม่กลองน้อย , แม่กลองใหญ่ (ท่าสองยาง) เลอตรอโกร มอโก้คี วะเบอลลู่ (แม่ละมาด) ดอยภูกา
เดิน-วิ่ง การกุศล กินลม...ชมวัง ครั้งที่ 1 (วังก้านเหลือง) 25 กุมภาพันธ์ 2567
กินลม...ชมวัง ครั้งที่ 1 (วังก้านเหลือง) เดิน-วิ่ง การกุศล เพื่อการศึกษา ศาสนา และสาธาณะประโยชน์ชุมชน 25 กุมภาพันธ์ 2567 สถานที่จัด : น้ำตกวังก้านเหลือง จ.ลพบุรี ระยะวิ่ง : 3 km5 km 10 km
ลูกทุ่งวิจิตรศิลป์ 40 ยังเสว 25 กุมภาพันธ์ 2567
ลูกทุ่งวิจิตรศิลป์ 40 ยังเสว วันอาทิตย์ที่ 25 กุมภาพันธ์ 2567 ณ หอศิลปวัฒนธรรม มหาวิทยาลัยเชียงใหม่ เวลา 17.00 น. เป็นต้นไป กิจกรรมเฉลิมฉลองครบรอบ 40 ปี คณะวิจิตรศิลป์ ลูกทุ่งวิจิตรศิลป์ อีกมากมาย โดยศิษย์เก่าวิจิตรศิลป์ สโมสรนักศึกษาคณะวิจิตรศิลป์ มหาวิทยาลัยเชียงใหม่และพันธมิตรเครือข่ายความบันเทิงแห่งภาคเหนือตอนบน ชวนเชิญกันมาม่วน มาจอย มาเสวเสวๆ พร้อมกันในงาน “ลูกทุ่งวิจิตรศิลป์ 40 ยังเสว” ผ่านเสียงดนตรีลูกทุ่ง รูปแบบใหม่ แบบหล่อ แบบละมุน แบบเสียวๆ สำเริงสำราญเสียงดนตรี จังหวะ และลีลา หางเครื่องอันเป็นเอกลักษณ์ เสพสมอารมณ์หมายคลายความเหงา หมายเหตุ: เนื่องด้วยงานนี้จัดอยู่ขอบเขตของมหาวิทยาลัยเชียงใหม่ จึงเป็นกิจกรรมที่ปลอดแอลกอฮอร์ ยาเสพติด หรือการทะเลาะวิวาท ผู้ใดฝ่าฝืนหรือผิดเงื่อนไข เจ้าภาพงานไม่รับผิดชอบทุกกรณี ข้อมูลเพิ่มเติม
ติดตามทางเพจเทศกาลดอกชมพูภูคาบาน สืบสานตำนานชาติพันธุ์ ประจำปี 2567 (27 ก.พ. - 5 มี.ค. 2567)

ขอเชิญเที่ยวงาน เทศกาลดอกชมพูภูคาบาน สืบสานตำนานชาติพันธุ์ ประจำปี 2567 วันที่ 27 ก.พ. - 5 มี.ค. 2567 บริเวณสถานีขนส่งเทศบาลอำเภอปัว จ.น่าน • ชมขบวนแห่ในพิธีเปิด , การประกวดธิดาพญาผานอง , หนูน้อยสุขภาพดี รำวงย้อนยุค , ผลิตภัณฑ์สินค้านานาชนิดจาก 4 ภาค , สินค้าราคาถูกจากโรงงาน เสือผ้า , แฟชั่น , เครื่องหนัง , เครื่องประดับ , ของใช้ในครัวเรือน , สวนสนุกชุดใหญ่ • คอนเสิร์ตศิลปินดัง อีกมากมาย อาทิ ครูเต้ย , รัชโย , 1 MILL x FIIXD_TDOUBLEE • สอบถาม จองล็อคร้านค้า 095-354-7738 คุณเอ , วัดเมตรติดต่อ 083-810-3828 คุณบี้ การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานน่าน เชิญชวนคู่รัก ร่วมกิจกรรม “เกี่ยวก้อยร้อยรัก กระซิบฮักเมืองน่าน” พิธีสมรสหมู่แบบโบราณ ล้านนาน่าน หนึ่งเดียวในโลก ระหว่างวันที่ 13 – 15 กุมภาพันธ์ 2567 สไตล์ล้านนา กับภาพจิตรกรรมฝาผนัง ปู่ม่าน - ย่าม่าน ตัวแทนความรักที่เป็นอมตะ เกี่ยวก้อยลอดซุ้มพญานาค เพื่อรักยืนยาวตามความเชื่อ รับวันวาเลนไทน์ ท่านที่สนใจสอบถามข้อมูลหรือสมัครได้ที่ ชมรมที่พักจังหวัดน่าน 099 -219 8747 , 061 -246 9399
งานนมัสการพระพุทธประโคนชัยมหามิ่งมงคล ประจำปี 2567 (27-29 กุมภาพันธ์ 2567)
งานนมัสการพระพุทธประโคนชัยมหามิ่งมงคล ประจำปี 2567 ซึ่งกำหนดจัดงานระหว่างวันที่ 27-29 กุมภาพันธ์ 2567 ณ อุทยานพระพุทธประโคนชัยมหามิ่งมงคล ตำบ้านไทร อำเภอประโคนชัย จังหวัดบุรีรัมย์ โดยมีกิจกรรมที่สำคัญๆ ประกอบด้วย ขบวนแห่สักการะพระพุทธประโคนชัย การรำสักการะพระพุทธประโคนชัย การสวดนต์เสริมสิริมงคล กิจกรรมการแสดงบนเวที การจำหน่ายสินค้า OTOP
เททองหล่อพระประธาน พุทธมณฑลประจำจังหวัดอุทัยธานี 28 กุมภาพันธ์ 2567
ทำบุญสมทบทุน เททองหล่อพระประธาน พุทธมณฑลประจำจังหวัดอุทัยธานี วาระที่ 2 จาก 6 วาระ ในวันพุธที่ 28 กุมภาพันธ์ 2567 เวลาประมาณ 15.19 น. ณ วัดหนองขุนชาติ อำเภอหนองฉาง จังหวัดอุทัยธานี
เกษตรบ้านพ่อ ครั้งที่.1 วันที่ 28 กุมภาพันธ์-5 มีนาคม 2567
เกษตรบ้านพ่อ ครั้งที่.1 วันที่ 28 กุมภาพันธ์-5 มีนาคม 2567 ศูนย์บริการการพัฒนาปลวกแดงตามพระราชดำริ อ.ปลวกแดง
กิจกรรม Earth Appreciation : Behind the Zoo 29 กุมภาพันธ์ - 2 มีนาคม พ.ศ. 2567
กิจกรรม Earth Appreciation : Behind the Zoo เปิดรับสมัคร Zoo Keeper สุด Exclusive ไปเป็นเด็กฝึกงาน 3 วัน 2 คืน ณ สวนสัตว์เปิดเขาเขียว จังหวัดชลบุรี 29 กุมภาพันธ์ - 2 มีนาคม พ.ศ. 2567 สวนสัตว์เปิดเขาเขียว จังหวัดชลบุรี
เทศกาลบอลลูน LOVE นวนคร เฟสติวัล 2024 วันที่ 29 กุมภาพันธ์ - 12 มีนาคม 2567
เทศกาลบอลลูน LOVE นวนคร เฟสติวัล 2024 วันที่ 29 กุมภาพันธ์ - 12 มีนาคม 2567 บริเวณลานข้างปั๊ม ปตท. นิคมอุตสาหกรรมนวนคร อำเภอคลองหลวง จังหวัดปทุมธานี ชมศิลปินดังขึ้นเวที มนต์แคน แก่นคูน เสก โลโซ ร็อคคงคย แอน ชวนชื่น ลาบานูน โจอี้บอย ลำไย ไหทองคำ ดีเจซาบะ ปู พงษ์สิทธิ์ คำภีร์
ปฎิทินเที่ยวเชียงราย ถึงมีนาคม 67
ปฎิทินเที่ยวเชียงราย ถึงมีนาคม 67
ปฎิทินเที่ยวเชียงราย ถึงมีนาคม 67
งานส้มโอนครชัยศรี ครั้งที่ 5 (15-24 มีนาคม 2567)
อำเภอนครชัยศรี จังหวัดนครปฐม ขอเชิญเที่ยวงาน ส้มโอนครชัยศรี ครั้งที่ 5 วันที่ 15-24 มีนาคม 2567 บริเวณด้านข้างโรงงานน้ำมันพืช ตำบลไทยาวาส อำเภอนครชัยศรี จังหวัดนครปฐม ผลิตภัณฑ์ OTOP และ ส้มโอนครชัยศรี สินค้าราคาถูก คอนเสิร์ตศิลปินดัง ทุกค่ำคืน
ปฎิทินกิจกรรมกระบี่ มีนาคม 2567
1 - 3 มีนาคม 67 งาน “นาตีน กรีนวิลเลจ” ณ หมู่บ้านนาตีน
FB : หลาดประตีน Prateen Market
1-5 มีนาคม 67 งานเมาว์ลิดกลางจังหวัดกระบี่ ครั้งที่ 43 (ฮ.ศ. 1445) | The 43rd Maulidur Rasul Krabi Province ณ มัสยิดกลางประจำจังหวัดกระบี่
FB : สำนักงานคณะกรรมการอิสลามประจำจังหวัดกระบี่
3 มีนาคม 67 งานวิ่ง “หงอนนาคเทรล 2024” Ngorn Nak Trail ณ เขาหงอนนาค กระบี่ ติดต่อ อบต.หนองทะเล
FB : Ngorn Nak Trail
7-9 มีนาคม 67 งาน “ลานตาลันตา” ครั้งที่ 19 ปีนี้มาใน Concept “ธรรมชาติยิ่งใหญ่ วัฒนธรรมรุ่งเรือง Great Nature Glorious Culture” ณ เมืองเก่าลันตา Lanta Oldtown ติดต่อ สมาคมธุรกิจการท่องเที่ยวเกาะลันตา และอำเภอเกาะลันตา FB : สมาคมธุรกิจการท่องเที่ยวเกาะลันตา
15 - 18 มีนาคม 67 การอัญเชิญพระบรมสารีริกธาตุ และพระอรหันตธาตุของพระสารีบุตรและพระโมคคัลลานะ จากสาธารณรัฐอินเดียมาประดิษฐานชั่วคราว ณ จังหวัดกระบี่ เพื่อเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลพระชนมพรรษา 72 พรรษา ณ วัดมหาธาตุวชิรมงคล อ. อ่าวลึก ณ วัดมหาธาตุวชิรมงคล (วัดบางโทง)
FB : วัดมหาธาตุวชิรมงคล
31 มีนาคม 67 งานปั่นจักรยาน...เก็บความทรงจำที่ เกาะจำ-ติงไหร-เกาะปู กระบี่ ณ เกาะจำ-ติงไหร-เกาะปู อสมท. กระบี่ 075- 623563 และ 084-051-3383 (เริ่มรับสมัคร 9 ก.พ. 2567) FB : อสมท กระบี่ FM 105.00 MHz
31 มีนาคม 67 งานวิ่ง Run for Life ก้าวต่อชีวิต วิ่งระยะ 5.7 กม. อบต. ห้วยยูง FB : อบต. ห้วยยูง
ปฏิทินงานพัทยา เดือนมีนาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวกาญจนบุรี ประจำเดือนมีนาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวกาญจนบุรี ประจำเดือนมีนาคม 2567 สอบถามข้อมูลเพิ่มเติม ททท. สำนักงานกาญจนบุรี โทร. 034 511200, 034 512500
เดือนมีนาคม 2567 รวม 24.63 ล้านคน
กระทรวงแรงงาน เปิดเผยถึง ตัวเลขผู้ประกันตนในระบบประกันสังคมเดือนมีนาคม 2567 ว่า จากข้อมูลสำนักสิทธิประโยชน์ สำนักงานประกันสังคม ประจำเดือนมีนาคม 2567 มีผู้ประกันตนในระบบประกันสังคมทุกมาตราคือ 33, 39, 40 โดยสรุป ดังนี้
- มาตรา 33 ลูกจ้างที่ทำงานในสถานประกอบการ ที่มีลูกจ้าง ตั้งแต่ 1 คนขึ้นไป มีอายุตั้งแต่ 15 ปีบริบูรณ์ อายุไม่เกิน 60 ปี บริบูรณ์ โดยจะได้รับสิทธิประโยชน์คุ้มครอง 7 กรณี คือ เจ็บป่วย คลอดบุตร ทุพพลภาพ ตาย สงเคราะห์บุตร ชราภาพ ว่างงาน สำหรับเดือนมีนาคม 2567 มียอดผู้ประกันตนมาตรา 33 ทั่วประเทศ จำนวน 11,882,607 คน
- มาตรา 39 ลูกจ้างที่เคยเป็นผู้ประกันตนมาตรา 33 นำส่งเงินสมทบมาแล้วไม่น้อยกว่า 12 เดือน และออกจากงานไม่เกิน 6 เดือน โดยจะได้รับสิทธิประโยชน์ความคุ้มครอง 6 กรณี คือ เจ็บป่วย คลอดบุตร ทุพพลภาพ ตาย สงเคราะห์บุตร ชราภาพ สำหรับเดือนมีนาคม 2567 มียอดผู้ประกันตนมาตรา 39 ทั่วประเทศ จำนวน 1,770,493 คน
- มาตรา 40 บุคคลทั่วไปที่มีอายุไม่ต่ำกว่า 15 ปีบริบูรณ์ และไม่เกิน 65 ปีบริบูรณ์ ประกอบอาชีพอิสระ ทำงานไม่มีนายจ้าง โดยจะได้รับสิทธิประโยชน์คุ้มครอง 3-4-5 กรณี ขึ้นอยู่กับทางเลือก จะได้รับเงินทดแทนการขาดรายได้ ทุพพลภาพ ชราภาพ สงเคราะห์บุตร ตาย สำหรับเดือนมีนาคม 2567 มียอดผู้ประกันตนมาตรา 40 ทั่วประเทศ จำนวน 10,980,484 คน
- ภาพรวมสรุปยอดจำนวนผู้ประกันตนทั่วประเทศ ประจำเดือนมีนาคม 2567 มีจำนวนทั้งสิ้น 24,633,584 คน
งานสุราษฏร์ธานีไบค์วีค ครั้งที่ 12 วันที่ 1-2 มีนาคม 2567
งานสุราษฏร์ธานีไบค์วีค (Surat Thani Bike Week) ครั้งที่ 12 วันที่ 1-2 มีนาคม 2567 ณ โรงแรมบรรจงบุรี จ.สุราษฎร์ธานี. **ชมคอนเสิร์ตจากศิลปินดัง ร้านค้าจำหน่ายสินค้าที่ระลึก อาหาร-เครื่องดื่ม ** กิจกรรมส่งเสริมการท่องเที่ยว / กิจกรรมมบำเพ็ญประโยชน์ต่อสาธารณะ / มอบทุนการศึกษา / มอบเครื่องมือแพทย์ ร่วมกิจกรรม วันที่ 2 มีนาคม 2567 ขอเชิญ ไบค์เกอร์ ร่วม รณรงค์ ขับขี่ ปลอดภัย เปิดไฟใส่หมวก หน้าจวนผู้ว่าราชการจังหวัด เวลา 13.00 น ลงทะเบียน รับเสื้อ(มีจำนวนจำกัด) เวลา 14.00 น เริ่มขบวนแห่รถ โดยมี ท่านผู้ว่าราชการจังหวัดสุราษฎร์ธานี ขับรถมอไซร้ นำขบวนแห่รถ
งานประจวบไบค์วีค 2024
งานประจวบไบค์วีค 2024 ครั้งที่ 14 วันที่ 30 มีนาคม 2567 ณ.ลานข้างสะพานปลาใหม่ ต.คลองวาฬ
ลงพื้นที่โครงการคชอาณาจักร ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า


19 มีนาคม 2567 น.สพ.อภิชัย นาคีสังข์ ปศุสัตว์จังหวัดสุรินทร์ มอบหมายให้นายสัตวแพทย์ จรูญวิทย์ นะพรรัมย์ นายสัตวแพทย์ชำนาญการพิเศษ หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ พร้อมด้วยนายสมพาน สีดา รก.ปศุสัตว์อำเภอท่าตูม และนายสัตวแพทย์ เจ้าหน้าที่สำนักงานปศุสัตว์จังหวัดสุรินทร์ สำนักงานปศุสัตว์อำเภอท่าตูม ลงพื้นที่โครงการคชอาณาจักรองค์การสวนสัตว์แห่งประเทศไทยในพระบรมราโชูปถัมภ์ โครงการโลกของช้าง องค์การบริหารส่วนจังหวัดสุรินทร์ หมู่บ้านช้างบ้านตากลาง ตำบลกระโพ อำเภอท่าตูมจังหวัดสุรินทร์ เพื่อฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมวทั้งที่มีเจ้าของและไม่มีเจ้าของ ซึ่งบูรณาการร่วมกับโรงพยาบาลท่าตูมโรงพยาบาลส่งเสริมสุขภาพบ้านตากลาง ตำบลกระโพ ในรูปแบบของสุขภาพหนึ่งเดียว (One Health) กลไกควบคุมโรคอุบัติใหม่ อุบัติซ้ำ โดยมีนายกรีติคุณ กรีธาพล ผู้จัดการโครงการคชอาณาจักร จังหวัดสุรินทร์ อำนวยความสะดวก พร้อมด้วยพนักงาน ลูกจ้าง เจ้าของช้างและควาญช้าง รณรงค์ฉีดวัคซีนป้องกันพิษสุนัขบ้า ในเขตหมู่บ้านตากลางให้กับคน สุนัข และแมว เพื่อเป็นการป้องกันโรคระบาด (พิษสุนัขบ้า) ในพื้นที่เสี่ยงจุดพบโรคในสุนัข #ครอบครัวปศุสัตว์ทำด้วยใจทำให้ไวทำได้จริง
ปฏิทินท่องเที่ยวจังหวัดนครปฐม ประจำเดือน มีนาคม-พฤษภาคม 2567
PELUPO 2024 (1-2 มีนาคม 2024)
PELUPO 2024 เฟสติวัลดนตรีในทุ่งโล่งบรรยากาศธรรมชาติ อนุรักษ์สิ่งแวดล้อม ปีที่ 2 จัด 2 วัน 1-2 มีนาคม 2024 ณ เดอะฟิลด์ แอท สยามคันทรีคลับ จังหวัดชลบุรี ภายใต้คอนเซ็ปต์ Friday maj7 (ฟรายเดย์ เมเจอร์ เซเว่น) ศิลปินดังในงานปีนี้ Jack Johnson Parcels วงดนตรีสัญชาติออสเตรเลีย Cosmo’s Midnight ดูโอฝาแฝดแห่งออสเตรเลีย, Dirty Loops Yung Bae ดีเจแนวหน้าสายฟิวเจอร์ฟังก์ H 3 F วงอาร์แอนด์บีฟังก์สัญชาติไทย The Walters เจ้าของเพลงฮิต “I Love You So” LANDOKMAI วงดูโอดรีมป็อปสัญชาติไทย และ Marc Rebillet ศิลปินวันแมนโชว์จอมบ้าคลั่ง
ตะพง หลาม อร่อย ประจำปี 1 มีนาคม 2567
ตะพง หลาม อร่อย ประจำปี 2567 วันที่ 1 มีนาคม 2567 สนามกีฬากลางตลาดผลไม้ตะพง ต.ะพง
เมืองเก่าเล่าเรื่อง บ้านฉาง 1-2 มีนาคม 2567
เมืองเก่าเล่าเรื่อง บ้านฉาง วันที่ 1-2 มีนาคม 2567 ถนนเทศบาล 46 หน้าสำนักงานเทศบาลเมืองบ้านฉาง อ.บ้านฉาง
1 มีนาคม โรงพยาบาลนครพิงค์ รับบริจาคอวัยวะ หญิงวัย 56 ปี
1 มีนาคม 2567 โรงพยาบาลนครพิงค์ สดุดีผู้วายชนม์และครอบครัว หญิงวัย 56 ปี บริจาคอวัยวะ ต่อลมหายใจ 4 ชีวิต สร้างบุญกุศลครั้งยิ่งใหญ่ ผู้ป่วยหญิง อายุ 56 ปี ประสบอุบัติเหตุรถจักรยานยนต์ล้ม หมดสติ ตรวจพบว่าผู้ป่วยมีเส้นเลือดสมองแตก และมีภาวะสมองตาย ทีมแพทย์จึงได้แจ้งการวินิจฉัยกับญาติ
เนื่องจากผู้ป่วยเป็นคนที่มีจิตใจดี ชอบทำบุญอยู่เสมอ และได้ทำบัตรประจำตัวผู้บริจาคดวงตากับสภากาชาดไว้ ญาติจึงมีความประสงค์ให้ผู้ป่วยได้มีโอกาสทำบุญครั้งใหญ่เป็นครั้งสุดท้าย ด้วยการบริจาคอวัยวะ ตามเจตนารมณ์ที่ผู้ป่วยได้เคยตั้งใจไว้ ซึ่งการบริจาคอวัยวะครั้งนี้ ได้ต่อลมหายใจผู้อื่นได้อีกถึง 4 ชีวิต จากไต 2 ข้าง และ กระจกตา 2 ข้าง
การบริจาคอวัยวะคือการให้ที่ไม่มีที่สิ้นสุด คือการทำบุญครั้งยิ่งใหญ่ คือทานบารมีขั้นสูง ด้วยบุญกุศลที่ได้มอบชีวิตใหม่ให้กับผู้อื่นอีกหลายชีวิตนั้น ขอให้ดวงวิญญาณของผู้วายชนม์ ไปสู่ภพภูมิที่ดีและได้รับรู้ว่าได้ช่วยเหลือผู้อื่นตามเจตนารณ์แล้ว
ขอขอบคุณผู้เกี่ยวข้องในภารกิจสะพานบุญในครั้งนี้ - หอผู้ป่วยหนักศัลยกรรมประสาท - ทีมห้องผ่าตัดและวิสัญญี รพ.นครพิงค์ - ทีมสภากาชาดไทย - ทีมผ่าตัด รพ.มหาราชนครเชียงใหม่ - คุณพิทักษ์ เขื่อนคำ ทีมจัดเก็บดวงตา รพ.นครพิงค์ - คุณกาญจนา แรงทน ผู้ประสานงานการปลูกถ่ายอวัยวะ ***ภาพและบทความนี้ ได้รับอนุญาตให้เผยแพร่จากญาติผู้เสียชีวิตแล้ว ภาพ/ข่าว คณะทำงานภาพลักษณ์องค์กรฯ
Bridgestone Gypsy Beach Camp#4 - 2 มีนาคม 2024
Bridgestone Gypsy Beach Camp 4 วันที่ 2 มีนาคม 2024 สวนสนประดิพัทธ์ อ.หัวหิน จ.ประจวบคีรีขันธ์
งาน ฟิน ฟิน ริมเล บ้านเพ ระยองฮิ 2-3 มีนาคม 2567
งาน ฟิน ฟิน ริมเล บ้านเพ ระยองฮิ 2 - 3 มีนาคม พ.ศ 2567เวลา16.00 - 22.00น. ณ ชายหาดบ้านเพ (หน้าทางเข้าชุมชนปากคลอง) ตำบลบ้านเพ อำเภอเมือง จังหวัดระยอง พบกับบอลลูนไฟสุดตระการตาการ การแสดงของชุมชนชม สาธิตอาหารพื้นถิ่นชิมช็อปร้านค้ามากกว่า 100 ร้านค้า
R.O.X. Fest 2 มีนาคม 2567
R.O.X. Fest 2 มีนาคม 2567 สวนละไม อ.วังจันทร์ งาน Camping Festival ที่มีทั้งแคมป์ปิ้ง ตลาดคอมมูนิตี้แบรนด์ดังระดับโลก ดนตรีสดจาก 3 ศิลปินดัง ที่จะมาเสิร์ฟความสนุกให้คุณแบบจุกๆ และยังมีกิจกรรมอีกมากมายจากแบรนด์ดัง
Sea Sand Love Music Fest#1 วันที่ 2-3 มีนาคม
Sea Sand Love Music Fest.#1 @Hadchaosamran เทศกาลเพลงริมทะเล วันที่ 2-3 มีนาคม 2567 ตั้งแต่ยามเย็นเป็นต้นไป (ดนตรีเริ่ม 18.00-23.00 น.) ณ หาดชมวาฬ(ซอยข้างการประปาฯ) ต.หาดเจ้าสำราญ อ.เมืองเพชรบุรี จ.เพชรบุรี
ศิลปะสร้างสรรค์ ชุบชีวิตผูกมิตรเมือง พิพิธภัณฑ์ของดีเมืองกาฬสินธุ์ 3-6 มีนาคม 2566
ศิลปะสร้างสรรค์ ชุบชีวิตผูกมิตรเมือง พิพิธภัณฑ์ของดีเมืองกาฬสินธุ์ 3-6 มีนาคม 2566 กิจกรรมน่าสนใจในงาน
-กิจกรรมฟื้นชีวิตไดโนเสาร์ไม้ไผ่
-กิจกรรมภาพวาดเสมือนจริงจากศิลปินระดับประเทศ
-การแสดงโชว์บัลเล่ห์ จากมหาวิทยาลัยมหาสารคาม
-พิธีเปิดโดย ศาสตราจารย์พิเศษอเนก เหล่าธรรมทัศน์ รัฐมนตรีว่าการกระทรวงอุดมศึกษา วิทยาศาสตร์วิจัยและนวัตกรรม
มาฆปูรณมีบูชา ทะเลธุงอีสาน เมืองโบราณฟ้าแดดสงยางพระธาตุยาคู 3-12 มีนาคม 2566
เชิญเที่ยวงาน"มาฆปูรณมีบูชา"ทะเลธุงอีสาน ในวันที่ 3-12 มีนาคม 2566 ทุกท่านที่มาเข้าร่วมงานจะได้พบความตระการกับทะเลธุงที่สวยงามกว่า 1,000 ต้น และนางรำมากกว่า 2,300 คน
Seema Running 2 วัดพระขาว 3 มีนาคม 2567
Seema Running 2 ฮาล์ฟมาราธอน วันอาทิตย์ ที่ 3 มีนาคม 2567 ณ วัดเทพพิทักษ์ปุณณาราม (วัดพระขาว) ต.กลางดง อ.ปากช่อง จ.นครราชสีมา
งานมหกรรมฟื้นใจเมือง "ภูมิถิ่น แก่งสำโรง โค้งสงเปลือย" 4 - 6 มีนาคม 2566
เทศบาลเมืองกาฬสินธุ์ ขอเชิญร่วมงานมหกรรมฟื้นใจเมือง "ภูมิถิ่น แก่งสำโรง โค้งสงเปลือย" ระหว่างวันที่ 4 - 6 มีนาคม 2566 ณ บริเวณศาลเจ้าโสมพะมิตร (ตลาดริมน้ำปาว) มีกิจกรรมต่างๆ มากมาย อาทิเช่น
✅ กิจกรรมศิลปะ วัฒนธรรม สร้างสรรค์ การฉายหนังกลางแปลง
✅การแสดงรำวงย้อนยุกต์จากชุมชนในเขตเทศบาลเมืองกาฬสินธุ์
✅ขบวนแห่ เจ้าเมืองกาฬสินธุ์ จากทั้งชุมชนทั้ง 9 คุ้มวัด การแสดงดนตรีโปงลาง
✅พิธีบวงสรวงสักการะศาลเจ้าโสมพะมิตร
✅รำถวายเจ้าโสมพะมิตร 230 ปี เมืองกาฬสินธุ์
✅การเดินแฟชั่นโชว์ผ้าพื้นเมืองกาฬสินธุ์ โดยทีม "นางงามเด็ก" Little Miss Kalasin และ“ทีน่า ธนวรรณ วิกก์” มิสแกรนด์กาฬสินธุ์ 2022 , "ปรายฟ้า ทองแร่" มิสแกรนด์กาฬสินธุ์ 2023 ,"จินนี่ สุมิตรา โคกัต" รองอันดับ 2 มิสแกรนด์กาฬสินธุ์ 2023
✅การแสดงฟ้อนรำละครวัฒนธรรมภูไท
✅กิจกรรมการประกวดเต้น Cover Dance ของเด็ก เยาวชน ในเขตเทศบาลเมืองกาฬสินธุ์
แล้วพบกัน ณ บริเวณศาลเจ้าโสมพะมิตร (ตลาดริมน้ำปาว) กับ มหกรรมฟื้นใจเมือง "ภูมิถิ่น แก่งสำโรง โค้งสงเปลือย"
ปศุสัตว์อำเภอนายายอาม ออกพื้นที่รณรงค์ฉีดวัคซีน
วันที่ 4 มีนาคม 2567 เวลา 09.00 น. นายทยากร เพ็ชร์ผ่อง ปศุสัตว์อำเภอนายายอาม พร้อมด้วย ว่าที่ ร.ต.ภรัณยู สาระคำ เจ้าพนักงานสัตวบาลปฏิบัติงาน นางสาวนันทนา พวงสุนทร เจ้าพนักงานสัตวบาล นางสาวณิชานันท์ จันทมงคล พนักงานจ้างเหมาด้านการเฝ้าระวัง ควบคุมและป้องกันโรคระบาด นางสาวพีรธิดา ชีวาภรณาภิวัฒน์ ตำแหน่งพนักงานจ้างเหมาฯ ร่วมกับองค์การบริหารส่วนตำบลวังใหม่ ลงพื้นที่ ณ หมู่ 10 ต.วังใหม่ อ.นายายอาม จ.จันทบุรี ออกรณรงค์และปฏิบัติงานการฉีดวัคซีนป้องกัน โรคพิษสุนัขบ้าประจำปี 2567 และให้คำแนะนำการดูแลสุขภาพสัตว์
งานฉลองอนุสาวรีย์ปราบฮ่อใต้ร่มพระบารมี 197 ปี เมืองหนองคายและงานกาชาด 2567 (5 - 13 มีนาคม 2567)
งานฉลองอนุสาวรีย์ปราบฮ่อใต้ร่มพระบารมี 197 ปี เมืองหนองคายและงานกาชาดพ.ศ.2567 ระหว่างวันที่ 5 - 13 มีนาคม 2567 ณ บริเวณหน้าอนุสาวรีย์ปราบฮ่อ(ศาลากลางหลังเดิม) จังหวัดหนองคาย ไฮไลท์ของงาน - ร้านมัจฉากาชาด - นิทรรศการของหน่วยงานราชการ - การแสดงแสง เสียง และสื่อผสม เปิดตำนานสงครามปราบกบฏฮ่อ - พิธีบวงสรวง - รำบายศรีเมือง - การจำหน่ายผลิตภัณฑ์ OTOP - ถนนอาหาร
มหรสพตลอดคืน 5 มี.ค. 67 พงษ์สิทธิ์ คัมภีร์ 6 มี.ค. 67 ไทรถแห่ 7 มี.ค. 67 น้ำแข็ง ทิพวรรณ 8 มี.ค. 67 ยังโอม 9 มี.ค. 67 เนสกาแฟ ศรีนคร 10มี.ค. 67 มหาหิงค์ 11 มี.ค. 67 แอนอรดี 12 มี.ค.67 มนต์แคน แก่นคูณ 13 มี.ค.67 ลำไย ไหทองคำ
งานประจำปีของอำเภอสังขละบุรี 6-19 มีนาคม 2567
งานประจำปีของอำเภอสังขละบุรี งานบำเพ็ญกุศล 113 ปี ชาตกาล พระราชอุดมมงคล หลวงพ่ออุตตมะ ระหว่างวันที่ 6-19 มีนาคม 2567 ณ เจดีย์พุทธคยา วัดวังก์วิเวการาม [
พิกัด] หลวงพ่อ พระมหาสุชาติ สิริปญฺโญ (เจ้าอาวาสองค์ปัจุบัน) มีความกรุณาจัดไฟให้ผู้คนรับชมปีนี้เป็นปีแรก หากเป็นด้วยความเรียบร้อยหลวงพ่อก็จะทำไปเรื่อยๆ ตามงบตามกำลังครับ ใช้ดวงไฟไปกว่า 150,000 ดวง
กำหนดการสำคัญ
• 6-14 มี.ค. สวดมนต์ 9 คืน ที่เจดีย์พุทธคยา ชมแสงไฟประดับประดาสุดงดงาม เปิดไฟ 18:30 พระเริ่มสวด 20:00 น.
• 15-19 มี.ค. ชมลิเกมอญ 5คืนเต็ม เดินเที่ยวชมงานวัดทั่วไป มีร้านค้า ของกิน ลิเกมอญ งานแสดงนักเรียน
สอบถามโทร 0624257152
ปศุสัตว์อำเภอแก่งหางแมว ให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้า ในโรงเรียนตำรวจตระเวนชายแดนบ้านคลองแดง
วันที่ 6 มีนาคม 2567 เวลา 13.00 น.นายสมฤกษ์ ม่วงไหมทอง ปศุสัตว์อำเภอแก่งหางแมว พร้อมด้วย เจ้าหน้าที่ สำนักงานปศุสัตว์อำเภอแก่งทางแมว, เจ้าหน้าที่สำนักงานปศุสัว์อำเภอเขาคิชณกูฎ ดำเนินให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าในโรงเรียน ณ โรงเรียนตำรวจตระเวนชายแดนบ้านคลองแดง โดยมีวัตถุประสงค์เพื่อเสริมสร้างความรู้ ความเข้าใจและทักษะให้กับนักเรียน ในด้านการเฝ้าระวัง การป้องกันโรคพิษสุนัขบ้า โดยมีนักเรียนผู้เข้ารับการฝึกอบรมจำนวน 35 คน
เทศกาลลานตา ลันตา ครั้งที่ 19 ประจำปี 2567 (7-9 มีนาคม 2567)
เทศกาลลานตา ลันตา ครั้งที่ 19 ประจำปี 2567 (LAANTA LANTA FESTIVAL 2024) ฉลอง 123 ปี “ธรรมชาติที่ยิ่งใหญ่และวัฒนธรรมรุ่งเรือง” Great Nature Glorious Culture งานเทศกาลลานตา ลันตา ครั้งที่ 19 (LAANTA LANTA FESTIVAS 2024) กำหนดจัดขึ้นในระหว่างวันที่ 7-9 มีนาคม 2567 ณ เมืองเก่าลันตา บ้านศรีรายา
7 มีนาคม 2567 โรคพิษสุนัขบ้าในสัตว์พื้นที่จังหวัดกาฬสินธุ์ พบการระบาด 6 พื้นที่รวม 2 อำเภอ
7 มีนาคม 2567 ณ ห้องประชุมสำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ นายธวัชชัย รอดงาม รองผู้ว่าราชการจังหวัดกาฬสินธุ์ เป็นประธานการประชุมติดตามสถานการณ์การระบาดของโรคพิษสุนัขบ้าในสัตว์ พื้นที่จังหวัดกาฬสินธุ์ โดยมีปศุสัตว์จังหวัดกาฬสินธุ์ ท้องถิ่นจังหวัดกาฬสินธุ์ ผู้แทนสาธารณสุขจังหวัดกาฬสินธุ์ ผู้แทนประชาสัมพันธ์จังหวัดกาฬสินธุ์ และเจ้าหน้าที่สำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ เข้าร่วมประชุม ซึ่งที่ประชุมได้รายงานสถานการณ์การระบาดของโรคพิษสุนัขบ้าในสัตว์พื้นที่จังหวัดกาฬสินธุ์ ว่า ในปีงบประมาณ พ.ศ. 2567 สำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ได้รับรายงานการตรวจพบเชื้อโรคพิษสุนัขบ้าในสัตว์ และประกาศกำหนดเขตโรคระบาดชั่วคราว ตามพระราชบัญญัติโรคระบาดสัตว์ พ.ศ. 2558 รวม 6 พื้นที่ ได้แก่
- วันที่ 13 ธันวาคม 2566 พบรายงานการเกิดโรค ณ บ้านยางคำเหนือ หมู่ที่ 12 ตำบลอิตื้อ อำเภอยางตลาด
- วันที่ 16 มกราคม 2567 พบรายงานการเกิดโรค ณ บ้านโพนสิมเหนือ หมู่ที่ 14 ตำบลหัวนาคำ อำเภอยางตลาด
- วันที่ 2 กุมภาพันธ์ 2567 พบรายงานการเกิดโรค ณ บ้านโคกกลาง หมู่ที่ 4 ตำบลหัวหิน อำเภอห้วยเม็ก
- วันที่ 22 กุมภาพันธ์ 2567 พบรายงานการเกิดโรค ณ บ้านดอนยานาง หมู่ที่ 5 ตำบลดอนสมบูรณ์ อำเภอยางตลาด
- วันที่ 27 กุมภาพันธ์ 2567 พบรายงานการเกิดโรค ณ บ้านท่าเรือ หมู่ที่ 3 ตำบลนาเชือก อำเภอยางตลาด
- วันที่ 5 มีนาคม 2567 พบรายงานการเกิดโรค ณ บ้านท่าเรือ หมู่ที่ 3 ตำบลนาเชือก อำเภอ ยางตลาด จังหวัดกาฬสินธุ์
สำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ ได้ดำเนินการมาตรการการเมื่อเกิดโรคระบาดในสัตว์ ดังนี้ ดำเนินการรายงานการตรวจพบเชื้อในสัตว์ และประกาศ กำหนดเขตโรคระบาดชั่วคราว ตามระราชบัญญัติโรคระบาดสัตว์ พ.ศ. 2558 ภายใน 24 ชั่วโมงหลังผลการ ตรวจทางห้องปฏิบัติการออก ต่อสำนักงานสาธารณสุขจังหวัดกาฬสินธุ์และท้องถิ่นจังหวัดกาฬสินธุ์ และคณะทำงานสอบสวนโรคสำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ดำเนินการสอบสวนโรค ค้นหา สัตว์ และผู้สัมผัสเสี่ยงสูง พร้อมทั้งจัดทำรายงานสอบสวนโรครายงานต่อปศุสัตว์เขต ๔ และอธิบดีกรมปศุสัตว์ ภายใน 72 ชั่วโมง หลังผลการตรวจทางห้องปฏิบัติการออก รวมทั้งได้ดำเนินการฉีดวัคซีนเพื่อกระตุ้นภูมิคุ้มกันในสัตว์โดนกัด และสัตว์กลุ่มเสี่ยงตามพื้นที่รัศมี 5 กิโลเมตรจากจุดเกิดโรค และดำเนินการสั่งกักสัตว์กลุ่มเสี่ยงเพื่อสังเกตอาการเป็นเวลา 180 วัน
นายธวัชชัย รอดงาม รองผู้ว่าราชการจังหวัดกาฬสินธุ์ กล่าวว่า ได้มอบหมายสำนักงานปศุสัตว์จังหวัดกาฬสินธุ์ ร่วมกับสำนักงานท้องถิ่นจังหวัดกาฬสินธุ์ จัดทำแผนล่วงหน้าเพื่อจัดหาวัคซีนมาฉีดให้กับสุนัขและแมว โดยในปีงบประมาณ พ.ศ.2568 ต้องฉีดให้ครอบคลุมในพื้นที่เสี่ยงทั้ง 6 พื้นที่ เพื่อป้องกันไม่ให้เกิดการระบาดซ้ำขึ้นอีก
มหัศจรรย์ของดีเนินมะปราง ประจำปี 2567 เทศกาลกินมะม่วงเนินมะปราง (8-17 มีนาคม 67)
มหัศจรรย์ของดีเนินมะปราง ประจำปี 2567 เทศกาลกินมะม่วงเนินมะปราง (จัดวันที่ 8-17 มีนาคม 67) เทศกาลงานการเกษตรประจำปี อ.เนินมะปราง จ.พิษณุโลก บริเวณหน้าที่ว่าการอำเภอเนินมะปราง กิจกรรมมากมายในงาน ได้แก่ การจำหน่ายผลผลิตทางการเกษตร ผลิตภัณฑ์โอท็อป งานกาชาด ประกวดสตริง ประกวดกินมะม่วง
เทศกาลดนตรีพัทยา 2024 (ตลอดเดือนมีนาคม 2567)
เทศกาลดนตรีพัทยา 2024 กำหนดการวันจัดงาน งานเทศกาลดนตรีเมืองพัทยา PATTAYA MUSIC FESTIVAL 2024 ตลอดเดือนมีนาคม 2567 ดังนี้ วันที 8-9 มีนาคม 2567 วันที่ 15-16 มีนาคม 2567 วันที่ 22-23 มีนาคม 2567 วันที่ 29-30 มีนาคม 2567 ส่วนรายชื่อศิลปิน คงจะทยอยเปิดกันออกมาตั้งแต่เดือนกุมภาพันธ์เป็นต้นไป อดใจรอฟังอัพเดต
ของดีชายแดนใต้ & OTOP ทั่วไทย ร่วมใจสู่ลุ่มแม่น้ำโขง วันที่ 8 - 17 มีนาคม 2567
งานมหกรรมการแสดงและจำหน่ายสินค้า "ของดีชายแดนใต้ & OTOP ทั่วไทย ร่วมใจสู่ลุ่มแม่น้ำโขง" ประจำปี 2567 ???? ระหว่างวันที่ 8 - 17 มีนาคม 2567 ณ โดมแอร์บริเวณหน้าศาลากลางจังหวัดนครพนม อำเภอเมืองนครพนม จังหวัดนครพนม มาร่วมช็อป ช่วยส่งเสริมผลิตภัณฑ์ชุมชน (OTOP) พัฒนาธุรกิจชุมชน
งาน The Connection Of Love บ้านไร่ อุทัยธานี 8 มีนาคม 2567
งาน The Connection Of Love สถานที่ Lemone Cafe & Resort อำเภอบ้านไร่ จังหวัดอุทัยธานี ศิลปินที่จะมาร่วมมอบความสนุกให้กับคุณลูกค้าใน วันที่ 8 มีนาคม 2567 วง #นูโว วง #มอร์กะจาย วง #ปากอง วง #actband และสุดท้าย #Raksbay
งานแผ่นดิน สมเด็จพระนั่งเกล้าเจ้าอยู่หัว 8-10 มีนาคม 2567
งานแผ่นดิน สมเด็จพระนั่งเกล้าเจ้าอยู่หัว (วันสร้างเมือง พ.ศ. 2374) จัดขึ้นในระหว่างวันที่ 8 – 10 มีนาคม 2567 จัดขึ้นเพื่อเป็นการรำลึกในพระมหากรุณาธิคุณของ พระบาทสมเด็จพระนั่งเกล้าเจ้าอยู่หัว รัชกาลที่ 3 ที่ได้ทรงมีต่อชาวจังหวัดกาญจนบุรีในการสร้างเมืองกาญจนบุรีจนเจริญรุ่งเรือง อยู่เย็นเป็นสุขจนถึงปัจจุบัน และทรงโปรดวางศิลาฤกษ์ให้สร้างกำแพงเมืองกาญจนบุรี ณ บริเวณบ้านปากแพรก เมื่อวันที่ 8 มีนาคม 2374 ภายในงานประกอบด้วยการแสดงทางวัฒนธรรม อาทิ โขนมรดกโลก หุ่นละครเล็ก ละครเสภา ขุนช้าง ขุนแผน
งานวันสร้างเมือง พ.ศ.2374 วันที่ 8-10 มีนาคม 2567
งานวันสร้างเมือง พ.ศ.2374 วันที่ 8-10 มีนาคม 2567 บริเวณศาลหลักเมือง ถนนคนเดิน ร้านค้า ตลาดย้อนยุคกว่า 60 ร้าน ในบรรยากาศสบายๆลมเย็นๆ
งานแสดงโขนประกอบแสงสี ครั้งประวัติศาสตร์เรื่องรามเกียรติ์ ชุด “สัจจะพาลี” ณ วัดไชยวัฒนาราม เข้าชมฟรี 9-10 มีนาคม 2567
เชิญชมงานแสดงโขนประกอบแสงสี ครั้งประวัติศาสตร์เรื่องรามเกียรติ์ ชุด “สัจจะพาลี” ณ วัดไชยวัฒนาราม จ.พระนครศรีอยุธยา ผสานสองมรดกโลกที่ขึ้นทะเบียนรับรองโดยองค์การยูเนสโก โดยสำนักการสังคีต กรมศิลปากร กระทรวงวัฒนธรรม ร่วมกับมูลนิธิสุทธิรัตน์ อยู่วิทยา กำกับการแสดงโดย ปกรณ์ พรพิสุทธิ์
การแสดงชุดนี้เป็นอีกตอนของรามเกียรติ์ที่สนุกสนาน สอดแทรกคติธรรมที่น่าสนใจ ทั้งยังรวบรวมตัวละครเอกของเรื่องไว้มากมาย ให้ได้ชมกันอย่างเพลิดเพลิน จัดเต็มด้วยเทคนิคแสง สี เสียง ตระการตาเพื่อเพิ่มอรรถรสในการรับชม ฉากถูกออกแบบมาให้กลมกลืนกับโบราณสถาน ก่อนการแสดงโขนผู้เข้าชมจะได้เพลิดเพลินกับการบรรเลงจากวงออร์เคสตรา โดยวงดุริยางค์สากล สำนักการสังคีต กรมศิลปากร ณ สถานที่แห่งประวัติศาสตร์ในบรรยากาศยามเย็นอย่างเต็มอิ่มอีกด้วย
จัดแสดง 2 รอบ
ในวันเสาร์ที่ 9 และ วันอาทิตย์ที่ 10 มีนาคม 2567 เวลา 17:30 น. เป็นต้นไป
เข้าชมฟรี โดยชำระค่าเข้าชมโบราณสถานเพียง 10 บาท/ท่าน (ชาวไทย) และ 50 บาท/ท่าน (ชาวต่างชาติ)
ซึ่งรายได้จากส่วนนี้ทางโบราณสถาน จะนำไปบำรุงสถานที่ต่อไป
PANGSIDA CHILL 2024 Run&Have Fan season 2 อาทิตย์ที่ 10 มีนาคม 2567
กลับมาพบกันอีกปี PANGSIDA CHILL 2024 Run&Have Fan >> season 2 จังหวัดสระแก้ว การท่องเที่ยวเเห่งประเทศไทยสำนักงานนครนายก (นครนายก ปราจีนบุรี สระเเก้ว) ร่วมกับอุทยานแห่งชาติปางสีดา สมาคมธุรกิจท่องเที่ยวและบริการจังหวัดสระแก้ว บริษัท เรคเรซ สปอร์ต จำกัด >>จัดกิจกรรมวิ่งครั้งที่ 2 สัมผัสใหม่ “สนามครอส คันทรี” ปางสีดา วิ่งชมธรรมชาติ ท่ามกลางขุนเขา **ปีนี้เส้นทางใหม่นะ** แข่งขันในวัน อาทิตย์ที่ 10 มีนาคม 2567 ณ อุทยานแห่งชาติปางสีดา อ.เมืองสระเเก้ว จ.สระแก้ว “รายได้ส่วนหนึ่ง ร่วมสนับสนุนการดำเนินงานของเจ้าหน้าที่อุทยานแห่งชาติปางสีดา เพื่อดูเเลผืนป่า..ป่าต้นน้ำ”
สุขาภิบาลท่าฉลอมฮาล์ฟมาราธอนครั้งที่ 2 วันที่ 10 มีนาคม 2567
งานสุขาภิบาลท่าฉลอมฮาล์ฟมาราธอนครั้งที่ 2 ตอนมังกรเล่งเกียฉู่ ตำนานมังกรแห่งลุ่มแม่น้ำท่าจีน วันที่ 10 มีนาคม 2567 ระยะวิ่ง 4K : 11.5K : 21K
Singora Lake Swim 2024 วันที่ 10 มีนาคม 2567
Singora Lake Swim 2024 ว่ายน้ำข้ามทะเลสาบสงขลา ลากูนแห่งเดียวของเมืองไทย วันที่ 10 มีนาคม 2567 (รับจำนวนจำกัด 300 ท่านเท่านั้น ) ณ โรงสีแดง (หับ โห้ว หิ้น) ระยะทาง 5 กิโลเมตรและ 2 กิโลเมตร จุดเริ่มต้น ณ โรงสี หับ โห หิ้น ถนนนครนอก อ. เมือง สงขลา จุดสิ้นสุด ณ สงขลาเพียร์ อ.สิงหนคร สงขลา
การแข่งขัน กีฬา E-Sports สุราษฎร์ธานี วันที่ 10 มีนาคม 2567
การแข่งขัน กีฬา E-Sports จังหวัดสุราษฎร์ธานี วันที่ 10 มีนาคม 2567 ณ อาคารศูนย์กลางการประชุมสัมมนาภาคใต้ตอนบนศาลากลางจังหวัดสุราษฎร์ธานี ตั้งแต่เวลา 07.00 น.ขึ้นไป ประเภทการแข่งขันดังนี้ 1. การแข่งขัน Arena of Valor (AOV) 2. การแข่งขัน Street Fighter 6 - ประเภทเดี่ยว ชาย/หญิง
วิ่งใจเกินร้อยพิชิตภูสิงห์ กาฬสินธุ์ 11 - 12 มีนาคม 2566
#วิ่งใจเกินร้อยพิชิตภูสิงห์ #กาฬสินธุ์ 11 - 12 มีนาคม 2566
9 มีนาคม โรงพยาบาลราชบุรี เชิดชูเกียรติผู้บริจาค ชายพม่า อายุ 56 ปี
11 มีนาคม 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยเป็น ชายพม่า อายุ 56 ปี ผู้ป่วยรับส่งต่อมาจากโรงพยาบาลปากท่อ มีอาการพูดไม่ออกเป็นทันทีทันใด เข้ารักษาที่ศูนย์โรคหลอดเลือดสมอง โรงพยาบาลราชบุรี ด้วยโรคหลอดเลือดสมองตีบ ให้ยาละลายลิ่มเลือดทางหลอดเลือดดำอาการไม่ดีขึ้น ส่งเอกซ์เรย์คอมพิวเตอร์สมอง พบมีเลือดออกในสมอง และมีภาวะสมองบวม ได้รับการผ่าตัดสมอง ผู้ป่วยมีอาการหนักมาก ญาติขอดูแลประคับประคอง ให้ข้อมูลเรื่องการบริจาคอวัยวะ ญาติประสงค์ในการบริจาคอวัยวะทุกส่วน แต่ผู้ป่วยอาการหนักมาก สามารถบริจาคได้เพียงดวงตาให้กับผู้ที่รอคอยการปลูกถ่ายกระจกตาเพื่อเป็นการสร้างกุศลครั้งใหญ่ให้กับผู้ป่วยในวาระสุดท้าย เมื่อวันที่ 9 มีนาคม 2567
โรงพยาบาลราชบุรี จึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือ การบริจาคดวงตาให้กับศูนย์รับบริจาคดวงตาสภากาชาดไทย ซึ่งถือเป็นการสร้างประโยชน์และกุศลอย่างสูงสุดในโอกาสนี้ นายแพทย์ณรงค์ เห็นประเสริฐแท้ รองผู้อำนวยการโรงพยาบาลราชบุรี นายแพทย์ ธนะศักดิ์ พัทมุข หัวหน้ากลุ่มงานอายุรกรรม และเจ้าหน้าที่โรงพยาบาลราชบุรีได้ร่วมมอบเกียรติบัตรและพวงหรีดเพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
กิจกรรมปั่นจักรยานส่งเสริมการท่องเที่ยววันช้างไทย Valley bike ปั่นไปหาช้าง ในวันที่ 12 มีนาคม 2567
กิจกรรมปั่นจักรยานส่งเสริมการท่องเที่ยววันช้างไทย "Valley bike ปั่นไปหาช้าง" ในวันที่ 12 มีนาคม 2567 เวลา 07.00 น. จุดสตาร์ท ณ อบต.วาเล่ย์ - ร่วมสักการะเจ้าพ่อพะวอ - บ้านยะพอ(บ้านเพราะช้าง) ระยะทางประมาณ 7 กม.
งานธรรมศาสตร์แฟร์ ครั้งแรก 18-29 มี.ค. 2567
งานธรรมศาสตร์แฟร์ ครั้งแรก วันที่ 18-29 มี.ค. 67 ม.ธรรมศาสตร์ ศูนย์รังสิต 12 วัน 12 คืน ที่จะเต็มไปด้วยสรรพสิ่งน่าดูน่าชม สรรพอาหาร เครื่องดื่ม ขนม ของกิน ของใช้ ละลานตา รอไปดูไปเดินชมกันว่า งานแฟร์ครั้งแรกของม.ธรรมศาสตร์ ”ธรรมศาสตร์แฟร์“ จะอลังการขนาดไหน
งานท้าวเทพกระษัตรี ท้าวศรีสุนทร ละครอิงประวัติศาสตร์ 13-15 มีนาคม 2567
อบจ.ภูเก็ต จัดงานท้าวเทพกระษัตรี ท้าวศรีสุนทร #THOHEROINES ละครอิงประวัติศาสตร์ 13-15 มีนาคม 2567 อนุสรณ์ สถานกลางชนะศึก จ.ภูเก็ต
ปศุสัตว์จันทบุรี ร่วมกับ อบต.โป่งน้ำร้อน ปล่อยขบวนรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแบบเคาะประตูบ้าน


13 มี.ค.67 เวลา 10.00 น. น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับนายชาติชาย ดำรงชีพ นายกองค์การบริหารส่วนตำบลโป่งน้ำร้อน นางรัตอรุณ ทวีผล ผู้ใหญ่บ้านม.5 ต.โป่งน้ำร้อน อาสาสมัครประจำหมู่บ้าน น.สพ.มนัสกิจ พลศรี หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ นายอดิเรก จันทะศิลา ปศุสัตว์อำเภอโป่งน้ำร้อน และเจ้าหน้าที่ในสังกัด ลงพื้นที่ ศาลาประชาคมบ้านเขาหอม ม.5 ต.โป่งน้ำร้อน อ.โป่งน้ำร้อน จัดพิธีเปิดรณรงค์ป้องกันโรคพิษสุนัขบ้า ประจำปี 2567 แก่สุนัข แมวของประชาชนที่อาศัยอยู่ในหมู่บ้าน สวนผลไม้ และสุนัขจรจัดตามแนวชายแดนไทย-กัมพูชา ซึ่งอาจข้ามไปมา จึงเป็นพื้นที่เสี่ยงต่อการเกิดโรคพิษสุนัขบ้า
กิจกรรมประกอบด้วย การปล่อยขบวนเดินรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สัตว์เลี้ยงแบบเคาะประตูบ้าน รวมทั้ง อบรมให้ความรู้เรื่องโรคพิษสุนัขบ้าแก่เด็กนักเรียนโรงเรียนบ้านเขาหอม รวม 60 คน และมอบกระติกใส่วัคซีน อุปกรณ์ให้อาสา ผลการปฏิบัติงาน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัข แมว รวม 300 ตัว โดย อบต.โป่งน้ำร้อนสนับสนุนวัคซีน พร้อมผูกคอ ห้อยเหรียญเครื่องหมายแสดงการได้รับวัคซีน รวมทั้งให้คำแนะนำแก่ประชาชนในการเลี้ยงสัตว์ การดูแลสวัสดิภาพสัตว์ การปฏิบัติตัวที่ถูกต้องหากถูกสุนัขกัด 4 ข้อ เพื่อไม่ให้เสียชีวิตด้วยโรคพิษสุนัขบ้า ด้วยการล้างแผลด้วยน้ำสบู่ ใส่ยาทาแผล กักสุนัขหรือเฝ้าสังเกตอาการอย่างน้อย 10 วัน แล้วรีบไปพบแพทย์ทันที ทั้งนี้ ขอความร่วมมือประชาชนนำสัตว์เลี้ยงที่มีอายุตั้งแต่ 2 เดือนขึ้นไป ไปขอรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยในช่วงนี้ เป็นช่วงรณรงค์ฉีดวัคซีนประจำปี ตามที่เทศบาลหรืออบต.ทุกแห่งนัดหมายโดยไม่เสียค่าใช้จ่ายใดๆ
งานพระนครคีรีเมืองเพชร 14-23 มีนาคม 2567
งาน“ พระนครคีรี สดุดีจอมราชัน มหัศจรรย์มรดกโลก ” จังหวัดเพชรบุรี ระหว่างวันที่ 14 – 23 มีนาคม 2567 ณ อุทยานเฉลิมพระเกียรติ ร.4 (พระนครคีรี) มหกรรมแห่งความบันเทิง ความหลากหลายทางวัฒนธรรม แสง สี เสียง นักท่องเที่ยวจะได้สัมผัสความมหัศจรรย์ ความอุดมสมบูรณ์ และความหลากหลายของพืชพรรณและสัตว์ป่าของอุทยานแห่งชาติแก่งกระจาน ที่ยกจำลองมาในงานนี้ พร้อมตื่นตาตื่นใจกับการประดับไฟบนพระนครคีรี ชมความสวยงามตระการตาของพลุดอกไม้ไฟหลากสีที่จะเบ่งบานทั่วทั้งผืนฟ้าเหนือพระนครคีรี พร้อมชิม ช้อป ร้านของกินของฝากของใช้หลากหลาย ทั้งสินค้าเกษตร สินค้า OTOP สินค้าประชารัฐ สินค้าธงฟ้าราคาประหยัด
ปศุสัตว์จันทบุรี ร่วมกับเทศบาลเมืองท่าใหม่ รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัข แมว ในช่วงหน้าร้อน


วันที่ 14 มีนาคม 2567 เวลา 10.00 น. น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับนายธวัชชัย สวัสดิชัย นายกเทศมนตรีเมืองท่าใหม่ คณะผู้บริหารเทศบาล ผู้นำชุมชน น.สพ.มนัสกิจ พลศรี หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ และเจ้าหน้าที่ในสังกัด เปิดการรณรงค์ฉีดวัคนป้องกันโรคพิษสุนัขบ้าแก่สุนัขแมวในหน้าร้อน ประจำปี 2567 ณ ลานกีฬาอเนกประสงค์ สวนเฉลิมพระเกียรติ ร.9 อ.ท่าใหม่ ตามโครงการป้องกันโรคพิษสุนัขบ้า ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธานศาตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒวรขัตติยราชนารี
โดยเทศบาลเมืองท่าใหม่ ได้สนับสนุนวัคน พร้อมเวชภัณฑ์ กำหนดช่วงรณรงค์ในระหว่างวันที่ 14-15 มี.ค.67 กิจกรรมประกอบด้วยการมอบกระติกใส่วัคนและอุปกรณ์ในการฉีดวัคซีนให้แก่อาสาสมัครประจำหมู่บ้าน การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
การผ่าตัดทำหมันเพื่อควบคุมประชากรสัตว์ของประชาชน 80 ตัวต่อวัน การเสริมสร้างความรู้ในการป้องกันสุนัขกัด ด้วยคาถา 5 ย ได้แก่ อย่าเหยียบหางหรือขาสุนัข อย่าหยิบจานข้าวขณะสุนัขกินข้าว อย่ายุ่งกับสุนัขที่ไม่รู้จัก อย่าแยกสุนัขที่กัดกันด้วยมือเปล่า อย่าแหยให้สุนัขโกรธ และการปฏิบัติตนหากถูกสุนัขกัด โดยล้างแผล ใส่ยา กักหมาไว้ดูอาการ 10 วัน แล้วรีบไปหาแพทย์ทันที รวมทั้ง สร้างความตระหนักให้ประชาชนเลี้ยงสัตว์อย่างมีความรับผิดชอบ ไม่นำสัตว์เลี้ยง
ไปปล่อยทิ้งเป็นสัตว์จรจัด ซึ่งจะมีความผิดตามพระราชบัญญัติป้องกันการทารุณกรรมและการจัดสวัสดิภาพสัตว์ พ.ศ.2557 กำหนดโทษปรับไม่เกิน 40,000 บาท ทั้งนี้ ขอเชิญชวนประชาชนนำสุนัขและแมว อายุตั้งแต่ 24 เดือนขึ้นไป ไปขอรับบริการฉีดวัคนป้องกันโรคพิษสุนัขบ้าตามที่ องค์กรปกครองส่วนท้องถิ่นในพื้นที่ทุกแห่ง กำหนด โดยไม่เสียค่าใช้จ่ายใดๆ
ปศุสัตว์อำเภอขลุง ให้ความรู้เรื่องโรคพิษสุนัขบ้าในโรงเรียน
วันที่ 14 มีนาคม 2567 เวลา 09.00 น. นายอยุทธ์ รจนากูล ปศุสัตว์อำเภอขลุง พร้อมด้วยเจ้าหน้าที่สำนักงานปศุสัตว์อำเภอขลุงดำเนินให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าในโรงเรียน ณ โรงเรียนวัด วันยาวล่าง ม.2 ต.วันยาว โดยมีวัตถุประสงค์เพื่อเสริมสร้างความรู้ ความเข้าใจและทักษะให้กับนักเรียน ในด้านการเฝ้าระวัง การป้องกันโรคพิษสุนัขบ้า โดยมีนักเรียน และครู เข้ารับการฝึกอบรมจำนวน 19 คน
งานประจำปีรวมของดีเมืองชุมแพ 15-22 มีนาคม 2567
งานประจำปีรวมของดีเมืองชุมแพ ครั้งที่ 21 บริเวณสนามที่ว่าการอำเภอชุมแพ จังหวัดขอนแก่น วันที่ 15-22 มีนาคม 2567
งานเขาหญ้าเฟส 2567 ภูเขาหญ้า จ.ระนอง 15-17 มีนาคม 2567
ไปฟังเพลงเพราะ ในบรรยากาศชิลๆ ที่ ภูเขาหญ้า จ.ระนอง กับงาน " งานเขาหญ้าเฟส 2567 " การท่องเที่ยวแห่งประเทศไทย ร่วมกับหน่วยงานภาครัฐและเอกชนจังหวัดระนอง ส่งมอบสีสันแห่งความสุข และความสนุกสนานให้กับทุกคน 15-17 มีนาคม 2567 ตั้งแต่ 17.00 - 22.00 น. ไปฟังเพลงเพราะกับศิลปินแบบเต็มวง พร้อมชมชิมช็อปสินค้าจากร้านค้าในท้องถิ่น ถ่ายรูปเช็คกับไฟสวยๆ ท่ามกลางบรรยากาศชิลๆ ณ ภูเขาหญ้า อำเภอเมือง จังหวัดระนอง งานนี้ชมฟรี!!! 15 มีนาคม พบกับ Tono & the dust, ครอบครัวเชิญยิ้ม (ถั่วแระเชิญยิ้ม เจี๊ยบเชิญยิ้ม กระรอกเชิญยิ้ม และอรชรเชิญยิ้ม) 16 มีนาคม พบกับ ชาติสุชาติ 17 มีนาคม พบกับ พลพล **สนุกกับวง house bands ทุกวัน** แล้วพบกันที่ภูเขาหญ้าจังหวัดระนอง สอบถามข้อมูลเพิ่มเติมได้ที่ การท่องเที่ยวแห่งประเทศไทยสำนักงานชุมพร-ระนอง โทร. 077 502-775-6
ประเพณีบุญผะเหวดร้อยเอ็ด ประจำปี 2567 วันที่ 15-17 มีนาคม 2567
งาน “มหาทานบารมี ประเพณีบุญผะเหวดร้อยเอ็ด” นับเป็นปีที่ 34 ของการจัดงาน จะจัดขึ้นระหว่างวันที่ 15-17 มีนาคม 2567 ที่ บึงพลาญชัย อำเภอเมือง ร้อยเอ็ด ที่จะมี พิธีแห่พระอุปคุตพระราชทาน, พิธีเจริญพระพุทธมนต์ “สืบชะตา เสริมบารมี, กิจกรรม “โดรนแปรอักษร” กว่า 500 ลำ รวมถึงการแสดงหมอลำพื้นถิ่น “ศิลปินภูไท” โดยศิลปินหมอลำวีระพงษ์ วงศ์ศิลป์, ขบวนแห่ “ตำนานพระเวสสันดรชาดก 13 กัณฑ์, ขบวนนครกัณฑ์ ช้าง 24 เชือก พร้อมด้วยกิจกรรม “อิ่มบุญทานข้าวปุ่นในสวน” บริการข้าวปุ้นฟรี การแสดงแสง สี เสียง เล่าขานตำนานบุญผะเหวด ซึ่งมีพาแลงมหาทานประชาชนรับประทานฟรี และขบวนแห่กัณฑ์จอบกัณฑ์หลอน 101 ต้น ทั้งนี้มีการจัด ซุ้มดอกสะแบงที่มีการตกแต่งอย่างสวยสดสวยงาม จากทั้ง 20 อำเภอ มาให้พี่น้องประชาชนและนักท่องเที่ยว ได้มาถ่ายรูปเช็คอิน และเยี่ยมชมคาวมสวยงามของดอกสะแบงมา เด้อ มากินข้าวปุ้น เอาบุญผะเหวด ฟังเทศน์มหาชาติ นำกันเด้อ ในงานประเพณีบุญผะเหวดร้อยเอ็ด พ.ศ. 2667
งานนมัสการพระแท่นดงรัง ปี 2567 (17-25 มีนาคม 2567)
งานนมัสการพระแท่นดงรัง ปี 2567 ระหว่างวันที่ 17 - 25 มีนาคม 2567 เรียนเชิญชาวไทยเดินทางมากราบนมัสการพระแท่น และ พระพุทธบาทจำลอง ณ วัดพระแท่นดงรังวรวิหาร อ.ท่ามะกา จ.กาญจนบุรี
วัดพระแท่นดงรังวรวิหารสร้างในสมัยใดไม่ปรากฏหลักฐานแน่ชัด แต่สันนิษฐานว่าคงสร้างในสมัยพระเจ้าบรมโกศ (พ.ศ.2375-2300) เมื่อครั้งทรงค้นพบพระแท่นดงรังและทรงโปรดให้ช่างหลวงสร้างพระพุทธบาทจำลองไม้เกะสลักประดับมุก ถวายเป็นพุทธบูชาไว้ ณ วิหารพระแท่น ภายในวัดมีปูชนียสถานและโบราณวัตถุ ประกอบด้วย มณฑปเขาถวายพระเพลิง รอยพระพุทธบาทจำลอง ลานนางฟ้า บันไดแก้ว บันไดนาคเจ็ดเศียร พระพุทธทวารวดีศรีมหาโชค พระสังกัจจายน์ (หลวงพ่อโต) พระอุโบสถจัตุรมุข วิหารพระแท่น วิหารบดยา วิหารพระอานนท์ พระพุทธบาทไม้ประดับมุก มณฑปพระบรมสารีริกธาตุ บ่อบ้วนพระโอษฐ์ วิหารพระพุฒมงคล รวมทั้ง พิพิธภัณฑ์พื้นบ้านซึ่งตั้งอยู่ภายในวิหารพระพุฒมงคล
วัดพระแท่นดงรังวรวิหาร เปิดให้นักท่องเที่ยวและประชาชนเยี่ยมชมและสักการะสิ่งศักดิ์สิทธิ์ทุกวัน สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่หมายเลขโทรศัพท์ 08-9820-0992, 09-8264-7737
ปศุสัตว์จันทบุรี บูรณาการ อบต.รำพัน ลงนาม MOU จัดตั้งสถานพักพิงสัตว์ และสนับสนุนกองทุนขยะสร้างบุญ เพื่อดูแลสุนัขจรจัด
18 มี.ค.67 เวลา 10.00 น. น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับนางสาวดวงเดือน ศรีคงรักษ์ นายกองค์การบริหารส่วนตำบลรำพัน นายธนภัทร ทวยจัด ผู้อำนวยการกองสาธารณสุขและสิ่งแวดล้อม นายชัยยันต์ ศรีคงรักษ์ ผู้ใหญ่บ้าน ม.8 ต.รำพัน และนายวิทยา สุจิรวรกุล ปศุสัตว์อำเภอท่าใหม่ ลงนามบันทึกความร่วมมือ(MOU) จัดตั้งสถานพักพิงสัตว์ชั่วคราว ณ องค์การบริหารส่วนตำบลรำพัน และสนับสนุนการตั้งกองทุนขยะสร้างบุญ ซึ่งเป็นตัวอย่างที่ดีแก่องค์กรปกครองส่วนท้องถิ่นแห่งอื่น เพื่อรับบริจาคขยะรีไซเคิลจากประชาชน นำไปขาย เป็นค่าใช้จ่ายในการบริหารจัดการสถานพักพิงสัตว์ โดยจะเลี้ยงสุนัขประมาณ 30 ตัว ในพื้นที่ 1 ไร่ วัตถุประสงค์เพื่อดูแลสุนัขจรจัดในพื้นที่ สุนัขที่บาดเจ็บ พิการ ชรา รวมทั้งใช้เป็นสถานที่ปรับพฤติกรรมสุนัขที่ดุร้ายหรือก้าวร้าว ลดอันตรายต่อประชาชนและทรัพย์สิน ซึ่งเป็นหนึ่งในมาตรการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าในระดับท้องถิ่น จากนั้น ลงพื้นที่บ้านไร่เก่า ม.8 ต.รำพัน อ.ท่าใหม่ ตรวจติดตามการสร้างสถานพักพิงสัตว์ ซึ่งคาดว่าจะเริ่มนำสุนัขเข้าเลี้ยง ภายในสิ้นเดือนมี.ค.67 โดยความร่วมมือและการมึส่วนร่วมของอบต.รำพัน วัด โรงเรียน ผู้นำหมู่บ้าน ประชาชน และส่วนราชการต่างๆ เจ้าหน้าที่ปศุสัตว์จะแนะนำการเลี้ยงสุนัขให้ถูกต้องตามหลักสวัสดิภาพสัตว์ ตรวจสุขภาพสุนัขที่จะรับเข้าในสถานพักพิงสัตว์ใหม่ กักตรวจโรค ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ผ่าตัดทำหมันทั้งตัวผู้และตัวเมีย ก่อนนำเข้าเลี้ยงรวมกับสุนัขในฝูงเดิมเพื่อควบคุมประชากรสัตว์ ไม่ให้มีมากเกินไป เป็นการลดปัญหาสุนัขจรจัด สร้างความปลอดภัยจากโรคพิษสุนัขบ้าแก่ประชาชน
ปศุสัตว์จันทบุรี บูรณาการ อบต.รำพัน ลงนาม MOU จัดตั้งสถานพักพิงสัตว์ และสนับสนุนกองทุนขยะสร้างบุญ เพื่อดูแลสุนัขจรจัด


18 มี.ค.67 เวลา 10.00 น. น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับนางสาวดวงเดือน ศรีคงรักษ์ นายกองค์การบริหารส่วนตำบลรำพัน นายธนภัทร ทวยจัด ผู้อำนวยการกองสาธารณสุขและสิ่งแวดล้อม นายชัยยันต์ ศรีคงรักษ์ ผู้ใหญ่บ้าน ม.8 ต.รำพัน และนายวิทยา สุจิรวรกุล ปศุสัตว์อำเภอท่าใหม่ ลงนามบันทึกความร่วมมือ(MOU) จัดตั้งสถานพักพิงสัตว์ชั่วคราว ณ องค์การบริหารส่วนตำบลรำพัน และสนับสนุนการตั้งกองทุนขยะสร้างบุญ ซึ่งเป็นตัวอย่างที่ดีแก่องค์กรปกครองส่วนท้องถิ่นแห่งอื่น เพื่อรับบริจาคขยะรีไซเคิลจากประชาชน นำไปขาย เป็นค่าใช้จ่ายในการบริหารจัดการสถานพักพิงสัตว์ โดยจะเลี้ยงสุนัขประมาณ 30 ตัว ในพื้นที่ 1 ไร่ วัตถุประสงค์เพื่อดูแลสุนัขจรจัดในพื้นที่ สุนัขที่บาดเจ็บ พิการ ชรา รวมทั้งใช้เป็นสถานที่ปรับพฤติกรรมสุนัขที่ดุร้ายหรือก้าวร้าว ลดอันตรายต่อประชาชนและทรัพย์สิน ซึ่งเป็นหนึ่งในมาตรการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าในระดับท้องถิ่น จากนั้น ลงพื้นที่บ้านไร่เก่า ม.8 ต.รำพัน อ.ท่าใหม่ ตรวจติดตามการสร้างสถานพักพิงสัตว์ ซึ่งคาดว่าจะเริ่มนำสุนัขเข้าเลี้ยง ภายในสิ้นเดือนมี.ค.67 โดยความร่วมมือและการมึส่วนร่วมของอบต.รำพัน วัด โรงเรียน ผู้นำหมู่บ้าน ประชาชน และส่วนราชการต่างๆ เจ้าหน้าที่ปศุสัตว์จะแนะนำการเลี้ยงสุนัขให้ถูกต้องตามหลักสวัสดิภาพสัตว์ ตรวจสุขภาพสุนัขที่จะรับเข้าในสถานพักพิงสัตว์ใหม่ กักตรวจโรค ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ผ่าตัดทำหมันทั้งตัวผู้และตัวเมีย ก่อนนำเข้าเลี้ยงรวมกับสุนัขในฝูงเดิมเพื่อควบคุมประชากรสัตว์ ไม่ให้มีมากเกินไป เป็นการลดปัญหาสุนัขจรจัด สร้างความปลอดภัยจากโรคพิษสุนัขบ้าแก่ประชาชน
20 มีนาคม โรงพยาบาลตรัง ได้รับบริจาคดวงตารายที่ 6
20 มีนาคม 2567 โรงพยาบาลตรังได้รับบริจาคดวงตา รายที่ 6 ประจำปีงบประมาณ 2567 จากผู้ป่วยเพศชาย อายุ 69 ปี ซึ่งได้สร้างทานบารมีอันยิ่งใหญ่ เพื่อต่อชีวิตให้ผู้อื่นที่รอคอยการบริจาค พร้อมยังบริจาคร่างกายเป็นอาจารย์ใหญ่ไว้กับโรงพยาบาลสงขลานครินทร์ โรงพยาบาลตรัง ขออนุโมทนาบุญกับการบริจาคในครั้งนี้ ขอให้กุศลผลบุญนี้ จงเป็นอานิสงค์ดลบันดาลให้ท่านและครอบครัว คำศรี มีแต่ความสุขความเจริญยิ่งขึ้นไป ขอให้ท่านไปสู่สัมปรายภพชั่วนิรันดร์
งานโลกทะเลชุมพร ครั้งที่ 31 ประจำปี 2567 วันที่ 22-26 มีนาคม 2567
งานโลกทะเลชุมพร ครั้งที่ 31 ประจำปี 2567 ระหว่างวันที่ 22-26 มีนาคม 2567 ณ ชายหาดทุ่งวัวแล่น ตำบลสะพลี อำเภอปะทิว จังหวัดชุมพร พบกับ แสง สี เสียง การแสดงต่างๆ ภายในงาน พร้อมจุดถ่ายรูปสวยๆ ตลอดทั้ง 5 วัน อาทิ เช่น ✅ มหกรรมอาหารทะเลกินฟรีในวันเปิดงาน ✅ การแสดงมินิคอนเสริ์ตจากศิลปิน/นักร้อง/นักแสดง ✅ ชมการแสดงพลุไฟในทะเล / การแสดงควงกระบองไฟ ✅ ชมการแสดงไหลเรือไฟในทะเล ✅ ชมการแสดงเรือประมงชุมพร ✅ ชมการแข่งขันกีฬา ✅ เลือกชิมอาหารทะเลชุมพร สด สะอาด อร่อย กว่า 150 ร้าน ✅ ผลิตภัณฑ์ OTOP ของดีจังหวัดชุมพร กว่า 60 ร้าน
งานของดี งานกาชาด จังหวัดสมุทรสาคร ประจำปี 2567 วันที่ 22-31 มีนาคม 2567
งานของดี งานกาชาด จังหวัดสมุทรสาคร ประจำปี 2567 วันที่ 22-31 มีนาคม 2567 ณ บริเวณศาลากลางจังหวัดสมุทรสาคร เลือกซื้อสลากกาชาดรางวัลใหญ่ นิทรรศการจากหน่วยราชการ ชมการเดินแบบผ้าไทย ใส่ให้สนุก เลือกซื้อสินค้าราคาถูกจากบริษัท ห้างร้านและโรงงาน ดนตรีฟรีคอนเสิร์ตทุกคืน สวนสนุกชุดใหญ่
22 มีนาคม 2567 ปศุสัตว์ระยอง พบ โรคพิษสุนัขบ้าระบาดในเขต อ.บ้านค่าย และ อ.บ้านฉาง
22 มีนาคม 2567 ข่าวแจ้งเตือนโรคระบาดสัตว์ สำนักงานปศุสัตว์ จังหวัดระยอง รายงานพบการระบาดของโรคพิษสุนัขบ้าระบาดในจังหวัดระยองแล้ว 3 พื้นที่ ได้แก่
1. พื้นที่หมู่ 10 ตำบลบางบุตร อำเภอบ้านค่าย
2. ชุมชนห้วยโป่งใน ตำบลห้วยโป่ง อำเภอเมืองระยอง
3. ชุมชนคลองบางไผ่ หมู่ 4 ตำบลสำนักท้อน อำเภอบ้านฉาง
ทั้งนี้ สำนักงานปศุสัตว์จังหวัดระยอง พร้อมด้วย สำนักงานปศุสัตว์อำเภอในพื้นที่เกิดโรค ร่วมกับ เจ้าหน้าที่องค์กรปกครองส่วนท้องถิ่น (อปท.) ที่พบโรค ได้แก่ อบต.บางบุตร ทม.มาบตาพุด และ อบต.สำนักท้อน เจ้าหน้าที่สาธารณสุขอำเภอ เจ้าหน้าที่รพ.สต. ผู้นำท้องที่ เจ้าหน้าที่อสม. และเจ้าหน้าที่อาสาปศุสัตว์ ร่วมกันดำเนินการฉีดวัคซีนป้องกันโรคแก่สุนัขและแมวทุกตัวในพื้นที่เสี่ยงรัศมีรอบจุดเกิดโรค พร้อมสั่งกักโรคสัตว์ที่มีความเสี่ยงสูง เพื่อดูอาการอย่างเข้มงวด สำหรับคนที่มีความเสี่ยงสัมผัสสัตว์ติดเชื้อได้แจ้งให้รีบพบแพทย์แล้ว
ขอเน้นย้ำเจ้าของนำสุนัขและแมวของตนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าเป็นประจำทุกปี เนื่องจากโรคพิษสุนัขบ้าเป็นโรคติดต่อจากสัตว์สู่คน โดยมีสุนัขและแมวเป็นพาหะนำโรคหลัก ทั้งนี้ สัตว์เลี้ยงลูกด้วยนมทุกชนิดสามารถติดเชื้อได้ หากมีอาการระบบประสาทแล้วไม่ว่าคนหรือสัตว์จะเสียชีวิตทุกราย แต่โรคนี้สามารถป้องกันได้โดยการฉีดวัคซีนให้สุนัขและแมวอย่างสม่ำเสมอ
กรณีเริ่มฉีดครั้งแรก ควรได้รับเข็มกระตุ้นในอีก 2-4 สัปดาห์ถัดไป แล้วจึงฉีดประจำปีๆละ 1 ครั้ง (วัคซีนพิษสุนัขบ้าฟรีสามารถสอบถามได้ที่อปท.ในพื้นที่นั้น)
ขอให้ประชาชนหลีกเลี่ยงการสัมผัสสุนัขและแมวที่ไม่ทราบประวัติวัคซีนทุกกรณี เพื่อลดความเสี่ยงการสัมผัสและติดเชื้อพิษสุนัขบ้าในคน
สำหรับอาการโรคพิษสุนัขบ้าในสัตว์ที่ต้องเฝ้าระวัง เช่น อาการพฤติกรรมเปลี่ยน เสียงเห่าเปลี่ยน ดุร้าย น้ำลายไหลยืด กลืนลำบาก เดินโซเซ ไร้จุดหมาย ซึม แยกตัว หากพบสัตว์มีอาการเหล่านี้ ให้รีบแจ้งเจ้าหน้าที่อปท.หรือเจ้าหน้าที่ปศุสัตว์ในพื้นที่โดยเร็ว
22 มีนาคม โรงพยาบาลตรัง ร่วมเคารพศพและมอบเกียรติบัตรให้กับครอบครัวผู้บริจาคดวงตา รายที่ 6/2567
22 มีนาคม 2567 ทีมคณะกรรมการรับบริจาคอวัยวะ โรงพยาบาลตรัง เป็นตัวแทนโรงพยาบาลตรังและศูนย์รับบริจาคดวงตาสภากาชาดไทย ร่วมวางพวงหรีดเคารพศพและ มอบเกียรติบัตรให้กับครอบครัวคำศรี ผู้บริจาคดวงตารายที่ 6 ปีงบประมาณ 2567 ของโรงพยาบาลตรัง ณ วัดตรัยสามัคคี ตำบลนาวง อำเภอห้วยยอด จังหวัดตรัง
เทศกาลดนตรี “สุขใจในป่ายาง ครั้งที่ 8 - 23 มี.ค.2567
เทศกาลดนตรี “สุขใจในป่ายาง ครั้งที่ 8 ตอน: ดิสโก้แลน จัดวันเสาร์ที่ 23 มีนาคม 2567 ณ.กระท่อมพาราฮัท “ดื่มดำใต้แสงจันทร์ แดนซ์สุดมันส์ ใต้โคนยาง “
Sirindhorn NEON Night Run 2024 (23 มีนาคม 2567)
Sirindhorn NEON Night Run 2024 ไนท์รันที่ทุกคนรอคอย‼️ เสาร์ที่ 23 มีนาคม 2567 ในธีมนีออน(Neon) ชิคแอนด์คูล! โกลว์(Glow) สว่างสดใสไปทั้งงาน! สมาคมศิษย์เก่าโรงเรียนสิรินธร ขอเชิญศิษย์เก่า อาจารย์ ผู้ปกครอง นักเรียน และบุคคลทั่วไป ร่วมกิจกรรมเดิน-วิ่ง เพื่อการกุศล รายได้หลังหักค่าใช้จ่ายมอบให้โรงเรียนสิรินธร เพื่อสาธารณะประโยชน์
HUAHIN LOVESTORY CONCERT 23 มีนาคม 2567
HUAHIN LOVESTORY CONCERT เสาร์ที่ 23 มีนาคม 2567 เวลา 16.00น. - 24.00น. madeespace (ตลาดเพิ่มทรัพย์หัวหิน 94) เทศกาลดนตรี คอนเสิร์ตจากศิลปินดัง วัชราวลี : สินเจริญ บราเธอร์ส : Mocca garden. : ปล้ำแรง : DJ Chill Deep Pm : DJ funky mama กิน ดื่ม ฟัง ช้อป สนุก บรรยากาศแสนอบอุ่น และเต็มไปด้วยความสนุก ในค่ำคืนที่แสนวิเศษ
งานย่าโม 23 มีนาคม - 3 เมษายน 2567
คอนเสิร์ตงานย่าโม เวทีกลาง 23 มีนาคม - 3 เมษายน 2567
23 มี.ค.67 มนต์แคน แก่นคูณ
24 มี.ค.67 Potato
25 มี.ค.67 โอ๊ต Pramote
26 มี.ค.67 Urboy TJ
27 มี.ค.67 YoungOhm
28 มี.ค.67 Taitosmith
29 มี.ค.67 มหาหิงค์ + ไทรถแห่
30 มี.ค.67 (ส่วนราชการ)
31 มี.ค.67 (ส่วนราชการ)
1 เม.ย. 67 โจอี้บอย
2 เม.ย. 67 โจอี้ ภูวศิษฐ์ + บาส สิทธิชัย
3 เม.ย. 67 Silly Fools
25 มีนาคม 2567 กรมปศุสัตว์ พบโรคพิษสุนัขบ้าใน 26 จังหวัด
25 มีนาคม 2567 นายสัตวแพทย์สมชวน รัตนมังคลานนท์ อธิบดีกรมปศุสัตว์ เปิดเผยถึงสถานการณ์โรคพิษสุนัขบ้า ประจำวันที่ 22 มีนาคม 2567 ว่ามีการส่งตัวอย่างส่งตรวจสะสมปี 2567 จำนวน 1,505 ตัวอย่าง ผลบวกสะสมจำนวน 110 ตัวอย่าง ชนิดสัตว์ที่เกิดโรค แบ่งเป็นสุนัข 104 โค 4 กระบือ 2 โดยมีพื้นที่ที่พบการเกิดโรค 14 จังหวัด 34 จุด ได้แก่ จังหวัดจันทบุรี สระแก้ว ชลบุรี ฉะเชิงเทรา ระยอง อำนาจเจริญ บุรีรัมย์ สุรินทร์ อุบลราชธานี เลย มหาสารคาม นครพนม กาฬสินธุ์ และสงขลา
ปัจจุบันมีพื้นที่ควบคุมที่พบการเกิดโรค 45 จุด ประกอบด้วย จังหวัดอุบลราชธานี สงขลา กาฬสินธุ์ จันทบุรี ชลบุรี ระยอง อำนาจเจริญ พัทลุง กรุงเทพมหานคร ฉะเชิงเทรา ปราจีนบุรี สระแก้ว บุรีรัมย์ สุรินทร์ เลย นครพนม มหาสารคาม มีพื้นที่เฝ้าระวังการเกิดโรค 65 จุด ประกอบด้วย จังหวัดสงขลา ชลบุรี อุบลราชธานี นครนายก บุรีรัมย์ เลย ระยอง อำนาจเจริญ กาฬสินธุ์ ปราจีนบุรี สระแก้ว สุรินทร์ มหาสารคาม ฉะเชิงเทรา สมุทรปราการ นครราชสีมา ศรีสะเกษ สมุทรสงคราม นครศรีธรรมราช และพบจุดเกิดโรคพิษสุนัขบ้าเพิ่มที่จังหวัดปราจีนบุรี เป็นสุนัขมีเจ้าของ ไม่ทราบประวัติการฉีดวัคซีน 1 ตัว และจังหวัดสงขลา เป็นสุนัขไม่มีเจ้าของ ไม่ทราบประวัติการฉีดวัคซีน 1 ตัว
สำหรับสถานการณ์โรคพิษสุนัขบ้าระหว่างวันที่ 1 ตุลาคม 2566 – 22 มีนาคม 2567 ทั้งหมด 26 จังหวัด 139 จุด คือ ลพบุรี จันทบุรี สระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง สมุทรปราการ นครนายก อำนาจเจริญ ชัยภูมิ บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ ยโสธร นครราชสีมา เลย มหาสารคาม นครพนม กาฬสินธุ์ อุตรดิตถ์ สมุทรสงคราม นครศรีธรรมราช พัทลุง และสงขลา ซึ่งขณะนี้ กรมปศุสัตว์ยังได้เร่งรัดควบคุมโรคทุกจุดเกิดโรค โดยฉีดวัคซีนรอบจุดเกิดโรค (ring vaccination) ร่วมในการเฝ้าระวัง ป้องกัน และควบคุมโรคได้ หากพบสัตว์แสดงอาการสงสัยเป็นโรคพิษสุนัขบ้าสามารถแจ้งเจ้าหน้าที่ปศุสัตว์อำเภอหรือปศุสัตว์จังหวัดได้ทุกพื้นที่ หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนกรมปศุสัตว์ เบอร์โทรศัพท์ 06 3225 6888 ตลอด 24 ชั่วโมง
งาน แห่ผ้าห่มพระธาตุศรีสุราษฎร์ แลธรรมชาติเขาท่าเพชร ครั้งที่ 14 วันที่ 26-27 มีนาคม 2567
องค์การบริหารส่วนจังหวัดสุราษฎร์ธานี หน่วยงานภาครัฐ ภาคเอกชน บริษัทห้างร้านต่างๆ รวมพลังแห่งศรัทธา ขอเชิญพุทธศาสนิกชน ร่วมงาน “ แห่ผ้าห่มพระธาตุศรีสุราษฎร์ แลธรรมชาติเขาท่าเพชร ” ครั้งที่ 14 :
วันอังคารที่ 26 มีนาคม 2567 ร่วมพิธีบวงสรวงศาลหลักเมืองจังหวัดสุราษฎร์ธานี เวลา 07.00 น. พิธีบวงสรวงพระธาตุศรีสุราษฎร์ (เขาท่าเพชร) / เวลา 10.00 น. พิธีสมโภชผ้าห่มพระธาตุศรีสุราษฎร์ ณ ศาลหลักเมืองจังหวัดสุราษฎร์ธานี เวลา 18.00 น.
วันพุธที่ 27 มีนาคม 2567 ร่วมพิธีอัญเชิญผ้าห่มพระธาตุศรีสุราษฎร์และพระบฏขึ้นพระธาตุศรีสุราษฎร์ เขาท่าเพชร ตั้งแต่เวลา 12.00 น. จากศาลหลักเมือง ผ่านเส้นทางตัวเมืองสุราษฎร์ สู่ พระธาตุศรีสุราษฎร์
Muk Street Art & Exhibition #3 วันที่ 29-31 มีนาคม 2567
Muk Street Art & Exhibition #3 ปลุกเมืองที่หลับไหล และเสริมสร้างเศรษฐกิจ "ด้วยงานศิลปะ" จัดขึ้นระหว่างวันที่ 29-31 มีนาคม 2567 การนำเสนองานศิลปะรูปแบบต่างๆ ทั่วทั้งงาน สถานที่จัดงาน Muk Street Art Walking Street เส้นทางขบวนพาเหรด by PrideMuk ถนนที่กิน ที่เที่ยว มุกฯ ถนนที่กิน ที่เที่ยว เวียดนามทาวน์ เตรียมชมงานเจ๋งๆ จากศิลปินสตรีท ได้แก่ Sculpture 8งานประติมากรรม / Art Talk พูดคุยเกี่ยวกับงานศิลปะ และกิจกรรมอีกเพียบ ได้แก่ Work Shop ลงมือทำไปพร้อมกัน / Market Place ตลาดนัดแบกะดิน / Walking Street ถนนคนเดิน / Food / Foodtruck ร้านอาหารท้องถิ่น / Lighting การตกแต่งไฟ / Music ดนตรี / เปิดหมวก / Parade ขบวนพาเหรด by PrideMuk / Mascot MSA 2024 ✨
เทศกาลดนตรีมิตรภาพลาบก้อย กางเต็นท์ ตั้งแคมป์ กลางสายน้ำ 30 มีนาคม 2567
MITTAPARBLARBKOI ขอเชิญมางาน เทศกาลดนตรีมิตรภาพลาบก้อย งานกางเต็นท์ ตั้งแคมป์ ล่องแก่ง เล่นน้ำ ฟังเพลงโฟลค์เบาๆ กลางสายน้ำ เสาร์ที่ 30 มีนาคม 2567 @ งามสายชลแคมป์ จ.นครนายก PRESENT - คณะขวัญใจ - เขียนไขและวานิช - T_047 - เกมส์ สุจิตรา - วสันต์ - จิ๋ว สกุณชัย - KLEE BHO - VIEW FROM THE BUS TOUR - DJ DAOKANONG AKA STARGAZER สอบถามเพิ่มเติม 097-2288599
นั่งเล 3 เทศกาลดนตรีและปาร์ตี้ริมทะเล หาดชะอำ 30 มีนาคม 2567
Chang Music Connection Presents นั่งเล beach party and music festival 3 เทศกาลดนตรีและปาร์ตี้ริมทะเลที่ใหญ่ที่สุด และเผ็ชที่สุดแห่งปี วันที่ 30 มีนาคม 2567 ณ TRIPLE TREE BEACH RESORT (ใกล้ครัวเม็ดทราย) ชะอำ รายชื่อศิลปินปีนี้ THREE MAN DOWN • PALMY • POTATO • NONT TANONT • TATTOO COLOUR • URBOYTJ • TILLY BIRDS • PIXXIE • JOEY PHUWASIT
30 มีนาคม รพ.สมุทรปราการ ขอขอบคุณ คุณสุชาติ ธรรมกิจและครอบครัวผู้บริจาค LINK
โรงพยาบาลสมุทรปราการ ขอขอบพระคุณ คุณสุชาติ ธรรมกิจและครอบครัวผู้บริจาค ได้มอบดวงตา 2 ข้าง, ไตข้างซ้าย, ม้าม และต่อมน้ำเหลือง เก็บอวัยวะโดยสถาบันโรคไตภูมิราชนครินทร์ เพื่อส่งต่อให้ผู้ที่ต้องการอวัยวะได้มีคุณภาพชีวิตที่ดี ต่อไป ขอให้ดวงจิตของผู้บริจาค คืนสู่ภพภูมิที่ดี ครอบครัวพบแต่ความสุขความเจริญค่ะ “บุญที่ยิ่งใหญ่ สู่การให้ไม่มีที่สิ้นสุด”
30 มีนาคม โรงพยาบาลสุรินทร์ รับโล่รางวัล การให้ความร่วมมือในการทำผ่าตัดผู้บริจาคอวัยวะจากผู้เสียชีวิตมากที่สุด เป็นจำนวน 56 ราย
30 มีนาคม 2567 นพ.ชวมัย สืบนุการณ์ ผู้อำนวยการโรงพยาบาลสุรินทร์ มอบหมายให้ พญ.ผการัตน์ แสงกล้า รองผู้อำนวยการฝ่ายการแพทย์ นำคณะทำงานศูนย์รับบริจาคและปลูกถ่ายอวัยวะ โรงพยาบาลสุรินทร์ ร่วมพิธีบำเพ็ญกุศลอุทิศแด่ผู้บริจาคอวัยวะให้สภากาชาดไทย เนื่องในวันศูนย์รับบริจาคอวัยวะสภากาชาดไทย ประจำปี 2567 และรับรางวัลจาก นายเตช บุนนาค เลขาธิการสภากาชาดไทย ซึ่งโรงพยาบาลสุรินทร์ได้รับโล่รางวัล การให้ความร่วมมือในการทำผ่าตัดผู้บริจาคอวัยวะจากผู้เสียชีวิตมากที่สุด เป็นจำนวน 56 ราย ตลอดการดำเนินงานของศูนย์รับบริจาคอวัยวะ 30 ปีที่ผ่านมา ณ ห้องประชุม ชั้นล่าง อาคารแพทยพัฒน์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย กรุงเทพมหานคร
งานวันไหลสงกรานต์ชลบุรี ประจำปี 2567
งานวันไหลสงกรานต์ชลบุรี 2567 ทุกอำเภอ
- 13 เม.ย. ประเพณีสงกรานต์ชลบุรี
- 14 เม.ย. วันไหลพนัสนิคม
- 15 เม.ย.วันไหลเกาะโพธิ์ / วันไหลพานทอง
- 16-17 เม.ย.วันไหลบางแสน
- 18 เม.ย.วันไหลนาเกลือ / วันไหลบางพระ / วันไหลเกาะสีชัง
- 19 เม.ย.วันไหลพัทยา
- 20 เม.ย.วันไหลบางเสร่
- 21 เม.ย.วันไหลบ้านบึง
ปฏิทินกิจกรรม เซ็นทรัลจันทบุรี เดือนเมษายน ต้อนรับเทศกาลสงกรานต์
ต้อนรับเทศกาลสงกรานต์ พบกับกิจกรรมดีๆ ต้อนรับซัมเมอร์แบบฉ่ำตลอดเดือนเมษายนนี้ Highlight Event
วันที่ 4 เม.ย. 67 : วิ่งเพื่อรักที่จันทบุรี RUN FOR LOVE
วันที่ 6 เม.ย. 67 : SUMMER KIDS MARKET
วันที่ 11 - 15 เม.ย. 67 : สงกรานต์ มาร์เก็ต
วันที่ 12 เม.ย. 67 : สงกรานต์มหาบันเทิง
วันที่ 13 -14 เม.ย 67 : CHANTHABURI SONGKRAN WONDER FEST
วันที่ 24 เม.ย - 5 พ.ค 67 : ครัวคุณต๋อย
เดือนเมษายน 2567 กว่า 24.6 ล้านคน
กระทรวงแรงงาน เปิดเผยว่า เดือนเมษายน 2567 ที่ผ่านมา มีผู้ประกันตนอยู่ในระบบประกันสังคม จำนวนทั้งสิ้น 24,602,082 คน จะได้รับสิทธิประโยชน์คุ้มครองทุกมาตรา คือ 33, 39, 40 ดังนี้
- ผู้ประกันตนมาตรา 33 ลูกจ้างที่ทำงานในสถานประกอบการ ที่มีลูกจ้าง ตั้งแต่ 1 คนขึ้นไป มีอายุตั้งแต่ 15 ปีบริบูรณ์ อายุไม่เกิน 60 ปี บริบูรณ์ โดยจะได้รับสิทธิประโยชน์คุ้มครอง 7 กรณี คือ เจ็บป่วย คลอดบุตร ทุพพลภาพ ตาย สงเคราะห์บุตร ชราภาพ ว่างงาน สำหรับเดือนเมษายน 2567 มียอดผู้ประกันตนมาตรา 33 ทั่วประเทศ จำนวน 11,857,864 คน
- ผู้ประกันตนมาตรา 39 ลูกจ้างที่เคยเป็นผู้ประกันตนมาตรา 33 นำส่งเงินสมทบมาแล้วไม่น้อยกว่า 12 เดือน และออกจากงานไม่เกิน 6 เดือน โดยจะได้รับสิทธิประโยชน์ความคุ้มครอง 6 กรณี คือ เจ็บป่วย คลอดบุตร ทุพพลภาพ ตาย สงเคราะห์บุตร ชราภาพ สำหรับเดือนเมษายน 2567 มียอดผู้ประกันตนมาตรา 39 ทั่วประเทศ จำนวน 1,759,628 คน
- ผู้ประกันตนมาตรา 40 บุคคลทั่วไปที่มีอายุไม่ต่ำกว่า 15 ปีบริบูรณ์ และไม่เกิน 65 ปีบริบูรณ์ ประกอบอาชีพอิสระ ทำงานไม่มีนายจ้าง โดยจะได้รับสิทธิประโยชน์คุ้มครอง 3-4-5 กรณี ขึ้นอยู่กับทางเลือก จะได้รับเงินทดแทนการขาดรายได้จากการประสบอันตรายหรือเจ็บป่วย ทุพพลภาพ ชราภาพ สงเคราะห์บุตร ตาย
สำหรับเดือนเมษายน 2567 มียอดผู้ประกันตน
ทางเลือก 1 จำนวน 2,752,149 คน
ทางเลือก 2 จำนวน 7,062,830 คน
ทางเลือก 3 จำนวน 1,169,611 คน
รวมยอดผู้ประกันตนมาตรา 40 ทั่วประเทศทั้งสิ้น จำนวน 10,984,590 คน ซึ่งจากตัวเลขได้แสดงให้เห็นถึงผู้ใช้แรงงานให้ความสำคัญเกี่ยวกับสวัสดิการในระบบความคุ้มครองของสำนักงานประกันสังคม
PHUKET BIKE WEEK 19-20 April 2024
งานภูเก็ตไบค์วีค 2024 PHUKET BIKE WEEK 2024 ฉลองครบรอบ 28 ปีภูเก็ตไบค์วีค 28th Anniversary " Amazing Experience Ride Together " Date 19-20 April 2024 at Loma Park Patong Beach
117 เกจิอาจารย์สังขารเหนือกาลเวลา แจกฟรี ภาพที่ระลึกมหามงคล ของพระเกจิอาจารย์
117 เกจิอาจารย์สังขารเหนือกาลเวลา 11 เม.ย. 67 ททท. ภูมิภาคภาคกลาง ขอเชิญ สายบุญ สายศรัทธา เดินทางตามรอย พระเกจิอาจารย์ ผู้มากด้วยอภิญญา และบารมี ใน 17 จังหวัดภาคกลาง ซึ่งทาง ททท. ได้รวบรวมประวัติ พระคาถา คำสอนต่างๆ เป็น E-book ให้ ท่านได้ใช้ตามรอยพระเกจิ แจกฟรี ภาพที่ระลึกมหามงคล ของพระเกจิอาจารย์ทุกรูป ซึ่งผ่านพิธีเมตตาอธิฐานจิต จาก 10 พระเกจิชื่อดังแห่งยุค ได้จากวัดนั้นๆ ข้อมูลรายละเอียดเพิ่มเติมได้ที่ Page / Facebook หรือโทรสอบถามได้ ที่สำนักงานททท ที่ดูแลจังหวัดนั้นๆ หรือโทร. 1672
Mother Class 2024 โรงพยาบาลกรุงเทพขอนแก่น LINK
ตารางกิจกรรม Mother Class “คุณแม่คุณภาพ” โรงพยาบาลกรุงเทพขอนแก่น ประจำปี 2567 ไม่มีค่าใช้จ่ายในการเข้าร่วมกิจกรรม เวลา 9-12.00 น. ณ ห้องประชุม G-2 ชั้น G โรงพยาบาลกรุงเทพขอนแก่น กำหนดการ ดังนี้
20 เมษายน 2567
3 สิงหาคม 2567
30 พฤศจิกายน 2567
Topic & Workshop การดูแลสุขภาพขณะตั้งครรภ์ การเปลี่ยนด้านร่างกายและอารมณ์ พัฒนาการลูกน้อยในครรภ์ ภาวะแทรกซ้อนขณะตั้งครรภ์ โดย ทีมแพทย์สูตินรีเวช นมแม่สำคัญไฉน ทำไมต้องให้ลูกกินนมแม่อย่างเดียว 6 เดือน, ประโยชน์ของการเลี้ยงลูกด้วยนมแม่ สอนและสาธิตท่าอุ้มให้นม โดย พยาบาลนมแม่ ออกกำลังกายสไตล์คุณแม่ ฝึกออกกำลังกายให้ฟิตพร้อมคลอด เทคนิคนวดผ่อนคลาย ออกกาลังกายให้ลูกแข็งแรงและอารมณ์ดี โดย ทีมนักกายภาพ อาหาร 5 หมู่ สำหรับคุณแม่ อาหาร 5 หมู่ สำหรับคุณแม่ โดย นักโภชนากร
งานประเพณีสงกรานต์พระสมุทรเจดีย์ประจำปี 2567 วันที่ 12 - 17 เมษายน 2567
งานประเพณีสงกรานต์ประจำปี 2567 เทศบาลตำบลพระสมุทรเจดีย์ กำหนดจัดงานประเพณีสงกรานต์ ประจำปี 2567 ตั้งแต่วันที่ 12 - 17 เมษายน 2567 ณ บริเวณองค์พระสมุทรเจดีย์ เพื่อให้ประชาชนในเขตเทศบาลตำบลพระสมุทรเจดีย์ ได้สืบสานประเพณีท้องถิ่นและวัฒนธรรมไทยให้คงอยู่สืบไป โดยขอเชิญร่วมงานแห่หงส์ สรงน้ำองค์พระสมุทรเจดีย์ ในวันที่ 12 เมษายน 2567 เวลา 16.00 น. เป็นต้นไป โดยขบวนแห่หงส์ จะตั้งขบวนบริเวณตลาดสามแยกเจดีย์มุ่งไปสู่องค์พระสมุทรเจดีย์ มีการสักการะองค์พระปางห้ามสมุทรและพระปฏิมาชัยวัฒน์ที่ประดิษฐานในวิหารหลวงและสรงน้ำพระบรมสารีริกธาตุที่ประดิษฐานที่คอระฆังองค์พระสมุทรเจดีย์ ทั้งนี้ ประชาชนสามารถสรงน้ำพระบรมสารีริกธาตุที่ประดิษฐานที่คอระฆังองค์พระสมุทรเจดีย์ ได้ระหว่างวันที่ 13-17 เมษายน 2567 ตั้งแต่เวลา 08.30 - 16:30 น.
ปฏิทินเทศกาลกิจกรรม สงขลา เมษายน-มิถุนายน 2567
1 เมษายน โรงพยาบาลขอนแก่น ได้รับรางวัล “โรงพยาบาลที่มีผลการดำเนินงานการขอบริจาคอวัยวะจากผู้เสียชีวิตสมองตายมากเป็นอันดับ 3 ของประเทศ จำนวน 304 ราย
1 เมษายน 2567 โรงพยาบาลขอนแก่นได้รับรางวัล “โรงพยาบาลที่มีผลการดำเนินงานการขอบริจาคอวัยวะจากผู้เสียชีวิตสมองตายมากเป็นอันดับ 3 ของประเทศ” เป็นจำนวน 304 ราย จากจำนวนผู้บริจาคอวัยวะทั้งหมด 4,191 ราย (ทั้งประเทศ) โดยนายแพทย์นิติเทพ หลายทวีวัฒน์ ประธานคณะทำงานฝ่ายผ่าตัดผู้บริจาคอวัยวะ ศูนย์รับบริจาคและปลูกถ่ายอวัยวะ โรงพยาบาลขอนแก่น เป็นตัวแทนเข้ารับโล่ จากเลขาธิการสภากาชาดไทย (นายเตช บุนนาค) เมื่อวันที่ 30 มีนาคม 2567 ในงาน “วันศูนย์รับบริจาคอวัยวะสภากาชาดไทย” ประจำปี 2567 ซึ่งจัดขึ้นเนื่องในโอกาสครบ 30 ปี ศูนย์รับบริจาคอวัยวะสภากาชาดไทย และเพื่อมอบโล่ให้แก่โรงพยาบาลและหน่วยงานต่างๆ ที่มีส่วนร่วมในการดำเนินงานของศูนย์รับบริจาคอวัยวะสภากาชาดไทย
คิชฌกูฏ ฟาร์มเมอร์ มาร์เก็ต 5-7 เมษายน 2567
ชวนเที่ยวงาน "คิชฌกูฏ ฟาร์มเมอร์ มาร์เก็ต" วันที่ 5 - 7 เมษายน 2567 ณ ตลาดค้าผลพัฒนา (ตลาดกระทิง) โดยงานนี้ เรารวบรวมผักผลไม้อินทรีย์ อาหารท้องถิ่น ผลิตภัณฑ์จากสมุนไพร สินค้าแฮนด์เมดจากผู้คนในชุมชน และไฮไลท์ของงานคือ Workshop สาระความรู้ จากผู้เชี่ยวชาญท้องถิ่น มามอบให้ทุกคนฟรีๆ ไม่มีค่าใช้จ่าย
Workshop ในงาน 3 วัน มีรายละเอียดดังต่อไปนี้;
1. สาธิตการทำ "ข้าวยำดอกลำดวน" จากสมุนไพร ผัก ผลไม้อินทรีย์ กว่า 20 ชนิด โดย ป้าณี จากสวนเปรมกมล ต.คลองเจริญ อ.เขาคิชฌกูฏ ต้นตำรับข้าวยำสมุนไพร ที่เคยปรุงถวายสมเด็จเจ้าฟ้าฯ กรมหลวงราชสาริณีสิริพัชร มหาวัชรราชธิดา ตอนที่ท่านเสด็จเยือนจังหวัดจันทบุรีค่ะ
2. สาธิตการทำ "เมี่ยงคะน้า" จากผักอินทรีย์สวนป้าเบส โดย ป้าเบส ศิวพร เอี่อมจิตกุศล ต.คลองพูล อ.เขาคิชฌกูฏ
3. สาธิตการทำปุ๋ยขี้ไก่แกลบอัดอากาศ โดย ดร. เข็มชาติ เชยชม อจ. ประจำคณะเทคโนโลยีอุตสาหกรรม ม.ราชภัฏรำไพพรรณี เจ้าของสวนเชยชม มังคุดอินทรีย์
4. สอนทำโยเกิร์ต กราโนล่าโฮมเมด จากผักผลไม้สไตล์ไทยไทย เมนูยามเช้าทำได้ง่าย แต่มีคุณประโยชน์ดีต่อร่างกาย โดน คุณนุ่น เพชรรุ่ง พุกกะเวส บ้านสวนดินหอม ต.วังใหม่ อ.นายายอาม
5. สอนต้มน้ำสมุนไพรชารางจืด ขับสารพิษตกค้างในร่างกาย พร้อมสาธิตการสุมยา ด้วยสมุนไพรในครัวเรือน เพื่อบรรเทาโรคทางเดินหายใจในยุค pm 2.5 โดย คุณหมอลำไย ยิ้มโสภา แพทย์แผนไทยประจำ ต.ชากไทย อ.เขาคิชฌกูฏ
อีกทั้งภายในงานฯ มีบริการตรวจวัดความดัน ตรวจวัดระดับไขมัน โดยโรงพยาบาลสิริเวช และพิเศษ เฉพาะงานนี้ มีบริการตรวจหาสารพิษตกค้างในเลือด ฟรี! ครับ
นอกจากนี้ เรามีศิลปินรับเชิญ INK THE VOICE, น้องปัณณ์ปัณณ์ ไมค์ทองคำ, ชมรมคนรักเสียงเพลงคิชฌกูฏ สลับกันมามอบเสียงเพลงภายในงานทุกวันครับ
ในส่วนของร้านค้าร้านอาหาร งานนี้เรารวบรวมผักผลไม้อินทรีย์จากกลุ่ม Young Smart Farmer คิชฌกูฏ และวังแซ้ม, อาหารปลอดภัย จากเกษตรกรในชุมชน , อาหารท้องถิ่นที่หาทานได้ยากจากกลุ่มชอง เช่น เมนูลุกกะทิ ขนมจีนน้ำยากะทิฟักทอง หรือร้านเด็ด อาทิ ทอดมันแหลมสิงห์ ฮ่อยจ๊ออาม่า ห่อหมกทะเล ผัดไทพลอยจันท์ หมูทอดกระวาน เป็นต้น
โซนสินค้าผลิตภัณฑ์ เราคัดสรรร้านค้าทั้งจากในท้องถิ่น และร้านที่น่าสนใจ เช่น สุราสานทราย, ผ้ามัดย้อมจากเปลือกมังคุด, ผ้ามัดย้อม To Dye For จากเชียงใหม่, เซรามิคมือสองญี่ปุ่น, แชมพูสบู่ออร์แกนิค Kaff and Herbal มาร่วมงานด้วย
มหกรรมประกวดการอนุรักษ์พระบูชา พระเครื่อง จ.สุรินทร์ 2567
สมาคมผู้นิยมพระเครื่อง พระบูชาไทย จังหวัดสุรินทร์ ขอเชิญร่วมงาน มหกรรมประกวดการอนุรักษ์พระบูชา พระเครื่องและเหรียญพระคณาจารย์ จ.สุรินทร์ ประจำปี 2567 ในวันอาทิตย์ที่ 7 เมษายน 2567 ณ หอประชุมข้าวหอมมะลิ อาคารอาทิตยาทร คณะเกษตรศาสตร์และเทคโนโลยี มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์ ผู้ว่าราชการจังหวัดสุรินทร์เป็นประธานที่ปรึกษากิตติมศักดิ์
งาน มนต์เสน่ห์ ถิ่นบัวหลวง เมืองรวงข้าว เชื้อชาวมอญ 4-8 เมษายน 2567
ขอเชิญชวนชาวจังหวัดปทุมธานี และจังหวัดใกล้เคียง เที่ยวชมงาน มนต์เสน่ห์ ถิ่นบัวหลวง เมืองรวงข้าว เชื้อชาวมอญ ในโครงการ เพื่อพัฒนาสินค้าและส่งเสริมอาชีพ จังหวัดปทุมธานี พร้อมทั้งเลือกซื้อผลิตภัณฑ์ สินค้าพื้นบ้านของปทุมธานี เพื่อเป็นการกระตุ้นเศรษฐกิจ ยกระดับสินค้าท้องถิ่นให้เป็นที่รู้จักมากยิ่งขึ้น อีกทั้งยังเป็นการอนุรักษ์ภูมิปัญญาของชาวบ้าน ให้อยู่คู่กับจังหวัดปทุมธานีต่อไป จัดขึ้นระหว่างวันที่ 4-8 เมษายน 2567 ณ Alive Park Hall ชั้น G ศูนย์การค้าฟิวเจอร์พาร์ค อำเภอธัญบุรี จังหวัดปทุมธานี ห้ามพลาด !!วันที่ 6 เมษายน พบกับ #ดำดง นุ่น เนตรชนก เบลล์ เต๋า เวลา 15.00 น.ย้อนวันวานเมืองเก่าหยงสตาร์-ท่าข้าม-ทุ่งยาว วันที่ 11-13 เมษายน 2567
กิจกรรม "ย้อนวันวานเมืองเก่าหยงสตาร์-ท่าข้าม-ทุ่งยาว" วันที่ 11-13 เมษายน 2567 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ แหลมหยงสตาร์ ตำบลท่าข้าม อำเภอปะเหลียน จังหวัดตรัง พบกับกิจกรรมภายในงาน ▪️ชิมอาหารท้องถิ่น ▪️ชิลล์ กับ บรรยากาศแหลมหยงสตาร์ ยามพระอาทิตย์ตก และชมสถานที่ท่องเที่ยวเต็มไปด้วยประวัติศาสตร์ ▪️ ช้อป สินค้าพื้นถิ่น ของดีของเด่นเมืองเก่าหยงสตาร์ ▪️ นั่งรถนำเที่ยวชมเส้นทางเมืองเก่า หยงสตาร์-ท่าข้าม-ทุ่งยาว
ปฏิทินสงกรานต์จันทบุรี ทุกอำเภอ อาบน้ำพระจันทร์ สงกรานต์ราตรี วิถีจันท์ Moon Splash Chanthaburi World Water Festival
มหาสงกรานต์ปีนี้ จันทบุรี จัดเต็ม ด้วยกิจกรรม อาบน้ำพระจันทร์ สงกรานต์ราตรี วิถีจันท์ Moon Splash Chanthaburi World Water Festival ในวันที่ 12-13 เมษายน 2567 นี้ร่วมสร้างสรรค์ความชุ่มฉ่ำ กับสงกรานต์กลางคืนแบบจัดเต็ม2คืน **ทั้งนี้กำหนดการเป็นเพียงข้อมูลเบื้องต้นเท่านั้น อาจมีการเปลี่ยนแปลง**
Songkran Festival Uthaithani เย็นฉ่ำวิถีไทย สุขใจอุทัยธานี 13-15 เมษายน 2566
งาน Songkran Festival Uthaithani เย็นฉ่ำวิถีไทย สุขใจอุทัยธานี เชิญชวนทุกท่านมาเที่ยวงานเทศกาลสงกรานต์ จังหวัดอุทัยธานี ร่วมสืบสานศิลปวัฒนธรรมและประเพณีอันดีงามของไทย มีกิจกรรมให้ร่วมสนุกมากมายตลอด 3 วัน ในวันที่ 13-15 เมษายน 2566 นี้ ณ หอนาฬิกา อำเภอเมือง จังหวัดอุทัยธานี [
แผนที่]
พบกับฟรีคอนเสิร์ตและกิจกรรมพิเศษมากมาย
วันที่ 13 เม.ย. คอนเสิร์ตจาก "บุรินทร์ บุญวิสุทธิ์"
วันที่ 14 เม.ย. คอนเสิร์ตจาก "หนิง The Voice"
วันที่ 15 เม.ย. คอนเสิร์ตจาก "Full Band"
มีกิจกรรมสุดพิเศษมากมายในงาน???? สนุกสนานไปกับฟรีคอนเสิร์ต ???? การแสดงดนตรีจากวง Chernobew ???? Amazing Miss Songkran การประกวดธิดาสงกรานต์ ???? Kids Contest การประกวดหนูน้อยสงกรานต์ ???? ก่อเจดีย์ทราย สรงน้ำพระ ???? ตลาดย้อนยุค ???? การแสดงฉ่อยพื้นบ้าน ???? การละเล่นวิถีไทย ???? ชวนน้องนุ่งฮ่อม ลุ้นรับรางวัลพิเศษ
Water War Chiang Mai 2024 (13 เมษายน 2567)
งาน Water War Chiang Mai 2024 งานสงกรานต์ประจำปีของเชียงใหม่ที่ต้องไปให้ได้กับ Water War Chiang Mai 2024 ปีนี้จัดแบบยิ่งใหญ่ และเปียกที่สุดกว่าทุกงานสงกรานต์เชียงใหม่งานไหนๆ อย่างแน่นอน 13 เมษายน 2024 ลานม่วนใจ๋ เซ็นทรัล เชียงใหม่ แอร์พอร์ต
13-14 เม.ย. 67 Chanthaburi Songkran Wonder Fest ฟรีคอนเสิร์ต สงกรานต์ เซ็นทรัล จันทบุรี
สงกรานต์ปีนี้ศูนย์การค้าเซ็นทรัล จันทบุรี เล่นใหญ่จัดเต็มกว่าเดิม! เตรียมพบกับงาน Chanthaburi Songkran Wonder Fest. ฟรีคอนเสิร์ต เอาใจวัยรุ่นเซ็นจันท์นำโดยนักร้อง Hip Hop ชื่อดังและ DJ สาวสวยที่มามอบความสนุกให้กับชาวจันทบุรี แสงสีเสียงและระบบน้ำแบบฉ่ำ
13 เม.ย. 67 : LAZYLOXY-SAMBLACK
14 เม.ย. 67 : CDGUNTEE และแขกรับเชิญสุดพิเศษ
ดาวน์โหลดและลงทะเบียนเข้าร่วมงาน ผ่าน Central Life X ฟรี! บอกเลยว่าสงกรานต์ปีนี้ที่เซ็นจันท์ จัดเต็มกว่าทุกที ไม่มีอ่อมแน่นอน ฟรีคอนเสิร์ต ‼️ วันที่ 13-14 เม.ย. 67 ลานกิจกรรม Outdoor ศูนย์การค้าเซ็นทรัล จันทบุรี
สงกรานต์ ประตูสาร ตำบลท่าพี่เลี้ยง อำเภอเมืองสุพรรณบุรี 13-17 เมษายน 2567
สงกรานต์ ประตูสาร นมัสการพระเจ้าทรงเครื่อง ขอเชิญกราบสักการะขอพร พระพุทธปฏิมาจักรพรรดิ วันที่ 13-17 เมษายน 2567 ณ วัดประตูสาร ตำบลท่าพี่เลี้ยง อำเภอเมืองสุพรรณบุรี จังหวัดสุพรรณบุรี
มหาสงกรานต์ตะปอน ตำนานแห่รอยพระพุทธบาทผ้า ๔๐๐ ปี 14-15 เมษายน 2567
หยุดยาวนี้ หลีกหนีความวุ่นวายจากเมืองใหญ่ คว้าผ้าถุง นุ่งโสร่ง ห่มสไบ ใส่ชุดไทย มาสุข...เพลิน เดินตะปอน กับงาน "มหาสงกรานต์ตะปอน ตำนานแห่รอยพระพุทธบาทผ้า ๔๐๐ ปี"
• "เปิดสำรับจันท์ สำราญสุข มาชิม ลิ้มรส อาหารโบราณ อาหารสุขภาพดีต่อกาย บำรุงหัวใจ จากชุมชนบ้านตะปอน และย้อนวันวานชมการละเล่นพื้นบ้าน" ณ วัดตะปอนน้อย วันที่ ๑๔-๑๕ เมษายน ๒๕๖๗ เวลา ๐๘.๐๐. น. - ๑๕.๐๐ น.
• สนุกกับการแข่งขันชักเย่อเกวียนพระบาท ของดี ๑ ปีมี ๑ ครั้ง และ ๑ เดียวในไทย ชมมหรสพสมโภชกองพระเจดีย์ทราย พร้อมเชิญชวนประกวดก่อกองพระเจดีย์ทราย ๒๕๖๗ กอง" ณ วัดตะปอนใหญ่ วันที่ ๑๗ เมษายน ๒๕๖๗ เวลา ๑๕.๐๐ น. เป็นต้นไป
เชิญข้าเก่าเฒ่าก่อน ชวนหนุ่มตะกอ สาวตนุวี มาตะโลมล้อมตะล่อม ตื่นตระการ ณ บ้านตะปอน อ.ขลุง จ.จันทบุรี
งานประเพณี “แห่ค้างดอกไม้” วันที่ 15 เมษายน 2567 อ.บ้านไร่ จ.อุทัยธานี
เชิญเที่ยวงานสืบสานงานประเพณี “แห่ค้างดอกไม้” วันที่ 15 เมษายน 2567 ณ บ้านผาทั่ง อ.บ้านไร่ จ.อุทัยธานี
ประเพณีแห่ค้างดอกไม้ ถือเป็นประเพณีท้องถิ่นของชาวไทยเชื้อสายลาวในพื้นที่อำเภอบ้านไร่โดยการนำดอกไม้ต่างๆ ที่หาเก็บได้ในท้องถิ่นมาจัดประดับตกแต่งที่ค้างไม้ไผ่ที่เป็นรูปทรงคล้ายเจดีย์ให้มีความสวยงามและแห่เข้าไปที่วัดเพื่อถวายเป็นพุทธบูชา ????????
กิจกรรมภายในงาน •ชมขบวนแห่พุ่มค้างดอกไม้ •ชมการแสดงพื้นบ้าน •ชมการแข่งขันมวยทะเล •อาหารและขนมพื้นถิ่น ชิมฟรี ‼️ #สุขทันทีที่เที่ยวอุทัยธานี #TATUthaithani
ย้อนวันวานเมืองเก่า กันตัง วันที่ 18-20 เมษายน 2567
กิจกรรม "ย้อนวันวานเมืองเก่ากันตัง" วันที่ 18-20 เมษายน 2567 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ บริเวณหน้าศาลเจ้าเก่งจิวโฮยก้วน ต.กันตัง อ.กันตัง จ.ตรัง กิจกรรมภายในงาน ▪️เดินชิมอาหารพื้นบ้านของอร่อย รสชาติดั้งเดิม เอกลักษณ์เฉพาะเมืองกันตัง ▪️เที่ยวชมย่านเมืองเก่ากันตัง ▪️ช้อป สินค้าพื้นเมือง ของดีเมืองเก่ากันตัง ▪️ชมการแสดงศิลปวัฒนธรรม สวยงาม สาธิตอาหารพื้นถิ่นหาทานยาก ▪️ นั่งรถนำเที่ยวชมเส้นทางเมืองเก่า กันตัง
23 เมษายน 67 สถานการณ์โรคพิษสุนัขบ้า (กรมปศุสัตว์รายงาน) LINK
23 เมษายน 2567 นายสัตวแพทย์สมชวน รัตนมังคลานนท์ อธิบดีกรมปศุสัตว์ เปิดเผยถึงสถานการณ์โรคพิษสุนัขบ้า ว่า
- มีการส่งตัวอย่างส่งตรวจสะสมปี 2567 จำนวน 2,143 ตัวอย่าง ผลบวกสะสมจำนวน 135 ตัวอย่าง
- ชนิดสัตว์ที่เกิดโรค แบ่งเป็นสุนัข 129 โค 4 กระบือ 2
- โดยมีพื้นที่ที่พบการเกิดโรค 10 จังหวัด 23 จุด ได้แก่ จังหวัดสระแก้ว ปราจีนบุรี ชลบุรี ระยอง อำนาจเจริญ สุรินทร์ อุบลราชธานี นครพนม กาฬสินธุ์ และสงขลา
- ปัจจุบันมีพื้นที่ควบคุมที่พบการเกิดโรค 24 จุด ประกอบด้วย จังหวัดอุบลราชธานี สงขลา ระยอง ชลบุรี ปราจีนบุรี สระแก้ว สุรินทร์ อำนาจเจริญ กาฬสินธุ์ นครพนม
- มีพื้นที่เฝ้าระวังการเกิดโรค 111 จุด ประกอบด้วย จังหวัดสงขลา อุบลราชธานี ชลบุรี กาฬสินธุ์ ระยอง อำนาจเจริญ บุรีรัมย์ เลย นครนายก จันทบุรี ฉะเชิงเทรา ปราจีนบุรี สระแก้ว สุรินทร์ มหาสารคาม พัทลุง กรุงเทพมหานคร สมุทรปราการ นครราชสีมา ศรีสะเกษ นครพนม สมุทรสงคราม นครศรีธรรมราช
สำหรับสถานการณ์โรคพิษสุนัขบ้าระหว่างวันที่ 1 ตุลาคม 2566 – 23 เมษายน 2567 ทั้งหมด 26 จังหวัด 156 จุด คือ ลพบุรี จันทบุรี สระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง สมุทรปราการ นครนายก อำนาจเจริญ ชัยภูมิ บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ ยโสธร นครราชสีมา เลย มหาสารคาม นครพนม กาฬสินธุ์ อุตรดิตถ์ สมุทรสงคราม นครศรีธรรมราช พัทลุง และสงขลา
กรมปศุสัตว์ยังได้เร่งรัดควบคุมโรคทุกจุดเกิดโรค โดยฉีดวัคซีนรอบจุดเกิดโรค (ring vaccination) ร่วมในการเฝ้าระวัง ป้องกัน และควบคุมโรคได้
หากพบสัตว์แสดงอาการสงสัยเป็นโรคพิษสุนัขบ้าสามารถแจ้งเจ้าหน้าที่ปศุสัตว์อำเภอหรือปศุสัตว์จังหวัดได้ทุกพื้นที่ หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนกรมปศุสัตว์ เบอร์โทรศัพท์ 06 3225 6888 ตลอด 24 ชั่วโมง
สำนักงานปศุสัตว์จังหวัดจันทบุรี ทำกิจกรรมรณรงค์
ปศุสัตว์จันทบุรี ร่วมกับเทศบาลตำบลสองพี่น้อง รณรงค์ป้องกันโรคพิษสุนัขบ้าแก่สุนัข แมว ในช่วงหน้าร้อน
วันที่ 23 เมษายน 2567 เวลา 10.00 น. น.สพ.ชาติชาย ยิ้มเครือ ปศุสัตว์จังหวัดจันทบุรี ร่วมกับ นายปัญญา ชนะสิทธิ์ นายกเทศมนตรีตำบลสองพี่น้อง อาสาสมัครประจำหมู่บ้าน ผู้นำชุมชน น.สพ.มนัสกิจ พลศรี หัวหน้ากลุ่มพัฒนาสุขภาพสัตว์ และเจ้าหน้าที่ในสังกัด รณรงค์ป้องกันโรคพิษสุนัขบ้าแก่สุนัข แมว ในหน้าร้อน ประจำปี 2567 ณ วัดสามผาน ต.สองพี่น้อง อ.ท่าใหม่ ตามโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธาน โดยเทศบาลตำบลสองพี่น้อง สนับสนุนวัคซีน 5,000 โด้ส กิจกรรมประกอบด้วยการมอบกระติกใส่วัคซีนและอุปกรณ์ในการฉีดวัคซีน ให้แก่อาสาสมัครประจำหมู่บ้าน การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การผ่าตัดทำหมันเพื่อควบคุมประชากรสัตว์ ของประชาชน รวม 72 ตัว การเจาะเลือดสัตว์ตรวจระดับภูมิคุ้มกันโรคพิษสุนัขบ้าภายหลังฉีดวัคชีน และการเสริมสร้างความรู้ในการปฏิบัติตนหากถูกสุนัขกัด โดยล้างแผล ใส่ยา กักหมาไว้ดูอาการ 10 วัน แล้วรีบไปหาแพทย์ทันที ในช่วงหน้าร้อนนี้ ขอเชิญชวนประชาชนนำสุนัขและแมว อายุตั้งแต่ 24 เดือนขึ้นไป ไปขอรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าตามที่ องค์กรปกครองส่วนท้องถิ่นในพื้นที่ทุกแห่งนัดหมาย โดยไม่เสียค่าใช้จ่ายใดๆ
23 เมษายน 2567 เวลา 9.00 น. ลงพื้นที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ร่วมกับเจ้าหน้าที่สธ.อบต.โป่งน้ำร้อน และ อสม. ในพื้นที่ ม.4 ต.โป่งน้ำร้อน จำนวนเกษตรกร 425 ราย สุนัข 490 ตัว แมว 291 ตัว
23 เมษายน โรงพยาบาลสุรินทร์ มอบพวงหรืดเคารพศพ ผู้บริจาค รายที่ 16/2567 และร่วมงานณาปนกิจ
23 เมษายน 2567 เวลา 11.00 น. นพ.ชวมัย สืบนุการณ์ ผู้อำนวยการโรงพยาบาลสุรินทร์ พร้อมด้วยนางวัชชรีภรณ์ รัตรสาร รองผู้อำนวยการฝ่ายการพยาบาล กล่าวขอบคุณผู้บริจาคอวัยวะให้กับสภากาชาดไทย พร้อมกับมอบพวงหรีดเคารพศพให้แก่ญาติ นายสมควร ศาลางาม อายุ 38 ปี ทางครอบครัวผู้เสียชีวิตได้แจ้งความประสงค์บริจาคอวัยวะและดวงตาให้กับสภากากาชาดไทย นำไปช่วยเหลือชีวิตผู้ป่วยที่กำลังรอคอยทั่วประเทศ ซึ่งสามามารถบริจาคไต 2 ข้าง และดวงตา 2 ข้าง โดยทีมแพทย์ผ่าตัด ส่งมอบให้ สภากาชาดไทย นำไปทำกาการปลูกถ่ายช่วยให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้นต่อไป
วันที่ 26 เมษายน 2567 เวลา 12.30 น. นพ.ชวมัย สืบนุการณ์ ผู้อำนวยการโรงพยาบาลสุรินทร์ มอบหมายให้นายพงค์พันธ์ สายยศ รองผู้อำนวยการฝ่ายบริหาร, นางวรรณลักษณ์ สืบนุการณ์ ประธานแม่บ้านสาธารณสุข สาขาจังหวัดสุรินทร์ นำคณะเจ้าหน้าที่โรงพยาบาลสุรินทร์ ร่วมงานฌาปนกิจ นายสมควร ศาลางาม อายุ 38 ปี ผู้บริจาคอวัยวะ ให้แก่ศูนย์รับบริจาคอวัยวะพร้อมกล่าวเชิดชูเกียรติและมอบใบประกาศจากสภากาชาดไทย ให้แก่ญาติผู้บริจาคอวัยวะ ณ วัดบ้านโคกไทร ตำบลบ้านจาน อำเภอสังขะ จังหวัดสุรินทร์ ซึ่งนับเป็นรายที่ 16/2567 ของศูนย์ประสานงานรับบริจาคอวัยวะโรงพยาบาลสุรินทร์ที่ได้บริจาค ซึ่งสภากาชาดไทย ได้ส่งต่อไปทำการปลูกถ่าย เพื่อช่วยเหลือผู้ป่วยที่กำลังรอคอยให้มีชีวิตรอด ทั้งนี้ โรงพยาบาลสุรินทร์ขอแสดงความเสียใจกับญาติผู้บริจาคอวัยวะ และขออนุโมทนาบุญกุศลอันยิ่งใหญ่ครั้งนี้ ที่ท่านมีจิตเมตตา เสียสละบริจาคอวัยวะเป็นทาน "ความดีที่ไม่สิ้นสุด คือการอุทิศอวัยวะ เมื่อยามสิ้นสูญ"
งานวันไหลสงกรานต์ สาดยับ วันที่ 24 เมษายน 2567 ตลาดนัดอู่ทองนิยม อำเภออู่ทอง
งานวันไหลสงกรานต์ สาดยับ วันที่ 24 เมษายน 2567 บริเวณตลาดนัดอู่ทองนิยม อำเภออู่ทอง จังหวัดสุพรรณบุรี
มหกรรมอาหาร เดินกินถิ่นนาจอมเทียน 26 - 28 เมษายน 2567
มหกรรมอาหาร เดินกินถิ่นนาจอมเทียน วันที่ 26 - 28 เมษายน 2567 เวลา 16.30 - 23.00 น. ชิมอาหารทะเลสดๆ , รถฟู๊ดทรัค ,บ้านลมริมทะเล ,บรรยายกาศสุดฟินริมทะเล และอาหารท้องถิ่นอีกมากมาย แล้วพบกัน ณ หาดบ้านอำเภอ ภาพยนต์กลางเเปลง และบรรยายกาศสุดฟิน ณ ริมชายหาดบ้านอำเภอ
ย้อนวันวานเมืองเก่า สิเกา วันที่ 26-28 เมษายน 2567
กิจกรรม "ย้อนวันวานเมืองเก่าสิเกา" วันที่ 26-28 เมษายน 2567 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ บริเวณหอนาฬิกาเทศบาลตำบลสิเกา อ.สิเกา จ.ตรัง พบกับกิจกรรมภายในงาน ▪️ช้อป ชิม ผลิตภัณฑ์และอาหารพื้นถิ่นของอำเภอสิเกา กว่า 30 ร้านค้า ▪️ชิลล์กับบรรยากาศ ย้อนวันวานย่านเมืองเก่าสิเกา ▪️ ชมการแสดงศิลปวัฒนธรรม สวยงาม ▪️ นั่งรถนำเที่ยวชมเส้นทางท่องเที่ยวเมืองเก่าสิเกา
Rock on The Beach 2024 เทศกาลดนตรีริมทะเลที่ร็อกที่สุด 27 เมษายน 2024
Rock on The Beach 2024 เทศกาลดนตรีริมทะเลที่ร็อกที่สุด BODYSLAM • BIG ASS • COCKTAIL • KLEAR • PARADOX • POTATO • TAITOSMITH • TATTOO COLOUR • TILLY BIRDS • THREE MAN DOWN ซัมเมอร์นี้ ขอชวนทุกคนเปลี่ยนบรรยากาศมาสัมผัสประสบการณ์ร็อกครั้งแรกริมทะเล ศิลปินร็อกแถวหน้าของเมืองไทย บนเวทีโปรดักชั่น แสง สี เสียง แบบจัดเต็มในบรรยากาศริมทะเล วันเสาร์ที่ 27 เมษายน 2024 หาดแหลมเจริญ ระยอง
งานเทศกาลวันวานอุทัย ภาค 2 วันที่ 27-28 เมษายน 2567 ที่วัดโบสถ์
งานเทศกาลวันวานอุทัย ภาค 2 วันที่ 27-28 เมษายน 2567 ที่วัดโบสถ์
แม่ยอดยาหยีของพี่ ลองไปส่องกันว่าในงานมีอะไรปังๆ เด็ดๆ ให้ร่วมสนุกกันบ้างงงง เดี๋ยวจะสนทนากับเค้าไม่รู้เรื่อง ในงานเรามีหนังกลางแปลงโดยเฟ้นหาหนังหนุกๆมาฉาย รวมของกินโบราณหร่อยมากที่สุดในอุทัยธา??ี มีรำวงโจ๊ะๆ ให้ทุกคนมาแดนซ์กระจาย ยังไม่หมด มีสวนสนุกทั้งชิงช้าสวรรค์ สาวน้อยตกน้ำ บ้านผีสิง รถไฟราง ระบายสี พูดเลยยยย ภาค 2 จัดเต็ม!!
28 เมษายน รพ.สมุทรปราการ ขอขอบพระคุณ คุณศุภสัณห์ จันทร์ทองและครอบครัวผู้บริจาค LINK
โรงพยาบาลสมุทรปราการ ขอขอบพระคุณ คุณศุภสัณห์ จันทร์ทองและครอบครัวผู้บริจาค ได้มอบ ดวงตา 2 ข้าง ไต 2 ข้าง ม้าม ต่อมน้ำ เหลือง ผิวหนัง กระดูก และเส้นเอ็น เก็บอวัยวะ โดยทีมสภากาชาดไทยและโรงพยาบาลศิริราช เพื่อดำเนินการส่งต่อให้ผู้ที่ต้องการอวัยวะได้มี คุณภาพชีวิตที่ดี ต่อไป แพทย์หญิงพรวิมล ลี่ทอง หัวหน้ากลุ่มภารกิจด้านพัฒนาระบบบ สนับสนุนบริการสุขภาพ เป็นตัวแทนโรงพยาบาลมุทรปราการ ได้มอบพวงหรีด ไว้อาลัยผู้บริจาคและขอแสดงความเสียใจแก่ครอบครัวผู้บริจาคอวัยวะ ขอให้ดวงจิต ของผู้บริจาคได้คืนสู่ภพภูมิที่ดี และครอบครัวพบแต่ความสุขความเจริญ
งานเทศกาลวันวานอุทัย 29-30 เมษายน 2566
ปักหมุดเที่ยวงานเทศกาลวันวานอุทัย วันที่ 29-30 เมษายน 2566 ณ วัดอุโปสถาราม (วัดโบสถ์) อ.เมือง จ.อุทัยธานี ชวนทุกคนมาสัมผัสเสน่ห์ความคลาสสิคเมืองอุทัย ได้รับประสบการณ์ย้อนวันวาน ถวิลหาอดีตความดั้งเดิมที่ทรงคุณค่า มีความสุขสนุกสนานตราตรึงใจ เหมือนกลับมาย้อนวัยอีกครั้ง ตั้งแต่ครั้งแรกที่ได้มา เสริมบรรยากาศบนสะพานข้ามเวลาจากฝั่งตลาด (ยุคปัจจุบัน) ย้อนเวลากลับไปเที่ยวงานวัด (ยุคอดีต) พร้อมอัดแน่นความบันเทิงและกิจกรรมไฮไลต์มากมาย
กิจกรรมน่าสนใจในงาน
• ดูหนังกลางแปลงฉายหนังยอดฮิต จากเครื่องฉายแบบเตาถ่าน
• พากย์หนังกลางแปลงด้นสดสุดฮา
• เวทีรำวงย้อนยุคจังหวะโจ๊ะๆ แดนซ์กระจาย
• จำลองบรรยากาศตลาดโบราณอุไทยธานี
• ชิงช้าสวรรค์ ชมวิวแม่น้ำสะแกกรัง
• ยิงปืนจุกน้ำปลา
• สาวน้อยตกน้ำ
• ร่วมเติมแต้มบุญ เสริมสิริมงคล
โปรแกรมฉายหนัง
• วันที่ 29 เมษายน 19.00 น.อีเรียมซิ่ง 21.00 น. นางนาก
• วันที่ 30 เมษายน 19.00 น.ส้มป่อย 21.00 น. พี่มาก พระโขนง
29 เมษายน 2567 พื้นที่พบการเกิดโรค 9 จังหวัด 21 จุด
นายสัตวแพทย์สมชวน รัตนมังคลานนท์ อธิบดีกรมปศุสัตว์ เปิดเผยถึงสถานการณ์โรคพิษสุนัขบ้า ประจำวันที่ 29 เมษายน 2567 ว่ามีการส่งตัวอย่างส่งตรวจสะสมปี 2567 จำนวน 2226 ตัวอย่าง ผลบวกสะสมจำนวน 136 ตัวอย่าง ชนิดสัตว์ที่เกิดโรค แบ่งเป็นสุนัข 130 โค 4 กระบือ 2 โดยมีพื้นที่ที่พบการเกิดโรค 9 จังหวัด 21 จุด ได้แก่ จังหวัดสระแก้ว ปราจีนบุรี ชลบุรี ระยอง อำนาจเจริญ สุรินทร์ อุบลราชธานี นครพนม และสงขลา
ปัจจุบันมีพื้นที่ควบคุมที่พบการเกิดโรค 20 จุด ประกอบด้วย จังหวัดอุบลราชธานี ปราจีนบุรี ระยอง สงขลา ชลบุรี สระแก้ว สุรินทร์ อำนาจเจริญ นครพนม มีพื้นที่เฝ้าระวังการเกิดโรค 116 จุด ประกอบด้วย จังหวัดสงขลา อุบลราชธานี ชลบุรี กาฬสินธุ์ อำนาจเจริญ ระยอง บุรีรัมย์ เลย นครนายก จันทบุรี ฉะเชิงเทรา ปราจีนบุรี สระแก้ว สุรินทร์ มหาสารคาม พัทลุง กรุงเทพมหานคร สมุทรปราการ นครราชสีมา ศรีสะเกษ นครพนม สมุทรสงคราม นครศรีธรรมราช
สำหรับสถานการณ์โรคพิษสุนัขบ้าระหว่างวันที่ 1 ตุลาคม 2566 – 29 เมษายน 2567 ทั้งหมด 26 จังหวัด 157 จุด คือ ลพบุรี จันทบุรี สระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง สมุทรปราการ นครนายก อำนาจเจริญ ชัยภูมิ บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ ยโสธร นครราชสีมา เลย มหาสารคาม นครพนม กาฬสินธุ์ อุตรดิตถ์ สมุทรสงคราม นครศรีธรรมราช พัทลุง และสงขลา ซึ่งขณะนี้ กรมปศุสัตว์ยังได้เร่งรัดควบคุมโรคทุกจุดเกิดโรค โดยฉีดวัคซีนรอบจุดเกิดโรค (ring vaccination) ร่วมในการเฝ้าระวัง ป้องกัน และควบคุมโรคได้ หากพบสัตว์แสดงอาการสงสัยเป็นโรคพิษสุนัขบ้าสามารถแจ้งเจ้าหน้าที่ปศุสัตว์อำเภอหรือปศุสัตว์จังหวัดได้ทุกพื้นที่ หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนกรมปศุสัตว์ เบอร์โทรศัพท์ 06 3225 6888 ตลอด 24 ชั่วโมง
งานประจำปีปิดทองไหว้พระและฟังเทศน์มหาชาติ วัดม่วงเจริญผล 29-30 เมษายน 2567
งานประจำปีปิดทองไหว้พระและฟังเทศน์มหาชาติ วัดม่วงเจริญผล วันที่ 29-30 เมษายน 2567 วัดม่วงเจริญผล ตำบลศรีประจันต์ อำเภอศรีประจันต์ จังหวัดสุพรรณบุรี 29 เม.ย. 67 ฟังเทศน์มหาชาติ พระเวสสันดรชาดก 13 กัณฑ์ & ลิเกคณะ พรเทพ พรทวี 30 เม.ย. 67 รำวงย้อนยุค อ๊อด โฟร์เอส
Chiang Mai Street Jazz Festival 2024 วันที่ 30 เมษายน 2567
Chiang Mai Street Jazz Festival · ฉลองวันดนตรีแจ๊สสากลกับ เชียงใหม่สตรีทแจ๊ส วันที่ 30 เมษายน 2567 นี้ มาร่วมปลดปล่อยจิตวิญญาณกับจังหวะดนตรีแจ๊สและเติมเต็มชีวิตชีวาให้เมืองเชียงใหม่ มาร่วมฉลองการเดินทางขอวดนตรีที่ไม่เหมือนใคร ณ 4 บาร์แจ๊สสุดไอคอนิกทั่วมุมเมือง - The Mellowship Jazz Club, Northgate Jazz Co-op, Moment’s Notice Jazz Club และ Mahoree City of Music. Free Entry วันที่: 30 เมษายน 2567 สถานที่: The Mellowship Jazz Club, Northgate Jazz Co-op, Moment’s Notice Jazz Club, Mahoree City of Music Jazz Master: 15:00 Jazz Bass Essentials ที่ Moment’s Notice
สะแกกรัง ไบค์ปาร์ตี้ 2567
Bangkok Hot Rod 2024
Bangkok Hot Rod 2024 งานประกวดรถสวย ที่ใหญ่ที่สุดในประเทศไทย
18-19 พฤษภาคม 2024 IMPACT Exhibition Center
Hall 11-12 เวลา 12.00 – 22.00 น.
ประเพณีบุญบั้งไฟ ประจำปี 2567 วันที่ 21-22 พฤษภาคม 2567
ประเพณีบุญบั้งไฟ ชุมชนชาวลาวเวียง ประจำปี 2567 ระหว่างวันที่ 21 - 22 พฤษภาคม 2567 ณ บริเวณลานใต้วัดโภคารามและสี่แยกตีนเป็ด ตำบลดอนคา อำเภออู่ทอง จังหวัดสุพรรณบุรี กิจกรรมภายในงาน - 21 พฤษภาคม 2567 เวลา 17.30 น. ชมขบวนแห่บั้งไฟ ณ บริเวณลานใต้วัดโภคาราม - 22 พฤษภาคม 2567 เวลา 08.30 น. ชมการแสดงดนตรีพื้นบ้าน การแสดงของกลุ่มชาติพันธุ์ลาวเวียงบ้านดอนคา ที่เป็นเอกลักษณ์ของชาวลาวเวียงบ้านดอนคา ชมการจุดบั้งไฟ ณ บริเวณสี่แยกตีนเป็ด
โรงพยาบาลวัฒนแพทย์ตรัง กิจกรรม Mother Class
โรงพยาบาลวัฒนแพทย์ตรัง กิจกรรม Mother Class พร้อมแลกเปลี่ยนประสบการณ์ กับคุณแม่ตั้งครรภ์ โดยสูตินรีแพทย์ และกุมารแพทย์ ประจำโรงพยาบาล
- วันที่ 18 พฤษภาคม 2567 เวลา 14.00-16.00 น. ณ ร้าน Pin House Cafe จ.พัทลุง
- วันที่ 3 สิงหาคม 2567 ณ ห้องประชุม ชั้น 6 อาคาร wellness center
ปฏิทินกิจกรรมนครศรีธรรมราช เดือนพฤษภาคม 2567
นิทรรศการ : 10/2 ฝนตกที่นคร
เปิด : ตั้งแต่วันนี้ - วันจันทร์ที่ 6 พฤษภาคม 2567 แดดออก gift & gallery หมู่บ้านเมืองทอง จ.นครศรีธรรมราช
facebook.com
เทศกาล กินปูพระจันทร์สังสรรค์หาดเทพา-ท่าหมาก
เปิด : วันศุกร์ที่ 3 - วันจันทร์ที่ 6 พฤษภาคม 2567 ณ หาดท่าหมาก ตำบลทุ่งปรัง
เทศกาลอาหาร สวนสนุกต่างประเทศ
เปิด : วันศุกร์ที่ 3 - วันอาทิตย์ที่ 12 พฤษภาคม 2567 ตลาดเสาร์-อาทิตย์ ถ.พัฒนาการคูขวาง
facebook.com
Thungsong Kids Run 2
เปิด : วันเสาร์ที่ 4 พฤษภาคม 2567 เหมืองแม่น้ำ SCG อ.ทุ่งสง
facebook.com
หลาดกำแพงเมืองคอน
เปิด : ทุกวันเสาร์ในวันที่ 4, 11, 18, 25 พฤษภาคม 2567 ริมกำแพงเมือง นครศรีธรรมราช
ยังหลาด
ยังหลาด • YoungLast 5 และวันอาทิตย์ที่ 12 พฤษภาคม 2567 สถานที่ : ท่ามอญ
งานประเพณีวันวิสาขบูชา แห่ผ้าหลวงพ่อองค์ใหญ่
วันศุกร์ที่ 17 - วันพฤหัสบดีที่ 23 พฤษภาคม 2567 สนามวัดเขาพระทอง
Thasala Coffee Camp Fest #1
วันเสาร์ที่ 18 - วันอาทิตย์ที่ 19 พฤษภาคม 2567 หาดบ่อนนท์ อ.ท่าศาลา
อาทิตย์ที่ 19 พฤษภาคม 2567 ศูนย์การค้าเซ็นทรัล นครศรีธรรมราช
facebook.com/thasala80160
Run For You ครูชวนวิ่ง ครั้งที่ 2
เปิด : วันอาทิตย์ที่ 26 พฤษภาคม 2567 มทร. วิทยาลัยเขตนครศรีธรรมราช ไสใหญ่
facebook.com
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดศรีสะเกษ พฤษภาคม - มิถุนายน 2567
กิจกรรมเดือนพฤษภาคม 2567
7 - 12 พฤษภาคม 2567 ประเพณีบุญบั้งไฟบ้านเสียวโดยชชาวบ้านเสียว
สถานที่จัดงาน : ณ วัดบ้านเสียว ต.เสียว อ.โพธิ์ศรีสุวรรณ จ.ศรีสะเกษ
8 - 9 พฤษภาคม 2567 งานประเพณีบวงสรวงกู่สมบูรณ์บูชาคุณปู่ยอดแก้ว ประจำปี พ.ศ. 2567
สถานที่จัดงาน:บริเวณกู่สมบูรณ์ ณ วัดป่าเนรัญชราวนาราม ต.เป๊าะ อ.บึงบูรพ์ จ.ศรีสะเกษ
9 - 10 พฤษภาคม 2567 งานรำลึกพระยาไกรภักดีศรีนครลำดวน (ตากะจะ)
สถานที่จัดงาน:ณ วัดดวนใหญ่ อ.วังหิน จ.ศรีสะเกษ
9 - 11 พฤษภาคม 2567 เที่ยวปราสาทปรางค์กู่ ดูวิถีชาวกูย
สถานที่จัดงาน:ณ บ้านกู่ ม.1 ต.กู่ อ.ปรางค์กู่
17 - 18 พฤษภาคม 2567 ประเพณีบุญบั้งไฟ ประจำปี 2567 ตำบลอีเซ
สถานที่จัดงาน : ณ สนามอบต.อีเซ อ.โพธิ์ศรีสุวรรณ จ.ศรีสะเกษ
17-19 พฤษภาคม 2567 ประเพณีบุญบั้งไฟยางชุมน้อย
สถานที่จัดงาน : ณ อำเภอยางชุมน้อย
29 พฤษภาคม -2 มิถุนายน 2567 ตลาดนัดสินค้าเกษตรจากกลุ่มเกษตรโขงชีมูล
สถานที่จัดงาน : ณ ลานจอดรถ ห้างสรรพสินค้า BIG C ศรีสะเกษ
เดือนมิถุนายน 2567
29 พฤษภาคม -2 มิถุนายน 2567 ตลาดนัดสินค้าเกษตรจากกลุ่มเกษตรโขงชีมูล
4 - 10 มิถุนายน 2567 เทศกาลข้าวโพดหวานและของดีศรีรัตนะ
สถานที่จัดงาน : ณ หน้าที่ว่าการอำเภอศรีรัตนะ
8 - 10 มิถุนายน 2567 ประเพณีบุญบั้งไฟตาโกน
สถานที่จัดงาน : ณ บริเวณบ้านตาโกน
12 -18 มิถุนายน 2567 งานเทศกาลทุเรียนภูเขาไฟศรีสะเกษ
สถานที่จัดงาน : สนามหน้าศาลากลางจังหวัดศรีสะเกษ
21 - 30 มิถุนายน 2567 เทศกาลผลไม้และของดีกันทรลักษ์
สถานที่จัดงาน : หน้าที่ว่าการอำเภอกันทรลักษ์
26 -28 มิถุนายน 2567 ฉลองครบรอบ 2 ปี พิพิธภัณฑ์ชายกูย
สถานที่จัดงาน : ณ บริเวณเกาะกลางน้ำบ้านกู่ ต.กู่
26 - 30 มิถุนายน 2567 มหกรรมสินค้า GI ภูมิปัญญาของดี จังหวัดศรีสะเกษ
สถานที่จัดงาน : ณ ลานอะควาเรียม ชั้น 1 ศูนย์การค้าเซ็นทรัลอุบล
29 - 30 มิถุนายน 2567 การแข่งขันหุ่นยนต์ศรีสะเกษโรบอติกส์ 2024
สถานที่จัดงาน : ณ มหาวิทยาลัยราชภัฏศรีสะเกษ
เทศกาลดนตรี เหนือสุด On the beach 3 - 4 พฤษภาคม 2567
เทศกาลดนตรี เหนือสุด On the beach 3 - 4 พฤษภาคม 2567 ณ ริมหาดพลา Serene Phla Resort and Restaurant ใกล้สนามบินอู่ตะเภา จังหวัดระยอง ขนทัพศิลปินสุดฮอต มาพักใจกันริมทะเลแบบจัดหนักจัดเต็ม NONT TANONT • Ink Waruntorn • PROXIE • Sarah.salola • Hers • bowkylion • Slot Machine • D Gerrard • PAUSE ร้านอาหารทะเลสดๆ มากกว่า 60 ร้าน ที่น้องเหนือคัดว่าแล้วว่าเริ่ดแบบตัวแม่ ตัวมารดาสุดๆ วิวมุมถ่ายรูปบนหาดที่สัมผัสได้ทั้ง Sunset และ Sunrise ในที่เดียวกัน
ปศุสัตว์อำเภอเมืองอำนาจเจริญ เร่งฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
วันศุกร์ที่ 3 พฤษภาคม 2567 เวลา 08.30 น. นายสัตวแพทย์อภิชาติ ภะวัง ปศุสัตว์จังหวัดอำนาจเจริญ มอบหมายให้ เจ้าหน้าที่สำนักงานปศุสัตว์อำเภอเมืองอำนาจเจริญ ร่วมกับเทศบาลเมืองอำนาจเจริญ, องค์การบริหารส่วนตำบลดอนเมย และอาสาสมัครสาธารณสุขประจำชุมชน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ ชุมชนเทศบาลเมือง และตำบลดอนเมย อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ ตามโครงการความร่วมมือการรณรงค์ป้องกันโรคพิษสุนัขบ้า ประจำปีงบประมาณ 2567 ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี เพื่อเป็นการเสริมสร้างภูมิคุ้มกันโรคให้สัตว์ในพื้นที่ พร้อมทั้งเฝ้าระวังโรคโดยเครือข่ายเฝ้าระวังโรคในพื้นที่ และประชาสัมพันธ์แจ้งข่าวสารเตือนภัยโรคพิษสุนัขบ้า ทั้งในคนและในสัตว์ หากพบสัตว์ป่วย ตาย หรือสงสัยด้วยโรคพิษสุนัขบ้าให้แจ้งเจ้าหน้าที่ปศุสัตว์ในพื้นที่โดยทันที
ในวันเดียวกัน นายธนุส ธนะวิโรจน์ ปศุสัตว์อำเภอหัวตะพาน ร่วมเป็นวิทยากรโครงการสัตว์ปลอดโรคคนปลอดภัยจากโรคพิษสุนัขบ้า ประจำปี 2567 ณ หอประชุมเฉลิมราชย์ 84 พรรษา องค์การบริหารส่วนตำบลสร้างถ่อน้อย ในการบรรยายให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าและส่งเสริมการเลี้ยงสุนัขและแมวอย่างถูกวิธี ให้แก่อาสาปศุสัตว์ป้องกันโรคพิษสุนัขบ้าและทีม อสม. ประจำหมู่บ้านในเขตตำบลสร้างถ่อน้อย อำเภอหัวตะพาน จังหวัดอำนาจเจริญ
วันพฤหัสบดีที่ 2 พฤษภาคม 2567 เวลา 9.00 น. สำนักงานปศุสัตว์อำเภอเสนางคนิคม ออกปฏิบัติงานรณรงค์ฉีดวัคซีนควบคุมและป้องกันโรคพิษสุนัขบ้าร่วมกับกองสาธารณสุขและสิ่งแวดล้อมเทศบาลตำบลเสนางคนิคม ในพื้นที่หมู่ที่ 2, 14 ตำบลเสนางคนิคม อำเภอเสนางคนิคม จังหวัดอำนาจเจริญ โดยเกษตรกรได้นำสุนัข-แมวของตนเองมารับบริการฉีดวัคซีนเป็นจำนวนมาก ทั้งนี้ยังให้คำแนะนำการดูแลสุขภาพสัตว์ในช่วงหน้าร้อนให้กับเกษตรกร ได้รับความสนใจจากเกษตรกรและผู้นำชุมชนในหมู่บ้านเป็นอย่างดี
วันพุธที่ 1 พฤษภาคม 2567 เวลา 8.30 น. สำนักงานปศุสัตว์อำเภอเมืองอำนาจเจริญ ร่วมกับเทศบาลเมืองอำนาจเจริญ, องค์การบริหารส่วนตำบลดอนเมย และอาสาสมัครสาธารณสุขประจำชุมชน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ ชุมชนเทศบาลเมือง และตำบลดอนเมย อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ
วันที่ 30 เมษายน 2567 เวลา 8.30 น. เจ้าหน้าที่สำนักงานปศุสัตว์อำเภอเมืองอำนาจเจริญ ร่วมกับเทศบาลเมืองอำนาจเจริญและอาสาสมัครสาธารณสุขประจำชุมชน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ ชุมชนเทศบาลเมือง อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ
วันเดียวกัน เจ้าหน้าที่สำนักงานปศุสัตว์อำเภอพนาร่วมกับองค์การบริหารส่วนตำบลไม้กลอน และอาสาปศุสัตว์ประจำหมู่บ้าน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ หมู่ 5,8,12,15 บ้านขาม,บ้านนายูง,บ้านโนนสูง,บ้านโคกกลาง ตำบลไม้กลอน อำเภอพนา จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ
วันจันทร์ที่ 29 เมษายน 2567 เวลา 09.00 น. ปศุสัตว์จังหวัดอำนาจเจริญ มอบหมายให้เจ้าหน้าที่สำนักงานปศุสัตว์อำเภอพนาร่วมกับองค์การบริหารส่วนตำบลไม้กลอน,สาธารณสุขอำเภอพนา และอาสาปศุสัตว์ประจำหมู่บ้าน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ หมู่ 4,6,10,16 บ้านดอนม่วง,บ้านถ่อน,บ้านหัวดอน ตำบลไม้กลอน อำเภอพนา จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ
วันที่ 26 เมษายน 2567 ปศุสัตว์จังหวัดอำนาจเจริญ ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว ในหลายพื้นที่
- ชุมชนเทศบาลเมือง อำเภอเมืองอำนาจเจริญ เป็นสัตว์ที่มีเจ้าของ
- ปศุสัตว์อำเภอพนาร่วมกับเทศบาลตำบลพระเหลา และอาสาปศุสัตว์ประจำหมู่บ้าน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ หมู่ 9 บ้านสว่างนาฝาย ตำบลพระเหลา อำเภอพนา จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ
- ผ่าตัดทำหมันและฉีดวัคซีน ณ หอประชุมเอนกประสงค์ เทศบาลตำบลน้ำปลีก หมู่ที่ 8 อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ โดยมีการสำรวจและขึ้นทะเบียนสุนัขและแมว ผ่าตัดทำหมันสุนัขและแมว 42 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมว 217 ตัว รวม 259 ตัว
วันที่ 25 เมษายน 2567 ปศุสัตว์จังหวัดอำนาจเจริญ ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว ในหลายพื้นที่
- เวลา 8.30 น. ปศุสัตว์อำเภอเมืองอำนาจเจริญ ร่วมกับเทศบาลเมืองอำนาจเจริญและอาสาสมัครสาธารณสุขประจำชุมชน ดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ ชุมชนเทศบาลเมือง อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ
- เวลา 8.30 น. ปศุสัตว์อำเภอชานุมานร่วมกับเทศบาลตำบลชานุมานและอาสาปศุสัตว์ประจำหมู่บ้าน ออกดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสุนัขและแมว พื้นที่ หมู่ 1 เทศบาลตำบลชานุมาน อำเภอชานุมาน จังหวัดอำนาจเจริญ ซึ่งเป็นสัตว์ที่มีเจ้าของ รวมจำนวนสุนัขและแมว 216 ตัว
- เวลา 08.00 น. ปศุสัตว์จังหวัดอำนาจเจริญ พร้อมด้วยกลุ่มพัฒนาสุขภาพสัตว์และสำนักงานปศุสัตว์อำเภอเมืองอำนาจเจริญ ร่วมปฏิบัติงานหน่วยปศุสัตว์เคลื่อนที่ได้ให้บริการผ่าตัดทำหมันสุนัข แมว 41 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมว 40 ตัว รวม 81 ตัว ณ โรงเรียนบ้านนาหมอม้า หมู่ที่ 7 ตำบลนาหมอม้า อำเภอเมืองอำนาจเจริญ จังหวัดอำนาจเจริญ
วันพุธที่ 24 เมษายน 2567 เวลา 09.00 น. นายสัตวแพทย์อภิชาติ ภะวัง ปศุสัตว์จังหวัดอำนาจเจริญ พร้อมด้วยกลุ่มพัฒนาสุขภาพสัตว์ ปศุสัตว์อำเภอเมืองอำนาจเจริญ ,หัวตะพาน,ปทุมราชวงศา,เสนางคนิคม และลืออำนาจ เข้าร่วมประชุมการติดตามและประเมินผลการดำเนินงานเร่งรัดกำจัดโรคพิษสุนัขบ้า พื้นที่ปศุสัตว์เขต 3 ครั้งที่ 2/2567 ผ่านการประชุมออนไลน์ Zoom meeting ณ ห้องประชุมพระพุทธอุดมสุข สำนักงานปศุสัตว์จังหวัดอำนาจเจริญ โดยมีนายสัตวแพทย์ เทอดศักดิ์ ดีเสมอ ผู้อำนวยการส่วนสุขภาพสัตว์ สำนักงานปศุสัตว์เขต 3 เป็นผู้ดำเนินการประชุม เพื่อเป็นการติดตามความก้าวหน้าและประเมินผลการดำเนินงานเร่งรัดกำจัดโรคพิษสุนัขบ้า และร่วมหาแนวทางแก้ไขปัญหาอุปสรรคในการดำเนินงานเร่งรัดกำจัดโรคพิษสุนัขบ้า ในพื้นที่จังหวัดอำนาจเจริญ ทั้งนี้ เพื่อให้การดำเนินงานด้านโรคพิษสุนัขบ้ามีความเหมาะสมตามบริบทการทำงานด้านป้องกันควบคุมโรคพิษสุนัขบ้า ในพื้นที่ของตนเอง เน้นการบูรณาการทุกหน่วยงานที่เกี่ยวข้อง ผ่านการกำกับควบคุมดูแลจากคณะกรรมการอำนวยการด้านป้องกันควบคุมโรคพิษสุนัขบ้าของจังหวัดนั้น
งานประเพณี บุญกลางบ้านและเผยแพร่เครื่องจักสานพนัสนิคม ครั้งที่ 27 วันที่ 3 - 5 พฤษภาคม 2567
เชิญเที่ยวงาน ประเพณี “บุญกลางบ้านและเผยแพร่เครื่องจักสานพนัสนิคม” ครั้งที่ 27 ระหว่างวันที่ 3 - 5 พฤษภาคม 2567 ณ สวนสาธารณะเทศบาลเมืองพนัสนิคม อำเภอพนัสนิคม จังหวัดชลบุรี ปีนี้จัดยิ่งใหญ่ ตื่นตาตื่นใจกับการประกวดขบวนเเห???รถจักสานที่สวยงาม ประกวดการสานผลิตภัณฑ์ของช่างฝีมือ การละเล่นท้องถิ่น พบกับของดีของเด่นอำเภอพนัสนิคม นักร้องชื่อดัง เเละการเเสดงเอ็งกอเลื่องชื่อ
ย้อนวันวาน เมืองเก่าย่านตาขาว 3-5 พฤษภาคม 2567
ย้อนวันวาน เมืองเก่าย่านตาขาว 3-5 พฤษภาคม 2567 โดย อบจ.ตรัง ณ หัวสะพานเก่าย่านตาขาว อ.ย่านตาขาว จ.ตรัง ชมการสาธิตทำข้าวเหนียวแก้ว กรอบเค็ม เมี่ยงข้าวยำ ขนมอี้บั๊วะ (ขนมหัวล้านไหหลำ) ชมช้อปผลิตภัณฑ์ผ้าพิมพ์ดอกย่านตาขาว พืชพื้นถิ่นของอำเภอย่านตาขาว ผลิตภัณฑ์สมุนไพรน้ำย่านาง แล้วแวะเที่ยวชุมชนเก่าหัวสะพานเก่าย่านตาขาว ร่วมสักการะศาลเจ้าทวดศาหลา ไหว้พระขอพรศาลเจ้า 108-109 พร้อมเยี่ยมชมธรรมชาติบ้านเพลินพฤกษา/มัสยิดปากีสถาน และชมภาพวาดบ้านศิลปินดินสอไม้ ศิลปะพื้นบ้านที่ควรอนุรักษ์ไว้ ในงานย้อนวันวานเมืองเก่าย่านตาขาว
ตลาดน้ำอัมพวา ฮาล์ฟมาราธอน ครั้งที่ 8
อัมพวาเฉิดไฉไล ตลาดน้ำอัมพวา ฮาล์ฟมาราธอน ครั้งที่ 8 INFINITY RUN สนุกอนันต์ ไม่รู้จบ วันอาทิตย์ ที่ 5 พฤษภาคม 2567 ณ วัดพระยาญาติ (ปากง่าม) อำเภออัมพวา จังหวัดสมุทรสงคราม
facebook.com9 พฤษภาคม 2567 Happy Healthy Society ฟิวเจอร์พาร์คและสเปลล์
งาน Happy Healthy Society จัดโดย โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ ร่วมกับ ฟิวเจอร์พาร์คและสเปลล์ ผศ.นพ.อาทิตย์ บุญยรางกูร รองผู้อำนวยการฝ่ายบริการสุขภาพ โรงพยาบาลธรรมศาสตร์เฉลิมพระเกียรติ เป็นประธานเปิดงาน Happy Healthy Society เพื่อส่งเสริมสุขภาพผู้สูงอายุให้มีคุณภาพชีวิตที่ดี โดยมี คุณณัฐรินทร์ พยุงวงศ์ รองกรรมการผู้จัดการสายตลาดและพัฒนาธุรกิจ และ คุณอมรเทพ เพชรกำแพงแสน ที่ปรึกษาด้านการตลาด ฟิวเจอร์พาร์คและสเปลล์ ให้เกียรติร่วมในงาน วันที่ 9 พฤษภาคม 2567 ณ ชั้น 2 โซนสเปลล์ ฝั่งเซ็นทรัล ฟิวเจอร์พาร์คและสเปลล์
เทศกาลศิลปะและวัฒนธรรม ครั้งที่ 8 ห้วยยอด จ.ตรัง Art and Cuture Festival วันที่ 9-11 พฤษภาคม 2567
เชิญเที่ยวงาน "เทศกาลศิลปะและวัฒนธรรม ครั้งที่ 8 Art and Cuture Festival" วันที่ 9-11 พฤษภาคม 2567 ณ ศูนย์ศิลปะวิถี ปากแจ่ม อ.ห้วยยอด จ.ตรัง . เทศกาลสร้างสรรค์ผ่านงานแสดงศิลปะ โดยเครือข่ายกลุ่มศิลปินอันดามัน และเผยแพร่วัฒนธรรม ประเพณี วิถีชีวิต การแสดงดนตรีร่วมสมัย การออกร้านจำหน่ายอาหารและสินค้าชุมชน
ย้อนวันวาน "เมืองเก่าห้วยยอด" วันที่ 10-12 พฤษภาคม 2567
กิจกรรมท่องเที่ยวย้อนวันวาน "
เมืองเก่าห้วยยอด" วันที่ 10-12 พฤษภาคม 2567 ณ ลานวัฒนธรรมวัดห้วยยอด อำเภอห้วยยอด จังหวัดตรัง กิจกรรมในงาน
- นิทรรศการภาพ PHOTO STREET ART ชุด ห้วยยอดสวยด้วยภู่กันศิลปิน
- ชมภาพวาดปลายพู่กันของศิลปินระดับประเทศ สุจิน ปานสมุท
- นิทรรศการเรียนรู้ประวัติศาสตร์ชาวห้วยยอดจากผู้เชี่ยวชาญ จากการบันทึก
- ชมการประกวดธิดาเมืองเก่าห้วยยอด
- บูธอาหารพื้นถิ่นชาวจีนและอาหารอร่อยกว่า 70 บูธจากอำเภอห้วยยอด
- การแสดงเวที แสงสีเสียง ของลูกหลานชาวห้วยยอด
- สาธิตและร่วมบันทึกเมนูอาหารและขนมท้องถิ่นคนห้วยยอด
- นำคุณเที่ยวเมืองเก่าห้วยยอดพร้อมถ่ายภาพสวยๆ
- เปิดสามประสานการท่องเที่ยว ท่างิ้ว ปากแจ่ม เขากอบ รับนักท่องเที่ยว
- ชมภาพยนต์ย้อนยุค พบบรรยากาศ ปู่ย่า อาก๋ง อาม่า ไปแลหนัง ที่โรงภาพยนต์เทียนศรีเเละเพชรเกษม
- ฟังเพลงโบราณ เพลงบอก หนึ่งเดียวในตรัง ชื่อขนบหนังลุงvsเพลงบอก
- การรำวงย้อนยุค
- สวนสนุกย้อนยุค
- ถ่ายภาพกับรถโบราณ
- พบกับการโกอินเตอร์ของ วังเทพธาโร อาจารย์ จรูญ แก้วละเอียด
- พบนิทรรศการ กินกาแฟ นั่งเเล"หนังตลุง"แลไม่พอ อาจารย์ใหญ่มาเล่าวิธีการแสดงออกโรงหนังตลุงกับ หนังตลุง อนันต์ สิกขาจารย์
- งานแสดงนิทรรศการศิลปะร่วมสมัย ชีวิตชาวมโนราห์ วัฒนธรรมพื้นถิ่นของชาวตรัง
- ย้อนฟังเพลงกับคีตาชลี เพลงสุนทราภรณ์ กับนักร้องระดับแชมป์ของห้วยยอด
- สนุกกับวงกลองยาวในตำนานตลอดงาน ชุดเปิดตัวครั้งใหม่วงกลองยาวห้วยยอด
- การประกวดภาพวาด ห้วยยอดในมุมมองของท่าน
- 11 พ.ค.2567 พบกับ ศิลปินเพลง สาวเทคนิค วงฌามา
DORAEMON RUN THAILAND 2024
งานวิ่งจากการ์ตูนขวัญใจของคนทุกเพศ ทุกวัย "DORAEMON RUN THAILAND 2024" สนามที่2 ชายหาดพัทยา จ.ชลบุรี (Night Run on the beach) วันเสาร์ที่ 11 พฤษภาคม 2567 ระยะ 5 km
HUA HIN Marathon 2024 (ครั้งที่ 4) 12 พฤษภาคม 2567
HUA HIN Marathon 2024 (ครั้งที่ 4) "...ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี..." รางวัล OVER ALL MARATHON ชาย 1 รางวัล หญิง 1 รางวัล วันรับอุปกรณ์ เสาร์ที่ 11 พฤษภาคม 2567 (09.00-18.00 น.) วันแข่งขัน อาทิตย์ที่ 12 พฤษภาคม 2567 (02.00-11.00 น.) วัดเขาไกรลาศ ต.หนองแก อ.หัวหิน จ.ประจวบคีรีขันธ์ ระยะการแข่งขัน MARATHON 42.195 km. / HALF MARATHON 21 km. / MINI MARATHON 10.5 km. / FUN RUN 5 km. (เดิน-วิ่งเพื่อสุขภาพ) จัดโดย ชมรมพิทักษ์หัวหิน 0845645305 / 0968020908
งานเทศกาลของดีรัตนวาปีและงานสับปะรดฉ่ำหวานรัตนวาปีประจำปี 2567 วันที่ 13 - 22 พฤษภาคม 2567
อำเภอรัตนวาปี ขอเชิญเที่ยว งานเทศกาลของดีรัตนวาปีและงานสับปะรดฉ่ำหวานรัตนวาปีประจำปี 2567 วันที่ 13-22 พฤษภาคม 2567 ณ บริเวณหน้าที่ว่าการอำเภอรัตนวาปี
พิธีสมโภชกระดิ่งสัมฤทธิ์และเครื่องพุทธบูชาและพิธีเสกน้ำสำหรับสรงน้ำพระบรมธาตุ 21-22 พฤษภาคม 2567
กิจกรรมพิธีสมโภชกระดิ่งสัมฤทธิ์และเครื่องพุทธบูชาและพิธีเสกน้ำสำหรับสรงน้ำพระบรมธาตุในวันอังคารที่ 21 - วันพุธที่ 22 พฤษภาคม 2567 ณ วัดพระมหาธาตุ วรมหาวิหาร
21 พฤษภาคม 2567
07.00 - 09.00 น. กิจกรรมธรรมยาตราพุทธมากะเนื่องในเทศกาลวิสาขบูชา 2567 ณ ศาลาประดู่หก / ถนนราชดำเนิน / ลานโพธิ์
09.00 - 17.00 น. กิจกรรมเสวนาธรรม "AI ทำให้ชีวิตก้าวหน้า พละ 5 ทำให้จิตใจมั่นคง" ณ ลานโพธิ์
06.00 - 17.00 น. พิธีเสกน้ำสำหรับสรงพระบรมธาตุ ณ วิหารธรรมศาลา
17.00 - 18.00 น. พิธีสมโภชกระดิ่งสัมฤทธิ์และเครื่องพุทธบูชา ณ วิหารธรรมศาลา
18.00 - 19.00 น. การเสวนา หัวข้อ "การฟื้นเครื่องพุทธบูชาในเมืองนคร" ณ ลานข้างพระวิหารธรรมศาลา / ลานโพธิ์
19.00 - 19.20 น. การแสดงชุด มหัคภัณฑ์วันทาพระธาตุ (ระบำเครื่องพุทธบูชา) ณ ลานข้างพระวิหารธรรมศาลา / ลานโพธิ์
19.20 - 20.00 น. สวดมนต์บนลานทรายถวายเป็นพุทธบุชาและราชสักการะ ณ ลานข้างพระวิหารธรรมศาลา / ลานโพธิ์
20.00 - 20.30 น. พิธีจุดเทียนพุทธบูชาและน้อมถวายราชสักการะ ณ ลานโพธิ์
22 พฤษภาคม 2567
06.00 - 08.00 น. พิธีทำบุญตักบาตรวันวิสาขบูชา 2567 ณ ลานโพธิ์
08.00 - 08.30 น. พิธีสรงน้ำพระบรมธาตุ ณ ลานข้างพระวิหารธรรมศาลา
08.30 - 10.30 น. - พิธีถวายเครื่องพุทธบูชา ณ วิหารธรรมศาลา ณ วิหารธรรมศาลา
- พิธีเชิญเครื่องพุทธบูชา เวียนรอบลานประทักษิณ ณ ลานข้างพระวิหารธรรมศาลา / ลานโพธิ์ / ลานประทักษิณพระบรมธาตุเจดีย์
09.00 - 18.00 น. สรงน้ำพระบรมธาตุ ณ ลานโพธิ์ / พระบรมธาตุเจดีย์
18.00 น. เป็นต้นไป พิธีเวียนเทียนวันวิสาขบูชา 2567 ณ ลานโพธิ์
ร่วมเวียนเทียน "วิสาขปุรณมีบูชา สักการะมหาสถูปเจดีย์เขาคลังนอก" ประจำ 2567 วันที่ 21 - 23 พฤษภาคม 2567
ททท.สำนักงานพิษณุโลก ขอเชิญทุกท่านร่วมเวียนเทียน "วิสาขปุรณมีบูชา สักการะมหาสถูปเจดีย์เขาคลังนอก" และตลาดชุมชนย้อนยุคทวารวดี ประจำ 2567 ระหว่างวันที่ 21 - 23 พฤษภาคม 2567 ณ โบราณสถานเขาคลังนอก อุทยานประวัติศาสตร์ศรีเทพ อำเภอศรีเทพ จังหวัดเพชรบูรณ์ รับฟรี ‼️ โคมเทียน LED รักษ์โลกไม่เป็นมลพิษต่อสิ่งแวดล้อม สามารถลงทะเบียนรับโคมได้ทีู่ทของ ททท.สำนักงานพิษณุโลกบริเวณจัดงาน ตั้งแต่เวลา 16.30 น. เป็นต้นไป มีจำนวนจำกัด ...
กิจกรรมประกอบด้วย ระหว่างวันที่ 21 - 23 พฤษภาคม 2567 การแสดงศิลปวัฒนธรรมท้องถิ่น โดย ชุมชนอำเภอศรีเทพ เวลา 17.00 น. ตลาดชุมชนย้อนยุคทวารวดี อาทิ อาหารพื้นถิ่น สินค้าพื้นเมือง ของฝากของที่ระลึก พิธีเวียนเทียน ๙๙๙ ย่าง "ทักษิณาวรรต รอบสถูปพันปี มหาเจดีย์เขาคลังนอก"
พิธีเปิดงานในวันพุธที่ 22 พฤษภาคม 2567 เวลา 17 30 น. การแสดงแสง สี เสียง "อัศจรรย์สายแสงแห่งศรัทธา" ตลาดชุมชนย้อนยุคทวารวดี อาทิ อาหารพื้นถิ่น สินค้าพื้นเมือง ของฝากของที่ระลึก พิธีเวียนเทียน ๙๙๙ ย่าง "ทักษิณาวรรต รอบสถูปพันปี มหาเจดีย์เขาคลังนอก" ณ โบราณสถานเขาคลังนอก อุทยานประวัติศาสตร์ศรีเทพ อำเภอศรีเทพ จังหวัดเพชรบูรณ์
งานประจำปี วัดบางปิ้ง 22-24 พ.ค. 2567
งานประจำปีวัดบางปิ้ง 22-24 พ.ค.2567 ณ วัดบางปิ้ง ซ.วัดบางปิ้ง ต.บางเมือง อ.เมืองสมุทรปราการ จ.สมุทรปราการ นมัสการพระพุทธเจ้าเปิดโลก ปิดทองพระอรหันต์ 8 ทิศ พระอาจารย์นา ธมฺมธีโร อดีตเจ้าอาวาส ขอพรท้าวเวสสุวรรณ มีของกิน ของใช้ มหรสพ นาฏดนตรี หนังกลางแปลง บัตรการกุศล [
ข้อมูลและภาพเพจที่นี่สมุทรปราการ]
เทศกาลปลาหมึกและอาหารทะเลริมชายหาด Pattaya Squid Fair 2024 "Taste of the Sea" 24-25 พฤษภาคม 2567
Pattaya squid Fair 2024 ธีมงานปีนี้ คือ "Teste of the sea" พบกับอาหารทะเลสด ๆ เด็ดทั้งรสชาติและราคา แถมเลือกสด ๆ ปรุงสุก ๆ ริมทะเล ฟังดนตรีสบาย ๆ ชมการแสดง ร่วมการแข่งขันทำอาหาร แข่งกินอาหารทะเล ไม่พลาดกับถ่ายรูปมุมสวยๆบรรยากาศเก๋ ๆ ริมทะเลจอมเทียน พบกันในวันที่ 24-25 พฤษภาคม 2567 ตั้งแต่เวลา 16:00 น. ณ หาดจอมเทียน หน้าโรงแรม The Now
งานประเพณีบุญบั้งไฟ ประจำปี 2567 ในวันที่ 24-26 พฤษภาคม 2567
เทศบาลเมืองบึงกาฬ ขอเชิญร่วมงานประเพณีบุญบั้งไฟ ประจำปี 2567 ในวันที่ 24-26 พฤษภาคม 2567 ณ ฐานจุดดอนหอ ชมขบวนแห่บั้งไฟเอ้ ณ ถนนข้าวเม่าริมโขง วันที่ 24 พฤษภาคม 2567 และ จุดบั้งไฟบวงสรวงเสี่ยงทาย วันที่ 25-26 พฤษภาคม 2567
Uthaithani Night Run 2024 วันที่ 25 พฤษภาคม 67
มาร่วมเป็นส่วนหนึ่งกับ Night Run ครั้งแรกของอุทัยธานี แล้วมาพบกัน ในวันเสาร์ที่ 25 พฤษภาคม 67 ณ ลานสุพรรณิการ์ ศาลากลางจังหวัดอุทัยธานี รายได้หลังหักค่าใช้จ่าย มอบให้มูลนิธิเพื่อการพัฒนากีฬาจังหวัดอุทัยธานี สำหรับ 700 คนแรกที่จะได้รับคูปอง 100 บาท สำหรับช้อปสินค้าและอาหาร ณ ถนนคนเดินตรอกโรงยา อุทัยธานี ในวันที่ 25 พฤษภาคม 67
งานอัฏฐมีบูชา วันทาพระพุทธเจ้า วัดท่าฬ่อ อ.เมือง จ.พิจิตร 26-30 พฤษภาคม 2567
งานอัฏฐมีบูชา วันทาพระพุทธเจ้า ประจำปี 2567 วันที่ 26-30 พฤษภาคม 2567
ขอเชิญผู้มีจิตศรัทธาร่วมงานอัฐมีบูชา วันทาพระพุทธเจ้า เพื่อเป็นการรำลึกถึงวันถวายพระเพลิงพระพุทธสรีระของสมเด็จพระสัมมาสัมพุทธเจ้า และถวายสักการะแด่พระพุทธรูปปางเข้านิพพาน หรือพระพุทธเจ้าเข้านิพพานของวัดท่าฬ่อ
กำหนดการ
26 พฤษภาคม พ.ศ.2567 เวลา 08.00 น. ชมขบวนแห่องค์พระพุทธเจ้าเข้านิพพาน และพิธีบรวงสรวง เวลา 16.00 น. พิธีเปิดงาน พิธีวางพานพุ่มถวายดอกสาละ และชมการแสดงฟ้อนรำหมู่เป็นพุทธบูชา
27 พฤษภาคม พ.ศ.2567 เวลา 20.00 น. ร่วมฟังเทศน์แหล่ 3 ธรรมมาสน์ จากพระนักเทศน์ธรรมมาสน์ทอง โล่พระราชทาน
28 พฤษภาคม พ.ศ.2567 เวลา 20.00 น. ร่วมสนุกกับรำวงกลองยาว และรำวงย้อนยุค
29 พฤษภาคม พ.ศ.2567 เวลา 20.00 น. ชมการแสดงโขนสด จากวิทยาลัยนาฏศิลปสุโขทัย
30 พฤษภาคม พ.ศ.2567 เวลา 19.00 น. ร่วมขบวนแห่สรีระพระพุทธเจ้า และถวายพระเพลิงองค์สมเด็จพระสัมมาสัมพุทธเจ้า(จำลอง) เวลา 20.00 น. ชมการแสดง แสง สี เสียง อิงพุทธประวัติ
***หมายเหตุ*** มีการสวดพระอภิธรรมเพื่อถวายเป็นกุศลในทุกคืน
27 พฤษภาคม 2567 อบรม ลดเวลา ลดคาร์บ ปราบเบาหวาน (online zoom)
ขอเชิญชวนผู้ที่เป็นเบาหวาน ญาติ ผู้ดูแล หรือผู้ที่สนใจทางด้านเบาหวาน เข้าร่วมอบรม "ลดเวลา ลดคาร์บ ปราบเบาหวาน" วันที่ 27 พฤษภาคม 2567 เวลา 08.30 - 12.00 น. ผ่านช่องทาง zoom applicationเพิ่มเพื่อนทางไลน์กับเรา https://lin.ee/W8PsA3h แล้วพิมพ์ว่า "สนใจเข้าร่วมอบรม" หรือ ท่านจะได้รับ link เพื่อลงทะเบียนและลิ้งเข้าร่วมอบรมผ่านช่องทางดังกล่าวฯ กดเพิ่มเพื่อนแล้ว อย่าลืมทักทายกันนะคะ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ 02 419 9568 ต่อ 101 ไม่มีค่าใช้จ่ายในการอบรม
27 พฤษภาคม โรงพยาบาลสุรินทร์ วางพวงหรีดเคารพศพ ร่วมงานฌาปนกิจ ญาติผู้บริจาคอวัยวะและดวงตา รายที่ 17/2567
27 พฤษภาคม 2567 นพ.ชวมัย สืบนุการณ์ ผู้อำนวยการโรงพยาบาลสุรินทร์ มอบหมายให้ พญ.ผการัตน์ แสงกล้า รองผู้อำนวยการฝ่ายการแพทย์ กล่าวขอบคุณผู้บริจาคอวัยวะให้กับสภากาชาดไทย พร้อมกับมอบพวงหรีดเคารพศพให้แก่ญาติ นางสาววิลัย สมศรี อายุ 51 ปี ทางครอบครัวผู้เสียชีวิตได้แจ้งความประสงค์บริจาคอวัยวะและดวงตาให้กับสภากากาชาดไทย นำไปช่วยเหลือชีวิตผู้ป่วยที่กำลังรอคอยทั่วประเทศ ซึ่งสามามารถบริจาคไต 2 ข้าง และดวงตา 2 ข้าง โดยทีมแพทย์ผ่าตัด ส่งมอบให้ สภากาชาดไทย นำไปทำกาการปลูกถ่ายช่วยให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้นต่อไป
วันที่ 30 พฤษภาคม 2567 เวลา 13.00 น. นพ.ชวมัย สืบนุการณ์ ผู้อำนวยการโรงพยาบาลสุรินทร์ มอบหมายให้นพ.ชายตา สุจินพรัหม รองผู้อำนวยการฝ่ายการแพทย์ นำคณะเจ้าหน้าที่โรงพยาบาลสุรินทร์ ร่วมงานฌาปนกิจ นางสาววิลัย สมศรี อายุ 51 ปี ผู้บริจาคอวัยวะ ให้แก่ศูนย์รับบริจาคอวัยวะพร้อมกล่าวเชิดชูเกียรติและมอบใบประกาศจากสภากาชาดไทย ให้แก่ญาติผู้บริจาคอวัยวะ ณ เมรุวัดแท่นศิลา ต.นานวน อ.สนม จ.สุรินทร์ ซึ่งนับเป็นรายที่ 17/2567 ของศูนย์ประสานงานรับบริจาคอวัยวะโรงพยาบาลสุรินทร์ที่ได้บริจาค ซึ่งสภากาชาดไทย ได้ส่งต่อไปทำการปลูกถ่าย เพื่อช่วยเหลือผู้ป่วยที่กำลังรอคอยให้มีชีวิตรอด
29 พฤษภาคม 2567 Marketing 6.0 Mutation in Healthcare โดย ผศ. ดร.เอกก์ ภทรธนกุล หัวหน้าภาควิชาการตลาด จุฬาลงกรณ์มหาวิทยาลัย
วงการ Healthcare เกี่ยวอะไรหรือต้องทำอะไรกับ การตลาด 6.0 มาร่วมหาคำตอบไปพร้อมกันได้ที่งานนี้ SiCOE Talks 5 "Marketing 6.0 Mutation in Healthcare" เจาะลึก เตรียมพร้อม เปลี่ยนแปลง เมื่อการตลาดกลายพันธ์ุ
ไม่ว่าคุณจะเป็นแพทย์ พยาบาล นักการตลาด นักธุรกิจ หรือคนในแวดวงไหน ก็หลีกหนีเทคโนโลยีใหม่ๆ และเกมส์การตลาดในโลกยุคแห่งการผันผวนอย่างรวดเร็วนี้ไม่พ้น
งานบรยายนี้จะช่วยให้คุณเห็นภาพการเปลี่ยนแปลงที่จะมาถึงในโลกยุค6.0 และเตรียมพร้อมสู่โลกอนาคตที่ไร้เส้นแบ่งนี้ไปด้วยกัน
วิทยากรโดย ผศ. ดร.เอกก์ ภทรธนกุล หัวหน้าภาควิชาการตลาด จุฬาลงกรณ์มหาวิทยาลัย และที่ปรึกษาคณะกรรมการดำเนินงานศิริราชมูลนิธิ
วันพุธที่ 29 พฤษภาคม 2567 เวลา 09.00 - 11.00 น. ณ ห้องประชุมราชปนัดดาสิรินธร อาคารศรีสวรินทิรา ชั้น G โรงพยาบาลศิริราช ฟรี!! ไม่มีค่าใช้จ่าย
ลงทะเบียนคลิก สอบถามรายละเอียดเพิ่มเติม: 02-414-1869, 02-414-1870
วันระกำหวาน ผลไม้ และของดีเมืองตราด 29 พฤษภาคม - 2 มิถุนายน 2567 LINK
ขอเชิญเที่ยวงานวันระกำหวาน ผลไม้ และของดีเมืองตราด กำหนดจัดงาน "วันระกำหวาน ผลไม้ และของดีเมืองตราด" ระหว่างวันที่ 29 พฤษภาคม - 2 มิถุนายน 2567 บริเวณสนามหลวงตราดเฉลิมพระเกียรติ อำเภอเมือง จังหวัดตราด
กิจกรรมภายในงานประกอบด้วย การประกวดผลไม้, การแข่งขันกินผลไม้, การประกวดสุนัขพันธุ์ไทยหลังอาน, การแข่งขันตำส้มตำลีลา, การจัดแสดงไก่ชนสายพันธุ์พื้นเมืองตราด, การแข่งขันแกะหอยนางรม, การประกวดเมนูหอยแมลงภู่, การแสดงสัตว์เลี้ยงแสนรู้, การปั่นจักรยานท่องเที่ยว การออกร้านจำหน่ายสินค้า, การแสดงนิทรรศการจากหน่วยงานภาครัฐ ภาคเอกชน และการแสดงดนตรีบนเวที
.
สอบถามเพิ่มเติม สำนักงานจังหวัดตราด 039-511-282
งานวันเกษตรปราจีนบุรี ครั้งที่ 58 วันที่ 29 พฤษภาคม-9 มิถุนายน 2567
ขอเชิญเที่ยว️งานวันเกษตรปราจีนบุรี ครั้งที่ 58 วันที่ 29 พฤษภาคม-9 มิถุนายน 2567 ณ บริเวณหน้าพระบรมราชานุสาวรีย์รัชกาลที่ 5 หน้าอาคารศาลากลางหลังเก่า อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี กิจกรรมที่สำคัญในงาน ได้แก่ การจัดตลาดนัดจำหน่าย ผลไม้ พันธุ์ไม้ ผลิตภัณฑ์การเกษตร สินค้าโอทอป จากผู้ผลิตโดยตรง การประกวดผลไม้คุณภาพ และพืชผักผลไม้ ใหญ่ ยักษ์ ยาว ภาคกลางคืน มีการแสดงมหรสพต่าง ๆ เป็นประจำตลอดงาน
งานวันเกษตรปราจีนบุรี มีวัตถุประสงค์เพื่อเผยแพร่ชื่อเสียง ด้านผลไม้ พันธุ์ไม้ และผลิตภัณฑ์การเกษตรที่ดีของจังหวัดปราจีนบุรี ให้เป็นที่รู้จักแก่ประชาชน ตลอดจนเพื่อให้ผู้ผลิตได้มีโอกาสจำหน่ายผลผลิต และผลิตภัณฑ์แก่ผู้บริโภคโดยตรง ผู้บริโภคสามารถเลือกซื้อผลไม้ และพันธุ์ไม้ ได้ในราคายุติธรรม โดยไม่ต้องผ่านพ่อค้าคนกลาง
เที่ยว️งานวันเกษตรปราจีนบุรี ครั้งที่ 58 วันที่ 29 พฤษภาคม-9 มิถุนายน 2567
ขอเชิญเที่ยว️งานวันเกษตรปราจีนบุรี ครั้งที่ 58 วันที่ 29 พฤษภาคม-9 มิถุนายน 2567 ณ บริเวณหน้าพระบรมราชานุสาวรีย์รัชกาลที่ 5 หน้าอาคารศาลากลางหลังเก่า อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี กิจกรรมที่สำคัญในงาน ได้แก่ การจัดตลาดนัดจำหน่าย ผลไม้ พันธุ์ไม้ ผลิตภัณฑ์การเกษตร สินค้าโอทอป จากผู้ผลิตโดยตรง การประกวดผลไม้คุณภาพ และพืชผักผลไม้ ใหญ่ ยักษ์ ยาว ภาคกลางคืน มีการแสดงมหรสพต่าง ๆ เป็นประจำตลอดงาน
งานวันเกษตรปราจีนบุรี มีวัตถุประสงค์เพื่อเผยแพร่ชื่อเสียง ด้านผลไม้ พันธุ์ไม้ และผลิตภัณฑ์การเกษตรที่ดีของจังหวัดปราจีนบุรี ให้เป็นที่รู้จักแก่ประชาชน ตลอดจนเพื่อให้ผู้ผลิตได้มีโอกาสจำหน่ายผลผลิต และผลิตภัณฑ์แก่ผู้บริโภคโดยตรง ผู้บริโภคสามารถเลือกซื้อผลไม้ และพันธุ์ไม้ ได้ในราคายุติธรรม โดยไม่ต้องผ่านพ่อค้าคนกลาง
30 พฤษภาคม ทีมแพทย์ รพ.ราชบุรี ร่วมกับ ทีมคณะแพทยศาสตร์ รพ.รามาธิบดี ผ่าตัดปลูกถ่ายไต
30 พฤษภาคม 2567 ทีมคณะแพทย์ รพ.ราชบุรี ร่วมกับ ทีมคณะแพทยศาสตร์ รพ.รามาธิบดี ผ่าตัดปลูกถ่ายไต จากผู้บริจาคที่มีชีวิต Living Donor เป็นรายที่ 4 ของเขตสุขภาพที่ 5 ผู้ป่วยเพศชาย อายุ 20 ปี สาเหตุไตวายเรื้อรังจากความดันโลหิตสูงต้องรับการฟอกเลือดด้วยเครื่องไตเทียมอาทิตย์ละ 3 ครั้ง/สัปดาห์ และผู้บริจาคเพศชายอายุ 47 ปี มีความสัมพันธ์เป็นบิดา-บุตร การผ่าตัดครั้งนี้ ทั้งผู้บริจาคไตและผู้รับไต ไม่มีภาวะแทรกซ้อนระหว่างการผ่าตัด และกำลังพักฟื้นร่างกายโดยมีทีมแพทย์และทีมพยาบาล รพ.ราชบุรี ให้การดูแลอย่างใกล้ชิดตลอด 24 ช.ม.
รพ.ราชบุรี ขอขอบคุณ • ทีมผ่าตัด รพ.รามาธิบดี รศ.นพ.วิสูตร คงเจริญสมบัติ ,นพ.กรกช เกษประเสริฐ, นพ.กัญจน์ ศิริโสภณา ,นายชรินทร์ ก่านหงส์ และ นายบุญฤทธิ์ จิตภูธโรจน์ • ทีมผ่าตัด รพ.ราชบุรี ทีมศัลยกรรมระบบทางเดินปัสสาวะ นพ.บุญรัตน์ อ้นมี, พญ.พรเพ็ญ ประสานชัยมนตรี , พญ.สรรพพร บุญวงศ์ • ศัลยแพทย์หลอดเลือด พญ.สุดาวดี เบญจประยูรศักดิ์ • วิสัญญีแพทย์ พญ.ช่อทิพย์ กาญจนจงกล • นพ.กิตติ สุวรรณประทีปและนพ.สมบูรณ์ อภิชัยยิ่งยอด ประธานและรองประธาน Service Plan สาขารับบริจาคและปลูกถ่ายอวัยวะ จ.ราชบุรี ตามลำดับ • ทีมพยาบาล นำโดย พว.สกาวเดือน ขำเจริญ รองผู้อำนวยการฝ่ายการพยาบาล และผู้ที่มีส่วนเกี่ยวข้องทุกท่านที่ช่วยให้ภาระกิจ ครั้งนี้สำเร็จลุล่วงไปได้ด้วยดี
เทศกาลโขนกรุงศรีปีที่ ๕ วันที่ 30 พฤษภาคม - 3 มิถุนายน 2567
เทศกาลโขนกรุงศรีปีที่ ๕ ปรากฏการณ์แห่งโขนในแผ่นดินต้นกำเนิด ตั้งแต่ 30 พฤษภาคม - 3 มิถุนายน 2567 ณ ลานหลังวัดมหาธาตุ อุทยานประวัติศาสตร์พระนครศรีอยุธยา ชมฟรีทุกการแสดง จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดพระนครศรีอยุธยา ถ่ายทอดสดทุกวันผ่านทางหน้าเพจ Ayutthaya Tourism and Sports
31 พฤษภาคม โรงพยาบาลตรัง ร่วมเคารพศพและมอบเกียรติบัตรให้กับครอบครัวผู้บริจาคดวงตา รายที่ 8/2567
31 พฤษภาคม 2567 แพทย์หญิงกรองแก้ว ทองเรืองสุกใส รองผู้อำนวยการฝ่ายการแพทย์ คนที่ 2 พร้อมด้วยทีมคณะกรรมการรับบริจาคอวัยวะ โรงพยาบาลตรัง เป็นตัวแทนโรงพยาบาลตรังและศูนย์รับบริจาคดวงตาสภากาชาดไทย ร่วมวางพวงหรีดเคารพศพและ มอบเกียรติบัตรให้กับครอบครัวบุญมั่น ผู้บริจาคดวงตารายที่ 8 ปีงบประมาณ 2567 ของโรงพยาบาลตรัง ณ วัดควนวิเศษ อำเภอเมือง จังหวัดตรัง
ททท.จัดโปรแกรม Rayong Workation วันนี้ –30 มิถุนายน 2567
โครงการ Rayong Workation มอบส่วนลดพิเศษเมื่อใช้บริการสถานประกอบการหรือเข้าพักโรงแรมที่ร่วมโครงการตั้งแต่ 2 คืนขึ้นไปได้รับส่วนลดทันที่ 300 บาท เงื่อนไขการใช้สิทธิ์สำหรับนักท่องเที่ยว
1. นักท่องเที่ยวที่ได้รับสิทธิ์จะต้องมีที่อยู่ตามบัตรประชาชน “นอกเขตจังหวัดระยอง”
2. สามารถสแกน QR CODE ใช้ “สิทธิ์” จากสถานประกอบการที่เข้าร่วมโครงการได้โดยตรงตั้งแต่ วันนี้ – 30 มิถุนายน 2567 หรือจนกว่าสิทธิ์จะหมด
3. QR CODE นี้ใช้เพื่อเป็นการลงทะเบียนรับส่วนลดเมื่อซื้อแพคเกจหรือเข้าพักในสถานประกอบการที่ร่วมโครงการเท่านั้น
4. ส่วนลดดังกล่าวไม่สามารถแลกเปลี่ยน หรือ ทอนเป็นเงินสดได้
5. ขอสงวนสิทธิ์ 1 booking / 1 สิทธิ์
6. ขอสงวนสิทธิ์การเปลี่ยนแปลงเงื่อนไขโดยไม่ต้องแจ้งให้ทราบล่วงหน้า
✅ สามารถใช้สิทธิ์ได้ตั้งแต่ วันนี้ - 30 มิถุนายน หรือ จนกว่าสิทธิ์จะหมด ใช้สิทธิ์ที่สถานประกอบการได้โดยตรง ตรวจสอบสถานประกอบการที่ร่วมโครงการและโปรโมชั่นได้
เพจ ททท.ระยอง ติดต่อ ททท.สำนักงานระยอง : 038-655-420
กิจกรรมผ่าตัดทำหมัน สุนัขและแมว ฟรี ปี 2567
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง และสำนักงานปศุสัตว์จังหวัดระยอง จัดกิจกรรมบริการผ่าตัดทำหมัน สุนัขและแมว ฟรี โดยไม่เสียค่าใช้จ่าย ในพื้นที่เทศบาลระยอง ดังนี้
- ครั้งที่ 1 วันที่ 14 พฤษภาคม 2567 เวลา 13.00 - 16.00 น. ณ ลานจอดรถหลังตลาดสตาร์ เริ่มลงทะเบียน เวลา 13.00 - 15.00 น.
- ครั้งที่ 2 วันที่ 21 พฤษภาคม 2567 เวลา 8.30 - 12.00 น. ณ ที่ทำการชุมชนพูนไฉ่ เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 3 วันที่ 11 มิถุนายน 2567 เวลา 8.30 - 12.00 น. ณ ศาลาริมน้ำ - ท่าเกตุ เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
- ครั้งที่ 4 วันที่ 24 มิถุนายน 2567 เวลา 8.30 - 12.00 น. ณ วัดตรีรัตนาราม เริ่มลงทะเบียน เวลา 08.30 - 10.00 น.
เงื่อนไขควรทราบ
- จำกัดบ้านละ 1 ตัว เฉพาะผู้่อยู๋ในเขต ทน.ระยอง เท่านั้น
- สุนัขและแมวที่เข้าผ่าตัดจะต้องมีสุขภาพดี ไม่อยู่ในช่วงตั้งท้องหรือให้นมลูก
- ต้องงดน้ำและอาหาร อย่างน้อย 8 ชม. ก่อนผ่าตัด
- สำหรับสุนัขและแมวขนาดเล็กหรือพันธุ์หน้าสั้น แนะนำให้ทำหมันที่สถานพยาบาลสัตว์ เนื่องจากมีความเสี่ยงในเรื่องการวางยาสลบ
นครไบค์วีค ครั้งที่ 19 วันที่ 21-22 มิถุนายน 2567
นครไบค์วีค ครั้งที่ 19 วันที่ 21-22 มิถุนายน 2567 ณ สวนน้ำเก่า ถนนสายนครศรี-ปากพนัง ใกล้โฮมโปรนครศรีฯ ชมคอนฯศิลปินร๊อคเพียบ 21 มิย Labanoon 22 มิย หินเหล็กไฟ 23 มิย อี๊ด วงฟลาย
TNR Harley-Davidson Sirikit Dam One Day Trip
กิจกรรมรวมตัวออกทริป เขื่อนสิริกิติ์ จ.อุตรดิตถ์ รับจำนวนจำกัด ร่วมงานฟรี
ตารางงานออกหน่วย ประจำเดือนสิงหาคม 2567 LINK
ตรวจคัดกรองมะเร็งเต้านมโดยเครื่องเอกเรย์เต้านมเคลื่อนที่ (Mammogram) ประสิทธิภาพสูง ๔ หน่วย ๔ ภาค ทั่วประเทศ
จ.ยะลา
ตรวจฟรีไม่เสียค่าใช้จ่าย ‼️ เริ่มลงทะเบียนตั้งแต่เวลา 08.00 น. เป็นต้นไป นำบัตรประชาชนตัวจริงมาด้วย
- 5-9, 13-16 ส.ค. 67 ณ สำนักงานสาธารณสุขจังหวัดยะลา อ.เมืองยะลา
- 19-21 ส.ค. 67 ณ โรงพยาบาลเบตง อ.เบตง
- 22-23 ส.ค. 67 ณ ที่ว่าการอำเภอรามัน อ.รามัน
จ.อุตรดิตถ์
เริ่มลงทะเบียนตั้งแต่เวลา 08.00 น. เป็นต้นไป นำบัตรประชาชนตัวจริงมาด้วย
- วันที่ 5 สิงหาคม • โรงพยาบาลพิชัย อ.พิชัย
- วันที่ 6 สิงหาคม • หอประชุมที่ว่าการอำเภอตรอน อ.ตรอน
- วันที่ 7 สิงหาคม • หอประชุมที่ว่าการอำเภอทองแสงขัน อ.ทองแสนขัน
- วันที่ 8-9 สิงหาคม • ลานก็ฬากลางจังหวัดอุตรดิตถ์(สนามหมอนไม้) อ.เมือง
- วันที่ 13 สิงหาคม • หอประชุมโรงเรียนบ้านโคกวิทยา อ.บ้านโคก
- วันที่ 14 สิงหาคม • โรงยิมเทศบาลตำบลฟากท่า อ.ฟากท่า
- วันที่ 15 สิงหาคม • หอประชุมที่ว่าการอำเภอน้ำปาด อ.น้ำปาด
- วันที่ 16 สิงหาคม • หอประชุมที่ว่าการอำเภอท่าปลา อ.ท่าปลา
- วันที่ 19-20 สิงหาคม • หอประชุมที่ว่าการลับแลเบ้านน้ำใส) อ.ลับแล
จ.พระนครศรีอยุธยา
เริ่มลงทะเบียนตั้งแต่เวลา 08.00 น. เป็นต้นไป นำบัตรประชาชนตัวจริงมาด้วย
- 19 สค. 2567 ณ วัดพนัญเชิงวรวิหาร อ.พระนครศรีอยุธยา
- 20 ส.ค. 2567 ณ วัดท่าซุง อ.บางไทร
- 21 ส.ค.2567 ณ เทศบาลอโยธยา อ.พระนครศรีอยุธยา
- 22-23 ส.ค.2567 ณ ที่ว่าการอำเภออุทัย อ.อุทัย
- 26 ส.ค. 2567 ณ วัดตะโก อ.ภาชี
- 27 ส.ค. 2567 ณ วัดเจ้าปลุก อ.มหาราช
- 28 ส.ค. 2567 เทศบาลตำบลลำตาเสา อ.วังน้อย
- 29 ส.ค. 2567 วัดสามกอ อ.เสนา
จ.สุพรรณบุรี
- 31 ก.ค., 1-2 สค. 2567 ณ วิทยาลัยการอาชีพ อ.อู่ทอง
- 5-9 ส.ค. 2567 ณ วัดหนองวัลย์เปรียง อ.สองพี่น้อง
- 13-14 ส.ค.2567 ณ วัดบ่อกรุ อ.เดิมบางนางบวช
- 15-16 ส.ค.2567 ณ ที่ว่าการอำเภอเดิมบางนางบวช อ.เดิมบางนางบวช
โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา อบรมครรภ์คุณภาพ Mothers Class
วันเสาร์ที่ 8 มิถุนายน 2567 โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา จัดกิจกรรมเพื่อคุณแม่และคุณพ่อมือใหม่ "9 เดือน มหัศจรรย์ อบรมครรภ์คุณภาพ Mothers Class" (ไม่มีค่าใช้จ่าย) ห้องประชุม ชั้น 6 โรงพยาบาลเกษมราษฎร์ ฉะเชิงเทรา ลงทะเบียน เวลา 08.40-09.00 น. สอบถามโทร 1218 กด 7 ต่อ 1948,1951,1953,1954,1959 แผนกการตลาดโรงพยาบาลพญาไท นวมินทร์ จัดกิจกรรม Mommy Kids Club LINK
โรงพยาบาลพญาไท นวมินทร์ จัดกิจกรรม Mommy Kids Club ครั้งที่ 1 กิจกรรมเสริมสร้างความรู้สำหรับคุณแม่และลูกน้อยวันเสาร์ที่ 8 มิถุนายน 2567 เวลา 08.30 - 12.00 น. ณ ลานกิจกรรมชั้น 2 รพ.พญาไท นวมินทร์ สอบถามเพิ่มเติม โทร 02-944-7111 กิจกรรมเสริมสร้างความรู้และแจกของรางวัลมากมาย - กิจกรรมให้ความรู้ในหัวข้อ "9 เดือน มหัศจรรย์กับครรภ์คุณภาพ คุณแม่ปลอดภัย ลูกน้อยสมบูรณ์" โดย พญ.ปวีณา บุตรดีวงศ์ สูตินรีแพทย์ ศูนย์สุขภาพหญิง - กิจกรรม Workshop "สาธิตเมนูพิเศษสำหรับคุณแม่ตั้งครรภ์" โดยนักโภชนาการ - กิจกรรม Workshop "การอาบน้ำลูกน้อยอย่างถูกวิธี" โดย พยาบาลแผนกเด็กแรกเกิด - กิจกรรม Lucky Draw ลุ้นรับรางวัลสุดพิเศษสำหรับลูกน้อย ลงทะเบียนตอนนี้รับไปเลย ชุดกิ๊ฟเซตสำหรับคุณแม่และลูกน้อย จำนวนจำกัด สำหรับ 20 ท่านเท่านั้น
เทศบาลเมืองสุรินทร์ ทำหมันให้กับสุนัขและแมว 26 มิถุนายน 2567
เทศบาลเมืองสุรินทร์ ร่วมกับ ปศุสัตว์จังหวัดสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว ในเขตเทศบาลเมืองสุรินทร์ รับจำนวนจำกัด (จำกัด จำนวน 1 ตัว / บ้าน) วันที่ 26 มิถุนายน 2567 เวลา 08.30 น. เป็นต้นไป ณ วัดหนองบัว ... เปิดรับลงทะเบียน ผ่าน QR code (เท่านั้น)
ปฏิทินกิจกรรมนครศรีธรรมราช เดือนมิถุนายน 2567
ปฏิทินเทศกาล และกิจกรรมต่างๆ ในจังหวัดสตูล เดือนมิถุนายน
ปฏิทินและกิจกรรมท่องเที่ยวฉะเชิงเทรา ประจำเดือนมิถุนายน 2567 LINK
1. ประเพณีบุญบั้งไฟ จังหวัดฉะเชิงเทรา วันที่ 15-16 มิถุนายน 2567 ณ บ้านหนองคอก และบ้านเกาะกระทิง อ.ท่าตะเกียบ จ.ฉะเชิงเทรา
2. งานประจำปีปิดทอง วัดดอนสีนนท์ วันที่ 31 พฤษภาคม - 6 มิถุนายน 2567 ณ วัดดอนสีนนท์ อ.บ้านโพธิ์ จ.ฉะเชิงเทรา
3. การแข่งขันเดิน-วิ่ง 132 ปี Benchama Fun Run วันที่ 16 มิถุนายน 2567 ณ โรงเรียนเบญจมราษฎร์รังสฤษดิ์ อ.เมือง จ.ฉะเชิงเทรา
4. Chachoengsao City Life Half Marathon (Color of EEC) วันที่ 29-30 มิถุนายน 2567 ณ โคงงการส่งน้ำและบำรุงรักษาเขื่อนบางปะกง อ.เมือง จ.ฉะเชิงเทรา
(ย้ายที่ปล่อยตัวจาก สนามหน้าศาลากลางจังหวัดฉะเชิงเทรา)
สอบถามข้อมูลเพิ่มเติมได้ที่
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานฉะเชิงเทรา
โทรศัพท์ : 038 514 009
ปฏิทินท่องเที่ยวระนอง ประจำเดือน มิถุนายน 2567
ปฏิทินกิจกรรมเพชรบูรณ์ เดือนมิถุนายน 2567
ปฏิทินกิจกรรมพิษณุโลก เดือนมิถุนายน 2567
ปฏิทินท่องเที่ยวสมุทรสาคร ประจำเดือนมิถุนายน 2567
งานประเพณีท่องเที่ยว จังหวัดสมุทรสาคร ประจำเดือนมิถุนายน 2567
งานประเพณีแห่เจ้าพ่อหลักเมืองสมุทรสาคร ประจำปี 2567
ณ ศาลเจ้าพ่อหลักเมืองสมุทรสาคร
วันที่ 12-17 มิ.ย.67 [
พิกัด]
งานถนนคนเดิน ณ บริเวณสวนสาธารณะเฉลิมพระเกียรติ 60 พรรษามหาราชา (ข้างศาลเจ้าพ่อหลักเมืองสมุทรสาคร)
วันที่ 12-17 มิ.ย.67 [
พิกัด]
งานประเพณีท่องเที่ยวสมุทรสงคราม ประจำเดือนมิถุนายน 2567
พิธีเททองหล่อหลวงพ่อบ้านแหลม องค์ใหญ่ที่สุดในโลก (วาระแรก) ณ วัดเพชรสมุทรวรวิหาร วันที่ 4 มิ.ย.67 [
พิกัด]
MAEKLONG Walking Street
ถนนคนเดินริมน้ำแม่กลอง
ณ ริมเขื่อนวัดเพชรฯ
ทุกวันศุกร์-เสาร์-อาทิตย์ [
พิกัด]
สมุทรสงครามสวยใสไร้ขยะ ครั้งที่ 4
เนื่องในวันสิ่งแวดล้อมโลก 5 มิถุนายน 2567
ณ วิทยาลัยเทคนิคสมุทรสงคราม
นิทรรศการสวนศิลป์ ART Garden
ณ บ้านสวนมะนาวโห่ลุงศิริ
วันที่ 7-9 มิ.ย.67 [
พิกัด]
“สมุทรสงครามไพรด์” งานเดินขบวนพาเหรดสีรุ้ง ????️????
ณ หน้าสนามกีฬาจังหวัดสมุทรสงคราม
เปิดตัวทริปแรก รถไฟ SRT Royal Blossom รับเทศกาลกิจกรรม "สิงหาพาแม่เที่ยว"
โปรแกรมท่องเที่ยวรถไฟ SRT Royal Blossom ประเดิมเปิดตัวการเดินทางทริปแรก 17 สิงหาคม 2567 รับเทศกาลกิจกรรม "สิงหาพาแม่เที่ยว" บนเส้นทางรถไฟท่องเที่ยว เส้นทางสายแห่งความสุข กรุงเทพ - กาญจนบุรี ราคา 1,799 บาทต่อท่าน
ความสุขตลอดเส้นทางไปกับรถไฟ SRT Royal Blossom
ชม สะพานข้ามแม่น้ำแคว สะพานประวัติศาสตร์ ที่ สร้างขึ้นในระหว่างสงครามโลกครั้งที่ 2 ชมวิวทิวทัศน์บนสะพานข้ามแม่น้ำแคว อนุสรณ์สถานสำคัญทางประวัติศาสตร์ที่โด่งดังดังไปทั่วโลก แวะชม จุดจอดรถไฟถ้ำกระแซ
นั่งรถไฟผ่านโค้งประวัติศาสตร์สำคัญ เป็นเส้นทางที่สวยที่สุดเส้นหนึ่ง ลัดเลาะไปตามหน้าผาและป่าโปร่ง ย้อนมิติกลับไปสู่อดีตสมัยสงครามโลกครั้งที่ 2
เยี่ยมชม ถ้ำกระแซ อดีตที่พักของเชลยศึกเมื่อครั้งก่อสร้างเส้นทางรถไฟสายมรณะ และภายในถ้ำยังมี พระพุทธรูปศักดิ์สิทดิ์สิทธิ์ประดิษฐานอยู่ภายในถ้ำ
ไหว้พระที่ วัดเมตตาธรรมโพธิญาณ วัดมหายานจีนนิกาย สร้างด้วยไม้ทั้งหลัง แกะสลักลงสีแบบสถาปัตยกรรมจีนสวยงาม กราบขอพรพระโพธิสัตว์กวนอิมพันมือองค์ใหญ่
แวะชม วัดถ้ำพุหว้า นำชมมหัศจรรรรย์ถ้ำกลางป่า หน้าถ้ำจะมีปราสากหินทราย เป็นรูปแบบของศิลปะขอมโบราณประยุกต์ขนาดใหญ่สีน้ำตาลแดง มีลวดลายประณีตที่สวยงามมาก
กำหนดการตลอดเส้นทาง
เวลา 05:30 น. ผู้ร่วมทริปลงทะเบียน พร้อมกัน ชานชลาที่ 4-5 สถานีกรุงเทพ (หัวลำโพง)
เวลา 06.00 น. ขบวนรถพิเศษ SRT Royal Blossom ออกจากสถานีกรุงเทพ (หัวลำโพง) มุ่งสู่ จังหวัดกาญจนบุรี
เวลา 06.19 น. ถึง สถานีชุมทางบางชื่อ
เวลา 06.38 น. ถึง สถานีบางบำหรุ
เวลา 06.44 น. ถึง สถานีชุมทางตลิ่งชัน
เวลา 06.58 น. ถึง สถานีศาลายา
เวลา 08.45 น. ถึง จุดจอดรถสะพานข้ามแม่น้ำแคว สะพานประวัติศาสตร์ สร้างขึ้นในระหว่างสงครามโลกครั้งที่ 2
เป็นส่วนหนึ่งของเส้นทางรถไฟของกองทัพญี่ปุ่นจากสถานีชุมทางหนองปลาดุก อำเภอบ้านโป่ง จังหวัดราชบุรี
ไปเมืองธันบูชายัต ประเทศพม่า
- นำทุกท่านลงจากขบวนรถ SRT Royal Blossom ชมวิวทิวทัศน์บนสะพานข้ามแม่น้ำแคว อนุสรณ์สถานสำคัญทางประวัติศาสตร์ ที่โด่งดังไปทั่วโลก (30 นาที)
เวลา 09:15 น. ออกเดินทางโดยขบวนรถ SRT Royal Blossom ไป จุดจอดรถถ้ำกระแซ นั่งรถไฟผ่านโค้งประวัติศาสตร์สำคัญ ที่ยังเปิดใช้งานมาจนถึงทุกวันนี้ ซึ่งถูกสร้างโดยเชลยศึกพันธมิตร เป็นเส้นทางที่สวยที่สุด
เส้นหนึ่ง ลัดเลาะไปตามหน้าผาและป่าโปร่ง ย้อนมิติกลับไปสู่อดีต สมัยสงครามโลกครั้งที่ 2 อย่างไม่รู้ตัว
เวลา 10.03 น. ถึง จุดจอดรถถ้ำกระแช หยุดรถ ให้ทุกท่านนั่งชมและรับฟังบรรยายสรุปจากวิทยากรผู้ทรงคุณวุฒิ (20 นาที)
- ถ้ำกระมร้ายแห่งนี้เคยที่ที่พักของของขลยศึก มื่อศิร้างสร้างสันทางรใฟสายมะจากไทยไทยใทยใปพม่า และภายในถ้ำยังมี พระพุทธรูปศักดิ์สิทธิ์ ประดิษฐานอยู่สถานที่ที่ครั้งหนึ่งเคยอยู่ในหน้าประวัติศาสตร์โลก
เวลา 10:25 น. เดินทางโดยขบวนรถ SRT Royal Blossom ไป สถานีกาญจนบุรี
เวลา 11.30 น. ถึง สถานีกาญจนบุรี เดินทางต่อโดยรถบัสปรับอากาศไป ร้านอาหาร แพหน้าเมือง
เวลา 12.00 น. นำทุกท่านลงแพ พร้อมรับประทานอาหารกลางวัน เคล้าเสียงเพลงอันไพเราะ ชมธรรมชาติสองฝั่งแม่น้ำแควน้อย - แควใหญ่ ผ่านชมวัดถ้ำเขาปูน Skywalk แม่กลอง-สองแคว
เวลา 14.00 น. เดินทางโดยรถบัสปรับอากาศ ไป วัดเมตตาธรรมโพธิญาณ วัดมหายานจีนนิกาย สร้างด้วยไม้ทั้งหลัง แกะสลักลงสีแบบสถาปัตยกรรมจีนสวยงาม
- นำทุกท่านกราบขอพรพระโพธิสัตว์กวนอิมพันมือองค์ใหญ่ แกะสลักจากไม้สูง 12 เมตร และเจ้าแม่กวนอิมที่แก่ะสลักจากไม้หอม ปางต่าง ๆ กว่า 100 ปาง
เวลา 15.30 น. ออกเดินทางโดยรถบัสปรับอากาศไป วัดถ้ำพุหว้า อีกหนึ่งวัดสวย นำชมมหัมมหัศจรรย์ถ้ำกลางปา ถ้ำพุหว้า มีลักษณะเป็นห้องโถงขนาดใหญ่ หน้าถ้ำจะมีปราสาทหินทราย เป็นรูปแบบของศิลปะขอมโบราณประยุกต์ขนาดใหญ่สีน้ำตาลแดง มีลวดลายประณีตที่สวยงามมาก บรรยากาศรอบ ๆ วัดจะมีภูเขาและป่าไม้ล้อมรอบมีความสงบร่มรื่น
เวลา 16.30 น. เดินทางไป สถานีกาญจนบุรี
เวลา 17:25 น. ออกเดินทางกลับโดยขบวนรถพิเศษ SRT Royal Blossom - บริการอาหารค่ำ ระหว่างการเดินทางบนรถไฟ
เวลา 19.15 น. ถึง สถานีศาลายา
เวลา 19.22 น. ถึง สถานีชุมทางตลิ่งชัน
เวลา 19.42 น. ถึง สถานีบางบำหรุ
เวลา 17.59 น. ถึง สถานีชุมทางบางซื่อ
เวลา 20.05 น. ถึง สถานีกรุงเทพ (หัวลำโพง) โดยสวัสดิภาพ
ปฏิทินท่องเที่ยวเดือนมิถุนายน 2567 จังหวัดนครปฐม
ปฏิทินกิจกรรมเด่นบึงกาฬ เดือนมิถุนายน 2567
ปฏิทินกิจกรรม จ.อุดรธานี เดือนมิถุนายน 2567
ปฏิทินกิจกรรมท่องเที่ยว จ.หนองคาย เดือนมิถุนายน 2567
Tanyongpo Fishing 2024 วันที่ 1-2 มิถุนายน 2567
Tanyongpo Fishing 2024 วันที่ 1-2 มิถุนายน 2567 ณ ลานหน้าหาด ต.ตันหยงโป อ.เมือง จ.สตูล
การแสดงโดรนเฉลิมพระเกียรติฯ 1–3 มิถุนายน 2567 วันละ 2 รอบๆ ละ 15 นาที
ขอเชิญรับชมการแสดงโดรนเฉลิมพระเกียรติฯ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 และสมเด็จพระนางเจ้าฯ พระบรมราชินี เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 3 มิถุนายน 2567 ระหว่างวันที่ 1-3 มิถุนายน 2567 เวลา 18.00 – 21.00 น. ณ บริเวณวงเวียนหอนาฬิกา อำเภอเมือง จังหวัดอุทัยธานี พร้อม ช็อป ชิม ชม การแสดงของนักเรียนในจังหวัดอุทัยธานี
การแสดงโดรนเฉลิมพระเกียรติฯ ระหว่างวันที่ 1 – 3 มิถุนายน 2567 วันละ 2 รอบๆ ละ 15 นาที
รอบที่ 1 เวลา 19.30 น. รอบที่ 2 เวลา 20.30 น.
ชาวอุทัยธานี พร้อมใจสวมใส่เสื้อสีเหลือง วันที่ 1-2 มิถุนายน 2567
และพร้อมใจสวมใส่เสื้อสีม่วง วันที่ 3 มิถุนายน 2567
และร่วมเป็นส่วนหนึ่งในพิธีจุดเทียนถวายพระพรชัยมงคล สมเด็จพระนางเจ้าฯ พระบรมราชินี เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 3 มิถุนายน 2567
งาน Krabi Music Coffee & Craft #3 1-9 มิถุนายน 2567
งาน Krabi Music Coffee & Craft #3 “ได้ดื่มกาแฟ & ได้ Care สิ่งแวดล้อม” วันที่ 1, 2, 3, 8, 9 มิถุนายน 2567 ณ บริเวณไม้มะหาด หน้าเมืองกระบี่ กิจกรรมคนรักกาแฟ แบบอบอุ่นและ Eco Friendly จุดเด่นปีนี้ มีกาแฟที่ได้ GI (Geographical Indication) ของกระบี่ มา นำเสนอ พร้อมกับ บูธกาแฟ & เบเกอรี่ของชาวกระบี่ กว่า 20 บูธ งาน Craft , DIY, งานศิลปะ, ดนตรี, ผ้ามัดย้อมสีกาแฟ, ภาพเขียนสีกาแฟ การ Scrub ผิวจากผงกาแฟ และอื่น ๆ อีกเพียบ
Thailand Buffalo Heritage ประกวดควายไทย มรดกไทย 1-2 มิถุนายน พ.ศ. 2567
Thailand Buffalo Heritage ควายไทย มรดกไทย ประกวดควายชิงถ้วยรางวัลนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงเกษตรและสหกรณ์ วันที่ 1-2 มิถุนายน พ.ศ. 2567 ณ ลานหลังวัดมหาธาตุ อุทยานประวัติศาสตร์ จังหวัดพระนครศรีอยุธยา
3 มิถุนายน ทีมแพทย์โรงพยาบาลสุราษฎร์ธานี ผ่าตัดปลูกถ่ายไต
วันจันทร์ที่
3 มิถุนายน 2567 นายแพทย์ปณิธาน สื่อมโนธรรม ผู้อำนวยการโรงพยาบาลสุราษฎร์ธานี ได้มอบหมายคณะแพทย์ทำการผ่าตัดปลูกถ่ายได้ให้กับผู้ป่วยโรคไตเรื้อรัง โดยได้รับบริจาคไตจากผู้บริจาคสมองตาย (Cadaveric KT) จากโรงพยาบาลเกาะสมุย โดยนายแพทย์รัตนพล ล้อประเสริฐกุล ผู้อำนวยการโรงพยาบาล เกาะสมุย ประสบความสำเร็จเป็นรายแรกของเขต ๑๓ ซึ่งที่ผ่านมาโรงพยาบาลสุราษฎร์ธานีได้ทำการผ่าตัด ปลูกถ่ายไตในผู้บริจาคที่มีชีวิตไปแล้ว 19 ราย โดยเข้าร่วมโครงการปลูกถ่ายไตถวายเป็นพระราชกุศล 100ปี ประสูติสมเด็จพระเจ้าพี่นางเธอ เจ้าฟ้ากัลยาณิวัฒนากรมหลวงนราธิวาสราชนครินทร์ และเนื่องในโอกาส วันเฉลิมพระชนมพรรษาสมเด็จพระนางเจ้าสุทิดา พัชรสุธาพิมลลักษณ พระบรมราชินี
นิทรรศการสร้างสรรค์ Art Therapy 3rd (เจร???ญ–สติ) 4 มิถุนายน - 30 กรกฎาคม 2567
กองส่งเสริมศิลปวัฒนธรรม ขอเชิญสัมผัสนิทรรศการสร้างสรรค์ Art Therapy 3rd (เจริญ – สติ) นำเสนอความเชื่อ ความศรัทธา หลักคำสอน เพื่อเสริมสร้างสติ สมาธิ ปัญญา นำแผ่นหลักธรรมนาวา “วัง” ภาพวาดฝีพระหัตถ์พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าโปรดกระหม่อม พระราชทาน “หลักปฏิบัติเพื่อความพ้นทุกข์” แก่พสกนิกรชาวไทย พร้อมวัตถุจัดแสดงในรูปแบบงานศิลปะสร้างสรรค์ สอดผสานการรับรู้กลิ่นและเสียงของธรรมชาติ เพื่อสร้างสัมผัสรู้ “อายตนะ” สื่อความหมาย ก่อให้เกิด “สติ” มองเห็นถึงความตั้งมั่นภายในจิตใจตน ก่อให้เกิด “สมาธิ” และความสงบนิ่งมองเหตุเห็นผลนั้น ก่อให้เกิด “ปัญญา” จัดแสดงตั้งแต่ 4 มิถุนายน - 30 กรกฎาคม 2567 เวลา: 08:30 - 16:30 น. (เปิดทุกวัน เว้นวันหยุดนักขัตฤกษ์) ณ ชั้น 2 หอศิลป์มหาวิทยาลัยนเรศวรอาคารวิสุทธิกษัตริย์ กองส่งเสริมศิลปวัฒนธรรม มหาวิทยาลัยนเรศวร
กิจกรรมเดิน วิ่ง ปั่น ธงตราสัญลักษณ์ เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา วันที่ 4-6 มิถุนายน 2567
กิจกรรมเดิน วิ่ง ปั่น ธงตราสัญลักษณ์ งานเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา ๖ รอบ ๒๘ กรกฎาคม ๒๕๖๗ ระหว่างวันที่ ๔ - ๖ มิถุนายน ๒๕๖๗
งานสีสันตะวันออก EEC Good Food Good Vibes 6 - 9 มิถุนายน 2567 ถนนเลียบชายหาดพัทยา
งาน สีสันตะวันออก EEC Good Food Good Vibes สีสันเมืองท่องเที่ยว ที่รวมทุกอย่างไว้ที่นี่แล้ว ครบรส ทั้งอาหารและดนตรี หลากอารมย์แห่งความสุข สีสันครั้งยิ่งใหญ่ของ 3 จังหวัด ชลบุรี ระยอง และ ฉะเชิงเทรา วันที่ 6 - 9 มิถุนายน 2567 ณ ถนนเลียบชายหาดพัทยา จังหวัดชลบุรี 3 โซน น่าสนใจ
• GOOD FOOD แบบฟินๆ กับอาหารหลากหลายที่เรายกมาจาก 3 จังหวัดภาคตะวันออก พร้อมกับการโชว์สาธิตการทำอาหารสุด Exclusive
• GOOD VIBES ชิลๆกับ MINI CONCERT ริมทะเล กับศิลปิน ชื่อดัง เตรียมตัวพบกับความสนุกกันได้เลย...จาก YES’SIR DAY (6 มิ.ย.) เบล วริศรา (7 มิ.ย.) M-PEE (8 มิ.ย.) และเน็ค นฤพล (9 มิ.ย.) และชมการแสดงศิลปวัฒนธรรมภาคตะวันออก ตลอด 4 วันงาน
• GOOD LIFE ไปกับกิจกรรมเพื่อสุขภาพและสิ่งแวดล้อม และกิจกรรม Exclusive อีกมากมายที่ไม่ควรพลาด
สัมมนาชาวเกาะการท่องเที่ยวเกาะลันตา อย่างยั่งยืน 6 - 8 มิถุนายน 2567
กรมการท่องเที่ยว ร่วมกับองค์กรภาคีเครือข่ายผู้นำชาวเกาะ 35 เกาะ จัดงาน สัมมนาชาวเกาะการท่องเที่ยวเกาะอย่างยั่งยืน 2567 : ผนึกพลังคุณค่า สู่มูลค่าใหม่ของเกาะไทย ครั้งที่ 2
The 2nd Thailand Sustainable Island Tourism Symposium 2024 : Awakening New Depths-Adding Value to Thailand’s Islands วันที่ 6 - 8 มิถุนายน 2567 ณ เกาะลันตา จังหวัดกระบี่
พบกับผู้นำเกาะทั่วทะเลไทย วิทยากรมากประสบการณ์ ที่จะมาแบ่งปันความรู้เรื่องราวของเกาะ คุณค่าความหลากหลายทางชีวภาพเกาะ การพัฒนาการท่องเที่ยวที่ยั่งยืน ร่วมเสวนาแลกเปลี่ยนองค์ความรู้ เสริมสร้างศักยภาพให้ผู้นำเกาะและภาคีเกี่ยวข้องให้ก้าวเดินและยกระดับไปด้วยกัน
ยุทธการเขย่าเกาะ สร้างพลังลูกใหม่
การใช้ภูมิปัญญา นวัตกรรม เทคโนโลยีเพื่อยกระดับการท่องเที่ยวเกาะคาร์บอนสุทธิเป็นศูนย์
การจัดการเกาะบนฐานองค์ความรู้ด้านทรัพยากรและความหลากหลายทางชีวภาพ
การพัฒนาโมเดลความร่วมมือบริหารจัดการวิกฤติขยะมูลฝอยเกาะ สู่เกาะไร้ถัง ไร้หลุม ทำได้จริงหรือ
Business Model for Sustainable Island Tourism Management
การตลาดกับการท่องเที่ยวเกาะวิถียั่งยืนโดยชุมชน
พันธมิตรเครือข่ายเกาะเพื่อการท่องเที่ยวยั่งยืน
ร่วมกันยกระดับการท่องเที่ยวสู่การพัฒนาเกาะที่ยั่งยืน เพื่อขับเคลื่อนประเทศไทยสู่การท่องเที่ยวคาร์บอนสุทธิเป็นศูนย์ในอนาคต
งานนิทรรศการ “สวนศิลป์ Art Garden” Dream & Draw Studio At Sirisompong Farm&Café 7-9 มิถุนายน 2567
ชวนเที่ยวชมงานนิทรรศการ “สวนศิลป์ Art Garden” Dream & Draw Studio At Sirisompong Farm&Café 7-9 มิถุนายน 2567 นี้
สวนมะนาวโห่ลุงศิริ
ภาพจัดแสดงได้รับแรงบันดาลใจจากธรรมชาติ ที่ทำออกมาในสไตล์ของเด็กๆเองแต่ละคนไม่เหมือนกัน ความชอบที่หลากหลายพาให้ใจชื่นบาน ชวนมารับชมแรงบันดาลใจดีดีของเด็กๆ กัน และ Dream & Draw Studio ได้มีกิจกรรมเวิร์คช็อปศิลปะมากมายสำหรับเด็กและผู้ใหญ่ให้ทุกท่านได้มาสร้างผลงานของตัวเอง อีกทั้งร้านค้า Gardener ผลิตภัณฑ์เกษตรกรยุคใหม่ งานฝีมือของชุมชนจาก Local Crafter เช่น ส้มโอขาวใหญ่ น้ำตาลมะพร้าว น้ำผึ้งดอกลิ้นจี่ ไข่ไก่ ผักไฮโดรโปนิกส์ และอีกมากมาย
Promotion‼️ สุดพิเศษเฉพาะงานนี้ เพียงท่านใช้จ่ายภายในงานฯ ครบ 200 uาท นำหลักฐานการชำระเงิน มาแสดงต่อเจ้าหน้าที่ที่บูธ ททท.สมุทรสงคราม ภายในงานฯ และสแกน QR Code กรอกข้อมูลลงทะเบียนตามกติกา แลกซื้อแพ็คเกจกิจกรรม Work Shop ทำผ้ามัดย้อมชิคๆคูลๆ ในราคาเพียง 99 uาท
รำลึกราชินีลูกทุ่ง พุ่มพวง ดวงจันทร์ ปีที่ 32 วันที่ 8-16 มิถุนายน 2567
งานประจำปี "รำลึกราชินีลูกทุ่ง พุ่มพวง ดวงจันทร์ ปีที่ 32" วันที่ 8-16 มิถุนายน 2567 ณ วัดทับกระดาน อ.สองพี่น้อง จ.สุพรรณบุรี รำลึกการจากไป ของนักร้องราชินีลูกทุ่ง พบกับ อภิมหาคอนเสิร์ตลูกทุ่ง ดารา นักร้อง ศิลปินรับเชิญชื่อดัง ตลก ลิเก ภาพยนตร์ มิตรรัก แฟนเพลง ฯลฯ ชมฟรีตลอดงาน
Satun Surf Festival 8-9 มิถุนายน 2567 LINK
Satun Surf Festival 8-9 มิถุนายน 2567 First wave Good vibes ณ ชายหาดปากน้ำ บ่อเจ็ดลูก อ.ละงู จ.สตูล
เปิดประสบการณ์ใหม่ๆ ของกีฬาทางน้ำ “การโต้คลื่น” ในวิถี Surfer แบบ “สตูล สไตล์” ที่มีเอกลักษณ์และอัตลักษณ์ทางพื้นที่ ที่มีเสน่ห์ไม่เหมือนที่ไหน ทั้งทะเล ชายหาด ภูเขา หน้าผา ป่าชายเลน ธรรมชาติที่สวยงามอุดมสมบูรณ์ วิถีชีวิตของผู้คน ชุมชนท้องถิ่น สภาพแวดล้อม หมู่บ้านชาวประมง และบริบทรอบๆที่น่าสนใจ
First wave good vibes คือ การเอนจอยในมวลความสุข เก็บเกี่ยวบรรยากาศดีๆ กับคลื่นแรกของพวกเรา เป็นคลื่นแรกของฤดูกาลเซิร์ฟที่เวียนกลับมาถึง พร้อมกับการเกิดงานครั้งนี้ เป็นครั้งแรกของจังหวัดสตูล
Surf สัมผัส และเรียนรู้การเล่นเซิร์ฟ จากนักเล่นเซิร์ฟระดับแนวหน้าของเมืองไทย และผู้สอนมืออาชีพมากประสบการณ์ ที่จะมาถ่ายทอดพื้นฐาน จนถึงรูปแบบการเล่นเซิร์ฟในระดับสูง พูดคุยบนเวทีในหัวข้อ “เซิร์ฟทาวน์” กับวิทยากรคนพิเศษ อีกทั้งการนำเสนอกีฬาทางน้ำในหลากหลายรูปแบบ หลากหลายประเภท
Eco การแสดงออกในการมีส่วนร่วมต่อการอนุรักษ์สิ่งแวดล้อม แก่ธรรมชาติ ท้องทะเล ชายหาดในพื้นที่ที่กิจกรรมในครั้งนี้เกิดขึ้น
Craft การทำกิจกรรมรักษ์สิ่งแวดล้อม และสร้างสรรค์ผลงานดีๆ ผ่านเวิร์คช็อปจากกลุ่มผู้ประกอบการ และกิจกรรมทางศิลปะจากกลุ่มศิลปิน
Music เพลิดเพลินกับเสียงเพลง ดนตรีดีๆ ริมชายหาดในบรรยากาศที่สวยงาม วิวทะเลที่โอบล้อมด้วยภูเขา ในพื้นที่หมู่บ้านบ่อเจ็ดลูก จังหวัดสตูล
Suratthani Pride Month 2024 ครั้งแรกในเมืองสุราษฎร์ธานี วันเสาร์ที่ 8 มิถุนายน 2567
Suratthani Pride Month 2024 ครั้งแรกในเมืองสุราษฎร์ธานี วันเสาร์ที่ 8 มิถุนายน 2567 กับการเฉลิมฉลองเดือนแห่งความภาคภูมิใจ ของกลุ่มความหลากหลายทางเพศ We’re All Human Equality and Non-Discrimination พบกับกิจกรรมที่เกิดจากความร่วมมือ ของมูลนิธิรักษ์ไทย สำนักงานสาธารณสุขจังหวัดสุราษฎร์ธานี หน่วยงานภาครัฐ และเอกชนหลากหลายองค์กร เพื่อรณรงค์สร้างการรับรู้ด้านความหลากหลายความเท่าเทียม การตระหนักถึงคุณค่าในความเป็นมนุษย์ การยุติการตีตรา และเลือกปฏิบัติฯ
วันเสาร์ที่ 8 มิถุนายน 2567 กิจกรรมเดินขบวนพาเหรด
เวลา 15.30 น. เริ่มรวมพลขบวน ณ เทศบาลนครสุราษฎร์ธานี
เวลา 16.00 น. จัดแถวขบวนพาเหรด
เวลา 17.00 น. เริ่มเคลื่อนขบวนไปยังสะพานนริศ
เวลา 17.45 น. ขบวนพาเหรดทยอยเข้าสู่ลานกิจกรรม
เวลา 18.30 น. พิธีเปิดงาน Surat Thani Pride 2024
เวลา 19.30 น. ประกวด MISS LGBT RAKSTHAI PRIDE 2024
บูทกิจกรรมในงานอีกมากมาย - การแสดงจากกลุ่มเยาวชนรุ่นใหม่ - บูทให้ความรู้ด้านเพศสภาวะ - บูทให้คำปรึกษาตรวจหาเอชไอวีและโรคติดต่อทางเพศสัมพันธ์ - บูทรับเรื่องร้องเรียนและคุ้มครองการละเมิดสิทธิด้านเอดส์ และเพศสภาพ บริการให้คำปรึกษา แจกชุดตรวจหาเชื้อเอชไอวีด้วยตนเอง (HIV Self Test) - บูทให้คำปรึกษาด้านสุขภาพจิต
11-23 มิถุนายน 2567 นิทรรศการผลงานนักศึกษา สาขาเทคโนโลยีการศึกษาแพทยศาสตร์ ศิริราช
ขอเชิญร่วมชมนิทรรศการแสดงผลงานของนักศึกษา หลักสูตรเทคโนโลยีบัณฑิต สาขาวิชาเทคโนโลยีการศึกษาแพทยศาสตร์ สถานเทคโนโลยีการศึกษาแพทยศาสตร์ ครั้งที่ 13” ประจำปีการศึกษา 2566 ระหว่างวันที่ 11 - 23 มิถุนายน 2567 เวลา 10.00 - 20.00 น. ณ โถงชั้น 1 และ ผนังโค้ง ชั้น 3 หอศิลปะวัฒนธรรมแห่งกรุงเทพมหานคร ภายในงาน..พบกับ ผลงานของนักศึกษา ทั้งภาพวาด ภาพถ่าย วีดิทัศน์ และหุ่นจำลองที่เกี่ยวข้องกับการแพทย์ และสื่อการศึกษาทั่วไป
12 มิถุนายน 2567 การบรรยาย เรื่อง “การนำ SERIOUS GAMES มาใช้เพิ่มการเรียนแบบมีปฏิสัมพันธ์ในโรงเรียนแพทย์”
Pearls in Medical Education เดือนมิถุนายน 2567 ขอเรียนเชิญอาจารย์หรือผู้สนใจเข้าร่วมรับฟังการบรรยาย เรื่อง “การนำ SERIOUS GAMES มาใช้เพิ่มการเรียนแบบมีปฏิสัมพันธ์ในโรงเรียนแพทย์” อ. นพ.สิชน ลือฤทธิ์พงษ์ ผู้ช่วยคณบดีฝ่ายนวัตกรรมบริการและคุณค่าองค์กร คณะแพทยศาสตร์ศิริราชพยาบาล น.ส.ณิชารัศม์ ชัยวันทนาพัชร์ ศูนย์ขับเคลื่อนคุณค่าการบริการ สำนักงานคณบดี วันพุธที่ 12 มิถุนายน 2567 เวลา 14.00 - 16.00 น. ณ ห้องประชุมสิรินธร ชั้น G อาคารเฉลิมพระเกียรติ คณะแพทยศาสตร์ศิริราชพยาบาล (สามารถรับชม Online ผ่าน ZOOM) **หมายเหตุ: อาจารย์ที่ต้องการเก็บชั่วโมง CPD จะต้องลงทะเบียนอีกครั้งในวันงาน /เข้าอบรม (On-site) สามารถเก็บชั่วโมง: CPD สำหรับคนในคณะฯ และ CME ได้ ลงทะเบียนร่วมกิจกรรม และ อ่านรายละเอียดเพิ่มเติม โดย Scan QR code
งานประเพณีแห่เจ้าพ่อหลักเมืองสมุทรสาคร ประจำปี 2567 วันที่ 12-16 มิ.ย. 2567
งานประเพณีแห่เจ้าพ่อหลักเมืองสมุทรสาคร ประจำปี 2567 ระหว่างวันที่ 12-16 มิ.ย. 2567 นี้ ชวนชมขบวนแห่เจ้าพ่อหลักเมือง รอบตลาดมหาชัย ทั้งทางบก และทางน้ำอย่างยิ่งใหญ่ ในวันที่ 13 มิ.ย. 67 นอกจากนี้ วันที่ 12-17 มิ.ย. 67 ขอเชิญชมงานถนนคนเดินส่งเสริมการท่องเที่ยว ในสวนสาธารณะเฉลิมพระเกียรติ 60 พรรษา มหาราชา ข้างศาลเจ้าพ่อหลักเมืองพบกับร้านค้า กว่า 185 ร้าน พร้อมชมดนตรีจากศิลปิน ฟรี ตลอดงาน และวันที่ 17 มิ.ย. 67 ร่วมชมการประกวดชายงาม และสาวประเพศสอง การแสดงอื่นๆ อีกมากมาย
เทศกาลทุเรียนภูเขาไฟศรีสะเกษ 2567 วันที่ 12-18 มิถุนายน
เทศกาลทุเรียนภูเขาไฟศรีสะเกษ 2567 ระหว่างวันที่ 12-18 มิถุนายน ณ ศาลากลางจังหวัดศรีสะเกษ จังหวัดศรีสะเกษ ภายในงานเทศกาลทุเรียนภูเขาไฟศรีสะเกษ 2567 พบกับกิจกรรมต่าง ๆ เช่น ได้ชิมและช้อปทุเรียนภูเขาไฟศรีสะเกษเกรดคุณภาพ ผลผลิตทางการเกษตร สินค้าวิสาหกิจชุมชน สินค้า OTOP และของดีศรีสะเกษมากมาย
เปิดฤดูกาลทุเรียนบ้านปากทรง อ.พะโต๊ะ ชุมพร 13-22 มิถุนายน 2567
เปิดฤดูกาลทุเรียนบ้านปากทรง 13-22 มิถุนายน 2567 ณ สนามบ้านปากทรง ต.ปากทรง อ.พะโต๊ะ ชุมพร
14 มิถุนายน โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยหญิงไทย อายุ 72 ปี
14 มิถุนายน 2567 โรงพยาบาลราชบุรี ผู้ป่วยหญิงไทย อายุ 72 ปี มีอาการชักเกร็ง ซึมลง ญาติจึงนำส่งโรงพยาบาลราชบุรี แพทย์ส่งเอกซเรย์คอมพิวเตอร์ พบมีเลือดออกในสมอง ลักษณกระจาย แพทย์สงสัยผู้ป่วยอาจมีความผิดปกติของเส้นเลือด จึงส่งตรวจพิเศษเพื่อดูเส้นเลือดในสมอง และพบว่ามีภาวะหลอดเลือดแดงและดำต่อกันอย่างผิดปกติบริเวณเยื่อหุ้มสมอง แพทย์จึงทำการผ่าตัดและภายหลังผ่าตัดผู้ป่วยได้พักรักษาที่หอผู้ป่วยศัลยกรรมระบบประสาท1 และได้ย้ายไปที่หออภิบาลผู้ป่วยหนักต่อมา เนื่องจากผู้ป่วยมีอาการหนักและทรุดลง ญาติจึงขอรักษาแบบประคับประคองและเสียชีวิตในวันที่ 12 มิ.ย. 67 ทางทีมพยาบาลผู้ดูแลผู้ป่วยจึงได้ให้ข้อมูลเรื่องการบริจาคดวงตา ญาติมีความประสงค์ที่จะบริจาคดวงตาให้กับผู้ที่รอคอยการปลูกถ่ายกระจกตา และเป็นการทำบุญใหญ่ให้กับผู้ป่วยในวาระสุดท้าย
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือ การบริจาคดวงตาให้กับศูนย์รับบริจาคดวงตาสภากาชาดไทย ซึ่งถือเป็นการสร้างประโยชน์และกุศลอย่างสูงสุด ในโอกาสนี้ นายแพทย์ปิยะณัฐ บุญประดิษฐ์ รองผู้อำนวยการด้านบริการปฐมภูมิ พว.สกาวเดือน ขำเจริญ รองผู้อำนวยการฝ่ายการพยาบาล และคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
14 มิถุนายน โรงพยาบาลสุรินทร์ วางพวงหรีดเคารพศพให้แก่ญาติผู้บริจาคดวงตา รายที่ 18/2567 ชายอายุ 67 ปี
14 มิถุนายน 2567 นพ.ชวมัย สืบนุการณ์ ผอ.โรงพยาบาลสุรินทร์ มอบหมายให้ นางจันทนา แพงบุดดี ผู้ช่วยหัวหน้าพยาบาลด้านบริหาร กล่าวขอบคุณผู้บริจาคดวงตา รายที่ 18/2567 ให้กับสภากาชาดไทย พร้อมกับมอบพวงหรีดเคารพศพ ให้แก่ญาติ นายบุญ บุญโนนแต้ อายุ 67 ปี ทางครอบครัวผู้เสียชีวิตได้แจ้งความประสงค์บริจาคดวงตาให้กับสภากาชาดไทย ส่งมอบให้สภากาชาดไทยนำไปปลูกถ่ายช่วยให้ผู้ป่วย มีคุณภาพชีวิตที่ดีขึ้นต่อไป
14 มิถุนายน โรงพยาบาลตรัง ร่วมเคารพศพและมอบเกียรติบัตรให้กับครอบครัวผู้บริจาคดวงตา รายที่ 9/2567
14 มิถุนายน 2567 ทีมคณะกรรมการรับบริจาคอวัยวะ โรงพยาบาลตรัง เป็นตัวแทนโรงพยาบาลตรังและศูนย์รับบริจาคดวงตาสภากาชาดไทย ร่วมวางพวงหรีดเคารพศพและ มอบเกียรติบัตรให้กับครอบครัวนุ้ยพัว ผู้บริจาคดวงตารายที่ 9 ปีงบประมาณ 2567 ของโรงพยาบาลตรัง ณ วัดคลองมวน อ.รัษฎา จังหวัดตรัง
เทศกาลบอลลูนโป่งเฟส อ.บ้านโป่ง 14 - 23 มิถุนายน 2567
เชิญเที่ยวงานเทศกาลบอลลูนโป่งเฟส ครั้งแรกของบ้านโป่ง ราชบุรี 14 - 23 มิถุนายน 2567 ณ ลานจัดกิจกรรม Icon Banpong 16.30 น. เข้าชมฟรี จัดโดยหอการค้าราชบุรี กิจกรรมในงานมากมายรับรองไม่เบื่อ - โซนบอลลูนแบบอลังการ - โซนคอนเสิร์ตจากศิลปินดัง พบกับ Live Music ศิลปินคับคั่ง อาทิ สิงโตนำโชค, มาลีฮวนน่า, Iboss, ปากอง, นุ่น ดำดง ฯลฯ - โซนสวนสนุกชุดใหญ่ - โซนตลาดนัดของอร่อยแบบชาวบ้านโป่ง
งาน Nakhon Si Pride Parade 15 มิถุนายน 2567
งาน Nakhon Si Pride Parade จัดขึ้นวันที่ 15 มิถุนายน 2567 ณ ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล นครศรีธรรมราช เริ่มเวลา 16:00 - 21:00 น.
กะปงเทรล Kapong Trail PhangNga 15-16 มิถุนายน 2567
"Kapong Trail Phangnga" 15-16 มิถุนายน 2567 ณ หนองค้างคาว การวิ่งออกกำลังกายที่ผสมผสานการผจญภัย
17 มิถุนายน 2567 คอนเสิร์ตจากคณะนักร้องประสานเสียงศิริราชอาวุโส "หลากหลายลายคราม เยือนยามย้อนยุค"
คณะนักร้องประสานเสียงศิริราชอาวุโส ภูมิใจเสนอ คอนเสิร์ตจากคณะนักร้องประสานเสียงศิริราชอาวุโส "หลากหลายลายคราม เยือนยามย้อนยุค" คอนเสิร์ตเพลงที่จะพาทุกท่านย้อนวัยไปสมัยยุค 50s 60s 70s 80s 90s ที่จะนำพาเรื่องราวแต่ละยุคสมัยผ่านบทเพลงที่หลากหลาย และติดกระแสในยุคนั้นๆ จากอดีตสู่ปัจจุบัน โดยคณะนักร้องประสานเสียงศิริราชอาวุโส ที่ได้เตรียมพร้อมมอบความสุขแก่ทุกท่าน ให้รับชมอ.ศรินทร์ จินตนเสรี (ผู้อำนวยเพลง/เปียโน)
วันจันทร์ที่ 17 มิถุนายน 2567 เวลา 13.30 น. เป็นต้นไป ณ ห้องสิรินธร อาคารเฉลิมพระเกียรติ ชั้น G โรงพยาบาลศิริราช ไม่มีค่าเข้าชม สำรองที่นั่งเข้าชมได้ที่ คุณสาลินี โทร. 089-811-7227 เเละ คุณดวงพร โทร. 089-125-3683
17 มิถุนายน โรงพยาบาลร้อยเอ็ด ขอขอบคุณครอบครัวนายสาคร โภคทรัพย์ ผู้บริจาคอวัยวะ
17 มิถุนายน 2567 ณ อาคารนิติเวช โรงพยาบาลร้อยเอ็ด นายแพทย์ชาญชัย จันทร์วรชัยกุล ผู้อำนวยการโรงพยาบาลร้อยเอ็ด นางพรรณี แสงอินทร์ รองหัวหน้าพยาบาลด้านทรัพยากรบุคคล พร้อมด้วยคณะกรรมการเหล่ากาชาดจังร้อยเอ็ด มอบพวงหรีด แสดงความเคารพร่าง นายสาคร โภคทรัพย์ ผู้บริจาคอวัยวะ ทำบุญมหาทานบารมี ด้วยการบริจาคอวัยวะตับ และดวงตา 2 ข้าง ให้กับศูนย์รับบริจาคอวัยวะสภากาชาดไทย เพื่อนำไปปลูกถ่ายช่วยชีวิตให้กับผู้ป่วยเรื้อรัง โรงพยาบาลร้อยเอ็ด ขออนุโมทนาบุญแก่ญาติและผู้บริจาคอวัยวะให้กับเพื่อนมนุษย์เพื่อต่อชีวิตต่อลมหายใจให้ผู้ป่วย ที่รอความหวัง ถือเป็นทานบารมีที่ยิ่งใหญ่และเป็นที่สุดแห่งการให้ครั้งสุดท้ายของชีวิต โดยมีนางสาวซุ้มผกา โภคทรัพย์ พี่สาวของผู้วายชนม์ร่วมอนุโมทนา สำหรับผู้ที่มีความประสงค์จะสร้างมหาทานบารมีอันยิ่งใหญ่ด้วยการบริจาคอวัยวะ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ คุณปาณิสรา ทองมี ผู้ประสานงานศูนย์รับบริจาคอวัยวะ โรงพยาบาลร้อยเอ็ด โทร 092-6452426 หรือที่หอผู้ป่วยหนักศัลยกรรมประสาท โรงพยาบาลร้อยเอ็ดโทร. 043-518200 ต่อ 2029
งานฉลองวันคล้ายวันเกิดเจ้าพ่อกวนอู ประจำปี 2567 วันที่ 17-22 มิถุนายน 2567
คณะกรรมการจัดงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568 เถ่านั้งปีที่ 109 ขอเป็นตัวแทนชาวตลาดปากน้ำโพ จัดงานฉลองวันคล้ายวันเกิดเจ้าพ่อกวนอู ประจำปี 2567 และขอเชิญไหว้เจ้าสักการะสิ่งศักดิ์สิทธิ์ เพื่อความเป็นสิริมงคล ระหว่างวันที่ 17-22 มิถุนายน 2567 ณ ศาลเจ้าชั่วคราว สี่แยกธนาคารกรุงไทย สาขานครสวรรค์ (ไปรษณีย์)
18 มิถุนายน 2567 วันคล้ายวันเกิดเจ้าพ่อกวนอู ร่วมรับประทานอาหารเพื่อความเป็นสิริมงคล (เจี???ยะเผ่งอัง)
20 มิถุนายน 2567 ร่วมประมูลวัตถุมงคลเบื้องหน้าเจ้า (เปียสิ่งโจ๊ย)
Rayong Walking Street ถนนคนเดินระยอง สองงาน มิถุนายน
Rayong Walking Street ถนนคนเดินระยอง สองที่สองงาน ❕ ชี้เป้าของอร่อยและการแสดงสนุกสนานภายในงาน วันที่ 21 - 23 มิถุนายน เวลา 15:00-23:00 น. อ่างเก็บน้ำดอกกราย วันที่ 22-28 มิถุนายน งานวันสุนทรภู่ประจำปี อ.แกลง อนุเสาวรีย์สุนทรภู่ประเพณีบุญบั้งไฟเทศบาลตำบลเวียงคุกประจำปี 2567 วันที่ 21-22 มิถุนายน 2567
ประเพณีบุญบั้งไฟเทศบาลตำบลเวียงคุกประจำปี 2567 ที่จัดขึ้นระหว่างวันที่ 21-22 มิถุนายน 2567 ณ หน้าวัดสาวสุวรรณาราม ตำบลเวียงคุก อำเภอเมือง จังหวัดหนองคาย ภายในงานชมขบวนแห่บั้งไฟสวยงาม การจุดบั้งไฟ พร้อมร่วมสืบสานประเพณีบูชาพญาแถน
งานประเพณีบุญบั้งไฟเดือน 7 ประจำปี 2567 เทศบาลเมืองหนองคาย ร่วมกับวัดโพธิ์ชัย 21-25 มิ.ย. 67
งานประเพณีบุญบั้งไฟเดือน 7 ประจำปี 2567 เทศบาลเมืองหนองคายร่วมกับวัดโพธิ์ชัย พระอารามหลวง อำเภอเมือง จังหวัดหนองคาย ขอเชิญร่วมสืบสานประเพณีงานบุญบั้งไฟ
วันที่ 21 มิ.ย. 67 เวลา 13.00 น. พิธีเปิดงานและชมขบวนแห่บั้งไฟของชุมชนภายในเขตเทศบาลเมือง ณ ถนนประจักษ์ฯ หน้าสถานีขนส่งผู้โดยสารจังหวัดหนองคาย
วันที่ 22-25 มิ.ย.67 เวลา 09.00 น. เป็นต้นไป พิธีจุดบั้งไฟตามประเพณี ณ บริเวณทุ่งหนองงูเหลือม บ้านโคกสำราญ ต.ค่ายบกหวาน อ.เมือง จ.หนองคาย
งานเทศกาลผลไม้ไทภูนางิ้ว บ้านนางิ้ว ต.นางิ้ว อ.สังคม จ.หนองคาย 22 มิถุนายน 2567
เชิญเที่ยวงานเทศกาลผลไม้ไทภูนางิ้ว บ้านนางิ้ว ต.นางิ้ว อ.สังคม จ.หนองคาย วันที่22 มิถุนายน 2567 #มีการประกวดผลไม้ - เงาะพวงใหญ่ -แข่งกินเงาะ -อื่นๆ #มีพาลูกค้าเที่ยวสวน -ค่าเข้าชิมเงาะถ่ายรูป50บาท /คน -ค่าเข้าชิมเงาะถ่ายรูป+ทานข้าว+น้ำหวาน 150 บาท /คน -ค่ารถซิ่งพาเที่ยวสวนแบบเหมา500บาท/8คน -ซื้อเงาะกลับ3โล100บาท เก็บเอง -ซื้อเงาะกลับ 1 โล 35 บาท เราตั้งขายกิจกรรมลานดนตรีในสวน Suphanburi Music in the garden 2567 ช่วงวันที่ 23 มิถุนายน - 6 กรกฎาคม2567
กิจกรรมลานดนตรีในสวน Suphanburi Music in the garden เวลา 16.00 น - 21.00 น.
ครั้งที่ 3 เมื่อวันที่ 23 มิถุนายน 2567 ณ สวนเฉลิมภัทรราชินีและหอคอยบรรหาร-แจ่มใส
ครั้งที่ 4 วันที่ 25 มิถุนายน 2567 ณ สวนสาธารณะอำเภอด่านช้าง
ครั้งที่ 5 วันที่ 29 มิถุนายน 2567 ณ ดอนเจดีย์ สตรีทฟู๊ด
ครั้งที่ 6 วันที่ 6 กรกฎาคม 2567 ณ ตลาดท่าช้าง อ.เดิมบางนางบวช
Kraseaw Cross Country 23 มิถุนายน 2567
Kraseaw Cross Country งานวิ่ง cross country พิชิตเส้นทางวิ่งลัดเลาะไปตามสันเขื่อนกระเสียวที่ยาวเป็นอันดับสองของประเทศไทย เส้นทางที่ผสมผสานเส้นทางชุมชนริมน้ำไปตลอดทั้งเส้นทาง START/FINISH : ณ อาคารศาตร์พระราชาเขื่อนกระเสียว อำเภอด่านช้าง จังหวัดสุพรรณบุรี วันจัดกิจกรรม 23 มิถุนายน 2567 ระยะเส้นทางวิ่ง 5 KM. / 10 KM. / 21 KM. / 35 KM.
24 มิถุนายน 2567 การบรรยาย “Genomics Thailand: Now and Future” โดย ศ. นพ.มานพ พิทักษ์ภากร ศูนย์จีโนมิกส์ศิริราช
การบรรยาย
“Genomics Thailand: Now and Future” วิทยากร โดย ศ. นพ.มานพ พิทักษ์ภากร ศูนย์จีโนมิกส์ศิริราช วันจันทร์ที่ 24 มิถุนายน 2567 เวลา 12.00 -13.00 น. ณ ห้องประชุม 304 -305 ชั้น 3 อาคารศูนย์วิจัยการแพทย์ศิริราช คณะเเพทยศาสตร์ศิริราชพยาบาล เริ่มลงทะเบียน เข้างานเวลา 11.30 น. เป็นต้นไป
ลงทะเบียนเข้าร่วมการประชุม โดยไม่เสียค่าใช้จ่าย ตั้งแต่วันนี้จนถึงวันที่ 21 มิถุนายน 2567 (รูปแบบการประชุม Hybrid meeting มีอาหารกลางวันสำหรับผู้ที่ลงทะเบียนล่วงหน้าแบบ onsite และ ถ่ายทอดสดผ่านระบบ zoom meeting)
25 มิถุนายน 2567 พื้นที่พบการเกิดโรค 8 จังหวัด 11 จุด
นายสัตวแพทย์สมชวน รัตนมังคลานนท์ อธิบดีกรมปศุสัตว์ เปิดเผยถึงสถานการณ์โรคพิษสุนัขบ้า ประจำวันที่ 25 มิถุนายน 2567 ว่ามีการส่งตัวอย่างส่งตรวจสะสมปี 2567 จำนวน 2976 ตัวอย่าง ผลบวกสะสมจำนวน 174 ตัวอย่าง ชนิดสัตว์ที่เกิดโรค แบ่งเป็นสุนัข 155 โค 13 แมว 3 กระบือ 3 โดยมีพื้นที่ที่พบการเกิดโรค 8 จังหวัด 11 จุด ได้แก่ จังหวัดจันทบุรี บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ มหาสารคาม ตาก และสุพรรณบุรี
ปัจจุบันมีพื้นที่ควบคุมที่พบการเกิดโรค 11 จุด ประกอบด้วย จังหวัดศรีสะเกษ สุรินทร์ จันทบุรี ชลบุรี บุรีรัมย์ อุบลราชธานี มหาสารคาม ตาก สุพรรณบุรี มีพื้นที่เฝ้าระวังการเกิดโรค 163 จุด ประกอบด้วย จังหวัดสงขลา นครศรีธรรมราช พัทลุง สมุทรสงคราม ตาก พิจิตร เลย กาฬสินธุ์ นครพนม มหาสารคาม มุกดาหาร ชัยภูมิ นครราชสีมา บุรีรัมย์ ศรีสะเกษ สุรินทร์ อำนาจเจริญ อุบลราชธานี จันทบุรี ฉะเชิงเทรา ชลบุรี นครนายก ปราจีนบุรี ระยอง สมุทรปราการ สระแก้ว กรุงเทพมหานคร
สำหรับสถานการณ์โรคพิษสุนัขบ้าระหว่างวันที่ 1 ตุลาคม 2566 – 25 มิถุนายน 2567 ทั้งหมด 30 จังหวัด 184 จุด คือ ลพบุรี จันทบุรี สระแก้ว ปราจีนบุรี ชลบุรี ฉะเชิงเทรา ระยอง สมุทรปราการ นครนายก อำนาจเจริญ ชัยภูมิ บุรีรัมย์ สุรินทร์ อุบลราชธานี ศรีสะเกษ ยโสธร นครราชสีมา เลย มหาสารคาม นครพนม กาฬสินธุ์ มุกดาหาร ตาก อุตรดิตถ์ พิจิตร สมุทรสงคราม สุพรรณบุรี นครศรีธรรมราช พัทลุง และสงขลา ซึ่งขณะนี้ กรมปศุสัตว์ยังได้เร่งรัดควบคุมโรคทุกจุดเกิดโรค โดยฉีดวัคซีนรอบจุดเกิดโรค (ring vaccination) ร่วมในการเฝ้าระวัง ป้องกัน และควบคุมโรคได้ หากพบสัตว์แสดงอาการสงสัยเป็นโรคพิษสุนัขบ้าสามารถแจ้งเจ้าหน้าที่ปศุสัตว์อำเภอหรือปศุสัตว์จังหวัดได้ทุกพื้นที่ หรือสอบถามรายละเอียดเพิ่มเติมได้ที่ สายด่วนกรมปศุสัตว์ เบอร์โทรศัพท์ 06 3225 6888 ตลอด 24 ชั่วโมง
Music in the Garden Danchang ด่านช้าง 25 มิถุนายน 2567
อำเภอด่านช้าง ขอเชิญร่วมกิจกรรมลานดนตรีในสวน Music in the Garden Danchang เชิญทุกท่านมานั่งชิลฟังดนตรีสด ดื่มดำบรรยากาศยามเย็นในสวนสาธารณะ ล้อมรอบด้วยบูธอาหารเครื่องดื่ม ร้านค้าชุมชน และพบกับบูธเสื้อ 50 ปี อำเภอด่านช้าง เพื่อสนับสนุนกองทุนช่วยเหลือผู้ยากไร้ ผู้ประสบภัย และสนับสนุนภารกิจช่วยเหลือสังคมของอำเภอด่านช้าง มาร่วมทำบุญกันเยอะๆ นะคะ ในวันที่ 25 มิถุนายน 2567 เวลา 16.00 - 22.00 น. ณ สวนสาธารณะอำเภอด่านช้าง (สระน้ำข้างที่ว่าการอำเภอด่านช้าง)
26 มิถุนายน รพ.เจ้าพระยาอภัยภูเบศร ร่วมพิธีแสดงความอาลัย และขอขมากรรมผู้บริจาคอวัยวะ ชายไทย อายุ 51 ปี
26 มิถุนายน 2567 แพทย์หญิงชนิดา สยุมภูริจินันท์ ผู้อำนวยการโรงพยาบาลเจ้าพระยาอภัยภูเบศร พร้อมด้วยคณะผู้บริหาร ได้ร่วมพิธีแสดงความอาลัย และขอขมากรรมผู้บริจาคอวัยวะ ชายไทย อายุ 51 ปี โดยได้รับ ไต 2 ข้าง ดวงตา 2 ดวง โดยจะมอบให้กับศูนย์บริจาคอวัยวะ สภากาชาดไทย ผ่านทางโรงพยาบาลเจ้าพระยาอภัยภูเบศร เพื่อนำไปปลูกถ่ายให้แก่ผู้ป่วยที่รอรับการปลูกถ่ายอวัยะ ซึ่งในการบริจาคอวัยวะครั้งนี้ ได้รับเกียรติจาก นางจารุณี กาวิล รองผู้ว่าราชการจังหวัดปราจีนบุรี/รองนายกเหล่ากาชาดจังหวัดปราจีนบุรี พร้อมด้วยเหล่ากาชาดจังหวัดปราจีนบุรี เเละเเพทย์หญิงอรรัตน์ จันทร์เพ็ญ นายเเพทย์สาธารณสุขจังหวัดปราจีนบุรี ในการมอบใบประกาศเกียรติคุณให้แก่ญาติของผู้วายชนม์ ในท้ายนี้ โรงพยาบาลเจ้าพระยาอภัยภูเบศร ต้องขอขอบพระคุณท่านผู้มีเมตตาที่เสียสละบริจาคอวัยวะเพื่อเป็นการต่อลมหายใจให้อีกหลายชีวิต ความดีที่ไม่มีสิ้นสุด คือการที่ได้บริจาคอวัยวะเมื่อยามสิ้นสูญ ขอให้บุญกุศลที่ได้ทำส่งผลให้ท่านไปสู่ภพภูมิที่ดี และขอให้ครอบครัวของท่านพบแต่ความสุขความเจริญยิ่ง ๆ ขึ้นไป
งานสมโภช 182 ปี เจ้าพ่อหลักเมืองสงขลา 27 มิถุนายน - 3 กรกฎาคม 2567
งานสมโภช 182 ปี เจ้าพ่อหลักเมืองสงขลา 27 มิถุนายน - 3 กรกฎาคม 2567 ณ ศาลเจ้าพ่อหลักเมืองสงขลา ชมงิ้วทุกคืน ชิมของหรอย เดินถนนนางงามอิ่มบุญอิ่มใจ เต็มอิ่มตลอด 7 วัน 7 คืน 1 ปีมีครั้งเดียว กับพิธีเปิดยิ่งใหญ่ งานพิธียกเสาโกเต็ง ชมการแสดง ลั่นกลองมหามงคล จ้านกู๋ สิงห์โตทองคู่มงคล และมังกร 5 ธาตุ5 สี 5 มงคล จากค่ายกลมังกร รับชมการแสดงอุปรากรจีน (งิ้ว) อิ่มท้องอิ่มบุญเก้าห้อง 9 บาทชมการแสดงคณะมังกร พิธีอัญเชิญองค์พระประทับเกี้ยวชมการแสดงคณะมังกร พิธีอิ่วเก้ง แห่พระรอบเมือง พิธีเวียนเทียนสะเดาะเคราะห์ เสริมดวงชะตา พิธีกราบไหว้เนื่องในวันคล้ายวัน ประสูติเจ้าพ่อศาลหลักเมืองสงขลา และกิจกรรมต่างๆ
งาน KHAOKHO PRIDE MONTH 28 มิถุนายน 2567
งาน "KHAOKHO PRIDE MONTH" วันศุกร์ที่ 28 มิ.ย. 2567 พบกันที่ไร่สองเรา เขาค้อ จ.เพชรบูรณ์ งานนี้จัดเต็ม สนุกสนาน ปังๆ แน่นอน แถมยังมีของรางวัลเพียบ ห้ามพลาดเด็ดขาด! ต้องขอขอบคุณผู้ใหญ่ใจดีมากมาย ที่ช่วยสนับสนุนงานนี้จนเป็นจริงได้ ทั้ง Voucher ที่พัก บัตรกำนัล ของรางวัล และเงินสนับสนุน จาก: ททท. สำนักงานพิษณุโลก มาสนุก ปลดปล่อย และแบ่งปันความสุขกัน มาร่วมสร้างความทรงจำดีๆ และเติมเต็มสีสันให้ชุมชนเขาค้อของเรากัน
ขอเชิญชมงานและพิธีมงคลสมรสงานย้อนรอยวิถีชีวิตวัฒนธรรมแห่งสายน้ำแม่กลอง ประจำปี 2567 เสาร์ที่ 29 มิถุนายน 2567
ททท.สำนักงานสมุทรสงคราม ขอเชิญชมงานและพิธีมงคลสมรสงานย้อนรอยวิถีชีวิตวัฒนธรรมแห่งสายน้ำแม่กลอง ประจำปี พ.ศ. 2567 ในวันเสาร์ที่ 29 มิถุนายน 2567 ณ อุทยาน ร.2 อำเภออัมพวา จังหวัดสมุทรสงคราม
จังหวัดสมุทรสงคราม โดยสำนักงานวัฒนธรรมจังหวัดสมุทรสงคราม ร่วมกับอุทยานพระบรมราชานุสรณ์พระบาทสมเด็จพระพุทธเลิศหล้านภาลัย (อุทยาน ร.2) และองค์กรภาคเอกชนในจังหวัดสมุทรสงคราม ร่วมสนับสนุนโครงการย้อนรอยวิถีชีวิตวัฒนธรรมแห่งสายน้ำแม่กลอง ประจำปี พ.ศ. 2567
เพื่อเป็นการย้อนรอยพิธีแต่งานแบบดั้งเดิมตามแนวทางวิถีชีวิตของชาวสมุทรสงครามในอดีต ไม่ว่าจะเป็นการแห่ขันหมากทางน้ำ, พิธีสงฆ์ และพิธีมงคลสมรส รับไหว้ รดน้ำสังข์ เพื่ออนุรักษ์วัฒนธรรมประเพณีการแต่งงานย้อนรอยวิถีชีวิตของคนในชุมชน เผยแพร่ทุนทางวัฒนธรรมและประเพณีของท้องถิ่นอย่างสร้างสรรค์ เพิ่มมูลค่าทางเศรษฐกิจ ก่อให้เกิดรายได้กระจายสู่ชุมชน
โดยในวันเสาร์ที่ 29 มิถุนายน 2567 ขบวนเรือแห่ขันหมากฝ่ายเจ้าบ่าวจะลงเรือ ณ ท่าน้ำ รีสอร์ทนพรัตน์ ตำบลบ้านปรก อำเภอเมือง จังหวัดสมุทรสงคราม ตั้งแต่เวลา 06.30 น. และถึงท่าน้ำบ้านเจ้าสาว ณ เรือนอาวุธสร้าง อุทยาน ร.2 เริ่มพิธีมงคลสมรสต่อไป
เที่ยวชุมชน ยลวิถี วัดปานประสิทธาราม(วัดปีกกา)อ.บางบ่อ 29 มิย. 2567
กิจกรรมฯ "เที่ยวชุมชน ยลวิถี" ณ วัดปานประสิทธาราม(วัดปีกกา)อ.บางบ่อ จ.สมุทรปราการ วันเสาร์ที่ 29 มิถุนายน 2567 พบกับ ตักบาตรทางเรือ กับ concept "ครอบครัวหิ้วตะกร้า ศรัทธาอิ่มบุญ เที่ยวชุมชน ยลวิถี" ชวนแต่งไทย พร้อมเดิน ชิม ช็อป ชิลล์กับตลาดน้ำปีกกา และเก็บภาพประทับใจกับจุด check in มุมสุดปัง (ปล.ใครไม่มีชุดงานนี้ มีให้เช่านะจ๊ะ) และยังพบกับกิจกรรมอีกมากมาย อาทิ การเปิดลานวัฒนธรรม มีทั้งการแสดงดนตรีไทย การรำ การเต้นบาสโลบ และสุดเซอร์ไพรส์พบกับ ครูเอิร์ธ&น้องเควิน☆รายการคุณพระช่วย !!:มาร่วมบรรเลงขลุ่ยไทยสุดฟินส์ และการแสดงเดินแบบผ้าไทย..งามๆ ฯลฯ ที่สำคัญวิวสวย..ของกินอร่อยมาก งานนี้..อิ่มบุญอิ่มใจ..แน่นอน
29 มิถุนายน รพ.เชียงราย ประชานุเคราะห์ มอบพวงหรีด ให้กับญาติผู้บริจาคอวัยวะให้กับสภากาชาดไทย
วันเสาร์ที่ 29 มิถุนายน 2567 คุณประภาศรี นามวงค์ และคุณพรทิพย์ วงษา เป็นตัวแทนผู้บริหารโรงพยาบาลเชียงรายประชานุเคราะห์ มอบพวงหรีด ให้กับญาติผู้บริจาคอวัยวะให้กับสภากาชาดไทย อวัยวะที่ได้รับบริจาคในครั้งนี้ ได้แก่ ไต 2 ข้าง ตับ และ ดวงตา 2 ดวง เพื่อนำไปปลูกถ่ายให้กับผู้ที่รอคอยการรักษาด้วยการปลูกถ่ายอวัยวะ โดยการตัดสินใจของบิดา มารดา เพื่อการบริจาคอวัยวะและดวงตาผู้ป่วยในครั้งนี้ ถือเป็นการทำบุญครั้งยิ่งใหญ่ให้กับผู้ป่วย ขอให้ไปอยู่ในภพภูมิที่ดี ครอบครัวพบแต่ความสุขความเจริญ
29 มิถุนายน โรงพยาบาลราชบุรี รับบริจาคอวัยวะผู้ป่วยหญิงไทย อายุ 66 ปี
30 มิถุนายน 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยหญิงไทย อายุ 66 ปี ได้รับอุบัติเหตุจราจรขี่รถจักรยานชนกับรถยนต์ มีเลือดออกในสมองและสมองชอกช้ำ แพทย์ทำการผ่าตัดด่วนทันที หลังกลับจากผ่าตัดผู้ป่วยยังมีอาการไม่ดี เนื่องจากผู้ป่วยมีโรคประจำตัวหลายโรค แพทย์ได้แจ้งอาการของผู้ป่วยกับบุตรสาวว่าผู้ป่วยมีอาการหนักมาก บุตรสาวรับฟังและเข้าใจอาการของผู้ป่วยจึงขอรักษาแบบประคับประคอง ทางทีมพยาบาลหอผู้ป่วยศัลยกรรมระบบประสาท1 ผู้ดูแลผู้ป่วยจึงได้ให้ข้อมูลเรื่องการบริจาคดวงตา ญาติมีความประสงค์ที่จะบริจาคดวงตาให้กับผู้ที่รอคอยการปลูกถ่ายกระจกตา และเป็นการทำบุญใหญ่ให้กับผู้ป่วยในวาระสุดท้าย ผู้ป่วยได้เสียชีวิตในวันที่ 29 มิถุนายน 2567
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือ การบริจาคดวงตาให้กับศูนย์รับบริจาคดวงตาสภากาชาดไทย ซึ่งถือเป็นการสร้างประโยชน์และกุศลอย่างสูงสุด ในโอกาสนี้ นายแพทย์กิตติ สุวรรณประทีป ประธานservice plan สาขารับบริจาคอวัยวะ คุณเตือนใจ วงทวี ผู้ตรวจการพยาบาล และคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
30 มิถุนายน โรงพยาบาลราชบุรี ผู้ป่วยหญิงไทย อายุ 66 ปี
30 มิถุนายน 2567 โรงพยาบาลราชบุรี ผู้ป่วยหญิงไทย อายุ 66 ปี ได้รับอุบัติเหตุจราจรขี่รถจักรยานชนกับรถยนต์ มีเลือดออกในสมองและสมองชอกช้ำ แพทย์ทำการผ่าตัดด่วนทันที หลังกลับจากผ่าตัดผู้ป่วยยังมีอาการไม่ดี เนื่องจากผู้ป่วยมีโรคประจำตัวหลายโรค แพทย์ได้แจ้งอาการของผู้ป่วยกับบุตรสาวว่าผู้ป่วยมีอาการหนักมาก บุตรสาวรับฟังและเข้าใจอาการของผู้ป่วยจึงขอรักษาแบบประคับประคอง ทางทีมพยาบาลหอผู้ป่วยศัลยกรรมระบบประสาท1 ผู้ดูแลผู้ป่วยจึงได้ให้ข้อมูลเรื่องการบริจาคดวงตา ญาติมีความประสงค์ที่จะบริจาคดวงตาให้กับผู้ที่รอคอยการปลูกถ่ายกระจกตา และเป็นการทำบุญใหญ่ให้กับผู้ป่วยในวาระสุดท้าย ผู้ป่วยได้เสียชีวิตในวันที่ 29 มิถุนายน 2567
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือ การบริจาคดวงตาให้กับศูนย์รับบริจาคดวงตาสภากาชาดไทย ซึ่งถือเป็นการสร้างประโยชน์และกุศลอย่างสูงสุด ในโอกาสนี้ นายแพทย์กิตติ สุวรรณประทีป ประธานservice plan สาขารับบริจาคอวัยวะ คุณเตือนใจ วงทวี ผู้ตรวจการพยาบาล และคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
พิธีและบริจาคปัจจัยทำบุญงานทำบุญซำฮะ บุญเดือน ๗ ประจำปี ๒๕๖๗ เสริมชะตาชีวิต 30 มิถุนายน 2567
วัดโพธิ์ชัย พระอารามหลวง อำเภอเมือง จังหวัดหนองคาย ขอเชิญพุทธศาสนิกชนทุกท่าน ร่วมในพิธีและบริจาคปัจจัยทำบุญงานทำบุญซำฮะ บุญเดือน ๗ ประจำปี ๒๕๖๗ เสริมชะตาชีวิต เพื่อความเป็นสิริมงคล ณ วัดโพธิ์ชัย พระอารามหลวง จังหวัดหนองคาย ในวันอาทิตย์ ที่ ๓๐ มิถุนายน ๒๕๖๗ วันแรม ๙ ค่ำ เดือน ๗ ปีมะโรง เวลา ๑๗.๑๗ น. เป็นต้นไป #ขอพุทธบารมีหลวงพ่อพระใส จงคุ้มครอง ปกปักรักษา เจริญด้วยอายุ วรรณะ สุขะ พละ ตลอดกาลเป็นนิตย์เทอญ
Alternative 12th Anniversary Koh Samui
Alternative 12th Anniversary Koh Samui 5-6 กรกฎาคม 2024 ณ ลานกลางแจ้ง พรุเฉวง
โรงพยาบาลหริภุญชัยฯ งาน Life Balance Smart Family คุณแม่คุณภาพ ลูกน้อยฉลาดและอารมณ์ดี
ในวันพุธที่ 7 สิงหาคม 2567 เวลา 8.30-12.00 น. ณ โถงหน้าห้อง SUPRA ชั้น 2 โรงพยาบาลหริภุญชัย ราม จัดกิจกรรม Life Balance Smart Family คุณแม่คุณภาพ ลูกน้อยฉลาดและอารมณ์ดี” กิจกรรมเตรียมความพร้อมการดูแลคุณแม่และลูกน้อย สำหรับคุณพ่อคุณแม่
ในงานร่วมพูดคุยแลกเปลี่ยนความคิดเห็น ในหัวข้อ “Support คุณแม่อย่างไร ในวันที่แม่ยุคใหม่ต้องทั้งเลี้ยงลูกและทำงาน” กับแพทย์หญิงปรัชญาวรรณ ทองนอก สูติแพทย์ โรงพยาบาลหริภุญชัย ฯ ร่วมพูดคุยในหัวข้อ “แม่ยุคใหม่ใส่ใจลูกน้อย” โดย แพทย์หญิงปิยธิดา จงรักษ์กุมารแพทย์เชี่ยวชาญด้านทารกแรกเกิด และ พว.พรพิมล เอ็งไพบูลย์ หัวหน้าพยาบาล Supra โรงพยาบาลหริภุญชัย ฯ ในหัวข้อ "เลี้ยงลูกให้แข็งแรงด้วยนมแม่" ผู้ร่วมกิจกรรมจะได้รับของที่ระลึก ฟรี ตลอดการจัดงาน
สอบถามข้อมูลเพิ่มเติมได้ที่ แผนกสูติกรรม โทร 053-581111 ต่อ 2601 , แผนกเด็กดี โทร 053-581111 ต่อ 2702 แผนกผู้ป่วยในชั้น 4 โทร 053-581111 ต่อ 4437, 4439
ปฏิทินกิจกรรมในจังหวัดภูเก็ต ประจำเดือน กรกฎาคม 2567
ปฎิทินเที่ยวอุตรดิตถ์ กรกฎาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวเมืองพัทยา เดือนกรกฎาคม 2567
เมืองพัทยา เดือนกรกฎาคม 2567 มีกิจกรรมโดดเด่นที่ต้องไม่พลาดเลย คือ งานแข่งรถยนต์ทางเรียบ (Bangsaen Grand Prix) ตามด้วยการประกวดวาดภาพศิลปะ ริมชายหาดพัทยา การแสดงแสงสีริมทะเลศรีราชา กับ งานวิจิตร@ชลบุรี
ปฏิทินกิจกรรมนครศรีธรรมราช เดือนกรกฎาคม 2567
ปฏิทินท่องเที่ยวเดือนกรกฎาคม - สิงหาคม 2567 LINK
ปฏิทินท่องเที่ยวเดือนกรกฎาคม - สิงหาคม 2567
19 - 21 กรกฎาคม 67
งานวันเกษตรและของดีอำเภอปลายพระยา ขอเชิญเที่ยวงานพร้อมกับชมวิถีถิ่น ชวนกินทุเรียนดี ทุเรียนที่ได้ GI ที่บ้านทะเลหอย อ. ปลายพระยา เค้ายกของดี กาแฟดัง ผลไม้เด็ด รวมถึงอาหารถิ่นมาให้เลือกกินอย่างฟินจ้า ณ สนามหน้าที่ว่าการอำเภอปลายพระยา
FB : เทศบาลตำบลปลายพระยา
31 กรกฎาคม - 4 สิงหาคม 67
งาน “กระบี่อันดามันฮาลาลเฟสติวัล” มาเลือกกินอาหารฮาลาลที่สุดฮหรอย ไม่ฮารอม เพราะฮาลาล ณ มัสยิดกลางประจำจังหวัดกระบี่
FB : สำนักงานคณะกรรมการอิสลามประจำจังหวัดกระบี่
2 - 4 สิงหาคม 67
งาน “ของดี ของหรอย ของอร่อยเหนือคลอง” ชม ชิม ช้อปอาหารหรอยแรงจากร้านเด่น ร้านดังกว่า 100 ร้าน ดนตรี การแสดงต่างๆ 16.00 น. เป็นต้นไป ณ ศาลเจ้าเฉ้งจุ้ยจ้อซู้ก๋ง ชุมชนตลาดในเหนือคลอง จ. กระบี่
FB : เทศบาลตำบลเหนือคลอง
4 สิงหาคม 67
Andaman Cycling 2024ร่วมปั่นจักรยานแบบเป็นมิตรกับสิ่งแวดล้อม ระยะทาง 20 km. , 42 km. , และ 84 km. ณ ที่ว่าการอำเภอเหนือคลอง
FB : ปั่นทุกที่ที่มีทาง
10 สิงหาคม 67
การแข่งขัน Krabi Skimboard Competition ครั้งที่ 2 พบกับการแข่งขัน Skimboard สายคลื่นที่ใหญ่ที่สุดในไทย
FB : Krabi Skimboard Thailand
31 สิงหาาคม - 1 กันยายน 67
งาน กระบี่ไตรกีฬา Krabi TRIATHLONS”
ร่วมสนุกกับการแข่งขันไตรกีฬาระยะมาตรฐาน (Olympic distance) ประกอบด้วย: ???? ว่ายน้ำ 1.5 ก.ม. ปั่นจักรยาน 40 ก.ม. ????????♂️ วิ่ง 10 ก.ม. ณ สวนสาธารณะธารา
FB : Krabi Triathlons
ปฏิทินเทศกาลและกิจกรรมต่างๆ ในจังหวัดสตูล เดือนกรกฎาคม 2567
ปฏิทินเทศกาล และกิจกรรมต่างๆ ในจังหวัดสตูล เดือนกรกฎาคม
ปฏิทินและกิจกรรมท่องเที่ยวฉะเชิงเทรา กรกฏาคม 2567 LINK
1. พายซัพ พายคายัค มาบอกฮัก ลำน้ำบางปะกง วันที่ 13 – 14 กรกฎาคม 2567
ณ แม่น้ำบางปะกง บริเวณตั้งแต่วัดโสธรฯ – สำนักงานทรัพย์สินพระมหากษัตริย์ - วัดโสธรฯ (ระยะทางรวม 7.2 กิโลเมตร)
ดูข้อมูลเพิ่มเติม : https://www.facebook.com/profile.php?id=61561200802248...
สมัครเข้าร่วมกิจกรรมได้ที่ : https://linktr.ee/SUP8Riew
2. งานประจำปีแห่เทียนเข้าพรรษา วัดสมานรัตนาราม วันที่ 18 - 29 กรกฎาคม 2567 (12 วัน 12 คืน) ณ วัดสมานรัตนาราม อ.เมือง จ.ฉะเชิงเทรา
3. งานแรงบันดาลใจแห่งสายน้ำ Inter & Inspire Week 2024 วันที่ 10 - 14 กรกฎาคม 2567 ณ มหาวิทยาลัยราชภัฎราชนครินทร์ อ.เมือง จ.ฉะเชิงเทรา
4. ฤดูกาลชมสวนป่าดอกกระเจียว และงานอนุรักษ์พืชวงศ์ขิง แห่งป่าตะวันออก วันที่ 18 กรกฎาคม – 30 กันยายน 2567 ณ สวนเภตรา อ.สนามชัยเขต จ.ฉะเชิงเทรา
5. ศึกวันมวยไทย บางปะกง ริเวอร์ไฟท์ วันที่ 14 กรกฎาคม 2567 ณ มหาวิทยาลัยราชภัฎราชนครินทร์ อ.เมือง จ.ฉะเชิงเทรา
6. การแข่งขันกอล์ฟ STC Golf forU Golf Tournament 2024 วันที่ 26 กรกฎาคม 2567
ณ ณ สนามกอล์ฟบางปะกง ริเวอร์ไซด์ คันทรีคลับ อ.บ้านโพธิ์ จ.ฉะเชิงเทรา
7. การประกวด “นางสาวน้ำดอกไม้กับนายน้ำหอม” วันที่ 28 กรกฎาคม 2567
ณ ห้างสรรพสินค้าโรบิ??สัน ไลฟ์สไตล์ อ.เมือง จ.ฉะเชิงเทรา
ปฏิทินท่องเที่ยวเชียงราย เดือนกรกฎาคม 2567
ปฏิทินท่องเที่ยวระนอง ประจำเดือน กรกฏาคม 2567
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน กรกฎาคม 2567
ปฏิทินกิจกรรมเพชรบูรณ์ เดือนกรกฎาคม 2567
ปฏิทินกิจกรรมพิษณุโลก เดือนกรกฎาคม 2567
ปฏิทินท่องเที่ยวสมุทรสงคราม ประจำเดือนกรกฎาคม 2567
1-7 ก.ค. 67 เทศกาลบอลงานวัดและมวยตับจากเฟื่องศิริอารีน่า
ณ สนามฟุตบอล เฟื่องศิริอารีน่า จ.สมุทรสงคราม [
พิกัด]
13-15 ก.ค. 67 งานอุปสมบทหมู่ วัดป้อมแก้ว ครั้งที่ 44
ณ วัดป้อมแก้ว จ.สมุทรสงคราม [
พิกัด]
20 ก.ค. 67 ประเพณีการทอดผ้าป่าทางน้ำ
ณ บริเวณหน้าที่ว่าการอำเภอบางคนที จ.สมุทรสงคราม [
พิกัด]
20 ก.ค. 67
กิจกรรม Go Green Clean MAEKLONG
ณ บริเวณท่าน้ำ วัดเพชรสมุทรวรวิหาร จ.สมุทรสงคราม [
พิกัด]
21 ก.ค. 67 ประเพณีแห่เทียนพรรษา และทอดผ้าป่าซาเล้ง
ครั้งที่ 8 ณ ศากลางจังหวัดสมุทรสงคราม สู่วัดดอนมะโนรา จ.สมุทรสงคราม [
พิกัด]
ปฏิทินท่องเที่ยวสมุทรสาคร ประจำเดือนกรกฎาคม 2567
13-14 ก.ค. 67 งานแข่งขันเรือยาวประเพณีจังหวัดสมุทรสาคร ประจำปี 2567 ครั้งที่ 18
ณ สนามคลองชลประทานดี 7 (คลองตาขำ) จ.สมุทรสาคร [
พิกัด]
19 ก.ค. 67 กิจกรรมเนื่องในเทศกาลวันอาสาฬหบูชา และวันเข้าพรรษา
ณ บริเวณหน้าศาลากลางจังหวัดสมุทรสาคร [
พิกัด]
21 ก.ค. 67 ประเพณีแห่เทียนพรรษา วัดหนองพะอง
ณ บริเวณที่ว่าการอำเภอกระทุ่มแบน จ.สมุทรสาคร (งดแห่ทางน้ำ) [
พิกัด]
ปฏิทินท่องเที่ยวจังหวัดนครปฐม เดือนกรกฎาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวเดือนกรกฎาคม 2567 ในจังหวัดสระแก้ว
ปฏิทินกิจกรรมท่องเที่ยวเดือนกรกฎาคม 2567 ในจังหวัดปราจีนบุรี
ปฏิทินกิจกรรมท่องเที่ยวเดือนกรกฎาคม 2567 ในจังหวัดนครนายก
ปฏิทินกิจกรรมท่องเที่ยว จ.หนองคาย เดือน กรกฎาคม 2567
ปฏิทินกิจกรรม จ.อุดรธานี เดือนกรกฏาคม 2567
ปฏิทินกิจกรรมเด่นบึงกาฬ เดือนกรกฎาคม 2567
ปฏิทินกิจกรรมสุราษฎร์ธานี เดือนกรกฎาคมและสิงหาคม 2567
Amazing Surat Coff Craft งานที่คอกาแฟพลาดไม่ได้
10-14 กรกฎาคม 2567 ณ ศูนย์การค้าเซนทรัลสุราษฎร์ธานี
งานเทศกาลเงาะโรงเรียนนาสาร ครั้งที่ 32 ประจำปี 2567
4-15 กรกฎาคม 2567 ณ ริมคลองฉวาง อ.บ้านนาสาร
งาน Amazing Muay Thai Experience
2-4 สิงหาคม 2567 ณ สวนสาธารณะแหลมโพธิ์ อ.ไชยา จ.สุราษฎร์ธานี
ปฏิทินกิจกรรมในจ.พังงา เดือนกรกฎาคม 2567
Music Mountain Mist
6 กรกฎาคม 2567 สวนสาธาณะเฉลิมพระเกียรติ สมเด็จพระศรีนครินทราบรมราชชนนี 80 พรรษา เมืองพังงา
Khaolak Surf Festival 2024
12-14 กรกฎาคม 2567 หาดปะการัง เขาหลัก
การแข่งไตรกีฬานานาชาติ
20 กรกฎาคม 2567 สะพานคนเดิน บ้านท่านุ่น
ㅤ
Amazing Beach Life Festival 2024
26-28 กรกฎาคม 2567 หาดเมมโมรี่ส์ เขาหลัก
ปฏิทินกิจกรรมเที่ยวบุรีรัมย์ เดือนกรกฎาคม 2567
กิจกรรมตลอดเดือนกรกฎาคม
วันที่ 5-7 กรกฎาคม 2567
“OR BRIC Superbike 2024 สนามที่ 3”
ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 21-22 กรกฎาคม 2567
“ประเพณีแห่เทียนพรรษา อำเภอประโคนชัย”
ณ หน้าที่ว่าการอำเภอประโคนชัย
สอบถามเพิ่มเติมโทร : 044 671 488
วันที่ 27-28 กรกฎาคม 2567
“Idemitsu Super Turbo Thailand 2024 สนาม 5-6”
ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท
(ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ถนนรมย์บุรี
เดือนต่อไปจะพาไปพบกับกิจกรรมท่องเที่ยวที่ไหน... อย่าลืมกดติดตามไว้นะคะ จะได้ไม่พลาดแหล่งท่องเที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม
เปิดพิชิตลานสนภูสอยดาว 1 กรกฎาคม 2567
1 กรกฎาคม 2567 เปิดภูสอยดาว พิชิตลานสน ภูสอยดาว "มนต์เสน่ห์ขุนเขา-ไอหมอก หยอกราชินีหงอนนาคแห่งลานสน" อุทยานแห่งชาติภูสอยดาว จ.อุตรดิตถ์
ขั้นตอนการจองพักแรมบนลานสน กิจกรรม คำ-ธรรม-นาย (COME THAM 9) เริ่ม 1 กรกฎาคม - 10 กันยายน 2567
กิจกรรม คำ-ธรรม-นาย (COME THAM 9) เริ่ม 1 กรกฎาคม - 10 กันยายน 2567 กิจกรรมขอพรสิ่งศักดิ์สิทธิ์ในรูปแบบใหม่ และเช็คอินสะสมแต้มตามสถานที่ทั้งหมด 58 แห่ง เพื่อลุ้นรับของรางวัลพิเศษ สายมูที่ชอบความ Cute ไม่ควรพลาด พบกันที่จังหวัดเชียงใหม่ และ จังหวัดเชียงราย เตรียมตัวให้พร้อม แล้วมาร่วมสนุกกันเยอะๆนะคะ
ดินแดนหิ่งห้อย ปราจีนบุรี เปิดชมทางการ 1 กรกฎาคม 2567 LINK
เชิญชมดินแดนหิ่งห้อยนับหมื่น ในส่วนป่าค่ายพรหมโยธี เปิดให้ชมอย่างเป็นทางการ ในวันจันทร์ที่ 1 กรกฎาคม 2567 เป็นต้นไป (เวลาที่พีค มีหิ่งห้อยเยอะที่สุด จะเป็นช่วง 18.30- 20.30 น.)
* เป็นปรากฎการณ์ทางธรรมชาติที่ 1 ปี มีเพียง 1 ครั้ง ซึ่งช่วงนี้เป็นช่วงฤดูที่หิ่งห้อยนับหมื่นตัว ในสวนป่าค่ายพรหมโยธี ออกมาบินว่อนให้นักท่องเที่ยวได้ยลโฉมรับชมความสวยงามทางธรรมชาติของระบบนิเวศที่ยังไม่ถูกทำลาย
สำหรับข้อมูลการเข้าชม
- ตั้งอยู่ ณ กรมทหารปืนใหญ่ที่ 2 รักษาพระองค์ฯ ค่ายพรหมโยธี ทางหลวงหมายเลข 33 (เส้นเก่า) ต.ไม้เค็ด อ.เมือง ปราจีนบุรี - สอบถามข้อมูลการเข้าชมเพิ่มเติมที่หน่วยรับผิดชอบพื้นที่ดังกล่าว โทร.037-570030
แผนที่
ดินแดนหิ่งห้อยปราจีนบุรี 1 กรกฎาคม 2567 เป็นต้นไป
ปรากฎการณ์ทางธรรมชาติที่ 1 ปี มีเพียง 1 ครั้ง ซึ่งช่วงนี้เป็นช่วงฤดูที่หิ่งห้อยนับหมื่นตัว ในสวนป่าค่ายพรหมโยธี ออกมาบินว่อนให้นักท่องเที่ยวได้ยลโฉมรับชมความสวยงามทางธรรมชาติของระบบนิเวศที่ยังไม่ถูกทำลาย พร้อมเปิดให้ชมอย่างเป็นทางการ ในวันจันทร์ที่ 1 กรกฎาคม 2567 เป็นต้นไป
สำหรับข้อมูลการเข้าชม ตั้งอยู่ ณ กรมทหารปืนใหญ่ที่ 2 รักษาพระองค์ฯ ค่ายพรหมโยธี ทางหลวงหมายเลข 33 (เส้นเก่า) ต.ไม้เค็ด อ.เมือง ปราจีนบุรี สอบถามข้อมูลการเข้าชมเพิ่มเติมที่หน่วยรับผิดชอบพื้นที่ดังกล่าว โทร.037-570030
Location Map เวลาที่พีค มีหิ่งห้อยเยอะที่สุด จะเป็นช่วง 18.30- 20.30 น.
*** ข้อเน้นย้ำ สำหรับข้อมูลการเข้าชม ขอให้ทุกคนที่เข้าชม ปฏิบัติตามกฎ เพื่อให้ความสมบูรณ์ของธรรมชาติอยู่กับเรานานๆ นะครับ
- ไม่จับหิ่งห้อย
- ไม่ควรใช้สเปรย์กันยุง
- ไม่ควรเปิดไฟรถ หรือไฟฉายบริเวณรอบๆ เพราะเป็นการรบกวนผู้อื่น และรบกวนหิ่งห้อย
#ดินแดนหิ่งห้อยปราจีนบุรี
กิจกรรมมูแลนด์แดนอีสาน เที่ยวฤดูฝน ยังงัยให้ปัง 1 ก.ค. – 31 ส.ค. 2567
กิจกรรมมูแลนด์แดนอีสาน เที่ยวฤดูฝน ยังงัยให้ปัง ททท.อีสาน จัดกิจกรรม "มูแลนด์ แดนอีสาน" ด้วยการ "เช็คอิน วัด ร้านอาหาร โรงแรม" บนเส้นทางสายศรัทธา 5 จังหวัด ได้แก่ อุดรธานี,หนองคาย, บึงกาฬ,นครพนมและมุกดาหาร ลุ้นรับวัตถุมงคล " พญานาคเกี้ยว " ที่ปลุกเสกโดยพระเกจิสายตรงหลวงปู่คำพันธ์ โฆสปัญโญ วัดธาตุมหาชัย จ.นครพนม ฟรี‼ ( เพียง 999 องค์ เท่านั้น) ตั้งแต่วันที่ 1 ก.ค. – 31 ส.ค. 2567 สแกน Q แล้วออกเดินทางได้เลย
งาน “หอมกลิ่น ถิ่นน่าน” 3-5 กรกฎาคม 2567
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานน่าน และภาคีเครือข่ายด้านการท่องเที่ยวน่าน เชิญชวนมาเที่ยวชม งาน “หอมกลิ่น ถิ่นน่าน” วันที่ 3 - 5 กรกฎาคมนี้ ณ ข่วงน้อย อ.เมือง จ.น่าน งานที่จะได้พบได้สัมผัสความเป็นเมืองน่านในหลายมิติ พร้อมความสนุกกับการแสดง ศิลปินบนเวทีในโซนเอ็นเตอร์เทน ตั้งแต่เวลา 19.00 น.
วันพุธที่ 3 กรกฎาคม 2567 : วงแมวเศษเล็บ
วันพฤหัสที่ 4 กรกฎาคม 2567 : วง fellow fellow
วันศุกร์ที่ 5 กรกฎาคม 2567 : เตวิชญ์
กับความสนุกโซนต่างๆ ทั้งโซนกาดศิลป์ถิ่นน่าน โซนอู้ม่วนจ๋าหวาน ถ่ายรูปสวยๆที่โซน Landmark สุดฟินไปกับอาหารท้องถิ่น ในโซนกำกิ๋นสุก และโซนจุ๊มอ๊กเย็นใจ๋
ตลาดนัดแรงงาน ณ ท่าอากาศยานสุวรรณภูมิครั้งที่ 9 วันที่ 3-5 ก.ค. 2567
งาน “ตลาดนัดแรงงาน ณ ท่าอากาศยานสุวรรณภูมิครั้งที่ 9” (Suvarnabhumi Airport Job Fair 2024) ท่าอากาศยานสุวรรณภูมิ ขอเชิญชวนผู้ที่มีภูมิลำเนาอาศัยโดยรอบท่าอากาศยานสุวรรณภูมิ ทั้งในเขตลาดกระบัง และจังหวัดสมุทรปราการ รวมถึงประชาชนทั่วไปที่สนใจมองหางานภายในท่าอากาศยานสุวรรณภูมิ เข้าร่วมงานได้ ตั้งแต่วันที่ 3-5 ก.ค. 2567 เวลา 09.00-15.00 น. ศูนย์การขนส่งสาธารณะ ท่าอากาศยานสุวรรณภูมิ
ในปีนี้มีผู้ประกอบการชั้นนำในท่าอากาศยานสุวรรณภูมิ มากกว่า 30 แห่ง มาออกบูธรับสมัครงานจำนวนหลายอัตรา ในหลากหลายตำแหน่ง เช่น พนักงานคลังสินค้า, เจ้าหน้าที่รักษาความปลอดภัย, ล่ามภาษาจีน, พนักงานขับรถ, พนักงานฝ่ายผลิตครัว, พนักงานขาย, ช่างทุกสาขา โดยรับสมัครวุฒิการศึกษาตั้งแต่ วุฒิ ป.6 ม.3 ปวช. ปวส. และ ป.ตรี
สอบถามข้อมูลเพิ่มเติมได้ที่ ส่วนมวลชนสัมพันธ์ ฝ่ายกิจการพิเศษและมวลชนสัมพันธ์ ท่าอากาศยานสุวรรณภูมิ โทร. 0 2132 9040 และ 0 2132 9042
งานเทศกาลเงาะโรงเรียนนาสาร (GI) ครั้งที่ 32 ประจำปี 2567 วันที่ 4-15 กรกฎาคม 2567
งานเทศกาลเงาะโรงเรียนนาสาร (GI) ครั้งที่ 32 ประจำปี 2567 ระหว่างวันที่ 4-15 กรกฎาคม 2567 ณ ริมคลองฉวาง อำเภอบ้านนาสาร จังหวัดสุราษฎร์ธานี จัดโดย เทศบาลเมืองนาสาร กิจกรรมมากมาย ได้แก่ พิธีทำขวัญเงาะโรงเรียนนาสาร กิจกรรมขบวนแห่รถพฤกษชาติ ในพิธีเปิดงานเทศกาล การจัดประกวดขบวนแห่รถพฤกษชาติ จำนวน 24 ขบวน การแข่งขันกรีดยาง กิจกรรมแข่งขันกินเงาะโรงเรียนนาสาร การประกวดธิดาเงาะโรงเรียนนาสารและขวัญใจชาวสวน การประกวดสวนผลไม้ กิจกรรมคาวบอนไนท์ ประกวดโคและการจัดทัวร์สวนผลไม้ กิจกรรมแข่งขันประกอบอาหารคาว(ขนมจีนน้ำยาปลาใส่กะทิ) และอาหารหวาน ประจำปี 2567 กิจกรรรมประกวดโคเนื้อสุราษฎร์ธานี
งาน “Second Hand Warehouse” 5-6 กรกฎาคม 2567
ชวนเที่ยวงาน “Second Hand Warehouse” 5 - 6 กรกฎาคม 2567 เวลา 10.00-23.00 น. The Union Nakhon Si Thammarat ครั้งแรกของนครศรีธรรมราชกับการรวบรวมกิจกรรมมากมายให้เหล่าสาย Street ????ตัวพ่อ! ตัวแม่! ได้เตรียมตัวมาจอยกัน ภายในงาน พบกับ มินิคอนเสิร์ตสายเมทัล จากวงชั้นนำของไทย, ตลาดวินเทจเสื้อผ้าชั้นนำจากทั่วภาคใต้, กลุ่ม Nakhon Coffee Community ที่รวบรวมกาแฟทุกรสชาติมาไว้ที่นี่, โชว์รูม Vespa, Skete jam จากกลุ่ม Skateboard ที่จะมาโชว์เทคนิคต่างๆเกี่ยวกับ Skateboard, Art Exhibition ศิษย์เก่ารั้วศิลปากรที่จะมาถ่ายทอดเรื่องราวภาพวาดจากสีธรรมชาติทำมือ
ไฮไลท์ภายในงาน จัดเต็มความสนุกกับศิลปินแนว Metal จากวงชั้นนำที่พร้อมระเบิดความมันส์ ไม่ว่าเป็นเป็น Whispers ๐ Rexrez ๐ Ecchymosis ๐ Biomorphic Engulfment ๐ Big Shock Band ๐ Blue Weekend ๐ DJ Supertatham ๐ DJ Iron Head เตรียมตัวให้พร้อม แล้วไปมันส์ด้วยกันแบบติดขอบเวที
ละครเลือดสุพรรณ 6 กรกฎาคม 2567 โรงละครแห่งชาติภาคตะวันตก สุพรรณบุรี LINK
กรมศิลปากร กระทรวงวัฒนธรรม ขอเชิญชมการแสดงละคร เรื่อง เลือดสุพรรณ ในวันเสาร์ที่ 6 กรกฎาคม 2567 เวลา 18.00 น. ณ โรงละครแห่งชาติภาคตะวันตก จังหวัดสุพรรณบุรี ประกอบการบรรเลงและขับร้องเพลงไทย และเพลงไทยสากล โดยวงดุริยางค์ไทย และวงดุริยางค์สากล สำนักการสังคีต นำแสดงโดยนาฏศิลปินรุ่นใหม่ อาทิ ปริญเมศร์ จูไหล รับบท มังราย นงลักษณ์ กลีบศรี รับบท ดวงจันทร์ วัชรวัน ธนะพัฒน์ รับบท มังมหาสุรนาท กำกับการแสดงโดย ปกรณ์ พรพิสุทธิ์ อำนวยการแสดงโดย ลสิต อิศรางกูร ณ อยุธยา ผู้อำนวยการสำนักการสังคีต เริ่มจำหน่ายในวัน 1 มิถุนายน 2567 เป็นต้นไป ผ่านช่องทางไลน์ทางการ บัตรราคา 80 บาท และ 60 บาท
ล่าสุด กรมศิลปากรจึงตัดสินใจเพิ่มรอบการแสดงอีกหนึ่งรอบในวันอาทิตย์ที่ 7 กรกฎาคม 2567 เวลา 14.00 น.
6 กรกฎาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยชายไทย อายุ 58 ปี
6 กรกฎาคม 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยชายไทย อายุ 58 ปี มาโรงพยาบาลด้วยอาการชาขาทั้ง 2 ข้าง อ่อนเพลีย วัดความดันโลหิตต่ำกว่าปกติ แพทย์ส่งเอกซเรย์ฉีดสีที่ขา พบว่ามีหลอดเลือดแดงใหญ่ฉีกขาด ได้ปรึกษาแพทย์เฉพาะทางเกี่ยวกับหลอดเลือด แพทย์พบว่าผู้ป่วยมีอาการรุนแรงมากและผู้ป่วยมีโรคประจำตัวหลายโรค ไม่สามารถทำการรักษาได้ จึงแจ้งข้อมูลกับญาติผู้ป่วย ญาติขอรักษาแบบประคับประคอง แพทย์จึงให้นอนพักรักษาตัวที่หอผู้ป่วยศัลยกรรมทรวงอกและหลอดเลือด ทางทีมพยาบาลผู้ดูแลผู้ป่วยได้ให้ข้อมูลเรื่องการบริจาคดวงตา ญาติมีความประสงค์ที่จะบริจาคดวงตาให้กับผู้ที่รอคอยการปลูกถ่ายกระจกตา และเป็นการทำบุญใหญ่ให้กับผู้ป่วยในวาระสุดท้าย ผู้ป่วยเสียชีวิตในวันที่ 5 กรกฎาคม 2567
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้กับศูนย์รับบริจาคดวงตาสภากาชาดไทย ซึ่งถือเป็นการสร้างกุศลอย่างสูงสุด ในโอกาสนี้ นายแพทย์กิตติ สุวรรณประทีป ประธาน service plan สาขารับบริจาคอวัยวะ นายแพทย์ชลธาร บำราศอรินทร์พ่าย แพทย์ประจำหอผู้ป่วยศัลยกรรมทรวงอกและหลอดเลือด และนางชนัดดา พันธ์มี ผู้ตรวจการพยาบาลและคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตรและพวงหรีดเพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
งานประเพณีบุญหลวงและการละเล่นผีตาโขน ประจำปี 2567 (7-9 กรกฎาคม 2567)
งานประเพณีบุญหลวงและการละเล่นผีตาโขน ประจำปี 2567อำเภอด่านซ้าย จังหวัดเลย 7-9 กรกฎาคม 2567 สอบถามเพิ่มเติม : 042 812 812 ททท. สำนักงานเลย (เลย,หนองบัวลำภู)
8 กรกฎาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยหญิงไทยอายุ 42 ปี
"ขอบคุณมากที่มาบอกบุญให้ลูกป้าได้ทำบุญใหญ่ครั้งสุดท้าย"
คำกล่าวของมารดาผู้บริจาคอวัยวะ ผู้ป่วยหญิงไทยอายุ 42 ปี มีอาการปวดศีรษะ อาเจียนพุ่ง ซึมลง ญาติจึงนำส่งโรงพยาบาลราชบุรี แพทย์ส่งเอกซเรย์คอมพิวเตอร์สมองพบว่ามีเลือดออกในสมองขนาดใหญ่ และได้เข้ารับการรักษาที่หอผู้ป่วยศัลยกรรมระบบประสาท1 แพทย์เจ้าของไข้แจ้งอาการกับญาติว่าผู้ป่วยมีอาการหนักมาก ญาติตัดสินใจรักษาแบบประคับประคอง ทางทีมพยาบาลผู้ดูแลผู้ป่วยได้ให้ข้อมูลการบริจาคอวัยวะ ญาติมีความประสงค์ที่บริจาคอวัยวะทุกส่วนที่สามารถไปช่วยผู้ที่รอการเปลี่ยนถ่ายอวัยวะ ทางทีมบริจาคอวัยวะได้มาดูแลผู้ป่วย แต่ผู้ป่วยมีโรคประจำตัวหลายโรค จึงบริจาคได้เพียงผิวหนัง กระดูกและดวงตาทั้ง 2 ข้าง
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคผิวหนังให้กับคลังเนื้อเยื่อ สภากาชาดไทย กระดูกให้กับศูนย์เนื้อเยื่อชีวภาพกรุงเทพฯในพระบรมราชูปถัมภ์และดวงตาให้กับศูนย์ดวงตาสภากาชาดไทย ในโอกาสนี้ นายแพทย์ปิยะณัฐ บุญประดิษฐ์ รอง ผู้อำนวยการฝ่ายการแพทย์ โรงพยาบาลราชบุรี นางสกาวเดือน ขำเจริญ รองผู้อำนวยการฝ่ายการพยาบาล และคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
สะแกกรัง มาราธอน 2023 วันที่ 9 กรกฎาคม 2566 LINK
จังหวัดอุทัยธานี เทศบาลเมืองอุทัยธานี ชมรมวิ่งเมืองพระชนกจักรี ร่วมกับการท่องเที่ยวแห่งประเทศไทย สำนักงานอุทัยธานี และสำนักงานการกีฬาแห่งประเทศไทย จังหวัดอุทัยธานี จัดงานวิ่ง "สะแกกรัง มาราธอน 2023" ในวันที่ 9 กรกฎาคม 2566 ณ สวนน้ำเฉลิมพระเกียรติ บึงพระชนก เพื่อส่งเสริมการออกกำลังกาย การแข่งขันกีฬา และการท่องเที่ยวในจังหวัดอุทัยธานี
เปิดรับสมัคร แบ่งเป็น 4 ระยะ คือ
• มาราธอน ระยะทาง 42.195 กม.
• ฮาล์ฟ มาราธอน ระยะทาง 21.1 กม.
• ซูเปอร์มินิมาราธอน ระยะทาง 12.5 กม.
• ฟันรัน ระยะทาง 5 กม.
นักวิ่งที่สมัครแต่ละระยะจะได้รับเสื้อแข่งขัน เมื่อวิ่งเข้าเส้นชัยจะได้รับเหรียญที่ระลึก ระยะฮาล์ฟมาราธอนและฟูลมาราธอน วิ่งจบในเวลาจะได้รับเสื้อฟินิชเชอร์อีก 1 ตัว
10-12 ก.ค. 2567 การจัดประชุมวิชาการ SICMPH 2024
งานประชุมวิชาการนานาชาติด้านการแพทย์และการสาธารณสุข SICMPH 2024 (Siriraj Conference in Medicine and Public Health) ประจำปี 2567 กำหนดจัดวันที่ 10-12 ก.ค. 2567 ณ อาคารศรีสวรินทิรา รพ.ศิริราช สำหรับปีนี้มีความพิเศษคือ มีนิทรรศการเฉลิมพระเกียรติ ๗๒ พรรษา พระบาทสมเด็จพระวชิรเกล้าเจ้าอยู่หัว และการจัดกิจกรรมภาคประชาชนพื่อให้ความรู้ด้านสุขภาพแก่ผู้สนใจทั่วไปอีกด้วย ซึ่งกิจกรรมทั้งหมดจะจัดขึ้นในระหว่างวันที่ 10-12 กรกฎาคม 2567 สอบถามโทร 024192673 024192674 [รายละเอียดเพิ่มเติมที่
SICMPH 2024]
Inter Inspire week 2024 แรงบันดาลใจแห่งสายน้ำ 10-14 กรกฎาคม 2567 LINK
ขอเชิญเที่ยวงาน “Inter Inspire week 2024: แรงบันดาลใจแห่งสายน้ำ” ระหว่างวันที่ 10-14 กรกฎาคม 2567 ณ มหาวิทยาลัยราชภัฏราชนครินทร์ อ.เมือง จ.ฉะเชิงเทรา กิจกรรมภายใน ประกอบด้วย ชม ชิม ช้อป แชะ Day-Night Market
- ร้านค้า ร้านอาหาร สินค้าชุมชน
- ตลาดวิสาหกิจชุมชน/OTOP ตลาดพอเพียง (สถาบันเศรษฐกิจพอเพียง มรร.)
- ร้านอาหารจากผู้ประกอบการที่รังสรรค์เมนูอัตลักษณ์ท้องถิ่น Soft Power ในโครงการ Integrated Smart Gastronomy Design
- ตลาดของดีของเด่น 43 ตำบล เส้นทางการท่องเที่ยว 1 ตำบล 1 เส้นทาง และผลิตภัณฑ์เด่น
- ตลาดผ้าพื้นถิ่นเมืองแปดริ้ว
- ตลาดโอกาสดี (O-Kart-D) อ.คลองเขื่อน
- ผลิตภัณฑ์อาหารแปรรูปจากปลานิลอารมณ์ดี อ.คลองเขื่อน
- นิทรรศการแสดงผลงานของคณะและหน่วยงานในมหาวิทยาลัย
- นิทรรศการโครงการยุทศาสตร์เพื่อการพัฒนาท้องถิ่น
- นิทรรการภาพเก่าเล่าเรื่อง และผลงานศิลปะเกี่ยวกับเมืองฉะเชิงเทรา
- นิทรรศการผลงาน และ Work Shop งานศิลปะ จากศิลปินท้องถิ่น
- นิทรรศการภาพศิลปะร่วมสมัย 38 มหาวิทยาลัยราชภัฏ
- กิจกรรม Walk Rally Tourisms, Food, Art รับของที่ระลึกจากชมรมธนาคารและผู้ประกอบการภาคอุตสาหกรรมในพื้นที่
- กิจกรรม “หิ้วปิ่นโตมาชิม–ถือตระกร้ามาช้อป” เป็นส่วนหนึ่งในการขับเคลื่อนการท่องเที่ยว Low Carbon
- กิจกรรม หิ้วถุงผ้า มาช้อป” เป็นส่วนหนึ่งในการขับเคลื่อนฉะเชิงเทรา Net Zero 2050
- ชมการแสดง Mini Concert จากศิลปิน
10 ก.ค. พบกับ ศิลปิน เฟิร์ส พรชิตา
11 ก.ค. พบกับ ศิลปิน แบงค์ คอพับ
12 ก.ค. พบกับ ทศพล หิมพานต์ -บัว กมลทิพย์
13 ก.ค. พบกับ ศิลปิน ทิดแอม
14 ก.ค. พบกับ ศิลปิน Sixnight รังสิตมันร้าย
- เสวนา “พลังสร้างสรรค์ (Soft Power) สืบสานคุณค่าดนตรี คีตศิลป์ ราชนครินทร์สู่การพัฒนาท้องถิ่น”
- กิจกรรมการประกวด Soft Power
- การประกวดวงดนตรีสากล การประกวดเดี่ยวเครื่องดนตรีไทย และการประกวดการแสดงศิลปะวัฒนธรรม ของนักเรียนระดับมัธยมศึกษา
- ชมโชว์เมนูอัตลักษณ์ท้องถิ่น Soft Power จากผู้ประกอบการในโครงการ Integrated Smart Gastronomy Design
- ชมโชว์ “ของดีของเด่น 43 ตำบล”
- การประกวดเมนูอาหารฟิวชั่น การประกวดเมนูอหารตามอัตลักษณ์ท้องถิ่น
- ชมการแสดงวาดภาพศิลปะ ธีม “แรงบันดาลใจแห่งสายน้ำ” โดย กลุ่มศิลปิน คณาจารย์ นักศึกษา
- ชมแฟชั่นโชว์ “ผ้าพื้นถิ่นเมืองฉะเชิงเทรา”
- มวยไทย Soft Power “ศึกวันมวยไทย บางปะกงริเวอร์ ไฟท์” วันที่ 14 ก.ค. 67
งาน Amazing Surat Coff Craft 10-14 กรกฎาคม 2567
มาสัมผัสกลิ่นหอมละมุน จนต้องลองชิมทุกเมนูเครื่องดื่มภายในงาน Amazing Surat Coff Craft ชั้น 1 ศูนย์การค้าเซ็นทรัล สุราษฎร์ธานี 10-14 กรกฎาคม 2567 พบกับร้านกาแฟที่มีชื่อเสียง เมนูกาแฟหลากหลายที่รังสรรค์จากวัตถุดิบท้องถิ่นของสุราษฎร์ธานี อาทิ กาแฟไข่เค็ม กาแฟเงาะ กาแฟมังคุดสกัดเย็น และการโชว์ฝีมือจากบาริสต้าชื่อดัง
Sakaeo Craft Coffee & Friend ครั้งที่ 2 LINK
กลับมาอีกครั้ง งานกาแฟเล็กๆ ของเราชาวสระแก้ว Sakaeo Craft Coffee & Friend วันที่ 11-12 สิงหาคม 2567 มาคราวนี้อบอุ่มกว่าเดิม เพราะเรามีสมาชิกเพิ่มขึ้นทั้ง Handcraft, Specialty Coffee, Coffee Roasters และกลุ่มคนรัก chocolate จังหวัดสระแก้ว รวมพลมาสร้างสีสันและให้สาระดีๆ ในงาน เราจะได้รู้จักกรรมวิธีการทำโกโก้ แบบละเอียดทุกขั้นตอน พร้อมกับช็อปผลิตภัณฑ์จากโกโก้ติดไม้ติดมือกลับบ้านไปด้วย
มาร่วมสนุกด้วยกัน เข้าชมงานฟรี ไม่มีค่าใช้จ่าย อย่าลืมเอาเก้าอี้สนามมากันนะจ้ะ
เริ่มตั้งแต่ 10.00 - 22.00 น.
สถานที่ : รร. ลา วิลล่า บูทีค (la villa boutique hotel)
ติดตามข่าวสารและสอบถามรายละเอียดเพิ่มเติมได้ที่ https://www.facebook.com/Specialty.Sakaeo/
หรือโทร 094-9239245 หรือ 092-6545588
Amazing Beach Life Festival 2024 @ Rayong 12-14 กรกฎาคม 2567 LINK
เตรียมไปสนุกกันริมชายหาดที่งาน Amazing Beach Life Festival 2024 @ Rayong ตั้งแต่วันที่ 12-14 กรกฎาคม 2567 (16:00-22:30 น.) ที่ชายหาดแหลมเจริญ จ.ระยอง
เอาใจสาย Soft Adventure สัมผัสบรรยาการและกิจกรรมหลากหลายริมชายหาด ทั้งกีฬาทางน้ำ ศิลปะดนตรี อาหารและไลฟ์สไตล์ Beach Life พร้อมยกศิลปินชื่อดังมาให้ความสนุกถึงที่ตลอดทั้งงาน
- ส้ม มารีย์
- สิงโต นำโชค
- Fellow Fellow
- SlapKiss
- Serious Bacon
- YourMood
** Free Entry / เข้างานฟรี
ติดต่อ ททท.สำนักงานระยอง : 038-655-420
เทศกาลดนตรี ศิลปะ และกีฬาสุดยิ่งใหญ่ Amazing Beach Life Festival 2024
ททท. จัดใหญ่ จัดเต็มถึง เทศกาลดนตรี ศิลปะ และกีฬาสุดยิ่งใหญ่ Amazing Beach Life Festival 2024 เข้าฟรี ไม่มีค่าใช้จ่าย 4 หาด 4 จังหวัด
วันที่ 12 - 14 ก.ค. หาดแหลมเจริญ จ.ระยอง ธีม Tropical Beach
วันที่ 26 - 28 ก.ค. Memories Beach จ. พังงา ธีม Beach RHYthms
วันที่ 2 - 4 ส.ค. หาดป่าตอง จ.ภูเก็ต ธีม Neon Waves
วันที่ 9 - 11 ส.ค. หาดชลาทัศน์ จ.สงขลา ธีม Art Paradise
ภายในงานเตรียมพบกับกิจกรรมมากมาย ทั้งมินิคอนเสิร์ตจากเหล่าศิลปิน นำทีมโดย F.Hero, Paradox, ออฟ ปองศักดิ์, สิงโต นำโชค, Atom ชนกันต์, ส้มมารี, Zeal, serious bacon, Earth patravee, WIM และเหล่าดีเจอีกมากมาย รวมไปถึงจุดถ่ายรูปต่างๆ ทั้ง Installation Art, Inflatable Landmark รวมถึงกิจกรรมศิลปะ Workshop DIY ที่พลาดไม่ได้จริง ๆ
เทศกาลอาหารและผลไม้ของดีจังหวัดสตูล 12-14 กรกฎาคม 2567
เทศกาลอาหารและผลไม้ของดีจังหวัดสตูล 12-14 กรกฎาคม 2567 ณ ตลาดนัดดุสน ต.ควนโดน อ.ควนโดน จ.สตูล
งาน Amazing Beach Life Festival 12-14 ก.ค. ชายหาดแหลมเจริญ
งาน Amazing Beach Life Festival วันที่ 12-14 ก.ค. ชายหาดแหลมเจริญ ทัพศิลปินและดีเจชื่อดังเพียบ หาดแหลมเจริญ จะลุกเป็นไฟก็งานนี้ Show Time ศิลปินและดีเจทั้ง 2 Stage ตลอดทั้ง 3 วัน กิจกรรมอีกมากมายภายในงาน ทั้งโซนศิลปะถ่ายภาพ Installtion Arts, Inflatable Landmark ปลาหมึกยักษ์ขนาด 7 เมตร พร้อม Workshop DIY จากวัสดุเหลือใช้ให้กลายเป็นพวงกุญแจและลูกปัดสุดน่ารัก ไปกับ YOUเทิร์น อีกทั้งยังเต็มอิ่มไปกับของอร่อยจากหลากหลายร้านอาหาร เครื่องดื่มที่เตรียมขนทัพมาเสิร์ฟความฟินให้ทุกคนแบบจัดเต็มในทุกพื้นที่
งาน Khaolak Surf Festival 2024 วันที่ 12-14 กรกฎาคม 2567
งาน Khaolak Surf Festival 2024 วันที่ 12-14 กรกฎาคม 2567 ที่ หาดปะการัง (ฝั่ง Memories Beach) ตั้งแต่ 10.00 เป็นต้นไป กิจกรรมสนุกสนานภายในงาน ของกินสุดอร่อย และวงดนตรีสุดปังอย่าง "วัชราวลี"
ร้อยเอ็ดบรรพชาอุปสมบทเทิดพระเกียรติ 13 กรกฎาคม - 3 สิงหาคม 2567
พายซัพ พายคายัค มาบอกฮัก…ลำน้ำบางปะกง 13-14 กรกฎาคม 2567 LINK
เตรียมพบกับกิจกรรมทางน้ำสุดคูล พายซัพ พายคายัค มาบอกฮัก…ลำน้ำบางปะกง
พลาดแล้วจะเสียใจนะ
วันที่ 13-14 ก.ค. นี้พบกับกิจกรรมพายซัพบอร์ด และพายเรือคายัค ในรูปแบบการท่องเที่ยวทางน้ำ พร้อมบอกฮัก ลำน้ำบางปะกงด้วยการเก็บขยะที่ตกค้างอยู่ในแม่น้ำ
สำหรับสายคอนเทนต์ บอกเลยว่ากิจกรรมนี้มีคอนเทนต์ปังๆ แน่นอน เพราะเส้นทางที่จัดไว้ 7.2 กม. ได้ผ่านสถานที่สำคัญๆ ของเมืองแปดริ้ว เช่น ชุมชนตลาดเก่า หอนาฬิกาเมืองแปดริ้ว สำนักงานทรัพย์สินพระมหากษัตริย์ กำแพงเมืองเก่า สวนสาธารณริมน้ำ และมุมถ่ายภาพกับโบสถ์วัดโสธรสุดปัง
- แพคเกจสายอุปกรณ์ครบครัน มีซัพบอร์ดหรือเรือพร้อมอุปกรณ์มาเอง จ่ายเพียง 388 บ.
- แพคเกจสายชิว เราเตรียมอุปกรณ์ให้
มาเดี่ยวพายซัพบอร์ด ก็จ่ายเพียง 888 บาท หรือ มาแบบคู่นั่งพายคายัก จ่ายเพียง 1,288 บาท
สุดคุ้ม!!! รับฟรี
1.เสื้อยืดพิมพ์ลายสีจี๊ด ลายอย่างเท่
2.ถุงตาข่ายเดินชายหาดสีเขียวเหนี่ยวทรัพย์
3.ชุดอาหารว่างมื้อพิเศษจากชุมชน
4.ประกันอุบัติเหตุ
5.ลุ้นรางวัลบัตรกำนัล ส่วนลดต่างๆมากมาย
* สอบถามเพิ่มเติม/ลงทะเบียนร่วมกิจกรรมที่นี่ https://linktr.ee/SUP8Riew
* ติดตามได้ที่เพจ : พายซัพ พายคายัค มาบอกฮัก ลำน้ำบางปะกง
https://www.facebook.com/profile.php?id=61561200802248...
วน “เวียน” เจียงฮาย 13 กรกฎาคม 2567
ขอเชิญชวนคนเจียงฮาย มาร่วมออกไอเดียขนส่งสาธารณะที่ใช่ไปด้วยกัน ในงานกิจกรรม วน “เวียน” เจียงฮาย วันที่ 13 กรกฎาคม 2567 เวลา 09.00 - 16.00 น. ณ หอประชุมอาคารคชสาร อบจ.เชียงราย
เพราะใครจะรู้จักเมืองเชียงรายได้ดีกว่าคนเชียงราย คราวนี้ Mayday! ร่วมกับ CEA องค์การบริหารส่วนจังหวัดเชียงราย เทศบาลนครเชียงราย และภาคีเครือข่ายสถาบันการศึกษา ร่วมจัดกิจกรรมเวิร์กชอปชวนคนเชียงรายมาปักหมุด ขีดเส้นสาย ความเป็นไปได้ในการพัฒนาขนส่งสาธารณะในรูปแบบใหม่ให้กับเมืองเชียงราย โดยมีต้นแบบการพัฒนามาจากโปรเจกต์ Go Go Bus! ที่เคยทดลองวิ่งใช้งานมาแล้วในงาน Bangkok Design Week 2024 เมื่อต้นปีที่ผ่านมา
การแข่งขันเรือยาวประเพณี จังหวัดสมุทรสาคร ชิงถ้วยพระราชทาน ฯ 13 - 14 กรกฎาคม 2567
จังหวัดสมุทรสาคร ร่วมกับ สำนักงานท่องเที่ยวและกีฬาจังหวัดสมุทรสาคร สมาคมกีฬาแห่งจังหวัดสมุทรสาคร องค์การบริหารส่วนตำบลชัยมงคล องค์การบริหารส่วนจังหวัด หน่วยงานภาครัฐและเอกชน ร่วมกันจัด #การแข่งขันเรือยาวประเพณี #จังหวัดสมุทรสาคร ประจำปี 2567 #ครั้งที่18 ชิงถ้วยพระราชทานสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ในระหว่างวันที่ 13 - 14 กรกฎาคม 2567 ตั้งแต่เวลา 08.30 - 17.00 น. ณ สนามคลองชลประทาน D7 (คลองตาขำ) ตำบลชัยมงคล อำเภอเมืองสมุทรสาคร จังหวัดสมุทรสาคร
ภายในงานจัดให้มีการแข่งขันเรือ 3 ประเภท ประกอบด้วย เรือ 55 ฝีพาย, เรือ 30 ฝีพาย และเรือ 7 ฝีพาย นอกจากนี้ ยังมีกีฬาพื้นบ้าน เป็นกีฬาประเภทขบขันประกอบด้วย การแข่งขัน โล้กระทะ การแข่งขันมวยทะเล พบกับทีมนักพากย์เรือมืออาชีพมันสะใจคนดู เชิญชมชุดการแสดงพิธีเปิดขบวนนางรำ กว่า 300 คน ตลอดจนมีสินค้า OTOP และสินค้าอุปโภคบริโภคมาจำหน่ายให้เลือกซื้ออีกมากมาย
สุข camp ที่เขาอีโต้ ปราจีนบุรี 13 กรกฎาคม 2567 LINK
พาคนที่คุณรักมาสุขกัน ไปกับงานสุข camp @เขาอีโต้ ปราจีนบุรี วันที่ 13 ก.ค. 67 เวลา
14.00 น.-21.00 น. เข้าเที่ยวงานและค่าเข้าป่านันทนาการฯ ฟรี
พิกัด กิจกรรมในงาน - สุขกายไปกับ Workshop โยคะ - สุขใจกับบรรเลงเสียงจากขันธิเบต - สุขจิตไปกับกิจกรรมปลูกต้นไม้ - สุขสนุกสนานกิจกรรม DIY ฟังดนตรีสนุกสนาน - อิ่มท้องไปขบวน Food Truck *** อย่าลืมนำเก้าอี้แคมป์และเสื่อปิคนิคมากันด้วยน้า หากใครสนใจกางเต้นท์มีค่าบริการสถานที่ ท่านละ 20 บาท ติดต่อกางเต้นท์ได้ที่ 037-210-253 ป่านันทนาการน้ำตกเขาอีโต้
การแข่งขันเจ็ตสกี “โตโยต้า-2W วอร์เตอร์เจ็ต โปรทัวร์ ไทยแลนด์ 2024" สนามที่ 3 หนองคาย 13-14 กรกฎาคม 2567
ชาวหนองคายเตรียมพร้อม เหล่าขุนพลนักเจ็ตสกีสุดแกร่ง พร้อมลุย “โตโยต้า-2W วอร์เตอร์เจ็ต โปรทัวร์ ไทยแลนด์ 2024" สนามที่ 3 วันเสาร์ที่ 13 และวันอาทิตย์ที่ 14 กรกฎาคมนี้ ณ บึงหนองคาย จังหวัดหนองคาย
งานวิ่ง Thai Lao Run Together 13 กรกฎาคม 2567
งานวิ่ง Thai Lao Run Together เฉลิมฉลองครบรอบ 30 ปี สะพานมิตรภาพไทยลาวแห่งที่ 1 จ.หนองคาย มาร่วมเปิดประสบการณ์วิ่งข้ามสะพานไทย-ลาว "ฮักมั่น ผูกพันธ์ สานสัมพันธ์สองฝั่งโขง" ในวันเสาร์ที่ 13 กรกฎาคม 2567 เวลา 03.00-06.00 น. ณ ลานจอดรถด่านพรมแดนสะพานมิตรภาพไทย-ลาว แห่งที่ 1 (ขาเข้า) ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ 042-411771 และ 094-3946423
งาน VIJITR 5 ภาค @อุบลราชธานี แสงศิลป์แห่งศรัทธา 13-21 กรกฎาคม 2567
เชิญชมความตระการตาของแสงสีในงาน “VIJITR 5 ภาค @อุบลราชธานี" แสงศิลป์แห่งศรัทธา 13-21 กรกฎาคม 2567 ถ่ายทอดอัตลักษณ์ความงดงามในสถานที่สำคัญทางประวัติศาสตร์ของจังหวัดอุบลราชธานี ระหว่างวันที่ 13-21 กรกฎาคม 2567 ตั้งแต่เวลา 18.00 น. - 24.00 น. ประกอบไปด้วยเทคนิคแสง สี เสียงในรูปแบบสมัยใหม่ ทั้ง Light Up, Projection Mapping, การแสดงศิลปวัฒนธรรมที่สะท้อนความงดงามของวิถีชีวิตภูมิปัญญาและประเพณีท้องถิ่นของจังหวัดอุบลราชธานีใน 7 พิกัด 15 จุดการแสดง คือ
✅ทุ่งศรีเมือง 6 จุด
1.ประเพณีแห่งศรัทธา
2.แสงเรืองรองส่องศรัทธา
3.แสงศิลป์ยุคสมัย
4.สถาปัตยศิลป์
5.วันวานที่สานศิลป์
6.เปลวเทียนส่องศิลป์
✅ศาลหลักเมือง 1 จุด
7.แสงศิลป์ ศิวิไล
✅พิพิธภัณฑสถานแห่งชาติอุบลราชธานี 4 จุด
8.แสงสี ศิลป์ ราชธานี
9.รากเหง้าศรัทธาศิลป์
10.ศรัทธาที่ผลิบาน
11.เจริญศิลป์เรืองรอง
✅วัดสุปัฏนารามวรวิหาร 1 จุด
12.สุปัฏตยศิลป์
✅วัดทุ่งศรีเมือง หอไตรกลางน้ำ 1 จุด
13.แสงศิลป์ยอดพระไตร
✅วัดบูรพาราม 1 จุด
14.แสงศิลป์บัวพ้นน้ำ
✅วัดมหาวนาราม 1 จุด
15.สวรรค์แสงศิลป์
จัดโดยการท่องเที่ยวแห่งประเทศไทย (ททท.)
งานวิ่งแล่นเบิ่งโขง ซีซั่น3 วันอาทิตย์ที่ 14 กรกฎาคม 2567
ททท.สำนักงานอุดรธานี... ชวนไปเลาะ ไปแล่น ริมฝั่งโขง กับงานวิ่ง แล่นเบิ่งโขง ซีซั่น3 วันอาทิตย์ที่ 14 กรกฎาคม 2567 ณ ชมโขงรีสอร์ท อ.สังคม จ.หนองคาย สนามเลียบริมโขง บรรยากาศสุดปัง ที่จะทำให้นักวิ่งได้เสพบรรยากาศสุดฟินกับทิวทัศน์สองฝั่งโขง ตลอดแนวอำเภอสังคม จังหวัดหนองคาย
กำหนดการเทศกาลวันอาสาฬหบูชา และวันเข้าพรรษา ประจำปี ๒๕๖๗
หนุมาน ดนตรีในสวน 17 กรกฎาคม 2567
เตรียมตัวให้พร้อม! มาแฮงค์เอาท์สุดชิลล์กับงานหนุมาน ดนตรีในสวน ที่สวนเฉลิมพระเกียรติ 72 พรรษา วันที่ 17 กรกฎาคม 2567 เวลา 14:00 - 22.00 น. มาฟังเพลงเพราะๆ เวิร์คช็อปสุดคูล ช้อปปิ้งเพลินๆ จิบเครื่องดื่มเย็นๆ เตรียมตัวมามันส์กัน
พิกัด กิจกรรมภายในงาน ดนตรีสด เวิร์คช็อป เพ้นท์กระเป๋า เพ้นท์หมวก ซอฟคุกกี้ วาดรูปเหมือน เขียนพู่กันจีน สร้างภาพด้วยทราย-ดินน้ำมัน ร้อยลูกปัด ทำพวงกุญแจ เพ้นท์ปูนปลาสเตอร์ ฯลฯ บูธสินค้า
งานประจำปี แห่เทียนพรรษา วัดสมานรัตนาราม 18-29 กรกฎาคม 2567 LINK
ขอเชิญเที่ยวงานประจำปีแห่เทียนพรรษา วัดสมานรัตนาราม ตั้งแต่วันที่ 18 กรกฎาคม - 29 กรกฎาคม 2567 มหรสพยิ่งใหญ่ 12 วัน 12 คืน
- พบกับของกินอร่อยๆ เพียบบบบ ร้านดังในโซเชียล Tiktok ยกพลกันมาออกงานหลายร้านเลย แถมยังมีกิจกรรมล้วงไห ใบละ 20 บาท ลุ้นรางวัลใหญ่ๆ เพียบ ถึงไม่ได้รางวัลใหญ่ก็ไม่เป็นไร ยังไงก็ถือว่าได้ทำบุญร่วมสร้าง ร.พ. กับทางวัดสมานฯ ครับ
- มีสวนสนุกก็มีเครื่องเล่นน่าสนุกๆ เพียบเลยครับ รถไฟเหาะ ไวกิ้ง ชิงช้าสวรรค์ บ้านผีสิง ก็น่าเล่นครับ
- มีคอนเสิร์ตทั้ง 12 วัน ไม่ซ้ำกันเลย
และอย่าลืมแวะไปกราบขอพร องค์พระพิฆเนศปางนอนเสวยสุขด้วยนะครับ ไปไหว้ตอนกลางคืนนี่แหล่ะดี คนไม่เยอะ อากาศไม่ร้อน เลือกมุมถ่ายรูปสวยๆ ได้สบายเลย
มหกรรม Soft Power สระแก้ว 18 - 20 ก.ค. 2567
ขอเชิญเที่ยวงาน "มหกรรม Soft Power สระแก้ว" ชายแดนเบื้องบูรพา สู่เศรษฐกิจสร้างสรรค์ พบกับกิจกรรมต่าง ๆมากมาย ชมฟรีทั้งวัน ตั่งแต่ 18 - 20 ก.ค.นี้ ณ มหาวิทยาลัยราชภัฎวไลยอลงกรณ์ ในพระบรมราชูปถัมภ์ สระแก้ว
กิจกรรม Come Home Ubon Creative Space 18-22 กรกฎาคม 2567
กิจกรรม Come Home Ubon 18-22 กรกฎาคม 2567 Creative Space ของคนรุ่นใหม่ มาสร้างหน้าใหม่ ของประเพณีแห่เทียนพรรษาที่มีมาแต่ดน ชวนมา หาเลาะเบิ่งต้นเทียน มาฟังลำม่วนๆ เฮ็ด work เฮ็ดเวียก กินข้าวแลงแบบ MADE IN อุบลของแทร่ ทุกคนจะได้พ้อกับ ดนตรี ศิลปะ อาหาร เครื่องดื่ม กาแฟ งานคราฟท์ จากความตั้งใจของสายเลือดความอุบล ฟิลลิ่งแบบพาเพื่อนมาเที่ยวบ้าน มากินข้าวบ้านเพื่อน มาม่วน มาซื่น มาคัมโฮม อุบลกันเด้ออ
งานแข่งเรือยาวประจำปี 2567 จ.ปทุมธานี 19-20 กรกฎาคม 2567 และงานสืบสานประเพณีเทศกาลวันเข้าพรรษา
11-20 กรกฎาคม 2567 การแข่งขันเรือยาวประเพณี เทศบาลนครรังสิต ประจำปี 2567 เริ่มด้วยงาน โครงการสืบสานประเพณีเทศกาลวันเข้าพรรษา กิจกรรมเข้าพรรษา (11-16 กรกฎาคม) หน้าสำนักงานเทศบาลนครรังสิต วันที่ 18 กรกฎาคม ขบวนแห่ถ้วยพระราชทานและขบวนแห่เทียน วันที่ 19-20 กรกฎาคม วันแข่งขันเรือยาว ประเภท 55 / 50 / 30 ฝีพาย และแข่งเรือท้องถิ่น (พายม้า) ณ สนามแข่งเรือยาวคลองรังสิตประยูรศักดิ์ บริเวณประตูน้ำจุฬาลงกรณ์
ศรัทธา อีสานมูแฮง 19-21 ก.ค. 67 LINK
กระทรวงการท่องเที่ยวและกีฬา โดยการท่องเที่ยวแห่งประเทศไทย (ททท.) ร่วมกับมหาวิทยาลัยขอนแก่น เชิญร่วมงาน “ศรัทธา อีสานมูแฮง” ปักหมุดเลย! 19-21 ก.ค. 67 ณ ลานวัฒนธรรม หอศิลป์มหาวิทยาลัยขอนแก่น จังหวัดขอนแก่น พบกับความมู ความม่วน ความบันเทิง และกิจกรรมร่วมสนุกลุ้นรับไอเท็มเสริมบุญ เสริมดวง เอาใจสายมู มากมาย!
เทศกาลศิลปะดนตรีเข้าพรรษา “มานคร นอนวัด” ครั้งที่ 3 วันที่ 19 -21 กรกฎาคม 2567 LINK
เทศกาลศิลปะดนตรีเข้าพรรษา “มานคร นอนวัด” ครั้งที่ 3 วันที่ 19 -21 กรกฎาคม 2567 ณ วัดโสภณตีธาราม(วัดเราะ) กิจกรรมในงาน ร่วมบุญระลึกคุณอดีตเจ้าอาวาสฯ รำวงย้อนยุคปลอดเหล้า ร่วมถวายเทียนและผ้าเข้าพรรษา เวียนเทียนอาสาฬหบูชา Light ART Performances กิจกรรมแสดง Religion, Amazing Culture ปวารณาเข้าพรรษา กิจกรรมดนตรีจากศิลปินและเยาวชนมากมาย กิจกรรมสอนวาดภาพสีน้ำ ประกวดวาดภาพสีน้ำรับโล่รางวัล กิจกรรมงานตอกหนังและทำของที่ระลึก กิจกรรมสอนภาพพิมพ์ กิจกรรมสอนงานปั้น งานคราฟทำมือ คาเฟ่แนวแคมป์ รวมของกินอาหารถิ่นของกินพื้นบ้าน ถนนคนเดินหน้าหาดเราะ 3 วัน 3 คืน
ปลอดเหล้า ปลอดยาเสพติด สร้างสรรค์คุณค่า ชุมชนพึ่งพา ตามแนวคิด บวร...ดนตรีและศิลปะเพื่อคนทุกวัย แหล่งเรียนรู้เสริมสร้างประสบการณ์ สืบสานวัฒนธรรมไทย‘
งานวันเกษตรและของดีอำเภอปลายพระยา ครั้งที่ 3 วันที่ 19 - 21 กรกฎาคม 2567
เชิญชวนเที่ยวงานวันเกษตรและของดีอำเภอปลายพระยา ประจำปี 2567 ครั้งที่ 3 ระหว่างวันที่ 19 - 21 กรกฎาคม 2567 จัดขึ้น ณ สนามที่ว่าการอำเภอปลายพระยา เชิญช็อป ชิม อาหารพื้นบ้าน และชมนิทรรศการจากหน่วยงานราชการวิสาหกิจและเอกชนในอำเภอปลายพระยาสินค้าเกษตรราคาถูก พบกิจกรรม ดังนี้
วันที่ 19 กรกฎาคม 2567 1. การประกวดทุเรียน 2. การประกวดรำวงเวียนครก 3. การประกวดปาล์มน้ำมัน 4. กิจกรรมการแสดงบนเวที ชุดการแสดงจากนักเรียนและประชาชนในพื้นที่อำเภอปลายพระยา สนับสนุนจาก เทศบาลตำบลปลายพระยา และอบต. 5. บูธแสดงสินค้ากว่า 100 ร้าน
วันที่ 20 กรกฎาคม 2567 1. การประกวดการทำอาหาร (คั่วกลิ้งเนื้อวัว) 2. กิจกรรม happy hour จำหน่ายทุเรียนราคาถูก จาก ททท.การท่องเที่ยวแห่งประเทศไทย 3. กิจกรรมการแสดงบนเวทีชุดการแสดงจากนักเรียนและประชาชนในพื้นที่อำเภอปลายพระยา สนับสนุนจาก องค์การบริหารส่วนจังหวัดกระบี่ การท่องเที่ยวแห่งประเทศไทย (ททท.) อำเภอปลายพระยา เทศบาลตำบลปลายพระยา องค์การบริหารส่วนตำบลปลายพระยา องค์การบริหารตำบลเขาเขน องค์การบริหารส่วนตำบลเขาต่อ องค์การบริหารส่วนตำบลคีรีวง 4. บูธแสดงสินค้ากว่า 100 ร้าน
วันที่ 21 กรกฎาคม 2567 1. กิจกรรมการแสดงบนเวทีชุดการแสดงจากนักเรียนและประชาชนในพื้นที่อำเภอปลายพระยา สนับสนุนจาก เทศบาลตำบลปลายพระยา และอบต. 2. บูธแสดงสินค้ากว่า 100 ร้าน
งาน ดอกไม้ในสายฝน 19-28 กรกฎาคม 2567
เทศบาลนครเชียงราย ชวนเชิญเที่ยวงาน “ดอกไม้ในสายฝน“ ที่จังหวัดเชียงราย ภายในงาน : ดอกไม้นานาพันธุ์นับล้านดอก งานจัดระหว่างวันที่ 19-28 กรกฎาคม 2567 พิกัดสวนสาธารณะหาดนครเชียงราย อำเภอเมื???งฯ พบกับศิลปินชื่อดังในพิธีเปิด ขบวนแห่แฟนตาซีสุดอลังการจากกลุ่มรุ้งสร้างสรรค์ การแสดงจากกลุ่มเยาวชนทุกค่ำคืน การออกร้านจำหน่ายอาหาร และเครื่องดื่ม จำหน่ายสินค้า OTOP,สินค้าธงฟ้า โซนหน่วยราชการ อปท. และโรงเรียนในสังกัดเทศบาลนครเชียงราย เข้าชมฟรี ไม่มีค่าใช้จ่าย
งานเทศกาลทุเรียนและของดีตำบลห้วยไคร้ 19 - 20 กรกฎาคม 2567
องค์บริหารส่วนตำบลห้วยไคร้ ร่วมกับองค์การบริหารส่วนจังหวัดเชียงรายและการท่องเที่ยวแห่งประเทศไทย สำนักงานเชียงราย ขอเชิญชวนเที่ยวงานเทศกาลทุเรียนและของดีตำบลห้วยไคร้ ในวันที่ 19 - 20 กรกฎาคม 2567 ลานอเนกประสงค์ หมู่ 5 บ้านสันต้นปุย อ.แม่สาย จ.เชียงราย แวะมาถ่ายรูปเช็คอินและเดินชมสวนทุเรียนนางนอนกันเยอะๆนะคะ มัดรวมของดี ของเด่นตำบลห้วยไคร้ อ.แม่สาย มาไว้ในงานนี้แล้ว ห้ามพลาดกั๋นเน้อเจ้า! เชิญรับชมกิจกรรมภายในงานอีกมากมาย ⭐️การประกวดเทพีตำบลห้วยไคร้ ⭐️การแข่งขันกินทุเรียน ⭐️การออกร้านจำหน่ายผลิตภัณฑ์ชุมชน ⭐️เดินชมและชิมผลไม้พื้นบ้านตามฤดูกาลให้อิ่มกันแบบจุกๆ ⭐️ช้อปกับบูธจำหน่ายสินค้าของกลุ่มพัฒนาสตรี และผลผลิตทางการเกษตร ⭐️เดินเที่ยวชมสวนทุเรียนนางนอน ⭐️ถ่ายรูปเช็คอินสวนทุเรียนนางนอน บ้านสันต้นปุย สอบถามรายละเอียดเพิ่มเติมได้ที่ องค์การบริหารส่วนตำบลห้วยไคร้ 053-763543
งาน รัตนรังสรรค์รำลึก 162 ปี สถาปนาเมืองระนอง 19–21 กรกฎาคม 2567 ณ พระราชวังรัตนรังสรรค์
ขอเชิญร่วมย้อนวันวานในงาน รัตนรังสรรค์รำลึก 162 ปี สถาปนาเมืองระนอง 19 – 21 กรกฎาคม 2567 ณ พระราชวังรัตนรังสรรค์ อ.เมือง จ.ระนอง ร่วมน้อมรำลึกพระมหากรุณาธิคุณ พระบาทสมเด็จพระจอมเกล้าเจ้าอยู่หัว เนื่องในการสถาปนาเมืองระนอง และพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว เนื่องในการเสด็จประพาสเมืองระนองและการประทับแรม ณ พระที่นั่งรัตนรังสรรค์
*ส่งเสริมการท่องเที่ยว สืบสานมรดกทางประวัติศาสตร์เมืองระนอง
*ชมนิทรรศการรำลึก ณ รัตนรังสรรค์
*ชมการแสดงศิลปวัฒนธรรมพื้นบ้าน
*การออกร้านจำหน่ายสินค้าพื้นเมือง
*อาหารพื้นถิ่นเมืองระนอง
19 กรกฎาคม 67 ร่วมพิธีเปิดงาน ชมการแสดงวัฒนธรรมไทย 4 ภาค และนิทรรศการ ฟังบรรเลงดนตรีไทยและ การแสดงจากเยาวชนชาวระนอง ????
20 กรกฎาคม 67 การแสดงคอนเสิร์ตลูกทุ่งวัฒนธรรม “นุ้ย สุวีณา อาร์สยาม” การแสดงศิลปะพื้นบ้าน มโนราห์ถิ่นแดนใต้
21 กรกฎาคม 67 วันสถาปนาเมืองระนอง ครบรอบ 162 ปี ชมการแสดงชุด เล่าเรื่องเมืองระนอง สุดพิเศษ ฟังเคล็ดลับเพิ่มพลังบวก จากสถานที่สำคัญแห่งดินแดนระนอง โดย อ.คฑา ชินบัญชร ผู้เชี่ยวชาญด้านศาสนา ศิลปวัฒนธรรม และการท่องเที่ยว
งาน "พุทธศรัทธา บูชาพระพุทธชินราช" 19-22 กรกฎาคม 2567
ขอเชิญร่วมงาน "พุทธศรัทธา บูชาพระพุทธชินราช" ระหว่างวันที่ 19-22 กรกฎาคม 2567 ณ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร อำเภอเมืองพิษณุโลก จังหวัดพิษณุโลก กิจกรรมภายในงาน ได้แก่ - ร่วมพับดอกบัว จำนวน 25,667 ดอก เพื่อถวายเป็นพุทธบูชา - ขบวนแห่พระพุทธชินราชจำลอง - รำบวงสรวงถวายเป็นพุทธบูชาพุทธชินราช - ประกวดโคมเครื่องแขวนไทยโบราณ - การแสดงแสง เสียง ประวัติศาสตร์เมืองพิษณุโลกและพระพุทธชินราช - ชม ชิม ช้อป ผลิตภัณฑ์ทางวัฒนธรรมและของดีเมืองพิษณุโลก
SMEs Fair สงขลา 2024 วันที่ 19 กรกฎาคม 2567
สำนักงานพาณิชย์จังหวัดสงขลา จัดงาน "SMEs Fair สงขลา 2024" วันที่ 19 - 21 กรกฎาคม 2567 เวลา 9.00 -21.00 น. ณ ลานจอดรถ หน้าบิ๊กซีเอ็กซ์ตร้า หาดใหญ่ อำเภอหาดใหญ่ จังหวัดสงขลา โดยสำนักงานพาณิชย์จังหวัดสงขลาร่วมกับหอการค้าจังหวัดสงขลา พาความพิเศษสุดยอดสินค้ากว่า 100 ร้านค้า มาให้เลือกช้อปกันอย่างจุใจ ช็อปสินค้าภายในงาน ร่วมลุ้นชิงโชค สร้อยคอทองคำ เครื่องใช้ไฟฟ้า คูปองเงินสด รวมมูลค่ากว่า 30,000 บาททุกวัน วันที่ 19 กรกฎาคม 2567 พบกับมินิคอนเสิร์ตของศิลปินมาแรงจากแดนใต้ “วงแบงค์ โมเดิร์น” พร้อมการแสดงศิลปวัฒนธรรมและดนตรีโฟล์คซอง ให้ได้ชมกันสดๆทุกวัน
งาน Nakorntrang Food Fit Fun 2 19-21 ก.ค. 2567
งาน Nakorntrang Food Fit Fun 2 19-21 ก.ค. 2567 ณ สวนทับเที่ยง อ.เมืองตรัง จ.ตรัง ในงานมีกิจกรรม #Food : อาหารรสเด็ด ร้านดัง กว่า 30 ร้านค้า #Fit : สนุกกับการออกกำลังกายหลากหลายรูปแบบทุกวัน ZUMBADANCE บาสโลบ แอโรบิค นวดสุขภาพ ฟรี!! ตรวจสุขภาพโดยการตรวจวัดมวลร่างกาย ตรวจมะเร็งปากมดลูก #Fun: เปิดประสบการณ์ใหม่ สนุกกับ หนังกลางแปลง 3 มิติ ศิลป์สุขใจ และมุมถ่ายรูปเกร๋ๆ
TRANG Art&Craft 19-21 ก.ค.2567
TRANG Art&Craft 19-21 ก.ค.2567 นี้ เวลา 16.00-22.00 น. ณ สวนทับเที่ยง อำเภอเมืองตรัง จังหวัดตรัง เป็นโซนหนึ่งในงาน Nakorntrang Food Fit Fun คราฟต์ๆเก๋ๆ ก็มี แฮนด์เมด สโลว์บาร์ มือสอง
ประเพณีแห่เทียนพรรษา นครนายก ประจำปี 2567 วันศุกร์ที่ 19 กรกฎาคม 2567
สืบสานประเพณีแห่เทียนพรรษา ประจำปี 2567 การประกวดขบวนรถแห่เทียนจำนำพรรษา อำเภอเมืองนครนายก วันศุกร์ที่ 19 กรกฎาคม 2567 ตั้งแต่เวลา 07.00-12.00 น. ลานถนนคนเดิน สวนหลวงเฉลิมพระเกียรติ จังหวัดนครนายก
มหกรรม Soft Power สระแก้ว ชายแดนเบื้องบูรพาสู่เศรษฐกิจสร้างสรรค์ 18-20 ก.ค.2567
ขอเชิญเที่ยวงานมหกรรม Soft Power สระแก้ว ชายแดนเบื้องบูรพาสู่เศรษฐกิจสร้างสรรค์ ณ มหาวิทยาลัยราชภัฏวไลยอลงกรณ์ ในพระบรมราชูปถัมภ์ สระแก้ว ชมฟรีทุกวันตลอดงาน!!! ร้านค้า สินค้า OTOP กว่า 150 ร้าน ภายในงานพบกับ ✅18 ก.ค. - คณะวงโปงลางหลานย่าโม วิทยาลัยนาฏศิลปนครราชสีมา” ✅19 ก.ค. - การประกวดวงดนตรี “นักเรียนนักศึกษา” ✅18-19 ก.ค. - รับชมการแข่งขันกีฬา "มวยไทย" กว่า 20 คู่ ✅20 ก.ค. - รับชมการแสดงคณะหมอลำวง “หนูภารวิเศษศิลป์”
งานแสดงสินค้าอัตลักษณ์จังหวัดพังงา (Identity by Phangnga) ครั้งที่ 4 วันที่ 19-23 กรกฎาคม 2567
ชวนทุกคนเที่ยว "งานแสดงสินค้าอัตลักษณ์จังหวัดพังงา (Identity by Phangnga) ครั้งที่ 4" วันที่ 19-23 กรกฎาคม 2567 ณ บริเวณศาลากลางจังหวัดพังงา (หลังเก่า) พบกับสินค้าดีเด่นของจังหวัดพังงา อาหารพื้นถิ่น และอื่นๆอีกมากมาย ㅤ
งาน “ร่มโพธิ์ทองไหว้พระนอน ขอพรพระใหญ่” 19-29 กรกฎาคม 2567
จังหวัดอ่างทอง ร่วมกับ อำเภอโพธิ์ทอง และ วัดขุนอินทประมูล ขอเชิญพุทธศาสนิกชน ร่วมทำบุญสร้างกุศล เนื่องในวันอาสาฬหบูชาและวันเข้าพรรษา ประจำปี 2567 ในงาน “ร่มโพธิ์ทองไหว้พระนอน ขอพรพระใหญ่” ระหว่างวันที่ 19 - 29 กรกฎาคม 2567 ณ พุทธมณฑลจังหวัดอ่างทอง วัดขุนอินทประมูล อ.โพธิ์ทอง จ.อ่างทอง
กิจกรรมภายในงาน เลือกซื้อสินค้าอุปโภคบริโภค และต้นไม้นานาพันธุ์ รับชมดนตรีในสวน การประกวดร้องเพลง และการแสดงศิลปะไทยประยุกต์ มุมถ่ายรูปสวยๆประดับไฟเต็มพื้นที่
พิเศษ...ร่วมพิธีสำคัญ พิธีห่มผ้าพระพุทธไสยาสน์ และเวียนเทียนเนื่องในวันเข้าพรรษาและอาสาฬหบูชา ประจำปี 2567 ในวันที่ 20 กรกฏาคม 2567 เวลาตั้งแต่ 17:00 น เป็นต้นไป
จุดสำคัญต่างๆ ของวัดขุนอินทประมูล...
- สายมูต้องห้ามพลาด มาเสริมบุญ กับสัมผัสศรัทธา ... เที่ยววัดวาเมืองอ่างทอง สัมผัสศรัทธา ฝ่าพระบาท องค์หลวงพ่อพระนอน กันที่ พระพุทธไสยาสน์นอนขุนอินทประมูล พระพุทธไสยาสน์กลางแจ้ง ที่งดงามที่สุดของประเทศไทย พร้อมเขียนใบโพธิ์ทองเพิ่มเงิน เพิ่มทอง แขวนซุ้มกักเงิน กักทอง
- สักการะรูปเหมือน ท่านขุนอินทประมูล นายอากร ผู้สร้างวัดแห่งนี้
- ลอดพระอุโบสถ ไฮเทค เสริมสิริมงคล ชมจิตรกรรมฝาผนังที่งดงาม
- ไหว้สมเด็จพระพุฒาจารย์โตพรหมรังสี พระเกจิอาจารย์ชื่อดัง ของประเทศไทย
- ชมโบราณสถานวิหารหลวงพ่อขาว โบราณสถานเก่าแก่ ที่อยู่คู่กับวัดขุนอินทประมูล มานับร้อยปี
????
เที่ยวสุพรรณกับรถไฟ KIHA 20-21 กรกฎาคม 2567 [มีค่าใช้จ่าย]
การรถไฟ จัดทริปเที่ยวสุพรรณบุรี กับรถไฟ KIHA วันที่ 20-21 กรกฎาคม 2567 นี้ เป็นทริปเที่ยวมหัศจรรญ์เมืองสุพรรณแหล่งอารยธรรมทวารวดี พบกับกิจกรรมพิเศษ เส้นทางสุพรรณบุรี พบกับปรมาจารย์เพลงฉ่อย "น้าโย่ง" จะมา "ฉ่อย" ครั้งแรก บนขบวนรถ KIHA 183 พร้อมฉ่อยเรื่องราว "กำเนิดเมืองอู่ทอง" เล่าเรื่องความรุ่งเรืองของผืนแผ่นดินสุรรณภูมิ ที่รุ่งเรือง ในยุคสมัยทวารวดี อันเป็นต้นกำนิดอู่ทอง ผ่านการเล่นเพลงพื้นบ้าน ที่เป็นเอกลักษณ์ของจังหวัดสุพรรณบุรี และในแถบภูมิภาคกลาง (2 วัน 1)
AMAZING THAILAND PATTAYA MARATHON 2024 วันเสาร์ที่ 20 กรกฎาคม 2567 LINK
การแข่งขันพัทยามาราธอน ครั้งที่ 31 ประจำปี 2567 ณ เมืองพัทยา จังหวัดชลบุรี วันเสาร์ที่ 20 กรกฎาคม 2567 เริ่ม 05.45-07.45 น. ปล่อยตัว-เส้นชัย ณ เทอร์มินอล21 พัทยา (พัทยาเหนือ) จังหวัดชลบุรี ประเภทแข่งขันและกลุ่มอายุ มาราธอน 42.195 กม. / ฮาล์ฟมาราธอน 21.1 กม. / ระยะ 10 กม. / วีลแชร์ระยะ 4.5 กม. / วิ่งระยะ 4.5 กม.
Khuansator Amazing Camping 2024 วันที่ 20-22 กรกฎาคม 2567
อบต.ควนสตอ ชวนเที่ยวงาน Khuansator Amazing Camping 2024 (วังตาหงาแคมป์ปิ้ง ปี 3) วันที่ 20-22 กรกฎาคม 2567 ณ อ่างเก็บน้ำวังตาหงา เพื่อส่งเสริมการท่องเที่ยวตำบลควนสตอ โดยเฉพาะกิจกรรม “แคมป์ปิ้ง ลานกางเต้นท์” ซึ่งเป็นที่แรกของจังหวัดสตูล รวมถึงการสร้างภาพจำด้วยแนวคิด “แคมป์กลางหุบเขา 1 เดียวในจังหวัดสตูล” ทั้งนี้เพื่อให้การท่องเที่ยวของตำบลควนสตอ อำเภอควนโดน จังหวัดสตูล เป็นที่รู้จักอย่างแพร่หลายในสังคมวงกว้าง ส่งเสริมเศรษฐกิจท้องถิ่น เพื่อขับเคลื่อนไปสู่เป้าหมายการพัฒนาที่ยั่งยืน
งานฯ ในปีนี้ มีกิจกรรมมากมายให้นักท่องเที่ยวและผู้ร่วมงานได้สัมผัสวิถีการท่องเที่ยวในตำบลควนสตอมากยิ่งขึ้น ทั้งกิจกรรม “ตั้งแคมป์ โยงเปล แลดาว”สหายแคมป์ วัง-ตา-หงา ปี 3 , การแข่งขันพายเรือคายัควังตาหงาเกมส์ ครั้งที่ 3 , แข่งขันดริปกาแฟโรบัสต้าสตูล และแข่งขันกินทุเรียนพันธุ์หมอนทองและพันธุ์พื้นบ้านสตูล , ชม ชิม ช็อป ตลาดนัด “อาหารถิ่นคนควนสตอ” ,“หลาดลูกไม้ควนสตอ” (จำหน่ายผลไม้นานาชนิด) , Show Jetski , Show รถ Big Bike & Camping Car จากประเทศมาเลเซีย และ Show รถยนต์คลาสสิกจากทั่วประเทศไทย และกิจกรรมอื่น ๆ อีกมากมาย
ผู้ที่สนใจเข้าร่วมงานฯ ณ อ่างเก็บน้ำวังตาหงา หมู่ที่ 5 ตำบลควนสตอ อำเภอควนโดน จังหวัดสตูล ระหว่างวันที่ 20 – 22 กรกฎาคม 2567
ห่มผ้าพระบรมธาตุสวี 20 กรกฎาคม 2567
จังหวัดชุมพร กำหนดจัดงานประเพณีเเห่ผ้าพระราชทาน ในสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ขึ้นห่มพระบรมธาตุสวี ประจำปี พ.ศ. ๒๕๖๗ ระหว่างวันที่ ๑๙ - ๒๐ กรกฎาคม ๒๕๖๗ ณ วัดพระบรมธาตุสวี อ.สวี จ.ชุมพร
EAT PRAY LOVE SEASON3 วันที่ 20-22 กรกฏาคม 2567
งาน EAT PRAY LOVE SEASON3 วันที่ 20 - 22 กรกฏาคม 2567 เวลา 17.00 - 23.00 น. ณ ถนนนิพัทธ์อุทิศ 1 ตึกชิโนยูโรเปียน (สาย 1) งานนิทรรศการบอกเล่าเรื่องราวพหุวัฒนธรรมที่หลากหลายของเมืองหาดใหญ่ ปีนี้ โชว์ แสง สี เสียงแบบจัดเต็ม กิจกรรมเชิงสร้างสรรค์อัดแน่นตลอดทั้งงาน รวมถึงร้านค้า,ร้านอาหารมากกว่า 20 ร้านค้า และ รับชมการแสดงฟรี ตลอด 3 วัน แบบจุกๆไปเลย อย่าลืมใส่ชุดเริ่ดๆและเตรียมกล้องมาด้วยน๊าาา เพราะมุมถ่ายรูปงานเราปัง‼️และ สวยทุกมุม
Go Green Clean MAEKLONG ท่องเที่ยวที่เป็นมิตรกับสิ่งแวดล้อม วันที่ 20 กรกฎาคม 2567
Go Green Clean MAEKLONG ททท.สมุทรสงคราม เชิญชวนนักท่องเที่ยวมาสร้างความสุขง่ายๆ จากประสบการณ์การท่องเที่ยวที่เป็นมิตรกับสิ่งแวดล้อม เรียนรู้วิถีชีวิตชุมชนและสายน้ำจังหวัดสมุทรสงคราม กิจกรรมพายเรือเก็บขยะในแม่น้ำแม่กลอง ระยะทาง 8.5 กม. เส้นทาง วัดเพชรสมุทรวรวิหาร - วัดประทุมคณาวาส - คลองบางเรือหัก - คลองบางแสม(อุโมงค์ต้นจาก) - วัดช่องลม - วัดใหญ่ – สุธาคาเฟ่ พร้อมเช็คอิน “สถานีรถไฟแม่กลอง” แหล่งท่องเที่ยวสุด Unseen วันที่ 20 กรกฎาคม 2567 ตั้งแต่เวลา 05.00 น. เป็นต้นไป ท่าเรือวัดเพชรสมุทรวรวิหาร
NAN MUSIC 2024 วันที่ 20-21 ก.ค. 2567 ข่วงเมืองน่าน
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานน่าน ชวนมาชมมาฟังดนตรีน่านในงาน NAN MUSIC 2024 งานดนตรีพื้นเมืองแนวใหม่ วันที่ 20-21 ก.ค. 2567 ตั้งแต่ 18.00 – 21.00 น. ที่ข่วงเมืองน่าน ในงานมีการแสดงสุดพิเศษ
20 ก.ค. 2567 การแสดงล้านนาร่วมสมัย วง "Lanna Soul" การบรรเลงดนตรีวงล่องน่านร่วมสมัย โดยครูนอร์ท เพลงคำเมืองเพราะ ๆ จากวงเดอะเพอะ
21 ก.ค. 2567 ชม การแสดงจากศิลปินล้านนา อ้อม รัตนัง ฟ้อนของดีเมืองน่าน การประชันกลองปูจา น่าน - ลำปาง ฟ้อนล่องน่าน โดยกลุ่มนาฏยศิลปินน่าน การบรรเลงดนตรีพื้นเมืองร่วมสมัย วงแสนหลวง
Vijitr @Chiang Mai สีสันแห่งเส้นแสง 20-28 กรกฎาคม 2567
มหกรรมสีสันยามค่ำคืน Vijitr @Chiang Mai สีสันแห่งเส้นแสง น้ำพุร้อนสันกำแพง โครงการตามพระราชดำริ วันที่ 20 - 28 กรกฎาคม 2567 เวลา 17:00น. - 22:00 น. ที่ น้ำพุร้อนสันกำแพง อ.แม่ออน จ.เชียงใหม่
การประกวด "ธิดากาแฟน่าน ประจำปี 2024 วันเสาร์ที่ 20 กรกฎาคม 2567
การประกวด "ธิดากาแฟน่าน ประจำปี 2024 ประกวดในวันเสาร์ที่ 20 กรกฎาคม นี้ เริ่ม เวลา 18.00 - 21.00 น. ณ ข่วงเมืองน่าน ( ข่วงน้อย ) " เปิดรับสมัครทุกท่านโดยไม่จำกัดเพศ รับ ทุกเพศ ทุกวัย ประกวดแบบสับๆ มิติใหม่ ไฉไลจริง ส่วนหนึ่งของงานเทศกาลคนปลูกกาแฟน่าน "Nan Coffee Farmer Fest 2024" ณ ข่วงเมืองน่าน ( ข่วงน้อย )
20 กรกฎาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยหญิงไทย อายุ 66 ปี
20 กรกฎาคม 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยหญิงไทย อายุ 66 ปี อุบัติเหตุขี่รถจักรยานยนต์พ่วงข้างชนกับรถปิคอัพ ไม่รู้สึกตัว เอกซเรย์คอมพิวเตอน์สมองพบว่ามีเลือดออกในสมอง ส่งตัวจากโรงพยาบาลจอมบึง เพื่อมารักษาต่อที่โรงพยาบาลราชบุรี เมื่อมาถึงแพทย์ได้ทำการผ่าตัดให้ทันทีและรักษาตัวที่หอผู้ป่วยศัลยกรรมระบบประสาท1 ผู้ป่วยมีอาการหนักมาก และเสียชีวิต ทางทีมพยาบาลผู้ดูแลจึงให้ข้อมูลการบริจาคดวงตาและเจรจาเพื่อขอรับการบริจาคดวงตา ญาติผู้ป่วยเห็นว่าผู้ป่วยเป็นคนชอบทำบุญ และได้เป็นการทำบุญใหญ่ครั้งสุดท้ายให้กับผู้ป่วยจึงยินดีที่จะบริจาคดวงตาให้กับศูนย์ดวงตา สภากาชาดไทย
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้กับผู้ที่รอคอยการเปลี่ยนถ่ายกระจกตา ในโอกาสนี้นายแพทย์อนุกูล ไทยถานันดร์ ผู้อำนวยการโรงพยาบาลราชบุรีและคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
20 กรกฏาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยชายไทยอายุ 28 ปี
20 กรกฏาคม 2567 โรงพยาบาลราชบุรี รายงานการบริจาคอวัยวะ โดย ผู้ป่วยชายไทยอายุ 28 ปี ประสบอุบัติเหตุขี่รถจักรยานยนต์ชนรถกระบะ ไม่รู้สึกตัว เอกซเรย์คอมพิวเตอร์สมองพบมีเลือดออกในสมอง ส่งตัวจากโรงพยาบาลบ้านโป่ง มาเพื่อรักษาตัวต่อที่โรงพยาบาลราชบุรี เมื่อมาถึงโรงพยาบาลราชบุรี แพทย์ได้ทำการผ่าตัดสมองให้ทันที และให้พักรักษาตัวที่หอผู้ป่วยศัลยกรรมระบบประสาท1 ผู้ป่วยอาการทรุดลง แพทย์ได้แจ้งอาการกับญาติผู้ป่วย พยาบาลได้ให้ข้อมูลการบริจาคอวัยวะ และได้เจรจาขอรับบริจาคอวัยวะ พ่อและแม่ผู้ป่วยมีความคิดเห็นตรงกันเพื่อให้ผู้ป่วยได้ทำบุญในวาระสุดท้าย จึงยินดีบริจาคอวัยวะทุกส่วนที่สามารถนำไปให้กับผู้ที่รอคอยอวัยวะ ผู้ป่วยบริจาคได้เพียงตาทั้ง 2 ข้าง ให้กับผู้รอคอยการปลูกถ่ายกระจกตา และเป็นการทำบุญใหญ่ให้กับผู้ป่วยในวาระสุดท้าย ผู้ป่วยเสียชีวิตในวันที่ 18 กรกฎาคม พ.ศ.2567
โรงพยาบาลราชบุรี จึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้ศูนย์ดวงตาสภากาชาดไทย ในโอกาสนี้นายแพทย์อนุกูล ไทยถานันดร์ ผู้อำนวยการโรงพยาบาลราชบุรี และคณะเจ้าหน้าที่ ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
งานประเพณีแห่เทียนพรรษาประจำปี 2567 วันเสาร์ที่ 20 กรกฎาคม 2567
เทศบาลเมืองหนองคาย ร่วมกับวัดโพธิ์ชัย ขอเชิญชวนร่วมสืบสานประเพณีอันดีงามและร่วมงานประเพณีแห่เทียนพรรษาประจำปี2567 ชมขบวนแห่เทียนพรรษาของชุมชนภายในเขตเทศบาลเมืองหนองคาย ในวันเสาร์ที่ 20 กรกฎาคม 2567 เวลา 13.00 น. เป็นต้นไป ณ บริเวณถนประจักษ์ศิลปาคม หน้าเทศบาลเมืองหนองคาย
การแข่งขันไตรกีฬานานาชาติ จังหวัดพังงา 20 กรกฎาคม 2567
การแข่งขันไตรกีฬานานาชาติ จังหวัดพังงา วันเสาร์ที่ 20 กรกฎาคม 2567 ณ ถนนคนเดินบ้านท่านุ่น อําเภอตะกั่วทุ่ง พังงา
งานประเพณีแห่เทียนพรรษา จังหวัดอุบลราชธานี ประจำปี 2567 วันที่ 20 กรกฎาคม 2567
ขอเชิญเที่ยวงานประเพณีแห่เทียนเข้าพรรษาจังหวัดอุบลราชธานี ประจำปี 2567 ภายใต้ชื่องาน " เฉลิมพระเกียรติ 72 พรรษา เมืองเทียน เมืองธรรมงามล้ำเมือง 4 แสง"
จังหวัดอุบลราชธานี ได้กำหนดการจัดงานประเพณีแห่เทียนพรรษาจังหวัดอุบลราชธานี ประจำปี 2567 ขึ้นในห้วงเดือนกรกฎาคม - สิงหาคม 2567 ภายใต้ชื่องาน "เฉลิมพระเกียรติ 72 พรรษา เมืองเทียน เมืองธรรม งานล้ำเมือง 4 แสง" พร้อมยกระดับการจัดงานและกิจกรรมต่างๆ ให้เป็นรูปแบบสากลนิยม เพื่อสนับสนุนวัฒนธรรมประเพณีไทยที่เป็นเอกลักษณ์สู่ระดับ World class ตามนโยบายการขับเคลื่อน Soft Power ของรัฐบาล โดยได้กำหนดกิจกรรมต่างๆในงานดังนี้
1. แถลงข่าวการจัดงานประเพณีแห่เทียนพรรษา จังหวัดอุบลราชธานีประจำปี 2567
สถานที่ : บริเวณลานเทียน ทุ่งศรีเมืองอุบลราชธานี
ระยะเวลา : วันที่ 25 มิถุนายน 2567 ตั้งแต่เวลา 17.00 น. เป็นต้นไป
2. พิธีบวงสรวงศาลหลักเมืองอุบลราชธานีและสักการะสิ่งศักดิ์สิทธิ์เมืองอุบลราชธานี
สถานที่ : ศาลหลักเมืองอุบลราชธานี ทุ่งศรีเมืองและลานขวัญเมือง
ระยะเวลา : วันที่ 4 กรกฎาคม 2567 เวลา 8.09 น.
3. กิจกรรมเยือนชุมชน ชมวิถีทำเทียนและการตกแต่งต้นเทียนพรรษา ทำบุญเสริมดวง 12 ราศี 12 คุ้มวัด
สถานที่ : วัดใต้พระเจ้าใหญ่องค์ตื้อ วัดพลแพน วัดใต้ท่า วัดแจ้ง วัดมหาวนาราม วัดทุ่งศรีเมือง วัดศรีประดู่ วัดพระธาตุหนองบัว วัดศรีแสงทอง วัดบูรพา วัดสุปัฎนาราม วัดสารพัดนึก นอกจากนี้ ยังมีวัดในพื้นที่อำเภอเมืองและอำเภอวารินชำราบเปิดให้นักท่องเที่ยว ร่วมกิจกรรม อาทิ วัดไชยมงคล วัดสุทัศน์ วัดเลียบ วัดปทุมมาลัย วัดกลาง วัดกุดคูณ วัดผาสุการาม และวัดหายโศก
ระยะเวลา : ระหว่างวันที่ 1-18 กรกฎาคม 2567 ตั้งแต่ 9.00 น. ถึง 20.00 น.
4. กิจกรรม ชมทุ่งดอกเทียนหอมเรืองแสง หนึ่งเดียวในโลก
สถานที่ : สวนสัตว์อุบลราชธานี
ระยะเวลา : ระหว่างวันที่ 12 กรกฎาคม - 19 สิงหาคม 2567 ตั้งแต่เวลา 9.00 - 16.30 น.
5. การประกวดนางงามเทียนพรรษาจังหวัดอุบลราชธานี Miss Ubonratchathani Candle Festival International 2024
สถานที่ : ศูนย์การค้าเซ็นทรัลอุบล และโรงแรมสุนีย์แกรนด์
ระยะเวลา : 17-21 กรกฎาคม 2567
6. การจำหน่ายสินค้าเศรษฐกิจชุมชน (OTOP)
สถานที่ : ลานวัฒนธรรมข้างศาลหลักเมืองอุบลราชธานี
ระยะเวลา : 17-23 กรกฎาคม 2567
7. พิธีอัญเชิญเทียนพรรษาพระราชทานและผ้าอาบน้ำฝนราชทาน มายังมณฑลพิธี
สถานที่ : ศาลาจตุรมุข ทุ่งศรีเมืองอุบลราชธานี
ระยะเวลา : 19 กรกฎาคม 2561 เวลา 8:00 น.
8. กิจกรรมการประกวดพานบายศรี
สถานที่ : บริเวณลานวัฒนธรรมข้างศาลหลักเมืองอุบลราชธานี
ระยะเวลา : 19 กรกฎาคม 2567 เวลา 13.00 น. เป็นต้นไป
9. กิจกรรมการประกวดต้นเทียนพรรษา ประเภทแกะสลัก ประเภทติดพิมพ์ และประเภทเทียนโบราณแบบดั้งเดิม
สถานที่ : บริเวณถนนรอบทุ่งศรีเมืองอุบลราชธานี
ระยะเวลา : วันรวมเทียน 19 กรกฎาคม 2567 ประกาศผล 21 กรกฎาคม 2567
10. พิธีเปิดงานฯ และปล่อยขบวนเทียนพรรษา นำโดยขบวนอัญเชิญเทียนพรรษาพระราชทานฯ และขบวนเทียนพรรษาจากคุ้มวัด/อำเภอต่างๆ ขบวนเรือชักพระ จ.สุราษฎร์ธานี ขบวนแห่ยักษ์คุ จ.อำนาจเจริญ และการแสดงศิลปวัฒนธรรม ประกอบแสง เสียง เต็มอิ่ม 2 วัน 2 คืน
สถานที่ : ปะรำพิธีหน้าวัดศรีอุบลรัตนาราม
ระยะเวลา : 20-21 กรกฎาคม 2567
11. จัดแสดงต้นเทียนพรรษาที่ได้รับรางวัล ในประเภทต่างๆ
สถานที่ : บริเวณรอบทุ่งศรีเมืองและศาลหลักเมืองอุบลราชธานี
ระยะเวลา : 22-23 กรกฎาคม 2567
12. งานเทียนอุบล ยลได้ตลอดเดือน ตั้งแต่ 24 กรกฎาคม - 24 สิงหาคม 2567
สอบถามข้อมูลเพิ่มเติมได้ที่ เพจ สำนักงานประชาสัมพันธ์จังหวัดอุบลราชธานี หมายเลขโทรศัพท์ (045) 344 583 - 4
เดินวิ่งเทรล สวนสัตว์สงขลา ครั้งที่ 5 วันที 21 กรกฎาคม 2567
งาน “ประเพณีแห่เทียนพรรษา” จังหวัดบุรีรัมย์ ประจำปี 2567
งาน “ประเพณีแห่เทียนพรรษา” จังหวัดบุรีรัมย์ ประจำปี 2567 ร่วมสืบสานประเพณีอันดีงามของไทย พร้อมชมขบวนรถเทียนพรรษาสุดอลังการ และกิจกรรมมากมาย ห้ามพลาด...
"ประเพณีแห่เทียนพรรษา อำเภอประโคนชัย” จังหวัดบุรีรัมย์ วันที่ 21-22 กรกฎาคม 2567 ณ ลานหน้าสำนักงานเทศบาลตำบลประโคนชัย
- ชมขบวนแห่เทียนพรรษาสุดยิ่งใหญ่ทั้ง 6 คุ้มวัด
- การแสดงศิลปวัฒนธรรม/วงโปงลาง
- การแสดงดนตรี
- การแสดงศิลปวัฒนธรรม/ดนตรี
สอบถามข้อมูลเพิ่มเติมติดต่อโทร : ที่ทำการปกครองอำเภอประโคนชัย 044 671 488
"ประเพณีแห่เทียนพรรษา อำเภอนางรอง” จังหวัดบุรีรัมย์ วันที่ 21-22 กรกฎาคม 2567
ณ บริเวณอ่างเก็บน้ำหนองตาหมู่
- การประกวดต้นเทียนพรรษา
- ชมขบวนแห่เทียนพรรษากว่า 7 คุ้มวัด
- การประกวดธิดาเทียนและงานสมโภชเทียนพรรษา
ประเพณีแห่เทียนพรรษา อำเภอประโคนชัย ประจำปี 2567 วันที่ 21-22 กรกฎาคม 2567
ททท. สำนักงานบุรีรัมย์ เชิญเข้าร่วมงาน "ประเพณีแห่เทียนพรรษา อำเภอประโคนชัย ประจำปี 2567" วันที่ 21-22 กรกฎาคม 2567 ณ ลานหน้าสำนักงานเทศบาลตำบลประโคนชัย วันที่ 21 กรกฎาคม 2567
ภาคเช้าชม ชมขบวนแห่เทียนพรรษาสุดยิ่งใหญ่
ภาคค่ำชม การแสดงศิลปวัฒนธรรม/วงโปงลาง
การแสดงดนตรี วันที่ 22 กรกฎาคม 2567
ภาคค่ำชม การแสดงศิลปวัฒนธรรม/ดนตรี
เวียนเทียนทางน้ำ กลางกว๊านพะเยา เนื่องในวันอาสาฬหบูชา ครั้งที่ 52
เวียนเทียนทางน้ำ กลางกว๊านพะเยา เนื่องในวันอาสาฬหบูชา ครั้งที่ 52 ททท.สำนักงานเชียงราย เชิญชวนสายศรัทธาออกมาเที่ยว ร่วมทำบุญแสวงประสบการณ์แห่งความสุขทันใจ! ที่ห้ามพลาดกันเลย เป็นประเพณีที่สำคัญของจังหวัดพะเยาด้วยนะ 1 ปี มี 3 ครั้ง โดยในปีนี้ สำนักงานวัฒนธรรมจังหวัดพะเยา กำหนดจัดงานขึ้น ในระหว่างวันที่ 20-22 กรกฎาคม 2567 ณ ลานอเนกประสงค์หลังเทศบาลเมืองพะเยา และวัดติโลกอารามถนนชายกว๊าน อ.เมืองพะเยา จ.พะเยา
•กิจกรรมภายในงาน•
ร่วม : ทำบุญตักบาตรข้าวสารอาหารแห้ง พระสงฆ์ 72 รูป (วันที่ 20 กรกฎาคม 2567)
•เวียนเทียนทางน้ำถวายเป็นพุทธบูชา (สามารถรับบัตรลงเรือรอบพิธีการฟรี ในวันที่ 20 กรกฎาคม 2567 ตั้งแต่เวลา 16.00 น.)
ชม : ทิวทัศน์กว๊านพะเยา
•ชมการแสดงศิลปวัฒนธรรมในพิธีเปิดงาน (วันที่ 20 กรกฎาคม 2567)
•มินิแสงสีเสียง "เล่าขานตำนานกว๊านพะเยา" (วันที่ 20 กรกฎาคม 2567)
•การแสดงวงดนตรีลูกทุ่ง SAFA UP BAND จากมหาวิทยาลัยพะเยา (วันที่ 20 กรกฎาคม 2567)
ชิม : อาหารพื้นถิ่น และของกินพื้นบ้านเมืองพะเยา
ช้อป : ผลิตภัณฑ์สินค้าทางวัฒนธรรมและสินค้า OTOP ของดีเมืองพะเยา
เชิญชวนนักท่องเที่ยวร่วมลงทะเบียน รับบัตรลงเรือ ฟรี! ในงานเวียนเทียนทางน้ำ กลางกว๊านพะเยา เนื่องในวันอาสาฬหบูชา ครั้งที่ 52 ระหว่างวันที่ 20-22 กรกฎาคม 2567 วันละ 100 ใบ เพื่อสักการะหลวงพ่อศิลา ณ วัดติโลกอาราม
ปะทิวฟิชชิ่งเกมส์ 2024 วันที่ 22-23 กรกฎาคม 2567
ปะทิวฟิชชิ่งเกมส์ 2024 วันที่ 22-23 กรกฎาคม 2567 ณ บ้านหน้าทับ อ.ปะทิว จ.ชุมพร ไฮไลท์ของงาน: การแข่งขันตกปลา แข่งขันตกปลาทราย แข่งขันพายคายัค แข่งขันชักเย่อ แข่งขันทำอาหาร แข่งขันผสมเครื่องดื่มประกอบลีลา กิจกรรมบันเทิงและอาหารอร่อย แสงสีเสียงครบตลอดงาน
งานบุญประเพณีใส่บาตรเทียน หนึ่งเดียวในโลก 22 ก.ค. 2567
งานบุญประเพณีใส่บาตรเทียน หนึ่งเดียวในโลก ที่จะจัดขึ้นหลังจากวันเข้าพรรษา 1 วัน ซึ่งตรงกับวันแรม 2 ค่ำ เดือน 8 ของทุกปี โดยในปีนี้ตรงวันที่ 22 ก.ค. 2567
ประเพณีใส่บาตรเทียนจะจัดขึ้นหลังวันเข้าพรรษา 1 วัน โดยจะจัดพิธีสูมาคารวะหรือพิธีขอขมาแก่เจ้าคณะอำเภอและพระเถระชั้นผู้ใหญ่ ในขณะที่พุทธศาสนิกชนทั้งหลายต่างก็ถือเอาวันเดียวกันนี้ นำเทียนและดอกไม้มาถวายแก่พระภิกษุ สามเณร เพื่อให้พระสงฆ์ในวัดได้นำเทียนกลับไปจุดบูชาองค์สัมมาสัมพุทธเจ้า และได้จุดศึกษาเล่าเรียนธรรมวินัยในยามค่ำคืน ประเพณีใส่บาตรเทียน ถือเป็นประเพณีที่มีแห่งเดียวในประเทศไทย ซึ่งอยู่คู่กับชาวอำเภอเวียงสามาเป็นเวลาช้านาน สันนิษฐานว่าน่าจะเริ่มถือปฏิบัติกันมาตั้งแต่ปีพุทธศักราช 2344 หลังจากเจ้าฟ้าอัตถวรปัญโญ สร้างวัดบุญยืนได้ 1 ปี เมื่อ พ.ศ. 2343 โดยในยุคเริ่มต้นถือเป็นประเพณีที่ทำเฉพาะวัดบุญยืน และจนถึงปัจจุบันก็มีเพียงวัดเดียวในจังหวัดน่านที่สืบสานประเพณีนี้อย่างเหนียวแน่น
เทศกาลว่าวและบอลลูนนานาชาติ ประจำปี 2567 อำเภอห้วยราช 22-23 กรกฎาคม 2567
ททท. สำนักงานบุรีรัมย์ เชิญเที่ยวงาน เทศกาลว่าวและบอลลูนนานาชาติ ประจำปี 2567 อำเภอห้วยราช จังหวัดบุรีรัมย์ วันที่ 22-23 กรกฎาคม 2567 ณ เวทีกลาง ลานอเนกประสงค์ ที่ว่าการอำเภอห้วยราช ภายในงานพบกับกิจกรรมมากมายอาทิ - การแห่ขบวนว่าวสุดอลังการ - การแข่งขันกรแกว่งว่าวแอกโบราณ - การจัดแสดงหมู่บ้านว่าวโบราณ - การประกวดธิดาว่าว - บอลลูนยักษ์ - การเดินแบบผ้าไทยใส่ให้สนุก - การแสดงดนตรี ศิลปวัฒนธรรมพื้นบ้าน - ชิม ช้อปไปกับสินค้าพื้นบ้นและผลิตภัณฑ์ OTOP
พิดโลก ปล่อยไก่ ตอน…มู เมาท์ มันส์ 23-27 กรกฎาคม 2567
" พิดโลก ปล่อยไก่ " ตอน… มู เมาท์ มันส์ . ยืนหนึ่ง เรื่องสายมู เฮงๆ ปังๆ เสริมศิริมงคล .มีเรื่องให้เมาท์ มีเรื่องเล่า มีของอร่อยเพียบ .ครั้งนี้ พิษณุโลกมันส์ ‼️สนุกกว่าที่คิด ภายใต้โครงการการพัฒนาเมืองพิษณุโลกสร้างสรรค์ เทศบาลนครพิษณุโลก (Creative Event Design Workshop for Creative District) ภายในงานพบกับกิจกรรม.. Art & Craft Market การแสดงดนตรี กิจกรรมเช็คอินรับของที่ระลึก กิจกรรมนิทรรศการแสดงผลงานภาพถ่าย กิจกรรม Workshop งานคราฟต์ ระหว่างวันที่ 23 - 27 กรกฎาคม 2567 ย่านประตูมอญ ย่านตลาดใต้
เวิร์คชอปมองภาพอนาคตเมืองเก่าสงขลา 23 กรกฎาคม 2567
กิจกรรมเวิร์คชอปมองภาพอนาคตเมืองเก่าสงขลาจัดขึ้นในวันอังคารที่ 23 กรกฎาคม 2567 ตั้งแต่เวลา 13.00 - 17.00 น. ณ
A.E.Y. space
ขอเชิญชวนชาวเมืองสงขลาเข้าร่วมกิจกรรมเวิร์คชอปมองภาพอนาคตเมืองเก่าสงขลา ผ่านคำถาม เราเห็นอะไรในปัจจุบัน ? อะไรอาจเกิดขึ้นได้บ้างในอนาคต ? เราจะไปทางไหนในอนาคต ? เราจะทำอะไรในปัจจุบัน ?
กิจกรรมนี้เป็นส่วนหนึ่งในโครงการแผนแม่บทการพัฒนาย่านเศรษฐกิจสร้างสรรค์ ย่านเมืองเก่าสงขลาระยะที่ 1 (พ.ศ. 2568 - 2570) โดยสำนักงานบริการวิชาการ มหาวิทยาลัยศิลปากร และศูนย์มิตรเมือง (Urban Ally ) คณะสถาปัตยกรรมศาสตร์ มหาวิทยาลัยศิลปากร ร่วมกับสำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ (องค์การมหาชน)
23 กรกฎาคม โรงพยาบาลนครพิงค์ · สดุดีคุณยายวัย 85 ปี บริจาคดวงตา
23 กรกฎาคม 2567 โรงพยาบาลนครพิงค์ สดุดีคุณยายวัย 85 ปี บริจาคดวงตา ส่งต่อแสงสว่างให้ผู้อื่น หลานของคุณยายเล่าว่า คุณยายต้องการอุทิศร่างกายให้เป็นประโยชน์มากที่สุดหากเสียชีวิตไป โดยขณะที่ยังมีชีวิต คุณยายได้เคยทำบัตรแสดงความจำนงบริจาคร่างกายและดวงตากับสภากาชาดไทยไว้ก่อนแล้ว เมื่อคุณยายเสียชีวิตลง ญาติจึงยินยอมให้คุณยายบริจาคร่างกายตามเจตนารมณ์ โดยแพทย์ตรวจประเมินว่าสามารถบริจาคกระจกตาได้ จึงได้บริจาคดวงตา แก่ศูนย์ดวงตาสภากาชาดไทย เพื่อนำไปปลูกถ่ายให้กับผู้ป่วยที่รอคอยต่อไป
การบริจาคอวัยวะคือการให้ที่ไม่มีที่สิ้นสุด คือการทำบุญครั้งยิ่งใหญ่ คือทานบารมีขั้นสูง ด้วยบุญกุศลที่ได้มอบชีวิตใหม่ให้กับผู้อื่นนั้น ขอให้ดวงวิญญาณของผู้วายชนม์ ไปสู่ภพภูมิที่ดีและได้รับรู้ว่าได้ช่วยเหลือผู้อื่นตามเจตนารณ์แล้ว
ขอขอบคุณผู้เกี่ยวข้องในภารกิจสะพานบุญในครั้งนี้ - สิริพร ฟองคำ - ธรินทร์ญา บุญษร ทีมจัดเก็บดวงตา รพ.นครพิงค์ - นางศรีสังวาลย์ เนตรอนงค์ รองผู้อำนวยการฝ่ายการพยาบาล - นพ.ประพนธ์ เปี่ยมอนันต์ ผู้ช่วยผู้อำนวยการภาพลักษณ์และสื่อสารองค์กร และ ประธาน Service plan สาขาปลูกถ่ายอวัยวะ - วัชรินทร์ ไชยวิรัตน์ ผู้ประสานงานปลูกถ่ายอวัยวะ - จันทรัศม์ เมืองดี ผู้ประสานงานปลูกถ่ายอวัยวะ - ศุภักษณา ตันซาว ผู้ประสานงานปลูกถ่ายอวัยวะ ***ภาพและบทความ ได้รับอนุญาตให้เผยแพร่จากญาติผู้เสียชีวิตแล้ว
งานเกษตรแฟร์ น่านเหนือ ลำไย ยืน1 อ.เชียงกลาง 24 - 30 กรกฎาคม 2567
อำเกอเชียงกลาง... ขอเชิญเที่ยวงานเกษตรแฟร์ น่านเหนือ ลำไย ยืน1 อ.เชียงกลาง จ.น่าน ณ ตลาดคลองถม 4 แยกบ้านเจดีย์ (ข้างเทศบาลตำบลเขียงกลาง) ระหว่างวันที่ 24 - 30 กรกฎาคม 2567 มีกิจกรรมต่างๆ ดังนี้ - พิธีลงนามบันทึกข้อตกลงซื้อขายลำไย ระหว่างสหกรณ์การเกษตรเชียงกลาง กับแปลงใหญ่ลำไยตำบลพญาแก้ว อำเภอเชียงกลาง จังหวัดน่าน - กิจกรรมประกวดลำไยสดช่อคุณภาพ - กิจกรรมประกวดแปรรูปอาหารจากลำไย - กิจกรรมจำหน่ายลำไยคุณภาพ ผ่านช่องทางออนไลน์ - กิจกรรมประกวดการจัดกระเช้าผลผลิตทางการเกษตร - กิจกรรมประกวดแม่หญิงเกษตร - กิจกรรมแข่งขันหลามไก่และส้มตำลีลา - กิจกรรมการประกวดดนตรีนักเรียนมัธยม - กิจกรรมแข่งขันลาบเนื้อและลาบปลา - กิจกรรมแข่งขันจับปลาไหล - กิจกรรมแข่งประกวดวาดภาพนักเรียน
งาน "เกษตรแฟร์ น่านเหนือ" ลำไยยืน 1 วันที่ 24-30 ก.ค 2567
งาน "เกษตรแฟร์ น่านเหนือ" ลำไยยืน 1 ระหว่างวันที่ 24 - 30 ก.ค 2567 ณ ตลาดคลองถม4แยกบ้านเจดีย์ (ข้างเทศบาลเชียงกลาง) จัดงานภายในโดมขนาดใหญ่ ไม่ต้องกลัวฝน กิจกรรมภายในงาน ✅สินค้าธงฟ้าราคาประหยัด ✅ซื้อผลไม้ในงาน มีกล่องผลไม้ 10 กก. ส่งฟรี ✅ประกวดแปรรูปอาหาร ประกวดลาบพื้นเมือง ประกวดส้มตำลีลา ประกวดจัดกระเช้าผลไม้ ✅ประกวดแม่หญิงเกษตร ✅วงดนตรี มหาหิงค์ ✅มวยมันส์ ✅หมอรำหนึ่งรุ่งทิวา อำนวยศิลป์ ✅กิจกรรมของสมาคมกว่างและประกวดไก่ชนสวยงาม ✅กระต่าย พรรณิภา ✅รำวงเสน่ห์จันทร์ ✅บอลลูนโชว์ ✅สวนสนุกชุดใหญ่ และการละเล่น
Creative Nakhon Festival 6/2024 วันที่ 25-28 ก.ค. 2567
Creative Nakhon Festival 6/2024 เทศกาลสร้างสรรค์ ครีเอทีฟนคร ครั้งที่6 ถึงเวลาออกมา "จ้าน" กันให้สุดกับงานสร้างสรรค์แสนครีเอทีฟ คนจ้าน หรอยจ้าน ศิลป์จ้าน เพลินจ้าน แล้วออกมาหนุกจ้าน ให้ออกรส ออกชาติ จ้านกันทั้งเมือง ในธีม "จ้าน" ธีมที่จะมาเล่าเรื่องความ"มากมายและหลากหลาย" ผ่านงานสร้างสรรค์หลายหลากแขนงที่เมืองนคร
พบกับกิจกรรมสร้างสรรค์ "จ้าน" ในเทศกาลสร้างสรรค์ ครีเอทีฟนคร - EXHIBITION & SHOWCASE สร้างสรรค์จ้าน - TALK แหลงดีจ้าน - WORKSHOP หนุกจ้าน - KHON MARKET ของดีจ้าน - EVENT & ENTERTAINMENT เพลินจ้าน - FOOD & DRINK หรอยจ้าน มาหนุกกันจ้าน ในเทศกาลสร้างสรรค์ CREATIVE NAKHON FESTIVAL ครั้งที่ 6/2567 วันที่ 25-28 ก.ค. 2567 นี้ ณ บวรนคร ย่านท่าวังเมืองนครศรีธรรมราช 10.00 น. - 21.00 น.สหกรุ๊ปแฟร์กบินทร์บุรี ครั้งที่28 ตั้งแต่ 25-28 ก.ค. 2567
กลับมาอีกครั้ง..พบกับงาน สหกรุ๊ปแฟร์กบินทร์บุรี ครั้งที่ 28 ร่วมกับ อุตสาหกรรมแฟร์ปราจีนบุรี ครั้งนี้จัดหนักจัดเต็ม สินค้าตัวเด็ดตัวดัง ลดเพียบบบ!!! เตรียมตัวให้พร้อมแล้วมาพบกัน ณ สวนอุตสาหกรรมเครีอสหพัฒน์กบินทร์บุรี อ.กบินทร์บุรี จ.ปราจีนบุรี เริ่มขาย ????วันพฤหัสบดีที่ 25 ก.ค. 67 เวลา 13.00 -21.00 น. วันศุกร์ที่26 - วันเสาร์ที่27 ก.ค. 66 เวลา 9.00 -21.00 น. วันสุดท้าย วันอาทิตย์ที่28 ก.ค. 67 เวลา 9.00 -17.00 น.
งานวัฒนธรรมสัมพันธ์ลุ่มน้ำโขง 26-28 กรกฎาคม 2567
งานวัฒนธรรมสัมพันธ์ลุ่มน้ำโขง ในงานพบกับการแสดงศิลปวัฒนธรรมประเพณีของกลุ่มประเทศลุ่มน้ำโขงจาก 4 ประเทศและการแสดงพลุสุดตระการตา ระหว่างวันที่ 26-28 กรกฎาคม 2567 ณ สวนสาธารณะหาดเชียงราย (พัทยาน้อย) อำเภอเมือง จังหวัดเชียงราย พิเศษสุดๆ พบกับมินิคอนเสิร์ตจากศิลปินชื่อดัง เข้าชมฟรี! วันที่ 26 กรกฎาคม 2567 ตั้งแต่เวลา 16.00-22.00 น. พบกับ หญิง ธิติกานต์ , เท่ห์ อุเทนพรหมมินทร์ . วันที่ 27 กรกฎาคม 2567 ตั้งแต่เวลา 18.00-21.00 น. พบกับ ไก่ พรรณนิภา . วันที่ 28 กรกฎาคม 2567 ตั้งแต่เวลา 18.00-21.00 น. พบกับ เต๋า ภูศิลป์ . สอบถามข้อมูลเพิ่มเติมได้ที่ : เทศบาลนครเชียงราย 053-711333 ท่องเที่ยวและกีฬาเชียงราย 052-029211 ททท.สำนักงานเชียงราย 053-744674-5
งานอิทผลัมเพชรบูรณ์ & บอลลูนเฟสติวัล 2567 วันที่ 26-28 กรกฎาคม 2567
งานอินทผลัมเพชรบูรณ์แอนด์บอลลูนเฟสติวัล 2024 วันที่ 26-28 กรกฎาคม 2567 ณ สนามหน้าศูนย์วิจัยและพัฒนาอาหารสัตว์เพชรบูรณ์ (ข้างพระใหญ่) อำเภอเมือง จังหวัดเพชรบูรณ์ การแสดง Balloon Light & Sound ในเวลา 18.30 น. และ 20.30 น. ภายในงานมีการออกร้านจากเกษตรกรกลุ่มอินทผลัมเพาะเลี้ยงเนื้อเยื่อจังหวัดเพชรบูรณ์ ที่นำอินทผลัมสดมาให้ทุกท่านได้เลือกชิม และเลือกซื้อ พร้อมโปรโมชั่นนาทีทอง การจำหน่ายสินค้าเกษตร สินค้าแปรรูป พร้อมทั้งสินค้าโอทอปจังหวัดเพชรบูรณ์ อิ่มอร่อยกับอาหารสไตล์ฟู้ดทรัค (Food truck) และร้านค้ามากมาย เด็กๆ เพลิดเพลินกับกิจกรรมสวนสนุกกลางแจ้ง และพิเศษ
เทศกาลละครร่วมสมัยหาดใหญ่ 26-28 กรกฎาคม 2567
เทศกาลละครร่วมสมัยหาดใหญ่ ที่ 26-28 กรกฎาคม 2567 จัดที่โรงละครเสน่หาเธียร์เตอร์ ชั้น2 ลีการ์เดนส์ พลาซ่า วัน
Sanehar Paradiso เชิญพี่น้องชาวหาดใหญ่ มาเปิดประสบการณ์ชมละครเวทีร่วมสมัย ละครเวทีชวนหัว จิกกัดสังคม 2 เรื่อง2 รสชาติ End Station และ บุพการี ที่กำลังเป็นที่ฮือฮาจากกาลิเลโอ โอเอซิส เธียร์เตอร์จากกทม. เมื่อไม่นานมานี้ พบกับ ปราโมทย์ แสงศร นักแสดงที่ติดอยู่ในหัวใจใครหลายคนจากยุค90 และ โอ๊ต รัฐธีร์ วรโรจน์โยธิน พระเอกดังจากช่อง7 พร้อมด้วย ทีมงานคนละครมืออาชีพอีกคับคั่ง
MANOHRA THE FUSION มโนราห์เดอะฟิวชั่น วันที่ 26 กรกฎาคม 2567
การแสดงชุด "MANOHRA THE FUSION มโนราห์เดอะฟิวชั่น" ในวันศุกร์ ที่ 26 กรกฎาคม 2567 เวลา 14.00 - 16.00 น. ณ หอเปรมดนตรี มหาวิทยาลัยทักษิณ จากชาดกพระสุธน มโนราห์ สู่การเล่าเรื่องด้วยศิลปะการแสดงร่วมสมัย จัดการแสดงโดยหลักสูตรศิลปะการแสดง คณะศิลปกรรมศาสตร์ มหาวิทยาลัยทักษิณ โดยความร่วมมือของเครือข่ายศิลปะการแสดงภาคใต้ และศิลปินแห่งชาติ ชมฟรี สำรองที่นั่ง 091-5241528
งาน Songkhla Signature ริมหาดชลาทัศน์ วันที่ 26-28 กรกฎาคม 2567
งาน Songkhla Signature ริมหาดชลาทัศน์ วันที่ 26-28 กรกฎาคม 2567
คนกันเองจอมพลเฟส 26-30 กรกฎาคม 2567
เทศกาลกราฟฟิตี้ ย่านจอมพลสตรีท โคราช มหกรรมการสร้างสรรค์ผลงานศิลปะลวยลายบนผนัง พบ 18 ศิลปิน GRAFFITI ระดับประเทศ
Amazing Beach Life Festival 26-28 กรกฎาคม 2567
งาน Amazing Beach Life Festival อีเวนต์ที่รวบรวมเทศกาล ดนตรี ศิลปะ และกีฬาริมชายหาด ณ จังหวัดพังงา ระหว่างวันที่ 26-28 กรกฎาคม 2567 เวลา 16:00 - 22:30 น. ณ Memories Beach เขาหลัก จังหวัดพังงา ภายใต้ธีม Rhythm Beach สนุกสนานไปกับสีสันความสดใสและจังหวะเสียงคลื่นกระทบหาดทราย
สุดมันส์กับคอนเสิร์ตริมชายหาดจากเหล่าศิลปินและดีเจ นำทีมโดย เอ๊ะ จิรากร, Earth Patravee, MAIYARAP, Whal&Dolph, Purpeech, WIM และเหล่า Dj ㅤ จุดถ่ายรูปสุดปังและมุมสุดเก๋ทั้ง Installation Arts, Inflatable Landmark ปลาหมึกยักษ์ ㅤ Beach Activities กิจกรรมกีฬาทางทะเลสุดมันส์ ที่สายแอดเวนเจอร์ห้ามพลาด ㅤ Workshop DIY กิจกรรมเวิร์กชอปงานแฮนด์เมดศิลปะสุดน่ารัก และของที่ระลึกในสไตล์ที่เป็นตัวเอง ㅤ Sustainable Zone โซนแยกขยะเพื่อให้เกิดการบริหารจัดการขยะได้อย่างเหมาะสม และโซนกิจกรรมที่ช่วยเพิ่มมูลค่าให้พลาสติก เช่น การ DIY สร้อยข้อมือจากฝาขวดน้ำพลาสติก ㅤ Food & Life Style Market เต็มอิ่มกับอาหารและเครื่องดื่มแสนอร่อยท่ามกลางเสียงเพลง พร้อมเติมความชิคไปกับ Rip curl Thailand อุปกรณ์เที่ยวทะเล อุปกรณ์เซิร์ฟ ที่จะมาทำให้กีฬาเอ็กซ์ตรีมทางน้ำ มันส์ สนุกสุดเหวี่ยงเพิ่มขึ้นไปอีก
งานเทศกาลอาหารและบอลลูน ของดี 4 ภาค อำเภออู่ทอง 26 กรกฎาคม - 4 สิงหาคม 2567
งานเทศกาลอาหารและบอลลูน ของดี 4 ภาค ตั้งแต่ 26 กรกฎาคม - 4 สิงหาคม 2567 ตั้งแต่ช่วงเวลา 18.00-22.00 ชมฟรี ตลอดงาน ณ ที่ว่าการอำเภออู่ทอง จ.สุพรรณบุรี ชมมินิบอลลูน บอลลูนโชว์ ทุกวัน (การแสดงอาจเปลี่ยนแปลงขึ้นกับสภาพอากาศ)
งานแข่งเรือยาวประเพณีจังหวัดปทุมธานี เฉลิมพระเกียรติฯ หน้าวัดมะขาม 27-28 กรกฏาคม 2567
งานแข่งเรือยาวประเพณีจังหวัดปทุมธานีเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว ชิงถ้วยพระราชทาน ณ ลำน้ำแม่น้ำเจ้าพระยาหน้าวัดมะขาม - วัดศาลเจ้า ตำบลบ้านกลาง อำเภอเมือง ปทุมธานี จังหวัดปทุมธานี ระหว่างวันที่ 27 - 28 กรกฏาคม 2567 สำหรับการแข่งขันเรือยาวในปี 2567 จะมีการแข่งขัน 3 ประเภท ได้แก่ เรือยาวเล็ก 30 ฝีพาย เรือยาวกลาง 40 ฝีพาย และเรือยาวใหญ่ 55 ฝีพาย โดย ถ่ายทอดสดการแข่งขันรอบชิง ฯ ในวันอาทิตย์ที่ 28 ก.ค.2567 ที่หน้าวัดมะขาม ต.บ้านกลาง อ.เมือง ปทุมธานีเวลา 14.30-16.30 น. ทาง ททบ.5 แล้วยังเพิ่มช่องทางรับชมการถ่ายทอดสดผ่านทางเพจเฟสบุ๊คและยูทูปTV5HD Online และเพจศึกเรือยาวไทย มรดกไทย เตรียมพบมหรสพและกิจกรรมความบันเทิงมากมาย ที่เตรียมพร้อมไว้มอบความสุขสนุกสนานให้กับทุกท่านได้มาร่วมงาน
Amazing phuket surf festival 2024 วันที่ 27 -28 กรกฎาคม 2567
Amazing phuket surf festival 2024 เตรียมตัวให้พร้อมกับสนามแรกที่เกิดขึ้น ณ ชายหาดกะรน แล้วเจอกันภายในงาน Karon Fin Fest 2024 ครั้งแรกของหาดกะรนที่จัดการแข่งขันกระดานโต้คลื่น วันที่ 27 -28 กรกฎาคม นี้ โดยรุ่นการแข่งขันมีดังต่อไปนี้
Men open longboard
Women open longboard
Beginner Men longboard
Beginner Women longboard
ผู้ชนะจะได้รับรางวัลถ้วยรางวัลและของที่ระลึกต่างๆอีกมากมายตามลำดับ
Karon Fin fest 2024 ไม่ได้มีแค่การแข่งขันกระดานโต้คลื่นเพียงอย่างเดียว ภายในงานเพื่อนๆ
Food - ชอปชิมจากร้านอาหารมากมาย
Art - work shop - กิจกรรมงานศิลปะ
Music – วงดนตรีและเสียงเพลง DJ
Surf - clinic ลองเรียน ลองเล่น กระดานโต้คลื่น
พร้อมชิลไปกับ Sunset Moment & Party ตลอดทั้ง 2 คืนที่หาดกะรน จังหวัดภูเก็ต
เข้าชมงานฟรีไม่มีค่าใช้จ่าย
งาน Amazing Phuket surf festival 2024 - 4 สนามแข่ง
งาน Amazing Phuket surf festival 2024 การแข่งขันกระดานโต้คลื่นจังหวัดภูเก็ต โดยปีนี้จะพบกันถึง 4 สนามแข่ง ได้แก่
- หาดกะรน Karon Fins Fest 2024 ในวันที่ 27 - 28 กรกฎาคม 2567
- หาดกมลา Beach Break @Kamala 2024 ในวันที่ 16 -18 สิงหาคม 2567
- หาดกะหลิม Kalim Patong Surfing contest 2024 ในวันที่ 30 สิงหาคม - 1 กันยายน 2567
- หาดป่าตอง Pearl of Andaman Surfing Contest 2024 ในวันที่ 19 -21 ตุลาคม 2567
สนุกเต็มที่ไปพร้อมกันตลอดฤดูกาลโต้คลื่นภูเก็ต
Amazing Phuket Surf festival 2024 มาพร้อมกับกิจกรรมต่างๆมากมาย อาทิ เช่น
Food - ชอปชิมจากร้านอาหารมากมาย
Art - work shop - กิจกรรมงานศิลปะ
Music - วงดนตรีและเสียงเพลง
Amazing Phuket Surf Festival งานดีๆ ที่เหมาะสำหรับคนที่ชอบโต้คลื่น กับดนตรีและศิลปะ ห้ามพลาด ที่ภูเก็ต
บุฟเฟต์ทุเรียนที่โลตัส หาดใหญ่ (หน้ามอ.) 27–28 กรกฎาคม 2567
บุฟเฟต์ทุเรียนที่โลตัส หาดใหญ่ (หน้ามอ.) 2 วันเท่านั้น วันที่ 27-28 กรกฎาคม 2567 เอาใจชาวทุเรียนเลิฟเวอร์ กับราคาน่ารักเพียง 599.-/คน ไม่แค่ทุเรียนนะ แต่ผลไม้อื่นก็มีให้ชิมเพียบ
งานวัฒนธรรมสัมพันธ์ มหาวิทยาลัยราชภัฏสงขลา ประจำปี 2567 "ตำนานโนรา เบญจคีตา ทักษิณาดุริยางค์" 27 กรกฎาคม - 4 สิงหาคม 2567
งานวัฒนธรรมสัมพันธ์ มหาวิทยาลัยราชภัฏสงขลา ประจำปี 2567 "ตำนานโนรา เบญจคีตา ทักษิณาดุริยางค์" 27 กรกฎาคม - 4 สิงหาคม 2567 ณ บริเวณบนถนนรอบเกาะลอย มหาวิทยาลัยราชภัฏสงขลา วัตถุประสงค์ เพื่อการส่งเสริม เผยแพร่ อนุรักษ์ สืบสาน สร้างสรรค์ศิลปะและวัมนธรรมท้องถิ่นและของชาติ รวมถึงการนำวัฒนธรรมท้องถิ่นเป็นพลังสร้างสรรค์พัฒนาเศรษฐกิจไทย (Soft Power) สร้างเครือข่ายความร่วมมือด้านศิลปะและวัฒนธรรม จัดนิทรรศการ การแสดง การละเล่นพื้นถิ่นให้คงอยู่สืบไป
การแข่งขันจักรยานขาไถ Balance Bik หาดใหญ่ฮอลล์ 27 กรกฎาคม 2567
โครงการจัดการแข่งขันจักรยานขาไถ (Balance Bike) เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 รุ่นนักแข่งทั่วไป จ. สงขลา วันที่ 27 กรกฎาคม 2567 ณ หาดใหญ่ ฮอล์ ชั้น 5 ห้างเซ็นทรัลหาดใหญ่ 10.00 - 17.00 น. สมัครฟรี
เที่ยวรถไฟ KIHA@ปราจีนบุรี 27-28 กรกฎาคม 2567
เที่ยวรถไฟ KIHA@ปราจีนบุรี สัมผัสมนต์เสน่ห์ปราจีนบูรพา 27-28 กรกฎาคม 2567 แพ็คเกจ 2 วัน 1 คืน สุดคุ้ม ติดต่อได้ที่ 1690 ท่องเที่ยวยังไงให้เสริมโชค ขบวนพิเศษเคล็ดลับสายมูกับ อาจารย์เป็นหนึ่ง วงษ์ภูดร เยี่ยมชมหลายวัดบนเส้นทางในจ.ปราจีน
งาน ทุเรียนโลก และเทศกาลผลไม้นานาพรรณ ของดีบ้านแยง วันที่ 27 กรกฎาคม - 4 สิงหาคม 2567
จังหวัดพิษณุโลก ขอเชิญเที่ยวงาน ทุเรียนโลก และเทศกาลผลไม้นานาพรรณ ของดีบ้านแยง ประจำปี 2567 วันที่ 27 กรกฎาคม - 4 สิงหาคม 2567 ณ บริเวณประตูกำแพงเมืองนครบางยาง ตลาดผลไม้บ้านแยง จังหวัดพิษณุโลก
เชิญมาประกวด สาวน้ำดอกไม้นายน้ำหอมประจำปี 2567 ในวันที่ 28 ก.ค. 2567 LINK
ขอเชิญชวนสาวสวย หนุ่มหล่อ รูปร่างหน้าตาดี พร้อมความสามารถ และทัศนคติที่ดี มาประกวดมง สาวมะม่วง หนุ่มมะพร้าวเมืองแปดริ้ว "สาวน้ำดอกไม้นายน้ำหอม " ปีที่ 3 ชิงเงินรางวัลและของรางวัลรวมมูลค่ากว่า 50,000 บาท พร้อมมงกุฏ และสายสะพาย
ประกวดวันที่ 28 กรกฎาคม 2567 สถานที่โรบินสันไลน์สไตล์ ฉะเชิงเทรา SF ชั้น 2
การแต่งกาย ชุดไทย-ชุดชาวสวน
คุณสมบัติ
- สาวสวยเพศหญิง
- หนุ่มหล่อเพศชาย
- ช่วงอายุ 18-30 ปี
กรอกใบสมัครออนไลน์ได้ https://forms.gle/f9yaddLYZk7is5SC7
ตั้งแต่วันนี้ – 27 กรกฎาคม 2567 หรือสามารถ สมัครได้ที่เคาน์เตอร์ Information
กิจกรรมระดมความคิดเห็น ผลักดันจังหวัดสงขลาสู่การเป็นเมืองสร้างสรรค์ UNESCO 28-29 มิ.ย.67 LINK
ขอ เสียง คนสงขลา เติมเต็มความคิดและข้อเสนอเพื่อผลักดัน สงขลาสู่เมืองสร้างสรรค์ UNESCO กิจกรรม 2 วัน 2 จุด
28 มิ.ย.67 (17.00-20.00น.) ณ ถนนคนเดินเมืองสงขลา
29 มิ.ย.67 (15.00-20.00น.) สวนสาธารณะเมืองสงขลา
กิจกรรมครั้งนี้เป็นส่วนหนึ่งของกิจกรรมสื่อสารประชาสัมพันธ์และสร้างการรับรู้ ตามแนวทางการเป็นเมืองสร้างสรรค์ ภายใต้โครงการจ้างที่ปรึกษาศึกษาการขับเคลื่อนการพัฒนาเมืองตามแนวทางเมืองสร้างสรรค์ โดย องค์การบริหารส่วนจังหวัดสงขลา
ขอเชิญชาวสงขลาทุกท่าน ร่วมเสนอความคิดเห็น และเติมเต็มข้อเสนอเพื่อร่วมผลักดันจังหวัดสงขลาสู่การเป็นเมืองสร้างสรรค์ UNESCO กับ 5 คำถามสำคัญ
(1) อะไรคือทรัพยากร แหล่ง วิถี ภูมิปัญญาองค์ความรู้ ที่โดดเด่นของสงขลาตามกรอบเมืองสร้างสรรค์ UNESCO
(2) ทรัพยากรนั้นอยู่พื้นที่ใด ใครทำ ใครดูแลได้รับการสนับสนุนจากใคร ช่องทางการติดต่อ
(3) ความเสี่ยง และความท้าทายของการรักษา และพัฒนาทรัพยากรดังกล่าว
(4) ข้อเสนอการพัฒนาแหล่งทรัพยากรสร้างสรรค์ ใครควรเป็นผู้เข้ามามีส่วนร่วม
(5) ข้อเสนอแนะ วิธีการ/แนวทาง ขับเคลื่อนเมืองสงขลาสู่เมืองสร้างสรรค์ UNESCO
ฟรีคอนเสิร์ต ช่อง 8 เพื่อชาวสมุทรสาคร 28 ก.ค. 2567
“คอนเสิร์ต ช่อง 8 presents THE BIG DAY เปย์ลั่น สนั่นนิคม SEASON 3“ ฟรีคอนเสิร์ต ช่อง 8 เพื่อชาวสมุทรสาคร วันอาทิตย์สิ้นเดือน 28 ก.ค.นี้ วัดโกรกกราก อ.เมือง จ.สมุทรสาคร หกโมงเย็น เชมฟรีตลอดงาน!! พบกับนักร้องคู่ซี้สายฮา #เบิ้ลปทุมราช #ก้องห้วยไร่ และศิลปินอาร์สยาม #นุ้ยสุวีณา #บิวพงค์พิพัฒน์ #ต้นข้าว #ลาดา #เปากิ่งกาญจน์
28 กรกฎาคม โรงพยาบาลร้อยเอ็ด ขอบคุณมารดา ผู้บริจาคอวัยวะ ชายอายุ 34 ปี
28 กรกฎาคม 2567 ณ อาคารนิติเวช โรงพยาบาลร้อยเอ็ด นายแพทย์ชาญชัย จันทร์วรชัยกุล ผู้อำนวยการโรงพยาบาลร้อยเอ็ด มอบหมายให้ พว.สุเพ็ญทิพย์ ทิพย์ประเสริฐ พยาบาลวิชาชีพชำนาญการ และคณะ มอบพวงหรีด และขอบคุณ นางวัน สมบูรณ์ มารดาของ นายวสันต์ สมบูรณ์ อายุ 34 ปี ผู้บริจาคอวัยวะที่เสียชีวิตจากมีภาวะสมองตาย จากเลือดออกในแกนสมอง ได้บริจาค ไต 2 ข้าง ให้กับศูนย์ดวงตาสภากาชาดไทย ไปปลูกถ่ายให้กับผู้พิการทางสายตาต่อไป โรงพยาบาลร้อยเอ็ด ขออนุโมทนาบุญแก่ญาติและผู้บริจาคอวัยวะให้กับเพื่อนมนุษย์เพื่อต่อชีวิตต่อลมหายใจให้ผู้ป่วย ที่รอความหวัง ถือเป็นทานบารมีที่ยิ่งใหญ่และเป็นที่สุดแห่งการให้ครั้งสุดท้ายของชีวิต สำหรับผู้ที่มีความประสงค์จะบริจาคอวัยวะ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ คุณปาณิสรา ทองมี ผู้ระสานงาน ศูนย์รับบริจาคอวัยวะ โรงพยาบาลร้อยเอ็ด โทร 092-6452426 และหอผู้ป่วยหนักศัลยกรรมประสาท โทร. 043-518200 ต่อ 2029 โรงพยาบาลร้อยเอ็ด
งาน "ลมหายใจของแผ่นดิน" เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว วันที่ 28-30 กรกฎาคม 2567 ณ สนามฟุตบอลช้างอารีนา
ททท. สำนักงานบุรีรัมย์ เชิญเข้าร่วมงาน "ลมหายใจของแผ่นดิน" เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 72 พรรษา 28 กรกฎาคม 2567 ในรูปแบบมิวสิคัล ด้วยเทคโนโลยีจัดแสดงระดับโลก สุดยิ่งใหญ่ตระการตา
วันที่ 28-30 กรกฎาคม 2567 ณ สนามฟุตบอลช้างอารีนา
พบกับกิจกรรมภายในงานมากมายอาทิ
- ชมกิจกรรมการแสดงเทิดพระเกียรติ สุดยิ่งใหญ่ด้วยเทคโนโลยีการจัดแสดงระดับโลก และกิจกรรมสาธารณกุศลมากมาย เปิดให้ชมฟรี!
- การแสดงแสงสีเสียงประกอบ 3D Mapping ตระการตา
- การแสดงวงดนตรีออร์เคสตรา (Orchestra) ลูกหลานชาวจังหวัดบุรีรัมย์ ร่วมบรรเลงดนตรีและแสดง กว่า 200 ชีวิต เครื่องดนตรีกว่า 120 ชิ้น
- การแสดง มิวสิคัล บอกเล่าเรื่องราวพระราชกรณียกิจ พระมหากรุณาธิคุณของพระบาทสมเด็จพระเจ้าอยู่หัวที่มีต่อปวงชนชาวไทย
- การแข่งขันประกวดวาดภาพ พระราชกรณียกิจของพระบาทสมเด็จพระเจ้าอยู่หัว
- บริจาคโลหิต ร่วมกันบำเพ็ญสาธารณประโยชน์ส่งต่อลมหายใจให้กับผู้ป่วย จำนวน 720 ยูนิตต่อวัน รวม 7,200 ยูนิต โดยบริจาคได้ถึงวันที่ 31 ธันวาคม 2567 สอบถามเพิ่มเติม สำนักงานสาธารณสุข จ.บุรีรัมย์ โทร.044-611-562
- โรงทานปันสุข ชาวจังหวัดบุรีรัมย์และร้านค้าชื่อดังต่างๆ นำอาหารเครื่องดื่มมาบริการแก่ผู้มาร่วมงาน ร่วมทำบุญได้ที่บัญชี “บุรีรัมย์ปันสุข เฉลิมพระเกียรติในหลวง รัชกาลที่ 10” ธนาคารกรุงไทย เลขที่ 308-3-21900-8
- เหรียญที่ระลึก เนื่องในโอกาสมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 จำนวน 80,000 เหรียญ มอบให้กับผู้ร่วมชมงาน
งานลานวัฒนธรรมสร้างสรรค์ “กาดฮิมต้าบ้านดอนแก้ว” 30–31 กรกฎาคม 2567
กระทรวงวัฒนธรรม ร่วมกับจังหวัดน่าน เทศบาลเมืองน่าน ชุมชนบ้านดอนแก้ว และกองทุนพัฒนาศักยภาพเครือข่ายเยาวชนจังหวัดน่าน (DNYC) ขอเชิญเที่ยวงานลานวัฒนธรรมสร้างสรรค์ 1 อำเภอ 1 ลานสร้างสรรค์ “กาดฮิมต้าบ้านดอนแก้ว” ระหว่างวันที่ 30 – 31 กรกฎาคม 2567 ตั้งแต่เวลา 17.00 - 20.00 น. ณ กาดฮิมต้า ลานกิจกรรมสาธารณะ ชุมชนบ้านดอนแก้ว ตำบลในเวียง อำเภอเมืองน่าน จังหวัดน่าน
เที่ยวชมตลาดวัฒนธรรม ร่วมกิจกรรมสร้างสรรค์งานศิลป์ จากปราชญ์ศิลปินในท้องถิ่นในจังหวัดน่าน สัมผัสวัฒนธรรมริมสายน้ำ ชมวิถีถิ่นชุมชนเมืองเก่า และชมการแสดงทางวัฒนธรรมท้องถิ่นทั้งแบบดั้งเดิมและร่วมสมัย ชวนมาช้อปกับสินค้าของดี ชวนมาชิมกับอาหารชุมชนอร่อยๆ จากชุมชนบ้านดอนแก้ว และชุมชนในเมืองเก่าน่าน ในบรรยากาศตลาดวัฒนธรรมริมน้ำน่าน พร้อมเช็คอิน ถ่ายภาพกับแม่น้ำน่านยามค่ำคืน และเพลิดเพลินไปกับการแสดงดนตรีโฟล์คซองร่วมสมัย จากเครือข่ายศิลปินเยาวชนจังหวัดน่าน
งานกระบี่ อันดามัน ฮาลาล เฟสติวัล | Krabi Andaman Halal Festival 2024
งานกระบี่ อันดามัน ฮาลาล เฟสติวัล | Krabi Andaman Halal Festival 2024 วันที่ 31 กรกฎาคม ถึง 4 สิงหาคม 67 นี้ ที่ มัสยิดกลางประจำจังหวัดกระบี่ มาเลือกกินอาหารฮาลาลที่สุดฮหรอย ไม่ฮารอม เพราะฮาลาล ช้อปแฟชั่นการแต่งกายแบบมุสลิม ที่ต้องมี ต้องจัด
Phang Nga Music Mountain MIST 6 กรกฎาคม 2567 ดนตรีในสวนสวยเมืองพังงา
Phang Nga Music Mountain MIST งานดนตรีในสวน ณ สวนสาธารณะเฉลิมพระเกียรติ สมเด็จพระศรีนครินทราบรมราชชนนี 80 พรรษา แลนด์มาร์คของเมืองพังงา วันเสาร์ที่ 6 กรกฎาคม 2567 ตั้งแต่เวลา 09.00 - 18.00 น. จัดโดยการท่องเที่ยวแห่งประเทศไทยสำนักงานพังงา และเทศบาลเมืองพังงา มาร่วมชมดนตรีท่ามกลางธรรมชาติร่มรื่น กับบทเพลงสุดไพเราะจากเหล่าศิลปินที่คิดถึง อาทิ ปั่น ไพบูลย์เกียรติ / ชมพู ปิง ฟรุ๊ตตี้ / เบิร์ด กุลพงศ์ / ฟอร์ด สบชัย / โกไข่ และ ไข่ตุ๋น เด็กน้อยเสียงใส จาก The Golden Song ชิม ช้อป อาหารหลากสไตล์ ในบรรยากาศสุดชิลล์
หาดใหญ่บิกไบค์วีค #5 วันที่ 9-10 สิงหาคม 2567
หาดใหญ่บิกไบค์วีค #5 วันที่ 9-10 สิงหาคม 2567 ณ สวนน้ำเดอะไพเรทปาร์ค หาดใหญ่ ถนนลพบุรีราเมศวร์ ชมคอนเสิร์ตและโชว์ น้ำกชพร
Malay #BikeWeek 2024 ด่านนอก 30-31 สิงหาคม 2567 #
งานไทย-มาเลเซียไบค์วีค Thai-Malay BikeWeek 2024 @ด่านนอก 30-31 สิงหาคม 2567 งานมอเตอร์ไซค์สานสัมพันธ์มิตรภาพสองประเทศ ชมศิลปิน 30 สิงหาคม 2567 - มาลีฮวนน่า, ม๊อคคาการ์เด้น 31 สิงหาคม 2567 - ปูพงสิทธิ์, ซูซู
Sichon-Khanom Family 4th นครศรีธรรมราช 10 สิงหาคม 2567
Sichon-Khanom Family 4th นครศรีธรรมราช 10 สิงหาคม 2567 เวลา 16.00 น. ณ หาดสิชล รายได้จากการจัดงานส่วนหนึ่ง ส่งมอบเพื่อจัดซื้ออุปกรณ์การกีฬาแก่โรงเรียนบ้านบางฉาง โรงเรียนวัดสุชน และศูนย์พัฒนาเด็กเล็กบ้านฝ้ายท่า
เบตง ไบค์วีค #8
เบตง ไบค์วีค #8 งานไบค์สุดยิ่งใหญ่สานมิตรภาพ 4 ประเทศ ระหว่างวันที่ 2-3 สิงหาคม 2567 ณ สถานีขนส่งอำเภอเบตง ชมรมบิ๊กไบค์อำเภอเบตงร่วมกับจังหวัดยะลาและการท่องเที่ยวยะลา ร่วมกันจัด มหกรรมคาราวานบิ๊กไบค์ ไทย-มาเลเซีย-อินโดนีเซีย-สิงคโปร์ ศิลปิน มาลีฮวนน่า มอคค่าการ์เด้น
รพ.วิภาวดี กิจกรรม Mother Class ประจำปี 2567 LINK
รพ.วิภาวดี เล็งเห็นความสำคัญของการให้ข้อมูลความรู้และเพิ่มทักษะสำหรับคุณแม่คนใหม่ที่กำลังตั้งครรภ์ จึงได้จัดกิจกรรม Mother Class สำหรับอายุครรภ์ตั้งแต่ 33-42 สัปดาห์ เพื่อให้คุณแม่และครอบครัวสามารถดูแลสุขภาพตนเอง สุขภาพเด็ก ทั้งกายและใจ ลดความกังวลช่วยเพิ่มความมั่นใจ และเสริมสร้างความรู้ ความเข้าใจในการดูแลตนเองได้อย่างเหมาะสมและนำไปใช้ได้อย่างมีประสิทธิภาพ วันที่จัดกิจกรรม ประจำปี 2567
1. วันอาทิตย์ที่ 7 มกราคม 2567
2. วันอาทิตย์ที่ 18 กุมภาพันธ์ 2567
3. วันอาทิตย์ที่ 10 มีนาคม 2567
4. วันอาทิตย์ที่ 21 เมษายน 2567
5. วันอาทิตย์ที่ 19 พฤษภาคม 2567
6. วันอาทิตย์ที่ 9 มิถุนายน 2567
7. วันอาทิตย์ที่ 14 กรกฏาคม 2567
8. วันอาทิตย์ที่ 4 สิงหาคม 2567
9. วันอาทิตย์ที่ 8 กันยายน 2567
10. วันอาทิตย์ที่ 6 ตุลาคม 2567
11. วันอาทิตย์ที่ 10 พฤศจิกายน 2567
12. วันอาทิตย์ที่ 15 ธันวาคม 2567
โรงพยาบาลพริ้นซ์ ลำพูน กิจกรรม Mother Class
โรงพยาบาลพริ้นซ์ ลำพูน จัด
กิจกรรม Mother Class เพื่อคุณแม่ตั้งครรภ์ จะได้เรียนรู้ทุกขั้นตอนของการตั้งครรภ์ พร้อมเทคนิคดูแลตนเองก่อนและหลังคลอด สถานที่จัดงาน วันเสาร์ที่ 24 สิงหาคม 2567 เวลา 08:30 – 12:00 น. ชั้น 1 โรงพยาบาลพริ้นซ์ ลำพูน หัวข้อ "เคล็ดลับดูแลตัวเองและเจ้าตัวน้อยในครรภ์" กิจกรรม Workshop ภายในงาน ▪️ การสอนอาบน้ำเด็ก ▪️ การเตรียมตัวสำหรับการคลอด ▪️ การเสวนาและแลกเปลี่ยนประสบการณ์ระหว่างคุณแม่ เสริมความมั่นใจและความอบอุ่นในการดูแลตนเองและลูกน้อยไปพร้อมๆ กัน
ปฏิทินท่องเที่ยวปทุมธานี เดือนสิงหาคม 2567
ปฏิทินกิจกรรมในจังหวัดภูเก็ต ประจำเดือน สิงหาคม 2567
งานศิลปะริมคลอง “KHAM JARB” ครั้งที่ 1 วันที่ 29-30 ส.ค. 2567 LINK
งานศิลปะริมคลอง.. “KHAM JARB” ครั้งที่ 1 ตอน: ART ริมคลอง วันที่ 29-30 ส.ค. 2567 นี้ เวลา 16.00 น.-23.00 น. ณ ริมคลองสมถวิล ช่วงสะพานถนนตัดใหม่ ถึง สะพานศรีรัตนโกสินทร์ (สะพานเซเว่นริมคลอง) . บรรยากาศงาน Art สนุกสนาน สร้างสรรค์ อบอุ่น.. แบบที่หลายคนคุ้นเคย.. ณ สถานที่จัดงานแห่งใหม่.. ณ ริมลองสมถวิล .
ภายในงานจะแบ่งออกเป็น 4 โซน 1. Art อีหลี: แสดงผลงานศิลปะ และกิจกรรมศิลปะต่างๆ 2. คักแท้ Sound: เวทีแสดงดนตรี กิจกรรมหลักหน้าเวที 3. Food ติโท้: อาหาร เครื่องดื่ม และขนม Homemade 4. เอ้เล่ Craft: งานคราฟท์ งานแฮนด์เมด
ปฏิทินท่องเที่ยวและกิจกรรมประจำเดือนสิงหาคม 2567 LINK
ปฏิทินท่องเที่ยวและกิจกรรมประจำเดือนสิงหาคม พร้อมด้วยโปรโมชั่นดีๆเตรียมพาคนรู้ใจออกไปเที่ยวกัน
3-4 สิงหาคม : Somewhere in Klaeng @Bake and More อ.แกลง
4 สิงหาคม : Scenic Half Marathon ณ สวนสาธารณะหาดแหลมเจริญ
9-13 สิงหาคม : Kite On The Beach ว่าว WOWWW 2024 ณ อนุสรณ์เรือรบหลวงประแสร์ อ.แกลง
10-14 สิงหาคม : Service Design Rayong Showcase ณ หลานเอก คอฟฟี่ เฮ้าส์
17 สิงหาคม : ฟรี Concert ศิลปิน Dept. @ Passion Hall Fr.3 Passione Shopping Destination
พิเศษ ททท.สำนักงานระยองมอบโปรโมชั่นดีๆ "ฝนนี้เที่ยวดีที่ระยอง" ร้านอาหาร คาเฟ่และที่พักที่ร่วมรายการในราคาพิเศษ สแกน Qr Code ตามภาพเพื่อตรวจสอบรายชื่อสถานประกอบการที่เข้าร่วมโครงการได้ที่รูปภาพด้านล่าง
- ระยะเวลาโครงการตั้งแต่15 กรกฎาคม - 30 กันยายน 2567
- กำหนดการสามารถเปลี่ยนแปลงได้ตามความเหมาะสม**
- ติดต่อ ททท.สำนักงานระยอง : 038-655-420
Mother class อบรมคุณแม่ครรภ์คุณภาพ เกษมราษฎร์ รามคำแหง
โรงพยาบาลเกษมราษฎร์ รามคำแหง ขอเชิญคุณแม่ตั้งครรภ์ร่วมกิจกรรม “Mother class อบรมคุณแม่ครรภ์คุณภาพ” ประจำปี 2567 งานนี้ไม่มีค่าใช้จ่ายและพร้อมรับของที่ระลึกภายในงาน
- ครั้งที่ 1 วันอาทิตย์ที่ 21 เมษายน 2567 เวลา 12.40-13.00 น. หัวข้อ “Ultrasound ทารกในครรภ์และการตรวจคัดกรองโครโมโซม หาความผิดปกติของทารกในครรภ์" โดย พญ.จารุวรรณ เนาว์รุ่งโรจน์ สูตินรีแพทย์
- ครั้งที่ 2 วันเสาร์ที่ 22 มิถุนายน 2567 เวลา 12.30 - 15.30 น. หัวข้อ ”การปฏิบัติตัวในระหว่างตั้งครรภ์ - ก่อนคลอด ที่ช่วยให้ปลอดภัยทั้งแม่และลูก“ พร้อม Workshop “ดนตรีบำบัดสำหรับคุณแม่ตั้งครรภ์” โดย อ.ภานุ เจริญเสริมสกุล นักดนตรีบำบัดทางระบบประสาท และครูดนตรี โรงเรียนดนตรีบ้านครูภานุ และ Workshop “ออกกำลังกายถูกวิธี ช่วยกระตุ้นพัฒนาการทารกในครรภ์“ โดย (ครูดาว) คุณอิ่มพร เพชรทองสิน ณ ห้องประชุมหาญพาณิชย์ 1 ชั้น 4 โรงพยาบาลเกษมราษฎร์ รามคําแหง
- ครั้งที่ 3 วันเสาร์ที่ 24 สิงหาคม 2567 เวลา 12.30 - 15.30 น. ณ ห้องประชุมหาญพาณิชย์ 1 ชั้น 4 โรงพยาบาลเกษมราษฎร์ รามคำแหง บรรยายพิเศษในหัวข้อ ”เคล็ดไม่ลับ รู้ทัน ครรภ์เป็นพิษ“ โดย พญ.กรรณาภรณ์ รัชชุศิริ สูตินรีแพทย์ พร้อม Workshop “สาธิตการอาบน้ำทารก” โดย พว.ปุญชรัสมิ์ กีรติกรพิสุทธิ์ และ Workshop “ออกกำลังกายเพื่อช่วยผ่อนคลายและกระตุ้นพัฒนาการทารกในครรภ์“ โดย คุณมาริสา จันทรัช ครูผู้เชี่ยวชาญด้านโยคะ งานนี้ไม่มีค่าใช้จ่ายและพร้อมรับของที่ระลึกภายในงาน
กิจกรรม Smart Mom รพ.นครธน วันเสาร์ที่ 17 ส.ค. 67
ศูนย์สุขภาพสตรี โรงพยาบาลนครธน จัดกิจกรรม Smart Mom วันเสาร์ที่ 17 ส.ค. 67 เวลา 09.00 - 12.00 น. ณ ห้องประชุมทองสิมา ชั้น 4 รพ.นครธน กิจกรรมที่พร้อมเปลี่ยนคุณแม่มือใหม่ ให้เป็นคุณแม่มือโปร Class 1 มาในหัวข้อ เรียนรู้วิธีการตั้งครรภ์ เพื่อก้าวแรกของการเป็นคุณแม่ Exclusive! สำหรับคุณแม่ที่ฝากครรภ์กับ รพ.นครธน อบรมฟรี! พร้อม Gift Set สุดพรีเมียมสำหรับคุณแม่และลูกน้อย มูลค่ากว่า 1,500 บาท สอบถามข้อมูลเพิ่มเติม 02-4509999 ต่อ 1306 - 1307
ปฎิทินเที่ยวอุตรดิตถ์ สิงหาคม 2567
ปฏิทินกิจกรรมนครศรีธรรมราช เดือนสิงหาคม 2567
สมโภชศาลหลักเมือง นครศรีธรรมราช 2567
บริเวณศาลหลักเมือง (สนามหน้าเมือง)
วันที่ : วันพฤหัสบดีที่ 1 - วันจันทร์ที่ 5 สิงหาคม 2567
ถนนคนเดินวิถีเมืองนัง
สถานที่ : ย่านเมืองเก่าปากพนัง อ.ปากพนัง จ. นครศรีธรรมราช / วันเสาร์ที่ 3 - วันอาทิตย์ที่ 17 สิงหาคม 2567
หลาดกำแพงเมืองคอน
ณ ริมกำแพงเมืองนครศรีธรรมราช / ทุกวันเสาร์ สิงหาคม 2567
ดวงดาวเดียวดาย
ตอน Talk in the rain ท่วงทำนองของสายฝน
สถานที่ : น้ำตกแม่เศรษฐี อ.ร่อนพิบูลย์ จ.นครศรีธรรมราช วันที่ : วันเสาร์ที่ 3 สิงหาคม 2567
THAI FIGHT คาดเชือก เมืองคอน
เซ็นทรัลพลาซา นครศรีธรรมราช วันอาทิตย์ที่ 4 สิงหาคม 2567
ยังหลาด
ยังทำฟาร์ม บ้านโปน อ.พรหมคีรี จ.นครศรีธรรมราช / วันที่ : วันอาทิตย์ที่ 4 สิงหาคม 2567
ตลาดท่ามอญ
ตรอกท่ามอญ (ท่าวัง) / วันอาทิตย์ัที่ 4 และ 18 สิงหาคม 2567
Nakhon Si Must Mu Fest
สถานที่ : บ้านท่านขุนรัฐวุฒิวิจารณ์ / วันเสาร์ที่ 10 - วันจันทร์ที่ 12 สิงหาคม 2567
“เกลอเล เกลอเขา” Thasala’s F4: Foods, fruits & Fun Fairs
ถนนศรีท่าศาลา (ถนนหน้าอำเภอ-ตลาดพฤหัส-ศาลาน้ำ) อำเภอท่าศาลา /วันเสาร์ที่ 20 - วันอาทิตย์ที่ 21 กรกฎาคม 2567
โขนสัมพันธ์ภาคใต้เฉลิมพระเกียรติ ครั้งที่ 23 โขนเรื่องรามเกียรติ์
ตอน ศึกมังกรกัณฐ์แสงอาทิตย์ เวทีหน้าอาคารศาลาประชาสันต์ อ.ปากพนัง / วันเสาร์ที่ 24 สิงหาคม 2567
Southern Bliss Fest : ความสุขแดนใต้
ถนนคนเดินชายเล ขนอม / วันศุกร์ที่ 30 สิงหาคม - วันอาทิตย์ที่ 1 กันยายน 2567
ปฏิทินเทศกาล และกิจกรรมต่างๆ ในจังหวัดสตูล เดือนสิงหาคม
ปฏิทินเทศกาล และกิจกรรมต่างๆ ในจังหวัดสตูล เดือนสิงหาคม
ปฏิทินท่องเที่ยวจังหวัดเชียงราย เดือนสิงหาคม - กันยายน 2567
ปฏิทินท่องเที่ยวระนอง ประจำเดือน สิงหาคม 2567
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน สิงหาคม 2567
ปฎิทินกิจกรรมเพชรบูรณ์ เดือนสิงหาคม 2567
ปฎิทินกิจกรรมพิษณุโลก เดือนสิงหาคม
นักท่องเที่ยวที่เดินทางมาเที่ยวงาน Pakk Taii Design Week และเข้าพักในจังหวัดสงขลา เพียงโชว์หลักฐานตั๋วเครื่องบิน หรือใบเสร็จรับเงินการเข้าพักในจังหวัดสงขลา พร้อมลงทะเบียน ณ บ้านสิงโต (ถนนนครนอก ย่านเมืองเก่าสงขลา) รับฟรี! ของที่ระลึกสุด Exclusive จาก ททท. สำนักงานหาดใหญ่
ปฏิทินท่องเที่ยวสมุทรสงคราม ประจำเดือนสิงหาคม 2567
ปฏิทินท่องเที่ยวสมุทรสงคราม ประจำเดือนสิงหาคม 2567
- งานสุดยอดชุมชนต้นแบบ เที่ยวชุมชนยลวิถี ชุมชนคุณธรรม บ้านท่าฉลอม วันที่ 3 สิงหาคม 2567 ณ ริมเขื่อนวัดช่องลม ต.ท่าฉลอม อ.เมืองฯ จ.สมุทรสาคร [พิกัด]
- งานฉลองครบรอบ 20 ปี ตลาดน้ำอัมพวา ระหว่างวันที่ 10-12 สิงหาคม 2567 ณ ตลาดน้ำอัมพวา อ.อัมพวา จ.สมุทรสงคราม [พิกัด]
- กิจก??รมสิงหาพาแม่เที่ยว ล่องเรือเที่ยวอัมพวา ฟรี ระหว่างวันที่ 10-12 และ 17-18 สิงหาคม 2567 ณ ตลาดน้ำอัมพวา อ.อัมพวา จ.สมุทรสงคราม [พิกัด]
- งานคืนความรักให้อัมพวา ครั้งที่ 9 วันที่ 11 สิงหาคม 2567 ณ ตลาดน้ำอัมพวา อ.อัมพวา จ.สมุทรสงคราม [พิกัด]
- กิจกรรมตักบาตรพระทางเรือ เนื่องในวันแม่แห่งชาติ วันที่ 12 สิงหาคม 2567 ณ ตลาดน้ำอัมพวา อ.อัมพวา จ.สมุทรสงคราม [พิกัด]
- งาน “เสน่ห์อัมพวา Night at The Museum ในวันที่ 23-25 สิงหาคม 2567 ณ อุทยาน ร.2 อ.อัมพวา จ.สมุทรสงคราม [พิกัด]
ปฏิทินกิจกรรมในจ.น่าน เดือนสิงหาคม 2567
กิจกรรมเดือนสิงหาคม 2567
โปรแกรมเดือนสิงหาคม กรุงเทพ-กาญจนบุรี 2 ทริป กับรถไฟท่องเที่ยว SRT Royal Blossom
โปรแกรมท่องเที่ยว Royal Blossom เส้นทางรถไฟสายแห่งความสุข กรุงเทพ – กาญจนบุรี แบบ One Day Trip ในวันเสาร์ที่ 24 และ 31 สิงหาคม 2567
โปรแกรมการเดินทาง เส้นทางแรก สำหรับขบวนรถไฟท่องเที่ยวสุดหรู Royal Blossom ไปบนเส้นทางประวัติศาสตร์ จ.กาญจนบุรี ที่จะไฮไลท์คือ การชมวิวทิวทัศน์บน “สะพานข้ามแม่น้ำแคว” ซึ่งเป็นอนุสรณ์สถานสำคัญทางประวัติศาสตร์ที่โด่งดังไปทั่วโลก แวะชม “สะพานถ้ำกระแซ” สะพานไม้ ที่สร้างเลียบไปตามหน้าผาริมแม่น้ำแควน้อย ผ่านโค้งน้ำที่สวยงามที่สุดแห่งหนึ่งของเส้นทางรถไฟ พร้อมขอพรพระพุทธรูปศักดิ์สิทธิ์ที่ประดิษฐานอยู่ภายใน “ถ้ำกระแซ” อดีตที่พักของเชลยศึกขณะที่ก่อสร้างเส้นทางรถไฟสายมรณะแห่งนี้ ดื่มด่ำสัมผัสกับบรรยากาศธรรมชาติสองฝั่งแม่น้ำแควน้อย – แควใหญ่ที่ร้านอาหาร “แพธาราบุรี” ตลอดจนไหว้พระขอพรที่ “วัดเมตตาธรรมโพธิญาณ” ชมความงดงามของสถาปัตยกรรมจีน และถ้ำสวยกลางป่า “วัดถ้ำพุหว้า” ที่มีหินงอกหินย้อยภายในถ้ำ พร้อมกับชมสถาปัตยกรรมขอมโบราณอันสวยงามของวัดอีกด้วย
ปฏิทินเทศกาลกิจกรรมจ.ตรัง เดือนสิงหาคม 2567
ปฎิทินท่องเที่ยวจังหวัดนครปฐม ประจำเดือนสิงหาคม 2567
ปฏิทินท่องเที่ยวจังหวัดพิจิตร เดือนสิงหาคม 2567
ปฏิทินท่องเที่ยวจังหวัดพิจิตร เดือนสิงหาคม 2567
วันที่ 3-4 ส.ค.2567
งานประเพณีแข่งขันเรือยาวชิงถ้วยพระราชทานฯ
ณ บริเวณลำน้ำน่าน หน้าวัดดาน อ.เมือง จ.พิจิตร
วันที่ 25 ส.ค.2567
พิธีรำลึกพ่อปู่บูชาหลักเมือง ครั้งที่ 5
ณ สวนรุกขชาติกาญจนกุมาร
วันที่ 30 ส.ค. - 8 ก.ย.2567
งานประเพณีแข่งขันเรือยาวจ.พิจิตร ชิงถ้วยพระราชทานฯ
ณ ลำน้ำน่าน หน้าวัดท่าหลวง พระอารามหลวง อ.เมือง จ.พิจิตร
ปฏิทินท่องเที่ยวจังหวัดนครสวรรค์ ประจำเดือน สิงหาคม 2567 LINK
ปฏิทินท่องเที่ยวจังหวัดนครสวรรค์ ประจำเดือน สิงหาคม 2567
- เเอ่วเหนือม่วนใจ๋ เเอ่วเชียงใหม่ม่วนฉ่ำ 2 - 4 สิงหาคม 2567 CENTRAL NAKHONSAWAN
- LOVE MOM LOVE MOMENT 10 - 12 สิงหาคม 2567 CENTRAL NAKHONSAWAN
- ตามรอยพระพุทธเจ้าหลวง เสด็จประพาสต้นวัดพระปรางค์เหลือง 11 - 12 สิงหาคม 2567 เทศบาลตำบลท่าน้ำอ้อย
- PET SAFARI 16 - 25 สิงหาคม 2567 CENTRAL NAKHONSAWAN
- ประเพณีทิ้งกระจาด 14 - 19 สิงหาคม 2567 ศาลเจ้าเเม่หน้าผา
- ตามรอยพระพุทธเจ้าหลวงเสด็จประพาสต้นบ้านเก้าเลี้ยว 16 สิงหาคม 2567 เทศบาลตำบลเก้าเลี้ยว
- NAKHONSAWAN BIG GRILL FEST 23 - 25 สิงหาคม 2567 CHAWANICH LUMBERYARD
- งานส้มโอเเละของดีอำเภอลาดยาว 26 สิงหาคม - 3 กันยายน 2567 ที่ว่าการอำเภอลาดยาว
กิจกรรม Lanta Green Day 31 สิงหาคม - 1 กันยายน 2567
กิจกรรม Lanta Green Day วันที่ 31 สิงหาคม - 1 กันยายน 2567 ณ ชุมชนทุ่งหยีเพ็ง เกาะลันตา จ.กระบี่ ชวนเปลี่ยนขยะ ให้เป็นประโยชน์
ร่วมส่งพลาสติกเหลือใช้เพื่อสร้างลานเอนกประสงค์ มาร่วมกันคัดแยกขยะให้ถูกวิธี และส่งต่อปลายทางที่เหมาะสม เพื่อลดปริมาณขยะที่บ่อฝังกลบและช่วยลดมลภาวะต่อสิ่งแวดล้อม
ปฏิทินกิจกรรมระยอง เดือนสิงหาคม 2567
ปฏิทินท่องเที่ยว@จังหวัดประจวบคีรีขันธ์ สิงหาคม 2567
ปฏิทินกิจกรรมนครนายก เดือนสิงหาคม 2567
ปฏิทินกิจกรรมสระแก้ว เดือนสิงหาคม 2567
ปฏิทินกิจกรรมปราจีนบุรี เดือนสิงหาคม 2567
ปฏิทินกิจกรรมท่องเที่ยว จ.หนองคาย เดือนสิงหาคม 2567
ปฏิทินกิจกรรม จ.อุดรธานี เดือนสิงหาคม 2567
ปฏิทินกิจกรรมเด่นบึงกาฬ เดือนสิงหาคม 2567
ปฏิทินกิจกรรมเที่ยวบุรีรัมย์ เดือนสิงหาคม 2567
วันที่ 3-4 สิงหาคม 2567
“อีสานสะบัดผ้า”
ณ ถนนคนเดิน เซราะกราว วอล์คกิ้ง สตรีท
สอบถามเพิ่มเติมโทร : 044 634 722
วันที่ 3-4 สิงหาคม 2567
“มหกรรมวัฒนธรรมสร้างสรรค์ Sofe Power OF Buriram”
ณ ถนนคนเดิน เซราะกราว วอล์คกิ้ง สตรีท
สอบถามเพิ่มเติมโทร : 044 666 577
วันที่ 18 สิงหาคม 2567
“Revo Thai League”
บุรีรัมย์ ยูไนเต็ด VS แบงค็อก ยูไนเต็ด
ณ สนามช้าง อารีนา
สอบถามเพิ่มเติมโทร : 08 1070 2626
วันที่ 23-25 สิงหาคม 2567
“B-Quik Thailand Super Series 2024 Event 4”
ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 29 สิงหาคม 2567
“Revo Thai League”
บุรีรัมย์ ยูไนเต็ด VS ขอนแก่น ยูไนเต็ด
ณ สนามช้าง อารีนา
สอบถามเพิ่มเติมโทร : 08 1070 2626
วันที่ 29 สิงหาคม - 1 กันยายน 2567
“PT Maxnitron Racing Series 2024”
ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท
(ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ถนนรมย์บุรี
เดือนต่อไปจะพาไปพบกับกิจกรรมท่องเที่ยวที่ไหน... อย่าลืมกดติดตามไว้นะคะ จะได้ไม่พลาดแหล่งท่องเที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม
เปิดประสบการณ์ท่องเที่ยวเมืองกีฬา เที่ยววิถีชุมชน กินอาหารถิ่น
เที่ยวทั้งปีที่ "บุรีรัมย์" เมืองปราสาทสองยุค...มหานครแห่งกีฬา
เที่ยวบุรีรัมย์ง่ายนิดเดียว สอบถามข้อมูลเพิ่มเติม : ททท. สำนักงานบุรีรัมย์ โทร. 0 4463 4722 หรือโทร. 1672 TAT Contact Center เพื่อนร่วมทาง
เดือนสิงหาคม 2567 รวมกว่า 24.79 ล้านราย
ยอดจำนวนผู้ประกันตนในระบบประกันสังคม ทั่วประเทศ เดือนสิงหาคม 2567 มีผู้ประกันตนในระบบประกันสังคมทุกมาตราคือ 33, 39, 40 รวม 24,796,392 ราย
ปฏิทินท่องเที่ยวประจำเดือน สิงหาคม 2567
งานบุญงานวัดงานวัฒนธรรมในปทุมธานี
- จังหวัดปทุมธานี เชิญเที่ยวงาน สมโภชศาลหลักเมืองปทุมธานีและของดี 4 ภาค 23 สิงหาคม - 1 กันยายน 2567 บริเวณสวนเทพ ศาลากลางหลังเก่า ชมคอนเสิร์ตศิลปินดัง
Coffee & Bakery Fest Hat Yai 2024 วันที่ 1-4 สิงหาคม 2567
Coffee & Bakery Fest Hat Yai 2024 วันที่ 1-4 สิงหาคม 2567 เวลา 10.30 - 20.30 น. ณ ศูนย์ประชุมนานาชาติฉลองสิริราชสมบัติครบ ๖๐ ปี งานดีปีละครั้งเท่านั้น Highlight Activities ในงาน
การแข่งขันลาเต้อาร์ตสแมคดาวน์ ปักษ์ใต้ ครั้งที่ 6
การแข่งขัน The Best Robusta Cup 2024
Exclusive Sharing & Tasting: เคล็ดลับเอสเย็น จาก แชมป์ Thailand Es Yen Championship 2024 คุณลี่ Pym Coffee & Roastery และ พี่อ๊อด a cup of joe
ผู้บุกเบิกสูตรเอสเย็นแชมป์ปี 2017 พร้อมพบกับ Pop-up Cafe เอสเย็นสูตรแชมป์
จำนวนจำกัด 50 แก้ว เท่านั้น
Exclusive Sharing & Tasting: กาแฟไทย เพาะ (เพราะ) “พิเศษ” ให้เติบโต
• พี่ลี (Akha Ama) ผู้สร้างแรงบันดาลใจ พัฒนากาแฟไทยสู่ระดับโลก
• พี่เม่น (Foresto) บทบาทสมาคมกาแฟพิเศษไทยต่อการพัฒนากาแฟไทย
• พี่ต่าย (Nutt-Phob Coffee) เจ้าของร้านต้องรับมือกับกระแสกาแฟพิเศษอย่างไร
• ดำเนินการเสวนา โดย พี่ลัค (Luck Coffee)
พร้อมร่วมกิจกรรม ล้อมวงจิบกาแฟพิเศษ Thailand Specialty Coffee Awards 2024 โดย สมาคมกาแฟพิเศษไทย รวมทั้ง หลากหลายเมล็ดกาแฟคุณภาพจากเกษตรกรบ้านแม่จันใต้ และกาแฟโรบัสต้าหาดใหญ่
Exclusive Sharing & Tasting: แชมป์บาริต้าประเทศไทย
พบกับเมนูที่ใช้ในการแข่งขัน พร้อมพูดคุยกับคุณ กิตติภพ เอ่งฉ้วน (ฟิวเจอร์) จาก Asterisk espresso (ภูเก็ต) แชมป์บาริต้าคนล่าสุดของประเทศไทย (Thailand Barista Champion 2025)
เปิดรับสมัครแล้ว #PlatooMusicContest season 1
เปิดรับสมัครแล้ว #PlatooMusicContest season 1 ปลดล็อคขีดจำกัด สู่สนามแห่งเสียงดนตรี เตรียมพบกับเวที Platoo Music Contest การแข่งขันวงดนตรี ในงานเทศกาลกินปลาทูและของดีเมืองแม่กลอง ครั้งที่ 26 เปิดรับสมัครตั้งแต่ 1 สิงหาคม 67 ถึง 15 กันยายน 67 รุ่นประถมศึกษา รุ่นมัธยมศึกษา รอบ online audition ส่งผลงานได้ถึง 15 กันยายน 67
โครงการเที่ยวกับบัสทัวร์ทั่วไทย 2567 เฟส 1 วันนี้ - 16 กันยายน 2567
"โครงการเที่ยวกับบัสทัวร์ทั่วไทย 2567 เฟส 1" ททท.ขอเชิญชวนผู้ประกอบธุรกิจนำเที่ยวและหน่วยงานพันธมิตรทางการท่องเที่ยวร่วมจัดโปรแกรมนำเที่ยวในเมืองรองทั่วประเทศไทย ตั้งแต่วันนี้ - 16 กันยายน 2567 สามารถยื่นเอกสารสำหรับการอนุมัติสิทธิอย่างน้อย 7 วันก่อนการเดินทาง สอบถามข้อมูลโครงการ 02-2505500
สิงหานี้...พาแม่มากินปลาแรด ฟรี ‼️ ที่ อุทัยธานี 1-31 สิงหาคม 2567
ททท.สำนักงานอุทัยธานี จัดกิจกรรม “ชวนแม่กินข้าว กินปลา อุทัยธานี” ตั้งแต่วันที่ 1-31 สิงหาคม 2567 รับเมนูพิเศษทันทีจาก ททท. “ปลาแรด ผอ. ” ทันที่ 1 จาน
เงื่อนไขการใช้สิทธิ์
1.แสดงใบเสร็จโรงแรม/ที่พัก/ร้านอาหาร/ร้านค้าในจังหวัดอุทัยธานีมูลค่า 500 บาทขึ้นไป
(ต้องเป็นใบเสร็จที่ระบุชื่อที่อยู่ เท่านั้น❗️)
2.สั่งอาหารทานเกิน 500 บาทขึ้นไป
รับฟรี ‼️ทันที เมนูปลาแรด ผอ. 1 จาน
3.สงวนสิทธิ์ 1 ใบเสร็จ ต่อ การรับเมนูปลาแรด ผอ.1 จาน ต่อ การทานอาหาร 1 ครั้งเท่านั้น
4.มีเพียง 400 สิทธิ์เท่านั้น
รายชื่อร้านอาหารที่เข้าร่วมกิจกรรม
อ.เมืองอุทัยธานี : ร้านป้าสำราญ -ร้านครัวน้องทราย -ร้านอาหารเรือนแพประมง -ร้านเรือนแพ เกาะเทโพ
อ.หนองขาหย่าง : ร้าน Insane3rd
อ.ทัพทัน : ร้านอาหาร4/7
อ.ลานสัก : ร้านอาหารแตน -ร้านหุบป่าตาด การ์เด้น
กิจกรรม “๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น” จังหวัดนครปฐม
จังหวัดนครปฐม ขอเชิญชวนผู้ประกอบการและผู้สนใจ ส่งรายการเมนูอาหารถิ่นประเภทอาหารคาว/อาหารว่าง/อาหารหวาน ซึ่งเป็นเมนูอาหารถิ่นที่เสี่ยงต่อการสูญหาย หรือใกล้จะสูญหาย หาทานได้เฉพาะถิ่น มีคุณค่าแก่การยกย่อง เชิดชู และอนุรักษ์ สืบทอดแก่เยาวชนรุ่นหลังสืบต่อไป กิจกรรม “๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น” จังหวัดนครปฐม ภายใต้แนวคิด “รสชาติ...ที่หายไป The Lost Taste” เพื่อคัดเลือกเมนูอาหารถิ่นของจังหวัดนครปฐม ภายใต้โครงการส่งเสริมและพัฒนายกระดับอาหารถิ่นสู่มรดกทางวัฒนธรรมและอัตลักษณ์ความเป็นไทย (Thailand Best Local Food) ประจำปี พ.ศ. ๒๕๖๗ โดยผู้ประกอบการร้านอาหาร และผู้ที่สนใจสามารถส่งรายการเมนูอาหารถิ่นสม้ครเข้ารับการพิจารณาคัดเลือกตามหลักเกณฑ์ของกรมส่งเสริมวัฒนธรรม เพื่อให้ประชาชนในจังหวัดนครปฐม ร่วมโหวตให้เป็น "๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น" ของจังหวัดนครปฐม ประจำปี พ.ศ. ๒๕๖๗ เปิดรับสมัครตั้งแต่วันที่ ๑๗ มิถุนายน - ๑๗ กรกฎาคม ๒๕๖๗
ร่วมโหวต ๑ จังหวัด ๑ เมนูเชิดชูอาหารถิ่นจังหวัดพิจิตร
๑ จังหวัด ๑ เมนูเชิดชูอาหารถิ่นจังหวัดพิจิตร สำนักงานวัฒนธรรมจังหวัดพิจิตร ขอเชิญชาวพิจิตร ร่วมโหวตคัดเลือกสุดยอดเมนูอาหารถิ่นของจังหวัดพิจิตร ประจำปี พ.ศ.2567 "๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น"
ประกาศผลแล้วนะ
ผลโหวตของพิจิตรได้แก่ร่วมโหวตสุดยอดเมนูอาหารถิ่น ของจังหวัดนครสวรรค์
สำนักงานวัฒนธรรมจังหวัดนครสวรรค์ ขอเชิญประชาชนทุกท่านร่วมโหวตสุดยอดเมนูอาหารถิ่น ของจังหวัดนครสวรรค์ "รสชาติ ....ที่หายไป The Lost Taste" ปีนี้นครสวรรค์ส่งประกวดดังนี้ ประเภทอาหารคาว ๑. ต้มกะทิสายบัวปลาทู ๒.แกงนอกหม้อ ๓.แกงบอน ประเภทอาหารหวาน ๑.กะลอจี๊ ๒.ขนมนวลแห้ว ๓.ขนมข้าวโปง ประเภทอาหารว่าง ๑.ข้าวยาคู ๒.ขนมถ้วยจีน ๓.ขนมผักกาด (ไชเถ่าก้วย)
ประกาศผลแล้วนะ
ผลโหวตของนครสวรรค์ได้แก่โหวต "๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น" จังหวัดกระบี่
ร่วมโหวต : "๑ จังหวัด ๑ เมนู เชิดชูอาหารถิ่น" |สำนักงานวัฒนธรรม จังหวัดกระบี่
ขอเชิญชวนทุกท่านร่วมเป็นส่วนหนึ่งในการคัดเลือกสุดยอดเมนูอาหารถิ่นของจังหวัด เป็น " ๑ จังหวัด ๑ เมนู เชิดชู อาหารถิ่น" ภายใต้แนวคิดรสชาติที่หายไป The Lost Taste ประจำปี พ.ศ. ๒๕๖๗ โดยสามารถ vote ได้ตั้งแต่บัดนี้จนถึง วันที่ ๙ สิงหาคม ๒๕๖๗ เวลา ๑๖.๓๐ น. ผ่านทางระบบ google form
ประกาศผลโหวตแล้ว โดย
อาหารที่ได้โหวตอันดับหนึ่ง ของ จ.กระบี่ ได้แก่โหวตสุดยอดเมนูอาหารถิ่นจังหวัดหนองคาย "รสชาติ...ที่หายไป The Lost Taste"
จังหวัดหนองคาย ขอเชิญชวนพี่น้องประชาชนชาวจังหวัดหนองคาย หรืออาศัยอยู่ในพื้นที่ จ.หนองคาย ร่วมโหวตสุดยอดเมนูอาหารถิ่นจังหวัดหนองคาย "รสชาติ...ที่หายไป The Lost Taste" ประจำปีงบประมาณ พ.ศ.2567 ภายใต้โครงการส่งเสริมและพัฒนายกระดับอาหารถิ่นสู่มรดกทางวัฒนธรรมและอัตลักษณ์ความเป็นไทย (Thailand Best Local Food) “รสชาติ...ที่หายไป The Lost Taste” จังหวัดหนองคาย ประจำปีงบประมาณ พ.ศ. ๒๕๖๗ ตั้งแต่บัดนี้ปิดโหวตวันที่ 9 สิงหาคม 2567 เวลา 16.30 น.
ประกาศผลโหวตแล้วนะเธอ
ผลโหวตอันดับหนึ่งของจ.หนองคายได้แก่ Brew Feels Good Thailand 2024 วันที่ 1-12 สิงหาคม 2567
Brew Feels Good Thailand 2024 วันที่ 1 - 12 สิงหาคม 2567 ณ Seacon Square Hall งานกาแฟครั้งยิ่งใหญ่ รสชาติอันแสนวิเศษจากคอมมูนิตี้ของคนรักกาแฟ
ไฮไลท์ภายในงาน
-แต่ละร้านที่มางานนี้เป็นร้านดังทั้งนั้นเลย แวะมาเดินชิมกาแฟ และเมล็ดกาแฟพิเศษระดับแชมป์จากไทย และต่างประเทศได้เลย เพลินมาก
-Workshop สุดพิเศษตลอดทุกวันจากร้านค้าชื่อดัง และบาริสต้าที่บอกเลยว่าสนุกมาก เพราะได้ความรู้ดีๆ กลับบ้านไปเพียบ ไม่ว่าจะเป็น สอนทำกาแฟดื่มเองที่บ้าน, drip กาแฟแบบมืออาชีพ,
-มาดื่มด่ำกับกลิ่นกาแฟสายพันธุ์ต่างๆ ที่เป็นเอกลักษณ์เฉพาะตัวของที่โซน Coffee Sensory
-เปิดประสบการณ์ชิมกาแฟแบบ Omakase ที่รวมเมล็ดกาแฟพิเศษระดับแชมป์ งานนี้จะได้รู้วิธีการแปรรูปกาแฟ และยังได้รู้จักเมล็ดกาแฟสายพันธุ์ต่างๆ ว่ามีความต่างกันยังไงอีกด้วยนะ เก๋มากเลย
Amazing Beach Life Festival 2024 วันที่ 2-4 สิงหาคม 2567
งาน Amazing Beach Life Festival 2024 เจอกันหาดป่าตอง วันที่ 2 - 4 ส.ค. 67 งานนี้เข้าฟรี ในธีม Neon Wave สนุกสนานไปกับสีสันความสดใสและจังหวะเสียงคลื่นกระทบหาดทราย พบคอนเสิร์ตจากเหล่าศิลปินและ Dj สุดมันส์ นำทีมโดย F.Hero, Paradox, Atom ชนกันต์, fellow fellow, Safeplanet, Slapkiss และเหล่า Dj ที่จะมามอบความสนุกสนานท่ามกลางบรรยากาศชายหาดริมทะเล
ของดี ของหรอย ของอร่อย เหนือคลอง ประจำปี 2567 วันที่ 2 ส.ค. - 4 ส.ค. 2567
ของดี ของหรอย ของอร่อย เหนือคลอง ประจำปี 2567 วันที่ 2 ส.ค. - 4 ส.ค. 2567 เวลา 16.00-22.00 น. ณ ศาลเจ้าเฉ้งจุ้ยจ้อซู้ก๋ง ชิมช็อปสินค้าจากผู้ประกอบการมากกว่า 125 ร้าน ชมการแสดง ดนตรีสด และกิจกรรมบันทิง สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายสวัสดิการสังคม สำนักงานเทศบาลตำบลเหนือคลอง โทร 075-691-481 ต่อ 24
การแข่งขันปั่นจักรยานชิงแชมป์ภาคใต้ “Satun Southern Bike 2024” วันที่ 2-4 สิงหาคม 2567
การแข่งขันปั่นจักรยานชิงแชมป์ภาคใต้ “Satun Southern Bike 2024” ในวันที่ 2-4 สิงหาคม 2567 ณ ที่ว่าการอำเภอมะนัง อ.มะนัง จ.สตูล
งานวันจำปาดะ ผลไม้และของดีอำเภอควนโดน 2-4 สิงหาคม 2567
งานวันจำปาดะ ผลไม้และของดีอำเภอควนโดน วันที่ 2-4 สิงหาคม 2567 ณ สำนักงานองค์การบริหารส่วนตำบลวังประจัน ตำบลวังประจัน อำเภอควนโดน จังหวัดสตูล พบกับ... ▪️ งาน/นิทรรศการ ▪️ ชุดการแสดงมากมาย ▪️ การแข่งขันสานโคระ ▪️ ขบวนรถแต่งผลไม้ ▪️ การประกวดผลผลิตทางการเกษตร ▪️ การประกวดหนูน้อยจำปาดะ ▪️ การแสดงของวงดนตรี กัวลาบารา, รองเง็ง ▪️ แข่งขันทอด กินจำปาดะ
แอ่วเหนือม่วนใจ๋ แอ่วเจียงใหม่ม่วนฉ่ำ 2-4 สิงหาคม 2567
ททท. สำนักงานเชียงใหม่ จัดงาน "แอ่วเหนือม่วนใจ๋ แอ่วเจียงใหม่ม่วนฉ่ำ" 2 - 4 สิงหาคม 2567 เวลา 10.00 - 20.00 น. ลานโปรโมชั่น ชั้น G ลานเจ้าพระยา ศูนย์การค้าเซ็นทรัล นครสวรรค์ งานโปรโมทการ เที่ยวเชียงใหม่ ที่ขนเอาโปรโมชั่นแอ่วเจียงใหม่โดนใจ แอ่วได้ 365 วัน มาเต็มงาน
ไฮไลท์ภายในงาน! โปรโมชั่นแพ็กเกจที่พัก ที่เที่ยว ที่กินเชียงใหม่ ราคาสุดคุ้มโดนใจ พิเศษสุด!! ลุ้นรับ Special Deals สิทธิพิเศษและส่วนลดจากร้านค้าและบริการมากมายภายในงาน กิจกรรม Workshop งานคราฟต์สุดสร้างสรรค์ ช้อปของดีเมืองเหนือ ของกิ๋นสุดลำ ของฝากจากเจียงใหม่ ม่วนจอยกับดนตรีโฟล์คซองล้านนา ร่วมสนุกลุ้นรับของที่ระลึกสุด Exclusive !! อาทิ กระเป๋าช้อปปิ้งสุดเก๋ พวงกุญแจจ๊างเจียงใหม่สุดคิวท์ พร้อมลุ้นรับ! Voucher ที่พักและกิจกรรมท่องเที่ยวภายในงานมากมาย
ดนตรี กวี ศิลป์ ถิ่นขลุงบุรี อำเภอขลุง 9-10 สิงหาคม 2567
ตลาดวัฒนธรรมสร้างสุข "ดนตรี กวี ศิลป์ ถิ่นขลุงบุรี" อำเภอขลุง วันที่ 9-10 สิงหาคม 2567 ณ วัดตะปอนใหญ่ อำเภอขลุง พบกับ ตลาดวัฒนธรรมสร้างสุข กว่า ๒๐ ร้าน / ตลาดสร้างศิลป์ ดนตรีสร้างสรรค์ มีการสอนวาดภาพ ระบายสี วาดการ์ตูน ฟรี! โดย ชมรมสานศิลป์ถิ่นจันทบูร/ การแสดงทางวัฒนธรรม ที่หาชมยาก และการแสดงจากสถานศึกษาในพื้นที่ / การสาธิตผลิตภัณฑ์ทางวัฒนธรรม / การสาธิตภูมิปัญญาอาหารพื้นบ้าน /การละเล่นพื้นบ้าน / ดนตรีโฟล์คซอง และร่วมสมัย ตลอดงาน พร้อมทั้ง กิจกรรมอื่น ๆ อีกมากมาย
Journey East เที่ยวผจญภัยในแดนบูรพา 2-4 สิงหาคม 2567
สำนักงานการท่องเที่ยวและกีฬาจังหวัดปราจีนบุรี ขอนำเสนอ Journey East เที่ยวผจญภัยในแดนบูรพา เทศกาลท่องเที่ยวเชิงผจญภัยกลุ่มจังหวัดภาคตะวันออก 2 วันที่ 2 - 4 สิงหาคม 2567 ณ ป่านันทนาการน้ำตกเขาอีโต้ ปราจีนบุรี
ภายในงานพบกับกิจกรรมท่องเที่ยวเชิงผจญภัย ตลอดทั้งวัน สนุกกับกิจกรรม Camping, Adventure การจัดแสดงบอลลูน กิจกรรมปีนหน้าผาจำลอง ผลิตภัณฑ์ อาหารและการแสดงจาก 5 จังหวัดภาคตะวันออก 2
Free! Concert พบกับ ศิลปินรับเชิญสุดพิเศษ เริ่มตั้งเวลาประมาณ 19.30 น. 2 สิงหาคม พบกับ วสันต์ 17 แขกรับเชิญสุดพิเศษ น้าหงา คาราวาน! 3 สิงหาคม พบกับ ทอดด์ ทองดี 4 สิงหาคม พบกับ เขียนไขและวานิช
กิจกรรม สนุก สุดฟินเดือนสิงหาคม @พิพิธภัณฑ์การเกษตรเฉลิมพระเกียรติ์ คลองหลวง ปทุมธานี LINK
พิพิธภัณฑ์การเกษตรเฉลิมพระเกียรติ์ คลองหลวง ปทุมธานี จัดเต็มกิจกรรมสุดสร้างสรร 8 กิจกรรม สนุก สุดฟินตลอดเดือนสิงหาคม 2567 นี้
- 3 - 4 ตลาดเศรษฐกิจพอเพียง รสมือแม่ รสเด็ดเจ็ดย่านน้ำ
- ท่องเที่ยวสุขสันต์ ที่พิพิธภัณฑ์เกษตรฯ สนุก เรียนรู้ได้ทั้งครอบครัว ทุกวันเสาร์และอาทิตย์ สัปดาห์ที่ 2 3 และ 4 ของเดือน
- Alive in Museum มีอะไรในพิพิธภัณฑ์ : กิจกรรมสนุก ตามหาตราประทับรับของที่ระลึกฟรี ทุกวันศุกร์-อาทิตย์
- ท่องเที่ยววิถีเกษตรไทย : นั่งรถราง เรียนรู้รอบพิพิธภัณฑ์ ทุกวันเสาร์-อาทิตย์
- Mado Farm Acadamy : เปิดห้องแล็ป เรียนรู้ด้านการเกษตรกันได้ทุกวัน ณ Mado Pavilion
- อบรมเข้มข้น : อบรมเกษตรแบบเข้มข้นที่มีให้เลือกตามความชอบถึง 3 วิชา ในวันที่ 25 สิงหาคมนี้
- One Day Trip เที่ยวยกครอบครัว : กิจกรรมใหม่ต้อนรับเดือนแห่งวันแม่ ร่วมสนุกแลกรับของที่ระลึกได้ตลอดทั้งเดือน
วิ่งใจเกินรร้อยพิชิตภูสิงห์ ครั้งที่ 5 วันที่ 3–4 สิงหาคม 2567
งาน “วิ่งใจเกินร้อยพิชิตภูสิงห์” ครั้งที่ 5 ซึ่งจังหวัดกาฬสินธุ์ กำหนดจัดขึ้นในระหว่างวันที่ 3–4 สิงหาคม 2567 ณ เกาะมหาราช ตำบลหนองบัว อำเภอหนองกุงศรี และวัดพุทธาวาสภูสิงห์ อำเภอสหัสขันธ์ จังหวัดกาฬสินธุ์ เพื่อส่งเสริมการท่องเที่ยวเชิงกีฬาและกระตุ้นตลาดการท่องเที่ยวจังหวัดกาฬสินธุ์ โดยมีการประชุมหารือร่วมกับทุก ๆ ภาคส่วนในจังหวัดกาฬสินธุ์ ซึ่งการจัด “วิ่งใจเกินร้อยพิชิตภูสิงห์” ครั้งนี้เป็นครั้งที่ 5 ซึ่งได้รับความสนใจและการตอบรับสมัครเข้าร่วมกิจกรรมเป็นจำนวนมาก ถือเป็นกิจกรรมนำร่องในการส่งเสริมการท่องเที่ยว และการกระตุ้นเศรษฐกิจของจังหวัดกาฬสินธุ์ รวมถึงเตรียมความพร้อมในการรองรับและอำนวยความสะดวกให้แก่นักท่องเที่ยว ตามนโยบายของรัฐบาลในการเปิดประเทศท่องเที่ยวอย่างเต็มรูปแบบ กิจกรรมครั้งนี้เป็นเสมือนประตูที่เปิดมุมมองของผู้ที่มาร่วมงานให้กว้างยิ่งขึ้น
งานลำไย-กระท้อน ของดีตำบลห้วยสัก ประจำปี 2567 ระหว่างวันที่ 3-4 สิงหาคม 2567
ยกขบวนผลไม้สดๆจากสวน มาให้แบบฉ่ำๆ ในงานลำไย-กระท้อน ของดีตำบลห้วยสัก ประจำปี 2567 ระหว่างวันที่ 3-4 สิงหาคม 2567 ตั้งแต่เวลา 08:00 น. เป็นต้นไป ณ สำนักงานเทศบาลห้วยสัก อ.เมือง จ.เชียงราย พบกับกิจกรรมภายในงาน •การประกวดลำไย กระท้อน •การประกวด “ทางเครื่องรำวงย้อนยุค” •การแข่งขันชกมวยไทย •การแข่งขันประกอบอาหารจากลำไย-กระท้อน "Master Chef ลำไย-กระท้อน" •การประกวดแฟชั่นชุดจากผลิตภัณฑ์ลำไย กระท้อน "Nature Fashion Show of the year" •การประกวดหนูน้อยลำไย กระท้อน ห้วยสัก •การประกวดร้องเพลงลูกทุ่ง •การจำหน่ายลำไย กระท้อน สดจากสวน •การจำหน่ายผลิตผลทางการเกษตร ผลิตภัณฑ์ชุมชน และของดีตำบลห้วยสัก •สนุกสนานกับเวทีรำวงย้อนยุค •สนุกสนานกับทีมงานรถแห่ “พลังหนุ่มชาวด์”
กิจกรรม Amazing 8riew EV Camp 2024 เดินทางวันที่ 3 - 4 สิงหาคม 2567
กิจกรรม Amazing 8riew EV Camp 2024 ร่วมเดินทางกับทริปสุดพิเศษ..โดยรถยนต์พลังงานไฟฟ้าล้วนๆ บุกตะลุยดูการปลูกไผ่ และผลิตภัณฑ์ชุมชนบ้านอ่างเตย แวะสักการะพระพุทธรูปแกะสลักจากไม้ตะเคียนทอง ที่วัดป่าเขาล้อม และพักค้างสไตล์แคมป์ปิ้ง ณ สอนไลโฮมสเตย์ ชมความสวยงามแนวสันเขื่อน อ่างเก็บน้ำคลองสียัด อ.ท่าตะเกียบ จ.ฉะเชิงเทรา
**สามารถร่วมกิจกรรมกับพวกเราได้ ..เฉพาะรถไฟฟ้า100% ไม่จำกัด Brand
เดินทางวันที่ 3 - 4 สิงหาคม 2567 รวมพล ณ จุดปล่อยตัวโชว์รูม BYD เลี่ยงเมืองฉะเชิงเทรา
ค่าสมัครเข้าร่วมกิจกรรม เพียงคันละ 789.- บาท (เดินทาง 2 ท่าน) หากมีผู้เดินทางเพิ่มเติม ผู้ใหญ่ ท่านละ 388.- บาท เด็ก 5-12 ปี ท่านละ 199 บาท
สิทธิประโยชน์ที่ได้รับ
- กิจกรรมคาราวานแรลลี่ ร่วมสนุกชิงรางวัลสุดคูล
- เรียนรู้ และสร้างประสบการณ์ที่มีคุณค่าผ่านกิจกรรมชุมชน และเมนูอาหารถิ่น “ชุมชนบ้านอ่างเตย” อำเภอท่าตะเกียบ จังหวัดฉะเชิงเทรา
- อาหาร 3 มื้อ เครื่องดื่มและอาหารว่าง 2 มื้อ
- ที่พัก 1 ห้อง 1 คืน ต่อคัน
งาน Cars and Coffee on Vacation 3 สิงหาคม 2567
งาน Cars and Coffee on Vacation วันที่ 3 สิงหาคม 2567 เข้าชมได้ตั้งแต่เวลา 14.00 น.-22.00 น. โดยไม่เสียค่าใช้จ่าย ภายในงานพบกับกิจกรรมที่น่าสนใจมากมาย อาทิ ลานจัดแสดงรถสวยงามจากผู้ชื่นชอบยานยนต์ Nissan Skyline GTR R32 R33 R34, Nissan Silvia S15, Honda Civic Type R – Ek9, Toyota FT86 และพร้อมสนุกสนานไปกับพิธีกรนักแข่งรถชื่อดัง บีม ศรัณยู ประชากริช และการแสดงดนตรีบนเวทีจากดีเจชื่อดัง DJ Riot Hunt ที่จะมา Scratch โชว์สร้างสีสันภายในงาน อิ่มอร่อยไปกับขบวน Food truck ร้านเด็ดร้านดัง ในจังหวัดสงขลา ที่ยกทัพความอร่อยมาเสิร์ฟถึงที่ นอกจากนี้มีแจกสติ๊กเกอร์สุดน่ารัก สุด Exclusive เป็นของที่ระลึกสำหรับผู้ที่มาร่วมงานในครั้งนี้ แล้วมาพบกันที่ ลานจอดรถสวนสาธารณะเมืองสงขลา จับกลุ่มผู้ชื่นชอบยานยนต์จากไทยและประเทศเพื่อนบ้านเดินทางผ่านพาหนะคู่ใจ
ย้อนวันวานเมืองเก่าตรัง 6 เมือง สิงหาคม-กันยายน 2567
องค์การบริหารส่วนจังหวัดตรัง ได้จัดสรรงบประมาณในการจัดงาน “ย้อนวันวานเมืองเก่าตรัง” ซึ่งเป็นการกระตุ้นเศรษฐกิจภาคการท่องเที่ยว และบริการ ในพื้นที่ชุมชนเมืองเก่าจังหวัดตรัง ในอำเภอกันตัง อำเภอห้วยยอด อำเภอปะเหลียน อำเภอเมืองตรัง อำเภอสิเกา และอำเภอย่านตาขาว
เริ่มตั้งแต่ เมืองเก่ากันตัง 3-5 สิงหาคม เมืองเก่าห้วยยอด 9-11 สิงหาคม เมืองเก่าท่าข้าม-หยงสตาร์-ทุ่งยาว 18-20 สิงหาคม เมืองเก่าทับเที่ยง 25-27 สิงหาคม. เมืองเก่าสิเกา 1-3 กันยายน และ เมืองเก่าย่านตาขาว 8-10 กันยายน 2567
เพื่อประชาสัมพันธ์ กิจกรรมการท่องเที่ยว เมืองเก่าตรังให้เป็นที่รู้จักมากยิ่งขึ้น ทั้งยังเป็นการร่วมกันอนุรักษ์เมืองเก่า และสืบทอดวัฒนธรรมอันเก่าแก่ของจังหวัดตรัง ให้คงอยู่ คู่กับจังหวัดตรังต่อไป สร้างการมีส่วนร่วมของคนในท้องถิ่น ให้เกิดความภาคภูมิใจ ในถิ่นกำเนิดของคนตรัง กระจายรายได้สู่ฐานราก ตามนโยบายของรัฐบาล อันจะส่งผลให้เกิดรายได้ที่มั่นคง สร้างความมั่งคั่ง ให้กับเศรษฐกิจของภูมิภาคและประเทศต่อไป
เทศกาลบอลลูนมิวสิคเฟสติวัลจันทบุรี 3-8 สิงหาคม 2567
งานเทศกาลบอลลูนมิวสิคเฟสติวัลจันทบุรีวันที่ 3 - 8 สิงหาคม 2567 ชมฟรี ทุกค่ำคืน บริเวณชายหาดแหลมสิงห์ จ.จันทบุรี ภายในงานจะพบกับโชว์สุดอลังการ โชว์บอลลูน โชว์ว่าวยักษ์แฟนซี โชว์ไฟฝูงปลานีโม่สัตว์น้ำทางทะเล ของกินหลากหลายอลังการแสงสีเสียงและวงดนตรีทุกค่ำคืน
งาน Mothers Day สิงหา พาแม่เที่ยว ตลาดสวนสมุนไพรฯ สุขภาพดี วิถีชุมชน วันเสาร์ที่ 3 สิงหาคม 2567
เชิญเที่ยวงานตลาดสวนสมุนไพรฯ สุขภาพดี วิถีชุมชน ปี2567 เสาร์แรกของเดือนสิงหาคม 2567 ณ สวนสมุนไพรสมเด็จพระเทพฯ กับธีมงาน "Mother’s Day สิงหา พาแม่เที่ยว " ในวันเสาร์ที่ 3 สิงหาคม 2567 ตั้งแต่เวลา 07.30 - 13.00 น. กิจกรรมภายในงาน ▶ การแสดงบนเวที จากโรงเรียนบ้านมาบตาพุด ▶ การแสดงจากโรงเรียนเทศบาลมาบตาพุด ▶กิจกรรมสาธิต “ สเปรย์มะลิหอม ” จากวิทยากรสวนสมุนไพรฯ ▶ กิจกรรมสาธิตร้านค้าชุมชน "งานประดิษฐ์" จากร้านสายชลต้นน้ำ ▶ กิจกรรม " สินค้า นาทีทอง " ประจำเดือนสิงหาคม ▶ พบกับสินค้าชุมชน สินค้า OTOP ผลิตภัณฑ์สมุนไพร งานหัตถกรรม ต้นไม้ และอาหารกว่า 120 ร้านค้า ▶ กิจกรรมพันธุ์ไม้สมุนไพรแจกฟรี (จำนวนจำกัด) *** เดือนสิงหาคม วันแม่แห่งชาติ เรามีแจกต้นมะลิ 40 ต้น ***
Thai Fight คาดเชือกเมืองคอน 2024 วันที่ 4 สิงหาคม 2567
การแข่งขันชกมวยไทยโลก Thai Fight คาดเชือกเมืองคอน 2024 มาสนุกกับเหล่าซุปเปอร์สตาร์ไทยไฟท์ นำทัพโดย แสนชัย, ป.ต.ท., เต็งหนึ่ง, น้องโอ, ขุนศึกเล็ก, ดาวแพร่ และเวโร พร้อมคู่มวยรอบ ISUZU THAILAND CHAMPIONSHIP รุ่นน้ำหนัก 65 กก. เพชรเอก พชร ยิม (ทีมภาคอีสานใต้) ปะทะ ธนูเงิน ภ.หลักบุญ (ทีมภาคอีสานเหนือ) และกล้าศึก ศิษย์ผู้ใหญ่เล็กเมืองระนอง (ทีมภาคเหนือ) ปะทะ เพชรภาคใหม่ ช.ชนะมวยไทย (ทีมภาคกลาง) ในวันอาทิตย์ที่ 4 สิงหาคม 2567 ณ เซ็นทรัลพลาซ่า นครศรีธรรมราช ประตูเปิดเวลา 16.00 - 17.00 น. ถ่ายทอดสดทางช่อง 8 (กดเลข 27) ชมฟรี เวลา 18.00 - 21.40 น.
5 สิงหาคม โรงพยาบาลร้อยเอ็ดรับบริจาคอวัยวะ ด.ญ.อายุ 13 ปี
5 สิงหาคม 2567 เวลา 13.00 น. ณ อาคารนิติเวช นายแพทย์ชาญชัย จันทร์วรชัยกุล ผู้อำนวยการโรงพยาบาลร้อยเอ็ด พร้อมด้วยนางบุษบา วงค์พิมล รองผู้อำนวยการฝ่ายการพยาบาลโรงพยาบาลร้อยเอ็ด นายแพทย์วิบูลย์ เตชะโกศล รองผู้อำนวยการด้านทุติยภูมิและตติยภูมิ โรงพยาบาลร้อยเอ็ด และคณะ มอบพวงหรีด แสดงความขอบคุณ นางชลลดา สาพาที มารดา ด.ญ.ชลลมาศ ถามะพันธ์ อายุ 13 ปี ผู้วายชนม์ ได้ทำบุญมหาทานบารมี ด้วยการบริจาคอวัยวะ รวมทั้งดวงตา อวัยวะที่ได้คือ ไต ตับ ลิ้นหัวใจ และดวงตา ให้กับศูนย์รับบริจาคอวัยวะสภากาชาดไทย เพื่อนำไปปลูกถ่ายช่วยชีวิตให้กับผู้ป่วยเรื้อรัง โรงพยาบาลร้อยเอ็ด ขออนุโมทนาบุญแก่ญาติและผู้บริจาคอวัยวะให้กับเพื่อนมนุษย์เพื่อต่อชีวิต ต่อลมหายใจให้ผู้ป่วย ที่รอความหวัง ถือเป็นทานบารมีที่ยิ่งใหญ่และเป็นที่สุดแห่งการให้ครั้งสุดท้ายของชีวิต สำหรับผู้ที่มีความประสงค์จะบริจาคอวัยวะ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ คุณปาณิสรา ทองมี ผู้ระสานงาน ศูนย์รับบริจาคอวัยวะ โรงพยาบาลร้อยเอ็ด โทร 092-6452426 หรือที่หอผู้ป่วยหนักศัลยกรรมประสาท โรงพยาบาลร้อยเอ็ด โทร. 043-518200 ต่อ 2029
นิทรรศการ อีสานบ้านผีป๊อป TCDC Khon Kaen 6 ส.ค. 67 - 26 ม.ค. 68 LINK
นิทรรศการ อีสานบ้านผีป๊อป Popular Isan Ghost Exhibition สำนักงานส่งเสริมเศรษฐกิจสร้างสรรค์ ขอนแก่น เชิญทุกท่าน สัมผัสความสยองขวัญที่ไม่สยองขวัญแบบอีสาน กับนิทรรศการ “อีสานบ้านผีป๊อป Popular Isan Ghost Exhibition” ที่จะมาเล่าตำนานความน่าขนลุกและสนุกสนานกับประวัติความเป็นมาของเหล่าผีแต่ละพื้นที่ในภาคอีสาน พร้อมเชื่อมโยงความน่าตื่นเต้นกับเศรษฐกิจสร้างสรรค์ ที่จะพาทุกท่านได้เห็นถึงการนำเรื่องราวความเชื่อพื้นบ้านของคนอีสานมาประยุกต์ใช้ในงานศิลปะรูปแบบต่าง ๆ ของเหล่าศิลปิน นักสร้างสรรค์ ที่มากความสามารถ จัดเต็มสาระและความบันเทิงแบบป๊อป ๆ กันมากถึง 5 โซน ได้แก่ โซนที่ 1 โคตรผีอีสาน ( Isan Ghost Family ) โซนที่ 2 เบิกเนตร ( Eye Opening โซนที่ 3 ผีบอก ( Ghost Whisper ) โซนที่ 4 ตำนานคนเล่าผี ( Ghost Story Teller Legend ) โซนที่ 5 แกลเลอรี่ผี ( Ghost Gallery )
มาร่วมม่วนจอยกันที่บ้านผีป๊อปได้ตั้งแต่วันที่ 6 ส.ค. 67 - 26 ม.ค. 68 เวลา 10.30 - 19.00 น. (ปิดบริการทุกวันจันทร์) ณ TCDC ขอนแก่น ชั้น 1 , ชั้น 2 บ่ต้องย่าน ผีอีสานโคตรม่วน !!! NO FEAR ALL FUN
งานทิ้งกระจาดมูลนิธิร่วมกุศลสมุทรปราการ 7-9 สิงหาคม 2567
ขอเชิญทำบุญงานทิ้งกระจาดมูลนิธิร่วมกุศลสมุทรปราการ ถนนท้ายบ้านซ.17 ตั้งแต่บัดนี้เป็นต้นไปจนถึง 7-8-9 สิงหาคม 2567 ช่องทางการทำบุญบริจาคออนไลน์ โอน บัญชี มูลนิธิร่วมกุศลสมุทรปราการ ธ.กสิกรไทย เลขที่ 224-2-22221-5 หรือผ่านคิวร์อาร์โค้ตใต้ภาพ หรือเดินทางมาที่มูลนิธิร่วมกุศลสมุทรปราการ ถนนท้ายบ้านซ.17 ต.ปากน้ำ อ.เมือง จ.สมุทรปราการ ติดต่อสอบถาม โทร.021758789 ,021758668 ,0841509101,
ตลาดวัฒนธรรมสร้างสุข "ดนตรี กวี ศิลป์ ถิ่นขลุงบุรี" อำเภอขลุง วันที่ 9-10 สิงหาคม 2567 LINK
ชวนมาชม มาชิม มาช้อป ระหว่างวันที่ 9-10 สิงหาคม ณ วัดตะปอนใหญ่ อำเภอขลุง พบกับ ตลาดวัฒนธรรมสร้างสุข กว่า ๒๐ ร้าน / ตลาดสร้างศิลป์ ดนตรีสร้างสรรค์ มีการสอนวาดภาพ ระบายสี วาดการ์ตูน ฟรี! โดย ชมรมสานศิลป์ถิ่นจันทบูร/ การแสดงทางวัฒนธรรม ที่หาชมยาก และการแสดงจากสถานศึกษาในพื้นที่ / การสาธิตผลิตภัณฑ์ทางวัฒนธรรม / การสาธิตภูมิปัญญาอาหารพื้นบ้าน /การละเล่นพื้นบ้าน / ดนตรีโฟล์คซอง และร่วมสมัย ตลอดงาน พร้อมทั้ง กิจกรรมอื่น ๆ อีกมากมาย
กิจกรรมนอนกางเต็นท์บริเวณลานกางเต็นท์ของจุดสกัดเขาสูงเขาแผงม้า 9-12 สิงหาคม 2567
ททท.นครราชสีมา เชิญชวนท่านลงทะเบียนผ่านออนไลน์ เพื่อเข้าร่วมกิจกรรม #นอนกางเต็นท์ บริเวณลานกางเต็นท์ของ จุดสกัดเขาสูงเขาแผงม้า #เขตห้ามล่าสัตว์ป่าเขาแผงม้า บ้านคลองทราย ได้จำนวน 50 หลัง (โดยมีค่าธรรมเนียมสถานที่คนละ 30 บาท ค่ากางเต็นท์ 30 บาท และรถ 60 บาท ) และถึงอีกหนึ่งสถานที่ คือ #หน่วยพิทักษ์อุทยานแห่งชาติเขาใหญ่ ขญ.4 บ้านคลองปลากั้ง ตำบลวังหมี ท่านสามารถกางเต็นท์ได้อีก 100 หลัง
โดยผู้ที่ลงทะเบียนผ่านออนไลน์ จะได้รับคูปองซื้อสินค้าผลิตภัณฑ์ชุมชน และอาหาร บริเวณสถานที่จัดงานลานวัดคลองทราย คูปองคนละ 100 บาท
นักท่องเที่ยว และประชาชน ที่ไปร่วมงานกรอกแบบสอบถาม ก็จะได้รับคูปอง คนละ 50 บาท เพื่อนำไปจับจ่ายซื้อสินค้าสินค้า บริเวณตลาดชุมชน ระหว่างวันที่ 9-11 สิงหาคมนี้
แสงไฟในสวนรุกขชาติ 9-12 สิงหาคม 2567 LINK
ททท.สำนักงานตราด ร่วมกับ ชมรมแล่นใบตราด, เทศบาลเมืองตราด หน่วยงานภาครัฐและเอกชน จัดกิจกรรม “แสงไฟในสวนรุกขชาติ” ระหว่างวันที่ 9 - 12 สิงหาคม 2567 บริเวณริมสระน้ำสวนรุกขชาติ ตำบลวังกระแจะ อำเภอเมือง จังหวัดตราด เนื่องในโอกาสวันเฉลิมพระชนมพรรษา สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง 12 สิงหาคม 2567 โดยจัดให้มีเรือใบประดับไฟพลังงานแสงอาทิตย์ติดตั้งในสระน้ำสวนรุกขชาติ อำเภอเมือง จังหวัดตราด เพื่อเป็นจุดถ่ายภาพสำหรับการท่องเที่ยวภาคกลางคืน
ขอเชิญชวนพี่น้องชาวจังหวัดตราด คู่รักแม่ลูก และนักท่องเที่ยวทุกท่านมาถ่ายภาพวิวเรือใบกันในวันที่ 9 - 12 สิงหาคมนี้ ตั้งแต่เวลา 18.00 - 20.00 น. พร้อมลุ้นรับของที่ระลึกจาก ททท. ได้เลย (ของที่ระลึกจำนวนจำกัด)
ร่วมโหวตสุดยอดเมนูอาหารถิ่นของจังหวัดอุตรดิตถ์
“1 จังหวัด 1 เมนู เชิดชูอาหารถิ่น”
ขอเชิญชวน ร่วมโหวตสุดยอดเมนูอาหารถิ่นของจังหวัด
“รสชาติ...ที่หายไป The Lost Taste”
ตั้งแต่วันที่ 1 สิงหาคม 2567 ถึงวันที่ 8 สิงหาคม 2567
จังหวัดอุตรดิตถ์ได้พิจารณาคัดเลือกเมนูอาหารคาว อาหารหวาน และอาหารว่างให้ร่วมโหวตถึง 8 เมนู ดังนี้
1. แกงปลีกระดูกอ่อน
2. แกงโอ๊ะเอ๊ะ
3. หมี่ยำลับแล
4. ขนมข้าวตอกตัด
5. ขนมดาดกระทะ
6. ขนมกวน
7. ลอดช่องเค็ม
8. ไส้กรอกใหญ่รสเด็ดโบราณพิชัย
โดยจะปิดโหวตเวลา 16.30 น.
ผ่านลิ้งค์แนบ หรือ QR CODE หรือ ผ่านเว็บไซต์ และ Facebook สำนักงานวัฒนธรรมจังหวัดอุตรดิตถ์ เพจอุตรดิตถ์ 24 ชั่วโมง เพจข่าวอุตรดิตถ์ และเพจสายเที่ยวสายแดก
พิธีมอบรางวัลโพธิคยานาคาธิบดี ศุกร์ที่ 9 สิงหาคม 2567
กระบี่ยิ่งไหว้ยิ่งปัง ให้ศรัทธานำทาง ความดีนำใจ... เสริมปังริมเล มูพญานาคน้ำเค็มแดนใต้ ???? มาตามรอยเส้นทางสายศรัทธาพญานาค...กระบี่ พิธีมอบรางวัลโพธิคยานาคาธิบดี ศุกร์ที่ 9 สิงหาคม 2567 เวลา 16.30 - 19.30 น. มณฑลพิธีองค์พญาภุชงค์นาคาธิบดี อบจ.กระบี่ สายพญานาค สายมูต้องห้ามพลาดเทศกาลออกแบบของคนเชียงรายสร้างสรรค์ “สิ่งมีชีวิตที่เรียกว่าเมือง” Chiang Rai Creature 9 -15 สิงหาคม 2567
เทศกาลออกแบบของคนเชียงรายสร้างสรรค์ “สิ่งมีชีวิตที่เรียกว่าเมือง” Chiang Rai Creature เทศกาลประจำปี ด้านการออกแบบเพื่อความยั่งยืน เปิดเมืองสร้างสรรค์ สาขาการออกแบบ ในเครือข่ายเมืองสร้างสรรค์ของยูเนสโก UCCN ชวนทุกคน มาออกแบบเชียงรายด้วยกัน ระหว่างวันที่ 9 -15 สิงหาคม 2567 ณ ศาลากลางหลังแรก เชียงราย จุดกำเนิดเทศกาลออกแบบเมืองมีชีวิต และพื้นที่สร้างสรรค์ทั่วเชียงราย
KITE ON THE BEACH ว่าว WOWWW 2024 วันที่ 9-13 สิงหาคม 2567
“KITE ON THE BEACH ว่าว WOWWW 2024” เทศกาลว่าวระยอง 2567 ว่าวยักษ์ริมทะเล วันที่ 9 - 13 สิงหาคม 2567 ณ อนุสรณ์เรือรบหลวงประแสร์ อ.แกลง พุงกาง Festival x เรือรบหลวงประแส สัมผัสบรรยากาศสุดว้าวในงาน และชุดโชว์ไฟเรือรบหลวงประแสสุดอลังการ พร้อมร้านค้ากว่า 100 ร้านค้า
งานเกษตรภาคใต้ ครั้งที่ 30 วันที่ 9-18 สิงหาคม 2567
งานเกษตรภาคใต้ ครั้งที่ 30 คณะทรัพย์ ม.อ.หาดใหญ่ วันที่ 9-18 สิงหาคม 2567 กิจกรรมต่างๆมากมายอีกทั้งนวัตกรรมทางการเกษตรและนิทรรศการให้ความรู้และการออกร้าน
เที่ยวงานวันแม่ อ่างเก็บน้ำดอกกราย ถนนคนเดินระยอง 9-12 สิงหาคม 67
เที่ยวงานวันแม่ อ่างเก็บน้ำดอกกราย RayongWalkingStreet ถนนคนเดินระยอง วันที่ 9-12 สิงหาคม 67 เวลา 15.00 - 22.30 น. ณ หอเฉลิมพระเกียรติ อ่างเก็บน้ำดอกกราย อ.ปลวกแดง จ.ระยอง ถนนคนเดินสำหรับครอบครัว จะพาพี่ พาน้อง พาคนรู้ใจ หรือ คนสนิทมาเดิน ก็ได้หมด และอย่าลืม‼️ จูงมือคุณแม่มาเที่ยวงาน ชิ??ของอร่อย และมาบอกรักแม่ไปกับถนนคนเดิน Rayong Walking Street ถนนคนเดินระยอง กิจกรรมภายในงาน โชว์ตัวตลกโบโซ่ โชว์ควงกระบองไฟ เวลา 21.00 น. สตรีทฟู้ดร้านเด็ดกว่า 200 ร้านค้า ดนตรีสด ทุกวัน
งานเทศกาลอาหารและบอลลูนนานาชาติ (ของดีสว่างแดนดิน) 9-18 สิงหาคม 2567
งานเทศกาลอาหารและบอลลูนนานาชาติ (ของดีสว่างแดนดิน) 9-18 สิงหาคม 2567 ณ.สนามบินเก่า อ.สว่างแดนดิน จ.สกลนคร ชมบอลลูนหลากสีนานาชาติ ร้านเด่นดังจากTikTok สินค้าอาหารราคาโรงงาน การแสดงแสงสีเสียงทุกคืน
งานเทศกาลอาหารและบอลลูน นครพนม 9-18 สิงหาคม 2567
งานเทศกาลอาหารและบอลลูนนานาชาติ 9-18 สิงหาคม 2567 ศาลากลาง จ.นครพนม ชมบอลลูนนานาชาติ สินค้าเด่นจากติ๊กตอก สินค้าดีราคาถูกจากโรงงาน ชมคอนเสิร์ตทุกคืน
งานทิ้งกระจาดวัดไผ่โรงวัว 10-20 สิงหาคม 2567
งานทิ้งกระจาดวัดไผ่โรงวัว ประจำปี 2567 วันที่ 10-20 สิงหาคม 2567 ณ วัดไผ่โรงวัว อ.สองพี่น้อง จ.สุพรรณบุรี วันทิ้งทาน 20 สิงหาคม 2567 ตลาดเปิดทุกวัน 10.00 - 22.30 น. (11 วัน 11 คืน)
ห่มผ้าหลวงปู่ทวด ในโอกาสครบ ๒ ทศวรรษ ณ วัดห้วยมงคล หัวหิน 10-11 สิงหาคม 2567
ททท. ขอเชิญท่านร่วมกิจกรรมสร้างบุญมหามงคล " ห่มผ้าหลวงปู่ทวด ในโอกาสครบ ๒ ทศวรรษ " ณ วัดห้วยมงคล หัวหิน ซึ่งในปีนี้จะเป็นครั้งแรกที่จะประกอบพิธีในเวลากลางคืน ประดับตกแต่ง ด้วยระบบแสงสีเสียงเพิ่มความเข้มขลังตระการตา และผู้ที่ร่วมพิธีจะได้เดินสวดมนต์ภาวนาได้อย่างมีสมาธิไม่ร้อนต่อแสงแดด
พิธีศักดิ์สิทธิ์ มี ๒ วันด้วยกัน ในเย็นวันเสาร์ที่ ๑๐ สิงหาคม ๖๗ เป็นพิธีสวดตัดเคราะห์ต่อชะตา และเย็นวันอาทิตย์ที่ ๑๑ สิงหาคม ๖๗ เป็นพิธีห่มผ้าองค์หลวงปู่ทวด ทั้ง ๒ วัน เริ่มพิธี เวลา ๑๗.๓๐ น. เป็นต้นไป และพิเศษสุดสำหรับ ผู้ที่ร่วมพิธีรับบุญทันตา หลวงปู่ทวดพิมพ์ใหญ่หลังเตารีดโบราณ ที่ผ่านพิธีปลุกเสกโดยพระเกจิอาจารย์ชื่อดัง ๑๕ รูป กลับไปบูชาเป็นสิริมงคลท่านละ ๑ องค์
งานเทศกาลมูเตลู Nakhon Si Must Mu Fest วันที่ 10-12 สิงหาคม 2567
งานเทศกาลมูเตลู “Nakhon Si Must Mu Fest” ระหว่างวันที่ 10-12 สิงหาคม 2567 ณ บ้านท่านขุนรัฐวุฒิวิจารณ์ อ.เมือง จ. นครศรีธรรมราช ไฮไลต์กิจกรรมภายในงาน แบ่งออกเป็น 4 โซน โซน Ma Mu (มามู) โซนจะพาทุกคนนั่งรถไม้คลาสสิก ไปมูแก้ชงและเสริมดวง ... ฟรี โซน Must Mu จุดถ่ายภาพเช็คอิน กับลูกแก้วมูเตลู สะท้อนพลังงานด้านลบ ดึงดูดพลังงานด้านบวก ทั้ง โชคลาภ เงินทอง สุขภาพ และความเจริญ และเสริมความปังไปกับ 5 หมุดหมายเด็ดที่ต้องมู ในจังหวัดนครศรีธรรมราช พร้อมลุ้นรับของที่ระลึกฟรี มากมาย โซน Mu Mix Match รวบรวมเครื่องรางของขลังที่ทุกคนสามารถนำมา Mix&Match Accessory มูแบบที่ใช่ ในสไตล์ที่ชอบ โซน Mu Ma Du (ดวง) โซนนี้สายเช็คดวงห้ามพลาด! กับโซนที่จะพาทุกคนไปไขเรื่องข้องใจ กับนักพยากรณ์ชื่อดังของจังหวัดนครศรีธรรมราช
Krabi Skimboard Competition#2 วันที่ 10 สิงหาคม 2567
Krabi Skimboard Competition 2 วันที่ 10 สิงหาคม 2567 ณ หาดอ่าวนาง จังหวัดกระบี่ พบกับการแข่งขัน Skimboard สายคลื่นที่ใหญ่ที่สุดในไทย งานสกิมประจำปี ชมการรวมตัวนักกีฬาสคิมบอร์ดผู้หลงรักในเกลียวคลื่นกว่า 50 คน จากทั้งในประเทศไทยและต่างประเทศ
Blu Monkey Friendly Market EP2 Picnic in the Nature วันที่ 10-11 สิงหาคม 2567
Blu Monkey Friendly Market EP2 Picnic in the Nature งานอีเวนท์ที่สุดกรีน อุดมไปด้วยสิ่งหล่อเลี้ยงที่จะทำให้การอยู่ร่วมกันนี้เกิดขึ้นได้อย่างยั่งยืน มางานนี้คุณจะได้เป็นส่วนหนึ่งที่สนับสนุนร้านค้าจากชุมชนละแวกใกล้เคียง ทั้งผลิตภัณฑ์ชุมชน งานแฮนด์เมด อาหารพื้นถิ่น ท่ามกลางบรรยากาศในสวนร่มรื่น มีเสียงดนตรี และกิจกรรม Workshop ที่ทำให้เราได้ใกล้ชิดกับตัวเองและธรมชาติอย่างแท้จริง เช่น Sound Healing, Puppy Yoga, Eco Printing, และ Recycle Workshop เป็นต้น อีกทั้งพื้นที่งานเหมาะสำหรับครอบครัวและสัตว์เลี้ยงด้วยนะ วันที่ 10-11 สิงหาคม 2567 เวลา 9.00 - 18.00 น.
Blu Monkey Pooltara Krabi เสวนาธรรม “กระบี่ประตูอารยธรรมศักดิ์สิทธิ์ พญาภุชงค์นาคราช เชิดชูมหาราชแห่งธรรม” 10 สิงหาคม พ.ศ.2567
เสวนาธรรม “กระบี่ประตูอารยธรรมศักดิ์สิทธิ์ พญาภุชงค์นาคราช เชิดชูมหาราชแห่งธรรม” (โครงการขยายผลต่อยอดจากพิธีอัญเชิญพระบรมสารีริกธาตุ พระอมพระอัครสาวกอรหันตธาตุ พระสารีบุตร พระมหาโมคัลลานะ จากสาธารณรัฐอินเดีย มาประดิษฐานชั่วคราวที่ประเทศไทย) วันเสาร์ที่ 10 สิงหาคม พ.ศ.2567 เวลา 8.30 น. สดจาก โรงแรม โซฟเทล กระบี่ โภคีธรา กอล์ฟ แอนด์ สปา รีสอร์ท อำเภอเมือง จ.กระบี่
ระนองมหานครน้ำแร่ ประจำปี 2567 วันที่ 10-11 สิงหาคม 2567
งาน "ระนองมหานครน้ำแร่" ประจำปี 2567 วันที่ 10-11 สิงหาคม 2567 ตั้งแต่เวลา : 17.00-21.00 น. ณ บ่อน้ำร้อนรักษะวาริน อ.เมือง จ.ระนอง
กิจกรรมกีฬา Air Sea Land หรอยแรง 360 องศา 10-12 สิงหาคม 2567
การกีฬาแห่งประเทศไทย (กกท.) ร่วมกับ จังหวัดระนอง และจังหวัดประจวบคีรีขันธ์ สมาคมกีฬาแห่งประเทศไทยฯ สมาคมกีฬาแห่งจังหวัด จัดการแข่งขันกีฬาเพื่อเชื่อมโยงการท่องเที่ยว การขับเคลื่อนกีฬา สังคม และเศรษฐกิจ ที่รวบรวมการแข่งขันกีฬาทางอากาศ กีฬาทางน้ำ และกีฬาทางบก ในการจัดการแข่งขัน Air Sea Land Southern International Sports Tourism Festival 2024
ปีนี้จัดขึ้นที่จังหวัดประจวบคีรีขันธ์ เมืองท่องเที่ยวที่ไม่ได้มีดีแค่เมืองหัวหิน และจังหวัดระนองเมืองรองถิ่นใต้ ฝนแปดแดดสี่ มากล้นด้วยเสน่ห์ทางธรรมชาติ ซึ่งเป็นรายการจัดต่อเนื่องทั้ง 2 จังหวัด
จ.ระนอง จัดการแข่งขันกีฬากระดานยืนพาย (Stand Up Paddle Board)
จ.ประจวบคีรีขันธ์ จัดการแข่งขันชนิดกีฬามวยไทย กีฬาพารามอเตอร์
และพลาดไม่ได้ กับกิจกรรม Sports Expo และคอนเสิร์ตจากเหล่าศิลปินชื่อดังมากมาย ระหว่างวันที่ 10 - 12 สิงหาคม 2567 นี้ แฟน ๆ กีฬาและจังหวัดใกล้เคียง สามารถเข้าร่วมชม เชียร์ ให้กำลังใจนักกีฬา ได้ฟรี พร้อมร่วมกิจกรรมมากมายภายในงาน
เฉลิมฉลอง 20 ปี ตลาดน้ำอัมพวา จัดกิจกรรม "สิงหาพาแม่เที่ยว" วันที่ 10-12 และ 17-18 สิงหาคม
ททท.สำนักงานสมุทรสงคราม ร่วมเฉลิมฉลอง 20 ปี ตลาดน้ำอัมพวา จัดกิจกรรม "สิงหาพาแม่เที่ยว" เพื่อส่งเสริมและกระตุ้นให้เกิดการเดินทางท่องเที่ยวในจังหวัดสมุทรสงคราม ช่วงวันแม่แห่งชาติ 2567 พร้อมส่งมอบความสุขและประสบการณ์ท่องเที่ยวที่ทรงคุณค่า กับกิจกรรมนั่งเรือ ฟรี !! ตลอดวันหยุดยาว 3 วัน วันที่ 10-12 และ 17-18 สิงหาคม นี้
โดยท่านสามารถลงทะเบียน รับคูปองนั่งเรือ ฟรี ‼️ได้ที่ ร้านชานชาลาโครงการอัมพวา ชัยพัฒนานุรักษ์ [
พิกัด]
เพียงแสดงหลักฐานการเข้าพักค้างระหว่างวันที่ 10-12 และ 17-18 สิงหาคม 2567 จากที่พัก โรงแรม/รีสอร์ท และใบเสร็จค่าอาหาร จากร้านอาหารที่ใดก็ได้ในจังหวัดสมุทรสงคราม รวมมูลค่า 1,000 บาทขึ้นไป ก็สามารถรับคูปองนักเรือเที่ยวอัมพวาได้แบบฟรีๆ กับ 11 ท่าเรือ ที่ร่วมกิจกรรม ณ ตลาดน้ำอัมพวา ดังนี้
1. ท่าเรืออัมพวา โทร 087-409-9254
2. ท่าเรือคุณย่า โทร 081-557-0824
3. ท่าเรือศิริโรจน์ โทร 081-732-7120
4. ท่าเรือชุมชนวัดอัมพวัน โทร 081-422-0726
5. ท่าเรือเทศบาล 2 โทร 090-299-2256
6. ท่าเรือชมรมคนรักอัมพวา โทร 089-415-4523
7. ท่าเรือจ่าภิญโญ โทร 084-085-7544
8. ท่าเรือพรประภา โทร 092-558-8845
9. ท่าเรือปรางทอง โทร 087-341-4856
10. ท่าเรือริมเขื่อนอัมพวา โทร 089-982-6915
11. ท่าเรือนันทพร โทร 086-007-1775
งานครบรอบ20ปีตลาดน้ำอัมพวา 10-12 สิงหาคม 2567
งานครบรอบ20ปีตลาดน้ำอัมพวา 20th Anniversary Amphawa Floating Market ในวันที่ 10-12 สิงหาคม นี้ ขอเชิญชวนนักท่องเที่ยวมาร่วม เฉลิมฉลองไปพร้อมกัน ...
พบกับพ่อค้าแม่ค้าพายเรือจำหน่ายสินค้ามากมายให้คุณได้เลือกชิม ช้อป และใช้ชีวิตท่ามกลางความสวยงามของวิถีชีวิตริมคลองแบบดั้งเดิม โดยงานนี้มาพร้อมกิจกรรมมากมาย นอกจากจะได้ชิม ช้อป และชมการแสดงศิลปวัฒนธรรมและการแสดงดนตรี จากเยาวชนในจังหวัดสมุทรสงครามบนเวทีกลางน้ำในคลองอัมพวา
ห้ามพลาด ! กับไฮไลต์สุดพิเศษ
วันที่ 11 สิงหาคม นี้ คอนเสิร์ต "คืนความรักให้อัมพวา" ครั้งที่ 9 พบกับศิลปิน หน้ากากอีกาดำ เอ๊ะ จิรากร และวง Labanoon ( ลาบานูน ) ที่จะมาสร้างสีสันให้เป็นค่ำคืนที่เต็มเปี่ยมไปด้วยความสุข พร้อมกับการต้อนรับแสนอบอุ่นจากชาวอัมพวาด้วยหัวใจ และหลังจากชมคอนเสิร์ตแล้วอย่าเพิ่งรีบกลับกันนะ นอนพักผ่อนดื่มด่ำในบรรยากาศสุดชิลล์ที่ #อัมพวา สักคืน เพราะช่วงเช้าในวันที่ 12 สิงหาคม 2567 ยังมี #กิจกรรมตักบาตรทางน้ำ บริเวณริมสองฝั่งคลองอัมพวา ตั้งแต่ 08.00 น. เป็นต้นไป ขอเชิญชวนมาร่วมสัมผัสประเพณีที่งดงามและร่วมทำบุญไปพร้อมกัน มาชาร์จพลัง เติมเต็มความสุขในช่วงวันหยุด Long Weekend พร้อมสัมผัสประสบการณ์ที่แสนอบอุ่น กับบรรยากาศตลาดน้ำที่มีเอกลักษณ์ของวิถีชีวิตริมสองฝั่งคลองไปด้วยกัน
สอบถามข้อมูลเพิ่มเติมได้ที่ Facebook : คืนความรักให้อัมพวา โทร. 09 8375 1048 หรือ สำนักงานเทศบาลตำบลอัมพวา โทร. 0 3475 3351
โครงการส่งเสริมกิจกรรม ๑ อำเภอ ๑ ลานวัฒนธรรม (อำเภอภูเพียง) 10 สิงหาคม 2567
สำนักงานวัฒนธรรมจังหวัดน่าน ร่วมกับ วัดพระธาตุแช่แห้ง พระอารามหลวง และภาคีเครือข่าย ขอเชิญทุกท่านร่วมงาน โครงการส่งเสริมกิจกรรม ๑ อำเภอ ๑ ลานวัฒนธรรม ( อำเภอภูเพียง ) ภายใต้แนวคิด “เที่ยว ชม ชิม ช้อป ชิลล์” วันเสาร์ที่ 10 สิงหาคม 2567 ณ ศาลาปฏิบัติธรรม (ศาลาหลวง) วัดพระธาตุแช่แห้งพระอารามหลวง อำเภอภูเพียง จังหวัดน่าน ตั้งแต่เวลา 09.00 น. เป็นต้นไป
กิจกรรมไฮไลท์ของงาน ????????ชมการแสดงศิลปวัฒนธรรมพื้นบ้าน ????????การสาธิตทอผ้า จากศูนย์การเรียนรู้ผ้าทอน่าน (วิทยาลัยสงฆ์นครน่านเฉลิมพระเกียรติ) ????????การสาธิตกิจกรรม และชมนิทรรศการ “น่าน เมืองเก่าที่มีชีวิต” (โรงเรียนน่านปัญญานุกุล) ????????การสาธิตการทำฟั่นเทียน และเทียนกระต่ายมงคล (ผู้สูงอายุบ้านหนองเต่า) ????????การสาธิตจักสาน (บ้านปัวชัย) ????????การสาธิตทำขนมหม้อแกง (กศน.น่าน) ????????การสาธิตทำสบู่สมุนไพร (บ้านหนองเต่า) ????????การสาธิตทำบายศรี สรวยดอกไม้ธูปเทียน บูชาพระธาตุแช่แห้ง (วัดพระธาตุแช่แห้ง) ????????กิจกรรมกาดมั่ว คัวศิลป์ (อพท.น่าน) ????????การจำหน่ายผลิตภัณฑ์พืชผักสวนครัวจากตลาดสีเขียว (ภูเพียงโมเดล) ????????การจำหน่ายอาหารพื้นเมือง ขนมพื้นเมือง น้ำสมุนไพรมะไฟจีน (บ้านหนองเต่า) ????????การจำหน่ายธงฟ้าราคาถูก (พาณิชย์จังหวัดน่าน) ติดต่อสอบถามเพิ่มเติม เพจ : สำนักงานวัฒนธรรม จ.น่าน
Amazing Outdoor Fest 2024 วันที่ 10 - 11 สิงหาคม 2567
ททท. นครนายก ร่วมกับ หอการค้าจังหวัดนครนายก YEC สมาคมส่งเสริมการท่องเที่ยวจังหวัดนครนายก จัดงาน Amazing Outdoor Fest 2024 วันที่ 10-11 สิงหาคม 2567 เวลา 15.00 - 22.00 น. ในงานจะพบกับคอนเสิร์ตจากศิลปินชื่อดัง เอ๊ะ จิรากร, วง Mocca Garden รวมถึงศิลปินยุค 90’s และอีกมากมาย และเล่นกิจกรรม Outdoor สุดมันส์และบูธอาหารอร่อยมากกว่า 100 บูธ แล้วพบกันที่ลานอเนกประสงค์ เขื่อนขุนด่านปราการชล จังหวัดนครนายก
10 สิงหาคม รพ.เจ้าพระยาอภัยภูเบศร เข้าร่วมพิธีแสดงความอาลัย และขอขมากรรม ผู้บริจาคอวัยวะหญิงไทย อายุ 47 ปี
10 สิงหาคม 2567 แพทย์หญิงชนิดา สยุมภูริจินันท์ ผู้อำนวยการโรงพยาบาลเจ้าพระยาอภัยภูเบศร มอบหมายให้ นางแสงสม เพิ่มพูล รองหัวหน้าพยาบาลด้านพัฒนาคุณภาพบริการพยาบาล พร้อมด้วยตัวแทน จากกลุ่มการพยาบาล เข้าร่วมพิธีแสดงความอาลัย และขอขมากรรม ผู้บริจาคอวัยวะหญิงไทย อายุ 47 ปี โดยได้รับ ไต 2 ข้าง ดวงตา 2 ดวง โดยจะมอบให้กับศูนย์บริจาคอวัยวะสภากาชาดไทย ผ่านทางโรงพยาบาลเจ้าพระยาอภัยภูเบศร เพื่อนำไปปลูกถ่ายให้แก่ผู้ป่วยที่รอรับการปลูกถ่ายอวัยะ ซึ่งในการบริจาคอวัยวะครั้งนี้ ได้รับเกียรติจาก นายรณรงค์ นครจินดา ผู้ว่าราชการจังหวัดปราจีนบุรี พร้อมด้วยเหล่ากาชาดจังหวัดปราจีนบุรี ในการมอบใบประกาศเกียรติคุณให้แก่ญาติของผู้วายชนม์ ในท้ายนี้ โรงพยาบาลเจ้าพระยาอภัยภูเบศร ต้องขอขอบพระคุณท่านผู้มีเมตตาที่เสียสละบริจาคอวัยวะเพื่อเป็นการต่อลมหายใจให้อีกหลายชีวิต และขอให้ครอบครัวของท่านพบแต่ความสุขความเจริญยิ่ง ๆ ขึ้นไป
วัฒนธรรมสายธาราดงกลาง วิจิตรตระการเมืองพิจิตร 10 สิงหาคม 2567
จังหวัดพิจิตร ร่วมกับสำนักงานวัฒนธรรมจังหวัดพิจิตรและชุมชนคุณธรรมวัดดงกลาง จังหวัดพิจิตร ขอเชิญเที่ยวงาน “วัฒนธรรมสายธาราดงกลาง วิจิตรตระการเมืองพิจิตร” ระหว่างวันที่ 10 – 11 สิงหาคม 2567 ณ บริเวณตลาดชุมชนคุณธรรมวัดดงกลาง ตำบลดงกลาง อำเภอเมืองพิจิตร จังหวัดพิจิตร
กิจกรรมส่งเสริมการท่องเที่ยว กระตุ้นเศรษฐกิจ ยกระดับและเพิ่มมูลค่าการท่องเที่ยวชุมชนคุณธรรม วัดดงกลาง ภายใต้โครงการพัฒนาการท่องเที่ยว และบริการในรูปแบบการท่องเที่ยวเชิงสร้างสรรค์ และสนับสนุนให้จังหวัดพิจิตรเป็นเมืองสร้างสรรค์ (Creative City)
พบกับกิจกรรมภายในงาน ตักบาตรทางน้ำ เปิดตลาดชุมชนคุณธรรมวัดดงกลาง และท่องเที่ยวชุมชนยลวิถีคลองข้าวตอก การสาธิตผลิตภัณฑ์ทางวัฒนธรรมไทย (CPOT)
ชม ชิม ช๊อป อาหารพื้นบ้าน และพืชผลทางการเกษตรปลอดสาร สนุกสนานกับการรำวงย้อนยุค กลองยาวพื้นบ้าน ลิเก จาก สมาคมลิเก จังหวัดพิจิตร ชมการแสดง Mini light and sound “วัฒนธรรมสายธาราดงกลาง วิจิตรตระการเมืองพิจิตร” ในวันเสาร์ที่ 10 สิงหาคม 2567 ตั้งแต่เวลา 19.00 เป็นต้นไป
กินเงาะ เลาะโขง ไหว้จตุธาตุ เมืองหนองคาย 10-11 สิงหาคม 2567
สมาคมส่งเสริมการท่องเที่ยวจังหวัดหนองคาย ชวนเที่ยวกิจกรรม "กินเงาะ เลาะโขง ไหว้จตุธาตุ เมืองหนองคาย" พาเที่ยว กิน ชม หนองคาย กับ เดอะแก๊งค์เที่ยวหน้าฝนที่จะพาไปทุกที่ กิจกรรม วันที่ 10 - 11 สิงหาคม 2567 ท่านละ 3,500 บาท รวมรถตู้บริการ ท่านละ 2,900 บาท ขับรถเที่ยวเอง พิเศษสุด : รับเสื้อที่ระลึกพร้อมของชำร่วย ราคานี้ รวมค่าอาหาร 5 มื้อ/ค่าที่พัก1คืน/ค่าเข้าชมสวนผลไม้/เบรกของว่าง/ค่าประกันอุบัติเหตุ
งาน ปิดทองไหว้พระพุทธโคดมและประเพณีทิ้งทานเทกระจาด ครั้งที่ 52 วันที่ 10-20 สิงหาคม 2567
ขอเชิญร่วมงาน ปิดทอง ไหว้พระพุทธโคดม และประเพณี ทิ้งทานเทกระจาด ครั้งที่ 52 วันที่ 10 ~ 20 สิงหาคม 2567 ณ บริเวณวัดไผ่โรงวัว (หลวงพ่อขอม) อำเภอสองพี่น้อง จังหวัดสุพรรณบุรี ช้อป มหกรรมสินค้าราคาถูก สินค้า OTOP ผลิตภัณฑ์พื้นบ้าน สินค้าจากโรงงานผู้ผลิต ชิม อาหารอร่อย ผลไม้ตามฤดูกาล ขนมหวานท้องถิ่นหลากหลาย ชม สวนสนุกชุดใหญ่ระดับประเทศ คอนเสิร์ตจากศิลปินดัง 10 ส.ค. 67 จ่อย ไมค์ทองคำ 11 ส.ค. 67 วงบ้านบ้าน ปทุมธานี 12 ส.ค. 67 แอน อรดี 13 ส.ค. 67 เฮดเดอร์ สุพรรณบุรี 14 ส.ค. 67 ลิเกคณะ พรเทพ พรทวี 15 ส.ค. 67 TN ชัยนาท 16 ส.ค. 67 หนุ่ม หนุมาน 17 ส.ค. 67 วงซี้ดแบนด์ 18 ส.ค. 67 วงพัทลุง 19 ส.ค. 67 ลิเกคณะ ศรราม น้ำเพชร 20 ส.ค. 67 อ๊อด โฟร์เอส
งาน Lampang Orchid Festival 10 - 18 สิงหาคม 2567
งาน Lampang Orchid Festival ระหว่างวันที่ 10 - 18 สิงหาคม 2567 ณ สวนสาธารณะหนองกระทิง จ.ลำปาง จุดถ่ายภาพทั้ง 6 จุด ได้แก่
1.) นิทรรศการ งามล้ำค่า บุปผาราชินี พระพันปีหลวง
2.) จุดถ่ายภาพกล้วยไม้ ณ เกาะกลางน้ำ
3.) Landmark "ดอกแคทลียายักษ์"
4.) Landmark "รถม้าจำลอง"
5.) กาดลำปางล้ำลำ
6.) กาดนั่งก้อม
สอบถามเพิ่มเติม ททท.สำนักงานลำปาง โทร.054-222214
งาน Amazing Beach Life Festival 2024 วันที่ 9 - 11 ส.ค. 2567
งาน Amazing Beach Life Festival 2024 วันที่ 9 - 11 ส.ค. 2567 เวลา 16.00 - 22.30 น. ลานดนตรี หาดชลาทัศน์ จ.สงขลา . พบกับความสนุกส่งท้ายเทศกาลศิลปะ ดนตรีและกีฬา โดยการท่องเที่ยวแห่งประเทศไทย ปัดหมุดพิกัดสุดท้ายที่จังหวัดสงขลา ในธีม Art Paradise เนรมิตรชายหาดให้เต็มไปด้วยสีสันและศิลปะผสมกับกลิ่นอายแห่งความเป็นเมืองเก่า เต็มไปด้วยวัฒนธรรมและความสนุกสนานตามสไตล์ Beach Festival ภายในงานพบกับมินิคอนเสิร์ตศิลปิน & ดีเจ พร้อมจุดถ่ายรูป กิจกรรม Workshop DIY และของอร่อยเพียบ!! งานนี้ ฟรี ไม่มีค่าใช้จ่าย . เพลิดเพลินไปกับเสียงดนตรีริมชายหาด จากเหล่าศิลปินและดีเจที่เปิดเพลงให้สนุกกันตลอดทั้ง 3 คืน 9 ส.ค. 67 อ๊อฟ ปองศักดิ์ , Slapkiss 10 ส.ค. 67 Zeal , TELEx TELEXs 11 ส.ค. 67 สิงโต นำโชค , YourMOOD
งาน 118 ปี ตามรอยพระพุทธเจ้าหลวง เสด็จประพาสต้นฯ วัดพระปรางค์เหลือง อ.พยุหะคีรี วันที่ 11 สิงหาคม 2567
ขอเชิญร่วมงาน 118 ปี ตามรอยพระพุทธเจ้าหลวง เสด็จประพาสต้นฯ วัดพระปรางค์เหลือง วันที่ 11 สิงหาคม 2567 เวลา 17.30 น. ชมขบวนเรือ(จำลอง)การเสด็จประพาสต้น/ขบวนรับเสด็จ ณ วัดพระปรางค์เหลือง อ.พยุหะคีรี จ.นครสวรรค์ ชมการแสดง แสง สี เสียง สื่อผสมทางวัฒนธรรม ผู้ชมร่วมศึกษาประวัติศาสตร์
กิจกรรม "สิงหาพาแม่เที่ยว สุขยกกำลังสอง" 11 สิงหาคม 2567 อ.ตะกั่วทุ่ง
ททท.สำนักงานพังงาร่วมกับหลาดลองแลชวนทุกคนมาร่วมกิจกรรม "สิงหาพาแม่เที่ยว สุขยกกำลังสอง" วันอาทิตย์ที่ 11 สิงหาคม 2567 พาคุณแม่มาชอปที่หลาดลองแล บ้านบางนุ ต.กะไหล อ.ตะกั่วทุ่ง จ.พังงา ครบ 500 บาท รับรางวัลจากททท.สำนักงานพังงา มูลค่า 100 บาท ทันที‼️ ห้ามพลาดมีเพียง 300 สิทธ์เท่านั้น‼️
แคมป์คอนเสิร์ตย้อนวันวานวัยเก๋า 11 สิงหาคม 2567
"แคมป์คอนเสิร์ตย้อนวันวานวัยเก๋า" 11 สิงหาคม 2567 ที่หุบเขา Wonder Mountain Resort พบกับบรรยากาศสุดพิเศษ พร้อมย้อนรำลึกความทรงจำไปกับตำนานศิลปินยุค 80s พิเศษ! บัตรราคา 1,000 บาท ฟรีเก้าอี้แคมปิ้ง
Phangnga Night Run 2024 วันอาทิตย์ที่ 11 สิงหาคม 2567
งาน "Phangnga Night Run 2024" วัน อาทิตย์ ที่ 11 สิงหาคม 2567 ณ ศูนย์ราชการจังหวัดพังงา ฟันรัน 5.5 Km. ทำการแข่งขัน : 19:00 น. งานวิ่งชมความสวยงามในเมืองพังงายามค่ำคืนที่หลายๆคนรอคอย งานนี้วิ่งฟรีรีบสมัครก่อนเต็ม จะซื้อเสื้อที่ระลึกก็มีให้พร้อม นอกจากวิ่งฟรียังมีชมคอนเสิร์ตฟรีอีกด้วย
งาน สัปดาห์วิทยาศาสตร์ Narit Science Week 2024 ระหว่างวันที่ 12-18 สิงหาคม 2567 LINK
หอดูดาวเฉลิมพระเกียรติฯ ขอนแก่น ชวนมางาน สัปดาห์วิทยาศาสตร์ Narit Science Week 2024 ระหว่างวันที่ 12-18 สิงหาคม 2567 ตั้งแต่เวลา 08:30-16:00 น. ณ หอดูดาวเฉลิมพระเกียรติฯ ขอนแก่น อ. อุบลรัตน์ จ. ขอนแก่น ชมการบรรยายท้องฟ้าจำลองรอบพิเศษ จัดเต็มภาพยนตร์ดาราศาสตร์ไม่ซ้ำในแต่ละวัน Walk Rallyร่วมกิจกรรมดาราศาสตร์มากมายที่ได้ทั้งความสนุก ความรู้ แถมได้ลุ้นรับของรางวัลกลับบ้านอีกด้วย พบกิจกรรมพิเศษ ในวันเสาร์และอาทิตย์ ที่ 17-18 สิงหาคม 2567 อาทิ
• LunarBomb ภารกิจระเบิดหลุมดวงจันทร์
• AstroBingo เกมบิงโกดาราศาตร์
• Moon Shard in the Sand
• ภารกิจค้นหาเศษดวงจันทร์ที่หายไป
• Rocket to the Moon
• ภารกิจปล่อยจรวดสู่ดวงจันทร์
ห้ามพลาด! คืนวันเสาร์เรามีนัดกันในกิจกรรม NARIT Public Night ดูดาวจริงผ่านกล้องโทรทรรศน์ ตั้งแต่เวลา 18:00-22:00 น. ฟรี ! ไม่มีค่าใช้จ่าย
รถจักรไอน้ำพาแม่เที่ยว ย้อนวันวานสู่เมืองแปดริ้ว 12 สิงหาคม 2567 LINK
ททท.สำนักงานฉะเชิงเทรา ร่วมกับ รฟท. นำขบวนรถจักรไอน้ำสายประวัติศาสตร์ นำมาวิ่งอีกครั้ง เพื่อเป็นการเฉลิมพระเกียรติสมเด็จพระพันปีหลวงฯ วันที่ 12 สิงหาคม 2567 ในเส้นทางหัวลำโพง - สถานีรถไฟชุมทางฉะเชิงเทรา
สำหรับขบวนพิเศษรถจักรไอน้ำดังกล่าว การรถไฟฯ ได้นำหัวรถจักรไอน้ำ รุ่นแปซิฟิก หมายเลข 824 และ 850 รุ่นหลังสงครามโลกครั้งที่ 2 ผลิตจากประเทศญี่ปุ่น เกิดเมื่อปี 1950 นับมาถึงวันนี้ก็ 74 ปีแล้วครับ ยังแข็งแรงเหมือนเดิม ซึ่งปัจจุบันได้เก็บรักษาและซ่อมบำรุงอยู่ที่โรงรถจักรธนบุรี ออกมาให้บริการแก่ประชาชนเพื่อร่วมเป็นส่วนหนึ่งในการเดินทางของขบวนรถไฟประวัติศาสตร์นี้อีกด้วย
ขอให้นักท่องเที่ยวทุกคน เที่ยวฉะเชิงเทราแบบมีความสุข และเก็บรอยยิ้มกลับบ้านไปเยอะๆ นะครับ
ไดโนพาแม่เลาะ ท่องโลกวิทยาศาสตร์ จ้วดจ้าดอุทยานธรณีขอนแก่น 13-18 สิงหาคม 2567 LINK
ศูนย์ศึกษาวิจัยและพิพิธภัณฑไดโนเสาร์ จังหวัดขอนแก่น ขอเชิญร่วมกิจกรรม "งานสัปดาห์วิทยาศาสตร์ 2567" ภายใต้ธีมงาน "ไดโนพาแม่เลาะ ท่องโลกวิทยาศาสตร์ จ้วดจ้าดอุทยานธรณีขอนแก่น" เต็มอิ่มกันไปเลย 6 วัน ตั้งแต่วันที่ 13 - 18 สิงหาคม 2567 เวลา 09.30 - 15.00 น ศูนย์ศึกษาวิจัยและพิพิธภัณฑ์ไดโนเสาร์ จ.ขอนแก่น (พิพิธภัณฑ์ไดโนเสาร์ภูเวียง) เปิดให้บริการ : วันอังคาร - วันอาทิตย์ (หยุดทุกวันจันทร์) เวลาทำการ : 09.30 - 16.30 น. โทรศัพท์ : 08 1846 2760 , 08 1845 8628
เปิดโลกอุทยานธรณีเพื่อการท่องเที่ยว ธรณีมหัศจรรย์ สร้างสรรค์ อัตลักษณ์เชียงราย" 13-15 สิงหาคม 2567
งานมหกรรมเปิดโลกอุทยานธรณีเพื่อการท่องเที่ยว จังหวัดเชียงราย ภายใต้ ธีมงาน #Softpower เชียงราย "ธรณีมหัศจรรย์ สร้างสรรค์ อัตลักษณ์เชียงราย" ระหว่างวันที่ 13 - 15 สิงหาคม 2567 ศูนย์วัฒนธรรมนิทัศน์และพิพิธภัณฑ์เมืองเชียงราย 750 ปี (หอประวัติเมืองเชียงราย) ✅️ ฟรี ‼️ ตลอดงาน ทุกกิจกรรมสาระ ความบันเทิง ครบวงจร ไปกับ Chiangrai Geopark •เชียงราย Geotrail ตะลุยเส้นทางการท่องเที่ยว •สายมู "หมอดูหิน" ตรวจอัญมณี/วัตถุทางธรณี •Showcase อาหาร/เครื่องดื่ม Geofood •กิจกรรมน่าสนใจอื่นๆ พร้อมลุ้นรับรางวัลพิเศษิกมากมาย
13 สิงหาคม โรงพยาบาลร้อยเอ็ด มอบพวงหรีด ผู้บริจาคดวงตา อายุ 54 ปี
13 สิงหาคม 2567 เวลา 12.00 น. ณ อาคารนิติเวช โรงพยาบาลร้อยเอ็ด พร้อมด้วย นางพรรณี แสงอินทร์ รองหัวหน้าพยาบาลด้านทรัพยากรบุคคล โรงพยาบาลร้อยเอ็ด มอบพวงหรีด แสดงความขอบคุณ นางมาลี มยุโรวาท มารดาของ นางสาวจีรวรรณ มยุโรวาท อายุ 54 ปี ผู้วายชนม์ ได้ทำบุญมหาทานบารมี ด้วยการบริจาคดวงตา ให้กับศูนย์รับบริจาคอวัยวะสภากาชาดไทย เพื่อนำไปปลูกถ่ายช่วยชีวิตให้กับผู้ป่วยเรื้อรัง โรงพยาบาลร้อยเอ็ด ขออนุโมทนาบุญแก่ญาติและผู้บริจาคอวัยวะให้กับเพื่อนมนุษย์เพื่อต่อชีวิต ต่อลมหายใจให้ผู้ป่วย ที่รอความหวัง ถือเป็นทานบารมีที่ยิ่งใหญ่และเป็นที่สุดแห่งการให้ครั้งสุดท้ายของชีวิต สำหรับผู้ที่มีความประสงค์จะบริจาคอวัยวะ ติดต่อสอบถามข้อมูลเพิ่มเติมได้ที่ คุณปาณิสรา ทองมี ผู้ระสานงาน ศูนย์รับบริจาคอวัยวะ โรงพยาบาลร้อยเอ็ด โทร 092-6452426 หรือที่หอผู้ป่วยหนักศัลยกรรมประสาท โรงพยาบาลร้อยเอ็ด โทร. 043-518200 ต่อ 2029
ชิม ช้อป ชม สินค้าจากชุมชน ณ "ตลาดบ้านราชภัฏ" มหาวิทยาลัยราชภัฏสุรินทร์ 13 สิงหาคม 2567 LINK
มหาวิทยาลัยราชภัฏสุรินทร์ ขอเชิญ ร่วม ชิม ช้อป ชม สินค้าจากชุมชน ณ "ตลาดบ้านราชภัฏ" มหาวิทยาลัยราชภัฏสุรินทร์ ตั้่งแต่ 13 สิงหาคม - 12 กันยายน 2567 ทุกวันอังคารและวันพฤหัสบดี ตั้งแต่วันที่ 13 สิงหาคม 2567 เป็นต้นไป เวลา 11.00 - 21.00 น. ณ บริเวณด้านข้างคณะมนุษยศาสตร์และสังคมศาสตร์ (อาคาร 38) มหาวิทยาลัยราชภัฏสุรินทร์
Grand Opening สัปดาห์แรกของการเปิดตลาด พบกับ :
การจำหน่ายผลิตภัณฑ์จากชุมชน
พิเศษ!! วันที่ 13 สิงหาคม ชมการแสดงจากโรงเรียนสังขะ จ.สุรินทร์ แชมป์ชิงช้าสวรรค์ 2024 แบบเต็มวง
พิเศษ !! วันที่ 15 สิงหาคม การแสดงจากลิเกคณะกล้วยหอม พร้อมการคอนเสิร์ตจากศิลปินนักร้องที่มีชื่อเสียง
พร้อมกับกิจกรรมการประกวดร้องเพลงลูกทุ่ง การประกวดคลิปวีดิโอ การประกวดถ่ายภาพ การประกวดส้มตำลีลา การประกวดเดินแบบผ้าไหม และการประกวดกิจกรรมอื่น ๆ อีกมากมาย ชิงเงินรางวัลรวมกว่า 100,000 บาท
มหกรรมอาหาร ร้อยแก่นสารสินธุ์ ครั้งที่ 2 จังหวัดร้อยเอ็ด 14 - 18 สิงหาคม 2567
มหกรรมอาหาร ร้อยแก่นสารสินธุ์ ครั้งที่ 2 จังหวัดร้อยเอ็ด พบกับพิธีเปิดสุดยิ่งใหญ่ คอนเสิร์ตจาก #แด๊กร็อคไรเดอร์ และร้านค้าร้านอาหารอีกมากมายให้เลือกช้อปปิ้งกันแบบจัดเต็ม พบกันวันที่ 14 - 18 สิงหาคม 2567 เริ่มตั้งแต่เวลา 16.00 น. เป็นต้นไป ณ หอโหวด๑๐๑ จังหวัดร้อยเอ็ด
พบกับมินิคอนเสริ์ตศิลปินมินิคอนเสิร์ตจาก แด๊ก ร็อคไรเดอร์ / มิน พิณทอง / แคท อารียา / ปรีชา ปัดภัย / ศาล สานศิลป์ ในงานมีการจัดจัดหน่ายอาหารเมนูเด็ดเมนูดังและร้านค้าร้านอาหารจากกลุ่มจังหวัดร้อยแก่นสารสินธุ์ ให้เลือกช้อปปิ้งกันแบบจัดเต็ม
ส้มโอหวานและของดี บ้านแท่น 14-20 สิงหาคม 2567
ส้มโอหวาน และ ของดี บ้านแท่น 14-20 สิงหาคม 2567 นี้ พบกันที่งานส้มโอหวานบ้านแท่น ณ สนามหน้าที่ว่าการอำเภอบ้านแท่น จังหวัดชัยภูมิ
งานประเพณีทิ้งกระจาดและเทศกาลสารทจีน ประจำปี 2567 วันที่ 14-19 สิงหาคม 2567 ณ ศาลเจ้าแม่ (หน้าผา)
คณะกรรมการจัดงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568 (เถ่านั้ง 109) ขอเชิญท่านผู้มีจิตศรัทธา ร่วมทำบุญเครื่องอุปโภคและบริโภคเพื่อบริจาค ให้แก่ผู้ที่มีรายได้น้อย เนื่องในโอกาส งานประเพณีทิ้งกระจาดและเทศกาลสารทจีน ประจำปี 2567 วันที่ 14 สิงหาคม 2567 ณ ศาลเจ้าแม่ (หน้าผา) ณ ศาลเจ้าแม่ (หน้าผา)
งาน หนองคายประตูสู่โอกาส 15-21 สิงหาคม 2567
งาน หนองคายประตูสู่โอกาส วันที่ 15-21 สิงหาคม 2567 นี้ เวลา 11.00 - 21.00 น. ณ ลานน้ำพุพญานาค อำเภอเมือง จังหวัดหนองคาย ช็ิอปสินค้ามากมาย ไม่ว่าจะเป็นเสื้อผ้า ของใช้ ของฝาก หรืออาหารสด อาหารแห้ง และอีกมากมาย มาร่วมกิจกรรมและลุ้นรับรางวัลภายในงาน และรับชมมินิคอนเสิร์ต ฟรี จากศิลปินได้ทุกวัน
มหกรรมเสน่ห์วัฒนธรรมบนเส้นทางการท่องเที่ยว 2 เส้นทางโรแมนติกรูทและนาคีรูท 15-18 สิงหาคม 2567
สำนักงานวัฒนธรรมจังหวัดอุดรธานี ขอเชิญเที่ยวชมงาน มหกรรมเสน่ห์วัฒนธรรมบนเส้นทางการท่องเที่ยว 2 เส้นทางโรแมนติกรูทและนาคีรูท เปิดเส้นทางการท่องเที่ยวทางธรรมชาติแบบ unseen วิถีชีวิตและวัฒนธรรมที่หลากหลาย ของกลุ่มจังหวัดลุ่มแม่น้ำโขง วิถีความเชื่อ ความศรัทธา ตามรอยพญานาค สายมู..ไม่ควรพลาด. วันที่ 15-18 สิงหาคม 2567 ศูนย์การค้า เซ็นทรัล อุดรธานี
ภายในงานพบกับ การออกบูธของดีของเด่นจาก กลุ่มสบายดี 5 จังหวัด ภาคอีสานตอนบน 1 อุดรธานี เลย หนองบัวลำภู เลย หนองคายและบึงกาฬ การแสดงศิลปวัฒนธรรมจังหวัดลุ่มน้ำโขง แฟชั่นโชว์ชุดผ้าไทยสุดอลังการ การสาธิตการทำอาหารประจำถิ่น นิทรรศการเส้นทางท่องเที่ยว โรแมนติกรูท และ นาคีรูท
งานรำลึกเสด็จประพาสต้น ล้นเกล้ารัชกาลที่ 5 วันที่ 15-19 สิงหาคม 2567


งานรำลึกเสด็จประพาสต้น ล้นเกล้ารัชกาลที่ 5 วันที่ 15 - 19 สิงหาคม 2567 ณ บริเวณหน้าศาลากลางจังหวัดอ่างทอง จังหวัดอ่างทอง
เพื่อน้อมรำลึกในพระมหากรุณาธิคุณของพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว รัชกาลที่ 5 ในโอกาสครบรอบ 117 ปี การเสด็จประพาสต้นทางชลมารคผ่านเมืองอ่างทอง ระหว่างวันที่ 5 - 7 สิงหาคม 2449 พระองค์เสด็จขึ้นทอดพระเนตรวัดป่าโมกวรวิหาร ตลาดอ่างทอง ศาลากลางเมืองอ่างทอง และวัดไชโยวรวิหาร ทรงบันทึกภาพถ่ายตลอดระยะทางเสด็จด้วยแผ่นฟิล์มกระจก อีกทั้งเพื่อน้อมรำลึกถึงพระมหากรุณาธิคุณ และพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร รัชกาลที่ 9 เมื่อครั้งพระองค์เสด็จพระราชดำเนิน พร้อมด้วยสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง ทรงเยี่ยมราษฎร ณ ศาลากลางจังหวัดอ่างทอง เมื่อวันที่ 28 กันยายน 2498 ซึ่งพระองค์ได้เสด็จมาทรงประกอบพระราชกรณียกิจ และทรงเยี่ยมเยียนดูแลทุกข์ สุข ของราษฎรในพื้นที่จังหวัดอ่างทอง รวมจำนวน 14 ครั้ง นำความปลื้มปิติยินดีมาสู่ชาวจังหวัดอ่างทองอย่างหาที่สุดมิได้ ตลอดจนเป็นการประชาสัมพันธ์การส่งเสริมการท่องเที่ยว ตลอดจนเป็นการเพิ่มช่องทางการจัดแสดงและจำหน่ายผลิตภัณฑ์ชุมชนจากทุกอำเภอ และสินค้า OTOP ของดีของจังหวัดอ่างทอง เป็นการเผยแพร่ภูมิปัญญาท้องถิ่น และสร้างรายได้ให้กับชาวจังหวัดอ่างทอง
กิจกรรมภายในงาน
- ชมพิพิธภัณฑ์ตำนานเมืองอ่างทอง / พิพิธภัณฑ์ภาพถ่ายพระราชพิธีพระบรมราชาภิเษกจังหวัดอ่างทอง / ชมนิทรรศการรำลึกเสด็จประพาสาต้นล้นเกล้ารัชกาลที่ 5
- ชมการแสดงศิลปวัฒนธรรมกลางแจ้ง รำบวงสรวงพระบรมราชานุสาวรีย์ รัชกาลที่ 5
- ชมการแสดงจากวิทยาลัยนาฎศิลปอ่างทอง
- ชม ชิม ช้อป เมนูอาหารคาวหวาน ของฝาก และสินค้าผลิตภัณฑ์ชุมชนของดีประจำจังหวัดอ่างทอง
- ชมการแสดงคอนเสิร์ตศิลปินทุกค่ำคืน
มหกรรมวิทยาศาสตร์และเทคโนโลยีแห่งชาติ อิมแพ็ค เมืองทองธานี 16-25 สิงหาคม 2567
งาน “มหกรรมวิทยาศาสตร์และเทคโนโลยีแห่งชาติ” นับเป็นกิจกรรมสำคัญในการสร้างความตระหนักด้านวิทยาศาสตร์และเทคโนโลยีของประเทศ ซึ่งปีนี้จัดขึ้นระหว่างวันที่ 16 - 25 สิงหาคม 2567 เวลา 9.00-19.00 น. ณ ศูนย์แสดงสินค้าและการประชุมอิมแพ็ค เมืองทองธานี อาคาร 9 - 12 เข้าชมงานฟรี ปีนี้จัดขึ้นภายใต้แนวคิด "Future Science Community for All" ส่งเสริมการมีส่วนร่วมในการสร้างสังคมวิทยาศาสตร์เพื่อพัฒนาศักยภาพของประเทศ เตรียมพร้อมสู่การเปลี่ยนแปลงของโลกอนาคต โดยภายในงานมีนิทรรศการที่นาสนใจมากมาย เพื่อให้เยาวชนและประชาชนทั่วไปได้เรียนรู้และสัมผัสกับวิทยาศาสตร์อย่างใกล้ชิด อาทิ นิทรรศการจักรวาลแห่ง AI ฉลาดเหนือมนุษย์ นิทรรศการอาชีพ STEM สร้างอนาคต ฯลฯ
ตลาดวัฒนธรรมสร้างสุข "ดนตรี กวี ศิลป์ ถิ่นจันทบูร" ครั้งที่ 2 วันที่ 16-17 สิงหาคม 2567 LINK
เชิญชวนเที่ยวงานตลาดวัฒนธรรมสร้างสุข "ดนตรี กวี ศิลป์ ถิ่นจันทบูร" ครั้งที่ ๒ ระหว่างวันที่ ๑๖ - ๑๗ สิงหาคม ๒๕๖๗ เวลา ๑๕.๐๐ - ๒๑.๐๐ น. ณ ลานหน้าพระบรมราชานุสาวรีย์พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว (หน้าศาลากลางจังหวัดจันทบุรี อำเภอเมืองจันทบุรี)
พบกับ ตลาดวัฒนธรรมสร้างสุข กว่า ๒๐ ร้าน / ตลาดสร้างศิลป์ ดนตรีสร้างสรรค์ มีการสอนวาดภาพ ระบายสี วาดการ์ตูน ฟรี! โดย ชมรมสานศิลป์ถิ่นจันทบูร/ การแสดงทางวัฒนธรรม ที่หาชมยาก และการแสดงจากสถานศึกษาในพื้นที่ / การสาธิตผลิตภัณฑ์ทางวัฒนธรรม / การสาธิตภูมิปัญญาอาหารพื้นบ้าน /การละเล่นพื้นบ้าน / ดนตรีโฟล์คซอง และร่วมสมัย ตลอดงาน พร้อมทั้ง กิจกรรมอื่น ๆ อีกมากมาย
บางบัวทองแฟร์ 16-25 สิงหาคม 2567
งานบางบัวทองแฟร์ 16-25 ส.ค.67 ณ ตลาดเอสปาร์ค นนทบุรี (ปากทางเข้าซอยวัดลาดปลาดุก-หลังห้างโฮมโปรบางบัวทอง) มีของกินของขายมากมาย สวนสนุกชุดใหญ่ (ชิงช้า, ไวกิ้ง, บ้านผีสิง ฯลฯ) ชมฟรีคอนเสิร์ตศิลปิน (ยกเว้น ทิดแอม, วงเนสกาแฟ)
เชิญร่วมงานเสวนา Design KORAT Together “ออกแบบเมืองโคราชน่าอยู่" 16 เดือนสิงหาคม 2567
จังหวัดนครราชสีมา ขอเชิญร่วมงานเสวนา Design KORAT Together “ออกแบบเมืองโคราชน่าอยู่" โดยสำนักงานวัฒนธรรมจังหวัดนครราชสีมา ในวันศุกร์ที่ 16 เดือนสิงหาคม พ.ศ. 2567 เวลา 09.00 – 16.00 น. ณ เรือนโคราช เฉลิมวัฒนา ตำบลในเมือง อำเภอเมือง จังหวัดนครราชสีมา ในงานเสวนาครั้งนี้ เราจะร่วมกัน สำรวจแนวคิดการพัฒนาเมือง ที่สมดุลระหว่างความงามและประโยชน์ใช้สอย โดยมุ่งเน้นการสร้างสภาพแวดล้อม ที่เอื้อต่อการเติบโตทางเศรษฐกิจ ควบคู่ไปกับการส่งเสริมสุนทรียภาพ ในชีวิตประจำวัน เราเชื่อว่าการ ออกแบบเมืองที่ดีจะช่วยยกระดับ คุณภาพชีวิตของทุกคน ตั้งแต่เด็กไปจนถึงผู้สูงอายุ และสร้างความภาคภูมิใจ ให้กับชาวโคราชทุกรุ่น
Amazing Phuket Surf festival 2024 วันที่ 16 - 18 สิงหาคม2567
Amazing Phuket Surf festival 2024 กลับมาอีกครั้งในรอบ 8 ปี การแข่งขันโต้คลื่นหาดกมลาครั้งที่ 16 ภายใต้ชื่องาน Beach Break @kamala 2024 ในวันที่ 16 - 18 สิงหาคม2567 นี้ที่ชายหาดกมลา มีรุ่นการแข่งขันทั้งหมด 7 รุ่นดังนี้ "Beach Break@Kamala 2024"
งานAmazing Muay Thai Experience มวยพระยาพิชัยดาบหัก และ มวยท่าเสา 16-18 สิงหาคม 2567
งานAmazing Muay Thai Experience สืบสานตำนานมวยไทยภาคเหนือ "มวยพระยาพิชัยดาบหัก" และ "มวยท่าเสา" งานจัดขึ้นระว่างวันที่ 16 - 18 สิงหาคม 2567 16.00 - 22.00 น. ณ วัดใหญ่ท่าเสา อำเภอเมืองอุตรดิตถ์ จังหวัดอุตรดิตถ์
มหกรรมท่องเที่ยวโดยชุมชนสตูล ครั้งที่ 9 Community Based Tourism Festival 2024 วันที่ 16-18 สิงหาคม 2567
มหกรรมท่องเที่ยวโดยชุมชนสตูล ครั้งที่ 9 Community Based Tourism Festival 2024 “มหัศจรรย์ไทยแลนด์...ดินแดนพหุวัฒนธรรม" ▫️นิทรรศการชุมชนท่องเที่ยว ▫️การแสดงหาดูยากจากชุมชน ▫️จำหน่ายอาหาร ผลไม้ ของดีสตูล ▫️กิจกรรมแลกเปลี่ยนการขาย B2B ▫️ฐานกิจกรรมสำหรับน้องๆ ▫️CBT.Youth ระหว่างวันที่ 16-18 สิงหาคม 2567 ณ ตลาดนัดดุสน อำเภอควนโดน จังหวัดสตูล
งานมหกรรมวัฒนธรรมแห่งชาติ วิถีถิ่นวิถีไทย ร่วมใจเทิดพระเกียรติ “สมเด็จพระบรมไตรโลกนาถ” วันที่ 16-20 สิงหาคม 2567


งานมหกรรมวัฒนธรรมแห่งชาติ วิถีถิ่นวิถีไทย ร่วมใจเทิดพระเกียรติ “สมเด็จพระบรมไตรโลกนาถ” ระหว่างวันที่ 16-20 สิงหาคม 2567 ณ พระราชวังจันทน์ ต.ในเมือง อ.เมือง จ.พิษณุโลก มีกิจกรรม ได้แก่ การแสดงแสง เสียง ละครอิงประวัติศาสตร์ “เทิดพระเกียรติ สมเด็จพระบรมไตรโลกนาถ” การแสดงศิลปวัฒนธรรม เช่น การแสดงของสถาบันบัณฑิตพัฒนศิลป์ ชุด “ทวยราษฎร์น้อมสดุดี พระบารมีพระบรมไตร” การแสดงศิลปะพื้นบ้านของเครือข่ายสภาวัฒนธรรมจังหวัดพิษณุโลก การแสดงชุดชาวล้านนาฮอมใจ น้อมไหว้สาสมเด็จพระบรมไตรโลกนาถจากลูกศิษย์แม่บัวเรียว ศิลปินแห่งชาติ การแสดงชุดม่านฟ้าเวียงพิงค์และการแสดงชุดนันทเภรีก้องฟ้า กลองล้านนามหามงคลจากสมาคมกลองและศิลปะการแสดงล้านนา การแสดงของสมาคมลิเกจังหวัดพิษณุโลก การแสดงโขนจากสถาบันบัณฑิตพัฒนศิลป์ เรื่องรามเกียรติ์ ตอนพระรามราชสุริยวงศ์ “ธรรมะ ย่อมชนะ อธรรม” การแสดงโฟล์คซองคำเมือง วงกลิ่นเอื้องเสียงซึงของกรมส่งเสริมวัฒนธรรม การแสดงของศิลปินพื้นบ้านภาคเหนือและสถานศึกษาในจังหวัดพิษณุโลก การแสดงมังคละจากชมรมอนุรักษ์ดนตรีพื้นบ้านมังคละจังหวัดพิษณุโลก การแสดงดนตรีสากล ดนตรีลูกทุ่งจากสถานศึกษาและกองกำลังมณฑลทหารบกที่ 39 เป็นต้น
นอกจากนี้ มีถนนสายวัฒนธรรมเลียบวัดเคียงวัง การสาธิตและจำหน่ายผลิตภัณฑ์วัฒนธรรมไทย(CPOT) และผลิตภัณฑ์ภูมิปัญญาทางวัฒนธรรมจาก 17 จังหวัดภาคเหนือ เช่น อาหาร ผ้า เสื้อผ้า เครื่องประดับ ของใช้ ผลิตภัณฑ์จักสาน โรงหมอยา บริการแพทย์แผนไทย ผลิตภัณฑ์จากสมุนไพร ถ่ายรูปจุดเช็คอินทุ่งไฟประดับและขอเชิญชวนประชาชนแต่งกายย้อนยุคเที่ยวชมงาน
น่านกระซิบรัก ฮักสมุนไพร 16-18 สิงหาคม 2567
นิทรรศการ น่านกระซิบรัก ฮักสมุนไพร 16-18 สิงหาคม 2567 ณ กาดข่วงเมืองน่าน (ข่วงใหญ่) นิทรรศการเพื่อเผยแพร่ เรื่องราวสมุนไพรใน จ.น่าน เมืองสมุนไพร ลำดับที่ 16 คลัสเตอร์ท่องเที่ยวเชิงสุขภาพ ความงาม และการแพทย์แผนไทย โดยได้รวบรวบผลิตภัณฑ์สมุนไพรจากผู้ที่ผ่านการพัฒนา Uplift Marketing Skills ต่อยอดการตลาด สร้างโอกาลเมืองสมุนไพร จำนวน 30 ราย / 30 ผลิตภัณฑ์ เข้าร่วมจัด นิทรรศการ เพื่อเปิดโอกาสให้ผู้ประกอบการได้แสดงศักยภาพสร้างการรับรู้และขยายตลาดผลิตภัตภัณฑ์ สมุนไพร จ.น่าน ให้เป็นที่รู้จักแก่สาธารณชนและกระตุ้บความนิยมใช้ผลิตภัณฑ์สมุนไพรใบชีวิต ประจำวันมากขึ้น ต่อยอดการตลาด สร้างโอกาสเมืองสมุนไพร เตรียมนำเข้าจำหน่ายบบห้าง สรรพสินค้า สนามบิน พร้อมดันไกลไปเปิดตลาดต่างประเทศ
งานตลาดนัดกาแฟน่านครั้งที่ 2 วันที่ 16 – 18 สิงหาคม 2567
“งานตลาดนัดกาแฟน่านครั้งที่ 2” วันที่ 16 – 18 สิงหาคม 2567 เวลา 10.00 - 20.00 น. ที่ข่วงน้อย เทศบาลเมืองน่าน มาเลือกช้อป เลือกชิม สุดยอดกาแฟเมืองน่าน อย่างจุใจ มากกว่า 50 ร้านค้า มาพบปะ คนปลูกกาแฟทุกพื้นที่ของเมืองน่าน ที่นำเมล็ดกาแฟ ผลิตภัณฑ์กาแฟ และผลิตภัณฑ์เกี่ยวเนื่องกับกาแฟ มาพร้อมเสริฟ (การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานน่าน โทร. 054 - 711 217)
งาน ไขอวด 2024 วันที่ 16 สิงหาคม 2567
หออัตลักษณ์นครน่าน วิทยาลัยชุมชนน่าน ขอเชิญร่วมงาน "ไขอวด 2024" ในวันที่ 16 สิงหาคม 2567 เวลา 09.00-17.00 น. ณ หออัตลักษณ์ วิทยาลัยชุมชนน่าน
กิจกรรม “ไขอวด 2024” ขึ้น ภายใต้โครงการตามพันธกิจวิทยาลัยชุมชนน่าน ประจำปีงบประมาณ 2567 โดยมีวัตถุประสงค์เพื่อเผยแพร่ผลการดำเนินโครงการ กิจกรรมที่ได้ทำร่วมกับชุมชน กลุ่มวิสาหกิจชุมชนและหน่วยงานภาคี โครงการกิจกรรมที่ดำเนินงานเป็นการยกระดับทุนชุมชนทั้งด้านภูมิปัญญา วัฒนธรรมและทรัพยากรธรรมชาติจากท้องถิ่น ด้วยเทคโนโลยี นวัตกรรม ภายใต้กรอบแนวคิด BCG Model และสอดคล้องเป้าหมายการพัฒนาที่ยั่งยืน (SDGs) วิทยาลัยชุมชนน่าน สังกัด สถาบันวิทยาลัยชุมชน กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม เป็นส่วนหนึ่งของการขับเคลื่อนน่านเพื่อบรรลุเป้าหมายการพัฒนาจังหวัดน่านอย่างยั่งยืน ภายใต้วิสัยทัศน์ของวิทยาลัยชุมชนน่าน “ปลุกการเรียนรู้ และพลังพหุปัญญา เพื่อความเข้มแข็งของชุมชน” ภายในงานมีการจัดนิทรรศการความรู้ จำหน่ายสินค้าผลิตภัณฑ์ และข่วงความรู้ (Workshop) มีกิจกรรมหลากหลาย อาทิ สาธิตวิธีการจุ๊ผึ้งเข้าโก๋น ผ้ามัดย้อมจากสีธรรมชาติ การผลิตสบู่สมุนไพร การร้อยลูกปัด ผลิตภัณฑ์จักสาน ผ้าปักอิ้วเมี่ยน Huai Mon Silver พัด WE JAIและหมวก ME JAI มือใหม่หัดดริป สมุนไพรมะแขว่นดีย์ พริกลาบเหลือ(สูตรน่าน) สวยตอกล้านนาบูชาพระรัตนตรัย เขียนตั๋วเมืองบนงานเซรามิค และนวดไทยเพื่อสุขภาพ
งานตลาดนัดกาแฟน่าน ครั้งที่ 2 วันที่ 16–18 สิงหาคม 2567
ฅนกาแฟต้องไม่พลาด กับการกลับมาอีกครั้ง ใน “งานตลาดนัดกาแฟน่านครั้งที่ 2” วันที่ 16 – 18 สิงหาคม 2567 นี้ ที่ข่วงน้อยเมืองน่าน มาเลือกช้อป เลือกชิม สุดยอดกาแฟเมืองน่าน อย่างจุใจ กว่า 50 ร้านค้า มาพบปะ คนปลูกกาแฟทุกพื้นที่ของเมืองน่านที่นำเมล็ดกาแฟ ผลิตภัณฑ์กาแฟ และผลิตภัณฑ์เกี่ยวเนื่องกับกาแฟ มาพร้อมเสริฟ ศุกร์ เสาร์ อาทิตย์ ที่ 16 – 18 สิงหาคม 2567 เวลา 09.00 - 21.00 น. แล้วมาเจอกันที่....ข่วงน้อย..นะเจ้า
Music in the market มหาวิทยาลัยมหิดล จ.นครปฐม 16-18 สิงหาคม 2567
Music in the market ไปเดินชิล ฟังเพลงสบายๆ ในบรรยากาศร่มรื่น บริเวณเรือนศิลปิน วิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดลจ.นครปฐม วันที่ 16-18 สิงหาคม 2567 เวลา 09.00-18.00 น.
เดินวิ่งกับผู้ว่าๆ บูชาพญาศรีสุทโธนาคราช 17 สิงหาคม 2567
เดินวิ่งกับผู้ว่าๆ บูชาพญาศรีสุทโธนาคราช วันวิ่ง 17 สิงหาคม 2567 ณ อ่างเก็บน้ำธวัชชัย อ.ธวัชบุรี จังหวัดร้อยเอ็ด ประเภทการแข่งขัน ระยะทาง 5 km ระยะทาง 11 km VIP OVERALL ประเภทชายและหญิง รายได้ทั้งหมดหลังหักค่าใช้จ่ายนำถวายแด่พระราชวัชราวิทยาคม(อ.ต้อม ปภัสโร) เพื่อเมตตาพิจารณามอบให้กับ ชมรมฟุตบอลร้อยเอ็ดซิตี้ (โหวดพิฆาต) ดำเนินการตามเจตนาและวัตถุประสงค์ต่อไป (เพื่อความเป็นสิริมงคล)
วงหมอลำไอดอล ไปร่วมแสดงในงาน Thai Expo Tokyo 2024 ประเทศญี่ปุ่น วันที่ 17 - 18 สิงหาคม 2567
CEA ขอนแก่น ร่วมสนับสนุน วงหมอลำไอดอล เป็นหนึ่งในศิลปิน ภายใต้โครงการส่งเสริมศิลปินท้องถิ่นอีสาน แสดงผลงานในเครือข่ายต่างประเทศ (Isan Music Export) เพื่อเผยแพร่วัฒนธรรม และเอกลักษณ์ความม่วนของดนตรีอีสานที่ไร้พรมแดน พร้อมกับปลุกกระแสดนตรี “อีสานฟีเวอร์” สู่เทศกาลดนตรี และเครือข่ายดนตรีระดับนานาชาติ ณ งาน Thai Expo Tokyo 2024 ประเทศญี่ปุ่น วันที่ 17 - 18 สิงหาคม 2567 @ สวนสาธารณะโยโยกิ กรุงโตเกียว ประเทศญี่ปุ่น
เทศกาลล่าหมอก หยอกเมฆ 17-18 สิงหาคม 2567 ตลาดนัดเวทมนตร์ : มนต์เสน่ห์แห่งเมืองสีคิ้ว
Amazing Sikhio เส้นทางแห่งความสุข Ep.3 เทศกาลล่าหมอก หยอกเมฆ 17-18 สิงหาคมนี้..พบกับ… "ตลาดนัดเวทมนตร์ : มนต์เสน่ห์แห่งเมืองสีคิ้ว" The Magicle Market @Wonderland Sikhio ตลาดที่บรรยากาศราวกับเดินอยู่ในดินแดนเทพนิยาย ภายในงานพบกับวงดนตรีสด ลานฟินนั่งกินนั่งชิลล์ เลือกซื้ออาหารและสินค้าชุมชนมากมาย มีเนื้อย่างอร่อยจากร้านในเมืองสีคิ้ว รวมไปถึงบูธแสดงเรื่องราวหรือผลิตภัณฑ์ที่น่าสนใจของเมืองสีคิ้ว ????พิกัดตลาดเวทมนตร์ ณ บ้านสวนน้อยรีสอร์ท ต.ลาดบัวขาว อ.สีคิ้ว
งานเทศกาลมังคุดหวานของดีลานสกาและงานกาชาด ประจำปี 2567 วันที่ 17-26 สิงหาคม 2567
งานเทศกาลมังคุดหวานของดีลานสกาและงานกาชาดเป็นประจำทุกปี โดยเริ่มจัดขึ้นครั้งแรกเมื่อปี 2536 ซึ่งปีนี้ถือเป็นปีที่ 31 แล้ว งานจะมีขึ้นระหว่างวันที่ 17-26 สิงหาคม 2567 นี้ โดยมีวัตถุประสงค์เพื่อสืบสานวัฒนธรรมประเพณีอันดีงามของลานสกา และเพื่อเผยแพร่ความรู้ ทักษะ การจำหน่ายผลิตผลทางการเกษตรและการส่งเสริมการท่องเที่ยวทั้งทางธรรมชาติ, การอุดหนุนสินค้า OTOP ผักและผลไม้นานาชนิด โดยเฉพาะ "มังคุด" ผลไม้อัตลักษณ์ของอำเภอลานสกา ที่มีรสชาติตีและปลูกในดินแดนอากาศดีที่ที่สุดในประเทศไทยจนได้รับการยกย่องให้เป็นเมืองมังคุดหวาน ซึ่งภายในงานมีกิจกรรมมากมาย อาทิ การประกวดแห่รถผลาชาติ ที่ตกแต่งด้วยมังคุด และผลไม้นานาชนิด ตลอดจนพืชผักในท้องถิ่น ,พิธีสมโภชผลไม้เพื่อความเป็นสิริมงคลและสร้างขวัญกำลังใจแก่เกษตรกร การประกวดผลผลิตทางการเกษตร, การประกวดอัตลักษณ์พื้นถิ่นและแหล่งท่องเที่ยว ,การจำหน่ายผลิตภัณฑ์ OTOP และจำหน่ายพืชผักและอาหารปลอดภัยในพื้นที่, การประกวดธิดามังคุดหวาน ,การออกร้านนาวากาชาด เพื่อหารายได้ไว้ใช้จ่ายในกิจการสาธารณกุศลและการแสดง???องเด็กนักเรียน นักศึกษาบนเวทีกลาง ตลอดจนวงดนตรีและมหรสพต่าง ๆ เพื่อสร้างความสนุกสนานและความเพลิดเพลินใจแก่ผู้มาเที่ยวชมงานทุกวัน จึงขอเชิญชวนมาเที่ยวงานเทศกาลมังคุดหวานของดีลานสกาและงานกาชาด ประจำปี 2567เมืองเก่าสตูลในใจ Satoy in My Mind ใน เทศกาลออกแบบปักษ์ใต้ 2024 หรือ Pakk Taii Design Week สงขลา 17-25 สิงหาคม 2567
เมืองเก่าสตูลในใจ Satoy in My Mind
ได้รับเลือกไปร่วม ✨เทศกาลออกแบบปักษ์ใต้ 2024 หรือ Pakk Taii Design Week สงขลา ระหว่างวันที่ 17-25 สิงหาคม 2567
ชวนทุกคนมาสร้างประสบการณ์ “สตูลสโตย” เมืองเก่าสตูลในใจของผู้คน
นิทรรศการที่เล่าเรื่องผู้คน อาหาร อาคาร เกร็ดประวัติศาสตร์สตูล ผ่านคลิปวิดีโอสั้น ๆ หนังสือภาพ ภาพประกอบ ภาพเขียนสีน้ำ
เมืองเก่าสตูล มีพื้นที่เพียง 0.85 ตร.กม. มีเรื่องเล่า มรดกวัฒนธรรมที่แสดงให้เห็นหลักฐานและเมืองที่มียังคงมีชีวิต รวมไปถึงมรดกวัฒนธรรมที่จับต้องไม่ได้ เช่น การใช้ภาษาถิ่นใต้ ภาษาถิ่นมลายู งานเทศกาลที่สืบทอดตามประเพณี พิธีกรรมตามความเชื่อต่าง ๆ อาหารท้องถิ่น สะท้อนความหลากหลายทางวัฒนธรรมของเมือง
เมืองเก่าสตูลในใจ ร่วมกับ Songkhla Sketchers
จัดกิจกรรมเวิร์คชอปสเก็ตช์สำหรับผู้ที่สนใจ
‼️‼️ เวิร์คชอปไม่มีค่าใช้จ่าย ‼️‼️
ที่นั่งจำนวนจำกัด
เทศกาลกาแฟล้านนาตะวันออก "สวรรค์ของเมืองกาแฟ" Eastern Lanna Coffee From Heaven 17-18 สิงหาคม 2567
งานเทศกาลกาแฟล้านนาตะวันออก "สวรรค์ของเมืองกาแฟ" Eastern Lanna Coffee From Heaven วันที่ 17-18 สิงหาคม 2567 ณ ศูนย์การค้าเซ็นทรัล เชียงราย ชั้น G กิจกรรมภายในงาน ชม ชิม ช้อป สุดยอดกาแฟ จากแหล่งปลูกกาแฟชั้นนำ ของ 4 จังหวัดภาคเหนือตอนบน 2 "เชียงราย พะเยา แพร่ และน่าน" ชมนิทรรศการและกิจกรรมสาธิต Workshop ความรู้ด้านกาแฟ การจับคู่ทางธุรกิจคู่ค้าของผู้ประกอบการกาแฟและนักธุรกิจที่สนใจ กิจกรรมนาทีทองสินค้าราคาพิเศษ เกมส์ร่วมสนุก ลุ้นรับของรางวัล ฟรี! ทุกวัน
แต่งใต้ได้แรงอก ชวนมาแต่งใต้แบบไหนก็ได้ตามสไตล์ที่คุณชอบ วันที่ 17 และ 24 สิงหาคม 2567
แต่งใต้ได้แรงอก ชวนมาแต่งใต้แบบไหนก็ได้ตามสไตล์ที่คุณชอบ แต่งได้ทุกวัฒนธรรม ความเชื่อ ศาสนา จะมาแบบจัดเต็มประเพณีนิยมหรือผสมผสานแบบร่วมสมัย จะเล่นใหญ่แบบดีไซน์วีคหรือใส่กิมมิคก็จัดมา ถ้าเห็นว่า “มันได้แรงอก” เฉพาะวันที่ 17 และ 24 สิงหาคม 2567 เวลา 16.00 - 21.00 น. ณ วัดมัชฌิมาวาสววรวิหาร (วัดกลาง)
พิเศษ 1 แจก-จบกันในงาน เพียงแต่งใต้สไตล์คุณ ถ่ายรูปกับบรรยากาศงาน โพสต์ลงสื่อ social รับของที่ระลึกจากเชฟรอนประเทศไทย ณ จุดลงทะเบียนบริเวณวัดกลาง
พิเศษ 2 สำหรับนักท่องเที่ยวที่เดินทางมาพักในสงขลาและเข้าร่วมงาน Pakk Taii Design Week 2024 สแกน QR Code ลงทะเบียน พร้อมแสดงหลักฐานการเข้าพักโรงแรมในจังหวัดสงขลา และรับรางวัลที่ร้านยาไทยเดิมอภิบาลบ่อพลับ (ย่านเมืองเก่าสงขลา) เพื่อรับของที่ระลึกสุดพิเศษจาก ททท. สำนักงานหาดใหญ่ เพิ่มเติม (เฉพาะวันที่ 17-18 และ 24-25 สิงหาคม 2567 เท่านั้น)
Vijitr 5 ภาค @ประจวบคีรีขันธ์ หัวหิน 17-25 สิงหาคม 2567
เดินทางไปย้อนวันวานสู่เมืองเก่าสถานีแห่งแสง Vijitr 5 ภาค @ประจวบคีรีขันธ์ สัมผัสมนต์เสน่ห์ของเมืองหัวหินแบบเหนือจินตนาการ ตระการตาไปกับแสง สี เสียง สุดยิ่งใหญ่ ตั้งแต่วันที่ 17 - 25 สิงหาคม 2567 เวลา : 18.00 - 24.00 น.ณ อำเภอ หัวหิน จังหวัด ประจวบคีรีขันธ์ ข้าชมฟรีตลอด 9 วัน จุดจัดแสดง 5 จุดหลัก ได้แก่ สวนสาธารณะโผนกิ่งเพชร สถานีรถไฟหัวหินเก่า ตึกพลาซ่า แท็งก์น้ำการประปา สถานีรถไฟหัวหินใหม่
เดินทางทะลุมิติย้อนเวลากลับสู่เมืองหัวหินเก่า ผ่านเทคนิค Mimedia lllumination และ
Interactive Art รวม 15 โซนสุดอลังการและการแสดงสุดพิเศษ
พิเศษสุด ๆ กับรางวัลพิเศษ เฉพาะวันที่มีการแสดงรอบพิเศษ (17-18, 23-25 สิงหาคม 2567) เพียงแค่ถ่ายคลิป เช็คอิน 15 จุด พร้อมโพสต์ลงช่องทาง TikTok เปิดเป็นสาธารณะ ใครมียอดไลค์และยอดเเชร์สูงสุดรับ Voucher ที่พักฟรี!! 5 รางวัล (วันละ 1 รางวัล )
ASEAN CONNECT มหกรรมคาราวานแห่งเสียงเพลง 17 สิงหาคม 2567 ณ ลานอนุสาวรีย์ปราบฮ่อ
ASEAN CONNECT มหกรรมคาราวานแห่งเสียงเพลง 17 สิงหาคม 2567 ณ ลานอนุสาวรีย์ปราบฮ่อ ฟรีคอนเสิร์ตช่อง8 เพื่อชาวหนองคาย และสปป.ลาว เสาร์นี้ หกโมงเย็น ชมฟรีตลอดงาน ศิลปินดัง ลำไยไหทองคำ ต่ายอากาศ TAIYAKARD บิวพงศ์พิพัฒน์ ลาดา เปากิ่งกาญจน์
เปิดเส้นทางไหว้จตุรธาตุ “ไหว้พระธาตุทั้ง 4 เสริมบารมี ดิน น้ำ ลม ไฟ” 17 สิงหาคม 2567
ททท.สำนักงานอุดรธานี ร่วมกับ จังหวัดหนองคาย วัดโพธิ์ชัย(พระอารามหลวง) สมาคมส่งเสริมการท่องเที่ยวจังหวัดหนองคาย และสภาอุตสาหกรรมท่องเที่ยวจังหวัดหนองคาย ขอเชิญร่วมเปิดเส้นทาง #ไหว้จตุรธาตุ ในวันเสาร์ ที่ 17 สิงหาคม 2567 เวลา 07.30 น.
ตามเส้นทาง พระธาตุหล้าหนอง . พระธาตุโพนจิกเวียงงัว . พระธาตุบังพวน . พระธาตุพระอรหันต์ “ไหว้พระธาตุทั้ง 4 เสริมบารมี ดิน น้ำ ลม ไฟ”
1. พระธาตุโพนจิกเวียงงัว “ธาตุดิน” อานิสงส์ : เมื่อได้มาสักการะองค์พระธาตุโพนจิกเวียงงัวแล้ว สมบูรณ์พูนสุข มีความเป็นปึกแผ่น มั่นคง มั่งคั่ง
2. พระธาตุกลางน้ำ “ธาตุน้ำ” อานิสงส์ : เมื่อได้มาสักการะแล้ว การงาน การเงิน ราบรื่น ลื่นไหล ทำมาค้าขึ้นและอยู่เย็นเป็นสุข
3. พระธาตุพระอรหันต์ วัดโพธิ์ชัย(พระอารามหลวง) “ธาตุลม” อานิสงส์ : เมื่อได้มาสักการะองค์พระธาตุพระอรหันต์แล้ว จะมีโชคลาภ วาสนา ชีวิตสดใสเจริญรุ่งเรือง ก้าวหน้าในหน้าที่การงานยิ่งขึ้น
4. พระธาตุบังพวน “ธาตุไฟ” อานิสงส์ : เมื่อได้สักการะองค์พระธาตุบังพวนแล้ว จะมีอำนาจ บารมี ปกปักษ์รักษาป้องกันจากภัยอันตราย ศัตรูแพ้พ่าย
งานแข่งขันเรือยาว วัดท่าฬ่อ ชิงถ้วยพระราชทาน 17-18 สิงหาคม 2567
ขอเชิญเที่ยวงานแข่งขันเรือยาว วัดท่าฬ่อ ชิงถ้วยพระราชทาน พระบาทสมเด็จพระวชิรเกล้าเจ้าอยู่หัว ระหว่างวันที่ 17-18 สิงหาคม 2567 ณ ลำน้ำน่านหน้าวัดท่าฬ่อ ตำบลท่าฬ่อ อำเภอเมืองพิจิตร จังหวัดพิจิตร . สนับสนุนโดย องค์การบริหารส่วนจังหวัดพิจิตร องค์การบริหารส่วนตำบลท่าฬ่อ เทศบาลท่าฬ่อ
ปฏิทินการแข่งขันเรือยาวประเพณี จังหวัดพิจิตร ประจำปี 2567 สิงหาคม-กันยายน
ปฏิทินการแข่งขันเรือยาวประเพณี จังหวัดพิจิตร ประจำปี 2567
การแข่งขันเรือยาวประเพณีตำบลท้อแท้ ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ประจำปี 2567 ในระหว่างวันที่ 14-15 กันยายน 2567 ณ แม่น้ำแควน้อยหน้าวัดทองแท้ ตำบลท้อแท้ อำเภอวัดโบสถ์ จังหวัดพิษณุโลก เรือประเภท 7 ฝีพาย
การแข่งขันเรือยาวประเพณีวัดหัวดง ชิงถ้วยพระราชทานฯลฯ ณ สนามลำน้ำน่าน หน้าวัดหัวดง อ.เมือง จ.พิจิตร วันที่ 31 สิงหาคม - 1 กันยายน 2567
การแข่งขันเรือยาวประเพณีวัดหาดมูล ชิงถ้วยพระราชทานฯลฯ ณ สนามลำน้ำน่าน หน้าวัดหาดมูลกระบือ อ.เมือง จ.พิจิตร วันที่ 25 สิงหาคม 2567
การแข่งขันเรือยาวประเพณีชิงถ้วยพระราชทานฯลฯ ณ สนามหนองหันตรา มหาวิทยาลัยสงฆ์ จ.พิจิตร วันที่ 24 สิงหาคม 2567
การแข่งขันเรือยาวประเพณีวัดด่าน ชิงถ้วยพระราชทานฯลฯ ณ สนามลำน้ำน่าน หน้าวัดด่าน ต.ไผ่ขวาง อ.เมือง จ. พิจิตร วันที่ 22 สิงหาคม 2567
การแข่งขันเรือยาวประเพณีวัดท่าฬ่อ ชิงถ้วยพระราชทานฯลฯ ณ สนามลำน้ำน่าน หน้าวัดท่าฬ่อ อ.เมือง จ.พิจิตร วันที่ 17-18 สิงหาคม 2567 สมโภชหลวงพ่อหิน สนับสนุนโดย องค์การบริหารส่วนจังหวัดพิจิตร องค์การบริหารส่วนตำบลท่าฬ่อ เทศบาลท่าฬ่อ
การแข่งเรือยาวชิงถ้วยพระราชทานฯ ณ ลำน้ำยม หน้าวัดรังนก อำเภอสามง่าม จังหวัดพิจิตร วันที่ 20 สิงหาคม 2567
การแข่งขันเรือยาวประเพณีวัดบึงตะโกน ณ สนามลำน้ำน่าน หน้าวัดบึงตะโกน อ.เมือง จ.พิจิตร วันที่ 17 สิงหาคม 2567
ล่องเรือ "ไหว้พระริมน้ำ ให้ฉ่ำบุญ" ปทุมธานี.... ตอน สิงหาพาแม่เที่ยว (มีค่าตั๋ว)
ล่องเรือ "ไหว้พระริมน้ำ ให้ฉ่ำบุญ" ปทุมธานี.... ตอน สิงหาพาแม่เที่ยว .... วันอาทิตย์ที่ 18 สิงหาคม 2567 ในโอกาสวันแม่ ททท.สำนักงานกรุงเทพมหานคร ร่วมกับร้านอาหารแม่น้ำ และ Jessica Trip จัดกิจกรรมพิเศษ ชวนคุณลูกควงคุณแม่ ล่องเรือไปไหว้ กับเส้นทาง : ค้าขายดี บารมี สมปรารถนา จังหวัดปทุมธานี ตารางกิจกรรม กราบสรีระสังขาร หลวงปู่เส็ง "วัดบางนา" และบูชาพญาครุฑ • ขอพรการค้า กับเซียนแปะโรงสี "วัดศาลเจ้า" • ชมของพระนอนอันซีนเก่าแก่ ณ "วัดมะขาม" • กราบหลวงพ่อสมปรารถนา ให้ได้ดังประสงค์ แล้วลอดโบสถ์ ให้แคล้วคลาดปลอดภัย ณ "วัดโบสถ์ หลวงปู่เทียน" • ชิมอาหารพื้นบ้านไทยรามัญ พิเศษสุด จากราคา 599 เหลือเพียง 399 บาท ด่วน! รับจำนวนจำกัด
เทศกาลอาหาร ของดี อ.คง ชุมชนบ้านปรางค์ วันที่ 18-19 สิงหาคม 2567
เทศกาลอาหาร ของดี อ.คง ชุมชนบ้านปรางค์ วันที่ 18-19 สิงหาคม 2567 ณ บริเวณสะพานบารายสวรรค์ ต.บ้านปรางค์ อ.คง จ.นครราชสีมา การท่องเที่ยวชุมชนบ้านปรางค์นคร พบกับเชฟชุมพล แจ้งไพร เชฟกระทะเหล็กอาหารไทย ประเทศไทย และกิจกรรมฟลูมูน&ซันเซต กิ๋นเข่าค่ำ การประกวดและแข่งขันทำอาหาร สวนสนุก และคอนเสิร์ตจากวงเพลินและอื่นๆอีกมากมาย
งานพายซับ Phangnga Bay SUP Fest Season 2 วันที่ 18 สิงหาคม 2567
งานพายซับครั้งที่ 2 Phangnga Bay SUP Fest Season 2 วันที่ 18 สิงหาคม 2567 บ้านสามช่องเหนือ พังงา
18 สิงหาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะผู้ป่วยชายไทยอายุ 34 ปี
19 สิงหาคม 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยชายไทยอายุ 34 ปี เข้ารับการรักษาที่โรงพยาบาลราชบุรี ห้องผู้ป่วยหนักศัลยกรรมระบบประสาท ด้วยอาการมีไข้ อาเจียนหลายครั้ง เอกซ์เรย์คอมพิวเตอร์สมอง มีน้ำไขสันหลังรั่ว แพทย์ทำผ่าตัดซ่อมทางเดินน้ำไขสันหลัง แต่ผู้ป่วยมีอาการ หนักมาก ญาติขอรักษาแบบประคับประคอง ผู้ป่วยเสียชีวิตวันที่ 18 สิงหาคม 2567 ทีมพยาบาลผู้ดูแลให้ข้อมูลการบริจาคดวงตา ภรรยาเห็นว่าการบริจาคดวงตาเป็นประโยชน์ต่อผู้อื่นดีกว่านำอวัยวะไปเผาโดยเปล่าประโยชน์ ยินดีที่บริจาคดวงตาเพื่อเป็นการทำบุญใหญ่ครั้งสุดท้าย
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้กับผู้ที่รอคอยการเปลี่ยนถ่ายกระจกตา ในโอกาสนี้นายแพทย์บรรจง เปรื่องประสพ รองผู้อำนวยการโรงพยาบาลราชบุรีและคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
กิจกรรมรถโรงหนังฉายภาพยนตร์ 19-22 สิงหาคม 2567
องค์การบริหารส่วนจังหวัดสุพรรณบุรี ขอเชิญชวนชม "กิจกรรมรถโรงหนังฉายภาพยนตร์แก่เด็กนักเรียน-ครู และประชาชนทั่วไป" จัดโดย หอภาพยนตร์ (องค์การมหาชน) กระทรวงวัฒนธรรม ระหว่างวันที่ 19 - 22 สิงหาคม 2567 สำนักงานเทศบาลตำบลท่าเสด็จ อ.เมืองสุพรรณบุรี จ.สุพรรณบุรี วันที่ 19-22 สิงหาคม 2567 รอบประชาชน เวลา 17.00 น. โปรแกรมภาพยนตร์ 19 ส.ค. 67 : ชั่วฟ้าดินสลาย (2498) 20 ส.ค. 67 : แผลเก่า (2520) 21 ส.ค. 67 : ไอ้ทุย (2514) 22 ส.ค. 67 : สวรรค์มืด (2501) เข้าร่วมกิจกรรมฟรี ไม่เสียค่าใช้จ่ายใด ๆ สอบถามข้อมูลเข้าร่วมกิจกรรมได้ที่ 094-7706999 (คุณวุฒินันท์) เวลาฉาย / โปรแกรมภาพยนตร์อาจมีการเปลี่ยนแปลงตามความเหมาะสม สามารถรองรับได้ไม่เกิน 70 ที่นั่ง / รอบ กรุณาสวมหน้ากากอนามัยขณะเข้าชมภาพยนตร์ งดอาหารและเครื่องดื่มเข้าไปในรถโรงหนัง
กิจกรรมขับเคลื่อน น่าน สู่ Nan Creative City 19 สิงหาคม 2567
กิจกรรมขับเคลื่อน น่าน สู่ Nan Creative City วันจันทร์ที่ 19 สิงหาคม 2567 นี้ ณ ห้องประชุมดอกเสี้ยว โรงแรมน่านตรึงใจ จังหวัดน่าน ตั้งแต่เวลา 08.30-12.00 น. กิจกรรมเพื่อความรู้และเข้าในถึงแนวทางการขับเคลื่อนเมืองน่านสู่การเป็นสมาชิกเครือข่ายเมืองสร้างสรรค์ขององค์การยูเนสโก ร่วมกันให้ข้อเสนอแนะการดำเนินงานเพื่อขับเคลื่อนเมืองน่านเป็นสมาชิกเครือข่ายเมืองสร้างสรรค์ด้านหัตถกรรมและศิลปะพื้นบ้าน
19 สิงหาคม โรงพยาบาลราชบุรี รับบริจาคดวงตาผู้ป่วยชายไทย 34 ปี
19 สิงหาคม 2567 โรงพยาบาลราชบุรี รายงานการบริจาคอวัยวะ ผู้ป่วยชายไทยอายุ 34 ปี เข้ารับการรักษาที่โรงพยาบาลราชบุรี ห้องผู้ป่วยหนักศัลยกรรมระบบประสาท ด้วยอาการมีไข้ อาเจียนหลายครั้ง เอกซ์เรย์คอมพิวเตอร์สมอง มีน้ำไขสันหลังรั่ว แพทย์ทำผ่าตัดซ่อมทางเดินน้ำไขสันหลัง แต่ผู้ป่วยมีอาการหนักมาก ญาติขอรักษาแบบประคับประคอง ผู้ป่วยเสียชีวิตวันที่ 18 สิงหาคม 2567 ทีมพยาบาลผู้ดูแลให้ข้อมูลการบริจาคดวงตา ภรรยาเห็นว่าการบริจาคดวงตาเป็นประโยชน์ต่อผู้อื่นดีกว่านำอวัยวะไปเผาโดยเปล่าประโยชน์ ยินดีที่บริจาคดวงตาเพื่อเป็นการทำบุญใหญ่ครั้งสุดท้าย
โรงพยาบาลราชบุรีจึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้กับผู้ที่รอคอยการเปลี่ยนถ่ายกระจกตา ในโอกาสนี้นายแพทย์บรรจง เปรื่องประสพ รองผู้อำนวยการโรงพยาบาลราชบุรีและคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
ขบวนแห่งานประเพณีพ้อต่อ 20 สิงหาคม 2567
ขบวนแห่งานประเพณีพ้อต่อ ขบวนออกจากลานมังกร ถนนถลาง - เลี้ยวซ้ายสี่แยกแถวน้ำ - ตรงไปผ่านพิพิธภัณฑ์เพอรานากันนิทัศน์ - เลี้ยวขวาเข้าถนนรัษฎา - ผ่านวงเวียนสุริยเดช (วงเวียนน้ำพุ) - เข้าสู่ตลาดสาธารณะ 1 ถนนระนอง โปรดหลีกเลี่ยงเส้นทางขบวนแห่งานประเพณีพ้อต่อ ตลาดสาธารณะ 1 ถนนระนอง ในวันอังคาร ที่ 20 สิงหาคม 2567 เวลา 11.40 น.
งานมหกรรมวัฒนธรรม ภูษาศิลป์ ถิ่นโคราช 20-24 สิงหาคม 2567
ททท.นครราชสีมา ชวนทุกท่านมาเที่ยวชม… งานมหกรรมวัฒนธรรม ภูษาศิลป์ ถิ่นโคราช 20-24 สิงหาคม 2567 ณ MCC HALL ชั้น 3 เดอะมอลล์ โคราช จังหวัดนครราชสีมา ชมนิทรรศการ “นวัตกรรมผ้าโคราช" จําหน่ายผลิตภัณฑ์จากผ้าไหม และผ้าพื้นเมืองโคราช กิจกรรมการประกวดออกแบบลายผ้า "Design Style Korat" ชมการแสดงผลงานจากการประกวด Fashion Design ชมการแสดงทางศิลปวัฒนธรรม ดนตรีตลอดการจัดงาน เสวนาวิชาการผ้าโคราช สาธิตภูมิปัญญาท้องถิ่น อัตลักษณ์โคราช เข้าชมฟรี
งานประเพณีทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี 20 สิงหาคม - 2 กันยายน 2567
งานประเพณี ทิ้งกระจาด เจ้าพ่อหลักเมืองสุพรรณบุรี ระหว่าง วันที่ 20 สิงหาคม ถึง 2 กันยายน 2567 ณ บริเวณศาลเจ้าพ่อหลักเมืองสุพรรณบุรี กำหนดพิธีการ
21 สิงหาคม 2567 เวลา 08.00 น ขบวนอัญเชิญเจ้าพ่อหลักเมืองสุพรรณบุรีให้ชาวสุพรรณสักการะ รอบตลาดในเมืองสุพรรณบุรี เวลา 19:00 น. ชมการแสดงมังกร ชมการแสดงสิงโต ถวายเจ้าพ่อหลักเมือง หน้าบริเวณงาน
22 สิงหาคม 2567 เวลา 18.00 น. พิธีลอยกระทงบริเวณแม่น้ำท่าจีน สี่แยกนางพิม
23 สิงหาคม 2567 เวลา 15.00 น. พิธีแจกทานข้าวสารกระจาดฟ้า
2 กันยายน 2567 เวลา 15.00 น. พิธีแจกทานข้าวสาร กระจาดดิน
กิจกรรม "SME Soft Power :เสริมพลัง SME ไทย สู่ความสำเร็จด้วย SOFT POWER" นครราชสีมา
ขอเชิญ....ผู้ประกอบการใหม่ในจังหวัดนครราชสีมา มาร่วมเดินทางไปกับ สสว.และ สภาอุตสาหกรรมฯ ในกิจกรรม "SME Soft Power :เสริมพลัง SME ไทย สู่ความสำเร็จด้วย SOFT POWER" สู่ความสำเร็จของการดำเนินธุรกิจให้ดังไกลไปทั่วไทย และทั่วโลก
ในกลุ่มธุรกิจ Soft Power ที่ดำเนินธุรกิจมาไม่เกิน 3 ปี (ทั้งที่จดทะเบียนแล้วและยังไม่จดทะเบียน) อาหาร ออกแบบแฟชั่น ท่องเที่ยว (สถานที่ท่องเที่ยว ระบบจอง ของที่ระลึก ไกด์ ช่างภาพ ฯลฯ) ภาพยนตร์ (Content ตัดต่อ บท ระบบเสียง สี เสียง อุปกรณ์ประกอบฉาก สถานที่ถ่ายทำ ฯลฯ)
สิ่งที่จะได้รับ
- ความรู้ในการประกอบธุรกิจ
- พี่เลี้ยงในการทำธุรกิจ จากนักธุรกิจตัวจริง
- เครือข่ายธุรกิจทั่วไทยและทั่วโลก
- เกียรติยศ ชื่อเสียง
- ขยายตลาด ฐานลูกค้า โอกาสในการจำหน่ายสินค้าบนแพลตฟอร์มที่ได้รับความนิยม
สมัครเข้าร่วมโครงการ ฟรี ไม่มีค่าใช้จ่าย
รับเพียงกลุ่มจังหวัดละ 43 รายเท่านั้น สมัครก่อน ได้รับสิทธิ์ก่อน
ลงทะเบียนได้ที่ bit.ly/smeSP
สอบถามข้อมูลได้ที่สถาบัน SMI
คุณเอิร์น 095-882-1039,
Pattaya Film Festival 2024 โปรแกรมหนังไทยและนานาชาติกว่า 20 เรื่อง 21 - 25 สิงหาคม 2567 LINK
เทศกาลภาพยนตร์เมืองพัทยา Pattaya Film Festival 2024 โปรแกรมหนังไทยและนานาชาติกว่า 20 เรื่อง 5 วันเต็ม ตั้งแต่ 21 - 25 สิงหาคม 2567 ส่องดูโปรแกรมหนังที่เลือกมาฉาย ครอบคลุมหลายกลุ่มวัยตั้งแต่วันเด็กวัยรุ่นและครอบครัว จุดฉายหลายจุดกระจายไปทั่วพื้นที่เมืองพัทยา ได้แก่ โรงภาพยนตร์ SF Cinema เซ็นทรัล มารีน่า โรงภาพยนตร์ เมเจอร์ ซีนีเพล็กซ์ พัทยา อเวนิว ห้องประชุมมหาไถ่ สวนสาธารณะลานโพธิ์ นาเกลือ หอศิลปะและวัฒนธรรมภาคตะวันออก มหาวิทยาลัยบูรพา Royal Garden Plaza Pattaya โรงเรียนเมืองพัทยา 7 และ ฯลฯ สุดสัปดาห์นี้ ไปดูหนังที่พัทยากัน.
เช็คโปรแกรมฉายทั้ง 5 วันที่นี่มวยโคราช ประกาศศักดา 21 สิงหาคม 2567
งาน "มวยโคราช ประกาศศักดา" วันพุธที่ 21 สิงหาคม 2567 Korat Hall 1 ชั้น 4 เซ็นทรัล โคราช 09.00 - 20.00 น. พบกับกิจกรรมสุดพิเศษที่เต็มไปด้วยความรู้ ความสนุก และความตื่นเต้น กับ 5 ไฮไลท์ที่คุณห้ามพลาด!
ไฮไลท์ 1 เมาท์มอยเมืองมวย
ไฮไลท์ 2 การแข่งขัน คีตะมวยโคราช
ไฮไลท์ 3 สืบตำนาน นิทรรศการมวยโคราช
ไฮไลท์ 4 ศึกชิงชัย Korat Fight
ไฮไลท์ 5 ร่วมสนุก รับรางวัลบูทกิจกรรมต่าง ๆ
ไม่เพียงแค่ชม แต่ยังสามารถร่วมสนุกกับกิจกรรมมากมายในบูทต่าง ๆ พร้อมลุ้นรับของรางวัลสุดพิเศษที่เราเตรียมไว้เพื่อคุณ!
Pattaya Film Festival 2024 วันที่ 21 - 25 สิงหาคม 2567
เทศกาลภาพยนตร์เมืองพัทยา Pattaya Film Festival 2024 โปรแกรมหนังไทยและนานาชาติกว่า 20 เรื่อง 5 วันเต็ม ตั้งแต่ 21 - 25 สิงหาคม 2567 ส่องดูโปรแกรมหนังที่เลือกมาฉาย ครอบคลุมหลายกลุ่มวัยตั้งแต่วันเด็กวัยรุ่นและครอบครัว จุดฉายหลายจุดกระจายไปทั่วพื้นที่เมืองพัทยา ได้แก่ โรงภาพยนตร์ SF Cinema เซ็นทรัล มารีน่า โรงภาพยนตร์ เมเจอร์ ซีนีเพล็กซ์ พัทยา อเวนิว ห้องประชุมมหาไถ่ สวนสาธารณะลานโพธิ์ นาเกลือ หอศิลปะและวัฒนธรรมภาคตะวันออก มหาวิทยาลัยบูรพา Royal Garden Plaza Pattaya โรงเรียนเมืองพัทยา 7 และ ฯลฯ สุดสัปดาห์นี้ ไปดูหนังที่พัทยากัน.
เช็คโปรแกรมฉายทั้ง 5 วันที่นี่การแสดงแสงสีเสียง สดุดี วีรชนไทย 21-25 สิงหาคม 2567
การแสดง แสง สี เสียง สดุดี วีรชนไทย วันที่ 21-25 สิงหาคม 2567 ตั้งแต่เวลา 17.00-22.00 น. ณ ลานพิพิธภัณฑ์เมืองลับแล ชิม ช้อป ใช้ กับบูธแสดงสินค้ากว่า 80 บูธ ตลาดของดี วิถีชุมชน ศูนย์รวมสินค้าอุปโภค บริโภคมากมาย
22 สิงหาคม 2566
โครงการเฝ้าระวังและป้องกันโรคพิษสุนัขบ้า ในพื้นที่เทศบาลเมืองกะทู้ เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี ประจำปีงบประมาณ 2566 เทศบาลเมืองกะทู้ ร่วมกับ ปศุสัตว์จังหวัดภูเก็ต ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และผ่าตัดทำหมันสุนัขบ้า - แมว ฟรี วันที่ 22 สิงหาคม 2566 ตั้งแต่เวลา 08.30 น. ณ สวนสาธารณะลานกีฬา@อำเภอกะทู้
กิจกรรม รับทำหมันสุนัขแมว จำกัดจำนวน 40 ตัว - เปิดรับลงทะเบียนจองคิวผ่าตัดทำหมันสุนัข-แมว ล่วงหน้าตั้งแต่วันนี้เป็นต้นไปผ่าน QR-CODE หรือเข้ามาลงทะเบียนผ่าตัดทำหมันสุนัข-แมว ด้วยตนเอง ในวันที่จัดกิจกรรมฯ ณ สวนสาธารณะ ลานกีฬา @อำเภอกะทู้ ตั้งแต่เวลา 08.30 เป็นต้นไป จนกว่าจะครบจำนวนที่เปิดรับ - ให้งดน้ำงดอาหารสุนัข และแมว 8 ชั่วโมง ก่อนที่จะนำไปรับบริการผ่าตัดตอนทำหมัน งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองกะทู้ โทร. 0 7632 1500 ต่อ 7
การแข่งขันเซปักตะกร้อพัทยาคัพ ครั้งที่ 21 ประจำปี 2567 วันที่ 22-25 สิงหาคม 2567
เมืองพัทยากำหนดจัดการแข่งขันเซปักตะกร้อพัทยาคัพ ครั้งที่ 21 ประจำปี 2567 ระหว่างวันที่ 22-25 สิงหาคม 2567 ณ โรงเรียนเมืองพัทยา 7 (บ้านหนองพังแค)
งานศาลเจ้าผ้อต่อก้งบางเหนียว ไหว้ขนมเต่า 22 สิงหาคม - 2 กันยายน 2567
งานศาลเจ้าผ้อต่อก้งบางเหนียว ไหว้ขนมเต่า วันที่ 22 สิงหาคม - 2 กันยายน 2567 ณ บริเวณโรงเรียนบ้านบางเหนียว จังหวัดภูเก็ต
22 สิงหาคม รพ.เจ้าพระยาอภัยภูเบศร ร่วมพิธีแสดงความอาลัย และขอขมากรรม ผู้บริจาคอวัยวะ ชายไทยวัย 47 ปี
วันพฤหัสบดีที่
22 สิงหาคม 2567 แพทย์หญิงชนิดา สยุมภูริจินันท์ ผู้อำนวยการโรงพยาบาลเจ้าพระยาอภัยภูเบศร มอบหมายให้ แพทย์หญิงสุพาพร ภู่พิทยา รองผู้อำนวยการฝ่ายการแพทย์ คนที่ 1 พร้อมด้วยนางสาวอภันตรี ประยูรวงษ์ หัวหน้าพยาบาล และตัวแทนจากกลุ่มการพยาบาล เข้าร่วมพิธีแสดงความอาลัย และขอขมากรรม ผู้บริจาคอวัยวะ ชายไทย อายุ 47 ปี ภูมิลำเนา อำเภอบ้านสร้าง จังหวัดปราจีนบุรี โดยได้รับ ไต 2 ข้าง ตับ ผิวหนัง กระดูก ดวงตา 2 ดวง โดยจะมอบให้กับศูนย์ บริจาคอวัยวะสภากาชาดไทย ผ่านทางโรงพยาบาลเจ้าพระยาอภัยภูเบศร เพื่อนำไปปลูกถ่ายให้แก่ผู้ป่วยที่รอรับการปลูกถ่ายอวัยะ ซึ่งในการบริจาคอวัยวะครั้งนี้ ได้รับเกียรติจาก นางรมิดา เรียงเงิน รามัญ รองนายกเหล่ากาชาดจังหวัดปราจีนบุรี พร้อมด้วยเหล่ากาชาดจังหวัดปราจีนบุรี ในการมอบใบประกาศเกียรติคุณให้แก่ญาติของผู้วายชนม์ ในท้ายนี้ โรงพยาบาลเจ้าพระยาอภัยภูเบศร ต้องขอขอบพระคุณท่านผู้มีเมตตาที่เสียสละบริจาคอวัยวะ เพื่อเป็นการต่อลมหายใจให้อีกหลายชีวิต และขอให้ครอบครัวของท่านพบแต่ความสุขความเจริญยิ่งๆ ขึ้นไป
เกษตรนครนายก ประจำปี 2567 วันที่ 22 - 26 สิงหาคม 2567
งานแสดงและจำหน่ายสินค้า เกษตรนครนายก ประจำปี 2567 ขอเชิญพี่น้องชาวจังหวัด นครนายก และจังหวัดใกล้เคียง เชิญมาเลือกชิมเลือกช้อป จุใจ ระหว่างวันที่ 22 - 26 สิงหาคม 2567 ณ ลานอเนกประสงค์ท้ายเขื่อน ขุนด่านปราการชล จังหวัดนครนายก ภายในงานพบกับสินค้าจาก… • กลุ่มเกษตรอินทรีย์ • ผลิตภัณฑ์เกษตรแปรรูป • ผัก-ผลไม้ปลอดสารพิษ มาจำหน่ายในราคาพิเศษ
กิจกรรมการประกวดแข่งขัน ผลผลิตทางการเกษตร • ส้มโอ พันธุ์ขาวทองดี • ส้มโอ พันธุ์ขาวน้ำผึ้ง • กิ่งพันธุ์มะยงชิด/มะปรางหวาน • ขนุนยักษ์ • แข่งขันจัดสวนถาดของนักเรียน นอกจากนี้ ยังมีศิลปินมากมาย • วันที่ 22 สิงหาคม พบกับ ศิลปิน แบงค์ ธนา • วันที่ 23 สิงหาคม พบกับ ศิลปิน เต๋า ภูศิลป์ • วันที่ 24 สิงหาคม พบกับ ศิลปิน เบน ศรัณยู • วันที่ 25 สิงหาคม พบกับ ศิลปิน พลอยใส ธัญลักษณ์ AF12 • วันที่ 26 สิงหาคม พบกับ ศิลปิน โฟกัส กิตติคุณ AF12
COFFEE AND BAKERY FAIR 2024 จ.ขอนแก่น 23-25 สิงหาคม 2567
Coffee&Bakery Fair 2024 งานกาแฟและเบเกอรี่ วันที่ 23-25 สิงหาคม 2567 ณ ศูนย์ประชุมอเนกประสงค์กาญจนาภิเษก มหาวิทยาลัยขอนแก่น จังหวัดขอนแก่น
เสวนา “ย้อนรอยโยไคญี่ปุ่น และภูตผีไทย-อีสาน : ผ่านมุมมองศิลปะ วัฒนธรรม และความเชื่อ” TCDC ขอนแก่น 23 สิงหาคม 2567
งานเสวนา “ย้อนรอยโยไคญี่ปุ่น และภูตผีไทย-อีสาน : ผ่านมุมมองศิลปะ วัฒนธรรม และความเชื่อ” Revisiting Japanese Yokai and Thai - Isan Spirits : Perspective on art, culture belief and creative industry. . The Japan Foundation, Bangkok ร่วมกับ CEA ขอนแก่น เรียนเชิญทุกท่านเข้าร่วมงานเสวนาที่จะพาทุกท่านไปสัมผัสศิลปะ วัฒนธรรม และความเชื่อ ย้อนรอยสำรวจทรัพยากรอันล้ำค่าจากสิ่งลี้ลับโยไคญี่ปุ่น และภูติผีไทย-อีสาน ไปพร้อมกับวิทยากรผู้เชี่ยวชาญทั้งจากญี่ปุ่นและไทย . วันที่ 23 สิงหาคม 2567 เวลา 13.30 - 17.00 น. ณ ห้องออดิทอเรียม TCDC ขอนแก่น
งานส้มโอ ของดีเมืองสูงเนิน 23-24 สิงหาคม 2567
งานส้มโอ ของดีเมืองสูงเนิน ระหว่างวันที่ 23 - 24 สิงหาคม 2567 ณ บริเวณหน้าที่ว่าการอำเภอสูงเนิน พบกับกิจกรรมการแสดง แสง สี เสียงมากมาย ในงานประกอบไปด้วย การแข่งขันส้มโอหวานรสดี การแข่งขันแปรรูปอาหารจากส้มโอ การแข่งขันผัดหมี่/ส้มตำ ลีลา การประกวดร้องเพลง ลูกทุ่งไมค์ทองคำ การแข่งขันการประกวดธิดาส้มโอ การแสดงจากสถานศึกษาและชุมชน การออกร้านจำหน่ายส้มโอจากสวนเกษตรกรในพื้นที่ การจัดแสดงสินค้าและผลิตภัณฑ์ OTOP ของดีเมืองสูงเนิน รวมทั้งการจัดนิทรรศการของดี จากองค์กรปกครองส่วนท้องถิ่นในพื้นที่ ฯลฯ
กิจกรรม Southern Bliss Fest : ความสุขแดนใต้ หาดทุ่งวัวแล่น 23-25 สิงหาคม 2567
กิจกรรม Southern Bliss Fest : ความสุขแดนใต้” กำหนดจัดขึ้นในวันที่ 23 - 25 สิงหาคม 2567 ณ หาดทุ่งวัวแล่น จังหวัดชุมพร และวันที่ 30 สิงหาคม - 1 กันยายน 2567 ณ ถนนคนเดินชายเล ขนอม จังหวัดนครศรีธรรมราช เพื่อกระตุ้นการท่องเที่ยวช่วง Green Season ในพื้นที่ฝั่งทะเลอ่าวไทย
ภายในงานประกอบด้วย การนำเสนอเสน่ห์ไทยแดนใต้ การออกร้านอัตลักษณ์ท้องถิ่น อาหารถิ่นสุดหรอยมากมาย พร้อมกิจกรรรมเวิร์กช้อป งานคราฟท์สุดเก๋ ไฮไลท์สำคัญ คือ คอนเสิร์ตดังอย่าง ซานิ Yes ‘Sir Day เพียว The Voice ที่ชุมพร และ Lomosonic หนิง The Voice ที่นครศรีธรรมราช ภายในงานยังมีการแนะนำ 4 เส้นทางชวนเที่ยวใต้พร้อมพาหนะคู่ใจ ได้แก่ เส้นทาง “รักษ์เขาฝั่งทราย” จังหวัดระนอง-ชุมพร อาหาร “รสใต้” จังหวัดตรัง เส้นทางศรัทธา “จตุธรรมธาตุแดนใต้” จังหวัดชุมพร - สุราษฎร์ธานี - พัทลุง - นครศรีธรรมราช และเส้นทาง “พหุวัฒนธรรมชายแดนใต้” จังหวัดปัตตานี
เทศกาลอาหารสองทะเล Songkhla Seafood Festival 2024 วันที่ 23 ส.ค. - 3 ก.ย. 2567
ขอเชิญเที่ยวงาน เทศกาล อาหารสองทะเล Songkhla Seafood Festival 2024 วันที่ 23 ส.ค. - 3 ก.ย. 2567 ณ บริเวณเวทีสระบัว แหลมสมิหลา จ.สงขลา พบกับศิลปินมากมาย 23 ส.ค. - วงลาบานูน 24 ส.ค. - ( แอลยังไม่ทราบชัดเจน ) 25 ส.ค. - วงกินรี 26 ส.ค. - มโนราห์ไข่เหลี้ยม 27 ส.ค. - ลิลลี่ VS หนังน้องเดียว 28 ส.ค. - เตย วีรยา VS วงพัทลุง 29 ส.ค. - มายมอมแมม 01 ก.ย. - บ่าววี อาร์สยาม 02 ก.ย. - เนส กาแฟ 03 ก.ย. - วงกลม #ชมฟรีทุกคืน
งาน เสน่ห์อัมพวา Night at The Museum ณ อุทยาน ร.2 สมุทรสงคราม 23-25 ส.ค.67 LINK
เชิญเที่ยวงาน เสน่ห์อัมพวา Night at The Museum ณ อุทยาน ร.2 สมุทรสงคราม ระหว่างวันที่ 23-25 ส.ค.67 นี้
พบกับกิจกรรมมากมาย การแสดงศิลปวัฒนธรรม โขนเด็ก / ดนตรีไทย / ศิลปะหุ่นคน / หุ่นสาย สาธิตภูมิปัญญาท้องถิ่น ทำผ้ามัดย้อม / เขียนลายเบญจรงค์ ร้านอาหาร และผลิตภัณฑ์ OTOP ของชุมชน สินค้าจากกลุ่มผู้ประกอบการ YEC และร้าน Food Truck กว่า 50 ร้านค้า สาธิตกิจกรรมท่องเที่ยวทางน้ำ (Kayak / Sup Board) ชมวิถีชีวิตพ่อค้าแม่ค้าพายเรือในบรรยากาศตลาดน้ำอัมพวา นิทรรศการภาพถ่ายจังหวัดสมุทรสงคราม ฉายหนังกลางแปลงในสวน เที่ยวพิพิธภัณฑ์ยามค่ำคืน Night at The Museum พิเศษ เที่ยวชมฟรี ตลอดการจัดงาน
สอบถามเพิ่มเติมได้ที่ โทรศัพท์ 0 3475-2847-8 หรือ Inbox FB : ททท. สำนักงานสมุทรสงคราม TAT Samut Songkhram
ประกวดอาหารว่างและเครื่องดื่ม “ลองลิ้ม ชิมน่าน” อาหารว่างสร้างสรรค์ 23 สิงหาคม 2567
อพท. น่าน เปิดรับสมัครผู้สนใจเข้าร่วมกิจกรรมการประกวดอาหารว่างและเครื่องดื่ม ภายใต้แนวคิด “ลองลิ้ม ชิมน่าน” อาหารว่างสร้างสรรค์ ในงาน DASTA Nan Sustainable Tourism Journey 2024 ในวันที่ 23 สิงหาคม 2567 ชิงเงินรางวัลมูลค่า 17,000 บาท ต่อยอดขนมท้องถิ่น โดยออกแบบเมนู “อาหารว่างสร้างสรรค์” จำนวน 1 ชุด โดยได้แรงบันดาลใจ และต่อยอดมาจากขนมท้องถิ่น ในเมนู “อาหารว่าง” จำนวน 1 ชุด ผู้เข้าแข่งขันต้องสร้างสรรค์ เมนู จากวัตถุดิบหลักต่อไปนี้ 1. มะไฟจีน 2.ส้มสีทองน่าน 3.ลูกชิต (ต๋าว) 4.งาขี้ม้อน 5.กาแฟ โดยเลือกอย่างน้อย 2 วัตถุดิบหลัก #ติดต่อสอบถามข้อมูลเพิ่มเติม FB fanpage : สำนักงานพื้นที่พิเศษเพื่อการท่องเที่ยวอย่างยั่งยืนเมืองเก่าน่าน - อพท.น่าน โทร 054 719 682 (087 064 8189)
งานเทศกาลอาหารและบอลลูน 23 สิงหาคม - 1 กันยายน 2567
งานเทศกาลอาหารและบอลลูน วันที่ 23 สิงหาคม - 1 กันยายน 2567 ณ สนามหน้าศาลากลางจังหวัดชลบุรี จัด ใหญ่ จัดเต็ม ทั้ง การแสดง แสง สี เสียง สวนสนุกต่างประเทศชุดใหญ่
23 สิงหาคม โรงพยาบาลเจ้าพระยาอภัยภูเบศร เป็นเจ้าภาพสวดอภิธรรมศพ ผู้บริจาคอวัยวะ ชายไทยอายุ 47 ปี
23 สิงหาคม 2567 แพทย์หญิงชนิดา สยุมภูรุจินันท์ ผู้อำนวยการโรงพยาบาลเจ้าพระยาอภัยภูเบศร มอบหมายให้ นางอุบล บัวเรือง รองหัวหน้าพยาบาลด้านบริหาร พร้อมด้วยตัวแทน จากกลุ่มการพยาบาล เป็นเจ้าภาพสวดอภิธรรมศพ ผู้บริจาคอวัยวะ ชายไทย อายุ 47 ปี ซึ่งเป็นผู้ที่ได้มอบ ไตทั้ง 2 ข้าง ตับ ผิวหนัง กระดูก ดวงตา ทั้ง 2 ดวง ให้กับ ศูนย์บริจาคอวัยวะสภากาชาดไทย ผ่านโรงพยาบาลเจ้าพระยาอภัยภูเบศร เพื่อนำไปปลูกถ่ายให้แก่ผู้ป่วยที่รอรับการปลูกถ่ายอวัยะ ณ วัดบางปลาร้า อำเภอบ้านสร้าง จังหวัดปราจีนบุรี โรงพยาบาลเจ้าพระยาอภัยภูเบศร ขอแสดงความเสียใจมา ณ ที่นี้ด้วย
งาน Nakhonpathom Guarantee best buy 2024 วันที่ 23-27 สิงหาคม 2567
งาน Nakhonpathom Guarantee best buy 2024 วันที่ 23-27 สิงหาคม 2567 งานแสดงจำหน่ายสินค้า อาหาร แหล่งท่องเที่ยวและบริการ ภายใต้ตราสัญลักษณ์ “นครปฐมการันตี/Nakhonpathom Guarantee” ของจังหวัดนครปฐม รวมสินค้า และการท่องเที่ยว ที่ได้รับตราสัณญาลักษณ์ นครปฐมการันตี ที่คุณไม่ควรพลาด ได้มาสัมผัส ได้มาชิมชม และได้มาเยือน จังหวัด นครปฐม ไหว้พระขอพร ซื้อสินค้า ดีมีคุณภาพ รักษาสิ่งเเวล้อม ไปพร้อมๆ กับ 5 อันทรงคุณค่า ด้านการท่องเที่ยว , ด้านเกษตร , พัฒนาชุมชน ศิลปวัฒนธรรม , และด้านสาธารณสุข
ปลวกแดง EXPO FAIR วันที่ 23 สิงหาคม - 1 กันยายน 2567
งาน ปลวกแดง EXPO FAIR วันที่ 23 สิงหาคม - 1 กันยายน 2567 บริเวณข้างสี่แยกห้าง CK ปลวกแดง (ตลาดเก่า) อำเภอปลวกแดง จังหวัดระยอง ชมคอนเสิร์ตทุกคืน คืนแรกประเดิมศิลปินเบอร์ใหญ่ ปู พงษ์สิทธิ์ คำภีร์ 23 ส.ค. 67 ปู พงษ์สิทธิ์ คำภีร์ 25 ส.ค. 67 สังคม ยอดนิยม & อิงอร 29 ส.ค. 67 ลูกแพร อุไรพร 30 ส.ค. 67 ใบปอ รัตติยา 31 ส.ค. 67 ผู้ใหญ่บ้านฟินแลนด์ 1 ก.ย. 67 เนส พรอำนาจ
งาน Nakhonsawan Big Grill Fest 2024 เทศกาลปิ้งย่างที่ฉ่ำที่สุดในภาคเหนือ 23-25 ส.ค.2567
Nakhonsawan Big Grill Fest 2024 เทศกาลปิ้งย่างที่ฉ่ำที่สุดในภาคเหนือ 23-25 ส.ค. 2567 เริ่มตั้งแต่เวลา 11.00 - 22.00 น. โรงไม้ชวนิชตรงสี่แยกพิษณุโลกขาล่อง จ.นครสวรรค์ (ติดร้านชนินทร์การยาง) *เข้าฟรีตลอดงาน* จอดรถได้ที่ รร.ประชานุเคราะห์และโรงแรมแกรนด์ฮิลล์ มีรถรับส่งตลอดงาน
เปิดประสบการณ์อาหารปิ้งย่างในแบบที่หลายคนไม่เคยลิ้มลอง กับการใช้ถ่าน ฟืนและไฟในการทำอาหาร ยกขบวนเชฟระดับประเทศกว่า 30 ชีวิต มาทำอาหารให้ทุกคนลิ้มลอง 40กว่าเมนูปิ้งย่างที่อร่อยจนต้องตะโกน ทั้ง สเต็ก ซี่โครงรมควัน เนื้อย่างอาเจนติน่า บริสเกต พิซซ่า สลัด และเมนูอื่นๆอีกเพียบ
สำหรับคนทำร้านอาหารหรือคาเฟ่ ไม่ควรพลาดกับกิจกรรมWorkshop grill และการสาธิตเมนูเด็ดๆจากเชฟระดับมิชลิน
อาหารดีๆต้องมีเครื่องดื่มเด็ดๆ เมนูพิเศษมีเฉพาะงานนี้เท่านั้น
ปาร์ตี้มันส์ๆกับดนตรีและดีเจตลอดทั้งวัน
สนับสนุนโดย การท่องเที่ยวแห่งประเทศไทย สำนักงานนครสวรรค์
งานเทศกาลอาหารจีน 5 ภาษา และศิลปะการแสดงเมืองปากน้ำโพ "ย่านเมืองเก่า ตรอกชุนหงษ์" "ชุด ชวน ชิม" 23-24 สิงหาคม พ.ศ.2567
ขอเชิญร่วมกิจกรรมงานเทศกาลอาหารจีน 5 ภาษา และศิลปะการแสดงเมืองปากน้ำโพ "ย่านเมืองเก่า ตรอกชุนหงษ์" "ชุด ชวน ชิม" สวม"ชุด"จีน : งดงาม นามฮั่นฝู "ชวน"ชมดู : เมืองเก่าตรอกชุนหงส์ ตรงไป"ชิม": อิ่มสำราญอาหารจีน (5กาษา) วันที่ 23 - 24 สิงหาคม พ.ศ.2567 ณ บริเวณ ตรอกชุนหงษ์
พบกับบูทอาหารจีน "ปากน้ำโพโหงวซก" และกิจกรรมการแสดงอีกมากมาย
Blue stage - Red street Chinese fest & food. การเส้นทางวัฒนธรรมจีน????
Blue stage คือเวทีการแสดงในชุดการแสดงที่เน้นความงดงาม เพลิดเพลิน อิ่มเอมใจเมื่อได้รับชมกับที่นั่งดูอย่างใกล้ชิดและและพอดีกับสายตา
Red street คือพื้นที่บนถนนที่เน้นการแสดงแบบ street ที่มีความสนุกสนาน ดุดัน แต่ผู้ชมที่ยืนชมจะสามารถกระโดดโลดเต้นด้วยได้ตามจังหวะกลองที่เร้าใจ โดยนักแสดงชาวไทยและชาวจีนเกือบ 30 ชีวิตที่เดินทางมาจากประเทศจีน เพื่อมาร่วมทำการแสดงในกิจกรรมครั้งนี้
Chinese fest & food หรือ อาหารจีน ใน Concept ปากน้ำโพโหงวซกอาหารสัญชาติจินที่หลากหลายจากกลุ่มชาติพันธ์จีนไม่ว่าจะเป็น กวางตั้ง ฮากกา แต่จิ๋ว ไหหนำ ฮกเกี๋ยน มากมายกว่า 20 ร้านค้า และกิจกรรม art work ที่เราสามารถเข้าไปเรียนรู้และลองลงมือทำได้เลย
ท่องเที่ยวบางสะพาน ตำนานเมืองทอง ครั้งที่ 15 วันที่ 23 สิงหาคม - 1 กันยายน 2567
งาน "ท่องเที่ยวบางสะพาน ตำนานเมืองทอง" ครั้งที่ 15 “บางสะพานเมืองแห่ง ความสุข“ วันที่ 23 สิงหาคม - 1 กันยายน 2567 ณ ลานกิจกรรม ที่ว่าการอำเภอบางสะพาน จ.ประจวบคีรีขันธ์ เริ่มงานเวลา 17.00 -22.00
กิจกรรมสนุกๆในงาน ร้านค้า ของกิน ร้านเด่น อร่อย ที่ได้รับการคัดเลือกจาก7ตำบล กว่า 35 ร้านค้า ซุ้มไฟ จุด check in ถ่ายรูปสุดชิค ร้านค้า OTOP ของดีของฝากประจำอำเภอ นิทรรศการ สุดตื่นตา สัมผัสทองบางสะพานแท้ๆ และประสบการณ์ การร่อนทองด้วยมือคุณเอง เสวนา 10 เรื่อง สุดว้าว ที่คุณอาจไม่เคยรู้มาก่อน คนบางสะพานของแทร้ ห้ามพลาด (เวทีย่อยใต้ต้นจามจุรี) ชมดอกไม้ไฟ กิจกรรมการแสดง สับเปลี่ยนหมุนเวียนจากน้องๆหนูๆนักเรียน จากโรงเรียนทั่วทั้งอำเภอ (เวทีย่อยใต้ต้นจามจุรี) ดนตรี Folk song ตลอด10 วัน (เวทีย่อยใต้ต้นจามจุรี) workshop , กิจกรรมสำหรับครอบครัว น้องๆหนูๆ ลงทะเบียนรับของรางวัล แจกฟรี เพียบ
งาน VIJITR 5 ภาค @PHUKET Pearl of Andaman The Undiscovered Treasure
งาน “VIJITR 5 ภาค @ภูเก็ต” “Pearl of Andaman The Undiscovered Treasure” ความวิจิตรอันทรงคุณค่าของเมืองภูเก็ต ที่เปล่งประกายดั่ง “ไข่มุกแห่งอันดามัน” ผ่านการนำเสนอรากเหง้าแห่งวัฒนธรรมด้วยนวัตกรรมสื่อผสมผสาน สะท้อนอัตลักษณ์อันโดดเด่น การแสดงแสง สี เสียงจัดเต็ม ณ สวนสาธารณะสะพานหิน ที่เราจะเนรมิตให้เป็นดินแดนสุดวิจิตรที่รอให้ทุกคนมาสัมผัส รวมไปถึงบริเวณย่านเมืองเก่าภูเก็ตที่จะเป็นจุดเริ่มต้น ที่พร้อมจะนำพาทุกคนมาสัมผัสประสบการณ์นี้
เข้าชมฟรี!! ตลอด 9 วัน ตั้งแต่ วันที่ 24 สิงหาคม ถึง 1 กันยายน 2567 เวลา: 18.00 - 24.00 น. ณ ย่านเมืองเก่าภูเก็ต และ สวนสาธารณะสะพานหิน จังหวัดภูเก็ต
การแสดงโขนพระราชทาน ชุดหนุมานชาญกำแหง 24-25 สิงหาคม 2567 LINK
ขอเชิญชมการแสดงโขนพระราชทาน จังหวัดตราด "ชุดหนุมานชาญกำแหง" ระหว่างวันเสาร์ที่ 24 - วันอาทิตย์ที่ 25 สิงหาคม 2567 เวลา 19.00 น. ณ องค์การบริหารส่วนจังหวัดตราด แสดงโดยคณะนักแสดงจากโรงมหรสพหลวงศาลาเฉลิมกรุง (ชมฟรี) ติดต่อลงทะเบียนเข้ารับชม และ สอบถามรายละเอียดเพิ่มเติมได้ที่ ที่ทำการอำเภอทุกแห่ง หรือโทร 1567
นิทรรศการ งานประกวดพระเครื่องชิงรางวัล" 24-25 สิงหาคม 2567 ศูนย์การค้าเซียร์ รังสิต
นิทรรศการ "งานประกวดพระเครื่องชิงรางวัล" การประกวดอนุรักษ์พระเครื่อง พระบูชาและเครื่องรางยอดนิยม ครั้งที่ 6 ภายในงานยังมีตรวจสอบพระแท้พร้อมออกใบรับรอง จัดโดย : อาณาจักรพระเครื่องทีม ร่วมกับศูนย์การค้าเซียร์รังสิต พบกับนักอนุรักษ์ นักสะสม บูชาพระเครื่องวัตถุมงคล เครื่องราง ฯลฯ วันที่ 24-25 สิงหาคม พ.ศ. 2567 ที่ ศูนย์พระเครื่อง ชั้น 3 ศูนย์การค้าเซียร์ รังสิต
การแสดงโขนเรื่องรามเกียรติ์ ตอนศึกมังกรกัณฑ์ แสงอาทิตย์ วันที่ 24 สิงหาคม 2567
การแสดงโขนเรื่องรามเกียรติ์ ตอนศึกมังกรกัณฑ์ แสงอาทิตย์ ในงานโขนสัมพันธ์ภาคใต้เฉลิมพระเกียรติครั้งที่23 วันที่ 24 สิงหาคม 2567 เวลา 18.00-22.00 น. เวทีหน้าอาคารศาลาประชาสันต์ อำเภอปากพนัง จังหวัดนครศรีธรรมราช โดย วิทยาลัยนาฏศิลปนครศรีธรรมราช ร่วมกับ วิทยาลัยนาฏศิลปพัทลุง ททท.สำนักงานนครศรีธรรมราช เทศบาลเมืองปากพนัง และหน่วยงานพันธมิตร เพื่อเฉลิมพระเกียรติเนื่องในวโรกาสมหามงคลเฉลิมพระชนมพรรษาพระบาทสมเด็จพระเจ้าอยู่หัว และวันเฉลิมพระชนมพรรษาสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถพระบรมราชชนนีพันปีหลวง
งานแสดงสินค้า ตลาดโอทอป ของดีเมืองน่าน 2567 วันที่ 24-25 สิงหาคม 2567
งานพบกับงานแสดงสินค้า “ตลาดโอทอป ของดีเมืองน่าน 2567” พบกับผู้ผลิต ผู้ประกอบการ OTOP จำนวน 45 ร้านค้า ภายใต้โครงการพัฒนาผลิตภัณฑ์ OTOP กลุ่มปรับตัวสู่การพัฒนา (Quadrant D) และโครงการส่งเสริมกระบวนการเครือข่ายองค์ความรู้ (Knowledge – Based OTOP : KBO) ประจำปี 2567 ในวันอาทิตย์ที่ 25 สิงหาคม 2567 ยังมีกิจกรรมการประกวด OTOP SINGING CONTEST ชิงเงินรางวัล พร้อมประกาศนียบัตร จำนวน 5 รางวัล ณ ศูนย์การค้าโลตัส น่าน บริเวณหน้าฟู๊ดคอร์ท ตั้งแต่เวลา 11.00 – 17.00 น. ผู้สนใจสามารถลงทะเบียนสมัครผ่านช่องทาง QR CODE สอบถามเพิ่มเติม เพจ :
พช.น่าน fanpage ดนตรีในสวน บอลลูนยัก บริเวณสวนเฉลิมพระเกียรติฯ หนองกระโดน 28 กรกฎาคม 2567
ขอเชิญร่วมกิจกรรม ดนตรีในสวน เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาส พระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ณ บริเวณสวนเฉลิมพระเกียรติฯ 6 รอบ 28 กรกฎาคม 2567 องค์การบริหารส่วนตำบลหนองกระโดน อ.เมือง จ.นครสวรรค์
ภายในงานมีกิจกรรมมากมาย ✅ เวลา 16.00 น. ถึงเวลา 21.00 น. ชมฟรี บอลลูน(ยักษ์) ✅ เวลา 17.00 น. กิจกรรมร้องเพลงพระราชนิพนธ์จากเด็กและเยาวชนโรงเรียนในเขตตำบลหนองกระโดน ✅ เวลา 18.00 น. การแสดงร้องเพลงเฉลิมพระเกียรติฯ 6 รอบ 28 กรกฎาคม 2567 จากโรงเรียนพระบางวิทยา ✅ เวลา 19.00 น.พิธีเปิดงานและร่วมจุดเทืยนชัยถวายพระพรแด่องค์พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ✅ เวลา 19.30 น. ชมการแสดงดนตรี เฉลิมพระเกียรติ พระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 จัดงานโดย องค์การบริหารส่วนตำบลหนองกระโดน
Arts Arise Festival 2024 วันที่ 25 สิงหาคม – 7 กันยายน 2567
"7-7: ศิลปะร่วมสมัยกับการสร้างสรรค์" "7-7: How Art is Made" งาน Arts Arise Festival 2024 วันที่ 25 สิงหาคม – 7 กันยายน 2567 เวลา 10:00-18:00 น @ Momentary Coffee & Host-tell สะเทือนผัสสะ 6 ทุกมิติในย่าน 7 ศิลปิน 7 ศิลปะร่วมสมัย 7 เวิร์กชอปสร้างสรรค์ ภายใต้แนวคิด The Sense of BaanSaan งานที่ศิลปินสร้างสรรค์ด้วยแรงบันดาลใจมากมายจากวิถีท้องถิ่นคนภูเก็ต และจะพาทุกคนไปรู้จักศิลปะที่พร้อมเปิดประสบการณ์เสพอย่างใกล้ชิดด้วยกระบวนการคิดและสร้าง
อันดามันอินเตอร์เนชั่นเนล รันนิ่ง เทรล 2024 (กระบี่เทรล 2024) 25 สิงหาคม 2567
งานวิ่งเทรลอันดามันอินเตอร์เนชั่นเนล รันนิ่ง เทรล 2024 (กระบี่เทรล 2024) วันที่วิ่ง: วันอาทิตย์ ที่ 25 สิงหาคม 2567 สถานที่วิ่ง: หาดคลองม่วง ต.หนองทะเล อ.เมือง จ.กระบี่
สำนักงานการท่องเที่ยวและกีฬาจังหวัดกระบี่ ได้จัดกิจกรรมการแข่งขันอันดามัน อินเตอร์เนชันแนล เทรล รันนิ่ง"Andaman International Trail Running @ Krabi" ขึ้น ซึ่งเป็นโครงการในพื้นที่กลุ่มจังหวัดภาคใต้อันดามัน เพื่อกระตุ้นเศรษฐกิจส่งเสริมการท่องเที่ยวช่วงกรีนซีซั่น และส่งเสริมรายได้ให้กับประชาชนในพื้นที่ การสร้างภาพลักษณ์ที่ดีและเพิ่มศักยภาพในการแข่งขัน อีกทั้งยังสามารถส่งเสริมการท่องเที่ยวในพื้นที่จังหวัดกระบี่โดยใช้กิจกรรมกีฬาและนันทนาการเป็นสื่อกลางในการนำนักท่องเที่ยวให้เข้ามาในจังหวัดกระบี่ โดยเน้นการสร้างความเชื่อมั่นด้านการท่องเที่ยว และเป็นอีกปัจจัยหนึ่งที่สามารถดึงดูดให้นักท่องเที่ยวเข้ามาท่องเที่ยวในจังหวัดกระบี่มากขึ้น อีกทั้งยังเป็นการส่งเสริมกิจกรรมกีฬาเพื่อการท่องเที่ยวอีกด้วย
งาน Happy Food & Music Festival 2024 ห้างโลตัส บ้านบึง 25 สิงหาคม -1 กันยายน 67
งาน Happy Food & Music Festival 2024 มหกรรมอาหารอร่อยจากร้านดังๆ มากมาย 25 สิงหาคม -1 กันยายน 2567 บริเวณหน้าห้างโลตัส บ้านบึง อ.บ้านบึง ชมฟรีคอนเสิร์ตจากศิลปินดัง 27 ส.ค. พบ แพรทอง ทอนาโด 28 ส.ค. พบ ปูแดง จอนนี่ มิวสิค 29 ส.ค. พบ บารมี 30 ส.ค. พบ เฟิร์ส พรชิตา 31 ส.ค. พบ บิ๊ก สุรินทร์ 1 ก.ย. พบ โบว์ ซุปเปอร์วาเลนไทน์
มหกรรมเทศนาธรรม "มีเทศน์ มีทอล์ค" ตอน เจริญธรรม (ช่วงที่1) วันที่ 25 สิงหาคม 2567
มหกรรมเทศนาธรรม "มีเทศน์ มีทอล์ค" ตอน เจริญธรรม (ช่วงที่1) วันที่ 25 สิงหาคม 2567 ณ เซ็นทรัล อุดร
คชสาร สานศิลป์ ศิลป์ ดิน ปั้น 26 สิงหาคม 2567
คชสาร สานศิลป์ ศิลป์ ดิน ปั้น 26 สิงหาคม 2567 ณ ศูนย์อนุรักษ์ช้างไทยเขาใหญ่ ศิลปะช้างปั้น จากดิน วัสดุท้องถิ่น ชมละครหุ่นสาย ช.ช้างสร้างเมือง เล่าเรื่องธรรมชาติวิทยา ร่วมสืบสานศิลป์ รักษาสินแผ่นดิน เปิดลาน เล่าขาน ตำนานช้างโคราช ชมละครหุ่นสาย ช.ช้างสร้างเมือง ล้อมวงนั่งกลางดิน กินปิ่นโต Workshop ปั้นช้างดิน กลางเดิ่น Workshop สร้างสรรค์หุ่นสายดิน Workshop. ออกแบบ ประติมากรรม โขลงช้าง จากกิ่งไม้ใบไม้ การจัดประชุมเชิงปฏิบัติการ (Workshop) การส่งเสริมเอกลักษณ์ประจำถิ่น เสน่ห์เมืองโคราช เมืองแห่งศิลปะ โครงการพัฒนาศักยภาพชุมชนสู่การเป็นเมืองแห่งศิลปะ จังหวัดนครราชสีมา สนับสนุนโดยสำนักงานศิลปวัฒนธรรมร่วมสมัย กระทรวงวัฒนธรรม
งานสุดยอดผ้าและของดีชัยภูมิ 26-30 สิงหาคม 2567
งานสุดยอดผ้าและของดีชัยภูมิ 26-30 สิงหาคม 2567 ที่หน้าศาลากลางจังหวัดชัยภูมิ จังหวัดชัยภูมิ โดยสำนักงานพัฒนาชุมจังหวัดชัยภูมิ และเครือข่ายโอทอปจังหวัดชัยภูมิ ....จัดงานสุดยอดผ้าและของดีชัยภูมิ...26-30 สิงหาคม พ.ศ.2567 ณ บริเวณศาลากลางจังหวัดชัยภูมิ #สุดยอดผ้าไหมที่สวยงาม #ตระการตาซึ่งมีลายเอกลักษณ์ประจำจังหวัด มีรางวัลกะรันตีระดับประเทศมากมาย #เสื้อผ้าสำเร็จรูปจากผู้ผลิตผู้ประกอบการในชุมชนที่สวยงามและโดดเด่น ????????เชิญมาชม มาช้อปกัน อีกทั้งอาหารมีหม่ำเลิศรสแต่ละท้องถิ่น ซึ่งเป็นสินค้าเด่นประจำจังหวัด สุดยอดอาหารท้องถิ่นรสชาติดี เด่น มาให้ทุกท่านได้ชิม ได้ลอง แซ่บคัก แซ่บแน่พี่น้องเอ๋ย อีกทั้งของใช้เครื่องใช้ในครัวเรือน #งานไม้งานทำมือ #เครื่องประดับอัญมณี# เครื่องประดับตกแต่งสวยงาม ซึ่งในงานยังมีบริการร้านนวด สมุนไพรให้ท่านได้นวดผ่อนคลาย โดย วันที่ 26และ 29 ส.ค. มีนักร้องสาวชื่อดัง อุ้ม สุจิตรา วันที่ 27-28 ส.ค.มีวงดนตรี วงเพชรซ้อมจ้อ และวันที่ 30 เตรียมพบกับนักร้องหนุ่ม ตั้มสิทธิพงษ์ แถมยังมีชิงโชครางวัลเครื่องใช้ฟ้าแจกทุกวันภายในงานนนน
สมุทรสาคร EXPO 2024 วันที่ 26 สิงหาคม - 1 กันยายน 2567
ขอเชิญเที่ยวงาน สมุทรสาคร EXPO 2024 วันที่ 26 สิงหาคม - 1 กันยายน 2567 ณ บริเวณลานกิจกรรม หน้าศูนย์การค้า เซ็นทรัล มหาชัย จังหวัดสมุทรสาคร 26 ส.ค. 67 แช็ค ชุมแพ 27 ส.ค. 67 หนิง ปัทมา 28 ส.ค. 67 ต้นข้าว อาร์สยาม 29 ส.ค. 67 ซัน ณัฐพล 30 ส.ค. 67 ฝ้ายไทย ไหทองคำ 31 ส.ค. 67 ตรี ชัยณรงค์ 1 ก.ย. 67 ณัฐ สุรศักดิ์
งานสมโภชศาลหลักเมืองสุรินทร์ 2567 วันที่ 26 สิงหาคม 2567
งานสมโภชศาลหลักเมืองสุรินทร์ 2567 พร้อมโรงทานกว่า 300 โรงทาน วันที่ 26 สิงหาคม 2567 เริ่มแจกโรงทาน 16:30 น.เป็นต้นไป (ปิดการจราจรถนนหลักเมืองตั้งแต่สี่แยกยูเมะพลัสไปจนถึงสี่แยกร้านลอร์ด)
ประกวด "การออกแบบชุดราตรีโดยไม่ตัดเย็บ" 27 สิงหาคม 2567 LINK
ประกวดผลงานการออกแบบชุดราตรีผ้าไหมแพรวาในงาน "พราวพัสตรา แพรวาผืนผ้าแห่งแผ่นดิน ครั้งที่ 2" กับกิจกรรมประกวด "การออกแบบชุดราตรีโดยไม่ตัดเย็บ" โดยจะประกวดในวันที่ 27 สิงหาคม 2567 เวลา 10.00 - 12.00 น. ณ เวทีหอประชุม 80 พรรษาเฉลิมพระเกียรติ สนามหน้าศาลากลางกาฬสินธุ์ (หลังเก่า)
งาน “อะโบ๊ยหมะ #10 ตอน จะนะยั่งยืน” การแข่งขันเรือเกยหาด หนึ่งเดียวในไทย 27 สิงหาคม 2567
งาน “อะโบ๊ยหมะ #10 ตอน จะนะยั่งยืน” - ชมและเชียร์ “การแข่งขันเรือเกยหาด” - ช๊อป “อาหารและขนมพื้นบ้าน” - เวทีเสนา “จะนะยั่งยืน” - ร่วมสนุกกับกิจกรรมสำหรับเด็กและเยาวชนและกีฬาพื้นบ้าน วันอังคาร ที่ 27 สิงหาคม 2567 เวลา 10.00 น. - 17.30 น. ณ ชายหาดบ้านสวนกง ต.นาทับ อ.จะนะ จ.สงขลา
2024 Thailand Coffee Hub 2024 @เซ็นทรัลหาดใหญ่ 28 สิงหาคม - 1 กันยายน 2567
THAILAND COFFEE HUB 2024 หาดใหญ่ กลับมาแล้ว!! เทศกาลกาแฟที่ใหญ่ที่สุดในภาคใต้ 28 สิงหาคม – 1 กันยายน 2567 ชั้น 1 เซ็นทรัล หาดใหญ่ Hubคนรักกาแฟภาคใต้ กับกิจกรรมเพียบดังนี้
• รวมแบรนด์กาแฟพิเศษชื่อดังจากทั่วไทย มากที่สุดในภาคใต้
• SIP Thai & SIP Talk by SCATH ร่วมเปิดประสบการณ์กาแฟพิเศษระดับเวทีประกวดไปกับสมาคมกาแฟพิเศษไทย
• SIP Inter ชวนเปิดประสบการณ์กาแฟใหม่ๆ จากบาริสต้าต่างประเทศ
• Fine Robusta Omakase สัมผัสรสชาติกาแฟ Fine Robusta รูปแบบใหม่ เสิร์ฟเป็นคอร์สแบบโอมากาเสะจากบาริสต้าชื่อดัง
• Coffee Idols กระทบไหล่คนดังวงการกาแฟพิเศษ ตลอดงาน
• รวมคราฟต์โกโก้จากแหล่งปลูกทั่วไทย การันตีด้วยรางวัลช็อกโกแลตระดับโลก
• ชวนเปิดโลก Specialty Matcha ชาเขียวสุดพรีเมียม หลากหลายเมนู
• ร่วมเชียร์การแข่งขันชงกาแฟระดับประเทศ 3 รายการสุดมันส์
กิจกรรมแรลลี่ ท่องเที่ยวสร้างการรับรู้การจัดงานมหกรรมพืชสวนโลก 2572 วันที่ 28 - 29 สิงหาคม 2567
กิจกรรมแรลลี่ ท่องเที่ยวสร้างการรับรู้การจัด??านมหกรรมพืชสวนโลก 2572 โดยการท่องเที่ยวแห่งประเทศไทย สนง.นครราชสีมา ร่วมกับ หอการค้าจังหวัดนครราชสีมา ระหว่างวันที่ 28 - 29 สิงหาคม 2567 (2 วัน 1 คืน) เส้นทาง อ.เมือง - อ.คง - อ.พิมาย - อ.เฉลิมพระเกียรติ สมัครเข้าร่วมกิจกรรมในอัตรา คันละ 1,900 บาท เข้าร่วมได้ 2 ท่าน/ เสื้อร่วมกิจกรรม 2 ตัว/ที่พัก 1 คืน/อาหาร 4 มื้อ (เช้า-กลางวัน-เย็น-เช้า)/ค่าเข้าชมและร่วมกิจกรรมสถานที่ต่างๆ / ของที่ระลึกสุด Exclusive /ของรางวัลต่างๆ มากมาย (เกิน 2 ท่านจ่ายเพิ่มท่านละ 990 บาท) สอบถามรายละเอียดได้ที่ (ผอ.หมวยหอการค้าฯ) Tel.&Line : 080-1647887 ด่วนจำนวนจำกัด สำรองเข้าร่วมกิจกรรมก่อนวันที่ 20 สิงหาคม 2567
Thailand Coffee Hub เซ็นทรัล หาดใหญ่ 28 ส.ค. – 1 ก.ย. 67
Thailand Coffee Hub เทศกาลกาแฟที่ใหญ่ที่สุดในภาคใต้ ตั้งแต่ 28 ส.ค. – 1 ก.ย. 67 ที่ลานกิจกรรม ชั้น 1 ศูนย์การค้าเซ็นทรัล หาดใหญ่ รวมไฮไลต์ในงาน
รวม Specialty Coffee จากทั่วไทยเยอะที่สุดของภาคใต้
Coffee Idols เตรียมพบกับเหล่าไอดอลชาวกาแฟคนดัง
SIP Thai ชิมฟรีทุกวัน กาแฟระดับเทพ จากสมาคมกาแฟพิเศษไทย (SCATH)
SIP Inter แบรนด์ ต้นตำรับ origami dripper จากญี่ปุ่น และร้านดังจากมาเลเชีย
SIP Fine Robusta เปิดโลก หลากหลายไอเดีย เมนู ไฟน์โรบัสต้า
ช้อปฉ่ำ กับไอเทม และอุปกรณ์กาแฟใหม่ล่าสุด!
ชวนเปิดโลก Specialty Tea หลากหลายเมนู
รวมคราฟต์โกโก้จากทั่วไทย คัดเน้น Bean to Bar ระดับรางวัล
พิเศษ! รับส่วนลดทันทีเมื่อซื้อสินค้าภายในงาน
รับฟรี!* ???องที่ระลึก เพียงดาวน์โหลดแอป Central Life X และ Check in ณ จุดลงทะเบียน
ทัวร์รถไฟ..แม่พาลูกเที่ยว ล่องแก่งหินเพิง 28 สิงหาคม 2567 LINK
เชิญชวนแม่-ลูก เที่ยวทัวร์รถไฟไปเที่ยวเขาใหญ่ ปราจีนบุรี ไหว้ขอพร "เจ้าแม่กวนอิม ที่วิหารอี่หงเทียนไห้ ล่องแก่งน้ำใสที่หินเพิง กินอาหารท้องถิ่น ชิมขนมพื้นถิ่น ซื้อสินค้าชุมชนในราคาพิเศษ 999 บาท สำรองที่นั่งได้ 081-715-9451 หรือสอบถามข้อมูลเพิ่มเติมที่ ททท.สำนักงานนครนายก โทร.0-3731-2282, 0-3731-2284 ในวันจันทร์ - ศุกร์ เวลา 08.30-16.30 น.
เที่ยวงานมุกดาหารแฟร์ 2024 วันที่ 28 สิงหาคม - 1 กันยายน 2567 เซ็นทรัลชลบุรี
เที่ยวงานมุกดาหารแฟร์ 2024 ของเยอะ ฟินเว่อร์ มีทั้งผ้างามๆ ตะกร้าสุดชิค ราคาน่ารัก น่าช๊อป ข้าวสารคุณภาพ ชาสมุนไพรรสเลิศ อาหารอีสานรสเด็ด ฯลฯ พบกันได้ที่ ลานกิจกรรมชั้น 1 เซ็นทรัลชลบุรี 28 สิงหา - 1 กันยานี้
เกาะลันตา ร่วมใจ รักษ์ชายหาด Beach Clean Up 2024 วันพุธที่ 28 สิงหาคม 2567
เกาะลันตา ร่วมใจ รักษ์ชายหาด ขอเชิญร่วมเก็บขยะชายหาด Beach Clean Up 2024 ภายใต้โครงการ คลีนอัพ ลันตาใส ไร้ขยะ ประจำปี 2567 โดยเทศบาลตำบลศาลาด่าน ร่วมกับสมาคมธุรกิจการท่องเที่ยวเกาะลันตา ในวันพุธที่ 28 สิงหาคม 2567 เวลา 08.00 น.ณ หาดลองบีช (Long Beach) จุดรวมพล ซายังบีช รีสอร์ท -สวนสาธารณะหาดพระแอะ ฤดูมรสุมตะวันตกเฉียงใต้ (พ.ค-ต.ค) แหล่งกำเนิดในมหาสมุทรอินเดีย ช่วงเวลาดั่งกล่าวจะมีขยะซัดขึ้นบริเวณชายฝั่ง ทำให้มีขยะตกค้างในหลายพื้นที่
งานฟาร์มสุกที่บ้านนา และ เทศกาลปีนเขาชมหมอกหยอกตะวัน 28 สิงหาคม - 1 กันยายน 2567
ท่องเที่ยวและกีฬาจังหวัดพัทลุง ร่วมกับเทศบาลตำบลบ้านนา ขอเชิญเที่ยวงาน
#งานฟาร์มสุกที่บ้???นนา และ #เทศกาลปีนเขาชมหมอกหยอกตะวัน ปี 2 วันที่ 28 สิงหาคม - 1 กันยายน 2567 ณ จุดชมวิวบ้านนาบ้านเรา ต.บ้านนา อ.ศรีนครินทร์ จ.พัทลุง พบกับบรรยากาศสุดชิค ปีนเขาชมหมอก ณ จุดชมวิวบ้านนาบ้านเรา
กิจกรรมภายในงาน
ร่วมรับฟังเสวนา เรื่อง"ทุเรียนพื้นบ้านและจำปาดะ ไม้ผลอัตลักษณ์ตำบลบ้านนา"
ร่วมฟังเสวนาเรื่อง "การท่องเที่ยวชุมชนอย่างยั่งยืนจังหวัดพัทลุง"
ช้อปและชิมอาหารพื้นบ้านและผลไม้ตามฤดูกาล
เชคอินกับธีมงานวิถีเกษตรแนวฟาร์ม / แนวแค้มป์และทุ่งดอกไม้จากสวนลุงเวศน์
การออกร้านจำหน่ายสินค้าจากกลุ่มอาชีพและกลุ่ม OTOP ทั้งในพื้นที่และเครือข่ายในจังหวัดพัทลุง
ชมการประกวดมิสทองเลี้ยว
เดินแบบผ้าไทยสโลว์ไลฟ์ที่บ้านนา
ชุดการแสดงจากหมู่บ้านและโรงเรียน
โต๊ะจีนผลไม้
นิทรรศการแหล่งท่องเที่ยวในตำบลบ้านนา
ลุ้นรางวัลทำความดีที่บ้านนากับกองทุนเยียวยาผู้ป่วยติดเตียง
ฟรีคอนเสิร์ต ทุกคืน
28 ส.ค. 67 พบกับ วงบรรเจิด / เมนทอล / และเดช อิสระ
29 ส.ค. 67 พบกับ วงบันดีลัน / บ่าววี
30 ส.ค. 67 พบกับ ดร คนจร / วงแบรนด์เนม / มายมอมแมม
31 ส.ค. 67 พบกับ วงสองกลม / วงมาลายู / คณะขวัญใจ
1 ก.ย. 67 พบกับ กล้วยแสตมป์ /ลาบานูน
28 สิงหาคม โรงพยาบาลราชบุรี รับบริจาคอวัยวะ ผู้ป่วยชายไทยอายุ 74 ปี
4 กันยายน 2567 โรงพยาบาลราชบุรี รายงานการรับบริจาคอวัยวะ ผู้ป่วยชายไทยอายุ 74 ปี สมณเพศพระภิกษุ มาด้วยอาการซึมลง ไม่รู้สึกตัว ใส่ท่อช่วยหายใจ รับส่งต่อจากโรงพยาบาลปากท่อ เข้ารักษาตัวที่ห้องผู้ป่วยหนักอายุรกรรม1 แพทย์ได้ให้การรักษาผู้ป่วยอย่างเต็มที่ เนื่องจากผู้ป่วยมีโรคประจำตัวหลายโรค และเสียชีวิตในวันที่ 28 สิงหาคม 2567 ทีมพยาบาลผู้ดูแลให้ข้อมูลการบริจาคดวงตา ภรรยาและบุตรเห็นว่าการบริจาคดวงตาเป็นการทำบุญใหญ่ให้ผู้ป่วย และเป็นประโยชน์ต่อผู้รอคอยการเปลี่ยนถ่ายกระจกตา
โรงพยาบาลราชบุรี จึงขอเชิดชูเกียรติผู้บริจาคที่ได้สร้างกุศลอันยิ่งใหญ่ คือการบริจาคดวงตาให้ศูนย์ดวงตาสภากาชาดไทย ในโอกาสนี้ นายแพทย์บรรจง เปรื่องประสพ รองผู้อำนวยการฝ่ายการแพทย์ โรงพยาบาลราชบุรี พว.ประจวบ ทองเจริญ ผู้แทนหัวหน้ากลุ่มการพยาบาล และคณะเจ้าหน้าที่โรงพยาบาลราชบุรี ร่วมมอบเกียรติบัตร และพวงหรีด เพื่อเป็นเกียรติกับผู้บริจาคและครอบครัว
ประกวดวงดนตรี น้องเหน่อ" Music Festival Award
ประกวดวงดนตรี "น้องเหน่อ" Music Festival Award สมัครด่วน วันนี้ถึง 5 ส.ค.67 รอบชิง 29 ส.ค.67
งานมหกรรมสินค้าสหกรณ์ ชิม ช้อป ใช้ 2024 วันที่ 29 สิงหาคม - 2 กันยายน 2567
งานมหกรรมสินค้าสหกรณ์ ชิม ช้อป ใช้ 2024 วันที่ 29 สิงหาคม - 2 กันยายน 67 ที่ลานหน้าเซ็นทรัลพิษณุโลก พบกับสินค้าอาหารสด อาหารแปรรูป ผักผลไม้สด และข้าวคุณภาพเยี่ยมจากเกษตรกรท้องถิ่น จัดโดยสำนักงานสหกรณ์ จังหวัดพิษณุโลก
งานฮาลาลยิ่งใหญ่แห่งปีของภาคใต้ WORLD HAPEX 2024 วันที่ 29 สิงหาคม - 1 กันยายน 2567
งานฮาลาลยิ่งใหญ่แห่งปีของภาคใต้ WORLD HAPEX 2024 งานแสดงสินค้าและการประชุมสัมนานานาชาติด้านฮาลาลณ ศูนย์ประชุมนานาชาติฉลองสิริราชสมบัติครบ ๖๐ ปี อำเภอหาดใหญ่ จังหวัดสงขลาวันที่ 29 สิงหาคม - 1 กันยายน 2567
9 วันปันน้ำใจ Amazing Nan Marathon ขอเชิญชวนเพื่อนๆ สั่งจองเสื้อที่ระลึก เพื่อช่วยเหลือเหตุการณ์น้ำท่วมในจังหวัดน่าน LINK
9 วันปันน้ำใจ (สั่งจอง 29 สิงหาคมถึง 6 กันยายน 2567) Amazing Nan Marathon ขอเชิญชวนเพื่อนๆ สั่งจองเสื้อที่ระลึก เพื่อช่วยเหลือเหตุการณ์น้ำท่วมในจังหวัดน่าน
ตัวละ 250 บาท (จัดส่งฟรี)
รายได้หักตัวละ 100 บาท เพื่อส่งมอบให้ ส่วนงานการศึกษาในจังหวัดน่าน เพื่อนำไปช่วยโรงเรียนในจังหวัดที่ได้รับผลกระทบจากน้ำท่วมในครั้งนี้
หมายเหตุ : จัดส่งภายในราชอาณาจักรไทยเท่านั้น
กรณีมีผู้ประสงค์สนับสนุนแบบไม่รับเสื้อ สามารถช่วยสนับสนุนผ่านบัญชีได้ที่
บัญชีไทยพาณิชย์
เลขที่ 077-276676-2
ชื่อบัญชี ศิรดา สีหโรจน์
โอนแล้วรบกวนแปะสลิปในคอมเม้นต์ใต้โพสให้ด้วยนะคะ เพื่อความโป่งใสในการตรวจสอบ
เปิดจองเสื้อที่ระลึก เพื่อช่วยเหลือเหตุน้ำท่วมในจังหวัดน่าน / Open for reservations for souvenir shirts To help with flooding in Nan Province >>
forms.gle
สำหรับนักวิ่งที่สมัครวิ่งในวันนี้ - 6 ก.ย 2567 ทุกการสมัคร จะปัน 100 บาท เพื่อสมทบ และส่งมอบให้ ส่วนงานการศึกษาในจังหวัดน่านด้วยเช่นกัน
เทศกาลขนหัวลุก...เวียงพิงค์ 29 สิงหาคม - 1 กันยายน 2567
เทศกาลขนหัวลุกที่สุดความสยอง ท้าคุณมาพิสูจน์ความกล้าในเทศกาล "เทศกาลขนหัวลุก...เวียงพิงค์" วันที่ 29 สิงหาคม - 1 กันยายน เวลา 16.00-23.00 น. ณ สวนสาธารณะบนที่ดินของการรถไฟ จังหวัดเชียงใหม่ [
พิกัด]
ภายในงานมีกิจกรรมมากมายให้ทุกคนได้สนุกสนาน ไหว้ขอพรสิ่งศักดิ์สิทธิ์ เสด็จพ่อ ร.5 พระพุทธรูปในหอธรรม ทำบุญโลงศพ รับสายสิญจน์จาก พระอาจารย์พยุงศักดิ์ วัดป่าแดด เชียงใหม่ มาดูดวงจากหมอดูชื่อดัง ไปสนุกกันต่อกับสวนสนุกย้อนยุค นั่งชิวดูหนังกลางแปลง พร้อมสยองไปกับ Haunted Gallery ปิดท้ายกับ คอนเสิร์ตมันส์ๆกับศิลปินชื่อดัง ที่เรารวมความสนุก
ใครกลัวแต่ชอบกิน ก็แวะมาชิม Street Food สายมู แทนได้ อาทิ ลูกชิ้นลงยันต์ ควายธนูแดดเดียว ข้าวจี่คำเปลว และอื่นๆอีกมามาย
มหกรรมของดี วิถีชุมชนคนชัยนาท 29-31 สิงหาคม 2567 LINK
ขอเชิญเที่ยวงาน “มหกรรมของดี วิถีชุมชนคนชัยนาท” ระหว่าง วันที่ 29-31 สิงหาคม 2567 ณ บริเวณเขื่อนเรียงหิน อำเภอเมือง จังหวัดชัยนาท ตั้งแต่เวลา 11.00-21:00 น. ภายในงานพบกับ * ชม - นิทรรศการโคกหนองนา - การออกบูธจำหน่ายสินค้าของผู้ประกอบการ OTOP-KBO- Quadrant D - การแสดงดนตรี * ช็อป - สินค้าจากผู้ประกอบการกว่า 95 บูธ รวม 300 กว่ารายการ - เลือกชื้อผลิตภัณฑ์อาหารปลอดภัยและผักอินทรีย์ ฯลฯ * ชิม - อาหารพื้นถิ่นและอาหารจากผลิตภัณฑ์ที่ยกระดับจากโครงการพัฒนาสินค้า KBO-Quadrant D รวมถึงเครือข่ายอาหารปลอดภัยจำนวน 10 บูธ เป็นต้น พร้อมทั้งเปิดเวทีเจรจาธุรกิจผู้ชื้อพบผู้ขายในราคาสุดพิเศษทุกวันเวลา 16.00 น. สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักงานพัฒนาชุมชนจังหวัดชัยนาท
งาน “ประชารัฐร่วมใจ ระนองก้าวต่อไป พัฒนาเครือข่ายเกษตรปลอดภัย สู่อาหารปลอดภัย สร้างรายได้ให้ชุมชน” 28-29 สิงหาคม 2567
ขอเชิญเที่ยวงาน “ประชารัฐร่วมใจ ระนองก้าวต่อไป พัฒนาเครือข่ายเกษตรปลอดภัย สู่อาหารปลอดภัย สร้างรายได้ให้ชุมชน” ระหว่างวันที่ 28-29 สิงหาคม 2567 เวลา 13.00 - 22.00 น. ณ ลานอเนกประสงค์หน้าเทศบาลเมืองระนอง พบกับกิจกรรม การส่งเสริมและเชื่อมโยงช่องทางการตลาด
การจัดแสดงและจำหน่ายผลิตภัณฑ์โดยกลุ่มผู้ประกอบการอาหารปลอดภัย และเครือข่ายเกษตรปลอดภัย เช่น มะม่วงหินพานต์ โกโก้ กาแฟ มังคุด อาหารทะเลแปรรูป ไข่เค็มดินขาวน้ำแร่บ้านหาดส้มแป้น สังขยาเกาะคณฑี ซาลาเปาบ้านทับหลี ฯลฯ และกิจกรรมบนเวที ดังนี้
วันที่ 28 ส.ค. 67 17.30 น. การเสวนา หัวข้อ “การส่งเสริมช่องทางการตลาด และการพัฒนาเครือข่ายเกษตรปลอดภัยสู่อาหารปลอดภัย สร้างรายได้ให้ชุมชน” 19.00 น. การแสดงจากกลุ่มไลน์แดนซ์ 20.00 น. วง Me Skill ร.ร.พิชัยรัตนาคารระนอง 21.00 น. วง Haff pass five ร.ร.ปากจั่นวิทยา
วันที่ 29 ส.ค. 67 18.30 น. การแสดงจากกลุ่มไลน์แดนซ์ 19.00 น. วง Set Zero ร.ร.กะเปอร์วิทยา 20.00 น. วง Me Skill ร.ร.พิชัยรัตนาคารระนอง มาให้กำลังใจผู้ประกอบการ และเยาวชน เศรษฐกิจฐานรากมั่นคง ชุมชนเข้มแข็งอย่างยั่งยืน ด้วยหลักปรัชญาของเศรษฐกิจพอเพียง
กิจกรรม "พันธุ์ทาง พันธุ์เท่" 29 สิงหาคม 2567 ลานกิจกรรมด้านหน้ามาร์เก็ตวิลเลจหัวหิน
กิจกรรม "พันธุ์ทาง พันธุ์เท่" และสนุกไปกับ ครอบครัว "เทย กะ ทะ" ภายในงานประกอบด้วยกิจกรรม -การฉีดวัคซีนให้แก่สุนัขและแมวฟรี จำนวน 100 ตัว -การไถขนฟรี โดยคุณแอ็ดดี้ ช่างตัดขนจิตอาสา -กิจกรรมแจกสินค้า รับอาหารตัวอย่างฟรี จากผู้ผลิตหลากหลายแบรนด์ดัง -พิเศษ !! ร่วมพูดคุยกับ ครอบครัวเทยกระทะของแม่บูม พร้อมร่วมสนุกเล่นเกมกับเซเลปพันทาง คุณหนูเป็ปซี่ และคุณนายหมูทะ เวลา 13.00 - 16.00 น. กิจกรรมนี้ จัดเพื่อเปิดรับบริจาคสิ่งของและอาหารให้น้องสี่ขา ผ่าน 8 มูลนิธิ ที่ดูแลสุขและแมวจรทั่วประเทศ วันที่ 29 สิงหาคม 2567 ณ ลานกิจกรรมด้านหน้ามาร์เก็ตวิลเลจหัวหิน เวลา 11:00-17:00 น.
อบรม รู้เขารู้เรา เข้าใจธุรกิจ พิชิตยอดขายออนไลน์ ต่อยอดเพิ่มมูลค่าพ่อค้าแม่ค้าonline 30-31 สิงหาคม 2567
กิจกรรมสุดปัง เอาใจพ่อค้าแม่ค้ายุคใหม่ “รู้เขารู้เรา เข้าใจธุรกิจ พิชิตยอดขายออนไลน์” กับโครงการอบรมต่อยอดเพิ่มมูลค่าให้กับสินค้าในชุมชนจังหวัดนนทบุรีและนครปฐม วันศุกร์ที่ 30 และ วันเสาร์ที่ 31 สิงหาคม 2567 ณ โรงแรมแกรนด์ ริชมอนด์ จังหวัดนนทบุรี พร้อมบริการอาหารกลางวัน จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดนนทบุรี
วันศุกร์ที่ 30 สิงหาคม 2567
09.00 - 12.00 จัดอมรบ ออกแบบบรรจุภัณฑ์ (Packaging Design)โดย ดร.กิตติโชค นิธิเสถียร
12.00 - 13.00 พักเบรค ทานอาหารกลางวัน
13.00 - 16.00 จัดอมรมพัฒนาสินค้า ( Product Development)โดย คุณอภินัทธ์ สมภักดี
วันเสาร์ที่ 31 สิงหาคม 2567
09.00 - 12.00 จัดอบรม กลยุทธ์การตลาด (Marketing Strategy)โดย คุณสมฤทัย ฮินชอว์
12.00 - 13.00 พักเบรค ทานอาหารกลางวัน
13.00 - 16.00 จัดอบรมการตลาดบนสื่อออนไลน์ (Online Marketing)โดย ผู้ช่วยศาสตราจารย์ ดร.เอก ชุณหชัชราชัย
ทุกท่านจะได้เรียนรู้การต่อยอดอาชีพในด้านต่าง ๆ ที่น่าสนใจ เช่น เรียนรู้เรื่องการพัฒนาสินค้า การออกแบบบรรจุภัณฑ์ การตลาดและการสร้างกลยุทธ์บนสื่อออนไลน์ พร้อมได้รับประกาศไปรษณียบัตรจากทางงาน
ห้ามพลาดกิจกรรมดี ๆ รอคุณอยู่เพียบในงาน “เสน่ห์ใกล้กรุง รักษ์คลองพระพิมล ท่องเที่ยววิถีสายธารสู่ความยั่งยืน”
จำกัดวันละ 50 ท่าน
• ต้องเป็นคนในจังหวัดนนทบุรีและนครปฐมเท่านั้น
• ต้องมีโทรศัพท์มือถือเข้าร่วมการอบรมหรือมีคอมพิวเตอร์ก็สามารถนำมาได้
• สามารถนำสินค้าเพื่อตัวอย่างให้ทางอาจารย์สอนได้
พิกัดโรงแรม แกรนด์ ริชมอนด์ นนทบุรี
เทศกาลดนตรีกับความสนุกตรงเส้นขอบฟ้า AMAZING MUSIC FESTIVAL Over The Horizon 30 สิงหาคม - 1 กันยายน 2567
เทศกาลดนตรีกับความสนุกตรงเส้นขอบฟ้า AMAZING MUSIC FESTIVAL Over The Horizon 30 สิงหาคม - 1 กันยายน 2567 นี้ ณ ชายหาดพัทยากลาง พบกับศิลปิน อาทิ NENE PORNNAPPAN / THE TOYS /DAOU PITTAYA/ YINWAR/ ATOM/VIOLETTE WAUTIER/TWOPEE และกิจกรรมอื่น ๆ มากมาย
เทศกาลแห่งความสุข Southern Bliss Fest แดนใต้ 30 สิงหาคม - 1 กันยายน 2567
เทศกาลแห่งความสุข Southern Bliss Fest ความสุขแดนใต้ คอนเสิร์ตในบรรยากาศติดหาดขนอมที่ไม่ควรพลาด มารับลมทะเล ฟังเสียงคลื่น ตะโกนเพลงรัก ร้องเพลงอกหักแบบทำถึง 30 สิงหาคม ถึง 1 กันยายน 2567 ณ ถนนคนเดินชายเล ขนอม จังหวัดนครศรีธรรมราช ตั้งแต่ 14.00 น. เป็นต้นไป งานนี้เข้าฟรี ไม่มีค่าใช้จ่าย
พบกับศิลปินชื่อดัง Lomosonic นักร้องวงร็อค เจ้าของเพลงฮิตร้อยล้านวิว หนิง The Voice นักร้องสาวเสียงห้าว และศิลปินอื่นๆอีกคับคั่ง พร้อมเต็มอิ่มกับบูธอาหาร เครื่องดื่มกว่า 40 บูธ workshop กิจกรรมสายอาร์ต พร้อมสนุกกับกิจกรรมมากมาย
Fashion on the Road 2nd” Chiang Rai Designer’s Competition 30,31 สิงหาคม - 1 กันยายน 2567
“Fashion on the Road 2nd” Chiang Rai Designer’s Competition งานแสดงและตัดสินเชียงรายแฟชั่นโชว์จาก Designers ซีซั่น 2 . วันที่ 30,31 สิงหาคม - 1 กันยายน 2567 เวลา 10.00 – 22.00 น. ณ บริเวณหน้าด่านพรมแดนไทย – เมียนมา อ.แม่สาย จ.เชียงราย
HATYAI OUTLOUD เทศกาลศิลปะ แสงสี ดนตรี ใจกลางหาดใหญ่ ศุกร์ 30 สิงหา ถึง อาทิตย์ 1 กันยา 67
HATYAI OUTLOUD เทศกาลศิลปะ แสงสี ดนตรี ใจกลางหาดใหญ่ ศุกร์ 30 สิงหา ถึง อาทิตย์ 1 กันยา 67 ณ ลานสุขใจ (หน้าสถานีรถไฟหาดใหญ่) และ ย่านตึกเก่า ถ.นิพัทธ์อุทิศ 1 พบกับศิลปินเหล่านี้
- ศ 30 สิงหา ไปสนุกกับ Paradox
- ส 31 สิงหา ไปจอยกับ Musketeers
- อา 1 กันยา ไปมันส์กับ Lomosonic
Free Entry เข้าชมฟรี
สานสัมพันธ์ ๕ ชาติพันธุ์ เพชรสมุทรคีรี จ.สมุทรสงคราม 30 สิงหาคม - 3 กันยายน 2567
ททท.สำนักงานสมุทรสงคราม ขอเชิญชวนร่วมงาน “สานสัมพันธ์ ๕ ชาติพันธุ์ เพชรสมุทรคีรี” จ.สมุทรสงคราม 30 สิงหาคม - 3 กันยายน 2567
อนุสรณณ์สถานแฝดอิน-จัน อ.เมือง จ. สมุทรสงคราม
งาน "สานสัมพันธ์ ๕ ชาติพันธุ์ เพชรสมุทรคีรี" เป็นงานท่องเที่ยววิถีไทยเชิงวัฒนธรรม ที่สำนักงานการท่องเที่ยวและกีฬากลุ่มจังหวัดภาคกลางตอนล่าง 2 จัดขึ้น โดยมี สำนักงานการท่องเที่ยวและกีฬาจังหวัดสมุทรสงครามเป็นเจ้าภาพ
ภายใต้ความร่วมมือของกลุ่มจังหวัดภาคกลางตอนล่าง 2 ประกอบด้วย จังหวัดสมุทรสงคราม จังหวัดสมุทรสาคร จังหวัดเพชรบุรี และจังหวัดประจวบคีรีขันธ์ ในงาน "สานสัมพันธ์ ชาติพันธุ์ เพชรสมุทรคีรี" จะนำเสนอวัฒนธรรมอันมาจากวิถีชีวิตที่สีบทอดกันมาจากประวัติศาสตร์ของกลุ่มชาติพันธุ์ เพื่อให้เกิดคุณค่าและการอนุรักษ์หวงแหนมรดกทางวัฒนธรรมให้คงอยู่และดำเนินต่อไป โดยได้นำบรรยากาศชีวิตความเป็นอยู่ ศิลปวัฒนธรรม อัตลักษณ์ของชาวชาติพันธุ์ทั้ง 5 คือ ไทยท้องถิ่น ไทยมอญรามัญ ไทยจีน ไทยทรงดำ และกะเหรี่ยง มาจัดแสดงให้นักท่องเที่ยวได้สัมผัสในแห่งเดียว
ภายในงานจะมีทั้งการโชว์และแลกเปลี่ยนศิลปวัฒนธรรม ดนตรี การแสดงของแต่ละชาติพันธุ์ รวมถึงส่งเสริมการจำหน่ายสินค้าชาติพันธุ์ และการประกวดนางงามชาติพันธุ์ เป็นการสร้างกระแสซอฟพาวเวร์เชิงวัฒนธรรมอันทรงคุณค่าของชาติพันธุ์เพื่อสื่อสารกับผู้มาเยี่ยมเยือน โดยเฉพาะกลุ่ม นักท่องเที่ยวคุณภาพที่เดินทางมาท่องเที่ยวในกลุ่มจังหวัดภาคกลางตอนล่าง 2 ให้เพิ่มมากขึ้นนอกเหนือจากที่เดินทางมาเพื่อชมความงดงามของฝั่งทะเลธรรมชาติของจังหวัดในโซนนี้
สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานการท่องเที่ยวและกีฬาจังหวัดสมุทรสงคราม โทร. 0 3471 7213 Facebook : @สำนักงานการท่องเที่ยวและกีฬาจังหวัด สมุทรสงคราม
กิจกรรมเก็บขยะทะเลชายหาดบ้านสอด เกาะลันตาน้อย จ.กระบี่ 30 สค - 1 กย 67
เชิญร่วมกิจกรรมเก็บขยะทะเลชายหาดบ้านสอด เกาะลันตาน้อย จ.กระบี่ . วันที่ 30 สค 67 ✅(7:30-9:00) เก็บขยะทะเลชายหาดบ้านสอด ✅(9:40-10:10) บรรยายเปลี่ยนขยะให้เป็นพลังงาน ✅(10:10-12:30) Workshop เปลี่ยนขยะเป็นผลิตภัณฑ์ใหม่ ✅(13:30-16:00) จิตอาสาร่วมปูพื้นลานเอนกประสงค์จากบล็อกรีไซเคิล . วันที่ 31 สค 67 ✅(9:00-16:00) จิตอาสาร่วมปูพื้นลานเอนกประสงค์จากบล็อกรีไซเคิล . วันที่ 1 กย 67 ✅(9:30-10:00) ส่งมอบลานเอนกประสงค์ให้แก่ชุมชนทุ่งหยีเพ็ง. สอบถามข้อมูล โทร 061-2747218
Thai International Travel Fair North 2024 TITF NORTH 24 วันที่ 30 สค - 1 กย 2567


งานแฟร์การท่องเที่ยวในเชียงใหม่ Thai International Travel Fair North 2024 TITF NORTH 24 กลับมาอีกแล้ว 30 สค - 1 กย 2567 ณ Central Chiang Mai (Cen Fest) พิธีเปิด 17:00 น วันที่ 30 สิงหาคม 2567 งานที่จะได้พบกับบูทการท่องเที่ยวจากนานาประเทศ - บูทการท่องเที่ยวมาเลเซีย - บูทการท่องเที่ยวเกาหลี - บูทการท่องเที่ยวจีน - บูทการท่องเที่ยวฟิลิปปินส์ - บูทการท่องเที่ยวไต้หวัน - บูทสายการบิน Air China - บูทสายการบิน Air Asia / Air Asia X - บูทสายการบิน EVA Air - บูทสายการบิน China Airlines - บูทสายการบิน STARLUX - บูทสายการบิน VietJet Air - บูทสายการบิน Bhutan Airlines - บูทสายการบิน Myanmar Int Airways - บูทสายการบิน Salam Air - บูทสายการบิน Nok Air - บูทสายการบิน Lion Air - บูท AIS 5G - บูท Central - บูท Travel Agency 15 บูท - บูทกาแฟ The Baristro Pop Up Store - พร้อมสปอนเซอร์ของงาน ได้แก่ Thai Amadeus Southeast Asia - TRAVELPORT - Best International - TTN tour - Real Journey tour -Tune Insurance - TBO. COM - ประกันภัยไทยวิวัฒน์ #มหกรรมการท่องเที่ยวต่างประเทศที่ยิ่งใหญ่ที่สุดในภาคเหนือ
Iconic Craft Coffee Expo 2024 @ไอคอนสยาม 30 สิงหาคม - 8 กันยายน 2567
Iconic Craft Coffee Expo 2024 งานกาแฟใหญ่ที่สุดแห่งปีในฝั่งธน คอกาแฟอย่าพลาด ตั้งแต่ 30 สิงหาคม - 8 กันยายน 2567 ที่ไอคอนสยามชั้น M เจริญนครฮอลล์ และ ธาราฮอลล์ ชั้น M และ ICS (ตรงข้ามไอคอนสยาม)
5 ปีที่ไอคอนสยามเปิดประวัติศาสตร์ความสำเร็จให้วงการกาแฟด้วยการยกระดับเทศกาลกาแฟสู่ความครบเครื่องที่สมบูรณ์แบบที่สุด ต่อยอดกาแฟไทยให้ก้าวไกลสู่ระดับโลก และตอบโจทย์ธุรกิจตั้งแต่ต้นน้ำจนถึงปลายน้ำอย่างครอบคลุม ไฮไลต์มหกรรมงานกาแฟที่ไอคอนสยาม
หนึ่งในไฮไลต์ของงานก็คือการแข่งขัน Thailand Iconic Coffee & Creativity Championship 2024 (TICC) “Thai Identity to the World เอกลักษณ์ไทยสู่ระดับโลก” ที่จะตัดสินผู้ชนะแชมป์บาริสต้าโดยกรรมการระดับโลก สมัครเข้าร่วมแข่งขันได้ที่ https://bit.ly/4dK3cZT โดยจะประกาศรายชื่อผู้ได้รับสิทธิ์เข้าร่วมแข่งขันในวันที่ 27 ส.ค. 67 ทาง FB ICONSIAM การแข่งขันตั้งแต่ 3 ก.ย. 67 – 8 ก.ย. 67 และสนุกไปกับบรรยากาศสุดรื่นรมย์ของงาน ICONIC CRAFT COFFEE EXPO ตั้งแต่ 30 ส.ค.67 – 8 ก.ย. 67
• กว่า 1,000 เมนู จาก 230 ร้านดัง บนพื้นที่กว่า 4,000 ตารางเมตรจะอัดแน่นด้วยความอร่อยของเครื่องดื่มจากฝีมือบาริสต้า
• ครั้งแรกกับการแข่งขันชิงเงินรางวัลกว่า 100,000 บาท Thailand Iconic Coffee & Creativity Championship 2024 (TICC) เพื่อเฟ้นหาบาริสต้าผู้ชนะโดยกรรมการระดับโลก
• เอ็กซ์คลูซีฟยิ่งกว่าเดิมกับการเปิดเวิร์คช็อปให้ทุกคนเข้าร่วมฟรี! ทุกเวิร์คช็อปจะดูแลโดยคุณแคท-ชัญญา ธาราธิคุณเดช กรรมการตัดสินบาริสตาเวทีระดับโลก World Barista Championship และ World Coffee in Good Spirits Championships
• ร่วมเอนจอยไปกับบรรยากาศที่รายล้อมด้วยตัวจริงเรื่องกาแฟ ICONIC PERSON จากทั่วโลกที่จะมาปักหมุดเสิร์ฟเคล็ดลับกันถึงที่
• ยิ่งช็อปยิ่งคุ้มกับโปรโมชั่นพิเศษ “ICONIC Craft Coffee Journey” ให้ทุกคนได้ช็อปเมล็ดกาแฟ อร่อยกับเมนูเอ็กซ์คลูซีฟที่ดูแลโดยแชมป์ระดับโลก เรื่อยไปจนถึงการช็อปอุปกรณ์ชงกาแฟแล้วสามารถสะสมแต้มเพื่อรับของรางวัลสุดพิเศษ
• รวบรวมสินค้าเกี่ยวกับกาแฟหลากหลายมิติ ตั้งแต่แบรนด์กาแฟระดับโลก เมล็ดกาแฟชื่อดังของไทยและต่างประเทศ รวมถึงเมล็ดกาแฟ GI หนึ่งใน Soft Power ของประเทศไทย เครื่องชงกาแฟ และอุปกรณ์เกี่ยวกับกาแฟต่าง ๆ แบบครบวงจร
• รวมร้านกาแฟเด็ดและดัง ตั้งแต่ร้านกาแฟชุมชน คาเฟ่สุดชิก ไปจนถึงร้านของเซเลบริตี้ ศิลปินดารา รวมถึงร้านขนมหวานและร้านเบเกอรี่
งาน ภูษาหัตถศิลป์ ถิ่นอุทัย 30 สิงหาคม - 1 กันยายน 2567
เชิญแวะเที่ยวงาน "ภูษาหัตถศิลป์ ถิ่นอุทัย" มหกรรมผ้าทอของเด่น ของดี จังหวัดอุทัยธานี และ สินค้าโรงงาน ชมฟรี ‼️ มินิคอนเสิร์ต เต๋า ภูศิลป์ ตระการตาแฟชั่นผ้าทอผ้าถิ่นอุทัยธานี และการแสดงศิลปะวัฒนธรรม พิเศษ!! ร่วมกิจกรรมรับของสมนาคุณ ห้ามพลาด "งานภูษาหัตถศิลป์ ถิ่นอุทัย" ระหว่างวันที่ 30 สิงหาคม 2567 - 1 กันยายน 2567 ณ บริเวณหอนาฬิกาจังหวัดอุทัยธานี สอบถามข้อมูลเพิ่มเติมได้ที่ : สำนักงานอุตสาหกรรมจังหวัดอุทัยธานี
งานมหกรรมของดีชายแดนใต้ OTOP ทั่วไทย ร่วมใจสู่เมืองระยอง วันที่ 30 สิงหาคม - 8 กันยายน 2567
งานมหกรรมของดีชายแดนใต้ OTOP ทั่วไทย ร่วมใจสู่เมืองระยอง วันที่ 30 สิงหาคม - 8 กันยายน 2567 บริเวณโดมแอร์สนามกีฬากลางระยอง จังหวัดระยอง
งาน OTOP ประชารัฐร่วมใจ ส่งเสริมตลาดของดี จังหวัดระยอง 30 สิงหาคม - 1 กันยายน 2567
ขอเชิญเที่ยวงาน OTOP ประชารัฐร่วมใจ ส่งเสริมตลาดของดี จังหวัดระยอง วันที่ 30 สิงหาคม - 1 กันยายน 2567 ณ บริเวณฮอลล์แสดงสินค้า ชั้น 3 ศูนย์การค้าแพชชั่น ช้อปปิ้ง เดสติเนชัน ระยอง ชมการแสดง 30 ส.ค. 67 กานต์ ทศน 31 ส.ค. 67 เต๋า ภูศิลป์ 1 ก.ย. 67 ไรอัล กาจบัณฑิต
The Idle X Siam Carnival สวนสนุกเคลื่อนที่ นวนคร 30 ส.ค - 15 ก.ย 2567
นวนคร ปทุมธานี เตรียมตัวสนุกกับ The Idle X Siam Carnival สวนสนุกเคลื่อนที่ ชิงช้าสวรรค์สูง 40 เมตร วันที่ 30 ส.ค- 15 ก.ย 2567 เวลา: 17:00 น. - 23:00 น. สถานที่: ลานด้านหลัง โตโยต้า เฟรนส์ชิบ นวนคร (ดิ ไอเดิล โฮเทล แอนด์ เรสซิเดนซ์)
พบกับบรรยากาศคาร์นิวัลสุดคลาสสิก สวนสนุกเคลื่อนที่ พร้อมเครื่องเล่นนานาชาติกว่า 20 ชนิด ร้านอาหาร พร้อมกิจกรรมพิเศษ ฟรี คอนเสิร์ต จากศิลปินดัง
1 ก.ย เจน ไทรถแห่ (เต็มวง)
4 ก.ย ร็อค คงคย (เต็มวง)
7 ก.ย รถแห่ ดาวเคียงเดือน
8 ก.ย วงไม้เลื้อย
ค่าบัตรเข้างาน: 15 บาท
ค่าเครื่องเล่น: อย่างละ 60 บาท
งานวัด"ย้อนยุคเมืองพระบาง" วันที่ 30-31 สิงหาคม 2567
ขอเชิญเที่ยวงานวัด"ย้อนยุคเมืองพระบาง" นมัสการพระพุทธชินวรมงคลบรรพต พระพุทธมหาธรรมราชาบรมปาล พระพุทธไสยาสน์ นมัสการปิดทองขอพรหลวงพ่อทอง สุวณฺโณ สุดยอดพระเกจิแห่งเมืองปากน้ำโพ ????ชมการแสดงศิลปวัฒนธรรมพื้นบ้าน การแสดงกลองยาว ระบำสุโขทัย สาธิตอาหารพื้นถิ่น ๑ จังหวัด ๑ เมนู เชิดชู อาหารถิ่นของจังหวัดนครสวรรค์ ประจำปี ๒๕๖๗ และตลาดวิถีชุมชนเมืองพระบาง วันที่ ๓๐ และ ๓๑ สิงหาคม ๒๕๖๗ วันที่ ๓๐ สิงหาคม ๒๕๖๗ ชมลิเกดังเมืองนครสวรรค์คณะไพศาล เพียรศิลป์ วันที่ ๓๑ สิงหาคม ๒๕๖๗ ชมโขนเยาวชนจาก วัดหนองโพ ลิเกดังเมืองนครสวรรค์คณะโด่ง พืสดาร และวงดนตรีลูกทุ่งเยาวชนโรงเรียนเทศบาลวัดไทรเหนือ ขอเชิญร่วมแต่งผ้าไทย เที่ยวงานวัดย้อนยุคเมืองพระบาง
The Chocolate Woods Festival วันที่ 30 สิงหาคม - 1 กันยายน 2567
The Chocolate Woods Festival วันที่ 30 สิงหาคม - 1 กันยายน 2567 เวลา 10.00 - 20.00 น. ณ The Harmony Resort อ.สวนผึ้ง จ.ราชบุรี เทศกาลช็อคโกแลตที่จะทำให้ทุกท่านได้พบกับเรื่องราวและรสชาติดี ๆ ของผลิตภัณฑ์ที่ได้รับการรังสรรค์จากโกโก้คุณภาพชั้นดีของจังหวัดราชบุรี
ภายในงานพบกับกิจกรรม - การออกบูทจำหน่ายผลิตภัณฑ์จากโกโก้มากมาย กิจกรรม Spa Chocolate กิจกรรม โยคะในสวน กิจกรรม Work Shop Chocolate Painting ฮีลใจ กิจกรรม สาธิตการทำอาหาร เมนูแสนพิเศษ กิจกรรม TALK 4 หัวข้อน่ารู้ของ Chocolate กิจกรรม ดนตรีในสวน ???? กิจกรรม Highlight : Chocolate Fine Dining กับ 8 เชฟ ร้านดังในสวนผึ้ง (31 ส.ค.) กิจกรรม Highlight : การประกวด The Chocolate Wood Young Model (1 ก.ย.)
มหัศจรรย์ แนวกิน ถิ่นสบายดี Esan Food Good Taste 30 สิงหาคม – 1 กันยายน 2567
สำนักงานการท่องเที่ยวและกีฬาจังหวัดหนองคาย และ อิสาน บ้านสาวเฉิ่มขอเชิญทุกท่านร่วมกิจกรรม งาน “มหัศจรรย์ แนวกิน ถิ่นสบายดี” Esan Food Good Taste ระหว่าง วันที่ วันที่ 30 สิงหาคม – 1 กันยายน 2567 ณ ลานวัฒนธรรมพญานาคคู่ หน้าวัดลำดวน จังหวัดหนองคาย ภายในงานพบกับของดี ของแซ่บ จาก 5 จังหวัด กลุ่มสบายดี (หนองคาย อุดรธานี หนองบัวลำภู บึงกาฬ เลย) และ รับชมการแสดงวัฒนธรรมอีสาน คณะโปงลาง และ หมอรำกลอน พร้อมกิจกรรม Work Shop อาหารพื้นถิ่น ไปกับเชฟคนดังมีชื่อเสียงระดับประเทศ จัดงานโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดหนองคาย
งานเกษตรสามโก้และของดีเมืองอ่างทอง 30 สิงหาคม – 1 กันยายน 2567
งาน “เกษตรสามโก้และของดีเมืองอ่างทอง” 30 สิงหาคม – 1 กันยายน 2567 ณ วัดสามโก้ ตำบลสามโก้ อำเภอสามโก้ จังหวัดอ่างทอง เพื่อประชาสัมพันธ์สินค้าเกษตรและผลิตภัณฑ์ชุมชนของจังหวัดอ่างทองให้เป็นที่รู้จัก และสร้างภาพลักษณ์ที่ดีในการเป็นแหล่งผลิตอาหารปลอดภัยเพิ่มช่องทางการจำหน่ายสินค้าการเกษตรให้เกษตรกรรายย่อยและกลุ่มเกษตรกร
เพราะที่ 3 สามโก้ มีแต่ของโก้โก้ โก้เก๋วัฒนธรรม / โก้เกษตรไฉไล / โก้ของกิน ถิ่นสามโก้ / กิจกรรมภายในงาน
☝️ การประกวดไก่พื้นเมือง
☝️ กิจกรรมการให้ความรู้ด้านการเกษตร
☝️ การจำหน่ายพันธุ์พืชนานาชินด
☝️ ชมงานศิลปะหนังใหญ่ และเครื่องจักรสาน
☝️ อิ่มอร่อยกับเมนูพิแศษจากชุมชนสามโก้ พร้อมกับการสาธิตการทำอาหารพื้นบ้าน
☝️ การแสดงดนตรี การแสดงศิลปวัฒนธรรม ตลอดงาน
การแข่งขันประกวดเต้น และ ประกวดวงดนตรีสตริง ประจำปี 2567 30 สิงหาคม – 1 กันยายน 2567
Suratthani Youngster Got Talent 2024 : การแข่งขันประกวดเต้น Cover Dance ประจำปี 2567 (Suratthani Battle Dance Star Contest #1st 2024) และ การแข่งขันประกวดวงดนตรีสตริง ประจำปี 2567 (Suratthani Battle Band Challenge 2024) ระหว่างวันที่ 30 สิงหาคม – 1 กันยายน 2567 ณ ลานด้านหน้าสุราษฎร์ธานีฮอลล์ ชั้น 4 ศูนย์การค้าเซนทรัล สุราษฎร์ธานี
งาน “สีสันเมืองเลย The Color of Loei และมหกรรมหน้ากาก Thailand Local Mask Festival 2024” วันที่ 30 - 31 สิงหาคม ถึง 1 กันยายน 2567
ขอเชิญเที่ยวงาน “สีสันเมืองเลย The Color of Loei และมหกรรมหน้ากาก Thailand Local Mask Festival 2024” ร่วมสืบสานวัฒนธรรม 3 ผี ผีตาโขน ผีบุ้งเต้า ผีขนน้ำ และพบกับขบวนสีสันคาร์นิวัลแห่งแดนอีสานหน้ากากภูมิภาคจาก 7 จังหวัดที่เดียวในโลก ยกระดับ Soft Power ของไทยสู่เวทีโลก ระหว่างวันที่ 30 - 31 สิงหาคม ถึง 1 กันยายน 2567 ณ ลานพญานาค ปู่ไหลคำมา สวนสาธารณะกุดป่อง อำเภอเมืองเลย จังหวัดเลย
งานเกษตรและของดีอุดรธานี 30 สิงหาคม - 8 กันยายน 2567
งานเกษตรและของดีอุดรธานี วันที่ 30 สิงหาคม - 8 กันยายน 2567 ณ บริเวณสนามทุ่งศรีเมืองอุดรธานี จังหวัดอุดรธานี 30 ส.ค. 67 พลอย พุ่มพวง & โบตั๋น ชนิกานต์ 31 ส.ค. 67 เวียง นฤมล 1 ก.ย. 67 ปอยฝ้าย & ยายแหวง 2 ก.ย. 67 ต้าร์ เพ็ญนภา แนบชิด & เกียรติ หนองโดน 3 ก.ย. 67 ต้าร์ เพ็ญนภา แนบชิด & เกียรติ หนองโดน 4 ก.ย. 67 มดแดง จิราพร & นนท์ พลเยี่ยม 5 ก.ย. 67 มดแดง จิราพร & นนท์ พลเยี่ยม 6 ก.ย. 67 ฝ้ายเมฆะ & หมาก้าวหาง 7 ก.ย. 67 มอส คำหมากบิน 8 ก.ย. 67 ดนตรี
Pattaya Beach Games 2024 ณ ชายหาดจอมเทียน 30 สิงหาคม - 1 กันยายน 2567
เมืองพัทยากำหนดจัดการแข่งขันกีฬาชายหาดเมืองพัทยา "Pattaya Beach Games 2024" 30 สิงหาคม - 1 กันยายน ณ ชายหาดจอมเทียน หน้าโรงแรมเดอะนาว กิจกรรมที่จะรวบรวมกีฬาชายหาดทั้ง 3 ชนิดไว้ที่เดียวกัน
วันที่ 31 สิงหาคม เวลา 17.00 น. กิจกรรมวิ่ง Fun Run 3 KM สมัครวิ่ง ฟรี‼️ จำกัด 500 คน เท่านั้น
วันที่ 30 - 31 สิงหาคม เวลา 16.00 - 23.00 น. ชมการแข่งขันวอลเลย์บอลชายหาด
วันอาทิตย์ที่ 1 กันยายน เวลา 06.30 - 13.00 น. การแข่งขันกีฬากระดานยืนพาย. เวลา 16.00 - 20.00 น. ชมการแข่งขันวอลเลย์บอลชายหาด
สอบถามข้อมูลเพิ่มเติมได้ที่ โทร 080-0849457
งานกระบี่ไตรกีฬา Krabi TRIATHLONS 31 สิงหาาคม - 1 กันยายน 2567
กิจกรรมกระบี่ไตรกีฬา (Krabi Triathlons) 31 สิงหาคม - 1 กันยายน 2567 ณ สวนสาธารณะธารา เทศบาลเมืองกระบี่ จังหวัดกระบี่ ภายใต้โครงการพัฒนาเมืองกีฬาเชื่อมโยงการท่องเที่ยว กำหนดเส้นทางการ ว่าย-ปั่น-วิ่ง ทั้งหมด 4 ประเภท ประกอบด้วย 1. การแข่งขันไตรกีฬาระยะโอลิมปิก 2. การแข่งขันไตรกีฬาระยะสปริ้นท์ 3. การแข่งขันว่ายน้ำระยะ 750 เมตร 4. การแข่งขันวิ่งชายหาดระยะ 5 กิโลเมตร นอกจากนี้ ยังมีกิจกรรมการแสดงดนตรีสด การแสดงทางวัฒนธรรม การแสดงสินค้าจากผู้ประกอบการกว่า 20 ร้านค้า นิทรรศการกีฬา และกิจกรรมนันทนาการอีกหลากหลายกิจกรรมอีก facebook.com/KrabiTriathlons
งาน Amazing Showpround & Food Taste @ลานวัฒนธรรมหาดชลาทัศน์ สงขลา 31 ส.ค.-1 กย.2567
งาน Amazing Showpround & Food Taste @ลานวัฒนธรรมหาดชลาทัศน์ สงขลา 31 ส.ค.-1 กย.2567 นี้ ชวนเพื่อน..ชวนคนรู้ใจ..แล้วไปพบกับ อาหารถิ่น vs ผลไม้ถิ่น..อาหารอร่อย..บรรยากาศปูเสื่อ..รับลม..ชม การโชว์ควงไฟ..ดนตรี.. จัดโดย ททท.สนง.หาดใหญ่..หาดทิพย์..เทศบาลนครสงขลาและพันธมิตร
โปรแกรมงานกิจกรรมน่าเที่ยว จ.บึงกาฬ เดือนกันยายน 2567
- 1 กันยายน 2567 งานประเพณีแข่งเรือยาวประเพณี ต.ไคสี ณ ริมฝั่งแม่น้ำโขง อ.เมือง จ.บึงกาฬ
- 4-8 กันยายน 2567 การแข่งเรือยาวหอคำ ของดี 4 ภาค อ.เมือง จ.บึงกาฬ
- 6-8 กันยายน 2567 การแข่งเรือยาวไทย-ลาว ชิงถ้วยพระราชทาน อ.เมือง จ.บึงกาฬ
- 1-15 กันยายน 2567 งานประเพณีแข่งเรือยาว ศึกไทย-ลาว ชิงเจ้าลำน้ำโขง ณ ริมฝั่งแม่น้ำโขง อ.เมือง จ.บึงกาฬ
- 20-22 กันยายน 2567 การแข่งเรือ อ.บุ่งคล้า จ.บึงกาฬ
19 ปี ภูเก็ตพระใหญ่ ไบค์คลับ พัทลุง 6-7 กันยายน 2567
19 ปี ภูเก็ตพระใหญ่ ไบค์คลับ (Prayai Bike Club) 6-7 กันยายน 2567 ณ ร้านอาหารลานนา วอเตอร์ไซด์เมืองพัทลุง ศิลปิน DJ มาเพียบ
ตารางจัดอบรมคุณแม่คุณภาพ Mother Class รพ.เกษมราษฎร์ ประชาชื่น
โรงพยาบาลเกษมราษฎร์ ประชาชื่น เปิดกำหนดการตารางการอบรมงานคุณแม่คุณภาพ Mother Class 2024 ตั้งแต่เดือนมกราคม - ธันวาคม 2567 ไม่มีค่าใช้จ่าย สำหรับคุณพ่อคุณแม่มือใหม่ เตรียมตัววางแผนไปอบรมได้ความรู้การดูแลสุขภาพตนเองและลูกน้อย หากคุณแม่ที่มีกำหนดคลอดในปี 2567 สามารถจองชำระซื้อแพ็กเกจคลอดก่อนที่ราคาจะปรับขึ้นได้ สอบถามข้อมูลเพิ่มเติมได้ที่แผนกประชาสัมพันธ์ โทร. 02-910-1600 ต่อ 1835 วันและเวลาทำการ (จันทร์-ศุกร์ เวลา 09.00 – 17.00 น.)
โรงพยาบาลพญาไท 2 PMC MOM CLASS อบรมครรภ์คุณภาพ สำหรับคุณแม่ตั้งครรภ์ LINK
โรงพยาบาลพญาไท 2 PMC MOM CLASS อบรมครรภ์คุณภาพ สำหรับคุณแม่ตั้งครรภ์ ในการเตรียมความพร้อมต้อนรับเจ้าตัวน้อย จำนวน 4 ครั้ง
วันที่ 21 กันยายน 2567
วันที่ 19 ตุลาคม 2567
วันที่ 16 พฤศจิกายน 2567
วันที่ 21 ธันวายน 2567
เวลา 08.00 – 14.00 น. ณ ห้อง We Before Me ชั้น Meeting อาคารจอดรถ A โรงพยาบาลพญาไท 2 ผู้ที่สนใจเข้าร่วมกิจกรรม สามารถลงทะเบียนสำรองที่นั่งอบรม รับสมัครจำนวนจำกัด ไม่เกิน 30 ท้อง ไม่เสียค่าใช้จ่าย (สามารถนำผู้ติดตามมาได้ 1 คนโดยมิใช่คุณแม่ตั้งครรภ์เช่นเดียวกัน)
ปฏิทินกิจกรรม เดือนกันยายน 2567 LINK
1 กันยายน 67
งาน กระบี่ไตรกีฬา Krabi TRIATHLONS” ณ สวนสาธารณะธารา FB : Krabi Triathlons
7 กันยายน 67
งาน “คเณศจตุรถี“ ลูกๆพระคเณศห้ามพลาด ✨
ชมพิธีบวงสรวงแบบอินเดียโบราณ ✨มหรสพสมโภชเนื่องในวันเกิดพระพิฆเนศ
ร่วมพิธีอารตีบูชาไฟ กับ Crystal Bowl Sound Therapy
ณ ลานพระคเณศ ท่าเรือพอร์ตตะโกลา กระบี่
FB : สวนอิศระ พระคเณศตะโกลา Isara Estuary Port Takola Krabi
7 – 8 กันยายน 67
การแข่งขันมอเตอร์ไซด์ทางเรียบ “กระบี่ โรด เรซซิ่ง”ณ สนามไสไทย (โกคาร์ทเก่า)FB : โก๋แก่ สุราษฎร์
14 – 15 กันยายน 67
Scenic Half Marathon Krabi 2024
ชวนนักวิ่งทุกท่านล่องใต้ ชมทะเลอ่าวนาง กับเส้นทางวิ่งสุดฟินพิชิตเส้นขอบฟ้า บนถนนสายโรแมนติก ณ หาดอ่าวนาง FB : Krabi Marathon
18 - 19 กันยายน 67
Gumball 3000 องค์การบริหารส่วนจังหวัดกระบี่ FB : Gumball 3000
20 กันยายน 67
งานดนตรี ฝนตกขึ้นฟ้า Reversed Rain the Concert ณ หน้าโรงหนัง ถนนมหาราช
มาร่วมเปลี่ยนผ่านฤดู ส่งฝนกลับฟ้า ผ่านจังหวะของดนตรี ปลุกเมืองกระบี่ให้คึกคัก เตรียมตัวให้พร้อม แล้วเปล่งเสียงไปด้วยกัน 15:00 - 23:00 น.
FB : ฝนตกขึ้นฟ้า เดอะ คอนเสิร์ต - Reversed Rain
26 - 27 กันยายน 67
งานประเพณีแห่จาดเดือนสิบจังหวัดกระบี่ ณ วัดแก้วโกรวาราม พระอารามหลวง
FB : องค์การบริหารส่วนจังหวัดกระบี่
29 กันยายน 67
Koh Lanta Kayak & Cycling Rally Day 2024
สัมผัสประสบการณ์สุดฟินกับกิจกรรม Low Carbon เช้าปั่นจักรยาน บ่ายพายคายัคชมป่าโกงกางผืนใหญ่ของเกาะลันตาบอกเลยป่าแน่นมากเขียวมากจ้า ณ ชุมชนทุ่งหยีเพ็ง อ.เกาะลันตา 07.30 - 19.30 น.
FB : สมาคมธุรกิจการท่องเที่ยวเกาะลันตา
29 กันยายน 67
“Culture เจิดจ้า ณ กระบี่” โดยวง “เพชรจรัสแสง” เสียงกลองกึกก้อง วัฒนธรรมเจิดจ้า มาชมและดื่มด่ำกับการแสดงทางศิลปวัฒนธรรมร่วมสมัยแนวไทยประยุกต์ พบกับการแสดงแบบจัดเต็มของวง “เพชรจรัสแสง” ที่ผ่านเวทีการแข่งขัน Thailand got talent ที่สุดอลังการ … ณ ถนนคนเดิน Krabi Walking Street 19..00 - 21.00 น.
FB : TAT Krabi Office FB : ถนนคนเดินกระบี่ Krabi Walking Street
ปฏิทินกิจกรรมท่องเที่ยวสมุทรสงคราม กันยายน 2567
ปฏิทินกิจกรรมท่องเที่ยว เดือนกันยายน 2567
งานสานสัมพันธ์ ๕ ชาติพันธุ์ เพชรสมุทรศีรี และงานเกษตรแฟร์แม่กลอง
วันที่ 30 สิงหาคม - 9 กันยายน 2567
ณ อนุสรณ์สถานแฝดสยามอินจัน อ.เมืองฯ สมุทรสงคราม
งานชมจันทร์ที่อัมพวา | FULL MOON @Amphawa
วันที่ 6-8 กันยายน 2567 เวลา 17.30-22.00 น.
ณ อุทยาน ร.2 อ.อัมพวา จ.สมุทรสงคราม
กิจกรรมวิ่งมหากาพย์รามเกียรติ์ l ทศกัณฑ์ยกทัพ
วันที่ 8 กันยายน 2567
ณ อุทยาน ร.2 อ.อัมพวา จ.สมุทรสงคราม
ประเพณีตักบาตรขนมครก-น้ำตาลทราย
วันที่ 10 กันยายน 2567 06.00-11.00 น.
ณ วัดแก่นจันทร์เจริญ อ.บางคนที จ.สมุทรสงคราม
ประเพณีตักบาตรน้ำผึ้ง
วันที่ 17 กันยายน 2567 เวลา 06.00 น.
ณ วัดศรัทธาธรรม อ.เมืองฯ จ.สมุทรสงคราม
สอบถามเพิ่มเติมได้ที่ โทรศัพท์ 0 3475-2847-8 หรือ Inbox FB : ททท. สำนักงานสมุทรสงคราม TAT Samut Songkhram
ปฏิทินกิจกรรมท่องเที่ยวสมุทรสาคร กันยายน 2567
ปฏิทินกิจกรรมท่องเที่ยว เดือนกันยายน 2567
งานสมุทรสาคร EXPO 2024
วันที่ 26 สิงหาคม - 1 กันยายน 2567 เวลา 14.00-21.00 น.
ณ ลานกิจกรรมหน้าศูนย์การค้า เซ็นทรัลมหาชัย อ.เมืองฯ จ.สมุทรสาคร
งาน “สีสันสาคร” (ตอน “วัสสานฤดู”)
วันที่ 4-8 กันยายน 2567 เวลา 16.00 น. เป็นต้นไป
ณ ริมเขื่อนศาลเจ้าพ่อหลักเมืองฯ อ.เมืองฯ จ.สมุทรสาคร
เทศกาลแลนด์ ออฟ บ้านแพ้ว มหกรรมสินค้าชุมชนของดีอำเภอบ้านแพ้ว
วันที่ 4-8 กันยายน 2567 เวลา 12.00-22.00 น.
ณ บริเวณที่ว่าการอำเภอบ้านแพ้ว จ.สมุทรสาคร
กิจกรรมส่งเสริมการท่องเที่ยว วิ่งมินิฮาร์ฟมาราธอน
วันที่ 8 กันยายน 2567
ณ บริเวณที่ว่าการอำเภอบ้านแพ้ว จ.สมุทรสาคร
ประเพณีตักบาตรน้ำผึ้ง
วันที่ 17 กันยายน 2567 เวลา 06.00 น.
ณ วัดเจ็ดริ้ว อ.บ้านแพ้ว จ.สมุทรสาคร
ประเพณีตักบาตรน้ำผึ้ง
วันที่ 17 กันยายน 2567 เวลา 06.00 น.
ณ วัดคลองครุ อ.เมืองฯ จ.สมุทรสาคร
สอบถามเพิ่มเติมได้ที่ โทรศัพท์ 03475-2847 - 8 หรือ Inbox FB : ททท. สำนักงานสมุทรสงคราม TAT Samut Songkhram
ปฏิทินกิจกรรมในจ.น่าน เดือนกันยายน 2567
โปรแกรมเดือนกันยายน เที่ยวหัวหิน 8 ทริป กับรถไฟท่องเที่ยว SRT Royal Blossom
การรถไฟฯ จัดทริปท่องเที่ยวสุดพิเศษกับขบวน “ROYAL BLOSSOM” ขบวนรถไฟแห่งความสุข ไปสัมผัสบรรยากาศเมืองหัวหิน เสน่ห์แห่งความคลาสสิค เส้นทางกรุงเทพ - หัวหิน - กรุงเทพ แบบ One Day Trip ในเดือนกันยายน 2567 ทุกวันหยุดเสาร์และอาทิตย์ รวม 8 ทริป พร้อมรายละเอียดดังนี้
- วันที่เดินทาง เสาร์ที่ 7 , อาทิตย์ที่ 8, เสาร์ที่ 14, อาทิตย์ที่ 15, เสาร์ที่ 21, อาทิตย์ที่ 22 ,เสาร์ที่ 28 และ อาทิตย์ที่ 29 กันยายน 2567
- สามารถเลือกที่นั่งได้ 2 แบบ 2 สไตล์ ทั้งแบบกลุ่มและแบบส่วนตัว
- จำกัดจำนวน 176 ที่นั่งต่อทริปเท่านั้น
- อัตราค่าโดยสารรวมแพ็กเกจ ผู้ใหญ่และเด็กราคาเดียวกัน ดังนี้
1. ตู้ Passenger Car ราคาท่านละ 1,799 บาท
2. ตู้ Group Car จำนวน 4 ห้อง ราคาห้องละ 15,999 บาท สามารถนั่งได้ 4 – 6 ท่าน/ห้อง
*ราคานี้ เป็นราคารวมค่าตั๋วโดยสารรถไฟ ค่ารถบัสปรับอากาศ ค่าเข้าชมสถานที่ต่างๆ พร้อมอาหารและเครื่องดื่มแบบจัดเต็มตลอดการเดินทาง รวมทั้ง ค่าประกันอุบัติเหตุ
เริ่มจำหน่ายตั๋วโดยสารพร้อมกันทั่วประเทศ ในวันอังคารที่ 3 กันยายน 2567 ตั้งแต่เวลา 08.30 น. เป็นต้นไป
ติดต่อซื้อตั๋วได้ที่สถานีรถไฟทุกแห่งทั่วประเทศ และช่องทางการจำหน่ายตั๋วระบบออนไลน์ D – Ticket ของการรถไฟฯ
สอบถามข้อมูลเพิ่มเติมได้ที่ศูนย์บริการลูกค้าสัมพันธ์ 1690 ตลอด 24 ชั่วโมง
ปฏิทินท่องเที่ยวระยองและกิจกรรมประจำเดือนกันยายน 2567 LINK
31 ส.ค - 2 ก.ย. : ย้อนรอยตลาดไผ่ล้อม 100 ปี ถนนอาทิตย์ประดิษฐ์ หน้าที่ว่าการอำเภอบ้านค่าย จ.ระยอง
5-8 ก.ย. : Food Fon in DokKrai อ่างเก็บน้ำดอกกราย ปลวกแดง จ.ระยอง
12-15 ก.ย. : Rayong Log Jam ชายหาดแม่รำพึง อ.เมือง
15 ก.ย. : วัดละหารไร่ ฮาล์ฟ มาราธอน 2024 ณ วัดละหารไร่ อ.บ้านค่าย
21 ก.ย. : Free Concert ศิลปิน Only Monday @ Passione Hall Fl.3 Passione Shopping Destination
29 ก.ย. : Charity Tulip Run อาคารพรรณพฤกษา จ.ระยอง
* กำหนดการสามารถเปลี่ยนแปลงได้ตามความเหมาะสม ติดต่อ ททท.สำนักงานระยอง : 038-655-420
ปฏิทินและกิจกรรมท่องเที่ยวฉะเชิงเทรา เดือนกันยายน 2567 LINK
1. งานมนต์เสน่ห์ บางปะกง ล่องนาวา ช้อป ชิม ชิลล์ 6-7 กันยายน 2567
ณ สวนสาธารณะเฉลิมพระเกียรติฯ (ข้างวัดโสธรวราราม) อ.เมือง จ.ฉะเชิงเทรา
2. งาน ชิม ช็อป แชะ สินค้าชุมชน อาหารถิ่น 30 สิงหาคม - 3 กันยายน 2567
ณ มหาวิทยาลัยราชภัฎราชนครินทร์ อ.เมือว จ.ฉะเชิงเทรา
3. โครงการนักสื่อสารดาราศาสตร์ 7 - 8 กันยายน 2567
ณ หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา ฉะเชิงเทรา อ.แปลงยา ฉะเชิงเทรา
4. งานคเณศจตุรถี 8 กันยายน 2567 ณ วัดโพรงอากาศ อ.บางน้ำเปรี้ยว จ.ฉะเชิงเทรา
5. งานมหามงคลพิธี คเณศจตุรถี 9 กันยายน 2567 ณ อุทยานพระพิฆเนศองค์ยืน คลองเขื่อน อ.คลองเขื่อน จ.ฉะเชิงเทรา
6. คอนเสิร์ต วง ภูมิมินทร์, วาทิน, เพลา 27 กันยายน 2567 ณ ลานกิจกรรมริมนาแปดริ้ว อ.เมือง จ.ฉะเชิงเทรา
สอบถามข้อมูลเพิ่มเติมได้ที่
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานฉะเชิงเทรา
โทรศัพท์ : 038 514 009
LINE ID : tatchoengsao
ปฏิทินและกิจกรรมท่องเที่ยวสมุทรปราการ เดือนกันยายน 2567
ปฏิทินและกิจกรรมท่องเที่ยวสมุทรปราการ เดือนกันยายน 2567
1. City Run @ บางกะเจ้า
1 กันยายน 2567
ณ สวนศรีนครเขื่อนขันธ์ อ.พระประแดง จ.สมุทรปราการ
2. ฟรีคอนเสิร์ต @ บางนา มาร์เก็ต
3 กันยายน 2567 : ฟอร์ด สบชัย
27 กันยายน 2567 : แก๊งตัวตึง Copy Show
ณ ตลาดนัดบางนามาร์เก็ต กม.12
3. จุ่มให้สะใจ ART TOY MU
4-8 กันยายน 2567
ณ ศูนย์การค้าโรบินสันไลฟ์สไตล์ อ.เมือง จ.สมุทรปราการ
4. งานสุดยอดผลิตภัณฑ์อุตสาหกรรม สมุทรปราการ
12-16 กันยายน 2567
ณ ศูนย์การค้าอิมพีเรียล เวิลด์ สำโรง อ.เมือง จ.สมุทรปราการ
5. City Run @ ป้อมพระจุลจอมเกล้า
15 กันยายน 2567
ณ ป้อมพระจุลจอมเกล้า
6. สมุทรปราการ Car Free Day
22 กันยายน 2567
ณ ตลาดเรือบิน อ.บางพลี จ.สมุทรปราการ
7. มหกรรมเรือยาว Long Trail Boat Thailand Racing 2024
22 กันยายน 2567
ณ วัดโคธาราม อ.บางบ่อ จ.สมุทรปราการ
8. บุญสารทเดือนสิบ ชาวใต้สมุทรปราการ
27 - 29 กันยายน 2567
ณ วัดบางนางเกรง อ.เมือง จ.สมุทรปราการ
สอบถามข้อมูลเพิ่มเติมได้ที่
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานฉะเชิงเทรา
โทรศัพท์ : 038 514 009
LINE ID : tatchoengsao
ปฏิทินท่องเที่ยวปทุมธานี ประจำเดือนกันยายน 2567
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน กันยายน 2567
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน กันยายน 2567
11-15 กันยายน 2567 การแข่งขันเรือยาวประเพณีขึ้นชิงธง ชิงถ้วยพระราชทาน ประจำปี 2567 ณ คลองในหลวงหัววัง-พนังตัก
20-21 กันยายน 2567 เทศกาลอวดชุมพรเมืองสร้างสรรค์ ณ ลานแอโรบิก ริมคลองท่าตะเภา
28-29 กันยายน 2567 หลังสวนฟิชชิ่งเกมส์ มหกรรมแข่งขันตกปลาอ่าวไทย ประจำปี 2567 ณ ท่าเทียบเรือ ร้านมายา
ปฏิทินกิจกรรมและกีฬา จ.กำแพงเพชร กันยายน 2567 LINK
เดือนกันยายน มีอะไรบ้างในจ.กำแพงเพชร ไปดูกัน
8 กันยายน / วิถี 4 สายน้ำ Marathon
11-15 กันยายน / เกษตรแฟร์จังหวัดกำแพงเพชร
12-20 กันยายน / การแข่งขันกีฬานักเรียนประจำจังหวัดและอำเภอ
18-20 กันยายน / การแข่งขันฟุตซอลโครงการป้องกันและแก้ไขปัญหายาเสพติดจังหวัดกำแพงเพชร
25 กันยายน - 5 ตุลาคม / งานประเพณีสาทรไทยกล้วยไข่และของดีเมืองกำแพง
*ปล. อาจมีการเปลี่ยนแปลงหรืออัพเดทข้อมูล
ปฏิทินกิจกรรมราชบุรี เดือนกันยายน 2567
ปฏิทินกิจกรรม จ.หนองคาย เดือนกันยายน 2567
24 สิงหาคม - 22 กันยายน 2567 กิจกรรมเที่ยวลุ้นทองกับโลตัส ชิงรางวัล กว่าล้าน
30 สิงหาคม - 1 กันยายน 2567 งาน Esan เที่ยวชิมช็อปแชร์ อ.เมือง หนองคาย
6-15 กันยายน 2567 งานหอการค้าแฟร์และบอลลูนนานาชาติ ณ ลานอนุสาวรีย์ปราบฮ่อ อ.เมือง หนองคาย
28-29 กันยายน 2567 งานวิ่ง หนองคายเทรล อ.สังคม
ปฏิทินกิจกรรม จ.อุดรธานี เดือนกันยายน 2567
12-22 กันยายน 2567 Jumptopia เซ็นทรัลอุดร
18-24 กันยายน 2567 เชิญยิ้ม เชิญอร่อย เซ็นทรัลอุดร
24 กันยายน 2567 ลำไย ไหทองคก บิ๊กคอนเสิร์ต
13-15 กันยายน 2567 งานเฉลิมฉลองมรดกโลกภูพระบาท อ.บ้านผือ
27-28 กันยายน 2567 จุ้ม บ้านเชียง Art & Craft ณ บ้านเชียง หนองหาน
30 สิงหาคม - 8 กันยายน 2567 งานเกษตรและของดี อุดร อ.เมือง อุดรฯ
7-8 กันยายน 2567 งาน 50 ปี หนองวัวซอรัน ที่ว่าการอ.หนองวัวซอ
24-30 กันยายน 2567 เทศกาลอาหารและดนตรี ที่ว่าการอ.หนองหาน
ปฏิทินท่องเที่ยวเชียงใหม่เดือนกันยายน 2567
ปฏิทินกิจกรรม พัทยา เดือนกันยายน 2567
3-5 ก.ย.67 งาน FOOD FUN FEST COUNTRY STREET ณ ลานเครื่องบิน Terminal 21 Pattaya
14 ก.ย.67 การประกวด EARTH KIDS THAILAND 2024 SEASON 2 เวทีระดับประเทศของเยาวชน ปีที่ 2 ณ ศูนย์การค้ารอยัลการ์เด้นพลาซ่า พัทยา
17-18 ก.ย.67 มหกรรมแสดงสินค้าเพื่อธุรกิจโรงแรมและการท่องเที่ยวเมืองพัทยา "PATTAYA HOSPITALITY CHALLENGE 2024" ณ โรงแรมเดอะซายน์ พัทยา
18 ก.ย.67 มหกรรมเครือข่ายสุขภาพชุมชน ครั้งที่ 4 "4TH PATTAYA HEALTH COMMUNITY NETWORK" ณ แหลมบาลีฮาย
20-22 ก.ย. และ 27-29 ก.ย.67 เทศกาลดนตรี CHONBURI INTERNATIONAL MUSIC FESTIVAL IN THE RAIN ณ ชายหาดพัทยา
22 ก.ย.67 กิจกรรมเดิน วิ่ง การกุศล LOMA RUN ON THE BEACH 2024 ณ ชายหาดดงตาล เมืองพัทยา
27-28 ก.ย.67 การแข่งขันกีฬายูยิตสู "JU-JITSU WORLD CUP BEACH 2024" ณ ชายหาดจอมเทียน
ปฏิทินกิจกรรมท่องเที่ยวประจวบคีรีขันธ์ กันยายน 2567
16 ส.ค. - 14 ก.ย. 67 ท่องเที่ยวถนนสายวัฒนธรรมสู้ศึก ชุมชนคุณธรรมหัวบ้าน "ย่านเก่าเล่าเรื่อง" ถนนสายวัฒนธรรมสู้ศึก อ.เมือง
6 - 8 ก.ย. 67 ประจวบ อาร์ต เฟสติวัล 2567 บ้านศิลปิน หัวหิน อ.หัวหิน
7 ก.ย. 67 Buakaw Run (ปิดรับสมัครแล้ว) ศูนย์การกำลังสำรอง (ศสร.) อ.ปราณบุรี
7 ก.ย. 67 ชวนเดินวิ่งปล่อยปู กินลมชมทะเล @เขาตะเกียบ 2024 ศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน อ.หัวหิน (จุดปล่อยตัว)
11 - 13 ก.ย. 67 Art Exhibition ชั้น G บลูพอร์ต หัวหิน อ.หัวหิน
13 - 22 ก.ย. 67 งานท่องเที่ยวประจวบคีรีขันธ์ มทัศจรรย์เมืองสามอ่าว และงานกาชาด ประจำปี พ.ศ. 2567 บริเวณสวนสาธารณะเฉลิมพระเกียรติ หน้าศาลากลาง และสะพานสราญวิถี อ.เมือง
15 ก.ย. 67 พิธีส่งเคราะห์ทางทะเลและทำบุญศาลเจ้าแม่ทับทิม ศาลเจ้าแม่ทับทิม อ.หัวหิน
21 ก.ย. 67 YUME COSPLAY PARTY ครั้งที่ 4 Hua Hin Market Village อ.หัวทิน
21 - 22 ก.ย. 67 3x3 Basketball Tournament BluHall ชั้น 1 บลูพอร์ต หัวหิน อ.หัวหิน
22 ก.ย. 67 ประมงไทยชวนวิ่ง #3 (ปิดรับสมัครแล้ว) ชายหาดดอนสำราญ อ.บางสะพาน
25 - 26 ก.ย. 67 Legend FC มวยรองครองแชมป์ บลูพอร์ต หัวหิน อ.หัวหิน SSS 67
30 ก.ย. - 2 ต.ค. 67 งานประเพณีสารทเดือนสิบ วัดธรรมรัตน์ อ.บางสะพาน
ปฏิทินการท่องเที่ยวจังหวัดสกลนคร เดือนกันยายน 2567
ปฏิทินการท่องเที่ยวจังหวัดสกลนคร เดือน กันยายน 2567
31 ส.ค 67 - 6 กันยายน 67 งานฉลองครบ 60 ปี อำเภอกุดบาก ณ บริเวณสนามหน้าที่ว่าการ อำเภอกุดบาก จังหวัดสกลนคร
13 - 17 กันยายน 67 ประเพณีไหลเรือไฟ ไหว้สาพญาเต่างอย ประจำปี 2567 ณ สวนสาธารณะริมลำน้ำพุง อำเภอเต่างอย จังหวัดสกลนคร
15 - 17 กันยายน 67 งานประเพณีบุญเดือนสิบฯ ณ บริเวณลำน้ำยาม อำเภออากาศอำนวย จังหวัดสกลนคร
18 - 24 กันยายน 67 งานบอลลูน ยักษ์หรรษาและเทศกาลอาหาร ณ บริเวณถนนหน้าที่ว่าการอำเภอวานรนิวาส จังหวัดสกลนคร
ปฏิทินกิจกรรมจ.สุรินทร์ เดือนกันยายน 2567
ปฏิทินท่องเที่ยวเลย กันยายน - ตุลาคม 2567
ปฏิทินท่องเที่ยวเลย ช่วงเดือน กันยายน - ตุลาคม 2567
ปฏิทินกิจกรรมเที่ยวบุรีรัมย์ เดือนกันยายน 2567
วันที่ 1 กันยายน 2567
“Revo Thai League”
บุรีรัมย์ ยูไนเต็ด VS นครปฐม ยูไนเต็ด
ณ สนามช้าง อารีนา
สอบถามเพิ่มเติมโทร : 08 1070 2626
วันที่ 5-8 กันยายน 2567
“Plan - B Media BRIC Superbike 2024 สนาม 4”
ณ สนามช้าง อินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 7-8 กันยายน 2567
“เทศกาลลูกชิ้นยืนกินชิงแชมป์โลกครั้งที่ 7”
ณ โดมเทศบาลบุรีรัมย์
สอบถามเพิ่มเติมโทร : 09 4515 6544
วันที่ 8-10 กันยายน 2567
“ปรากฏการณ์พระอาทิตย์ขึ้นสาดส่องตรง 15 ช่องประตูปราสาทพนมรุ้ง”
ณ อุทยานประวัติศาสตร์พนมรุ้ง
สอบถามเพิ่มเติมโทร : 044 666 251
วันที่ 13-14 กันยายน 2567
“Toyota Gazoo Razing Motorsport 20234 สนาม 3”
ณ สนามช้าง อินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 14-15 กันยายน 2567
“RATT Thailand Endurance International Championship 2024”
ณ สนามช้างอินเตอร์เนชั่นแนลเซอร์กิต
สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 22 กันยายน 2567
“Revo Thai League”
บุรีรัมย์ ยูไนเต็ด VS พีที ประจวบ เอฟซี
ณ สนามช้าง อารีนา
สอบถามเพิ่มเติมโทร : 08 1070 2626
วันที่ 29 กันยายน 2567
“Revo Thai League”
บุรีรัมย์ ยูไนเต็ด VS เมืองทอง ยูไนเต็ด
ณ สนามช้าง อารีนา
สอบถามเพิ่มเติมโทร : 08 1070 2626
เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท
(ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ถนนรมย์บุรี
เดือนต่อไปจะพาไปพบกับกิจกรรมท่องเที่ยวที่ไหน... อย่าลืมกดติดตามไว้นะคะ จะได้ไม่พลาดแหล่งท่องเที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม
เปิดประสบการณ์ท่องเที่ยวเมืองกีฬา เที่ยววิถีชุมชน กินอาหารถิ่น
เที่ยวทั้งปีที่ "บุรีรัมย์" เมืองปราสาทสองยุค...มหานครแห่งกีฬา
เที่ยวบุรีรัมย์ง่ายนิดเดียว สอบถามข้อมูลเพิ่มเติม : ททท. สำนักงานบุรีรัมย์ โทร. 0 4463 4722 หรือโทร. 1672 TAT Contact Center เพื่อนร่วมทาง
หมายเหตุ : กำหนดการอาจมีการเปลี่ยนแปลงกรุณาตรวจสอบข้อมูลก่อนการเดินทาง
ปฏิทินกิจกรรมจังหวัดภูเก็ต เดือนกันยายน 2567
ปฏิทินท่องเที่ยวจังหวัดลำพูน ประจำเดือนกันยายน-พฤศจิกายน 2567
ปฏิทินท่องเที่ยวจังหวัดลำปาง ประจำเดือนกันยายน - พฤศจิกายน 2567
ฤดูกาลชมสวนป่าดอกกระเจียวและงานอนุรักษ์พืชวงศ์ขิงแห่งป่าตะวันออก 18 ก.ค. - 30 ก.ย. 2567 LINK
เครือข่ายท่องเที่ยวเกษตรนิเวศและชุมชนฉะเชิงเทรา ขอเชิญชวนผู้รักความงดงามของธรรมชาติ และวิถีชีวิตแบบบ้านป่าเที่ยวชมงาน “ฤดูกาลชมสวนป่าดอกกระเจียวและงานอนุรักษ์พืชวงศ์ขิงแห่งป่าตะวันออก” ณ สวนเภตรา ต.ลาดกระทิง อำเภอสนามชัยเขต จ.ฉะเชิงเทรา ตั้งแต่ วันที่ 18 กรกฎาคม ถึงวันที่ 30 กันยายน 2567 เวลา 09.00 – 15.00 น. เข้าชมฟรี
หมายเหตุ
- กำหนดการอาจมีการเปลี่ยนแปลงตามความเหมาะสม
- นักท่องเที่ยวทั่วไปสามารถร่วมงาน และเข้าชมสวนได้โดยไม่เสียค่าใช้จ่าย
- กรุ๊ปนักท่องเที่ยว คณะศึกษาดูงานกรุณาติดต่อล่วงหน้า
- สามารถนำสัตว์เลี้ยงเข้าสวนได้ แต่ขอความกรุณาป้องกันการเกิดความเสียหายกับสถานที่ และไม่สร้างความเดือดร้อนรำคาญแก่นักท่องเที่ยวท่านอื่น
สอบถามเพิ่มเติมโทร. 062-426-2565
https://web.facebook.com/petragardenchachoengsao
ที่ตั้ง: ตำบลลาดกระทิง อำเภอสนามชัยเขต
เทศกาลกินปลาลำตะคอง 1-7 กันยายน 2567@ท่างอย เขื่อนลำตะคอง
เทศกาลกินปลาลำตะคอง ฟรีคอนเสิร์ตพร้อมชมบอลลูนอลังการ 1-7 กันยายน 2567 @ท่างอย เขื่อนลำตะคอง ถนนมิตรภาพสายเก่า หมู่บ้านท่างอย ต.จันทึก อ.ปากช่อง จ.นครราชสีมา
กิจกรรมมากมาย อาทิ กองทัพ “บอลลูน” โชว์สุดอลังการเพิ่มสีสันใหม่ “ท่างอย บอลลูน เฟสติวัล” แข่งขันการจับปลาในเขื่อนลำตะคอง การประกวดธิดามัจฉา การแข่งขันวาดภาพระบายสี และการแข่งขันปรุงอาหารพื้นถิ่น ฯลฯ พร้อมคอนเสิร์ตศิลปิน วันที่ 1 ก.ย.พบกับ “วงเหนือเมฆ”, วันที่ 2 ก.ย.พบกับ “วงมะละกอ”, วันที่ 3 ก.ย.พบกับ “หน่อง บ้านนอกแบนด์”, วันที่ 4 ก.ย.พบกับ “เอ็นพีแบนด์”, วันที่ 5 ก.ย. พบกับ “เต๋า ภูศิลป์”, วันที่ 6 ก.ย.พบกับ “หญิง ธิติกานต์”, วันที่ 7 ก.ย.พบกับ “แสน นากา”
งานสืบสานตำนาน สาวบ้านแต้ ประจำปี 2567 วันที่ 1-6 กันยายน 2567
งานสืบสานตำนาน สาวบ้านแต้ ประจำปี 2567 ณ.หน้าที่ว่าการอำเภอเกษตรสมบูรณ์ จังหวัดชัยภูมิ เตรียมตัวเตรียมใจให้พร้อม กับขบวนแห่ของดีทั้ง 12 ตำบล และกิจกรรมอีกมากมาย
วันที่ 1 กันยายน 2567 สาวบ้านแต้พาแลน วิ่งสืบสานสาวบ้านแต้ กลางคืนชม... เวทีคอนเสิร์ต จ่าลอด บ๊วบอง ผู้บ่าวไทบ้าน
วันที่ 2 กันยายน 2567 กิจกรรมปั่นจักรยานท่องเที่ยวสาวบ้านแต้ และจัดแสดงสินค้าการเกษตร
วันที่ 3 กันยายน 2567 ชม..การประกวด ธิดาสาวบ้านแต้ คอนเสิร์ตฟรี
วันที่ 4 กันยายน 2567 การแข่งกีฬากระโดดเชือก สาวบ้านแต้ห่าวด่องๆ
วันที่ 5 กันยายน 2567 ชม.. ขบวนแห่งของดี ทั้ง 12 ตำบล และขบวนจักรยานสาวบานแต้
วันที่ 6 กันยายน 2567 ชมการประกวดและจำหน่ายผ้าลายสาวบ้านแต้ ผ้าขาวมา 11 สี
แรลลี่ปั่น ชิลล์ ชิลล์ เดิน ชมวิว กินข้าวเย็น " สะพานรักบ้านเตย @พิมาย วันอาทิตย์ที่ 1 กันยายน 2567
ชวน ชม ชิม แชะ แรลลี่ปั่น ชิลล์ ชิลล์ เดิน ชมวิว กินข้าวเย็น " สะพานรักบ้านเตย @พิมาย วันอาทิตย์ที่ 1 กันยายน 2567 ณ สะพานรักบ้านเตย ตำบลกระเบื้องใหญ่ อำเภอพิมาย จังหวัดนครราชสีมา ** อำเภอพิมาย ร่วมกับ ท่องเที่ยวและกีฬาจังหวัดนครราชสีมา ททท นครราชสีมา ชมรมจักรยานอำเภอพิมาย และ อบต.กระเบื้องใหญ่ ขอเชิญร่วมกิจกรรมฯ มาปั่น มาเดิน ด้วยกันนะ จุด START ณ หน้าอุทยานประวัติศาสตร์พิมาย จุด FINISH ณ สะพานรักบ้านเตย พบกับกิจกรรมภายในงาน
ชม สินค้า OTOP จากชุมชนชาวตำบลกระเบื้องใหญ่
การแสดงดนตรีอังกะลุง จากโรงเรียนบ้านเตยประชาบำรุง
ฟังการแสดงเพลงโคราชจากชุมชนชาวบ้านเตย
ดนตรีโฟล์คซอง และรับประทานอาหารเย็นร่วมกัน
ท่องเที่ยวจันทบุรีประจำเดือนกันยายน 2567 LINK
2 ก.ย. งานทิ้งกระจาด
7-8 ก.ย. มหกรรมการศึกษาแห่งอนาคตพัฒนาทักษะสู่สากล
12 ก.ย. เดิน-วิ่ง เพื่อสุขภาพ ณ ชายหาดแหลมสิงห์
14-15 ก.ย. รากรส ชาติพันธ์ ณ บ้านเล็ก วิลล่า
14 ก.ย. เที่ยวล่องชม 2 ตลาดแปลก (ชุมชนขนมแปลก ตลาดสี่มุมเมรุ)
ปฏิทินประเพณีแข่งเรือจังหวัดน่าน ประจำปี 2567
ปฏิทินประเพณีแข่งเรือจังหวัดน่าน ประจำปี 2567 สนามแข่ง 7 สนาม เดือนกันยายน - ตุลาคม ตามกำหนดการ ดังนี้
สนามที่ 1 วันที่ 14 – 15 กันยายน 2567 ประเพณีแข่งเรือจังหวัดน่าน (ทานสลากภัตวัดพระธาตุช้างค้ำวรวิหารพระอารามหลวง ณ บริเวณแม่น้ำน่าน (สนามเทศบาลเมืองน่าน) อำเภอเมืองน่าน จังหวัดน่าน
สนามที่ 2 วันที่ 21 – 22 กันยายน 2567 ประเพณีแข่งเรือเอกลักษณ์น่าน สานสัมพันธ์น่านเหนือ น่านกลาง น่านใต้ จังหวัดน่าน ประจำปี 2567 ณ เชิงสะพานพัฒนาภาคเหนือ อำเภอเมืองน่าน จังหวัดน่าน
สนามที่ 3 วันที่ 28 – 29 กันยายน 2567 ประเพณีแข่งเรืออำเภอท่าวังผา “แข่งเรือปลอดเหล้า เข้าหาพระธรรม” ณ เชิงสะพานท่าวังผาพัฒนา อำเภอท่าวังผา จังหวัดน่าน
สนามที่ 4 วันที่ 16-17 ตุลาคม 2567 ประเพณีแข่งเรือวันออกพรรษา ต๋านก๋วยสลากวัดบุญยืน พระอารามหลวง อำเภอเวียงสา ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ณ บริเวณสะพานข้ามแม่น้ำน่าน (ท่าน้ำบ้านป่ากล้วย) อำเภอเวียงสา จังหวัดน่าน
สนามที่ 5 วันที่ 18 ตุลาคม 2567 ประเพณีแข่งเรือตักบาตรเทโวโรหณะวัดศิลามงคล อำเภอท่าวังผา ณ สนามแข่งเรือ บ้านท่าวังผา อำเภอท่าวังผา จังหวัดน่าน
สนามที่ 6 วันที่ 23 ตุลาคม 2567 ประเพณีแข่งเรือโบราณบ้านท่าล้อ อำเภอภูเพียง จังหวัดน่าน ประจำปี 2567 ณ สนามแข่งเรือบ้านท่าล้อ อำเภอภูเพียง จังหวัดน่าน
สนามที่ 7 วันที่ 26-27 ตุลาคม 2567 ประเพณีแข่งเรือจังหวัดน่าน (เฉลิมฉลองกฐินพระราชทาน) ณ บริเวณแม่น้ำน่าน (สนามเทศยาลเมืองน่าน) อำเภอเมืองน่าน จังหวัดน่าน
ข้อมูลจาก : สมาคมเรือแข่งจังหวัดน่าน
เที่ยวสระแก้ว One Day Trip LINK
เที่ยวสระแก้ว One day trip กับ 3 จุดเช็คอินที่น่าเที่ยว และน่าสนใจ โดยเป็นทริปง่ายๆ เที่ยวได้ในหนึ่งวัน แต่เป็นหนึ่งวันที่ จะให้ความสุขกับเพื่อนๆทุกคนได้อย่างแน่นอน
1. อุทยานแห่งชาติปางสีดา (น้ำตกปางสีดา)
อัพเดทช่วงนี้ น้ำตกมีน้ำ สวยงามมากๆ แล้วครับ สามารถพาตัวเองมาพบความสุขได้ทึ่นี่ สูดอากาศบริสุทธิ์ ให้ความสดชื่นของไอน้ำจากน้ำตก ปะทะกับใบหน้า ถ่ายรูปกับน้ำตกฟูๆ ช่วงฤดูแห่งความสดชื่นแบบนี้ ไม่มีที่ไหนทำให้ใจฟู ได้เท่าน้ำตกปางสีดาอีกแล้วครับ
2. อ่างเก็บน้ำพระปรง
เป็นอีกหนึ่งสถานที่ ที่เหมาะกับการชวนเพื่อน หรือพาครอบครัว มาเติมเต็มความสุข กันครับ ผมยกให้ที่นี่เป็นที่ตากอากาศสำหรับแกงค์เพื่อนและครอบครัว ลมเย็นๆ กับวิวอ่างเก็บน้ำ รวมถึงสามารถสั่งอาหารอร่อยๆมานั่งรับประทานได้ เป็นอีกที่ที่สามารถให้เรามีความสุขกับเพื่อนๆและครอบครัวได้มากขึ้นอีกด้วย
3. สถานีเพาะเลี้ยงสัตว์ป่าช่องกล่ำบน
ที่นี่คนมาเที่ยวน้อยมากครับ แต่ผมอยากให้ทุกคนได้มากัน เหตุผลก็เพราะว่า ที่นี่เป็นแหล่งเพาะเลี้ยงและขยายพันธุ์สัตว์ป่าหายากและใกล้สูญพันธุ์ อีกทั้งยังเป็นสถานีวิจัยและให้ความรู้เกี่ยวกับสัตว์ป่า ไฮไลท์คือ “เป็ดก่า” ที่เป็นสัตว์ที่หาดูได้ยาก และยังเป็นสัญลักษณ์ของจังหวัดสระแก้วอีกด้วย เหมาะสำหรับการพักผ่อนหย่อนใจพร้อม ๆ กับเก็บเกี่ยวความรู้เรื่องราวสัตว์ป่าในคราวเดียวกันครับ
และนี่คือ สระแก้ว อีกมุมมอง ที่ผมอยากให้ทุกคนได้ไปสัมผัส ผมเชื่อว่าทั้ง 3 ที่ สามารถเติมความสุขให้ตัวเราได้ ไม่มากก็น้อยอย่างแน่นอน
นั่งรถไฟ เที่ยว กิน เช็คอิน กบินทร์บุรี 1 วัน LINK
แนะนำทริปธรรมดาที่แสนพิเศษ สำหรับใครชอบนั่งรถไฟ หรือใครชอบเที่ยวแบบประหยัด มีเวลาลาน้อยแค่ 1 วัน หรือ หยุดเสาร์ อาทิตย์ 2 วัน อยากให้มาเที่ยวที่กบินทร์บุรี เพื่อนๆสามารถนั่งรถไฟมาได้หลายขบวนมาก ทั้งจาก กทม หรือ จะนั่งต้นทางมาจากคลองลึก สระแก้ว ก็ได้ เสน่ห์ของที่นี่คือ ตลาดบริเวณสถานีรถไฟ เค้าเรียกกันว่า “ตลาดพระปรง” ครับ จะมีแม่ค้า พ่อค้า นั่งรถไฟมาจากคลองลึกและจากพระปรง มาขายกันที่นี่ ตั้งแต่ช่วงเช้า ไปจนถึง สายๆ เกือบ 10 โมง เรียกว่า รวมของดีของเด็ดชุมชนเลยก็ว่าได้ครับ อยากให้ทุกคนได้มามากๆ
นอกจากตลาดพระปรง ยังมีอีกหลายจุดที่แนะนำ ดังนี้ - ตลาดพระปรง สถานีรถไฟ กบินทร์บุรี - ร้านเจริญชัย ข้าวมันไก่ - ร้านก๋วยเตี๋ยวต้มยำตาน้อย หน้าสถานีรถไฟ - ร้านศรีนวลชวนชิม - ร้านราดหน้า รสทิพย์ ยอดผัก - ปังคอฟฟี่ คาเฟ่ - บ้านนอก คาเฟ่ - สตรีทอาร์ตตลาดกบินทร์บุรี
Legend Siam Pattaya เข้าฟรี สำหรับชาวไทย 1-30 กันยายน 2567
พิเศษ!!! สำหรับชาวไทย ตลอดเดือนกันยายน เข้าฟรี!! ต่อเนื่องอีก 1 เดือน Legend Siam Pattaya มอบความสุขให้กับคนไทยทั้งประเทศต่อเนื่อง ฟรีค่าบัตรผ่านประตู ตั้งแต่ วันที่ 1-30 กันยายน 2567 ตระการตากับซุ้มประตูยักษ์ “ท้าวทศกัณฐ์” และ “ท้าวสหัสเดชะ” สุดยิ่งใหญ่ กราบไหว้สักการะขอพรสิ่งศักดิ์สิทธิ์ สายมูห้ามพลาด เชิญร่วมขอพรกราบไหว้สักการะสิ่งศักดิ์สิทธิ์ด้วยกันทั้งหมด 5 จุด 1.ยักษ์คู่ ท้าวทศกัณและท้าวสหัสเดชะ 2.พระอินทร์ทรงช้างเอราวัณ 3.พยานาคเจ้าย่าศรีปทุมมานาคินี 4.พระพรหมทรงหงส์สี่ห้า 5.พระพุทธรูปโบราณอายุรวมกันมากกว่า 4,000 ปี
ปฏิทินท่องเที่ยวตราด กันยายน 2567
กิจกรรมเดือนกันยามาแล้ว เอาใจคนรักสุขภาพที่แท้จริง
The Crystal Ekamai-Ramindra Foresta Coffee 1-7 กันยายน 2567
The Crystal Ekamai-Ramindra Foresta Coffee งานกาแฟหอมกรุ่น ณ เดอะคริสตัล เอกมัย – รามอินทรา ลานวีรันด้า ชั้น 1 วันที่ 1-7 กันยายน 2567 ในงานมีกิจกรรมไฮไลท์น่าสนใจ ชิมรสละมุนของเมล็ดกาแฟไทยจาก ???? ดอย บนพื้นที่ความสูงกว่า 1,000 เมตร ผลิตผลพิเศษในป่าใหญ่สุดพรีเมียมออร์แกนิค 1 ปีมีครั้งเดียว
นอกจากนี้ยังจะได้พบกับ Highlight ภายในงาน ไม่ว่าจะเป็น
- สุดยอดกาแฟโรบัสต้าอันดับ 5 ของโลก พร้อม Workshop "Coffee Cupping“
- กาแฟที่ราคาแพงที่สุด กาแฟขี้ชะมดสีม่วง
- กาแฟคั่วมือหม้อดินถิ่นภูซาง จากจังหวัดหนองบัวลำภู
- กาแฟลองเลย จากจังหวัดเลย
งานอาหารปลอดภัย เมืองปากน้ำ 28 – 30 สิงหาคม 2567
เชิญชวนมาเที่ยวชมชิมช็อป ในงานอาหารปลอดภัย วันที่ 28 – 30 สิงหาคม 2567 ณ บริเวณหน้าศาลากลางจังหวัดสมุทรปราการ (ทางขึ้น – ลง BTS ปากน้ำ) งานนี้ อาหารอร่อยๆ ของกินมากมายครบทุกแบบทั้งคาวหวาน ปิ้งย่าง ขนมไทย เครื่องดื่มชื่นใจ
ตามรอยอารยธรรมโบราณ ตระการตาปราสาทนครหลวง ตั้งแต่ 30 สิงหาคม - 3 กันยายน 2567 LINK
ขอเชิญมาร่วมเฉลิมฉลองครบรอบ 393 ปี ปราสาทนครหลวง กับงาน "ตามรอยอารยธรรมโบราณ ตระการตาปราสาทนครหลวง" ตั้งแต่วันนี้ - 3 กันยายน 2567
* พบกับการแสดง แสง สี เสียง สุดตระการตา ชุด "อยุธยาเรืองงาม ตำนานปราสาทนครหลวงคู่แผ่นดิน" การแสดงศิลปวัฒนธรรมจากนักเรียนในพื้นที่อำเภอนครหลวง คอนเสิร์ตจากศิลปินดังตลอด 5 วัน ตลาดย้อนยุคจัดแสดงและจำหน่ายสินค้าผลิตภัณฑ์ชุมชน OTOP ฯลฯ
สถานที่ ปราสาทนครหลวง อ.นครหลวง จ.พระนครศรีอยุธยา
สอบถามรายละเอียดข้อมูลเพิ่มเติมได้ที่เพจ https://www.facebook.com/profile.php?id=100072216288730 หรือ โทร. 035-359946
งาน กระบี่ไตรกีฬา Krabi TRIATHLONS 1 กันยายน 2567
กิจกรรมกระบี่ไตรกีฬา (Krabi Triathlons) 31 สิงหาคม - 1 กันยายน 2567 ณ สวนสาธารณะธารา เทศบาลเมืองกระบี่ จังหวัดกระบี่ ภายใต้โครงการพัฒนาเมืองกีฬาเชื่อมโยงการท่องเที่ยว กำหนดเส้นทางการ ว่าย-ปั่น-วิ่ง ทั้งหมด 4 ประเภท ประกอบด้วย 1. การแข่งขันไตรกีฬาระยะโอลิมปิก 2. การแข่งขันไตรกีฬาระยะสปริ้นท์ 3. การแข่งขันว่ายน้ำระยะ 750 เมตร 4. การแข่งขันวิ่งชายหาดระยะ 5 กิโลเมตร นอกจากนี้ ยังมีกิจกรรมการแสดงดนตรีสด การแสดงทางวัฒนธรรม การแสดงสินค้าจากผู้ประกอบการกว่า 20 ร้านค้า นิทรรศการกีฬา และกิจกรรมนันทนาการอีกหลากหลายกิจกรรมอีก
facebook.com/KrabiTriathlonsตารางสายการบินแอร์เอเชีย หัวหิน-เชียงใหม่ / เชียงใหม่-หัวหิน 1 กันยายน - 26 ตุลาคม 2567
ตารางการบิน สายการบินแอร์เอเชีย หัวหิน-เชียงใหม่ เชียงใหม่-หัวหิน
1 กันยายน - 26 ตุลาคม 2567 วันจันทร์ พุธ ศุกร์ อาทิตย์
เชียงใหม่ - หัวหิน ออกจากเชียงใหม่ 10.20 น. ถึงหัวหิน 11.50 น.
หัวหิน - เชียงใหม่ ออกจากหัวหิน 12.20 น. ถึงเชียงใหม่ 13.35 น.
เคาน์เตอร์เปิด 10.20 น. /เคาน์เตอร์ปิด 11.35 น. เกทเปิด 10.50 น. /เกทปิด 12.00 น.
ปฎิทินท่องเที่ยวและกิจกรรม จ.นครสวรรค์ เดือนกันยายน 2567 LINK
4 - 6 ก.ย. 2567 โครงการฟื้นฟูเศรษฐกิจตลาดพาณิชย์ บริเวณสำนักงานพาณิชย์จังหวัดนครสวรรค์
10 - 16 ก.ย. 2567 Art Toys Fest @ Central Nakhonsawan
11 - 15 ก.ย. 2567 Japan Signature 2024 @ Central Nakhonsawan
13 - 22 ก.ย. 2567 เทศกาลหนังสือนครสวรรค์ @ Central Nakhonsawan
13 - 22 ก.ย. 2567 มหกรรมของดี...ชายเเดนใต้ ณ โดมเเอร์สนามกีฬา จ.นครสวรรค์
28 ก.ย. 2567 การประกวด Miss Grand @ Central Nakhonsawan
ปฏิทินกิจกรรมท่องเที่ยวพิจิตร กันยายน 2567 LINK
ปักหมุดเที่ยวปลายฝน ต้นหน้าหนาว จังหวัดพิจิตร กันยายน 2567
* 30 ส.ค. - 8 ก.ย.2567
งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร ชิงถ้วยพระราชทานพระบาทสมเด็จพระเจ้าอยู่หัว ประจำปี 2567
ณ ลำน้ำน่าน หน้าวัดท่าหลวง พระอาราม อ.เมือง จ.พิจิตร
* 14 - 22 ก.ย.2567
งานประเพณีแข่งขันเรือยาวประเพณี ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา สยามบรมราชกุมารี แชมป์VSแชมป์
ณ วัดท่าบัวทอง อ.โพธิ์ประทับช้าง
* 23-29 ก.ย.2567
งานประเพณีปิดทองไหว้พระ แข่งขันเรือยาว ณ วัดบางมูลนาก อ.บางมูลนาก
* 28 ก.ย.2567
Forest Music Camp สายแคมป์ 2 ณ ป่ากลางเมือง ตรงข้ามโกลบอลเฮ้าส์ อ.เมือง
งานอาร์ตกลางหุบเขา นิทรรศการภาพเขียนพระโพธิสัตว์กวนอิม 1 กันยายน - 14 ตุลาคม 2567 LINK
เชิญชวนทุกท่านร่วมสัมผัสประสบการณ์งานอาร์ตกลางหุบเขา "นิทรรศการภาพเขียนพระโพธิสัตว์กวนอิมโดย มาสเตอร์หวัง ฉางลี่" ศิลปินระดับโลกชาวจีน ตั้งแต่วันที่ 1 กันยายน - 14 ตุลาคม 2567 สถานที่จัดงาน หอมนสิการ อ.แก่งคอย จ.สระบุรี
GPS. โดยงานนี้อาจารย์หวัง ฉางลี่ จะนำผลงานภาพออริจินัลของพระโพธิสัตว์กวนอิมมาแสดงมากถึง 6 ภาพ 6 ปาง แต่ละภาพมีความใหญ่สูงสุดถึง 4 เมตร แต่ละปางมีความหมายและความศักดิ์สิทธิ์ตามความเชื่อแบบจีนโบราณที่หากได้มาชมสักครั้งในชีวิตถือเป็นความสิริมงคลอย่างที่สุด
สำรองบัตรล่วงหน้าได้แล้ว เวลาเข้าชมแบ่งเป็นรอบๆ ตั้งแต่ : 10.00–17.00 น.
ค่าบัตรเข้าชมงานนิทรรศการภาพเขียนฯ - คนไทย 250 บาท - ชาวต่างชาติ 500 บาท - เด็กต่ำกว่า 12 ปี และผู้สูงอายเกิน 60 ปี เพียงครึ่งราคา - นักบวช พระสงฆ์ เข้าชมฟรีไม่มีค่าใช้จ่าย * จำกัดผู้เข้าชมต่อรอบไม่เกิน 20 ท่าน **ขอสงวนสิทธิ์ผู้เข้าชมอายุตั้งแต่ 7 ปีขึ้นไป ***อัตราข้างต้นรวมค่าเข้าชมหอมนสิการแล้ว (ปิดทำการทุกวันจันทร์)
3 Mountain Trail 2024 Season 2 @KHAO TEENKAI" Nakhonnayok 1 กันยายน 2567
3 Mountain Trail 2024 Season 2 @KHAO TEENKAI" Nakhonnayok สนามที่ 1 วันอาทิตย์ ที่ 1 กันยายน 2567 เขาตีนไก่ 12 KM 6 Km นครนายก จุดจัดการแข่งขัน สวนคัยวะ อำเภอบ้านนา จังหวัดนครนายก
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครนายก ร่วมกับบริษัท เรคเรซ สปอร์ต จำกัด หน่วยงานภาครัฐและเอกชนในพื้นที่จังหวัดนครนายก จังหวัดสระแก้ว จังหวัดปราจีนบุรี จัดกิจกรรมส่งเสริมการท่องเที่ยว “กิจกรรมแข่งขันวิ่ง 3 สนาม 3 จังหวัด” เชิญนักวิ่งร่วมสัมผัสประสบการณ์ใหม่ของเมืองน่าเที่ยวช่วงฤดูฝนนี้กับกิจกรรมการแข่งขันวิ่ง 3 สนาม 3 ประสบการณ์ที่ทุกท่านจะรับกลับไปจากพื้นที่ท่องเที่ยวนครนายก สระแก้ว และปราจีนบุรี ตลอดเดือนกันยายนนี้
- สนามที่ 1 เขาตีนไก่ : กำหนดจัดในวันอาทิตย์ที่ 1 กันยายน 2567 ณ หุบเขาตีนไก่ อำเภอบ้านนา จังหวัดนครนายก
- สนามที่ 2 เขาฉกรรจ์ : กำหนดจัดในวันอาทิตย์ที่ 15 กันยายน 2567 ณ บริเวณสวนรุกขชาติเขาฉกรรจ์ อำเภอเขาฉกรรจ์ จังหวัดสระแก้ว
- สนามที่ 3 เขาอีโต้ : กำหนดจัดในวันอาทิตย์ที่ 29 กันยายน 2567 ณ บริเวณป่านันทนาการน้ำตกเขาอีโต้ อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี
งานประเพณีแข่งเรือยาว ศึกไทย-ลาว ชิงเจ้าลำน้ำโขง วันที่ 1-15 กันยายน 2567
งานประเพณีแข่งเรือยาว ศึกไทย-ลาว ชิงเจ้าลำน้ำโขง วันที่ 1-15 กันยายน 2567 ณ ริมฝั่งแม่น้ำโขง อ.เมือง จ.บึงกาฬ
ประกวดคลิปโฆษณา งาน “เบิ่งคักๆ แล้วสิฮักหนองคาย” หัวข้อ "มนต์เสน่ห์ออกพรรษา magic of Nongkhai"
ขอเชิญผู้สนใจร่วมส่งประกวดคลิปวิดีโอสั้นเพื่อใช้ในการโฆษณาการท่องเที่ยวในเทศกาลออกพรรษา จังหวัดหนองคายในงาน “เบิ่งคักๆ แล้วสิฮักหนองคาย” ชิงเงินรางวัลมูลค่ารวมกว่า 85,000 บาทพร้อมใบประกาศเกียรติคุณ . ภายใต้หัวข้อ "มนต์เสน่ห์ออกพรรษา magic of Nongkhai" . ส่งผลงานได้ตั้งแต่วันนี้ - วันที่ 24 กันยายน 2567 ติดต่อสอบถามรายละเอียดเพิ่มเติม สมัครเข้าแข่งขันผ่านไลน์แอดเบิ่งคักๆ Line@ : @818tmpvp [
ไทหนองคาย]
ปฎิทินท่องเที่ยวจังหวัดเพชรบุรี เดือนกันยายน 2567 LINK
- 14-21 กันยายน 67 17.00 น. เป็นต้นไป เทศกาลกินหอย ตกหมึก ที่ชะอำ ณ จุดชมวิวชายหาดชะอำ อ.ชะอำ
- 14 กันยายน 67 15.30-20.00 น. ตลาดสวนสนลอย ณ Centra Life Cha Am Beach Resort อ.ชะอำ
- 15 กันยายน 67 05.30-09.30 น. งานวิ่ง หนองหญ้าปล้อง ฮาล์ฟมาราอน ณ เขื่อนแม่ประจันต์ อ.หนองหญ้าปล้อง
- ทุกเย็นวันเสาร์ 17.00 น. เป็นต้นไป ถนนคนเดิน : ถนนมีชีวิต พานิชเจริญ เปิดหมวก ณ ถนนพานิชเจริญ อ.เมือง
- เสาร์-อาทิตย์ 09.00-17.00 น. ตลาดริมน้ำจามจุรี ณ โฮมสเตย์บ้านถ้ำเสือ อ.แก่งกระจาน
งานโอท็อปและของดีอำเภอป่าซาง ลำพูน 1-8 กันยายน 2567
ไปเที่ยวชมงาน Otop ป่าซาง ณ ณ ศูนย์ศิลปหัตถกรรมพื้นบ้าน เทศบาลป่าซาง อำเภอป่าซาง จังหวัดลำพูน เสาร์ที่ 7 -อาทิตย์ที่ 8 กันยายน 2567 นี้ จัดโดยอำเภอป่าชาง ร่วมกับชมรมกำนันผู้ใหญ่บ้านและองค์กรปกครองส่วนท้องถิ่นในอำเภอป่าซาง จังหวัดลำพูน พบกับกิจกรรมภายในงาน การเดินแบบผ้าไทยการกุศล "ผ้าไทย ใส่ให้สนุก" การออกร้านสินค้า OTOP ของดีอำเภอป่าซาง การประกวดหนุ่มสาวชาวสวน การแข่งขันกลองหลวง การประกวดธิดาดวงดี (สาวประเภทสอง) การแข่งขันรำวงย้อนยุค สินค้ามากมายจากร้านค้า Otop "ของดี ของอร่อย" ที่ต้องลิ้มลอง
ร่วมทำบุญเทศกาลประเพณีทิ้งกระจาดประจำปี 2567 วันที่ 2 กันยายน 2567 LINK
ขอเชิญชวนร่วมทำบุญเทศกาลทิ้งกระจาดประจำปี 2567 ที่วัดเขต์นาบุญญารามจังหวัดจันทบุรี วันจันทร์ที่ 2 กันยายน 2567
เวลา 12:30 น. พระสงค์อนัมนิกายประกอบพิธีทิ้งกระจาด
เวลา 14:00 น. ปิดประตูทั้ง 3 ด้านของวัด
เวลา 15:00 น. เสร็จพิธีและเริ่มแจกข้าวสาร
สามารถติดต่อสอบถามและร่วมบริจาคสิ่งของได้ที่วัดเขตร์นาบุญญาราม
เทศกาลอาหารฮาลาลแห่งปีของจังหวัดสตูล 2-4 กันยายน 2567
เทศกาลอาหารฮาลาลแห่งปีของจังหวัดสตูล ควบคู่ไปกับบรรยากาศคฤหาสน์กูเด็นยามค่ำคืน การแสดงมากมายเพื่อให้ทุกท่านได้มีความสุข อิ่ม อร่อย อบอุ่นไปด้วยกัน เร็วๆ นี้ 2-4 กันยายน 2567 ณ คฤหาสน์กูเด็น อ.เมืองสตูล จ.สตูล
มูลนิธิกาญจนบารมี ออกหน่วยตรวจคัดกรองมะเร็งเต้านมในจ.น่าน เดือนกันยายน 2567
มูลนิธิกาญจนบารมี ออกหน่วยเคลื่อนที่ ตรวจคัดกรองมะเร็งเต้านม ในจ.น่าน เดือนกันยายน 2567 กำหนดการดังนี้
2-6 กันยายน 2567 ห้างโลตัส อ.เมืองน่าน
9-13 กันยายน 2567 ที่ว่าการอำเภอเวียงสา
16-20 กันยายน 2567 ที่ว่าการอำเภอปัว
23-27 กันยายน 2567 โรงเรียนนาน้อย อ.นาน้อย
เงื่อนไขเข้ารับบริการ : สตรีผู้ที่มีความผิดปกติทางเต้านม สตรีที่มีอายุมากกว่า 35 ปีขึ้นไป หรือผู้ที่สนใจ ที่ไม่อยู่ระหว่างตั้งครรภ์ หากท่านใดเคยตรวจและพบความผิดปกติ ให้นำผลตรวจเดิมมาด้วย
การให้บริการ : สอนตรวจเต้านมด้วยตนเอง ตรวจเต้านมผิดปกติโดยแพทย์ เอ็กซเรย์และอัลตราซาวด์เต้านม รับผลตรวจใน 1 วัน
หมายเหตุ : การทำแมมโมแกรม ไม่ได้ทำให้ทุกราย แต่ขึ้นกับดุลยพินิจของแพทย์
โรงพยาบาลสิชลมินิมาราธอน ครั้งที่ 16 วันที่ 2 กันยายน 2567
โรงพยาบาลสิชลมินิมาราธอน ครั้งที่ 16 ออกกำลังกาย ลดเสี่ยง ลดโรค NCD จัดกิจกรรม : วันอาทิตย์ ที่ 6 ตุลาคม 2567 ณ โรงพยาบาลสิชล จ.นครศรีธรรมราช ระบบเริ่มเปิดรับสมัคร ในวันจันทร์ ที่ 2 กันยายน 2567 เวลา 12.00 น. เป็นต้นไป
PHIST 2024 - 2 กันยายน 2567
PHIST 2024 Monday, 2nd September 2024 at Angsana Laguna Phuket 9.00-18.00 pm South East Asia largest and best sustainable tourism learning event.
รำลึก 23 ปีราชาโฟล์คซองคำเมือง จรัล มโนเพ็ชร 3 กันยายน 2567
มาร่วมรำลึก 23 ปีการจากลา ของราชาโฟล์คซองคำเมือง “จรัล มโนเพ็ชร” ที่ลานดิน เชียงใหม่ 3 กันยายน 2567 ร่วมกันสืบสานบทเพลงคำเมืองส่งต่อให้ลูกหลาน ร่วมเชิดชูคารวะครูใหญ่ผู้นำและบุกเบิกดนตรีเหนือให้เป็นที่รู้จักกันทั่วประเทศผ่านบทเพลงและบรรเลงจากเหล่าศิลปินล้านนา
การรวมตัวฮอมปอยของศิลปินและคนรักคนคิดถึง“จรัล มโนเพ็ชร” ราชาโฟล์คซองคำเมือง ผู้เป็นทั้งนักร้อง นักดนตรี นักแต่งเพลง ที่ได้รับการยอมรับว่าเป็นศิลปินล้านนาผู้ยิ่งใหญ่แห่งยุคสมัย งานนี้ไม่มีธุรกิจ ไม่มีค่าจ้าง มีแต่การฮอมแรง ฮอมใจ ฮอมตังค์ ฮอมครัว เพื่อจัดงานแด่ศิลปินชั้นครูที่เรารักและสืบทอดเจตนาสืบสานเพลงคำเมืองต่อไป
กิจกรรมภายในงาน
- มาฟังบทเพลงจากหมู่มวล เพื่อน พ้อง น้อง พี่ ศิลปินล้านนาที่จะยกขบวนฮอมปอยมาขับขานบทเพลงอันไพเราะ ท่ามกลางบรรยากาศของดนตรีในสวนใต้ร่มเงาไม้ใหญ่
- มาชมนิทรรศการเรื่องราวและของสะสมของ“จรัล มโนเพ็ชร” ราชาโฟล์คซองคำเมืองหลายมุมมองที่หลายคนไม่เคยรู้ (นิทรรศการจัดตั้งแต่วันที่30 ส.ค – 3 ก.ย. 67)
-ร่วมชมผลงานผลงานของอ้ายจรัลผ่าจอภาพยนตร์ขนาดเล็ก
- มาฟังเรื่องราวความประทับของศิลปินกับความทรงจำเกี่ยวอ้ายจรัล
- มาร่วมจุดเทียนร้องเพลงรำลึกถึงอ้ายจรัลพร้อมกัน ในบทเพลงรางวัลแด่คนช่างฝัน
-มากินของอร่อยของลำกับบรรยากาศกาดเมืองๆ
-ร่วมกันทำบุญผ้าป่าช่วยเหลือน้องๆที่อยู่ห่างไกล
- ชมฟรี จูงลูกจูงหลาน แต่งผ้าเมืองมาฟังบทเพลงของ “จรัล มโนเพ็ชร” ได้ตั้งแต่ 12.00 น.- 22.00 น.
ต่างจังหวัดสามารถชมถ่ายทอดสด (live)ออนไลน์ โดย ชมรมสื่อออนไลน์เชียงใหม่ และเครือข่ายพันธมิตรต่างๆ
กิจกรรมปีนี้ 2567 เป็นงานปอยหลวง ฮอมแฮงกั๋น คือการร่วมมือร่วมแรงกันโดยไม่มีค่าตอบแทนใดๆ ทั้งสิ้น ทั้งศิลปินและผู้จัด เพื่อเป็นน้ำหนึ่งใจเดียวกันในการรำลึกถึงจรัล มโนเพ็ชร ครูเพลงและศิลปินล้านนาผู้ยิ่งใหญ่
ร่วมสนับสนุนกิจกรรมดีๆ ศิลปินที่ต้องการฮอมปอยเล่นดนตรี การแสดง เครื่องเสียง ติดต่อได้ที่ อ้ายน้อง น้อง ปฏิญญา ตั้งตระกูล 0869228169
คอนเสิร์ต รำลึกการจากไปของ จรัล มโนเพ็ชร "จรัลในดวงใจ" 3 กันยายน 2567
คอนเสิร์ต รำลึก 23 ปี การจากไปของ จรัล มโนเพ็ชร "จรัลในดวงใจ" 2567 ในปีนี้งานที่เชียงใหม่ จะจัดขึ้นที่ เฮือนสุนทรี เวชานนท์ วันอังคารที่ 3 กันยายน 2567 18.00-22.00น. รับชมฟรีโดยไม่มีค่าใช้จ่าย โดยร้านเปิดให้บริการตามปกติ และจำหน่ายอาหารเครื่องดื่มตามปกติ ในวันเวลาดังกล่าว กำหนดการ (เวลาโดยประมาณ) กำหนดการตามเวลา 18.00น. : RibbindaSky 18.30น. : บอย อิมเมจิ้น , ชา ฮาโม , สายกลาง จินดาสุ 19.00น. : สุนทรี เวชานนท์ และวงเฮือนสุนทรี 19.30น. : พีสะเดิด 19.50น. : ไตรศุลี และ กิจจา มโนเพ็ชร 20.00น. : เลิศยศ ขันติธรรมวงศ์ , ธีรภัทร บุญพรหม , ชัญสุธดา เทพวรรณ์ , ปรินญาภัคร สนธิ , นัทธวัฒน์ กัญญา 20.20น. : ไม้เมือง 20.40น. : ลานนา คัมมินส์ & The Opposite Band
ถ่ายทอดสดผ่าน Fanpage :
จรัล มิวเซียมงานวังสะพุงแฟร์ มหกรรมสินค้า อาหาร ของดี 4 ภาค อำเภอวังสะพุง 3-12 กันยายน 2567
งานวังสะพุงแฟร์ มหกรรมสินค้า อาหาร ของดี 4 ภาค วันที่ 3-12 กันยายน 2567 ณ บริเวณหน้าที่ว่าการอำเภอวังสะพุง จังหวัดเลย
มหกรรมสินค้าชุมชนและของดีอำเภอบ้านแพ้ว 4-8 กันยายน 2567 LINK
"แลนด์ ออฟ บ้านแพ้ว" มหกรรมสินค้าชุมชนและของดีอำเภอบ้านแพ้ว 4-8 กันยายน 2567 ตั้งแต่เวลา 12.00-22.00 น ณ บริเวณริมเขื่อนหน้าที่ว่าการอำเภอบ้านแพ้ว มหกรรมสินค้าชุมชนและของดีอำเภอบ้านแพ้ว ชม ชิม ช้อป สุดฟิน ภายในงานพบกับบูธจำหน่ายสินค้าแปรรูปจากมะพร้าว ลำไย ปลาสลิด กุ้ง พันธุ์ไม้ดอกไม้ประดับ นานาชนิดพร้อมกับบูธจำหน่ายอาหารสตรีทฟู้ดเจ้าดัง พร้อมรับชมการแสดงจากนักเรียน และการแสดงดนตรีสดสุดชิลล์ การแสดงพื้นถิ่นบ้านแพ้ว ฟังดนตรีโฟล์คซอง เบาๆกับบรรยากาศริมคลองดำเนิน นั่งเรือเที่ยวฟรี ไป-กลับ หน้าที่ว่าการอำเภอบ้านแพ้ว- วัดหลักสี่ราษฎร์สโมสร
งานสีสันสาคร (ตอน วัสสานฤดู) วันที่ 4–8 กันยายน 2567 ริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร
ชวนตะลุยกิน ฟินกับบรรยากาศพระอาทิตย์ตกยามเย็น ในงานสีสันสาคร (ตอน วัสสานฤดู) วันที่ 4 – 8 กันยายน 2567 ณ
บริเวณริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร
ไฮไลท์คอนเสิร์ต 5 วัน 5 ศิลปิน อย่าพลาดกับคอนเสิร์ตสุดมันส์ทุกคืน เริ่มตั้งแต่ 19.00 น. 4 ก.ย. 67 – วงบลูด้า 5 ก.ย. 67 – วงปากอง 6 ก.ย. 67 – สินเจริญ บราเธอร์ส 7 ก.ย. 67 – หงา คาราวาน 8 ก.ย. 67 – สลัมบอมเบย์
คอนเสิร์ต “มันส์ เลิฟ มิวสิก“ 4-8 กันยายน 2567 เข้าได้ไม่จำกัดอายุ (ต่ำกว่า 12 ปีเข้าฟรี ‼️) บัตรเข้างาน 99 บาท
คอนเสิร์ต “ มันส์ เลิฟ มิวสิก“ 4-8 กันยายน 2567 ที่ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส) มันส์สุด แดนซ์สุด จัดเต็ม 5 คืน กับศิลปินดัง แนวเพลงฮิตวัยรุ่น และแนวเพลงระดับตำนาน มันส์กันแบบจัดเต็ม จัดเต็มโดมหลังคาขนาดใหญ่ทั้งลานไม่ต้องกลัวเปียกฝน งานนี้เข้าได้ไม่จำกัดอายุ (ต่ำกว่า 12 ปีเข้าฟรี ‼️) บัตรเข้างาน 99 บาท
ตารางการแสดงศิลปิน 4 ก.ย Tilly birds 5 ก.ย Dax rock rider 6 ก.ย หิน เหล็ก ไฟ 7 ก.ย Indigo 8 ก.ย ปู่จ๋าน ลองไมค์&เคนน้อย ✅ เงื่อนไขการเข้าพื้นที่ : ภายในงานจะมี wristband สำหรับแบ่งโซนลูกค้า
Chill Chill Coffee Craft @pacific 4–8 กันยายน 2567 แปซิฟิคพาร์ค ศรีราชา
งานชิลล์ๆ ของคนรักงานกาแฟ ในงาน Chill Chill Coffee Craft @pacific จิบกาแฟเพลินๆ กับบรรยากาศที่แสนเย็นสบาย Style Café ริมทะเล ดนตรีฟอล์คซอง สัมผัสบรรยากาศชิล หอมกลิ่นกาแฟทุกวัน 4 – 8 กันยายน 2567 ลานโปรโมชั่น ชั้น B ศูนย์การค้าแปซิฟิคพาร์ค ศรีราชา
บด ชง ชิม กับเมล็ดกาแฟคุณภาพ รสชาติดีมีเอกลักษณ์...ความสุขที่ คอกาแฟไม่ควรพลาด เพลิดเพลินไปกับกิจกรรมสุดพิเศษ อาทิ
6 กันยายน พบกับ คุณอั๋น สโลบาร์ เจ้าของร้านกาแฟในสุสาน ผู้สร้างแรงบันดาลใจ
7 กันยายน พบกับ คุณแซนด์ พชร โชว์ศิลปะการเท "ลาเต้ อาร์ท" ดีกรีแชมป์ อันดับที่ 5 ของโลก ในรายการ World Latte Art Championship 2023
8 กันยายน พบกับ คุณต้า PINE TREE Coffee Roasters มา Cupping กาแฟกว่า 20 ชนิด และพบกับ KUNNAN COFFEE คืนผืนป่าให้แม่ด้วยกาแฟพ่อ ชวนลิ้มลอง สุดยอดกาแฟพิเศษไทย จากน่าน การันตี 3 รางวัล พร้อมกาแฟคั่วพิเศษ เฉพาะงานนี้เท่านั้น
งานฉลอง 60 ปี อำเภอกุดบาก จังหวัดสกลนคร ประจำปี 2567 วันที่ 4–6 กันยายน 2567
อำเภอกุดบากร่วมกับทุกภาคส่วน จัด "งานฉลอง 60 ปี อำเภอกุดบาก จังหวัดสกลนคร" ประจำปี 2567 ขึ้น ในระหว่างวันที่ 4 – 6 กันยายน 2567 เพื่อเป็นการแสดงออกซึ่งความกตัญญูต่อวิญญูชน และทำบุญอุทิศส่วนกุศลให้แก่บรรพบุรุษผู้ก่อตั้งอำเภอกุดบาก ส่งเสริมและสนับสนุนความรัก ความสามัคคีกลมเกลียว ความเป็นอันหนึ่งอันเดียวในชุมชน ซึ่งตลอดทั้งงาน มีการจัดกิจกรรมหลากหลาย เช่น พิธีทำบุญตักบาตรพระสงฆ์ ทำบุญถวายกองผ้าป่าสมทบทุนก่อสร้างอาคารศูนย์ฟอกไต โรงพยาบาลกุดบาก การแสดง การแสดงศิลปวัฒนธรรมและดนตรีพื้นบ้านของเหล่านักเรียน นิทรรศการ บูธแสดงสินค้าผลิตภัณฑ์ชุมชน และชิมอาหารท้องถิ่นตลอดทั้งวัน บรรยากาศทั่วไปมีประชาชนในพื้นที่เดินทางมาร่วมงานจับจ่ายซื้อสินค้าอย่างคึกคักเกษตรแฟร์แม่กลอง ปี 2567 วันที่ 5-9 กันยายน 2567
งานเกษตรแฟร์แม่กลอง ปี 2567 กำหนดจัดขึ้นระหว่างวันที่ 5-9 กันยายน 2567 ณ อนุสรณ์สถานแฝดอิน-จัน อำเภอเมืองฯ จังหวัดสมุทรสงคราม ภายในงานจัดให้มีร้านค้าจำหน่ายสินค้าเกษตร ต้นไม้ พันธุ์ไม้ วัสดุอุปกรณ์การเกษตร การจำหน่ายสินค้าวิสาหกิจชุมชน สินค้าOTOP สินค้าปลอดภัย และสินค้าชุมชน อีกทั้งยังจัดให้มีนิทรรศการการป้องกันกำจัดโรคพืช การให้ความรู้การเพาะเลี้ยงแหนแดง การให้ความรู้เกี่ยวกับปลาหมอคางดำ และเมนูอาหารจากปลาหมอคางดำ การประกวดพริกมันบางช้าง ซึ่งเป็นสินค้าGI ของจังหวัดสมุทรสงคราม การประกวดแพะสวยงาม การแสดงนิทรรศการสินค้า GI ของจังหวัดสมุทรสงคราม อีกด้วย
Food Fin In Dokkrai ฟู้ดฟิน อินดอกกราย ครั้งที่ 1 วันที่ 5-8 กันยายน 2567
Food Fin In Dokkrai (ฟู้ดฟิน อินดอกกราย) ครั้งที่ 1 วันที่ 5-8 กันยายน 67 เวลา 15.00 - 22.30 น. ณ
หอเฉลิมพระเกียรติ อ่างเก็บน้ำดอกกราย อ.ปลวกแดง จ.ระยอง ชวนครอบครัวมาสนุกกันในบรรยากาศสุดชิวอ่างเก็บน้ำดอกกราย สนุกกับกิจกรรมภายในงาน : ละครลิงประกิตโชว์ วันละ 2 รอบ : บอลลูน วันที่ 7-8 กันยายน : สตรีทฟู้ดร้านเด็ดกว่า 150 ร้านค้า : ดนตรีสด
งานแถลงข่าวการจัดการประกวดนางสาวไทยชลบุรีประจำปี 2568 วันที่ 5 กันยายน 2567
กองประกวดนางสาวไทยชลบุรีขอเชิญแขกผู้มีเกียรติทุกท่านร่วมงานแถลงข่าว “การจัดการประกวดนางสาวไทยชลบุรีประจำปี2568” วันพฤหัสบดีที่ 5 กันยายน 2567 เวลา 14.30 - 17.30 น. ณ โรงแรมโอ๊ควู๊ด โฮเทล แอนด์ เรสซิเดนซ์ ศรีราชา
facebookCraft Drink by Diprom 5–10 กันยายน 2567
งาน “CRAFT DRINK BY DIPROM” ศาสตร์และศิลป์เครื่องดื่มไทย นำธุรกิจไกลสู่สากล วันที่ 5 – 10 กันยายน 2567 ณ ลานหน้าศูนย์การค้าเซ็นทรัลเวิลด์ ภายในงาน ได้นำผู้ประกอบการผลิตภัณฑ์ชุมชนด้านผลิตภัณฑ์ โกโก้ กาแฟ และสุราชุมชน นำสินค้าเข้าร่วมจัดแสดง และจำหน่ายให้กับผู้ที่เข้าชมงาน กว่า 120 ร้านค้า
นอกจากนี้ ยังได้กิจกรรมให้คำปรึกษาแนะนำทางธุรกิจ และการให้บริการสินเชื่อ รวมทั้งการประกวดแข่งขันเพื่อกระตุ้นให้คนรุ่นใหม่เข้าถึง ผลิตภัณฑ์โกโก้ และกาแฟ อาทิ การแข่งขัน Cocoarista DIPROM Contest ทำเครื่องดื่มจากโกโก้ในโจทย์ที่ท้าทาย เน้นความคิดสร้างสรรค์ โดดเด่นด้านการตกแต่ง และรสชาติ ชิงเงินรางวัลมากกว่า 20,000 บาท พร้อมโล่รางวัล และการแข่งขัน Speed Latte Art DIPROM Contest ที่ประชันทั้งฝีมือและการสร้างสรรค์ผลงานศิลปะบนด้วยกาแฟ ภายใต้ระยะเวลาที่กำหนด ชิงเงินรางวัลมากกว่า 20,000 บาท พร้อมโล่รางวัล และยังมีมินิคอนเสิร์ต จากศิลปินชื่อดัง อาทิ sarah salora , อะตอม ชนกันต์ และคริส พีรวัส มาร่วมให้ความบันเทิงกับผู้ร่วมงาน
งาน ตลาดพาณิชย์พัทลุง โครงการฟื้นฟูเศรษฐกิจ ลดรายจ่าย เพิ่มรายได้ ขยายโอกาส ในวันพฤหัสบดีที่ 5 กันยาน 2567
สำนักงานพาณิชย์จังหวัดพัทลุง ขอเชิญ ชม ชิม ช็อป สินค้าชุมชน สินค้าเกษตร สินค้าอุปโภคบริโภคราคาประหยัด และสินค้าอื่น ๆ ในงาน “ตลาดพาณิชย์พัทลุง” โครงการฟื้นฟูเศรษฐกิจ ลดรายจ่าย เพิ่มรายได้ ขยายโอกาส ในวันพฤหัสบดีที่ 5 กันยาน 2567 เวลา 10.00 - 15.00 น. ณ บริเวณสนามหน้าศาลากลางจังหวัดพัทลุง (บริเวณด้านหน้าอาคารโรงอาหาร)
มาชม ชิม ช็อป สินค้าชุมชน สินค้าเกษตร จากบูทจำหน่ายสินค้ากว่า 15 ร้าน ประกอบด้วย ผัดไทย ข้าวคลุกกะปิ แกงน้ำเคยยอดหวาย ขนมดอกโดน ข้าวเหนียวสองดัง ขนมของฝาก สินค้าอุปโภคบริโภคราคาประหยัด และสินค้าอื่น ๆ ราคาประหยัดอีกมากมาย จัดโดยสำนักงานพาณิชย์จังหวัดพัทลุง
ภูมิศิลป์ ถิ่นวัฒนธรรม ลุ่มแม่น้ำเจ้าพระยา-ป่าสัก 5-7 ก.ย. 67 ณ ลานหน้าศาลากลางจังหวัดอ่างทอง (หลังเก่า)
งาน “ภูมิศิลป์ ถิ่นวัฒนธรรม ลุ่มแม่น้ำเจ้าพระยา-ป่าสัก” 5-7 ก.ย. 67 ณ ลานหน้าศาลากลางจังหวัดอ่างทอง (หลังเก่า) เข้าชมฟรี! ตั้งแต่เวลา 14.00-22.00 น.
เต็มอิ่มกับของดี อาหารเด็ด จาก 6 จังหวัด กลุ่มภาคกลางตอนบน อ่างทอง พระนครศรีอยุธยา สิงห์บุรี สระบุรี ลพบุรี ชัยนาท พร้อมชมการแสดงศิลปวัฒนธรรมหาชมยาก อาทิ การแสดงโขนชุดใหญ่ “ศึกนาคบาท” , การแสดงชุด “สิบสองภาษาออกตัว” อลังการงานสร้างหาชมยาก , การแสดงโขนสด , การแสดงวิพิธทัศนา , เพลงพื้นบ้าน (เพลงเรือ) , รำมะนา , หนังใหญ่วัดสว่างอารมณ์ , รำไทยพวน , โปงลาง (สุขดีดนตรีไทย) , ฟ้อนก๋ายลาย , ฟ้อนประทีปบูชา , รำร้องจากท้องทุ่งสู่ยุ้งฉาง , รำรับขวัญข้าว , ดนตรีมโหรี และดนตรีร่วมสมัย ยังไม่พอ ! พบกับศิลปินชั้นนำที่จะมามอบความสุขภายในงาน
5 ก.ย. 67 : นักร้องหนุ่มยอดกตัญญูผู้มีเสียงไพเราะเสนาะหู นัน อนันต์ , นักร้องสาวเสียงสวย เกมส์ สุจิตรา เจ้าของบทเพลงยอดวิวกว่า 200 ล้านวิว มาพร้อมวง Ghetto All Stars
6 ก.ย. 67 : Parkmalody เจ้าของเพลงฮิตกับท่อนฮุคที่ฮัมกันได้ทั้งบ้านทั้งเมือง "วาสนาผู้ใดหนอ..."
7 ก.ย. 67 : เตรียมพบความสนุกสนาน แบบลิเกคืนถิ่นอ่างทอง กับ “ลิเกไม่ธรรมดา ไชยา มิตรชัย”
ชวนเที่ยวชม ชิม ช้อป "งานมหกรรมไหมสุรินทร์ สุดยอดไหมโลก" วันที่ 5 – 9 กันยายน 2567
สำนักงานพาณิชย์จังหวัดสุรินทร์ ขอเชิญชวนเที่ยวชม ชิม ช้อป "งานมหกรรมไหมสุรินทร์ สุดยอดไหมโลก" ระหว่างวันที่ 5 – 9 กันยายน 2567 ตั้งแต่เวลา 09.00-21.00 น. ณ สวนสาธารณะเฉลิมพระเกียรติฯ 80 พรรษา (สวนใหม่)
พบกับ สินค้าดี สินค้าเด่น จากจังหวัดสุรินทร์ กลุ่มจังหวัดนครชัยบุรินทร์ จังหวัดชายแดนภาคตะวันออกเฉียงเหนือ และสินค้าจากราชอาณาจักรกัมพูชา มากกว่า 200 ร้านค้า อาทิเช่น สินค้าชุมชน สินค้า OTOP / SMEs สินค้าเกษตรแปรรูป และสินค้าอื่นๆ อีกมากมาย
มินิคอนเสิร์ตจากศิลปินนักร้องที่มีชื่อเสียง
กิจกรรมการประกวด ชิงเงินรางวัลรวมกว่า 20,000 บาท
- การประกวดออกแบบผ้าไหมสุรินทร์ สู่สากล
- การประกวด Live สด ขบวนไหมสุรินทร์สุดยอดไหมโลก
- การประกวดถ่ายภาพกิจกรรมงาน มหกรรมไหมสุรินทร์ สุดยอดไหมโลก
กิจกรรมพิเศษ
- นิทรรศการสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง
- นิทรรศการสมเด็จพระเจ้าลูกเธอ เจ้าฟ้าสิริวัณณวรี นารีรัตนราชกัญญา
- นิทรรศการ เรื่องเล่าสุรินทร์
- นิทรรศการ โรงทอ ผ้าไหมสุรินทร์ลายอัตลักษณ์เมืองสุรินทร์
แสดงและจำหน่ายสุดยอดผ้าไหมสุรินทร์ ของดีเมืองสุรินทร์ สายมูเตลู ห้ามพลาด
ขบวนแห่ สุดยอดผ้าไหมสุรินทร์ สู่สากล
แล้วพบกันนะคะ
สอบถามรายละเอียดเพิ่มเติม 044-514385
กินปลาสันเขื่อน ชมนกกระเรียนพันธุ์ไทย ทุ่งข้าวใหม่เกษตรอินทรีย์ ของดีตลาดเซราะแอง วันที่ 5-6 กันยายน 2567
ททท. สำนักงานบุรีรัมย์ ขอเชิญร่วมกิจกรรม "กินปลาสันเขื่อน ชมนกกระเรียนพันธุ์ไทย ทุ่งข้าวใหม่เกษตรอินทรีย์ ของดีตลาดเซราะแอง" วันที่ 5-6 กันยายน 2567 ณ บริเวณอ้างเก็บน้ำห้วยจรเข้มาก ตั้งแต่เวลา 09.00-24.00 น.
ภายในงานพบกับกิจกรรมมากมายอาทิ
-ประกวดทำอาหารจากปลา
-ประกวดส้มตำลีลา
-ประกวดนักร้องเสียงทอง
-ประกวดขบวนฟ้อนรำ
และกิจกรรมอื่นๆอีกมากมาย
-ตลาดนัดสินค้า OTOP ของจังหวัดบุรีรัมย์
สอบถามข้อมูลเพิ่มเติมติดต่อ : ที่ทำการองค์การบริหารส่วนตำบลสะแกโพรง 044 184 000
AMAZING MUAY THAI EXPEREIENCE 2024 วันที่ 6-8 กันยายน 2567
การท่องเที่ยวแห่งประเทศไทย (ททท.) ขอเชิญคอมวยร่วมปลุกตำนานมวยไทย 4 สาย อนุรักษ์ศิลปะแม่ไม้มวยไทยโบราณ ในงาน AMAZING MUAY THAI EXPEREIENCE 2024 ท่องเที่ยวรูปแบบใหม่ ตามรอยต้นกำเนิดหนึ่งใน Soft power อย่าง “มวยไทย” ที่โด่งดังทั่วโลก วันที่ 6-8 กันยายน 2567 ณ ลานเมรุพรหมทัต อ.พิมาย จ.นครราชสีมา ทุกคนจะได้เพลิดเพลินร้านอาหารดังเมนูเด็ด และมินิคอนเสิร์ตจากศิลปินชื่อดังตลอดทั้ง 3 วัน
มหกรรมสตรีทฟู้ด (Chonburi Street Food Festival) 6-8 กันยายน 2567
งาน มหกรรมสตรีทฟู้ด (Chonburi Street Food Festival) 6-8 กันยายน 2567 นี้ ณ บริเวณหน้าศูนย์การค้า เซ็นทรัล ศรีราชา จังหวัดชลบุรี อร่อย ฟิน กับของกินรสเด็ด กว่า 100 ร้านค้า ✅รวมร้านอร่อย ทั้งคาว-หวาน และอาหารทะเลรสแซ่บ ซี้ด ✅กรี๊ดสนั่นหาด กับมินิคอนเสิร์ต จากศิลปินชื่อดัง 6 ก.ย. 2567- FELLOW FELLOW 7 ก.ย.2567 - ไรอัล กาจบัณฑิต 8 ก.ย.2567 - MUSKETEERS จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดชลบุรี
Wet Series Music Festival 2024 เชียงราย 6-7 กันยายน 2567
Wet Series Music Festival 2024 วันที่ 6-7 กันยายน 2567 @ สิงห์ปาร์ค เชียงราย
วันศุกร์ที่ 6 กันยายน 2567 - PATCHA - INDIGO - MAIYARAP - JOEYBOY
วันเสาร์ที่ 7 กันยายน 2567 - CHAMOOKxBOM SLAYERZ - P HOT - OAT PRAMOTE - JSPKK สอบถามข้อมูลเพิ่มเติมได้ที่ Facebook Page:
Singha Park Chiang Rai งานMOC MARKET 6-8 กันยายน 2567
งานMOC MARKET สุดยอดของดีเมืองปทุม ณ ตลาดอินเตอร์มาร์ท วันที่ 6 - 8 กันยายน 2567
ชมจันทร์ที่อัมพวา | FULL MOON @Amphawa วันที่ 6 - 8 กันยายน 2567
ขอชวนมาเติมใจ ให้เต็มดวง @อัมพวา กับกิจกรรม “ชมจันทร์ที่อัมพวา | FULL MOON @Amphawa” วันที่ 6 - 8 กันยายน 2567 เวลา 17.30 - 22.00 น. ณ อุทยานพระบรมราชานุสรณ์พระบาทสมเด็จพระพุทธเลิศหล้านภาลัย (อุทยาน ร.2) อำเภออัมพวา จังหวัดสมุทรสงคราม ...เนรมิตอุทยาน ร.2 ให้งดงามราวสวนแสงที่มีหิ่งห้อยนับพันนำทาง ...มาสร้างซีนสุดว้าวกับประติมากรรมโคมไฟดวงจันทร์ดวงยักษ์ ที่มีฉากหลังเป็นหมู่เรือนไทยอันงดงาม ...เพลิดเพลินไปกับแสงไฟประดับ และดิจิทัลอาร์ตสุดคูล ...ชมการแสดงศิลปวัฒนธรรมไทย ปูเสื่อดูหนังกลางแปลง ...เพลินพุงไปกับของอร่อยสารพัด ดื่มด่ำกับบรรยากาศดีๆ ริมแม่น้ำแม่กลอง ความสุขที่พร้อมเติมเต็มช่วงเวลาดีๆ ให้กับครอบครัว
Prachinburi Night at Museum ตอนคเณศจตุรถี รัตติกาลมหัศจรรย์ 6-8 กันยายน 2567 LINK
เชิญเที่ยวชม “PRACHINBURI” Night at the Museum ตอน คเณศจตุรถี รัตติกาลมหัศจรรย์” วันที่ 6 - 8 กันยายน 2567 ที่พิพิธภัณฑสถานแห่งชาติ ปราจีนบุรี ซึ่งงานอยู่ในช่วงวันคเนศจตุรถีหรือ วินายกะจตุรถี เทศกาลในศาสนาฮินดูที่เฉลิมฉลองการประสูติของพระพิฆเนศ ในวันที่ 7 กันยายน 2567 นั่นเอง. งานเริ่มเวลา 15.00-21.00 น. มีกิจกรรมบนอาคารนิทรรศการ ได้แก่..
- กิจกรรม Museum Tour เข้าชมนิทรรศการภายในอาคารพิพิธภัณฑสถานแห่งชาติ ปราจีนบุรี ในเวลาพิเศษ 16.00 -21.00 น. (มีค่าเข้าชม)
- กิจกรรม Curator Tour นำชมนิทรรศการโดยภัณฑารักษ์
รอบที่ 1 : 18.00 – 19.00 น. และ รอบที่ 2 : 19.30 – 20.30 น. (มีค่าเข้าชม)
- กิจกรรมสักการะพระคเณศ อายุมากกว่า 1,400 ปี เปิดให้สักการะพระคเณศเป็นกรณีพิเศษ (มีค่าเข้าชม) พร้อมมีดอกดาวเรืองบริการ และรับการ์ดที่ระลึกรูปพระคเณศฟรี
- แสดงผลงาน และจำหน่ายสินค้าของที่ระลึกของกลุ่มศิลปิน ART TOYS ชั้นนำ ได้แก่ Kappa coll /Insine Cartoonist / Munkky Studio / เต็มมือ / Sloth Doll / Ceremi / Poly Holy / Little Turtle Studio
อีกทั้งมีการจำหน่ายสินค้าของที่ระลึกของพิพิธภัณฑสถานแห่งชาติ ปราจีนบุรีอีกมากมาย
งานมหกรรมสตรีทฟู้ด Chonburi Street Food Festival 6-8 กันยายน 2567
มหกรรมสตรีทฟู้ด (Chonburi Street Food Festival) 6-8 กันยายน 2567 ณ บริเวณหน้าศูนย์การค้า เซ็นทรัล ศรีราชา จังหวัดชลบุรี อร่อย ฟิน กับของกินรสเด็ด กว่า 100 ร้านค้า ‼️ ✅รวมร้านอร่อย ทั้งคาว-หวาน และอาหารทะเลรสแซ่บ ซี้ด ✅กรี๊ดสนั่น กับมินิคอนเสิร์ต จากศิลปินชื่อดัง 6 ก.ย. - FELLOW FELLOW 7 ก.ย. - ไรอัล กาจบัณฑิต 8 ก.ย. - MUSKETEERS
Trang Art & Craft : Sounds of Rain, Colors of Art 6-8 กันยายน 2567
Trang Art & Craft : Sounds of Rain, Colour of Art ฟังเพลงกลางสายฝน(เล่น)ซนงานศิลป์ ทาง ททท.สำนักงานตรัง : TAT Trang ร่วมกับ YEC Trang และ มะนิลาคาเฟ่ตรัง จัดขึ้นในวันที่ 6-8 กันยายน 67 เวลา 16.00-23.00 น. ณ.มะนิลาคาเฟ่ตรัง มานั่งฟังเพลงชิวๆ ร่วม work shop เลือกซื้ออาหารหลายมากมายจากร้านค้าต่างๆ
ถนนท่องเที่ยว วิถีชาวเล เสน่ห์ ประแส 6-7 กันยายน 2567
ขอเชิญเที่ยวงาน ถนนท่องเที่ยว วิถีชาวเล เสน่ห์ ประแส วันที่ 6-7 กันยายน 2567 บริเวณอนุสรณ์เรือรบหลวงประแส ตำบลปากน้ำประแส อำเภอแกลง จังหวัดระยอง ชมคอนเสิร์ต 6 ก.ย. 67 ลีโอ อธิป 7 ก.ย. 67 เอิ้นขวัญ วรัญญา
เทศกาลศิลปะร่วมสมัยประจวบคีรีขันธ์ Prachuap Khiri Khan Art Festival 2024 วันที่ 6-8 กันยายน 2567
บ้านศิลปินหัวหิน" ร่วมกับ สำนักงานวัฒนธรรมจังหวัดประจวบคีรีขันธ์ จัดงาน เทศกาลศิลปะร่วมสมัยประจวบคีรีขันธ์ : Prachuap Khiri Khan Art Festival 2024 ระหว่างวันที่ 6-8 กันยายน 2567 เวลา 10:00 - 17:00 น. ณ หมู่บ้านศิลปินหัวหิน เข้าชมฟรีตลอดทั้งงาน
facebook.com/artvillagehuahin
เทศกาลศิลปะร่วมสมัยประจวบคีรีขันธ์ในครั้งนี้เตรียมพบกับนิทรรศการศิลปะจัดแสดงโดยศิลปินมากกว่า 120 ศิลปิน และ กิจกรรมสุดพิเศษอีกมากมายภายในงานอาทิ... ????• การจัดแสดงผลงานนิทรรศการ / Exhibition and Showcase - จิตรกรรม / Fine Art - ประติมากรรม / Sculpture - ภาพถ่าย / Photography - สตรีทอาร์ต / Street Art - อาร์ตทอย / Art Toy - ดิจิตอลอาร์ต / Digital Art - แทท ทูอาร์ต / Tattoo Art • เสวนา / Talk • เวิร์คช็อป / Creative Workshop • การแสดงบนเวที / Show on stage • การแสดงดนตรี / Live Music • ตลาดนัดภูมิปัญญา / Traditional and Local Market • การประกวดวาดภาพ / Art Contest
งานเทศกาลในครั้งนี้ยังได้รับการสนับสนุนจากหน่วยงานภาคเอกชนอย่างศูนย์การค้า Market Village HuaHin ในการการประชาสัมพันธ์และอำนวยความสะดวกบริการรถรับ-ส่งในช่วงจัดเทศกาลอีกด้วย สะดวกที่ไหนขึ้นที่นั่นได้เลย ปลายทางบ้านศิลปิน
รอบออกจากมาร์เก็ตวิลเลจ } บ้านศิลปิน หัวหิน ( รอบที่ 1: 10.00-10.15 น. และ รอบที่ 2 : 13.00-13.15น.)
รอบออกจากบ้านศิลปิน } มาร์เก็ตวิลเลจ หัวหิน (รอบที่ 1: 14.00-14.15 และรอบที่ 2 : 17.00น.)
งานย้อนตำนานเมืองตะโกลา สู่เสน่ห์อารยะเมืองเก่าตะกั่วป่า 6-10 กันยายน 2567
"งานย้อนตำนานเมืองตะโกลา" สู่เสน่ห์อารยะเมืองเก่าตะกั่วป่า 6-10 กันยายน 2567 นี้ ณ สวนสาธารณะทุ่งพระโพธิ์ อ.ตะกั่วป่า จ.พังงา พบกิจกรรมน่าสนใจมากมายในงาน - ชมพิธีเปิดงานและเดินแบบชุดพื้นเมือง - ฟรีคอนเสิร์ตจากศิลปินต่าง ๆ - ชมบรรยากาศเมืองเก่าตะกั่วป่ากับนทรรศการมีชีวิต - ชิมชอปเมนูเด็ดอาหารพื้นเมืองและของดีจังหวัดพังงา - ชมการแสดงแสงสีเสียงทุกค่ำคืน
งานส่งเสริมภูมิปัญญาท้องถิ่น อัตศิลป์ถิ่นตรัง ประจำปี 2567 วันที่ 6- 15 กันยายน 2567
จังหวัดตรัง ขอเชิญเที่ยวงาน ส่งเสริมภูมิปัญญาท้องถิ่น อัตศิลป์ถิ่นตรัง ประจำปี 2567 วันที่ 6-15 กันยายน 2567 ณ บริเวณหน้าศาลากลางจังหวัดตรัง ชมคอนเสิร์ตทุกคืน 6 ก.ย. 67 นุ่น ซุปเปอร์วาเลนไทน์ & แคท อาทิติยา & วงอสูรน้อย 7 ก.ย. 67 มโนราห์ ไข่เหลี้ยม 9 ก.ย. 67 หนังตะลุง น้องเดียว 10 ก.ย. 67 มาลีฮวนน่า 11 ก.ย. 67 เพลง วิสสุตา & วงอสูรน้อย 12 ก.ย. 67 บ่าววี อาร์สยาม 13 ก.ย. 67 วงอสูรน้อย 14 ก.ย. 67 เตย วีรยา 15 ก.ย. 67 มโนราห์ ศรีธน ธนนชัย
งานวันส้มโอขาวแตงกวาชัยนาท ครั้งที่ 40 ประจำปี 2567 วันที่ 29 สิงหาคม - 8 กันยายน 2567
จังหวัดชัยนาท จัดงานวันส้มโอขาวแตงกวาและของดีศรีท้องถิ่น จังหวัดชัยนาทครั้งที่ 40 ประจำปี 2567 ระหว่างวันที่ 29 สิงหาคม - 8 กันยายน 2567 รวม 11 วัน ณ บริเวณสนามกีฬาเฉลิมพระเกียรติ และเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท มีวัตถุประสงค์ เพื่อสนับสนุนเผยแพร่และส่งเสริมการปลูกส้มโอพันธุ์ขาวแตงกวา ซึ่งเป็นผลไม้ท้องถิ่นที่มีชื่อเสียงของจังหวัดชัยนาท การจำหน่ายส้มโอขาวแตงกวา ผลิตภัณฑ์ด้านการเกษตร ไม้ผล กิ่งพันธุ์และส่งเสริมการจำหน่ายผลิตภัณฑ์ชุมชนและท้องถิ่น (OTOP) ผลิตภัณฑ์ของกลุ่มแม่บ้านเกษตรกรและส่งเสริมการท่องเที่ยวในจังหวัดชัยนาท
เทศกาลอาหารและบอลลูนนานาชาติ จอมบึง ราชบุรี 6-15 ก.ย. 2567
เทศกาลอาหาร และ บอลลูนนานาชาติ จอมบึง ราชบุรี ปักวัน 6-15 ก.ย. 67 ที่ หน้าถ้ำจอมพล อ.จอมบึง จ.ราชบุรี จัดเต็ม 10 วัน ชมบอลลูนยักษ์ และ เซลฟี่กันแบบจุใจบอกเลยน่าไปสุดๆ จัดตารางเที่ยวรอกันไว้ได้เลย งานนี้ทั้งสนุกสุดฟิน อิ่มอร่อย พบศิลปินดัง คาราบาว(เต็งวง) วันที่ 6 - 15 ก.ย. 67
งาน หอการค้าแฟร์และบอลลูนนานาชาติ 6-15 กันยายน 2567 ณ ลานอนุสาวรีย์ปราบฮ่อ
งานหอการค้าแฟร์และบอลลูนนานาชาติ 6-15 กันยายน 2567 ณ ลานอนุสาวรีย์ปราบฮ่อ เวลาแสดงโชว์บอลลูน 18.00 - 21.00 น. ทุกวัน
งานหอการค้าแฟร์และบอลลูน ณ ลานอนุสาวรีย์ปราบฮ่อ จ.หนองคาย 6-15 กันยายน 2567
งานหอการค้าแฟร์และบอลลูน ณ ลานอนุสาวรีย์ปราบฮ่อ จ.หนองคาย 6-15 กันยายน 2567 นี้ เวลาแสดงโชว์บอลลูน 18.00 - 21.00 น. ทุกวัน
เทศกาลชมปรากฏการณ์กุ้งเดินขบวน ประจำปี 2567@ แก่งลำดวน อำเภอน้ำยืน วันศุกร์ ที่ 6 กันยายน 2567
ขอเชิญร่วมพิธีเปิดเทศกาลชมปรากฏการณ์กุ้งเดินขบวน ประจำปี 2567@ แก่งลำดวน อำเภอน้ำยืน จังหวัดอุบลราชธานีในวันศุกร์ ที่ 6 กันยายน 2567 สถานที่: แก่งลำดวน อำเภอน้ำยืน จังหวัดอุบลราชธานี กิจกรรมจะเริ่มตั้งแต่เวลา 6.00 น. เป็นต้นไป กิจกรรมในวันพิธีเปิด
1. ปั่นกินลม ชมกุ้งเดินขบวน ชวนทุกท่านชมธรรมชาติที่งดงาม
2. ค่ายเยาวชนอาสาสมัครพิทักษ์สิ่งแวดล้อม สำหรับน้องๆ เยาวชนที่รักการอนุรักษ์
3. มัคคุเทศน์น้อย นำเที่ยวแก่งลำดวน สำรวจธรรมชาติอย่างใกล้ชิด
4. ชมวงดนตรีสื่อความหมายธรรมชาติ เพลิดเพลินกับเสียงดนตรีที่เชื่อมโยงกับธรรมชาติ
5. การแสดงดนตรีพื้นบ้าน สัมผัสวัฒนธรรมดั้งเดิมผ่านเสียงดนตรี
6. การแสดง แสง สี เสียง “ตำนานแห่งจันลานาโดม ณ ดินแดนสามเหลี่ยมมรกต ที่จะพาทุกท่านเข้าสู่บรรยากาศแห่งตำนาน
7. ชมกุ้งเดินขบวน ปรากฏการณ์ธรรมชาติที่น่าตื่นตาตื่นใจ
นิทรรศการในงาน
1. แหล่งท่องเที่ยวทางธรรมชาติ เปิดมุมมองใหม่ๆ กับแหล่งท่องเที่ยวในพื้นที่
2. แจกกล้าไม้ เพิ่มพื้นที่สีเขียว ลดโลกร้อน
3. ป่าสร้างรายได้ เรียนรู้วิธีการทำป่าให้เป็นแหล่งรายได้
4. ผลิตภัณฑ์สินค้าชุมชน สินค้าเด่น สินค้าดี และอาหารพื้นบ้านให้ทุกท่านได้เลือกสรร
มาร่วมเป็นส่วนหนึ่งของประสบการณ์อันยิ่งใหญ่ในการชื่นชมธรรมชาติและวัฒนธรรมอันหลากหลาย รอคอยทุกท่านที่แก่งลำดวน ตำบลโดมประดิษฐ์ อำเภอน้ำยืน จังหวัดอุบลราชธานี!
ประกวดภาพถ่าย อะเมซิ่งท่าปลานะคราฟต์ LINK
กิจกรรมประกวดภาพถ่าย ในงาน "อะเมซิ่งท่าปลานะคราฟต์ " ในวัน.....ที่ 7 กันยายน 2567 อ.ท่าปลา อุตรดิตถ์ แสดงอัตลักษณ์แหล่งท่องเที่ยว สถานที่ ผู้คน ชุมชน ในอำเภอท่าปลา สำหรับประชาชนทั่วไป ชิงรางวัล รวม 7,000 บาท รางวัลชนะเลิศ 3,000 บาท รางวัลรองชนะเลิศอันดับ 1 1,500 บาท รางวัลรองชนะเลิศอันดับ 2 1,000 บาท รางวัลชมเชย 3 รางวัล 500 บาท
กติกาการประกวด 1 ภาพที่ถ่ายที่ถ่ายภายใน วันที่ 1 ส.ค. 67 ถึง 31 ส.ค. 67 เท่านั้น 2 ใช้อุปกรณ์การถ่ายภาพ ได้ทุกรูปแบบ กล้องโทรศัพท์มือถือ กล้อง DSLR และกล้องจากdrone 3 ความละเอียดภาพไม่ต่ำกว่า 10 ล้านพิกเซล 4 ไม่ดัดแปลง เพิ่มเติมหรือแก้ไขภาพถ่ายจนเกินความเป็นจริง 5 ห้ามใช้ AI generated
เทศกาลการท่องเที่ยว อะเมซิ่ง ท่าปลานะคราฟต์ 7 กันยายน 2567
เทศกาลการท่องเที่ยว ครั้งแรกของชาว อ.ท่าปลา
“อะเมซิ่ง ท่าปลานะคราฟต์”
7 กันยายน 2567 นี้ เวลา 10.00 น.-17.00 น. @ หมอนอุ่นรีสอร์ท ปากทางแยกแซดเดิ้ล รวมแหล่งท่องเที่ยวเด็ดๆ พร้อมใจกันมาทั้งอำเภอ • รวมสุดยอดแคมป์สุดสวย วิวหลักล้าน • ลานกางเต้นท์สุดชิลล์ • รวมแพที่พักจากเขื่อนและริมน้ำน่าน ยกกันมาให้จองล่วงหน้า ราคาพิเศษ‼️ • รวมร้านคาเฟ่ร้านอาหารเด็ดๆจัดมาให้ชิมก่อนใครในงาน • พร้อม work shop ศิลปะงานมือกับศิลปินในท้องถิ่นสุดตีสส์ และพลาดไม่ได้ การประกวดภาพภายแหล่งท่องเที่ยวมุมใหม่ที่ไม่เคยแสดงที่ไหนมาก่อน
กลุ่มท่องเที่ยวท่าปลาร่วมกับการท่องเที่ยวแห่งประเทศไทย ททท. สนง.แพร่-อุตรดิตถ์ จัดรวบรวมแหล่งท่องเที่ยวและสร้างบรรยากาศ สีสัน ส่งเสริมภาพลักษณ์ กระตุ้นเตรียมความพร้อมของผู้ประกอบการด้านการท่องเที่ยว ในช่วงปลายฝนต้นหนาวของ จ.อุตรดิตถ์ ให้กลับมาคึกคักอีกครั้ง และเข้าสู่ฤดูการท่องเที่ยวของภาคเหนือ แบบเหนือความคาดหมาย
งาน ระนองสดชื่น 7 กันยายน 2567
งาน "ระนองสดชื่่น" ชวนทุกคนมาสนุกกับเสียงเพลง พบกับศิลปินชื่อดัง "เบน ชลาทิศ" วันที่ 7 กันยายน 2567 เวลา 17.00 - 21.00 น. ณ วิทยาลัยเทคนิคระนอง อ.เมือง จ.ระนอง
ปั่นทะลุหมอก บอกรักฝน Chumphon – Ranong วันเสาร์ที่ 7 กันยายน 2567
"ปั่นทะลุหมอก บอกรักฝน" Chumphon – Ranong วันเสาร์ที่ 7 กันยายน 2567 เวลา 06:00-18:00 น. Start สนามกีฬากลางจังหวัดชุมพร Finish วิทยาลัยเทคนิคระนอง (เส้นทางถนนเพชรเกษม) รวมระยะทาง 130 กิโลเมตร โค้งสุดท้ายแล้ว....นักปั่นที่ยังไม่ลงทะเบียนสมัคร...รีบสมัครจับจองพื้นที่ปั่นจักรยานกันครับ.....สายชิว สายปั่น สายสบายๆ กับเส้นทางสวยงาม ของรางวัล ของที่ระลึก สวยงาม อาหารการกินสุดฟิน......กับ ททท.ชุมพร-ระนอง ชมรมกีฬาจักรยานจังหวัดระนอง..... สอบถามข้อมูลเพิ่มเติมได้ที่โทร ททท.สำนักงานชุมพร-ระนอง 077-502775-6 ประธานชมรมกีฬาจักรยาน 0805198595 สอบถามรายชื่อผู้สมัครในระบบ : ติดต่อ มินนา 0953544456
งาน VIJITR 5 ภาค@พิษณุโลก เล่าขานตำนานเมืองสองแคว 7-15 กันยายน 2567 LINK
งาน VIJITR 5 ภาค@พิษณุโลก เล่าขานตำนานเมืองสองแคว การแสดงโชว์แสง สี เสียง สุดตระการตา ยิ่งใหญ่ริมแม่น้ำน่าน วันที่ 7 - 15 กันยายน 2567 ตั้งแต่เวลา: 18.00 - 24.00 น. เข้าชมฟรี!! ตลอด 9 วัน จุดจัดแสดง ป้อมประตูเมืองพิษณุโลก : เจดีย์หลวงวัดราชบูรณะ 700 ปี : ต้นโพธิ์ วัดพระศรีมหาธาตุ : ศาลหลักเมือง : สะพานพระราชวังจันทน์ : พระราชวังจันทน์ : สะพานนเรศวร
ประเพณีไหว้พระจันทร์ ศาลเจ้านำเหยามาโจ้วเก็ง (เจ้าแม่ทับทิม) 7-17 กันยายน 2567
ขอเชิญเที่ยวงาน ประเพณีไหว้พระจันทร์ ศาลเจ้านำเหยามาโจ้วเก็ง (เจ้าแม่ทับทิม) วันที่ 7-17 กันยายน 2567 ณ ศาลเจ้านำเหยามาโจ้วเก็ง (เจ้าแม่ทับทิม) ตำบลนาดี (ติดวัดบางปิ้ง) จังหวัดสมุทรสาคร ชมคอนเสิร์ตทุกคืน 7 ก.ย. 67 พลอย พุ่มพวง 8 ก.ย. 67 เนสกาแฟ ศรีนคร 9 ก.ย. 67 เสก ไฮโล 10 ก.ย. 67 ปูป้อม ตีสิบ 11 ก.ย. 67 วง Family 12 ก.ย. 67 วง รามสูร จันทบุรี 13 ก.ย. 67 เสก ไฮโล 14 ก.ย. 67 บัวผัน ทังโส 15 ก.ย. 67 วงเพื่อนแท้ 16 ก.ย. 67 โดนัท PTR 17 ก.ย. 67 ลำไย ขนิษฐา
LOPBURI COFFEE SPACE 2024 งานเทศกาลกาแฟจังหวัดลพบุรี วันที่ 7-8 กันยายน 2567
ลพบุรีก็มีงานกาแฟนะ ในงาน LOPBURI COFFEE SPACE 2024 วันที่ 7-8 กันยายน 2567 ณ Robinson Lifestyle Lopburi ชั้น 2 ลานกิจกรรม พบกับ 32 ร้านค้า ร้านกาแฟชื่อดังมากมาย เครื่องดื่ม Non-Coffee และ เบเกอรี่สุดฮิตต่างๆ จากทั้งในจังหวัด และต่างจังหวัด ที่รอให้ทุกท่านมาสัมผัสความอร่อย สามารถมาเดินชิมเลือกซื้อแบบไม่ซ้ำได้ทั้ง 2 วัน ภายในงานยังมีกิจกรรมต่างๆ ทั้งการ เสวนาเรื่องกาแฟ , การ CUPPING และครั้งแรกในจังหวัดลพบุรีกับการแข่งขันในรายการ ESPRESSO YEN THAI STYLE & BREWING โดยมีผู้เข้าร่วมการแข่งขันกว่า 60 คน มาร่วมค้นหาผู้ชนะไปด้วยกัน
LOPBURI COFFEE SPACE 2024 เทศกาลงานกาแฟจังหวัดลพบุรี วันที่ 7-8 กันยายน 2567 LINK
ททท.สำนักงานลพบุรี ชวนเที่ยวงาน "LOPBURI COFFEE SPACE 2024“ เทศกาลงานกาแฟจังหวัดลพบุรี ระหว่างวันที่ 7 - 8 กันยายน 2567 เวลา 10.00 - 18.00 น. ณ Robinson Lifestyle Lopburi ชั้น 2 ลานกิจกรรม
พบกับ 32 ร้านดัง อาทิ โรงคั่วกาแฟ, ร้านกาแฟและเครื่องดื่มอื่นๆ, ร้านเบเกอรี่ และขนมต่างๆ ทั้งร้านดังในจังหวัดลพบุรี และ COFFEE LOVER ทุกท่าน จะได้พบกาแฟหลากหลายรูปแบบ เมล็ดกาแฟหลายสายพันธุ์ที่รอให้ทุกท่านได้มาชิมมาสัมผัสกลิ่น รสชาติ และเรียนรู้ร่วมกัน นอกจากนี้ ยังมีกิจกรรมต่างๆ ที่น่าสนใจ ไม่ว่าจะเป็นการแข่งขันเพื่อค้นหาผู้ชนะรายการ ESPRESSO YEN THAI STYLE และ BREWING, การให้ความรู้ทางด้านกาแฟ, Latte Art และกิจกรรมการ Cupping ให้ผู้ที่สนใจได้เข้าร่วมในงานนี้
พิเศษ! "LCSmug2024" แก้วเซรามิกของที่ระลึก Limited ประจำงานปีนี้ ที่ผลิตโดยแบรนด์เซรามิกทางภาคเหนือ เป็นแบรนด์ชั้นนำของคนไทย ที่ผลิตมายาวนานกว่า 39 ปี เป็นผู้เชี่ยวชาญงานเซรามิกที่มีผลงานการผลิตทั้งแก้ว Mug และ Dripper ชื่อดัง
พบกันที่
LOPBURI COFFEE SPACE 2024
สอบถามข้อมูลด้านการท่องเที่ยวเพิ่มเติมได้ที่ : ททท.สำนักงานลพบุรี โทร. 036-770096-7 หรือ Facebook Fanpage : ททท.สำนักงานลพบุรี :
Tat Lopburi กิจกรรมขับเคลื่อน ตลาดการค้าชายแดนไทย - เมียนมา 7-8 กันยายน 2567
กิจกรรมโครงการขับเคลื่อนเขตเศรษฐกิจพิเศษด้วยตลาดการค้าชายแดนไทย - เมียนมา สักการะสิ่งศักดิ์สิทธิ์ ณ วัดทิคี่ ตลาดนัดชายแดน คาราวานสินค้าราคาถูก การประกวดมิสกาญจนบุรี-ทิคี่ 2024 การแสดงศิลปวัฒนธรรม ดนตรี ของกลุ่มชาติพันธุ์และประชาชนในพื้นที่ชายแดนไทย-เมียนมา ในระหว่างวันที่ 7-8 กันยายน 2567 ณ ตลาดประชารัฐบ้านพุน้ำร้อน ตำบลบ้านเก่า อำเภอเมืองกาญจนบุรี จังหวัดกาญจนบุรี
เทศกาลเชียงใหม่คเณศจาตุรถี 7-8 กันยายน 2567
"เทศกาลเชียงใหม่คเณศจาตุรถี 2567" (Chiang Mai Ganesh Chaturthi Festival) วันเสาร์ที่ 7 ถึงวันอาทิตย์ที่ 8 กันยายน 2567 (14:00 น. ถึง 21:30 น.) ณ ข่วงประตูท่าแพเทศกาลงานศิลปะ การออกร้าน และผลิตภัณฑ์เพื่อสุขภาพในงาน
Facebook34 ปี สืบ นาคะเสถียร "เพราะรักและอยากให้เข้าใจแม่น้ำ" มาโนช พุฒตาล 7 กันยายน 2567
34 ปี สืบ นาคะเสถียร สืบ สว่าง กลางใจป่า เรียนเชิญครับ พจนาถ พจนาพิทักษ์ กับ มาโนช พุฒตาล จะไปร้องเพลง เล่นกีตาร์ อ่านบทกวี และเล่าเรื่อง "เพราะรักและอยากให้เข้าใจแม่น้ำ" เสาร์ 7 กันยายน 19:00 น. ที่สวนป่าพญาไม้รีสอร์ต ริมแม่น้ำสะแกกรัง จังหวัด อุทัยธานี
พิธีคัดเลือกองค์สมมติพระโพธิสัตว์กวนอิม กิมท้ง-เง็กนึ่ง และธิดามังกร งานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568
ขอเชิญลูกหลานชาวนครสวรรค์ ร่วมสืบสานประเพณีฯ ในพิธีกรรมอันศักดิ์สิทธิ์ที่มีมายาวนานกว่าร้อยปี พิธีคัดเลือกองค์สมมติพระโพธิสัตว์กวนอิม กิมท้ง-เง็กนึ่ง และธิดามังกร ในงานประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ ประจำปี 2567-2568
เปิดรับสมัครวันที่ 30 สิงหาคม ถึง 1 กันยายน 2567 ณ ศาลเจ้าแม่ (หน้าผา)
7 กันยายน 2567 พิธีคัดเลือก กิมท้ง-เง็กนึ่ง
17 กันยายน 2567 พิธีคัดเลือก องค์สมมติพระโพธิสัตว์กวนอิม และพิธีไหว้พระจันทร์ ประจำปี 2567
งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร หน้าวัดท่าหลวง 7-8 กันยายน 2567
ขอเชิญชวนรับชมความสนุกสนาน กับการแข่งเรือยาวสนามระดับประเทศ งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร หน้าวัดท่าหลวง พระอารามหลวง ชิงถ้วยพระราชทานพระบาทสมเด็จพระเจ้าอยู่หัว รัชกาลที่ 10 วันที่ 7-8 กันยายน 2567 ณ ลำน้ำน่าน หน้าวัดท่าหลวง พระอารามหลวง กำหนดการ
7 ก.ย.67
09.00 น. - พิธีเปิดการแข่งขันและชมขบวนเรือพระราชพิธีจำลองจังหวัดพิจิตร เชิญถ้วยพระราชทานฯ - ชมการแข่งขันเรือยาวประเพณีชิงถ้วย พระราชทาน รอบคัดเลือก
20.30 น. - ชมการแสดงดนตรีจากศิลปินดัง
8 ก.ย.67
09.00 น. - ชมการแข่งขันเรือยาวประเพณีชิงถ้วยพระราชทาน รอบก่อนและรอบชิงชนะเลิศทุกประเภท
15.30 น. - ชมการแข่งขันเรือยาวประเพณีชิงถ้วยพระราชทาน รอบชิงชนะเลิศ
และพบกับ มหกรรมอาหารท้องถิ่นและสินค้า OTOP ได้ตั้งแต่ วันที่ 30 สิงหาคม - 8 กันยายน 2567
คเณศจตุรถี 7 กันยายน 2567
งานคเณศจตุรถี 7 กันยายน 2567 ณ ลานพระคเณศ ท่าเรือพอร์ตตะโกลา พิธีบวงสรวงแบบอินเดียโบราณ มหรสพสมโภชเนื่องในวันเกิดพระพิฆเนศ ร่วมพิธีอารตีบูชาไฟ กับ Crystal Bowl Sound Therapy
นั่งรถไฟท่องเที่ยว ROYAL BLOSSOM 8 ทริป เที่ยวเมืองหัวหิน 7,8,14,15,21,22,28 และ 29 กันยายน 2567
ชวนนั่งรถไฟท่องเที่ยว ROYAL BLOSSOM 8 ทริป เที่ยวเมืองหัวหินเสน่ห์แห่งความคลาสสิค ร่วมสร้างประสบการณ์สุดพิเศษช่วงวันหยุดทุกเสาร์ – อาทิตย์ เริ่มจำหน่ายตั๋วพร้อมกันทั่วประเทศ วันที่ 3 กันยายน 2567 นี้ [
ตารางรถไฟท่องเที่ยว SRT Royal Blossom ประจำปี 2567]
ร่วมเป็นส่วนหนึ่งของการเดินทางทริปท่องเที่ยวสุดพิเศษกับขบวน “ROYAL BLOSSOM” ขบวนรถไฟแห่งความสุข ไปสัมผัสบรรยากาศเมืองหัวหิน เสน่ห์แห่งความคลาสสิค เส้นทางกรุงเทพ - หัวหิน - กรุงเทพ แบบ One Day Trip ในเดือนกันยายน 2567 ทุกวันหยุดเสาร์และอาทิตย์ รวม 8 ทริป คือ วันที่ 7,8,14,15,21,22,28 และ 29 กันยายน 2567 สามารถเลือกที่นั่งได้ 2 แบบ 2 สไตล์ ทั้งแบบกลุ่มและแบบส่วนตัว เริ่มจำหน่ายตั๋วโดยสารพร้อมกันทั่วประเทศ ในวันอังคารที่ 3 กันยายน 2567 ตั้งแต่เวลา 08.30 น. เป็นต้นไป จำกัดจำนวน 176 ที่นั่งต่อทริปเท่านั้น
อัตราค่าโดยสารรวมแพ็กเกจ ผู้ใหญ่และเด็กราคาเดียวกัน ดังนี้
1. ตู้ Passenger Car ราคาท่านละ 1,799 บาท
2. ตู้ Group Car จำนวน 4 ห้อง ราคาห้องละ 15,999 บาท สามารถนั่งได้ 4 – 6 ท่าน/ห้อง
ทั้งนี้ ผู้สนใจสามารถสำรองที่นั่งได้ตั้งแต่วันอังคารที่ 3 กันยายน 2567 เวลา 08.30 น. เป็นต้นไป จำกัดจำนวน 176 ที่นั่งต่อทริปเท่านั้น ซึ่งราคาดังกล่าวเป็นราคารวมค่าตั๋วโดยสารรถไฟ ค่ารถบัสปรับอากาศ ค่าเข้าชมสถานที่ต่างๆ พร้อมอาหารและเครื่องดื่มแบบจัดเต็มตลอดการเดินทาง รวมทั้ง ค่าประกันอุบัติเหตุ โดยสามารถติดต่อซื้อตั๋วได้ที่สถานีรถไฟทุกแห่งทั่วประเทศ และช่องทางการจำหน่ายตั๋วระบบออนไลน์ D – Ticket ของการรถไฟฯ สอบถามข้อมูลเพิ่มเติมได้ที่ศูนย์บริการลูกค้าสัมพันธ์ 1690 ตลอด 24 ชั่วโมง
Buakaw Run 7 กันยายน 2567
Buakaw Run วันที่ 7 กันยายน พ.ศ. 2567 ณ ศูนย์การกำลังสำรอง (ศสร.) อ.ปราณบุรี จ.ประจวบคีรีขันธ์ งานวิ่งบัวขาวจัดขึ้นเพื่อส่งเสริมการออกกำลังกายและสุขภาพที่ดีให้กับชุมชน โดยมีเป้าหมายในการเชิญชวนให้ผู้คนมาร่วมกิจกรรมที่สร้างสรรค์และมีประโยชน์ บัวขาว บัญชาเมฆ ในฐานะนักมวยชื่อดัง มุ่งหวังที่จะเป็นตัวอย่างที่ดีในการส่งเสริมวิถีชีวิตที่มีสุขภาพดี
งานตลาดสวนสมุนไพรฯ สุขภาพดี วิถีชุมชน ปี 2567 จ.ระยอง เสาร์แรกเดือนกันยายน 2567
เชิญเที่ยวงานตลาดสวนสมุนไพรฯ สุขภาพดี วิถีชุมชน ปี 2567 ณ สวนสมุนไพรสมเด็จพระเทพฯ จ.ระยอง ในวันเสาร์ที่ 7 กันยายน 2567 ตั้งแต่เวลา 07.30 - 13.00 น. เดือนนี้พบกับธีมงาน " เดินช็อปชิว Green market " กิจกรรมภายในงาน
การแสดงบนเวที จากโรงเรียนวัดมาบข่า (มาบข่าวิทยาคาร)
กิจกรรมสาธิต “ น้ำมันเขียวสะท้านเส้น ” จากวิทยากรสวนสมุนไพรฯ
กิจกรรม " สินค้า นาทีทอง " ประจำเดือนกันายนยน
- ร้านน้ำตาลสดแม่มณีบ้านแพ้ว (น้ำตาลมะพร้าว 10 กระปุก)
- ร้าน Corn Hub Popcorn (ขนม popcorn 20 ชุด)
- ร้านเครื่องหนังคชนิล (พวงกุญแจรีโมทรถ 10 พวง)
สินค้าชุมชน สินค้า OTOP ผลิตภัณฑ์สมุนไพร งานหัตถกรรม ต้นไม้ และอาหารกว่า 120 ร้านค้า
กิจกรรมพันธุ์ไม้สมุนไพรแจกฟรี (จำนวนจำกัด) 1. ต้นบานบุรีเหลือง 24 ต้น 2. ต้นกระชาย 24 ต้น 3. ผักปลัง 20 ต้น 4. ต้นเฒ่าหลังลาย 24 ต้น 5. ผักเป็ดแดง 24 ต้น
ศิวิไลซ์ เฟสติวัล เทศกาลวงดนตรี + ดีเจ เขื่อนป่าสักชลสิทธิ์ ลพบุรี 7 กันยายน 2567
ศิวิไลซ์ เฟสติวัล เทศกาลดนตรี + ดีเจ ณ หาดศิวิไลซ์ ท้ายเขื่อนป่าสักชลสิทธิ์ บ้านมะนาวหวาน อำเภอพัฒนานิคม จังหวัดลพบุรี 7 กันยายน 2567 งานเดียว 2 เวที 1 โซนดีเจ สัมผัสประสบการณ์ แห่งความสร้างสรรค์ผ่านพลังแห่งดนตรี ศิลปะ และวัฒนธรรมร่วมสมัย ที่จะพาพวกเรากลับมาฟังเสียงหัวใจและเสียงธรรมชาติรอบตัว
#เวทีสายลม - พงษ์สิทธิ์ คำภีร์ - ธีร์ ไชยเดช - GREASY CAFE - T-BONE aRootstic - ZWEED N ROLL - ไววิทย์ - T_047
#เวทีแสงแดด Stage Culture (เวทีวัฒนธรรมพื้นถิ่น ศิลปิน นักร้อง/นักดนตรี จ.ลพบุรี) SUNDER ( Ethnic Music อีสานฟิวชั่นแนวใหม่ ) LAWANARIN (ดนตรีไทยผสมดนตรีสากลคลาสสิกประยุกต์) CHARLIE ( แนวเพลง คันทรีโฟล์ค บลูแกรส) FORESTER( แนว Pop เพลงเล่าเรื่องราวธรรมชาติป่าไม้) TANG KHONG ( แนวเพลงอะคูสติกอินดี้โฟล์ค) ASATISS ( แนวเพลง Alternative-Folk) STORY MODE (แนวเพลงอะคูสติกโฟล์คแค้มป์)
#หมายเหตุ นำเก้าอี้แค้มป์ มานั่งได้ รถเข็นแคมป์ปิ้ง มาได้ ห้ามน้ำอาหาร เครื่องดื่มเข้างานในงานมีขายอุดหนุนชาวบ้านกัน ห้ามนำสัตว์เลี้ยงทุกชนิดเข้างาน ห้ามนำอาวุธและยาเสพติดทุกชนิด
กิจกรรมที่จะมอบความสุขให้กับทุกคน
- สินค้าจากจากชุมชนพี่น้องมะนาวหวาน
ทั้งของกินของใช้ของสะสมทำด้วยความรัก
- รวมพลคนทำกาแฟตั้งแต่ต้นน้ำถึงปลายน้ำ
ทุกสายพันธุ์มาออกบูธพบปะแลกเปลี่ยนซื้อขายแบบมิตรภาพ
- กิจกรรม SUPBOARD, Yoga , Slack line
- ECO Print ย้อมผ้าลายใบไม้ เพ้นท์สีจากธรรมชาติ
- ECO Art ศิลปะจากขยะ
- Kids playground มุมเด็กๆ เล่น
เพ้นท์หน้า, โยคะ kids สอนฟรีให้กับเด็กๆ
- รถ RETRO CLASSIC ทั้ง2ล้อและ4ล้อ ทุกสายพันธุ์
- ว่าวไทย และ ว่าวนานาชาติ
ภายในงาน
- เชิญชวนทุกแบรนด์ที่เป็นผู้สนับสนุน
และที่ร่วมออกบูธในงาน หันมาใช้และสนับสนุนสินค้าหมุนเวียน ลดการใช้ทรัพยากรใหม่ หรือการใช้วัสดุจาก ธรรมชาติอย่างจริงจัง
- ไม่มีการจำหน่ายเครื่องดื่มที่ใส่ในเเก้วพลาสติก
- ผู้เข้าร่วมงานทุกคน ใช้แก้วที่นำมาเอง ไม่ก่อให้เกิดขยะในภายหลัง
งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร วัดท่าหลวง 7-8 กันยายน 2567
งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร ชิงถ้วยพระราชทานพระบาทสมเด็จพระเจ้าอยู่หัว ในปีนี้กำหนดจัดระหว่างวันที่ 30 สิงหาคม - 8 กันยายน 2567 วันแข่งขัน เป็นวันที่ 7 - 8 กันยายน 2567 ณ ลำน้ำน่าน หน้าวัดท่าหลวง พระอารามหลวง จังหวัดพิจิตร
วันที่ 30 สิงหาคม 2567 พิธีบวงสรวงแม่ย่านางเรือและพิธีเจริญพระพุทธมนต์ เบิกฤกษ์งานประเพณีแข่งขันเรือยาวจังหวัดพิจิตร ที่บริเวณลานบุญหน้าพระอุโบสถหลวงพ่อเพชร วัดท่าหลวง พระอารามหลวง จังหวัดพิจิตร โดยมีนายอดิเทพ กมลเวชช์ ผู้ว่าราชการจังหวัดพิจิตร ร่วมประกอบพิธี
วันที่ 7 กันยายน 2567 เชิญชมไฮไลท์ขบวนเรือพระราชพิธีจำลอง อัญเชิญถ้วยพระราชทานพระบาทสมเด็จพระเจ้าอยู่หัว พิธีเปิดการแข่งขันเรือยาวจังหวัดพิจิตร ถ่ายทอดสดทางช่อง NBT2HD ตั้งแต่เวลา 9.00 น. ตลอดการจัดงานประเพณีแข่งขันเรือยาวชิงถ้วยพระราชทาน พระบาทสมเด็จพระเจ้าอยู่หัว มีการจัดแสดงนิทรรศการ ผลิตภัณฑ์ OTOP มหกรรมคาราวานสินค้า และการแสดงศิลปวัฒนธรรมของเด็ก เยาวชน ศิลปินท้องถิ่น รวมทั้งคอนเสิร์ตในภาคค่ำตลอดทุกคืน
งานประเพณีสานสัมพันธ์วัฒนธรรม 4 ไต (ไตเขิน ไตยอง ไตลื้อ และไตยวน) วันที่ 7-8 กันยายน 2567 อ.สันกำแพง
เทศบาลตำบลสันกำแพง ร่วมกับชุมชนไทเขินบ้านสักก้างปลา ขอเชิญร่วมงานประเพณีสานสัมพันธ์วัฒนธรรม 4 ไต (ไตเขิน ไตยอง ไตลื้อ และไตยวน) วันที่ 7-8 กันยายน 2567 เวลา 16.00 น. - 20.00 น. ณ เฮือนไทเขินบ้านสันก้างปลา อ.สันกำแพง
พบกับการแสดงนิทรรศการ ผลิตภัณฑ์ การสาธิตทำอาหารของชาวไตเขิน ไตลื้อ ไตยอง ไตยวน กาดมั่วคัวฮอมของชาติพันธุ์ ช่วงคำพบกับ วงดนตรีร่วมสมัย วงเดอะระมิงค์ พร้อมรับประทานอาหารขันโตก และการประกวดหนูน้อยชาติพันธ์
พังงาบีชรัน 7 กันยายน 2567 ณ ชายทะเลหาดท้ายเหมือง
พังงาบีชรัน วันที่ 7 กันยายน 2567 ณ ชายทะเลหาดท้ายเหมือง
อีสานนครศิลป์ สุรินทร์ฟินเฟอร์ งาน วิ่งกับช้าง ELEPHANTWORLDHALF MARATHON 2024@ SURIN 7 กันยายน 2567
อีสานนครศิลป์ สุรินทร์ฟินเฟอร์ มาสนุกกับงาน วิ่งกับช้าง ELEPHANT WORLD HALF MARATHON 2024@ SURIN ▶️วันที่ 7 กันยายน 2567 งานต้อนรับนักวิ่ง นักกีฬา วอร์มร่างกาย ชมหมอลำอีสานนครศิลป์ ลานวัฒนธรรม ศูนย์ศึกษา อ.ท่าตูม ▶️วันที่ 8 กันยายน 2024 วิ่งกับช้างไปพร้อมๆกัน ELEPHANT WORLD HALF MARATHON 2024@ SURIN หมู่บ้านช้าง อ.ท่าตูม
การแข่งขันกีฬาจักรยานเสือภูเขาและถนน ไทแลนด์โอเพ่น สนามที่ 4 วันที่ 7-8 กันยายน 2567 อำเภอภูเรือ
จังหวัดลยร่วมกับ สมาคมกีฬาจักรยานแห่งประเทศไทย ในพระบรมราชูปถัมภ์ จัดการแข่งขันกีฬาจักรยานเสือภูเขาและถนน ไทแลนด์โอเพ่น ชิงแชมป์ประเทศไทย ชิงถ้วยพระราชทานฯ สนามที่ 4 ระหว่างวันที่ 7 - 8 กันยายน 2567 ณ อำเภอภูเรือ จังหวัดเลย
เทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 7 วันที่ 7-8 กันยายน 2567
เทศกาลลูกชิ้นยืนกินชิงแชมป์โลก ครั้งที่ 7- 7 Wonders มหัศจรรย์ลูกชิ้นยืนกินบุรีรัมย์ วันที่ 7-8 กันยายน 2567 ณ โดมสวนรมย์บุรี เทศบาลเมืองบุรีรัมย์ พบกับ 7 ความมหัศจรรย์ลูกชิ้นยืนกินบุรีรัมย์
• มหัศจรรย์ การยืนกินความอร่อยไม่เหมือนใคร 1 เดียวในโลก
• มหัศจรรย์ การรวมร้านลูกชิ้นยืนกิน หลากหลาย มากมายที่สุดในโลก
• มหัศจรรย์ สุดยอดร้านลูกชิ้นยืนกินยอดเยี่ยม ครั้งที่ 7
• มหัศจรรย์ สุดยอดน้ำจิ้มลูกชิ้นยินกินยอดเยี่ยม ครั้งที่ 7
• มหัศจรรย์ การหาแชมป์โลกลูกชิ้นยืนกิน คนที่ 7
• มหัศจรรย์ การแข่งขัน Cover Dance ลิซ่า ลูกชิ้นยืนกินบุรีรัมย์
• มหัศจรรย์ กับโปรโมทชั่น ลด แลก แจกรางวัล ครั้งใหญ่
จัดโดย การท่องเที่ยวแห่งประเทศไทย ร่วมกับ สภาอุตสาหกรรมท่องเที่ยวจังหวัดบุรีรัมย์ และ สมาคมธุรกิจท่องเที่ยวจังหวัดบุรีรัมย์ สนับสนุนโดย ✅ องค์การบริหารส่วนจังหวัดบุรีรัมย์ ✅ เทศบาลเมืองบุรีรัมย์ ✅ หอการค้าจังหวัดบุรีรัมย์ ✅ บริษัทประชารัฐรักสามัคคีบุรีรัมย์
มหกรรมสุขภาพ "นครภูเก็ต สร้างสุขภาพดี ชีวีมีสุข" (HEALTHY HAPPY LIFE) ในวันเสาร์ที่ 7 กันยายน 2567
เทศบาลนครภูเก็ต ขอเชิญร่วมมหกรรมสุขภาพ "นครภูเก็ต สร้างสุขภาพดี ชีวีมีสุข" (HEALTHY HAPPY LIFE) ในวันเสาร์ที่ 7 กันยายน 2567 เวลา 08.00 - 17.00 น. ณ อาคารยิมเนเซียม 4000 ที่นั่ง (สะพานหิน) พบกับกิจกรรมต่างๆ มากมายอาทิเช่น
- ตลาดนัดสุขภาพ ร้านอาหาร ผัก ผลไม้ ผลิตภัณฑ์เพื่อสุขภาพ
- บูทกิจกรรมสุขภาพ ออกร้านสุขภาพของหน่วยงานราชการ/เอกชน, เสวนาบรรยายพิเศษ Healthy Happy Life และออกกำลังกาย
- ตรวจสุขภาพฟรี!! คัดกรองโรคเบื้องต้นโดยกองการแพทย์ เทศบาลนครภูเก็ต และทดสอบสมรรถภาพทางกาย โดยมหาวิทยาลัยราชภัฏภูเก็ต
สะเดาคอฟฟี่ แอนด์เฟรนด์ #1 วันเสาร์-อาทิตย์ ที่ 7-8 กันยายน 2567
งานสะเดาคอฟฟี่ แอนด์เฟรนด์ #1 วันเสาร์-อาทิตย์ ที่ 7-8 กันยายน 2567 เวลา 13.00 - 20.00 น. ณ สวนสาธารณะเกหลัง เทศบาลเมืองสะเดา งานที่รวบรวมร้านกาแฟ เบเกอรี่ โกโก้ มัทฉะ และเครื่องดื่มไว้มากที่สุดในสะเดา กับงานคูลๆ ที่มีดนตรีในสวน พร้อมบูธร้านค้าทั่วสะเดากว่า 20 ร้าน ยกกันมาให้เลือกทานกันแบบฉ่ำๆ WorkShop งานศิลปะจาก 2 ที่ 22pottery และ Little Wonders - ลิตเติ้ล วันเดอร์ส ให้นั่งกันในพื้นหญ้า มีดนตรีจากน้องๆ นักเรียน และพี่ๆนักดนตรีในพื้นที่สลับหมุนเวียนกันมามอบควาามบันเทิงกัน
วิ่งมหากาพย์รามเกียรติ์ 8 กันยายน 67 อุทยาน ร.2 อัมพวา LINK
สนามแรก เหล่ายักษามารวมตัวยกทัพ!!!! ศึกครั้งนี้ต้องฮึกเหิม และเกรียงไกร!!!!! ทศกัณฐ์ยกทัพ เตรียมเคลื่อนทัพที่ เมืองสมุทรสงคราม ณ อุทยาน ร.๒ พร้อมรบ วันที่ 8 กันยายน 67 ระยะยกทัพ : 3 K : 5K : 13 K เปิดรับสมัคร 5 สิงหาคมนี้ !!!!!! สมัครออนไลน์ : www.ramakienrun3.com
ทัพแรก : ทศกัณฑ์ยกทัพ ณ อุทยาน ร.2 อัมพวา สมุทรสงคราม วันออกทัพ: วันอาทิตย์ที่ 8 กย. 67
ทัพสอง : พระนารายณ์อวตาร ณ วัดขนอนหนังใหญ่ โพธาราม ราชบุรี วันออกทัพ : วันอาทิตย์ที่ 15 กย. 67
ทัพสาม: ศึกกุมภกรรณ ณ วัดเขาสมอคอน ท่าวุ้ง ลพบุรีวันออกทัพ : วันอาทิตย์ที่ 22 กย. 67
งานเปิดสุดยอดชุมชนต้นแบบ เที่ยวชุมชนยลวิถี เสาร์ที่ 3 สิงหาคม 2567
จากที่ ชุมชนท่าฉลอม ได้รับรางวัล "สุดยอดชุมชนต้นแบบ เที่ยวชุมชน ยลวิถี ประจำปี 2566" จากกระทรวงวัฒนธรรม สำนักงานวัฒนธรรมจังหวัดสมุทรสาคร จึงขอเชิญทุกท่านเที่ยว งานเปิดสุดยอดชุมชนฯ ในวันเสาร์ที่ 3 สิงหาคม นี้ ตั้งแต่ 16.00 น. เป็นต้นไป ณ บริเวณริมเขื่อนวัดสุทธิวาตวราราม (วัดช่องลม) ต.ท่าฉลอม อ.เมืองฯ จ.สมุทรสาคร และชวนเที่ยวต่อในงาน 1 อำเภอ 1 ลานสร้างสรรค์ จ.สมุทรสาคร ในวันอาทิตย์ที่ 4 สิงหาคม นี้ 15.00 น. เป็นต้นไป ณ สถานที่เดียวกัน
สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานวัฒนธรรมจังหวัดสมุทรสาคร โทร. 0 34811 325
Elephant World Half Marathon 2024 งานวิ่ง สุดอะเมซซิ่ง แห่งสุรินทร์ 8 กันยายน 2567
งานวิ่ง สุดอะเมซซิ่ง ที่คุณจะทำให้การวิ่งมาราธอนของคุณไม่เหมือนเดิมอีกต่อไป! Elephant World Half Marathon 2024 presented by กองกำลังสุรนารี และส่วนราชการจังหวัดสุรินทร์ งานที่จะได้วิ่ง พร้อมกับกองเชียร์ช้าง กว่า 200 เชือก
วันอาทิตย์ ที่ 8 กันยายน ที่หมู่บ้านช้างสุรินทร์ ระยะแข่งขัน ฮาล์ฟมาราธอน (21 กิโลเมตร), มินิมาราธอน (10 กิโลเมตร), และฟันรัน (5 กิโลเมตร)
**ไฮไลท์พิเศษ:**
- วิ่งท่ามกลางเส้นทางธรรมชาติและช้าง สัตว์ประจำชาติไทย กว่า200 เชือก!
- ร่วมถ่ายรูป และเล่นน้ำกับไอดอลช้าง ที่มีFanclub นับแสน
- แวะชมสถานที่ท่องเที่ยว สนุกสนานไปกับกิจกรรมต่างๆ ที่ Elephant world
- เงินรางวัล และของที่ระลึก เสื้อวิ่ง, เหรียญ, และเสื้อ Finisher ที่ออกแบบสุดพิเศษ สำหรับงานนี้โดยเฉพาะ
เทศกาลดูเหยี่ยวอพยพ 2024 จุดชมวิวเขาดินสอ อ.ปะทิว กันยายน - พฤศจิกายน 2567
เทศกาลดูเหยี่ยวอพยพ 2024 ในช่วงเดือนกันยายน - พฤศจิกายน ของทุกปี จะมีเหยี่ยวหลากหลายสายพันธ์ุอพยพย้ายถิ่นมา Vacation พักร้อนที่เขาดินสอ ซึ่งมีอากาศอบอุ่นและอาหารที่อุดมสมบูรณ์มาก
จุดชมวิวเขาดินสอ ต.บางสน อ.ปะทิว จ.ชุมพร ถือเป็นจุดชมเหยี่ยวอพยพที่เหมาะสมในการดูและศึกษาเส้นทางอพยพที่ดีที่สุดของประเทศไทย สามารถดูได้ด้วยตาเปล่า ความสูงกว่าระดับน้ำทะเล 345 เมตร และใกล้ทะเลอ่าวไทย จึงมองเห็นวิวได้แบบ 360 องศาเลยทีเดียว ช่วงเดือน: กันยายน - พฤศจิกายน 2567
สถานที่: จุดชมวิวเขาดินสอ ตำบลบางสน อำเภอปะทิว จังหวัดชุมพร ช่วงเวลาที่ดีที่สุดสำหรับการดูเหยี่ยวอพยพ เช้า 07.00 -10.00 น. บ่าย 15.00-17.00 น.
สอบถามข้อมูลเพิ่มเติมได้ที่: เทศบาลตำบลบางสน: 077-591-003 ททท. สำนักงานชุมพร: 077-502-775
พิธีเทวาภิเษก เเผ่นทองเจ้าเเม่ทับทิม โชคทรัพย์นับอนันต์ 9 กันยายน 2567
ททท.สำนักงานนครสวรรค์ ขอเชิญร่วมพิธีเทวาภิเษก เเผ่นทองเจ้าเเม่ทับทิม โชคทรัพย์นับอนันต์ วันที่ 9 กันยายน 2567 เวลา 09.09 น. ณ ศาลเจ้าพ่อเทพารักษ์ - เจ้าเเม่ทับทิม โดยร่างทรงเจ้าเเม่ทับทิม (โผโต่ว) พิเศษ รับเเผ่นทองเจ้าเเม่ทับทิม หลังจบพิธี 99 ท่านเเรก ที่ร่วมลงทะเบียนภายในงาน เริ่มลงทะเบียนทั้งเเต่ เวลา 08.00 - 09.00 น. *เงื่อนไขเป็นไปตามที่ ททท.กำหนด
พิมายฬองวีค 9-15 กันยายน 2567
พิมายฬองวีค นิทรรศการผลงานศิลปะ จัดแสดง ระหว่างวันที่ 9 – 15 กันยายน พ.ศ. 2567 ณ เมืองเก่าพิมาย, โคราช นำชมนิทรรศการโดยศิลปินและภัณฑารักษ์ ในวันที่ 14 กันยายน พ.ศ. 2567 ตั้งแต่เวลา 16:00 น. ศิลปินร่วมแสดง: ชิตพล แพงเวียงจันทร์, ณภัทร รุ้งระวีวรรณ, พสธร วัชรพาณิชย์, ภัคพล วันเนา และ มนธิการ์ คำออน ภัณฑารักษ์: ปิยธิดา อินตา ที่ปรึกษาด้านศิลปะ: พชรกฤษณ์ โตอิ้ม จัดแสดง
พิมายฬองวีค เมื่อฬองจินตนาการหากเรากลายเป็นเมฆ พุงหนักพลุ้ยด้วยหยดน้ำ ลอยล่องมาเกาะก้อนรวมตัวกันเหมือนงานเลี้ยงของเหล่าทวยเทพอย่างเริงร่า ครื้นกึกก้อง จนหยดน้ำในพุงของเธอหลายหยดทั้งเริ่มร้อนและยังคงเย็น เต้นชนไปชนมาในพุงของเธอ และ เปรี้ยง ! สายฝนในพุงเราโปรยปราย แผ่เขตอาณา ที่เมืองพิมาย ตอนนี้ ! นิทรรศการ พิมายฬองวีค (Phimailongweek) เปรียบเสมือนสายฝนที่กำลังหลั่งไหลสู่เมืองพิมาย อันกล่าวด้วยเรื่องของการทดฬองกระบวนการปฏิบัติทางศิลปะที่สัมพันธ์กับพื้นที่อย่างเฉพาะเจาะจง เทียบเคียงกับการมุ่งฬองขยายความหมายของพื้นที่ผ่านแนวคิดทาง ประวัติศาสตร์ อำนาจ ถิ่นที่ และปรากฏการณ์ รวมถึงการก่อร่างตั้งเค้านิทรรศการนี้เป็นผลสืบจากการรวมกลุ่มกันของศิลปินและภัณฑารักษ์รุ่นใหม่ ที่มุ่งหวังบ่มเพาะกระบวนวิธีการทางศิลปะผ่านการฬองรู้ซึ่งกันและกัน
Korat Farmer Market 2024 วันที่ 9-11 กันยายน 2567
Korat Farmer Market 2024 งานแสดงและจัดจำหน่ายสินค้าแปรรูปทางการเกษตร ของดีเมืองโคราช ระหว่างวันที่ 9-11 กันยายน 2567 ณ ชั้น G ปารีส ศูนย์การค้าเทอร์มินอล21 โคราช พบกับสินค้าเกษตรแปรรูปจากเกษตรกรโดยตรง ผัก ผลไม้ปลอดสารพิษ สดจากไร่ และสินค้าอื่นๆอีกมากมาย กิจกรรมสุดพิเศษภายในงาน
กิจกรรมสาธิตการทำอาหารจากวัตถุดิบเกษตรอินทรีย์
สินค้านาทีทอง คูปองแทนเงินสด
ดนตรีโฟคซอง ตลอดทั้งการจัดงาน
จัดโดย จังหวัดนครราชสีมา ร่วมกับ สำนักงานเกษตรและสหกรณ์จังหวัดนครราชสีมา
งาน Lopburi Tourism Roadshow “พราว เสน่ห์ ลพบุรี” 9-10 กันยายน 2567
ชาวลพบุรีเยือนถิ่นโคราช กับงาน Lopburi Tourism Roadshow “พราว เสน่ห์ ลพบุรี” วันที่ 9 – 10 กันยายน 2567 ที่ บริเวณลานกิจกรรม ชั้น 1 ศูนย์การค้าเซ็นทรัลโคราช จ.นครราชสีมา นำทัพโดยจังหวัดลพบุรี และสำนักงานท่องเที่ยวและกีฬาจังหวัดลพบุรี พร้อมโชว์พราวแหล่งท่องเที่ยวยอดฮิต โปรแกรมเที่ยวเด่น เสน่ห์งานแผ่นดินสมเด็จพระนารายณ์มหาราช และศิลปวัฒนธรรมที่เก่าแก่ของจังหวัดลพบุรี พร้อมลิ้มรสอาหารพื้นถิ่น และช็อปสินค้าดีสินค้าเด่น
ปรากฏการณ์พระอาทิตย์ขึ้นสาดส่องผ่าน 15 ช่องประตูปราสาทพนมรุ้ง 9 กันยายน 2567
วันจันทร์ที่ 9 กันยายน 2567 (9 เดือน 9 ) บรรยากาศปรากฏการณ์พระอาทิตย์ขึ้นสาดส่องผ่าน 15 ช่องประตูปราสาทพนมรุ้ง
ตลาดพาณิชย์ ฟื้นฟูเศรษฐกิจ ครั้งที่ 1 วันที่ 10 - 13 ก.ย. 67
สำนักงานพาณิชย์จังหวัดสมุทรสาคร เชิญชวนช็อปสินค้าในงาน ตลาดพาณิชย์ ฟื้นฟูเศรษฐกิจ ครั้งที่ 1 วันที่ 10 - 13 ก.ย. 67 ณ ลานหน้าศาลากลาง (หลังเก่า) จังหวัดสมุทรสาคร พบกับ...... ✅ สินค้าอุปโภคบริโภค ✅ สินค้าชุมชน ✅ สินค้าเกษตร ✅ สินค้าแปรรูป ✅ สินค้า BCG ✅ และอื่นๆ อีกมากมาย
โปรแกรมท่องเที่ยว ROYAL BLOSSOM เที่ยวเมืองหัวหิน เสน่ห์แห่งความคลาสสิค
สำหรับโปรแกรมท่องเที่ยว ROYAL BLOSSOM ขบวนรถไฟแห่งความสุข เที่ยวเมืองหัวหิน เสน่ห์แห่งความคลาสสิค ขบวนที่ 913/914 เส้นทางกรุงเทพ - หัวหิน – กรุงเทพ
- ออกจากสถานีกรุงเทพ (หัวลำโพง) เวลา 06.45 น. ถึงสถานีหัวหิน เวลา 10.30 น.
- เที่ยวชมสถานีหัวหิน(เดิม) สัมผัสกับเสน่ห์วันวาน ชมอาคารและสิ่งปลูกสร้างที่มีคุณค่าทางสถาปัตยกรรมและประวัติศาสตร์มากมาย อาทิ อาคารสถานีหัวหิน พลับพลาพระมงกุฎเกล้า ห้องสมุดรถไฟ ตามรอยนวนิยาย “ปริศนา” ซึ่งเป็นนวนิยายสุดโรแมนติกที่ยังครองใจผู้คนมาทุกยุคทุกสมัย พร้อมชวนถ่ายภาพเช็คอินสร้างแลนด์มาร์ก
- เดินทางไปรับประทานอาหารกลางวันที่ร้านอาหาร “ครัวบ้านครู” พร้อมดื่มด่ำกับบรรยากาศสุดชิคริมชายทะเลหัวหิน
- แวะ “ร้านผ้าพิมพ์โขมพัสตร์” ร้านผ้าพิมพ์แบรนด์ไทยที่เป็นเอกลักษณ์คู่เมืองหัวหินมายาวนาน
- ทอดน่องชมอ่างเก็บน้ำเขาเต่า ไปแวะชมโครงการชลประทานตามพระราชดำริแห่งแรก และ “พลับพลากลางน้ำ” ที่จำลองแบบมาจากพระที่นั่งคูหาคฤหาสน์พลับพลาในถ้ำพระยานคร สักการะพระบรมรูปพระบาทสมเด็จพระเจ้าอยู่หัวรัชกาลที่ 5 “พลับพลาพระปิยะสามัคคีรังสังสรรค์” แวะชอปสินค้า OTOP ระดับ 5 ดาว ที่ศูนย์หัตถกรรมทอผ้าบ้านเข้าเต่า
- ปิดท้ายด้วยการชอปปิงที่ตลาดซิเคด้า และ ตลาดแทมมารีน มาร์เก็ต ซึ่งเป็นตลาดนัดยามเย็นที่มัดรวมงานศิลปะแฮนด์เมดต่างๆ และของกินสุดน่ารับประทานมาไว้ในจุดเดียว
- ขบวนรถเที่ยวกลับออกจากสถานีหัวหิน เวลา 17.53 น. ถึงสถานีกรุงเทพ (หัวลำโพง) เวลา 21.55 น.
- นักท่องเที่ยวสามารถขึ้นลงตามจุดต่าง ๆ โดยมีสถานีที่หยุดรับ-ส่ง ได้แก่ สถานีชุมทางบางซื่อ บางบำหรุ ชุมทางตลิ่งชัน และศาลายา
การแข่งขันเรือยาวประเพณีขึ้นชิงธง 11-15 กันยายน 2567
11-15 กันยายน 2567 การแข่งขันเรือยาวประเพณีขึ้นชิงธง ชิงถ้วยพระราชทาน ประจำปี 2567 ณ คลองในหลวงหัววัง-พนังตัก ตำบลนาชะอัง อำเภอเมือง จังหวัดชุมพร
การแข่งขันเรือยาวประเพณีขึ้นโขนชิงธง จังหวัดชุมพร ประจำปี 2567 เพื่อเฉลิมพระเกียรติและสำนึกในพระมหากรุณาธิคุณพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร ที่พระราชทานพระราชทรัพย์ส่วนพระองค์ผ่านมูลนิธิชัยพัฒนา ให้กรมชลประทานดำเนินการขุดคลองหัววัง-พนังตัก และแก้ไขปัญหาอุทกภัยในจังหวัดชุมพรอย่างยั่งยืน
กิจกรรมในงาน ประกอบด้วย การแข่งขันเรือยาวขึ้นโขนชิงธง 4 ประเภท ได้แก่ เรือยาว 32 ฝีพายผู้นำ , เรือยาว 32 ฝีพายทั่วไป , เรือยาว 16 ฝีพายทั่วไป และเรือยาว 8 ฝีพาย นอกจากนี้ยังมีกิจกรรมสร้างสีสันภายในงาน อาทิ การประกวดกองเชียร์เรือแข่ง มีเงินรางวัล 118,000 บาท, นิทรรศการแสดงถึงพระราชกรณียกิจของพระบาทสมเด็จพระบรมชนกาธิเบศรมหาภูมิพล อดุลยเดชมหาราช บรมนาถบพิตร และพระบาทสมเด็จพระเจ้าอยู่หัว, ขบวนอัญเชิญถ้วยรางวัลพระราชทาน, ลานวัฒนธรรม ประกวดร้องเพลง หนังตะลุง มโนราห์ อีกด้วย
งาน Sakaeo Craft Coffee & Friend #2 วันที่ 11-12 สิงหาคม 2567
ขอเชิญชวนเที่ยวงาน Sakaeo Craft Coffee & Friend #2 พบกันที่งาน Sakaeo Craft Coffee & Friend#2 วันที่ 11-12 สิงหาคม 2567 เวลา 10.00 - 22.00 น. รร. ลา วิลล่า บูทีค (la villa boutique hotel) โทร 094-9239245 หรือ 092-6545588
Google Map ติดตามข่าวสาร
facebook.com/Specialty.Sakaeo/งานงิ้วศาลเจ้าพ่อเสือ ประจำปี 2567 วันที่ 11-17 ตุลาคม 2567 คลองขลุง จังหวัดกำแพงเพชร
ขอเชิญเที่ยวงานงิ้ว ประจำปี 2567 ศาลเจ้าพ่อเสือ วันที่ 11 ~ 17 ตุลาคม 2567 ณ บริเวณตลาดใต้ท่ามะเขือ อำเภอคลองขลุง จังหวัดกำแพงเพชร 11 ต.ค. 67 วงดนตรี PM แบนด์ สุพรรณบุรี 12 ต.ค. 67 คอนเสิร์ต วงเก๋าซึม 13 ต.ค. 67 คอนเสิร์ต บรรพต ไหทองคำ 14 ต.ค. 67 คอนเสิร์ต แอน อรดี 15 ต.ค. 67 คอนเสิร์ต เจน ไทรถแห่ 16 ต.ค. 67 คอนเสิร์ต ปู พงษ์สิทธิ์ คำภีร์ 17 ต.ค. 67 คอนเสิร์ต S.T.BAND
งานของดีปักธงชัย ประจำปี 2567 วันที่ 11-17 กันยายน 2567
งานของดีปักธงชัย ประจำปี 2567 วันที่ 11-17 กันยายน 2567 ณ บริเวณหน้าที่ว่าการอำเภอปักธงชัย จังหวัดนครราชสีมา
ประเพณีสลากย้อมเมืองลำพูน ประจำปี 2567 11-17 กันยายน 2567 ณ วัดพระธาตุหริภุญชัยฯ อ.เมือง จ.ลำพูน
ททท.สำนักงานลำปาง ขอเชิญนักท่องเที่ยวร่วมงานประเพณี "สลากย้อมเมืองลำพูน ประจำปี 2567 " ประเพณีหนึ่งเดียวในโลก ระหว่างวันที่ 11-17 กันยายน 2567 ณ วัดพระธาตุหริภุญชัยฯ อ.เมือง จ.ลำพูน
สลากย้อมถือเป็นทานสลากพิเศษของชาวลำพูน ต้นสลากมีขนาดสูงใหญ่กว่าสลากชนิดอื่น นอกจากนั้นผู้ที่จะเป็นเจ้าภาพหรือเจ้าของต้นสลากจะต้องเป็นหญิงสาวในวัยพร้อมออกเรือน คือมีอายุ 20 ปีขึ้นไป ตามความเชื่อที่ว่าการถวายทานสลากย้อมเป็นการทำบุญครั้งใหญ่ของผู้หญิง ซึ่งทำได้เพียงครั้งเดียว เปรียบได้กับการบวชของผู้ชาย และยังเชื่อว่าหากหญิงใดทานสลากย้อมแล้วถือว่าพร้อมที่จะแต่งงานเป็นแม่บ้านที่ดีได้
โดยนักท่องเที่ยวจะมีส่วนร่วมได้อย่างไร มาวันไหน แต่ละวันมีกิจกรรมอะไรบ้าง ซึ่งจะมีรายละเอียดดังนี้
- 11 กันยา 2567
เวลา16.00 น มีการประกวดต้นสลากย้อม สูง 12 เมตร
เวลา 18.30 การแสดง ชุดย้อมสลากด้วยแสงสี ประกอบท่ารำ และพีธีแถลงข่าวการจัดงาน ของหน่วยงานภาครัฐในจังหวัดลำพูน
- 12-16 กันยายน ทุกวันมีการแสดงชุด ย้อมสลากด้วยแสงสี วันละ 2 รอบ 19.00 น และ 20.00 น พร้อมการแสดงทางวัฒนธรรมมากมาย
- วันที่ 15 กันยายน 2567 วันดา วันเปิดงาน พิธีเปิดงาน และการแสดงขบวนแห่สลากย้อมภาคกลางคืน ประกอบการแสดง ผสมแสงสีเสียง จากบนขัวมุงเก่าสู่ลานหน้าวัดพระธาตุหริภุญชัย เริ่มเวลา 18.30 เป็นต้นไป
- วันที่ 16 กันยายน วันแห่ต้นสลากขบวนแห่ต้นสลากย้อม สูง 8 เมตร 5 เมตร 3 เมตร จำนวน 25 ต้น พร้อมขบวนแห่ ประกอบ อย่างยิ่งใหญ่งดงาม จากหน้าศาลากลางหลังเก่า สู่ ลานบริเวณหน้าวัดพระธาตุหริภุญชัย
ท่านสามารถรอชมขบวนแห่ได้สองจุดคือหน้าศาลากลางเก่า และหน้าวัดพระธาตุหริภุญชัย (มีที่นั่งชม) เริ่มปล่อยขบวนเวลา 16.30 น.
- วันที่ 17 กันยายน 2567 วันตานต้นสลากท่านสามารถนำสลากของท่าน(ของที่จะถวายทาน) มาร่วมถวายทานร่วมกับพี่น้องชาวลำพูน ได้ตั้งแต่ เวลา 8.00 - 10.00 นำเส้นสลากมารวมกันในวิหารหลวง และรอพระสงฆ์มารับสลากภัตของท่าน ตั้งแต่เวลา 12.30 น เป็นต้นไป
นักท่องเที่ยวสามารถเลือกวันมาเที่ยวได้ มาร่วมทำบุญ และมาชมความงดงานของวัฒนธรรม ในรูปแบบ มีรากเหง้า สร้างสรรค์แสงสีเสียง รับกับโลกปัจจุบัน และที่สำคัญ กระจายรายได้สู่ชุมชนคนทำสลากย้อม ของจังหวัดลำพูน อย่างยั่งยืน และมันคือประเพณี #สลากย้อมเมืองลำพูนหนึ่งเดียวในโลก สร้างสรรค์งานท่องเที่ยวทางวัฒนธรรม ที่เป็นรูปธรรม อย่างชัดเจน ออกแบบสร้างสรรค์งานโดยทีมงาน ปิดทองหลังธาตุ วัดพระธาตุหริภุญชัย จังหวัดลำพูน
สอบถามรายละเอียดเพิ่มเติมได้ที่ 087-714-4448
Music Journey To The South 12-15 กันยายน 2567 ทริปแรก ชุมพร เกาะเต่า เกาะนางยวน เกาะสมุย
Music Journey To The South ชวนเที่ยวภาคใต้ 2 ทริป 2 สไตล์ ทริปแรก ชุมพร เกาะเต่า เกาะนางยวน เกาะสมุย นำทริปโดย พี่ปั่น ไพบูลย์เกียรติ และฟอร์ด สบชัย เจ้าพ่อเพลงรักสุดแสนโรแมนติกกับบรรยากาศสุดฟินริมชายหาด พร้อมเทศกาล Samui Summer Jazz 2024 วันที่12-15 กันยายน 2567
ทริปที่ 2 สัมผัสธรรมชาติ ทานอาหารอร่อย เที่ยวเมืองเก่า กันที่ตรัง พัทลุง สงขลา โดย ปิง + ชมพู ฟรุตตี้ และเติมความอบอุ่นด้วย พี่ปั่น ไพบูลย์เกียติ เขียวแก้ว ไฮไลท์พิเศษคอนเสิร์ตของวง สาว สาว สาว วันที่ 26 - 29 กันยายน 2567
เทศกาลอะโวคาโดและของดีอำเภอหางดง ครั้งที่ 4 วันที่ 12-16 กันยายน 2567
อบจ.เชียงใหม่ เชิญชวนร่วมงาน “เทศกาลอะโวคาโด และของดีอำเภอหางดง ครั้งที่ 4” ระหว่างวันที่ 12-16 กันยายน 2567 ณ เทศบาลตำบลบ้านปง อำเภอหางดง จังหวัดเชียงใหม่ โครงการจัดงานส่งเสริมผลผลิตอะโวคาโดและของดีตำบลบ้านปง เพื่อส่งเสริมการตลาด และเป็นการช่วยเหลือพี่น้องเกษตรกร อ.หางดง จ.เชียงใหม่ สร้างงาน สร้างรายได้ให้กับชุมชน เป็นการกระตุ้นเศรษฐกิจของ จ.เชียงใหม่ กิจกรรมภายในงาน ✨การออกร้านจำหน่ายสินค้า OTOP ✨ชมการแสดง ซอพื้นเมือง ✨การประกวดผลผลิตทางการเกษตร และอะโวคาโด ✨การแข่งขัน ลาบเมือง และการทำอาหารจากอะโวคาโด ✨ชมการแสดงชุดศิลปะ วัฒนธรรมของตำบลบ้านปง และร่วมสนุกกับกิจกรรมอีกมากมายภายในงาน
งาน สุดยอด! ผลิตภัณฑ์ อุตสาหกรรม สมุทรปราการ 12-16 กันยายน 2567
จังหวัดสมุทรปราการ ร่วมกับ สำนักงานอุตสาหกรรมจังหวัดสมุทรปราการ ขอเชิญทุกท่านร่วมงาน สุดยอด! ผลิตภัณฑ์ อุตสาหกรรม สมุทรปราการ จากโครงการพัฒนาผลิตภัณฑ์โดยใช้นวัตกรรม และปรับปรุงประสิทธิภาพ ผู้ประกอบการ SME และวิสาหกิจชุมชนเพื่อการปรับตัวสู้วิถีชีวิตใหม่ สู่การพัฒนา และต่อยอดผลิตภัณฑ์วิถีชุมชน
ระหวางวันที่ 12-16 กันยายน 2567 นี้ ที่ Grand Hall ชั้น 1 ศูนย์การค้าอิมพีเรียลเวิลด์ สำโรง พบสุดยอด! สินค้าดี สินค้าเด่น สินค้าOTOP และกิจกรรมพิเศษมากมาย พร้อมมินิคอนเสิร์ต 12 กันยายน พบ เอิ้นขวัญ วรัญญา 13 กันยายน พบ เจน นุ่น โบว์ ซุปเปอร์วาเลนไทน์ 14 กันยายน พบ ไรอัล กาจบัณฑิต 15 กันยายน พบ ดอกแค ท๊อปไลน์ 16 กันยายน พบ ออร์ดี้ ภูบดินทร์
Rayong Log Jam 2024 แข่งขันกระดานโต้คลื่นครั้งยิ่งใหญ่แห่งปี 12-15 กันยายน 2567 LINK
เตรียมตัวออกมาเฉิดฉาย Enjoy กับ Beach Lifestyle ริมชายหาด สองขั้วความสนุกแบบ Surfer กับ ‘การแข่งขันกระดานโต้คลื่นครั้งยิ่งใหญ่แห่งปีในภาคตะวันออก’ ผสานเข้ากับความสนุก จังหวะมันส์ๆ ของ ‘Live Music’ ที่มีเกลียวคลื่นเป็น Background
เข้างานฟรี เริ่มวันที่ วันที่ 12 - 15 กันยายน 2567 ที่ Leam Ya Surf Club หาดแม่รำพึง จ.ระยอง
พิกัด
ติดตามรายละเอีบดเพิ่มเติมได้ที่ Rayong Log Jam
ติดต่อ ททท.สำนักงานระยอง : 038-655-420
Dogs & Friends#2 ธีม Pet Heroes 12–13 กันยายน 2567
Dogs & Friends #2 ในธีม “Pet Heroes” วันพฤหัสบดีและศุกร์ที่ 12 – 13 กันยายน 2567 ตั้งแต่เวลา 16.00 น. – 20.00 น. บริเวณลานก้ามปู โครงการจริงใจมาร์เก็ต จ.เชียงใหม่
พาน้องหมาน้องแมวมาตรวจสุขภาพฟรี! กับคุณหมอใจดีจากโรงพยาบาลสัตว์ Cozy & Care พร้อมชวนพูดคุยในบรรยากาศสบาย ๆ กับคุณหมอผู้เชี่ยวชาญเรื่องความรู้เกี่ยวกับสัตว์เลี้ยงตลอดทั้ง 2 วัน วันที่ 12 ก.ย. 67 ; ทำความเข้าใจกับ ความสำคัญของฟันซี่เล็ก วันที่ 13 ก.ย. 67 ; พูดคุยกันในหัวข้อ เลี้ยงสัตว์อย่างไรให้เข้าสังคมได้ นอกจากนี้ยังมีกิจกรรมเวิร์คช้อปสุดสร้างสรรค์ ระบายสีเปเปอร์มาเชและเฟรมผ้า ● วาดภาพจาก Skill Art Training Studio ● ทำชุดน้องหมาน้องแมว ● เพ้นท์คุกกี้ลายสัตว์เลี้ยง เกมสนุกสำหรับคนรักสัตว์ ลุ้นของรางวัลมากมาย บูธจำหน่ายสินค้าสำหรับสัตว์เลี้ยง อาหาร ขนม และเครื่องดื่มอร่อย แล้วพบกันเน้อเจ้า แต่งตัวธีมซูเปอร์ฮีโร่มาร่วมงาน รับของที่ระลึกสุดน่ารักไปเลย!!
งาน Lighting of Songkhla Lagoon 2024 วันที่ 13-17 กันยายน 2567 LINK
งาน “ Lighting of Songkhla Lagoon 2024 ” วันที่ 13-17 กันยายน 2567 ย่านเมืองเก่าสงขลา (ถนนนางงาม / ถนนนครนอก / ถนนนครใน) ครั้งแรกของสงขลากับเทศกาลงานไฟส่งเสริมอัตลักษณ์จังหวัดสงขลาที่มีเสน่ห์ สัมผัส DNA ของสงขลาในมุมมองใหม่ ผ่านการจัดแสดงสถาปัตยกรรมแสงไฟที่ตื่นตาตื่นใจ ผ่านการร้อยเรียงทุกเรื่องราวพหุวัฒนธรรมผ่านศิลปะ ดนตรี และอาหารอย่างลงตัว กิจกรรมภายในงาน
สถาปัตกรรมไฟส่งเสริมอัตลักษณ์
ถนนแสงไฟ 3 สายพหุวัฒนธรรม
การแสดงดนตรี จาก “เก่ง ธชย”และ Fino the ranad
มนต์เสน่ห์อาหารดังสงขลา
การแสดงศิลปะไฟเล่าเรื่องสงขลา
งานผู้ไทนานาชาติ จังหวัดกาฬสินธุ์ 13–17 กันยายน 2567
งานผู้ไทนานาชาติ จังหวัดกาฬสินธุ์ ประจำปี 2567 ระหว่างวันที่ 13 – 17 กันยายน 2567 ณ สวนเฉลิมพระเกียรติฯ ใต้อ่างเก็บน้ำห้วยสายนาเวียง ตำบลคุ้มเก่า อำเภอเขาวง จังหวัดกาฬสินธุ์ ซึ่งได้กำหนดจัดพิธีเปิดงานฯ ในวันเสาร์ที่ 14 กันยายน 2567 เวลา 18.00 น. ณ สวนเฉลิมพระเกียรติฯ ใต้อ่างเก็บน้ำห้วยสายนาเวียง ตำบลคุ้มเก่า อำเภอเขาวง จังหวัดกาฬสินธุ์ โดยได้รับเกียรติจากท่านรัฐมนตรีว่าการกระทรวงการท่องเที่ยวและกีฬา (นายเสริมศักดิ์ พงษ์พาณิช) เดินทางมาเป็นประธารในพิธีเปิดงานฯ ซึ่งในพิธีเปิดงานฯ จะมีการแสดงฟ้อนผู้ไท จากนางรำ จำนวน 1,000 คน การสาธิตพิธีเหยา การแสดง แสง เสียง เล่าขานตำนานคนผู้ไท โดย คุณยายฉวีวรรณ ดำเนิน, คุณยายคำม่วง, คุณยายสวาท การลำตำนานผู้ไท โดย ป.ฉลาดน้อย การแสดง ทีมงานอ้น แคนเขียว และการแสดง ทีมงานจินนี่ ผู้ไท
ฉายภาพยนต์ "มันดาลาในจักรวาลธารา" 13-14 กันยายน 2024 อุทยานประวัติศาสตร์พิมาย จ.นครราชสีมา
ภาพยนต์ "มันดาลา"(Rivulet of Universe) เตรียมฉายรอบพิเศษครั้งแรกในประเทศไทย! ครั้งแรกในสถานที่ที่พร้อมสร้างประสบการณ์ทางภาพยนตร์แสนพิเศษ พร้อมทั้งแขกรับเชิญและงานเสวนาหลังจบภาพยนตร์!
“มันดาลาในจักรวาลธารา” มันดาลาในแสงสีค่ำคืนของปราสาทพิมาย
13-14 กันยายน 2024 อุทยานประวัติศาสตร์พิมาย จ.นครราชสีมา ฉายหนัง มันดาลา ที่ปราสาทหินพิมาย ชวนดูหนังไทยที่เดินสายมาแล้วทั่วโลก กับการฉายครั้งแรกในไทย ณ พื้นที่ประวัติศาสตร์
หลังจากตระเวนออกฉายในเทศกาลภาพยนต์นานาชาติไปทั่วโลก ล่าสุด ภาพยนตร์ไทยเรื่อง มันดาลา (Rivulet of Universe) ของ พสธร วัชรพาณิชย์ ก็ได้ฤกษ์ฉายรอบปฐมทัศน์ในประเทศไทยแล้ว พร้อมเพิ่มความอินให้มากขึ้นด้วยการร่วมมือกับภาครัฐจัดรอบฉายครั้งแรกที่ปราสาทพิมายในยามค่ำคืน สถานที่สำคัญที่เป็นจุดเริ่มต้นของแรงบันดาลใจในภาพยนตร์เรื่องนี้
มันดาลา (Rivulet of Universe) คือภาพยนตร์เรื่องยาวครั้งแรกของ พสธร วัชรพาณิชย์ ผู้กำกับรุ่นใหม่วัย 25 ปี ที่ลงมือกำกับและเขียนบทด้วยตัวเอง โดยเขาได้ดัดแปลงตำนานเรื่อง ท้าวปาจิตกับนางอรพิม หรือที่รู้จักกันในชื่อ ‘ตำนานปราสาทพิมาย’ ให้กลายเป็นบทภาพยนตร์ร่วมสมัย ที่จะพาเราไปพบกับความหมายใหม่ ๆ ผ่านการเดินทางของ ‘จิต’ ชายหนุ่มผู้มีความสามารถพิเศษในการมองเห็นการเชื่อมโยงระหว่างอดีต ปัจจุบัน และอนาคต โดยในระหว่างทางเขาก็ได้พบกับ พิม และ ทัต อีกสองตัวละครสำคัญที่จะพาเราเข้าสู่สถานที่ที่มีความลึกลับและเปิดเผยความลับที่ซ่อนอยู่ระหว่างเวลาและสถานที่ไปด้วยกัน
นอกเหนือจากการจัดฉายภาพยนตร์ ภายในงานยังมีการจัดงานเสวนา มันดาลาในจักรวาลธารา ในหัวข้อ ‘อวกาล มันดาลา ธาราแห่งแม่น้ำมูล’ และ ‘ภาพแทนบนเขตแดนเรื่องเล่า’ ที่จะนำเสนอความเชื่อมโยงระหว่างประวัติศาสตร์ ศิลปะ และภูมิทัศน์ของเมืองพิมาย โดยงานเสวนานี้จะช่วยให้ผู้เข้าร่วมงานได้เข้าใจเบื้องหลังของภาพยนตร์และตำนานที่เป็นแรงบันดาลใจในการสร้างภาพยนตร์
สำหรับผู้ที่สนใจเข้าร่วมชมภาพยนตร์เรื่อง มันดาลา (Rivulet of Universe) รอบปฐมทัศน์ และงานเสวนา ‘มันดาลาในจักรวาลธารา’ สามารถมาร่วมสัมผัสประสบการณ์ที่ไม่เหมือนใครได้ที่อุทยานประวัติศาสตร์พิมาย ในวันที่ 13-14 กันยายน 2567 นี้ ตั้งแต่เวลา 17.00 น. เป็นต้นไป งานนี้ถือเป็นโอกาสพิเศษที่ไม่ควรพลาดสำหรับผู้ที่สนใจในภาพยนตร์ ศิลปะ และประวัติศาสตร์
งานเทศกาล ลางสาด ลองกองหวาน เมืองมหัศจรรย์แห่งผลไม้ และสินค้า OTOP จังหวัดอุตรดิตถ์ ประจำปี 2567 วันที่ 13-22 กันยายน
จังหวัดอุตรดิตถ์ เชิญเที่ยวงานเทศกาล "ลางสาด ลองกองหวาน เมืองมหัศจรรย์แห่งผลไม้ และสินค้า OTOP จังหวัดอุตรดิตถ์ ประจำปี 2567" ระหว่างวันที่ 13-22 กันยายน 2567 ณ สนามกีฬาพระยาพิชัยดาบหัก อำเภอเมือง จังหวัดอุตรดิตถ์ 13 ก.ย. 67 - ปู พงษ์สิทธิ์ คำภีร์ 14 ก.ย. 67 - หลี่ซัง ไหทองคำ 15 ก.ย. 67 - TN ชัยนาท 16 ก.ย. 67 - บังนัส ฟิวเจอร์แบนด์ 17 ก.ย. 67 - พิมดา อาร์สยาม 18 ก.ย. 67 - วงไม้เลื้อยแบนด์ 19 ก.ย. 67 - กานต์ ทศน 20 ก.ย. 67 - เรไร ไลฟ์สด 21 ก.ย. 67 - วงทรายทอง ชัยนาท 22 ก.ย. 67 - แอน อรดี
งานแสง สี เสียง เปิดบันทึกพระยาพิชัยดาบหัก 13- 14 กันยายน 2567
งานแสง สี เสียง งานเปิดบันทึกพระยาพิชัยดาบหัก วันที่ 13- 14 กันยายน 2567 เวลา 17.00 - 22.00 น. ณ วัดเอกา บ้านปากคลอง ต.คอรุม อ.พิชัย จ.อุตรดิตถ์ บรรยากาศเล่าเรื่องราวท่านพ่อพระยาพิชัยดาบหักผ่าน ศิลปะ วัฒนธรรม ประเพณีของชุมชน พร้อมทั้ง
✅ กิจกรรมการแสดงจากโรงเรียนและชุมชม
✅ การประกวดสำรับอาหารท่านพ่อพระยาพิชัย
✅ การประกวดTo be number 1 ของตำบลคอรุม
✅ ถ่ายรูป เช็คอิน กินอาหารอร่อยจากตลากชุมชนตำบลคอรุม 12 หมู่บ้าน รวมทั้งผลิตภัณฑ์สินค้าชุมชม otop
✅ ทีเด็ดที่ห้ามพลาด “ตลาดกินในวัด” รวบรวมความอร่อยทั่วอำเภอพิชัยมาไว้ที่นี่
จัดโดย ✔️กลุ่มท่องเที่ยวตำบลคอรุม✔️ทีมงานพิชัยคราฟท์✔️สำนักวัฒนธรรมจังหวัดอุตรดิตถ์
งานอุทัยธานี ของดีอยู่ที่ผ้า ครั้งที่ ๓ วันที่ 13-15 กันยายน 2567
มาชม ช้อป ชิม แชะ "งานอุทัยธานี ของดีอยู่ที่ผ้า ครั้งที่ ๓ " ระหว่างวันที่ 13-15 กันยายน 2567 ณ สวนสุขภาพเฉลิมพระเกียรติฯ วงเวียนหอนาฬิกาจังหวัดอุทัยธานี
รับชมนิทรรศการองค์ความรู้เสด็จประพาสต้นฯ นิทรรศการผ้าอัตลักษณ์เมืองอุทัยธานี
ชมการสาธิตภูมิปัญญาทางวัฒนธรรม ผ้าทอลาวครั่ง ผ้าทอกะเหรี่ยง และอาหารพื้นบ้านกะเหรี่ยง
เยี่ยมชมบูธจัดแสดงและจำหน่ายผ้าทอ ผ้าพื้นถิ่น ผลิตภัณฑ์จากผ้า และผลิตภัณฑ์ทางวัฒนธรรม
มาแต่งไทยย้อนยุคตามรอยเสด็จประพาสต้น เมืองอุทัยธานี ครบรอบ ๑๑๘ ปี กันเยอะๆนะคะ
โปรแกรมท่องเที่ยวเชิงสร้างสรรค์ "เที่ยวท่องล่องชม 2 ตลาดแปลกจันทบุรี"
โปรแกรมท่องเที่ยวเชิงสร้างสรรค์ "เที่ยวท่องล่องชม 2 ตลาดแปลกจันทบุรี" (ตลาดขนมแปลก ริมคลองหนองบัว, ตลาดสี่มุมเมรุ บางสระเก้า) เที่ยวตลาดขนมแปลก ชมวิถีชุมชนบางสระเก้า ล่องเรือมาดชมธรรมชาติ เพลิดเพลินกับฝูงเหยี่ยวแดง ช้อปอาหารทะเลสดๆ และชิมอาหารถิ่นรสเด็ด ปลาเงี่ยน เมี่ยงยืนกิน โปรแกรมท่องเที่ยว ทุกวันเสาร์ - อาทิตย์ ตั้งแต่เวลา 10.00 น. ถึง 15.00 น. หากมาเป็นหมู่คณะ สามารถเหมารอบพิเศษได้ ราคา 199.- บาท /ต่อคน
งานเทศกาลอาหารและบอลลูนหลากสีสันแปดริ้ว 13-22 กันยายน 2567 ศูนย์การค้าตะวันออกคอมเพล็กซ์
ขอเชิญเที่ยวงานเทศกาลอาหารและบอลลูนหลากสีสัน ครั้งแรกของแปดริ้ว วันที่ 13-22 กันยายน 2567 ศูนย์การค้าตะวันออกคอมเพล็กซ์ (แยกพล 11) อ.เมือง จ.ฉะเชิงเทรา ภายในงานพบกับบูธ ของกิน ของใช้ มากมายหลากหลาย สวนสนุกชุดใหญ่ ลานคอนเสิร์ตศิลปินดัง ชมฟรีทุกค่ำคืน 19 กย. พบกับ ทิดแอมป์ เจ้าของผลงานเพลง สวยขยี้ใจ บักคนชั่ว 21 กย. พบกับ ร็อคคงคอย เจ้าของผลงานเพลง วอนวัยรุ่น กระจอกแท้ 22 กย. พบกับ บังนัส ฟิวเจอร์แบนด์ เจ้าของผลงานเพลง รักคนมีเจ้าของ
งาน AMAZING MUAY THAI EXPEREIENCE 13-15 กันยายน 2567 ณ พระนารายณ์ราชนิเวศน์
งาน AMAZING MUAY THAI EXPEREIENCE ณ พระนารายณ์ราชนิเวศน์ อำเภอเมืองลพบุรี จังหวัดลพบุรี วันที่ 13 - 15 กันยายน 2567 เวลา 16.00 - 22.00 น. พบกับต้นกำเนิดมวยไทย Soft power ที่โด่งดังไปทั่วโลกอย่าง “ฉลาดลพบุรี” นำโดย ครูยะ ส.สุนีย์ มวยไทยยิม ตามด้วย ท่าดีไชยา จ.สุราษฎร์ธานี, ไวกว่าท่าเสา จ. อุตรดิตถ์ และ หมัดหนักโคราช จ.นครราชสีมา กับการสาธิตศิลปะการต่อสู้ที่ควรค่าแก่การได้เรียนรู้โดยปรจารย์ผู้เชี่ยวชาญ ครูมวยฝีมือดีและเหล่าลูกศิษย์
แคมป์ หนังฉาย เกาะสมุย MUI CINEMA FESTIVAL EP.3 “CAMP CINEMA” 13-15 กันยายน 2567
องค์การบริหารส่วนจังหวัดสุราษฎร์ธานี จัดกิจกรรม ร่วมย้อนวันวานสืบสานเรื่องราว เปลี่ยนภาพจำ เป็นภาพจริง ! “แคมป์ หนังฉาย” MUI CINEMA FESTIVAL EP.3 “CAMP CINEMA” “Rewind,Relive,Realize:Where Memories Become Reality” งานดีๆเข้าฟรี 13-15 กันยายน 2567 นี้ ณ สนามกีฬานานาชาติพรุหน้าเมือง อำเภอเกาะสมุย จังหวัดสุราษฎร์ธานี
นอกจากชมหนังฉายกลางแปลง ซุ้มอาหารถิ่นเกาะสมุย สินค้า-ผลิตภัณฑ์ชุมชน การแสดงมหรสพพื้นบ้าน นิทรรศการศิลปะวัฒธรรมร่วมสมัย และสิ่งน่าสนใจอีกมากมาย
มหัศจรรย์เมืองสามอ่าวและงานกาชาด ประจวบฯ 13-22 กันยายน 2567
ท่องเที่ยวประจวบฯ เที่ยวชมงาน มหัศจรรย์เมืองสามอ่าวและงานกาชาด ประจวบฯ 13-22 กันยายน 2567 ณ ศาลากลางจังหวัดและถนนเลียบชายทะเล จัดโดยจังหวัดประจวบ และเหล่ากาชาดจังหวัดประจวบ สัมผัส "เมืองทองเนื้อเก้า มะพร้าวสับปะรด สวยสดหาดเขาถ้ำ งามล้ำน้ำใจ" ชมคอนเสิร์ตแน่นๆ ทุกคืน กับการแสดงของศิลปินชื่ดัง คืน 19 กันยายน ชมประกวด miss queen 20 กันยายน ประกวดสามงามเมืองสามอ่าว 15 และ 22 กันยายน การแสดงจากชิงช้าสวรรค์
งานเฉลิมฉลองครบรอบ 30 ปี สะพานมิตรภาพไทย-ลาว แห่งที่ 1 “ฮักมั่น ผูกพัน สานสัมพันธ์ สองฝั่งโขง” 13-15 กันยายน 2567
จังหวัดหนองคาย โดยสำนักงานวัฒนธรรมจังหวัดหนองคาย ขอเรียนเชิญทุกท่าน ร่วมงานเฉลิมฉลอง ครบรอบ 30 ปี สะพานมิตรภาพไทย-ลาว แห่งที่ 1 “ฮักมั่น ผูกพัน สานสัมพันธ์ สองฝั่งโขง” วันที่ 13-15 กันยายน 2567 ณ ลานวัฒนธรรม พญานาคคู่ หน้าวัดลำดวน อำเภอเมืองหนองคาย จังหวัดหนองคาย ภายในงาน พบกับ
ชมการแสดงศิลปวัฒนธรรมสองฝั่งโขง ประกอบ แสง เสียง ผสมผสานสื่อทันสมัย สุดตระการตา
มินิคอนเสิร์ตจากศิลปินชื่อดัง นำโดย เต๋า ภูศิลป์ และศิลปินไทย - ลาว
พิธีบายศรีสู่ขวัญมหามงคล สองแผ่นดิน
ชม ชิม ชอป สินค้าจากชุมชนคุณธรรม และผลิตภัณฑ์ CPOT จากกลุ่มจังหวัด “สบายดี” หนองคาย อุดรธานี เลย บึงกาฬ หนองบัวลำภู
Unseen ไปกับนิทรรศการแหล่งท่องเที่ยวโดดเด่น 10 แห่ง จังหวัดกลุ่มสบายดี
ย้อนรอยความทรงจำกับนิทรรศการภาพถ่ายย้อนอดีต 30 ปี สะพานมิตรภาพ ไทย - ลาว แห่งที่ 1
กิจกรรม Work Shop ด้านศิลปวัฒนธรรม และกิจกรรมอื่น ๆ อีกมากมาย
ประเพณีไหลเรือไฟไหว้สาพญาเต่างอย ปีที่ 24 ประจำปี 2567 วันที่ 13–17 กันยายน 2567
การท่องเที่ยวแห่งประเทศไทย ชวนเที่ยว “ประเพณีไหลเรือไฟ ไหว้สาพญาเต่างอย” ปีที่ 24 วันที่ 13–17 กันยายน 2567 ณ สวนสาธารณะอำเภอเต่างอย จังหวัดสกลนคร กิจกรรมภายในงานมีดังนี้ ชมขบวนแห่ไหลเรือไฟบกสุดอลังการ สร้างสรรค์จากวัสดุธรรมชาติ การรำบวงสรวงพญาเต่างอย กว่า 500 ชีวิต การแสดง แสง สี เสียง “ปกรณัมแห่งศรัทธา ไหว้สาพญาเต่างอย” ขอพรพญาเต่างอย ลอยเรือไฟโบราณ ขอขมาพระแม่คงคา เพลิดเพลินกับศิลปวัฒนธรรมท้องถิ่น และเสียงเพลงจากศิลปินดัง การแข่งขันเรือยาวสุดมันส์ ชมมวยไทย ช้อปสินค้าพื้นเมือง ลุ้นรางวัลกับกิจกรรม “เรือไฟให้โชค”
ท่องเที่ยวประจวบคีรีขันธ์ มหัศจรรย์เมืองสามอ่าว และงานกาชาด 67 วันที่ 13-22 กันยายน 2567
จังหวัดประจวบคีรีขันธ์ และเหล่ากาชาดจังหวัดประจวบคีรีขันธ์ ขอเชิญมาท่องเที่ยวงาน ประจวบคีรีขันธ์ มหัศจรรย์เมืองสามอ่าว และงานกาชาด 67 วันที่ 13-22 กันยายน 2567 ณ ศาลากลางจังหวัดและถนนเลียบทะเล
งานเฉลิมฉลองภูพระบาทมรดกโลกทางวัฒนธรรมแห่งที่ 2 ณ อุทยานประวัติศาสตร์ภูพระบาท 13 กันยายน 2567
จ.อุดรธานี จัดงานเฉลิมฉลองภูพระบาทมรดกโลกทางวัฒนธรรมแห่งที่ 2 ณ อุทยานประวัติศาสตร์ภูพระบาท อ.บ้านผือ จ.อุดรธานี 13 กันยายน 2567
งานมหกรรมขนมกระยาสารทอาหารและของดีบ้านยาง ประจำปี 2567 วันที่ 13-15 กันยายน 2567
ชวนชิม ช้อป เที่ยวงานมหกรรมขนมกระยาสารทอาหารและของดีบ้านยาง ประจำปี 2567 ระหว่างวันที่ 13-15 กันยายน 2567 ณ สนามกีฬาเทศบาลตำบลบ้านยาง อ.เสาไห้ จ.สระบุรี พบกับกิจกรรมมากมาย
วันศุกร์ที่ 13 กันยายน 2567
- ชมนิทรรศการ และการออกร้านสินค้าของดีบ้านยาง
- ชมการแสดงดนตรี (วงไม้เลื้อยแบนด์)
วันเสาร์ที่ 14 กันยายน 2567
- 16.30 น. เยี่ยมชมนิทรรศการ และการออกร้านสินค้าของดีบ้านยาง
- 18.00 น. เวทีเสวนา "หวานกรอบกระยาสารท ยามสารทเดือนสิบ"
- 19.00 น. ชมการแสดงวิถีไทยวนและพิธีเปิดงาน ประธานและแขกผู้มีเกียรติ ร่วมกวนกระยาสารท จำนวน 8 กระทะ จากร้านกระยาสารทในเขตเทศบาล จำนวน 8 ราย
- 20.00 น. ชมการแสดงดนตรี (วงข้าวเปลือก)
วันอาทิตย์ที่ 15 กันยายน 2567
- 16.00 น. ประกวดกระยาสารกไทยก้าวสู่กระยาสารกโลก" และการแข่งขันกินขนมกระยาสารท
- 17.00 น. เวทีเสวนา "กระยาสารทไทยก้าวสู่กระยาสารทโลก Soft power"
- 18.00 น. ชมการแสดงเวทีของชุมชนเทศบาลตำบลบ้านยาง 4 ชุมชน และชมการแสดงดนตรี (ใหญ่วาเลนไทน์ ปะทะ ซ่อมาลีแบรนด์)
ติดต่อสอบถามข้อมูลเพิ่มเติม สำนักงานเทศบาลตำบลบ้านยาง โทร. 036-725110
กิจกรรม STAR PARTY 2024 ณ สวนประวัติศาสตร์ พลเอกเปรม 13 กันยายน 2567
กิจกรรม STAR PARTY 2024 ณ สวนประวัติศาสตร์ พลเอกเปรม ติณสูลานนท์ สงขลา 13 กันยายน 2567 เวลา 17:00 - 21:30 น.
พบกับกิจกรรม ดูดาวผ่านกล้องโทรทรรศน์ ดวงจันทร์ ดาวเสาร์ DIY กล่องดวงดาว ร้อยเรียงกลุ่มดาว ภาพวาดดาราศาสตร์ ถ่ายภาพกับบอลลูนดวงจันทร์ ดาวพฤหัสบดีขนาดใหญ่ ฟังเพลงชิว อิ่มอร่อยจากขบวนฟู้ดทรัค บรรยากาศในสวน
พิเศษ ‼️ รับร่มที่ระลึก ททท. หาดใหญ่ 30 ท่านแรกลงทะเบียนออนไลน์ 20 ท่านสุ่มรายชื่อลงทะเบียนออนไลน์ 50 ท่านแรกลงทะเบียนหน้างาน
กิจกรรม ล่องเรือสุดชิล ชมเสน่ห์คลองพระพิมลกับกิจกรรม One Day Trip ฟรี 14-15, 21-22 กันยายน 2567
สำนักงานการท่องเที่ยวและกีฬาจังหวัดนนทบุรี จัดกิจกรรม ล่องเรือสุดชิล ชมเสน่ห์คลองพระพิมลกับกิจกรรม เที่ยววันเดียว One Day Trip วันเสาร์และอาทิตย์ที่ 14-15,21-22 กันยายน 2567 ร่วมทริปฟรี ติดต่อสอบถามเพิ่มเติมได้ที่ Inbox
เพจสำนักงานการท่องเที่ยวและกีฬาจังหวัดนนทบุรี ตารางกำหนดการ ดังนี้
เวลา 08.40 น. เที่ยวชมวัดละหาร ไหว้พระทำบุญ เพื่อความเป็นสิริมงคลตั้งแต่เริ่มเดินทาง
เวลา 10.00 น. ล่องเรือชมคลองพระพิมล เก็บบรรยากาศสุดประทับใจ
เวลา 11.00 น. ขึ้นเรือที่ตลาดน้ำไทรน้อย และร่วมชมกิจกรรม “เสน่ห์ใกล้กรุง”
เวลา 12.00 น. - เดินทางไปศูนย์เรียนรู้ศูนย์การเรียนรู้ฟาร์มลุงเครา ชมผักปลอดสาร - รับประทานอาหารกลางวันเติมพลัง - ร่วมกิจกรรม workshop เพนท์พัดของกลุ่มตาชายายสา
เวลา 14.00 น. เดินทางไปฟาร์มกล้วยไม้ แอร์ออร์คิดส์ด้วยรถบัสแวะเลือกซื้อของที่ระลึก
เวลา 15.30 น. แวะชมศาลเจ้าแม่คลองทอง (เจ้าแม่ทับทิม) ขอโชคเหมาะกับสายมู
เวลา 16.00 น. เลือกซื้อสินค้าชุมชนและขนมเปี๊ยะชื่อดังในตลาดบางเลน
เสน่ห์คลองพระพิมลหวนชวนนึกถึงอดีต เที่ยวนนทบุรี-นครปฐม ฉบับคนรักษ์โลก 14-15, 21-22 กันยายน 2567
ชาวนนทบุรีต้องไม่พลาด กับงาน
กิจกรรมส่งเสริมการท่องเที่ยวรักษ์คลองพระพิมล เพราะเที่ยวครั้งนี้ดีต่อโลก ร่วมชมเสน่ห์คลองพระพิมลหวนชวนนึกถึงอดีต เที่ยวนนทบุรี-นครปฐม ฉบับคนรักษ์โลก วันเสาร์อาทิตย์ที่ 14-15 และ 21-22 กันยายน 2567 เตรียมพบกับความสนุกสุดมันส์ของหลากหลายกิจกรรม ที่จะพาคุณไปท่องเที่ยวและสัมผัสกับวิถีชีวิตอันงดงามแห่งคลองพระพิมล พร้อมทั้งชมการแสดงศิลปวัฒนธรรมของจังหวัดนนทบุรี-นครปฐมและกิจกรรมอื่นๆ อีกมากมาย
กิจกรรมภายในงานเสน่ห์ใกล้กรุงฯ ณ ตลาดน้ำไทรน้อย วัดไทรใหญ่ การประกวดร้องเพลงเยาวชน “ลูกทุ่ง ดาวรุ่งเสียงทอง” การประกวดแข่งขันทำอาหารจากเชฟร้านดังระดับโรงแรม โชว์การแสดงศิลปวัฒนธรรม
- กิจกรรมทางน้ำ
- วันที่ 14,15,21,22 กันยายน กิจกรรมล่องเรือ One Day Trip
- วันที่ 14,21,22 กันยายน การท่องเที่ยวเชิงอนุรักษ์ ล่องเรือเก็บขยะ
- วันที่ 21,22 กันยายน กิจกรรมสอนพายเรือ มวยทะเล
การประกวดชิงเงินรางวัล : การประกวดภาพถ่ายและวีดิทัศน์ ในโจทย์ วิถีชีวิตความสวยงามวัฒนธรรมความเป็นอยู่ของคลองพระพิมลในอดีต และปัจจุบัน
พร้อมกับบูทร้านค้ากว่า 60 ร้านทั้งของฝากและอาหารจัดเต็มตลอดทั้งงาน พร้อมยกทัพศิลปินจัดเต็มในวันพิธีเปิดงาน
ประกวดเต้นรำ (ไลน์แดนซ์) 14-15 กันยายน 2567
ประกวดเต้นรำ (ไลน์แดนซ์) ระดับจังหวัด ภายใต้โครงการศูนย์นันทนาการเติมฝัน ปันสุข สู่ภูมิภาค ประจำปีงบประมาณ พ.ศ. 2567 วันแข่ง 14-15 กันยายน 2567 ณ ลานหน้าศูนย์การค้าเซ็นทรัล ชลบุรี สอบถามข้อมูลเพิ่มเติมได้ที่ : สำนักงานการท่องเที่ยวและกีฬาจังหวัดชลบุรี โทร. 038-274-284
รากรสชาติพันธุ์ Chim Chan The Journey Ep.1 สำรับ(ลับ) ในบ้านเล็ก 14-15 ก.ย. 2567
ททท.สำนักงานจันทบุรี ชวนมาชิม เมนูลับในงาน "รากรสชาติพันธุ์ Chim Chan The Journey" Ep.1 สำรับ(ลับ) ในบ้านเล็ก วันที่ 14-15 ก.ย. 2567 ณ
บ้านเล็กวิลล่า ต.จันทนิมิต อ.เมือง จ.จันทบุรี เวลา 11.00 - 21.00 น. [
จุดจอดรถ] กิจกรรมภายในงาน
• Taste & Talk มาชิม 16 เมนูลับ จากย่านชุมชนเก่าสองฝั่งแม่น้ำจันทบูร พร้อมพูดคุย ในหัวข้อ "เราคือใคร? วิถีแห่งอาหาร" กับบรรยากาศร่มรื่นของบ้านเล็ก วิลล่า บ้านไทยร่วมสมัยใต้ถุนสูง มุมลับๆ ของชุมชนจันทนิมิต
• Route to Roots สัมผัสวิถีชีวิตชุมชนคาทอลิก กับอาหารนำทาง ศรัทธานำเที่ยว เช็คอิน landmark ของจันทบุรี อาสนวิหารพระนางมารีอาปฏิสนธินิรมล ถือเป็นวิหารที่สวยแห่งหนึ่งในประเทศไทย
• Sip & Share : สายกาแฟห้าม...พลาด มาจิบกาแฟ เม้าท์มอย ในร้านกาแฟเล็กๆ บรรยากาศโฮมมี่ อบอุ่นๆ ณ Ruen Lek เรือนเล็ก
• Workshop ทำข้าวเกรียบยายเที่ยง และ โคมจีน
งานเสน่ห์ไทย @ นครศรีธรรมราช ณ หาดหน้าด่าน อำเภอขนอม 14-22 กันยายน 2567
งานเสน่ห์ไทย @ นครศรีธรรมราช ณ หาดหน้าด่าน อำเภอขนอม จังหวัดนครศรีธรรมราช วันที่ 14-15 กันยายน 2567 และ 20-22 กันยายน 2567 ณ หาดหน้าด่าน อำเภอขนอม จังหวัดนครศรีธรรมราช เวลาความสนุกตั้งแต่ 16.00 – 22.30 น. งานนี้ เข้าฟรี
งานปีนี้ อัดแน่นความฟิน ด้วยกิจกรรมมากมาย FREE CONCERT จากศิลปินดังมากมาย ให้คุณได้มันส์สนั่นขนอม ทั้ง WHAL & DOLPH, PARADOX, YOURMOOD, MIRRR, GAVIN D ,MAIYARAP, THE PARKINSON, TWOPEE, PURPEECH และ TILLY BIRDS MARKET สุดชิคเอาใจสายช๊อป ที่รวบรวม ร้านแฟชั่น และ ร้านอาหารกว่า 100 ร้านค้า ไม่จึ้งยังไงไหว เพลิดเพลินไปกับกิจกรรมศิลปวัฒนธรรมสุดเท่เก๋ได้ทุกวัย STREET ART จากศิลปินที่มีชื่อเสียง สนุกไปกับโซนถ่ายภาพ good vibes อวดโซเชียล กิจกรรม WORKSHOP Craft & MU Market และกิจกรรมมากมายภายในงาน เตรียมตัวให้พร้อมและ ชิลสไตล์ BEACH LIFE ไปด้วยกัน ในวั
Hello Hatyai 2024 เทศกาลแห่งความสนุกใจกลางเมืองหาดใหญ่ ทุกเสาร์-อาทิตย์ กันยายน-ตุลาคม
Hello Hatyai 2024 เทศกาลแห่งความสนุกใจกลางเมืองหาดใหญ่ Market Festival ที่ทุกคนรอคอย จัดใหญ่จัดเต็มด้วย FLEA MARKET, MUSIC, FOOD, STREET ART, LIFESTYLE และกิจกรรมที่น่าสนใจอีกมากมาย กำหนดจัดทุกวันเสาร์-อาทิตย์ (เวลา 18.00 - 23.00 น.) ถนนประชารมย์ - ภราดร อ.หาดใหญ่ จ.สงขลา
14 - 15 กันยายน 2567
21 - 22 กันยายน 2567
28 - 29 กันยายน 2567
5 - 6 ตุลาคม 2567
รับสมัครร้านค้า Fashion / Food & Drink / Second hands / Art & Craft / Workshop
งานนมัสการหลวงพ่อองค์ดำโบสถ์สีน้ำเงิน 14-22 กันยายน 2567 วัดปากน้ำแขมหนู
งานนมัสการหลวงพ่อองค์ดำโบสถ์สีน้ำเงิน 14-22 กันยายน 2567 วัดปากน้ำแขมหนู ต.ตะกาดเง้า อ.ท่าใหม่ จ.จันทบุรี กราบหลวงพ่อองค์ดำ พระแก้วมรกต พระพุทธชืนราช ชมไฟเรือประมงวิถีชาวเลทุกค่ำคืน ชมคอนเสิร์ตมาเต็ม 9 คืน ชมช็อปชิมสินค้าอาหารอร่อยมากมาย ของใช้กว่า 100 ร้านค้า
The Cave Run 2024 วิ่งทะลุมิติ 14-15 กันยายน 2567
ททท. ชวนนักวิ่งเทรลทั่วไทยร่วมสัมผัสประสบการณ์ "วิ่งทะลุมิติ" ในอุโมงค์เหมืองแร่เก่าสุด UNSEEN ที่ทองผาภูมิในวันที่ 14 - 15 กันยายน 2567 โดยเส้นทางจะวิ่งผ่าน "อุโมงค์สามมิติ" อุโมงค์เหมืองแร่เก่าของ ดร.ผล กลีบบัว ที่ ต.สหกรณ์นิคม อ.ทองผาภูมิ ซึ่งเป็นสถานที่ท่องเที่ยวที่มีความสวยงามและมีเรื่องราวในอดีตที่น่าสนใจท่ามกลางบรรยากาศธรรมชาติ และยังเป็นสถานที่ท่องเที่ยว Unseen New Chapters 1 ใน 25 แหล่งของประเทศไทย
ไฮไลท์ที่พลาดไม่ได้ก็คือ การได้วิ่งเข้าอุโมงค์เหมืองแร่ 3 อุโมงค์ที่มีความยาวโดยรวมถึง 1,000 เมตร นับเป็นมิติใหม่ของประสบการณ์การวิ่งที่ต้องห้ามพลาดเด็ดขาด
นักวิ่งที่สนใจสามารถติดตามความเคลื่อนไหว และสอบถามข้อมูลเพิ่มเติมเติมได้ทางเพจเฟสบุ๊ค
www.facebook.com/thecaverun หรือโทรศัพท์ 090 949 6425 และทาง Line : @reflect
ตลาดหัวปลี ตลาดสร้างสุข ชุมชนร่วมสร้าง LINK
ทุกวันเสาร์ อาทิตย์ และวันหยุดนักขัตฤกษ์ มาอิ่มอร่อยและช็อปปิ้งกันที่ “ตลาดพาณิชย์” โครงการฟื้นฟูเศรษฐกิจ ณ ตลาดหัวปลี จ.สระบุรี ที่นี่คุณจะได้พบกับสินค้าและของฝากหลากหลาย รวมถึงอาหารอร่อยมากมาย ตอบโจทย์ทุกความต้องการของชีวิตประจำวันในที่เดียว! นอกจากการช็อปปิ้งและการอิ่มอร่อยแล้ว ยังมีการแสดงดนตรีที่จะทำให้บรรยากาศสนุกสนานและผ่อนคลาย
ตลาดหัวปลี ตั้งอยู่ที่ท้ายศูนย์ OTOP คอมเพล็กซ์ พุแค เจอป้ายตลาดหัวปลีตรงเข้ามาด้านในอีก 300 เมตร
พิกัด : ต.พุแค อ.เฉลิมพระเกียรติ จ.สระบุรี
ตั้งแต่เวลา 09.00-17.00 น.
ติดต่อ : 081-8529391, 085-1237365
เทศกาลหุ่นตุ๊กตาโคมไฟ จังหวัดพิษณุโลก 14-22 กันยายน 2567
เชิญเที่ยวงานเทศกาลหุ่นตุ๊กตาโคมไฟ จังหวัดพิษณุโลก 14-22 กันยายน 2567 ณ ลานข้างอาคารอุทยานฯ KNECC (เค-เน็ค) หน้ามหาวิทยาลัยนเรศวร ติดถนนเส้นหลัก อ.เมือง จ.พิษณุโลก ชมการแสดงโชว์หุ่นตุ๊กตาโคมไฟขนาดใหญ่ หุ่นตุ๊กตาโคมไฟมังกร พญานาค ซุปเปอร์ฮีโร่ นกยูงรำแพน และหุ่นอีกมากมาย ชิม ช็อป สินค้าหลายร้านดัง ของกิน ของใช้ ไม้ดอก ไม้ประดับ สวนสนุกชุดใหญ่ เรือไวกิ้ง หมึกยักษ์ ดนตรีชมฟรีทุกค่ำคืน
เทศกาล กินหอย ตกหมึก@ชะอำ 2567 วันที่ 14-21 กันยายน 2567
เทศกาลที่ทุกคนรอคอย "กินหอย ตกหมึก@ชะอำ 2567" วันที่ 14-21 กันยายน 2567 ณ จุดชมวิวหาดชะอำ ชิม ของทะเลสดๆ ใหม่ๆ ชอป สินค้ามากมาย และอย่าพลาดร่วมกิจกรรมไฮไลท์ของงาน การ "ขึ้นเรือ ไปตกหมึก"
วิ่งเทรล ชีวมณฑล@สะแกราช 15 กันยายน 2567
กิจกรรมการท่องเที่ยวเชิงกีฬา วิ่งเทรล ชีวมณฑล @ สะแกราช วิ่งสัมผัสธรรมชาติมรดกโลก จัดขึ้น ณ สถานีวิจัยสิ่งแวดล้อมสะแกราช อ.วังน้ำเขียว และ อ.ปักธงชัย วันที่ 15 กันยายน 2567 เวลา 06.00 น. เป็นต้นไป
โคราช เมืองหลักแหล่งการท่องเที่ยวที่มีความหลากหลาย จังหวัดนครราชสีมาเป็นจังหวัดเดียวในประเทศไทย ที่ได้รับการรับรองจากยูเนสโกให้เป็นเมืองแห่ง 3 มรดกโลก ได้แก่ 1.อุทยานแห่งชาติเขาใหญ่ 2 พื้นที่สงวนชีวมณฑล ป่าสะแกราช อ.วังน้ำเขียว และ อ.ปักธงชัย และ 3 อุทยานธรณีโลก โคราชจีโอพาร์ค และเมืองโคราชเป็นเมืองกีฬา Sport city ภายใต้ยุทธศาสตร์ชาติเน้นการพัฒนาทรัพยากรมนุษย์ส่งเสริมคนไทยมีสุขภาพชีวิตที่ดีนำกีฬามายกระดับเศรษฐกิจของจังหวัดและประเทศ และส่งเสริมการท่องเที่ยวสู่ความยั่งยืน
วัดละหารไร่ ฮาล์ฟ มาราธอน ครั้งที่ 3 อาทิตย์ที่ 15 กันยายน 2567
วัดละหารไร่ ฮาล์ฟ มาราธอน ครั้งที่ 3 วันรับอุปกรณ์ เสาร์ที่ 14 กันยายน 2567 เวลา 09.30-18.00 น. วันแข่งขัน อาทิตย์ที่ 15 กันยายน 2567 เวลา 04.00-10.00 น. START / FINISH หน้าหลวงปู่ทิมองค์ใหญ่สีทอง วัดละหารไร่ ต.หนองละลอก อ.บ้านค่าย จ.ระยอง
Google Map วัดละหารไร่ เทศกาลดนตรี ไฮโฮะ เชียงใหม่ 15 กันยายน - 14 ตุลาคม 2567
เทศกาลดนตรี ไฮโฮะ เชียงใหม่ เทศกาลดนตรี 20 วัน 80 bands 20 music venues ที่จะทำให้เชียงใหม่ "ไฮ" ครึกครื้นกันตลอดทั้งเดือน แบบฉบับ Chaing Mai Original
Line up ศิลปิน : Thapae East - Venue for the Creative Arts สุดสะแนน Minimal Bar North Gate Jazz Co-Op mewfeelalive @ต๋องบาร์ Porjai Bar Imagine’s House Baansuan @เวิ้งคุณนลี Kindred Studio ทับสิบสอง Slash Twelve Moment’s Notice Jazz Club LVMC , Living Machine Bar & Break สนิมทุน Sanimthoon Community Café Deep Green @D.O.D Den of Drinks เฟอร์ คาเฟ่ เชียงใหม่ Paapu House @Troubadour
งานบุญประเพณีประจำปี พิธีปล่อยเรือส่งเคราะห์ทางทะเล ของชุมชนชาวประมงหัวหิน 15 กันยายน 2567 บริเวณทางขึ้นศาลเจ้าแม่ทับทิม
คณะกรรมการชุมชนชาวประมงหัวหิน จัดงานบุญใหญ่ประจำปี " พิธีปล่อยเรือส่งเคราะห์ทางทะเล ของชุมชนชาวประมงหัวหิน." พร้อมกับ งานทำบุญศาลเจ้าแม่ทับทิม เพื่อสืบทอดประเพณีดั้งเดิม ไม่ให้เลือนไปจากท้องถิ่น
ซึ่งปีนี้ ทางกรรมการจัดงาน ฯ กำหนดวันงานในวันอาทิตย์ที่ 15 กันยายน 2567 ณ บริเวณ ศาลเจ้าทับทิม ริมทะเลชายหาดหัวหิน
ทั้งนี้ ท่านสามารถทำบุญเปลี่ยนตุ๊กตาแทนตัวเรา เพื่อนำความทุกข์ ความโศก โรคภัย สิ่งที่ไม่ดีออกจากตัวเรา ฝากไปกับตุ๊กตา ได้ที่ หน้าวิหารหลวงพ่อนาค วัดหัวหิน ตั้งแต่บัดนี้เป็นต้นไปจนถึงวันเสาร์ที่ 14 กันยายน 2567 หรือในวันงาน วันอาทิตย์ที่ 15 กันยายน 2567 ที่บริเวณทางขึ้นศาลเจ้าแม่ทับทิม
งานวิ่งมหากาพย์รามเกียรติ์ ทัพสอง : พระนารายณ์อวตาร 15 กันยายน 2567 วัดขนอนหนังใหญ่ โพธาราม ราชบุรี
งานวิ่งมหากาพย์รามเกียรติ์ 3 ซีรีย์ 3 จังหวัด ทัพสอง : พระนารายณ์อวตาร ณ วัดขนอนหนังใหญ่ โพธาราม ราชบุรี วันออกทัพ : วันอาทิตย์ที่ 15 กันยายน 2567
กิจกรรมปั่นจักรยาน "ปั่นพระปรง" 15 กันยายน 2567
ชวนคุณมาร่วมปั่น โครงการดีดี อาทิตย์ 15 กันยายน 2567 การท่องเที่ยวแห่งประเทศไทย สำนักงานนครนายก เชิญชวนร่วมกิจกรรมปั่นจักรยาน "ปั่นพระปรง" ในวันที่ 15 กันยายน พ.ศ. 2567 จุดปล่อยตัว บริเวณสวนกาญจนาภิเษก ร.9 อ.อรัญประเทศ จ.สระแก้ว ระยะทาง 89 KM - 05:30 ลงทะเบียน รับประทานอาหารเช้า - 06:30 ปล่อยตัว - 11:00 รับประทานอาหารกลางวัน - 12:00 จบงาน สามารถสมัครเข้าร่วมกิจกรรมได้แล้ววันนี้ ถึงวันที่ 30 สิงหาคม 2567 ค่าสมัครเพียง 399.-/คน จำนวน 400 ท่านเท่านั้น สมัครได้ที่ FB: คุณช่วยปั่น เราช่วยปลูก
หอการค้าแฟร์ 2024 วันที่ 15-23 กันยายน 2567
ทท.เลย ขอเชิญชมงาน "หอการค้าแฟร์ 2024" ระหว่างวันที่ 15-23 กันยายน 2567 ณ สนามหน้าศาลากลาง จ.เลย พบสินค้าพาณิชย์ ราคาประหยัด เสื้อผ้าแฟชั่น สินค้าเกษตร เครื่องหนัง เครื่องประดับ ของใช้ในครัวเรือน สินค้าอุปโภคบริโภค และอื่นๆมากมาย งานมหัศจรรย์หน่อไม้ไทเลย พบหน่อไม้สด กิ่งพันธุ์ ฝ้ายเมืองเลย จักสานไทเลย สินค้าแปรรูป
งานของดีเมืองแคนจากขอนแก่นสู่ปักษ์ใต้ วันที่ 15-19 กันยายน 2567 เซ็นทรัล ภูเก็ต
งานของดีเมืองแคน จากขอนแก่นสู่ปักษ์ใต้ วันที่ 15-19 กันยายน 2567 ณ บริเวณลานกิจกรรมแกรนด์ฮอลล์ ชั้น 1 ฝั่งเฟสติวัล เซ็นทรัล ภูเก็ต 15 ก.ย. 67 ต่าย อรทัย 16 ก.ย. 67 เบลล์ นิภาดา 17 ก.ย. 67 หนิง ปัทมา 18 ก.ย. 67 ก๊อต สุทธิรักษ์ 19 ก.ย. 67 วึ พนมภูไท
ข้าวใหม่ปลามัน ณ นาริมเล 16 กันยายน 2566
ข้าวใหม่ปลามัน ณ นาริมเล รร.บ้านปากประ Thai Lagoon ท่ามกลางธรรมชาติและวิถีชีวิตที่อบอุ่น พร้อมดนตรีคลาสสิค ยามเย็นริมเล เสาร์ที่ 16 กันยายน 2566 15.00-20.00น. ณ นาริมเล รร. บ้านปากประ
ประเพณีลอยเรือสะเดาะเคราะห์ 16-18 กันยายน 2567
เชิญนักท่องเที่ยวร่วมสืบสาน
ประเพณีลอยเรือสะเดาะเคราะห์ หรืองานบุญเดือนสิบ ของพี่น้องชาวไทยเชื้อสายมอญบ้านวังกะ อ.สังขละบุรี จ.กาญจนบุรี ซึ่งกำหนดจัดในช่วงวันขึ้น 14-15 ค่ำ และวันแรม 1 ค่ำ เดือน 10 ของทุกปี ปีนี้จัดระหว่างวันที่ 16 - 18 กันยายน 2567 ณ บริเวณลานหน้าเจดีย์พุทธคยา วัดวังก์วิเวการาม อ.สังขละบุรี จ.กาญจนบุรี
ไฮไลท์ของงานจะอยู่ที่ช่วงเช้าวันที่ 3 ของการจัดงาน หรือเช้าวันแรม 1 ค่ำ ชาวบ้านทั้งหมดจะมารวมตัวกันตั้งขบวนแห่ มีการเล่นปล่อยโคมลอยขนาดเล็ก-ใหญ่ที่ช่วยกันทำขึ้นมา ประกอบการร้องรำทำเพลงอย่างสนุกสนาน จากนั้นชาวบ้านจะช่วยกันลากเรือที่บรรจุทานต่าง ๆ ไปลอย ณ บริเวณจุดบรรจบของแม่น้ำสามสาย ได้แก่ ซองกาเลีย รันตี และบิคลี่ ที่เรียกกันว่า “สามสบ” หรือ “สามประสบ” เพื่อเป็นพุทธบูชา และเป็นการทำทานในโอกาสเดียวกัน
งานเทศกาลอาหารและดนตรี ปากน้ำแขมหนู 16-22 ก.ย. 2567
งานเทศกาลอาหารและดนตรี ณ จุดชมวิวปากน้ำแขมหนู จ.จันทบุรี ระหว่างวันที่ 16-22 ก.ย. 2567 ชมคอนเสริ์ตทุกคืน ศิลปินดัง ร๊อคคงคย ทะยงดาวอีสานใต้ วงสกุลรัตน์เต็มวง บังนัสฟิวเจอร์แบนด์
Pattaya Hospitality Challenge 2024 วันที่ 17-18 กันยายน 2567
งานมหกรรมแสดงสินค้าเพื่อธุรกิจโรงแรมและการท่องเที่ยวเมืองพัทยา "Pattaya Hospitality Challenge 2024" ระหว่างวันที่ 17-18 ก.ย.67 ณ รร.เดอะซายน์ โฮเทล พัทยา
มหกรรมงานอาหารและเครื่องดื่มเมืองพัทยา 2567 “Pattaya Food & Hospitality Show 2024” วันที่ 17-18 กันยายน 2567
เมืองพัทยา ร่วมกับสมาคมโรงแรมไทยภาคตะวันออก (Thai Hotels Association Eastern Chapter) กำหนดจัดโครงการมหกรรมงานอาหารและเครื่องดื่มเมืองพัทยา 2567 “Pattaya Food & Hospitality Show 2024” ระหว่างวันที่ 17 – 18 กันยายน 2567 ณ โรงแรม เดอะซายน์ พัทยา จังหวัดชลบุรี เพื่อยกระดับมาตรฐานบุคลากร ผู้ให้บริการด้านโรงแรมของพัทยา จังหวัดชลบุรี และพื้นที่ใกล้เคียง ให้ก้าวไปสู่มืออาชีพและเป็นที่ยอมรับในระดับสากล
Hotel Innovation & Sustainable Summit 2024 @Pattaya 17 กันยายน 2567
ททท. และ สทท. ชลบุรี ขอเชิญผู้ประกอบการโรงแรมเข้าร่วม "Hotel Innovation & Sustainable Summit 2024 @Pattaya" ลงทะเบียน ฟรี วันอังคาร ที่ 17 กันยายน 2567 เวลา 13.00 น. - 17.30 น. และ Networking Dinner 17.30-20.30 น. โรงแรม TSix5 พัทยา ภายในงานพบกับเนื้อหาดังนี้
- เทรนด์การท่องเที่ยว Smart Green Well Tourism
- เพิ่มประสิทธิภาพและประสบการณ์ที่ดีของลูกค้าด้วย Cloud PMS
-การเพิ่มรายได้โรงแรมด้วย Digital Platform
- การจัดการรายได้และเพิ่มผลกำไรโรงแรม
- PDPA กฏหมายข้อมูลส่วนบุคคลสำหรับโรงแรม
- KPIs และการบริหารบัญชีโรงแรมอย่างยั่งยืน
- eTax Invoice / eReceipt และการจัดการเพื่ออนาคต
- การขับเคลื่อนสู่การท่องเที่ยวอย่างยั่งยืน STG - Sustainable Tourism Goal
มรดกเมืองกาญจน์ โรงงานกระดาษไทยกาญจนบุรี การแสดงโชว์ Projection Mapping ชุด Kanchanaburi Heritage วันที่ 17-20 กันยายน 2567
งาน มรดก เมืองกาญจน์ โรงงานกระดาษไทยกาญจนบุรี การแสดงโชว์ Projection Mapping ชุด Kanchanaburi Heritage วันที่ 17-20 กันยายน 2567 ณ บริเวณโรงงานกระดาษไทยกาญจนบุรี ตำบลบ้านใต้ อำเภอเมืองกาญจนบุรี จังหวัดกาญจนบุรี ตื่นตาตื่นใจการแสดง แสง สี เสียง "โรงงานกระดาษ แห่งความทรงจํา ประวัติความเป็นมาของโรงงานกระดาษฯ ด้วยเทคโนโลยี Projection Mapping ชุด Kanchanaburi Heritage ชมการแสดงโดรนแปรอักษร (Drone Light Show) พร้อมเสวนา หัวข้อ โรงงานกระดาษไทย พบกับบูทร้านค้าให้ชิมช็อปอีกมากมาย ชมนิทรรศการเครื่องจักรและจุดเช็กอินถ่ายรูปการประดับไฟรอบโรงงานกระดาษฯ สุดตระการตา
งานประเพณีไหว้พระจันทร์ จิบน้ำชา กินขนม ชมพระจันทร์ ในวันอังคารที่ 17 กันยายน 2567
เทศบาลนครภูเก็ตเพื่อประชาชน ขอเชิญร่วมงานประเพณีไหว้พระจันทร์ จิบน้ำชา กินขนม ชมพระจันทร์ ในวันอังคารที่ 17 กันยายน 2567 เวลา 19.00 น. เป็นต้นไป ณ สวนเฉลิมพระเกียรติ 72 พรรษา มหาราชินี ถนนถลาง (ลานมังกร)
มหกรรมอาหารสุดบันเทิง พาฮาไปกับตลกคาเฟ่ 18 - 24 กันยายน 2567
มหกรรมอาหารสุดบันเทิง พาฮาไปกับตลกคาเฟ่ จาก ตลกดังชั้นครูและตลกรุ่นใหม่ พร้อมยกขบวนแม่ค้าพ่อค้า ของกินของอร่อย ร้านเด็ด คัดสรรจากทั่วไทย กว่า 90 ร้านค้า วันที่ 18 - 24 กันยายน 2567 นี้ ณ ลานกิจกรรม ชั้น 1 เซ็นทรัล อุดร ชมฟรีทุกวัน!!
งาน "เปิดตลาดพาณิชย์ยะลา" ฟื้นฟูเศรษฐกิจ 18-20 กันยายน 2567
สำนักงานพาณิชย์จังหวัดยะลา ขอเชิญชวนเที่ยวงาน "เปิดตลาดพาณิชย์ยะลา" ตามโครงการฟื้นฟูเศรษฐกิจ ประจำปีงบประมาณ พ.ศ. 2567 พบกับสินค้าชุมชน สินค้าเกษตร ผลไม้ตามฤดูกาล อาหารและเครื่องดื่ม กิจกรรมส่งเสริมการขาย รับคูปองส่วนลดแลกซื้อสินค้า ครั้งที่ 1 ระหว่างวันที่ 18-20 กันยายน 2567 ตั้งแต่เวลา 10.00 น. เป็นต้นไป ณ บริเวณข้างรั้วสำนักงานพาณิชย์จังหวัดยะลา อำเภอเมืองยะลา จังหวัดยะลา สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานพาณิชย์จังหวัดยะลา โทร. 073-212018
รำลึก 171 ปี พระปิยมหาราช ณ เกาะสีชัง 19-22 กันยายน 2567
“รำลึก 171 ปี พระปิยมหาราช“ ณ เกาะสีชัง ระหว่างวันที่ 19-22 กันยายน 2567 ตั้งแต่เวลา 16.00 - 22.00 น. ณ เกาะสีชัง จังหวัดชลบุรี ✅ ตื่นตาตื่นใจ กับ แสง สี เสียง สุดยิ่งใหญ่ อลังการ ✅ สวยงาม กับการแสดงศิลปวัฒนธรรมไทย ✅ ฟินให้สุด หยุดไม่อยู่ กับมินิคอนเสิร์ต จากศิลปินชื่อดัง ✅ ลุ้นรางวัลกับการประกวด “ธิดาย้อนยุค” ✅ ชิมอาหารพื้นถิ่นรสเด็ดของชาวเกาะสีชัง
งานเทศกาลอาหารและบอลลูนนานาชาติ โรบินสันร้อยเอ็ด 19-28 กันยายน 2567
งานเทศกาลอาหารและบอลลูนนานาชาติ โรบินสันร้อยเอ็ด 19-28 กันยายน 2567 ชมบอลลูนยักษ์ในงาน ชิม ช็อป อาหารอร่อยเต็มงาน
Reversed Rain the Concert "ฝนตกขึ้นฟ้า" เดอะ คอนเสิร์ต 20 กันยายน 2567
งานดนตรี "ฝนตกขึ้นฟ้า" เดอะ คอนเสิร์ต ครั้งที่1 งานดนตรีที่จะเปล่งเสียงชาวกระบี่ สร้างตำนานบทใหม่ ฟื้นคืนความสดใส สู่ใจกลางเมืองกระบี่อีกครั้ง !
พบกับศิลปินสุดพิเศษ อาทิ 1.THE TOYS 2.THE PARKINSON 3.KOH MR.SAXMAN 4.MEE THE STAR 5.MIN PATTREEYA และการรวมพลังของปรมาจารย์ชาวกระบี่ วง RHYTHM OF ANDAMAN
งานนี้เข้าฟรี ไม่มีค่าตั๋ว แต่ต้องกดบัตรกันให้ทันนะจ๊ะ กดติดตาม
เพจ ฝนตกขึ้นฟ้า เดอะ คอนเสิร์ต - Reversed Rain เพื่อไม่พลาดวันลงทะเบียน
แสดงวันที่ 20 กันยายน 2567 ณ โรงหนังมหาราชกระบี่ ตั้งแต่ 15:00 - 23:00 น.
เทศกาลอวดชุมพรเมืองสร้างสรรค์ 20-21 กันยายน 2567
20-21 กันยายน 2567 เทศกาลอวดชุมพรเมืองสร้างสรรค์ ณ ลานแอโรบิก ริมคลองท่าตะเภา
HOP Chiangmai Art and Music Festival 20-29 กันยายน 2567
"HOP Chiangmai Art and Music Festival" เทศกาลศิลปะ วัฒนธรรม และ ดนตรี วันที่ 20-29 กันยายน 2567 เวลา 16.00-22.00 น. 10 วันเต็มกลางเมืองเชียงใหม่ บน 3 เวที 3 สไตล์ กับศิลปินกว่า 500 ชีวิต 70 วง ที่จะมาระเบิดความสนุก ย้อมเชียงใหม่ให้เป็นเมืองแห่งแสง สี ศิลปะและเสียงดนตรี การแสดงประดับไฟ 3 จุด วันที่ 17-29 กันยายน 2567 เวลา 18.00-24.00 น. สถานที่ 1. ลานท่าแพ และ ไนท์บาซ่า 2. ขัวเหล็ก 3. หอพิพิธภัณฑ์พื้นถิ่นล้านนา
สนุกสนานเพลิดเพลินกับการแสดงดนตรีจากศิลปินชื่อดัง 3 เวที 3 สไตล์
* Pop Stage: สัมผัสความสนุกของดนตรีกระแสหลักทุกแนวเพลง พบกับศิลปินชื่อดังระดับประเทศมากมาย อาทิ บุรินทร์, ตู่ ภพธร, เจนนิเฟอร์ คิ้ม, คาราบาว, The Toys และ นุนิว Season Five วง Mean ศิลปินท้องถิ่น ฯลฯ
* Classic Stage: ดื่มด่ำไปกับดนตรีต้นตำรับเชียงใหม่ อาทิ ลานนา คัมมินส์ Yented ไม้เมือง และวงศิลปินท้องถิ่น ผสมผสานไปกับการแสดงวัฒนธรรมร่วมสมัย อาทิ ดนตรีล้านนากับบัลเล่ต์ และการฟ้อนเหนือแบบเมดเล่ย์ ที่จะทำให้คุณหลงใหลไปในความงาม
* Hopping Stage: สนุกสุดเหวี่ยงไปกับเวทีเคลื่อนที่บนรถบัส ที่ศิลปินรุ่นใหม่ไฟแรง จะนำพาความสนุกและความบันเทิงไปให้คุณถึงที่ ไม่ว่าจะเป็น หน้าศูนย์การค้าเมญ่า, More Space, ลานข้างโรงแรม Dusit d2 ไนท์บาซ่า
ร่วมสนุก รับส่วนลด และรับของที่ระลึกจากสถานประกอบการ ทั้งโรงแรม ร้านอาหาร และคาเฟ่ กว่า 200 แห่งทั่วเมืองเชียงใหม่
งานดนตรีกลางสายฝน Chonburi International Music Festival in the Rain วันที่ 20-22 และ 27-29 กันยายน 2567
เมืองพัทยา ร่วมกับ ททท.ภาคตะวันออก กำหนดจัดงานมิวสิคกลางสายฝน Chonburi International Music Festival in the Rain ที่ชายหาดพัทยา ระหว่างวันที่ 20-22 กันยายน และ 27-29 กันยายน 2567 เวลา 17.00 - 23.00 น. บริเวณชายหาดพัทยากลาง ภายใต้โครงการเสน่ห์ไทย ฟรีไม่มีค่าใช้จ่าย! จอดรถฟรี ที่เซ็นทรัล พัทยา
พบกับการแสดงคอนเสิร์ตจากศิลปินไทยที่มีชื่อเสียง หลากหลายสไตล์ ประกอบด้วย 3 เวที ได้แก่ Main Stage (บริเวณ ซอย 6) Jazz & Chill Stage (โรงแรมฮาร์ดร็อค) Dance Stage (ซอย 9) ภายในงานพบกับการจำหน่ายอาหารทะเลสดใหม่ อาหารถิ่นและเครื่องดื่ม หลากหลายรสนิยม Premium และแบบ Street Food จากร้านชั้นนำได้รับความนิยมและที่เป็นจุดเด่นของภาคตะวันออก
update รายชื่อศิลปิน จัดเต็มตลอดทั้ง 6 วัน 3 เวที ดังนี้
Colorful Burapha Stage : พบกับศิลปินตัวท็อปแนวหน้าของเมืองไทย พร้อมสนุกไปกับแนวเพลง Pop Rock จาก Palmy, Paradox, F.HERO, Pop Pongkool, BOWKYLION, The Toys, Tilly Birds, Slapkiss, Serious Bacon, Lomosonic, Lham Somphol, Mirrr, Zom Marie, Earth Patravee, Atom Chanakan, Purpeech, Paper Planes, Singto Numchok, Safeplanet
Chonburi Jazz & Chill Stage : โยกตัวเบา ๆ ไปกับแนวเพลง Jazz and Chill จากศิลปินมากความสามารถและประสบการณ์อย่าง Up Soul Town, KHAMAS, TARR The Voice, Namm Ronnadet, Thomas Reimer’s Jazz Pit Band, Mr. Grooves Quintet, Mild, Anthony Wei, That Doog, Sararn Quintet, ABOY, PAE SAX, Ploy Jitvara, The Funkster, Arin Jazz Trio, Spy The Golden Song, Swing Dude, ADAM CHIMS & FAM, PETITE
Pattaya Dance Stage : ออกสเต็ปวาดลวดลายปลดปล่อยพลังไปกับ DJ ชื่อดัง เอาใจสายปาร์ตี้ การันตีความมันส์โดย BOTCASH, Don’t Blink, Haus of Panda, Kartypartyy, Mars’ Moon, PIXZY, Acid Basis, Alex Edels, Bravery, Bvzserx, Cameron Glasgow, ckmona, GUIDE, Jewxls, Kanshriya, Maditak, Pvlmfck, Staygold
Pattaya Oktoberfest 2024 เทศกาลอาหารและเครื่องดื่มสไตล์เยอรมัน ที่ใหญ่ที่สุดในพัทยา 20 ก.ย. - 6 ต.ค. 67
Pattaya Oktoberfest 2024 เทศกาลอาหารและเครื่องดื่มสไตล์เยอรมัน ที่ใหญ่ที่สุดในพัทยา 20 ก.ย. - 6 ต.ค. 67 ลานกิจกรรม ชั้น G ฝั่งชายหาด ศูนย์การค้าเซ็นทรัล พัทยา อิ่มอร่อยกับอาหารเยอรมันและดื่มด่ำกับเครื่องดื่มนานาชาติมากมายในบรรยากาศสุดชิลริมทะเล
งาน #เทึ่ยวเมืองจันท์วันสินค้าไทย สนามทุ่งนาเชย จันทบุรี 20-29 กันยายน 2567
เขิญเที่ยวงาน #เทึ่ยวเมืองจันท์วันสินค้าไทย ณ.สนามทุ่งนาเชย อ.เมือง จ.จันทบุรี 20-29 กันยายน 2567 ชมศิลปินดัง พลอย พุ่มพวง โบตั๋น ชนิกานต์ ปูแดง ร๊อค คงคย ทิดแอมป์ โบว์ ซุปเปอร์วาเลนไทน์ แป้งฝุ่น การประกวดดนตรีสากล
มหกรรม “เสน่ห์ไทย “HOP Chiangmai Art & Music Festival” เชียงใหม่ วันที่ 20-29 กันยายน 2567
มหกรรม “เสน่ห์ไทย “HOP Chiangmai Art & Music Festival” เชียงใหม่ไนท์บาซาร์�เริ่มสนุกตั้งแต่ วันที่ 20-29 กันยายน 2567 เวลา 16.00 – 22.00 น.
เทศกาลดนตรีและศิลปะครั้งแรกใจกลางเมืองเชียงใหม่ การประดับตกแต่งเมืองด้วยซุ้มไฟ และ Art Installation ภายใต้บรรยากาศ Harmony & Art performance 10 วันเต็ม! กับศิลปินกว่า 500 ชีวิต 70 วง จัดพร้อมกัน 3 เวที :
1.เวที Main Stage: ณ ลานประตูท่าแพ
2.เวที Classic Stage: ณ ลานอนุสาวรีย์สามกษัตริย์
3.เวที Hopping Stage: หน้าห้างMAYA / MORe SPACE / ลานข้างโรงแรมDusitD2แถมยังได้ชิม ช้อป กันแบบเพลินๆ แบบจัดหนัก จัดเต็มกว่า 130 ร้านค้ากันอีกด้วย สอบถามข้อมูลเพิ่มเติมโทร 1672
งาน Mahidol Music Fest 20-22 กันยายน 2567 ฉลองครบรอบ 30 ปีการก่อตั้งวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล
Mahidol Music Fest. "The 30th Anniversary" งานฉลองครบรอบ 30 ปีการก่อตั้งวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล ในวันที่ 20-22 กันยายน 2567 เข้าชม ฟรี ไม่มีค่าใช้จ่าย
งานนี้จัดเต็มแบบยิ่งใหญ่ พบกิจกรรมสนุกๆ ช็อปสินค้าจากตลาดนัด Art & Craft โดย Little Tree Market ชมนิทรรศการ การเสวนา Workshop บูธเกมส์ และการแสดงดนตรี จากนักเรียน นักศึกษา ศิษย์เก่า พร้อมด้วยศิลปินจากพาร์ทเนอร์ Earth Patravee / Serious Bacon / Monica / Frizter / V3RSE / Yes Indeed / Kalipse / I Hate Monday / Clockwork Motionless / Nisatiwa / Synthia
ประมงไทยชวนวิ่ง #3 Music 20-22 กันยายน 2567
ประมงไทยชวนวิ่ง #3 Music วันที่ 20 21 22 กันยายน 2567 FREE‼️ เข้าได้ฟรี ทั้ง3 วัน
งาน "ช็อป ชิม ชิลล์ โชว์ Hello Hatyai" 20-22 กันยายน 2567
ชาวอำเภอหาดใหญ่เชิญชวนเพื่อนพี่น้องและนักท่องเที่ยว มาเที่ยวงาน "ช็อป ชิม ชิลล์ โชว์ Hello Hatyai" วันที่ 20-22 กันยายน 2567 ณ จุดนัดพบ ลานสุขใจ ถนนธรรมนูญวิถี ร้านอาหาร Fashion มากมาย ชมคอนเสิร์ตใหญ่ทุกวัน ตามโปรแกรม ดังนี้ 20 กันยายน 2567 - DJ มิ้นหมวย - ANALOG TONE -ชมคอนเสิร์ต ชาติ สุชาติ 21 กันยายน 2567 - DJ Cra4z - MIDI STORY - ชมคอนเสิร์ต 7DAYS CRAZY 22 กันยายน 2567 - BILL BRAND -DJ มุกหมวย - ชมคอนเสิร์ต Mocca Garden
“ธันเดอร์เฟสติวัล” เทศกาลดนตรีเพลงร็อกที่เร้ากาญจนบุรี ที่สุด 21 กันยายน 67
“ธันเดอร์เฟสติวัล” เสาร์ที่ 21 กันยายน 67 ที่ SINKAN SAND PLANT กาญจนบุรี เทศกาลดนตรีเพลงร็อกที่เร้าที่สุด กับศิลปิน 12 วงร็อกที่โคตรเอา Sweet Mullet / Lomosonic / Cocktail / FLURE The richman toy / POTATO / PARADOX Paper Planes / Ebola / Bomb at Track Greasy Cafe และ HARD BOY พร้อมระเบิดความเดือดจัดๆ
"แซนโฎนตา" บุญเดือนสิบ ประเพณีเซ่นไหว้ผีบรรพบุรุษของชาวไทยเชื้อสายเขมร สุรินทร์ 21 กันยายน 2567


"แซนโฎนตา" บุญเดือนสิบ ประเพณีเซ่นไหว้ผีบรรพบุรุษของชาวไทยเชื้อสายเขมร ในปี 2567 นี้ จังหวัดสุรินทร์ กำหนดจัดงานในวันที่ 21 กันยายน 2567 ณ บริเวณ อนุสาวรีย์พระยาสุรินทรภักดีศรีณรงค์จางวาง (ปุม) อ.เมืองสุรินทร์
ประเพณีแซนโฎนตา เป็นประเพณีดั้งเดิมที่ประชาชนชาวไทยเชื้อสายเขมรได้ถือปฏิบัติสืบทอดกันมาอย่างต่อเนื่องยาวนาน เป็นการทำบุญให้แก่บรรพบุรุษที่ล่วงลับไปแล้ว ให้ได้รับกุศลผลบุญ ที่ลูกหลานได้อุทิศให้ซึ่งตรงกับวันแรม 14 ค่ำ เดือน 10 ของทุกปี หยุดภารกิจหน้าที่การงานทั้งหมด และนัดหมายไปรวมกัน ณ บ้านที่เป็นศูนย์กลางของครอบครัวส่วนใหญ่จะเป็นบ้านของผู้ที่อาวุโสที่สุดของครอบครัว พร้อมกับเตรียมเครื่องไหว้มาทำพิธีเซ่นหรือแซน เช่นหัวหมู ไก่ เนื้อ ปลา ข้าวสาร ข้าวสวย ผลไม้ ขนมหวาน ขนมกระยาสารท ข้าวต้ม หมูและข้าวต้มหางยาว เพื่อไหว้บรรพบุรุษของตนเองที่ล่วงลับไปแล้ว ประเพณีแซนโฎนตา นอกจากเป็นการอุทิศส่วนบุญส่วนกุศลให้แก่บรรพบุรุษที่ล่วงลับไปแล้ว ยังเป็นกุศโลบายของบรรพบุรุษ ที่มีจุดหมายให้ลูกหลาน ได้แสดงออกถึงความกตัญญูกตเวทีต่อบรรพบุรุษผู้มีพระคุณ และมีโอกาสได้พบปะเครือญาติ เพื่อสร้างปฏิสัมพันธ์ที่ดีต่อกัน ได้พึ่งพาอาศัยช่วยเหลือซึ่งกันและกันทั้งยังมีความเชื่อว่า วันแซนโฏนตานี้ ถ้าลูกหลานคนใดไม่ได้ไม่ไปร่วมแซนโฎนตา โดยไม่มีเหตุผลอันสมควร บรรพบุรุษที่ล่วงลับไปแล้วอาจไม่พอใจ ส่งผลให้การทำมาหากินประกอบอาชีพไม่ราบรื่น ไม่ก้าวหน้า จิตใจเป็นกังวลไม่เป็นสุข
ภาพยนตร์นานาชาติโคราช 21 กันยายน 2567
งานภาพยนตร์นานาชาติโคราช Korat International Film Festival 2024 วันที่ 21 กันยายน 2567 รับชมฟรี ณ ลานอนุสาวรีย์ท้าวสุรนารี ตั้งแต่เวลา 17.00 น. เป็นต้นไป
เทศกาลภาพยนตร์นานาชาติโคราช 2024 มาพร้อมกับคอนเซปต์ “เล่าเรื่องเมือง ชีวิต จิตวิญญาณ ผ่านภาพยนตร์และคนทำหนัง” ที่จะพาคุณไปสัมผัสจิตวิญญาณของคนสร้างภาพยนตร์ และส่งต่อแรงบันดาลใจสู่คนรุ่นใหม่ ผ่านภาพยนตร์ที่สะท้อนอัตลักษณ์ท้องถิ่นของโคราช
ชวนย้อนไปในบรรยกาศเก่า ๆ หนังกลางแปลงงานวัด ร่วมชมผลงานภาพยนต์สั้น 6 ผลงานจากเด็กรุ่นใหม่และ 1 ภาพยนตร์เรื่องดัง ในรอบฉายภาพยนตร์ในพื้นที่สาธารณะ
งาน Samui Food Fiesta 21-22 กันยายน 2567
งาน Samui Food Fiesta วันที่ 21-22 กันยายน 2567 เวลา: 17:00 - 22:00 น. สถานที่ ลานตรงข้ามพรุเฉวง เกาะสมุย โอกาสสัมผัสเอกลักษณ์ของเกาะสมุย อาหารจากร้านดังและโรงแรมชั้นนำกว่า 72 แห่งทั่วเกาะสมุย เสริมด้วยนิทรรศการอาหาร กิจกรรม Cooking Class อาหารพื้นถิ่นโดยชุมชนจากเกาะสมุย และกิจกรรมการสร้างความตระหนักรู้ในการจัดการขยะอย่างเป็นรูปธรรมและการอนุรักษ์สิ่งแวดล้อม
สนุกไปกับการแสดงสดจาก Boyjozz ที่จะนำเสนอเพลงใต้ในสไตล์ Soul Funk ประกอบการแสดงมโนราห์ที่ไม่เหมือนใคร
ติดต่อจองบูธภายในงานฟรี ไม่มีค่าใช้จ่าย
เทศกาลงานอาร์ตและดนตรี FAT CAMP@Cha-am Beach 21- 22 กันยายน 2567
"เทศกาลงานอาร์ตและดนตรี FAT CAMP@Cha-am Beach" งานอาร์ตสไตล์แคมป์ริมหาดชะอำ...ที่ประดับไฟและตกแต่งสวยๆ วันที่ 21- 22 กันยายน 2567 เวลา 18.00 - 24.00 น. ณ หาดชะอำ (เหนือ) จ.เพชรบุรี ชมฟรี...ไม่มีค่าใช้จ่าย
Main Stage...ร้องเล่นเต้นไปกับคอนเสิร์ตจากศิลปิน 21 ก.ย. "เล็ก พงษธร" 22 ก.ย. "ActArt" และดนตรีแนว Beach Style อีกมากมาย LOCAL FOOD - อิ่มอร่อยกับสารพัดของน่ากิน THE ARTS PLAYGROUD...ช้อปปิ้งงานอาร์ตฮีลใจ เปิดพื้นที่ลานทรายให้มาสนุกกับกิจกรรมอาร์ตๆ ฟรี TRAVEL BOOTH - มัดรวมแพ็กเกจอเมซิงเมืองเพชร
วันเขาใหญ่ปลอดรถ 2024 วันที่ 22 กันยายน 2567 ณ อุทยานแห่งชาติเขาใหญ่ LINK
ปีมีครั้งเดียว วันเขาใหญ่ปลอดรถ 2024 (Khao Yai Car Free Day 2024) วันที่ 22 กันยายน 2567 ณ อุทยานแห่งชาติเขาใหญ่ คุณจะเดิน จะวิ่ง จะปั่น บนเขาใหญ่ โดยไม่มีรถ
กิจกรรมสนับสนุน “World Car Free Day” (สมาคมปลอดรถยนต์โลก) “In Town Without my car!”
ด้วยในวันที่ 22 กันยายน ของทุกปี องค์กรในประเทศต่าง ๆ ทั่วโลก จะรณรงค์ให้ประชาชนลดการใช้รถยนต์ส่วนบุคคล หันมาใช้รถขนส่งมวลชน และรถจักรยานเพิ่มขึ้น เพื่อลดปริมาณรถยนต์ในท้องถนน อันส่งผลถึงการลดปัญหามลพิษทางอากาศจากยานพาหนะ และยกระดับคุณภาพอากาศให้ดีขึ้น รวมทั้งลดปัญหาการจราจรติดขัด การเกิดอุบัติเหตุ ช่วยประหยัดเวลาในการเดินทาง และจะส่งผลต่อการประหยัดพลังงานน้ำมัน รวมทั้งช่วยลดค่าใช้จ่ายในการเดินทาง
สภาอุตสาหกรรมท่องเที่ยวจังหวัดนครราชสีมา ร่วมกับสมาคมการท่องเที่ยวเขาใหญ่ และภาคีเครือข่ายทั้งภาครัฐและเอกชน จัดงานวันเขาใหญ่ปลอดรถ 2024 (Khao Yai Car Free Day 2024 ) ในวันอาทิตย์ที่ 22 กันยายน 2567 ณ อุทยานแห่งชาติเขาใหญ่ มรดกโลก
เชิญชวนกันมาเดิน ปั่น วิ่ง ขึ้นเขาใหญ่ เตรียมฟิตซ้อมกันให้ดีๆ ภายหลังเสร็จงาน (มีรถรับ-ส่งลงมาจากเขาใหญ่ )
ภายในงาน มีบูธอาหารและของที่ระลึก ผักผลไม้ สินค้าชุมชน ผลิตภัณฑ์รีไซเคิล บูธเครือข่ายสิ่งแวดล้อม ชมรมฮักเขาใหญ่ การคัดแยกขยะ ซุ้ม Green D.I.Y ฯลฯบริเวณลานจอดรถศูนย์อาหารอุทยานแห่งชาติเขาใหญ่
ชมนิทรรศการ “Creative Health & Wellbeing” โดยสมาคมการท่องเที่ยวเขาใหญ่ศูนย์การศึกษาทั่วไป จุฬาลงกรณ์มหาวิทยาลัย และ มหาวิทยาลัยเทคโนโลยี ราชมงคลอีสาน
Workshop “ From Zero Waste to Khorat Fossil” โดยพิพิธภัณฑ์ไม้กลายเป็นหิน
การแสดงดนตรี “Thai Blind Orchestra” จากร.ร.สอนคนตาบอดมกุฎคีรีวัน สนับสนุนโดย สถานเอกอัครราชทูตสาธารณรัฐคอซอวอประจำประเทศไทย
(โครงการ Be My Eyes, By MY Ears) แล้วมาร่วมกันสร้าง Event คาร์บอนต่ำ ลดโลกร้อนอย่างยั่งยืนด้วยกัน
เสน่ห์ไทย สายน้ำแห่งกาญจน์เวลา วันที่ 22-30 กันยายน 2567 LINK
22 - 30 กันยายน นี้ เตรียมมาเติมความสุข เพิ่มสีสันประสบการณ์การท่องเที่ยวอย่างจุใจอีกครั้ง กับงานเสน่ห์ไทย "สายน้ำแห่งกาญจน์เวลา" The River of Time ณ โรงงานกระดาษไทยกาญจนบุรี
งานโชว์แสง สี เสียง ครั้งยิ่งใหญ่ 9 วัน 9 คืน อัดแน่นไปด้วยกิจกรรมมากมาย เข้าชม และร่วมกิจกรรม เข้าชมฟรี !!
- FREE CONCERT จากศิลปินดัง
- แสง สี เสียง 3D Mapping บนอาคารโรงงานกระดาษ สถาปัตยกรรมอายุกว่า 80 ปี ที่มีกลิ่นอายยุโรปสุดคลาสสิค
- เอาใจสายชอปด้วยตลาดวินเทจ สุดชิค สุดชิล รวบรวมร้านแฟชั่น และร้านอาหารกว่า 100 ร้านค้า
- โซนถ่ายภาพ มุมถ่ายรูปเก๋ไก๋
- ทริปเที่ยวฟรีรอบเมือง และกิจกรรมอื่น ๆ อีกหลากหลายประสบการณ์
กิจกรรมเริ่มตั้งแต่ 09.00 – 22.30 น. ณ โรงงานกระดาษ จ.กาญจนบุรี
งานประเพณีแข่งเรือ หนองบ่อออง ครั้งที่ 18 โซ่พิสัย 22-23 กันยายน 2567
ร่วมชม และเชียร์ "โครงการจัดงานประเพณีแข่งเรือ ครั้งที่ 18 ประจำปีงบประมาณ 2567" ในวันที่ 22-23 กันยายน 2567 ณ หนองบ่อออง บ.ดอนเสียด ต.คำแก้ว อ.โซ่พิสัย จ.บึงกาฬ ชมการแข่งขันเรือยาว
- เรือยาว 12 ฝีพาย ภายในตำบล จำนวน 13 ทีม
- เรือยาว 12 ฝีพาย ทั่วไป จำนวน 8 ทีม
- เรือยาว 25-30 ฝีพาย ทั่วไป จำนวน 4 ทีม
**แจ้งความประสงค์จับจองสถานที่จำหน่ายสินค้าได้ที่
งานพัฒนาและจัดเก็บรายได้ กองคลัง อบต.คำแก้ว โทร.042-490592
NSDF Women Futsal Championship2024 วันที่ 22-28 กันยายน 2567 ณ ศูนย์การค้าเทอร์มินอล 21
NSDF Women Futsal Championship2024 ระหว่างวันที่ 22-28 กันยายน 2567 ณ ศูนย์การค้าเทอร์มินอล 21 จ.นครราชสีมา 5 ชาติ ร่วมฟาดแข้งประกอบด้วย ไทย ,เวียดนาม ,อินโดนีเซีย ,ไต้หวัน และจีน เข้าฟรี!! ณ เทอร์มินอล21 ฮอลล์ ชั้น4 ศูนย์การค้าเทอร์มินอล21 โคราช และถ่ายทอดสดทางFacebookและYoutube : Futsalthailand - ฟุตซอลไทยแลนด์
กิจกรรม เขาใหญ่ คาร์ ฟรี เดย์ 2024 วันอาทิตย์ที่ 22 กันยายน 2567
กิจกรรม เขาใหญ่ คาร์ ฟรี เดย์ 2024 ภายใต้ Campain " LOW CARBON KHAO YAI FOR ALL " กิจกรรมดีๆเพื่อสิ่งแวดล้อม ฮีลป่า ฮีลใจ เดิน ปั่น วื่งขึ้นอุทยานแห่งชาติเขาใหญ่ แบบปลอดรถยนต์ 100 เปอร์เซ็น ในวันอาทิตย์ที่ 22 กันยายน 2567 ระหว่างเวลา 06.00-09.00 (ช่วงเวลาขออนุญาตปิดอุทยานเพื่อทำกิจกรรม) เดินไป วิ่งไป ปั่นไป ปล่อยจอย ปล่อยใจ ไปกับธรรมชาติบนผืนป่าดงพญาเย็น
มหกรรมเสน่ห์ไทย สายน้ำแห่งกาญจน์เวลา The River of Time 22-30 กันยายน 2567
มหกรรมเสน่ห์ไทย สายน้ำแห่งกาญจน์เวลา The River of Time 22-30 กันยายน 2567 ณ โรงงานกระดาษไทยกาญจนบุรี และ สกายวอล์คเมืองกาญจนบุรี ชมการแสดงแสงสีเสียง การ 3D Mapping มหัศจรรย์สวนลอยฟ้า โดรนแปรอักษร หนังกลางแปง คอนเสิร์ตศิลปินดัง Line up ดังนี้ 22 กันยายน 67 : F.Hero + Fellow Fellow 23 กันยายน 67 : Getsunova 24 กันยายน 67 : เจ เจตริน 25 กันยายน 67 : ปาล์มมี่ 26 กันยายน 67 : No One Else 27 กันยายน 67 : Mean 28 กันยายน 67 : Slot Machine 29 กันยายน 67 : อ๊อฟ ปองศักดิ์ 30 กันยายน 67 : Indigo
กิจกรรมรวมใจ "ล้างอ๊าม" ร่วมสืบสานประเพณีถือศีลกินผักภูเก็ต 2567 วันที่ 22-29 กันยายน 2567
เทศบาลนครภูเก็ต ขอเชิญร่วมกิจกรรม รวมใจ "ล้างอ๊าม" ร่วมสืบสานประเพณีถือศีลกินผักภูเก็ต 2567 ตั้งแต่วันที่ 22-29 กันยายน 2567 ณ บริเวณอ๊ามภายในเขตเทศบาลนครภูเก็ต ดังนี้
- อ๊ามกิ้วเที้ยนเก้ง (สะพานหิน) วันอาทิตย์ ที่ 22 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
- อ๊ามหลิมฮู้ไท้ซู้ (สามกอง) วันอาทิตย์ ที่ 22 กันยายน 2567 เวลา 07.00 น. เป็นต้นไป
- อ๊ามซัมเทียนเฮวกึ๋ง (แม่ย่านาง) วันพุธ ที่ 25 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
- อ๊ามซำเซ้จูฮุด (เขารัง) วันพฤหัสบดี ที่ 26 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
- อ๊ามจุ้ยตุ่ยเต้าโบ้เก้ง วันศุกร์ ที่ 27 กันยายน 2567 เวลา 07.00 น. เป็นต้นไป
- อ๊ามปุดจ้อ วันศุกร์ ที่ 27 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
- อ๊ามบางเหนียว (มูลนิธิเทพราศี) วันเสาร์ ที่ 28 กันยายน 25676 เวลา 08.00 น. เป็นต้นไป
- อ๊ามเจ่งอ๋อง (หน้ารพ.วชิระภูเก็ต) วันอาทิตย์ ที่ 29 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
- อ๊ามซุ่ยบุ่นต๋อง (หล่อโรง) วันอาทิตย์ ที่ 29 กันยายน 2567 เวลา 08.00 น. เป็นต้นไป
ร่วมกันล้างอ๊ามต้อนรับงานประเพณีถือศีลกินผัก ประจำปี 2567 ระหว่างวันที่ 22 – 29 กันยายน 2567 ร่วมกันเก็บกวาดรวบรวมขยะมูลฝอย ตัดตกแต่งหญ้า วัชพืช ปรับปรุงภูมิทัศน์ ให้สวยงาม เก็บขนขยะมูลฝอยที่ไม่ใช้งาน ล้างทำความสะอาดด้วยน้ำผสมสารฆ่าเชื้อภายในโรงเจ นอกศาลเจ้าพร้อมดูดสิ่งปฏิกูล
งานประเพณีสารทไทยกล้วยไข่และของดีเมืองกำแพง ประจำปี 2567 วันที่ 25 กันยายน - 5 ตุลาคม 2567
งานใหญ่ที่ชาวกำแพงเพชรและจังหวัดใกล้เคียงรอคอย งานประเพณีสารทไทยกล้วยไข่และของดีเมืองกำแพง ประจำปี 2567 วันที่ 25 กันยายน - 5 ตุลาคม 2567 ณ บริเวณหน้าอำเภอเมืองกำแพงเพชร จังหวัดกำแพงเพชร เชิญชม การแสดง แสง สี เสียง ที่ยิ่งใหญ่ ร่วมพิธีท่าบุญตักบาตร วันสารทไทย ชมขบวนแห่รถกล้วยไข่ตระการตา ประกวดกล้วยไข่สุก-ดิบ ประกวดธิดากล้วยไข่ เลือกซื้อสินค้า หนึ่งตำบล หนึ่งผลิตภัณฑ์ การออกร้านจําหน่ายสินค้าราคาถูกจากโรงงาน สวนสนุกชุดใหญ่ ชมคอนเสิร์ต หมอลำครบชุด กำหนดการ ดังนี้ 25 ก.ย. 67 แอน อรดี 26 ก.ย. 67 Only Monday 27 ก.ย. 67 SARAN 28 ก.ย. 67 เนสกาแฟ ศรีนคร 29 ก.ย. 67 แก๊งเซียนหรั่ง 30 ก.ย. 67 TimeThai 1 ต.ค. 67 FllXD & 1MILL 2 ต.ค. 67 ลำไย ไหทองคำ 3 ต.ค. 67 1LIFE 4 ต.ค. 67 YOUNGOHM 5 ต.ค. 67 PAPER PLANES
"เสน่ห์อีสานม่วนซื่น ณ ขอนแก่น" สเน่ห์ไท ขอนแก่น ม่วนสุด 25-29 กันยายน 2567
มหกรรม เสน่ห์ไทย 5 ภาค เดินทางมาถึงขอนแก่น งาน "เสน่ห์อีสานม่วนซื่น ณ ขอนแก่น" 25-29 กันยายน 2567 ณ ลาน บขส. 3 จังหวัดขอนแก่น ตั้งแต่เวลา 14:00 - 24:00 น. ฟรีไม่มีค่าใช้จ่าย! AmazingThailand กันให้สุด กับความภูมิใจสเน่ห์ไทยสไตล์อีสาน
@หมู่เฮาชาวอีสานเตรียมตัวม่วนกันให้แม่น อีสานTastic มหัศจรรย์ความสุข ม่วนสุดเฉียงเหนือ งานเดียวที่รวมศิลปินอีสานรุ่นใหม่พร้อมหมอลำเบอร์ใหญ่ที่สุดในเมืองไทยและหางเครื่องสุดอลังการกว่า 1,000 ชีวิต ที่จะมาสร้างความม่วนในงานนี้ภายในงานมีกิจกรรมต่างๆมากมาย อาทิ
Zone คอนเสิร์ตมันส์อีหลี จาก 2 เวทีใหญ่ ขนทัพศิลปินมาม่วน 5 วันเต็ม พบกับ หมอลำวงประถม บันเทิงศิลป์ หมอลำใจเกินร้อยร่วมกับแอน อรดี หมอลำวงสาวน้อย เพชรบ้านแพง หมอลำวงอีสานนครศิลป์ หมอลำวงระเบียบ วาทะศิลป์ พร้อมศิลปินรุ่นใหม่มาร่วมทัพ พบกับ มีนตรา อินทิรา น้ำอ้อย สมใจรักษ์ ต้นฮัก ประธานฮ่าง ฝ้าย เมฆะ เต้ ตระกูลตอ ก๊อตซิลล่า ปิยวัฒน์ แจ๊คกี้ ณัฐวุฒิ ไข่มุก อาทิตตา ต้า ตจว คะแนน นัจนันท์ ทิดแอม โซน ธนกาญจน์ ฟุ๊กกี้ ศิริลักษณ์ ไอดิน อภินันท์ มินตรา น่านเจ้า ออย แสงศิลป์ ออมดาว เอ ณภัทร์ สายแนน โพธิ์งาม วงฮันแนว ศาล ศาลศิลป์ ไข่มุก พิชญา บิว สรรชัย วี พนมภูไท บุ๋ม กนกพร วงอ้ายมีผัวแล้ว ออยเลอร์ เป็นต้น
Zone ตลาดแซ่บอีหลี เอาใจสายกินช๊อปที่รวบรวม ร้านอาหาร ของฝาก ของที่ระลึกกว่า 100 ร้านค้าในงาน ที่คัดสรรพิเศษมาสำหรับงานม่วนแบบนี้โดยเฉพาะ
Zone “KhonKraft Showcase” จากอัตลักษณ์ที่โดดเด่นงาน Craft ของภาคอีสาน พร้อมร่วมสนุก กิจกรรมworkshop ที่น่าสนใจ
กิจกรรม เสน่ห์ม่วนซื่น ฟรีทัวร์ พร้อมกับการลุ้นรางวัล voucher ฟรี!!! มูลค่า 1.5 ล้านบาท ที่ทำให้ลุ้นให้ตัวโก่ง ม่วนกันคักๆ
งานรำลึกพระยาไกรภักดี ประเพณีแซนโฎนตา บูชาหลักเมือง ลือเลื่องกล้วยแสนหวี ประจำปี 25 กันยายน - 3 ตุลาคม 2567
"งานรำลึกพระยาไกรภักดี ประเพณีแซนโฎนตา บูชาหลักเมือง ลือเลื่องกล้วยแสนหวี!! ประจำปี 2567 สารทเดือนสิบ เมืองขุขันธ์ วัฒนธรรมบุญใหญ่ แห่งอีสานใต้ จังหวัดศรีสะเกษ เริ่ม 25 กันยายน - 3 ตุลาคม 2567 ณ บริเวณลานอนุสาวรีย์ พระยาไกรภักดีศรีนครลำดวน (ตากะจะ) อำเภอขุขันธ์ จังหวัดศรีสะเกษ 27 ก.ย. 67 ชมขบวนแห่ แซนโฎนตาและพิธีเซ่นไหว้ พร้อมชมการแสดง แสงสีเสียง อันยิ่งใหญ่ตระการตา
ภายในงาน ท่านจะได้พบกับ มหกรรมสินค้า จากโรงงาน เลือกซื้อสินค้า ราคาถูก สินค้าโอท๊อป เลือกจับจ่าย ผลิตภัณฑ์พื้นเมืองขุขันธ์ ตลาดกล้วยแสนหวี ของกินของใช้ มากมาย ตลอดงาน พร้อมสวนสนุกชุดใหญ่ ๆ ชมการแสดง “วัฒนธรรมสี่เผ่า” จาก กลุ่มชาติพันธุ์ คือ ส่วย, เขมร, ลาว และเยอ ภายในงาน ฯลฯ
งานรำลึกพระยาไกรภักดี ประเพณีแซนโฎนตา บูชาหลักเมือง ลือเลื่องกล้วยแสนหวี เป็นประเพณีที่ชาวอำเภอขุขันธ์และชาวจังหวัดศรีสะเกษที่มีเชื้อสายเขมรได้สืบทอดกันมาอย่างยาวนาน งานจัดขึ้นในช่วงแรม 15 ค่ำเดือน 10 เป็นประเพณีสืบทอดกันมาตั้งแต่บรรพบุรุษ แต่เดิมนั้นจะประกอบพิธีเฉพาะในครอบครัวและชุมชน ต่อมาได้จัดงานที่ยิ่งใหญ่และทำให้ผู้คนได้รู้จัก ปัจจุบันได้จัดงานบริเวณลานอนุสาวรีย์พระยาไกรภักดีศรีนครลำดวน (ตากะจะ) อำเภอขุขันธ์ ภายในงานได้จัดพิธีกรรมต่างๆ และมีของเซ่นไหว้ให้ผู้คนได้รำลึกถึงบรรพบุรุษการจัดงานขึ้นเพื่อเป็นการอนุรักษ์และสืบสานวัฒนธรรมประกอบพิธีกรรมเซ่นไหว้บรรพบุรุษตามความเชื่อที่แสดงออกถึงความกตัญญูต่อบรรพบุรุษและเป็นการส่งเสริมการท่องเที่ยวอีกเพื่อส่งเสริมความรัก ความสามัคคีของชาว อำเภอขุขันธ์ ตลอดจนการใช้ประเพณีให้เป็นสายใยผูกพันในครอบครัว
งานเทศกาล อาหารระยอง วันที่ 25-29 กย 2567
งานเทศกาล อาหารระยอง วันที่ 25-29 กย 67 ณ ชายหาดแสงจันทร์ ตัวเมืองระยอง
ประเพณีสารทเดือนสิบและงานกาชาด จ.นครศรีธรรมราช ประจำปี 2567 วันที่ 26 ก.ย. - 5 ต.ค. 2567
จังหวัดนครศรีธรรมราช เตรียมจัดงานประเพณีบุญสารทเดือนสิบและงานกาชาดจังหวัดนครศรีธรรมราช ประจำปี 2567 อย่างยิ่งใหญ่ ระหว่างวันที่ 24 กันยายน - 8 ตุลาคม 2567 นี้ ณ สวนสมเด็จพระศรีนครินทร์ 84 (ทุ่งท่าลาด) รวม 15 วัน 15 คืน ภายใต้แนวคิด นครา ศรัทธา อารยธรรม 101 ปี บุญสารทเดือนสิบนครศรีธรรมราช The 2nd Century Begins @ 2024
กิจกรรมในงานปีนี้มีหลากหลาย ใน 5 กลุ่ม ประกอบด้วยกิจกรรมศาสนศรัทธา พิธีบวงสรวงก่อนเริ่มงาน 7 จุด การยกหฺมฺรับ ถวายหฺมฺรับแบบประเพณีโบราณ ,กิจกรรมสนับสนุนการจัดงาน การแถลงข่าวการจัดงาน พิธีเปิดงาน ซึ่งจะมีขึ้นในวันที่ 24 กันยายน 2567การแข่งขันสามล้อพ่วงท้ายหรือสามล้อรับจ้าง การแข่งขันเซปักตะกร้อ ตะกร้อลอดห่วงและตะกร้อลีลา ,กิจกรรมลานวัฒนธรรม การประกวดวรรณกรรมไทย เพลงร้องเรือเด็กชิงถ้วยพระราชทานสมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถ พระบรมราชชนนีพันปีหลวง การประชันหนังตะลุง ชิงถ้วยพระราชทานสมเด็จพระกนิษฐาธิราชเจ้ากรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ขบวนแห่หฺมฺรับและการประกวดหฺมฺรับ ชิงหฺมฺรับทองคำพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ในวันที่ 1 ตุลาคม 2567 การประกวดกลอนสด/การปะกวดยุวมโนราห์/หนังตะลุงทอล์กโชว์และหนังตะลุงเยาวชน การแสดงหนังตะลุง และการจัดนิทรรศการหุ่นเปรต ขบวนพาเหรดเปรตและการประกวดหุ่นเปรต ,กิจกรรมกาชาดสร้างสรรค์บุญสารทเดือนสิบนครศรีธรรมราช การประกวดเทพบุตรเมืองนคร การประกวดนางสาวนครศรีธรรมราช การประกวดร้องเพลง MCOT มิวสิคแชมป์เปี้ยน การแสดงมโนราห์/เพลงบอกและการออกรางวัลสลากกาชาด ประจำปี 2567 วันที่ 8 ตุลาคม 2567
เทศกาลอาหารและบอลลูนเมืองเพชร 26 ก.ย. - 5 ต.ค. 2567
เทศกาลอาหารและบอลลูนเมืองเพชร 26 ก.ย. - 5 ต.ค. 67 ถนนหน้าวัดถ้ำแก้ว อ.เมือง จ.เพชรบุรีงานนมัสการถ้ำฤาษีเขางู ราชบุรี 26 กันยา - 7 ตุลา 2567
งานนมัสการถ้ำฤาษีเขางู ราชบุรี 26 กันยา - 7 ตุลา 2567 ที่อุทยานหินเขางู 12 วัน 12 คืน ชมศิลปินวงดัง Klear บิ๊กแอส แอน อรดี บอลเชิญยิ้ม รีโทรสเปคทีฟ แบ้งค์ วงแคลช ปิดท้ายคืน 7 ตุลาคม กับคาราบาวเต็มวง
เชิญทำบุญ งานประเพณี บุญสารทเดือนสิบ ณ วัดกะทู้ 26 กันยายน - 1 ตุลาคม 2567
เชิญทำบุญ งานประเพณี บุญสารทเดือนสิบ ณ วัดกะทู้ อำเภอกะทู้ จังหวัดภูเก็ต 26 กันยายน - 1 ตุลาคม 2567 พร้อมชมคอนเสิร์ตศิลปินวงดังทุกคืน ชมพิธีเปิดวันที่ 26 กันยายน เวลา 18.30 น.
การแข่งขันกีฬายูยิตสู Ji-Jitsu World Cup Beach 2024วันที่ 27- 28 กันยายน 2567
สมาคมกีฬายูยิตสูแห่งประเทศไทย กำหนดจัดการแข่งขันกีฬายูยิตสู รายการ Ji-Jitsu World Cup Beach 2024 ระหว่างวันที่ 27- 28 กันยายน 2567 เพื่อเป็นการส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจให้ประชาชนในพื้นที่ พร้อมเพิ่มศักยภาพการท่องเที่ยวเชิงกีฬา(Sports Tourism) ซึ่งจะมีนักกีฬาจากหลากหลายประเทศตบเท้าเข้าร่วมการแข่งขันเป็นจำนวนมาก ผลักดันให้เป็นการแข่งขันประจำปีของเมืองพัทยา โดยการเข้าพบครั้งนี้ เป็นการนำเสนอและหารือขอคำแนะนำรูปแบบการจัดกิจกรรม พร้อมขอความอนุเคราะห์สิ่งอำนวยความสะดวกต่างๆ อาทิ รถสุขาเคลื่อนที่, เจ้าหน้าที่รักษาความปลอดภัย เป็นต้น
สำหรับกีฬายูยิตสู เป็นศิลปะการต่อสู้ป้องกันตัวประจําชาติของประเทศญี่ปุ่น ประเทศไทยมีการนํายูยิตสูเข้ามาฝึกเป็นศิลปะป้องกันตัว ใช้เทคนิคการเตะ-ต่อย เทคนิคการทุ่ม แบบยูโด เทคนิคการล็อค รัดคอ และหักแขน ต่อมาได้พัฒนามาเป็นกีฬาที่แข่งขันกันทั่วโลก
งานประเพณีอุ้มพระดำน้ำ จ.เพชรบูรณ์ ประจำปี 2567 LINK
งานประเพณีอุ้มพระดำน้ำ ปี 2567 งานประเพณีใหญ่ทุกแรม 15 ค่ำ เดือน 10 งานปีนี้จัดตั้งแต่วันที่ 27 กันยายน - 6 ตุลาคม 2567 สถานที่ หอโบราณคดีเพชรบูรณ์อินทราชัย(ศาลากลางเก่า)
พิกัด พิธีอุ้มพระดำน้ำจังหวัดเพชรบูรณ์ ประเพณีหนึ่งเดียวในหล้า ศรัทธาเหนือกาลเวลา ประเพณีหนึ่งเดียวในโลก มรดกภูมิปัญญาทางวัฒนธรรมของชาติ ขบวนแห่พระฯรอบเมือง พิธีเปิดงานอุ้มพระดำน้ำ สุดแสนอลังการ บอกเลยว่างานไม่ควรพลาดมากๆ
ไฮไลท์สำคัญ
- 30 กันยายน 2567 พิธีรำบวงสรวงถวายพระพุทธมหาธรรมราชา นางรำกว่า 2,567 คน ณ พุทธอุทยานเพชบุระ (พระใหญ่)
- 1 ตุลาคม 2567 ช่วงเช้า พิธีบวงสรวงเทพยาดาฟ้าดิน และเสี่ยงทายทิศในการดำน้ำ ณ วัดไตรภูมิ
- 1 ตุลาคม 2567 ช่วงค่ำ ขบวนแห่พระพุทธมหาธรรมราชา (ทางบก) และพิธีเปิดงานประเพณีอุ้มพระดำน้ำ ประจำปี 2567 ณ เวทีชั่วคราวด้านหน้าวัดมหาธาตุ
- 2 ตุลาคม 2567 ช่วงเช้า เวลา 9.09 น.อัญเชิญพระจากท่าน้ำวัดไตรภูมิ เวลา10.09 น.ทำพิธีที่ท่าน้ำวัดโบสถ์ชนะมาร
- 2 ตุลาคม 2567 ช่วงค่ำ การแสดง แสง เสียง มหกรรมคอนเสิร์ต สวนสนุกช้อป ชิม อาหาร ร้านเด็ดร้านดังภายในงาน
- 3-4 ตุลาคม 2567 การแข่งขันพายเรือทวนน้ำ งานประเพณีอุ้มพระดำน้ำ ประเภทเรือสั้น 18 ฝีพาย และ เรือยาว 30 ฝีพาย ณ ท่าน้ำ หน้าวัดไตรภูมิ
มหกรรมถนนคนเดิน และวันเกษตร ราชภัฏสุรินทร์ 27 ก.ย.–6 ต.ค. 2567
มหกรรมถนนคนเดิน และวันเกษตร ราชภัฏสุรินทร์ วันที่ 27 ก.ย. – 6 ต.ค. 2567 บริเวณถนนหน้าตึกคณะมนุษยศาสตร์ โรงแรมลานช้าง มหาวิทยาลัยราชภัฏสุรินทร์ ชิม ช็อป สินค้า ของดีจากทุกภูมิภาค และผลผลิตทางการเกษตร เพลิดเพลินกับกิจกรรมการประกวดร้องเพลงลูกทุ่ง การประกวดวงกันตรึม การแสดงดนตรีจากมหาวิทยาลัยราชภัฏสุรินทร์ ศิลปินรับเชิญ เหลือง บริสุทธิ์ เจ้าของผลงานเพลงคืนลับฟ้า พร้อมศิลปินชาวสุรินทร์นำโดย โก๋ย วรมัน เจี๊ยบ พิมพ์ขวัญ และกันตรึมชื่อดัง ส่องแสง รุ่งเรืองชัย
Sip Around the World : Wine Tasting เฮาส์ ออฟ กิน อยุธยา 27 กันยายน 2567
Sip Around the World : Wine Tasting เฮาส์ ออฟ กิน อยุธยา เตรียมพบกับงาน Wine Tasting ครั้งแรกที่ House of Kin Ayutthaya! ลิ้มลองไวน์กว่า 14 ฉลากชั้นนำจาก Winery ทั่วโลก พร้อมคำแนะนำจาก Wine Specialist จาก ???????????? โอกาสพิเศษสำหรับคนรักไวน์ ห้ามพลาดเด็ดขาด! วันเดียวเท่านั้น : ศุกร์ที่ 27 กันยายน 2567 ราคา: 1,900 บาท/ท่าน (รวม Tapas ระดับพรีเมี่ยม) เวลา: เพลิดเพลินกับไวน์และอาหารตลอด 3 ชั่วโมง
งาน MINI Balloon Festival 2-29 กันยายน 2567
งาน MINI Balloon Festival 27 - 29 กันยายน 2567 ณ ลานสโมสรมหาราช อ.ปราณบุรี จ.ประจวบคีรีขันธ์ เวลา 16.00-22.00 น. ชมบอลลูนกว่า 20 ลูก ฟรี คอนเสิร์ต
ปฐมนคร Cafe & Gallery Fest 2024 วันที่ 27-29 กันยายน 2567
“ปฐมนคร Cafe & Gallery Fest” งานเฟสติวัลสุดยิ่งใหญ่ครั้งแรกที่รวมทุกความชิคทั้ง "คาเฟ่" และ "งานศิลปะ" เข้าไว้ในงานเดียว จิบกาแฟคุณภาพเยี่ยม พร้อมชมงานศิลป์ ไปพร้อมกัน! 27 - 29 กันยายน 2567 ศูนย์การค้าเซ็นทรัล นครปฐม ชั้น G
ไฮไลท์ของงาน กาแฟสุดพิเศษ จากร้านกาแฟชั้นนำทั่วนครปฐมที่รวบรวมหลากหลายเมนูสุดสร้างสรรค์ พร้อมเสิร์ฟให้คุณได้สัมผัสรสชาติกาแฟที่หลากหลาย! มุมศิลปะสุดอินสไปร์ เพลิดเพลินไปกับงานศิลปะจัดแสดงจากศิลปินชั้นนำ ให้คุณได้ชื่นชมและเปิดมุมมองใหม่ ???? ดนตรีสดสุดชิลล์ นั่งจิบกาแฟฟังดนตรีในบรรยากาศผ่อนคลาย เพิ่มความรื่นรมย์ให้กับวันพักผ่อนของคุณ
งาน สุพรรณบุรี Food & Music Festival วันที่ 27-28 กันยายน 2024
การท่องเที่ยวแห่งประเทศไทย ขอเชิญเที่ยวชมงาน ”สุพรรณบุรี Food & Music Festival“ วันที่ 27-28 กันยายน 2024 (2 คืน) ตั้งแต่ 16.00 น. ถึง 22.00 น. ณ. สวนเฉลิมภัทรราชินี (หอคอยบรรหาร แจ่มใส) จังหวัดสุพรรณบุรี มาร่วมแกะกล่องความสุข เปิดเมนูประสบการณ์ท่องเที่ยวแบบ อิ่มอร่อย บันเทิง ครบรส เสิร์ฟอาหารยกทัพร้านคนดัง อาทิ เอ็มมี่ แม็กซิม,ครูไพบูลย์,เจ๊แม็กซ์ปังเว้ยเฮ้ย,เจ๊สีสำเพ็ง,คิงก่อนบ่าย,จั๊กกะบุ๋ม ฯลฯ ในรูปแบบ บู้ธอาหาร และ ฟู้ดทรัค (กว่า 20 ร้านค้า) ดีกรีโด่งดังจากโซเชียลสาดความอร่อย พร้อมกระทบไหล่อินฟลูเอนเซอร์สุดฮอต อาหารหลากหลายที่เป็นเอกลักษณ์ของจังหวัดสุพรรณบุรี และอื่นๆ ขนความสนุกด้วยวงดนตรีสุดมันส์มากมาย และการแสดงศิลปวัฒนธรรมท้องถิ่นสุดอลังการ
ไฮไลท์เด็ด! พบกับโชว์สุดพิเศษจากลูกทุ่งสาวสั้นเสมอหูเบอร์หนึ่ง "ใบเตย อาร์สยาม" โชว์ลูกคอ เต็มวงพร้อมแดนซ์เซอร์แบบนันสต๊อปกับทุกบทเพลงฮิต และซิงเกิ้ลใหม่ที่ทุกคนต้องว้าว
หลังสวนฟิชชิ่งเกมส์ มหกรรมแข่งขันตกปลาอ่าวไทย ประจำปี 28-29 กันยายน 2567
28-29 กันยายน 2567 หลังสวนฟิชชิ่งเกมส์ มหกรรมแข่งขันตกปลาอ่าวไทย ประจำปี 2567 ณ ท่าเทียบเรือ ร้านมายางาน Amazing KHA-MA Sakaeo 2024 งานแสดง ผ้าขาวม้า ของดี soft power แห่งสระแก้ว 28-29 กันยายน 2567
ททท.นครนายก ขอเชิญเที่ยวงาน Amazing KHA-MA Sakaeo 2024 ระหว่างวันที่ 28-29 กันยายน 2567 ณ ลานสยามมินทร์เทศบาลเมืองอรัญญประเทศ จังหวัดสระแก้ว งานแสดง ผ้าขาวม้า ของดี สินค้าที่เป็น soft power มุ่งยกระดับมาตรฐานผ้าขาวม้าสู่สากล โชว์อัตลักษณ์แห่งสระแก้ว ด้วยการเดินแบบผ้าของสระแก้ว ที่ใส่ทำงานได้ แบบไม่ซ้ำ และ ดูเก๋ ทันสมัย ใช้งานได้จริง ทุกเพศทุกวัย ✅กิจกรรมภายในงาน บูธจำหน่ายสินค้า ผลิตภัณฑ์จากผ้าขาวม้า และอาหารมากมายกว่า 30 ร้าน และ Food Truck พบกับศิลปินภายในงาน อาทิเช่น เต๋า ภูศิลป์ / วงซามูไร ในวันที่ 28 วง Mocca Garden / วงกิ่งแก้ว ในวันที่ 29 !!!อย่าลืม มาแวะ เที่ยว ชม ชิม กันเยอะๆนะ
KOH CHANG TRAIL 2024 - Awaken Koh 29 กันยายน 2567 LINK
เปิดรับสมัครแล้ว!! KOH CHANG TRAIL 2024 - Awaken Koh 29 กันยายน 2567
**ได้รับหนังสืออนุญาตจากอุทยานแห่งชาติหมู่เกาะช้างแล้ว**
รายละเอียดการแข่งขัน
วันแข่งขัน : วันอาทิตย์ที่ 29 กันยายน 2567 (Race Day)
สถานที่ : อุทยานแห่งชาติหมู่เกาะช้าง จังหวัดตราด
วันรับอุปกรณ์ : วันเสาร์ที่ 28 กันยายน 2567 (Expo Day)
เวลา 10.00 - 18.00 น. ลงทะเบียน ตรวจอุปกรณ์บังคับ และ รับหมายเลขการแข่งขัน(BIB)
สถานที่ : โรงเรียนบ้านบางเบ้า
แผนที่ - ไม่มีการจัดส่งอุปกรณ์ทางไปรษณีย์
- ไม่สามารถรับอุปกรณ์วันแข่งขันได้
วิ่งคนชนวิ่งควาย 2024 วันอาทิตย์ที่ 29 กันยายน 2567
วิ่งคนชนวิ่งควาย Chonburi Authentic Half Marathon 2024 วันอาทิตย์ที่ 29 กันยายน 2567 เวลา 04.00 น. - 10:00 น. สถานที่จัดงาน สะพานชลมารควิถี 84 พรรษา จังหวัดชลบุรี ประเภทการแข่งขัน ฮาล์ฟมาราธอน 21k / มินิมาราธอน 10K / ฟันรัน 5K (ไม่แบ่งรุ่นอายุ) - ถ้วยรางวัล Overall ชาย อันดับที่ 1-10 - ถ้วยรางวัล Overall หญิง อันดับที่ 1-10
การแสดง Culture เจิดจ้า ณ กระบี่ ในงานถนนคนเดินกระบี่ Krabi Walking Street 29 กันยายน 2567
การแสดงทางศิลปวัฒนธรรมร่วมสมัยแนวไทยประยุกต์ “Culture เจิดจ้า ณ กระบี่” 29 กันยายน 2567 เวลา 19.00 - 21.00 น. ณ ถนนคนเดินกระบี่ Krabi Walking Street พบกับการแสดงสุดอลังของ “วงเพชรจรัสแสง” ที่จะพาคุณข้ามพรมแดนวัฒนธรรม และเปิดประตูไปสู่มิติใหม่ร่วมยุคสมัยกับกระแสโลกของนักแสดงระดับมืออาชีพ ที่มากด้วยประสบการณ์ มีผลงานเชิงประจักษ์มากมายทั้งในประเทศ และต่างประเทศตลอดระยะเวลากว่าสิบปีที่ผ่านมา..เช่น รางวัลจากเวทีการประกวด Thailand Got Talent, การแสดงในงานสำคัญๆ ระดับประเทศ การนำวัฒนธรรมไทยไปเผยแพร่สู่สายตาชาวโลก
สกาดซีนิคเทรล- SAKAD SCENIC TRAIL 2024 วันอาทิตย์ที่ 29 กันยายน 2567
งานวิ่งเทรล "สกาดซีนิคเทรล- SAKAD SCENIC TRAIL 2024" วันอาทิตย์ที่ 29 กันยายน 2567 ณ โรงเรียนบ้านสกาดใต้ ต.สกาด อ.ปัว จ.น่าน การแข่งขัน 3 ระยะทาง 11 km./25 km./50 km. รับสมัครจำนวนจำกัด 500 คนเท่านั้น เปิดรับสมัครวันนี้ - 10 กันยายน 2567
Koh Lanta Kayak & Cycling Rally Day 2024 วันที่ 29 กันยายน 2567
Koh Lanta Kayak & Cycling Rally Day 2024 วันที่ 29 กันยายน 2567 ณ ชุมชนทุ่งหยีเพ็ง อ.เกาะลันตา 07.30 - 19.30 น. สัมผัสประสบการณ์สุดฟินกับกิจกรรม Low Carbon เช้าปั่นจักรยาน บ่ายพายคายัคชมป่าโกงกางผืนใหญ่ของเกาะลันตาบอกเลยป่าแน่นมากเขียวมากจ้า
DoiTung The Auction 2024 งานประมูลกาแฟพิเศษประจำปีของดอยตุง 29 กันยายน 2567
DoiTung The Auction 2024 กลับมาอีกครั้งกับงานประมูลกาแฟพิเศษประจำปีของดอยตุง การประมูลกาแฟคุณภาพระดับ Specialty Grade ของดอยตุงในปีนี้ พวกเรามีกาแฟมานำเสนอทุกคนมากถึง 14 ตัว ประกอบด้วย กาแฟสายพันธุ์ต่าง ๆ ถึง 8 สายพันธุ์ ได้แก่ Typica, Gayo, Gesha, Catimor, Caturra, Bourbon, Red Java และ Yellow Java ที่ผ่านกระบวนการแปรรูปแบบต่าง ๆ มาอย่างพิถีพิถัน ผู้ที่สนใจเข้าร่วมการประมูลสามารถ
ลงทะเบียนตามลิงก์นี้ สามารถลงทะเบียนได้ตั้งแต่วันที่ 1-15 กันยายน 2567 ผู้ที่ลงทะเบียนได้รับ Box Set กาแฟทั้ง 14 ตัวเพื่อชิมก่อนการประมูล นอกจากนี้สำหรับท่านที่สนใจชิมกาแฟดอยตุงสามารถติดตามการชิมกาแฟทั่วไทยได้ระหว่างวันที่ 20 ถึง 28 กันยายน 2567 การประมูลออนไลน์ในปีนี้จะเกิดขึ้นในวันอาทิตย์ที่ 29 กันยายน 2567
ขอนแก่นไบค์วีค #14 (26 ตุลาคม 2567)
งานขอนแก่นไบค์วีค #14 "Live Love Ride" 26 ตุลาคม 2567 ณ ลานตลาดอู้ฟู่ ศิลปิน ลำไยไหทองคํา รายได้หลังหักค่าใช้จ่ายมอบให้โรงเรียนขาดแคลนในพื้นที่จ.ขอนแก่น
Krabi BikeWeek 2024 - 11-12 ตุลาคม 2567
Krabi BikeWeek 2024 กระบี่ไบค์วีค ครั้ง11 วันที่ 11-12 ตุลาคม 2567 ยินดีต้อนรับพี่น้องไบค์เกอร์ทุกท่าน พบกับศิลปินมากมายจัดหนักจัดเต็ม 2 วัน 2 คืน
งานประเพณีถือศีลกินผักจังหวัดภูเก็ต2567 วันที่ 3-11 ตุลาคม 2567 LINK
ประเพณีถือศีลกินผักจังหวัดภูเก็ต ปี 2567 (Phuket Vegetarian Festival) กำหนดจัดวันที่ 3-11 ต.ค. 2567 ประเพณีกินผักที่มีประวัติศาสตร์ยาวนานกว่า 100 ปี และมีเชื่อเสียงไปทั่วโลกของจังหวัดภูเก็ต ดึงดูดนักท่องเที่ยวทั่วโลกหลั่งไหลมาชม มาร่วมงานเทศกาลนี้มากขึ้นทุกปี ปีนี้จะจัดพิธีกรรมต่างๆ ตลอด 9 วัน 9 คืน เช็คตารางพิธีกรรม ขบวนแห่อ๊าม (ศาลเจ้า) ในภูเก็ต เส้นทางแห่ขบวนพระ 4 อ๊ามหลักของงานปีนี้ และข้อมูลต่างๆ
ได้ที่นี่ปฏิทินกิจกรรมในจ.น่าน เดือนตุลาคม 2567
ปฏิทินกิจกรรมท่องเที่ยวประจวบคีรีขันธ์ ตุลาคม-พฤศจิกายน 2567
4-6 ต.ค. 67 ประจวบ...ชวนเที่ยว ลานด้านหน้าศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน อ.หัวหิน
12 - 14 ต.ค. 67 กิจกรรมพิชิตยอดเขาล้อมหมวก กองบิน 5 อ.เมือง
27 ต.ค. 67 วิ่งเพื่อหัวใจและสมอง "Run With The Flow 2024" Presented by Bangkok Hospital (สมัครได้ถึง 27 n.e.67) อุทยานราชภักดิ์ หัวหิน อ.หัวหิน
พฤศจิกายน 67
**15 พ.ย. 67 วันลอยกระ
1 - 2 พ.ย. 67 Glamping Festival 2024 สนามอารีน่า หัวหิน อ.หัวหิน
17 พ.ย. 67 Road To Give Hua Hin 2024 (เปิดรับสมัครอยู่) ลานมหาราช ปากน้ำปราณ อ.ปราณบุรี
พอลาลา
23 พ.ย. 67 มิวสิคเฟสติวัล พือลาลา ไร่ทวีกาญจน์ ป่าละอู อ.หัวหิน
ปฏิทินท่องเที่ยวครึ่งปีหลังตั้งแต่เดือน ต.ค.-ธ.ค. 2567 เมืองร้อยเอ็ด
เทศบาลเมืองร้อยเอ็ด ประชาสัมพันธ์ ปฏิทินท่องเที่ยวครึ่งปีหลังตั้งแต่เดือน ต.ค.-ธ.ค. 2567 เมืองร้อยเอ็ด
เดือนตุลาคม
16 ต.ค. 2567 งานประเพณีออกพรรษา "รำวงหรรษา ออกพรรษากวนข้าวทิพย์" ประจำปี 2567 ณ ลานสาเกตนคร สวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด
เดือนพฤศจิกายน
2 พ.ย. 2567 กฐินร้อยเอ็ดรวมใจ ณ ศาลากลาง จ.ร้อยเอ็ด
9-10 พ.ย. 2567 ชมการแข่งขันสิงโตดอกเหมยนานาชาติ จาก 10 ประเทศ ชิงถ้วยพระราชทานจาก สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ณ ลานสาเกตนคร บึงพลาญชัย จ.ร้อยเอ็ด
11-22 พ.ย. 2567 งานงิ้วร้อยเอ็ด ณ วัดราษฎร์ศิริ อ.เมือง จ.ร้อยเอ็ด
14-15 พ.ย. 2567 งานลอยกระทง " สมมาน้ำ คืนเพ็ง เส็งประทีป" ณ บึงพลาญชัย จ.ร้อยเอ็ด
เดือนธันวาคม
11-15 ธ.ค. 2567 งานข้าวหอมมะลิโลก จังหวัดร้อยเอ็ด World Hommali Rice ณ อ่างธวัชชัย ต.มะอึ อ.ธวัชบุรี จ.ร้อยเอ็ด
27 ธ.ค. 67 - 1 ม.ค. 68 ROIETTowerCountdown ส่งท้ายปีเก่าต้อนรับปีใหม่ ณ ลานสาเกตนคร สวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด
ปฏิทินการท่องเที่ยวจังหวัดสกลนคร เดือนตุลาคม 2567
ห้วงตุลาคม 67 ครั้งแรกของ Viu Thailand กับการขนซีรีส์ไปให้ชมกันถึงที่!ขอเชิญชวน "พ่อแม่พี่น้องชาวอีสาน" มาเบิ่งหนัง & ซีรีย์กลางแปลง ในงาน #อีสานชมวิว รอติดตามรายละเอียดสถานที่และเรื่องที่จะนำไปฉายได้ เร็ว ๆ นี้
3 - 11 ตุลาคม 67 เทศกาลถือศีลกินเจ เมตตาธรรมมูลนิธิสกลนคร
12 - 17 ตุลาคม 67 ประเพณีออกพรรษาแห่ปราสาทผึ้ง และแข่งขันเรือยาวชิงถ้วยพระราชทานฯ
26 - 27 ตุลาคม 67 เทศกาลดนตรีอิสานโซล ||| เพลินพยุง Plern Playung แคมป์ปิ้ง อ.ภูพาน จ.สกลนคร
26 – 27 ตุลาคม 67 งานนิทรรศการ การประกวดอนุรักษ์พระเครื่องและเหรียญคณาจารย์ ณ โรงแรมแกรนด์พาเลซ
กิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนตุลาคม 2567
12 ตุลาคม 2567 Luylay Music Festival (Rock Legends by ลุยเล 2) ณ บ้านไม้บนหาด รีสอร์ท หาดบางเก่า อ.ชะอำ
12 ตุลาคม 2567 . ตลาดสวนสนลอย ณ เซนทารา ไลฟ์ ชะอำ บีช รีสอร์ท อ.ชะอำ
12-14 ตุลาคม 2567 ตลาดทำเพราะชอบ ณ โคโค่ แอนด์ คอฟ อ.บ้านแหลม
19 ตุลาคม 2567 เทศกาลดนตรีและปาร์ตี้เรืองแสง ZEADOM FEST ณ TRIPLE TREE BEACH RESORT หาดชะอำเหนือ อ.ชะอำ
19 ตุลาคม 2567 เพชรพรี โฟล์ค ณ อาชาธารา อ.แก่งกระจาน
25-27 ตุลาคม 2567 มหกรรม ช้อป ฟิน กินคุ้ม ณ Robinson Lifestyle Phetchaburi อ.บ้านลาด
ขอเชิญร่วมอนุโมทนา งานมหาบุญใหญ่ในจังหวัดเพชรบุรี
2-3 ตุลาคม 2567 : เทศน์มหาชาติพระเวสสันดรชาดก วัดสุทธาวาส (วัดใหม่สะพานสูง) อ.บ้านแหลม
18 ตุลาคม 2567 : ตักบาตรเทโวโรหณะ วันออกพรรษา
20 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดพวงมาลัย ถ้ำเขาอีโก้ อ.เขาย้อย
20 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดสำมะโรง อ.เมือง
21 ตุลาคม 2567 : ประกอบพิธีเททองหล่อสิ่งศักดิ์สิทธิ์ วัดสำมะโรง อ.เมือง
26 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดช้าง อ.เมือง
26 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดสระบัว อ.เมือง
26 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดชีสระอินทร์ อ.เมือง
26 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดหนองตาพด อ.ชะอำ
27 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดสหธรรมิการาม (วัดหนองแขม) อ.ท่ายาง
27 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดป่าชลประทานราษฎร์ อ.ท่ายาง
27 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดหุบกระพง อ.ชะอำ
27 ตุลาคม 2567 : ทอดกฐินสามัคคี วัดธรรมรังษี อ.เมือง
เดือนตุลาคม 2567 รวม 24.71 ล้านคน
ยอดจำนวนผู้ประกันตนในระบบประกันสังคม ทั่วประเทศ เดือนตุลาคม 2567 มีผู้ประกันตนในระบบประกันสังคมทุกมาตราคือ 33, 39, 40 รวม 24,718,892 ราย
Phatthalung Morning Drip #2
Phatthalung Morning Drip #2 วันอาทิตย์ที่ 1/10/2023 เวลา 06.00-08.00 น.
-ดื่มกาแฟ หลากหลาย แหล่งทั่วโลก พบกับเมล็ดกาแฟระดับเเชมป์รายการ "The winner Professional coffee roaster championship 2023"
-ดื่มดำบรรยากาศยามเช้า
-พูดคุยเเลกเปลี่ยน เรื่องกาแฟ ๆลๆ
-พร้อมดลตรีขับกล่อมที่ไพเราะ
-ผู้สนใจเข้าร่วมกิจกรรม ฟรี
หรือร่วมสนับสนุน Tip box ไว้ซื้อเมล็ดกาแฟครั้งต่อไป ก็ยินดี Special Guest
-แชมป์ ดริป Thailand Brewer League#hatyai 2023
-รองเเชมป์ ดริป Thailand Brewer League#Khanom 2023
-รองเเชมป์ ดริป #PCCm Phatthalung coffee Craft Music2023
เทศกาลอาหารบอลลูนนานาชาติและของดีบางเลน 1-10 ตุลาคม 2567
เทศกาลอาหารบอลลูนนานาชาติและของดีบางเลน ณ สนามหน้าที่ว่าการอำเภอบางเลน ระหว่าง วันที่ 1-10 ตุลาคม 2567
กิจกรรมเดือนตุลาคม 2567 จังหวาดตราด LINK
กิจกรรมต่างๆ ดังนี้
1-11 ต.ค. เทศกาลกินเจ ถ.ชัยมงคล ต.บางพระ อ.เมืองตราด
3-9 ต.ค. บอลลูนตราด บริเวณสวนรุกชาติ ต.วังกระแจะ อ.เมืองตราด
18 ต.ค. ตักบาตรเทโวโรหณะ ติดต่อสำนักงานพระพุทธศาสนาจ.ตราด 02-441-7999
กิจกรรมท่องเที่ยวจันทบุรี ประจำเดือนตุลาคม 2567 LINK
2-11 ต.ค. เทศกาลกินเจ ณ บ้านเฮงเจตั้ว วัดเขตร์นาบุญญาราม
6 ต.ค. กิจกรรมชมจันท์สัญจร คืนปูม้าสู่ทะเล
10-14 ต.ค. Balloon and Foodtruck เซ็นทรัลจันทบุรี
11-17 ต.ค. Amazing The Beach ชายหาดแหลมสิงหื
18-20 ต.ค. มนต์เสน่ห์วิถีริมคลอง ชุมชมย่านยาว-เถาสะบ้า นายายอาม
23-27 ต.ค. ช้อปฟิน กินเพลิน ถนนคนเดิน นายายอามเซ็นเตอร์
กิจกรรมท่องเที่ยวจันทบุรี ประจำเดือนตุลาคม 2567 LINK
2-11 ต.ค. เทศกาลกินเจ ณ บ้านเฮงเจตั้ว วัดเขตร์นาบุญญาราม
6 ต.ค. กิจกรรมชมจันท์สัญจร คืนปูม้าสู่ทะเล
10-14 ต.ค. Balloon and Foodtruck เซ็นทรัลจันทบุรี
11-17 ต.ค. Amazing The Beach ชายหาดแหลมสิงหื
18-20 ต.ค. มนต์เสน่ห์วิถีริมคลอง ชุมชมย่านยาว-เถาสะบ้า นายายอาม
23-27 ต.ค. ช้อปฟิน กินเพลิน ถนนคนเดิน นายายอามเซ็นเตอร์
งาน Thailand Coffee Hub ธีม Coffee Universe “จักรวาลกาแฟที่ใหญ่ที่สุดใจกลางเมือง” 2-8 ตุลาคม 2567
งาน Thailand Coffee Hub ที่คนรักกาแฟรอคอย ในธีม Coffee Universe “จักรวาลกาแฟที่ใหญ่ที่สุดใจกลางเมือง” 2-8 ตุลาคม 2567 ชั้น 1-3 (เต็มพื้นที่) ศูนย์การค้าเซ็นทรัลเวิลด์ ชวนคนกาแฟ มาท่องประสบการณ์กาแฟที่ไม่เหมือนใคร ตื่นตาตื่นใจไปกับบูทจากร้านกาแฟพิเศษชั้นนำ คัดสรรมาจากทั่วไทยและต่างประเทศ
งานวัดพระพุทธฉาย 2567
ประเพณีตักบาตรข้าวต้มลูกโยนวัดพระพุทธฉาย
งานเทศกาลบอลลูนตราด 3-9 ตุลาคม 2567
สโมสรโรตารี่ท่าเรือตราด ชวนเที่ยวงานเทศกาลบอลลูนตราด 3-9 ตุลาคม 2567 บริเวณสวนรุกขชาติ อ.เมืองตราด โชว์บอลลูน 17.00-21.00 น. ชมชิมช็อปสินค้าราคาถูก สินค้าอุปโภคบริโภค อาหารอร่อย เสื้อผ้าแฟช่ัน สวนสนุกชุดใหญ่
ประเพณีถือศีลกินผักจังหวัดตรัง 3-11 ตุลาคม 2567
นับถอยหลัง เข้าสู่ ประเพณีถือศีลกินผักจังหวัดตรัง 3 ตุลาคม – 11 ตุลาคม 2567 แรงศรัทธา กายพร้อม #ใจพร้อม ประเพณีถือศิลกินผัก จังหวัดตรัง 2567 ระหว่างวันที่ 3 - 11 ตุลาคม 2567 ณ ศาลเจ้าในจังหวัดตรัง และ งาน "มหาทาน มหาบุญ มหากุศล กินเจนครตรัง" ระหว่างวันที่ 9 - 11 ตุลาคม 2567 ณ บริเวณมูลนิธิกุศลสถานตรัง
เทศกาล ถือศีล กินเจ ประจำปี 2567 วันที่ 3-11 ตุลาคม 2567
เทศกาล ถือศีล กินเจ ประจำปี 2567 วันที่ 3-11 ตุลาคม 2567 ณ บริเวณโรงเจรักศีลธรรม ปากน้ำชุมพร อำเภอเมืองชุมพร จังหวัดชุมพร
ประเพณีถือศีลกินผักจังหวัดพังงา ประจำปี 2567 เริ่มตั้งเเต่วันที่ 3 - 11 ตุลาคม 2567
ททท.สำนักงานพังงา ชวนทุกคนมาเติมพลังกาย พลังใจ และพลังบุญกันที่พังงาใน "งานประเพณีถือศีลกินผักจังหวัดพังงา" ประจำปี 2567 เริ่มตั้งเเต่วันที่ 3 - 11 ตุลาคม 2567 มาร่วมเป็นส่วนหนึ่งตามความเชื่อและความศรัทธากับชาวพังงาใน พิธียกเสาโกเต้งสัญลักษณ์ของการเริ่มต้นถือศีลกินผัก ตื่นตาตื่นใจกับขบวนแห่พระอันยิ่งใหญ่ พิธีรับพระ พิธีสะเดาะเคราะห์ ไหว้พระขอพรเทพเจ้าและไหว้ 7 ดาวเสริมโชค เสริมมงคลแห่งชีวิต ทั่วทุกศาลเจ้าต่างๆ ในจังหวัดพังงา
งานประเพณี ถือศีลกินเจ จังหวัดกระบี่ วันที่ 3-11 ตุลาคม 2567
งานประเพณี ถือศีลกินเจ จังหวัดกระบี่ วันที่ 3-11 ตุลาคม 2567 เติมพลังใจกับพิธีสวดมนต์ พิธีสะเดาะเคราะห์ เสริมบุญบารมี เพื่อเป็นสิริมงคลแก่ตนเองและครอบครัว ไหว้พระขอพรเทพเจ้ามากกว่า 80 ศาลเจ้าทั่วกระบี่ ตลอด 9 วัน 9 คืน
Hilight วันที่ 6 ตุลาคม 2567 ร่วมพิธีกรรมศักดิ์สิทธิ์ “รวมพลคนกินเจ” พิธีบวงสรวงศาลหลักเมืองกระบี่ สืบชะตาดวงเมือง แห่พระรอบตัวเมืองกระบี่
102 ปี ชาตกาล พระอุบาลีคุณูปมาจารย์ (ปัญญา อินทปญมหาเถร) 4-12 ตุลาคม 2567 วัดไร่ขิง
ขอเชิญสาธุชนร่วมงาน 102 ปี ชาตกาล พระอุบาลีคุณูปมาจารย์ (ปัญญา อินทปญมหาเถร) สมโภชนพระบรมธาตุเจดีย์พระอุบาลีมหามงคล ณ วัดไร่ขิง พระอารามหลวง นครปฐม วันที่ 4-12 ตุลาคม 2567 ถ่ายทอดสดทาง Facebook Live
วัดไร่ขิง พระอารามหลวง (ประมูลร้านค้าวันที่ 17 สิงหาคม 2567)
งานมหกรรมการเงินอุดรธานี ครั้งที่ 11 MONEY EXPO 2024 UDONTHANI 4-6 ตุลาคม 2567
งานมหกรรมการเงินอุดรธานี ครั้งที่ 11 MONEY EXPO 2024 UDONTHANI ระหว่างวันที่ 4-6 ตุลาคม 2567 ณ อุดรธานี ฮอลล์ ชั้น 4 ศูนย์การค้าเซ็นทรัล อุดร งานมหกรรมการเงิน การลงทุน ระดับประเทศ มาเยือนจ.อุดรธานี อีกครั้ง บริการการเงินการลงทุนครบวงจร แคมเปญโปรโมชั่น สินเชื่อบ้าน ประกัน และ ผลิตภัณฑ์ด้านการเงินการลงทุนจาก ธนาคาร บริษัทการเงิน สินเชื่อ ประกัน มากมายทุกค่ายทุกแบรนด์ ฟังเสวนาพิเศษ จากกูรูการเงินการลงทุนที่มีชื่อเสียง
ขนอม บีช เฟสติวัล Khanom Beat Festival 2024 วันที่ 5 ตุลาคม 2567
Khanom Beat Festival 2024 - ขนอม บีท เฟสติวัล เทศกาลดนตรีริมหาด..ที่ใหญ่ที่สุดในภาตใต้“ SIAM FESTIVAL Present : Khanom Beat Festival 2024 - ขนอม บีท เฟสติวัล ณ หาดหน้าด่าน อ.ขนอม จ.นครศรีธรรมราช พบกัน 5 ตุลาคม 2567 ประตูเปิด 16.30 น.เป็นต้นไป
งานประเพณีแข่งขันเรือยาวเขมราฐ ชิงถ้วยพระราชทาน วันที่ 7-13 ตุลาคม 2567 ณ ลำน้ำโขงหน้าเทศบาลเขมราฐ
ขอเชิญเที่ยวงานประเพณีแข่งขันเรือยาวเขมราฐ ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราช กรมสมเด็จพระเทพรัตนราชสุดา สยามบรมราชกุมารี ศึกชิงเจ้าสายน้ำเขมราฐ อ.เขมราฐ จ.อุบลราชธานี วันที่ 7-13 ตุลาคม 2567 ณ ลำน้ำโขงหน้าเทศบาลเขมราฐ
7-11 ตุลาคม 2567 เที่ยวงาน ฮักกันมั่นแก่น ค้าขายร่วมกัน สานสัมพันธ์ สองแผ่นดิน ม่วนซื่นไทย-ลาว
ขอเชิญเที่ยวงาน ฮักกันมั่นแก่น ค้าขายร่วมกัน สานสัมพันธ์ สองแผ่นดิน วันที่ 7-11 ตุลาคม 2567 ณ บริเวณลานเฉลิมพระเกียรติสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี (ลานน้ำพุพญานาค) อำเภอเมืองหนองคาย จังหวัดหนองคาย ชม ชิม ช้อป OTOP สองแผ่นดิน ตำจอก ซอกซื่อ ม่วนซื่นไทย-ลาว 7 ต.ค. 67 กระต่าย พรรณนิภา 8 ต.ค. 67 เวียง นฤมล 9 ต.ค. 67 ลำเพลิน วงศกร 10 ต.ค. 67 ปรีชา ปัดภัย 11 ต.ค. 67 เต๋า ภูศิลป์
งานประเพณีวิ่งควายจังหวัดชลบุรี ประจำปี 2567 ครั้งที่ 153 วันที่ 8-16 ตุลาคม 2567
ขอเชิญเที่ยว
งานประเพณีวิ่งควายจังหวัดชลบุรี ประจำปี 2567 ( Chonburi Buffalo Racing 2024) ครั้งที่ 153 วันที่ 8-16 ตุลาคม 2567 ณ สนามหน้าที่ว่าการอำเภอเมืองชลบุรี
กิจกรรมคอนเสิร์ต 8 ต.ค. โบว์ ซุปเปอร์วาเลนไทย์ แป้งฝุ่น 9 ต.ค. เนส พรอำนาจ 10 ต.ค. แสงดาว 11 ต.ค. ร๊อคคงคย 12 ต.ค. นุ่น ดำดง 13 ต.ค. ทิดแอน 14 ต.ค. การประกวด นางฟ้าจำแลง บ้านนา 15 ต.ค. การประกวด น้องนาง บ้านนา 16 ต.ค. การประกวด สาว(เหลือ)น้อย บ้านนา
สอบถามรายละเอียดเพิ่มเติมที่ 038-283449 ต่อ 508 และ 605
งานประเพณีรับบัว ประจำปี 2567 วันที่ 10-18 ตุลาคม 2567
งานประเพณีรับบัว ประจำปี 2567 งานวัดหลวงพ่อโต วัดบางพลีใหญ่ใน อ.บางพลี จ.สมุทรปราการ วันที่ 10 - 18 ต.ค. 67 กำหนดการสำคัญดังนี้
14 ต.ค. เวลา 08:00 น. ขบวนแห่หลวงพ่อโตทางรถ
15 ต.ค. เวลา 08:00 น. ขบวนแห่หลวงพ่อโตทางเรือ
16 ต.ค. 67 ไฮไลท์ประเพณีรับบัว เวลา 07:00 น. พิธีโยนบัว สักการะองค์หลวงพ่อโต ชมการประกวดขบวนเรือสวยงาม สักการะปิดทององค์หลวงพ่อโต ชมเรือแห่สวยงามภายในงานมีของกิน ของใช้ มากมาย เที่ยวสวนสนุก ชมมหรสพทุกค่ำคืน
ประเพณีรับบัวประจำปีนี้ 2567 วัดบางพลีใหญ่ใน สมุทรปราการ 10-18 ตุลาคม 2567 LINK
งานใหญ่ประจำปีของชาวบางพลี นั่นคือ งานประเพณีรับบัว ประจำปี 2567 กำหนดจัดขึ้นวันที่ 10-18 ตุลาคม 2567 โดยวันที่ 16 ตุลาคม 2567 จะเป็นวันโยนบัว (เริ่ม 7.00 น.) กิจกรรมโยนบัวรับบัว เป็นประเพณีโบราณที่ยังคงจัดในประเทศไทยเพียงแห่งเดียวในโลก ณ ที่ว่าการอำเภอบางพลี และวัดบางพลีใหญ่ใน จ.สมุทรปราการ เช็คกำหนดการงานประเพณี 9 วัน 9 คืนอันยิ่งใหญ่ได้แล้ว
งาน “ออกพรรษา ที่เชียงคาน” ประจำปี 2567 วันที่ 10 - 18 ตุลาคม 2567
ขอเชิญเที่ยวงาน “ออกพรรษา ที่เชียงคาน” ประจำปี 2567 ณ บริเวณถนนริมน้ำโขง และหน้าที่ว่าการอำเภอเชียงคาน จังหวัดเลย ระหว่างวันที่ 10 - 18 ตุลาคม 2567 พบกับคอนเสิร์ตจากศิลปินชั้นนำทุกคืน พร้อมเลือกซื้อสินค้าราคาถูก ของกินอีกมากมาย และสวนสนุกชุดใหญ่
วันที่ 14 ตุลาคม 2567 ชมแห่ปราสาทผึ้ง นางรำ วัฒนธรรมท้องถิ่น
วันที่ 16-17 ตุลาคม 2567 ชมแข่งขันเรือกาบ-เรือยาวมิตรภาพไทย-ลาว ชมการแสดงศิลปวัฒนธรรมของเชียงคาน
วันที่ 17 ตุลาคม2567 ชมไหลเรือไฟ-กระทงสาย
เทศกาลบอลลูนที่ Pattana Sports Resort 11 - 14 ตุลาคม 2567
งานเทศกาลบอลลูนที่ Pattana Sports Resort กัน ปีนี้จัดเต็มความอลังทั้งบอลลูนยักษ์ขึ้นได้ และคอนเสิร์ตเวทีใหญ่กับ 6 ศิลปินดังตลอด 3 วัน เตรียมตัวมาจอยกัน ในวันที่ 11 - 14 ตุลาคม 2567 ชมบอลลูน พร้อมฟังดนตรีสดจากศิลปิน
18:00-19:00 น. Fellow Fellow
20:00-21:00 น. The Parkinson
21:30-22:30 น. Nont Tanont
23:00-00:00 น. URBOY TJ
งานโรตารี่เกษตรแฟร์ลพบุรี 11-20 ตุลาคม 2567
สโมสรโรตารีพระรามเมศวรลพบุรี ขอเชิญเที่ยวงาน โรตารี่เกษตรแฟร์ลพบุรี ตั้งแต่วันที่ 11-20 ตุลาคม 2567 ณ ที่ว่าการอำเภอจังหวัดลพบุรี ชมฟรีศิลปินดังทุกค่ำคืน
งานประเพณีปิดทองพระพุทธไสยาสน์และงานแข่งเรือออกพรรษา วัดป่าโมก ประจำปี วันที่ 11-18 ตุลาคม 2567
ขอเชิญเที่ยวงาน ประเพณี ปิดทอง พระพุทธไสยาสน์ และงานแข่งเรือออกพรรษา วัดป่าโมก ประจำปี 2567 วันที่ 11 - 18 ตุลาคม 2567 ณ บริเวณริมแม่น้ำเจ้าพระยา อำเภอป่าโมก จังหวัดอ่างทอง 17 ต.ค. 67 การแข่งเรือยาว ชิงถ้วยรางวัล & อ๊อด โฟร์เอส 18 ต.ค. 67 การแข่งขันเรือยาว ชิงถ้วยรางวัล
งานกินเที่ยวใช้ โครงการหนึ่งใจให้ประชาชน อ.ด่านช้าง สุพรรรณบุรี 11-20 ตุลาคม 2567
โครงการ โครงการหนึ่งใจให้ประชาชน โดยมูลนิธิ มิราเคิล ออฟ ไลฟ์ จัดงาน งานกินเที่ยวใช้ ณ อ.ด่านช้าง สุพรรรณบุรี 11-20 ตุลาคม 2567 พบกับการออกร้านจำหน่ายสินค้ามากมาย ของกิน ของใช้ ของอร่อย เฟอร์นิเจอร์ ไม้ดอกไม้ประดับ สัตว์เลี้ยง ชมการแสดงคอนเสิร์ตและศิลปินดนตรี ทุกคืน
อ๊ะละละแดนซ์เฟส ALaLa Dance Fest เชียงใหม่ 11-14 ตุลาคม 2567
งาน
อ๊ะละละแดนซ์เฟส ALaLa Dance Fest การแสดงและเวิร์คชอปจาก SIRISOOK Dance Theatre (ล้านนา), Khampha Dance (ล้านนา), KDA_Bali & Bajranyana Music Theatre (บาหลี, อินโดนีเซีย) และ Ambrita Sunshine (โกตดิวัวร์, แอฟริกาตะวันตก) 4 ศิลปิน 3 สัญชาติ แถมด้วยนิทรรศการฟ้อนต๊ะต่อนยอน จากทีม tomorrow.Lab และกาดอาหารชาติพันธุ์ที่มีให้เลือกกว่า 30 ร้านค้า วันที่ 11-14 ตุลาคม 2567 ที่ Old Chiangmai
งานบั้งไฟพญานาคโลก อ.รัตนวาปี หนองคาย 11-17 ตุลาคม 2567
บทเพลงรัก วันหยุดยาว และชาวแคมป์ ธีร์ ไชยเดช เสาร์ 12 ตุลาคม 2567
บทเพลงรัก วันหยุดยาว และชาวแคมป์ ธีร์ ไชยเดช เสาร์ 12 ตุลาคม 2567สถานที่ : The Moments Khao Yai ราคาบัตร : บัตรเข้างานอย่างเดียว 700.- บาทต่อคน บัตรพร้อมลานกางเต็นท์ 900.- บาทต่อคน (ลูกค้านำเต็นท์มาเอง)
Line up
12.00 เปิดเข้าจองจุดกางเต็นท์
17.00 ประตูโซนเวทีเปิด
19.00 JUMBO LAMDUAN LATIGO (จัมโบ้ วงลำดวน)
20.30 ธีร์ ไชยเดช
22.30 จบงาน
กำหนดการงานประเพณีออกพรรษาแห่ปราสาทผึ้งและแข่งขันยาวชิงถ้วยพระราชทานฯ จังหวัดสกลนครประจำปี 2567 วันที่ 12-17 ตุลาคม 2567
ขอเชิญเที่ยวงานประเพณีออกพรรษาแห่ปราสาทผึ้งและแข่งขันเรือยาวชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯสยามบรมราชกุมารี จังหวัดสกลนคร ประจำปี 2567 ในระหว่างวันที่ 12-17 ตุลาคม 2567 โดยมีกำหนดการดังนี้
1-11 ตุลาคม 67 กิจกรรมเยือนวิถีชน คนทำปราสาทผึ้ง ร่วมชมและร่วมสัมผัสการรังสรรค์ปราสาทผึ้ง ในโรงปราสาทผึ้งตามคุ้มวัดและชุมชนต่างๆ
12 ตุลาคม 67 พิธีเปิดงาน และการแสดงแสงสีเสียง ณ บริเวณจัดงาน ลานพระบรมรูปรัชกาลที่ 5 ศูนย์ราชการจังหวัดสกลนคร
12-16 ตุลาคม 67 ชนลานวัฒนธรรม กิจกรรมติดดอกผึ้ง การจำหน่ายสินค้าชุมชน ลานอาหารปลอดภัย และการแสดงคอนเสิร์ต ณ บริเวณจัดงาน ลานพระบรมรูปรัชกาลที่ 5 ศูนย์ราชการจังหวัดสกลนคร
12-13 ตุลาคม 67 การแข่งขันเรือยาว ชิงถ้วยพระราชทานฯ สนามแข่งเรือหนองหาร หน้าโรงพยาบาลศูนย์สกลนคร ถ่ายทอดสดรอบชิงชนะเลิศทาง ThaiPBS
15 ตุลาคม 67 ชมการประกวดธิดาปราสาทผึ้ง
16 ตุลาคม 67 ร่วมชมขบวนแห่ปราสาทผึ้งอย่างยิ่งใหญ่ ตลอดเส้นทางขบวนแห่ยาว 2 กิโลเมตร จากสี่แยกหอนาฬิกา ถึงวัดพระธาตุเชิงชุมวรวิหาร
17 ตุลาคม 67 ร่วมทำบุญตักบาตรวันออกพรรษา และชมความสวยงามของปราสาทผึ้งทุกขบวน ณ ลานวัดพระธาตุเชิงชุมวรวิหาร
18 ตุลาคม - 30 พฤศจิกายน 67 กิจกรรมปราสาทผึ้ง เบิ่งได้ตลอดเดือน ณ โรงปราสาทผึ้งวัดพระธาตุเชิงชุมวรวิหาร และทุกวัดในกลุ่มชุมชนที่ทำปราสาทผึ้ง
งานประเพณีแข่งขันเรือยาวสัมพันธ์ไทย-ลาว ชิงถ้วยพระราชทาน วันที่ 14-20 ตุลาคม 2567
ขอเชิญเที่ยวงานประเพณีแข่งขันเรือยาวสัมพันธ์ไทย-ลาว ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราช กรมสมเด็จพระเทพรัตนราชสุดา สยามบรมราชกุมารี วันที่ 14-20 ตุลาคม 2567 ณ ริมน้ำโขงหน้าเทศบาลชานุมาน อ.ชานุมาน จ.อำนาจเจริญ
ประเพณีออกพรรษาจุดไฟตูมกา ออกพรรษายโสธรวันที่ 15-17 ตุลาคม 2567 วัดบูรพา บ้านทุ่งแต้
เชิญเที่ยวประเพณีออกพรรษาจุดไฟตูมกา ออกพรรษายโสธรวันที่ 15-17 ตุลาคม 2567 ณ วัดบูรพา บ้านทุ่งแต้ ต.ทุ่งแต้ อ.เมือง จ.ยโสธร
สำหรับการจุดไฟตูมกา เป็นประเพณีของชาวบ้านทุ่งแต้ ตำบลทุ่งแต้ อำเภอเมืองยโสธร ที่มีมาแต่ช้านานพร้อมกับการก่อตั้งหมู่บ้านโดยดั้งเดิมชาวบ้านจะนำผลตูมกามาคว้านเอาเมล็ดข้างในออก เจาะฉลุลวดลายให้สวยงาม นำเทียนไขจุดไว้ข้างในลูกตูมกาแล้วถือไปถวายเป็นพุทธบูชาในวัด ในคืนวันออกพรรษา ซึ่งเป็นวิถีชีวิตของชาวบ้าน พุทธศาสนิกชนในอดีต ต่อมาวิถีชีวิตนี้ได้เลือนหายไป เนื่องจากมีความเจริญและมีไฟฟ้าใช้ ต่อมาชาวบ้านทุ่งแต้ ได้เริ่มรื้อฟื้นการจุดไฟตูมกาในช่วงวันออกพรรษาให้กลับมาอีกครั้ง และได้เพิ่มเติมกิจกรรมอื่นเข้าไปด้วย เพื่อให้ชาวบ้าน เยาวชน และนักเรียน ได้ร่วมกิจกรรมอย่างพร้อมเพรียงกันและ เพื่อเป็นการสืบสานการจุดไฟตูมกาในช่วงวันออกพรรษา ซึ่งเชื่อกันว่าเป็นการถวายเป็นพุทธบูชา พระพุทธเจ้าในโอกาสเสด็จกลับจากสรวงสวรรค์ เนื่องจากเสด็จไปเทศนาโปรดพระพุทธมารดา ชาวพุทธทั้งหลายจึงแสดงความปิติยินดี ด้วยเครื่องสักการบูชา คือจุดไฟตูมกาแล้วแขวนไว้บูชาเพื่อให้ชีวิตประสบแต่ความสุข สงบและเจริญรุ่งเรือง
งานประเพณี ต่างซอมต่อโหลง ปอยออกหว่าพาราลงเมิง 16-17 ตุลาคม 2567
งานประเพณี "ต่างซอมต่อโหลง ปอยออกหว่าพาราลงเมิง" วันที่ 16-17 ตุลาคม 2567 (วันออกพรรษา) ณ วัดไทยวัฒนาราม อ.แม่สอด จ.ตาก เทศกาลพระพุทธเจ้าเสด็จจากดาวดึงส์ถวายข้าวพระพุทธขึ้น 15 ค่ำ เดือน 11
16 ตุลาคม 2567 รำวงหรรษา ออกพรรษา กวนข้าวทิพย์
เทศบาลเมืองร้อยเอ็ด ชวนเที่ยวงานบรรยากาศย้อนยุค "รำวงหรรษา ออกพรรษา กวนข้าวทิพย์ " วันที่ 16 ตุลาคม 2567 ณ ลานสาเกตนคร หอโหวด๑๐๑ เนรมิตบรรยากาศย้อนยุค กับแฟชั่นย้อนยุคสีสันคัลเลอร์ฟูล ที่จะมาสร้างบรรยากาศย้อนยุคย้อนวัยให้แก่ชาวเทศบาลเมืองร้อยเอ็ด ภายในงานท่านจะได้ ” สนุกกับรำวงย้อนยุคพร้อมหางเครื่องสาวสวยอีกมากมาย“ และชมการประกวดกวนข้าวทิพย์ ประกวดประทีปโคมไฟสวยงาม
กิจกรรมพายเรือคายักท่องเที่ยวป่าชายเลนอ่าวคุ้งกระเบน 16 ตุลาคม 2567 LINK
ศูนย์ศึกษาและพัฒนาป่าไม้อ่าวคุ้งกระเบน จ.จันทบุรี กำหนดเปิดให้บริการกิจกรรมพายเรือคายักท่องเที่ยวป่าชายเลนอ่าวคุ้งกระเบน ตั้งแต่วันที่ 16 ตุลาคม 2567 เป็นต้นไป
เปิดให้บริการทุกวันเวลา 09.00 น. - 15.30 น. (เวลาการให้บริการ พายเรือคายัก อาจมีการปลี่ยนแปลง ขึ้นอยู่กับการขึ้น - ลงของน้ำทะเล )
สอบถามรายละเอียดเพิ่มเติมได้ที่ โทร. 039–460771 ในวันและเวลาราชการ
ออกพรรษาบั้งไฟพญานาคโลกปี 2567 วันที่ 17 ตุลาคม 2567 พบกับ แอนโทเนีย โพซิ้ว รองอันดับหนึ่งมิสยูนิเวิส 2023
ออกพรรษาบั้งไฟพญานาคโลกปีนี้ พบกับ แอนโทเนีย โพซิ้ว รองอันดับหนึ่งมิสยูนิเวิส 2023 วันที่ 17 ตุลาคม 2567 โดย เทศบาลตำบลโพนพิสัย หนองคาย ออกพรรษาบั้งไฟพญานาคโลก2567 ออกพรรษานี้ที่หนองคาย ประเพณีออกพรรษาบั้งไฟพญานาคโลกหนองคาย 2567
งานประเพณีออกพรรษาบั้งไฟพญานาคโลกและประเพณีแข่งเรือยาวโพนพิสัย ปี2567 วันที่ 17 ตุลาคม
เทศกาลงานประเพณีออกพรรษาบั้งไฟพญานาคโลกและประเพณีแข่งเรือยาวชิงถ้วยพระราชทานประจำปี 2567 วันที่ 17 ตุลาคม 2567 ณ เทศบาลตำบลโพนพิสัย ร่วมชมปรากฏการณ์บั้งไฟพญานาค และการไหลเรือไฟของชุมชนต่างๆ ตลอดแนวลำน้ำโขงอำเภอโพนพิสัย และนางรำชาวโพนพิสัย 1,000 ชีวิต ร่วมรำบวงสรวงองค์พญาพิสัยสัตนาคราช ณ ลานนาคาเบิกฟ้าเฟส 1 และ ไฮไลท์งาน พลาดไม่ได้กับการต้อนรับ ️️แอนโทเนีย โพซิ้ว รองอันดับ 1 มิสยูนิเวิร์ส 2023 มาร่วมงาน กิจกรรมเด่นในประจำวัน
16 ตุลาคม กิจกรรม "ปั่นตามรอยนาคา" ประจำปี 2567
17 ตุลาคม ชมพิธีรําบวงสรวงบูชาพญาพิสัยสัตนาคราช เนื่องในงานประเพณีออกพรรษาบั้งไฟพญานาคโลก ประจําปี 2567 นําโดย แอนโทเนีย โพซิ้ว รองอันดับ 1 มิสยูนิเวิร์ส 2023 พร้อมนํางรํา จํานวน 1,000 คน ชมการไหลเรือไฟวิทยาศาสตร์ จากชุมชน 8 ชุมชน ชมการประกวด Mister Tourism Intercontinental 2024
18 ตุลาคม ชมการประกวดเทพีบั้งไฟพญานาคโลก (สาวประเภท2)
19 ตุลาคม ชมการประกวดธิดาบั้งไฟพญานาคโลก ประจําปี 2567
20 ตุลาคม ชมการแสดงจากศิลปิน เต้ย อธิบดินทร์
21 ตุลาคม ชมการแสดงจากศิลปิน บุ๊ค ศุภกาญจน์
22 ตุลาคม ชมการประกวดร้องเพลงลูกทุ่งหมอลํา ผู้นําชุมชนอําเภอโพนพิสัย ประจําปี 2567
23 ตุลาคม ชมเชียร์การแข่งขันเรือยาวชิงถ้วยพระราชทานฯ ประเภทไม่เกิน12 ฝีพาย
(ท่าน้ำวัดไทย-ท่าน้ำวัดจอมนาง) กลางคืนพบกับนักร้องยอดฮิต แพรวพราว แสงทอง
24 ตุลาคม ชมกํารประกวดร้องเพลงลูกทุ่งประชาชนทั่วไป ประจําปี 2567
25 ตุลาคม ชมการแข่งขันเรือยาวชิงถ้วยพระราชทานฯ ประเภทเรือประเภทไม่เกิน 30 ฝีพาย (ท่าน้ำวัดไทย-ท่าน้ำวัดจอมนาง) กลางคืนพบกับน้องร้องสุดหล่อ เบียร์ พร้องพงษ์
ตลอดการจัดงานมีการจำหน่ายสินค้าของใช้ของกินเครื่องเล่นสวนสนุกมากมายเพื่อการกระตุ้นเศรษฐกิจและสร้างความเชื่อมั่นในการค้าขายและส่งเสริมอนุรักษ์ประเพณีอันดีงานของชาวโพนพิสัยให้เป็นที่ท่องเที่ยวระดับโลก
Cr : วัชรพงษ์ โพธิ์ศรีไมล์
การแข่งขันเรือยาวประเพณีจังหวัดนครสวรรค์ ประจำปี 2567 ชิงถ้วยพระราชทาน 18-27 ตุลาคม 2567
ขอเชิญเที่ยวงานการแข่งขันเรือยาวประเพณีจังหวัดนครสวรรค์ ประจำปี 2567 ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตน์ราชสุดาฯ สยามบรมราชกุมารี วันที่ 18-27 ตุลาคม 2567 นี้ ชมฟรี‼️ สนามแข่งเรือ ต้นแม่น้ำเจ้าพระยา หน้าศาลากลางจังหวัดนครสวรรค์
✅ 24-25 ตุลาคม 67 แข่งขันเรือตะเข้(กลางคืน)
✅ 26-27 ตุลาคม 67 แข่งขันเรือยาว(กลางวัน)
✅ 27 ตุลาคม 67 เวลา 15.00 น.-17.00 น.
ถ่ายทอดสด ภายในงานมีสินค้าออกจำหน่ายให้ได้ช็อปกันอย่างหลากหลาย และทุกคืนมีการแสดงคอนเสิร์ตของนักร้องชื่อดังมากมายมาร้องเพลงสร้างความสุขให้กับผู้ชมที่มาเที่ยวงาน
เทศกาล Jazz Arabica 18 ตุลาคม 2567 ลานก้ามปู Jing Jai Market Chiang Mai
เทศกาล Jazz Arabica เสียงดนตรีแจ๊สและดนตรีพื้นเมือง ที่บรรเลงในบรรยากาศที่อบอุ่นและเป็นกันเอง มาร่วมแบ่งปันเรื่องราวดีๆไปกับพวกเราในงาน “Jazz Arabica #2” วันศุกร์ ที่ 18 ตุลาคม เวลา 10.00-20.00 น. บริเวณลานก้ามปู Jing Jai Market Chiang Mai
งาน Amazing Phuket surf festival 2024 การแข่งขันกระดานโต้คลื่นจังหวัดภูเก็ต สนามที่ 4 วันที่ 19 -21 ตุลาคม 2567
งาน Amazing Phuket surf festival 2024 การแข่งขันกระดานโต้คลื่นจังหวัดภูเก็ต โดยปีนี้จะพบกันถึง 4 สนามแข่ง ได้แก่
- หาดกะรน Karon Fins Fest 2024 ในวันที่ 27 - 28 กรกฎาคม 2567
- หาดกมลา Beach Break @Kamala 2024 ในวันที่ 16 -18 สิงหาคม 2567
- หาดกะหลิม Kalim Patong Surfing contest 2024 ในวันที่ 30 สิงหาคม - 1 กันยายน 2567
- หาดป่าตอง Pearl of Andaman Surfing Contest 2024 ในวันที่ 19 -21 ตุลาคม 2567
สนุกเต็มที่ไปพร้อมกันตลอดฤดูกาลโต้คลื่นภูเก็ต
Amazing Phuket Surf festival 2024 มาพร้อมกับกิจกรรมต่างๆมากมาย อาทิ เช่น
Food - ชอปชิมจากร้านอาหารมากมาย
Art - work shop - กิจกรรมงานศิลปะ
Music - วงดนตรีและเสียงเพลง
Amazing Phuket Surf Festival งานดีๆ ที่เหมาะสำหรับคนที่ชอบโต้คลื่น กับดนตรีและศิลปะ ห้ามพลาด ที่ภูเก็ต
เทศกาลดนตรีและปาร์ตี้เรืองแสง ZEADOM FEST 19 ต.ค. 2567
เทศกาลดนตรีและปาร์ตี้เรืองแสง ZEADOM FEST ณ TRIPLE TREE BEACH RESORT หาดชะอำเหนือ วันที่ 19 ต.ค. 2567 พร้อมเสียงเพลงจากศิลปินตัวจี๊ดอีกมากมาย NONT TANONT, ATLAS, PIXXIE, TATTOO COLOUR, TILLYBIRDS, TIMETHAI, YOURMOOD, ZEAL, CHILEE, DJ P-U
สุโขทัย มาราธอน ครั้งที่ 2 วันที่ 20 ตุลาคม 2567
สุโขทัย มาราธอน ครั้งที่ 2 พร้อมกลับมาสร้างความสุข บนเส้นทางประวัติศาสตร์อีกครั้ง แข่งขันวันที่ 20 ตุลาคม 2567 ณ อุทยานประวัติศาสตร์ สุโขทัย
Amazing Nan Marathon เลื่อนเป็นวันที่ 20 ตุลาคม 2567 เหตุน้ำท่วมน่าน
จากเหตุอุทกภัยในพื้นที่จ.น่าน Amazing Nan Marathon ได้เลื่อนวันจัดกิจกรรม เป็นวันที่ 20 ตุลาคม 2567 ติดตามข้อมูล/ประกาศจากเพจ
facebook.com/marathonofnanKhaoyai Half Marathon 20 ตุลาคม 2567
Khaoyai Half Marathon 2024 จัดที่ Chante Cafe อ.ปากช่อง จ.นครราชสีมา วันที่ 20 ตุลาคม 2567 ระยะแข่งขัน 21.1K / 10.5K / 5K / VIP
งานนมัสการองค์พระสมุทรเจดีย์และงานกาชาดสมุทรปราการ 2567 เริ่ม 22 ตุลาคม ถึง 2 พฤศจิกายน 2567
งานนมัสการองค์พระสมุทรเจดีย์และงานกาชาดจังหวัดสมุทรปราการ ปี 2567 ที่จะเริ่มในวันที่ 22 ตุลาคม ถึง 2 พฤศจิกายน 2567 ณ ศาลากลางจังหวัดสมุทรปราการ และองค์พระสมุทรเจดีย์ ในงานมีร้านค้า พร้อมอาหารคาวหวาน รสชาติดี ราคาถูก พร้อมสินค้าชุมท้องท้องถิ่นที่หาชิมได้แค่ที่นี่ที่เดียว นอกจากนี้ยังมีเครื่องเล่นหลากหลายประเภทที่เตรียมไว้ให้น้อง ๆ หนู ๆ ที่ไปเที่ยวกับครอบครัวได้สนุกสนานอีกด้วย
ASEAN Café Show 2024 วันที่ 24-27 ตุลาคม 2567
งาน
ASEAN Café Show วันที่ 24-27 ต.ค. 2567 ไบเทค บางนา กรุงเทพฯ งานแสดงสินค้าสำหรับธุรกิจคาเฟ่ ร้านเบเกอรี่ ชา ไอศครีม และของหวานแบบครบวงจร ที่ครบเครื่องทั้งอุปกรณ์ เครื่องใช้สำหรับร้านคาเฟ่ ร้านเบเกอรี่และ F&B โรงแรมที่ทันสมัยและวัตถุดิบที่มีคุณภาพ รวมถึงโซลูชันสำหรับร้านค้าแบบครบวงจร การรวมตัวของผู้ผลิต ผู้นำเข้า และตัวแทนจำหน่ายตั้งแต่อุปกรณ์ล้ำสมัย วัตถุดิบชั้นดี ไปจนถึงระบบบริหารร้านค้าและการทำการตลาดที่ทันสมัยสำหรับการเปิดร้าน ขยายสาขา หรือทดแทนสินค้าเดิม
คอนเสิร์ตรับลมหนาว "ฮักน่าน" ณ ยอดเขาลานแดนพนาปัว 25 ตุลาคม 2567
ชมคอนเสิร์ตรับลมหนาว "ฮักน่าน" ณ ยอดเขาลานแดนพนาปัว...วันที่ 25 ตุลาคม 2567 ศิลปิน..หงา คาราวาส, คาราบาว, พยัพ คำพันธุ์, สีเผือก คนด่านเกวียน, บ่าววี อาร์สยาม รายได้ช่วยเหลือโรงพยาบาลปัวจ.น่าน,โรงพยาบาลจ.พัทลุง,เครือข่าย 14 ตุลาคม,สภอ.ปัว,เยาวชนจิตอาสาจ.น่าน
งานประเพณีวิ่งควาย เทศบาลชุมแสง วันที่ 25 ตุลาคม - 3 พฤศจิกายน 2567
ขอเชิญเที่ยวงานประเพณีวิ่งควาย เทศบาลชุมแสง วันที่ 25 ตุลาคม - 3 พฤศจิกายน 2567 เทศบาลชุมแสง อำเภอวังจันทร์ จังหวัดระยอง ชมการแสดงคอนเสิร์ต ตลอด 10 คืน 25 ต.ค. 67 คอนเสิร์ต ทิดแอม 26 ต.ค. 67 คอนเสิร์ต ขิม เบญญา 27 ต.ค. 67 คอนเสิร์ต ร็อคคงคย 28 ต.ค. 67 คอนเสิร์ต แพนเค้ก กชกร 29 ต.ค. 67 คอนเสิร์ต วันเวย์มิวสิค 30 ต.ค. 67 คอนเสิร์ต ลิ้นจี่ CMM 31 ต.ค. 67 คอนเสิร์ต วง L.กฮ. 1 พ.ย. 67 คอนเสิร์ต มนต์แคน แก่นคูน & ชิตนัยมิวสิค 2 พ.ย. 67 คอนเสิร์ต บัว กมลทิพย์ 3 พ.ย. 67 คอนเสิร์ต บิ๊ก สุรินทร์
เทศกาลแสงสีสิงห์ ปี 2567 วันที่ 25 ตุลาคม - 3 พฤศจิกายน 2567 ธีม “เสน่ห์สิงห์ เสน่ห์ไทย”
เทศกาลแสงสีสิงห์ ปี 2567 วันที่ 25 ตุลาคม - 3 พฤศจิกายน ปีนี้ มาใน ธีม “เสน่ห์สิงห์ เสน่ห์ไทย” LET’S GLOW SINGBURI ขบวนพาเหรด “เสน่ห์สิงห์ เสน่ห์ไทย” ยกทัพมนต์เสน่ห์สิงห์บุรี เป็นขบวนคานิวัล
กิจกรรมในงาน มากมาย ตั้งแต่ การแสดง แสง สี เสียง ตระการตา หนังกลางแปลง คอนเสิร์ตศิลปินดัง ทุกค่ำคืน ดนตรีคลาสสิค และเต้นรำ ยุค 70 ณ โรงภาพยนต์ เมืองทองรามา ตามหา ใจใจสิงห์ ทั้ง 4 จุด ถ่ายภาพกับคอร์สวอร์คอาร์ท ร้านค้า ร้านอาหารเจ้าดัง จุใจ ชมไฟ นีออนไลท์อาร์ท ตลอดเส้นทาง
ชมการแสดงดนตรี 25 ตุลาคม พบ.ปลาตะเพียน 26. ตุลาคม พบ พลอย เดอะวอยซ์ 27. ตุลาคม พบ Somluedee 28.ตุลาคม พบ ไม้เลื้อยแบนด์ 29.ตุลาคม พบ บังนัส ฟิวเจอร์แบนด์ 30.ตุลาคท พบ แมงมุมแบนด์ 31. ตุลาคม พบ วิด ไฮเปอร์ 1 พฤศจิกายน พบ ศรสุพรรณโชว์ 2.พฤศจิกายน พบ หลี่ซัง ไหทองคำ 3.พฤศจิกายน พบ บอย ก็อปปี้โชว์ คาราบาว #SangSeeSing โทร 088-2141111 โดย สมาคมส่งเสริมการท่องเที่ยวจังหวัดสิงห์บุรี และ การท่องเที่ยวแห่งประเทศไทย
งาน มหกรรม ช้อป ฟิน กินคุ้ม วันที่ 25-27 ตุลาคม 2567
BETAGRO ขอเชิญเที่ยวงาน มหกรรม ช้อป ฟิน กินคุ้ม วันที่ 25-27 ตุลาคม 2567 ตั้งแต่ 15:00 - 22:00 น. ณ Robinson Lifestyle Phetchaburi โรบินสัน ไลฟ์สไตล์ เพชรบุรี} อำเภอบ้านลาด จังหวัดเพชรบุรี มหกรรมอาหารสุดยิ่งใหญ่ ที่ยกเอาความอร่อยรวม 300 ร้านค้ามาเสริ์ฟให้ทั่วทั้ง 5 ภาค
เที่ยวงาน แสง สี สิงห์ 25 ต.ค. - 3 พ.ย. 2567
ททท.จังหวัดสิงห์บุรีเชิญเที่ยวงาน แสง สี สิงห์ ณ. สนามหน้าศาลากลางเก่า รศ.130 25 ต.ค. - 3 พ.ย. 67
งานมหกรรมสินค้าพาณิชย์ปันสุข สุโขทัย 25 ตุลาคม - 3 พฤศจิกายน 2567
ขอเชิญเที่ยวชม งานมหกรรมสินค้าพาณิชย์ปันสุข สุโขทัย 25 ตุลาคม - 3 พฤศจิกายน 2567 บริเวณริมแม่น้ำศาลแม่ย่า จ.สุโขทัย ชิมช็อปใช้ Street Food Festival พิธีเปิดยิ่งใหญ่ สินค้ามากมาย สินค้าโอท็อป สินค้าพื้นบ้าน สินค้าเกษตร สินค้าโรงงาน มหกรรมเฟอร์นิเจอร์ ไม้ดอก ไม้ประดับ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกคืน
งานเทศกาลไม้ดอก ไม้ประดับ และอาหาร บริเวณสะพานขาว อ.ชัยบาดาล ลพบุรี วันที่ 25 ตุลาคม ถึง 3 พฤศจิกายน 2567
โครงการหนึ่งใจให้ประชาชน โดยมูลนิธิ มิราเคิล ออฟ ไลฟ์ ชวน "กินเที่ยวใช้" ในงานเทศกาลไม้ดอก ไม้ประดับ และอาหาร บริเวณสะพานขาว อ.ชัยบาดาล ลพบุรี วันที่ 25 ตุลาคม ถึง 3 พฤศจิกายน 2567 พบกับการออกร้านจำหน่ายสินค้ามากมาย ของกิน ของใช้ ของอร่อย เฟอร์นิเจอร์ ไม้ดอกไม้ประดับ สัตว์เลี้ยง ชมการแสดงคอนเสิร์ตและศิลปินดนตรี ทุกคืน สวนสนุกชุดใหญ่
เทศกาลอาหารดีดนตรีดังและบอลลูนนานาชาติ ราชบุรี 25 ตุลาคม - 3 พฤศจิกายน 2567
สโมสรโรตารี พลอยราชบุรี เชิญเที่ยวงาน เทศกาลอาหารดีดนตรีดังและบอลลูนนานาชาติ โรตารี พลอยราชบุรี ปี 2567 บริเวณตลาดศรีเมือง อาคาร 18 อ.เมือง ราชบุรี วันที่ 25 ตุลาคม - 3 พฤศจิกายน 2567 ชมชิมช็อปอาหารอร่อย สินค้าโรงงานราคาถูก สินค้าท้องถิ่นโอทอป ไม้ดอกไม้ประดับ เฟอร์นิเจอร์ ภาพยนต์ สวนสนุกชุดใหญ่ ศิลปินดัง ทุกคืน วง Full มาลีฮวนนา น้ำฝน Copy คาราบาล รถแห่ เธค ปิดท้ายคืน 3 พ.ย. โป่งหินเหล็กไฟ
กิจกรรม Food as Medicine ครั้งที่ 3 วันที่ 26-28 ตุลาคม 2567
กิจกรรม Food as Medicine ครั้งที่ 3 วันที่ 26-28 ตุลาคม 2567 ณสุข เวลเนส รีสอร์ท Na Sook Wellness Resort ภายใต้หัวข้อ Plant Power : The art of vegetariant food therapy พลังแห่งพืช : ศิลปะการกินอาหารมังสวิรัติ สู่สุขภาพดี
ร่วมเดินทางไปกับเรากับเเพคเกจ 3 วัน 2 คืน เพื่อไปสู่การดูเเลสุขภาพที่ยั่งยืน สร้างประสบการณ์ใหม่ ในการฟื้นฟูร่างกาย จิตใจ และจิตวิญญาณ อย่างลึกซึ้ง โดยเน้นไปที่ประโยชน์ของการกินอาหารจากพืช ภายใต้ธีม ศิลปะการกินอาหารมังสวิรัติ สู่สุขภาพดี พร้อมไปกับการฟังคลื่นเสียงในหลายๆรูปแบบ เเละการทำสมาธิที่มีเอกลักษณ์เฉพาะ
วันปล่อยเสือ 4 สามัคคีชุมมันส์ เทศกาลดนตรี นอนกางเต็นท์ เล่นกลางป่า 26-27 ตุลาคม 2567
วันปล่อยเสือ 4 สามัคคีชุมมันส์ เสาร์-อาทิตย์ 26-27 ตุลาคม 2567 ค่ายลูกเสือ ภูริทัศ มวกเหล็ก สระบุรี เทศกาลดนตรี นอนกางเต็นท์ เล่นกลางป่า 2 วัน 6 เวที กว่า 80 ศิลปิน 10 ZONE กิจกรรม
งานงิ้วโนนดินแดง ศาลเจ้าพ่อหนองหงส์ อ.โนนดินแดง จ.บุรีรัมย์ วันที่ 29 ตุลาคม - 4 พฤศจิกายน 2567
งานงิ้วโนนดินแดง ศาลเจ้าพ่อหนองหงส์ อ.โนนดินแดง จ.บุรีรัมย์ วันที่ 29 ตุลาคม - 4 พฤศจิกายน 2567 บริเวณถนนคู่ขนานหน้าตลาด ชมการแสดง ศิลปินดัง ร๊อคคงคย ลิเกวรต้อ เนสกาแฟ ศรีนคร
โปรแกรมท่องเที่ยวเดือนมกราคม 2567
โปรแกรมท่องเที่ยวเดือนมกราคม 2567 มีรายละเอียดเส้นทางต่างๆ ดังต่อไปนี้
ออกหน่วยฉีดวัคซีน ฟรี (มกราคม-มีนาคม-เมษายน 2567)
กำหนดการหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จุดต่างๆ ดังนี้ (จากเพจ
กลุ่มควบคุมโรคพิษสุนัขบ้า)
- วันอังคารที่ 23 มกราคม 2567 ชุมชนบ้านคลองเก้า แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 มกราคม 2567 ชุมชนสหกรณ์ 93 คลองสิบ แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 26 มกราคม 2567 ชุมชนประชาอุทิศ แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 30 มกราคม 2567 ชุมชนหมู่ 4 พัฒนา แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 31 มกราคม 2567 ชุมชนประชาสำราญ แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 1 กุมภาพันธ์ 2567 ที่ชุมชนนำไกร หมู่ 9 แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 6 กุมภาพันธ์ 2567 ชุมชนแผ่นดินทองวัดพระยาปลา แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 7 กุมภาพันธ์ 2567 ชุมชนบ้านคลองนาหมอน แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 13 กุมภาพันธ์ 2567 ชุมชนหมู่ 6 ก้าวหน้า แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 16 กุมภาพันธ์ 2567 ชุมชนสุทธาวาส แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 20 กุมภาพันธ์ 2567 ชุมชนกิตติเหมกรณ์ แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 21 กุมภาพันธ์ 2567 ชุมชนอัลฟาลาห์ แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 22 กุมภาพันธ์ 2567 ชุมชนเลียบคลองมอญ (ตั้งจุดฉีดวัคซีนที่วัดสุทธาโภชน์) แขวงทับยาว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันศุกร์ที่ 23 กุมภาพันธ์ 2567 แฮปปี้ คอนโด (บริเวณ Dog Park อาคารเซาท์) ซอยลาดพร้าว 101 แขวงคลองเจ้าคุณสิงห์ เขตวังทองหลาง เวลา 9.00 - 11.30 น.
- วันอังคารที่ 27 กุมภาพันธ์ 2567 ชุมชนอุมาร์ 2 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 28 กุมภาพันธ์ 2567 ชุมชนแผ่นดินทองสะฟีรุสซาลาม แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 29 กุมภาพันธ์ 2567 ชุมชนทิวไผ่พัฒนา แขวงลำปลาทิว เขตลาดกระบัง เวลา 9.00 - 11.30 น.
- วันจันทร์ที่ 18 มีนาคม 2567 ชุมชนวัฒนานันท์ แขวงดอนเมือง เขตดอนเมือง เวลา 9.00 - 11.00 น.
- วันอังคารที่ 19 มีนาคม 2567 กรมสรรพาวุธทหารบก แขวงถนนนครไชยศรี เขตดุสิต เวลา 9.30 - 11.30 น.
- วันพุธที่ 20 มีนาคม 2567 ชุมชนรามอินทรา 83 , 85 แขวงรามอินทรา เขตคันนายาว เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 22 มีนาคม 2567 ชุมชนหมู่บ้านพัฒนา หมู่ 12-13 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 26 มีนาคม 2567 ชุมชนแผ่นดินทองดารุ้ลฮาซานัย แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 27 มีนาคม 2567 ชุมชนก้าวใหม่พัฒนาบึงปรง แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 28 มีนาคม 2567 ชุมชนทิวสนร่วมจิตมณียา แขวงทับยาว เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 29 มีนาคม 2567 ชุมชนแผ่นดินทองดารุ้ลฮาซานัย แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 2 เมษายน 2567 ชุมชนสะพานปูน แขวงดอนเมือง เขตดอนเมือง เวลา 9.30 - 11.30 น.
- วันพุธที่ 3 เมษายน 2567 เคหะชุมชนบางนา 2 เขตบางนา
- วันพฤหัสบดีที่ 4 เมษายน 2567 ชุมชนเคหะรามอินทรา กม.4 แขวงท่าแร้ง เขตบางเขน เวลา 9.30 - 11.30 น.
- วันพุธที่ 10 เมษายน 2567 ณ วัดปรินายกวรวิหาร เขตพระนคร
- วันพฤหัสบดีที่ 18 เมษายน 2567 ชุมชนอัลฟาลาห์ แขวงคลองสิบ เขตหนองจอก
- วันศุกร์ที่ 19 เมษายน 2567 ที่ชุมชนก้าวไกลพัฒนา แขวงคลองสิบสอง เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 23 เมษายน 2567 ที่ชุมชนหมู่บ้านพัฒนา หมู่ 12-13 แขวงคลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 24 เมษายน 2567 ที่ชุมชนแผ่นดินทองดารุ้ลนาฮีม แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 30 เมษายน 2567 ที่หมู่บ้านเคหะธานี 4 แขวงราษฎร์พัฒนา เขตสะพานสูง เวลา 9.00 - 11.30 น.
ออกหน่วยทำหมัน ฟรี (มกราคม 2567)
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนมกราคม 2567 (สอบถามโทร 02-2487417 02-2453311)
- 3 ม.ค. เวลา 9-12.00 น. ชุมชนวังทอง ดอนเมือง และ เวลา 9-12.00 น. ชุมชนสามัคคีเทวสุนทร เขตจตุจักร
- 4 ม.ค. เวลา 9-12.00 น. ชุมชนผู้ใหญ่ชม เขตคันนายาว / 9-12.00 น. วัดเทวีวรญาติ เขตป้อมปราบฯ [แผนที่]
- 5 ม.ค. เวลา 9-12.00 น. ชุมชนนำไกร เขตลาดกระบัง / 9-12.00 น. ชุมชนสินทรัยพ์นคร เขตบางเขน
- 9 ม.ค. เวลา 9-12.00 น. ซอยมัสยิดบ้านสมเด็จ เขตธนบุรี / 9-12.00 น. ตลาดบางพัฒนา เขตบางพลัด
- 10 ม.ค. เวลา 9-12.00 น. วันจันทน์ใน เขตบางคอแหลม / 9-12.00 น. วัดทุ่งครุ เขตทุ่งครุ
- 11 ม.ค. เวลา 9-12.00 น. ชุมชนนูรุ้ลอิสลาม เขตมีนบุรี / 9-12.00 น. ชุมชนโฟร์โมสต์ เขตบางขุนเทียน
- 12 ม.ค. เวลา 8-14.00 น. ศูนย์นันทนาการคลองเตย เขตคลองเตย
- 16 ม.ค. เวลา 9-12.00 น. ชุมชนปรีชา เขตยานนาวา / 9-12.00 น. ชุมชนสามัคคี 53 เขตบึงกุ่ม
- 17 ม.ค. เวลา 9-12.00 น. สถานที่ ชุมชนร่วมกันสร้าง เขตบางกะปิ / 9-12.00 น. ชุมชนหมู่บ้านรางไผ่ เขตบางบอน
- 18 ม.ค. เวลา 9-12.00 น. หมู่บ้านซิลค์วิลเลจ เขตสายไหม / 9-12.00 น. ศูนย์ฯ 45 เขตลาดกระบัง
- 19 ม.ค. เวลา 9-12.00 น. โรงเรียนมะเซาะฮะดุดดีน 2 เขตสะพานสูง
- 23 ม.ค. เวลา 9-12.00 น. ชุมชนแฟลต 11-18 เขตคลองเตย / 9-12.00 น. วัดสวัสดิ์วารีสีมาราม เขตดุสิต
- 24 ม.ค. เวลา 9-12.00 น. ชุมชนเคหะทุ่งสองห้อง 310 เขตหลักสี่ / 9-12.00 น. หมู่บ้านเคซีการเด้นโฮม เขตคลองสามวา
- 25 ม.ค. เวลา 9-12.00 น. ตลาดผู้ใหญ่อ้วน เขตลาดพร้าว
- 26 ม.ค. เวลา 9-12.00 น. ชุมชนศาลเจ้าพ่อเสือ เขตพระนคร / 9-12.00 น. สวนเฉลิมพระเกียรติใต้สะพานตากสิน (ลงทะเบียนหน้างาน) เขตคลองสาน
THE SUN night party 2024 นครนายก
THE SUN night party 2024 นครนายก 9 พฤศจิกายน 2567 งานครบรอบ 15 ปี กลุ่ม THE SUN @ ณ ปานีวิลล์รีสอร์ท จังหวัดนครนาย
Ironhorse เชียงใหม่ 10th 2 พฤศจิกายน 2567
Ironhorse เชียงใหม่ ฉลองครบรอบ 10 ปี วันที่ 2 พฤศจิกายน 2567 เวลา 18.00-24.00 น. พบกันที่ ลานกิจกรรม Modern education mall
แยกหลุยส์ สันกำแพง เชียงใหม่ (ห้ามพกอาวุธมาในงาน ทะเลาะวิวาทปรับ 200,000 บาท)
Loei Bike Week 2024 - 9 พฤศจิกายน 2567
หนาวนี้ เตรียมไปลุยกันในงานเลยไบค์วีค Loei Bike Week 9 พฤศจิกายน 2567 ณ Silver Rock Bike Park ชมคอนเสริ์ตร๊อคสตาร์ หินเหล็กไฟ (รายได้หลังหักค่าใช้จ่ายมอบให้โรงเรียนขาดแคลนในจ.เลย)
งานบุญควายสุพรรณ ครบรอบ 9 ปี 23 พฤศจิกายน 2567
งานบุญควายสุพรรณ (KHWAI SUPHAN) ครบรอบ 9 ปี เสาร์ที่ 23 พฤศจิกายน 2567 ณ โรงเรียนวัดประชุมชน อ.เมือง สุพรรณบุรี วัตถุประสงค์เพื่อมอบเงินรายได้จัดซื้อคอมพิวเตอร์ให้กับโรงเรียน
ประเพณีลอยกระทงพัทยา ประจำปี 2567
เมื่อถึงเดือนพฤศจิกายน ก็ต้องนึกถึงงานประเพณีลอยกระทงพัทยาประจำปี (LOY KRATHONG PATTAYA FESTIVAL) ซึ่งกำหนดจัดงานต้องรอประกาศอีกครั้ง (สำหรับงานประเพณีลอยกระทงพัทยาประจำปี 2566 ที่ผ่านไป จัดเมือวันที่ 27พฤศจิกายน 2023 @ Central Pattaya Beach ณ ชายหาดพัทยากลาง)ปฏิทินกิจกรรมในจ.น่าน เดือนพฤศจิกายน 2567
งานประเพณีพิธีอัญเชิญหลวงพ่อโสธร ขึ้นจากแม่น้ำบางปะกง ประจำปี 2567 วันที่ 20-24 เมษายน
งานประเพณีพิธีอัญเชิญหลวงพ่อโสธร ขึ้นจากแม่น้ำบางปะกง ประจำปี 2567 วันที่ 20-24 เมษายน ณ วัดโสธรวราราม วรวิหาร กำหนดการรายวันดังนี้
จันทร์ที่ 22 เมษายน 2567
14.00 น. พิธีอัญเชิญหลวงพ่อโสธรขึ้นจากแม่น้ำบางปะกง
16.00 น. พิธีเจริญพระพุทธมนต์ ธัมมจักกัปปวัตตนสูตร และ พิธีพุทธาภิเษกวัตถุมงคลของวัด
18.00 น. คณะนางรำถวายหลวงพ่อโสธร จำนวน 2,540 คน
20, 21, 22, 24 เมษายน 2567
17.00 น. พิธีเจริญพระพุทธมนต์ ธัมมจักกัปปวัตตนสูตร และ พิธีพุทธาภิเษกวัตถุมงคลของวัด เปิดพระอุโบสถให้สักการะองค์หลวงพ่อโสธร จนถึงเวลา 22.00 น. และช่วงกลางคืน มีการแสดงโขนจากกรมศิลปากร และการแสดงของนักเรียน นักศึกษา เพื่ออนุรักษ์ศิลปวัฒนธรรมไทย
เดือนพฤศจิกายน 2567 รวม 24.79 ล้านราย
ยอดจำนวนผู้ประกันตนในระบบประกันสังคม ทั่วประเทศ เดือนพฤศจิกายน 2567 มีผู้ประกันตนในระบบประกันสังคมทุกมาตราคือ 33, 39, 40 รวม 24,796,332 ราย
Glamping Festival 2024 วันที่ 1-2 พฤศจิกายน 2567
Glamping Festival 2024 วันที่ 1-2 พ.ย. 2567 ณ สนามอารีน่า หัวหิน จ.ประจวบคีรีขันธ์ งานเฟสสุดแกลมที่ยกทัพศิลปินมามากมาย และฟังทอล์คโชว์จากแก็งค์โคตรคูล โอ๊ต, ป๊อบ, อาร์ต และแก็งค์โต้วาเทย ฝน, นินิว,โย, ปูเป้
Glamping Festival 2024 วันที่ 1-2 พฤศจิกายน 2567 สนามอารีน่า หัวหิน
Glamping Festival 2024 วันที่ 1-2 พฤศจิกายน 2567 ณ สนามอารีน่า หัวหิน จ.ประจวบคีรีขันธ์ งานเฟสสุดแกลมที่ยกทัพศิลปินมามากมาย พร้อมผลงานเพลงดังที่จะทำให้ทุกคนได้เอ็นจอย และที่สำคัญไม่ควรพลาด กับการฟังทอล์ค จากแก็งค์โคตรคูล โอ๊ต, ป๊อบ, อาร์ต และแก็งค์โต้วาเทย ฝน, นินิว,โย, ปูเป้
งานเปิดตัวตลาดพร้อมมิตร 1-10 พฤศจิกายน 2567 บึงคำพร้อย ปทุมธานี
งานฉลองตลาดเปิดใหม่ "ตลาดพร้อมมิตร" ลำลูกกาคลอง7 บึงคำพร้อย จ. ปทุมธานี วันที่ 1-10 พฤศจิกายน 2567 สินค้าราคาถูก อาหารอร่อย ร้านค้ามากมาย สวนสนุกชุดใหญ่ คอนเสิร์ตฟรี
2 พฤศจิกายน 2567 โครงการเดิน วิ่ง ป้องกันอัมพาต ครั้งที่ 10 เฉลิมพระเกียรติฯ
โครงการเดิน วิ่ง ป้องกันอัมพาต ครั้งที่ 10 เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนพรรษา 6 รอบ 28 กรกฎาคม 2567 - วันเสาร์ที่ 2 พฤศจิกายน 2567 เวลา 05.30 น. ณ สนามกีฬาองค์การบริหารส่วนจังหวัดนนทบุรี ตำบลบางเลน อำเภอบางใหญ่ จังหวัดนนทบุรี ระยะทาง 5 กิโลเมตร โดยผู้สมัครจะได้รับ"เสื้อโครงการฯ"และไม่มีค่าใช้จ่ายใดๆ
Cheeze Carbootsale Festival 2-3 พฤศจิกายน 2024
Cheeze Carbootsale Festival 2-3 พฤศจิกายน 2024 สถานที่ MAC Off Road Track, Muak Lek District, Saraburi กลับมาอีกครั้งในชื่อใหม่ “KHUENKHAO FESTIVAL” เทศกาลดนตรีและแฟชั่น ที่จะเปลี่ยนผืนป่าให้กลายเป็นลานกว้าง เปลี่ยนผืนหญ้าให้กลายเป็นรันเวย์ พร้อมลานกิจกรรมไว้ กิน ดื่ม เต้น ขี่จักรยาน แคมปิ้ง และนอนเกลือกกลิ้ง ท่ามกลางขุนเขา 2 วัน 2 คืน กับ 5 เวที ที่ซ่อนตัวอยู่ให้ทุกคนได้ค้นหาและสัมผัสกับความสนุก
กิจกรรม เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 10 ณ บึงพระชนก อุทัยธานี วันเสาร์ที่ 2 พฤศจิกายน 2567
ขอเชิญชวนชาวอุทัยธานี สวมเสื้อสีเหลือง เข้าร่วมกิจกรรม เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 10 เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 วันเสาร์ที่ 2 พฤศจิกายน 2567 เวลา 17.00 น. ณ สวนน้ำเฉลิมพระเกียรติ (บึงพระชนก) สนใจสมัครร่วมกิจกรรมฟรี ได้ที่
wrb10.thai.run/event/UTIน้ำตกโกรกอีดก ท่องเที่ยวเกษตรเชิงอนุรักษ์ชะอม LINK
เที่ยวสระบุรีแบบ One day trip น้ำตกโกรกอีดก เพื่อส่งเสริมการท่องเที่ยวเกษตรเชิงอนุรักษ์ โดยวิสาหกิจชุมชนท่องเที่ยวเชิงอนุรักษ์ชะอม ก่อนไปต้องทำการจองก่อน หรือ จะ walk in หน้างานได้ (จำนวนจำกัด)
ค่าเข้า คนละ 300 บาท (ต่างชาติ 660 บาท)
(ค่าเข้าอุทยาน +ไกด์นำทาง+รถรางรับส่ง +ค่าประกันชีวิต )
ข้อปฏิบัติในการจอง
ลมหนาวเขาใหญ่ ปราจีนบุรี Live in Prachinburi 2 พฤศจิกายน 2567
ลมหนาวเขาใหญ่ ปราจีนบุรี Live in Prachinburi / 2 November 2024 คอนเสิร์ตสุดยิ่งใ??ญ่ในจังหวัดปราจีนบุรี : ลมหนาว เขาใหญ่ แล้วพบกัน 2 พฤศจิกายน 2567 บริเวณทางขึ้นเขาใหญ่ฝั่งปราจีนบุรี พบกับศิลปินสุดพิเศษ เตรียมตัวมันไปพร้อมกันกับพวกเค้าเหล่านี้ เสกโลโซ Gunner Diamond Younggu TG Tiger เก๋าซึม มเหสี DJ L3MON ติดตามรายละเอียด สอบถามข้อมูลเพิ่มเติม facebook : ลมหนาวเขาใหญ่ ปราจีนบุรี *** สอบถามข้อมูลเพิ่มเติม CALL : 061-2356159
2 พฤศจิกายน 2567 ร่วมเป็นเจ้าภาพกองกฐินร้อยเอ็ดร่วมใจ ปีที่ 17
ประชาสัมพันธ์ เทศบาลเมืองร้อยเอ็ด ขอเชิญร่วมเป็นเจ้าภาพกอง กฐินร้อยเอ็ดร่วมใจ ปีที่ 17 ขอเชิญชวนผู้มีจิตศรัทธาร่วมเป็นเจ้าภาพกองกฐินร้อยเอ็ดร่วมใจ ปีที่ 17 ประจำปี 2567 เพื่อทอดถวายวัดในจังหวัดร้อยเอ็ด ที่ไม่มีเจ้าภาพจัดกองกฐินไปถวาย โดยกำหนดถวายกฐิน ในวันที่ 2 พฤศจิกายน 2567 เวลา 08.00 น. ณ ลานหน้าศาลากลางจังหวัดร้อยเอ็ด สนใจจองใบกฐินได้ที่ สำนักการศึกษา เทศบาลเมืองร้อยเอ็ด โทร 043-513390 ต่อ 472 หรือ Scan QR Code ด้านล่าง
ชวนชาวภูเก็ต เดิน วิ่ง ป้องกันอัมพาต ครั้งที่ 10 เสาร์ที่ 2 พฤศจิกายน 2567
ขอเชิญชวนชาวภูเก็ต รวมพลังลงทะเบียนเข้าร่วมกิจกรรม โครงการเดิน วิ่ง ป้องกันอัมพาต ครั้งที่ 10 เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 ในวันเสาร์ที่ 2 พฤศจิกายน พ.ศ. 2567 เวลา 06.00 น เปิดลงทะเบียนตั้งแต่วันนี้ - 30 กย. 67 สามารถเข้าร่วมกิจกรรมได้โดยใส่เสื้อสีเหลือง สมัครผ่าน QR code และเว็บไซต์
https://wrb10.thai.run/งานประเพณีแห่องค์หลวงพ่อปาน วัดมงคลโคธาวาส 4 พฤศจิกายน 2567
งานประเพณี แห่องค์หลวงพ่อปาน ณ วัดมงคลโคธาวาส (วัดหลวงพ่อปาน) ต.คลองด่าน อ.บางบ่อ จ.สมุทรปราการ 4 พฤศจิกายน 2567 กำหนดการแห่ทางเรือ เวลา 7.09น. ทางรถ เวลา 9.39น.
ท่านใดที่อยากจะมาร่วมชม และ เก็บภาพ บรรยากาศ งานแห่ สามารถมาร่วมได้ โดยจะมีเรือประมงของชาวบ้านที่ศรัทธา มาร่วมขบวนจำนวนมาก สามารถขึ้นเรือได้ ที่ท่าน้ำหน้าวัด มีเรือรับตลอดจนกว่าจะอัญเชิญหรือเรือหมด ให้รีบมาก่อนพิธีจะเริ่ม 1 ปี 1 เดียว ในโลก งานแห่พระที่ใหญ่ที่สุด ด้วยพลังศรัทธาต่อองค์หลวงพ่อปาน พระครูพิพัฒนิโรธกิจ 114 ปี บารมีหลวงพ่อปาน
งานฉลองศาลเจ้าพ่อหลวงบรรเทา งานงิ้วจตุรัส อ.จตุรัส ชัยภูมิ วันที่ 6-12 พฤศจิกายน 2567
งานฉลองศาลเจ้าพ่อหลวงบรรเทา งานงิ้วจตุรัส อ.จตุรัส ชัยภูมิ วันที่ 6-12 พฤศจิกายน 2567 ณ สนามกีฬาเฉลิมพระเกียรติ 80 พรรษา ชมคอนเสิร์ต วงดัง ประถมบันเทิงศิลป์ หมอลำใจเกินร้อย อีสานนครศิลป์ ระเบียบวาทะศิลป์ ยิ่งใหญ่มากๆ
งานประเพณีลอยกระทงสาย ประจำปี 6-15 พฤศจิกายน 2567
เชิญร่วมงานสืบสานประเพณี งานประเพณีลอยกระทงสาย ประจำปี 6-15 พฤศจิกายน 2567 บริเวณถนนริมทางรพไฟ ราชบุรี ชมมหกรรม แสงสีเสียง ขบวนแห่ ประกวนหนูน้อยนพมาศ ประกวดร้องเพลง กระทงสวยงาม สินค้าโอท็อป สินค้าราคาโรงาน สินค้าเกษตร ศิลปินแสดงทุกคืน
งานประจำปีปักธงชัย ไหว้พ่อขุนศรีอินทราทิตย์และงานกาชาด อ.นครไทย พิษณุโลก ประจำปี 2567 วันที่ 6-15 พฤศจิกายน 2567
ขอเชิญเที่ยวงานประจำปีปักธงชัย ไหว้พ่อขุนศรีอินทราทิตย์และงานกาชาด ประจำปี 2567 บริเวณพระบรมราชานุสาวรีย์ อ.นครไทย พิษณุโลกวันที่ 6-15 พฤศจิกายน 2567 พบมหกรรมสินค้าราคาถูกจากโรงงาน สินค้าพื้นบ้าน โอท้อป ไม้ดอกไม้ประดับ สวนสนุก คอนเสิร์ตทุกคืน ศิลปินดัง
ลอยกระทง ประจำปี 2567 เมืองกระบี่ 8-18 พฤศจิกายน 2567
เทศบาลเมืองกระบี่ ขอเชิญร่วมสืบสานงานประเพณี ลอยกระทง ประจำปี 2567 วันที่ 8-18 พฤศจิกายน 2567 บริเวณสวนสาธารณะธารา (ใจกลางเมืองกระบี่) จังหวัดกระบี่
งานลอยกระทงและงานบอลลูนนานาชาติ อำเภอสหัสขันธ์ 8-15 พฤศจิกายน 2567
ขอเชิญเที่ยวงานลอยกระทง และ งานบอลลูน นานาชาติวันที่ 8-15 พฤศจิกายน 2567 ณ บริเวณถนนหน้าเทศบาลตำบลโนนบุรี อำเภอสหัสขันธ์ จังหวัดกาฬสินธุ์
งานประเพณีลอยกระทง เผาเทียน เล่นไฟ สุโขทัย 8-17 พฤศจิกายน 2567
เตรียมตัวไปร่วมงานลอยกระทงที่ยิ่งใหญ่ที่สุดของประเทศ ในงานประเพณีลอยกระทง เผาเทียน เล่นไฟ สุโขทัย 8-17 พฤศจิกายน 2567 ณ อุทยานประวัติศาสตร์สุโขทัย
เทศกาลดนตรีกลางหุบเขา สุพรรณติวัล3 เสาร์ที่ 9 พฤศจิกายน 2567
เทศกาลดนตรีกลางหุบเขาที่ใหญ่ที่สุด สุพรรณติวัล3 เสาร์ที่ 9 พฤศจิกายน 2567 เขากำแพง อู่ทอง สุพรรณบุรี เทศกาลดนตรีที่ขอชวนเพื่อนๆมาเปิดประสบการณ์ร็อกกลางหุบเขาที่ใหญ่ที่สุดในสุพรรณบุรีพร้อมรับบรรยากาศลมหนาวกลางเสียงเพลงจากศิลปินร็อกชั้นนำเมืองไทยกว่า 12 ศิลปิน เต็มอิ่มยาว 12 ชั่วโมง แบบไม่ต้องพัก BODYSLAM • JOEYBOY • POTATO • NUM KALA • CARABAO • PALMY • COCKTAIL • SLOT MACHINE • SINGTO NUMCHOK • SILLY FOOLS • GREASY CAFE • SUNSET
จำหน่ายบัตร Early bird 799 บาท
เสาร์ที่ 9 พฤศจิกายน 2567เขากำแพง อู่ทอง สุพรรณบุรี
LEO FEST The Adventure Pattaya 2024 วันที่ 9 - 10 พฤศจิกายน 2024
LEO FEST The Adventure Pattaya 2024 สมรภูมิความมันส์ ในอาณาจักรทะเลทรายที่เดือดที่สุด 9-10 พฤศจิกายน 2024 ที่
Wisdom Valley, Pattaya
จัดเต็ม 2 วัน 3 เวที 35 ศิลปิน ครบทุกแนวเพลง!
9 NOVEMBER 2024
INK WARUNTORN / TAITOSMITH / THREE MAN DOWN / BOWKYLION / 4EVE
ZEAL / RETROSPECT / YOUNGOHM / THE MOUSSES / FREEHAND / DEPT / ONLY MONDAY
MOBYE / SLAPKISS / BOSS THAPANAT / TALAY / MOVING AND CUT
10 NOVEMBER 2024
PALMY / COCKTAIL / BIG ASS / TATTOO COLOUR / POP PONGKOOL / OAT PRAMOTE PIXXIE / MILLI / THE TOYS / PARADOX / LHAM SOMPHOL / PURPEECH
COPTER / BEAN NAPASON / YENTED / TELEVISION OFF / BELL WARISARA / MITEENNN
งานประเพณีลอยกระทงสายไหลประทีป 1,000 ดวง ประจำปี 2567 วันที่ 9-18 พฤศจิกายน 2567
ขอเชิญเที่ยวงานประเพณีลอยกระทงสายไหลประทีป 1,000 ดวง ประจำปี 2567 วันที่ 9-18 พฤศจิกายน 2567 ณ บริเวณริมน้ำปิง จังหวัดตาก ชมการแสดงวัฒนธรรมพื้นบ้าน สินค้า OTOP ของดีจังหวัดตาก สินค้าทางการเกษตร สินค้าชั้นนำจากผู้ผลิต อาหารดี 4 ภาค ไม้ดอก ไม้ประดับ สวนสนุกชุดใหญ่ มหกรรมคอนเสิร์ตจากศิลปินชั้นนำ 9 พ.ย. 67 โบตั๋น ชนิกานต์ 10 พ.ย. 67 ST BAND 11 พ.ย. 67 แนนซี่ ท็อปไลน์ 12 พ.ย. 67 เนสกาแฟ ศรีนคร 13 พ.ย. 67 คาราบาว ก็อปปี้โชว์ 14 พ.ย. 67 TN CHAINAT 15 พ.ย. 67 วานร ลพบุรี 16 พ.ย. 67 นัน อนันต์ ไมค์ทองคำ 17 พ.ย. 67 L.กฮ. 18 พ.ย. 67 การแข่งขันประกวดวงดนตรีลูกทุ่ง
ยี่เป็งลอยกระทงกว๊านพะเยา 9-16 พฤศจิกายน 2567
ยี่เป็งลอยกระทงกว๊านพะเยา 9-16 พฤศจิกายน 2567 ณ ลานพ่อขุนงำเมือง หน้ากว๊านพะเยา จ.พะเยา ชมดนตรีสดแสงสีเสียงครบเครื่องเต็มเวทีทุกคืน 8 คืนเต็ม ชมประกวดร้องเพลงชิงแชมป์ประเทศไทย วันที่ 9-11 พฤศจิกายน รอบชิง 16 พฤศจิกายน การแสดงบนเวทีจากศิลปิน โปงลางสะออก (14) ประกวดแห่กระทง วง muse การแสดงโขน (15-16) จัดโดยเทศบาลเมืองพะเยา
ประเพณีลอยกระทง ตลาดเทศบาลประทาย อ.ประทาย 9-15 พฤศจิกายน 2567
ประเพณีลอยกระทง ตลาดเทศบาลประทาย อ.ประทาย นครราชสีมา 9-15 พฤศจิกายน 2567
งานแห่เจ้าพ่อมังกรทอง (เล่งบ๊วยเอี๊ย) และ เทศกาลงานลอยกระทง ประจำปี 2567 วันที่ 10-19 พฤศจิกายน 2567
งานประจำปีอีกงานที่คนนครสวรรค์และจังหวัดใกล้เคียงทั่วไทย เฝ้ารอคอย งาน แห่เจ้าพ่อมังกรทอง (เล่งบ๊วยเอี๊ย) และ เทศกาลงานลอยกระทง ประจำปี 2567 วันที่ 10-19 พฤศจิกายน 2567 ณ บริเวณศาลเจ้าพ่อมังกรทอง ตลาดศรีนคร จังหวัดนครสวรรค์ ปีนี้ศิลปินขึ้นแสดงเต็มเวทีทุกคืนเช่นเคย ดังนี้ 10 พ.ย. 67 คอนเสิร์ต แนนซี่ ท็อปไลน์ 11 พ.ย. 67 คอนเสิร์ต ทรายทอง ชัยนาท 12 พ.ย. 67 คอนเสิร์ต โบว์ ซุปเปอร์วาเลนไทน์ 13 พ.ย. 67 คอนเสิร์ต PM BAND สุพรรณบุรี 14 พ.ย. 67 พิธีเปิดการแสดงศาลเจ้า 15 พ.ย. 67 ประกวดหนูน้อยนพมาศ และ นางนพมาศ 16 พ.ย. 67 ตลกนัตตี้เดอะคอมเมเดี้ยน 17 พ.ย. 67 ประกวดธิดามังกร 18 พ.ย. 67 ประกวดสาวประเภทสอง 19 พ.ย. 67 คอนเสิร์ต วงเก๋าซึม
จัดงานนมัสการหลวงพ่อโสธรและงานประจำปี จ.ฉะเชิงเทรา วันที่ 12 - 24 พ.ย. 2567 LINK
ขอเชิญร่วมงานนมัสการหลวงพ่อโสธรและงานประจำปีจังหวัดฉะเชิงเทรา พ.ศ.2567 ระหว่างวันที่ 12 - 24 พ.ย. 2567 (13 วัน 13 คืน)
- วันที่ 12 พ.ย.2567 พิธีบวงสรวงสิ่งศักดิ์สิทธิ์ 5 จุด และพิธีแห่หลวงพ่อโสธรทางบก
- วันที่ 14 พ.ย. 2567 พิธีแห่หลวงพ่อโสธรทางน้ำ ไป อ.บางปะกง
- วันที่ 15 พ.ย. 2567 พิธีแห่หลวงพ่อโสธรทางน้ำ ไป อ.บางคล้า
- วันที่ 8-10 พ.ย. 2567 กิจกรรมแข่งขันกีฬาเจ็ตสกี
เทศกาลนมัสการองค์พระปฐมเจดีย์ ปิดทองพระร่วงโรจนฤทธิ์ 12-20 พฤศจิกายน 2567
งานเทศกาลนมัสการองค์พระปฐมเจดีย์ ปิดทองพระร่วงโรจนฤทธิ์ บูชาพระบรมสารีริกธาตุ 3 แผ่นดิน ปีนี้จัดระหว่างวันที่ 12-20 พฤศจิกายน 2567 ณ วัดพระปฐมเจดีย์ ราชวรมหาวิหาร ตำบลพระปฐมเจดีย์ อำเภอเมือง จังหวัดนครปฐม
สีฐานเฟสติวัล บุญสมมาบูชานาค 2567 วันที่ 13-15 พฤศจิกายน 2567 ม.ขอนแก่น
การกลับมาอีกครั้ง อย่างยิ่งใหญ่ งาน สีฐานเฟสติวัล บุญสมมาบูชานาค 2567 (Sithan KKU Festival 2024 ) 13 - 15 พฤศจิกายน 2567 ณ ริมบึงสีฐาน มหาวิทยาลัยขอนแก่น จัดเต็ม 3 วัน 3 คืน บรรยากาศ ความสนุกสนาน ความอลังการยิ่งใหญ่กว่าเดิม
งานลอยกระทงที่วัดท่าฬ่อ 14-15 พฤศจิกายน 2567
ร่วมงานประเพณีลอยกระทง ลำน้ำน่านหน้าวัดท่าฬ่อ พบกิจกรรมขบวนแห่กระทง การประกวดนางนพมาศ 3 ประเภท คือ ธิดาน้อย นางนพมาศสูงวัย นางนพมาศจำแลง และอีกมากมาย
มหัศจรรย์งานช้างสุรินทร์ ปี 2567 วันที่ 14-25 พฤศจิกายน 2567 นี้
งาน "มหัศจรรย์งานช้างสุรินทร์ ประจำปี 2567" และงานกาชาดจังหวัดสุรินทร์ ปีนี้ กำหนดวันจัดงานระหว่างวันที่ 14-25 พฤศจิกายน 2567 โดยกำหนดการ วันที่ 13 พฤศจิกายน 2567 แถลงข่าวการจัดงาน / 14 พฤศจิกายน พิธีเปิด,ซ้อมใหญ่ช้าง / 15 พฤศจิกายน งานเลี้ยงโต๊ะจีนช้าง / และ 16-17 พฤศจิกายน 2567 งานแสดงช้าง
ตารางคอนเสิร์ตงานช้าง 2567 - 14 พ.ย. 67 บุ๊ค ศุภกาญจน์ 15 พ.ย. 67 SARAN 16 พ.ย. 67 บิวบอง & จ่าลอด ลุ่มน้ำชี 17 พ.ย. 67 SPRITE 18 พ.ย. 67 วงคาราบาว 19 พ.ย. 67 เต้ย อภิวัฒน์ 20 พ.ย. 67 1MILL 21 พ.ย. 67 เนสกาแฟ ศรีนคร 22 พ.ย. 67 PARADOX 23 พ.ย. 67 ร็อคคงคย & กันตรึม 24 พ.ย. 67 BOMB at TRACK 25 พ.ย. 67 นันทวัน ภาพยนตร์ vs บิ๊กสุรินทร์
งานประเพณีแข่งขันเรือยาว เทศกาลลอยกระทง อ.ชุมพวง 14-20 พฤศจิกายน 2567
ขอเชิญเที่ยวงานประเพณีแข่งขันเรือยาว เทศกาลลอยกระทง อ.ชุมพวง นครราชสีมา 14-20 พฤศจิกายน 2567
งานประเพณีลอยกระทง วัดสมานรัตนาราม 14 - 24 พฤศจิกายน 2567
ขอเชิญเที่ยวงาน ประเพณี ลอยกระทง และ ร่วมนมัสการรับหลวงพ่อโสธรทางน้ำ ณ บริเวณวัดสมานรัตนาราม อำเภอเมือง จังหวัดฉะเชิงเทรา วันที่ 14 - 24 พฤศจิกายน 2567 งานแสงสีเสียง 11 วัน 11 คืน ร่วมลุ้นรางวัลไหทองการกุศล นำรายได้ใช้ในกิจการของวัดสมานรัตนาราม ลุ้นรางวัลมากมาย ชมมหกรรมบอลลูนนานาชาติ คอนเสิร์ตศิลปินดัง
งานกระบองเพชร เขาค้อ KHAO KHO Cactus Festival 2024 วันที่ 15-17 พฤศจิกายน 2567
งานกระบองเพชรครั้งแรกที่เขาค้อ KHAO KHO Cactus Festival 2024 วันที่ 15-17 พฤศจิกายน 2567 ณ ลานกิจกรรมจุดชมวิวเขาค้อ ภายในงานพบกับการออกร้านจากร้านต้นไม้ อาหาร และเครื่องดื่มจากทั่วประเทศและกิจกรรมอื่นๆ มากมาย อาทิเช่น การประกวดกระบองเพชรตัดสินโดยกรรมการผู้ทรงคุณวุฒิจากชมรมกระบองเพชรและไม้อวบน้ำแห่งประเทศไทย การแสดงดนตรีสด กับ บรรยากาศ ชิล ๆ ร้านอาหารเด็ด ๆ และเครื่องดื่มที่พร้อมมาบริการ สำหรับพ่อค้าแม่ค้าหรือผู้มาร่วมงานแอบกระซิบว่าแต่งชุดชนเผา ชาวเขา ชิค ๆ คูล ๆ มาเด้ออ ในงานมีประกวดชิงเงินรางวัลและสายสะพายนะจ๊ะสิบอกให่
ประเพณีลอยกระทงปักธงชัย เทศกาลงานงิ้วปักธงขัย 15-25 พฤศจิกายน 2567
เชิญเที่ยวงานประเพณีลอยกระทงปักธงชัย เทศกาลงานงิ้วปักธงขัย 15-25 พฤศจิกายน 2567 บริเวณถนนสืบสิริ ตลาดปักธงชัย อ.ปักธงชัย นครราชสีมา
วิ่งการกุศล Road To Give Hua Hin 17 พ.ย. 2567 LINK
กิจกรรมการวิ่งการกุศล จัดโดยโรงแรมหัวหิน แมริออท ร่วมกับทาง โรงแรมเชอราตัน หัวหิน และเชอราตันปราณบุรี วันที่ 17 พ.ย. 2567 ณ ลานมหาราช ปากน้ำปราณ อ.ปราณบุรี เปิดรับสมัครนักวิ่งจำนวนมาก มาร่วมวิ่งรักษาสุขภาพ และร่วมทำบุญให้กับน้องๆ 3 ชายแดนภาคใต้ กับ โครงการ save the children
งาน NaSatta Light Festival Winter Illumination 2025 ณ สัทธา อุทยานไทย
งาน NaSatta Light Festival Winter Illumination 2025 ตั้งแต่วันที่ 21 พฤศจิกายน 2567 - 27 เมษายน 2568 ณ สัทธา อุทยานไทย จ.ราชบุรี เปิด : ทุกวันอังคาร - วันอาทิตย์ และวันหยุดนักขัตฤกษ์ เปิดไฟ : 18:00-22:00 น.(ปิดจำหน่ายบัตร 21.30น.) โทร : 032 383 333, 081 527 2782
Chonburi Coffee on The Beach 2024 งานกาแฟริมชายหาดพัทยา 22-24 พฤศจิกายน 2567
Chonburi Coffee on The Beach 2024 งานกาแฟริมชายหาด ปีนี้พบกัน 22-24 พฤศจิกายน 2567 ณ ชายหาดพัทยา (ตรงข้าม Hard Rock Hotel Pattaya) ตั้งแต่เวลา 09.00-21.00 น
ปีนี้มาในแนวคิด “ Variety of coffee and people: Where cultures meet over a cup “ งานกาแฟริมชายหาด ที่รวบรวมความหลากหลายของผู้คนวัฒนธรรมและความชอบ สื่อสารผ่านกาแฟแก้วโปรด
สุดพิเศษในงาน กับการแข่งขัน ทำกาแฟริมชายหาด CBC King Of Coffee เงินรางวัลรวมสูงสุดถึง 100,000 บาท สนุกสนานกับการเยี่ยมชม ชิม ดื่ม กับร้านคาเฟ่ ร้านอาหารและขนม ดังกว่า 60 ร้านค้า รวมร้านกาแฟทุกแบบ ทั้งขนาดเล็กขนาดใหญ่ กาแฟโบราณ ชา โกโก้ จากในพื้นที่จังหวัดชลบุรี และภูมิภาคอื่นๆ นอกจากนั้น ยังมีกิจกรรมพิเศษมากมายภายในงาน อาทิ เวิร์คช็อปการทำกาแฟ เวิร์คช็อปงานศิลปะ กิจกรรมจากชุมชนต่างๆ อย่าลืมพกแก้วส่วนตัวมาร่วมงาน เพื่อลดการใช้ขยะและเพื่อชายหาดที่สะอาดของเรา ติดตามข้อมูลเพิ่มเติมได้ที่
Cafe&Bistro Club Pattaya /Chonburi -CBC Rolling Loud Thailand 2024 เทศกาลฮิปฮอประดับโลกบนเวทีพัทยา 22 - 24 พ.ย. 67
"
Rolling Loud" เทศกาลฮิปฮอประดับโลกที่ใหญ่ที่สุดในโลกที่ทุกคนรอคอย ประกาศหวนคืนสู่เอเชียอีกครั้งกับ "Rolling Loud Thailand 2024" ที่ Legend Siam พัทยา ประเทศไทย ใน 22 - 24 พ.ย. 2567 ปีนี้ยังคงจัดเต็มศิลปินฮิปฮอปดัง แห่งอเมริกาและเอเชีย ที่มาร่วมโชว์มากกว่า 60 ศิลปิน
Samer Dao Mountain Trail #2 วิ่งนับดาว คืนฟื้นฟูป่า 23–24 พฤศจิกายน 2567
กิจกรรม Samer Dao Mountain Trail #2 “วิ่งนับดาว คืนฟื้นฟูป่า” กับสนาม Trail ตะลุยสายหมอกในป่าต้นน้ำน่าน วันที่ 23–24 พฤศจิกายน 2567 ณ ดอยเสมอดาว อุทยานแห่งชาติศรีน่าน จังหวัดน่าน โดยสมาคมอุทยานแห่งชาติ ร่วมกับอุทยานแห่งชาติศรีน่าน ทุก 100 บาท จากค่าสมัครของทุกท่าน มอบให้สมาคมอุทยานแห่งชาติ เพื่อใช้ในการขับเคลื่อนการอนุรักษ์ และโครงการคืนฟื้นฟูป่าประชาร่วมใจ เป้าหมาย 5,000 ไร่ ประเภทแข่งขัน Trail 60 KM / Trail 40 KM / Trail 21 KM / Trail 12 KM /Trail 6 KM / VIP
งานสักการะเจ้าพ่อหลวงอุดม งานกาชาดและของดีคูเมือง วันที่ 23-29 พฤศิจกายน 2567
เชิญเที่ยวงานสักการะเจ้าพ่อหลวงอุดม งานกาชาดและของดีคูเมือง อ.คูเมือง บุรีรัมย์ วันที่ 23-29 พฤศิจกายน 2567 ณ สนามที่ว่าการอำเภอคูเมือง
ปลาทูฮาล์ฟมาราธอนครั้งที่ 8 วันสับ 24 พฤศจิกายน 2567
ปลาทู มินิ-ฮาล์ฟ มาราธอน ครั้งที่ 8 วันอาทิตย์ ที่ 24 พฤศจิกายน 2567 ณ บริเวณลานหน้าศาลากลางจังหวัดสมุทรสงคราม
การแข่งขันจักรยาน L’Etape Udon Thani by Tour de France 2024 บนเส้นทางมรดกโลก อุดรธานี 24 พฤศจิกายน 2567
LET’S RIDE UDON! ร่วมสัมผัสประสบการณ์ Tour de France L’Etape Udon Thani by Tour de France 2024 บนเส้นทางแสนอัศจรรย์ของผืนแผ่นดินแห่งมรดกโลก UNESCO WORLD HERITAGE SITES จังหวัดอุดรธานี ปลอดภัยด้วยการจัดการมาตรฐานงานปั่นจักรยานระดับโลก ร่วมฉลอง The 6th Edition ของ L’Etape Thailand by Tour de France กับดีลสุดพิเศษครั้งแรกและครั้งเดียว 146KM ราคาพิเศษ เริ่มต้นเพียง 960 บ. 65KM ราคาพิเศษ เริ่มต้นเพียง 640 บ.
เทศกาลกาลงานเส้น & บอลลูนนานาชาติ 26 พ.ย. - 5 ธ.ค.2567
หอการค้าพิษณุโลก ขอเชิญเที่ยวงาน "เทศกาลกาลงานเส้น & บอลลูนนานาชาติ" 26 พ.ย. - 5 ธ.ค. 2567 ณ มหาวิทยาลัยนเรศวร ต.ท่าโพธิ์ อ.เมือง จ.พิษณุโลก
Pattaya Street Basketball 3x3 2024 LINK
Pattaya Street Basketball 3x3 2024 ประกาศวันแข่งแล้วคือ วันที่ 29 พฤศจิกายน - 1 ธันวาคม 2024 ชิงเงินรางวัลรวม 300,000 บาท เปิดรับผู้กล้าเข้าแข่งขันบาสเก็ตบอล3on3 แล้ว ได้แก่ อายุไม่เกิน U12 MIX (พ.ศ.2555-ปัจจุบัน) อายุไม่เกิน U15 ชาย (พ.ศ.2552-ปัจจุบัน) อายุไม่เกิน U18 ชาย (พ.ศ.2549-ปัจจุบัน) ประชาชนชาย 40+ Master (พ.ศ.2527) ประชาชนชาย จำกัดดีกรี, Amateur ประชาชนชาย ไม่จำกัดดีกรี, Professional
เทศกาลดนตรี ศรีราชา 29-30 พฤศจิกายน 2567
เทศกาลดนตรี “ศรีราชา” แห่งภาคตะวันออก 29 - 30 พฤศจิกายน 2567 นอนแคมปิ้งสุดชิล ดูดาว ฟังดนตรี บนพื้นที่ 100ไร่ 2 วัน 2 คืน ท่ามกลางธรรมชาติ อากาศเย็นสบาย ศิลปิน Sriracha Artist Paradox • คาราบาว • Big Ass • พงษ์สิทธิ์- คำภีร์ • LOSO • คณะขวัญใจ • Hugo • ไววิทย์ • Grease Cafe • เขียนไขและวานิช • Safe Planet • อภิรมย์ • Zweed NRoll • วรินทร์ • Game Sujitra • วสันต์17 • YENA • บัวบูชา แบนด์ • Scootslande • ดึกดำบรรพ์ • Luster • ธีร์ ไชยเดช • FAUVIS • เสือ ธนพล
งานเทศกาลไหมนานาชาติ ประเพณีผูกเสี่ยว งานกาชาดจังหวัดขอนแก่น และงานขอนแก่นซอฟต์พาวเวอร์ ประจำปี 2567 วันที่ 29 พฤศจิกายน - 10 ธันวาคม 2567
งานเทศกาลไหมนานาชาติ ประเพณีผูกเสี่ยว งานกาชาดจังหวัดขอนแก่น และงานขอนแก่นซอฟต์พาวเวอร์ ประจำปี 2567 วันที่ 29 พฤศจิกายน - 10 ธันวาคม 2567 ณ ศาลากลางจังหวัดขอนแก่น โดมใหญ่ทั้งงาน กิจกรรมมามาย ชมขบวนแห่สุดอลังการ หมอลำคณะใหญ่ ศิลปินดัง สวนสนุกชุดใหญ่ อลังการไฟแสงสีคาราวานร้านค้า ร้านเด็ดร้านดังจาก TikTok
Sunflower music festival 2 ไร่บุปผชาติ จ.ลพบุรี 30 พฤศจิกายน 2567
Sunflower music festival 2 Welcome to the Future 30 พฤศจิกายน 2567 ณ ไร่บุปผชาติ จ.ลพบุรี
30 พฤศจิกายน 2567 RUN FOR YOU 101/2024 เดิน-วิ่งการกุศล พลังบุญสานฝัน คน 101 ครั้งที่ 1
กิจกรรมเดิน-วิ่งการกุศล รายการ “RUN FOR YOU 101/2024” เดิน-วิ่งการกุศล พลังบุญสานฝัน เพื่อน้องเยาวชน “คน 101” ครั้งที่1 ในวันเสาร์ที่ 30 พฤศจิกายน 2567 ณ อ่างเก็บน้ำธวัชชัย ตำบลมะอึ อำเภอธวัชบุรี จ.ร้อยเอ็ด รายได้ทั้งหมดหลังหักค่าใช้จ่ายนำถวายแด่พระราชวัชราวิทยาคม(อ.ต้อม ปภัสโร) เพื่อเมตตาพิจารณามอบให้กับ ชมรมฟุตบอลร้อยเอ็ดซิตี้ (โหวดพิฆาต) ดำเนินการตามเจตนาและวัตถุประสงค์ต่อไป (เพื่อความเป็นสิริมงคล)
6 และ 7 มกราคม และ วันที่ 13 และ 14 มกราคม 2567 เที่ยวทุ่งทานตะวัน นั่งรถไฟลอยน้ำ
วันที่ 6 และ 7 มกราคม และ วันที่ 13 และ 14 มกราคม 2567 (ทริปที่ 1-4) แบบไปเช้าเย็นกลับ โปรแกรมนั่ง KIHA 183 “เที่ยวทุ่งทานตะวัน นั่งรถไฟลอยน้ำ ชมพระอาทิตย์ตกดิน เหนือเขื่อนป่าสักชลสิทธิ์” ราคาท่านละ 1,499 บาท
- ชมผาเสด็จ เรือ ผาเสด็จพัก หน้าผาที่พระบาทสมเด็จพระจุลจอมกล้าเจ้าอยู่หัว และสมเด็จพร ะศรีพัชรินทราบรมราชินีนาถ เคยเสด็จมาเมื่อคราวเปิดเดินรถไฟสายกรุงทพ-นครราชสีมา เมื่อ พ.ศ. 2438
- เยือน บ้านกล้วย & ไข่ คาเฟ่ ชมสวนไม้ดอกไม้ประดับและแปลงดอกทานตะวันที่บานสะพรั่ง ชวนกัน แชะ CHECK-IN ภาพประทับใจ
- เที่ยวชม สวนบญจมาศ ไร่บิ๊กเต้ พื้นที่ของสวนดอกไม้กว่า 100 ไร่ ชมดอกเบญจมาศ ที่มีมากกว่า 30 สายพันธุ์ สีสันสดใส
- เดินทางสู่ ไร่ทรัพย์ประยูร เพลิดเพลินกับความสวยงามของต้นเฟิร์นนานาพันธุ์ และตามทางเดินจะได้สัมผัสกับพืชชนิดต่างๆและสัตว์หลากหลายชนิด ทั้งนก กระต่ายปลา และม้า
- มุ่งหน้าสู่ ที่หยุดรถเชื่อนป่าสักชลสิทธิ์ ขึ้นขบวนรถพิเศษ KIHA 183 เดินทางสู่จุดชมวิวถ่ายภาพพระอาทิตย์ยามเย็นหนือเชื่อนป่าสักชลสิทธิ์
20 และ 21 มกราคม 2567 เทศกาล แห่งความสุข เที่ยวเมืองแปดริ้ว
วันที่ 20 และ 21 มกราคม 2567 (ทริปที่ 5 และ 6) แบบไปเช้าเย็นกลับ
โปรแกรมนั่ง KIHA 183 “เทศกาล แห่งความสุข เที่ยวเมืองแปดริ้ว พลิ้วตามสายน้ำ สัมผัสเสน่ห์ริมแม่น้ำบางปะกง”
ราคาท่านละ 1,499 บาท
- แวะจุดชมวิวกลางสะพานข้ามแม่น้ำบางปะกง จ.ฉะเชิงเทรา แลนด์มาร์กแห่งใหม่ของจังหวัดฉะเชิงเทรา
- เยือนวัดโสธรวรารามวรวิหาร สักการะหลวงพ่อโสธร พระคู่บ้านคู่เมืองฉะเชิงเทรา ชมความงดงามสถาปัตยกรรมของพระอุโบสถ
- ขอพรพระพุทธมหาลาภ วัดหัวสวน ชม โบสถ์แสตนเลส ที่มีความสวยงามโดดเด่น
- ชอป แชะ CHECK-IN อย่างอิสระ ที่ ลาดบ้านใหม่ ตลาด 100 ปี แห่งเมืองฉะเชิงเทรา
- เยี่ยมชมวิถีย้อนยุด เลือกชิมอาหารและขนมรสอร่อย เพลิมพลินกับคาฟ่ริมน้ำ และดื่มด่ำวิวแม่น้ำบางปะกง
- แวะตลาดน้ำบางคล้า ล่องรือชมรอบกาะลัด ชมวิถีชีวิตชุมชนคนริมน้ำ ผ่านวัดโผธิ์บางคล้า วัดคุ้มกร่างและวัดพุทธพรหมยาน
- ชมความงดตามของโบสถ์สิทอง วัดปากน้ำโจ้โล้ ที่มีพระอุโบสถงดงามตระการต เสมือนการจำลองภาพบนสวรรค์ชั้นดาวถึงส์
27 - 28 มกราคม 2567 เที่ยวเมืองโคราช (แบบพักค้างคืน)
27 - 28 มกราคม 2567 (ทริปที่ 7) แบบพักค้างคืน
โปรแกรมนั่ง KIHA 183 “เที่ยวเมืองโคราช ชมปราสาทหินพิมาย ตระการตา แสง สี เสียง วิมายะนาฏการ”
ราคาท่านละ 3,999 บาท
- ชมผาเสด็จ หรือ ผาเสด็จพัก หน้าผาที่พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัวและสมเด็จพระศรีพัชรินทราบรมราชินีนาถ เคยเสด็จมาเมื่อคราวเปิดเดินรถไฟสวยกรุงเทพ-นครราชสีมา เมื่อ พ.ศ. 2438
- เยือนอุทยานประวัติศาสตร์พิมาย ชมปราสาทหินพิมาย สถาปัตยกรรมล้ำค่าศิลปะสมัยอาณาจักรขอมโบราณ
- ชมการแสดง แสง สีเสียงชุด "วิมายะนาฎการ" เป็นการแสดงนาฏลีลา ได้แก่ ฉากการสร้างปราสาทหิน การแสดงรำมวยโบราณ รำดึงครกดึงสาก รำตั๊กแตน ลาวกระทบไม้ ขบวนแห่พุทธบูชา และระบำพิมายปุระ
- ชมพิพิธภัณฑ์เครื่องปั้นดินผา และนั่งรถรางเยี่ยมชมฐานการเรียนรู้เส้นทางท่องเที่ยวชุมชนด่านเกวียน
- แวะอุทยานประวัติศาสตร์นักรบไทยไทรทองเทพนิมิต จ.นครราชสีมา สักการะพระบรมรูป 3 พระองค์ คือ สมเด็จพระนเรศวรมหาราช สมเด็จพระเอกาทศรถ และสมเด็จพระสุพรรณกัลยา
โปรแกรมท่องเที่ยวเดือนกุมภาพันธ์ 2567
โปรแกรมท่องเที่ยวเดือนกุมภาพันธ์ 2567 มีรายละเอียดเส้นทางต่างๆ ดังต่อไปนี้
อ่าวมะขามป้อมเคาท์ดาวน์ปีใหม่ 2567
เคาท์ดาวน์ปีใหม่ 2567 "อ่าวมะขามป้อมเคาท์ดาวน์" พบกับความสุขส่งท้ายปีเก่าต้อนรับปีใหม่ท่ามกลางบรรยากาศแห่งความสุข ฟิน ฟีล ชิล ช็อป ชมพลุ ริมเล พบกับสินค้าราคาพิเศษ กิจกรรมสนุกสนานและศิลปินที่มาสร้างความสุขมากมายภายในงาน ท่าเรืออ่าวมะขามป้อม แกลง ระยอง วันที่ 28-31 ธันวาคมนี้ 28-29 พบกับวงดนตรีสด 30 ธันวาคม 2566 One one เอิ๊ต ภัทรวี อี๊ด วงฟลาย 31 ธันวาคม 2566 เหน่ง Y NOT 7 ปราโมทย์ วิเลปานะ ว่าน ธนกฤต ล่องเรือชมหมู่เกาะมัน ชมบรรยากาศทะเล ทั้งแสงสีเสียง ชมพลุและดอกไม้ไฟหลากสีสันบนท้องฟ้า ที่นานถึง 15 นาที ชมและช็อปผลิตภัณฑ์งานคราฟท์สุดสร้างสรรค์ที่มีให้เลือกทำตามใจชอบ ร่วมส่งท้ายปีเก่าต้อนรับปีใหม่แบบอบอุ่นและยั่งยืนในชุมชนประมงเรือเล็กที่หนึ่งปีมีครั้งเดียว มาร่วมเป็นส่วนหนึ่งของงาน “อ่าวมะขามป้อมเคาท์ดาวน์” ริมทะเล จังหวัดระยอง *** ไม่เสียค่าใช้จ่ายฟรีตลอดงาน ❕ ร่วมกันจัดความสนุกสนานโดย ททท. ระยอง ร่วมกับเทศบาลตำบลสุนทรภู่ สมาคมประมงสุนทรภู่ และบริษัท สตาร์ ปิโตรเลียม รีไฟน์นิ่ง จำกัด (มหาชน) และ โรงแรมเดอะรีสอร์ทวิลล่า
ออกหน่วยทำหมัน ฟรี (กุมภาพันธ์ 2567)
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน ฉีดวัคซีน เดือนกุมภาพันธ์ 2567 (สอบถามโทร 02-2487417 02-2453311)
- 1 ก.พ. เวลา 9-12.00 น. ชุมชนนวลจิตร เขตวัฒนา / เวลา 9-12.00 น. วัดขุมทอง เขตลาดกระบัง
- 2 ก.พ. เวลา 9-12.00 น. ห้างบิ๊กซี เขตธนบุรี
- 6 ก.พ. เวลา 9-12.00 น. วัดกระทุ่มเสือปลา เขตประเวศ / ชุมชนหมู่ 7 ราษฎร์บูรณะ เขตราษฎร์บูรณะ
- 7 ก.พ. เวลา 9-12.00 น. วัดทรัพย์สโมสรนิกรเกษม เขตหนองจอก / วัดกุนนทีรุทธาราม เขตดินแดง
- 8 ก.พ. เวลา 9-12.00 น. ชุมชนอัมรินทร์นิเวศน์ 3 ผัง 2 เขตสายไหม / ลานกีฬาปลอดยาเสพติด ใต้ทางด่วนมหานคร เขตบางรัก
- 9 ก.พ. เวลา 9-12.00 น. เรือนจำพิเศษมีนบุรี / ชุมชนยิ้มประยูร เขตบางซื่อ
- 13 ก.พ. เวลา 9-12.00 น. ชุมชนพลับพลา เขตวังทองหลาง / วัดบุญยประดิษฐ์ เขตบางแค
- 14 ก.พ. เวลา 9-12.00 น. วัดสัมพันธวงศ์ เขตสัมพันธวงศ์ / กรมทหารขนส่ง รักษาพระองค์ เขตบางเขน
- 15 ก.พ. เวลา 9-12.00 น. วัดทุ่งครุ
- 16 ก.พ. เวลา 8-14.00 น. วัดบางกระดี่ เขตบางขุนเทียน
- 20 ก.พ. เวลา 9-12.00 น. สำนักงานเขตบางกอกน้อย / กลุ่มควบคุมตรวจเนื้อสัตว์ เขตหนองแขม
- 21 ก.พ. เวลา 9-12.00 น. ชุมชนบ้านครัวตะวันตก ราชเทวี / หมู่บ้านเลิศอุบล 5 เขตคันนายาว
- 22 ก.พ. เวลา 9-12.00 น. ชุมชนเมืองอยู่ดี เขตบางคอแหลม / หมู่บ้านวรางกูล เขตคลองสามวา
- 23 ก.พ. เวลา 8-14.00 น. ตลาดปัฐวิกรณ์ เขตบึงกุ่ม (กิจกรรมสุขภาพดี ใกล้บ้าน ใกล้หมอ)
Black Angel MC.Thailand 14 Dec 2024
งานกลุ่ม แบล็คแองเจิล ครบรอบ 34 ปี 14 ธันวาคม 2567 ณ สนาม OFF ROAD MAX ไร่เขาล้อม อำเภอ หมวกเหล็ก จังหวัด สระบุรี
1 ทศวรรษ Baphomet MC. แพร่
1 ทศวรรษ Baphomet MC. แพร่ 7 ธันวาคม 2567
หัวหินไบค์วีค 2024 - 13-14 ธ.ค. 67
หัวหินไบค์วีค 2024 ครั้ง 18 วันที่ 13-14 ธ.ค.2567 ณ ลานจอดรถ 25 ไร่ บลูพอร์ตหัวหิน ซอย 102 งานไบค์ใหญ่อีกงานแห่งปีที่ต้องไม่พลาด
20ปี มิตรภาพแห่งการเดินทาง
21 ธันวาคม 2567 ฉะเชิงเทรา
ฉ.ช.๘ บันทึกการเดินทาง 20th
เดินกินถิ่นนาเกลือ 2567-2568
งาน "เดินกินถิ่นนาเกลือ" งานถนนคนเดินที่คนพัทยาตั้งตารอ ปกติกำหนดจัดงานทุกวันเสาร์และวันอาทิตย์ ช่วงเดือนธันวาคมและมกราคาปีถัดไป สถานที่จัดงานตั้งแต่ที่ทำการตำรวจชุมชนเขตงานที่ 8 (ป้อมตำรวจนาเกลือ) ถึงสะพานยาวนาเกลือ โดยงานเดินกินถิ่นนาเกลือ เป็นงานที่เมืองพัทยาร่วมกับสำนักการท่องเที่ยวและกีฬา จัดขึ้นตามแนวทางการพัฒนาพื้นที่นาเกลือเป็นแหล่งท่องเที่ยวอย่างยั่งยืนของเมืองพัทยา และจังหวัดชลบุรี
กำหนดการวันงานที่แน่นอน โปรดติดตามจากเมืองพัทยา หรือ ติดตามจาก
ข้อมูลงานบน eatfuntravel ก็ได้เช่นกัน
ปฏิทินกิจกรรมในจ.น่าน เดือนธันวาคม 2567
ปฏิทินกิจกรรมจังหวัดสตูล เดือนธันวาคม 2567
กิจกรรมเคาท์ดาวน์จังหวัดนนทบุรี ประจำปี 2567
จำนวนผู้ประกันตนในระบบประกันสังคม เดือนธันวาคม 2567
จำนวนผู้ประกันตนในระบบประกันสังคม เดือนธันวาคม 2567 ยอดรวมทั้งหมด 24,812,815 ราย
Chiang Mai Street Jazz Festival 2024 เทศกาลดนตรีเชียงใหม่สตรีทแจ๊ส ครั้งที่ 6 วันที่ 1- 8 ธันวาคม 2567
Chiang Mai Street Jazz Festival 2024 เทศกาลดนตรีเชียงใหม่สตรีทแจ๊ส ครั้งที่ 6 Chiang Mai Soul: The Rhythm of Healing “จิตวิญญาณเชียงใหม่: ประโลมใจด้วยเสียงดนตรี” ในวันที่ 1- 8 ธันวาคม 2567 ด้วยความร่วมมือของ 5 บาร์ดนตรีคุณภาพ: Moment’s Notice Jazz Club, The Mellowship Jazz Club, Thapae East, Mahoree City of Music, และ The North Gate Jazz Co-op และเวทีใหญ่ “ศูนย์วัฒนธรรมเชียงใหม่”
ร่วมเป็นส่วนหนึ่งของการเฉลิมฉลองในครั้งนี้ และสัมผัสจิตวิญญาณของเชียงใหม่ที่อบอวลอยู่ในทุกบทเพลง ซื้อบัตร Early Bord ในราคาพิเศษได้แล้ววันนี้ - 20 ตุลาคม 2567 ที่ ticketmelon ส่วน Line up ศิลปิน จะอัพเดตต่อไป
เทศกาลนานาชาติพลอยและเครื่องประดับจันทบุรี 5-9 ธันวาคม 2024
GIT ขอเชิญผู้ประกอบการทุกท่านสมัครเข้าร่วมงาน "เทศกาลนานาชาติพลอยและเครื่องประดับจันทบุรี 2024” ตั้งแต่วันที่ 5-9 ธันวาคม 2567 ที่ศูนย์ส่งเสริมอัญมณีและเครื่องประดับจันทบุรี - เปิดรับสมัครตั้งแต่วันนี้ถึงวันที่ 30 กรกฎาคม 2567 - สแกนคิวอาร์โค้ดเพื่อดาวน์โหลดใบสมัคร - สอบถามรายละเอียดเพิ่มเติมได้ที่ นางสาวช่อเพชร แสนสุข Tel: 02-634 4999 ต่อ 636 Email: schopetch@git.or.th
5 ธันวาคม 2567 งานวิ่ง KNT RUNN 2024 @คุ้งบางกะเจ้า
KNT RUNN 2024 @คุ้งบางกะเจ้า ร่วมเป็นส่วนหนึ่งในงานวิ่งการกุศลสุดยิ่งใหญ่ ที่จะจัดขึ้นในวันที่ 5 ธันวาคม 2567 ณ ลานอเนกประสงค์ (หลังตลาดน้ำบางน้ำผึ้ง) อ.พระประแดง จังหวัดสมุทรปราการ เพื่อนำรายได้ร่วมสนับสนุนเตียงสำหรับผู้ป่วยและผู้สูงอายุในชุมชนบางกะเจ้า ประเภทการสมัคร ประเภทที่ 1 วิ่งมินิมาราธอน 10.5 km. ประเภทที่ 2 วิ่งฟันรัน 4.5 km. ประเภทที่ 3 แฟมิลี่รัน 2.5 km. ประเภทที่ 4 VIP วิ่ง-เดิน ได้ทุกระยะ
งานประจำปีปิดทองฝังลูกนิมิต สมโภช 101ปี วัดธรรมิการาม เขาช่องกระจก ประจวบฯ 6-14 ธันวา 2567
งานประจำปีปิดทองฝังลูกนิมิต สมโภช 101 ปี วัดธรรมิการามวรวิหาร เขาช่องกระจก ประจวบฯ ข้างศาลากลางจ.ประจวบฯ วันที่ 6-14 ธันวาคม 2567 9 วันเต็ม กับการเฉลิมฉลอง มหกรรมสินค้ามากมาย ของกินของอร่อย สวนสนุกชุดใหญ่ คอนเสิร์ตทุกคืน
Longlay Beach Life Festival 2024 วันที่ 7-8 ธันวาคม 2567
Longlay Beach Life Festival 2024 วันที่ 7-8 ธันวาคม 2567 ณ หาดชะอำ เพชรบุรี ได้เวลากลับมารวมตัวกันแบบกลมกล่อมอีกครั้ง กับเทศกาลอาบแดด อาบลม ห่มดนตรีที่รอมาทั้งปี ความพิเศษครั้งนี้ นอกจากเสน่ห์ของผู้คนแล้ว เรามีฉากหลังเป็นท้องฟ้าเหนือน้ำทะเลสีสวย หาดทรายยาวสุดลูกหูลูกตา บนฝั่งทะเลอ่าวไทยที่ยังบริสุทธิ์ผุดผ่อง ไม่เคยมีใครได้เคยสัมผัส และเราจะได้เห็นพร้อมกันเป็นครั้งแรก! 2 วัน 2 คืน กับ 4 เวทีหลัก รวมถึงแอคทิวิตี้บนชายหาดที่จะทำให้หลายคนตกหลุมรักในบรรยากาศแบบลงเลที่ไม่เหมือนใคร
งานวิ่งกลางคืนจันทบุรี NIGHT COLOR RUN CHANTHABURI 2024 ครั้งที่ 3 วันที่ 7 ธันวาคม 2567 LINK
งานวิ่งกลางคืนจันทบุรี “NIGHT COLOR RUN CHANTHABURI 2024” ครั้งที่ 3 วันที่ 7 ธันวาคม 2567 ภายใต้แนวความคิด “Canival Chanthaburi” ดินแดนแห่งความสุข จันทบุรีเมืองแห่งสีสัน ระยะแข่งขัน Mini Marathon 10 KM (ชาย - หญิง) / VIP (ชาย - หญิง) นอกจากงานวิ่ง กิจกรรมมากมายไม่ว่าจะเป็นกิจกรรมเรืองแสง การเพนท์ตัว เพนท์หน้า จุดเชคอินถ่ายภาพแสงสี กิจกรรมแฮนเมดสีสัน และกิจกรรมสุดชิค อุบไว้ก่อน ฯลฯ เริ่ม 17.00 น.เป็นต้นไป แล้วมาสนุกไปด้วยกัน
Big Mountain Music Festival คร้ังที่ 14 มัน ใหญ่ แทร่ 7 – 8 ธันวาคม 2567
Pepsi Presents
Big Mountain Music Festival คร้ังที่ 14 มัน ใหญ่ แทร่ เทศกาลดนตรีมันใหญ่แทร่ของประเทศไทย จัดเต็ม 2 วัน 2 คืน 8 เวที กว่า 200 ศิลปิน เยอะที่สุด ครบทุกแนวดนตรี
วันที่ 7 – 8 ธันวาคม 2567 The Ocean เขาใหญ่ จ. นครราชสีมา บัตร Early Cow ราคา 1,800 บาท บัตร VIP Cow ราคา 3,800 บาท พร้อมรับสิทธิพิเศษของแทร่แบบแน่นเวอร์! ทั้ง VIP Fast Lane / VIP Zone / VIP Toilet / VIP Lounge เปิดขายแล้ววันนี้ – 5 กันยายน 2567
ซาวสื่นครั้งที่2 เทศกาลงานกาแฟและดนตรีจังหวัดศรีสะเกษ Sisaket Coffee & Music Fest. II วันที่ 7-8 ธันวาคม 2567
เทศกาลงานกาแฟและดนตรีจังหวัดศรีสะเกษ "ซาวสื่น ครั้งที่2" Sisaket Coffee & Music Fest. II พบกับการออกบูธของร้านกาแฟและเบเกอรี่ชั้นนำของจังหวัดศรีสะเกษ การแสดงดนตรีจากศิลปินท้องถิ่น กิจกรรม Workshop การเสวนาคนกาแฟ Food zone การประกวดครีเอทเมนูเครื่องดื่ม Signature การประกวด Latte Art แล้วมาสื่นไปด้วยกัน วันที่ 7-8 ธันวาคม 2567 ณ ลานกางเต็นท์ หลังอควาเรียมศรีสะเกษ เกาะห้วยน้ำคำ
ถนนคนดริป 7 ธค. ลานใต้ต้นโพธิ์ ตรงข้ามวัดจองคำ
" ถนนคนดริป " เทศบาลเมืองแม่ฮ่องสอน เชิญชวนคนที่ ชื่นชอบกาแฟนำกาแฟมาพบกัน แล้วชวนเชิญมิตรรักแฟนคลับกาแฟมานั่งดื่มกาแฟ พร้อมกับดื่มด่ำ บรรยากาศยามเช้าที่สดชื่นด้วยกัน ณ ลานใต้ต้นโพธิ์ ตรงข้ามวัดจองคำ ริมหนองจองคำ เริ่มเปิดตัวเป็นทางการเช้าวันเสาร์ ที่ 7 ธค. นี้เวลา 7 โมงเช้าเป็นต้นไปถึง 9โมง..จัดทุกเช้า วันเสาร์-อาทิตย์ ..ตลอดช่วงฤดูหนาวนี้ แล้วมาบวก บวกกับ "ถนนเดินได้ วิ่งปั่นดี " เชิญชวนร่วมออกกำลังกายเดิน วิ่ง ปั่น เต้น กันก่อนแล้วแวะมาชิมกาแฟชื่นชมบรรยากาศเย็นสบาย
งานว่าวและบอลลูนนานาชาติ กาชาดร่วมใจของดีห้วยราช วันที่ 11-17 ธันวาคม 2567
เชิญเที่ยวงานว่าวและบอลลูนนานาชาติ กาชาดร่วมใจของดีห้วยราช วันที่ 11-17 ธันวาคม 2567 ณ สนามหน้าที่ว่าการอำเภอห้วยราช จ.บุรีรัมย์ ชมประกวดว่าว การแสดงวัฒนธรรมพื้นบ้าน งานออกบูทกาชาด ของดีและสินค้าโอท็อป ประจำตำบล อำเภอห้วยราช ช็อป ชิม ชมสินค้าราคาถูก สวนสนุกชุดใหญ่
Thailand Coffee Fest Year End 2024 งานเทศกาลกาแฟส่งท้ายปลายปี 12-15 ธันวาคม 2567
Thailand Coffee Fest Year End 2024 งานเทศกาลกาแฟส่งท้ายปลายปีซึ่งจัดขึ้นเป็นครั้งที่ 2 งานจัดขึ้นวันที่ 12 - 15 ธันวาคม 2567 10.00 - 20.00 น. ศูนย์การประชุมแห่งชาติสิริกิติ์ ชั้น LG ฮอลล์ 5 เปิดลงทะเบียนบูทร้านค้าแล้ว! ตั้งแต่วันนี้จนถึงวันที่ 31 ก.ค. (หรือจนกว่าจะมีผู้จองบูทครบตามจำนวน)
ชัยพัฒนาแฟร์ สัญจร จังหวัดนครนายก 12 - 15 ธันวาคม 2567 ณ เขื่อนขุนด่านปราการชล
ปลายปีนี้ ...ปักหมุดกันไว้เลย “ชัยพัฒนาแฟร์ สัญจร” จังหวัดนครนายก วันที่ 12 - 15 ธันวาคม 2567 ณ เขื่อนขุนด่านปราการชล และศูนย์ฝึกอบรมสุดาเดือนเพ็ญและที่พักของมูลนิธิชัยพัฒนา เตรียมมา ช็อป ชิม ชิล ของอร่อยและมีคุณภาพ ท่ามกลางบรรยากาศของสวนร่มรื่นและธารน้ำยามฤดูหนาว
งานยอยศยิ่งฟ้าอยุธยามรดกโลก ประจำปี 2567 วันที่ 13-22 ธันวาคม 2567
งานยอยศยิ่งฟ้าอยุธยามรดกโลก ประจำปี 2567 วันที่ 13-22 ธันวาคม 2567
งานฤดูหนาวอำเภอปากช่อง 13-24 ธันวาคม 2567
มาแน่ๆ งานฤดูหนาวอำเภอปากช่อง ปีนี้กำหนดจัดวันที่ 13-24 ธันวาคม 2567 บริเวณถนนหน้าโรงทอ อำเภอปากช่อง จังหวัดนครราชสีมา มาชิมชมช็อป สินค้ามากมาย สินค้าอุปโภคบริโภค สินค้า OTOP ผลิตภัณฑ์พื้นบ้าน สินค้าทางการเกษตร มหกรรมเฟอร์นิเจอร์ ไม้ดอกไม้ประดับ สินค้าจากโรงงาน ชม มหกรรมสวนสนุก ชิงช้า ม้าหมุน
มหกรรมคอนเสิร์ตทุกค่ำคืน 13 ธ.ค. 67 พราว ภัทราวดี 14 ธ.ค. 67 เนส พรอำนาจ 15 ธ.ค. 67 นิวสตาร์แบนด์ 16 ธ.ค. 67 บุ๊ค ศุภกาญจน์ & ทิดแอม 17 ธ.ค. 67 บิว จิตรฉรีญา 18 ธ.ค. 67 TN CHAINAT 19 ธ.ค. 67 B.B.BAND 20 ธ.ค. 67 TN CHAINAT 21 ธ.ค. 67 เม้ก อภิสิทธิ์ 22 ธ.ค. 67 บรรพต ไหทองคำ 23 ธ.ค. 67 บรรพต ไหทองคำ 24 ธ.ค. 67 เสียงอิสาน นกน้อย อุไรพรงานฤดูหนาว ปากช่อง 13-24 ธันวาคม 2567
สโมสรไลอ้อนเขาใหญ่ เชิญเที่ยว งานฤดูหนาว ปากช่อง 13-24 ธันวาคม 2567 บริเวณถนนหน้าโรงทอกระสอบ อ.ปากช่อง นครราชสีมา ชมดนตรีทุกคืน ศิลปินดัง เนส พรอำนาจ นิว สตาร์แบนด์ บิว จิตรฉรีญา TN ชัยนาท บรรพต ปิดท้ายคืน 24 ธันวา วงเสียงอีสาน
นั่งเล่น 8 Nanglen Music Festival 2024 วันที่ 14 ธันวาคม 2567
นั่งเล่น 8
Nanglen Music Festival เทศกาลดนตรีท่ามกลางธรรมชาติ ที่บรรยากาศดีที่สุด 14 ธันวาคม 2567 ทองสมบูรณ์คลับ เขาใหญ่ ปีนี้มากอดกันอีกครั้ง ให้รู้สึกเหมือนครั้งแรกที่เคยกอดกัน ในเทศกาลดนตรีที่บรรยากาศน่ากอดที่สุด
ลุยเขา มิวสิคเฟสติวัล 2024 วันเสาร์ที่ 16 พ.ย. 67
ลุยเขา มิวสิคเฟสติวัล 2024 วันเสาร์ที่ 16 พ.ย. 67 ลานกิจกรรมเขาใหญ่มาราธอน ถนนธนะรัชต์ กม.21 เขาใหญ่ เทศกาลดนตรี แห่งเขาใหญ่ ปีนี้ จัดเต็ม 2 เวที 25 ศิลปิน 12 ชั่วโมงเต็ม! มีที่จอดรถภายในงาน พื้นที่กว้างขวาง เดินทางสะดวก ห้องน้ำและสิ่งอำนวยความสะดวกพร้อม #มารับลมหนาวแบบไม่ต้องสู้ชีวิต รายชื่อศิลปินลุยเขา มิวสิคเฟสติวัล
เวทีลุยมาโยก : มนัสวีร์ / ฮิวโก้-ใหม่ สิบล้อ / คณะขวัญใจ / ไววิทย์ / เขียนไขและวานิช / อภิรมย์ / เกมส์ สุจิตรา / SITTA / วสันต์ 17 / Whatfalse / ดวงดาวเดียวดาย / T_047
เวทีลุยมามันส์ : คาราบาว / ปู พงษ์สิทธิ์ / เสก โลโซ / หงา คาราวาน / คนด่านเกวียน / ซูซู / แฮมเมอร์ / ทอม ดันดี / หิน เหล็ก ไฟ / ปู แบล็คเฮด / เหน่ง Y NOT 7 / อี๊ด FLY / บุ๊ค ศุภกาญจน์
Prudential Scenic Marathon Chanthaburi 2024 วันที่ 21-22 ธันวาคม 2567
Prudential Scenic Marathon Chanthaburi 2024 วันแข่งขัน : 21 - 22 ธันวาคม 2567 วันเสาร์ที่ 21 ธันวาคม 2567 เวลา 16.00 - 18.30 น. [FUNRUN 5KM | MANGROOVE 3 KM] วันอาทิตย์ที่ 22 ธันวาคม 2567 เวลา 03.30 – 11.00 น. [42.195KM I 21.1KM | 10KM] จุดปล่อยตัว : ณ ศูนย์ศึกษาการพัฒนาอ่าวคุ้งกระเบน โครงการพระราชดำริ หาดแหลมเสด็จ จ.จันทบุรี (GPS )
เคาท์ดาวน์ปีใหม่ เมืองคนงามบ้านโป่ง ประจำปี 2567 วันที่ 27 ธันวา- 5 มกรา 2567
เทศบาลเมืองบ้านโป่ง ขอเชิญเที่ยวงาน เคาท์ดาวน์ปีใหม่ เมืองคนงามบ้านโป่ง ประจำปี 2567 วันที่ 27 ธันวาคม- 5 มกราคม 2567 บริเวณถนนริมน้ำกลางเมือง อ.บ้านโป่ง พบกับมหกรรมสินค้าราคาถูกจากโรงงาน อาหารอร่อย สวนสนุกชุดใหญ่ มหกรรมคอนเสิร์ต
งานตากสินมหาราชานุสรณ์ และงานกาชาด ประจำปี 27 ธันวาคม - 4 มกราคม 2568
จังหวัดตาก ขอเชิญเที่ยวงาน ตากสินมหาราชานุสรณ์ และงานกาชาด ประจำปี 2567-2568 วันที่ 27 ธันวาคม - 4 มกราคม 2568 ณ บริเวณหน้าศาลพระเจ้าตากสิน จังหวัดตากPhuket Coffee Hub Connect วันที่ 27 ธันวาคม 2567 - 2 มกราคม 2568
ศูนย์การค้าเซ็นทรัล ภูเก็ต เฟสติวัล จัดงาน “Phuket Coffee Hub Connect 2024” วันที่ 27 ธันวาคม 2567 - 2 มกราคม 2568 เทศกาลกาแฟครั้งยิ่งใหญ่ส่งท้ายปีที่ภูเก็ต งานที่จะพาทุกคนมาเชื่อมต่อกับความหลงใหลในกาแฟ ไม่ว่าคุณจะเป็นคอกาแฟ สายชิม หรือผู้ประกอบการในวงการกาแฟ
ในงานมีกิจกรรมมากมายสำหรับคนรักกาแฟและขนมอร่อยคาเฟ่สไตล์ คาเฟ่และร้านกาแฟชื่อดังจากทั่วไทย อิ่มอร่อยกับขนม ชาเขียว คราฟโกโก้ และสินค้าเกี่ยวกับกาแฟจากแบรนด์ต่างๆ ร่วมเวิร์คชอปความรู้เกี่ยวกับการทดสอบทาง Sensory และเทคนิคการ Brewing พิเศษ! ชิมกาแฟคุณภาพจาก โครงการ Q Project Thailand พร้อมกิจกรรม Cupping และเวิร์คชอปจากทางโครงการ
การแข่งขันที่ไม่ควรพลาด! Phuket Preseason: Drip Battle การแข่งขันชงกาแฟดริปสุดเร้าใจ ผู้ชนะจะได้รับ ตั๋วเข้าแข่งขัน TCBL พร้อมถ้วยและเงินรางวัลจากสปอนเซอร์ PassionBrew Cup Battle สำหรับสายชิมที่อยากทดสอบทักษะการชิมกาแฟของตนเองและสนุกไปกับความท้าทายใหม่ๆ
งานส่งท้ายปีเก่า ต้อนรับปีใหม่ 28 ธันวาคม -3 มกราคม 2568
ขอเชิญเที่ยวงานส่งท้ายปีเก่า ต้อนรับปีใหม่ บริเวณหน้าโรงเรียนชุมชนแท่นประจัน อ.บ้านแท่น ชัยภูมิ 28 ธันวาคม -3 มกราคม 2568
งานเทศกาล แสง สี เสียง สดุดีพระเจ้าตากสินมหาราช ร้อยเรียงเรื่องเล่าเมืองบางคล้า 28-29 ธ.ค. 67
ขอเชิญเที่ยวงานเทศกาล แสง สี เสียง สดุดีพระเจ้าตากสินมหาราช ร้อยเรียงเรื่องเล่าเมืองบางคล้า 28-29 ธ.ค. 67 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ ลานกิจกรรม อนุสรณ์สถานพระสถูปเจดีย์สมเด็จพระเจ้าตากสินมหาราช ปากคลองท่าลาด อำเภอบางคล้า จังหวัดฉะเชิงเทรา
PATTAYA COUNTDOWN ส่งท้ายปีเก่าต้อนรับปีใหม่
และแน่นอนที่สุดสำหรับเมืองพัทยาและชาวโลก คือ งาน PATTAYA COUNTDOWN ส่งท้ายปีเก่าต้อนรับปีใหม่ ที่กระหึ่มไกลไปถึงดาวอังคาร คาดว่าปีนี้คงไม่ต่างกับปีที่ผ่านมาสำหรับวันจัดงาน ที่จะอยู่ในช่วงวันที่ 29-31 ธันวาคม 2567 เพื่อต้อนรับวันที่ 1 มกราคม 2568 ศกใหม่ที่จะไฉไลเกรียงไกรกว่าเดิม สถานที่ก็คือหาดพัทยาแน่นอน [
ข้อมูลงาน PATTAYA COUNTDOWN]
งาน "PATTAYA COUNTDOWN 2025" 29-31 ธันวาคม นี้
งาน "PATTAYA COUNTDOWN 2025" ร่วมเฉลิมฉลองส่งท้ายปีเก่าต้อนรับปีใหม่ไปด้วยกัน วันที่ 29-31 ธันวาคม 2567 ณ ชายหาดพัทยากลาง เวลา 17.00 น. เป็นต้นไป พบกับฟรีคอนเสิร์ตจากศิลปินนักร้องชื่อดังทั่วฟ้าเมืองไทยตลอดทั้งสามวัน เข้าชมฟรี ! ที่สำคัญ อย่าลืมมาร่วมลุ้นรับรางวัลใหญ่ รถกระบะอีซูซุ ดีแมค มูลค่า 770,000 บาท และรางวัลอื่นๆ มูลค่ารวมกว่า 2,200,000 บาท พลาดไม่ได้! วันที่ 31 ธ.ค.2567 กับการจุดพลุเฉลิมฉลอง CEREMONY FIREWORK SHOW นับถอยหลังก้าวสู่ศักราชใหม่ ปี 2568 ไปพร้อมๆกัน
เที่ยวที่ใช่กับเพื่อนซี้ 4 ขา ณ ตราด LINK
ททท. ตราดเอาใจสาย Pet Friendly เพียงพาน้องหมา น้องแมว ไปเช็คอินถ่ายรูปลงเฟซบุคที่ร้านคาเฟ่-ร้านอาหารที่ร่วมโครงการตั้งแต่วันนี้ รับทั้งส่วนลดและสิทธิประโยชน์มากมายให้ได้ฟินกันทั้งทาสทั้งเจ้านายเลย
กติกา การร่วมสนุก
1. ถ่ายรูปเรากับสัตว์เลี้ยงสุดรัก+เช็คอินที่ร้าน โพสต์ลง Facebook
2. ใส่ hashtag #เพื่อนซี้4ขาตราด แล้วเปิดการมองเห็นเป็นสาธารณะ
3. เมื่อโพสต์แล้ว ยื่นหลักฐานให้ร้านค้าดูได้เลย
ร้านค้าที่ร่วมโครงการ
- Warista cafe and garden
- Little Cozy Cafe
- Alarm cafe kohchang
- Nong Bua Seafood Koh Chang Signature
- Chompu farm and cafe ชมปูฟาร์มแอนด์คาเฟ่
- NaBan Cafe & Big Dog
- ร้านต้องลิ้มกาแฟสด
- GROW CAFE TRAT
- Kruabaanche ครัวบ้านเช
หมายเหตุ:
* เงื่อนไขส่วนลด, ของแถมจะแตกต่างกันไปในแต่ละร้าน
* แสดงหลักฐานที่โพสต์ให้กับร้านค้าดูเพื่อรับสิทธิประโยชน์ได้เลย
* บางร้านสัตว์เลี้ยงเข้าตัวร้าน หรือโซนห้องแอร์ไม่ได้ ยังไงก็สอบถามกับทางร้านก่อนนะครับ
3 และ 4 กุมภาพันธ์ 2567 เรอทัก รักเธอ @ แปดริ้ว แบบไปเช้าเย็นกลับ
วันที่ 3 และ 4 กุมภาพันธ์ 2567 (ทริปที่ 8 และ 9) แบบไปเช้าเย็นกลับ โปรแกรมนั่ง KIHA 183 “เรอทัก รักเธอ @ แปดริ้ว พลิ้วตามสายน้ำ” ราคาท่านละ 1,499 บาท
10 - 11 กุมภาพันธ์ 2567 ชมดนตรีในสวน แห่งความรัก @ กาญจนบุรี
วันที่ 10 - 11 กุมภาพันธ์ 2567 (ทริปที่ 10) แบบพักค้างคืน โปรแกรมนั่ง KIHA 183 ชมดนตรีในสวน แห่งความรัก @ กาญจนบุรี ราคาท่านละ 3,999 บาท
17 และ 18 กุมภาพันธ์ 2567 ชวนแต่งไทยไปเที่ยวเมืองรอง เที่ยวล่องเมืองลิง
วันที่ 17 และ 18 กุมภาพันธ์ 2567 (ทริปที่ 11 และ 12) แบบไปเช้าเย็นกลับ โปรแกรมนั่ง KIHA 183 “ชวนแต่งไทยไปเที่ยวเมืองรอง เที่ยวล่องเมืองลิง เที่ยววัง งานแผ่นดินสมเด็จพระนารายณ์มหาราช” ราคาท่านละ 1,499 บาท
24 และ 25 กุมภาพันธ์ 2567 รื่นรมย์ชมพระราชนิเวศน์มฤคทายวัน @ เพชรบุรี
วันที่ 24 และ 25 กุมภาพันธ์ 2567 (ทริปที่ 13 และ 14) แบบไปเช้าเย็นกลับ โปรแกรมนั่งรถ KIHA 183 “รื่นรมย์ชมพระราชนิเวศน์มฤคทายวัน @ เพชรบุรี” ราคาท่านละ 1,499 บาท
ปฏิทินการบริการเดือน มีนาคม 2567
กทม.เชิญชวนคนกรุงเทพแบบจริงจัง ไปใช้บริการตรวจสุขภาพกัน ใกล้ที่ไหน ไปที่นั่น [
ปฏิทินมีนาคม]
ออกหน่วยทำหมัน ฟรี (มีนาคม 2567)
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนมีนาคม 2567 (สอบถามโทร 02-2487417 02-2453311)
บริการฉีดวัคซีน 50 เขตกทม. ป้องกันพิษสุนัขบ้า รอบมีนาคม เช็คกำหนดการและจุดบริการที่นี่
- 1 มี.ค. เวลา 8-14.00 น. ตลาดเอซี สายไหม เขตสายไหม งาน สุขภาพดี ใกล้บ้าน ใกล้หมอ
- 5 มี.ค. เวลา 9-12.00 น. ชุมชนเขมาเนรมิต บางซื่อ / ชุมชนทับแก้ว ห้วยขวาง
- 6 มี.ค. เวลา 9-12.00 น. ซอยลาดพร้าว 101/2 เขตบางกะปิ / ชุมชนพึ่งทรัพย์ เขตบางนา
- 7 มี.ค. เวลา 9-12.00 น. ชุมชนโฟร์โมสต์ เขตบางขุนเทียน / วัดบวรมงคล บางพลัด
- 8 มี.ค. เวลา 8-14.00 น. ลานกีฬาพัฒน์ 2 เขตราชเทวี
- 12 มี.ค. เวลา 9-12.00 น. ชุมชนลาดพร้าว 45 เขตห้วยขวาง / หมู่บ้านดวงวิภา เขตบางบอน
- 13 มี.ค. เวลา 9-12.00 น. วัดราษโกษา ลาดกระบัง / ชุมชนอัลเอี๊ยะติชอม สวนหลวง
- 14 มี.ค. เวลา 9-12.00 น. ตลาดผู้ใหญ่อ้วน ลาดพร้าว / ชุมชนสุขอนันต์ คันนายาว
- 15 มี.ค. เวลา 9-12.00 น. วัดทองบางเชือกหนัง ตลิ่งชัน
- 19 มี.ค. 9-12.00 น. มัสยิดสวนพลู ธนบุรี / ชุมชนเย็นอากาศ 2 ยานนาวา
- 20 มี.ค. 9-12.00 น. โรงเรียนวัดพลับพลาชัย ป้อมปราบฯ / ชุมชนสุวรรณี 3 วัฒนา
- 21 มี.ค. 9-12.00 น. ผ่าตัดทำหมันสุนัขและแมว ฟรี‼️ ณ วัดไผ่ตัน ซ.พหลโยธิน 15
- 22 มี.ค. 8-14.00 น. วิทยาลัยพาณิชยการบางนา เขตบางนา (ลงทะเบียนหน้างาน)
โปรแกรมท่องเที่ยวเดือนมีนาคม 2567
โปรแกรมท่องเที่ยวเดือนมีนาคม 2567 มี 4 โปรแกรม วันที่และรายละเอียดเส้นทางต่างๆ ดังต่อไปนี้
9-10 มีนาคม 2567 ท่องดินแดนดึกดำบรรพ์ มหัศจรรย์ ดาวบนดิน
ทริปที่ 1 แบบพักค้างคืน (วันที่ 9-10 มีนาคม 2567) โปรแกรม “ท่องดินแดนดึกดำบรรพ์ มหัศจรรย์ ดาวบนดิน” จังหวัดนครราชสีมา พาเที่ยวเมืองโคราชจีโอพาร์คโลก ร่วมงานประเพณี ”กินเข่าค่ำ“ และการแสดง แสง สี เสียง ”Mini Light and Sound“ คนละ 3,999 บาท
16-17 มีนาคม 2567 โปรแกรม ท่องเมืองศิลป์ ถิ่นสัทธา ดาราพราว
ทริปที่ 2 แบบพักค้างคืน (วันที่ 16-17 มีนาคม 2567) โปรแกรม “ท่องเมืองศิลป์ ถิ่นสัทธา ดาราพราว” ที่จังหวัดราชบุรี พาชมโรงงานในป่า สู่ความยั่งยืน ชมปฏิมากรรมกลางแจ้ง ยามค่ำคืน ด้วยเทคนิคไฟประดับนับล้านดวง โดย Lighting Designer ณ สัทธา อุทยานไทย คนละ 3,999 บาท
23-24 มีนาคม 2567 โปรแกรม “คู่กรรม” ตามหาดาวแห่งรัก ที่จังหวัดกาญจนบุรี
ทริปที่ 3 แบบพักค้างคืน (วันที่ 23-24 มีนาคม 2567) โปรแกรม “คู่กรรม” ตามหาดาวแห่งรัก ที่จังหวัดกาญจนบุรี ร่วมแต่งกายยุค “มาลานำไทย” พาเที่ยวย้อนรอยสงครามโลกครั้งที่ 2 นั่งดูหนังกลางแปลง ”คู่กรรม“ ริมสะพานรถไฟสายมรณะ และชมดนตรีในสวน คนละ 3,999 บาท
30 และ 31 มีนาคม 2567 โปรแกรม “มูเตลู ลิขิตแห่งดวงดาว” ที่จังหวัดฉะเชิงเทรา
ทริปที่ 4 และ 5 แบบไปเช้าเย็นกลับ (วันที่ 30 และ 31 มีนาคม 2567) โปรแกรม “มูเตลู ลิขิตแห่งดวงดาว” ที่จังหวัดฉะเชิงเทรา ชวนกันไปมูเตลูกับโหรดัง “อาจารย์ คฑา ชินบัณชร“ มูอย่างไรให้รวยกับพระพิฆเนศ 3 ปาง เปิดดวงมหาเศรษฐี ตลอดทริป คนละ 1,499 บาท
โปรแกรมท่องเที่ยว เดือนเมษายน 2567
โปรแกรมท่องเที่ยวเดือนเมษายน 2567 มี 2 โปรแกรม วันและรายละเอียดเส้นทางต่างๆ ดังต่อไปนี้
20-21 เมษายน 2567 โปรแกรม “นั่ง 4WD เที่ยวป่าต้นน้ำ ที่พะเนินทุ่ง” จังหวัดเพชรบุรี
ทริปที่ 1 แบบพักค้างคืน (วันที่ 20-21 เมษายน 2567) โปรแกรม “นั่ง 4WD เที่ยวป่าต้นน้ำ ที่พะเนินทุ่ง” จังหวัดเพชรบุรี พาไปเช็กอินที่ผืนป่ามรดกโลกแห่งที่ 3 ของไทย สัมผัสหมอกยามเช้าที่เขาพะเนินทุ่ง อุทยานแห่งชาติแก่งกระจาน คนละ 3,999 บาท
27-28 เมษายน 2567 โปรแกรม “มูเตลู ลิขิตแห่งสายน้ำ” จังหวัดฉะเชิงเทรา
ทริปที่ 2 และ 3 แบบไปเช้าเย็นกลับ (วันที่ 27 และวันที่ 28 เมษายน 2567) โปรแกรม “มูเตลู ลิขิตแห่งสายน้ำ” ที่จังหวัดฉะเชิงเทรา พาไปมูเตลู เสริมสิริมงคล เปิดโชครับทรัพย์ เพิ่มวาสนา เติมบารมี ตามตำราศาสตร์เส้นสายมังกร กับ “อาจารย์วิโรจน์ ตั้งวาณิชย์“ คนละ 1,499 บาท
ออกหน่วยทำหมัน ฟรี (เมษายน 2567)
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนเมษายน 2567 (สอบถามโทร 02-2487417 02-2453311)
- 2 เม.ย. 9-12 น. อุทยาน 100 ปี จุฬาฯ / หมุ่บ้าน เคซี การ์เด้นโอม เขตคลองสามวา
- 3 เม.ย. 9-12 น. เคหะบางนา 2 เขตบางนา / วัดกระทุ่มเสือปลา เขตประเวศ
- 4 เม.ย. 9-12 น. ชุมชนรามอินทราเนรมิต มีนบุรี / สวนป่าเฉลิมพระเกียรติใต้สะพานตากสิน คลองสาน
- 5 เม.ย. 9-12 น. เคหะฉลองกรุง เขตหนองจอก
- 9 เม.ย. 9-12 น. ลานกีฬาปลอดยาเสพติด ใต้ทางด่วนมหานคร เขตบางรัก / เคหะธนบุรี 1 ส่วน 2 เขตบางขุนเทียน
- 10 เม.ย. 9-12 น. วัดปรินายก พระนคร / ชุมชนเฟลต 16 คลองเตย
- 23 เม.ย. 9-12 น. สำนักงานเขตบางกอกน้อย / ลานนันทนาการ สำนักงานเขตสาทร
- 24 เม.ย. 9-12 น. วัดบางบัว เขตบางเขน / ตลาดสองคุณจ่า เขตบางแค
- 25 เม.ย. 9-12 น. ชุมชนโรงเจ บางคอแหลม / วัดสสวัสดิ์วารีสีมาราม เขตดุสิต / ศูนย์สาธารณสุข 45 ร่มเกล้า เขตลาดกระบัง
- 26 เม.ย. 8-14 น. ลานปฏิบัติธรรม วัดมัชฌันติการาม เขตบางซื่อ
- 30 เม.ย. 9-12 น. มัสยิดอัสลาม บึงกุ่ม / ชุมชนเสนานิคม 2 จตุจักร
ออกหน่วยทำหมัน ฟรี (พฤษภาคม 2567)
กำหนดการหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี จุดต่างๆ ดังนี้ (จากเพจ
กลุ่มควบคุมโรคพิษสุนัขบ้า)
- วันพุธที่ 1 พฤษภาคม 2567 ที่ชุมชนพ้ฒนาศาลาร่วมใจ แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 2 พฤษภาคม 2567 ที่ชุมชนซอยพระธรรมนูญ แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 3 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองอัรเราะห์มาน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 7 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองบ้านเกาะพ้ฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 8 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองบาหยัน 2 แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 9 พฤษภาคม 2567 ที่ชุมชนบ้านบึงเตย แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันจันทร์ที่ 13 พฤษภาคม 2567 ที่ชุมชนพุทธ-มุสลิมสามัคคี แขวงคลองสามประเวศ เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 15 พฤษภาคม 2567 ที่ชุมชนอัลฮุสนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 16 พฤษภาคม 2567 ที่หมู่บ้านเคซี การ์เด้นท์โฮม ซ.นิมิตใหม่ 40 แขวงสามวาตะวันออก เขตคลองสามวา เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 17 พฤษภาคม 2567 ที่ชุมชนบึงฝรั่งพัฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 21 พฤษภาคม 2567 ที่ชุมชนมิตรไมตรีสัมพันธ์ แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 24 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองดารุสชุนนี แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันจันทร์ที่ 27 พฤษภาคม 2567 ที่ชุมชนหมู่ 4 ร่วมพัฒนา แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันอังคารที่ 28 พฤษภาคม 2567 ที่ชุมชนดารุ้ลมูกีมอุปถัมป์ แขวงขุมทอง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
- วันพุธที่ 29 พฤษภาคม 2567 ที่ชุมชนหมู่ 2 คู้ฝั่งเหนือ (สื่อสันติ) แขวงคู้ฝั่งเหนือ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพุธที่ 29 พฤษภาคม 2567 ที่วัดปากบ่อ แขวงสวนหลวง เขตสวนหลวง เวลา 9.00 - 12.00 น.
- วันพฤหัสบดีที่ 30 พฤษภาคม 2567 ที่ชุมชนแผ่นดินทองนูรุดดีน แขวงหนองจอก เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันศุกร์ที่ 31 พฤษภาคม 2567 ที่ชุมชนรุ่งเรืองพัฒนา แขวงลาดกระบัง เขตลาดกระบัง เวลา 9.30 - 11.30 น.
โปรแกรมท่องเที่ยวเดือนพฤษภาคม 2567
ทริปสุดพิเศษกับขบวนรถไฟ KIHA 183 เดือนพฤษภาคม : ท่องไปตามสายลม
- วันที่ 4 และ 5 พฤษภาคม 67 ทริปที่ 1 และ 2 แบบไปเช้าเย็นกลับ โปรแกรม Unseen แห่งใหม่ สายลมพลังบวก จังหวัดสระบุรี พาเที่ยววัดถ้ำพระโพธิสัตว์ ตลาดสร้างสุข ชุมชนร่วมสร้าง สักการะพระพุทธบาทเขาน้อย หอนมสิการ สถานที่ท่องเที่ยวเชิงวัฒนธรรม Unseen แห่งใหม่ของไทย คนละ 1,499 บาท
- วันที่ 11 - 12 พฤษภาคม 67 ทริปที่ 3 แบบค้างคืน โปรแกรม Night Run on the beach กับสายลมแห่งทะเล จังหวัดชลบุรี พาไปเล่นน้ำทะเล เกาะติดกิจกรรม Night Run On The Beach (Doraemon Run) พาเล่นน้ำทะเลให้ชุ่มฉ่ำใจ คนละ 3,999 บาท
- วันที่ 18 และ 19 พฤษภาคม 67 ทริปที่ 4 และ 5 แบบไปเช้าเย็นกลับ โปรแกรม ท่องนครล่องธารา ลมพัดพา เที่ยวเพลินใจ จังหวัดฉะเชิงเทรา พาล่องเรือชมวิถีชีวิตชุมชนสองฟากฝั่งแม่น้ำบางปะกง ขอพรสิ่งศักดิ์สิทธิ์ วัดวีระโชติธรรมาราม ชมพระอุโบสถแก้วกลางน้ำราชพรหมยานอนุสรณ์ คนละ 1,499 บาท
- วันที่ 25 - 26 พฤษภาคม 67 ทริปที่ 6 แบบค้างคืน โปรแกรม เสน่ห์เมืองเพชร กับสายลมแห่งรัก จังหวัดเพชรบุรี พาชมพระราชนิเวศน์มฤคทายวัน สักการะองค์พ่อปู่พญาศรีเพชรคีรี มหามุนี ศรีสุทโธนาคราช สนุกกับกิจกรรม “เสน่ห์ทะเลบ้านฉัน” ปั่นจักรยานสองแรงปั่น เล่นน้ำทะเล ฮาเฮกับบานาน่าโบ๊ท คนละ 3,999 บาท
บริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี เดือนมีนาคม-เมษายน 2567
ขอเชิญชาวเขตเทศบาลนครระยอง นำสุนัขและแมวของท่านเข้ารับบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่1) ประจำปีงบประมาณ 2567 ในโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ โดยงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม บริการตามแต่ละชุมชนเวลา 13.30 - 16.00 น.
เงื่อนไขการเข้ารับบริการ
1. เตรียมบัตรประชาชน และต้องอาศัยอยู่ในเขตเทศบาลนครระยอง
2. สุนัขและแมวต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี
3. สุนัขและแมวไม่อยู่ในช่วงตั้งท้อง และให้นมลูก
โปรแกรมท่องเที่ยวเดือนมิถุนายน 2567
ทริปสุดพิเศษกับขบวนรถไฟ KIHA 183 เดือนมิถุนายน : ฟ้าใส ป่าโปร่ง พฤกษานานาพรรณ
- วันที่ 1 และวันที่ 2 มิถุนายน 67 ทริปที่ 7 และ 8 แบบไปเช้าเย็นกลับ โปรแกรม ท่องเมืองสองบุรี ยางนาป่าบางเลา จังหวัดลพบุรี ชวนปลูกต้นยางนา สร้างบ้านให้นกแก้วหัวแพร สัมผัสวิถีชุมชน “ลาวเวียง” และพิพิธภัณฑ์ร่วมสมัยแห่งเมืองสิงห์บุรี คนละ 1,499 บาท
- วันที่ 8 - 9 มิถุนายน 67 ทริปที่ 9 แบบค้างคืน โปรแกรม ขุนด่านปราการชล ป่าต้นน้ำ จังหวัดฉะเชิงเทรา - นครนายก พาเล่นน้ำตกนางรอง ล่องเรือยาง ขุนด่านปราการชล น้ำตกช่องลม ชมฝูงผีเสื้อสวยงาม พาเที่ยวถ้ำวงศ์รัตนมณีมหานครนาคราช คนละ 3,999 บาท
- วันที่ 15 และ 16 มิถุนายน 67 ทริปที่ 10 และ 11 แบบไปเช้าเย็นกลับ โปรแกรม เสน่ห์ตะวันออก ปลูกป่ากาสะลอง จังหวัดปราจีนบุรี พาเที่ยววัดแก้วพิจิตร พิพิธภัณฑ์สถานแห่งชาติปราจีนบุรี สักการะสิ่งศักดิ์สิทธิ์ วนอุทยานเขาอีโต้ ร่วมกิจกรรมปล่อยปลา ปลูกป่ากาสะลอง ชิม ชอป สินค้าชุมชนและผลิตผลทางการเกษตร คนละ 1,499 บาท
- วันที่ 22 - 23 มิถุนายน 67 ทริปที่ 12 แบบค้างคืน โปรแกรม หาดสวย ฟ้าใส สวนสนประดิพัทธ์ จังหวัดประจวบคีรีขันธ์ พาไปเล่นน้ำทะเลที่หาดสวนสนประดิพัทธ์ เที่ยวชมอุทยานราชภักดิ์ วัดห้วยมงคล อ่างเก็บน้ำเขาเต่า โครงการชลประทานตามรอยพระราชดำริแห่งแรกของในหลวงรัชกาลที่ 9 พาเที่ยวตลาดชิกกาด้า และเมืองหัวหิน คนละ 3,999 บาท
- วันที่ 29 และ 30 มิถุนายน 67 ทริปที่ 13 และ 14 แบบไปเช้าเย็นกลับ โปรแกรม ปลูกป่า ดำนา พิพิธภัณฑ์ศิลป์แผ่นดิน จังหวัดพระนครศรีอยุธยา พาชมศูนย์การเรียนรู้เศรษฐกิจพอเพียง “บ้านของพ่อ” ล่องเรือชมความงามสองฟากฝั่งแม่น้ำเจ้าพระยา ชมวัดใหญ่ชัยมงคล ชวนกัน check-in ที่หมู่บ้านญี่ปุ่น คนละ 1,499 บาท
บริการวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี เดือนเมษายน-พฤษภาคม 2567
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศตั้งจุดออกให้บริการวัคซีนป้องกันโรคพิษสุนัขบ้า เริ่มให้บริการตั้งแต่ 17.00 น. - 19.00 น. - กรุณาเตรียมบัตร ปชช. ก่อนเข้ารับบริการ - สุนัขและแมวตั้งมีอายุมากกว่า 3 เดือนขึ้นไป ไม่ป่วย และอยู่ช่วงระหว่างตั้งท้อง
หน่วยสัตวแพทย์เคลื่อนที่ ทำหมัน เมษายน 2567
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือนเมษายน 2567 (สอบถามโทร 02-2487417 02-2453311)
บริการฉีดวัคซีน 50 เขตกทม. ป้องกันพิษสุนัขบ้า รอบมีนาคม เช็คกำหนดการและจุดบริการที่นี่
- 2 เม.ย. 9-12 น. อุทยาน 100 ปี จุฬาฯ / หมุ่บ้าน เคซี การ์เด้นโอม เขตคลองสามวา
- 3 เม.ย. 9-12 น. เคหะบางนา 2 เขตบางนา / วัดกระทุ่มเสือปลา เขตประเวศ
- 4 เม.ย. 9-12 น. ชุมชนรามอินทราเนรมิต มีนบุรี / สวนป่าเฉลิมพระเกียรติใต้สะพานตากสิน คลองสาน
- 5 เม.ย. 9-12 น. เคหะฉลองกรุง เขตหนองจอก
- 9 เม.ย. 9-12 น. ลานกีฬาปลอดยาเสพติด ใต้ทางด่วนมหานคร เขตบางรัก / เคหะธนบุรี 1 ส่วน 2 เขตบางขุนเทียน
- 10 เม.ย. 9-12 น. วัดปรินายก พระนคร / ชุมชนเฟลต 16 คลองเตย
- 23 เม.ย. 9-12 น. สำนักงานเขตบางกอกน้อย / ลานนันทนาการ สำนักงานเขตสาทร
- 24 เม.ย. 9-12 น. วัดบางบัว เขตบางเขน / ตลาดสองคุณจ่า เขตบางแค
- 25 เม.ย. 9-12 น. ชุมชนโรงเจ บางคอแหลม / วัดสสวัสดิ์วารีสีมาราม เขตดุสิต / ศูนย์สาธารณสุข 45 ร่มเกล้า เขตลาดกระบัง
- 26 เม.ย. 8-14 น. ลานปฏิบัติธรรม วัดมัชฌันติการาม เขตบางซื่อ
- 30 เม.ย. 9-12 น. มัสยิดอัสลาม บึงกุ่ม / ชุมชนเสนานิคม 2 จตุจักร
งานประเพณีชักพระ-ทอดผ้าป่า และแข่งเรือยาว จังหวัดสุราษฎร์ธานี ประจำปี 2567 วันที่ 14-22 ตุลาคม 2567
องค์การบริหารส่วนจังหวัดสุราษฎร์ธานี ประกาศกำหนดการจัดงาน “งานประเพณีชักพระ-ทอดผ้าป่า และแข่งเรือยาว จังหวัดสุราษฎร์ธานี ประจำปี 2567” โดยจัดวันที่ 14-22 ตุลาคม 2567 บริเวณบริเวณถนนดอนนก หน้าศูนย์ราชการจังหวัดสุราษฎร์ธานี ในงานจะมีกิจกรรม การประกวดเรือพนมพระทางบกและขบวนแห่เรือพนมพระทางบก ขบวนประเพณีชักพระ การทอดผ้าป่า และการแข่งเรือยาวประเพณี
4 และ 5 พฤษภาคม 67 โปรแกรม Unseen แห่งใหม่ สายลมพลังบวก จังหวัดสระบุรี
ทริปที่ 1 และ 2 แบบไปเช้าเย็นกลับ (วันที่ 4 และ 5 พฤษภาคม 67) โปรแกรม Unseen แห่งใหม่ สายลมพลังบวก จังหวัดสระบุรี พาเที่ยววัดถ้ำพระโพธิสัตว์ ตลาดสร้างสุข ชุมชนร่วมสร้าง สักการะพระพุทธบาทเขาน้อย หอนมสิการ สถานที่ท่องเที่ยวเชิงวัฒนธรรม Unseen แห่งใหม่ของไทย คนละ 1,499 บาท
- เยี่ยมชม "วัดถ้ำพระโพธิสัตว์" หรือ "ถ้ำพระงาม" เรือ "ถ้ำเขาน้ำพุ" ถ้ำหินสวยงาม ชมภาพสลักศิลปะแบบทวาราวดีอายุมากกว่าพันปี และได้รับการขึ้นทะเบียนเป็นโบราณสถานจากกรมศิลปากร
- ชม ชิมชอป ที่ ตลาดหัวปลี "ตลาดสร้างสุขชุมชนร่วมสร้าง" ตลาดในสวนไผ่ เลือกซอปสินค้า OTOP จากชาวบ้านและสินค้าอื่น ฯ เช่น ของกิน ของใช้ต่าง ๆ มากมาย
- แวะชม "หอมนสิการ" สถานที่ท่องเที่ยวเชิงวัฒนธรรมรูปแบบแห่งใหม่ของไทย และของโลก ภายในเป็นที่ประดิษฐานพระพุทธรูปพระบรมโลกนาถ พระบรมสารีริกธาตุ ภาพปักพระบรมโลกนาถ และนิทรรศการร่วมสมัยจำลองมรรคา และคำสอนของพระบรมศาสดา
- สักการะ พระพุทธบาทเขาน้อย พระพุทธบาทจำลอง ซึ่งเชื่อกันว่าเป็นรอยพระพุทธบาทขององค์สมเด็จพระสัมมาสัมพุทธเจ้า
11 - 12 พฤษภาคม 67 ทริปแบบค้างคืน โปรแกรม Night Run on the beach กับสายลมแห่งทะเล จังหวัดชลบุรี
วันที่ 11 - 12 พฤษภาคม 67 ทริปที่ 3 แบบค้างคืน โปรแกรม Night Run on the beach กับสายลมแห่งทะเล จังหวัดชลบุรี พาไปเล่นน้ำทะเล เกาะติดกิจกรรม Night Run On The Beach (Doraemon Run) พาเล่นน้ำทะเลให้ชุ่มฉ่ำใจ คนละ 3,999 บาท
- กราบสักการะ ศาลกรมหลวงชุมพรฯ เพื่อความเป็นสิริมงคล
- ชมวิวอ่าวสัตหีบ อ่าวเตยงาม เกาะพระ เกาะเตาหม้อ ทอดโค้งตามแนวชายหาดทรายที่สวยงาม
- ชม ชิม ชอป แซะ ที่ ตลาดจีนโบราณซากแง้ว สัมผัสเสน่ห์ชุมชนโบราณ ชมบ้านรือนเก่าแก่ ร้านค้า ตกแต่งให้มีกลิ่นอายแบบจีนโบราณ มีสินค้าให้เลือกซื้อ ทั้งอาหารคาว หวาน และของฝากต่าง ๆ มากมาย
- ร่วมกิจกรรม NIGHT RUN ON THE BEACH ที่หาดพัทยา
- เพลิดเพลินที่ "THE LEGEND SIAM " รีม พาร์คชิงวัฒนธรรมแห่งใหม่หลากยุคสมัยตลาดน้ำกลางรือนไทยที่สวยที่สุดในเมืองพัทยา สถานที่ท่องเที่ยวในรูปแบบเมืองจำลองประเทศไทย ตอบโจทย์ทุก LFESTE ของครอบครัว
- เยี่ยมชม วิหารเซียน สถานที่รวบรวมศิลปะไทย - จีนชั้นสูงที่สำคัญยิ่งแห่งหนึ่งในไทย เพื่อแสดงออกถึงความภักดี
- พักฝอนที่ COFFEE WAR 331 STATION สัมผัสบรรยากาศคาเฟ่บนแอร์บัส ร้านกาแฟบนเครื่องปินแห่งแรกในจังหวัดชลปุริ มีมุมถ่ายรูปลวยๆ ให้ CHECK-IN และเมนูเครื่องดื่มร้อน / เย็นให้ลิ้มลอง
18 และ 19 พฤษภาคม 67 แบบไปเช้าเย็นกลับ โปรแกรม ท่องนครล่องธารา ลมพัดพา เที่ยวเพลินใจ จังหวัดฉะเชิงเทรา
วันที่ 18 และ 19 พฤษภาคม 67 ทริปที่ 4 และ 5 แบบไปเช้าเย็นกลับ โปรแกรม ท่องนครล่องธารา ลมพัดพา เที่ยวเพลินใจ จังหวัดฉะเชิงเทรา พาล่องเรือชมวิถีชีวิตชุมชนสองฟากฝั่งแม่น้ำบางปะกง ขอพรสิ่งศักดิ์สิทธิ์ วัดวีระโชติธรรมาราม ชมพระอุโบสถแก้วกลางน้ำราชพรหมยานอนุสรณ์ คนละ 1,499 บาท
- พบกับศิลปีน INFLUENCER ที่มีชื่อเสียงร่วมเดินทางไปตลอดทริป
- สักการะขอพรสิ่งศักดิ์สิทธิ์ "วัดวีระโชสิธรรมาราม"ชม พระอุโบสถแก้วกลางน้ำราชพรหมยานอนุสรณ์ ที่ด้านในประดับกระจกเงา ลวดลายทรงไทย อักขระยันต์ที่สวยงาม
- สักการะ สมเด็จองค์ปรุม เป็นพระประธานและหลวงพ่อ 5 พี่น้อง ด้านบนยังบรรจุพระบรมสารีริกธาตุและพระเกศาหลวงพ่อฤษีลิงดำ
- ชม ชิม ชอป ที่ ตลาดบ้านใหม่ ตลาด 100 ปีแห่งเมืองฉะชิงเทรา
- เลือกซื้อสินค้าต่าง ๆ ทั้งของคาวหวาน และของฝาก ของที่ระลึก
- เลือกซิมอาหารและขนมอร่อย อาทิ กะลอจี้ ข้าวตังไอศกรีมโบราณ และขนมย้อนวัยในยุค Y2K
- แวะ วัดไซยภูมิธาราม หรือ วัดท่าอิฐ นำทุกท่านกราบสักการะขอพร หลวงพ่อสมปรารถนา พระพุทธรูปปางมารวิชัย องค์ใหญ่สุดในภาคตะวันออก
- ล่องเรือสัมผัสธรรมชาติและวิถีชวิตชุมชนสองพากฝั่งแม่น้ำบางปะกงและมองเห็นวัดหลวงพ่อโสรรในมุมมองใหม่
- ไหว้พระที่วัดโสธรวรารามวร์วิหาร
- สักการะหลวงพ่อโสธร พระคู่บ้านคู่เมืองฉะชิงเทรา
- ถวายสังมทาน รับขอพรจากพระผู้ใหญ่ พร้อมรับมอบวัตถุมงคล เพื่อเป็นสิริมงคล
- ชมความงดงามสถาปัตยกรรมของพระอุโบสถ
- ชมวิวที่จุดชมวิวกลางสะพานแม่น้ำบางปะกงแลนด์มาร์กใหม่ของจังหวัดฉะชิงเทรายามเย็น
25 - 26 พฤษภาคม 67 ทริปแบบค้างคืน โปรแกรม เสน่ห์เมืองเพชร กับสายลมแห่งรัก จังหวัดเพชรบุรี
25 - 26 พฤษภาคม 67 ทริปที่ 6 แบบค้างคืน โปรแกรม เสน่ห์เมืองเพชร กับสายลมแห่งรัก จังหวัดเพชรบุรี พาชมพระราชนิเวศน์มฤคทายวัน สักการะองค์พ่อปู่พญาศรีเพชรคีรี มหามุนี ศรีสุทโธนาคราช สนุกกับกิจกรรม “เสน่ห์ทะเลบ้านฉัน” ปั่นจักรยานสองแรงปั่น เล่นน้ำทะเล ฮาเฮกับบานาน่าโบ๊ท คนละ 3,999 บาท
- เยี่ยมชม วัดถ้ำแจง กราบสักการะสิ่งศักดิ์สิทธิ์ "องค์ฟอปู่พญาศรีพชรศิรมหามุนี ศรีสุทโธนาคราช" พญานาคใหญ่ที่สุดของไทย แลนด์มารกแห่งใหม่ของจังหวัดเพชรปุรี
- เยี่ยมชม พระราชนิเวศน์มฤคทายวันประทับแปรพระรชฐานในฤดูร้อนของพระบาทสมเด็จพระมงกุฎเกล้าจ้าอยู่หัว ชมหมู่พระที่นั่งทั้ง 3 องค์ ได้แก่ พระที่นั่งสโมสรสวกามาตย์ หมู่พระที่นั่งสมุทรพิมาน หมู่พระที่นั่งพิศาลสาคร
- สนุกเพลิดเพลินกับกิจกรรมตลอดแนวชายหาดตามสไตล์ "เสน่ห์ทะเลบ้านฉัน" อาทิ ปั่นจักรยานสองแรงปั่น เล่นน้ำทะเล ฮาเฮกับบานานำโบ๊ท
- แวะฟาร์มแกะ ม้าแคระกระต่าย ที่ "พันธ์สุขฟู้ด แอนด์ ฟาร์ม" พร้อมถ่ายภาพในมุมสวย ๆ และชอปของฝาก ของที่ระลึก
- ไหว้พระที่ วัดสำมะโรง ชม พุทธวิหารสร้างจากไม้สักแกะสลักทั้งหลังโดยช่างจากอยุ
- กราบขอพร ท้าววสสุวรรณไม้จันทน์หอม ที่อยู่คู่กับวัดสำมะโรง มาอย่างยาวนานที่มีอายุก่าแก่ 400 ปี
- แวะ ชิม ชอป ขนมหวานเมืองเพชร ที่ โรงงานลุงอเนก เลือกซื้อขนมหวานพื้นเมือง อาทิ ขามหม้อแกงถ้วย ขนมหม้อแกงชีสหน้าไหม้ ทองหยอด ทองหยิบฝอยทอง ฯลฯ ที่ได้รับการรับรองตามมาตรฐาน ในราคาพิเศษ
1 และ 2 มิถุนายน 67 แบบไปเช้าเย็นกลับ โปรแกรม ท่องเมืองสองบุรี ยางนาป่าบางเลา จังหวัดลพบุรี
วันที่ 1 และวันที่ 2 มิถุนายน 67 ทริปที่ 7 และ 8 แบบไปเช้าเย็นกลับ โปรแกรม ท่องเมืองสองบุรี ยางนาป่าบางเลา จังหวัดลพบุรี ชวนปลูกต้นยางนา สร้างบ้านให้นกแก้วหัวแพร สัมผัสวิถีชุมชน “ลาวเวียง” และพิพิธภัณฑ์ร่วมสมัยแห่งเมืองสิงห์บุรี คนละ 1,499 บาท
- เยี่ยมชม วัดพระศรีรัตนมหาธาตุ มรดกทรงคุณค่าที่เต็มไปด้วยร่องรอยแห่งประวัติศาสตร์
- เลือกซื้อผลิตภัณฑ์สินค้า 0TOP เมืองสิงห์บุรี
- ชม พิพิธภัณฑ์เมืองพรหม หอไตรกลางน้ำ และกราบสักการะพระพุทธไสยาสน์ ที่วัดพรหมเทพาวาส
- สัมผัสวิถีชีวิตชุมชน "ลาวเวียง" และร่วมกิจกรรม "ปลูกต้นยางนา"และ "สร้างบ้านให้นกแก้วหัวแพร"
- ชม มิวเซียมสิงห์บุรี ร.ศ.130 พิพิธภัณฑ์ร่วมสมัยแห่งเมืองสิงห์ที่เป็นแหล่งเรียนรู้ทางวัฒนธรรมแห่งใหม่ประจำภาคกลาง จัดแสดงนิทรรศการถาวร "ทรัพย์เมืองสิงห์" ภายใต้รูปแบบแสง สี เสียงที่สวยงาม
- นั่งรถผ่านชม STREET ART ที่ยาวที่สุดในประเทศไทย
8 - 9 มิถุนายน 67 ทริปแบบค้างคืน โปรแกรม ขุนด่านปราการชล ป่าต้นน้ำ จังหวัดฉะเชิงเทรา - นครนายก
วันที่ 8 - 9 มิถุนายน 67 ทริปที่ 9 แบบค้างคืน โปรแกรม ขุนด่านปราการชล ป่าต้นน้ำ จังหวัดฉะเชิงเทรา - นครนายก พาเล่นน้ำตกนางรอง ล่องเรือยาง ขุนด่านปราการชล น้ำตกช่องลม ชมฝูงผีเสื้อสวยงาม พาเที่ยวถ้ำวงศ์รัตนมณีมหานครนาคราช คนละ 3,999 บาท
- ชมทิวทัศน์กลางสะพานข้ามแม่น้ำบางปะกง แลนด์มาร์กใหม่ของจังหวัดฉะชิงเทรา
- เยี่ยมชม ศูนย์ช่วยเหลือสัตว์ป่าที่ 1 (นครนายก) และร่วมกันมอบปัจจัยและอาหารสัตว์
- ไปสูดอากาศบริสุทธ์ และเล่นน้ำตกที่ น้ำตกนางรอง
- สนุกสนานกับ การล่องเรือยาง ที่แม่น้ำนครนายก
- สัมผัสบรรยากาศยามเช้าที่ เชื่อนขุนด่านปราการชล และผ่อนคลายที่น้ำตกเขาช่องลม ซึ่งอุดมสมบูรณ์ไปด้วยธรรมชาติสีเขียว และฝูงผีเสื้อที่บินอยู่โดยรอบ
- เที่ยวถ้ำวงศ์ริตนมณีมหานครนาคราช ที่วัดมณีวงศ์ ภายในประดิษฐานพระรัตนมณีมหาบาดาล พระพุทธรูปปางป่าเลไลยก็
- เยี่ยมชมพุทธอุทยานมามบูชานุสรณ์ มีพระพุทธรูปปางแสดงโอวาทปาติโมกข์ มีพระพุทธรูป 1,250 องค์ ล้อมรอบ และรูปปั้น พระอสติมหาสาวก กว่า 80 รูป
15 และ 16 มิถุนายน 67 ทริปแบบไปเช้าเย็นกลับ โปรแกรม เสน่ห์ตะวันออก ปลูกป่ากาสะลอง จังหวัดปราจีนบุรี
วันที่ 15 และ 16 มิถุนายน 67 ทริปที่ 10 และ 11 แบบไปเช้าเย็นกลับ โปรแกรม เสน่ห์ตะวันออก ปลูกป่ากาสะลอง จังหวัดปราจีนบุรี พาเที่ยววัดแก้วพิจิตร พิพิธภัณฑ์สถานแห่งชาติปราจีนบุรี สักการะสิ่งศักดิ์สิทธิ์ วนอุทยานเขาอีโต้ ร่วมกิจกรรมปล่อยปลา ปลูกป่ากาสะลอง ชิม ชอป สินค้าชุมชนและผลิตผลทางการเกษตร คนละ 1,499 บาท
- เยี่ยมชมวัดแก้วพิจิตร พระอารามหลวงเก่าแก่ที่สร้างเมื่อปี พ.ศ. 2422 สักการะ หลวงพ่ออภัย พระประธานปางอภัยทาน เพื่อความเป็นสิริมงคล
- เยี่ยมชม พิพิธภัณฑสถานแห่งชาติปราจีนบุรี ที่จัดตั้งขึ้นเพื่อเป็นสถานที่จัดแสดงและรวบรวมโบราณวัตถุ ศิลปวัตถุ ที่ได้จากแหล่งโบราณคดีต่างๆ จัดแสดงเรื่องราว ประวัติศาสตร์ของพื้นที่ตั้งแต่การเข้ามาตั้งถิ่นฐานของมนุษย์ ตั้งแต่อดีตจนถึงปัจจุบัน
- สักการะ "พระพุทธทวารวดีศรีปราจีน สิรินธรโลกนาถ" (พระปางนาคปรก) สิ่งศักดิ์สิทธิ์ที่ประดิษฐานอยู่ปริเวณ วนพุทธอุทยานโลกเขาอีโต้ เป็นพระพุทธรูป ปางนาคปรกองค์ใหญ่ที่สุดในประเทศไทย
- พักผ่อนที่ อ่างเก็บน้ำจักรพงษ์ หรือ อ่างเก็บน้ำเขาอีโต้
- ร่วมกิจกรรม ปล่อยปลา ณ อ่างเก็บน้ำจักรพงษ์ และ ปลูกต้นป่า กาสะลอง พยุง ตะแบก และ อินทนิล
- ชม ชิมชอป สินค้าชุมชนและผลิตผลทางการเกษตร เช่น ทุเรียน ลองกอง
- เยี่ยมชม พิพิธภัณฑ์เจ้าพระยาอภัยภูเบศร เป็นพิพิธภัณฑ์การแพทย์แผนไทย เลือกซื้อของฝาก ชอป ผลิตภัณฑ์สมุนไพรแผนไทยกลับบ้าน
22 - 23 มิถุนายน 67 ทริปแบบค้างคืน โปรแกรม หาดสวย ฟ้าใส สวนสนประดิพัทธ์ จังหวัดประจวบคีรีขันธ์
วันที่ 22 - 23 มิถุนายน 67 ทริปที่ 12 แบบค้างคืน โปรแกรม หาดสวย ฟ้าใส สวนสนประดิพัทธ์ จังหวัดประจวบคีรีขันธ์ พาไปเล่นน้ำทะเลที่หาดสวนสนประดิพัทธ์ เที่ยวชมอุทยานราชภักดิ์ วัดห้วยมงคล อ่างเก็บน้ำเขาเต่า โครงการชลประทานตามรอยพระราชดำริแห่งแรกของในหลวงรัชกาลที่ 9 พาเที่ยวตลาดชิกกาด้า และเมืองหัวหิน คนละ 3,999 บาท
- เพลิดเพลินกับการเล่นน้ำพักผ่อนที่ หาดสวนสนประดิพัทธ์
- เยี่ยมชมอุทยานราชภักดิ์ ที่ตั้งพระบรมราชานุสาวรีย์ของพระมหากษัตริย์ไทยในอดีต
- ซม ชิม ชอป แซะ ที่ตลาดชิเคด้า ตลาดนัดที่รวบรวมสิ่งของ งานเฮนด์เมด เครื่องใช้และอาหารต่างๆ มากมาย
- เยี่ยมชม "วัดเขาเต่า" ซึ่งอยู่บนภูเขาขนาดเล็ก หันหน้าเข้าสัมผัสคลื่นลมท้องทะเล บนยอดเขาสามารถมองเห็นทิวทัศน์ทะเล หาดเขาเต่า เกาะสิงโต และหาดสวนสนประดิพัทธ์ได้อย่างชัดเจน
- สักการะ "พระโพธิสัตว์กวนอิม" พระพุทธศากยชินมหาราชและถ้ำหลวงพ่อองค์ใหญ่
- แวะชม อ่างเก็บน้ำเขาเต่า โครงการซลประทานตามพระราชดำริแห่งแรก ของพระบาทสมเด็จพระบรมชนกาธิเบศรมหาภูมิพลอดุลยเดชมหาราช ชมความงามของศาลากลางน้ำ ถือเป็น UNSEEN THAILAND อันเลื่องชื่อของจังหวัดประจวบคิรีขันธ์
- กราบสักการะหลวงพ่อทวดองค์ใหญ่ที่สุดในโลก ที่ วัดห้วยมงคล
- เพลิดเพลินที่ สยามเวนเซีย กับมุมถ่ายรูปสวย ๆ ที่มีอย่างมากมาย
- ชม พลับพลาพระมงกุฎเกล้าฯ พลับพลาจตุรมุที่สร้างขึ้นในสมัยพระบาทสมเด็จพระมงกุฎเกล้าเจ้าอยู่หัว
29 และ 30 มิถุนายน 67 ทริปแบบไปเช้าเย็นกลับ โปรแกรม ปลูกป่า ดำนา พิพิธภัณฑ์ศิลป์แผ่นดิน จังหวัดพระนครศรีอยุธยา
วันที่ 29 และ 30 มิถุนายน 67 ทริปที่ 13 และ 14 แบบไปเช้าเย็นกลับ โปรแกรม ปลูกป่า ดำนา พิพิธภัณฑ์ศิลป์แผ่นดิน จังหวัดพระนครศรีอยุธยา พาชมศูนย์การเรียนรู้เศรษฐกิจพอเพียง “บ้านของพ่อ” ล่องเรือชมความงามสองฟากฝั่งแม่น้ำเจ้าพระยา ชมวัดใหญ่ชัยมงคล ชวนกัน check-in ที่หมู่บ้านญี่ปุ่น คนละ 1,499 บาท
- เยี่ยมชม ศูนย์การเรียนรู้เศรษฐกิจพอเพียง "บ้านของพ่อ" สถานที่เรียนรู้เชิงเกษตรที่นำเสนอเแนวคิด แรงบันดาลใจ และการสร้างจิตสำนึกดี ๆ ผ่านหลักคำสอนและหลักการทรงงานของพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชรัชกาลที่9
- ร่วมกิจกรรมตามแนวเศรษฐกิจพอเพียง เช่น การปักดำนา เลี้ยงแพะและแกะ สานปลาตะเพียน ฯลฯ
- ล่องเรือชมความสวยงามของธรรมชาติ วัดวาอาราม บ้านเรือน วิถีชีวิตและสถาปัตยกรรมริมแม่น้ำในจังหวัดพระนครศรีอยุธยา
- ชม "พระเจดีย์ชัยมงคล" ที่ วัดใหญ่ชัยมงคล อนุสรณ์แห่งชัยชนะอันยิ่งใหญ่ของสมเด็จพระนเรศวรมหาราช และเป็นที่ประดิษฐานพระพุทธ์ไสยาสน์ขนาดใหญ่
- เพลิดเพลินที่ หมู่บ้านญี่ปุ่น หรือ พิฟิภัณฑ์หมู่บ้านญี่ปุ่น เช็กอินและถ่ายรูปสวยๆในสวนญี่ปุ่นที่มีความสวยงาม
- เยี่ยมชมความสวยงามของ "พลับพลาสถานีบางปะอิน" สถานที่ประวัติศาสตร์ที่อยู่ดูกิจการรถไฟตั้งแต่แรกการก่อสร้างทางรถไฟสายแรก
11-19 มีนาคม 2567 ฉีดวัคซีนหมาแมวฟรี เขตเทศบาลตำบลหลักห้า สมุทรสาคร
เทศบาลตำบลหลักห้า ขอเชิญนำสุนัข/แมว ที่อยู่ในเขตเทศบาลตำบลหลักห้าไปรับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 11-19 มีนาคม 2567
อบต.หาดพันไกร ทำหมันสุนัข ฟรี 6 มกราคม 2567
กลุ่มจิตอาสา Love Dog ร่วมกับ
อบต.หาดพันไกร จัดทำโครงการทำหมันสุนัขในตำบลหาดพันไกร อำเภอเมืองชุมพร จังหวัดชุมพร ..ฟรี ทำกิจกรรมทำหมันสุนัข ฟรี ในวันเสาร์ที่ 6 มกราคม 2567 ตั้งแต่เวลา 09.00 น.เป็นต้นไป สถานที่ : อาคารจอดรถ ที่ทำการองค์การบริหารตำบลหาดพันไกร อำเภอเมืองชุมพร จังหวัดชุมพร ** หลักเกณฑ์ ดังนี้ ** ทำหมันสุนัข สุนัขเพศเมีย ฟรี สุนัขเพศ ผู้ อายุ ไม่เกิน 6 เดือน .... ฟรี (อายุเกิน 6 เดือน มีค่าเวชภัณฑ์ตัวละ 500.- บาท) ทำหมันแมว ทุกตัวมีค่าเวชภัณฑ์ ตัวละ 500.- บาท สอบถามรายละเอียดเพิ่มเติมได้ที่ ... คุณถั่วเขียว 086-3662750 คุณถั่วคั่ว 081-5975165 ปลัดเกียรติพงษ์ 089-9083598
1 มีนาคม 2567 เทศบาลเมืองสระบุรี ฉีดวัคซีนโรคพิษสุนัขบ้า
เทศบาลเมืองสระบุรี ฉีดวัคซีนโรคพิษสุนัขบ้า 1 มีนาคม 2567 เวลา 8.30 - 11.30 น. สำหรับชุมชนในเขตเทศบาลเมืองสระบุรี ขอความร่วมมือจากพี่น้องชาวเขตเทศบาลเมืองสระบุรีนำสุนัขและแมวของท่านออกมาฉีดวัคซีนพิษสุนัขบ้าเพื่อห่างไกลจากโรคพิษสุนัขบ้า
โรงพยาบาลในจังหวัดชลบุรี
รพ.ศูนย์/ทั่วไป
รพ.ชุมชน (อำเภอ)
รพ.เอกชน
ลานนา3 Admit Fast track กักตัวที่โรงพยาบาล LINK
โรงพยาบาลลานนา3 ให้บริการห้องพักเดี่ยว สำหรับผู้ป่วยติดเชื้อโควิด-19 ATK ด้วยตนเอง ขึ้น 2 ขีด โดยผู้ที่ประสงค์จะเข้ามากักตัวรักษาโควิด-19 ที่โรงพยาบาลลานนา
อัตราค่าบริการ การตรวจ PCR แบบปกติ รู้ผลภายใน 24 ชั่วโมง ราคา 2,000 บาท
อัตราค่าบริการ การตรวจ PCR แบบด่วน รู้ผลภายใน 6 ชั่วโมง ราคา 3,000 บาท
- แพ๊กเกจ ห้องพักเดี่ยว 3 วัน ราคา 18,000 บาท
- แพ๊กเกจ ห้องพักเดี่ยว 5 วัน ราคา 20,000 บาท
- แพ๊กเกจ ห้องพักเดี่ยว 7 วัน ราคา 25,000 บาท
* ราคานี้ รวมค่าตรวจเอกซเรย์ และยารักษาโรคโควิด-19 แล้ว
** ไม่รวมค่าใช้จ่ายที่อาจเกิดจากโรคประจำตัวเดิมหรือการรักษาโรคแทรกซ้อน ขณะรักษาตัวด้วยโรคโควิด-19
ติดต่อสอบถามเจ้าหน้าที่ 063-9024927
เดือนตุลาคม 2566
ทริป 1 วันเสาร์ที่ 7 และวันอาทิตย์ที่ 8 ตุลาคม 2566
ทริป 2 วันเสาร์ที่ 14 – วันอาทิตย์ที่ 15 ตุลาคม 2566
ทริป 3 วันเสาร์ที่ 21 - วันอาทิตย์ที่ 22 ตุลาคม 2566
ศูนย์บริการสาธารณสุข 68 สะพานสูง
สำนักงานเขตสะพานสูงโดยฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับศูนย์บริการสาธารณสุข 68 สะพานสูงจัดกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในพื้นที่เขตสะพานสูงประจำปี 2567 ครั้งที่ 2 ระหว่างวันที่ 2 - 13 กันยายน 2567 ตั้งแต่เวลา 10.00 -12.00 น. ไม่เสียค่าใช้จ่ายใดๆ (ฟรี)
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสะพานสูง ชั้น 3 โทรศัพท์. 0-2372-2918 ต่อ 7118 และ 7119 หรือศูนย์บริการสาธารณสุข 68 สะพานสูง โทรศัพท์ 02-3722225 ต่อ 7
เทศกาลงานกิจกรรมลพบุรีปี 2568
กิจกรรมน่าสนใจจ.สิงห์บุรี ปี 2568
แชร์พิกัด ไหว้พระ 9 วัดดังจังหวัดพะเยา
แชร์พิกัด ไหว้พระ 9 วัดดังจังหวัดพะเยา • วัดศรีโคมคำ อ.เมือง • วัดพระธาตุจอมทอง อ.เมือง • วัดติโลกอาราม อ.เมือง • วัดห้วยผาเกี๋ยง อ.เมือง • วัดอนาลโยทิพยาราม อ.เมือง • วัดศรีชุม อ.ดอกคำใต้ • วัดม่อนพญานาค อ.ภูกามยาว • วัดนันตาราม อ.เชียงคำ • วัดแสนเมืองมา อ.เชียงคำ
สอบถามข้อมูลเพิ่มเติมได้ที่ Facebook : ททท.สำนักงานเชียงราย โทร 053-7446745, 053-717433 E-Mail: tatchrai@tat.or.th Line ID: @tatchiangrai Facebook : ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา ( ททท.) โทร. 054-430 400, 054-430 401 E-mail : tatphayao@gmail.com
สวดมนตร์ข้ามปี สระแก้ว 2567-2568
สวดมนตร์ข้ามปี นครนายก 2567-2568
เส้นทางท่องเที่ยวไหว้พระ 5 อำนาจ จ.อำนาจเจริญ
เปิดเส้นทางท่องเที่ยวไหว้พระ 5 อำนาจ จ.อำนาจเจริญ "สุขเกินคาดที่อำนาจเจริญ" เดินทางรับพระ 5 วัด ได้แก่ พุทธอุทยาน พระมงคลมิ่งเมือง อ.เมือง เสริมบารมีสิริมงคล วัดพระศรีเจริญ อ.หัวตะพาน เจริญรุ่งเรืองแคล้วคลาดปลอดภัย วัดอำนาจ พระเจ้าใหญ่ลือชัย อ.ลืออำนาจ บันดาลโชคลาภ วัดพระเหลาเทพนิมิต อ.พนา ดลบันดาลความสำเร็จ วัดสี่แยกแสงเพชร อ.เมือง เพื่อความมั่นคงในชีวิต [ททท.สำนักงานอุบลราชธานี]
++ กิจกรรมที่ผ่านไปในปี 2568 ++
ปฏิทินท่องเที่ยวสตูล 2568
ปฏิทินท่องเที่ยวจังหวัดสตูล วางแผนการท่องเที่ยวเพื่อร่วมกิจกรรมดีดี กันได้เลย ตั้งแต่เดือนพฤศจิกายน 2567 - เดือนกันยายน 2568 โดย สำนักงานจังหวัดสตูล
++ กิจกรรมที่ผ่านไป ++
ถ่ายโอน อบจ.ปี 2568
ถ่ายโอนให้ อบจ.ปี2568 จำนวน 256 แห่ง (2.59%)
- ถ่ายโอนไป อบจ. 256 แห่ง
- รับถ่ายโอน 63 อบจ.
- ยังไม่รับถ่ายโอน 13 อบจ.
เดือนมกราคม 2568
โปรแกรมท่องเที่ยวทางรถไฟ Royal Blossom มกราคม - กุมภาพันธ์ 2568
โปรแกรมท่องเที่ยวทางรถไฟสุดพิเศษต้อนรับต้นปี 2568 ชวนนักท่องเที่ยวสัมผัสประสบการณ์การเดินทางท่องเที่ยวทางรถไฟ กับขบวนรถท่องเที่ยว Royal Blossom ขบวนรถท่องเที่ยว KIHA 183 ตลอดเดือนมกราคม - กุมภาพันธ์ 2568 ด้วยเส้นทางท่องเที่ยวหลากหลาย สามารถเลือกเดินทางท่องเที่ยวได้ทุกวันเสาร์และอาทิตย์ ทั้งแบบไปเช้าเย็นกลับ และแบบพักค้างคืน เริ่มจำหน่ายตั๋วล่วงหน้าพร้อมกันทั่วประเทศในวันที่ 11 มกราคม 2568 เวลา 08.30 น. เป็นต้นไป
1) ขบวนรถท่องเที่ยว Royal Blossom จะพานักท่องเที่ยวเข้าสู่โลกแห่งความหรูหราและสะดวกสบาย ท่ามกลางทิวทัศน์สองข้างทางรถไฟที่สวยงาม ผ่านกระจกกว้างแบบ 180 องศา ให้บริการแบบไปเช้าเย็นกลับ ราคาท่านละ 1,799 บาท ต่อท่าน นอกจกนี้ ยังมอบความเป็นส่วนตัวด้วยห้อง VVIP ในราคาห้องละ 15,999 บาท (แบบห้องละ 4-6 ท่าน) ซึ่งเป็นราคาที่รวมบริการอาหารเช้า กลางวัน อาหารว่าง และเครื่องดื่ม บริการนำเที่ยว ประกันอุบัติเหตุ ค่ารถบัสปรับอากาศ จำนวน 2 โปรแกรม ประกอบด้วย
• เดือนมกราคม โปรแกรมเที่ยวทุ่งทานตะวันชมเขื่อน นั่งรถไฟลอยน้ำ ชมพระอาทิตย์ตกดิน ในวันที่ 18, 19, 25 และ 26 มกราคม 2568
• เดือนกุมภาพันธ์ โปรแกรมกุมภาเทศกาลแห่งความรัก ชวนเที่ยว Royal Blossom ขบวนรถไฟสายโรแมนติก เส้นทาง เพลินเพชรบุรี ในวันที่ 1, 2, 8, 9, 15, 16, 22 และ 23 กุมภาพันธ์ 2568
ตารางออกหน่วยเดือนมกราคม 2568
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน มกราคม 2568
เวลาออกหน่วยบริการ 8.30 - 11.00 น.
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
ปฏิทินท่องเที่ยวจังหวัดนครปฐม เดือนมกราคม-กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวจังหวัดราชบุรี เดือนมกราคม-กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวสระบุรี เดือนมกราคม 2568
ปฏิทินกิจกรรมประจวบคีรีขันธ์ เดือนมกราคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดพะเยา เดือนมกราคม - มีนาคม 2568
การท่องเที่ยวจังหวัดพะเยารวบรวมปฏิทินกิจกรรมท่องเที่ยวจังหวัดพะเยา เดือนมกราคม - มีนาคม 2568 มาให้ทุกคนได้วางแผนการเดินทางมาเที่ยวกันแบบยาวๆ บอกเลยว่ากิจกรรมในช่วงไฮซีซั่นนี้แน่นมาก
หมายเหตุ : ข้อมูลอาจมีการเปลี่ยนแปลงได้ ควรสอบถามข้อมูลและรายละเอียดเพิ่มเติมกับทางหน่วยงานผู้จัดโดยตรง รวบรวมข้อมูลโดย ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา วันที่ 23 มกราคม 2568
ติดตาม ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา ได้ที่ WEBSITE : www.tourismchiangrai-phayao.com FACEBOOK : ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา E-MAIL : tatphayao@gmail.com TEL : 054-430400
เดือนมกราคม
ปฎิทินท่องเที่ยวกิจกรรมสงขลาหาดใหญ่ เดือนมกราคม 2568
ปฎิทินกิจกรรมปราจีนบุรี มกราคม 2568
ปฎิทินกิจกรรมสระแก้ว มกราคม 2568
ปฎิทินกิจกรรมนครนายก มกราคม 2568
ปฏิทินกิจกรรมจันทบุรี เดือนมกราคม 2568
สวนดอกไม้เมืองหนาว Flora Exhibition Hall ใจกลางเมืองระยอง
สวนดอกไม้เมืองหนาว Flora Exhibition Hall ใจกลางเมืองระยอง ทั้งดอกทิวลิป ไฮเดรนเยีย แดฟโฟดิล ปรับเปลี่ยนไปตลอดทั้งปี ใช้พลังงานความเย็นสะอาด LNG เหลือใช้ ควบคุมอุณภูมิในโดมแก้วเอาไว้ที่ 14-16 องศา อากาศเย็นสบาย เดินถ่ายรูปได้ชิลๆ เข้าชมฟรี ไม่เสียค่าใช้จ่าย มีดอกทิวลิปหลากหลายสีจำหน่าย (งดรับเงินสด) มีร้านจำหน่ายเครื่องดื่มให้บริการ
อาคาร Flora Exhibition Hall มาบตาพุด อ.เมือง จ.ระยอง เปิดบริการทุกวันจันทร์ - เสาร์ (ปิดวันอาทิตย์และวันหยุดนักขัตฤกษ์) เวลา 09:00 - 16:00 น. Facebook :
Miracle of Natural
งานวัดในจ.ลพบุรี
- งานพิธีมหาพุทธาภิเษก เททองรูปหล่อ สมเด็จพระพุฒาจารย์ (โต) พรหมรังษี และงานทำบุญครบรอบวันมรณภาพ พระพิพัฒน์คณาภรณ์ (หลวงพ่อทองหล่อ นนฺทสาโร) ณ วัดพรหมรังษี ต.ดีลัง อ.พัฒนานิคม จ.ลพบุรี วันพุธที่ 30 เมษายน 2568
- งานประจำปี ไหว้พระปิดทอง หลวงพ่อองค์ดำ แสนทันใจ ณ วัดดำรงบุล ตำบลช่องสาริกา อำเภอพัฒนานิคม จังหวัดลพบุรี วันที่ 7-9 มีนาคม 2568
- งานประจำปี วัดศรีธรรมโสภณ อ.เมือง ลพบุรี 28 มีนา - 1 เมษา 2568 สักการะหลวงพ่อขาวศักดิ์สิทธิ์ พร้อมด้วยหลวงปู่แสง และสมเด็จพระพุฒาจารย์โต พรหมรังสี
- งานประจำปี 2568 วัดสิริจันทรนิมิตรวรมหาวิหาร (วัดเขาพระงาม) ปิดทองนมัสการพระพุทธปฏิภาคมัธยมพุทธกาล ปีที่ 113 ณ อำเภอเมือง จังหวัดลพบุรี วันที่ 13-14 กุมภาพันธ์ 2568
- งานปิดทองฝังลูกนิมิต วัดป่าเทพเนรมิต อ.เมือง ลพบุรี 31 มค - 12 กพ 2568
- งานประจำปีปิดทองหลวงปู่จันทร์ จนฺทโชติ และพิธีเททองหล่อพระจักรพรรดิ ณ.วัดข่อยใต้ ต.บ้านข่อย อ.เมือง จ.ลพบุรี วันที่ 11-12 กุมภาพันธ์ พ.ศ. 2568
- งานประจำปี ปิดทองหลวงพ่อนาค ณ วัดวิหารขาว ต.บางคู้ อ.ท่าวุ้ง จ.ลพบุรี วันที่ 11 - 12 กุมภาพันธ์ 2568
- งานปิดทองไหว้พระประจำปี ณ วัดแก้วจันทราราม อ.โคกสําโรง จ.ลพบุรี วันที่ 12-13-มีนาคม 2568
ปฎิทินกิจกรรมท่องเที่ยวพิษณุโลก เพชรบูรณ์ เดือนมกราคม 2568
กิจกรรมเทศกาลต่างๆ ของจังหวัดร้อยเอ็ด ปี 2568
จังหวัดร้อยเอ็ดโดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดร้อยเอ็ด ขอประชาสัมพันธ์กิจกรรมเทศกาลต่าง ๆ ของจังหวัดร้อยเอ็ด ปี 2568
ปฏิทินท่องเที่ยวจังหวัดตาก เดือนมกราคม-กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวจังหวัดตาก เดือนมกราคม-กุมภาพันธ์ 2568
11 ม.ค. - 28 ก.พ. 68 กิจกรรมส่งเสริมการท่องเที่ยวร่วมกับแม่ละเมาอีโคทัวร์ ณ อำเภอแม่สอด
15 ม.ค. - 15 มี.ค. 68 กิจกรรมส่งเสริมการท่องเที่ยวร่วมกับผู้ประกอบการที่พักและร้านอาหาร ร้านกาแฟอุ้มผาง ณ อำเภออุ้มผาง
31 ม.ค. - 1 ก.พ. 68 งานม่วนชื่นแม่ระมาด ณ โรงเรียนแม่จะเราวิทยาคม อำเภอแม่ระมาด
21-23 ก.พ. 68 งานฤดูกาลกาแฟ ครั้งที่4 “บทกวีคือชีวิต” ณ น้ำตกพาเจริญ (อุทยานแห่งชาติน้ำตกพาเจริญ) อำเภอพบพระ
28 ก.พ. - 2 มี.ค 68 กิจกรรมวิ่งตามภูมิประเทศ Tulay Skytrail (Camptrail) ณ แคมป์ปิ้งคูณชาย บ้านแม่ตะวอ อำเภอท่าสองยาง
ติดต่อสอบถามเพิ่มเติม โทร. 055-514-341
ปฏิทินท่องเที่ยวจังหวัดกาญจนบุรี ประจำเดือนมกราคม 2568
สอบถามข้อมูลเพิ่มเติม : ททท.สำนักงานกาญจนบุรี (034) 511200, 512500 Facebook : tatkan Line : @tatkan
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนมกราคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนมกราคม 2568
27 ธ.ค. 67 – 4 ม.ค. 68 COUNTDOWN 2025 @CHA-AM ณ จุดชมวิวชายหาดชะอำ อ.ชะอำ จ.เพชรบุรี
27 ธ.ค. 67 – 5 ม.ค. 68 PHETCHABURICOUNTDOWN 2025 ณ โรบินสันไลฟ์สไตล์ อ.บ้านลาด จ.เพชรบุรี
28 ธ.ค.67 – 1 ม.ค. 68 ตลาดทำเพราะชอบ ณ Coco&coff อ.บ้านแหลม จ.เพชรบุรี
30 ธ.ค. 67 - 2 ม.ค. 68 ไปถ่ายรูปกับนาเกลือกันที่ ร้านยุ้งเกลือ บ้านแหลม อ.บ้านแหลม จ.เพชรบุรี
3-5 ม.ค. 68 Palm Street Art ถนนต้นตาล ครั้งที่ 4 ณ อบต.ไร่สะท้อน อ.บ้านลาด จ.เพชรบุรี
4 ม.ค. 68 ไร่ชัยราชพฤกษ์ มิวสิคแคมป์ ณ ไร่ชัยราชพฤกษ์ อ.แก่งกระจาน จ.เพชรบุรี.
4-5 ม.ค. 68 กระทิง แคมป์ 2 ณ อาชาธาราแคมป์ อ.ท่ายาง จ.เพชรบุรี
19 ม.ค. 68 กิจกรรมเพชรบุรีโคลนRUN มันส์ทุกก้าว Application Calories Credit Challenge (CCC) ณ เขื่อนแม่ประจันต์ อ.หนองหญ้าปล้อง จ.เพชรบุรี งานผูกพัทธสีมา ปิดทองฝังลูกนิมิต จ.เพชรบุรี
29 ม.ค. – 6 ก.พ. 68 วัดห้วยตะแกละ ต.ท่าแลง อ.ท่ายาง จ.เพชรบุรี วัดหนองมะกอก ต.วังจันทร์ อ.แก่งกระจาน จ.เพชรบุรี วัดเพชรสุวรรณ ต.บางตะบูนออกอ.บ้านแหลม จ.เพชรบุรี
ปฏิทินกิจกรรม นราธิวาส ยะลา ปัตตานี เดือนมกราคม 2568
ปฏิทินท่องเที่ยวพังงา ประจำเดือนมกราคม 2568
ปีใหม่นี้มีกิจกรรมอะไรบ้าง
กางเต็นท์เล่นดนตรี เสียงเพลงในผืนป่า ท้ายเหมืองแคมป์ปิ้ง จ.พังงา FB: ท้ายเหมือง แคมป์ปิ้ง 11 มกราคม 2568 ㅤ
CIRCOLOCO XX BABA BEACH CLUB บาบาบีช คลับ นาใต้ (Baba Beach Club Natai) FB: Baba Beach Club 11และ 18 มกราคม 2568
งานกาชาดจังหวัดพังงาประจำปี 2568 ศูนย์ราชการจังหวัดพังงา FB: จังหวัดพังงา 17- 26 มกราคม 2568 ㅤ
Phang-nga International Art Night ศูนย์ราชการจังหวัดพังงา FB: สำนักงานการท่องเที่ยวและกีฬาจังหวัดพังงา 17- 26 มกราคม 2568
กิจกรรมบุรีรัมย์ เดือนมกราคม 2568
กิจกรรมตลอดเดือนมกราคม 2568
วันที่ 21 ธันวาคม 2567 - 1 มกราคม 2568 Yippee New year 2025 ณ บุรีรัมย์ คาสเซิล สอบถามเพิ่มเติมโทร : 09 8103 5331
วันที่ 30 ธันวาคม 2567 - 1 มกราคม 2568 งานปีใหม่พนมรุ้ง รับอรุณเบิกฟ้า 2568 ณ อุทยานประวัติศาสตร์พนมรุ้ง สอบถามเพิ่มเติมโทร : 044 628 119
วันที่ 9-15 มกราคม 2568 เทศกาลข้าวมะลิหอม ปลาจ่อมกุ้ง ชมทุ่งนก กาชาดประโคนชัย ประจำปี 2568 ณ อุทยานน้ำหนองระแซซัน อำเภอประโคนชัย สอบถามเพิ่มเติมโทร : 06 1162 5430
วันที่ 10 มกราคม 2568 ประเพณีสืบสาน บุญคูณลาน ณ วัดตาไก้พลวง อำเภอนางรอง สอบถามเพิ่มเติมโทร : 09 4535 1465
วันที่ 15 มกราคม 2568 Revo Thai League "บุรีรัมย์ ยูไนเต็ด VS เชียงราย ยูไนเต็ด" ณ สนามช้าง อารีนา สอบถามเพิ่มเติมโทร : 044 666 445
วันที่ 19 มกราคม 2568 Revo Thai League "บุรีรัมย์ ยูไนเต็ด VS ขอนแก่น ยูไนเต็ด" ณ สนามช้าง อารีนา สอบถามเพิ่มเติมโทร : 044 666 445
วันที่ 25 มกราคม 2568 Buriram Marathon ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต สอบถามเพิ่มเติมโทร : 044 604 200
วันที่ 25 มกราคม 2568 งานประเพณีบุญหัวมันใหญ่ ณ บ้านปลื้มพัฒนา อำเภอปะคำ สอบถามเพิ่มเติมโทร : 08 9584 6887
ฤดูชมนกอพยพหนีหนาวจากจีน ไซบีเรีย ญี่ปุ่น ตลอดเดือนพฤศจิกายน - มกราคม ของทุกปี เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท (ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ถนนรมย์บุรี เดือนต่อไปจะพาไปพบกับกิจกรรมท่องเที่ยวที่ไหน... อย่าลืมกดติดตามไว้นะคะ จะได้ไม่พลาดแหล่งท่องเที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม เปิดประสบการณ์ท่องเที่ยวเมืองกีฬา เที่ยววิถีชุมชน กินอาหารถิ่น เที่ยวทั้งปีที่ "บุรีรัมย์" เมืองปราสาทสองยุค...มหานครแห่งกีฬา
เที่ยวบุรีรัมย์ง่ายนิดเดียว สอบถามข้อมูลเพิ่มเติม : ททท. สำนักงานบุรีรัมย์ โทร. 0 4463 4722 หรือโทร. 1672 TAT Contact Center เพื่อนร่วมทาง
พิกัดถนนคนเดิน @สุโขทัย 4 จุด น่าไปเดินเที่ยว
พิกัดถนนคนเดิน @สุโขทัย 4 จุด น่าไปเดินเที่ยว
- ตลาดท่าน้ำรับเสด็จ สถานที่จัด : อุทยานประวัติศาสตร์สุโขทัย ทุกวันศุกร์ เสาร์ อาทิตย์ และวันหยุดนักขัตฤกษ์ที่ติดกับวันเสาร์อาทิตย์ Tel : 094-6080922 [พิกัด]
- ถนนคนเดินเมืองสุโขทัยธานี สถานที่จัด : บริเวณถนนสายริมน้ำยมตั้งแต่หน้าสนามเด็กเล่นไปจนถึงจวนผู้ว่าราชการจังหวัดสุโขทัย : ทุกวันเสาร์ Tel : 055-611126 [พิกัด]
- ถนนคนเดินหวันโลกเมาะ Walking Street สถานที่จัด : สวรรคโลกสตรีทอาร์ต ถนนกลางเมือง ทุกวันศุกร์-เสาร์ 16.00-22.00 น. Tel : 055-641374 [พิกัด]
- ถนนคนเดิน กอกใหม่-ท่าชัยอินดี้ สถานที่จัด : กอกใหม่-ท่าชัยอินดี้ : วันเสาร์แรกของเดือน Tel : 055-019825
ปฏิทินท่องเที่ยวน่าน ธันวาคม 2567 - มีนาคม 2568
ปฏิทินท่องเที่ยวน่าน ธันวาคม 2567 - มีนาคม 2568
ปฏิทินกิจกรรมจังหวัดสตูล เดือนมกราคม 2568
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน มกราคม 2568
ปฏิทินท่องเที่ยวระนอง ประจำเดือน มกราคม 2568
ปฏิทินท่องเที่ยวจังหวัดนนทบุรี ประจำเดือน มกราคม 2568
ปฏิทินท่องเที่ยวและงานกิจกรรมดีๆ เทศกาล/งานประเพณีต่างๆ จังหวัดพระนครศรีอยุธยา เดือนมกราคม-มีนาคม 2568
ปฏิทินท่องเที่ยวและงานกิจกรรมดีๆ เทศกาล/งานประเพณีต่างๆ ในพื้นที่จังหวัดพระนครศรีอยุธยา เดือนมกราคม-มีนาคม 2568
ปฏิทินท่องเที่ยวและงานกิจกรรมดีๆ เทศกาล/งานประเพณีต่างๆ ในพื้นที่จังหวัดสระบุรี เดือนมกราคม-มีนาคม 2568
ปฏิทินท่องเที่ยวและงานกิจกรรมดีๆ เทศกาล/งานประเพณีต่างๆ ในพื้นที่จังหวัดสระบุรี เดือนมกราคม-มีนาคม 2568
กิจกรรมชลบุรี เดือนมกราคม 2568
กิจกรรมเดือนมกราคม ปักหมุดมาเที่ยวชลบุรีกันได้เลยยย
1 ม.ค.68 ตักบาตรข้าวสารอาหารแห้ง เนื่องในวารดิถีวันขึ้นปีใหม่ 2568
3-5 ม.ค.68 การแข่งขันนกพิราบแข่งนานาชาติ พัทยา ครั้งที่ 9
4-12 ม.ค.68 (เสาร์-อาทิตย์) งานเดินกินถิ่นนาเกลือ ปีที่ 16 ณ ถนนคนเดินตลาดเก่านาเกลือ
11 ม.ค.68 วันเด็กแห่งชาติ ประจําปี 2568
17-19 ม.ค.68 Bangsaen Koff Fest 2025 ณ หาดบางแสน
18-19 ม.ค.68 การแข่งขันกีฬาทางน้ำเมืองพัทยา ประจำปี 2568 ณ บริเวณลานกีฬาอเนกประสงค์ หาดจอมเทียน เมืองพัทยา
29 ม.ค.68 เทศกาลตรุษจีนเมืองพัทยา 2568 ณ สวนสาธารณะลานโพธิ์นาเกลือ
ปฏิทินกิจกรรม ตรัง มกราคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเชียงราย เดือนมกราคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเชียงราย เดือนมกราคม 2568
Royal Blossom มกราคม 2568
โปรแกรมเดือนมกราคม 4 ทริป เที่ยวทุ่งทานตะวัน ชมเขื่อน นั่งรถไฟลอยน้ำ ชมพระอาทิตย์ตกดิน
ทุกวันเสาร์อาทิตย์ วันที่ 18, 19, 25, 26 ราคาตั๋ว 1,799 บาท
- เช็กอิน ทุ่งทานตะวันที่ ไร่จำปี ที่บานสะพรั่ง
- แวะ บ้านกล้วย & ไข่คาเฟ่ มีมุมถ่ายรูปให้สัมผัสธรรมชาติ ทุ่งดอกไม้ นานาพรรณ พร้อมใกล้ชิดกับสัตว์ต่าง ๆ เช่น แพะ กระต่าย วัว หมูแคระ ให้บริการอาหารคาว - หวาน และเครื่องดื่ม รวนทั้งโขนร้านขาย ของฝากและพืชผลทางการเกษตรจากไร่
- เยี่ยมชม พิพิธภัณฑ์ลุ่มน้ำป่าสัก แหล่งเรียนรู้ที่จะทำให้รู้จักลุ่มน้ำป้าสักสัก แห่งนี้ได้อย่างหลากหลายมิติ ซึ่งแสดงมรดกทางวัฒนธรรมในพื้นที่ กักเก็บน้ำในเขื่อนป้าสักชลสิทธิ์ เป็นหลักฐานที่สำคัญในด้านโบราณคดี ประวัติศาสตร์ และวัฒนธรรมของพื้นที่โครงการฯ รวมทั้งการดำรง ชีวิต สภาพแวดล้อม ตลอดจนความรุ่งเรื่องของชมชน
- พานั่งรถไฟลอยน้ำ "ทอดผ่านผืนน้ำกลางเขื่อนป่าสักชลสิทธิ์ ในบรรยากาศยามเย็น ชมทัศนียภาพพระอาทิตย์ตกดินที่สุดแสนประทับใจ (Romantic Route)
สวดมนต์ข้ามปี ณ วัดท่าหลวง พระอารามหลวง จังหวัดพิจิตร
สวดมนต์ข้ามปี ๓๑ ธันวาคม ๒๕๖๗ เวลา ๒๐:๐๐ เป็นต้นไป ณ หน้าพระอุโบสถวัดท่าหลวง พระอารามหลวง จ.พิจิตร
งาน “มหกรรมการเกษตรและท่องเที่ยวถนนสายดอกไม้งามริมกว๊านพะเยา” 27 ธันวาคม 2567 - 5 มกราคม 2568
เทศบาลเมืองพะเยา ชวนเที่ยวงาน “มหกรรมการเกษตรและท่องเที่ยวถนนสายดอกไม้งามริมกว๊านพะเยา” 27 ธันวาคม 2567 - 5 มกราคม 2568 กับกิจกรรมโซนต่างๆ
โซนที่ 1 ศูนย์พิรุณราช ให้บริการด้านการเกษตร ให้คำปรึกษา แนะนำ และรับเรื่องร้องทุกข์ ผ่านระบบออนไลน์ของทุกหน่วยงานในสังกัดกระทรวงเกษตรและสหกรณ์ โดยมีการให้บริการ 14 หน่วยงาน กรมส่งเสริมการเกษตร - โซน A ร้านค้าจำหน่ายอาหารพื้นเมือง ซุ้มกาแฟ น้ำผลไม้ พื้นที่รับประทานอาหาร - โซน B นิทรรศการ "พะเยาโมเดล สู่เกษตรมูลค่าสูง เป้าหมายการ พัฒนาที่ยั่งยืน" ตระหนักรู้และเห็นคุณค่าใน food loss food waste ตระหนักรู้สู่การปรับเปลี่ยนจาก R1 สู่ R2 เวทีเสวนา Young Smart Farmer และเครือข่าย YSF ร้านจำหน่ายสินค้าเกษตรมูลค่าสูง จังหวัดพะเยาและภาคเหนือตอนบน
โซนที่ 2 กรมส่งเสริมสหกรณ์ ร่วมกับ กรมตรวจบัญชีสหกรณ์ อ.ต.ก. องค์การสะพานปลา และหน่วยงานอื่น ๆ ในจังหวัดพะเยา เช่น สำนักงานพัฒนาชุมชนจังหวัดพะเยา สำนักงานพาณิชย์จังหวัดพะเยา และหอการค้าจังหวัดพะเยา พบกับกิจกรรมการตลาด จำหน่ายสินค้า การจับคู่ธุรกิจ เจรจาการค้า การเสวนา กิจกรรมส่งเสริมการตลาดการแจกคูปอง นาทีทอง ลดแลกแจกแถม การ Live สด จำหน่ายสินค้าออนไลน์ การแสดง การจัดที่นั่งสำหรับผู้มาชมงาน เพื่อผ่อนคลาย จุดเช็คอิน เพื่อบันทึกภาพที่ระลึก กิจกรรม Providing knowledge about adaptation to change
โซนที่ 3 สำนักงานการปฏิรูปที่ดินเพื่อเกษตรกรรม (ส.ป.ก.) โครงการออกโฉนดเพื่อการเกษตร ศูนย์บริการประชาชนเพื่อให้คำปรึกษาทางกฎหมาย นำเกษตรกรจากทุกภาคร่วมจำหน่ายสินค้าเกษตร จัดอบรมเกษตรกร กิจกรรมส่งเสริมอาชีพสานหวาย ทำพวงกุญแจ ทำสบู่ สำนักงานมาตรฐานสินค้าเกษตร และอาหารแห่งชาติ (มกอช.) จัดแสดงโครงการของ ม.พะเยา ที่ได้รับรางวัลโครงการเกษตรเพื่อชีวิต จัดแสดงและจำหน่ายสินค้าพืชสัตว์ ประมงของนักเรียน จัดแสดงมาตรฐาน สินค้าเกษตร Q restaurant นำร่องในจังหวัดพะเยา ระดับ Premium จัด Landmark รูปตัว Q เพื่อให้สามารถถ่ายรูป check-in และนั่งพังพักผ่อน สำนักงานพัฒนาการวิจัยการเกษตร (สวก.) จัดแสดงงานวิจัยและนวัตกรรม 7 โครงการ ฯลฯ
โซนที่ 4 กรมพัฒนาที่ดิน ร่วมกับ สำนักงานพิพิธภัณฑ์เกษตรเฉลิมพระเกียรติฯ (พกฉ.) สถาบันวิจัยและพัฒนาพื้นที่สูง (สวพส.) จัดกิจกรรม Workshop ต่อยอดอาชีพด้านการเกษตร เพื่อขับเคลื่อนเกษตรมูลค่าสูง, จัดแสดงนิทรรศการบนพื้นที่สูง การทำงานใน โครงการหลวง จัดแสดงพืชผักเมืองหนาว ตลาดชาวดอย
โซนที่ 5 กรมชลประทาน จัดนิทรรศการภายใต้แนวคิดเรื่องน้ำและต้นไม้, กรมประมง จัดนิทรรศการ ประมงอาสาพาปลากลับบ้าน การเลี้ยงปลาในนาข้าว ความหลากหลายของปลาในกว๊านพะเยา เป็นต้น , กรมการข้าว จัดแสดง เสน่ห์ศิลป์ถิ่นล้านนา น้ำมีปลา นามีข้าว ก้าวสู่ความยั่งยืนของศูนย์ข้ามชุมชน "แอ่ว ม่วน อิ่ม ลำ" ในรูปแบบล้านนา พาวิลเลี่ยน, กรมฝนหลวงและการบินเกษตร จัดนิทรรศการ ภายใต้แนวคิด ฝนหลวง Play and Learn จัดแสดงเครื่องบินจำลอง ฐานเรียนรู้ 4 ฐาน ตามภารกิจของกรมฝนหลวง, กองนโยบายเทคโนโลยีเพื่อการเกษตรและเกษตรกรรมยั่งยืน จัดแสดง 1 ท้องถิ่น 1 สินค้าเกษตรมูลค่าสูง (กาแฟ)
โซนที่ 6 นวัตกรรมผลิตพืช หม่อนไหม ยางพารา อย่างยั่งยืน สู่สังคาร์บอนต่ำ โดยกรมวิชาการเกษตร จัดนิทรรศการ Wolffia : พืชจิ๋วมหัศจรรย์ ซูเปอร์ฟู้ดแห่งอนาคต / โปรตีนทางเลือกใหม่ นวัตกรรมพืชไร่ เป็นต้น การยางแห่งประเทศไทย นิทรรศการนวัตกรรมยางพารา กรมหม่อนไหม นิทรรศการวิจัยและพัฒนาสู่นวัตกรรม การปลูกหม่อนเลี้ยงไหม (พะเยาโมเดล)
โซนที่ 7 กรมปศุสัตว์ ร่วมกับ องค์การส่งเสริมกิจการโคนมแห่งประเทศไทย จัดแสดง LIVESTOCK ARENA (โซนปศุสัตว์) ได้แก่ โคบีฟมาสเตอร์ โคบราห์มัน โคไทยแบล็ค โคชาโรเลส์ ไก่ชน ไก่พื้นเมือง สัตว์ปีกสวยงาม แพะ แกะ ม้า ควาย งู Pet Animals สุนัข แมว สัตว์เลี้ยงนันทนาการ และ Exotic เป็นต้น กิจกรรมแจกผลิตภัณฑ์นมไทย-เดนมาร์ก
จุดบริการจอดรถ 3 จุด - จุดที่ 1 ลานหน้าวัดศรีโคมคำ - จุดที่ 2 จุดจอดรถลานข้างร้านสยามอิเลคทรอนิกส์ - จุดที่ 3 สนามฟุตบอลเทศบาลเมืองพะเยา
งานเชียงรายดอกไม้งาม ปีที่ 21 วันที่ 27 ธันวาคม 2567 ถึง 16 กุมภาพันธ์ 2568
งานเชียงรายดอกไม้งาม ปีที่ 21 เตรียมล็อควันมาเที่ยวกันได้เลย~ ชวนเพื่อน ชวนครอบครัว มาชมความงดงาม ความเบ่งบานของหมู่มวลดอกไม้ และเพลิดเพลินไปกับดนตรีในสวน Music in the Park จากศิลปินชื่อดัง (มีทุกวันเสาร์) ไฮไลท์ของงานในปีนี้อุโมงค์หนอนผีเสื้อที่ประดับตกแต่งด้วยต้นไม้ทั้งภายใน และภายนอกนับแสนต้น นอกจากนี้มีลานวัฒนธรรม การแสดงชาติพันธุ์ ซุ้มอาหารเหนือ อาหารหลากหลาย และร้าน ชา กาแฟ บรรยากาศติดริมน้ำกกอีกด้วย!
ปีนี้มีกิจกรรมพิเศษ การเพิ่มเส้นทางใหม่เพื่ออำนวยความสะดวกให้กับนักท่องเที่ยว โดยสามารถนั่งเรือชมความงดงามของธรรมชาติแม่น้ำกกได้อีกด้วยนะ! สามารถขึ้นเรือได้ที่ ท่าเรือซีอาร์ ต.ริมกก อ.เมือง จ.เชียงราย ตั้งแต่เวลา 08.00 -16.30 น. ซึ่งเป็นการสนับสนุนเศรษฐกิจและเพิ่มรายได้ให้กับผู้ขับเรือในพื้นที่
27 ธันวาคม 2567 ถึง 16 กุมภาพันธ์ 2568 เวลา 07.00 – 23.00 น. เข้าชมฟรี สวนสาธารณะหาดนครเชียงราย อ.เมือง จ.เชียงราย
Google Maps
สอบถามข้อมูลเพิ่มเติมได้ที่ : เทศบาลนครเชียงราย 053-715952 ททท.สำนักงานเชียงราย 053-744674-5
เทศกาลดนตรีเชียงราย ส่งท้ายปีเก่าต้อนรับปีใหม่ พ.ศ. 2568 (Countdown 2025)
เชียงราย จัดใหญ่! เทศบาลนครเชียงราย จัดงานเทศกาลดนตรีส่งท้ายปีเก่าต้อนรับปีใหม่ พ.ศ. 2568 (Countdown 2025) เมื่อวันที่ 24 ธันวาคม 2567 เทศบาลนครเชียงรายโดย นายวันชัย จงสุทธานามณี นายกเทศมนตรีนครเชียงราย และ นายวรพงศ์ อัญชลีสังกาศ ผู้จัดการอีเว้นท์ภาคการขายที่ 5 บริษัท ป้อมคลัง จำกัด บริษัท ช้าง อินเตอร์เนชั่นแนล จำกัด ร่วมกันจัดงานเทศกาลดนตรีส่งท้ายปีเก่าต้อนรับปีใหม่ พ.ศ. 2568 (Countdown2025) เพื่อเป็นการส่งเสริมการท่องเที่ยวจังหวัดเชียงรายเผยแพร่และอนุรักษ์ศิลปวัฒนธรรมอันดีของท้องถิ่น โดยเฉพาะการท่องเที่ยวเชิงสร้างสรรค์และวัฒนธรรมให้ความสำคัญกับการเพิ่มมูลค่าให้กับสินค้าและบริการ จัดกิจกรรมเฉลิมฉลองเสริมสร้างความสมานฉันท์สร้างความเป็นสิริมงคล สร้างขวัญกำลังใจในการดำเนินชีวิตของประชาชน เนื่องในวันส่งท้ายปีเก่าต้อนรับ ปีใหม่ พ.ศ. 2568 เป็นการดึงดูดให้นักท่องเที่ยวเดินทางมาท่องเที่ยว ทำให้นักท่องเที่ยวเกิดความประทับใจที่ได้มาเยือน และเป็นการกระตุ้นเศรษฐกิจการท่องเที่ยว การค้า การลงทุน และการสร้างรายได้ให้กับประชาชน
บอกเลยว่าเค้าท์ดาวปีนี้ที่ •เชียงราย• ห้ามพลาดกันเลย! จัดขึ้นในวันที่ 31 ธันวาคม 2567 เริ่มตั้งแต่เวลา 18.00 น. เป็นต้นไป ณ หอนาฬิกาเฉลิมพระเกียรติเชียงราย อ.เมือง จ.เชียงราย ภายในงาน มีกิจกรรมมากมาย อาทิ การแสดงศิลปวัฒนธรรม จุดถ่ายภาพ กิจกรรมศิลปะสร้างสรรค์ เสี่ยงเซียมซีแห่งความสุข ขบวนส่งความสุขพร้อมของที่ระลึกเตรียมมอบเป็นของขวัญปีใหม่ให้กับผู้ร่วมงาน คือ ช็อคโกแลตแท่งทองมงคลจำนวน 500 ชิ้น
การแสดงคอนเสิร์ตโดยศิลปินชื่อดัง อาทิ มิ้น มิณฑิตา วัฒนกุล The playground, Whal & Dolph และหนู มิเตอร์
งาน สำราญ สำเนียง เสียงอัมพวา "รื่นเริงเถลิงศกใหม่ ๒๕๖๘" วันที่ ๓๑ ธันวาคม ๒๕๖๗ - ๑ มกราคม ๒๕๖๘ ณ อุทยาน ร.๒
จังหวัดสมุทรสงคราม ชวนเที่ยวงาน สำราญ สำเนียง เสียงอัมพวา "รื่นเริงเถลิงศกใหม่ ๒๕๖๘" วันที่ ๓๑ ธันวาคม ๒๕๖๗ - ๑ มกราคม ๒๕๖๘ ณ อุทยาน ร.๒, วัดอัมพวันเจติยาราม, โครงการอัมพวาชัยพัฒนานุรักษ์ ลานการแสดงนาคะวะรัง, ตลาดริมคลองอัมพวา, หน้าที่ว่าการอำเภออัมพวา และหน้าเทศบาลตำบลอัมพวา อำเภออัมพวา จังหวัดสมุทรสงคราม
ภายในงานมีกิจกรรมมากมาย ดังนี้ ชวนเที่ยวชมพิพิธภัณฑ์หุ่นกระบอก นิทรรศการศิลปะ วัฒนธรรม และวิถีไทย สอนนุ่งโจงห่มสไบ สาธิตการทำลูกประคบสมุนไพร สอนทำบุหงารำไป การจำหน่ายสินค้าโอทอป ร่วมขับขานบทเพลง “สำราญ สำเนียง เสียงอัมพวา” ณ อุทยาน ร.๒
ร่วมชมประดับตกแต่งไฟลานหน้าพระบรมราชานุสาวรีย์พระบาทสมเด็จพระพุทธเลิศหล้านภาลัย และสวดมนต์ข้ามปี ณ อุโบสถวัดอัมพวันเจติยาราม
ร่วมกิจกรรมและชมการแสดงต่างๆ อีกมากมาย ณ โครงการอัมพวาชัยพัฒนานุรักษ์ และ ลานการแสดงนาคะวะรังค์
ชมการแสดงเดินแบบหนูน้อย , การแสดงนาฏศิลป์ , “อังกะลุง”, “กลองยาว”, “รำโทน” ละครชาตรี ตอน “พระอภัยมณีหนีนางผีเสื้อสมุทร ไป เคาท์ดาวน์” , การบรรเลงเพลงโดยวงดนตรีสุนทราภรณ์ /ลีลาศ ดนตรีร่วมสมัย ดนตรีไทย การแสดง “โขน” , “บาสโลป” การบรรเลงเพลงแซกโซโฟน การจำน่ายสินค้า OTOP สินค้าพื้นบ้าน ของฝาก/ของที่ระลึก และ ร่วมเค้าท์ดาวน์เฉลิมฉลองปีใหม่ ๒๕๖๘ กับบรรยากาศที่สวยงาม ณ บริเวณชานชาลาริมน้ำ
กิจกรรมชม ชิม ช้อป สินค้า อาหาร ของฝาก ของที่ระลึก ริมคลองอัมพวา กิจกรรมนั่งเรือชมวิถีชีวิตชาวอัมพวา และชมหิ่งห้อยยามค่ำคืน, กิจกรรม Amphawa Countdown 2025 ณ บริเวณหน้าที่ว่าการอำเภออัมพวา และกิจกรรมทำบุญตักบาตรต้อนรับปีใหม่ ณ หน้าเทศบาลตำบลอัมพวา
งานตากสินมหาราชานุสรณ์ และงานกาชาด ประจำปี 2567-2568 วันที่ 28 ธันวาคม 2567 ถึงวันที่ 3 มกราคม 2568
จังหวัดตาก ร่วมกับองค์การบริหารส่วนจังหวัดตาก และเหล่ากาชาดจังหวัดตาก กำหนดจัดงานตากสินมหาราชานุสรณ์ จังหวัดตาก ประจำปี 2567 - 2568 ขึ้น ณ บริเวณศาลสมเด็จพระเจ้าตากสินมหาราช อำเภอเมืองตาก จังหวัดตาก ระหว่างวันที่ 28 ธันวาคม 2567 ถึงวันที่ 3 มกราคม 2568 รวมทั้งสิ้น 7 วัน ซึ่งจังหวัดตากได้จัดงานเป็นประจำทุกปี เพื่อเป็นการเทิดพระเกียรติแด่พระองค์ท่าน รวมถึงเป็นการอนุรักษ์สืบสานศิลปวัฒนธรรม จารีตประเพณีท้องถิ่นของจังหวัดตากด้วย
ทั้งนี้ กิจกรรมในงานดังกล่าว มีหลากหลายกิจกรรม อาทิ ขบวนเทิดพระเกียรติฯ จำนวน 5 ขบวน ประกอบด้วย ขบวนเทิดพระเกียรติฯ ขบวนหลวงยกกระบัตรรั้งราชการเมืองตาก ขบวนพระยาตากรวมพลผู้กล้ากู้ชาติคืนถิ่น ขบวนจอมภูมินทร์แผ่นดินกรุงธนบุรี และขบวนแห่สิงโต , กิจกรรมการแสดงแสง สี เสียง ชุดการแสดง “ตากสิน จอมราชันย์ ตำนานวีรกษัตริย์ศึก” , การออกร้านมัจฉากาชาด , การจัดนิทรรศการของหน่วยงานต่างๆ ตลอดจนการจำหน่ายสินค้าเครื่องอุปโภค บริโภคของผู้ประกอบการ เป็นต้น
นอกจากนี้ ยังมีกิจกรรมอื่นๆ ที่น่าสนใจตลอดระยะเวลา 7 วัน 7 คืน เช่น กิจกรรมการแสดงแสง สี เสียง ระหว่างวันที่ 28-31 ธันวาคม 2567 , กิจกรรมตักบาตรเนื่องในวันขึ้นปีใหม่ , การออกร้านมัจฉากาชาด และออกสลากกาชาด ของเหล่ากาชาดจังหวัดตาก , การประกวดสาวงามจังหวัดตาก
สวดมนต์ข้ามปี เสริมสิริมงคลส่งท้ายปีเก่า ต้อนรับปีใหม่ ๒๕๖๘ วัดมหาธาตุ วรวิหาร จังหวัดเพชรบุรี
ขอเชิญร่วมสวดมนต์ข้ามปี เสริมสิริมงคลส่งท้ายปีเก่า ต้อนรับปีใหม่ ๒๕๖๘ รับน้ำพระพุทธมนต์รับขวัญปีใหม่ พร้อมทั้งสักการะสิ่งศักดิ์สิทธิ์ ๑๐ จุดบุญ เพื่อความเป็นสิริมงคล และฉลอง ๑๑ ทศวรรษ ยกฐานะเป็นพระอารามหลวง ณ วัดมหาธาตุ วรวิหาร จังหวัดเพชรบุรี วันที่ ๓๑ ธ.ค. ๒๕๖๗ - ๑ ม.ค. ๒๕๖๘ พิเศษ ผู้ร่วมพิธีจะได้รับแจกปฏิทิน ๔ สีอย่างประณีต (จำนวนจำกัด)
งานประเพณีเดินขึ้นเขาพนมรุ้ง "ปีใหม่พนมรุ้ง รับอรุณเบิกฟ้า" ประจำปี 2568 วันที่ 30 ธันวาคม 2567 - 1 มกราคม 2568
ททท. สำนักงานบุรีรัมย์ ขอเชิญร่วมกิจกรรมงานประเพณีเดินขึ้นเขาพนมรุ้ง "ปีใหม่พนมรุ้ง รับอรุณเบิกฟ้า" ประจำปี 2568 วันที่ 30 ธันวาคม 2567 - 1 มกราคม 2568
ภายในงานพบกับกิจกรรม - ชม ชิม ช้อป การออกร้านค้าผลิตภัณฑ์ชุมชน ตลาดย้อนยุค - สักการะและขอพรบัวแปดกลีบ,ชมการออกร้านค้าผลิตภัณฑ์ชุมชน ตลาดย้อนยุค การแสดงศิลปวัฒนธรรมพื้นบ้าน - วันที่ 31 ธันวาคม 2567 พิธีเปิดงาน ,กิจกรรมสวดมนต์ส่งท้ายปีเก่าต้อนรับปีใหม่ , ชมการออกร้านค้าผลิตภัณฑ์ชุมชนตลาดย้อนยุค,ชมการแสดงศิลปวัฒนธรรมพื้นบ้าน - วันที่ 1 มกราคม 2568 ขบวนกองบุญเดินขึ้นเขาพนมรุ้ง พิธีรับแสงอรุณแรกแห่งศักราชใหม่ พิธีบวงสรวงสิ่งศักดิ์สิทธิ์ พิธีทำบุญตักบาตร ชมการออกร้านค้าผลิตภัณฑ์ชุมชน ตลาดย้อนยุค การแสดงศิลปวัฒนธรรมพื้นบ้าน
สอบถามรายละเอียดเพิ่มเติม ได้ที่ ที่ทำการปกครองอำเภอเฉลิมพระเกียรติ จังหวัดบุรีรัมย์ 044-628119
สรุปผลการบริหารกองทุนประกันสังคม และกองทุนเงินทดแทน มกราคม 2568
Royal Blossom กุมภาพันธ์ 2568
โปรแกรมเดือนกุมภาพันธ์ One Day Trip 8 ทริป ในธีม "กุมภา เทศกาลแห่งความรัก ชวนเที่ยวรถไฟสายโรแมนติก เส้นทางเพลินเพชรบุรี" ทุกวันเสาร์อาทิตย์ ที่ 1,2,8,9,15,16, 22,23 กุมภาพันธ์ 2568 ราคา 1,799 บาท
- กิจกรรมพิเศษคู่รักชวนเที่ยว สำหรับคู่รักที่ร่วมเดินทางบนขบวนรถ กับการท่องเที่ยวฯ เพชรบุรี
- กราบสักการะพระพุทธไสยาสน์องค์ใหญ่ ณ วัดพระพุทธไสยาสน์ พระพุทธรูปก่ออิฐถือปูนลงรักปิดทอง นับเป็นองค์ใหญ่อีกองค์ของไทย
- ชม Wall Art สายน้ำวิถี ชีวีเมืองเพชร แลนด์มาร์คใหม่แห่งเพชรบุรี
- ชมพระรามราชนิเวศน์ (วังบ้านปืน) ชวนจิบน้ำชายามบ่าย ฟังเพลงบรรเลง เคล้าบรรยากาศที่ร่มรื่น ในบรรยากาศสุดคลาสสิค และเป็นที่ประทับแปรพระราชฐาน ที่ ร.5 โปรดเกล้าให้สร้างขุ้นเมื่อเสด็จประพาสเพชรบุรี
- แวะช็อปที่ บ้านขนมนันทวัน เลือกซื้อขนมหวานเมืองเพชร เป็นของฝากก่อนกลับ
เทศกาลกาแฟและชาล้านนาตะวันออก 2024 (Eastern Lanna Coffee & Tea Festival 2024) วันที่ 27 ธันวาคม 2567 – วันที่ 1 มกราคม 2568
ชวนไปจิบชา-กาแฟ ให้ตาสว่างต้อนรับปีใหม่ 2568 กันที่งาน “เทศกาลกาแฟและชาล้านนาตะวันออก 2024” (Eastern Lanna Coffee & Tea Festival 2024) วันที่ 27 ธันวาคม 2567 – วันที่ 1 มกราคม 2568 เวลา 16.00 – 22.00 น. ณ สิงห์ปาร์คจังหวัดเชียงราย
กิจกรรมภายในงาน •. สุดยอดร้านค้าผู้ประกอบการชา-กาแฟ มากกว่า 50 ร้านค้า ของกลุ่มจังหวัดภาคเหนือตอนบน 2 และ กิจกรรมการแข่งขันลาเต้อาร์ต Amazing ไทยแลนด์ดริ้ง จากกลุ่มจังหวัดภาคเหนือตอนบน 2 รวมไปถึงกิจกรรมเจรจาธุรกิจ (Business Matching) กับคู่ค้าทั้งในและ/หรือต่างประเทศ •.
นิทรรศการเกี่ยวกับชาและกาแฟ •.
กิจกรรมการประกวดชา กาแฟ •.
กิจกรรมการแสดงวัฒนธรรม/ดนตรีตลอดงาน อาทิ วง มิลค์ เดอะวอยซ์ •.
ศิลปินหญิงล้านนา อ้อม รัตนัง หรือ มณีรัตน์ รัตนัง •.
กิจกรรมส่งเสริมการขายตลอดการจัดงานงานสืบสานวัฒนธรรมและภูมิปัญญา ชาติพันธุ์ม้งพะเยา ประจำปี 2568 วันที่ 30ธันวาคม 2567-1 มกราคม 2568
ททท.สำนักงานเชียงรายโดยศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา ขอเชิญชวนทุกท่านเที่ยวงานสืบสานวัฒนธรรมและภูมิปัญญา ชาติพันธุ์ม้งพะเยา ประจำปี 2568 วันที่ 30ธันวาคม 2567-1 มกราคม 2568 ณ บ้านประชาภักดี หมู่ที่ 13 ต.ร่มเย็น อ.เชียงคำ จ.พะเยา
กิจกรรมวันที่ 31 ธันวาคม 2567 • ชมแฟชั่นโชว์ชุดชาติพันธุ์ม้ง •ชมการแสดงของชาติพันธุ์ม้ง • ชมการประกวดเต้นประกอบเพลงม้ง • ชมการแข่งขันไก่ต่อ • ร่วมโยนลูกช่วงกับเยาวชนม้ง • ร่วมส่งท้ายปีเก่า ต้อนรับปีใหม่ • ชม ชิม ช้อป ผลิตภัณฑ์ของดีชาติพันธุ์ม้ง/ของดีจังหวัดพะเยา
กิจกรรมวันที่ 1 มกราคม 2568 • ชมการประกวดร้องเพลงม้ง • ร่วมโยนลูกช่วงกับเยาวชน • ชม ชิม ช้อป ผลิตภัณฑ์ของดีชาติพันธุ์ม้ง/ของดีจังหวัดพะเยา
เทศกาลปีใหม่กาชาดจังหวัดตราด ประจำปี 2568 27 ธันวาคม 2567 – วันที่ 2 มกราคม 2568
งาน “เทศกาลปีใหม่จังหวัดตราด” ประจำปี 2568 จังหวัดตราดร่วมกับสำนักงานเหล่ากาชาดจังหวัดตราด เทศบาลเมืองตราด และองค์กรปกครองส่วนท้องถิ่นในพื้นที่ กำหนดจัดงานขึ้นระหว่างวันที่ 27 ธันวาคม 2567 – วันที่ 2 มกราคม 2568 บริเวณสนามหน้าศาลากลางจังหวัด ตราด บริเวณหน้าศาลา 100 ปี ตราดรำลึก ทั้งนี้เพื่อร่วมเฉลิมฉลองเนื่องในวันส่งท้ายปีเก่าต้อนรับปีใหม่ และส่งเสริมการท่องเที่ยวของจังหวัดตราด สำหรับการจัดงานครั้งนี้มีการแสดงและจำหน่ายสินค้า OTOP จังหวัดตราด รวมถึงการแสดงและมหรสพบนเวทีให้ชมฟรีทุกคืน
เทศกาลดนตรีในสวนกรุงเทพมหานคร เดือนมกราคม 2568
กิจกรรมดนตรีในสวนกรุงเทพมหานคร เทศกาลดนตรีในสวน เทศกาลดนตรีกรุงเทพ และกรุงเทพดีต่อใจ โดย ความร่วมมือของ กรุงเทพมหานคร สถาบันดนตรีกัลยาณิวัฒนา มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้า ศูนย์การประชุมแห่งชาติสิริกิติ์ Thai Beverage One Bangkok ศิลปินอิสระ วงดนตรีประชาชนและเยาวชน
วันศุกร์ที่ 3 มกราคม 2568 • ลาน Playground สวนเบญจกิติ เขตคลองเตย วง BKK Jazz Group เริ่ม 17.00 น.
วันเสาร์ที่ 4 มกราคม 2568
• ลาน Playground สวนเบญจกิติ เขตคลองเตย ศิลปิน ซิดนีย์ - เวธกา (Small Room) เริ่ม 17.00 น.
• หอนาฬิกา สวนลุมพินี เขตคลองเตย วงดนตรีกรุงเทพมหานคร เริ่ม 17.00 น.
วันอาทิตย์ที่ 5 มกราคม 2568
• ลานกิจกรรมริมบึง สวนเบญจกิติ เขตคลองเตย Bangkok Metropolitan Orchestra พร้อมศิลปินรับเชิญ Joke Bandwagon พัทธนันท์ อาจองค์ และ กองปราบ ปณิธาน เริ่ม 16.30 น.
• ลาน Playground สวนเบญจกิติ เขตคลองเตย วงดนตรีกรุงเทพมหานคร เริ่ม 17.00 น
• หอนาฬิกา สวนลุมพินี เขตคลองเตย วงดนตรีกรุงเทพมหานคร เริ่ม 17.00 น.
• สวนทางแยกต่างระดับพรานนก-พุทธมณฑลสาย 4 ตัดกับถนนพุทธมณฑลสาย 2 วงดนตรีกรุงเทพมหานคร เริ่ม 17.00 น.
งาน Coffee or Tea ฮับชาหรือกาแฟดีจ้าว 4-5 มกราคม 2568
งาน “Coffee or Tea ฮับชาหรือกาแฟดีจ้าว” วันที่ 4-5 มกราคม 2568 เวลา: 09.00 – 20.00 น. ณ ลานวัฒนธรรม งานเชียงรายดอกไม้งาม ปีที่ 21 สวนสาธารณะหาดนครเชียงราย ต.รอบเวียง อ.เมือง จ.เชียงราย จัดโดย สำนักงานท่องเที่ยวและกีฬาจังหวัดเชียงราย และจังหวัดเชียงราย
ในงานมีกิจกรรมน่าสนใจ อาทิ มาจิบชา ดื่มกาแฟ ท่ามกลางสวนดอกไม้ บรรยากาศชิลๆ ลิ้มรสชาพันธุ์ดี และ เมล็ดกาฟาเกรดพรีเมี่ยม จากจังหวัดเชียงราย พร้อมชมกิจกรรมการแข่งขัน “Blend Brew Battle แข่งขันผสมเมล็ดกาแฟ พันธุ์ดีจากจังหวัดเชียงราย” ผู้เข้าแข่งขันกว่า 20 คน หรือใครที่เป็นสายทำกิจกรรม ภายในงานก็มี Workshop สุดพิเศษให้ได้ทำกัน
กิจกรรมWorkshop 4 กิจกรรม ได้แก่ Workshop 1 : Basic Brewing มือใหม่หัดดริป กิจกรรม Workshop 2 : TEA-LICIOUS เบลนด์ชาอย่างมีสไตล์ กิจกรรม Workshop 3 : Art In A Cup Latte Art Workshop กิจกรรม Workshop 4 : ถุงกากชาและกาแฟ
ดนตรีในสวน เชียงราย เดือนธันวา 67 - กุมภาพันธ์ 68
ดนตรีในสวน music in the park มาฟังเพลงเพราะๆ กับบรรยากาศ ในม่านหมอก ดอกไม้ สายน้ำ และขุนเขา ในงานเชียงรายดอกไม้งาม ปีที่ 21 ณ สวนสาธารณะหาดนครเชียงราย ทุกค่ำคืนวันเสาร์ เริ่ม 19.00- 20.00 น. 28-30 ธันวาคม 2567. 1,4,11,18,25 มกราคม 2568 และ 1,8,15 กุมภาพันธ์ 2568
งาน "ท่องเที่ยวครบครัน มหกรรมชาติพันธุ์ จังหวัดนครปฐม" วันที่ 4 - 6 มกราคม 2568
จังหวัดนครปฐม โดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดนครปฐม ขอเชิญชวนร่วมงาน "ท่องเที่ยวครบครัน มหกรรมชาติพันธุ์ จังหวัดนครปฐม" วันที่ 4 - 6 มกราคม 2568 ณ ศูนย์การค้าเซ็นทรัล ศาลายา จ.นครปฐม
กิจกรรมส่งเสริมการท่องเที่ยวทางวัฒนธรรมประเพณีและวิถีชีวิตชุมชนชาติพันธุ์ในจังหวัดนครปฐม
ภายในงานพบกับ ▪️บูธจัดแสดงสินค้า เสื้อผ้า ผ้ามัดย้อม ขนม อาหาร ผลิตภัณฑ์จากชุมชนชาติพันธุ์ในจังหวัดนครปฐม ▪️การเเสดงจากกลุ่มชุมชนชาติพันธุ์ในจังหวัดนครปฐม ชาติพันธุ์ลาวครั่ง, ชาติพันธุ์ไทยทรงดำ, ชาติพันธุ์ลาวเวียง, ชาติพันธุ์ไทย-จีน, ชาติพันธุ์ไท-ยวน เเละ ชาติพันธุ์มอญ ▪️การสาธิตการทำอาหาร ▪️การแสดงดนตรี และกิจกรรมอื่น ๆ พิธีเปิดงาน ในวันที่ 4 มกราคม 2568 เวลา 16.30 น. เป็นต้นไป ร่วมงานลุ้นรับรางวัลและของที่ระลึกมากมาย
งานฤดูหนาว นางสาวเชียงใหม่และงาน OTOP ของดีเมืองเชียงใหม่ ประจำปี 2568 วันที่ 5-19 มกราคม 2568
องค์การบริหารส่วนจังหวัดเชียงใหม่ ประกาศกำหนด การจัดงานฤดูหนาว นางสาวเชียงใหม่และงาน OTOP ของดีเมืองเชียงใหม่ ประจำปี 2568 กำหนดจัดขึ้นในวันที่ 5-19 มกราคม 2568 ในงานครั้งนี้ เหล่ากาชาดเชียงใหม่ จะจัดจำหน่ายสลากกาชาดการกุศลเพิ่มขึ้นจากปีที่ผ่านมา ซึ่งอาจเพิ่มสูงถึง 3 แสนฉบับ เพื่อให้พี่น้องประชาชนได้ร่วมลุ้นรับรางวัลใหญ่จากกาชาด นอกจากนั้นยังมีกิจกรรมมากมาย ได้แก่ การจัดประกวดนางสาวเชียงใหม่ การออกร้านกาชาด การจัดงานวันเด็กแห่งชาติ การออกร้านผลิตภัณฑ์ของชุมชนหนึ่งตำบลหนึ่งผลิตภัณฑ์ สินค้าตลาดประชารัฐ การส่งเสริมการท่องเที่ยวภายในจังหวัดเชียงใหม่ ซึ่งจะก่อให้เกิดการสร้างงานสร้างอาชีพและสร้างรายได้ให้กับชุมชน การจัดนิทรรศการผลการดำเนินงานโครงการอันเนื่องมาจากพระราชดำริที่สำคัญในพื้นที่จังหวัดเชียงใหม่ รวมถึงการจัดแสดงมหรสพคอนเสิร์ต การเฉลิมฉลองต้อนรับศักราชใหม่
เที่ยวสงขลาตามล่าตราประทับ 26 พิกัด Landmark แคมเปญ Collect & Go Songkhla Beyond Expectations ช่วงเวลาการร่วมสนุก 1 กุมภาพันธ์ - 30 เมษายน 2568
กิจกรรมสนุกท้าทายนักท่องเที่ยวที่มาเยือนสงขลา เริ่มแล้ว ททท. สำนักงานหาดใหญ่ ชวนทุกคนออกเดินทาง ตามล่าตราประทับ 26 พิกัด Landmark กับแคมเปญ
Collect & Go Songkhla Beyond Expectations ช่วงเวลาการร่วมสนุก 1 กุมภาพันธ์ - 30 เมษายน 2568
ตราประทับ 26 พิกัด Landmark ทั่วสงขลาหาดใหญ่ ทั้งแหล่งท่องเที่ยว , พิพิธภัณฑ์, ร้านอาหาร , คาเฟ่ , Souvenir
26 โลเคชั่นที่เข้าร่วมแคมเปญ สามารถรับ passport ได้เลย (ยกเว้น หาดสมิหลา , หาดเก้าเส้ง , มัสยิดกลางประจำจังหวัดสงขลา) 1. หาดสมิหลา 2. Khao Tang Kuan SongKhla สถานีลิฟท์เขาตัวกวน พระธาตุเจดีย์หลวงสงขลา 3. Songkhla National Museum : พิพิธภัณฑสถานแห่งชาติ สงขลา 4. โรงสีแดง หับ โห้ หิ้น 5. Titan Project Space 6. San.Songkhla 7. ห้องสมุด ยับ เอี่ยน ฉ่อย 8. dot.b 9. Lyns The Shanghai Cafe 10. ดาษดื่น 11. Songkhla Station สถานีความสุข สถานีสร้างสรรค์ 12. บ้านสิงโต (ตรอกสิงโต) 13. หาดเก้าเส้ง (หัวนายแรง) 14. เล่ากาแฟ: Laow Kafae : Specialty Coffee and Creative Cafe 15. สวนสัตว์สงขลา Songkhla zoo 16. หอดูดาวเฉลิมพระเกียรติ 7 รอบ พระชนมพรรษา สงขลา 17. โคโคโระเค้ก เค้กจำปาดะขนุนเกาะยอ 18. สถาบันทักษิณคดีศึกษา มหาวิทยาลัยทักษิณ (พิพิธภัณฑ์คติชนวิทยา) 19. มัสยิดกลางประจำจังหวัดสงขลา 20. Cable Car หาดใหญ่ 21. Princess Maha Chakri Sirindhorn Natural History Museum 22. Lunaray 23. เจ๊หงษ์มะม่วงแช่อิ่มหาดใหญ่ 24. วัดฉื่อฉาง 慈善禪寺 25. locals.hdy 26. REALM Songkhla
Remarks: 1. รับ passport ได้ที่ TAT Hatyai - ททท. สำนักงานหาดใหญ่ หรือ ร้านที่เข้าร่วมแคมเปญ 2. สามารถแลกรับของที่ระลึกได้ 1 ชิ้น ต่อ 1 พาสปอร์ต เท่านั้น 3. เพื่อความน่ารักนุบนิบของ passport พิกัดอาจจะมีคลาดเคลื่อนจากสถานที่จริงไปบ้าง แนะนำให้กด gps ค้นหาร้านอีกครั้ง
รางวัล
เก็บ stamp ครบตามเงื่อนไขที่ ททท. กำหนด รับเลย!!! ของที่ระลึก จาก ททท. เฉพาะแคมเปญนี้เท่านั้น พิเศษแบบสุดๆ...
เก็บสะสมพิกัด Hidden Gems ครบทั้ง 5 สถานที่ รับไปเลย !! ของรางวัลสุด Exclusive จาก ททท. งานนี้บอกเลย ททท. เตรียมของที่ระลึกให้แบบจุกๆ
ช่วงเวลาการร่วมสนุก 1 กุมภาพันธ์ - 30 เมษายน 2568
"สืบสานวิถีแห่งศรัทธา สักการะพุทธ-พราหมณ์" สักการะบูชาพระพุทธรูปและพระคเณศ วันที่ ๒๕ ธันวาคม ๒๕๖๗ - วันที่ ๕ มกราคม ๒๕๖๘
พิพิธภัณฑสถานแห่งชาติ ปราจีนบุรี
ขอเชิญร่วมกิจกรรม
"สืบสานวิถีแห่งศรัทธา สักการะพุทธ-พราหมณ์"
สักการะบูชาพระพุทธรูปและพระคเณศ
เพื่อความเป็นสิริมงคล เนื่องในเทศกาลปีใหม่ ๒๕๖๗
ตั้งแต่วันที่ ๒๕ ธันวาคม ๒๕๖๗ - วันที่ ๕ มกราคม ๒๕๖๘
และยกเว้นค่าธรรมเนียมเข้าชม
ตั้งแต่วันที่ ๓๐ ธันวาคม ๒๕๖๗ - ๑ มกราคม ๒๕๖๗
ผู้สนใจสามารถเข้าชมได้ที่
พิพิธภัณฑสถานแห่งชาติ ปราจีนบุรี
ถนนปราจีนอนุสรณ์ อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี
ตั้งแต่เวลา ๐๙.๐๐ น. - ๑๖.๐๐ น.
สอบถามข้อมูลเพิ่มเติม โทร. ๐๓๗-๒๑๑-๕๘๖
งานวันสมเด็จพระเจ้าตากสินมหาราชรำลึก และงานกาชาดจังหวัดจันทบุรี ประจำปี 2568 วันที่ 28 ธันวาคม 2567 – 5 มกราคม 2568
ขอเชิญเที่ยวงานวันสมเด็จพระเจ้าตากสินมหาราชรำลึก และงานกาชาดจังหวัดจันทบุรี ประจำปี 2568 วันที่ 28 ธันวาคม 2567 – 5 มกราคม 2568 ณ บริเวณสวนสาธารณะสมเด็จพระเจ้าตากสินมหาราช (ทุ่งนาเชย) จังหวัดจันทบุรี การแสดงแต่ละคืน 28 ธ.ค. 67 : ประกวดวงดนตรีสากล 29 ธ.ค. 67 : ปอยฝ้าย มาลัยพร & ยายแหวง 30 ธ.ค. 67 : แป้งฝุ่น & เจน ซุปเปอร์วาเลนไทน์ 31 ธ.ค. 67 : เต้ย อธิบดินทร์ & มดแดง จิราพร 1 ม.ค. 68 : เบียร์ พร้อมพงษ์ 2 ม.ค. 68 : ไม้เลื้อย 3 ม.ค. 68 : เนสกาแฟ ศรีนคร & หญิง ธิติกานต์ 4 ม.ค. 68 : ร็อคคงคย 5 ม.ค. 68 : ลำไย ไหทองคำ
SME HALAL FOOD FEST #2 วันที่ 27 ธันวาคม 2567 - 5 มกราคม 2568
SME HALAL FOOD FEST #2 วันที่ 27 ธันวาคม 2567 - 5 มกราคม 2568 ชมชิมอาหารฮาลาลดี ปลอดภัย กว่า100 บูธ มาช๊อปเสื้อผ้าแฟชั่นมุสลิมหลากหลายสไตส์ พร้อมกิจกรรมมากมายบนเวที ทุกค่ำคืน!! พบกับกิจกรรมมากมายบนเวที คณะอาจารย์จากมหาวิทยาลัยชื่อดัง ผู้บริหารจากสมาพันธ์เอสเอ็มอีไทย ทีม influencer ดาว Tiktok กระทบไหล่"น้องบีม"จากภาพยนตร์เรื่อง"ผู้บ่าวนิกะห์" "บังฮาซัน" นักธุรกิจออนไลน์ชื่อดัง พร้อม!! ฟังการบรรยายจากอาจารย์ชื่อดังสถาบันต่างๆ พบกับคลัสเตอร์ฮาลาล คลัสเตอร์กาแฟ คลัสเตอร์อาหารทะเล EXPO ยานยนต์ ยานยนต์ไฟฟ้า และนวัตกรรมEVพลังงานทางเลือก
งานรับแสงแรกแห่งตะวัน 4 มหัศจรรย์ @ อุบลราชธานี ประจำปี 2568 วันที่ 27 ธันวาคม 2567 - 6 มกราคม 2568
งานประจำปีจังหวัดอุบลราชธานี ประจำปี 2568 ภายใต้ชื่องานรับแสงแรกแห่งตะวัน 4 มหัศจรรย์ @ อุบลราชธานี จังหวัดอุบลราชธานี ร่วมกับหน่วยงานราชการ รัฐวิสาหกิจ อำเภอ องค์กรปกครองส่วนท้องถิ่น และภาคเอกชน ได้มีการจัดงานประจำปี เป็นประจำทุกปี เพื่อหารายได้ช่วยกิจการสาธารณกุศล กระตุ้นเศรษฐกิจ ส่งเสริมการท่องเที่ยวจังหวัดอุบลราชธานี และเป็นการเฉลิมฉลองเทศกาลปีใหม่ ซึ่งในปีนี้กำหนดจัดระหว่างวันที่ 27 ธันวาคม 2567 ถึงวันที่ 6 มกราคม 2568 รวม 11 วัน 11 คืน โดยกิจกรรมภายในงาน มีการจำหน่ายสินค้ามากมาย โดยเฉพาะสินค้า OTOP นอกจากนี้ยังมี การออกสลากกาชาด การล่วงไหชิงรางวัลแม่บ้านมหาดไทย การออกร้านจากหน่วยงานและอำเภอ การแสดงบนเวที และคอนเสิร์ต รวมทั้งหมด 11 วัน 11 คืน
งานพระยาพิชัยดาบหักและงานกาชาดจังหวัดอุตรดิตถ์ ประจำปี 2568 วันที่ 7 - 16 มกราคม 2568
งานพระยาพิชัยดาบหัก และงานกาชาดจังหวัดอุตรดิตถ์ ประจำปี 2568 วันที่ 7 – 16 มกราคม 2568 ณ สนามกีฬาพระยาพิชัยดาบหัก จังหวัดอุตรดิตถ์
ชมการแสดง แสง สี เสียง ตำนานพระยาพิชัยดาบหัก ตระการตากับขบวนแห่เทิดพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว ขบวนแห่ศิลปวัฒนธรรม 9 อำเภอ นิทรรศการเทิดเกียรตินักรบผู้กล้าพระยาพิชัยดาบหัก นิทรรศการผ้าทออุตรดิตถ์เมืองงาม 3 วัฒนธรรม ร่วมเชียร์เหล่านักสู้มวยไทยพระยาพิชัยดาบหัก ช็อป ชิม เพลิน สินค้าโอท็อป อาหารและผลิตภัณฑ์ของดีของเด่น ลุ้นรางวัลสลากกาชาด ลุ้นทองคำหนัก 15 บาท และรางวัลอื่นๆ อีกมากมาย
ติดตามข้อมูลด้านท่องเที่ยวหรือสอบสอบข้อมูลเพิ่มเติมได้ที่ ศูนย์ประสานงานการท่องเที่ยวจังหวัดอุตรดิตถ์ 055 479 824 , 065 525 4962
งานประเพณี “ตานข้าวใหม่ ใส่บาตรหลวง" 8-13 มกราคม 2568
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานเชียงราย และศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา , จังหวัดพะเยา, สถาบันนวัตกรรมการเรียนรู้ มหาวิทยาลัยพะเยา และวัดศรีโคมคำ ขอเชิญชวนนักท่องเที่ยวทุกท่านร่วมงานบุญสืบสานประเพณีและวัฒนธรรมที่ดีงาม ในงานประเพณี "ตานข้าวใหม่ ใส่บาตรหลวง" ระหว่างวันที่ 8-13 มกราคม 2568
ร่วมทำบุญใส่บาตรตานข้าวใหม่ ตานข้าวทิพย์ และร่วมพิธีทางพุทธศาสนา
ชมขบวนแห่เรือพายตานข้าวทิพย์แบบล้านนาสร้างสรรค์, ขบวนแห่เทพบุตร เทพธิดา, ขบวนเครื่องถวายที่มีความสวยงามอลังการหนึ่งเดียวในโลก ที่เป็น High light หาชมได้ยาก
กิจกรรมภายในงาน : 8-10 มกราคม 2568 ร่วมทำบุญถวายวัตถุดิบสำหรับกวนข้าวทิพย์ ณ โต๊ะรับของทำบุญ บริเวณ ณ วัดศรีโคมคำ และมหาวิทยาลัยพะเยา เวลา 08.30 น.-16.30 น. จำนวน 4 จุด
จุดที่ 1 หน้าพระวิหารพระเจ้าตนหลวง วัดศรีโคมคำ
จุดที่ 2 ลานโถงชั้น 1 อาคารสำนักงานอธิการบดี มหาวิทยาลัยพะเยา
จุดที่ 3 อาคารศิลปวัฒนธรรม ข้างหอประชุมพญางำเมือง มหาวิทยาลัยพะเยา
จุดที่ 4 หน้าประตูทางเข้าสถาบันนวัตกรรมการเรียนรู้ มหาวิทยาลัยพะเยา
12 มกราคม 2568 ณ ลานอนุสาวรีย์พญางำเมือง เวลา 16.30 น .-20.30 น. เชิญร่วมพิธีเปิดกิจกรรมตานข้าวใหม่ใส่บาตรหลวง เยี่ยมชมกาดวัฒนธรรมภูมิปัญญา และชมการประกวดข้าวต้มข้าวหลาม ภูมิปัญญาท้องถิ่น กิจกรรม การเสี่ยงทายธิดาข้าวทิพย์ ประกอบพิธีเจริญพระพุทธมนต์ และกวนข้าวทิพย์
13 มกราคม 2568 เวลา 06.30 น.-11.00 น. ชมขบวนแห่เรือพายตานข้าวทิพย์แบบล้านนาสร้างสรรค์, ขบวนแห่เทพบุตร เทพธิดา, ขบวนแห่เรือเครื่องถวายเครื่องสักการะและข้าวใหม่ เส้นทาง จากท่าเรือวัดติโลกอาราม ไปตามร่องน้ำแม่อิงในกว๊านพะเยา ผ่านเรือนโบราณชายกว๊านพะเยา, อนุสาวรีย์พญางำเมือง มุ่งหน้าไปขึ้นท่าน้ำวัดศรีโคมคำ (พระอารามหลวง) ต.เวียง อ.เมือง จ.พะเยา ชมการประกวดเรือ จากชุมชนรอบกว๊านพะเยา ชมขบวนแห่ทางบกที่หน้าพระอุโบสถกลางน้ำ วัดศรีโคมคำ เคลื่อนขบวนสู่พระวิหารพะเจ้าตนหลวง ร่วมพิธีตานข้าวใหม่ ข้าวทิพย์พระเจ้าตนหลวง
สอบถามข้อมูลเพิ่มเติมได้ที่
สถาบันนวัตกรรมการเรียนรู้ มหาวิทยาลัยพะเยา โทร 054-466-666 ต่อ 3806 https://www.facebook.com/upili.official
Facebook: ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา E-mail : tatphayao@gmail.com ททท.สำนักงานเชียงราย โทร 053-7446745, 053-717433 Facebook: ททท.สำนักงานเชียงราย
ตลาดวลายาวินเทจ เข้าชมฟรี 8 มกราคม 2568
เปิดตลาดวลายาวินเทจ เข้าชมฟรี!!! VALATA Market Vintage Music Falk #1 / 8 มกราคม 2568 / เวลา 17.00 น. 22.00 น. / ณ หลัง มรภ.วไลยอลงกรณ์ฯ สระแก้ว (ข้าง อบจ. ติดถนน 359) พบกับ - วงดนตรี ชราภาพ - วงดนตรี หนุ่มเดอะปิ๊ง - วงดนตรี นักเก็ตปลา - ร้านอาหารและ Food Truck มากมาย
เทศกาลกินปู เผาปลา ย่างกุ้ง วันที่ 8-14 มกราคม 2668
พบกับเทศกาลกินปู เผาปลา ย่างกุ้ง วันที่ 8-14 มกราคม2668 ที่ลานด้านหน้า บิ๊กซีสระแก้ว พบกับคาราวานสินค้าราคาถูกอาหารอร่อยเครื่องเล่นสวนสนุก และศิลปินดังมากมาย 8 มค พบกับ วิด ไฮเปอร์ 9 มค พบกับ ศร หวิว 10 มค พบกับ ร็อคคงคย 11 มค พบกับ ม่อน วรวิทย์ 12 มค พบกับ เล็กสเร็น ปะทะบิ๊ก สุรินทร์ 13 มค พบกับ หนุ่ม หนุมาน 14 มค พบกับ มิสแกรนด์แพร่ อาม ชุติมา
“Fun Food Festival” ที่เซ็นทรัลจันทบุรี 9-15 มกราคม 68
“Fun Food Festival” ที่เซ็นทรัลจันทบุรี
ใครหาที่เที่ยววันเด็ก สะดวก ในเมือง
พบกับเทศกาลอาหารได้ที่เซ็นทรัลค่า
มีฟรีคอนเสิร์ตและกิจกรรมต่างๆ
วันที่ 9-15 มกราคม 68 นะคะ
บริเวณลานกิจกรรมข้างลานน้ำพุ
Jungceylon Kids Day 2025 x Giant Dog วันที่ 10-12 มกราคม 2568
งาน “Jungceylon Kids Day 2025 x Giant Dog” วันที่ 10-12 มกราคม 2568 เวลา 11.00 – 22.00 น. ณ โซนเดอะจังเกิ้ล ศูนย์การค้าจังซีลอน ป่าตอง ภูเก็ต กิจกรรมไฮไลท์ Kids Day SPECIAL วันที่ 11 มกราคม 2568 สนุกกับเกม “Puppy Game” ลุ้นของรางวัลจุใจ พบกับ เจ้าตูบยักษ์ใจดี หลากหลายสายพันธุ์ น่ากอดที่สุดในโลก! สายแฟชั่นห้ามพลาด! ช้อปกระจายกับแฟชั่นสุดคิวต์และของใช้น้องหมาที่ “Dog Cart”
เทศกาลดนตรีในสวน : Students Talent Show in the Garden @ป้อมพระสุเมรุ 20 ธันวาคม 2567 - 24 มกราคม 2568
เทศกาลดนตรีในสวน : Students Talent Show in the Garden @ป้อมพระสุเมรุ เขตพระนคร จัดยาว ๆ ตั้งแต่ 20 ธันวาคม 2567 - 24 มกราคม 2568 พบกับการแสดงดนตรี ศิลปวัฒนธรรม นิทรรศการ Workshop การเสวนา และอื่นๆ อีกมากมาย
งาน "เขาช่องพราน ราชบุรีเรืองงาม โพธารามใต้ร่มพระบารมี" 10-12 มกราคม 2568
องค์การบริหารส่วนจังหวัดราชบุรี เชิญชวนเที่ยวงาน "เขาช่องพราน ราชบุรีเรืองงาม โพธารามใต้ร่มพระบารมี" ระหว่างวันที่ 10 - 12 มกราคม 2568 ณ บริเวณวัดเขาช่องพราน อ.โพธาราม จ.ราชบุรี เข้าชมฟรีตลอดงาน!
กิจกรรมไฮไลท์ไม่ควรพลาด
• ชมการแสดงละครประกอบแสง สี เสียง Light & Sound เรื่อง "ราชบุรีเรืองงาม โพธารามใต้ร่มพระบารมี" ผสมผสานเทคนิค 3D Mapping สุดอลังการ! นำแสดงโดยนักแสดงจากช่อง 7 ได้แก่ ฟิวส์ กิติกร, เจด้า ศรัญย่า, บิว ณัฐพล และต่าย เชิญยิ้ม ร่วมด้วยนักฟุตซอลทีมชาติไทย อาร์ม ศุภวุฒิ และศิลปินอีกมากมาย
• ครั้งแรกกับกิจกรรมนั่งรถรางเที่ยวชมบรรยากาศจำลองของดีเมืองโพธาราม เพื่อประชาสัมพันธ์ให้นักท่องเที่ยวได้รู้จักมากยิ่งขึ้น
• ชม ชิม ช้อป สินค้าชุมชน สินค้าของดี ของเด่นอำเภอโพธาราม และสินค้า OTOP พร้อมชมค้างคาวร้อยล้าน ไฮไลท์สำคัญของแหล่งท่องเที่ยวเขาช่องพราน ชมได้ทุกวัน ตั้งแต่ช่วงเวลาประมาณ 18.00 น. เป็นต้นไป
งานแผ่นดินดินสมเด็จพระนเรศวรมหาราชพิษณุโลก ประจำปี 2568 วันที่ 10-24 มกราคม 2568
"งานแผ่นดินดินสมเด็จพระนเรศวรมหาราชพิษณุโลก ประจำปี 2568" ระหว่างวันที่ 10-24 มกราคม 2568 ณ บริเวณศาลากลางจังหวัดพิษณุโลก และบริเวณพระราชวังจันทน์ โดยกิจกรรมในงาน ดังนี้
พิธีบวงสรวง 2 ครั้งในวันที่ 10 มกราคม 2568 เพื่อเป็นการขอบรมราชาอนุญาตจัดงาน วันที่ 18 มกราคม 2568 บวงสรวงเพื่อเป็นการเทิดพระเกียรติเนื่องในวันยุทธหัตถี (รัฐพิธี)
พิธีเปิดงานในวันที่ 10 มกราคม 2568 เวลา 19:09 น. ณ เวทีกลางบริเวณสนามหน้าศาลากลางจังหวัดพิษณุโลก โดยมีท่านผู้ว่าราชการจังหวัดพิษณุโลกเป็นประธาน การออกร้านจำหน่ายสินค้าผลิตภัณฑ์ของชุมชนตามนโยบายหนึ่งผลิตภัณฑ์หนึ่งตำบลของดีของจังหวัดพิษณุโลก ตลาดประชารัฐซึ่งมีร้านค้าจัดเตรียมกว่า 70 ร้านค้า วันที่ 13 มกราคม 2568 เวลา19:00 น. การเดินแบบภาพไทยการกุศล ณ เวทีการแสดงแสงเสียง บริเวณศาลสมเด็จพระนเรศวรมหาราช
งานของดีและงานกาชาดจังหวัดสระบุรี ประจำปี 2568 วันที่ 10 - 18 ม.ค. 2568
งานของดีและงานกาชาดจังหวัดสระบุรี ประจำปี 2568 วันที่ 10 - 18 ม.ค. 2568 ณ บริเวณศาลากลางหลังใหม่ อ.เมือง จ.สระบุรี งานของดีสระบุรีและงานกาชาด ประจำปี 2568 ณ ศาลากลางหลังใหม่ จังหวัดสระบุรี จัดเต็ม 9 วัน 9 คืน ตั้งแต่วันที่ 10 - 18 มกราคม 2568 มีร้านอาหารชื่อดังมากมาย OTOP ของดีสระบุรี ตลาดหัวปลีฉบับย่อ สวนสนุกสุดมันส์ รถบั๊ม ชิงช้าสวรรค์ บ้านผีสิง ไวกิ้ง ให้อาหารสัตว์แสนน่ารักเอาใจเด็ก ๆ เฟอร์นิเจอร์ รวมถึงพืชพันธุ์ไม้นานาชนิด และคอนเสิร์ตจากศิลปินคุณภาพตลอดทั้งคืน
Ma Chill Kun Ep.1 Ignite Banchang (มาชิลล์กัน) คอนเสิร์ต 10-12 มกราคม 2568
Ma Chill Kun Ep.1 Ignite Banchang (มาชิลล์กัน ฟรี คอนเสิร์ต) 10-12 มกราคม 2568 ลานหน้าห้าง Robinson Lifestlye Banchang วันที่ 10 มกราคม 2568 ฟรีคอนเสิร์ตให้ชมฟรีกับวง Sleep Less วงดังในบ้านฉาง และคุณเอ ไมค์ทองคำ วันที่ 11 มกราคม 68 พบกับวงดังยุค 90 "Dr.Fuu" เจ้าของบทเพลง เศษใจเหลือเหลือและอีกหลายเพลงที่ยังคงดังอยู่จนถึงทุกวันนี้ พร้อมฟังเพลงใหม่ "ไม่คุ้มเสี่ยง" พร้อมๆกัน วันที่ 12 มกราคม 68 มาม่วนซื่นกับผู้ใหญ่บ้านฟินแลนด์ พร้อมทัพน้องร้องกว่า 10 ชีวิต มาแสดงสดให้ทุกคนได้ชมกัน คนไทยหัวใจหมอลำ
ปฏิทินกิจกรรมกีฬา จังหวัดสระแก้ว ประจำปี 2568
งานวัดนครปฐม 2568
งานวัดนครปฐม ไม่น้อยหน้าที่ไหน มีจัดกันตลอดปี ตอนนี้เดือนนี้มีที่ไหนบ้าง เช็คดู
- งานประจำปีวัดห้วยจระเข้ ตำบลพระปฐมเจดีย์ อำเภอเมือง 22-26 ม.ค.2568
- งานประจำปีปิดทอง วัดกกตาล 28-31 ม.ค.2568
- งานวัดเพลินเพชร พุทธมณฑลสาย5 อ.สามพราน 28 ม.ค. - 3 ก.พ. 2568
- งานวัดธรรมศาลา ไหว้พระ ปิดทอง สวดภาณยักษ์ใหญ่ เสริมมงคล แก้ปีชง 28 ม.ค. - 1 ก.พ. 2568
- งานวัดพระประโทนเจดีย์ 28 ก.พ. - 9 มี.ค. 2568
- งานวัดบางวัฒนาสามัคคี 24-26 ม.ค. 2568
- งานวัดป่าศรีถาวรคลองโยง 25 ม.ค. - 2 ก.พ. 2568
- งานวัดสว่างอารมณ์ (แคแถว) 25 ม.ค. - 9 ก.พ. 2568
- งานวัดรัตนรังสี 26 ม.ค. - 3 ก.พ. 2568
- งานประจำปีวัดตาก้อง ทำบุญปิดทองรูปหล่อหลวงพ่อแช่ม 10-16 ก.พ. 2568
- งานประจำปีกราบนมัสการปิดทองหลวงพ่อแดงวัดเกาะวังไทร อ.เมือง 21-25 ก.พ. 2568
- งานประจำปีวัดลาดสะแก (พระครูปลัดเผือก ธมุมกาโม) พ่อปู่ 22-23 ก.พ. 2568
- งานนมัสการปิดทองพระพุทธสิหิงค์ วัดสิรินธร เทพรัตนาราม ตำบลอ้อมใหญ่ สามพราน วันที่ 18-24 ก.พ. 2568
- งานประจำปีปิดทองยาวท้าว วัดทัพยายท้าว ตำบลหนองปากโลง อำเภอเมือง 22-24 ก.พ. 2568
- งานประจำปีวัดดอนหวาย อ.สามพราน 19-23 ก.พ. 2568
- งานวัดจินดารามปี 23 ก.พ. 2568
- งานประจำปีวัดเกาะวังไทร อ.เมือง กราบนมัสการปิดทองหลวงพ่อแดง 21-25 ก.พ. 2568
- งานวัดสรรเพชญ สามพราน นครปฐม 19-23 ก.พ. 2568
- งานปิดทองหลวงพ่อทาองค์ใหญ่ วัดพะเนียงแตก 7-13 มี.ค.68
- งาน เทศกาลนมัสการ ปิดทอง หลวงพ่อวัดไร่ขิง วัดไร่ขิง พระอารามหลวง ตำบลไร่ขิง อำเภอสามพราน 8-16 เม.ย. 68
KUDEN NIGHT AT THE MUSEUM ปีที่ 2 ในวันที่ 10 - 11 มกราคม 2568
KUDEN NIGHT AT THE MUSEUM ปีที่ 2 ในวันที่ 10 - 11 มกราคม 2568 เวลา 16.00 - 22.00 น. ณ พิพิธภัณฑสถานแห่งชาติ สตูล เข้าชมฟรี ตลอดงาน !!!
วันศุกร์ที่ 10 มกราคม 2568 - นิทรรศการภายในจัดแสดงพิพิธภัณฑสถานแห่งชาติ สตูล - ชมชุดการแสดงเปิดโครงการ - ชมการสาธิตการตีกริช และนิทรรศการศาสตราวุธ - ชมการแสดงดนตรีบรรเลงเพลง - ชมนิทรรศการเคบายาและรองเท้าลูกปัด จากสมาคมเปอร์รานากันสตูล - การแสดงดนตรีจากเยาวชนในจังหวัดสตูล - บูธจำหน่ายสินค้า ** แต่งชุดเคบายา ลุ้นรับรางวัล
วันเสาร์ที่ 11 มกราคม 2568 (วันเด็ก) - กิจกรรมซุ้มตามความถนัดและความสามารถของเด็กและเยาวชน (การเล่นหมากขุม วาดภาพระบายสี กิจกรรมสันทนาการ เล่นเกมลุ้นรางวัล) - กิจกรรมการแสดงเกี่ยวกับการอนุรักษ์ศิลปวัฒนธรรมของเด็ก - กิจกรรมจับหางบัตรลุ้นรางวัล - ชมนิทรรศการภายในห้องจัดแสดงพิพิธภัณฑสถานแห่งชาติ สตูล - การแสดงดนตรีจากเยาวชนจังหวัดสตูล
งานประจำปีนมัสการปิดทอง หลวงพ่อปู่วัดโกรกกราก ประจำปี 2568 วันที่ 11-19 มกราคม 2568
ขอเชิญเที่ยวงาน ประจำปี นมัสการปิดทอง หลวงพ่อปู่ วัดโกรกกราก ประจำปี 2568 วันที่ 11 ~ 19 มกราคม 2568 ณ วัดโกรกกราก อำเภอเมือง จังหวัดสมุทรสาคร ตารางแสดงดนตรี 11 ม.ค. 68 จ๊ะ นงผณี & กิมกลอย ไทดอลมิวสิค 12 ม.ค. 68 ลำไย ไหทองคำ & ยูกิ เพ็ญผกา ไหทองคำ & เชอร์รี่ ปิยะพร 13 ม.ค. 68 หมอลำคณะ สาวน้อยเพชรบ้านแพง 14 ม.ค. 68 หมอลำคณะ ระเบียบวาทะศิลป์ 15 ม.ค. 68 หมอลำคณะ ประถมบันเทิงศิลป์ 16 ม.ค. 68 หมอลำคณะ ใจเกินร้อย บอย ศิริชัย & แอน อรดี 17 ม.ค. 68 หมอลำคณะ อีสานนครศิลป์ 18 ม.ค. 68 หมอลำคณะ เสียงวิหค นก พงศกร 19 ม.ค. 68 หมอลำคณะ เสียงอิสาน นกน้อย อุไรพร
วิ่ง เมืองเงาะมาราธอน 2025 วันที่ 11 มกราคม - 12 มกราคม 2568
วิ่ง เมืองเงาะมาราธอน 2025 วันที่ 11 มกราคม - 12 มกราคม 2568 โรงเรียนนาสาร จ.สุราษฎร์ธานี
งานเกษตรสุรนารี 68 วันที่ 11-19 มกราคม 2568
งานเกษตรสุรนารี งานแสดงความก้าวหน้าด้านเทคโนโลยีและนวัตกรรมทางการเกษตรที่ยิ่งใหญ่ 9 วัน 9 คืน ภายใต้แนวคิด “Sustainable Agri-Innovation for BCG เกษตรสร้างสรรค์ นวัตกรรมก้าวหน้า สู่การพัฒนาเศรษฐกิจสีเขียวอย่างยั่งยืน” ✅ ระหว่างวันที่ 11 – 19 มกราคม 2568 ✅ ณ มหาวิทยาลัยเทคโนโลยีสุรนารี จังหวัดนครราชสีมา
ภายในงานมีกิจกรรมที่น่าสนใจ ประกอบด้วย - นิทรรศการแสดงความก้าวหน้าด้านการวิจัย - การพัฒนาเทคโนโลยีและนวัตกรรมทางการเกษตรและอาหาร - นิทรรศการขององค์กรภาครัฐ ภาคเอกชน และเครือข่ายวิสาหกิจชุมชน เพื่อเผยแพร่ความรู้ทางวิชาการที่เหมาะสมให้แก่เกษตรกร ผู้ประกอบการ และประชาชนที่สนใจ - การจัดอบรม สัมมนา และ Workshop - อบรมหลักสูตรระยะสั้นสร้างอาชีพ ยกระดับเกษตรกรไทย ขับเคลื่อนเกษตรปลอดภัยด้วยโมเดลเศรษฐกิจ BCG - การประกวดพืช ได้แก่ มันสำปะหลัง กล้วยไม้ แคคตัส - การประกวดสัตว์ ได้แก่ ไก่แจ้ สุนัข และแมว . พร้อมทั้ง ชม...ชิม...ช้อป...!!! ผลิตผลทางการเกษตร ผักปลอดสาร อาหารปลอดภัย ผลิตภัณฑ์จากเครือข่ายที่ได้รับการถ่ายทอดเทคโนโลยีและนวัตกรรมจาก มทส. สินค้าจากกลุ่มเกษตรกร และสินค้าอุปโภคบริโภคหลากหลาย การออกร้านจำหน่ายสินค้ามากมาย รวมถึง Food Truck ร้านค้าชมรมนักศึกษา นักศึกษาสาขาวิชา คอนเสิร์ตจากวงดนตรีและศิลปินชื่อดัง มาร่วมให้ความบันเทิงแก่ผู้ชมภายในงาน
แจ่มจันท์ Market 11-12 และ 18-19 มกราคม 2568
แจ่มจันท์ Market วันที่ 11-12 และ18-19 มกราคม 2568 เวลา 10.00-18.00 น. สถานที่ Chatrium Golf Resort Soi Dao Chanthaburi ชวนสายกรีนมาชิลล์ในบรรยากาศรักษ์โลก! ขอชวนทุกคน: ✅ พก ถุงผ้า ไว้ใส่ของเก๋ ๆ ✅ พา กระบอกน้ำมา ลดพลาสติก ???? ✅ หิ้ว เก้าอีกแคมป์มาเอง เพิ่มความสบายไม่ต้องเปลืองทรัพยากร เพราะเราอยากให้ทุกคนสนุกไปใส่ใจสิ่งแวดล้อมไปด้วยกัน ไม่ว่าจะ มาช้อป มาชิลล์ มาเช็คอินแบบรักษ์โลกได้ในสไตล์ที่เป็นคุณ!
หลาดดีดติ้ง EP#5 วันที่ 11-12 มกราคม 2568
หลาดดีดติ้ง EP5 ประจำเดือน มกราคม 2568 หลาดริมเขาบรรยากาศดีดี ที่ ตลาดยามเย็น ริมเขา เขาเจียก จ.พัทลุง วันที่ 11-12 มกราคม 2568
กิจกรรม KID’S MOUNTH ตอน ตะลุยเมืองอาหาร city of Gastronomy วันที่ 11 มกราคม ถึง วันที่ 2 กุมภาพันธ์ 2568
มิวเซียมภูเก็ตจัดวันเด็กตลอดเดือน ตลอดเดือนมกราคมนี้มิวเซียมภูเก็ตขอชวนเด็ก ๆ มาสนุกรู้กับกิจกรรม KID’S MOUNTH ตอน ตะลุยเมืองอาหาร city of Gastronomy . เปิด Playground ชวนเล่น เรียนรู้อย่างเพลิดเพลินตลอดเดือนกับเรื่องราวอาหารภูเก็ต city of Gastronomy . ทุกวันเสาร์และอาทิตย์ตลอดเดือนมกราคม เริ่มตั้งวันที่ 11 มกราคม ถึง วันที่ 2 กุมภาพันธ์ 2568
พบกับฐานกิจกรรมการเรียนรู้ 1.Bingo ตะลุยเมืองอาหาร city of Gastronomy 2. Journey Book สมุดบันทึกการเดินทางที่จะพาน้อง ๆ ไปตลุยตามหาอาหารอร่อยอัตลักษณ์ทางวัฒนธรรมภูเก็ตพร้อมนำมาสร้างสรรค์เป็นสมุดบันทึกในฉบับของตัวเอง 3. นิทรรศการ “กินได้ กินดีย์” ชวนมาชิมและสัมผัสรสชาติและค้นหาความเป็นอัตลักษณ์ของขนมภูเก็ตไปด้วยกัน 4. Workshop หรอยติดตู้ เรียนรู้เรื่องราวอาหารท้องถิ่นภูเก็ตพร้อมทำเป็นของที่ระลึก diy กลับบ้าน 5. เกมท่องเที่ยวนครภูเก็ต เกมขนาดยักษ์ที่จะพาน้อง ๆ ไปท่องเที่ยวเรียนรู้ผ่านสถานที่สำคัญของนครภูเก็ต 6. Museum Game Zone สารพัดเกมที่จะพาน้องไปเรียนรู้เรื่องราวประวัติศาสตร์ วัฒนธรรม ประเพณี และอาหารท้องถิ่นของนครภูเก็ต 7. เด็กสร้างเมือง ชวนน้อง ๆ มาเล่นสร้างเมือง เมืองแบบไหนที่น้อง ๆ อยากอยู่สามารถสร้างสรรค์ได้ด้วยตัวเอง . เข้าร่วมฟรี ได้ทุกเพศ ทุกวัย ร่วมกิจกรรมครบตามเงื่อนไข จุ่มของขวัญจากมิวเซียมภูเก็ตได้เลย . #เปิดรอบกิจกรรมพิเศษทุกวันอาทิตย์ สนใจลงชื่อจองรอบล่วงหน้าได้ที่ Page Facebook มิวเซียมภูเก็ต Museum Phuket หรือโทร 094-807-7873
B-QUIK KHAO YAI MARATHON 2025 มาราธอนแห่งผืนป่ามรดกโลก 11-12 มกราคม 2568 LINK
B-QUIK KHAO YAI MARATHON 2025
มาราธอนแห่งผืนป่ามรดกโลก
11-12 มกราคม 2568
42.195 กม. / 21.1 กม. / 10 กม. / 5 กม. และ 2 กม.
พิเศษ! สำหรับลูกค้าสมาชิก B-Member เตรียมตัวพบกับสิทธิพิเศษของงานจาก บี-ควิก ได้เลย
รายละเอียดการแข่งขัน
วันแข่งขัน : อาทิตย์ที่ 12 มกราคม 2568 (Race Day)
วันรับอุปกรณ์ : เสาร์ที่ 11 มกราคม 2568 (Expo Day) เวลา 10.00 - 18.00 น.
สถานที่ : ลานกิจกรรมเขาใหญ่มาราธอน
เทศกาลดนตรีในสวน ครั้งที่ 32 (Concert in the Park No. 32) 12 มกราคม ถึง 2 มีนาคม 2568
เทศกาลดนตรีในสวน ครั้งที่ 32 (Concert in the Park No. 32) จะจัดการแสดงที่ ศาลาภิรมย์ภักดี สวนลุมพินี วันที่ 12, 19, 26 มกราคม / 2, 9, 16, 23 กุมภาพันธ์ / 2 มีนาคม 2025 เวลา: 17:30 น. เข้าชมฟรี ไม่เสียค่าใช้จ่าย บรรเลงโดยวง รอยัลแบงค์คอกซิมโฟนีออร์เคสตร้า (RBSO) ภายใต้การอำนวยเพลงของ ดร.วานิช โปตะวนิช พร้อมด้วยนักร้องรับเชิญ ศรัณย์ คุ้งบรรพต และ Chattara โดยมี ดร. อภิชาต อินทรวิศิษฏ์ รับหน้าที่เป็นพิธีกร โครงการนี้จัดขึ้นโดยมูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้า ในพระอุปถัมภ์สมเด็จพระเจ้าลูกเธอ เจ้าฟ้าสิริวัณณวรี นารีรัตนราชกัญญา ร่วมกับกรุงเทพมหานคร โดยความสนับสนุนของบริษัท บุญรอดบริวเวอรี่ จำกัด และ บี.กริม
กทม. ชวนชมการแสดงดนตรีในสวน 12-26 มกราคม 2568
กทม. ชวนชมการแสดงดนตรีในสวน โดย วง Bangkok Metropolitan Orchestra
วันอาทิตย์ที่ 12 มกราคม 2568 เวลา18.00 น. วัดประยุรวงศาวาสวรวิหาร ศิลปินรับเชิญ ปราโมทย์ วิเลปะนะ, Ant Emotion Town, นันทวัน เมฆใหญ่, วินัย พันธุรัตน์, อุมาพร บัวพึ่ง, อุไรวรรณ ทรงงาม, ภูริ ปริวิสุทธิ์ (the Golden Song) และ เชี่ยวชาญ(เอ็ม) สมบัติเทพ
วันเสาร์ที่ 18 มกราคม 2568 เวลา 16.30 น. สวนวชิรเบญจทัศ ศิลปินรับเชิญ Jelly Roll Jazz Club
วันอาทิตย์ที่ 19 มกราคม 2568 เวลา 16.30 น. สวนลุมพินี วง BMO (Bangkok Metropolitan Orchestra) ศิลปินรับเชิญ มี่ ปุญญาดา (Mee The Star) และ กองปราบ ปณิธาน
วันอาทิตย์ที่ 26 มกราคม 2568 เวลา 17.00 น. Museum Siam วง BMO (Bangkok Metropolitan Orchestra) ศิลปินรับเชิญ กบ เสาวนิตย์ นวพันธ์, กบ ทรงสิทธิ์ รุ่งนพคุณศรี, มี่ ปุญญาดา (Mee The Star) และ กองปราบ ปณิธาน
ศึกเดือดที่สุดแห่งปี! LEGEND FIGHTING CHAMPIONSHIPS 12 มกราคม 2568
ศึกเดือดที่สุดแห่งปี! LEGEND FIGHTING CHAMPIONSHIPS 2024 รอบชิงชนะเลิศมวยไทยไลท์เวท ชิงแชมป์แบบเดือดสุดขีด! “สามล้าน ลูกพ่อพระยาเสือ” ปะทะ “ฤทธิชัย ชูวีระ” ในพิกัดรุ่นไลท์เวท 61.3 กก. เดิมพันด้วย เข็มขัดแชมป์อันทรงเกียรติ และ เงินรางวัล 100,000 บาท! จะมีเพียงหนึ่งเดียวเท่านั้นที่ได้ก้าวขึ้นเป็นแชมป์! เตรียมพบกับบรรยากาศสุดเร้าใจ! ครบทั้ง แสง สี เสียง และ ความมันส์จัดเต็มแบบขีดสุด! วันอาทิตย์ที่ 12 มกราคม 2568 เวทีมวยชั่วคราว หัวหิน คอนเวนชั่น เซ็นเตอร์ ชั้น 1 บลูพอร์ต หัวหิน เปิดประตูเวลา 16.00 น. ถ่ายทอดสดสุดมันส์ ผ่าน Amarin TV ช่อง 34 ตั้งแต่ 17.00-19.00 น. ฟรี! ไม่มีค่าใช้จ่าย!
ทอดผ้าป่าทางน้ำ 16 วัด สองฟากฝั่งแม่น้ำน้อย 12 มกราคม 2568
ททท.สุพรรณชวนร่วมบุญใหญ่ “ทอดผ้าป่าทางน้ำ" 16 วัด ตลอดสองฟากฝั่งแม่น้ำน้อย เชิญชวนผู้มีจิตศรัทธา ร่วมทำบุญตั้งกองผ้าป่า ในกิจกรรม “ทอดผ้าป่าทางน้ำ” จำนวน 16 วัด ตลอดริมสองฟากฝั่งแม่น้ำน้อย ในพื้นที่อำเภอวิเศษชัย ในวันอาทิตย์ที่ 12 มกราคม 2568 นี้ เวลา 13.00 - 19.00 น. ณ วัดฝาง อ.วิเศษชัยชาญ จ.อ่างทอง
ดื่มด่ำศิลปวัฒนธรรมชมการแสดงศิลปะพื้นบ้านอันงดงาม ที่สะท้อนเอกลักษณ์ของชาวอ่างทอง และ เสียงเพลงแห่งความสุข สนุกสนานกับโชว์พลุสุดตระการตา และดนตรีสดยามเย็นจาก "เดอะ คอมเมเดียน ณ วัดสี่ร้อย ต.สี่ร้อย อ.วิเศษชัยชาญ จ.อ่างทอง
งานเจ้าพ่อพญาแลและงานกาชาดจังหวัดชัยภูมิ ประจำปี 2568 จังหวัดชัยภูมิ 12-20 มกราคม 2568
งานเจ้าพ่อพญาแลและงานกาชาดจังหวัดชัยภูมิ ประจำปี 2568 จังหวัดชัยภูมิ 12-20 มกราคม 2568 บริเวณหน้าอนุสาวรีย์เจ้าพ่อพญาแล เทศบาลเมืองชัยภูมิ จังหวัดชัยภูมิ
ปีนี้พิธีเริ่มวันที่ 12 มกราคม 2568 ตั้งแต่เวลา 04.45 น. พิธีบวงสรวงดวงวิญญาณ 06.00 น. พิธีแห่บายศรีและถวายช้างแด่เจ้าพ่อพญาแล เวลา 08.30 น. พิธีเปิดงานฉลองอนุสาวรย์เจ้าพ่อพญาแลและงานกาชาด ประจำปี 2568
ชมพิธีเปิดงานสุดยิ่งใหญ่ จัดเต็มทุกเวที ทุกบูธ ตลอด 9 วัน 9 คืน ลุ้นโชคกับร้านหรรษากาชาด ช้อปสินค้า OTOP ของดี ชัยภูมิ ทั้ง 16 อำเภอ รวมร้านดังใน Tiktok อร่อยเด็ดทุกร้านยกขโยงมาเพียบ
งานทำขวัญพระแม่โพสพ ของดีอำเภอบ้านด่าน จ.บุรีรัมย์ 13-19 มกราคม 2568
ขอเชิญเที่ยวงานทำขวัญพระแม่โพสพ ของดีอำเภอบ้านด่าน จ.บุรีรัมย์ 13-19 มกราคม 2568 บริเวณหน้าที่ว่าการอำเภอบ้านด่าน ชมการรำบวงสรวง ออกร้านนิทรรศการทุกตำบล สินค้าโอท็อป การแข่งขันกีฬาพื้นบ้าน สวนสนุกทุกใหญ่
โปรแกรมภาพยนตร์สัปดาห์นี้ วันที่ 14-19 มกราคม 2568
เจียไต๋แฟร์ 2025 วันที่ 15-19 มกราคม 2568 อ.เมือง จ.กาญจนบุรี
"เจียไต๋แฟร์ 2025" ในธีม "สมาร์ทฟาร์ม สมาร์ทไลฟ์" 15-19 มกราคม 2568 เวลา 08:00-17:00 น. ณ เจียไต๋ กาญจนบุรี ต.วังด้ง อ.เมือง จ.กาญจนบุรี เข้าชมฟรี!
แผนที่สถานที่จัดงาน
งานที่จะพาคุณก้าวสู่โลกเกษตรยุคใหม่เพื่อความยั่งยืน 8 โซนมหัศจรรย์ที่คุณห้ามพลาด! โซน A: เต็นท์กลางสุดไฮไลท์ พบสายพันธุ์พืชโดดเด่นระดับโลก เช่น ฟักทองลักกี้, ข้าวโพดแว็กซี่ ไอริส และแตงโมเซ็นจูรี่ สตาร์ • โซน B: สวนสายพันธุ์เด็ด ชมแปลงสาธิตพืชคุณภาพกว่า 600 สายพันธุ์ • โซน C: เออเบิร์น การ์เดน ดื่มด่ำกับสวนดอกไม้และพืชผักสไตล์โฮมการ์เดน • โซน D: มหัศจรรย์โรงเรือน สัมผัสเทคโนโลยีการเพาะปลูกพืชสุดล้ำ • โซน E: สีสันแห่งความยั่งยืน สนุกกับสวนต้นไม้และกิจกรรมที่ส่งเสริมความยั่งยืน • โซน F: นิทรรศการโซลูชันเจียไต๋ นวัตกรรมเกษตรอัจฉริยะ เช่น โดรนไร้คนขับ และระบบน้ำอัจฉริยะ • โซน G: พักจิบ พักใจ ชิลล์กับเครื่องดื่มเย็น ๆ ในบรรยากาศสบาย ๆ • โซน H: ชอปฟิน กินอร่อย ลิ้มรสเมนูซิกเนเจอร์ที่ใช้วัตถุดิบสดใหม่จากเจียไต๋
งานเทศกาลยอนหอยหลอดและวัฒนธรรมพื้นบ้านละงู ครั้งที่ 16 ระหว่างวันที่ 15-19 มกราคม 2568
องค์การบริหารส่วนตำบลละงู กำหนดจัดงานเทศกาลยอนหอยหลอดและวัฒนธรรมพื้นบ้านละงู ครั้งที่ 16 ระหว่างวันที่ 15-19 มกราคม 2568 ณ องค์การบริหารส่วนตำบลละงู และชายหาดบ้านหัวหิน หมู่ 1 ตำบลละงู อำเภอละงู จังหวัดสตูล
เพื่อส่งเสริมประชาสัมพันธ์การท่องเที่ยวของตำบลละงูและจังหวัดสตูลให้เป็นที่รู้จักอย่างกว้างขวาง อีกทั้งเพื่อพัฒนาศักยภาพของคนในชุมชนให้มีความรู้ความสามารถในการจัดการด้านการท่องเที่ยวในพื้นที่ได้ด้วยตนเองอย่างยั่งยืน เผยแพร่ศิลปะ วัฒนธรรม ประเพณีอันดีงามซึ่งแสดงถึงอัตลักษณ์ที่สำคัญของท้องถิ่น เพื่อสร้างจิตสำนึกการอนุรักษ์ทรัพยากรธรรมชาติการท่องเที่ยวให้แก่คนในพื้นที่และนักท่องเที่ยว ตลอดจนเพื่อกระตุ้นการท่องเที่ยวในพื้นที่ตำบลละงู และส่งเสริมการท่องเที่ยวในจังหวัดสตูล เกิดการสร้างรายได้ให้กับคนในชุมชน
ภายในงานฯ มีกิจกรรมมากมาย อาทิ การแข่งขันยอนหอยหลอด , แข่งขันกินหอยหลอด , แข่งขันประกอบอาหารจากหอยหลอด , ประกวดร้องเพลงลูกทุ่งเสียงทอง 2025 , การแสดงศิลปวัฒนธรรมพื้นบ้าน , การแสดงรองเง็ง , การแสดงจากนักเรียนในพื้นที่ , ชมแฟชั่นโชว์ชุดผ้าไทยและผ้าพื้นเมือง , การประกวดมิสลากู Junior 2025 และพบกับการแสดงจากศิลปินทุกค่ำคืน คืนวันที่ 15 มกราคม 2568 พบกับวงทับห้า , วันที่ 16 มกราคม 2568 โชว์ผัดหอยหลอด โดยพี่หลวงจง ดาว Tik Tok และวงเพ้อ , วันที่ 17 มกราคม 2568 ก้อย กินรี , วันที่ 18 มกราคม 2568 กิม ชญาภา และวันที่ 19 มกราคม 2568 อานัส สันละกะยา จึงขอเชิญชวนประชาชนและผู้ที่สนใจเข้าร่วมงานฯ ตามวันและสถานที่ดังกล่าวต่อไปด้วย
Bangsaen Koff Fest 2025 วันที่ 17-19 มกราคม 2568 LINK
Bangsaen Koff Fest 2025 วันที่ 17-19 มกราคม 2568 เวลา 09.00 - 19.00 น. สถานที่: หาดบางแสน (ตรงข้ามโรงแรม Heritage) ฟรี! ไม่มีค่าเข้างาน พบกับร้านกาแฟสุดชิคมากมายกว่า 80 ร้านค้า ร่วมชมการประกวดการแข่งขันกาแฟระดับเอเชีย งานคราฟต์ ดนตรีสด และกิจกรรมอื่นๆอีกมากมาย ที่จะทำให้วันหยุดของคุณพิเศษสุด!
งาน Expat Travel Fair 2025 @ Hatyai 17 – 19 มกราคมนี้ ณ ลานโปรโมชั่นชั้น 1 ศูนย์การค้าเซ็นทรัลหาดใหญ่
งาน Expat Travel Fair 2025 @ Hatyai ยกทัพ 7 หมุดหมายท่องเที่ยวที่คุณต้องลอง กระบี่ พังงา ภูเก็ต นครศรีธรรมราช สงขลา สุราษฎร์ธานี และสมุย พบกับ โรงแรมสุดคูล แพคเกจท่องเที่ยวสุดเจ๋ง และกิจกรรมที่คุณต้องร้อง WOW ในราคาสุดพิเศษลดสูงสุด 30% ฟรี Upgrade ฟรี Top Up ฟรีของที่ระลึก กิจกรรม Flash Sale พร้อมลุ้นรับของรางวัลใหญ่ที่ขนมาให้คุณได้ลุ้นทุกวัน 17–19 มกราคมนี้ ณ ลานโปรโมชั่นชั้น 1 ศูนย์การค้าเซ็นทรัลหาดใหญ่ เที่ยวใต้ เที่ยวง่าย เที่ยวได้ทุกวัน
งานกาชาดจังหวัดพังงาประจำปี 2568 นที่ 17-26 มกราคม 2568
"งานกาชาดจังหวัดพังงาประจำปี 2568" วันที่ 17-26 มกราคม 2568 น ณ บริเวณศูนย์ราชการจังหวัดพังงา (ศาลากลางหลังใหม่) มาเที่ยวช้อปและสนุกไปกับอุโมงค์ไฟยักษ์และชมบอลลูนนอกจากนี้ยังมีคอนเสิร์ตจากศิลปินมากมาย
งานเทศกาลแสดงศิลปะและการแสดงร่วมสมัย Phang-nga International Art Night วันที่ 17-29 มกราคม 2568
งานเทศกาลแสดงศิลปะและการแสดงร่วมสมัย Phang-nga International Art Night วันที่ 17-29 มกราคม 2568 ที่บริเวณศูนย์ราชการจังหวัดพังงา
จังหวัดพังงาโดยสำนักงานท่องเที่ยวและกีฬาจังหวัดพังงา ได้จัดงานขึ้นด้วยเล็งเห็นถึงจุดเด่นและศักยภาพทางศิลปะ วัฒนธรรม ประเพณี วิถีท้องถิ่น ที่สามารถส่งเสริมอัตลักษณ์ของจังหวัดพังงาได้โดดเด่น สามารถสร้างสรรค์งานศิลปะที่มีความสวยงามลงตัว โดยการรังสรรค์ร่วมกันระหว่างศิลปินในท้องถิ่น และคนพื้นถิ่น กับศิลปินทั้งประเทศไทย และศิลปินต่างชาติ มาร่วมรังสรรค์ผลงานในงานเทศกาลแสดงศิลปะและการแสดงร่วมสมัย Phang-nga International Art Night ในครั้งนี้ เพื่อดึงดูดนักท่องเที่ยวกระตุ้นเศรษฐกิจ สร้างมูลค่าการท่องเที่ยวให้สูงขึ้น กระตุ้นตลาดการท่องเที่ยวผ่านกิจกรรมการท่องเที่ยวเชิงศิลปะที่หลากหลาย ทำให้จังหวัดฟังงาเป็นจุดหมายปลายทาง (Destination) ของนักท่องเทียวทั่วโลกในการมาท่องเที่ยว กิจกรรมไฮไลท์สุดพิเศษภายในงาน คือ การแสดง แสง สี ฉายไปบนตัวอาคารศาลากลางจังหวัดพังงา การแสดงศิลปวัฒนธรรม การแสดงร่วมสมัย กิจกรรม Work Shop ด้านศิลปะแขนงต่างๆ รวมไปถึงการประดับไฟตกแต่งบริเวณงาน มีขบวนพาเหรดที่ประกอบด้วย มาสคอต แฟนชี รวมทั้งการแต่งกายที่แสดงถึงอัตลักษณ์ของจังหวัดพังงาและสื่อความหมายถึงการเป็นเมืองแห่งศิลปะและเมืองแห่งความผาสุก แห่รอบบริเวณงาน นอกจากนี้ยังมีการแสดงจากศิลปินนักร้องทุกๆคืน และกิจกรรมสุดพิเศษภายในงานอีกมากมาย
กิจกรรม "Maehongson Scenic Route 4088 Moto Camp" 2025 วันที่ 17-19 มกราคม 2568
กิจกรรม "Maehongson Scenic Route 4088 Moto Camp" 2025 ในวันที่ 17-19 มกราคม 2568 เดินทางท่องเที่ยวแบบคาราวาน มอเตอร์ไซด์ ครบ 7 อำเภอ สบเมย แม่สะเรียง แม่ลาน้อย ขุนยวม เมืองแม่ฮ่องสอน ปางมะผ้า ปาย ขับขี่ปลอดภัย ????️ ไปแบบชิวชิว ชมวิวสวยบนเส้นทาง Scenic Route แห่งเดียวในประเทศไทย ที่ทอดยาวครบ 7 อำเภอ ที่ได้รับการขนานนามว่า "เส้นทางมังกร [Dragon Route]"
พร้อมกิจกรรมแคมปิ้ง ท่ามกลางลมหนาว และดาวเดือน สนุกสนานกับวงดนตรีภูผาชน ณ เนเจอร์ วัลเล่ย์ แคมป์ อ.ปางมะผ้า จ.แม่ฮ่องสอน ท่องเที่ยววิถีชุมชน บ้านผาบ่อง ถ้ำปลา ถ้ำลอด บ้านแพมบก รับฟรี อาหาร 3 มื้อ, เสื้อยืด เสื้อที่ระลึก 1 ตัว และใบประกาศผู้พิชิต เส้นทางมังกร 4,088 โค้ง รับเฉพาะมอเตอร์ไซด์เท่านั้น สมัครด่วน จำนวนจำกัด 200 คนเท่านั้น เพียงคน ละ 500 บาท
งาน " หนาวนี้ ... กระซิบรัก ... ที่น่าน ปีที่ 12+ 1 วันที่ 17 - 19 มกราคม 2568
เชิญเลือก ช๊อป แชะ แชร์ ผลิตภัณฑ์ OTOP ในงาน " หนาวนี้ ... กระซิบรัก ... ที่น่าน ปีที่ 12+ 1 พบกับ กิจกรรมแสดงและจำหน่ายสินค้า กิจกรรมเดินแบบชุดผ้าทอฯ และ เครื่องเงินจังหวัดน่าน และอื่นๆอีกมากมาย ระหว่างวันที่ 17 - 19 มกราคม 2568 ณ บริเวณข่วงเมืองน่าน (ข่วงน้อย) ด้านข้างศูนย์บริการนักท่องเที่ยวเทศบาลเมืองน่าน สอบถามข้อมูลเพิ่มเติม โทร 054-710234 ต่อ 132,133 งานประชาสัมพันธ์ ฝ่ายอำนวยการ สำนักปลัดเทศบาล เทศบาลเมืองน่าน โทร 0 54710 234 ต่อ 110,119
งานอนุสรณ์ดอนเจดีย์ สุพรรณบุรี ประจำปี 2568 วันที่ 18 ม.ค.-1 ก.พ. 2568
งานอนุสรณ์ดอนเจดีย์ และงานกาชาดจังหวัดสุพรรณบุรี ประจำปี 2568 ชมการแสดงแสงสีเสียงสงครามยุทธหัตถี ในระหว่างวันที่ 18 มกราคม - 1 กุมภาพันธ์ 2568 ณ บริเวณพระบรมราชานุสรณ์ดอนเจดีย์ อำเภอดอนเจดีย์ จังหวัดสุพรรณบุรี
ชมการต่อสู้บนหลังช้างสมจริงช้างชนช้าง การแสดง แสง สี เสียง ที่ยิ่งใหญ่ในศึกยุทธหัตถี....โดยทำการแสดงรวม 10 วัน ๆ ละ 1 รอบ โดยเริ่มแสดงตั้งแต่เวลา 19.30 - 21.00 น. ทุกรอบ รอบการแสดงยุทธหัตถี ได้แก่ วันที่ 17 ซ้อมใหญ่, 18, 19, 23, 24, 25, 26, 29, 30, 31 มกราคม และ 1 กุมภาพันธ์ 2568 / ราคา 100 บ. ทุกที่นั่ง
นอกจากนี้ยังมีการแสดงเวทีกลาง การแสดงโชว์ศิลปวัฒนธรรม การแสดงประชันแตรวง การดนตรี sc.band การแสดงดนตรีจากโรงเรียนบรรหาร-แจ่มใส วิทยา 1 การแสดงดนตรีกองทัพบก การแสดงดนตรีเพื่อชีวิตวงเลิศดวงเลิศคันไถ การแสดงโขนจากสมาคมศิลปะเพื่อเยาวชน กรมส่งเสริมวัฒนธรรมกระทรวงวัฒนธรรม การแสดงชาติพันธุชาติพันธุ์ไทยพวน บางปลาม้า ไทยพื้นถิ่นตำบลรั่วใหญ่ และลาวเวียงบ้านดอนดา การแสดงดนตรีไทยจากนักเรียนโรงเรียนสุพรรณบุรีปัญญานุกูล การแสดงเพลงอีแซวของวิทยาลัยพยาบาลบรมราชชนนี และโรงเรียนวัดบ้านกรวด การแสดงเพลงทรงเครื่อง เรื่องแก้วหน้าม้า ตอนถวายลูก การแสดงดนตรีไทย จากบ้านดนตรีไทย by ครูเอียด การแสดงดนตรีคอนเสิร์ตจากศิลปินชื่อดัง การออกร้านจำหน่ายสินค้าต่างๆ มากมาย
ติดต่อ-สอบถามรายละเอียดได้ที่ สำนักงานมูลนิธิพระบรมราชานุสรณ์ดอนเจดีย์ 035-535377 สำนักงานจังหวัดสุพรรณบุรี โทร. 035-535106 ที่ทำการปกครองจังหวัดสุพรรณบุรี โทร 035-536022
ประกวดแมว Thailand Grand Cat Show 2025 @Korat
ประกวดแมว Thailand Grand Cat Show 2025 @Korat ประกวด วันเสาร์ที่ 18 มกราคม 2568 ณ อาคารสุรพัฒน์ 2 มหาวิทยาลัยเทคโนโลยีสุรนารี ประเภทการประกวด 1. ประกวดแมวไทยพันธุ์แท้ 5 สายพันธุ์ 2. ประกวดแมว สายพันธุ์ต่างประเทศ 3. ประกวดแมวแสนรัก : เป็นแมวพันธุ์ทางหรือแมวผสมข้ามสายพันธุ์ที่ขึ้นทะเบียนไม่ได้ หรือแมวพันธุ์แท้ที่มีปัญหาความบกพร่องของโครงสร้าง
สสส. จอมบึงมาราธอน ครั้งที่ 38 วันที่ 18 - 19 มกราคม 2568
"สสส. จอมบึงมาราธอน ครั้งที่ 38" งานวิ่งมาตรฐานสากล Association of International Marathons and Distance Races (AIMS) หรือ สมาคมมาราธอนและการแข่งขันระยะไกลนานาชาติ วันที่ 18 - 19 มกราคม 2568 ณ มหาวิทยาลัยราชภัฏหมู่บ้านจอมบึง อ.จอมบึง จ.ราชบุรี
เทศกาลเที่ยวนฤบดินทรฯ กินปลาชมเขื่อน ครั้งที่ 1 วันที่ 18-19 ม.ค. 68
เทศกาลเที่ยวนฤบดินทรฯ กินปลาชมเขื่อน ครั้งที่ 1 วันที่ 18 - 19 ม.ค. 68 เวลา 10.00 น. - 22.00 น. อ่างเก็บน้ำนฤบดินทรจินดา อ.นาดี จ.ปราจีนบุรี กิจกรรมภายในงาน-บูธจำหน่ายอาหารและผลิตภัณฑ์ปลา-เมนูปลาหายากจากเขื่อนฯ ตามฤดูกาล จาก 12 หมู่บ้าน-แข่งขันตกปลา-วงดนตรีสุดชิล-กิจกรรมเดินป่า เช้าวันที่ 19 ม.ค.68-ล่องเรือชมเขื่อน-แคมป์ปิ้ง กินปลาธรรมชาติ ชมวิวสวย คลอเสียงเพลง ต้องมาเที่ยวงานนี้เท่านั้น
ดนตรีในสวนจันทบุรี สวน SONG สุข ณ สวนสาธารณะทุ่งนาเชย
มารื่นเริงบันเทิงใจท่ามกลางร่มไม้ใหญ่ในสวน
กับกิจกรรม “สวน SONG สุข”
ณ สวนสาธารณะทุ่งนาเชย (ฝั่งถนนข้าวทิพย์)
ตั้งแต่เวลา 16:00 น. - 18:00 น.
สุขได้ทุกที่ทุกวัน…เมืองจันท์ที่ฉันรัก
งานสักการะสมเด็จพระนเรศวรมหาราช กาชาดจังหวัดหนองบัวลำภู ปี 2568 ระหว่างวันที่ 18-27 ม.ค. 2568
ขอเชิญเที่ยวงานสักการะสมเด็จพระนเรศวรมหาราช กาชาดจังหวัดหนองบัวลำภู ปี 2568 ระหว่างวันที่ 18-27 ม.ค. 2568 ณ บริเวณสนามสมเด็จพระนเรศวรมหาราช จังหวัดหนองบัวลำภู สักการะศาลสมเด็จพระนเรศวรมหาราช ชมบขวนแห่และพิธีบวงสรวงของกลุ่มสตรีหนองบัว 2,500 คน นิทรรศการ และ การออกร้านจำหน่ายผลิตภัณฑ์สินค้าพื้นเมือง หนึ่งตำบล หนึ่งผลิตภัณฑ์ ชมการประกวดสาวงามหนองบัวลำภู ประกวดร้องเพลง กำนัน ผู้ใหญ่บ้าน และ ผู้นำชุมชน สวนสนุกชุดใหญ่ หมอลำ ดนตรี คอนเสิร์ต
ทุ่งเฉลิมสุขคราฟท์ #1 วันเสาร์ที่ 18 มกราคม 2568
“ทุ่งเฉลิมสุขคราฟท์ #1“ วันเสาร์ที่ 18 มกราคม 2568 เวลา 09.00 น. เป็นต้นไป ถ.คูหาประเวศน์ ซ.1 ต.พิมาน อ.เมืองสตูล จ.สตูล เด็กๆสนุกได้ ผู้ใหญ่สนุกดี กิจกรรมดีๆ ที่ ”ทุ่งเฉลิมสุข“ มีกิจกรรมมากมายภายในงาน market : music : food art workshop : coffee workshop : bicycle
Khun Wang Cross-Country Run 2025 วันอาทิตย์ที่ 19 มกราคม 2568 ณ อำเภอแม่วาง จังหวัดเชียงใหม่
กิจกรรม เดิน วิ่ง ปั่น บางคล้ารวมใจ WALK RUN BIKE ช่วยกิ่งกาชาด วันอาทิตย์ที่ 19 มกราคม 2568
กิ่งกาชาดอำเภอบางคล้า ขอเชิญเข้าร่วมกิจกรรม เดิน วิ่ง ปั่น บางคล้ารวมใจ WALK RUN BIKE ช่วยกิ่งกาชาด ในวันอาทิตย์ที่ 19 มกราคม 2568 ณ ลานหน้าที่ว่าการอำเภอบางคล้า อำเภอบางคล้า จังหวัดฉะเชิงเทรา ติดต่อสอบถามได้ที่ 0957427222 รายได้จากการจัดกิจกรรม สนับสนุนภารกิจกิ่งกาชาดอำเภอบางคล้า เดิน-วิ่ง-ปั่น ร่วมทำบุญ ช่วยกิ่งกาชาดอำเภอบางคล้า
งานมหกรรมอาหารจานเด็ด ประจำปี 2568 ระหว่างวันที่ 19 – 25 มกราคม 2568
เทศบาลเมืองสตูล เชิญชวนร่วมงานมหกรรมอาหารจานเด็ด ประจำปี 2568 ระหว่างวันที่ 19 – 25 มกราคม 2568 ส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจในพื้นที่ เพื่อให้ผู้บริโภคได้บริโภคอาหารที่สะอาด รสชาติอร่อย และมีคุณค่าตามหลักโภชนาการ ส่งเสริมให้สถานประกอบการร้านอาหารมีมาตรฐานมากขึ้นและถูกหลักสุขาภิบาลอาหาร รวมทั้งส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจในพื้นที่ ตลอดจนเผยแพร่ศิลปะ วัฒนธรรม ประเพณีที่ดีงาม และเอกลักษณ์ที่สำคัญของท้องถิ่น ให้เป็นที่รู้จักอย่างแพร่หลาย
ภายในงานฯ มีการออกร้านจำหน่ายสินค้า บูธอาหารเมนูขึ้นชื่อของจังหวัดสตูล , , ร่วมสนุกกับกิจกรรมร้านเด็ด ร้านดังเมืองสตูล , ชมการแสดงจากนักเรียนในสังกัดเทศบาลเมืองสตูล และศิลปินนักร้องชื่อดังเพื่อสร้างความบันเทิงในทุกค่ำคืน ดังนี้ วันที่ 19 มกราคม 2568 วงเนคไท , วันที่ 20 มกราคม 2568 กานดา อาร์สยาม , วันที่ 21 มกราคม 2568 วงโกปี้ , วันที่ 22 มกราคม 2568 บ.เบิ้ล 300 , วันที่ 23 มกราคม 2568 ทราย ศิวาพร และวงเพ้อ , วันที่ 24 มกราคม 2568 วงพัทลุง และวันที่ 25 มกราคม 2568 ชมการประกวดธิดาอาหารจานเด็ด จึงขอเชิญชวนชาวสตูล นักท่องเที่ยว และผู้ที่สนใจ เข้าร่วมงานฯ ระหว่างวันที่ 19 – 25 มกราคม 2568 ณ ถนนราษฎร์อุทิศ (ถนนบายพาสเลี่ยงเมือง ช่วงสี่แยกโรงเรียนจงหัว) ตำบลพิมาน อำเภอเมือง จังหวัดสตูล
ย้อนรอยเล่าขานตำนานเมืองแพรกศรีราชา ถิ่นวีรชนขุนสรรค์ วีรบุรุษแห่งลุ่มแม่น้ำน้อย 20 - 21 มกราคม 2568
ย้อนรอยเล่าขานตำนานเมืองแพรกศรีราชา ถิ่นวีรชนขุนสรรค์ วีรบุรุษแห่งลุ่มแม่น้ำน้อย การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานลพบุรี เชิญร่วมงาน “ย้อนรอยเล่าขานตำนานเมืองแพรกศรีราชา ถิ่นวีรชนขุนสรรค์ วีรบุรุษแห่งลุ่มแม่น้ำน้อย” ระหว่างวันที่ 20 - 21 มกราคม 2568 ตั้งแต่เวลา 15.00 - 22.00 น. ณ บริเวณสนามหน้าที่ว่าการอำเภอสรรคบุรี จังหวัดชัยนาท
ภายในงานพบกับ
- การแสดง แสง สี เสียง ชุด “ขุนสรรค์ชำนาญยุทธ วีรบุรุษแห่งลุ่มแม่น้ำน้อย” สุดยิ่งใหญ่ตระการตา นำแสดงโดย
- การแสดงเฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว รัชกาลที่ 10
- การแสดงดนตรีไทย
- การแสดงเทิดวีรกรรมขุนสรรค์ ศิลปะวัฒนธรรรมท้องถิ่น
- การแสดงดนตรี
- ชม ชิม ช้อป สินค้าชุมชนวิถีเมืองแพรกศรีราชา ชมฟรีตลอดงาน!
เทศกาลงาน “ทรงเพชร...สิว้าว” อาหาร ดนตรี วิถีชุมชน วันที่ 20 - 22 ม.ค. 2568
การท่องเที่ยวแห่งประเทศไทย (ททท.) ร่วมกับ เทศบาลตำบลบ้านลาด และสภาวัฒนธรรมอำเภอบ้านลาด เทศกาลงาน “ทรงเพชร...สิว้าว” อาหาร ดนตรี วิถีชุมชน วันที่ 20 - 22 ม.ค. 2568 ตั้งแต่ 17.00 น.เป็นต้นไป ณ ทุ่งนาขนอน สะพานเทศบาล 9 อ.บ้านลาด จ.เพชรบุรี ชมฟรีตลอดงาน
เฟสติวัลเมืองเพชรสุดยิ่งใหญ่ มาดูให้เห็นกับตา ว่าทรงไหนจะว้าว!!! เท่า “ทรงเพชร” สัมผัสบรรยากาศแห่งความสุข และกิจกรรมสุดจึ้ง เปิดสนามประลองความเร็วสุดระทึกกับ “มหกรรมวัวลานหยุดโลก” พาย้อนยุค “นั่งวัวเทียมเกวียน” ถ่ายภาพสวยๆ เก็บภาพความประทับใจกับแลนด์มาร์ก จุดถ่ายรูปกับหุ่นฟางวัวลาน และไฟประดับระยิบระยับ จับจ่ายสนุก อุดหนุนชุมชน กับร้านค้าวินเทจ “ตลาดทรงเพชร” “ตลาดสุขใจ” “ร้านค้าชุมชน” “ร้านของดีประจำตำบล … การแสดงดนตรีจากศิลปินรับเชิญ 20 ม.ค. วงฟูล (Full) และ วงฮอลิเดย์ 21 ม.ค. วงคาราบาว และ วงปากอง 22 ม.ค. บ่าววี และ ไม้ซุงแบรนด์
โปรแกรมภาพยนตร์ วันที่ 21-26 มกราคม 2568
โปรแกรมภาพยนตร์สัปดาห์นี้ วันที่ 21-26 มกราคม 2568 ที่หอภาพยนตร์
งานนมัสการหลวงพ่อเพชร และสมโภชเมืองพิจิตร วันที่ 21 มกราคม 2568
งานนมัสการหลวงพ่อเพชร และสมโภชเมืองพิจิตร วันที่ 21-31 มกราคม 2568 ณ วัดท่าหลวง พระอารามหลวง จังหวัดพิจิตร
งานเทศกาลตรุษจีน จากจีนสู่ไทยสุขใจในแผ่นดินน่าน “China Town of Nan” 2568 ระหว่างวันที่ 21 – 29 มกราคม 2568
เทศบาลเมืองน่าน ขอเชิญเที่ยวงานเทศกาลตรุษจีน จากจีนสู่ไทยสุขใจในแผ่นดินน่าน “China Town of Nan” 2568 ระหว่างวันที่ 21 – 29 มกราคม 2568 ณ ศาลเจ้าปึงเถ่ากง น่าน
เทศบาลเมืองน่าน ร่วมกับ สำนักงานวัฒนธรรมจังหวัดน่าน การท่องเที่ยวแห่งประเทศไทย สำนักงานน่าน การไฟฟ้าฝ่ายผลิตแห่งประเทศไทย ศาลเจ้าปึงเถ่ากง น่าน ชุมชนหัวเวียงใต้ และ ภาคีเครือข่ายภาครัฐ เอกชน กำหนดจัดงานงานเทศกาลตรุษจีน จากจีนสู่ไทยสุขใจในแผ่นดินน่าน “China Town of Nan” 2568 ระหว่างวันที่ 21 – 29 มกราคม 2568 ณ ศาลเจ้าปึงเถ่ากง น่าน และถนนสุมนเทวราช (บริเวณหน้าศาลเจ้าปึงเถ่ากง น่าน) โดยจะมีการจัดแถลงข่าวในวันที่ 21 ม.ค.2567 เวลา 18.00 น. และพิธีเปิดงาน ในวันที่ 23 ม.ค.2568 เวลา 18.00 น. ตลอดช่วงเทศกาลมีกิจกรรมที่น่าสนใจอาทิ จำหน่ายอาหารและสินค้าถนนคนเดิน ของฝากของที่ระลึก การประดับโคมไฟ ประกวดภาพถ่าย จุดถ่ายภาพ Check in ชมการแสดงทางวัฒนธรรม เซียมซีเสี่ยงทาย เชิดสิงโต การแสดงแสงสีเสียง ไทเก็ก เขียนคำอวยพรพู่กันจีนและกิจกรรมอื่นๆอีกมากมาย สอบถามข้อมูลเพิ่มเติม โทร 054-710234 ต่อ 132,133 งานประชาสัมพันธ์ ฝ่ายอำนวยการ สำนักปลัดเทศบาล เทศบาลเมืองน่าน โทร 0 54710 234 ต่อ 110,119
งานประเพณี บุญกุ้มข้าวใหญ่ ของดี อำเภอประทาย วันที่ 22-28 มกราคม 2568
ขอเชิญเที่ยวงานประเพณี บุญกุ้มข้าวใหญ่ ของดี อำเภอประทาย วันที่ 22-28 มกราคม 2568 สนามหน้าที่ว่าการอำเภอประทาย นครราชสีมา ร่วมพิธีสู่ขวัญและบูชาพระแม่โพสพ นิทรรศการส่วนราชการต่างๆ สินค้าของดีอำเภอประทาย สินค้าโอท็อป ของกินของใช้ สวนสนุกชุดใหญ่
มหกรรมสุขภาพผู้สูงอายุ ครั้งที่ 5 วันที่ 22-24 มกราคม2568
การประชุมวิชาการด้านเวชศาสตร์ผู้สูงอายุและวิทยาการผู้สูงวัย มหกรรมสุขภาพผู้สูงอายุ ครั้งที่ 5 “The 5th Thailand Elderly Health Service Forum 2025” 22-24 มกราคม2568 ที่ อาคารอิมแพคฟอรั่ม เมืองทองธานี จังหวัดนนทบุรี จัดขึ้นเพื่อร่วมกันเน้นย้ำจุดมุ่งหมาย ตลอดจนปูทางให้ทุกภาคส่วน ทั้งภาครัฐ ภาคเอกชน ท้องถิ่น และภาคประชาสังคม ร่วมมือร่วมใจกันพัฒนาองค์ความรู้และวิทยาการต่างๆ ที่เกี่ยวข้องกับผู้สูงอายุให้กับบุคลากรทุกสาขาวิชาชีพ ชุมชน ครอบครัว และตัวผู้สูงอายุเอง ได้มีภูมิคุ้มกันในการก้าวสู่สังคมสูงอายุได้อย่างมีคุณภาพ โดยมีมีวิทยากรผู้ทรงคุณวุฒิทั้งในประเทศและต่างประเทศร่วมให้ความรู้กว่า 100 ท่าน และยังมีการจัดนิทรรศการด้านวิชาการและการให้บริการประชาชนจากองค์กรทั้งในและนอกกระทรวงสาธารณสุข และหน่วยงานอื่นๆ ที่เกี่ยวข้อง ครอบคลุมทุกมิติ กว่า 40 องค์กรประเพณีแห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ 109 ปี วันที่ 22 มกราคม ถึง 2 กุมภาพันธ์ 2568
ประเพณีประจำปีระดับประเทศ แห่เจ้าพ่อ-เจ้าแม่ปากน้ำโพ "109 ปี สืบสานประเพณีวิถีแห่งศรัทธา" จ.นครสวรรค์ ระหว่างวันที่ 22 มกราคม ถึง 2 กุมภาพันธ์ 2568
แห่กลางคืน (ชิวซา) 31 มกราคม 2568 ชมขบวนแห่แสง สี เสียง ในรูปแบบ Wonder Festival Night Parade ตั้งแต่เวลา 18.00-22.00 น.
แห่กลางวัน (ชิวสี่) 1 กุมภาพันธ์ 2568 ขบวนแห่จะเริ่มตั้งแต่หน้าอุทยานสวรรค์ ตั้งแต่เวลา 05.00 น. แล้วเริ่มออกแห่รอบตลาดปากน้ำโพ ในเวลา 07.00 น. เป็นต้นไป
ตรุษจีนหนองคาย 2568 - 22-26 มกราคม 2568
ร่วมสัมผัสบรรยากาศ ตรุษจีนหนองคาย 2568 ตรุษจีนสุดตระการตา พร้อมความบันเทิงแบบจัดเต็ม! 5 วันมหามงคล 22-26 มกราคม 2568 ตั้งแต่เวลา 17.00-22.00 น. สถานที่จัดงาน : เต็กก่า จีไน้เกาะ (ข้างวัดลำดวน)
ไฮไลท์ความพิเศษที่คุณห้ามพลาด ดังนี้ พบกับ "ก้อง สหรัถ" ในคอนเสิร์ตสุดพิเศษ เครื่องเล่นเป่าลมยักษ์ที่ใหญ่ที่สุดในไทย ตลาด 4 วัฒนธรรม สุดยิ่งใหญ่ ร้านอาหารชื่อดังจาก Fin Market และร้านดังเมืองหนองคายกว่า 100 ร้าน ลุ้นโชคกับกิจกรรม "ขุมทรัพย์ไข่มังกร"
งาน สืบสาน วัฒนธรรม ประเพณี อำเภอบ้านหลวง ประจำปี 2568 วันที่ 22-27 มกราคม 2568
อำเภอบ้านหลวงขอเชิญเที่ยวงาน สืบสาน วัฒนธรรม ประเพณี อำเภอบ้านหลวง ประจำปี 2568 ระหว่างวันที่ 22 มกราคม ถึง 27 มกราคม 2568 ณ สนามหน้าที่ว่าการอำเภอบ้านหลวง อ.บ้านหลวง จ.น่าน ร่วมพิธีเปิด วันที่22 มกราคม 2568 เวลา 16.00 น. เป็นต้นไป พบกับกิจกรรมต่างๆ มากมายในงาน เช่น - กิจกรรมประกวดร้องเพลงและหางเครื่อง - ธิดาบ้านหลวง - นางงามมะขามเกิ้ม - ตลาดประชารัฐ - การประกวดสินค้าทางการเกษตร และกิจกรรมอื่น ๆ อีกมากมาย
Chiangmai Coffee Week 2025 วันที่ 23 - 26 มกราคม 2568
Chiangmai Coffee Week 2025 วันที่ 23 - 26 มกราคม 2568 ณ จริงใจมาร์เก็ตเชียงใหม่ งานกาแฟที่ยิ่งใหญ่ที่สุดในเชียงใหม่! ร่วมเป็นส่วนหนึ่งในการรักษ์โลก และเป็นมิตรต่อสิ่งแวดล้อม กับอีเว้นท์สายกรีนนี้ BETTER CUP for a BETTER DAY / Coffee : ผลิตภัณฑ์กาแฟ เครื่องดื่มและเมล็ดกาแฟ / Tea : ผลิตภัณฑ์จากชา ไร่ชา และเครื่องดื่มชา / Cocoa : ผลิตภัณฑ์คราฟโกโก้ ช็อกโกแลตจากทั่วประเทศ / Bakery : เบเกอรี่ ขนมปัง คู่หูทุกเครื่องดื่ม พร้อมเอาใจสายหวาน / Equipment : อุปกรณ์และงานคราฟที่เกี่ยวข้องกับชา กาแฟ โกโก้ / Food & Snack : อาหารและอาหารทานเล่น การแข่งขัน Latte Art ครั้งที่ 7 และ Free Style Slow Bar Talk แลกเปลี่ยนความรู้กับเหล่าผู้เชี่ยวชาญในวงการ Workshop ลงมือทำจริงจากผู้เชี่ยวชาญ ที่จริงใจมาร์เก็ตเชียงใหม่ วันที่ 23 - 24 มกราคม 2568 เวลา 09:00 - 21:00 น. วันที่ 25 - 26 มกราคม 2568 เวลา 06:30 - 21:00 น. Hua Hin Grand Inter Pride 2025 จดทะเบียนคู่รัก LGBTQIAN+ 23 มกราคม 2568
หัวหิน บันทึกประวัติศาสตร์
“Hua Hin Grand Inter Pride 2025”
เฉลิมฉลองกฎหมายสมรสเท่าเทียม พร้อมจดทะเบียนสมรส LGBTQIAN+
และรับแพ็กเกจฮันนีมูนสุดโรแมนติก 23 ม.ค.นี้
จังหวัดประจวบคีรีขันธ์ โดย อำเภอหัวหิน ร่วมกับ บลูพอร์ต หัวหิน พร้อมพันธมิตรภาครัฐและภาคเอกชน อาทิ การท่องเที่ยวแห่งประเทศไทยสำนักงานประจวบคีรีขันธ์ เทศบาลเมืองหัวหิน สมาคมธุรกิจการท่องเที่ยวหัวหิน - ชะอำ เชิญชวนประชาชนร่วมบันทึกประวัติศาสตร์ของการเดินทางของความเชื่อในความหลากหลายทางเพศ และนับถอยหลังสู่การบังคับใช้พระราชบัญญัติ (พ.ร.บ.) แก้ไขเพิ่มเติม ประมวลกฎหมายแพ่งและพาณิชย์ (ฉบับที่ 24) พ.ศ. 2567 หรือที่รู้จักในชื่อของกฎหมายสมรสเท่าเทียม ด้วยการประกาศความพร้อมจดทะเบียนสมรสสำหรับคู่รัก LGBTQIAN+ ภายใต้ชื่องาน “Hua Hin Grand Inter Pride 2025”
โดยจะจัดขึ้นในวันที่ 23 มกราคม 2568 ณ หัวหิน คอนเวนชั่นเซ็นเตอร์ ชั้น 1 บลูพอร์ต หัวหิน เป็นครั้งแรก
งาน มหกรรมพันธุกรรม ครั้งที่ 25 Seed for future : คนรุ่นใหม่ เมล็ดพันธุ์แห่งอนาคตการเกษตร
ขอเชิญเที่ยวงาน มหกรรมพันธุกรรม ครั้งที่ 25 การคุ้มครองพันธุ์พืชท้องถิ่น โดยชุมชนและองค์กรท้องถิ่น “Seed for future : คนรุ่นใหม่ เมล็ดพันธุ์แห่งอนาคตการเกษตร” วันที่ 23-24 มกราคม 2568 ณ ศาลากลางจังหวัดยโสธร ถ.แจ้งสนิท อ.เมือง ยโสธร
งานวันเกษตรภาคอีสาน ประจำปี 2568 ม.ขอนแก่น วันที่ 24 มกราคม – 2 กุมภาพันธ์ 2568
งานวันเกษตรภาคอีสาน 2568 ESAN Agricultural Fair 2025 ระหว่างวันที่ 24 มกราคม – 2 กุมภาพันธ์ 2568 ณ อุทยานเทคโนโลยีการเกษตร มหาวิทยาลัยขอนแก่น
SUNFLOWER Bike Rally Together@Saraburi 30 KM 24-25 ม.ค.68
SUNFLOWER Bike Rally Together@Saraburi 30 KM ณ ลานหลวงปู่ใหญ่ป่าสัก พระพุทธรัตนมณีมหาบพิตรชลสิทธิ์มงคลชัย(สระบุรี) โครงการ การจัดกิจกรรมกระตุ้นการท่องเที่ยวกลุ่มจังหวัดภาคกลางตอนบนผ่านกิจกรรมท่องเที่ยวเชิงกีฬา (Sport Tourism For Upper Central Provincial) . สมัครฟรีม่มีค่าใช้จ่าย จำกัด 500 Slots . นักปั่นที่ลงทะเบียนในลำดับที่กำหนดจะได้รับ BIB / เสื้อ / อาหาร&เครื่องดื่ม (ผู้ที่เข้าเส้นชัย 100 คนแรก ได้รับเหรียญรางวัลและตุ๊กตาที่ระลึก) Race Pack : วันศุกร์ที่ 24 ม.ค.68 Race Day : วันเสาร์ที่ 25 ม.ค. 68
งานมหัศจรรย์นวด-สมุนไพรไทย ใส่ใจสุขภาพ 24-26 มกราคม 2568
มาบำบัดกาย ผ่อนคลายจิตใจ ในอ้อมกอดธรรมชาติ ครั้งแรกในจังหวัดสระแก้ว! งานมหัศจรรย์นวด-สมุนไพรไทย ใส่ใจสุขภาพ 24-26 มกราคม 2568 บ้านทับทิมสยาม05 อ.คลองหาด จ.สระแก้ว
25 ม.ค. 2568 เวลา 10.00 น. พิธีเปิดโดย นายสรวงศ์ เทียนทอง รัฐมนตรีว่าการกระทรวงการท่องเที่ยวและกีฬา
กิจกรรมไฮไลต์ 1️⃣ โซนบริการสุขภาพ รวมพลหมอนวดมือดีของสระแก้ว บริการตรวจ-รักษา-จ่ายยาสมุนไพร ด้วยแพทย์แผนไทย-แพทย์ทางเลือก พอกเข่า, ตอกเส้น, ฝังเข็ม, ครอบแก้ว และอีกมากมาย 2️⃣ โซนนิทรรศการ ประวัติแพทย์แผนไทยและเมืองสมุนไพรสระแก้ว การดูแลผู้ป่วยแบบบูรณาการด้วยการแพทย์แผนไทย แหล่งท่องเที่ยวเชิงสุขภาพ ศูนย์เวลเนสสระแก้ว 3️⃣ โซนสินค้าและอาหาร เลือกซื้อสินค้าชุมชน ผลิตภัณฑ์สมุนไพร และสินค้าโอท็อป อร่อยกับอาหารพื้นบ้านและ Food Truck 4️⃣ โซนท่องเที่ยวชุมชน ชมแหล่งปลูกสมุนไพรอินทรีย์มาตรฐาน IFOAM กระบวนการแปรรูปสมุนไพร และไร่พุทรานมสด วิ่งออกกำลังกาย ยืดเหยียดฤาษีดัดตน และจิบชาสมุนไพร กิจกรรมพิเศษ สาธิตทำยาดมพิมเสน, ลูกประคบ สาธิตนวดตนเองแก้อาการออฟฟิศซินโดรม ฟังเสวนา “จากโรงพยาบาลถึงชุมชน” และ “จับมือ ก้าวไป เมืองสมุนไพรสระแก้ว” มิวสิคแคมป์กลางธรรมชาติ 24 ม.ค. พบกับ คลัง เดอะวอยซ์ 25 ม.ค. พบกับ วง Chanita
หลงเข้าสวน ชวนมารักษ์บางสะแก ครั้งที่ 3 วันที่ 24-26 มกราคม 2568
“หลงเข้าสวน ชวนมารักษ์บางสะแก ครั้งที่ 3” วันที่ 24-26 มกราคม 2568 ตั้งแต่เวลา 10.00 น. - 17.00 น. ณ
ศูนย์เรียนรู้เศรษฐกิจพอเพียงตำบลบางสะแก 1 ปี มี 1 ครั้ง กับงานท่องเที่ยวชุมชนในสวนส้มโองานเล็กๆของชุมชนที่อบอวลไปด้วยความสุข พบกับ ผลิตภัณฑ์ชุมชน ผลผลิตทางการเกษตร อาหารพื้นถิ่น ขนมพื้นบ้าน ของกิน ของฝาก พร้อมกิจกรรมต่างๆภายในงาน มาเที่ยว มาเดินเล่น มาฟังดนตรีกันเยอะๆนะคะ #จัดโดยวิสาหกิจชุมชนรักษ์บางสะแก
เทศกาลอาหาร Chiang Mai Food Festival 2025 วันที่ 24-26 มกราคม 2568
เทศกาลอาหารที่อบอุ่นที่สุดแห่งปี! Chiang Mai Food Festival 2025 ขอนำเสนอ HAPPY FOOD, HAPPY MOOD “คำสุข: อาหารดี ชีวิตมีสุข” วันที่ 24-26 มกราคม 2568 ศูนย์วัฒนธรรมเชียงใหม่ 10:00 - 22:00 น. นี่ไม่ใช่แค่เทศกาลอาหาร แต่คือการเฉลิมฉลองที่รวมเอา สุขภาพ ความสุข และวัฒนธรรม เข้าไว้ด้วยกัน! ค้นพบ รสชาติแห่งรากเหง้า เสวนาเรื่องอาหารการกินที่ส่งผลถึงความเป็นอยู่ที่ดี และนิทรรศการสูตรอาหารล้านนาที่หายไป ตลาดนัดชาติพันธุ์ ฯลฯ และร่วมลิ้มรสความหลากหลายทางวัฒนธรรมของเชียงใหม่ มาร่วมเปิดประสบการณ์อาหาร และการท่องเที่ยวเชิงสุขภาพ สาย healthy สาย wellness ไม่ควรพลาด
กิจกรรม “สันกำแปง ONSEN FESTIVAL ครั้งที่ 1” วันที่ 24 - 26 มกราคม 2568
HEALING YOURSELF กับกิจกรรม “สันกำแปง ONSEN FESTIVAL ครั้งที่ 1” ที่ “น้ำพุร้อน สันกำแพง” วันที่ 24 - 26 มกราคม 2568 ครั้งแรกกับการเปิดโลกท่องเที่ยวเชิงสุขภาพ HEALTH&WELLNESS สัมผัสความผ่อนคลายด้วยกิจกรรมที่หลากหลาย “REFRESH YOURSELF!” ท่ามกลางธรรมชาติและน้ำพุร้อนที่จะช่วยเยียวยาและฟื้นฟูสุขภาพกายใจของคุณ เต็มอิ่มกับการฟังดนตรี ชิมอาหารและเครื่องดื่มพื้นถิ่นเพื่อสุขภาพ ศาสตร์การนวดแผนไทย ศาสตร์แห่งความเย็นสุดฮิต ICE BATH เรียนรู้วิถีชีวิต, วัฒนธรรม และภูมิปัญญาท้องถิ่น สนับสนุนเศรษฐกิจชุมชน สร้างประสบการณ์สนุกๆ อย่างสร้างสรรค์ด้วยตัวคุณเอง มีกิจกรรม WORKSHOP ให้ลองลงมือทำจริง อาทิ อาหารและเครื่องดื่มเพื่อสุขภาพ, เบลนกาแฟ, ย้อนรอยตำนานช่างคนปั้นดิน
เกษตรและของดีเมืองอ่างทอง ขุนอินเกษตรแฟร์ 68 วันที่ 24 มกราคม - 2 กุมภาพันธ์ 2568
ชวนเที่ยวงาน เกษตรและของดีเมืองอ่างทอง ขุนอินเกษตรแฟร์ 68 ณ วัดขุนอินทประมูล อ.โพธิ์ทอง จ.อ่างทอง ระหว่างวันที่ 24 มกราคม - 2 กุมภาพันธ์ 2568
งานประเพณีบุญเบิกฟ้าและงานกาชาดจังหวัดมหาสารคาม ประจำปี 2568 วันที่ 24 มกราคม - 2 กุมภาพันธ์ 2568
จังหวัดมหาสารคามและสำนักงานเหล่ากาชาดจังหวัดมหาสารคาม ได้กำหนดการจัดงานประเพณีบุญเบิกฟ้าและงานกาชาดจังหวัดมหาสารคาม ประจำปี 2568 ระหว่างวันศุกร์ที่ 24 มกราคม 2568 ถึงวันอาทิตย์ที่ 2 กุมภาพันธ์ 2568 บริเวณหน้าที่ว่าการอำเภอเมืองมหาสารคาม จังหวัดมหาสารคาม รวม 10 วัน 10 คืน
เพื่อเป็นการอนุรักษ์ศิลปวัฒนธรรมและฟื้นฟูประเพณีพื้นบ้านของชาวอีสาน และส่งเสริมการท่องเที่ยวของจังหวัดมหาสารคามให้เป็นที่รู้จักอย่างแพร่หลาย โดยการจัดงานดังกล่าว กำหนดจัดเมื่อถึงวันขึ้น 3 ค่ำ เดือน 3 ของทุกปี ด้วยมีความเชื่อตั้งแต่โบราณสืบต่อกันมาว่า ฟ้าจะไขประตูฝนลงสู่โลกมนุษย์เป็นวันแรกของปี เป็นวันที่ชาวโลกมีความอิ่มเอม อุดมสมบูรณ์ และเป็นวันแรกที่เกษตรกรจะเริ่มบำรุงดินเพื่อทำการเพาะปลูกในฤดูกาลถัดไป ซึ่งในปี 2568 วันขึ้น 3 ค่ำ เดือน 3 ตรงกับวันศุกร์ที่ 31 มกราคม 2568
งานฉ่ำฟู้ดติวัล – Charm Foodtival 24 - 26 มกราคม 2568
งานฉ่ำฟู้ดติวัล – Charm Foodtival 24 - 26 มกราคม 2568 ณ หาดวาสุกรี ต.ตะลุบัน อ.สายบุรี จ.ปัตตานี
กิจกรรมไฮไลต์ที่ไม่ควรพลาด - ตลาดอาหารพื้นถิ่น - สาธิตทำอาหาร Chef Table โดยเชฟมืออาชีพ - การแข่งขันม้า - การแข่งขันยิงธนูเทรดดี้ - แข่งเรือยอกอง - ควงไฟ การแสดงสุดตื่นตาในยามค่ำคืน - มายากลและตัวตลก ความบันเทิงสำหรับทุกวัย - บอลลูนลอยฟ้าและกล่องสุ่มมหาสนุก - กิจกรรมแคมป์ปิ้งริมชายหาด - การแสดงพลุ ปิดท้ายค่ำคืนด้วยความสวยงามของดอกไม้ไฟ - อานาซีดและการแสดงดนตรีท้องถิ่น - กิจกรรมเล่าเรื่อง “ฉ่ำๆ” ถ่ายทอดวัฒนธรรมและความประทับใจของท้องถิ่น
งาน ประเพณีบุญเบิกฟ้าและงานกาชาด จังหวัดมหาสารคาม ประจำปี 2568 วันที่ 24 มกราคม - 2 กุมภาพันธ์ 2568
จังหวัดมหาสารคาม ขอเชิญเที่ยวงาน ประเพณีบุญเบิกฟ้า และ งานกาชาด จังหวัดมหาสารคาม ประจำปี 2568 วันที่ 24 มกราคม - 2 กุมภาพันธ์ 2568 ณ บริเวณสนามที่ว่าการอำเภอเมืองมหาสารคาม
งาน “สุขซุกศิลป์” Bangkhlang Art From Agriculture วันที่ 24 - 25 มกราคม 2568
ททท.สุโขทัย ขอเชิญเที่ยวงาน “สุขซุกศิลป์” "Bangkhlang Art From Agriculture" วันที่ 24 - 25 มกราคม 2568 เวลา 10.00 น. - 20.00 น. ณ บ้านศิลปะอุเทนลำไย บ้านนากลาง ต.เมืองบางขลัง อ.สวรรคโลก จ.สุโขทัย (
พิกัดสถานที่จัดงาน)
กิจกรรมภายในงาน:
1. ศิลปะจากพืชและดอกไม้: - Workshop ทำสีธรรมชาติจากพืช วาดภาพระบายสีบนกระดาษจากเยื่อไม้ จากกาบไผ่ -การจัดดอกไม้ศิลปะ
2. ศิลปะจากวัสดุธรรมชาติ: -สานตะกร้าจากไม้ไผ่หรือทางมะพร้าว -ประดิษฐ์ของตกแต่งจากฟางข้าว ใบไม้แห้ง และเปลือกผลไม้
3. งานปั้นและแกะสลัก: -ปั้นดินเหนียวจากแปลงนา -แกะสลักผักผลไม้เป็นลวดลายสร้างสรรค์
4. ดนตรีและการแสดงในสวน: -การแสดงดนตรีโฟล์คและดนตรีพื้นบ้าน -การแสดงศิลปะพื้นบ้านจากชุมชน
5. นิทรรศการศิลปะการเกษตร: จัดแสดงผลงานศิลปะจากธรรมชาติและผลงานของผู้เข้าร่วมงาน กิจกรรมพิเศษ : -การถ่ายภาพธรรมชาติพร้อมมุมจัดสวนศิลปะ -ตลาดมีเขียว ขายสินค้าทำมือและพืชผักอินทรีย์ -การแลกเปลี่ยนเมล็ดพันธุ์เพื่อความยั่งยืน
งานมหกรรมส้มสีทอง และของดีเมืองน่าน 2568 วันที่ 24-26 ม.ค. 2568


เชิญเที่ยวงานมหกรรมส้มสีทอง และของดีเมืองน่าน 2568 ระหว่างวันที่ 24-26 ม.ค. 2568 ชวนมาชิมส้มชมดนตรี และช้อปของดีเมืองน่าน อาทิ สินค้าเกษตรแปรรูป กาแฟน่าน เครื่องเงินน่าน ผ้าทอน่าน และสินค้า OTOP ยกมาทั้งจังหวัดน่าน ที่นี่ที่เดียว!!! ณ ลานรวมใจ ริมแม่น้ำน่าน เชิงสะพานพัฒนาภาคเหนือ อ.เมืองน่าน จังหวัดน่าน โดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดน่าน และชมรมผู้ประกอบการค้าอาหารจังหวัดน่าน • ขอเชิญเกษตรกรผู้ปลูกส้มสีทอง ส่งผลส้มสีทองเข้าร่วมการประกวด สุดยอดส้มสีทองจังหวัดน่าน ประเภทการประกวด 1. ส้มปลอดภัย 2. ส้มอินทรีย์ ชิงเงินรางวัลมูลค่ารวมกว่า 46,000 บาท พร้อมเกียรติบัตร ประกวดวันศุกร์ที่ 24 มกราคม 2568 • ขอเชิญผู้สนใจที่มีใจรักในการรังสรรค์อาหารสุดสร้างสรรค์ ร่วมแข่งขันเมนูจากส้มสีทองน่าน ทั้งอาหารคาวและหวาน ชิงเงินรางวัลมูลค่ารวมกว่า 20,000 บาท พร้อมโล่รางวัล และใบประกาศนียบัตร ทีมละ 3 คน ไม่จำกัดอายุและเพศ (รับจำนวนจำกัด) พร้อมเงินสนับสนุนค่าวัตถุดิบและค่าอุปกรณ์ ???? แข่งขันวันเสาร์ที่ 25 มกราคม 2568 ครบทุกความสุข สนุกไปกับกิจกรรมและความบันเทิง ลุ้นรับรางวัลมากมาย อย่าพลาดความพิเศษนี้ 3 วันเท่านั้น 24 - 26 มกราคม 2568
งานเทศกาลของดีตำบลเขาขาว (ตำข้าวเม่า) ปีที่ 3 วันที่ 24-25 มกราคม 2568
ขอเชิญเที่ยว "งานเทศกาลของดีตำบลเขาขาว (ตำข้าวเม่า) ปีที่ 3 ในระหว่างวันที่ 24-25 มกราคม 2568 ณ ลานวัฒนธรรม ตำบลเขาขาว อำเภอละงู จังหวัดสตูล โดยพบกับกิจกรรมมากมาย นิทรรศการสินค้าและผลิตภัณฑ์ชุมชน ขบวนพาเหรดวิถีชีวิตชาวเขาขาว การแข่งขัน "ไก่แจ้ขัน" การแข่งขัน "นกกรงหัวจุก" การแข่งขัน "ว่าว" ประกวดธิดาข้าวเม่า บูธสินค้าตำบลเขาขาว พร้อมรับชมการแสดงจากศิลปินวงมะลิซ้อน และจ๊อบ บรรจบ พลอินทร์
งาน "เทศกาลหลงลุม ฟู้ดเฟสติว้าววว" วันที่ 24 -26 มกราคม พ.ศ. 2568
สำนักงานพาณิชย์จังหวัดยโสธร ขอเชิญเที่ยวชมงาน "เทศกาลหลงลุม ฟู้ดเฟสติว้าววว" และร่วมช้อปสินค้าดีอาหารอร่อยมากมายจากผู้ประกอบการในจังหวัดยโสธร ระหว่างวันที่ 24 -26 มกราคม พ.ศ. 2568 ณ บริเวณคลองถมบ้านลุมพุก ตำบลลุมพุก อำเภอคำเขื่อนแก้ว จังหวัดยโสธร พบกับกิจกรรม อาหาร มินิคอนเสิร์ต การแสดงอีกมากมายและพบกับกิจกรรมสินค้านาทีทอง ช้อปสินค้าราคาสุดว้าว จากผู้ประกอบการในจังหวัดยโสธร ณ บูธกิจกรรมสำนักงานพาณิชย์จังหวัดยโสธร ????ระหว่างวันที่ 24-26 มกราคม 2568 เท่านั้น เวลา 16.00 น. เป็นต้นไป (จนกว่าของจะหมด)
Burirum Marathon 2025 วันที่ 25 มกราคม 2568 LINK
บุรีรัมย์ มาราธอน ประจำปี 2025 วันที่ 25 มกราคม 2568 แบ่งเป็น 4 ระยะการแข่งขัน ได้แก่ ระยะมาราธอน (42.195 กม.), ระยะฮาล์ฟมาราธอน (21.1 กม.),ระยะมินิมาราธอน (10.0 กม.), ระยะฟันรัน (4.554 กม.) จะออกสตาร์ทปล่อยตัวจากสนามแข่งรถระดับโลก “ช้าง อินเตอร์เนชั่นแนล เซอร์กิต” โดยมี จุด Finish เข้าเส้นชัยที่ “สนามฟุตบอลช้าง อารีนา” ในวันที่ 25 มกราคม 2568 และมีการจัดงานเอ็กซ์โป เวลา 10.00-20.00 น. ขนทัพสินค้ากีฬาและสุขภาพเอาใจนักวิ่งปอดเหล็กจากทั่วโลกอีกด้วย
เมดอินบ้านมุง ณ นามุง คาเเฟ่ 25 มกราคม 2568
“เมดอินบ้านมุง ณ นามุง คาเเฟ่ “ บ้านมุง อ.เนินมะปราง จ.พิษณุโลก งานดนตรีฟีลแคมป์ที่ฟีลกู๊ดดด วันเสาร์ที่ 25 มกราคม 2568 พบกับศิลปิน เขียนไขและวานิช อภิรมย์ วอทฟอลซ์ ฑิฆัมพร พิมชญา
กิจกรรม SUP Clinic และ Board Testing จาก Starboard และนักกีฬาทีมชาติ
กิจกรรม SUP Clinic และ Board Testing จาก Starboard และนักกีฬาทีมชาติ วันเสาร์ที่ 25 มกราคม 2568 ณ Unique77 ต.ท่าผา อ.บ้านโป่ง จ.ราชบุรี.
กิจกรรมภายในงาน
การแข่งขันพาย SUP Board 3 รายการหลัก 1.1 Technical Race ระยะทาง 2,000 เมตร 1.2 Sprint Race ระยะทาง 300 เมตร 1.3 SUP Fun / SUP PET / SUP FANCY ระยะทาง 3,000 เมตร โดยแบ่งประเภทชาย-หญิง ตามกลุ่มอายุ ได้แก่ - รุ่นมืออาชีพ อายุตั้งแต่ 45 ปี - รุ่นทั่วไป อายุระหว่าง 16 – 44 ปี - รุ่นเยาวชน อายุไม่เกิน 16 ปี - SUP Pets , SUP Fancy
ร่วมจัดโดย ททท.สำนักงานราชบุรี / องค์การบริหารส่วนจังหวัดราชบุรี / ชมรมกีฬาเรือพายจังหวัดราชบุรี / Unique77 / บริษัท ชิวนที จำกัด / Riverdale Marina / 308 Studio Design / Fulfill Park / Star Board / ชมรมลูกหลานบ้านโป่ง
เทศกาลลมหนาวและดาวเดือน วันเสาร์ที่ 25 มกราคม 2568 [ซื้อบัตร]
ททท.สำนักงานราชบุรี ชวนมาดูดาว พบกับ #เทศกาลลมหนาวและดาวเดือน ในวันเสาร์ที่ 25 มกราคม 2568 @ขุนเขา ตำนานไพร รีสอร์ท อ.สวนผึ้ง จ.ราชบุรี (เขตท้องฟ้ามืด ระดับ 3) ลงทะเบียนร่วมกิจกรรมล่วงหน้า ท่านละ 150฿ (รับจำนวนจำกัด 200 ท่านเท่านั้น)
งานประกวดควายงามระดับประเทศครั้งที่ 2 ชิงถ้วยรัฐมนตรีกระทรวงเกษตรและสหกรณ์ วันที่ 25-26 มกราคม 2568
งานประกวดควายงามระดับประเทศครั้งที่ 2 ชิงถ้วยรัฐมนตรีกระทรวงเกษตรและสหกรณ์ วันที่ 25-26 มกราคม 2568 สถานที่จัดงานสนามข้างอาคารหอประชุม มหาวิทยาลัยราชภัฏเชียงราย พบกับการประกวดควายงามชิงถ้วย (รัฐมนตรีว่าการกระทรวงเกษตรและสหกรณ์) พร้อมกิจกรรมสุดพิเศษมากมาย
กิจกรรมภายในงาน Work Shop ศิลปะสุดอลังการ นำโดย (อาจารย์เฉลิมชัย โฆษิตพิพัฒน์) ศิลปินแห่งชาติ พร้อมทีมนักศิลปะเชียงราย ที่จะมาร่วมสร้างสรรค์งานศิลป์และเพนท์ "โก้เมืองเพชร" ควายเผือกมูลค่า 18 ล้านบาท คอนเสิร์ตสุดมันส์ สนุกไปกับวงดนตรีชื่อดังจากเชียงรายถึง 7 วง ท่ามกลางบรรยากาศงานวัดสุดชิลล์
งานแค้มป์สุดมันส์ คนมันส์แค้มป์ 25 มกราคม 2568
ชงเจริญพานิชย์ present งานแค้มป์สุดมันส์ คนมันส์แค้มป์ เชิญพบกับ ศิลปิน ในงาน เล็ก รัชเมศฐ์ Clockwork motionless เสาร์ที่ 25 มกราคม 2568 ✅ จองบัตรออนไลน์ก่อนใคร Ticket บัตรปกติ 150b กางเต็นท์+ 100b Ticket หน้างาน 299b จำกัด 500 คน เท่านั้น * เด็กอายุไม่เกิน 12 ปี ไม่เสียค่าใช้จ่าย PROMOTION DD โปรมันส์1 มา 5 แถม 1 750b โปรมันส์2 มา 10 แถม 3 1,500b *ใช้ได้เฉพาะซื้อบัตรออนไลน์ เท่านั้น
สระแก้ววินเทจ วันที่ 25-26 มกราคม 2568
สระแก้ววินเทจ วันที่ 25-26 มกราคม 2568 ณ ลานสยามมินทร์ อ.อรัญประเทศ จ.สระแก้ว เวลา 15.00 น. เป็นต้นไป พบกับ ร้านค้าวินเทจ แฟชั่น ชอปปิงสินค้าหลากหลาย วง THE JUKKS DJ TOFUFUE
มะขามหวานนครบาลเพชรบูรณ์ 25 มกราคม - 2 กุมภาพันธ์ 2568
จังหวัดเพชรบูรณ์ ร่วมกับ การท่องเที่ยวเที่ยวแห่งประเทศไทย องค์การบริหารส่วนจังหวัดเพชรบูรณ์ ขอเชิญเที่ยวงานประจำปี มะขามหวานนครบาลเพชรบูรณ์ วันที่ 25 มกราคม - 2 กุมภาพันธ์ 2568 ณ บริเวณหน้าศาลากลางจังหวัดเพชรบูรณ์
งานพ่อขุนเม็งรายมหาราช และงานกาชาด ประจำปี 2568 วันที่ 25 มกราคม - 5 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานพ่อขุนเม็งรายมหาราช และงานกาชาดประจำปี 2568วันที่ 25 มกราคม - 5 กุมภาพันธ์ 2568 ณ บริเวณฝูงบิน 416 เชียงราย (สนามบินเก่า) อำเภอเมือง จังหวัดเชียงราย จังหวัดเชียงราย
ภายในงานพบกับกิจกรรม การออกร้านของหน่วยงานภาครัฐ และเอกชน การออกรางวัลสลากกาชาดการกุศล การเดินแบบการกุศล การประกวดร้องเพลงลูกทุ่ง การประกวดธิดาดอย การประกวดรำวงประยุกต์ การเเข่งขันกีฬา และกิจกรรมอื่น ๆ อีกมากมาย โดยกิจกรรมในปีนี้ ประกอบไปด้วย กิจกรรมเดินแบบการกุศล การประกวดร้องเพลงลูกทุ่ง การประกวดดาวจรัสฟ้า ประกวดธิดาดอย การประกวดลูกทุ่งแสงสี To Be Number 1 ประกวดรำวงย้อนยุค และไฮไลท์ในปีนี้คือ การออกสลากกาชาดการกุศล โดย สำนักงานเหล่ากาชาดจังหวัดเชียงราย ซึ่งมีสลากทั้งหมด 200,000 ฉบับ รางวัลมูลค่ารวมกว่า 6 ล้านบาท ได้แก่ บ้านเดี่ยว บ้านแฝด รถยนต์กระบะ รถเก๋งไฟฟ้า Ipad โทรศัพท์มือถือ และจักรยานยนต์ เพื่อจัดหารายได้สำหรับใช้ในกิจการที่ไม่มีงบประมาณสนับสนุนของงานสาธารณกุศลของจังหวัดเชียงราย รวมถึงเป็นการกระตุ้นเศรษฐกิจ และส่งเสริมการท่องเที่ยวของจังหวัดเชียงรายภายหลังสถานการณ์อุทกภัยที่ผ่านมางาน "Bokluea Coffee & Flower Fest” 25-26 มกราคม 2025
เชิญร่วมงาน "Bokluea Coffee & Flower Fest” 25-26 มกราคม 2025 เวลา 10.00 น. - 19.00 น. ณ สวนธน สวนสาธิตมหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี อำเภอบ่อเกลือ จังหวัดน่าน "
“ คน ป่า กาแฟ น่าน เสน่ห์บ่อเกลือ สัมผัสอากาศหนาว กลางหุบเขาเขียว ท่ามกลางสายหมอก พร้อมจิบกาแฟจากดอยบ่อเกลือ มากกว่า 10 ดอย กลางสวนดอกไม้ เคล้าคลอกับเสียงเพลงบรรเลง
ไฮไลท์ห้ามพลาด: ✅ กาแฟจากดอยบ่อเกลือมากกว่า 10 ดอย มางานเดียวเหมือนได้กินกาแฟ 10 ดอย ✅ กิจกรรม workshop มากมาย ไม่ว่าจะเป็น กาแฟคั่วเกลือ ถ้ามัดย้อมจากสีกาแฟ ✅ ดนตรีโฟล์คซอง สร้างบรรยากาศแสนผ่อนคลาย ตลอดงาน ✅ กิจกรรมการแข่งขัน มือวางอันดับหนึ่ง
พิเศษ! รับฟรีคูปองส่วนลดมูลค่า 30 บาท สำหรับผู้ลงทะเบียนหน้างาน 100 ท่านแรก มาร่วม “ดื่ม ดม ชม เที่ยว ” เพลิดเพลินกับกาแฟบ่อเกลือ กาแฟน่าน
เทศกาลชมดอกซากุระ ประจำปี 2568 นที่ 25 มกราคม ถึง 9 กุมภาพันธ์ 2568
เทศกาลชมดอกซากุระ ประจำปี 2568 (2025 Hanami Festival) ณ หมู่บ้านญี่ปุ่น จังหวัดพระนครศรีอยุธยา (@Japanese Village, Ayutthaya) เริ่มวันที่ 25 มกราคม ถึง 9 กุมภาพันธ์ 2568
ขอเชิญทุกท่านเข้าร่วมงานเทศกาลชมดอกซากุระ สัมผัสบรรยากาศงดงามของสวนญี่ปุ่นริมแม่น้ำเจ้าพระยา ภายในงานมีกิจกรรมให้เช่าชุดยูกาตะและกิโมโน สำหรับเด็กและผู้ใหญ่ Special Events: วันเสาร์ที่ 1 กุมภาพันธ์ 2568 กิจกรรมทำโมจิแบบโบราณ, สอนวิธีการชงมัทฉะ, และแต่งหน้าคัพเค้ก การแสดงดนตรีสด เวลา 16.00 น. เป็นต้นไป และพบกับการออกร้าน Food Truck ตลอดทั้งวัน
Special Event: วันเสาร์ 8 กุมภาพันธ์ 2568 กิจกรรมเกม Fukuwarai
Special Event: วันอาทิตย์ที่ 9 กุมภาพันธ์ 2568 กิจกรรมสอนทำเครื่องรางญี่ปุ่น Omamori (お守り)
เวลาเปิดทำการ (Opening Hours) วันจันทร์ - วันศุกร์ เวลา 09.30 - 17.00 น. (Weekdays: 09:30 - 17:00) วันเสาร์ - วันอาทิตย์ เวลา 09.30 - 18.30 น. (Weekends: 09:30 - 18:30)
เทศกาลตรุษจีน เมืองพัทยา วันที่ 25 มกราคม 68
ตรุษจีนปีนี้ ขอเชิญมาสนุกพร้อมรับความเฮงที่เมืองพัทยา ในเทศกาลตรุษจีน เมืองพัทยา วันที่ 25 มกราคม 68 ตั้งแต่ 18.00 เป็นต้นไป ณ สวนสาธารณะลานโพธิ์ (นาเกลือ) ในงานพบกับการประกวดหนูน้อย ตี๋-หมวย ไชนีส พัทยา ชิงรางวัลมูลค่ารวม 100,000 บาท การแสดงมังกรและเชิดสิงโต และปิดท้ายด้วยฟรีคอนเสิร์ตจากวงอินดี้ Safeplanet และในวันตรุษจีน 29 มกราคม 68 ทางเมืองพัทยา มีการจัดพิธีบวงสรวงและบูชาสิ่งศักดิ์สิทธิ์ 3 แห่ง ประกอบด้วย - เวลา 7.00 น. ที่พระบรมราชานุสาวรีย์พระเจ้าตากสินมหาราช ศาลาว่าการเมืองพัทยา - เวลา 10.00 น. ที่อนุสาวรีย์กรมหลวงชุมพรเขตอุดมศักดิ์ เขา ส.ทร.5 (พัทยา) - เวลา 11.00 น. ที่ มูลนิธิสว่างบริบูรณ์ธรรมสถาน นาเกลือ
เขื่อนป่าสักชลสิทธิ์ ฮาล์ฟมาราธอน วันอาทิตย์ที่ 26 ม.ค.68
PASAK JOLASID DAM Half Marathon เขื่อนป่าสักชลสิทธิ์ ฮาล์ฟมาราธอน วันอาทิตย์ที่ 26 ม.ค. 68 ณ ลานหลวงปู่ใหญ่ป่าสัก พระพุทธรัตนมณีมหาบพิตรชลสิทธิ์มงคลชัย(สระบุรี)
สมัครฟรี...จำนวนจำกัด 1,500 Slots ระยะ 5 KM-Fun Run จำกัดเพียง 500 Slots ระยะ 10 KM-Mini Marathon จำกัดเพียง 600 Slots ระยะ 21 KM-Half Marathon จำกัดเพียง 400 Slots
งานวิ่ง Klong suan 100 years Market walk-run 2025 วันที่ 26 มกราคม 2568
Klong suan 100 years Market walk-run 2025 ณ ตลาดคลองสวน 100 ปี วันจัดงาน วันที่ 26 มกราคม 2568 อย่ารอช้า! สมัครได้ฟรี! พร้อมรับเสื้อเป็นของที่ระลึก เปิดรับสมัครเพียง 600 คนเท่านั้น
เดิน-วิ่งการกุศล วิ่งเพื่อน้อง Bo Kluea Run 2025 วันอาทิตย์ที่ 26 มกราคม 2568
มก. ขอเชิญร่วมการแข่งขันเดิน-วิ่งการกุศล วิ่งเพื่อน้อง Bo Kluea Run 2025
คณะศึกษาศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ ร่วมกับสภากาชาดไทย มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี ศูนย์ประสานงาน (มจธ.) พื้นที่น่าน และจังหวัดน่าน จัดกิจกรรมการแข่งขันเดิน-วิ่งการกุศล วิ่งเพื่อน้อง Bo Kluea Run 2025 ในวันอาทิตย์ที่ 26 มกราคม 2568 ณ สนามโรงเรียนบ้านบ่อหลวง อ.บ่อเกลือ จังหวัดน่าน เพื่อส่งเสริม สุขภาพอนามัย ส่งเสริมการท่องเที่ยว และเพื่อพัฒนาเด็กและเยาวชนบนพื้นที่สูงและทุรกันดาร ให้สามารถเข้าถึงโอกาสและความเสมอภาคในการศึกษาที่มีคุณภาพ โดยการแข่งขันแบ่งเป็น 3 ระยะ ได้แก่ มินิมาราธอน 10 กิโลเมตร ค่าสมัคร 700 บาท Funrun 5 กิโลเมตร ค่าสมัคร 600 บาท ผู้เข้าเส้นชัยอันดับที่ 1 2 และ 3 ได้รับถ้วยรางวัล และระยะ 2.5 กิโลเมตร เดิน-วิ่ง เพื่อสุขภาพ ค่าสมัคร 500 บาท สำหรับ VIP ทุกระยะทาง ค่าสมัคร 1,500 บาท โดยมอบเงินรายได้หลังหักค่าใช้จ่ายให้กับสภากาชาดไทย เพื่อสนับสนุนโครงการพัฒนาการจัดการศึกษาให้กับเด็กและเยาวชนในพื้นที่จังหวัดน่าน
พัทลุง Morning drip #5 ครั้งที่ 5 วันอาทิตย์ที่ 26 มกราคม 2568
"Morning drip #5" ครั้งที่ 5 "ภูเขา สายธาร ลานหญ้า กาแฟ“ ชวนทุกคน มาจิบกาแฟ เคล้าเสียงดนตรีบรรเลงในบรรยากาศยามเช้า มาเก็บความทรงจำ ความสุข และประสบการณ์จากกาแฟดีๆ จุดนัดรวมเหล่าผู้รัก และชื่นชอบการดื่มกาแฟ เช้าวันอาทิตย์ที่ 26 มกราคม 2568 ตั้งแต่เวลา 06.00 - 10.30 น. พบกันที่ลานสนามหญ้า
งาน สืบสานประเพณีบุญคูณลาน ตำนานข้าวอินทรีย์ วิถีวัฒนธรรมยโสธร 26-28 มกราคม 2568
ขอเชิญเที่ยวงาน
สืบสานประเพณีบุญคูณลาน ตำนานข้าวอินทรีย์ วิถีวัฒนธรรมยโสธร ระหว่างวันที่ 26-28 มกราคม 2568 ณ บริเวณหน้าที่ว่าการอำเภอกุดชุม จังหวัดยโสธร
เฉลิมฉลองตรุษจีนสุดยิ่งใหญ่ The Great Chinese New Year 2025 วันที่ 27 ม.ค. – 10 ก.พ. 68
เฉลิมฉลองตรุษจีนสุดยิ่งใหญ่ The Great Chinese New Year 2025 มะเส็งมาเฮงที่เซ็นทรัล 27 ม.ค. – 10 ก.พ. 68 ลานโปรโมชั่น ชั้น 1 เซ็นทรัล สุราษฎร์ธานี พบกับกิจกรรมมากมาย อาทิ • สักการะขอพรเทพเจ้าไฉ่ซิงเอี้ย เทพเจ้าแห่งโชคลาภ ความมั่งคั่งและความสำเร็จ • ชมการแสดงสิงโตปีเสาดอกเหมย และการแสดงมังกร LED สุดตระการตา • ถ่ายรูปเช็คอินกับโคมไฟดอกไม้เรืองแสง • ร่วมชมความความน่ารักในการประกวดหมวยน้อย - ตี๋น้อย 2025 • ชมฟรีการแสดงวัฒนธรรมไทย-จีน • ช้อปสินค้ามงคลกับ Chinese Market • สมาชิก Central X แสดงใบเสร็จ 300 บาท รับสิทธิ์ Workshop พวงกุญแจโคมไฟมงคล ฟรี
วันเต่าโลกครั้งที่ 8 วันที่ 27 มกราคม - 2 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน วันเต่าโลกครั้งที่8 ระหว่างวันที่ 27 มกราคม - 2 กุมภาพันธ์ 2568 กิจกรรมภายใน ภาคกลางคืน - การแสดงของวง “กัวลาบารา” - วีดิทัศน์แนะนำ อบต.กำแพง และแหล่งท่องเที่ยวในพื้นที่ - พิธีเปิดงานวันเต่าโลกครั้งที่ 8 / มอบของที่ระลึกผู้สนับสนุน - การแสดงพิธีเปิดงานวันเต่าโลก “โรงเรียนราชประชานุเคราะห์ 42 จ.สตูล” - เดินแบบผ้าไทย “ผ้าไทยใครใส่ก็ดูดี” - การแสดงของวง “กัวลาบารา” - การแสดงของศิลปินนักร้อง “ธีเดช ทองอภิชาติ” เที่ยวฟรี ชมฟรี มาเที่ยวกันเยอะๆ น่ะจ้าภายในงานมีสินค้ามากมาย อาหารอร่อย และมีกิจกรรมสนุกๆมากมาย ที่รอทุคนอยู่ เตรียมตัวให้พร้อมแล้วมาสนุกด้วยกันกับเราที่งานวันเต่าโลก
โปรแกรมภาพยนตร์สัปดาห์นี้ วันที่ 28 มกราคม - 2 กุมภาพันธ์ 2568
ฉลองตรุษจีนหาดใหญ่ 28 มกราคม - 6 กุมภาพันธ์ 2568
มูลนิธิมิตรภาพสามัคคี(ท่งเซียเซี่ยงตึ๊ง) หาดใหญ่ จัดงานมหากุศลแห่พระสะเดาะเคราะห์ประจำปี ฉลองตรุษจีนหาดใหญ่ 28 มกราคม - 6 กุมภาพันธ์ 2568 10 วัน 10 คืน
เทศกาลตรุษจีนประจำปี 2568 โรงเรียนศรีนครมูลนิธิ 28 มกราคม – 2 กุมภาพันธ์ 2568
ร่วมเฉลิมฉลองต้อนรับเทศกาลตรุษจีนสุดยิ่งใหญ่ จัดเต็มกับการแสดงแสง สี เสียง ชมการแสดงตำนานตรุษจีน การแสดงมังกร สิงโตทุกค่ำคืน ชมฟรี!คอนเสิร์ตจากศิลปินชื่อดัง Pixxie, เป้ MVL, ASIA7 และเตรียมพบกับกิจกรรมอีกมากมายภายในงาน
แล้วพบกันที่งาน "เทศกาลตรุษจีนประจำปี 2568"
28 มกราคม – 2 กุมภาพันธ์ 2568
โรงเรียนศรีนครมูลนิธิ อ.หาดใหญ่ จ.สงขลา
ตรุษจีนเมืองเพชร 28 มกราคม - 2 กุมภาพันธ์ 2568
เทศบาลเมืองเพชรบุรี จังหวัดเพชรบุรี ขอเชิญชวนทุกท่านเที่ยวงาน "ตรุษจีนเมืองเพชร" - วันที่ 28 มกราคม - 2 กุมภาพันธ์ 2568 - บริเวณถนนสุรินทรฦๅชัย (ถนน 18 เมตร) จัดใหญ่ จัดเต็ม อิ่มท้อง พร้อมอิ่มเอม อิ่มใจ สอบถามเพิ่มเติม 032-403 888
เทศกาลเที่ยวงานวัดเขาวงพระจันทร์ 29 มกราคม - 12 กุมภาพันธ์ 2568
ขอเชิญชวนสาธุชนร่วมงานประจำปีนมัสการสักการะรอยพระพุทธบาทเขาวงพระจันทร์ จัดขึ้นระหว่างวันที่ 29 มกราคม - 16 กุมภาพันธ์ 2568 รวม 15 วัน 15 คืน ณ
วัดเขาวงพระจันทร์ ตำบลห้วยโป่ง อำเภอโคกสำโรง จังหวัดลพบุรี
เทศกาลตรุษจีนพะเยา ประจำปี วันที่ 29 - 31 มกราคม 2568
“เทศกาลตรุษจีนสุดยิ่งใหญ่อลังการ@ เมืองน่าเที่ยวพะเยา” ททท.สำนักงานเชียงราย และศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา (ททท.) ขอเชิญชวนนักท่องเที่ยวทุกท่านมาร่วมเฉลิมฉลองต้อนรับปีมะเส็ง เพลิดเพลินกับแสดงสิงโต มังกร และเอ็งกอ ช้อปปิ้งถนนคนเดิน ชิมอาหารไทย-จีนเลิศรส ชมขบวนแห่ตรุษจีน สุดยิ่งใหญ่อลังการ ในงาน ”เทศกาลตรุษจีน ประจำปี 2568” ที่เมืองน่าเที่ยวจังหวัดพะเยา ระหว่างวันที่ 29 - 31 มกราคม 2568 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ บริเวณสามแยกหน้าตลาดสดพะเยา ถึงศาลหลังเมืองพะเยา
กิจกรรมภายในงาน : - พบกับการแสดงสิงโตและมังกร ทุกค่ำคืน - ชมการแสดงเอ็งกอ ในคืนวันที่ 30 - 31 มกราคม 2568 - เชิญช็อป ชิม ชม มหกรรมอาหารไทย - จีน - ถนนคนเดินย่านวัฒนธรรมเศรษฐกิจ สายน้ำสองแผ่นดิน พี่น้องไทย - จีน กิจกรรม Highlight : ชมขบวนแห่ตรุษจีน สุดยิ่งใหญ่อลังการ ในวันที่ 31 มกราคม 2568 พิเศษสุด! สำหรับนักท่องเที่ยวที่มาร่วมงาน“ตรุษจีน”ที่เมืองน่าเที่ยวพะเยา แล้วพักในโรงแรมในจังหวัดพะเยา ที่ร่วมกิจกรรมในแคมเปญ “Check In ชิม ช้อม พะเยา” 1 คืนขึ้นไป รับฟรี! E-Coupon มูลค่ารวม 300 บาท ใช้เป็นส่วนลดอาหาร เครื่องดื่ม และของที่ระลึก เลือกใช้ได้ในร้านค้าที่ร่วมรายการกว่า 21 แห่งทั่วพะเยา จำกัดสิทธิพิเศษนี้เพียง 500 สิทธิ์ เท่านั้น! ตั้งแต่บัดนี้ จนถึง 28 ก.พ.2568
เยือนถิ่นบ้านลูกหลานมังกร เที่ยวงานสืบสานประเพณีวัฒนธรรมไทย - จีน “ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร 2568” ระหว่างวันที่ 25-29 มกราคม
ททท. สำนักงานสมุทรสงคราม ขอเชิญทุกท่านเยือนถิ่นบ้านลูกหลานมังกร เที่ยวงานสืบสานประเพณีวัฒนธรรมไทย - จีน “ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร 2568” ระหว่างวันที่ 25-29 มกราคม นี้ ตั้งแต่เวลา 16.00-21.00 น. ณ ริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร จังหวัดสมุทรสาคร
ภายในงานพบกับกิจกรรมมากมาย ดังนี้
ขบวนแห่เทพเจ้า “ไช้ซิ่งเอี้ย” อย่างยิ่งใหญ่ ในวันที่ 25 มกราคม 2568 เวลา 14.30 น. จากศูนย์การค้าแลนด์มาร์ค มหาชัย มายังบริเวณริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร
ไฮไลท์สำคัญ การผัดหมี่มงคล การไหว้พระหยกขาว และการไหว้ขอพรเทพเจ้าไช้ซิ่งเอี้ย ซึ่งเป็นเทพเจ้าแห่งโชคลาภและความมั่งคั่ง ในวันอังคารที่ 28 มกราคม 2568 ตั้งแต่เวลา 23.00 น. เป็นต้นไป อีกทั้งยังมีไฮไลท์การประกวดแต่งกายแฟนซี (ชุดจีน) ลุ้นรับเงินรางวัลรวมมูลค่ากว่า 10,000 บาท
การแสดงแสง สี เสียง สืบสานตำนานมังกร การแสดงเรือประดับไฟบริเวณริมแม่น้ำท่าจีน การแสดงเชิดสิงโตกลางแม่น้ำ การแสดงจุดพลุไฟกลางแม่น้ำท่าจีนสุดอลังการ (วันที่ 25 และ 28 ม.ค. 68) นิทรรศการเรื่องเล่าความเชื่อ ประเพณีตรุษจีนในจังหวัดสมุทรสาคร
การออกร้านจำหน่ายสินค้าของดีจังหวัดสมุทรสาคร ผลิตภัณฑ์ของฝากคุณภาพ สากล จากวิสาหกิจชุมชน, สินค้า OTOP, สินค้าทางวัฒนธรรมไทย-จีน การสาธิตการเขียนภู่กันจีน 100 ตระกูลแซ่ รวมกว่า 100 ร้านค้า
ห้ามพลาด !! พิเศษสุดกับกิจกรรมฟรีคอนเสิร์ตจากศิลปิน-ดาราชื่อดัง 5 วันเต็ม เช่น แอนนา เสืองามเอี่ยม, ปนัดดา เรืองวุฒิ, ป๊อป ปองกูล, ตรี ชัยณรงค์, ไอซ์ ศรัณยู และลุลา ▫️ชวนสัมผัสอัตลักษณ์ชุมชนกับกิจกรรมทริปท่องเที่ยวยลวิถีชีวิต ชุมชนชาวไทยเชื้อสายจีน ไหว้เจ้าขอพร "ย่านชุมชนเก่าตำบลท่าฉลอม" โดยสามารถลงทะเบียนได้ทาง QR Code ในราคาบัตรใบละ 100.-บาท ซึ่งนักท่องเที่ยวจะได้รับกลับคืนเป็นคูปองสำหรับแลกซื้อสินค้าในชุมชนในมูลค่า 100.-บาท สอบถามข้อมูลในการสมัครร่วมกิจกรรมฯ เพิ่มเติม โทร. 081-805-4644 (ในวัน/เวลาราชการ)
งานสืบสานประเพณีวัฒนธรรมไทย - จีน “ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร 2568” จัดโดยจังหวัดสมุทรสาคร ร่วมกับสำนักงานวัฒนธรรมจังหวัดสมุทรสาคร อบจ.สมุทรสาคร เทศบาลนครสมุทรสาคร ททท. สำนักงานสมุทรสงคราม ศาลเจ้าพ่อหลักเมืองสมุทรสาคร หน่วยงานภาครัฐและเอกชน กำหนดจัดขึ้นในระหว่างวันที่ 25-29 มกราคม 2568 ตั้งแต่เวลา 16.00-21.00 น. ณ ริมเขื่อนศาลเจ้าพ่อหลักเมืองสมุทรสาคร จ.สมุทรสาคร โดยมีวัตถุประสงค์ส่งเสริม ปลูกจิตสำนึก เผยแพร่ประชาสัมพันธ์ขนบธรรมเนียม ประเพณีและวัฒนธรรมของชาวไทยเชื้อสายจีนที่อาศัยอยู่ในจังหวัดสมุทรสาคร อีกทั้งเพื่อส่งเสริมการต่อยอดทุนทางวัฒนธรรม ตลอดจนส่งเสริมกิจกรรมการท่องเที่ยวทางวัฒนธรรมจังหวัด เพื่อยกระดับงาน “ตรุษจีน เล่ง เกีย ฉู่ สืบสานตำนานมังกร 2568 ให้เป็นเทศกาลประเพณีในระดับชาติ และเป็นซอฟต์พาวเวอร์ของจังหวัดสมุทรสาคร
สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานวัฒนธรรมจังหวัดสมุทรสาคร โทร. 0 3441 1325 Facebook : สำนักงานวัฒนธรรมจังหวัดสมุทรสาคร และททท. สำนักงานสมุทรสงคราม โทร. 0 3475 2847-8 Facebook : ททท.สำนักงานสมุทรสงคราม (TAT Samut Songkhram Office)
งานตรุษจีนสุพรรณบุรี มหัศจรรย์ 17 ปี มังกรสวรรค์ 29-30 มกราคม 2568
งานตรุษจีนสุพรรณบุรี มหัศจรรย์ 17 ปี มังกรสวรรค์ 29-30 มกราคม 2568 ศาลเจ้าพ่อหลักเมืองสุพรรณบุรี และ อุทยานมังกรสวรรค์ สุพรรณบุรี เวลา 16.00น. เป็นต้นไป ชมฟรีตลอดงาน พบกับ การแสดง แสง สี เสียง มีมุมถ่ายภาพที่เนรมิตสวนดอกไม้ให้เป็น สวน แสง สีสัน สวรรค์ เมืองสุพรรณฯ สวยงามตื่นตาตื่นใจ มีร้านค้าของกินอร่อยๆชื่อดังในจังหวัดสุพรรณบุรี ให้ได้เลือกชิม ช็อป ชมการแสดงศิลปวัฒนธรรมไทย - จีน ร่วมสมัย อาทิ การแสดงชุดลูกหลานพันธุ์มังกร , กลองศึก , สิงโตวูซู , มังกร 9 เซียน , กังฟู , เอ็งกอบู๊ , เจ้าแม่กวนอิมพันมือ , งิ้วเปลี่ยนหน้ากาก และการแสดงดนตรีฟรีคอนเสิร์ตจากศิลปินดัง
บุญเดือนสาม ไหว้ปู่อือลือ บวงสรวงพญานาค ประจำปี 2568 วันที่ 29 – 31 มกราคม 2568
ขอเชิญทุกท่านร่วมงานประเพณี "บุญเดือนสาม ไหว้ปู่อือลือ บวงสรวงพญานาค ประจำปี 2568" ระหว่างวันที่ 29 – 31 มกราคม 2568 ณ ตำหนักปู่อือลือนาคราช ต.บึงโขงหลง อ.บึงโขงหลง จ.บึงกาฬ สัมผัสบรรยากาศพิธีกรรมบวงสรวงแบบโบราณ พร้อมขอพรเพื่อความเป็นสิริมงคลจากปู่อือลือพญานาคราช
กาแฟดีวิถีเมี่ยน และงานประเพณีปีใหม่เมี่ยน วันพุธที่ 29 มกราคม 2568
ขอเชิญร่วมงาน “ กาแฟดีวิถีเมี่ยน และงานประเพณีปีใหม่เมี่ยน ” ในวันพุธที่ 29 มกราคม 2568 เวลา 08.30 น. เป็นต้นไป ณ บ้านสันเจริญ ตำบลผาทอง อำเภอท่าวังผา จังหวัดน่าน ชมการแสดง เป่าปี่ ตีกลอง ต้อนรับ, การแสดงรำถาดต้อนรับ พร้อม เสิร์ฟน้ำชา) รับไข่แดงเพื่อความเป็นสิริมงคล พร้อมประกอบพิธีไหว้ปีใหม่เมี่ยน และชมการแสดงบนเวที ของนักเรียนในพื้นที่ ไปชมการแข่งขันดริปกาแฟ ชิงแชมป์ สวนยาหลวง Drip Battle ครั้งที่ 1 ตั้งแต่เวลา 13.00 -17.30 น. ณ วิสาหกิจชุมชนกาแฟสวนยาหลวง อ.ท่าวังผา จ.น่าน “ให้ทุก ๆ วัน เป็นวันกาแฟน่าน”
HUB OF SEAFOOD ครั้งที่ 2 วันที่ 30 ม.ค.- 3 ก.พ.68
งานอาหารทะเลสุดยิ่งใหญ่ HUB OF SEAFOOD ครั้งที่ 2 วันที่ 30 ม.ค.- 3 ก.พ.68 ลานกิจกรรมหน้าศูนย์การค้า เซ็นทรัลมหาชัย สมุทรสาคร ยกขบวนอาหารทะเลสดใหม่จากท้องทะเล มารวมไว้ที่งานนี้เพื่อให้ทุกคนได้อิ่มอร่อยกับอาหารทะเลหลากหลายในราคาสุดพิเศษ พร้อมชมการสาธิตเมนูเด็ดจากร้านดัง พร้อมฟังเพลงเพราะๆ ชิวๆ ชมฟรี !! ทุกคืน ✅️ 30 ม.ค. แอนท์ อีโมชั่นทาวน์ ✅️ 31 ม.ค. ฟาร์ม The Voice ✅️ 1 ก.พ. คิง The Voice ✅️ 2 ก.พ. Hohore Company ✅️ 3 ก.พ. ชามุก
PUA ART FEST เทศกาลศิลปะปัว วันที่ 30-31 ม.ค. 2568
PUA ART FEST เทศกาลศิลปะปัว ดื่มด่ำบรรยากาศศิลปะของคนน่าน ต้นกล้าศิลปะ - ถนนศิลปะปัว - เปิดบ้านศิลปิน
ต้นกล้าศิลปะ พบกับการอบรมเชิงปฏิบัติการเด็กและเยาวชน การวาดภาพทิวทัศน์และหัวเรือ วันที่ 30-31 ม.ค. 68 เวลา 08.30 น. - 16.00 น. ที่ โรงเรียนบ้านปรางค์
ถนนศิลปะปัว ร่วมกิจกรรม เขียนภาพบนผืนผ้าใบที่ยาวที่สุดในประเทศไทย ชมนิทรรศการผลงานศิลปะ ของศิลปินน่าน ฟังเพลง จากวงดนตรี และการแสดงศิลปะร่วมสมัย ❕สุดพิเศษ❕ วันที่ 31 ม.ค. 68 พบกับ วงดนตรี เดอะเพอะ วันที่ 1 ก.พ. 68 พบกับ วงดนตรี แชมป์ แพรว **ร่วมกับกลุ่มแก้วสหายคำ และ Performing Arts เวลา 17.00 น. - 22.00 น. ที่ ข่วงเมืองปัว
เปิดบ้านศิลปิน วันที่ 7 ก.พ. 68 “ศิลปะ กวี ดนตรี ความรัก” เวลา 17.00 น. - 21.00 น. ที่ ฮอมฮักแกลลอรี่ วันที่ 8 ก.พ. 68 “เวิร์คช็อปกลุ่มศิลปินและเยาวชน เคล้าเสียงดนตรี” เวลา 09.00 น. - 16.00 น. ที่ บ้านศิลปะภักดี วันที่ 9 ก.พ. 68 “เวิร์คช็อปกลุ่มศิลปินและเยาวชน เคล้าเสียงดนตรี” เวลา 09.00 น. - 16.00 น. ที่ ปวินท์ศิลป์แกลลอรี่
SCATH ลุยสวน… ชวนทำกาแฟ แม่ฮ่องสอน วันที่ 31 มกราคม - 2 กุมภาพันธ์ 2568
“SCATH ลุยสวน… ชวนทำกาแฟ” กำลังจะเริ่มต้นขึ้น
เชิญชวนเกษตรกรผู้ปลูกกาแฟในพื้นที่จังหวัด “แม่ฮ่องสอน” เข้าร่วมโปรเจกต์นี้ด้วยกัน เพื่อแลกเปลี่ยนองค์ความรู้ด้านการปลูกกาแฟพิเศษ และแนวทางการพัฒนาเกษตรกรรมอย่างยั่งยืน พร้อมกับการพัฒนาคุณภาพทางด้านรสชาติ
จัดขึ้น ณ บ้านห้วยห้า จังหวัดแม่ฮ่องสอน วันที่ 31 มกราคม - 2 กุมภาพันธ์ 2568 (3 วัน 2 คืน) ฟรี ไม่มีค่าใช้จ่าย รั บ จำ น ว น จำ กั ด
เงื่อนไขการเข้าร่วม
● สมัครผ่านลิ้งก์ Google Form : https://forms.gle/f1rdoYqiHUkNdrCd7
● ต้องเป็นเกษตรกรที่อยู่ในพื้นที่จังหวัดแม่ฮ่องสอนเท่านั้น
สมาคมฯ ขอสงวนสิทธิ์ในการชี้แจงเกณฑ์การคัดเลือก และผลการตัดสินทุกกรณี
ประกาศผลผู้เข้าร่วมกิจกรรมในวันที่ 19 มกราคม 2568 ผ่านทาง เฟสบุ๊คเพจ (Facebook Page) SCATH Specialty Coffee Association of Thailand งานเกษตรแฟร์ 2568 ม.เกษตรฯ บางเขน วันที่ 31 มกราคม - 8 กุมภาพันธ์ 2568
งานเกษตรแฟร์ 2568 ปีนี้จัดระหว่างวันที่ 31 มกราคม - 8 กุมภาพันธ์ 2568 ภายใต้แนวคิด “เศรษฐกิจเจริญก้าวไกล สังคมไทยไร้คาร์บอน” โซนกิจกรรม เกษตรแฟร์ 2568 โซน A เกษตรชวนชิม อร่อยชวนแชร์ (สินค้าบริโภค) โซน B ตลาดน้ำเกษตร (ตลาดน้ำโบราณ ตลาดน้ำใหญ่) โซน C เทคโนโลยีก้าวไกล (เทคโนโลยีการเกษตร อุปโภคและบริโภค) โซน D สราญรมย์ ชมพฤกษา (ต้นไม้ ปุ๋ย อุปกรณ์ตกแต่งบ้านและสวน) โซน E ช้อปละไม หัวใจสีเขียว (งานศิลปะ แฮนด์เมด งานดีไซน์รักษ์โลก) โซน F สีสันตะวันฉาย (สินค้าคาเฟ่ และสินค้าอุปโภคบริโภคจากหน่วยงานต่าง ๆ) โซน G ครบเครื่องเรื่องอร่อย (สินค้าเกษตรบริโภค เช่น มะขาม หอม กระเทียม) โซน H นวัตกรรมงานวิจัย (งานวิจัย ร้านค้าจากมูลนิธิราชวงศ์ และธุรกิจแฟรนไชส์) โซน I เพื่อนรักสัตว์เลี้ยง (สัตว์เลี้ยงและอุปกรณ์) โซน J ของดีทั่วไทย ส่งใจถึงมือ (ผ้าไหม ผ้าไทย เครื่องประดับ) โซน K ฟินสุดหยุดไม่ได้ (สินค้าอุปโภคบริโภคของบริษัทห้างร้าน) โซน L สร้างสรรค์เรื่องงานดี (หน่วยงานพันธมิตรและร้านค้าทั่วไป) ศูนย์อาหาร สวนสนุก
งานเทศกาลดนตรีสุดฟีลกู้ดด สิงห์ในสวน Music festival 2025 @ ลานสังคีต มช. 31 ม.ค. - 1 ก.พ.
งานเทศกาลดนตรีสุดฟีลกู้ดด สิงห์ในสวน Music festival 2025 วันที่ 31 ม.ค. - 1 ก.พ. 2568 ตั้งแต่เวลา 16.00 น. เป็นต้นไป ณ ลานสังคีต(ลานควายยิ้ม) พบกับวงดนตรีและศิลปินมากมาย ดื่มด่ำกับบรรยากาศสุดฟิน ของกินอร่อยๆแบบจุกๆ ปล่อยใจไปกับเสียงดนตรี ณ สิงห์ในสวนกัน [
teammorchor]
เทศกาลขึ้นเขาไหว้พระ วัดเชิงเขา 31 มกราคม - 16 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานเทศกาลขึ้นเขาไหว้พระ วัดเชิงเขา เมืองสระบุรี งานวัดที่ใหญ่ที่สุดในจังหวัดสระบุรี จัดขึ้นวันที่ 31 มกราคม ถึง 16 กุมภาพันธ์ 2568 ร่วมทำบุญซื้อที่ดินกับวัด ชมการแสดงช้าง ไฟประดับสวยๆ คอนเสิร์ตอลังการ อร่อยกับของกินของใช้มากมาย จัดยาว 17คืน
งานเทศกาลโส้รำลึก ครั้งที่ 44 ประจำปี 2568 วันที่ 31 ม.ค - 2 ก.พ 2568
งานเทศกาลโส้รำลึก ครั้งที่ 44 ประจำปี 2568 วันที่ 31 ม.ค - 2 ก.พ 2568 ณ สนามหน้าศูนย์วัฒนธรรมไทโส้ อำเภอกุสุมาลย์ จังหวัดสกลนคร • พิธีบวงสรวงพระอรัญอาสาเจ้าเมืองเผ่าไทโส้ • ขบวนแห่เจ้าเมืองกุสุมาลย์มณฑลและขบวนแห่ทางวัฒนธรรมแห่งวิถีชีวิตไทโส้ • นิทรรศการวิถีชีวิตชาวโส้ การแสดงจากตำบล ต่างๆ ในเขตอำเภอกุสุมาลย์ ชมนิทรรศการของหน่วยงานต่างๆ
Srivichai Rider ศรีวิชัยไรเดอร์ 2025 ครบ 15 ปี 15 กุมภาพันธ์ 2568
ศรีวิชัยไรเดอร์ (Srivichai Rider) นครศรีธรรมราช ครบ 15 ปี 15 กุมภาพันธ์ 2568 ณ ไร่นาฟาร์ม อ.เมืองจ.นครศรีธรรมราช
เดือนกุมภาพันธ์ 2568
โปรแกรมรถท่องเที่ยว KIHA 183 • เดือนมกราคม - กุมภาพันธ์ 2568
ขบวนรถท่องเที่ยว KIHA 183 เป็นขบวนรถสไตล์ญี่ปุ่น เหมาะสำหรับผู้ที่ชื่นชอบการเดินทางแบบคลาสสิก ให้บริการนำเที่ยวแบบเช้าไปเย็นกลับ ราคา 1,499 บาท และแบบพักค้างคืน ราคา 3,999 บาท (รวมบริการอาหารเช้า กลางวัน อาหารว่าง และเครื่องดื่ม บริการนำเที่ยว ประกันอุบัติเหตุ ค่ารถบัสปรับอากาศ ในกรณีพักค้างคืนจะรวมค่าที่พักไว้แล้ว) จำนวน 6 โปรแกรม ประกอบด้วย
• เดือนมกราคม
(1) โปรแกรมรื่นรมย์ชมพระราชนิเวศน์มฤคทายวัน จังหวัดเพชรบุรี ในวันที่ 18 และ 19 มกราคม 2568 (One Day Trip)
(2) โปรแกรม “เที่ยวเมืองโคราช ชมปราสาทหินพิมาย ตระการตา แสง สี เสียง วิมายะนาฏการ” ในวันที่ 25 - 26 มกราคม 2568 (2 วัน 1 คืน)
• เดือนกุมภาพันธ์
(1) โปรแกรมเที่ยวฟาร์ม ชมความงามประดู่แดงที่ อ.ส.ค. ในวันที่ 1 และ 2 กุมภาพันธ์ 2568 (One Day Trip)
(2) โปรแกรมท่องเมืองศิลป์ ถิ่นสัทธา ดาราพราว ในวันที่ 8 และ 9 กุมภาพันธ์ 2568 (One Day Trip)
(3) โปรแกรมแต่งไทย นั่งรถไฟ KIHA 183 เที่ยวงานแผ่นดินสมเด็จพระนารายณ์ “ลพบุรี” เยือนถิ่นวีรชนคนกล้าแห่งลุ่มน้ำเจ้าพระยา “สิงห์บุรี” ในวันที่ 15 - 16 กุมภาพันธ์ 2568 (2 วัน 1 คืน)
(4) โปรแกรมนั่งรถไฟชมสะพานย้อนรอยประวัติศาสตร์สงครามโลก ครั้งที่ 2 แวะถ้ำกระแซ ล่องแพชมธรรมชาติริมแม่น้ำแควน้อย ในวันที่ 22 และ 23 กุมภาพันธ์ 2568 (One Day Trip)
ตารางออกหน่วยเดือนกุมภาพันธ์ 2568
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กุมภาพันธ์ 2568
เวลาออกหน่วยบริการ 8.30 - 11.00 น.
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
โปรแกรมภาพยนตร์เดือนกุมภาพันธ์ 2568
เดือนแห่งความรักปีนี้ ระหว่างวันที่ 14-16 กุมภาพันธ์ หอภาพยนตร์จะมีงานNight@Maya City มายาราตรี 5 กุมภา ราตรี มีรัก ที่เปิดเมืองมายายามค่ำคืน กิจกรรม ดนตรี ร้านค้างานคราฟต์ ส่วนช่วงบ่ายก็จะมีโปรแกรมพิเศษวันวาเลนไทน์ เริ่มที่วันศุกร์ที่ 14 จัดฉายหนัง ลอง ลีฟ เลิฟว์ และต่อด้วยมนต์รักทรานซิสเตอร์ที่ เป็นเอก รัตนเรื่อง ผู้กำกับภาพยนตร์เรื่องนี้จะมาพูดคุยหลังจบภาพยนตร์ วันเสาร์ที่ 15 ทึ่ง! หนังโลก The Lovers on the Bridge หนังรักรสชาติหวานขมเรื่องดังจากปี 1992 โดยผู้กำกับ ลีโอ การาซ และวันอาทิตย์ที่ 16 กิจกรรมลานดารา ก้อง สหรัถ ที่จะจัดฉายคู่แท้ 2 โลก พร้อมเชิญ ก้อง สหรัถ สังคปรีชา มาประทับรอยมือรอยเท้า เรียกได้ว่ามาเที่ยวชมกันได้ตั้งแต่กลางวันยันกลางคืน นอกจากนี้ตลอดเดือนยังมีโปรแกรมที่น่าสนใจดังนี้
- โปรแกรมลานดารา สหรัถ สังคปรีชา ที่จัดฉายผลงานของ ก้อง สหรัถ นอกจากมีฝีมือด้านดนตรีแล้ว ยังได้แสดงภาพยนตร์มาอย่างยาวนาน
- พระเอกนักร้อง อีกหนึ่งโปรแกรมเพื่อต้อนรับกิจกรรมลานดาราก้อง สหรัถ สังคปรีชา ในเดือนนี้ โดยได้คัดเลือกภาพยนตร์ที่แสดงให้เห็นถึงประวัติศาสตร์ของวงการบันเทิง ที่มีดารานำชายจำนวนมากที่มีบทบาทเป็นนักร้องควบคู่ไปด้วย บ้างก้าวข้ามจากเวทีเพลงมาอยู่หน้ากล้องถ่ายหนัง บ้างเริ่มต้นจากการเป็นนักแสดงกลายเป็นนักร้องชื่อดัง ทั้งภาพยนตร์ไทยและต่างประเทศ
- ภาณุพันธุ์รำลึก โปรแกรมที่จัดขึ้นเนื่องในวาระครบรอบ 30 ปีแห่งการจากไปของพลตรี พระเจ้าวรวงศ์เธอ พระองค์เจ้าภาณุพันธุ์ยุคล ทรงเป็นเจ้านายชั้นสูงที่มีบทบาทสำคัญอย่างยิ่งในประวัติศาสตร์ภาพยนตร์ไทย ทรงเชี่ยวชาญในด้านศิลปะบันเทิง ทั้งทรงพระนิพนธ์เรื่องและคำร้องเพลง ทรงอำนวยการสร้างและกำกับภาพยนตร์ เป็นที่เคารพยกย่องและเรียกขานกันในวงการว่า “เสด็จพระองค์ชายใหญ่” และบางครั้งทรงใช้พระนามในผลงานของพระองค์ว่า “ภาณุพันธุ์” หอภาพยนตร์จึงนำผลงานภาพยนตร์ที่พระองค์ทรงสร้างสรรค์มาจัดฉายทั้ง พันท้ายนรสิงห์ (2493) เรือนแพ (2504) และ เงาะป่า (2523) ที่ได้รับการขึ้นทะเบียนเป็นมรดกภาพยนตร์ของชาติและได้นำฟิล์มมาสแกนภาพใหม่ รวมทั้งงานที่ยังอยู่ในความทรงจำของแฟนหนังไทย ได้แก่ เป็ดน้อย (2511) ละครเร่ (2512) และ น้ำผึ้งขม (2517) นอกจากนี้ยังมีเรื่อง คนมีคาว (2521) ที่สร้างโดยอัศวินภาพยนตร์ ซึ่งจัดรวมอยู่ในโปรแกรม Archive Rediscovery .
- โปรแกรมภาพยนตร์โลกที่น่าสนใจ จากเยอรมัน เม็กซิโก ฝรั่งเศส สเปน และญี่ปุ่น
ภาพยนตร์ทั้งหมดจัดฉายที่หอภาพยนตร์ ไม่เสียค่าใช้จ่ายในการรับชม อ่านเรื่องย่อและสำรองที่นั่งได้ที่
fapot.or.thกิจกรรมพัทยาเดือนกุมภาพันธ์ 68
กิจกรรมดีๆ ต้อนรับเดือนแห่งความรักเดือนกุมภาพันธ์นี้..พัทยาไม่มาได้ไง Pattaya City, your everyday destination
8-9 ก.พ.68 การแข่งขันกีฬาเทควันโดสุดยิ่งใหญ่! รายการ "12th CHOI YOUNG SEOK CUP INTERNATIONAL TAEKWONDO CHAMPIONSHIPS PATTAYA 2025" ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก
8-9 ก.พ.68 งาน "CLASSIC CAR SHOW PATTAYA" ครั้งที่ 6 ณ บริเวณถนนพระตำหนักซอย 4 และซอย 5 และขบวนคาราวานรถคลาสสิครอบเมืองพัทยา
9 ก.พ.68 สนุกสุดมันส์! กับการแข่งขัน "วิ่งเกาะล้านเทรล" (KOH LARN TRAIL 2025) ณ หาดแสม เกาะล้าน
13-15 ก.พ.68 รวมพลเหล่าไบค์เกอร์ กับงาน "สัปดาห์มอเตอร์ไซค์และเสียงเพลงแห่งเสรีภาพ ครั้งที่ 28" (28th BURAPA PATTAYA BIKE WEEK) ณ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซ.ชัยพฤกษ์ 2
13-23 ก.พ.68 เทศกาลอาหาร FOOD FUN FEST ณ ลานเครื่องบินศูนย์การค้าเทอร์มินอล 21 พัทยา
14 ก.พ.68 งานเฉลิมฉลองการแต่งงานครั้งยิ่งใหญ่ต้อนรับสมรสเท่าเทียม "PATTAYA MARRIAGE EQUALITY CELEBRATION 2025" ณ ศูนย์การค้ารอยัลการ์เด้นพลาซ่า พัทยา
14-23 ก.พ.68 ตอกย้ำการเป็นเมืองกีฬา Sports City & SportsTourism กับการแข่งขันฟุตบอลชายหาดนานาชาติเมืองพัทยา (PATTAYA INTERNATIONAL BEACH FOOTBALL 2025) ณ ชายหาดจอมเทียน หน้าโรงแรมเดอะนาว
20-23 ก.พ.68 การแข่งขันกอล์ฟหญิง HONDA LPGA THAILAND 2025 ณ สยามคันทรีคลับ โอลด์คอร์ส พัทยา จ.ชลบุรี
26 ก.พ.-2 มี.ค.68 อีกหนึ่งสีสันการท่องเที่ยวที่ทุกคนรอคอย.."เทศกาลว่าวนานาชาติบนชายหาดพัทยา" (PATTAYA INTERNATIONAL KITE ON THE BEACH 2025) ณ ริมชายหาดพัทยา
28 ก.พ.-1 มี.ค.68 งานดี ดนตรีเพราะ ในบรรยากาศสุดชิล.."เทศกาลปลาหมึกและอาหารทะเลริมชายหาด" (PATTAYA SQUID FAIR SEAFOOD FESTIVAL) ณ ชายหาดจอมเทียน
28 ก.พ.-2 มี.ค.68 ปิดท้ายเดือนกุมภาพันธ์ด้วยการแข่งขันเทนนิสชายหาดนานาชาติเมืองพัทยา (PATTAYA INTERNATIONAL BEACH TENNIS) ณ ชายหาดจอมเทียน ตลาดประมงพื้นบ้าน
ปฏิทินท่องเที่ยวจังหวัดนครสวรรค์ ประจำเดือนกุมภาพันธ์ 2568
22 มกราคม 2568 - 28 กุมภาพันธ์ 2568 กิจกรรม ไหว้ขอพร...ถิ่นมังกร นครสวรรค์ มงคล (Passport Check in ถิ่นมังกรนครสวรรค์)
6 -10 กุมภาพันธ์ 2568 งานประเพณี "บุญเดือนสาม ปิดทอง หลวงพ่อเดิม วัดหนองโพ"
9 - 12 กุมภาพันธ์ 2568 งาน 119 ปี สืบสานประเพณีเเห่จ้าวพ่อจ้าวเเม่เก้าเลี้ยว
9 กุมภาพันธ์ 2568 Nakhonsawan Dragon Run 2
ตลอดเดือนกุมภาพันธ์ CENTRALNAKHONSAWAN 1YEAR ANNIVERSARY
กิจกรรมพิจิตร เดือนกุมภาพันธ์ 2568
3-6 กุมภาพันธ์ 2568 ศึกเทิดพระเกียรติสมเด็จพระเจ้าเสือ พระบิดามวยไทย +มวยดีวิถีไทย ณ หน้าที่ว่าการอำเภอโพธิ์ประทับช้าง
4-10 กุมภาพันธ์ 2568 งานวันเกิดเจ้าพ่อแก้ว ณ ศาลเจ้าพ่อแก้ว อ.บางมูลนาก จ.พิจิตร
9-13 กุมภาพันธ์ 2568 ปิดทองไหว้พระขึ้นเขาเพ็ญเดือนสาม ณ วัดเขารูปช้าง อ.เมือง จ.พิจิตร
7-16 กุมภาพันธ์ 2568 การแข่งขันจักรยานชิงแชมป์เอเชีย ระดับนานาชาติ ณ บึงสีไฟ อ.เมือง จ.พิจิตร
12-15 กุมภาพันธ์ 2568 งานวันแตงโมโชว์กรงนก ครั้งที่ 31 ณ หน้าที่ว่าการอำเภอวังทรายพูน จ.พิจิตร
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดราชบุรี เดือนกุมภาพันธ์ - มีนาคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดราชบุรี
เดือนกุมภาพันธ์ - มีนาคม 2568
ปฏิทินกิจกรรมท่องเที่ยวนครปฐม เดือนกุมภาพันธ์-มีนาคม 2568
ปฏิทินท่องเที่ยวสระบุรี เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมประจวบคีรีขันธ์ เดือนกุมภาพันธ์ 2568
เดือนกุมภาพันธ์
ปฎิทินท่องเที่ยวกิจกรรมสงขลาหาดใหญ่ เดือนกุมภาพันธ์ 2568
ปฎิทินกิจกรรมปราจีนบุรี กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวและกีฬาจังหวัดสระแก้ว เดือนกุมภาพันธ์ 2568
ปฎิทินกิจกรรมนครนายก กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวและกีฬา ประจำเดือนกุมภาพันธ์ 2568
ปฎิทินเที่ยวจันทบุรี กุมภาพันธ์ 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดระยอง เดือนกุมภาพันธ์ 2568
1-2 กุมภาพันธ์ : พายทะลุปอด SUP Board ณ ป่าชายเลนพระเจดีย์กลางน้ำ อ.เมือง
5-9 กุมภาพันธ์ : อ่าวสมุทรสุดหาดสวนสน in Love ณ ปากคลองแกลง
8 กุมภาพันธ์ : Shimano Blue Race 2025 ณ เกษตรศิริ ฟาร์ม
13-15 กุมภาพันธ์ : แข่งเรือพาย ชิงถ้วยพระราชทาน ณ ท่าน้ำวัดตรี ต.ปากน้ำ อ.เมือง
14-16 กุมภาพันธ์ : Rayong Mesook Festival ณ มีสุขฟาร์ม อ.เมือง
14-16 กุมภาพันธ์ : Somewhere in วังจันทร์ ณ ชุมชนคลองไผ่ อ.วังจันทร์
16 กุมภาพันธ์ : Trail Master Series @ Brookside Valley, Rayong
28 กุมภาพันธ์ - 1 มีนาคม : Rayong Long Beach ชายหาดแหลมแม่พิมพ์ อ.แกลง
กำหนดการสามารถเปลี่ยนแปลงได้ตามความเหมาะสม
ติดต่อ ททท.สำนักงานระยอง : 038-655-420
กิจกรรมสมุทรสงคราม ประจำเดือน กุมภาพันธ์ 2568
31 ม.ค. - 2 ก.พ. 68 | ถนนคนเดินแม่กลอง ณ บริเวณสุธา คาเฟ่ อ.เมืองฯ จ.สมุทรสงคราม
7-9 ก.พ. 68 | งานเฉลิมพระเกียรติพระบาทสมเด็จพระพุทธเลิศหล้านภาลัย ประจำปี 2568 (เชิญชวนเข้าชมงาน วันที่ 8-9 ก.พ. 68) ณ อุทยาน ร.2 อ.อัมพวา จ.สมุทรสงคราม
14 ก.พ. 68 | ขบวนรถไฟ สายใยแห่งรัก ตอน เส้นทางรัก : Love Map in Samutsongkhram ณ สถานีรถไฟแม่กลอง อ.เมืองฯ จ.สมุทรสงคราม
15 ก.พ. 68 | การแข่งขัน SUP ลุ่มแม่กลอง สนามที่ 3 ณ วัดปากน้ำ และตลาดน้ำอัมพวา อ.อัมพวา จ.สมุทรสงคราม
สอบถามข้อมูลเพิ่มเติมและติดตามข่าวสารได้ที่ - ททท.สำนักงานสมุทรสงคราม 0 3475 2847 - Facebook : ททท.สำนักงานสมุทรสงคราม : TAT Samut Songkhram Office - Tiktok : TAT_Samut Songkhram
กิจกรรมสมุทรสาคร เดือน กุมภาพันธ์ 2568
วันที่ 30 มกราคม - 3 กุมภาพันธ์ 2568 | งาน HUB of Seafood ครั้งที่ 2 ณ ลานด้านหน้าศูนย์การค้าเซ็นทรัลมหาชัย อ.เมืองฯ จ.สมุทรสาคร
วันที่ 5-9 กุมภาพันธ์ 2568 | งานประจำปีศาลพันท้ายนรสิงห์ พิธีบวงสรวง 321 ปี ณ ศาลพันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร
วันที่ 6-10 กุมภาพันธ์ 2568 | กิจกรรม Sakhon Guide Fair ตอน CoFFee & SWEET FEST ณ ลานกิจกรรม ชั้น 1 เซ็นทรัลมหาชัย อ.เมืองฯ จ.สมุทรสาคร
วันที่ 26 กุมภาพันธ์ - 3 มีนาคม 2568 | เทศกาลอาหารทะเลจังหวัดสมุทรสาคร ครั้งที่ 22 ณ ศูนย์การค้าแลนด์มาร์คมหาชัย อ.เมืองฯ จ.สมุทรสาคร
สอบถามข้อมูลเพิ่มเติมและติดตามข่าวสารได้ที่ - ททท.สำนักงานสมุทรสงคราม 0 3475 2847 - Facebook : ททท.สำนักงานสมุทรสงคราม : TAT Samut Songkhram Office - Tiktok : TAT_Samut Songkhram
ปฎิทินกิจกรรมท่องเที่ยวพิษณุโลก เพชรบูรณ์ เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวกาญจนบุรี เดือนกุมภาพันธ์
ปฏิทินกิจกรรมท่องเที่ยวอยุธยา เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมท่องเที่ยวสระบุรี เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวสุพรรณบุรี เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวสุพรรณบุรี เดือนกุมภาพันธ์ 2568 สอบถามข้อมูลเพิ่มเติม ททท.สำนักงานสุพรรณบุรี 035-525-880 Facebook : ททท.สำนักงานสุพรรณบุรี : TAT Suphanburi Office
ปฏิทินท่องเที่ยวอ่างทอง เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนกุมภาพันธ์ 2568
28 ม.ค. - 2 ก.พ. 2568 เทศกาลตรุษจีน ปี 2568 สืบสานประเพณีวัฒนธรรมชาวไทยเชื้อสายจีน ณ บริเวณถนนสุรินทรฦๅชัย (ถนน 18 เมตร) อ.เมือง จ.เพชรบุรี
31 ม.ค. - 2 ก.พ. 2568 เปิดโลกทะเลโคลน ครั้งที่ 13 ประจำปี 2568 ณ ตลาดนัดกิ่งแก้ว อ.บ้านแหลม จ.เพชรบุรี
7 - 9 ก.พ. 2568 ชมนก ช้อนดอกเกลือ ลงเรือแถกเลน ท่องเที่ยวเชิงอนุรักษ์ชุมชนตำบลปากทะเล ณ ศูนย์เรียนรู้เรื่องนกและระบบนิเวศ ต.ปากทะเล อ.บ้านแหลม จ.เพชรบุรี
8 ก.พ. 2568 ตลาดสวนสนลอย (Suan Son Loi Market) ณ Centara Life Cha-Am Beach Resort อ.ชะอำ จ.เพชรบุรี
8 ก.พ. 2568 ชมตะวัน_Music Camp ณ ไร่ชมตะวัน หุบกะพง อ.ชะอำ จ.เพชรบุรี
9-10 ก.พ. 2568 เทศน์มหาชาติ และเวียนเทียน บูชาพระบรมสารีริกธาตุ ถวายเป็นพุทธบูชา เนื่องในเทศกาลวันมาฆบูชา ณ พุทธสถานวัดพระแก้วน้อย และพระธาตุจอมเพชร พิพิธภัณฑสถานแห่งชาติ พระนครคีรี อ.เมือง จ.เพชรบุรี
14 ก.พ. 2568 ชะอำ วาเลนไทน์ สไตล์เวนิส ณ สยามเวเนเซีย หัวหิน-ชะอำ อ.ชะอำ จ.เพชรบุรี
21 ก.พ. - 2 มี.ค. 2568 (10 วัน 10 คืน) งานพระนครคีรีเมืองเพชร ครั้งที่ 38 ณ อุทยานประวัติศาสตร์พระนครคีรี (เขาวัง) และบริเวณโดยรอบ อ.เมือง
งานวัดประจำปี ปิดทอง-ฝังลูกนิมิต จ.เพชรบุรี
29 ม.ค. - 6 ก.พ. 2568 เพชรสุวรรณ อ.บ้านแหลม
29 ม.ค. - 6 ก.พ. 2568 วัดห้วยตะแกละ อ.ท่ายาง
29 ม.ค. - 6 ก.พ. 2568 วัดหนองมะกอก อ.แก่งกระจาน
8 - 16 ก.พ. 2568 วัดถ้ำเขาย้อย อ.เขาย้อย
9 - 13 ก.พ. 2568 วัดในกลาง อ.บ้านแหลม
9 - 13 ก.พ. 2568 วัดพระพุทธบาทเขาลูกช้าง อ.ท่ายาง
13 - 15 ก.พ. 2568 วัดเจริญศรีมณีผล (วัดใหม่บางจาก)
ปฏิทินกิจกรรม นราธิวาส ยะลา ปัตตานี เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวพังงา ประจำเดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวพังงา ประจำเดือนกุมภาพันธ์ 2568 ㅤ
งานประเพณีแห่ผ้าขึ้นธาตุประจำปี 2568 วัดราษอุปถัมภ์ (วัดบางเหรียง) พังงา FB: อบต.บางเหรียง อ.ทับปุด จ.พังงา 04-12 กุมภาพันธ์ 2568
งานแตงโมคุระบุรี สนามที่ว่าการอำเภอคุระบุรี FB: ที่ทำการปกครองอำเภอคุระบุรี จังหวัดพังงา 07-16 กุมภาพันธ์ 2568 ㅤ KHAOLAK BREW FEST 2025 ลานโวยวายพาร์ค ซอยบางเนียง ตะกั่วป่า FB: Khaolak Brew Master 08-09 กุมภาพันธ์ 2568
มาฆบูชา วัดพระธาตุคีรีเขต เมืองตะกั่วป่า FB: วัดพระธาตุคีรีเขต 11-12 กุมภาพันธ์ 2568 ㅤ
จากตะโกลา สู่ตะกั่วป่า ครั้งที่ 11 (Takua Pa Past to The Present) เมืองตะกั่วป่า อ.ตะกั่วป่า FB: เทศบาลเมืองตะกั่วป่า 11-14 กุมภาพันธ์ 2568 ㅤ
ประเพณีจุดมาฆประทีปโคมไฟ วัดมาตุคุณาราม ต.กระโสม อ.ตะกั่วทุ่ง FB: เทศบาลตำบลกระโสม 12 กุมภาพันธ์ 2568 ㅤ มหกรรมอาหาร สร้างงาน สร้างรายได้สู่ชุมชน ครั้งที่ 1 ซอยเทศบาล 1 (ซอยลูกแจ) อ.ทัปปุด จ.พังงา FB: เทศบาลตำบลทับปุด 13-14 กุมภาพันธ์ 2568 ㅤ
Natai 5 K, Run on the Beach สะพานนาใต้ โคกกลอย พังงา FB: The Original Night run in Phangnga 22 กุมภาพันธ์ 2568
ปฏิทินกิจกรรมจ.อุดรธานี เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมบึงกาฬ เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรม จ.หนองคาย เดือนกุมภาพันธ์ 2568
กิจกรรมบุรีรัมย์ เดือนกุมภาพันธ์ 2568
เที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม พบกับกิจกรรมตลอดเดือนกุมภาพันธ์ 2568
วันที่ 2 กุมภาพันธ์ 2568 REVO THAI LEAGUE บุรีรัมย์ ยูไนเต็ด VS การท่าเรือ เอฟซี ณ สนามช้าง อารีนา สอบถามเพิ่มเติมโทร : 044 666 445
วันที่ 9-10 กุมภาพันธ์ 2568 ปล่อยนกกระเรียนคืนสู่ธรรมชาติ ครั้งที่ 13 ณ จุดสกัดป่ามะพร้าว อ่างเก็บน้ำห้วยจรเข้มาก สอบถามเพิ่มเติมโทร : 09 0286 8327
วันที่ 12 กุมภาพันธ์ 2568 AFC Champions League Elite 2025 บุรีรัมย์ ยูไนเต็ด vs อุลซันฮุนได ณ สนามช้าง อารีนา สอบถามเพิ่มเติมโทร : 044 666 445
วันที่ 12-13 กุมภาพันธ์ 2568 PT Grand Prix of Thailand 2025 (PRE SEASON TEST) ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต สอบถามเพิ่มเติมติดต่อ : 044 604 200
วันที่ 14 กุมภาพันธ์ 2568 Love Wins @ เพ ลา เพลิน รักมั่นคง ยืนยง ดั่งนกกระเรียน ณ เพ ลา เพลิน บุรีรัมย์ สอบถามเพิ่มเติมติดต่อ : 08 7797 6425
วันที่ 9-15 กุมภาพันธ์ 2568 งานปิดทองพระเจ้าใหญ่ ปีที่ 80 ณ วัดหงษ์ บ้านศีรษะแรต สอบถามเพิ่มเติมติดต่อ : 08 1807 9665
วันที่ 16 กุมภาพันธ์ 2568 กินปลาหน้าเขื่อน ชวนเพื่อนวิ่ง @โนนดินแดง ณ เขื่อนลำนางรอง อำเภอโนนดินแดง สอบถามเพิ่มเติมโทร : 06 3901 2625
วันที่ 19-25 กุมภาพันธ์ 2568 เทศกาลกินปลาน้ำมูลและงานกาชาดอำเภอสตึก ณ หน้าที่ว่าการอำเภอสตึก สอบถามเพิ่มเติมติดต่อ : 08 0329 7878
วันที่ 26 กุมภาพันธ์ 2568 Revo Cup บุรีรัมย์ ยูไนเต็ด VS บีจี ปทุม ยูไนเต็ด ณ สนามช้าง อารีนา สอบถามเพิ่มเติมโทร : 044 666 445
วันที่ 28 กุมภาพันธ์ – 2 มีนาคม 2568 PT Grand Prix of Thailand 2025 ณ สนามช้าง อินเตอร์เนชั่นแนล เซอร์กิต สอบถามเพิ่มเติมติดต่อ : 044 604 200 เที่ยวชมถนนคนเดินเซราะกราววอล์คกิ้ง สตรีท (ทุกวันเสาร์ - อาทิตย์ 16.00 - 21.00 น.) ถนนรมย์บุรี เดือนต่อไปจะพาไปพบกับกิจกรรมท่องเที่ยวที่ไหน... อย่าลืมกดติดตามไว้นะคะ จะได้ไม่พลาดแหล่งท่องเที่ยวบุรีรัมย์ 365 วัน Amazing ยิ่งกว่าเดิม เปิดประสบการณ์ท่องเที่ยวเมืองกีฬา เที่ยววิถีชุมชน กินอาหารถิ่น เที่ยวทั้งปีที่ "บุรีรัมย์" เมืองปราสาทสองยุค...มหานครแห่งกีฬา
เที่ยวบุรีรัมย์ง่ายนิดเดียว สอบถามข้อมูลเพิ่มเติม : ททท. สำนักงานบุรีรัมย์ โทร. 0 4463 4722 หรือโทร. 1672 TAT Contact Center เพื่อนร่วมทาง
ปฏิทินท่องเที่ยวสกลนคร เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวสกลนคร เดือนกุมภาพันธ์ 2568
วันที่ 24 ม.ค - 2 ก.พ 2568 งานรวมน้ำใจไทสกลและงานกาชาดจังหวัดสกลนคร ประจำปี 2568 จัดเต็ม 10วัน 10คืน ที่ศูนย์ราชการจังหวัดสกลนคร ลุ้นเสี่ยงโชคได้ของรางวัล อิ่มอร่อยกับร้านอาหาร และสตรีทฟู้ดกว่า 100 ร้านค้า • สนุกกับการเดินช้อปปิ้ง และกิจกรรมความบันเทิงอื่นๆ มากมาย
วันที่ 31 ม.ค - 2 ก.พ 2568 งานเทศกาลโส้รำลึก ครั้งที่ 44 ประจำปี 2568 ณ สนามหน้าศูนย์วัฒนธรรมไทโส้ อำเภอกุสุมาลย์ จังหวัดสกลนคร • พิธีบวงสรวงพระอรัญอาสาเจ้าเมืองเผ่าไทโส้ • ขบวนแห่เจ้าเมืองกุสุมาลย์มณฑลและขบวนแห่ทางวัฒนธรรมแห่งวิถีชีวิตไทโส้ • นิทรรศการวิถีชีวิตชาวโส้ การแสดงจากตำบล ต่างๆ ในเขตอำเภอกุสุมาลย์ ชมนิทรรศการของหน่วยงานต่างๆ
วันที่ 1 - 9 กุมภาพันธ์ 2568 งานจัดการแข่งขันบาสเกตบอล 3x3 และ 5x5 พร้อมเงินรางวัล และถ้วยรางวัล สำหรับทีมผู้ชนะการแข่งขัน สถานที่แข่งขัน มหาวิทยาลัยราชภัฏสกลนคร
วันที่ 1 - 9 กุมภาพันธ์ 2568 งาน โฮมเธอละปี Home Therapy Rally Workshop at Sakonnakhon กิจกรรม Rally Workshop 10 แบรนด์ ที่สกลนคร อาทิ ภูคราม Bhukram > นิทรรศการ 10 ปีภูคราม , แสดงและเล่าเรื่องผลงานผ้าปักโดยศิลปินผู้ทอผ้า ย้อมผ้า ตัดผ้า และปักผ้า เป็นต้น กะเลิง ผัก เทิงภู > Workshop ธรรมชาติเขาบำบัด/hill heal
วันที่ 9 - 11 กุมภาพันธ์ 2568 งานประเพณีบุญเบิกฟ้าเดือน 3 ครั้งที่ 8 ประจำปี 2568 สภาวัฒนธรรมอำเภอบ้านม่วง ณ ลานที่ว่าการอำเภอบ้านม่วง อำเภอบ้านม่วง จังหวัดสกลนคร กิจกรรมในงาน อาทิ • ชมการจัดนิทรรศการภูมิปัญญาชาวบ้านจักสาน จากวัสดุธรรมชาติฯ • ชมการแสดงการสืบสานศิลปะวัฒนธรรมเผ่าพันธุ์พื้นเมือง 3 ตำบล ประกอบด้วย ตำบลบ้านม่วง ตำบลมาย ตำบลบ่อแก้ว • ร่วมงานพาแลงและกิจกรรมรำวงย้อนยุคการกุศล
วันที่ 13 - 15 กุมภาพันธ์ 2568 งานมหกรรมมูนมังอีสาน ครั้งที่ 16 “อีโพะพาเล่น อิเบ๊ะพารำ” ณ บริเวณริมห้วยทราย มหาวิทยาลัยราชภัฏสกลนคร ตั้งแต่เวลา 09.00 - 21.00 น. • ประกวดการแสดงศิลปวัฒนธรรมอีสาน ในหัวข้อ “การละเล่นพื้นบ้านอีสาน” พร้อมชิงรางวัลรวมมูลค่า 21,000 บาท • กิจกรรมพิ้นบ้าน ชมการแสดงสุดตระการตา • ชิมอาหารอีสานรสเด็ด และช้อปสินค้าท้องถิ่นคุณภาพ กิจกรรมที่ไม่ควรพลาด Workshop การละเล่นอีสานภูมิปัญญาท้องถิ่น
วันที่ 13-15 กุมภาพันธ์ 2568 พบกับงาน ผ้าไทยใส่ให้สนุก "ดอนกอยโมเดล" ณ วิชชาลัยดอนกอย วิถีแห่งการพัฒนาที่ยั่งยืน หมู่ที่ 2 ตำบลสว่าง อำเภอพรรณานิคม จังหวัดสกลนคร กิจกรรมภายในงาน • การแสดงและจัดจำหน่ายสินค้าผ้าไทยขึ้นชื่อแต่ละพื้นที่ของจังหวัดสกลนคร • การแสดงและจำหน่ายสินค้า OTOP • กิจกรรม Work Shop ผ้าย้อมคราม • กิจกรรมสินค้านาทีทอง
วันที่ 13 กุมภาพันธ์ 2568 พบกับ เต๋า ภูศิลป์ ชมฟรี !! จัดโดยสำนักงานพัฒนาชุมชนจังหวัดสกลนคร ร่วมกับ อำเภอพรรณานิคม
วันที่ 14 - 20 กุมภาพันธ์ 2568 งานเกษตรและเทคโนโลยีพื้นบ้านอีสาน ครั้งที่ 29 ประจำปี 2568 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน • ปีนี้เนรมิตรทุ่งทานตะวัน พร้อมให้ผู้เที่ยวชมได้ถ่ายภาพ • ชิม ช้อป ชม ตลาดนัดสินค้า OTOP สินค้าจากชุมชน และอีกมากมายภายในงาน
กาดระเบียงสุข (ตลาดเช้าริมกว๊านพะเยา)
งานส่งเสริมการท่องเที่ยว เทศบาลเมืองพะเยา 14 กุมภาพันธ์ เวลา 16:56 น. กาดระเบียงสุข (ตลาดเช้าริมกว๊านพะเยา) กลับมาอยู่ที่จุดเดิมแล้วนะคะ ชมรมผู้ประกอบการด้านอาหาร ระเบียงสุข พักผ่อนวันหยุด เดินเที่ยวกาดระเบียงสุข รับประทานอาหาร ชมวิว จิบกาแฟริมกว๊านพะเยา อากาศสดชื่น เย็นสบาย ผ่อนคลายกับธรรมชาติ ที่นี่ที่เดียวกว๊านพะเยา กาดระเบียงสุข มีทุกวันเสาร์ - อาทิตย์ เวลา 06.30 - 11.30 น กิจกรรมตักบาตร มีทุกวันเสาร์ - อาทิตย์ เวลา 07.30 น. เป็นต้นไป พิกัด : บริเวณตรงข้ามกับเรือนโบราณริมกว๊านพะเยา *** กิจกรรมตักบาตรริมกว๊านพะเยา เริ่มอาทิตย์หน้านะคะ
ปฏิทินกิจกรรมจังหวัดสตูล เดือนกุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวชุมพร ประจำเดือน กุมภาพันธ์ 2568
ปฏิทินท่องเที่ยวระนอง ประจำเดือน กุมภาพันธ์ 2568
ปฏิทินกิจกรรม ปทุมธานี เดือนกุมภาพันธ์-มีนาคม 2568
ปฏิทินกิจกรรม นนทบุรี เดือนมีนาคม 2568
กิจกรรมชลบุรี เดือนกุมภาพันธ์ 2568
กิจกรรมชลบุรี เดือนกุมภาพันธ์ 2568 ปักหมุดมาเที่ยวชลบุรีกันได้เลย
8-9 ก.พ. Classic Car Show Pattaya
9 ก.พ. งานวิ่งเกาะล้านเทรล 2025
13-15 ก.พ. BURAPA PATTAYA BIKE WEEK
14 ก.พ. PATTAYA MARRIAGE EQUALITY CELEBRATION 2025
14 -15 ก.พ. เทศกาล แห่โคม ชมพระฉาย สืบสายศิลป์ ถิ่นหนองจับเต่า เขาชีจรรย์ ครั้งที่ 11
14-23 ก.พ. การแข่งขันฟุตบอลชายหาดนานาชาติเมืองพัทยา
20-23 ก.พ. Honda LPGA Thailand 2025
26 ก.พ.-2 มี.ค. เทศกาลว่าวนานาชาติบนชายหาดพัทยา
28 ก.พ.-1 มี.ค. Pattaya Squid Fair 2025
28 ก.พ.-2 มี.ค. การแข่งขันเทนนิสชายหาดนานาชาติเมืองพัทยา
ปฏิทินกิจกรรม ตรัง กุมภาพันธ์ 2568
ต้อนรับสู่เดือนแห่งความรักด้วยอีเวนต์สุดเลิฟ ชวนคู่รักทุกแบบทุกสไตล์มาบอกรักกัน และสายรักษ์ทะเลห้ามพลาดกิจกรรมศิลปะจากขยะทะเลปฏิทินกิจกรรมท่องเที่ยวจังหวัดยโสธร ประจำเดือนกุมภาพันธ์ ปี 2568
ตารางปฏิทินท่องเที่ยวและกิจกรรมในจังหวัดภูเก็ต ประจำเดือน กุมภาพันธ์ 2568
ตารางปฏิทินท่องเที่ยวและกิจกรรมในจังหวัดภูเก็ต ประจำเดือน กุมภาพันธ์ 2568
ปฏิทินกิจกรรม กระบี่ เดือนกุมภาพันธ์ 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเชียงราย เดือนกุมภาพันธ์ - มีนาคม 2568
ปฏิทินกิจกรรมท่องเที่ยวจังหวัดเชียงราย เดือนกุมภาพันธ์ - มีนาคม 2568 มีทั้งเทศกาล งานประเพณี และกิจกรรมอีกมากมาย
งานวันหอมแดง แข่งเรือยาวและงานกาชาด ประจำปี 2568 วันที่ 1-5 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน วันหอมแดง แข่งเรือยาวและงานกาชาด ประจำปี 2568 วันที่ 1-5 กุมภาพันธ์ 2568 บริเวณหนองสระแก้ว อ.หนองหงส์ บุรีรัมย์
KIHA 183 เพชรบุรี 18 และ 19 มกราคม 2568 (One Day Trip)
Good coffee and green market เทศกาลกาแฟครั้งที่ 2 ที่ราชภัฏแม่สอด วันที่ 1 - 2 กุมภาพันธ์ 2568
Good coffee and green market เทศกาลกาแฟครั้งที่ 2 ที่มหาวิทยาลัยราชภัฏกำแพงเพชร แม่สอด วันที่ 1 - 2 กุมภาพันธ์ 2568 กิจกรรมต่าง ๆ มากมาย เช่น ✅ร้านกาแฟ ✅การแสดงดนตรีสด ✅ร้านค้าสีเขียว ร้านอาหาร ✅การเสวนาสภากาแฟสู่เมืองสีเขียวเชิงสร้างสรรค์ กิจกรรม workshop เก๋ๆจากทีม ENJOYOURS ที่ได้เล่นรู้อย่างสนุกกันได้ทั้งครอบครัว อาทิ workshop ครัวจิ๋ว workshop เกลือหอมสปาสมุนไพร workshop กระถางโกโก้รักษ์โลก workshop Doodle Paper Art
ตลาดนัดสีเขียว Tak Green Heart - Green Market 1 กุมภาพันธ์ 2568 LINK
ตลาดนัดสีเขียว Tak Green Heart - Green Market สัปดาห์ที่ 7 วันเสาร์ที่ 1 กุมภาพันธ์ 2568 ตลาดตากวินเทจ ที่ ตลาดนัดสีเขียว โดย สำนักงานพาณิชย์จังหวัดตาก ✅มีสินค้าที่เขาจะนำมาจำหน่าย อาทิเช่น สินค้าเกษตรอินทรีย์ ผัก ผลไม้ ปลอดสาร รวมไปถึง ผลผลิตจากศูนย์พัฒนา โครงการหลวงเลอตอ ผลผลิตจากโคกหนองนา ✅สินค้าอัตลักษณ์ชุมชน สินค้า GI สินค้าbcg /sdg ของจังหวัดตาก และภายในตลาดยังมี ศูนย์รวม “กาแฟแห่งขุนเขา” ของจังหวัดตากอีกด้วย สกัดแก้วต่อแก้วกันเลย โดย บาริสต้า ชั้นนำ จาก TAK COFFEE TEAM และร้านกาแฟชื่อดัง กว่า 10 ร้าน และร้านดังอีกหลายร้าน
Coffee & Crafts พนัสนิคม 1-2 ก.พ. 2568
งาน PLAYพนัสนิคม ประจำเดือน กุมภาพันธ์ มาในธีม Coffee & Crafts 1-2 ก.พ. 2568 ครั้งแรกของการรวมพลคนรักกาแฟและงานคราฟต์ ในอ.พนัสนิคม ยกร้านกาแฟและคาเฟ่มาอยู่กลางสวนสาธารณะเมืองพนัสนิคม 22 ร้าน มีกาแฟหลากหลายสายพันธุ์ หลากหลายเมนู มาให้ทุกคนได้ชิมตั้งแต่เข้ายันค่ำ รวมศิลปินงานคราฟต์ 16 ร้าน นำ #ผลิตภัณฑ์ทำมือ #งานศิลปะ #งานเวิร์คช็อปสร้างสรรค์ มาแชร์และแบ่งปันไอเดีย ในการสร้างงานแบบชิ้นเดียวในโลก
งานเพลย์พนัสนิคม จัดทุกวันเสาร์-อาทิตย์ ต้นเดือน เดือนละครั้ง สถานที่จัด : สวนสาธารณะเทศบาลบาลเมืองพนัสนิคม เวลา 10.00-20.00 น. งานนี้ เป็นส่วนหนึ่ง ของโครงการวิจัย"การพัฒนาเมืองแห่งทุนทางวัฒนธรรมที่ยั่งยืน และเครือข่ายย่านวัฒนธรรมชุมชน" เทศบาลเมืองพนัสนิคม จังหวัดชลบุรี . ซึ่งเป็นโครงการวิจัย โดย มหาวิทยาลัยศิลปากร ได้รับทุนอุดหนุนจาก บพท. "หน่วยบริหารและจัดการทุนด้านการพัฒนาระดับพื้นที่
โฮมเธอละปีแรลลี่เวิร์คช๊อป @สกลนคร 1- 9 กุมภาพันธ์ 2568
Home Therapy Rally Workshop @SakonnaKhon โฮมเธอละปีแรลลี่เวิร์คช๊อป @สกลนคร 1- 9 กุมภาพันธ์ 2568 กิจกรรมรวมกลุ่มสร้างสรรค์ และบอกเล่าเรื่องราว ผ่านงานสร้างสรรค์ในชุมชน วิถีคนสกลนคร ทั้งงานศิลปะ หัตถกรรม เพาะปลูก ทอผ้า ย้อมผ้าด้วยสีธรรมชาติ ปักผ้า เย็บผ้า ทำเครื่องปั้นดินเผา เครื่องเคลือบเซรามิก เครื่องหนัง ปลูกผัก ปลูกข้าว ทำขนม
รวม10 สตูดิโอสร้างสรรค์ พร้อมให้คุณมาworkshop กัน ดังนี้ 1.Vitme Handcraft Studio 2. ดอนหมูดิน Donmoodin บ้านช่างปั้น 3. ภูคราม: Bhukram 4.กะเลิง ผัก เทิงภู 5.ป่านาคำหอม: Pa Na Come Home 6. Mann Craft 7.สุขชม: SukChom 8. รักกูหลงกู Home Breaded 9. อาร์ตเพลย์ สตูดิโอ: Art-play studio 10.ข้าวหอมดอกฮัง: HomDoKHung Rice
แนะนำเส้นทางดังนี้ เส้นทางที่ 1 อ.เมือง-ภูพาน : Vitme Handcrafted > DonMooDin > Bhukram > KaLeong Pak ToengPhu เส้นทางที่ 2 บ้านหนองแดง-บ้านหนองยาง: Pa Na Come Home > Mann Craft > Sukchom > รักกูหลงกู เส้นทางที่ 3 กุสุมาลย์ -บ้านโคกสะอาด: Art Play Studio, ข้าวหอมดอกฮัง
ซุโขทัย Light up : Light & Love ทุกวันศุกร์ - วันเสาร์ - วันอาทิตย์ ตลอดเดือนกุมภาพันธ์ 2568
ซุโขทัย Light up : Light & Love ชมการเปิดไฟประดับโบราณสถาน Light Up และการประดับตะคัน ณ วัดมหาธาตุ อุทยานประวัติศาสตร์สุโขทัย ทุกวันศุกร์ - วันเสาร์ - วันอาทิตย์ ตลอดเดือนกุมภาพันธ์ 2568
กิจกรรมภายในงาน : -ประดับไฟโบราณสถานวัดมหาธาตุ แบบเต็มรูปแบบ -ออกร้านจำหน่ายอาหาร ของที่ระลึก ร้านเช่าชุดไทย ร้านจำหน่ายหนังสือกรมศิลปากร -การแสดงทางศิลปวัฒนธรรมทุกวันเสาร์ และวันมาฆบูชา (โดยวิทยาลัยนาฏศิลปสุโขทัย) ดังนี้ วันเสาร์ที่ 1 กุมภาพันธ์ 2568 การแสดงวิพิธทัศนา “รุ่งอรุณแห่งความสุข” วันเสาร์ที่ 8 กุมภาพันธ์ 2568 การแสดงวิพิธทัศนา “ชวนเต้น ชวนรำ ทำ Craft” วันเสาร์ที่ 15 กุมภาพันธ์ 2568 การแสดงอิงประวัติศาสตร์ “นักรบแห่งบางขลัง” วันเสาร์ที่ 22 กุมภาพันธ์ 2568 การแสดงดนตรีสากล “Song of Love” โดย วง Super Natural (ชนะเลิศการประกวดระดับประเทศ) วันเสาร์ที่ 1 มีนาคม 2568 การแสดง “หมากรุกคน” การแจกตะคันแสงแห่งความรัก (Light & Love) เป็นตะคันรูปดอกกุหลาบ จำนวน 200 อัน ให้ผู้เข้าร่วมกิจกรรมนำไปบูชาโบราณสถาน ในวันแห่งความรัก วันที่ 14 กุมภาพันธ์ 2568
งาน Nan Connect on Tour 1-2 กุมภาพันธ์ 2568
ชวนกันมาเวิร์คชอปทั้งครอบครัว กับงาน Nan Connect on Tour ร่วม ช้อปปิ้งสินค้า ทานอาหาร เครื่องดื่มและงาน Craft ต่างๆ อีกมากมาย วันที่ 1-2 กุมภาพันธ์ 2568 เวลา 13:00-18:00 น. ณ 105 VILLE เวียงสา พบกับ เมนูสร้างสรรค์วัตถุดิบจากเมืองน่าน • ย้อมคราม by Srimorn Indigo • ร้อยสร้อยเครื่องเงิน by Mhan • ทานาบาตะตั๋วเมือง by อ.โชติ ปราชญ์ล้านนา • งานปักผ้าเขียนเทียน by คณะครูและนักเรียน โรงเรียนราชประชานุเคราะห์ 56
LAGUNA Phuket LUNAR FEST 2025 Date: 1 – 2 February 2025
LAGUNA Phuket LUNAR FEST 2025 Celebrate Chinese New Year in style at the Laguna Phuket Lunar Fest, a family-friendly festival blending traditional culture with modern entertainment. Set in the stunning Laguna Phuket, this event invites both local and international guests to experience the best of Chinese traditions in a world-class setting. Date: 1 – 2 February 2025 Venue: Laguna Grove Time: 17:00 – 22:00 Festival Highlights: • Live Concerts by Thai Boy Band "Proxie" (1 Feb) and "China Dolls, the Legendary Duo with Chinese Charm” (2 Feb) • Little Angpao Kids Contest (6-8 years old) • Live Music by Khaitun Yannarint, winner of The Golden Song Season 5, 2023 • Annie Guzheng Angel • Lion Dance • Chinese Cultural Performances • Food Stall Market and Handicraft Activities Join us for two unforgettable days of cultural celebration, entertainment, and family fun at Laguna Phuket Lunar Fest 2025! Free Entry
KIHA 183 โคราช ปราสาทหินพิมาย 25 - 26 มกราคม 2568 (2 วัน 1 คืน)
งาน Ayutthaya Morning Drip # 5 วันอาทิตย์ที่ 2 กพ 2568 LINK
งาน Ayutthaya Morning Drip # 5 “The Season of Love “ มาจิบกาแฟ ทานขนม นั่งฟังเพลงจากแผ่น Vinyl ขับขานด้วยมนต์เสน่ห์ของ saxophone และ Folk song ใต้ร่มไม้ สายลม แสงแดด และสองเราไปด้วยกัน วันอาทิตย์ที่ 2 กพ 2568 ตั้งแต่ 06:00 - 18:00 ป้อมเพชร ริมน้ำเจ้าพระยา - ป่าสัก อยุธยา
สดุดีวีรชนค่ายบางระจัน ประจำปี 2568 วันที่ 2-8 กุมภาพันธ์ 2568
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานลพบุรี ขอเชิญร่วมงาน “สดุดีวีรชนค่ายบางระจัน” ประจำปี 2568 เพื่อรำลึกถึงวีรกรรมอันกล้าหาญของเหล่าวีรชนชาวบ้านบางระจัน ที่ได้เสียสละชีวิต แสดงความรักชาติ และความสามัคคี รวมพลังต่อสู้กองทัพพม่าข้าศึกจนได้รับชัยชนะถึง 7 ครั้ง นานถึง 5 เดือน จึงได้พ่ายแพ้ข้าศึก เมื่อวันแรม 2 ค่ำเดือน 8 ปีจอ พ.ศ. 2309 สำหรับในปีนี้ สถานที่จัดงานจะมีอยู่ 2 แห่งด้วยกัน ซึ่งอยู่คนละฝั่งถนน นักท่องเที่ยวสามารถเดินเที่ยวชมได้ทั้ง 2 ฝั่ง ดังนี้
1. ฝั่งอุทยานวีรชนค่ายบางระจัน อำเภอค่ายบางระจัน จังหวัดสิงห์บุรี จัดขึ้นระหว่างวันที่ 2-6 กุมภาพันธ์ 2568 และ
2. ฝั่งวัดโพธิ์เก้าต้น อำเภอค่ายบางระจัน จังหวัดสิงห์บุรี จัดขึ้นระหว่างวันที่ 2-8 กุมภาพันธ์ 2568
ภายในงานพบกับกิจกรรม อาทิ งานปิดทองไหว้พระประจำปี กราบสักการะหลวงปู่ธรรมโชติ สักการะอนุสาวรีย์วีรชนค่ายบางระจัน ชมตลาดไทยย้อนยุคบ้านระจัน ชิมอาหารอร่อยห้ามพลาด อาทิ เมี่ยงกลีบบัว ผัดไทย ปลาเห็ด ขนมไทย ขนมกง เลือกซื้อสินค้า OTOP ของดีสิงห์บุรี นอกจากนี้ยังมี การแสดงแสง สี เสียง อิงประวัติศาสตร์ พิพิธภัณฑ์ประวัติศาสตร์วีรชนค่ายบางระจัน (เปิดให้เข้าชมยามค่ำคืนเป็นกรณีพิเศษ) และชมการแสดงคอนเสิร์ตจากศิลปินดังทุกค่ำคืน
เจี๊ยะ โม่ง โร่ง โม่น เดิง ราชบุรี : กินอยู่ดูมอญ เมืองราชบุรี ครั้งที่ 9 ประจำปี 2567 วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568
งานสืบสานประเพณีวิถีวัฒนธรรมชาติพันธุ์มอญ "เจี๊ยะ โม่ง โร่ง โม่น เดิง ราชบุรี : กินอยู่ดูมอญ เมืองราชบุรี ครั้งที่ 9 ประจำปี 2567 วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568 ณ วัดมะขาม ต.คุ้งพยอม อ.บ้านโป่ง จ.ราชบุรี
พบกับความงดงามของพระเจดีย์มอญ อายุกว่า 200 ปี ร่วมเขียนชื่อห่มผ้าพระเจดีย์ และชมขบวนแห่วัฒนธรรมมอญสุดยิ่งใหญ่ พร้อมด้วยกิจกรรมที่น่าสนใจอีกมากมาย ????ชม การแสดงศิลปวัฒนธรรมมอญและการแสดงของกลุ่มชาติพันธุ์ , การประกวดสำรับข้าวแช่มอญ , การสาธิตภูมิปัญญาท้องถิ่น และการสาธิตอาหารพื้นถิ่นของชาวมอญ ????ชิม อาหารมอญอันเป็นเอกลักษณ์จากสามตำบล ????ช้อป สินค้าชุมชนนานาชนิด ผลิตภัณฑ์ท้องถิ่น ผลิตภัณฑ์วัฒนธรรม
พิกัดสถานที่จัดงาน : วัดมะขาม ต.คุ้งพยอม อ.บ้านโป่ง จ.ราชบุรี
กิจกรรมปั่นจักรยาน "Slow Life Bike Rally @RATCHABURI" วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568
สำนักงานการท่องเที่ยวและกีฬาจังหวัดราชบุรี เชิญชวนผู้ที่สนใจ สมัครเข้าร่วมปั่นจักรยานกิจกรรม "Slow Life Bike Rally @RATCHABURI" วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568 รวมระยะทาง 46 กิโลเมตร จุด Start : วัดเขาช่องพราน อ.โพธาราม จุด Finish : วัดโขลงสุวรรณคีรี อ.เมืองราชบุรี ✅ ลงทะเบียนเข้าร่วมกิจกรรม [
รายละเอียด]
กาดราชวงศ์ ถนนคนรักต้นไม้...แหล่งพบปะของคนรักต้นไม้ วันอาทิตย์ที่ 2 กุมภาพันธ์ 68
พบกับ กาดราชวงศ์ ถนนคนรักต้นไม้...แหล่งพบปะของคนรักต้นไม้ ที่เราจะมาพบกันบนถนนราชวงศ์ ในเดือนกุมภาพันธ์นี้ วันอาทิตย์ที่ 2 กุมภาพันธ์ 68 เวลา 08.00 - 13.00 น. ณ แนวถนนราชวงศ์ จากร้านนิทานบ้านต้นไม้ ถึง
ร้านข้าวซอยแสงเพียร
รายละเอียดสินค้าภายในงาน - ต้นไม้มงคล ไม้ประดับ ไม้ด่าง ดินปลูก - ผักสลัดนานาชนิด - งานคราฟท์ งานทำมือ - สัตว์เลี้ยง สัตว์แปลก ปลากัด - น้ำเงี้ยว ส้มตำ ฯ และยังมีดนตรีเพลงเพราะๆ ให้เราเพลิดเพลินไปกับการจิบกาแฟ
เดินวิ่งงานวันเต่าโลก ครั้งที่ 8 RUN WORLD TURTLE DAY 2025 วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568
เดินวิ่งงานวันเต่าโลก ครั้งที่ 8 RUN WORLD TURTLE DAY 2025 กำหนดการวิ่ง (Running date) : วันอาทิตย์ที่ 2 กุมภาพันธ์ 2568 เวลา 05.00-08.00 น. สถานที่ : ณ บริเวณงานวันเต่าโลก ลานตลาดนัดหน้าเขา KM Park ถนนสายฉลุง-ทุ่งหว้า (สาย 404) ตำบลกำแพง อำเภอละงู จังหวัดสตูล ประเภท/ ระยะการแข่งขัน (Categories) - Fun Run 5.5 KM. ชาย/ หญิง - Mini Marathon 10 KM. ชาย/ หญิง
6 ไฮไลท์ประเพณีภาคใต้ ประจำเดือนกุมภาพันธ์ 2568
ยลเสน่ห์เมืองใต้ สัมผัสประเพณีและวัฒนธรรมกับ 6 ไฮไลท์ประเพณีภาคใต้ ประจำเดือนกุมภาพันธ์ 2568 เที่ยวใต้ by ททท. ขอเชิญชวนทุกท่านไปทำบุญ ไปเที่ยวพร้อมร่วมงานประเพณีต่างๆ เปิดประสบการณ์ที่แปลกใหม่และน่าประทับใจไปด้วยกัน
1. งานมหกรรมท่องเที่ยวปัตตานี อาเซียนกตัญญูคู่ฟ้า มหาสมโภชเจ้าแม่ลิ้มกอเหนี่ยว ณ ศาลเจ้าเล่งจูเกียงปัตตานี (ศาลเจ้าแม่ลิ้มกอเหนี่ยว) จังหวัดปัตตานี 9 - 15 กุมภาพันธ์ 2568
2. งานสมโภชเจ้าพ่อเล่าเอี๊ยะกง ตำนานเกี้ยวปักดิน หนึ่งเดียวในประเทศไทย ณ ศาลเจ้าจ่ายเฮงเกียง (เล่าเอี๊ยะก๋ง) จังหวัดปัตตานี 10 - 14 กุมภาพันธ์ 2568
3. กิจกรรมแห่ผ้าห่มเจดีย์ วัดเขาเมืองเก่าชัยบุรี ณ พระธาตุเจดีย์วัดเขาเมืองเก่าพัทลุงตำบลชัยบุรี่ อำเภอเมือง จังหวัดพัทลุง 12 กุมภาพันธ์ 2568
4. มาฆะบูชา แห่ผ้าขึ้นธาตุ ประจำปี 2568 ณ วัดพระมหาธาตุ วรมหาวิหาร จังหวัดนครศรีธรรมราช 12 กุมภาพันธ์ 2568
5. กิจกรรมแห่ผ้าขึ้นธาตุ วัดพระบรมธาตุเจดีย์เขียนบางแก้ว ณ วัดพระบรมธาตุเจดีย์เขียนบางแก้ว อำเภอเขาชัยสน จังหวัดพัทลุง 12 กุมภาพันธ์ 2568
6. งานแห่ผ้าห่มพระธาตุศรีสุราษฎร์ แลธรรมชาติเขาท่าเพชร ณ ศาลหลักเมืองฯ และพระธาตุศรีสุราษฎร์ (เขาท่าเพชร) อ.เมือง จ.สุราษฎร์ธานี 26 - 27 มีนาคม 2568
KIHA 183 อ.ส.ค. 1 และ 2 กุมภาพันธ์ 2568 (One Day Trip)
ตรุษจีนภูเก็ต Phuket Festival 2025 วันที่ 3 -5 กุมภาพันธ์ 2568
เที่ยวงาน ตรุษจีนภูเก็ต เดือนสามบ้านเราประจำปี 2568 “Phuket Festival 2025” วันที่ 3 -5 กุมภาพันธ์ 2568 เทศบาลนครภูเก็ต เตรียมจัดงาน ตรุษจีนภูเก็ต (เดือนสามบ้านเรา) ประจำปี 2568 ระหว่างวันที่ 3 -5 กุมภาพันธ์ 2568 ณ ย่านเมืองเก่าภูเก็ต โดยงานในปีนี้จัดขึ้นภายใต้แนวคิด “Phuket Festival 2025 : มนต์เสน่ห์แห่งวัฒนธรรม สายสัมพันธ์เมืองภูเก็ต” มุ่งเน้นสร้างจิตสำนึกให้ประชาชนได้ตระหนักถึงคุณค่าของ "มรดกทางวัฒนธรรมและวิถีชีวิตดั้งเดิม"ที่ได้รับการสืบทอดจากบรรพบุรุษ
งานปิดเทอมสร้างสรรค์เฟสติวัลในวันที่ 2 มีนาคม 2568
งานปิดเทอมสร้างสรรค์เฟสติวัลในวันที่ 2 มีนาคม 2568 ณ หอศิลปวัฒนธรรม มหาวิทยาลัยขอนแก่น งานเริ่มตั้งแต่ 13.00 - 21.00 น. 13:00 - 16:00 น. (แถลงข่าว & ลงนาม MOU) 16:30 - 21:00 น. (เฟสติวัล) กิจกรรมที่น่าสนใจภายในงาน
งานแถลงข่าวและพิธีลงนาม MOU 13:00 - 16:00 น. ภายในหอศิลปวัฒนธรรม มหาวิทยาลัยขอนแก่น •เสวนาวิชาการ “Lifelong Learning Ecosystem” ปิดเทอมสร้างสรรค์สู่การสร้างนิเวศการเรียนรู้ตลอดชีวิต •พิธีลงนาม MOU กับ 10 องค์กรเครือข่าย •ฉายภาพรวมกิจกรรมปิดเทอมสร้างสรรค์ทั่วประเทศ •ฉายภาพ Learning Station ภายในจังหวัดขอนแก่น 75 จุด ปิดเทอมสร้างสรรค์ Festival 16:30 - 21:00 น. ลานหน้าหอศิลปวัฒนธรรม มหาวิทยาลัยขอนแก่น Main Stage: Youth Talk โดย ครูสอญอ, น้องสิงห์ โรงเรียนริมราง/KK-VoY, ครูแคท และ กลุ่มวัยรุ่นจาก มหา’ลัยไทบ้าน การแสดงละคร โดย โรงเรียนริมราง Performance Art โชว์การแสดงดนตรี โดย Jarb Cat, Sunder และ Anatomy Rabbite Activity & Workshop Zone: บูธร้านค้า ขายของ Workshop และ บูธภาคียุทธศาสตร์ + ปิดเทอมสร้างสรรค์ มากกว่า 30 บูธ Food Zone: บูธอาหารเด็ดห้ามพลาดจากทั่วขอนแก่น
Ayutthaya Morning Drip #6 “The Art Of Coffee“ 2 มี.ค. 2568 (วันเดียวเท่านั้น)
Ayutthaya Morning Drip #6 “The Art Of Coffee “ เชิญ เพื่อน ๆ และชาวอยุธยา มาเดินเล่นจิบกาแฟทานขนม ในบรรยากาศริมแม่น้ำสุดชิล ในงานมีทั้ง Folksong, Vinyl Session กิจกรรมแน่น ๆ ทั้ง Workshop งานคราฟท์ ฯลฯ และร้านค้าที่คัดสรรคุณภาพมีมากกว่า 50 ร้าน #เข้างานฟรีไม่มีค่าใช้จ่ายค่ะ ????️ วันอาทิตย์ที่ 2 มี.ค. 2568 (วันเดียวเท่านั้น) ตั้งแต่เวลา 06.00 – 18.00 น. ป้อมเพชร ริมน้ำเจ้าพระยา - ป่าสัก อยุธยา จุดจอดรถ วัดสุวรรณดารารามราชวรวิหาร มีบริการรถรับส่งเข้างานฟรี บริการรถสุขาเคลื่อนที่ฟรี
KIHA 183 ท่องเมืองศิลป์ ถิ่นสัทธา ดาราพราว ในวันที่ 8 และ 9 กุมภาพันธ์ 2568 (One Day Trip)
โปรแกรม วันที่ 4-9 กุมภาพันธ์ 2568
จันทบูรพูนสุข 4-6 กุมภาพันธ์ 2568 Central Chanthaburi
มาพิสูจน์ว่า "จันทบุรี เมืองแห่งความสุข สุขทุกวันที่จันทบุรี" ได้ที่งาน "จันทบูรพูนสุข" วันที่ 4-6 กุมภาพันธ์ ลานกิจกรรม Central Chanthaburi เทศกาลความสุขแบบพูน ๆ ของคนจันท์
เตรียมพบกับความสุขหลากรูปแบบ... เริงสุข: มาสนุกสนานกับงานอาร์ต เพลิดเพลินกับเสียงดนตรี พร้อมจิบเครื่องดื่มยามราตรีฝีมือชุมชน อิ่มสุข: เมื่อเหล่าอินฟลูเมืองจันท์ขนกองทัพสตรีทฟู้ด "สุขเข้าเส้น • สุขเน้นคาว • สุขเคล้าหวาน" มาเสิร์ฟถึงที่ เลยอยากชวนทุกคนมาซู้ด มาซี้ด มา EAT มาอิ่ม...สุข ไปด้วยกัน ถักทอสุข: ชวนทุกคนมาลองเล่น ลอง LEARN ลองเพลิน ลองทำกิจกรรมเวิร์กชอป พร้อมฟัง 7 ประเด็น TALK OF THE TOWN "ตื่นเถิดชาวจันท์ มาสร้างสรรค์เมือง(ให้)เกิด" พร้อมสัมผัสสุขอื่น ๆ ทั้ง กายสุข • ปลูกสุข • เจียระไนสุข • ใจสุข
งานบุญงานประเพณีแห่ผ้าขึ้นธาตุ ประจำปี ๒๕๖๘ วันที่ ๔-๑๒ กุมภาพันธ์
ขอเชิญชวนทุกท่านร่วมงานบุญงานประเพณีแห่ผ้าขึ้นธาตุ ประจำปี ๒๕๖๘ ณ วัดราษฎร์อุปถัมป์ หรือ วัดบางเหรียง วันที่ ๔-๑๒ กุมภาพันธ์ ๒๕๖๘ นี้ โดยจะมีพิธีกรรมให้ทุกท่านได้ร่วมกันทำบุญดังนี้ พิธีกวนข้าวมธุปายาส พิธีทอดผ้าป่าและแห่ผ้าขึ้นธาตุ
KIHA 183 เที่ยวงานแผ่นดินสมเด็จพระนารายณ์ “ลพบุรี” เยือนถิ่นวีรชนคนกล้าแห่งลุ่มน้ำเจ้าพระยา “สิงห์บุรี” 15 - 16 กุมภาพันธ์ 2568 (2 วัน 1 คืน)
งาน "เทศกาลมาฆปูรมีศรีปราจีน ครั้งที่ 39" วันที่ 5-13 กุมภาพันธ์ 2568
งานเทศกาลมาฆปูรมีศรีปราจีน ครั้งที่ 39 ปี 2568 "เส้นทางแห่งศรัทธา รอยพระพุทธบาทคู่ เมืองอวัธยะปุระ" ณ โบราณสถานวัดสระมรกต อ.ศรีมโหสถ จ.ปราจีนบุรี
จังหวัดปราจีนบุรี ขอเชิญชวนประชาชนและนักท่องเที่ยวร่วมสัมผัสความงดงามของประเพณีและวัฒนธรรมไทย ในงาน "เทศกาลมาฆปูรมีศรีปราจีน ครั้งที่ 39" ซึ่งจะจัดขึ้นระหว่างวันที่ 5-13 กุมภาพันธ์ 2568 ณ โบราณสถานวัดสระมรกต อำเภอศรีมโหสถ จังหวัดปราจีนบุรี
กิจกรรมภายในงาน - ชมการแสดง แสง สี เสียง สุดตระการตา ถ่ายทอดเรื่องราวย้อนรอยประวัติศาสตร์ และวิถีแห่งวัฒนธรรม - การแสดงศิลปวัฒนธรรมพื้นบ้าน การประกวดขบวนแห่พระพุทธรูปศักดิ์สิทธิ์ - การเดินธุดงค์ การเวียนเทียนรอบรอยพระพุทธบาทคู่ พร้อมกิจกรรมการปฏิบัติธรรม - ตลาดวัฒนธรรมเมืองอวัธยะปุระ การออกร้านจำหน่ายสินค้าและอาหารท้องถิ่นกว่า 50 ร้านค้า - นิทรรศการเฉลิมพระเกียรติฯ และการแสดงดนตรีพื้นบ้าน
นอกจากนี้ ยังมีกิจกรรมเสวนาแลกเปลี่ยนเรียนรู้มรดกปัญญาทางวัฒนธรรม ผ้าป่าลอยฟ้านำเที่ยวเมืองโบราณ เพื่อร่วมกันอนุรักษ์และสืบสานมรดกทางประเพณีอย่างยั่งยืน
ร่วมสัมผัสมนต์เสน่ห์แห่งประเพณีโบราณ ในบรรยากาศที่อบอวลไปด้วยศิลปวัฒนธรรม พร้อมทั้งสนุกสนานกับการชิม ช้อป และเพลิดเพลินกับกิจกรรมที่หลากหลาย
กิจกรรม ๑ อำเภอ ๑ ลานสร้างสรรค์ ในวันพุธที่ 5 กุมภาพันธ์ 2568
ขอเชิญร่วมกิจกรรม ๑ อำเภอ ๑ ลานสร้างสรรค์ ในวันพุธที่ 5 กุมภาพันธ์ 2568 ตั้งแต่เวลา 18.00 น. - 20.00 น. ณ ถนนคนเดินค่ายสุริยพงษ์ มณฑลทหารบกที่ 38 ตำบลในเวียง อำเภอเมืองน่าน จังหวัดน่าน
งานประเพณีไหว้เทวดา ประจำปี 2568 วันพุธที่ 5 กุมภาพันธ์ 2568
เทศบาลนครภูเก็ตเพื่อประชาชน ขอเชิญร่วมงานประเพณีไหว้เทวดา ประจำปี 2568 วันพุธที่ 5 กุมภาพันธ์ 2568 ตั้งแต่เวลา 22:00 น. เป็นต้นไป ศูนย์การเรียนรู้ลานมังกร สวนเฉลิมพระเกียรติ 72 พรรษา มหาราชินี เทศบาลนครภูเก็ต ร่วมสักการะและขอพรเสริมสิริมงคลร่วมสืบสานวัฒนธรรมและประเพณีไปด้วยกัน
KIHA 183 ย้อนรอยประวัติศาสตร์สงครามโลกครั้งที่ 2 - 22 และ 23 กุมภาพันธ์ 2568 (One Day Trip)
Coffee & Sweet Fest เซ็นทรัลมหาชัย 6-10 กุมภาพันธ์ 2568
งาน "Coffee & Sweet Fest" ที่ เซ็นทรัลมหาชัย ระหว่างวันที่ 6-10 กุมภาพันธ์ 2568 เทศกาลที่คนรักกาแฟและขนมหวานไม่ควรพลาด ชวนมาสัมผัสรสชาติของกาแฟจากร้านค้าที่คัดสรรมาอย่างดี พร้อมกับขนมหวานหลากหลายชนิดที่เตรียมมาเพื่อสร้างความประทับใจให้กับผู้เข้าชม จัดโดย Sakhon Guide by อบจ.สมุทรสาคร
ไฮไลท์ร้านกาแฟชื่อดังจากจังหวัดสมุทรสาคร ที่นำเสนอเมนูพิเศษเฉพาะงานนี้เท่านั้น อาทิ LIM COFFEE SLOWBAR , Fellboy , Behind The Beans , Ahouse banphaeo , Doodle cup , หัวโตคาเฟ่ x สเตวิชมี , Cup craf , Between Coffee Roaster , Arinji Cafe และ Rubrom Cafe เป็นต้น มาลิ้มลองขนมหวานจากร้านเบเกอรี่ชั้นนำ ที่จะทำให้คุณหลงใหลในรสชาติ ร้านยินดีพานิช(ท่าฉลอม) , B&B Bakery บ้านแพ้ว พบกับกิจกรรมเวิร์กช็อป เรียนรู้การชงกาแฟจากผู้เชี่ยวชาญในวงการ
งานสมโภชศาลหลักเมืองราชบุรี วันที่ 6 กุมภาพันธ์ 2568
จังหวัดราชบุรี...ขอเชิญร่วมงานสมโภชศาลหลักเมืองราชบุรี วันที่11-20 กุมภาพันธ์ 2568
สำหรับพิธี เปิดงานสมโภชศาลหลักเมืองราชบุรี วันที่ 6 กุมภาพันธ์ 2568 เวลา 16.00 น. เรียนเชิญทุกท่านใส่เสื้อสีเหลืองไปร่วมสักการะหลวงพ่อแก่นจันทน์ บริเวณริมเขื่อนรัฐประชาพัฒนา ซึ่งทางกรมการทหารช่างได้อัญเชิญทางน้ำเป็นครั้งแรกในรอบ 208 ปี
เทศกาลกินกุ้งและของดีอำเภอบางแพ ประจำปี วันที่ 6 - 9 กุมภาพันธ์ 2568
อำเภอบางแพ ขอเชิญเที่ยวงาน "เทศกาลกินกุ้งและของดีอำเภอบางแพ ประจำปี 2568" วันที่ 6 - 9 กุมภาพันธ์ 2568 ตั้งแต่เวลา 10.00 - 22.00 น. ณ บริเวณที่ว่าการอำเภอบางแพ จังหวัดราชบุรี มาพบกับสุดยอดเมนูกุ้ง ของดีอำเภอบางแพ สินค้า OTOP และคาราวานสินค้ามากมาย ให้เลือกชิม เลือกช็อป งานนี้ห้ามพลาดจ้า เพราะกุ้งก้ามกรามบางแพ เป็นสินค้า GI ที่สำคัญของจังหวัดราชบุรี
งาน มหัศจรรย์ วันมวยไทย ดังไกลสู่ชาวโลก 2568 Amazing MuayThai World Festival 2025 - 6 กุมภาพันธ์ 2568
"Amazing MuayThai World Festival 2025" รากเหง้าภูมิปัญญามวยไทย เกรียงไกรสู่ชาวโลก มาร่วมสัมผัสมนต์เสน่ห์แห่งศิลปะการต่อสู้ที่เป็นมรดกล้ำค่าของชาติไทย วันที่ 5-6 กุมภาพันธ์ 2568 อุทยานราชภักดิ์ อ.หัวหิน จ.ประจวบคีรีขันธ์
ภายในงานพบกับไฮไลท์สุดอลังการ พิธีย้อนประวัติศาสตร์รากเหง้ามวยไทย ด้วยนักแสดงกว่า 2,000 คน โชว์แม่ไม้มวยไทยและรำไหว้ครูอันงดงาม การแปรรูปขบวนทหารเป็นตัวเลขไทย 323 ปี การแข่งขันชกมวยไทย การแสดงแสง สี เสียง และพลุสุดตระการตา ช้อปสินค้า OTOP และอาหารพื้นเมืองจากร้านดังทั่วเมืองประจวบฯ กว่า 60 ร้าน พิเศษ!
เข้าชมฟรี ไม่มีค่าใช้จ่าย อย่าพลาดงานมหัศจรรย์แห่งปี ที่จะมาสร้างประวัติศาสตร์ครั้งใหม่ให้วงการมวยไทย!
Hat Yai Learning Fair 2025 และ Summer Sweet 2025 วันที่ 6 - 9 กุมภาพันธ์ 2568
Hat Yai Learning Fair 2025 และ Summer Sweet 2025 จัดระหว่างวันที่ 6-9 กุมภาพันธ์ 2568 เวลา 10.00-20.00 น. (เสาร์-อาทิตย์ เปิดเวลา 09.00 น.) ณ ห้อง Convention Hall ศูนย์ประชุมนานาชาติฉลองสิริราชสมบัติครบ ๖๐ ปี
Summer Sweet 2025 วันที่ 6 - 9 กุมภาพันธ์ 2568
Summer Sweet 2025 จัดระหว่างวันที่ 6 - 9 กุมภาพันธ์ 2568 เวลา 10.00 - 20.00 น. (เสาร์-อาทิตย์ เปิดเวลา 09.00 น.) ณ ห้อง Convention Hall ศูนย์ประชุมนานาชาติฉลองสิริราชสมบัติครบ ๖๐ ปี
ตลาดนัดชุมชน คนแปดริ้วยิ้มได้ ครั้งที่ 3 วันที่ 6-7 กุมภาพันธ์ 2568
ตลาดนัดชุมชน คนแปดริ้วยิ้มได้ ครั้งที่ 3 วันที่ 6 - 7 กุมภาพันธ์ 2568 เวลา 07.00 - 20.00 น. สนามหญ้าหน้าศาลากลางจังหวัดฉะเชิงเทรา มาอุดหนุนสินค้าชุมชนแปดริ้วกัน
เที่ยวงานประจำปีเเละพิธีบวงสรวงดวงวิญญาณองค์ท่านพ่อพันท้ายนรสิงห์ วันที่ 6 กุมภาพันธ์ 2568
ททท.สำนักงานสมุทรสงคราม ขอเชิญเที่ยวงานประจำปีพิธีบวงสรวงพ่อพันท้ายนรสิงห์ 321 ปี ณ ศาลพันท้ายนรสิงห์ ต.พันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร ระหว่างวันที่ 5 - 9 กุมภาพันธ์ 2568 วันที่ 6 ก.พ. 2568 เวลา 08.00 น. รำบวงสรวงพ่อพันท้ายนรสิงห์ เวลา 09.39 น. พิธีบวงสรวงพ่อพันท้ายนรสิงห์
ขอเชิญชม ฟรี ละครเวที พันท้ายนรสิงห์เทพเเห่งความซื่อสัตย์ เพื่อสืบสานตำนานคลองโคกขามสายน้ำแห่งความซื่อสัตย์ 321 ปี ในวันที่ 6 - 7 กุมภาพันธ์ 2568 เริ่มการแสดงตั้งแต่ 18.00 น. เป็นต้นไป
งานมหกรรมหุ่นฟางนกและของดีศรีท้องถิ่นจังหวัดชัยนาท และงานกาชาดประจำปี 2568 ครั้งที่ 40 วันที่ 6–16 กุมภาพันธ์ 2568
จังหวัดชัยนาท ขอเชิญเที่ยวงานมหกรรมหุ่นฟางนกและของดีศรีท้องถิ่นจังหวัดชัยนาท และงานกาชาดประจำปี 2568 ครั้งที่ 40 ระหว่างวันที่ 6 – 16 กุมภาพันธ์ 2568 ณ บริเวณสนามกีฬาเฉลิมพระเกียรติ และเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท มีวัตถุประสงค์เพื่อสืบสานประเพณี วัฒนธรรม และภูมิปัญญาท้องถิ่น สนับสนุนและส่งเสริมการจำหน่ายผลิตภัณฑ์ชุมชนและท้องถิ่น (OTOP) ผลิตภัณฑ์ของกลุ่มแม่บ้านเกษตรกร และส่งเสริมการท่องเที่ยวในจังหวัดชัยนาท รวมทั้งกระตุ้นเศรษฐกิจให้มีเม็ดเงินไหลเข้าสู่ระบบเศรษฐกิจในพื้นที่จังหวัดชัยนาทมากขึ้น
กิจกรรมภายในงาน พบกับการประกวดขบวนแห่วัฒนธรรมและภูมิปัญญาท้องถิ่นของอำเภอทั้ง 8 อำเภอ การแสดงศิลปวัฒนธรรม สักการะศาลหลักเมือง นมัสการรูปหล่อหลวงปู่ศุข การประกวด หุ่นฟางนกไฮเทค การประกวดหุ่นฟางนกสวยงาม การประกวดโมบายนก ชมหุ่นฟางนกไฮเทค หุ่นฟางนกสวยงาม โมบายนก แสง สี เสียง ท่ามกลางบรรยากาศสวนป่าสวยงามบริเวณสนามกีฬาเฉลิมพระเกียรติ จุดนั่งพักผ่อน และมุมถ่ายภาพสำหรับนักท่องเที่ยว การจำหน่ายสลากกาชาดและร่วมสนุกชิงโชคกับร้านสกุณากาชาด การจัดจำหน่ายสินค้าของศรีท้องถิ่นจังหวัดชัยนาท สินค้าโอทอป – นวัตวิถี สินค้าเกษตร สินค้าราคาถูก นิทรรศการ และศิลปวัฒนธรรมพื้นบ้าน ชิมอาหารพื้นถิ่นชัยนาท นิทรรศการส่วนราชการ และกิจกรรมอื่นๆ อีกมากมาย
งานประเพณี วัฒนธรรมท้องถิ่น ประจำปี 2568 วันที่ 6 - 9 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานประเพณี วัฒนธรรมท้องถิ่น ประจำปี 2568 ระหว่างวันที่ 6 - 9 กุมภาพันธ์ 2568 ณ บ้านขุนสถาน ตำบลสันทะ อำเภอนาน้อย จังหวัดน่าน มีกิจกรรมทั้งภาคกลางวันและกลางคืน • ภาคกลางวันจะเป็นการแข่งขันกีฬาส่งเสริมวัฒนธรรมชาติพันธุ์ม้ง เช่น ยิงหน้าไม้ ตีลูกข่าง และเปอะกะหล่ำ • ภาคกลางคืนจะเป็น การแข่งขันร้องเพลงม้ง แข่งขันมิสม้งจูเนียร์ และนักร้องม้งอีกมากมาย ห น า ว นี้ ที่ น่ า น การท่องเที่ยวแห่งประเทศไทย สำนักงานน่าน โทร. 054 - 711 217 โทรสาร 054-711 219
WOOF PACK ชวนดูหนังไทยคลาสสิก 3 เรื่อง ฟรี วันนี้ - 16 กุมภาพันธ์
หอภาพยนตร์ (องค์การมหาชน) ร่วมสนับสนุน WOOF PACK นำ 3 หนังไทยคลาสสิก สันติ-วีณา (2497) สมิงบ้านไร่ (2507) ชั่วฟ้าดินสลาย (2498) มาจัดฉายเป็นส่วนหนึ่งในงาน Bangkok Design Week ตั้งแต่วันนี้ - 16 กุมภาพันธ์ ที่ Small World (ชั้น 3), The Corner House เจริญกรุง
รอบฉาย Screening Time:
12:00 - 14:00 | Santi-Vina สันติ-วีณา (2497)
15.30 - 17.30 | Saming Baan Rai สมิงบ้านไร่ (2507)
20.00 - 22.00 |Forever Yours ชั่วฟ้าดินสลาย (2498)
ไม่เสียค่าเข้าชม
งานเกษตรอีสานใต้ ม.อุบลราชธานี ประจำปี 2568
มหาวิทยาลัยอุบลราชธานี ขอเชิญ... ชิม – ชม – ช๊อป และเที่ยว “งานเกษตรอีสานใต้ ประจำปี 2568” ระหว่างวันที่ 7 - 16 กุมภาพันธ์ 2568 รวม 10 วัน 10 คืน
ภายในงานกำหนดให้มีการจัดนิทรรศการทางวิชาการของมหาวิทยาลัยอุบลราชธานีและหน่วยงานงานราชการภายนอก โดยแบ่งพื้นที่จัดงานหลัก 3 ส่วน รูปแบบการจัดนิทรรศการทางวิชาการของมหาวิทยาลัยอุบลราชธานีและหน่วยงานราชการภายนอกในการจัดงานเกษตรอีสานใต้ ประจำปี พ.ศ. 2568 มีพื้นที่จัดงานหลัก 3 ส่วน ได้แก่ 1) การจัดอุทยานวิชาการ ผลงานวิจัยเด่นของคณะเกษตรศาสตร์ การจัดแสดงนิทรรศการทางวิชาการการของ 5 ภาควิชาในสังกัด คณะเกษตรศาสตร์ การจัดแสดงนิทรรศการทางวิชาการการของคณะต่างๆในสังกัดมหาวิทยาลัยอุบลราชธานี การจัดนิทรรศการทางวิชาการของหน่วยงานราชการภายนอก 2) การจัดนิทรรศการเทคโนโลยีการเกษตรสมัยใหม่ การแสดงและจำหน่ายผลิตภัณฑ์ของบริษัทเอกชนรายใหญ่ และ 3) พื้นที่แสดงและจำหน่ายผลิตภัณฑ์ของวิสาหกิจชุมชนและผู้ประกอบการรายย่อย
งานมหกรรม อิ้วเมี่ยนไทย สานสัมพันธ์ อิ้วเมี่ยนโลก ประจำปี 2568 วันที่ 7-9 กุมภาพันธ์ 2568
งานมหกรรม อิ้วเมี่ยนไทย สานสัมพันธ์ อิ้วเมี่ยนโลก ประจำปี 2568 วันที่ 7-9 กุมภาพันธ์ 2568 ณ ข่วงศึกษาวิถีชีวิตวัฒนธรรมล้านนาและอาเซียน องค์การบริหารส่วนจังหวัดเชียงราย ต.ริมกก อ.เมืองเชียงราย จ.เชียงราย
งาน " เดิน กิน ชิม เที่ยว " ถนนคนเดินรังสิต Walking Street @Rangsit วันที่ 7 - 9 กุมภาพันธ์ 2568
เทศบาลนครรังสิต ขอเชิญร่วมงาน " เดิน กิน ชิม เที่ยว " ถนนคนเดินรังสิต Walking Street @Rangsit เดินชิมช้อป อาหาร สินค้าหลากหลาย มากมาย ลั่นชัตเตอร์ ถ่ายภาพ ชมวิว บรรยากาศริมคลองรังสิตประยูรศักดิ์ วันที่ 7 - 9 กุมภาพันธ์ 2568 เวลา 17.00 - 23.00 น. ณ บริเวณริมเขื่อนหน้าโรงเรียนชุมชนประชาธิปัตย์วิทยาคาร
งาน "วันรำลึกบรรพชนมอญ ครั้งที่ 78 ในวันที่ 7-9 กุมภาพันธ์ 2568 วัดพุตะเคียน อำเภอไทรโยค
ชุมชนคุณธรรมต้นแบบวัดพุตะเคียน ขอเชิญชวนนักท่องเที่ยว และชาวไทยเชื้อสายมอญทั่วประเทศ ร่วมงาน "วันรำลึกบรรพชนมอญ ครั้งที่ 78" ในวันที่ 7-9 กุมภาพันธ์ 2568 ณ วัดพุตะเคียน อำเภอไทรโยค จังหวัดกาญจนบุรี . ร่วมพิธีบวงสรวงบรรพชนมอญ และเจ้าเมืองมอญ 7 หัวเมือง ชมพิธีเสี่ยงทายนางหงส์ ขบวนแห่ทางวัฒนธรรม กิจกรรมรามัญเสวนา นิทรรศการและซุ้มสาธิตภูมิปัญญามอญ การละเล่นพื้นบ้าน การแสดงแสง สี เสียง นาฎศิลป์มอญ ลิเกมอญ ทะแยมอญ ฯลฯ
อเล็ก เฟส Cycle Upon Cycle ดรีม กราฟ แกลเลอรี่ 07.02-01.03.2068
อเล็ก เฟส Cycle Upon Cycle ดรีม กราฟ แกลเลอรี่ , เชียงใหม่ 07.02-01.03.2068 อเล็ก เฟส สานต่อซีรีส์ผลงานจิตรกรรมภูมิทัศน์ en plein air (การวาดภาพกลางแจ้ง) หลังจากการสร้างสรรค์ผลงานเมื่อปีที่แล้วที่เขาหลัก และที่ฉะเชิงเทรา บ้านเกิดของเขา ใน ‘CYCLE UPON CYCLE‘ เขาและเพื่อนๆ ใช้เวลาสี่วันในการปั่นจักรยานจากอำเภอเมืองเชียงใหม่ไปยังอำเภอพร้าว โดยนำอุปกรณ์วาดภาพทั้งหมดติดตัวไปด้วย เพื่อวาดภาพทิวทัศน์ระหว่างทาง และสะท้อนประสบการณ์ร่วมของการใช้ชีวิตท่ามกลางหมอกควันตามฤดูกาล ในวงจรที่เราไม่ได้เลือกหรือปรารถนา ผ่านช่วงเวลาในชีวิตประจำวันอย่างการปั่นจักรยานและการเดินทาง ขณะที่เราเคลื่อนผ่านฤดูมลพิษที่มนุษย์สร้างขึ้น ศิลปินบันทึกภูมิทัศน์ที่อากาศสะอาดกลายเป็นสิ่งที่เราไม่อาจเข้าถึงได้ตลอดเวลา บันทึกการยอมจำนนอย่างเงียบงันในบางคราว และแรงผลักที่ทำให้เราออกเดินทางเคลื่อนที่ไปข้างหน้าในวันที่สภาพอากาศไม่โหดร้ายจนเกินไป
มหกรรมไม้ดอกไม้ประดับจังหวัดเชียงใหม่ ครั้งที่ 48 วันที่ 7 - 9 กุมภาพันธ์ 2568
มหกรรมไม้ดอกไม้ประดับจังหวัดเชียงใหม่ ครั้งที่ 48 ประจำปี 2568 ภายใต้แนวคิด “เสน่ห์บุปผชาติ งามพฤกษา นครเชียงใหม่ Chiang Mai’s Floral Fantasy” 7 - 9 กุมภาพันธ์ 2568
จังหวัดเชียงใหม่มีกำหนดจัดงานไม้ดอกไม้ประดับฯ เป็นประจำทุกปีในวันศุกร์ เสาร์ อาทิตย์ แรกของเดือนกุมภาพันธ์ โดยในปีนี้กำหนดจัดขึ้น ระหว่างวันที่ 7-9 กุมภาพันธ์ 2568 ณ สวนสาธารณะหนองบวกหาด อำเภอเมืองเชียงใหม่ จังหวัดเชียงใหม่ ภายใต้แนวคิด “เสน่ห์บุปผชาติ งามพฤกษาเวียงพิงค์” เพื่อส่งเสริมการท่องเที่ยว สร้างภาพลักษณ์ที่ดี ส่งเสริมการเป็นเมืองเทศกาลโลก (World Festival and Event City) พร้อมกระตุ้นเศรษฐกิจและสร้างรายได้เข้าสู่จังหวัดเชียงใหม่ โดยในปีนี้จะมีพิธีเปิดและปล่อยขบวนรถบุปผชาติ วันที่ 8 กุมภาพันธ์ 2568 ณ เชิงสะพานนวรัฐ หน้าจวนผู้ว่าราชการจังหวัดเชียงใหม่
งานกาชาดจังหวัดร้อยเอ็ด ประจำปี 2568 วันที่ 7-16 กุมภาพันธ์ 2568
งานกาชาดจังหวัดร้อยเอ็ด ประจำปี 2568 ตั้งแต่วันที่ 7 - 16 กุมภาพันธ์ 2568 บริเวณศาลากลางจังหวัดร้อยเอ็ด อ.เมือง จ.ร้อยเอ็ด ร้อยเอ็ด พบกับความสนุกสนานและกิจกรรมมากมาย ตลอด 10 วัน เต็ม
ภายในงานมีกิจกรรมให้ร่วมสนุกมากมาย อาทิ การออกสลากกาชาด: ลุ้นรับรางวัลใหญ่ การแสดงนิทรรศการ: ชมผลงานของเหล่ากาชาดจังหวัดร้อยเอ็ด การแสดงศิลปวัฒนธรรม: สืบสานประเพณีไทย จำหน่ายสินค้า OTOP: ช้อปสินค้าพื้นเมืองคุณภาพดี การแสดงคอนเสิร์ตจากศิลปินดัง : มนต์แคน แก่นคูน ลาบานูน ปู พงษ์สิทธิ์ คำภีร์ แอน อรดี เวียง นฤมล นนท์ พลเยี่ยม บุ๊ค ศุภกาญจน์ ฝ้าย เมฆะ เนสกาแฟ ศรีนคร ยูกิ ไหทองคำ โชค ไหทองคำ ยังโอม และโอม สรัล นอกจากนี้ ยังเป็นโอกาสดีที่จะได้ร่วมทำบุญ สนับสนุนกิจกรรมของเหล่ากาชาดจังหวัดร้อยเอ็ด เพื่อนำไปช่วยเหลือผู้ยากไร้และผู้ประสบภัย
งานประจำปีและของดีเมืองน่าน ประจำปี 2568 วันที่ 7-16 กุมภาพันธ์ 2568
งานประจำปีและของดีเมืองน่าน ประจำปี 2568 จัดระหว่างวันที่ 7 - 16 ก.พ. 2568 เวทีกลางบริเวณริมน้ำน่าน เชิงสะพานพัฒนาภาคเหนือ จ.น่าน
จังหวัดน่าน และเหล่ากาชาดจังหวัดน่าน ร่วมกับภาคเอกชน ขอเชิญเที่ยวงานประจำปีและของดีเมืองน่าน ประจำปี 2568 ในระหว่างวันที่ 7-16 กุมภาพันธ์ 2568 ณ เวทีกลางบริเวณริมน้ำน่าน เชิงสะพานพัฒนาภาคเหนือ โดยมีกิจกรรมต่างๆมากมาย เช่น การออกร้านกาชาดน่าน, การแสดงนิทรรศการหน่วยงานราชการ บริษัท ห้างร้าน, มินิมอเตอร์โชว์, สวนสนุกสำหรับเด็กๆ และกิจกรรมหลาย เพื่อส่งเสริมพัฒนาการผลิตภาคเกษตรและผลิตภัณฑ์ชุมชน (OTOP) ของท้องถิ่น อนุรักษ์ศิลปวัฒนธรรมประเพณีของท้องถิ่นและชนเผ่าต่าง ๆ โดยจัดแสดงนิทรรศการตามแนวคิดปรัชญาเศรษฐกิจพอเพียง ส่งเสริมการท่องเที่ยวของจังหวัดน่าน และจัดหารายได้เพื่อเป็นค่าใช้จ่ายด้านสาธารณกุศลของเหล่ากาชาดจังหวัดน่าน โดยในการจัดงาน มีการแสดงของเวทีกลาง ดังนี้ วันศุกร์ที่ 7 กุมภาพันธ์ 2568 เวลา 19.00 น. เป็นต้นไป พิธีเปิดงานประจำปี และของดีเมืองน่าน ประจำปี 2568 มีการแสดงวงดนตรีดุริยางค์ มทบ.๓๘ และการเปิดตัวผู้เข้าประกวดนางสาวน่าน และผู้เข้าประกวดธิดาดอย วันเสาร์ที่ 8 กุมภาพันธ์ 2568 การแสดงดนตรีสด และการแสดงคอนเสิร์ต (ไรอั้ล กาจบัณฑิต/ไมค์หมดหนี้) วันอาทิตย์ที่ 9 กุมภาพันธ์ 2568 การแสดงดนตรีของเยาวชนจังหวัดน่าน การประกวดธิดาดอย และการแสดงวัฒนธรรรมชนเผ่า วันจันทร์ที่ 10 กุมภาพันธ์ 2568 การแสดงดนตรีของเยาวชนจังหวัดน่าน การประกวดร้องเพลงไทยลูกทุ่งและหางเครื่อง ขององค์กรปกครองส่วนท้องถิ่น วันอังคารที่ 11 กุมภาพันธ์ 2568 การแสดงดนตรีสด และการแสดงคอนเสิร์ต (โบว์ ซุปเปอร์วาเลนไทน์) วันพุธที่ 12 กุมภาพันธ์ 2568 การแสดงดนตรีสด, การแสดง (ก๊อปปี้ โชว์) วันพฤหัสบดีที่ 13 กุมภาพันธ์ 2568 การแสดงของเด็กนักเรียนและเยาวชนจังหวัดน่าน การแสดงกิจกรรมเยาวขนต้นแบบ To Be Number One จังหวัดน่าน วันศุกร์ที่ 14 กุมภาพันธ์ 2568 การแสดงดนตรีสด, การแสดงคอนเสิร์ต (แอ้ม ชลธิชา) วันเสาร์ที่ 15 กุมภาพันธ์ 2568 การแสดงดนตรีสด และ การประกวดนางสาวน่าน วันอาทิตย์ที่ 16 กุมภาพันธ์ 2568 การแสดงดนตรีสด, การประกวดร้องเพลงไทยลูกทุ่ง ประเภทกำนัน ผู้ใหญ่บ้าน, ผู้ช่วยผู้ใหญ่บ้าน แพทย์ประจำตำตำบลและสารวัตรกำนัน และ การออกรางวัลสลากกาชาดการกุศล ประจำปี 2568
ชมนก ช้อนดอกเกลือ ลงเรือแถกเลน 7-9 กุมภาพันธ์ 2568
ชมนก ช้อนดอกเกลือ ลงเรือแถกเลน เริ่มแล้ววันนี้ 7 - 9 กุมภาพันธ์ 2568 ณ ศูนย์เรียนรู้เรื่องนกและระบบนิเวศ หมู่2 ตำบลปากทะเล อ.บ้านแหลม จ.เพชรบุรี กิจกรรมเริ่มตั้งแต่ 08:00 น. เป็นต้นไป ฟังดนตรีชิลล์ๆ ตั้งแต่ 19:00 น. เป็นต้นไป พบกับ!!! 7 ก.พ. : วงฮอลิเดย์ และบอลลี่ (เปิดงาน) 8 ก.พ. : โฟล์คซอง วงละเมอ 9 ก.พ. : โฟล์คซอง วงจรรโลงชล
ภายในงานพบกับ กิจกรรมการดูนกชายเลนอพยพ ชมวิถีชีวิตชุนชนคนหาหอย กับการลงเรือแถกเลน ช็อป ชิม อาหารทะเลสดๆ เส้นทางท่องเที่ยวสายบุญ ไหว้พระ ชมแข่งขันกีฬาพื้นบ้าน สืบสานวิถีนาเกลือ สานสัมพันธ์ชุมชน ชมบูธ นิทรรศการ, ร้านค้า,ร้านอาหาร ฟังดนตรี สไตล์โฟล์คซอง จากศิลปินเพชรบุรี
งาน Sungai Golok Bike week 2025 ครั้งที่ 4 #SGBW4 วันที่ 7-8 กุมภาพันธ์ 2025
มาระเบิดความมันส์ไปด้วยกัน ในงาน Sungai Golok Bike week 2025 ครั้งที่ 4 #SGBW4 การรวมตัวครั้งยิ่งใหญ่ของสิงห์นักบิด 4 ประเทศ ไทย มาเลเซีย สิงคโปร์ อินโดนีเซีย พบกับคอนเสิร์ตในธีม Rock Never Die รวมศิลปินร็อคหลายสาย อาทิ - พลพล - 7 days crazy - RLEAF - Fahrenheit - เหน่ง Y not 7 - Bulletguyz ยกทัพความอร่อย จำหน่ายอาหาร เครื่องดื่ม มากกว่า 60 ร้าน อีกทั้งจำหน่ายเสื้อที่ระลึก SGBW#4
ทั้งหมดรวมในแพ็คเกจในราคา 500 THB สามารถติดต่อสั่งจองได้แล้ววันนี้ เพจ สำนักงานการท่องเที่ยวและกีฬาจังหวัดนราธิวาส งานวันที่ 7-8 กุมภาพันธ์ 2025 ณ สวนมิ่งขวัญ สุไหงโก-ลก จ.นราธิวาส
งานเฉลิมฉลองมรดกโลกบ้านเชียง ปี 2568 วันที่ 7 กุมภาพันธ์ 2568
ขบวนแห่ฉลองมรดกโลกสุดอลังการ ในงานเฉลิมฉลองมรดกโลกบ้านเชียง ปี 2568 วันที่ 7 กุมภาพันธ์ 2568 16.00 น.เป็นต้นไป ด้านหน้าบึงนาคำ และนี่คือ 1 ในไฮไลท์ของขบวนแห่ปีนี้ ขบวนอารยธรรมบ้านเชียง ที่ถูกรวบรวมความเป็นอารยธรรมบ้านเชียงที่ผสมผสานกับวัฒนธรรมร่วมสมัยที่ทุกคนจะได้เห็นเฉพาะในขบวนแห่ขบวนนี้เท่านั้น ใครพลาดปีนี้ ไม่รู้จะได้เห็นอีกทีตอนไหน
amazing Glow night: จุ้ม•บ้านเชียง 7 - 9 ก.พ. 68
amazing Glow night: จุ้ม•บ้านเชียง 7 - 9 ก.พ. 68 เวลา
11.00 - 23.30 น.
งาน จุ้ม•บ้านเชียง เทื่อที่ 2 จุดประกายจินตนาการ โลดเล่นไปกับงานศิลป์ยามค่ำคืน เปล่งแสงอวดลวดลายโดยศิลปินบ้านเชียง ชวนตื่นตาประทับใจ “ถ้าวันหนึ่งบ้านเชียงสามารถส่องแสงสว่างได้ในตอนกลางคืนจะงดงามแค่ไหน: GLOW IN THE DARK
งาน "กินปลาสันเขื่อน ชมนกกระเรียนพันธุ์ไทย ทุ่งข้าวใหม่เกษตรอินทรีย์ ของดีตลาดเซราะแอง ประจำปี 2568" วันที่ 7 - 9 กุมภาพันธ์ 2568
ททท.สำนักงานบุรีรัมย์ เชิญร่วมงาน "กินปลาสันเขื่อน ชมนกกระเรียนพันธุ์ไทย ทุ่งข้าวใหม่เกษตรอินทรีย์ ของดีตลาดเซราะแอง ประจำปี 2568" วันที่ 7 - 9 กุมภาพันธ์ 2568 ณ บริเวณลานหน้าสันเขื่อนอ่างเก็บน้ำห้วยจระเข้มาก อำเภอเมืองบุรีรัมย์ จังหวัดบุรีรัมย์
ภายในงานพบกับกิจกรรมมากมายอาทิ -ประกวดทำอาหารจากปลา -ประกวดส้มตำลีลา -ประกวดร้องเพลง -ประกวดขบวนฟ้อนรำ -ชิม ช้อป ใช้ ตลาดเซราะแอง -ตลาดนัดสินค้า OTOP ของจังหวัดบุรีรัมย์
สอบถามข้อมูลเพิ่มเติมติดต่อ : ที่ทำการองค์การบริหารส่วนตำบลสะแกโพรง 044 184 000 เที่ยวบุรีรัมย์ง่ายนิดเดียว สอบถามข้อมูลเพิ่มเติม : ททท. สำนักงานบุรีรัมย์ โทร. 0 4463 4722 หรือโทร. 1672 TAT Contact Center เพื่อนร่วมทาง
เฮือนพวนชวนคราฟต์ งานคราฟต์ แบบชิวๆ สบายๆ ร้านสุนทรีผ้าไทย อ.ศรีสัชนาลัย 7 - 9 กุมภาพันธ์ 2568
"เฮือนพวนชวนคราฟต์" วันที่ 7-9 กุมภาพันธ์ 2568 (วันศุกร์ เสาร์ อาทิตย์) ตั้งแต่เวลา 10.00 -17.00 น. ณ เฮือนไทยพวนโบราณ ร้านสุนทรีผ้าไทย อ.ศรีสัชนาลัย จ.สุโขทัย
งานคราฟต์ แบบชิวๆ สบายๆ ในคอนเซ็ปต์ Colorful Bright & Fun กิจกรรมภายในงาน แบ่งโซนสีสันความสุข ออกเป็น 3 โซน โซน สนุกคราฟต์ ชวนมาสนุกกับชิ้นงาน DIY งาน Handmade ที่มาเปิดพื้นที่ให้กับผู้ที่ชื่นชอบการทำ DIY ได้ลงมือสร้างสรรค์ผลงานกันอย่างอิ่มเอมใจ พวงกุญแจจากเศษวัสดุ , การระบายสีตุ๊กตาผู้หนุ่มสาวไทยพวน, ร้อยกระดิ่งร้อยลูกปัดเครื่องปั้นดินเผา , กาชาปองมหาสนุก , DIY วาดขนมเค้ก คุ้กกี้, ลงสีผ้าบาติก โซน อร่อยคราฟต์ อิ่มอร่อยกับอาหารพื้นถิ่น และอาหารพวนฟิวชั่น อย่าง ก๋วยเตี๋ยวเฮอืนไทยพวน , ปลีทอด , ขนมต้ม , Ice cream , ขนมครกโบราณ , ส้มตำเขย่า , ขนมข้าวโค้ง, ขนมไทยพื้นบ้าน, ผลไม้แผ่นกรอบ , น้ำผลไม้ และ , มุม Cafe โซน เพลินคราฟต์ เพลิดเพลินไปกับมุมถ่ายรูปน่ารักๆภายในงาน มุมเฮือนพวนโบราณ มุมผ้าทอ และปีนี้จะมีน้องทอใจ (มาเป็น Gimmick ถ่ายรูปในงาน)
เทศกาลข้าวสาลีน่าน Nan Wheat Fest 2025 วันที่ 7-9 กุมภาพันธ์ 2568
ขอเชิญร่วมงาน “เทศกาลข้าวสาลีน่าน Nan Wheat Fest 2025” วันที่ 7-9 กุมภาพันธ์ 2568 นี้ ณ ข่วงเมืองน่าน • ชมนิทรรศการ การผลิตข้าวสาลีด้วย BCG model จ.น่าน • สาธิต การทำอาหารและเครื่องดื่มจากข้าวสาลี อาทิเช่น เชฟนนท์ จากร้านโว้วล่า เชฟทวน จากบ่อเกลือวิลล์ เชฟแซ็ค จากร้าน Zac Ta-Ry และคุณนิดา จากน่านไวน์เนอรี่ • เลือกซื้อ ผลิตภัณฑ์แปรรูปจากข้าวสาลี เมนูอาหารทั้งอาหารคาว อาหารหวาน และเครื่องดื่มจากข้าวสาลี พบปะกลุ่มเกษตรกรและผู้ประกอบการ มาร่วมพัฒนาเกษตรปลอดภัยและมูลค่าสูงของจังหวัดน่าน ดำเนินงานโดย ศูนย์วิจัยข้าวแพร่ และ สถานีพัฒนาที่ดินน่าน ห น า ว นี้ ที่ น่ า น
การท่องเที่ยวแห่งประเทศไทย สำนักงานน่าน โทร. 054 - 711 217 โทรสาร 054-711 219
มหกรรมของดีวิถีตันหยง 7-9 ก.พ. 2568
อบต.ตันหยงโป จัดงานมหกรรมของดีวิถีตันหยง ครั้งที่ 13 ระหว่างวันที่ 7-9 กุมภาพันธ์ 2568 ณ สนามหาดชายเล บ้านหายทรายยาว หมู่ 2 ตำบลตันหยงโป อำเภอเมือง จังหวัดสตูล เพื่อส่งเสริมการท่องเที่ยวโดยชุมชนในพื้นที่ กระตุ้นเศรษฐกิจ ต่อยอดการท่องเที่ยวบริการและอาหารฮาลาล รองรับกลุ่มนักท่องเที่ยวมุสลิม
ภายในงานฯ มีการจำหน่ายอาหารทะเลสด อาหารพื้นบ้าน สินค้าโอทอป การแสดงศิลปวัฒนธรรมพื้นบ้าน การแสดงของเด็กเยาวชนและประชาชนในพื้นที่ตำบลตันหยงโป และการแข่งขันกีฬาพื้นบ้าน เช่น กินกั้ง ยั้งไม่อยู่ อู้หูหรอยจัง , แข่งขันตีล้อขอใจเธอ ตลอดจนการประกวดต่าง ๆ เช่น ประกวดทำนาซิ กอแร็ง ตันหยง , ทำกะตูปัต ซอตอง , ประกวดวาดภาพ หัวข้อ“ตันหยงโป บ้านฉัน เสน่ห์เมืองสตูล” เป็นต้น และการประกวดหนูน้อยตันหยงโป พร้อมชมฟรีคอนเสิร์ตจากศิลปินทุกค่ำคืน คืนวันที่ 7 กุมภาพันธ์ 2568 วงมนูญดาหวี , คืนวันที่ 8 กุมภาพันธ์ 2568 วงรีแบน (บังลี) และคืนวันที่ 9 กุมภาพันธ์ 2568 วงแทมมะรีน
พร้อมกันนี้ได้กำหนดจัดงานวิ่งพิชิตตะวันตันหยงโป ครั้งที่ 2 ประจำปี 2568 ในวันที่ 8 กุมภาพันธ์ 2568 ในประเภทฟันรัน ระยะ 6.45 กิโลเมตร เส้นทางโดยรอบแหลมตันหยงโป เพื่อจัดหารายได้ช่วยเหลือเด็กกำพร้า ผู้ด้อยโอกาสและผู้ป่วยติดเตียงในพื้นที่ตำบลตันหยงโป จึงขอเชิญชวนชาวสตูล ผู้ที่สนใจ นักท่องเที่ยว และนักวิ่ง เข้าร่วมงานฯ ตามวันเวลาและสถานที่ข้างต้น
งาน ประเพณีแห่มาลัยข้าวตอก ประจำปี 2568 วันที่ 7 - 11 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน "ประเพณีแห่มาลัยข้าวตอก ...หนึ่งเดียวในโลก ประจำปี 2568 " ✅กำหนดจัดระหว่างวันที่ 7 - 11 กุมภาพันธ์ 2568 ณ บริเวณหน้าที่ว่าการอำเภอมหาชนะชัย จังหวัดยโสธร
วันที่ 7 กุมภาพ้นธ์ 2568 พิธีอัญเชิญถ้วยพระราชทานฯ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯสยามบรมราชกุมารี และแห่ขบวนรถมาลัยข้าวตอกเข้าสู่บริเวณจัดงานฯ พิธีเปิดงานประเพณีแห่มาลัยข้าวตอก ชมการแสดงศิลปวัฒนธรรมบนเวที (แสง สี เสียง สื่อประสม)
วันที่ 8 กุมภาพันธ์ 2568 ชมขบวนรถแต่งมาลัยข้าวตอกสวยงามตลอดทั้งวัน ชมการประกวดร้องเพลง (ท้องถิ่น) ชมการแข่งขันเซปักตะกร้อ ชม ชิม ช้อป สินค้าโอทอป และตลาดถนนคนเดิน ชมประกวดธิดามาลัยข้าวตอก ชมการแสดงคอนเสิร์ต ณ. อุบลแบรนด์
วันที่ 9 กุมภาพันธ์ 2568 ชมขบวนรถแต่งมาลัยข้าวตอกสวยงามตลอดทั้งวัน ?ชมการแข่งขันเซปักตะกร้อ ชมการแสดงคอนเสิร์ต วงซูซู ชม ชิม ช้อป สินค้าโอทอป และตลาดถนนคนเดิน
วันที่ 10 กุมภาพันธ์ 2568 ชมขบวนรถแต่งมาลัยข้าวตอกสวยงามตลอดทั้งวัน ชมการประกวดส้มตำลีลาประกอบเพลง ชมการประกวดการจัดสำหรับอาหารพื้นบ้าน ชมการแสดงคอนเสิร์ต หมอลำซิ่ง บีม จุฑา จันทร์เมือง ชม ชิม ช้อป สินค้าโอทอป และตลาดถนนคนเดิน ประกาศผลการประกวดมาลัยข้าวตอก
วันที่ 11 กุมภาพันธ์ 2568 พิธีมอบรางวัลมาลัยข้าวตอกสวยงาม ณ บริเวณหน้าศาลหลักเมืองพระเรืองไชยชำนะ พิธีปล่อยขบวนแห่มาลัยข้าวตอกไปทอดถวาย ณ วัดหอก่อง หมายเหตุ : กำหนดการอาจเปลี่ยนแปลงได้ตามความเหมาะสม
งานดนตรี Song By The River @ Krabi #3 วันที่ 7-9 กุมภาพันธ์ 2568
งานดนตรี Song By The River @ Krabi #3 บทเพลงแห่งรัก Rthym Of The Andaman วันที่ 7-9 กุมภาพันธ์ 2568 17.30 - 22.00 น. สถานที่ ลานปูดำ ถนนอุตรกิจ อำเภอเมือง จังหวัดกระบี่ เต็มอิ่ม ตลอด 3 วัน ฟรีตลอดทั้งงาน
Local Food & Coffee Workshop ครั้งที่ 1 วันเสาร์ ที่ 8 กุมภาพันธ์ 2568
Local Food & Coffee Workshop ครั้งที่ 1 วันเสาร์ ที่ 8 กุมภาพันธ์ 2568 เวลา 09.30 เป็นต้นไป ที่ร้านเขียวขจี อาหารไทย วังเจ้า,ตาก กิจกรรมดีๆ ที่อยากเชิญชวนมาทำ workshop กับเมนูสุดคิ้วท์ อย่างหมูห่อใบชะพลูย่าง และตกแต่งจานอาหารด้วยดอกไม้ (Edible Flower) โดยที่จะทีมงานดูแลในทุกๆขั้นตอนและการเสริฟเมนูเครื่องดื่ม จากน้องหนึ่ง Hanng Over Coffee, Specialty Coffee & Roaster ที่ีจะมาดริปกาแฟให้ทุกท่านได้ชิมกัน
งาน Pet Wedding You are Pawfect วันที่ 8 ก.พ. 2568
งาน Pet Wedding You re Pawfect ณ Central Westville วันที่ 8 ก.พ. นี้ เวลา14.00-18.00น. พิธีจดทะเบียนสมรสกับฟอร์กี้เฟอร์บี้
งานรักษ์เหลืองจันท์ 2568 วันดอกไม้บาน ครั้งที่ 23 วันที่ 8-16 กุมภาพันธ์ 2568
ราชมงคลรักษ์เหลืองจันท์ วันดอกไม้บาน ครั้งที่ 23 ประจำปี 2568 กำหนดจัดวันที่ 8-16 กุมภาพันธ์ 2568 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก วิทยาเขตจันทบุรี เลือกซื้อสินค้าเกษตร พันธุ์ไม้ สินค้าออร์แกนิค ผักปลอดสารพิษ ของกินของใช้ สินค้า OTOP สินค้าจากวิสาหกิจชุมชนท้องถิ่น ของดีเมืองจันท์ และจังหวัดต่างๆ ชมการประกวดกล้วยไม้พื้นเมืองเหลืองจันบูร กลัวยไม้ทั่วไป บอนสี หม้อข้าวหม้อแกงลิง โชคเก้าชั้น และจัดผักสวนครัว 5 ชนิดในภาชนะ 15 นิ้ว -การประกวดสุนัขพันธุ์ไทยหลังอาน -การอบรม เสวนา และถ่ายทอดเทคโนโลยี -ลานสวนสนุก เครื่องเล่น และเกมส์มันส์ๆ
ดนตรีในสวน เดือนแห่งความรัก 8-9 กุมภาพันธ์ 2568
ดนตรีในสวนในสัปดาห์ที่ 2 ของเดือนแห่งความรัก โดยความร่วมมือของกรุงเทพมหานคร สถาบันดนตรีกัลยาณิวัฒนา มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้า ศิลปิน ศิลปินอิสระ วงดนตรีประชาชนและเยาวชน
วันเสาร์ที่ 8 กุมภาพันธ์ 2568 สวนหลวงพระราม 8 เขตพระนคร งาน PGVIM POP-UP! Nattie and the band เริ่ม 17.30 น.
วันอาทิตย์ที่ 9 กุมภาพันธ์ 2568
• สวนเบญจกิติ เขตคลองเตย วง Alcatraz เริ่ม 16.30 น.
• อุทยานเบญจสิริ เขตคลองเตย วง Blackberry วง SYNK วง Root 36 วง KFC เริ่ม 16.30 น.
• สวนลุมพินี เขตคลองเตย เทศกาลดนตรีในสวน วง Royal Bangkok Symphony Orchestra เริ่ม 17.30 น.
• Museum Siam เทศกาลดนตรีกรุงเทพฯ วงดนตรีร่วมสมัยกรุงเทพมหานคร วง 3 ครู (ณพ จักร พัชร) ศิลปินรับเชิญ เบิ่ง ระนาดโหมโรง เก่ง คพช เริ่ม 17.00 น.
การอาชีพปราจีนฯ Mini Marathon 2025 วันที่ 8 กุมภาพันธ์ 2568
การอาชีพปราจีนฯ Mini Marathon 2025 วันที่ 8 กุมภาพันธ์ 2568 เดิน-วิ่ง เพื่อการศึกษา
ณ ป่านันทนาการน้ำตกเขาอีโต้ จังหวัดปราจีนบุรี
เริ่มเวลา (ช่วงเย็น)
ประเพณีโคมไฟเฟสติวัล 2025 แสงสีแห่งเมืองปากน้ำ 8-23 กุมภาพันธ์ 2568
ประเพณีโคมไฟเฟสติวัล 2025 แสงสีแห่งเมืองปากน้ำ ศาลเจ้าห้าพระองค์ เสียนหลอไต้เทียนกง ระหว่างวันที่ 8 - 23 กุมภาพันธ์ 2568 ศาลเจ้าห้าพระองค์ มูลนิธิธรรมกตัญญู เสียนหลอไต้เทียนกง อ.เมือง จ.สมุทรปราการ
คาราวานสีเขียวเที่ยวเนินมะปราง 8-9 กุมภาพันธ์ 2568
ททท. สำนักงานพิษณุโลก ชวนนักท่องเที่ยวที่มีรถไฟฟ้าเข้าร่วมกิจกรรม คาราวานสีเขียวเที่ยวเนินมะปราง 8-9 กุมภาพันธ์ 2568 Free เสื้อยืดคาราวาน 1 ตัว อาหาร 4 มื้อ กิจกรรม DIY ผ้ามัดย้อมและข้าวแดกงา ฟังโฟล์คซองค์ท่ามกลางสายลมหนาว
ใต้แสงดาว พราวสุพรรณ Starlit Suphanburi Experience ทุกวันเสาร์ ที่ 8, 15, 22 กุมภาพันธ์ 2568
ททท.สำนักงานสุพรรณบุรี ชวนมาเปิดประสบการณ์ดูดาว กับบรรยากาศแสนโรแมนติก ริมอ่างเก็บน้ำลำตะเพิน ที่มีวิวพระอาทิตย์ตกสวยที่สุด และจุดดูดาวที่สวยที่สุดเช่นกัน ในกิจกรรม ใต้แสงดาว พราวสุพรรณ Starlit Suphanburi Experience ทุกวันเสาร์ ที่ 8, 15, 22 กุมภาพันธ์ 2568 CAMP MORE camp & café อ.ด่านช้าง จ.สุพรรณบุรี
กิจกรรมไฮไลท์ กิจกรรมดูดาวโดยผู้เชี่ยวชาญ ▪️นำชมดาวเคราะห์ ดาวฤกษ์ กลุ่มดาว กาแล็กซี่ และเนบิวลาต่าง ๆ ▪️นำชมวัตถุท้องฟ้าด้วยกล้องโทรทรรศน์ ฟังเพลงชิลล์จากน้องๆนักเรียน กิจกรรมดูดาวสู่ดูดวง กิจกรรม work shop งาน Craft กิจกรรมสอยดาว กิจกรรมบันทึกภาพความทรงจำกับหมู่ดาว
งาน "ดอกฝ้ายบานสืบสานวัฒนธรรมไทเลย" ประจำปี 2568 วันที่ 8-17 กุมภาพันธ์ 2568
จังหวัดเลยขอเชิญชวนพี่น้องประชาชนและนักท่องเที่ยว มาเที่ยวงาน "ดอกฝ้ายบานสืบสานวัฒนธรรมไทเลย" ประจำปี 2568 ระหว่างวันที่ 8-17 กุมภาพันธ์ 2568 ณ สนามหน้าศาลากลางจังหวัดเลย รวม 10 วัน
กำหนดพิธีเปิดงานในวันที่ 8 กุมภาพันธ์ 2568 โดยมีขบวนแห่ จำนวน 6 ขบวนใหญ่ ซึ่งจะเริ่มเคลื่อนขบวนเวลา 15.00 น. จากบริเวณแยกโรงพยาบาลเลย ถนนมลิวรรณ ไปตามถนนนกแก้ว และเข้าสู่สนามกีฬากลางจังหวัดเลย อันเป็นสถานที่ประกอบพิธีเปิดงานฯ และในปีนี้จะมีการถ่ายทอดสดพิธีเปิดงานฯ ผ่านสถานีโทรทัศน์ NBT11ทีวีอีสานด้วย
กิจกรรมภายในงานที่สำคัญ เช่น กิจกรรมของเหล่ากาชาดจังหวัดเลย "ขาดทุนคือกำไร ยิ่งทำ ยิ่งได้ ยิ่งให้ ยิ่งมี" การประกวดร้องเพลงลูกทุ่งท้องที่-ท้องถิ่นไทเลย การประกวดหางเครื่อง การประกวดแม่สาวลูกสวย การประกวดธิดาดอกฝ้ายบานสืบสานวัฒนธรรมไทเลย ประเภทผู้สูงอายุ การประกวดผลผลิตทางการเกษตร การเดินแบบชุดผ้าไทยเพื่อการกุศล การประกวดแข่งขันส้มตำลีลา การแข่งขันวิ่งดอกฝ้ายบานมาราธอน การแข่งขันกีฬาประเภทต่าง ๆ รวมทั้งการออกร้านของหน่วยงานราชการระดับจังหวัด และอำเภอทั้ง 14 อำเภอของจังหวัดเลยอีกด้วย
งานนมัสการองค์พระธาตุพนม ประจำปี 2568 (8-13 กุมภาพันธ์ 2568)
กำหนดการงานนมัสการองค์พระธาตุพนม ประจำปี ๒๕๖๘ ระหว่างวันพุธ ที่ ๕ กุมภาพันธ์ ถึงวันพฤหัสบดี ที่ ๑๓ กุมภาพันธ์ ๒๕๖๘ (ขึ้น ๘ ค่ำ เดือน ๓ ถึง แรม ๑ ค่ำ เดือน ๓) วัตถุประสงค์ของการจัดงานนมัสการองค์พระธาตุพนม ประจำปี 2568 มุ่งเน้นการสืบสานและอนุรักษ์ประเพณีอันดีงามของจังหวัดนครพนม ส่งเสริมการท่องเที่ยวเชิงวัฒนธรรม กระตุ้นเศรษฐกิจในพื้นที่ และเผยแพร่ความรู้เกี่ยวกับองค์พระธาตุพนม - ร่วมอัญเชิญพระอุปคุต ในวันที่ ๕ กุมภาพันธ์ ๒๕๖๘ เวลา ๐๗.๐๐ น. ณ วัดพระธาตุพนม วรมหาวิหาร ตำบลธาตุพนม อำเภอธาตุพนม จังหวัดนครพนม
พัทลุงรุงรัง มีตติ้ง ณ กาแฟในสวน บ้านพน วันที่ 8 กุมภาพันธ์ 2568
พัทลุงรุงรัง มีตติ้ง ณ กาแฟในสวน บ้านพน วันที่ 8 กุมภาพันธ์ 2568 ภายในงานเป็นกันเอง อบอุ่นน่ารัก กิจกรรมภายในงานมากมาย มีทั้งงานคราฟ กาแฟ ของกิน บรรยากาศชิลล์ มีดนตรีสดฟังสบายๆ ภายในสวน
งาน KHAOLAK BREW FEST 2025 วันที่ 8-9 กุมภาพันธ์ 2568
งาน KHAOLAK BREW FEST 2025 วันที่ 8-9 กุมภาพันธ์ 2568 เวลา 17:01 - 23:59 น. ลานโวยวายพาร์ค ซอยบางเนียง ตะกั่วป่า เทศกาลเครื่องดื่มสร้างสรรค์แห่งปีของเขาหลัก งานสังสรรค์สร้างสรรค์ที่มาพร้อมกับความสนุกแบบไม่อั้นฟังเพลงกันยาว ๆ ตลอด 2 วัน พร้อมกิจกรรมเกมสุดมันส์ และที่พลาดไม่ได้คือ แบรนด์คราฟต์หลากหลายกว่า 40 แบรนด์ จากทั่วประเทศ นอกจากนี้ยังมีโซนอาหารให้ได้ช้อปได้ชิมกันแบบจุใจ เข้างานฟรี !!
งานนมัสการ องค์พระธาตุบังพวน 8-12 ก.พ.68
สืบสานงานประเพณี ขอเชิญเที่ยวงานนมัสการ องค์พระธาตุบังพวน 8-12 ก.พ. 2568 ณ วัดพระธาตุบังพวน อ.เมือง จ.หนองคาย
สะปัน มินิคอนเสริ์ต #1 วันเสาร์ ที่ 8 กุมภาพันธ์ 2568
สะปัน มินิคอนเสริ์ต #1 ใน วันเสาร์ ที่ 8 กุมภาพันธ์ 2568 ณ ลานที่พัก เดอะกรีน เม้าเท่น (บ้านเด่น) เตรียมตัวเตรียมใจมามันส์กับพวกเรา วงเดอะ มังกี้ ในกิจกรรมของโลกดนตรี และบรรยากาศสไตล์แคมป์ปิ้ง ที่โอบล้อมด้วยภูเขา เพื่อต้อนรับช่วงเทศกาลวันแห่งความรัก ช่วงเดือนกุมภาพันธ์ จำหน่าย บัตรเข้าชมแล้ว ในราคา ท่านละ 120 บาท กิจกรรมในครั้งนี้ จัดขึ้นเพื่อหารายได้ เข้าชมรมผู้ประกอบการหมู่บ้านสะปัน
เดินวิ่งพิชิตตะวันตันหยงโป ครั้งที่ 2 เสาร์ ที่ 8 ก.พ. 2568
เดินวิ่งพิชิตตะวันตันหยงโป ครั้งที่ 2 ประจำปี พ.ศ. 2568 เดิน - วิ่ง การกุศล เพื่อเด็กกำพร้า ผู้ด้อยโอกาส และผู้ป่วยติดเตียง ร่วมถึงส่งเสริมการท่องเที่ยวตำบลตันหยงโป เดิน วิ่ง วัน เสาร์ ที่ 8 ก.พ. 2568 เวลาปล่อยตัว 17.00 น.สถานที่จัดงาน: จุดปล่อยตัว ณ สนามหาดชายเลบ้านหาดทรายยาว หมู่ที่ 2 ต.ตันหยงโป อ.เมืองสตูล จ.สตูล วิ่ง FUN RUN 6.5 KM.
งาน "CLASSIC CAR SHOW PATTAYA" ครั้งที่ 6 วันที่ 8-9 ก.พ.68
งาน "CLASSIC CAR SHOW PATTAYA" ครั้งที่ 6 วันที่ 8-9 ก.พ.68 ณ บริเวณถนนพระตำหนักซอย 4 และซอย 5 และขบวนคาราวานรถคลาสสิครอบเมืองพัทยา
วันเสาร์ที่ 8 ก.พ.68 จะเป็นการจัดแสดงรถคลาสสิค ระหว่างเวลา 14.00-20.00 น. บริเวณถนนพระตำหนักซอย 4 และซอย 5
วันอาทิตย์ที่ 9 ก.พ.68 จะเป็นกิจกรรมขบวนคาราวานรถคลาสสิคซึ่งเป็นรถโบราณหายาก จำนวนกว่า 100 คัน ตั้งแต่เวลา 10.00 น. โดยเคลื่อนขบวนจากถนนพระตำหนักซอย 4 ไปตามถนนสายชายหาดจอมเทียน แล้ววนกลับไปยังจุดพื้นที่จัดแสดง คือบริเวณถนนพระตำหนักซอย 4 และซอย 5 ใช้เส้นทาง 1 ช่องจราจร โดยไม่มีการปิดถนน พร้อมเจ้าหน้าที่ตำรวจ สภ.เมืองพัทยา และเจ้าหน้าที่เทศกิจเมืองพัทยา ร่วมอำนวยความสะดวกตลอดเส้นทางขบวนคาราวาน
PKRU x Chalong: Revamping Creative Tourism
Phuket Rajabhat University in collaboration with Chalong Municipality invites you to Shop, Taste, and Enjoy at PKRU x Chalong: Revamping Creative Tourism ✅ Shop for local products and handicrafts ✅ Taste signature local dishes and beverages ✅ Enjoy student musical performances and cultural shows from the Chalong community
Join us on February 8-9, 2025 Event Venue: Activity Area, 1st Floor, in front of Tops Robinson Lifestyle Chalong Come and experience the essence of Chalong’s culture!
ดนตรีในสวนวง BMO กทม. เดือนกุมภาพันธ์ 68
กรุงเทพมหานคร ชวนฟังดนตรี กับวง BMO (Bangkok Metropolitan Orchestra)
อาทิตย์ที่ 9 กมภาพันธ์ 2568 เวลา 15.00 น. Bangkok Metropolitan Youth Orchestra Concert ณ ห้องแสดงดนตรี ชั้น 16 อาคาร 27 วิทยาลัยการดนตรี มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา
อาทิตย์ที่ 16 กุมภาพันธ์ 2568 เวลา 17.00 น. เทศกาลดนตรีกรุงเทพฯ ณ Terminal 21 พระราม 3 ????พบกับศิลปินรับเชิญ • ลูกหว้า พิจิกา จิตตะปุตตะ • โน้ต ศรัณย์ คุ้งบรรพต • มุก เปมิกาเงินส่งเสริม • ปอนด์ พัทธนันท์ อาจองค์ • กองปราบ ปณิธาน จวงครุฑ
อาทิตย์ที่ 23 กุมภาพันธ์ 2568 เวลา 17.00 น. เทศกาลดนตรีกรุงเทพฯ ณ Museum Siam ????พบกับศิลปินรับเชิญ • กบ เสาวนิตย์ นวพันธ์ • โน้ต ศรัณย์ คุ้งบรรพต • ปอนด์ พัทธนันท์ อาจองค์ • ฟิช กฤตรัช พิสุทธิวงษ์
อาทิตย์ที่ 8 มีนาคม 2568 เวลา 15.00 น. RSUniverse Concert โดยความร่วมมือของ กรุงเทพมหานครและมหาวิทยาลัยรังสิต ณ ศาลาดนตรีสุริยเทพ วาทยากร • ดร.วานิช โปตะวนิช • สรพจน์ วรแสง พบกับศิลปินรับเชิญ • Violin ณชพล ทิพย์ธัญ
ประเพณีตักบาตรพระอรหันต์ ปิดทองไหว้พระขึ้นเขาเพ็ญเดือนสาม เสริมมงคล 9 - 13 กุมภาพันธ์ 2568
ททท.สำนักงานนครสวรรค์-พิจิตรขอเชิญร่วมสืบสานประเพณีตักบาตรพระอรหันต์ ปิดทองไหว้พระขึ้นเขาเพ็ญเดือนสาม เสริมมงคล ครั้งหนึ่งในชีวิต ก้าวขึ้นบันได 428 ขั้น นมัสการพระมหาธาตุคชลักษณ์จอมคีรี วันทาพระพุทธไตรโลกาธิบดีศรีสาคร กราบบูชาขอพรหลวงพ่อเตียง ในงานสืบสานประเพณีตักบาตรพระอรหันต์ปิดทองไหว้พระขึ้นเขาเพ็ญเดือนสาม วันที่ 9 - 13 กุมภาพันธ์ 2568
วัดเขารูปช้าง ต.ดงป่าคำ อ.เมืองพิจิตร จ.พิจิตร
พิเศษ!!ชมการแสดง ประกอบแสงและเสียง ชุด "คชลักษณ์คีรีศรีสะหลวง" ในพิธีตักบาตรพระอรหันต์ เนื่องในงานประจำปีปิดทองไหว้พระขึ้นเขาเพ็ญเดือนสาม 2568 วันที่ 12 กุมภาพันธ์ 2568 ตั้งแต่เวลา 18.30 น. เป็นต้นไป ● 9 กุมภาพันธ์ 17:00 น. พิธีเจริญพระพุทธมนต์เปิดงาน ชมการแสดงโขน เรื่อง รามเกียรติ์ ชุด วสันตนิยาย และจัดเต็มแบบวาไรตี้ กับวงดนตรีของลูกหลานชาวพิจิตร “ออลเวย์แบนด์” ● 10 กุมภาพันธ์ โจ๊ะทุกจังหวะ มันทุกท่วงท่า ย้อนยุค ย้อนเวลา กับวง “วีซ่าคอมโบ้” ● 11 กุมภาพันธ์ ทั้งสนุก ทั้งฮา กับสาวสำเนียงกัมพูชา แดนซ์ระเบิด “เฟิร์ส พรชิตา” และ “เรดแบนด์ นครสวรรค์” ● 12 กุมภาพันธ์ (ตรงกับขึ้น 15 ค่ำ เดือน 3 +วันมาฆบูชา) ☆ 10:00 น. ชมการแสดงลิเกภาคกลางวัน และพิเศษภาคกลางคืน พบกับนักแสดงรับเชิญ “หลุยส์ ชวนชื่น” ☆ 13:00 น. ฟังเทศน์แหล่ โฆสัปปมาณิกา โดยพระครูสมุห์ภาณุวัฒน์ ฐิตสุทโธ และพระมหาขวัญชัย ชาตวิริโย ☆ ภาคค่ำ 18:30 น. เป็นต้นไป
ชมความงดงามตระการตา “พลุสวรรค์ อัศจรรย์เพ็ญเดือนสาม” ความยิ่งใหญ่หนึ่งเดียวในพิจิตร ร่วมสืบสานประเพณีตักบาตรพระอรหันต์ ชมการแสดง Light and Sound ชุด “คชลักษณ์คีรี ศรีสระหลวง” ละลานตากับกระบวนทัพพระอินทร์ทรงช้างเอราวัณ ☆ เสริมทัพความมันส์ในค่ำคืนวันเพ็ญ กับคอนเสิร์ตกระทิงแดง มาปลดปล่อยความอัดอั้นบั้นเอว แดนซ์กันยาวๆ กับนักร้องสาวขวัญใจแฟนๆ “ตั๊กแตน ชลดา” ● 13 กุมภาพันธ์ 19:00 น. เป็นต้นไป ☆ ร่วมส่งท้ายงานประเพณี ร่วมจารึกชื่อ และแห่ผ้าห่มพระมหาธาตุเจดีย์ปฐวีปิฎก ไม่พลาดกับคอนเสิร์ตกระทิงแดง ปิดท้ายแบบม่วนๆ ออนซอน เร้าใจ พร้อมยกทั้งค่ายมาโชว์ “โตเกียวมิวสิค และ ผู้ใหญ่บ้านฟินแลนด์ ¤ 11 และ 12 กุมภาพันธ์ ชมการแข่งขันฟุตบอลเขารูปช้างกระทิงแดงคัพ ครั้งที่ 28 ชิงถ้วยและเงินรางวัล จากบริษัทเครื่องดื่มกระทิงแดง ณ สนามกีฬาโรงเรียนวัดเขารูปช้าง ¤ ทุกค่ำคืนชมภาพยนตร์กลางแปลง และลิเกชื่อดัง ทายาทและผองศิษย์ ลิเกตลก ป.ปากควาย พบกับคณะ ป.ปลายฟ้า และณิชกานต์ดาวรุ่ง ¤ 5 วัน 5 คืน ร่วมสอยดาว ใบเซียมซีหลวงพ่อเตียง ลุ้นรับของรางวัลมากมาย สอบถามเพิ่มเติม สำนักงานวัดเขารูปช้าง โทร. 085-3313280
โครงการสีสันแห่งแสงทวารวดี ศรีรัตนมหาธาตุ ราชบุรี 9-12 กุมภาพันธ์ 2568
อบจ.ราชบุรี และ วัดมหาธาตุวรวิหารราชบุรี ขอเชิญชวนชาวราชบุรีทุกท่าน ร่วมงาน โครงการสีสันแห่งแสงทวารวดี ศรีรัตนมหาธาตุ ราชบุรี จัดแสดง แสง สี วันที่ 9-12 กุมภาพันธ์ 2568 วัดมหาธาตุวรวิหารราชบุรี เทศน์มหาชาติ เสริมสิริมงคล ขบวนแห่ผ้าห่มพระมหาธาตุ พิธีห่มผ้าพระมงคลบุรี พระศรีนัคร์ เพื่อความเป็นสิริมงคล พิธีเปิดโครงการ ฯ ชมการรำบวงสรวง ร่วมเวียนเทียนวันมาฆบูชา จุดแสงศรัทธาให้สว่างไสว ไถ่ชีวิตโค สร้างบุญใหญ่ เสริมบารมี สัมผัสมนต์เสน่ห์แห่งแสงศรัทธา แล้วพบกันที่ วัดมหาธาตุราชบุรี
เทศกาลดนตรีรินมาอินดี้ 4 วันอาทิตย์ ที่ 9 กุมภาพันธ์ 2568 [ซื้อบัตร]
เทศกาลดนตรีรินมาอินดี้ 4 วันอาทิตย์ ที่ 9 กุมภาพันธ์ 2568 RM PARK SALAYA ถนนบรมราชนนี (ตรงข้ามเซ็นทรัลศาลายา) 3 เวที MOON STAGE/ CHILL STGAE/CAMP STAGE ศิลปินเพียบดังนี้ TAITOSMITH • SILLY FOOLS • LOMOSONIC • PARADOX • PURPEECH • POLYCAT • SAFEPLANET • BLACKBEANS • GREASY CAFE’ • ONLY MONDAY • FREEHAND • LANDOKMAI • AYLA’S • DEPT • YEW • ANATOMY RABBIT • LITTLE JOHN • คณะขวัญใจ • มนัสวีร์ • ไววิทย์ • วสันต์ 17 • ภูมินทร์ • เขียนไขและวานิช • ดร บม
หลาดใต้ถุน ปากพะยูน วันอาทิตย์ที่ 9 กุมภาพันธ์ 2568
ปักหมุด หลาดใต้ถุน ปากพะยูน วันอาทิตย์ที่ 9 กุมภาพันธ์ 2568 เวลา 10.00-15.00น. ของกิน หรอยๆ พื้นบ้านหาทานยาก เดือนละครั้ง
กิจกรรมสุดพิเศษ ไม่ควรพลาด ศิลปิน เชน มะยม นักร้อง ลูกหลานคนปากพะยูน ร่วมมอบความบรรเทิงและสนับสนุนบ้านเกิดปากพะยูน ศิลปิน วงเลใน วงในดวงใจ สร้างความสุขความบรรเทิง เชิญจากปีที่แล้ว ปีนี้ได้คิวแก่หลาดใต้ถุนเช่นกันต้องมาฟังกัน งานคราฟท์ กระจูด บุษญา ที่หาตัวจับยากผู้สืบทอดงานหัตกรรมกระจูดจากบรรพบุรุษแม่หยา ประยุกต์กับไอเดียเก๋ๆ ทุกใบเกิดจากแรงบันดาลใจที่ตั้งใจและใส่หัวใจ เดินทางจากทะเลน้อย เพื่อหลาดใต้ถุน กาแฟสด เด็ดทุกเม็ด ทุกกรรมวิธีการชง สวนบ้านปั้นดิน เครือข่ายงานคราฟท์ ที่ใส่ใจทุกรายละเอียด ความสุขของคนดื่มคือความสุขของคนชง ตั้งใจเดินทางจากควนขนุน เพื่อหลาดใต้ถุน WorkShop การเรียนรู้ทรัพยากรทะเลสาบ งานศิลปะ และอาหารพื้นบ้าน Living museum เรื่องราวปากพะยูน เมืองท่า เมืองพหุวัฒนธรรม ....ยังๆยังไม่หมด.... อาหาร ขนม พื้นบ้านมากมาย ร้านค้านักธุรกิจน้อยของเยาวชน ผลผลิตทางเกษตรปลอดสารเคมีหลากหลาย ผลิตภัณฑ์ของฝากจากเครือข่ายรอบทะเลสาบสงขลา และโครงการแก้จน มหาวิทยาลัยทักษิณ ขนมาไว้ที่นี้
กิจกรรมปล่อยนกกระเรียนพันธุ์ไทย ครั้งที่ 13 จำนวน 8 ตัว วันที่ 9 - 10 กุมภาพันธ์ 2568
ททท. สำนักงานบุรีรัมย์ ขอเชิญร่วมกิจกรรมปล่อยนกกระเรียนพันธุ์ไทย ครั้งที่ 13 จำนวน 8 ตัว วันที่ 9 - 10 กุมภาพันธ์ 2568 ภายใต้หัวข้อ(Concept) “PROTECTING WETLANDS FOR OUR COMMON FUTURE – Value, Protect, Inspire” “ปกป้องพื้นที่ชุ่มน้ำ เพื่ออนาคตของเรา – รู้คุณค่า ร่วมปกป้อง สร้างแรงขับเคลื่อน
วันที่ 9 กุมภาพันธ์ 2568 ภายในงานพบกับกิจกรรม ตั้งแต่เวลา 09.00 - 18.00 น. นิทรรศการและกิจกรรม จากหน่วยงานเครือข่ายอนุรักษ์ ถนนศิลปะสร้างสรรค์งานศิลปะเพื่อการอนุรักษ์ร่วมกันได้ทั้งครอบครัว ล่องเรือชมธรรมชาติ พร้อมชมวิวอ่างเก็บน้ำช่วงพระอาทิตย์ตก โดยไม่ต้องจองล่วงหน้าเพราะกลุ่มพายเรือมาเตรียมพร้อมบริการทุกท่านแล้วในงานนี้เท่านั้น ” ตลาดเซราะเกรียล “ ชิม&ช้อป ผลิตภัณฑ์ท้องถิ่นของชุมชนรอบพื้นที่ชุ่มน้ำอันเป็นแหล่งอาศัยของนกกระเรียนพันธุ์ไทย และกิจกรรมอื่นๆ อีกมากมายให้ได้ร่วมภายในงาน
วันที่ 10 กุมภาพันธ์ 2568 ลงทะเบียนเข้างาน ตั้งแต่เวลา 06.00 น. ณ ศูนย์เรียนรู้พื้นที่ชุ่มน้ำและนกกระเรียนพันธุ์ไทย จังหวัดบุรีรัมย์ ร่วมปล่อยนกกระเรียนพันธุ์ไทยคืนสู่ธรรมชาติ 08.30 - 09.00 น. ณ อ่างเก็บน้ำห้วยจระเข้มาก จังหวัดบุรีรัมย์
มหกรรมเครื่องปั้นดินเผาของดีด่านเกวียน 10-14 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน มหกรรมเครื่องปั้นดินเผาของดีด่านเกวียน วันที่ 10-14 กุมภาพันธ์ 2568 บริเวณถนนหน้าเทศบาลด่านเกวียน อ.โชคชัย นครราชสีมา งานแสดงสินค้าของดีด่านเกวียน การประกวดเครื่องปั้นดินเผา ชมชิมช็อปสินค้าราคาถูกมากมาย สวนสนุกชุดใหญ่
ฟังดนตรีฟรี ที่ศิริราช 10-11 กุมภาพันธ์ และ 11-12 มีนาคม 68
ฟังดนตรีฟรี!! ที่ศิริราช ตลอดปี 2568 กิจกรรมดนตรีจิตอาสาจากกลุ่มอาสาสมัคร ที่จะมาขับร้องบทเพลงให้ทุกคนได้อบอุ่นหัวใจ วันที่ 10-11 กุมภาพันธ์ และ 11-12 มีนาคม 68 (สำหรับเดือนอื่นๆ จะอัพเดตให้ทราบกันอีกครั้ง) ศาลาศิริราช 100 ปี ค่าเข้าชมฟรี! [
ศิริราชเพื่อสังคม]
เทศกาลโคมไฟ บ้านโป่ง "นูดเดิ้ลแลนด์แดนของอร่อย" วันที่ 10-12 กุมภาพันธ์ 2568
เทศกาลโคมไฟ บ้านโป่ง "นูดเดิ้ลแลนด์แดนของอร่อย" วันที่ 10-12 กุมภาพันธ์ 2568
ณ บริเวณโรงเจบ๊วนฮกตั้ว และตลาดดงมะพร้าว อ.บ้านโป่ง จ.ราชบุรี จัดโดย ชมรมลูกหลานบ้านโป่ง ร่วมกับ สำนักงานพาณิชย์จังหวัดราชบุรี
งานประจำปี ชมพู่หวานของดีคลองหาด ครั้งที่ 30 ตั้งแต่ 10 - 19 ก.พ. 2568
ขอเชิญเที่ยวงานประจำปี ชมพู่หวานของดีคลองหาด ครั้งที่ 30 ณ บริเวณหน้าอำเภอคลองหาด จ.สระแก้ว จัดเต็ม 10 วัน 10 คืน ตั้งแต่ 10 - 19 ก.พ. 2568 กิจกรรมไฮไลต์: ชมและชิมผลผลิตทางการเกษตร เพลิดเพลินกับพันธุ์ชมพู่หวานและไม้ผลชั้นดี การประกวดชมพู่หวานพร้อมกิจกรรมสุดพิเศษ ศิลปินที่พร้อมสร้างความสนุก: 10 ก.พ.: เฟิร์ส 12 ก.พ.: น้ำแข็ง ทิพวรรณ 13 ก.พ.: เอ็กซ์ เขามักรี 18 ก.พ.: ผู้ใหญ่บ้านฟินแลนด์ 19 ก.พ.: LABANOON เต็มวง
งานบูชาดาวนพเคราะห์ จุดเทียนอายุวัฒนะ แก้ปีชงไหว้ไท้ส่วยเอี้ยประจำปี2568 วันที่ 10-16 กุมภาพันธ์ 2568
มาร่วมเป็นส่วนหนึ่งในพิธีอันศักดิ์สิทธิ์ งานบูชาดาวนพเคราะห์ จุดเทียนอายุวัฒนะ แก้ปีชงไหว้ไท้ส่วยเอี้ยประจำปี2568 งานจะเริ่มในวันที่ 10-16 กุมภาพันธ์ 2568 นี้ ณ วัดเขตร์นาบุญญาราม อ เมือง จ.จันทบุรี ปีมะเส็ง สุข สมบูรณ์ สำเร็จ สมปรารถนา
ทำพะเก่งเสริมดวงเพื่อความเป็นสิริมงคล จุดเทียนบูชาดาวนพเคราะห์เสวยอายุ แก้ปีชงกับองค์ไท้ส่วยเอี้ย (ขุนพลโกว่ซุ่ยเจียงกุง) ปีชง คือ ปีที่ได้รับผลเสียมากที่สุดหรือที่เราเรียกกันว่าชงโดยตรง (ชง 100%) ได้แก่ ปีกุน ปีที่ชงร่วมได้แก่ ปีขาล ปีมะเส็ง ปีวอก
งานมหกรรมมาฆบูชาแห่ผ้าขึ้นห่มองค์พระบรมธาตุเจดีย์ ณ วัดพระบรมธาตุเจดีย์เขียนบางแก้ว 10-12 กุมภาพันธ์ 2568
งานมหกรรมมาฆบูชาแห่ผ้าขึ้นห่มองค์พระบรมธาตุเจดีย์
ณ วัดพระบรมธาตุเจดีย์เขียนบางแก้ว 10-12 กุมภาพันธ์ 2568
งานมรกตอันดามัน มหัศจรรย์อาหารอร่อยของดีที่ละงู ครั้งที่ 17 ประจำปี 2568 (La-ngu food festival 2025) วันที่ 10–16 กุมภาพันธ์ 2568
เทศบาลตำบลกำแพง ร่วมกับองค์การบริหารส่วนจังหวัดสตูล , สำนักงานท่องเที่ยวและกีฬาจังหวัดสตูล , การท่องเที่ยวแห่งประเทศไทย สำนักงานสตูล และชมรมผู้ประกอบการร้านอาหารและแผงลอยเทศบาลตำบลกำแพง กำหนดจัดงานมรกตอันดามัน มหัศจรรย์อาหารอร่อยของดีที่ละงู ครั้งที่ 17 ประจำปี 2568 (La-ngu food festival 2025) ระหว่างวันที่ 10 – 16 กุมภาพันธ์ 2568 ณ สนามกีฬาตรงข้ามสำนักงานเทศบาลตำบลกำแพง อำเภอละงู จังหวัดสตูล เพื่อส่งเสริมการท่องเที่ยวและประชาสัมพันธ์อาหารและสินค้าพื้นเมืองของเทศบาลตำบลกำแพงและจังหวัดสตูลให้แพร่หลายยิ่งขึ้น
ภายในงานฯ มีการออกร้านจำหน่ายอาหารทั้งในและนอกพื้นที่ , การออกร้านจำหน่ายสินค้า OTOP จากทั่วประเทศ , การออกบูธโชว์ยานยนต์จากบริษัทรถยนต์ชั้นนำ และการแสดงจากศิลปินนักร้องทุกค่ำคืน ดังนี้ วันที่ 10 กุมภาพันธ์ 2568 วงมาลีฮวนน่า , วันที่ 11 กุมภาพันธ์ 2568 ธีเดช , วันที่ 12 กุมภาพันธ์ 2568 วงพัทลุง , วันที่ 13 กุมภาพันธ์ 2568 บ่าววี และชมการประกวดมิสมรกต 2025 , วันที่ 14 กุมภาพันธ์ 2568 วงวันใหม่และโนรามอส , วันที่ 15 กุมภาพันธ์ 2568 วงเมนทอล เจ้าของเพลงดัง “บุษบา” และวันที่ 16 กุมภาพันธ์ 2568 นุ้ย สุวีณา
โปรแกรมภาพยนตร์สัปดาห์นี้ วันที่ 11-16 กุมภาพันธ์ 2568
โปรแกรมภาพยนตร์สัปดาห์นี้ วันที่ 11-16 กุมภาพันธ์ 2568 ที่หอภาพยนตร์
งานเวียนเทียนทางน้ำกลางกว๊านพะเยา เนื่องในวันมาฆบูชา ครั้งที่ 53 วันที่ 11-13 กุมภาพันธ์ 2568 ณ วัดติโลกอาราม จ.พะเยา
ขอเชิญชวนทุกคู่รักมาร่วม "งานเวียนเทียนทางน้ำกลางกว๊านพะเยา เนื่องในวันมาฆบูชา ครั้งที่ 53 " หนึ่งเดียวในโลก ซึ่งทางสำนักงานวัฒนธรรมจังหวัดพะเยา ร่วมกับ ที่ทำการปกครองจังหวัดพะเยา, สำนักงานพัฒนาชุมชนจังหวัดพะเยา ,สำนักงานพระพุทธศาสนาจังหวัดพะเยา และศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา (ททท.) จัดขึ้นในช่วงระหว่างวันที่ 11-13 กุมภาพันธ์ 2568 ณ วัดติโลกอาราม จ.พะเยา
• ร่วมตักบาตรข้าวสารอาหารแห้ง พระภิกษุสงฆ์ จำนวน ๖๙ รูป
• นั่งเรือประกอบพิธีเวียนเทียนทางน้ำถวายเป็นพุทธบูชา
• ยลทิวทัศน์อันงดงามของกว๊านพะเยา
• ชมการแสดงศิลปวัฒนธรรมล้านนา
• ชิมอาหารพื้นถิ่น ของกินพื้นบ้านเมืองพะเยา
• ช้อปผลิตภัณฑ์สินค้าทางวัฒนธรรม OTOP ของดีเมืองพะเยา
พิเศษ : สำหรับท่านที่ชวนคู่รัก คู่พ่อแม่-ลูก หรือคู่สมรส ที่เดินทางมาจากต่างจังหวัด มาร่วมงานเวียนเทียนทางน้ำกลางกว๊านพะเยา ในช่วงวันวาเลนไทน์ ระหว่างวันที่ 11-14 กุมภาพันธ์ 2568 • รับ “ฟรี” คูปองล่องเรือพายไปไหว้ “หลวงพ่อศิลา” ณ วัดติโลกอารามกลางกว๊านพะเยา • เพียงท่าน : เช็คอิน ถ่ายภาพคู่รัก ที่ท่าเรือ/วัดติโลกอาราม แชร์โพสต์ภาพใน Facebook ของตนเอง • ติด#สุขทันทีที่เมืองน่าเที่ยวพะเยา • แคปหน้าจอแล้วส่งมาทาง Line OA ( TAT Chiang Rai ) Link : https://line.me/R/ti/p/@486nfjae • จำกัดสิทธิ์เพียง 299 คู่แรกเท่านั้น (1 คูปอง/2 คน) • รับคูปองได้ที่ท่าเรือกว๊านพะเยาและศูนย์ประสานงานท่องเที่ยวจังหวัดพะเยา (ททท.)
ประเพณีขึ้นเขาเผาข้าวหลาม วันที่ 11-12-13 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานประจำปี ประเพณีขึ้นเขาเผาข้าวหลาม วันที่ 11-12-13 กุมภาพันธ์ 2568 ( ขึ้น 15 ค่ำเดือน 3 ของทุกปี ) ณ วัดสุวรรณคีรี - เขาดงยาง อ.พนมสารคาม จ.ฉะเชิงเทรา พิกัด วัดสุวรรณคีรี (เขาดงยาง)
งานประเพณีนบพระ-เล่นเพลงและงานกาชาดจังหวัดกำแพงเพชร ประจำปี วันที่ 11-22 กุมภาพันธ์ 2568
จังหวัดกำแพงเพชรขอเชิญเที่ยวงานประเพณี “นบพระ-เล่นเพลงและงานกาชาดจังหวัดกำแพงเพชร” ประจำปี พ.ศ. 2568 ระหว่างวันที่ 11-22 กุมภาพันธ์ 2568 ณ วัดพระบรมธาตุพระอารามหลวง และบริเวณหน้าที่ว่าการอำเภอเมือง จังหวัดกำแพงเพชร เพื่อเป็นการอนุรักษ์ขนบธรรมเนียม วัฒนธรรม และประเพณีอันดีงามและส่งเสริมการท่องเที่ยวของจังหวัดกำแพงเพชร
ชม ขบวนแห่นบพระ-เล่นเพลง ชมการแสดงรำพุทธบูชา การแสดงศิลปวัฒนธรรม การประดับไฟอย่างสวยงาม ณ บริเวณวัดพระแก้ว วัดพระบรมธาตุ อุทยานประวัติศาสตร์กำแพงเพชร การออกร้านจำหน่ายสินค้า การจำหน่ายสินค้า OTOP ของดีเมืองกำแพง ร่วมลุ้นรางวัลจากการออกสลากกาชาดการกุศล ชมการจัดแสดงนิทรรศการ สะท้อนวิถีวัฒนธรรมชนเผ่า การจำหน่ายอาหารพื้นบ้าน ตลาดย้อนยุคนครชุม ตลาดย้อนรอยชากังราว การแสดงบนเวทีกลางทุกค่ำคืน เชิญเที่ยวงานประเพณี “นบพระ-เล่นเพลง และงานกาชาดจังหวัดกำแพงเพชร” ประจำปี พ.ศ. 2568 ระหว่างวันที่ 11-22 กุมภาพันธ์ 2568
งาน...จากตะโกลา สู่ ตะกั่วป่า ครั้งที่ 11 วันที่ 11 - 14 กุมภาพันธ์ 2568
งาน...จากตะโกลา สู่ ตะกั่วป่า ครั้งที่ 11 "ย้อนวันวาน...กับความทรงจำ ...แห่งรัก" ระหว่างวันที่ 11 - 14 กุมภาพันธ์ 2568 ณ วงเวียนเสนานุชรังสรรค์
เชิญชวนร่วมทำบุญตักบาตรเป็งปุ๊ด ณ วัดศรีชุม 11 กุมภาพันธ์ 2568
ขอเชิญชวนพุทธศาสนิกชนและผู้สนใจทุกท่านร่วมทำบุญตักบาตรเป็งปุ๊ด เพื่อความเป็นสิริมงคลแก่ตนเองและครอบครัว ณ วัดศรีชุม ต.พระบาท อ.เมือง จ.ลำปาง และ ณ วัดพระธาตุหริภุญชัย วรมหาวิหาร อ.เมือง จ.ลำพูน วันที่ 11 กุมภาพันธ์ 2568 เวลา 22.09 - 00.00 น.
งาน “นมัสการพระธาตุกู่จาน ประจำปี 2568“ วันที่ 11 -15 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน “นมัสการพระธาตุกู่จาน ประจำปี 2568 “ ระหว่างวันที่ 11 -15 กุมภาพันธ์ 2568 ณบ้านกู่จาน ตำบลกู่จาน อำเภอคำเขื่อนแก้ว จังหวัดยโสธร  วันที่ 11 กุมภาพันธ์ 2568 พิธีเปิดงาน / บวชชีพราหมณ์ วันที่ 12 กุมภาพันธ์ 2568 พิธีเวียนเทียนรอบองค์พระธาตุ วันที่ 13 กุมภาพันธ์ 2568 ชมสาวน้อยเพชรบ้านแพง วันที่ 14 กุมภาพันธ์ 2568 ชมเสียงอีสาน วันที่ 15 กุมภาพันธ์ 2568 ชมศิลปินภูไท วีระพงษ์ วงศ์ศิลป์
งาน “นมัสการพระธาตุกู่จาน ประจำปี 2568 “ ระหว่างวันที่ 11 -15 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน “นมัสการพระธาตุกู่จาน ประจำปี 2568 “ ระหว่างวันที่ 11 -15 กุมภาพันธ์ 2568 ณบ้านกู่จาน ตำบลกู่จาน อำเภอคำเขื่อนแก้ว จังหวัดยโสธร  วันที่ 11 กุมภาพันธ์ 2568 พิธีเปิดงาน / บวชชีพราหมณ์ วันที่ 12 กุมภาพันธ์ 2568 พิธีเวียนเทียนรอบองค์พระธาตุ วันที่ 13 กุมภาพันธ์ 2568 ชมสาวน้อยเพชรบ้านแพง วันที่ 14 กุมภาพันธ์ 2568 ชมเสียงอีสาน วันที่ 15 กุมภาพันธ์ 2568 ชมศิลปินภูไท วีระพงษ์ วงศ์ศิลป์
งาน Pet Complex Expo 2025 วันที่ 12-16 ก.พ.2025
งาน Pet Complex Expo 2025 วันที่ 12-16 ก.พ.2025 สถานที่ประกวด ลานกิจกรรมชั้น 4 Sunee Tower จ.อุบลราชธานี ประกวดวันอาทิตย์ที่ 16 ก.พ. 2025
กิจกรรมสัปดาห์ส่งเสริมพระพุทธศาสนา เนื่องในเทศกาลวันมาฆบูชา ปี 2568 วันพุธที่ 12 กุมภาพันธ์ 2568
กิจกรรมสัปดาห์ส่งเสริมพระพุทธศาสนา เนื่องในเทศกาลวันมาฆบูชา ปี 2568 วันพุธที่ 12 กุมภาพันธ์ 2568 ณ วัดท่าหลวง พระอารามหลวง เวลา 07.00น. ทำบุญ ตักบาตร ฟังธรรม (ศาลาใหญ่) เวลา 09.00น. ปฏิบัติธรรม สำนักวิปัสสนากรรมฐาน เวลา 18.30 น. สวดมนต์ เจริญจิตภาวนา ฟังธรรม เวลา 19.00 น. เวียนเทียน ติดต่อสอบถามเพิ่มเติม ประชาสัมพันธ์วัดแอดมินเพจ โทร. 099-298-8598 แฟนเพจ : วัดท่าหลวง พระอารามหลวง พิจิตร
ตักบาตรข้าวหลาม เนื่องในวันมาฆบูชา ประจำปี 2568 วันที่ 12 กุมภาพันธ์ 2568 ณ วัดพระงาม นครปฐม
ขอเชิญชวนร่วมสืบสานประเพณี ตักบาตรข้าวหลาม เนื่องในวันมาฆบูชา ประจำปี 2568 ในวันที่ 12 กุมภาพันธ์ 2568 ณ วัดพระงาม พระอารามหลวง อ.เมือง จ.นครปฐม เวลา 08.00 น. (งานจัดบริเวณเนินเขาวัดพระงาม ประตูทิศที่ติดกับทางรถไฟ) ประเพณีตักบาตรข้าวหลาม เป็นวิถีดั้งเดิมที่ชาวชุมชนวัดพระงามทำมาแต่อดีต (เป็นชุมชนเผาข้าวหลามขนาดใหญ่ ริมทางรถไฟ)
งานมหกรรมการแสดงและจําหน่ายสินค้า “เชียงราย - Northern Border Trade Festival”???? ????️ ระหว่างวันที่ 12 - 16 กุมภาพันธ์ 2568
สำนักงานพาณิชย์จังหวัดเชียงราย ร่วมกับสํานักงานพาณิชย์จังหวัดภาคเหนือ 16 จังหวัด เชิญชวนพี่น้องชาวเชียงราย และจังหวัดใกล้เคียง เตรียมตัวมาช้อปกันให้ฉ่ำ! ได้ที่งานมหกรรมการแสดงและจําหน่ายสินค้า “เชียงราย - Northern Border Trade Festival” ระหว่างวันที่ 12 - 16 กุมภาพันธ์ 2568 เวลา 10.00 - 21.00 น. ณ ลานธรรม ลานศิลป์ ถิ่นพญามังราย (ศาลากลางหลังเก่า) อ.เมือง จ.เชียงราย
พบกับสินค้าชุมชน อัตลักษณ์เด่น ระดับพรีเมี่ยม จากผู้ประกอบการจาก 17 จังหวัดภาคเหนือ และสินค้าจากประเทศเพื่อนบ้าน ลาว เมียนมา กว่า 50 ร้านค้า มาช้อปปิ้งสินค้าดีส่วนลดสุดคุ้ม กิจกรรมนาทีทอง วันละ 2 ช่วง ลุ้นรับรางวัลมากมาย กับกิจกรรม แชะ แชร์โชว์ เพลิดเพลินกับเสียงเพลง และการแสดงศิลปวัฒนธรรม พร้อมชมการแสดงมินิคอนเสิร์ตจากศิลปินชื่อดัง
12 กุมภาพันธ์ พบกับ ไม้เมือง
13 กุมภาพันธ์ พบกับ หญิง ธิติกานต์
14 กุมภาพันธ์ พบกับ ก้านตอง
15 กุมภาพันธ์ พบกับ นุ้ย สุวีณา
16 กุมภาพันธ์ พบกับ ไข่มุก เพ็ญสินี
สอบถามข้อมูลเพิ่มเติมได้ที่ : สำนักงานพาณิชย์จังหวัดเชียงราย โทร. 053-150200
งานเทศกาลโคมไฟง่วนเซียว ประจำปี 12–16 กุมภาพันธ์ 2568
งานเทศกาลโคมไฟ “ง่วนเซียว” ประจำปี 2568 จังหวัดพิษณุโลก 12 – 16 กุมภาพันธ์ 2568 ณ บริเวณศาลเจ้าปุนเถ้ากง - ม่า ศาลเจ้าพ่อเสือ และบริเวณสวนสาธารณะไนท์บาร์ซ่า
วันมาฆบูชา ๒๕๖๘ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร
วันมาฆบูชา ๒๕๖๘ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร อำเภอเมือง จังหวัดพิษณุโลก • ─ ✤ ─ • วันพุธที่ ๑๒ กุมภาพันธ์ พ.ศ.๒๕๖๘ __เวลา ๐๗.๓๐ น. ทำบุญตักบาตร ณ ศาลาพิบูลธรรม __เวลา ๑๓.๐๐ น. พระภิกษุฟังพระปาฏิโมกข์ ณ พระอุโบสถ __เวลา ๑๗.๐๐ น. ทำวัตร สวดมนต์เย็น ณ พระวิหารพระพุทธชินราช __เวลา ๑๘.๐๐ น. - ฟังพระธรรมเทศนา ๑ กัณฑ์ - เวียนเทียนรอบพระวิหารพระพุทธชินราช
Chonburi CoffeeHub Connect 12-18 ก.พ. 68
Chonburi CoffeeHub Connect 12-18 ก.พ. 68 ลานกิจกรรม ชั้น 1 เซ็นทรัล ชลบุรี ส่งต่อความรักผ่านแก้วกาแฟในบรรยากาศสุดอบอุ่น ช่วงเวลาพิเศษที่คุณจะได้เชื่อมต่อกับคนที่รักกาแฟเหมือนกัน ไม่ว่าจะมาเดี่ยว มาคู่ หรือมาทั้งครอบครัว งานนี้อบอวลไปด้วยความรักและกลิ่นหอม! กิจกรรมพิเศษตลอดทั้งงาน ชิมกาแฟจากคาเฟ่ชื่อดังทั่วไทย อิ่มอร่อยกับขนม ชาเขียว และคราฟโกโก้สุดละมุน เวิร์กชอปกาแฟที่จะทำให้คุณตกหลุมรักการ Brewing และการทดสอบทาง Sensory กิจกรรมการแข่งขัน ดริปกาแฟ ชิงรางวัลห้องพัก จาก Go! Hotel ชวนคนที่คุณรักมาสร้างความทรงจำพิเศษในวันวาเลนไทน์นี้ พร้อมเชื่อมต่อทุกความหลงใหลในกาแฟไปด้วยกัน!
งาน Moo Te Magic Love 12-16 กุมภาพันธ์ 68
งาน Moo Te Magic Love 12-16 กุมภาพันธ์ 68 ตั้งแต่เวลา 17.00-24.00 น. ณ ลานกิจกรรม Think Park Shibuya My World ร่วมกับ Think Park Shibuya ฉลองวาเลนไทน์นี้ให้กับเหล่าคนโสด ที่งาน Moo Te Magic Love "มูเสกใจ ให้เจอรัก" พบกับกิจกรรมสนุกๆ วงดนตรีสด ลานเบียร์ และบูธอาหารกว่า 30 ร้านค้า สนุกกันที่โซน Moo Te Magic Zone พาหมอดูไพ่ทาโร่มาถึงที่ ให้เหล่าคนโสดได้ถามหาเนื้อคู่ กิจกรรมกล่องสุ่ม และแทททูสุดเท่ .หรือจะเป็นโซนอาหาร ที่รวมร้านอร่อยในเชียงใหม่ยกมาไว้ถึงใจกลางแยกนิมมาน ในบรรยากาศสุดญี่ปุ่น กว่า 30 ร้านค้า .เพลิดเพลินกับวงดนตรี ลานเบียร์ และการประกวดคัฟเวอร์แดนซ์
งานมหกรรมอาหารอร่อยและของดีเมืองสุพรรณ ครั้งที่ 23 ตั้งแต่ 12-18 กุมภาพันธ์ 2568
งานมหกรรมอาหารอร่อยและของดีเมืองสุพรรณ ครั้งที่ 23 ตั้งแต่ 12-18 กุมภาพันธ์ 2568 ที่กังสดาลย์ ปาร์ค อ.เมือง จ.สุพรรณบุรี Must taste เสน่ห์อาหารเมืองสุพรรณบุรี ร้านอร่อย ร้านดังกว่า 80 ร้าน รวมมาไว้ที่เดียว ชมการแสดงดนตรีจากน้องๆ เยาวชนในพื้นที่ และการแสดงของศิลปินดังทุกคืน 13 กพ Dax Rockrider 14 กพ ปาล์ม นันทวัฒน์ 15 กพ เอ มหาหิงค์ 16 กพ Indigo 17 กพ ปราง ปรางทิพย์ 18 กพ น้าหมู พงษ์เทพ
วัดไร่ขิง ร่วมทำบุญตักบาตรเวียนเทียน วันมาฆบูชา ๑๒ กุมภาพันธ์ พ.ศ. ๒๕๖๘
ขอเชิญพุทธศาสนิกชน ร่วมทำบุญ ตักบาตร เวียนเทียน เนื่องใน วันมาฆบูชา (ขึ้น ๑๕ ค่ำ เดือน ๓) วันพุธที่ ๑๒ กุมภาพันธ์ พ.ศ. ๒๕๖๘ ณ วัดไร่ขิง พระอารามหลวง อำเภอสามพราน จังหวัดนครปฐม
กิจกรรม “เวียนเทียน ตะคันเมืองโบราณสุโขทัย” เนื่องในวันมาฆบูชา ณ วัดมหาธาตุ อุทยานประวัติศาสตร์สุโขทัย ในวันที่ 12 กุมภาพัรธ์ 2568
ขอเชิญร่วมกิจกรรม “เวียนเทียน ตะคันเมืองโบราณสุโขทัย” เนื่องในวันมาฆบูชา ณ วัดมหาธาตุ อุทยานประวัติศาสตร์สุโขทัย ในวันที่ 12 กุมภาพัรธ์ 2568 เวลา 17:00 น. ลงทะเบียนรับตะคันฟรี จำนวน 400 ลูก
พิเศษ 1️⃣ ชมการแสดงพลุ ดอกไม้ไฟ และการตกแต่งประดับไฟโบราณสถาน วัดมหาธาตุ 2️⃣ ชมการแสดงโขน เรื่องรามเกียรติ์ ตอน วายุบุตรวุฒิไกร (หนุมาน) 3️⃣เที่ยวชม/ชิม อาหารจากตลาดโบราณ-ท่าน้ำรับเสด็จ ณ บริเวณดงตาล หน้าวัดมหาธาตุ
กิจกรรมร่วมทำบุญตักบาตร เนื่องในวันมาฆบูชา 2568 ในจ.ลำปาง
ขอเชิญชวนพุทธศาสนิกชนร่วมทำบุญตักบาตร เนื่องในวันมาฆบูชา 2568
เนื่องในวันมาฆบูชา 2568
กิจกรรมร่วมทำบุญตักบาตร เนื่องในวันมาฆบูชา 2568 ในจ.ลำพูน
กิจกรรม MEMORY OF LOVE (ร้อย-รส-รัก…ความทรงจำ) Trang Food Festiwow 12-16
กิจกรรม MEMORY OF LOVE (ร้อย-รส-รัก…ความทรงจำ) Trang Food Festiwow 12-16 กุมภาพันธ์ 2025 เวลา 16.00 - 22.00 น. สวนทับเที่ยง ตรัง (Tabtiang Park)
ม.นเรศวร ชวนส่งผลงานเพื่อจัดแสดงในนิทรรศการ หอม-กรุ่น Coffee Art จัดแสดงระหว่างวันที่ 13 ก.พ. – 13 มี.ค. 68 LINK
มหาวิทยาลัยนเรศวร ขอเชิญชวนร่วมส่งผลงาน เพื่อจัดแสดงในนิทรรศการ หอม-กรุ่น Coffee Art จัดแสดงระหว่างวันที่ 13 ก.พ. – 13 มี.ค. 68 ณ หอศิลป์มหาวิทยาลัยนเรศวร เปิดรับผลงานตั้งแต่วันนี้ – 3 ก.พ. 68 (ในเวลาราชการ)
คุณลักษณะของผลงาน • ไม่จำกัดรูปแบบ และขนาด คนละ ไม่เกิน 3 ชิ้นงาน • ต้องสร้างสรรค์ หรือลงสีด้วยกาแฟ • ผลงานที่รังสรรค์บนกระดาษต้องใส่กรอบ • ผู้ที่นำผลงานจัดแสดงจะได้รับเกียรติบัตรจากมหาวิทยาลัยนเรศวร • รับผลงานคืน ตั้งแต่วันที่ 17 มี.ค. 68 เป็นต้นไป (ในเวลาราชการ)
สอบถามข้อมูลเพิ่มเติม 055961207 (ว่าที่ร้อยตรีขัณฑพงศ์ เนื่องโนราช) Webpage: กองส่งเสริมศิลปวัฒนธรรม มหาวิทยาลัยนเรศวร Webpage: หอศิลป์มหาวิทยาลัยนเรศวร
เทศกาลดอกชมพูพันธุ์ทิพย์ ม.เกษตร กำแพงแสน วันที่ 13-20 กุมภาพันธ์ 2568
เทศกาลดอกชมพูพันธุ์ทิพย์ ประจำปี 2568 มาถึงแล้ว 13-20 กุมภาพันธ์ 2568 ณ มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสน พิธีเปิดงาน ในวันเสาร์ที่ 15 กุมภาพันธ์ 2568 เวลา 08.00 - 09.00 น. ณ บริเวณถนนวัฒนาเสถียรสวัสดิ์ (ด้านหน้าโรงเรียนสาธิตแห่งมหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสนฯ ) จุดชมดอกชมพูพันธุ์ทิพย์ 3 จุด ดังนี้
1. ถนนวัฒนาเสถียรสวัสดิ์(ถนนหน้าโรงเรียนสาธิตม.เกษตรฯ กำแพงแสน) [
พิกัด]
2. ถนนหน้าคณะวิศวกรรมศาสตร์ กำแพงแสน
3. สระพระพิรุณ [
พิกัด]
หมายเหตุ : ดอกชมพูพันธุ์ทิพย์ บานประมาณ 7 วัน ทั้งนี้ ขึ้นอยู่กับสภาพอากาศ *โปรดติดตามสถานการณ์การบาน ที่เพจ ก่อนมาเที่ยวชม
หมายเหตุ ขอความกรุณาผู้เข้าชมอย่าดึง อย่าโน้ม อย่าหักกิ่งต้นชมพูพันธุ์ทิพย์ เพื่อการถ่ายภาพ ขอบคุณข้อมูลจาก คุณ นันทนัช อนันทาวุฒิ ผู้อำนวยการกองบริการกลาง มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสน
งานเทศกาลอาหารและบอลลูน 13-22 กุมภาพันธ์ 2568 ศาลากลางจังหวัดชลบุรี
งานเทศกาลอาหารและบอลลูน วันที่ 13-22 กุมภาพันธ์ 2568 ณ สนามหน้าศาลากลางจังหวัดชลบุรี อาหาร เครื่องดื่ม สินค้า เครื่องเล่น และบอลลูน พร้อมรับนักท่องเที่ยวและชาวชลบุรีเต็มที่ (งานนี้ร้านดังจาก TikTok มากันเพียบ)งาน Singha Park Chiang Rai International Balloon Fiesta 2025 ตั้งแต่ 13-17 กุมภาพันธ์ 2568
งาน Singha Park Chiangrai International Balloon Fiesta 2025 สิงห์ปาร์ค เชียงราย ตั้งแต่ 13-17 กุมภาพันธ์ 2568 ไฮไลท์คือบอลลูนยักมากมาย นอกจากบอลลูนยังมีกิจกรรมดีๆ อีกเพียบ! (เด็กๆ สูงไม่เกิน 100 เซ็นติเมตร เข้าฟรี!) ✅ การแข่งขันบอลลูน นานาชาติ จาก 13 ประเทศทั่วโลก ✅ BalloonLove บอกรักบนฟ้า เฉลิมฉลองวันแห่งความรัก ✅ คอนเสิร์ต ศิลปินชื่อดังตลอด 5 วัน 5 คืน ✅ การแสดง โขนกลางแปลง ชุดใหญ่สุดอลังการ หาชมได้ยาก ✅ แสงสีเสียง จัดเต็ม ชมความสวยงามของบอลลูนยามค่ำคืน ✅ บูธอาหารเครื่องดื่ม มากกว่า 60 ร้านค้า จุใจสุดๆ ✅ งานชากาแฟ ครบจบใน 1 งานที่เดียว ✅ กิจกรรมพิเศษ อื่นๆ ที่ต้องมาสัมผัสด้วยตัวเอง ไม่ว่าจะเป็น เที่ยวรถฟาร์มทัวร์ BalloonTethering ขับรถATV ปั่นจักรยานชมไร่ เป็นต้น
วันรักนกเงือก ปางสีดา วันที่ 13 - 15 กุมภาพันธ์ 2568
เชิญชวนทุกท่านร่วมกิจกรรม "วันรักนกเงือก ปางสีดา" ที่จะจัดขึ้นในวันที่ 13-15 กุมภาพันธ์ 2568 ณ ลานกางเต็นท์ อุทยานแห่งชาติปางสีดา จังหวัดสระแก้ว เพื่อร่วมกันอนุรักษ์และสัมผัสความงดงามของธรรมชาติ พร้อมกิจกรรมที่หลากหลายให้ทุกคนได้สนุกสนานและเรียนรู้ไปพร้อมกัน
กิจกรรมไฮไลท์ 13 ก.พ. เวลา 13.00 น. พิธีเปิดงานอย่างเป็นทางการ ชมนิทรรศการ "ศาลาอนุรักษ์นกเงือก" 13 - 15 ก.พ. ทุกคืน กิจกรรม แคมป์ปิ้ง ท่ามกลางธรรมชาติ เพลิดเพลินกับกิจกรรม ผิงไฟ และ ฟังเพลง
หมายเหตุ การเข้าร่วมกิจกรรมเป็นไปตามระเบียบของอุทยานแห่งชาติ สอบถามข้อมูลเพิ่มเติม โทร: 08-1209-3615 และ 09-9397-6529
วนเกษตรแฟร์ 2568 (ครั้งที่ 2) พนมสารคาม ฉะเชิงเทรา วันที่ 13 – 15 กุมภาพันธ์ 2568
เครือข่ายวนเกษตรป่าตะวันออก และเครือข่ายท่องเที่ยวเกษตร นิเวศ และชุมชน ฉะเชิงเทรา เชิญชวนเที่ยวงาน “วนเกษตรแฟร์ 2568” (ครั้งที่ 2) วันที่ 13 – 15 กุมภาพันธ์ 2568 ณ ศูนย์เรียนรู้เศรษฐกิจพอเพียงด้านวนเกษตร ตำบลเกาะขนุน อำเภอพนมสารคาม จังหวัดฉะเชิงเทรา
เพื่อเปิดโอกาสให้เยาวชน ประชาชนในท้องถิ่นและผู้ที่สนใจ ได้มีโอกาสสัมผัส แลกเปลี่ยนเรียนรู้ ทั้งเรื่องการทำเกษตรในระบบวนเกษตร การทำเกษตรอินทรีย์ การใช้พลังงานสะอาด การแปรรูปผลิตผลเป็นอาหาร ของใช้ สมุนไพร การดูแลสุขภาพด้วยภูมิปัญญาไทย การแพทย์ทางเลือก สามารถนำความรู้ที่ได้ ไปใช้ในชีวิตประจำวัน การคิดค้นพัฒนาผลิตภัณฑ์เพื่อจำหน่ายสร้างรายได้เพิ่มให้กับครัวเรือน พัฒนาคน ความรู้ สามารถจัดการทรัพยากรได้อย่างยั่งยืน
กิจกรรมในงาน • เวทีเสวนาองค์ความรู้ ✅“ถอดบทเรียนโครงการคาร์บอนเครดิต:พื้นที่นำร่องอำเภอแปลงยาว” ผ่านการทำงานนำร่องร่วมกันระหว่าง ธกส, ฉะเชิงเทรา และเครือข่ายธนาคารต้นไม้บ้านหลุมมะขาม ต.หนองไม้แก่น อ.แปลงยาว จ.ฉะเชิงเทรา ✅“การเปลี่ยนผ่านสู่ความยั่งยืนทางพลังงาน :โซล่าเซลส์ในภาคเกษตร” ✅“วนเกษตรร่วมสมัย อยู่รอดได้แม้วิกฤต” ✅“นิวเจเนอเรชั่นกับวิถีเกษตรที่ออกแบบเอง” ✅“พรีไบโอติกส์ในผักพื้นบ้าน: อาหารเสริมจุลินทรีย์ดีในลำไส้” ✅“เกษตรกรกับการสร้างคุณค่าทางการท่องเที่ยว” ✅ การแสดงผลงานการทำเกษตรเพื่อสิ่งแวดล้อม ทั้งแนวทางวนเกษตร และเกษตรอินทรีย์ จากหน่วยงานภาครัฐ องค์กร SE และเกษตรกรตัวจริง ✅ฐานกิจกรรมเรียนรู้ศาสตร์วนเกษตร สำหรับเยาวชนและประชาชนทั่วไป
การออกร้านจำหน่ายสินค้า ✅ภูมิปัญญาไทยด้านอาหารพื้นถิ่น พืชผักพื้นบ้าน ✅ผลผลิตและผลิตภัณฑ์ทางการเกษตร สมุนไพร และสินค้าเกษตรแปรรูป ✅ผลิตภัณฑ์สุขภาพ ✅ผลิตภัณฑ์ชุมชน ✅งานศิลปะและงานฝีมือ ✅การบริการนวดไทย ร่วมงานและฟังการเสวนา ฟรี‼
สถาบันการศึกษาและคณะดูงาน กรุณาติดต่อแจ้งเวลาการเข้าชมล่วงหน้าค่ะ โทร. 062 426 2565 Line: wanakaset F/B: ศูนย์เรียนรู้เศรษฐกิจพอเพียงด้านวนเกษตร
งานนมัสการปิดทองหลวงพ่อพระนอนจักรสีห์ วัดพระนอนจักรสีห์วรวิหาร 13-14 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานนมัสการปิดทอง หลวงพ่อพระนอนจักรสีห์ หลวงพ่อพระแก้ว หลวงพ่อพระกาฬ วันที่ 13-14 กุมภาพันธ์ 2568 ณ วัดพระนอนจักรสีห์วรวิหาร อำเภอเมือง จังหวัดสิงห์บุรี
งานเกษตรแฟร์ ครั้งที่ 3 "ศึกชนช้าง" 13-19 กุมภาพันธ์ 2568 มหาวิทยาลัยราชภัฏพิบูลสงคราม
มหาวิทยาลัยราชภัฏพิบูลสงคราม เชิญเที่ยวชมงานเกษตรแฟร์ ครั้งที่ 3 "ศึกชนช้าง" ระหว่างวันที่ 13-19 กุมภาพันธ์ 2568 ณ บริเวณด้านหน้าหอประชุมศรีวชิรโชติ มหาวิทยาลัยราชภัฏพิบูลสงคราม ส่วนทะเลแก้ว จังหวัดพิษณุโลก
ภายในงานมีกิจกรรมที่น่าสนใจมากมาย อาทิ การประกวดกล้วยไม้เมืองหนาว "Best of Chang - Best of Shows" " การจำหน่ายอาหาร สินค้าชุมชน พันธุ์ไม้ผล ไม้ประดับ และไม้ดอก พร้อมการแสดงจากศิลปินนักร้องทุกค่ำคืน นอกจากนี้ ยังมีการแสดงศิลปวัฒนธรรมจากนักศึกษา การแสดงลิเกจากคณะเพชรพิบูล และการประกวดขับร้องเพลงลูกทุ่งสังคมศาสตร์ ครั้งที่ 3 ชิงถ้วยรางวัลจากรัฐมนตรีว่าการกระทรวงวัฒนธรรม พร้อมเงินรางวัลรวมกว่า 40,000 บาท
Valentine Sweet Nights 13-14 กุมภาพันธ์ 2568
Valentine Sweet Nights ชวนคนรักมาสร้างความทรงจำสุดโรแมนติกในบรรยากาศแสนพิเศษที่โครงการจริงใจมาร์เก็ต ของกลุ่มเซ็นทรัล วันพฤหัสบดีที่ 13 และวันศุกร์ที่ 14 กุมภาพันธ์ 2568 เวลา 16.00 น. - 22.00 น. . บริเวณลานก้ามปู โครงการจริงใจมาร์เก็ต ของกลุ่มเซ็นทรัล ดูหนังกลางแปลงท่ามกลางแสงดาว วันละ 2 เรื่องทั้ง 2 วัน (13-14 ก.พ. 68) และเพลิดเพลินกับกิจกรรมพิเศษ ปรึกษาปัญหาความรักกับนักจิตวิทยาผู้เชี่ยวชาญ ถ่ายภาพกับ Photo Booth แสนน่ารัก เวิร์คช้อปสุดครีเอทีฟ ช้อปปิ้งสินค้าแฮนด์เมดธีมวาเลนไทน์ อร่อยกับอาหาร ขนม และเครื่องดื่มมากมาย . Valentine Sweet Nights
งานประเพณี “เทศกาลนุ่งผ้าไหม ใส่ประเกือม เรือมกันตรึม ประจำปี2568” วันที่ 13 - 15 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานประเพณี “เทศกาลนุ่งผ้าไหม ใส่ประเกือม เรือมกันตรึม ประจำปี2568” วันที่ 13 - 15 กุมภาพันธ์ 2568 ณ สนามหน้าที่ว่าการอำเภอเขวาสินรินทร์ อำเภออำเภอเขวาสินรินทร์ จังหวัดสุรินทร์ ชม ชิม ช้อป สินค้าโอทอป ผ้าไหม ประเกือม เครื่องเงิน เครืองทองเหลือง และอื่นๆ อีกมากมาย
งานแนวอุบล (NAEW UBON) ครั้งที่ 2 วันที่ 13-16 กุมภาพันธ์ 2568
งานแนวอุบล (NAEW UBON) ครั้งที่ 2 วันที่ 13-16 กุมภาพันธ์ 2568 เวลา 17.00 - 21.00 ณ เมืองเก่า ถนนยุทธภัณฑ์ - สี่แยกพรหมราช
อีเว้นต์ ม่วนแซ่บสีอีสาน แนวอุบล FESTI…WOW!! ปลุกย่านเมืองเก่าอุบลกลับมาซุมแซวสดใสอีกครั้ง ปีนี้มาหลายแนวแซ่บๆ ดังนี้
แนวม่วนซื่น เบิ่งการแสดงดนตรีจากศิลปิน หลากหลายแนวพร้อม ขบวนแห่ทางวัฒนธรรม และศิลปะการแสดงสุด ว้าวว!! เดินเลาะเมืองเก่า พร้อมแนวกินแนวอยากแบบพื้นเมืองกับสตรีทฟู้ด
เนวเฮ็ด เวิร์กช็อปศิลปะ และกิจกรรมสนุกๆ สำหรับทุกวัยและบรรยากาศถ่ายรูปสุดชิคท่ามกลางความเป็นเอกลักษณ์ของย่านเมืองเก่า
แนวลอง รวบรวม ร้านอาหารหลากหลายเชื้อชาติที่อยู่ในอุบล ลองมาทำ ลองเทเบิ้ล พร้อมกับเมนูแนวๆ เคล้าดนตรี และ ดีเจ
แนวเพลง / HEAR MARKETเรารวบรวม หลายหลายแนวเพลง มาโชว์ให้ได้ หัวใจเต้นเป็นจังหวะเดียวกันพร้อมกับตลาดนัดมือสองและของทำมือ
แนวขนคีงลุก พบกับกิจกรรมมากมาย ตลาดขนคีงลุก ร้านอาหารสายกินเเล้วเฮง สายเสริมบุญ เครื่องประดับมงคล สายไหว้ ลัดเลาะไหว้พระโซนเมืองเก่าเพื่อเป็นศิริมงคล สายดวง พบกับหมอดูในหลายรูปแบบ ตรวจเช็คดวงชะตาให้หมาน ปัง ดัง เฮง
แนวบ้านบ้าน พบกับ อาหารวัฒนธรรม และอาหารการกินแบบบ้านๆ นิทรรศการอุบลราชธานีศรีศิลป์ และกิจกรรมอีกมากมาย ที่พวกเราร่วมแรงร่วมใจรวมความหลากหลายแนวไว้ด้วยกัน ในชุมชนย่านเมืองเก่า ถนน เส้นยุทธภัณฑ์ - สี่แยกพรหมราช ตามตรอกซอกหลืบ เตรียมตัวให้พร้อมแล้วมาม่วนกันในเทศกาลสุดแนวนี้
จัดโดยจังหวัดอุบลราชธานี ททท.สำนักงานอุบลราชธานี เทศบาลนครอุบลราชธานี ชุมชนเมืองเก่า และหน่วยงานพันธมิตรแบบแนวๆงานมหกรรมอาหารสร้างงานสร้างรายได้สู่ชุมชนครั้งที่ 1 Thapput Fest 2025 วันที่ 13-14 กุมภาพันธ์ 2568
ขอเชิญชวนร่วมงานมหกรรมอาหารสร้างงานสร้างรายได้สู่ชุมชนครั้งที่ 1 Thapput Fest 2025 ยกทัพอาหารมาให้ทุกคนได้ช้อปและชิมกันแบบเต็มที่
พบกันวันที่ 13-14 กุมภาพันธ์ 2568
ณ ซอยเทศบาล 1 (ซอยลูกแจ) ต.ทับปุด อ.ทับปุด จ.พังงา
งานมหกรรมมูนมังอีสานครั้งที่ 16 "อีโพะพาเล่น อีเบ๊ะพารำ" 13 - 15 กุมภาพันธ์ 2568
งานมหกรรมมูนมังอีสานครั้งที่ 16 "อีโพะพาเล่น อีเบ๊ะพารำ" วันที่ 13 - 15 กุมภาพันธ์ 2568 ตั้งแต่ 09.00 - 22.00 น. ณ บริเวณริมห้วยทราย มหาวิทยาลัยราชภัฏสกลนคร Workshop การละเล่นพื้นบ้านสุดสนุก! สัมผัสเสน่ห์ของภูมิปัญญาอีสานผ่านการละเล่นดั้งเดิม เรียนรู้และสนุกไปกับ "อีโพะพาเล่น อีเบ๊ะพารำ" มาเล่น มาเรียนรู้ และมารำไปด้วยกัน!
งานบุญเข้าจี่วาเลนไทน์ 2025 วันที่ 13 – 14 กุมภาพันธ์ 2568
กิจกรรมงานบุญเข้าจี่วาเลนไทน์ 2025 ระหว่างวันที่ 13 – 14 กุมภาพันธ์ 2568 ณ ริมบึงสีฐานฝั่งทิศตะวันตก มหาวิทยาลัยขอนแก่น “งานฮีตเดือนสาม หรือ บุญข้าวจี่เป็นประเพณีรากเหง้าทางวัฒนธรรมที่ชาวอีสานสืบทอดกันมาช้านาน หากกล่าวถึงกิจกรรมในเดือนเดียวกันนี้ ทางศาสนาคริสต์ คือ วันแห่งความรัก (วันวาเลนไทน์) ฉะนั้นการผสมผสานสองวัฒนธรรมอย่าง ประเพณีฮีตเดือนสามหรือบุญข้าวจี่ และ วันวาเลนไทน์ มาผสานกัน จึงเป็นไปตามแนวคิด “ไม่หลงของเก่า ไม่เมาของใหม่” ถือได้ว่าเป็นการนำทุนทางวัฒนธรรมและประเพณีที่ดีงามในอดีต ที่ถูกหลงลืม ให้กลับมามีชีวิตอีกครั้งเป็นการฟื้นฟู ประยุกต์ให้เหมาะสมกับยุคสมัย ก่อให้เกิดกิจกรรมที่สร้างสรรค์” ชม concert จากศิลปิน กิจกรรมจี่ข้าวฟังลำ ทำบุญหนุนรัก ซึ่งผู้ร่วมกิจกรรมสามารถนำข้าวจี่ไปทำบุญใส่บาตรยามเช้าร่วมกัน
งาน ผู้หญิงทำมาหากิน สี่แม่พาตะลุย 13-19 ก.พ. เซ็นทรัลนครปฐม
งานผู้หญิงทำมาหากิน สี่แม่พาตะลุย พี่หนูแหม่ม ฮายอาภาพร และตั๊กศิริพร @เซ็นทรัลนครปฐม 13-19 ก.พ. 68 เซ็นทรัลนครปฐม ✅น้ำพริกพี่ยาคนรุม ✅เฮียอ๊อฟ หมูย่างเมืองตัง ✅จั๊กกะบุ๋ม ปลาร้าทอด ✅ธาม ขนมเปี๊ยะจักรพรรดิ ✅กุ๋ยช่ายมหานคร พ่อค้าหล่อเอวร่อน ✅ส้มตำน้อย โพธิ์งาม ✅โอลิฟ โตเกียวเนยกรอบ ✅ไอติมหมูแดงอัมพวา ✅สุวิมล หอยจ๊อปู ✅ปลาสลิด มุฑิตาของดีบางบ่อ ✅ขนมครก วังเดิมธนบุรี ✅ลุงเฮงป้าใจดี ปลาหมึกบด ✅ลุงเงิน กาแฟหม้อดิน ✅กับข้าวกับปู หอยจ๊อปูเจ้าดังบางแสน ✅เจ๊จุก หมูทอด3รส ✅บ๊ะจ่างใบบัว อัมพวา ✅ราชวัตน์ บ้าบิ่นมะพร้าวอ่อนน้ำหอม ✅ไก่ย่างสัมฤทธิ์ ✅ปลาหมึกย่าง ครัวรสหนึ่ง ✅เฮียหงีกระเพาะปลา ของอร่อยเยาวราช
งานสืบศิลป์นคราจำปาศรี เฉลิม 160 ปี ตักศิลามหาสารคาม 13 กุมภาพันธ์ 2568
งานสืบศิลป์นคราจำปาศรี เฉลิม 160 ปี ตักศิลามหาสารคาม แสดงในวันที่ 13 กุมภาพันธ์ 2568 ตั้งแต่เวลา 18.00 น. ณ ลานหน้ามหาเจดีย์มหาสารคาม วัดป่าวังน้ำเย็น
สไตล์บ้านบ้าน 13-16 กุมภาพันธ์ 2568
“สไตล์บ้านบ้าน” วันที่ 13-16 กุมภาพันธ์ 2568 ณ สวนน้ำเปรมสุข อ.เมืองฯ จ.สุโขทัย งานที่มีเอกลักษณ์เฉพาะตัว เก๋ไก๋ กับลานเบียร์คราฟต์ กลางทุ่งนา / Cocktail / Baan Baan Bar / ดนตรีสด / บูธ DJ / Workshop / Art Craft / ตลาดผักปลอดสารพิษ / อิ่มอร่อยกับบูธอาหารอีกกว่า 50 ร้านค้า รอให้ทุกคนมาสนุกกันได้ทั้งครอบครัว รับรองได้ว่า สนุก สุข แบบ X2 แน่นอน
มหกรรมผ้าและหัตถศิลป์ถิ่นลำพูน ประจำปี 2568 วันที่ 13–16 กุมภาพันธ์ 2568
ททท.สำนักงานลำปาง ขอเชิญเที่ยวงาน มหกรรมผ้าและหัตถศิลป์ถิ่นลำพูน ประจำปี 2568 ระหว่างวันที่ 13 – 16 กุมภาพันธ์ นี้ ณ บ้านดอนหลวง ตำบลแม่แรง อำเภอป่าซาง จังหวัดลำพูน ภายในงาน พบกับ การเปิดร้านจำหน่ายผ้าฝ้ายทอมือ ราคาประหยัด สินค้า OTOP ขึ้นชื่อของตำบลแม่แรง กว่า 300 ร้านค้า • การจำหน่ายสินค้า OTOP ผลิตภัณฑ์ผ้าฝ้ายและหัตถกรรมของแต่ละอำเภอในจังหวัดลำพูน (ทั้ง 8 อำเภอ) • ชมการเดินแบบผ้าทอพื้นเมืองทุกวัน • ชมการแสดงศิลปินล้านนา ชื่อดังมากมาย • การจำหน่ายอาหารพื้นเมือง กาดมั่ว ครัวเมือง ลานขันโตก จากร้านอาหารอร่อยคัดสรรมาเพื่องานนี้ • สัมผัสวิถีและศิลปวัฒนธรรมอันดีงามของคนไทยอง ที่ต้อนรับแขกผู้มาเยือนทุกท่าน
สอบถามรายละเอียดเพิ่มเติมได้ที่ บริษัท อนันดา แอดเวอร์ไทซิ่ง จำกัด โทร.066-0121955
งาน Burapa Pattaya Bike week 2025 The way of life never war วันที่ 13-15 กุมภาพันธ์ 2568
รวมพลคนรัก Bigbike เหล่าไบค์เกอร์ทั้งหลายห้ามพลาด เมืองพัทยา ร่วมกับสมาคมบูรพามอเตอร์ไซค์เคิลคลับ จัดงาน Burapa Pattaya Bike week 2025 The way of life never war ???? 28th ระหว่างวันที่ 13-15 กุมภาพันธ์ 2568 ณ บริเวณสวนสาธารณะ ศูนย์กีฬาแห่งชาติภาคตะวันออก ซอยชัยพฤกษ์ 2
Amazing Thailand Love Wins Carnival 13-14 FEBRUARY 2025
งานวิวาห์ใต้สมุทรที่ยิ่งใหญ่ระดับโลก กลับมาอีกครั้ง! เชิญคู่รักร่วมเฉลิมฉลองเทศกาลแห่งความรัก ท่ามกลางความงดงามของท้องทะเลตรัง 13-14 FEBRUARY 2025 Trang, Thailand
กิจกรรมภายในงาน ขบวนแห่งความรักสุดยิ่งใหญ่ Dinner Love Wins Party ปาร์ตี้ที่อบอวลไปด้วยเสียงหัวเราะ Wedding Moment เก็บภาพหวานใต้ทะเล และบนชายหาด
Chiangrai Brewtopia 14-16 กุมภาพันธ์ 2568– เทศกาลของคนรักชาและกาแฟ
Chiangrai Brewtopia – เทศกาลของคนรักชาและกาแฟ 14-16 กุมภาพันธ์ 2568 ณ สิงห์ปาร์ค เชียงราย โซนบ้านชนเผ่า ตั้งแต่เวลา 10.00-20.00 น. *10.00-14.00 เข้าฟรี (*15.00-20.00 ต้องซื้อบัตรงานบอลลูนเข้าชมงาน) ครั้งแรกกับงานที่รวมสุดยอดชาและกาแฟจากทั่วเอเชีย! พบกับกูรูตัวจริงจากไทย และต่างประเทศพร้อมร้านชากาแฟชั้นนำกว่า 40 ร้าน พบกับไฮไลท์พิเศษ! ✅ เวิร์กช็อป & สัมมนาสุดเข้มข้น ✅ Business Matching เชื่อมต่อเครือข่ายธุรกิจระดับโลก ✅ Coffee Farm Visit เรียนรู้การผลิตกาแฟบนดอย
Rayong Mesook Festival : แฟ(ร์) แห่ง ฟาร์มสุข 14-16 ก.พ. 2568
Rayong Mesook Festival : แฟ(ร์) แห่ง ฟาร์มสุข 14-16 ก.พ. 2568 เวลา 09.00-18.00 น. ณ มีสุขฟาร์ม ระยอง Mesook Farm งานแฟร์ดีๆ ในบรรยากาศชิลๆ ท่ามกลางผืนป่ากฤษณา มีโซนให้ถ่ายรูปเพียบ มีกิจกรรมเด็ดๆ มากมาย :
- คอกาแฟต้องห้ามพลาดงานนี้ เพราะเรารวบรวมร้านกาแฟ Specialty ร้านดังไว้ที่นี่กว่า 20 ร้าน
- เบเกอรี่ โฮมเมด อร่อยๆ เพียบ
- งานอาร์ต งานแฮนเมด น่ารัก มากมาย
- Workshop สุดครีเอทีฟ สำหรับทุกวัย : มีทั้งทำคัพเค้ก, ปลูกต้นไม้ในโหลแก้ว, งานเพ้นท์, ทำกำไล มีหลากหลายเลย
- workshop ด้านกาแฟ ที่สายกาแฟต้องหลงรัก - กิจกรรม ดนตรีจากน้องๆนักเรียน
- เครื่องดื่ม เย็นๆ ซ่าส์ๆ ก็มีให้จิบ ให้ชิมตลอดงาน มีดนตรีสดเพราะๆ ตลอดทั้งวัน
- งานนี้ Pet friendly นะ
Coffee Summer โมริยาห์ สวนดอกไม้ งานกาแฟฤดูร้อน 14-16 กุมภาพันธ์ 2568
Coffee Summer โมริยาห์ งานกาแฟฤดูร้อน โมริยาห์ สวนดอกไม้ บ้าน13 ต.คีรีราษฎร์ อ.พบพระ จ.ตาก เข้าชมฟรี ตั้งแต่วันที่ 14-16 กุมภาพันธ์ 2568 เวลา 08:00-20:00น.
Night@Maya City 5 วันที่ 14-16 กุมภาพันธ์ 2568
การแสดงดนตรีในงาน Night@Maya City 5 ในปีนี้ หอภาพยนตร์ได้เชิญ ธีร์ ไชยเดช ศิลปินผู้มีน้ำเสียงอันเป็นเอกลักษณ์ มาขับร้องให้คุณได้รับฟังท่ามกลางห้วงเวลาสัปดาห์แห่งความรักพร้อมด้วย 2 ศิลปินจาก The Voice อย่าง น้องขวัญใจ และต้า - คีตา อินทรสูต และยังมี Once Dogs ที่สร้างประทับใจในการแสดงจากปีที่แล้ว รวมถึงวงน้องๆจากมหาวิทยาลัยรอบศาลายา โดยมีรอบการแสดงดังนี้
- วันศุกร์ที่ 14 กุมภาพันธ์ 2568 18.00 Yellow Flora จากสถาบันบัณฑิตพัฒนศิลป์ และมหาวิทยาลัยศรีนครินทรวิโรฒ 19.00 ขวัญใจ The Voice 20.00 มันบด จากมหาวิทยาลัยเทคโนโลยีราชมงคลรัตนโกสินทร์ .
- วันเสาร์ที่ 15 กุมภาพันธ์ 2568 18.00 somink จากมหาวิทยาลัยมหิดล 19.00 โสกัง จากมหาวิทยาลัยมหิดล 20.00 Once Dogs
- วันอาทิตย์ที่ 16 กุมภาพันธ์ 2568 18.00 ธีร์ ไชยเดช 20.00 ต้า The Voice .
Night@Maya City 5 เปิดเมืองมายายามค่ำคืน พร้อมดนตรี ร้านค้า งานคราฟต์ และกิจกรรมมากมาย จะจัดระหว่างวันที่ 14-16 กุมภาพันธ์ 5 โมงเย็น – 3 ทุ่ม ที่หอภาพยนตร์ ถ.พุทธมณฑลสาย 5 ศาลายา ไม่เสียค่าเข้าชม
การแสดงประวัติศาสตร์จินตนาการ ในชุด ”Lopburi Renaissance นารายณ์จอมราชปราชญ์ราชัน“
เทศบาลเมืองเขาสามยอด จัดการแสดงประวัติศาสตร์จินตนาการ ในชุด ”Lopburi Renaissance นารายณ์จอมราชปราชญ์ราชัน“ พบกับความพิเศษของการแสดง แสง สี เสียง ที่ยิ่งใหญ่ตระการตา ประกอบเทคนิคพิเศษ 3D Projection Mapping & Lighting และรูปแบบของการแสดง The Musical [
ชมการแสดงรอบสื่อมวลชน]
ประชาชนและนักท่องเที่ยวสามารถติดตามและรับชมการแสดงประวัติศาสตร์จินตนาการ โดยเทศบาลเมืองเขาสามยอด ระหว่างวันที่ 14 - 23 กุมภาพันธ์ 2568 (วันละ 1 รอบ) โดยประตูจะเปิดให้เข้าชมเวลา 19.30 น. และเริ่มการแสดงเวลา 20.00 น. ณ ตึกเลี้ยงรับแขกเมือง ในพระนารายณ์ราชนิเวศน์ จังหวัดลพบุรี
ดนตรีในสวน ณ สวนสันติชัยปราการ วาเลนไทน์ใจฟู 14 ก.พ. 2568 รู้เท่าทันยาเสพติด
ดนตรีในสวน ณ สวนสันติชัยปราการ ชวนคนรู้ใจมาโยกเบา ๆ ไปกับเสียงเพลง ที่งาน "วาเลนไทน์ใจฟู รู้เท่าทันยาเสพติด" 14 ก.พ. 2568 16.00 น. เป็นต้นไป สวนสันติชัยปราการ เขตพระนคร กทม. สนุกสุดมันส์ไปกับ บุ๋ม ดอกแค & ดีเจเต้ ของที่ระลึกเพียบ
อุ่นไอฮัก น่าน ในเสียงดนตรี 14 กุมภาพันธ์ 2568


ปักหมุดเลย วาเลนไทน์ปีนี้ ลงทะเบียนล่วงหน้ารับสิทธิพิเศษมากมาย ครั้งแรกกับวาเลนไทน์ปีนี้ วันศุกร์ที่ 14 กุมภาพันธ์ 2568 เวลา 16.30 – 21.00 น. ชวนแฟน ชวนครอบครัวมานั่งฟังดนตรีสบาย ๆ บรรยากาศ ของความรู้สึกดีดี ในวันแห่งความรักที่ไม่มีข้อจำกัด กับงาน“อุ่นไอฮัก น่าน ในเสียงดนตรี“ ที่จุฬาฯน่าน พิเศษชวนคู่รักมาในงาน 20 คู่แรกรับฟรี กระเป๋าผ้าจากทาง CUNEX พบกับ เสียงดนตรีในสายลมหนาวจาก วงแชมป์แพรว วงFRIENDSHIP จาก มทร.ล้านนาน่าน วงCUSARBAND จากจุฬาลงกรณ์มหาวิทยาลัย ฟรี กิจกรรมWorkshopศิลปะสื่อใจผ่านธรรมชาติ จากที่หลบฝน ฟรี กิจกรรมWorkshop “การขอบคุณตัวเรา”จากChula Student Wellness ต่อด้วยกิจกรรม เวทีแลกเปลี่ยนการเกษตรร่วมกันของ จุฬาลงกรณ์มหาวิทยาลัย และ มทร ล้านนาน่าน ในหัวข้อการเกษตรของน่านในยุคปัจจุบัน พบกับร้านค้าจากนิสิตที่ขนความอร่อยมาบริการ ลงทะเบียนล่วงหน้าเพื่อรับสิทธิพิเศษภายในงาน มาร่วมเป็นส่วนหนึ่งของงานดนตรีในสวน “อุ่นไอฮัก น่าน”เมื่อสายลมหนาวของรอบปีได้พาพัด เมื่อวันแห่งความรักได้วนมาถึง ก่อให้เกิดเป็นงาน อุ่นไอฮัก น่าน เสียงดนตรีในสายลมหนาว พบกันในงาน วันที่ 14 กุมภาพันธ์ 2568 ตั้งแต่เวลา 16.30 เป็นต้นไป สถานที่ ศูนย์เครือข่ายการเรียนรู้เพื่อภูมิภาค จุฬาลงกรณ์มหาวิทยาลัย
เทศกาลเอ็งกอพนัสนิคม 14-16 ก.พ. 2568
งาน เทศกาลเอ็งกอพนัสนิคม วันศุกร์ที่ 14-16 ก.พ. 2568 สถานที่แสดง : ลานกิจกรรม โรงเรียนบุญญวิทยาคาร
กำหนดการแสดงเอ็งกอ
วันศุกร์ที่ 14 ก.พ.68
19.00 น. คณะเอ็งกอโรงเรียนเทศบาล 2 วัดกลางทุมมาวาส พนัสนิคม
19.30 น. คณะเอ็งกอมูลนิธิสว่างกุศลธรรมสถาน พนัสนิคม
วันเสาร์ที่ 15 ก.พ.68 **พิธีเปิด**
17.30 น. ขบวนแห่เปิดเทศกาล รวมเอ็งกอ7คณะ ชมรถแห่เอ็งกอสร้างสรรค์
18.30 น. พิธีเปิดเทศกาลเอ็งกอ ณ วงเวียนหอนาฬิกา ชมโชว์พิเศษรวม4คณะเอ็งกอพนัสนิคม และ ประเทศจีน **การแสดง** ณ ลานกิจกรรมโรงเรียนบุญญวิทยาคาร
20.00 น. คณะเอ็งกอโรงเรียนเทศบาล 2 วัดกลางทุมมาวาส พนัสนิคม
20.20 น. คณะเอ็งกอลูกเจ้าพ่อหลักเมือง จ.ขอนแก่น
21.50 น. คณะเอ็งกอโรงเรียนบุญญวิทยาคาร พนัสนิคม
21.10 น. คณะเอ็งกอศาลเจ้าปู่ย่า จ.หนองบัวลำภู
21.40 น. คณะเอ็งกอมูลนิธิสว่างกุศลธรรมสถาน พนัสนิคม
22.00 น. คณะเอ็งกอซ่างเหลียว ประเทศจีน
วันอาทิตย์ที่ 16 ก.พ.68
18.30 น. คณะเอ็งกอเจ้าพ่อปุนเถ่ากง จ.พิจิตร
19.30 น. คณะเอ็งกอโรงเรียนบุญญวิทยา พนัสนิคม
20.30 น. คณะเอ็งกอมูลนิธิเต็กก่า พนัสนิคม
21.00 น. คณะเอ็งกอซ่างเหลียว ประเทศจีน
เทศกาล แห่โคม ชมพระฉาย สืบสายศิลป์ ถิ่นหนองจับเต่า เขาชีจรรย์ ครั้งที่ 11 วันที่ 14-15 ก.พ. 68
เชิญชวนเที่ยวงานประเพณีแห่โคม สุดยิ่งใหญ่แห่งปี ของจังหวัดชลบุรี ในงาน “เทศกาล แห่โคม ชมพระฉาย สืบสายศิลป์ ถิ่นหนองจับเต่า เขาชีจรรย์ ครั้งที่ 11” ณ ลานหน้าพระพุทธรูปแกะสลักหน้าผาเขาชีจรรย์ อำเภอสัตหีบ จังหวัดชลบุรี จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดชลบุรี กำหนดการแสดง
14 ก.พ. 68 ชมขบวนแห่โคมประทีปสุดงดงาม ชมการแสดงศิลปวัฒนธรรมไทย
15 ก.พ. 68 ชมการแสดงศิลปวัฒนธรรมไทย ชม “โขนกลางแปลง” สุดยิ่งใหญ่อลังการ เรื่อง รามเกียรติ์ ชุด ทศคีรีวัน ทศคีรีธร เวลา 17.00 น. เป็นต้นไป
งาน ไปเขาหน่อ ขอเธอเป็นแฟน @เขาหน่อ 14-16 กุมภาพันธ์ 2568
ขอเชิญร่วมงาน "ไปเขาหน่อ ขอเธอเป็นแฟน" @เขาหน่อ 14-16 กุมภาพันธ์ 2568 พบรักกันที่ ตลาดต้องชม ริมทางที่ลานโพธิ์ กิจกรรมรัก สมรสเท่าเทียม คล้องกุญแจรัก เพ้นท์เสื้อคู่รัก จุดถ่ายภาพคู่รัก ดนตรี 14 ก.พ. 》วงวานร ลพบุรี 15 ก.พ. 》วงTHE MONKEY’S 16 ก.พ. 》วงTN CHAINAT บรรยากาศแห่งความรัก เลือกชื้อสินค้าราคาถูก อาหารอร่อย และเครื่องดื่ม
จดทะเบียนสมรสบนเรือ @อำเภอวัดเพลง 14 กุมภาพันธ์ 68
14 กุมภาพันธ์ 68 อำเภอวัดเพลง เชิญชวนคู่รัก มาจดทะเบียนสมรส @ อำเภอวัดเพลง จังหวัดราชบุรี จดทะเบียนสมรสบนเรือ พร้อมสักการะศาลเจ้าพ่อหลักหิน สิ่งศักดิ์สิทธิ ประจำอำเภอ ฟรี ! ของชำร่วย งาสลัด ท๊อฟฟี่โบราณ ของดีอำเภอวัดเพลง ฟรี ! WelCome Drink น้ำมะพร้าวสดจากสวน ฟรี ! ชุดสักการะศาลเจ้าพ่อหลักหิน แล้วมาลงเรือลำเดียวกันน้าา เอกสารที่ต้องใช้ 1. บัตรประจำตัวประชาชนตัวจริง 2. พยาน จำนวน 2 ท่าน สอบถามรายละเอียดเพิ่มเติม โทร : 032-398525 สำนักทะเบียนอำเภอวัดเพลง จังหวัดราชบุรี.-
Valentine Night Museum : วาเลนไทน์นี้ที่มิวเซียม พิพิธภัณฑสถานแห่งชาติ ราชบุรี 14 กุมภาพันธ์ 2568
กิจกรรมชมพิพิธภัณฑ์ยามค่ำคืน ครั้งแรกของจังหวัดราชบุรี งาน "Valentine Night Museum : วาเลนไทน์นี้ที่มิวเซียม" วันเดียววันศุกร์ที่ 14 กุมภาพันธ์ 2568 ตั้งแต่ 17.00 น. เป็นต้นไป ณ พิพิธภัณฑสถานแห่งชาติ ราชบุรี อ.เมือง จ.ราชบุรี พร้อมกิจกรรมหวานๆ น่ารักๆ เยอะเลย • ชมพิพิธภัณฑ์ รอบพิเศษ (17.00 น. / 18.00 น. / 18.30 น.) • ดูหนัง (รัก) ฟังเพลง (เลิฟ) • ชมรถพิพิธภัณฑ์สัญจร กิจกรรม Art & Craft Workshop ไปรษณีย์สื่อรัก อิ่มอร่อยกับ Food Truck
Night @Maya City มายาราตรี 5 : กุมภา ราตรี มีรัก 14-16 กุมภาพันธ์ 2568 หอภาพยนตร์ อ.พุทธมณฑล
ปักหมุดแล้วชวนคนที่คุณรักมาดื่มด่ำกับบรรยากาศเมืองมายา ยามค่ำคืนในงาน "Night @Maya City มายาราตรี 5 : กุมภา ราตรี มีรัก" 14-16 กุมภาพันธ์ 2568 นี้ ที่หอภาพยนตร์ อ.พุทธมณฑล จ.นครปฐม
กลับมาอีกครั้ง กับการเปิดเมืองมายายามค่ำคืน พร้อมประดับไฟสีสันสวยงามต้อนบรรยากาศแห่งความรักช่วงวันวาเลนไทน์ พร้อมกิจกรรมมากมาย! ทั้งการเข้าชมเส้นทางประวัติศาสตร์ภาพยนตร์ไทยและภาพยนตร์โลก ผ่านนิทรรศการในหอภาพยนตร์ ฟังดนตรีสดสุดไพเราะ ซุ้มอาหารอร่อย รวมทั้งร้านขายสินค้านานาชนิด และร้านคราฟต์สุดเก๋
แล้วพบกัน Night @Maya City มายาราตรี 5 : กุมภา ราตรี มีรัก ในวันที่ 14 - 16 กุมภาพันธ์ 2568 ตั้งแต่เวลา 17.00 - 21.00 น. ณ หอภาพยนตร์ (องค์การมหาชน) ถนนพุทธมณฑลสาย 5 ศาลายา จังหวัดนครปฐม ???? ไม่เสียค่าเข้าชม
งาน"รักสุดเขตประเทศไทย" @ผาได ม่วงยายเวียงแก่น ครั้งที่ 10 วันที่ 14 กุมภาพันธ์ 2568
วันวาเลนไทน์นี้ เทศบาลตำบลม่วงยาย ขอเชิญทุกท่านมาสัมผัสบรรยากาศแห่งความรัก ท่ามกลางธรรมชาติสวยงามริมฝั่งโขง ในงาน"รักสุดเขตประเทศไทย" @ผาได ม่วงยายเวียงแก่น ครั้งที่ 10 วันที่ 14 กุมภาพันธ์ 2568 สวนสาธารณะแก่งผาได ตำบลม่วงยาย อำเภอเวียงแก่น จังหวัดเชียงราย
ไฮไลท์ กิจกรรม • พิธีตักบาตรสองฝั่งโขง (ไทย - ลาว) • แข่งขันกีฬาวู้ดบอล และกีฬาพื้นบ้าน • ถ่ายรูปกับทุ่งดอกไม้งาม • นิทรรศการอาหารอร่อย & สินค้า OTOP • ล่องเรือหารักชมวิวทิวทัศน์สองฝั่งโขง • กิจกรรมสมรสสมรัก มอบทะเบียนสมรสแก่คู่รัก • การแสดงวัฒนธรรมชนเผ่า ดนตรีมวนใจ๋สุดโรแมนติก เติมเต็มบรรยากาศแห่งความรัก!
สอบถามข้อมูลเพิ่มเติมได้ที่ เทศบาลตําบลม่วงยาย โทร. 053-608-000 ททท.สำนักงานเชียงราย โทร. 053-744674-5
เปิดตัวแหล่งท่องเที่ยวใหม่ ทุ่งข้าวเจ็ดสีสุดอลังการแห่งพะเยา Rainbow Rice มหัศจรรย์แห่งรัก วันเปิดตัว 14 กุมภาพันธ์ 2568
เปิดตัวแหล่งท่องเที่ยวใหม่ ในวันแห่งความรัก “PHAYAO Rainbow Rice” ทุ่งข้าวเจ็ดสีสุดอลังการแห่งพะเยา Rainbow Rice มหัศจรรย์แห่งรัก วันเปิดตัว 14 กุมภาพันธ์ 2568 (วันวาเลนไทน์) สถานที่ ทางขึ้นวัดอนาลโย ตำบลสันป่าม่วง อำเภอเมือง จังหวัดพะเยา [
พิกัด]
พบกับเสน่ห์แห่งท้องทุ่งที่ไม่เหมือนใคร! “PHAYAO RAINBOW RICE” หรือ “ทุ่งข้าวเจ็ดสี” คือแหล่งท่องเที่ยวเชิงเกษตรแห่งใหม่ของจังหวัดพะเยา ที่จะทำให้ทุกคนได้สัมผัสความงดงามของผืนนากว้างใหญ่ 74 ไร่ ที่ถูกแต่งแต้มด้วยสีสันจากข้าวหลากหลายสายพันธุ์ ความพิเศษของที่นี่คือการออกแบบแปลงนาข้าวให้เป็นภาพไดโนเสาร์และนกยูง สัญลักษณ์สำคัญของพะเยา ไดโนเสาร์สื่อถึงการค้นพบซากฟอสซิลในอุทยานแห่งชาติดอยภูนาง อำเภอเชียงม่วน ขณะที่นกยูงเป็นนกประจำถิ่นของพะเยา มีประชากรมากกว่า 5,000 ตัวในเขตอำเภอจุน ดอกคำใต้ และเชียงม่วน ทุ่งข้าวแห่งนี้ได้รับการออกแบบอย่างสร้างสรรค์ให้เกิดเฉดสีสวยงาม คล้ายสายรุ้งที่ทอดยาวเหนือผืนนา โดยมีฉากหลังเป็นขุนเขาสูงตระหง่านของดอยหลวงดอยหนอกและทิวทัศน์ธรรมชาติที่งดงาม
นอกจากจะเป็นจุดเช็คอินใหม่ของพะเยาแล้ว ที่นี่ยังเตรียมพัฒนาเป็นศูนย์การเรียนรู้ด้านเกษตรกรรม ให้ผู้สนใจได้มาสัมผัสและศึกษาความมหัศจรรย์ของข้าวไทย
ไม่ควรพลาด! มาสัมผัสความงดงามของ “ทุ่งข้าวเจ็ดสี” และเก็บภาพสุดประทับใจที่นี่ สอบถามข้อมูลเพิ่มเติม • เทศบาลตำบลสันป่าม่วง โทร 054-888-870 • ททท. สำนักงานเชียงราย โทร 053-744-6745, 053-717-433 | E-mail: tatchrai@gmail.com • ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา ททท. โทร 054-430-400 | E-mail: tatphayao@gmail.com
งาน Melayu Day @Yala ครั้งที่ 10 วันที่ 14 - 16 กุมภาพันธ์ 2568
ชวนทุกท่านเที่ยวงาน Melayu Day @Yala ครั้งที่ 10 ระหว่างวันที่ 14 - 16 กุมภาพันธ์ 2568 ณ สนามโรงพิธีช้างเผือก อ.เมือง จ.ยะลา
เพลิดเพลินกับกิจกรรมมากมาย • การแสดงแลกเปลี่ยนวัฒนธรรมระหว่าง 3 ประเทศ • ขบวนแห่ 3 วัฒนธรรมสุดยิ่งใหญ่ และการแข่งขันทักษะวิชาการ • การจัดแสดงนิทรรศการจาก ประเทศไทย มาเลเซีย และอินโดนีเซีย • ร่วมชม ช้อป ร้านจำหน่ายอาหารฮาลาล-เครื่องแต่งกายมลายู ตลอด 3 คืน
งาน Melayu Day @ Yala โดยเทศบาลนครยะลา บูรณาการความร่วมมือกับสถานกงสุลใหญ่มาเลเซีย ประจำจังหวัดสงขลา สถานกงสุลใหญ่สาธารณรัฐอินโดนีเซีย ประจำจังหวัดสงขลา สำนักงานวัฒนธรรมจังหวัดยะลา และจังหวัดยะลา ได้ร่วมบูรณาการจัดงาน Melayu Day@Yala รวมทั้งสิ้น 9 ปี โดยมีวัตถุประสงค์เพื่อให้เด็ก เยาวชน และประชาชนในพื้นที่ ซึ่งจัดให้มีกิจกรรมร่วมกันในการอนุรักษ์และส่งเสริมประเพณีอันดีงามบนคาบสมุทรแหลมมลายู เน้นการปลูกฝังคุณธรรม จริยธรรม สร้างค่านิยมและจิตสำนึกที่ดี บนความหลากหลายทางศาสนาและวัฒนธรรม อีกทั้งยังเป็นกิจกรรมที่สร้างความสัมพันธ์อันดี ให้เกิดขึ้นแก่ประชาชนในจังหวัดยะลา โดยผ่านเรื่องราววัฒนธรรมที่ทุกคนอยู่ร่วมกันได้ โดยมีจุดศูนย์รวมของวัฒนธรรม ทั้งในเรื่องของวัฒนธรรมประเพณี ด้านภาษา ด้านอาหารพื้นเมือง ด้านเครื่องแต่งกาย ที่มีอัตลักษณ์โดดเด่นความเป็นมลายู ส่งผลให้ประชาชนสามารถอยู่ร่วมกันได้อย่างผสมกลมกลืน ซึ่งถือเป็นเอกลักษณ์อย่างหนึ่งของจังหวัดยะลา
Marriage Equality 2025 ปักหมุด หาดใหญ่ไพร์ด ณ อำเภอหาดใหญ่ 14 ก.พ.2568
Marriage Equality 2025 ปักหมุดงานจดทะเบียนสมรสเท่าเทียมทั่วไทย ปักหมุด หาดใหญ่ไพร์ด ณ อำเภอหาดใหญ่ walk in หรือ ลงทะเบียน รับของที่ระลึกพิเศษ ทุกคู่!!! สงขลา ปักหมุด ณ สำนักงานอำเภอหาดใหญ่ , รูปปั้นพระเสน่หา หน้าโอเดียนหาดใหญ่ และปางช้างเผือกหาดใหญ่ (14 ก.พ.2568)
วาเลนไทน์นี้ มาร่วมกันสร้างสังคมที่เคารพความรักทุกรูปแบบ และเฉลิมฉลองไปกับสมรสเท่าเทียมที่เกิดขึ้นแล้ว ในประเทศไทย จัดโดยหาดใหญ่ไพร์ด การท่องเที่ยวแห่งประเทศไทย (ททท.) และกองทุนส่งเสริมความเท่าเทียมระหว่างเพศ กระทรวงการพัฒนาสังคมและความมั่นคงของมนุษย์ (พม.) ร่วมสนับสนุนการสร้างพื้นที่แห่งความรักและความเสมอภาคให้เกิดขึ้นทั่วประเทศ
เพราะประเทศไทยคือจุดหมายปลายทางของทุกความรัก
กิจกรรม “รักร้อยปี…ที่คลองร้อยสาย” วันที่ 14 กุมภาพันธ์ 2568
ททท.สำนักงานสุราษฎร์ธานี ชวนนักท่องเที่ยว ร่วมกิจกรรมแรลลี่ท่องเที่ยวเรือหางยาว สัมผัสประสบการณ์ของวิถีชุมชนคลองร้อยสาย กับกิจกรรมแรลลี่ท่องเที่ยวเรือหางยาว “รักร้อยปี…ที่คลองร้อยสาย โดยออกเดินทางจากจุดปล่อยตัว ณ ชุมชนท่องเที่ยวเชิงอนุรักษ์บางใบไม้ ผ่านการเก็บคะแนนหา RC ตลอดเส้นทาง และมีกิจกรรมไฮไลต์ในระหว่างเส้นทางสอดแทรกแนวคิดเชิงอนุรักษ์ให้ผู้เข้าร่วมแข่งขันมีส่วนร่วมในการทำกิจกรรม CSR เก็บขยะในคลองร้อยสาย ซึ่งจะมีการนับคะแนนพิเศษตามจำนวนขยะที่เรือแต่ละลำเก็บได้ สำหรับผู้ชนะแข่งขันแรลลี่ฯ 3 อันดับแรก รับของรางวัลสุดพิเศษจากการท่องเที่ยวแห่งประเทศไทย
SIP & SPIN 14 – 16 กุมภาพันธ์ 2025
SIP & SPIN – สัมผัสประสบการณ์สุดพิเศษทั้งกลางวันและกลางคืน! DAY – เพลิดเพลินกับ เมนูกาแฟสุดพิเศษ พร้อมฟังดนตรีแจ๊สสุดคลาสสิกที่อบอวลไปด้วยเสน่ห์ NIGHT – สนุกสุดเหวี่ยงไปกับ เครื่องดื่มซิกเนเจอร์ และจังหวะดนตรีเร้าใจจาก DJ ชั้นนำ! วันที่ 14 – 16 กุมภาพันธ์ 2025 เวลา10:00 น. – 22:00 น. สถานที่โซน Starbucks, เซ็นทรัล สมุย
งานของดีเมืองสุราษฎร์ธานีและกาชาดจังหวัด ประจำปี 2568 วันที่ 14 - 23 กุมภาพันธ์ 2568
เชิญชวนเที่ยวงานของดีเมืองสุราษฎร์ธานีและกาชาดจังหวัด ประจำปี 2568 ระหว่างวันที่ 14 - 23 กุมภาพันธ์ 2568 ณ บริเวณริมเขื่อนแม่น้ำตาปี อำเภอเมืองฯ จังหวัดสุราษฎร์ธานี กิจกรรมภายในงานมากมาย ณ บริเวณริมเขื่อนแม่น้ำตาปี อำเภอเมืองสุราษฎร์ธานี เพื่อจัดหารายได้สมทบทุนเหล่ากาชาดจังหวัดสุราษฎร์ธานี นำไปบรรเทาทุกข์แก่ประชาชนที่ประสบความเดือดร้อน และส่งเสริมเผยแพร่ศิลปวัฒนธรรมประเพณีท้องถิ่น รวมถึงช่วยกระตุ้นเศรษฐกิจ ให้เกิดการจับจ่ายของประชาชนในพื้นที่
งานประเพณีสู่ขวัญข้าว บอกเล่าเรื่องราว เราชาวเวียง ประจำปี 2568 วันที่ 14 - 16 กุมภาพันธ์ 2568
ขอเชิญชวนทุกท่านร่วมกิจกรรม งานประเพณีสู่ขวัญข้าว บอกเล่าเรื่องราว เราชาวเวียง ประจำปี 2568 ในระหว่างวันที่ 14 - 16 กุมภาพันธ์ 2568 เวลา 16.00 น. เป็นต้นไป ณ สนามกีฬาองค์การบริหารส่วนตำบลนนทรี อำเภอกบินทร์บุรี จังหวัดปราจีนบุรี
ภายในงานพบกิจกรรมมากมาย อาทิเช่น พิธีสู่ขวัญข้าว ที่สืบทอดมาตั้งแต่อดีต • กิจกรรมการแข่งขันฟุตบอล กองฟางสเตเดี้ยม • การประกวดพานบายศรี • การประกวดเต้นบาสโลบ • ลานกิจกรรมบอกเล่าเรื่องราว เราชาวเวียง • ชิม ช็อป สินค้าและอาหารพื้นถิ่น พบกับ ศิลปินรับเชิญสุดพิเศษ • 15 กุมภาพันธ์ 2568 พบกับ สุรชัย สมบัติเจริญ • 16 กุมภาพันธ์ 2568 พบกับ เต๋าภูศิลป์
Moon Art Space ep.1 Walking to the Moon วันที่ 14-15 กุมภาพันธ์ พ.ศ. 2568
"ก้าวสู่ดวงจันทร์ พร้อมเปิดโลกแห่งศิลปะกับเรา" Moon Art Space ep.1 Walking to the Moon วันที่ 14-15 กุมภาพันธ์ พ.ศ. 2568 เวลา 16.30 – 20.30 น. ณ ลานไทร มหาวิทยาลัยราชภัฏรำไพพรรณี
พบกับผลงานศิลปวัฒนธรรมที่หลากหลายจากศิลปินและชุมชน ผ่านการจัดแสดงและจำหน่ายผลงานที่สะท้อนเอกลักษณ์และความงดงามจากศิลปินท้องถิ่น ร่วมสัมผัสบรรยากาศแห่งศิลปะและการสร้างสรรค์ ที่เปิดโอกาสให้ทุกคนได้มาร่วมแบ่งปันและสร้างแรงบันดาลใจร่วมกัน
กิจกรรมฉ่ำ ๆ • นิทรรศการภาพถ่าย จิตรกรรม ประติมากรรม และสื่อผสม • สตรีตอาร์ต • กิจกรรมเวทีหลัก เพียบ !! • ภาพยนตร์จิตวิญญาณแห่งริมน้ำจันทบูร The spirit of Rimnam Chanthaboon • ออกแบบเครื่องแต่งกาย • โซนถ่ายรูป • งาน DIY น่ารัก เวิร์กช็อปปัง ๆ ทำถึง จัดเต็ม • บูธจับไข่ • จุ่มม๊วฟ • จุด แลก รัก • บอร์ดเกม • บูธวัฒนธรรม 4DNA อัตลักษณ์จันท์ • ไพ่ยิปซีศาสตร์แห่งตัวเลข • นวดเพื่อสุขภาพ • NTM BRAND • สินค้าที่ระลึกสวนบ้านแก้ว • เมนูอร่อย
กิจกรรมจดทะเบียนสมรสนอกสำนักทะเบียนอําเภอ ภายในงาน ขบวนรถไฟ สายใยแห่งรัก ตอน เส้นทางรัก : Love Map in Samutsongkhram วันศุกร์ที่ 14 กุมภาพันธ์ 2568
ขอเชิญชวนคู่รัก ชาย หญิง และ LGBTQ สมัครร่วมกิจกรรมจดทะเบียนสมรสนอกสำนักทะเบียนอําเภอ ภายในงาน "ขบวนรถไฟ สายใยแห่งรัก ตอน เส้นทางรัก : Love Map in Samutsongkhram" วันศุกร์ที่ 14 กุมภาพันธ์ 2568 เวลา 07.30 น. เป็นต้นไป ณ ลานจัดกิจกรรมสถานีรถไฟแม่กลอง (สุดรางรถไฟ) ต.แม่กลอง อ.เมืองฯ จ.สมุทรสงคราม อำเภอเมืองสมุทรสงคราม สนับสนุนความหลากหลายทางเพศตามกฎหมาย #สมรสเท่าเทียม เพื่อเป็นสัญญาใจ ย้ำจุดยืนความเท่าเทียม ความเสมอภาค และไม่เลือกปฏิบัติในชีวิตสมรสที่สมบูรณ์ทางกฎหมาย ⭕️การสมัครเข้าร่วมกิจกรรม⭕️ ระยะเวลาการรับสมัคร : ตั้งแต่บัดนี้ จนถึงวันที่ 12 กุมภาพันธ์ 2568 ทุกวันเวลาทำการ 08.30 - 16.30 น. ณ สำนักทะเบียนอำเภอเมืองสมุทรสงคราม อำเภอเมืองสมุทรสงคราม จังหวัดสมุทรสงคราม
ติดต่อสอบถามเพิ่มเติม โทร : 034-714-870 แฟนเพจ FB : ที่ว่าการอำเภอเมืองสมุทรสงคราม
การแข่งขันจักรยานประเภทถนนชิงแชมป์เอเชีย 2025 ( ระดับนานาชาติ ) เส้นทางพิษณุโลก-พิจิตร ช่วงวันที่ 14 - 16 กุมภาพันธ์ 2568
จังหวัดพิษณุโลก เป็นเจ้าภาพร่วมจัดการแข่งขันจักรยานประเภทถนนชิงแชมป์เอเชีย 2025 ( ระดับนานาชาติ ) เส้นทางพิษณุโลก-พิจิตร ช่วงวันที่ 14 - 16 กุมภาพันธ์ 2568
สมาคมกีฬาจักรยานแห่งประเทศไทยในพระบรมราชูปถัมภ์ กำหนดจัดการแข่งขันจักรยานประเภทถนนชิงแชมป์เอเชีย 2025 ( ระดับนานาชาติ ) ระหว่างวันที่ 7 - 16 กุมภาพันธ์ 2568 เพื่อเก็บสะสมคะแนนเพื่อให้ได้สิทธิ์ในการแข่งขันโอลิมปิกเกมส์ ครั้งที่ 34 ณ ลอสแอนเจลิส สหรัฐอเมริกา ในปี 2028
ทั้งนี้ การแข่งขันดังกล่าวใช้สนามสราญจิตมงคลสุข เป็นสนามแข่งหลัก และจังหวัดพิษณุโลก-บ้านรักไทย-สนามสราญจิตมงคลสุข(บึงสีไฟ)เป็นสถานที่แข่งขัน ซึ่งจังหวัดพิษณุโลกเป็นเจ้าภาพจัดการแข่งขันฯ 3 วัน ระหว่างวันที่ 14-16 กุมภาพันธ์ 2567 รายละเอียดเส้นทาง
วันศุกร์ที่ 14 กุมภาพันธ์ 2568 : เวลา 09.00-12.00 น. การแข่งขันจักรยานโรดเรช รุ่นไม่เกิน 23 ปีชาย ระยะทาง 130.20 กิโลเมตร เส้นทาง : ศาลสมเด็จพระนเรศวรมหาราช จังหวัดพิษณุโลก - สนามจักรยานสราญจิตมงคลสุข 7 รอบ จังหวัดพิจิตร
วันเสาร์ที่ 15 กุมภาพันธ์ 2568 : เวลา 09.00-13.11 น. การแข่งขันจักรยานโรดเรช รุ่นประชาชนหญิง รุ่นอายุ ไม่เกิน 23 ปี ระยะทาง 108.80 กิโลเมตร เริ่มต้นออกสตาร์ท ศาลสมเด็จพระนเรศวรมหาราช อำเภอเมืองพิษณุโลก ไปยัง สนามสราญจิตมงคลสุข(บึงสีไฟ) จังหวัดพิจิตร
วันอาทิตย์ที่ 16 กุมภาพันธ์ 2568 : เวลา 10.00 -14.37 น. การแข่งขันจักรยานโรดเรช รุ่นประชาชนชาย ระยะทาง 171.80 กิโลเมตร เริ่มต้นออกสตาร์ท ศาลสมเด็จพระนเรศวรมหาราช จังหวัดพิษณุโลก ไปสนามจักรยานสราญจิตมงคลสุข 5 รอบ จังหวัดพิจิตร และไปต่อบ้านรักไทย อำเภอเนินมะปราง จังหวัดพิษณุโลก เป็นจัดสิ้นสุด
งาน เสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม : ฤดูกาญจน์ แห่งความรัก 14 - 16 กุมภาพันธ์ 2568
สำนักงานพัฒนาชุมชนจังหวัดกาญจนบุรี ขอเชิญเที่ยวงาน เสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม : ฤดูกาญจน์ แห่งความรัก 14 - 16 กุมภาพันธ์ 2568 ลานหน้าสโมสรโรงงานกระดาษไทย กาญจนบุรี มาสัมผัสมนต์เสน่ห์แห่งศิลปะ วัฒนธรรม และอาหารพื้นถิ่น ในบรรยากาศสุดชิลล์ พร้อมกิจกรรมมากมาย!
งานเสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม : ฤดูกาญจน์ แห่งความรัก 14 - 16 กุมภาพันธ์ 2568
สำนักงานพัฒนาชุมชนจังหวัดกาญจนบุรี ขอเชิญเที่ยวงาน เสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม : ฤดูกาญจน์ แห่งความรัก 14-16 กุมภาพันธ์ 2568 ลานหน้าสโมสรโรงงานกระดาษไทย กาญจนบุรี มาสัมผัสมนต์เสน่ห์แห่งศิลปะ วัฒนธรรม และอาหารพื้นถิ่น ในบรรยากาศสุดชิลล์ พร้อมกิจกรรมมากมาย! สอบถามข้อมูลเพิ่มเติม : สำนักงานพัฒนาชุมชนจังหวัดกาญจนบุรี โทรศัพท์ 034-511782
"สะพานมอญ กลางแปลง" สังขละบุรี 14-15 กุมภาพันธ์
เทศกาลหนังต้อนรับวันวาเลนไทน์ คล้องดวงใจคนรัก ดื่นด่ำธรรมชาติ บรรยากาศสุดคลาสสิค ท่ามกลางสายลมหนาว และอารยธรรมหลากหลากชาติพันธุ์ สุดแดนตะวันตกประเทศไทย "สะพานมอญ กลางแปลง" สังขละบุรี มอบความสุขโดย ขุนแผน ภาพยนตร์ สนับสนุนงานโดย บริษัท เรดแคท เอ็นจิเนียริ่ง จำกัดไทรโยคมิวสิคเฟสติวัล วันที่ 14-15 กุมภาพันธ์ 2568
ไทรโยคมิวสิคเฟสติวัล วันที่ 14-15 กุมภาพันธ์ 2568 นี้ แล้วพบกัน เทศกาลดนตรีครั้งยิ่งใหญ่ ริมภูเขา ห้อมล้อมด้วยธรรมชาติ และสัมผัสอาการเย็นสบาย ใกล้สถานที่ท่องเที่ยวสำคัญ เเละครั้งเเรกในพื้นที่อำเภอไทรโยค เอาใจคนรักเสียงเพลง ที่จอดรถฟรี มีบริการเกือบ 5,000 คัน ยังไม่รวมพื้นที่เอกชนอีกรอบงาน ไม่ต้องกลัวเดินไกลเรามีบริการรถรับส่งฟรีด้วยจ้าศิลปินดี ฟรี คอนเสิร์ต แถมมีกิจกรรมให้ร่วมสนุกมากมาย โดย...องค์การบริหารส่วนจังหวัดกาญจนบุรี
งาน ของดี เมืองสุราษฎร์ และกาชาดจังหวัด ประจำปี 14-23 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน ของดี เมืองสุราษฎร์ และกาชาดจังหวัด ประจำปี 2568
วันที่ 14-23 กุมภาพันธ์ 2568
ณ บริเวณริมเขื่อนแม่น้ำตาปี จังหวัดสุราษฏร์ธานี
งาน วันรวมน้ำใจ กิ่งกาชาดอำเภอพระประแดง วันที่ 14-23 กุมภาพันธ์ 2568
สภากาชาดไทย อำเภอพระประแดง กิ่งกาชาด อำเภอพระประแดง ขอเชิญเที่ยวงาน วันรวมน้ำใจ กิ่งกาชาดอำเภอพระประแดง วันที่ 14-23 กุมภาพันธ์ 2568 ณ บริเวณลานพระประแดงอาเขต จังหวัดสมุทรปราการ
COFFEE MANIA #8 วันที่ 14-16 กุมภาพันธ์ 2025
COFFEE MANIA #8 วันที่ 14-16 กุมภาพันธ์ 2025 เวลา 08:00 - 19:00 น. บ้านโบราณเชียงใหม่ (Ancient House Chiangmai) "หลงรักตั้งแต่กลิ่นแรกของกาแฟ" รวมคนรักกาแฟตัวจริง! พบกับ กาแฟ Specialty หายาก ชา / อุปกรณ์กาแฟ เบเกอรีสุดอร่อย กิจกรรม & ดนตรีชิล ๆ
คู่สมรส LGBTQ+ ร่วมพิธีจดทะเบียนบนหลังช้าง ศูนย์คชศึกษา 14 กุมภาพันธ์ 2568
ขอเชิญคู่รัก คู่สมรส LGBTQ+ ร่วมพิธีจดทะเบียนบนหลังช้าง วันที่14 กุมภาพันธ์ 2568 ณ โครงการโลกของช้าง ศูนย์คชศึกษา บ้านตากลาง ตำบลกระโพ อำเภอท่าตูม จังหวัดสุรินทร์ บันทึกภาพประวัติศาสตร์สุดประทับใจในบรรยากาศการแต่งงานในหมู่บ้านช้างที่ใหญ่ที่สุดในโลก ในวันวาเลนไทน์ ลงทะเบียน พร้อมรับของที่ระลึกจากทาง ททท.
งาน"ตำนานพระตำหนักคำหยาด" 14 - 16 กุมภาพันธ์ 2568 อำเภอโพธิ์ทอง อ่างทอง
ขอเชิญเที่ยวงาน"ตำนานพระตำหนักคำหยาด" 14 - 16 กุมภาพันธ์ 2568 ณ พระตำหนักคำหยาด ตำบลคำหยาด อำเภอโพธิ์ทอง จังหวัดอ่างทอง ร่วมน้อมรำลึกถึงสมเด็จ พระเจ้าอุทุมพร หรือขุนหลวงหาวัด ณ พระตำหนักคำหยาด ตำบลคำหยาด อำเภอโพธิ์ทอง จังหวัดอ่างทอง
The Adventure Million Years Petchabun Geopark #2 วันที่ 14-16 กุมภาพันธ์ 2568
ย้อนเวลาสู่โลกดึกดำบรรพ์ กับกิจกรรมสุดมันส์ในธีมไดโนเสาร์! The Adventure Million Years Petchabun Geopark #2 วันที่ 14-16 กุมภาพันธ์ 2568 เริ่มเวลา 09.30 น. - 20.00 น.
กิจกรรมไฮไลต์ที่คุณไม่ควรพลาด: จุดถ่ายภาพสุดอลังการ พบกับหุ่นจำลองไดโนเสาร์สายพันธุ์ต่างๆ พร้อมป้ายให้ความรู้สุดน่าสนใจ กิจกรรมสร้างสรรค์เพื่อทุกวัย สุ่มไข่ไดโนเสาร์สุดเซอร์ไพรส์ (Surprised Dinosaurs) ระบายสีเทียนหอมรูปไดโนเสาร์และฟอสซิล วาดภาพและระบายสีซากดึกดำบรรพ์แบบจัดเต็ม! ผจญภัยในโลกดึกดำบรรพ์ ตามล่าสมบัติมูลค่าล้านปี (Million Years Treasure Hunting) ขุดฟอสซิลกระดูกไดโนเสาร์แบบสมจริง สนุกพร้อมลุ้นรางวัลใหญ่ ตอบคำถามชิงรางวัลสุดพิเศษ พบปะเพื่อนไดโนเสาร์ในกิจกรรม Meet The Dinosaurs สนุกได้ทั้งครอบครัว ทั้งความรู้และความบันเทิงครบจบในที่เดียว!
งานเสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม ฤดูกาญจน์ แห่งความรัก 14 - 16 กุมภาพันธ์ 2568
สำนักงานพัฒนาชุมชนจังหวัดกาญจนบุรี ขอเชิญเที่ยวงาน เสน่ห์ศิลป์ ถิ่นเมืองกาญจน์ ครั้งที่ 1 ธีม : ฤดูกาญจน์ แห่งความรัก 14-16 กุมภาพันธ์ 2568 ลานหน้าสโมสรโรงงานกระดาษไทย กาญจนบุรี
มาสัมผัสมนต์เสน่ห์แห่งศิลปะ วัฒนธรรม และอาหารพื้นถิ่น ในบรรยากาศสุดชิลล์ พร้อมกิจกรรมมากมาย! เพลิดเพลินกับดนตรีไพเราะ ดนตรีโฟล์คซองจาก KN BRAND / วงบักจ่อย / เฉิดฉาย ดื่มด่ำกับเสียงไวโอลีนสุดโรแมนติก OTOP ชวนชิม – อิ่มอร่อยกับของดีเมืองกาญจน์ ช้อปสนุก – ผลิตภัณฑ์ OTOP และสินค้าชุมชนหลากหลาย กิจกรรมพิเศษ "คู่หูรู้ใจ เรารักกัน"
เมนูเด็ดต้องลอง! ✅ แกงป่าครัวเมืองกาญจน์ – เผ็ดร้อนจัดจ้าน ✅ ผัดไทยสงครามโลกครั้งที่สอง – การันตีความอร่อยจากครัวคุณต๋อย ✅ เต้าหู้ทอดไหหลำ – กรอบนอกนุ่มใน น้ำจิ้มซอสมะขามสุดฟิน ✅ แกงส้มครัวไทย – ใครทำก็อร่อย ✅ ขนมตาลนึ่งสด – หอมตาลแท้ๆ อร่อยนุ่ม ✅ หมูกรอบเมืองกาญจน์ ✅ น้ำแกงส้มปรุงสำเร็จครัวไทยนิว ✅ โรตีสายไหม และอาหารรสเด็ด อีกมากมาย สินค้าเกษตรปลอดสาร – สด สะอาด ดีต่อสุขภาพ แฟชั่นพื้นเมืองสุดเก๋ ผ้าทอกะเหรี่ยง จากไลโว่ & สาละวะ ผ้าทอมือ by สรินทร แฟชั่นผ้าขาวม้า หลากสี สุดชิค ร้านจันทร์เพ็ญผ้าขาวม้า
สอบถามข้อมูลเพิ่มเติม : สำนักงานพัฒนาชุมชนจังหวัดกาญจนบุรี โทรศัพท์ 034 511782
งาน Melayu Day @Yala ครั้งที่ 10 วันที่ 14-16 ก.พ. 2568
เชิญชวนเที่ยวงาน Melayu Day @Yala ครั้งที่ 10 ระหว่างวันที่ 14-16 ก.พ. 2568 ณ สนามโรงพิธีช้างเผือก อ.เมือง จ.ยะลา เพลิดเพลินกับกิจกรรมมากมาย
การแสดงแลกเปลี่ยนวัฒนธรรมระหว่าง 3 ประเทศ ขบวนแห่ 3 วัฒนธรรมสุดยิ่งใหญ่ และการแข่งขันทักษะวิชาการ การจัดแสดงนิทรรศการจาก ประเทศไทย มาเลเซีย และอินโดนีเซีย ร่วมชม ช้อป ร้านจำหน่ายอาหารฮาลาล-เครื่องแต่งกายมลายู ตลอด 3 คืน
งาน Melayu Day @ Yala โดยเทศบาลนครยะลา บูรณาการความร่วมมือกับสถานกงสุลใหญ่มาเลเซีย ประจำจังหวัดสงขลา สถานกงสุลใหญ่สาธารณรัฐอินโดนีเซีย ประจำจังหวัดสงขลา สำนักงานวัฒนธรรมจังหวัดยะลา และจังหวัดยะลา ได้ร่วมบูรณาการจัดงาน Melayu Day@Yala รวมทั้งสิ้น 9 ปี โดยมีวัตถุประสงค์เพื่อให้เด็ก เยาวชน และประชาชนในพื้นที่ ซึ่งจัดให้มีกิจกรรมร่วมกันในการอนุรักษ์และส่งเสริมประเพณีอันดีงามบนคาบสมุทรแหลมมลายู เน้นการปลูกฝังคุณธรรม จริยธรรม สร้างค่านิยมและจิตสำนึกที่ดี บนความหลากหลายทางศาสนาและวัฒนธรรม อีกทั้งยังเป็นกิจกรรมที่สร้างความสัมพันธ์อันดี ให้เกิดขึ้นแก่ประชาชนในจังหวัดยะลา โดยผ่านเรื่องราววัฒนธรรมที่ทุกคนอยู่ร่วมกันได้ โดยมีจุดศูนย์รวมของวัฒนธรรม ทั้งในเรื่องของวัฒนธรรมประเพณี ด้านภาษา ด้านอาหารพื้นเมือง ด้านเครื่องแต่งกาย ที่มีอัตลักษณ์โดดเด่นความเป็นมลายู ส่งผลให้ประชาชนสามารถอยู่ร่วมกันได้อย่างผสมกลมกลืน ซึ่งถือเป็นเอกลักษณ์อย่างหนึ่งของจังหวัดยะลา
มหกรรมอัตลักษณ์วัฒนธรรมชายแดนใต้ 14 - 16 กุมภาพันธ์ 2568
สำนักงานวัฒนธรรมจังหวัดนราธิวาส ขอเชิญชวนร่วมงาน “มหกรรมอัตลักษณ์วัฒนธรรมชายแดนใต้” ระหว่างวันที่ 14 - 16 กุมภาพันธ์ 2568 เวลา 10.00 - 22.00 น. ณ บริเวณศาลากลางจังหวัดนราธิวาส (หลังเก่า) อำเภอเมืองนราธิวาส จังหวัดนราธิวาส ร่วมกิจกรรม Hilight มากมาย อาทิ
14 ก.พ. 2568 การเสวนามรดกภูมิปัญญาทางวัฒนธรรม หัวข้อ ภาษาเจ๊ะเห ภาษาพิเทน และมรดกภูมิปัญญาทางวัฒนธรรมสร้างสรรค์ จากคุณค่าสู่มูลค่า การเสวนา “มรดกภูมิปัญญาทางวัฒนธรรม” การแสดงดนตรีร่วมสมัย วง KLP เสวนา เรื่อง วัฒนธรรมที่อยู่อาศัย ในท้องถิ่นชายแดนใต้ การแสดงวงดนตรี เปอมูดออัสลี การแสดงมโนราห์ควน การแสดงแบบแฟชั่นผ้าและเอกลักษณ์งานผ้าชายแดนใต้ การแสดงโขนเยาวชนชายแดนใต้ การแสดงคณะรองเง็ง การแสดงดิเกร์ฮูลู คณะซรีตันหยง Small Talk ชวนคุยเรื่อง “หุงหาอาหาร”
15 ก.พ. 2568 การเสวนามรดกภูมิปัญญาทางวัฒนธรรม “ภาษามลายู” จ.ยะลา และหัวข้อ “ภาษาใต้” จ. สงขลา ชมขบวนแห่อัตลักษณ์ทางวัฒนธรรมชายแดนภาคใต้ 17.30 น. พิธีเปิดงาน นิทรรศการ การสาธิต และการจำหน่ายผลิตภัณฑ์ชุมชน การแสดงตารีกีปัส ซัมเป็ง โยเก็ต การแสดงโขน Small Talk ชวนคุยเรื่อง “การแต่งกายร่วมสมัย”
16 ก.พ. 2568 การแสดงดนตรีร่วมสมัย วง KAWAEGU SONG การเสวนา ศาสตราวุธ ในดินแดนภาคใต้ การแสดงดิเกร์ฮูลู การแสดงกุมปัง การแสดงซีละซายาตี อัสมัน การแสดงมโนราห์ การแสดงวงดนตรี แร็ปเปอร์ มลายู PROP Small Talk ชวนคุยเรื่อง “เครื่องประดับโบราณ”
หมายเหตุ : เวลาและการแสดงอาจมีการเปลี่ยนแปลงตามความเหมาะสม
งาน "สีสันสินค้าอัตลักษณ์ชายแดนใต้" 14-18 กุมภาพันธ์ 2568
ไป “ชม ชิม ช้อป” กันทุกคนที่ งาน "สีสันสินค้าอัตลักษณ์ชายแดนใต้" ณ สวนกรมหลวงนราธิวาสราชนครินทร์ อ.เมือง จังหวัดนราธิวาส (ข้าง TK Park นราธิวาส) 14-18 กุมภาพันธ์ 2568 14.00 - 22.00 น. ช้อปจุใจ กับสินค้าอัตลักษณ์ชายแดนใต้ กว่า 60 ร้านค้า
เทศกาลบอลลูน สื่อรักริมบึงละหาน สานรักวันวาเลนไทน์ Valentine Sweet Day 14-15 ก.พ.2568
เชิญเที่ยวชมงาน “เทศกาลบอลลูน” สื่อรักริมบึงละหาน สานรักวันวาเลนไทน์ Valentine Sweet Day” ในงานเทศกาลท่องเที่ยวบึงละหาน Bung Lahan Festival ประจำปี 2568 วันที่ 14-15 ก.พ.2568 แสดงเทศกาลบอลลูน เวลา 17.30-20.00 น. ณ ริมบึงละหาน บ้านหนองไผ่งาม หมู่ที่ 16 ต.ละหาน อำเภอจัตุรัส จังหวัดชัยภูมิ 14 ก.พ. 68 ชมดนตรีวง ”3 ช.มิวสิค” การประกวดรำวงย้อนยุค และมหกรรมอาหารปลอดภัย 15 ก.พ.68 ชมดนตรี วง ”ยองบ่าง" ณ ริมบึงละหาน บ้านหนองไผ่งาม หมู่ที่ 16 ต.ละหาน อำเภอจัตุรัส จังหวัดชัยภูมิ
เทศกาลแห่งความรัก กับเมืองแห่งความสุข 14 กุมภาพันธ์ 2568 อำเภอเมืองชัยภูมิ
เทศกาลแห่งความรัก กับเมืองแห่งความสุข
14 กุมภาพันธ์ 2568 อำเภอเมืองชัยภูมิ เชิญชวนคู่รักร่วมกิจกรรม จดทะเบียนสมรส ณ มอหินขาว
งานนี้ฟรี ไม่มีค่าใช้จ่าย รับเพียง 68 คู่เท่านั้น
กิจกรรมถ่ายภาพคู่รัก ทานอาหารแบบบุฟเฟ่ ค๊อกเทล ฟังดนตรีในสวน กับบรรยากาศสุดฟิน สมัครวันนี้ -13 กุมภาพันธ์ 2568 ณ ที่ว่าการอำเภอเมืองชัยภูมิ โทร.044-812732
Khao Yai Food & Wine Festival Celebrating Korat GI 14-16 ก.พ. 2568
Khao Yai Food & Wine Festival Celebrating Korat GI วันที่ 14-16 ก.พ. 2568 เวลา 09:00 - 22:00 น. รวมสินค้า GI โคราช มาไว้ในงานเดียว เช่น ไวน์เขาใหญ่, น้อยหน่าปากช่อง, ข้าวทุ่งสัมฤทธิ์, ผ้าไหมปักธงชัย, เครื่องปั้นดินเผาด่านเกวียน,มะขามเทศโนนไทย, กาแฟวังน้ำเขียว, กาแฟดงมะไฟ
ไฮไลต์ภายในงาน Wine Tasting เปิดโลกรสชาติไวน์แห่งขุนเขา โดยผู้ผลิตไวน์ชั้นนำของประเทศ จากไร่ GranMonte Vineyard and Winery, PB Valley Khao Yai Winery, Alcidini Winery, Village Farm Winery • ศิลปะการดื่มไวน์ โดย “Wine Maker” คุณ ณิชกานต์ สายะสิทธิ์ • เสน่ห์ไวน์เขาใหญ่สู่ไวน์ GI ระดับโลก โดย คุณ สุวิสุทธิ์ โลหิตนาวี Director of Marketing and Public Relations GranMonte Vineyard and Winery • “A Symphony of Flavors Discovering Khao yai Wine GI Master Class” บรรเลงซิมโฟนีแห่งรสชาติไวน์ GI เขาใหญ่ โดย คุณ วิสุตา โลหิตนาวี General Manager, Oenologist and Winemaker GranMonte Vineyard and Winery • สร้างสรรค์เมนูอีสานฟิวชั่น และเมนู GI ครีเอทจานเด็ดจากวัตถุดิบท้องถิ่น และยังมีกิจกรรมอื่นๆ อีกมากมายรอให้ทุกคนมาร่วมจอย • ดนตรีสดสุดโรแมนติก • 14 ก.พ. วัชราวลี เวลา 18:00-19:00 น. • 15 ก.พ. เอก สุระเชษฐ์ เวลา 18:00-19:00 น. • โฟล์คซองจากวง MEEIN ทุกวัน วันละ 3 รอบ !
งานถิ่นฐานตาลโตนด 14-23 กุมภาพันธ์ 2568 อำเภอวัดโบสถ์
งานถิ่นฐานตาลโตนด (งานน้ำตาลสด) ของอำเภอวัดโบสถ์ จังหวัดพิษณุโลก เริ่มตั้งแต่วันที่ 14-23 กุมภาพันธ์ 2568 ณ บริเวณที่ทำการอำเภอ (หลังเก่า)
SMART BUSINESS EXPO 2025 - 14-16 กุมภาพันธ์ 2568
SMART BUSINESS EXPO 2025 งานรวมสุดยอด นวัตกรรมดิจิทัล AI เพื่อธุรกิจแห่งปี 14-16 กุมภาพันธ์ 2568 HALL 1-2 ศูนย์ประชุมและแสดงสินค้านานาชาติขอนแก่น
เทศกาลถนนศิลปะ ART LANE ครั้งที่ 22 - 14-16 กุมภาพันธ์ 2568
เทศกาลถนนศิลปะ ART LANE ครั้งที่ 22 วันที่ 14 - 16 กุมภาพันธ์ 2568 เวลา 18.30 เป็นต้นไป บริเวณวงคณะคณะศิลปกรรมศาสตร์ มหาวิทยาลัยขอนแก่น ชมผลงานศิลปะ การออกแบบ การแสดง หนังกลางแปลง ดนตรี การประกวด Artlane 22# TikTok Cosplay Contest มาในธีม “Love is blooming now : ฤดูรักมาถึงแล้ว” งานคราฟงานทำมือ ร้านค้ามากมาย อาหารอร่อย food truck เพียบ
Japanese Film Festival 2025@ขอนแก่น 14 – อาทิตย์ที่ 16 กุมภาพันธ์ 2568
Japanese Film Festival 2025 ศุกร์ที่ 14 – อาทิตย์ที่ 16 กุมภาพันธ์ 2568 ณ หอศิลป์ใหม่อีหลี ขอนแก่น (ริมบึงแก่นนคร) ในความร่วมมือระหว่าง The Japan Foundation, Bangkok , MAIELIE Khonkean และ BERNG NANG CLUB นำภาพยนต์ญี่ปุ่นมาให้ชาวขอนแก่นได้ชมกัน งาน JFF2025 ปีนี้จัดพร้อมกัน 4 จังหวัด (กรุงเทพ ขอนแก่น เชียงใหม่ สงขลา) ดู
โปรแกรมหนังทั้งหมดInternational Food Fest 2025 by TEKKU 14-16 กุมภาพันธ์ 2568
งานเทศกาลอาหารนานาชาติ International Food Fest 2025 by TEKKU วันที่ 14-16 กุมภาพันธ์ 2568 คณะเทคโนโลยี มหาวิทยาลัยขอนแก่น ภายใต้แนวคิด “INNOVATIVE x COZY FOOD: Craft the Wellness” นวัตกรรมอาหารสุขภาพแสนอบอุ่นสู่วิถีดูแลกายใจอย่างยั่งยืน
งานเกษตรและเทคโนโลยีพื้นบ้านอีสาน ครั้งที่29 วันที่ 14-20 กุมภาพันธ์ 2568
งานเกษตรและเทคโนโลยีพื้นบ้านอีสาน ครั้งที่29 วันที่ 14-20 กุมภาพันธ์ 2568 ขอเชิญร่วมชิม ช้อป ชม สินค้า กิจกรรมต่างๆในงาน ณ คณะทรัพยากรธรรมชาติ มทร.อีสาน วิทยาเขตสกลนคร
Lampang Coffee Fest 2025 วันที่ 14-16 กุมภาพันธ์ 2568 สวนสาธารณะหนองกระทิง อ.เมือง จ.ลำปาง
คอกาแฟต้องห้ามพลาดกับงาน
Lampang Coffee Fest 2025 วันที่ 14-16 กุมภาพันธ์ 2568 สวนสาธารณะหนองกระทิง อ.เมือง จ.ลำปาง เอาใจคนรักกาแฟ รวมกาแฟจากหลากหลายที่ หลากหลายชนิดให้ได้มาลิ้มลอง และ Chill out สบายๆใต้ร่มไม้สีเขียวสบายตา และอากาศที่เย็นสบาย มีทั้งกาแฟ ชาเขียว เครื่องดื่มต่างๆ ขนมเบอเกอรี่อบใหม่หอมติดจมูก
กิจกรรมจดทะเบียนสมรส ณ สะพานขาวทาชมภู 14 กุมภาพันธ์ 2568
เชิญชวนคู่รัก กิจกรรม จดทะเบียนสมรส ณ สะพานขาวทาชมภู 14 กุมภาพันธ์ 2568 อำเภอแม่ทา จังหวัดลำพูน
มาร่วมเป็น สักขีพยานแห่งความรัก และ จดทะเบียนสมรสวันแห่งความรัก @ สะพานขาวทาชมภู ของรางวัลสุดพิเศษสำหรับคู่รักที่มาจดทะเบียนสมรส 30 คู่แรก – รับ เสื้อคลุมสุดพิเศษ จาก ททท. สำนักงานลำปาง (ลงทะเบียนภายใน 10 ก.พ. 2568 *พิเศษเสื้อตามไซส์) 15 คู่ถัดมา – รับ Gift Voucher ห้องพัก 1 คืน จาก กัซซัน กอล์ฟ แอนด์ รีสอร์ท (ใช้ได้ตั้งแต่ 1 มี.ค. - 31 ต.ค. 2568) 5 ต่อมา – รับ สิทธิ์พักบ้านพัก 1 คืน ณ อุทยานแห่งชาติดอยขุนตาล (ใช้ได้ตั้งแต่ 15 - 28 ก.พ. 2568) สอบถามรายละเอียดเพิ่มเติมได้ที่ ฝ่ายทะเบียนและบัตร ที่ว่าการอำเภอแม่ทา จังหวัดลำพูนหรือ โทร: 053-976637
โรจน์ระวีศรีนครน่าน เสน่ห์มนตรา คุณค่าแห่งเมืองล้านนา 14-15-16 กุมภาพันธ์ 2568
ส่งเสริมการท่องเที่ยวเชิงวัฒนธรรมของจังหวัดน่าน ขอเชิญชวนร่วมงาน “โรจน์ระวีศรีนครน่าน เสน่ห์มนตรา คุณค่าแห่งเมืองล้านนา” วันที่ 14-15-16 กุมภาพันธ์ 2568 ณ ถนนคนเดิน ข่วงเมืองน่าน หน้าวัดภูมินทร์ - ชมการแสดงศิลปะวัฒนธรรม ดนตรีสด - สินค้าพื้นเมือง - โชว์การทำกาแฟดริป กาแฟเมืองน่าน ซึ่งเป็นแหล่งผลิตกาแฟพรีเมียมจากบาเรสต้ามืออาชีพ - เสวนาจากอินฟลูเอนเซอร์สายท่องเที่ยว - ชมมินิคอนเสิร์ต กัน นภัทร ,ลูกตาล ชลธิชา, มินตรา น่านเจ้า - ดนตรีโฟล์คซองเต็มอิ่มกับแสงสีเสียง ทั้ง 3 วัน - บูทอาหารสินค้าหัตถกรรมพื้นเมือง งานประชาสัมพันธ์ ฝ่ายอำนวยการ สำนักปลัดเทศบาล เทศบาลเมืองน่าน โทรศัพท์ 054 710234 ต่อ 110,119
งานดนตรีในสวน “อุ่นไอฮัก น่าน” วันศุกร์ที่ 14 กุมภาพันธ์ 2568
งานดนตรีในสวน “อุ่นไอฮัก น่าน” เมื่อสายลมหนาวของรอบปีได้พาพัด เมื่อวันแห่งความรักได้วนมาถึง ก่อให้เกิดเป็นงาน อุ่นไอฮัก น่าน เสียงดนตรีในสายลมหนาว พบกันในงาน วันศุกร์ที่ 14 กุมภาพันธ์ 2568 เวลา 16.30 – 21.00 น. สถานที่ ศูนย์เครือข่ายการเรียนรู้เพื่อภูมิภาค จุฬาลงกรณ์มหาวิทยาลัย
ครั้งแรกกับวาเลนไทน์ปีนี้ ชวนแฟน ชวนครอบครัวมานั่งฟังดนตรีสบาย ๆบรรยากาศ ของความรู้สึกดีดี ในวันแห่งความรักที่ไม่มีข้อจำกัด กับงาน“อุ่นไอฮัก น่าน ในเสียงดนตรี“ ที่จุฬาฯน่าน พิเศษชวนคู่รักมาในงาน 20 คู่แรกรับฟรี กระเป๋าผ้าจากทาง CUNEX พบกับ เสียงดนตรีในสายลมหนาวจาก วงแชมป์แพรว วงFRIENDSHIP จาก มทร.ล้านนาน่าน วงCUSARBAND จากจุฬาลงกรณ์มหาวิทยาลัย ฟรี กิจกรรมWorkshopศิลปะสื่อใจผ่านธรรมชาติ จากที่หลบฝน ฟรี กิจกรรมWorkshop “การขอบคุณตัวเรา”จากChula Student Wellness ต่อด้วยกิจกรรม เวทีแลกเปลี่ยนการเกษตรร่วมกันของ จุฬาลงกรณ์มหาวิทยาลัย และ มทร ล้านนาน่าน ในหัวข้อการเกษตรของน่านในยุคปัจจุบัน พบกับร้านค้าจากนิสิตที่ขนความอร่อยมาบริการ
งาน BALLOON FESTIVAL PHUKHAO-YA OF LOVE @RANONG 14 - 15 กุมภาพันธ์ 2568
วาเลนไทล์นี้ เตรียมมาบอกรักกันในงาน BALLOON FESTIVAL PHUKHAO-YA OF LOVE @RANONG ระหว่างวันที่ 14 - 15 กุมภาพันธ์ 2568 ณ ภูเขาหญ้า ตำบลหงาว พบกับศิลปินชื่อดัง INSTINCT SONGKARN ปราง ปรางทิพย์ วงวัชราวลี พลอยชมพู กล้วย แสตมป์ เชิญชวนทุกคนไปถ่ายรูปเช็คอินกัน ในงานเทศกาลบอลลูนจังหวัดระนอง บอกเลยมุมถ่ายรูปเยอะมาก หรือจะถ่ายคู่บอลลูนแบบเลิศๆ ภายในงานมีร้านค้าร้านอาหารร้านเด็ดร้านดังสุดแสนอร่อยและพบกับคอนเสิร์ตศิลปินชื่อดังมากมาย
Nonthaburi International Art & Craft Festival 2025 วันที่ 14-16 กุมภาพันธ์ 2568
กิจกรรม Nonthaburi International Art & Craft Festival 2025 ในวันที่ 14-16 กุมภาพันธ์ 2568 เวลา 16:00 - 21:00 น. ณ ริมเขื่อนท่าน้ำนนท์ อ.เมืองนนทบุรี จังหวัดนนทบุรี
ภายในงานจัดกิจกรรมที่คัดสรรสำหรับผู้ที่ชื่นชอบงานศิลปะหลากหลายรูปแบบ อาทิ งานแสดงนิทรรศการศิลปะนานาชาติ ผลงานศิลปินแห่งชาติ ศิลปินต่างชาติกว่า 9 ประเทศ ศิลปินชั้นนำของไทย เสวนาวิชาการ ฟังสบายสบายเข้าถึงเข้าใจนำไปใช้ ได้อย่างแท้จริง เวิร์คช็อปการทำเครื่องประดับ DIY อย่างง่ายจากเทคนิคการเป่าแก้ว เครื่องประดับว้าวว้าวสุดปังจากฝีมือของตนเอง เวิร์คช็อปเพ้นท์กระถางดินเผาสุดชิคผ่านฝีมือตนเอง ชิ้นเดียวของโลก เวิร์คช็อป "EZY Batik" ง่ายสุดสุดประทับใจผู้ทำ TUCHใจผู้รับ ชิม ช็อป สินค้าชิคๆ และกิจกรรมแจกของรางวัลมากมาย
งานเทศกาลไก่ย่างบ้านแคน "กระต๊าก FESTIVAL 2025" วันที่ 14 - 15 กุมภาพันธ์ 2568
งานเทศกาลไก่ย่างบ้านแคน "กระต๊าก FESTIVAL 2025" ระหว่างวันที่ 14 - 15 กุมภาพันธ์ 2568 ณ สนามโรงเรียนชุมชนดงแคนใหญ่ ตำบลดงแคนใหญ่ อำเภอคำเขื่อนแก้ว จังหวัดยโสธร (index pointing right)พบกับการแสดงศิลปะวัฒนธรรมและกิจกรรมภายในงาน ตั้งแต่เวลา 16.00 น. เป็นต้นไป การประกวดไก่ย่างบ้านแคนแสนอร่อย การประกวดส้มตำแซ่บหลายสายบ้านแคน และชมการแสดงดนตรีจากศิลปิน ตั้งแต่เวลา 18.00 น. เป็นต้นไป วันที่ 14 ก.พ. 68 : ศิลปิน "ศรีจันทร์ วีสี" วันที่ 15 ก.พ. 68 : ศิลปิน "ดอกรัก ดวงมาลา" ชมฟรีตลอดงาน
เที่ยวงานมหกรรมการท่องเที่ยว โดยชุมชนจังหวัดนครศรีธรรมราช ปีที่ 2 ระหว่างวันที่ 14-16 กุมภาพันธ์ 2568
เชิญชวน เที่ยวงานมหกรรมการท่องเที่ยว โดยชุมชนจังหวัดนครศรีธรรมราช ปีที่ 2 ระหว่างวันที่ 14-16 กุมภาพันธ์ 2568
ณ วิสาหกิจชุมชนบ้านแหลมโฮมสเตย์ อำเภอท่าศาลา จังหวัดนครศรีธรรมราช ลุ้น!! รับของที่ระลึกจากการท่องเที่ยวแห่งประเทศไทย สำนักงานนครศรีธรรมราช เพียงร่วมกิจกรรมสนุกภายในงาน
Thailand Es Yen Championship 2025 รอบภูมิภาค
Thailand Es Yen Championship 2025 การแข่งขันเอสเย็นชิงแชมป์ประเทศไทย รอบภูมิภาค [ติดตามการเปิดรับสมัครในแต่ละภูมิภาคผ่าน Facebook :
Thailand Coffee Fest]
- ภาคเหนือ จังหวัดเชียงใหม่ วันแข่งขัน วันเสาร์ที่ 15 กุมภาพันธ์ 2568 เวลา 13.00 - 17.00 น. ณ ร้าน Espressoman Chiangmai (ภาคเหนือ ประกอบด้วย 17 จังหวัด ได้ เชียงใหม่, เชียงราย, ลําปาง, ลําพูน, แม่ฮ่องสอน, น่าน, พะเยา, อุตรดิตถ์, ตาก, สุโขทัย, พิษณุโลก, พิจิตร, กําแพงเพชร, เพชรบูรณ นครสวรรค์, อุทัยธานี)
- ภาคกลาง (กรุงเทพมหานคร, อ่างทอง, ชัยนาท, พระนครศรีอยุธยา, ลพบุรี, นครปฐม นนทบุรี, ปทุมธานี, สมุทรปราการ, สมุทรสาคร, สมุทรสงคราม, สระบุรี, สิงห์บุรี, สุพรรณบุรี, นครนายก, ฉะเชิงเทรา, จันทบุรี, ชลบุรี, ปราจีนบุรี ระยอง, สระแก้ว, ตราด, กาญจนบุรี, ราชบุรี, เพชรบุรี, ประจวบคีรีขันธ์)
- ภาคตะวันออกเฉียงเหนือ เดือนมีนาคม พ.ศ. 2568 จังหวัดอุดรธานี (ภาคอีสาน ประกอบด้วย 20 จังหวัด ได้ อํานาจเจริญ, บึงกาฬ, บุรีรัมย์, ชัยภูมิ, กาฬสินธุ์, ขอนแก่น, เ มหาสารคาม, มุกดาหาร, นครพนม, นครราชสีมา, หนองบัวลําภู, หนองคาย, ร้อยเอ็ด, สกลนคร, ศรีสะเกษ, สุรินทร์, อุบลราชธาน อุดรธานี, ยโสธร)
- ภาคใต้ เดือนพฤษภาคม พ.ศ. 2568 จังหวัดสงขลา (ภาคใต้ประกอบด้วย 14 จังหวัด ได ชุมพร, นครศรีธรรมราช, นราธิวาส, ปัตตานี, พัทลุง, สงขลา, สุราษฎร์ธาน ยะลา, กระบี่, พังงา, ภูเก็ต, ระนอง, สตูล, ตรัง)
- การแข่งขัน Thailand Es Yen Championship 2025 รอบชิงชนะเลิศ ในงาน Thailand Coffee Fest 2025 ระหว่างวันที่ 10 - 13 กรกฎาคม พ.ศ. 2568 ณ IMPACT Exhibition Center Hall 5 - 8 เมืองทองธานี
แอมเวย์ เอ็กซ์โป 2568 วันที่ 15-16 กุมภาพันธ์ 2568
งาน “แอมเวย์ เอ็กซ์โป 2568” (AMWAY EXPO 2025) งานมหกรรมสุขภาพที่แอมเวย์ยกทัพเสิร์ฟการมีสุขภาพและสุขภาวะที่ดี (Health & Wellbeing) เปิดเส้นทางสู่ “สุข” ทุกมิติ ด้วยแนวทางการสร้างสุขภาพและสุขภาวะที่ดีเพื่อนำไปสู่การมี Healthspan ที่ยืนยาว ในวันที่ 15-16 กุมภาพันธ์ นี้ ที่ อาคารชาเลนเจอร์ ฮอลล์ 3 อิมแพ็ค เมืองทองธานี กิจกรรมในโซนต่าง ๆ อาทิ โซนผลิตภัณฑ์เสริมอาหารนิวทริไลท์ กับกิจกรรม Health Check-in ประเมินสุขภาพโดยรวมจากการรับประทาน กิจกรรมแชะแล้วแชร์กับน้อง Good Morning Mascot สุดน่ารัก โซนโปรแกรมผลิตภัณฑ์ควบคุมน้ำหนักและโปรแกรมฟิตเนสเอ็กซ์เอส กับกิจกรรมตรวจวัดองค์ประกอบและทดสอบสมรรถภาพทางกาย โซนผลิตภัณฑ์อาร์ทิสทรี กับกิจกรรมสอนแต่งหน้าแบบ Day & Night Look โซนเครื่องกรองน้ำอีสปริงและเครื่องกรองอากาศแอทโมสเฟียร์ กับสาธิตการกรองน้ำและการกรองอากาศที่สะอาดมีคุณภาพ และอีกมากมาย
งาน Doggiday#20 15-16 ก.พ. 2568 ที่ k village
งาน Doggiday#20 ที่ k village สุขุมวิท 26 รักเท่าไหนเปย์ไปเลยเท่านั้น เพราะภายในงานเรารวบรวม ร้านค้าสินค้าบริการเกี่ยวกับต้าวน้อน ไว้มากมายกว่า 70 ร้านค้า เอาใจสายทาสหมา ทาสแมวแบบครบจบที่เดียว 15-16 ก.พ. 2568 10.00-20.00 k village สุขุมวิท 26 มีที่จอดรถ ใส่สายจูงพาเดินในศูนย์การค้าได้ Free petpark บริการตรวจสุขภาพฟรีจาก Thonglor Pet Hospital โรงพยาบาลสัตว์ทองหล่อ
งาน Coffee Fest 2025 วันที่ 15 – 20 ก.พ. 68
งาน "Coffee Fest 2025" ตั้งแต่วันที่ 15 – 20 ก.พ. 68 ที่โรบินสันไลฟ์สไตล์ ราชพฤกษ์ บริเวณลานโปรโมชั่น ชั้น 1 (หน้า Studio 7) พับกับกาแฟ เครื่องดื่ม และร้านขนมแสนอร่อยกว่า 20 ร้าน
หนังโลก “Les Amants du Pont-Neuf (The Lovers on the Bridge)” วันเสาร์ที่ 15 กุมภาพันธ์ 2568
หนังโลก “Les Amants du Pont-Neuf (The Lovers on the Bridge)” หนังรักเรื่องดังจากปี 1991 โดยผู้กำกับ ลีโอส์ การากซ์ (Leos Carax) นี่อาจไม่ใช่หนังโรแมนติกในขนบแห่งรสนิยมมาตรฐาน อาจไม่ใช่หนังรักที่หนุ่มสาวทั่วไปในเมืองใหญ่จะยึดถือเป็นต้นแบบ แต่ปฏิเสธไม่ได้ว่า นี่คือหนังที่ท้าทายความรู้สึกคนดูด้วยสไตล์ที่หวือหวา ผสมผสานความดิบของชีวิตข้างถนนในปารีส เข้ากับความมหัศจรรย์จากภาพและเสียง หนังทำให้คนดูต้องตะลึงกับเนื้อเรื่อง และพฤติกรรมตัวละครที่แหวกธรรมเนียมภาพยนตร์โรแมนติกทั่วไป
ฉายในวันเสาร์ที่ 15 กุมภาพันธ์ 2568 เวลา 14:00 น. ณ โรงภาพยนตร์ศาลาศีนิมา ชั้น 6 อาคารสรรพสาตรศุภกิจ หอภาพยนตร์ (องค์การมหาชน) ไม่มีค่าใช้จ่ายในการเข้าชม (ภาพยนตร์จัดฉายด้วยระบบ DCP เสียงต้นฉบับภาษาฝรั่งเศส คำบรรยายภาษาไทยและอังกฤษ) สำรองที่นั่งล่วงหน้าที่
fapot.or.thดนตรีในสวน 15-16 กุมภาพันธ์ 2568
ดนตรีในสวน กับ 4 วงดนตรี ใน 3 สถานที่ ! โดยความร่วมมือของกรุงเทพมหานคร มูลนิธิรอยัลแบงค์คอกซิมโฟนีออร์เคสตร้า ศิลปิน ศิลปินอิสระ วงดนตรีประชาชนและเยาวชน
วันเสาร์ที่ 15 กุมภาพันธ์ 2568
• สวนเบญจกิติ Bangkok Brass Quintet เริ่ม 16.45 น.
วันอาทิตย์ที่ 16 กุมภาพันธ์ 2568
• สวนลุมพินี เขตคลองเตย เทศกาลดนตรีในสวน วง Royal Bangkok Symphony Orchestra เริ่ม 17.30 น.
• Terminal 21 พระราม 3 เทศกาลดนตรีกรุงเทพฯ Piano & Cello Duets (Piano - Heather Stainer, Cello - Napat Naklada) จากโรงเรียนนานาชาติฮาร์โรว์กรุงเทพฯ Bangkok Metropolitan Orchestra ศิลปินรับเชิญ ลูกหว้า พิจิกา จิตตะปุตตะ โน้ต ศรัณย์ คุ้งบรรพต มุก เปมิกา เงินส่งเสริม ปอนด์ พัทธนันท์ อาจองค์ และ กองปราบ ปณิธาน จวงครุฑ เริ่ม 17.00 น.วิ่งพิชิตยอดเขากบ นครสวรรค์ 2025 วันเสาร์ที่ 15 กุมภาพันธ์ 2568
วิ่งพิชิตยอดเขากบ นครสวรรค์ 2025 ระยะ 5 KM. วันเสาร์ที่ 15 กุมภาพันธ์ 2568 ณ วัดวรนาถบรรพต พระอารามหลวง สมัครฟรี ไม่มีค่าใช่จ่าย รับจำนวนจำกัด 666 คน จัดโดย สำนักงานการท่องเที่ยวและกีฬาจังหวัดนครสวรรค์ โครงการบูรณาการและขับเคลื่อนแผนพัฒนาการกีฬาแห่งชาติสู่การปฎิบัติในระดับพื้นที่ ประจำปี พ.ศ.2568
Something To BEE Market อ.สวนผึ้ง วันเสาร์ที่ 15 กุมภาพันธ์ 2568
มาร์เก็ตงานคราฟท์กลางคืนแห่งแรกของสวนผึ้ง! โดยกลุ่มผู้ประกอบการท่องเที่ยวสวนผึ้ง "Something To BEE Market" วันเสาร์ที่ 15 กุมภาพันธ์ 2568 นี้ ตั้งแต่เวลา 17.00 - 22.00 น. ณ บริเวณลานสนามด้านหน้าร้าน The Fav อ.สวนผึ้ง จ.ราชบุรี ชวนกันมาเดินเล่น ในบรรยากาศแสนชิลล์ เพลิดเพลินกับงานคราฟท์ อาหาร ขนม เครื่องดื่ม สินค้าโฮมเมด สินค้ามือสองคุณภาพดี และกิจกรรม Workshop ต่าง ๆ พร้อมดนตรีสดฟังสบาย ๆ
วิ่งสานใจไกลกังวล ครั้งที่1 วันเสาร์ที่ 15 กุมภาพันธ์ 2568
สมาคมนักเรียนเก่าโรงเรียนวังไกลกังวล ขอเชิญทุกท่านเตรียมพบกับความสุข และสนุกกับกิจกรรมงานวิ่งการกุศล "
วิ่งสานใจไกลกังวล ครั้งที่1" ในวันเสาร์ที่ 15 กุมภาพันธ์ 2568 เวลา 16.00 น. ณ สวนหลวงราชินี 19 ไร่ ถนนเลียบวัง อ.หัวหิน จ.ประจวบคีรีขันธ์
การแข่งขันกระดานยืนพาย SUP ลุ่มแม่กลองจังหวัดสมุทรสงคราม วันเสาร์ที่ 15 กุมภาพันธ์ 2568
ททท.สำนักงานสมุทรสงคราม เชิญชวนนักกีฬา และผู้สนใจสมัครร่วมกิจกรรม “การแข่งขันกระดานยืนพาย SUP ลุ่มแม่กลองจังหวัดสมุทรสงคราม วันเสาร์ที่ 15 กุมภาพันธ์ 2568 เวลา 06.30 น. ณ ตลาดน้ำอัมพวา (ค่าสมัคร 599.- บาท/คน) จ.สมุทรสงคราม
งานสมโภชหลวงพ่อทศพล 15 - 23 กุมภาพันธ์ 2568
เชิญเที่ยวงาน “ สมโภชหลวงพ่อทศพล ” วันที่ 15 - 23 กุมภาพันธ์ 2568 จัดเต็ม 9 วัน 9 คืน ในภายในงานพบกับ ✅ คอนเสิร์ตศิลปินชื่อดังตลอด 9 วัน 9 คืน ✅ รำวงย้อนยุคเเละสวนสนุกสุดยิ่งใหญ่ ✅ การประกวดธินางฟ้าจำแลง ✅ ล้วงไหการกุศลรางวัลใหญ่ ✅ ร้านค้า ร้านอาหารเจ้าดังใน TikTok มากมาย มหรสพชมฟรีตลอดงาน มีลิเกดังทุกคืน
Run Love Strawberry วันเสาร์ที่ 15 กุมภาพันธ์ 2568
Run Love Strawberry วันเสาร์ที่ 15 กุมภาพันธ์ 2568 นี้ มาวิ่งที่แหล่งปลูกสตรอว์เบอร์รี่ที่ใหญ่ที่สุด (บ้านบ่อแก้ว อ.สะเมิง) สมัครฟรี 100 ท่าน เต็มแล้ว เต็มเลย ฟรีเสื้อ ! ฟรี Bib !! ฟรีเก็บแบบฉ่ำๆ กินได้ไม่อั้น !!! และพบกับกิจกรรมอื่น ๆ อีกมากมายให้ร่วมสนุกสนานกัน
มูลนิธิชุมพรการกุศลสงเคราะห์ ขอเชิญร่วมงาน แห่พระ-แห่เจ้า ลุยไฟ วันที่ 15-19 กุมภาพันธ์ 2568
มูลนิธิชุมพรการกุศลสงเคราะห์ ขอเชิญร่วมงาน แห่พระ-แห่เจ้า ลุยไฟ วันที่ 15-19 กุมภาพันธ์ 2568 ณ มูลนิธิชุมพรการกุศลสงเคราะห์ ร่วมเป็นส่วนหนึ่งในเทศกาลประเพณีอันศักดิ์สิทธิ์ พบกับขบวนแห่พระ-แห่เจ้า ขบวนสิงโต-มังกร การแสดงสุดอลังการ และพิธีลุยไฟสุดตื่นตา เสริมสิริมงคล ต้อนรับปีใหม่จีนอย่างยิ่งใหญ่
กิจกรรมดีๆ ตลาดนัดฅนดี เสาร์ ที่ 15 ก.พ. 68
กิจกรรมดีๆ ตลาดนัดฅนดี เกษตรอินทรีย์แบบมีส่วนร่วม PGS ในเดือนแห่งรักนี้ เสาร์ ที่ 15 ก.พ. 68
ฤดูหนัง ฤดูรัก Love on Screen Film festival 15 - 16 กุมภาพันธ์ 2568
กิจกรรม “ฤดูหนัง ฤดูรัก Love on Screen Film festival” 15 - 16 กุมภาพันธ์ นี้….ที่ลานจามจุรี โรงแรมมาริไทม์ เริ่มเวลา …15.00 น. …. ความสุข ความอิ่ม..ความใจฟู ตลอด 48 ชั่วโมง Notting Hill About Time Friend Zone "สัปเหร่อ
งาน คนไทยมีดี เฟสติวัล 2025 วันที่ 16 กุมภาพันธ์ 2568
งาน คนไทยมีดี เฟสติวัล 2025 วันที่ 16 กุมภาพันธ์ 2568 ตั้งแต่เวลา 16.00 เป็นต้นไป ณ ลานประตูท่าแพ จังหวัดเชียงใหม่ ชมฟรีตลอดงาน
ม่วนชื่นหรรษา ละลานตาสินค้าชุมชน ชมดนตรีลูกทุ่งตระการตา พบกับร้านค้าเจ้าเด็ดอร่อยจุใจ สรรค์สร้างความสุขทุกเพศทุกวัย ในงานคนไทยมีดี เฟสติวัล 2025 ภายใต้ธีม "รวมพลังชุมชน รวมพลคนมีดี" กิจกรรมภายในงาน "คนไทยมีดี เฟสติวัล 2025 ✅ ชม ประกวดเพลงลูกทุ่งระดับมัธยมฯ ✅ ชิม อาหารและเครื่องดื่มจากร้านดังของเชียงใหม่ หลากหลายวัฒนธรรม ✅ ช็อป ของดีของเด็ดจาก 14 ชุมชนทั่วภาคเหนือ ✅ ชิล เวิร์กช็อป งานฝีมือท้องถิ่น"มีดี" . พิเศษ! มินิคอนเสิร์ตโดย บิ๊ก The Golden Song และร่วมลุ้นชิงรางวัลไปกับฉลากพาโชค งาน คนไทยมีดี เฟสติวัล 2025 จัดโดย โครงการการยกระดับศักยภาพผู้นำฯ โครงการภายใต้การดำเนินงานของวิทยาลัยการศึกษาตลอดชีวิต มหาวิทยาลัยเชียงใหม่
เดิน-วิ่ง “เมืองมาย แอมโมไนต์รัน” 16 กุมภาพันธ์ 2568
สำหรับนักวิ่งเรามีนัดกัน ณ อบต.เมืองมาย เดิน-วิ่ง “เมืองมาย แอมโมไนต์รัน” อาทิตย์ที่ 16 กุมภาพันธ์ 2568 ณ ลานเอนกประสงค์ องค์การบริหารส่วนตำบลเมืองมาย ต.เมืองมาย อ.แจ้ห่ม จ.ลำปาง เส้นทางวิ่ง 240 ล้านปี วัตถุประสงค์การจัดงาน เพื่อพัฒนาเส้นทางการท่องเที่ยวเชิงนิเวศน์ ยกระดับการขับเคลื่อนเศรษฐกิจในระดับท้องถิ่นด้วยการท่องเที่ยวเชิงกีฬาและศึกษาเส้นทางธรรมชาติ และเพื่อส่งเสริมการออกกำลังกาย สร้างความสัมพันธ์ที่ดี ส่งเสริมความสามัคคี และเชื่อมโยงเครือข่ายระหว่างชุมชน หน่วยงานภาครัฐและภาคเอกชน
ร่วมทำบุญตักบาตร เทศกาล มาฆปุรณมีศรีนครน่าน 1,743 รูป ทำบุญฉลองนครน่าน ครบ 743 ปี วันอาทิตย์ ที่ 16 กุมภาพันธ์ 2568
ขอเชิญร่วมทำบุญตักบาตรพระภิกษุ-สามเณร
เทศกาล มาฆปุรณมีศรีนครน่าน 1,743 รูป
ทำบุญฉลองนครน่าน ครบ 743 ปี
วันอาทิตย์ ที่ 16 กุมภาพันธ์ 2568
เวลา 06.00 - 08.30 น.
ณ ข่วงเมืองน่าน ถนนข้างวัดภูมินทร์ อ.เมือง จ.น่าน
"SUPHANBURI MUEANGNHOE HALF MARATHON ครั้งที่ 6" 16 ก.พ.68
งานวิ่ง"สุพรรณบุรีเมืองเหน่อฮาร์ฟมาราธอน ครั้งที่6" ในวันอาทิตย์ที่ 16 ก.พ.68 ตั้งแต่เวลา 04.00 น.- 09.00 น.
เทศกาลกินปลา ชิมพุทรา ชัยบาดาล 7-16 กุมภาพันธ์ 2568
ชวนเที่ยวงานประจำปี อ.ชัยบาดาล ในงานเทศกาลกินปลา ชิมพุทรา ชัยบาดาล ณ ตลาดปลาชัยบาดาล จ.ลพบุรี วันที่ 7-16 กุมภาพันธ์ 2568 ชมการแข่งขันจับปลา แข่งตำส้มตำลีลา พุทธาจากสวน สินค้าโอท็อป สวนสนุกชุดใหญ่ คอนเสิร์ตวงดังทุกคืน
งาน “ดูเพลิน เดินโฟล์ค” 17-18 กุมภาพันธ์ 2568
งาน “ดูเพลิน เดินโฟล์ค” ที่มาพร้อมกับหนังกลางแปลง 3 มิติ ที่นี่ ที่เดียว พบกันวันที่ 17-18 กุมภาพันธ์ 2568 เวลา 16.00-22.00 น. ณ ลานสังคีต (อ่างแก้ว) มหาวิทยาลัยเชียงใหม่ กลับมาอีกครั้งกับกิจกรรมแสดงศักยภาพนักศึกษาพร้อมทั้งดูหนังสุดมันส์กับระบบ3มิติ ครั้งแรกที่อ่างแก้ว พร้อมทั้งอาหารและเครื่องดื่ม และกิจกรรมอื่นๆอีกเพียบ ขนมาไว้ที่นี่แล้ว พบกับกิจกรรม - หนังกลางแปลง 3 มิติครั้งแรกในมช. - ดนตรี folk song สุดชิล - เครื่องดื่ม&อาหารสุดฟิน - กิจกรรม Workshops สุดคูล???? - ลุ้นรับของรางวัลมากมายภายในงาน และยังไม่หมดเพียงเท่านี้ ยังขนทัพกิจกรรมอื่นๆมาอีกเพียบ
มหกรรมของดีเมืองสุราษฎร์ธานี 17-23 กุมภาพันธ์ 2568 เซ็นทรัลขอนแก่น
จังหวัดสุราษฎร์ธานี โดย สำนักงานพาณิชย์จังหวัดสุราษฎร์ธานี ขอเชิญพี่น้องชาวขอนแก่น และจังหวัดใกล้เคียง พบกับมหกรรมแสดงและจำหน่ายสินค้า “ของดีเมืองสุราษฎร์ธานี” ที่ยกทัพสินค้าจากแดนใต้สู่อีสาน มาม่วน มาแซ่บ กันให้จุใจ กับสินค้าชุมชน สินค้าอัตลักษณ์เด่น อาหารทะเลแปรรูป และอาหารทะเลสดๆ มาตรฐาน GI กว่า 30 ร้าน 17-23 กุมภาพันธ์ 2568 เวลา 10.00 - 21.00 น. ณ บริเวณลานกิจกรรมชั้น 1 ศูนย์การค้าเซ็นทรัลขอนแก่น อำเภอเมือง จังหวัดขอนแก่น
มหกรรมมอาหาร วิถีน่าน วิถีถิ่น วิถีไทย ประจำปี 2568 ครั้ง 17 วันที่ 5 - 9 กุมภาพันธ์ 2568
ขอเชิญเชิญเที่ยวมหกรรมมอาหาร วิถีน่าน วิถีถิ่น วิถีไทย ประจำปี 2568 ครั้ง 17 ระหว่างวันที่ 5 - 9 กุมภาพันธ์ 2568 ณ ลานจอดรถห้างสรรพสินค้านราไฮเปอร์มาร์ท พบการจำหน่ายอาหารกว่า 40 บูธ ชมการประกวดนักร้องหางเครื่อง การประกวดแข่งลาบหมูคั่ว การประกวดธิดามหกรรมอาหาร ปี 2568 การประกวดส้มตำลีลา และการแสดงดนตรีศิลปิน วงเดอะเพอะ
งาน นิฮนไซ ครั้งที่34 NIHONSAI CMU34 วันอังคารที่ 18 กุมภาพันธ์ 2568
งาน ‘นิฮนไซ ครั้งที่34’ ‘NIHONSAI CMU34’ พบกับงานที่สามารถสัมผัสกลิ่นอายความเป็นญี่ปุ่นผ่านวัฒนธรรมและกิจกรรมนันทนาการต่างๆ อาทิ พิธีชงชาแบบญี่ปุ่นแท้ การพับกระดาษแบบญี่ปุ่น การเขียนพู่กัน รวมไปถึงอาหารน่ากินละลานตามากมาย และโชว์สุดพิเศษที่จะทำให้ตกตะลึง วันจัดงาน : วันอังคาร ที่ 18 กุมภาพันธ์ 2568 สถานที่จัดงาน : ศาลาอ่างแก้ว มหาวิทยาลัยเชียงใหม่ เวลา : 16.00 - 21.00 น. โดยงานเปิดลงทะเบียนตั้งแต่ 16.00 น. เป็นต้นไป
หอมกลิ่นถิ่นน่าน Season 2 วันที่ 18 - 20 กุมภาพันธ์ 2568
การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานน่าน และภาคีเครือข่ายด้านการท่องเที่ยว ชวนเที่ยวงาน หอมกลิ่น ถิ่นน่าน Season 2 วันที่ 18 - 20 กุมภาพันธ์ 2568 เวลา 15.00 - 21.00 น. ณ ข่วงน้อย อ.เมือง จ.น่าน
เสิร์ฟความอร่อยกับเมนูอาหารท้องถิ่น ฟินกับเครื่องดื่มแบบจุ้มอ๊กเย็นใจ๋ จำนวน 30 กว่าร้านดัง เพลินเพลินไปกับกิจกรรม Workshop และงานคราฟต์ พร้อมสนุกไปกันศิลปินสุดพิเศษที่ยกขบวนมามอบความสนุกภายในงาน ลิ้มรส อาหารท้องถิ่น และเครื่องดื่มเย็นๆ กับเมนูซิกเนเจอร์กว่า 30 ร้านค้า สนุกไปกับกิจกรรม Workshop ที่ชวนให้ทุกคนได้ลองทำ และนำไปเป็นของฝากกลับบ้าน เพลินเพลินกับดนตรีเพราะๆภายในงาน ที่ยกขบวนความสนุกมาเสิร์ฟทุกคน ร่วมเล่นกิจกรรม เพื่อรับของที่ระลึก และส่วนลดพิเศษซื้อสินค้าภายในงานจากบูธ ททท.สำนักงานน่าน Lineup วงดนตรีเพราะ ๆ ของน่าน และศิลปินสุดพิเศษ วันอังคารที่ 18 กุมภาพันธ์ 2568 พบกับ เพียว The Voice วันพุธที่ 19 กุมภาพันธ์ 2568 พบกับ Guitar Sky และ Guncharlie วันพฤหัสบดีที่ 20 กุมภาพันธ์ 2568 พบกับวง ChampPreaw Full Brand และ วง Only Monday
เทศกาลงานไหมนาโพธิ์ ประจำปี 2568 วันที่ 19-25 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงาน เทศกาลงานไหมนาโพธิ์ ประจำปี 2568 วันที่ 19-25 กุมภาพันธ์ 2568 สนามหน้าที่ว่าการอำเภอนาโพธิ์ จ.บุรีรัมย์
งาน Nan Coffee Day 2025 ครั้งที่สอง วันที่ 19-23 กุมภาพันธ์ 2568 ณ ศูนย์การค้าเซ็นทรัล ศรีราชา LINK
“Nan Coffee Day 2025” ครั้งที่สอง จัดขึ้นระหว่างวันที่ 19-23 กุมภาพันธ์ 2568 ณ ศูนย์การค้าเซ็นทรัล ศรีราชา อำเภอศรีราชา จังหวัดชลบุรี งาน "Nan Coffee’s Day 2025" เป็นกิจกรรมเพื่อประชาสัมพันธ์ผลิตภัณฑ์กาแฟและผลิตภัณฑ์ต่อเนื่อง จังหวัดน่าน จำนวน 2 ครั้ง ดังนี้
- ครั้งที่ 1 ระหว่างวันที่ 5-7 ธันวาคม 2567 ณ บริเวณข่วงน้อย อำเภอเมืองน่าน จังหวัดน่าน
- ครั้งที่ 2 ระหว่างวันที่ 19-23 กุมภาพันธ์ 2568 ณ เซ็นทรัลศรีราชา จังหวัดชลบุรี
โดยในงาน Nan Coffee’s Day 2025 จะมีกิจกรรมต่าง ๆ ประกอบไปด้วย
-การแสดงและจำหน่ายผลิตภัณฑ์กาแฟ และผลิตภัณฑ์ต่อเนื่องจังหวัดน่าน
-การจัดแสดงนิทรรศการเกี่ยวกับกาแฟจังหวัดน่าน
-กิจกรรมเจรจาจับคู่ธุรกิจ ทั้งระบบแบบออนไซต์ และออนไลน์
-กิจกรรมการเสวนาเรื่อง “กาแฟน่าน : เส้นทางสู่ความยั่งยืน”
-กิจกรรมส่งเสริมการขาย และกิจกรรมความบันเทิงต่าง ๆ ได้แก่ การสาธิตดริปกาแฟ - การทำลาเต้อาร์ต - การ Cupping / การแข่งขันการทำเมนูกาแฟ ได้แก่ การทำเมนูเอสเพรสโซ่เย็นกาแฟน่าน, การทำเมนู Fusion coffee, การทำเมนู Black Coffee และการทำขนมเบเกอรี่จากกาแฟ
งานเทศกาลอาหารและดนตรี ของดีแปดริ้ว วันที่ 19 - 27 กุมภาพันธ์ 2568
เชิญเที่ยวงานเทศกาลอาหารและดนตรี ของดีแปดริ้ว ณ ลานหน้าห้างตะวันออกคอมเพล็กซ์ ฉะเชิงเทรา วันที่ 19 - 27 กุมภาพันธ์ 2568
งานเทศกาลปิดทองประจำปี ตลาดน้ำดอนหวาย 19-23 กุมภาพันธ์ 2568
งานเทศกาลปิดทอง หลวงพ่อวิไลเลิศ หลวงพ่อวิสาหาร ตลาดน้ำดอนหวาย วันที่ 19-23 กุมภาพันธ์ 2568 มหรสพสมโภช ดนตรี ภาพยนต์ ศิลปินดังโชว์ตลอด 5 คืน (จ๊ะ นงผณี ปู่จ๋าน บอล ตั๊ก แจ๊ส)
AMAZING เหวนเมืองใต้ 19-23 กุมภาพันธ์ 2568
สายกิน สายเที่ยว สาย Workshop มาด่วน Ep.AMAZING เหวนเมืองใต้ เริ่ม 19-23 กุมภาพันธ์ 2568 15:00 น.เป็นต้นไป ที่ Robinfood Lifestyle Trang สนับสนุนโดย การท่องเที่ยวแห่งประเทศไทย
pet in wonderland 20-23 ก.พ.2568
pet in wonderland 20-23 ก.พ.2568 ที่ Emsphere at EM District ในงานจะได้พบกับกิจกรรมมากมาย ได้แก่ market สินค้าสัตว์เลี้ยงกว่า 60 ร้านค้า - น้องหมาหาบ้าน - โซนป้อนอาหารสัตว์ Exotic - เติมน้อนหมา กับคาเฟ่หมาปอม - บริการตรวจสุขภาพฟรีจากโรงพยาบาลสัตว์ทองหล่อ - ส และ อา มิตติ้ง ต้าวน้อนดัชชุน และชิวาว่า - promotion ในงาน ช็อปสินค้าภายในงานครบ 3,000 บาทแลกคูปองถ่ายรูปที่ Photobooth ฟรี!
FIF 2025 (Fruit Innovation Fair Chanthaburi) 20-23 กุมภาพันธ์ 2568
FIF 2025 (Fruit Innovation Fair Chanthaburi) กำหนดจัดวันที่ 20-23 กุมภาพันธ์ 2568 ณ ศูนย์การค้าเซ็นทรัล จันทบุรี
งานนวัตกรรมผลไม้เมืองร้อนแห่งเอเชีย งานเดียวที่รวมไว้ครบทุกด้านของการทำสวนผลไม้ ทั้งเทคโนโลยี นวัตกรรม ปุ๋ย ยา อาหารเสริมพืชสวน เครื่องจักร และอุปกรณ์ทางการเกษตร พบกับบริการทางการเกษตรและส่วนลดพิเศษ เพื่อลดต้นทุนทางการเกษตร เสวนา "วิกฤตน้ำล้นกับพืชสวนไทย"จับคู่เจรจาธุรกิจ ของคู่ค้าธุรกิจผลไม้ไทย Farm Trip ชมสวนผลไม้ที่ประสบความสำเร็จ
สอบถามโทร. 089 831 4779 (หอการค้าจังหวัดจันทบุรี)
เทศกาลดนตรี สีสันฤดูหนาว (Khao E-To Music Festival) 20 - 22 กุมภาพันธ์ 2568
เทศกาลดนตรี สีสันฤดูหนาว (Khao E-To Music Festival) ระหว่างวันที่ 20-22 กุมภาพันธ์ 2568 ณ ป่านันทนาการน้ำตกเขาอีโต้ อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี
กิจกรรมภายในงาน: - เช็กอินถ่ายภาพกับชุมชนประติมากรรมไฟ แสง สี ในบรรยากาศหนาว - นักรักศิลป์สามารถเพลิดเพลินกับตลาดศิลปะ Art & Craft Market - อาหารหลากหลายจาก Food Truck - การประกวดดนตรีสุดมันส์สำหรับเยาวชน นักศึกษา และประชาชนทั่วไป พบคอนเสิร์ต: 20 ก.พ. คอนเสิร์ตจากศิลปิน วงเขียนไขและวานิช 21 ก.พ. คอนเสิร์ตจากศิลปินวงแมวเศษเล็บ 22 ก.พ. คอนเสิร์ตจากศิลปินวงวชิราวลี งานนี้เป็นโอกาสดีสำหรับผู้ที่รักดนตรีและต้องการสัมผัสบรรยากาศหนาวที่เขาอีโต้ พร้อมสนุกกับกิจกรรมหลากหลายตลอด 3 วัน
งาน Bangkok Farmers Market 20-23 ก.พ. 68
Bangkok Farmers Market 20-23 ก.พ. 68 เวลา 10.00 - 20.00 น. ชั้น 1 ลานไนน์ สแควร์ ศูนย์การค้าเดอะไนน์ เซ็นเตอร์ พระราม 9 เอาใจคนรักสุขภาพ กับงาน Bangkok Farmers Market พบกับตลาดสินค้าคุณภาพ สินค้าออแกนิก สินค้าเกษตรอินทรีย์ สินค้าเกษตรจากชาวสวน และอื่น ๆ อีกเพียบ กว่า 40 ร้าน ด้วยกัน
งานสมโภชหลักเมืองเพชรบูรณ์ 1,004 ปี วันที่ 20 - 28 กุมภาพันธ์ 2568


เทศบาลเมืองเพชรบูรณ์ จัดงานสมโภชหลักเมืองเพชรบูรณ์ 1,004 ปี ในระหว่างวันที่ 20 - 28 กุมภาพันธ์ 2568 ณ บริเวณศาลเจ้าพ่อหลักเมืองเพชรบูรณ์ เพื่อเป็นการเสริมดวงเมือง สร้างขวัญและกำลังใจให้กับประชาชน เสริมสร้างสังคมให้อยู่เย็นเป็นสุข แสดงถึงความยึดมั่นศรัทธาเคารพสักการะศูนย์รวมจิตใจชาวเพชรบูรณ์ และเป็นสถานที่สำคัญคู่บ้านคู่เมืองของจังหวัดเพชรบูรณ์มาช้านาน โดยได้กำหนดจัด 8 พิธีสำคัญ เพื่อความเป็นสิริมงคลของเมืองเพชรบูรณ์ ประกอบด้วยพิธีเจริญ พระพุทธมนต์,บวงสรวง พิธีพราหมณ์,สืบชะตาเมือง พิธีล้านนา,รำสมโภช 1004 ปี ศรีหลักเมืองเพชรบูรณ์,สู่ขวัญเมือง พิธีล้านช้าง,สักการะ พิธีจีน,พิธีรับขวัญเมือง พิธีพื้นบ้านสะเดียง,และการเลี้ยงเจ้าพ่อ เจ้าแม่คุ้ม นอกจากนี้ยังมี การแข่งขันชกมวยสตรีท Club Fight Phetchabun การประกวดหนูน้อยหลักเมืองเพชรบูรณ์ การประกวดธิดาหลักเมืองเพชรบูรณ์ รำวงย้อนยุคฉลองสมโภช กิจกรรมคาราวานสินค้า การแสดงดนตรีศิลปิน มหกรรมอาหาร ไม้ดอกไม้ประดับ เฟอร์นิเจอร์ ทุกค่ำคืน ณ บริเวณศาลเจ้าพ่อหลักเมืองเพชรบูรณ์ หอโบราณคดีเพ็ชรบูรณ์อินทราชัย และลานกิจกรรมผาเมือง อ.เมืองเพชรบูรณ์ จังหวัดเพชรบูรณ์
ทั้งนี้ “เสาหลักเมืองเพชรบูรณ์” เป็นศิลาจารึกโบราณอายุ 1,004 ปี บนหลักมีอักษรจารึก 2 ยุค ยุคแรกเป็นอักษรขอมโบราณ เกี่ยวกับสรรเสริญพระศิวะ ยุคต่อมากล่าวถึงพระพุทธศาสนา สันนิษฐานว่าเสาหลักเมืองหลักนี้ถูกนำมาจากเมืองโบราณศรีเทพ ก่อนจะถูกยกเป็นเสาหลักเมืองในปี พ.ศ. 2443 โดยหลวงนิกรเกียรติคุณ ปัจจุบันเสาหลักเมือง ณ ศาลเจ้าพ่อหลักเมือง เป็นศูนย์รวมความศรัทธาของชาวเพชรบูรณ์
มหกรรมว่าวประเพณี และว่าวนานาชาติครั้งที่ 44 ประจำปี 2568 วันที่ 20-23 กุมภาพันธ์ 2568
มหกรรมว่าวประเพณี และว่าวนานาชาติครั้งที่ 44 ประจำปี 2568 Satun International Kite Festival 2025 งานว่าวที่ดีและยิ่งใหญ่ที่สุดในประเทศ Satun is Thailand Biggest & Best International Kite Festival ระหว่างวันที่ 20-23 กุมภาพันธ์ 2568 ณ สนามบินกองทัพอากาศจังหวัดสตูล
รับชมการแสดงฟรีคอนเสิร์ตของศิลปินชื่อดัง ทุกค่ำคืนพบกับมหกรรมเทศกาลอาหารสยามอันดามัน มีสินค้าหลากหลายมากมายให้เลือกชิมช็อป ไฮไลท์พบกับการแสดงว่าวบังคับ ว่าวแฟนซีต่างๆ นานาชนิด ทั้งภาคกลางวันและว่าวไฟ ภาคกลางคืน อีกทั้ง พบกับสวนไฟประดับตกแต่งนานาชนิด (จุด Check in ถ่ายภาพ ) ภายใต้ Concept “ลานไฟ เล่นลม ” และกิจกรรมหลากหลาย จากการท่องเที่ยวแห่งประเทศไทย
ติดต่อสอบถามเพิ่มเติมได้ที่ : องค์การบริหารส่วนจังหวัดสตูล 074-711273 ประชาสัมพันธ์ อบจ.สตูล
เทศกาลดนตรี สีสันฤดูหนาว (Khao E-To Music Festival) 20-22 กุมภาพันธ์ 2568
เทศกาลดนตรี สีสันฤดูหนาว (Khao E-To Music Festival)วันที่ 20-22 กุมภาพันธ์ 2568 ณ ป่านันทนาการน้ำตกเขาอีโต้ อำเภอเมืองปราจีนบุรี จังหวัดปราจีนบุรี
กิจกรรมภายในงาน: เช็กอินถ่ายภาพกับชุมชนประติมากรรมไฟ แสง สี ในบรรยากาศหนาว นักรักศิลป์สามารถเพลิดเพลินกับตลาดศิลปะ Art & Craft Market อาหารหลากหลายจาก Food Truck การประกวดดนตรีสุดมันส์สำหรับเยาวชน นักศึกษา และประชาชนทั่วไป พบคอนเสิร์ต : 20 กุมภาพันธ์ คอนเสิร์ตจากศิลปิน วงเขียนไขและวานิช 21 กุมภาพันธ์ คอนเสิร์ตจากศิลปินวงแมวเศษเล็บ 22 กุมภาพันธ์ คอนเสิร์ตจากศิลปินวงวชิราวลี งานนี้เป็นโอกาสดีสำหรับผู้ที่รักดนตรีและต้องการสัมผัสบรรยากาศหนาวที่เขาอีโต้ พร้อมสนุกกับกิจกรรมหลากหลายตลอด 3 วัน
เชิญ ชมช้อปใช้ ”ถนนคนเดินค่ายสุริยพงษ์“ เปิดถึง วันพุธ ที่ 26 กุมภาพันธ์ 2568
เชิญ ชมช้อปใช้ ”ถนนคนเดินค่ายสุริยพงษ์“ เปิดถึง วันพุธ ที่ 26 กุมภาพันธ์ 2568 เปิดจำหน่ายสินค้าให้กับประชาชนในพื้นที่ กระตุ้นเศรษฐกิจ ในการจับจ่าย ซื้อขายสินค้า สร้างรายได้แก่ประชาชนรอบค่ายและกำลังพล กิจกรรมนันทนาการ ผ่อนคลายจากการทำงาน กระตุ้นเศรษฐกิจ ให้กับชุมชนรอบค่ายและประชาชนในพื้นที่ จว.น.น. รวมทั้งส่งเสริมให้เกิดกิจกรรมท่องเที่ยวบริเวณหน้าค่ายสุริยพงษ์ ในกิจกรรมมีการขายสินค้า ผลิตผลของโครงการทหารพันธุ์ดีน่าน การแสดงดนตรีขับกล่อมเสียงเพลงจาก มว.ดย.มทบ.38 และมีจุดบริการพยาบาลเบื้องต้น บริการนวดจาก รพ.ค่ายสุริยพงษ์ และเป็นเวทีในการส่งเสริมให้เยาวชนได้แสดงออกทางด้านดนตรี ณ หน้าค่ายสุริยพงษ์
งานเกษตรแฟร์ และOTOP จังหวัดกระบี่ ครั้งที่ 12 ประจำปี 2568 วันที่ 20-26 กุมภาพันธ์ 2568
งานเกษตรแฟร์ และOTOP จังหวัดกระบี่ ครั้งที่ 12 ประจำปี 2568 ระหว่างวันที่ 20-26 กุมภาพันธ์ 2568 ณ องค์การบริหารส่วนจังหวัดกระบี่ ตลอด 7 วัน 7 คืน ตั้งแต่เวลาประมาณ 10.00 -22.00 น.
✅โซนสินค้าการเกษตร และ OTOP กว่า 150 ร้านค้า ✅โซนนิทรรศการ/การประกวด/การอบรมสัมมนา 20 กพ.68 1.ประกวดกล้วยไม้นารี-กล้วยไม้ต่างๆ 2.ประกวดพืชกินแมลง 3.แข่งขันกรีดยางพารา 4.ประกวดเมนูอร่อยกับข้าวพันธุ์หอมหัวบอน35 21-22 กพ.68 1.อบรมเคล็ดลับถ่ายภาพให้ดูแพง-ทำคอนเทนต์ให้ปัง 23 กพ.68 1.ประกวดบอนไซกระบี่ ครั้งที่7 และประกวดไก่แจ้สวยงาม 24 กพ.68 1.อบรมสัมมนาหลักสูตร แปรรูปผลิตภัณฑ์ทางทะเล บูรณาการร่วมกับศูนย์วิจัยและบริการภูมิภาคอันดามัน จังหวัดกระบี่ คณะประมง มหาวิทยาลัยเกษตรศาสตร์ 25 กพ.68 1. อบรมหลักสูตร เรียน รู้จริง เรื่องทุเรียน บูรณาการร่วมกับสำนักงานเกษตรจังหวัดกระบี่ 26 กพ.68 1. การประกวดทำอาหารที่ใช้วัตถุดิบจากเนื้อแพะ ✅ตารางการแสดงเวทีกลาง 20 กพ.68 พิธีเปิด 17.00 น. 21-25 กพ.68 เวลา 18.30-21.30 น.(ดนตรี 18.30-21.30 น.) 26 กพ.68 พิธีปิด เวลา 22.00 น.
ฤดูกาลกาแฟ๔ 21-23 กุมภาพันธ์ 2568 น้ำตกพาเจริญ อ.พบพระ
"ฤดูกาลกาแฟ๔" วันที่ 21-23 กุมภาพันธ์ 2568 ณ น้ำตกพาเจริญ อ.พบพระ จ.ตาก งานประจำปีที่จัดมาเพื่อ คนรักกาแฟและรักงานศิลป์ให้มาร่วมตัวกัน โดยเฉพาะปีนี้ ที่มาใน คอนเซ็ปต์ "บทกวีคือชีวิต" พบกับ ร้านกาแฟ และอาหารหลากรส ที่คัดสรรมาเสริฟ กันให้จุใจ เวิร์คช็อปงานศิลปะกว่า ๒๐ บูธ ดนตรีสดขับกล่อมตลอดทั้งวัน ท่ามความฉ่ำเย็นของธารน้ำตก และความร่มรื่นของเงาไม้ใหญ่
งานวันเกษตรและเทคโนโลยีอีสาน ครั้งที่ 12 มทร.สุรินทร์ วันที่ 21 กุมภาพันธ์ - 2 มีนาคม 2568
ขอเชิญเที่ยวงานยิ่งใหญ่ประจำปี "งานวันเกษตรและเทคโนโลยีอีสาน ครั้งที่ 12" Agri Tech Surin ระหว่างวันที่ 21 กุมภาพันธ์ - 2 มีนาคม 2568 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์
พบกับกิจกรรมหลากหลาย • นิทรรศการด้านการเกษตรและเทคโนโลยี • สินค้าพืชผลและผลิตภัณฑ์จากชุมชน • เวิร์กชอปด้านพืชและเลี้ยงสัตว์ • การแสดงดนตรีและการแสดงพื้นบ้าน • การประกวดแข่งขันที่หลากหลาย • อาหารอร่อยจากร้านดังมากมาย • มาร่วมสนุกและเรียนรู้ไปด้วยกัน! • อย่าพลาดงานดีๆ แบบนี้
Hua Hin Yoga Festival 2025 (ครั้งที่ 5) 21-23 กุมภาพันธ์ 2568
Hua Hin Yoga Festival 2025 (ครั้งที่ 5) งานโยคะสุดชิลล์ริมหาดเขาตะเกียบ หัวหิน ท่ามกลางบรรยากาศสบายๆ ยามเย็นกับแสงแดดอ่อนๆ ตอนพระอาทิตย์ตกดิน…ที่ไม่เหมือนที่ไหน!! 21-23 กุมภาพันธ์ 2568 17.00-19.30 น. ชายหาดหน้าโรงแรมเวอร์โซ หัวหิน - อะ วีวันดา คอลเลคชั่น อ.หัวหิน จ.ประจวบคีรีขันธ์
นำสอนโดยครูโยคะที่มีประสบการณ์ทั้งไทยและต่างชาติ 21 ก.พ. 68 SATIT 22 ก.พ. 68 JIMMY 23 ก.พ. 68 KAMLESH
และพิเศษสุดปีนี้ กับ Yoga Workshop กิจกรรมโยคะฟรีก่อนงาน 31 ม.ค. 68 @ มาร์เก็จวิลเลจ หัวหิน 8 ก.พ. 68 @ บลูพอร์ต หัวหิน 15 ก.พ. 68 @ ชายหาดหัวหิน ซอยหัวหิน 85 17.00-18.00 น. ลงทะเบียนร่วมกิจกรรมล่วงหน้า
Suphan Soul Festival 2025 สุพรรณ โซล เฟสติวัล 21-22 กุมภาพันธ์ 2568
สุพรรณ โซล เฟสติวัล 21-22 กุมภาพันธ์ 2568 กลางวันและกลางคืน ตั้งแต่เวลา 09.30 - 24.00 น. ณ โบราณสถานวัดสนามชัย, สุพรรณบุรี …เข้าฟรี… มีกิจกรรมหลากหลายตลอดเทศกาล DOCUMENTARY FILMS MUSIC ART WORK SHOP MERIT งานที่มีทั้งเสียงเพลงและงานศิลป์ให้ชม ตั้งแต่เยาวชนไปจนถึงวัยเก๋า
งานวันเกษตรและของดีตำบลแม่ท้อ ประจำปี 2568 วันที่ 21-22 ก.พ. 2568
งานวันเกษตรและของดีตำบลแม่ท้อ ประจำปี 2568" วันที่ 21-22 ก.พ. 2568 ณ ศูนย์จำหน่ายสินค้าทางการเกษตรพื้นที่สูงและสินค้าชุมชนตำบลแม้ท้อ (ตรงข้าม อบต.แม่ท้อ) กิจกรรมภายในงาน การประกวดพืชผลทางการเกษตร การแข่งขันชงกาแฟ การแข่งขันไก่อบฟาง การแข่งขันลาบเหนือหมูสุก การแข่งขันส้มตำลีลา การแข่งขันไก่แจ้ขยันขัน
กิจกรรมมหกรรมถนนสายวัฒนธรรมชาติพันธุ์ ๔ แผ่นดิน BUENGKAN CRAFT สืบศิลป์ ถิ่นอิสาน" 21 กุมภาพันธ์ 2568
สำนักงานวัฒนธรรมจังหวัดบึงกาฬ ขอเรียนเชิญทุกท่านร่วม"กิจกรรมมหกรรมถนนสายวัฒนธรรมชาติพันธุ์ ๔ แผ่นดิน BUENGKAN CRAFT สืบศิลป์ ถิ่นอิสาน" ในวันที่ ๒๑ กุมภาพันธ์ ๒๕๖๘ เวลา ๑๖.๐๐ น. เป็นต้นไป ณ บริเวณเฮือนบึงกาญจน์ไชยบุรี จวนผู้ว่าราชการจังหวัดบึงกาฬ (หลังเก่า) อำเภอเมืองบึงกาฬ จังหวัดบึงกาฬ
กิจกรรมและการแสดงมากมาย อาทิ - การสาธิตและจำหน่ายสินค้าทางวัฒนธรรม - เมนูเชิดชูอาหารถิ่น/ชาติพันธุ์ "รสชาติ...ที่หายไป The lost test" - การจำหน่ายสินค้า OTOP โดยสำนักงานพัฒนาชุมชนจังหวัดบึงกาฬ การจำหน่ายสินค้าการเกษตร โดยสำนักงานเกษตรและสหกรณ์จังหวัดบึงกาฬ - นิทรรศการ "BUENGKAN คราฟท์" จากมหาวิทยาลัยราชภัฏอุดรธานี - "น้องวันวาฬ" Mascot บึงกาฬ โดยสำนักงานท่องเที่ยวและกีฬาจังหวัดบึงกาฬ ก็มานร้าาาา - การแสดงศิลปะวัฒนธรรมท้องถิ่น/ศิลปะร่วมสมัย จากเครือข่ายวัฒนธรรม - ชมภาพยนตร์ (หนังกลางแปลง) เรื่อง บึงกาฬ
งาน UDON HUG MUSEUM อุดรฮักมิวเซียม #3 Art Eat Peak Music ตอน : ฮักบ้านเกิด 21-22 กุมภาพันธ์ 2568
งาน UDON HUG MUSEUM อุดรฮักมิวเซียม #3 Art Eat Peak Music ตอน : ฮักบ้านเกิด วันที่ 21-22 กุมภาพันธ์ 2568 ลานกิจกรรม ด้านหลังพิพิธภัณฑ์เมืองอุดรธานี (ริมสวนสาธารณะหนองประจักษ์)
พบกับ ศิลปินลูกหลานชาวอุดรธานี มาร่วมฮัก Museum ฮัก…พิพิธภัณฑ์เมืองอุดรธานี กับ บรรยากาศเดือนกุมภาพันธ์ เดือนแห่งความรัก 21 กุมภาพันธ์ 2568 พบกับ ศิลปิน "แนต The Voice" 22 กุมภาพันธ์ 2568 พบกับ ศิลปิน "อาร์ The Star" และขอเชิญชวนทุกท่าน…ร่วมเฉลิมฉลอง รำลึกถึงอาคารราชินูทิศ งานครบรอบ ๑๐๐ ปี อาคารราชินูทิศ ณ พิพิธภัณฑ์เมืองอุดรธานี ไปด้วยกัน
งานประเพณี ส่งต่อ สืบสาน ไชยวาน มีดี ประจำปี 2568 ระหว่างวันที่ 21-23 กุมภาพันธ์ 2568
เชิญเที่ยวชมงานประเพณี ส่งต่อ สืบสาน ไชยวาน มีดี ประจำปี 2568 ระหว่างวันที่ 21-23 กุมภาพันธ์ 2568 ณบริเวณลานหน้าที่ว่าการอำเภอไชยวาน จังหวัดอุดรธานี การสมัครประกวดร้องเพลง งานประเพณี ส่งต่อสืบสาน ไชยวาน ประจำปี 2568 ผู้สนใจติดต่อได้ที่ เคาน์เตอร์เวรบริการประชาชน ชั้นที่ 1 ที่ว่าการอำเภอไชยวาน - เปิดรับสมัครตั้งเเต่วันนี้ - 23 ก.พ 2567 หรือ โทร 063-904-4673Maehongson Con Coff Camp @ Romance Farm วันที่ 21-23 กุมภาพันธ์ 2568
งานสุดชิล
Maehongson Con Coff Camp @ Romance Farm
วันที่ 21-23 กุมภาพันธ์ 2568
เทศกาลดอกชมพูภูคาบาน สืบสานตำนานชาติพันธุ์ วันที่ 21 ก.พ - 2 มี.ค 2568
เทศกาลดอกชมพูภูคาบาน สืบสานตำนานชาติพันธุ์ วันที่ 21 ก.พ - 2 มี.ค 2568 ณ บริเวณสถานีขนส่งอำเภอป้ว ชม...ขบวนแห่, การประกวดธิภาพญาผานอง หนูน้อยสุขภาพดี, รำวงย้อนยุค ผลิตภัณฑ์สินค้านานานาชนิดจาก 4 ภาค สินค้าราคาถูกจากโรงงาน, เสื้อผ้าแฟชั่น เครื่องหนัง เครื่องประดับ ของใช้ในครัวเรือน สวนสนุกชุดใหญ่ และคอนเสิร์ตศิลปินดัง มากมาย
งาน Thailand โอนลี่ มาร์เก็ต 1 จังหวัด 1 เมนู เชิดชูอาหารถิ่น ฟินทุกจาน! วันที่ 21 ก.พ. - 5 มี.ค. 68
งาน Thailand โอนลี่ มาร์เก็ต 1 จังหวัด 1 เมนู เชิดชูอาหารถิ่น ฟินทุกจาน! วันที่ 21 ก.พ. - 5 มี.ค. 68 ณ ลานกิจกรรม ชั้น G เซ็นทรัล นครปฐม พร้อมลิ้มรสอาหารไทยหาทานยาก จากทุกภาคทั่วไทย ที่เซ็นทรัล นครปฐม อร่อยครบทุกภาค! มาฟินกับเมนูเด็ดทั่วไทยในงาน Thailand โอนลี่ มาร์เก็ต
เทศกาลงานงิ้วต้นปี ประจำปี 2568 วันที่ 21 - 24 กุมภาพันธ์ 2568
สักการะกราบไหว้ขอพร ปึงเก่ากง - ม่า ในเทศกาลงานงิ้วต้นปี ประจำปี 2568 ในวันที่ 21 - 24 กุมภาพันธ์ 2568 ณ ศาลเจ้าพ่อจุ้ย ตลาดบางบัวทอง ตำบลโสนลอย อำเภอบางบัวทอง จังหวัดนนทบุรี
งาน "กาดดาราเทวี" ตลาดแห่งอารยธรรมล้านนา 21-23 กุมภาพันธ์ และ 28-30 มีนาคม 2568
งาน "กาดดาราเทวี" ตลาดแห่งอารยธรรมล้านนา จัดขึ้นที่โรงแรมดาราเทวี เชียงใหม่ 21-23 กุมภาพันธ์ และ 28-30 มีนาคม 2568
ภายในงานเพลิดเพลินไปกับอาหารเหนือท้องถิ่นกว่า 20 ร้านค้า สินค้าหัตถกรรมในพื้นที่อาทิเสื้อผ้า เครื่องประดับอีกกว่า 10 ร้านค้า ที่ล้วนแต่สะท้อนให้เห็นความล้านนาของเวียงเจียงใหม่ และกิจกรรม Workshop และการจัดแสดงผลงานภูมิปัญญาชาวบ้าน ที่คุณสามารถมีส่วนร่วมได้ ซึ่งถือเป็นสัญลักษณ์ของชาวล้านนา อาทิ การทำโคมจากกลุ่มทำโคมหมู่ที่ 1 ผลิตภัณฑ์จากจิตรกรรมฝาผนังกลุ่มวิสาหกิจชุมชน การตอกเล็บโบราณและวัฒนธรรมล้านนาน่าหลงใหลอีกมากมาย ที่รอสร้างความสุข สร้างรอยยิ้มและความประทับใจให้คุณ
โครงการ "กาดดาราเทวี" เป็นการบูรณาการความร่วมมือระหว่าง เทศบาลตำบลท่าศาลา และดาราเทวี เชียงใหม่ เพื่อพัฒนาพื้นที่เศรษฐกิจสร้างสรรค์แห่งใหม่ที่สะท้อนถึงอัตลักษณ์ล้านนาแบบดั้งเดิม โดยมีการจัดแสดงและจำหน่ายสินค้าหัตถกรรม ผลิตภัณฑ์ชุมชน อาหารพื้นเมือง การแสดงศิลปวัฒนธรรม และการสาธิตภูมิปัญญาท้องถิ่น เพื่อส่งเสริมการมีส่วนร่วมของชุมชน และสร้างโอกาสทางเศรษฐกิจให้แก่ประชาชนในพื้นที่
หอการค้าตราดเกษตรแฟร์ ครั้งที่ 1 วันที่ 22 กุมภาพันธ์ – 2 มีนาคม 2568
งาน “หอการค้าตราดเกษตรแฟร์ ครั้งที่ 1” วันที่ 22 กุมภาพันธ์ – 2 มีนาคม 2568 ณ สนามบินฝูงบิน 306 อำเภอเมืองตราด จะจัดแบ่งเป็น 5 โซนหลัก ได้แก่
1. โซนต้นไม้ – จำหน่ายพันธุ์ไม้ ผลิตภัณฑ์จากพืช และอุปกรณ์ตกแต่งสวน
2. โซนอาหาร – อาหารพื้นถิ่น อาหารแปรรูป และของดีจากชุมชน
3. โซนของใช้ – สินค้าหัตถกรรม และผลิตภัณฑ์จากกลุ่มวิสาหกิจชุมชน
4. โซนเทคโนโลยีทางการเกษตร ประมง และปศุสัตว์ – นวัตกรรมและอุปกรณ์สำหรับภาคเกษตรกรรม
5. โซนมอเตอร์โชว์ – แสดงและจำหน่ายยานยนต์เพื่อการเกษตรและการเดินทาง
นอกจากนี้ ภายในงานยังมี เวทีเสวนาทางการเกษตรและประมง อาทิ เทคนิคการเลี้ยงกุ้ง การเลี้ยงผึ้ง และการจัดการสวนผลไม้ เช่น มังคุด เงาะ และทุเรียน โดยมีผู้เชี่ยวชาญให้คำแนะนำ รวมถึงการแสดงจากนักเรียนจากสถานศึกษาต่าง ๆ ในจังหวัดตราด
เทศกาลดนตรี SOMTHIP MUSIC FESTIVAL ครั้งที่ 3 [ซื้อบัตร]
เทศกาลดนตรีครั้งใหญ่…ใจกลางเมืองราชบุรี "SOMTHIP MUSIC FESTIVAL ครั้งที่ 3" วันเสาร์ที่ 22 กุมภาพันธ์ 2568 ???? ลานสนามหญ้าเครื่องบินบังคับ เดอะนายน์ ถนนเส้นบายพาส อ.เมือง จ.ราชบุรี เริ่มลงทะเบียนเวลา 12.00 น. ประตูเปิดเวลา 14.00 น.
ครบทุกความสนุกแน่นอน ชวนกันมาถ่ายรูปพลุสวยๆ งานดีๆ บอลลูนกลางเมือง ร้านอาหารอร่อยๆเพียบ!!!! และกิจกรรมในงานมากมาย ไลน์อัพศิลปินสุดโดนใจ BODYSLAM • NONTTANONT • BIGASS • TIMETHAI • THEPAKINSON • RESTROSPECT •THEGENTLEMAN • SLAPKISS • BEDROOMAUDIO • SEASONFIVE • (SECRET ARTIST) พร้อมด้วยศิลปินรับเชิญพิเศษ
SUP & Camp River to Rock (จากแม่น้ำสู่ยอดผา) 22-23 กุมภาพันธ์ 2568
“ พายเพลิน ปีนมันส์ แคมป์สนุก เติมเต็มความสุขกลางธรรมชาติ ” ในงาน SUP & Camp River to Rock ( จากแม่น้ำสู่ยอดผา) 22-23 กุมภาพันธ์ 2568 แม่น้ำป่าสัก จังหวัดสระบุรี ที่คุณจะได้สัมผัส 4 กิจกรรมใน 1 ทริป (พาย SUP ปีนหน้าผา เดินป่า แคมป์ปิ้ง) 2 วัน 1 คืน ใกล้ชิดธรรมชาติที่สุด
ไฮไลต์ที่ พาย SUP ท่ามกลางทัศนียภาพสวยงามของแม่น้ำป่าสัก • ปีนหน้าผาสุดท้าทาย วัดพลังและความกล้าของคุณ • แคมป์ปิ้งใกล้ชิดธรรมชาติ บนเนินทรายลับที่กลับมาอีกครั้งในรอบ 3 ปี • เดินขึ้นยอดเขา สัมผัสธรรมชาติยามเช้าจากมุมสูง ชมวิวแม่น้ำป่าสักแบบ 360 องศา [
เช็คค่าใช้จ่าย]
Camping+Music+Coffee=Happy "ค้างคาวIN-LOVE" ร่วมกิจกรรมกางเต็นท์ ฟังเพลง 22 กุมภาพันธ์ 2568
"Camping+Music+Coffee=Happy" ค้างคาวIN-LOVE แคมป์ชิล แคมป์ม่วน ปี 2568 วันที่ 22 กุมภาพันธ์ 2568 ณ ลานกางเต็นท์ ตลาดทองคำ อำเภอเขาฉกรรจ์ จังหวัดสระแก้ว
ชวนเพื่อน ชวนคนรัก คนคุย ออกไปใช้ชีวิตนอกบ้านกันซักคืน นั่งฟังเพลง กินจุ๊บกินจิ๊บ ดื่ม ดริงค์ ปิ้ง ย่าง เพลินๆ ในบรรยากาศเดือนแห่งความรัก ในบรรยากาศสุดว้าวค้างคาวบิน ตลาดทองคำ อ.เขาฉกรรจ์ ประเทศสระแก้วมหานคร
เสาร์ 22 ก.พ. 68 ช่วงบ่าย เย็น ยาวไปแบบเวลาชาวแคมป์ ต่อเนื่องเช้าวันอาทิตย์ 23 ก.พ. 68 กิจกรรมยามเช้ามีให้ลุ้นกันอีกเหมือนเดิม เก็บเต็นท์ แยกย้าย ประมาณเที่ยง กางเต็นท์ : ค่าบริการลานกางเต็นท์ คนละ 150 บาท เด็กอายุน้อยกว่า 15 ปี ฟรี ลงทะเบียนจ่ายค่าบริการลานกางเต็นท์หน้างาน ขอบอกว่า วิวสวยมากกก อันซีนมาก นั่งดูค้างคาว ชมวิวภูเขาแบบจึ้งๆ บรรยากาศดี๊ดี แม้จะอยู่กลางตลาด กลางเมืองเขาฉกรรจ์ [มีห้องน้ำ ห้องอาบน้ำ บริเวณล้างจาน ไม่มีปลั๊กไฟ]
*** มีจุดจำหน่ายอาหาร เครื่องดื่ม Food Truck ติดต่อสอบถาม ททท.สำนักงานนครนายก โทร. 08-1715-9457
เส้นทางอร่อยสุดฟิน กินมะยงชิด มะปรางหวาน@นครนายก
รายชื่อสวนมะยงชิด/มะปราง 15 สวนที่เข้าร่วมกิจกรรม “
เส้นทางอร่อยสุดฟิน กินมะยงชิด มะปรางหวาน@นครนายก” ***หมายเหตุ กรุณาโทรติดต่อสั่งจองสินค้าก่อนเดินทางไปรับที่สวน
ตำบลดงละคร อำเภอเมือง
1. สวนบุญล้อม (ลุงแอ๋ว) ตำบลดงละคร เลขที่ 104 หมู่ 6 ตำบลดงละคร อำเภอเมือง จังหวัดนครนายก 26000 โทร 084-1426777
พิกัด
2. สวนภาณุพงศ์ (ดงละคร) ตำบลดงละคร เลขที่ 12 หมู่ 10 ตำบลดงละคร อำเภอเมือง จังหวัดนครนายก 26000 โทร 086-3253254 / 086-3457537
พิกัด
3. สวนนพรัตน์ (ดาบนวย) ตำบลดงละคร เลขที่ 99 หมู่ 10 ตำบลดงละคร อำเภอเมือง จังหวัดนครนายก 26000 โทร 081-7624082
พิกัด
ตำบลท่าช้าง อำเภอเมือง
4. สวนภาณุพงศ์ (ท่าช้าง) ตำบลท่าช้าง เลขที่ 72 หมู่ 7 ตำบลท่าช้าง อำเภอเมือง จังหวัดนครนายก 26000 โทร 086-3253254 / 086-3457537
พิกัด ตำบลหินตั้ง อำเภอเมือง
5. สวนสมเกียรติ วังยายฉิม ตำบลหินตั้ง เลขที่ 85 หมู่ 6 ตำบลหินตั้ง อำเภอเมือง จังหวัดนครนายก 26000 โทร 089-0203064
พิกัด
ตำบลพรหมณี อำเภอเมือง
6. สวนบุญส่ง ตำบลพรหมณี เลขที่ 133 หมู่ 9 ตำบลพรหมณี อำเภอเมือง จังหวัด นครนายก 26000 โทร 089-2125705 ลุงส่ง / 081-6589007 อ.ปราณีต / 062-8311633 ออมทรัพย์
พิกัด ตำบลสาริกา อำเภอเมือง
7. สวนละอองฟ้า (2) ตำบลสาริกา เลขที่ 153 หมู่ 3 ตำบลสาริกา อำเภอเมือง จังหวัดนครนายก 26000 โทร 065-9964566 นนท์
พิกัด
8. สวนนพรัตน์ (ดาบนวย) ตำบลสาริกา เลขที่ 333 หมู่ที่ 3 ตำบลสาริกา อำเภอเมือง จังหวัดนครนายก 26000 โทร 085-1685882 ปุ้ม / 097-2739520 พร ***เข้าทางร้านไก่ย่างน้องเล็ก
พิกัด
9. สวนแก้วคูณ ตำบลสาริกา 55 หมู่ 3 ต.สาริกา อ.เมือง จ. นครนายก โทร 081-3639249 คุณสมจิต
พิกัด
10. สวนศรีทอง ตำบลสาริกา ที่อยู่ 176 ม.4 ต.สาริกา อ.เมืองนครนายก จ.นครนายก โทร : 099-9565464 คุณฟาง
พิกัด
ตำบลเขาพระ อำเภอเมือง
11. สวนละอองฟ้าคุณแหม่ม ตำบลเขาพระ เลขที่ 112 หมู่ 8 ตำบลเขาพระ อ.เมือง จ.นครนนายก โทร 089-2486401 ไอซ์
พิกัด
ตำบลศรีกะอาง อำเภอบ้านนา
12. สวนป้าอ้วน ตำบลศรีกะอาง อำเภอบ้านนา เลขที่ 112 หมู่ 1 ตำบลศรีกะอาง อำเภอบ้านนา นครนายก 26110 โทร 086-1559497 จินตนา บุญมี (อ้วน)
พิกัด
13. สวนทอฝันบ้านนา ตำบลศรีกระอาง อำเภอบ้านนา เลขที่ 228 หมู่ 2 ตำบลศรีกระอาง อำเภอบ้านนา จังหวัดนครนายก 26110 โทร 086-9730519 สุบิน เจริญศักดิ์
พิกัด
14. มะยงชิดนครนายก สวนครูสมนึก ตำบลศรีกะอาง เลขที่ 44 หมู่ 6 ตำบลศรีกะอาง อำเภอบ้านนา จังหวัดนครนายก โทร 095-7108974
พิกัด
ตำบลป่าขะ อำเภอบ้านนา
15. มะยงชิด สวนชั้นหนึ่ง จังหวัดนครนายก ตำบลป่าขะ เลขที่ 67 หมู่ 1 ตำบลป่าขะ อำเภอบ้านนา จังหวัดนครนายก 26110 โทร 0863411363 คุณเอ
พิกัด หรือซื้อได้ที่ ร้านชั้นหนึ่งคาเฟ่ เลขที่ 248 หมู่4 ตำบลป่าขะ อำเภอบ้านนา จังหวัดนครนายก 26110 เบอร์โทร0834626841 โทร 083-4626841
พิกัด Blu Monkey Little Market 2025 @Hotel Krabi Town วันที่ 22 - 23 กุมภาพันธ์ 2568
เตรียมพบกับ Blu Monkey Little Market อีเว้นท์สุดสร้างสรรค์ที่รวบรวมไอเดียเก๋ ๆ มาไว้ในบรรยากาศสุดชิค ภายใต้คอนเซ็ปต์การอยู่ร่วมกันอย่างยั่งยืน Sustainable ภายในงานคุณจะได้เพลิดเพลินไปกับกิจกรรมมากมาย งานนี้เหมาะสำหรับเดอะแก็งค์,ครอบครัวและสัตว์เลี้ยง มีพื้นที่ให้ทำกิจกรรม workshop เรียนรู้ สนุกตลอดระยะเวลา 2 วัน วันที่ 22 - 23 กุมภาพันธ์ 2568 เวลา 15.00 - 22.00 น. Blu Monkey Hub & Hotel Krabi Town สัมผัสประสบการณ์ใหม่ร่วมกันอย่างยั่งยืนกับ: Creative Dish & Craft Drink Eco Art Workshop ???? Live Music Local Shop
Championship Dog Show 2025 วันที่ 22 - 23 กุมภาพันธ์ 2568
Championship Dog Show 2025 พบกับสุดยอดน้องหมาสายพันธุ์หายาก การแข่งขันสุดยิ่งใหญ่ และโชว์สุดพิเศษ! วันที่ 22 - 23 กุมภาพันธ์ 2568 Bangna Hall ชั้น B1 เซ็นทรัล บางนา
กิจกรรม Paws in the Valley วันเสาร์ที่ 22 กุมภาพันธ์ 2568
กิจกรรม Paws in the Valley หุบเขาแห่งมิตรภาพสี่ขา วันเสาร์ที่ 22 กุมภาพันธ์ 2568 สถานที่ WTF Coffee Camp at J Valley แม่ริม จ.เชียงใหม่ ตั้งแต่เวลา 11.00 น.- 16.00 น. กิจกรรมสุดน่ารักตลอดทั้งงาน พาเจ้า 4 ขาตะลุย Journey Map สะสมสติ้กเกอร์ check in ครบ 3 จุด รับเลย! ของรางวัลสุดน่ารัก • กิจกรรม Workshop สแตมป์เท้าน้อน บันทึกความทรงจำของนุดและเจ้าตูบ ฟรีไม่มีค่าใช้จ่าย! • ถ่ายภาพสัตว์เลี้ยงคู่ใจ พร้อม Upload ลง Social Media และ Check In รับไปเลย ไอศกรีมที่แสนอร่อยสำหรับน้องหมา ฟรี! • จับฉลาก Lucky Draw ลุ้นรับรางวัลมูลค่ามากกว่า 5,000 บาท (เพียงลงทะเบียนเข้างานได้รับสิทธิ์นี้ทันทีเลยน้า) • กิจกรรม Popular Vote Photogenic 3 รางวัล กิจกรรม Vet Talk กับคุณหมอจากโรงพยาบาลสัตว์ทองหล่อ เชียงใหม่ และ ตรวจสุขภาพสัตว์เลี้ยงของคุณพร้อมทั้งสมัครสมาชิกฟรี!! ไม่มีค่าใช้จ่าย
วิ่งตามรอยไดโนเสาร์มินิมาราธอน 2025 ร้อยเอ็ด-ขอนแก่น-กาฬสินธุ์
กิจกรรมส่งเสริมการท่องเที่ยวเชิงกีฬา "วิ่งตามรอยไดโนเสาร์มินิมาราธอน" ในโครงการส่งเสริมการท่องเที่ยวยุดคก่อนประวัติศาสตร์เชิงสร้างสรรค์และอุทยานธรณี กิจกรรมหลัก : ส่งเสริมการท่องเที่ยวเชิงกีฬา "วิ่งตามรอยไดโนเสาร์มินิมาราธอน"
Stage-1 จังหวัดร้อยเอ็ด
จุด Start-Finish : วัดภูกุ้มข้าวตำบลคำพอุง อำเภอโพธิ์ชัย จังหวัดร้อยเอ็ด
Race Pack : วันเสาร์ที่ 22 ก.พ. 68
Race Day : วันอาทิตย์ที่ 23 ก.พ. 68
ระยะ 5 KM-Fun Run จำกัดเพียง 750 Slots ระยะ 10 KM-Mini Marathon จำกัดเพียง 750 Slots
Stage-2 จังหวัดกาฬสินธุ์
จุด Start-Finish : พิพิธภัณฑ์สิรินธร อำเภอสหัสขันธ์ จังหวัดกาฬสินธุ์
Race Pack : วันเสาร์ที่ 15 มี.ค. 68
Race Day : วันอาทิตย์ที่ 16 มี.ค. 68
ระยะ 5 KM-Fun Run จำกัดเพียง 750 Slots ระยะ 10 KM-Mini Marathon จำกัดเพียง 750 Slots
Stage-3 จังหวัดขอนแก่น
จุด Start-Finish : พิพิธภัณฑ์พิพิธภัณฑ์ไดโนเสาร์ภูเวียง ตำบลในเมือง อำเภอเวียงเก่า จังหวัดขอนแก่น
Race Pack : วันเสาร์ที่ 29 มี.ค. 68
Race Day : วันอาทิตย์ที่ 30 มี.ค. 68
ระยะ 5 KM-Fun Run จำกัดเพียง 750 Slots ระยะ 10 KM-Mini Marathon จำกัดเพียง 750 Slots
งานเทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 22 ก.พ.-2 มี.ค. 2568
งานเทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 22 ก.พ.-2 มี.ค. 2568 โรบินสันบ่อวิน จ.ชลบุรี
เชฟส์เทเบิ้ล ณ พระนครคีรี ในงานพระนครคีรี ครั้งที่ 38 เพียง 84 ที่นั่งเท่านั้นที่ 22 กุมภาพันธ์ 2568
เชฟส์เทเบิ้ล ณ พระนครคีรี ในงานพระนครคีรี ครั้งที่ 38 เสาร์ที่ 22 กุมภาพันธ์ 2568 เวลา 18.00 - 21.00 น. เพียง 84 ที่นั่งเท่านั้น ในธีมตามรอยพระราชอาคันตุกะในสมัยรัชกาลที่ 4 บัตรที่นั่งละ 2,000 บาท สนใจจองบัตร โทร. 086 396 3420 บัญชีกสิกรไทย 017 2585 043 ชาญณรงค์ บำราพรักษ์ รายได้หลังหักค่าใช้จ่าย มอบเป็นกองทุนเพื่อสาธารณประโยชน์ใน จ.เพชรบุรี ขอเชิญ แต่งกายสมัยรัชกาลที่ 4 หรือชุดสุภาพผ้าไทย พร้อมฟังเกร็ดประวัติศาสตร์ การรับแขกบ้านแขกเมือง สมัยรัชกาลที่ 4 และรับชมการแสดงสื่อผสมเทิดพระเกียรติ สอบถามข้อมูลเพิ่มเติม โทร. 086 396 3420 An Evening to memorable & Exclusive Gala Dinner
Monsoon Valley Harvest Festival 2025 เทศกาลเก็บเกี่ยวองุ่นสุดพิเศษ 22 กุมภาพันธ์ - 2 มีนาคม 2568
Monsoon Valley Harvest Festival 2025 เทศกาลเก็บเกี่ยวองุ่นสุดพิเศษ 22 กุมภาพันธ์ - 2 มีนาคม 2568 ครั้งหนึ่งในรอบปี ที่จะพาคุณดื่มด่ำไปกับเสน่ห์ของไร่องุ่นอันงดงามของมอนซูน แวลลีย์ หัวหิน
กิจกรรมไฮไลท์ : ทัวร์ไร่องุ่น เช็กอิน & เก็บภาพสวย ๆ กับบรรยากาศโรแมนติกของไร่องุ่น เก็บองุ่นสด ๆ จากไร่ การย่ำองุ่นในถังไม้โอ๊ค สัมผัสประสบการณ์เบลน สุดเอ็กซ์คลูซีฟ ค่าเข้าชมเพียง 490 บาท/ท่าน (วันละ 6 รอบ) เท่านั้น! พิเศษ! งาน Harvest Dinner สุดเอ็กซ์คลูซีฟในค่ำคืน วันเสาร์ที่ 1 มีนาคม 2568 เสิร์ฟเมนูรังสรรค์สุดพิเศษ ดื่มกับ Monsoon Valley ท่ามกลางบรรยากาศแสนอบอุ่นใต้แสงดาว
งาน Natai 5K Run on the Beach วันที่ 22 กุมภาพันธ์ 2568
งาน Natai 5K Run on the Beach วันที่ 22 กุมภาพันธ์ 2568 ณ สะพานนาใต้ ตำบลโคกกลอย จังหวัดพังงา พร้อมชิงโล่รางวัลและมินิคอนเสิร์ต มาวิ่งชมพระอาทิตย์ตกดินริมชายหาดนาใต้ไปด้วยกัน
Music Of Princess คอนเสิร์ตการกุศลเพื่อการศึกษาเพลงบรรเลงจากการ์ตูนเจ้าหญิงและการผจญภัยสุดมหัศจรรย์ 22 กุมภาพันธ์ 2568
Music Of Princess คอนเสิร์ตการกุศลเพื่อการศึกษาเพลงบรรเลงจากการ์ตูนเจ้าหญิงและการผจญภัยสุดมหัศจรรย์ โดยวินด์ซิมโฟนีหรือวงดุริยางค์เครื่องลมจากวิทยาลัยนาฏศิลปนครราชสีมา วันและเวลา 22 กุมภาพันธ์ 2568 เวลา 17.00 น. สถานที่: MCC HALL ชั้น เดอะมอลล์โคราช
กลับมาพบกับประสบการณ์สุดมหัศจรรย์ในโลกแห่งเวทมนตร์และการผจญภัยที่คุณหลงรัก! ร่วมสัมผัส คอนเสิร์ตเพลงบรรเลงสุดพิเศษ ที่จะพาคุณย้อนเวลากลับไปในโลกแห่งการ์ตูนเจ้าหญิงที่จะทำให้หัวใจคุณเต้นรัวไปกับเสียงเพลงที่คุ้นเคย! สัมผัสมนต์เสน่ห์จากเพลงประกอบการ์ตูนเจ้าหญิงที่คุณชื่นชอบที่จะทำให้คุณตกหลุมรักซ้ำแล้วซ้ำเล่า การบรรเลงเพลงด้วยวงวินด์ซิมโฟนี ที่จะทำให้ทุกเพลงมีชีวิตชีวา พร้อม การจัดแสงและการแสดงที่น่าตื่นตาตื่นใจ ทำให้คุณรู้สึกเหมือนหลุดเข้าไปในโลกการ์ตูน ห้ามพลาด! ซื้อบัตรและเตรียมพบกับเวทมนตร์แห่งดนตรีที่พร้อมจะพาคุณย้อนกลับไปในช่วงเวลาแห่งความทรงจำอันแสนหวาน
บัตรเข้าชม: 1,000 บาท, 700 บาท, 500 บาท, 300 บาท, 150 บาท, 200 บาท และ 100 บาท !!!สามารถจองซื้อบัตรคอนเสิร์ตผ่านช่องทางออนไลน์ได้จากลิ้งค์ข้างล่างนี้ หรือสามารถ Walk in ซื้อบัตรได้ที่หน้างาน โทรติดต่อสอบถามได้ที่เบอร์ 083-750-7473, 044-465-152
Night Run Phrae 2025 มาวิ่ง Super Fun Run 7K ฉลองสมรสเท่าเทียมกัน เสาร์ 22 กุมภาพันธ์ 2568
Night Run Phrae 2025 มาวิ่ง Super Fun Run 7K ฉลองสมรสเท่าเทียมกัน วันแข่งขัน: เสาร์ 22 กุมภาพันธ์ 2568 สถานที่จัดงาน สวนสุขภาพเฉลิมพระเกียรติรัชกาลที่ 9 อำเภอเมืองแพร่ จังหวัดแพร่ ระยะทางวิ่ง: 7 กิโลเมตร ลงทะเบียนรับเสื้อ รับเหรียญ ไม่มีค่าใช้จ่ายใดๆทั้งสิ้น! รับสมัครจำนวนจำกัด 1000 คน เปิดรับลงทะเบียน วันเสาร์ที่ 15 กุมภาพันธ์ 2568 ตั้งแต่เวลา 15.00 น. เป็นต้นไป ปิดรับสมัครเมื่อได้นักวิ่งครบตามจำนวน ประกาศรายชื่อวันจันทร์ที่ 17 กุมภาพันธ์ 2568 เวลา 14.00 น.
18 ปี อะเมริกัง เพื่อนทุกสถาบัน วันที่ 22 กุมภาพันธ์ 2568
18 ปี อะเมริกัง เพื่อนทุกสถาบัน การรวมตัวของเพื่อนพี่น้องรถคลาสสิกอเมริกันในนาม "อะเมริกัง" เพื่อนทุกสถาบันจากทั่วประเทศ และมิตรสหายรถคลาสสิก 4 ล้อและ 2 ล้อทุกสายพันธุ์ วันที่ 22 กุมภาพันธ์ 2568 ณ ลานเอกชนหน้าเขื่อนขุนด่านปราการชล จ.นครนายก
พบกับกิจกรรมต่าง ๆ มากมาย ดังนี้ - ท่องแดนดิน ถิ่นอินเดียน - ยิปซีราตรี ชีวีแห่งการเดินทาง - ตะเกียงโบราณ ตำนานในอดีต - เครื่องยนต์โบราณ ตำนานคลาสสิก - ร้านอาหาร และ ฟู้ดทรัค - ของที่ระลึก บทบันทึกความสัมพันธ์ ชมการแสดงของศิลปิน EBOLA และเสียงดนตรีจากอุดมสุข / หัวนกเค้า / LOKEE REDLIGHT / BEGIN / อโคจร ใส่เสื้อ 18 ปี อะเมริกัง เดินเข้างานฟรี
เต้ย FRESHTIVAL ครั้งที่ 8 วันเสาร์ที่ 22 กุมภาพันธ์ 2025
เต้ย FRESHTIVAL ครั้งที่ 8 ในวันเสาร์ที่ 22 กุมภาพันธ์ 2025 ณ. ศูนย์ค้าส่งอู้ฟู่ จังหวัด ขอนแก่น งานดนตรีที่จะทำให้คุณสนุกไปจนถึงกระดูกดำ (บางครั้งก็ปวดหลัง ปวดข้อเข่าบ้างนิดๆ) ครั้งนี้มาพร้อมกับ “น้องข้าวโพด” ที่จะชวนทุกคน แต่ง Dresscode “อาชีพในฝัน” ไปลงดันเจี้ยนเก็บเลเวลแห่งความประทับใจไปด้วยกับ 9 ศิลปิน พี สะเดิด DESKTOP ERROR KHUN NARIN THE DARKEST ROMANCE NINEOKMAI WAV feat. BENJAMIN VARNEY COMMON PEOPLE LIKE YOU YOUTHBRUSH CORNBOI
งาน "คน เคลื่อน เมือง" นครพนม 22 กุมภาพันธ์ 2568
งาน "คน เคลื่อน เมือง" นครพนม ในวันที่ 22 กุมภาพันธ์ 2568 ลานหอสมุดแห่งชาติเฉลิมพระเกียรติ สมเด็จพระนางเจ้าสิริกิติ์ พระบรมราชินีนาถนครพนม กิจกรรมขับเคลื่อนพัฒนา เปิดกว้างการเรียนรู้ เพื่อยกระดับเมืองนครพนม สู่การเป็น Learning City กิจกรรมหลากหลาย : ทอล์กสร้างแรงบันดาลใจ, งานศิลปะสุดเก๋, นิทรรศการภาพถ่ายสวยๆ, เวิร์กช้อปศิลปะสร้างสรรค์, หนังสารคดีนอกกระแส, สุนทรียะแห่งกาแฟ และคอนเสิร์ตสุดมันส์จากศิลปินชื่อดัง ศิลปินเบอร์ดัง "รัสมี อีสานโซล", "เดวิด อินธี", "เป้ โฟลค์ข้างบ้าน", "เกมส์ สุจิตรา" และอีกมากมาย จะมาร่วมสร้างความสุข สนุกสนาน แบบที่ไม่เคยมีมาก่อน
นครพนมไนท์รัน ซีซั่น 1 วันที่ 22 กุมภาพันธ์ พ.ศ. 2568
สำนักงานการท่องเที่ยวและกีฬาจังหวัดนครพนม ภายใต้โครงการบูรณาการขับเคลื่อนแผนพัฒนาการกีฬาแห่งชาติสู่การปฏิบัติในระดับพื้นที่ ขอเชิญชวนผู้ที่สนใจเข้าร่วมกิจกรรมวิ่ง นครพนมไนท์รัน ซีซั่น 1
ในวันที่ 22 กุมภาพันธ์ พ.ศ. 2568
ณ ถนนสวรรค์ชายโขง อ.เมืองนครพนม จ.นครพนม
การประกวดคัดเลือก "เยาวชนต้นแบบเก่งและดี TO BE NUMBER ONE IDOL รุ่นที่ 15" ประจำปี 2568 วันที่ 22 กุมภาพันธ์ 2568
โครงการ TO BE NUMBER ONE ในทูลกระหม่อมหญิงอุบลรัตนราชกัญญา สิริวัฒนาพรรณวดี
ขอเชิญชมการประกวดคัดเลือก "เยาวชนต้นแบบเก่งและดี TO BE NUMBER ONE IDOL รุ่นที่ 15" ประจำปี 2568
วันที่ 22 กุมภาพันธ์ 2568 เวลา 11.00 - 15.00 น.
ณ โคราช ฮอลล์ ชั้น 4 เซ็นทรัล โคราช
ฟาร์มสุข ปิ้งย่างสุดพรีเมี่ยม บรรยากาศสุดชิลในสวนออร์แกนิค วันที่ 22 - 23 กุมภาพันธ์ และ 1-2 มีนาคม 2568
" ฟาร์มสุข " มาพร้อมกับปิ้งย่างสุดพรีเมี่ยม บรรยากาศสุดชิลในสวนออร์แกนิค ในราคาที่คุ้มค่าสุดๆ ห้ามพลาด วันที่ 22 - 23 กุมภาพันธ์ และ 1-2 มีนาคม 2568 เท่านั้น ณ โรงแรมสุโขทัย เทรเชอร์ รีสอร์ท แอนด์ สปา Sukhothai Treasure Resort and Spa
สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 4 วันที่ 22 กุมภาพันธ์ – 6 เมษายน 2568
ททท. สำนักงานราชบุรี ร่วมกับ วัดขนอน จังหวัดราชบุรี เชิญนักท่องเที่ยวร่วมกิจกรรม “สืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 4 ” เพื่อร่วมอนุรักษ์และเผยแพร่ศิลปวัฒนธรรมหนังใหญ่วัดขนอนอันเป็นเอกลักษณ์ของจังหวัดราชบุรี พร้อมทั้งส่งเสริมให้นักท่องเที่ยวได้เรียนรู้และเปิดประสบการณ์ใหม่ด้านการท่องเที่ยวจากการทำกิจกรรม DIY. จัดทุกวันเสาร์-อาทิตย์ เวลา 09.00-16.00 น. เริ่มตั้งแต่วันที่ 22 กุมภาพันธ์ – 6 เมษายน 2568 ณ วัดขนอน อ.โพธาราม จ.ราชบุรี
นักท่องเที่ยวสามารถร่วมกิจกรรมได้ฟรี ดังนี้ 1. กิจกรรม DIY กิจกรรมตอกพวงกุญแจหนังใหญ่จำลองและระบายสี 2. ชมการแสดงหนังใหญ่ วันเสาร์ เวลา 10.00 น. วันอาทิตย์ เวลา 11.00 น 3. ชมพิพิธภัณฑ์หนังใหญ่ (เปิดให้เข้าชมทุกวัน)
งานเกษตรลุ่มน้ำโขง ครั้งที่ 26 จ.นครพนม 23 กุมภาพันธ์ - 2 มีนาคม2568
งาน เกษตรลุ่มน้ำโขง ครั้งที่ 26 วันที่ 23 กุมภาพันธ์ - 2 มีนาคม 2568 ณ
คณะเกษตรและเทคโนโลยี มหาวิทยาลัยนครพนม ภายใต้แนวคิด BCG เกษตรพื้นถิ่นสู่ความยั่งยืน - กิจกรรมประกวดการแข่งขัน - นวัตกรรมเกษตรสมัยใหม่ - โซนพืชพันธุ์และไม้ดอกไม้ประดับ - ตลาดสินค้าเกษตร - เสวนาวิชาการด้านการเกษตร
ประจำปีเจดีย์พุทธคยา(จำลอง) ประจำปี 2568 วันที่ 23 ก.พ. - 3 มี.ค. 2568
ททท. กาญจนบุรี ขอเชิญไปเที่ยว ไหว้พระ ขอพร ในงานประจำปีเจดีย์พุทธคยา(จำลอง) ประจำปี 2568 วันที่ 23 ก.พ. - 3 มี.ค. 2568 พิธีเจริญพระพุทธมนต์ตลอด 9 คืน เริ่มเวลา 20.00 น. เป็นต้นไป 4 มี.ค. งานบำเพ็ญกุศล 114 ปีชาตกาลพระราชอุดมมงคล (หลวงพ่ออุตตมะ) 4-8 มี.ค. งานมหรสพสมโภชน์หลวงพ่ออุตตมะฯ ณ เจดีย์พุทธคยา (จำลอง) วัดวังก์วิเวการาม อ.สังขละบุรี จ.กาญจนบุรี ชมความสวยงามของไฟประดับกว่า 25,000 ดวง อลังการที่สุดของปี จัดแสดงตั้งแต่วันที่ 23 ก.พ. - 8 มี.ค. 2568 เวลา 18.00 - 23.59 น. Cr : เพจชุมชนมอญ บ้านวังกะ อำเภอสังขละบุรี จังหวัดกาญจนบุรี และเพจที่นี่ วัดวังก์ฯ สังขละบุรี กาญจนบุรี
"สองล้อ สองน่อง ท่องสองแผ่นดิน" ปั่นข้ามโขง เชื่อมโยงสองแผ่นดิน วันอาทิตย์ที่ 23 กุมภาพันธ์ 2568
"สองล้อ สองน่อง ท่องสองแผ่นดิน" ปั่นข้ามโขง เชื่อมโยงสองแผ่นดิน ขอเชิญนักปั่นทุกท่าน ร่วมสัมผัสประสบการณ์สุดพิเศษในกิจกรรม "2 สองล้อ สองน่อง ท่องสองแผ่นดิน (มุกดาหาร - สะหวันนะเขต) ครั้งที่ 11" ระยะทาง 60 กิโลเมตร (ไม่มีการแข่งขัน) วันอาทิตย์ที่ 23 กุมภาพันธ์ 2568 ณ ศูนย์การค้าโรบินสัน ไลฟ์สไตล์ จังหวัดมุกดาหาร สัมผัสธรรมชาติที่สวยงาม และวัฒนธรรมที่หลากหลาย และวิถีชีวิตที่ไม่เหมือนใคร ของสองฝั่งโขง
สิ่งที่จะได้รับ : เสื้อที่ระลึก ฟรีค่าผ่านแดน (ในกรณีคนไทย) อาหารเช้า อาหารกลางวัน เครื่องดื่ม มาแชล และ เจ้าหน้าที่อำนวยความสะดวกตลอดเส้นทาง
งานนี้จัดโดยสมาคมอุตสาหกรรมท่องเที่ยวจังหวัดมุกดาหาร ซึ่งยืนยันความพร้อมในการจัดงานอย่างยิ่งใหญ่ ขอเชิญทุกท่านมาร่วมสนุกและสัมผัสประสบการณ์สุดพิเศษนี้ด้วยกัน
เดิน-วิ่งการกุศล ท่าไม้มินิมาราธอน ครั้งที่ 1 วันอาทิตย์ ที่ 23 กุมภาพันธ์ 2568
ขอเชิญชวนทุกท่านร่วมกิจกรรม "เดิน-วิ่งการกุศล ท่าไม้มินิมาราธอน ครั้งที่ 1" วันอาทิตย์ ที่ 23 กุมภาพันธ์ 2568 ณ วัดท่าไม้ อำเภอกระทุ่มแบน จังหวัดสมุทรสาคร สอบถามเพิ่มเติมได้ที่ วัดท่าไม้ โทร. 09 3026 8795, 06 2254 7565 หรือ Facebook : วัดท่าไม้ จังหวัดสมุทรสาคร
วิ่งรักษ์ไต เชียงม่วน 2025 วันที่ 23 กุมภาพันธ์ 2568
กองทุนพัฒนาคุณภาพชีวิตผู้ป่วยโรคไต และผู้ป่วยเรื้อรัง อำเภอเชียงม่วน จัดกิจกรรม “วิ่งรักษ์ไต เชียงม่วน 2025“ ขอเชิญชวนทุกท่าน สัมผัสกับธรรมชาติอันงดงามในพื้นที่สวนสาธารณะฝั่งต้าไชยสถาน อำเภอเชียงม่วน จังหวัดพะเยา และร่วมทำบุญช่วยเหลือผู้ป่วยไตวายและผู้ป่วยเรื้อรัง ในพื้นที่ อำเภอเชียงม่วน วันอาทิตย์ที่ 23 กุมภาพันธ์ 2568
รับอุปกรณ์และแข่งขัน 22 กุมภาพันธ์ 2568 สอบถามข้อมูลเพิ่มเติม
fanpage ** รายได้จากการจัดกิจกรรม นำไปสมทบกองทุนช่วยเหลือผู้ป่วยภาวะไตวาย และผู้ป่วยเรื้อรัง ตลอดจนสนับสนุนการปรับปรุงอาคารฟอกใตโรงพยาบาลเชียงม่วน
KKU Race to love by omi 23 กุมภาพันธ์ 2568
KKU Race to love by omi 23 กุมภาพันธ์ 2568 คุ้มสีฐาน มหาวิทยาลัยขอนแก่น งานวิ่ง ภายใต้ธีม “Race to Love” แลนหารัก มักไผกะจ้วด เน้นความสนุกสนานและการมีส่วนร่วมของทุกคน
งานพระธาตุรวงข้าว เมืองหนองคาย อำเภอสระใคร วันที่ 23 กุมภาพันธ์ ถึง 1 มีนาคม 2568
เที่ยวงานพระธาตุรวงข้าว เมืองหนองคาย อำเภอสระใคร มหกรรมข้าวพันธุ์ดีฉลองครบรอบ 31 ปี และของดีอำเภอสระใครประจำปี 2568 วันที่ 23 กุมภาพันธ์ - 1 มีนาคม 2568 ณ สนามหน้าที่ว่าการอำเภอสระใคร จังหวัดหนองคาย
กิจกรรมภายในงานประกอบด้วย - การประกวดธิดาข้าวหอม - การประกวดธิดาจำแลง - การประกวดร้องเพลงไทยลูกทุ่ง - ชมการเเสดงศิลปะวัฒนธรรม - ชมมหกรรมหุ่นจักสานไม้ไผ่
บุญฟังเทศน์มหาชาติประจำปี 2568 ณ วัดจอมมณี วันที่ 23 - 24 กุมภาพันธ์ 2568
เชิญร่วมบุญฟังเทศน์มหาชาติประจำปี 2568 ณ วัดจอมมณี วันที่ 23 - 24 กุมภาพันธ์ 2568 วันอาทิตย์ ที่ 23 กุมภาพันธ์: เวลา 14.45 น.: ร่วมพิธีแห่พระเวสสันดรเข้าเมือง ณ บริเวณหอเจ้าพ่อบัวลอย ซอย 6 จอมมณี เวลา 16.00 น.: ฟังพระสงฆ์เจริญพระพุทธมนต์ และเทศน์มาลัยหมื่น มาลัยแสน กลางคืนสนุกสนาน: ชมการแสดงหมอลำจากคณะเสียงอีสาน นกน้อย อุไรพร ตลอดคืน! วันจันทร์ ที่ 24 กุมภาพันธ์: เวลา 04.00 น.: ฟังเทศน์สังกาซ เทศน์มหาชาติ ถวายกัณฑ์สมโภชตลอดวัน ขอเชิญสาธุชนทุกท่านมาร่วมบุญ และสัมผัสบรรยากาศอันอบอุ่นของชุมชนเรา
การแสดงโขน ณ สวรรค์บนดินกลางหุบเขา ที่ หอมนสิการ 23 กุมภาพันธ์ 2568
ชมฟรี!! การแสดงโขน ณ สวรรค์บนดินกลางหุบเขา ที่...หอมนสิการ ขอเชิญชมการแสดงโขน 3 ชุด เรื่อง "หนุมานจับนางสุพรรณมัจฉา รำแม่บทเล็ก และเชิดฉิ่งเบญกาย" แสดงโดย นักเรียนโรงเรียนเทพศิรินทร์พุแค สระบุรี .ในวันอาทิตย์ที่ 23 กุมภาพันธ์ 2568 เวลา 11.00 น. ที่ หอมนสิการ แสดงรอบเดียวเท่านั้น! จับจองที่นั่งได้ที่ อาคารรับรองพิเศษ วางแผนการเดินทางกันได้แล้ววันนี้ หอมนสิการไม่ไกลจากกรุงเทพฯ เดินทางเพียง 1 ชั่วโมงครึ่งเท่านั้น
หอมนสิการเปิดบริการ อังคาร - ศุกร์ : 10.00 - 17.00 น. เสาร์ - อาทิตย์ : 09.30 - 18.00 น. (หยุดทุกวันจันทร์) เปิดให้เข้าชมกรุ๊ปสุดท้ายของแต่ละวัน ก่อนเวลาปิดทำการ 30 นาที กรุณาแต่งกายสุภาพ ไม่ใส่กางเกง/กระโปรงสั้น และเสื้อไม่มีแขน (ทางหอมนสิการมีบริการชุดให้เปลี่ยน) หอมนสิการ 86/3 หมู่ 10 ต.สองคอน อ.แก่งคอย จ.สระบุรี 18110
นมัสการพระพุทธบาท สระบุรี 24 กุมภาพันธ์ - 4 มีนาคม 2568
นมัสการพระพุทธบาท สระบุรี 24 กุมภาพันธ์ - 4 มีนาคม 2568 หมายกำหนดการ ขบวนนมัสการพระพุทธบาท สระบุรี
• 24 ก.พ.68 ออกเดินทางจากมูลนิธิฯ แวะตามจุดต่างๆ
• 25 ก.พ.68 ช่วงเช้าเข้าพื้นที่กรุงเทพ เพื่อเดินทางไปยังโรงงานพรทิพย์อุตสาหกรรมแต่งแร่ พุแค จังหวัดสระบุรี (ระหว่างเส้นทางไปโรงงานพรทิพย์ฯ ขบวนจะแวะตามจุดต่างๆ) • 26 ก.พ.68 ตั้งปรัมพิธีที่วัดพระพุทธบาทสระบุรี
• 27 ก.พ.68 ขบวนเกี้ยวแห่องค์พระจากโรงงานพรทิพย์อุตสาหกรรมแต่งแร่ เข้าประทับ ณ วัดพระพุทธบาทสระบุรี
• 28 ก.พ.68 ขบวนนมัสการพระพุทธบาทสระบุรี ออกเดินทางจากวัดพระพุทธบาทเข้ามูลนิธิป่อเต็กตึ๊ง จุดพลับพลาไชย กรุงเทพฯ (เกี้ยวพระจะประทับอยู่ที่มูลนิธิป่อเต็กตึ๊ง 3 วัน )
• 3 มี.ค. 68 ขบวนนมัสการพระพุทธบาท สระบุรี ออกจากมูลนิธิป่อเต็กตึ๊ง จุดพลับพลาไชย กรุงเทพฯ เพื่อเดินทางกลับหาดใหญ่ และจะแวะตามจุดต่างๆ
• 4 มี.ค.68 ขบวนนมัสการพระพุทธบาท สระบุรี เดินทางถึงมูลนิธิฯ โดยสวัสดิภาพ
มูลนิธิมิตรภาพสามัคคี(ท่งเซียเซี่ยงตึ๊ง) หาดใหญ่ สายด่วน 1163
เกษตรอินทรีย์ วิถีอีสานกลาง Central Esan Organic Natural & BCG Fair 2025 วันที่ 24 กุมภาพันธ์ - 2 มีนาคม 2568
เกษตรอินทรีย์ วิถีอีสานกลาง : Central Esan Organic Natural & BCG Fair 2025 ระหว่างวันที่ 24 กุมภาพันธ์ - 2 มีนาคม 2568 ณ ลานโปรโมชั่น ชั้น 1 ศูนย์การค้าเซ็นทรัลขอนแก่น จัดโดย จังหวัดร้อยเอ็ด โดยสํานักงานพาณิชย์จังหวัดร้อยเอ็ด และกลุ่มจังหวัดอีสานกลาง ชิม ช้อป สินค้ากว่า 40 ร้าน พร้อมกิจกรรมเจรจาจับคู่ธุรกิจการค้าแบบ Onsite และออนไลน์ (Online Business Matching) กับผู้ประกอบการ สนุกกับความบันเทิงตลอดงานกับการแสดงจากศิลปิน ยอด High view ????
ฉลองเทศกาลตรุษจีนอุดรธานี 2568
ฉลองเทศกาลตรุษจีนอุดรธานี 2568
เทศกาลตรุษจีนอุดร ขอพรองค์ ปู่-ย่า" ปี 2568 24 - 27 มกราคม 2568 ตั้งแต่เวลา 18.00 น. เป็นต้นไป ณ ศาลเจ้าปู่-ย่า อุดรธานี กิจกรรมไฮไลท์ ✔️ 24 ม.ค. 68 พิธีเปิดงานสุดยิ่งใหญ่ ชมการแสดง 4 คณะและบูธกิจกรรม ลุ้นโชคใหญ่ทุกวัน (มอเตอร์ไซค์ ทองคำ ฯลฯ) ✔️ 25 ม.ค. 68 การประกวด Cover Dance การแสดงคณะสิงโต ✔️ 26 ม.ค. 68 การประกวดหนูน้อยตรุษจีน การแสดงคณะมังกรทอง ✔️ 27 ม.ค. 68 การประกวดร้องเพลง การแสดงคณะเอ็งกอ ติดตามข้อมูลเพิ่มเติม
puyaudon
เทศกาลตรุษจีนอุดรธานี (ถนนอาหาร) ปี 2568 29 - 31 มกราคม 2568 เวลา 17.00 น. เป็นต้นไป ณ บริเวณถนนประจักษ์ (แยกวงเวียนหอนาฬิกาถึงบริวณทุ่งศรีเมือง) จังหวัดอุดรธานี
กิจกรรมดำน้ำตื้น (Snorkeling) บริเวณเกาะจาน-เกาะท้ายทรีย์ ตั้งแต่วันที่ 24 กุมภาพันธ์ 2568 เป็นต้นไป
อุทยานแห่งชาติหาดวนกร ประกาศเปิดกิจกรรมดำน้ำตื้น (Snorkeling) บริเวณเกาะจาน-เกาะท้ายทรีย์ ตั้งแต่วันที่ 24 กุมภาพันธ์ 2568 เป็นต้นไป ติดต่อสอบถาม 063 142 1121 อุทยานแห่งชาติหาดวนกร จ.ประจวบคีรีขันธ์
งานเกษตรแฟร์ นครชัยศรี 25 กุมภาพันธ์ - 8 มีนาคม 2568
งานเกษตรแฟร์ อำเภอนครชัยศรี จังหวัดนครปฐม วันที่ 25 กุมภาพันธ์ - 8 มีนาคม 2568 ณ บริเวณข้างโรงงานน้ำมันพืช ตำบลไทยาวาส อำเภอนครชัยศรี จังหวัดนครปฐม ชมการแสดงดนตรีวงดัง มากมาย เช่น คาราบาว พลอย เดอะวอยซ์ & วงสไลด์เด้อ วาไรตี้ เฟิร์ส พรชิตา และอีกมาก
TATTOO FEST | ING GHOST 2nd เทศกาลสักสุดยิ่งใหญ่ ที่ Central Samui 25-27 กุมภาพันธ์ 2025
TATTOO FEST | ING GHOST 2nd – สุดยอดเทศกาลสักแห่งปี เทศกาลสักสุดยิ่งใหญ่ ที่ Central Samui! ช่างสักระดับโลกกว่า 100 คน จากทั่วทุกมุมโลก โชว์สักสด & กิจกรรมสุดเอ็กซ์คลูซีฟ ตลอดทั้งงาน! พบปะศิลปินดัง สัมผัสลวดลายสุดยูนีค และดื่มด่ำกับวัฒนธรรมแห่งศิลปะบนเรือนร่างในบรรยากาศสุดชิลของสมุย! วันที่: 25-27 กุมภาพันธ์ 2025 เวลา: 10:00 น. – 22:00 น. สถานที่: ลานโปรโมชั่น เซ็นทรัล สมุย
งาน TSI Food Truck FAIR 2025 ม.เกษตร กำแพงแสน 25 กุมภาพันธ์ 2568
งาน TSI Food Truck FAIR 2025 ในบรรยากาศครึกครื้นที่ ตึก 3 ชั้น คณะอุตสาหกรรมบริการ มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสน จังหวัดนครปฐม วันที่ 25 กุมภาพันธ์ 2568 เวลา 08.00 - 16.00 น. ขอเชิญสายกิน นักชิม นักศึกษา บุคลากร และนักท่องเที่ยวทุกท่าน มาสัมผัสประสบการณ์สุดฟินกับขบวน Food Truck สุดชิค และเต็มไปด้วยเหล่าวัยรุ่นมากมาย อิ่มอร่อย กับเมนูอาหารสุดครีเอทีฟจากรถ Food Truck มากมาย! เติมความสดชื่นด้วยเครื่องดื่ม จากร้านเด็ด! ได้รับความรู้เรื่องราวเกี่ยวกับธุรกิจการท่องเที่ยว จากอาจารย์คณะอุตสาหกรรมบริการ รับฟังเสวนาสาระดีๆ บอกต่อ - หัวข้อ Food Truck ชวนกิน ฟินเที่ยว ไทยแลนด์ โดยวิทยากร อ.ดร.ศุศราภรณ์ แต่งตั้งลำ - หัวข้อ Food Truck เงินติดล้อ โดยวิทยากร อ.ชนม์ชนก ชิตประเสริฐ เพลิดเพลินกับดนตรีสด จากนักศึกษามหาวิทยาลัยเกษตรศาสตร์ฯ
งานเทศกาล "มหัศจรรย์กาฬสินธุ์ เมืองล้านธุง" ทะเลธุงอีสานสุดยิ่งใหญ่ ทั่วเมืองกาฬสินธุ์ เช็คอินให้โลกสะเทือนกับประวัติศาสตร์หน้าใหม่ 25 - 26 กุมภาพันธ์ 2568
ขอเชิญเที่ยวงานเทศกาล "มหัศจรรย์กาฬสินธุ์ เมืองล้านธุง" ทะเลธุงอีสานสุดยิ่งใหญ่ ทั่วเมืองกาฬสินธุ์ เช็คอินให้โลกสะเทือนกับประวัติศาสตร์หน้าใหม่ ระหว่างวันที่ 25 - 26 กุมภาพันธ์ 2568 พิกัด อนุสาวรีย์พระยาชัยสุนทร | ศูนย์ราชการจังหวัดกาฬสินธุ์ | วงเวียนโปงลาง | หอศิลป์กาฬสินธุ์ | วัดใต้โพธิ์ค้ำ
พบกับกิจกรรม สูตรขวัญบ้านขวัญเมืองและบายศรีธุง ตระการตากับขบวนแห่เจ้าเมืองกาฬสินธุ์ การแสดงแสง สี เสียง "เล่าขานตำนานบรรพชนคนกาฬสินธุ์" เช็คอินลานวัฒนธรรม ทะเทธุงอีสาน 5 จุด รอบเมืองกาฬสินธุ์ และร่วมฟ้อนรำบวงสรวงดวงวิญญาณพระยาชัยสุนทร มาร่วมสร้างภาพประวัติศาสตร์ ความวิจิตรงดงาม อัตลักษณ์ของหมู่เฮาชาวกาฬสินธุ์ไปพร้อมกัน
ละครเวที สถาปัตย์ มข. “มาเด้อ ขวัญเอ้ย” 25 กุมภาพันธ์ - 1 มีนาคม 2568
ละครเวทีสุดสร้างสรรค์จากสถาปัตย์ มข. “มาเด้อ ขวัญเอ้ย” 25 กุมภาพันธ์ - 1 มีนาคม 2568 แสดงที่ คณะสถาปัตยกรรมศาสตร์ มข. ละครเวทีสนุกสุดหลอนปนฮา ที่จะทำให้คุณต้องทึ่งและหัวเราะไปพร้อมกัน! บัตรราคา: 179 บาท
เทศกาลอินทผาลัม วันที่ 25 -28 กุมภาพันธ์ 2568
กิจกรรมส่งเสริมการท่องเที่ยวด้วยวิถีถิ่น เทศกาลอินทผาลัม วันที่ 25 -28 กุมภาพันธ์ 68 เวลา 15.30 -21.30 น. ณ หลาดเกตเวย์ไนท์ ติดตลาดนัดดุสนลานปูนปั้น
ชมการแสดงอนาชีด แอกอินทผาล้มฟรีทุกวัน โชว์อ่านอัลกุรอ่านจากนักเรียนสถาบันฮาฟิส Special Talk โดยพบกับนักบรรยายธรรรมชื่อดัง -อีหม่ามอาหลี หมูดงาม 25 ก.พ.68 ประตูสู่รอมฏอน โปรโมชั่นสู่สวรรค์ -อีหม่ามฮาสัน พรัดขำ 26 ก.พ.68 การตื่นธรรมกับอิสลาม -อาจารย์นาวาวี หลังปูเต๊ะ 27 ก.พ.68 รอมฏอนมาเราดีใจ -อาจารย์อาลาวี หมัดหมัน 28 ก.พ.68 มุสลิมะห์ที่รัก ห่างฟิตนะห์ กิจกรรม Islamic art เสริมสร้างกิจกรรมสำหรับเด็กๆ ฟรีการออกบูธจำหน่ายอาหาร เสื้อผ้า และสินค้าเบ็ดเตล็ดอินทผาลัม จัดโดย อบจ.สตูล และคณะกรรมการตลาดเกตเวยไนท์
25 กุมภาพันธ์ 2568 เชิญชวนนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ฟรี ที่ มหาวิทยาลัยเทคโนโลยีมหานคร
25 กุมภาพันธ์ 2568 ขอเชิญชวนนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ที่ มหาวิทยาลัยเทคโนโลยีมหานคร “ฟรี” เวลา 11:00-15:00 น. พร้อมสนุกกับกิจกรรม และ รับของที่ระลึก ฟรี มากมาย
กิจกรรมภายในงาน เปิดโลกโครงงานมหานคร ครั้งที่ 3 โชว์ไอเดียเจ๋ง ๆ จากโครงงานนักศึกษากว่า 100 โครงงาน (MiiX ชั้น5) ผลงานสุดครีเอทีฟ จากนักศึกษา Multimedia (Mii ชั้น1) ช้อปสินค้าสุดเก๋ จากน้อง ๆ บริหารธุรกิจ (MiiX ชั้น5) บริการตรวจสุขภาพ & ฉีดวัคซีนสัตว์เลี้ยง (BWIN) แมวเหมียวสุดปัง กับการแข่งขันแมวสุขภาพดี, แข่งกินขนมแมวเลีย & การประกวดแฟนซีคู่ซี้นายและทาส (BWIN)
นวนคร FESTIVAL 2025 วันที่ 25 กุมภาพันธ์ - 9 มีนาคม 2568
งานเมืองแห่งความรัก นวนคร FESTIVAL 2025 วันที่ 25 กุมภาพันธ์ - 9 มีนาคม 2568 ณ บริเวณลานข้างปั๊ม ปตท. นิคมอุตสาหกรรมนวนคร อำเภอคลองหลวง จังหวัดปทุมธานี
Phayao Hill Tribe Coffee Hub ครั้งที่ 3 วันที่ 26 กุมภาพันธ์ 2568
จิบกาแฟแลภู สุขทันทีที่ผาแดง "Winter of Love กลับมาอีกครั้งกับ Phayao Hill Tribe Coffee Hub ครั้งที่ 3 26 กุมภาพันธ์ 2568 เริ่ม 08.00 น. เป็นต้นไป สถานที่จัดกิจกรรม : ลานเอนกประสงค์บ้านผาแดง ต.ศรีถ้อย อ.แม่ใจ จ.พะเยา
งานที่จะพาคุณไปสัมผัสรสชาติกาแฟสด พร้อมกิจกรรมมากมายให้ได้เพลิดเพลิน กิจกรรม Work Shop ผ้าปักเมี่ยนและกาแฟพะเยา นั่งฟังดนตรีสด ในโซนกิจกรรม MUSIC LOVER ชิมกาแฟและชา ในโซน Coffee & Tea Testing กิจกรรมทดลองดริปกาแฟและเรียนรู้วิถีกาแฟของราษฎรบนพื้นที่สูง เลือกซื้อผลิตภัณฑ์และของที่ระลึกจากราษฎรบนพื้นที่สูง ทั้งชา กาแฟสด และอาหารชาติพันธ์ สัมผัสวัฒนธรรมชนเผ่าเมี่ยน พร้อมชมการแสดงพื้นเมือง
ใครที่ชอบกาแฟและบรรยากาศดี ๆ มาพบกันที่ บ้านผาแดง… สอบถามข้อมูลเพิ่มเติม • ศูนย์พัฒนาราษฎรบนพื้นที่สูงจังหวัดพะเยา โทร 095-293-9546 • ททท. สำนักงานเชียงราย โทร 053-744-6745, 053-717-433 | E-mail: tatchrai@gmail.com • ศูนย์ประสานงานการท่องเที่ยวจังหวัดพะเยา ททท. โทร 054-430-400 | E-mail: tatphayao@gmail.com
เทศกาลอาหารทะเล จังหวัดสมุทรสาคร ครั้งที่ 22 วันที่ 26 กุมภาพันธ์ - 3 มีนาคม 2568
เทศกาลอาหารทะเล จังหวัดสมุทรสาคร ครั้งที่ 22
วันที่ 26 กุมภาพันธ์ - 3 มีนาคม 2568
ณ ศูนย์การค้าแลนด์มาร์ค มหาชัย
เทศกาลว่าวนานาชาติ บนชายหาดพัทยา Pattaya International Kite On The Beach 2025 วันที่ 26 ก.พ. - 2 มี.ค. 68
1ปีมีครั้ง เทศกาลว่าวนานาชาติ บนชายหาดพัทยา Pattaya International Kite On The Beach 2025 โดยศูนย์การค้าเซ็นทรัล พัทยา พร้อมหรือยัง มาถ่ายรูปสวยจึ้ง กับว่าวเต็มท้องฟ้าตระการตา พบกับไฮไลท์สุดพิเศษพบกับว่าวน้อง Snoopy 26 ก.พ. - 2 มี.ค. 68 เวลา 11.00 น. - 18.00 น. การเเสดงว่าว เริ่ม 16.00 น. พบกับการแสดง Sport Kite จากประเทศไต้หวัน บนชายหาด หน้าศูนย์การค้าเซ็นทรัล พัทยา
Pattaya Colour Fun Beach Run 2023 อาทิตย์ที่ 26 กุมภาพันธ์ 2566
Pattaya Colour Fun Beach Run 2023
อาทิตย์ที่ 26 กุมภาพันธ์ 2566
ณ ชายหาดพัทยากลาง ระยะทาง / ค่าสมัคร
2-4Km. / 500 บาท
งานเดินวิ่งการกุศลที่สนุกไปกับการสาดสีบนชายหาด
งาน "นุ่งซิ่น กินอั่วพริกเยือนถิ่นอีติ่งลาวแง้ว" 26 กุมภาพันธ์ - 4 มีนาคม 2568
งาน "นุ่งซิ่น กินอั่วพริกเยือนถิ่นอีติ่งลาวแง้ว" ตามโครงการอนุรักษ์สืบสานวัฒนธรรมลาวแง้ว ตำบลหนองแก เพื่ออนุรักษ์สืบสานส่งเสริมวัฒนธรรมอันดีงามของท้องถิ่น ระหว่างวันที่ 26 กุมภาพันธ์ - 4 มีนาคม 2568 บริเวณวัดหนองจิก ต.หนองแก อ.พระพุทธบาท จ.สระบุรี
กิจกรรมภายในงาน - การแข่งขันประกวดทำอั่วพริก - การแสดงวิถีชีวิตของกลุ่มชาติพันธุ์ลาวแง้ว - ชวนชิมอาหารลาวแง้ว สุดแสนอร่อย - สินค้า OTOP ผลิตภัณฑ์ชุมชน - สนุกกับดนตรีและนักร้องดัง (ชมฟรี)กิจกรรมการอบรมเชิงปฏิบัติการสร้างสรรค์ผลงานเครื่องเคลือบดินเผาระดับนานาชาติ วันที่ 26 กุมภาพันธ์ - 5 มีนาคม 2568
Lampang: Different shades of clay international ceramic workshop 2025 กิจกรรมการอบรมเชิงปฏิบัติการสร้างสรรค์ผลงานเครื่องเคลือบดินเผาระดับนานาชาติ วันที่ 26 กุมภาพันธ์ - 5 มีนาคม 2568 ณ หอศิลป์เสรี ต.ลำปางหลวง อ.เกาะคา จ.ลำปาง จัดโดย สำนักศิลปะและวัฒนธรรม มหาวิทยาลัยราชภัฏลำปาง
กิจกรรมที่จะมีงานรวมศิลปินระดับชาติและระดับนานาชาติในการสร้างสรรค์ผลงานด้านเครื่องเคลือบดินเผา กว่า 16 ประเทศ ภายใต้โครงการเพิ่มศักยภาพชุมชน Softpower บนฐานอัตลักษณ์ศิลปวัฒนธรรมท้องถิ่น
งาน “วิสาหกิจชุมชนนนทบุรี 2025” วันที่ 26 กุมภาพันธ์ - 2 มีนาคม 2568
งาน “วิสาหกิจชุมชนนนทบุรี 2025” ระหว่างวันที่ 26 กุมภาพันธ์ - 2 มีนาคม 2568 ณ ศูนย์การค้าเซ็นทรัล เวสต์เกต ตำบลเสาธงหิน อำเภอบางใหญ่ จังหวัดนนทบุรี
ร่วมอุดหนุนสินค้าจากวิสาหกิจชุมชนจังหวัดนนทบุรี
งานประจำปีแห่เจ้าพ่อเขาตก ประจำปี2568 ระหว่างวันที่ 26 กพ.- 1 มีค.68
ศาลเจ้าพ่อเขาตก โดยมูลนิธิเขาตกพระพุทธบาท สระบุรี ขอเชิญศิษย์ยานุศิษย์ลูกเจ้าพ่อเขาตกและสาธุชนผู้มีจิต ศรัทธาทุกท่าน ร่วมงานประเพณีแห่เจ้าพ่อเขาตก มีงิ้วสมโภช 4 วัน 4 คืน
เริ่มงาน 26 ก.พ.2568 เจ้าพ่อประทับร่างทรง เจ้าพ่อปีนบันไดมีด
กลางคืน 27 ก.พ.2568 ชมการแสดงหน้าศาลเจ้าพ่อเขาตก พิธีเปิดการแสดงโดยคณะล่อโก้วและดุริยางค์จีน ชมการแสดงมังกรทองลูกเจ้าพ่อเขาตก คณะสิงโต พิธีลุยไฟ อันศักดิ์สิทธิ์ ปีนบันไดมีด และวันที่ 28 กุมภาพันธ์ ชมริ้วขบวนแห่เจ้าพ่อเขาตก รอบอำเภอ พระพุทธบาท ขอเชิญศิษยานุศิษย์ชาวพระพุทธบาท ตั้งโต๊ะรับองค์เจ้าพ่อเขาตกและสิ่งศักดิ์สิทธิ์ทุกๆพระองค์ เพื่อความเป็นสิริมงคลแก่ท่านและครอบครัว
กลางวัน 28 ก.พ.2568 ชมขบวนแห่รอบตลาด พระพุทธบาท ชมการเล่นเกี้ยว การแสดงมังกรทองลูกเจ้าพ่อ ปีนเสาหน้าศาล
เสาร์ที่ 1 มี.ค. 2568 ชมงิ้วสมโภช 1 คืน เช่าวัตถุมงคล เครื่องรางที่ผ่านพิธีลุยไฟและพิธีพุทธาภิเษกแล้ว
ขอเชิญชวน ศิษยานุศิษย์ลูกเจ้าพ่อเขาตก และประชาชนทั่วไปเข้าร่วมสักการะเจ้าพ่อเขาตกและเทพศักดิ์สิทธิ์ทุกพระองค์ในศาลเจ้าพ่อเขาตก และร่วมชมกิจกรรมต่างๆในงานประเพณีแห่เจ้าพ่อเขาตก
งานสักการะใส่ขันดอก "พระรอดหลวง วัดมหาวัน ลำพูน" ประจำปี 2568 ไหว้พระขอพร เทศกาลตรุษจีน 27 ม.ค. - 2 ก.พ. 2568


ททท.สำนักงานลำปาง ขอเชิญร่วมงานสักการะใส่ขันดอก "พระรอดหลวง วัดมหาวัน ลำพูน" ประจำปี 2568 ไหว้พระขอพร เทศกาลตรุษจีน 27 ม.ค. - 2 ก.พ. 2568 ณ วัดมหาวัน อ.เมือง จ.ลำพูน พบกับ กิจกรรม "ใส่ขันดอกพระรอดหลวง คู่เมืองลำพูน 1,400 ปี" เพียงบูชาชุดขันดอก 1 ชุด หนึ่งใบแดง รับชุดไหว้เสริมสิริมงคลจำนวน 10 ชุดพร้อมเทียนเสริมชะตา นำไปไหว้ตามจุดต่างๆที่กำหนด 10 จุด ตามภาพ เสริมความเป็นสิริมงคลดังนี้ ????จุดที่ 1 > บนวิหารหน้าพระรอดหลวง ????จุดที่ 2 > พระรอดจำลองหน้าวิหาร ????จุดที่ 3 > เจ้าแม่จามเทวี หน้าวิหาร ????จุดที่ 4 > พระอุปคุต ????จุดที่ 5 > พระเจดีย์หลังวิหาร ทิศเหนือ ????จุดที่ 6 > พระเจดีย์หลังวิหาร ทิศตะวันตก ????จุดที่ 7 > พระเจดีย์หลังวิหาร ทิศใต้ ????จุดที่ 8 > พระพันปี (บริเวณหอระฆัง) ????จุดที่ 9 > ครูบาศรีวิชัย ????จุดที่ 10 > พระฤาษี นารอด ในวันนี้ เวลา 15.00 น. จะมีพิธีแห่ขบวนอัญชิญพระรอดหลวงคุ้มเมือง พระฤาษีนารอด แห่อัญเชิญองค์พระพุทธรูปหยก ไปรอลเมืองลำพูนอีกด้วย นอกจากนี้ภายในงานยังมีการแสดงดนตรี รื่นเริง กิจกรรมพิธีทางศาสนา และการออกร้านขายของอีกมากมายให้นักท่องเที่ยวได้มาสัมผัส
งานมหกรรมอาหารปลอดภัย ครั้งที่ 18 Food Festival 2025 วันที่ 27 กุมภาพันธ์ – 3 มีนาคม 2568
งานมหกรรมอาหารปลอดภัย ครั้งที่ 18 Food Festival 2025 Good Food Good Health Good Music ระหว่างวันที่ 27 กุมภาพันธ์ – 3 มีนาคม 2568 ณ สวนศรีภูวนาถ ตำบลวิชิต พบกับร้านอาหาร เครื่องดื่ม Food Truck ในบรรยากาศสบายๆ พร้อมเสียงเพลงเพราะๆ ที่นั่งพักผ่อนทานอาหารทั่วทั้งงาน พิเศษในวันที่ 28 กุมภาพันธ์ ชิมฟรี หมี่ผัดอายุยืน พร้อมสนุกสนานไปกับฟรีคอนเสิร์ตของศิลปินชื่อดังมากมาย วันที่ 27 กุมภาพันธ์ พบกับวงพัทลุง วันที่ 28 กุมภาพันธ์ พบกับ ลีโอ ไมค์หมดหนี้ และ วงซุปเปอร์แดนซ์ วันที่ 1 มีนาคม พบกับต้นข้าว อาร์สยาม บนเวทีกลางสวนศรีภูวนาถ
งานทุ่งใหญ่เกษตรแฟร์ ประจำปี 2568 อ.ทุ่งใหญ่ จ.นครศรีธรรมราช 28 กุมภาพันธ์ – 9 มีนาคม 2568
งานทุ่งใหญ่เกษตรแฟร์ ประจำปี 2568 ภายใต้แนวคิด “นวัตกรรมเกษตร อาหาร สร้างสุข” ระหว่างวันที่ 28 กุมภาพันธ์ – 9 มีนาคม 2568 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลศรีวิชัย วิทยาเขตนครศรีธรรมราช อ.ทุ่งใหญ่ จ.นครศรีธรรมราช ปีนี้กิจกรรมมากมายจริงๆ
เทศกาลหนังกลางแปลง2 วันที่ 28 กุมภาพันธ์ - 3 มีนาคม 2568 ณ ตลาดเนินอุไร ระยอง
เทศกาลหนังกลางแปลง2 วันที่ 28 กุมภาพันธ์ - 3 มีนาคม 2568 ณ ตลาดเนินอุไร ข้างสวนศรีเมือง ระยอง
ย้อนวันวานแห่งความสุข กับการดูหนังจอใหญ่ยักษ์สูง 35 เมตร เทียบเท่าตึก 4 ชั้น จากวัฒนธรรมการชมภาพยนตร์ของวัยรุ่น Y2K สู่ยุค 2025 ที่เต็มไปด้วยความสนุกและสีสันของกิจกรรมสุดคลาสสิกอาทิ สาวน้อย-หนุ่มน้อยตกน้ำ ยิงปืนจุกน้ำปลา ช้อนปลาสวยงาม นั่งม้าหมุน รถบังคับวิทยุ ปลากระป๋องนม อิ่มอร่อยกับของกินในวันวาน โรตีหยดเหรียญ น้ำตาลปั้น หมึกบด ข้าวเกรียบปิ้งโบราณ .
งานสมโภชพระบรมราชาอนุสาวรีย์รัชกาลที่ 5 และส่งเสริมการท่องเที่ยวกระตุ้นเศรษฐกิจภายในจังหวัดฉะเชิงเทรา ระหว่างวันที่ 28 ก.พ.- 9 มี.ค.2568
จังหวัดฉะเชิงเทรา ขอเชิญเที่ยวงาน สมโภชพระบรมราชาอนุสาวรีย์รัชกาลที่ 5 (ที่บูรณะแล้วเสร็จหน้าศาลากลางจังหวัดฉะเชิงเทรา) และส่งเสริมการท่องเที่ยวกระตุ้นเศรษฐกิจภายในจังหวัดฉะเชิงเทรา ระหว่างวันที่ 28 ก.พ.- 9 มี.ค.2568 วันที่ 3 มี.ค. ช่วงเช้า มีพิธีสมโภชบวงสรวงสักการะพระบรมราชานุสาวรีย์พระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว ร.5 ณ ลานพระบรมรูป ร.5 หน้าศาลากลางจังหวัดฉะเชิงเทรา
สำหรับการออกบูธจำหน่ายสินค้ามีตั้งแต่ช่วง 10.00 น.- 24.00 น.ทุกวัน ภายในงานพบกับ สินค้าทางการเกษตร ผัก,ผลไม้ต่างๆเช่น มะม่วง มะพร้าวน้ำหอม ผลผลิตของเกษตรกร สินค้า OTOP สินค้าพื้นเมืองต่างๆ ฯลฯ ที่มีชื่อเสียงของจังหวัดฉะเชิงเทรา (จากสำนักงานเกษตรจังหวัดและพัฒนาชุมชนเป็นผู้รวบรวมมา) สินค้าธงฟ้าราคาถูกหลากหลาย เช่น ไข่ไก่,น้ำตาลทราย,ข้าวสาร,น้ำมันพืช,ของใช้จำเป็น ฯลฯ จากสำนักงานพาณิชย์จังหวัดฉะเชิงเทรา มีการออกบูธในส่วนของภาคเอกเช่น อาหาร ของกิน ของใช้ต่างๆหลากหลายสินค้าราคาถูกจากผู้ผลิตโดยตรง กลางคืนมีมหรสพ ศิลปินนักร้องจากค่ายต่างๆการแสดงทุกคืน ณ สนามยิงปืนช. พัน 2 ฯ ถนนศรีโสธรตัดใหม่ห่างจากวัดหลวงพ่อโสธร 400 เมตร
สำหรับวันที่ 6 มีนาคม 2568 ชมการเดินแบบ วันรวมน้ำใจแม่บ้านมหาดไทยฉะเชิงเทรา ภายใต้ชื่อ"บุหงาวันทาภัสตราภรณ์ ณ ลานหน้าศาลาจตุรมุขศาลากลางจังหวัดฉะเชิงเทรา
งาน "FAB FEST 2025" วันที่ 20 – 28 ก.พ.68
งาน "FAB FEST 2025" 20 – 28 ก.พ.68 ณ ลานกิจกรรมหน้าศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส) ครั้งแรกของเซ็นทรัล เชียงใหม่ เอาใจวัยมันส์ สัมผัสประสบการณ์ความอร่อยกับคาราวานอาหารและขบวน Food Trucks วาไรตี้เมนูอาหารคาวหวาน ที่จะทำให้ทุกเมนูเต็มไปด้วยความสุข พร้อมเอ็นจอยกับ Live Music และเสียงเพลงจากศิลปินชาวเชียงใหม่สุดแนว กับวง "สมปอง" วันที่ 28 ก.พ.68
งานมหกรรมมะม่วงแปดริ้ว ครั้งที่ 20 Fashionisland 28 ก.พ. - 9 มี.ค.68
Fashion island ชวนมาชิมมะม่วง ในงาน งานมหกรรมมะม่วงแปดริ้ว ครั้งที่ 20
ตั้งแต่วันที่ 28 ก.พ. - 9 มี.ค. 2568
ณ ลานกิจกรรม ชั้น 3 ศูนย์การค้าแฟชั่นไอส์แลนด์ เชิญชวนทุกคนสัมผัสเสน่ห์ของมะม่วงไทย ต้นกำเนิดของมะม่วงสายพันธุ์ไทยที่ดีที่สุดในประเทศ รวบรวมร้านค้าจำหน่ายมะม่วงหลายสายพันธุ์ มาจำหน่ายให้ได้ลิ้มลองรสชาติความอร่อยของมะม่วงเกรดพรีเมี่ยมส่งตรงผลไม้จากสวนของเกษตรกรโดยตรงมาให้เลือกช้อปอย่างจุใจพร้อมโปรโมชั่นพิเศษให้ได้เลือกซื้อกันในราคาสุดคุ้ม ช้อปมะม่วงหลายสายพันธุ์เกรดพรีเมี่ยม และอร่อยกับเมนูจากมะม่วงส่งตรงจากสวนรวมกว่า 30 ร้านค้า
งานสักการะพระแม่ย่า ประจำปี 2568 วันที่ 28 กพ - 9 มีค 68
จ.สุโขทัยขอเชิญเที่ยว งานสักการะพระแม่ย่า ประจำปี 2568 วันที่ 28 กพ - 9 มีค 68 บริเวณศาลพระแม่ย่า จ.สุโขทัย ชมพิธีเปิดงานและขบวนแห่ย่ิงใหญ่ ร่วมสักการะพระแม่ย่า นิทรรศการส่วนราชการ การแสดงร้องเพลงลูกทุ่งการกุศล เดินแฟชั่นการกุศล โชว์ดนตรีจากวงชั้นนำ สินค้าโอท็อป สินค้าราคาถูก สวนสนุกชุดใหญ่ ร้านดังTikTok
งานบวงสรวงพญางำเมือง และงานกาชาดจังหวัดพะเยา 2568 วันที่ 28 กุมภาพันธ์ถึง 9 มีนาคม 2568
จังหวัดพะเยาร่วมกับเหล่ากาชาดจังหวัดพะเยา กำหนดจัดงานบวงสรวง พญางำเมือง สืบสานประเพณีของดีจังหวัดพะเยา ประจำปี พ.ศ. 2568 ระหว่างวันศุกร์ที่ 28 กุมภาพันธ์ – วันอาทิตย์ที่ 9 มีนาคม 2568 รวม 10 วัน 10 คืน
งานประจำปีเพื่อส่งเสริมศิลปวัฒนธรรมขนบธรรมเนียม ประเพณีล้านนา การออกร้านแสดงและ จำหน่ายสินค้าผลิตภัณฑ์ชุมชนและท้องถิ่น การจัดนิทรรศการของส่วนราชการและ ภาคเอกชน รวมทั้งเพื่อเป็นการหารายได้ในงานสาธารณกุศลของเหล่ากาชาดจังหวัดพะเยา เพื่อให้การส่งเสริมสุขภาพอนามัยและการพัฒนาคุณภาพชีวิต รวมทั้ง บรรเทาความเดือดร้อนของผู้ยากไร้ ผู้พิการ และผู้ด้อยโอกาส ในพื้นที่จังหวัดพะเยา และสร้างกำลังใจ แก่ผู้ยากไร้ ผู้พิการ ผู้ด้อยโอกาสให้เห็นคุณค่าของชีวิต และพร้อมที่จะ ดำรงชีวิตต่อไป โดยมีหัวหน้าส่วนราชการ หน่วยงาน รัฐวิสาหกิจ องค์กรภาครัฐและเอกชน ร้านค้า ห้างสรรพสินค้า และประชาชนทั่วไป สนับสนุนเงินสดหรือสิ่งของเพื่อใช้เป็นรางวัลสลากกาชาดและกิจกรรมออกร้านมัจฉา กาชาด ประจำปี พ.ศ.2568
พิธีอัญเชิญพระบรมสารีริกธาตุสู่เวฑีชำเวกากอง วัดพระธาตุผาซ่อนแก้ว จังหวัดเพชรบูรณ์ วันศุกร์ที่ 28 กุมภาพันธ์ 2568
ขอเชิญร่วมพิธีอัญเชิญพระบรมสารีริกธาตุสู่เวฑีชำเวกากอง วัดพระธาตุผาซ่อนแก้ว จังหวัดเพชรบูรณ์ ด้วยปณิธานอันแรงกล้าของ หลวงพ่อปารมี ที่มุ่งมั่นให้พระบรมสารีริกธาตุเป็นศูนย์รวมแห่งศรัทธาและความเป็นสิริมงคลแก่พุทธศาสนิกชนทั้งหลาย จึงขอเชิญชวนทุกท่านมาร่วมเป็นส่วนหนึ่งใน พิธีอัญเชิญพระบรมสารีริกธาตุ ณ ชเวดากอง วัดพระธาตุผาซ่อนแก้ว อันศักดิ์สิทธิ์ วันศุกร์ที่ 28 กุมภาพันธ์ 2568 เริ่มพิธีเวลา 13.00 น.
พิธีอัญเชิญจัดขึ้นอย่างยิ่งใหญ่ ประกอบด้วยขบวนช้าง 9 เชือก ขบวนม้า ขบวนชาวพุทธจากทั่วทุกสารทิศ พร้อมทั้งพระสงฆ์เจริญพระพุทธมนต์เพื่อความเป็นสิริมงคลแก่ผู้ร่วมงานทุกท่าน ขอเชิญร่วมบูชาธาตุด้วยดวงใจ ประกอบด้วยพระยารำ 500 ท่าน ขบวนอัญเชิญพระบรมสารีริกธาตุอย่างสมเกียรติ น้อมถวายเป็นพุทธบูชา ด้วยจิตศรัทธา หลังพิธีอัญเชิญ เชิญร่วมฉลองเวฑีพระพุทธพลุไฟสุดยิ่งใหญ่ ร่วมเป็นส่วนหนึ่งของพลังศรัทธาอันบริสุทธิ์ แล้วพบกัน ณ วัดพระธาตุผาซ่อนแก้ว
งาน Khao Ya Fest ครั้งที่ 4 วันที่ 28 ก.พ. - 2 มี.ค. 68 ภูเขาหญ้า จังหวัดระนอง
มาชิลล์กันท่ามกลางธรรมชาติที่ “ภูเขาหญ้า จังหวัดระนอง” กับงาน Khao Ya Fest ครั้งที่ 4 วันที่ 28 ก.พ. - 2 มี.ค. 68 ตั้งแต่เวลา 17: 00 - 23:00 น. ณ ภูเขาหญ้า จังหวัดระนอง ชมคอนเสิร์ตฟรี!
ครบทุกอารมณ์ จัดเต็ม ศิลปินดังพร้อมความมันส์! พบกับศิลปินสุดปัง! ป๊อบ ปองกูล - 28 ก.พ. 68 YESSIRDAYS - 1 มี.ค. 68 มินตรา อินทิรา - 2 มี.ค. 68 อิ่มอร่อย กับอาหารและเครื่องดื่มสุดคูล เช็กอินวิวหลักล้าน ถ่ายรูปสวยสุดปังกับจุดเช็คอินและภูเขา ฟู้ดทรัคและกิจกรรมสนุก ๆ มากมาย
เฉลิมฉลองมรดกโลกภูพระบาท ๒๘ กุมภาพันธ์ ๒๕๖๘
ขอเชิญร่วมเฉลิมฉลองมรดกโลกภูพระบาท เนื่องในโอกาสที่ได้รับประกาศรับรองการขึ้นทะเบียนแหล่งมรดกทางวัฒนธรรมอย่างเป็นทางการจากยูเนสโก ณ อุทยานประวัติศาสตร์ภูพระบาท จังหวัดอุดรธานี วันศุกร์ที่ ๒๘ กุมภาพันธ์ ๒๕๖๘ ฟังธรรมเทศนา และเจริญจิตภาวนา โดยพระราชภาวนาวชิรากร วิ. (อินทร์ถวาย สนฺตุสฺสโก) ชมการแสดงจากสำนักการสังคีต กรมศิลปากร ละครตำนานภูพระบาท เรื่อง "อุสา - บารส“ โขนเรื่องรามเกียรติ์ ตอน สุครีพถอนต้นรัง
Rayong Long Beach Festival 2025 @ Leammaephim 28 กุมภาพันธ์ - 2 มีนาคม 2568
เทศกาลดนตรีริมชายหาด Rayong Long Beach Festival 2025 @ Leammaephim วันที่ 28 กุมภาพันธ์ - 2 มีนาคม 2568 หาดแหลมแม่พิมพ์ จ.ระยอง กองทัพศิลปินดังมากมายที่จะมาสร้างสีสันต์และความสนุก พร้อมชิม ช้อปอาหารทะเลและกิจรรมอื่นๆ อีกมากมาย.
Line Up ศิลปินภายในงาน 28 กุมภาพันธ์ : Yessirday / PARADOX / Restrospect 1 มีนาคม : Fool Stepts / Num Kala / Getsunova 2 มีนาคม : LAXYLOXY x SAMBLACK / Sweet Mullet / Joey Boy
งานเทศกาลประจำปี “งานสืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาดจังหวัดสระแก้ว ประจำปี 2568
งานเทศกาลประจำปี “งานสืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาดจังหวัดสระแก้ว ประจำปี 2568 วันที่ 28 ก.พ. - 8 มี.ค. 2568 บริเวณอุทยานพุทธมณฑล จ.สระแก้ว ชมดนตรีทุกคืนศิลปินดัง (เจ เจตริน ก้องห้วยไร่ มินตรา อินทิรา เปิ้ล ปทุมราช) การประกวดวงดนตรีนักเรียน
งานประจำปี วัดพระประโทนเจดีย์วรวิหาร 28 กุมภาพันธ์ - 9 มีนาคม 2568
ขอเชิญเที่ยวงานประจำปี วัดพระประโทนเจดีย์วรวิหาร
28 กุมภาพันธ์ - 9 มีนาคม 2568
“เทศกาลอาหารอร่อย ลุ่มเจ้าพระยาชัยนาท” ประจำปี 2568 วันที่ 28 กุมภาพันธ์ – 4 มีนาคม 2568
“เทศกาลอาหารอร่อย ลุ่มเจ้าพระยาชัยนาท” ประจำปี 2568 กำหนดจัดขึ้นระหว่างวันที่ 28 กุมภาพันธ์ – 4 มีนาคม 2568 ณ บริเวณเขื่อนเรียงหิน หน้าศาลากลางจังหวัดชัยนาท จังหวัดชัยนาท ตั้งแต่เวลา 15.00-22.00 น. (บางร้านเริ่มเปิดบริการตั้งแต่เที่ยงวัน) ร้านอาหารชื่อดัง อร่อยๆ ในชัยนาท เมนูเด็ด เมนูดัง และของฝากกว่า 140 ร้านค้า ร้านอาหาร food truck 15 คัน มัดรวมมาอยู่ในงานนี้ ขอย้ำว่าร้านคนชัยนาท 100%
กิจกรรมภายในงานดังนี้ เดินแบบแฟชั่นโชว์ (28 ก.พ.68 เวลา 19.00 น.) • กิจกรรมการประกอบอาหารโดยใช้วัตถุดิบท้องถิ่น (Chefs Table) • การประกวดการทำอาหารคาว-หวาน และเครื่องดื่ม • สาธิตการทำเครื่องดื่มจากสมุนไพรไทย • การแสดงศิลปวัฒนธรรม • กิจกรรมนาทีทอง (จำหน่ายสินค้าลดราคา 50%) • จุดถ่ายรูปสวยๆภายในงาน • การแสดงดนตรี Folk Song รวมถึงการแสดงคอนเสิร์ตจากศิลปินมากมาย
การแสดง "ล่องลอยไปตามจังหวะ ณ อาคเนย์ไร้แห่งหน" (Drifting to the Rhythms at the Southeast of Nowhere) โดย Nguyễn + Transitory พิพิธภัณฑ์ศิลปะร่วมสมัยใหม่เอี่ยม 28 กุมภาพันธ์ และ 1 มีนาคม 2568 (2 รอบการแสดง)
ล่องลอยไปตามจังหวะ ณ อาคเนย์ไร้แห่งหน การแสดงสดโดย Nguyễn + Transitory วันที่: 28 กุมภาพันธ์ และ 1 มีนาคม 2568 (2 รอบการแสดง) เวลา: 19.00 - 20.30 น. สถานที่: โถงหลัก พิพิธภัณฑ์ศิลปะร่วมสมัยใหม่เอี่ยม
พิพิธภัณฑ์ศิลปะร่วมสมัยใหม่เอี่ยม มีความยินดีนำเสนอ "ล่องลอยไปตามจังหวะ ณ อาคเนย์ไร้แห่งหน" (Drifting to the Rhythms at the Southeast of Nowhere) โดย Nguyễn + Transitory การแสดงนี้ปรับเปลี่ยนพื้นที่ชั่วคราวให้กลายเป็นสถาปัตยกรรมทางดนตรีที่ผสานเสียงสะท้อนของดนตรีพื้นบ้านดั้งเดิมเข้ากับรูปแบบร่วมสมัย งานของพวกเขาสำรวจศักยภาพแห่งการเปลี่ยนแปลงของเสียง ไม่ใช่เพียงในฐานะสื่อทางสุนทรียศาสตร์ แต่ในฐานะพลังทางละครที่เชื่อมโยงอย่างลึกซึ้งกับความทรงจำทางปัญญา ประวัติศาสตร์ที่สูญหาย และประสบการณ์ร่วมในโลกปัจจุบัน แทนที่จะทำให้เส้นแบ่งระหว่างดนตรีพื้นบ้านและแนวทางร่วมสมัยเลือนหายไป Nguyễn + Transitory สร้างภาษาศิลปะที่ถือกำเนิดจากแรงเสียดทานและความตึงเครียดที่ก่อให้เกิดผลระหว่างรูปแบบที่แตกต่างกันเหล่านี้ ผ่านบทสนทนานี้ พวกเขาเปิดโอกาสให้แต่ละประเพณีคงไว้ซึ่งอัตลักษณ์ของตนเอง ขณะเดียวกันก็ให้กำเนิดสิ่งใหม่—การแสดงออกที่พัฒนาไปเรื่อย ๆ ซึ่งดำรงอยู่ระหว่างอดีตและปัจจุบันโดยไม่ให้คุณค่าหรือบั่นทอนฝ่ายใดเป็นพิเศษ สำหรับ Nguyễn + Transitory อดีตไม่ใช่มรดกที่หยุดนิ่ง หากแต่เป็นพลังที่มีชีวิตและเปลี่ยนแปลงอยู่เสมอซึ่งหล่อหลอมปัจจุบัน งานของพวกเขาปฏิเสธผลลัพธ์ที่ตายตัว ทว่า โอบรับกระบวนการแสดงสดในฐานะพื้นที่แห่งการก่อร่างใหม่ ซึ่งเสียง พื้นที่ และประวัติศาสตร์ถูกนิยามและประกอบสร้างขึ้นใหม่อย่างต่อเนื่อง
กาชาดบางกรวย ประจำปี 28 กุมภาพันธ์ - 9 มีนาคม 2568
งาน กาชาดอำเภอบางกรวย ประจำปี 2568
วันที่ 28 กุมภาพันธ์ - 9 มีนาคม 2568
ณ บริเวณสะพานพระราม 7 ตรงข้ามโรงไฟฟ้าฝ่ายผลิตแห่งประเทศไทย จังหวัดนนทบุรี คอนเสิร์ต ยูกิ เพ็ญผกา ไหทองคำ เบนซ์ ปรีชา น้ำแข็ง ทิพวรรณ
MED ART FESTIVAL 2025 วันที่ 28 กุมภาพันธ์ - 4 มีนาคม 2568
MED ART FESTIVAL 2025 "Where the Med Meets the Art" . เมื่อศิลปะและการแพทย์บรรจบกัน สร้างสรรค์พื้นที่แห่งการเยียวยาที่สมบูรณ์แบบ...ร่วมเป็นส่วนหนึ่งในการสร้างสะพานเชื่อมระหว่างศาสตร์แห่งการรักษากายและศิลปะแห่งการบำบัดใจ ในงาน Med Art Festival ที่จะหลอมรวมสุนทรียภาพและวิทยาการทางการแพทย์เข้าด้วยกันอย่างลงตัว . ภายในงานพบกับกิจกรรมสร้างสรรค์มากมายทีจะจุดประกายพลังบวกในการรักษา
ระหว่างวันที่ 28 กุมภาพันธ์ - 4 มีนาคม 2568 เวลา 11.00 - 22.00 น. ณ Alive Park Hall, Future Park Rang-sit . ทั้งนี้การจัดงาน Med Art Festival มีวัตถุประสงค์เพื่อหารายได้สมทบทุนจัดซื้ออุปกรณ์การแพทย์ในการสร้างอาคารศูนย์นวัตกรรมด้านมะเร็งและรังสีรักษา (อาคาร 90 ปี มหาวิทยาลัยธรรมศาสตร์) . ศิลปะดูแลใจ วิทยาการแพทย์ดูแลกาย ก้าวไปด้วยกัน สู่การเยียวยาที่สมบูรณ์แบบ
งาน ฟาร์มเมอร์ มาร์เก็ต วันที่ 28 ก.พ. - 9 มี.ค. 68
งาน ฟาร์มเมอร์ มาร์เก็ต วันที่ 28 ก.พ. - 9 มี.ค. 68 ชั้น G - ไอเฟล สแควร์ Terminal 21 Korat สินค้าเกษตรอินทรีย์สดๆ จากไร่ชั้นนำทั่วประเทศ ผักออร์แกนิค, ผลไม้ตามฤดูกาล, ผลิตภัณฑ์นม, และอาหารอร่อยเพื่อสุขภาพ พิเศษกับ สินค้าเกษตรนาทีทอง เริ่มต้น กก. ละ 1 บาท (ทุกวันเสาร์-อาทิตย์)
มรดกภูมิปัญญา ผ้านาข่า 100 ปี 28 กุมภาพันธ์ - 2 มีนาคม 2568
ททท.สำนักงานอุดรธานี... เชิญชวนนักท่องเที่ยวทุกท่านร่วมงาน ตามหา "มรดกภูมิปัญญา ผ้านาข่า 100 ปี" “มูลมังนาข่า”... วันที่ 28 กุมภาพันธ์ - 2 มีนาคม 2568 ตั้งแต่เวลา 16.00 - 21.00 น. ณ วัดนาคาเทวี ตลาดผ้าบ้านนาข่า จ.อุดรธานี
ภายในงานคุณจะได้พบกับ เช็คอินกับ Street Art กลางชุมชนนาข่า Street Food อร่อยๆ สินค้าชุมชน OTOP และผลิตภัณฑ์พื้นเมือง เทศกาลอาหารอีสาน ร้านค้าผ้าไทย ลดสูงสุดถึง 50% ยังมีความบันเทิงมากมาย! รับชมหมอลำกลอน ดนตรีสดโฟล์คซอง และกิจกรรมสนุกๆ ที่พร้อมให้ทุกท่านมาสัมผัส คืนนี้มาพบกัน ชม ชิม ช้อป แช๊ะ ไม่ควรพลาด!
เทศกาลปลาหมึกและอาหารทะเลริมชายหาด 2025 วันที่ 28 กุมภาพันธ์ - 1 มีนาคม 2568
เทศกาลปลาหมึกและอาหารทะเลริมชายหาด 2025 วันที่ 28 กุมภาพันธ์ - 1 มีนาคม 2568 สถานที่ หาดจอมเทียน (ฝั่งตรงข้าม The Now Hotel Jomtien) เตรียมตัวให้พร้อม! โจรสลัดจะบุกหาดจอมเทียน พาความอร่อยของ ซีฟู้ดสดๆ จากประมงพื้นบ้าน และบูธอาหารหลากหลาย มาให้ทุกคนได้ลิ้มลอง พร้อมสนุกกับกิจกรรมสุดมันส์ตลอดทั้งงาน!
กิจกรรมไฮไลต์ที่พลาดไม่ได้! แข่งตกปลาหมึกริมหาด – ใครสายตกหมึกต้องไม่พลาด แข่งกินจุ – ท้าให้ลอง ใครกินไว กินเก่ง มาลุ้นรางวัล คอนเสิร์ตสุดมันส์ – สนุกไปกับเสียงเพลงและบรรยากาศชิลๆ ริมทะเล ไดโนเสาร์ยักษ์ – เด็กๆ สนุกสนานกับโซนไดโนเสาร์สุดน่ารัก ถ่ายรูปได้เพลินๆ แวะมาช้อป! มาชิม! มาชิล! ในบรรยากาศสุดฟินริมทะเล งานเดียวที่รวม ความอร่อย ความสนุก และความบันเทิง ไว้ครบ!
มหกรรมมะม่วงแปดริ้ว ครั้งที่ 20 วันที่ 28 ก.พ. - 9 มี.ค.68 ศูนย์การค้าแฟชั่นไอส์แลนด์
มหกรรมมะม่วงแปดริ้ว ครั้งที่ 20 ตั้งแต่วันที่ 28 ก.พ. - 9 มี.ค.68 ณ ลานกิจกรรม ชั้น 3 ศูนย์การค้าแฟชั่นไอส์แลนด์ เทศกาลสุดยอดมะม่วงแห่งปี คุณภาพส่งออก ส่งตรงจากสวน ในราคาสุดคุ้มกับงาน ไฮไลท์เด็ดห้ามพลาด ช้อปมะม่วงหลายสายพันธุ์เกรดพรีเมี่ยม และอร่อยกับเมนูจากมะม่วงส่งตรงจากสวนรวมกว่า 30 ร้านค้า สัมผัสเสน่ห์ของมะม่วงไทย ต้นกำเนิดของมะม่วงสายพันธุ์ไทยที่ดีที่สุดในประเทศ รวบรวมร้านค้าจำหน่ายมะม่วงหลายสายพันธุ์ มาจำหน่ายให้ได้ลิ้มลองรสชาติความอร่อยของมะม่วงเกรดพรีเมี่ยมส่งตรงผลไม้จากสวนของเกษตรกรโดยตรงมาให้เลือกช้อปอย่างจุใจพร้อมโปรโมชั่นพิเศษให้ได้เลือกซื้อกันในราคาสุดคุ้ม
เดือนมีนาคม 2568
Pattaya Music Festival 2025 มีนาคม 2568
Pattaya Music Festival 2025 เทศกาลดนตรีพัทยาประจำปี 2568 กำหนดจัด 3 สัปดาห์ได้แก่ วันที 7-8 มีนาคม, 15-16 มีนาคม, 22-23 มีนาคม 4 เวทีใน 4 จุด คือชายหาดพัทยา หาดจอมเทียน ลานโพธิ์ นาเกลือ และเกาะล้าน
เช็ครายชื่อศิลปินแต่ละเวทีได้ที่นี่ สอบถามรายละเอียดได้ที่ ฝ่ายส่งเสริมการท่องเที่ยวเชิงการแสดง ส่วนส่งเสริมการท่องเที่ยว สำนักการท่องเที่ยวและกีฬา โทร. 038 253100 ต่อ 4115 หรือที่ Pattaya Contact Center 1337 Max ตลอด 24 ชั่วโมง
ปฏิทินท่องเที่ยวและกีฬา จังหวัดฉะเชิงเทรา ประจำเดือนมีนาคม 2568
สำนักงานการท่องเที่ยวและกีฬาจังหวัดฉะเชิงเทรา MOTS Chachoengsao ขอนำเสนอปฏิทินท่องเที่ยวและกีฬา ประจำเดือนมีนาคม 2568
กิจกรรมท่องเที่ยวจังหวัดเพชรบุรี เดือนมีนาคม 2568
1 มีนาคม 2568 ปั่นพาเที่ยว สัมผัสวิถีอารยธรรมเมืองเก่า ณ โบราณสถานทวารวดีโคกเศรษฐี อ.ชะอำ
7 - 16 มีนาคม 2568 งานเกษตรและของดีอำเภอท่ายาง ณ ถนนใหญ่และสนามฟุตบอลตลาดเก่าท่ายาง อ.ท่ายาง
8 – 15 มีนาคม 2568 เทศกาลชิมปูชัก@ชะอำ ครั้งที่ 10 ประจำปี 2568 ณ จุดชมวิวชายหาดชะอำ อ.ชะอำ 9 มีนาคม 2568 PHRACHOMKLAO RUN 2025 ครั้งที่ 23 ณ สนามหน้าโรงเรียนเบญจมเทพอุทิศ อ.เมืองเพชรบุรี
14-16 มีนาคม 2568 ART OF SALT #10 ณ จุดชมวิวบางแก้ว อ.บ้านแหลม 16 มีนาคม 2568 CHA-AM BIKINI BEACH RUN 2025 ณ ชายหาดชะอำ (เหนือ) อ.ชะอำ
21-23 มีนาคม 2568 เทศกาลว่าวนานาชาติ ณ ชายหาดชะอำ (ฝั่งเหนือ) อ.ชะอำ
22 มีนาคม 2568 เทศกาลดนตรีและปาร์ตี้ริมทะเล "นั่งเล 4" ณ Triple Tree Beach Resort อ.ชะอำ
22-30 มีนาคม 2568 งานเทศกาลอาหารและบอลลูนนานาชาติ ณ ถนนหน้าที่ว่าการอำเภอแก่งกระจาน อ.แก่งกระจาน
23 มีนาคม 2568 Run for the Ocean ครั้งที่ 4 ณ โครงการฟาร์มทะเลตัวอย่างในสมเด็จพระนางเจ้าสิริกิติ์ อ.บ้านแหลม
กิจกรรมท่องเที่ยวนครปฐม เดือนมีนาคม2568
กิจกรรมท่องเที่ยวนครปฐมเดือนมีนาคม2568
งานเกษตรแฟร์ นครชัยศรี วันที่ 25 กุมภาพันธ์ - 8 มีนาคม 68 บริเวณข้างโรงงานน้ำมันพืช อ.นครชัยศรี จ.นครปฐม
งานปิดทองประจำปี วัดพระประโทณเจดีย์ วรวิหาร ????️ วันที่ 28 กุมภาพันธ์ - 9 มีนาคม 68 วัดพระประโทณเจดีย์ วรวิหาร อ.เมืองนครปฐม จ.นครปฐม
ตลาดนัดกาแฟสถานีผัก ประจำเดือนมีนาคม 68 ????️ วันที่ 1 - 2 มีนาคม 68 สถานีผัก & คนรักกาแฟ พุทธมณฑล 4-5
อ.สามพราน จ.นครปฐม
งาน Jib Share Chill 2025 วันที่ 4 มีนาคม 68 สวนทองอุไร คณะอุตสาหกรรมบริการ ม.เกษตรศาสตร์ วิทยาเขตกำแพงแสน จ.นครปฐม
เทศกาลชมพูพันธุ์ทิพย์ "คาดการณ์ รอบที่ 3" วันที่ 7 - 13 มีนาคม 68 ม.เกษตรศาสตร์ วิทยาเขตกำแพงแสน จ.นครปฐม
งานวิ่ง KU MARATHON 2025 วันที่ 9 มีนาคม 68 ม.เกษตรศาสตร์ วิทยาเขตกำแพงแสน จ.นครปฐม
สอบถามข้อมูลท่องเที่ยวได้ที่ ททท.สำนักงานราชบุรี ▪️โทร. 032-919176-8 (ในวันและเวลาราชการ) ▪️Inbox Page : ททท.สำนักงานราชบุรี ▪️Line Official : @TATratchaburi
กิจกรรมท่องเที่ยวราชบุรี เดือนมีนาคม 2568
กิจกรรมท่องเที่ยวราชบุรี เดือนมีนาคม 2568
Something To BEE Market ครั้งที่ 2 วันที่ 1 มีนาคม 68 ลานสนามหญ้าหน้าร้าน The FAV อ.สวนผึ้ง จ.ราชบุรี
Young Smart Farmer Fair จ.ราชบุรี วันที่ 1 - 2 มีนาคม 68 เดอะซีนเนอรี่วินเทจฟาร์ม อ.สวนผึ้ง จ.ราชบุรี
Nasatta Light Festival Winter Illumination 2025 ????️ วันที่ 21 พฤศจิกายน 67 - 27 เมษายน 68 ณ สัทธา อุทยานไทย อ.บางแพ จ.ราชบุรี
กิจกรรมสืบสานงานศิลป์ ถิ่นหนังใหญ่วัดขนอน ครั้งที่ 4 วันที่ 22 กุมภาพันธ์ - 6 เมษายน 68 วัดขนอน (หนังใหญ่) อ.โพธาราม จ.ราชบุรี
งานท่องเที่ยวราชบุรีของดีเมืองโอ่ง และงานกาชาดราชบุรี ประจำปี 2568 วันที่ 22 - 31 มีนาคม 68 บริเวณโดยรอบศาลากลางจังหวัดราชบุรี อ.เมืองราชบุรี จ.ราชบุรี
คอนเสิร์ต Campfire Music Festival วันที่ 29 มีนาคม 68 155 Camp อ.เมืองราชบุรี จ.ราชบุรี
สอบถามข้อมูลท่องเที่ยวได้ที่ ททท.สำนักงานราชบุรี ▪️โทร. 032-919176-8 (ในวันและเวลาราชการ) ▪️Inbox Page : ททท.สำนักงานราชบุรี ▪️Line Official : @TATratchaburi
ปฏิทินท่องเที่ยวกาญจนบุรี ประจำเดือนมีนาคม 2568
สอบถามข้อมูลเพิ่มเติม: ททท. สำนักงานกาญจนบุรี 034 511200, 034 512500
ปฏิทินกิจกรรม ปทุมธานี เดือนมีนาคม 2568
ปฏิทินกิจกรรม นนทบุรี เดือนมีนาคม 2568
กิจกรรมท่องเที่ยวสมุทรสาคร ประจำเดือน มีนาคม 2568
ททท.สำนักงานสมุทรสงคราม ชวนเที่ยวใกล้ๆ ที่ สมุทรสาคร ตามพิกัดกิจกรรมท่องเที่ยวประจำเดือน มีนาคม 2568
วันที่ 26 กุมภาพันธ์ - 3 มีนาคม 2568 เทศกาลอาหารทะเลจังหวัดสมุทรสาคร ครั้งที่ 22 ณ ศูนย์การค้าแลนด์มาร์คมหาชัย อ.เมืองฯ จ.สมุทรสาคร
วันที่ 9 มีนาคม 2568 งานสมุทรสาครพันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 23 ณ ศาลพันท้ายนรสิงห์ อ.เมืองฯ จ.สมุทรสาคร
วันที่ 16-24 มีนาคม 2568 งานปิดทองขอพรหลวงพ่อโต งานเกษตรและของดีอำเภอบ้านแพ้ว ณ วัดหลักสี่ราษฎร์สโมสร อ.บ้านแพ้ว จ.สมุทรสาคร
วันที่ 16 มีนาคม 2568 กิจกรรมปั่นจักรยานเพื่อการท่องเที่ยว ครั้งที่ 4 ณ บ้านคลองสะพานดำ อ.กระทุ่มแบน จ.สมุทรสาคร
วันที่ 18 มีนาคม 2568 งาน "วันท้องถิ่นไทย" ณ ลานพระบรมราชานุสาวรีย์ รัชกาลที่ 5 วัดสุทธิวาตวราม (วัดช่องลม) พระอารามหลวง อ.เมืองฯ จ.สมุทรสาคร
วันที่ 21-31 มีนาคม 2568 | งานของดีและงานกาชาดจังหวัดสมุทรสาคร ณ หน้าศาลากลางจังหวัดสมุทรสาคร และหน้าที่ว่าการอำเภอเมืองสมุทรสาคร
สอบถามข้อมูลเพิ่มเติมและติดตามข่าวสารได้ที่ - ททท.สำนักงานสมุทรสงคราม 034752847 - Facebook : ททท.สำนักงานสมุทรสงคราม : TAT Samut Songkhram Office - Tiktok : TAT_Samut Songkhram
ปฏิทินกิจกรรม ตรัง มีนาคม 2568
เสิร์ฟ Event ตรัง เดือน "มีนาคม" มาแบบชิลๆกับกิจกรรมเอาใจทั้งสายอนุรักษ์ทะเล สายชิลล์ สายแคมป์ และสายลุยต้องห้ามพลาด เที่ยวตรังอย่างฟินเวอร์
27 กุมภาพันธ์ - 2 มีนาคม 2568 Trash Art Trang International 2025 หาดฉางหลาง อ.สิเกา จ.ตรัง
28 กุมภาพันธ์ - 2 มีนาคม 2568 Talad Pinich Love the Earth ครั้งที่ 2 ลานโปรโมชั่น ชั้น 1 โรบินสันตรัง
5-9 มีนาคม 2568 แลลูกลมชมถ้ำเรียนรู้วัฒนธรรมนาหมื่นศรี ครั้งที่ 27 บริเวณลานหน้าถ้าเขาช้างหาย ต.นาหมื่นศรี จ.ตรีง
15 มีนาคม 2568 เขาดาวเรา โคตรควินน์ Music Camp ครั้งที่ 2 ณ เขาดาวเรา อ.ย่านตาขาว
23 มีนาคม 2568 มหัศจรรย์กะช่องเทรล ค่ายลูกเสือพระยารัษฎานุประดิษฐ์ อ.นาโยง จ.ตรัง
ปฏิทินกิจกรรม จ.หนองคาย เดือนมีนาคม 2568
ปฏิทินกิจกรรมจ.อุดรธานี เดือนมีนาคม 2568
ปฎิทินชัยภูมิมีอีเวนท์ เดือนมีนาคม 2568
เทศกาลท่องเที่ยวบึงละหาน - กุมภาพันธ์-มิถุนายน 2568 - บึงละหาน อ.จัตุรัส
เทศกาลรับขวัญนกเป็ดน้ำและบอลลูนนานาชาติ 24 กุมภาพันธ์-2 มีนาคม 2568 - ที่ว่าการอำเภอคอนสวรรค์ อ.คอนสวรรค์
งานพระไกรสิงหนาท 27 กุมภาพันธ์-5 มีนาคม 2568 - อนุสาวรีย์พระไกรสิงหนาท อ.เกษตรสมบูรณ์
งานบุญเดือนสี่ ประเพณีไทคอนสาร - 28-31 มีนาคม 2568 - วัดเจดีย์ อ.คอนสาร
งานมหกรรมแตงไทย - มีนาคม 2568 - อำเภอหนองบัวแดง
งานประจำปี วันตะโกดัด ศูนย์ไม้ดัดบ้านแข้ - มีนาคม 2568 - อำเภอภูเขียว
ปฏิทินท่องเที่ยวขอนแก่น ร้อยเอ็ด กาฬสินธุ์ มหาสารคาม ประจำเดือน มีนาคม 2568
ปฏิทินท่องเที่ยวขอนแก่น ร้อยเอ็ด กาฬสินธุ์ มหาสารคาม ประจำเดือน มีนาคม 2568
ตารางปฏิทินท่องเที่ยวและกิจกรรมในจังหวัดภูเก็ต ประจำเดือน มีนาคม 2568
1-2 มีนาคม 2568 งานยกซิ้ว Yok Chill Season 3
1-2 มีนาคม 2568 หลาดชุมชนวัดบ่าง ซอยชุมชนต้นโพธิ์ ริมคลองบางใหญ่
13-15 มีนาคม 2568 งานสดุดีท้าวเทพกระษัตรี ท้าวศรีสุนทร ประจำปี
8 มีนาคม 2568 คอนเสิร์ตแสงแห่งความหวัง
9 มีนาคม 2568 คอนเสิร์ตการกุศลแสงแรก bodyslam
15 มีนาคม 2568 ตลาดคนดี เรือนจำชั่วคราว บางโจ
1-31 มีนาคม 2568 Expat Explorer Deal
ปฏิทินตลาดนัดฅนดี เกษตรอินทรีย์แบบมีส่วนร่วม PGS ปี 2568
ปฏิทิน
ตลาดนัดฅนดี เกษตรอินทรีย์แบบมีส่วนร่วม PGS ปี 2568 เรือนจำท่องเที่ยว (เรือนจำชั่วคราวบางโจ) สอบถามโทร 084 056 9858
คุณคือ คนหนึ่งที่ “สร้างโอกาส” กับพวกเรา ”โอกาส“ ที่พวกเราได้นำเสนออาหารภูเก็ต ”โอกาส“ ให้อาชีพเกษตร ในภูเก็ต คงอยู่ยั่งยืน “โอกาส“ ให้น้องผู้ต้องขัง พัฒนาฝีมือ สร้างอาชีพปรับตัวก่อนออกสู่สังคม มาร่วมกันสร้างโอกาสไปด้วยกัน เพื่อภูเก็ตที่ยั่งยืน พบกับเรา ตลาดนัดฅนดี” ตลาดแห่งโอกาส สู่ความยั่งยืน ทุกวันเสาร์ที่สามของเดือน เวลา 7.30-13.00 น. ร่วม รักษ์สิ่งแวดล้อม ลดขยะ ไปด้วยกัน อย่าลืมนำถุงผ้า กระเป๋า ตะกร้า กล่องใส่อาหาร ติดไม้ติดมือ มานะคะ
ปฏิทินกิจกรรมพัทยา เดือนมีนาคม 2568
ปฏิทินกิจกรรมพัทยา เดือนมีนาคม 2568
ปฏิทินท่องเที่ยวระนอง ประจำเดือน มีนาคม 2568
จำนวนผู้ประกันตนมาตรา 33 มาตรา 39 และมาตรา 40 ประจำเดือนกุมภาพันธ์ 2568
สำนักงานประกันสังคม เผยสถิติ จำนวนผู้ประกันตนมาตรา 33 มาตรา 39 และมาตรา 40 ประจำเดือนกุมภาพันธ์ 2568
Sathaneepak ธีม“Summer Vibes Market” 1-2 มีนาคม 2568
Sathaneepak ธีม“Summer Vibes Market” 1-2 มีนาคม 2568 เวลางาน : 9.00-18.00 น.
Young Smart Farmer จังหวัดราชบุรี วันที่ 1-2 มีนาคม 2568
“Young Smart farmer fair“ มหกรรมแสดงสินค้า จังหวัดราชบุรี วันที่ 1-2 มีนาคม 2568 ณ เดอะซีนเนอรี่ วินเทจ ฟาร์ม อ.สวนผึ้ง จ.ราชบุรี ภายในงานพบกับ สินค้าเกษตรคุณภาพ มากกว่า 30 ร้านค้า และอาหารปลอดภัยจากเกษตรกรตัวจริง ผลิตภัณฑ์สินค้าเกษตร สินค้าแปรรูปทางการเกษตร, กิจกรรม Workshop และกิจกรรมอื่นๆอีกมากมาย
มหกรรมท่องเที่ยวดูดาว Dark Sky Star Party วันเสาร์ที่ 1 มีนาคม 2568 จุดชมวิวเขาร่ม
มหกรรมท่องเที่ยวดูดาวที่ใหญ่ที่สุดในประเทศไทย “Dark Sky Star Party” ปีนี้พบกันที่ เขาใหญ่ เขตอุทยานท้องฟ้ามืดที่มีทัศนวิสัยท้องฟ้าดีที่สุดแห่งหนึ่งของไทย วันเสาร์ที่ 1 มีนาคม 2568 เวลา 17:00 - 23:00 น. ณ ลานกางเต็นท์จุดชมวิวเขาร่ม อุทยานแห่งชาติเขาใหญ่ จ. นครราชสีมา
NARIT ร่วมกับ อุทยานแห่งชาติเขาใหญ่ สมาคมท่องเที่ยวเขาใหญ่ ชมรมดาราศาสตร์ปากช่อง และการท่องเที่ยวแห่งประเทศไทย ชวนไปตั้งแคมป์ดูดาวในงานมหกรรมท่องเที่ยวดูดาวครั้งยิ่งใหญ่ “
Dark Sky Star Party” ณ ลานกางเต็นท์จุดชมวิวเขาร่ม อุทยานแห่งชาติเขาใหญ่ จ. นครราชสีมา
พบกับการรวมตัวอีกครั้งของคาราวานกล้องโทรทรรศน์จาก NARIT นักดาราศาสตร์สมัครเล่น และเครือข่ายดาราศาสตร์ทั่วไทย พร้อมหลากหลายกิจกรรมทางดาราศาสตร์ และธรรมชาติ อาทิ
• ชมดาวท่ามกลางธรรมชาติ ของเขาใหญ่ สัมผัสความสวยงามของท้องฟ้ายามค่ำคืนที่สวยที่สุดแห่งหนึ่งของไทย • ตั้งแคมป์ใต้แสงดาว เนรมิตลานกางเต็นท์จุดชมวิวเขาร่มเป็นจุดแคมป์ปิ้งดูดาว ชวนกางเต็นท์นอนมองท้องฟ้า รอคอยทางช้างเผือกยามเช้า ความโรแมนติกที่ครั้งหนึ่งในชีวิตต้องลอง • คาราวานกล้องโทรทรรศน์ สัมผัสประสบการณ์ส่องดาวผ่านกล้องดูดาวหลากหลายขนาด ชมดาวพฤหัสบดี ดาวอังคาร ดาวศุกร์ เนบิวลา กาแล็กซี กระจุกดาว ฯลฯ • ดูดาวด้วยกล้องสองตา พร้อมใช้แอปพลิเคชันบนมือถือฝีมือคนไทย “NAPA” ช่วยทำความรู้จักท้องฟ้ายามค่ำคืน • เรียนรู้การดูดาวเบื้องต้น การหาทิศ และเทคนิคการดูดาวด้วยตาเปล่า • วาดภาพด้วยแสง Light Painting พร้อมเก็บภาพเป็นที่ระลึก • Glow in the Dark ในธีม Stars & Planets เนรมิตป่าเรืองแสง ในพื้นที่อุทยาน ชมความสวยงามและถ่ายรูปได้ตามอัธยาศัย • Stellar Light Box ประดิษฐ์กล่องกลุ่มดาวเรืองแสง แบบ DIY • Night Safari ท่องป่ายามค่ำคืน สำรวจพฤติกรรมสัตว์ป่ายามค่ำคืนในพื้นที่อุทยานแห่งชาติเขาใหญ่ สถานที่ที่อุดมไปด้วยความหลากหลายของสัตว์ป่า และสัตว์ป่าหายากของไทย
พิเศษ ! สำหรับผู้ลงทะเบียนล่วงหน้าทาง
nps.dnp.go.th รับของที่ระลึกสุดลิมิเต็ดภายในงาน
รายละเอียดกิจกรรม NARIT 053-121268 / อช.เขาใหญ่ 086-0926527
กาลครั้ง 8 หนีกรุง INFUNITY วันที่ 1 มี.ค. 2568 ณ Wisdom Valley เขาไม้แก้ว พัทยา
ความสนุกแบบไร้ขีดจำกัดพร้อมทัพศิลปิน เตรียมมาระเบิดความมันส์ที่งาน กาลครั้ง 8 หนีกรุง INFUNITY วันที่ 1 มี.ค. 2568 ณ Wisdom Valley เขาไม้แก้ว พัทยา บัตร FUN ZONE ซื้อ 4 แถม 1 ทาง LINE: @NeekrungToGo AGENDA: 16.00 ‣ ประตูเปิด 17.00 - 18.00 ‣ 4EVE 18.15 - 19.15 ‣ INK WARUNTORN 19.30 - 20.45 ‣ PECK – AOF - ICE 21.00 - 22.00 ‣ JEFF SATUR 22.15 - 23.15 ‣ MODERNDOG พบกับโชว์สุดพิเศษ MODERNDOG Feat. JEFF SATUR 23.30 - 24.30 ‣ F.HERO
งานพระนครคีรีเมืองเพชร ครั้งที่ 38 วันที่ 21 กพ -2 มีค 68
จังหวัดเพชรบุรีกำหนดจัดงาน พระนครคีรี-เมืองเพชร ครั้งที่ 38 ระหว่างวันที่ 21 กุมภาพันธ์ - 2 มีนาคม 2568 ใช้แนวคิดในการจัดงาน คือ วิมานฟ้าพระนครคีรี อัญมณีแห่งสยาม กิจกรรมประกอบด้วย พิธีบวงสรวงพระมหากษัตริย์ 4 พระองค์แห่งราชวงศ์จักรี ได้แก่ รัชกาลที่ 4 รัชกาลที่ 5 รัชกาลที่ 6 และรัชกาลที่ 9 กิจกรรมศิลปวัฒนธรรม เน้นสกุลช่างทั้งหมดของจังหวัดเพชรบุรี ขบวนแห่จากทั้ง 8 อำเภอ และที่โดดเด่นคือ การจุดพลุไฟและการประดับไฟสวยงามทั้งพระนครคีรี เขาวังตลอด 10 วันของการจัด
ชมการแสดงเทิดพระเกียรติ “พิพิธภัณฑ์ชีวิต เสียงสะท้อนแห่งความทรงจำ” จัดแสดง วันที่ 21 กุมภาพันธ์ - 2 มีนาคม 2568
ขอเชิญชวน ร่วมย้อนจิรกาล..สู่วิมานพระนครคีรี ชมการแสดงเทิดพระเกียรติ “พิพิธภัณฑ์ชีวิต เสียงสะท้อนแห่งความทรงจำ” จัดแสดง วันที่ 21 กุมภาพันธ์ - 2 มีนาคม 2568 เวลา 20:00 - 21:00 น. ณ ลานโขน อุทยานประวัติศาสตร์พระนครคีรี จัดโดย จังหวัดเพชรบุรี ลงทะเบียน
สำรองที่นั่งเข้าชมการแสดง งานอนุรักษ์พันธุ์เต่าทะเลหรือที่เรียกกันว่างานปล่อยเต่าประจำปี 2568 วันที่ 1-10 มีนาคม 2568
ขอเชิญชวนทุกท่านมาร่วมกันอนุรักษ์ธรรมชาติ และปล่อยเต่าสู่ท้องทะเล งานอนุรักษ์พันธุ์เต่าทะเลหรือที่เรียกกันว่างานปล่อยเต่าประจำปี 2568 วันที่ 1-10 มีนาคม 2568 ณ บริเวณสนามริมทะเลท้ายเหมือง
Hello Summer KPP Coffee Fest 2025 วันที่ 1 - 2 มี.ค. 2568
Hello Summer KPP Coffee Fest 2025 วันที่ 1 - 2 มี.ค. 2568 เข้าท่าแคมป์ปิ้ง & ลานเพลิน จังหวัดกำแพงเพชร มหกรรมกาแฟที่ใหญ่ที่สุดของจังหวัดกำแพงเพชร มีกิจกรรมน่าสนใจมากมาย ไม่ว่าจะเป็น กิจกรรมเวิร์กช็อป Drip & Cupping แข่งดริปกาแฟสุดมันส์ สนุกกับการประกวดแต่งกายธีมซัมเมอร์ เพลิดเพลินกับดนตรีสด เลือกซื้อกาแฟคุณภาพภายในงาน
Pazan Music Festival ROAD FOR LIFE EP.3 วิถีเพื่อชีวิต 1 มีนาคม 2568
Pazan Music Festival : ROAD FOR LIFE EP.3 วิถีเพื่อชีวิต วันเสาร์ที่ 1 มีนาคม 2568 ณ ลานกิจกรรมเขาใหญ่มาราธอน ถนนธนะรัชต์ กม.21 เอ็กคลูซีฟแคมป์ปิ้งคอนเสิร์ตสุดอบอุ่น เต็มอิ่มกับ 13 ศิลปินเต็ม . - คาราบาว - พงษ์สิทธิ์ คำภีร์ - พงษ์เทพ กระโดนชำนาญ - หงา คาราวาน - สีเผือก คนด่านเกวียน - ทอม ดันดี - สันติภาพ - คณะขวัญใจ - ไววิทย์ - หิน เหล็ก ไฟ - เสือ ธนพล - มนต์แคน แก่นคูน - ก้อง ห้วยไร่ X เบิ้ล ปทุมราช
งานมหกรรมหมอลำโลก 1 มีนาคม 2564
งานมหกรรมหมอลำโลก วันที่ 1 มีนาคม 2568 ณ วิทยาลัยสงฆ์ร้อยเอ็ด มหาวิทยาลัยมหาจุฬาลงกรณราชวิทยาลัย อ.ธวัชบุรี จ.ร้อยเอ็ด เปิดงานโดยนางสาวจิราพร สินธุไพร รัฐมนตรีประจำสำนักนายกรัฐมนตรี เพื่อส่งเสริมศิลปวัฒนธรรมและภูมิปัญญาท้องถิ่น! พบกับการเสวนาวิชาการสุดพิเศษในหัวข้อ "ศตวรรษที่ 21: ทิศทางศิลปินและศิลปวัฒนธรรมแห่งยุคสมัย" โดยวิทยากรผู้ทรงคุณวุฒิ อาทิ อ. ทรงศักดิ์ ประทุมสินธุ์, ผศ.ดร.สนุก สิงห์มาตร, ตร.วีระพงษ์ วงศ์ศิลป์, ผศ.ดร.มนูศักดิ์ เรืองเดช, บอย ศิริชัย, ป.ฉลาดน้อย ส่งเสริม, อ.บิ๊ก ภูมารินทร์ และคุณแม่นวีวรรณ ดำเนิน ️
เทศกาลอาหารบอลลูนหลากสี 1-9 มีค วงเวียนขุนหาญ
เทศกาลอาหารบอลลูนหลากสี 1-9 มีค วงเวียนขุนหาญ อ.ขุนหาญ จ.ศรีษะเกศ
ศึกมวยไทย วิถีถิ่นไทย 2025 วันเสาร์ที่ 1 มีนาคม 2568
การกีฬาแห่งประเทศไทย โดยคณะกรรมการกีฬามวย จับมือพันธมิตร ระเบิดศึกหมัด สนั่นสังเวียน กับการจัดกิจกรรมส่งเสริมและเผยแพร่ศิลปะกีฬามวยไทย ในการจัดการแข่งขันรถจักรยานยนต์ชิงแชมป์โลก โมโต จีพี รายการ PT Grand Prix of Thailand 2025 ภายใต้ชื่อ “ศึกมวยไทย วิถีถิ่นไทย 2025” พบกันวันเสาร์ที่ 1 มีนาคมนี้ ที่หน้าสนามช้าง อารีน่า จ.บุรีรัมย์ . กระทรวงการท่องเที่ยวและกีฬา การกีฬาแห่งประเทศไทย จังหวัดบุรีรัมย์ และสำนักงานคณะกรรมการกีฬามวย ผนึกกำลังโปรโมเตอร์มหาชน "ชุ้น เกียรติเพชร" และ "เดียร์ เกียรติเพชร" จัดกิจกรรมส่งเสริมและเผยแพร่ศิลปะกีฬามวยไทย ในการจัดการแข่งขันรถจักรยานยนต์ชิงแชมป์โลก โมโต จีพี รายการ PT Grand Prix of Thailand 2025 ภายใต้ชื่อ ศึกมวยไทย SAT Super Fight ที่ยิ่งใหญ่ที่สุดในสยามประเทศ รายการ “ศึกมวยไทย วิถีถิ่นไทย 2025” .
คู่เอกนำรายการ “ยอดมวยเมืองกระบี่” วุฒิกร สวนน้ำธารคีรี ดวล “พระเอก 7 สี ราชเดช” TN มวยไทย พร้อมคู่รองที่โด่งดังไม่แพ้กัน “เพชรฆาตแข้งทอง”ฉัตรพลอย พ.หอมกลิ่น ปะทะ “ยอดมวยบุรีรัมย์” ฤทธิเดช ลูกเจ้าพ่อโรงต้ม และยังมีคู่มวยสุดมันส์อีกมายมาก แล้วพบกันวันเสาร์ที่ 1 มีนาคม 2568 ที่บริเวณหน้าสนามช้าง อารีน่า จ.บุรีรัมย์ เริ่ม 18.00 น. เป็นต้นไป . ถ่ายทอดสดผ่านทาง Facebook : T - Sport สำนักงานคณะกรรมการกีฬามวย และThaiBev ThaiTalent
ถนนคนเดินริมน้ำจันทบูร 1 - 3 มีนาคม 2025
ถนนคนเดินริมน้ำจันทบูร วันนี้ 1 - 3 มีนาคม 2025 งานฉลองศาลเจ้าที่ตลาดล่าง พิกัด ชุมชนริมน้ำจันทบูรMuseum Siam “KHON” ศาสตร์ศิลป์ แผ่นดินสยาม เรื่อง “รามเกียรติ์”
Museum Siam เทศกาลดนตรีกรุงเทพมหานคร ๒๕๖๘ “KHON” ศาสตร์ศิลป์ แผ่นดินสยาม เรื่อง “รามเกียรติ์” ตอน นารายณ์ปราบนนทุก และ พระรามตามกวาง วงดนตรีไทยกรุงเทพมหานคร ศิลปินรับเชิญ คณะโขน ศิษย์วังหน้า วันเสาร์ที่ 1 มีนาคม 2568 เริ่ม 17.00 น.
Trash Art Trang International 2025 วันที่ 1 - 2 มี.ค. 2568
Trash Art Trang International 2025 ระหว่างวันที่ 1 - 2 มี.ค. 2568
ณ หาดฉางหลาง อำเภอสิเกา จังหวัดตรัง
พบกับ งานศิลป์สุดสร้างสรรค์ จากศิลปินนานาชาติกว่า 27 ประเทศ ชิมอาหารอร่อย ช้อปงานคราฟต์ และร่วมกิจกรรมเวิร์กชอปสนุกๆ
งาน “วันสถาปนาจังหวัดยโสธรและงานกาชาด ประจำปี 2568” วันที่ 1-9 มีนาคม 2568
จังหวัดยโสธร เหล่ากาชาดจังหวัดยโสธร ขอเชิญเที่ยวงาน “วันสถาปนาจังหวัดยโสธรและงานกาชาด ประจำปี 2568 ” ระหว่างวันที่ 1-9 มีนาคม 2568 ณ บริเวณสวนสาธารณะบุ่งน้อย-บุ่งใหญ่ ตำบลในเมือง อำเภอเมืองยโสธร จังหวัดยโสธร
งาน off Road trophy yasothon ครั้งที่ 1 วันที่ 7- 9 มีนาคม 2568
ขอเชิญเที่ยวงาน off Road trophy yasothon ครั้งที่ 1 และชมการแข่งขัน รถยนต์ออฟโรด 4 x 4 ระดับประเทศ วันที่ 7 - 8 - 9 มีนาคม 2568 ณ สนาม off Road trophy yasothon by น้ำปลาร้าแม่เภา อำเภอคำเขื่อนแก้ว จังหวัดยโสธร ภานในงานมาร่วมสนุกสนาน ช้อปชิม จุใจ ลานอาหารเครื่องดื่ม พร้อมสวนสนุกเต็มรูปแบบ ชมฟรี คอนเสิร์ต ทุกคืน มหาหิงค์ เสถียรทำมือ เย็นตาโฟ และการประกวดมิสมอเตอร์สปอร์ต ขอย้ำ ชมฟรี ชมฟรี
อบรม “การออกแบบวัฒนธรรมอาหารเพื่อความยั่งยืน” วันที่ 1-13 มีนาคม 2568
TAT Hatyai - ททท. สำนักงานหาดใหญ่ 3 วัน · เชิญชวนร่วมเป็นส่วนหนึ่งในการขับเคลื่อนเมืองสร้างสรรค์ และการท่องเที่ยวจังหวัดสงขลาผ่านมิติวัฒนธรรมด้านอาหาร สมัครเข้าร่วมอบรม “การออกแบบวัฒนธรรมอาหารเพื่อความยั่งยืน” ที่จะเปิดโอกาสให้ทุกท่านได้แลกเปลี่ยนความรู้ สร้างเครือข่าย และร่วมกันพัฒนาศักยภาพอาหารท้องถิ่นสู่ระดับสากล ระหว่างวันที่ 1-13 มีนาคม 2568
คุณสมบัติ เจ้าของร้านอาหาร คาเฟ่ และโรงแรม เชฟมืออาชีพและมือสมัครเล่น อาจารย์และนักศึกษาที่หลงใหลในวัฒนธรรมอาหาร ผู้สนใจในการพัฒนาธุรกิจอาหารและการท่องเที่ยว มาร่วมเป็นส่วนหนึ่งในการยกระดับวัฒนธรรมอาหารสงขลาสู่เวทีระดับประเทศและระดับโลก
งาน Craft Drink Art & Music 2025 วันที่ 1-2 มีนาคม 2568
ททท.สำนักงานนครศรีธรรมราช ชวนเที่ยวงาน Craft Drink Art & Music 2025 วันที่ 1-2 มีนาคม 2568 เวลา 10:00 น. - 22:00 น. สถานที่: ณ บวรนคร ท่าวัง อ.เมือง นครศรีธรรมราช ตามมาชิม มาเชียร์ มาจิบเบียร์ชิมไวน์ ดื่มด่ำบรรยากาศรื่นรมย์ เคล้าเสียงดนตรี อิ่มท้องกับอาหารและขนมหลากหลาย ทั้งเครื่องดื่มกาแฟ โกโก้ สุราไทยและอื่นๆอีกมากมาย ที่ต่างพร้อมปล่อยไอเดียเมนูใหม่ๆ รังสรรค์พิเศษในงานนี้โดยเฉพาะ
เทศกาลเรียงร้อยวัฒนธรรม หอมดินกลิ่นซัง @ทุ่งนาปาน วันเสาร์ที่ 1 มีนาคม 2568
"เทศกาลเรียงร้อยวัฒนธรรม หอมดินกลิ่นซัง @ทุ่งนาปาน" อบจ.สงขลา เชิญชวนทุกท่านมา ดื่มด่ำบรรยากาศทุ่งนาสุดงดงาม อิ่มอร่อยกับอาหารพื้นบ้านรสเด็ด สูตรดั้งเดิมหาทานยาก เสวนาริ่มทุ่ง แลกเปลี่ยนเรื่องราวดี ๆ ท่ามกลางสายลมเย็น เพลิดเพลินกับดนตรีกลางทุ่ง สัมผัสชีวิตแบบสโลว์ไลฟ์ และเก็บเกี่ยวความสุขไปด้วยกัน ณ บ้านทุ่งนาปาน ตำบลทุ่งตำเสา อำเภอหาดใหญ่ จังหวัดสงขลา วันเสาร์ที่ 1 มีนาคม 2568 (ตั้งแต่เวลา 17.00น. เป็นต้นไป) . มาต๊ะ มาเที่ยว ทุ่งนาปาน...ทุ่งตำเสา
EXPAT EXPLORER DEAL March 1-31, 2025
EXPAT EXPLORER DEAL – Exclusive Spa Discount! Calling all expats! Treat yourself to ultimate relaxation with a 100 THB discount when you purchase a massage package or a spa package worth 850 THB or more! How to Claim Your Discount: ✅ Visit a participating spa ✅ Scan the QR Code at the spa ✅ Enjoy 100 THB off instantly! Valid from March 1-31, 2025 1 discount per person per package
หลาดชุมชนตัวบ่าง! 1–2 มีนาคม 2568
หลาดชุมชนตัวบ่าง! 1 – 2 มีนาคม 2568 เวลา 09.00 – 19.00 น. ชุมชนซอยต้นโพธิ์ ริมคลองบางใหญ่ ช็อปจัง ฟังชิว ชมวิวริมคลอง พายเรือคายัค สัมผัสเสน่ห์ชุมชนริมคลอง Workshop สร้างสรรค์ งาน DIY จากขยะ เพลิดเพลินกับดนตรีสด และบรรยากาศชิลล์ ๆ มาสัมผัสเสน่ห์ชุมชน กิน เที่ยว ช้อป และร่วมกิจกรรมรักษ์โลกไปด้วยกัน!
Yok Chill Season 3 วันที่ 1-2 มีนาคม 2025
พร้อม! Yok Chill Season 3 วันที่ 1-2 มีนาคม 2025 เวลา 17:00-23:00 ลานด้านนอก Limelight รวมตัวชิ้ว Community สุดคูลในภูเก็ต! อาหารเด็ด เครื่องดื่มเพียบ ดนตรีสดตลอดคืน! นัดชิ้วเลย! มันส์ไปกับ Golf The Voice 2 & Book The Voice 6 สนุกกับ DJ & MC สุดมันส์
นิทรรศการ Phuket Toilet : ความศิวิไลซ์ในคอห่าน มิวเซียมภูเก็ต วันนี้ - 30 กันยายน 2568
มิวเซียมภูเก็ตชวนเปิดประสบการณ์การเรียนรู้เรื่อง ขี้ ๆ ที่ไม่เล็กอย่างที่คิด ในนิทรรศการ Phuket Toilet : ความศิวิไลซ์ในคอห่าน เรียนรู้เรื่องของส้วม สุขาน้อย ๆ ที่ไม่ใช่แค่ที่ปลดทุกข์เท่านั้นพร้อมสัมผัสความสุขในการถ่ายทุกข์หลากสไตล์ในส้วมทดลอง . #เข้าชมฟรี ตั้งแต่วันนี้ - 30 กันยายน 2568 ณ มิวเซียมภูเก็ต จังหวัดภูเก็ต
พิกัด
สอบถามข้อมูลเพิ่มเติมได้ที่ 094-807-7873 . ชวนมาคลี่คลายว่าส้วมนั้นสำคัญไฉน? ผ่าน 5 โซนจัดแสดง โซนที่ 1 โลกของส้วม นำเสนอเรื่อง ขี้ ๆ ของมนุษยชาติผ่านเกมส้วมของโลก โซนที่ 2 ความศิวิไลซ์ในห้องส้วม นำเสนอส้วมประเภทต่าง ๆ ที่สะท้อนพัฒนาการของบ้านเมืองในแต่ละช่วงเวลา โซนที่ 3 ส้วมในความทรงจำเมืองภูเก็ต นำเสนอระบบการจัดการส้วมและสาธารณะสุขครั้งแรกที่อยู่ในภาพจำของคนภูเก็ต โซนที่ 4 ส้วม(เรื่อง)สาธารณะ นำเสนอความเป็นเมืองท่องเที่ยวที่มีผู้คนเดินทางมาอย่างไม่ขาดสาย นอกจากที่กิน ที่เที่ยวแล้ว ที่ถ่ายก็ถือเป็นเรื่องสำคัญไม่แพ้กัน ชวนมาสำรวจส้วมสาธารณะในเมืองภูเก็ตผ่านเกมนักสืบส้วม และพูดคุยแลกเปลี่ยนเรื่องส้วมในเมืองท่องเที่ยว โซนที่ 5 ขี้อวด ชวนสัมผัสประสบการณ์ส้วมสร้างความสุขในการถ่ายทุกข์หลากสไตล์ ในแบบทะเล สวนดอกไม้และเพอรานากัน
มิวเซียมภูเก็ต Museum Phuket พื้นที่สร้างสรรค์การเรียนรู้สำหรับคนภูเก็ตและนักท่องเที่ยว ผ่านสื่อเทคโนโลยีและกิจกรรมสร้างสรรค์ สอบถามข้อมูลได้ที่ 094-807-7873
งาน NORTHERN VOLKSWAGEN : ACOUSTIC CAMP LIFE 2025 ครั้งที่ 4 วันเสาร์ที่ 1 มีนาคม 2025
เตรียมพบกันในงาน NORTHERN VOLKSWAGEN : ACOUSTIC CAMP LIFE 2025 ครั้งที่ 4 วันเสาร์ที่ 1 มีนาคม 2025 ประตูเปิดเวลา 14.00 น. ม่อนจ๊อด, โป่งแยง, อ.แม่ริม, เชียงใหม่ วันของชาว VW และเพื่อนๆ ขับรถ Volkswagen คันโปรด หรือขับรถยี่ห้ออื่น หรือมอเตอร์ไซค์ มาร่วมแคมป์สนุกๆ พร้อมกิจกรรมมากมายจาก TRANE ทั้งพูดคุย แลกเปลี่ยนไอเดีย ช้อปตลาดวินเทจ ฟังดนตรีเพราะๆ ท่ามกลางบรรยากาศธรรมชาติสุดชิล วิวหุบเขาและทะเลสาบ พร้อมสร้างมิตรภาพใหม่ๆ ในแบบ VW Life ที่ต้องมาให้ได้!
โฮม บาย เกษียณมาร์เก็ต วันที่ 1-2 และ 15-16 มีนาคม 2568 ศูนย์วัฒนธรรมเชียงใหม่
โฮม บาย เกษียณมาร์เก็ต ตลาดนัดสินค้าทำด้วยใจ เพื่อคนทุกวัยใน "บ้าน" ตลาดเปิดวันที่ 1-2 และ 15-16 มีนาคม 2568 เวลา 09.00น. - 15.00น. ณ ศูนย์วัฒนธรรมเชียงใหม่ มาพักผ่อนหย่อนกายคลายเหงา มาร่วมสร้างความสุข สนุกสนาน ส่งท้ายตลาดกัน!
งานกาแฟสัมพันธ์ครั้งที่ 2 : Jungle in the hometown วันที่ 1-2 มีนาคม 2568
งานกาแฟสัมพันธ์ครั้งที่ 2 : Jungle in the hometown วันที่ 1-2 มีนาคม 2568 วันเสาร์ 7.00น - 21.00น. วันอาทิตย์ 7.00น - 16.00น. สถานที่จัดงาน เข้ามาใน โรงสีไฟธาราเจริญ 1993 ข้างโฮมโปร กิจกรรมในงาน 21 ร้านกาแฟทั้งเหย้าและเยือน • 5 ร้านเครื่องดื่มเสริมพลังพิเศษ • 13 พลพรรคร้านอาหารคาว&หวาน • โซนแต้มสุข กับกิจกรรมอีกมากมาย • โชว์ดนตรีจากศิลปินท้องถิ่น • นิทรรศการ "สารตั้งต้น" • Work shop การจัดดอกไม้สไตล์ญี่ปุ่น
OTOP Chonburi Fair 2025 วันที่ 2 - 9 มีนาคม 2568
งาน OTOP Chonburi Fair 2025 อัตลักษณ์แห่งชล ความภูมิใจแห่งไทย งานที่รวบรวมของอร่อย ของดี ของเด็ด ในจังหวัดชลบุรี และต่างจังหวัด กว่า 300 ร้านค้า ระหว่างวันที่ 2 - 9 มีนาคม 2568 ณ บริเวณสนามหน้าศาลากลางจังหวัดชลบุรี อำเภอเมืองชลบุรี จังหวัดชลบุรี
4th SMST MEDRathon วิ่งกับหมอ ครั้งที่ 4 วันที่ 2 มีนาคม 2568
4th SMST MEDRathon หรือ โครงการวิ่งกับหมอ ครั้งที่ 4 โดยสหพันธ์นิสิตนักศึกษาแพทย์แห่งประเทศไทย ในพระอุปถัมภ์ฯ (สพท.) เพื่อนำรายได้หลังหักค่าใช้จ่ายมอบให้ “กองทุนศูนย์โรคหัวใจ มูลนิธิโรงพยาบาลมหาวิทยาลัยนเรศวร” มาร่วมกัน “เปลี่ยนจังหวะฝีเท้า ก้าวสู่จังหวะหัวใจที่แข็งแรง” ไปด้วยกันในวันที่ 2 มีนาคม 2568 ณ อ.เมือง จ.พิษณุโลก สามารถสมัครได้ตั้งแต่วันนี้-3 กุมภาพันธ์ 2568 ปีนี้เรามาด้วยกันกับ 3 package ได้แก่ - Funrun 5 kM 550 บาท - Mini marathon 10 kM 750 บาท - VIP เลือกได้ทุกระยะ 2000 บาท
งาน สดุดีวีรกรรมทุ่งสัมฤทธิ์ อำเภอพิมาย วันที่ 2 - 5 มีนาคม 2568
งาน สดุดีวีรกรรมทุ่งสัมฤทธิ์ ประจำปี 2568 วันที่ 2 - 5 มีนาคม 2568 ณ บริเวณอนุสรณ์สถานวีรกรรมทุ่งสัมฤทธิ์ ตำบลสัมฤทธิ์ อำเภอพิมาย จังหวัดนครราชสีมางานวัฒนธรรมสร้างบ้านแปงเวียง พญามังรายหลวง วันที่ 3 - 4 มีนาคม 2568
ททท.สำนักงานเชียงราย ขอเชิญชวน ร่วมงานวัฒนธรรมสร้างบ้านแปงเวียง พญามังรายหลวง วันที่ 3 - 4 มีนาคม 2568 ณ ลานธรรม ลานศิลป์ ถิ่นพญามังราย (ศาลากลางจังหวัดเชียงรายหลังแรก) ตั้งแต่เวลา 13.00 - 20.00 น.
ภายในงานพบกับ นิทรรศการเทิดพระเกียรติพญามังรายหลวง กิจกรรมการสาธิต และ จำหน่ายผลิตภัณฑ์ทางวัฒนธรรม การแสดงแสงสีแสง "เล่าขานตำนาน พญามังรายหลวง" เสวนา การสร้างบ้านแปงเวียงของพญามังรายหลวง
ร่วมเป็นส่วนหนึ่งในการน้อมรำลึก พระมหากรุณาธิคุณ พญามังรายหลวง ผู้ทรงสร้างบ้าน แปงเมืองเชียงราย ให้เป็นปึกแผ่น รุ่งเรืองตราบจนปัจจุบัน
งานวีรกรรมไทยอาสาป้องกันชาติรำลึกอำเภอนากลาง และการประกวดควายสวยงาม จังหวัดหนองบัวลำภู ประจำปี 2568 วันที่ 4 - 9 มีนาคม 2568
ประชาสัมพันธ์เชิญชวนพ่อแม่พี่น้องลูกหลานชาวจังหวัดหนองบัวลำภู และจังหวัดใกล้เคียงมาเที่ยวงานประเพณี "งานวีรกรรมไทยอาสาป้องกันชาติรำลึกอำเภอนากลาง และการประกวดควายสวยงาม" จังหวัดหนองบัวลำภู ประจำปี 2568 วันที่ 4 - 9 มีนาคม 2568
Jib Share Chill 2025 จิบ แชร์ ชิลล์ 4 มีนาคม 2568
Jib Share Chill 2025 จิบ แชร์ ชิลล์ สัมผัสบรรยากาศปิกนิกในสวน! วันอังคารที่ 4 มีนาคม 2568 เวลา 08.00 - 16.00 น. สถานที่ : สวนทองอุไร คณะอุตสาหกรรมบริการ มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตกำแพงแสน จังหวัดนครปฐม
สายคาเฟ่ สายชิลล์ และคนรักเครื่องดื่มห้ามพลาด! เตรียมพบกับงาน Jib Share Chill 2025 เทศกาลแห่งความสดชื่น ที่รวมร้านน้ำ slow bar กาแฟ moka pot และเครื่องดื่มสุดครีเอทีฟมาให้คุณได้ลิ้มลองกันแบบจัดเต็ม ท่ามกลางบรรยากาศสวนสวยสุดชิลล์ ที่จะเปลี่ยนวันธรรมดาให้กลายเป็นวันพิเศษ!
งานประจำปีปิดทอง วัดกำแพง บางขุนเทียน 5-9 มีนาคม 2568
ขอเชิญเที่ยวงานประจำปี 68 วัดกำแพง บางขุนเทียน ปิดทอง 5-9 มีนาคม 2568 ✅️ หลวงพ่ออู่ทอง ✅️ หลวงพ่อไปล่_ฉนฺทสโร ✅️ อาจารย์ชุบ โอภาโส ✅️ พระครูเกษมธรรมาภินันท์ ✅️ พระครูพิศาลปริยัติยานุกูล อดีตเจ้าอาวาสวัดกำแพง มหรสพ ชมฟรี ตลอดงาน
โนราโรงครู บูชาหิ้ง 5-8 มีนาคม 2568
โนราโรงครู บูชาหิ้ง ระหว่างวันที่ ๕-๘ มีนาคม ๒๕๖๘ ณ อ่าวเจ้ ทะเลน้อยชุมชนแห่งศรัทธา ดินแดนโนราหลายร้อยหิ้ง ณ อ่าวเจ้ บ้านทะเลน้อยน้อย อ.ควนขนุน จ.พัทลุง ในงานมี พิธีโนราโรงครู การแสดงปฐมฤกษ์กำเนิดหิ้ง ร่วมบูชาผ้าขาวม้าบูชาตาพราน Workshop ถุงผ้าโนราของฉัน โรงทาน อาหารทะเลน้อย [
โนรา]
การแสดงอันถกลเกียรติ ตำนานสงครามปราบกบฏฮ่อ วันที่ 5-13 มีนาคม 2568
จังหวัดหนองคาย ขอเชิญร่วมชมการแสดงอันถกลเกียรติ ตำนานสงครามปราบกบฏฮ่อ วันที่ 5-13 มีนาคม 2568 นี้ เวลา 18.00 เป็นต้นไป ณ เวทีหน้าอนุสาวรีย์ปราบฮ่อ ในงานฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี 198 ปี เมืองหนองคาย และงานกาชาด พ.ศ. 2568
เทศกาลลูกลมชมถ้ำเขาช้างหาย วันที่ 5-9 มีนาคม 2568
เทศกาลลูกลมชมถ้ำเขาช้างหาย วันที่ 5-9 มีนาคม 2568 เทศกาลประจำปีของชาวนาหมื่นศรี บริเวณหน้าถ้ำเขาช้างหาย ตำบลนาหมื่นศรี อำเภอนาโยง จังหวัดตรัง งานนี้มีทั้ง ชม ชิม ช้อป กับร้านค้ากว่า 50 ร้าน ประกอลด้วย อาหารพื้นถิ่น และสินค้าหัตถกรรมแสนประณีต เคล้าดนตรี ในบรรยากาศทุ่งนา
Best Buy Fair วันที่ 5 – 9 มี.ค. 68
Best Buy Fair @ สนามกีฬากลางจันทบุรี วันที่ 5 – 9 มี.ค. 68 เวลาเปิด-ปิด ทุกวัน 10:00 - 22:00 น. งานแฟร์ลดจัดเต็ม กับหลากหลายแบรนด์! ช้อปฟิน กินเพลินโชว์บอลลูน มหกรรมสินค้าแบรนด์ดัง/อาหารอร่อย สายช้อป สายกิน ห้ามพลาดค่ะ
PET UNIWOW โลกใบใหม่ของสัตว์เลี้ยงตัวป่วนและสัตว์หาชมยาก 5-9 มี.ค. 68
PET UNIWOW โลกใบใหม่ของสัตว์เลี้ยงตัวป่วนและสัตว์หาชมยาก 5-9 มี.ค. 68 Event Space ชั้น M, ICS Lifestyle Complex ตรงข้ามไอคอนสยาม กับ ความน่ารักของสัตว์เลี้ยง ที่จะยกขบวนมาเอาใจเหล่า Pet Lover โดยมีไฮไลต์เป็นสัตว์เลี้ยงตัวป่วน และสัตว์หาชมยาก สนุกกับการป้อนอาหารและเล่นกับน้องๆ อย่างใกล้ชิดใน Open Zoo Café ช็อปสินค้าสำหรับน้องๆ ตัวโปรดเพื่อเป็นเซอร์ไพรส์ชิ้นพิเศษ เอนจอยกับบรรยากาศความคึกคักของเหล่าสัตว์เลี้ยง
งาน “ฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี ๑๙๘ ปี เมืองหนองคาย และงานกาชาด ประจำปี ๒๕๖๘ วันที่ 5 มีนาคม 2568
ขอเชิญชาวหนองคาย และผู้ที่สนใจ ร่วม “ฟ้อนบายศรีเมืองหนองคาย” ในงาน “ฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี ๑๙๘ ปี เมืองหนองคาย และงานกาชาด ประจำปี ๒๕๖๘ ฝึกซ้อม ๓ - ๔ มีนาคม ๒๕๖๘ เวลา ๑๖.๐๐ น. เป็นต้นไป รำจริง วันที่ ๕ มีนาคม ๒๕๖๘ เวลา ๑๖.๐๐ น. เป็นต้นไป ณ บริเวณลานเฉลิมพระเกียรติสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ตำบลในเมือง อำเภอเมืองหนองคาย จังหวัดหนองคาย
หมายเหตุ การแต่งกายวันซ้อมย่อยและซ้อมใหญ่ วันที่ ๓ - ๔ มีนาคม ๒๕๖๘ : แต่งกายตามอัธยาศัย/ชุดสุภาพ การแต่งกาย วันที่ ๕ มีนาคม ๒๕๖๘ - สุภาพสตรี แต่งกายด้วยเสื้อขาว (แขนยาว) ผ้าถุงโทนสีน้ำเงินเข้มหรือสีคราม ห่มด้วยสไบโทนสีม่วง - สุภาพบุรุษ แต่งกายด้วยเสื้อสีขาว (แขนสั้น/แขนยาว) นุ่งผ้าโสร่งพื้นเมือง คาดเอวด้วยผ้าขาวม้าหรือผ้าโทนสีม่วง กำหนดการอาจเปลี่ยนแปลงได้ตามความเหมาะสม
SmartHeart presents Thailand International Pet Variety Exhibition @CNX 6-9 มีนาคม 2568
SmartHeart presents Thailand International Pet Variety Exhibition @CNX วันที่ 6-9 มีนาคม 2568 ที่เชียงใหม่ฮอลล์ เซ็นทรัลเชียงใหม่แอร์พอร์ต งานมหกรรมสัตว์เลี้ยงอันดับ 1 ในประเทศไทย ที่พร้อมให้เจ้าของสัตว์เลี้ยง และสัตว์เลี้ยงสุดแสนน่ารักน่ากอด เข้าร่วมงาน ที่มีทั้งการแข่งขันตื่นเต้นเร้าใจ และกิจกรรมสนุกๆที่ให้เหล่าสัตว์เลี้ยงและเจ้าของมาโชว์ศักยภาพ พร้อมยกร้านค้าสัตว์เลี้ยง และสินค้าหลากหลายพร้อมโปรโมชั่นตลอดทั้งงาน ไม่ว่าจะเป็น อาหารและขนม ของใช้ แฟชั่นเครื่องประดับ และบริการที่เกี่ยวกับสุขภาพสัตว์ต่างๆ มากกว่า 200 บูธ งานนี้ห้ามพลาด! พร้อมมาเปิดประสบการณ์แบบใหม่ที่ถูกใจทั้งคนรักสัตว์และสัตว์เลี้ยงอย่างแน่นอน
งานเกษตรนครนายก ปี 2568 มะยงชิด มะปรางหวาน ตระการตา วันที่ 6 - 10 มีนาคม 2568
งานเกษตรนครนายก ปี 2568 มะยงชิด มะปรางหวาน ตระการตา @นครนายก ระหว่างวันที่ 6 - 10 มีนาคม 2568 บริเวณ ลานอเนกประสงค์ท้ายเขื่อนขุนด่านปราการชล ตำบลหินตั้ง อำเภอเมืองนครนายก จังหวัดนครนายก
ภายในงานพบกับ มะยงชิด มะปรางหวาน • กิ่งพันธุ์มะยงชิดมะปรางหวาน • สินค้าเกษตรแปรรูปของเกษตรกรนครนายก • การประกวดต่างๆ เช่น มะยงชิด มะปรางหวาน กิ่งพันธุ์มะยงชิด กิ่งพันธุ์มะปรางหวาน การประกอบอาหารจากมะยงชิด เป็นต้น รายละเอียดกิจกรรมภายในงาน ติดตามได้ที่ Facebook :
สำนักงานเกษตรจังหวัดนครนายก กรมส่งเสริมการเกษตร หรือ โทร 037 311 289
งานประจำปีวัดพระเเท่นดงรังวรวิหาร 6-14 มีนาคม 2568
งานประจำปีวัดพระเเท่นดงรังวรวิหาร เริ่ม 6-14 มีนาคม 2568
Pet Variety X FIN FOOD FESTIVAL 6-9 มีนาคม 2568
Pet Variety X FIN FOOD FESTIVAL ตอน สหายห้าวเป้งอลเวงแดนคาวบอย จัดใหญ่ 4 วันเต็ม 6 - 9 มีนาคม 2568 ตั้งแต่ 11.00 - 21.00 น. ลานน้ำพุ ศูนย์การค้าเซ็นทรัลเชียงใหม่แอร์พอร์ต
การแข่งว่าวงานลาซัง 2025 งานรื่นเริงหลังการเก็บเกี่ยวที่ใหญ่ที่สุดในพัทลุง 6-8 มีนาคม 2568
การแข่งว่าวงานลาซัง 2025 งานรื่นเริงหลังการเก็บเกี่ยวที่ใหญ่ที่สุดในพัทลุง 6-8 มีนาคม 2568 ณ ทุ่งโตนดด้วน อ.ควนขนุน จ.พัทลุง กิจกรรมในงานลาซัง มาแซ่บกันให้สนั่นทุ่งโตนดด้วน ของหรอยเพียบ ดนตรีสุดมันส์ วงพญานาค ร้านระรื่น การแสดงจัดเต็ม เดอะชิลล์พัทลุง รำวงเวียงครกกันมันหยด
26th Thailand Cat Show 2025 วันที่ 7-9 มีนาคม 2025
26th Thailand Cat Show 2025
BCC Hall ชั้น 5 เซ็นทรัลลาดพร้าว
วันที่ 7-9 มีนาคม 2025 เวลา 10:00 - 21:00น.
Pattaya Music Festival 2025 (มีนาคม 2568)
Pattaya Music Festival 2025 เทศกาลดนตรีพัทยาประจำปี 2568 กำหนดจัด 3 สัปดาห์ได้แก่ วันที 7-8 มีนาคม, 15-16 มีนาคม, 22-23 มีนาคม 4 เวทีใน 4 จุด คือชายหาดพัทยา หาดจอมเทียน ลานโพธิ์ นาเกลือ และเกาะล้าน
เช็ครายชื่อศิลปินแต่ละเวทีได้ที่นี่
วันที่ 7 และ 8 มี.ค. 2568 ชายหาดพัทยา 3 เวที เวทีโค้งดุสิต เวทีพัทยาเหนือ ซอย 6 เวทีหลัก พัทยากลาง
วันที่ 14 และ 15 มี.ค. 2568 ชายหาดจอมเทียน 1 เวที แผนที่หาดจอมเทียน
วันที่ 21 และ 22 มี. ค. 2568 สวนสาธารณะลานโพธิ์ นาเกลือ 1 เวที แผนที่ลานโพธิ์ นาเกลือ
วันที่ 22 มี.ค. 2568 เกาะล้าน 1 เวที แผนที่หาดแสม เกาะล้าน
งานประเพณี ไหว้เจ้าพ่อเขาตกประจำปี 7-15 มีนาคม 2568
งานประเพณี ไหว้เจ้าพ่อเขาตก ประจำปี 2568 วันที่ 7-15 มีนาคม 2568 (9 วัน 9 คืน) ณ บริเวณถนนสายคู่ ทางเข้าวัดพระพุทธบาท อำเภอพระพุทธบาท จังหวัดสระบุรี ร่วมชมศิลปินดัง พร้อมการแสดงคอนเสิร์ตสุดพิเศษ ภายในงานมีเครื่องเล่น ของกินมากมาย
งานเทศกาลอาหาร@เกาะโพธิ์ ชลบุรี วันที่ 7-16 มีนาคม 2568
งานเทศกาลอาหาร@เกาะโพธิ์ ลานปั้ม ปตท.เกาะโพธิ์ สาย 331 จ.ชลบุรี วันที่ 7- 16 มีนาคม 2568 สวนสนุกชุดใหญ่ อาหารอร่อย คอนเสิร์ตศิลปินชื่อดัง
เสน่ห์ไม่จางที่บางสระเก้า ท่องเที่ยวชมวิถี 7-9 มีนาคม 2568
"เสน่ห์ไม่จางที่บางสระเก้า" ท่องเที่ยวชมวิถี ชิมอาหารพื้นถิ่น ช้อปสินค้าพื้นบ้าน ศุกร์ - เสาร์ - อาทิตย์ 7-9 มีนาคม 2568 ณ ตลาดสี่มุมเมรุ สนาม ร.ร.วัดบางสระเก้า อ.แหลมสิงห์ จ.จันทบุรี เริ่มจำหน่ายสินค้า 09.30 น. เป็นต้นไป
เสน่ห์ไม่จางที่บางสระเก้า 7-9 มีนาคม 2568
"เสน่ห์ไม่จางที่บางสระเก้า"
ร่วมสัมผัสเส้นทางท่องเที่ยวชุมชน 5 หมู่บ้าน
ศุกร์ - เสาร์ - อาทิตย์ 7-9 มีนาคม 2568 นี้ ขอเชิญชวนเที่ยวงานกันนะครับ ที่ตลาดสี่มุมเมรุ สนาม ร.ร.วัดบางสระเก้า อ.แหลมสิงห์ จ.จันทบุรี
เริ่มจำหน่ายสินค้า 09.30 น. เป็นต้นไป
งานมหาทานบารมีประเพณีบุญผะเหวดจังหวัดร้อยเอ็ด ประจำปี 2568 วันที่ 7-9 มีนาคม 2568
มากินข้าวปุ้น เอาบุญผะเหวด ฟังเทศมหาชาติ งานมหาทานบารมีประเพณีบุญผะเหวดจังหวัดร้อยเอ็ด ประจำปี 2568 ระหว่างวันที่ 7-9 มีนาคม 2568 ณ ลานสาเกตนคร สวนสมเด็จพระศรีนครินทร์ อำเภอเมืองร้อยเอ็ด จังหวัดร้อยเอ็ด
กำหนดการจัดงานฯ
วันที่ 7 มี.ค. 2568 -การประกวดธงผะเหวด -ร่วมแห่พระอุปคุตพระราชทาน -ร่วมพิธีสืบชะตาเสริมบารมี รับชมการแสดงหมอลำ"ศิลปินภูไท" ฟรี
วันที่ 8 มี.ค. 2568 -ชมขวานแห่ 13 กัณฑ์ -การประกวดเดี่ยวโหวด และเดี่ยวพิณ -อิ่มบุญทานข้าวปุ้นในสวน ฟรี -ชมการแสดง แสง สี เสียง รับชมการแสดงหมอลำ"หนูภารวิเศษศิลป์ , เจม จตุรงค์ " ฟรี
วันที่ 9 มี.ค 2568 -ฟังเทศมหาชาติ 13 กัณฑ์ -ร่วมขบวนแห่ กัณฑ์จอบ - กัณฑ์หลอน กว่า 101 ต้น - อิ่มบุญทานข้าวปุ้นในสวน ฟรี รับชมการแสดงหมอลำ"สาวน้อยลำเพลินโชว์" ฟรี
ติดต่อสอบถามรายละเอียดเพิ่มเติม ได้ที่ สำนักงานวัฒนธรรมจังหวัดร้อยเอ็ด Facebook : Pr.สำนักงานวัฒนธรรมจังหวัดร้อยเอ็ด โทร : 043-512606 ในวันเวลาราชการ
มหกรรมหมอลำเฟสติวัล ร้อยแก่นสารสินธุ์ 7-9 มีนาคม 2568
งาน "มหกรรมหมอลำเฟสติวัล ร้อยแก่นสารสินธุ์" 7-9 มีนาคม 2568 ณ ลานศาลากลางจังหวัดร้อยเอ็ด และบริเวณสวนสมเด็จพระศรีนครินทร์ร้อยเอ็ด งานที่รวมศิลปินแห่งชาติ สาขาหมอลำ จากเกือบทั้งภาค อีสานมาแสดงด้วยกัน ร่วมกับงานบุญใหญ่แห่งปี "มหาทานบารมี ประเพณีบุญผะเหวดร้อยเอ็ด" โดยสมาคมหมอลำภาคอีสาน ซึ่งนำโดยกลุ่มศิลปินแห่งชาติ เสาหลักภาคอีสาน คุณแม่ฉวีวรรณ ดำเนิน ราชินีหมอลำ, คุณแม่ราตรี ศรีวิไล ราชินีหมอลำซิ่ง, ป.ฉลาดน้อย ส่งเสริม, อ. ทรงศักดิ์ ประทุมสินธุ์ ผู้ให้กำเนิดเครื่องดนตรีโหวด, และศิลปิน หมอลำรุ่นใหม่ที่มีชื่อเสียง สมทบมากมาย
งานประจำปีปิดทองหลวงพ่อเพ็ง วัดอ้อมน้อย 7 - 13 มีนาคม 2568
งานประจำปีปิดทองหลวงพ่อเพ็ง วันที่ 7 - 13 มีนาคม 2568 ณ วัดอ้อมน้อย ตำบลอ้อมน้อย อำเภอกระทุ่มแบน จังหวัดสมุทรสาคร คอนเสิร์ตรถแห่ ทุกคืน รถแห่กำนันยุ่ง รถแห่ข้าวหอมมิวสิค รถแห่ชาญชัย รถแห่ไหทองคำ รถแห่ ร็อคออร์โต้ ซาวด์ รถแห่ S&P รถแห่ขวัญใจพ่อหลวง
งานเกษตรของดีอำเภอท่ายาง เพชรบุรี 7-16 มีนาคม 2568
งานเกษตรของดีอำเภอท่ายาง เพชรบุรี ครั้งที่ 32 วันที่ 7-16 มีนาคม 2568 บริเวณถนนใหญ่ และสนามฟุตบอลตลาดท่ายาง จ.เพชรบุรี ชมคอนเสิร์ตและการแสดงทุกคืน วงดัง เช่น บ่าววี เมนทอล ปิ๋ม ชุติมา เมลตวิษา ฯลฯ ชมขบวนแห่พิธีเปิดงาน การประชันขบวนแห่ นางรำงง 30 คณะและโชว์พิเศษ
ตามรอยอารยธรรมโบราณ ปราสาทนครหลวง 7-11 มีนาคม 2568
ตามรอยอารยธรรมโบราณ ปราสาทนครหลวง 7-11 มีนาคม 2568 บริเวณปราสาทนครหลวง อ.นครหลวง จ.พระนครศรีอยุธยา ชม ช็อป ชิม อาหารรสเด็ด สินค้าชุมชน การแสดงศิลปวัฒนธรรม งานรื่นเริง คอนเสริ์ตศิลปินดัง ตลอด 5 วัน ชมแสงสีเสียงชุด อยุธยาเรืองงาม ตำนานปราสาทนครหลวงคู่แผ่นดิน
มหกรรมว่าวสงขลา Songkhla Kite Festival 7 - 9 มีนาคม 2568
ขอเชิญชวนเที่ยวงาน มหกรรมว่าวสงขลา Songkhla Kite Festival ในระหว่างวันที่ 7 - 9 มีนาคม 2568 ณ ชายหาดเเหลมสมิหลา (ลานว่าวสระบัว) พบกับ การเเสดงว่าวเเฟนซีสวยงาม (เวลาแสดง 10.00-18.00) การเเสดงว่าวบินผาดโผน ว่าวไฟ วันละ 3 รอบ การแสดงว่าวไฟ เเสง สี (Night Fly) เวลา 18.00-20.00 น. กิจกรรม DIY สำหรับน้องๆเยาวชน ประดิษฐ์ว่าว ชิลๆ กับการแสดงดนตรีโฟล์คซอง บรรยากาศรับลมทะเล จัดโดย เทศบาลนครสงขลา
โคราชแซ่บ ทะเลซี้ด 7-9 มีนาคม 2568
โคราชแซ่บ ทะเลซี้ด : งานเดียวที่รวมอาหารถิ่นโคราชและอาหารทะเลไว้ด้วยกัน! แล้วมาพบกันกับ..งานที่รวมความอร่อยของอาหารถิ่นโคราชรสจัดจ้านและอาหารทะเลสดใหม่ไว้ในงานเดียว จะจัดขึ้นในวันที่ 7-9 มีนาคม 2568 เวลา 11.00 21.00 น. ตลอด 3 วัน
โซน “อาหารถิ่นโคราช” รวมเมนูพื้นเมืองรสชาติเข้มข้นที่หาทานได้ยาก
โซน “ซีฟู้ดสดจากทะเล” ยกขบวนอาหารทะเลสด ๆ มาปรุงเสิร์ฟถึงที่ การปรุงเมนูเด็ดจากวัตถุดิบไก่โคราชและกุ้งทะเลสดๆ “จานเด็ด ปะทะ จานเดือด” โดยเชฟชื่อดัง/ร้านอาหาร
การแสดงดนตรีโปงลาง “สายแนนลำตะคอง” การแสดงวงเดอะฮอบเปอร์, ดนตรีโฟล์คซอง สินค้าโปรโมชั่น “นาทีทอง” กุ้งตัวละบาท
กิจกรรมช็อป ชิม ชิล กับสินค้าท้องถิ่น และของฝากมากมาย โปรโมชั่นร่วมกับสถานประกอบการโรงแรมในเขตเมืองนครราชสีมา (ผู้ที่เข้าพักในโรงแรมที่เข้าร่วมโครงการ) รับคูปองส่วนลด ช็อป ชิม สินค้าภายในงาน บริเวณ Mall Parc ชั้น 1 เดอะมอลล์โคราช สอบถามรายละเอียด : ททท.สำนักงานนครราชสีมา 044-213-666
ประกวดร้องเพลง และการร้องเพลงเพื่อการกุศล งานฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี 198 ปี เมืองหนองคาย และงานกาชาด พ.ศ. 2568
จังหวัดหนองคาย จัด
การประกวดร้องเพลง และการร้องเพลงเพื่อการกุศล “งานฉลองอนุสาวรีย์ปราบฮ่อ ใต้ร่มพระบารมี 198 ปี เมืองหนองคาย และงานกาชาด พ.ศ. 2568” ส่วนราชการ หน่วยงาน อำเภอ สมาคมองค์กร บริษัท ห้าง ร้าน เชิญชวนประชาชนทั่วไป เข้าร่วมการประกวดร้องเพลง และการร้องเพลงเพื่อการกุศล ฯ ในวันที่ 7- 9 มีนาคม 2568 เวลา 18.00 น.เป็นต้นไป ณ เวทีถนนอาหารหน้าบริษัท เอ็นที จำกัด (มหาชน) ศูนย์บริการลูกค้าเอ็นที หนองคาย
งานแสดงศิลปะ Bangsaen Gallery โดย อ.ช้าง ศักดิ์จิระ เวียงเก่า 7 มีนาคม 2568
งานแสดงศิลปะ Bangsaen Gallery โดย อ.ช้าง ศักดิ์จิระ เวียงเก่า ในฐานะศิษย์เก่า มศว บางแสน ได้เข้าร่วมแสดงงานครั้งนี้ ซึ่งจัดโดย ม.บูรพาร่วมกับ ททท.และจังหวัดชลบุรี จัดขึ้นบริเวณหาดทรายริมทะเลหน้าโรงแรมเฮอริเทจ ในเย็นวันศุกร์ที่ 7 มีนาคม 2568 นี้ ภายใต้แนวคิดนำเอาศิลปะบนเฟรมที่เป็นภาพเขียนมาเป็นเสื้อผ้าที่สวมใส่ได้ หรือ wearable art ในคอลเลคชั่นที่ชื่อว่า เส้นสายและลายพื้น Space and Line จึงกลายเป็นศิลปินคนเดียวที่แสดงแฟชั่นโชว์ นอกนั้นศิลปินท่านอื่นจะเป็นภาพเขียน ภาพปั้น เซรามิคหรือสื่อผสม นั่นเอง
งานแสงศิลป์วิจิตรตระการตาเมืองแกลง 7-12 มี.ค. 68
งานแสงศิลป์วิจิตรตระการตาเมืองแกลง ระหว่างวันที่ 7-12 มี.ค. 68 ที่ปั๊มไต๋บางจาก อ.แกลง จ.ระยอง สัมผัสความงดงามที่ไม่เหมือนใครกับไฮไลต์ที่คุณต้องตื่นตาตื่นใจ: ทุ่งซากุระและทุ่งหญ้ามอญเหมือนหลุดเข้าไปในเทพนิยาย ทุ่งดอกไม้ไฟสีสันสดใสระยิบระยับทั่วพื้นที่ ท้องฟ้าจำลองสัมผัสความงดงามอันน่าหลงใหล หิมะจำลองสร้างบรรยากาศสุดพิเศษ พร้อมกิจกรรมสนุกมากมายที่จะเติมเต็มความสุขในทุกมุมมอง
งาน The Mall Korat X KlangSaeng Summer Camp 7-9 มีนาคม 2568
งาน The Mall Korat X KlangSaeng Summer Camp ตลาดวินเทจขึ้นห้างฯที่ใหญ่ที่สุดในภาคอีสาน THE MALL KORAT X KLANGSAENG SUMMER CAMP วันที่จัดงาน : 7-9 มีนาคม 2568 ที่ MCC Hall และ วาไรตี้ ฮอลล์ ชั้น 3 เดอะมอลล์โคราช
จัดเต็มของแรร์ไอเท็มแบบล้นฮอลล์กว่าเดิม ต้อนรับ SUMMER กว่า 120,000 ชิ้น จาก 250 ร้านค้าทั่วประเทศ นักสะสมของวินเทจ เตรียมช้อปที่ Share Rare Market "แหล่งรวมของแรร์ที่แท้ทรู" ยกขบวนสินค้าสุดคลาสสิก หายาก จากไทยและทั่วโลก มาให้คุณเลือกสะสมกันอย่างใกล้ชิด อาทิ สินค้ามือสอง,สินค้ายุค 90 เสื้อยืดแรร์ไอเท็ม เสื้อวง กระเป๋า รองเท้า สินค้าแฟชั่น ของตกแต่งบ้าน และอื่นๆอีกมากมาย ให้คุณเลือก Mix & Match Vintage fashion style ได้ตามใจคุณ ไฮไลท์สุดจึ้ง กับ Community Vintage Taste คอมมูโดนใจ ซื้อ-ขายตัวแรร์ กับพี่น้องเราชาวซัมเมอร์แคมป์ ชวนมาฟินไปกับเพลงอินดี้โดยศิลปินวงโปรด ตลอด 3 วันจัดงาน 7 มี.ค. 68 เวลา 18.00 น. พบ Doorplant 8 มี.ค. 68 เวลา 18.00 น. พบ YouthBrush 9 มี.ค. 68 เวลา 18.00 น. พบ Surff
งานเทศกาลผลไม้นานาพรรณ มหัศจรรย์ ของดีเนินมะปราง งานเทศกาลมะม่วงเนินมะปราง ประจำปี 2568 วันที่ 7-16 มีนาคม 2568
เชิญเที่ยวงานเทศกาลผลไม้นานาพรรณ มหัศจรรย์ ของดีเนินมะปราง งานเทศกาลมะม่วงเนินมะปราง (Amazing fruits and unseen noenmaprang festival 2025) ประจำปี 2568 ระหว่างวันที่ 7-16 มีนาคม 2568 ทุกวันชมการแสดงของทางอำเภอและผู้นำท้องถิ่น พบกิจกรรมปั่นจักรยาน ประกวดผลผลิต มะม่วง ประกวดร้องเพลง ประกวดประเพณีเสน่ห์ของดีเนินมะปราง ประกวดส้มตำมะม่วงลีลา แข่งขันจับปลาไหล ซ้อมไก่เก่งเพื่อเพิ่มมูลค่าทางเศรษฐกิจ ประกวดข้าวเหนียวมูลหน้ามะม่วง ประกวดรำวงย้อนยุค อปท. เดินแบบผ้าไทใส่สนุก แข่งขันเปตอง ประกวดธิดามะม่วง 12 มีค ชมคอนเสิร์ต ไผ่ พงศธร
“เสน่ห์ไม่จาง ที่บางสระเก้า” 7-9 มีนาคม 2568
“เสน่ห์ไม่จาง ที่บางสระเก้า” 7-9 มีนาคม 2568 ที่ สนามตลาดสี่มุมเมรุ ตำบลบางสระเก้า อำเภอแหลมสิงห์ จังหวัดจันทบุรี ตั้งแต่เวลา 10.00 น. เป็นต้นไป
เชิญชวนเดินเล่นแบบสบาย ๆซึมซับบรรยากาศแห่งวิถีชุมชนบางสระเก้า พร้อมนั่งรถซาเล้งท่องเที่ยวไปตามเส้นทางที่เรียบง่ายแต่เปี่ยมไปด้วยสีสัน ลิ้มลองอาหารคาวหวานรสเลิศ เดินชมและเลือกซื้อผลิตภัณฑ์พื้นบ้าน โดยเฉพาะเสื่อกกบางสระเก้า งานฝีมือที่บอกเล่าความประณีตของคนในชุมชน สัมผัสการเรียนรู้ผ่านประสบการณ์ตรงกับ D-HOPE (ดี-โฮป) ที่เปิดโอกาสให้คุณได้ ลงมือทำด้วยตัวเอง ศึกษาความงดงามของ ภูมิปัญญาท้องถิ่น และเข้าใจแก่นแท้ของวิถีชีวิตที่สืบทอดกันมา
งาน SAEN INDIE ดนตรีนอกกระแส EP.2 วันที่ 7-8 มีนาคม 2568
งาน "SAEN INDIE ดนตรีนอกกระแส" EP.2 วันที่ 7-8 มีนาคม 2568 สถานที่ Bora Bora เริ่ม 15.00-00.00 การรวมตัวของศิลปินนักผลิตเพลงจากอุตสาหกรรมบางแสน SAEN INDIE ดนตรีนอกกระแส เฉพาะกลุ่มใน พื้นที่บางแสน ที่มีหลากหลายแนวเพลง pop / rock / reggae synth-pop / Electronic rock / alternative rock surf punk Hardcore punk / Post Rock / heavy metal
เต็มอิ่มกับเพลงดีที่คุณอาจยังไม่เคยฟัง จัดเต็ม 2 วันกับ 18 วง กว่า 100 บทเพลง พาราเซตามอล / Niyom Khom / Mind Wanders / Ride Away ANALOG / FUNG HER / HIGHxVOLTAGE / Fortamaya TH / Monkey Clinic Mind be better / catnip.band / กรวี / NOISE-Næ / Acid Jesus / ????????????????. / Songpaku / Toy chayapon / A SariD
มักม่วน มิวสิคฟ้อน เทศกาลงานดนตรีลูกทุ่งอินดี้ 8 มีนาคม 2568
“มักม่วน มิวสิคฟ้อน” เทศกาลงานดนตรีลูกทุ่งอินดี้ สำหรับคนมักม่วน มักฟ้อน มักจอย “บักเสี่ยว” จะนำท่านพบกับ 7 ศิลปินลูกทุ่งสุดอินดี้ชื่อดังทั่วฟ้าเมืองไทย ที่จะนำทุกท่านเข้าสู่บรรยากาศม่วนจอย สอย สอย สอย วันเสาร์ที่ 8 มีนาคม 2568สถานที่จัดงาน Manus Vintage Room Park บ้านในดง (แถววัดเขาดีสลัก) ต.ดอนคา อ.อู่ทอง จ.สุพรรณบุรี
Dark Sky Tourism l Star Party 2025 แคมป์ปิ้งดูดาวที่ควนหรนฮิลล์ 8-9 มีนาคม 2568
Dark Sky Tourism l Star Party 2025 ณ ควนหรนฮิลล์ อำเภอนาทวี จังหวัดสงขลา 8-9 มีนาคม 2568 การท่องเที่ยวเชิงดาราศาสตร์ 2 วัน 1 คืน
เยี่ยมชมชุมชนการท่องเที่ยว • สังเกตการณ์วัตถุท้องฟ้าที่น่าสนใจ ดวงจันทร์ ดาวพฤหัสบดี ดาวอังคาร • ตื่นเช้าดูทางช้างเผือก ดูดวงอาทิตย์ขึ้น • แคมป์ปิ้งจุดชมวิว 360 องศา ควนหรนฮิลส์
คัดเลือกเพียง 30 ท่าน เท่านั้น 12-20 กุมภาพันธ์ 2568 รับสมัคร 22 กุมภาพันธ์ 2568 ประกาศผลการคัดเลือก 22-23 กุมภาพันธ์ 2568 ยืนยันเข้าร่วมกิจกรรม และชำระค่าลงทะเบียน 300 บาท ✅ ค่าลงทะเบียน 300 บาท/คน ✅ ฟรีค่าอาหาร ✅ ค่าธรรมเนียมพื้นที่กางเต๊นท์ (ผู้เข้าร่วมนำเต๊นท์มาเอง) ✅ ค่ารถเดินทางภายในกิจกรรม ✅ ค่าเข้าชม
ลงทะเบียนออนไลน์ชิมปูชัก@ชะอำ 8-16 มีนาคม 68
เทศบาลเมืองชะอำ และททท.สาขาชะอำ เชิญชวนเที่ยวงาน ชิมปูชัก@ชะอำ 8-16 มีนาคม 68 บริเวณจุดชมวิวชายหาดชะอำ จ.เพชรบุรี ชมคอนเสิร์ตทุกคืน
งาน King of Burnout 8 มีนาคม 2025 งานจัดอันดับการแข่งรถAmerican V-Twin
งาน King of Burnout 8 มีนาคม 2025 @ Bangkok Drag Avenue คลอง5 ปทุมธานี งานจัดอันดับการแข่งรถ American V-Twin และคอนเสิร์ตที่มีศิลปินชั้นนำเช่น 1. โจรลอยนวล 2. Zamzenlazer 3. ฟลุ๊ค ไอน้ำ , วิดไฮเปอร์ , หวิว ณัฐพนธ์ 4. Ninety dogz พร้อม สินค้าจากทั้งไทยและต่างประเทศอีกมายมาย
เทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 8-16 มีนาคม 2568 โรบินสันบ้านฉาง
เทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 8-16 มีนาคม 2568 โรบินสันบ้านฉาง จ.ระยอง ลานหุ่นตุ๊กตาโคมไฟ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกค่ำคืน&ลานเบียร์
Spicy On The Beach ครั้งที่ 3 วันเสาร์ที่ 8 มีนาคม 2568 หาดแหลมเจริญ จ.ระยอง
Chang Cold Brew Cool Club presents Spicy On The Beach ครั้งที่ 3 The Original วันเสาร์ที่ 8 มีนาคม 2568 ณ หาดแหลมเจริญ จ.ระยอง ศิลปิน J JETRIN, NON TANONT, SINGTO NUMCHOK, WIN SQWEEZ ANIMAL, THE PARKINSON, BETTER WEATHER และ SHERRY
งาน "เพลินพิจิตร พิสมัย แสงศรัทธาราตรี ที่ย่านเก่าวังกรด" 8-9 มีนาคม 2568
ททท.สำนักงานนครสวรรค์ ขอเชิญร่วมสัมผัสมนต์เสน่ห์ยามราตรี ในงาน "เพลินพิจิตร พิสมัย แสงศรัทธาราตรี ที่ย่านเก่าวังกรด" ในวันที่ 8-9 มีนาคม 2568 ณ ย่านเก่าวังกรด อ.เมือง จ.พิจิตร ค่ำคืนแห่งศรัทธา มนต์เสน่ห์แห่งแสงไฟยามราตรีที่ชวนให้คุณหลงใหล พบ 4 จุด Highlights
• 1 มุม(ไม่)ลับ สถานีรถไฟวังกรด: สัมผัสความงดงามของสถาปัตยกรรม และประวัติศาสตร์อายุกว่า 100 ปี ที่จะถูกแต่งแต้มด้วยแสงไฟสีสันสดใส
• บ้านหลวงประเทืองคดี: ชมความสง่างามสถาปัตยกรรมที่สะท้อนความรุ่งเรืองในอดีต แหล่งเรียนรู้ประวัติศาสตร์สำคัญ พร้อมการประดับไฟที่เพิ่มความโดดเด่น
• ศาลเจ้าพ่อวังกลม: สักการะสิ่งศักดิ์สิทธิ์คู่บ้านคู่เมือง ขอพรเลื่อนขั้น เลื่อนตำแหน่ง ค้าขายร่ำรวย พร้อมชมการประดับไฟที่สร้างบรรยากาศอันศักดิ์สิทธิ์
• หอนาฬิกา: ชมความงามของหอนาฬิกาเก่าแก่ที่ตั้งตระหง่านอยู่ใจกลางย่านการค้า พร้อมการประดับไฟที่เพิ่มความโดดเด่น ❔จุด Secret (ไม่)ลับ ที่ซ่อนบรรยากาศความสุขให้ได้ค้นหา เพลิดเพลินกับกิจกรรม 5 เพลิน - เพลินมู : ขอพรเจ้าพ่อ-เจ้าแม่วังกลม เสริมมงคล เฮงทั้งปี - เพลินใจ : ชมเเสงศรัทธา ยามราตรี - เพลินจิต : กิจกรรม เปิดดวง เปิดโชค รับทรัพย์ - เพลินชิม : ตำนาน อาหารอร่อย - เพลินสนุก : รำวง 3ส & Swing Dance
LakelandFest ปรากฏการครั้งแรกในจังหวัดพะเยา วันเสาร์ที่ 8 มีนาคม 2568
LakelandFest ปรากฏการครั้งแรกในจังหวัดพะเยา กับงานเทศการดนตรีเฟสติวัลที่รวบรวม Culture, Music และ Street art เข้าไว้ด้วยกัน บนพื้นที่จัดงานที่สวยที่สุด ชิลล์ที่สุด และมันส์ที่สุด ในบรรยากาศริมน้ำกว๊านพะเยา ในวันเสาร์ที่ 8 มีนาคม 2568
ภายในงานพบกับ * Playground * ปลานิลเต็มบ้าน * Moving and Cut * DJ ชื่อดังของภาคเหนือ นอกจากนั้นภายในงานยังมี * เวที Street show ที่เปิดโอกาสให้ศิลปินรุ่นใหม่ รวมถึง DJ มาปล่อยของกันเต็มที่ * จุดถ่ายภาพเช็คอิน กับโซน Street art โดยศิลปินรุ่นใหม่จากพะเยา ที่ความสามารถไม่น้อยไปกว่าที่อื่น * พบกับ Pop culture ที่สะท้อนถึงความเป็นพะเยา และชุมชนรอบกว๊าน ที่จะมาสร้างสีสันภายในงาน * อิ่มอร่อยไปกับโซนอาหาร และเครื่องดื่มหลากหลาย ที่พร้อมเสิร์ฟให้ทานกันอย่างจุใจ
River Craft Market ครั้งที่ 4 วันที่ 8- 9 มีนาคม 2568
River Craft Market ครั้งที่ 4 จะจัดขึ้นวันที่ 8- 9 มีนาคม 2568 (เสาร์-อาทิตย์ ที่สอง ของทุกเดือน ) ณ บริเวณสวนใต้ต้นไม้ ร้าน H2 River Cafe ซ.ท่ามะขาม ทางเข้าร้านก่อนขึ้นสะพานจินดา ที่มาจากแยกแก่งเสี้ยนค่ะ มีร้านใหม่ๆ รอ update และ workshop เก๋ๆ จากหลายๆ ร้าน ให้ทุกคนมาสัมผัสและทดลองทำ
เทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 8-16 มีนาคม 2568
เทศกาลหุ่นตุ๊กตาโคมไฟนานาชาติ 8-16 มีนาคม 2568 โรบินสันบ้านฉาง จ.ระยอง ลานหุ่นตุ๊กตาโคมไฟ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกค่ำคืน&ลานเบียร์
สมุทรสาครพันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 23 วันอาทิตย์ที่ 9 มีนาคม 2568
งาน "สมุทรสาครพันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 23" วันอาทิตย์ที่ 9 มีนาคม 2568 ณ ศาลพันท้ายนรสิงห์ จังหวัดสมุทรสาคร ระยะทางเส้นแข่งขันใหม่ #สะพานแดง แลนด์มาร์คใหม่สมุทรสาคร ระยะ 21.1 km. / 10 km. / 4km.
พิธีทำบุญเมือง ฉลอง 557 ปี เมืองนครราชสีมา ตักบาตรพระ 10,000 รูป วันอาทิตย์ที่ 9 มีนาคม 2568
ขอเชิญร่วมพิธีทำบุญเมือง ฉลอง 557 ปี เมืองนครราชสีมา ตักบาตรพระ 10,000 รูป น้อมถวายเป็นพุทธบูชา ถวายเป็นพระราชกุศล แด่สมเด็จพระบรมไตรโลกนาถ สมเด็จพระนารายณ์มหาราช อุทิศส่วนกุศลแด่ท่านท้าวสุรนารี บรรพบุรุษ และผู้มีอุปการคุณต่อประเทศชาติพระพุทธศาสนาและแผ่นดิน ในวันอาทิตย์ที่ 9 มีนาคม พ.ศ. 2568 เวลา 06.00-08.30 น. ณ บริเวณอนุสาวรีย์ท้าวสุรนารี จังหวัดนครราชสีมา
สนับสนุนโครงการได้ที่ คณะสงฆ์จังหวัดนครราชสีมา โดยฝ่ายสาธารณสงเคราะห์ ชื่อบัญชี ตักบาตรโคราช ธนาคารออมสิน บัญชี 020 432 702 874
Verasu Bakery & Coffee Fair วันนี้ – 23 มี.ค. 68
Verasu Bakery & Coffee Fair Double Deal ดีลพิเศษพลาดไม่ได้! เครื่องทำขนม อุปกรณ์เบเกอรี่ และเครื่องชงกาแฟ แบรนด์ดังนำเข้าราคาพิเศษ วันนี้ – 23 มี.ค. 68 ช้อปเลย! ที่วีรสุ สาขา แฟชั่นไอส์แลนด์ (ชั้น B)
วัดโสธรวรารามวรวิหาร LINK
ที่นี่คือวัดสำคัญที่สุดของจังหวัดฉะเชิงเทราเนื่องจากเป็นที่ประดิษฐาน "หลวงพ่อพุทธโสธร" พระพุทธรูปคู่บ้านคู่เมืองของจังหวัดฉะเชิงเทรา ทุกวันภายในพระอุโบสถจะอบร่ำไปด้วยควันจากธูปเทียน อันเป็นเสมือนตัวแทนแห่งศรัทธาของผู้คนจากทุกสารทิศที่เดินทางมาสักการะและขอพรจากหลวงพ่อพุทธโสธรกันอย่างเนืองแน่น
เชื่อกันว่าพระพุทธรูปรูปองค์นี้มีความศักดิ์สิทธิ์มาก ดลบันดาลให้ทุกสิ่งที่ขอสำเร็จสมปรารถนา พืชพันธุ์ธัญญาหาร อุดมสมบูรณ์ ปราศจากโรคภัยไข้เจ็บนั่นเอง
ที่ตั้งวัดโสธรวรารามวรวิหาร :134 ถ.เทพคุณากร ต.หน้าเมือง อ.เมือง จ.ฉะเชิงเทรา
เบอร์โทรศัพท์ : 038-511-048
Saraburi Central of Food Expo 2025 วันที่ 12-16 มีนาคม 2568
Saraburi Central of Food Expo จัดงานระหว่างวันที่ 12 -16 มีนาคม 2568 ณ บริเวณลานจอดรถศูนย์การค้าโรบินสัน ไลฟ์สไตล์ สระบุรี ตั้งแต่เวลา 10.00 - 21.00 น.
"งานเทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทศรีสะเกษ" ประจำปี 2568 วันที่ 12-16 มีนาคม 2568
"งานเทศกาลดอกลำดวนบาน สืบสานประเพณีสี่เผ่าไทศรีสะเกษ" ประจำปี 2568 งานจัดขึ้นระหว่างวันที่ 12-16 มีนาคม 2568 ณ สวนสมเด็จพระศรีนครินทร์ศรีสะเกษ กิจกรรมภาคกลางคืน 14-16 มีนาคม 2568 เริ่มตั้งแต่ เวลา 19.00 น. -ชมการแสดง เเสงสี เสียง "อารยธรรมแห่งศรัทธา มนตราศรีพฤเธศวร" ตอนใหม่ "กำเนิดเทวราชา สถาปนาศรีพฤทเธศวร"
การแข่งขัน Asia Continental Barista Championship 2025 วันที่ 13-16 มีนาคม 2568 - The Mall Korat
เชิญชวนบาริสต้าทั่วประเทศไทย มาโชว์ฝีมือทั้งศาสตร์และศิลป์ในการชงกาแฟ ร่วมลงสนามประลองในการแข่งขัน Asia Continental Barista Championship 2025 เวทีเพื่อเฟ้นหาแชมป์บาริสต้าประเทศไทย ชิงถ้วยพระราชทาน ”สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณ วลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี“ การแข่งขันมีทั้งหมด 4 วัน วันที่ 13-16 มีนาคม 2568 - The Mall Korat ดูรายละเอียดและสมัครเข้าร่วมแข่งขัน Asia Continental Barista Championship 2025 ได้ที่
https://register.acbc2025.org รับผู้เข้าแข่งขันจำนวน 60 ท่าน สมัครได้แล้ววันนี้ (ลิ้งจะเปิด และปิดอัตโนมัติ เมื่อผู้เข้าแข่งขันสมัครครบ)
งาน "AIR SEA LAND PHUKET 2025" สุดยอดมหกรรมกีฬา & คอนเสิร์ตแห่งปีที่ภูเก็ต 13 - 16 มีนาคม 2568 หาดป่าตอง ภูเก็ต
งาน "AIR SEA LAND PHUKET 2025" สุดยอดมหกรรมกีฬา & คอนเสิร์ตแห่งปีที่ภูเก็ต! โดย การกีฬาแห่งประเทศไทย 13 - 16 มีนาคม 2568 หาดป่าตอง ภูเก็ต ดวลเดือดกีฬามันส์ สู้กันแบบยิบตา! Muay Thai SOFT POWER • 3X3 Basketball • Teqball & Taekwondo • Sports Expo พร้อมคอนเสิร์ตริมชายหาดสุดเร้าใจ! ยกทัพศิลปินและ DJ มาแบบจัดเต็ม THE TOYS • URBOYTJ • DJ 22Bullet • DJ Tong Apollo • DJ Roxy June
Chumphon Robusta Coffee Fest 2025 วันที่ 14-16 มีนาคม 2568
งาน ”Chumphon Robusta Coffee Fest 2025“ จังหวัดชุมพร ในวันที่ 14-16 มีนาคม 2568 ณ สวนสาธารณะอาภากรเกียรติวงศ์ อำเภอเมืองชุมพร จังหวัดชุมพร ตั้งแต่เวลา 10.30 - 21.00 น. จัดโดยสำนักงานพาณิชย์จังหวัดชุมพร เพื่อผลักดันให้ชุมพร ขึ้นแท่นเป็นมหานครโรบัสตา ได้รวบรวมร้านกาแฟโรบัสต้าขึ้นชื่อในจังหวัดชุมพร มาให้กับพี่น้องชาวชุมพรทุกคน พร้อมด้วยกิจกรรมต่างๆ ภายในงานมากมาย รวมถึงการแสดงดนตรีจากศิลปินชั้นนำ อาทิ เขียนไขและวานิช, ชาติ สุชาติ (The Voice) และหญิง ธิติกานต์ มามอบความสนุกและความสุขให้กับพี่น้องชาวชุมพร นอกจากนี้ยังมีกิจกรรมให้ทุกท่านได้ร่วมสนุกอีกมากมาย อาทิ กิจกรรมถ่ายรูปจาก Photo Booth ฟรี! พร้อมรับรูปสุดชิค สุดคูล ไม่มีค่าใช้จ่าย, กิจกรรมเช็คอินรับคูปองแทนเงินสด เป็นต้น
นอกจากนี้ยังเปิดโอกาสให้กับ ”บาริสต้าหน้าใหม่“ ในการแข่งขันดริปกาแฟโรบัสตา ซึ่งเปิดรับสมัครเพียง 20 คนเท่านั้น เข้าร่วมประลองฝีมือการดริปกาแฟชั้นเลิศ โดยการตัดสินได้รับเกียรติจาก Q Robusta Grader ทีมผู้เชี่ยวชาญกาแฟโรบัสตาของจังหวัดชุมพร
กิจกรรม Muk street art 2025 #4 วันที่ 14-16มีนาคม 2568
กิจกรรม
Muk street art 2025 #4 วันที่ 14-16มีนาคม 2568 ที่ Muk Street Art & Exhibition 2025 ครั้งที่ 4 ปลุกเมืองที่หลับไหล และเสริมสร้างเศรษฐกิจ "ด้วยงานศิลปะ" ครั้งนี้เป็นการจัดงานผสมผสานระหว่างการชมนิทรรศการและงานเทศกาล มาในรูปแบบ ”ศิลปะบอกเล่าชนพื้นเมืองลุ่มนำ้โขง“ ภายใต้คำแทนว่า “เล่นมุก” เราเติม“มา”เพื่อเชิญชวนมาร่วมกิจกรรมและมาเที่ยวมุกดาหารกัน
สถานที่จัดงาน Muk Street Art ย่านเมืองเก่า ถนนคนเดินย่านเมืองเก่า นิทรรศการภาพวาดและผ้ามุกดาหาร ถนนที่กิน ที่เที่ยว เวียดนามทาวน์ พิกัด: ย่านเมืองเก่ามุกดาหาร การนำเสนอกลิ่นอายของมุกดาหารผ่านงานสร้างสรรค์แขนงต่างๆ โดยรวบรวมจากศิลปินในภาคอิสาน มุกดาหารและสะหวันนะเขตมาร่วมสร้างสรรค์ผลงานในบรรยากาศใหม่ๆ
การนำเสนองานศิลปะรูปแบบต่างๆ ทั่วทั้งงาน ???? นิทรรศการภาพวาด ???? นิทรรศการผ้าพื้นเมืองมุกดาหาร ????การแสดงศิลปะวัฒนธรรมลุ่มนำ้โขง ????การแสดงดนตรีวัฒนธรรมลุ่มแม่นำ้โขง ????เดินแบบสตรีทแฟชั่นโชว์ผ้ามุกดาหาร ???? Art Talk พูดคุยเกี่ยวกับงานศิลปะและผ้าพื้นเมืองจังหวัดสนุก ???? Work Shop ลงมือทำไปพร้อมกัน ???? DJ หมอลำและแนวเพลงร่วมสมัย ???? Food & Music ???? Walking Street ถนนคนเดินย่านเมืองเก่า ???? Lighting การตกแต่งไฟ ???? การแสดงผลงานศิลปะจากศิลปินรับเชิญ ????การแสดงผ้าพื้นเมืองสำเร็จรูปจากผู้ประกอบการ
ร่วมสนับสนุนกิจกรรมดังกล่าว เพื่อพัฒนาคน พัฒนาเมือง เสริมสร้างเศรษฐกิจ ผ่านงานศิลปะและเพื่อบันทึกเป็นสมบัติ ของชาวจังหวัดมุกดาหารต่อไป
PELUPO 2025 14-15 March 2025 Treasure Hill Golf Club Chonburi
PELUPO 2025 14-15 March 2025 Treasure Hill Golf Club Chonburi FULL PELUPO 2025 lineup: Friday, March 14 * Corinne Bailey Rae * DEPAPEPE Official * Hiromi * tahiti 80 * Unda Alunda * Alfa Mist * Ginger Root * Matthew Ifield Saturday, March 15 * HONNE * Dayglow * The Paper Kites * JUST” * Yung Kai * TOFU * Dengue Fever * Autograf If you haven’t grabbed your ticket yet, now’s the perfect time! Don’t miss this unforgettable weekend of music, connection, and pure magic.
หอการค้าแฟร์และของดีแม่สอด จ.ตาก ครั้งที่ 1 ประจำปี 2568 จัดขึ้นในวันที่ 14-23 มีนาคม 2568
หอการค้าจังหวัดตาก ขอเชิญเที่ยวงานหอการค้าแฟร์และของดีแม่สอด ครั้งที่ 1 ประจำปี 2568 จัดขึ้นในวันที่ 14-23 มีนาคม 2568 ณ สนามกีฬาสมเด็จพระนเรศวรมหาราช ชุมชนชุมพลพัฒนา ถนนแม่สอด-ตาก ตำบลแม่สอด อำเภอแม่สอด จังหวัดตาก ชมการแสดงศิลปวัฒนธรรมชนเผ่าต่างๆ มวยไทย-พม่าคาดเชือกย้อนยุค ละครพม่า สตริงพม่า การแสดงดนตรีไทยที่ท่านชื่นชอบ สวนสนุกชุดใหญ่ มหกรรมคอนเสิร์ตจากศิลปินชั้นนำ
ฮัก เกลือหวาน เทศกาลประติมากรรมเกลือ ครั้งที่ 10 ART of SALT #10 FEST 2025
ฮัก เกลือหวาน เทศกาลประติมากรรมเกลือ ครั้งที่ 10 ART of SALT #10 FEST 2025 “ชมงานศิลป์ ชิมอาหารถิ่น เช็คอินความสุข” 10 ปี สำหรับการเดินทางของ Art และ Salt วันที่ 14-16 มี.ค. 2568 ณ จุดชมวิวบางแก้ว อ.บ้านแหลม จ.เพชรบุรี ตั้งแต่เวลา 17.00 น. เป็นต้นไป
ฟังเพลงชิลล์ๆ บรรยากาศริมทะเล พบกับ 14 มี.ค. : มหาหิงค์ 15 มี.ค. : Joker Family 16 มี.ค. : The Gentlemans ร่วมด้วย : สุขอนันต์ หนมโหนด ไทยเชย จั๊กจี๋ แบลคโรส ดูซี่ อาหารพื้นถิ่นคัดเน้นๆ กว่า 60 ร้านค้า
งาน "hi สีสัน อุตรดิตถ์" มหกรรมศิลปะดนตรีและของดีจังหวัดอุตรดิตถ์ ในวันศุกร์ เสาร์ อาทิตย์ ที่ 14 15 16 มีนาคม 2568
สำนักงานวัฒนธรรมจังหวัดอุตรดิตถ์ ชวนเที่ยวงาน "hi สีสัน อุตรดิตถ์" มหกรรมศิลปะดนตรีและของดีจังหวัดอุตรดิตถ์ ในวันศุกร์ เสาร์ อาทิตย์ ที่ 14-16 มีนาคม 2568 นี้ ณ จวนผู้ว่าฯหลังเก่าและหอวัฒนธรรมจังหวัดอุตรดิตถ์
พบกับ!! การแสดงผลงานศิลปะของศิลปินที่ยิ่งใหญ่หลากหลายแขนงของชาวอุตรดิตถ์ รวมทั้งกิจกรรมเปิดถนน street art แสดงผลงานจากนักสร้างสรรค์แห่งเมืองอุตรดิตถ์ มารวมตัวกัน แบบที่ท่านจะไม่เคยเจอมาก่อน!! และเปิดจวนผู้ว่าฯหลังเก่าให้ทุกท่าได้เข้าชมและสัมผัสนิทรรศการประวัติศาสตร์ I’m อุตรดิตถ์ ตั้งแต่ 4 โมงเย็นถึง 4 ทุ่ม ภายในงานยังมีการจัดแสดงดนตรีพื้นบ้านและร่วมสมัยรวมทั้งวงลูกทุ่งและสตริงเต็มรูปแบบ รวมทั้งถนนของกินอาหารพื้นถิ่นมากกว่า 70 ร้าน และการออกร้านสาธิตอาหารเมนูดีเมนูเด็ดๆของอุตรดิตถ์มากมาย
เทศกาลกาแฟgi กาแฟวังน้ำเขียว โคราช coffee Gi korat fest 2025 ครั้งที่2 วันที่ 14-16 มีนาคม 2568


เทศกาลกาแฟgi กาแฟวังน้ำเขียว โคราช coffee Gi korat fest 2025 ครั้งที่2" วันที่ 14-16 มีนาคม 2568 นี้ เวลา 10.00 - 20.00 น. จะมาจิบกาแฟ ชมบรรยากาศวิวอ่างเก็บน้ำห้วยขมิ้น และพบกับเกษตรกรที่ปลูกกาแฟวังน้ำเขียว และโรงคั่วกาแฟชื่อดัง ที่ตั้งใจจัดกิจกรรมเล็กๆ ภายใต้คอนเซ็ป หมู่บ้านกาแฟเล็กๆแห่งหนึ่ง Small Coffee Village รวมเรื่องราวของคนปลูก แปรรูป คั่ว ชง ส่งต่อการชิมไปสู่ผู้เข้ามาร่วมงาน . ภายในงานพบกับ -การเรียนรู้เรื่องการปลูก และโปรเซสกาแฟ แบบรวบรัด.. -เวิร์คช้อปกาแฟคั่วมือ คั่วยังไงให้เซียนเหมือนโรงคั่ว ฟรี สำหรับคนที่อยากเป็น Home roasting จนถึงนำไปประกอบอาชีพแบบโปร คั่วเสร็จจะชงชิมเลยหรือเอากลับบ้านได้ ไม่มีค่าใช้จ่าย.. -กาแฟชิมฟรีตลอดงาน จากโรงคั่วหลายแหล่ง หลายพื้นที่ปลูก หลายโปรเซส มีกาแฟจากโรงคั่วชั้นนำ กาแฟประกวดระดับท้องถิ่น นิดๆหน่อยๆพอเป็นพิธี..มาแล้วไม่เหงาแน่ ในงานมีสินค้าและกิจกรรมมากมายพบกับการรวมตัวคนรักกาแฟ ได้ใน พิเศษ พบกับศิลปิน “ อภิรมย์ ” ในวันที่ 15 มีนาคม เข้าชมฟรีไม่มีค่าใช้จ่าย
Ranong Coffee Connext : ระนองคอฟฟี่คอนเน็กซ์ SS2 14-16 มีนาคม 2568
งานกาแฟระนอง 2568 Ranong Coffee Connext : ระนองคอฟฟี่คอนเน็กซ์ SS2 จัดวันที่ 14-16 มีนาคม 2568 บริเวณ สุขพาร์ค ระนอง งานกาแฟ รวมพลคนกาแฟ เบเกอรี่ โกโก้ โรงคั่ว และทุกส่วนที่เกี่ยวข้อง ชมศักยภาพ สร้างเครือข่ายของคนกาแฟทั้งต้นน้ำถึงปลายน้ำ อีกทั้งเชื่อมโยงไปยังพื้นที่อื่นๆ นอกจังหวัด
อรัญไนท์รัน ARAN NIGHT RUN วันที่ 15 มีนาคม 2568
อรัญไนท์รัน ARAN NIGHT RUN วันที่ 15 มีนาคม 2568 ณ สวนสาธารณใจกลางเมืองอรัญประเทศ สวนกาญจนาภิเษก ร.9 อำเภออรัญประเทศ จังหวัดสระแก้ว ททท.สำนักงานนครนายก ร่วมกับเทศบาลอรัญประเทศ สำนักงานการท่องเที่ยวและกีฬาจังหวัดสระแก้ว และบริษัท เรคเรซ สปอร์ต จำกัด จัดการแข่งขันวิ่งอรัญไนท์รัน พร้อมเสริฟดนตรี ETC หลังการแข่งขัน ฟังกันเพลินๆ 1 ชั่วโมงเต็ม
Thong Pha Phum Music Fest 2025 วันเสาร์ที่ 15 มีนาคม 2025
งานมิวสิคเฟสแรกของอำเภอทองผาภูมิ Thong Pha Phum Music Fest 2025 วันเสาร์ที่ 15 มีนาคม 2025 เริ่มตั้งแต่ 16:00 - 00:00 สามแยก อำเภอทองผาภูมิ ศิลปินดัง NNUM KALA • FLAME • I-BOSS
N-Joy Band • Sore Band • Kwae Yai Bamd
Chiangmai Fashion Week / Summer 2025 วันที่ 15-16 มีนาคม 2568
Chiangmai Fashion Week / Summer 2025 วันที่ 15-16 มีนาคม 2568 ที่สุดของแฟชั่นโชว์ฤดูร้อนแห่งภาคเหนือ! ศูนย์การค้าเซ็นทรัล เชียงใหม่ ชวนคุณดื่มด่ำมนต์เสน่ห์ของดอกไม้เมืองเหนือ ผ่านรันเวย์ดอกไม้สุดอลังการ พบกับแฟชั่นโชว์จาก Fashion Brand ชั้นนำ และ Lingerie Show ที่ฮอตที่สุดของซัมเมอร์นี้ ท่ามกลางทุ่งดอกไม้ฤดูร้อนสุดโรแมนติก
ธรรมศาสตร์แฟร์ ครั้งที่ 2 ประจำปี 2568 วันที่ 16-28 มีนาคม 2568
ธรรมศาสตร์แฟร์ ครั้งที่ 2 ประจำปี 2568 วันที่ 16-28 มีนาคม 2568 ณ มหาวิทยาลัยธรรมศาสตร์ รังสิต (ตลาดนัดเชียงราก - ลานพญานาค)
ครบทุกโซน ฟินทุกวัน! • โซนร้านค้านักศึกษา • นิทรรศการสุดสร้างสรรค์ • บริการสังคมและกิจกรรมชุมนุมต่างๆ• เพลิดเพลินกับอาหาร ของใช้ ต้นไม้ และเครื่องเล่นสวนสนุก ชาวปทุมธานีต้องมา! • พาครอบครัวมาเดินชิลล์ กิน เที่ยว และช้อปกันทั้งวัน • พบกับร้านค้าท้องถิ่น สินค้าแฮนด์เมด และอาหารพื้นบ้านเด็ด ๆ • บรรยากาศสบาย ๆ เหมาะกับทุกวัย นักศึกษาห้ามพลาด! • ชมการแสดงสุดมันส์จากชุมนุมและศิลปินตัวท็อป • ถ่ายรูปเช็กอินในโซนไฮไลต์และโชว์บอลลูนยักษ์สุดอลังการ •ร่วมกิจกรรมสุดคูลที่จัดโดย องค์การนักศึกษามหาวิทยาลัยธรรมศาสตร์ ไม่ว่าจะเป็น • เทศกาลภาพยนตร์นานาชาติ • งานสตรีสากล • Musical Gathering: Where We Find Love ไฮไลต์ห้ามพลาด! • โชว์บอลลูนยักษ์อลังการทุกคืน • การแสดงพิเศษจากนักศึกษาและศิลปินสุดปัง • ของกิน ของใช้ และเครื่องเล่นสวนสนุกแบบจัดเต็ม! ธรรมศาสตร์แฟร์ ครั้งที่ 2 คูณสองความสนุก อลังการกว่าเดิม ห้ามพลาด!
งานปิดทองขอพรหลวงพ่อโต วัดหลักสี่ราษฎร์สโมสร วันที่ 16-24 มีนาคม 2568
งานปิดทองขอพรหลวงพ่อโต งานเกษตรและของดีอำเภอบ้านแพ้ว วัดหลักสี่ราษฎร์สโมสร 16-24 มีนาคม 2568 ต.กระบัตร อ.บ้านแพ้ว สมุทรสาคร ชมฟรี มหรสพ ลิเก ภาพยนต์ ดนตรี งิ้ว ละคร ครบทุกรส
CHA-AM BIKINI BEACH RUN 2025 ครั้งที่ 16 ในวันที่ 16 มีนาคม 2568
CHA-AM BIKINI BEACH RUN 2025 ครั้งที่ 16 ในวันที่ 16 มีนาคม 2568 หาดทรายหน้าโรงแรมลองบีช ชะอำ
Expo Day 15 มีนา 2568 Race Day 16 มีนา 2568
3 ระยะทาง HALF MARATHON 21.1 KM วิ่งถนน 19.6 กม.+หาดทราย 1.5 กม. ปล่อยตัวเวลา 05.00 น. MINI MARATHON 10 KM STANDARD (นักวิ่งทั่วไป) MINI MARATHON 10 KMBIKINI (ใส่ชุดบิกินี ) วิ่งถนน 8.5 กม.+หาดทราย 1.5 กม. ปล่อยตัวเวลา 05.50 น. SMILE RUN 5 KM STANDARD (นักวิ่งทั่วไป) / BIKINI (ใส่ชุดบิกินี ) วิ่งบนถนน 3.5 กม.+วิ่งบนหาดทราย 1.5 กม. ปล่อยตัว เวลา 05.50 น. CASH PRIZES: เงินรางวัล Over All 21K / 10K
งานไหว้ครูมวยไทยโลก ครั้งที่ 17 วันที่ 16 มี.ค. - 17 มี.ค. 2568
งานไหว้ครูมวยไทยโลก ครั้งที่ 17 วันที่ 16 มี.ค. - 17 มี.ค. 2568 วัดมหาธาตุและวัดหลังคาขาว อุทยานประวัติศาสตร์พระนครศรีอยุธยา ตอกย้ำอัตลักษณ์วิถีไทยผ่านทางกิจกรรมให้ผู้เข้าร่วมกิจกรรมชาวต่างชาติได้เรียนรู้ จดจำ ประทับใจ ยกระดับกิจกรรมท่องเที่ยวนานาชาติและขยายฐานตลาดคุณภาพอย่างต่อเนื่อง โดยนำเสนอเอกลักษณ์ “ความเป็นไทย” ซึ่งจะเป็นการส่งเสริมและสร้างความรู้ความเข้าใจให้กับ ชาวต่างชาติที่มีความสนใจต่อการชกมวยไทยได้เข้าใจและเห็นความสำคัญของพิธีไหว้ครูและตระหนักว่า “ครั้งหนึ่งในชีวิตการเรียนมวยไทย ต้องมาร่วมพิธีไหว้ครูที่ประเทศไทย" กิจกรรมภายในงาน - พิธีไหว้ครูมวยไทยโลก - การแข่งขันชกมวยไทย - การสาธิตศิลปะแบบไทยที่มีความเกี่ยวข้องกับการต่อสู่ เช่น การสักยันต์ ตีดาบ - สาธิตศิลปะการต่อสู้ป้องกันตัวแบบไทย - นิทรรศการให้ความรู้ การสอนมวยไทยโบราณ
เทศกาลท่องเที่ยว มะม่วง อาหาร และของดีอำเภอบางคล้า ประจำปี 2568 ครั้งที่ 21 วันที่ 17-23 มีนาคม 2568
อำเภอบางคล้าประชาสัมพันธ์เชิญเที่ยวงานเทศกาลท่องเที่ยว มะม่วง อาหาร และของดีอำเภอบางคล้าประจำปี 2568 ครั้งที่ 21 ระหว่างวันที่ 17-23 มีนาคม 2568 ระยะเวลา 7 วัน
กิจกรรมการออกร้านค้าของเกษตรกร ผลิตภัณฑ์ OTOP ในพื้นที่ และร้านค้าอื่นๆ ตั้งแต่เวลา 10.00 -22.00 น. ตลอด 7 วัน ทั้งนี้ยังมีกิจกรรมบนเวทีกลางให้ประชาชนได้ร่วมสนุก ดังนี้ วันที่ 17 มี.ค. 68 ประกวดผลผลิตทางการเกษตร,พิธีเปิด,เดินแบบผ้าไทย วันที่ 18 มี.ค. 68 แข่งขันกินจุมะม่วง,ประกวดหนูน้อยมะม่วง วันที่ 19 มี.ค. 68 แข่งขันกินกุ้งเร็ว,ประกวดเทพีมะม่วงในวันวาน วันที่ 20 มี.ค. 68 ประกวดส้มตำลีลา,การแสดงนักเรียนในพื้นที่ วันที่ 21 มี.ค. 68 ประกวดร้องเพลงลูกทุ่งเสียงสนั่น พ่อกำนัน พี่ผู้ใหญ่ฯลฯ ผู้บริการอปท. วันที่ 22 มี.ค. 68 ประกวดร้องเพลงไทยลูกทุ่ง ระดับประถมศึกษา และมัธยมศึกษา (รอบคัดเลือก) วันที่ 23 มี.ค. 68 ประกวดร้องเพลงไทยลูกทุ่ง ระดับประถมศึกษา และมัธยมศึกษา (รอบชิงชนะเลิศ) ติดตามความเคลื่อนไหวและรายละเอียดกิจกรรมผ่านทางเพจ ที่ว่าการอำเภอบางคล้า
งาน Street food good health แก่งคอย 17-26 มีนาคม 2568
งาน Street food good health เทศกาลอาหารสตรีทฟู๊ดดีดี วันที่ 17-26 มีนาคม 2568 ถนนหน้าอำเภอแก่งคอย ชมคอนเสิร์คศิลปินดังทุกคืน
การแข่งขันกินจุมะม่วงขายตึก ในงานเทศกาลท่องเที่ยว มะม่วง อาหาร และของดีอำเภอบางคล้า ครั้งที่ 21 ปี 2568
อำเภอบางคล้า จัดการแข่งขัน กินจุมะม่วงขายตึก ในงานเทศกาลท่องเที่ยว มะม่วง อาหาร และของดีอำเภอบางคล้า ครั้งที่ 21 ปี 2568 ให้กับเหล่าคนชอบมะม่วง ใครที่ว่าแน่ ที่ว่าเก่ง กินจุ ทานมะม่วงให้ได้มากที่สุด ในเวลา 15 นาที เราขอท้าผู้ชนะที่ทานจุ รับรางวัลการแข่งขันกินจุมะม่วงไปเลย เงินสด มูลค่า 3,000 บาท
แข่งขันในวันที่ 18 มีนาคม 2568 เวลา 17.00 น. ณ เวทีบริเวณหน้าที่ว่าการอำเภอบางคล้า
สนใจสามารถสมัครได้ที่ สำนักงานอำเภอบางคล้า ที่ว่าการอำเภอบางคล้า อายุ 15 - 65 ปี ไม่จำกัดเพศ มีชื่อในทะเบียนบางคล้า ตั้งแต่วันนี้ถึง 14 มีนาคม 2568 (ตามวัน และเวลาราชการ)
Chiangmai Summer Music&Brew fest 2025 วันที่ 19-23 มีนาคม 2568
Chiangmai Summer Music&Brew fest 2025 วันที่ 19-23 มีนาคม 2568 ลานน้ำพุหน้าห้างสรรพสินค้า Central Festival Chiang Mai เชียงใหม่เฟส รวมร้านอาหารกว่า 50 ร้านค้า และเครื่องดื่มจากแบรนด์ต่างๆ มากมาย หลากหลายชนิด พร้อมวงดนตรี และกิจกรรมบนเวที
Coffee Traveler Latte Love Fest 20-23 มีนาคม 2568
Coffee Traveler ชวนมา Mun กับอีเว้นท์ใหม่ประจำปี 2025 ครั้งที่ 1 ธีมงาน Latte Love Fest อีเว้นท์เพื่อคนรัก Latte Art ที่จะมาแสดงงานฝีมืออันประณีตและซับซ้อนในการสร้างสรรค์ลวดลายที่สวยงามบนแก้วกาแฟ 20-23 มีนาคม 2568 ที่ MunMun Srinakarin
งานกาชาดและของดีจังหวัดสมุทรสาคร 21-30 มีนาคม 2568
งานกาชาดและของดีจังหวัดสมุทรสาคร งานเริ่มวันที่ 21-30 มีนาคม 2568 (10วัน10คืน)
เทศกาลอาหารดีดนตรีเป็นสุข วันที่ 21-30 มีนาคม 2568
เทศกาลอาหารดีดนตรีเป็นสุข วันที่ 21-30 มีนาคม 2568 บริเวณตลาดนัดเป็นสุข (ถนนบายพาส) อ.เมือง กาญจนบุรี
UTTARADIT COFFEE FEST 2025 "on the beach" 22-23 มี.ค.2568
งาน UTTARADIT COFFEE FEST 2025 "on the beach" 22-23 มี.ค.2568 งานมหกรรมกาแฟที่ยิ่งใหญ่ที่สุดในจังหวัดอุตรดิตถ์ จัดโดย
หอการค้า จังหวัดอุตรดิตถ์
ในงานพบร้านกาแฟ และโรงคั่วกาแฟชั้นนำ ทั้งในจังหวัดและต่างจังหวัด มากกว่า 50ร้าน พร้อมร้านอาหารและเบอเกอรี่ งานคราฟท์ Workshop Kids zone และ Music Art พบกับ influencer กาแฟชื่อดัง กาแฟคุณพระ และกิจกรรมในงานอื่นๆอีกมากมาย และเตรียมตัวพบกับ กิจกรรมแข่งขันกาแฟระดับประเทศของ Thailand Coffee Brewer League เพื่อแข่งขัน Uttaradit Cup Battle และ Uttaradit Drip Battle ชิงแชมป์สนามอุตรดิตถ์ เป็นตัวแทนไปแข่ง TCBL Grand Final พร้อมเงินรางวัลกว่า 10,000 บาท พิกัดการจัดงาน :
สวนสาธารณะเทศบาลเมืองอุตรดิตถ์งานท่องเที่ยวเมืองราชบุรีของดีเมืองโอ่งและงานกาชาดราชบุรี วันที่ 22 มีนาคมถึง 31 มีนาคม 2568
งานท่องเที่ยวเมืองราชบุรีของดีเมืองโอ่งและงานกาชาดราชบุรี ประจำปี 2568 ระหว่างวันที่ 22 มีนาคมถึง 31 มีนาคม 2568 ณ บริเวณศาลากลางราชบุรี จ.ราชบุรี
คอนเสิร์ต TEENTAG-FEST SUMMER RAPPER MUSIC 2025 - 22 มีนาคม 2568
คอนเสิร์ตที่รวมสายเดือดไว้ในงานเดียวกัน ชาวระยอง ห้ามพลาด TEENTAG-FEST " SUMMER RAPPER MUSIC 2025 " 22 มีนาคม 2568 เวลา 17.00 น เป็นต้นไป ณ แพชชั่น ฮอลล์ ชั้น 3 ศูนย์การค้าแพชชั่น ช้อปปิ้ง เดสติเนชั่น นำทัพความเดือดโดย TWOPEE / Saran & Dieout / Diamond และ Chonburi flow
“ประมงไทยฟิชชิ่งบางสะพาน ครั้งที่ 3” 22-23 มีนาคม 2568
“ประมงไทยฟิชชิ่งบางสะพาน ครั้งที่ 3” 22-23 มีนาคม 2568 อ่าวเทียน บางสะพาน ประจวบฯ เปิดรับสมัครการแข่งขัน สายตกปลาห้ามพลาด! ตกมันส์ 1 คืน 1 วัน ทุกประเภทเรือ 9 ปลาเกมส์ | 1 น้ำหนักสูงสุด ของรางวัลแน่น! ของแจกเพียบ! ค่าสมัครคุ้มชัวร์! ฟีลแคมป์ริมทะเล อาหารทะเลจัดเต็ม ดนตรีสด ฟังชิลล์ไปกับคลื่น
ตะลุยหุบเขาไดโนเสาร์ เที่ยวชุมชนน่าฮัก 22-23 มี.ค. 2568


ตะลุยหุบเขาไดโนเสาร์ เที่ยวชุมชนน่าฮัก 22-23 มี.ค. 2568 นี้ ชวนมาร่วมกิจกรรมท่องเที่ยว สนุกกับทริป #UNSEEN ถิ่นไดโนเสาร์ เที่ยวชุมชนน่าฮัก @ อ.เวียงเก่า จ.ขอนแก่น กับ วิสาหกิจชุมชนท่องเที่ยวและเรียนรู้หุบเขาแห่งไดโนเสาร์ โดย ไร่แทนคุณแผ่นดิน X ททท. สำนักงานขอนแก่น #วันแรก เสาร์ 22 มี.ค. 2568 // ตะลุยหุบเขาไดโนเสาร์ (มิกกี้เม้าส์ โซนแก้มซ้าย) เวลา 09.00 น. คณะพร้อมกัน ณ ไร่แทนคุณแผ่นดิน อ.เวียงเก่า จ.ขอนแก่น เช้า ???? เดินป่า อาบธรรมชาติ #เที่ยวถ้ำแมงป่อง หินสวยตระหง่าน ร่องรอยและงานศิลป์ของมนุษย์ยุคก่อนประวัติศาสตร์ อายุกว่า 4,500 ปี, ทานข้าวป่า (มื้อเที่ยง) เที่ยง ???? เที่ยวชุมชนน่าฮัก #ชุมชนบ้านนาตาด ชมขั้นตอนกว่าจะเป็นผ้าฝ้ายทอมือ ทำกิจกรรม DIY ผ้ามัดย้อม #เสื้อยืดย้อมสีหินถิ่นไดโนเสาร์ สีสันสดใสสไตล์คุณ และมีตัวเดียวในโลก (พร้อมรับกลับบ้านเป็นของฝาก) เย็น ???? อิ่มอร่อยมื้อเย็น กับ Isan Community Cocktail Party คัดสรรเมนูอร่อยจากชุมชน พร้อมชิลดนตรีบรรยากาศริมโคกหนองนา แค้มป์ปิ้ง พักค้างคืน ณ ไร่แทนคุณแผ่นดิน #วันที่สอง อาทิตย์ 23 มี.ค. 2568 // เที่ยวชุมชนน่าฮัก สโลว์ไลฟ์วิถีชุมชน (มิกกี้เม้าส์ โซนแก้มขวา) เช้า ???? นั่งคาราวานซาเล้งไดโน่ ลัดเลาะ วิถีชุมชน ชมธรรมชาติสุขสัมผัสทั้ง 5 #สโลว์ไลฟ์กับกาแฟดริป บนพลาญหิน 130 ล้านปี ชมวิวพาโนรามา #วัดถ้ำกวาง ???? สนุกกับกิจกรรม Workshop ถักกำไลแฝกของพ่อ ไหมของแม่ เรียนรู้ธรรมชาติ รู้จักหญ้าแฝก กับปราชญ์ชาวบ้าน ณ สวนธรรมจักร เที่ยง ???? อิ่มอร่อยมื้อเที่ยง #พาข้าวสวย ณ #ชุมชนบ้านหินร่อง พร้อมร่วมทำปราสาทดอกผึ้ง ไหว้พระขอพรก่อนเดินทางกลับ (เสร็จสิ้นกิจกรรมเวลาประมาณ 14.00 น.)
เทศกาลว่าวนานาชาติ @ชะอำ 22 - 23 มีนาคม 2568
งานเทศกาลว่าวนานาชาติ 2025 วันที่ 22 - 23 มีนาคม 2568 ณ ชายหาดชะอำเหนือ จังหวัดเพชรบุรี เตรียมพบกับ "เทศกาลว่าวนานาชาติ" สุดอลังการ ที่จะเปลี่ยนท้องฟ้าให้กลายเป็นเวทีแสดงงานศิลปะสุดสร้างสรรค์จากว่าวไทยและนานาชาติ นักท่องเที่ยวจะได้สัมผัสกับว่าวที่มีความงดงามและเทคนิคการบินที่น่าทึ่งจากทั่วโลก!
ไฮไลท์กิจกรรมที่พลาดไม่ได้! การแสดงว่าวยักษ์แฟนตาซีจาก 10 ประเทศ ว่าวอัตลักษณ์ไทย 4 ภูมิภาค – ชมว่าวประจำภาคที่สะท้อนศิลปะและวัฒนธรรมไทย กิจกรรม DIY ว่าวสุดสร้างสรรค์ – สนุกกับการประดิษฐ์ว่าวในแบบของคุณเอง! นิทรรศการศิลปะว่าว – ชมผลงานว่าวจากศิลปินทั้งไทยและต่างชาติ เทศกาลนี้เหมาะสำหรับทุกคน ไม่ว่าจะเป็นครอบครัวที่ต้องการหากิจกรรมสนุกๆ สำหรับเด็กๆ หรือคนรักการถ่ายภาพ ที่ต้องการเก็บภาพความประทับใจของว่าวสีสันสดใสที่ลอยอยู่เหนือชายหาด
เทศกาลดนตรีรอบกองไฟ ชัมบาลา มิวสิคแคมป์ #4 23 มีนาคม 2568
เทศกาลดนตรีรอบกองไฟ ชัมบาลา มิวสิคแคมป์ #4 คณะขวัญใจ x WHATFALSE และศิลปินรับเชิญ 23 มีนาคม 2568 ณ ชัมบาลาแคมป์ พัทลุ
งานเทศกาลอาหาร Fin Food Festival ตอน See Food make me Feel Good 26-30 มีนาคม 68
งานเทศกาลอาหารที่รวบรวมอาหารมากมายที่สุดในงาน Fin Vacation ตอน See Food Make วันที่ 26-30 มีนาคม 68 ณ ลานด้านหน้าโรงแรมชุมพร แกรนด์พาเลซWellness to ISAN 27-28 มีนาคม 2568 เจาะตลาด Wellness สู่ภูมิภาคอีสาน
ISAN Wellness Summit เจาะตลาด Wellness สู่ภูมิภาคอีสาน 27-28 มีนาคม 2568 ณ โรงแรมพูลแมน ขอนแก่น Wellness to ISAN – เปิดมุมมองใหม่สู่ศักยภาพของอีสานในการเป็น Wellness Hub การรวมตัวผู้บริหาร C-level ของโรงพยาบาล, เจ้าของคลินิกด้านความงามและสุขภาพ, ผู้บริหารโรงแรมและสปา, แพทย์, นักวิจัย, ผู้ให้บริการโซลูชัน, หน่วยงานรัฐบาล, สมาคม, และผู้เชี่ยวชาญด้านสุขภาพ โดยมีการบรรยายและนำเสนอแนวคิดใหม่ๆ พร้อมกิจกรรมเวิร์กช็อปพิเศษอีกมากมาย โดยมีเป้าหมายหลักในการส่งเสริมอุตสาหกรรมสุขภาพในภาคอีสาน พร้อมสนับสนุนวิสัยทัศน์ของประเทศไทยในการเป็นศูนย์กลางด้านสุขภาพ Wellness ในเอเชีย
Thailand Cat Lovers Fair 2025 วันที่ 28-30 มีนาคม 2568
Thailand Cat Lovers Fair 2025 วันที่ 28 - 30 มีนาคม 2568 นี้ ณ อาคาร 8 อิมแพ็ค เมืองทองธานี
งานแสดงสินค้าและบริการของเจ้าเหมียวและเหล่าทาสสุดยิ่งใหญ่ พบกับ พบกับอาหาร สินค้า ของเล่นแมว กิจกรรมมากมาย
ไม่ว่าจะเป็น…
- การแสดงโชว์จากแมวสายพันธุ์ไทย รวมถึงแมวสายพันธุ์ต่าง ๆ
- การแข่งขันกิจกรรมต่าง ๆ เช่น แข่งขันแมวเลีย
- เวิร์คช็อปเกี่ยวกับการดูแลแมว เช่น ฟาร์มแมว บริการอาบน้ำตัดขน
- สินค้าสุดน่ารักสำหรับแมว เช่น แฟชั่นแมว ของเล่นแมว
- มาร่วมกันสร้างความทรงจำดี ๆ กับเหล่าเพื่อนแมว และเหล่าทาสแมวกัน
- มาร่วมเดินชม ช้อป ใช้กันใน #งานแมวอิมแพ็ค
- และมาสัมผัสความน่ารักของเหล่าเหมียวที่หลากหลายสายพันธุ์ ที่คุณไม่ควรพลาด !
งานวันมะม่วงและของดีเมืองแปดริ้ว ครั้งที่ 54 ปี 2568 (ครั้งที่ 2)
งานวันมะม่วงและของดีเมืองแปดริ้ว ครั้งที่ 54 ปี 2568 (ครั้งที่ 2) ระหว่างวันที่ 28 มีนาคม – 7 เมษายน 2568 ณ โรงเรียนวัดโสธรวรารามวรวิหาร ตำบลหน้าเมือง อำเภอเมืองฉะเชิงเทรา จังหวัดฉะเชิงเทรา
สำนักงานเกษตรจังหวัดฉะเชิงเทรา เปิดจองแล้วร้านค้า “ในจังหวัด” งานวันมะม่วงและของดีเมืองแปดริ้ว ครั้งที่ 54 ประจำปี 2568 ✅จองได้ตั้งแต่วันนี้ ถึง 19 กุมภาพันธ์ 2568 จำหน่ายสินค้าในงาน ระหว่าง 28 มีนาคม - 7 เมษายน 2568 ติดต่อสอบถามเพิ่มเติมได้ที่ สำนักงานเกษตรจังหวัดฉะเชิงเทรา 038-511-635 สำนักงานเกษตรอำเภอ ทุกอำเภอ
งานแมว Thailand Cat Lovers Fair 2025 ที่นี่ที่แรก ณ. อิมแพ็ค เมืองทองธานี
เหล่าทาสแมวต้องไม่พลาด มาสนุกกับงานแมว Thailand Cat Lovers Fair 2025 วันที่ 28-30 มีนาคม 2568 ณ. อิมแพ็ค เมืองทองธานี งานแมวอิมแพ็ค พร้อมให้เหล่าทาสแมว พาลูก ๆ สุดที่รักมาร่วมเดินงานแล้ว ภายในงานจะมีสินค้ามากมายสำหรับเจ้าเหมียว เช่น อาหารแมว ขนมแมว และแฟชั่นของแมว จากร้านค้าที่มาร่วมออกงาน มากกว่า 100+ ร้านค้า งานนี้เดินช้อปกระหน่ำแน่นอน
เทศกาลอาหารและบอลลูนนานาชาติ ร้อยเอ็ด 28 มี.ค.- 7 เม.ย 68
"เทศกาลอาหารและบอลลูนนานาชาติ" วันที่ 28 มี.ค.- 7 เม.ย 68 ณ ศูนย์การค้าโรบินสันไลฟ์สไตล์ ร้อยเอ็ด เชิญชมบอลลูนนานาชาติ สีสันสวยงามตื่นตา พาเหรดสินค้ามากมาย อาหารเครื่องดื่มหลากหลาย การแสดงแสงสีเสียงตระการยิ่งใหญ่อลังการ
Aquaverse Music Fest 2025 เสาร์ที่ 29 มีนาคม 2025
ทั้งเปียกทั้งมันส์! กับไลน์อัพ T-Pop แน่นๆ 4EVE, PIXXI, ALLY, ATLAS และ DAOU OFFROAD ใน Aquaverse Music Fest 2025 คอนเสิร์ตกลางน้ำที่พัทยา ขนศิลปินตัวตึงมาแน่นๆ 4EVE, ALLY, ATLAS, DAOU OFFROAD เเละ PIXXIE บอกเลยว่ามันส์ แซ่บและดีย์มาก วันเสาร์ที่: 29 มีนาคม 2025 สถานที่: Mega Wave, Columbia Pictures Aquaverse ซื้อบัตรได้แล้ววันนี้ ราคาบัตร Early Bird เปิดซื้อวันนี้ - 22 ก.พ. บริษัทขอสงวนสิทธิ์การเปลี่ยนแปลงโดยที่ไม่ต้องแจ้งให้ทราบล่วงหน้า โปรดศึกษารายละเอียดให้ครบ ชำระเงินแล้วไม่สามารถคืนเงินได้ (Tickets are Non -Refundable )
มาเหนือ Scooters Day #7 น่าน-แพร่ 29-30 มีนาคม 68
มาเหนือ Scooters Day #7 น่าน-แพร่ 29-30 มีนาคม 68 ส่งฤดูหนาวเข้าสู่ฤดูร้อน นอนที่น่าน จัดบริเวณ ลานกิจกรรมคาราวานมาเหนือ หลังโรงแรมวันบัดเจทน่าน ตรงข้ามรร.ฮอปอินน่าน "งานนี้ร่วมงานฟรี โชคดีได้รถฟรีกลับบ้าน"
Campfire Music Festival คอนเสิร์ตสุดชิล 29 มีนาคม 2568
Campfire Music Festival คอนเสิร์ตสุดชิล วันเสาร์ที่ 29 มีนาคม 2568 At 155-Camp ต.หนองกลางนา อ.เมือง จ.ราชบุรี กับบรรยากาศสุดจะบรรยาย Lost in Paradise ช่วงเวลาดี ๆ บรรยากาศดี ๆ กับความทรงจำแสนอบอุ่นรอคุณอยู่ Good Times, Good Vibes, and Great Memories Await! พบกับศิลปิน : เขียนไขและวานิช I วสันต์ 17 I อภิรมย์ I T_047 I ปลานิลเต็มบ้าน
FTI CHIANGMAI FAIR 2025 @ CHIANGMAI ปี 2568 วันที่ 29 มี.ค. - 7 เม.ย. 2568
งาน "FTI CHIANGMAI FAIR 2025" ภายในงาน ONE STOP SHOPPING EXPO @ CHIANGMAI ปี 2568 วันที่ 29 มี.ค. - 7 เม.ย. 2568 เวลา 10.00 - 20.00 น. ณ ศูนย์ประชุมและแสดงสินค้า นานาชาติฯ จังหวัดเชียงใหม่
งาน Pet Paradise Fair @นครสวรรค์ 30 มีนาคม - 8 เมษายน 2568
งาน Pet Paradise Fair @นครสวรรค์ วันที่จัดงาน 30 มีนาคม - 8 เมษายน 2568 (10วันเต็มตรงวันหยุด) Central Nakhon Sawan ปีนี้มาใน Concept นักรบ นักต่อสู้ กิจกรรมป้อนอาหารสัตว์แปลก – ดึงดูดผู้เข้าร่วมงานได้เยอะ! เหมาะสำหรับร้านค้าเหล่านี้ อาหารสัตว์ ขนมสัตว์เลี้ยง อุปกรณ์สัตว์เลี้ยง ของเล่นสัตว์ เสื้อผ้า ของใช้สัตว์เลี้ยง โรงแรมสัตว์,โรงพยาบาลสัตว์ คาเฟ่สัตว์เลี้ยงหมาแมว
เขตพระนคร วันที่ 3-14 มีนาคม 2568 เวลา 10.00 - 12.00 น. ไม่เสียค่าใช้จ่าย
สำนักงานเขตพระนคร ร่วมกับศูนย์บริการสาธารณสุขในพื้นที่ จัดหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 ระหว่างวันที่ 3 - 14 มีนาคม 2568 (ในวันราชการ) เวลา 10.00 - 12.00 น. ไม่เสียค่าใช้จ่าย
สัตว์เลี้ยงที่เข้ารับวัคซีนจะต้องมีสุขภาพแข็งแรง ไม่ป่วย และมีอายุ 3 เดือนขึ้นไป .. ขอประชาสัมพันธ์เชิญชวนประชาชนเตรียมความพร้อมนำสัตว์เลี้ยง เข้ารับวัคซีนฯ ตามวัน เวลา และสถานที่ที่กำหนด สอบถามเพิ่มเติม โทร. 02-2818921
เขตห้วยขวาง หน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 3-14 มีนาคม 2568
เขตห้วยขวาง หน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 3-14 มีนาคม 2568 เวลา 10.00 - 12.00 น.
เขตดุสิต ออกหน่วยเคลื่อนที่ 3-14 มีนาคม 2568
เขตดุสิต ออกหน่วยเคลื่อนที่ไปตามชุมชนต่างๆ ท่านสามารถนำสุนัขและแมว เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ ระหว่างวันที่ 3-14 มีนาคม 2568 นี้
เขตราชเทวี ร่วมกับ ศูนย์บริการสาธารณสุข2 วัดมักกะสัน
ศูนย์บริการสาธารณสุข2 วัดมักกะสัน ประชาสัมพันธ์ รณรงค์ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประจำปี 2568 ฟรี ท่านสามารถพาสัตว์เลี้ยงของท่านมาใช้บริการได้ ตามวัน เวลา และสถานที่ที่แนบมาด้านล่างได้เลย สอบถามโทร 02-2517735-37
เขตบางซื่อร่วมกับ ศูนย์บริการสาธารณสุข 3 วันที่ 3-7 มีนาคม 2568 ตั้งแต่เวลา 09.00-12.00 น.
เขตบางซื่อ เชิญชวนพี่น้องชาวบางซื่อ พาน้องหมาน้องแมวที่บ้าน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ได้ ฟรี!! ไม่เสียค่าใช้จ่าย ระหว่างวันที่ 3-15 มีนาคม 2568 ตั้งแต่เวลา 09.00-12.00 น. ณ สถานที่ตามตารางกำหนดการ สอบถามข้อมูลเพิ่มเติม โทร 02-5869982 ต่อ 6017-8 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล
**ทั้งนี้ เวลาออกปฏิบัติงานอาจมีการเปลี่ยนแปลงตามภารกิจเร่งด่วน**
**ข้อควรระวัง** 1. สัตว์เลี้ยงเพศเมีย ต้องไม่อยู่ในระหว่างตั้งท้องหรือให้นม 2. สุนัข แมวกระรอก หนู กระต่าย หรือสัตว์เลี้ยงลูกด้วยนม มีอายุตั้งแต่ 3 เดือนขึ้นไป
เขตดินแดง ร่วมกับศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 ออกหน่วยวันที่ 3-14 มีนาคม 2568 เวลา 10.00 - 12.00 น.
เขตดินแดง ร่วมกับศูนย์บริการสาธารณสุข 4 และศูนย์บริการสาธารณสุข 52 “การออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง ครั้งที่ 1/ 2568“ ระหว่างวันที่ 3-14 มีนาคม 2568 เวลา 10.00 - 12.00 น. ขอเชิญประชาชนผู้ที่สนใจทุกท่านนำสุนัข แมว และสัตว์เลี้ยง เข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่เสียค่าบริการ สอบถามข้อมูลเพิ่มเติม โทร 02-2468546
เขตยานนาวาร่วมกับ ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์และศูนย์บริการสาธารณสุข 55 เตชะสัมพันธ์
สำนักงานเขตยานนาวาร่วมกับ ศูนย์บริการสาธารณสุข 7 บุญมี ปุรุราชรังสรรค์และศูนย์บริการสาธารณสุข 55 เตชะสัมพันธ์ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง ฟรี‼ ระหว่างวันที่ 3 - 14 มีนาคม 2568 เวลา 09.00 - 12.00น.
เขตบางซื่อ ร่วมกับ ศูนย์บริการสาธารณสุข 9 วันที่ 10-15 มีนาคม 2568
สอบถามข้อมูลเพิ่มเติม โทร 02-5869982 ต่อ 6017-8 ฝ่ายสิ่งแวดล้อมและสุขาภิบาล
เขตคลองเตยร่วมกับศูนย์บริการสาธารณสุข 10 สุขุมวิท
ประชาสัมพันธ์กิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในกรุงเทพมหานคร สำนักงานเขตคลองเตยร่วมกับศูนย์บริการสาธารณสุข 10 สุขุมวิท และศูนย์บริการสาธารณสุข 41 คลองเตย ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3 – 21 มีนาคม 2568 จำนวน 10 วัน ตั้งแต่เวลา 10.00 – 12.00 นี้
เขตพญาไท ร่วมกับ ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์
สัปดาห์รณรงค์ป้องกันโรคพิษสุนัขบ้า ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตพญาไท ร่วมกับ ศูนย์บริการสาธารณสุข 11 ประดิพัทธ์ ให้บริการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกัน โรคพิษสุนัขบ้า (สำหรับสัตว์เลี้ยง) ✅ ฟรี ไม่มีค่าใช้จ่าย
สำหรับประชาชนท่านใดที่มีสัตว์เลี้ยง ได้แก่ สุนัข แมว เป็นต้น สามารถนำสัตว์เลี้ยงมารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ได้ในวันที่ 3 -14 มีนาคม 2568 ตั้งแต่ เวลา 09.00 - 12.00 น. ตามวันและสถานที่ดังกล่าว การเตรียมตัว เจ้าของสัตว์เลี้ยงนำบัตรประชาชนตัวจริงมาลงทะเบียน สัตว์เลี้ยงต้องมีอายุมากกว่า 3 เดือนขึ้นไป และมีสุขภาพแข็งแรงดี ไม่มีอาการเจ็บป่วย
เขตสัมพันธวงศ์ ร่วมกับศบส.13 ไมตรีวานิช บริการ 3-14 มีนาคม 2568
เขตสัมพันธวงศ์ ขอเชิญชวนเจ้าของสุนัขและแมว ซึ่งเลี้ยงในพื้นที่เขตสัมพันธวงศ์ มาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า..ฟรี !! โดยขอให้มีข้อกำหนด ดังนี้ - สุนัขและแมวของท่านต้องมีอายุ 3 เดือนขึ้นไป และสุขภาพแข็งแรง - ท่านสามารถเลือก วัน เวลา และสถานที่ ที่สะดวกเพื่อนำสัตว์เลี้ยงเข้ารับการฉีดวัคซีนตามข้อมูลที่แจ้งไว้ในรูป - ด่วน! ฟรีเพียง 10 วันเท่านั้น (3 - 14 มีนาคม 2568) สอบถามข้อมูลเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล โทร. 02-2330846
เขตวังทองหลาง ศูนย์บริการสาธารณสุข 15 ลาดพร้าว จัดหน่วยบริการฉีดวัคซีน 4-13 มีนาคม 2568
ผู้ที่สนใจอยากพาสัตว์เลี้ยงไปฉีดวัคซีนป้องกันพิษสุนัขบ้า ทางเขตวังทองหลาง ร่วมกับศูนย์บริการสาธารณสุข 15 ลาดพร้าว ได้จัดหน่วยบริการฉีดวัคซีนป้องกันพิษสุนัขบ้าประจำปี 2568 ระหว่างวันที่ 4-13 มีนาคม 2568 ตามสถานที่ต่างๆ ดังรูป หากมีข้อสงสัยสามารถสอบถามได้ที่ เพจ Facebook ศูนย์บริการสาธารณสุข 15 ลาดพร้าว สอบถามข้อมูลเพิ่มเติม โทร 02-5418380 02-9399538
เขตจตุจักร ศูนย์บริการสาธารณสุข 17 ประชานิเวศน์
ศูนย์บริการสาธารณสุข สิบเจ็ด ประชานิเวศน์ ประชาสัมพันธ์เชิญชวนประชาชน นำสุนัขและแมวเข้ารับการฉีดวัคซีนพิษสุนัขบ้า ตามวันและเวลาที่ระบุ ฟรีไม่มีค่าบริการ เจ้าของสัตว์เลี้ยง กรุณานำบัตรประชาชนของท่านมาด้วย
เขตป้อมปราบศัตรูพ่าย ร่วมกับ ศูนย์บริการสาธารณสุข 20
สำนักงานเขตป้อมปราบศัตรูพ่าย ร่วมกับ ศูนย์บริการสาธารณสุข 20 ป้อมปราบศัตรูพ่าย จัดหน่วยเคลื่อนที่บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยงฟรี ตั้งแต่วันที่ 3 – 14 มีนาคม 2568 เวลา 10.00-12.00 น. สะดวกที่ไหนพาน้องหมา น้องแมวไปใช้บริการได้ฟรี!! ** สอบถามเพิ่มเติมที่ ** ศูนย์บริการสาธารณสุข 20 ป้อมปราบศัตรูพ่าย โทร. 02-223-0004 - ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตป้อมปราบศัตรูพ่าย ชั้น 3 โทร. 02-281-3965
เขตวัฒนา ร่วมกับศูนย์ฯ21 วัดธาตุทอง ชวนทุกท่านนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า(ฟรี)
เขตวัฒนาประชาสัมพันธ์เชิญชวนทุกท่านนำสัตว์เลี้ยงมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า(ฟรี) โดยทางฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตวัฒนา ร่วมกับศูนย์บริการสาธารณสุข 21(วัดธาตุทอง) กำหนดการออกหน่วยบริการเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง(สุนัขและแมว) ประจำปี 2568 ระหว่างวันที่ 3-14 มีนาคม 2568 เวลา 10.00-12.00 น. ตามกำหนดการ
เขตบางเขน ร่วมกับศูนย์บริการสาธารณสุข 24 บางเขน
สำนักงานเขตบางเขน ร่วมกับศูนย์บริการสาธารณสุข 24 บางเขน ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 3-14 มีนาคม 2568 ตั้งแต่เวลา 09.00 ถึง 11.00 น. สอบถาม ฝ่ายสิ่งแวดล้อม 02-5528062 หรือ ศูนย์ฯ24 โทร 02-5791342 ต่อ 15
เขตธนบุรี ร่วมกับศูนย์ฯ 26,27 และ 34
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เขตธนบุรี ร่วมกับศูนย์ฯ 26,27 และ 34 เชิญชวนนำสัตว์เลี้ยงของท่านเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 3-14 มีนาคม นี้ ตามกำหนดการที่ระบุ
เขตคลองสานร่วมกับศูนย์บริการสาธารณสุข 28 กรุงธนบุรี ออกหน่วยฉีดวัคซีน วันที่ 3-14 มีนาคม 2568
สำนักงานเขตคลองสานร่วมกับศูนย์บริการสาธารณสุข 28 กรุงธนบุรี ขอเชิญชวนประชาชนนำสัตว์เลี้ยงของท่าน (สุนัข หรือแมว) มารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3-14 มีนาคม 2568 เวลา 10.00 -12.00 น. หมายเหตุ: ไม่มีค่าใช้จ่ายใดๆทั้งสิ้น
เขตจอมทอง ร่วมกับ ศูนย์บริการสาธารณสุข29 (ช่วง นุชเนตร)
สำนักงานเขตจอมทอง ร่วมกับ ศูนย์บริการสาธารณสุข29 (ช่วง นุชเนตร) สำนักอนามัย ให้บริการ จัดหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยง เพื่อเสริมสร้างภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยง ประจำปี 2568 ระหว่างวันที่ 4- 14 มีนาคม 2568 ตั้งแต่เวลา 10.00- 12.00 น. สามารถเข้ารับบริการได้ฟรี!! สอบถามเพิ่มเติมได้ที่ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ชั้น 4 สำนักงานเขตจอมทอง โทร 02-4276671
เขตบางพลัด ศูนย์บริการสาธารณสุข 31 เอิบ-จิตร ทังสุบุตร 3-14 มีนาคม 68
ศูนย์บริการสาธารณสุข 31 เอิบ-จิตร ทังสุบุตร ร่วมกับ สำนักงานเขตบางพลัด ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง บริการฉีดฟรีไม่มีค่าใช้จ่าย ระหว่างวันที่ 3-14 มีนาคม 68 เวลา 9.30-11.30 น. สอบถามโทร 02-4347304
เขตบางกะปิ ร่วมกับ ศูนย์บริการสาธารณสุข 35 หัวหมาก เปิด หน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสัตว์เลี้ยง ระหว่างวันที่ 3- 14 มีนาคม 2568
สำนักงานเขตบางกะปิ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล ร่วมกับ ศูนย์บริการสาธารณสุข 35 หัวหมาก เปิด หน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในสัตว์เลี้ยง ระหว่างวันที่ 3- 14 มีนาคม 2568 (เวลา 09.00-11.00 น) สถานที่จุดตั้งหน่วยบริการตามประกาศ
**หากท่านใดมีความประสงค์ สามารถนำสัตว์เลี้ยงของท่านเข้ารับบริการได้ ตามจุดที่ใกล้บ้านของท่านหรือตามสถานที่ ตั้งหน่วยบริการได้เลยนะคะ วัคซีนป้องกันโรคพิษสุนัขบ้า (บริการฟรี)
เขตสวนหลวง เร่วมกับศูนย์บริการสาธารณสุข 37 ประสงค์-สุดสาคร ตู้จินดา ให้บริการ ฟรี
สำนักงานเขตสวนหลวง ร่วมกับศูนย์บริการสาธารณสุข 37 ประสงค์-สุดสาคร ตู้จินดา ให้บริการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 ระหว่างวันที่ 3 - 14 มีนาคม 2568 บริการฟรี!! ไม่มีค่าใช้จ่าย
ทั้งนี้ เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสุนัขและสัตว์เลี้ยงในเขตกรุงเทพมหานคร ตามภารกิจยุทธศาสตร์โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามปณิธานของศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอเจ้าฟ้าจุฬาภรณ์วลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี
เขตคลองเตยร่วมกับ ศูนย์บริการสาธารณสุข 41 คลองเตย
ประชาสัมพันธ์กิจกรรมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในกรุงเทพมหานคร สำนักงานเขตคลองเตยร่วมกับศูนย์บริการสาธารณสุข 10 สุขุมวิท และศูนย์บริการสาธารณสุข 41 คลองเตย ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3 – 21 มีนาคม 2568 จำนวน 10 วัน ตั้งแต่เวลา 10.00 – 12.00 นี้
เขตบางขุนเทียน ศูนย์บริการสาธารณสุข 42 ถนอม ทองสิมา จัดหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3 - 14 มีนาคม 2568
เขตบางขุนเทียน ศูนย์บริการสาธารณสุข 42 ถนอม ทองสิมา จัดหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3 - 14 มีนาคม 2568 ประชาชนท่านใดที่มีสุนัขและแมวที่ต้องการฉีดวัคซีนสามารถนำมาเข้ารับการฉีดวัคซีนได้ตามวันเวลาและสถานที่ ✅สุนัขและแมวต้องสุขภาพดี ✅สุนัขและแมวไม่ตั้งครรภ์หรืออยู่ในช่วงให้นมลูก ✅สุนัขและแมวที่จะฉีดวัคซีนต้องมีอายุ 3 เดือนขึ้นไป!!!
ประชาชนท่านใดที่ต้องการเบิกวัคซีนไปฉีดเองที่บ้าน ให้จดชื่อจำนวนน้องหมา-แมว และนำกระติกใส่น้ำแข็งมาเพื่อรับวัคซีนได้เลยครับ
ศูนย์บริการสาธารณสุข 43 มีนบุรี หน่วยเคลื่อนที่ 3-14 มีนาคม 2568
ศูนย์บริการสาธารณสุข 43 มีนบุรี ประชาสัมพันธ์ หน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 ระหว่างวันที่ 3-14 มีนาคม 2568 ผู้ที่จะมารับบริการ โปรดนำบัตรประชาชนมาด้วยนะคะ และสัตว์เลี้ยงที่มาฉีดวัคซีนป้องกันพิษสุนัขบ้าต้องมีอายุ 3 เดือนขึ้นไป ไม่มีอาการป่วย และไม่ท้อง
เขตหนองจอก ร่วมกับศูนย์บริการสาธารณสุข 44
เขตหนองจอก ร่วมกับศูนย์บริการสาธารณสุข 44 ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1 ประจำปี 2568 ฟรี ณ ชุมชนในพื้นที่ จำนวน 8 เเห่ง โดยนำสัตว์เลี้ยงมารับบริการได้ตามวัน เวลา สถานที่ ระหว่างวันที่ 3 - 13 มีนาคม 2568 เวลา 09.00- 12.00 น. สุนัขเเละเเมวที่เข้ารับบริการ ควรมีสุขภาพเเข็งเเรง เเละมีอายุ 3 เดือนขึ้นไป เอกสารที่ใช้ : 1. บัตรประจำตัวประชาชน (เจ้าของสัตว์เลี้ยง) 2. สมุดประจำตัวสัตว์เลี้ยง
เขตลาดกระบัง ร่วมกับ ศบส.46 กันตารัติอุทิศ 3-14 มีนาคม 2568
เขตลาดกระบัง ร่วมกับ ศบส.46 กันตารัติอุทิศ ออกหน่วยเคลื่อนที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า (ในสัตว์เลี้ยง) ระหว่างวันที่ 3-14 มีนาคม 2568 ตาม สถานที่และเวลาดังระบุในภาพ สอบถามข้อมูลเพิ่มเติม โทร 02-3290320
เขตภาษีเจริญ โดยศูนย์บริการสาธารณสุข 47 คลองขวาง
เขตภาษีเจริญ โดยศูนย์บริการสาธารณสุข 47 คลองขวาง ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ระหว่างวันที่ 10-14 มีนาคม 2568 เวลา 9.00-11.00 น.
เขตหนองแขม ร่วมกับศูนย์บริการสาธารณสุข 48
สำนักงานเขตหนองแขม ร่วมกับศูนย์บริการสาธารณสุข 48 (นาควัชระอุทิศ) กำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 ระหว่างวันที่ 3 - 14 มีนาคม 2568 ตั้งแต่เวลา 10.00 – 12.00 น. ฟรี ฟรี ฟรี ฟรี สอบถามข้อมูลเพิ่มเติม โทร 02-4211227 #7318 02-4212147 02-4212148 02-4212149
เขตหนองแขมร่วมกับศูนย์บริการสาธารณสุข 48 นาควัชระอุทิศ จัดทีมเชิงรุกเข้าชุมชนให้บริการ
สำนักงานเขตหนองแขมร่วมกับศูนย์บริการสาธารณสุข 48 นาควัชระอุทิศ จัดทีมเชิงรุกเข้าชุมชนให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสำหรับสัตว์เลี้ยง ระหว่างวันที่ 3 - 7 มีนาคม 2568 ติดต่อสอบถาม ✅ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล 0 2421 1227 ต่อ 7318 ✅ ศูนย์บริการสาธารณสุข 48 นาควัชระอุทิศ โทร. 0 2421 2147 - 9 ในวันจันทร์ - ศุกร์ ระหว่างเวลา 08.00 - 12.00 น.
ขอให้ประชาชนเพิ่มความระมัดระวังในการดูแลสัตว์เลี้ยง ไม่ให้สัมผัสกับสัตว์อื่นที่ต้องสงสัย
หากสัตว์ของท่านมีอาการผิดปกติหรือพบสัตว์ที่มีพฤติกรรมเปลี่ยนไป เช่น กระวนกระวาย กัดไม่เลือก ขากรรไกรค้าง น้ำลายฟูมปาก โปรดติดต่อ 1555 (24 ชม.) หรือ 0 2245 3311, 0 2328 7460 และ 0 2328 7355
เขตหลักสี่ ศูนย์บริการสาธารณสุข 53 ทุ่งสองห้อง ระหว่างวันที่ 3-14 มีนาคม 2568
สำนักงานเขตหลักสี่ ร่วมกับศูนย์บริการสาธารณสุข 53 ทุ่งสองห้อง ออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง ประจำปี 2568 ระหว่างวันที่ 3-14 มีนาคม 2568 เวลา 09.00-11.30 น.
เขตประเวศ ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ ออกหน่วยฉีด ตั้งแต่วันที่ 3-14 มีนาคม 2568
เขตประเวศ ศูนย์บริการสาธารณสุข 57 บุญเรือง ล้ำเลิศ ขอประชาสัมพันธ์ตารางออกหน่วยฉีดวัคซีนพิษสุนัขบ้า ประจำปี 2568 ตั้งแต่วันที่ 3-14 มีนาคม 2568
เขตราษฎร์บูรณะ ร่วมกับ ศูนย์บริการสาธารณสุข 58 ล้อม-พิมเสน ฟักอุดม วันที่ 10- 14 มีนาคม 2568 เวลา 09.00-12.00 น.
เขตราษฎร์บูรณะ ร่วมกับ ศบส 58 ล้อม-พิมเสน ฟักอุดม ร่วมรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 (ฟรี) วันที่ 10- 14 มีนาคม 2568 เวลา 09.00-12.00 น. สถานที่ดังนี้
10 มีนาคม 2568 สถานที่: ชุมชนรุ่งอรุณ จุดนัดบริการ: ภายในชุมชน
11 มีนาคม 2568 สถานที่: วัดเกียรติประดิษฐ์ จุดนัดบริการ: ลานอเนกประสงค์
12 มีนาคม 2568 สถานที่: ชุมชนสุขสวัสดิ์ 26 จุดนัดบริการ: หน้าชุมชน
13 มีนาคม 2568 สถานที่: ชุมชนมิ่งประชา จุดนัดบริการ: ลานอเนกประสงค์ (ตลาดเก่า)
14 มีนาคม 2568 สถานที่: วัดบางปะกอก จุดนัดบริการ: ลานอเนกประสงค์
เขตทุ่งครุ ร่วมกับศูนย์บริการสาธารณสุข 59 ทุ่งครุ วันที่ 3-7 มีนาคม 2568
สำนักงานเขตทุ่งครุ ศูนย์บริการสาธารณสุข 59 ทุ่งครุ ออกให้บริการฉีดวัคซีนพิษสุนัขบ้า ฟรี วันที่ 3-14 มีนาคม 2568 เวลา 9.00-11.00 น. ฟรี สอบถามโทร 02-4644393
เขตดอนเมือง ร่วมกับศูนย์บริการสาธารณสุข 60 (รสสุคนธ์มโนชญากร)
สำนักงานเขตดอนเมืองร่วมกับศูนย์บริการสาธารณสุข 60 (รสสุคนธ์มโนชญากร) ออกให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับน้องหมา น้องแมวและสัตว์เลี้ยงลูกด้วยนม ฟรี! 3-7 และ 10-14 มีนาคม 2568 นี้
วันที่ 3 มีนาคม 2568 ชุมชนแสงไพรฑูรย์
วันที่ 4 มีนาคม 2568 ชุมชนแหลมทองนิเวศน์
วันที่ 5 มีนาคม 2568 ชุมชนสินวงศ์
วันที่ 6 มีนาคม 2568 ชุมชนศิริสุข
วันที่ 7 มีนาคม 2568 ชุมชนโกสุมรวมใจ2
วันที่ 10 มีนาคม 2568 ชุมชนบูรพา 24
วันที่ 11 มีนาคม 2568 ชุมชนร่วมใจพัฒนา กรป.กลาง
วันที่ 12 มีนาคม 2568 ชุมชนเปรมประชา
วันที่ 13 มีนาคม 2568 ชุมชนอยู่เจริญวิภาวดี
วันที่ 14 มีนาคม 2568 ชุมชนวังทอง เจ้าของน้องๆ #อย่าลืม นำบัตรประจำตัวประชาชนมายื่นของรับบริการนะคะ
สอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมฯ โทร. 0 2565 9424 ต่อ 5341 ในวันเวลาค่ะ
เขตภาษีเจริญ ศูนย์บริการสาธารณสุข 62 ตวงรัชฏ์
ศูนย์บริการสาธารณสุข 62 ตวงรัชฏ์ เชิญชวน รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงในพื้นที่เขตภาษีเจริญกรุงเทพมหานคร ตั้งแต่วันที่ 3 - 7 มีนาคม 2568
เขตคลองสามวา ร่วมกับ ศูนย์บริการสาธารณสุข64 คลองสามวา จัดหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประจำปี 3-14 มีนาคม 2568
ศูนย์บริการสาธารณสุข64 คลองสามวา ร่วมกับสำนักงานเขตคลองสามวา จัดหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสัตว์เลี้ยง ประจำปี2568 ระหว่างวันที่ 3 - 14 มีนาคม 2568 เวลา 09.00 - 11.30 น.
เขตบางบอน ร่วมกับ ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ออกหน่วยวันที่ 3-14 มีนาคม 2568
ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันพิษสุนัขบ้าให้กับสัตว์เลี้ยง ฟรี ในวันที่ 3-14 มีนาคม 2568 เวลา 09.00 - 11.00 น. สอบถามโทร 02-4530526 ศบส.65
เขตบางบอน ร่วมกับ ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน
เขตบางบอน ร่วมกับ ศูนย์บริการสาธารณสุข 65 รักษาศุข บางบอน ร่วมกับ สำนักงานเขตบางบอน ให้บริการออกหน่วย "ฉีดวัคซีนป้องกันพิษสุนัขบ้า" ในสัตว์เลี้ยง ในเดือน "มีนาคม" กำหนดการออกหน่วยเคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2568 ในวันที่ 3-14 มีนาคม นี้ ฟรี วัน-เวลา และสถานที่ ตามรายละเอียดด้านล่างนี้
3 มี.ค. ชุมชนรางไผ่
4 มี.ค. หมู่บ้านดีเค
5 มี.ค. สมฤทัยคอนโด
6 มี.ค. หมู่บ้านภาสกร 1
7 มี.ค. หมู่บ้านบางบอนวิลล่า 1
10 มี.ค. ชุมชนกำนันแม้น 13
11 มี.ค. การเคหะบางบอน
12 มี.ค. หมู่บ้านทองภูมิวิลล่า
13 มี.ค. หมู่บ้านเอสเค
14 มี.ค. ชุมชนมั่นคง 133
เขตลาดพร้าว ร่วมกับศูนย์บริการสาธารณสุข 66 ตำหนักพระแม่กวนอิม โชคชัย 4
เขตลาดพร้าว ร่วมกับศูนย์บริการสาธารณสุข 66 ตำหนักพระแม่กวนอิม โชคชัย 4 ออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ระหว่างวันที่ 3-14 มีนาคม 2568 (ครั้งที่ 1) สอบถามโทร 02-5394895 , 02-5394828 (ในวันเวลาราชการ)
เขตทวีวัฒนา ร่วมกับศูนย์บริการสาธารณสุข 67 ออกหน่วย 3 - 19 มีนาคม 2568
เขตทวีวัฒนา ร่วมกับศูนย์บริการสาธารณสุข 67 ออกหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ครั้งที่ 1 ประจำปี 2568 ฟรี ณ ชุมชนในพื้นที่ จำนวน 13 เเห่ง โดยนำสัตว์เลี้ยงมารับบริการได้ตามวัน เวลา สถานที่ที่เเจ้งไว้ ระหว่างวันที่ 3 - 19 มีนาคม 2568 เวลา 10.00 - 12.00 น. สุนัขเเละเเมวที่เข้ารับบริการ ควรมีสุขภาพเเข็งเเรง เเละมีอายุ 3 เดือนขึ้นไป เอกสารที่ใช้ : บัตรประจำตัวประชาชน (เจ้าของสัตว์เลี้ยง)
เขตสะพานสูง ร่วมกับศูนย์บริการสาธารณสุข 68 วันที่ 3 - 14 มีนาคม 2568 เวลา 10.00 -12.00 น.
สำนักงานเขตสะพานสูง ประชาสัมพันธ์กำหนดการออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ร่วมกับศูนย์บริการสาธารณสุข 68 สะพานสูงจัดกำหนดการออกหน่วยเคลื่อนที่รณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในพื้นที่เขตสะพานสูงประจำปี 2568 ครั้งที่ 1 ระหว่างวันที่ 3 - 14 มีนาคม 2568 ตั้งแต่เวลา 10.00 -12.00 น.
จึงขอประชาสัมพันธ์เชิญชวนประชาชนนำสัตว์เลี้ยงสุนัขหรือแมวอายุ 3 เดือนขึ้นไปมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่หน่วยบริการฉีดวัคซีนเคลื่อนที่ใกล้บ้านท่าน โดยไม่เสียค่าใช้จ่ายใดๆ (ฟรี)
สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตสะพานสูง ชั้น 3 โทรศัพท์. 0-2372-2918 ต่อ 7118 และ 7119 หรือศูนย์บริการสาธารณสุข 68 สะพานสูง โทรศัพท์ 02-3722225 ต่อ 7
เดือนเมษายน 2568
งานสืบสานศิลป์ถิ่นโนรา อนุรักษ์มรดกไทย ประจำปี 2568 วันที่ 1-12 เมษายน 2568
จังหวัดพัทลุงร่วมกับองค์การบริหารส่วนจังหวัดพัทลุง ขอเชิญเที่ยวงานสืบสานศิลป์ถิ่นโนรา อนุรักษ์มรดกไทย ประจำปี 2568 วันที่ 1-12 เมษายน 2568
ณ บริเวณสนามหน้าศาลากลางและบนถนนทางเสด็จ จังหวัดพัทลุง
กำหนดการ Thailand Coffee Hub 2025
เทศกาลกาแฟที่ใหญ่ที่สุด “Thailand Coffee Hub 2025” พร้อมเอาใจคอกาแฟสายเข้ม จัดเต็มทั่วประเทศไทย 3 งาน 3 จังหวัด เซ็นทรัล เชียงใหม่ : วันที่ 2-6 เม.ย. 2025 (5 วัน)
เซ็นทรัล ขอนแก่น : วันที่ 3-8 มิ.ย. 2025 (6 วัน)
เซ็นทรัล หาดใหญ่ : วันที่ 25-31 ส.ค. 2025 (7 วัน)
*สำหรับกรุงเทพฯ สามารถรอติดตามรายละเอียดได้ในภายหลัง*
Thailand Coffee Hub 2025 เชียงใหม่ วันที่ 2-6 เม.ย. 2568
เทศกาลกาแฟที่ใหญ่ที่สุด “Thailand Coffee Hub 2025” เซ็นทรัล เชียงใหม่ : วันที่ 2-6 เม.ย. 2568 (5 วัน) พร้อมเอาใจคอกาแฟสายเข้ม เปิดจักรวาลกาแฟสุดยิ่งใหญ่ มาเหนือ
โคxรเปียก 2025 Songkran Festival ครั้งที่ 4 วันที่ 3-6 เมษายน 2568
โคxรเปียก 2025 Songkran Festival ครั้งที่ 4 วันที่ 3-6 เมษายน 2568 ณ บริเวณลานจอดรถ ตะวันนา 2 บางกะปิ กรุงเทพมหานคร 3 เม.ย. 68 คอนเสิร์ต Num KALA & จ๊ะ นงผณี 4 เม.ย. 68 คอนเสิร์ต ลำไย ไหทองคำ 5 เม.ย. 68 คอนเสิร์ต Joeyboy 6 เม.ย. 68 คอนเสิร์ต Taitosmith
เทศกาลสับปะรดหวาน อำเภอบ้านคา 3-12 เมษายน 2568
เทศกาลสับปะรดหวาน อำเภอบ้านคา 3-12 เมษายน 2568 ที่ว่าการอำเภอบ้านคา จ.ราชบุรี มหกรรมสินค้าราคาถูก สินค้าท้องถิ่นโอท้อป เฟอร์นิเจอร์ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกคืน
งาน พระเจ้าใหญ่ของดีซำสูง กาชาดอำเภอซำสูง 4-10 เมษายน 2568
ขอเชิญเที่ยวงาน พระเจ้าใหญ่ของดีซำสูง กาชาดอำเภอซำสูง 4-10 เมษายน 2568 สนามหน้าที่ว่าการอำเภอซำสูง จ.ขอนแก่น
SALAYA WATER FEST 2025 เทศกาลดนตรีแห่งสายน้ำ 4-5-6 เมษายน 2568
SALAYA WATER FEST 2025 (เทศกาลดนตรีแห่งสายน้ำสุดมันส์) ศุกร์ 4 เสาร์ 5 อาทิตย์ 6 เมษายน 2568 (3 วันเต็ม) SS PARK SALAYA ลานหน้าร้านสกินชิพ
Phatthalung Coffee Craft Music ครั้งที่ 5 วันที่ 4-6 เมษายน 2568
งานกาแฟที่ใหญ่ที่สุด ของจังหวัดพัทลุง Phatthalung Coffee Craft Music ครั้งที่ 5 วันที่ 4-6 เมษายน 2568 เวลา 09.00 น.-22.00 น. สถานที่จัดงาน อาคารฟอสซิล ซากดึกดำบรรพ์ เทศบาลตำบลมะกอกเหนือ อำเภอควนขนุน จังหวัดพัทลุง
กิจกรรมภายในงาน - พบปะ/แลกเปลี่ยนกับเกษตรกรต้นน้ำกาแฟจากจังหวัดพัทลุงและพื้นที่ใกล้เคียง -การแข่งขันดริปกาแฟ PCCM Brewer Cup -การแข่งขันเอสเย็นสโลว์บาร์ PCCM ES YEN Slowbar -การแข่งขันผสมเครื่องดื่ม PCCM TIPCO Mixology -การคัพปิ้งกาแฟโรบัสต้า -มีการออกร้านของร้านกาแฟทั้งในจังหวัดพัทลุงและจากต่างจังหวัด ร้านค้าร้านอาหารหลากหลาย -งาน Craft -ฟังดนตรีชิวๆ สบายๆ จัดเต็ม -เทศกาลอาหารดีปากคลอง -กิจกรรมการเรียนรู้จากพิพิธภัณฑ์ธรรมชาติ ม.อ. -กิจกรรมเวิร์คชอปจากกลุ่มงานคราฟท์พัทลุง
โคตรฉ่ำ 2025 music festival 4-6 เมษายน 2568
โคตรฉ่ำ 2025 music festival โคตรฉ่ำ2025 ครั้งที่1 เทศกาลความมันส์ที่สุดในย่านนครปฐม จัดหนักจัดเต็ม สนุกสุดเหวี่ยงแน่นอน จัดขึ้นในวันที่ 4-6 เมษายน 2568 นี้ วันที่ 5 เมษายน พบกับทีมศิลปินและเหล่า DJ MC ชั้นแนวหน้า เช่น MAIYARAP AUDI TITIE SPARROW KORN PLAYBOY HARDVEARN LAMBIIZZKIIT SINGNOI TONAOR KANAN PAPRAN
LAMEA BEACH MUSIC FESTIVAL 5 เม.ย. 2568 หาดละแม ชุมพร
LAMEA BEACH MUSIC FESTIVAL 5 เม.ย. 2568 หาดละแม อำเภอละแม จังหวัดชุมพร ชุมพร ภาคใต้ เตรียมมันส์สะเทือนหาด! ครั้งแรกของ LAMEA BEACH MUSIC FESTIVAL วันที่ 5 เมษายน 2568 | เวลา 14:00 - 02:00 น. ณ หาดละแม อำเภอละแม จังหวัดชุมพร รวมศิลปินสุดฮอต! The TOYS | Musketeers | Meentra Intira | Aof Pongsak | F. Hero Whatcharawalee | Kaimook Rungrat | Mocca Garden | Mean Band Lilly Daimodthasodchuen | Kanom Whan DJ Barbiemozz & DJ Mizz Ramon ระเบิดความมันส์! หาดทรายขาว x ดนตรีมันส์ x แสงสีสุดอลังการ! ทะเลสุดชิล - เสียงเพลงสุดฟิน - บรรยากาศสุดว้าว! ชวนแก๊งเพื่อนแล้วมาเดือดไปด้วยกัน! รีบเลย! แล้วมาสนุกแบบเต็มแม็กซ์กันที่ LAMEA BEACH MUSIC FESTIVAL 2025! นี้
AQUA MUSIC FESTIVAL 2025 05.04.25 @ASIATIQUE
ต้อนรับเทศกาลเปียก เตรียมสาดความมันส์ไปกับ AQUA MUSIC FESTIVAL รับประกันชุ่มฉ่ำกันแน่นอน AQUA MUSIC FESTIVAL 2025 05.04.25 @ASIATIQUE ”เปียกสุดมันส์ FUNสุดTEEN” สาดความสุขทั้ง 9 ศิลปินในงานเดียว • PURPEECH • LITTLE JOHN • SAFE PLANET • 1LIFE • ONLY MONDAY • PUN • URBOYTJ • MILLI • BADMIXXY FT.Alie Blackcobra "พร้อมเซอร์ไพร์สสุดพิเศษ" Asiatique "เปียกสุดมันส์ FUN สุด TEEN" กดบัตรพร้อมกัน 24 กุมภาพันธ์ 2568
การแข่งขัน TCBL2025 สนามแรก ณ เชียงใหม่ วันที่ 5-6 เมษายน 2025
การแข่งขัน TCBL2025 สนามแรก ณ เชียงใหม่ วันที่ 5-6 เมษายน 2025 จัดที่ เซ็นทรัลเฟสติวัล เชียงใหม่
Thailand Coffee Brewer League ประเพณีมหาสงกรานต์เมืองตาก ประจำปี 2568 วันที่ 7-15 เมษายน 2568
เทศบาลเมืองตาก ขอเชิญเที่ยวงาน ประเพณีมหาสงกรานต์เมืองตาก ประจำปี 2568 วันที่ 7-15 เมษายน 2568 ณ ลานเอนกประสงค์ ศาลสมเด็จพระเจ้าตากสินมหาราช (ที่จัดงานกาชาดเดิม) ชมการแสดงวัฒนธรรมพื้นบ้าน สินค้าพื้นเมือง สินค้าราคาถูก สินค้าโอทอป สินค้าการเกษตรอาหารดีสี่ภาค ไม้ดอกไม้ประดับ สวนสนุกชุดใหญ่ คอนเสิร์ตศิลปินดัง
แม่กลอง สะเทือน ปลาทูสะดุ้ง Festival 2025 เทศกาลสงกรานต์มิวสิคเฟสติวัล สมุทรสงคราม วันที่ 9 , 12-15 , 18-19 เมษายน 2568
แม่กลอง สะเทือน ปลาทูสะดุ้ง Festival 2025 เทศกาลสงกรานต์มิวสิคเฟสติวัลที่ใหญ่ที่สุด วันที่ 9 , 12-15 , 18-19 เมษายน 2568 ณ บริเวณลาน BOOZY HOUSE แม่กลอง สมุทรสงคราม
งานประเพณีสงกรานต์หนองบัวลำภู 9 -16 เมษายน 2568
งานประเพณีสงกรานต์หนองบัวลำภู 9 -16 เมษายน 2568 ณ สวนสาธาณศาลสมเด็จพระนเรศวรมหาราช จังหวัดหนองบัวลำภู
งานนมัสการพระพุทธสิหิงค์ฯ และงานกาชาดจังหวัดชลบุรี ปีที่ 93 ประจำปี 2568 วันที่ 11-19 เมษายน 2568
งานนมัสการพระพุทธสิหิงค์ฯ และงานกาชาดจังหวัดชลบุรี ปีที่ 93 ประจำปี 2568 วันที่ 11-19 เมษายน 2568 ณ สนามหน้าศาลากลางจังหวัดชลบุรี SIAM SONGKRAN MUSIC FESTIVAL 2025 “THE DAWN” 11 เม.ย. - 14 เม.ย. 2568 RCA
SIAM SONGKRAN MUSIC FESTIVAL 2025 “THE DAWN” 11 เม.ย. - 14 เม.ย. 2568 RAVO BKK, ARENA AREA (RCA, RAMA 9 BANGKOK, THAILAND) เมื่อรุ่งอรุณได้ใกล้เข้ามา นั้นคือเวลาเริ่มต้นแห่งการผจญภัยครั้งใหม่ ที่ทุกคนจะไม่มีวันลืม เตรียมโชว์ศิลปินใหม่ FROSTTOP ดาวรุ่งมาแรง แห่งวงการ EDM TRAP & BASS MUSIC ผู้ได้ขึ้นโชว์บน COSMIC MEADOW STAGE 1 ในเวทีใหญ่ ของ งาน Electric Daisy Carnival (EDC) LAS VEGAS ที่ลาส เวกัส สหรัฐ 2 ปีติด ! และ ปีล่าสุด 2024 ก็ได้โชว์ปิดเวที จะมาโชว์ที่ประเทศไทย งานสงกรานต์ 2025 ปีนี้ เป็นครั้งแรก ของประเทศไทย ไม่ต้องบินไปดูถึง EDC ที่เวกัส
gCircuit Song Kran เซอร์กิตปาร์ตี้ของชุมชน LGBT 11 เม.ย. - 14 เม.ย. 2568
GCIRCUIT 11 เม.ย. - 14 เม.ย. 2568 กรุงเทพมหานคร gCircuit Song Kran เซอร์กิตปาร์ตี้ของชุมชน LGBT สนุก ตื่นตาตื่นใจ และประทับใจกับทุกโมเมนต์แห่งความสนุกที่เกิดขึ้นเพียง 1 ครั้งในรอบปี ด้วยโปรดักชั่นสุดตระการตา ทั้งแสง สี เสียง เอฟเฟกต์ และเลเซอร์
Bangkok Songkran Bear Week 11- 14 เม.ย. 2568


Bangkok Songkran Bear Week 11 เม.ย. - 14 เม.ย. 2568 กรุงเทพมหานคร BSBW 2025: เข้าสู่โลกแห่งความฝัน Dream Sphere ปีนี้ Bangkok Songkran Bear Week ขอพาคุณสู่ Dream Sphere โลกแห่งความฝันที่ทุกจินตนาการกลายเป็นจริง ตั้งแต่ปาร์ตี้โฟมเรืองแสง ไปจนถึงปาร์ตี้ริมสระสุดอลังการ การประกวดระดับนานาชาติ และพาเหรดที่เต็มไปด้วยสีสัน! -11 Apr 2025 Bangkok Twilight ปาร์ตี้โฟมบางกอกทไวไลท์ (Dreamscape) เริ่มต้นการผจญภัยในธีม Dreamscape ที่ปาร์ตี้โฟมเรืองแสง บรรยากาศดาดฟ้าริมแม่น้ำเจ้าพระยา -12 Apr 2025 GCIRCUIT ปาร์ตี้ Big Oasis Bear Pool สนุกสุดเหวี่ยงที่ปาร์ตี้ริมสระสุดยิ่งใหญ่จาก gCircuit -13 Apr 2025 Bearism X Mr Bear International 2025 ร่วมชมการประกวดรอบชิงชนะเลิศสุภาพบุรุษหุ่นหมีจากทั่วโลก Mr. Bear International 2025 และต่อด้วยปาร์ตี้สุดมันส์ Bearism ในธีม Nightmare -14 Apr 2025 Bangkok Parade Songkran ขบวนพาเหรดน้ําในตํานาน ปิดท้ายด้วยพาเหรดสงกรานต์สุดอลังการ ผสมผสานวัฒนธรรมไทยกับความภูมิใจของ LGBTQ+ ซื้อตั๋วได้แล้ววันนี้ที่ eventpop.me เตรียมตัวให้พร้อมสำหรับ 4 วันแห่งความสนุก ความตื่นเต้น และประสบการณ์ที่ไม่เหมือนใคร
เทศกาลสงกรานต์ มันส์เปียกสุดซอยปี 3 จัดเต็มทุกวัน 11-15เม.ย. 68
เทศกาลสงกรานต์
มันส์เปียกสุดซอยปี 3 สงกรานต์นี้ ไม่มีเบา! 5 วัน 5 คอนเสิร์ต จัดหนัก จัดเต็มทุกวัน! 11-15เม.ย. 68 วันที่ 4 มีนาคม เปิดไลน์อัพ ศิลปิน DJ&Mc ที่จะพาคุณทะลุทุกขีดจำกัดความสนุก! กดติดตามเพจ มันส์เปียกสุดซอย ไว้เลย เพราะปีนี้ ความเดือดระดับ MAX!
งาน MUSIC JUNGLE 2 by KIYOMIZU 11-12 เม.ย 68
งาน MUSIC JUNGLE 2 by KIYOMIZU สงกรานต์สไตล์ฟูลมูนปาร์ตี้ ปาร์ตี้ธีม Neon Paradise 11-12 เม.ย 68 ตั้งแต่ 13.00 - 01.30 น. Kiyomizu Onsen And Glamping
ไหว้พระ 11 อำเภอของแปดริ้ว จ.ฉะเชิงเทรา
ททท.สำนักงานฉะเชิงเทรา แนะนำนักท่องเที่ยวสายศรัทธาไหว้พระ 11 อำเภอของแปดริ้ว จ.ฉะเชิงเทรา
1. วัดโสธรวรารามวรวิหาร (อำเภอเมืองฉะเชิงเทรา)
2. วัดหงษ์ทอง (อำเภอบางปะกง)
3. วัดปากน้ำโจ้โล้ (อำเภอบางคล้า)
4. วัดสนามจันทร์ (อำเภอบ้านโพธิ์)
5. วัดโพรงอากาศ (อำเภอบางน้ำเปรี้ยว)
6. วัดโพธิ์ใหญ่ (อำเภอพนมสารคาม)
7. วัดห้วยน้ำทรัพย์ (พระธาตุวาโย) (อำเภอสนามชัยเขต)
8. วัดป่าพรหมยาน (อำเภอแปลงยาว)
9. วัดสะแกงาม (อำเภอราชสาส์น)
10. วัดป่าเขาล้อม (อำเภอท่าตะเกียบ)
11. วัดคุ้งกร่างภาราม (อำเภอคลองเขื่อน)
S2O Songkran Music Festival 12 เม.ย. - 14 เม.ย. 2568
S2O Songkran Music Festival 12 เม.ย. - 14 เม.ย. 2568 ราชมังคลากีฬาสถาน สนามกีฬาแห่งชาติ S2O เทศกาลดนตรีสงกรานต์ที่ใหญ่ที่สุด เปียกที่สุด และมันที่สุด เตรียมตัวให้พร้อมกับปาร์ตี้ที่สงกรานต์ที่ทุกคนรอคอย พบกับดีเจระดับโลก โปรดักชันเวทีสุดอลังการ ดับร้อนไปกับเครื่องฉีดน้ำที่จะทำให้ทุกคนสดชื่นแบบ 360 องศา ฉลองให้สุดเหวี่ยงกับประสบการณ์ที่คุณจะไม่มีวันลืม สนุกกันแบบไม่รู้จบ * ผู้ร่วมงานต้องมีอายุตั้งแต่ 20 ปีขึ้นไปเท่านั้น
งานมหาสงกรานต์วันไหลลำลูกกา 12-18 เมษา 68
งานมหาสงกรานต์วันไหลลำลูกกา 12-18 เมษา 68 ปิดถนนเล่นน้ำ7 วัน 3กิโลระยะ ตั้งแต่เวลา15:00-24:00น เดินเล่นน้ำได้ จอดรถฟรี ของเล่นนานาชนิด อุโมงค์น้ำ ชมคอนเสิร์ตแสงสีเสียงฟรี วันที่12 วง Kingsize วง DJ. Beet RKO วันที่13 วง ลำไย ไหทองคำเต็มวง วันที่14 วง DJ. ENVY วง DJ. CHERTAM วันที่15 วง DJ. DARREN วง OKS BAND วันที่16 วง Tj URBOY วง MC ก็อต วันที่17 วง รถแห่นกคุ้มอืด มิวสิค วันที่18 วง Bie House Eand
WATERTIME งานเปียกสาดดดด 12-13 เมษายน 2568
WATERTIME งานเปียกสาดดดด พบกับคอนเสิร์ตรุ่นใหญ่
THAITANIUM และ J JETRIN แบบจัดเต็มในวันสงกรานต์ เตรียมตัวในพร้อม วันที่ 12-13 เมษายน 2568 Bedtime Stories - นิทานก่อนนอน Bar&Restaurant
สงกรานต์เชียงใหม่ ”Chiangmai Songkran Fun Fest 2025“ 13-15 เมษายน 2568 เซ็นทรัล เชียงใหม่
สงกรานต์ในเชียงใหม่ สาดไม่หยุด สนุกสุด ที่สุดของความเปียก ความสนุก เเลนด์มาร์คที่ใหญ่ที่สุดของภาคเหนือ ”Chiangmai Songkran Fun Fest 2025“ พร้อมสาด พร้อมเปียก จัดเต็ม 3 วัน ! สาดให้สุดกับ 6 ศิลปินที่จะพาทุกคนไปม่วนกันเเบบไม่ยั้ง 13-15 เมษายน 2568 ตั้งแต่ 16:00-24:00 น. 13 เม.ย. No One Else l The Parkinson 14 เม.ย. Num Kala l Aof Pongsak 15 เม.ย. Burin Boonvisut l Zom Marie ที่ศูนย์การค้าเซ็นทรัล เชียงใหม่ (เซ็นเฟส) เเล้วปะกั๋นเน้อ งานนี้เข้าได้ไม่จำกัดอายุ (มีเเบ่งโซน) ต่ำกว่า 10 ปี เข้าฟรี!
งานสรงน้ำสงกรานต์ประจำปี วัดจุฬามณี 13-15 เมษายน 2568
งาน สรงน้ำประจำปี สงกรานต์ วันที่ 13-15 เมษายน 2568 ณ วัดจุฬามณี ตำบลบางช้าง อำเภออัมพวา จังหวัดสมุทรสงคราม
งาน สงกรานต์สยามผ้าขาวม้า สาดสนุก สุดอะเมซิ่ง ใจกลางสยามสแควร์ 13-15 เมษายน 2568
งาน สงกรานต์สยามผ้าขาวม้า สาดสนุก สุดอะเมซิ่ง
วันที่ 13-15 เมษายน 2568 ณ ใจกลางสยามสแควร์ กรุงเทพมหานคร
สงกรานต์วันไหลรังสิต 17-20 เม.ย. 68
สงกรานต์วันไหลรังสิต 17-20 เม.ย. 68 ออกเดินทางแล้ว! ลูกทัวร์ทุกท่าน เตรียมตัวรับแรงสาด แล้วกระโดดขึ้นมา! รังสิตสาด 3 “ทัวร์ซิ่ง 4 DX” สงกรานต์นี้ ไม่มีเบา! 4 วัน 4 มิติแห่งความเดือด ที่ ESC PARK RANGSIT จัดใหญ่ จัดเต็มทุกโซน
WATER WAR CHIANG MAI 2025 13 เทศกาลดนตรีน้ำสุดยิ่งใหญ่ 13 เมษายน 2568
WATER WAR CHIANG MAI 2025 13 เทศกาลดนตรีน้ำสุดยิ่งใหญ่ 13 เมษายน 2568 ลานม่วนใจ๋ เซ็นทรัล เชียงใหม่ แอร์พอร์ต อัดแน่นศิลปินที่ดีที่สุดไว้ในวันเดียว ขอกระซิบนิดนึง ไลน์อัพสุดมาก WATER WAR CHIANG MAI 2025 เทศกาลดนตรีน้ำสุดยิ่งใหญ่ หนึ่งเดียวของภาคเหนือ BODYSLAM / TAITOSMITH / SLOT MACHINE / THREE MAN DOWN / BIG ASS / POTATO / NONT TANONT / PERSES / MEAN BAND
หรอยสาดด 2025 วันที่ 4 - 19 เม.ย. 2568
หรอยสาดด 2025 เทศกาลดนตรีวันสาดก่อน และวันไหลแห่งแรกของภาคใต้ ปักหมุดเตรียมสาดแบบจัดใหญ่ สาดก่อนใคร "สุราษฎร์ธานี"
วันที่ 4 เมษายน 68 GUNNER • URBOY TJ • LOMOSONIC
วันที่ 5 เมษายน 68 SARAN • FIIXD x 1MILL • YOUNGOHM สาดวันไหล "หาดใหญ่" วันที่ 19 เมษายน 68 FIIXD x 1MILL • GUNNER • ZEAL สาดกับศิลปินเดือดๆ จัดเต็ม!
Miss Amazing Queen Songkran 2025 Final Night วันจันทร์ที่ 14 เมษายน 2568
Miss Amazing Queen Songkran 2025 เวทีประกวดเพื่อเฟ้นหาสาวงาม ผู้เป็นตัวแทนแห่ง ความเท่าเทียม และการเฉลิมฉลอง สมรสเท่าเทียม ที่กำลังจะเกิดขึ้นในประเทศไทย อีกทั้งยังเป็น ทูตวัฒนธรรมการท่องเที่ยว ในเทศกาล สงกรานต์ ปี 2025 กับหน่วยงานภาครัฐ และภาคเอกชน ชิงมงกุฎอัตลักษณ์ สายสะพาย ถ้วยรางวัล และเงินสด มูลค่ารวมกว่า 300,000 บาท
✅กำหนดการ การประกวด • เปิดรับสมัครตั้งแต่วันนี้ จนถึง 20 มีนาคม 2568 เวลา 23.59 น. • รอบเปิดตัว Introduction ช่วงปลายเดือนมีนาคม 2568 เปิดตัวเข้ากองประกวดฯ ด้วยการแข่งขัน ชุดเอกลักษณ์ความเป็นไทยสร้างสรรค์ และ ชุดว่ายน้ำ ณ ศูนย์การค้า MBK Center • รอบ Final Night วันจันทร์ที่ 14 เมษายน 2568 ณ งาน Songkran Songkran Silom Parade Festival 2025 ณ ถ.สีลม
เทศกาลอาหารและดนตรี โลตัสโรจนะ 14-18 เมษายน 2568
เทศกาลอาหารและดนตรี จังหวัดพระนครศรีอยุธยา 14-18 เมษายน 2568 บริเวณหน้าห้างโลตัสโรจนะ สี่แยกอุทัย ต.สามเรือน อ.บางปะอิน จังหวัดพระนครศรีอยุธยา ชมการแสดงคอนเสิร์ต ลิเก รถแห่ สินค้าดีจากโรงงาน สวนสนุกชุดใหญ่
หลักสูตรวิชาชีพระยะสั้น การติดตั้งโซล่าเซลล์เพื่อใช้งานกับอาคารขนาดเล็ก
หลักสูตรวิชาชีพระยะสั้น การติดตั้งโซล่าเซลล์เพื่อใช้งานกับอาคารขนาดเล็ก เรียนเฉพาะวันอาทิตย์ 20 เมษายน - 1 มิถุนายน 68 (9.00-16.00) ค่าเรียน 1,260บาท จบแล้วสามารถประกอบอาชีพได้เลย
งานท่องเที่ยวประจวบคีรีขันธ์ มหัศจรรย์เมืองสามอ่าว และงานกาชาด ประจำปี 2568
จังหวัดประจวบคีรีขันธ์ และเหล่ากาชาดจังหวัดประจวบคีรีขันธ์ ขอเชิญเที่ยวงานท่องเที่ยวประจวบคีรีขันธ์ มหัศจรรย์เมืองสามอ่าว และงานกาชาด ประจำปี 2568 วันที่ 25 เมษายน - 4 พฤษภาคม 2568 ชมการแสดงแสงสีเสียง และคอนเสิร์ตเต็มเวทีทุกคืน มหกรรมสินค้าราคาถูก อาหารอร่าย สินค้าโอทอป สินค้าร้านดังจาก TikTok สวนสนุกชุดใหญ่
งานสุราษฎร์ฟู้ดแฟร์ 25 เม.ย. - 3 พ.ค. 2568
งานสุราษฎร์ฟู้ดแฟร์ 25 เม.ย. - 3 พ.ค. 2568 ถนนสายริมเขื่อนแม่น้ำตาปี อำเภอเมือง จังหวัดสุราษฎร์ธานี การจำหน่ายอาหารพื้นเมือง อาหารทะเลสด เลิศรส การออกร้านนิทรรศการ และมีการแสดงดนตรีจากเหล่าเด็กเยาวชน และศิลปินนักร้อง นักแสดงชื่อดัง ที่หมุนเวียนกันร่วมสนุกกันแบบทุกคืน ตลอดระยะเวลาของงาน ณ บริเวณ ถนนสายริมเขื่อนแม่น้ำตาปี อำเภอเมือง จังหวัดสุราษฎร์ธานี
ประเพณีสงกรานต์พระประแดง ประจำปี 2568 25 - 27 เม.ย. 2568
ประเพณีสงกรานต์พระประแดง ประจำปี 2568 ระหว่างวันที่ 25 - 27 เมษายน 2568 อำเภอพระประแดง จังหวัดสมุทรปราการ กิจกรรมภายในงาน - ประกวดรางสงกรานต์และหนุ่มลอยชาย - ชมการละเล่นพื้นเมือง (สะบ้ารามัญ) - ชมการกวนกาละแมของดีเมืองพระประแดง - ชมการปนะดับไฟ แสง สี บริเวณอุทยานประวัติศาสตร์ป้อมแผลงไฟฟ้า - พิธีสรงน้ำพระพุทธรูป พิธีรดน้ำขอพรผู้ใหญ่ - ขบวนแห่งานสงกรานต์พระประแดง - พิธีปล่อยนก ปล่อยปลา - การเล่นน้ำสงกรานต์
งานวันมะม่วงและของดีอำเภอปากท่อ ครั้งที่ 26 วันที่ 25 เมย - 4 พค 68
งานวันมะม่วงและของดีอำเภอปากท่อ ครั้งที่ 26 วันที่ 25 เมย - 4 พค 2568 บริเวณสนามหญ้าหน้าที่ว่าการอำเภอปากท่อ ราชบุรี
คอนเสิร์ตรวมใจวันแรงงานแห่งชาติ 25 เม.ย. - 4 พ.ค. 2568
คอนเสิร์ตรวมใจวันแรงงานแห่งชาติ วันที่ 25 เม.ย. - 4 พ.ค. 2568 ณ หน้าศาลากลางจังหวัดนครสวรรค์
Rock on the Beach 2025 วันเสาร์ที่ 26 เมษายน 2568
Chang Music Connection Presents Rock on the Beach 2025 เทศกาลดนตรีริมทะเลที่ร็อกที่สุด วันเสาร์ที่ 26 เมษายน 2568 ศิลปินร๊อคกระหึ่ม หาดแหลมเจริญ ระยอง BIG ASS • BODYSLAM • JOEY PHUWASIT• LOMOSONIC • NUM KALA • ONLY MONDAY • PARADOX • TAITOSMITH • THREE MAN DOWN • TILLY BIRDS จำหน่ายบัตร Early Bird 1,800 บาท (จากปกติ 2,200 บาท) วันที่ 27 กุมภาพันธ์ - 1 มีนาคม 2568
SUNSET BEACH MUSIC FEST 2025 เทศกาลดนตรีเร็กเก้สกาใหญ่สุดในเมืองไทย 26 เมษายน 2568
เทศกาลดนตรีเร็กเก้สกาใหญ่สุดในเมืองไทย “SUNSET BEACH MUSIC FEST 2025” เสาร์ 26 เมษายน 2568 หาดทรายร้านปลาทู อ.ชะอำ จ.เพชรบุรี
งานประเพณีบุญเดือนหก ศาลเจ้าพ่อพญาแล ชัยภูมิ 28 เมษายน -6 พฤษภาคม 2568
งานประเพณีบุญเดือนหก ศาลเจ้าพ่อพญาแล หนองปลาเฒ่า ชัยภูมิ จัดระหว่างวันที่ 28 เมษายน - 6 พฤษภาคม 2568 ชมขบวนแห่บายศรี วันที่ 30 เมษายน 2568
งานบุญเดือนหกของ จ.ชัยภูมิ ถือเป็นเทศกาลฉลองความยิ่งใหญ่ของชาวชัยภูมิ เป็นงานสักการะเจ้าพ่อพญาแล เรียกว่า “งานเทศกาลบุญเดือนหก” อันเป็นการรำลึกถึง ความดีของเจ้าพ่อพญาแล โดยจะมีขบวนแห่พานบายศรีถวายเจ้าพ่อพญาแลและขบวนแห่ของอำเภอต่าง ๆ เริ่มจากหน้าที่ทำการเทศบาลเมืองชัยภูมิแห่ไปรอบตัวเมืองชัยภูมิไปจนถึงศาลเจ้าพ่อพญาแล หนองปลาเฒ่า ระยะทางกว่า 5 กิโลเมตร เพื่อร่วมกันประกอบพิธีถวายบายศรี แด่ดวงวิญญาณอันศักดิ์สิทธิ์ของพระยาภักดีชุมพล(แล) หรือเจ้าพ่อพญาแล เจ้าเมืองชัยภูมิคนแรกเดือนพฤษภาคม 2568
Pet Expo Thailand 2025 วันที่ 1-4 พฤษภาคม 2568
Pet Expo Thailand 2025 วันที่ 1 - 4 พฤษภาคม 2568 ณ ฮอลล์ 5 - 8 ศูนย์การประชุมแห่งชาติสิริกิติ์ งานแสดงสินค้า บริการ สำหรับสัตว์เลี้ยง งานแรกของไทย ที่ได้รับความนิยมจาก ผู้แสดงสินค้าและผู้เข้าชมงานมากกว่า 20 ปี พร้อมด้วยกิจกรรมที่ตอบสนอง ต่อไลฟสไตล์ของสัตว์เลี้้ยงและผู้รักสัตว์เลี้ยงโดยภายในงานได้รวบรวมสินค้า อย่างครบครันอาทิ อาหาร ขนม อุปกรณ์ เวชภัณฑ์ อาหารเสริม แชมพู เสื้อผ้า เครื่องประดับ โรงแรม โรงพยาบาล และอื่นๆ
เทศกาลอาหารโคมไฟ 2025 วันที่ 2-11 พ.ค.68
เทศกาลอาหารโคมไฟ 2025 วันที่ 2-11 พ.ค.68 ณ สระขุนมูลศาสตร์สาธร อ.สังขะ สุรินทร์ ชมคอนเสิร์ต เนสกาแฟ ศรีนคร มนต์แคน แก่นคูน ร็อคคงคย ปะทะ บัวฟ้าใส
Octopus Music Festival 2025 วันที่ 3 พ.ค. 2568
Octopus Music Fest เจอกัน 3 พ.ค. 2568 นี้ ณ หาดหน้าด่าน อ.ขนอม จ.นครศรีธรรมราช จำหน่ายบัตร วันแรก 1 มี.ค. นี้ ตั้งแต่ 12.00 น. จ่ายเบา ๆ แต่ความมันส์เต็มแม็กซ์! ความมันส์แบบตะโกน! จัดเต็มทุกความสนุกแบบล้นหาดไปกับศิลปินสุดต๊าซของเมืองไทย พบกับ 8 ศิลปินสุดว้าวเกินต้าน Taitosmith Potato The Toys Nont Tanont Zom Marie JoeyBoy Fellow Fellow Three Man Down
งานเกษตรแฟร์ราชบุรี 8-17 พฤษภาคม 2568
งานเกษตรแฟร์ราชบุรี 8-17 พฤษภาคม 2568 อาคาร 18 ตลาดศรีเมือง จ.ราชบุรี มหกรรมสินค้าราคาถูก สินค้าท้องถิ่นโอท้อป เฟอร์นิเจอร์ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกคืน
เทศกาลดนตรี ปราจีนบุรี ETO fest 9 พฤษภาคม 2568
ครั้งแรกกับเทศกาลดนตรีที่ยิ่งใหญ่ที่สุดของ ปราจีนบุรี ETO fest ความมันส์กลางหุบเขา
พบกับศิลปินแถวหน้าของเมืองไทยที่พร้อมจะมาระเบิดความมันส์ วันศุกร์ที่ 9 พฤษภาคม 2568
ฟินน์แลนด์ ปราจีนบุรี
งานดนตรีริมเขื่อนแก่งกระจานครั้งที่ 2 วันที่ 10 พฤษภาคม 2568
งานดนตรีริมเขื่อนแก่งกระจานครั้งที่ 2 ????️ วันที่ 10 พฤษภาคม 2568 Tamarind Tree Camping แทมมาริน ทรี แคมป์ปิ้ง 15.00-00.00 น. มามันส์กับดนตรีริมเขื่อนแก่งกระจาน พบกับศิลปิน - จรรโลงชล - The Fighter band - Musketeers - tattoo Colour -Slot Machine
ลิ้นจี่ และมหกรรมอาหาร อ.แม่ใจ จ.พะเยา 16-25 พ.ค.2568
งานมหกรรมลิ้นจี่ และมหกรรมอาหาร อ.แม่ใจ จ.พะเยา 16-25 พ.ค.2568 บริเวณตลาดสดบีบี ต.ศรีถ้อย อ.แม่ใจ พะเยา จัดโดย กระทรวงเกษตรฯ อตก. เกษตรจังหวัดพะเยา และภาคเอกชนในจังหวัด
งานกาชาดประจำปี 2568 จังหวัดสงขลา 16-30 พฤษภาคม 2568
จังหวัดสงขลาประกาศจัดงานกาชาดประจำปี 2568 อย่างยิ่งใหญ่กว่าทุกปี โดยกำหนดจัดขึ้นระหว่างวันที่ 16-30 พฤษภาคม 2568 รวม 15 วัน 15 คืน ณ บริเวณสระบัว แหลมสมิหลา
งานนี้จัดขึ้นเพื่อระดมทุนสนับสนุนภารกิจของเหล่ากาชาดจังหวัดสงขลาและสภากาชาดไทย พร้อมมอบความบันเทิงและกิจกรรมมากมายให้ประชาชนและนักท่องเที่ยวที่มาร่วมงาน สำหรับไฮไลต์ของงานคือ การพิมพ์สลากกาชาด 5,000 เล่ม และ บัตรนาวากาชาดอีก 5,000 เล่ม เพื่อนำรายได้ไปช่วยเหลือผู้ด้อยโอกาส โดยของรางวัลใหญ่ในปีนี้ประกอบด้วย เดอเซนส์ คอนโดมิเนียม ท่าสะอ้าน อ.เมือง จ.สงขลา พร้อมตกแต่ง มูลค่ากว่า 1 ล้านบาท จำนวน 1 รางวัล, รถยนต์โตโยต้า Yaris ATIV Sport จำนวน 1 รางวัล, รถจักรยานยนต์ 5 รางวัล, สร้อยคอทองคำ หนัก 2 สลึง จำนวน 5 รางวัล และของรางวัลอื่น ๆ รวมกว่า 500,000 ชิ้น ซึ่งคาดว่าจะช่วยดึงดูดประชาชนให้มาร่วมสนับสนุนงานกาชาดมากขึ้น
Katakk Music Fest 17 พฤษภาคม 2568
Katakk Music Fest งานดนตรีที่มาพร้อมกับความสุข ความสนุก และความมันส์แบบจัดเต็มที่ราชบุรี! วันที่ 17 พฤษภาคม 2568 สวนหินจินตนาการเฮียปลา เขาปากกว้าง อ.โพธาราม จ.ราชบุรี ศิลปินแน่น ๆ Three Man Down▪️Jeff Satur▪️PARADOX▪️Klear▪️Joeyboy▪️สิงโต นำโชค▪️Only Monday▪️Fellow Fellow▪️มนัสวีร์▪️Mocca Garden▪️Zamzenlazer▪️Special Guest
งานวันเกษตรปราจีนบุรี ครั้งที่ 59 วันที่ 28 พฤษภาคม - 8 มิถุนายน 2568
งานวันเกษตรปราจีนบุรี ครั้งที่ 59 วันที่ 28 พฤษภาคม - 8 มิถุนายน 2568 ณ ลานพระบรมราชานุสาวรีย์ รัชกาลที่ 5 (ศาลากลางหลังเก่า) จัดโดยจ.ปราจีนบุรี สำนักงานเกษตรจังหวัดปราจีนบุรี ชมคอนเสิร์ตทุกคืน สินค้าเกษตร ประกวดผลไม้คุณภาพ พันธุ์ไม้ขึ้นชื่อ ผลไม้เอกลักษณ์จ.ปราจีนบุรี
Thailand Health, Fitness & Wellness Expo 2025
เนื่องด้วยเหตุสุดวิสัย งาน
Thailand Health, Fitness & Wellness Expo ประจำปี 2024 จึงจำเป็นต้องถูกเลื่อนออกไป กำหนดการจัดงานสำหรับปี 2025 จะแจ้งให้ทราบในภายหลัง
เดือนมิถุนายน 2568
งานกระท้อนหวานของดีลพบุรี ครั้งที่ 32 ปลายเดือนมิถุนายน 2568
งานกระท้อนหวานของดีลพบุรี ครั้งที่ 32 ปลายเดือนมิถุนายน 2568 ณ บริเวณหน้าที่ว่าการอำเภอเมืองลพบุรีเปิดฤดูกาลงานเทศกาลท่องเที่ยวดอกกระเจียวบาน @ชัยภูมิ
จังหวัดชัยภูมิ ร่วมกับการท่องเที่ยวแห่งประเทศไทย สนง.นครราชสีมา เปิดงานเทศกาลท่องเที่ยวดอกกระเจียวบาน @ชัยภูมิ มีนายอนันต์ นาคนิยม ผู้ว่าราชการจังหวัดชัยภูมิ เป็นประธานเปิดงาน มีส่วนราชการ พ่อค้า ประชาชน ผู้บริหารการปกครองส่วนท้องถิ่น กำนัน ผู้ใหญ่บ้าน และประชาชนชาวชัยภูมิ ร่วมงานอย่างคึกคัก ที่อุทยานแห่งชาติป่าหินงาม อ.เทพสถิต ประกาศความพร้อมรับนักท่องเที่ยว ที่จะเดินทางเข้ามาสัมผัสบรรยากาศ ทุ่งดอกกระเจียว สีชมพูอมม่วง เบิ่งบาน กลางขุนเขา ท่ามกลางธรรมชาติที่สดชื่น บางวันจะมีเมฆหมอกปกคลุม เมฆวิ่งผ่านตัวเรา เสมือนเราเดินอยู่บนปุยเมฆ เป็นบรรยากาศที่สร้างความประทับใจให้กับนักท่องเที่ยวเป็นอย่างมาก
นายอนันต์ นาคนิยม ผู้ว่าราชการจังหวัดชัยภูมิ กล่าวว่า เทศกาลท่องเที่ยวดอกกระเจียวบาน @ชัยภูมิ มีให้เลือกท่องเที่ยวได้ 2 แห่ง คืออุทยานแห่งชาติป่าหินงาม แห่งนี้ และอุทยานแห่งชาติไทรทอง อ.หนองบัวระเหว จ.ชัยภูมิ นอกจากาทุ่งดอกกระเจียว ที่เป็นราชินีดอกไม้ ช่วยดึงดูดนักท่องเที่ยวเข้ามาสัมผัสแล้ว อีกสิ่งหนึ่งที่เป็นเสน่ห์ของ ทั้งสองแห่ง นั่นก็คือ บรรยากาศเมฆหมอกช่วงยามเช้า วันไหนที่มีฝนตกช่วงกลางคืน เช้ามาก็จะเต็มไปด้วยหมอก ให้นักท่องเที่ยวได้สัมผัส ความสดชื่น แบบใกล้ชิด ชนิดว่ายืนกอดหมอกกันเลยทีเดียว
สำหรับปีนี้มีกิจกรรมส่งเสริมการท่องเที่ยว หลากหลาก เพื่อเป็นตัวช่วยกระตุ้นให้มีคนมาเที่ยวมากขึ้น เช่นการชมดาว การทำไลท์ติ้ง การวิ่งเทล และกิจกรรมอื่นๆอีกมากมาย โดยเฉพาะการจำหน่ายผลิตภัณฑ์โอทอป ศิลปวัฒนธรรมวิถีชีวิตชุมชน คน"ญัฮกุร" หรือ เนียะกุล คือกลุ่มชาติพันธุ์กลุ่มหนึ่งที่ใช้ภาษามอญโบราณอาศัยบนเทือกเขาพังเหย เทือกเขาเพชรบูรณ์ การจำหน่ายผลไม้ประจำถิ่น เช่นอทุเรียนโอโซล อะโวคาโด สะตอ การเชื่อมโยงการท่องเที่ยวไปยังแหล่งอื่นๆ ในจังหวัดชัยภูมิ เช่น ทุ่งบัวแดง บึงละหาน รวมถึงใน 4 ตำบล บนเทือกเขาภูแลนคา ซึ่งมีมอหินขาว ผาหัวนาค ป่าปรงพันปี ล้วนมีอากาศสดชื่นเช่นเดียวกัน
ในเรื่องการให้บริการนักท่องเที่ยว จังหวัดได้บูรณาการทุกภาคส่วนเข้ามาดูแล และจัดการให้เกิดความประทับใจ แก่นักท่องเที่ยวทั้งด้านการจราจร ด้านการรักษาความปลอดภัย ด้านที่พัก ร้านอาหาร การแสดงความเป็นเจ้าบ้านที่ดีรับนักท่องเที่ยวตลอด 3 เดือนช่วงฤดูฝน มิถุนายน - สิงหาคมนี้
งานสมโภชพระพุทธนิรโรคันตรายชัยวัฒน์จตุรทิศและงานกาชาดประจำปีของดีเมืองลุง ปี 2568 วันที่5-16 มิถุนายน 2568
"งานสมโภชพระพุทธนิรโรคันตรายชัยวัฒน์จตุรทิศและงานกาชาดประจำปีของดีเมืองลุง ปี 2568" ณ บริเวณศาลากลางจังหวัดพัทลุง ตั้งแต่วันที่ 5-16 มิถุนายน 2568 มหกรรมร้านเด็ด ร้านดัง การแสดงทุกค่ำคืน ศิลปิน
งานมหาลัยเกษตรแฟร์จอมบึง ประจำปี 2568 ระหว่างวันที่ 6-15 มิถุนายน 2568
งานมหาลัยเกษตรแฟร์จอมบึง ประจำปี 2568 ระหว่างวันที่ 6-15 มิถุนายน 2568 บริเวณมหาวิทยาลัยราชภัฎหมู่บ้านจอมบึง อ.จองบึง ราชบุรี พบกับ มหกรรมสินค้าราคาถูก สินค้าท้องถิ่นโอท้อป เฟอร์นิเจอร์ สวนสนุกชุดใหญ่ คอนเสิร์ตทุกคืน
เทศกาลอาหาร บอลลูนนานาชาติและสวนสนุกต่างประเทศ 13-22 มิถุนายน 2568
งาน เทศกาลอาหาร บอลลูนนานาชาติและสวนสนุกต่างประเทศ 13-22 มิถุนายน 2568 ที่ หน้าอาคารKNECC มหาวิทยาลัยนเรศวร จังหวัดพิษณุโลก
10 มิถุนายน 2567 การบรรยาย “Quantitative Metabolomics: The Holy Grail for Kidney Diseases and Beyond ????วิทยากร โดย รศ. ดร.ศักดิ์ดา คุ้มหรั่ง
การบรรยาย “Quantitative Metabolomics: The Holy Grail for Kidney Diseases and Beyond วิทยากร โดย รศ. ดร.ศักดิ์ดา คุ้มหรั่ง กลุ่มวิจัย Metabolomics and Systems Biology, Siriraj Metabolomics and Phenomics Center (SiMPC) วันจันทร์ที่ 10 มิถุนายน 2567 เวลา 12.00 -13.00 น. ณ ห้องประชุม 304 -305 ชั้น 3 อาคารศูนย์วิจัยการแพทย์ศิริราช คณะเเพทยศาสตร์ศิริราชพยาบาล เริ่มลงทะเบียน เข้างานเวลา11.30 น. เป็นต้นไป
ลงทะเบียนเข้าร่วมการประชุม โดยไม่เสียค่าใช้จ่าย ตั้งแต่บัดนี้จนถึงวันที่ 7 มิถุนายน 2567 (รูปแบบการประชุม Hybrid meeting มีอาหารกลางวันสำหรับผู้ที่ลงทะเบียนล่วงหน้าแบบ onsite และ ถ่ายทอดสดผ่านระบบ zoom meeting)
Thailand wellness & Healthcare Expo 2025 วันที่ 26-29 มิถุนายน 2025
งาน Thailand wellness & Healthcare Expo 2025 วันที่ 26-29 มิถุนายน 2025 ณ ฮอลล์ 101 ไบเทค บางนา รวมสุดยอดนวัตกรรมเพื่ออุตสาหกรรมสุขภาพ และบริการ เพื่อความเป็นอยู่อย่างยั่งยืน จากผู้นำอุตสาหกรรมสุขภาพและบริการทั้งในประเทศและต่างประเทศ ไว้ในงานเดียว
พบกับ
- สุดยอดธุรกิจกลุ่ม Wellness, Health care, Future food & Healthy food , Medical Industry, Digital Health, Skincare, Banking
- เจรจาจับคู่ธุรกิจกับนักลงทุนจาก 45 ประเทศทั่วโลก
- กิจกรรมสัมมนา วิทยากรทั้งภายในประเทศ และต่างประเทศ Thailand International Dog Show 2025 – The 23rd edition
Thailand International Dog Show 2025 มหกรรมคนรักสุนัขยิ่งใหญ่แห่งปี SmartHeart presents Thailand International Dog Show 2025 ครั้งที่ 23 26-29 มิถุนายน 2568 10.00 – 20.00 น. อิมแพ็ค เมืองทองธานี อาคาร 5-6
.
Thailand International Dog Show 2025 – The 23rd edition June 26-29, 2025 10:00 AM – 8:00 PM at IMPACT Muang Thong Thani, Hall 5-6 Experience the largest and only dedicated "B2B2C" Dog exhibition in ASEAN! Discover the latest in the dog industry, from top-tier products and innovations to world-class competitions and showcases! A must-visit event for dog lovers and professionals alike!
26 สิงหาคม วันสุนัขแห่งชาติ
รู้หรือไม่ วันที่ 26 สิงหาคมของทุกปี ถือเป็นวันสุนัขแห่งชาติ จัดขึ้นเป็นครั้งแรกเมื่อปี 2547 (2004) ในสหรัฐอเมริกา โดย คอลลีน เพจ (Colleen Paige) ผู้เชี่ยวชาญเกี่ยวกับสัตว์เลี้ยงและชีวิตความเป็นอยู่ของสัตว์ เพื่อให้ทุกท่านได้ร่วมฉลองวันนี้กับสุนัขแสนรักของเรา และ ตอบแทนที่เขาเป็นเพื่อนที่ดีที่สุดของเราอีกด้วย
เดือนกรกฎาคม 2568
CPHI South East Asia 2025
งานน้อยหน่างานกาชาดและของดีเมืองปากช่อง ประจำปี 2568 วันที่ 1-12 ก.ค. 2568
งานน้อยหน่างานกาชาดและของดีเมืองปากช่อง ประจำปี 2568 อำเภอปากช่อง จังหวัดนครราชสีมา วันที่ 1-12 ก.ค. 2568
เทศกาลอาหารสองทะเล 4-15 กรกฎาคม 2568 แหลมสมิหลา
เทศบาลนครสงขลา ขอเชิญเที่ยวงาน เทศกาล อาหารสองทะเล วันที่ 4-15 กรกฎาคม 2568 ณ บริเวณเวทีสระบัว แหลมสมิหลา จังหวัดสงขลา
งานมหกรรมการเงินหาดใหญ่ Money Expo 2025 ครั้งที่ 15 จ.สงขลา วันที่ 4-6 กรกฎาคม 2568
งานมหกรรมการเงินหาดใหญ่ Money Expo 2025 ครั้งที่ 15 จ.สงขลา
วันที่ 4-6 กรกฎาคม 2568 ณ หาดใหญ่ฮอลล์ ชั้น 5, ลานโปรโมชั่น ชั้น 1 ศูนย์การค้าเซ็นทรัล หาดใหญ่
Ranong PAO Virtual Run 2024
Ranong PAO Virtual Run 2024 องค์การบริหารส่วนจังหวัดระนอง เชิญชวนทุกท่านสมัครเข้าร่วมกิจกรรมสร้างเสริมสุขภาพกับ อบจ.ระนอง วิ่งสะสมระยะทาง เริ่มลงทะเบียน 10 ก.ค. - 15 ส.ค. 2567 เริ่มส่งผล 13 ก.ค. - 31 ส.ค. 2567
Thailand Coffee Fest 2025 วันที่ 10 - 13 กรกฎาคม 2568
Thailand Coffee Fest 2025 วันที่ 10 - 13 กรกฎาคม 2568 ณ IMPACT Exhibition Center Hall 5 - 8 เมืองทองธานี เทศกาลกาแฟที่ใหญ่ที่สุดในภูมิภาคเอเชียตะวันออกเฉียงใต้ ซึ่งกำลังจะก้าวสู่ปีที่ 10 อย่างเต็มรูปแบบ จองบูทได้แล้วตั้งแต่วันนี้จนถึงวันที่ 31 มกราคม 2568 ที่ https://thailandcoffeefest.org/ สอบถามข้อมูลเพิ่มเติม โทร 096-858-1419 (ในวันจันทร์-ศุกร์ เวลา 10.00 – 17.00 น.)
งานวันจำปาดะ ผลไม้ของดีสตูล ระหว่างวันที่ 21-23 กรกฎาคม 2568
องค์การบริหารส่วนจังหวัดสตูล เชิญชวนเที่ยวงานวันจำปาดะ ผลไม้ของดีสตูล ระหว่างวันที่ 21-23 กรกฎาคม 2566 ณ ลานอเนกประสงค์ เทศบาลตำบลฉลุง (ข้างวัดดุลยาราม) อำเภอเมืองสตูล เปิดตั้งแต่เวลา 10.00 -21.30 น.
ภายในงานฯ จะได้พบกับการจำหน่วยผลไม้สดราคาถูกจากสวนเกษตรกรในพื้นที่ พร้อมเปิดให้ชิมฟรีผลไม้สดช่วงนาทีทองวันละ 3 รอบ, จำหน่ายสินค้า OTOP และมหกรรมอาหารจานเด็ดร้านดังจากจังหวัดสตูล เช่น ร้านจากชมรมอาหารละงู, ขนมบ้าบิ่นเงินล้านเจ้าดัง ขวัญใจทับโทน, มันเผาชีส, สารพัดเมนูยำ, ชาคุรัม (ชาชักหวานมันต้นตำหรับชาชักชายเเดน) และเมนูอื่นๆ อีกมากมาย อีกทั้งพบกับอินฟลูเอนเซอร์ ดาวติ๊กต๊อก ชื่อดัง นอกจากนี้ยังจัดให้มีการประกวดผลไม้ที่มีคุณภาพ ซึ่งเกษตรกรสามารถส่งผลผลิตเข้าร่วมประกวดได้ ประกอบด้วยผลไม้สายพันธุ์พื้นเมือง กระท้อนปุยฝ้าย ทุเรียนหมอนทอง และจำปาดะ รวมถึงผู้ที่มีความสามารถด้านการร้องเพลง สมัครร่วมประกวดร้องเพลง รุ่นเยาวชนและรุ่นประชาชนทั่วไป ชิงเงินรางวัลกว่า 6 พันบาท
เดือนสิงหาคม 2568
ททท. ชวนเที่ยวเช็คอินอุทยานชมทุ่งดอกกระเจียว
ททท. ชวนเที่ยวเช็คอินอุทยานชมทุ่งดอกกระเจียว รับคูปองแทนเงินสด 100 บาท ไปใช้กับร้านค้ารอบอุทยานได้ฟรี! (มีจำกัด 800 สิทธิ์เท่านั้น) เพียงเช็คอินที่อุทยานแห่งชาติป่าหินงาม หรืออุทยานแห่งชาติไทรทอง ก็กดรับคูปองไปใช้ได้ทันที
วิธีร่วมสนุก
1. เพิ่มเพื่อนไลน์ @tripniceday
2. ลงทะเบียน และกดร่วมกิจกรรม
3. กดเช็คอินเมื่ออยู่ที่อุทยาน
4. กดรับคูปอง 100 บาท ไปใช้ได้ทันที
ข้อมูลร้านค้าที่ร่วมโครงการทั้ง 7 ร้าน
รวมถึงวิธีการลงทะเบียนร่วมกิจกรรม ดู
ได้ที่นี่
เก็บคูปองได้ตั้งแต่วันนี้ ถึง 31 ส.ค. 67
THAILAND REPTILES EXPO (T-REX) วันที่ 1-3 สิงหาคม 2025
THAILAND REPTILES EXPO ครั้งที่ 4 !!! จัดงานวันที่ 1-3 สิงหาคม 2025 เซ็นทรัล ลาดพร้าว (CENTRAL LADPRAO) งานแสดงสัตว์เลี้ยง Exotic ระดับโลก ผ่านแนวคิดเชื่อมโยงให้ประเทศไทยเป็นผู้นำและศูนย์กลาง ด้านการเพาะพันธ์ุ และจำหน่ายสินค้าของสัตว์ Exotic ในภูมิภาค ตอบสนองตามความต้องการของ ผู้เลี้ยงสัตว์ ผู้เพาะพันธุ์ และผู้ประกอบการด้านสัตว์เลี้ยง
งานเกษตรภาคใต้ คณะทรัพย์ ม.อ.หาดใหญ่ 8-17 สิงหาคม 2568
งานเกษตรภาคใต้ คณะทรัพย์ ม.อ.หาดใหญ่ วันที่ 8-17 สิงหาคม 2568
ติดตามข้อมูลงานมหกรรมการเงินโคราช Money Expo 2025 ครั้งที่ 19 จ.นครราชสีมา วันที่ 8-10 สิงหาคม 2568
งานมหกรรมการเงินโคราช Money Expo 2025 ครั้งที่ 19 จ.นครราชสีมา วันที่ 8-10 สิงหาคม 2568 ณ เอ็มซีซี ฮอลล์ ชั้น 3 ห้างสรรพสินค้าเดอะมอลล์ โคราช
Food & Hospitality Thailand (FHT) 2025 วันที่ 20-23 สิงหาคม 2025
งาน Food & Hospitality Thailand (FHT) 2025 ซึ่งจัดขึ้นเป็นครั้งที่ 31 กำหนดจัดวันที่ 20-23 สิงหาคม 2025 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ ภายใต้แนวคิด "Connecting Excellence in Food & Hospitality" เป็นงานสำหรับอุตสาหกรรมอาหารและเครื่องดื่มและการบริการในระดับนานาชาติ ได้รวบรวมบริษัทชั้นนำและผู้เชี่ยวชาญในอุตสาหกรรมมาจัดแสดงโซลูชันชั้นนำและเทคโนโลยีล้ำสมัย งานที่เต็มไปด้วยพลังนี้ช่วยสร้างการเชื่อมโยง จุดประกายความคิดใหม่ๆ และส่งเสริมอุตสาหกรรมการท่องเที่ยวของไทยด้วยการส่งเสริมความเป็นเลิศในทุกแง่มุมFHT 2025 ทำหน้าที่เป็นแพลตฟอร์มชั้นนำสำหรับธุรกิจในท้องถิ่นและต่างประเทศในภาคส่วนอาหารและการบริการเพื่อเชื่อมต่อ แบ่งปันความเชี่ยวชาญ และผลักดันให้ประสบความสำเร็จในระดับใหม่
การแข่งขันสปาร์ตันคิดส์ 2025
การแข่งขันสปาร์ตันคิดส์ในปีนี้ และเป็นหนึ่งในสนาม 2025 Spartan Kids Trifecta ครั้งแรกในประเทศไทย ที่ Pattana Sports Resort จังหวัดชลบุรี วันแข่ง 30-31 สิงหาคม 2025
Medical Fair Asia 2025 Bangkok 10 - 12 September 2025
Better Networking. Better Meetings. Better Business.
10 - 12 September 2025
Reimagining the marketplace amidst a changing landscape, the 11th edition of MEDICAL FAIR THAILAND will return in September 2025 and continues to be Thailand’s leading medical and healthcare exhibition and industry sourcing platform.
Since 2003, MEDICAL FAIR THAILAND organised by Messe Düsseldorf Asia (MDA) continues to grow from strength to strength as Thailand’s No. 1 medical and health care event. Bringing you the best business opportunities to navigate the dynamic marketplace of Thailand and Southeast Asia, be a part of MEDICAL FAIR THAILAND 2025!
เดือนกันยายน 2568
Health & Innovation Asia 2025 วันที่ 3-5 กันยายน 2568
Health & Innovation Asia 2025 วันที่ 3 - 5 กันยายน 2568 ณ EH 104 ศูนย์นิทรรศการและการประชุมไบเทค งานแสดงนวัตกรรม เทคโนโลยี ผลิตภัณฑ์และบริการด้านการแพทย์สุขภาพ
งานฤดูหนาวลพบุรี 28 พฤศจิกายน - 8 ธันวาคม 2567
หนาวปลายปีนี้ เตรียมไปเที่ยวรับลมหนาวที่เมืองลพบุรี กัน งานฤดูหนาวลพบุรี 28 พฤศจิกายน - 8 ธันวาคม 2567 ณ บริเวณถนนหน้าโรงเรียนพิบุลวิทยาลัย จ.ลพบุรี ชมคอนเสิร์ตทุกคืน ศิลปนิดัง ลำไย ไหทองคำ เสก โลโซ เนสกาแฟ มาลีฮวนน่า รัช ปะทะ ปู่จ๋าน ลองไมค์ และอีกเพียบ
ขอพรพระพิฆเนศองค์ยืนที่สูงที่สุดในประเทศไทย LINK
สายมูห้ามพลาด ! ขอพรพระพิฆเนศองค์ยืนที่สูงที่สุดในประเทศไทยที่อุทยานพระพิฆเนศองค์ยืนคลองเขื่อน เพราะที่นี่เป็นที่ตั้งของพระพิฆเนศองค์ใหญ่ถึงสามปางด้วยกัน มาที่นี่ที่เดียวไหว้ได้ครบ ทั้งปางนั่ง ปางนอน ปางยืน แต่ละแห่งนั้น ใหญ่โตมโหฬาร มีความสูงหลายสิบเมตร มีความศักดิ์สิทธิ์เป็นที่เคารพของคนทั่วไป ตั้งอยู่ในริมแม่น้ำบางปะกง ในอำเภอคลองเขื่อน จังหวัดฉะเชิงเทรา
อีกหนึ่งความพิเศษของพระพิฆเนศองค์นี้นั้น นั่นคือพระหัตถ์ทั้ง 4 นั้นถือ มะม่วง, กล้วย, อ้อย และขนุน ส่วนที่พระบาทมีหนูมุสิกะกำลังกอดลูกมะพร้าว หมายถึงความอุดมสมบูรณ์ไปด้วยพืชพรรณธัญญาหาร ผลหมากรากไม้ของจังหวัดฉะเชิงเทรา ส่วนเท้าข้างหนึ่งกำลังก้าวไปข้างหน้า หมายถึงความเจริญก้าวหน้า เมื่อรวมกันแล้วจึงหมายถึงความเจริญก้าวหน้า มีกินมีใช้อุดมสมบูรณ์นั่นเอง และด้วยความศักดิ์สิทธิ์ขององค์พระพิฆเนศองค์ยืนแห่งนี้ จึงทำให้ที่นี่มีประชาชนและนักท่องเที่ยวที่มีความเลื่อมใสศรัทธา เดินทางกันมากราบสักการะขอพรกันอย่างไม่ขาดสายครับ
ที่ตั้ง : 62 หมู่ 4 ต.บางตลาด อ.คลองเขื่อน จ.ฉะเชิงเทรา
งานมหกรรมการเงินระยอง ครั้งที่ 7 จ.ระยอง วันที่ 5-7 กันยายน 2568
งานมหกรรมการเงินระยอง ครั้งที่ 7 จ.ระยอง
วันที่ 5-7 กันยายน 2568 ณ ลานกิจกรรม ชั้น 1 ศูนย์การค้าเซ็นทรัล ระยอง
Medical Fair Thailand Sep 10-12, 2025 at BITEC
The 11th edition of Medical Fair Thailand, the region’s leading healthcare event, will be held from September 10 to 12, 2025 at BITEC in Bangkok.
It is the leading medical trade fair in the Asian region. The event, which is known for its extremely dynamic growth, offers the entire medical industry the opportunity to come together to forge new relationships and promote co-operation. The Medical Fair Thailand is therefore an ideal platform.
Also in 2025 the foreign trade fair program of the Federal Ministry for Economic Affairs and Climate Action enables German companies to participate in this event at attractive conditions as part of an official German group participation in the form of information center (IZ) and individual stands. 12 พฤษภาคม 64 เวลา 20.00 น.
16ล้านโดสเพื่อ16ล้านคน
หมอพร้อม LINEOA
Line Official Account "หมอพร้อม"
เดือนตุลาคม 2568
ASEAN Café Show 2025 วันที่ 2-5 ตุลาคม 2025
งานแสดงสินค้านานาชาติ ASEAN Café Show 2025
วันที่ 2-5 ตุลาคม 2025 ณ ศูนย์ประชุมไบเทค งาน สำหรับผู้ผลิต ผู้นำเข้า และตัวแทนจำหน่ายให้ได้พบกับกลุ่มลูกค้าเป้าหมายในบรรยายกาศการซื้อ-ขายและเจรจาธุรกิจที่คึกคัก
งานมหกรรมการเงินอุดรธานี ครั้งที่ 12 จ.อุดรธานี วันที่ 3-5 ตุลาคม 2568
งานมหกรรมการเงินอุดรธานี ครั้งที่ 12 จ.อุดรธานี วันที่ 3-5 ตุลาคม 2568 ณ ลานโปรโมชั่น ชั้น 1 ศูนย์การค้าเซ็นทรัล อุดร
Khon Beat Festival 2025 - คอน บีท เฟสติวัล 2025 วันที่ 28 มิถุนายน 2568
เทศกาลดนตรีที่มันส์ที่สุด ยิ่งใหญ่ที่สุด กลางเมืองคอน Khon Beat Festival 2025 - คอน บีท เฟสติวัล 2025 ระเบิดความมันส์พร้อมกัน 28 มิถุนายน 2568 นี้
ณ ลาน Khon beat festival ถนนเทิดพระเกียรติ อ.เมือง จ.นครศรีธรรมราช เปิดขายบัตร EARLY KHON ราคาพิเศษ 1 - 5 เมษยายน 2568 นี้ เวลา 10.00 น. เป็นต้นไป หมดแล้วหมดเลย
กำหนดการหน่วยทำหมัน และฉีดวัคซีน เดือน มกราคม 2568
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือน มกราคม 2568 (สอบถามโทร 02-2487417 02-2453311)
- 6 มกราคม 2568 ลานกีฬา ชุมชนพิพัฒน์ 2 เขตบางรัก / กลุ่มควบคุมและพักพิงสุนัข เขตประเวศ
- 7 มกราคม 2568 ชุมชนนูรุ้ลอิสลาม มีนบุรี / วัดไผ่ตัน
- 8 มกราคม 2568 ชุมชนหลังวัดปทุมวนาราม ปทุมวัน / หมู่บ้านเอสเค
- 9 มกราคม 2568 ชุมชนพัฒนาริมคลองบ้านป่า สวนหลวง / วัดบุญรอดธรรมาราม พระโขนง
- 10 มกราคม 2568 วัดปากบึง ลาดกระบัง
- 14 มกราคม 2568 วัดโบสถ์อินทรสารเพชร ภาษีเจริญ / วัดบุณยประดิษฐ์ บางแค
- 15 มกราคม 2568 วัดบางมดโสธราราม (กลางนา) ทุ่งครุ / วัดสุนทรธรรมทาน (วัดแคนางเลิ้ง) ป้อมปราบฯ
- 16 มกราคม 2568 ชุมชนวัดดาวดึงษาราม บางพลัด / วัดช่างเหล็ก ตลิ่งชัน
- 17 มกราคม 2568 ศูนย์นันทนาการคลองเตย (หน่วยแพทย์เคลื่อนที่)
- 21 มกราคม 2568 วัดลาดปลาเค้า ลาดพร้าว / ชุมชนทับช้างนาลุ่ม สะพานสูง
- 22 มกราคม 2568 บ้านเอื้ออาทรบางเขน (คลองถนน) สายไหม / ลานจอดรถร้าน 7-11 สาขาปากซอยฉลองกรุง 53 ลาดกระบัง
- 23 มกราคม 2568 สำนักงานเขตบางกอกน้อย / ชุมชนรวมน้ำใจ ราษฎร์บูรณะ
- 24 มกราคม 2568 วัดบางขุนเทียนกลาง จอมทอง
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- 3 มกราคม 2568 ชุมชนริมคลองประเวศฝั่งเหนือ และชุมชนสุเหร่าทางควาย แขวงประเวศ เขตประเวศ
- 6 มกราคม 2568 ชุมชนวัดพลมานีย์ แขวงทับยาว เขตลาดกระบัง
- 7 มกราคม 2568 ที่ชุมชนนำไกร หมู่ 9 เขตลาดกระบัง
- 9 มกราคม 2568 ที่บ้านเอื้ออาทร ลาดกระบัง 2 เขตลาดกระบัง
- 10 มกราคม 2568 ที่ชุมชนหลัง สน.ประเวศ แขวงประเวศ เขตประเวศ
- 13 มกราคม 2568 ที่ชุมชนสามัคคีธรรม แขวงประเวศ เขตประเวศ
- 13 มกราคม 2568 ที่ชุมชนอาคารสงเคราะห์ อ่อนนุช 86 แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 20 มกราคม 2568 ที่ชุมชนอ่อนนุช 40 ไร่ แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
- วันอังคารที่ 21 มกราคม 2568 ที่ศูนย์พัฒนากีฬากองทัพบก รามอินทรา เขตบางเขน เวลา 8.30 - 12.00 น.
- วันอังคารที่ 21 มกราคม 2568 ที่ชุมชนพัฒนาคลองสะแก เขตสวนหลวง เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 23 มกราคม 2568 ที่ชุมชนหมู่บ้านสุธาทิพย์ แขวงประเวศ เขตประเวศ เวลา 9.00 - 11.00 น.
10 มกราคม 2568 ณ วัดปากบึง เขตลาดกระบัง
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 10 มกราคม 2568 ณ วัดปากบึง เขตลาดกระบัง ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
15 มกราคม 2568 ผ่าตัดทำหมันสุนัข-แมว ศาลาประชาคม เขตหนองจอก
โครงการปศุสัตว์ร่วมใจกำจัดภัยพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี โดยสำนักงานปศุสัตว์พื้นที่ 1 เขตหนองจอก ร่วมออกหน่วยสัตวแพทย์เคลื่อนที่บูรณาการร่วมกับภาคีเครือข่ายในพื้นที่กรุงเทพมหานคร
ในวันพุธที่ 15 มกราคม 2568 ระหว่างเวลา 08.00 - 12.00 น. (*เริ่มแจกบัตรคิวตั้งแต่เวลา 07.00 น. เป็นต้นไป) ณ ศาลาประชาคม เขตหนองจอก ให้บริการผ่าตัดทำหมันสุนัข-แมว (*บริการทำหมันเฉพาะสุนัขและแมวเท่านั้น) ฉีดวัคซีนโรคพิษสุนัขบ้า ให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าและกฎหมาย
ติดต่อสอบถาม สํานักงานปศุสัตว์เขตหนองจอก โทร. 086 989 1399 (ในวันและเวลาราชการ)
17 มกราคม 2568 ณ ศูนย์นันทนาการคลองเตย เขตคลองเตย
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 17 มกราคม 2568 ณ ศูนย์นันทนาการคลองเตย เขตคลองเตย ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
22 มกราคม 2568 กิจกรรมฉีดวัคซีน ทำหมัน โดย CPALL
กิจกรรมฉีดวัคซีน ทำหมัน โดย CPALL วันพุธที่ 22 มกราคม 2568 ️เวลา 9.00-12.00 น. ณ บริเวณร้าน 7-Eleven สาขา 17306 (ปากซอยฉลองกรุง 53) แขวงลำปลาทิว เขตลาดกระบัง กรุงเทพฯ
22 มกราคม 2568 วัดบางนา
เขตบางนา หน่วยปศุสัตว์เคลื่อนที่ ให้บริการผ่าตัดทำหมันสุนัขและแมว...ฟรี โครงการปศุสัตว์ร่วมใจกำจัดภัยพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี . โดยสำนักงานปศุสัตว์พื้นที่ 10 เขตบางนา ร่วมออกหน่วยสัตวแพทย์เคลื่อนที่บูรณาการร่วมกับภาคีเครือข่ายในพื้นที่กรุงเทพมหานคร .
วันพุธที่ 22 มกราคม 2568 เวลา 08.00 - 12.00 น. (*เริ่มแจกบัตรคิว Walk in ตั้งแต่เวลา 07.00 น. เป็นต้นไป) ณ วัดบางนาใน พระอารามหลวง เขตบางนา
ให้บริการผ่าตัดทำหมันสุนัข-แมว (*บริการทำหมันเฉพาะสุนัขและแมวเท่านั้) ฉีดวัคซีนโรคพิษสุนัขบ้า ให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าและกฎหมาย
ลงทะเบียนล่วงหน้า 30 ตัว เท่านั้น
ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางนา โทร. 095-874-9889 Line ID : fonnarin หรือ สำนักงานปศุสัตว์พื้นที่ 10 เขตบางนา โทร. 084-541-7591 (ในวันและเวลาราชการ)
Khlong Pheka Trail วันอาทิตย์ที่ 19 ตุลาคม 2568
Khlong Pheka Trail วันอาทิตย์ที่ 19 ตุลาคม 2568 ณ แดนสนธยา แคมป์ปิ้งวิว อ.ประจันตคาม จ.ปราจีนบุรี ระยะวิ่ง 30 km Cut Off 8 hrs. 16 km Cut Off 5 hrs. 5 km Cut Off 2 hrs.
ขุนด่านมาราธอน ครั้งที่ 6 Race Day 19.10.2025
ขุนด่านมาราธอน ครั้งที่ 6 ระยะแข่งขัน 4 ระยะ เส้นทาง Marathon 42.195 km. Cutoff 7.00 ชม. (ความชัน +|- 400) เส้นทาง Half Marathon 21.10 km. Cutoff 4.00 ชม. (ความชัน +|- 390) เส้นทาง Mini Marathon 10 km. Cutoff 2.30 ชม. (ความชัน +|- 360)
กำหนดการหน่วยทำหมันและฉีดวัคซีน เดือนกุมภาพันธ์-มีนาคม 2568
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่
ทำหมัน เดือน กุมภาพันธ์-มีนาคม 2568 (สอบถามโทร 02-2487417 02-2453311)
- 4 กุมภาพันธ์ 2568 ชุมชนวัดศาลาครืน จอมทอง / สวนป่าเฉลิมพระเกียรติ คลองสาน
- 5 กุมภาพันธ์ 2568 วัดเทพธิดาราม พระนคร / มัสยิดนูรุ้ลอิสลาม (วังใหญ่) บางกะปิ
- 6 กุมภาพันธ์ 2568 กลุ่มควบคุมและตรวจเนื้อสัตว์ หนองแขม / วัดสวัสดิ์วารีสีมาราม ดุสิต
- 7 กุมภาพันธ์ 2568 เคหะชุมชนธนบุรี 1 ส่วน 1 บางขุนเทียน
- 11 กุมภาพันธ์ 2568 เคหะชุมชนฉลองกรุง โซน 2 หนองจอก / ชุมชนริมคลองบางซื่อ ลาดพร้าว 42-44
- 13 กุมภาพันธ์ 2568 ชุมชนพัฒนาบ้านสามอิน เขตวัฒนา / สำนักงานเขตสัมพันธวงศ์
- 14 กุมภาพันธ์ 2568 วัดเทพพล ตลิ่งชัน
- 18 กุมภาพันธ์ 2568 วัดเลา บางขุนเทียน / วัดมหาพฤฒาราม บางรัก
- 19 กุมภาพันธ์ 2568 โปโลฟุตบอลพาร์ค ปทุมวัน
- 20 กุมภาพันธ์ 2568 หมู่บ้านเคซี การ์เด้นโฮม คลองสามวา / คอนโดบ้านสวนรัชธานี หลักสี่
- 21 กุมภาพันธ์ 2568 วัดนวลจันทร์ บึงกุ่ม
- 4 มีนาคม 2568 วิทยาลัยพาณิชยการบางนา
- 5 มีนาคม 2568 วัดอัมพวา บางกอกน้อย / วัดวรจรรยาวาส บางคอแหลม
- 6 มีนาคม 2568 วัดสิริกมลาวาส ลาดพร้าว / ลานกีฬาสวนราษฎร์บำเพ็ญ ห้วยขวาง
- 7 มีนาคม 2568 เคหะชุมชนออเงิน สายไหม
- 11 มีนาคม 2568 มัสยิดอัลอิสติกอมะห์ ทุ่งครุ / กรมทหารปืนใหญ่ ที่ 1 ดุสิต
- 12 มีนาคม 2568 รร.มัธยมสุวิทย์เสรีอนุสรณ์ ประเวศ
- 13 มีนาคม 2568 วัดหงส์รัตนาราม บางกอกใหญ่ / วัดพระพิเรนทร์ ป้อมปราบฯ
- 14 มีนาคม 2568 หมู่บ้านชุมชนพลับพลา วังทองหลาง
กำหนดการออกหน่วยบริการ
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้กับสุนัขและแมว ฟรี
- วันจันทร์ที่ 3 กุมภาพันธ์ 2568 ชุมชนจรเข้ขบ (เกาะล่าง) แขวงประเวศ เขตประเวศ
- วันอังคารที่ 4 กุมภาพันธ์ 2568 ชุมชนบ้านทับยาว แขวงทับยาว เขตลาดกระบัง
- วันพุธที่ 5 กุมภาพันธ์ 2568 ที่ชุมชนลำพุทรา เขตลาดกระบัง เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 10 กุมภาพันธ์ 2568 ที่ชุมชนประชาอุทิศ เขตลาดกระบัง เวลา 9.00 - 11.00 น.
- อังคารที่ 11 กุมภาพันธ์ 2568 ที่ชุมชนสหกรณ์ 93 คลองสิบ เขตหนองจอก เวลา 9.30 - 11.30 น.
- วันพฤหัสบดีที่ 13 กุมภาพันธ์ 2568 ที่มัสยิดดอกไม้ เขตประเวศ เวลา 9.00 - 11.00 น.
- วันอังคารที่ 18 กุมภาพันธ์ 2568 ที่กรมสรรพาวุธทหารบก เขตดุสิต เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 24 กุมภาพันธ์ 2568 ที่ชุมชนอัลเอี๊ยะติซอม เขตสวนหลวง เวลา 9.00 - 11.00 น.
- วันพุธที่ 19 กุมภาพันธ์ 2568 ที่ชุมชนหมู่ 4 พัฒนา เขตหนองจอก เวลา 9.00 - 11.00 น.
- วันพฤหัสบดีที่ 20 กุมภาพันธ์ 2568 ฟรี ที่ชุมชนร่วมใจพัฒนา เขตลาดกระบัง เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 24 กุมภาพันธ์ 2568 ที่ชุมชนอัลเอี๊ยะติซอม เขตสวนหลวง เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 3 มีนาคม 2568 สำนักงานที่ชุมชนหลังวัดลานบุญ เขตลาดกระบัง เวลา 9.00 - 11.00 น.
- วันพุธที่ 5 มีนาคม 2568 สำนักงาน ที่หมู่บ้านวนารมย์ ซ.ฉลองกรุง 24 เขตลาดกระบัง เวลา 9.00 - 11.00 น.
- วันจันทร์ที่ 17 มีนาคม 2568 สำนักงานสัตวแพทย์สาธารณสุข จัดหน่วยบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัข/แมว ฟรี ที่ชุมชนพุทธ-มุสลิมสามัคคี ร่มเกล้า 50 เขตลาดกระบัง เวลา 9.00 - 11.00 น.
6 กุมภาพันธ์ 2568 ทำหมันสุนัขและแมว ฟรี กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานเขตหนองแขม จัดหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ในวันพฤหัสบดีที่ 6 กุมภาพันธ์ 2568 เวลา 09.00 ถึง 11.00 น. ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม สอบถามโทร 02 409 5986 [แผนที่] รับจำนวนจำกัด 40 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
ประเพณีถือศีลกินผักภูเก็ต ประจำปี 21- 29 ต.ค. 2568
ประเพณีถือศีลกินผัก หรือ เทศกาลกินเจภูเก็ต เป็นประเพณีสำคัญสำหรับชาวไทยเชื้อสายจีนเพื่อเป็นเกียรติแก่เทพเจ้าจักรพรรดิทั้งเก้า โดยการละเว้นการเบียดเบียนสิ่งมีชีวิต รักษาศีล กินเจ สำรวมกาย วาจา ใจ ให้บริสุทธิ์ ถือเป็นการเจริญเมตตากรุณา นำมาซึ่งความเป็นสิริมงคลแก่ตนเองและครอบครัว ภูเก็ตเป็นจังหวัดที่จัดประเพณีถือศีลกินผัก หรือเทศกาลกินเจภูเก็ต อย่างยิ่งใหญ่มายาวนานกว่า 200 ปี มีศาลเจ้าภูเก็ตมากกว่า 30 แห่ง ที่ร่วมจัดประเพณี และในปีนี้จัดขึ้นระหว่างวันที่ 21-29 ตุลาคม 25678 มีพิธีกรรมต่าง ๆ ตลอด 9 วัน 9 คืน ขบวนแห่หลากสีสัน พิธีการที่มีชีวิตชีวา และอาหารเจอร่อยนานาชนิด ล้วนเป็นสิ่งที่ทำให้ งานเทศกาลกินเจภูเก็ต เป็นที่น่าจดจำ
19 กุมภาพันธ์ 2568 ทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว ฟรี โปโลฟุตบอลพาร์ค เขตปทุมวัน
หน่วยสัตวแพทย์เคลื่อนที่ วันพุธที่ 19 กุมภาพันธ์ 2568 ณ โปโลฟุตบอลพาร์ค เขตปทุมวัน ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
21 กุมภาพันธ์ 2568 ทำหมันสุนัข/แมว ฟรี วัดนวลจันทร์ เขตบึงกุ่ม
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 21 กุมภาพันธ์ 2568 ณ วัดนวลจันทร์ เขตบึงกุ่ม ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
25 กุมภาพันธ์ 2568 ชาวหนองจอก นำสัตว์เลี้ยงเข้ารับการฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ฟรี ที่ มหาวิทยาลัยเทคโนโลยีมหานคร
ขอเชิญชวน ชาวหนองจอก นำสัตว์เลี้ยงเข้ารับการฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ที่ มหาวิทยาลัยเทคโนโลยีมหานคร “ฟรี” ในวันอังคารที่ 25 กุมภาพันธ์ 2568 เวลา 11:00-15:00 น. . พร้อมร่วมสนุกกับกิจกรรมมากมาย ภายในงาน เปิดโลกโครงงานมหานคร ครั้งที่ 3
โชว์ไอเดียเจ๋ง ๆ จากโครงงานนักศึกษากว่า 100 โครงงาน (MiiX ชั้น5) ผลงานสุดครีเอทีฟ จากนักศึกษา Multimedia (Mii ชั้น1) ช้อปสินค้าสุดเก๋ จากน้อง ๆ บริหารธุรกิจ (MiiX ชั้น5) บริการตรวจสุขภาพ & ฉีดวัคซีนสัตว์เลี้ยง (BWIN) แมวเหมียวสุดปัง กับการแข่งขันแมวสุขภาพดี, แข่งกินขนมแมวเลีย & การประกวดแฟนซีคู่ซี้นายและทาส (BWIN)
26 กุมภาพันธ์ 2568 เขตภาษีเจริญ ให้บริการผ่าตัดทำหมันสุนัขและแมวพันธุ์ไทย...ฟรี
สำนักงานเขตภาษีเจริญ ขอประชาสัมพันธ์ โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า หน่วยปศุสัตว์เคลื่อนที่ ให้บริการผ่าตัดทำหมันสุนัขและแมวพันธุ์ไทย...ฟรี ตามโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามปณิธาน ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัติยราชนารี โดยสำนักงานปศุสัตว์พื้นที่ 13 ร่วมออกหน่วยสัตวแพทย์เคลื่อนที่บูรณาการร่วมกับภาคีเครือข่ายในพื้นที่กรุงเทพมหานคร
ในวันพุธที่ 26 กุมภาพันธ์ 2568 ระหว่างเวลา 08.00 - 12.00 น. ณ วัดนิมมานรดี แขวงบางหว้า เขตภาษีเจริญ กทม.
ผ่าตัดทำหมันสุนัขและแมวพันธุ์ไทยเท่านั้น โดยต้องงดน้ำและอาหารสุนัขและแมว 8-12 ชั่วโมงก่อนทำหมัน
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้า
ติดต่อสอบถาม สำนักงานปศุสัตว์ พื้นที่เขต 13 โทร 06 2329-6324 สำนักงานเขตภาษีเจริญ โทร 0 2413 2724 (ในวันและเวลาราชการ)
26 กุมภาพันธ์ 2568 ณ วัดยาง ซอยอ่อนนุช 23 เขตสวนหลวง ให้บริการผ่าตัดทำหมันสุนัขและแมวพันธุ์ไทย...ฟรี
หน่วยสัตวแพทย์เคลื่อนที่ วันพุธที่ 26 กุมภาพันธ์ 2568 ณ วัดยาง ซอยอ่อนนุช 23 เขตสวนหลวง ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก สุนัข/แมวหน้าสั้น แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
28 กุมภาพันธ์ 2568 ณ ลานกีฬาพัฒน์ 2 เขตราชเทวี
หน่วยสัตวแพทย์เคลื่อนที่ วันศุกร์ที่ 28 กุมภาพันธ์ 2568 ณ ลานกีฬาพัฒน์ 2 เขตราชเทวี ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก สุนัข/แมวหน้าสั้น สุนัข/แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
3 มีนาคม 2568 เขตบางพลัด ออกหน่วยทำหมันแมวจรจัด ณ วัดสามัคคีสุทธาวาส ซอยจรัญสนิทวงศ์ 85
สำนักงานเขตบางพลัด ร่วมกับสำนักงานสัตวแพทย์ สำนักอนามัย กรุงเทพมหานคร ออกหน่วยเคลื่อนที่ทำหมันแมวจรจัด ตามโครงการควบคุมจำนวนแมวจรจัดในพื้นที่กรุงเทพมหานคร และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยง ในวันที่ 3 มีนาคม 2568 เวลา 09.00 - 11.00 น. ณ วัดสามัคคีสุทธาวาส ซอยจรัญสนิทวงศ์ 85 แขวงบางอ้อ เขตบางพลัด กทม.
ทำหมันแมว สามารถลงทะเบียนจองคิวรับบริการได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางพลัด โทร. 02 4346371 (จำกัดจำนวน 40 ตัว)
ข้อปฏิบัติในการนำแมวมาทำหมัน 1.แมวตัวเมีย ต้องมีอายุ 6 เดือนขึ้นไป 2.แมวตัวผู้ ต้องมีอายุ 1 ปีขึ้นไป 3.กรณีแม่แมว ต้องคลอดลูกแล้ว 3 เดือน
***หมายเหตุ : 1. ต้องงดน้ำงดอาหารแมว อย่างน้อย 8-10 ชม. หรือหลัง 4 ทุ่มของคืนก่อนทำหมัน 2. แมวที่เข้ารับการทำหมันทุกตัว จะถูกทำการสักบริเวณหูและท้อง
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสามารถ walk in รับบริการได้ไม่จำกัดจำนวน
ข้อปฏิบัติในการนำสัตว์เลี้ยงมารับการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 1.แมว/สุนัข/กระต่าย/กระรอก อายุ 3 เดือนขึ้นไป 2.แม่แมวมีลูกอายุ 3 เดือนขึ้นไป
4 มีนาคม 2568 ณ วิทยาลัยพาณิชการบางนา เขตบางนา
หน่วยสัตวแพทย์เคลื่อนที่ วันอังคารที่ 4 มีนาคม 2568 ณ วิทยาลัยพาณิชการบางนา เขตบางนา ✅ รับทำหมันสุนัข/แมว จำนวนจำกัด 80 ตัว (ลงทะเบียนหน้างานเท่านั้น จนกว่าคิวจะเต็ม) ✅ เริ่มรับคิวทำหมัน 7.00 น. ✅ จำกัดสิทธิ์ทำหมัน คนละไม่เกิน 3 ตัว ✅ ไม่รับทำหมันสุนัขพันธุ์เล็ก สุนัข/แมวหน้าสั้น สุนัข/แมวน้ำหนักมากหรือผอมเกินไป ✅ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว (ไม่จำกัดจำนวนตัว) ✅ ทำหมัน ต้องจับสัตว์ขังกรง อดอาหารและน้ำ ก่อนนำมาทำหมัน 10 ชม.
12 มีนาคม 2568 ทำหมันสุนัข/แมว ฟรี โรงเรียนมัธยมสุวิทย์เสรีอนุสรณ์ เขตประเวศ
ทำหมันสุนัข/แมว ฟรี ในงานกิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" วันที่ 12 มีนาคม 2568 นี้ ตั้งแต่เวลา 08.00 - 14.00 น. ณ โรงเรียนมัธยมสุวิทย์เสรีอนุสรณ์ เขตประเวศ
13 มี.ค.68 ที่วัดพระพิเรนทร์
13 มี.ค. ที่วัดพระพิเรนทร์ ทำหมันหมา แมว ฟรี ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ฝังไมโครชิพ ฟรี โดยสำนักอนามัย กรุงเทพมหานคร ทำหมันจองคิวกันเข้ามาได้เลยนะคะ รับจำกัดเพียง 30 ตัวเท่านั้นค่ะ จองคิวทำหมันโทร. ส.ก. กุ๊บ 092-639-7446
14 มีนาคม 2568 ทำหมันหมาแมวได้ฟรี บริการสุขภาพเคลื่อนที่ ชุมชนหมู่บ้านพลับพลา เขตวังทองหลาง
ทำหมันหมาแมวฟรี ในงานกิจกรรม บริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" วันที่ 14 มีนาคม 2568 นี้
ตั้งแต่เวลา 08.00 - 14.00 น. ณ ชุมชนหมู่บ้านพลับพลา เขตวังทองหลาง และมีบริการสุขภาพอื่นๆ รวมทั้งการตรวจสุขภาพ ฟรี อีกมากมาย
วันอาทิตย์ที่ 23 มีนาคม 2568 สำนักงานเขตจอมทอง
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ สำนักงานเขตจอมทอง ขอเชิญชวนประชาชน นำสุนัขและแมวในพื้นที่เขตจอมทอง เข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตจอมทอง กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
⏩️ ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถจองคิว โดยสแกน QR code ตามที่ให้ไว้
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า (สามารถพาสัตว์เลี้ยงมาได้ทุกเขต)
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 23 มีนาคม 2568 ตั้งแต่เวลา 08.00 - 12.00 น. ณ สำนักงานเขตจอมทอง เขตจอมทอง (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
✅️ สัตว์เลี้ยงที่นำมารับบริการทำหมัน
1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
2. ถ้าเป็นเพศเมียต้องไม่ท้อง
3. มีอายุตั้งแต่ 6 เดือนขึ้นไป
4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 10 ชั่วโมง ก่อนพามาทำหมันเพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต
5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ
6. สำหรับแมวให้นำตระกร้า หรือ กรงขัง แมว ขนาดใหญ่มาด้วย เพื่อความสะดวกในการนำสัตว์กลับหลังจากการทำหมันเสร็จ
7. สุนัขให้ผูกโซ่ หรือเชือก กับสายจูง ให้แน่นหนา ขณะที่นำมารับบริการ
8. สุนัขพันธุ์เล็ก หรือพันธุ์ที่หน้าสั้น หรือมีปัญหาเกี่ยวกับโรคหัวใจ โรคทางระบบทางเดินหายใจ ไม่สามารถรับบริการทำหมันได้
*** ทั้งนี้อาจมีปัจจัยอื่นๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
เขตบางรัก ร่วมกับ สำนักอนามัย และศูนย์บริการสาธารณสุข 23 สี่พระยา
สำนักงานเขตบางรัก ร่วมกับ สำนักอนามัย และศูนย์บริการสาธารณสุข 23 สี่พระยา ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ในพื้นที่เขตบางรัก ประจำปี 2568 ระหว่างวันที่ 3-14 มีนาคม นี้ ตั้งแต่เวลา 10.00 - 12.00 น. ได้แก่
3 มี.ค. ชุมชนศรีเวียง
4 มี.ค. ชุมชนซอยสองพระ
5 มี.ค. ชุมชนตรอกขุนนาวา
6 มี.ค. ชุมชนซอยพระนคเรศ
7 มี.ค. ชุมชนตรอกห้านาย
10 มี.ค. ชุมชนสมบูรณ์ปัญญา
11 มี.ค. ชุมชนซอยหลังวัดแก้วแจ่มฟ้า
12 มี.ค. ชุมชนซอยพิพัฒน์ 2
13 มี.ค. ชุมชนซอยสันติภาพ
14 มี.ค. ชุมชนซอยหลังวัดหัวลำโพง
ทั้งนี้ให้บริการฉีดวัคซีนฟรี! ไม่มีค่าใช้จ่าย สามารถนำน้องหมา-น้องเหมียว มาฉีดวัคซีนกันได้เลย! ติดต่อสอบถามเพิ่มเติม ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางรัก โทร. 02 236 1395 ต่อ 6215
เดือนพฤศจิกายน 2568
กำหนดออกหน่วย เดือนมกราคม 2568
กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนมกราคม 2568 ตั้งแต่เวลา 09.00 - 15.00 น.
- วันจันทร์ที่ 20 มกราคม 2568 ณ ที่ทำการชุมชนบ้านโรงไม้ขีด ( ขอย้ายสถานที่ไปในวิทยาลัยเทคนิคพัทยา ซอยสุขุมวิทพัทยา 15 )
- วันพุธที่ 22 มกราคม 2568 ณ ที่ทำการชุมชนวัดช่องลม
- วันจันทร์ที่ 27 มกราคม 2568 ณ วัดช่องลมนาเกลือ
- วันพุธที่ 29 มกราคม 2568 ณ ที่ทำการชุมชนตลาดเก่านาเกลือ
งานมหกรรมการเงินเชียงใหม่ ครั้งที่ 20 จ.เชียงใหม่ วันที่ 7-9 พฤศจิกายน 2568
งานมหกรรมการเงินเชียงใหม่ ครั้งที่ 20 จ.เชียงใหม่
วันที่ 7-9 พฤศจิกายน 2568 ณ เชียงใหม่ฮอลล์ ศูนย์การค้าเซ็นทรัล เชียงใหม่ แอร์พอร์ต
Rolling Loud Thailand 2025 วันที่ 14-16 พฤศจิกายน 2025
Rolling Loud Thailand 2025 วันที่ 14-16 พฤศจิกายน 2025 PATTAYA, WE’RE COMING BACK! READY TO GO CRAZY THIS NOVEMBER EARLY BIRD TICKETS ON SALE NOW THIS IS THE BEST PRICE FOR TIX PRICES GO UP WHEN WE DROP THE LINEUP!
สัตวแพทย์เกษตรอาสา ม.เกษตร บางเขน ทำหมันน้องหมาน้องแมว ฟรี (17 มิย 67 - 31 มค 68)
กิจกรรมสัตวแพทย์เกษตรอาสา ม.เกษตร บางเขน ทำหมันน้องหมาน้องแมว ฟรี โดยรพ.สัตว์ ม.เกษตร บางเขน น้องหมาแมวทุกตัว จะได้รับการวางยาสลบชนิดสูดดม และผ่าตัดด้วยวิธีมาตรฐาน โดยนิสิตคณะสัตวแพทย์ปี 6 นายสัตวแพทย์ที่เข้าอบรมหลักสูตรสัตวแพทย์เพิ่มพูนทักษะ ภายใต้การดูแลควบคุมอย่างใกล้ชิด ของสัตวแพทย์ผู้เชี่ยวชาญเฉพาะทางด้านศัลยกรรม
เปิดรับลงทะเบียน ระหว่างวันที่ 17 มิย 67 - 31 มค 68 คิวผ่าตัดจะเริ่มตั้งแต่ 24 มิถุนายน 2567
เงื่อนไขการร่วมโครงการ 1) สุนัขและแมว มีอายุระหว่าง 1-5 ปี 2) ต้องมีน้ำหนักตัว 2.5-20 กก. 3) ไม่รับสุนัขพันธุ์หน้าสั้น 4) สุขภาพแข็งแรงสมบูรณ์ ไม่มีโรคประจำตัว 5) ไม่รับสุนัขและแมวเพศเมีย ที่อยู่ในระหว่างเป็นสัด ตั้งท้อง หรือให้นมลูก
เดือนธันวาคม 2568
หน่วยบริการในจังหวัดต่างๆ (ยกเว้นกรุงเทพ)
ข่าว พบ โรคพิษสุนัขบ้าระบาดใน 3 อำเภอ จ.ระยอง
ก.พ. 2567 พบ โรคพิษสุนัขบ้า ระบาดแล้ว ในเขต อ.เขาชะเมา อ.บ้านฉาง และ อ.นิคมพัฒนา จ.ระยอง
พื้นที่ปริมณฑล ภาคกลาง
เทศบาลนครพิษณุโลก กำหนดออกหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า เดือนกุมภาพันธ์ - พฤษภาคม 2568
7 กุมภาพันธ์ 2568 เทศบาลนครพิษณุโลก
ประกาศสำนักสาธารณสุขและสิ่งแวดล้อม ได้กำหนดการออกหน่วยเคลื่อนที่ฉีดวัดซีนป้องกันโรคพิษสุนัขบ้า ไปตามชุมชนในเขตเทศบาลนครพิษณุโลก
ในช่วงเดือนกุมภาพันธ์ - พฤษภาคม 2568 [ดูกำหนดการทั้งหมด] ตามโครงการสัตว์ปลอดโรคคนปลอดภัย จากโรคพิษสุนัขบ้า ประจำปีงบประมาณ 2568
สอบถามข้อมูลเพิ่มเติม โทร 055-9863221 ถึง 28 เพจ
เทศบาลนครพิษณุโลกfanpageจันทร์ที่ 10 มีนาคม 2568 ชุมชนชัยพรวิถี พัทยา
กลุ่มงานสัตวแพทย์ ส่วนส่งเสริมอนามัยสิ่งแวดล้อม สำนักสาธารณสุขและสิ่งแวดล้อม เมืองพัทยา ได้จัดทำแผนปฏิบัติงานโครงการรณรงค์ควบคุมและป้องกันโรคพิษสุนัขบ้าในเขตเมืองพัทยา ครอบคลุมพื้นที่ ตำบลนาเกลือ หมู่ 1 – 7 ตำบลหนองปรือ หมู่ 5, 6, 9, 10, 11, 12, 13 ตำบลหนองปลาไหล หมู่ 6 – 8 ตำบลห้วยใหญ่ หมู่ 4 เพื่อให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดป้องกันเห็บหมัดในสุนัข และผ่าตัดทำหมันคุมกำเนิดถาวร วันจันทร์ที่ 10 มีนาคม 2568 ชุมชนชัยพรวิถี โดยเริ่มให้บริการตั้งแต่เวลา 09.00 - 15.00 น.
พื้นที่ภาคเหนือ
เทศบาลตำบลทุ่งหลวง แม่ระมาด จ.ตาก ทำหมันฟรี 16 ธันวาคม 2567 - 15 มกราคม 2568
การทำหมันสุนัข&แมว ผู้ที่มีความประสงค์จะนำสุนัขและแมวมารับบริการทำหมัน สามารถเข้ามาลงทะเบียนได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลทุ่งหลวง ตั้งแต่วันที่ 16 ธันวาคม 2567 - 15 มกราคม 2568 ฟรี!ไม่มีค่าใช้จ่าย *สำหรับวันและเวลาจะแจ้งให้ทราบในลำดับต่อไป*
ทำหมันสุนัขฟรีเชียงใหม่ Hand to Paw เดือนกุมภาพันธ์ 2568
ทำหมันสุนัขฟรีเชียงใหม่ Hand to Paw
- วันที่ 2 , 9 และ 22 กุมภาพันธ์ 2568 สุนัขในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด สันกำแพง(ต.สันกำแพง ต.ต้นเปา ต.แม่ปูคา ต.ออนใต้ ต.บวกค้า ต.แช่ช้าง)
- วันที่ 15 กุมภาพันธ์ 2568สุนัขในพื้นที่ อำเภอแม่แตง
ลงทะเบียนได้ ดังนี้ เริ่มลงทะเบียน 27 มค.68
1.เทศบาล(สถานที่จัด) วันเวลาราชการ
2.มูลนิธิฯ โทร 080 673 1770 (เวลา 17.00-20.00 น) ยกเว้นเสาร์-อาทิตย์ เนื่องจากออกหน่วยเคลื่อนที่
พื้นที่ภาคตะวันออก
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ปศุสัตว์จังหวัดชลบุรี ประจำเดือน มกราคม 2568
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน มกราคม 2568 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนมกราคม 2568
"พกบัตร ปชช." นำสุนัขและแมว เข้ารับบริการหมัน ประจำเดือนมกราคม ฟรี กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนมกราคม 2568 ตั้งแต่เวลา 09.00 - 15.00 น. ดังนี้
วันพุธที่ 8 มกราคม 2568 ณ ที่ทำการชุมชนกระทิงลาย
วันจันทร์ที่ 13 มกราคม 2568 ณ วัดกระทิงลาย
วันพุธที่ 15 มกราคม 2568 ณ วัดหนองใหญ่
วันจันทร์ที่ 20 มกราคม 2568 ณ ที่ทำการชุมชนบ้านโรงไม้ขีด
วันพุธที่ 22 มกราคม 2568 ณ ที่ทำการชุมชนวัดช่องลม
วันจันทร์ที่ 27 มกราคม 2568 ณ วัดช่องลมนาเกลือ
วันพุธที่ 29 มกราคม 2568 ณ ที่ทำการชุมชนตลาดเก่านาเกลือ
ขอเชิญประชาชนที่อาศัยในชุมชนดังกล่าว นำบัตรประชาชนมาลงทะเบียน เพื่อนำสัตว์เลี้ยงเข้ารับบริการด้านต่างๆ ดังนี้ การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า / การผ่าตัดทำหมันสุนัขและแมว / การให้คำแนะนำด้านสุขภาพสัตว์เลี้ยง หมายเหตุ : ให้บริการในสุนัขและแมว ที่มีอายุ 6 เดือน ขึ้นไป ควรงดน้ำ งดอาหารสัตว์เลี้ยง อย่างน้อย 12 ชั่วโมง และรับเฉพาะสุนัขพันธุ์ไทยและแมวพันธุ์ ไทย เท่านั้น กรณีทำหมันตัวเมีย ให้บริการบ้านละไม่เกิน 2 ตัว ตัวผู้ไม่จำกัด สอบถามรายละเอียดเพิ่มเติมที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
เมืองพัทยา ออกหน่วยทำหมันหมาแมว เดือนมกราคม 2568
เมืองพัทยา จัดโครงการรณรงค์ควบคุมและป้องกันโรคพิษสุนัขบ้าในเขตเมืองพัทยา ประจำปี 2568 โดยให้บริการ ทำหมันสุนัขแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ระหว่างเดือนมกราคม-สิงหาคม 2568 โดยเริ่มให้บริการตั้งแต่เวลา 09.00 – 15.00 น. สอบถามเพิ่มเติม กลุ่มงานสัตวแพทย์ 038-111-826
หมายเหตุ : รับเฉพาะประชาชนผู้ที่มีสำเนาทะเบียนบ้านอยู่ในเมืองพัทยาเท่านั้น :ตารางการออกหน่วยสามารถเปลี่ยนแปลงได้ตามความเหมาะสม : พักรับประทานอาหารกลางวัน ๑๒.๐๐ - ๑๓.๐๐ น. จำกัดบ้านละ 2 ตัวเท่านั้นนะ
ไม่มีทะเบียนท้องถิ่นเมืองพัทยา แต่อาศัยหรือเช่าห้องในพื้นที่พัทยา ท่านสามารถแจ้งบ้านเลขที่ที่อาศัยอยู่ในเมือง
ปศุสัตว์จังหวัดชลบุรี ออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ประจำเดือน กุมภาพันธ์ 2568
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีนสุนัขและแมว ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กุมภาพันธ์ 2568
- เวลาออกหน่วยบริการ 8.30 - 11.00 น.
- รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) **เท่านั้น**
- พื้นที่อื่นๆสามารถโทรสอบถาม อบต./เทศบาล ในพื้นที่เพื่อสอบถามข้อมูลโครงการได้เลย
เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว เดือนกุมภาพันธ์ 2568
กลุ่มงานสัตวแพทย์ เมืองพัทยา ออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว สำหรับประชาชนที่อาศัยอยู่ในเมืองพัทยา ประจำเดือนกุมภาพันธ์ 2568 ตั้งแต่เวลา 09.00 - 15.00 น. ดังนี้
- วันจันทร์ที่ 3 กุมภาพันธ์ 2568 ชุมชนลานโพธิ์ (บริเวณลานจอดรถยนต์ฝั่งทะเล)
- วันพุธที่ 5 กุมภาพันธ์ 2568 ชุมชนซอยไปรษณีย์
- วันจันทร์ที่ 10 กุมภาพันธ์ 2568 วัดสว่างฟ้าพฤฒาราม
- วันพฤหัสบดีที่ 13 กุมภาพันธ์ 2568 ชุมชนแหลมราชเวช
- วันพุธที่ 19 กุมภาพันธ์ 2568 ชุมชนหัวทุ่ง
- วันจันทร์ที่ 24 กุมภาพันธ์ 2568 ชุนชนโพธิสัมพันธ์
- วันพุธที่ 26 กุมภาพันธ์ 2568 วัดโพธิสัมพันธ์
นำบัตรประชาชนมาลงทะเบียน เพื่อนำสัตว์เลี้ยงเข้ารับบริการด้านต่างๆ ดังนี้ การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า / การผ่าตัดทำหมันสุนัขและแมว / การให้คำแนะนำด้านสุขภาพสัตว์เลี้ยง
หมายเหตุ : ให้บริการในสุนัขและแมว ที่มีอายุ 6 เดือน ขึ้นไป ควรงดน้ำ
งดอาหารสัตว์เลี้ยง อย่างน้อย 12 ชั่วโมง และรับเฉพาะสุนัขพันธุ์ไทยและแมวพันธุ์ ไทย เท่านั้น กรณีทำหมันตัวเมีย ให้บริการบ้านละไม่เกิน 2 ตัว ตัวผู้ไม่จำกัด
สอบถามรายละเอียดเพิ่มเติมที่ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง ปศุสัตว์ปราจีนบุรี จัดหน่วยทำหมันสุนัขแมวฟรี
ฝ่ายพัฒนาสุขภาพสัตว์สำนักงานปศุสัตว์ปราจีนบุรี จัดกิจกรรมทำหมันฟรี เขต อ.เมืองปราจีนบุรี และอ.อื่นๆ ในปราจีนบุรี ผู้สนใจหรือเจ้าของหมาแมว แนะนำให้ กด
ติดตามข่าวสารจากเพจของฝ่ายฯ ไว้จะได้ไม่พลาดประกาศบริการและการจองคิว
27 กุมภาพันธ์ 2568 เมืองพัทยา ทำหมันฉีดวัคซีนสุนัขแมว
27 ก.พ. 2568 เมืองพัทยาออกหน่วยเคลื่อนที่ให้บริการสาธารณสุข ตรวจคัดกรองสุขภาพเบื้องต้น ฟรีตลอดงาน
ฝ่ายบริการสาธารณสุขเมืองพัทยา จัดกิจกรรมออกหน่วยบริการสาธารณสุขเคลื่อนที่ ครั้งที่ 1 ตามโครงการสุขภาพดีมีสุข ประจำปีงบประมาณ 2568 วันพฤหัสบดีที่ 27 กุมภาพันธ์ 2568 ณ โรงเรียนเมืองพัทยา 2 (เจริญราษฎร์อุทิศ) ตั้งแต่เวลา 07.30 - 14.30 น. โดยภายในงานมีการให้บริการตรวจคัดกรองสุขภาพเบื้องต้นฟรี อาทิ วัดความดัน , เจาะน้ำตาลปลายนิ้ว , ตรวจคัดกรองภาวะโรคไตเสื่อม , ค่าไขมันอายุ 35 ปีขึ้นไป (งดน้ำอาหารหลัง 4 ทุ่ม) , ตรวจคัดกรองมะเร็งลำไส้ มะเร็งปากมดลูก , เอกซเรย์ปอด , อัลตร้าซาวด์ช่องท้อง , ตรวจหาเชื้อไวรัสตับอักเสบ b และ c , บริการตรวจรักษาโรคทั่วไป , บริการกายภาพบำบัด, ให้บริการทางแพทย์แผนไทย , บริการแช่เท้าด้วยสมุนไพร และสาธิตทำยาดม , ให้บริการตรวจสุขภาพช่องปาก และบริการทางทันตกรรม ได้แก่ อุดฟัน ขูดหินปูน และถอนฟัน , ตรวจคัดกรองข้อเข่าเสื่อม , ให้ความรู้ช่วยฟื้นคืนชีพ , การให้บริการฉีดวัคซีนป้องกันโรคมะเร็งปากมดลูก (อายุตั้งแต่ 11 - 20 ปี) ฉีดวัคซีนคอตีบ บาดทะยัก วัคซีนหัดเยอรมัน คางทูม , เปิดให้ลงทะเบียนรับคำร้องขอรับการดูแลผู้ป่วยที่มีภาวะพึ่งพิง และลงชื่อขอรับผ้าอ้อมผู้ใหญ่ , บริการเปลี่ยนแปลงสิทธิสถาน พยาบาล , ให้ความรู้ในการป้องกันและควบคุมโรคติดต่อ , ให้ความรู้เกี่ยวกับเรื่องการวางแผนการเงินจากธนาคารออมสินพัทยา , แจกทรายเคลือบสารเคมีกำจัดยุงลูกยุงลาย , แจกยาเบื่อหนู , บริการรับคำร้องและให้ความรู้ด้านสุขาภิบาลสิ่งแวดล้อม , ตรวจหาความผิดปกติของสายตา เช่นจอประสาทตาเสื่อม , ให้บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สุนัขและแมว , ให้บริการตรวจ HPV Hep B/C HIV self OV พยาธิใบไม้ตับ , แจกถุงยางอนามัย , บริการตัดผมฟรี นอกจากนี้มีการจำหน่ายสินค้าจากชุมชนและวิสาหกิจ และกิจกรรมอื่นๆ อีกมากมาย
เมืองพัทยาขอเชิญผู้ที่สนใจเข้ารับบริการ ในวันพฤหัสบดีที่ 27 กุมภาพันธ์ 2568 ณ โรงเรียนเมืองพัทยา 2 ตั้งแต่เวลา 07.30 - 14.30 น. สอบถามรายละเอียดเพิ่มเติมได้ที่ฝ่ายบริการสาธารณสุขเมืองพัทยา หมายเลขโทรศัพท์ 094-458 6493
พื้นที่ภาคอีสาน
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครนครราชสีมา ฉีดวัคซีนและทำหมันหมา-แมว ฟรี! LINK
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครนครราชสีมา ฉีดวัคซีนและทำหมันหมา-แมว ฟรี!
• ฉีดวัคซีนพิษสุนัขบ้า : ทุกวันจันทร์ - ศุกร์ เวลา 08.30 - 15.30 น.
• ทำหมันสัตว์เลี้ยง : ทุกวันพุธ เวลา 08.30 - 15.30 น. (เฉพาะคิวที่จองไว้)
• นัดคิวทำหมัน/สอบถาม : 044-251398 กลุ่มงานสัตวแพทย์
• พิกัด ถนนมิตรภาพ ตำบลในเมือง อำเภอเมืองนครราชสีมา ติดห้าง BigC
เกณฑ์ที่กำหนด • เป็นสัตว์เลี้ยงจรจัดเก็บมาเลี้ยง • เป็นสัตว์เลี้ยงด้อยโอกาส • อยู่ในเขตเทศบาลนครฯ ต.ในเมือง สอบถาม : 044-251398 กลุ่มงานสัตวแพทย์
พื้นที่ภาคใต้
เทศบาลตำบลวิชิต ทำหมันสุนัขและแมว (นอกสถานที่)ในวันพฤหัสบดี ที่ 16 มกราคม 2568
เทศบาลตำบลวิชิต ร่วมกับปศุสัตว์จังหวัดภูเก็ตให้บริการทำหมันสุนัขและแมว (นอกสถานที่)ในวันพฤหัสบดี ที่ 16 มกราคม 2568 เวลา 09.00 - 12.00 น. บริเวณหลังเวทีกลางสวนศรีภูวนาถ
- รับจำนวนจำกัด แมว 40 ตัว สุนัข 10 ตัว
- เฉพาะสุนัขและแมวในเขตตำบลวิชิตเท่านั้น
สามารถติดต่อเพื่อทำการจองได้ที่ งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลวิชิต ในวันที่ 11-15 มกราคม 2568 (หากเต็มจำนวนแล้วจะปิดรับสมัครทันที)
สอบถามเพิ่มเติมโทร.0 7652 5100 ต่อ 164
หมายเหตุ
1.สุนัขและแมวที่ทำหมันต้องงดน้ำและอาหารหลังเที่ยงวันที่ 15 มกราคม 2568
2.แมวที่ลงทะเบียนทำหมัน ต้องมีอายุ 4 เดือนขึ้นไป และมีน้ำหนักไม่น้อยกว่า 1.5 กิโลกรัม
3.สุนัขที่ลงทะเบียนทำหมัน ต้องมีอายุ 3 เดือนขึ้นไป และมีน้ำหนักไม่น้อยกว่า 3.0 กิโลกรัม
4. สัตว์ที่ป่วย หรือสุนัขและแมวหน้าสั้น ต้องติดต่อสอบถามเจ้าหน้าที่ก่อนวันมาทำหมัน ว่าสามารถทำหมันได้หรือไม่เพื่อความปลอดภัยของสัตว์เลี้ยงของท่าน
คณะสัตวแพทยศาสตร์ มทร.ศรีวิชัย ทำหมันสุนัขแมว (ครี่งราคา) งานทุ่งใหญ่เกษตรแฟร์2568
คณะสัตวแพทยศาสตร์ มทร.ศรีวิชัย ขอเชิญผู้สนใจเข้าร่วม กิจกรรมทำหมันสัตว์เลี้ยง โครงการควบคุมประชากรสัตว์เลี้ยง งานทุ่งใหญ่เกษตรแฟร์2568 ณ ห้องศัลยกรรม อาคารโรงพยาบาลปศุสัตว์ คณะสัตวแพทยศาสตร์ มทร.ศรีวิชัย
บริการทำหมันสุนัขและแมว(ครึ่งราคา)
• สำหรับสุนัข วันที่ 28 กุมภาพันธ์ 2568
• สำหรับแมว วันที่ 7 มีนาคม 2568
• เวลา 08.30 - 16.30 น. ณ ห้องศัลยกรรม อาคารโรงพยาบาลปศุสัตว์ คณะสัตวแพทยศาสตร์ มทร.ศรีวิชัย โทร 075-489611
ลงทะเบียนคลิกอบต.กมลา ภูเก็ต ทำหมันสุนัขและแมว ฟรี 4 กุมภาพันธ์ 2568
องค์การบริหารส่วนตำบลกมลา ให้บริการทำหมันสุนัขและแมว ฟรี ในวันที่ 4 กุมภาพันธ์ 2568 เวลา 09:00-12.00 น. ณ โรงจอดรถองค์การบริหารส่วนตำบลกมลา สอบถามข้อมูลเพิ่มเติมได้ที่ เบอร์โทรศัพท์ 076-385640 ต่อ 26
fb อบต.กมลาเทศบาลเมืองเขารูปช้าง จ.สงขลา ทำหมันสุนัขแมว ฟรี วันนี้ จนถึง 30 ก.ย. 68
เทศบาลเมืองเขารูปช้าง จังหวัดสงขลา บริการ ทำหมันสุนัขแมว ฟรี สำหรับชาวเขารูปช้าง โดยเป็นความร่วมมือของ เทศบาลเมืองเขารูปช้าง ร่วมกับมูลนิธิบ้านหมายิ้ม และโรงพยาบาลสัตว์เว็ทเมด ผู้สนใจ สามารถลงทะเบียนทำหมันได้ 2 ช่องทาง
- กรอกใบสมัคร พร้อมแนบสำเนาทะเบียนบ้านที่อยู่ในเขตเทศบาลเมืองเขารูปช้าง และภาพถ่ายสุนัข-แมว (รับใบสมัครได้ที่ ชั้น 5 กองสาธารณสุข เทศบาลเมืองเขารูปช้าง)
- สมัครทางออนไลน์
- สแกน QR Code ลงทะเบียนได้ตั้งแต่วันนี้ จนถึง 30 ก.ย. 68 หลังจากลงทะเบียนเจ้าหน้าที่ติดต่อกลับภายใน 7 วัน
- รับเฉพาะสุนัขไทยพื้นบ้าน(มีเจ้าของและสุนัขจรจัด) และแมวจรจัด เท่านั้น
เทศบาลนครหาดใหญ่ ทำหมัน ฉีดวัคซีนแมว ฟรี
เทศบาลนครหาดใหญ่ บริการ ทำหมัน ฉีดวัคซีนแมว ฟรี (เฉพาะสายพันธุ์ไทย)
• กรณีทำหมัน ให้ท่านจองคิวก่อนล่วงหน้า เพื่อความรวดเร็วในการรับบริการ
• กรณีฉีดวัคซีน ท่านสามารถติตต่อเจ้าหน้าที่โดยตรง ณ งานสัตวแพทย์ ฝ่ายบริการสิ่งแวดล้อมสำนักงานสาธารณสุขและสิ่งแวดล้อม เทศบาลนครหาดใหญ่ในวันจันทร์-ศุกร์ เวลา 08:30 น. - 16:30 น.
• ผู้มารับบริการต้องอาศัยอยู่ภายในเขตเทศบาลนครหาดใหญ่ และนำบัตรประจำตัวประชาชนมาด้วย
• สอบถามข้อมูลเพิ่มเติม โทร.074-200134
ข้อมูลเป็นประโยชน์เพิ่มเติม
ยันต์กันผีโควิด-19 - 6 เมษายน 64 LINK
ยันต์กันผีโควิด-19
6/4/64
1- รักษาวินัยส่วนตน
2-รักษาระยะห่าง
3- ระยะเวลาที่ใกล้ชิด
4- พฤติการณ์ ณ ขณะนั้น
5- สถานที่ อับ
ในสถานบันเทิงเช่น ผับ ขาดทุกข้อ
แต่ที่ที่สามารถเกิดขึ้นได้เช่นกัน เช่น การโดยสารรถคันเดียวกันโดยเฉพาะรถสาธารณะคนหนาแน่น
ทั้งนี้เนื่องจากมีคนที่ติดเชื้อและแพร่เชื้อได้กระจายอยู่ทั่วไปที่ไม่ได้ตรวจ “โดยไม่มีอาการ”
11 พฤษภาคม 64 เวลา 20.00 น.
สสจ.ชลบุรี และ สสอ. อำเภอต่างๆในชลบุรี
สำนักงานสาธารณสุขจังหวัดชลบุรี สสจ.ชลบุรี (โทร 038932450)
แจ้งข้อมูลการประสานการตรวจหาเชื้อโควิด-19 ทุกวัน เวลา 08.30 – 16.30 น. ได้ที่
สสอ.เมืองชลบุรี (038282148)
สสอ.บางละมุง (038221925)
สสอ.ศรีราชา (038322503)
สสอ.สัตหีบ (038245330)
สสอ.บ้านบึง (038443209)
สสอ.บ่อทอง (038211277)
สสอ.พนัสนิคม (0972322372)
สสอ.พานทอง (038451712)
สสอ.หนองใหญ่ (038219232)
สสอ.เกาะจันทร์ (038166264)
สสอ.เกาะสีชัง (0646648088)
ติดตามข่าวอัพเดตเกี่ยวกับโควิด มาตรการ สถานที่เสี่ยง ฯลฯ ได้จาก
วิภาราม สมุทรสาคร จัด Package รักษาผู้ป่วยโควิด 3 แพคเกจ เริ่ม 5000 ต่อวัน LINK
โรงพยาบาลวิภาราม สมุทรสาคร จัด Package รักษาผู้ป่วยCovid-19
บริการรักษาผู้ป่วยCovid-19 ที่โรงพยาบาล (กลุ่มสีเขียว)
- Package ผู้ใหญ่ นอนรพ.น้อยกว่า 7 วัน ราคา 6,000 บาท/ต่อวัน
- Package ผู้ใหญ่ นอนรพ.มากกว่า 7 วัน ราคา 5,000 บาท/ต่อวัน
- Package เด็กลด นอนรพ. ลด 10% ใน Package ผู้ใหญ่
สอบถามข้อมูลเพิ่มเติมได้ที่
โทรศัพท์ 034-116999 แผนก การตลาด ต่อ 2153
ททท.สำนักงานพัทยา แนะนำที่กินเที่ยว
#ChonChecklist ททท.สำนักงานพัทยา พากินพาเที่ยวพาชมคาเฟ่ใหม่ๆเด็ดๆ น่าจะไปเยี่ยมเยือน
- Palyn Cafe & Eatery คาเฟ่สีขาว ริมทะเลแห่งเมืองสัตหีบได้ เป็นคาเฟ่ Pet Friendy อีกด้วย เวลาเปิด - ปิด : 8:30 - 20:30 น. [พิกัด]
- Yes Vegan ร้านอาหารมังสวิรัติ ของดีประจำพัทยาอีกร้านที่ห้ามพลาด เปิด - ปิด : 11:00 - 20:00 น. หยุดวันพุธ [พิกัด] fb/yesveganpattayaช
ศูนย์บริการสาธารณสุข 69 คันนายาว
ฝ่ายสิ่งแวดล้อมฯ เขตคันนายาว ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สัตว์เลี้ยงฟรี ประจำปี 2567 ระหว่างวันที่ 2 - 13 กันยายน 2567 เวลา 09:00 - 12:00 น. เพื่อสร้างเสริมภูมิคุ้มกันโรคพิษสุนัขบ้าให้กับสัตว์เลี้ยงของท่าน ผู้ที่สนใจสามารถนำสัตว์เลี้ยงของท่านเข้ารับการฉีดวัคซีนพิษสุนัขบ้า ตามวันเวลาดังกล่าว
2025 International Coffee fair and event in Asia & The World
กิจกรรมงานกาแฟในประเทศต่างๆ ในเอเซียและทั่วโลกปี 2025
- การประชุมและนิทรรศการกาแฟพิเศษระดับโลก SCAJ 2025 วันที่ 24 กันยายน 2025 ถึง 27 กันยายน 2025 ที่ Tokyo Big Sight South Exhibition Hall
- World of Coffee Jakarta 2025 วันที่ 15-17 พฤษภาคม 2025 จัดขึ้นที่ศูนย์การประชุมจาการ์ตา (Jakarta Convention Center (JCC), Indonesia)
- World of Coffee Geneva 2025วันที่ 26 ถึง 28 มิถุนายน 2025 จัดขึ้นที่ Palexpo Exhibition and Convention Center นับเป็นครั้งแรกที่งาน World of Coffee จะจัดขึ้นที่เจนีวา ประเทศสวิตเซอร์แลนด์ ซึ่งเป็นส่วนหนึ่งของงานแสดงสินค้า World of Coffee ประจำปีของ SCA ซึ่งมีกำหนดจัดขึ้นในปีหน้าที่ดูไบ สหรัฐอาหรับเอมิเรตส์ และจาการ์ตา ประเทศอินโดนีเซียเช่นกัน
- Coffee Expo Seoul 2025 วันที่ 2 - 5 เมษายน 2025 ศูนย์การประชุม COEX กรุงโซล ประเทศเกาหลี
- 2025 World Coffee Championships Season 1) Houston World Coffee Championships April 25-27, 2025 Specialty Coffee Expo | Houston, TX, USA 2) Jakarta World Coffee Championships May 15-17, 2025 World of Coffee | Jakarta, Indonesia 3) Geneva World Coffee Championships June 26-28, 2025 World of Coffee | Geneva, Switzerland. 4) Milan World Coffee Championships October 17-21, 2025 HostMilano | Milan, Italy
- Tokyo Coffee Festival 2025 Different coffee types from all over the world 2024.10.19(Sat) - 20(Sun) @UNU 国連大学中庭
- CAFERES Japan 2025 date 16-18 July 2025 Tokyo Big Sight, Tokyo, Japan. This is the big event for café owners, restaurateurs, caterers, hoteliers, retailers and other professionals in the F&B industry will find new suppliers and will connect with business partners. A vast array of products will be available across the three main exhibition areas.
ที่เที่ยวลพบุรีฤดูฝน
ททท.สำนักงานลพบุรี ปักหมุดที่เที่ยวฉ่ำฮีลใจ เที่ยวธรรมชาติลพบุรีในฤดูฝน #สุขทันทีที่เที่ยวหน้าฝน 6 จุด ได้แก่ เขาวงพระจันทร์ วัลลภาฟาร์มสเตย์ สวนกระท้อนตะลุง พระนารายณ์ราชนิเวศน์ ไร่ทรัพย์ประยูร บ้านกล้วยและไข่
งานมหกรรมโปงลาง แพรวา และงานกาชาดจังหวัดกาฬสินธุ์ ประจำปี 2568 วันที่ 26 กุมภาพันธ์ - 9 มีนาคม 2568
จังหวัดกาฬสินธุ์ ร่วมกับเหล่ากาชาดจังหวัดกาฬสินธุ์ จัดงานมหกรรมโปงลาง แพรวา และงานกาชาดจังหวัดกาฬสินธุ์ ประจำปี 2568 ที่กำลังจะจัดขึ้นระหว่างวันที่ 26 กุมภาพันธ์ 2568 ถึงวันที่ 9 มีนาคม 2568 ณ สนามหน้าศาลากลางจังหวัดกาฬสินธุ์
กิจกรรมที่น่าสนใจภายในงานประกอบด้วย การประกวดวงดนตรีพื้นบ้านโปงลาง ชิงถ้วยพระราชทานฯ การแสดงแสงสี เสียง โชว์พิเศษจาก ศิลปินแมน ภิสิทธิ์พงษ์ จากรายการไมค์หมดหนี้ และอาจารย์ศิริวรรณ จันทร์สว่าง จาก The Golden Song เวทีเพลงเพราะ การแสดงศิลปวัฒนธรรมโปงลางสร้างสรรค์ ในงานมหกรรม โปงลาง Festival การแสดงศิลปวัฒนธรรมดนตรีพื้นบ้านโปงลาง การถวายตัวเป็นลูกหลานพระยาชัยสุนทร และการรำบวงสรวง กว่า ๑,๐๐๐ คน การแสดงแบบผ้าไทย/ผ้าแพรวา ชม ชิม ช้อป สินค้าทางวัฒนธรรม CPOT และ OTOP การสาธิตอาหาร การประกวดอาหาร ประกวดผลิตภัณฑ์ทางการเกษตร กิจกรรมมัจฉากาชาด หมุนวงล้อออกรางวัลสลากกาชาด
สอบถามข้อมูลเพิ่มเติมได้ที่ สำนักงานวัฒนธรรมจังหวัดกาฬสินธุ์ Facebook : วัฒนธรรม กาฬสินธุ์ โทร. 043-815806
หลักสูตรฝึกอบรม Pediatric CPR โรงพยาบาลจุฬาภรณ์ LINK
โรงพยาบาลจุฬาภรณ์ จัดโครงการพัฒนาความรู้และทักษะในการช่วยฟื้นคืนชีพเด็ก (Pediatric CPR) ระยะเวลาการฝึกอบรมภาคทฤษฎี ระหว่างวันที่ 12 เมษายน 2566 ถึง วันที่ 21 เมษายน 2566 ผ่านระบบออนไลน์ ระยะเวลาการฝึกอบรมภาคปฏิบัติ
รอบที่ 1 วันที่ 24 เมษายน 2566 เวลา 08.30 – 12.00 น.
รอบที่ 2 วันที่ 25 เมษายน 2566 เวลา 08.30 – 12.00 น.
ณ ศูนย์จำลองสถานการณ์เพื่อการเรียนรู้ อาคารศูนย์การแพทย์จุฬาภรณ์เฉลิมพระเกียรติ
แม่สอดสงกรานต์ มิวสิคเฟสติวัล 2025 5 เม.ย. - 6 เม.ย. 2568
แม่สอดสงกรานต์ มิวสิคเฟสติวัล 2025 วันที่ 5 - 6 เม.ย. 2568 Robinson Lifestyle Center Maesod จังหวัดตาก ตาก ภาคเหนือ แม่สอดสงกรานต์ มิวสิคเฟสติวัล 2025 เทศกาลดนตรีท่ามกลางเสียงเพลงและสายน้ำสุดมันส์แห่งปีกลับมาอีกครั้ง พร้อมเสริ์ฟความเปียกฉ่ำสุดขีด 2 คืนเต็มๆ เตรียมร่างกายและชุดสีขาวของทุกคนไว้ให้พร้อม แล้วมาร่วมเฉลิมฉลองครบรอบ 10 ปีไปด้วยกัน วาระแห่งชาติ ห้ามพลาดด้วยประการทั้งปวง….
รายงานผู้ติดเชื้อ 15 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 188 ราย ในประเทศ 81 ราย เชิงรุก 73 ราย ต่างประเทศ 33 ราย รวมผู้ป่วยยืนยันสะสม 11,450 ราย
- ศบค. ผู้ป่วยในประเทศ+เชิงรุก ตามจังหวัด กรุงเทพ 24 ราย นครสวรรค์ 1 ราย นนทบุรี 1 ราย นราธิวาส 1 ราย สมุทรปราการ 5 (2+3) ราย สมุทรสาคร 99 (47+52) ราย ชลบุรี 4 (1+3) ราย ระยอง 6 (1+5) ราย ปทุมธานี 1 ราย จันทบุรี 2 ราย ฉะเชิงเทรา 7 ราย
- ศบค. ติดเชื้อต่างประเทศ 34 ราย ฟิลิปปินส์ 1 ราย ปากีสถาน 1 ราย ฮังการี 1 ราย สหรัฐอเมริกา 1 ราย อียิปต์ 1 ราย สาธารณรัฐเช็ก 1 ราย เยอรมันี 6 ราย เบลเยี่ยม 1 ราย ซูดาน 1 ราย รัสเซีย 1 ราย สวิส 1 ราย สหรัฐอาหรับเอมิเรตส์ 1 ราย คูเวต 1 ราย
รายงานผู้ติดเชื้อ 14 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 271 ราย ในประเทศ 78 ราย เชิงรุก 181 ราย ต่างประเทศ 12 ราย รวมผู้ป่วยยืนยันสะสม 11,262 ราย
รายงานผู้ติดเชื้อ 13 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 157 ราย ในประเทศ 90 ราย เชิงรุก 42 ราย ต่างประเทศ 25 ราย รวมผู้ป่วยยืนยันสะสม 10,991 ราย
- ศบค. ผู้ติดเชื้อจากต่างประเทศ 25 ราย - ไอซ์แลนด์ 1 ราย สหรัฐอเมริกา 1 ราย เยอรมันี 1 ราย กาตาร์ 1 ราย เมียนมา 21 ราย
- ศบค. สรุป รายจังหวัด
เชียงใหม่ 2 ราย เพชรบุรี 4 ราย กรุงเทพ 24 ราย นนทบุรี 15 ราย ปทุมธานี 2 ราย สมุทรปราการ 17 ราย ชลบุรี 14ราย สมุทรสงคราม 1 ราย สมุทรสาคร 35 ราย อ่างทอง 3 ราย พิษณุโลก 1 ราย ตรัง 1 ราย หนองคาย 1 ราย ระยอง 12 ราย
รายงานผู้ติดเชื้อ 12 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 287 ราย ในประเทศ 153 ราย เชิงรุก125 ราย ต่างประเทศ 9 ราย รวมผู้ป่วยยืนยันสะสม 10,834 ราย
- ศบค. ผู้ติดเชื้อจากต่างประเทศ 9 ราย - จีน 1 ญี่ปุ่น 1 สหรัฐอเมริกา 2 สหรัฐอาหรับเอมิเรตส์ 1 สหราชอาณาจักร 2 อินโดนีเซีย 1 อินเดีย 1
- ศบค. สรุป รายจังหวัด
สมุทรสาคร 51+125 (เชิงรุก) ราย สุพรรณบุรี 1 ราย อ่างทอง 8 ราย สิงห์บุรี 1 ราย กรุงเทพ 1 ราย สมุทรปราการ 9 ราย ชลบุรี 8 ราย ระยอง 7 ราย เชียงใหม่ 2 ราย กรุงเทพ 31 ราย ขอนแก่น 1 ราย ฉะเชิงเทรา 2 ราย สิงห์บุรี 1 ราย ปทุมธานี 5 ราย พระนครศรีอยุธยา 3 ราย ร้อยเอ็ด 1 ราย ลพบุรี 6 ราย
รายงานผู้ติดเชื้อ 11 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 249 ราย ในประเทศ 176 ราย เชิงรุก 48 ราย ต่างประเทศ 14 ราย รวมผู้ป่วยยืนยันสะสม 10,547 ราย
- ศบค. ผู้ติดเชื้อจากต่างประเทศ 21 ราย - UK 2 สวิส 2 สหรัฐอาหรับเอมิเรตส์ 1 ตุรกี 1 ฮังการี 1 สหรัฐอเมริกา 1 บาห์เรน 1 เดนมาร์ก 1 มาเลเซีย 1
- ศบค. สรุป รายจังหวัด
สมุทรสาคร 37 ราย นนทบุรี 31 ราย อ่างทอง 19 ราย กาญจนุบรี 1 ราย เชียงใหม่ 1 ราย ชลบุรี 8 ราย ปทุมธานี 1 ราย กรุงเทพ 36 ราย จันทบุรี 2 ราย นครสวรรค์ 1 ราย พระนครศรีอยุธยา 2 ราย สมุทรปราการ 6 ราย สิงห์บุรี 2 ราย
แล้วรถโดยสาร รถสาธารณะ รถไฟฟ้า โรงเรียน ทุกหนแห่ง คนเดินไปมา ไม่รู้ว่าใครติดหรือไม่ ? - 5 เมษายน 64 LINK
แล้วรถโดยสาร รถสาธารณะ รถไฟฟ้า โรงเรียน ทุกหนแห่ง คนเดินไปมา ไม่รู้ว่าใครติดหรือไม่ ?
แล้วจะรู้ได้อย่างไร ว่าตัวเองติดหรือเปล่า ติดมาจากไหนมา เพราะทุกแห่งมีติดอยู่แล้ว แต่ไม่เคยมีการตรวจเชิงรุก
หลักฐานว่ามีการติดอยู่แล้ว
ในพื้นที่หมู่บ้านหนึ่ง ของจังหวัดหนึ่ง ที่ไม่ได้มีสถานบริการอย่างเช่น กทม หรือในเขต จว ใหญ่ มีบ้านเรือน ตลาดตามปกติ
ตรวจ 1,159 รายในช่วงเดือนพฤษภาคมถึงเดือนพฤศจิกายน 2563 พบว่ามีผู้ติดเชื้อ 129 ราย
และต่อมาในการตรวจ 455 ราย ช่วงเดือนมกราคมถึงมีนาคม 2564 พบว่ามีผู้ติดเชื้อ 32 ราย
หลักปฎิบัตื ป้องกันการแพร่ คืออะไร ?
สำนักงานสาธารณสุขจังหวัดภูเก็ต ประกาศเชิญชวน ให้ชาวภูเก็ตลงชื่อรับการฉีดวัคซีนโควิด 19 สามารถลงทะเบียนผ่านทางเว็บไซต์
www.ภูเก็ตต้องชนะ.com
ตั้งแต่วันที่ 31 มีนาคม 2564 เป็นต้นไป
สิ่งที่ต้องทำ
- ลงทะเบียนผ่านแบบฟอร์มออนไลน์ แบบบุคคล
- ลงทะเบียน แบบกลุ่มองค์กร
- โหลดแบบฟอร์ม กรอกประวัติผู้ป่วยใหม่* - เอาไปยื่นวันฉีด
- โหลดแบบคัดกรองและใบยินยอมฉีดวัคซีนโควิด 19* - เอาไปยื่นวันฉีด
* โปรดนำแบบฟอร์มกรอกประวิติผู้ป่วยใหม่ (2) และแบบคัดกรองใบยินยอมฉีดวัคซีนโควิด 19 (3) มายื่นให้กับสถานที่ที่มีบริการฉีดวัคซีน ณ วันที่ฉีดวัคซีน
**สำหรับผู้ที่มีอายุ 60 ปี ขึ้นให้ลงทะเบียนในเดือนพฤษภาคม**
‼ สำหรับใครที่ลงทะเบียนแล้วไม่ต้องลงทะเบียนใหม่ ‼
สอบถามข้อสงสัยเกี่ยวกับระบบนำส่งรายชื่อผู้ฉีดวัคซีนของกิจการบนเวปไซด์ได้ที่ Line : @155lmkob
สอบถามข้อมูลเพิ่มเติมเรื่องการรับวัคซีนโควิด 19 ได้ที่
สำนักงานสาธารณสุขจังหวัดภูเก็ตโทร. 094-593-5342 โทร. 094-593-8876
เพจ
สสจ ภูเก็ต 31 มีนาคม 2564
/////////////
- ภูเก็ตได้รับโควต้ารอบแรก 50,000 โดส
- 5 จุดฉีด
- โรงยิมสะพานหิน 4000 ที่นั่ง (ผู้มีทะเบียนบ้านในพื้นที่เทศบาลนคร ต.พิชิต รัษฎา เกาะแก้ว) 3000 คน/วัน
- จังซีลอน (ป่าตอง กะทู้ กมลา)
- รร.ออร์คิดรีสอร์ท (กะตะ กะรน ราไวย์ ชะลอ)
- อังสนา ลากูน่า (เชิงทะเล)
- สนามบินภูเก็ต อาคาร X (ในยาง สาคู)
- รับวัคซีนเข็มแรก 1-7 เมษายน 64
- รับเข็มที่สอง 22-30 เมษายน 64 - ที่จุดเดิม
- ลงทะเบียนล่วงหน้า
10 พฤษภาคม 2564 เวลา 20.00 น.
ยอดจองวัคซีน 77 จังหวัด (10 พค 64)
รักษาโควิด-19 กับ รพ.ขอนแก่นราม LINK
รักษาโควิด-19 กับ รพ.ขอนแก่นราม สำหรับผู้ป่วยอาการไม่มาก ผู้ป่วยประเภทสีเขียว หรือมีอาการเล็กน้อย คือ มีไข้ 37.5 องศาขึ้นไป สำหรับ กรณีที่ท่านติดเชื้อแล้วไม่สะดวก ไม่มีความพร้อมที่จะแยกกักตัวที่บ้าน (Home Isolation) หรือกักตัวในชุมชน Community Isolation) ได้ เนื่องจากสภาพแวดล้อมที่บ้านไม่เหมาะสม มีผู้สูงอายุ หญิงตั้งครรภ์
เด็กเล็กสมาชิกที่บ้านเป็นกังวลกลัวจะติดกันในครอบครัว
ท่านสามารถเข้ารับการรักษาและกักตัวที่รพ.ขอนแก่นรามได้
เพื่อความปลอดภัยของท่าน และครอบครัว สอบถามได้ที่ ศูนย์บริการข้อมูล โทร. 043 002 002 ต่อ 1905
การอบรม แบบมีค่าใช้จ่าย/ค่าอบรม
หลายหน่วยงาน สถาบันองค์กร จัดให้มีการฝึกอบรม โดยคิดค่าบริการ/ค่าอบรม ตามเหมาะสม ดูข้อมูลและสอบถามแต่ละแห่งได้โดยตรง
ราชวิทยาลัยจุฬาภรณ์ ก่อตั้งจากพระปณิธานใน ศาสตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี องค์ประธานราชวิทยาลัยจุฬาภรณ์ เมื่อวันที่ 18 มกราคม พ.ศ. 2559 เพื่อเป็นศูนย์กลางการเรียนการสอนและการวิจัย ที่จะสร้างบัณฑิตและพัฒนาบุคลากรทางการแพทย์ วิทยาศาสตร์ สาธารณสุข เทคโนโลยีและสิ่งแวดล้อม ที่มุ่งมั่นทำประโยชน์ให้ผู้อื่นก่อนคิดถึงประโยชน์ตัวเอง มีคุณธรรมจริยธรรม จิตอาสา พร้อมบริการสังคมด้วยความรู้ความชำนาญและด้วยความเป็นเลิศในวิชาชีพ ภายใต้ปรัชญา “เป็นเลิศเพื่อทุกชีวิต”
กิจกรรม CRA Open House 2024 ที่จัดครั้งแรกในปีนี้ทำให้หลายๆ คน ค้นพบโลกแห่งวิทยาศาสตร์สุขภาพในหลากหลายสาขาและสาขาพยาบาลศาสตร์อย่างเต็มที่ นับเป็นการเริ่มต้นที่ดีสำหรับเยาวชนระดับมัธยมศึกษาในการเดินทางสู่การเรียนรู้ที่จะเติมเต็มสู่เส้นทางอาชีพที่มั่นคงในอนาคตต่อไป ข้อมูลเพิ่มเติม WWW.CRA.AC.TH และ https://www.facebook.com/CRAPCCMS
2 พฤษภาคม 2567 ทำหมันหมาแมว เขตตำบลเทพกระษัตรี ภูเก็ต
เทศบาลตำบลเทพกระษัตรี ขอเชิญชวนประชาชนในเขตเทศบาลตำบลเทพกระษัตรี นำสุนัขและแมว เข้ารับการทำหมัน ประจำปีงบประมาณ 2567 ฟรี‼️ วันที่ 2 พฤษภาคม 2567 เวลา 09.00 - 15.00 น. ณ เทศบาลตำบลเทพกระษัตรี(ลานจอดรถดับเพลิงด้านหน้า สอบถามรายละเอียดเพิ่มเติมได้ที่ 076-311-381 ต่อ 30 กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตําบลเทพกระษัตรี2 พฤษภาคม 2567 เทศบาลตำบลเทพกระษัตรี ทำหมันสุนัขและแมว ฟรี‼️
ขอเชิญชวนประชาชนในเขตเทศบาลตำบลเทพกระษัตรี นำสุนัขและแมว เข้ารับการทำหมัน ประจำปีงบประมาณ 2567 ฟรี‼️ วันที่ 2 พฤษภาคม 2567 เวลา 09.00 - 15.00 น. ณ เทศบาลตำบลเทพกระษัตรี(ลานจอดรถดับเพลิงด้านหน้า **หมายเหตุ** ประชาชนท่านใดที่มีความประสงค์จะทำหมันสุนัขและแมวโปรดแจ้งเจ้าหน้าที่ในวันที่เข้ารับวัคซีน‼️ ทำหมันสุนัขและแมว อายุ 6 เดือนขึ้นไป มีสุขภาพร่างกายแข็งแรง ไม่มีอาการป่วย ไม่อยู่ในระหว่างตั้งท้อง และไม่ติดสัตว์ สอบถามรายละเอียดเพิ่มเติมได้ที่ 076-311-381 ต่อ 30 กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตําบลเทพกระษัตรี
7 กุมภาพันธ์ – 9 มิถุนายน 2567 ต.รัษฏา ภูเก็ต กิจกรรมผ่าตัดทำหมันสุนัขและแมว
เทศบาลตำบลรัษฎาร่วมกับมูลนิธิเพื่อสุนัขในซอย (Soi Dog) จัดกิจกรรมผ่าตัดทำหมันสุนัขและแมว ภายใต้ “โครงการอบรมให้ความรู้รณรงค์การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าและผ่าตัดทำหมัน ประจำปีงบประมาณ 2567” ทุกวันพุธ - วันอาทิตย์ ตั้งแต่วันที่ 7 กุมภาพันธ์ – 9 มิถุนายน 2567 โดยเปิดให้บริการตั้งแต่ เวลา 08.00 – 10.00 น. ณ.ศาลาสหกรณ์ออมทรัพย์ ซอยโหนทรายทอง (ซอย 4) หมู่ที่ 3 ตำบลรัษฎา อำเมืองจังหวัดภูเก็ต >> งดน้ำงดอาหารสัตว์ที่จะทำหมัน ตั้งแต่ เวลา 20.00 น. เป็นต้นไป
22 มกราคม - 2 กุมภาพันธ์ 2567 ทำหมันสุนัข ฟรี เทศบาลตำบลโพธิ์เสด็จ อำเภอเมือง นครศรีธรรมราช
เทศบาลตำบลโพธิ์เสด็จ ร่วมกับ มูลนิธิเพื่อสุนัขในซอย Soi Dog Foundation ขอเชิญชวนประชาชนในเขตเทศบาลตำบลโพธิ์เสด็จ นำสุนัข มาทำหมัน ฟรี ‼️ ณ สำนักงานเทศบาลตำบลโพธิ์เสด็จ (หลังเก่า) หมู่ที่ 4 ตำบลโพธิ์เสด็จ อำเภอเมืองนครศรีธรรมราช จังหวัดนครศรีธรรมราช ได้ตั้งแต่วันจันทร์ ที่ 22 มกราคม - 2 กุมภาพันธ์ 2567 บริการจันทร์ - ศุกร์ เวลา 08.00 น. เป็นต้นไป (เฉพาะสุนัขเท่านั้น) *** กรณีพาสุนัขมาไม่ได้ให้แจ้งทันที !! ทางเทศบาลจะมีเจ้าหน้าที่อำนวยความสะดวกรับส่งสุนัขให้
สำหรับสุนัขที่ต้องการทำหมัน
- งดน้ำและอาหาร 6 - 12 ชั่วโมง
- สุนัขเคยเกิดอุบัติเหตุ+โรคประจำตัวหรือเคยป่วย ให้แจ้งเจ้าหน้าที่ก่อน
- กรณีที่ฉีดวัคซีนพิษสุนัขบ้าหรือวัคซีนอื่นมาแล้วให้แจ้งเจ้าหน้าที่ก่อน
6-12 กุมภาพันธ์ 2567 ทำหมันสุนัขจร ใน จ.ชุมพร ฟรี (และมีค่าเวชภัณฑ์บางกรณี)
โครงการทำหมันสุนัขจ.ชุมพร โดยการสนับสนุนของมูลนิธิซอยด๊อก ประกาศ ตารางทำหมันเดือน กุมภาพันธ์ 2567 ตั้งแต่วันที่ 6-12 ก.พ.2567 หน่วยเปิด 9.00 มาก่อนทำก่อน พบเห็นสุนัขจรสามารถแจ้งได้ มีบริการยิงยาสลบสำหรับสุนัขที่จับไม่ได้จริงๆ มีรถรับส่งสุนัขกรณีที่รวบรวมได้หลายๆตัว
- สุนัขต้องงดน้ำงดอาหารอย่างน้อย 6 ชั่วโมงก่อนเข้ารับการทำหมัน
- ทำฟรี สุนัขในพื้นที่อำเภอเมือง จ.ชุมพร เฉพาะ 5 ตำบลนี้ ต.บางลึก ต. นาชะอัง ต.นาทุ่ง ต.หาดพันไกร ต.ท่ายาง
- เพศเมีย ตั้งแต่ 2 เดือนขึ้นไป ทำฟรี (ตัวเมียทำฟรีทุกตัว)
- เพศผู้ทำเฉพาะ 2-6 เดือน ทำฟรี เกิน 6 เดือน มีค่าเวชภัณฑ์
- โปรดแจ้งเจ้าหน้าที่ก่อนการทำหมันหากสุนัขของท่าน มีอาการผิดปกติเช่น ซึม ป่วย มีกลิ่นการขับถ่ายผิดปกติ หรือหากสุนัขเคยประสบอุบัติเหตุมาก่อน
- สุนัขที่ฉีดยาคุมมา แนะนำว่าควรรีบนำมาทำ
สิ่งที่จะได้รับ 1) ทำหมันกับสัตวแพทย์ผู้เชี่ยวชาญ. 2) ฉีดวัคซีนพิษสุนัขบ้า 3) ฉีดยาป้องกันเห็บหมัด แก้ปวด และแก้อักเสบ สอบถามรายละเอียดเพิ่มเติม. 086-3662750 ถั่วเขียว , 0815975165 ถั่วคั่ว
12 มิถุนายน - 31 กรกฎาคม 2567 เทศบาลเมืองกะทู้ รับผ่าตัดทำหมันสุนัขและแมวฟรี
เทศบาลเมืองกะทู้ โดยกองสาธารณสุขและสิ่งแวดล้อม ร่วมกับ มูลนิธิสุนัขในซอย (Soi Dog) เปิดรับผ่าตัดทำหมันสุนัขและแมวฟรี ภายใต้โครงการเพิ่มศักยภาพการควบคุมดูแลและติดตามสุนัขและแมวในพื้นที่เทศบาลเมืองกะทู้ ประจำปีงบประมาณ พ.ศ.2567
ระหว่างวันที่ 12 มิถุนายน - 31 กรกฎาคม 2567 (ทุกวันพุธ - อาทิตย์) (หยุดวันจันทร์ - อังคาร) เวลาให้บริการ 08.00-17.00 น. ณ สวนสาธารณะลานกีฬา @อำเภอกะทู้ โดยเปิดรับลงทะเบียนจองคิว ณ จุดออกหน่วยผ่าตัดทำหมัน ตั้งแต่เวลา 08.00 - 12.00 น. รับจำนวนจำกัด สุนัขและแมวที่ไม่มีเจ้าของ วันละ 20 ตัว สุนัขและแมวที่มีเจ้าของวันละ 20 ตัว
- วันอังคารที่ 9 กรกฎาคม 2567 เวลา 08.30 - 16.30 น. ณ สวนสาธารณะลานกีฬา @ อำเภอกะทู้ รับทำหมันสุนัข-แมว จำกัดจำนวน 40 ตัว
หมายเหตุ
- กรุณา เตรียมบัตรประจำตัวประชาชนมาแสดงต่อเจ้าหน้าที่ในวันที่มารับบริการ
- จำกัด เฉพาะผู้ที่พักอาศัยอยู่ในพื้นที่เทศบาลเมืองกะทู้ ตำบลกะทู้ เท่านั้น
- ในวันที่รับบริการ ให้งดน้ำงดอาหารสุนัขและแมว 8 ชั่วโมง ก่อนที่จะนำมารับบริการผ่าตัดทำหมัน
- สุนัขและแมวที่จะผ่าตัดทำหมันต้อง #มีอายุตั้งแต่ 6 เดือนขึ้นไป และต้องไม่ตั้งท้อง
สอบถามรายละเอียดเพิ่มเติม งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองกะทู้ โทร. 076-321500 ต่อ 7
มูลนิธิเพื่อสุนัขในซอย 167/9 หมู่ที่ 4 ซอยไม้ขาว 10 ตำบลไม้ขาว อำเภอถลาง จังหวัดภูเก็ต 83110
สปสช.ย้ำ สิทธิบัตรทองของทุกคนยังอยู่ LINK
สปสช.ขอย้ำว่า สิทธิหลักประกันสุขภาพแห่งชาติหรือสิทธิบัตรทอง 30 บาทของประชาชนกลุ่มดังกล่าวยังคงอยู่ และการยกเลิกสัญญาเกิดขึ้นเฉพาะในพื้นที่ กทม.เท่านั้น ต่างจังหวัดไม่ได้รับผลกระทบ
นพ.ศักดิ์ชัย กล่าวว่า ในช่วงที่ สปสช.กำลังดำเนินการจัดหาหน่วยบริการแห่งใหม่แทนหน่วยบริการเดิม เพื่อดูแลสุขภาพและรักษาพยาบาลให้กับประชาชนกลุ่มดังกล่าว จึงมีแนวทางให้กับประชาชนในการเข้ารับบริการสาธารณสุข ประกอบด้วย กรณีเจ็บป่วยทั่วไปหรือมีแผนการรักษาพยาบาลกับหน่วยบริการทั้ง 64 แห่ง ประชาชนกลุ่มดังกล่าวสามารถเข้ารับบริการรักษาพยาบาลต่อเนื่องได้ที่หน่วยบริการภาครัฐและเอกชน ได้แก่ โรงพยาบาลของรัฐ โรงพยาบาลเอกชนในระบบหลักประกันสุขภาพแห่งชาติ หรือศูนย์บริการสาธารณสุขใกล้บ้าน ได้โดยไม่ต้องใช้หนังสือส่งตัว ทั้งนี้ สามารถดูรายชื่อหน่วยบริการในพื้นที่ กทม. ได้ที่
https://bkk.nhso.go.th/ucs-around-me/
สำหรับหน่วยบริการที่ประชาชนสิทธิบัตรทองกลุ่มดังกล่าวเข้าไปรักษานั้น สปสช.ได้ทำหนังสือแจ้งหน่วยบริการทุกแห่งว่า ให้บริการสาธารณสุขและขอรับค่าใช้จ่ายเป็นกรณีผู้ป่วยสิทธิว่างมาที่ สปสช. โดยไม่ต้องเก็บเงินจากผู้ป่วย ดูรายละเอียดเพิ่มเติมได้ที่
https://bkk.nhso.go.th/main/shownews.php?newsid=4666
ที่มา: สำนักงานหลักประกันสุขภาพแห่งชาติ
สปสช ยกเลิกสัญญา 64 หน่วยบริการ
ใน กทม.
แต่ไม่ได้ยกเลิกสิทธิ "บัตรทอง" 9 พฤษภาคม 64 เวลา 20.00 น.
ต่างจังหวัดทั่วประเทศ
โรงพยาบาลราชพฤกษ์ ให้บริการดูแลรักษาผู้ป่วยโควิด เหมาจ่าย 30,000 บาท/ท่าน LINK
โรงพยาบาลราชพฤกษ์ ให้บริการดูแลรักษาผู้ป่วยโควิด ในกลุ่มสีเขียวไม่มีอาการ หรือมีอาการเล็กน้อย ที่มีความประสงค์เข้ารักษาโควิด ในโรงพยาบาล
- แพ็กเกจรักษาโควิดสำหรับเด็กอายุ 1-15 ปี และ สำหรับผู้ใหญ่
- เข้าพักรักษาตัว 5 วัน พร้อมอาหาร 3 มื้อ
- ห้องดีลักซ์ SUPER DELUXE B ROOM
ราคาเหมาจ่าย 30,000 บาท/ท่าน
นัดหมายเข้ารักษาและสอบถามข้อมูลเพิ่มเติมที่ มือถือ 066 121 0901 โทร 0 4333 3555 ต่อ 2116, 2117 เริ่ม 5 กรกฎาคม 2565 จนกว่าจะมีการเปลี่ยนแปลง
ย้อนรอยประวัติศาสตร์เมืองแปดริ้ว 25, 26 กุมภาพันธ์ และ 11 , 12 มีนาคม 2566
1. ย้อนรอยประวัติศาสตร์เมืองแปดริ้ว
ท่องเที่ยว ย้อนรอยประวัติศาสตร์เมืองแปดริ้ว กับ KIHA 183
ทริปวันเดียว จัดวันที่ 25, 26 กุมภาพันธ์ และ 11 , 12 มีนาคม 2566
สำหรับเส้นทางแปดริ้วนี้ จะได้พบกับ
- ชมแลนด์มาร์คแห่งใหม่ล่าสุดบนเส้นทางรางรถไฟ
- สักการะหลวงพ่อโสธร วัดโสธรวรารามวรวิหาร พระคู่บ้านคู่เมืองฉะเชิงเทรา
- เรียนรู้ประวัติศาสตร์เมืองแปดริ้ว
- ขอพรสิ่งศักดิ์สิทธิ์จากวัดจีนประชาสโมสร วัดจีนเก่าแก่ในพุทธศาสนามหายาน
- สัมผัสธรรมชาติลุ่มแม่น้ำบางปะกง และสถานที่สำคัญ
จองตั๋วได้ที่สถานีรถไฟทั่วประเทศ และผ่านระบบ D-Ticket ราคาเพียง 1,999 บาทต่อที่นั่ง Call center 1690
เทศบาลเมืองคอหงส์ จัดกิจกรรมทำหมันสุนัข (ที่มีเจ้าของและไม่มีเจ้าของ) ในเขตพื้นที่เทศบาลเมืองคอหงส์ เดือนละ 100 ตัว ตลอดปี 2567....ฟรี
เทศบาลเมืองคอหงส์ร่วมกับมูลนิธิบ้านหมายิ้ม และมูลนิธิเพื่อสุนัขในซอย (SoiDog) และโรงพยาบาลสัตว์หมอสุรศักดิ์และเพื่อน จัดกิจกรรมทำหมันสุนัข (ที่มีเจ้าของและไม่มีเจ้าของ) ในเขตพื้นที่เทศบาลเมือง เดือนละ 100 ตัว ตลอดปี 2567....ฟรี!! ไม่มีค่าใช้จ่าย!!
จองคิวทำหมันได้ที่ : งานป้องกันและควบคุมโรค กองสาธารณสุขและสิ่งแวดล้อม สำนักงานเทศบาลเมืองคอหงส์ (ในวันและเวลาราชการ) และที่เพจ
มูลนิธิบ้านหมายิ้ม
สอบถามข้อมูลเพิ่มเติม : งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม โทร.074-280000 ต่อ 3407 หรือโทร.093-7906019 (คุณสุริยา ช่วยเอียด)
8 พฤษภาคม 64 เวลา 20.00 น.
เที่ยวเมืองอาร์ต ราชบุรี 4 และ 5 มีนาคม 2566
2. เที่ยวเมืองอาร์ต ราชบุรี
One Day ทริป เที่ยวเมืองอาร์ต ราชบุรี ชมเชิดหนังใหญ่ เพ้นท์โอ่ง มังกร ผสมผสานการเดินทางบนเส้นทางศิลปะและวัฒนธรรม ผ่านเสน่ห์และกลิ่นอายญี่ปุ่น จำนวน 2 เที่ยว ในวันที่ 4 และ 5 มีนาคม 2566
- สัมผัสสะพานพึงทางรถไฟแห่งแรกของประเทศไทย
- ชม "พิพิธภัณฑ์แห่งชาติราชบุรี" ชมการแสดงศิลปวัฒนธรรมพื้นถิ่น
- ร่วมถวายสังฆทาน รับพรจากเจ้าอาวาส "วัดขนอน" อำเภอโพราราม วัดที่ได้รับการขึ้นทะเบียนยูเนสโภ
- เยือน "พิพิธภัณฑ์หนังใหญ่" พร้อมชมการแสดงการเชิดหนังใหญ่ มหรสพโบราณที่เป็นมรดกทางวัฒนธรรมของชาติไทย
- ชม ช้อป ชิล ที่ "ตลาดด่านขนอน" (ตลาดวัฒนธรรม) และ "กาดวิถีชุมชนคูบัว" ตลาดโบราณวิถีชุมชนคนไทยวน
- รับประทานอาหารกลางวัน ที่ห้องอาหาร ณ สัทธา อุทยานไทย พิผิธภัณฑ์เอกซนกลางแจ้งชื่อดัง
- ฟังบรรยาย ...ว่าด้วยเรื่องราวโอ่ง (ราชบุรี พร้อมกิจกรรมเพ้นท์โอ่ง เพื่อเป็นของที่ระลึกหนึ่งเดียวในโล
จองตั๋วได้ที่สถานีรถไฟทั่วประเทศ และผ่านระบบ D-Ticket ราคาเพียง 1,499 บาทต่อที่นั่ง Call center 1690
ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย จัดการอบรมหลายรายการ (มีค่าใช้จ่าย) LINK
ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย
จัดการอบรมหลายรายการ ดังนี้ (เบอร์โทรติดต่อโทร : 02-256-4041-2)
1.การปฐมพยาบาลขั้นพื้นฐาน สำหรับประชาชนทั่วไปนอกสถานที่
ระยะเวลาการอบรม 1 วัน
รับจานวน 30 คน
ค่าลงทะเบียนอบรม 600 บาท ต่อ/คน
สิทธิที่จะได้รับ ประกาศนียบัตร หลักสูตรการปฐมพยาบาลขั้นพื้นฐาน มีอายุ 3 ปี
2.การปฐมพยาบาลครบตามมาตรฐาน ( แบบผสมผสาน ) สำหรับประชาชน
ระยะเวลาการอบรม 2 วัน
รับจานวน 20 คน
ค่าลงทะเบียนอบรม 2500 บาท ต่อ/คน
สิทธิที่จะได้รับ วุฒิบัตร หลักสูตรการปฐมพยาบาลครบตามมาตรฐาน และบัตรประจำตัวผู้สำเร็จการอบรม มีอายุ 3 ปี และชุดลงทะเบียนการอบรม
3.การปฐมพยาบาลขั้นพื้นฐาน ( แบบผสมผสาน ) เจ้าหน้าที่สภากาชาดไทย
ระยะเวลาการอบรม 1 วัน ณ ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย
รับจานวน 35 คน
ค่าลงทะเบียนอบรม 0 บาท ต่อ/คน
สิทธิที่จะได้รับ ประกาศนียบัตรหลักสูตรการปฐมพยาบาลขั้นพื้นฐาน มีอายุ 3 ปี
4.การปฐมพยาบาลขั้นพื้นฐาน ( แบบผสมผสาน ) สำหรับประชาชนทั่วไป
ระยะเวลาการอบรม 1 วัน ณ ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย
รับจานวน 30 คน
ค่าลงทะเบียนอบรม 600 บาท ต่อ/คน
สิทธิที่จะได้รับ ประกาศนียบัตร หลักสูตรการปฐมพยาบาลขั้นพื้นฐาน มีอายุ 3 ปี
5.การช่วยชีวิตขั้นพื้นฐาน ( แบบผสมผสาน ) สำหรับประชาชน
ระยะเวลาการอบรม 1 วัน ณ ศูนย์ฝึกอบรมปฐมพยาบาลและสุขภาพอนามัย สภากาชาดไทย
รับจานวน 30 คน
ค่าลงทะเบียนอบรม 1500 บาท ต่อ/คน
สิทธิที่จะได้รับ ประกาศนียบัตรหลักสูตรการช่วยชีวิตขั้นพื้นฐาน พร้อมบัตรประจำตัวผู้ผ่านการอบรม มีอายุ 3 ปี
7 พฤษภาคม 64 เวลา 08.00 น.
พริบพรีภิรมย์ ชมงานพระนครคีรีจ.เพชรบุรี 18-19 มี.ค. 66
3. พริบพรีภิรมย์ ชมงานพระนครคีรี
ท่องเที่ยวทริปพิเศษ กับ ขบวนรถไฟ คิฮะ 183 เส้นทาง พริบพรีภิรมย์ ชมงานพระนครคีรี ครั้งที่ 36 อ.เมือง จ.เพชรบุรี 18-19 มี.ค. 66
- นั่งรถไฟคิฮะเที่ยวเมืองเพชร แต่งกายเก๋ไก๋สไตล์วินเทจ
- เที่ยวเมืองเพชร ด้วยรถรางทริปพิเศษ ชมสถานที่สำคัญตามเส้นทาง
วัดมหาธาตุและชุมชนริมน้ำแม่น้ำเพชรบุรี (สตรีทอาร์ท)
- ชมพิพิธภัณฑ์หนั่งใหญ่ วัดพลับพลาชัย พร้อมสาธิตเชิดหนังโดยเยาวชน
- ชมวัดใหญ่สุวรรณาราม จิตรกรรมฝาผนังและศาลาการเปรียญไม้ สมัยอยุธยา
หอไตรสามขากลางน้ำและทำกิจกรรม ณ หอคิลป์ วัดใหญ่สุวรรณาราม
- ระหว่างทาง ผ่านชมสะพานข้ามอุรุพงศ์ข้ามแม่น้ำเพชรบุรีพร้อม
บรรยายประวัติของพระองค์เจ้าอุรุพงศ์รัชสมโภชพระราชโอรส พระองค์เล็กของร.5
และผ่านชมประติมากรรมปูนปั้นโดยฝีมือช่าง ชาวเพชรบุรีตลอดถนนราชดำเนิน
- ชมพระรามราชนิเวศน์ (วังบ้านปืน) และกิจกรรมชิมขนม ชมวัง บรรยากาศพริบพรีภิรมย์
- นิทรรศการพระจอมเกล้าฯ บรมราชานิทศน์
- ชมการแสดงทางวัฒนธรรม ณ ลานจักรราศี และ ชิมเมนูอาหารเชิงสร้างสรรค์เพชรบุรี
- ชมพระนครคีรี ประดับไฟทั่วทั้งเขาวัง ตระการตายามค่ำคืน
พิเศษ - อาหารว่างและเครื่องดื่มบนรถไฟ (แบบกล่อง)
- ของว่างเมนูสร้างสรรค์เพชรบุรี "ชิมขนมชมวังบ้านปืน"
- ของที่ระลึกชุดสเปรย์แอลกอฮอล์
สะพานอุรุพงษ์
จองตั๋วได้ที่สถานีรถไฟทั่วประเทศ และผ่านระบบ D-Ticket ราคาเพียง 699 บาทต่อที่นั่ง ราคาเดียวทั้งเด็กและผู้ใหญ่ Call center 1690
อยู่ที่ใดก็ติดเชื้อได้ ถ้าไม่ได้มีวินัยและรักษาระยะห่าง - 5 เมษายน 64 LINK
อยู่ที่ใดก็ติดเชื้อได้ ถ้าไม่ได้มีวินัยและรักษาระยะห่าง 5/4/64
การตรวจผู้ติดเชื้อที่เห็นในขณะนี้ และระบุเน้นมีที่มาจากผับสถานบริการ
• ต้องไม่ลืมว่าการติดเชื้อนั้นเกิดขึ้นได้ทุกที่ ที่ไม่รักษาระยะห่างและคนทั่วไปวางใจเพราะเป็นการแพร่โดยไม่มีอาการ แต่เมื่อตรวจจริง
มาดูข้อมูลจริงๆ ในพื้นที่หมู่บ้านหนึ่ง ของจังหวัดหนึ่ง ที่ไม่ได้มีสถานบริการอย่างเช่น กทม หรือในเขต จว ใหญ่
ตรวจ 1,159 รายในช่วงเดือนพฤษภาคมถึงเดือนพฤศจิกายน 2563 พบว่ามีผู้ติดเชื้อ 129 ราย
และต่อมาในการตรวจ 455 ราย ช่วงเดือนมกราคมถึงมีนาคม 2564 พบว่ามีผู้ติดเชื้อ 32 ราย
ในโรงงานเดียว จังหวัดหนึ่งในช่วงเดือนกุมภาพันธ์ 2564 ตรวจ 1,901 ราย พบว่าติดเชื้อ 283 รายและสามารถแพร่เชื้อได้ 148 ราย
และในช่วงเดือนมีนาคมตรวจ 1,854 รายมีติดเชื้อเพิ่มขึ้นเป็น 538 รายและแพร่เชื้อได้ 200 ราย
หรือ ในเรือนจำ ที่แออัด มีติดเชื้อ หนึ่งรายก็แพร่ไปหมด
มาตรการ มาตรฐานในการป้องกันการแพร่เชื้อต้องตั้งอยู่ในหลักการ การแพร่เชื้อ และการป้องกัน ในบริบทเดียวกัน
การตรวจ ในปัจจุบันนี้ ต้องระบุ เป็นการตรวจเชิงรุก ในกลุ่มที่เกิดเหตุ ตามสถานการณ์ เท่านั้น
6 พฤษภาคม 64 เวลา 08.00 น.
เกษมราษฎร์ รัตนาธิเบศร์ (การุญเวชเดิม) รักษาผู้ป่วยโควิด แบบ เจอ จ่าย จบ ทุกสิทธิ ฟรี LINK
โรงพยาบาลเกษมราษฎร์ รัตนาธิเบศร์ (การุญเวชเดิม) รักษาผู้ป่วยโควิด กลุ่มสีเขียว ไม่มีอาการ โดยไม่มีค่าใช้จ่ายสำหรับ ผู้ป่วยสิทธิประกันสังคมของทุกโรงพยาบาล (ม.33-39)
"เจอ จ่าย จบ " OP with self Isolation ประเภทการรักษา OPD
กิจกรรมการรักษา
• แยกกักตัวที่บ้าน
• จ่ายยาตามอาการ
• โทรติดตามอาการ (เมื่อครบ 48 ชั่วโมง)
เปิดให้บริการทุกวันจันทร์ - อาทิตย์ เวลา 08.00-16.00 น.
ชวนนุ่งโจง สะบัดสไบ นั่งรถไฟ KIHA183 เที่ยวกรุงเก่าอโยธยา 21 มีนาคม 2566


โปรแกรม “นุ่งโจง สะบัดสไบ ขึ้นรถไฟ KIHA 183 เที่ยวเมืองเก่าอยุธยา” เส้นทางกรุงเทพ-อยุธยา-กรุงเทพ ในวันเสาร์ที่ 25 มีนาคม 2566 จำนวน 200 ที่นั่ง เริ่มออกเดินทางจากสถานีกรุงเทพ (หัวลำโพง) สู่จังหวัดพระนครศรีอยุธยา ในเวลา 08.10 น. และจะกลับถึงสถานีกรุงเทพ เวลา 19.45 น. อัตราค่าบริการ 1,499 บาท พร้อมบริการอาหารเช้า อาหารกลางวัน อาหารว่างและเครื่องดื่ม ทั้งเที่ยวไป-กลับ พร้อมรับของที่ระลึกสุดพิเศษจากการรถไฟฯ และการท่องเที่ยวแห่งประเทศไทย โดยขอเชิญชวนให้นักท่องเที่ยวร่วมแต่งกายชุดไทย นุ่งโจงห่มสไบย้อนเวลาไปชมพิพิธภัณฑสถานแห่งชาติเจ้าสามพระยา ชมห้องสมบัติพระมหากษัตราธิราชชมเครื่องราชกกุธภัณฑ์ทองคำ ล่องเรือชมวิวทิวทัศน์เมืองเก่า ชมวัดไชยวัฒนาราม อุทยานประวัติศาสตร์พระนครศรีอยุธยา วัดพนัญเชิงวรวิหาร และไปต่อที่ตลาดโก้งโค้ง ชม ชิม ช้อป อาหารและของฝากท่ามกลางบรรยากาศตลาดโบราณ ปิดท้ายที่สถานีบางปะอิน สถานีแห่งแรกที่ขบวนรถไฟหยุดในประวัติศาสตร์ ชมพลับพลาที่ประทับ ที่สร้างขึ้นในเวลาใกล้เคียงกับการก่อสร้างทางรถไฟสายกรุงเทพ – อยุธยา เคยเป็นที่รับเสด็จและที่ประทับของพระบาทสมเด็จพระจุลจอมเกล้าเจ้าอยู่หัว รัชกาลที่ 5 เมื่อครั้งเสด็จพระราชดำเนินเปิดการเดินรถไฟหลวงเป็นครั้งแรก ระหว่างระหว่างกรุงเทพ - อยุธยา เมื่อวันที่ 26 มีนาคม พ.ศ. 2439 โดยได้ทรงพระกรุณาโปรดเกล้าฯ ให้หยุดขบวนรถที่พลับพลาแห่งนี้ เพื่อทรงพระราชทานเลี้ยงอาหารกลางวันแก่ข้าราชบริพารและคณะทูตานุทูต หลังจากนั้น คณะฯ เดินทางกลับด้วยขบวนรถไฟ KIHA 183 มาที่สถานีกรุงเทพเพื่อร่วมชมงาน“Unfolding Bangkok” ย้อนรอยรำลึก เรียนรู้ประวัติศาสตร์สำคัญของชาติ กว่าจะมาเป็น “สถานีหัวลำโพง” ผ่านการแสดงแสง สี เสียง ดนตรี ตลอดจนกิจกรรมต่างๆ มากมาย ฉลองครบรอบ 126 ปีวันสถาปนากิจการรถไฟ
ทั้งนี้ ผู้สนใจสามารถติดต่อซื้อตั๋วโดยสารล่วงหน้าได้ที่สถานีรถไฟทุกแห่ง หรือ สอบถามข้อมูลเพิ่มเติมที่ศูนย์บริการลูกค้าสัมพันธ์ หมายเลขโทรศัพท์ 1690 ตลอด 24 ชั่วโมง
ขอแค่คนเดียว ก็พอ!! - 4 เมษายน 64 LINK
ขอแค่คนเดียว ก็พอ!!
ถ้าเข้าไปใน รพ เข้าในเรือนจำ เข้าในสถานบันเทิง
ในเรือนจำ ถ้าผู้คุมติด กลับบ้าน แพร่ได้
ใน รพ หมอ พยาบาล ติด ต้องดูแลคนหมู่มาก
คิด อัตราการแพร่ ตามตำราไม่ได้ (R0)
ต้องดูตามลักษณะของหมู่กลุ่ม การสัมผัสใกล้ชิด ไม่ใช่ หนึ่งไปหนึ่งหรือไปสองเท่านั้น
5 พฤษภาคม 64 เวลา 14.00 น.
ฉีดๆๆ และมีวินัยต่อ LINK
ฉีดๆๆ และมีวินัยต่อ
วัคซีน ยังเป็นเรื่องความจำเป็นอย่างเร่งด่วน คลุมให้มากสุดทั่วประเทศให้เร็วที่สุด
แม้ว่ามีผลข้างเคียง แต่เราเริ่มสังเกตุ มองออก และป้องกัน รักษาได้
ต้องขยาย การฉีด จัดหาวัคซีน รวมที้งภาครัฐ เอกชน ใช้ระบบการฉีด ทะเบียน ติดตาม แบบเดียวกัน
เอกชน ไม่ถือโอกาสค้ากำไรอย่างไม่สมเหตุสมผล
และ เมื่อเกิดผลช้างเคียงอย่างเลี่ยงไม่ได้ กรณีของเอกชน เป็นการรับผิดชอบของใคร?
อิสราเอล ฉีดทั้งประเทศแล้ว และได้ผล แต่ยังตระหนักว่า “ยังคงติดเชื้อได้ แต่ตนเองไม่ตาย และถ้าเกิดติดยังสามารถปล่อยได้ โดยเชื้อที่ปล่อยน้อย และปล่อยสั้นลง”
ฉีดๆๆๆๆๆๆๆ และมีวินัยต่อ แต่แน่นอน เศรษฐกิจ ธุรกิจ คนหารายวัน ฟื้นแน่
5 พฤษภาคม 64 เวลา 08.00 น.
สถาบันฝึกอบรม Safetyinthai จัดอบรมปฐมพยาบาลเบื้องต้น (First Aid & CPR) มีค่าใช้จ่าย LINK
สถาบันฝึกอบรม Safetyinthai จัดอบรมการปฐมพยาบาลเบื้องต้น (First Aid & CPR) หน่วยงานองค์กรในชลบุรี โดย วิทยากรผู้ทรงคุณวุฒิ ที่มีความรู้ความสามารถในการกู้ชีพ การบรรยาย กรณีศึกษา (Workshop) ระยะเวลา : 1 วัน (เวลา 09.00 – 16.00 น.) สถานที่อบรม : ศูนย์พัฒนาทรัพยากรมนุษย์แห่งภาคตะวันออก (HROD ESIE CENTER) จ.ชลบุรี มีค่าใช้จ่าย 1,500 บาท/คน (สมาชิก 1,000) กำหนดการอบรม มิถุนายน - พฤศจิกายน 2566 (เดือนละ 2 ครั้ง)
มูลนิธิเพื่อสัตว์เกาะลันตา ทำหมันฟรี
ทะเบียนราษฎร์อำเภอเกาะลันตา ทำหมันฟรี!! ณ
มูลนิธิเพื่อสัตว์เกาะลันตา ต.ศาลาด่าน อ.เกาะลันตา จ.กระบี่ ปิดทุกวันอาทิตย์ เปิดรับลงทะเบียนจันทร์-เสาร์ (เท่านั้น) เวลา 09.00-11.00น. ไม่รับจอง ไม่รับลงทะเบียนออนไลน์. สอบถามโทร 084-3044331
รายงานผู้ติดเชื้อ 10 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 245 ราย ในประเทศ 181 ราย เชิงรุก 43 ราย ต่างประเทศ 21 ราย รวมผู้ป่วยยืนยันสะสม 10,298 ราย
- ศบค. สรุป รายจังหวัด
เพชรบุรี 3 ราย (หญิงไทย 41, 43, 55) อ่างทอง 2 ราย (ชายไทย) ชลบุรี 12 ราย (ชายไทย 5 หญิงไทย 6) เชียงใหม่ 5 ราย (ชายไทย 2 หญิงไทย 3) นนทบุรี 2 ราย (ชาย 1 หญิง 1) สุพรรณบุรี 1 ราย (ชายไทย) ปทุมธานี 7 ราย (ชาย 3 หญิง 4 / ลาว 1 เมียนมา 6) สมุทรสงคราม 1 ราย หญิงไทย สพบุรี 8 ราย (ชายไทย 6 หญิงไทย 2) กรุงเทพ 14 ราย (ชาย 6 หญิง 8 / ไทย 13 กัมพูชา 1) สิงห์บุรี 2 ราย (ชายไทย และหญิงไทย) พระนครศรีอยุธยา 3 ราย (ชายไทย 1 หญิงไทย 2) สมุทรปราการ 14 ราย (ชาย 9 หญิง 5 / ไทย 13 ลาว 1)
- ศบค. ผู้ติดเชื้อจากต่างประเทศ 21 ราย - ตุรกี 1 สหรัฐอเมริกา 1 อินเดีย 1 เมียนมา 17 ฮังการี 1
รายงานผู้ติดเชื้อ 9 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 212 ราย ในประเทศ 187 ราย เชิงรุก 6 ราย ต่างประเทศ 19 ราย รวมผู้ป่วยยืนยันสะสม 10,053 ราย
- ศบค. ผู้ติดเชื้อในประเทศ สมุทรสาคร 46 ราย อ่างทอง 18 ราย พระนครศรีอยุธยา 6 ราย ปทุมธานี 1 ราย นครปฐม 1 ราย เลย 1 ราย นนทบุรี 3 ราย กรุงเทพ 27 ราย ชลบุรี 26 ราย สระบุรี 1 ราย นครศรีธรรมราช 1 ราย ตราด 1 ราย ปราจีนบุรี 1 ราย ราชบุรี 1 ราย สมุทรปราการ 24 ราย
- ตาก สรุปยอดผู้ป่วย 8 มกราคม 2564 ผู้ป่วยรักษาในโรงพยาบาล ทั้งหมด 23 คน [9 คนเดิม + 14 คนใหม่] พนง.จิตรมอเตอร์ 1 คน สามี พนง.จิตรมอเตอร์ 1 คน คนขับ taxi 1 คน ผู้ป่วยชาย มีประวัติไปพัทยา 1 คน คัดกรองเชิงรุกต่างชาติ 1 คน มามาโฮมมาร์ท 1 คน พนักงานสถานบันเทิง 2 คน ผู้ป่วยตั้งครรภ์ 1 คน ผู้ป่วยใหม่จาก Sky complex 14 คน ผู้ป่วยรักษาในสถานกักกันตัว (LQ) ทั้งหมด 6 คน [3 คนเดิม + 3 คน ใหม่] Star complex 3 คน ผู้ป่วยใหม่จาก Sky complex 3 คน รอยืนยันผลอีก 3 คน (อยู่ใน LQ) // หมอแม่สอด
- พระนครศรีอยุธยา ผู้ป่วยใหม่ 5 ราย เป็นชายไทย 1 ราย อายุ 51 ปี อ.นครหลวง เป็นหญิงไทย 4 ราย (อายุ 48 44 52 และ 38 ปี) ใน อ.บางไทร อ.บางปะอิน และอ.ท่าเรือ รวมสะสม 28 ราย // งานประชาสัมพันธ์ สสจ.อยุธยา
- นครศรีธรรมราช ติดเชื้อรายใหม่ 1 ราย เพศหญิง อายุ 24 ปี อ.ขนอม เป็นผู้สัมผัสเสี่ยงสูงจากผู้ป่วยยืนยัน จ.สุราษฎร์ฯ รวมยอดติดเชื้อสะสม 4 ราย รักษาตัวในโรงพยาบาล3 ราย รักษาหายแล้ว 1 ราย // สสจ นครศรีธรรมราช
- เชียงใหม่ พบผู้ติดเชื้อโควิด-19 เพิ่ม 4 ราย เป็นผู้ป่วยรายที่ 60-63 ของจ.เชียงใหม่ โดยที่ CM60 รับไว้รักษาที่รพ.สันทราย ส่วน CM61,62,63 รับไว้รักษาที่รพ.ประสาท อยู่ระหว่างการสอบสวนไทม์ไลน์ // รพ.นครพิงค์
- หนองบัวลำภู พบผู้ติดเชื่้อ 1 ราย ชายไทย อายุ 23 ปี ชาวอ.สุวรณคูหา พบจากการตรวจเชิงรุก ผู้ที่มาจาก 5 จังหวัด // COVID-19 จังหวัดหนองบัวลำภู
รายงานผู้ติดเชื้อ 8 มค 2564
- ศบค. มีผู้ติดเชื้อโควิดรายใหม่ 205 ราย ติดเชื้อในประเทศ 131 ราย การตรวจคัดกรองเชิงรุก 58 ราย เป็นผู้เดินทางมาจากต่างประเทศไม่เข้าสถานที่กักกัน 7 ราย และอยู่ในสถานที่กักกัน 9 ราย รวมผู้ป่วยยืนยันสะสมในประเทศ 9,841 ราย แบ่งป็น
1) ผู้ที่มีประวัติเสี่ยง อาชีพเสี่ยง สัมผัสผู้ป่วยยืนยันก่อนหน้า จำนวน 123 ราย พบใน กรุงเทพมหานคร(กทม.) 29 ราย สมุทรสาคร 37 ราย อ่างทอง 4 ราย นครปฐม 4 ราย เชียงใหม่ 4 ราย เลย 4 ราย ชลบุรี 11 ราย สมุทรปราการ 22 ราย และ ลพบุรี บุรีรัมย์ ปทุมธานี ลำพูน สุพรรณบุรี สุราษฎร์ธานี สมุทรสงคราม กระบี่ จังหวัดละ 1 ราย
2) ผู้ที่อยู่ระหว่างสอบสวนโรค 8 ราย พบใน จ.สมุทรปราการ 3 ราย อ่างทอง 3 ราย และกทม. 1 ราย
3) ผู้ป่วยจากการคัดกรองเชิงรุกในแรงงานข้ามชาติ 58 ราย พบใน จ.สมุทรสาคร 21 ราย ชลบุรี 21 ราย ระยอง 7 รายและจันทบุรี 9 ราย
// ประชาชาติ
- ศบค. จังหวัดที่ไม่มีรายงานผู้ป่วยมี 20 จังหวัด ประกอบด้วย จ.ศรีสะเกษ ยโสธร บึงกาฬ หนองบัวลำภู ร้อยเอ็ด กาฬสินธุ์ สกลนคร นครพนม มุกดาหาร แพร่ พะเยา เชียงราย แม่ฮ่องสอน อุทัยธานี พิษณุโลก พังงา ชุมพร พัทลุง ปัตตานี และ ยะลา
- สุราษฎร์ธานี ยืนยันมีผู้ติดเชื้อเพิ่มจากไทม์ไลน์เดิมเพิ่มอีก 1 ราย เป็นหญิงวัยรุ่น อายุ 26 ปี โรงพยาบาลสุราษฎร์ธานี // TNN Thailand
- ลำปาง แจ้งว่ามีผู้ติดเชื้อโควิด-19 เป็นหญิงอายุ 25 ปี มีภูมิลำเนาอยู่ที่ อ.วังเหนือ มีประวัติเข้าพื้นที่ในช่วงวันที่ 26-31 ธันวาคม 2563 ขณะนี้รักษาตัวในโรงพยาบาลเอกชนแห่งหนึ่ง // PPTV
- เชียงใหม่ พบผู้ติดเชื้อโควิด-19 เพิ่ม 2 ราย อยู่ระหว่างสอบสวน Timeline // รพ.นครพิงค์
- ชลบุรี ผู้ป่วยรายใหม่ยืนยัน 31 ราย เป็นชาย 18 ราย หญิง 13 ราย รวมสะสม 478 ราย // สสจ.ชลบุรี
- นนทบุรี พบผู้ป่วยยืนยันเพิ่ม 5 คน ทั้ง 5 คน ที่เพิ่มขึ้น สัมผัสกับผู้ป่วยยืนยันก่อนหน้า 2 ราย เกี่ยวกับสถานบันเทิง 2 ราย อยู่ระหว่างสอบสวนโรค 1 ราย ผู้ป่วยยืนยันสะสม รอบใหม่ 137 คน // ศูนย์ปฏิบัติการ COVID-19 จังหวัดนนทบุรี
- พระนครศรีอยุธยา ผู้ป่วยใหม่ 6 ราย เป็นชายไทย 2 ราย อายุ 27 และ 39 ปี เป็นเด็กชาย 9 ปี 1 ราย เป็นหญิงไทย 3 ราย (อายุ 59, 56และ 48 ปี) ทั้งหมด อยู่อ.บางปะอิน 4 ใน 6 ไม่มีอาการ // งานประชาสัมพันธ์ สสจ.อยุธยา
- สมุทรสาคร ผู้ป่วยรายใหม่ 46 ราย ผู้ป่วยยืนยันสะสม 3,188 ราย หายป่วย/จำหน่ายแล้ว 1,197ราย // COVID-19 สมุทรสาคร
- นครปฐม พบผู้ป่วยยืนยัน รายใหม่ รวม 1 ราย หญิงไทย อายุ 69 ปี อ.ดอนตูม รวมยอดผู้ป่วยสะสม 77 ราย (ไทย 75 ต่างชาติ 2) // สสจ.นครปฐม
- ราชบุรี มียอดผู้ป่วยเพิ่ม 1 ราย เป็นรายที่ 22 หญิงไทย อายุ 60 ปี อ.จอมบึง (เป็นแม่ของผู้ป่วยยืนยันระลอกใหม่ รายที่ 3 ของจ.กาญจนบุรี) เข้ารักษาที่รพ.จอมบึง // สสจ ราชบุรี
- อ่างทอง 2 ราย คนไทยทั้งหมด รวมสะสม 76 ราย // สสจ.อ่างทอง
รายงานผู้ติดเชื้อ 7 มค 2564
- ศบค. มีผู้ป่วยรายใหม่เพิ่ม 305 ราย (สะสม 9,636 ราย) - กลับบ้านแล้ว 4,521 ราย (+103 ราย) - ยังรักษาใน รพ. 3,786 ราย - เสียชีวิต 67 ราย (+1 รายจากเมื่อวาน) // ไทยรู้สู้โควิด
- ติดเชื้อในประเทศ 302 ราย แบ่งเป็น
สมุทรสาคร 37 ราย ชาย 12 ราย หญิง 24 ราย (ไทย 29 ไม่ระบุ 7 ราย ไม่ระบุเพศ สัญชาติ 1 ราย)
กรุงเทพ 1 ราย ชายไทย อายุ 47 ปี รพ.ราชวิถี
พระนครศรีอยุธยา 3 ราย ชายไทย อายุ 31 49 และ 39 ปี รพ.บางไทร รพ.ผักไห่ รพ.วังน้อย
สุพรรณบุรี 1 ราย ชายไทย อายุ 35 ปี รพ.เจ้าพระยายมราช
สิงห์บุรี 2 ราย ชายไทย อายุ 30 และ 57 ปี รพ.สิงห์บุรี
ลพบุรี 2 ราย ชายไทย อายุ 41 ปี รพ.พระนาราย์มหาราช และ หญิงไทย อายุ 67 ปี รพ.โคกสำโรง
ขอนแก่น 1 ราย ชายไทย อายุ 20 ปี รพ.ขอนแก่น
ปทุมธานี 6 ราย ชายไทย 2 หญิงไทย 1 เมียนมา 4 ราย รพ.ธรรมศาสตร์ฯ รพ.ลาดหลุมแก้ว รพ.ประชาธิปัตย์ จากการดำเนินงานเชิงรุก active case finding ในแรงงานข้ามชาติ ตลาดสุชาติและตลาดพรพัฒน์ ต.ประชาธิปัตย์ อ.ธัญบุรี จำนวน 5 ราย // สสจ.ปทุมธานี
ราชบุรี 1 ราย ชายไทย อายุ 73 ปี รพ.โพธาราม
เชียงใหม่ 2 ราย หญิงไทย อายุ 37 และ 50 ปี รพ.นครพิงค์
+สมุทรสาคร 3 ราย ชายไทย 2 หญิงไทย 1
+กรุงเทพ 46 ราย ชาย 27 หญิง 1 (ไทย 38 ญีปุ่น 4 เมียนมา 3 ลาว 1)
+สมุทรปราการ 25 ราย ชาย 12 หญิง 13 (ไทย 24 เมียนมา 1)
- สมุทรปราการ การทางพิเศษแห่งประเทศไทย (กทพ.) รายงานพบว่ามีพนักงาน 1 คน ติดเชื้อ COVID-19 // การทางพิเศษแห่งประเทศไทย
- เชียงใหม่ พบผู้ป่วยโควิด-19 เพิ่ม 4 ราย ไทม์ไลน์เกี่ยวข้องกับสถานบันเทิง อยู่ระหว่างการสอบสวนโรค // ปชส.สสจ.เชียงใหม่
- บุรีรัมย์ พบผู้ป่วยโควิด-19 รายแรก เป็นหญิงไทย อายุ 42 ปี อาชีพขายอาหารตามสั่งและส่งอาหารในบ่อนพัทยา เข้ารับการรัษาที่รพ.นางรอง // สสจ.บุรีรัมย์
- กรุงเทพ BTS แจ้ง พบพนักงานสำนักงานใหญ่ติดโควิด เปิดไทม์ไลน์พบไปร้านตำนัว แจงไม่เกี่ยวการให้บริการรถไฟฟ้า // ประชาชาติ
- นนทบุรี รายงานพบผู้ติดเชื้อใหม่ 8 ราย เกี่ยวข้องกับตลาดบางใหญ่ 4 คน ตลาดพิชัย 1 คน และตลาดบางบัวทอง 1 คน ส่งผลให้จำนวนผู้ติดเชื้อสะสมรอบใหม่ เพิ่มเป็น 132 ราย ติดเชื้อสะสมรวม 248 ราย รักษาหาย 131 ราย อยู่โรงพยาบาล 115 ราย เสียชีวิต 2 ราย // ประชาชาติ
- สมุทรสาคร เมื่อเวลา 17.00 น รายงานตัวเลขผู้ป่วยรายใหม่จากโควิดล่าสุดว่า มีผู้ป่วยรายใหม่ 58 ราย โดยเป็นการค้นหาเชิงรุก 21 ราย(เป็นคนไทย 5 ราย เป็นคนต่างด้าว 16 ราย) และอยู่ในโรงพยาบาล 37 ราย เป็นคนไทย 14 ราย ต่างด้าว 23 ราย // ประชาชาติ
- สิงห์บุรี พบผู้สัมผัสใกล้ชิดกันติดเชื้อโควิด-19 เพิ่มอีก 3 ราย เป็นรายที่ 5-7 โดย รายที่ 5 Time Line เดินทางไปสนามชนไก่ จังหวัดอ่างทอง รายที่ 6 และ 7 คือภรรยาและเพื่อนสนิท ของรายที่ 4 ยอดล่าสุดมีผู้ติดเชื้อรวม 8 คน (สิงห์บุรี 7 คน รวมของเก่าจากเชียงราย 1 คน) // สำนักงานประชาสัมพันธ์จังหวัดสิงห์บุรี
- ตราด พบผู้ป่วย 1 ราย รวมสะสม 32 ราย รักษาตัวทั้งหมด // สสจ.ตราด
- สมุทรสงคราม มีผู้ติดเชื้อรายใหม่ จำนวน 1 ราย รายที่ 27 ผู้ป่วยเพศชาย อายุ 34 ปี อาชีพพนักงานโรงงานแห่งหนึ่ง หมู่ที่ 7 ต.บางแก้ว อ.เมือง ที่อยู่ หมู่ที่ 6 ตำบลบางแก้ว อำเภอเมือง // Covid-19 สมุทรสงคราม
- นครปฐม พบผู้ป่วยยืนยันรายใหม่ 5 ราย (เป็นรายที่ 72-76) รวมมีผู้ป่วยสะสม 76 ราย โดยทั้ง 5 ราย เป็นคนไทยทั้งหมด ดังนี้
รายที่ 72) เพศหญิง อายุ 29 ปี ต.บางแขม อ.เมือง
รายที่ 73) เพศหญิง อายุ 58 ปี ต.บางแขม อ.เมือง
รายที่ 74) เพศหญิง อายุ 1 ปี ต.อ้อมใหญ่ อ.สามพราน
รายที่ 75) เพศชาย อายุ 39 ปี ต.อ้อมใหญ่ อ.สามพราน
รายที่ 76) เพศหญิง อายุ 43 ปี อ.สามพราน // สสจ นครปฐม
- อ่างทอง 10 ราย คนไทยทั้งหมด รวมสะสม 74 ราย // สสจ.อ่างทอง
รายงานผู้ติดเชื้อ 6 มค 2564
- ศบค. สถานการณ์การติดเชื้อ COVID-19 รายใหม่เพิ่ม 365 ราย เป็นผู้ติดเชื้อภายในประเทศ 250 ราย แรงงานต่างด้าวเพิ่ม 99 ราย และเป็นผู้เดินทางมาจากต่างประเทศอยู่ในสถานที่กักกัน 16 ราย โดยวันนี้มีผู้เสียชีวิตเพิ่ม 1 ราย
- กรุงเทพ ธนาคารกรุงศรีอยุธยา ประกาศว่า ธนาคารได้รับรายงานยืนยันผลการตรวจจากแพทย์ในวันที่ 3 ม.ค.2564 ว่า พนักงาน 2 รายจากสาขาพาราไดซ์ พาร์ค และพนักงาน 1 รายจากสาขาเทสโก้ โลตัส สุขุมวิท 50 จังหวัดกรุงเทพมหานคร ติดเชื้อไวรัสโคโรนา 2019 หรือ โควิด-19 จากการไปรับประทานอาหารภายนอก เมื่อวันที่ 29 ธ.ค.2563 // ข่าวสด
- นครปฐม เผยข้อมูลมีผู้ติดเชื้อไวรัสโควิด-19 เพิ่ม 3 ราย รวมป่วยสะสม 71 ราย รักษาตัว 46 ราย รักษาหาย 25 ราย พร้อมเพิ่มเติมข้อมูลไทม์ไลน์ผู้ป่วยรายที่ 66 ที่เดินทางไปพะเยา เชียงใหม่ เชียงราย และรายที่ 68 เพศหญิง อายุ 35 ปี // MGR online
- ลำพูน มีผู้ติดเชื้อเพิ่ม 1 รายนั้น เป็นชายวัย 25 ปี ภูมิลำเนาอยู่ ต.มะเขือแจ้ อ.เมืองลำพูน ถือเป็นผู้ติดเชื้อรายที่ 6 ของลำพูน หลังจากการระบาดระลอกแรกมีผู้ติดเชื้อ 4 ราย ส่วนระลอกใหม่มีผู้ติดเชื้อเป็นหญิงก่อนหน้านี้ 1 ราย // MGR online
- ขอนแก่น ผู้ว่าฯ แถลง พบผู้ป่วยติดเชื้อโควิด-19 รายที่ 4 และ รายที่ 5 ของจังหวัด เป็นชาย อายุ 20 ปี และ 17 ปี โดยมีประวัติการเดินทางมาจากพื้นทีจังหวัดกลุ่มเสี่ยงคือ จ.อ่างทอง โดยเดินทางเข้ามาในพื้นที่ จ.ขอนแก่น ในวันที่ 3 ม.ค. โดยรถไฟ จากนั้นญาติที่ จ.อ่างทอง ซึ่งยืนยันว่าเป็นผู้ป่วยติดเชื้อได้แจ้งมาว่าป่วยยืนยันติดเชื้อ จึงให้ผู้ป่วยทั้ง 2 รายของ จ.ขอนแก่นนั้นได้เข้ารับการตรวจและรายงานตัวที่ รพ.ขอนแก่น // NationTV
- ระยอง รายงานตัวเลขผู้ติดเชื้อรายใหม่เพิ่มขึ้นอีกจำนวน 16 ราย ส่งผลให้ในวันนี้ จ.ระยอง มียอดผู้ป่วยสะสมรวมทั้งสิ้น 472 ราย เสียชีวิต 1 ราย ส่วนผู้รักษาหายกลับบ้านได้แล้วมีจำนวน 37 คน // MGR Online
- ลพบุรี พบผู้ติดเชื้อเพิ่ม 1 ราย ต.บ้านเบิก อ.ท่าวุ้ง ไม่แสดงอาการ มาตรวจตามประกาศค้นหาผู้ป่วยเชิงรุกของ สสจ.ลพบุรี เข้ารับการรักษา ณ รพ.พระนารายณ์มหาราช อ.เมือง ลพบุรี แล้ว รวมลพบุรีมียอดสะสม 7 ราย ส่วนใหญ่มาจากบ่อนไก่ // MGR Online
- สมุทรสาคร 17 น. พบผู้ป่วยติดเชื้อรายใหม่เพิ่มอีก 146 ราย โดยแบ่งเป็นคนไทย 31 ราย และต่างด้าว 115 ราย ยอดสะสมเป็น 3,084 ราย // สำนักงานประชาสัมพันธ์สมุทรสาคร
- ราชบุรี รายงานผู้ป่วยรายใหม่ 4 ราย รวมผู้ป่วยสะสมระลอกใหม่ 20 ราย อยู่ในโรงพยาบาล 11 ราย รักษาหายแล้ว 9 ราย // สสจ.ราชบุรี
- ชลบุรี พบผู้ป่วยยืนยันรายใหม่ 30 ราย เป็นชาย 18 ราย หญิง 12 ราย ผู้ป่วยยืนยันสะสม 420 ราย เสียชีวิต 1 ราย // สสจ.ชลบุรี
- ตราด ผู้ป่วยรายใหม่ 6 ราย ผู้ป่วยสะสม 31 ราย // สสจ. ตราด
- ฉะเชิงเทรา พบผู้ป่วยใหม่ 2 คน รวมผู้ป่วยสะสมรอบใหม่ 15 ราย รักษาอยู่ 11 ราย รักษาหาย 4 ราย // สสจ.ฉะเชิงเทรา
- เชียงใหม่ ตรวจพบผู้ป่วยโควิด-19 เพิ่มอีก 2 ราย (รายที่ 52 และ 53) ทุกรายล้วนเชื่อมโยงกับผู้ป่วยรายที่ 50 ของเชียงใหม่ และร้านวอร์มอัพ รายที่ 52 เป็นหญิงไทย อายุ 50 ปี ภูมิลำเนา อ.เมือง รายที่ 53 หญิงไทย อายุ 37 ปี ภูมิลำเนา อ.สันทราย ประวัติเดินทางไปในร้านวอร์มอัพในคืนวันที่ 31 ธ.ค. 63 // สสจ.เชียงใหม่
- อยุธยา พบผู้ป่วยรายใหม่ 3 ราย รวมสะสม 15 ราย โดย รายที่ 13 เป็นชายไทย อายุ 49 ปี อ.บางไทร รายที่ 14 ชายไทย อายุ 31 ปี อ.ผักไห่ รายที่ 15 หญิงไทย อายุ 19 ปี อ.บางปะหัน // สสจ.อยุธยา
- เลย ผู้ว่าฯ แถลง พบผู้ป่วยยืนยันรายใหม่ 2 ราย ที่อ.ภูกระดึง และ อ.วังสะพุง รวมสะสม 3 ราย // สสจ.เลย
- อ่างทอง พบ 7 ราย ไทยทั้งหมด // สสจ.อ่างทอง
มูลนิธิรางวัลสมเด็จเจ้าฟ้ามหิดล ในพระบรมราชูปถัมภ์ LINK
มูลนิธิรางวัลสมเด็จเจ้าฟ้ามหิดล ในพระบรมราชูปถัมภ์ ได้รับพระบรมราชานุญาตให้จัดตั้งขึ้น เมื่อวันที่ 9 กรกฎาคม พ.ศ. 2534 ด้วยการริเริ่มของคณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล ในวโรกาสเฉลิมฉลองวันคล้ายวันพระราชสมภพ ในสมเด็จพระมหิตลาธิเบศร อดุลยเดชวิกรม พระบรมราชชนก ครบ 100 ปี ในวันที่ 1 มกราคม พ.ศ. 2535 เพื่อดำเนินการมอบรางวัลสมเด็จเจ้าฟ้ามหิดล ถวายเป็นพระราชอนุสรณ์ และเพื่อเผยแพร่พระราชเกียรติคุณ แห่งสมเด็จพระมหิตลาธิเบศร อดุลยเดชวิกรม พระบรมราชชนก ”องค์บิดาแห่งการแพทย์แผนปัจจุบันและการสาธารณสุขของไทย”
เมื่อแรกตั้งใช้ชื่อมูลนิธิว่า “มูลนิธิรางวัลมหิดล ในพระบรมราชูปถัมภ์” และได้เปลี่ยนแปลงเป็น “มูลนิธิรางวัลสมเด็จเจ้าฟ้ามหิดล ในพระบรมราชูปถัมภ์” เมื่อวันที่ 28 กรกฎาคม พ.ศ. 2540
รางวัลสมเด็จเจ้าฟ้ามหิดล ประกอบด้วย
- เหรียญรางวัล
- ประกาศนียบัตร
- เงินรางวัลๆ ละ 100,000 เหรียญสหรัฐ
งานที่จัดไปแล้วปีนี้
พัทยามีจุดท่องเที่ยวมากมาย และมีหลายแห่งที่ใครมาเที่ยวจะต้องไปสักครั้ง
- ปราสาทสัจธรรม ปราสาทไม้ขนาดใหญ่ที่สุดในประเทศไทย มีชื่อเสียงไปทั่วโลก ด้วยความยิ่งใหญ่อลังการละเอียดประณีตศิลป์ ปราสาทสัจธรรมอยู่ที่ ถ.พัทยา-นาเกลือ รอบปกติเปิดบริการทุกวัน 8.00-18.00 น. จำหน่ายบัตรรอบสุดท้าย 17.00 น. รอบค่ำเปิด ศุกร์ และ เสาร์ เข้าชม รอบ 18.00 น. และรอบ 19.30 น. เปิดจำหน่ายบัตรรอบค่ำ 17.00 - 19.00 น. สอบถามโทร 038-110653 facebook
- Nongnooch Garden Pattaya สวนนงนุชพัทยา กับธีม Nongnooch Wonder World หุบเขาไดโนเสาร์ มีไดโนเสาร์กว่า 230 ชนิด 814 ตัว สวนพฤกษศาสตร์ พันธุ์ไม้ชนิดต่างๆ 19,528 สายพันธุ์ ได้ขึ้นทะเบียนเป็นสถานเพาะพันธ์ุพืชพร้อมการรับรองถูกต้องตามกฎหมาย สวนนงนุช เปิดทุกวัน เวลา 8.00 น. – 18.00 น. สอบถามโทร 081-9192153 038-415145 038-425748 facebook
- Legend Siam Pattaya เมืองแห่งตำนานสยาม อารยะความเป็นไทยในยุคสมัยต่างๆ สนุกกับเครื่งเล่นโซนงานวัดป่าหิมพานต์ ชิงช้าสวรรค์กินรีกินนร ไฮไลท์ บ้านผีสิงบ้านแม่นาค โซนเปิดใหม่ Nine Rabbit House Cafe เมืองกระต่าย ตลาดร้อยปี Legend Siam Pattaya เปิดทุกวัน เวลา 10.00 น. - 18.00 น. ติดต่อสอบถาม 033-073-333 facebook ฟรี!!.บัตรผ่านประตูเมืองสำหรับลูกค้าชาวไทยทั่วประเทศตลอดเดือน สิงหาคม 2567
+++ กิจกรรมที่จัดไปแล้ว +++
++ กิจกรรมที่ผ่านไป ++
จุดท่องเที่ยวเด่นในจ.ระยอง ที่ต้องไม่พลาด
ศาลสมเด็จพระเจ้าตากสิน วัดสมุทรคงคาราม เกาะเสม็ด แหลมแม่พิมพ์ ตลาดบ้านเพ สวนสมุนไพรสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมาร เมืองเก่าระยอง ถนนยมจินดา ชุมชนท่องเที่ยวบ้านทะเลน้อย อุทยานแห่งชาติเขาแหลมหญ้า-หมู่เกาะเสม็ด เกาะกรวย เกาะขาม และเกาะปลายตีน หาดน้ำริน เรือรบหลวงประแส พิพิธภัณฑ์บ้านครูกัง สำนักสงฆ์น้ำตกธรรมรส สวนวังแก้ว ชุมชนตะพง ศาลหลักเมืองจังหวัดระยอง วัดสมมติเทพฐาปนาราม วัดบ้านแลง มิราเคิล ออฟ เนเจอร์รัล วัดละหารไร่ สวนปาหนัน ตลาดเกาะกลอย วัดสารนารถธรรมาราม สวนพฤกษชาติโสภา เดอะปาร์คแอดเวนเจอร์แลนด์ ชุมชนเกษตรบ้านชากมะกรูด ศูนย์ส่งเสริมการพัฒนาอาชีพการเกษตร จังหวัดระยอง อ่าวทับทิม หาดแสงจันทร์ หาดพยูนและหาดพลา อ่าววงเดือน สวนพฤกษศาสตร์บ้านเพ ระยอง สวนยายดา-เจ๊บุญชื่น ศูนย์การเรียนรู้พระเจดีย์กลางน้ำ เขาแหลมหญ้า หาดแม่รำพึง สตรอว์เบอร์รี่ ทาวน์ วิสาหกิจชุมชนท่องเที่ยววิถีชุมชนตำบลปากน้ำประแส วิสาหกิจชุมชนท่องเที่ยว บ้านทะเลน้อยระยองฮิ วิสาหกิจชุมชนท่องเที่ยวเชิงอนุรักษ์กระแสบน วิสาหกิจชุมชนท่องเที่ยวเชิงเกษตรและวัฒนธรรมบ้านวังหว้า แหลมแม่พิมพ์ หาดแหลมแม่พิมพ์ เกาะมันกลาง เกาะมันนอก สวนพฤกษศาสตร์ระยอง สวนสุภัทราแลนด์ ศูนย์เรียนรู้ป่าวังจันทร์ อุทยานแห่งชาติเขาชะเมา-เขาวง หาดแหลมเจริญ ทุ่งโปรงทอง พิพิธภัณฑ์หนังใหญ่วัดบ้านดอน พระเจดีย์กลางน้ำ วัดโขดทิมธาราม วัดป่าประดู่ สถานแสดงพันธุ์สัตว์น้ำระยอง เกาะค้างคาว เกาะกุฎี (เกาะกุด) เกาะทะลุ ศาลสมเด็จกรมหลวงชุมพรเขตรอุดมศักดิ์ สวนลำดวน ผาสวรรค์ เกาะมันใน อนุสาวรีย์สุนทรภู่ หาดทรายแก้ว ฟาร์มเห็ดบูรพา อ่าวไข่-แหลมตาล-อ่าวมะขามป้อม มหาวิทยาลัยบ้านนอก บ้านจำรุง มีสุขฟาร์ม (วิสาหกิจชุมชนกลุ่มเกษตรผลิตไม้กฤษณา) พระแม่กวนอิมมหาโพธิสัตว์(หยกขาว) สวนลุงทองใบ สวนผู้ใหญ่สมควร ศูนย์วิจัยทรัพยากรแร่และหิน จังหวัดระยอง
+++ กิจกรรมที่จัดไปแล้ว +++
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยวพิษณุโลก อุทยานแห่งชาติภูหินร่องกล้า น้ำตกชาติตระการ อุทยานแห่งชาติทุ่งแสลงหลวง ศาลสมเด็จพระนเรศวรมหาราช ภูแผงม้า ถ้ำเดือนถ้ำดาว เขื่อนแควน้อยบำรุงแดน อนุสาวรีย์พ่อขุนบางกลางท่าว พิพิธภัณฑ์ผ้า มหาวิทยาลัยนเรศวร สวนนกไทยศึกษา วัดนางพญา หอศิลปและวัฒนธรรมมหาวิทยาลัยนเรศวร เรนฟอเรสท์ ฟาร์ม น้ำตกแก่งซอง เขาล่องเรือตาหมื่น ชุมชนบ้านวังส้มซ่า ชุมชนบ้านมุงเหนือ ชุมชนบ้านผารังหมี อุทยานแห่งชาติน้ำตกชาติตระการ พระราชวังจันทน์ วัดพระศรีรัตนมหาธาตุวรมหาวิหาร เสาหลักเมืองพิษณุโลก อุทยานแห่งชาติแก่งเจ็ดแคว วัดราชคีรีหิรัญยาราม เขตห้ามล่าสัตว์ป่าถ้ำผาท่าพล กำแพงเมืองคูเมือง น้ำตกปอยและสวนป่าเขากระยาง วัดราชบูรณะ เขาโปกโล้น เขตห้ามล่าสัตว์ป่าเขาน้อย-เขาประดู่ วัดเจดีย์ยอดทอง น้ำตกแก่งโสภา เจดีย์ยอดด้วน (เขาสมอแคลง) พิพิธภัณฑ์พื้นบ้านจ่าทวี (จ่าสิบเอกทวี-พิมพ์ บูรณเขตต์) น้ำตกวังนกแอ่น (สวนรุกชาติสกุโณทยาน) วัดจุฬามณี อุทยานแห่งชาติภูสอยดาว น้ำตกไผ่สีทอง สวนพฤกษศาสตร์สกุโณทยาน ชุมชนนครชุม สวนป่าเขากระยาง
++ กิจกรรมที่ผ่านไป ++
สัมผัสวัฒนธรรมเอกลักษณ์สุราษฎร์ธานี ผ่านการท่องเที่ยวเส้นทางสายวัฒนธรรมของอารยธรรมศรีวิชัย ณ เมืองไชยา-ท่าชนะ สะท้อนอารยธรรมที่เคยรุ่งเรืองในอดีต และความหลายหลายของวัฒนธรรม วัดพระบรมธาตุไชยาราชวรวิหาร สวนโมกขพลาราม โบราณสถานวัดรัตนาราม โบราณสถานวัดหลง วัดป่าท่าไท ถํ้าแม่นางสงค์ ถนนเลียบเขาประสงค์ ผ้าทอพุมเรียง ไข่เค็มไชยา
ที่มาของการคำนวณจำนวนเขตและ ส.ส.
เมื่อเดือน ม.ค. ที่ผ่านมา ที่ประชุม กกต. ชุดใหญ่ พิจารณากำหนดจำนวนสมาชิก ส.ส.แบ่งเขตเลือกตั้ง ที่แต่ละจังหวัดพึงจะมี และจำนวนเขตเลือกตั้งแบบแบ่งเขตเลือกตั้งของแต่ละจังหวัด โดยพิจารณาจากจำนวนราษฎรทั่วราชอาณาจักร เมื่อ 31 ธ.ค. 2565 ซึ่งมีจำนวน 66,090,475 คน จึงมีจำนวนประชากรโดยเฉลี่ยประมาณ 165,226 คน ต่อจำนวน ส.ส. 1 คน [
BBC]
หลักสูตรการช่วยชีวิตขั้นพื้นฐานสำหรับประชาชนทั่วไป คณะกรรมการมาตรฐานการช่วยชีวิต LINK
คณะกรรมการมาตรฐานการช่วยชีวิต (Thai Resuscitation Council) สมาคมแพทย์โรคหัวใจแห่งประเทศไทยในพระบรมราชูปถัมภ์ จัดหลักสูตร หลายระดับรองรับ ความต้องการของผู้ที่เกี่ยวข้อง ตั้งแต่ ประชาชนทั่วไป การ์ด AHA บุคลากรทางการแพทย์ หลักสูตรการช่วยชีวิตขั้นสูง หลักสูตรการช่วยชีวิตเด็กขั้นสูง - การ์ด TRC เป็นต้น แต่ละคอร์สมีค่าใช้จ่าย
หลักสูตรสำหรับประชาชน
1.หลักสูตรการช่วยชีวิตขั้นพื้นฐานสำหรับประชาชนทั่วไป ([TRC] BLS Provider for Non-HCP)
จำนวนวันที่เรียน ครึ่งวัน ค่าเรียน 1,000 บาท
2.หลักสูตรครูผู้สอนการช่วยชีวิตขั้นพื้นฐานสำหรับประชาชนทั่วไป ([TRC] BLS Instructor for Non-HCP)
จำนวนวันที่เรียน 1 วัน จำนวนวันฝึกสอน ครึ่งวัน ค่าเรียน 5,500 บาท
3.หลักสูตรการช่วยชีวิตขั้นพื้นฐาน สำหรับประชาชนทั่วไป - การ์ด AHA ([AHA] Heartsaver)
จำนวนวันที่เรียน ครึ่งวัน ค่าเรียน 1,200 บาท
*หลักสูตรสำหรับบุคลากรทางการแพทย์ มีหลายหลักสูตร
คณะกรรมการมาตรฐานการช่วยชีวิต
ชั้น 5 อาคารเฉลิมพระบารมี 50 ปี
ซอยศูนย์วิจัย ถนนเพชรบุรีตัดใหม่ กรุงเทพ 10310
Email info@thaicpr.org
++ กิจกรรมที่ผ่านไป ++
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยวในจ.ชลบุรี ได้แก่ สวนสัตว์เปิดเขาเขียว พิพิธภัณฑ์ศิลปะในขวดแก้ว สวนผีเสื้อสายทิพย์ เกาะไผ่ เมืองน้ำแข็ง พัทยา บางเสร่ วัดใหญ่อินทราราม อุทยานสามก๊ก หอพระพนัสบดี พัทยา ดอลฟิน เวิลด์ แอนด์ รีสอร์ท อาร์ท อิน พาราไดซ์ พิพิธภัณฑ์ตุ๊กตาหมี พัทยา จังเกิล บันจี้จัมป์ วัดธรรมนิมิตต์ วัดหลวงพรหมวาส สวนสนุกพัทยาปาร์ค เกาะลอยศรีราชา สถานที่ประดิษฐานพระพุทธมหาวชิรอุตตโมภาสศาสดา สวนน้ำการ์ตูนเน็ทเวิร์ค อเมโซน เกาะแสมสาร พิพิธภัณฑ์พระจุฑาธุชราชฐาน บ้านสุขาวดี หาดถ้ำเขาพัง อ่างเก็บน้ำบางพระ พิพิธภัณฑ์พุทธศิลปะหนองปรือ ชมรมส่งเสริมการท่องเที่ยวโดยชุมชนตำบลตะเคียนเตี้ย ฟาร์มแกะพัทยา วัดญาณสังวรารามวรมหาวิหาร จุดชมวิวเขาพระตำหนัก สวนน้ำรามายณะ พัทยา หุบเขาไดโนเสาร์ หาดนางรำ ศูนย์อนุรักษ์พันธุ์เต่าทะเล กองทัพเรือ พระพุทธรูปแกะสลักเขาชีจรรย์ หาดนางรอง แกรนด์แคนยอน ชลบุรี เอเลเฟ่น จังเกิ้ล แซงค์ชัวรี่ พัทยา อุทยานใต้ทะเลเกาะขาม อ่างศิลา สถาบันวิทยาศาสตร์ทางทะเล สเปซ อินสไปเรียม หาดจอมเทียน หาดพัทยา อันเดอร์ วอเตอร์ เวิลด์ พัทยา พัทยา ดอลฟินาเรียม เมืองจำลองพัทยา พิพิธภัณฑ์ริบลีส์ เชื่อหรือไม่ พิพิธภัณฑ์ภาพวาดสามมิติ น้ำตกชันตาเถร อ่าวดงตาล ศูนย์ศึกษาธรรมชาติและอนุรักษ์ป่าชายเลนเพื่อการท่องเที่ยวเชิงนิเวศ จังหวัดชลบุรี ไทธานี หมู่บ้านวัฒนธรรมและศิลปะ อาณาจักรปลาการ์ตูนเพอคูล่าฟาร์ม ทิฟฟานี่โชว์ หาดวงพระจันทร์ อัลคาซ่าร์ คาบาเร่ต์ โชว์ หมู่บ้านช้างพัทยา ศูนย์แสดงเรือพระราชพิธีจำลอง 4 มิติ ไร่องุ่นซิลเวอร์เลค วัดเขาพระพุทธบาทบางทราย เดอะ ฮอร์สชู พ้อยท์ สวนนงนุช โรงละครไทยอลังการ อุทยานหินล้านปี และฟาร์มจระเข้พัทยา หมู่บ้านช่องแสมสาร เรือรบหลวงจักรีนฤเบศร ตลาดน้ำ 4 ภาค พัทยา ปราสาทสัจธรรม ตลาดเก่าอ่างศิลา 133 ปี ชุมชนจีนโบราณ บ้านชากแง้ว ตลาดหนองมน หาดบางแสน เขาสามมุข หาดเตยงาม เกาะสีชัง ช้างสยามกระทิงลายและมอนสเตอร์เวิลด์ หอพระพุทธสิหิงค์ แหลมแท่น พิพิธภัณฑ์ธรรมชาติวิทยา เกาะและทะเลไทย (เกาะแสมสาร) อเนกกุศลศาลา (วิหารเซียน) หาดทรายแก้ว วิหารเทพสถิตพระกิติเฉลิม (ศาลเจ้าหน่าจาซาไท้จื้อ) วัดสัตหีบ (วัดหลวงพ่ออี๋) เกาะล้าน วัดใต้ต้นลาน โจโจ้ฮอร์สคลับ วัดชุมแสงศรีวนาราม น้ำตกอ่างผักหนาม Columbia Pictures Aquaverse LOF LAND Siam Cannabis Land Art Venture NFT House of Benedict เกาะค้างคาว พัทยาคาร์ท สปีดเวย์ เลคแลนด์ วอเตอร์ เคเบิ้ล สกี เกาะสาก ไทเกอร์พาค พัทยา ถ้ำเขาชะอางค์ห้ายอด ถ้ำเขาชะอางค์ทรงเครื่อง สวนกล้วยไม้ศิริพร วัดใต้ต้นลาน
++ กิจกรรมที่ผ่านไป ++
ของกินอร่อยๆ กันที่นครนายก - ร้านกล้วยทอด สองพี่น้อง เยื้องธนาคารกสิกรไทย - ขนมจีบเฮียซื้อ - เจ๊ย้ง ไอศกรีมโบราณ - เจ๊ปุ๊ ไอศกรีมโบราณ - ก๋วยเตี๋ยวป้าเกียว ก๋วยเตี๋ยวหมูเกี้ยมอี๋โบราณ - แดงแกงป่า - ลูกชิ้นทอดเหลียนหัว - ก๋วยเตี๋ยวเหลียนหัว - แจ๋วซาลาเปา - ร้านบะหมี่-เกี๊ยวโชกุน - ร้านเจ๊หมวยข้าวต้มปลา - ร้านโรงเต้าหู้ - ร้านวันหวาน นครนายก - บรรยากาศตลาดโต้รุ่งนครนายก - ก๋วยเตี๋ยวเนื้อเจ๊อ่าย-เจ๊เม้ง - ร้านขนมไทยแม่เล็ก - ร้านโรตีอามีน
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยวในจ.หนองคาย อนุสาวรีย์ปราบฮ่อ หลวงพ่อพระใส หาดจอมมณี สะพานมิตรภาพไทย-ลาว แห่งที่ 1 การแข่งขันบั้งไฟเพื่อบูชาพญาแถนหรือเทวดา ศูนย์วัฒนธรรมเฉลิมราชพิพิธภัณฑ์เมืองโพนพิสัย พระธาตุหนองคาย หรือพระธาตุกลางน้ำ หมู่บ้านทำแผ่นกระยอ หลวงพ่อพระเจ้าองค์ตื้อ วัดอรัญบรรพต พระสุธรรมเจดีย์ วัดไทย น้ำตกวังน้ำมอก วัดผาตากเสื้อ และสกายวอร์ก วัดผาตากเสื้อ ตลาดท่าเสด็จ พระธาตุบังพวน พระธาตุหล้าหนอง ณ ตลาดท่าเรือ พิพิธภัณฑ์สัตว์น้ำ จังหวัดหนองคาย บ้านวังน้ำมอก วัดหินหมากเป้ง ภูห้วยอีสัน น้ำตกธารทอง น้ำตกธารทิพย์ พิพิธภัณฑ์โคกคอน วัดโพธิ์ชัย ศาลาแก้วกู่ (วัดแขก) ถ้ำศรีมงคล (ถ้ำดินเพียง) ภูผาดัก พันโขดแสนไคร้ ถนนคนเดินหนองคาย
++ กิจกรรมที่ผ่านไป ++
สถานที่สำคัญและแหล่งท่องเที่ยว จ.พะเยา ไปเก็บได้กี่ที่กันแล้ว อนุสาวรีย์พญางำเมือง เทศบาลเมืองพะเยา กว๊านพะเยายามเย็น น้ำตกภูซาง อนุสาวรีย์พญางำเมือง กว๊านพะเยา วัดติโลกอาราม สถานีประมงน้ำจืดพะเยา วัดศรีโคมคำ หอวัฒนธรรมนิทัศน์ วัดพระธาตุจอมทอง วัดอนาลโยทิพยาราม วัดศรีอุโมงค์คำ วัดลี เวียงโกมคำนคร วัดงิ้วหงกศรีโกมคำ วัดต้นต้องศรีโกมคำ เวียงผาคำม่อนผาคำ คุ้มหลวงหอเจ้าพ่อล้านช้าง อุทยานแห่งชาติดอยหลวง ไดโนเสาร์เชียงม่วน วัดท่าฟ้าใต้ แม่น้ำฮ่องจ้างมหานที ดอกคำใต้ เวียงห้าว คูเมืองเวียงห้าว ถนนแสนคำถนนลายคำเวียงโกมคำ อาณาจักรโบราณ อาณาจักรเวียงโกมคำนคร อุทยานแห่งชาติดอยภูนาง วัดพระนั่งดิน วัดพระธาตุสบแวน วัดนันตาราม เชียงคำ ถนนดอกคำใต้-เชียงคำ อ่างแม่ต๋ำหลวง วัดพระธาตุจอมไคร้ ถนนพันผางเวียงงิ้วหงก ศูนย์วัฒนธรรมไทยลื้อ อุทยานแห่งชาติภูซาง น้ำตกภูซาง เวียงงิ้วหงก โบราณสถานเวียงลอ โบราณสถานบ้านฮ่องไฮ้แม่นาเรือ บ้านบัว ข่วงนกยุง ถ้ำผาแดง ถ้ำน้ำลอด ตลาดการค้าชายแดนไทย-ลาว น้ำตกธารสวรรค์ น้ำตกห้วยต้นผึ้ง หนองหล่มตำบลสุขภาวะ (แหล่งท่องเที่ยวชุมชน) บ่อสิบสอง หน้าผาเกี๋ยงชมพระอาทิตย์ตกดิน ฮ่องขุยหลง คูเมืองโบราณ วัดพระธาตุจอมคีรีศรีเวียงหม้าย (บ้านปิน) อ่างร่องสัก (บ้านปิน) น้ำตกจำปาทอง ดอยบุษราคัม หาดน้ำดัง วัดพระนั่งดิน วัดศรีชุม (พระเจ้าทันใจอายุกว่า 700 ปี) ถนนศรีลมแล้ง (บ้านปิน) ผาหัวเรือ วัดศรีจอมเรือง ศาลเจ้าพ่อคำปวน ศาลเจ้าพ่อพญาลิ้นก๋าน ศาลเจ้าพ่อพญาหาญ คุ้มหลวง สะดือเมืองพะเยา -- wikipedia
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยวไฮไลท์จ.อุดรธานี ศาลเจ้าปู่-ย่า เป็นศาลเจ้าของชาวจีนที่ใหญ่โตและสวยงาม มีมังกรทองยาวถึง 99 เมตร อุทยานแห่งชาตินายูง-น้ำโสม มีแหล่งท่องเที่ยวที่น่าสนใจ คือ น้ำตกยูงทอง วัดป่าภูก้อน มีความสวยงามในด้านสถาปัตยกรรม และสงบร่มรื่นเพราะอยู่กลางป่า วนอุทยานน้ำตกธารงาม ทะเลบัวแดง หนองหานกุมภวาปี อุทยานประวัติศาสตร์ภูพระบาท วัดป่าภูก้อน วัดมัชฌิมาวาส อ่างเก็บน้ำห้วยหลวง วนอุทยานวังสามหมอ สวนกล้วยไม้หอมอุดรซันไฌน์ ศาลหลักเมืองอุดรธานี ตลาดผ้านาข่า พระพุทธบาทบัวบาน หมู่บ้านคีรีวงกต วัดโพธิสมภรณ์ ศูนย์วัฒนธรรมไทย-จีน และมูลนิธิศาลเจ้าปู่-ย่า อุดรธานี พิพิธภัณฑ์เมืองอุดรธานี วัดป่าบ้านตาด วัดป่าบ้านค้อ คำชะโนด โครงการท่องเที่ยงเชิงนิเวศภูฝอยลม สวนสาธารณะหนองประจักษ์ศิลปาคม ศาลเจ้าปู่-ย่า ถ้ำสิงห์ วนอุทยานน้ำตกธารงาม อนุสาวรีย์พระเจ้าบรมวงศ์เธอกรมหลวงประจักษ์ ศิลปาคม พิพิธภัณฑสถานแห่งชาติ บ้านเชียง แหล่งศึกษาและท่องเที่ยวเชิงประวัติศาสตร์ (โฮจิมินห์) พระธาตุดอนแก้ว วัดทิพยรัฐนิมิตร (วัดป่าบ้านจิก) วัดป่าภูก้อน วัดสันติวนาราม หมู่บ้านท่องเที่ยว OTOP นวัตวิถี บ้านโนนกอก จังหวัดอุทยานแห่งชาตินายูง-น้ำโสม ถนนคนเดินอุดรธานี
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยวแห่งจ.สุโขทัย ที่ต้องไปเยือน โครงการเกษตรอินทรีย์สนามบินสุโขทัย สาธรพิพิธภัณฑ์ผ้าทองคำ พิพิธภัณฑสถานแห่งชาติ สวรรควรนายก ศาลพระแม่ย่า วัดพิพัฒน์มงคล Street Art สวรรคโลก ชุมชนท่องเที่ยวบ้านนาต้นจั่น จังหวัดสุโขทัย อุทยานประวัติศาสตร์ศรีสัชนาลัย โบราณสถานวัดเจดีย์เจ็ดแถว โบราณสถานวัดเขาสุวรรณคีรี ถ้ำเจ้าราม โบราณสถานวัดนางพญา วัดพระพายหลวง ศาลตาผาแดง เนินปราสาทพระร่วง อุทยานแห่งชาติศรีสัชนาลัย พิพิธภัณฑสถานแห่งชาติรามคำแหง วัดชนะสงคราม (อุทยานประวัติศาสตร์สุโขทัย) น้ำตกตาดเดือน (อุทยานแห่งชาติศรีสัชนาลัย) น้ำตกตาดดาว (อุทยานแห่งชาติศรีสัชนาลัย) ถ้ำค้างคาว (อุทยานแห่งชาติศรีสัชนาลัย) ถ้ำธาราวสันต์ (อุทยานแห่งชาติศรีสัชนาลัย) วัดทุ่งเสลี่ยม (หลวงพ่อศิลา) น้ำตกสายรุ้ง (อุทยานแห่งชาติรามคำแหง) โบราณสถานวัดพระศรีรัตนมหาธาตุ (วัดพระบรมธาตุเมืองเชลียง) โบราณสถานวัดช้างล้อม (อุทยานประวัติศาสตร์สุโขทัย) โบราณสถานวัดช้างล้อม (อุทยานประวัติศาสตร์ศรีสัชนาลัย) วัดตระพังเงิน (อุทยานประวัติศาสตร์สุโขทัย) โบราณสถานวัดมหาธาตุ ศูนย์ศึกษาและอนุรักษ์เตาสังคโลก (เตาทุเรียง) เขื่อนสรีดภงส์ (ทำนบพระร่วง) วัดสระศรี (อุทยานประวัติศาสตร์สุโขทัย) อุทยานประวัติศาสตร์สุโขทัย (เมืองเก่าสุโขทัย) วัดสะพานหิน อุทยานแห่งชาติรามคำแหง (เขาหลวง) วัดศรีชุม (อุทยานประวัติศาสตร์สุโขทัย) วัดศรีสวาย (อุทยานประวัติศาสตร์สุโขท้ย) โรงพักทรงปั้นหยา โบราณสถานวัดเชตุพน กำแพงเมืองสุโขทัย น้ำตกห้วยทรายขาว (อุทยานแห่งชาติศรีสัชนาลัย) โบราณสถานวัดเขาพนมเพลิง โบราณสถานวัดชมชื่น โบราณสถานวัดช้างรอบ เตาทุเรียง โบราณสถานวัดสวนแก้วอุทยานน้อย โบราณสถานวัดสวนแก้วอุทยานใหญ่ วัดไทยชุมพล โบราณสถานวัดตระพังทองหลาง
++ กิจกรรมที่ผ่านไป ++
เทศบาลนครเชียงใหม่ บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2565
เทศบาลนครเชียงใหม่ กำหนดการออกให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ประจำปี 2565 ระหว่าง วันที่ 4 กรกฎาคม - 11 สิงหาคม 2565
อ้างอิง
- คู่มือดำเนินการตามนโยบายสถานชีวาภิบาล กระทรวงสาธารณสุข
- กุฏิชีวาบาล@ทั่วไทย สมุดปกขาว (Whitepaper) ภูริวฑฺฒโนภิกฺข
ที่ท่องเที่ยวโดดเด่นของมุกดาหาร ที่ต้องไม่พลาด
สถานที่ท่องเที่ยวจ.ร้อยเอ็ด หอโหวด 101 พระเจดีย์มหามงคลบัว วัดผาน้ำทิพย์เทพประสิทธิ์วนาราม กู่กาสิงห์ พระมหาเจดีย์มงคลบัว สวนสาธารณะพุทธประวัติเวสสันดรชาดก บ้านหวายหลึม สวนพฤกษศาสตร์วรรณคดีภาคตะวันออกเฉียงเหนือ วัดสระทอง เขตห้ามล่าสัตว์ป่าถ้ำผาน้ำทิพย์ ทุ่งกุลาร้องไห้ แหลมพยอม ปรางค์กู่ หรือ ปราสาทหนองกู่ วัดบูรพาภิราม พิพิธภัณฑสถานแห่งชาติร้อยเอ็ด วัดประชาคมวนาราม หรือวัดป่ากุง พิพิธภัณฑ์สถานแห่งชาติร้อยเอ็ด ร้อยเอ็ด วัดป่าโนนสวรรค์ พระมหาเจดีย์ชัยมงคล วัดสระเกตุ กลุ่มทอผ้าไหม บ้านหวายหลึม กู่พระโกนา วัดกลางมิ่งเมือง เมืองไม้บาติก น้ำตกถ้ำโสดา สถานแสดงพันธุ์สัตว์น้ำเทศบาลเมืองร้อยเอ็ด ผาน้ำย้อย (พุทธอุทยานอีสาน) บึงเกลือ (ทะเลอีสาน) อนุสาวรีย์พระขัติยะวงษา (ทน) บึงพลาญชัย สุวรรณฟาร์ม ฟาร์มดอกไม้ ผาหมอกมิวาย สวนสมเด็จพระศรีนครินทร์ ร้อยเอ็ด สวนน้ำร้อยเอ็ด ศูนย์วิทยาศาสตร์และวัฒนธรรมเพื่อการศึกษาร้อยเอ็ด
ไฮไลท์ที่ท่องเที่ยว จ.อุตรดิตถ์ อุทยานแห่งชาติภูสอยดาว อนุสาวรีย์พระยาพิชัยดาบหัก อนุสาวรีย์เจ้าฟ้าฮ่ามกุมาร อนุสาวรีย์พระศรีพนมมาศ วัดพระบรมธาตุทุ่งยั้ง วัดท่าถนน วัดดอนสัก อุทยานแห่งชาติภูสอยดาว พิพิธภัณฑ์บ้านเกิดพระยาพิชัยดาบหัก พิพิธภัณฑ์เมืองลับแล วัดพระแท่นศิลาอาสน์ บ้านพระยาสุรสีห์วิสิษฐศักดิ์ พิพิธภัณฑ์ผ้าทอตีนจก ไท-ยวน พิพิธภัณฑ์บ่อเหล็กน้ำพี้ วัดพลอยสังวรนิรันดร์ อุทยานแห่งชาติลำน้ำน่าน เขื่อนสิริกิติ์ สกายวอล์กห้วยน้ำรี ชุมชนบ้านหาดไก่ต้อย พิพิธภัณฑ์บ้านกนกมณี วัดท่าถนน อำเภอลับแล น้ำตกแม่พูล วัดท้องลับแล เขื่อนดินช่องเขาขาด วัดพระยืนพุทธบาทยุคล วัดใหญ่ท่าเสา บ้านท่าเรือ วนอุทยานต้นสักใหญ่ ซุ้มประตูเมืองลับแล วัดบ้านแก่งใต้ ม่อนลับแล วัดธรรมาธิปไตย กลุ่มหัตถกรรมผลิตภัณฑ์ผักตบชวา หอวัฒนธรรมวิทยาลัยครูอุตรดิตถ์ อุทยานแห่งชาติน้ำตกคลองตรอน วัดเจดีย์คีรีวิหาร (วัดป่าแก้ว) วัดพระฝางสวางคบุรีมุนีนาถ (วัดพระฝาง) วัดผักราก วัดไผ่ล้อม อนุสาวรีย์เจ้าพ่อพญาปาด ศูนย์ฝึกและพัฒนาอาชีพราษฎรไทยบริเวณชายแดนอุตรดิตถ์ ภูสะนาว ชุมชนลาวเวียงบ้านหาดสองแคว ตลาดการค้าชายแดนไทย-ลาว (ตลาดนัดบ้านบ่อเบี้ย) ขุนฝางสวนม้าโฮมสเตย์ ภูพญาพ่อ จุดชมวิวเขาพลึง
สถานที่ท่องเที่ยวเด่นจ.มหาสารคาม ได้แก่ พิพิธภัณฑ์มหาวิทยาลัยมหาสารคาม พิพิธภัณฑ์บ้านเชียงเหียน แก่งเลิงจาน บึงบอน อุทยานมัจฉาโขงกุดหวาย สถาบันวิจัยวลัยรุกขเวช พระธาตุนาดูน สิมวัดโพธาราม สิมวัดป่าเลไลย์ วัดป่าหนองชาด หมอลำหุ่นกระติบ คณะเด็กเทวดา พระพุทธรูปยืนมงคล พิพิธภัณฑ์คุ้มบุญตามทัน พระพุทธรูปมิ่งเมือง หรือพระพุทธรูปสุวรรณมาลี สะพานไม้แกดำ วัดหนองหูลิง วนอุทยานโกสัมพี กู่สันตรัตน์ สวนป่าจุฬาภรณ์ หรือเขตห้ามล่าสัตว์ป่าดูนลำพัน หมู่บ้านหัตถกรรมบ้านหนองเขื่อนช้าง พิพิธภัณฑ์นครจำปาศรี สะดืออีสาน ศาลเจ้าพ่อหลักเมือง ดิกชั่นนารี่ พาร์ค มหาสารคาม วัดมหาชัย (วัดเหนือ) วัดพุทธวนาราม (วัดป่าวังน้ำเย็น) กู่มหาธาตุ (ปรางค์กู่บ้านเขวา) อ่างเก็บน้ำห้วยค้อ พระธาตุอินทร์แปลง
++ กิจกรรมที่ผ่านไป ++
สถานที่ท่องเที่ยว จ.สตูล น้ำตกโตนปาหนัน พิพิธภัณฑ์แห่งชาติคฤหาสถ์กูเด็น ที่ทำการอุทยานแห่งชาติหมู่เกาะเภตรา น้ำตกยาโรย อ่าวสน เกาะบุโหลน ถ้ำลอดปูยู เกาะราวี เกาะลิดีใหญ่ เกาะรอกลอย หาดปากบารา พิพิธภัณฑ์พื้นบ้านละงู น้ำตกธารปลิว น้ำตกโตนปลิว สวนสาธารณะเขาโต๊ะพญาวัง แหลมตันหยงโปและหาดทรายยาว หมู่เกาะสาหร่าย อ่าวเมาะและ อ่าวพันเตมะละกา บึงทะเลบัน ถ้ำจระเข้ อุทยานธรณีสตูล ถ้ำเลสเตโกดอน เกาะตาลัง หรือกองตาลัง เกาะอาดัง-ราวี อุทยานแห่งชาติหมู่เกาะเภตรา เกาะหลีเป๊ะ เกาะหินงาม น้ำตกวังสายทอง ถ้ำเจ็ดคต หรือถ้ำสัตคูหา พิพิธภัณฑ์อุทยานธรณีสตูล และพิพิธภัณฑ์ช้างดึกดำบรรพ์ มัสยิดกลางจังหวัดสตูล วัดชนาธิปเฉลิม วนอุทยานน้ำตกธาราสวรรค์ ชุมชนท่องเที่ยวบ้านบากันใหญ่ อุทยานแห่งชาติทะเลบัน บ่อน้ำพุร้อนทุ่งนุ้ย อุทยานแห่งชาติตะรุเตา เกาะตะรุเตา เกาะหินซ้อน เกาะลิดีเล็ก ถ้ำภูผาเพชร สันหลังมังกร เกาะเขาใหญ่ และ ปราสาทหินพันยอด เกาะอาดัง ปราสาทหินพันยอด เขาทะนาน เกาะจาบัง เกาะยาง (เกาะกาต๊ะ) ถนนคนเดินบนเกาะหลีเป๊ะ ชุมชนตันหยงโป
งาน BIKE WEEK ยโสธร 2023 วันที่ 14-15 มกราคม 2566 ที่วิมานพญาแถน
พบกับสุดยอดงานเทศกาลอาหาร และงาน BIKE WEEK ระดับประเทศ ! ในกิจกรรม "YASOTHON BIKE WEEK FOOD FEST AMAZING THAILAND 2023" วันที่ 14-15 มกราคมนี้ พบกันที่วิมานพญาแถน จังหวัดยโสธร โดยหอการค้าจังหวัดยโสธร จับมือกับการท่องเที่ยวแห่งประเทศไทย ขอเชิญเที่ยวงานเทศกาลอาหารที่ใหญ่ที่สุดของจังหวัดยโสธร และรวมพลคนที่รักในการขับขี่รถ BIG BIKE จากทั่วประเทศ...ภายในงานท่านจะได้พบกับ
✅ กิจกรรมเทศกาลอาหารของดีของดัง ไม่ต่ำกว่า 50 ร้านค้า จากพี่น้องจังหวัดยโสธร
✅ คาราวาน BIG BIKE จากทั่วประเทศ ขับชมเมืองและแหล่งท่องเที่ยวในจังหวัดยโสธร
✅ กิจกรรมการแต่งกายแหยมยโสธร
กิจกรรมในงาน
วันที่ 14 มกราคม 2566 พบกับการแสดงโชว์จาก #ดีเจลีน่า และท่าประจำร้อยล้านวิวใน TIKTOK กับท่าเต้นกระชากใจ ปูหนีบอีปิ๊ กลางคืนมีมหกรรมคอนเสิร์ตจากวงดนตรีดังมากมาย และไฮไลท์ตำนาน ร็อคขวัญใจยุค 90 พี่เหน่ง Y NOT 7 เจ้าของเพลง ทิ้งรักลงแม่น้ำ
วันที่ 15 มกราคม 2566 กลางคืนพบกับมหกรรมคอนเสิร์ต พร้อมศิลปินรับเชิญ "พี่อ้น ธวัชชัย ชูเหมือน" ศิลปินชื่อดังจากเมืองใต้ เจ้าของเพลง #ปล่อย และผลงานเพลงดังอีกมากมาย
ภายในงานท่านสามารถร่วมทำบุญ 200 บาท และรับเสื้อที่ระลึกจากงาน มีเพียง 100 ตัวเท่านั้น ! (รายได้ทั้งหมดทำบุญให้กับองค์กรการกุศลในจังหวัดยโสธร)
25 ปี ชาร์ค ไรเดอร์ 28 มกราคม 2566
ครบรอบ 25 ปี ชาร์ค ไรเดอร์ 28 มกราคม 2566 ณ ลาน 15 ไร่ เทพธิดา บ้านหนองแสง ต.ลาดกระทิง อ.สนามชัยเขต ฉะเชิงเทรา
25 ปี กลุ่ม FORMULATE HELL
งานครบรอบ 25 ปี กลุ่ม FORMULATE HELL 28 มกราคม 2566 ณ เเยกหลุยส์พล่าซ่า อำเภอสันกำแพง จังหวัดเชียงใหม่
Highland BIKE FESTIVAL2023
Highland BIKE FESTIVAL2023 / 28 มกราคม 2566 IMMORTALS THAILAND
เทศบาลเมืองสุรินทร์ ฉีดวัคซีนโรคพิษสุนัขบ้า ฟรี
เทศบาลเมืองสุรินทร์ พร้อมให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ในเขตเทศบาลเมืองสุรินทร์ ตามโครงการสัตว์ปลอดโรค คนปลอดภัย ตามพระปณิธานฯ สัตว์ที่จะฉีดได้ ต้องมีอายุ 2 เดือนขึ้นไป ไปรับบริการได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองสุรินทร์ อาคาร 5 ชั้น 1 เวลา 8.30-16.30 น. สอบถามโทร 044-515074
ปศุสัตว์เขต 1 - กรุงเทพและ 7 จังหวัด
สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร
909 ถนนงามวงศ์วาน แขวงลาดยาว เขตจตุจักร กรุงเทพมหานคร 10900
โทร. 02-004-4407
Website
facebook.com/DLD1942
- ปศุสัตว์จังหวัดปทุมธานี โทร. 02-5012169 , 081-2078410 website | facebook
- ปศุสัตว์จังหวัดนนทบุรี โทร. 02-5950992 , 02-5950687 , 093-3343113 website | facebook
- ปศุสัตว์จังหวัดลพบุรี โทร. 036-423970 , 036-423969 , 089-6896106 website | facebook
- ปศุสัตว์จังหวัดสระบุรี โทร. 036-230814 website | facebook
- ปศุสัตว์จังหวัดพระนครศรีอยุธยา โทร. 035-335592 , 081-9949266 website | facebook
- ปศุสัตว์จังหวัดชัยนาท โทร. 056-476597 - 8 , 081-5967401 website | facebook
- ปศุสัตว์จังหวัดอ่างทอง โทร. 035-611746 , 080-2243350 website | facebook
ปศุสัตว์เขต 2 - ภาคตะวันออก
ปศุสัตว์เขต 3 - ภาคอีสานตอนล่าง
- ปศุสัตว์จังหวัดสุรินทร์ โทร. 044-511488 , 083-3679466
- ปศุสัตว์จังหวัดอำนาจเจริญ โทร. 045-541204
- ปศุสัตว์จังหวัดนครราชสีมา โทร. 044-25 1822 , 081-2650338
- ปศุสัตว์จังหวัดชัยภูมิ โทร. 044-812334 , 044-821307 , 089-8456722
- ปศุสัตว์จังหวัดอุบลราชธานี โทร. 045-255005 , 083-7962655
- ปศุสัตว์จังหวัดบุรีรัมย์ โทร. 044-611988 ต่อ 104 , 099-1935536
ปศุสัตว์เขต 4 - ภาคอีสานตอนบน
- ปศุสัตว์จังหวัดบึงกาฬ โทร. 042-492734 , 084-7876458
- ปศุสัตว์จังหวัดอุดรธานี โทร. 042-222984 , 084-0293030
- ปศุสัตว์จังหวัดร้อยเอ็ด โทร. 043-511701 , 081-1700364
- ปศุสัตว์จังหวัดสกลนคร โทร. 042-711756 , 084-4280822
- ปศุสัตว์จังหวัดนครพนม โทร. 042-511089 , 081-8792177
- ปศุสัตว์จังหวัดขอนแก่น โทร. 043-221844 , 095-2575655
- ปศุสัตว์จังหวัดกาฬสินธุ์ โทร. 043-811535
- ปศุสัตว์จังหวัดเลย โทร. 042-811572 , 087-9391588
- ปศุสัตว์จังหวัดหนองคาย โทร. 042-423285 , 082-5926936
- ปศุสัตว์จังหวัดมหาสารคาม โทร. 043-777960 , 081-6610778
- ปศุสัตว์จังหวัดมุกดาหาร โทร. 042-640096 , 081-1700364 , 085-2743936
- ปศุสัตว์จังหวัดหนองบัวลำภู โทร. 042-313117-8 , 084-5178485
ปศุสัตว์เขต 5 - ภาคเหนือ
- ปศุสัตว์จังหวัดเชียงราย โทร. 053-711604 , 053-718878 , 084-157413
- ปศุสัตว์จังหวัดแพร่ โทร. 054-511098 , 089-7002445
- ปศุสัตว์จังหวัดแม่ฮ่องสอน โทร. 053-611580 , 081-9518207
- ปศุสัตว์จังหวัดลำพูน โทร. 053-511288 , 089-9449895
- ปศุสัตว์จังหวัดน่าน โทร. 054-719434 , 081-7160069
- ปศุสัตว์จังหวัดเชียงใหม่ โทร. 053-892516 , 084-6103647
- ปศุสัตว์จังหวัดลำปาง โทร. 054-209610 , 092-929225
- ปศุสัตว์จังหวัดพะเยา โทร. 054-431322 , 081-5309429
ปศุสัตว์เขต 6 - ภาคกลางตอนบน
- ปศุสัตว์จังหวัดกำแพงเพชร โทร. 055-711458 , 081-6756873
- ปศุสัตว์จังหวัดพิษณุโลก โทร. 055-258654 , 085-1846919
- ปศุสัตว์จังหวัดอุทัยธานี โทร. 056-970004 , 081-7406614
- ปศุสัตว์จังหวัดเพชรบูรณ์ โทร. 056-720761 , 086-8042540
- ปศุสัตว์จังหวัดพิจิตร โทร. 056-990389 , 081-9292214
- ปศุสัตว์จังหวัดสุโขทัย โทร. 055-699427
- ปศุสัตว์จังหวัดตาก โทร. 055-513473 , 082-3565299
- ปศุสัตว์จังหวัดสุโขทัย โทร. 055-699427
- ปศุสัตว์จังหวัดอุตรดิตถ์ โทร. 055-816813 , 080-5201782
- ปศุสัตว์จังหวัดนครสวรรค์ โทร. 056-221455 , 093-6826589
ปศุสัตว์เขต 7 - ภาคกลางตะวันตก
- ปศุสัตว์จังหวัดเพชรบุรี โทร. 032-425496 , 081-2915480
- ปศุสัตว์จังหวัดนครปฐม โทร. 034-257705 , 089-1084267
- ปศุสัตว์จังหวัดประจวบคีรีขันธ์ โทร. 032-60 2422 , 081-3039618
- ปศุสัตว์จังหวัดสุพรรณบุรี โทร. 035-555466 , 095-3063184
- ปศุสัตว์จังหวัดสมุทรสาคร โทร. 034-412600 , 063-6156353
ปศุสัตว์เขต 8 - ภาคใต้ตอนบน
- ปศุสัตว์จังหวัดกระบี่ โทร. 075-611791 , 081-0775766
- ปศุสัตว์จังหวัดพัทลุง โทร. 074-610834 , 097-3546776
- ปศุสัตว์จังหวัดตรัง โทร. 075-218377 , 081-6779454
- ปศุสัตว์จังหวัดชุมพร โทร. 077-511511 , 081-6113675
- ปศุสัตว์จังหวัดสุราษฎร์ธานี โทร. 077-272900 , 085-0688076
- ปศุสัตว์จังหวัดนครศรีธรรมราช โทร. 075-356254 , 089-0719408
- ปศุสัตว์จังหวัดพังงา โทร. 076-412080 , 081-3188107
- ปศุสัตว์จังหวัดระนอง โทร. 077-812225 , 081-7196425
ปศุสัตว์เขต 9 - ภาคใต้ตอนล่าง
- ปศุสัตว์จังหวัดยะลา โทร. 073-203787 , 089-4575313
- ปศุสัตว์จังหวัดสงขลา โทร. 074-315728 , 081-4433661
- ปศุสัตว์จังหวัดปัตตานี โทร. 073-335996 , 085-5788956
- ปศุสัตว์จังหวัดนราธิวาส โทร. 073-511205 , 081-7936563
- ปศุสัตว์จังหวัดสตูล โทร. 074-711357 , 091-8214041
++ ทริปเดือนตุลาคม ที่ผ่านไป ++
ทริป 1 วันเสาร์ที่ 7 และวันอาทิตย์ที่ 8 ตุลาคม 2566
ชวนท่องเที่ยวรับลมหนาวแบบไปเช้าเย็นกลับเส้นทางกรุงเทพ - ฉะเชิงเทรา - กรุงเทพ โดยพาไป check-in ที่สะพานแม่น้ำบางปะกงแลนด์มาร์กใหม่ของฉะเชิงเทรา พาไปสักการะหลวงพ่อโสธร ที่วัดโสธรวราราม สักการะหลวงพ่ออู่ทอง “แห่งความสำเร็จ” สักการะหลวงพ่อโสธรขนาดใหญ่ที่วัดวีระโชติธรรมาราม เยี่ยมชมพระวิหารแก้วพระราชพรหมยาน อุโบสถแก้วกลางน้ำพระราชพรหมยานที่ดูคล้ายแสงดาวเกลื่อนท้องฟ้า สักการะสมเด็จองค์ปฐมหลวงพ่อ 5 พี่น้อง (เบญภาคี) และดื่มด่ำชม ชิม ช้อป ที่ตลาดโบราณคลองสวน 100 ปี ศูนย์กลางการค้าที่สำคัญในอดีตที่ยังมีลมหายใจ ราคาท่านละ 1,499 บาท
ทริป 2 วันเสาร์ที่ 14 – วันอาทิตย์ที่ 15 ตุลาคม 2566
พาเที่ยวปากช่อง ท่องฟาร์ม อ.ส.ค. มวกเหล็ก แบบ 2 วัน 1 คืน เส้นทางกรุงเทพ – ปากช่อง – กรุงเทพ วันแรก แวะกราบสักการะพระอนุสาวรีย์รัชกาลที่ 5 ที่ผาเสด็จ ชวนนักท่องเที่ยวไปเยี่ยมการผลิตไฟฟ้าพลังงานน้ำ ณ อุโมงค์ใต้ดินโรงไฟฟ้าลำตะคลองชลภาวัฒนา
ศูนย์การเรียนรู้ กฟผ.ลำตะคลอง ร่วมทำกิจกรรม CSR ปลูกป่าลอยฟ้าสร้างหลังคาสีเขียวให้เมืองโคราช และสัมผัสบรรยากาศยามบ่าย ทุ่งกังหันลมลำตะคลอง วันที่สอง พานักท่องเที่ยวไปสัมผัสบรรยากาศช่วงปลายฝนต้นหนาวที่สวนดอกไม้ Hokkaido Flower Park เขาใหญ่ ถ่ายภาพแปลงดอกไม้ สีสันสดใส อาทิ ทุ่งดอกเวอร์บีน่าสีม่วงละมุน ดอกสร้อยไก่ซีโรเซียโทนสีหวาน ดอกคัตเตอร์ขาว ดอกมากาเรตม่วง และดอกคอสมอสหลากสี ก่อนแวะไปทำกิจกรรม ชิม แชะ ช้อป ที่ฟาร์มโคมนมไทย เดนมาร์ค ราคาท่านละ 3,999 บาท
cms_detail_row
ทริป 3 วันเสาร์ที่ 21 - วันอาทิตย์ที่ 22 ตุลาคม 2566
ชวนเที่ยวฟาร์ม ตระการหนังใหญ่ ชื่นใจภูผา ดาวเกลื่อนฟ้า @ราชบุรี แบบ 2 วัน 1 คืน เส้นทางกรุงเทพ - ราชบุรี - กรุงเทพ วันแรก พาไปสัมผัส “สะพานจุฬาลงกรณ์” สะพานขึงสำหรับรถไฟแห่งแรกในประเทศไทย และเป็นแลนด์มาร์กแห่งใหม่ของจังหวัดราชบุรี ชมหนังใหญ่วัดขนอน ให้อาหารแกะและทำกิจกรรมมากมายในหมู่บ้านชาวฟาร์มสไตล์วินเทจที่ The Scenery Vintage Farm วันที่สอง พาชมตลาดยามเช้าและสัมผัสวิถีชีวิตชาวกระเหรี่ยงที่ “ตลาดโอ๊ะป่อย” พาแช่น้ำพุร้อนโป่งกระทิง ที่อุทยานแห่งชาติเฉลิมพระเกียรติประจัน ชมอุโบสถเปลือกหอย และสักการะพระพุทธเนรมิตและหลวงพ่อใหญ่ แห่งสำนักสงฆ์พุน้ำร้อน ราคาท่านละ 3,999 บาท
ทริป 4 วันเสาร์ที่ 28 - วันอาทิตย์ 29 ตุลาคม 2566
ชวนเที่ยวเมืองโบราณทวารวดี อู่ทอง – นั่งรถราง ฟังเรื่องเก่า เล่าเรื่องเมืองสุพรรณ แบบ 2 วัน 1 คืน เส้นทางกรุงเทพ - สุพรรณบุรี - กรุงเทพ วันแรก พากันไปเรียนรู้วิถีชีวิตและจิตวิญญาณของชาวนาไทย “นาเฮียใช้” ชมพิพิธภัณฑ์แห่งชาติอู่ทอง เรือนลาวโซ่ง สักการะพระพุทธรูปแกะสลักหน้าผาปางโปรดพระมารดาที่ “ผามังกรบิน” เยี่ยมชมลานวัฒนธรรมและชมการแสดงย้อนยุคของคนอู่ทอง วันที่สอง พาชมเมืองสุพรรบุรี ศาลหลักเมืองสุพรรณบุรี วัดพระรูป วัดประตูสาร อุทยานมังกรสวรรค์ แนวคูเมืองโบราณ วัดป่าเลไลย์วรวิหาร เที่ยวตลาดร้อยปี หรือตลาดสามชุก ราคาท่านละ 3,999 บาท
ประชาชนที่สนใจ สำรองที่นั่งได้แล้วตั้งแต่วันนี้ จำนวนจำกัดทริปละ 200 ที่นั่งเท่านั้น จองตั๋วได้ที่สถานีรถไฟทุกแห่ง และช่องทางการจำหน่ายตั๋วในระบบออนไลน์ D-Ticket ของการรถไฟฯ สอบถามข้อมูลเพิ่มเติมได้ที่ศูนย์บริการลูกค้าสัมพันธ์ หมายเลขโทรศัพท์ 1690 ตลอด 24 ชั่วโมง
รายงานผู้ติดเชื้อ 5 มค 2564
- ศบค. ผู้ป่วยรายใหม่ 527 ราย เป็นการติดเชื้อในประเทศ 82 ราย ติดเชื้อในแรงงานต่างด้าวจากการคัดกรองเชิงรุก 439 ราย และอยู่ในสถานกักกันที่รัฐจัดให้ 6 ราย ผู้ป่วยยืนยันสะสม 8,966 ราย หายป่วยแล้ว 4,397 ราย เสียชีวิตสะสม 65 ราย
- ศบค. ยกระดับ 5 จังหวัด สมุทรสาคร ชลบุรี ระยอง จันทบุรี และตราด เป็น "พื้นที่ควบคุมสูงสุดและเข้มงวด" เพิ่มมาตรการคุมการเดินทางให้มากขึ้น
- กาญจนบุรี ผู้ว่าฯ โพสต์ เฟซบุ๊กว่า ได้รับแจ้งจากท่าน นพ.สสจ.ว่า พบผู้ติดเชื้ออีก 2 รายที่ ต.ดอนชะเอม อ.ท่ามะกา รวมขณะนี้ของกาญจนบุรี 4 ราย // ไทยรัฐ
- ตาก แม่สอด พบผู้ติดเชื้อเพิ่ม 2 ราย เป็นชายพม่า 1 และสาวเอนเตอร์เทน 1 ราย สธ.จังหวัด-รพ.แม่สอด // ไทยรัฐ
- กรุงเทพ หอพักนิสิตจุฬาลงกรณ์มหาวิทยาลัย แจ้งว่ามีผู้ได้รับผลการตรวจเชื้อไวรัสโคโรนา 2019 มีผลเป็นบวก จำนวน 1 คน // TNN
- นครราชสีมา พบผู้ติดเชื้อโควิดรายใหม่ 2 ราย มีความสัมพันธ์ เป็น สามี (59) - ภรรยา (55) เดินทางกลับจากเยี่ยมญาติที่จังหวัดสมุทรสาคร รวมสะสม 9 ราย โดยมีจำนวน 2 ราย รักษาหายและอีก 7 ราย รักษาตัวอยู่ที่โรงพยาบาลมหาราช นครราชสีมา ซึ่งมีอาการดีขึ้นและไม่ต้องใส่ท่อช่วยหายใจ // ประชาชาติ
- กรุงเทพ พบมีผู้ติดเชื้อใหม่ 15 ราย เป็นคนไทย 13 ราย ลาว 1 ราย เมียนมา 1 ราย รวมยอดสะสม 245 ราย // ประชาชาติ
- สุรินทร์ ได้รายงานว่า พบมีผู้ป่วยยืนยันโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) เพิ่มอีก 1 ราย เป็นชาวอำเภอกาบเชิง ซึ่งเดินทางมาจากจังหวัดสมุทรสาคร เมื่อวันที่ 28 ธันวาคม 2563 และตรวจพบเชื้อในวันที่ 2 มกราคม 2564 ขณะนี้ ได้เข้ารับการรักษาที่โรงพยาบาลกาบเชิง สำหรับข้อมูลระหว่างวันที่ 1 ธันวาคม 2563 ถึง 4 มกราคม 2564 พบผู้ป่วยเข้าเกณฑ์สอบสวนโรค (PUI) รายใหม่ 16 ราย สะสม 332 ราย ไม่พบชื้อ 304 ราย รอผลการตรวจ 26 ราย โดยมีผู้ป่วยติดเชื้อไวรัสโควิด-19 รวมเป็น 3 ราย // Bangkok Biz News
- ชลบุรี สสจ.ชลบุรี เผยพบผู้ป่วยเพิ่ม 50 ราย ทำให้มีผู้ป่วยสะสมรวม 390 ราย ในพื้นที่ 6 อำเภอ ได้แก่ อ.เมือง 29 ราย, อ.บางละมุง 200 ราย, อ.ศรีราชา 121 ราย ,อ.พนัสนิคม 5 ราย ,อ.สัตหีบ 10 ราย, อ.บ้านบึง 12 ราย // Bangkok Biz News
- สุราษฎร์ธานี พบติดเชื้อ โควิด-19 เพิ่มอีก 2 ราย จากครอบครัวเดียวกัน ทำให้ครอบครัวนี้มีผู้ติดเชื้อรวม 9 ราย ส่งผลทำให้ยอดสะสมของจังหวัดสุราษฎร์ธานีมีผู้ป่วยโควิดขณะนี้ 10 ราย // Bangkok Biz News
- นนทบุรี พบผู้ป่วยโควิด-19 เพิ่ม 5 ราย รวมยอดป่วยสะสม รอบใหม่ 112 คน // ไทยรัฐ
- สมุทรสาคร พบผู้ป่วยยืนยันรายใหม่ 67 ราย แบ่งเป็นคนไทย 20 ราย และต่างด้าว 47 ราย รวมยอด สะสม 2,938 ราย // ประชาชาติ
- เพชรบุรี พบผู้ติดเชื้อรายใหม่อีก 1 ราย เป็นเพศหญิง อายุ 48 ปี ชาวห้วยข้อง อำเภอบ้านลาด อาชีพรับจ้างทำงานโรงงานปลากระป๋อง จังหวัดสมุทรสาคร มีประวัติเดินทางมาจากพื้นที่เสี่ยงสูง รายที่พบนี้มาจากการตรวจคัดกรองบุคคลกลุ่มเสี่ยง จำนวน 6,487 ราย ผลการตรวจไม่พบเชื้อ จำนวน 5,046 ราย กำลังรอผล 1,417 ราย รวมยอดสะสมผู้ติดเชื้อรวม 24 ราย รักษาหาย 2 ราย ยังคงรักษาอยู่ 22 ราย // ประชาชาติ
- อ่างทอง พบผู้ป่วยเพิ่ม 13 ราย ยอดสะสมรวม 57 ราย ส่วนใหญ่อยู่ในกลุ่มที่เกี่ยวข้องกับสนามชนไก่ // MGR Online
- นครปฐม พบผู้ป่วยใหม่ 2 ราย รวมยอดผู้ป่วยสะสมเป็น 68 ราย พักรักษาตัวในโรงพยาบาลจำนวน 48 ราย รักษาหายแล้ว 20 ราย สำหรับผู้ป่วยรายใหม่ คือ รายที่ 67 เพศชาย อายุ 15 ปี อาศัยอยู่ที่ ต.ลำลูกบัว อ.ดอนตูม ส่วนรายที่ 68 เพศหญิง อายุ 35 ปี อาศัยอยู่ที่ ต.ไร่ขิง อ.สามพราน // MGR Online
- เชียงใหม่ พบผู้ติดเชื้อโควิด-19 เพิ่ม 1 ราย เป็นรายที่ 51 เป็นชาย ชาวไทยใหญ่ อายุ 28 ปี ทำงานที่ร้านวอร์มอัพ มา 4 ปี โดยในวันที่ 31 ธ.ค. 2563 ที่ผ่านมาได้ ทำงานที่ร้านวอร์มอัพ โซนเดียวกับที่ผู้ป่วยรายที่ 50 ไปใช้บริการ ขณะนี้ได้ส่งตัวมารักษาที่รพ.นครพิงค์แล้ว // โรงพยาบาลนครพิงค์
รายงานผู้ติดเชื้อ 4 มค 2564
- ศบค. แถลง "ยอดผู้ติดเชื้อโควิด-19 วันนี้" ไทยพบผู้ติดเชื้อรายใหม่เพิ่ม 745 ราย ยอดผู้ป่วยสะสม 8,439 ราย ติดเชื้อภายในประเทศ 729 คน เสียชีวิต เพิ่ม 1 ราย // ศูนย์ข้อมูล COVID-19
- สุราษฎร์ธานี แถลงพบผู้ป่วยโควิด-19 เพิ่มอีก 7 ราย โดยส่วนใหญ่พบว่าเป็นชาว จ.สมุทรสาคร เดินทางมา จ.สุราษฎร์ธานี ตั้งแต่วันที่ 28 ธ.ค.ที่ผ่านมา // BangkokBizNews
- กรุงเทพ ยอดผู้ติดเชื้อโควิด เพิ่มอีก 27 ราย แบ่งเป็น เพศชาย 6 ราย เพศหญิง 21 ราย มีอาการป่วย 22 ราย และไม่มีอาการ 5 ราย ติดจากในประเทศทั้งหมด รวมติดเชื้อสะสม 244 ราย // ประชาชาติ
- สุพรรณบุรี รายงาน พบติดเชื้อเพิ่ม 1 ราย (อ.บางปลาม้า) ชายไทย อายุ 66 ปี เกี่ยวข้องกับสนามชนไก่ สะสมรวม 11 ราย (อ.สองพี่น้อง 10 ราย อ.บางปลาม้า 1 ราย) // สำนักงานประชาสัมพันธ์จังหวัดสุพรรณบุรี
- นนทบุรี มีคำสั่ง ปิดสถานที่และอาคารพาณิชย์ รอบตลาดบางบัวทอง ตั้งแต่ 4-12 ม.ค. รวมถึงปิดสถานศึกษา จนถึง 31 ม.ค. // ประชาชาติ
- ชัยนาท คุมเข้ม ออกคำสั่งบุคคลใดเดินทางจากพื้นที่ควบคุมสูงสุด ต้องแสดงหนังสือรับรองสุขภาพไม่ติดโควิด อายุไม่เกิน 72 ชั่วโมง // ประชาชาติ
- นครราชสีมา ผู้ว่าฯ ออกประกาศมาตรการเฝ้าระวัง ป้องกัน และควบคุม โควิด-19 สำหรับผู้พักอาศัยในโคราชที่เดินทางกลับจากพื้นที่ควบคุมสูงสุด(สีแดง)ทุกคนต้องกักตัว 14 วัน ที่บ้าน // ประชาชาติ
- ชลบุรี ออกประกาศพื้นที่เสี่ยง 60 แห่ง ระบุหากประชาชนเดินทางไปแล้วมีอาการป่วยให้รีบกักตัว-พบแพทย์ // BangkokBizNews
- ชลบุรี ล็อกดาวน์ "เกาะล้าน" ตั้งแต่ 5-20 ม.ค. 64 แจ้งนักท่องเที่ยวออกจากเกาะภายในวันนี้ (4 ม.ค.) พร้อมออกมาตรการคุมเข้มขั้นสูงสุด ห้ามออกจากบ้าน 4 ทุ่ม-ตี 5 งดเดินทางของคนในพื้นที่ทั้งหมด 100% // BangkokBizNews
- กรุงเทพ มีคำสั่งให้ร้านอาหารทุกประเภทในทุกพื้นที่กทม. สามารถให้ลูกค้านั่งทานในร้านเวลา 06.00-19.00 น. ส่วนเวลาหลังจากนั้น 19.01-05.59 น.ให้ลูกค้าสั่งกลับบ้านเท่านั้น ทั้งนี้ คำสั่งดังกล่าวเริ่มมีผลบังคับใช้พรุ่งนี้ (5 ม.ค.) // BangkokBizNews
- สมุทรสงคราม โควิดเพิ่ม 22 ราย เปิดไทม์ไลน์ผู้ป่วยรายที่ 21 มาจากสมุทรสาคร // ไทยรัฐ
- ประจวบคีรีขันธ์ พบผู้ป่วยรายที่ 1 เป็นหญิง อายุ 61 ปี ผลตรวจห้องปฏิบัติการวันที่ 2 มค 64 พบติดเชื้อวันที่ 3 มค 64
- พิจิตร พบ 3 ราย เป็นครอบครัวเดียวกัน เป็นพ่ออายุ 81 ปี แม่อายุ 83 ปี ลูกชายอายุ 53 ปี ติดเชื้อจากชายอีกคนซึ่งเดินทางจากสมุทรสาครมาเยี่ยมบ้านพร้อมภรรยาและลูก เมื่อวันที่ 18 ธ.ค .63 กลับ 19 ธ.ค.63 // MGR online
- เพชรบุรี พบ 1 ราย หญิง สัญชาติไทย อายุ 62 ปี
- นครปฐม พบ 2 ราย เป็นชาย สัญชาติไทย อายุ 43 และ 44 ปี
- นนทบุรี พบผู้ป่วยยืนยันเพิ่ม 8 คน ผู้ป่วยยืนยันสะสม รอบใหม่ 107 คน // ศูนย์ข้อมูล COVID-19 นนทบุรี
- ปทุมธานี พบ 9 ราย เป็นสัญชาติไทย 2 เมียนมา 7 เป็นชาย 6 หญิง 3
- สมุทรปราการ พบผู้ป่วยรายใหม่ จำนวน 20 ราย ผู้ป่วย 19 ราย เป็นผู้ป่วยในพื้นที่จังหวัดสมุทรปราการ และอีก 1 เป็นผู้ป่วยรับส่งต่อมารักษา ที่โรงพยาบาลเอกชนในจังหวัดสมุทรปราการ // กลุ่มงานควบคุมโรคติดต่อ สำนักงานสาธารณสุขจังหวัดสมุทรปราการ
- ระยอง พบผู้ป่วยใหม่จากการค้นหาเชิงรุกจำนวน 42 ราย เป็นคนไทยทั้งหมด ยืนยันสะสม 428 ราย // ศูนย์โควิด19จังหวัดระยอง
- กรุงเทพ เจ็ทส์ ฟิตเนส (ประเทศไทย) ได้รับการยืนยันว่ามีพนักงานจำนวน 1 คน ติดเชื้อโควิด-19 เมื่อวันที่ 3 ม.ค. 64 พนักงานดังกล่าวมีอาการไม่สบายตั้งแต่วันที่ 31 ธันวาคม ปัจจุบันได้เข้ารับการรักษาอยู่ที่โรงพยาบาลแล้ว
- กรุงเทพ กลุ่มทรู รายงานว่า มีพนักงานบริษัทในเครือทรู คอร์ปอเรชั่น จำนวน 1 ราย ปฏิบัติหน้าที่ในส่วนสนับสนุน วิเคราะห์ข้อมูล มิได้เกี่ยวข้องกับการให้บริการลูกค้าแต่อย่างใด เข้ารับการรักษาตัวในโรงพยาบาลแล้ว // Nation TV
- น่าน พบผู้ติดเชื้อโควิด - 19 รายแรก เป็นหญิงชาวลาว อายุ 23 ปี เดินทางกลับจากพรานนก พื้นที่เชื่อมต่อกรุงเทพ - นครปฐม พร้อมเพื่อน จำนวน 5 คน มาเยื่ยมลูกที่ อ.นาหมื่น จ.น่าน ผลตรวจยืนยัน 2 แล็บ ว่าติดเชื้อโควิด - 19 ขณะนี้รักษาตัวที่โรงพยาบาลจังหวัดน่าน ส่วนผู้ร่วมเดินทาง 4 คน ผลตรวจเป็นลบ // สำนักประชาสัมพันธ์เขต 3 กรมประชาสัมพันธ์
- สิงห์บุรี พบผู้ป่วยแล้ว จำนวน 3 คน เป็นชาย สัญชาติไทย อ.พหรบุรี 2 คน อ.ท่าช้าง 1 คน จากการค้นหาเชิงรุก ปัจจุบันมีผู้ที่มารายงานตัวตรวจเชื้อทั้งหมด 73 รายพบผู้ติดเชื้อโควิด-19 จำนวน 3 ราย และยังรอผลการตรวจอีกจำนวน 36 ราย // สาธารณสุขจังหวัดสิงห์บุรี
- สมุทรสาคร รายงานสถานการณ์โควิด-19 พบผู้ป่วยรายใหม่เพิ่มขึ้น 470 ราย เป็นผู้ป่วยจากการค้นหาเชิงรุก 439 ราย จำแนกเป็นชาวไทย 49 ราย ต่างด้าว 390 ราย และในโรงพยาบาลอีก 31 ราย จำแนกเป็นคนไทย 25 ราย ต่างด้าว 6 ราย รวมมียอดผู้ป่วยสะสมทั้งสิ้น 2,871 ราย จำแนกเป็นจากการค้นหาเชิงรุก 2,384 ราย และตรวจค้นพบในโรงพยาบาลอีก 487 ราย // ไทยรัฐ
- ชลบุรี รายงานสถานการณ์ "โควิด-19" ประจำวันนี้ โดยพบผู้ป่วยยืนยันรายใหม่ 35 ราย เป็นเพศชาย 14 ราย เพศหญิง 21 ราย // ไทยรัฐ
- เชียงใหม่ พบผู้ติดเชื้อโควิด -19 รายที่ 50 โดยพบว่าผู้ป่วยโควิด-19 เป็นเพศหญิง อายุ 25 ปี ภูมิลำเนา อ.เมือง จ.เชียงใหม่ // เชียงใหม่นิวส์ Chiang Mai News ข่าวเชียงใหม่
รายงานผู้ติดเชื้อ 3 มค 2564
- ศบค. แถลงสถานการณ์ระบาดของไวรัส โควิด-19 ประจำวันว่า พบผู้ติดเชื้อรายใหม่ 315 ราย ประกอบด้วย ผู้ติดเชื้อในประเทศ 274 ราย ผู้ติดเชื้อในแรงงานต่างด้าวโดยคัดกรองเชิงรุก 20 ราย ส่วนผู้ที่เดินทางมาจากต่างประเทศเข้าสถานกักกันที่รัฐจัดให้ (Quarantine Facilities) 21 ราย // TNN
- กรุงเทพ สมาคมผู้ค้าปลีกไทยและสมาคมศูนย์การค้าไทย มีข้อสรุปให้ทุกศูนย์การค้า รวมถึงร้านค้าในศูนย์การค้าและร้านค้าภาคี เครือข่ายยกระดับมาตรการการคัดกรองและเข้มงวดความปลอดภัยสุขอนามัย และ สรุปให้ทุกศูนย์การค้ากำหนดปิดทำการเวลา 21.00 น. นับตั้งแต่วันที่ 4 มค 64 เป็นต้นไป // TNN
- จันทบุรี พบผู้ป่วยโควิดรายใหม่อีก 68 ราย มีความเกี่ยวโยงบ่อนพนัน-มวยตู้ // ประชาชาติ
- สมุทรสาคร มีผู้ป่วยรายใหม่เพิ่มขึ้น 541 ราย เป็นผู้ป่วยจากการค้นหาเชิงรุก 541 รายเป็นชาวไทย 57 ราย ต่างด้าว 448 ราย ผู้ป่วยที่มาโรงพยาบาลเอง 36 ราย โดยเป็นชาวไทย 29 ราย ต่างด้าว 7 ราย รวมผู้ป่วยยืนยันยันสะสม 2,401 ราย // NationTV
- กรุงเทพ ติดเชื้อเพิ่ม 19 ราย จากสมุทรสาคร ระยอง แหล่งอื่น ๆ สถานบันเทิง อาชีพเสี่ยง สถานที่แออัด ทำยอดพุ่ง 217 ราย // ประชาชาติ
- ระยอง พบผู้ติดเชื้อโควิด-19 เพิ่มขึ้น 43 ราย เป็นคนไทย 42 ราย และต่างชาติ 1 ราย ส่งผลให้มีผู้ป่วยสะสม 386 ราย พบผู้ป่วยมากที่สุดในอ.เมืองระยอง ล่าสุดพบผู้ป่วยรายใหม่ใน อ.ปลวกแดง // NationTV
- ชลบุรี พบผู้ติดเชื้อรายใหม่ 62 ราย บ่งเป็บพบที่อำเภอศรีราชา 50 ราย ,อำเภอบางละมุง 7 ราย ,อำเภอเมืองชลบุรี 2 ราย, อำเภอบ้านบึง 2 ราย และอำเภอเมืองระยอง 1 ราย รวมยอดสะสม 305 ราย // ประชาชาติ
- อ่างทอง พบผู้ป่วยรายใหม่ 18 ราย เป็นการค้นหาเชิงรุก 17 ราย และในโรงพยาบาล 1 ราย รวมผู้ป่วยยืนยันสะสมของจังหวัดอ่างทอง 30 ราย // ไทยรัฐ
- ลำปาง พบผู้ติดเชื้อ COVID-19 รายใหม่ จำนวน 2 ราย ชายไทย อายุ 33 ปี หญิงไทยอายุ 24 ปี ซึ่งขณะนี้รักษาตัวอยู่ที่โรงพยาบาล // สวท.ลำปาง
- อำนาจเจริญ พบผู้ป่วย 1 ราย รวมสะสม 4 ราย กำลังรักษา 2 ราย หายแล้ว 2 ราย // สสจ.อำนาจเจริญ
รายงานผู้ติดเชื้อและสถานการณ์ 2 มค 2564
- บุรีรัมย์ กรมท่าอากาศยานแจ้งให้ผู้โดยสาร เส้นทาง จากกรุงเทพฯ -บุรีรัมย์ ตั้งแต่ 2 ม.ค. เป็นต้นไป ต้องกักตัว14 วัน ตามประกาศจังหวัด // MGR online
- สมุทรสาคร รายงานว่านางชุติพร วิจิตร์แสงศรี นายกเหล่ากาชาดจังหวัดสมุทรสาคร ภรรยาของนายวีระศักดิ์ วิจิตร์แสงศรี ผู้ว่าราชการจังหวัดสมุทรสาคร ได้เข้ารับการตรวจหาเชื้อโควิด 19 ครั้งแรกเมื่อวันที่ 27 ธันวาคม 2563 พร้อมกับนายวีระศักดิ์ แต่ไม่พบเชื้อ กระทั่งต่อมาเมื่อวันที่ 31 ธันวาคม 2563 ได้เข้ารับการตรวจหาเชื้อโควิด 19 ซ้ำอีกครั้ง ที่โรงพยาบาลสมุทรสาคร แล้วพบว่ามีเชื้อโควิด 19 ในร่างกาย // TNN
- ปทุมธานี ผู้ว่าฯ ลงนามคำสั่งเรื่อง ปิดสถานที่ซึ่งมีโอกาสเสี่ยงต่อการแพร่ระบาดและมาตรการควบคุมและป้องกันการแพร่ระบาดของโควิด-19 โดยสถานที่ ที่ถูกสั่งปิดชั่วคราว อาทิ สนามชนไก่ สนามกัดปลา สนามกีฬาในร่ม โรงยิม สถานที่ออกำลังกาย ฟิตเนส สนามมวย โต๊ะสนุกเกอร์ ร้านสัก ร้านนวดแผนโบราณ ร้านเกมส์ สวนสนุก ตู้เกมส์ หรือเครื่องเล่นเกมส์ทุกประเภท ร้านเกมส์และร้านอินเทอร์เน็ต สระว่ายน้ำ สวนน้ำ ศูนย์พระเครื่อง บ่อตกกุ้ง บ่อปลาฯลฯ พร้อมกันนี้ยังห้ามชุมนุม ทำกิจกรรมมั่วสุม ณ ที่ใดๆในสถานที่แออัด และห้ามเคลื่อนย้ายแรงงานต่างด้าว เข้า-ออก พื้นที่จังหวัดปทุมฯ ซึ่งผู้ใดฝ่าฝืนจะต้องระวางโทษจำคุกไม่เกิน 1 ปี หรือปรับไม่เกิน 1 แสนบาท หรือทั้งจำและปรับ มีผล 2-15 ม.ค.64 // TNN
- ระยอง ผู้ว่าฯ กล่าวว่า ยอดผู้ติดเชื้อโควิดของวันที่ 31 ธ.ค. 63 พบผู้ติดเชื้อโควิด-19 เพิ่มอีก 37 ราย รวมผู้ติดเชื้อทั้งหมด 316 ราย และมีกลุ่มเสี่ยงคือผู้โดยสารที่ขึ้นรถมินิบัส 10-3457 สาย บขส. เก่าสนามบินอู่ตะเภา ช่วงวันที่ 18-30 ธ.ค.63 และผู้ที่เข้าร้านต้นหมูกะทะ อำเภอเมืองระยอง เมื่อวันที่ 17-29 ธ.ค.63 ให้เข้ารายงานตัวกับเจ้าหน้าที่สาธารณสุข เนื่องจากพบว่าพนักงานขับรถ เจ้าของร้าน หมูกะทะ พนักงานล้างจานและแขกติดโควิด ประกาศให้ผู้ที่ไปในจุดดังกล่าวในวันที่แจ้งเข้ามาตรวจหาเชื้ออย่างเร่งด่วน ซึ่งหลังจากพบว่าสถานที่ดังกล่าวเป็นจุดเสี่ยง เจ้าหน้าที่ได้เข้าไปทำความสะอาดฆ่าเชื้อโรคกักตัวกลุ่มเสี่ยงทั้งหมดแล้ว // TNN
- ราชบุรี รายงาน พบผู้ป่วยยืนยันรายใหม่ 5 ราย เป็นครอบครัวเดียวกัน นับเป็นรายที่ 12-16 // ประชาชาติ
- เชียงใหม่ ได้รับรายงานพบผู้ติดเชื้อโควิด-19 เพิ่มอีก 2 ราย (รายที่ 48 และ 49 ของจังหวัดเชียงใหม่) เป็นชายชาวญี่ปุ่น 2 คน อายุ 59 ปี และ 64 ปี // ประชาชาติ
- ระยอง ธนาคารกรุงไทย สั่งงดให้บริการ สาขาระยอง หลังพบพนักงานติดเชื้อโควิด 4 ราย มีต้นตอจาก เทรนเนอร์ฟิตเนส // ประชาชาติ
- นนทบุรี ศูนย์ข้อมูล COVID-19 นนทบุรี รายงานสถานการณ์ การติดเชื้อไวรัสโควิดในจังหวัด ล่าสุดพบผู้ป่วยยืนยันเพิ่มอีก 7 ราย ทำให้ตอนนี้มียอดผู้ป่วยสะสมรอบใหม่อยู่ที่ 97 ราย รวมผู้ป่วยยืนยันสะสม ทั้งหมด 213 ราย ซึ่งทั้งหมดกำลังรักษาตัวอยู่ในโรงพยาบาล โดยมีผู้ป่วยรักษาหายแล้ว 116 ราย เสียชีวิตสะสม 2 ราย โดยผู้ป่วยทั้ง 7 ราย ที่เพิ่มขึ้นวันนี้ มีความสัมพันธ์เกี่ยวข้องกับตลาดบางใหญ่ทุกราย
รายงานผู้ติดเชื้อ 1 มค 2564
- นครปฐม ผู้ว่าฯ ประกาศ 6 ตำบลในอำเภอ ‘นครชัยศรี-กำแพงแสน-บางเลน’ เป็นพื้นที่ควบคุมสูงสุด ตั้งแต่ 31 ธค 63 จนกว่าจะมีคำสั่งเปลี่ยนแปลง
- นครปฐม พบผู้ป่วยโควิด-19 เพิ่มอีก 2 ราย รายที่ 61 เพศชาย อายุ 43 ปี ต.บ่อพลับ อ.เมือง รายที่ 62 เพศหญิง อายุ 46 ปี ต.บ่อพลับ อ.เมือง รวมยอดผู้ป่วยสะสมรอบใหม่อยู่ที่ 62 ราย // TNN
- สระแก้ว พบผู้ติดเชื้อแล้ว 2 ราย เป็นชายวัย 33 ปี อาชีพไม่แน่ชัด แต่ประวัติแน่นเล่นพนันหลายพื้นที่ ส่วนอีกรายชายวัย 26 ปี อาชีพทำไร่ มีประวัติเชื่อมโยงผู้ติดเชื้อรายแรก เพราะไปบ่อนด้วยกัน พักอยู่ในตำบลเดียวกันเพียงแต่อยู่คนละหมู่บ้าน // MGR online
- ลำพูน พบผู้ติดเชื้อแล้ว 1 ราย เป็นผู้พักอาศัยอยู่พื้นที่ตำบลแม่ตืน อำเภอลี้ เดินทางไปพื้นที่เสี่ยงจังหวัดระยอง และเข้ามาในจังหวัดลำพูน เมื่อวันที่ 23 ธันวาคม 2563 เพื่อการควบคุมการแพร่กระจายของเชื้ออย่างรวดเร็วและมีประสิทธิภาพ จึงขอให้ประชาชนที่ใช้บริการดังต่อไปนี้ เฝ้าระวังสังเกตอาการและเข้ารับการตรวจคัดกรองหาเชื้อโควิด 19 // ประชาชาติ
- สมุทรสาคร พบผู้ติดโควิดรายใหม่พุ่ง 67 ราย เผยเป็นแรงงานต่างด้าวถึง 45 ราย รวมยอดทะลุ 1,805 ราย // ประชาชาติ
- กรุงเทพ ศบค. ผู้ติดเชื้อโควิดวันนี้ (1 ม.ค.) ทำสถิติใหม่พุ่ง 279 ราย เสียชีวิตเพิ่ม 2 ราย
- กรุงเทพ การพบผู้ติดเชื้อแบบกลุ่มในสถานบันเทิงร้านอาหารในกทม.วันนี้ พบผู้ป่วยเพิ่มอีก 5 คน รวมเป็น 49 คน จากการตรวจคัดกรองทั้งหมดรวม 374 คนรายงานผู้เสียชีวิต 2 ราย 1) สำหรับผู้เสียชีวิตรายที่ 62 เป็นชายไทย อายุ 44 ปี มีประวัติอ้วน วันที่้ 20 ธ.ค. เที่ยวร้านอาหารกึ่งบาร์ในกทม. วันที่ 26 ธ.ค. มีไข้ น้ำมูก วันที่ 28 เหนื่อยหอบ วันที่ 30 ธ.ค. รู้สึกเหนื่อย ไปตรวจที่ รพ.เจริญกรุงประชารักษ์ หายใจเหนื่อยหอบ ออกซิเจนต่ำ ส่งicu เพื่อใส่ท่อช่วยหายใจ ทำให้ใช้เวลานาน ในการใส่ท่อช่วยหายใจ เวลา 22.00 น. ผลตรวจพบเชื้อโควิด วันที่ 31 ธ.ค. ผู้ป่วยอาการไม่ดีขึ้น หายใจล้มเหลว ส่งต่อไปที่ รพ.จุฬา เวลาประมาณ 15.00 น.เสียชีวิต มีผู้เสี่ยงสูงในครอบครัว 7 คน ในรพ. 6 คน
รายที่ 63 เป็นชายไทย อายุ70 ปี อ.แม่สอด จ.ตาก เป็นผู้ป่วยที่เคยรายงานแล้ว ลักลอบเดินทางเข้าประเทศ เมื่อวันที่ 29 พ.ย. มีลูกเขยดูแล วันที่ 2 ธ.ค. ลูกสาวกลับมาจาก กทม.ดูแล วันที่ 4ธ.ค. เหนื่อยเรียก รถรพ.เอกชนมารับ ไม่ดีขึ้น ส่งรพ.รัฐ วันที่ 31 ธ.ค. รักษาโควิดครบแล้ว แต่ปอดอักเสบ ระบบทางเดินหายใจล้มเหลว เสียชีวิต เวลา 22.00 น. // ประชาชาติ
- กรุงเทพ ประกาศขยายเวลาปิด โรงเรียนในสังกัด กทม. เพิ่มเติม ถึง 17 ม.ค. 2564 // ประชาชาติ
- ชลบุรี พบผู้ติดโควิดรายใหม่อีก 51 ราย รวมยอดทะลุ 211 ราย // ประชาชาติ
- ระยอง พบโควิดใหม่ 37 ราย รวมยอดทะลุ 316 ราย ผู้ว่าฯ เผยวานนี้ ยังจับบ่อนไฮโล-ชนไก่ หวั่นแพร่โรคพุ่ง // ประชาชาติ
- นนทบุรี ออกประกาศ สั่งปิดตลาดอีก 2 แห่ง คือ ตลาดเทศบาลเมืองบางบัวทอง และตลาดพิชัย อ.ปากเกร็ด มีผลตั้งแต่วันที่ 1-4 ม.ค.2564 พร้อมให้ผู้ค้าทั้ง 2 ตลาดเข้าตรวจหาเชื้อโควิด-กักตัว
- ชัยนาท ตรวจพบผู้ป่วยโรคโควิด – 19 เพิ่มอีก 1 คน เป็นวิศวกรของบริษัทในจังหวัดสมุทรสาคร เพศหญิง อายุ 27 ปี อยู่อาศัยใน ตำบลโพนางดำตก อำเภอสรรพยา จังหวัดชัยนาท ปัจจุบันรักษาตัวอยู่ที่ โรงพยาบาลชัยนาทนเรนทร โดยเดินทางมาจากจังหวัดสมุทรสาคร เมื่อวันที่ 30 ธันวาคม 2563 // TNN
- สุพรรณบุรี แจ้งว่า พบผู้ป่วยเพิ่มอีก 1 ราย เป็นเด็กหญิงวัย 1 ปี 3 เดือน โดยรายนี้อยู่ที่อ.สองพี่น้อง จ.สุพรรณบุรี ได้รับการรักษาตัวที่ รพ.สมเด็จพระสังฆราชองค์ที่ 17 รวมผู้ป่วยสะสมในพื้นที่ อ.สองพี่น้อง จ.สุพรรณบุรี อยู่ที่ 10 รายแล้ว // TNN
- ตราด พบผู้ติดเชื้อโควิด-19 เพิ่มอีก 7 ราย เชื่อมโยงมาจากสถานที่ลักลอบเล่นการพนันในพื้นที่ ต.แสนตุ้ง อ.เขาสมิง จ.ตราด // ไทยรัฐ
- จันทบุรี พบผู้ติดเชื้อโควิด-19 รวม 44 ราย รอยืนยันผลอีก 10 ราย ผู้ป่วยกระจายทั่วเกือบทุกอำเภอ และมีติดเชื้อจากในจังหวัดแล้ว // ไทยรัฐ
- ราชบุรี พบผู้ติดเชื้อเพิ่ม 1 ราย หญิง อายุ 44 ปี ชาวอ. บางแพ // Covid-19 ราชบุรี
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศจุดฉีดวัคซีน เมษายน-พฤษภาคม
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ประกาศตั้งจุดออกให้บริการวัคซีนป้องกันโรคพิษสุนัขบ้า
เริ่มให้บริการตั้งแต่ 17.00 น. - 19.00 น.
- กรุณาเตรียมบัตร ปชช. ก่อนเข้ารับบริการ
- สุนัขและแมวตั้งมีอายุมากกว่า 3 เดือนขึ้นไป ไม่ป่วย และอยู่ช่วงระหว่างตั้งท้อง
รายงานผู้ติดเชื้อ 31 ธค 2563
- ศบค. เผยผู้ติดเชื้อโควิดรายใหม่วันนี้( 31 ธ.ค.) 194 ราย เป็นการติดเชื้อในประเทศ 181 ราย
- กรุงเทพ กพท. ออกประกาศ 1) ห้ามไม่ให้รับประทานอาหารและเครื่องดื่มในระหว่างการปฏิบัติการบิน ในกรณีที่มีเหตุฉุกเฉินหรือจำเป็น ลูกเรืออาจพิจารณาจัดน้ำดื่มให้บริการแก่ผู้โดยสารได้ ทั้งนี้ ให้กระทำในพื้นที่ที่ห่างจากผู้โดยสารคนอื่นให้มากที่สุดเท่าที่จะเป็นได้ 2) งดการให้บริการหนังสือพิมพ์ นิตยสาร หรือแผ่บพับโฆษณาต่าง ๆ สำหรับผู้โดยสาร ยกเว้น เอกสารที่เกี่ยวข้องกับความปลอดภัยเท่านั้น ในกรณีที่มีการออกระเบียบ หลักเกณฑ์ แนวปฏิบัติ หรือมาตรการซึ่งหน่วยงานของรัฐที่รับผิดชอบได้กำหนดขึ้นเพื่อป้องกันการแพร่ระบาดของโรคโควิด-19 ให้ผู้ดำเนินการเดินอากาศปฏิบัติตามอย่างเคร่งครัด // สำนักงานการบินพลเรือน แห่งประเทศไทย
- กรุงเทพ พบผู้ติดเชื้อโควิด-19 เพิ่ม 17 ราย รวมพบผู้ติดเชื้อ ตั้งแต่วันที่ 20-30 ธ.ค. 2563 รวมทั้งสิ้น 125 ราย เป็นคนต่างจังหวัดที่ admit โรงพยาบาลในพื้นที่ กทม. จำนวน 35 ราย // ประชาชาติ
- นครปฐม พบป่วยยืนยัน รายใหม่ 2 ราย ทั้งนี้ ผู้ป่วยรายใหม่ รายที่ 59 เพศหญิง อายุ 20 ปี ต.ไร่ขิง อ.สามพราน และรายที่ 60 เพศหญิง อายุ 47 ปี ต.บ้านใหม่ อ.สามพราน รวมยอดผู้ป่วยสะสมเป็น 60 ราย โดยพักรักษาตัวในโรงพยาบาลทั้งหมด // ประชาชาติ
- กาญจนบุรี แถลงข่าวการตรวจพบผู้ป่วยติดเชื้อไวรัสโคโรนา 2019 ของจังหวัดกาญจนบุรีเป็นรายแรก จำนวน 1 ราย โดยผู้ป่วยรายดังกล่าวเป็นนักศึกษาหญิง ซึ่งมีภูมิลำเนาอยู่ที่จังหวัดระยอง // TNN Thailand
- ระยอง ผู้ว่าฯ เปิดเผยสถานการณ์ผู้ติดเชื้อรายใหม่ 77 ราย รวมยอดตัวเลขผู้ติดเชื้อสะสม 279 ราย เสียชีวิตสะสม 1 ราย // ประชาชาติ
- จันทบุรี แถลงพบผู้ป่วยเพิ่ม 15 ราย และรอยืนยันผลตรวจอีก 29 ราย (คนไทย 10 คน แรงงานต่างด้าว 19 คน // ประชาชาติ
- นนทบุรี พบผู้ป่วยโควิดยืนยันเพิ่มขึ้นอีก 21 ราย รวมผู้ป่วยยืนยันสะสม รอบใหม่ 58 คน ผู้ป่วยยืนยันสะสมทั้งหมด 174 คน รักษาหายแล้ว 114 คน เสียชีวิตสะสม 2 รายอยู่ในโรงพยาบาล 58 คน โดยผู้ป่วยยืนยันที่เพิ่มขึ้น 21 ราย เกี่ยวข้องกับพื้นที่ตลาดกลางบางใหญ่
- สมุทรสาคร ติดเชื้อโควิดเพิ่มอีก 104 ราย เฉพาะคนไทยติดเชื้อพุ่ง 93 ราย รวมยอดสะสมผู้ป่วย 1738 รายสั่งปิดสถานที่เสี่ยงห้าง-รร.ถึง 15ม.ค.64 // ประชาชาติ
- หนองคาย พบผู้ป่วยรายแรกของการระบาดรอบบนี้แล้ว เป็นหญิงอายุ 35 ปี ชาวตำบลกุดบง อ.โพนพิสัย มีอาชีพขายอาหารทะเลที่กรุงเทพ โดยใช้รถส่วนตัวไปรับอาหารทะเลจากตลาดทะเลไทย // MGR online
- อ่างทอง พบอีกรายเป็นชายต่างชาติวัย 39 ปี ติดโควิด-19 ทำงานในตลาดแห่งหนึ่ง เจ้าหน้าที่สอบสวนโรคนำภรรยาที่เป็นคนไทยไปตรวจเพิ่ม ทม.อ่างทองเร่งพ่นยาฆ่าเชื้อ รวมยอดถึงวันนี้ 2 ราย // MGR online
รายงานผู้ติดเชื้อ 30 ธันวาคม 2563
- อังกฤษ อังกฤษเป็นประเทศแรกที่ได้อนุมัติการใช้วัคซีนป้องกันโควิด-19 ของบริษัท “แอสตราเซเนกา พีแอลซี ” (AstraZeneca Plc) ที่ได้ร่วมผลิตกับ “มหาวิทยาลัยออกซ์ฟอร์ด” โดยจะเริ่มการฉีดวัคซีนตั้งแต่วันที่ 4 ม.ค. เป็นต้นไป
- ระยอง ผู้ว่าฯ ประกาศยกระดับพื้นที่ควบคุมสูงสุด ห้ามแรงงานชาวไทย ขอให้งดเดินทางกลับภูมิลำเนา // ประชาชาติ
- สมุทรสาคร มีผู้ป่วยติดเชื้อรายใหม่เพิ่มอีก 1 ราย เป็นชายวัย 50 ปี ชาว ต.แม่กลอง อ.เมือง จ.สมุทรสงคราม รับจ้างเข็นผักตลาดแม่พ่วง จังหวัดสมุทรสาคร รวมยอดผู้ติดเชื้อสะสมตั้งแต่วันที่ 17-29 ธันวาคม 2563 รวม 19 ราย // มติชน
- กรุงเทพ ศบค. รายงานตัวเลขสถานการณ์ผู้ติดเชื้อโควิด-19 ประจำวันว่า มีผู้ติดเชื้อรายใหม่วันนี้ 250 ราย เป็นจำนวน 239 ราย ติดเชื้อในประเทศ (แรงงานต่างด้าว) เป็นการคัดกรองเชิงรุก 2 ราย และอยู่ในสถานที่กักกันที่รัฐจัดให้ 8 ราย รวมเป็น 250 ราย // ประชาชาติ
- กรุงเทพ ศบค.กทม.ราบงาน วันนี้พบผู้ติดเชื้อเพิ่ม 17 ราย มี 2 รายที่เชื่อมโยงจ.สมุทรสาคร และ 15 ราย เป็นกลุ่มเสี่ยงจากชุมชนหรือในอาชีพเสี่ยง เช่น สถานบันเทิง รวมแล้วกรุงเทพฯมีผู้ติดเชื้อ 125 ราย
- ชลบุรี ผู้ว่า แถลงคำสั่งปิด สถานที่ใน อ. บางละมุง สั่งปิดห้างสรรพสินค้า ยกเว้นในส่วนของ ธุรกิจหลักทรัพย์ ธุรกรรมทางการเงิน ซุปเปอร์ ร้านยา ธนาคาร มือถือ ร้านอาหารเปิดได้แค่ซื้อกลับ ปิดร้านสะดวกทุกประเภทที่เปิดบริการ 24 ชม. ให้ปิดบริการตั้งแต่เวลา 22.00 ถึง 05.00 น.เป็นการชั่วคราว ปิดสถานศึกษาทั้งภาครัฐและภาคเอกชนทุกระดับชั้น ปิดสระว่ายน้ำ สวนน้ำ สวนสนุกฯลฯ // TNN Thailand
- นนทบุรี ศูนย์ปฏิบัติการ COVID-19 จังหวัดนนทบุรี เปิดไทม์ไลน์ของผู้ป่วยโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19) รายที่ 153 (รายที่ 37 ของการระบาดรอบใหม่) ซึ่งเป็นหญิงไทย อายุ 41 ปี อ.เมือง // MGR online
- ระยอง ผู้ติดเชื้อรายใหม่ 54 ราย รวมผู้ติดเชื้อสะสม 202 ราย เสียชีวิต(วานนี้) 1 ราย ที่สำคัญมีบุคคลทางการแพทย์ติดเชื้อ 1 ราย แต่สาเหตุไม่ได้มาจากในโรงพยาบาล เนื่องจากสัมพันธ์กับผู้ป่วยติดเชื้อกลุ่มเก่าอยู่แล้ว จำนวนผู้ป่วยในแต่ละอำเภอ 202 ราย แบ่งเป็นอ.เมือง 163 ราย ,อ.แกลง 8 ราย อ.บ้านค่าย 6 ราย ,อ.บ้านฉาง 5 ราย ,อ.เขาชะเมา 4 ราย ,อ.พัฒนานิคม 2 ราย และอ.ปลวกแดง 2 ราย // ประชาชาติ
- นนทบุรี สั่งปิดสถานที่เป็นการชั่วคราว คือ อาคารคอนโดสีชมพู 7 ชั้น หมู่ที่ 6 ตำบลเสาธงหิน อำเภอบางใหญ่ ตั้งแต่วันที่ 30 ธันวาคม 2563 - 12 มกราคม 2564 และ ตลาดกลางบางใหญ่ หมู่ที่ 6 ตำบลเสาธงหิน อำเภอบางใหญ่ ตั้งแต่วันที่ 30 ธันวาคม 2563 - 1 มกราคม 2564 รวมถึงกำหนดมาตรการเพื่อป้องกันการแพร่ระบาดของโรคติดเชื้อ โควิด-19 // TNN
- ตราด ได้พบติดเชื้อไวรัสรายแรก คือ หญิงไทย อายุ 65 ปี อาชีพแม่บ้าน ภูมิลำเนา ตำบล วังกระแจะ อำเภอเมือง มีไทม์ไลน์เดินทางไประยอง // มติชน
- นครศรีธรรมราช ยืนยันพบผู้ป่วยโควิด-19 รายที่ 2 ของจังหวัด เป็นชาย อายุ 53 ปี อยู่ในเขตเทศบาลนคร ทำงานเป็นพนักงานขับรถส่งกุ้งจาก จ.พังงา ไปยังตลาดกลางกุ้ง จ.สมุทรสาคร และกลับมทบ้านหลังจากมีการปิดตลาดกุ้ง // มติชน
- ร้อยเอ็ด ได้รับแจ้งจากสำนักงานสาธารณสุขจังหวัดชลบุรี ว่ามีผู้ติดเชื้อโรคโควิด-19 เป็นเพศชาย อายุ 33 ปี ทำงานอยู่ที่อำเภอบางละมุง จังหวัดชลบุรี เดินทางกลับมายังจังหวัดร้อยเอ็ด วันนี้ (30 ธันวาคม 2563) โดยสารเครื่องบิน ถึงจังหวัดร้อยเอ็ด เวลา 08.15 น. แล้วเดินทางกลับบ้านโดยรถยนต์ส่วนตัวไม่ได้แวะสถานที่ใดในระหว่างเดินทาง // ไทยรัฐ
- ระนอง ผู้ว่าฯ แถลงพบผู้ติดเชื้อโควิด-19 รายแรก เป็นชายอายุ 57 ปี อาชีพขับรถส่งของตลาดมหาชัย จังหวัดสมุทรสาคาร ส่งตรวจตัวอย่าง 12 รายกลุ่มเสี่ยงสูง ผลตรวจภรรยา-บุตรชายเป็นลบ ที่เหลืออยู่ระหว่างรอผล // NationTV
- อำนาจเจริญ พบผู้ติดเชื้อรายใหม่ 1 ราย เป็นหญิง อายุ 37 ปี มีผู้ที่เข้าเกณฑ์สงสัย(PUI) จำนวน 6 ราย ตรวจไม่พบเชื้อ 1 ราย รอผลตรวจ 5 ราย // สสจ.อำนาจเจริญ
- มหาสารคาม พบผู้ป่วยยืนยันติดเชื้อโควิด-19 จำนวน 1 ราย เป็นหญิงอายุ 42 ปี ในพื้นที่ อ.บรบือ จ.มหาสารคาม โดยหญิงคนดังกล่าวมีอาชีพขายส้มตำอยู่หลังตลาดไทยยูเนี่ยน ต.ท่าทราย อ.เมือง จ.สมุทรสาคร // Bangkok biz news
รายงานผู้ติดเชื้อ 29 ธค 63
- กรงเทพ สั่งปิดสถานที่ชั่วคราว 4 แห่ง "สนามม้า-ชนไก่-ชนโค-กัดปลา-อาบอบนวด" เพื่อลดการแพร่ระบาดของเชื้อไวรัสโควิด ตั้งแต่วันที่ 29 ธ.ค. 63 - 4 ม.ค. 64 // TNN Thailand
- ตาก ผู้ว่า ประกาศล็อกดาวน์ เฉพาะ อ.แม่สอด ได้สั่งให้งดบริการรถยนต์แท็กซี่รับจ้างทุกประเภททุกคัน ทั้งภาคเอกชน และสหกรณ์ จนถึงวันที่ 3 มกราคม 2564 งดปฏิบัติศาสนกิจ และศาสนพิธีของทุกศาสนาที่มีการรวมกลุ่มตั้งแต่ 20 คนขึ้นไป ณ สถานที่ใด ๆ เว้นแต่มีความจำเป็นให้นายอำเภอแม่สอดพิจารณาเป็นกรณีไป งดทานอาหารที่ร้านจำหน่ายอาหารทุกชนิดตามสถานที่สาธารณต่าง ๆ เช่น สถานีขนส่ง ท่าอากาศยาน และสถานที่บริการ ร้านค้าต่าง ๆ ตลาดทุกประเภทที่มีผู้ใช้บริการจะต้องมีมาตรการการป้องกันตามที่ทางสาธารณสุขกำหนดโดยเคร่งครัด ปัจจุบัน มีผู้ป่วยที่รักษาตัวอยู่ในโรงพยาบาลแม่สอดจนถึงขณะนี้ จำนวน 12 คน // ประชาชาติ
- ชลบุรี รายงานสถานการณ์การแพร่ระบาดของโควิด-19 ในพื้นที่ ล่าสุด พบผู้ป่วยยืนยันรายใหม่ 12 ราย ในอำเภอเมืองชลบุรี 6 ราย, บางละมุง 4 ราย และ สัตหีบ 2 ราย รวมผู้ป่วยยืนยันสะสม 36 ราย // ประชาชาติ
- นนทบุรี ศูนย์ปฏิบัติการ COVID-19 จังหวัดนนทบุรี ระบุพบผู้ป่วยยืนยันเพิ่ม 10 คน ผู้ป่วยยืนยันสะสม รอบใหม่ 37 คน ผู้ป่วยยืนยันสะสม ทั้งหมด 153 คน // ประชาชาติ
- จันทบุรี จันทบุรี แถลงความคืบหน้ากรณีพบผู้ติดเชื้อ โควิด19 จำนวน 3 ราย เมื่อวันที่ 28 ธันวาคม ที่ผ่านมา โดยระบุว่าวันนี้พบผู้ติดเชื้อเพิ่มอีก 7 ราย รวมยอดผู้ติดเชื้อในการระบาดใหม่ครั้งนี้ 10 ราย // ประชาชาติ
- เพชรบุรี รายงานมีผู้ป่วยติดเชื้อโรคโควิด-19 เพิ่มอีก 1 ราย เป็นหญิงอายุ 47 ปี ชาว ต.แก่งกระจาน อ.แก่งกระจาน ซึ่งเป็นบุคลากรทางการแพทย์ของสาธารณสุขจังหวัดเพชรบุรี ซึ่งได้ไปปฏิบัติหน้าที่ตรวจคัดกรองโควิดที่ตลาดมหาชัยนิเวศน์ และตลาดโกรกกราก จังหวัดสมุทรสาคร ตามคำสั่งของกระทรวงสาธารณสุข เมื่อวันที่ 25 ธันวาคมที่ผ่านมา // ประชาชาติ
- ชลบุรี พบผู้ป่วยยืนยันรายใหม่ 12 ราย ในอำเภอเมืองชลบุรี 6 ราย, บางละมุง 4 ราย และ สัตหีบ 2 ราย รวมผู้ป่วยยืนยันสะสม 36 ราย // ประชาชาติ
- ระยอง ผู้ว่าราชการจังหวัดระยอง เปิดเผยว่า พบผู้ติดเชื้อโควิด-19 รายใหม่ในจังหวัด 56 ราย รวมยอดสะสมผู้ติดเชื้อทั้งหมดเป็น 148 ราย จากการตรวจหาเชื้อสะสม 2,561 ราย เสียชีวิต 1 ราย ทั้งนี้ผู้ติดเชื้อส่วนใหญ่เกี่ยวโยงกับบ่อนการพนัน // ประชาชาติ
- ลำปาง ผู้ว่าฯ แถลงยืนยันพบผู้ติดเชื้อโควิด-19 รายใหม่ 1 ราย เปิดไทม์ไลน์ทำงานระยอง บินไปเที่ยวเชียงใหม่ ก่อนร่วมงานแต่งที่ลำปาง // TNN Thailand
- นครปฐม พบผู้ป่วยยืนยันรายใหม่ เพิ่ม 5 ราย รวมยอดผู้ป่วยสะสม 58 ราย เป็นคนไทย 56 ราย ต่างชาติ 2 ราย แบ่งออกเป็น พักรักษาตัวในโรงพยาบาลจำนวน 58 ราย // ประชาชาติ
- กรุงเทพ พบติดเชื้อโควิดเพิ่มอีก 14 ราย จากกลุ่มเสี่ยงสถานบันเทิง ชุมชน 11 ราย เป็นคนไทยทั้งหมด ยังรอสอบสวนโรค 3 ราย เผยยอดสะสมพุ่ง 108 ราย // ประชาชาติ
รายงานผู้ติดเชื้อ 28 ธค 63
- กรุงเทพ เปิดเผยไทม์ไลน์ผู้ป่วยยืนยันรายใหม่ในพื้นที่เพิ่มเติมอีก 17 คน โดยเป็นผู้ป่วยรายที่ 22-43 จากที่ในการระบาดรอบใหม่ 20-27 ธันวาคม ทำให้ล่าสุดกรุงเทพมหานครมีผู้ป่วยสะสมจำนวน 75 คน และยังอยู่ระหว่างสอบสวนโรค อีก 23 ราย เผยยอดป่วยโควิดสะสมพุ่ง 75 ราย พร้อมเผยไทม์ไลน์ผู้ติดเชื้อ 22 คน // TNN Thailand
- ตาก โรงพยาบาลแม่สอด จ.ตาก เปิดเผยว่า พบผู้ติดเชื้อโควิดเพิ่มขึ้นอีก 4 คน ในจำนวนนี้มีพนักงานขับรถยนต์แท็กซี่ในพื้นที่ 1 ราย และเด็ก 1 ราย รวมผู้ติดเชื้อโควิด-19 ทั้งหมด 12 ราย // ไทยรัฐ
- สมุทรสาคร นายวีระศักดิ์ วิจิตร์แสงศรี ผู้ว่าราชการจังหวัดสมุทรสาคร ติด COVID-19 เร่งสอบสวนโรคผู้บริหารกระทรวงสาธารณสุข รวมทั้งนายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรี และรมว.สาธารณสุข ที่ลงพื้นที่และอยู่ร่วมกับผู้ว่าฯ 4 ชั่วโมง ล่าสุดนายอนุทิน-ขรก.กักตัว 14 วัน // Thai PBS
- สมุทรสาคร รายงานล่าสุด พบว่ามีผู้ป่วยจากการระบาดระลอกใหม่เพิ่มขึ้นอีก 42 ราย ส่งผลให้มีผู้ป่วยสะสม 1,590 ราย อยู่ระหว่างการรักษา 297 ราย แบ่งเป็นคนไทย 263 ราย ต่างด้าว 34 ราย สังเกตอาการ 1,293 ราย เป็นคนไทย 3 ราย และต่างด้าว 1,290 ราย // COVID-19 สมุทรสาคร
- ระยอง ผู้ว่าฯ แถลง วันนี้มียอดผู้ติดเชื้อโควิดเพิ่มขึ้น 7 ราย เป็นผู้ชาย 4 ราย ผู้หญิง 3 ราย รวมจากยอดเก่า 85 คน จ.ระยอง มียอดผู้ป่วยทั้งหมดขณะนี้ 92 ราย ทั้งหมดที่พบในวันนี้เชื่อมโยงจากบ่อนการพนันทั้งหมด // ประชาชาติ
- นครปฐม สำนักงานสาธารณสุขจังหวัดนครปฐม พบป่วยยืนยันรายใหม่ คนไทย 16 ราย เป็นหญิง 12 ราย ชาย 4 ราย จาก 5 อำเภอ (เมือง นครชัยศรี กำแพงแสน สามพราน ดอนตูม) รวมยอดผู้ป่วยสะสม 53 ราย เป็นคนไทย 51 ราย ต่างชาติ 2 ราย พักรักษาตัวในโรงพยาบาล // MGR online
- ระยอง "มีเคส เสียชีวิต 1 ราย ที่โรงพยาบาลระยอง เป็นชาย อายุ 45 ปี มีโรคประจำตัวคือโรคหัวใจขาดเลือดอยู่เดิม พบประวัติมีความเสี่ยง เป็นคนโบกรถที่บ่อนจากผลตรวจวันที่ 27 ธันวาคม 2563 พบว่าชายรายนี้มีผลตรวจติดเชื้อโควิด-19 และในเช้าวันนี้ (28 ธันวาคม 2563) ผู้ป่วยมีอาการหอบเหนื่อย จึงถูกนำตัวส่งโรงพยาบาลโดยรถซาเล้งของเพื่อน แต่มีอาการหยุดหายใจระหว่างทาง เมื่อถึงโรงพยาบาล แพทย์จึงทำ CPR เป็นเวลา 30 นาทีแต่ไม่สามารถยื้อไว้ได้ หมายเหตุ ผู้ป่วย มีโรคประจำตัวเป็น โรคหัวใจขาดเลือด CVA และเบาหวาน (ไม่ได้ทานยาเบาหวาน) มารับรักษาครั้งล่าสุดที่ รพ.ระยอง เมื่อเดือน มี.ค 63 แพทย์ที่ให้การช่วยเหลือสวมใส่ PPE ทุกคน // สาธิต ปิตุเตชะ
- ชลบุรี พบผู้ติดเชื้อโควิด-19 ระลอกใหม่วันเดียวพุ่ง 22 ราย อ.เมือง 5 ราย อ.บางละมุง 17 ราย ยอดสะสม 24 ราย // สำนักงานประชาสัมพันธ์จังหวัดชลบุรี
- นนทบุรี พบผู้ป่วยยืนยันเพิ่ม 9 คน ผู้ป่วย 7 ใน 9 คน เป็นแรงงานต่างชาติ และเป็นผู้สัมผัสใกล้ชิดของผู้ป่วยยืนยัน รอบใหม่ รายที่ 16 ซึ่ง มีประวัติไปตลาดแพกุ้งสมุทรสาคร ผู้ป่วยรอบใหม่ ยืนยันสะสม 27 คน // ศูนย์ปฏิบัติการ COVID-19 จังหวัดนนทบุรี
- ปทุมธานี ผู้ติดเชื้อรายใหม่ จำนวน 2 ราย เป็นรายที่ 9-10 ของการระบาดรอบใหม่ (ทั้งหมด 53 ราย) รายที่ 9 เป็นชาย อายุ 15 ปี อ.ธัญบุรี รายที่ 10 เป็นหญิง อายุ 31 ปี อ.ลำลูกกา // ศูนย์ปฏิบัติการ COVID-19 จังหวัดปทุมธานี
- จันทบุรี พบผู้ติดเชื้อโควิด 3 ราย (จากการส่งผลตรวจ 4 ราย) เป็นผู้เสี่ยงที่เดินทางไปเล่นการพนันจังหวัดระยอง เป็นชายไทยอายุ 34 ปี หญิงไทย อายุ 53 ปี และ ชายไทยอายุ 54 ปี 2 ใน 3 ราย อาศัยอยู่ในพื้นที่อำเภอเมือง และ อีก 1 ราย มีที่พักที่ อ.มะขาม และ อำเภอเมือง แต่ไปทำงานจังหวัดระยอง ทั้ง 3 คนอยู่ในการดูแลของแพทย์อย่างใกล้ชิด // สาธารณสุขจังหวัดจันทบุรี
- นครราชสีมา ล่าสุดพบมีผู้ป่วยติดเชื้อโควิด-19 รายใหม่เพิ่มอีก 1 ราย จากเดิมพบผู้ติดเชื้อรายใหม่แล้ว 6 ราย เป็นชายไทย อายุ 55 ปี มีอาชีพขับรถรับส่งอาหารทะเลมาจากเขตมหาชัย และเดินทางมาส่งอาหารทะเลที่ตลาดร่วมใจ อำเภอเมือง จังหวัดนครราชสีมา รวมทั้งเดินทางไปส่งอาหารทะเลที่ฉะเชิงเทรา และกลับบ้านที่จังหวัดตราดบ่อยครั้ง ทำให้ขณะนี้พบผู้ติดเชื้อรายใหม่แล้ว 7 ราย รวมผู้ติดเชื้อสะสมทั้งหมด 26 ราย // ประชาชาติ
รายงานผู้ติดเชื้อ 27 ธค 63
- กรุงเทพ ศบค. รายงาน วันอาทิตย์ที่ 27 ธันวาคม 2563 เวลา 11.30 น. สถานการณ์การติดเชื้อ COVID-19 ผู้ป่วยรายใหม่ 121 ราย ผู้ป่วยยืนยันสะสม 6,141 ราย
- ระนอง ผู้ว่าระนองยืนยัน ต่อพี่น้องชาวระนอง และพี่น้องทั่วประเทศว่า ณ วินาทีนี้ จังหวัดระนองยังเป็นศูนย์ ยังไม่พบผู้ติดเชื้อ และจังหวัดของเราเป็นแหล่งผลิตอาหารทะเลเราอยากสร้างความเชื่อมั่นให้กับพี่น้องทั่วประเทศว่าอาหารทะเลของจังหวัดระนองมีมาตรฐาน มีคุณภาพ และปลอดจากเชื้อโควิด-19 แน่นอน // กรมควบคุมโรค
- สุโขทัย พบผู้ติดเชื้อโควิด-19 จำนวน 1 ราย เพศหญิง อายุ 42 ปี ที่อำเภอเมือง เป็นพนักงานนวดแผนไทย มีประวัติเดินทางมาจากตำบลมหาชัย อำเภอเมือง จังหวัดสมุทรสาคร // สำนักงานประชาสัมพันธ์จังหวัดสุโขทัย
- นครปฐม ออกประกาศแจ้งมีผู้ติดเชื้อไวรัสโควิด-19 เพื่มอีก 7 ราย รวมยอดสะสมระลอกใหม่ติดเชื้อ 37 ราย โดยยังคงรักษาตัวอยู่ทั้งหมด ซึ่งผู้ป่วยที่ตรวจพบมีพื้นที่ใน 3 อำเภอ ประกอบด้วย อำเภอดอนตูม บางเลน และอำเภอเมืองนครปฐม // MGR online
- สุรินทร์ พบผู้ติดเชื้อเป็นหญิง อายุ 32 ปี เดินทางมากจากสมุทรสาคร และถือว่าเป็นผู้ป่วยรายแรกของจังหวัดที่ติดเชื้อมาจากที่อื่น // ประชาชาติ
- กรุงเทพ พบรายใหม่ 16 ราย รอสอบสวนโรค 1 ราย เป็นคนไทย เชื่อมโยงจ.สมุทรสาคร ยอดสะสม 74 ราย // ประชาชาติ
- ระยอง ตรวจพบผู้ติดเชื้อโควิดรายใหม่เพิ่มอีกเกือบ 50 ราย โดยมีความเกี่ยวโยงกับบ่อนการพนัน รวมกับยอดผู้ติดเชื้อเดิม จำนวน 36 ราย ทำให้ยอดผู้ติดเชื้อโควิดทั้งจังหวัดระยองพุ่งขึ้นไปกว่า 80 ราย // ประชาชาติ
- กรุงเทพ ผู้อำนวยการท่าอากาศยานดอนเมือง เผยพบผู้ติดเชื้อโควิด-19 เป็น นักศึกษาฝึกงานของสายการบินที่ทำงานที่นี่ ขณะนี้ ได้ตรวจหาเชื้อผู้ที่มีความใกล้ชิดแล้ว 23 คน และให้กักตัวจนครบ14วัน // PPTV
- เพชรบุรี พบหญิง อายุ 27 ปี ชาวไร่สะท้อน อ.บ้านลาด ติดโควิดเพิ่ม 1 ราย รวมยอด 18 ราย // ประชาชาติ
- ลพบุรี พบผู้ติดเชื้อโควิด-19 1 ราย หญิงอายุ 35 ปี เดินทางจากสมุทรสาคร กลับมาเลือกตั้ง // MGR online
- ระยอง พบผู้ติดเชื้อโควิดรายใหม่ เพิ่มอีก 49 ราย มีความเกี่ยวข้องกับบ่อนพนัน ยอดรวม 85 ราย // ประชาชาติ
- นครปฐม พบผู้ติดเชื้อโควิด เพิ่มอีก 7 ราย (หญิง 1 ชาย 6) จาก 3 อำเภอ (เมือง บางเลน ดอนตูม) ยอดรวม 37 ราย // ประชาชาติ
- สมุทรสาคร ติดโควิด 93 ราย คนไทย 74 ต่างด้าว 19 ยอดรวม 1,548 ราย // COVID - 19 สมุทรสาคร
- เกาหลีใต้ อธิบดีกรมสารนิเทศและโฆษกกระทรวงการต่างประเทศ เปิดเผยความคืบหน้าล่าสุด พบผู้ติดเชื้อชาวไทยแล้วทั้งสิ้น 67 คน ในเมืองชอนัน จังหวัดชุงชอง เกาหลีใต้ // TNN Thailand
- นครนายก วันนี้ (27 ธ.ค.63) พบติดเชื้อไวรัสโควิด-19 เพิ่มอีก 1 ราย เป็นเด็กอายุ 1 ปี 10 เดือน เป็นบุตรของผู้ติดเชื้อรายแรก รวมมีผู้ติดเชื้อ 2 ราย เข้ารักษาตัวที่โรงพยาบาลแล้ว // ประชาสัมพันธ์นครนายก
- เชียงใหม่ พบผู้ติดเชื้อโควิด-19 รายใหม่ 1 ราย เป็นรายที่ 47 ของ จ.เชียงใหม่ เป็นผู้ที่เดินทางมาจากจังหวัดระยอง ตรวจพบว่าติดเชื้อโควิด-19 จากรพ.เอกชน ขณะนี้ส่งตัวมารักษาที่รพ.นครพิงค์ // รพ.นครพิงค์
- ราชบุรี พบผู้ป่วยติดเชื้อรายใหม่เพิ่ม 1 ราย เป็นหญิง อายุ 24 ปี ชาว อ.บางแพ สรุปมีผู้ติดเชื้อสะสมรวม 9 ราย ชาย 4 ราย หญิง 5 ราย รักษาอยู่รพ.ราชบุรี 1 ราย รพ.ดำเนิน 6 ราย รพ.บางแพ 2 ราย // สาธารณสุขราชบุรี + ประชาชาติ
- นราธิวาส พบผู้ป่วยติดเชื้อ COVID-19 รอบใหม่แล้ว 1 คน เป็นหญิงอายุ 60 ปี ติดเชื้อจากลูกชายที่เป็นผู้ป่วยติดเชื้อรายแรกของ จ.สงขลา และไปร่วมปาร์ตี้กลุ่มบิ๊กไบค์ที่ จ.กระบี่ // Thai PBS
- ปทุมธานี รายงาน Timeline ผู้ป่วย 1 ราย เป็นหญิง อายุ 61 ปี อ.หนองเสือ เป็นรายที่ 8 ของการระบาดรอบใหม่ (รายที่ 51 ทั้งหมด) // ศูนย์ปฏิบัติการ COVID-19 จังหวัดปทุมธานี
รายงานผู้ติดเชื้อ 26 ธค 63
- ราชบุรี พบพบผู้ติดเชื้อโควิด-19 ระลอกใหม่ 1 ราย เป็นชาย อายุ 24 ปี ซึ่งเดินทางไปรับอาหารทะเล จากตลาดทะเลไทย จ.สมุทรสาคร ขณะนี้ยังรักษาตัวอยู่ในโรงพยาบาลราชบุรี ยอดรวม 5 ราย // สำนักงานประชาสัมพันธ์จังหวัดราชบุรี
- เชียงราย รายงานผลตรวจหาเชื้อโควิด-19 เชิงรุก กลุ่มผู้ค้าขายปลีก/ขายส่งอาหารทะเลในตลาดสด พนักงานโซนอาหารทะเลในซุปเปอร์มาเก็ต ร้านอาหารทะเลและแรงงานต่างด้าว ในพื้นที่จังหวัดเชียงราย ระหว่างวันที่ 21-24 ธ.ค.63 จำนวน 850 คน ผลตรวจทั้งหมดไม่พบเชื้อแต่ประการใด // สำนักงานสาธารณสุขจังหวัดเชียงราย
- พิษณุโลก สถานการณ์ตอนนี้ "ยังไม่พบผู้ป่วย" มีการตรวจ ผู้ที่มีความเสี่ยงสูงอยู่ตลอดด้วย การตรวจเชิงรุก ได้แก่ ตรวจผู้ค้าอาหารทะเล ในจังหวัดพิษณุโลก ตรวจผู้ที่เดินทางจากสมุทรสาครตั้งแต่วันที่ 1 ธันวาคม และมีการสุ่มตรวจเจ้าหน้าที่ที่อยู่ในสถานที่มีคนเดินทางจำนวนมาก เช่น ขนส่ง เป็นต้น มีการลงตรวจแรงงานต่างด้าวในพื้นที่จังหวัดพิษณุโลก จำนวน 107 ราย ผลปรากฏว่า เป็นลบทั้งหมด // NationTV
- ปทุมธานี ผู้ว่าสั่งปิดตลาดนัด 4 แห่ง ในพื้นที่ 4 อำเภอ เหตุเป็นพื้นที่เสี่ยงต่อการแพร่ระบาดของโรค หลังก่อนหน้ามีผู้ป่วยแล้ว 5 ราย มีผลตั้งแต่ 26 ธ.ค.63 ถึง 8 ม.ค.64 ได้แก่ 1) ตลาดสดอินเตอร์มาร์ท ต.บางปรอก อ.เมือง 2) ตลาดคลองสี่เมืองใหม่ ต.คลองสี่ อ.คลองหลวง 3) ตลาดชุมชนเคหะรังสิต คลอง 6 ต.รังสิต อ.อธัญบุรี 4) ตลาดนัดวัดปทุมนายก ต.ศาลาครุ อ.หนองเสือ // สำนักงานสาธารณสุขจังหวัดปทุมธานี
- กรุงเทพ สธ. สรุปผลการตรวจพบผู้ติดเชื้อจากร่วมงานเลี้ยงบิ๊กไบค์เกาะลันตา จ.กระบี่ รวม 10 ราย // ประชาชาติ
- นครราชสีมา พบผู้ป่วยโควิด-19 รายใหม่เพิ่มอีก 3 ราย รายที่ 4 เป็นชาย อายุ 24 ปี รายที่ 5 เป็นชาย อายุ 52 ปี ทำงาน อบต. ที่ อ.บัวใหญ่ รายที่ 6 เป็นหญิง อายุ 46 ปี ทำงานที่ อบต. ใน อ.บัวใหญ่ รวมพบผู้ติดเชื้อรายใหม่แล้ว 6 ราย ขณะที่ยอดผู้ป่วยสะสมรวม 25 ราย // ประชาชาติ
- นครปฐม รายงานล่าสุด เมื่อเวลา 12.00 น. พบผู้ป่วยยืนยันรายใหม่จำนวน 13 ราย ใน 3 อำเภอ คือ อ.เมือง อ.นครชัยศรี อ.บางเลน ทำให้ยอดผู้ป่วยรวมสะสมรวมเป็น 30 ราย ทั้งหมดพักรักษาตัวในโรงพยาบาล // ประชาชาติ
- ตาก แพทย์โรงพยาบาลแม่สอด ได้โพสต์เฟซบุ๊กส่วนตัวว่า ล่าสุดพบผู้ป่วยโควิด-19 ทั้งหมด 8 รายแล้ว // NationTV
- เพชรบุรี ผู้ติดเชื้อรายใหม่ 9 ราย อยู่ใน 4 อำเภอ ประกอบด้วย อ.บ้านลาด 4 ราย (ชาย 2 หญิง 3) อ.เมือง 2 ราย (หญิงทั้งคู่) อ.บ้านแหลม 1 ราย (หญิง 54 ปี อาชีพค้าขาย) อ.ท่ายาง 1 ราย (หญิง 37 ปี) ยอดรวม 17 ราย // ข่าวสด
- ระยอง รายงานว่ามีผู้ติดเชื้อ 27 ราย โดยมาจากบ่อนพนันแห่งหนึ่งในพื้นที่ จ.ระยอง เบื้องต้นได้สั่งเป็นพื้นที่ควบคุมสูงสุดในพื้นที่ อ.เมืองระยอง เนื่องจากผู้ป่วยทั้งหมดยังอยู่ในพื้นที่ อ.เมือง พบผู้ป่วยรายแรกวันที่ 24 ธ.ค. จากนั้นวันที่ 25 ธ.ค.พบอีก 8 ราย และวันนี้ (26 ธ.ค.) พบผู้ป่วยที่โรงพยาบาลในระยอง 18 ราย และพบที่โรงพยาบาลเอกชน 2 แห่งอีก 9 ราย และรวมตั้งแต่วันแรกเป็น 36 คน // ประชาชาติ
- กระบี่ พบผู้ป่วยเพิ่มอีก 2 คน เป็นรายที่ 28-29 เป็นเพศชาย อายุ 26 ปี และหญิง อายุ 27 ปี ยกระดับพื้นที่เสี่ยงเป็นโซน “สีส้ม” // ประชาชาติ
- ราชบุรี พบติดเชื้อโควิดรายใหม่ เป็นหญิง 3 ราย อ.บางแพ เกี่ยวโยงเป็นหลานสาวผู้ป่วยรายที่ 4-5 โดย รายที่ 6 เป็นหญิงอายุ 49 ปี รายที่ 7 เป็นหญิง อายุ 81 ปี ไม่มีอาการใดๆ รายที่ 8 เป็นหญิงอายุ 17 ปี รวมทั้งจังหวัดติดเชื้อสะสมแล้ว 8 ราย // ประชาชาติ + สาธารณสุขราชบุรี
- สตูล ผู้ว่าฯ แถลงข่าวพบผู้ติดเชื้อไวรัสโควิด-19 จำนวน 2 ราย เป็นชาว อ.ทุ่งหว้า เป็นพนักงานสาวร้านสปา และคนขับรถส่งอาหารทะเลในพื้นที่ จ.สมุทรสาคร // BangkokBizNews
- กรุงเทพ พบผู้ป่วยโควิดใหม่ 18 ราย รวมสะสม 58 ราย (20–26 ธ.ค. 63) เผยเป็นคนต่างจังหวัด 10 ราย อีก 8 รายเป็นคนกทม. ไทย 5 ราย เมียนมา 3 ราย // ประชาชาติ
- สระบุรี พบผู้ป่วยโควิด ระลอกใหม่เพิ่มอีก 1 ราย เป็นหญิง อายุ 40 ปี ยอดรวม 8 ราย เผยเป็นสาวโรงงาน // ข่าวสด
- สมุทรสาคร ผู้ว่าฯ เผยยอดผู้ติดเชื้อโควิด-19 ล่าสุด 1,455 ราย เพิ่มขึ้นจากวันก่อน 87 ราย เร่งตั้ง“ศูนย์ห่วงใยคนสาคร”สนามกีฬากลาง เปิดได้ 200 เตียงในวันจันทร์ 28 ธ.ค.นี้ ก่อนเปิดเพิ่มเป็น 500 เตียงวันพฤหัสฯ // MGR online
- พระนครศรีอยุธยา สาธารณสุขกรุงเก่าเผยไทม์ไลน์หญิงไทย อายุ 44 ปี อ.ผักไห่ ทำงานที่ตลาดทะเลไทย สมุทรสาคร ติดเชื้อ covid-19 ไม่มีอาการ โดยผู้สัมผัสสูง 4 ราย ตรวจไม่พบเชื้อ แต่ให้กักตัวให้ครบ 14 วัน // งานประชาสัมพันธ์ สสจ.อยุธยา
- นครนายก มีผลยืนยันพบผู้ติดเชื้อโรคโควิด - 19 จำนวน 1 ราย เป็นชายอายุ 30 ปี อาชีพพ่อค้ารับส่งอาหารทะเล จากตลาดไทสมุทรสาคร มาขายยังเทศบาลเมืองนครนายก // NBT Chanthaburi
- ปทุมธานี รายงาน ผู้ติดเชื้อรายใหม่ จำนวน 1 ราย เป็นชายไทย อายุ 37 ปี อ.สามโคก รวมเป็นรายที่ 7 (ทั้งหมดนับเป็นราย 50 ) // ศูนย์ปฏิบัติการ COVID-19 จังหวัดปทุมธานี
ระลอก 3 เห็นได้จาก - 3 เมษายน 64 LINK
ระลอก 3 เห็นได้จาก
- ผู้ติดเขื้อที่พบหาเส้นทางโยงไยไม่ได้ชัดเจน และทำให้มีโอกาศขยายการติดไปได้โดยติดตามไม่ได้
- และเริ่มเห็นคนติดเชื้อที่มีความผิดปกติ จากการตรวจเช่นเอกซเรย์ปอดหรือการตรวจทางระบบอื่น ทั้งๆที่ไม่มีอาการ และที่มีอาการ
ข่าวที่เกี่ยวข้อง
"8 แสนคน" กระทบปมเลิกสัญญาคลินิก-รพ.โกงบัตรทอง - ไทย พีบีเอส
สปสช.ยืนยันจำเป็นต้องยกเลิกสัญญา คลินิก-โรงพยาบาล หลังขยายผลพบทุจริตเงินบัตรทอง กระทบประชาชน 800,000 คน ระบุ ประชาชนเข้ารับบริการหน่วยบริการของรัฐได้ทุกแห่งก่อน โดยไม่เสียค่าใช้จ่าย แนะผู้ป่วย 4 กลุ่มเร่งด่วนติดต่อสายด่วน 1330
จากกรณีสื่อสังคมออนไลน์วิพากษ์วิจารณ์เกี่ยวกับการไปใช้บริการโรงพยาบาลหรือคลินิกหลายแห่งในพื้นที่ กทม.แต่พบป้ายประกาศว่า มีการยกเลิกเป็นเครือข่ายบัตรทอง และเตรียมให้ผู้ป่วยไปรักษาตามสิทธิบัตรทองที่โรงพยาบาลอื่น
วันนี้ (18 ก.ย.2563) นพ.การุณย์ คุณติรานนท์ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) เปิดเผยว่า ก่อนหน้านี้ สปสช.ได้ยกเลิกสัญญาคลินิกชุมชนอบอุ่น 18 แห่ง เมื่อวันที่ 19 ก.ค.เนื่องจากตรวจสอบพบทุจริต ส่งผลให้กระทบประชาชนจำนวน 200,000 คน ในการดำเนินการระยะถัดไปจึงต้องการดำเนินการให้รอบคอบ แต่ สปสช.มีความจำเป็นต้องขยายผลหลังพบการทุจริต จนพบอีก 66 คลินิกมีข้อสงสัย และได้ดำเนินคดีไปแล้วเมื่อวันที่ 29 ก.ค.
นพ.การุณย์ ระบุว่า สปสช.มีความจำเป็นจริงๆ ที่ตจะต้องบอกเลิกสัญญากับคลินิกและโรงพยาบาลเหล่านี้ เนื่องจากพบประชาชนถูกสวมสิทธิ โดยประชาชนกลุ่มนี้จะไม่ได้มีโอกาสคัดกรองความเสี่ยงโรคเบาหวาน และความดัน ทำให้ไม่รู้ตัวว่ามีโรคประจำตัวหรือไม่ และไม่ได้เข้ารับการรักษา งบประมาณที่ถูกทุจริตก็เป็นงบประมาณของประเทศและมาจากภาษีประชาชน สปสช.จึงจำเป็นต้องดำเนินการ
ทั้งนี้ สปสช.ได้ประสานให้ กทม.ประสานหน่วยบริการในพื้นที่รองรับประชาชนทั้ง 800,000 คน ที่ได้รับผลกระทบ โดยทุกคนสามารถเข้ารับบริการที่โรงพยาบาลรัฐที่ใดก็ได้ใน กทม. หรือโรงพยาบาลและคลินิกที่เป็นคู่สัญญากับ สปสช. กรณีผู้ป่วยโรคเรื้อรัง หากต้องการข้อมูลยาหรือผลเลือดครั้งก่อนๆ กทม.ได้เตรียมการไว้รองรับแล้ว โดยประชาชนสามารถขอข้อูมลจากคลินิที่รักษาได้ หรือขอรับข้อมูลได้ที่ศูนย์บริการสาธารณสุขในพื้นที่ กทม.
ขณะเดียวกัน สปสช.ยังได้เร่งหาผู้ประกอบการรายใหม่เข้ามาทดแทน เนื่องจากหน่วยบริการสุขภาพของภาครัฐต้องรองรับประชาชนกว่า 4 ล้านคน อาจทำให้เกิดความแออัดและได้รับการดูแลไม่ทั่วถึง ซึ่งผู้ประกอบการหลายรายอยู่ระหว่างขึ้นทะเบียน โดย สปสช.อำนวยความสะดวกให้ ปรับเกณฑ์ให้ง่ายขึ้นเพื่อเข้ามาดำเนินการ
“ประชาชนไม่ต้องกังวล ทุกคนที่ได้รับผลกระทบสามารถเข้ารับบริการที่หน่วยใดก็ได้ ที่อยู่ในหลักประกันสุชภาพแห่งชาติเบื้องต้น คือ เข้าใช้บริการที่หน่วยบริการของรัฐได้ทุกแห่งโดยไม่ต้องเสียค่าใช้จ่าย”
แนะ 4 กลุ่มผู้ป่วยเร่งด่วน ติดต่อสายด่วน สปสช.
ด้าย ทพ.อรรถพร ลิ้มปัญญาเลิศ รองเลขาธิการสำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ระบุว่า สำหรับประชาชนที่เคยไปคลินิกไหน แล้วกลายเป็นคลินิกที่ไม่ได้เป็นหน่วยบริการคู่สัญญากับ สปสช.แล้ว สปสช.ได้แบ่งผู้ป่วยออกเป็น 4 กลุ่มเร่งด่วน ดังนี้
- ผู้ป่วยคลินิกชุมนุม กลุ่มโรงพยาบาลรับส่งต่อ ซึ่งโรงพยาบาลนัดผ่าตัดแล้ว สปสช. และ กทม.ได้ติดต่อขอรายชื่อรวมถึงประสานเตรียมโรงพยาบาลรองรับการรักษาต่อเนื่องไว้แล้ว
- ผู้ป่วยในโรงพยาบาล
- หญิงตั้งครรภ์ ซึ่งนัดวันผ่าตัดหรือคลอดไว้แล้ว
- ผู้ป่วยที่ต้องฟอกไตต่อเนื่อง
ทั้ง 4 กลุ่มถือเป็นผู้ป่วยเร่งด่วน สปสช.ได้ติดต่อไปแล้วบางส่วน หากใครยังไม่ได้รับการ
ติดต่อ สามารถโทรมาได้ที่สายด่วน 1330 ตลอด 24 ชั่วโมง โดย สปสช.เตรียมไว้ 60 คู่สาย หรือติดต่อมาได้ที่
เฟซบุ๊ก สำนักงานหลักประกันสุขภาพแห่งชาติ หรือ
ไอดีไลน์ 1330_2 โดยขอให้ระบุรายละเอียดได้แก่ ชื่อ เลขบัตรประชาชน เบอร์โทรติดต่อกลับ และปัญหาที่พบ เพื่อให้เจ้าหน้าที่ได้ติดต่อกลับ
“กรณีฉุกเฉินไปที่ไหนก็ได้ เป็นโรงพยาบาลรัฐไปได้เลย เอกชนอยู่ในหลักประกันสุขภาพใช่ไหม ถ้าใช่ก็ไปได้ ต้องขออภัยในความไม่สะดวก แต่ยืนยันว่า คลินิกไม่ใช่คลิกนิกทุกแห่งทุจริต แต่ตอนนี้ สปสช.พยายามทำให้ระบบเป็นไปอย่างที่ควรจะเป็นให้ได้มากที่สุด ”
รายงานผู้ติดเชื้อ 25 ธค 63
- นนทบุรี พบผู้ติดเชื้อเพิ่ม 4 คน ยอดรวมการระบาด COVID-19 รอบใหม่ 12 คน ไทม์ไลน์ทั้ง 4 คน ดังนี้ 1) ผู้ป่วยรายที่ 9 หญิงไทย อายุ 33 ปี อ.เมือง 2) ผู้ป่วยรายที่ 10 ชายชาวเมียนมา อายุ 46 ปี อ.บางใหญ่ 3) ผู้ป่วยรายที่ 11 เป็นหญิงไทย อายุ 31 ปี อ.บางกรวย 4) ผู้ป่วยคนที่ 12 เป็นหญิงไทยอายุ 40 ปี อ.บางใหญ่ มีประวัติไปมหาชัย พร้อมสามี ล่าสุดออกคำสั่งปิดสถานศึกษาทุกระดับชั้น ศูนย์เด็กเล็ก สถาบันกวดวิชา พร้อมคุมเข้มสถานประกอบการ ห้ามขายเครื่องดื่มแอลกอฮอล์ ห้ามเล่นดนตรีสด ตั้งแต่ 22.00-05.00 น. // Thai PBS
- สงขลา พบอาจารย์ ม.อ.หาดใหญ่ มีผลตรวจโควิด-19 เป็นบวก ตรวจกลุ่มเสี่ยง 200 ราย และประกาศ งดการเรียนการสอนในชั้นเรียนทั้งหมด ตั้งแต่วันที่ 25 ธ.ค. 2563 ไปจนกว่าจะมีประกาศเปลี่ยนแปลง // ประชาชาติ
เปิดไทม์ไลน์ ไปห้าง-เดินตลาด-ร่วมงานของมหาวิทยาลัย TNN Thailand
- สมุทรสาคร จัดเตรียมคลินิกสนามภายในตลาดกลางกุ้ง อ.เมืองสมุทรสาคร เพื่อรองรับแรงงานข้ามชาติที่มีอาการป่วยจากการติดเชื้อ COVID-19 มี 30 เตียง การรักษาสำหรับผู้ป่วยเล็กน้อย รับยากลับไป ไม่มีการนอนพักรักษา // ไทย พีบีเอส
- กระบี่ เผยไทม์ไลน์ของผู้ป่วยโควิด 3 ราย ที่ได้แถลงไปเมื่อ 24 ธค แล้ว โดย รายแรก เป็นหนุ่มวัย 35 ปี เป็นเจ้าของโรงแรมแห่งหนึ่งในเมืองกระบี่ และเป็นสามีของพนักงานสาวแบงค์อายุ 34 ปี ซึ่งทั้ง 2 คน ติดเชื้อโควิด 19 และอีกรายเป็นหนุ่มวัย 23 ปี ติดเชื้อโควิดหลังไปส่งกุ้งที่สมุทรสาคร สรุป กระบี่มีคนติดเชื้อแล้ว 4 คน // TNN Thailand
- สาธารณสุขเผย ผู้ป่วย 8 รายแรก จากตลาดกุ้ง จ.สมุทรสาคร อาการดีขึ้นอย่างต่อเนื่อง หากพ้นระยะ 10 วัน ออกจากโรงพยาบาลได้ // ประชาชาติ
- อุบลราชธานี เคสยืนยัน COVID-19 อ.วารินชำราบ เพศชาย อายุ 47 ปี อาชีพ ค้าขาย วันที่ 17 ธค.63 เดินทางไป จ.สมุทรสาคร มาถึง อุบลฯ วันที่ 23 ธค.63 เข้ารับการตรวจที่ รพ.วารินฯ วันที่ 24 ธค.63 ผลตรวจ ติดเชื้อ // ปชส สสจ.อุบลราชธานี
- กรุงเทพ ตลาดอ่อนนุช ประกาศว่า ได้รับแจ้งจาก ศูนย์บริการสาธารณสุข 21 สำนักอนามัย กรุงเทพมหานคร ว่าผลการตรวจ ผู้ค้าในตลาด 1 ราย มีผลเป็นบวก และพบอีก 1 ราย จากการตรวจกลุ่มผู้ใกล้ชิด 10 ราย ทั้ง 2 ราย ได้เข้ารับการรักษาที่โรงพยาบาลแล้ว // เพจตลาดอ่อนนุช Onnuch Freshmart
- ฉะเชิงเทรา พบผู้ติดเชื้อโควิด-19 เพิ่มอีก 1 ราย เป็นผู้ป่วยรักษาตัวที่โรงพยาบาลรัฐแห่งหนึ่ง สรุปตอนนี้ใน จ.ฉะเชิงเทรา มีผู้ป่วยติดเชื้อ รวม 10 ราย // ประชาชาติ
- นครปฐม สำนักงานสาธารณสุขจังหวัดนครปฐม พบผู้ติดเชื้อโควิด-19 เพิ่มอีก 2 ราย 1) รายที่ 39 อ.บางเลน เพศชาย อายุ 40 ปี ต.บัวปากท่า 2) รายที่ 40 อ.เมืองนครปฐม เพศชาย อายุ 33 ปี ต.ดอนยายหอม รวมยอดผู้ป่วยสะสมเป็น 40 ราย // TNN Thailand
- เกาหลีใต้ คนไทย ติดเชื้อโควิด-19 จำนวน 31 ราย โดยอาศัยอยู่ทางตอนใต้ของกรุงโซล โดยรายแรกติดเชื้อเมื่อวันที่ 23 ธันวาคม // TNN Thailand
- สุไหงโก-ลก จับ 11 แรงงานเมียนมา ข้ามจากมาเลเซีย เร่งนำตรวจสุขภาพหวั่นแพร่เชื้อ COVID-19 ก่อนควบคุมตัวขยายผลขบวนการค้าแรงงานเถื่อน // ไทย พีบีเอส
- กรุงเทพ ผู้ป่วย COVID-19 กลุ่มแรก 8 คนจากตลาดกลางกุ้ง จ.สมุทรสาคร อาการดีขึ้น หากพ้นระยะปลอดภัยจากการแพร่โรค 10 วันก็สามารถออกจากโรงพยาบาลได้ // ไทย พีบีเอส
- ชลบุรี ผู้ป่วยยืนยันรายใหม่ สัญชาติไทย 2 ราย ทั้งคู่มีประวัติเดินทางไปยังจังหวัดสมุทรสาคร - เพศชาย อายุ 24 ปี พื้นที่ อำเภอเมืองชลบุรี - เพศชาย อายุ 37 ปี พื้นที่ อำเภอบางละมุง // สำนักงานสาธารณสุขจังหวัดชลบุรี
- ศูนย์ข้อมูล COVID-19 ผลการค้นหาผู้ป่วย โควิด-19 จ.สมุทรสาคร วันที่ 17- 23 ธ.ค.63 - ตรวจหาเชื้อ 8,810 ราย - พบเชื้อ 1,308 ราย
- สุพรรณบุรี แถลงผลยืนยันยอด ผู้ติดเชื้อโควิด-19 ในระลอกใหม่ เพิ่มขึ้นอีก 2 ราย รวมเป็น 9 ราย เป็นชาวอำเภอสองพี่น้อง ทั้ง 2 ราย โดยรายที่ 7 ผู้ป่วย หญิงไทย อายุ 43 ปี ชาว อ.สองพี่น้อง เป็นผู้สัมผัสใกล้ชิดกับผู้ป่วย รายที่ 2 ส่วน รายที่ 9 หญิงไทย อายุ 24 ปี ชาว อ.สองพี่น้อง เป็นบุคคลสัมผัสกลุ่มเสี่ยงสูง ซึ่งหลังจากทำการกักตัว และเริ่มมีอาการป่วย ได้เข้ารับการรักษาที่ รพ.สมเด็จพระสังฆราชองค์ที่ 17 // ประชาชาติ
- สมุทรปราการ พบผู้ติดเชื้อโควิด-19 รายใหม่ 3 ราย รวมผู้ติดเชื้อระลอกใหม่เป็นทั้งหมด 12 ราย โดย รายที่ 10 เป็นหญิง อายุ 49 ปี ชาว อ.พระประแดง อาชีพค้าขายอาหารทะเลที่สะพานปลา พระประแดง รายที่ 11 เป็นหญิง อายุ 40 ปี ชาวทุ่งครุ กทม อาชีพขายอาหารทะเลที่ตลาดครุใน พระประแดง รายที่ 12 เป็นชาย อายุ 62 ปี ชาว ต.ท้ายบ้าน อ.เมือง อาชีพขายอาหารทะเล ที่ตลาดมหาชัย ทั้งหมดรักษาตัวอยู่ในโรงพยาบาล // กลุ่มงานควบคุมโรคติดต่อ สำนักงานสาธารณสุขจังหวัดสมุทรปราการ
- นนทบุรี เผยแพร่ไทม์ไลน์ผู้ป่วย รายที่ 129 ของจังหวัด หรือ รายที่ 13 ของการระบาดระลอกใหม่ เป็น ชายไทย อายุ 36 ปี อ.บางบัวทอง พบว่า ผู้ป่วยไปตลาดมหาชัย, รับ-ส่ง ลูก ที่โรงเรียนชื่อดังย่านบางบัวทอง, ซื้ออาหารที่ตลาดสมบสมบัติบุรี-ตลาดบางเลน // ประชาชาติ
- กระบี่ รายงานผลทางห้องปฏิบัติการพบผู้ป่วยโควิด-19 เพิ่ม 2 ราย โดยเป็นรายที่ 26-27 ของจังหวัด โดยทั้งสองราย เป็น เพศหญิง อายุ 4 ปี และ เพศชาย อายุ 29 ปี ทั้ง 2 ราย สัมผัสใกล้ชิดกับผู้ป่วยยืนยันรายที่ 23-24 ของจังหวัดกระบี่ ซึ่งเข้าร่วมงานบิ๊กไบก์ อ.เกาะลันตา // สำนักงานสาธารณสุขจังหวัดกระบี่
- กรุงเทพ พบผู้ป่วยเพิ่มในพื้นที่กรุงเทพฯ จำนวน 6 ราย รวมผู้ติดเชื้อโควิด-19 ในพื้นที่กรุงเทพฯ ทั้งสิ้น 40 ราย โดยได้สอบสวนโรคแล้วเสร็จจำนวน 9 ราย ซึ่งในจำนวน 9 รายนี้เป็นผู้ป่วยที่เป็นคน กทม. 7 ราย และผู้ป่วยต่างจังหวัดที่เข้าพักรักษาตัวในโรงพยาบาลในพื้นที่กรุงเทพฯ 2 ราย // ประชาชาติ
- สมุทรสาคร เผยตรวจพบผู้ป่วยรายใหม่วันนี้เพิ่ม 87ราย เป็นการตรวจเชิงรุก 50 ราย Walk in 37 ราย รวมผู้ป่วยยืนยันสะสม 1,443 ราย ส่วนการตรวจคัดกรองทั้งหมด 12,962 ราย ตรวจแล็บแล้ว 9,000 ราย ผลพบเชื้อรวม 1,323 ราย เป็นคนไทย 75 ราย แรงงานต่างด้าว 1,248 ราย // ประชาชาติ
- ตรัง แถลงข่าว พบผู้ติดเชื้อไวรัสโควิด-19 จำนวน 1 ราย เป็นหญิง อายุ 31 ปี มีที่พักอาศัยในเขตพื้นที่ อ.เมือง มีธุรกิจร้านชาพะยอมอยู่ใน จ.สมุทรสาคร 22 ธ.ค. มีอาการไข้ ไอ ระคายคอ มีอุณหภูมิ 37.3 องศา ผลจากแล็บโรงพยาบาลตรังออกมาเป็นผลบวก ขณะนี้รักษาที่โรงพยาบาลศูนย์ตรัง // ไทยรัฐ
- นนทบุรี สั่งปิดวัดเล่งเน่ยยี่ 2 ตั้งแต่ 25 ธค 63 – 8 มค 64 หลังพบผู้ติดเชื้อโควิด-19 2 คน นับเป็นรายที่ 14 และ 15 ของการระบาดระลอกใหม่ โดยรายที่ 14 เป็น หญิงชาวเมียนมา อายุ 54 ปี อาศัยอยู่ที่ อ.บางบัวทอง จ.นนทบุรี ส่วนรายที่ 15 เป็นหญิงชาวเมียนมา อายุ 46 ปี พักอยู่ที่ อ.บางบัวทอง เป็นเพื่อนกับหญิงรายแรก // NationTV
- ปทุมธานี รายงาน ผู้ติดเชื้อรายใหม่ จำนวน 2 ราย เป็นรายที่ 5-6 (รวมทั้งหมด 49 ราย) // ศูนย์ปฏิบัติการ COVID-19 จังหวัดปทุมธานี
รายงานผู้ติดเชื้อ 24 ธค 63
- กรุงเทพ ศูนย์การค้าสีลมคอมเพล็กซ์ แจ้งว่าได้ดำเนินการทำความสะอาด และ deep cleaning ทุกบริเวณศูนย์การค้า และทุกจุดสัมผัส ยังคงเปิดให้บริการตามปกติ หลังจากที่มีรายงานว่ามีผู้ป่วยติดเชื้อโควิด-19 ใช้บริการที่ร้านบอนชอนและร้านสเวนเซ่น ซึ่งอยู่ที่ชั้นใต้ดิน เมื่อวันที่ 15 ธันวาคม 2563 // ไทยรัฐ
- นนทบุรี เปิดไทม์ไลน์ ผู้ป่วยไวรัสโควิด-19 รายใหม่ทั้ง 4 ราย มีประวัติขึ้น BTS รวมสะสมเป็น 8 ราย // TNN Thailand
- ฉะเชิงเทรา พบผู้ป่วย COVID-19 เพิ่มอีก 5 คน รวมเป็น 6 คน อาศัยอยู่ใน อ.บางปะกง 3 คน และ อ.บ้านโพธิ์ 3 คน โดยหนึ่งในนั้นเป็นนักเรียนหญิง อายุ 17 ปี (อ.บ้านโพธิ์) ขณะที่โรงเรียนหลายแห่งในจังหวัดประกาศปิดการเรียนการสอน ไปจนถึง 4 ม.ค.64 // Thai PBS
- กระบี่ สาธารณสุขจังหวัดออกประกาศพบผู้ติดเชื้อไวรัส COVID-19 อีก 1 คน เป็นแรงงานข้ามชาติชาวเมียนมา ที่อาศัยอยู่ในที่พักคนงานในสถานประกอบการของ อ.เมืองกระบี่ ซึ่งได้เดินทางไปต่อวีซ่าที่ จ.สมุทรสาคร ด้วยรถตู้โดยสาร มีผู้ร่วมเดินทางไปด้วย 7 คน ระหว่างวันที่ 17-20 ธ.ค.ที่ผ่านมา ขณะนี้ผู้ป่วยรักษาตัวอยู่ที่โรงพยาบาลจังหวัดกระบี่ // Thai PBS
- เชียงใหม่ ไม่มีผู้ป่วยโควิดเพิ่ม ตรวจกลุ่มเสี่ยง 979 ราย ผลเป็นลบ
• 21 ธ.ค. สุ่มตรวจย่านตลาดคำเที่ยง และย่านป่าแพ่ง รวมทั้งในพื้นที่ อ.แม่อาย ยอดตรวจรวมทั้งสิ้น 376 ราย
• 22 ธ.ค. สุ่มตรวจบริเวณตลาดเมืองใหม่ ซึ่งเป็นแหล่งที่คาดว่าเป็นพื้นที่ที่มีความเสี่ยงสูงสุดของเชียงใหม่ และตรวจในพื้นที่ อ.แม่อาย ต่อเนื่อง รวม 603 ราย
• 23 ธ.ค. ตรวจเพิ่มอีก 588 ราย ยังรอผล
• เตรียมคืนพื้นที่ 3 ตำบลของแม่อายเข้าสู่สภาวะปกติ // รพ.นครพิงค์
- เชียงราย ผลตรวจหาเชื้อโควิด-19 เชิงรุก กลุ่มผู้ค้าขายปลีก ขายส่ง อาหารทะเลตลาดสด และพ่อค้าแม่ค้า ในพื้นที่อำเภอเมืองเชียงราย ระหว่าง 21-21 ธ.ค.63 ที่ผ่านมา จำนวน 495 คน ทั้งหมดไม่พบเชื้อแต่ประการใด // สำนักงานสาธารณสุขจังหวัดเชียงราย
- นครปฐม 23 ธันวาคม 2563 มีผู้ติดเชื้อรายใหม่เพิ่ม 4 คน อยู่ในพื้นที่อำเภอกำแพงแสน
รายที่ 32 อ.กำแพงแสน เพศชาย อายุ 26 ปี ต.สระพัฒนา
รายที่ 33 อ.กำแพงแสน เพศชาย อายุ 45 ปี ต.ทุ่งลูกนก
รายที่ 34 อ.กำแพงแสน เพศชาย อายุ 33 ปี ต.ห้วยม่วง
รายที่ 35 อ.กำแพงแสนเพศชาย อายุ 49 ปี ต.ห้วยม่วง // สำนักงานประชาสัมพันธ์จังหวัดนครปฐม
- ระยอง พบผู้ป่วยติดเชื้อไวรัสโคโรนา 2019 แล้ว 1 ราย หญิง วัย 51 ปี อาศัยใน อำเภอเมือง จังหวัดระยอง เป็นผู้ดูแลหมู่บ้านจัดสรรแห่งหนึ่ง // ประชาชาติ
- สงขลา พบผู้ป่วยสงสัยติดเชื้อโควิด-19 จำนวน 1 ราย เชื่อมโยงกับกลุ่มบิ๊กไบค์ เกาะลันตา รอผลการยืนยัน // รพ หาดใหญ่
- กรุงเทพ แถลงพบผู้ป่วยติดเชื้อโควิด-19 ใหม่ 14 ราย ระบุ SWAP ต่างด้าวแล้ว 531 ราย พบติดเชื้อที่ตลาด แคมป์ก่อสร้าง และโรงงาน ทั้งหมดอยู่ระหว่างการสอบสวนโรค ซึ่งส่วนใหญ่พบว่าติดเชื้อมาจาก จ.สมุทรสาคร // ประชาชาติ
- นครปฐม พบผู้ติดเชื้อโควิด-19 เพิ่มอีก 3 ราย อยู่ในพื้นที่อำเภอกำแพงแสน อำเภอบางเลน และอำเภอดอนตูม // TNN Thailand
- ชัยนาท พบผู้ติดเชื้อเพิ่มอีก 5 ราย รวมเป็น 6 ราย พบเป็นพ่อค้าแม่ค้าขายอาหารเล ที่ไปรับมาจาก จ.สมุทรสาคร // ประชาชาติ
เพิ่มเติม
รายที่ 1-2) ผู้ป่วยที่เป็นผู้สัมผัสใกล้ชิดกับผู้ป่วยรายแรก 2 ราย คือ แม่และลูกชายอายุ 5 ปี ที่เดินทางมารับการรักษาที่คลินิกเดียวกับผู้ป่วยรายแรก
รายที่ 3-4) เป็นคู่สามีภรรยา ต.ห้วยงู อ.หันคา เดินทางไปซื้ออาหารทะเล ที่ตลาดสดทะเลไทย วันที่ 15 ธค
รายที่ 5) เป็นภรรยา (ใหม่) ของพ่อของผู้ป่วยโดยรับอาหารทะเลไปจำหน่ายต่อ ในเบื้องต้นผู้ป่วยทั้ง 5 คน ได้เข้ารับการรักษาที่โรงพยาบาลชัยนาทนเรนทร // TNN Thailand (25 ธค 63)
- ราชบุรี ผู้ป่วย COVID-19 ระลอกใหม่ รายที่ 1 ผู้ป่วยชาย อายุ 24 ปี ตำบลหนองกระทุ่ม อำเภอปากท่อ 9-10 ธค ไปตลาดทะเลไทย วันที่ 19 ธค ไม่ได้กลิ่น รักษาตัวอยู่บ้าน 22 ธค ไปตรวจที่ รพ.ราชบุรี เข้าเกณฑ์สอบสวนโรค จนผลตรวจยืนยัน // สำนักงานสาธารณสุขจังหวัดราชบุรี
- เลย พบผู้ติดเชื้อโควิดแล้ว 1 ราย เป็นหญิง อายุ 42 ปี อ.ด่านซ้าย อาชีพขายล็อตเตอรี่ เดินทางไปขายที่ตลาดกุ้ง จ.สมุทรสาคร มีผู้ร่วมสัมผัส 24 คน // สำนักงานสาธารณสุขจังหวัดเลย
- กระบี่ ยอดโควิดเพิ่มรายที่ 2 เป็นภรรยาสาวพนักงานแบงก์ติดเชื้อตามสามี ด้านธนาคารกรุงเทพ สั่งปิดสาขากระบี่ 24-25 ธ.ค.63 ชั่วคราว // ไทยรัฐ
- ฉะเชิงเทรา เผย พบผู้ติดโควิด-19 เพิ่มอีก 3 ราย รวม 3 วัน สะสม 9 ราย // ไทยรัฐ
การรักษาระยะห่าง วินัย เป็นเรื่องจำเป็น:บทเรียน - 2 เมษายน 64 LINK
การรักษาระยะห่าง วินัย เป็นเรื่องจำเป็น:บทเรียน
โรงงานแห่งหนึ่งที่สมุทรสาคร bubble and seal ผล แพร่กันต่อ ตรวจครั้งแรกวันที่ 27 มกราคม ประมาณ 2200 คน มีเชื้อ จาก แยงจมูก 300 คน ค้ดออก ที่เหลือ 1,900 คน ทำงานต่อ ที่โรงงาน และที่พักในและนอกโรงงาน
ตรวจหลังจากนั้น
ครั้งที่ 1 : 14/2/64
มี เลือด บวก 283 และในจำนวนนี้ยังปล่อยเชื้อได้ 148 คน
ตรวจครั้งที่ 2 : 5/3/64 มีเลือดบวก 538 ราย และเป็นคนที่เลือดบวกทั้งครั้งที่หนึ่งและครั้งที่สอง 230 ราย แสดงว่ามีผู้ที่ติดเชื้อใหม่อีก และเมื่อตรวจหาเชื้อพบว่าสามารถปล่อยเชื้อได้ 200 ราย
หมายความว่า
- การแยงจมูกตรวจเชื้อครั้งเดียว ไม่แน่นอน
- การคิดว่าคนที่เหลือ ไม่มีเชื้อ จากการตรวจแยง ปลอดภ้ย เป็นเรื่องไม่ปลอดภัย
- การที่พบเลือดเป็นบวก และมีภูมิคุ้มกันที่ยับยั้งไวรัสในเลือดได้ในระดับสูงไม่ได้เป็นเครื่องแสดงว่าปล่อยเชื้อไม่ได้ เรื่องนี้เป็นเรื่องสำคัญมากเพราะเกี่ยวโยงไปถึงเรื่องวัคซีนพาสปอร์ตที่ดูประวัติการฉีดวัคซีนและดูผลเลือด
- การแพร่โดยไม่มีอาการยังคงเป็นการแพร่ที่มีประสิทธิภาพจากการตรวจครั้งที่หนึ่งและครั้งที่สองห่างกันสามสัปดาห์มีผู้ติดเชื้อเพิ่มขึ้น 255 ราย (583-238) และใน การตรวจครั้งที่ สองนี้ พบ ว่ายังแพร่เชื้อได้ 200 ราย
- ถึงแม้ว่าผู้ที่ติดเชื้อจะไม่มีอาการแต่ความสามารถในการแพร่ต่อไปเรื่อยๆ ยังมีอยู่อย่างสมบูรณ์ เมื่อออกไปยังชุมชนทั่วไปที่เปราะบาง จะเกิดอาการชึ้น
ประการสำคัญก็คือการแพร่ไปเรื่อยๆ ในลักษณะที่ไม่รู้ตัวแบบนี้จะเป็นการเปิดโอกาสให้ไวรัสมีการพัฒนาการและกลายเป็นสายพันธุ์ที่เพิ่มความสามารถในการแพร่กระจาย และดื้อต่อประสิทธิภาพของวัคซีนที่ใช้อยู่
รพ.วิภาวดีพร้อม LINK
โรงพยาบาลวิภาวดี ออกประกาศพร้อมร่วมให้บริการวัคซีนโควิด-19 แก่ประชาชน วันนี้ (1 พค 64) โดยขอให้ท่าน ลงทะเบียนที่
Application หมอพร้อมได้ เลือกฉีดวัคซีนที่โรงพยาบาลวิภาวดี กรุงเทพมหานคร และรพ.จะเปิดระบบเองเพื่อรับลงทะเบียนจองฉีดวัคซีนโควิด-19 ในเร็วๆ นี้ อีกทางหนึ่งเพื่อให้คนไข้ของรพ.มั่นใจว่าจะได้รับวัคซีนครบตามลำดับที่ภาครัฐกำหนด หากท่านมีปัญหาในการลงทะเบียนที่ Application หมอพร้อม ไม่ต้องกังวล ทันทีที่ระบบจองคิวฉีดวัคซีน โควิด 19 ของรพ.พร้อมแล้วจะรีบแจ้งให้ทราบทันที คนไข้ต้องเข้าเกณฑ์ กลุ่มผู้มีอายุ 60 ปีขึ้นไป และกลุ่มผู้มีโรคประจำตัวเรื้อรัง 7 กลุ่ม
Hospitel รพ.ธนบุรี-ชุมพร LINK
รพ.ธนบุรี-ชุมพร เปิดบริการห้องพักผู้ป่วยเฉพาะกิจ Hospitel ร่วมกับ โรงแรม Novotel Chumphon Beach Res
รพ.ธนบุรี-ชุมพร
077 658 555
++ Past Event ++
++ กิจกรรมที่ผ่านไป ++
++ กิจกรรมที่ผ่านไป 2567 ++
หัวข้อข่าว ชีวาภิบาล
มูลนิธิแฮนด์ทูพอว์ (Hand to Paw) ตารางออกหน่วย ทำหมันสุนัขเพศเมีย ฟรี เชียงใหม่
มูลนิธิแฮนด์ทูพอว์ (Hand to Paw) บริการ ทำหมันสุนัขเพศเมีย ฟรี เชียงใหม่ โทร 080-6731770
เช็คตารางการให้บริการประจำแต่ละเดือน กำหนดการทำหมันสุนัขฟรี
- อาทิตย์ 3 มีนาคม 2567 ทำหมันสุนัขฟรี ณ สนามกีฬาดอยสะเก็ด(สนามวัวชน) อ.ดอยสะเก็ด ลงทะเบียน 0806731770
- อาทิตย์ 10 มีนาคม 2567 ณ เทศบาลเมืองแม่โจ้ อ.สันทราย ลงทะเบียนได้ที่เบอร์ 0806731770
- อาทิตย์ 17 มีนาคม 2567 แม่ริม เทศบาลตำบลสันโป่ง สุนัขในเขต แม่ริม สันทราย ดอยสะเก็ด และ สันกำแพง เฉพาะ ตำบลแม่ปูคา ตำบลสันกำแพง ตำบลต้นเปา สุนัขเพศผู้และเพศเมีย น้ำหนัก 10-20 กิโลกรัม / ลงทะเบียนฉีดวีคซีน 6 โรค สุนัขฟรี สำหรับสุนัข อายุ 3 เดือน ขึ้นไป 09.30-11.00 น ลงทะเบียนได้ที่ เบอร์ 0806731770
- อาทิตย์ 31 มีนาคม 2567 แม่แตง ฝ่ายส่งน้ำและบำรุงรักษาแม่แตง
- เสาร์ ที่ 6 เมษายน 2567 เทศบาลตำบลตลาดใหญ่ อำเภอดอยสะเก็ด
- เสาร์ ที่ 20 เมษายน 2567 เทศบาลตำบลสันมหาพน อำเภอแม่แตง
- อาทิตย์ ที่ 21 เมษายน 67 เทศบาลตำบลแม่แรม อำเภอแม่ริม
- ทำหมันสุนัขฟรี ฉีดวัคซีน 6 โรคฟรี วันอาทิตย์ที่ 12 พฤษภาคม 2567 ณ เทศบาลตำบลสันทรายหลวง จำนวน 100 ตัว
- อาทิตย์ 9 มิย 67 ทต.เจดีย์แม่ครัว สุนัขเพศเมียและเพศผู้ น้ำหนัก 10-20 กิโลกรัม
- อาทิตย์ 23 มิย 67 ม.ราชภัช สะสวง สุนัขเพศเมียและเพศผู้ น้ำหนัก 10-20 กิโลกรัม
- เสาร์ 29 มิย 67 ทต.สันมหาพน แม่แตง สุนัขทั้งเพศผู้และเพศเมีย น้ำหนัก 10-20 กิโลกรัม
- อาทิตย์14 กรกฎาคม 2567 ณ เทศบาลตำบลสำราญราษฎร์ อำเภอดอยสะเก็ด
- อาทิตย์ ที่ 21 กรกฎาคม 2567 ณ เทศบาลเมืองต้นเปา สันกำแพง
สุนัข พันธุ์ต่างประเทศ ลูกผสมพันธุ์ต่างประเทศ ไม่รับทำหมันเนื่องจากมีความเสี่ยงสูง (สอบถามความเสี่ยงตามเบอร์ 0806731770)
รายงานผู้ติดเชื้อ 23 ธค 63
- ขอนแก่น พบผู้ป่วยโควิด 19 เป็นหญิงวัย 24 ปี เป็นพนักงานโรงงานแห่งหนึ่งที่สมุทรสาคร มีประวัติสัมผัสกับแรงงานชาวเมียนมาที่ตลาดมหาชัย มีอาการป่วยและเดินทางกลับมาบ้าน เมื่อวันที่ 21 ธันวาคม ด้วยรถโดยสารสาธารณะ กรุงเทพ-ขอนแก่น ถึงแล้วเข้ารับการตรวจคัดกรอง ที่รพ.ศูนย์ขอนแก่นทันที // TNN Thailand
- ภูเก็ต พบผู้ติดเชื้อโควิด-19 เป็นชายไทย อายุ 40 ปี ทำงานใน อ.เมืองภูเก็ต สัมผัสกับผู้ที่เดินทางมาจากมหาชัย ซึ่งทราบข่าวภายหลัง ว่าเมื่อวันที่ 20 ธันวาคม เพื่อนคนนี้ติดชื้อโควิด-19 จึงตัดสินใจไปตรวจที่โรงพยาบาลวชิระภูเก็ต // TNN Thailand
- สุพรรณบุรี ประกาศผลการตรวจหาเชื้อไวรัสโควิด-19 พบผู้ติดเชื้อเพิ่มอีก 5 ราย จากเดิม 2 ราย รวมตรวจพบผู้ติดเชื้อแล้วทั้งหมด 7 ราย ทั้งหมดอยู่ระหว่างการรักษา // TNN Thailand
- โคราช พบ 3 คนติดเชื้อ COVID -19 รอบใหม่
1) ชายไทย อายุ 57 ปี อาชีพค้าขายทะเล เดินทางไปซื้ออาหารทะเลที่ จ.สมุทรสาคร วันที่ 20 ธ.ค.63 ยังไม่มีอาการ
2) หญิงไทย อายุ 47 อาชีพค้าขายอาหารทะเล 17 ธ.ค.63 ผู้ป่วยเริ่มมีอาการไอ ระหว่างเดินทางมาที่ อ.สีคิ้ว 21 ธ.ค.ไปรักษาตัวที่ รพ.เอกชน บนถนนพระราม 2 ติดกับ จ.สมุทรสาคร ซึ่งผลการตรวจจะทราบในวันที่ 22 ธ.ค.แต่ไม่ได้รอผล และได้เดินทางมา อ.หนองน้ำใส
3) ชายไทย อายุ 43 ปี ข้าราชการ อบต.ในพื้นที่ อ.บัวใหญ่ เดินทางไปเยี่ยมมารดาที่ จ.สมุทรสาคร วันที่ 18 ธค.63 มีอาการไข้ ไอ เจ็บคอ ก่อนวันที่ 22 ค.63 เข้าตรวจที่ รพ. ปรากฏว่าพบเชื้อ // ไทยพีบีเอส
- นครศรีธรรมราช พบ COVID-19 รายแรก ระบาดรอบใหม่ เป็นหญิงอายุ 42 ปี ขายเครื่องแกงที่ตลาดมหาชัย จ.สมุทรสาคร 22 ธ.ค. ผลตรวจยืนยัน ติดเชื้อ ส่วนคนในครอบครัวไม่พบเชื่อ และเข้ากักตัวแล้ว // ไทยพีบีเอส
- กระบี่ รายงานพบผู้ติดเชื้อ COVID-19 จำนวน 1 คน เป็นแรงงานหญิงชาวเมียนมาอายุ 48 มีประวัติเดินทางไป จ.สมุทรสาคร เมื่อวันที่ 14-16 ธ.ค. พบเชื้อ COVID-19 ในวันที่ 22 ธ.ค. ขณะนี้ผู้ป่วยรักษาตัวที่ รพ.กระบี่ // ไทยพีบีเอส
- ปราจีนบุรี ยืนยัน 2 คนขับรถส่งกุ้ง ติด COVID-19 เข้ารักษาตัวที่โรงพยาบาลเจ้าพระยาอภัยภูเบศร // ไทยพีบีเอส
- ชลบุรี พบแรงงานข้ามชาติชาวกัมพูชาลักลอบเข้าเมืองโดยรถตู้จำนวน 11 คน พบติดเชื้อ COVID-19 แล้ว 1 คน เป็นหญิง อายุ 19 ปี นำตัวเข้าไปรักษาที่โรงพยาบาลแล้ว ขณะที่พบผู้มีประวัติเสี่ยงสมุทรสาคร 2 คน เป็นคนขนส่งอาหาร อยู่ระหว่างรอผลตรวจเชื้อ // ไทยพีบีเอส
- สมุทรสงคราม ผู้ว่าฯ มีคำสั่งล็อกดาวน์จังหวัด 13 วัน ให้ปิดสถานศึกษาทุกแห่ง ศูนย์พัฒนาเด็กเล็ก โรงภาพยนตร์ ห้างสรรพสินค้า ยกเว้นแผนกซูเปอร์มาร์เก็ต แผนกขายยา แผนกอาหาร หลังพบผู้ติดเชื้อแล้ว 6 คน รอผลยืนยันอีก 2 คน // ไทยพีบีเอส
- สมุทรสงคราม แถลงยืนยันผลตรวจหาเชื้อครั้งที่ 2 พบผู้ติดเชื้อ 6 คน รอผลอีก 2 คน ทั้งหมดเป็นคนไทย เป็นหญิง 3 คน ชาย 3 คน (1 คู่สามีภรรยา) จาก อ.อัมพวา อ.เมือง // ไทยพีบีเอส
- ชัยนาท ไม่รอด! พบผู้ป่วยโควิด-19 รายแรก อายุ 35 ปี เป็นพ่อค้าขายอาหารทะเลตามตลาดนัด โดยมีประวัติเดินทางไปที่ตลาดบางบอนและตลาดทะเลไทย ช่วง 1- 19 ธ.ค.63 ผู้ป่วยได้เดินทางไปกับภรรยา ซึ่งภรรยาตรวจแล้วผลเป็นลบ // TNN Thailand
- กรุงเทพ สั่งปิด 12 วัน “โรงเรียน-ศูนย์เด็กเล็ก” ทั้งหมดขอความร่วมมือทำงานที่บ้าน หวังหยุดเชื้อโควิด เข้มจัดงานรื่นเริงปีใหม่เกิน 300 คน ต้องขออนุญาต ลุยตรวจแรงงานต่างด้าวโรงงานย่านบางขุนเทียน บางบอน ไซต์ก่อสร้าง เผยตรวจ 100 ตลาด ยังไม่พบผู้ติดเชื้อ ยังไม่ประกาศล็อกดาวน์ รอประเมินสถานการณ์วันต่อวัน // ประชาชาติ
- สุราษฎร์ธานี เปิดไทม์ไลน์ผู้ติดเชื้อโควิดรายแรก ชายวัย 53 ปี เดินทางไปตลาดทะเลไท ส่งกุ้งที่ระนอง เข้ารับการตรวจที่ รพ. กาญจนดิษฐ์ เมื่อ 21 ธค 63 ไม่มีอาการ 22 ธค 63 ผลพบเชื้อโควิด-19 // ประชาชาติ
- ปทุมธานี 29 โรงเรียน ในปทุมธานี และพื้นที่ใกล้เคียง ประกาศปิดเรียนวันที่ 22 ธ.ค. 2563 – 3 ม.ค. 2564 เนื่องจากสถานการณ์ระบาดโควิด-19 ระลอกใหม่ // ประชาชาติ
- กรุงเทพ ศูนย์การค้าสยามเซ็นเตอร์ ระบุว่า ได้รับแจ้งจากร้านพัลแซก Palsaik Korean BBQ ชั้น 2 ศูนย์การค้าสยามเซ็นเตอร์ ว่า มีพนักงานของร้านจำนวน 1 คน เป็นผู้ป่วยติดเชื้อโควิด-19 เนื่องจาก ได้เดินทางไปยังพื้นที่เสี่ยงในจังหวัดสมุทรสาคร โดยศูนย์ได้รับแจ้งยืนยันผลการตรวจเชื้อโควิด-19 ในค่ำวันที่ 22 ธันวาคมที่ผ่านมา // ประชาชาติ
- ภูเก็ต พบติดโควิดเพิ่มอีก 2 ราย เป็นลูกชายคนโต และลูกชายคนเล็ก ของผู้ป่วยรายแรก ทั้ง 2 คนอยู่ในความดูแลของแพทย์ โรงพยาบาลป่าตอง ส่วนกลุ่มเสี่ยง 26 ราย ผลตรวจเป็นลบ // ไทยรัฐ
- นนทบุรี พบผู้ติดเชื้อโควิด-19 รายใหม่เพิ่มอีก 4 ราย ทำให้มีผู้ป่วยยืนยันสะสมรอบใหม่เป็น 8 ราย // ไทยรัฐ
- นนทบุรี เทศบาลได้ยกเลิกการจัดงานเคาต์ดาวน์วันที่ 31 ธค 63 รวมทั้งการจัดงานทำบุญตักบาตรปีใหม่วันที่ 1 มค 64 และสั่งปิดสถานศึกษาสังกัดเทศบาล โรงเรียนประถม และมัธยมทั้ง 6 โรงเรียน และสถานดูแลเด็กเล็กอีก 12 แห่ง ไปจนถึงวันที่ 3 มค 64 // ไทยรัฐ
- ชลบุรี พัทยา-อ่างศิลา ลุ้นหนัก เจอ 2 ราย ลูกจ้างส่งอาหารทะเลไปพื้นที่เสี่ยงสมุทรสาคร ตรวจโควิดรอบแรกเป็นบวก รอผลรอบ 2 // ไทยรัฐ
- อ่างทอง ผู้ว่าฯ ยืนยันพบผู้ติดโควิด-19 แล้ว 1 ราย เป็นเพศหญิง เดินทางไปตลาดอาหารทะเลสดที่จังหวัดสมุทรสาคร เมื่อวันที่ 20 ธ.ค.63 (ไม่แสดงอาการ) ได้แยกกลุ่มเสี่ยง 6 คน ตรวจหาเชื้อแล้ว // ไทยรัฐ
- ชัยภูมิ มีการยืนยันว่าพบผู้ป่วยแล้ว 2 ราย ซึ่งเป็นแม่ค้า วัย 41 ปี และลูกสาววัย 15 ปี ส่วนอีกรายเป็นชาย ซึ่งเป็นพ่อค้า อยู่ระหว่างการรอผลแล็บยืนยันจากส่วนกลาง ทั้งหมดมีการเดินทางไปซื้อของที่ตลาดในสมุทรสาคร // ไทยรัฐ
- กรมควบคุมโรค เปิดเผยถึงความคืบหน้าผลการสอบสวนโรคโควิด-19 จ.สมุทรสาครว่า จากข้อมูลการตรวจคัดกรองเชิงรุกในชุมชน เมื่อเวลา 14.00 น. พบว่ามียอดผู้ติดเชื้อโควิด-19 สะสมเพิ่มขึ้นเป็น 1,192 ราย โดยมาจากตลาดกลางกุ้ง 901 ราย, ตลาดทะเลไทย 137 ราย, ชุมชนซอยเศรษฐกิจ 13 จำนวน 134 ราย, สะพานปลา 2 ราย และชุมชนท่าจีน 18 ราย
- พิจิตร พบแรงงานต่างด้าวติดโควิด-19 จำนวน 3 ราย ทั้งหมดเป็นแรงงานต่างด้าวทำงานในฟาร์มหมู และโรงสี ซึ่งเป็นสถานที่ปิด มีที่พักอาศัยเป็นสัดส่วน มีไทม์ไลน์เดินทางไปทำพาสปอร์ต หรือหนังสือเดินทาง ที่ จ.สมุทรสาคร เมื่อวันที่ 14 ธ.ค ขณะนี้อยู่ในการดูแลของแพทย์ // เดลินิวส์
- การพบผู้ติดเชื้อเพิ่มเติมจากจังหวัดต่างๆ นอก จ.สมุทรสาคร ในช่วงวันที่ 1-22 ธ.ค.63 พบว่า ล่าสุดมีการติดเชื้อแล้ว 65 ราย มาจากกรุงเทพฯ 16 ราย, นครปฐม 10 ราย, ฉะเชิงเทรา 6 ราย, สมุทรปราการ 5 ราย, สระบุรี 5 ราย, ปทุมธานี 3 ราย, กำแพงเพชร 2 ราย, นนทบุรี 2 ราย, ปราจีนบุรี 2 ราย, พระนครศรีอยุธยา 2 ราย นอกนั้นจังหวัดละ 1 ราย คือ กระบี่, ขอนแก่น, นครราชสีมา, เพชรบุรี, เพชรบูรณ์, ภูเก็ต, สุพรรณบุรี, อุตรดิตถ์, สุราษฎร์ธานี,นครศรีธรรมราช, ประจวบคีรีขันธ์ และชัยนาท // TNN Thailand
- ตาก เปิดไทม์ไลน์ผู้ติดโควิด 4 ราย รายแรกเป็นพนักงานเก็บเงินในห้างฯ รายที่สองอาชีพรับจ้าง รายที่สามเป็นพนักงานเก็บเงินในมินิมาร์ท ส่งรายที่สี่ อาชีพขับรถส่งสินค้า เป็นสามีพนักงานเก็บเงินในมินิมาร์ท // ประชาชาติ
- อุดรธานี พบผู้ติดโควิด-19 ในระลอก 2 รายแรก เป็นชายไทยอายุ 30 ปี มีอาชีพขายอาหารทะเล มีการสัมผัสมาจากจังหวัดสมุทรสาคร ผู้เสี่ยงแวดล้อมมากกว่า 500 ราย ต้องสั่งปิดตลาด // ประชาชาติ
- นครสวรรค์ พบผู้ติดเชื้อรายแรก เป็นชาย อายุ 59 ปี อยู่ 14 ต.วัดไทรย์ อ.เมือง จังหวัดนครสวรรค์ หลังเดินทางไปตลาดทะเลไทย จ.สมุทรสาคร เมื่อ 15 ธันวาคม โดยไปกับหลาน วัย 31 ปี แต่หลานผลตรวจเป็นลบ // มติชน
- กรุงเทพ Lamptitude สาขาเอกมัย แจ้งว่า เมื่อวันที่ 22 ธค ได้รับแจ้งจากพนักงาน 1 ท่านติดเชื้อโควิด จึงได้แจ้งปิดสาขา หยุดรับลูกค้าทันที และรีบติดต่อประสานงาน แจ้ง กระทรวงสาธารณสุขให้เข้าพื้นที่ และ ทำความสะอาดฆ่าเชื้อและปิดพื้นที่ ทั้งสาขา เอกมัยในวันที่ 23 ธค 63 // มติชน
- กรุงเทพ พบป่วยโควิด-19 รอบใหม่ เพิ่มอีก 11 ราย รวมเป็น 20 ราย // มติชน
- เพชรบุรี พบผู้ป่วยติดเชื้อ 1 ราย เป็นหญิงไทย อายุ 50 ปี อาชีพรับซื้อกุ้ง ตรวจเชื้อเมื่อ 20 ธค 63 // สสจ.เพชรบุรี
- ปทุมธานี สั่งปิดตลาด 4 แห่ง ตั้งแต่วันที่ 23 ธันวาคม 2563 ถึงวันที่ 4 มกราคม 2564 ได้แก่ 1.ตลาดนัดวัดสระบัว ตำบลบึงน้ำรักษ์ อำเภอธัญบุรี 2.ตลาดนัดวัดนพรัตน์ ตำบลนพรัตน์ อำเภอหนองเสือ 3.ตลาดนัดวัดเจริญบุญ ตำบลบึงกาสาม อำเภอหนองเสือ 4.ตลาดนัดวัดสุทธการาม ตำบลหนองสามวัง อำเภอหนองเสือ // ประชาชาติ
รายงานผู้ติดเชื้อ 22 ธันวาคม 2563
- นนทบุรี พบผู้ป่วยโควิดรายแรกของการระบาดใหม่ เป็น ผู้ป่วยชายไทย อายุ 63 ปี ที่อยู่ อำเภอเมืองนนทบุรี จังหวัดนนทบุรี ผู้สัมผัสร่วมบ้าน 1 ราย (ภรรยา) ตรวจ Lab ให้ผลลบ ผู้สัมผัสใกล้ชิด (High Risk) จำนวน 15 คน ติดตามได้ครบทุกคน ตรวจ Lab 22 ธันวาคม 2563 ผู้สัมผัสเสี่ยงต่ำ (Low Risk) อยู่ระหว่างการติดตามโดย สสอ.เมืองนนทบุรี สสอ.บางใหญ่ และกทม. // ประชาชาติ
- ฉะเชิงเทรา พบผู้ติดเชื้อโควิด-19 จำนวน 1 ราย เป็นเพศหญิง อายุ 24 ปี พนักงานบริษัท ในเขตพื้นที่อำเภอบางปะกง // ประชาชาติ
- นครปฐม พบผู้ติดเชื้อโควิดเพิ่ม 5 ราย เร่งสอบสวนไทม์ไลน์ โดยผู้ป่วยรายใหม่
รายที่ 27 เป็น เพศชาย อายุ 33 ปี บ้านอยู่ในเขตตำบลธรรมศาลา อ.เมืองนครปฐม
รายที่ 28 เป็นเพศชาย อายุ 34 ปีบ้านอยู่ในเขต ต.ดอนตูม อ.บางเลน
รายที่ 29 เพศชาย อายุ 37 ปี ต.บางหลวง อ.บางเลน
รายที่ 30 เพศชาย อายุ 46 ปี ต.บางหลวง อ.บางเลน
รายที่ 31 เพศชาย อายุ 59 ปี ต.ห้วยม่วง อ.กำแพงแสน // ประชาชาติ
- สมุทรสงคราม ติดโควิดแล้ว 8 ราย เป็นคนไทยทั้งหมด (จากกลุ่มเสี่ยง 91 ราย) สัมผัสตลาดกลางกุ้งมหาชัยและตลาดทะเลไทย 6 ราย ไปห้างบิ๊กซีและโลตัสมหาชัย 1 ราย ไปเซ็นทรัลมหาชัย 1 ราย // ประชาชาติ
- กรุงเทพ กรมชลประทานปิดตึก-กักตัว พ่นเชื้อภายในอาคาร 2 วัน หลังพบเจ้าหน้าที่ติดโควิด-19 มีประวัติเดินทางไปรับประทานอาหารในพื้นที่เสี่ยง จังหวัดสมุทรสาคร เมื่อวันที่ 13 ธันวาคม // ประชาชาติ
- เพชรบูรณ์ พบผู้ป่วยยืนยันติดโควิด 1คน เป็นชายอายุ 64 ปี มีประวัติเดินทางไปยตลาดทะเลไทย จ.สมุทรสาคร ระหว่างเดินทางกลับได้แวะส่งสินค้าและทำธุระในพื้นที่ จ.สระบุรี ลพบุรี และนครราชสีมา ก่อนเดินทางกลับ จ.เพชรบูรณ์ ส่วนนายจ้างหญิง อายุ 68 ปี ที่เดินทางไปพร้อมกัน ยังอยู่ระหว่างรอผลตรวจยืนยัน // ไทยพีบีเอส
- กำแพงเพชร พบติดโควิด 2 คน
คนแรก) เป็นชายอายุ 43 ปี ใน อ.ขาณุวรลักษบุรี จากการสอบสวนโรคพบว่า เดินทางไปตลาดทะเลไทย จ.สมุทรสาคร ในวันที่ 4, 9, 13 ธ.ค. และเดินทางกลับกำแพงเพชรในวันรุ่งขึ้น วันที่ 17 ธ.ค. ไปตลาดทะเลไทยอีกครั้ง วันที่ 18 ธ.ค. นำสินค้าไปไว้ที่ร้านอาหารซีฟู๊ด
คนที่ 2) เป็นชายอายุ 43 ปี ใน อ.คลองขลุง โดยในวันที่ 6-19 ธ.ค. ทำงานขับรถส่งอาหารทะเลตลาดแม่กลอง ไปยังตลาดทะเลไทย วันที่ 20 ธ.ค. เดินทางโดยรถยนต์ส่วนตัว พร้อมภรรยาและลูกชาย ออกจาก จ.สมุทรสาคร ไปยัง ต.คลองสมบูรณ์ อ.คลองขลุง จ.กำแพงเพชร วันที่ 21 ธ.ค. เข้ารับการตรวจที่โรงพยาบาลคลองขลุง พร้อมภรรยาและลูกชาย โดยผลตรวจชายวัย 43 ปี พบเชื้อ แต่ไม่มีอาการ และเข้าสถานที่กักกันในวันที่ 22 ธ.ค. // ไทยพีบีเอส
- ประจวบคีรีขันธ์ เผยไทม์ไลน์ผู้ติดโควิด ซึ่งเป็นหญิงอายุ 54 ปี อาชีพ รับราชการ (ผู้ป่วยรายนี้เป็นน้องสาวขอผู้ป่วยรายแรกของ จ.สมุทรสาคร) พบติดเชื้อวันที่ 21 ธ.ค. และเข้ารับการรักษาที่ รพ.วชิระ กรุงเทพฯ // ประชาชาติ
รายงานผู้ติดเชื้อ 21 ธค 63
- สระบุรี ติดเชื้ออีก 3 ราย ไปรับอาหารทะเลจากสมุทรสาครมาขายที่ร้านบุฟเฟต์อาหารทะเล ทางจังหวัดเตรียมแถลงยืนยันช่วงสายวันนี้ // Saraburi สระบุรี
- กรุงเทพ เผยผลตรวจโควิด กทม. พบติดเชื้อ 2 ราย ทำงานแพกุ้งสมุทรสาคร พักอาศัยอยู่ ”บางขุนเทียน” อีกรายอยู่ระหว่างสอบสวนโรค ขณะที่เมื่อวานพบ 2 ราย เป็นแม่ค้าย่านบางซื่อ ตรวจ 51 กลุ่มเสี่ยงไม่พบ ด้านแม่ค้าย่านคลองสามวา อยู่ระหว่างตรวจอีก 4 ราย // ประชาชาติ
- อุตรดิตถ์ ยืนยันพบแม่ค้าอาหารทะเล อายุ 48 ปี ป่วยโควิด-19! พบนำอาหารทะเลมาจากตลาดมหาชัย จ.สมุทรสาคร นอกจากนี้ยังมีกลุ่มคนใกล้ชิดทั้งคนล้างอาหารทะเล และ ผู้ช่วยรวม 8 ราย ก็มีความเสี่ยงสูงเช่นเดียวกัน ซึ่งทั้งหมดได้ส่งสารคัดหลั่งไปทำการตรวจแล้วเช่นเดียวกันแต่ผลก็ยังไม่ออก // ประชาชาติ
- นครปฐม พบผู้ป่วยโควิด-19 เพิ่มอีก 1 ราย เป็นหญิงวัย 57 ปี // มติชน
- สมุทรปราการ ติดโควิดเพิ่ม 1 ราย เป็นชายวัย 52 ปี เป็นพ่อค้าที่ขายของอยู่ใกล้ตรอกหอย ซึ่งเป็นบริเวณเดียวกับที่พบผู้ป่วยรายแรก ซึ่งมีความเชื่อมโยงกับผู้ป่วยรายแรก นอกจากนี้ยังมีการเฝ้าระวังลูกชาย ที่กำลังเรียนอยู่ชั้น ม.5 และลูกสาว ที่กำลังเรียนอยู่ชั้น ป.5 ของผู้ป่วยรายที่ 2 และ 3 ที่เป็นสามีภรรยากัน ที่ทางเจ้าหน้าที่ได้เก็บตัวอย่างเนื้อเยื่อส่งตรวจ ซึ่งจะทราบผลในวันพรุ่งนี้ สรุปว่าขณะนี้มีผู้ป่วยติดเชื้อโควิด-19 ระลอกใหม่ จำนวน 4 ราย // ประชาชาติ
- กรุงเทพ - จ้าของร้านอาหารดัง สมศักดิ์ ปูอบ” สาขาบีทีเอสกรุงธนบุรี ติดเชื้อโควิด หลังเดินทางไปแพกุ้งที่มหาชัย พร้อมแจงไทม์ไลน์ ทำงานที่ร้าน เดินทางไปสยามสแควร์วัน // ประชาชาติ
- ปทุมธานี พบ 2 ผัวเมียขายอาหารทะเลติดโควิด หลังไปซื้อกุ้งและอาหารทะเลสดจากแพกุ้ง จ.สมุทรสาคร และนำมาขายในตลาดนัดวัดสระบัว ตอนนี้อยู่ระหว่างรักษาตัวที่ ร.พ.ธัญบุรี // ประชาชาติ
GIFT PROJECT เพื่อหมาแมวจรน่าน
กลุ่มคนเล็กๆ ช่วยกันระดมทุนเพื่อหมาแมวจรน่าน (ไม่ใช่มูลนิธิ) จัดกิจกรรมทำหมันแมวฟรี ในพื้นที่จ.น่าน โดยร่วมกับคลินิกสัตว์ ผู้สนใจ ร่วมสมทบทุนได้ที่ บัญชี ธ.กสิกร 171-3-22379-0 หรือซื้อสินค้า Art & Crafts ที่เพจ
Gift Project เพื่อหมาแมวจรน่านรพ.วิมุต เปิดรับผู้ที่ต้องการรับวัคซีนโควิด-19 ระยะที่ 2 LINK
รพ.วิมุต เปิดรับผู้ที่ต้องการรับวัคซีนโควิด-19 ระยะที่ 2
รพ.วิมุต เปิดให้บริการแล้ววันนี้ ท่านสามารถแสดงเจตจำนงค์รับวัคซีนโควิด-19 ที่โรงพยาบาลวิมุต ด้วย 3 ขั้นตอนง่ายๆ
1) ลงทะเบียนใน Line Official /App "หมอพร้อม"
2) ลงทะเบียน ใน Google Form
ของ รพ.วิมุต เพื่อขอส่งชื่อเข้าระบบวัคซีน
แบบ Form เพื่อแสดงความจำนงค์รับวัคซีนที่รพ.วิมุต
คลิ๊ก https://qrgo.page.link/AcDdY
3) เมื่อ รพ.วิมุตได้รับวัคซีนโควิด-19 จากภาครัฐบาลมาเพิ่ม จะประกาศให้ทราบทาง Line OA และ Facebook
ท่านถึงจะสามารถ "จองวันและเวลา" ที่จะมาฉีดวัคซีนที่รพ.วิมุต
โดยจองในระบบหมอพร้อม (เริ่มฉีด มิถุนายน 2564 เป็นต้นไป)
โรงพยาบาลวิมุต Call center : 02-079-0000
จัดตั้ง กุฏิชีวาภิบาล ทุกอำเภอ ดูแลสุขภาพพระสงฆ์ 7.2 หมื่นรูป LINK
รัฐมนตรีว่าการกระทรวงสาธารณสุข หารือร่วมกับ รัฐมนตรีประจำสำนักนายกรัฐมนตรี และสำนักงานพระพุทธศาสนาฯ เดินหน้าดูแลส่งเสริมสุขภาพพระสงฆ์ หลังพบยังอาพาธด้วยโรคไม่ติดเรื้อรังสูง เตรียมจัดโครงการดูแลสุขภาพพระสงฆ์ 72,000 รูป เทิดพระเกียรติในหลวง 72 พรรษา จัดตั้งกุฏิชีวาภิบาลอำเภอละ 1 แห่ง อบรมพระคิลานุปัฏฐาก 420 ชั่วโมง เป็น Care Giver ดูแลพระสงฆ์อาพาธติดเตียง พร้อมคิกออฟเชื่อมโยงระบบข้อมูลสิทธิการรักษา
24 พฤษภาคม 2567 อบต.ถ้ำวัวแดง ทำหมันหมาแมวฟรี
โครงการจัดทำหมันสุนัขและแมวในพื้นที่ตำบลถ้ำวัวแดง ประจำปีงบประมาณ พ.ศ.2567 ประชาสัมพันธ์ กองสาธารณสุขและสิ่งแวดล้อม องค์การบริหารส่วนตำบลถ้ำวัวแดง ราวมกับ ปศุสัตว์จังหวัดชัยภูมิ จัดทำโครงการจัดทำหมันสุนัขและแมวในพื้นที่ตำบลถ้ำวัวแดง ประจำปีงบประมาณ พ.ศ.2567 ภายใต้แผนยุทธศาสตร์การดำเนินการโครงการสัตว์ปลอดโรค คนปลอดภัย ตามพระปณิธานศาตราจารย์ ดร. สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณ์วลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัติยราชนารี วันศุกร์ ที่ 24 พฤษภาคม 2567 ณ องค์การบริหารส่วนตำบลถ้ำวัวแดง (อาคารโดม) ตั้งแต่เวลา 08.00 น. - 12.00 น. รับจำนวนจำกัด 40 ตัว ให้เจ้าของสัตว์นำบัตรประชาชนมาลงทะเบียนรับบริการ ที่ องค์การบริหารส่วนตำบลถ้ำวัวแดง ให้งดน้ำ งดอาหาร สุนัข - แมว ก่อนที่จะมารับบริการ อย่างน้อย 6-8 ชั่วโมง สอบถามรายละเอียดเพิ่มเติมได้ที่ 044-052-971 ต่อ 2191 กองสาธารณสุข ฯ
12 มกราคม 67 ทำหมันสุนัขในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ ศูนย์นันทนาการคลองเตย
บริการทำหมันน้องหมาแมว ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป (น้องหมา) ในงาน "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับในวันที่ 12 มกราคม ตั้งแต่เวลา 08.00 - 14.00 น. ณ ศูนย์นันทนาการคลองเตย เขตคลองเตย ในงานมีบริการและกิจกรรมตรวจสุขภาพ อื่น ๆ อีกมากมาย
19 มกราคม 67 ทำหมันหมาแมว ณ โรงเรียนมะเซาะฮะตุดดีน เขตสะพานสูง
บริการทำหมันหมาแมว ฉีดวัคซีนหมาแมว และกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย จากหน่วยบริการสุขภาพเคลื่อนที่ กรุงเทพมหานคร ในงาน "สุขภาพดี ใกล้บ้าน ใกล้หมอ" วันที่ 19 มกราคม ตั้งแต่เวลา 08.00 - 14.00 น.
ณ โรงเรียนมะเซาะฮะตุดดีน เขตสะพานสูง
2 กุมภาพันธ์ 2567 ทำหมันหมาแมว บิ๊กซี่ ซูเปอร์เซ็นเตอร์ สาขาดาวคะนอง เขตธนบุรี
บริการทำหมันหมาแมว ฉีดวัคซีนหมาแมว และกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย จากหน่วยบริการสุขภาพเคลื่อนที่ กรุงเทพมหานคร ในงาน "สุขภาพดี ใกล้บ้าน ใกล้หมอ" วันศุกร์ที่ 2 กุมภาพันธ์ 2567 ณ บิ๊กซี่ ซูเปอร์เซ็นเตอร์ สาขาดาวคะนอง เขตธนบุรี
16 กุมภาพันธ์ 2567 ทำหมันสุนัขแมว ในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ วัดบางกระดี่ เขตบางขุนเทียน
"สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 16 กุมภาพันธ์ 2567 ตั้งแต่เวลา 08.00 - 14.00 น. ณ วัดบางกระดี่ เขตบางขุนเทียน
รัฐบาล มุ่งยกระดับการดูแลสุขภาพ “พระสงฆ์-สามเณร” ตั้งเป้า มี “กุฏิชีวาภิบาล” ทุกอำเภอ ทั่วประเทศ
รัฐบาล เปิด โครงการดูแลสุขภาพพระภิกษุสงฆ์และสามเณร เฉลิมพระเกียรติพระบาทสมเด็จพระเจ้าอยู่หัว เนื่องในโอกาสพระราชพิธี มหามงคลเฉลิมพระชนมพรรษา 6 รอบ 28 กรกฎาคม 2567 โดยสร้างกลไกการดำเนินงานให้เอื้อต่อการดูแลสุขภาพพระภิกษุสงฆ์ระดับพื้นที่ ครอบคลุมทั้งการให้ความรู้ส่งเสริมสุขภาพ การดูแลรักษาพยาบาลในสถานพยาบาล การเข้าถึงสิทธิการรักษา การจัดตั้งกุฏิชีวาภิบาลและสถานชีวาภิบาลสำหรับดูแลพระสงฆ์อาพาธ มีเป้าหมายจัดตั้ง กุฏิชีวาภิบาล อำเภอละ 1 แห่ง โดยปัจจุบันมีกุฏิ/บ้านชีวาภิบาล ที่พร้อมดำเนินการแล้ว 788 แห่งทั่วประเทศ
ทั้งนี้ ข้อมูลปี 2564 ทั่วประเทศไทยมีวัดกว่า 43,000 แห่ง พระสงฆ์-สามเณร ประมาณ 2.4 แสนรูป กว่า 50% อยู่ในวัยสูงอายุ อาพาธโรคเรื้อรัง รวมถึงอาพาธระยะท้าย ซึ่งการดูแลส่งเสริมสุขภาพ ป้องกันโรค รักษาพยาบาล การควบคุมโรคและการจัดการปัจจัยคุกคามสุขภาพ ต้องเป็นไปตามหลักพระธรรมวินัยและธรรมนูญสุขภาพพระสงฆ์ พ.ศ.2566 [
thaigov]
////////////////
กองควบคุมวัตถุเสพติด สำนักงานคณะกรรมการอาหารและยา กระทรวงสาธารณสุข ถนนติวานนท์ อำเภอเมือง จังหวัดนนทบุรี 11000 โทร 02 590 7772-3 โทรสาร 02 590 7772 narcotic@fda.moph.go.th
โรงพยาบาลสงฆ์จัดตั้ง กุฏิชีวาภิบาล ดูแลพระสงฆ์อาพาธระยะท้าย LINK
โรงพยาบาลสงฆ์ ร่วมมือกับคณะพระสังฆาธิการ สำนักงานพระพุทธศาสนาแห่งชาติ รวมทั้งองค์กรภาคีเครือข่าย ด้านการแพทย์ การสาธารณสุขในพื้นที่ ร่วมขับเคลื่อนโครงการกุฏิชีวาภิบาล พร้อมมีการอบรมถวายความรู้พระคิลานุปัฏฐาก ให้สามารถดูแลพระสงฆ์อาพาธระยะท้าย โดยทำหน้าที่เป็นผู้ดูแลพระสงฆ์อาพาธเสมือนเป็น อสว. เพื่อให้พระสงฆ์อาพาธระยะท้าย มีคุณภาพชีวิตที่ดี และมีการนำนวัตกรรมเทคโนโลยี (Virtual Hospital) อันทันสมัยมาใช้เพื่อเพิ่มประสิทธิภาพให้พระสงฆ์เข้าถึงการบริการอย่างมีประสิทธิภาพ
9 ที่เที่ยวหน้าฝน...ตราด LINK
ปักหมุด 9 ที่เที่ยวฤดูฝน ใครชอบเที่ยวหน้าฝน บรรยากาศสดชื่นสบายใจ ตามรอยไปเลย
1. ชุมชนรักษ์คลองบางพระ ชุมชนนี้ตั้งอยู่ริมคลอง ชื่อคลองบางพระ (เมื่อก่อนตราดชื่อบ้านบางพระ) จอดรถใกล้ตลาด ด้านในเป็นเส้นทางเดินริมคลองให้ชมบรรยากาศความดิบ ๆ เดิม ๆ ย่านค้าขายอันเก่าแก่ของเมืองตราด ใครชอบแนวสตรีทอาร์ตแนะนำให้เตรียมรองเท้าสบาย ๆ เพราะมีจุดให้เดินถ่ายภาพเพียบเลย
พิกัด ติดต่อกับชุมชนรักษ์คลองบางพระได้ที่ 081-428-1909
2. ชุมชนท่องเที่ยวบ้านช้างทูน ที่นี่คือชุมชนท่องเที่ยวแห่งแรกของประเทศไทย ที่นำเสนอกิจกรรม “ร่อนพลอยแดง และสปาสุ่มไก่” เรื่องราวในยุค “ตื่นพลอย” ที่ในสมัยก่อนนั้น อำเภอบ่อไร่ได้ชื่อว่าเป็นอำเภอที่มีการขุดพบพลอยแดง “ทับทิมสยาม” มากที่สุดในประเทศ ส่วนอีกกิจกรรมนึงก็คือ สปาสุ่มไก่ บ้านช้างทูนได้นำเสนอ วิถีชีวิตชาว “ชองซัมเร” ที่นำเอาการอยู่ไฟหลังคลอดบุตร มาประยุกต์ให้เป็นกิจกรรมอบสมุนไพรเก๋ ๆ
พิกัด สอบถามเพิ่มเติม 061-412-3852
3. อุทยานแห่งชาติน้ำตกคลองแก้ว ตั้งอยู่เกือบติดชายแดนไทย - กัมพูชา มีที่จอดรถสะดวก มีห้องสุขาบริการ มีเจ้าหน้าที่ป่าไม้คอยดูแลเรา น้ำตกนี้มี 3 ชั้น ชั้นแรกกับชั้นที่ 2 ลงเล่นน้ำได้ บรรยากาศดีมาก ๆ
พิกัด สอบถามเพิ่มเติม 063-958-5404
4. ชุมชนบ้านน้ำเชี่ยว ที่นี่คือชุมชนชาวประมง 2 ศาสนา 3 วัฒนธรรม ที่อยู่ร่วมกันอย่างสันติ บ้านน้ำเชี่ยวอยู่ห่างจากตัวเมืองประมาณ 8 กิโลเมตร ขับรถ 10 นาทีก็ถึงแล้ว การท่องเที่ยวของที่นีมีให้เลือก 2 แบบ คือ แบบเดินเที่ยวเอง ไม่เสียค่าใช้จ่ายอะไรเลย กับ ซื้อกิจกรรมท่องเที่ยวชุมชน ซึ่งต้องจองล่วงหน้าเท่านั้น โดยกิจกรรมหลัก ๆ ที่มีให้เลือกคือ การทำข้าวเกรียบยาหน้า (ขนมพื้นถิ่น), การทำหมวกงอบ (ผลิตภัณฑ์ของที่ระลึก), การทำขนมตังเมกรอบ (ขนมพื้นถิ่น) และการล่องเรือเที่ยวชมธรรมชาติ นอกจากนี้ ถ้าใครชอบสัมผัสแบบวิถีชีวิตลึกลงไปอีก ที่นี่ก็มีโฮมสเตย์บริการพร้อมอาหารทะเลสดใหม่จากทะเลตราดเลย
พิกัด สอบถามเพิ่มเติม 089-244-6702
5. ไปถ่ายรูป Landmark ตราด “จุดชมวิวแหลมงอบ” ด้วยความโดดเด่นของประภาคารแหลมงอบสีขาวแดง บวกกับพื้นที่ติดชายทะเลและเห็นพระอาทิตย์ตก ทำให้พื้นที่ตรงนี้กลายเป็นจุดชมวิวที่สวยงามที่สุดบนฝั่งตราด ถือเป็น Landmark ที่เรียกว่า ไปตราด ต้องไปตรงนี้เลย
พิกัด 6. ไปทำผ้า 3 ป่า ผลิตภัณฑ์ชุมชนให้ทุกคนสร้างชิ้นงานด้วยตัวเอง ที่นี่... ชุมชนท่องเที่ยวบ้านธรรมชาติล่าง ชุมชนนี้ตั้งอยู่ที่ตำบลบางปิด อำเภอแหลมงอบ จุดเด่นของเขาในช่วงฤดูฝน คือ จะได้สัมผัส 2 บรรยากาศ คือ ความเขียวชอุ่มของต้นไม้และชายทะเลที่มีวิวเกาะช้างกับพระอาทิตย์ตก ชุมชนนี้มีจุดแข็งในเรื่องของกิจกรรมที่เป็นมิตรกับสิ่งแวดล้อม โดยเฉพาะการทำผ้า 3 ป่าที่มีกระบวนการใช้วัสดุจากธรรมชาติในท้องถิ่นมาสร้างเป็นผลิตภัณฑ์ของชุมชน และการจัดการขยะจากธรรมชาติ ใครสนใจดูงาน ที่นี่เหมาะมาก ๆ นอกจากนี้ มีสถานที่พักใกล้เคียงหลายแห่ง มีอาหารทะเลสด ๆ พร้อมบริการนักท่องเที่ยวทุกกลุ่มไม่ว่าจะเป็นกลุ่มเล็กหรือกลุ่มใหญ่ รับได้แบบสบาย ๆ
พิกัด สอบถามเพิ่มเติม 087-835-6723
7. ไปเที่ยวน้ำตกธารมะยม เกาะช้าง เป็นแหล่งท่องเที่ยวหลักของเกาะช้าง ภายใต้ความดูแลของอุทยานแห่งชาติหมู่เกาะช้าง อยู่ห่างจากท่าเรืออ่าวสับปะรดประมาณ 13 กิโลเมตร ขับรถประมาณ 15 นาที จอดรถสะดวก มีห้องสุขาบริการ ตัวน้ำตกมีหลายชั้น แต่ขอแนะนำให้เที่ยวแค่ชั้นแ??กเพราะค่อนข้างปลอดภัย มีเจ้าหน้าที่ดูแล ด้านหน้าน้ำตกมีแอ่งน้ำให้ลงเล่นได้สบาย ๆ เลย
พิกัด สอบถามเพิ่มเติม 039-510-297
8. ไปล่องเรือมาด บ้านสลักคอก เกาะช้าง สำหรับคู่รักทั้งหลายที่ที่นี่โรแมนติกสุด ๆ กิจกรรมล่องเรือมาดนี้บริหารจัดการโดย ชมรมนำเที่ยวพื้นบ้านสลักคอก ชุมชนชาวประมงพื้นถิ่นที่ใช้การท่องเที่ยวเป็นเครื่องมือในการพัฒนาชุมชน กิจกรรมล่องเรือมาดนี้ใช้เรือไม้โบราณ แจวแบบสองหลักโดยพี่ ๆ ในชุมชนที่ว่างเว้นจากการออกเรือประมง เรือ 1 ลำนั่งได้ 4 คน ใช้เวลาล่องเรือไป-กลับประมาณ 45 นาที เราจะได้ใช้เวลาบนเรือชมวิวป่าโกงกางแบบใกล้ชิด บรรยากาศเงียบสงบ ปลายทางคืออ่าวสลักคอก วิวทะเลเกาะช้าง ทั้งนี้ การล่องเรือขึ้นอยู่กับระดับน้ำด้วย
พิกัด สอบถามเพิ่มเติม 087-748-9497
9. ไปโดดน้ำตกให้เย็นฉ่ำที่ น้ำตกคลองเจ้า เกาะกูด น้ำตกแห่งนี้ถือว่าเป็นที่เที่ยวที่ป็อปสุดของเกาะกูดเลย ด้วยตำแหน่งที่ตั้งที่อยู่ช่วงเกือบตรงกลางเกาะกูด เข้าถึงสะดวก เดินง่าย ทางเดินมีเนินบ้างเล็กน้อย ผู้สูงอายุพอเดินได้ แค่ไม่ถึง 10 นาทีก็ถึงตัวน้ำตกแล้ว
พิกัด สอบถามเพิ่มเติม อบต.เกาะกูด 081-949-0938
++ กิจกรรมที่ผ่านไป 2566 ++
เที่ยวตราด 3 แหล่ง ตามรอยรางวัลกินรี LINK
เช็กลิสต์ แหล่งท่องเที่ยวจังหวัดตราด 3 แห่ง ที่ได้รับรางวัล อุตสาหกรรมท่องเที่ยวไทย Thailand Tourism Awards ครั้งที่ 14 ประจำปี 2566 เพิ่มสถานที่ที่เราแนะนำให้ลงลิสต์ได้เลย
1. อุทยานแห่งชาติหมู่เกาะช้าง ตำบลเกาะช้าง อำเภอเกาะช้าง จังหวัดตราด
รางวัลยอดเยี่ยม Thailand Tourism Gold Awards สาขาแหล่งท่องเที่ยวธรรมชาติ
2. กลุ่มท่องเที่ยวบ้านน้ำเชี่ยว (ชุมชนบ้านน้ำเชี่ยว) ตำบลน้ำเชี่ยว อำเภอแหลมงอบ จังหวัดตราด
รางวัลดีเด่น Thailand Tourism Silver Awards สาขาแหล่งท่องเที่ยวชุมชน
3. วิสาหกิจชุมชนท่องเที่ยวบ้านธรรมชาติล่าง ตำบลบางปิด อำเภอแหลมงอบ จังหวัดตราด
รางวัลยอดเยี่ยม Thailand Tourism Gold Awards สาขาแหล่งท่องเที่ยวเพื่อการเรียนรู้
+++++
Past event
+++++
++กิจกรรมที่จัดไปแล้ว ++
งานแสดงดนตรีปี 2565 ที่ผ่านไป
งานที่จัดไปแล้วปีนี้
งานไบค์วีค สุดกระหึ่มที่เคยจัดไม่นานมานี้
แม้ว่าจะมีโควิด แต่ไม่อาจหยุดความกระหึ่มและเสียงหัวใจเร่งเร้าของชาวไบค์เกอร์ไปได้ ย้อนกลับไปดูช่วงปี 2564-2565 มีงานไบค์วีคทั่วประเทศไม่น้อยเลยทีเดียว
+++ งานต่างๆที่จัดไปแล้ว +++
กิจกรรมที่จบไปแล้ว
ดูข้อมูลย้อนหลัง
งานวิ่งเทรลปีนี้ที่จัดไปแล้ว
+++++
แนะนำตามไปชมภาพกิจกรรมสวยที่เพจของผู้จัด+++ กิจกรรมที่จัดไปแล้ว
++ กิจกรรมที่ผ่านไป ++
กิจกรรมที่จัดไปแล้ว
+++ กิจกรรมที่ผ่านไปแล้ว +++
++ กิจกรรมที่ผ่านไป ++
++ Past events ++
++ กิจกรรมที่ผ่านไปแล้ว
++ กิจกรรมที่ผ่านไปในปี 2566 นี้ ++
*ติตตามข้อมูลบริการทำหมันหมาแมวต่างๆ ล่าสุด ได้จาก
++ กิจกรรมที่ผ่านไปปีนี้ ++
++ กิจกรรมที่ผ่านไป ++
ปีนี้มีจัดกิจกรรมทำหมันหมาแมว ฉีดวัคซีนหลายแห่งทั่วประเทศ ดูข้อมูลย้อนหลังได้ตามลิงค์นี้
++ กิจกรรมที่ผ่านไป 2566 ++
++ กิจกรรมปี 2565 ++
++ กิจกรรมที่ผ่านไป ++
++ กิจกรรมที่จัดไปแล้ว ++
++ กิจกรรมที่ผ่านไป ++
++ กิจกรรมที่ผ่านไป 2567 ++
จุดชาร์จรถยนต์ไฟฟ้าเกาะช้าง LINK
เกาะช้างพร้อมรับรถยนต์ไฟฟ้า ใครจะไปเที่ยวเกาะช้างด้วยรถยนต์ไฟฟ้าไม่ต้องห่วงเลย เพราะบนเกาะช้างมีผู้ประกอบการธุรกิจสถานที่พัก ร้านอาหาร และสถานีบริการพลังงาน เปิดให้บริการจุดชาร์จไฟฟ้ารถยนต์บนเกาะช้างหลายรายแล้ว รายละเอียดเบื้องต้นตามนี้
1. มารีน่าเเซนด์ รีสอร์ท หาดคลองสน จำนวน 1 จุด ประเภท AC (ปลั๊กบ้าน)
พิกัด เบอร์ติดต่อ 089-474-4335
2. อัยยะปุระ รีสอร์ท หาดคลองสน จำนวน 2 หัวชาร์จ ประเภท AC
พิกัด เบอร์ติดต่อ 039-555-111
3. เกาะช้างพาราไดซ์ รีสอร์ท หาดคลองพร้าว จำนวน 2 หัวชาร์จ ประเภท AC
พิกัด เบอร์ติดต่อ 039-551-100
4. ร้านอาหารไอยราซีฟู้ด หาดคลองพร้าว จำนวน 1 หัวชาร์จ ประเภท AC
พิกัด เบอรติดต่อ 081-751-0058
5. เซ็นทาราเกาะช้าง หาดคลองพร้าว จำนวน 1 จุด ประเภท
AC (ปลั๊กบ้าน)
พิกัด เบอร์ติดต่อ 039-557-122
6. ปตท. มาบค้างคาว หาดคลองพร้าว จำนวน 2 หัวชาร์จ ประเภท DC
พิกัด เบอร์ติดต่อ 065-547-1934
7. ไก่แบ้บีช รีสอร์ท หาดไก่แบ้ จำนวน 2 หัวชาร์จ ประเภท AC และปลั๊กบ้าน 6 จุด
พิกัด เบอร์ติดต่อ 063-669-5416
8. ซิลวัลย์ รีสอร์ท หาดไก่แบ้ จำนวน 1 หัวชาร์จ ประเภท AC
พิกัด เบอร์ติดต่อ 039-552-888
9. สยามเบย์ รีสอร์ท หาดไก่แบ้ จำนวน 1 หัวชาร์จ ประเภท AC
พิกัด เบอร์ติดต่อ 086-306-9000
10. สยามบีช รีสอร์ท หาดท่าน้ำ จำนวน 1 หัวชาร์จ ประเภท AC
พิกัด เบอร์ติดต่อ 089-161-6664
26 มกราคม 2566 ชุมชนหมู่บ้านร่วมเกื้อ เขตทวีวัฒนา
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 26 มกราคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ชุมชนหมู่บ้านร่วมเกื้อ เขตทวีวัฒนา กรุงเทพมหานคร
9 กุมภาพันธ์ 2566 @ชุมชนหัวรถจักรตึกแดง เขตบางซื่อ
กิจกรรม หน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ฟรี ไปร่วมกิจกรรมกันได้ในวันที่ 9 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00-14.00 น. ณ ชุมชนหัวรถจักรตึกแดง เขตบางซื่อ
22 กุมภาพันธ์ 2566@มัสยิดอัตตั๊กวาพัฒา (คลองสองนุ่น) ซอยร่มเกล้า 6
กิจกรรม หน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ฟรี ไปร่วมกิจกรรมกันได้ในวันที่ 22 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.00-14.00 น. ณ มัสยิดอัตตั๊กวาพัฒา (คลองสองนุ่น) ซอยร่มเกล้า 6 ในงานจัดฉีดวัคซีนพิษสุนัขบ้า 200 ตัว ทำหมัน 60 ตัว [
ชมคลิปกิจกรรม]
8 มีนาคม 2566@วัดกระทุ่มเสือปลา ซอยอ่อนนุช 67
ตรวจสุขภาพมาทางนี้จ้าา สำนักอนามัยพร้อมให้บริการกับกิจกรรม หน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ฟรี ฟรี ฟรี‼️ ????ไปร่วมกิจกรรมกันได้ในวันที่ 8 มีนาคม 2566 ตั้งแต่เวลา 08.00-14.00 น. ณ วัดกระทุ่มเสือปลา ซอยอ่อนนุช 67 เขตประเวศ พบกับกิจกรรมอีกมากมาย
อบต.หนองพลับ บริการ “ทำหมันสุนัขและแมว” ฟรี 25 มิถุนายน 2565
วันเสาร์ที่ 25 มิถุนายน 2565 เวลา 08.30-12.00 น. มีเจ้าหน้าที่จากมูลนิธิ (ไม่หวังผลประโยชน์) มาบริการ “ทำหมันสุนัขและแมว” ฟรี
ขอเชิญผู้ที่สนใจสามารถมาใช้บริการได้ที่ โรงเรียนหนองพลับวิทยา
ให้สัตว์เลี้ยงงดอาหารและน้ำ ตั้งแต่ 19.00 น. (วันศุกร์)
ข้อควรปฏิบัติก่อนทำหมัน สุนัขและแมว
1. งดน้ำงดอาหารสัตว์ อย่างน้อย 8 ชม. ก่อนทำหมัน
2. สัตว์ที่นำมาทำหมันต้องมีอาการปกติ ไม่ป่วย
3. อายุสัตว์ที่สามารถทำหมันได้ คือตั้งแต่ 5 เดือนขึ้นไป
4. สัตว์ที่นำมาทำหมัน (สุนัข) ไม่ควรมีประจำเดือนเพราะจะทำให้สัตว์เสียเลือดมาก
5. สุนัขหรือแมวแม่ลูกอ่อน 2 เดือนเหมาะที่จะทำหมัน
8 มิถุนายน 2566 วัดอินทราวาส ตลิ่งชัน เวลา 8.00-14.00 น.
กิจกรรมบริการในงาน ฟรี ทุกรายการ ได้แก่
1. ชวนเช็ค - ตรวจเบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอ็กซเรย์ปอด ตรวจฟัน (อุด ขูด ถอน) ตรวจสุขภาพใจ คุยกับนักจิตวิทยา
2. ชวนรู้ - ความรู้สุขภาพและการดูแลสุขภาพ ด้านต่างๆ ได้แก่ กินเป็นเน้นสุขภาพ ยาเสพติด ไข้เลือดออก รู้ทันผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ปลอดภัยจากฝุ่น PM2.5 ดูแลคนป่วยที่บ้าน
3. ชวนช็อป - สินค้าโอท็อป สินค้าชุมชน
4. บริการน้องหมาน้องแมว - ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฝังไมโครชิป (น้องหมา) ทำหมัน 60 ตัว/วัน ฉีดวัคซีน 200 ตัว/วัน ฝังไมโครชิป 50 ตัว/วัน
5. แจกแว่นสายตายาว
13 กรกฎาคม 66 ณ วัดวชิรธรรมสาธิต พระโขนง
สำนักงานเขตพระโขนงเชิญชวนร่วมกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 13 กรกฎาคม 2566 เวลา 08.00 - 14.00 น. ณ วัดวชิรธรรมสาธิตวรวิหาร เขตพระโขนง โดยในงานมีกิจกรรมมากมาย
- ชวนเช็คเบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอกซเรย์ปอด ตรวจฟัน (ุอุด ขุด ถอน) สุขภาพใจ คุยกกับนักจิตวิทยา
- ชวนรู้ กินเป็น เน้นสุขภาพ ยาเสพติด ไข้เลือดออก รู้ทันผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ปลอดภัยจากฝุ่นจิ๋ว PM2.5 ดูแลคนป่วยที่บ้าน สื่อน่ารู้
- ชวนช็อป สินค้าโอทอป สินค้าชุมชน
- บริการน้องหมาแมว ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป (น้องหมา)
- แจกแว่นสายตายาว
10 สิงหาคม 66 @ลานใต้สะพานพระราม 8 บางพลัด
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 10 สิงหาคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ลานใต้สะพานพระราม 8 เขตบางพลัด กทม. ทำหมันสุนัขและแมว รับจำนวนจำกัด 60 ตัว ได้สิทธิ์คนละไม่เกิน 2 ตัว (ทำหมันมาลงทะเบียนก่อน 11.00 น. หรือ จนกว่าคิวจะเต็ม)
ต้องจับขังกรง อดอาหารและน้ำ 10 ชม. ก่อนพามาทำหมัน
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว
14 กันยายน 2566 @วัดม่วง เขตบางแค
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 14 กันยายน 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ วัดม่วง เขตบางแค กทม. [
แผนที่ google map] พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย + ทำหมันน้องหมาน้องแมว ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิปน้องหมา
ตารางให้บริการเดือนพฤศจิกายน 2565
- วันศุกร์ที่ 11 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่วัดประดู่ธรรมาธิปัตย์ เขตบางซื่อ และ วัดทุ่งเศรษฐี เขตประเวศ เวลา 8.30 - 11.00 น. **แต่ละสถานที่รับทำหมันจำนวนจำกัดแค่ 30 ตัว** **สุนัขและแมวที่จะทำหมัน ต้องจับขังกรง อดอาหารและน้ำ 8 ถึง 10 ชม. ก่อนนำมาทำหมัน**
- วันพฤหัสบดีที่ 10 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนหมู่บ้านพิบูลย์เวศน์ ซอยปรีดีพนมยงค์ 13 เขตวัฒนา เวลา 8.30 - 11.00 น.
- วันพฤหัสบดีที่ 10 พ.ย. 65 ทำหมันสุนัขและแมว จำนวน 100 ตัว ณ วัดแสมดำ เขตบางขุนเทียน **ทำหมันรับจำนวนจำกัด 30 ตัว** **สุนัขและแมวที่จะทำหมัน ต้องจับขังกรง อดอาหารและน้ำ 8 ถึง 10 ชม. ก่อนนำมาทำหมัน**
- วันอังคารที่ 8 พฤศจิกายน 2565 ณ ลานกีฬา ม.สังสิทธิ์ ซอยเอกชัย 46 เวลา 09.00น. - 11.00น.
- 8 พ.ย. 65 ทำหมันสุนัขและแมว ณ ลานกีฬา ม.สังสิทธิ์ ซอยเอกชัย 46
- วันศุกร์ที่ 4 พ.ย.65 สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ กองสร้างเสริมสุขภาพ กองทันตสาธารณสุข และศูนย์บริการสาธารณสุข 46 กันตารัติอุทิศ ออกหน่วยสาธารณสุขเคลื่อนที่เชิงรุกในศาสนสถาน ให้บริการตรวจคัดกรองสุขภาพ ตรวจจอประสาทตา ตรวจฟัน ถอนฟัน ขูดหินปูน ให้แก่พระภิกษุและประชาชน ทำหมันสุนัขและแมว ฉีดป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิป ณ วัดลานบุญ เขตลาดกระบัง
- วันศุกร์ที่ 4 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย แก้ไขเรื่องร้องเรียน ผ่านแอปพลิเคชั่น Traffy Foundue จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิปจดทะเบียนสุนัข ที่วัดอุทัยธาราม เขตห้วยขวาง
- วันพฤหัสบดีที่ 3 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร กองสวัสดิภาพสัตว์และสัตวแพทย์บริการ กรมปศุสัตว์ และสมาชิกสภากรุงเทพมหานคร เขตบางบอน ร่วมจัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ที่วัดบางบอน เขตบางบอน
- วันพฤหัสบดีที่ 3 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตปทุมวัน และศูนย์บริการสาธารณสุข 5 จุฬาลงกรณ์ จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิปจดทะเบียนสุนัข ที่วัดบรมนิวาสราชวรวิหาร เขตปทุมวัน
- วันพุธที่ 2 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล เขตดุสิต จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิปจดทะเบียนสุนัข ที่วัดน้อยนพคุณ เขตดุสิต
- วันอังคารที่ 1 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ ศูนย์บริการสาธารณสุข 55 เตชะสัมพันธ์ และ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตยานนาวา จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และฉีดไมโครชิปจดทะเบียนสุนัข ที่ชุมชนเย็นอากาศ 2 เขตยานนาวา
- วันอังคารที่ 1 พ.ย. 65 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานปศุสัตว์พื้นที่กรุงเทพมหานคร กองสวัสดิภาพสัตว์และสัตวแพทย์บริการ กรมปศุสัตว์ และสมาชิกสภากรุงเทพมหานคร เขตบางขุนเทียน ร่วมจัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ที่วัดท่าข้าม เขตบางขุนเทียน
โปรแกรม KIHA 183 ทริปเหมันต์หรรษา เที่ยวทุ่งดอกไม้งาม 14 เที่ยว พฤศจิกายน-ธันวาคม
เดือนมกราคม-มีนาคม 2567
กำหนดการออกหน่วยให้บริการประจำเดือน มกราคม 2567 รับหน่วยละ 50 ตัว ให้บริการ 09.00 – 12.00 น.
- วันที่ 8 มกราคม 2567 วัดทองพัฒนาราม
- วันที่ 10 มกราคม 2567 วัดทองพัฒนาราม
- วันที่ 17 มกราคม 2567 วัดใหม่หาดกระทึงทอง
- วันที่ 19 มกราคม 2567 วัดใหม่หาดกระทึงทอง
- วันที่ 22 มกราคม 2567 วัดบุณย์กัญจนาราม
- วันที่ 24 มกราคม 2567 วัดบุณย์กัญจนาราม
- วันที่ 31 มกราคม 2567 วัดเขาพระใหญ่
- 2 กุมภาพันธ์ 2567 วัดเขาพระใหญ่
- 5 กุมภาพันธ์ 2567 วัดเขาพระบาท บริเวณหน้าโบสถ์
- 7 กุมภาพันธ์ 2567 วัดเขาพระบาท บริเวณหน้าโบสถ์
- 14 กุมภาพันธ์ 2567 วัดชัยมงคล
- 16 กุมภาพันธ์ 2567 วัดชัยมงคล
- 19 กุมภาพันธ์ 2567 วัดธรรมสามัคคี
- 21 กุมภาพันธ์ 2567 วัดธรรมสามัคคี
- 28 กุมภาพันธ์ 2567 สำนักสงข์หนองอ้อ
- 1 มีนาคม 2567 สำนักสงข์หนองอ้อ
- 4 มีนาคม 2567 เกาะล้าน
- 6 มีนาคม 2567 วัดหนองใหญ่
- 13 มีนาคม 2567 วัดหนองใหญ่
- 15 มีนาคม 2567 วัดโพธิสัมพันธ์
- 18 มีนาคม 2567 วัดโพธิสัมพันธ์
- 20 มีนาคม 2567 วัดสว่างฟ้าพฤฒาราม
- 27 มีนาคม 2567 วัดสว่างฟ้าพฤฒาราม
- 29 มีนาคม 2567 วัดป่าสุทธิภาวัน
โปรแกรม KIHA 183 ทริปเหมันต์หรรษา เที่ยวทุ่งดอกไม้งาม 14 เที่ยว พฤศจิกายน-ธันวาคม
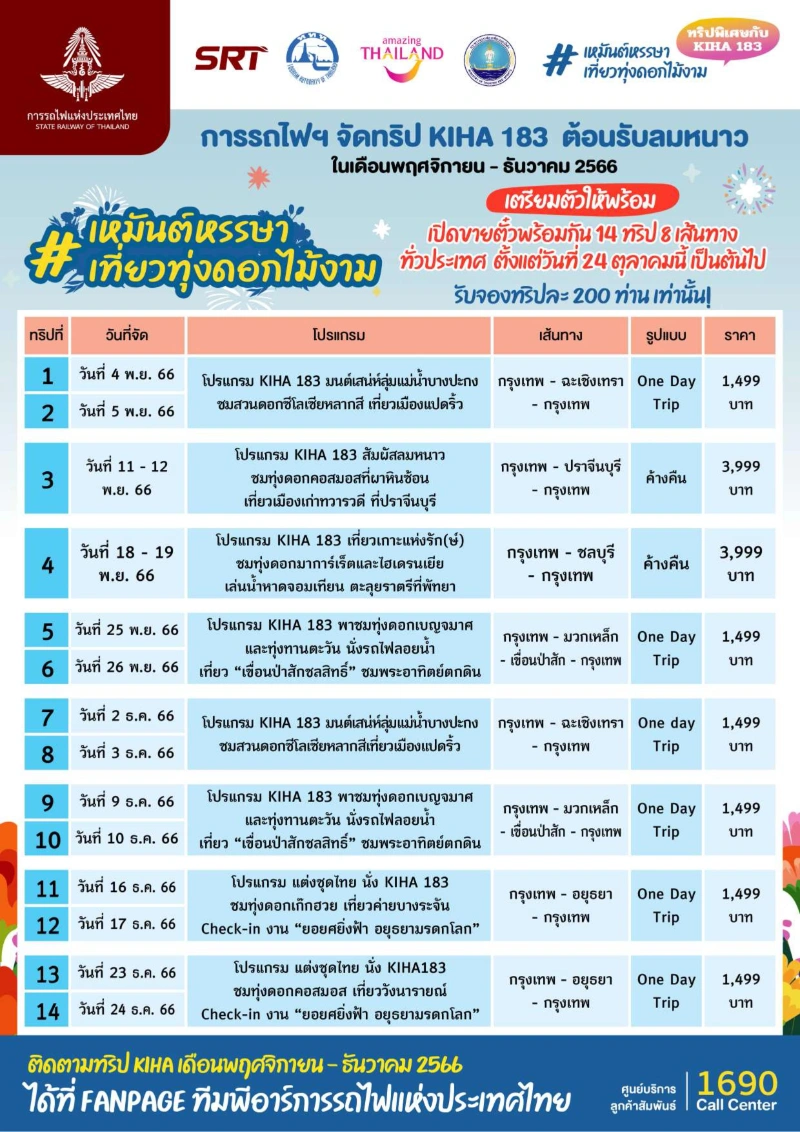

การรถไฟฯ จัดทริปท่องเที่ยวสุดพิเศษกับขบวนรถไฟ KIHA 183 ต้อนรับลมหนาว #เหมันต์หรรษา เที่ยวทุ่งดอกไม้งาม 14 ทริป ดังนี้
ทริปที่ 1 และ 2 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 4 และวันอาทิตย์ที่ 5 พฤศจิกายน 2566) โปรแกรม มนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
ทริปที่ 3 แบบพักค้างคืน (วันเสาร์ที่ 11 – วันอาทิตย์ที่ 12 พฤศจิกายน 2566) โปรแกรมสัมผัสลมหนาว ชมทุ่งดอกคอสมอสที่ผาหินซ้อน เที่ยวเมืองเก่าทวารวดี ที่ปราจีนบุรี ราคาท่านละ 3,999 บาท
ทริปที่ 4 แบบพักค้างคืน (วันเสาร์ที่ 18 - วันอาทิตย์ที่ 19 พฤศจิกายน 2566) โปรแกรมเที่ยวเกาะแห่งรัก(ษ์) ชมทุ่งดอกมาการ์เร็ตและไฮเดรนเยีย เล่นน้ำหาดจอมเทียน ตะลุยราตรีที่พัทยา ราคาท่านละ 3,999 บาท
ทริปที่ 5 และ 6 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 25 และวันอาทิตย์ที่ 26 พฤศจิกายน 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
ทริปที่ 7 และ 8 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 2 และวันอาทิตย์ที่ 3 ธันวาคม 2566) โปรแกรมมนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
ทริปที่ 9 และ 10 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 9 และวันอาทิตย์ที่ 10 ธันวาคม 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
ทริปที่ 11 และ 12 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 16 และวันอาทิตย์ที่ 17 ธันวาคม 2566) โปรแกรม แต่งชุดไทย นั่ง KIHA 183 ชมทุ่งดอกเก๊กฮวย เที่ยวค่ายบางระจัน Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
ทริปที่ 13 และ 14 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 23 และวันอาทิตย์ที่ 24 ธันวาคม 2566 โปรแกรม แต่งชุดไทย นั่ง KIHA183 ชมทุ่งดอกคอสมอส เที่ยววังนารายณ์ Check-in งาน “ยอยศยิ่งฟ้า อยุธยามรดกโลก” ราคาท่านละ 1,499 บาท
ทริปท่องเที่ยว KIHA 183 เดือนพฤศจิกายน
ทริปที่ 1 และ 2 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 4 และวันอาทิตย์ที่ 5 พฤศจิกายน 2566) โปรแกรม มนต์เสน่ห์ลุ่มแม่น้ำบางปะกง ชมสวนดอกซีโลเซียหลากสี เที่ยวเมืองแปดริ้ว ราคาท่านละ 1,499 บาท
ทริปที่ 3 แบบพักค้างคืน (วันเสาร์ที่ 11 – วันอาทิตย์ที่ 12 พฤศจิกายน 2566) โปรแกรมสัมผัสลมหนาว ชมทุ่งดอกคอสมอสที่ผาหินซ้อน เที่ยวเมืองเก่าทวารวดี ที่ปราจีนบุรี ราคาท่านละ 3,999 บาท
ทริปที่ 3 แบบพักค้างคืน (วันเสาร์ที่ 11 – วันอาทิตย์ที่ 12 พฤศจิกายน 2566) โปรแกรมสัมผัสลมหนาว ชมทุ่งดอกคอสมอสที่ผาหินซ้อน เที่ยวเมืองเก่าทวารวดี ที่ปราจีนบุรี ราคาท่านละ 3,999 บาท
ทริปที่ 4 แบบพักค้างคืน (วันเสาร์ที่ 18 - วันอาทิตย์ที่ 19 พฤศจิกายน 2566) โปรแกรมเที่ยวเกาะแห่งรัก(ษ์) ชมทุ่งดอกมาการ์เร็ตและไฮเดรนเยีย เล่นน้ำหาดจอมเทียน ตะลุยราตรีที่พัทยา ราคาท่านละ 3,999 บาท
ทริปที่ 5 และ 6 แบบไปเช้าเย็นกลับ (วันเสาร์ที่ 25 และวันอาทิตย์ที่ 26 พฤศจิกายน 2566) โปรแกรมชมทุ่งดอกเบญจมาศและทุ่งทานตะวัน นั่งรถไฟลอยน้ำ เที่ยวเขื่อนป่าสักชลสิทธิ์ ชมพระอาทิตย์ตกดิน ราคาท่านละ 1,499 บาท
ขอบคุณข้อมูลและภาพจากรพ.บำรุงราษฎร์
รวมใจช่วยภัยน้ำท่วมเชียงราย ศูนย์วิปัสสนาสากลไร่เชิญตะวัน มูลนิธิไร่เชิญตะวัน
"รวมใจช่วยภัยน้ำท่วมเชียงราย"
ศูนย์วิปัสสนาสากลไร่เชิญตะวัน ขอเชิญชาวไทยและศิษยานุศิษย์
ร่วมบริจาคเครื่องอุปโภคบริโภคและปัจจัย
เพื่อช่วยเหลือผู้ประสบอุทกภัย
บริจาคโดยตรงได้ที่ สำนักธรรมบริการไร่เชิญตะวัน
บริจาคผ่านบัญชี ธนาคารออมสิน
ชื่อบัญชี มูลนิธิไร่เชิญตะวัน
หมายเลขบัญชี 0203-4314-9256
หรือส่งเครื่องอุปโภคบริโภคมาได้ที่
ศูนย์วิปัสสนาสากลไร่เขิญตะวัน
217 หมู่ 25 บ้านสันป่าเหียง อ.เมืองเชียงราย
จ.เชียงราย 57000
โทรศัพท์ 082-804-8954, 063-576-5565, 082-787-1445
เทศบาลเมืองบางคูรัด ทำหมันสุนัขฟรี 25 พฤษภาคม 2565
"เทศบาลเมืองบางคูรัด" โดย ดร.พิมพ์พัชชา หยิมการุณ นายกเทศมนตรีเมืองบางคูรัด และคณะผู้บริหาร ร่วมกับสำนักงานปศุสัตว์อำเภอบางบัวทอง และสำนักงานปศุสัตว์จังหวัดนนทบุรี ขอเชิญประชาชนที่สนใจ นำสุนัขและแมวของท่าน ทำหมัน ฟรี เฉพาะประชาชนที่มีทะเบียนบ้านอยู่ในเขตเทศบาลเมืองบางคูรัด จำนวน 50 ตัว (จำกัดจำนวน 3 ตัว / 1 ครอบครัว) ในวันพุธที่ 25 พฤษภาคม 2565 เวลา 9.00 - 12.00 น. ขอสงวนสิทธิเฉพาะผู้ที่ลงทะเบียนเท่านั้น
ลงทะเบียนได้ที่ 02-963-4007 ต่อ 407 กองสาธารณสุขและสิ่งแวดล้อม
หมายเหตุ ผู้ที่จะนำสุนัขและแมวมาทำหมัน สุนัขและแมวต้องมีอายุ 6 เดือนขึ้นไป พร้อมงดอาหารและน้ำอย่างน้อน 8 ชั่วโมงขึ้นไป
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน มีนาคม 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน มีนาคม 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่ก่อนได้จ้า
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน เมษายน 2567
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน เมษายน 2567 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ โทรสอบถาม อบต./เทศบาล ในพื้นที่
อบต.อ้อมเกร็ด ทำหมันสุนัขจรจัด 1 กรกฎาคม 2565
วันที่ 1 กรกฎาคม 2565 เวลา 15:00 น. นายบัญชา ภักขำ นายกองค์การบริหารส่วนตำบลอ้อมเกร็ด และนางสาวรัชนีวรรณ คุ้มด้วง รองนายกอบต. เยี่ยมชมโครงการ “การจัดการประชากรสุนัขจรจัดประเทศไทย” หรือ “CNVR-Thailand” ซึ่งองค์การบริหารส่วนตำบลอ้อมเกร็ด ร่วมกับ มูลนิธิเพื่อสุนัขในซอย (Soi Dog Foundation) โครงการจัดตั้งแต่วันที่ 20 มิถุนายน - 1 กรกฎาคม รวมเป็น 10 วัน ยอดสุนัขจรจัดและมีเจ้าของมาทำในเขตพื้นที่ตำบลอ้อมเกร็ด จำนวนทั้งหมด 433 ตัว สำเร็จลุล่วงไปได้ด้วยดี จัดออกหน่วยทำหมันเคลื่อนที่ สุนัขที่เข้ารับการทำหมันจะได้รับการฉีดวัคซีนรวมและวัคซีนป้องกันโรคพิษสุนัขบ้า รวมถึงยาป้องกันเห็บหมัด (สุนัข เท่านั้น) อายุ 3 เดือนขึ้นไป ให้บริการพื้นที่ตำบลอ้อมเกร็ดและพื้นที่ใกล้เคียง เทศบาลเมืองบางกร่าง ร่วมกับซอยด๊อกทำหมันฟรี 15-26 สิงหาคม 2565
เทศบาลเมืองบางกร่าง ร่วมกับ มูลนิธิเพื่อสุนัขในซอย ประเทศไทย (Soi Dog - in Thai) ขอเรียนเชิญเจ้าของนำสัตว์เลี้ยงเข้ารับบริการ ทำหมันสุนัขฟรี ณ อาคารอเนกประสงค์ หมู่ที่ 10 หน้าค่ายลูก ในวันที่15-26 สิงหาคม 2565 (เว้นวันหยุดราชการ) ตั้งแต่เวลา 8:00 น. ถึงเวลา 13:00 น.
- รับทำหมันสุนัข อายุตั้งแต่ 3 เดือน ขึ้นไป (ไม่เกิน10ปี) ทำได้ทั้งเพศผู้ และเมีย
- งดให้อาหารสุนัขก่อนรับการทำหมัน อย่างน้อย 8 ชั่วโมง (กรณีสุนัขมีเจ้าของเลี้ยงระบบปิด)
- สามารถนำสุนัขมาที่หน่วยทำหมันได้เอง (แนะนำให้ติดต่อล่วงหน้า1วัน)
- ไหมที่ใช้เป็นไหมละลาย ไม่ต้องตัดไหมหรือทำแผลเพิ่มเติม(กรณีสุนัขมีเจ้าของแนะนำให้ซื้อคอลล่าร์ ปลอกคอกันเลียแผล)
- ท่านที่ไม่สามารถนำสุนัขมาเองได้ ทางหน่วยมีรถบริการรับส่งให้ฟรี ไม่เสียค่าใช้จ่ายใดๆทั้งสิ้น
- สามารถติดต่อสอบถามเพิ่มเติมได้ที่เบอร์ 0875526305 บอล (เจ้าหน้าที่)
หมายเหตุ : สุนัขที่มาทำหมันทุกตัวจะได้รับวัคซีนพิษสุนัขบ้า และวัคซีนรวม 5 โรคฟรีทุกตัว
ประชาชนท่านใดไม่สะดวกนำสุนัขมาทำหมันสามารถแจ้งรายละเอียดให้เจ้าหน้าไปรับฟรี สามารถแจ้งรายละเอียดให้ทางกองสาธารณสุข และสิ่งแวดล้อม ชั้น 3 เทศบาลเมืองบางกร่าง ภายในวันพฤหัสที่ 25 สิงหาคม 2565 เวลา 11:00 น.
กองสาธารณสุขและสิ่งแวดล้อมเทศบาลเมืองบางกร่าง ชั้น 3
โทร. 02-446-3434 , 02-446-3567 , 02-408-8155 ต่อ 301
เทศบาลบางกรวย ทำหมัน 60 ตัว 25 สิงหาคม 2565 LINK
เทศบาลบางกรวยร่วมกับปศุสัตว์จังหวัดนนทบุรี บริการทำหมันสุนัขและแมว จำนวน 60 ตัว (แบ่งเป็นจรจัด 30 ตัว ประชาชนทั่วไป 30 ตัว) วันที่ 25 สิงหาคม 2565 ตั้งแต่วเลา 8.30 น. บริเวณลานจอดรถฝั่งตรงข้ามเทศบาลเมืองบางกรวย
ตารางให้บริการ ปี 2565
ตารางให้บริการ ปี 2565
เมษายน
4 เมษายน 2565 ณ วัดจิตตภาวัน
11 เมษายน 2565 ณ วัดกระทิงลาย
18 เมษายน 2565 ณ วัดช่องลมนอก
20 เมษายน 2565 ณวัดป่าสุทธิภาวัน
25 เมษายน 2565 ณวัดสว่างฟ้าพฤฒาราม
27 เมษายน 2565 ณ วัดโพธิสัมพันธ์
พฤษภาคม
9 พฤษภาคม 2565 ณ สำนักสงฆ์หนองอ้อ
11 พฤษภาคม 2565 ณ วัดหนองใหญ่
18 พฤษภาคม 2565 ณ วัดธรรมสามัคคี
23 พฤษภาคม 2565 ณ วัดชัยมงคล
25 พฤษภาคม 2565 ณ วัดเขาพระใหญ่
30 พฤษภาคม 2565 ณ วัดเขาพระบาท
มิถุนายน
6 มิถุนายน 2565 ณ วัดใหม่หาดกระทึงทอง
8 มิถุนายน 2565 ณ เกาะล้าน
13 มิถุนายน 2565 ณ วัดจิตตภาวัน
15 มิถุนายน 2565 ณ วัดกระทิงราย
20 มิถุนายน 2565 ณ วัดช่องลมนอก
22 มิถุนายน 2565 ณ วัดป่าสุทธิภาวัน
27 มิถุนายน 2565 ณ วัดสว่างฟ้าพฤฒาราม
29 มิถุนายน 2565 ณ วัดโพธิสัมพันธ์
กรกฏาคม
6 กรกฎาคม 2565 ณ วัดหนองใหญ่
11 กรกฎาคม 2565 ณ วัดธรรมสามัคคี
18 กรกฎาคม 2565 ณ วัดชัยมงคลพระอารามหลวง
20 กรกฎาคม 2565 ณ วัดเขาพระใหญ่
25 กรกฎาคม 2565 ณ วัดเขาพระบาท
27 กรกฎาคม 2565 ณ วัดบุณย์กัญจนาราม
สิงหาคม
8 สิงหาคม 2565 ให้บริการ ณ วัดธรรมสามัคคี
15 สิงหาคม 2565 ให้บริการ ณ วัดชัยมงคล พระอารามหลวง
เทศบาลตำบลเสาธงหิน ทำหมันให้สุนัขและแมวฟรี 21 ธันวาคม 2565
เทศบาลตำบลเสาธงหิน ร่วมกับปศุสัตว์จังหวัดนนทบุรี จัดกิจกรรมทำหมันให้สุนัข และแมวฟรี (ไม่มีค่าใช้จ่าย) วันที่ 21 ธันวาคม 2565 ตั้งแต่เวลา 08.30-12.00 น. ให้บริการออกหน่วยเคลื่อนที่ บริเวณอาคารเอนกประสงค์ หมู่บ้านมิตรประชา หมู่ที่ 8 ตำบลเสาธงหิน
สามารถลงทะเบียนล่วงหน้าได้ที่ ศูนย์บริการสาธารณสุข 1 เทศบาลตำบลเสาธงหิน หรือ ติดต่อสอบถามเพิ่มเติมได้ที่ โทร 02-5950888
ผู้รับบริการ กรุณานำบัตรประชาชนด้วย และขอสงวนสิทธิ์ บัตรประชาชน 1 ใบ ต่อสัตว์เลี้ยง 1 ตัว
หมายเหตุ: กรุณาให้สัตว์เลี้ยงงดน้ำงดอาหาร อย่างน้อย 8-12 ชม.
เทศบาลตำบลบางเลน ทำหมันฟรี 12 ธันวาคม 2565
เทศบาลตำบลบางเลน ร่วมกับ มูลนิธิเพื่อสุนัขในซอย "Soi Dog" ขอเชิญประชาชนในพื้นที่เทศบาลตำบลบางเลน นำสัตว์เลี้ยงมารับบริการ ทำหมัน "ฟรี" ในวันจันทร์ที่ 12 ธันวาคม 2565 เวลา 08.00 - 12.00น. ณ วัดยุคันธราวาส ต.บางเลน อ.บางใหญ่ จ.นนทบุรี หมายเหตุ : รับเฉพาะสุนัขใหญ่สายพันธุ์ไทย **สามารถลงทะเบียนได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลบางเลน โทร.02-147-1700-2 ต่อ 122,124, 087-699-0318 หรือ คุณบอล 087-552-6305++ กรุงเทพ ++
ร่วมส่งพลังใจช่วยเหลือผู้ประสบอุทกภัย กับสภากาชาดไทย LINK
ร่วมส่งพลังใจ ช่วยเหลือผู้ประสบอุทกภัย กับสภากาชาดไทย
บริจาค ผ่านบัญชี ธนาคารไทยพาณิชย์ สาขาสภากาชาดไทย
• ชื่อบัญชี “สภากาชาดไทย เพื่อภัยพิบัติ” ประเภทบัญชี “กระแสรายวัน”
• เลขที่บัญชี 045-3-04637-0
**กรณีการโอนเงิน - หากประสงค์รับใบเสร็จรับเงิน แจ้งชื่อ-นามสกุล เลขที่บัตรประชาชนผู้เสียภาษี ที่อยู่ เบอร์โทรศัพท์ และอีเมล ระบุ “เพื่อช่วยเหลือผู้ประสบอุทกภัย” พร้อมแนบสลิปการโอนเงินบริจาค มาทาง e-mail : donation@redcross.or.th หรือ โทรสาร 0 2250 0312 หรือ Line : @redcrossfund
หรือสแกน QR Code e-Donation ที่ปรากฏบนโพสต์ (โดยไม่ต้องแจ้งขอรับใบเสร็จรับเงินและไม่สามารถออกใบเสร็จรับเงินในนามบุคคลอื่นได้จะต้องเป็นชื่อผู้ที่เป็นเจ้าของบัญชีเท่านั้น)
ข้อสังเกต : กรณีสแกนผ่าน SCB Mobile Apps เมื่อสแกนแล้วท่านจะพบข้อความปรากฏที่หน้าจอว่า "ท่านกำลังทำรายการ e-Donation" และให้เลือกกด "ไม่ยอมรับ" หรือ "ยอมรับ" หากท่านกด "ยอมรับ" จะพบหน้าจอทำรายการบริจาค มีข้อความขึ้นว่า "เพื่อสภากาชาดไทย" และมีหมายเลข Biller ID "099400016012795" เลขที่อ้างอิงคือ "005FLOODDISASTER" และตามด้วยช่องหมายเลขบัตรประชาชนที่เป็นเจ้าของบัญชี ทำรายการบริจาคดังกล่าวโดยข้อมูลของท่านจะนำส่งไปที่กรมสรรพากร หากไม่ปรากฏข้อมูลดังกล่าวให้ยกเลิกรายการทันที และ ตรวจสอบประวัติการบริจาคได้ที่
www.rd.go.th
* สำหรับข้อมูลของผู้บริจาค สภากาชาดไทยดำเนินการตามแนวปฏิบัติ
เรื่อง การคุ้มครองข้อมูลส่วนบุคคล สภากาชาดไทย พ.ศ.2564 (PDPA) อย่างเคร่งครัด สามารถดูข้อมูลเพิ่มเติมได้ที่
redcross.or.th/trcs-pdpaรวมพลคนกาแฟ เพื่อความยั่งยืนกาแฟเมืองน่าน 7-8 ม.ค.66
งานรวมพลคนกาแฟ เพื่อความยั่งยืนกาแฟเมืองน่าน 7-8 มกราคม 2566 (เลื่อนจาก 24-25 ธันวาคม 2565) สร้างการรับรู้ กาแฟน่าน กาแฟคุณภาพ ให้รู้จักอย่างแพร่หลาย นายศักดิ์สิทธิ์ ศรีวิชัย เกษตรจังหวัดน่าน พร้อมด้วยนายมานพ ทาจาก เกษตรและสหกรณ์จังหวัดน่าน ร่วมเป็นประธานประชุมคณะทำงาน ครั้งที่ 2 การจัดงานรวมพลคนกาแฟ เพื่อความยั่งยืนกาแฟเมืองน่าน ณ ห้องประชุมศูนย์การเรียนรู้และบริการวิชาการ เครือข่ายแห่งจุฬาลงกรณ์มหาวิทยาลัย ตำบลผาสิงห์ อำเภอเมืองน่าน จังหวัดน่าน โดยจัดขึ้นระหว่างวันที่ 7-8 มกราคม 2566 (เลื่อนจาก 24-25 ธันวาคม 2565) ณ บริเวณข่วงน้อย อ.เมืองน่าน เพื่อระดมพลคนกาแฟจากชุมชนต่างๆให้ร่วมมือกันพัฒนา การผลิตกาแฟน่านให้สามารถแข่งขันได้ มีคุณภาพ มีมาตรฐานการผลิต ตอบโจทย์ความต้องการของผู้เกี่ยวข้องในห่วงโซ่อุปทาน อีกทั้งประชาสัมพันธ์ สร้างการรับรู้กาแฟน่านให้แก่ผู้บริโภค นักท่องเที่ยว เพื่อเชื่อมโยงเศรษฐกิจการท่องเที่ยวจังหวัดน่านอย่างมีส่วนร่วม ระหว่างภาคชุมชน ผู้ประกอบการ และหน่วยงานภาครัฐ
World Tea & Coffee Expo 2023 วันที่ 26-29 ม.ค.66 LINK
TCEB ชวนขึ้นเหนือ ไปชิมชา จิบกาแฟในอีเว้นท์ชา กาแฟครั้งใหญ่ใจกลางเมืองเชียงใหม่ ในงาน World Tea & Coffee Expo 2023 งานประชุมและแสดงสินค้าชา กาแฟที่ใหญ่ที่สุดในภูมิภาค
26-29 มกราคม 2566 ณ ศูนย์การค้า One Nimman เชียงใหม่
- พบกับบูธจำหน่ายชาและกาแฟที่คัดสรรมาให้ชิมจากภาคเหนือ ใต้ อีสาน และต่างประเทศกว่า 50 บูธ
- เติมเต็มความรู้เกี่ยวกับชา กาแฟ ใน การประชุมนานาชาติ The 3rd Tea and Coffee International Symposium โดยวิทยากรทั้งในประเทศและต่างประเทศ ในระบบออนไลน์และออฟไลน์ อาทิ คุณ Yasuo Suzuki จาก Trunk Coffee ประเทศญี่ปุ่น, คุณอุษาพรรณ อินทีวรวงศ์ CEO จาก Boncafe, Mr. Rolf Johan Kenneth Rimdahl จาก Monsoon Tea, คุณวงเดือน วังวิวัฒน์ จากชาระมิงค์ และอีกมากมาย
- การสาธิตการชงชา กาแฟจากหลากวัฒนธรรม
- นิทรรศการแสดงศักยภาพของชา กาแฟภาคเหนือ
- และกิจกรรมอื่นๆ อีกมากมายภายในงาน
จัดโดย สำนักงานส่งเสริมการจัดประชุมและนิทรรศการ (องค์การมหาชน) หรือ สสปน.
ร่วมกับหน่วยงานภาคี
Gathering Coffee People for Sustainable Coffee in Nan 7-8 Jan 2023


Coffee gathering For Sustainability, Nan Coffee, 7-8 January 2023 to raise awareness of Nan coffee and quality coffee to be widely known. Mr. Saksit Sriwichai, Agriculture Officer, Nan Province together with Mr. Manop Tachak, Agriculture and Cooperatives of Nan Province Co-chaired the 2nd meeting of the working group, organizing a gathering of people for coffee For Sustainability Nan Coffee at Learning Center Conference Room and Academic Service Network of Chulalongkorn University, Pha Sing Subdistrict, Mueang Nan District, Nan Province, held between 7-8 January 2023 (postponed from 24-25 December 2022) at Khuang Noi, Mueang Nan District to mobilize coffee people from various communities to develop together The production of Nan coffee can be competitive with quality and production standards. Meet the needs of those involved in the supply chain. Also public relations Create awareness of Nan coffee for consumers. tourist to connect the tourism economy in Nan Province with participation between communities, entrepreneurs and government agencies.
World Tea & Coffee Expo 26-29 Jan 2023
TCEB invites you to the north to taste tea and sip coffee at tea events. Big coffee in the heart of Chiang Mai at the World Tea & Coffee Expo 2023, a conference and tea exhibition. Largest coffee in the region
26-29 January 2023 at One Nimman Shopping Center, Chiang Mai
- Meet more than 50 booths selling tea and coffee selected to taste from the North, South, Northeast and other countries.
- Enhancing knowledge about tea and coffee at The 3rd Tea and Coffee International Symposium by both domestic and international speakers. In both online and offline systems, such as Mr. Yasuo Suzuki from Trunk Coffee Japan, Mr. Usaphan Inteewarawong, CEO from Boncafe, Mr. Rolf Johan Kenneth Rimdahl from Monsoon Tea, Mr. Wongduean Wangwiwat from Raming Tea and many more.
Organized by Thailand Convention and Exhibition Bureau (Public Organization) or TCEB together with partner agencies.
Sukhothai Coffee Festival 4 Jan 2023
Sukhothai Coffee Festival: Friend Trade Sukhothai Coffee Festival: Bring your friends to know each other on February 4th at Jongkol Cafe (Jongkol Cafe) 9:00 - 17:00 with many activities within the event. share knowledge and talk with The owner of award-winning coffee plantation, Q grader and the first drip coffee shop in Sukhothai More than 20 booths at the event, including coffee, food, various dessert shops and workshops for people who are interested in coffee.
Ladkacher Coffee Camp 2023 วันที่ 17-18 ม.ค.66
Ladkacher Coffee Camp 2023 17-18 มกราคม 2566 @Ladkacher Coffee Farm
งานประเพณีทิ้งกระจาด มูลนิธิแม่กอเหนี่ยว (ฉื่อเซี่ยงตึ้ง) ยะลา วันที่ 30 กรกฎาคม - 2 สิงหาคม 2565
2 สิงหาคม 2565 ที่ มูลนิธิแม่กอเหนี่ยวยะลา ได้มีพี่น้องประชาชน ในพื้นที่ อ.เมืองยะลา ที่ยากไร้ ทั้งชาวไทยพุทธ ชาวไทยเชื้อสายจีน และชาวไทยมุสลิม เด็ก ผู้ใหญ่ ผู้สูงอายุ นับพันคน เดินทางไปเข้าคิว รอรับการแจกทาน ประเพณีทิ้งกระจาด ประจำปี 2565 โดยทางมูลนิธิฯ ได้จัดเต็ม นอกจากการแจกสิ่งของเครื่องอุปโภค บริโภค เครื่องอุปโภค บริโภค จำนวน กว่า 3,000 ชุด มีการแจกขนม ไอศกรีมให้กับเด็ก ๆ ผู้สูงอายุ คนชรา
สำหรับการจัดงานประเพณีทิ้งกระจาดของมูลนิธิแม่กอเหนี่ยวยะลา ได้จัดเป็นงานประเพณีติดต่อมายาวนานกว่า 70 ปี ตั้งแต่ได้มีการก่อตั้งมูลนิธิฯ แห่งนี้ โดยนับตามปฏิทินจีนตรงกับวันที่ 2 เดือน 7 ของจีน และในปีนี้จัดขึ้นตรงกับวันที่ 30 กรกฎาคม ถึงวันที่ 3 สิงหาคม พ.ศ. 2565 การจัดงานในครั้งนี้ ก็เพื่อเป็นการสืบสานประเพณีทิ้งกระจาด หรือ ซิโกว ซึ่งเป็นประเพณีอันดีงามของชาวไทยเชื้อสายจีนให้คงอยู่สืบไป ในงานจัดให้มีการเซ่นไหว้บรรพบุรุษที่ล่วงลับไปแล้ว เพื่อเป็นการแสดงความกตัญญู กตเวทิตา เซ่นไหว้ดวงวิญญาณไร้ญาติ และสรรพสัตว์ทั้ง 36 จำพวก ซึ่งหลังจากทำพิธีบวงสรวงดวงวิญญาณตามศาสนพิธีแล้ว ก็จะนำข้าวสารอาหารแห้ง และเครื่องอุปโภคบริโภค ซึ่งได้รับการสนับสนุนบริจาค จากร้านค้า พ่อค้า พี่น้องประชาชน มาแจกจ่ายให้กับพี่น้องประชาชน ต่อไป
งาน Coffee and friends Chanthaboon 2023 วันที่ 18-19 ก.พ.66 LINK
งาน Coffee and Friends CHANTHABOON 18-19 กุมภาพันธ์ 2566 ณ ศาลเจ้าที่ตลาดล่าง ชุมชนริมน้ำจันทบูร อำเภอเมืองจันทบุรี จังหวัดจันทบุรี ตั้งแต่เวลา 09:00-16.00 น. พบบูธกาแฟและBakery จากคาเฟ่ร้านดัง กว่า 30 ร้าน คอกาแฟห้ามพลาด ลิ้มลองรสชาติและสัมผัสกลิ่นอันหอมกรุ่นจากกาแฟไทย อิ่มเอมกับเบเกอรี่และดนตรีแสนไพเราะ บรรยากาศริมแม่น้ำจันทบูร สบายๆ มาจิบแบบไม่รู้จบไปด้วยกัน
เทศกาลกาแฟและชาล้านนาตะวันออก (Eastern Lanna Coffee & Tea Festival) 17-19 ก.พ.66
เทศกาลกาแฟและชาล้านนาตะวันออก (Eastern Lanna Coffee & Tea Festival) กิจกรรมเพื่อคอชาและกาแฟ ชาวเชียงรายและจ.ใกล้เคียง วันที่ 17-19 กุมภาพันธ์ 2566 ณ เชียงรายไนท์บาซาร์ อ.เมืองเชียงราย จ.เชียงราย เชิญมาดื่มด่ำชาและกาแฟให้หนำใจ จากกลุ่มจังหวัดภาคเหนือตอนบน 2 เชียงราย พะเยา แพร่ น่าน และกิจกรรมเวิคชอปชากาแฟมากมาย ดนตรีสดทุกวัน สายแค้มป์ สายดริป สายสุขภาพ
เทศกาลกาแฟขนาดมินิ 3 - 5 ก.พ.66 LINK
เทศกาลกาแฟขนาดมินิ ครั้งแรกในปัตตานี โดยทีม PARTY STUDIO ถนนปัตตานีภิรมย์ ปัตตานี ในวันที่ 3 - 5 กุมภาพันธ์ 2566 ณ PARTY STUDIO ถนนปัตตานีภิรมย์ ภายใต้คอนเซ็ปต์ Signature Stories เรื่องราวของเมนูซิกเนเจอร์ จากคาเฟ่กว่า 20 แห่งในปัตตานี ยะลา และนราธิวาส ชิม ชง ดื่ม ดม ไปด้วยกัน
งานตลาดนัดกาแฟ นครปฐม 4-5 ก.พ. 66 LINK
งานตลาดนัดกาแฟ นครปฐม 4-5 ก.พ. 66 ณ สถานีผัก & คนรักกาแฟ พุทธมณสาย 5 นครปฐม
รวมร้านกาแฟอร่อยๆมากมายภายในงาน Slow bar เก๋ๆ มาให้เลือกชิมเยอะมาก เมล็ดกาแฟ หม้อชงกาแฟ เบเกอรี่ ขนมหวาน ของทานเล่นและอาหารโรงคั่วกาแฟ สนุกไปกับการเลือกเมล็ดและลองคั่วด้วยตัวเอง
Hand Brew Coffee Fest 2023 บางเสร่ 17-19 ก.พ.66 LINK
Hand Brew Coffee Fest งานกาแฟที่ "รวมตัวจริง" ไว้ในบาร์เดียว (Bico Roots Gallery Drip Coffee เชียงใหม่ โรงคั่วกาแฟปรีดา Beans Looker น.น่าน Bluekoff x Brewna Wanderlust Bkk JWC) เปิดบริการแค่ปีละสามวัน สำหรับปีนี้ 17-19 กุมภาพันธ์ 2023 ร้านเปิด 10.00-18.00 สถานที่ Wonderfarm at Sunsaray บางเสร่ ชลบุรี
งานกาแฟ The Coffee camper ณ Yala park 10-12 ก.พ.66
ครั้งแรกกับการรวมตัวผู้ประกอบการร้านกาแฟจากสามจังหวัดชายแดนใต้ไว้ในที่เดียว พร้อมสัมผัสกลิ่นอายของแคมป์กาแฟใจกลางเมืองยะลา และการรวมตัวครั้งนี้เพื่อการสนับสนุนและเป็นการยกระดับอีกขั้นของวงการผู้ประกอบการร้านกาแฟในพื้นที่สามจังหวัดชายแดนใต้ อีกทั้งยังสนับสนุนและยกระดับเมล็ดกาแฟพื้นเมืองที่ได้จากเกษตรกรภายในจังหวัดยะลาโดยตรง ไม่ใช่แค่เพียงช่วยกระตุ้นเศรษฐกิจเท่านั้น การจัดงานครั้งนี้ยังเป็นการสร้าง coffee community หรือ วงการคอกาแฟอีกด้วย แล้วเจอกันในงาน The Coffee camper ณ Yala park วันที่ 10-12 กุมภาพันธ์2023 งานเริ่มตั้งแต่ บ่าย 3 โมงเย็น ถึง เที่ยงคืนนี้ แล้วเจอกันเหล่าสาวก THE CAMPER 10-12 FEB 23
Sukhothai Coffee Festival: Friend Trade สุโขทัย คอฟฟี เฟสติวัล 4 ม.ค.66 LINK
Sukhothai Coffee Festival: Friend Trade สุโขทัย คอฟฟี เฟสติวัล: พาเพื่อนมารู้จักกัน วันที่ 4 กุมภาพันธ์ ณ ร้านจงกล คาเฟ่ (จงกล คาเฟ่ ) 9:00 - 17:00 พร้อมกิจกรรมภายในงานมากมาย ร่วมแลกเปลี่ยนความรู้และพูดคุยกับ เจ้าของสวนกาแฟรางวัล, Q grader และ ร้านกาแฟดริปร้านแรกๆในสุโขทัย บูธร้านค้ามากกว่า 20 บูธภายในงาน ทั้งกาแฟ อาหาร ร้านขนมต่างๆ และ workshop สำหรับคนที่กำลังสนใจกาแฟ ร่วมซื้อบัตรและลงทะเบียน workshop ล่วงหน้าได้ที่
ตลาดนัดกาแฟ วันที่ 4-5 ก.พ.66 @สถานีผัก & คนรักกาแฟ LINK
ตลาดนัดกาแฟ วันที่ 4-5 ก.พ. 2566 ที่ สถานีผัก & คนรักกาแฟ งานกาแฟของเราไม่ได้มีแค่กาแฟ - อาหาร - เบเกอรี่ - กิ๊ปชอป - งานเซรามิก - Workshop - ชา เครื่องดื่ม - ของแฮนเมด - น้ำหอม - เมล็ดกาแฟ มีมากกว่า 50 ร้านค้า!! จิบกาแฟ เดินชอป ฟังเพลงชิวๆ ในสวน แถมพาสัตว์เลี้ยงเข้าได้ด้วย จอดรถได้ ในโรงเรียนบางกระทึก และพื้นที่ตรงข้าม โรงเรียนบางกระทึก
COFFEE MANIA #4 2023 ครั้งที่ 4 วันที่ 10- 12 ก.พ.66
ต้อนรับเดือนแห่งความรักและก่อนลมหนาวจะพัดผ่านไป โครงการบ้านโบราณเชียงใหม่ ริมน้ำปิง เดินหน้าจัดงานกาแฟต่อเนื่อง COFFEE MANIA #4 2023 ครั้งที่ 4 ใน คอนเซปต์ “COFFEE IN LOVE ” เทศกาลกาแฟ ที่จะเปลี่ยนความขมเป็นความหวาน วันที่ 10- 12 กุมภาพันธ์ 2566 สำหรับงาน COFFEE MANIA นับเป็นกิจกรรมประจำปี ของโครงการบ้านโบราณ ซึ่งจะจัดทุกปี ปีละ 2 ช่วง ช่วงต้นปี ประมาณกุมภาพันธ์ และ ธันวาคม ในช่วงไฮซีซั่น และ รับลมหนาว ซึ่งมุ่งหวัง เพื่อส่งเสริมการท่องเที่ยว สร้างภาพลักษณ์ และสร้างการรับรู้เพื่อมุ่งสู่เชียงใหม่เมืองกาแฟและยังเป็นการสนับสนุนส่งเสริมอุตสาหกรรมกาแฟภาคเหนือให้เติบโตและยั่งยืน กิจกรรมในครั้งนี้ เรายังพาทุกท่านมาพบกับผู้ประกอบการร้านกาแฟแบรนด์ชั้นนำชั้นนำของจังหวัดเชียงใหม่ กว่า 30 ร้านค้า
Chiang Mai Coffee Week 2023 วันที่ 22 - 26 ก.พ.66 LINK
Chiang Mai Coffee Week 2023 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคเหนือ ภายใต้คอนเส็ป “AWAKE YOUR JOURNEY” เทศกาลที่จะชวนคุณมาปลุกการเดินทางด้วยกลิ่นหอมกรุ่นของกาแฟ 22 - 26 กุมภาพันธ์ 2566 ณ จริงใจมาร์เก็ต เชียงใหม่ +บูธจำหน่ายกาแฟ เมล็ดกาแฟ อุปกรณ์ งานคราฟต์ และสินค้าอื่น ๆ ที่เกี่ยวข้องกับกาแฟและธุรกิจคาเฟ่ อาหาร เครื่องดื่ม เบเกอรี่ ฯลฯ รวมกว่า 200 ร้านค้า + workshop + เสวนา และอื่น ๆ
Lampang coffee fest 2023 วันที่ 17-19 ก.พ.66
Lampang coffee fest รวมสุดยอด กาแฟ ชา โกโก้ จากแหล่งปลูกในจังหวัดลำปาง และกิจกรรมอีกมากมาย จัดโดย องค์การบริหารส่วนจังหวัดลำปาง ได้ร่วมกับสำนักงานการท่องเที่ยวและกีฬาจังหวัดลำปาง และธนาคารเพื่อการเกษตรและสหกรณ์การเกษตรจังหวัดลำปาง จัดงาน Lampang Coffee Fest ขึ้นระหว่างวันที่ 17 - 19 กุมภาพันธ์ 2566 เพื่อส่งเสริมและพัฒนารูปแบบการท่องเที่ยวเชิงเกษตร วัฒนธรรมกาแฟ ส่งเสริมให้ผู้ประกอบการและเกษตรกรพัฒนาทักษะการแปรรูป การสร้างมูลค่ากาแฟ และกระตุ้นเศรษฐกิจด้านการท่องเที่ยวในจังหวัดลำปาง
กิจกรรมภายในงาน มีการออกร้านนิทรรศการแสดงสินค้า รวมสุดยอด กาแฟ ชา โกโก้ จากแหล่งปลูกในจังหวัดลำปาง การสาธิตการทำกาแฟคั่วมือและชิมกาแฟ โฮมเมดเบเกอรี่ outdoor camping ,Slow bar โรงคั่วกาแฟ เกษตรกรไร่กาแฟจากหลายดอยในจังหวัดลำปาง และผู้ประกอบการร้านกาแฟ จำนวนกว่า 60 ร้านค้า เวทีเสวนาถ่ายทอดองค์ความรู้ การสาธิต การแข่งขัน ดริฟกาแฟ และลาเต้ อาร์ต กิจกรรมจากหน่วยงาน/สถาบันการศึกษาและสาธิตการดริฟกาแฟพิเศษจากทีมวิจัย Arabica Research Team มหาวิทยาลัยเทคโนโลยีราชมงคลล้านนา ลำปาง
Coffee and friends Chanthaboon 18-19 February 2023
Coffee and Friends CHANTHABOON event 18-19 February 2023 at the shrine at the lower market Chanthaboon Riverside Community Mueang Chanthaburi District Chanthaburi Province from 9:00 AM to 4:00 PM. Meet the coffee booth and Bakery. From more than 30 famous cafes, coffee lovers should not miss. Taste and feel the aroma of Thai coffee. Enjoy the bakery and beautiful music. Atmosphere along the Chanthaboon River.
Eastern Lanna Coffee & Tea Festival 17-19 February 2023
Eastern Lanna Coffee & Tea Festival, an activity for tea and coffee lovers. People of Chiang Rai and nearby provinces, February 17-19, 2023 at Chiang Rai Night Bazaar. Mueang Chiang Rai District, Chiang Rai Province, invites you to enjoy tea and coffee to your heart’s content. From the upper northern provinces group 2, Chiang Rai, Phayao, Phrae, Nan and many tea and coffee workshop activities Live music every day, campers, drippers, health lovers.
Mini coffee festival PARTY STUDIO 3 - 5 February 2023
Mini coffee festival For the first time in Pattani by the PARTY STUDIO team, Pattani Phirom Road, Pattani, on 3 - 5 February 2023 at PARTY STUDIO Pattani Phirom Road. Under the concept of Signature Stories, the stories of signature menus from more than 20 cafes in Pattani, Yala and Narathiwat taste, brew, drink and smell together.
Sunset Coffee Fest 2023, February 10-12
Sunset Coffee Fest 2023, the 2nd Coffee Festival of the West, “Milky Way, the Way of Coffee” at MAS. Stay-at-Café, Mueang Kanchanaburi District. The event is scheduled to take place on February 10-12, 2023 at The Zeit River Kwai Resort, Muang District, Kanchanaburi Province.
Nakhon Pathom Coffee Market Fair 4-5 Feb 2023
Nakhon Pathom Coffee Market Fair 4-5 Feb 2023 at Vegetable Station & Coffee Lover Phutthamon Sai 5, Nakhon Pathom. Inside the event, there are many delicious coffee shops in the event. Slow bar, chic to choose from. Lots of coffee beans, coffee pots. Bakery, dessert, appetizers and coffee roaster It’s fun to pick the seeds and try roasting them yourself.
Hand Brew Coffee Fest 17 -19 February 2023
Hand Brew Coffee Fest, a coffee event that "gets the real thing together" in one bar (Bico Roots Gallery Drip Coffee, Chiang Mai, Prida Coffee Factory, Beans Looker, Nan Bluekoff x Brewna Wanderlust Bkk JWC), open for service only three days a year, this year 17 -19 February 2023 Shop open 10.00-18.00 Location Wonderfarm at Sunsaray, Bang Saray, Chonburi
The Coffee camper ณ Yala park 10-12 Feb 2023
This is the first time that coffee shop operators from the three southernmost provinces have gathered together in one place. Ready to experience the aura of a coffee camp in the heart of Yala. And this gathering is to support and raise another level of coffee shop entrepreneurs in the three southern border provinces. It also supports and raises the level of native coffee beans obtained directly from farmers in Yala Province. It’s not just helping to stimulate the economy. This event also creates a coffee community or the coffee industry as well. See you at The Coffee camper event at Yala park on February 10-12, 2023. The event starts from 3:00 p.m. until midnight. See you all THE CAMPER disciples 10-12 FEB 23.
COFFEE MANIA #4 2023, February 10-12
Welcome the month of love and before the cold wind blows. Chiang Mai Ancient House Project along the Ping River continues to organize coffee events for the 4th time COFFEE MANIA #4 2023 under the concept of “COFFEE IN LOVE”, a coffee festival that will change bitterness to sweetness on February 10-12, 2023. For the COFFEE MANIA event, it is an annual event. of the ancient house project Which will be held every year 2 times a year at the beginning of the year around February and December during the high season and receive the cold wind, which aims to promote tourism create an image And create awareness to aim to Chiang Mai, the city of coffee, and also support and promote the northern coffee industry to grow and sustainably. Activities this time We also bring everyone to meet with coffee shop operators, leading brands in Chiang Mai, more than 30 shops.
Chiang Mai Coffee Week 2023, 22 - 26 February
Chiang Mai Coffee Week 2023, the largest coffee festival in the North. Under the concept "AWAKE YOUR JOURNEY", a festival that invites you to wake up your journey with the aroma of coffee from 22 - 26 February 2023 at Jingjai Market, Chiang Mai + booths selling coffee, coffee beans, craft tools and other products. Related to coffee and cafe business, food, beverages, bakeries, etc., including more than 200 shops + workshops + seminars and more.
Lampang coffee fest 2023, Feb 17-19
Lampang coffee fest, a collection of the best coffee, tea, cocoa from plantations in Lampang province. and many other activities organized by Lampang Provincial Administrative Organization in conjunction with the Lampang Provincial Tourism and Sports Office And the Bank for Agriculture and Agricultural Cooperatives of Lampang Province organized the Lampang Coffee Fest between 17 - 19 February 2023 to promote and develop agro-tourism, coffee culture, and encourage entrepreneurs and farmers to develop processing skills. coffee value creation And stimulate the tourism economy in Lampang Province.
Activities There is an exhibition booth showing products including the best coffee, tea, cocoa from plantations in Lampang province. Demonstration of hand-roasted coffee making and coffee tasting Homemade bakery, outdoor camping, Slow bar, coffee roasting plant, coffee farmers from many hills in Lampang province. And coffee shop operators, numbering more than 60 shops, forums to transfer knowledge, demonstrations, competitions, drip coffee and latte art, activities from agencies / educational institutions and demonstrations of special drip coffee from the research team Arabica Research. Team Rajamangala University of Technology Lanna Lampang.
Amazing Robusta @Chumphon ประจำปี 2566 วันที่ 31 มี.ค.66
Amazing Robusta @Chumphon ประจำปี 2566 วันที่ 31 มี.ค. 2023 สวนสาธารณะอาภากรเกียรติวงศ์ อำเภอเมือง จังหวัดชุมพร กิจกรรมออกร้านกาแฟโรบัสต้า กิจกรรมดนตรี กิจกรรม Coffee tasting กิจกรรม Coffee battle กิจกรรม DIY กิจกรรมเสวนากาแฟ กิจกรรม Coffee Omakase เป็นต้น
งาน COFFEE PLAYGROUND 10-12 มี.ค.66 ริมทะเลสาบเมืองทองธานี LINK
10-12 มีนาคม 2566 คอกาแฟ ห้ามพลาด! งาน COFFEE PLAYGROUND สุดชิลริมทะเลสาบเมืองทองธานี เชิญชวนมาร่วมเติมความสนุก มาชิลเอ้าท์ ดื่มด่ำกับรสชาติกาแฟที่หลากหลาย และไลฟ์สไตล์ที่เพลย์กราวด์แห่งนี้ ในงาน “Coffee Playground” ซึ่งจัดในธีม Coffee , Human and Nature สายชิลและคนที่หลงรักรสชาติของการแฟริมทะเลสาบเมืองทองธานี ห้ามพลาด!
NAN DRIP BATTLE x HARIO ครั้งที่ 1 น่าน เบฟเวอเรจ เฟสติวัล 4-5 มีนาคม 2566 LINK
การแข่ง DRIP #NAN DRIP BATTLE x HARIO ครั้งที่ 1 ในงาน น่าน เบฟเวอเรจ เฟสติวัล ที่จะจัดขึ้นในวันที่ 4-5 มีนาคม 2566 นี้ (ตรงกับวันหยุดยาว 4-5-6) ปีนี้ Hario Thailand เป็นสปอนเซอร์ในการแข่งขัน โดยจะรับสมัครผู้เข้าแข่งขันทั้งหมด 50 ท่าน สำรอง 5 ท่าน ค่าสมัคร ท่านละ 1,000 บาท ได้รับเสื้อยืดที่ระลึกงานแข่ง ใส่ในการแข่ง ของรางวัลสำหรับท่านที่ชนะเลิศ ถ้วยรางวัลเกียรติบัตร เงินสดและของรางวัลจาก Hario รวมมูลค่ากว่า 20,000 บาท
ในการแข่งครั้งนี้แต่ละรอบเราจะใช้เมล็ดกาแฟ Nan Specialty จากไร่กาแฟรางวัล ประกวดกาแฟหลากหลายเวทีของไทย อาทิ มณีพฤกษ์ ห้วยขวาก ห้วยโทน สวนยาหลวง รับประกันความดีงามแน่นอน -
ชมรมกาแฟพิเศษน่าน
ตลาดกาแฟสัญจร เทศกาลดื่ม Sun Coff and Moon Craft 17 – 19 มี.ค.66
“ตลาดกาแฟสัญจร” เทศกาลดื่ม Sun Coff and Moon Craft ( AM : Drink Coffee , PM : Drink Craft ) 17 – 19 มีนาคม 2566 ที่ Thew Talay World ชะอำ จ.เพชรบุรี อาหาร เครื่องดื่ม ดนตรี ช้อป ชิม ชิว ครบจบที่งานเดียว - เบเกอรี่ - อาหาร - เสื้อผ้า / กิ๊ปชอป - งานแฮนด์เมด - งานวินเทจ - Work Shop ศิลปะ - Work Shop กาแฟ - Food Truck - Coffee Truck - Coffee Camp
ตลาดกาแฟสัญจร Sun Coff and Moon Craft @หัวหินวัน 17 - 19 มี.ค.66 LINK
ตลาดกาแฟสัญจร Sun Coff and Moon Craft ของคนรักกาเเฟ ในวันศุกร์ เสาร์ อาทิตย์ ที่ 17 - 19 มีนาคม 2566 ณ สถานีผัก&คนรักกาแฟ หัวหินวัน ถนนเพชรเกษม กม 196 จุดเด่นในปั๊ม Shell 9.00-22.00 น. - พาสัตว์เลียงเข้าได้ด้วย
ตลาดนัดกาแฟ ในบรรยากาศสวนสีเขียว พร้อมสนามเด็กเล่น พื้นที่กว้างขวาง ร้านกาแฟ มากกว่า 80 ร้าน มีเมล็ดกาแฟทั้งในและนอก ให้เลือกกลับไปลองทำเองที่บ้านอีกด้วย มีโรงคั่วกาแฟด้วยน้า อยากให้ทุกคนได้มา พูดคุย แลกเปลี่ยนประสบการณ์ที่นี่กันได้น้า แนะนำเลย ตลาดนัดกาแฟแต่ไม่ได้มีแค่กาแฟและเมล็ดกาแฟนะเพื่อนๆ - อาหาร - เครื่องดื่ม / เบียร์สด - เบเกอรี่ - ดนตรีสดตลอดทั้งวัน - โซนด้านในมุมถ่ายรูปเพียบ!!
เมืองกาแฟ แลดอกเสี้ยว เที่ยวเทพเสด็จ ครั้งที่ 9 วันที่ 4 - 5 มีนาคม 66 อ.ดอยสะเก็ด
คอกาแฟห้ามพลาด "เมืองกาแฟ แลดอกเสี้ยว เที่ยวเทพเสด็จ" ครั้งที่ 9 สนับสนุนโดย อบจ.เชียงใหม่ สัมผัสกับบรรยากาศดอกเสี้ยวบานในอ้อมกอดแห่งขุนเขา การออกร้านจำหน่ายสินค้าโอทอป ร้านกาแฟ และชิมกาแฟสายพันธ์อาราบิก้าของดีตำบลเทพเสด็จ ฯลฯ ตั้งแต่วันที่ 4 - 5 มีนาคม 2566 ที่ลานอเนกประสงค์ บ้านปางไฮ ต.เทพเสด็จ อ.ดอยสะเก็ด จ.เชียงใหม่
Tak Exotic Coffee Championship Thailand 2023 วันที่ 25-26 มีนาคม 66 LINK
งานมหัศจรรย์กาแฟดี จังหวัดตาก ครั้งที่ 2 วันที่ 25-26 มีนาคม นี้ ณ สวนริมแม่น้ำปิง เทศบาลเมืองตาก มาสัมผัสอัตลักษณ์กาแฟดีจังหวัดตาก การแข่งขัน Drip coffee (Drip/Pour-Over) ด้วยรุปแบบ slow bar สกัดรสชาติ รสหอมกรุ่นกลิ่นกาแฟตาก การแข่งขัน Moka pot เย็น เนรมิตเมนูกาแฟ Es Yen เมนูกาแฟยอดนิยม สร้างสรรค์ไอเดียกาแฟรูปแบบ Espresso Signature Drink การเสวนาหัวข้อ "โอกาสและอนาคตของกาแฟตาก" และชิมเมนูกาแฟมากมายในงาน
WESTKOFF 2023 : The Art of Asadong ราชบุรี 24-26 มีนาคม 2566 LINK
WESTKOFF 2023 : The Art of Asadong เทศกาลกาแฟและศิลปะของจังหวัดราชบุรี 24-26 มีนาคม 2566 เวลา 10.00-20.00 น. ณ 155-Camp อ.เมือง จ.ราชบุรี กิจกรรมเชื่อมโยงผู้คน วัฒนธรรม ศิลปะที่หลากหลาย เข้าด้วยกัน โดยมีกาแฟเป็นจุดเชื่อมโยงที่เข้าถึงและเข้าใจง่ายในบริบทปัจจุบัน โดยการเล่าเรื่องผ่านอัตลักษณ์ในฉบับชาวราชบุรี ประกอบด้วย กาแฟ งานศิลปะหัตถกรรม งานศิลปะร่วมสมัย แหล่งท่องเที่ยว ดนตรีและธรรมชาติ ภายใต้คอนเซ็ปท์ The Art of Asadong : เมื่ออาทิตย์ อัสดง ลงปัจฉิม สนธยา ส่องแสงพริ้ม...ก่อนลับดวงตะวัน"
เตรียมพบกับกิจกรรมมากมายในงาน☑️ งานออกบู๊ทกาแฟ เครื่องดื่ม ขนม และอาหาร ร้านดัง ☑️ กิจกรรม Workshop ทั้งด้านกาแฟและศิลปะ (เพ้นท์เซรามิค /กิจกรรมศิลปะจากธรรมชาติรอบตัว) ☑️ กิจกรรม เสวนา (Coffee Playground) ☑️ กิจกรรมการแข่งขัน Aeropress เพื่อหาตัวแทนภาคตะวันตก ☑️ วงดนตรีชิลล์ๆ ช่วงเย็นกับบรรยากาศริมน้ำช่วงพระอาทิตย์ตกดิน ** เข้างานฟรีไม่มีค่าใช้จ่าย **
iTAC2023 (ISAN Thailand AeroPress Championship 2023) 11 -12 มีนาคม
iTAC2023 (ISAN Thailand AeroPress Championship 2023) งานระดับภูมิภาคงานแรกของ Thailand AeroPress Championship ในปีนี้ iTAC จัดร่วมกับงาน @brewbarnfest2023 ซึ่งมี Anna Coffee Roasters เป็นเจ้าบ้านภาคอีสานให้กับเรา ในงานนอกจากจะมีการแข่งขันของเราแล้ว ยังมีการออกร้านจำหน่ายกาแฟ อุปกรณ์กาแฟ demon และ workshops ต่าง ๆ เพื่อสร้างแรงบันดาลใจให้กลุ่มคนกาแฟในระดับภูมิภาค ทำให้วงการกาแฟโดยรวมได้พัฒนายิ่งขึ้น ส่งต่อไปถึงกลุ่มคนรักกาแฟในวงกว้างอีกด้วย งานจะจัดขึ้นในวันเสาร์-อาทิตย์ที่ 11 -12 มีนาคม นี้ ที่ ANNA COFFEE ROASTERS (AT HUA RUEA) บ้านหัวเรือ ต.ในเมือง อ.เมือง จ.อุบลราชธานี
Cupping Coffee Workshop 11-12 มีนาคม 66
Cupping Coffee Workshop ชวนมาเวิร์กช็อปสัมผัสรสชาติกาแฟดอยตุงสายพันธุ์ต่างๆ ริมทะเลสาบ เมืองทองธานี เปิดเพียง 2 รอบเท่านั้น! รอบที่ 1 : วันที่ 11 มีนาคม 66 เวลา 15.15 - 16.15 น. รอบที่ 2 : วันที่ 12 มีนาคม 66 เวลา 15.15 - 16.15 น. รับรอบละ 8 ท่าน สมัครฟรี ไม่มีค่าใช้จ่าย!
Craft Coffee Fest 2023 @ Terminal21 Asok
Craft Coffee Fest 2023 @ G & M Floor Terminal21 Asok วันที่ 31 มีนาคม – 9 เมษายน 2023 รวมร้านกาแฟดังทั่วประเทศ Roast Runner, Rolling Roasters Coffee, The Summer Coffee, Double Slash, Y’EST WORK, POUR OVER LAB, HEY Coffee, Hacking Coffee Roasters, Over Brew, BRAME Coffee, Tonbab Camp Coffee, ISARA COFFEE, Jason Coffee Roaster, Brew Flavor, HINT COFFEE ROASTER, PHAKPHUM Coffee, Chin.gu.cafe, Auntie Coffee, Coffee Bean Chocolate
Amazing Robusta @Chumphon 2023, March 31
Amazing Robusta @Chumphon 2023 March 31, 2023 Apakornkiatwong Public Park, Muang District, Chumphon Province Robusta coffee shop activities, music activities, Coffee tasting activities, Coffee battle activities, DIY activities, Coffee discussion activities, Coffee Omakase activities, etc.
COFFEE PLAYGROUND 2023, 10-12 March
10-12 March 2023, coffee lovers, don’t miss out! COFFEE PLAYGROUND event, the coolest place by the lake, Muang Thong Thani Invite you to join in the fun, come to chill out and enjoy a variety of coffee flavors. And lifestyle at this playground in the "Coffee Playground" event organized in the theme of Coffee, Human and Nature, chill and people who love the taste of coffee by the lake, Muang Thong Thani, don’t miss it!
The 1st DRIP #NAN DRIP BATTLE x HARIO competition March 4-5, 2023
The 1st DRIP #NAN DRIP BATTLE x HARIO competition at the Nan Beverage Festival, which will be held on March 4-5, 2023 (corresponding to the 4-5-6 long holiday) this year, Hario. Thailand is the sponsor of the competition. Which will recruit all 50 contestants, reserve 5 persons, application fee 1,000 baht per person, receive a commemorative t-shirt to wear in the competition, prizes for the winner trophy Cash and prizes from Hario worth more than 20,000 baht
For each round of this competition, we will use Nan Specialty coffee beans from the award-winning coffee plantation. Many Thai coffee contests, such as Manee Phruek, Huay Kwak, Huay Thon, Suan Ya Luang, are guaranteed to be good.
Sun Coff and Moon Craft 17-19 Mar 2023
"Roaming Coffee Market" Sun Coff and Moon Craft Drinking Festival ( AM: Drink Coffee , PM: Drink Craft ) 17 - 19 March 2023 at Thew Talay World, Cha-Am, Phetchaburi Province. Food, drinks, music, shopping, tasting, chilling, complete in one event. - Bakery - Food - Clothing / Gift Shop - Handmade - Vintage - Work Shop Art - Work Shop Coffee - Food Truck - Coffee Truck - Coffee Camp
Sun Coff and Moon Craft @Hua Hin 17-19 Mar 2023
Sun Coff and Moon Craft Travel Coffee Market for coffee lovers on Friday, Saturday, Sunday, March 17 - 19, 2023 at Hua Hin Wan Vegetable & Coffee Lover Station, Petchkasem Road, km. 196, featured in the Shell gas station, 9:00 a.m. - 10:00 p.m. - Bring animals. You can also enter.
Coffee market in a green garden atmosphere with playground Spacious area, more than 80 coffee shops, with coffee beans inside and outside Choose to go back and try to do it yourself at home as well. There is also a coffee roasting plant. Would like everyone to come, talk, exchange experiences here. I recommend it. Coffee market, but not just coffee and coffee beans, friends. - Food - Drinks / Draft beer - Bakery - Live music all day long. - The zone inside the photo corner is plentiful!!
Brew Barn Fest 2023 Competition @ITAC2023
Brew Barn Fest 2023 Competition @ITAC2023: Isan Thailand AeroPress Championship 2023 March 11-12, 2023 Location: Anna Coffee Roasters (AT HUA RUEA) Ban Hua Ruea, Nai Mueang Subdistrict, Mueang District, Ubon Ratchathani Province, Mueang Ubon Ratchathani District
Tak Exotic Coffee Championship Thailand 2023
The 2nd Miracle of Good Coffee, Tak Province, on 25-26 March at a park along the Ping River. Tak Municipality Come and experience the good coffee identity of Tak province, Drip coffee competition (Drip/Pour-Over) with a slow bar style, extracting the aromatic flavor and smell of dry coffee, Yen Moka pot competition, creating Es Yen coffee menu, a popular coffee menu. Creating coffee ideas in the form of Espresso Signature Drinks. "Opportunities and Futures of Dried Coffee" and tasting many coffee menus at the event
WESTKOFF 2023 : The Art of Asadong 24-26 March 2023
WESTKOFF 2023 : The Art of Asadong Coffee and Art Festival of Ratchaburi Province 24-26 March 2023 from 10:00 a.m. to 8:00 p.m. at 155-Camp, Muang District, Ratchaburi Province, activities connecting people, cultures, and various arts together with coffee. It is a link that is accessible and easy to understand in the current context. By telling stories through the identity of the Ratchaburi people, including coffee, handicrafts contemporary art attraction music and nature under the concept of The Art of Asadong : when the sun goes down, finally twilight, shines brightly before the sun sets"
Prepare to meet many activities in the event ☑️ Booth event, coffee, beverages, snacks and food, famous restaurants ☑️ Workshop activities, both coffee and art. (painted ceramic / art activities from nature around) ☑️ Discussion activity (Coffee Playground) ☑️ Aeropress competition event to find representatives in the western region ☑️ Chilling band In the evening with the atmosphere by the water during the sunset ** Free entry, free of charge.
Craft Coffee Fest 2023 @ Terminal21 Asok
Craft Coffee Fest 2023 @ G & M Floor Terminal21 Asok, March 31 - April 9, 2023, including famous coffee shops across the country Roast Runner, Rolling Roasters Coffee, The Summer Coffee, Double Slash, Y’EST WORK, POUR OVER LAB, HEY Coffee. , Hacking Coffee Roasters, Over Brew, BRAME Coffee, Tonbab Camp Coffee, ISARA COFFEE, Jason Coffee Roaster, Brew Flavor, HINT COFFEE ROASTER, PHAKPHUM Coffee, Chin.gu.cafe, Auntie Coffee, Coffee Bean Chocolate.
Esan Coffee Fair 2023 วันที่ 27 - 30 เม.ย.66 LINK
Esan Coffee Fair 2023 งานกาแฟสุดยิ่งใหญ่ ครั้งแรกในภาคอีสาน วันที่ 27 - 30 เม.ย. 2566 ณ เซ็นทรัลโคราช Korat Hall ชั้น 4 ไฮไลท์ภายในงาน พบกับ King and Queen Of Latte Art ดีกรีแชมป์ระดับโลก พร้อมกิจกรรมต่างๆ ไม่ว่าจะเป็นการแข่งขันบาริสต้า กิจกรรม Work Shop เสริมองค์ความรู้จากผู้เชี่ยวชาญและเหล่าคนดังในวงการกาแฟ พร้อมเปิดให้ชิมกาแฟพันธุ์หายากและมินิคอนเสิร์ตจากศิลปินและบูธร้านกาแฟชื่อดังต่างๆ อีกมากมายภายในงาน [
facebook]
Wha Pai Coffee Show NST เทศกาลกาแฟหรอย นครศรีธรรมราช 8-9 เม.ย.66 LINK
เทศกาลกาแฟหรอยจังหวัดนครศรีธรรมราช พบปะบูธจำหน่ายกาแฟจากคาเฟ่ชื่อดังทั่วทั้งภาคใต้ พร้อมกับงานแข่ง Thailand AeroPress Championship Workshop จากแชมป์ Aropress Thailand และแขกรับเชิญสุดพิเศษ บรูน่า ซิลวา ที่จะมาแลกเปลี่ยนพูดคุยการทำกาแฟแบบ Home Brew วันที่ 8-9 เมษายน 2566 เวลา 10:00 - 21:00 น. สถานที่จัดงาน The Union ชั้น 1 สอบถามข้อมูลเพิ่มเติมโทร 080-2959877
Thailand Coffee Hub 2023 เซ็นทรัล จันทบุรี 1-7 เม.ย. 66
Thailand Coffee Hub 2023 งานเทศกาลกาแฟที่ใหญ่ที่สุดแห่งภาคตะวันออก Thailand Coffee Hub 2023 ครั้งแรกที่ศูนย์การค้าเซ็นทรัล จันทบุรี 1-7 เม.ย. 66 จัดเต็มกว่าที่เคย เพื่อคอกาแฟตัวจริง!! พบร้าน Specialty Coffee ร้านดังจากกทม. และภาคตะวันออก รวมทั้ง Craft Cocoa จากทั่วไทย ในงานเดียว - Specialty Coffee มากกว่า 50 ร้านดัง - Best Brew of East รวมร้านดังภาคตะวันออก - Craft Cocoa Village รวมโกโก้จากทั่วประเทศ - Bakery pairing Coffee ขนมอร่อยทานคู่กาแฟ งานนี้คนรักกาแฟพลาดไม่ได้ กับงาน Thailand Coffee Hub 2023 @ Central Chanthaburi
งานเทศกาลกาแฟ Central Ayutthaya Coffee Society 2023 (28 เมย - 4 พค 66) LINK
งานเทศกาลกาแฟ และการแข่งขัน ที่ยิ่งใหญ่ที่สุดของจังหวัดพระนครศรีอยุธยา Central Ayutthaya Coffee Society 2023 งานที่รวบรวมร้านกาแฟชื่อดังมากกว่า 40 ร้าน และการแข่งขันกาแฟ 3 รายการใหญ่ จาก Thailand Coffee Brewery Leagueพร้อมพบกิจกรรมสุดพิเศษที่ คนกาแฟ ไม่ควรพลาดตลอดทั้ง 7 วัน พิเศษพบกับ Mini Concert ศิลปิน เรนิษรา เจ้าของเพลงดัง ผู้ถูกเลือกให้ผิดหวัง วันที่ 28 เมษายน - 4 พฤษภาคม 2566 C ณ ลานกิจกรรมชั้น G ศูนย์การค้าเซ็นทรัล อยุธยา
Cafe Asia 25 - 27 May 2023
Cafe Asia 25 - 27 May 2023 Sands Expo and Convention Centre, Singapore
"Southeast Asia’s Biggest Cafe, Coffee and Tea Industry Expo" Cafe Asia will showcase an array of equipment, machinery, accessories, and other supplies and products for the effective running of coffee establishments and tea businesses. This makes the exhibition the perfect one-stop sourcing platform for industry professionals to cater to the needs of the growing industry. Gain valuable insights on the latest cafe trends, innovative products, and services that are brewing in the region and beyond.
16 พฤษภาคม 2566 ประกาศผลการประกวดสุดยอดเมล็ดกาแฟพิเศษไทย Thai Specialty Coffee Awards ประจำปี 2566 LINK
การประกวดสุดยอดเมล็ดกาแฟพิเศษไทย Thai Specialty Coffee Awards ประจำปี 2566 ประจำปี 2566 เวทีที่ทุกคนรอคอย โดยสมาคมกาแฟพิเศษไทย SCATH กำหนดการและรายละเอียด
- 14 กุมภาพันธ์ - 20 มีนาคม 2566 ลงทะเบียนผู้ประกวดกาแฟ เพื่อรับรหัสประจำตัว ผู้ประกวดกาแฟ
- 1 - 7 เมษายน 2566 ผู้เข้าร่วมประกวด ส่งตัวอย่างกาแฟรอบคัดเลือก (กาแฟกะลา 2 กก. + กาแฟสาร 2 กก.)
- 17 - 19 เมษายน 2566 ตรวจสอบกายภาพ
- 24 - 25 เมษายน 2566 ตัดสินรอบคัดเลือก washed process ด้วยการชิม โดยคณะกรรมการ
- 26 - 27 เมษายน 2566 ตัดสินรอบคัดเลือก honey process ด้วยการชิม โดยคณะกรรมการ
- 28 - 29 เมษายน 2566 ตัดสินรอบคัดเลือก natural process ด้วยการชิม โดยคณะกรรมการ
- 1 - 7 พฤษภาคม 2566 ผู้เข้ารอบชิงชนะเลิศ ส่งตัวอย่างกาแฟสาร 35 กก.
- 8 - 13 พฤษภาคม 2566 ตัดสินรอบชิงชนะเลิศ ด้วยการชิมโดยคณะกรรมการ
- 16 พฤษภาคม 2566 ประกาศผลรางวัล สุดยอดกาแฟพิเศษไทย ประจำปี 2566
สอบถามการลงทะเบียนติดต่อ: กองประกวด "สุดยอดเมล็ดกาแฟพิเศษไทย"
โทร 099-1988887 E-mail : info@scath.org
Thailand AeroPress Championship 2023 by The Coffee Calling 6 ภาค LINK
Thailand AeroPress Championship 2023 by The Coffee Calling กระจายการแข่งขันสู่ 6 ภาค ก่อนชิงแชมป์ที่กรุงเทพฯ ได้แก่ ภาคอีสาน ภาคตะวันตก ภาคใต้ ภาคเหนือ ภาคกลาง และภาคตะวันออก เพื่อเฟ้นหาตัวแทนที่ชงกาแฟที่ดีที่สุด 6 คน จากแต่ละภูมิภาค รวม 36 คน มาเข้าร่วมการแข่งในระดับประเทศ (National) เพื่อหาผู้ชนะเพียง 1 เดียวอีกครั้งที่กรุงเทพมหานครฯ จังหวัดตัวแทนและผู้จัดร่วม (Co-host) ของ Regional Thailand AeroPress Championship 2023 ทั้ง 6 ภาคมีดังนี้
- ภาคอีสาน iTAC2023 x Anna Coffee Roasters จัดร่วมกับงาน brew barn fest 2023 ที่ Anna Coffee Roaster (หัวเรือ), อุบลราชธานี วันที่ 11-12 มีนาคม 2566
- ภาคตะวันตก wTAC2023 x WestKoff จัดร่วมกับงาน WESTKOFF 2023 ที่ 155-Camp , ราชบุรี วันที่ 25-26 มีนาคม 2566
- ภาคใตั sTAC2023 x Wha Pai Coffee Show NST จัดร่วมกับงาน Wha Pai Coffee Show 2023 ที่ The Union ชั้น 3, นครศรีธรรมราช วันที่ 8-9 เมษายน 2566
- ภาคเหนือ nTAC2023 x DoiTung Club Coffee จัดร่วมในงาน (TBA) ที่ ไร่แม่ฟ้าหลวง, เชียงราย วันที่ 6-7 พฤษภาคม 2566
- ภาคกลาง cTAC2023 x The Summer Coffee Company จัดร่วมในงาน (TBA) ที่ The Summer Coffee Roasters, อยุธยา วันที่ 20-21 พฤษภาคม 2566
- ภาคตะวันออก eTAC2023 x To Die For Coffee - Bangsaen จัดร่วมในงาน (TBA) ที่ Wheeler Bed & Bike Hotel, บางแสน (ชลบุรี) วันที่ 3-4 มิถุนายน 2566
ข้อมูลและสมัครได้ผ่านเพจ FB: TheCoffeeCalling ช่องทางเดียวเท่านั้น [Wongnai Vibes]
2023 NHEN WAED NHUEA เหน่น แวด เหนือ ไร่แม่ฟ้าหลวง 6 - 7 พ.ค. 2566 LINK
2023 NHEN WAED NHUEA เหน่น แวด เหนือ Coffee Roastery, Café, Bakery, Cocoa & Tea Shop Announcement ดอยตุงและกลุ่มคนรักกาแฟเชียงรายจะจัดงาน ‘เหน่นแวดเหนือ’ ที่ไร่แม่ฟ้าหลวง จ.เชียงราย หลายคนก็สงสัยว่าชื่องานมีความหมายว่าอย่างไร
‘เหน่น’ และ ‘แวด’ มาจากภาษาเหนือที่มีความหมายว่า ‘กด’ และ ‘ทั่ว’ ตามลำดับ เมื่อนำมารวมกัน จึงแปลได้ว่า ‘กดทั่วเหนือ’ โดยภายในงานจะมีการแข่งขันเอโร่เพรสระดับภูมิภาค North Thailand AeroPress Championship 2023 (nTAC2023) ซึ่งเป็นการแข่งขันชงกาแฟด้วยเครื่องเอโร่เพรสที่ใช้แรงดันจากการ ‘กด’ เพื่อดึงรสชาติที่ดีของกาแฟออกมา ดังนั้น เหน่นแวดเหนือ จึงถือเป็นการเชิญชวนให้ทุกคนมาร่วมกด (เอโร่เพรส) กันทั่วทั้งภาคเหนือนั่นเอง 6 - 7 พ.ค. 2566 เวลา 10.00 - 21.00 น. อุทยานศิลปะวัฒนธรรมแม่ฟ้าหลวง (ไร่แม่ฟ้าหลวง) อำเภอเมืองเชียงราย จังหวัดเชียงราย
Thailand AeroPress Championship 2023 by The Coffee Calling
Thailand AeroPress Championship 2023 by The Coffee Calling spreads the competition to 6 regions before the championship in Bangkok, namely Isaan, Western, Southern, Northern, Central and Eastern. To determine the best coffee representatives, 6 people from each region, a total of 36 people, come to compete at the national level (National) to find only 1 winner again in Bangkok.
Representative provinces and co-hosts (Co-hosts) of the Regional Thailand AeroPress Championship 2023 in all 6 regions are as follows:
21 - 28 พ.ค.66 FORESTA COFFEE เทศกาลของคนรักกาแฟ เซ็นทรัล พระราม 9
เทศกาลของคนรักกาแฟ ในบรรยากาศธรรมชาติใจกลางเมือง ที่งาน "FORESTA COFFEE" สัมผัสความหอมกรุ่นของเมล็ดกาแฟแท้ๆ หลากหลายพันธุ์จากทั่วไทยและทั่วโลก อร่อยกับเมนูกาแฟแก้วโปรดจากคาเฟ่ร้านดัง โรงคั่วกาแฟต้นตำรับ และกาแฟท้องถิ่นกว่า 40 ร้าน พร้อมชมความน่ารักของเหล่าสัตว์สายพันธุ์ป่า ที่ "Mini Zoo Cafe" จาก BlueGold Coffee ได้ตลอดทั้งวัน 21 - 28 พฤษภาคม 2566 ลาน Work & Play ชั้น 1 ศูนย์การค้าเซ็นทรัล พระราม 9
Phitsanulok Coffee & Bakery Fest 2023 วันที่ 16 - 20 มิย. 2566
Phitsanulok Coffee & Bakery Fest 2023 งานมหกรรมกาแฟและเบเกอรี่ ครั้งที่ 2 ในภาคเหนือตอนล่าง วันที่ 16 - 20 มิย. 2566 ณ เซ็นทรัลพิษณุโลก ไฮไลท์ภายในงาน พบกับ King Of Latte Art ดีกรีแชมป์ระดับโลก พร้อมกิจกรรมต่างๆ ไม่ว่าจะเป็นการแข่งขันบาริสต้า กิจกรรม Work Shop เสริมองค์ความรู้จากผู้เชี่ยวชาญและเหล่าคนดังในวงการกาแฟ พร้อมเปิดให้ชิมกาแฟพันธุ์หายากและมินิคอนเสิร์ตจากศิลปินและบูธร้านกาแฟมีชื่อ อาทิ Caffa Maker
งาน Coffee Cation X Surf Edition 2-5 มิถุนายน 2566 LINK
กิจกรรมงานสุดปังของคนรักกาแฟ Coffee Cation X Surf Edition 2-5 มิถุนายน 2566 ณ Laybay Khaolak AT La Vela Khaolak อีกงานกาแฟในภาคใต้ ที่คอกาแฟรอคอย กิจกรรมเด็ดในงาน ✅️Public Cupping & Robusta Green Coffee Community ✅️Leva Contest Speed ✅️Speed Sufskate ✅️Coffee Community และอีกเพียบที่จะทยอยเปิดเผยในอีกไม่ช้า ติดตามข้อมูลกิจกรรมและช่องทางการสมัครได้ที่เพจ LA VELA KHAOLAK โทร.076-428555
24-25 มิย.66 งานกาแฟนครสวรรค์ NakhonSawan Coffee Season : Artist Market LINK
NakhonSawan Coffee Season : Artist Market งานกาแฟนครสวรรค์ 24-25 มิย.66 นี้ 9.00 น.-20.00 น. พบกันที่ ภูทองโกลเด้นปาร์คฮิล
"นครสวรรค์ จะกลายเป็นสวรรค์ของคนรักกาแฟ "
งานกาแฟ การแข่งขันดริปกาแฟระดับประเทศ กิจกรรม และ Workshop จาก อาจารย์ และ เซเล็บในวงการกาแฟหลากหลายท่าน กิจกรรมงานคราฟ และสินค้าจากศิลปินท้องถิ่น งานออกร้านจากร้านค้า ร้านกาแฟใน นครสวรรค์ และ จังหวัดใกล้เคียง รวมถึงร้านกาแฟ และโรงคั่วชื่อดังจากทั่วประเทศไทย บูทโกโก้ ชา อาหาร ขนมไทย ของฝากมากมาย พบเกษตรกรต้นน้ำ นำกาแฟโปรเสทพิเศษใหม่ๆมาให้เลือกซื้อเลือกชิม [
facebook]
21 - 25 มิ.ย. 2566 Coffee or Tea @Future Park LINK
Coffee or Tea @Future Park งานกาแฟปังสุดในย่าน รังสิต ปทุมธานี รวมที่สุดของกาแฟ ชา จากสุดยอดแชมป์ระดับประเทศ ฟินกันทุกแก้ว อินได้ทั้งวัน เอ็นจอยกับร้านกาแฟกว่า 50 ร้านที่มาร่วมในงาน วันที่ 21 - 25 มิ.ย. 2566 ณ ชั้น G ลานกิจกรรม cascata และข้างลานฝั่งโรบินสัน, เซ็นทรัล ศูนย์การค้าฟิวเจอร์พาร์ค
13 - 16 ก.ค. 2566 Thailand Coffee Fest 2023 LINK
Thailand Coffee Fest 2023 : Good Coffee for Everyone - งานมหกรรมกาแฟที่ใหญ่ที่สุดในเอเชีย ปีนี้ วันที่ 13 - 16 ก.ค. 2566 ณ อิมแพ็ค เอ็กซิบิชั่น เซ็นเตอร์ ฮอลล์ เมืองทองธานี เวลา 10.00 น. - 20.00 น. [
facebook]
งานปีนี้มาพร้อมความยิ่งใหญ่กว่าทุกปี บนพื้นที่จัดแสดง 4 ฮอลล์ รวม 20,000 ตร.ม. พบกับกิจกรรมไฮไลต์มากมาย รวบรวมกว่า 300 ร้านค้าที่เกี่ยวข้องในวงการกาแฟ งานนี้จึงเป็นเหมือนจุดเชื่อมโยงที่ทำให้ทุกแวดวงรอบอุตสาหกรรมกาแฟได้มาพบกัน สร้างความเป็นปึกแผ่นของวัฒนธรรมกาแฟให้แน่นแฟ้นยิ่งกว่าเดิม
เช็คชื่อแบรนด์ ร้านค้า และ ผู้ประกอบการที่ร่วมในงานนี้ได้แล้ว23-26 ส.ค. 66 Coffee & Bakery Thailand LINK
Coffee & Bakery Thailand 23-26 August 2023 at Queen Sirikit National Convention Center (QSNCC)
Held concurrently with FHT, Coffee & Bakery Thailand (CBT) is a stage for coffee and bakery businesses to discover solutions to make distinctive points in this exciting market. It is where decision makers can meet the most extensive line-up of leading coffee & tea, bread, cakes, pastries and confectionery suppliers. With its showcase of fresh new products and connection with professionals, this premium platform will help expand the coffee and bakery industry and make this fascinating business more flavorful than ever.
10-13 ส.ค. 66 Hua Hin Coffee Fest 2023 LINK
10-13 สิงหาคม ชวนเพื่อนๆเที่ยวงานกาแฟ Hua Hin Coffee Fest 2023 ครั้งแรกของหัวหิน ที่จัดเต็ม ทั้งความสนุกและความรู้ เกี่ยวกับกาแฟมาไว้ที่เดียวกัน กิจกรรมเด่นๆในงานนี้
1. ร่วมเชียร์การแข่งขันดริปเย็น ที่จัดขึ้นครั้งแรกในประเทศไทย
“Drip Yenn Championship Thailand 2023” ในวันเสาร์ และ วันอาทิตย์ที่ 12-13 ส.ค. 66 โดยผู้ร่วมงานจะได้ร่วมตัดสิน แชมป์ดริปเย็น คนแรกของประเทศไทย
2. เพลิดเพลินกับงานออกบูธจากร้านค้า ร้านกาแฟใน หัวหิน และ จังหวัดใกล้เคียง รวมถึงร้านกาแฟ และโรงคั่วชื่อดังจากทั่วประเทศไทย นำทีมโดย CAFFA , Jason Roaster บูธโกโก้ ชา เบเกอรี่ อุปกรณ์กาแฟ ของฝากมากมาย พบเกษตรกรต้นน้ำที่จะนำกาแฟพิเศษหลากหลายโพรเซสมาให้เลือกซื้อเลือกชิม
3. ร่วมกิจกรรม และ workshop จาก แชมป์คนดัง เสวนากาแฟกับ อาจารย์ และ เซเลบในวงการกาแฟหลากหลายท่าน อย่างใกล้ชิด ในบรรยากาศสบายๆ ที่เป็นกันเอง
สถานที่จัดงาน ปลีกวิเวกคาเฟ่ หัวหิน [
พิกัด] และติดตามกิจกรรมในงานได้ที่เพจ
25-31 ส.ค. 66 Thailand Coffee Hub 2023 เทศกาลกาแฟที่ใหญ่ที่สุดในภาคใต้
เทศกาลกาแฟที่ใหญ่ที่สุดในภาคใต้ Thailand Coffee Hub 2023 ลานโปรโมชั่น ชั้น 1 เซ็นทรัล หาดใหญ่ Hubคนรักกาแฟภาคใต้ คอกาแฟตัวจริงห้ามพลาด! รวมร้าน Specialty Coffee ชื่อดังจากกทม. และทั่วภาคใต้ ชิมฟรี ! กาแฟระดับเทพทั้งอาราบิก้า และ Fine Robusta ช้อปอุปกรณ์กาแฟชั้นนำ กระทบไหล่แชมป์บาริสต้ากับซิกเนเจอร์เมนูที่ห้ามพลาด รวมคราฟต์โกโก้จากทั่วไทย และร่วมเฟ้นหาสุดยอดบาริสต้าในการแข่งขันชงกาแฟระดับประเทศ
23-26 ส.ค. 66 Food & Hospitality Thailand 2023
งานแสดงสินค้าด้านอาหารและการบริการ ด้านโรงแรม ร้านอาหาร บาร์ ร้านกาแฟ และธุรกิจบริการ ครบจบที่เดียว! ตอบโจทย์อุตสาหกรรมอาหารและการบริการ งานใหญ่และครบวงจรที่สุดในประเทศ ที่คนในวงการไม่ควรพลาด! วันที่ 23 - 26 สิงหาคม 2566 10.00-18.00น. ฮอลล์ 1-3 ชั้น G ศูนย์ฯสิริกิติ์ กรุงเทพฯ
27 ส.ค. - 4 ก.ย. 66 งาน Ubon Coff Caff เซ็นทรัล อุบล
สายกาแฟห้ามพลาด ! กับงานกาแฟของชาวอุบล ที่ยกร้านกาแฟสุดชิคจากเมืองอุบลราชธานีและทั่วประเทศมารวมกันในงาน "Ubon Coff Caff" ที่เซ็นทรัล อุบล วันที่ 27 ส.ค. - 4 ก.ย. 66 ที่ ลานลูกยางลิ่วลม ชั้น 1 ศูนย์การค้าเซ็นทรัล อุบล
10 – 20 ส.ค. 66 งาน Brew Feels Good @Seacon Square Hall
ฟีลกู๊ดเติมเต็มช่วงเวลาแห่งความสุข The Anatomy of Happiness สารสร้างสุข : Dopamine ฮอร์โมนฟีลกู๊ด งาน Brew Feels Good 10 – 20 ส.ค. 66 Seacon Square Hall
13 ส.ค. 66 Phatthalung coffee Craft Music2023
PCA สมาคมกาแฟพัทลุง ขอเชิญร่วมดื่มกาแฟยามเช้า ชมบรรยากาศพระอาทิตย์ขึ้นก่อนใครในพัทลุง ที่ปากประ ชื่องาน Phatthalung Morning Drip #1 วันที่ 13 ส.ค. 66 เวลา 06.00-08.00 น. ณ เรือนไม้ชายเล ปากประ กิจกรรมในงาน น่าสนใจ อาทิ -ดื่มกาแฟ หลากหลาย แหล่งทั่วโลก
-ดื่มดำบรรยากาศยามเช้า -พูดคุยเเลกเปลี่ยน เรื่องกาแฟ ๆลๆ -ผู้สนใจเข้าร่วมกิจกรรม ฟรี หรือร่วมสนับสนุน Tip box เมล็ดกาแฟ ไว้ครั้งต่อไป ก็ยินดี
Special Guest
-แชมป์ ดริป Socof 2023,แชมป์ ดริป Khanom Coffee Fest 2022
-รองเเชมป์ ดริป Thailand Brewer League#Khanom 2023
-รองเเชมป์ ดริป PCCm
Thailand National Latte Art Championships 2023
การแข่งขัน เวทีที่ยิ่งใหญ่ 2 รายการ Thailand National Latte Art Championship 2023 ????????Thailand National Coffee In Good Spirits Championship 2023 จัดภายในงาน FHT 2023 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์ ในระหว่างวันที่ 23-26 สิงหาคม 2566 บริเวณ Hall 3
งาน ฅน..คอกาแฟ น่านเมืองแห่งกาแฟ 27 – 28 สิงหาคม 65
ขอเชิญรวมพลคนกาแฟ ในงาน “ฅน..คอกาแฟ
#น่านเมืองแห่งกาแฟ” 27 – 28 สิงหาคม 2565 ณ ลานต่อสุข เฮือนฮังต่อ อ.เมือง จ.น่าน ลองลิ้มชมรสกาแฟน่าน จากแหล่งปลูกชื่อดัง อาทิ มณีพฤกษ์, ห้วยขาบ, ห้วยโทน แลกเปลี่ยนเรียนรู้ เสวนากาแฟ Cupping คุณภาพกาแฟ ร่วมสร้างสรรค์เมนูจากกาแฟ, การแข่งขันดริปกาแฟ และเลือกซื้อผลิตภัณฑ์กาแฟจากแหล่งปลูกที่ได้รับรางวัลจากการประกวดกาแฟระดับประเทศมากมาย ในบรรยากาศสบายๆ สไตล์แคมป์ปิ้ง
1-10 ก.ย. 66 เทศกาลงานกาแฟ ICONIC CRAFT COFFEE FEST 2023
เทศกาลงานกาแฟครั้งยิ่งใหญ่แห่งปี เริ่มต้นขึ้นแล้ว ICONIC CRAFT COFFEE FEST 2023
เทศกาลงานกาแฟครั้งยิ่งใหญ่แห่งปีเริ่มต้นขึ้นแล้ว "ICONIC CRAFT COFFEE FEST 2023" ชวนคนรักกาแฟมาเปิดประสบการณ์การดื่มกาแฟที่ครบครันที่สุด ที่ไอคอนสยามได้รวบรวมเหล่าบาริสต้าระดับโลก มาพร้อมกับเมนูกาแฟกว่า 1,500 เมนูจากคาเฟ่แบรนด์ดังกว่า 100 แบรนด์และเมล็ดกาแฟจากทั่วประเทศมากที่สุด ให้เหล่าคอฟฟี่เลิฟเวอร์ได้ลิ้มรสชาติกาแฟแบบจัดเต็ม และพบกับกิจกรรมมากมายภายในงาน ตั้งแต่วันที่ 1 – 10 ก.ย. 66 นี้
ภายในงานแบ่งเป็นโซนสำหรับคอกาแฟที่หลากหลาย ไม่ว่าจะเป็น
Specialty Coffee Brand รวมสุดยอดเมนูกาแฟ ชา ช็อคโกแลต และของหวานมากกว่า 1,500 รายการ จากร้านค้ากว่า 100 แบรนด์ดัง ที่เจริญนคร ฮอลล์ ชั้น M ไอคอนสยาม และ Event Space ชั้น M ไอซีเอส ให้คุณได้เพลิดเพลินกับ “ The World of Beans” โลกของคนรักกาแฟ พบกับร้านกาแฟ Specialty Coffee Brand ชื่อดัง อาทิ Roast8ry, ASAMA Coffee & Roastery, Fika&Co. Cafe และ ROAST RUNNER และคาเฟ่สุดฮิปชื่อดังอีกมากมาย
Coffee Hunter Workshop แหล่งรวมอุปกรณ์ทำกาแฟเอาใจสายแคมป์ปิ้งจากสยาม ทาคาชิมายะ และยังมีเวิร์กช็อปทำกาแฟ ให้กับคนรักกาแฟ พร้อมเปิดรับสมัครผู้ที่สนใจหลักสูตรการเป็นบาริสต้าอาชีพ โดยกรุงเทพมหานคร ที่รัษฎา ฮอลล์ ชั้น 1
Coffee Truck & Coffee Prince สายคาเฟ่ฮ็อปเปอร์ต้องห้ามพลาด กับขบวน Food Truck กาแฟ และของหวาน นั่งจิบกาแฟริมน้ำ พร้อมกิจกรรมสุดเอ็กซ์คลูซีฟกับ 6 หนุ่มหล่อ ที่ ริเวอร์ พาร์ค ชั้น G ไม่ว่าจะเป็น แมน-ธฤษณุ สรนันท์ และ เบน-บัญญพนต์ ลิขิตอำนวยพร, แมน-ธฤษณุ สรนันท์ และ เบน-บัญญพนต์ ลิขิตอำนวยพร,และหนุ่มฮอต พอร์ช-ศรัณย์ ศิริลักษณ์
Exclusive Menu Only at ICONSIAM พบกับเมนูสุดพิเศษจากร้านดังในไอคอนสยามและไอซีเอส ที่มีขายเฉพาะในงานนี้เท่านั้น ไม่ว่าจะเป็น Double Slash, James Boulangerie, Kokolatier, MIKKA, PACAMARA COFFEE ROASTERS , Rep Coffee, UCC สำหรับโซนนี้พบกับเมนูสุดเอ็กซ์คลูซีฟที่มีให้เลือกชิมกันอย่างละลานตา อาทิ Tiramisu Soft Serve และ Tiramisu Croissant จากร้าน James Boulangerie รวมถึงเมนูใหม่ล่าสุด Espresso Praline ซึ่งเปิดตัวในงานนี้เป็นที่แรก
1-10 ก.ย. 66 COFFEE & BAKERY LOVER เทศกาลจิบกาแฟ ชิมเบเกอรี่ เทอร์มินอล21 พระราม3
งาน COFFEE & BAKERY LOVER เทศกาลจิบกาแฟ ชิมเบเกอรี่ สัมผัสกลิ่นหอม พร้อมดื่มด่ำความอร่อย ไปกับร้านกาแฟชื่อดัง RED DIAMOND รวมคาเฟ่เบเกอรี่กว่า 20 ร้านค้า ที่เทอร์มินอล21 พระราม3 พิเศษ! วันที่ 1 ก.ย. พบกับโชว์ดริปกาแฟ โดยบาริสต้ามากความสามารถ NICOLAS HAW โปรโมชั่นห้ามพลาด รับทันที! สิทธิ์จับรางวัลพิเศษ เมื่อช้อปสินค้าภายในศูนย์รวม 1,000 บาทขึ้น *จำกัดจำนวน (สูงสุด 2 สิทธิ์/วัน/คน) 1-10 ก.ย. 66 เทอร์มินอล21 พระราม3
กินทุเรียนกันให้โกลด์ฟิงเกอร์ 2 by Greyhound Café 18 - 23 เมษายน 2566 LINK
กินทุเรียนกันให้โกลด์ฟิงเกอร์ 2 by Greyhound Café ( KIN DURIAN GUN HAI GOLD FINGER 2) กิจกรรมกินทุเรียนบุฟเฟต์สุดล้ำ กินกันให้ “นิ้วเป็นสีทอง” เราคัดสรรทุเรียนพันธุ์ดี และเกรดที่ดีที่สุด จากสวนทุเรียนคุณภาพส่งออก ไม่ว่าจะเป็น หมอนทอง, ก้านยาว, พวงมณี, และ สายพันธ์ุหายากให้กินกันแบบไม่อั้น ท่ามกลางบรรยากาศสุด Exclusive สไตล์เกรฮาวด์ พร้อมสินค้าที่ระลึกสุดคูล และกิจกรรมภายในงานอีกมากมาย พร้อมกินทุเรียนกันให้ “นิ้วเป็นสีทอง” ริมแม่น้ำเจ้าพระยาที่ The River Park (ICONSIMA) (โซน Outdoor) วันที่ 18 เมษายน 2566 - วันที่ 23 เมษายน 2566 ราคา 1,290 บาทต่อท่าน (ราคานี้ยังไม่รวม 7%Vat) เริ่มจำหน่ายบัตรตั้งแต่วันที่ 1 เมษายน 2566 แล้วพบกันชาวนิ้วทอง!
ทุเรียนบุฟเฟต์ เทศกาล Tropical Fruit Parade 2023 @GOURMET MARKET LINK
ทุเรียนบุฟเฟต์ เทศกาล Tropical Fruit Parade 2023 ของ GOURMET MARKET อิ่มสุดคุ้มกินได้ไม่อั้น ราคา 559.- เปิดจองบัตรวันที่ 10 เม.ย. 66 - 19 เม.ย. 66 เริ่มบุฟเฟต์วันที่ 26 เม.ย. 66 - 3 พ.ค. 66 เฉพาะที่ พาร์ค พารากอน ศูนย์การค้าสยามพารากอน เท่านั้น *เงื่อนไขเป็นไปตามที่บริษัทกำหนด / ติดต่อสอบถามรายละเอียดเพิ่มเติมได้ที่เบอร์ 02-2391234
เทศบาลเมืองบางแม่นาง ทำหมันสุนัขและแมว ฟรี 20 กรกฎาคม 66
เทศบาลเมืองบางแม่นาง ร่วมกับปศุสัตว์จังหวัดนนทบุรี ขอเชิญท่านเจ้าของสัตว์ที่มีรายชื่อตามทะเบียนบ้านในเขตเทศบาลเมืองบางแม่นาง นำสุนัขและแมว ทำหมันฟรี จำกัดจำนวน 80 ตัว ลงทะเบียนล่วงหน้า 50 ตัว walk in 30 ตัว วันพฤหัสบดีที่ 20 กรกฎาคม 2566 เวลา 8.30-12.00 น. ณ โดมอเนกประสงค์ สอบถาม/ลงทะเบียน โทร. 02-1918911 ต่อ 116 กองสาธารณสุขและสิ่งแวดล้อม
ตารางบริการ ปี 2563
มิถุนายน 2563 ดังนี้
วันจันทร์ที่ 1 มิถุนายน 2563 ณ ชุมชนกระบก 33
วันศุกร์ที่ 5 มิถุนายน 2563 ณ วัดธรรมสามัคคี
วันจันทร์ที่ 8 มิถุนายน 2563 ณ ชุมชนวัดธรรมสามัคคี
วันพุธที่ 10 มิถุนายน 2563 ณ ชุมชนพัทยาเหนือ
วันศุกร์ที่ 12 มิถุนายน 2563 ณ ชุมชนรุ่งเรือง
วันจันทร์ที่ 15 มิถุนายน 2563 ณ ชุมชนซอย 5 ธันวา
วันที่พุธที่ 17 มิถุนายน 2563 ณ ชุมชนเจริญสุขพัฒนา
วันศุกร์ที่ 19 มิถุนายน 2563 ณ ชุมชนเพนียดช้าง
วันจันทร์ที่ 22 มิถุนายน 2563 ณ สำนักสงฆ์หนองอ้อ
วันพุธที่ 24 มิถุนายน 2563 ณ ชุมชนชุมสาย
วันศุกร์ที่ 26 มิถุนายน 2563 ณ ชุมชนซอยบงกช
วันจันทร์ที่ 29 มิถุนายน 2563 ณ ชุมชนอรุโณทัย
ข้อมูลสำคัญเกี่ยวกับโควิด-19 ที่ต้องรู้
ใครมีสิทธ์ตรวจหาเชื้อโควิด-19 ฟรี มีประวัติเสี่ยงอย่างใดอย่างหนึ่งในช่วง 14 วัน ก่อนมีอาการ (ทั้งนี้ขึ้นอยู่กับดุลพินิจของแพทย์) ดังนี้
1. เดินทางมาจากเขตติดโรค/พื้นที่ที่มีการระบาดต่อเนื่อง
2. ประกอบอาชีพที่สัมผัสใกล้ชิดกับผู้ที่เดินทางมาจากเขตติดโรค/พื้นที่ที่มีการระบาดต่อเนื่อง
3. สัมผัสใกล้ชิดกับผู้ป่วยสงสัย/ผู้ป่วยยืนยัน
4. เป็นบุคลากรทางการแพทย์ที่สัมผัสกับผู้ป่วยยืนยัน
อาการที่เข้าข่ายโควิด -19 มีอาการอย่างไร
ไอ, น้ำมูก, เจ็บคอ, หายใจเหนื่อยหอบ, จมูกไม่ได้กลิ่น ลิ้นไม่รับรส
สามารถเข้ารับการตรวจรักษาโควิด -19 ได้ที่ไหน
โรงพยาบาลตามสิทธิ์ (บัตรทอง ประกันสังคม ราชการ) หรือสอบถามข้อมูลสิทธิการรักษาเพิ่มเติมที่ สายด่วน สปสช. โทร 1330
ความเสี่ยงของผู้สัมผัสผู้ติดเชื้อโควิด–19 แบ่งความเสี่ยงเป็นกี่ระดับ
ความเสี่ยงของผู้สัมผัสผู้ติดเชื้อโควิด – 19 แบ่งความเสี่ยงเป็น 3 ระดับ ได้แก่
1. ผู้สัมผัสเสี่ยงสูง คือ ผู้ใกล้ชิดผู้ป่วย
2. ผู้สัมผัสเสี่ยงต่ำ คือ ผู้ใกล้ชิดผู้สัมผัสเสี่ยงสูง
3. ไม่มีความเสี่ยง คือ ผู้ใกล้ชิดผู้สัมผัสเสี่ยงต่ำ
ผู้สัมผู้ติดเชื้อโควิด–19 ต้องปฏิบัติอย่างไร
1. ผู้สัมผัสเสี่ยงสูง คือ ผู้ใกล้ชิดผู้ป่วย ต้องเข้ารับการกักกันโรค และเข้ารับการตรวจหาเชื้อจากการตรวจทางห้องปฏิบัติการ
2. ผู้สัมผัสเสี่ยงต่ำ คือ ผู้ใกล้ชิดผู้สัมผัสเสี่ยงสูง ให้สังเกตอาการตนเอง หลีกเลี่ยงไปในที่ชุมชน และสวมหน้ากากอนามัย
3. ไม่มีความเสี่ยง คือ ผู้ใกล้ชิดผู้สัมผัสเสี่ยงต่ำ ไม่ต้องกักตัว และไม่ต้องตรวจทางห้องปฎิบัติการ
สภากาชาดไทย จึงขอเชิญชวนร่วมให้การสนับสนุนการช่วยเหลือผู้ประสบอุทกภัยในพื้นที่ อำเภอแม่สาย
กิ่งกาชาดอำเภอแม่สาย จังหวัดเชียงราย ได้จัดตั้งโรงครัว ณ ที่ว่าการอำเภอแม่สาย เพื่อเตรียมอาหารและน้ำดื่ม ให้กับประชาชนผู้ได้รับความเดือดร้อน ในพื้นที่ประสบภัยน้ำท่วมและเจ้าหน้าที่จากหน่วยงานต่างๆ ผู้ปฏิบัติงานช่วยเหลือประชาชน
สภากาชาดไทย จึงขอเชิญชวนร่วมให้การสนับสนุนการช่วยเหลือผู้ประสบอุทกภัยในพื้นที่ #อำเภอแม่สาย ด้วยการบริจาค ข้าวสาร อาหารแห้ง น้ำดื่ม และวัตถุดิบ เพื่อประกอบอาหาร ได้ที่สำนักงานกิ่งกาชาดอำเภอแม่สาย
สอบถามรายละเอียดเพิ่มเติมได้ที่ กิ่งกาชาดอำเภอแม่สาย โทรศัพท์ 081 796 2095
มหากุศลทิ้งกระจาด มูลนิธิมิตรภาพสามัคคี (ท่งเซียเซี่ยงตึ๊ง) หาดใหญ่ ประจำปี 2565
มหากุศลทิ้งกระจาดประจำปี 2565 วันที่ 29 กรกฎาคม 2565 มูลนิธิมิตรภาพสามัคคี (ท่งเซียเซี่ยงตึ๊ง) หาดใหญ่ อ.หาดใหญ่ จ.สงขลา ได้มีการจัดงานมหากุศลทิ้งกระจาดประจำปี
โดยงานดังกล่าวได้จัดอย่างต่อเนื่องทุกๆ ปี เพื่อเป็นการแผ่ส่วนบุญส่วนกุศล โดยภายในงานจะมีการจัดเครื่องเซ่นสังเวยดวงวิญญาณที่ไร้ญาติที่ล่องลอยอยู่ตามสถานที่ต่างๆ ให้ได้รับผลบุญ เพื่อที่จะได้ไปสู่สุคติภพ
นอกจากนั้นในวันนี้ ซึ่งเป็นวันสุดท้ายของงาน ยังได้มีการจัดพิธีทิ้งกระจาดโปรยทานให้แก่ผู้ยากไร้ ยากจน และด้อยโอกาส โดยมี นายเจษฎาพงศ์ ชูแก้ว รองนายกเทศมนตรีนครหาดใหญ่ เป็นประธาน พร้อมด้วย สมาชิกสภาฯ นายอรุณชัย ศิริมหาชัย ประธานกรรมการมูลนิธิมิตรภาพสามัคคี(ท่งเซียเซี่ยงตึ๊ง)หาดใหญ่ คณะรองประธานกรรมการฯ คณะกรรมการฯ ร่วมในพิธีทิ้งกระจาดโปรยทาน ซึ่งสิ่งของที่มอบให้มีทั้งข้าวสาร อาหารแห้ง สิ่งของอุปโภคบริโภคที่จำเป็นในชีวิตประจำวัน ซึ่งมีผู้เดินทางเข้มาร่วมรับสิ่งของกันเป็นจำนวนมาก ส่วนใหญ่จะเป็นผู้ยากไร้ตามชุมชนหลายแห่งใน อ.หาดใหญ่
งานดังกล่าวถือว่าเป็นงานใหญ่ประจำปีที่จัดต่อเนื่องมาอย่างยาวนาน ซึ่งนอกจากจะเป็นสิริมงคลให้กับเมืองหาดใหญ่แล้ว ก็ยังเป็นการช่วยเหลือต่อชีวิตให้กับผู้ยากไร้ในสังคมได้เป็นจำนวนมากอีกด้วย
26 มิถุนายน 2567 กิจกรรมทำหมันให้กับสุนัขและแมว ในเขตเทศบาลเมืองสุรินทร์
เทศบาลเมืองสุรินทร์ ร่วมกับ ปศุสัตว์จังหวัดสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว ในเขตเทศบาลเมืองสุรินทร์ รับจำนวนจำกัด (จำกัด จำนวน 1 ตัว / บ้าน) วันที่ 26 มิถุนายน 2567 เวลา 08.30 น. เป็นต้นไป ณ วัดหนองบัว ... โดยเปิดรับลงทะเบียน ผ่าน QR code (เท่านั้น) วันที่ 24 มิถุนายน 2567 เวลา 09.00 น. เป็นต้นไป
งานประเพณีทิ้งกระจาดวัดพนัญเชิงวรวิหาร ประจำปี 2565 LINK
งานประเพณีทิ้งกระจาดวัดพนัญเชิงวรวิหาร ประจำปี 2565 พระเดชพระคุณ พระธรรมรัตนมงคล เจ้าอาวาสวัดพนัญเชิงฯ เป็นประธานฝ่ายสงฆ์ นางสาวนุชนาถ ประทีปธีรานันต์ รองผู้ว่าราชการจังหวัดพระนครศรีอยุธยา เป็นประธานฝ่ายฆราวาส พร้อมด้วยคณะศรัทธาสาธุชนผู้ใจบุญ มาร่วมแจกทานข้าวสารสิ่งของ และเผาหุ่นพญายมราช ในงานประเพณีทิ้งกระจาด ประจำปี 2565 ณ วัดพนัญเชิง วรวิหาร จังหวัดพระนครศรีอยุธยา วันที่ 26 สิงหาคม 2565
เทศบาลอุบลฯ ทำหมัน ฉีดวัคซีน ฟรี 2567
เทศบาลนครอุบลราชธานี ร่วมกับ กรมปศุสัตว์ และสำนักงานปศุสัตว จ.อุบลฯ บริการทำหมันสุนัขและแมว ฟรี เวลา 09.00-15.30 น.
- วันที่ 5 มิถุนายน 2557 ที่วัดท่าวังหิน
- วันที่ 6 มิถุนายน 2557 ที่วัดทุ่งศรีเมือง
บริการฉีดวัคซีนฟรี (อายุ 2 เดือนขึ้นไป)
- 5 มีนาคม 2567 ศูนย์บริการสาธารณสุขอยู่วงศ์ธรรม และ วัดทองนพคุณ ถ.สรรพสิทธิ์ เวลา 8-12:00 น.
- 9 เมษายน 2567 9-12.00 น. วัดนาควาย
- 10 เมษายน 2567 9-12.00 น. วัดป่าแสนอุดม
- 23 เมษายน 2567 9-12.00 น. วัดกุดคูณ
- 24 เมษายน 2567 9-12.00 น. วัดไชยมงคล
- 25 เมษายน 2567 9-12.00 น. วัดศรีอุบลรัตนาราม
- 30 เมษายน 2567 9-12.00 น. วัดสุปัฏนารามวรวิหาร
- 1 พฤษภาคม 2567 9-12.00 น. วัดทุ่งศรีเมือง
- 2 พฤษภาคม 2567 9-12.00 น. วัดกลาง
- 7 พฤษภาคม 2567 9-12.00 น. วัดท่าวังหิน
- 8 พฤษภาคม 2567 9-12.00 น. ศาลากลางบ้านวังสว่าง
สนับสนุนมูลนิธิกระจกเงา มูลนิธิไอแคร์ มอบอาหาร และน้ำดื่มสะอาด
เชียงรายกำลังเผชิญวิกฤตน้ำท่วมครั้งใหญ่ โดยเฉพาะ อ.แม่สาย อ.เทิง และ อ.เชียงของ บ้านเรือนเสียหาย ประชาชนจำนวนมากขาดแคลนอาหารและน้ำดื่ม อีกทั้งยังมีบางส่วนที่ติดอยู่ในพื้นที่ที่การคมนาคมถูกตัดขาด ขอเชิญชวนร่วมบริจาคเพื่อช่วยเหลือพี่น้องเชียงรายที่กำลังประสบกับน้ำท่วมหนัก ผ่าน 2 โครงการ
1. สนับสนุนมูลนิธิกระจกเงา
เพื่อช่วยแก้ไขปัญหาเฉพาะหน้า และฟื้นฟูชุมชนหลังน้ำลด
นำทีมโดย มูลนิธิกระจกเงา
2. มอบอาหาร และน้ำดื่มสะอาด
ทีมจากแม่ฮ่องสอนย้ายมาช่วยเชียงราย นำชุดยังชีพไปช่วยเหลือผู้ประสบภัย
นำทีมโดย มูลนิธิไอแคร์ ประเทศไทย
ทุกการบริจาคของคุณจะช่วยเหลือผู้ที่กำลังเดือดร้อนอย่างเร่งด่วน
ประเพณีทิ้งกระจาด (ซีโกว) อำเภอวารินชำราบ อุบลราชธานี ประจำปี 2565
มูลนิธิการกุศลสมัคคีสว่างบูชาธรรมสถาน อำเภอวารินชำราบ จังหวัดอุบลราชธานี จัดงาน ประเพณีทิ้งกระจาด (ซีโกว) ประจำปี 2565 ระหว่างวันที่ 29 - 31 กรกฎาคม 2565 เพื่ออุทิศส่วนกุศลให้กับบรรพบุรุษผู้ส่วงลับและวิญญาณไร้ญาติทั้งปวง ตามประเพณีที่เคยปฏิบัติมา
พิธีฉลองวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาด ประจำปี 2565 LINK
24 สิงหาคม 2565 ศาลเจ้าเล่งจูเกียง (ศาลเจ้าแม่ลิ้มกอเหนี่ยว) อำเภอเมืองปัตตานี จัดพิธีฉลองวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาด ประจำปี 2565 เพื่อเป็นการน้อมรำลึกถึงความกตัญญูขององค์เจ้าแม่ลิ้มกอเหนี่ยว และร่วมทำบุญให้ทาน การบริจาคข้าวสารน้ำตาลทรายเพื่อถวายให้กับวัด โรงเรียน หน่วยงานที่ช่วยสาธารณประโยชน์ ให้กับสังคมที่ขาดแคลนและผู้ยากไร้ในจังหวัดปัตตานีด้วย
สำหรับงานฉลองวันเกิดเจ้าแม่ลิ้มกอเหนี่ยว และประเพณีทำบุญเทกระจาด ประจำปี 2565 นี้ จัดขึ้นในระหว่างวันที่ 21-27 สิงหาคม 2565 โดยในวันนี้ได้มีพิธีเจริญพระพุทธมนต์ มอบทุนการศึกษาเพื่อช่วยเหลือนักเรียน นักศึกษาที่มีผลการเรียนดี แต่ขาดแคลนทุนทรัพย์แก่มูลนิธิโรงพยาบาลสงขลานครินทร์ โรงเรียนเมืองปัตตานี และสถานสงเคราะห์เด็กปัตตานี พิธีไหว้สักการะเทวดาฟ้าดิน ไหว้สักการะองค์เจ้าแม่ลิ้มกอเหนี่ยวและองค์พระต่างๆในศาลเจ้าเล่งจูเกียง นอกจากนี้ในวันที่ 25 สิงหาคม 2565 จะมีกิจกรรมมอบข้าวสาร เพื่อเป็นวัตถุดิบอาหารกลางวันแก่นักเรียนในโรงเรียนที่ขาดแคลนและหน่วยงานต่างๆที่ช่วยเหลือสาธารณประโยชน์ให้กับสังคมในถิ่นทุรกันดาร และวันที่ 26 สิงหาคม2565 จะเป็นประเพณีทำบุญเทกระจาด บริจาคมอบเครื่องอุปโภคบริโภคแก่ผู้ยากไร้โดยเท่าเทียมกันทุกศาสนิก โดยไม่มีการแบ่งเชื้อชาติ ศาสนาใดๆ
มูลนิธิป่อเต็กตึ๊ง ลงพื้นที่จังหวัดนครราชสีมา แจกจ่ายชุดข้าวสารพร้อมเครื่องอุปโภคบริโภค
8 สิงหาคม 2565 มูลนิธิป่อเต็กตึ๊ง โดย นายวิเชียร เตชะไพบูลย์ ประธานกรรมการ มอบหมายให้ นางศิริพร กระจ่างหล้า ผู้จัดฝ่ายสังคมสงเคราะห์ จัดทีมเจ้าหน้าที่ และอาสาสมัคร นำโดย นายรัชพร ประสงค์ทรัพย์ รักษาการหัวหน้าแผนกสาธารณภัย พร้อมด้วย นางสาวศุภรัตน์ สมบัติเจริญไทย รักษาการหัวหน้าแผนกส่งเสริมการศึกษาและอาชีพ ลงพื้นที่จังหวัดนครราชสีมา แจกจ่ายชุดข้าวสารพร้อมเครื่องอุปโภคบริโภค ประกอบด้วย ข้าวสาร บะหมี่กึ่งสำเร็จรูป ปลากระป๋อง น้ำมันพืช น้ำปลา บรรจุกระเป๋าผ้าดิบมูลนิธิฯ แก่ผู้ขาดแคลนในพื้นที่อำเภอเมือง อำเภอสูงเนิน อำเภอปากช่อง และอำเภอสีคิ้ว จังหวัดนครราชสีมา รวม 4 อำเภอ ชุดข้าวสารจำนวน 2,000 ชุด รวมงบประมาณทั้งสิ้น 700,000 บาทโดยมี ผู้แทนหน่วยงานรัฐ เป็นประธานในพิธี พร้อมด้วย สมาคม/มูลนิธิแต่ละจังหวัด เป็นผู้ประสานงานและร่วมในพิธี รวมทั้งนายสัญญา พรนารายณ์ นายสดใส รุ่งโพธิ์ทอง นายสิริพงศ์ สุขสมนาค (กิ๊ฟ โคกคูน) อาสาสมัครศิลปินมูลนิธิป่อเต็กตึ๊ง ร่วมในพิธี26 มิถุนายน 2567 เทศบาลเมืองสุรินทร์ ทำหมันให้กับสุนัขและแมว
เทศบาลเมืองสุรินทร์ ร่วมกับ ปศุสัตว์จังหวัดสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว ในเขตเทศบาลเมืองสุรินทร์ รับจำนวนจำกัด (จำกัด จำนวน 1 ตัว / บ้าน) วันที่ 26 มิถุนายน 2567 เวลา 08.30 น. เป็นต้นไป ณ วัดหนองบัว ... โดยเปิดรับลงทะเบียน ผ่าน QR code (เท่านั้น) วันที่ 24 มิถุนายน 2567 เวลา 09.00 น. เป็นต้นไป
ตารางออกหน่วยทำผ่าตัด-หมัน ปศุสัตว์ศรีสะเกษ ฟรี
กลุ่มพัฒนาสุขภาพสัตว์
สำนักงานปศุสัตว์ จังหวัดศรีสะเกษ ตารางหน่วยเคลื่อนที่กิจกรรม พอ.สว. ออกหน่วยทำผ่าตัด-หมัน ตรวจรักษาเบื้องต้น ให้คำปรึกษาในการเลี้ยงดูแลสุขภาพสัตว์ ถ่ายพยาธิ ภายนอก-ภายใน สุนัข และแมว ฉีดวัคซีน ฟรี ปี 2567
- 9 พฤษภาคม 2567 วัดสระกำแพงน้อย อ.อุทุมพรพิสัย
- 21 พฤษภาคม 2567 ณ หอประชุมบึงระนาม อบต.กุดเสลา อ.กันทรลักษ์
- 6 มิถุนายน 2567 ณ องค์การบริหารส่วนตำบลด่าน อ.ราษีไศล
- 20 มิถุนายน 2567 ณ โรงเรียนบ้านกันตม ต.สังเม็ก อ.กันทรลักษ์
- 4 กรกฎาคม 2567 ณ ศาลาอเนกประสงค์วัดหลวงปู่หมุน ต.จาน อ.กันทรารมย์
- 18 กรกฎาคม 2567 ณ โรงเรียนบ้านละเอาะ ต.ละเอาะ อ.น้ำเกลี้ยง
- 19 กรกฎาคม 2567 ณ อบต.โพนข่า ต.โพนข่า อ.เมืองศรีสะเกษ
- 26 กรกฎาคม 2567 ณ อาคารอเนกประสงค์ อบต.ภูเงิน อ.กันทรลักษ์
- 15 สิงหาคม 2567ณ โรงเรียนบ้านคอนกาม หมู่ 7 ต.คอนกาม อ.ยางชุมน้อย
- 19 กันยายน ณโรงเรียนชุมชนบ้านหนองคู ต.เป๊าะ อ.บึงบูรพ์ ศรีสะเกษ
- 16 ตุลาคม โรงเรียนบ้านสามขา ต.กู่ อ.ปรางค์กู่
- 21 พฤศจิกายน โรงเรียนไพรธรรมคุณวิทยา หมู่ 2 ต.ไพร อ.ขุนหาญ
ผ่าตัดทำหมัน
- สุนัขและแมวต้องมีอายุ 6 เดือนขึ้นไป
- มีสุขภาพดี ไม่ตั้งท้อง
- งดน้ำ อย่างน้อย 4 ชั่วโมงก่อนผ่าตัด
- งดอาหาร อย่างน้อย 8 ชั่วโมงก่อนผ่าตัด
หมายเหตุ - ยอดลงทะเบียนสัตว์เพื่อผ่าตัด ทำหมัน จะกำหนดให้เหมาะสม กับเจ้าหน้าที่ผู้มาร่วมปฏิบัติงาน (อาจปิดลงทะเบียนก่อน 11:00 น) ติดต่อสอบถาม 045-612928
งานประเพณีทิ้งกระจาด ศาลเจ้าปุญเท่ากงเบี้ยว ระยอง ประจำปี 2565
13 ส.ค.65 ที่ศาลเจ้าปุญเท่ากงเบี้ยว ต.บ้านแลง อ.เมือง จ.ระยอง นายกำธร เวหน นายอำเภอเมืองระยอง เป็นประธานเปิดงานประเพณีทิ้งกระจาด ประจำปี 2565 กู้ภัยมูลนิธิสว่างพรกุศลระยอง พร้อมกับมีประชาชนแห่รับของแจก ของไหว้เจ้า และข้าวสาร อาหารแห้งเป็นจำนวนมาก ศาลเจ้าปุญเท่ากงเบี้ยวแห่งนี้ มีอายุมากกว่า 100 ปี ซึ่งคนไทยเชื้อสายจีนได้เคารพและศรัทธากราบไหว้ศาลแห่งนี้ และได้จัดงานประจำปีประเพณีทิ้งกระจาดทุกปี เพื่ออุทิศส่วนกุศลให้ผู้ที่เสียชีวิตไปแล้ว ให้ได้รับบุญกุศล และมอบข้าวสาร อาหารแห้งให้กับผู้ยากไร้ เพื่อให้นำไปใช้ในการดำรงชีวิตต่อไป งานประเพณีทิ้งกระจาด และแจกข้าวสาร ประจำปี 2565 สมาคมตังเอ็ง สว่างกตัญญูธรรมสถานจันทบุรี
3 ส.ค.65 งานประเพณีทิ้งกระจาด และแจกข้าวสาร ประจำปี 2565 โรงเรียนตังเอ็งจันทบุรี สมาคมตังเอ็ง สว่างกตัญญูธรรมสถานจันทบุรี จ.จันทบุรี ปีนี้ทางสมาคมตังเอ็ง-สว่างกตัญญูธรรมสถานจันทบุรี ได้จัดเตรียมข้าวสารที่ได้รับบริจาคจากผู้มีจิตศรัทธา และที่คณะกรรมการสมาคมร่วมกันบริจาค จำนวน 7,000 ถุงๆ ละ 5 กิโลกรัม มอบให้แก่ผู้ด้อยโอกาส ผู้ยากไร้เป็นการแบ่งเบาภาระค่าใช้จ่ายในครัวเรือน 1 ชีวิต 1 ถุง ภายใต้มาตรการป้องกันโควิด -19 ซึ่งผู้ร่วมงานทุกคนต้องผ่านการคัดกรองจากอาสาสมัครกู้ภัยสว่างกตัญญูและต้องเดินเข้ารับแบบเป็นระเบียบ สวมใส่หน้ากากอนามัยทุกคน
+++ จัดไปแล้ว +++
++ กิจกรรมที่ผ่านไป 2565 ++
++ กิจกรรมที่ผ่านไป 2566 ++
"ภูมิบุรี ศรีระยอง ครั้งที่ 16 งวันที่ 9-10 ธันวาคม 2565
ขอเชิญร่วมงาน "ภูมิบุรี ศรีระยอง ครั้งที่ 16" “ยลเมืองเก่า เล่าขานอดีต อิ่มสุข อุ่นรัก ณ ยมจินดา” รำลึกอดีตไปกับ อาหารพื้นเมืองระยอง การแสดงนักเรียน นิทรรศการเมืองระยอง การแข่งขันพูดจาภาษาถิ่นระยอง ระหว่างวันที่ 9-10 ธันวาคม 2565 ณ ถนนยมจินดา เมืองเก่าระยอง
++ กิจกรรมที่ผ่านไป 2566 ++
+++ งานที่ผ่านพ้นไปแล้ว +++
ติดตามข้อมูลจากแต่ละเพจ/เว็บไซต์ของผู้จัด //////////
กิจกรรมคุณแม่ตั้งครรภ์ที่ได้จัดไปแล้ว
//////////
สสส.จอมบึงมาราธอน (ครั้งที่ 36) วันอาทิตย์ที่ 15 ม.ค. 66 LINK
หลังจากเลื่อนมา 2 ปี สำหรับงาน สสส.จอมบึงมาราธอน (ครั้งที่ 36) ตั้งแต่ปี พ.ศ.2564 เป็นต้นมา เหตุมาจากสถานการณ์การแพร่ระบาดของโรคไวรัสโคโรนา 2019 (โควิค-19) มาบัดนี้ สถานการณ์ได้ผ่อนคลายลงแล้ว มหาวิทยาลัยราชภัฏหมู่บ้านจอมบึง โดยคณะกรรมการจัดงานฯ จึงได้กำหนดการจัดงาน สสส.จอมบึงมาราธอน (ครั้งที่ 36) ในวันที่ 15 มกราคม พ.ศ. 2566
ประเภทการแข่งขัน 42.195K / 21.1K / 10K
เปิดรับสมัครแบบ Charity Run รายได้หลังหักค่าใช้จ่ายมอบให้ชุมชน ในช่วงวันที่ 3-9 พ.ย. 2565 กดสมัครได้ที่
runningconnect.com/CBM20238 ม.ค.66 เขาอีโต้ เทรล 2023 ครั้งที่ 3 LINK
เขาอีโต้ เทรล ครั้งที่ 3
วันอาทิตย์ที่ 8 มกราคม 2566
ณ ป่านันทนาการเขาอีโต้ ป่าในเมืองเดิม อ. เมือง จ. ปราจีนบุรี
ระยะ 7 km / 17 km / 26 km
เปิดรับสมัคร ทางออนไลน์ วันที่ 30 สิงหาคม. 2565
เวลา 9.00.น.ถึง วันที่ 20 พฤศจิกายน 2565 เวลา 00.00น.
BURIRAM MARATHON 2023 - 21 ม.ค.66 LINK
“บุรีรัมย์ มาราธอน 2023 พรีเซ็นเต็ด บาย เครื่องดื่มตราช้าง” จัดแข่งขันในรูปแบบไนท์รัน ในวันที่ 21 มกราคม 2566 เปิดรับสมัครแล้วอย่างเป็นทางการ โดยแบ่งการแข่งขันเป็น 4 ระยะวิ่งได้แก่ มาราธอน ระยะทาง 42.195 ก.ม.ปล่อยตัวเวลา 18.30 น. เข้าเส้นชัยภายใน 02.00 น. (7.30 ชั่วโมง), ฮาล์ฟ มาราธอน ระยะทาง 21.1 ก.ม. ปล่อยตัวเวลา 20.00 น. เข้าเส้นชัยภายใน 00.30 น. (4.30 ชั่วโมง), มินิมาราธอน ระยะทาง 10 ก.ม. ปล่อยตัวเวลา 21.00 น. เข้าเส้นชัยภายใน 23.45 น. (2.45 ชั่วโมง) และ ฟันรัน ระยะทาง 4.554 ก.ม. ปล่อยตัวเวลา 21.45 น. เข้าเส้นชัยภายในเวลา 23.30 น. (1.45 ชั่วโมง) นอกจากนี้ยังมีการงานจัดงานเอ็กซ์โป เวลา 10.00-20.00 น. เอาใจนักวิ่งสายช้อปจากทั่วโลกด้วยสินค้ากีฬาและสุขภาพ
กิจกรรมเดิน - วิ่ง การกุศล สวนสุนันทาฮาล์ฟมาราธอน ครั้งที่ 3 วันที่ 29 ม.ค.66 LINK
กิจกรรมเดิน - วิ่ง การกุศลสมทบทุนการศึกษา สวนสุนันทาฮาล์ฟมาราธอน ครั้งที่ 3 วันที่ 29 มกราคม 2566 ณ มหาวิทยาลัยราชภัฏสวนสุนันทา สมัครได้ที่
ssrurun.com ตั้งแต่บัดนี้เป็นต้นไป
SSRU RUN3 มีหนึ่งเดียวเท่านั้น!!…นอกจากได้เสื้อ..ได้เหรียญ..ได้ชิงถ้วยรางวัลกว่าสองร้อยรางวัลแล้ว..ยังได้ทานอาหารชาววังต้นตำรับนำ้พริกลงเรือ..ได้ออกกำลังกาย..ได้บุญ..ได้เจอเพื่อนร่วมรุ่น ได้ชมบรรยากาศชาววัง..ได้ชมตำหนักสายสุธานภดล..ได้ชมบรรยากาศสองฝั่งแม่น้ำเจ้าพระยาบนสะพานประวัติศาสตร์(ซังฮี้)..ได้ชมการแสดงของนักศึกษา และยังมีกิจกรรมอีกมากมาย สิ่งสำคัญมีรางวัลแฟนซี 10 รางวัล..มีกองเชียร์จากนักศึกษาตลอดเส้นทางวิ่งในรั้ว
สอบถามรายละเอียดเพิ่มเติมได้ที่ กองพัฒนานักศึกษา มหาวิทยาลัยราชภัฏสวนสุนันทา โทร.081-3448226 และ 089-8872938 และ 02-1601352
งานนี้ ผู้ว่าฯ ชัชชาติ" ร่วมเดิน-วิ่งการกุศลสมทบทุนการศึกษา ด้วยนะ
เดิน-วิ่งการกุศล SJB FAMILY RUN 2023 สวนหลง ร.9 วันเสาร์ที่ 14 ม.ค.66 LINK
กลับมาอีกครั้งกับงาน เดิน-วิ่ง ของชาว SJB (สมาคมผู้ปกครองและครูโรงเรียนเซนต์โยเซฟบางนา) กับงาน เดิน-วิ่งการกุศล SJB FAMILY RUN 2023 โดยจะนำรายได้ไปปรับปรุงห้องคอมพิวเตอร์ให้กับโรงเรียนเซนต์โยเซฟ บางนา และสมทบกองทุนครูเกษียณ โรงเรียนเซนต์โยเซฟ บางนา และ เป็นการรณรงค์ส่งเสริมให้ทุกคน หันมาสนใจต่อการออกกำลังกาย
กำหนดวันวิ่ง : วันเสาร์ที่ 14 มกราคม 2566
สถานที่วิ่ง : สวนหลง ร.9
ประเภท Mini Marathon 10KM / Fun Run 5 KM / Fun Run 3 KM
ศรีมโหสถ มินิมาราธอน ปราจีนบุรี ครั้งที่ 2 วันที่ 29 ม.ค.66 LINK
“ศรีมโหสถ มินิมาราธอน ครั้งที่ 2” งานวิ่ง บนเส้นทางศักดิ์สิทธิ์ #เมืองโบราณทวารวดี ศรีมโหสถ เมืองโบราณยุคทวารวดี ที่มีอาณาบริเวณกว่า 700 ไร่ ที่ค้นพบ พระคเณศองค์ใหญ่และเก่าแก่ที่สุดในประเทศ โดยวิ่งเลาะเลียบ #คูเมืองโบราณที่ได้รับการบูรณะ และ #สระแก้ว สระน้ำศักดิ์สิทธิ์ ที่มีรูปสลักสัตว์มงคลรอบสระ ผ่านจุดที่เป็นโบราณสถานสำคัญ เหรียญและเสื้อวิ่งเป็นรูป “ลายมกร” หนึ่งในภาพสลักสัตว์มงคลจากสระแก้ว งานวิ่งที่จะทำให้ท่านรู้จัก #อำเภอศรีมโหสถ แหล่งอารยธรรมทวารวดีที่สำคัญแห่งภูมิภาคตะวันออก ของ จ.ปราจีนบุรี
วันที่ 29 มกราคม 2566 ณ โบราณสถานเมืองศรีมโหสถ อ.ศรีมโหสถ จ. ปราจีนบุรี แวะมาวิ่งแล้วแวะเยี่ยมชม #เมืองโบราณศรีมโหสถ #สระแก้ว #นั่งรถราง ช้อปผลิตภัณฑ์ของดีเมืองศรีมโหสถ แวะไหว้สิ่งศักดิ์สิทธิ์ #รอยพระพุทธบาทคู่ และ #ต้นพระศรีมหาโพธิ์ ที่เก่าแก่ที่สุดในประเทศ
Tiger Run By Maybank 2023 วันอาทิตย์ที่ 15 ม.ค.66
Tiger Run By Maybank 2023 วัน อาทิตย์ ที่ 15 มกราคม 2566 สถานที่จัดกิจกรรม สวนวชิรเบญจทัศ กรุงเทพฯ สมัครออนไลน์ได้ที่
RunlahDBD RUN 2023 กรมพัฒนาธุรกิจการค้า วันอาทิตย์ที่ 29 ม.ค.66
DBD RUN 2023 วัน อาทิตย์ ที่ 29 มกราคม 2566 สถานที่จัดกิจกรรม กรมพัฒนาธุรกิจการค้า กระทรวงพาณิชย์ จังหวัดนนทบุรี
Thonburi Run 2023 วันที่ 8 ม.ค.66 LINK
เครือรพ.ธนบุรี จัดวิ่ง Thonburi Run 2023 วันที่ 8 มกราคม 2566 @ลานกิจกรรมสะพานพระราม 8 เปิดรับสมัคร ถึง วันที่ 30พฤศจิกายน ระยะทาง 5Km. - 600บาท 10Km. - 600บาท
Brother Beat Cancer Run 2023 วิ่งด้วยกัน สู้ด้วยกัน 29 ม.ค.66 LINK
Brother Beat Cancer Run 2023 วิ่งด้วยกัน สู้ด้วยกัน
SAVE THE DATE ! 29 มกราคม 2566 ที่ สะพานพระราม 8 (ฝั่งอรุณอัมรินทร์)
บริษัท บราเดอร์ คอมเมอร์เชี่ยล (ประเทศไทย) จำกัด ร่วมกับโรงพยาบาลรามาธิบดี จัดวิ่งการกุศล Brother Beat Cancer Run 2023 วิ่งด้วยกัน สู้ด้วยกัน เส้นทางใต้สะพานพระราม 8 – คู่ขนานลอยฟ้าบรมราชชนนี 29 มกราคม 2566 เพื่อนำรายได้โดยไม่หักค่าใช้จ่าย ช่วยเหลือผู้ป่วยโรคมะเร็งที่ยากไร้ โดยผ่านมูลนิธิรามาธิบดีกองทุนมะเร็งโลหิตวิทยาผู้ใหญ่ โรงพยาบาลรามาธิบดี
กิจกรรม Brother Beat Cancer Run 2023 วิ่งด้วยกัน สู้ด้วยกัน ถือเป็นส่วนหนึ่งของกิจกรรมด้าน CSR ของบริษัทฯ เพื่อช่วยเหลือผู้ป่วยโรคมะเร็ง ที่ขาดแคลนทุนทรัพย์ในการรักษา ในโครงการของมูลนิธิรามาธิบดี กองทุนมะเร็งโลหิตวิทยาผู้ใหญ่โรงพยาบาลรามาธิบดี ภายใต้นโยบายการดำเนินกิจกรรมเพื่อชุมชนท้องถิ่น ซึ่งถือเป็นหนึ่งในปรัชญาการดำเนินธุรกิจตามพันธสัญญาสากล (Global Charter) ของกลุ่มบริษัทบราเดอร์ ภายใต้โครงการ “Golden Ring” ของบราเดอร์สำนักงานใหญ่ ประเทศญี่ปุ่น
2023 Taiwan Charity Run 29 ม.ค.66
2023 Taiwan Charity Run วิ่งวันที่ 29 มกราคม 2566 บริเวณ สวนหลวง ร 9 ประตูดาวเรือง - 4 ระยะทาง 5/10 กิโลเมตร เปิดรับสมัคร วันที่ 25 พฤศจิกายน 2565
สมาคมการค้าไทย-ไต้หวัน (TTBA) ก่อตั้งขึ้นเมื่อปี 1988 เพื่อตอบสนองนโยบายมุ่งใต้ใหม่ของรัฐบาล ปัจจุบันมีสถานประกอบการไต้หวันในประเทศไทยกว่า 5000 แห่ง ในโอกาสครบรอบ 30 ปีของการก่อตั้งสมาคม จึงได้จัดกิจกรรม เดิน-วิ่งการกุศล "2023 Taiwan Charity Run" ขึ้น เพื่อนำรายหลังหักค่าใช้จ่าย มอบสมทบให้หน่วยงาน หรือองค์กรสาธารณกุศลในกรุงเทพมหานคร
LESA RUN 2023 วันที่ 21 ม.ค.66 LINK
LESA RUN 2023 วันที่ 21 มกราคม 2566 สวนป่าเบญจกิตติ บริเวณลานกิจกรรมกรุงเทพ
แบ่งประเภทการวิ่ง ระยะงานวิ่งจริง 5 /3 / 1.5 กม.
Virtual Run 50 / 100 / 205 กม.
ปิดรับสมัคร ตั้งแต่วันนี้ ถึง 14 มกราคม 2566
Ramayana Run 2023 สวนน้ำรามายณะ 8 ม.ค.66 LINK
Ramayana Run 2023 (ฟรีเครื่องเล่นทุกชนิด) วิ่งวันที่ 8 มกราคม 2566 บริเวณ สวนน้ำรามายณะ จ.ชลบุรี สวนน้ำรามายณะ Ramayana Water Park ระยะทาง 10/6/3 กิโลเมตร ที่เเรกของการวิ่ง เเล้วต่อด้วยการเล่นสวนน้ำที่ใหญ่ที่สุดในประเทศไทย ฟรีเครื่องเล่นทุกชนิด
วิ่งเติมรัก กระซิบฮักน่าน ครั้งที่ 2 วันที่ 20 - 22 ม.ค.66
วิ่งเติมรัก กระซิบฮักน่าน 20 - 22 มกราคม 2566 ณ ข่วงกระซิบรัก ข่วงเมืองน่าน มาเติมเต็มทุก อรรถรสแห่งรัก ณ ดินแดนศักดิ์สิทธิ์ เมืองเก่าน่าน
รุ่นการแข่งขัน ระยะทาง 5 และ 10 กิโลเมตร / วิ่งแฟนซี
หนึ่งในกิจกรรมไฮไลท์ ของงาน “หนาวนี้...กระซิบรักที่น่าน ปีที่ 11 วิ่งเติมรัก กระซิบฮักน่าน”
ตำนานแห่งรัก ปู่ม่าน - ย่าม่าน กระซิบรักบันลือโลก จะกลับมาอีกครั้ง
งานประชาสัมพันธ์ เทศบาลเมืองน่าน โทร 0 54710 234 ต่อ 102,321
ผาสิงห์ เทรล 2023 วันอาทิตย์ที่ 29 มกราคม 2566 LINK
ผาสิงห์ เทรล 2023 วันอาทิตย์ที่ 29 มกราคม 2566 จุดปล่อยตัวนักวิ่ง : วนอุทยานถ้ำผาตูบ ต.ผาสิงห์ อ.เมืองน่าน จ.น่าน ประเภทที่เปิดรับสมัคร ฟันรัน 5 กิโลเมตร ครอสคันทรี่ 12 กิโลเมตร 06.30 น. ปล่อยตัวระยะ 12 กิโลเมตร (Cutt Off : 2.30 Hr.) 06.40 น. ปล่อยตัวระยะ 5 กิโลเมตร
8 ม.ค.66 - เดินเล่นในสวนชวนฟังดนตรี งานรวมพลคนรักษ์ข้อ ครั้งที่ 16 ลานพลับพลา ศิริราช
ภาควิขาศัลยศาสตร์ออร์โธปิดิคส์และกายภาพบำบัด ขอเชิญชวนผู้สนใจร่วมงานรวมพลคนรักษ์ข้อ ครั้งที่ 16 "เดินเล่นในสวนชวนฟังดนตรี" พร้อมพบกับเเขกรับเชิญสุดพิเศษ เเม่ลูกสุดน่ารัก คุณแอฟ ทักษอร เเละน้องปีใหม่มาร่วมกิจกรรม ในวันอาทิตย์ที่ 8 มกราคม 2566 ตั้งเเต่เวลา 16.00 น.เป็นต้นไป ณ ลานพลับพลาสยามินทราศิริราชานุสรณีย์ คณะเเพทยศาสตร์ศิริราชพยาบาล
25 ธ.ค.65 - 29 ม.ค.66 เทศกาลดนตรีกรุงเทพมหานคร Bangkok Music Fest
ตารางการแสดง เทศกาลดนตรีกรุงเทพมหานคร Bangkok Music Fest
- วันอาทิตย์ที่ 25 ธ.ค. 2565 ในชื่อ “New Year Concert” บรรเลงโดย วง Bangkok Metropolitan Orchestra โดยมี ศิลปินรับเชิญ คุณโน้ต ศรัณย์ คุ้งบรรพต และนักร้องคุณภาพจากกรุงเทพมหานคร คุณน้ำฟ้า แก้วรัตนศรีโพธิ์ และ คุณกาญจนา จันทร์ไผ่ และพบกับการแสดงวงออเคสตราประกอบจินตาลีลาชุด “รัตนโกสินทร์” การบรรเลงเดี่ยว Violin และ เดี่ยวระนาด ร่วมกับวงออเคสตร้า โดย คุณตอง พงศ์สิต การย์เกรียงไกร และคุณเอื้อย อภิญญา อินทร์สกุล ณ Museum Siam เริ่มเวลา 17.00 น.
- วันอาทิตย์ที่ 8 ม.ค. 2566 วง Bangkok Big Band และ วง Bangkok Jazz ศิลปินรับเชิญ สปาย ภาสกรณ์ รุ่งเรืองเดชาภัทร์ ณ Museum Siam เวลา 17.00 น.
- วันอาทิตย์ที่ 15 ม.ค. 2566 วง Bangkok Metropolitan Orchestra ศิลปินรับเชิญ ครูกิต The Voice กิตตินันท์ ชินสำราญ และครูปอนด์ พัทธนันท์ อาจองค์ ณ Museum Siam เวลา 17.00 น.
- วันอาทิตย์ที่ 22 ม.ค. 2566 วงดนตรีไทยร่วมสมัย ศิลปินรับเชิญ พี่เบิ่ง (กรมศิลปากร) ณ Museum Siam เวลา 17.00 น.
- วันที่เสาร์ที่ 28 ม.ค. 2566 วงลีลาศกรุงเทพมหานคร ศิลปินรับเชิญ พี่เบิ่ง (กรมศิลปากร) ณ ศูนย์เยาวชนกรุงเทพมหานคร (ไทย-ญี่ปุ่น) ดินแดง เวลา 14.00 น. วัน
- อาทิตย์ที่ 29 ม.ค. 2566 วงโปงลางกรุงเทพมหานคร ศิลปินรับเชิญ คุณอี๊ด โปงลาง ณ Museum Siam เวลา 17.00 น.
6 ม.ค.66 คอนเสิร์ตเชื่อมสัมพันธ์ไทย-ญี่ปุ่น Thai Japan Friendship Concert #2 LINK
Bangkok Metropolitan Orchestra, Music Division, Culture, Sports and Tourism Department, Bangkok, Thailand Trombone Ensemble & AE Friendship Trombone Ensemble Proudly Present "Thai Japan Friendship Concert #2"
Program
N. Matsumoto : Fanfare for ITF 2020 Japan
Maurice Ravel : Pavane Pour Une Infante Défunte
C.M. Schoenberg : Les Miserables Medley
Georges Bizet : L’Arlésienne Suite
Camille Saint-Saëns : Excerpts from Symphony No. 3 “Organ”
M. Sada & S. Tanimura : J Pops : Kosumosu〜Iihi Tabidachi
J.S.Bach : Jesus bleibet meine Freude B.W.V.147
Conductor : Dr. Vanich Potavanich
Saturday, 7 January 2023 - 3 P.M.
Auditorium, 5th Floor, Bangkok Art and Culture Centre
Free Admission
“กวนอิม แชริตี้รัน 2023” วิหารเจ้าแม่กวนอิม สวนอุตสาหกรรมเครือสหพัฒน์ กบินทร์บุรี 15 ม.ค.66 LINK
วิหารอี่ทงเทียนไท้ (วิหารเจ้าแม่กวนอิม) ร่วมกับ สวนอุตสาหกรรมเครือสหพัฒน์ กบินทร์บุรี จัดกิจกรรม “กวนอิม แชริตี้รัน 2023” ในวันอาทิตย์ที่ 15 มกราคม 2566 ณ วิหารเจ้าแม่กวนอิม สวนอุตสาหกรรมเครือสหพัฒน์ กบินทร์บุรี จังหวัดปราจีนบุรี โดยงานนี้จัดขึ้นเพื่อประชาสัมพันธ์ส่งเสริม กระตุ้นเศรษฐกิจ และแหล่งท่องเที่ยวเชิงธรรมชาติในเขตอำเภอกบินทร์บุรี เพื่อส่งเสริมการออกกำลังกาย การดูแลสุขภาพของพนักงาน ประชาชนในพื้นที่และบริเวณใกล้เคียงด้วยกิจกรรมการเดิน-วิ่งเพื่อสุขภาพ โดยรายได้หลังหักค่าใช้จ่าย จะสมทบทุนจัดซื้อเครื่องควบคุมการไหลของสารน้ำ (Air Diffuser Pump) มอบให้กับโรงพยาบาลกบินทร์บุรี
นักวิ่งและผู้ที่สนใจเข้าร่วม “กวนอิม แชริตี้รัน 2023” สามารถสมัครได้แล้วตั้งแต่วันนี้ จนถึง 31 ธันวาคม 2565 โดยสามารถสมัครผ่านช่องทางออนไลน์ที่ www.paiwing.com หรือ เฟซบุ๊ก: Guanyin Charity Run ไลน์: @GuanyincharityrunKB หรือสมัครด้วยตนเอง ณ สำนักงานโครงการสวนอุตสาหกรรมเครือสหพัฒน์ กบินทร์บุรี สนามกอล์ฟ KBSC
Khao Yai Half Marathon อาทิตย์ 15 มค.66 LINK
เส้นทางท่ามกลางบรรยากาศธรรมชาติ สุดแสนพิเศษ กลางเขาใหญ่ อุทยานที่ได้รับสมญานามว่าเป็น อุทยานมรดกของกลุ่มประเทศอาเซียน และในปี 2563 ยังได้รับรางวัลอุทยานแห่งชาติสีเขียว (Green National Parks) ระดับทอง
ช่วงเปิดรับสมัคร 18 สิงหาคม – 31 ธันวาคม 2565
3 ประเภท ระยะทาง 5 I 10 I 21 กม.
เทศกาลดนตรีในสวน 2023 กรุงเทพมหานคร มกราคม 2566 LINK
เทศกาลดนตรีในสวนโดยกรุงเทพมหานคร กลับมาอีกครั้ง สำหรับปี 2023 เริ่มกันตั้งแต่เดือนมกราคมนี้ “28 ครั้ง 10 สถานที่ (9 สวน + มิวเซียสยาม) ” ดังนี้
เสาร์ที่ 7 มกราคม 2566 • สวนวชิรเบญทัศ (สวนรถไฟ) - A Little Bit High /S.A. Band จาก โรงเรียนศรีอยุธยา/ Berry Berry/ Chameen • สวนสันติชัยปราการ -คลองเตยดีจัง /Grand Brother /อัพวา ทรีโอ /The Cold Shot feat. สุรสีห์ และพบกับการแสดงครั้งไปใน
อาทิตย์ที่ 8 มกราคม 2566 • สวน 60 พรรษา สมเด็พระนางเจ้าฯ พระบรมราชินีนาถ (เคหะร่มเกล้า) เขตลาดกระบัง เวลา 17:00 น. : Fah Sansin / 17:40 น. : RU Band / 18: 20 น. : Happily / 19:00 น. : The Rube • สวน สวนรมณีนาถ เขตพระนคร เวลา 17:00 น. : Thai Chiyo / 17:40 น. : Cozy Corner Feat.Tienparb / 18: 20 น. : Berry Berry / 19:00 น. : แหนม รณเดช / สวนหลวงพระราม 8 / ลานมิวเซียมสยาม
เสาร์ที่ 14 มกราคม 2566 • สวนวชิรเบญทัศ(สวนรถไฟ) / สวนสันติชัยปราการ เขตพระนคร
อาทิตย์ที่ 15 มกราคม 2566 • สวน 60 พรรษา สมเด็จพระนางเจ้าฯ พระบรมราชินีนาถ (เคหะร่มเกล้า) / สวนรมณีนาถ / สวนหลวงพระราม 8 / ลานมิวเซียมสยาม
เสาร์ที่ 21 มกราคม 2566 • อุทยานเบญจสิริ /สวนเสรีไทย
อาทิตย์ที่ 22 มกราคม 2566 • สวนเฉลิมพระเกียรติ 80 พรรษา พระบาทสมเด็จพระเจ้าอยู่หัว (บางกอกน้อย) / สวนเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา (สะพานพระราม 9) / สวนหลวงพระราม 8 / ลานมิวเซียมสยาม
เสาร์ที่ 28 มกราคม 2566 • อุทยานเบญจสิริ / สวนเสรีไทย / ศูนย์เยาวชนกรุงเทพมหานคร (สนามกีฬาไทย-ญี่ปุ่น ดินแดง)
อาทิตย์ที่ 29 มกราคม 2566 • สวนเฉลิมพระเกียรติ 80 พรรษา พระบาทสมเด็จพระเจ้าอยู่หัว (บางกอกน้อย) / สวนเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา (สะพานพระราม 9) / สวนหลวงพระราม 8 / ลานมิวเซียมสยาม
8 ม.ค.66 วง Bangkok Big Band และ วง Bangkok Jazz @ลานมิวเซียมสยาม LINK
เทศกาลดนตรีกรุงเทพมหานคร Bangkok Music Fest วันอาทิตย์ที่ 8 มกราคม 2566 เวลา 17.00 น. ลานมิวเซียมสยาม เข้าชมฟรี … ไม่มีค่าใช้จ่าย "Happy New Year” พบกับศิลปินรับเชิญ สปาย (The Golden Song) ภาสกรณ์ รุ่งเรืองเดชาภัทร์ บรรเลงโดยวง Bangkok Big Band & BKK Jazz Group รับชม รับฟัง บทเพลงหลากหลายสไตล์ พร้อมด้วยนักร้องจากกองการสังคีต
15 ม.ค. 2566 วง Bangkok Metropolitan Orchestra @Museum Siam เวลา 17.00 น.
วันอาทิตย์ที่ 15 ม.ค. 2566 วง Bangkok Metropolitan Orchestra ศิลปินรับเชิญ ครูกิต The Voice กิตตินันท์ ชินสำราญ และครูปอนด์ พัทธนันท์ อาจองค์ ณ Museum Siam เวลา 17.00 น.
7 ม.ค. 2566 เทศกาลดนตรีในสวน@2 สวน - สวนวชิรเบญทัศ (สวนรถไฟ) และ สวนสันติชัยปราการ • สวนวชิรเบญทัศ (สวนรถไฟ) - A Little Bit High - S.A. Band จาก โรงเรียนศรีอยุธยา - Berry Berry - Chameen• สวนสันติชัยปราการ - คลองเตยดีจัง - Grand Brother - อัพวา ทรีโอ - The Cold Shot feat. สุรสีห์
8 ม.ค.66 เทศกาลดนตรีในสวน @2 สวน - สวน 60 พรรษาเคหะร่มเกล้า และ สวนรมณีนาถ พระนคร • สวน 60 พรรษา สมเด็จพระนางเจ้าฯ พระบรมราชินีนาถ (เคหะร่มเกล้า) เขตลาดกระบัง
เวลา 17:00 น. : Fah Sansin / 17:40 น. : RU Band / 18: 20 น. : Happily / 19:00 น. : The Rube • สวนรมณีนาถ เขตพระนคร เวลา 17:00 น. : Thai Chiyo / 17:40 น. : Cozy Corner Feat.Tienparb / 18: 20 น. : Berry Berry / 19:00 น. : แหนม รณเดช • สวนหลวงพระราม 8 • ลานมิวเซียมสยาม วง Bangkok Big Band และ วง Bangkok Jazz เวลา 17.00 น.
10 ม.ค.66 มช.ขอเชิญรับฟังบทเพลงพระราชนิพนธ์ ในวันที่ระลึก "วันทรงดนตรี" LINK
มหาวิทยาลัยเชียงใหม่ ขอเชิญร่วมน้อมรำลึกในพระอัจฉริยภาพของพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร องค์อัครศิลปิน ผ่านบทเพลงพระราชนิพนธ์ ในวันที่ระลึก “วันทรงดนตรี” วันอังคารที่ 10 มกราคม 2566 เวลา 17.00 – 20.00 น. ณ ลานสังคีต มช. ขับร้องและบรรเลงโดย CMU Band โดยไม่เสียค่าใช้จ่าย
28 มกราคม 2566 Strong Heart Smart Mom 2023 รพ.เจ้าพระยา LINK
สัมมนาดีๆ และกิจกรรมเพิ่มความรู้สำหรับคุณแม่ตั้งครรภ์ทั้งมือใหม่และมือเก่าได้ทุกท่านกับงาน“Strong Heart Smart Mom 2023” พบกับหัวข้อที่น่าสนใจกับกิจกรรมความรู้ต่างๆ
✅ไขข้อข้องใจสำหรับคุณแม่ตั้งครรภ์ และภาวะครรภ์เสี่ยง
✅ประโยชน์ของการเก็บสเต็มเซลล์เพื่อลูกน้อย
✅Workshop การสอนอาบน้ำลูกน้อยวัยแรกเกิด
วันเสาร์ที่ 28 มกราคม 2566 เวลา 11.00 - 14.00 น. ณ หอประชุม ชั้น 2 รพ.เจ้าพระยา สอบถามโปรโมชั่นสุขภาพ ติดต่อแผนก Call Center เวลา 08.00-17.00 น. 024338222
28 มกราคม 2566 กิจกรรมคุณแม่คุณภาพ ครั้งที่ 1/2566 รพ.เกษมราษฎร์ อินเตอร์เนชั่นแนล รัตนาธิเบศร์
กิจกรรมคุณแม่คุณภาพ ครั้งที่ 1/2566 เชิญคุณแม่ที่สนใจเข้าร่วมอบรมในหัวข้อ " 9 เดือนคุณภาพของคุณแม่ตั้งครรภ์ " พร้อมจองแพ็กเกจคลอด โปรโมชั่นเฉพาะในงานนี้เท่านั้น !!!
ลงทะเบียนสำรองที่นั่งได้ที่ https://lin.ee/DrQbUwT
ฝากครรภ์จากคลินิก หรือ รพ.อื่นๆ สามารถเข้าร่วม กิจกรรมได้ โดยไม่มีค่าใช้จ่ายใดๆ ทั้งสิ้น
วันเสาร์ที่ 28 มกราคม 2566 เวลา 08.30 - 12.00 น. ณ ห้องประชุมหาญพาณิชย์ ชั้น G (ลานจอดรถ) สอบถามเพิ่มเติม / ลงทะเบียนสำรองที่นั่ง 098-270-9055 ฝ่ายการตลาด
8 มกราคม 2566 Workshop Happy&Healthy Mom ครั้งที่ 4 โรงพยาบาลสินแพทย์ รามอินทรา
เชิญชวนคุณพ่อและคุณแม่ที่กำลังตั้งครรภ์ มาเตรียมตัว Workshop Happy&Healthy Mom ครั้งที่ 4 อบรมเตรียมความพร้อมเข้าสู่การเป็นคุณแม่คุณภาพ พร้อมพบกับ ‘พญ.อรดา ปัทมสิงห์ ณ อยุธยา สูตินรีแพทย์ ผู้ชำนาญการ’ มาให้ความรู้ คำแนะนำในการดูแลครรภ์ไปจนถึงการดูแลทารก ทั้งเทคนิคการอาบน้ำ การดูแลสะดือ จนไปถึงการฝึกหายใจคลายกล้ามเนื้อ
วันอาทิตย์ที่ 8 มกราคม 2566 เวลา 09:00-15:30 น. ณ โรงพยาบาลเด็กสินแพทย์ ชั้น 7 รับทันที Premium Gift Set ต้อนรับสมาชิกตัวน้อย ***กิจกรรมนี้ไม่มีค่าใช้จ่าย***
เงื่อนไขการร่วมกิจกรรม: ต้องมีอายุครรภ์ 7 เดือนขึ้นไป สำรองที่นั่งและสอบถามเพิ่มเติม 0-2793-5099 ต่อ 5211, 5212, 5778
เทศกาลดนตรีในสวน เชียงรายดอกไม้งาม ทุกๆ เสาร์ 1 มกราคม ถึง 18 กุมภาพันธ์ 2566
เทศกาลดนตรีในสวน "เชียงรายดอกไม้งาม" กับศิลปินเสียงหวานนุ่มไพเราะที่จะมาขับกล่อมบทเพลงรักในสายลมหนาว ท่ามกลางทุ่งดอกไม้นานาพันธุ์ ทุกวันเสาร์ เริ่มตั้งแต่วันที่ 1 มกราคม 2566 และทุกๆเสาร์ ถึง วันเสาร์ที่ 18 กุมภาพันธ์ 2566 ณ สวนตุงและโคมเชียงราย อำเภอเมือง จังหวัดเชียงราย เวลา 18.00 น. เป็นต้นไป
Phuket Grand Run 2023 วันเสาร์ที่ 28 ม.ค.66
Phuket Grand Run 2023 วันเสาร์ที่ 28 มกราคม 2566 ณ สวนสาธารณะสะพานหิน จังหวัดภูเก็ต ไนท์รัน กิจกรรมเริ่ม 18.00 น. ผู้วิ่งเข้าเส้นชัยคนแรกของทุกระยะการวิ่ง (แบ่งชาย-หญิง) จะได้รับนาฬิกา G-Shock เป็นของรางวัล หรือลุ้นรับอีกช่องทางเมื่อเข้าร่วมกิจกรรม PHUKET GRAND FANMEET
รายได้ส่วนหนึ่งหลังหักค่าใช้จ่ายมอบให้เหล่ากาชาด จังหวัดภูเก็ต
เปิดรับสมัครแล้ววันนี้ - 21 มกราคม 2566
สอบถามข้อมูลเพิ่มเติมได้ที่ เพจเฟสบุ๊ค :
Phuket Grand Run
เบอร์โทรติดต่อ : 080-5262121
ดนตรีในสวนลุมพินี ครั้งที่ 30 มกราคม-กุมภาพันธ์ 2566
กลับมาอีกครั้ง ดนตรีในสวนลุมพินี ครั้งที่ 30 Concert in the Park #30 การแสดงโดยวง Royal Bangkok Symphony Orchestra ทุกวันอาทิตย์ เวลา 5.30 - 17.30 น. ณ ศาลาภิรมย์ภักดี สวนลุมพินี บริเวณสวนปาล์ม ชมฟรี
กำหนดวันแสดง
15, 22 และ 29 มกราคม
5, 12 และ 19 กุมภาพันธ์
PANGSIDA Chill : CAMP & HAVE FUN วันที่ 14 - 15 มกราคม 2566
PANGSIDA Chill : CAMP & HAVE FUN
Lover Camper @สระแก้ว #3
วันที่ 14 - 15 มกราคม 2566
ณ ลานกางเต็นท์ ช่องกล่ำบน พื้นที่ของอุทยานแห่งชาติปางสีดา จังหวัดสระแก้ว
ชวนสายชิลมาแคมป์ปิ้งริมอ่างเก็บน้ำช่องกล่ำบน ฟังดนตรี ชมดาว ทางพร้อมกิจกรรมเดินทางเส้นศึกษาประวัติศาสตร์ และการประกวดชุดอาหารเช้าของชาวแคมป์ปิ้งชิงรางวัลของที่ระลึก
งานประจำปีนมัสการ ปิดทอง วัดหนองพะอง 27-29 มกราคม 2566 กระหึ่มกับ ปู พงษ์ สิทธิ์ คำภีร์ LINK
งานประจำปีนมัสการ ปิดทองรอยพระพุทธบาทจำลอง หลวงพ่อโต หลวงพ่อองค์ดำ หลวงพ่อดำ หลวงพ่อพุทธศักดิ์สิทธิ์ หลวงพ่อทันใจ หลวงพ่อพุทธเมตตา หลวงพ่ออุปคุต หลวงปู่ทองอยู่ วัดหนองพะอง ต.สวนหลวง อ.กระทุ่มแบน สมุทรสาคร 27-29 มกราคม 2566 ถวายสังฆทานสด 29 มกราคม เวลา 8.00 น. กิจกรรมการแสดง 3 วัน 27 ม.ค. รถแห่ซุ้มเมืองกาญจน์ 28 ม.ค ไท ธนาวุฒิ ตั๊กกี้ ปอย 29 ม.ค. กระหึ่มสุดๆ กับ ปู พงษ์ สิทธิ์ คำภีร์ (จองร้านค้าตั้งแต่ 22 ม.ค.)
งานนมัสการหลวงปู่วัดโกรกกราก 6-15 มกราคม 2566 LINK
10 วัน 10 คืน กับงานนมัสการหลวงปู่วัดโกรกกราก จังหวัดสมุทรสาคร ปี 2566 ระหว่างวันที่ 6-15 มกราคม 2566 ศิลปินขนกันมาเต็มๆ เจนนี่ ลิลลี่ ได้หมดถ้าสดชื่น แบงค์ เส้นเล็ก มอส ปฏิภาณ เต๋า สมชาย เข็มกลัด แท่ง ศักดิ์สิทธิ์ เสือ ธนพล เหน่ง y not 7 อู๋ ธรรฬ์ณธร คณะหลานยายอิ่ม เอกชัย ศรีวิชัย และอีกเพียบ เช็คตารางการแสดงที่นี่
งานประจำปีปิดทอง วัดพรหมคุณาราม (บางตะคอย) 19-23 มกราคม 2566 LINK
5 วัน 5 คืน งานประจำปีปิดทองหลวงพ่อรวย วัดพรหมคุณาราม (บางตะคอย) 2566 จ.สมุทรสาคร กราบไหว้หลวงพ่อรวยตั้งแต่ต้นปี รับรองจะมีเงินมีทอง ร่ำรวยตั้งแต่ต้นปีและตลอดไป เตรียมตัวให้พร้อมไปสนุกให้เต็มแบบได้บุญ กับงานประจำปีปิดทอง วัดพรหมคุณาราม (บางตะคอย) ต.ชัยมงคล อ.เมือง สมุทรสาคร งาน 5 วัน 5 คืน ตั้งแต่ 19-23 ม.ค.2566 เชิญชวน อย่าลืมและอย่างพลาด ตรุษจีนปีนี้ เที่ยวสนุกสุดอลังการ กับงานบุญใหญ่ประจำปี งานนมัสการปิดทองหลวงพ่อรวย มหรสพสมโภชน์ และขอพรพระพรหมอุดมโชค
กิจกรรมมหรสพสมโภชน์ ดูฟรี ชมฟรี สนุกได้ทั้งคืน ตามตารางดังนี้ 19 มกราคม อาร์ม ชุติมา 20 มกราคม วงพัทลุง จัดมาเต็มวง 21 มกราคม มิน เฉาก๊วย 22 มกราคม พ็อก บิ๊กอาย 23 มกราคม เจน รถแห่
CAMPPA แคมป์ป้ะ ครั้งที่ 4 Music Camping วันที่ 13-14 มกราคม 2566
CAMPPA แคมป์ป้ะ ครั้งที่ 4 Music Camping - กางเต็นท์ ชมดาว ดูหนังกลางแปลง @Tinkhao cafe ทางขึ้นเขาใหญ่ฝั่งปราจีนบุรี วันที่ 13-14 มกราคม 2566 พบกับศิลปินชั้นนำ 13มกราคม 2566 จุลโหฬาร 14มกราคม 2566 -ดวงดาวเดียวดาย -สถาพร -พลลพ -เภตรา กิจกรรมภายในงาน -ฉายหนังกลางแปลง -workshops Moka pot -Market Village (Streetfood / Foodtruck / Vintage/ Otop) -ออกบูธศิลปิน -ดนตรีเปิดหมวกเยาวชน -โชว์รถเก่าคลาสสิค บัตรกางเต็นท์ ราคา วันละ 350 บาท พิเศษบัตรกางเต็นท์ 2 วัน ราคา 500 บาท Campercar จอดในพื้นที่จัดงานได้
งานสืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาด จ.สระแก้ว ประจำปี 2566 วันที่ 27 ม.ค. – 4 ก.พ. 66
9 วัน 9 คืน ฟรี !! จังหวัดสระแก้ว ขอเชิญเที่ยว “งานสืบสานวัฒนธรรมเบื้องบูรพาและงานกาชาด ประจำปี 2566 ระหว่างวันที่ 27 มกราคม – 4 กุมภาพันธ์ 2566 ณ บริเวณอุทยานพุทธมณฑลสระแก้ว ตำบลท่าเกษม อำเภอเมืองสระแก้ว ชม ชิม ช๊อป แช๊ะ นิทรรศการการออกร้านจำหน่ายสินค้า อาหาร ของดีสระแก้ว นิทรรศการเสมือนจริง ทุกคืน !!ลุ้นโชค ลุ้นรางวัล ที่ร้านมัจฉากาชาด พบกันที่ บริเวณอุทยานพุทธมณฑลจังหวัดสระแก้ว
อบต.เขาสามสิบ สระแก้ว กำหนดจัดงานประเพณีบายศรีสู่ขวัญข้าว ประจำปี 2566 LINK
อบต.เขาสามสิบ กำหนดจัดงานประเพณีบายศรีสู่ขวัญข้าว ประจำปี 2566 ในวันอังคารที่ 24 มค.66 ณ วัดคลองสิบสาม หมู่ที่ 3 ต.เขาสามสิบ อ.เขาฉกรรจ์ จ.สระแก้ว
6.30 น. พิธีเรียกขวัญข้าวจากท้องนา
7.30 น. ขบวนแห่ขวัญข้าวและพระแม่โพสพ
10.30 น. พิธีเปิดงาน โดย ผวจ.สระแก้ว
13.00 น. ประกวด "วิถีชุมชนกับอาหารพื้นบ้านไทย"
++ ตารางให้บริการหน่วยสัตวแพทย์เคลื่อนที่เดือนมกราคม 2566
หน่วยสัตวแพทย์เคลื่อนที่ ให้บริการ เดือนมกราคม ดังนี้
วันที่ 27 ม.ค. 66 ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้านในสัตว์เลี้ยง 200 ตัว ทำหมันสุนัขและแมว 30 ตัว ฝังไมโครชิป 50 ตัว ณ ลานหน้าวัดเทพนิมิตต์ เขตดอนเมือง เวลา 9-12 น. สอบถามโทร. 089-4562896 02-5655257 ต่อ 210 สิ่งที่ต้องนำมา - บัตรประชาชน
*กรณีนำสัตว์เลี้ยงมารับบริการ ควรนำถุงเก็บอุจจาระและกระดาษเช็ดทำความสะอาดมาด้วย
วันศุกร์ที่ 27 ม.ค. 66 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สุนัขและแมว ฟรี ที่ชุมชนทิวสนร่วมจิตมณียา เเขวงทับยาว เขตลาดกระบัง เวลา 9.00 ถึง 11.00 น.
วันพฤหัสบดีที่ 26 ม.ค. 66 งานกิจกรรมสุขภาพ ใกล้บ้าน ใกล้หมอ เขตทวีวัฒนา ณ ชุมชนหมู่บ้านร่วมเกื้อ เขตทวีวัฒนา กรุงเทพมหานคร ตั้งแต่เวลา 08.00 - 14.00 น. มีบริการฉีดวัคซีน/ทำหมันสุนัขแมว
วันพฤหัสบดีที่ 26 ม.ค. 66 มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่วัดไผ่ตัน เขตพญาไท เวลา 8.00 ถึง 12.00 น. รับจำนวนจำกัด 50 ตัว เท่านั้น ลงทะเบียนทำหมันหน้างาน
วันพุธที่ 25 ม.ค. 66 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สุนัขและแมว ฟรี ที่ชุมชนประชาอุทิศ เเขวงทับยาว เขตลาดกระบัง เวลา 9.00 ถึง 11.00 น.
วันอังคารที่ 24 ม.ค. 66 มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่วัดสุขใจ เขตคลองสามวา เวลา 8.00 ถึง 12.00 น. รับจำนวนจำกัด 50 ตัว เท่านั้น ลงทะเบียนทำหมันหน้างาน
วันพฤหัสบดีที่ 19 ม.ค. 66 ให้บริการ ทำหมันแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนบ้านครัวเหนือ เขตราชเทวี เวลา 9.00 ถึง 11.00 น. รับเฉพาะแมวเท่านั้น เพราะเป็นชุมชนมุสลิม จำนวนจำกัด 30 ตัว ลงทะเบียนทำหมันหน้างาน
* อย่าลืม ต้องขังกรง อดน้ำและอาหาร 10 ถึง 12 ชม. ก่อนนำมาทำหมัน ด้วย
วันอังคารที่ 17 ม.ค. 66 ให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และ ทำหมันสุนัขและแมว ฟรี จำนวน 100 ตัว ณ วัดบางกระดี่ เวลา 8.30 ถึง 11.00 น.
วันอังคารที่ 17 ม.ค. 66 สำนักงานเขตบางเขน ให้บริการ ออกหน่วยทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่บริเวณทางเข้าหมู่บ้านมัณฑนา 1 ซอยร่วมมิตรพัฒนา แยก 10 ถนนวัชรพล แขวงท่าแร้ง เขตบางเขน เวลา 09.00 ถึง 11.00 น. รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
* อย่าลืม ต้องขังกรง อดน้ำและอาหาร 8 ถึง 12 ชม. ก่อนนำมาทำหมัน
วันจันทร์ที่ 16 ม.ค. 66 ให้บริการ ออกหน่วยทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ ศาลา 7 วัดสังข์กระจายวรวิหาร เวลา 09.00 ถึง 11.00 น. รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
วันศุกร์ที่ 13 ม.ค. 66 ให้บริการทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดพรพระร่วงประสิทธิ์ เขตสายไหม เวลา 8.30 ถึง 11.00 น.
วันพฤหัสบดีที่ 12 ม.ค. 66 ให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ลานจอดรถ สำนักงานเขตวังทองหลาง เขตวังทองหลาง เวลา 9.00 ถึง 11.00 น.
วันพฤหัสบดีที่ 12 ม.ค. 66 ให้บริการ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่บริเวณลานใต้ทางด่วน ชุมชนวัดมะกอก (กลางสวน) เขตพญาไท เวลา 8.30 ถึง 12.00 น. รับจำนวนจำกัด 50 ตัว เท่านั้น รับจำนวนจำกัด 50 ตัว เท่านั้น
วันอังคารที่ 10 ม.ค. 66 ให้บริการ หน่วยสัตวแพทย์เคลื่อนที่ ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนวังใหญ่พัฒนา เขตสะพานสูง เวลา 9.00 ถึง 11.00 น.
วันจันทร์ที่ 9 ม.ค. 66 ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่โดมเอนกประสงค์ ชุมชนเคหะออเงิน สุขาภิบาล 5 ซอย 66 เขตสายไหม เวลา 9.00 ถึง 11.00 น.
วันศุกร์ที่ 6 ม.ค. 66 ให้บริการ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดบางแวก เขตภาษีเจริญ เวลา 8.30 ถึง 11.00 น.
วันพุธที่ 4 ม.ค. 66 ให้บริการ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ วัดกุนนทีรุทธาราม เขตดินแดง เวลา 8.30 ถึง 11.00 น.
กัญชาเวชศาสตร์ ภาคพิเศษ 2566 ม.ราชภัฏสวนสุนันทา
กัญชาเวชศาสตร์ ภาคพิเศษ 2566 หลักสูตรปริญญาตรี วิทยาศาสตรบัณฑิต เปิดรับสมัคร 1 ม.ค. ถึง 31 มี.ค. 2566 คุณสมบัติ: จบ ม.6 หรือเทียบเท่า เกรด 2.00 ขึ้นไป จบปริญญาตรีแล้ว สามารถเทียบโอนได้ 30 หน่วยกิต เรียนเสาร์และอาทิตย์: online และ onsite มหาวิทยาลัยราชภัฏสวนสุนันทา กรุงเทพฯ คิดถึงกัญชา ต้องที่สวนสุนันทา
สมัครได้ที่
admission.ssru.ac.th/หลักสูตรการสร้างแอพพลิเคชั่นมือถือด้วย Google AppSheet วันที่ 14-15 มกราคม 2566
"หลักสูตรการสร้างแอพพลิเคชั่นมือถือด้วย Google AppSheet" วันที่ 14-15 มกราคม 2566 เวลา 09.00-16.30 น.
AppSheet เป็นแพลตฟอร์มที่สร้างขึ้นเพื่อช่วยพัฒนา Mobile Application แบบไม่ต้องใช้โค้ด ไม่ว่าคุณจะเป็นผู้ที่ไม่มีความรู้เรื่องการ Coding ก็สามารถสร้าง Mobile Application ที่ใช้งานได้จริงได้ด้วยตัวเอง โดยไม่จำเป็นต้องมีความรู้เรื่องการเขียนโปรแกรมโดยเชื่อมต่อข้อมูลจากแหล่งต่างๆ เช่น Google Sheets, Excel หรือ Cloud SQL
AppSheet เป็นเครื่องมือเพื่อช่วยพัฒนากระบวนการทำงานด้วยหลากหลายฟังก์ชันในแอปฯ เดียว โดยออกแบบมาให้ใช้งานง่าย และตอบโจทย์หลากหลายธุรกิจ เช่น การจัดเก็บข้อมูลลูกค้า ทำ Data Visualization ติดตามและรายงานผลคลังสินค้า จัดการระบบทางบัญชีของบริษัท รวมทั้งสามารถเชื่อมต่อกับบริการต่างๆ ของ Google ได้ เช่น Goolgle Maps, Google Calendar หรือ Google Forms
หลักสูตรการออกแบบและสร้างงานกราฟิกด้วย Illustrator 28-29 มกราคม 2566
"หลักสูตรการออกแบบและสร้างงานกราฟิกด้วย Illustrator"
อบรมระหว่างวันที่ 28-29 มกราคม 2566 เวลา 09.00-16.30 น.
ถ้าต้องการออกแบบกราฟฟิกต่างๆ แต่ไม่เคยใช้โปรแกรมตกแต่งภาพด้านออกแบบมาก่อนเลย ไม่เป็นปัญหาค่ะ หลักสูตรนี้จะปูพื้นฐานในการออกแบบให้ตั้งแต่ระดับเริ่มต้น ตั้งแต่เครื่องมือคำสั่งต่างๆ ของโปรแกรม หลักการใช้แนวคิดในการออกแบบ การออกแบบภาพและวัตถุพื้นฐานอย่างเป็นลำดับขั้นตอน และสามารถนำมาประยุกต์ใช้ได้ทันที ผู้เข้าอบรมสามารถเรียนรู้ทฤษฏีการจัดวางวัตถุ การใช้สี นำจินตนาการมาใส่ในงาน ฯลฯ ด้วยโปรแกรมออกแบบ Graphic ที่ได้รับความนิยมในปัจจุบันนี้ ซึ่งหลักสูตรนี้จะมีการสร้างงานให้ได้ฝึกปฏิบัติจริง
หลักสูตรการสร้างอุปกรณ์้ IoT และการประยุกต์ใช้งาน วันที่ 26-27 พฤศจิกายน 2565
หลักสูตรการสร้างอุปกรณ์้ IoT และการประยุกต์ใช้งาน
อบรมระหว่างวันที่ 26-27 พฤศจิกายน 2565
เวลา 09.00-16.30 น.
มุ่งเน้นสำหรับการเรียนรู้การพัฒนาระบบสมองกลฝังตัว และสามารถนำไปประยุกต์ใช้งานได้จริง โดยมีวัตถุประสงค์หลักเพื่อสร้างระบบแจ้งเตือนแบบออนไลน์ ผ่านแอพพลิเคชั่นบนสมาร์ทโฟน ซึ่งสามารถนำไปประยุกต์ใช้ในการแจ้งเตือนต่างๆ ได้ เช่น เตือนไฟใหม้ น้ำล้น ผู้บุกรุก ผู้ป่วยกดปุ่มส่งสัญญาณแจ้งเตือน และอื่นๆ อีกมากมาย โดยการอบรมดังกล่าวจะมีทั้งภาคทฤษฎีและภาคปฏิบัติการด้วยการใช้งานบอร์ด Arduino และการเขียนโปรแกรมควบคุมอุปกรณ์ต่างๆ
งานวันสมเด็จพระเจ้าตากสินมหาราช และงานปีใหม่ จ.ระยอง
งานวันสมเด็จพระเจ้าตากสินมหาราช และงานปีใหม่ จ.ระยอง ประจำปี 2565 วันที่ 28 ธันวาคม 65 - 3 มกราคม 66 ณ สนามกีฬาจังหวัดระยอง
นมัสการรอยพระพุทธบาทเขาคิชฌกูฏ 22 มกราคม - 22 มีนาคม 2566 LINK
ปีนี้อุทยานแห่งชาติเขาคิชฌกูฏ จังหวัดจันทบุรี ได้เปิดนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ระหว่างวันที่ 22 มกราคม 2566 ถึงวันที่ 22 มีนาคม 2566 การกำหนดจำนวนนักท่องเที่ยวและผู้แสวงบุญจะแบ่งออกเป็น 4 ช่วงเวลาใน 1 วัน เริ่มตั้งแต่ ช่วงเวลา 0.00 น.- 06.00 น. ช่วงเวลา 06.00 - 12.00 น. ช่วงเวลา 12.00 - 18.00 น. และเวลา 18.00 - 24.00 น. จำนวนนักท่องเที่ยวแต่ละช่วงเวลา ประมาณ 6,000 คน โดยอุทยานฯ ได้พิจารณาตามขีดความสามารถในการรองรับของพื้นที่ คำนวณจากพื้นที่ใช้สอยบริเวณที่จัดงานประเพณี การจองขึ้นนมัสการฯ จะเปิดจองในแอปพลิเคชัน KCKQue (พระบาทเขาพลวง) วันละ 4,500 คน / ช่วงเวลา ผู้ที่จองหน้างาน 1,500 คน / ช่วงเวลา การเดินทางขึ้นไปนมัสการ ประจำปี 2566 มี 2 วิธี คือ 1. ขึ้นรถ ที่คิวรถวัดกะทิง หรือคิวรถวัดพลวง 2. เดินเท้า โดยเดินทางหน่วยพิทักษ์ฯ ที่ คก.1 (พระบาทพลวง) เดินทางบ้านแกลง ต.พลวง สอบถามเพิ่มเติมได้ที่ อุทยานแห่งชาติเขาคิชฌกูฏ จ.จันทบุรี โทร. 039 609 672
วันบวงสรวง : วันศุกร์ที่ 20 มกราคม 2566 (แรม 14 ค่ำ เดือนยี่ (2) ปีเถาะ)
วันปิดป่า-เปิดงาน : วันอาทิตย์ที่ 22 มกราคม 2566 (ขึ้น 1 ค่ำ เดือนสาม (3) ปีเถาะ)
วันเปิดป่า-ปิดงาน : วันพุธที่ 22 มีนาคม 2566 (ขึ้น 1 ค่ำ เดือนห้า (5) ปีเถาะ)
ติดตามข้อมูลข่าวสารได้เรื่อยๆ ที่เพจ ททท.สำนักงานจันทบุรี
Facebook : ททท.สำนักงานจันทบุรี
Line OA: @tatchanthaburi
โทร.039-480220
วัดพลวง โทร. 097-9541650
Facebook อุทยานแห่งชาติเขาคิชฌกูฏ
โทร. 039-609666, 039-69672 ,096-8875796, 094-1401952 และ 094-0514208
KHEK NOI ULTRA TRAIL 14 - 15 มกราคม 2566
KHEK NOI ULTRA TRAIL องค์การบริหารส่วนตำบลเข็กน้อย Phetchabun running วิ่งในงาน 14 - 15 มกราคม 2566 “เข็กน้อยอัลตร้าเทรล 2023” แบ่งการแข่งขันออกเป็น 5 ระยะทาง ดังนี้ - Kheknoi 100 - Kheknoi 70 - Kheknoi 50 - Kheknoi 30 - Kheknoi 10 วันที่และสถานที่วิ่ง - ณ. องค์การบริหารส่วนตำบลเข็กน้อย อำเภอเขาค้อ จังหวัดเพชรบูรณ์ (ผาตัด - ดอยตั่วเพ้ง)
18 มกราคม 2565 ตลาดพงษ์พระราม เขตปทุมวัน
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ฟรี พบกับกิจกรรมตรวจสุขภาพและอื่นๆ อีกมากมาย ในวันที่ 18 มกราคม 2565 ตั้งแต่เวลา 08.00 ถึง 14.00 น. ณ ตลาดพงษ์พระราม เขตปทุมวัน กรุงเทพมหานคร
เทศบาลตำบลคลองด่าน MOU มูลนิธิเพื่อสุนัขในซอย (soidog)
เทศบาลตำบลคลองด่าน กับ มูลนิธิเพื่อสุนัขในซอย (soidog) ร่วมลงนามบันทึกข้อตกลง (MOU) ว่าด้วยความร่วมมือ การรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การทำหมันสุนัขและแมว
เมื่อวันจันทร์ที่ 30 มกราคม พ.ศ.2566 เวลา 09.30 น. เทศบาลตำบลคลองด่าน โดยนายณรงค์ กลมกล่อม นายกเทศมนตรีตำบลคลองด่าน ร่วมลงนามบันทึกข้อตกลง (MOU) ว่าด้วยความร่วมมือ การรณรงค์ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การทำหมันสุนัขและแมว ระหว่าง เทศบาลตำบลคลองด่าน กับ มูลนิธิเพื่อสุนัขในซอย (soidog) ซึ่งเป็นองค์กรการกุศลและองค์กรจัดสวัสดิการภาพสัตว์ เป็นโครงการ การจัดการประชากรสุนัขจรจัดประเทศไทย หรือ CNVR-Thailand โดยการออกหน่วยทำหมันเคลื่อนที่ทั่วประเทศไทย ฉีดวัคซีนรวมและวัคซีนป้องกันโรคพิษสุนัขบ้า รวมถึง ยาป้องกันเห็บ หมัด และปล่อยกลับคืนถิ่นที่อยู่เดิม เพื่อสนับสนุนแผนยุทธศาสตร์โครงการ “สัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า"ร่วมกับคณะผู้บริหารฯ และสมาชิกสภาเทศบาลฯ พร้อมด้วยนายอนันต์ พิมพ์ศรี ปลัดเทศบาล หัวหน้าส่วนราชการ และพนักงานเทศบาล ร่วมพิธีลงนามบันทึกข้อตกลงฯ ณ ลานอเนกประสงค์ สำนักงานเทศบาลตำบลคลองด่าน
เทศบาลนครตรัง ได้ดำเนินการจัดกิจกรรมดนตรีในสวน มกราคม - มีนาคม 2566
เทศบาลนครตรัง ได้ดำเนินการจัดกิจกรรมดนตรีในสวน ณ สวนสาธารณะและสถานที่พักผ่อนภายในเขตเทศบาลนครตรัง ระหว่างเดือนมกราคม - มีนาคม 2566 โดยกำหนดจัดในวันพุธของแต่ละสัปดาห์ ระหว่างเวลา 17.00 - 18.00 น. และมีการหมุนเวียนการจัดกิจกรรม จำนวน 2 แห่งต่อสัปดาห์ เพื่อให้ประชาชนได้ใช้เวลาว่างเพื่อการพักผ่อน สร้างความสุขให้กับคนนครตรัง และเป็นการส่งเสริมสนับสนุนการออกมาใช้ชีวิตบนพื้นที่สาธารณะ เพื่อสร้างการเคลื่อนไหวทางสังคม เศรษฐกิจ และวัฒนธรรม ในทุกมุมเมือง อีกทั้ง เป็นการเปิดพื้นที่แสดงความสามารถทางดนตรีของเด็ก เยาวชน และประชาชนผู้สนใจด้านดนตรี โดยครั้งแรกจัดขึ้นเมื่อ วันที่ 11 มกราคม 2566
กิจกรรมในวันที่ 8 กุมภาพันธ์ 2566 เวลา 17.00 – 18.00 น. ชมการแสดงได้ที่ สระกะพังสุรินทร์ พบกับวงดนตรีจากโรงเรียนเทศบาล 1 (สังขวิทย์) ส่วนที่อนุสาวรีย์พระยารัษฎานุประดิษฐ์ มหิศรภักดี (คอซิมบี้ ณ ระนอง) พบกับวงดนตรีจากโรงเรียนเทศบาล 2 (วัดกะพังสุรินทร์)
ดนตรีในสวน สวนหลวงพระราม 8 - 8, 15, 22, 29 มกราคม 2566 วันที่ 5 และ 12 กุมภาพันธ์ 2566
ดนตรีในสวน เป็นการแสดงดนตรีในสวนหลวงพระราม 8 เป็นประจำทุกวันอาทิตย์ แสดงทั้งหมด 6 ครั้ง ได้แก่ วันอาทิตย์ที่ 8, 15, 22, 29 มกราคม 2566 วันที่ 5 และ 12 กุมภาพันธ์ 2566 เป็นการแสดงของวงดนตรีขนาดใหญ่ ประกอบด้วย วงสถาบันดนตรีกัลยาณิวัฒนา วงมหาวิทยาลัยเกษตรศาสตร์ วงดุริยางค์สากลกรมศิลปากร วงดุริยางค์ทัพบก วงไทยซิมโฟนี และวงดุริยางค์ซิมโฟนีกรุงเทพมหานคร ซึ่งครั้งนี้จะเป็นการยกระดับการแสดงให้มีคุณภาพมากขึ้น และเปลี่ยนภาพลักษณ์ของดนตรีในสวน โดยเป็นการแสดงบทเพลงรักชาติ เพลงที่แสดงถึงเอกลักษณ์ชาติ เพลงสัญลักษณ์ชาติ เพลงดังเพลงดีของครูเพลงที่เสียชีวิตไปแล้ว อาทิ เพลงปลุกใจ เพลงหลวงวิจิตรวาทการ หลวงสุขุมนัยประดิษฐ์ พระเจนดุริยางค์ ครูไพบูลย์ บุตรขัน สุรพล สมบัติเจริญ ทูลกระหม่อมบริพัตร จิตร ภูมิศักดิ์ โดยแต่ละวงให้เรียบเรียงเพลงอย่างสุดฝีมือ ซึ่งเป็นความร่วมมือของสถาบันกัลยาณิวัฒนา กรุงเทพมหานคร และมูลนิธิสุกรี เจริญสุข
วันอาทิตย์ เวลา 17.30-19.00 น. ณ สวนหลวงพระราม 8 (บริเวณหน้าสถาบันดนตรีกัลยาณิวัฒนาติดกับสวนสะพานพระราม 8)
SWU MOVIE & MUSIC In The Garden & Walking Street 24-26 ม.ค.66
ขอเชิญชวนอาจารย์ บุคลากร และนิสิต มศว ร่วมกิจกรรมในโครงการ SWU MOVIE & MUSIC In The Garden & Walking Street ดูหนัง ฟังดนตรีสด ช๊อป ชิม ชิล ชม ในระหว่างวันที่ 24-26 มกราคม 2566 ตั้งแต่เวลา 17.00-21.00 น ณ สนามฝึกซ้อมซอฟท์บอล มศว องครักษ์ กิจกรรมภายในงานประกอบด้วย - กิจกรรมแอโรบิคเพื่อสุขภาพ - กิจกรรมดนตรี (Happy Music With good health and well-being) - กิจกรรมดูหนังกลางแปลง โดย นิสิต มศว ที่เข้าร่วมกิจกรรม 3 กิจกรรม จะได้รับการบันทึกกิจกรรมเลือก สอบถามเพิ่มเติมได้ที่ งานกิจกรรมนิสิต ส่วนกิจการนิสิต เคาน์เตอร์ 2 ชั้น 1 อาคารสำนักงานอธิการบดี ประสานมิตร เบอร์โทรศัพท์ 02-649-5000 ต่อ 15351 หรือ 02-260-9547 องครักษ์ ชั้น 1 อาคารกิจกรรมนิสิต มศว องครักษ์ เบอร์โทรศัพท์ 0-2649-5000 ต่อ 21307 หรือ 037-395-556
เกษตรอยุธยา หันตรา รัน 4 ก.พ.66 LINK
"ทุ่งหันตรา ทุ่งหาญกล้า เส้นทางศึกษาประวัติศาสตร์ วิ่งในเส้นทางเดินทัพพระยาตาก" งานวิ่งชิงแชมป์ ทุ่งหันตรา อยุธยา จัดโดย มหาวิทยาลัยราชมงคลเทคโนโลยีสุวรรณภูมิ วิทยาเขตอยุธยา 4 กุมภาพันธ์ 2566 ประเภทการแข่งขัน 10.5k ชาย/หญิง และ 5.7K ชาย/หญิง Overall และประเภท VIP วิ่งได้ทุกระยะทาง
งานวิ่งการกุศลไชยแสงปาร์ตี้รัน ฟันคอนเสิร์ต 2023 วันเสาร์ที่ 18 ก.พ.66 LINK
งานวิ่งการกุศลไชยแสงปาร์ตี้รัน ฟันคอนเสิร์ต 2023 วันเสาร์ที่ 18 กุมภาพันธ์ 2566 ณ ซีเอส พาร์ค อ. เมือง จ.สิงห์บุรี สอบถาม 036-595424 ต่อ 0 หรือ 082-917-4969 รายได้เพื่อนำไปซื้อเครื่องมือทางการแพทย์ให้แก่โรงพยาบาลท่าช้าง จ.สิงห์บุรี
ห้างไชยแสง ซูเปอร์สโตร์ ห้างคนไทยในจังหวัดสิงห์บุรี จัดงานวิ่งยามเย็นบรรยากาศดีๆชิลๆกับวิวทุ่งนาช่วงพระอาทิตย์ตกดิน และเสื้อวิ่งดีไซน์สุดแนวไม่เหมือนใคร นอกจากวิ่งแล้วยังมีอาฟเตอร์ปาร์ตี้สุดมันส์จากวง KLEAR และ DJ P-U ที่มาร่วมสร้างสีสันในงาน แอบกระซิบว่างานวิ่งนี้ของแจกเยอะมากกก อาหารก็คัดเจ้าดังในจังหวัดมาให้นักวิ่งได้อิ่มอร่อยกันแบบสุดๆ และยังได้ร่วมทำบุญ เพราะงานนี้รายได้หลังหักค่าใช้จ่ายจะนำไปมอบให้กับโรงพยาบาลท่าช้าง จ.สิงห์บุรี
วิ่ง ONAB RUN 2022 ครบรอบ 20 ปี สำนักงานพระพุทธศาสนา 12 ก.พ.66 LINK
สำนักงานพระพุทธศาสนาแห่งชาติ ขอเชิญชวนทุกท่านเข้าร่วมกิจกรรมวิ่ง mini half marathon ONAB RUN 2022 เนื่องในโอกาสวันสถาปนาสำนักงานพระพุทธศาสนาแห่งชาติ ครบรอบ 20 ปี
งานวิ่งจัดวันที่ 12 กุมภาพันธ์ 2566 ณ สวนพุทธมณฑล ต.ศาลายา อ.พุทธมณฑล จ.นครปฐม
ระยะการแข่งขัน 10 km. และ 5 km. เริ่มรับสมัครตั้งแต่วันนี้ จนถึงวันที่ 16 ธันวาคม 2565
DECATHLON RUN IN LOVE วิ่งหารัก ตามหาของ อาทิตย์ที่ 12 ก.พ.66 LINK
DECATHLON RUN IN LOVE วิ่งหารัก ตามหาของ
ในวันอาทิตย์ที่ 12 กุมภาพันธ์นี้ ????
จูงมือคนที่คุณรักมาที่ ดีแคทลอน พระราม2 กันได้เลย
เข้าร่วมได้ฟรีไม่มีค่าใช้จ่าย
กฎกติกาในการเข้าร่วม
- ผู้ที่เข้าร่วมจะต้องมาเป็นคู่หรือจับคู่กันมาแนะนำเป็นการใส่เสื้อคู่หรือสีเดียวกัน(ไม่บังคับเพศ)
- สำหรับคน walk in จะมีการจับคู่หน้างานให้
- Family (ผู้ใหญ่ 1 เด็ก 1/ผู้ใหญ่ 2 เด็ก 1)
วิธีการเล่นของกิจกรรม
ผู้เข้าร่วมทุกคนจะได้รับแผนที่รอบร้านดีแคทลอนพระราม2 ของเรา
โดยในแผนที่จะมีหมุดปักตามจุดไว้ นอกจากแผนที่ที่ได้รับแล้ว จะมีคำใบ้ปริศนาไว้ให้เพื่อที่จะเชื่อมโยงไปหาจุด RC นั้นๆ (ทุกครั้งที่เจอป้ายปริศนา RC ต้องถ่ายเซลฟี่คู่กับป้าย RC ทุกครั้ง) 1 จุด RC ในแผนที่มีคะแนน เท่ากับ 1 คะแนน
งานวิ่งเพื่อการกุศล UTHUMPHON RUN 2023 Season 2 วันอาทิตย์ที่ 12 ก.พ.66 LINK
งานวิ่งเพื่อการกุศล UTHUMPHON RUN 2023 Season 2 "เที่ยว วัด ปราสาท ไหว้หลวงปู่เครื่อง" วันจัดงาน : วันอาทิตย์ที่ 12 กุมภาพันธ์ 2566
สถานที่ : ณ วัดสระกำแพงใหญ่ อำเภออุทุมพรพิสัย จังหวัดศรีสะเกษ
ระยะที่เปิดรับสมัคร Fun Run 3 Km.
รายได้หลังหักค่าใช้จ่าย เพื่อพัฒนาคุณภาพชีวิตผู้ด้อยโอกาส โดยระดมทุนช่วยเหลือจัดซื้ออุปกรณ์ดูแล ช่วยเหลือผู้ป่วยติดเตียง ในการดูแลระยะยาว long term care ช่วยเหลือผู้ยากไร้และผู้ด้อยโอกาส ในพื้นที่อำเภออุทุมพรพิสัย จังหวัดศรีสะเกษ
เปิดรับสมัคร : วันอังคารที่ 8 พฤศจิกายน 2565 ตั้งแต่บัดนี้เป็นต้นไป
สมัครด้วยตัวเองได้ที่ : ณ ที่ว่าการอำเภออุทุมพรพิสัย
ชั้น 2 เวลา 08.30-16.30 น.(วันเวลาราชการ)
วิ่ง ดูด นม THAI-DENMARK RUN 2023 วันที่ 19 ก.พ.66 LINK
วิ่ง ดูด นม THAI-DENMARK RUN 2023 ฟาร์มโคนมไทย-เดนมาร์ค องค์การส่งเสริมกิจการโคนมแห่งประเทศไทย วิ่งวันที่ 19 กุมภาพันธ์ 2566 บริเวณ ฟาร์มโคนมไทย-เดนมาร์ค อ.มวกเหล็ก จ.สระบุรี ระยะทาง 21/12/5/3กิโลเมตร VIP ระยะทาง 3 / 5 / 12 / 21 กิโลเมตร
วิ่งเล่นบนทุ่งฟาร์มโคนมไทยเดนมาร์ค เส้นทางธรรมชาติ ผสมผสานถนนลาดยาง สลับสับเปลี่ยนให้ได้อรรถรสของครอส คันทรี เส้นทางทุกระยะจะพาทุกท่านไปชมคอกวัว เเละได้วิ่งดื่มนมยามเช้า ซึ่งจะเป็นไฮไลท์ของสนามนี้
BETTER BANGKOK RUN 2023 วิ่งเพื่อกรุงเทพที่ดีกว่า การไฟฟ้านครหลวง 5 ก.พ.66 LINK
MEA ขอเชิญร่วมกิจกรรม BETTER BANGKOK RUN 2023 : วิ่งเพื่อกรุงเทพที่ดีกว่า จัดโดย MEA ร่วมกับ AIS และกรุงเทพมหานคร เพื่อระดมทุนจัดหาซื้ออุปกรณ์อินเตอร์เนตไร้สาย (WiFi) ให้กับ 52 โรงเรียนในเครือกรุงเทพมหานคร โดยกิจกรรมจะจัดขึ้นในวันอาทิตย์ที่ 5 กุมภาพันธ์ 2566 ณ MEA อาคารวัฒนวิภาส การไฟฟ้านครหลวง สำนักงานใหญ่ คลองเตย
รับสมัครนักวิ่งจำนวนจำกัดรวมทุกระยะ เพียง 2,000 คนเท่านั้น
ระยะวิ่ง 13.5K / 5K ทุกระยะจัดส่ง RACE PACK ทางไปรษณีย์ ก่อนวันที่ 20 มกราคม 2566
ผู้สนใจสามารถสมัครร่วมกิจกรรมได้ระหว่างวันที่ 5 ธันวาคม 2565 (เปิดระบบ 06.00 น.) ถึงวันที่ 15 มกราคม 2566 ได้ที่
https://race.thai.run/bbr2023วิ่งสร้างเมือง RUN FOR BETTER CITY 2023 คณะสถาปัตย์ จุฬา 12 ก.พ.66 LINK
วิ่งสร้างเมือง RUN FOR BETTER CITY 2023 มีวัตถุประสงค์หาทุนดำเนินกิจกรรมบำเพ็ญประโยชน์เพื่อสาธารณะและชุมชน ซึ่งในปีนี้จะนำรายได้ส่วนหนึ่งจากการจัดงานนำไปสนับสนุนการสร้างที่อยู่อาศัย ให้กับคนไร้บ้านในเขตกรุงเทพมหานคร ( BANGKOK SHELTER ) และรายได้ที่เหลือจะนำไปสนับสนุนกิจกรรม ของนิสิตในคณะสถาปัตย์ จุฬาฯ และสนับสนุนการดำเนินงานของสมาคมนิสิตเก่าฯ
วันวิ่ง 12 กุมภาพันธ์ 2566 ปล่อยตัว ณ หน้าคณะสถาปัตยกรรมศาสตร์ จุฬามหาวิทยาลัย ตั้งแต่ 05.00 -09.00 น. จำนวนรับสมัครเพียง 2,566 คน เต็มปิดระบบทันที สอบถาม Hotline : 095-558-1556 สมัครได้ที่
race.thai.run/r4bc2023SEEMA RUNNING วันอาทิตย์ที่ 5 ก.พ.66 LINK
SEEMA RUNNING วันอาทิตย์ที่ 5 กุมภาพันธ์ 2566 ณ วัดเทพพิทักษ์ปุณณาราม (วัดพระขาว) ระยะวิ่ง 9.98 กิโลเมตร Mini Marathon / ระยะทาง 4.5 กิโลเมตร Fun Run / VIP วิ่งได้ทุกระยะทาง สนใจสอบถามรายละเอียดได้ที่ เทศบาลตำบลสีมามงคล 0-44361444 หรือ 0-845553557
สมัครออนไลน์ได้ที่ : www.pakchongrunning.com
67 ปี รพ.น่าน RUN RUN GUG รัน รัน กั๊ก (วิ่งรักกัน) 19 ก.พ.66 LINK
รพ.น่าน ขอเชิญรวมพล คน รัก กัน มาเดิน-วิ่ง ในงานครบรอบ 67 ปีโรงพยาบาลน่าน ในชื่องาน RUN RUN GUG รัน รัน กั๊ก (วิ่งรักกัน) รายได้เพื่อช่วยเหลือผู้ป่วยและสมทบทุนในการจัดซื้ออุปกรณ์ทางการแพทย์ ในวันอาทิตย์ที่ 19 กุมภาพันธ์ 2566 โดยจะเริ่มทำการเปิดรับสมัครตั้งแต่วันที่ 1 ธันวาคมนี้เป็นต้นไป สนใจรายละเอียดเพิ่มเติมทาง เฟซบุ๊ก เพจ : 67 ปี รพ น่าน Run Run Gug โดยจะเริ่มทำการเปิดรับสมัครตั้งแต่วันที่ 1 ธันวาคมนี้เป็นต้นไป สนใจรายละเอียดเพิ่มเติมทาง เฟซบุ๊ก เพจ : 67 ปี รพ น่าน Run Run Gug หรือทาง
งานวิ่ง 67 ปี รพ น่าน run run gug ให้วิ่งรักกัน ประเภท 5 / 10 / 21 กม. สมัครได้ถึง ขยายเวลารับสมัครถึง 31 มกราคม 2566 ที่
running.nanhospital.go.th/Chiangrai Marathon 2023 วันที่ 12 ก.พ.66 LINK
Chiangrai Marathon 12 กุมภาพันธ์ 2566 ศาลากลางจังหวัดเชียงราย
เปิดรับสมัคร 18 สิงหาคม 2565 เวลา 10:00 น.
ปิดรับสมัคร 31 มกราคม 2566 เวลา 23:59 น.
4 ประเภท ระยะทาง 5 I 10 I 21 I 42 กม.
วิ่งพันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 22 วันที่ 19 ก.พ.66
วิ่งพันท้าย สมุทรสาคร พันท้ายนรสิงห์ มินิ-ฮาล์ฟมาราธอน ครั้งที่ 22
วันจัดงาน 19 กุมภาพันธ์ 2566 เวลา 05.00 น.
สถานที่ ศาลพันท้ายนรสิงห์
Hum Music Run 2023 งานเดิน-วิ่งพร้อมดนตรีบรรเลง ม.เกษตร บางเขน 25 ก.พ.66 LINK
Hum Music Run 2023 งานเดิน-วิ่งพร้อมดนตรีบรรเลงบนเส้นทางที่สวยที่สุดใน ม.เกษตรศาสตร์ บางเขน จัดขึ้นโดยสมาคมนิสิตเก่าคณะมนุษยศาสตร์และสโมสรนิสิตคณะมนุษยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์
พบกับแขกรับเชิญสุดพิเศษทั้งศิษย์เก่าและศิษย์ปัจจุบันคณะมนุษยศาสตร์ฯ
สำหรับนิสิต มก.ทุกวิทยาเขตได้รับชั่วโมงกิจกรรมด้วยนะ!!
สถานที่ : พิพิธภัณฑ์วัฒนธรรมการเกษตร มหาวิทยาลัยเกษตรศาสตร์
วันที่: เสาร์ที่ 25 กุมภาพันธ์ 2566
เวลา: 05.00 น.
ระยะ: 3 km. และ 5 km.
ร่วมวิ่งและสนุกกับกิจกรรมภายในงาน พร้อมรับรางวัลมากมาย
ตาดหมอก มาราธอน 2023 วันที่ 12 ก.พ.66
วันที่ 12 กุมภาพันธ์ 2566
สถานที่ อุทยานแห่งชาติตาดหมอก (ด่านห้วยบง) จ.เพชรบูรณ์
ประเภทที่เปิดรับสมัคร : ฟูลมาราธอน 42 km. / ฮาล์ฟมาราธอน 21 km. / มินิมาราธอน 10 km. / ฟันรัน 5 km.
ข้อมูลเพิ่มเติม
เพจ Tatmok Marathon BORABUE RUN 2023 (บรบือรัน) 19 ก.พ.66
BORABUE RUN 2023 : THE ORIGIN OF SRIPHUME’S RIVER ต้นกำเนิดสายนทีแห่งศรีภูมิ งานวิ่งการกุศล เพื่อจัดซื้ออุปกรณ์การกีฬาให้แก่โรงเรียนในสังกัดองค์การบริหารส่วนตำบลหนองสิม อำเภอบรบือ จังหวัดมหาสารคาม โดย องค์การบริหารส่วนตำบลหนองสิม ร่วมกับชมรมนักวิ่งในอำเภอบรบือ ส่วนราชการ เอกชน ในพื้นที่อำเภอบรบือ
วันที่ 19 กุมภาพันธ์ 2566 เวลา 04.30-09.30 น
สถานที่ เส้นทางระหว่างหนองแจแว (บริเวณ อบต.หนองสิม) ไปยังบริเวณอ่างเก็บน้ำชลประทาน หนองบ่อ ในเขต อบต.หนองสิม/เทศบาลตำบลบรบือ อำเภอบรบือ จังหวัดมหาสารคาม
ตามข้อมูลที่
เพจ Borabue Run 2023Colorful Night Run 4 ก.พ.66 LINK
Colorful Night Run งานวิ่งกลางเมืองจันท์ กับสีสันคัลเลอร์ฟูล ยามค่ำคืน
วันเสาร์ที่ 4 กุมภาพันธ์ 2023 เวลา 18.00 น.
Start - Finish ศูนย์การค้าเซ็นทรัล จันทบุรี
ระยะวิ่ง 5KM / 10KM
รับสมัครวันนี้ - 21 มกราคม 2023
กิจกรรม Run Bike For love Uthaithani 12 ก.พ.66 LINK
กิจกรรม Run Bike For love Uthaithani “เพื่อส่งเสริมการท่องเที่ยว ตำบลทุ่งนางาม อำเภอลานสัก จังหวัดอุทัยธานี
วันอาทิตย์ ที่ 12 กุมภาพันธ์ 2566
ณ หุบป่าตาดแคมป์ และแหล่งท่องเที่ยวหุบป่าตาด ตำบลทุ่งนางาม อำเภอลานสัก จังหวัดอุทัยธานี
กิจกรรมในงานมีดังนี้
วิ่ง ระยะทาง 7 Km.
ปั่นจักรยาน ระยะทาง 10 Km.
หรือทั้งวิ่ง และปั่นจักรยาน
ทุกคนที่เข้าเส้นชัย จะไดรับเหรียญรางวัล
สมัครฟรีไม่เสียค่าใช้จ่าย รับสมัครได้ตั้งแต่วันที่ 15 มกราคม – 3 กุมภาพันธ์ 2566
:: 056 510981 องค์การบริหารส่วนตำบลทุ่งนางาม
:: 088-4270190 นุ
:: 0946349187 มาย
Chiang Mai Blooms Run 2023 อ.แม่ออน 18 ก.พ.66 LINK
Chiang Mai Blooms Run กิจกรรมส่งเสริมการท่องเที่ยวและสุขภาพ วัตถุประสงค์เพื่อ
1. ส่งเสริมการออกกำลังกาย ดูแลสุขภาพกับบรรยากาศธรรมชาติของอำเภอแม่ออน
2. รณรงค์ส่งเสริมการท่องเที่ยวในพื้นที่ของ อ.แม่ออน จ.เชียงใหม่
3. แนะนำสถานที่ท่องเที่ยวและของดีในพื้นที่ของ อ.แม่ออน จ.เชียงใหม่
4. ส่งเสริมวิสาหกิจชุมชน และร้านค้ารวมถึงชาวชุมชนในพื้นที่ของ
ระยะเวลาการจัดงาน: วันเสาร์ ที่ 18 กุมภาพันธ์ 2566 ตั้งแต่เวลา 05.00 น. - 11.00 น
สถานที่จัดงาน: ที่ว่าการอำเภอแม่ออน จังหวัดเชียงใหม่
วิ่ง Fun Run ระยะทาง 5 กิโลเมตร / Mini Marathon ระยะทาง 10.5 กิโลเมตร
ติดต่อเราได้ที่ (+66)8 9435 5256 อ.ดอย หรือ 08 1960 6431 คุณอู๋
รับสมัครจำนวนจำกัด เพียง 500 ท่านแรก
เปิดรับสมัคร ตั้งแต่ วันที่ 25 มกราคม 2566 - 10 กุมภาพันธ์ 2566
Free Workshop by Caffa 3 - 5 ก.พ. 2566 ลงทะบียนฟรี LINK
กลับมาอีกครั้ง กับ "Free Workshop by Caffa" คนรักกาแฟ อยากเรียนรู้เรื่องกาแฟ อยากเปิดร้านกาแฟ ไม่ควรพลาด มาที่เดียวจบทุกเรื่องกาแฟ สอนโดยเทรนเนอร์มืออาชีพ การันตีผลรางวัลมากมาย พร้อมทั้งเกร็ดความรู้ เทคนิคต่างๆ ในการชงกาแฟให้ได้อย่างมืออาชีพ
"Free Work Shop" (ลงทะเบียนฟรีไม่มีค่าใช้จ่ายใดๆ ทั้งสิ้น) **สิทธิ์มีจำนวนจำกัด รีบเลย!!
วันที่ 3 - 5 ก.พ. 2566 คัฟฟ่าฯสำนักงานใหญ่แจ้งวัฒนะ
สอบถามเพิ่มเติม 02-960-5228
26 ก.พ.66 Khlong Madeua Trail 2023 LINK
คลองมะเดื่อเทรล ครั้งที่ 6 จ.นครนายก พบกันที่ ภูเขางาม พาโนรามา รีสอร์ท วันอาทิตย์ที่ 26 กุมภาพันธ์ 2566 เทรลนี้ไม่เหมือนใครกับทางลาดหินชั้น บนเส้นทางเทรลที่เต็มไปด้วยความร่มรื่น และสวยงามของธรรมชาติที่สนุก สุดมันส์ พร้อมรับการท้าทาย จากสายน้ำ ต้นไม้มะเดื่อขนาดใหญ่มากในป่าลึก ที่โอบล้อมด้วยขุนเขา....
25-26 ก.พ.66 Suan Phueng 100 Ultra Marathon LINK
Suan Phueng 100 Ultra Marathon จัดโดย ชมรมวิ่งสวนรถไฟ ณ อำเภอสวนผึ้ง จ.ราชบุรี ระหว่างวันที่ 25-26 กุมภาพันธ์ 2566
นักวิ่งในระยะ 102, 80, 60, 42, 20 จะเริ่มสตาร์ทพร้อมกัน ณ บริเวณ จุด สต๊าร์ท ด้านหน้าที่ว่าการ อำเภอ สวนผึ้ง เวลา 15:00 น ของวันเสาร์ ที่ 25 กุมภาพันธ์ 2566
วิ่ง ชุมชน คน ช้าง ป่า 2022 (Run for community, wild elephant and forest 2022) LINK
กิจกรรมวิ่ง ชุมชน คน ช้าง ป่า 2022 (Run for community, wild elephant and forest 2022)ในวันอาทิตย์ที่ 5 กุมภาพันธ์ 2566 ณ วนอุทยานหริรักษ์ จังหวัดเลย ระยะทางวิ่ง 5 KM, 10 KM รายได้ทั้งหมดหลังหักค่าใช้จ่าย เพื่อนำมาเป็นกองทุนเยียวยาราษฎรที่ได้รับผลกระทบจากช้างป่าที่ออกมาทำลายทรัพย์สินราษฎรรอบแนวเขตป่าอนุรักษ์ และช่วยเหลือเจ้าหน้าที่ผู้ที่ได้รับความเดือดร้อนจากสัตว์ป่าทำร้ายร่างกายในพื้นที่รับผิดชอบ ของสำนักบริหารพื้นที่อนุรักษ์ที่ 8 (ขอนแก่น)
สัมมนาวิชาการยกระดับการเพาะปลูกกัญชาทางการแพทย์สู่มาตรฐานสากล 10 ก.พ.66
สัมมนาวิชาการยกระดับการเพาะปลูกกัญชาทางการแพทย์สู่มาตรฐานสากล โดยกรมแพทย์แผนไทยและการแพทย์ทางเลือก ร่วมกับเครือข่ายวิสาหกิจชุมชนนิคมสมุนไพรสัมพันธ์ตะวันตก ศุกร์ที่ 10 กุมภาพันธ์ 2566 เวลา 8-16.30 น. ณ วิสาหกิจชุมชนนิคมสมุนไพรสัมพันธ์ตะวันตก ต.วังกระแจะ อ.ไทรโยค กาญจนบุรี
อบรม กัญชง-กัญชา เชิงพาณิชย์และอุตสาหกรรม Goldenleaf Thailand 26 กุมภาพันธุ์ 2566 LINK
อบรม "กัญชง-กัญชา เชิงพาณิชย์และอุตสาหกรรม" พบกับวิทยากรผู้เชี่ยวชาญด้านการปลูกกัญชากัญชงเชิงพาณิชย์และอุตสาหกรรม เรียนทฤษฎีช่วงเช้า บ่ายเรียนภาคปฎิบัติจริงในการปลูกต้นกัญชง-กัญชา รุ่นที่ 11 ได้ความรู้กลับไปต่อยอด ธุรกิจ ????ความรู้อัดแน่น พาทำทุกขั้นตอน ????ตอบทุกข้อสงสัย ในการทำธุรกิจ ????ไม่ใช่แค่สอนปลูก ????แต่เราสอน ให้ทุกๆอย่าง ????ตั้งแต่การขอใบอนุญาต ????การปลูก ????การเพาะ ????หรือ การต่อยอดธุรกิจ พร้อมรับ Certificate และรับฟรี ผลิตภัณฑ์จากฟาร์ม
อบรมวันที่ 26 กุมภาพันธุ์ 2566 เวลาการจัดอบรม 09:00-17:00 น. Goldenleaf Hemp ต.สุรศักดิ์ อ.ศรีราชา จ.ชลบุรี ฟรีอาหารกลางวันและพักเบรค 2 มื้อ *มีค่าอบรม
++ จัดไปแล้ว ตารางให้บริการหน่วยเคลื่อนที่กทม.เดือนกุมภาพันธ์ 2566
วันอังคารที่ 28 ก.พ. 66 หมู่บ้านเมืองประชา ซ.หทัยราษฎร์ 35 เขตคลองสามวา เวลา 8.00 ถึง 12.00 น. ลงทะเบียนทำหมันหน้างาน รับจำนวนจำกัด 50 ตัว เท่านั้น
วันพุธที่ 22 ก.พ. 66 มัสยิตอัตตั๊กวา มีนบุรี
วันจันทร์ที่ 20 ก.พ. 66 หมู่บ้านเสนานิเวศน์ โครงการ 2 ลาดพร้าว
วันศุกร์ที่ 17 ก.พ. 66 ชุมชนร่วมใจ เขตสวนหลวง
ชุมชนเพชรสยาม เขตบางเขน เวลา 8.00 ถึง 12.00 น. ลงทะเบียนทำหมันหน้างานรับจำนวนจำกัด 50 ตัว เท่านั้น
วันพฤหัสบดีที่ 16 ก.พ. 66 วัดดีดวด บางกอกใหญ่
ณ วัดสุคันธาราม เขตดุสิต ตั้งแต่เวลา 09.00 - 13.00 น. อดอาหารก่อนนะ สอบถามโทร.02-2435311 ถึง 5 ต่อ 5421
วันพุธที่ 15 ก.พ. 66 ชุมชนบางกระบือ 14 เขตดุสิต
ซอยคู้บอน 27 แยก 42 เขตบางเขน
เวลา 8.00 ถึง 12.00 น. ลงทะเบียนทำหมันหน้างาน รับจำนวนจำกัด 50 ตัว เท่านั้น
วันอังคารที่ 14 ก.พ. 66 ณ ชุมชนริมทางรถไฟมักกะสัน เขตราชเทวี กรุงเทพมหานคร ทำหมัน จำกัดจำนวน 20 ตัว บริการฉีดวัคซีนโรคพิษสุนัขบ้า 200 ตัว ฟรีไม่เสียค่าใช้จ่าย - สามารถลงทะเบียนจองคิวทำหมันสุนัขและแมวได้ที่ https://lin.ee/aM5XGZ9 - กรณีลงทะเบียนจองคิวไม่ทันสามารถลงทะเบียนที่หน้างานได้ตั้งแต่ 08.30-10.00น. จำนวนจำกัด ขึ้นอยู่กับเจ้าหน้าที่ปฏิบัติงาน
วันจันทร์ที่ 13 ก.พ. 66 ณ วัดเพลง ซอยจรัญสนิทวงศ์75 ตั้งแต่เวลา 09.00 น. จำกัดจำนวน 30 ตัว เฉพาะบริการทำหมัน เท่านั้น เฉพาะคนในพื้นที่บางพลัดเท่านั้น ต้องลงทะเบียนล่วงหน้าเท่านั้น (ไม่รับลงทะเบียนหน้างาน) ลงทะเบียนติดต่อสอบถามเพิ่มเติม โทร.097-2796016
วันอาทิตย์ที่ 12 ก.พ. 66 ณ สวนลุมพินี งาน Health in Park เวลา 08.00 - 12.00 น.
วันพฤหัสบดีที่ 9 ก.พ. 66 ที่หมู่บ้านเคหะธาณี 2 ซ.นวลจันทร์ 56 เขตบึงกุ่ม เวลา 8.00 ถึง 12.00 น. รับจำนวนจำกัด 50 ตัว เท่านั้น ลงทะเบียนทำหมันหน้างาน
วันพฤหัสบดีที่ 9 ก.พ. 66 กทม. จัดกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" มีทำหมันหมาแมว ฉีดวัคซีน ฝังไมโครชิป ณ ชุมชนหัวรถจักรตึกแดง เขตบางซื่อ ตั้งแต่เวลา 08.00-14.00 น.
วันอังคารที่ 7 ก.พ. 66 มีหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่หมู่บ้านสหกรณ์ ซ.เสรีไทย 57 เขตบึงกุ่ม เวลา 8.00 ถึง 12.00 น.
วันจันทร์ที่ 6 ก.พ. 66 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยสัตวแพทย์เคลื่อนที่ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้แมว ฟรี ที่มัสยิดอัลอิสติกอมะห์ เขตทุ่งครุ เวลา 9.00 - 11.00 น
วันศุกร์ที่ 3 ก.พ. 66 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สุนัขและแมว ฟรี ที่ชุมชนวัดสุทธาโภชน์สุนทรอุปถัมป์ เเขวงทับยาว เขตลาดกระบัง เวลา 9.00 ถึง 11.00 น.
วันพฤหัสบดีที่ 2 ก.พ. 66 สำนักงานสัตวแพทย์สาธารณสุข มีหน่วยฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ให้สุนัขและแมว ฟรี ที่ชุมชนการเคหะทุ่งสองห้อง เขตหลักสี่ เวลา 9.00 - 11.00 น.
วันพฤหัสบดีที่ 2 ก.พ. 66 มีทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่หมู่บ้านมโนรมย์ 4 แขวงสามวาตะวันตก เขตคลองสามวา เวลา 8.00 ถึง 12.00 น.
วันพุธที่ 1 ก.พ. 66 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้สุนัขและแมว ฟรี ที่ชุมชนบ้านทับยาว เเขวงทับยาว เขตลาดกระบัง เวลา 9.00 ถึง 11.00 น.
เทศกาลดนตรีท่ามกลางมรดกโลก 2023 รับเทศกาลแห่งความรัก 11-12 กุมภาพันธ์ 2566 LINK
เทศกาลดนตรีท่ามกลางมรดกโลก2023 รับเทศกาลแห่งความรัก
11 กุมภาพันธ์ 2566 ซิมโฟนีศรีอยุธยา เสพดนตรีจากวงออเคสตร้า เจ้าของเหรียญทองระดับโลก Nontri Orchestra Wind ที่จะเล่าเรื่องราวของอยุธยาผ่านเสียงเพลง
12 กุมภาพันธ์ 2566 ฟรีคอนเสิร์ตสุดสนุกทนำโดยบร๊ะเจ้าโจ๊ก โจ๊ก โซคูล
ตลาดร้านค้ากว่า 60 ร้าน จุดถ่ายภาพ ประดับไฟงดงาม นิทรรศการภาพวาด โดยมีความงดงามของอาคารศาลากลางหลังเก่าอยู่เบื้องหลัง พบกันหน้าศาลากลางเก่า พระนครศรีอยุธยา 16.30 น. เป็นต้นไป เข้าชมฟรีตอดงาน
คอนเสิร์ตเทศกาลขับร้องประสานเสียงจุฬาฯ FESTIVAL CONCERT 1 & 2
คอนเสิร์ตเทศกาลขับร้องประสานเสียงจุฬาฯ (มี 2 วัน – วงไม่ซ้ำ )
FESTIVAL CONCERT 1: วันเสาร์ที่ 11 กุมภาพันธ์ 2566 เวลา 19.00 น. ณ หอแสดงดนตรี อาคารศิลปวัฒนธรรม จุฬาลงกรณ์มหาวิทยาลัย
⦁ Yala Municipality Orchestra Choir
⦁ คณะนักร้องประสานเสียงโรงเรียนสารสาสน์วิเทศร่มเกล้า
⦁ YAMP Choir วิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล
⦁ KMUTT CHORUS มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี
⦁ KMITL Chorus สถาบันเทคโนโลยีพระจอมเกล้าเจ้าคุณทหารลาดกระบัง
FESTIVAL CONCERT 2: วันอาทิตย์ที่ 12 กุมภาพันธ์ 2566 เวลา 18.00 น. ณ หอแสดงดนตรี อาคารศิลปวัฒนธรรม จุฬาลงกรณ์มหาวิทยาลัย
⦁ Chulalongkorn University Concert Choir
⦁ Siam Ruby Women’s Choir
⦁ Kasetsart University Concert Choir
⦁ AU Chorus มหาวิทยาลัยอัสสัมชัญ
⦁ ชมรมขับร้องประสานเสียง CMU Choir โรงเรียนเบญจมเทพอุทิศ จังหวัดเพชรบุรี
⦁ MU Men’s Choir มหาวิทยาลัยมหิดล
⦁ คณะนักร้องประสานเสียง แห่งมหาวิทยาลัยมหิดล (MU Choir)
⦁ Mass Choir - under the baton of Dr. Jo-Michael Scheibe
ไม่เสียค่าเข้าชม
โปรดลงทะเบียนล่วงหน้า
ไม่มี LIVE
รับชมบันทึกการแสดงได้ภายหลังที่ Youtube: CU Art Culture
ประวัติศาสตร์วัฒนธรรมจีนในไทยผ่านบทเพลง A Musical Journey Through A Century of Yaowarat LINK
สำนักงานศิลปวัฒนธรรมร่วมสมัย กระทรวงวัฒนธรรม ร่วมกับ SATARANA และ วิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล นำโดย ดร.ณรงค์ ปรางค์เจริญ คณบดีวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล ศิลปินศิลปาธร สาขาดนตรี ปี ๒๕๕๐
นำเสนอการแสดงดนตรีร่วมสมัย “ประวัติศาสตร์วัฒนธรรมจีนในไทยผ่านบทเพลง A Musical Journey Through A Century of Yaowarat” ควบคุมวงโดย ภมรพรรณ โกมลภมร เป็นการนำเสนอบทเพลงที่เป็นตัวแทนของช่วงสมัยต่างๆ ของเยาวราชในช่วงประมาณ ๑๐๐ ปีที่ผ่านมา โดยคัดเลือกบทเพลงที่สะท้อนอิทธิพลและบทสนทนาระหว่างสังคมจีน – ไทย นำโดย ศ.(เกียรติคุณ) นพ.พูนพิศ อมาตยกุล และ ธนพล เศตะพราหมณ์ อีกทั้งยังมีศิลปินรับเชิญ พญ.พันทิวา สินรัชตานันท์ นักร้องต้นฉบับ เพลงเทพธิดาดอย ปี 2523 รวมถึงบทเพลงที่โด่งดังในสมัยนั้น เพลงไทยเดิมที่มีรากเติบโตมาจากสังคมจีน เพลงละครเวที และเพลงละครโทรทัศน์ เป็นต้น
สามารถเข้าร่วมรับชมการแสดง โดยไม่มีค่าใช้จ่าย ในวันที่ 12 กุมภาพันธ์ 2566
เวลา 18.30 -19.30 น ณ ตลาดเก่าเยาวราช
BCS ชวนปั่นเดือนกุมภาพันธ์ ในธีม ชวนปั่น BKKDW2023 วันเสาร์ที่ 11 กุมภาพันธ์ 2566
BCS ชวนปั่นเดือนกุมภาพันธ์ ในธีม “ชวนปั่น BKKDW2023”
ปีละครั้งที่จะชวนนักปั่นสายอาร์ตดูงาน Bangkok Design Week
วันเสาร์ที่ 11 กุมภาพันธ์ 2566
(รับจำนวน 10 คน)
16.00 น. นัดพบบริเวณ ที่จอดรถราชนาวีสโมสร (ท่าช้าง)
16.30 น. เริ่มปั่น ปั่น ปั่นตามเส้นทางบนท้องถนนไปชมภาพวาดจากตัวอักษร ณ บ้านเจ้าพระยาธรรมศักดิ์มนตรี พาไปเล่าเรื่องย่านผ่านเรื่องทอง ณ โรงพิมพ์บำรุงนุกูลกิจ สักการะสิ่งศักดิ์สิทธิ์ของศาลเจ้าเล่งบ๊วยเอี๊ยะด้วยธูปต้นแบบศิลปากรรังสรรค์ ชมศิลปะการออกแบบสิ่งทอที่บอกเล่าวิถีชีวิตและความเป็นมาของชุมชนเลื่อนฤทธิ์ ปิดท้ายปั่นย้อนรอยชมอาคารประวัติศาสตร์ ณ การประปาแม้นศรี ก่อนพาทานของอร่อยให้หายคลายหิวเป็นอันจบทริปปั่นค่ำคืนนี้
21.00 น. เสร็จสิ้นกิจกรรม (โดยประมาณ)
สิ่งที่ต้องเตรียม : บรอมตันคันโปรด หมวกกันน็อค ไฟหน้าหลัง น้ำดื่ม หน้ากากอนามัย
หมายเหตุ :
1. ผู้เข้าร่วมกิจกรรมเป็นผู้ดูแลค่าอาหาร เครื่องดื่ม ค่าบริการที่จอดรถ ระหว่างเข้าร่วมกิจกรรมด้วยตนเอง
2. ระยะทางปั่น 20 กม. โดยประมาณ
3. กำหนดการอาจมีการเปลี่ยนแปลง ขึ้นอยู่กับสภาพดินฟ้าอากาศ
4. กรณีที่ค่าฝุ่นสูงถึงระดับที่ไม่ควรทำกิจกรรมกลางแจ้ง BCS ขออนุญาตยกเลิกการจัดกิจกรรม โดยจะแจ้งให้ทุกท่านทราบล่วงหน้า
กิจกรรม "ปั่นส่งน้องเรียน" วันอาทิตย์ที่ 19 กุมภาพันธ์ 66 LINK
รับสมัครร่วมปั่น ฟรีไม่มีค่าใช้จ่าย !!...กับกิจกรรม "ปั่นส่งน้องเรียน" รับจำนวนจำกัด วันอาทิตย์ที่ 19 กุมภาพันธ์นี้ เวลา 05.30 น. เริ่มปั่นประมาณ 06.00 น. ณ วัดบวรนิเวศราชวรวิหาร บริเวณลานด้านหน้าพระอุโบสถ ที่จอดรถรอบๆ วัด และลานคนเมือง ศาลาว่าการกรุงเทพมหานคร ***สมาชิกท่านใดสนใจจะไปร่วมกิจกรรมปั่นในครั้งนี้ด้วยกันในนามของเพจกลุ่มBike Story…”จักรยานเล่าเรื่อง” สามารถแจ้งชื่อนามสกุล ในคอมเมนต์ใต้โพสต์นี้ (
Bike Community) เพื่อเข้าร่วมปั่นได้เลยครับ รับเพียง 250 ท่าน...ไม่ได้รับเสื้อ
สิรินธรราชวิทยาลัย มินิมาราธอน ครั้งที่ 2 วันที่ 19 ก.พ.66 LINK
สิรินธรราชวิทยาลัย มินิมาราธอน ครั้งที่ 2 ( ภาพวิ่งฟรีทุกระยะทาง ) วันที่ 19 กุมภาพันธ์ 2566 โรงเรียนสิรินธรราชวิทยาลัย จ.นครปฐม ชิงถ้วยพระราชทานและเหรียญรางวัลพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ระยะทาง 10.5 / 5.8 / 3 กิโลเมตร
แม่โจ้ อบรมเชิงปฏิบัติการ การผลิตกัญชาอินทรีย์ระดับพรีเมี่ยม 25 กุมภาพันธ์ 2566 LINK
ศูนย์วิจัยและพัฒนาเกษตรธรรมชาติ มหาวิทยาลัยแม่โจ้ เปิดอบรมเชิงปฏิบัติการที่คุณไม่ควรพลาดเรื่อง การผลิตกัญชาอินทรีย์ระดับพรีเมี่ยม และการนำชิ้นส่วนกัญชาไปใช้ประโยชน์ พร้อมบรรยายพิเศษ
- ข้อจำกัดพืชกัญชาที่ไม่ควรมองข้าม
- สายพันธุ์กัญชาที่เหมาะสม
- การจัดการแปลงปลูกในโรงเรือนและกลางแจ้ง
- การจัดการดิน วัสดุปลูก ธาตุอาหาร และศัตรูพืชในระบบเกษตรอินทรีย์
- การแปรรูปผลผลิตเป็นผลิตภัณฑ์
ในวันเสาร์ที่ 25 กุมภาพันธ์ 2566 เริ่มตั้งแต่เวลา 08.30 – 17.00 น. ณ ห้องประชุมใหญ่ ศูนย์วิจัยและพัฒนาเกษตรธรรมชาติ มหาวิทยาลัยแม่โจ้ ต้องทำการ
ลงทะเบียนเพื่อเข้าร่วมเท่านั้น!!
สอบถามเพิ่มเติมได้ทาง :LINE ID : @rpf_mjushop
งานมหกรรม รากกัญชาอินทรีย์เพื่อทางการแพทย์ 2 กุมภาพันธ์ 2566
งานมหกรรม รากกัญชาอินทรีย์เพื่อทางการแพทย์ ร่วมชม ร่วมชิม ร่วมฟัง บรรยายพิเศษเกี่ยวกับการใช้ประโยชน์จากรากและชิ้นส่วนกัญชา เพื่อทางการแพทย์, การขออนุญาติปลูกและจำหน่ายอย่างถูกต้องตามกฏหมาย ร่วมรับชมกิจกรรมสาธิตการนำรากกัญชามาใช้ประโยชน์ และบูธจำหน่ายผลิตภัณฑ์กัญชาอีกมากมาย ในวันพฤหัสบดีที่ 2 กุมภาพันธ์ 2566 ตั้งแต่เวลา 08.30 - 15.00 น. ณ ศูนย์วิจัยและพัฒนาเกษตรธรรมชาติ มหาวิทยาลัยแม่โจ้ ฟรี!! ไม่มีค่าใช้จ่าย
การขยายพันธุ์กัญชงระดับอุตสาหกรรม รุ่นที่ 1 และ 2 วันที่ 4-5 และ 11-12 กุมภาพันธ์ 2566 LINK
ศูนย์ความเป็นเลิศด้านกัญชาและเกษตรอินทรีย์นานาชาติ มหาวิทยาลัยราชภัฏเชียงใหม่ ขอเชิญเข้าร่วม การอบรมเชิงปฏิบัติการ เรื่อง “การขยายพันธุ์กัญชงระดับอุตสาหกรรม ด้วยเทคนิคการเพาะเลี้ยงเนื้อเยื่อพืชอย่างง่าย รุ่นที่ 1 และ 2”
ฟรี!!! ค่าลงทะเบียน พร้อมเอกสาร และอาหารกลางวัน
รับจำนวนจำกัดเพียง 30 ท่าน
????รุ่นที่ 1 วันที่ 4-5 กุมภาพันธ์ 2566 เวลา 9.00-16.00 น
การสมัคร
https://forms.gle/oaQC1yKEsooqbQUZ9
????รุ่นที่ 2 วันที่ 11-12 กุมภาพันธ์ 2566 เวลา 9.00-16.00 น
การสมัคร
https://forms.gle/698cVp5v1oJBZfm66
สถานที่อบรม
ณ ห้องเก็บและเตรียมตัวอย่าง ชั้น 1 อาคาร ศูนย์ความเป็นเลิศด้านกัญชาและเกษตรอินทรีย์นานาชาติ มหาวิทยาลัยราชภัฏเชียงใหม่ (อาคาร B)
163 หมู่ 3 ต.แม่สา อ.แม่ริม จ.เชียงใหม่
กิจกรรมดนตรีในสวนกรุงเทพมหานคร 18-19 กุมภาพันธ์ 2566
กิจกรรมดนตรีในสวนกรุงเทพมหานครสัปดาห์นี้ ออกไปใช้ชีวิตกัน!! ใกล้สวนไหนไปสวนนั้น
*ดนตรีในสวน กิจกรรมพักผ่อนหย่อนใจ สร้างเศรษฐกิจ เปิดพื้นที่สวนสาธารณะ สังกัด กทม. ให้เด็กรุ่นใหม่ มีฝัน มีไฟ ได้โชว์ของ
วันเสาร์ ที่ 18 กุมภาพันธ์ 2566
สวนลุมพินี พบกับ...
✨ Together เวลา 17.00 - 17.40 น.
✨ I love Wednesday x Elle เวลา 17.40 - 18.20 น.
✨ วง 2 ทุ่ม เวลา 18.20 - 19.00 น.
✨ Nursery Sound เวลา 19.00 - 20.00 น.
สวนสันติชัยปราการ พบกับ..
✨ AMARA Brass เวลา 16.30 - 17.00 น.
✨ Christ The Pianist เวลา 17.00 - 17.40 น.
✨ Mark Atkins สถานทูตออสเตรเลีย เวลา 17.40 - 18.20 น.
✨ 21 JAZZBAND เวลา 18.20 - 19.00 น.
✨ ขุนอิน เวลา 18.20 - 19.00 น.
วันอาทิตย์ ที่ 19 กุมภาพันธ์ 2566
สวนเฉลิมพระเกียรติ 6 รอบ พระชนมพรรษา (สะพานพระราม 9) พบกับ...
✨ Man Auttawut เวลา 17.00 - 17.40 น.
✨ Bestfeels เวลา 17.40 - 18.20 น.
✨ Pimploy Band เวลา 18.20 - 19.00 น.
✨ Rooftop เวลา 19.00 - 20.00 น.
สวนสันติชัยปราการ พบกับ...
✨ Yellow Brown Band โรงเรียนหอวัง เวลา 17.00 - 17.40 น.
✨ Proprio เวลา 17.40 - 18.20 น.
✨ OME เวลา 18.20 - 19.00 น.
✨ PAE SAX เวลา 19.00 - 20.00 น.
สวนลุมพินี พบกับ...
ดนตรีในสวน ครั้งที่ 30 ณ ศาลาภิรมย์ภักดี (บริเวณสวนปาล์ม) เวลา 17.30 น. เป็นต้นไป
โดยวง ROYAL BANGKOK SYMPHONY ORCHESTRA
ตารางการให้บริการเดือนกุมภาพันธ์ 2566
6 ก.พ. เขตบึงกุ่ม หมู่บ้านร่มไทร ศบส.56 , เขตบางนา ชุมชนเคหะบางนา ศบส.8
7 ก.พ. เขตบึงกุ่ม หมู่บ้านสราญรมย์ ศบส.56 , เขตบางเขน มรภ.พระนคร ศบส.24
8 ก.พ. เขตบางเขน มรภ.พระนคร ศบส.24, เขตภาษีเจริญ ชุมชนราชมนตรีร่วมใจ ศบส.47
9 ก.พ. บางซื่อ ชุมชนหัวรถจักรตีกแดง กองสร้างเสริมสุขภาพ , ราชเทวี ชุมชนริมทางรถไฟมักกะสัน ศบส.2
10 ก.พ. เขตบึงกุ่ม หมู่บ้านร่มไทร ศบส.56 , บางคอแหลม ศบส.14
13 ก.พ. เขตบึงกุ่ม ชุมชนคลองลำเจียก ศบส.56 , เขตบางนา ชุมชนเฉลียง ศบส.8
14 ก.พ. เขตบึงกุ่ม หมู่บ้านวังทองเฮ้าส์ ศบส.56 , เขตภาษีเจริญ ชุมชนวัดมะพร้าวเตี้ย ศบส.47
15 ก.พ. เขตจตุจักร ตลาดประชานิเวศน์ ศบส.17 , ตลิ่งชัน วัดชัยพฤกษมาลา ราชวรวิหาร ศบส.49
16 ก.พ. เขตบึงกุ่ม หมู่บ้านอินทรารักษ์ ศบส.56 , ตลิ่งชัน วัดชัยพฤกษมาลา ราชวรวิหาร ศบส.49
17 ก.พ. เขตบึงกุ่ม หมู่บ้านวังทองเฮ้าส์ ศบส.56 , ลาดกระบัง รร.วัดปากบึง รร.เคหะชุมชนลาดกระบัง ศบส.45
20 ก.พ. เขตบึงกุ่ม ชุมชนสินธนา 5 ศบส.56 , ทุ่งครุ ศบส.59
21 ก.พ. เขตบึงกุ่ม มหาทรัพย์คอนโด ศบส.56 , เขตจตุจักร ตลาดอมรพันธ์ ศบส.17
22 ก.พ. เขตบึงกุ่ม หมู่บ้านสามัคคี 53 ศบส.56 , เขตมีนบุรี มัสยิดอัตตั๊กวา กองสร้างเสริมสุขภาพ
23 ก.พ. เขตบึงกุ่ม บุญสิตาคอนโด ศบส.56 , ตลิ่งชัน วัดชัยพฤกษมาลา ราชวรวิหาร ศบส.49
24 ก.พ. เขตจตุจักร ศูนย์กีฬาประชานิเวศน์ ศบส.17 , เขตคลองเตย ชุมชนวัดคลองเตยใน 2 ศบส.41
27 ก.พ. เขตราชเทวี ซอยเพชรบุรี 21 ศบส.2 , เขตบึงกุ่ม ศบส.56
28 ก.พ. เขตบางเขน ตลาดถนอมมิตร ศบส.24 , ทุ่งครุ รร.ราษฏร์บูรณะ ศบส.59
หลักสูตรการใช้งาน MS Office อย่างมืออาชีพสำหรับสำนักงาน วันที่ 18-19 กุมภาพันธ์ 2566
"หลักสูตรการใช้งาน MS Office อย่างมืออาชีพสำหรับสำนักงาน"
อบรมระหว่างวันที่ 18-19 กุมภาพันธ์ 2566
เวลา 09.00-16.30 น.
เหมาะสำหรับผู้ที่ต้องการฝึกเริ่มต้นใช้งานโปรแกรม Microsoft Office เพราะการมีความรู้ คอมพิวเตอร์เบื้องต้น มีความจำเป็นในชีวิตการทำงานปัจจุบัน ดังนั้นผู้ที่มีความรู้และสามารถใช้งาน โปรแกรมคอมพิวเตอร์ได้ ย่อมมีโอกาสในการได้งานที่สูงกว่า
ศูนย์พัฒนาทักษะและการเรียนรู้ ICT เทศบาลนครขอนแก่น จึงได้จัดทำหลักสูตรสำหรับอบรมการใช้งานคอมพิวเตอร์สำหรับโปรแกรม Microsoft Office เบื้องต้น Version 2019 โดยใช้เวลาการอมรมทั้งสิ้น 2 วัน (12 ชั่วโมง)
หลักสูตรการพัฒนาอุปกรณ์ Smart Device และการประยุกต์ใช้งาน วันที่ 25-26 กุมภาพันธ์ 2566
"หลักสูตรการพัฒนาอุปกรณ์ Smart Device และการประยุกต์ใช้งาน"
อบรมระหว่างวันที่ 25-26 กุมภาพันธ์ 2566 เวลา 09.00-16.30 น.
ในปัจจุบันอุปกรณ์หรือเครื่องมือสมัยใหม่ได้นำเทคโนโลยีระบบสมองกลฝังตัว (Embedded System) เข้ามาใช้ควบคุมการทำงานทำให้ได้อุปกรณ์ต่างๆ สามารถประมวลผลและควบคุมการทำงานที่มีความซับซ้อนได้ โดยมีวัตถุประสงค์หลักเพื่อสร้างระบบแจ้งเตือนแบบออนไลน์ ผ่านแอพพลิเคชั่นบนสมาร์ทโฟน ซึ่งสามารถนำไปประยุกต์ใช้ในการแจ้งเตือนต่างๆ ได้ เช่น เตือนไฟใหม้ น้ำล้น ผู้บุกรุก ผู้ป่วยกดปุ่มส่งสัญญาณแจ้งเตือน และอื่นๆ อีกมากมาย โดยการอบรมดังกล่าวจะมีทั้งภาคทฤษฎีและภาคปฏิบัติการด้วยการใช้งานบอร์ดไมโครคอนโทรลเลอร์ และการเขียนโปรแกรมควบคุมอุปกรณ์ต่างๆ
ท่ายางดีจัง ตอน ท่ายางที่รัก 18 - 19 ก.พ.66
งานท่ายางดีจัง ตอน ท่ายางที่รัก วันที่ 18 - 19 กุมภาพันธ์ 2566 เวลา 16.30 เป็นต้นไป ณ ซอยโกอาง / ซอย 1(เก่า) / ซอย 2 (เก่า) - ชม ชิม แชะ : อาหารถิ่น ศิลปะวัฒนธรรมชุมชน มาเดินเล่นชิล ๆ ฟังเพลงเพลิน ๆ ชมแกลอรี่ถ่ายภาพ ว้าว@ท่ายาง และสนุกสนานไปกับกิจกรรมมากมาย สอบถามข้อมูลเพิ่มเติม : 032-463-000
ฉายหนังไทย สันติ - วีณา เครื่องฉายฟิล์ม เตาถ่าน 3 กุมภาพันธ์ 66 LINK
ภาพยนตร์ไทย กับ เครื่องฉายฟิล์ม เตาถ่าน สันติ - วีณา ภาพยนตร์ไทยที่ใช้ฉากถ่ายทำที่จังหวัดเพชรบุรี ออกฉายเมื่อปี 2597 เป็นภาพยนตร์ไทยเรื่องแรกที่สร้างด้วยฟิล์มสี 35 มม. วันศุกร์ที่ 3 กุมภาพันธ์ 2566 นี้ หอภาพยนตร์ (องค์การมหาชน) จะนำฟิล์มภาพยนตร์เรื่อง สันติ - วีณา มาฉายที่ นาบุญข้าวหอม ตำบลไร่ส้ม อำเภอเมืองเพชรบุรี ให้ได้ชมกันเต็มเรื่อง วันศุกร์ที่ 3 พรประเสริฐภาพยนตร์ ทีมงานหนังกลางแปลงที่สร้างความสุขให้กับชาวเมืองเพชรมารุ่นต่อรุ่น โดย สุภาพ สุสุทธิ จะนำเครื่องฉายหนังที่เก็บ ดูแล รักษาไว้เป็นอย่างดี ออกมาฉายภาพยนตร์เรื่อง สันติ - วีนา ที่กลางทุ่ง นา บุญข้าวหอม เพื่อสร้างความสุขให้กับชาวเมืองเพชรอีกครั้ง จัดโดย นาบุญข้าวหอมและเพื่อนเครือข่าย ร่วมกับ หอภาพยนตร์ (องค์การมหาชน)
งานวิ่ง Kaengkrachan Explorer Run 2023 วันที่ 5 ก.พ.66
"งานวิ่ง Kaengkrachan Explorer Run 2023" งานวิ่งที่เส้นทางสวยสุดในพื้นที่แก่งกระจาน พบกัน วันที่ 5 กุมภาพันธ์ 2566 ณ แก่งกระจาน ริเวอร์ไซด์รีสอร์ท แอนด์ แค้มป์ปิ้ง (KRSC Thailand) อำเภอแก่งกระจาน จังหวัดเพชรบุรี
งานทำบุญข้าวใหม่เดือนสาม เผาข้าวหลามชากบก 13 - 15 กุมภาพันธ์ 2566
งานทำบุญข้าวใหม่เดือนสาม เผาข้าวหลามชากบก กิจกรรมเผาข้าวหลาม 10,000 กระบอก ร้านค้าร้านอาหาร รำวงย้อนยุค และการแสดงจากศิลปิน พบกัน 13 - 15 กุมภาพันธ์ 2566 นี้ เทศบาลตำบลชากบก
ราชมงคลรักษ์เหลืองจันท์วันดอกไม้บาน ครั้งที่ 21 วันที่ 11 - 19 กุมภาพันธ์ 2566
ชวนเที่ยวงาน ราชมงคลรักษ์เหลืองจันท์วันดอกไม้บาน ครั้งที่ 21 ระหว่างวันที่ 11 - 19 กุมภาพันธ์ 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก วิทยาเขตจันทบุรี
งาน Coffee And Friends Chanthaboon 2023 วันที่ 18-19 กุมภาพันธ์ 66
กลับมาอีกครั้งกับงาน Coffee And Friends Chanthaboon 2023 ???? วันที่ 18-19 กุมภาพันธ์ 66 ตั้งแต่เวลา 09:00-16.00 น. ณ ศาลเจ้าที่ตลาดล่าง ชุมชนริมน้ำจันทบูร อ.เมืองจันทบุรี จ.จันทบุรี มาลิ้มลองรสชาติและสัมผัสกลิ่นอันหอมกรุ่นจากกาแฟไทย อิ่มเอมกับเบเกอรี่และดนตรีแสนไพเราะ บรรยากาศริมแม่น้ำจันทบูร สบายๆ มาจิบแบบไม่รู้จบไปด้วยกัน เตรียมพบบูธกาแฟและBakery จากคาเฟ่ร้านดัง กว่า 30 ร้าน มาร่วมกันรักษ์และใส่ใจโลกของเรา เพียงคุณพก ถุงผ้า กระบอกน้ำ หรือแก้วกาแฟส่วนตัว มาใส่กาแฟภายในงาน รับส่วนลด 5 บาท
งานพิธีบูชาดาว ประจำปี 2566 วันที่ 2-6 ก.พ.2566
ขอเชิญร่วมงานพิธีบูชาดาว ประจำปี 2566 วันที่ 2-6 ก.พ.2566 ณ วัดเขตร์นาบุญญาราม อ.เมือง จ.จันทบุรี อารามเก่าแก่ในจังหวัดจันทบุรี
ปฏิทินการท่องเที่ยวจังหวัดจันทบุรี เดือนมกราคม-กุมภาพันธ์ 2566
ปฏิทินการท่องเที่ยวจังหวัดจันทบุรี เดือนมกราคม-กุมภาพันธ์ 2566
งานมหกรรมการแสดงศิลปวัฒนธรรมไทย 4 ภาค
"สืบศิลป์ สร้างสรรค์ บัณฑิตพัฒนศิลป์ สู่แดนดินถิ่นบูรพา"
????ในวันที่ 14 - 15 มกราคม 2566
ณ วิทยาลัยนาฏศิลปจันทบุรี อ.เมือง จ.จันทบุรี
????♂️กิจกรรมวิ่งงาน KU RUN Chanthaburi ฉลองครบรอบ 80 ปี มหาวิทยาลัยเกษตรศาสตร์
????ในวันที่ 15 ม.ค. 66 ปล่อยตัวเวลา 6.30 น.
ณ สวนสาธารณะ สมเด็จพระเจ้าตากสินมหาราช (ทุ่งนาเชย)
????ปิดทองฝังลูกนิมิต จันทบุรี ปี 2566
อ.เมืองจันทบุรี
วัดเนินโพธิ์ ต.หนองบัว อ.เมือง จ.จันทบุรี
????วันที่ 20-29 ม.ค.66
????วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต ร่วมพิธีเวลา 17.00 น.
วัดพลับพลา ต.พลับพลา อ.เมือง จ.จันทบุรี
????วันที่ 19-27 ม.ค.66
????วันที่ 27 ม.ค.66 ตัดหวายลูกนิมิต
อ.ท่าใหม่
วัดตะพง ต.เขาแก้ว อ.ท่าใหม่ จ.จันทบุรี
???? วันที่ 20-29 ม.ค.66
???? วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
อ.ขลุง
วัดกมลธรรมาราม (ทุ่งเสาธง) ต.ซึ้ง อ.ขลุง จ.จันทบุรี
???? วันที่ 20-29 ม.ค.66
???? วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
อ.แหลมสิงห์
วัดเขาแหลมสิงห์ อ.แหลมสิงห์ จ.จันทบุรี
???? วันที่ 20-29 ม.ค.66
???? วันที่ 30 ม.ค.66 ตัดหวายลูกนิมิต
อ.สอยดาว
วัดโพธิ์ศรี ต.ทุ่งขนาน อ.สอยดาว จ.จันทบุรี
???? วันที่ 20-29 ม.ค.66
???? วันที่ 29ม.ค.66 ตัดหวายลูกนิมิต
ประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ประจำปี 2566
???? กำหนดการจัดงานในระหว่างวันที่ 22 มกราคม ถึง 22 มีนาคม 2566
กิจกรรม Wonder Sport Thamai Run Chanthaburi 2023
???? ในวัน 28-29 มกราคม 2566 ณ สนามบินท่าใหม่ ต.ท่าใหม่ อ.ท่าใหม่ จ.จันทบุรี
งานราชมงคล รักษ์เหลืองจันท์ วันดอกไม้บาน ครั้งที่ 21
???? ในวัน 11-19 กุมภาพันธ์ 2566
ณ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก วิทยาเขตจันทบุรี
เพชรบูรณ์กลางแปลง 17-18 กพ.66
เพชรบูรณ์กลางแปลง จูงมือคนรักไปดูหนัง 17-18 กพ.ณ สนามข้างอุทยานเพชบุระ
ชมฟรี ภาพยนตร์ในระบบ 3มิติ (มีแว่น 3มิติให้ใส่) คืนละ 2 เรื่อง 3D/2D
✔เตรียมเสื่อปูนั่ง เตรียมเก้าอี้ Camping ให้พร้อม
ลงทะเบียนหน้างานรับหูฟังฟรี
(มีจำนวนจำกัด มาก่อนได้ก่อน)เอาไว้ใช้ฟังเสียงตอนดูหนัง บนมือถือ
17 พค 66
19.30 น Jurassic World 1 (3D)
2.50 น Fast 9 (2D)
18 กพ 66
19.30 น Dolittle (3D)
20.50 น Top gun maverick (2D)
ปฏิทินกิจกรรมเดือนกุมภาพันธ์ 2566
วันที่ 10-14 ก.พ. 66
ชื่องาน : คพอ. FEST FOOD FIN IN LOVE 2023 "เทศกาลอาหารกิน ถิ่นสองแคว"
สถานที่จัด : Cental Phitsanulok
วันที่ 11 ก.พ. 66
ชื่องาน : Chang Music Connection presents Rock Mountain 2023
สถานที่จัด Jolly Land อ.เขาค้อ จ.เพชรบูรณ์
วันที่ 12 ก.พ. 66
ชื่องาน : เฟี้ยว ฟิน อินฟาร์ม
สถานที่จัด : บ้านสวนเพชรนภัทร สวนเกษตรอินทรีย์
วันที่ 17-18 ก.พ. 66
ชื่องาน : เพชรบูรณ์กลางแปลง
สถานที่จัด : อ.เมือง จ.เพชรบูรณ์
วันที่ 17-18 ก.พ. 66
ชื่องาน : เขาค้อเฟสติวัล ครั้งที่ 1 เทศกาลดนตรีแคมป์ส่งท้ายลมหนาว
สถานที่จัด : ไร่บีเอ็นฟาร์ม อ.เขาค้อ จ.เพชรบูรณ์
วันที่ 27 ม.ค. - 2 ก.พ. 66
ชื่องาน : มะขามหวานนครบาลเพชรบูรณ์ ประจำปี 2566
สถานที่จัด : ศูนย์ราชการจังหวัดเพชรบูรณ์
วันที่ 27 ม.ค. - 2 ก.พ. 66
ชื่องาน : สมโภชพระพุทธชินราช ประจำปี 2566
สถานที่จัด : วัดพระศรีรัตนมหาธาตุวรมหาวิหาร
Hua Hin Yoga Festival 2023 (ครั้งที่ 3) เดือนกุมภาพันธ์ 2566
โยคะ ริมชายหาดสุดคลาสสิกของเมืองไทย ในงาน Hua Hin Yoga Festival 2023 (ครั้งที่ 3) ทุกวันเสาร์ของเดือนกุมภาพันธ์ 2566 ชวนคนรัก(ษ์) สุขภาพมาออกกำลังกายและมาสร้างประสบการณ์ด้วยกันในบรรยากาศริมชายหาดเขาตะเกียบ กับครูโยคะผู้ที่มีประสบการณ์สอนมากกว่า 10 ปี วันที่ : 4,11, 18 และ 25 เดือนกุมภาพันธ์ 2566 เวลา : 17.00-18.00 น. สถานที่ : ณ ชายหาดเขาตะเกียบ หน้าโรงแรมเวอร์โซ หัวหิน - อะ วีรันดา คอลเลคชั่นหัวหิน อ.หัวหิน จ.ประจวบคีรีขันธ์ การแต่งกาย : ชุดที่สวมใส่สบาย และมีความยืดหยุ่น พร้อมเสื่อโยคะ
Green Market Plus 22 -26 ก.พ. 66
มะพร้าว มันส์ ว้าวมาก (Wow ! Holy Coconut !) . ถ้าคุณคิดว่ารู้จัก "มะพร้าว" ดีแล้ว เราขอ "ท้า" คุณ ให้มาเจอกับพวกเรา ในงาน Green Market Plus (Farmer’s Market Plus Festival) 22 -26 ก.พ. 66 นี้ บริเวณลานด้านหน้า HuaHin Market Village
กิจกรรม “เตรียมความพร้อมให้แม่ เพื่อดูแลอีกหนึ่งชีวิต” โรงพยาบาลราชธานี 11 กุมภาพันธ์ 2566 LINK
โรงพยาบาลราชธานีขอเชิญผู้สนใจ ร่วมกิจกรรม “เตรียมความพร้อมให้แม่ เพื่อดูแลอีกหนึ่งชีวิต” วันที่ 11 กุมภาพันธ์ 2566 สำหรับคุณแม่ท่านไหนที่สนใจเข้าร่วม สามารถสแกน QR Code ในภาพ หรือโทร ติดต่อ 063 202 3855 ต่อ 300, 301 ได้เลยค่ะ . เข้าร่วมกิจกรรมได้ ฟรี! ไม่มีค่าใช้จ่าย พร้อมรับของที่ระลึกจาก รพ. ราชธานี กิจกรรมดีๆ แบบนี้ ไม่มาไม่ได้แล้วนะแม่ๆ งานนี้รับจำนวนจำกัด รีบลงทะเบียนกันนะคะ
เทศกาลไทยในกรุงปักกิ่ง 19 – 20 มีนาคม 2565 LINK
THAI FESTIVAL IN BEIJING 2022
สถานเอกอัครราชทูต ณ กรุงปักกิ่ง ขอเชิญชวนเพื่อน ๆ ทุกคนเข้าร่วมงานเทศกาลไทย ณ กรุงปักกิ่ง ประจำปี 2565 ซึ่งเป็นงานวัฒนธรรมไทยในกรุงปักกิ่งที่ใหญ่ที่สุดแห่งปี ภายใต้ธีมงาน “ANCIENT SIAM” ที่จะพาทุกคนไปย้อนเสน่ห์วันวานอันหวานชื่นของเมืองไทย ผ่านการลิ้มลองอาหารไทยเลิศรส ช็อปปิ้งสินค้าคุณภาพดี และร่วมเล่นเกมส์สนุก ๆ มากมาย ณ ทำเนียบเอกอัครราชทูต ณ กรุงปักกิ่ง ระหว่างวันที่ 19 – 20 มีนาคม 2565 วันละ 3 รอบ ตั้งแต่ 10.00 – 17.00 น.
โดยเทศกาลไทยในปีนี้เปิดให้เข้า ฟรี ! ไม่มีค่าใช้จ่าย เปิดให้จองบัตรเข้างานแล้ววันนี้!
สามารถลงทะเบียนผ่าน QR Code ในโปสเตอร์
ในปีนี้ สถานเอกอัครราชทูต ณ กรุงปักกิ่ง ร่วมกับสำนักงานทีมประเทศไทย หอการค้าไทยในจีน บริษัทผู้ประกอบการไทยในจีน ตลอดจนแพลตฟอร์มดิจิทัล Kuaishou จัดกิจกรรมเทศกาลไทยที่ยิ่งใหญ่แห่งปีให้ชาวไทยและเพื่อน ๆ คนจีนได้สัมผัสวัฒนธรรมไทยทั้งในรูปแบบออนไลน์และออฟไลน์
งานเทศกาลไทยถือเป็นการรวมตัวของร้านอาหารไทยทั่วกรุงปักกิ่งที่มากที่สุด มีอาหารไทยมากมายให้เลือกสรรมากกว่า 30 เมนู ที่ทุกท่านสามารถเลือกซื้อและชิมได้ในราคาที่ย่อมเยา อีกทั้งยังสามารถเลือกซื้อสินค้าและบริการของไทยจากผู้ประกอบการ รวมบูธสินค้าและร้านอาหารกว่า 40 ร้านค้า ตลอดจนเพลิดเพลินไปกับการชมการแสดงดนตรีสด การสาธิตมวยไทย การเดี่ยวระนาดเอก และการแสดงนาฏศิลป์ไทย รวมทั้งยังมีแจกสูตรผัดไทยผ่านเทคโนโลยีแบบ 3D ให้เอาไปทำที่บ้านได้ด้วย
นอกจากนี้ยังสามารถร่วมสนุกไปกับการละเล่นไทย ประดิษฐ์กระทงจำลอง แต่งชุดไทยถ่ายภาพเก๊ๆ ตามมุมต่าง ๆ และร่วมลุ้นรับของรางวัลอีกมากมายด้วย
ชมพูฟ้า รันนิ่ง 2023 / Pink Blue Run 2023
ชมพูฟ้า รันนิ่ง 2023 Pink Blue Run 2023 วันอาทิตย์ที่ 19 มีนาคม 2566 ณ โรงเรียนสวนกุหลาบวิทยาลัย ระยะ 3 กิโลเมตรและ 10 กิโลเมตร
กิจกรรม เดิน-วิ่ง ศิริราช-สมุทรสาคร เพื่อผู้สูงวัย 12 มี.ค.66 LINK
โรงพยาบาลศิริราช ร่วมกับจังหวัดสมุทรสาคร จัดกิจกรรม เดิน-วิ่ง ศิริราช – สมุทรสาคร เพื่อผู้สูงวัย ชิงถ้วยพระราชทานจาก สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี เป็นกิจกรรมการระดมทุนสร้างศูนย์วิทยาการเวชศาสตร์ผู้สูงอายุระดับชาติ จ.สมุทรสาคร กำหนดจัดขึ้นในวันอาทิตย์ที่ 12 มีนาคม 2566 เวลา 05.00 - 08.00 น. ณ สนามกีฬากลางจังหวัดสมุทรสาคร ระยะทาง 3 กม. และ 10.5 กม. เป็นกิจกรรมการระดมทุนสร้างศูนย์วิทยาการเวชศาสตร์ผู้สูงอายุระดับชาติ จ.สมุทรสาคร ผู้ชนะเลิศจะได้รับรางวัลถ้วยพระราชทานจาก สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดา ฯ สยามบรมราชกุมารี และถ้วยรางวัลคณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล นอกจากนี้ ยังมีรางวัลพิเศษสำหรับนักวิ่งผู้สร้างสีสัน ได้แก่ รางวัลนักวิ่งแต่งกายแฟนซี 10 รางวัล และส่งเสริมแนวคิดการดูแลผู้สูงอายุ ด้วยรางวัลนักวิ่งวัยเก๋า ประเภทเดี่ยวและทีม รวม 15 รางวัล สอบถามเพิ่มเติมได้ที่ งานกิจการพิเศษและองค์กรสัมพันธ์ คณะแพทยศาสตร์ศิริราชพยาบาล โทร. 0 2414 1555, 0 2414 1888 ในวันและเวลาราชการ
Nakhon Marathon 2023 วันที่ 26 มี.ค.66 LINK
Nakhon Marathon 2023 วันที่ 26 มีนาคม 2566 สนามหน้าเมือง นครศรีธรรมราช เปิดรับสมัคร 18 สิงหาคม 2565 เวลา 10:00 น. ปิดรับสมัคร 28 กุมภาพันธ์ 2566 เวลา 23:59 น. 4 ประเภท ระยะทาง 5 I 10 I 21 I 42 กม.
PANGSIDA CHILL 2023 อุทยานแห่งชาติปางสีดา 12 มี.ค.66 LINK
กิจกรรม สัมผัสใหม่ “สนามครอส คันทรี” ปางสีดา วิ่งชมธรรมชาติ ท่ามกลางขุนเขา แข่งขันในวัน อาทิตย์ที่ 12 มีนาคม 2566 ณ อุทยานแห่งชาติปางสีดา อ.เมืองสระเเก้ว จ.สระแก้ว “รายได้ส่วนหนึ่ง ร่วมสนับสนุนการดำเนินงานของเจ้าหน้าที่อุทยานแห่งชาติปางสีดา เพื่อดูเเลผืนป่า..ป่าต้นน้ำ” ติดต่อสอบถาม ททท.สำนักงานนครนายก โทร.0817159457 หรือ FB:tatnayokfans
CPF & KASETPHAND RUN FOR CHARITY 2023 วันอาทิตย์ที่ 26 มี.ค.66
CPF & KASETPHAND Run for Charity 2023 วิ่งถิ่นรามัญ ป้อมปราการสูงสง่า กราบเสด็จหลวง ร.5 พาชมเรือหลวงไทย ครั้งที่ 3 กิจกรรมเดิน-วิ่งเพื่อการกุศล ณ ป้อมพระจุลจอมเกล้า จ.สมุทรปราการ ที่เปิดโอกาสให้ทุกคนแสดงศักยภาพและร่วมเป็นส่วนหนึ่งในกิจกรรมเพื่อการกุศล
วันอาทิตย์ที่ 26 มีนาคม 2566 เวลา 05.00 - 8.00 น. สถานที่ : ป้อมพระจุลจอมเกล้า จ.สมุทรปราการ เปิดรับสมัครตั้งแต่วันที่ 5 มกราคม 2566 - 10 กุมภาพันธ์ 2566 หรือจนกว่าจะครบจำนวน จำกัดจำนวนเพียง 3,000 ท่าน เท่านั้น
รายได้หลังหักค่าใช้จ่ายมอบให้แก่โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย เพื่อดำเนินการอันเป็นประโยชน์ต่อประชาชนตามเจตนารมณ์ของโรงพยาบาลต่อไป
facebook.comโกงกางรัน 2 วันอาทิตย์ที่ 19 มี.ค.66
โกงกางรัน 2 ตอน "บุญคุณ ปูแสม" วันอาทิตย์ ที่ 19 มีนาคม 2566 ณ มหาวิทยาลัยราชภัฏสวนสุนันทา วิทยาเขตสมุทรสงคราม สมัครได้ที่
kongkangrun.com -
facebook.com/kongkangrunBikini Run Chanthaburi 31 มี.ค.-2 เม.ย.65 LINK
BIKINI RUN CHANTHABURI 2023 วันที่ 31 มี.ค.-2 เม.ย.65 ริมชายหาดเจ้าหลาว จันทบุรี กับบรรยากาศยามเย็นริมทะเล ในธีม Bohemain fulfillment Festival เบื่อกับสิ่งเดิมๆ แล้วมาเฉิดฉายในแบบฉบับของตัวเอง 1 เมษายน 2566 เตรียมมาวิ่งให้เต็มหาด จัดเต็มทั้ง Bikini แฟชั่น กิน เที่ยว เพื่อเป็นการส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจของ จ.จันทบุรี มาสูดอากาศที่ดีกับเมืองที่สมบูรณ์เรื่องธรรมชาติกัน ชาย/หญิง ระยะ 4 Km ต่ำกว่า 18 ปี /18-29ปี / 30-39ปี /40-49ปี /50-59 ปี/ 60ปีขึ้นไป
Thamai Run Chanthaburi 2023 วันที่ 11-12 มี.ค.66 LINK
WONDER SPORT Thamai Run Chanthaburi 2023 วิ่งท่าไหน ?ท่าใหม่ Runway TAKE OFF โดย เทศบาลเมืองท่าใหม่ X Wonder Sport Thailand วันที่ 11 มีนาคม 2566 - รับเสื้อวิ่ง 5km และ 10km เวลา 13:00น-17:00 น. - แข่งขัน Runway TAKE OFF 900m วันที่ 12 มีนาคม 2566 - แข่งขันวิ่งระยะ 5 km และ 10km
Buri Run บุรีรัน ครั้งที่ 1 วันที่ 5 มี.ค.66 LINK
งานวิ่ง “Buri Run 2023” ครั้งที่ 1 วันที่ 5 มีนาคม 2023 เปิดรับสมัครแล้ววันนี้ ‼️ สถานที่ : รัตนะบุรี น้ำตกพลิ้ว จันทบุรี “มาร่วมวิ่งตามรอยเสด็จประพาส....พระพุทธเจ้าหลวง” สัมผัสเส้นทางธรรมชาติกับเมืองแห่งจินตนาการ ตามรอยเส้นทาง ร. 5 เสด็จน้ำตกพลิ้วถึง 4 ครั้ง พักผ่อนหย่อนใจหนึ่งในน้ำตกเลื่องชื่อของจันทบุรี “น้ำตกพลิ้ว” ...ทั้งยังได้ร่วมทำบุญตักบาตรในวันสำคัญทางพระพุทธศาสนา "ได้วิ่ง ได้เที่ยว ได้บุญ "กับบุรีรัน
มาร่วมกิจกรรมส่งเสริมการท่องเที่ยวและกระตุ้นเศรษฐกิจของ จ.จันทบุรี บรรยากาศดีกับเมืองแห่งจินตนาการ เมืองที่ห้ามพลาดด้วยประการทั้งปวง และรายได้ส่วนหนึ่งยังมอบให้กับ
- สำนักงานเหล่ากาชาดจังหวัดจันทบุรี - อุทยานแห่งชาติน้ำตกพลิ้ว จันทบุรี - โรงพยาบาลแหลมสิงห์ - สถานีตำรวจภูธรแหลมสิงห์
ระยะทาง 6 Km. ระยะเดียว ชาย/หญิง ระยะ 6 Km ต่ำกว่า 18 ปี /18-29ปี / 30-39ปี /40-49ปี /50-59 ปี/ 60ปีขึ้นไป
4-5 มี.ค. 66 Baroy Eco Trail : บาโรย อีโค เทรล LINK
บาโรย อีโค เทรล 2 วันที่ 4-5 มีนาคม 2566 โรงเรียนสังวาลย์วิท 2 ต.ปาดังเบซาร์ อ.หาดใหญ่ สงขลา พร้อมต้อนรับนักวิ่ง และนักผจญภัยทุกคนแล้ว สนามที่สนุกๆ ไม่โหดร้าย ได้เปิดมุมมองและประสบการณใหม่ๆ เส้นทางที่จะพาลัดเลาะเลียบ แนวชายแดนประเทศไทย- มาเลเซีย สนามที่อบอุ่น และอร่อยกับอาหารพื้นบ้านแบบ จุกๆ
19 มี.ค.66 กะช่องเทรล LINK
กะช่องเทรล 19 มีนาคม 2566 จุด START/FINISH ค่ายลูกเสือพระยารัษฎานุประดิษฐ์ ตำบลช่อง อำเภอนาโยง จ.ตรัง ระยะวิ่ง 31 กิโลเมตร และ 15 กิโลเมตร จำนวนเปิดรับสมัคร ระยะละ 300 ท่าน
Plan For Kids Run 2023 วันที่ 5 มี.ค.66 LINK
Plan For Kids Run 2023 งานวิ่งแสนสนุก สุดหฤหรรษ์ เปิดโลกจินตนาการไปด้วยกันกับ แปลน ฟอร์ คิดส์ จะวิ่งทั้งครอบครัว วิ่งเดี่ยว วิ่งคู่ จะเป็นนักวิ่งตัวจิ๋วที่อยู่ในรถเข็นเด็ก นักวิ่งมืออาชีพ หรือจะเดินเดิน วิ่งวิ่ง ก็ร่วมได้ งานวิ่ง Kids and Family Run ที่มีเหล่ามาสคอตจากนิทานเรื่องโปรดของเด็ก ๆ อย่างแก๊งไดโนน้อยสุดเก๋า เจ้าเก่าจากงาน Dino Run กุ๋งกิ๋ง ต้นกล้า ตุ๊กติ๊ก ตุ๊บปอง น้านกฮูก และอีกมากมายที่จะคอยเซอร์ไพรส์เด็ก ๆ ตามจุดต่าง ๆ พร้อมโซน Happy Fun 4 ฐานกิจกรรมสุดมันจากสำนักพิมพ์แฮปปี้คิดส์ และสำนักพิมพ์เฮลไลคิดส์ และร้องเล่นเต้นสนุกที่เวทีแบบสุดปัง!
วันอาทิตย์ที่ 5 มีนาคม 2566 สถานที่จัดกิจกรรม สวนวชิรเบญจทิศ (สวนรถไฟ)
CHONLAMAK10 วิ่งสะพานชลมารควิถี ๘๔ พรรษา 19 มี.ค.66 LINK
CHONLAMAK10 ( ปิดถนน 100% ) สะพานชลมารควิถี ๘๔ พรรษา วันที่ 19 มีนาคม 2566 ณ สะพานชลมารควิถี 84 พรรษา เลียบชายทะเลชลบุรี ปิดถนน 100% พร้อมทีมแพทย์ดูแลตลอดเส้นทางการแข่งขัน จังหวัดชลบุรี ร่วมกับ ชมรมคู่สมรสตุลาการศาลยุติธรรม จัดงานวิ่งการกุศล เพื่อนำรายได้จากค่าสมัครทั้งหมด โดยไม่หักค่าใช้จ่าย มอบในภารกิจคืนคนดีสู่สังคม ผ่านกิจกรรมของชมรมคู่สมรสตุลาการศาลยุติธรรม
Nakhonphanom 10 วันที่ 18 มี.ค.66 LINK
Nakhonphanom 10 บริเวณลานหน้าวัดพระอินทร์แปลง อ.เมือง จ.นครพนม เพื่อกระตุ้นเศรษฐกิจและการท่องเที่ยวจังหวัดนครพนม ส่งเสริมให้ชาวนครพนมออกกำลังกาย รักสุขภาพมากยิ่งขี้น และส่งเสริมนักกีฬาวิ่ง ไปสู่ความเป็นมืออาชีพ วันที่ 18 มีนาคม 2566 เวลา 10:00-19:00 น. บริเวณลานหน้าวัดพระอินทร์แปลง อ.เมือง จ.นครพนม
วิ่งเปิดเมือง ปันน้ำใจ ครั้งที่ 1 วันที่ 12 มี.ค.66 LINK
โรงพยาบาลท่าอุเทน เปิดรับสมัคร โครงการ วิ่งเปิดเมือง" Running Tha Uthen 2023 โดย เอกชนพัฒนาท่าอุเทน มินิมาราธอน ครั้งที่ 1 ในวันที่ 12 มีนาคม 2566 วิ่งด้วยกัน ปันน้ำใจ ให้กับโรงพยาบาลท่าอุเทน เส้นทางวิ่ง ริมแม่น้ำโขง อ.ท่าอุเทน ผ่านแลนด์มาร์คท่องเที่ยวในอำเภอ อาทิ ศาลเจ้ามณีธรรม, หอพระบาง วัดไตรภูมิ, ท่าเรือตลาดนัดไทย-ลาว อ.ท่าอุเทน, ศาลเจ้าพ่อหลักเมือง, องค์พระธาตุท่าอุเทน วัดพระธาตุท่าอุเทน สมัครลงทะเบียน
https://bit.ly/3H7XUZpคลองสามวา Running วิ่งเพื่อโรงพยาบาล ครั้งที่ 1 วันที่ 26 มี.ค.566 LINK
ขอเชิญร่วมกิจกรรม คลองสามวา Running วิ่งเพื่อโรงพยาบาล คลองสามวา Running วิ่งเพื่อโรงพยาบาล ครั้งที่ 1 งานวิ่งการกุศล เพื่อระดมทุนในการจัดซื้อวัสดุ ครุภัณฑ์ทางการแพทย์ที่จำเป็นในการให้บริการผู้ป่วยและกิจการให้บริการของ รพ.คลองสามวา
วันที่จัดงาน : วันอาทิตย์ที่ 26 มีนาคม 2566
สถานที่ : โรงพยาบาลคลองสามวา
วันที่รับเสื้อ : วันศุกร์ที่ 24 มีนาคม และ วันเสาร์ที่ 25 มีนาคม 2566
น้องหมีพี่เสือ Tono & The Gang : Run For Charity 2023 เดิน – วิ่งการกุศล 26 มี.ค.66 LINK
สมาคมส่งเสริมการท่องเที่ยวนครนายก ร่วมกับ การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครนายก ชมรมฅนรักษ์สัตว์ป่า จัดกิจกรรม “น้องหมีพี่เสือ Tono & The Gang : Run For Charity 2023” เดิน – วิ่งการกุศล “5 KM” ณ เส้นทางอ่างเก็บน้ำห้วยปรือ – ศูนย์ช่วยเหลือสัตว์ที่ 1 นครนายก – อ่างเก็บน้ำห้วยปรือ ตำบลเขาพระ อำเภอเมืองนครนายก จังหวัดนครนายก เพื่อสนับสนุนการดำเนินงานของศูนย์ช่วยเหลือสัตว์ป่าที่ 1 นครนายก และสร้างสรรค์กิจกรรมดีๆ เส้นทางใหม่ของจังหวัดนครนายก
กำหนดการแข่งขัน วันอาทิตย์ที่ 26 มีนาคม 2566 อ่างเก็บน้ำห้วยปรือ - ศูนย์ช่วยเหลือสัตว์ป่าที่ 1 นครนายก - อ่างเก็บน้ำห้วยปรือ
++ จัดไปแล้ว ตารางให้บริการหน่วยเคลื่อนที่กทม.เดือนมีนาคม-เมษายน 2566 LINK
1 มีนาคม หลังตลาดแสงจันทร์ สาทร
2 มีนาคม ชุมชนโฟร์โมสต์ บางขุนเทียน
3 มีนาคม ชุมชนบ้านบาตร ป้อมปราบฯ
9 มีนาคม วัดทอง ซ.จรัลฯ 46
20 มีนาคม 2566 ถึง 14 เมษายน 2566 (หยุดวันเสาร์และวันอาทิตย์) จุดบริการเคลือนที่วัดภาวนาภิรตาราม
21 มีนาคม ชุมชนธนินทร 1 ซอยวิภาวดีรังสิต 35
23 มีนาคม ชุมชนอยู่เจริญวิภาวดี ซอยวิภาวดีรังสิต 37
28 มีนาคม ชุมชนโกสุมรวมใจ 1 ซอยโกสุมรวมใจ 37
30 มีนาคม ชุมชนดอนเมืองวิลล่า ซอยสรงประภา 16
4 เมษายน ชุมชนโกสุมรวมใจ 3 ซอยโกสุมรวมใจ 15
*
ศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร
เขตดอนเมือง Suanmokkh Playground ล้อมวงเล่นในรูปแบบ Mini Concert วันมาฆบูชา 6 มี.ค.66 LINK
Suanmokkh Playground ชวนมาล้อมวงเล่นในรูปแบบ Mini Concert การแสดงดนตรี ท่ามกลางธรรมชาติ (ดนตรีในสวน) พร้อมทั้งวันมาฆบูชานี้ ชวนฟังธรรม เวียนเทียนในสวน ภายใต้แสงจันทร์กันด้วยน้าาา
วันจันทร์ที่ 6 มีนาคม 2566 (วันมาฆบูชา) เวลา 16.00 - 20.00 น.
ลงทะเบียนเข้าร่วมกิจกรรมได้ที่ https://bit.ly/3lZxxhA
(สะดวกมา ช่วงเวลาใดก็ได้ โปรดลงทะเบียนกันด้วยนะ)
กำหนดการ
ภาคเย็น : ชวนฟังเพลง ฟังธรรม และเวียนเทียนในสวน
16.00 – 18.00 น. Suanmokkh Playground กับ Apdul Rowja & Fah Sansin
บทเพลง ในฐานะบทเรียนของชีวิต พร้อมเรียนรู้ธรรมะจากเสียงดนตรี
18.00 – 19.00 น. เวียนเทียนในสวนและฟังธรรม ท่ามกลางบรรยากาศธรรมชาติ
19.00 – 20.00 น. Suanmokkh Playground กับ Yokee Playboy
สะดวกมาช่วงเวลาใดก็ได้ชวนเพื่อนๆ น้องๆ และคนในครอบครัว มาร่วมฟังเพลง ฟังธรรมและเวียนเทียนในสวนกัน แล้วเจอกันวันมาฆบูชานี้
Song by The River @Krabi ดนตรีฟังเพลิน จ.กระบี่ 17–18 มี.ค.66
Song by The River @Krabi ทุกวันศุกร์และเสาร์ 3-4 , 10-11 และ 17 – 18 มีนาคม 2566
17.00 – 21.00 น. ลานปูดำ 19.00 – 21.00 น. ถนนคนเดิน เดินกันชิลๆ ให้ตัวปลิวตามสายลม ท่ามกลางหมู่ดาว ที่พร่างพราวเหนือเขาขนาบน้ำ [
ททท กระบี่]
Nursery Music Concert มาถึงเซ็นทรัล รามอินทรา 19 มี.ค. 66
Nursery Music Concert มาถึงเซ็นทรัล รามอินทราแล้ววว โดนัทยังมีรู แล้วเมื่อไหร่ยูจะมาติ่งที่เซ็นทรัล รามอินทรา พลาดไม่ได้กับคอนเสิร์ตเอาใจขาแด๊นซ์ สนุกกับคอนเสิร์ตศิลปินคนโปรดสุฮอต New Country 4 หนุ่มหล่อ นุ-กีตาร์-ติณติณ-เอ็มโบ ควงคู่ 2 สาว มัทรี-กิ๊ก ติ่งพร้อมเต้นแบบสุดเหวี่ยง Stand by หล่อพร้อมกัน 19 มี.ค. นี้เวลา 16.30 - 17.30 น. ณ ลานกิจกรรม ชั้น 4 เซ็นทรัล รามอินทรา
#NurseryMusicConcert #แก๊งฟันน้ำนม #NewCountry #นิวคันทรี่
กิจกรรมดนตรีในสวนกรุงเทพมหานครฯ 11-12 มี.ค.66
กิจกรรมดนตรีในสวนกรุงเทพมหานครฯ กิจกรรมที่จะพาทุกคนไปผ่อนคลายในช่วงวันหยุดเสาร์อาทิตย์ สำหรับวันเสาร์ ที่ 11 มีนาคม 2566 พบกันที่ อุทยานเบญจสิริ สำหรับวันอาทิตย์ ที่ 12 มีนาคม 2566 พบกันที่ สวนหลวงพระราม 8
ภูเก็ต ชวนวิ่งงาน KILORUN วิ่งไปกินไป รอบเมืองเก่าภูเก็ต 25 มี.ค.66 LINK
ภูเก็ต 25 มี.ค. 66 นี้ ชวนวิ่งงาน KILORUN วิ่งไปกินไป รอบเมืองเก่าภูเก็ต ระหว่างทางแวะกินร้านเด็ด หรอยๆ ถึงเส้นชัยใครน้ำหนักเพิ่มมากสุดชนะ รับไปเลยกับตั๋วเครื่องบิน ไป-กลับ ภายในประเทศ จาก Air Asia วันเสาร์ที่ 25 มีนาคม พศ. 2566 สถานที่จัดงาน : สวนเฉลิมพระเกียรติ 72 พรรษา มหาราชินี (ลานมังกร) เทศบาลนครเมืองภูเก็ต
หลงเล @แหลมผักเบี้ย 10-11 มี.ค.66
อบต.แหลมผักเบี้ย จ.เพชรบุรี เชิญสัมผัสบรรยากาศงาน "หลงเล @แหลมผักเบี้ย" มาบอกรักกันให้พระจันทร์อิจฉา ในวันที่ 10 - 11 มีนาคม 2566 งานเริ่มตั้งแต่ 17.00 น. - 23.00 น. ณ
หาดชมจันทร์ แหลมผักเบี้ย ในงานมีกิจกรรมถ่ายรูปพรีเวดดิ้ง ในราคาพิเศษจากร้านระดับมืออาชีพในจังหวัดเพชรบุรี ถ่ายรูปครอบครัว ถ่ายรูปกลุ่มเพื่อน ถ่ายรูปคู่รัก ให้บริการนั่งรับลมชมหมู่ดาวเคล้าเสียงเพลงเบาๆพร้อมเอาใจสายโซเชียล กับจุดเช็คอินถ่ายรูป อิ่มอร่อยกับโซนอาหารบนถนน สตรีทฟู้ด จากร้านค้าต่างๆในตำบลแหลมผักเบี้ย
การเสวนาออนไลน์ เรื่อง "กัญชากับยาโด๊ปทางกีฬา" วันอังคารที่ 21 มีนาคม 66 LINK
สมาคมกีฬาเวชศาสตร์แห่งประเทศไทยร่วมกับอนุกรรมการฝ่ายแพทย์ คณะกรรมการโอลิมปิกแห่งประเทศไทย ขอเชิญท่านผู้สนใจเข้าร่วมการเสวนา (ฟรี ไม่ต้องลงทะเบียน)
เรื่อง "กัญชากับยาโด๊ปทางกีฬา" สิ่งที่แพทย์และผู้เกี่ยวข้องทางกีฬาควรระวัง
เล่าและตอบปัญหาเรื่องโด๊ปทางกีฬาโดยผู้เชี่ยวชาญ:
1. กฎการห้ามใช้และการพบสารต้องห้ามของนักกีฬาไทย โดย นพ.มีชัย อินวู๊ด
2. Testosterone, Anabolic Steroid,Growth Hormone etc. โดย ผศ. พญ. ปวีณา ชุณหโรจน์ฤทธิ์ Endrocrinologist รพ.ศิริราช
3. Beta2 agonist , Fluid and Blood infusion และ Erythropoietinโดย อจ. อรรถ นานา
4. Glucocorticoid โดย นพ.อี๊ด
ลอประยูร
5. กัญชา กัญชง กระท่อม โดยดร.จุฑามณี อดีตคณบดีคณะเภสัชฯ มหิดล
6. การเขียนเอกสารการขอใช้ยาต้องห้ามทางกีฬา TUE โดย นพ อี๊ด,อจ.อรรถ และ นพ.มีชัย
เวลา 20:00 ถึง 22:00 นาฬิกา
วันอังคารที่ 21 มีนาคม 66 ทาง Zoom Meeting
อุตสาหกรรมระยองแฟร์ 17-19 มีนาคม 2566
สวนสมุนไพรสมเด็จพระเทพฯ ขอเชิญเที่ยวงาน "อุตสาหกรรมระยองแฟร์ ในเทศกาล Summer in the Garden" ในวันที่ 17-19 มีนาคม 2566 ตั้งแต่เวลา 10.00-20.00 น. ณ สวนสมุนไพรสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี
✅มาชม✅มาช้อป✅มาชิม
✅ในงานทุกท่านจะได้พบกับนิทรรศการด้านอุตสาหกรรม
✅สินค้าโรงงานราคาประหยัด
✅สินค้ามาตรฐานผลิตภัณฑ์ชุมชน (มผช.)
✅และผลิตภัณฑ์จากชุมชนอีกมากมาย
กิจกรรมพิเศษ ชวนช้อปมันส์ สินค้านาทีทองและลุ้นรับของรางวัลมากมาย????
ชวนเที่ยวชุมชนยลวิถี 17 - 19 มีนาคม 2566
เชิญเที่ยวงาน #บวร ประจำปี ๒๕๖๖ ชวนเที่ยวชุมชนยลวิถี ณ วัดละหารไร่ อ.บ้านค่าย จ.ระยอง 17 - 19 มีนาคม 2566 เวลา 17.00 น ถึง 21.00 น ไหว้พระเกจิดัง 8 อำเภอ ชมการแสดงพิธีเปิดละครเพลง ร้านค้าอาหารอร่อยของดี 8 อำเภอ การแสดงทางศิลปะวัฒนธรรมท้องถิ่น 17 มีนาคม พบ โบ๊ท เพลงเอก 18 มีนาคม พบ ตุ้มเม้ง เถิดเทิง วาไรตี้ 19 มีนาคม พบ เอมมี่ ลูกทุ่งไอดอล โดย วัฒนธรรมจังหวัดระยอง กับมหกรรมขับเคลื่อนจังหวัดคุณธรรม เที่ยวชุมชนยลวิถี
งานประเพณีบุญกลางบ้าน ปีที่ 17 วันที่ 22 - 26 มีนาคม พ.ศ.2566
เที่ยวงานประเพณีบุญกลางบ้าน ปีที่ 17 ตั้งแต่วันที่ 22 - 26 มีนาคม พ.ศ.2566 ณ ท่าน้ำศาลาต้นโพธิ์ ซอยศรีประชุมชล ( ถนนสุนทรโวหาร ซอย 5 )
ปฏิทินท่องเที่ยวเดือนมีนาคม จังหวัดระยอง
Banchang Bikeweek 2023 วันที่ 4 - 5 มีนาคม พ.ศ. 2566
ครั้งแรกกับการจัดงานบ้านฉางไบท์วีค บริเวณริมชายหาดพลา ตำบลพลา อำเภอบ้านฉาง จังหวัดระยอง ระหว่างวันที่ 4 - 5 มีนาคม พ.ศ. 2566
พาลูกวิ่งดะ 25-26 มีนาคม 2566 LINK
พาลูกวิ่งดะ 25-26 มีนาคม 2566 ครั้งแรกของงานวิ่งฝ่าด่าอุปสรรคบนชายหาดของประเทศไทย ท้าทายความแกร่งกับ 16 ด่านอุปสรรคทั้งแบบสะเทินน้ำสะเทินบก ตลอดระยะทาง 5 กิโลเมตร ณ ชายหาดส่วนตัว SERENE PHLA RESORT หาดพลา อ.บ้านฉาง จ.ระยอง
กิจกรรม “รักษ์ลานหินสีชมพู “ เก็บ "ขยะ" แลก "ของที่ระลึก" จาก ททท. 25 มี.ค.66 – 25 พ.ค. 2566
การท่องเที่ยวแห่งประเทศไทย สำนักงานจันทบุรี ร่วมกับ เขตห้ามล่าสัตว์ป่าคุ้งกระเบน จัดกิจกรรม “รักษ์ลานหินสีชมพู “ เก็บ "ขยะ" แลก "ของที่ระลึก" จาก ททท. โดยเริ่มดำเนินกิจกรรม ตั้งแต่วันที่ 25 มี.ค.66 – 25 พ.ค. 2566 (2 เดือน) มาร่วมทำความดี แบบมีส่วนร่วมในการรักษ์โลก และรักษาสิ่งแวดล้อมกันง่ายๆ เพียงเก็บขยะในพื้นที่เขตห้ามล่าสัตว์ป่าคุ้งกระเบน นำมาแลกของรางวัล กับเจ้าหน้าที่ฯ ดังนี้
1.ขยะประเภทขวดพลาสติก น้ำหนักเกิน 1 กิโลกรัม รับเลย กระเป๋าสะพายเสื่อกกจันทบูร
2.ขยะประเภทอลูมิเนียม น้ำหนักเกิน 1 กิโลกรัม รับเลย แก้วกาแฟ พร้อมดริปเปอร์
3.ขยะประเภทขวดแก้ว น้ำหนักเกิน 2 กิโลกรัม กระเป๋าเป้ ททท.
4.ขยะประเภท อื่นๆ โฟม เชือกไมลอน ถุงพลาสติก กระสอบ ฯลฯ น้ำหนักไม่เเกิน 1 กก. รับเลย กระเป๋าผ้า แคนวาส (ขาว) Amazing Thailand
*หมายเหตุ (ของที่ระลึก มีจำนวนจำกัด มาก่อนมีสิทธิ์ก่อน)
ปฏิทินท่องเที่ยวจังหวัดจันทบุรี เดือนมีนาคม 2566
ปฏิทินท่องเที่ยวจังหวัดจันทบุรี เดือนมีนาคม 2566
ประเพณีนมัสการรอยพระพุทธบาทเขาคิชฌกูฏ (พระบาทพลวง) ประจำปี 2566
กำหนดการจัดงานในระหว่างวันที่ 22 มกราคม ถึง 22 มีนาคม 2566
งาน "เสน่ห์ไม่จางที่บางสระเก้า"
ระหว่างวันที่ 3-5 มีนาคม 2566
ณ ตลาดสี่มุมเมรุ วัดบางสระเก้า ต.บางสระเก้า อ.แหลมสิงห์ จ.จันทบุรี
งานเปิดตัวหมู่บ้านท่องเที่ยวชุมชน "ไปแล้วจะรู้ อยู่แล้วจะรัก" @ปะตงล่าง เขาสอยดาว
ระหว่างวันที่ 3-5 มีนาคม 2566
ณ บริเวณอนุสาวรีย์ ร.5 ข้างที่ว่าการอำเภอสอยดาว จ.จันทบุรี
งานวิ่ง “Buri Run 2023” บุรีรัน ครั้งที่ 1 ♀️
วันที่ 5 มีนาคม 2566
ณ อุทยานแห่งชาติน้ำตกพลิ้ว อ.แหลมสิงห์ จ.จันทบุรี
งาน " Laem Sadet Walk & Run 2023" ♀️
วันที่ 26 มีนาคม 2566
ณ หาดแหลมเสด็จ อ.ท่าใหม่ จ.จันทบุรี
งาน "เสน่ห์ไม่จางที่บางสระเก้า" 3-5 มีนาคม 2566
ขอเชิญเที่ยวงาน "เสน่ห์ไม่จางที่บางสระเก้า" ณ ตลาดสี่มุมเมรุ วัดบางสระเก้า ต.บางสระเก้า อ.แหลมสิงห์ จ.จันทบุรี ระหว่างวันที่ 3-5 มีนาคม 2566 เวลา 9.30 - 21.30 น. สัมผัสวิถีชีวิตชุมชน 3น้ำ9นา พบกับกิจกรรมมากมาย อาทิ.......???? การสาธิตการทำอาหารพื้นบ้าน.เช่นแกงเป็ดกะลามะพร้าวหมูชะมวงฯ ???? การจำหน่ายสินค้าอาหารชุมชนราคาถูกและสินค้าโอท๊อปบางสระเก้าและในอำเภอแหลมสิงห์ ???? การแสดงศิลปวัฒนธรรมพื้นถิ่น. @การสาธิตการทอเสื่อการทำผลิตภัณฑ์ท้องถิ่น @ทานอาหารแบบปูเสื่อกกนั่งกินชิวๆบนโตก @ชมรำเท่งตุ๊ก ???? การประกวดร้องเพลงลูกทุ่ง นั่งซาเล้ง นั่งเรือชมวิถีบางสระเก้า. ปั่นปันบุญยลวิถี ???? การประกวดส้มตำลีลา @ลานรำวงย้อนยุคฟรีสไตล์ สอบถามเพิ่มเติม 082-1856556
LAEM SADET WALK & RUN 2023 วันที่ 26 มีนาคม 2566
LAEM SADET WALK & RUN 2023 แข่งขันวันที่ 26 มีนาคม 2566 ณ หาดแหลมเสด็จ อ.ท่าใหม่ จ.จันทบุรี
งานกาชาดและของดีอำเภอหัวหิน ครั้งที่ 25 31 มี.ค.- 9 เม.ย.66
เชิญเที่ยวงานงานกาชาดและของดีอำเภอหัวหิน ครั้งที่ 25 31 มี.ค.- 9 เม.ย.66 ณ สนามหลังห้างบลูพอทหัวหิน
งานแผ่นดินสมเด็จพระเจ้าเสือ พิจิตร ประจำปี 2566 ระหว่างวันที่ 24 มีนาคม - 3 เมษายน 2566
ขอเชิญเที่ยวงานแผ่นดินสมเด็จพระเจ้าเสือ จังหวัดพิจิตร ประจำปี 2566 ระหว่างวันที่ 24 มีนาคม - 3 เมษายน 2566 ณ บริเวณสนามกีฬากลางจังหวัดพิจิตร ชม การแสดง แสง สี เสียง ที่ยิ่งใหญ่ตระการตา กิจกรรมส่งเสริมการท่องเที่ยว การออกร้านส่วนราชการ รับโชคกับมัจฉากาชาดและสลากกาชาดการกุศล การแสดงและจำหน่ายผลิตภัณฑ์ทางการเกษตร ไม้ดอกไม้ประดับ สินค้า OTOP เลือกซื้อสินค้าราคาถูกจากโรงงาน สวนสนุกใหญ่จากอิตาลี กิจกรรมมากมายบนเวที ชมฟรี มหกรรมคอนเสิร์ตจากศิลปินดัง
Illumination Music Festival 24 - 26 มีนาคม 2566
Illumination Music Festival Summer Happiness Phetchabun ร้อนนี้ที่เพชรบูรณ์ 24 - 26 มีนาคม 2566 ตั้งแต่เวลา 17.00 น. เป็นต้นไป ณ พุทธอุทยานเพชรบุระ จ.เพชรบูรณ์
สมโภช 1002 ปี ศรีหลักเมืองเพชรบูรณ์ 22 – 31 มีนาคม 2566
สมโภช 1002 ปี ศรีหลักเมืองเพชรบูรณ์ ระหว่างวันที่ 22 – 31 มีนาคม 2566 บริเวณศาลเจ้าพ่อหลักเมืองเพชรบูรณ์ อำเภอเมืองเพชรบูรณ์ จังหวัดเพชรบูรณ์
ปฏิทินกิจกรรม เพชรบูรณ์ เดือนมีนาคม 2566
LAMPHUN DUATHLON ลำพูนทวิกีฬา 2023 วันที่ 26 มี.ค.66 LINK
จ.ลำพูน จัดการแข่งขัน LAMPHUN DUATHLON ลำพูนทวิกีฬา 2023 วิ่งปั่นวิ่ง ส่งเสริมการท่องเที่ยว ผลักดันเศรษฐกิจในพื้นที่ 26 มีนาคม 2566 ณ บริเวณสะพานขาวทาชมภู อ.แม่ทา จ.ลำพูน ระยะการแข่งขันแบบวิ่งสลับปั่น วิ่ง 5 กิโลเมตร/ปั่น 22 กิโลเมตร/วิ่ง 5 กิโลเมตร จัดโดยสำนักงานการท่องเที่ยวและกีฬาจังหวัดลำพูน ภายใต้โครงการส่งเสริมการท่องเที่ยวเชิงกีฬาจังหวัดลำพูน 1 จังหวัด 1 Sport Event
เทศกาลชิมปูชัก@ชะอำ 11-18 มีนาคม 2566
เทศบาลเมืองชะอำ ขอเชิญเที่ยวงานเทศกาลชิมปูชัก@ชะอำ ระหว่างวันที่ 11-18 มีนาคม 2566 ณ จุดชมวิวชายหาดชะอำ
Hua Hin Old Days Festival 3-5 มีนาคม 2566
Hua Hin Old Days Festival 3-5 มีนาคม 2566 The Square Bluport Hua Hin ดนตรี Jazz เวทีจัดเต็มโดนใจ พบกับศิลปินบนเวที Hua Hin Old Days Stage พร้อมให้ทุกคนเข้ามาสัมผัสและร่วมเป็นส่วนหนึ่งในการย้อนวันวานของเมืองหัวหิน
Bike For Zero Trash 2023 ปั่นจักรยานการกุศล 19 มี.ค.66
ปั่นจักรยานการกุศลกับกิจกรรม Bike For Zero Trash 2023 ... ปั่นลดขยะ มาปั่นเป็นฮีโร่...ช่วยกันสร้างโลกที่สะอาด ปราศจากมลพิษจากขยะกันค่ะ ปั่นท่องเที่ยวเลียบทะเล ผ่านจุดชมวิวสวยหลายจุด เป็นส่วนหนึ่งที่ได้ร่วมช่วยลดขยะ นำรายได้ส่วนหนึ่งสนับสนุนโครงการของ Trash Hero . Bike For Zero Trash 2023 ปั่น...ลดขยะ จัดงานวันที่ 19 มีนาคม 2566
Hua-Hin Camping Fest 1-10 มี.ค.66
รวมพลคนรักแคมป์..ชาวแคมป์สายคูล ต้องมาแล้ว ที่รวบรวมสินค้า ของใช้ และอุปกรณ์สำหรับนักเดินป่า หรือการตั้งแคมป์ จากแบรนด์ดังมากมาย อาทิ K2, Lowe Alpine, Equinox, MATALL, Karana ร้านอาหารมากมาย จาก Chang Street Food&Beverage Garden เพลินไปกับการ กิน ช้อป พร้อมฟังเพลงเพราะยามค่ำคืน #ในบรรยากาศแสนชิว พบกันวันที่ 1-10 มี.ค.66 ณ ลานด้านหน้าศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน
CAMPFIRE ON THE BEACH BOWKY LION 11 มีนาคม 2566
"CAMPFIRE ON THE BEACH" พบกับศิลปิน --- BOWKY LION 11 มีนาคม 2566 หน้าหาด Veranda Lodge, Hua-Hin.
งาน ชิมอาหาร ทานของดี ดนตรีดังที่ เรือหลวงประแส อำเภอแกลง 31 มีนาคม - 6 เมษายน 2566
เทศบาลตำบลปากน้ำประแส ขอเชิญเที่ยวงาน ชิมอาหาร ทานของดี ดนตรีดังที่ เรือหลวงประแส อำเภอแกลง จังหวัดระยอง ประจำปี 2566 วันที่ 31 มีนาคม - 6 เมษายน 2566 ณ เรือหลวงประแส อำเภอแกลง จังหวัดระยอง ชม..การออกร้านอาหาร ของใช้ ของฝาก ภาครัฐ เอกชน เดินเล่นชิลล์ๆ ชายทะเลฟังเพลง ชิมอาหารรสเลิศ สวนสนุกชุดใหญ่ ศิลปินครบทุกคืน อาทิ พจน์ สุวรรณพันธ์ มิน เฉาก๊วย น้ำแข็ง ทิพวรรณ โบว์ ซุปเปอร์วาเลนไทน์ กินรี มณีศิลป์ & โสธร วงษ์สามารถ การแข่งขันทำอาหารพื้นบ้านปากน้ำประแส ประกวดร้องเพลง เดินแบบผ้าไทย ประกวดแม่ม่าย ขวัญใจประแส
งานย้อนรอยตลาดไผ่ล้อม 100 ปี (ตลาดวันวาน) 31 มีนาคม - 2 เมษายน 2566
ขอเชิญเที่ยวงาน ย้อนรอย ตลาดไผ่ล้อม 100 ปี (ตลาดวันวาน) วันที่ 31 มีนาคม - 2 เมษายน 2566 ⛩ ณ ถนนอาทิตย์ประดิษฐาน(ถนนเทศบาล2) หน้าที่ว่าการอำเภอบ้านค่าย งานเริ่มเวลา 15.00 - 21.00 น. • เที่ยว ชม ช้อป ของกินและกิจกรรมมากมาย • ผลิตภัณฑ์กลุ่มตำบล ร่วมสนับสนุนวิถีชุมชน • กราบไหว้สิ่งศักดิ์สิทธิ์ หลวงเตี่ยแต้จิ๋ว หลวงเตี่ยไหหลำ • มุมถ่ายภาพสวยๆในงาน ที่จอดรถสะดวกสบาย
งาน มหกรรมเล่าขานตำนานเมืองระยอง เฉลิมพระเกียรติ 68 พรรษา 31 มีนาคม - 2 เมษายน 2566
ขอเชิญเที่ยวงาน มหกรรมเล่าขานตำนานเมืองระยอง เฉลิมพระเกียรติ 68 พรรษาสมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เนื่องในวันอนุรักษ์มรดกไทย ประจำปี 2566 วันที่ 31 มีนาคม - 2 เมษายน 2566 ณ ถนนยมจินดา อ.เมือง จ.ระยอง ในงานเพิ่มเติมด้วยกิจกรรม โครงการจัดแสดงไฟเฉลิมพระเกียรติ สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ผ่านลายอัตลักษณ์ ระยอง (DNA) และงาน “สมัชชาคุณธรรม จังหวัดคุณธรรมระยอง” วันที่ 31 มีนาคม 2566 วันที่ 1 – 2 เมษายน 2566 ณ ศาลเจ้าแม่ทับทิมระยอง ถนนยมจินดา ตำบลท่าประดู่ อำเภอเมือง จังหวัดระยอง
งาน "เสน่ห์วิถีถิ่น แผ่นดินระยอง" เที่ยวชุมชน ยลวิถี ชมของดี ที่เนินฆ้อ 30- 31 มีนาคม 2566
องค์การบริหารส่วนจังหวัดระยอง ร่วมกับสำนักงานวัฒนธรรมจังหวัดระยอง เทศบาลตำบลเนินฆ้อ ขอเชิญชวนเที่ยวงาน "เสน่ห์วิถีถิ่น แผ่นดินระยอง" เที่ยวชุมชน ยลวิถี ชมของดี ที่เนินฆ้อ วันที่ 30- 31 มีนาคม 2566 ณ สะพานรักษ์แสม ต.เนินฆ้อ อ.แกลง จ.ระยอง งานเริ่มตั้งแต่ 10.00 น. - 21.00น. ร่วมสักการะรอยพระพุทธบาทจำลอง อายุ 161 ปี ร่วมยินดี พิธีแต่งงานปู ชมการแข่งขันเรือพื้นบ้าน การแสดงพื้นถิ่น ชิม ช้อป อาหารพื้นถิ่น ผลิตภัณฑ์พื้นบ้านสนุกสนาน รำวงย้อนยุค และกิจกรรมอื่นๆ อีกมากมาย
งานหัวหินฟู๊ดคาร์นิวัล 2023 HUAHIN FOOD CANIVAL 2023 - 25 มีนาคม - 16 เมษายน 66
งานหัวหินฟู๊ดคาร์นิวัล 2023 HUAHIN FOOD CANIVAL 2023 ตั้งแต่ 25 มีนาคม - 16 เมษายน 66 ตั้งแต่เวลา 17.00น. - 22.00น. ณ ลานด้านหน้า ศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน เทศกาลความอร่อยต้อนรับซัมเมอร์ รวบรวมร้านค้าร้านอร่อย อาหาร และ เครื่องดื่มมากมาย จากสิงห์ ชวนทุกท่านมาร่วมดื่มด่ำและร่วมฟังดนตรีสดในบรรยากาศสุดชิลทุกวัน พลาดไม่ได้! ชมคอนเสิร์ตจากศิลปินดัง แบบอัดแน่นจัดเต็มตลอดเดือน
31 มี.ค.66 พบกับคอนเสิร์ตจาก INSTINCT
6 เม.ย.66 พบกับคอนเสิร์ตจาก LOMOSONIC
11 เม.ย 66 พบกับคอนเสิร์ตจาก ลุลา กันยารัตน์
HuaHin Bikini Run ครั้งที่ 1 วันที่ 25 มีนาคม 2566
งาน HuaHin Bikini Run ครั้งที่ 1 วันที่ 25 มีนาคม 2566 บริเวณชายหาดเขาตะเกียบ เดิน/วิ่งระยะ 3 กม. และ 5 กม. การแสดงวง paradox
งาน Hua Hin Old Days Festival #2 @BluPort 31 มี.ค. - 12 เม.ย. 66
งาน Hua Hin Old Days Festival ที่ The Square Bluport Hua Hin เข้างานฟรี พบกับวงดนตรีหลากหลายสไตล์ ดนตรี Bossa Nova - Latin - Jamaica - Samna เวทีจัดเต็มโดนใจ พบกับศิลปินบนเวที Hua Hin Old Days Stage พร้อมให้ทุกคนเข้ามาสัมผัสและร่วมเป็นส่วนหนึ่งในการย้อนวันวานของเมืองหัวหิน
งาน Huahin Food Carnival 26 มีนาคม 2566
ในงาน Huahin Food Carnival ณ ลานด้านหน้า HuaHin Market Village วันที่ 26 มีนาคม 2566 เวลา 18.00 น. ชวนวัยรุ่นY2K ชมแฟชั่นโชว์ “Varda Y2K Summer Fashion Show ของน้องๆหนูๆ ตัวแม่ตัวมัม จากวาร์ดาบายสินี
งานชุมชนขนมแปลกริมคลองหนองบัว ชุมชนขนมแปลกริมหนองบัว จันทบุรี 18 มี.ค.66 - 9 เม.ย.66
เชิญเที่ยวงานชุมชนขนมแปลกริมคลองหนองบัว พบกับกิจกรรมฟื้นฟูวัฒนธรรม ประเพณี ท้องถิ่นต่างๆ นั่งเรือ ปล่อยปู ดูเหยี่ยวแดง สาธิตการทำไม้กวาดจากดอกอ้อ งานหัตถกรรมของชุมชน ขนมประจำท้องถิ่น และการละเล่นแบบโบราณ วันที่จัดงาน : ทุกวันเสาร์และอาทิตย์ เริ่ม 18 มี.ค.66 - 9 เม.ย.66 พิกัด : ชุมชนขนมแปลกริมหนองบัว
เที่ยวชุมชนยลวิถี วัดละหานไร่ อ.บ้านค่าย 17-19 มีนาคม 2566
เที่ยวชุมชนยลวิถี มหกรรมรวมพลังขับเคลื่อนจังหวัดคุณธรรม วัดละหานไร่ อ.บ้านค่าย จ.ระยอง 17-19 มีนาคม 2566 เวลา 17.00-21.00 น. กิจกรรมในงาน ไหว้พระเกจิดัง 8 อำเภอ ชมการแสดงพิธีเปิด ละครเพลง ร้านค้า อาหารอร่อยของดี 8 อำเภอ การแสดงศิลปวัฒนธรรมท้องถิ่น ศิลปินขึ้นเวทีทั้ง 3 คืน
กิจกรรมงาน สมโภช ๑๐๐๒ ปี ศรีหลักเมืองเพชรบูรณ์
กิจกรรมงาน สมโภช ๑๐๐๒ ปี ศรีหลักเมืองเพชรบูรณ์ มีมหรสพการแดสง ภาพยนต์กลางคืน ลิเก ดนตรี ชมฟรีทุกวัน ตลอดงาน สอบถามโทร 056-711007 ต่อ 306
ตลาดวัฒนธรรมเพชบุระ 22 มีนาคม-2 เมษายน 2566
ตลาดวัฒนธรรมเพชบุระ โครงการที่จะส่งเสริมเศรษฐกิจชุมชนได้ทำการค้าขายสินค้าชุมชน รวมถึงการแสดงออกทางวัฒนธรรมชุมชน ปีนี้เป็นปีแรกได้จัดขึ้นที่ ลานกิจกรรมหลักเมือง ในข่วงแรกจัดในพื้นที่ศูนย์การเรียนรู้เกาะเพขร ระหว่างวันที่ 22 มีนาคม ถึง 2 เมษายน ร่วมกับงานสมโภชหลักเมือง 1002 ปี
Phuket Cannabis Cup ครั้งที่ 1 วันที่ 25 มีนาคม 2566
งานแสดงผลิตภัณฑ์และการประกวดการแข่งขันกัญชา 4 รายการ ได้แก่ Best Indoor Sativa, Best Indoor Indica, Best Indoor Hybrid และ Best Greenhouse การแข่งขันย่อยอีก 2 รายการ ได้แก่ Miss Cannabis Cup และ Fastest Joint Roller จัดวันที่ 25 มีนาคม 2566 ณ โรงแรมประมุกโก้ รีสอร์ท หาดกะตะ จ.ภูเก็ต โดย
สมาคมกัญชาภูเก็ต เช็ครายชื่อผู้ชนะในแต่ละการแข่งขัน
หน่วยทันตกรรมเคลื่อนที่ เดือนมีนาคม 2566
8 มี.ค. 66 บริเวณหน้าศาลา 100 ปี วัดกระทุ่มเสือปลา เขตประเวศ
9 มี.ค. 66 บริเวณลานกีฬาหมู่บ้านพรรณพฤกษา ซ.บรมราชชนนี 121 เขตทวีวัฒนา บริเวณชุมชนช่างนาคสะพานยาว ซ.สมเด็จเจ้าพระยา 5 เขตคลองสาน
10 มี.ค. 66 บริเวณแฟลตจุฬา เขตปทุมวัน
14 มี.ค. 66 บริเวณหน้าโบสถ์ วัดธาตุทอง เขตวัฒนา
ให้บริการตรวจและให้คำแนะนำในการดูแลสุขภาพช่องปากและฟัน ขูดหินปูน อุดฟัน ถอนฟัน
โดยหน่วยทันตกรรมเคลื่อนที่
- สามารถให้บริการได้ประมาณวันละ 12 – 15 ราย
- กรณีมีประชาชนต้องการรับบริการมากกว่าที่กำหนด ทันตแพทย์จะทำการนัดหมายให้เข้ารับบริการที่ศูนย์บริการสาธารณสุข
หมายเหตุ กำหนดการอาจมีการยกเลิกกรณีพระราชกฤษฎีกาการเลือกตั้ง
งาน THE MUSICIAN DOG มหกรรมสัตว์เลี้ยงสุดยิ่งใหญ่ 16 - 22 มี.ค. 66
งาน "THE MUSICIAN DOG" มหกรรมสัตว์เลี้ยงสุดยิ่งใหญ่ 16 - 22 มี.ค. 66 ลานโปรโมชั่น บริเวณโถงลิฟต์แก้ว ชั้น 1 เซนทรัลพระราม 3 ในงานมีกิจกรรมและดนตรี มากมาย กิจกรรมเด่น อาทิ Dog Contest ร่วมเชียร์การประกวดแต่งกายน้องหมาภายใต้ Concept “Dog Super Star” Dog Hero พบกับน้องเซียร่าและน้องซาฮาร่า สุนัขค้นหา K9 : USAR Thailand ซูปเปอร์ด็อกซ์ฮีโร่ จากปฎิบัติการณ์ค้นหาผู้รอดชีวิตจากแผ่นดินไหวที่ซีเรีย และโชว์สุดพิเศษ Dog Music Show ชมความสามารถพิเศษน้องหมาเล่นดนตรี Dog Meet & Greet พบกับชมรมสุนัขอลาสกัน มาลามิวท์ ที่ยกขบวนมาโชว์ความน่ารัก ปุกปุย นอกจากนี้ยังมีกิจกรรมเอาใจเจ้าตูบแสนรัก ให้ได้ร่วมสนุกอีกมากมาย อาทิ
Dog Café คาเฟ่เจ้าตูบสุดน่ารักขนาดใหญ่กว่า 8 เมตร
Dog Studio สตูดิโอถ่ายรูปน้องหมาสุดคิ้วท์
Dog Tattoo Sticker สติ๊กเกอร์ Tattoo ลายน้องหมา
Dog Griptok กริ๊บต๊อกติดเคส ไอเทมสุดคิ้วท์ ที่ต้องมี
กิจกรรม Workshop พาเพื่อนซี้สี่ขามาร่วมออกแบบ กระเป๋า หรือ สายจูง หรือ ปลอกคอ ในแบบสไตล์เจ้าตูบแสนรักกันนะคะ
คอร์สอบรมการปลูกกัญชา กัญชง อย่างถูกกฎหมาย บ้านไร่ อุทัยธานี 23 เม.ย.65 LINK
เฌอตฤณ จับมือกับ ฟาร์ม 420 Forest park อ.บ้านไร่ จ.อุทัยธานี คอร์สอบรมการปลูกกัญชา กัญชง อย่างถูกกฎหมาย วันเสาร์ที่ 23 เมษายน 2565 สำหรับผู้ที่สนใจ - มีต้นน้ำ ปลายน้ำ พร้อมทำMOU สำหรับกัญชง - แนะนำการขออนุญาต การปลูกสำหรับกัญชา มามองหาทางเลือกที่อนาคตอันใกล้จะเปิดให้ทำอย่างถูกต้องตามกฏหมาย รู้ก่อนได้เปรียบ รู้สายดีกว่าไม่รู้เลย เราเปิดเรียนแบบ workshop เรียนหลักการให้รู้เรื่องก่อน เเล้วลงมือทำ จับมือทำโดยนักปลูกมืออาชีพ รับจำนวนจำกัด 20 ท่าน เท่านั้น ท่านละ 3,000 บาท สอบถามเพิ่มเติมได้ที่ 093 451 3300 คุณสาวิตรี @420 Forest Park
สวทช.จัดหลักสูตรการปลูกพืชด้วย โรงปลูกพืชแนวตั้ง (Vertical Farming) 28 เม.ย.65 LINK
สวทช.จัดหลักสูตรการปลูกพืชสมุนไพรด้วย โรงปลูกพืชแนวตั้ง (Vertical Farming) ตอน “กัญชา (Cannabis)” รุ่นที่ 3 เรียนออนไลน์ผ่าน Zoom เรียนรู้การปลูกกัญชาในโรงปลูกพืชแนวตั้ง (Vertical Farming) ทั้งเทคนิคการปลูก และการเพิ่มคุณภาพผลผลิตของกัญชา จากผู้มีประสบการณ์จริง เข้าใจห่วงโซ่อุปทาน (Supply Chain) ของกัญชา และเห็นโอกาสทางธุรกิจ ระหว่างวันพฤหัสบดีที่ 28 เมษายน 2565 เวลา 09.00 – 16.00 น. (ระยะเวลาอบรมจำนวน 1 วัน) ค่าลงทะเบียน ท่านละ 3,900 บาท
HEMP & CBD Education Tour - Exclusive Trip ฟาร์มกัญชง GTG 21 เม.ย.65 LINK
Prop2morrow จับมือกับ บริษัทโกลเด้น ไทรแองเกิ้ล กรุ๊ป จำกัด (มหาชน) และ มหาวิทยาลัยราชภัฎเชียงราย ในการจัด HEMP & CBD EDUCATION TOUR Exclusive Trip แบบ VIP 21-22 April เฉพาะกลุ่มนักธุรกิจ นักลงทุนที่สนใจชมโครงการศึกษาวิจัยสายพันธุกัญชา เพื่อวิจัยสายพันธุ์กัญชงที่ CBD สูง
ณ ฟาร์มกัญชา ระบบปิด ที่สามารถสกัดสาร CBD ได้สูงถึง 18% ของบริษัทโกลเด้นไทรแองเกิ้ล กรุ๊ป จำกัด (มหาชน) จังหวัดเชียงราย รวมทั้งเข้าชมศูนย์วิจัยและเพาะเนื้อเยื่อต้นกัญชามหาวิทยาลัยราชภัฎเชียงราย พร้อมชิมอาหารและเครื่องเมนูสุดพิเศษจากใบกัญชาที่รังสรรค์โดยคณะคหกรรมมหาวิทยาลัยราชภัฎเชียงราย โทรสอบถามได้ที่ 0649348739
สัมมนาวิชาการ กัญชา กัญชง และกระท่อม มหาวิทยาลัยเกษตรศาสตร์ 20 เม.ย.65 LINK
กัญชา กัญชง และกระท่อม นโยบาย ขั้นตอน กรอบในการดำเนินงานวิจัย 20 เม.ย.65 เวลา 13.15 น. ห้องประชุมรวงข้าว คณะเกษตร มก. หรือ ทาง WebEx สายเขียวเชิญมารวมกัญตรงนี้ 20 เมษายน 2565 ขอเชิญเข้าร่วมกิจกรรมสัมมนาวิชาการ เรื่อง "การดำเนินงานที่เกี่ยวข้อง กับพืชกัญชา กัญชง และกระท่อม มหาวิทยาลัยเกษตรศาสตร์ ประจำปี พ.ศ.2565" ณ ห้องประชุมรวงข้าว อาคารชิรานุสรณ์ คณะเกษตร มหาวิทยาลัยเกษตรศาสตร์ เวลา 13.30-16.00 น. นอกจากนี้ยังมีนิทรรศการ ที่นำเสนอผลงานจาก โครงการบริการวิชาการ ที่เกี่ยวข้องกับพืชกัญชา กัญชง และกระท่อม อาทิ ผลิตภัณฑ์โซดากัญชา น้ำกระท่อม ให้ทุกท่านได้ลองชิม หรือพบกัญแบบออนไลน์ ที่ Webex
โครงการ Seoul Thai Festival Online 2022 : Healthy Thai 23-24 เมษายน 2565 LINK
โครงการ Seoul Thai Festival Online 2022 : Healthy Thai
สถานเอกอัครราชทูต ณ กรุงโซล ร่วมกับศูนย์อาเซียน-เกาหลี เชิญชวนเพื่อนชาวไทยและเกาหลีรับชม video streaming งาน “Seoul Thai Festival Online 2022” ในวันที่ 23 และ 24 เมษายน 2565 ที่ Facebook: RoyalThaiEmbassySeoul
เทศกาลไทยเป็นงานประจำปีที่จัดขึ้นโดยสถานเอกอัครราชทูตฯ ตั้งแต่ปี 2558 เพื่อส่งเสริมความสัมพันธ์ฉันมิตรระหว่างไทยและเกาหลีใต้โดยเฉพาะความสัมพันธ์ระหว่างประชาชนของทั้งสองประเทศ ตลอดจนส่งเสริมการท่องเที่ยวในประเทศไทย และความนิยมในสินค้าไทย รวมทั้ง อาหารไทย โดยงานจัดขึ้นในช่วงต้นปี 2562 ที่ Cheonggye Plaza มีผู้เข้าร่วมมากกว่า 45,000 คน อย่างไรก็ดี เนื่องจากสถานการณ์การแพร่ระบาดของเชื้อไวรัส COVID -19 สถานเอกอัครราชทูตฯ จึงได้จัดงานSeoul Thai Festival Online ครั้งที่ 1 ในปี 2564 ภายใต้ธีม “Imagine Thailand” ซึ่งการจัดงานประสบความสำเร็จอย่างยิ่ง
มีจำนวนการรับชมประมาณ 2 ล้านวิว (views) ในช่วงระยะเวลา 1 เดือน
แม้ว่าสถานการณ์การระบาดของเชื้อไวรัส COVID-19 ในไทยและเกาหลีใต้ในปีนี้ มีพัฒนาการที่ดีขึ้น อาทิ สามารถควบคุมการแพร่ระบาดฯ ได้ดีในระดับหนึ่ง ประชากรของทั้งสองประเทศได้รับวัคซีนป้องกันเชื้อไวรัส COVID-19 มากขึ้น แต่สถานการณ์การติดเชื้อไวรัส COVID-19 ในทั้งสองประเทศยังคงต้องเฝ้าระวัง สถานเอกอัครราชทูตฯ จึงจะจัดงาน Seoul Thai Festival Online ครั้งที่ 2 โดยเน้น concept ว่า Seoul Thai Festival 2022 “Healthy Thai” เพื่อนำเสนอการดูแลสุขภาพ โดยเชื่อมโยงกับศิลปะวัฒนธรรมไทย อาหารไทยที่ดีต่อสุขภาพ การดูแลสุขภาพด้วยตนเอง การออกกำลังกาย เพื่อรักษาสุขภาพให้แข็งแรงอยู่เสมอ และการท่องเที่ยวไทยเชิงสีเขียว โดยสถานเอกอัครราชทูตฯ ได้เลือกหนุมานและมัจฉานุ จากรามเกียรติ์ ซึ่งเป็นตัวละครที่มีพลัง แข็งแรง กระฉับกระเฉง และมีความสุข เป็นตัวแทนนำเสนอเทศกาลไทยออนไลน์ในปีนี้ โดยแบ่งเป็น 7 รายการ ดังนี้
1.รายการมวยไทยเพื่อสุขภาพ
2.Boxing_TH Boxing_KR
3.รายการแนะนำสนามกอล์ฟและเทคนิคการเล่นกีฬากอล์ฟ
4.รายการแนะนำศักยภาพทางการแพทย์ของไทย
5.รายการแนะนำการท่องเที่ยวของประเทศไทยเชิงสีเขียว
6.รายการแนะนำการ์ตูนไทย โดย Kakao Webtoon Thailand
7.การแสดงดนตรี และร้องเพลงของศิลปินชื่อดังไทย และวงดนตรีไทยรุ่นใหม่
สัมมนาทางวิชาการ “แพทย์พบแพทย์ เพื่อกัญชาทางการแพทย์” LINK
สมาคมนักวิจัยแห่งประเทศไทย ได้กำหนดจัดการสัมมนาทางวิชาการ “แพทย์พบแพทย์ เพื่อกัญชาทางการแพทย์” โดยจัดร่วมกันระหว่าง บริษัท เนเจอร์ ไทย วิสดอม จำกัดและศูนย์บูรณาการความรู้กัญชา และจัดการประชุมใหญ่สามัญประจำปี 2565 ในวันพุธที่ 20 เมษายน 2565 ลงทะเบียนการสัมมนาทางวิชาการเวลา 8.00 น. ณ ห้องประชุม จอมพลสฤษดิ์ ธนะรัชต์ อาคาร วช.1 ชั้น 2 สำนักงานการวิจัยแห่งชาติ เขตจตุจักร กรุงเทพมหานคร
4 กันยายน - BKK-เรนเจอร์ @ศูนย์เยาวชนดอนเมือง LINK
"BKK-เรนเจอร์ @ ศูนย์เยาวชนดอนเมือง"
ขอพาไปไล่เรียงความสนุก และทำความรู้จักกับ 5 Workshop จาก "Urban art Design" เพื่อเตรียมตัวไปร่วมกิจกรรม ที่มีทั้งความรู้ ความสนุก และความสดใสรออยู่ ช่วงเวลาตั้งแต่ 13.00 - 16.00 น. ไปดูกิจกรรมและรายละเอียดกันได้เลย
ห้องที่ 1 Mabling Art : โดย Mai Bai Crafte (พี่ปัท)
เพราะจินตนาการปิดกั้นกันไม่ได้ กิจกรรมนี้จะชวนกันปลดปล่อยออกมา ผ่านงานศิลปะทำมือ ที่จะเป็นผลงานสร้างขึ้นด้วยตัวเอง และมีชิ้นเดียวในโลก มาลองทำ ลองเล่น ให้เป็นงานศิลปะ เป็นลวดลาย ด้วยเทคนิคการหยดสีลงบนผิวน้ำ ให้มีลักษณะคล้ายชั้นของหินอ่อน หรือเป็นจะเป็นลวดลายที่อยากออกแบบด้วยเทคนิคเฉพาะตัวก็ได้
รับรอบละ 15 คน
จำนวน 3 รอบ รอบละ 1 ชั่วโมง
ห้องที่ 2 ละครใบ้และมายากล : โดย Urban Street Bangkok (พี่หลุยและพี่ซัน)
เปิดประสบการณ์ความสนุก ความตื่นเต้น มาสร้างรอยยิ้ม เสียงหัวเราะ และขึ้นแสดงบนเวทีด้วยกัน กิจกรรมที่จะชวนทุกคนใช้ร่างกายสื่อสารออกมา ผ่านการแสดงสีหน้า แววตา ท่าทาง และความรวดเร็ว จะรวมกันอยู่ในกิจกรรมนี้ มาร่วมเนรมิตทักษะการแสดงให้กับตัวเอง
รับจำนวน 15 คน
ห้องที่ 3 นิทานหุ่นมือ : โดย สวนครูองุ่น
เปิดโลกแห่งจินตนาการที่สร้างจากเศษผ้าของคุณยาย ให้ออกมาเป็นนิทาน มาดูกันว่าจะเพิ่มคุณค่าให้กับเศษผ้าได้ยังไง จะกลายเป็นตัวละครแบบไหน มาร่วมออกแบบคาเรคเตอร์ให้ออกมาเป็นหุ่นมือที่นำมาเล่าเรื่องได้ สร้างทักษะให้กับตัวเองและสร้างความสุขให้กับผู้คนได้
รับจำนวน 20 คน
ห้องที่ 4 บิวตี้บล็อกเกอร์ : โดย ปุณิกา หรั่งฉายา
สะบัดแปรงเติมความมั่นใจ เรียนรู้การแต่งหน้า กับช่างแต่งหน้ามืออาชีพ การแต่งหน้าอาจจะเป็นสิ่งที่หลายคนอยากทำความเข้าใจ ว่าแต่งยังไง? และมีเทคนิคอะไรบ้าง? อยากชวนทุกคนมาลองแต่งหน้าให้ตัวเอง เรียนรู้ ลองใช้เครื่องมือ และการแต่งหน้าแบบมืออาชีพ เป็นกิจกรรมที่ช่วยเสริมได้ทั้งความมั่นใจและเสริมอาชีพได้
รับจำนวน 15 คน
ห้องที่ 5 Designer : โดย ครูโป้ง จรัญ คงมั่น
การสร้างสรรค์ชุดแต่ละตัวต้องผ่านกระบวนการอะไรบ้าง
มาลองร่าง ลองวาด ลองออกแบบ ใส่ไอเดียแฟชั่นสุดบรรเจิดไปด้วยกัน
รับจำนวน 15 คน
หลังจากจบ Workshop พบกับความสนุกกันต่อกับกิจกรรมบางกอกกำลังดีตั้งแต่ 16.00 - 20.30 น. วันนี้อาทิตย์ที่ 4 กันยายนนี้ตั้งแต่เวลา 13.00 - 20.30 เตรียมตัวให้พร้อมและมาเจอกัน!
++++
วิธีการเดินทางมา "BKK เรนเจอร์ ณ ศูนย์เยาวชนดอนเมือง" จัดโดยบางกอกกำลังดี
ด้วยรถสาธารณะ
ขาเข้างาน
SRT รถไฟฟ้าสายสีแดง : สถานีดอนเมือง (ทางออก 2)
รถประจำทาง : สาย 1-1AC, 59, 95ก, 504, 510, 538, 555 ลงป้ายตลาดใหม่ดอนเมือง
• เดินต่อมาหน้าธนาคารไทยพาณิชย์
• มีรถตู้ 2 คัน รับ-ส่ง เข้าศูนย์เยาวชนดอนเมือง ตั้งแต่ 14.00 - 18.00 น. ฟรี!
ขาออกจากงาน
มีวินมอเตอร์ไซค์ หน้าศูนย์เยาวชนดอนเมือง
มีรถสองแถว 1 คันสำหรับ รับ-ส่ง ฟรี ลงสถานีรถไฟฟ้าดอนเมือง
มีที่จอดรถในศูนย์เยาวชนดอนเมืองประมาณ 30 คัน
เมตตารัน วิ่งการกุศล โรงพยาบาลเมตตาประชารักษ์ (วัดไร่ขิง) 23 เม.ย.66
กิจกรรมการวิ่งเพื่อการกุศล โดยโรงพยาบาลเมตตาประชารักษ์ (วัดไร่ขิง) สองขาสับสร้างแสงแห่งใจ เมตตารัน RUN FOR SEE งานวิ่งเพื่อส่งต่อการมองเห็น รายได้สมทบทุนงานโรงพยาบาลเมตตาประชารักษ์ (วัดไร่ขิง) เปิดรับสมัคร 17 พฤศจิกายนนี้ 3K 5K 14K วิ่งรอบเกาะลัดอีแท่น ติดต่อทีมงานรับสมัคร โทรศัพท์ : 080-5233637 , 094-1070182
facebook.com/mettarun/สินสมุทรรัน 2566 อนุสาวรีย์สุนทรภู่ วันที่ 30 เม.ย.66
Sinsamut Run 2023 การจัดกิจกรรม วิ่ง สินสมุทรรัน 2566 ณ อนุสาวรีย์สุนทรภู่ อำเภอแกลง จังหวัดระยอง วันที่ 30 เมษายน 2566 ระยะแข่งขัน 5 KM 10 KM 21 KM ธีมงาน เน้นเอกลักษณ์ของวรรณคดีชื่อดัง เรื่องพระอภัยมณี พร้อมกับการสัมผัสเส้นทางวิ่งไฮไลต์ สะพานประแสสิน เพื่อชื่นชมความงาม สัมผัสกับอากาศที่บริสุทธิ์ของธรรมชาติปากน้ำประแส และส่งเสริมการท่องเที่ยวในจังหวัดระยอง ในช่วงฤดูผลไม้
ม.เกษตร จัดประชุมวิชาการพืชกัญชา กัญชง และกระท่อมระดับชาติ ครั้งที่ 1 วันที่ 20 เมษายน 2566 LINK
มหาวิทยาลัยเกษตรศาสตร์จัดการประชุมวิชาการพืชกัญชา กัญชง และกระท่อมระดับชาติ ครั้งที่ 1 ในหัวข้อ "การเพิ่มศักยภาพการผลิตพืชและสารสกัดทางการแพทย์จากกัญชา กัญชง และกระท่อม ด้วยผลงานวิจัยและนวัตกรรม" ในวันที่ 20 เมษายน พ.ศ. 2566 ณ อาคารวชิรานุสรณ์ คณะเกษตร มหาวิทยาลัยเกษตรศาสตร์ ผู้ที่สนใจส่งผลงานทางวิชาการเข้าร่วมการประชุมวิชาการพืชกัญชา กัญชง และกระท่อมระดับชาติ มหาวิทยาลัยเกษตรศาสตร์ ครั้งที่ 1 สามารถลงทะเบียน และส่งผลงานได้ทั้งรูปแบบเรื่องเต็ม หรือเฉพาะบทคัดย่อได้ ขยายเวลาส่งผลงานถึงวันที่ 6 กุมภาพันธ์ พ.ศ. 2566
9 เม.ย.66 Pattana Triathlon Festival 2023 พัฒนา สปอร์ต รีสอร์ท ชลบุรี LINK
Pattana Triathlon Festival 2023 "พัฒนา ไตรแอทลอน เฟสติวัล 2023" งานแข่งไตรกีฬาประจำปีจัดขึ้นที่พัฒนา สปอร์ต รีสอร์ท ชลบุรี กลับมาท้าทายขีดจำกัด เพิ่มอัตราการเต้นของหัวใจ ของเหล่านักไตรฯพลังล้นทั้งไทยและต่างประเทศ ในเส้นทางที่จะทำให้เลือดคุณสูบฉีดอีกครั้ง ด้วยระยะแข่งที่หลากหลาย รวมถึงระยะไฮไลท์ long course 70.3 ที่หลายคนรอคอย งานนี้พลาดไม่ได้ พร้อมระเบิดความมันส์ในวันอาทิตย์ที่ 9 เมษายน 2023 นี้ SAVE THE DATE : 9 April 2023 PATTANA SPORTS RESORT, CHONBURI
Haad Sai Kaew Suimmer Beach Run 2023 วันอาทิตย์ที่ 23 เม.ย.66 LINK
Haad Sai Kaew Suimmer Beach Run 2023 ระยะวิ่ง 21K / 10K / 5K
วันอาทิตย์ที่ 23 เมษายน 2023 สถานที่จัดกิจกรรม โรงเรียนชุมพลทหารเรือ อำเภอสัตหีบ จังหวัดชลบุรี ทุกระยะจะได้รับเหรียญเสด็จเตี่ย รุ่น ๙๓ ปี โรงเรียนชุมพล จัดสร้างและปลุกเสกครบวาระ โดยโรงเรียนชุมพลทหารเรือ
ก้าวท้าใจ Season 5
ก้าวท้าใจกลับมาแล้ว พร้อมกับพลังอันล้นเหลือ และฮึกเหิมยิ่งกว่าเดิม!! เริ่มต้นก้าวแรกของ Season 5 กับพิธีเปิดสุดยิ่งใหญ่ Kick Off ก้าวท้าใจ Season 5 “ร่วมกันท้า 150 วัน 15 ล้านแต้มสุขภาพ” วันที่ 1 มีนาคม นี้ 16.00-19.00 น. ณ สวนเบญจกิติ เขตคลองเตย, กรุงเทพมหานคร หรือรับชมถ่ายทอดสดผ่านทาง Facebook Fanpage : ก้าวท้าใจ
ซีมะโด่ง ไนท์รัน 2023 งานวิ่งในหอใน จุฬา 2 เม.ย.66 LINK
ซีมะโด่ง ไนท์รัน 2023 / Cmadong Night Run 2023 งานวิ่งที่ยิ่งใหญ่ที่สุดในหอในกับ CMADONG Night run 2023! กนห.จึงขอเชิญชวนนิสิตจุฬาฯ และบุคคลทั่วไป มาร่วมเป็นส่วนหนึ่งในงานวิ่งประจำปีของหอในของเรา วันที่จัดงาน : วันที่ 2 เมษายน 2566 สถานที่จัดงาน : หอพักนิสิตจุฬาฯ - จุฬาลงกรณ์มหาวิทยาลัย
งานวันกัญชาโลก 2023 : Green Cannabis Krabi 420 กระบี่ 20 เมษายน 2566 LINK
งานวันกัญชาโลก 2023 : Green Cannabis Krabi 420 วันที่ 20 เมษายน 2566 12.00น. - 24.00 น. กิจกรรม เสวนา แถลงการณ์ถึงจุดยืนกัญชาเพื่อประชาชน ณ เมืองกระบี่ การแสดงสาธิตการปลูก การทำยากัญชา การแสดงผลิตภัณฑ์จากกัญชาจากกลุ่มองค์กรต่างๆ แนวทางการพัฒนาสู่การใช้กัญชาเพื่อการดูแลสุขภาพ รวมทั้งการแสดงศิลปะดนตรีของศิลปินท้องถิ่น
PPAO MiniMarathon 2023 งานวิ่งอบจ.ภูเก็ต 2 เม.ย.66
PPAO MiniMarathon 2023 งานวิ่งอบจ.ภูเก็ต วันที่ 2 เมษายน 2566 ณ. โครงการอ่างเก็บน้ำบางเหนียวดำ ต.ศรีสุนทร อ.ถลาง จ.ภูเก็ต
ขลุงฟันรัน วันสงกรานต์ 2566 วิ่งฟรี!!! มีรางวัล วันเสาร์ที่ 15 เมษายน 2566
ขลุงฟันรัน วันสงกรานต์ 2566 วิ่งฟรี!!! มีรางวัล ไม่มีค่าใช้จ่าย ระยะทาง 4.8 กิโลเมตร ???? ???? วันแข่งขัน วันเสาร์ที่ 15 เมษายน 2566 (วันเล่นน้ำสงกรานต์ประจำปีเมืองขลุง) ⏰เวลา 06:00 น. ???? ณ หอประชุมเอนกประสงค์เทศบาลขลุง
บาง•กะ•จ๊ะ | เดิน-วิ่ง เพื่อน้องตามรอยวัฒนธรรมเมืองจันท์ วันอาทิตย์ที่ 2 เมษายน 2566
รักใครให้ชวนวิ่ง มาวิ่งกันเถอะ "บาง•กะ•จ๊ะ | เดิน-วิ่ง เพื่อน้องตามรอยวัฒนธรรมเมืองจันท์" ???? ในวันอาทิตย์ที่ 2 เมษายน 2566 ณ โรงเรียนบางกะจะ อ.เมือง จ.จันทบุรี ประเภท 3K | 5K | 10K
วิ่งการกศุล HAPPY RUN FOR FUN MINI-HALF MARATHON วันอาทิตย์ที่ 23 เม.ย.66
ขอเชิญผู้สนใจร่วมสมัครวิ่งการกศุล HAPPY RUN FOR FUN MINI-HALF MARATHON วันอาทิตย์ที่ 23 เมษายน 2566 ณ จุดชมวิวหินโคร่ง คุ้งวิมาน อ.นายายอาม รายได้เพื่อจัดซื้อเตียงทันตกรรมและเครื่องเอ็กซเรย์ฟันให้กับโรงพยาบาลพระปกเกล้า จังหวัดจันทบุรี และเพื่อมอบเป็นทุนการศึกษาให้กับนักเรียนด้อยโอกาสและช่วยเหลือผู้ยากไร้
สมัครชาววัง Walk & Run 2023 วันอาทิตย์ที่ 30 เม.ย.66 LINK
“ชาววัง Walk & Run 2023” วันอาทิตย์ ที่ 30 เมษายน 2566 ณ วิสาหกิจชุมชนกลุ่มเกษตรกรรมชาววัง หมู่ที่ 1 ตำบลวังท่าช้าง อำเภอกบินทร์บุรี จังหวัดปราจีนบุรี
ด้วยปัญหาช้างป่า เข้ามาทำลายพืชผลทางการเกษตร ภายในตำบลวังท่าช้าง และปัจจุบันได้เข้ามาถึงบ้านเรือนพี่น้องประชาชน ตำบลวังท่าช้าง อำเภอกบินทร์บุรี จังหวัดปราจีนบุรี
เนื่องจากไม่มีงบประมาณ ค่าใช้จ่าย วัสดุ อุปกรณ์ และสิ่งอำนวยการอื่นๆ สำหรับทีมงานที่ปฎิบัติหน้าที่ ในการดูแลความปลอดภัย ชีวิต และทรัพย์สิน ของพี่น้องประชาชน จากปัญหาช้างป่าบุกรุกพื้นที่ภายในเขตตำบลวังท่าช้าง
งานนมัสการสมโภช ”หลวงพ่อเหลือ” จ.พิจิตร ประจำปี 2566
งานนมัสการสมโภช ”หลวงพ่อเหลือ” จ.พิจิตร ประจำปี 2566 ร่วมกราบไหว้สักการะ ชมประวัติความเป็นมา ความศักดิ์สิทธิ์อิทธิฤทธิ์ปาฏิหาริย์ของหลวงพ่อเหลือ พิธีแก้บน????และร่วมพิธีหล่อพระพุทธรูปหลวงพ่อเหลือจำลอง ปีนี้ตรงกับวันที่ 5 - 8 มีนาคม 2566
กำหนดการ
วันที่ 5 มีนาคม 2566
- 07.19 น. พิธีบวงสรวงฯ
- 09.49 น. พิธีเจริญพระพุทธมนต์สมโภชหลวงพ่อเหลือ
- 18.00น. การแสดงแสงสีเสียง ประวัติหลวงพ่อเหลือ
19.19 น. พิธีเปิดงานนมัสการสมโภชหลวงพ่อเหลือ
วันที่ 6-8 มีนาคม 2566
- 08.00 น.-12.00 น. พิธีแก้บน
วันที่ 8 มีนาคม 2566
- 21.19 น. พิธีเททองหล่อพระพุทธรูป 5 องค์
ปฏิทินเที่ยว ประจวบคีรีขันธ์ เดือนเมษายน
ชุ่มฉ่ำสงกรานต์ย่านยมจินดา 13 เมษายน 2566
"ชุ่มฉ่ำสงกรานต์ย่านยมจินดา" องค์การบริหารส่วนจังหวัดระยอง ขอเชิญเที่ยวงานโครงการสืบสานประเพณีวันสงกรานต์ ครั้งที่ 1 ประจำปี 2566 ในวันที่ 13 เมษายน 2566 ณ ถ.ยมจินดา อ.เมืองระยอง จ.ระยอง กิจกรรมภายในงาน ร่วมทำบุญตักบาตรข้าวสารอาหารแห้ง สรงน้ำพระ รดน้ำขอพรผู้สูงอายุ กิจกรรมการแสดง รำวงย้อนยุคจากวงสกุลรัตน์ ลำเจียกดนตรีไทย ร่วมสนุกเล่นน้ำสงกรานต์ (อุโมงค์น้ำ) มีบริการน้ำตลอดเส้นทางถนนยมจินดา และมีร้านค้าจำหน่ายอาหารต่างๆ ตลอดงาน
งานลานวัฒนธรรมไทย หนังใหญ่ไฟกะลา ครั้งที่๘ วันที่ 13-15 เมษายน 2566
แต่งกายย้อนยุค แล้วมาสนุกกับวัฒนธรรม “งานลานวัฒนธรรมไทย หนังใหญ่ไฟกะลา ครั้งที่๘”
วันที่ 13-15 เมษายน 2566 ณ ลานวัฒนธรรมวัดบ้านดอน จังหวัดระยอง
13 เมษายน
- การแสดงผู้สูงอายุบ้านดอน
- การแสดงหุ่นละครเล็กร่วมสมัย
14 เมษายน
- การแข่งขันตะกร้อลอดบ่วง ชิงเงินรางวัล
- การแสดงผู้สูงอายุบ้านดอน
- การแสดงมายากลไทยประยุกต์
- การแสดงเพลงพื้นบ้าน คณะอรชุน ลูกสุนทรภู่
- การแสดงหนังตะลุง ๗ คณะ
15 เมษายน
- ขบวนแห่หนังใหญ่ ยิ่งใหญ่อลังการ
- พิธีเปิดงาน “หนังใหญ่ไฟกะลา ครั้งที่๘”
- การแสดงรำกลองยาว
- การแสดงฟ้อน โรงเรียนมัธยมตากสินระยอง
- การแสดงหนังใหญ่ไฟกะลา
หนังใหญ่วัดพลับพลาชัย ปะทะ หนังใหญ่วัดบ้านดอน
สํารับจันท์ x มหัศจันท์แห่งรสชาติ Chanthaburi Gastronomy หุง ปรุง รสชาติฉบับจันทบูร 7-9 เมษายน 2566
มาร่วมเปิดประสบการณ์ใหม่กับศิลปวิทยาการอาหาร การท่องเที่ยวเชิงอาหาร พร้อมร่วมกิจกรรม Sensory Workshop แล้วคุณจะได้สัมผัสกับความ “มหัศจันท์” แห่งรสชาติ อาหารจันทบูร สํารับจันท์ x มหัศจันท์แห่งรสชาติ Chanthaburi Gastronomy หุง ปรุง รสชาติฉบับจันทบูร 7-9 เมษายน 2566 ณ ลานกิจกรรม Outdoor ศูนย์การค้าเซ็นทรัล จันทบุรี เวลา 16.00-21.00 น.
การท่องเที่ยวแห่งประเทศไทย สำนักงานจันทบุรี
ร่วมกับคณะวิทยาศาสตร์และศิลปศาสตร์
มหาวิทยาลัยบรูพา วิทยาเขตจันทบุรี
สมาคมส่งเสริมการท่องเที่ยวจังหวัดจันทบุรี
และศูนย์การค้า เซ็นทรัล จันทบุรี
จัดงาน “สํารับจันท์ x มหัศจันท์แห่งรสชาติ”
- เพื่อส่งเสริมการรับรู้อาหารถิ่น
- การท่องเที่ยวเชิงอาหารของจังหวัดจันทบุรี
- พัฒนาศิลป์ในการปรุงอาหาร
- ยกระดับ การพัฒนาผลิตภัณฑ์อาหารท้องถิ่นสู่ของฝาก
ของที่ระลึกเชิงวัฒนธรรมประจำจังหวัด
..
กิจกรรมภายในงาน
- พบกับการแข่งขันรังสรรค์สำรับคาวหวานจันทบุรีในวันที่ 8 เมษายน 2566
- “ชื่น ชม ชิม” อาหารสำรับจันท์ที่รวบรวมทั้ง ร้าน Street food ร้านเด็ด ร้านดังมาทั้งจังหวัดรวมกว่า 30 บูธ ละลานตาไปด้วยเมนูอร่อยในท้องถิ่นให้ไ้ด้ลิ้มรสมากมายเช่นหมชูะมวง ข้าวระกำขยำมือ
ก๋วยเตี๋ยวผัด น้ำกุ้ง ทอดมันกระวาน แกงคั่วกระวาน หมึกต้มน้ำดำ ข้าวเกรียบอ่อนน้ำจิ้มกุ้ง ฯลฯ
- การออกร้านจำหน่ายสินค้าจากชุมชน
- ชมนิทรรศการ“มหัศจันทแ์ห่งรสชาติ” Chanthaburi Gastronomy ที่จะพาคุณเปิดประสบการณ์ใหม่กับศิลปวิทยาการอาหารการท่องเที่ยวเชิงอาหารจันทบรู
- ร่วมสนุกกบักิจกรรมต่างๆและลุ้นรับรางวัลอีกมากมาย
..
สำหรับพิธีเปิดจัดขึ้นในวันที่ 7 เมษายน 2566 เวลา 17.30 น.
โดยมีนายมนต์สิทธิ์ ไพศาลธนวัฒน์ผู้ว่า ราชการจังหวัดจันทบุรี เป็นประธานในพิธี
โชว์นางเงือก ที่อุทยานฯ หว้ากอ 14 - 16 เมษายน 2566 LINK
อุทยานวิทยาศาสตร์พระจอมเกล้า ณ หว้ากอ จังหวัดประจวบคีรีขันธ์ จัดโชว์พิเศษสุดๆ รับสงกรานต์ปี 2566 "โชว์นางเงือก" ในวันศุกร์ เสาร์ อาทิตย์ ที่ 14 - 16 เมษายน 2566 นี้ @ตู้ Big tank พิพิธภัณฑ์สัตว์น้ำหว้ากอ เวลา 09.00 น. - 11.30 น. และ 13.00 น. - 15.30 น. ตะลึงไปกับเงือกสาวสาว ในการแสดงโชว์สุดพิเศษ เน้นย้ำ 3 วันสุดพิเศษเท่านั้น ราคาเข้าชมเท่าเดิม 181 หมู่ 4 ตำบลคลองวาฬ อำเภอเมือง จังหวัดประจวบคีรีขันธ์ 77000 (อุทยานวิทยาศาสตร์พระจอมเกล้า ณ หว้ากอ จังหวัดประจวบคีรีขันธ์) [
แผนที่]
Songkran Festival รื่นเริงสงกรานต์ไทย Hua Hin One 13-15 เมษายน 2566
Songkran Festival รื่นเริงสงกรานต์ไทย @Hua Hin One วันที่ 13-15 เมษายน 2566 เวลา 16.00-22.00 น. ที่ตลาดนัดหัวหินวัน @ ทิวทะเลเวิลด์ ถนนเพชรเกษม กม.196 ในบรรยากาศธีมงานวัด กิน ช้อป ฟังเพลง เล่นเกมส์ ตรีม กินอาหารอร่อย พร้อมขบวนฟู้ดทรัคมากมาย ช้อปสินค้าสุดน่ารัก กิ๊ฟเก๋ ชวนมาเล่นเกมส์แนวงานวัดแบบสนุกๆ มาฟังเพลง ดนตรีสดเพราะๆ พร้อมลานเบียร์สด ดื่มด่ำกับบรรยากาศแบบสุดฟิน
การแข่งขันขี่ม้าโปโลชายหาด 2023 วันที่ 1 เมษายน 2566
1 เมษายน 2566 การแข่งขันขี่ม้าโปโลชายหาด 2023 ณ บริเวณชายหาดหัวหิน หน้าอินเตอร์คอนติเนนตัล หัวหิน รีสอร์ท
สงกรานต์คอกระเช้าหัวหินสำราญใจ อนุรักษ์วิถีไทย ครั้งที่ 4 12 เม.ย. 66
12 เม.ย. สงกรานต์คอกระเช้าหัวหินสำราญใจ อนุรักษ์วิถีไทย ครั้งที่ 4 ถนนเดชานุชิต สืบสานประเพณีสงกรานต์ ประจำปี 2566 เทศบาลหัวหิน 12-13 เมษายน 2566
เทศบาลเมืองหัวหิน กำหนดจัดงานประเพณีสงกรานต์ ประจำปี 2566 ระหว่างวันที่ 12 - 13 เมษายน 2566 เพื่อส่งเสริม สืบสาน อนุรักษ์ประเพณีไทย อันดีงามของชาติ สร้างความสามัคคีในการประกอบกิจกรรมร่วมกันของ ประชาชนในเขตเทศบาล เพื่อเป็นการแสดงออกถึงความเคารพ ความกตัญญูกตเวทีที่มีต่อผู้สูงอายุ เพื่อส่งเสริมให้เด็ก เยาวชน ประชาชนและนักท่องเที่ยวได้ร่วมกิจกรรม ในการรักษาขนบธรรมเนียมประเพณีวันสงกรานต์ และเป็นการ ส่งเสริมการท่องเที่ยวของอำเภอหัวหิน
วันไหลปากน้ำปราณ มหาสงกรานต์ อาหารทะเลสด 13 เม.ย .-23 เม.ย.66
เทศบาลตำบลปากน้ำปราณ จ.ประจวบฯ เตรียมจัดงาน “วันไหลปากน้ำปราณ มหาสงกรานต์ อาหารทะเลสด” วันที่ 13 เม.ย .-23 เม.ย.66 เวลา 17.00 น. เป็นต้นไป ณ บริเวณชายหาดปากน้ำปราณ พื้นที่ 24 ไร่ จัดขึ้นเป็นครั้งแรก เพื่อเผยแพร่อัตลักษณ์ของตำบลปากน้ำปราณ ที่เป็นแหล่งอาหารทะเลสด สะอาด รวมทั้งมีร้านอาหารที่มีชื่อเสียง อาหารพื้นบ้านหลากหลายเมนู ซึ่งภายในงานมีการออกร้านอาหารพื้นบ้าน อาหารทะเลสดนับร้อยร้านให้นักท่องเที่ยวได้ลิ้มลองรสชาติความอร่อย พร้อมการแสดงคอนเสิร์ตจากศิลปินชื่อดัง เสก โลไซ, L.ก.ฮ., มินตรา อินทิรา, เนส กาแฟ, เก๋าซึม, พัทลุง, ทอมดันดี, โชโย ธนาวัฒน์ และรำวงพื้นบ้าน
งานสงกรานต์สามร้อยยอด ระหว่างวันที่ 12 - 15 เมษายน 2566
อบต.สามร้อยยอด ร่วมกับการท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานประจวบคีรีขันธ์ จัดงานสงกรานต์สามร้อยยอด ระหว่างวันที่ 12 - 15 เมษายน 2566 บริเวณตลาดลงเล ชายหาดสามร้อยยอด โดยการจัดงานครั้งนี้ เพื่อแนะนำตำบลสามร้อยยอด สืบสานวัฒนธรรมที่ยอดเยี่ยมของสามร้อยยอด และเพื่อกระตุ้นเศรษฐกิจ ไปสู่สากลให้นักท่องเที่ยว ทั้งชาวไทยและชาวต่างชาติได้รู้จักมากขึ้น โดยกิจกรรมในวันงาน จะมีการแห่เรือไปทำพิธีบวงสรวงเจ้าแม่นมสาว, ทำบุญเลี้ยงพระ ตักบาตรข้าวสารอาหารแห้งตามประเพณี, วันไหลสามร้อยยอด และยังมีดนตรีให้นั่งฟังกันแบบชิลล์ๆ ในทุกค่ำคืน
บรรยายการดูแลสุขภาพ โรคเรื้อรัง ชะลอวัยด้วยสมุนไพรกัญชงกัญชาและโภชนบำบัด 8 เมษายน 2566
บรรยาย ความรู้การดูแลสุขภาพ และการทำธุรกิจ ดูแลสุขภาพ โรคเรื้อรัง ผู้สูงอายุ ด้วยสมุนไพร กัญชง กัญชา เพื่อการชะลอวัย เสาร์ที่ 8 เมษายน 2566 นพ.สมยศ กิตติมั่นคง ณ ชีวาสหคลินิก ถนนสุขุมวิท พระโขนง
กิจกรรมวิ่งการกุศล “ผู้ว่าฯ พาวิ่ง by Thammasat 101” ร้อยเอ็ด 8 เม.ย.66 LINK
กิจกรรมวิ่งการกุศล “ผู้ว่าฯ พาวิ่ง by Thammasat 101” ในวันเสาร์ที่ 8 เมษายน 2566 เวลา 05.00 น. ณ อ่างเก็บน้ำธวัชชัย ตำบลมะอึ อำเภอธวัชบุรี จังหวัดร้อยเอ็ด โดย แบ่งประเภทการวิ่งเป็น 3 ประเภท ประกอบด้วย 1.เดินวิ่งเพื่อสุขภาพ (Fun Run) 5 ก.ม. 2.มินิมาราธอน (Mini Marathon) 10.5 ก.ม. 3.VIP ไม่จำกัดกลุ่มอายุ วิ่งได้ทุกระยะ เปิดรับสมัคร ตั้งแต่บัดนี้ – วันที่ 31 มีนาคม 2566 ผ่านทางระบบออนไลน์ หรือสมัครด้วยตนเองได้ที่ กลุ่มงานปกครอง ที่ทำการปกครองจังหวัดร้อยเอ็ด ชั้น 3 ศาลากลางจังหวัดร้อยเอ็ด ในวันและเวลาราชการ
สงกรานต์@ บ้านเพ 16 เมษายน 2566
ขอเชิญเที่ยวงาน Songkarn Festival @ Ban Phe 16 เมษายน 2566 ณ ตลาดร้อยเสา ต.เพ อ.เมือง ระยอง กิจกรรมแห่องค์หลวงพ่อทอง หลวงปู่โต่ง สรงน้ำพระ รดน้ำขอพรผู้สูงอายุ เล่นน้ำสงกรานต์ อุโมค์น้ำ วงดนตรีสกุลรัตน์ กิจกรรมประกวดแข่งขันทำข้าวคลุกกะปิ
บ้านฉางถนนคนเดินและของดีเมืองระยอง 5 เมษายน 2566
เทศบาลเมืองบ้านฉาง จัดกิจกรรม “บ้านฉางถนนคนเดินและของดีเมืองระยอง” Banchang Walking Street & Famous Products of RAYONG วันพุธที่ 5 เมษายน 2566 เวลา 16.19 น. -21.00 น.(วันพุธแรกและวันพุธสุดท้ายของเดือน) บริเวณถนนเทศบาล 46 (ถนนทางเข้าสำนักงานเทศบาลเมืองบ้านฉาง)
Pattana Triathlon Festival 2023, Saturday 8 April LINK
Pattana Triathlon Festival 2023 , the race takes in open and astonishing countryside view and landscape of Chonburi Province, finishing off a run around the Pattana Golf courses. The race on Saturday 8 April 2023 Pattana Sports Resort, Sriracha District, Chonburi Province, Thailand.
Race category: Fun Run 5 KM / 70.3 (Middle Distance) / Standard Distance / Sprint Distance / Team Relay 70.3 KM (Middel Distance)
งานเทศกาลถนนผลไม้แกลง ระยอง 28 เม.ย - 2 พ.ค.66 LINK
กลับมาอีกครั้งสำหรับงานเทศกาลถนนผลไม้และของดีอำเภอแกลง จ.ระยอง ครั้งที่ 41 ประจำปี 2566 ระหว่างวันที่ 28 เม.ย - 2 พ.ค. 2566 ณ ตลาดกลางผลไม้เสี่ยไต๋ (หลังปั๊มน้ำมันบางจาก) ตำบลทางเกวียน อำเภอแกลง จังหวัดระยอง
งานเทศกาลถนนผลไม้ อ.วังจันทร์ วันที่ 27 เม.ย.- 3 พ.ค.66 LINK
งานประจำปีที่ชาววังจันทร์เตรียมพร้อมต้อนรับนักท่องเที่ยวผู้รักผลไม้ ขอเชิญไปเที่ยวชม ชิม ช็อป ใน "เทศกาลถนนผลไม้ของอำเภอวังจันทร์" ประจำปี 2566 ระหว่างวันที่ 27 เม.ย.- 3 พ.ค.2566 จัดบริเวณ ณ.อบต พลงตาเอี่ยม อ.วังจันทร์ ระยอง โอกาสเลือกซื้อผลไม้นานาชนิด โดยเฉพาะทุเรียน มังคุด ลองกอง เงาะ สดสด จากชาวสวนโดยตรง และสินค้ามากมาย ฟรี !! ตลอดงาน หน้าร้อนอย่างนี้ต้องได้ชิมผลไม้อร่อยๆ จะชื่นใจมากๆ สิ้นเดือนเมษา เตรียมตัวไปวังจันทร์กัน
งานวันสับปะรดหวาน ปลวกแดง 22 เม.ย - 1 พ.ค.66 LINK
งานประจำปี วันสับปะรดหวาน ครั้งที่ 17 ตั้งแต่ 22 เมษายน - 1 พฤษภาคม 2566 บริเวณ ถนนที่ว่าการอำเภอปลวกแดง จังหวัดระยอง การประกวดผลผลิตทางการเกษตร การประกวดอาหารต่างๆจากสับปะรด การประกวดธิดาสับปะรด การประกวดไก่ชน กิจกรรมแข่งขันปอกสับปะรด การออกร้าน OTOP การออกร้านของโรงงานอุตสาหกรรม การจำหน่ายสินค้าราคาถูกจากโรงงาน
เทศกาลผลไม้และของดีอำเภอเขาชะเมา ครั้งที่ 13 วันที่ 19-25 เม.ย.66 LINK
เทศกาลผลไม้และของดีอำเภอเขาชะเมา ครั้งที่ 13 ประจำปี 2566 เปิดเขาเล่าเรื่องเมืองชะเมา วันที่ 19-25 เมษายน 2566 ณ ลานข้าง อบต.เขาชะเมา จ.ระยอง สนุกกัน 7 วัน 7 คืนเต็ม ชมสินค้าราคาถูก ของกินของใช้ มหกรรมอาหาร เฟอร์นิเจอร์โรงงาน ลานเบียร์ วงดนตรี สวนสนุกชุดใหญ่ การละเล่นอื่นๆ การแสดงบนเวที
กินลมชมว่าว Kite Festival ครั้งที่ 1 วันที่ 25-27 เมษายน 2566
เชิญเที่ยวงาน กินลมชมว่าว Kite Festival ครั้งที่ 1 วันที่ 25-27 เมษายน 2566 ณ ลานหน้าเทศบาลตำบลบ้านค่ายพัฒนา เทศกาลกินลมชมว่าว ช้อป ชิม ชิลล์ ชมการประกวดว่าว ช้อปสินค้าชุมชนภายในงาน สนุกสนานทุกวันไปกับวงดนตรีย้อนยุค วงสกุลรัตน์ ฟรีทั้ง 3 วันแบบจุกๆ หนำใจ บอกเลย ห้ามพลาด! ติดต่อสอบถามข้อมูลเพิ่มเติม ททท.สำนักงานระยอง 038-655420-1
ประจำเดือน เมษายน 2566
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี
ประจำเดือน เมษายน 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียด/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปใช้บริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่ก่อนได้จ้า
- 4-5 เมษายน เทศบาลตำบลจอมเทียน อ.สัตหีบ
- 10 เมษายน เทศบาลบ่อทอง อ.บ่อทอง
- 11-12 เมษายน อบต.สระสี่เหลี่ยม อ.พนัสนิคม
- 18 เมษายน อบต.วัดสุวรรณ อ.บ่อทอง
- 19 เมษายน วัดหุบบอน อ.ศรีราชา (เทศบาลนครเจ้าพระยาสุรศักดิ์)
- 20 เมษายน เทศบาลเมืองสัตหีบ อ.สัตหีบ
- 24-25 เมษายน อบต.พลูตาหลวง อ.สัตหีบ
- 27 เมษายน ศาลเจ้าเียเทียนซือ อ.เมือง ชลบุรี (เทศบาลเมืองบ้านสวน)
- 27 เมษายน เทศบาลตำบลตะเคียนเตี้ย อ.บางละมุง
เทศบาลตำบลบางเสาธง ทำหมันสุนัขและแมว(ไม่มีเจ้าของ)และผู้มีรายได้น้อยในพื้นที่ วันที่ 4 เมษายน 2566 LINK
เทศบาลตำบลบางเสาธง ร่วมกับ ปศุสัตว์อำเภอบางเสาธงร่วมกันควบคุมปริมาณสุนัขและแมวจรจัดในพื้นที่เทศบาลตำบลบางเสาธงโดยดำเนินการทำหมันสุนัขและแมว(ไม่มีเจ้าของ)และผู้มีรายได้น้อยในพื้นที่เทศบาลตำบลบางเสาธง ในวันที่ 4 เมษายน 2566 เริ่มลงทะเบียนเวลา 8.30 - 9.30 น. ณ โดมสนามกีฬาการกีฬาแห่งประเทศไทย
**สำหรับผู้ที่จะนำสุนัขหรือแมวมาทำหมันต้องงดน้ำและอาหารก่อนอย่างน้อย 12 ชั่วโมง (ตั้งแต่เวลาหลัง 20.00 น.ของวันที่ 3 เมษายน 2566)**
***เปิดรับ Walk in***
สอบถามข้อมูลเพิ่มเติมที่กองสาธารณสุขและสิ่งแวดล้อม 02-130-0298
เทศบาลตำบลบางปู ทำหมันแมวจรจัด
เทศบาลตำบลบางปู ดำเนินการทำหมันแมวให้กับ #แมวจรจัด พร้อมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ภายในเขตเทศบาลตำบลบางปู (14 ก.พ.) ตัดเขี้ยวและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมว พร้อมทั้งทำการสักเบอร์หูขึ้นทะเบียนสุนัขและแมวจรจัด ภายในเขตเทศบาลตำบลบางปู (13 ก.ค.) ทำหมันแมวจรจัดภายในเขตเทศบาลตำบลบางปู (24 มี.ค. และ 20 เม.ย.) สอบถามรายละเอียดเพิ่มเติมได้ที่ งานสัตว์แพทย์ กองสาธารณสุขและสิ่งแวดล้อม 0-2174 - 3390 - 99 ต่อ 1610 ในวันเวลาราชการ
อบรม WORKSHOP กัญชา รุ่นที่ 14 อ.บ้านไร่ จ.อุทัยธานี 21 พ.ค.65 LINK
อบรม WORKSHOP กัญชา รุ่นที่ 14 เฌอตฤณ จัดร่วมกับ 420 Forest Park อ.บ้านไร่ จ.อุทัยธานี อบรมกันในฟาร์มกัญชา ตั้งเเต่ลงมือผสมดิน ไปถึง ตัดเเต่งกิ่ง วันเสาร์ที่ 21 พฤษภาคม 2565 ที่ 420 Forest Park ต.บ้านบึง อ.บ้านไร่ จ.อุทัยธานี รับเพียง 20 ท่าน เท่านั้น เพียงท่านละ 3,000 บาท สอบถามเพิ่มเติมได้ที่ 093 451 3300 คุณสาวิตรี
เสวนากัญชากัญชง จากการแพทย์สู่มิติทางเศรษฐกิจ 25 พ.ค.65
งานเสวนาเรื่อง "กัญชากัญชง จากการแพทย์สู่มิติทางเศรษฐกิจ" หัวข้อ "กัญชากัญชง จากการแพทย์สู่มิติทางเศรษฐกิจ" วันพุธ ที่ 25 พฤษภาคม 2565 เวลา 13.00-16.30 น. สถานที่ : ณ ห้องประชุม MR214- MR215 ศูนย์นิทรรศการและการประชุมไบเทค บางนากรุงเทพมหานคร จัดโดย : สมาคมสื่อมวลชนเกษตรแห่งประเทศไทย” ร่วมกับ วีเอ็นยู เอ็กซิบิชั่นส์ เอเชีย แปซิฟิคงาน AGRITECHNICA ASIA & HORTI ASIA 2022
ดูบรรยายได้ที่
Youtube Thai Festival 2022 Japan goes online May 1-31, 2022
With the Thai Festival Organizing Committee in Tokyo, the Thai Festival 2022 will be held from May 1 - 31, 2022. This year, the Thai festival will be held online under the theme "T-POP" to support disseminating “Thai music” and using Thai music as a tool to promote culture and promote the image of Thailand in Japan
In addition, under the situation of the epidemic of the Covid-19 virus Organizing Committee has adapted the format to an online event for the safety of the participants and all related parties The event format consists of T-POP Entertainment activities. In collaboration with T-Pop Stage Show, concerts by Thai artists will be released on Facebook Live and YouTube Live on May 15, 2022.
In addition, there will be activities "Thai food near you" by collaborating with more than 60 Thai Select restaurants in 7 provinces to organize special menus. Give away gifts while visiting the restaurant. including activities "Nearby Thai products" by collaborating with distributors of Thai products in Japan who have online sales channels. including a large supermarket in Japan so that visitors from home can also buy Thai food and Thai products. Throughout May 2022
for this year’s poster embassy Received cooperation from Khun Wisuth Pornnimit in designing "Nong Mamuang" as the main character of the event. [
source]
LINE: @thaifestivaltokyo
Facebook: thaifestival.jp
Instagram: gotothailand.jp
Twitter: @rtetokyo
YouTube: RTETOKYO
TikTok: @thaifestival.jp
Spotify: ThaiFestival.JP
Thailand Grand Festival 2022 Sydney May 14-15, 2022
Thailand Grand Festival returns to Sydney at Belmore Park, Haymarket.
The long-awaited Thailand Grand Festival finally came back to Sydney on 14 – 15 May 2022. The biggest Thai event was organised by the Royal Thai Consulate-General in Sydney in close collaboration with Thai community organizations in Sydney and New South Wales, with the support from Thai Trade Centre, Thailand Board of Investment (BOI) Sydney Office, Tourism Authority of Thailand (TAT) Sydney Office, Office of Agricultural Affairs in Australia, Thai Airways, Singha Beer and RATCH-Australia Corporation.
The opening ceremony was held on Saturday 14 May 2022 at 11 am, with Mrs Hataya Khusakul, Consul-General of Thailand in Sydney, as host. Notable representatives from the Thai side were H.E. Ms Busadee Santipitaks, the Ambassador of the Kingdom of Thailand to Australia, and Ms Somradee Chitchong, Deputy Governor for Administration, Tourism Authority of Thailand. The whole Thai community felt very honoured that the Honourable Magaret Beazley AC QC, Governor of New South Wales, presided over the opening ceremony, as well as Councillor Robert Kok as the representative of Lord Mayor of Sydney.
The Festival featured authentic Thai cuisine, art and handicraft, as well as sport and cultural performances for the residents of Sydney and New South Wales to enjoy. The event was also one of the celebration activities to commemorate the 70th anniversary of the establishment of diplomatic relations between Thailand and Australia. [
source]
Magic of Thailand Festivals 2022 | 10 events in UK from May - Sep 2022
Magic of Thailand Festivals 2022
- Poole 28-29 May 2022, Harbourside Park, Labrador Drive, Poole, BH15 1UX
- Basingstoke 11- 12 June 2022 The War Memorial Park, Crossborough Hill, Basingstoke, RG21 4AG
- Manchester 25- 26 June 2022 Platt Fields Park, Platt Lane, Manchester, M14 5NF
- Warwick 09- 10 July 2022 Warwick Racecourse, Warwick, CV34 6HN
- Nottingham 16- 17 July 2022 Forest Recreation Ground, Gregory Blvd, Nottingham, NG7 6AQ
- Norwich 30- 31 July 2022 Eaton Park, S Park Ave, Norwich, NR4 7AU
- Cambridge 06- 07 August 2022 Parker’s Piece, A603, Cambridge, CB1 1NA
- Bournemouth 13- 13 August 2022 Kings Park, Kings Park Drive, Bournemouth, BH7 6JD
- Brighton 20- 21 August 2022 Preston Park, Preston Road, Brighton, BN1 6AU
- London (Ealing) 03- 04 September 2022 Ealing Common, Uxbridge Road, London, W5 3HN
Keep update via facebook.com/poole.thaifestival
เทศกาลไทย ณ กรุงโตเกียว วันที่ 1 – 31 พฤษภาคม 65 รูปแบบออนไลน์ LINK
เทศกาลไทย ณ กรุงโตเกียว มีกำหนดจัดงานเทศกาลไทยประจำปี 2565 ระหว่างวันที่ 1 - 31 พฤษภาคม 2565 โดยในปีนี้ งานเทศกาลไทยจะขึ้นในรูปแบบออนไลน์ ภายใต้หัวข้อ “T-POP” เพื่อสนับสนุนการเผยแพร่ “เพลงไทย” และให้เพลงไทยเป็นเครื่องมือในการประชาสัมพันธ์วัฒนธรรมและส่งเสริมภาพลักษณ์ของประเทศไทยในญี่ปุ่น
เนื่องจากยังอยู่ช่วงการระบาดโควิด จึงปรับรูปแบบเป็นการจัดงานออนไลน์แทน เพื่อความปลอดภัยของผู้เข้าร่วมงานฯ และผู้ที่เกี่ยวข้องทุกฝ่าย โดยรูปแบบการจัดงานประกอบด้วยกิจกรรม T-POP Entertainment โดยจะร่วมมือกับรายการ T-Pop Stage Show จัดคอนเสิร์ตศิลปินไทยเผยแพร่ทางช่อง Facebook Live และ YouTube Live ในวันที่ 15 พฤษภาคม 2565
นอกจากนี้ จะมีการจัดกิจกรรม “อาหารไทยใกล้ตัว” โดยร่วมมือกับร้านอาหารที่ได้รับมาตรฐาน Thai Select กว่า 60 สาขา ใน 7 จังหวัด ร่วมจัดเมนูพิเศษ แจกของสมนาคุณในระหว่างที่ไปใช้บริการที่ร้านอาหาร รวมทั้งกิจกรรม “สินค้าไทยใกล้ตัว” โดยร่วมมือกับผู้จำหน่ายสินค้าไทยในญี่ปุ่นที่มีช่องทางการขายออนไลน์ รวมถึงซูเปอร์มาร์เก็ตขนาดใหญ่ในญี่ปุ่นเพื่อให้ผู้ชมจากที่บ้านสามารถซื้อหาอาหารไทยและผลิตภัณฑ์สินค้าไทยได้ด้วย ตลอดเดือนพฤษภาคม 2565
สำหรับโปสเตอร์ประจำงานในปีนี้ สถานเอกอัครราชทูตฯ ได้รับความร่วมมือจากคุณวิศุทธิ์ พรนิมิต ในการออกแบบ “น้องมะม่วง” เป็นคาแรกเตอร์ประจำงาน
เที่ยวเทศกาล Thailand Grand Festival 2022 นครซิดนีย์ LINK
เที่ยวเทศกาล Thailand Grand Festival ปีนี้ ร่วมอนุรักษ์สิ่งแวดล้อม ลดการใช้โฟมและพลาสติก ติดไม้ติดมือภาชนะส่วนตัวไปใช้ในงานกัน แล้วพบกันในงาน "Thailand Grand Festival 2022" ระหว่างวันที่ 14 - 15 พ.ค. 2565 เวลา 11.00-18.00 น. ณ Belmore Park นครซิดนีย์
อัมพวามินิมาราธอน ครั้งที่ 7 อัมพวาเด็ด 7สะระตี่ 7 พ.ค.66
ปักหมุดรอเลย 7 พค.นี้ อัมพวามินิมาราธอน ครั้งที่ 7 อัมพวาเด็ด 7สะระตี่ งานวิ่งที่รวมของกินเด็ดๆ 7 อย่าง ที่ท่องเที่ยว 7 แห่ง เสื้อ 7 สี 7 ว้าว แล้วพบกันที่นี่ เร็วๆ นี้ ติดตามข้อมูลที่
เพจเดินวิ่งที่ตลาดน้ำอัมพวา 6 พ.ค.66 The NAViTRAiL 2023 LINK
2023 The NAViTRAiL Race day 6th May 2023 Save the DATE! Find your teammate NOW! พร้อมไหมครับ! เตรียมตัว หาคู่ หาบัดดี้ หาทีม ไว้ได้เลยครับ! 6 พ.ค. ความสนุก ความมันส์ จะกลับมาอีกครั้ง!
ดนตรีในสวน อ.เมืองประจวบคีรีขันธ์ ทุกเย็นวันพุธ
องค์การบริหารส่วนจังหวัดประจวบคีรีขันธ์ จัดกิจกรรมดนตรีในสวน ทุกวันพุธ เวลา 17.30 - 19.30 น. ณ สวนสาธารณะ สนามกีฬากลางจังหวัดประจวบคีรีขันธ์
Rayong Fruit Farm Run 2023 (ครั้งที่ 3) 21 พ.ค.66 LINK
Rayong Fruit Farm Run 2023 (ครั้งที่ 3) งานวิ่งที่จะพานักวิ่งเปิดประสบการณ์ใหม่กับเส้นทางระยะ HALF / MINI และ FUN RUN ซึ่งจะจัดงานวิ่งในช่วงฤดูกาลผลไม้จังหวัดระยอง พ.ค-มิย. นักวิ่งจะได้สัมผัสวิถีชีวิตชาวสวนผลไม้ ได้ใกล้ชิดทั้งราชาแห่งผลไม้ (ทุเรียน) ราชินีแห่งผลไม้ (มังคุด) และผลไม้อีกมากมายไม่ว่าจะเป็น เงาะ ลองกอง สละ เป็นต้น รวมถึงทุ่งนา ฟาร์มสัตว์ บึงน้ำ นกน้ำ และเขายายดา กลิ่นอายชนบทระยองที่อยู่ในเขตอำเภอเมืองระยอง นั่นคือ ชุมชนชาวสวนผลไม้ตะพง-เขายายดา วันแข่งขัน 21 พฤษภาคม 2566 เส้นทางการแข่งขัน ชมสวนผลไม้ตะพง-เขายายดา อ.เมืองระยอง ประเภทวิ่ง HALF / MINI และ FUN RUN พร้อม
งานแถลงข่าวโค้งสุดท้ายรวมพลกำหนดอนาคตกัญชาของประชาชน 7 พฤษภาคม 2566
งานแถลงข่าวโค้งสุดท้ายรวมพลกำหนดอนาคตกัญชาของประชาชน ร่วมแถลงการณ์ประวัติศาสตร์ครั้งนี้อย่างพร้อมเพรียง วันอาทิตย์ที่ 7 พฤษภาคม 2566 ณ ชั้น 2 ห้อง LA201. ห้องอดุล วิเชียรเจริญ คณะศิลปศาสตร์ มหาวิทยาลัยธรรมศาสตร์ท่าพระจันทร์ โดยจะเปิดลงทะเบียนเวลา 14.00 น. และแถลงการณ์ในเวลา 15.00 น.
OCEANMAN PATTAYA 2023 ชายหาดจอมเทียน 20-21 พ.ค. 2566
OCEANMAN PATTAYA 2023 วันที่ 20-21 พ.ค. 2566 ณ บริเวณชายหาดจอมเทียน เมืองพัทยา สอบถามรายละเอียดที่ Pattaya Contact Center 1337
การแข่งขันไตรกีฬา เมืองไทย ไตรกีฬา @ ห้วยไม้เต็ง จังหวัดราชบุรี วันที่ 27-28 พฤษภาคม 2566
นักกีฬาสายผจญภัยห้ามพลาด...การแข่งขันไตรกีฬา MuangThai Triathlon Huaymaiteng Ratchaburi 2023 (เมืองไทย ไตรกีฬา @ ห้วยไม้เต็ง จังหวัดราชบุรี) วันที่ 27-28 พฤษภาคม 2566 ณ อ่างเก็บน้ำห้วยไม้เต็ง อ.เมือง จ.ราชบุรี
การแข่งขันไตรกีฬา เมืองไทย ไตรกีฬา@ ห้วยไม้เต็ง จังหวัดราชบุรี 27-28 พ.ค.66
นักกีฬาสายผจญภัยห้ามพลาด...การแข่งขันไตรกีฬา MuangThai Triathlon Huaymaiteng Ratchaburi 2023 (เมืองไทย ไตรกีฬา @ ห้วยไม้เต็ง จังหวัดราชบุรี) วันที่ 27-28 พฤษภาคม 2566 ณ อ่างเก็บน้ำห้วยไม้เต็ง อ.เมือง จ.ราชบุรี
นิทรรศการศิลปะ WATER COLOR AND WOOD BLOCK PRINT 6 พ.ค. - 6 ก.ค.66
นิทรรศการศิลปะ " WATER COLOR AND WOOD BLOCK PRINT โดยอาจารย์ทองเติม ทุรันตะวิริยะ " ศิลปินชาวจังหวัดราชบุรี ผู้ที่รักธรรมชาติ จัดแสดงผลงานวันที่ 6 พฤษภาคม - 6 กรกฎาคม 2566 ณ Spring 22 & Gallery ไม้แก้วดำเนิน รีสอร์ท อ.ดำเนินสะดวก จ.ราชบุรี
ดนตรีในสวน Music In The Park (Season 2) สวนสาธารณะเมืองสงขลา ทุกวันเสาร์ LINK
ดนตรีในสวน Music In The Park (Season 2) ฟังบทเพลงไพเราะ กับบรรยากาศดนตรีในสวนสวยริมทะเล หนึ่งเดียวในประเทศไทย องค์การบริหารส่วนจังหวัดสงขลา ร่วมกับสถาบันการศึกษาและองค์กรภาคีเครือข่าย จัดการแสดงดนตรีในสวน ในทุกวันเสาร์ เวลา 17.30 - 19.30 น. ณ สวนสาธารณะเมืองสงขลา อำเภอเมืองสงขลา จังหวัดสงขลา เพื่อเป็นเวทีส่งเสริมการแสดงความสามารถของเด็กและเยาวชน รวมถึงผู้ที่มีความสามารถด้านดนตรี อีกทั้งเพื่อเป็นการส่งเสริมการท่องเที่ยวในจังหวัดสงขลา
ดนตรีในสวน Music In The Park (Season 2) ปี 2566 เริมครั้งแรก วันเสาร์ที่ 18 มีนาคม 2566 แสดงดนตรีโดย วงดนตรีโรงเรียนเกาะแต้วพิทยาสรรค์
อบจ.สงขลา
เริ่มจัดดนตรีในสวน Music In The Park (Season 1) ครั้งแรก เมื่อเดือนสิงหาคม-กันยายน 2565 จำนวน 8 ครั้ง
Supersports 10 Mile Run 2023 Thailand Presented by adidas 21 พ.ค.66
CentralWorld วิ่งวันที่ 21 พฤษภาคม 2566 บริเวณ เซ็นทรัลเวิลด์ กรุงเทพฯ
เส้นทางการแข่งขันวิ่งระยะ 10 ไมล์ เริ่มจากจุดปล่อยตัวที่ลานกิจกรรมเซ็นทรัลเวิลด์ ใช้ถนนราชดำริ มุ่งหน้าสู่ถนนราชปรารภ, ถนนดินแดง, ถนนวิภาวดีรังสิต, ซอยพหลโยธิน 2, ซอยพหลโยธิน 5, พระราม 6 ซอย 30, ถนนพระราม 6, ถนนเพชรบุรี, ถนนบรรทัดทอง, ถนนพระราม 4, ถนนอังรีดูนังต์, ถนนพระราม 1 และกลับมาที่เส้นชัยลานกิจกรรมเซ็นทรัลเวิลด์
เส้นทางการแข่งขันวิ่งระยะ 5 ไมล์ เริ่มจากจุดปล่อยตัวที่ลานกิจกรรมเซ็นทรัลเวิลด์ ใช้ถนนราชดำริ ผ่านถนนเพชรบุรี ถนนบรรทัดทอง ถนนพระราม 4 ถนนอังรีดูนัง ถนนพระราม 1 และกลับมาที่เส้นชัยลานกิจกรรมเซ็นทรัลเวิลด์
ดนตรีในสวนปทุมวนานุรักษ์ 20-21 พ.ค. 66
Music in the park ต้อนรับสวนแห่งใหม่ล่าสุดของกรุงเทพฯ สวนปทุมวนานุรักษ์
วันเสาร์ (20 พ.ค. 66) วง Bangkok Trio
วันอาทิตย์ (21 พ.ค. 66)
วง BMO Youth String Quartet
วง Bangkok String Ensemble
เริ่มเวลา 16.30 น. เป็นต้นไป
29 พ.ค. - 2 มิ.ย.66 สัตวแพทย์เกษตรอาสา ทำหมันน้องหมาน้องแมวฟรี LINK
สัตวแพทย์เกษตรอาสา ทำหมันน้องหมาน้องแมวฟรี !! โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน จัดโครงการ สัตวแพทย์เกษตรอาสา บริการทำหมันสุนัขและแมวให้กับประชาชนฟรี ระหว่างวันที่ 29 พฤษภาคม 2566 - 2 มิถุนายน 2566 สำหรับสุนัขและแมวทุกตัวที่เข้าร่วมโครงการ ฯ จะได้รับการวางยาสลบชนิดสูดดม และผ่าตัดด้วยวิธีมาตรฐาน โดยมีรายละเอียดการนำสุนัขและแมวเข้าร่วมโครงการ
วิ่งล่าสมบัติ สลัดพุง วันอาทิตย์ที่ 28 พ.ค.66 LINK
“วิ่งล่าสมบัติ สลัดพุง” จัดขึ้นในวันอาทิตย์ที่ 28 พฤษภาคม 2566 สถานที่ : สวนวชิรเบญจทัศ ( สวนรถไฟ ) เพื่อหารายได้ส่วนหนึ่งมอบให้กับมูลนิธิศุภนิมิตแห่งประเทศไทย
ระยะทาง - Fun run 5 km (วิ่ง 2 สวน = สวนรถไฟ + สวนสมเด็จพระนางเจ้าสิริกิติ์)
- Mini Marathon 10 km (วิ่ง 3 สวน = สวนรถไฟ + สวนสมเด็จพระนางเจ้าสิริกิติ์ + สวนจตุจัตร)
รสจันท์ที่จางหาย 12-13 พฤษภาคม 2566
รสจันท์ที่จางหาย" ร่วมรื้อฟื้นรสชาติของเมืองจันท์ ผ่านอาหาร วัฒนธรรม และวิถีชีวิตชาวจันท์ในรูปแบบของ Set Table วันที่ 12-13 พฤษภาคม 2566
> ลิ้มรส อาหารคาว-หวาน ที่กำลังถูกลืมเลือน
จากรสมือของแม่ครัวท้องถิ่นชาวจันท์
เซ็ทเมนูอาหาร รสจันท์ที่จางหาย
> ยลยินคุณค่าทางวัฒนธรรมของ เท่งตุ๊ก ที่กำลังเลือนลาง
> ถักทอเรื่องราวของ เสื่อจันทบูร ที่กำลังลางเลือน
ร่วมประมูลผลงานที่รังสรรค์จากคุณค่าของเสื่อกกและพลอยจันท์ ณ เรือนราย วังสวนบ้านแก้ว มหาวิทยาลัยราชภัฏรำไพพรรณี จ.จันทบุรี
คลินิกทำหมันสัตว์เลี้ยง กลุ่มควบคุมโรคพิษสุนัขบ้า (ดินแดง) เปิดจองคิวทำหมัน เดือนกรกฎาคม 2566 แล้ว LINK
คลินิกทำหมันสัตว์เลี้ยง กลุ่มควบคุมโรคพิษสุนัขบ้า (ดินแดง)
เปิดให้ทำการนัดหมายทำหมันสัตว์เลี้ยงของท่าน ในช่วงเดือนกรกฎาคม 2566 แล้ว
เรียนเชิญท่านที่สนใจ ใช้บริการได้ที่
เงื่อนไขการนัดหมาย
-สัตว์เลี้ยงที่จะเข้ารับบริการทำหมัน ต้องมีสุขภาพแข็งแรง
-ไม่อยู่ในระหว่างการตั้งครรภ์
-ต้องสามารถแสดงบัตรประชาชนตัวจริงที่เลขที่บัตรตรงกับที่ลงทะเบียนไว้ (อาศัยอยู่ในกรุงเทพมหานคร) ในวันที่เข้ารับบริการ
-1คน สามารถนัดได้ไม่เกิน3ตัว ในทุกช่องทาง เมื่อใช้บริการแล้วจึงสามารถนัดเพิ่มได้
-ยอดการรับทางonline ไม่เกิน20ตัว/วัน
ประจำเดือน พฤษภาคม 2566
พฤษภาคม 2566 สำนักงานปศุสัตว์จังหวัดชลบุรี ออกให้บริการหน่วยทำหมันและฉีดวัคซีน 15 วันทำการ เช็คกำหนดการ
PET EXPO THAILAND 2023
PET EXPO THAILAND 2023 งานแฟร์ที่ดีที่สุด เพื่อเพื่อนที่ดีที่สุดของคุณ จัดวันที่ 4-7 พฤษภาคม 2566 เวลา :10.00 น. - 20.00 น. ฮอลล์ 6-8 ศูนย์การประชุมแห่งชาติสิริกิติ์
โครงการคลินิกเกษตรเคลื่อนที่ ทำหมันสุนัขแมว 26 พฤษภาคม 2566
สำนักงานปศุสัตว์จังหวัดสมุทรปราการ บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
วันศุกร์ที่ 26 พฤษภาคม 2566 ณ สำนักงานเทศบาลเมืองแพรกษา ต.แพรกษา อ.เมืองสมุทรปราการ จ.สมุทรปราการ
เทศบาลเมืองแพรกษา บริการทำหมันหมาแมว ฟรี 26 พฤษภาคม 2566 LINK
เทศบาลเมืองแพรกษา ขอเชิญประชาชนตำบลแพรกษา และประชาชนจังหวัดสมุทรปราการที่สนใจ นำสุนัขและแมวมารับบริการตรวจสุขภาพ ฉีดวัคซีนฯ ทำหมันฟรี ในโครงการคลินิกเกษตรเคลื่อนที่ในพระราชานุเคราะห์ ฯ วันที่ 26 พฤษภาคม 2566 เวลา 8.30 เป็นต้นไป ทำหมันสุนัขและแมวไม่จำกัดจำนวน ปิดรับคิว 11.00 น. และให้ท่านงดน้ำงดอาหารสัตว์ อย่างน้อย 12 ชั่วโมง ก่อนทำหมัน สอบถามข้อมูลเพิ่มเติม 02-1369610 หรือ 085-8423297 ในเวลาทำการ
ดนตรีในสวนกรุงเทพมหานคร พฤษภาคม-มิถุนายน 66
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว โดยกองการสังคีต กำหนดจัดกิจกรรม “ดนตรีในสวนกรุงเทพมหานคร” ช่วงเวลา 17.00 – 20.00 น.
มหกรรม 360 องศา ปลดล็อคกัญชา ประชาชนได้อะไร 10-12 มิ.ย.65 จ.บุรีรัมย์ LINK
งานใหญ่งานแรก หลังจากการปลดล็อคกัญชาพ้นยาเสพติดมีผลบังคับใช้ (9 มิ.ย.65) สำหรับ "งานมหกรรม 360 องศา ปลดล็อคกัญชา ประชาชนได้อะไร วันที่ 10-12 มิถุนายน 2565" จะเป็นจังหวะก้าวที่สำคัญของการพัฒนากัญชาทางการแพทย์ ร่วมไปกับการพัฒนาเศรษฐกิจของพืชกัญชาของประเทศไทย ที่หลายฝ่าย หลายภาคส่วน รวมทั้งประชาชนไทย เฝ้ารอมาอย่างยาวนาน
ในงานพบกับการให้บริการคลินิกกัญชาทางการแพทย์แผนปัจจุบันและแพทย์แผนไทย สัมมนาทางวิชาการจากวิทยากรผู้เชี่ยวชาญ นิทรรศการกัญชา-กัญชง Work Shop การทำอาหารคาว หวานและเครื่องดื่มที่มีส่วนผสมของกัญชา และการจำหน่ายสินค้าที่มีส่วนผสมของกัญชา-กัญชง
The 7th Thailand 420 : Legalaew!? 11-12 มิ.ย.65 LINK
11-12 มิถุนายน 2565 (หลังปลดกัญชาจากบัญชียาเสพติด 2วัน) ในบรรยากาศหาดทราย และสายลม ณ หาดทรายขาว อ.นครชัยศรี นครปฐม
ร่วมเฉลิมฉลองการเปลี่ยนแปลงครั้งสำคัญในหน้าประวัตศาสตร์ และประกาศให้โลกรู้ว่ากัญชาไม่ใช่ยาเสพติดแล้ว!!! เต็มความบันเทิงแบบครบครัน 3 เวที 3 สไตล์
- Main State พบกับศิลปินคุณภาพที่จะพาคุณเคลิบเคลิ้มไปกับดนตรีสุดชิลตลอด 2 วันเต็ม!
11 มิถุนายน 2565 : Numcha Rootsman Creation Phum Viphurit Paradise Bangkok Kai-Jo Brothers
12 มิถุนายน 2565 : สมัยไหนนิยม จุลโหฬาร : Junlaholaan Band Ga-pi And Guest Rastafari Master Srirajah Rockers
- DJ Island By GTG เวที DJ บนเกาะกลางน้ำ สนุกไปกับ DJ ชั้นนำและเสียงเพลงเต้นรำกันตลอดคืน ทั้ง 2 วัน
- Green Party Stage เวทีของศิลปินหน้าใหม่ หลากหลายแนวเพลง ที่จะมาร่วมสร้างสีสันกันในงาน
- กิจกรรมวิชาการ Workshop ต่างๆ เกมส์สนุกๆ อีกมากมายมาให้ได้ทำกันตลอดงาน
ค่าบัตร 900, 1500, 1800 สอบถาม ติดต่อเพจ : Thailand420 หรือ Line ID : @thailand420
อภัยภูเบศร อบรม "เรียนรู้ หลังปลดล็อก" 18-19 มิ.ย.65 LINK
สถาบันการแพทย์แผนไทยอภัยภูเบศร เปิดอบรม หลักสูตรเพื่อการใช้จริงภาคประชาชน 18-19 มิถุนายน 2565 "เรียนรู้ หลังปลดล็อก" รับจำนวนจำกัด 30 ท่าน
คุณจะได้เรียนรู้ ปูพื้นฐานการใช้ประโยชน์จากส่วนต่างๆของกัญชา ได้อย่างไร เทคนิค วิธีการจัดการวัตถุดิบ การสกัดกัญชา เพื่อใช้ประโยชน์ และแปรรูป การใช้กัญชาในรูปแบบอาหาร และ การใช้กัญชาเพื่อรักษา 5 กลุ่มโรค
สอบถามเพิ่มเติม : ภูมิภูเบศร 097-0983582
สัมนา ฟรี "ครบเครื่อง...เรื่องกัญชา" ในงาน ProPak Asia 2022 15 มิ.ย.65 ไบเทค LINK
สัมนาดี ๆ ไม่มีค่าใช้จ่าย จัดโดยสถาบันวิจัยวิทยาศาสตร์และเทคโนโลยีแห่งประเทศไทย (วว.) ในงานแสดงสินค้าอาหารและบรรจุภัณฑ์ (ProPak Asia 2022) วันที่ 15 มิย 65 13.00-16.00 น หัวข้อ "ครบเครื่อง...เรื่องกัญชา " ตั้งแต่ปลูก สกัดน้ำมันกัญชา และการวิเคราะห์ทดสอบผลิตภัณฑ์จากกัญชาทั้งอาหารและอื่น ๆ ผู้สนใจในการธุรกิจผลิตภัณฑ์กัญชาและผู้สนใจทั่วไปไม่ควรพลาด
กิจกรรม เดินหน้า…กัญชาเสรี แก้เจ็บแก้จน กองการแพทย์ทางเลือก 15-16 มิ.ย.65
กิจกรรม “เดินหน้า…กัญชาเสรี แก้เจ็บแก้จน”
การเพาะปลูกและการเก็บเกี่ยวที่ดีของพืชกัญชาเพื่อประโยชน์ทางการแพทย์และการส่งออก
วันที่ 15 – 16 มิถุนายน 2565 ณ โรงแรมอัศวิน แกรนด์ คอนเวนชั่น กรุงเทพมหานคร และผ่านระบบออนไลน์ ลงทะเบียนเพื่อเข้าร่วมกิจกรรมผ่านระบบออนไลน์ ด้วยโปรแกรม Zoom Cloud Meetings >>
ลงทะเบียน อภัยภูเบศร เปิดอบรมระยะสั้น "กัญชา กัญชง กระท่อม" การพัฒนาเพื่อเศรษฐกิจ 17 มิ.ย.65 LINK
อภัยภูเบศร เปิดอบรมระยะสั้น หลักสูตร "กัญชา กัญชง กระท่อม" การพัฒนาเพื่อเศรษฐกิจ
เรียนรู้สั้น กระชับ เข้าใจ และนำไปใช้ได้จริง จากผู้เชี่ยวชาญด้านกัญชา ทีมวิทยากรโดย อภัยภูเบศร รับจำนวนจำกัด รอบละ ไม่เกิน 50 คน
วันอบรม ปี 65
• ศุกร์ 22, 29 เมษายน
• ศุกร์ 13,20,27 พฤษภาคม
• ศุกร์ 3,10,17 มิถุนายน
• เสาร์ 4 มิถุนายน
สถานที่ : โรงพยาบาลเจ้าพระยาอภัยภูเบศร จ.ปราจีนบุรี
ค่าใช้จ่าย : 500 บาท/คน (มีใบประกาศหลังการอบรม)
เหมาะสำหรับ : ผู้ที่สนใจการพัฒนาธุรกิจจากกัญชา กัญชง กระท่อม , ผู้ประกอบการ , ประชาชนทั่วไป
สอบถามเพิ่มเติม 037-211289
เสวนา คราฟเบียร์กัญชา HOP Beer House Korat 25-26 มิ.ย.65
คราฟเบียร์กัญชา ที่ดีต้องมีการจัดการในเรื่องของการปรับสมดุลให้ดี ระหว่างรูป(สี) รสและกลิ่นหอม เสน่ห์ของคราฟเบียร์จึงยังคงเป็นทั้งศาสตร์และศิลป์ เป็นงานฝีมือที่บริวเวอร์แต่ละสำนักจะสรรสร้างขึ้นมาเพื่อให้เหล่าสาวกได้ชมชิม
ร่วมพบปะเสวนาเชิงลึกในเรื่องของกระบวนการคราฟเบียร์ได้ในปลายเดือนนี้ (25-26 มิ.ย.) ที่
HOP Beer House KoratWorkshop : Master Of Outdoor Grow Operation กับ Ryan Doran 12 มิ.ย.65 LINK
สาย Outdoor ไม่ควรพลาด Workshop : Master Of Outdoor Grow Operation (ระบบการปลูกกัญชากลางแจ้ง) กับ Ryan Doran
Ryan เป็นชาวอเมริกันที่โตขึ้นมาพร้อมกับองค์ความรู้และประสบการณ์ด้านการปลูกกัญชาที่สืบทอดกันมาในครอบครัวตั้งแต่รุ่นปู่ เค้าทำงานเป็น Grower Outdoor อยู่ที่อเมริกาอยู่หลายปีก่อนที่จะย้ายมาอยู่ไทย และได้พิสูจน์ฝีมือการปลูก Outdoor แบบออแกนิคที่ไทยในโครงการของวิสาหกิจชุมชนเพชรลานนา จ.ลำปาง (ตามรูป)
เข้า Workshop กับ Ryan ได้ในวันที่ 12 มิถุนายน เวลา 17.00-17.45 น. ในงาน Thailand 420
คอร์สอบรม 2DAYsกับหมอเดชา 25-26 มิ.ย.65 ใช้กัญชาจริงใน Workshop การสกัดและปลูกได้แล้ว
คอร์สอบรม2DAYs กับหมอเดชา รอบมิถุนายน 65 ตอนนี้เหลือรอบ 25-26 มิ.ย.65
สอน Woekshop โดยใช้กัญชาจริงในการสกัดและปลูกได้แล้ว
เนื้อหาที่สอน (โดยอาจารย์เดชา ศิริภัทร)
- สอนการปลูก
- สอนการสกัด
- สอนการใช้น้ำมันกัญชาเพื่อการรักษาที่ถูกต้อง
ค่าอบรมท่านละ 2,500 บาท (ไม่รวมที่พัก)
THC เสรีกัญ ก้าวสู่ผู้ผลิตมืออาชีพ 17-19 มิถุนายน 2565 LINK
THC ปาร์ตี้ "เสรีกัญ" (Thai Herb Centers วิสาหกิจชุมชน) กิจกรรม THC เสรีกัญ ชวนเติมความรู้ ก้าวสู่ผู้ผลิตมืออาชีพ (สมัครเข้าร่วมกิจกรรม 1,000 บาท)
- ปลูกกัญชาแล้วทำอะไรได้บ้าง?
- ขั้นตอนการขอ อย. ผลิตภัณฑ์กัญชา ทำอย่างไร?
- สอนแปรรูปผลิตภัณฑ์กัญชา 5 สไตล์
- ลงทะเบียนล่วงหน้า รับฟรี! กัญชา 3 สายพันธุ์ (หางกระรอก หางเสือ ศรีสงคราม)วันละ 400 ต้น
- รวมถึงสินค้าลดพิเศษ 50%
17-19 มิถุนายนนี้ ณ ศูนย์การเรียนรู้วิสาหกิจชุมชน Thai Herb Centers
ที่อยู่: ศูนย์การเรียนรู้ 22 เลขที่6/8 ตำบล ไทรม้า อำเภอเมืองนนทบุรี นนทบุรี 11000
สอบถาม โทร. 063-898-9895
รู้งี้ Edutainment จัดคอร์สเปิดตัวเอาใจสายเขียว เรียนออนไลน์
รู้งี้ Edutainment จัดคอร์สเปิดตัวเอาใจสายเขียว เรียนออนไลน์ รู้ขั้นตอนตั้งแต่ปลูกในบ้าน จนถึงปลูกในโรงเรือน ได้เลย! แถมเปิดวาร์ป แหล่งวัตถุดิบราคาพิเศษ + พาไปดูงานที่โรงเรือนจริง สำหรับผู้ที่ลงคอร์สนี้เท่านั้น เรียนคอร์สนี้จะได้อะไรบ้าง - เรียนรู้ประวัติของกัญชา กัญชง - เรียนรู้สายพันธุ์ของกัญชาในแบบต่างๆ - แยกแยะเพศของกัญชา แบบไหนใช้อย่างไร แตกต่างกันอย่างไร - ต้องวางแผนอย่างไร หากต้องการทำธุรกิจสายเขียว
จะนำผู้เชี่ยวชาญที่รู้ลึก รู้จริง มาอธิบายให้ฟัง พร้อมตอบคำถามทันทีผ่านห้องเรียน Live Steam
คอร์สอบรม กัญชง-กัญชา เชิงพาณิชย์และอุตสาหกรรม รุ่นที่ 5 Goldenleaf Hemp 5 มิ.ย.65 LINK
คอร์สอบรม "กัญชง-กัญชา เชิงพาณิชย์และอุตสาหกรรม" รุ่นที่ 5 พบกับวิทยากรผู้เชี่ยวชาญด้านการปลูกกัญชากัญชงเชิงพาณิชย์และอุตสาหกรรม เรียนทฤษฎีช่วงเช้า บ่ายเรียนภาคปฎิบัติจริงในการปลูกต้นกัญชง-กัญชา ในหัวข้อเรื่อง
- การต่อยอดธุรกิจในอนาคตของ กัญชง-กัญชา ในประเทศไทย
- วิธีการขอใบอนุญาติปลูกกัญชง-กัญชาเชิงพาณิชย์
- วิธีการปลูกกัญชง-กัญชา
- การจัดการวัสดุปลูก พร้อมปฏิบัติจริง
- วิธีการป้องกันศัตรูพืชของกัญชง-กัญชา
- เทคนิคและเคล็ดลับในการปลูก
- พร้อมรับ Certificate และรับฟรี ผลิตภัณฑ์จากฟาร์ม
- เวลาการจัดอบรม 09:00-17:00 น. ฟรีอาหารกลางวันและพักเบรค 2 มื้อ
อบรมวันที่ 5 มิถุนายน 2565 Goldenleaf Hemp ต.สุรศักดิ์ อ.ศรีราชา จ.ชลบุรี
ค่าอบรมท่านละ 4,999 บาท
รับจำนวนจำกัด สนใจ โทร 099-4462679 (กรรณิการ์)
สมัครได้เลยตามลิ้งค์มหกรรมท่องเที่ยวโดยชุมชนจังหวัดตราดเมืองสุขภาพ 29 มิถุนายน - 3 กรกฎาคม 2565
"มหกรรมท่องเที่ยวโดยชุมชนจังหวัดตราดเมืองสุขภาพ" 29 มิถุนายน - 3 กรกฎาคม 2565 สนามหน้าศาลากลางจังหวัดตราด หน่วยงาน ชุมชน ท่องเที่ยวมากันครบ มีโอกาสชวนแวะเดินชม กินขนม กินอาหารอร่อยๆ
งานกระท้อนหวาน ปี 65 ศูนย์ OTOP ตลาดต้องชม สี่แยกนเรศวร เมือง ปราจีนบุรี 24 มิ.ย. - 3 ก.ค. 65 LINK
งานกระท้อนหวาน ประจำปี 2565 กระท้อน ผลไม้ต่างๆ และไม้พันธุ์ดีของปราจีนบุรี ที่ต้องมาชมและช้อปกันจ้า มาหาของกินอร่อยๆกัน ในงานนี้มีผลไม้ อาหาร ขนม เครื่องดื่ม ต้นไม้ หมอน ที่นอน เสื้อผ้า ของใช้ ดูดวง ทำบุญโลงศพ การประกวดร้องเพลง การประกวดหนูน้อยกระท้อนหวาน ธิดากระท้อนหวาน วงดนตรี และอีกมากมายมาเดินชิลๆหาอะไรอร่อยๆกินกันจ้า งานนี้จัดโดยอบต.บ้านพระ จ.ปราจีนบุรี อยู่ในตลาดต้องชมเลย ซึ่งก็เป็นตลาดสด มีของกินอร่อยๆเยอะอยู่แล้ว ยิ่งมีงานก็เลยทำให้คึกคักไปอีกก ⏰งานจัดระหว่างวันที่ 24 มิ.ย. - 3 ก.ค. 65 เวลาช่วง 09:00-23:00 น. โดยประมาณจ้า ????พิกัด : ศูนย์ OTOP ตลาดต้องชม สี่แยกนเรศวร ต.บ้านพระ อ.เมือง จ.ปราจีนบุรี
เสวนาเชิงวิชาการ เรื่อง “กัญชากับอนาคตของสังคมไทย” 29 มิ.ย.65 LINK
เสวนากับหมอ มข EP 31 เสวนาเชิงวิชาการ เรื่อง “กัญชากับอนาคตของสังคมไทย” ในวันพุธที่ 29 มิถุนายน 2565 เวลา 13:30 - 15:00 น. หัวข้อเรื่องเสวนา
1 กัญชา ที่คุณรู้จักเป็นอย่างไร?
2 กัญชากับระบบประสาทของเรา
3 กัญชาทำอะไรกับลูกหลานของเรา
4 อาการทางจิตเวช จากกัญชาในระยะยาว
อัลตร้าเทรลเขาค้อ 2023 วันที่ 25 มิ.ย.66 LINK
อัลตร้าเทรลเขาค้อ วันที่ 25 มิถุนายน 2566 เบิร์ดแลนด์รีสอร์ท เขาค้อ เพชรบรูณ์ ระยะ 48 KM/30KM/20KM/10KM/5KM สมัครและโอนเงินภายในวันนี้ ถึง 30 พย 65 รับส่วนลด EarlyBird (16-30 NOV 2022)
ถึง 30 มิ.ย.66 สัตวแพทย์อาสา ม.เกษตร ทำหมันหมาแมว ฟรี
เปิดรับเข้าร่วมโครงการ ระหว่าง 13 มิย 65 ถึง 30 มิย 66 สุนัขและแมวทุกตัวจะได้รับการวางยาสลบชนิดสูดดม และผ่าตัดด้วยวิธีมาตรฐานโดยนิสิตคณะสัตวแพทย์ปีสุดท้าย นายสัตวแพทย์ที่เข้าอบรมหลักสูตรสัตวแพทย์เพิ่มพูนทักษะ ภายใต้การควบคุมอย่างใกล้ชิดของสัตวแพทย์ ผู้เชี่ยวชาญด้านศัลยกรรม
ติดต่อสอบถาม
• หน่วยศัลยกรรม 02-7971900 ต่อ 3216
• ประชาสัมพันธ์ 02-7971900 กด 9
• ลูกค้าสัมพันธ์ 02-7971955 (นัดหมาย)
เงื่อนไข
• สุนัขและแมวไม่จำกัดเพศ อายุ 1-5 ปี น้ำหนักตัวไม่เกิน 20 กก.
• สุขภาพแข็งแรง ไม่มีโรคประจำตัว
• กรณีเป็นเพศเมีย ต้องไม่อยู่ในระหว่างเป็นสัด ตั้งท้องหรือให้นมลูก
วิธีการเข้าร่วมโครงการ
1. นำสุนัขและแมว มาลงทะเบียนสัตว์ป่วยตามระบบของรพ. เพื่อตรวจร่างกายและตรวจเลือด (มีค่าใช้จ่ายในการตรวจ)
2. ลงทะเบียนเข้าร่วมโครงการและนัดหมายวันผ่าตัด (จันทร์-ศุกร์ เวลาราชการ)
3. มารับการผ่าตัดตามกำหนด ไม่มีค่าใช้จ่ายเฉพาะเฉพาะในการดมยาสลบและผ่าตัดทำหมัน
4. ยาและอุปกรณ์การดูแลแผล เจ้าของอาจจัดหาด้วยตนเองตามแนะนำของสัตวแพทย์ หรือซื้อจากโรงพยาบาลสัตว์
5.นำสุนัขและแมวเข้าตรวจแผลและตัดไหม (มีค่าใช้จ่ายเฉพาะค่าบริการสัตวแพทย์)
*สงวนสิทธิ์พิจารณารับสุนัขและแมวเข้าโครงการตามดุลยพินิจของสัตวแพทย์ผู้ตรวจ
ดนตรีในสวนเดือนมิถุนายน 2565
ดนตรีในสวน จัดโดย สำนักงานกรุงเทพมหานคร
เปิดด้วยหนึ่งในนโยบายของ นายชัชชาติ สิทธิพันธุ์ ผู้ว่าราชการกรุงเทพมหานคร ที่มุ่งสร้างกรุงเทพฯ ให้เป็นพื้นที่แห่งดนตรีและศิลปะการแสดง จุดเด่นของวงดนตรีในสวนนี้จึงเน้นสนับสนุนวงดนตรีท้องถิ่น รวมถึงวงดนตรีจากมหาวิทยาลัยรอบ กทม. เพื่อสร้างความสุขให้กับผู้คน
วันอาทิตย์ที่ 19 มิถุนายน 2565
เวลา 16.00 น. ณ สวนสันติชัยปราการ วง Brass Quintet วงดุริยางค์ซิมโฟนี กรมศิลปากร
เวลา 17.00 น. ณ ลานนก อุทยานเบญจสิริ วง BKK Jazz Group กองการสังคีต
เวลา 17.00 น. ณ สวนวชิรเบญจทัศ (สวนรถไฟ) วง Bangkok Metropolitan String Ensemble
วันอาทิตย์ที่ 26 มิถุนายน 2565
เวลา 16.00 น. ณ สวนหลวงพระราม 8 วง String Quintet วง Princess Galyani Symphony Orchestra, PGVSO สถาบันดนตรีกัลยาณิวัฒนา
เวลา 17.00 น. ณ ลานนก อุทยานเบญจสิริ วง BMO : Bangkok Metropolitan Orchestra
กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร
วันอาทิตย์ที่ 3 กรกฎาคม 2565
เวลา 16.00 น. ณ สวนรมณีนาถ (เรือนจำเก่า) วง Jazz Quintet วง Brass Quintet วง CU bandวง Big Band จุฬาลงกรณ์มหาวิทยาลัย
+++
ดนตรีในสวน จัดโดย สำนักวัฒนธรรม กีฬา และการท่องเที่ยว (สวท.)
สำหรับ ดนตรีในสวน ของ สวท. จะให้ความสำคัญกับการฟื้นฟูและเผยแพร่วัฒนธรรมเป็นหลัก กิจกรรมส่วนใหญ่จึงเน้นที่สร้างความสุขพร้อมๆกับอนุรักษ์ศิลปการตรีทุกสมัยได้มีพื้นที่ในการแสดงผลงานของตนเอง
วันอาทิตย์ที่ 19 มิ.ย. 2565
เวลา 16.00-18.00 น. ณ สวนสันติชัยปราการ วง Brass Quintet วงดุริยางค์ซิมโฟนี กรมศิลปากร บรรเลงเพลงคลาสสิก เพลงไทย เพลงไทยสากล เพลงลูกทุ่ง
วันอาทิตย์ที่ 26 มิ.ย. 2565
เวลา 16.00-18.00 น. ณ สวนพระราม 8 วง String Quintet วง Princess Galyani Symphony Orchestra, PGVSO สถาบันดนตรีกัลยาณิวัฒนา
วันอาทิตย์ที่ 3 ก.ค. 2565
เวลา 16.00-18.00 น. ณ สวนรมณีนาถ (เรือนจำเก่า)
Jazz Quintet
วง Brass Quintet
CU band วง Big Band จุฬาลงกรณ์
ดนตรีในสวน ทบ.เติมพลังใจให้คนกรุง จัดโดย กองทัพบก
กองทัพบก ก็ขอร่วมสร้างความสุขหลังจากสถานการณ์โควิด-19 คลี่คลายลง ให้กับประชาชนที่มาออกกำลังกายและพักผ่อนในสวนสาธารณะของกรุงเทพมหานคร 2 แห่ง คือ สวนป่าเบญจกิติ เขตคลองเตย และสวนหลวง ร.9 เขตประเวศ ตลอดเดือน มิ.ย. – ส.ค. นี้ โดยจุดเด่นจะเป็นการนำวงดุริยางค์ทหารบกเป็นวงหลัก
สวนหลวง ร.9 เวลา 17.00น. – 19.00 น.
วันศุกร์ที่ 17 มิ.ย. 2565 วงสามล้อ
วันอาทิตย์ที่ 19 มิ.ย. 2565 วงลินดา
เสาร์ที่ 25 มิ.ย. 2565 วงไอรีน
สวนเบญจกิตติ เวลา 17.00น. – 19.00 น.
วันเสาร์ที่ 18 มิ.ย. 2565 วงระลินทิพย์
วันศุกร์ที่ 24 มิ.ย. 2565 วงอินดี้
วันอาทิตย์ที่ 26 มิ.ย. 2565 วงสามล้อ
ทั้งนี้ สำหรับกิจกรรม ดนตรีในสวน ถือเป็นกิจกรรมที่ช่วยขับเคลื่อนวงการศิลปะอุตสาหกรรมดนตรีไปพร้อมๆกับการมอบความสุขให้กับประชาชนแบบฟรีๆ นอกจากนี้ยังช่วยผลักดันให้ใครๆหลายคนมีทางเลือกในการทำกิจกรรมนอกบ้าน พัฒนาเศรษฐกิจให้หมุนเวียนผ่านโน๊ตดนตรีด้วยเช่นกัน
HUA HIN Marathon 2023 (ครั้งที่ 3) 11 มิ.ย.66 LINK
HUA HIN Marathon 2023 (ครั้งที่ 3) งานวิ่งที่ทุกคนต้องมาสัมผัส #มาราธอนบรรยากาศเมืองหัวหิน...สุดคลาสสิค และชายหาด...สุดชิค และร่วมเป็นส่วนหนึ่งของงานวิ่งเพื่ออนุรักษ์สิ่งแวดล้อม และกระตุ้นเศรษฐกิจด้านการท่องเที่ยว ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี..." รางวัล OVER ALL MARATHON ชาย 1 รางวัล หญิง 1 รางวัล
วันแข่งขัน อาทิตย์ที่ 11 มิถุนายน 2566
วัดเขาไกรลาศ ต.หนองแก อ.หัวหิน จ.ประจวบคีรีขันธ์
ซูเปอร์สปอร์ต ลากูน่า ภูเก็ต มาราธอน 10-11 มิ.ย.66
ซูเปอร์สปอร์ต ลากูน่า ภูเก็ต มาราธอน 2566 วิ่งทางเรียบ ลากูน่า โกรฟ, ภูเก็ต 10-11 มิถุนายน 2566 สปอร์ตอีเว้นท์ที่ใหญ่ที่สุดในจังหวัดภูเก็ตและเป็นงานวิ่งมาราธอนชั้นนำของประเทศไทย โดยได้รับการการันตีมาตรฐานสนามวิ่งมาราธอนระดับสากลจากสมาคมวิ่งมาราธอนนานาชาติและการแข่งขันทางเรียบ (IAAF AIMS) ตั้งแต่เริ่มจัดงานในปีแรกจนถึงปัจจุบันและเป็นงานที่นักวิ่งสามารถนำไปควอลิฟายเพื่อเข้าแข่งขันวิ่งระดับโลก อาทิ บอสตัน มาราธอน ได้อีกด้วย
งานไทยแลนด์ เฮลท์ ฟิตเนส แอนด์ เวลเนส เอ็กซ์โป 2566
งานไทยแลนด์ เฮลท์ ฟิตเนส แอนด์ เวลเนส เอ็กซ์โป 2566 8 มิถุนายน ถึง 11 มิถุนายน 2566 นี่เป็นโอกาสของคุณที่จะเป็นส่วนหนึ่งของงานไทยแลนด์ เฮลท์ ฟิตเนส แอนด์ เวลเนส เอ็กซ์โป ที่จะรวบรวมหลากหลายแบรนด์จากอุตสาหกรรมเกี่ยวกับการมีสุขภาพดี ฟิตเนส และความเป็นอยู่ที่ดี งานจะจัดขึ้น ณ ลานเซ็นทรัลเวิลด์ กรุงเทพมหานครเดือน มิถุนายน 2566 ซึ่งจะจัดขึ้นเป็นประจำทุกปี
RU OK RUN 25 มิ.ย.66 LINK
กิจกรรม RU OK RUN 2023 กับงานวิ่งสุดจี๊ดของคนรักสุขภาพ กับกิจกรรมวิ่งดีมีรางวัล ประเภทการสมัคร มีทั้งหมด 3 ประเภท
1) ฟันรัน 5 กม. ค่าสมัคร 600.-
2) มินิมาราธอน 10 กม. ค่าสมัคร 600.-
3) VIP ค่าสมัคร 1,500.-
RU OK Run 2023 วิ่งพร้อมกันได้ในวันที่ 25 มิถุนายน 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก
พระพุทธฉาย มังกี้รัน 25 มิ.ย.66 LINK
Phraphutthachay Monkey RUN : พระพุทธฉาย มังกี้รัน
ปิดรับสมัคร 28 พฤษาคมนี้ ใครยังไม่สมัครรีบเลยค่า
วัดพระพุทธฉาย จังหวัดสระบุรี
25 มิถุนายน 2566
PHRAPHUTTHACHAY MONKEY RUN 10K 2023
PMR10K2023
AEON Mini Marathon #4 สวนสมเด็จพระนางเจ้าสิริกิติ์ วันที่ 18 มิ.ย.66 LINK
“TO THE DELIGHTFUL FUTURE” มาวิ่งสู่อนาคตไปด้วยกันกับเรามูลนิธิอิออนประเทศไทย
สู่อนาคตใหม่ในการรักษาโรคมะเร็ง สู่ความหวังที่เป็นความจริงของผู้ป่วย
AEON MINI MARATHON #4 TO THE DELIGHTFUL FUTURE
Park Run & Virtual Run รายได้จากการสมัครวิ่งทั้งหมด นำไปมอบให้มูลนิธิรามาธิบดี ใน “โครงการพัฒนานวัตกรรมในการรักษาโรคมะเร็ง”
18 มิถุนายน 2566 สวนสมเด็จพระนางเจ้าสิริกิติ์
การพบปะกันของผู้ประกอบการกัญชาชาวไทยในภูเก็ตครั้งที่ 1 โดยสมาคมกัญชาภูเก็ต LINK
"การพบปะกันของผู้ประกอบการกัญชาชาวไทยในภูเก็ตครั้งที่ 1 โดยสมาคมกัญชาภูเก็ต" สำหรับ : ผู้ปลูก พ่อค้าแม่ค้า ร้านค้า วันที่ 1 มิถุนายน 2566 เวลา 4 - 6 โมงเย็น ที่
Phuket high & Sweet eye โทร. 064 925 2719
หัวข้อในการประชุม
1) แนวทางทิศทางของการเมืองและกัญชาไทย
2) ดอกนำเข้า
3) ต่างชาติทำธุรกิจ
4) ข้อแนะนำและวิธีการแก้ไข
วิธีในการประชุม : open discussion ให้ทุกคนเรียงกันออกความคิดเห็น วิเคราะห์เกี่ยวกับปัญหาระยะสั้น ระยะยาว รวมถึงข้อเสนอแนะแบบมีโครงสร้างและแผนงานชัดเจน
หลังจากจบการประชุม:
เพื่อให้เราได้ยินเสียงของพี่น้องผู้ประกอบการกัญชาในภูเก็ตอย่างใกล้ชิดมากขึ้น เพื่อสมาคมสามารถพัฒนาได้อย่างมีประโยชน์กับผู้ประกอบการในพื้นที่มากขึ้น และเป็นกระบอกเสียงที่สำคัญให้กับกัญชาภูเก็ต
21 มิ.ย.66 หน่วยเคลื่อนที่ ทำหมันสุนัขและแมว ณ ซอยโรงกำจัดขยะหนองแขม พุทธมณฑลสาย 3 LINK
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ณ
กลุ่มควบคุมและตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม ในวันที่ 21 มิถุนายน 2566 เวลา 09.00 ถึง 11.00 น. [
ดูแผนที่]
รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
ลงทะเบียน ติดต่อสอบถาม กลุ่มควบคุมและการตรวจเนื้อสัตว์ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร โทร. 02-4095986
16 มิถุนายน 66 เขตบางเขน ทำหมันหมาแมว ฉีดวัคซีน ฟรี LINK
สำนักงานเขตบางเขน ร่วมกับสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ออกหน่วยทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ วันที่ 16 มิถุนายน 2566 เวลา 09.00 ถึง 11.00 น. บริเวณชุมชนเคหะรามอินทรา ถนนรามอินทรา แขวงท่าแร้ง เขตบางเขน รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว
8 มิถุนายน วัดอินทราวาส ตลิ่งชัน กิจกรรมสุขภาพดี ใกล้บ้าน ใกล้หมอ
8 มิถุนายน วัดอินทราวาส ตลิ่งชัน เวลา 8.00-14.00 น.
กิจกรรมบริการในงาน ฟรี ทุกรายการ ได้แก่
1. ชวนเช็ค - ตรวจเบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอ็กซเรย์ปอด ตรวจฟัน (อุด ขูด ถอน) ตรวจสุขภาพใจ คุยกับนักจิตวิทยา
2. ชวนรู้ - ความรู้สุขภาพและการดูแลสุขภาพ ด้านต่างๆ ได้แก่ กินเป็นเน้นสุขภาพ ยาเสพติด ไข้เลือดออก รู้ทันผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ปลอดภัยจากฝุ่น PM2.5 ดูแลคนป่วยที่บ้าน
3. ชวนช็อป - สินค้าโอท็อป สินค้าชุมชน
4. บริการน้องหมาน้องแมว - ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฝังไมโครชิป (น้องหมา)
ทำหมัน 60 ตัว/วัน ฉีดวัคซีน 200 ตัว/วัน ฝังไมโครชิป 50 ตัว/วัน
5. แจกแว่นสายตายาว
อบรมปลูกพืชสมุนไพรด้วยโรงปลูกพืชแนวตั้ง รุ่นที่ 4 ตอน "กัญชา" 19 – 20 มิถุนายน 2566 LINK
หลักสูตรการปลูกพืชสมุนไพรด้วย โรงปลูกพืชแนวตั้ง (Vertical Farming) ตอน “กัญชา (Cannabis)” รุ่นที่ 4 (Mastering Indoor Vertical Farming for Cannabis : VFC) วันที่ 19 – 20 มิถุนายน 2566 ณ โรงแรมเซ็นจูรี่ พาร์ค กรุงเทพ (บรรยาย) และศึกษาดูงานการปลูกกัญชาในโรงปลูกพืชแนวตั้ง อ.บางใหญ่ จ.นนทบุรี ค่าอบรม ท่านละ 7,490 บาท จัดโดย สถาบันพัฒนาบุคลากรแห่งอนาคต (Career for the Future Academy) สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.)
15 มิ.ย. 66 ทำหมันหมาแมว ชุมชนหมู่บ้านอัมรินทร์นิเวศน์ 2 เขตคันนายาว
วันพฤหัสบดีที่ 15 มิ.ย. 66 สำนักงานสัตวแพทย์สาธารณสุข ร่วมกับ ชุมชนหมู่บ้านอัมรินทร์นิเวศน์ 2 และฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตคันนายาว จัดหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ที่ชุมชนหมู่บ้านอัมรินทร์นิเวศน์ 2 เขตคันนายาว เวลา 9.00 ถึง 11.00 น. ทำหมันจำนวนจำกัด 30 ตัว จองทำหมันได้ไม่เกินคนละ 2 ตัว ติดต่อสอบถามได้ที่ 096-885-0633 (แอดมิน)
ลงทะเบียนตามนี้20-23 มิถุนายน 66 หน่วยสัตวแพทย์เคลื่อนที่
สำนักอนามัย ชวนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิป และทำหมัน โดยหน่วยสัตวแพทย์เคลื่อนที่ ดังนี้ *เจ้าของสัตว์เลี้ยง นำบัตรประชาชนมาแสดงด้วยนะคะ
20 มิถุนายน 66 สถานที่ ชุมชนบ้านครัวเหนือ เวลา 9.00-12.00 น. (กรณีทำหมัน จองคิวกับชุมชนครบแล้ว)
21 มิถุนายน 66 สถานที่ กลุ่มควบคุมและตรวจเนื้อสัตว์ เขตหนองแขม เวลา 9.00-12.00 น. (กรณีทำหมัน จองคิวกับสนง.สัตวแพทย์สาธารณสุขครบแล้ว)
22 มิถุนายน 66 สถานที่ ชุมชนพลับพลา เขตวังทองหลาง เวลา 9.00-12.00 น. (รับลงทะเบียนหน้างาน ที่หน่วยแพทย์เคลื่อนที่)
23 มิถุนายน 66 สถานที่ วัดบางขุนเทียนใน เขตจอมทอง เวลา 9.00-12.00 น. รับลงทะเบียนหน้างาน
22 มิ.ย. 66 ฟรี ที่ชุมชนพลับพลา เขตวังทองหลาง เวลา 8.00 - 14.00 น.
22 มิ.ย. 66 สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร มีหน่วยสัตวแพทย์เคลื่อนที่ ให้บริการทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ที่ชุมชนพลับพลา เขตวังทองหลาง เวลา 8.00 - 14.00 น.
- ทำหมัน รับจำนวนจำกัด 60 ตัว ได้สืทธิ์คนละไม่เกิน 2 ตัว
- ฉีดวัตซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว
- ฉีดไมโครชิปสุนัข 40 ตัว
- สัตว์ที่จะนำมาทำหมัน ต้องขังกรง อดอาหารและน้ำ 10 ชม. ก่อนนำมารับบริการทำหมัน
TRAMS MOVE @Hua Hin Station 23-25 มิ.ย. 2566
TRAMS MOVE @Hua Hin Station 23-25 มิ.ย. 2566 ลานกิจกรรม 25 ไร่ ด้านหลังศูนย์การค้าบลูพอร์ต หัวหิน ฟรีคอนเสิร์ต ตั้งแต่ 18.00 ถึง 22:00 น. จากวง MEAN / MUSKETEERS / ZEAL / แมวเศษเล็บ (The Voice) และอีกเพียบบ! พกบัตร(ประชาชน)กับใจมาก็พอ จอดรถที่บลูพอร์ตได้เลยนะจ๊ะ มีรถรับส่ง
พบกับศิลปินมากมายภายในงาน และกิจกรรมสนุกๆ ชิม ช้อป ชิล
23 มิถุนายน 2566 พบกับ MEAN
24 มิถุนายน 2566 พบกับ MUSKETEERS
25 มิถุนายน 2566 พบกับ ZEAL
พร้อมวง แมวเศษเล็บ (The Voice) / Cassette / la’da / 3 Hums folk band / Inside
เทศกาลทุเรียนป่าละอู Durian Festival ครั้งที่ 8 ระหว่างวันที่ 30 มิ.ย. - 4 ก.ค.66
1 ปีมีครั้งเดียว ที่จะได้ชิม ได้สัมผัสกลิ่นความหอม กลิ่นความอร่อย สัมผัสลิ้นรสหอม หวาน มัน กรอบ ของทุเรียนป่าละอูแท้ เอกลักษณ์พื้นถิ่นที่ไม่เหมือนใคร จากป่าละอู หัวหิน มากมาย พบกันในงานเทศกาลทุเรียนป่าละอู Durian Festival ครั้งที่ 8 ระหว่างวันที่ 30 มิ.ย. - 4 ก.ค.66 ณ บริเวณลานด้านหน้าศูนย์การค้ามาร์เก็ตวิลเลจ หัวหิน พลาดงานนี้ เสียใจตลอดปีแน่ๆ
ปฏิทินท่องเที่ยว@ประจวบคีรีขันธ์ เดือน มิถุนายน 2566
งาน NakhonSawan Coffee Season : Artist Market 24-25 มิถุนายน 2566
งาน NakhonSawan Coffee Season : Artist Market 24-25 มิถุนายน 2566 เวลา 09.00.-20.00 น. งานกาแฟที่ใหญ่ที่สุดในนครสวรรค์ สวรรค์ของคนรักกาแฟ ร้านกาแฟมากกว่า 50 บูธ ใครเป็นแฟนตัวยงร้านกาแฟร้านไหน ตามไปชิมได้เลยที่งานนี้ มาชิมกาแฟฟังเพลงเบาๆกัน สถานที่จัดงาน : Golden hill village (ภูทองวิลเลจ สี่แยกเขาทอง)
Aqua Fest พัทยา 24 มิถุนายน 2566
มาสาดความสุขสนุกไปด้วยกันในงาน Flex Aqua Fest เทศกาลดนตรีที่ชุ่มฉ่ำที่สุดแห่งปีที่ทุกคนรอคอย 24 มิถุนายน 2566 COLUMBIA PICTURES AQUAVERSE, PATTAYA
สัมมนาวิชาการนานาชาติ เรื่อง กัญชา กัญชง วันที่ 28-30 มิถุนายน 2566 LINK
สัมมนาวิชาการนานาชาติ เรื่อง กัญชา กัญชง
MEDICAL CANNABIS & GACP THAILAND
"the International Medical Cannabis Conference"
วันที่ 28-30 มิถุนายน 2566
เวลา 10.00 - 16.00 น.
ณ ห้อง Phoenix 1-2 ฮอลล์ 11-12 อิมแพค เมืองทองธานี
DAY#3 งานสัมมนาวิชาการนานาชาติเรื่องกัญชากัญชง (บรรยายอังกฤษ)
MEDICAL CANNABIS & GACP THAILAND
"the International Medical Cannabis Conference"
วันที่ 30 มิถุนายน 2566
ณ ห้อง Phoenix 1 เวลา 10.00 - 12.00 น.
ฮอลล์ 11-12 อิมแพค เมืองทองธานี
ประจำเดือน มิถุนายน 2566
มิถุนายน 2566 สำนักงานปศุสัตว์จังหวัดชลบุรี ออกให้บริการหน่วยทำหมันและฉีดวัคซีน 12 วัน 10 จุดบริการ เช็คกำหนดการ
29 มิถุนายน 2566 เทศบาลเมืองสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว
เทศบาลเมืองสุรินทร์ ร่วมกับ ปศุสัตว์จังหวัดสุรินทร์ จัดกิจกรรมทำหมันให้กับสุนัขและแมว ในเขตเทศบาลเมืองสุรินทร์ รับ จำนวนจำกัด ในวันที่ 29 มิถุนายน 2566 เวลา 08.30-163.0 น. ณ วัดพรหมสุรินทร์ โดยเปิดรับลงทะเบียน ผ่าน QR code วันที่ 22 มิถุนายน 2566 เวลา 09.00 น. เป็นต้นไป
23 มิ.ย.66 เทศบาลตำบลหนองแค LINK
กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลหนองแค ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า และการทำหมันสุนัข-แมว เขตพื้นที่เทศบาลตำบลหนองแค ท่านที่สนใจสามารถ จองคิวทำหมันสุนัข-แมว ได้ที่ QR Code ด้านหลัง เพื่อขอเข้ารับบริการ (จำนวนจำกัดเพียง 50 ตัวเท่านั้น)
** กำหนดการจะมีขึ้นในวันศุกร์ที่ 23 มิถุนายน 2666 ตั้งแต่เวลา 09.00 น. เป็นต้นไป ณ อาคารจิรนที เทศบาลตำบลหนองแค **
(คำแนะนำ : ให้ท่านเจ้าของสัตว์เลี้ยงนำบัตร ปปช. ตัวจริงมาด้วยในวันรับบริการและปฎิบัติตามข้อแนะนำการดูแลสัตว์เลี้ยงอย่างเคร่งครัด)
สอบถามรายละเอียดเพิ่มเติมได้ที่ : กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลหนองแค โทร. 036-371334 ต่อ 125 - 126 (ในวันเวลาราชการ)
29 มิ.ย และ 4 ก.ค.66 ปศุสัตว์จังหวัดพะเยา ออกหน่วยทำหมันใน อ.จุน และอ.เชียงคำ
สำนักงานปศุสัตว์จังหวัดพะเยา กำหนดออกหน่วยให้บริการผ่าตัดทำหมันสุนัขและแมว
1. วันพฤหัสบดี ที่ 29 มิถุนายน 2566 ร่วมกับเทศบาลตำบลทุ่งรวงทอง ออกหน่วยให้บริการฯ ในพื้นที่ตำบลทุ่งรวงทอง อำเภอจุน
2. วันอังคาร ที่ 4 กรกฎาคม 2566 ร่วมกับองค์การปกครองส่วนตำบลน้ำแวน จัดโครงการปศุสัตว์ร่วมใจ กำจัดภัย โรคพิษสุนัขบ้า ออกหน่วยให้บริการฯ ในพื้นที่ตำบลน้ำแวน อำเภอเชียงคำ
***ขอสงวนสิทธิให้บริการฯ สำหรับผู้ที่ติดต่อลงทะเบียนล่วงหน้าแล้วเท่านั้น***
ติดต่อสอบถามได้ที่องค์การปกครองส่วนท้องถิ่นตามพื้นที่ หรือกลุ่มพัฒนาสุขภาพสัตว์ สำนักงานปศุสัตว์จังหวัดพะเยา โทร 096-2913170
8 มิ.ย.66 ปศุสัตว์ อำเภอสามพราน ทำหมันฉีดวัคซีนหมาแมว วันละ 50 ตัว
สำนักงานปศุสัตว์ อำเภอสามพราน จัดกิจกรรม ผ่าตัดทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สุนัขและแมวฟรี วันที่ 8 มิถุนายน 2566 เวลา 08:30-11:00 น. สถานที่ ณ วัดสรรเพชร ตำบลยายชา อำเภอสามพราน จำนวนจำกัด เพียง 50 ตัวเท่านั้ สำหรับท่านที่สนใจ โปรดงดน้ำและอาหารสัตว์เลี้ยงของท่านอย่างน้อย 8-12 ชั่วโมงอย่างเคร่งครัด (หากสัตว์เลี้ยงของท่านกินอาหารมา คุณหมอจะไม่ทำหมันให้นะครับ)
23 มิ.ย.66 เทศบาลเมืองบ้านพรุ ร่วมกับ ปศุสัตว์จังหวัดสงขลา ทำหมันสุนัขและแมวจรจัด (เท่านั้น)
เทศบาลเมืองบ้านพรุ ร่วมกับ ปศุสัตว์จังหวัดสงขลา และปศุสัตว์อำเภอหาดใหญ่ จัดกิจกรรมทำหมันสุนัขและแมวจรจัด ในวันศุกร์ที่ 23 มิถุนายน 2566 ณ ศาลาร่วมใจ วัดเทพชุมนุม เวลา 09.00 น. - 15.00 น. รับทำหมันสำหรับสุนัขและแมวจรจัดเท่านั้น สามารถมาแจ้งเจ้าหน้าที่ และพาเจ้าหน้าที่ไปชี้ตำแหน่งที่สุนัขหรือแมวอยู่เพื่อเป่ายาซึมนำมาทำหมัน สอบถามรายละเอียดเพิ่มเติม โทร. 094-8792414
13 มิ.ย.66 ปศุสัตว์อำเภอปากช่อง บริการทำหมันฉีดวัคซีนสุนัขแมว ฟรี
สำนักงานปศุสัตว์อำเภอปากช่อง ขอแจ้งประชาสัมพันธ์ ผู้เลี้ยงสุนัข/แมว เข้ารับบริการฉีดวัคซีนพิษสุนัขบ้า และ ผ่าตัดทำหมันให้แก่สุนัข/แมว ในวันอังคารที่ 13 มิถุนายน 2566 เวลา 09.00-12.00 น. ณ ฟาวเท่นทรี รีสอร์ท อำเภอปากช่อง จังหวัดนครราชสีมา สามารถติดต่อลงทะเบียนและสอบถามรายละเอียดเพิ่มเติม ได้ที่ สำนักงานปศุสัตว์อำเภอปากช่อง 080-6682572
ปฏิทินกิจกรรม เพชรบูรณ์ เดือนมิถุนายน 2566
Healthy Living & Innovation Expo 2023 - 29 มิถุนายน – 2 กรกฎาคม 2566
Healthy Living & Innovation Expo 2023 วันที่ 29 มิถุนายน – 2 กรกฎาคม 2566 เวลา 10.00 – 20.00 น. ณ ศูนย์ประชุมนานาชาติฯ ม.อ. หาดใหญ่ งานแสดงสินค้า บริการ และนวัตกรรมเพื่อผู้รักสุขภาพ รวบรวมผู้ประกอบการ รวมทั้งงานวิจัยและนวัตกรรม ด้านสุขภาพ ความงาม และผู้สูงอายุ ที่ใหญ่ที่สุดในภาคใต้
- Innovation Market นิทรรศการนำเสนอผลงานวิจัยและนวัตกรรมด้านการดูแลสุขภาพและคงวามงาม ที่พร้อมต่อยอดเชิงพาณิชย์
- Exhibition Showcase นิทรรศการผลงานวิจัยพืชกระท่อมไทยในทุกมิติรวมทั้งแนวทางการขออนุญาตและการกำกับดูแลด้วยความร่วมมือจากสำนักงานคณะกรรมการอาหารและยา (อย.)
- Seminar การใช้สารสกัดจากกัญชา กัญชง กระท่อม ในวงการสุขภาพและความงาม
- Business Matching กิจกรรมจับคู่เจรจาธุรกิจ
- Hosted Buyer Program สนับสนุนค่าเดินทางและที่พักสำหรับผู้ซื้อศักยภาพสูง
- Health Check บริการตรวจสุขภาพหลากหลายโปรแกรมจากแพทย์ผู้เชี่ยวชาญ
- Workshop บริการตรวจสุขภาพผิว พร้อมให้คำปรึกษาเลือกใช้ผลิตภัณฑ์
Thailand Healthcare 2023 เกษียณสโมสร 29 มิ.ย. – 2 ก.ค. 66 สามย่านมิตรทาวน์ LINK
เครือมติชน เตรียมจัดงานมหกรรมสุขภาพอีกครั้ง Thailand Healthcare 2023 “เกษียณสโมสร” งานแฟร์สุขภาพอันดับ 1 ของประเทศ เริ่ม 29 มิ.ย. – 2 ก.ค. เวลา 10.00 – 20.00 น. ณ สามย่านมิตรทาวน์ฮอลล์ ชั้น 5 สามย่านมิตรทาวน์ พาเหรดกิจกรรมและบริการสุขภาพจากสถานพยาบาลมากมายพร้อมต้อนรับผู้มาเยี่ยมชมงาน งานเดียวที่รวมพันธมิตรด้านสุขภาพทั้งจากภาครัฐและภาคเอกชนไว้ด้วยกัน ภายใต้แนวคิด “เกษียณสโมสร” เปิดโลกความสุขของคนรักสุขภาพวัยก่อนเกษียณ วัยเกษียณ และครอบครัวผู้ดูแล
ภายในงานยังมีแคมเปญพิเศษ Thailand Healthcare 2023 ยิ่งเก๋า ยิ่งได้ เพียงแสดงบัตรประชาชนแล้วอายุเข้าเกณฑ์ 70 ขึ้นไป รับทันทีคูปองสอยดาวฟรี พร้อมของขวัญฉลองวัยได้ทันที และกิจกรรมโปรโมชั่นสุดปังอื่นๆอีกมากมาย
มหกรรมสมุนไพรแห่งชาติครั้งที่ 20 @อิมแพคเมืองทองธานี 28 มิ.ย. - 2 ก.ค.2566 LINK
งานมหกรรมสมุนไพรแห่งชาติครั้งที่ 20 ประจำปี 2566 มหกรรมยิ่งใหญ่ด้านสมุนไพรไทย ภูมิปัญญาไทย เศรษฐกิจไทย ที่ขจรไกลไปทั่วโลก กลับมาอีกครั้ง วันที่ 28 มิถุนายน - 2 กรกฎาคม 2566 ณ อิมแพคเมืองทองธานี ฮอลล์ 11-12 เตรียมไปเดิมชมชิมช็อปให้สนุกเหมือนปีที่ผ่านมากันนะ เช็คตารางกิจกรรมได้แล้วเช่นกัน การอบรมน่าสนใจหลายรายการ อบรมฟรี ห้องฟีนิกซ์ 2-6
Pet market by หมาติดเที่ยว CentralPlaza Rama 3
23-25 มิถุนายน 2566 CentralPlaza Rama 3 ช้อปปิ้งสินค้า และ บริการสัตว์เลี้ยงกว่า 20 ร้านค้า และร้านค้าดังจากใน IG ภายในงาน ซื้อสินค้าครบ 3000 บาท รับสิทธิ์ workshop กระเป๋าผ้า หรือ เพ้นท์คุกกี้สำหรับสัตว์เลี้ยง ฟรี! สำหรับน้งหมาตัวโต จอดรถชั้น 1
Dog Diaries Pet Pawty 18 มิถุนายน 2566
งาน PAWTY ของทางเพจ Dog Diaries-เรื่องเล่าหมาหาบ้าน วันอาทิตย์ที่ 18 มิถุนายน 2566 เวลา 12.00 น.-16.00 น. อำนวยความสะดวกให้ใช้สถานที่ในการจัดงานโดยร้าน โซวาส บาย มิสเตอร์ชู (Sauvage by Mr Chou) แจ้งวัฒนะ หลักสี่ กรุงเทพ งานนี้จัดขึ้นเพื่อให้ผู้สนใจรับอุปการะสุนัขได้มีโอกาสมาดูตัว ทำความรู้จัก และรับทราบข้อมูลของสุนัขที่ท่านสนใจ แต่ท่านจะยังไม่ได้พาสุนัขกลับบ้านไปในวันงานได้
หาดสุขสำราญ on The BEAT Music Festival 26 - 28 มิถุนายน 2566
หาดสุขสำราญ on The BEAT Music Festival ณ หาดทรายโพธาราม จังหวัดราชบุรี วันที่ 26 - 28 มิถุนายน 2566 เวลา 17.00 กิจกรรมที่น่าสนใจภายในงาน
มหกรรมไฟประดับ Vintage illumination ธีม Disco Vintage
คาราวานอาหาร ขนม เครื่องดื่ม ของฝาก กับ Food Market
มันส์ on Stage กับการแสดงดนตรีจากนักร้องชื่อดัง
การฉายหนังกลางแปลง เวลา 19.00 น. เป็นต้นไป
เทศบาลตำบลบางเมือง โครงการป้องกันและควบคุมโรคพิษสุนัขบ้า LINK
เทศบาลตำบลบางเมือง จัดโครงการป้องกันและควบคุมโรคพิษสุนัขบ้า เพื่อดำเนินกิจกรรม “สัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า” ตามพระปณิธาน ศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี ประจำปีงบประมาณ พ.ศ. 2566
วันอังคารที่ 13 มิถุนายน พ.ศ. 2565 เวลา 09.00 น. นาวาเอก อนุศักดิ์ นาคทิม นายกเทศมนตรีตำบลบางเมือง พร้อมด้วย นายปาณวัฒน์ อุทัยเลิศ รองนายกเทศมนตรีตำบลบางเมือง นายเลิศชาย ยั่งยืน รองนายกเทศมนตรีตำบลบางเมือง นางกาญจนา ปั้นศิริ รองปลัดเทศบาล ร่วมกิจกรรม สัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ในการให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สัตว์เลี้ยงของประชาชนในชุมชนยั่งยืน 1 ชุมชนยั่งยืน 2 ชุมชนทางตะวัน ชุมชนอุดมพร ชุมชนทดน้ำ ชุมชนบุญศิริ ชุมชนกลางนา ชุมชนทิพวัล 1, 2, 3 และ 5 โดยมี นายเฟื่องวุฒิ จินาวัลย์ สมาชิกสภาเทศบาลตำบลบางเมือง ร่วมกิจกรรม
วันจันทร์ที่ 19 มิถุนายน พ.ศ. 2565 เวลา 09.00 น. นาวาเอก อนุศักดิ์ นาคทิม นายกเทศมนตรีตำบลบางเมือง พร้อมด้วย นายเฟื่องวุฒิ จินาวัลย์ สมาชิกสภาเทศบาลตำบลบางเมือง ร่วมกิจกรรม สัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ในการให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า แก่สัตว์เลี้ยงของประชาชนในชุมชนคลองมหาวงษ์ ชุมชนยูลิ ชุมชนราชศุภนิมิต 1,2 ชุมชนเอื้ออาทรพร้อมมิตร ชุมชนทวีทอง 5 ชุมชนบุญศิริ ชุมชนทวีทอง 1
เสวนาวิชาการ เหล้า บุหรี่ไฟฟ้า กัญชา ยาเสพติด เต็มพื้นที่ออนไลน์ ผู้บริโภคพร้อมรับมืออย้างไร 26 มิถุนายน 2566
เสวนาวิชาการ “เหล้า บุหรี่ไฟฟ้า กัญชา ยาเสพติด เต็มพื้นที่ออนไลน์ ผู้บริโภคพร้อมรับมืออย้างไร” • วันจันทร์ ที่ 26 มิถุนายน 2566 เวลา 13.00 – 15.00 น. • บรรยายเรื่อง พิษจากสารต่าง ๆ
โดย อ.พญ.จริยา ภูดิศชินภัทร ภาควิชาเวชศาสตร์ป้องกันและสังคม คณะแพทยศาสตร์ศิริราชพยาบาล
• บรรยายเรื่อง เหล้า บุหรี่ไฟฟ้า กัญชา ยาเสพติด เต็มพื้นที่ออนไลน์ผู้บริโภคพร้อมรับมืออย่างไร
โดย คุณสารี อ๋องสมหวัง เลขาธิการ สภาองค์กรของผู้บริโภค
• บรรยายเรื่อง เสพติดสารและผลการสำรวจผลิตภัณฑ์อาหาร
โดย รศ.ดร.เกื้อการุณย์ ครูส่ง ภาควิชาชีวเคมี คณะวิทยาศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
• บรรยายเรื่อง ผลของเหล้า บุหรี่ กัญชา ยาเสพติด ต่อร่างกายและจิตใจผู้ใช้
โดย คุณกัณณิกา สิทธิพงษ์ นักจิตวิทยาคลินิกชำนาญการพิเศษ โรงพยาบาลธัญญารัก์ ขอนแก่น
ซิมโฟนีออร์เคสตร้า โดยวง Thai Symphony Orchestra ชมฟรี 2 มิถุนายน 2566 สนามกีฬาเทศบาลนครตรัง 2 (ทุ่งแจ้ง)
การแสดงซิมโฟนีออร์เคสตร้า โดยวง Thai Symphony Orchestra ชมฟรี “เสียงใหม่” พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ ณ โรงยิม 4,000 ที่นั่ง สนามกีฬาเทศบาลนครตรัง 2 (ทุ่งแจ้ง) วันศุกร์ที่ 2 มิถุนายน 2566 เวลา 19.00 - 21.30 น.
บรรเลงโดย วงไทยซิมโฟนีออร์เคสตร้า (Thai Symphony Orchestra) อำนวยการเพลง โดย ดร.ธีรนัย จิระสิริกุล สร้างสรรค์ภาพจิตรกรรมประกอบบทเพลง โดย ดร. สุชาติ วงษ์ทอง อ.เนาวรัตน์ พงศ์ไพบูลย์ ศิลปินแห่งชาติ ร่วมอ่านบทกวี ศิลปินรับเชิญ
- วงรองเง็งเสียงใหม่
- วงปล่อยแก่ยะลา
- จ๊อบ บรรจบ พลอินทร์
เสียงใหม่ พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ วง Thai Symphony Orchestra ณ หอนาฬิกาจังหวัดตรัง
ครั้งแรกใจกลางเมืองตรัง “เสียงใหม่” ณ หอนาฬิกาจังหวัดตรัง พื้นที่วัฒนธรรมดนตรีเพื่อพัฒนาสร้างสรรค์จินตนาการ วง Thai Symphony Orchestra ในวันศุกร์ที่ 2 มิถุนายน 2566เวลา 19.00 - 20.30 น. บริเวณหอนาฬิกา ถนนวิเศษกุล อำเภอเมืองตรัง จังหวัดตรัง บรรเลงโดย วงไทยซิมโฟนีออร์เคสตร้า (Thai Symphony Orchestra) อำนวยเพลง โดย ดร.ธีรนัย จิระสิริกุล สร้างสรรค์ภาพจิตรกรรมประกอบบทเพลง โดย ดร. สุชาติ วงษ์ทอง อาจารย์เนาวรัตน์ พงศ์ไพบูลย์ ศิลปินแห่งชาติร่วมอ่านบทกวี
การเตรียมตัวพาน้องหมาแมว ก่อนไปทำหมัน
มหกรรมสมุนไพรแห่งชาติ ครั้งที่ 19 วันที่ 6-10 ก.ค.65 LINK
มหกรรมสมุนไพรแห่งชาติ ครั้งที่ 19 ประจำปี 2565 ณ อิมแพ็ค เมืองทองธานีฮอลล์ 11 - 12 และ ห้องประชุมฟินิกซ์ 2-6 ติดตามและสอบถามได้ที่ website : https://natherbexpo.dtam.moph.go.th/index.php?lang=th FB : https://www.facebook.com/natherbexpo โทรศัพท์ : 021495649
The 23rd Thai Festival of the Year 2022 in Bern, Switzerland July 9-10, 2022 LINK
With the Royal Thai Embassy in Bern scheduled to organize the 23rd Thai Festival for the year 2022 on July 9-10, 2022 at the Royal Thai Embassy’s office area. with an objective to promote and publicize Thailand in various fields including Thai tourism, Thai food, Thai massage for health Thai sports and Thai cultural traditions for Thailand to be widely known Create Thai popularity in Switzerland as well as strengthening the close relationship between the Thai community and Swiss and foreigners living in Switzerland.
In this regard, the Embassy Invitation to the Thai Association restaurant operator Drinks and Crafts participated in the Thai festival which can send the application form attached to the embassy for consideration Please submit an application by email. events.thaiemb@gmail.com by May 13, 2022 (mail will not be accepted)
Free entry
Royal Thai Embassy, Bern
Kirchstrasse 56, 3097 Liebefeld-Berne
Tel. (41-31) 970-3030-34
Announcement [เลื่อน] มหกรรมกัญชา ม่วนกัญ ล้านนา LINK
ขอเชิญชวนประชาชน หน่วยงานภาครัฐ ภาคเอกชน วิสาหกิจชุมชน หรือผู้ที่สนใจ ร่วมงาน มหกรรมกัญชา เพื่อเศรษฐกิจ "ม่วนกัญ ล้านนา" เขตสุขภาพที่ 1 ระหว่างวันที่ 22-24 กรกฎาคม 2565 ณ หอประชุมใหญ่ ม.ราชภัฎเชียงราย ในงานพบกับกิจกรรมมากมาย
- ประชุมวิชาการ
- คลินิกกัญชาทางการแพทย์
- บูทขายสินค้าแปรรูปชั้นนำภาคเหนือ
- ให้คำปรึกษาการปลูกกัญชาทางการแพทย์
- องค์ความรู้ด้านการผลิต วิจัย กัญชา กัญชง
- สาธิตเมนูอาหารปรุงด้วยใบกัญชา
ทัวร์เกษตรสัญจร เขาค้อ จัดโดย สมาคมสื่อมวลชนเกษตรแห่งประเทศไทย 2-3 ก.ค.65
ทัวร์เกษตรสัญจร เขาค้อ จ.เพชรบูรณ์ ชมแปลงกัญชง กัญชา กระท่อม อะโวกาโด โกโก้ ผักสลัดไฮโดรโปรนิกส์ ไหว้พระพุทธเจ้า 5 พระองค์วัดผาซ่อนแก้วจ.เพชรบูรณ์ 2-3 กรกฎาคม 2565 จัดโดย สมาคมสื่อมวลชนเกษตรแห่งประเทศไทย
มทร.อีสาน เปิดหลักสูตร ผู้ดูแลแปลงปลูกกัญชาระดับอุตสาหกรรม 5 วัน ค่าลงทะเบียน 15,000 บาท/คน LINK
สถาบันวิจัยพัฒนากัญชากัญชงสมุนไพร มทร.อีสาน Rmuti Cannabis&Herbs Institute
สำหรับผู้ที่สนใจในเรื่องกัญชา ขอเชิญผู้ที่สนใจเข้าร่วมอบรมหลักสูตร "ผู้ดูแลแปลงปลูกกัญชาระดับอุตสาหกรรม "
- หลักสูตร 5 วัน
- ค่าลงทะเบียน 15,000 บาท/คน
- สถานที่ฝึกอบรม มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสกลนคร
- ผู้รับผิดชอบโครงการ ผู้ช่วยศาตราจารย์ ดร.นำพน พิพัฒน์ไพบูลย์
ติดต่อสอบถามรายละเอียดได้ที่ : 0-4277-2285 หรือ 08-7231-7480 (คุณรุ่งนภา)
หมายเหตุ : ค่าลงทะเบียน 15000 บาท, สวัสดิการ มี อาหารเที่ยง, เบรคเช้า-บ่าย, เสื้อ GROWER RMUTI TEAM 1 ตัว, ห้องพัก 4 คืน
ประกาศอบรมกัญชา เทคโนโลยีเพื่อการปลูกพืชกัญชาให้มีคุณภาพสูง ภาคปฏิบัติ รุ่นที่ 2 เสาร์ที่ 2 ก.ค.65
อบรมกัญชา “เทคโนโลยีเพื่อการปลูกพืชกัญชาให้มีคุณภาพสูง ภาคปฏิบัติ รุ่นที่ 2”
วันเสาร์ที่ 2 กรกฎาคม พศ.2565
สถานที่ : ศูนย์การเรียนรู้เกษตรดิจิทัล วิถีคนเมืองD Farm (ระหว่างซอยรามคำแหง150 - 148)
เพิ่มหัวข้อ “การเพิ่มผลผลิตและประสิทธิภาพสูงสุดจากความหนาแน่นของต้นกัญชา” อีก 30 นาที
เนื้อหาการอบรม :
https://shorturl.at/kKLOZหรือติดต่อ คุณอรรถพล(บูม) 097-169-0508
คอร์สอบรม ก้าวสู่เส้นทางสายเขียว รุ่นที่ 4 กับนางฟ้ากัญชา 23 ก.ค.65
คอร์สอบรม ก้าวสู่เส้นทางสายเขียว รุ่นที่ 4 กับนางฟ้ากัญชา
อบรมเสาร์ที่ 23 กรกฎาคม 2565 เวลา 9-17 น. @แคนนาบิซเวย์ วัลเล่ย์ @Cannabiz Way Valley อ.วิหารแดง สระบุรี ค่าอบรม 6,000 บาท
เมืองกัญชาในม่านหมอก ชุดเช็คอินแห่งใหม่ในสระบุรี เรียนรุ่นนี้ แถมได้ตัดดอกด้วยกับรุ่นที่ 3 ได้ชิมผลิตภัณฑ์ทั้งเครื่องดื่มร้อน-เย็นกัญ อาหารอร่อยครบทุกแบบหลากสไตล์ เดิมชมสวนกัญที่สมบูรณ์ที่สุดและใหญ่ที่สุด ในเอเชียตะวันออกเฉียงใต้ อิ่ม อร่อย ได้ความรู้สู่สายเขียวแบบจัดเต็ม
คอร์สเพิ่มโอกาสทางธุรกิจ กัญชา กัญชง (หลักสูตรการออกแบบแผนธุรกิจ) คอร์สอบรม 1 วัน 23 ก.ค.65
คอร์สอบรม 1 วัน ผู้เข้าอบรมจะได้เรียนรู้สิ่งเหล่านี้อย่างใกล้ชิด
- การลงทะเบียนปลูกในแอพและเว็บไซต์
- ทำความรู้จักเรื่อง
-การนำผลผลิตมาต่อยอดธุรกิจ
-การเดินเส้นทางธุรกิจให้ประสบความสำเร็จ
-วิธีการเพาะปลูก,การดูแล ,ออกแบบระบบสมาร์ฟาร์ม Iot ,ระบบการให้น้ำ
-เยี่ยมชมแปลงเพาะปลูกจริง
- Workshop เรียนรู้การผสมดินเพาะปลูก (ปฏิบัติจริง)
- Workshop สอนทำแผนธุรกิจให้ประสบการณ์ความสำเร็จ (ปฏิบัติจริง)
เรียนรู้แบบใกล้ชิดกับฟาร์มจริง โดยผู้เชี่ยวชาญ พร้อมชิมเมนูเด็ดจากส่วนผสมของ จิบน้ำชาใบกัญชาหอมๆ
วันที่ 23 กรกฎาคม 2565 ( ระยะเวลาอบรม 1 วัน) ราคา 3,900 บาท
‼️ลงทะเบียนวันนี้รับฟรี‼️ **ต้นกัญชาสายพันธุ์ หางกระรอกภูพาน พร้อมอุปกรณ์การปลูก จำนวน 2 ต้น มูลค่า 600 บาท
จัดขึ้นโดย Triple Food Innovation Co.,Ltd. สถานที่จัดอบรม : ณ ศูนย์การเรียนรู้ตามศาสตร์พระราชา มหาวิทยาลัยเทคโนโลยีราชมงคลสุวรรณภูมิ ศูนย์สุพรรณบุรี เขต 2
เบอร์โทร : 082-3728439,063-5599694
อบรมการพัฒนาธุรกิจด้านอาหารกัญชาเลิศรส รุ่นที่ 2 มทร.อีสาน วิทยาเขตสกลนคร 1 ก.ค.65
อบรมการพัฒนาศักยภาพผู้ประกอบการต่อยอด ธุรกิจด้านอาหารกัญชาเลิศรส รุ่นที่2
ในวันศุกร์ที่ 1 กรกฎาคม 2565
ณ ห้องภูเม่าหลวง คณะทรัพยากรธรรมชาติ มทร.อีสาน วิทยาเขตสกลนคร
ค่าอบรมเพียงท่านละ 2,000 บาท‼️‼️
ลงทะเบียนโดยการสแกนคิวอาร์โค้ดหรือสมัครผ่านลิงค์: https://forms.gle/rnziq9As83eKo5MN8
ติดต่อสอบถามเพิ่มเติม : 088-6019080 คุณเนตรนภา
Rayong Fun on the Beach 1-3 ก.ค.65 หาดแหลมเจริญ ระยอง
Rayong Fun on the Beach 1-3 กรกฎาคมนี้ 16.00 – 22.00 น. หาดแหลมเจริญ ระยอง
ศิลปินดัง 3 วันรวด
1 กรกฎาคม - ตี๋ AF | Vitamin D from The Sun | Season Five
2 กรกฎาคม – Musketeers | หนิง The Voice
3 กรกฎาคม – โคตรยิ้ม | KRUNGCHON
จัดเต็มกิจกรรมสุดฟิน ให้ได้ชิลตลอดทั้งงาน เอาใจสายกิน สายโซเชียลโดยเฉพาะ!! ร้านค้า ร้านอาหาร ขบวนรถ Foodtruck บุฟเฟต์ผลไม้ จุดถ่ายรูปอลังการ
Coffee Crawl มาจิบกาแฟ พูดคุย ริมน้ำจันทบูร 10 ก.ค.65 LINK
สายกาแฟห้ามพลาด!!! กับกิจกรรม Coffee Crawl มาจิบกาแฟ พูดคุย แลกเปลี่ยนข้อมูลด้านกาแฟกัน ในเช้าวันอาทิตย์ ที่ 10 ก.ค.65 เวลา : 08:30-12:00 น.
สถานที่จัดงาน ตรงข้ามร้าน Wacko, ชุมชนริมน้ำจันทบูร
Project ทดลองจัดการและชุบชีวิตพื้นที่รกร้าง ให้กลับมามีชีวิตชีวา ด้วยความหลากหลายของกิจกรรม โดยตลอดระยะเวลา 6 เดือน (กรกฎาคม จนถึง ธันวาคม พ.ศ. 2565) พื้นที่แห่งนี้จะถูกจัดสรรกิจกรรม อาทิ วงเสวนากาแฟ, งานดนตรีขนาดย่อม, Popup Market หรือจัดฉายภาพยนตร์ เป็นต้น
ฟังดนตรีทั่วกรุงเทพ เดือน ก.ค.65
งาน ลอยเล แลเล เขรถ
งาน ลอยเล แลเล เขรถ 9 กรกฏาคม 2565 ณ ชายหาด หมู่ที่ 5 ตำบล กระดังงา อำเภอ สทิงพระ จังหวัดสงขลา
ยะลา มาราธอน ครั้งที่ 3 วันที่ 30 ก.ค.66 LINK
กลับมาอีกครั้ง “ยะลา มาราธอน ครั้งที่ 3” ปี 2566 ในวันที่ 30 กรกฎาคม 2566 ณ สนามโรงพิธีช้างเผือก เทศบาลนครยะลา จังหวัดยะลา . ซึ่งจะเปิดรับสมัครรอบ Early Bird ในวันที่ 23 มีนาคม - 2 เมษายน 2566 นี้ :: ออนไลน์ : www.yalamarathon.com :: สมัครด้วยตนเอง : เทศบาลนครยะลา เวลา 08:30 - 16:00 น.
อีเล้งเค้งโค้งล้อลมปราณ งานวิ่งระดมทุนทำหนังสือนิทาน 23 ก.ค.66 LINK
อีเล้งเค้งโค้งล้อลมปราณ 1-7 เมษายน 2566 กิจกรรมงานวิ่งเส้นทางเลียบทะเลยาว ผ่านตาลสามต้น (ไมอามี่เมืองไทย) สัมผัสบรรยากาศยามเช้า ชมพระอาทิตย์ขึ้น ในงานมีกิจกรรม Family Rally ระยะ 2.5 KM เหมาะสำหรับการพาครอบครัวมาวิ่ง มาพักผ่อน รายได้หลังหักค่าใช้จ่ายเป็นทุนในการจัดทำหนังสือนิทาน อีเล้งเค้งโค้งวันดีดีประจวบคีรีขันธ์ และ สมทบทุนการจัดงานการแข่งขันทักษะวิชาการและประกวดสิ่งประดิษฐ์นักเรียนโรงเรียนเอกชนในปี พ.ศ.2567
อีเล้งเค้งโค้งล้อลมปราณ 23 กรกฏาคม 2566
อีเล้งเค้งโค้งล้อลมปราณ 23 กรกฏาคม 2566 กิจกรรมงานวิ่งเส้นทางเลียบทะเลยาว ผ่านตาลสามต้น (ไมอามี่เมืองไทย) สัมผัสบรรยากาศยามเช้า ชมพระอาทิตย์ขึ้น ในงานมีกิจกรรม Family Rally ระยะ 2.5 KM เหมาะสำหรับการพาครอบครัวมาวิ่ง มาพักผ่อน รายได้หลังหักค่าใช้จ่ายเป็นทุนในการจัดทำหนังสือนิทาน อีเล้งเค้งโค้งวันดีดีประจวบคีรีขันธ์ และ สมทบทุนการจัดงานการแข่งขันทักษะวิชาการและประกวดสิ่งประดิษฐ์นักเรียนโรงเรียนเอกชนในปี พ.ศ.2567
สะแกกรัง มาราธอน 2023 วันที่ 9 ก.ค.66 LINK
จังหวัดอุทัยธานี เทศบาลเมืองอุทัยธานี ชมรมวิ่งเมืองพระชนกจักรี ร่วมกับการท่องเที่ยวแห่งประเทศไทย สำนักงานอุทัยธานี และสำนักงานการกีฬาแห่งประเทศไทย จังหวัดอุทัยธานี จัดงานวิ่ง "สะแกกรัง มาราธอน 2023" ในวันที่ 9 กรกฎาคม 2566 ณ สวนน้ำเฉลิมพระเกียรติ บึงพระชนก เพื่อส่งเสริมการออกกำลังกาย การแข่งขันกีฬา และการท่องเที่ยวในจังหวัดอุทัยธานี
เปิดรับสมัคร แบ่งเป็น 4 ระยะ คือ
• มาราธอน ระยะทาง 42.195 กม.
• ฮาล์ฟ มาราธอน ระยะทาง 21.1 กม.
• ซูเปอร์มินิมาราธอน ระยะทาง 12.5 กม.
• ฟันรัน ระยะทาง 5 กม.
นักวิ่งที่สมัครแต่ละระยะจะได้รับเสื้อแข่งขัน เมื่อวิ่งเข้าเส้นชัยจะได้รับเหรียญที่ระลึก ระยะฮาล์ฟมาราธอนและฟูลมาราธอน วิ่งจบในเวลาจะได้รับเสื้อฟินิชเชอร์อีก 1 ตัว
Suk-Kho Run วิ่งสุขโข Sukhothai 2023 - 30 ก.ค.66 LINK
SUK-KHO RUN >>> วิ่งสุขโข RACE DAY : 30 ก.ค.66 อุทยานประวัติศาสตร์สุโขทัย จังหวัดสุโขทัย วิ่งระยะไหน⁉️...ก็ไม่เท่า "วิ่งระยะทำใจ" . ▪️ FUN RUN 5 KM ▪️ MINI MARATHON 11 KM ▪️ HALF MARATHON 21.5 KM . ได้รับ : BIB / CHIP TIMING / เสื้อ / เหรียญ / ผ้าBUFF / อาหาร&เครื่องดื่ม พร้อมถุงผ้า FINISHER BAG สำหรับนักวิ่งที่เข้าเส้นชัย ทุกระยะได้รับผ้า BUFF . ถ้วยรางวัล อันดับ 1-5 ของแต่ละรุ่นอายุ อายุไม่เกิน 29 ปี อายุ 30-39 ปี อายุ 40-49 ปี อายุ 50-59 ปี อายุ 60 ปี ขึ้นไป "วิ่งออกกำลังกาย ปังท่องเที่ยว กินเตี๋ยว โข่ทัย" มาร่วมวิ่งรับอรุณรุ่ง ค้นพบความความสุขยามรุ่งอรุณที่สุโขทัย ลงวิ่งระยะไหนก็สุขใจได้เท่ากัน... . ❤️รายได้ทั้งหมดสนับสนุนสมาคมกีฬาแห่งจังหวัดสุโขทัย
บุรีรัน 2023 ครั้งที่ 1 สนามที่ 3 วันที่ 23 ก.ค.66 LINK
บุรีรัน 2023 ครั้งที่ 1 สนามที่ 3 ❤️ สาริกาบุรี นครนายก เมืองแห่งความอร่อย พบกัน : วันที่ 23 กรกฎาคม 2566 สาริกาบุรี นครนายก เมืองแห่งความอร่อย
✅ เสื้อสวย ใส่สบาย ✅ สถานที่สวย ✅ เส้นทางธรรมชาติ บรรยากาศดี ✅ เส้นทางนักวิ่งสวย และปลอดภัย
ประเภทการแข่งขัน (ชาย-หญิง) - รุ่นอายุต่ำกว่า 18 ปี / รุ่นอายุ 18-29 ปี / รุ่นอายุ 30-39 ปี / รุ่นอายุ 40-49 ปี / รุ่นอายุ 50-59 ปี /
รุ่นอายุ 60 ปีขึ้นไป
Bangkok Double Bridge Run 2023 วิ่ง 3 สะพานข้ามแม่น้ำเจ้าพระยา 16 ก.ค.66 LINK
Bangkok Double Bridge Run 2023 ชวนคุณมา วิ่ง 3 สะพาน ข้ามแม่น้ำเจ้าพระยา ครั้งแรกของเมืองไทย สะพานพระราม 8 สะพานกรุงธน และสะพานสมเด็จพระปิ่นเกล้า เป็นเส้นทางวิ่งที่จะพาคุณไปพบกับความหลากหลายของวิถีเมือง มาร่วมสัมผัสวิถีชุมชนร่วมสมัยสองฟากฝั่งแม่น้ำเจ้าพระยาไปด้วยกัน วันอาทิตย์ที่ 16 กรกฎาคม นี้ ห้ามพลาด!! จัดโดย : Inspire Runner
รายได้เพื่อบูรณะวัด และพัฒนาชุมชนโดยรอบ วัดบวรมงคลราชวรวิหาร
ประเภทการสมัคร
Super Mini Marathon 12.7 KM เวลาปล่อยตัวนักวิ่ง 04.45 น.
Fun Run 5 KM เวลาปล่อยตัวนักวิ่ง 05.00 น.
Cut off : 06.45 น. เส้นชัยบนสะพาน พระราม 8
WARRIX Thailand Earth Trail 4 สนาม 22-23 ก.ค.66 LINK
WARRIX PRESENTED THAILAND EARTH TRAIL SERIES 2023 (TETS2023) (ไทยแลนด์ เอิร์ธ เทรล)
Thailand Earth Trail - วิ่งเทรลวิถีใหม่ ใส่ใจสิ่งแวดล้อม พร้อมให้คุณมาสัมผัสแล้วในปี 2023 นี้ 4 สนาม
Thailand Earth Trail@Saraburi ลานรักแคมป์ ต.ชะอม อ.แก่งคอย จ. สระบุรี 22-23 กรกฎาคม 2566 ระยะการแข่งขัน 40k/ 15k/ 8k
Thailand Earth Trail @Rayong
Thailand Earth Trail@Chaiyaphum
Thailand Earth Trail@Suphanburi
HUAHIN BEACH LIFE 2023 จัดขึ้นในวันที่ 21-23 กรกฎาคม 2566 LINK
“HUAHIN BEACH LIFE 2023” จัดขึ้นในวันที่ 21-23 กรกฎาคม 2566 ณ ริมหาดหัวดอน เขาตะเกียบ จังหวัดประจวบคีรีขันธ์ ส่งท้ายความสุขที่หัวหิน เอาใจสาย HIPSTER ชวนมาสนุกไปกับแอคทิวิตี้บนชายหาดจาก SUP CLINIC พร้อมเพลิดเพลินไปกับคอนเสิร์ตริมชายหาดจาก THE TOYS / VIOLETTE WAUTIER / ZOM MARIE / MUSKETEERS / WHAL & DOLPH / LOSERPOP รวมถึงศิลปินและดีเจอีกมากมาย
มหกรรมทุเรียนเขาจ้าว ของดีปราณบุรี ครั้งที่ 6 วันที่ 14-23 ก.ค.66
มหกรรมทุเรียนเขาจ้าว ของดีปราณบุรี ครั้งที่ 6 วันที่ 14-23 ก.ค.66
ณ ศูนย์ราชการ หน้าอำเภอปราณบุรี ประจวบคีรีขันธ์ จัดโดยอำเภอปราณบุรี และชมรมส่งเสริมสินค้าไทย
ข้าวขวัญกัญชาศาสตร์ เปิดอบรมกัญชาศาสตร์ รุ่นหมอเทวดา 22 กรกฎาคม 2566
ข้าวขวัญกัญชาศาสตร์ เปิดอบรมกัญชาศาสตร์ รุ่นหมอเทวดา หลักสูตรวิทยาทาน 1 วัน เพื่อผู้ป่วยรักษาตนเอง และผู้เยียวยา หมอจำเป็น อบรบกับหมอเดชา ศิริภัทร วันเสาร์ที่ 22 กรกฎาคม 2566 เวลา 8.00-17.00 น. สถานที่ มูลนิธิข้าวขวัญ จ.สุพรรณบุรี รับจำนวนจำกัด ค่าอบรม 700 บาท รวมอาหาร/เครื่้องดื่มมื้อกลางวัน พระภิกษุ/ผู้นำศาสนา อบรม ฟรี ติดต่อสอบถามโทร. 062-4988383 รายได้การอบรมหลังหักค่าใช้จ่าย สมทบทุนทำยาเพื่อผู้ป่วยยากไร้
4-7 กรกฎาคม 66 หน่วยสัตวแพทย์เคลื่อนที่ สำนักอนามัย กทม.
ตารางหน่วยเคลื่อนที่ ทุกที่เวลา 9.00-12.00 น.
4 ก.ค. 66 - วัดไผ่ตัน (ลงทะเบียนหน้างาน) และ วัดสุทธิสะอาด คลองสามวา
5 ก.ค. 66 - หมู่บ้านศรีนครพัฒนา บึงกุ่ม
6 ก.ค. 66 - ชุมชนปรีชา 1 ยานนาวา และ ชุมชนพัฒนาริมคลองบ้านป่า สวนหลวง
7 ก.ค. 66 - ชุมชนพัชราภา หลักสี่
ประจำเดือน กรกฎาคม 2566
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กรกฎาคม 2566 ทุกจุด เวลาออกหน่วยบริการ 8.30 - 11.00 น.
- 3 ก.ค. ซอยไก่ต๊อก เทศบาลต.หนองไม้แดง อ.เมืองชลบุรี
- 6 ก.ค. ตลาดนัดซอย 9 เทศบาลเมืองบ้านสวน อ.เมืองชลบุรี
- 13 ก.ค. ที่ทำการชุมชนบ้านห้วยทวน เทศบาลบ้านสวน
- 14 ก.ค. วัดหนองขาม เทศบาลเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- 19 ก.ค. หมู่บ้านภูสิริ เทศบาลหนองไม้แดง อ.เมืองชลบุรี
- 20 ก.ค. โดมเทศบาลบ้านสวน เทศบาลเมืองบ้านสวน อ.เมืองชลบุรี
- 21 ก.ค. ซอยสมานดำริ เทศบาลหนองไม้แดง อ.เมืองชลบุรี
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
ตารางการให้บริการเดือนกรกฎาคม 2566
ตรวจคัดกรองสุขภาพปอด โดยรถเอกซเรย์เคลื่อนที่ เปิดรับลงทะเบียนหน้างาน สำหรับผู้ที่มีอายุ 15 ปีขึ้นไป จำกัดจำนวนไม่เกิน 150 คน/แห่ง
4 ก.ค. 66 เทศบาลตำบลช้างเผือก เชียงใหม่ ทำหมันหมาแมว
กองสาธารณสุขและสิ่งแวดล้อม เชิญชวนเจ้าของสัตว์เลี้ยง ลงทะเบียนทำหมันสุนัขและแมว วันทำหมัน 4 กรกฎาคม 2566 เวลา 08.00 น. เป็นต้นไป ณ สำนักงานปศุสัตว์เขต 5 ตรงข้ามสวนสัตว์เชียงใหม่ ลงทะเบียนตั้งแต่บัดนี้ - 30 มิถุนายน 2566 เวลา 16.00 น.
โทรลงทะเบียนล่วงหน้า / สอบถามรายละเอียดเพิ่มเติม กองสาธารณสุขและสิ่งแวดล้อม 053-217923 ต่อ 20
คำแนะนำ : อายุที่เหมาะสมแก่การทำหมันคือ 8- 10 เดือน สำหรับสุนัข และ 6-8 เดือน สำหรับแมว เพื่อให้ระบบสืบพันธุ์มีการพัฒนาเต็มที่แล้ว • สัตว์เลี้ยงควรมีสุขภาพดี แข็งแรง ไม่เจ็บป่วยก่อนทำหมัน • งดอาหารและน้ำ อย่างน้อย 8-12 ช.ม. ก่อนผ่าตัด (งดอาหารมื้อเย็นตั้งแต่วันจันทร์ที่ 3 ก.ค.2566 นะคะ)
10 ก.ค. 66 เทศบาลตำบลคำพราน อ.วังม่วง สระบุรี เชิญเจ้าของสัตว์เลี้ยง ลงทะเบียนทำหมันสุนัขและแมว
เทศบาลตำบลคำพราน อ.วังม่วง จ.สระบุรี ขอเชิญเจ้าของสัตว์เลี้ยง ลงทะเบียนทำหมันสุนัขและแมว วันที่ 10 กรกฎาคม 2566 เวลา 08.30 - 16.30 น. ณ อาคารอเนกประสงค์ (โดม) เทศบาลตำบลคำพราน เจ้าของสัตว์เลี้ยง สามารถลงทะเบียนได้ที่ เทศบาลตำบลคำพราน หรือ อสม.ในเขตพื้นที่ของท่าน ภายในวันนี้ - 7 กรกฎาคม 2566 หากไม่สะดวกลงทะเบียน สามารถเตรียมสุนัขและแมว เข้ารับบริการได้ ในวันที่ 10 กรกฎาคม 2566
** นำบัตรประชาชนของเจ้าของสุนัขและแมว มายื่นในการดำเนินการ
13 ก.ค.66 วัดวชิรธรรมสาธิต ทำหมันหมาแมว ฟรี งานมหกรรมสุขภาพสัญจร
สำนักงานเขตพระโขนงเชิญชวนร่วมกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 13 กรกฎาคม 2566 เวลา 08.00 - 14.00 น. ณ วัดวชิรธรรมสาธิตวรวิหาร เขตพระโขนง โดยในงานมีกิจกรรมมากมาย
- ชวนเช็คเบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอกซเรย์ปอด ตรวจฟัน (ุอุด ขุด ถอน) สุขภาพใจ คุยกกับนักจิตวิทยา
- ชวนรู้ กินเป็น เน้นสุขภาพ ยาเสพติด ไข้เลือดออก รู้ทันผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ปลอดภัยจากฝุ่นจิ๋ว PM2.5 ดูแลคนป่วยที่บ้าน สื่อน่ารู้
- ชวนช็อป สินค้าโอทอป สินค้าชุมชน
- บริการน้องหมาแมว ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป (น้องหมา)
- แจกแว่นสายตายาว
ไทยเที่ยวไทย กินเที่ยวป่าละอู 21-30 กรกฎาคม 2566
ขอเชิญเที่ยวงาน ไทยเที่ยวไทย กินเที่ยวป่าละอู 21-30 กรกฎาคม 2566 ณ บริเวณหน้าด่านศูนย์โอทอปห้วยสัตว์ใหญ่ ตำบลห้วยสัตว์ใหญ่ อำเภอหัวหิน จังหวัดประจวบคีรีขันธ์
ปฏิทินเที่ยวประจวบ เดือนกรกฎาคม 66
เทศกาลอะโวคาโด-กาแฟ เขาค้อ ประจำปี 2566
เทศกาลอะโวคาโด-กาแฟ เขาค้อ ประจำปี 2566 วันที่ 21-23 กรกฎาคม 2566 ณ จุดชมวิว อำเภอเขาค้อ จังหวัดเพชรบูรณ์ เชิญจิบแฟ แลเขา กับเรา ที่เขาค้อ พบกับการรวมตัวของร้านกาแฟชื่อดังเขาค้อ ✅ ชิม ช้อป ชม อะโวคาโด ✅ การประกวดสุดยอดอะโวคาโด ✅ นิทรรศการวิชาการ ✅ งานออกร้านมหกรรมสินค้าเกษตร และสินค้าOTOP
Doi Licious ชิม ชม ชิลด์ ฟินบนดอย
Doi Licious ชิม ชม ชิลด์ ฟินบนดอย ไปกับตลาดไทภูเขา ในคอนเซ็ป “เยือนเย้าที่เขาค้อ”
วันเสาร์ที่ 8 กรกฎาคม 2566 เวลา 13.00-20.00 น. เปิดประสบการณ์ ชิมอาหารชนเผ่าประยุกต์ร่วมสมัยที่เหล่าชาวดอยยกทัพมานำเสนอหลากหลายเมนู ชม การแสดงชนเผ่าลีซอจากบ้านเพชรดำ ( เต้นจะคึ) เผ่าม้งจากทับเบิกและเข็กน้อย (วิถีชีวิตสาวชาวดอย) เผ่าถิ่นจากบ้านนาสะอุ้ง (รำไทดำ) เพลิดเพลิน เดินชิลด์ กับตลาดอาหารวิถีชนเผ่าท่ามกลางบรรยากาศธรรมชาติสุดฟิน
นมัสการเขาปู่ กราบรอยพระพุทธบาท เปลี่ยนผ้ารอบเจดีย์ 31 กรกฎาคม 2566
นมัสการเขาปู่ กราบรอยพระพุทธบาท เปลี่ยนผ้ารอบเจดีย์ ความยาว 319 เมตร #ในวันที่ 31 กรกฎาคม พ.ศ. 2566 เวลา 08.39 น.
เขาปู่ ตั้งอยู่ในเขตป่าชุมชน ในพื้นที่หมู่ 7 บ้านวังไทรทองเหนือ และหมู่ 1 บ้านวังไทรทองใต้ ต.ซับเปิบ อ.วังโป่ง จ.เพชรบูรณ์ ระยะทางกว่า 2.5 กิโลเมตร มีความสูงจากระดับน้ำทะเลประมาณ 700 เมตร ระหว่างทางมีรอยพระพุทธบาทเพื่อให้พุทธศาสนิกชนได้กราบไหว้ และเมื่อถึงยอดเขาปู่จะพบองค์เจดีย์ โดยมีการนำพระผงสมเด็จวัดปากน้ำ สมเด็จวัดระฆัง จำนวนกว่า 20,000 องค์ มาประดับรอบองค์เจดีย์ มีขนาดความสูง วัดจากฐานถึงยอด ราว 8 เมตร เส้นผ่านศูนย์กลาง 5 เมตร
พระเจดีย์องค์นี้ชาวบ้านได้ร่วมแรงร่วมใจสร้างขึ้น เพื่อให้เป็นที่ยึดเหนี่ยวจิตใจ และใช้สำหรับประกอบพิธีสำคัญทางพระพุทธศาสนา อีกทั้งชาวบ้านในพื้นที่ยังมีความเชื่อว่าสถานที่ศักดิ์สิทธิ์บนยอดเขาปู่แห่งนี้จะปกปักรักษาผืนป่า และเป็นร่มโพธิ์ร่มไทรของชาววังโป่งมาแต่โบราณ
อิ่มบุญ สุขใจ นุ่งผ้าไทย ใส่บาตร 21 กรกฎาคม 66
สำนักงานวัฒนธรรมจังหวัดเพชรบูรณ์ ขอประชาสัมพันธ์ชวนเชิญใส่ผ้าไทย ผ้าพื้นเมือง ร่วมพิธีทำบุญตักบาตรข้าวสารอาหารแห้ง ในโครงการเข้าวัดปฏิบัติธรรมจังหวัดเพชรบูรณ์ ประจำปีงบประมาณ พ.ศ. ๒๕๖๖ “อิ่มบุญ สุขใจ นุ่งผ้าไทย ใส่บาตร” วันศุกร์ที่ ๒๑ กรกฎาคม ๒๕๖๖ พร้อมกันเวลา ๐๖.๔๐ น. ทุกวันศุกร์ที่ ๓ ของทุกเดือนณ บริเวณลานพระมหาธาตุ วัดมหาธาตุ พระอารามหลวง อำเภอเมืองเพชรบูรณ์ จังหวัดเพชรบูรณ์ เชิญใส่ผ้าไทยทำบุญตักบาตร ตักบาตรข้าวสารอาหารแห้ง รณรงค์ใช้วัสดุเป็นมิตรกับสิ่งแวดล้อม เช่น ตะกร้า ถุงผ้า ลดใช้ถุงพลาสติกและโฟม ข้าวสารอาหารแห้งจากการใส่บาตรส่วนหนึ่งจะนำมาเป็น “ถุงบุญ” เพื่อช่วยเหลือพี่น้องประชาชนกลุ่มเปราะบางในจังหวัดเพชรบูรณ์
แทมมารีน มาร์เก็ต เปิดพิเศษ 5 วัน รับหยุดยาว 28 กค - 1 สค 66
วันหยุดยาวแบบนี้ จัดเต็มคาราเบล แทมมารีน มาร์เก็ต เปิดพิเศษ 5 วัน 28-29-30-31 July + 1 Aug (ศุกร์ เสาร์ อาทิตย์ จันทร์ อังคาร)
กิจกรรม นั่งรถราง แอ่วแวดเวียงเชียงราย (Chiangrai Destination) LINK
ททท. สำนักงานเชียงราย ร่วมกับ เทศบาลนครเชียงราย กระตุ้นการท่องเที่ยว กับกิจกรรม แอ่วแวดเวียงเชียงราย (Chiangrai Destination)
นั่งรถรางชมถนนสายวัฒนธรรมพร้อมคาเฟ่ ที่กิน ที่พัก สุดฟินอินเชียงราย พร้อมสแกน QR Code สะสมแต้มแลกของรางวัลสุดชิค
ตั้งแต่วันที่ 21 กรกฎาคม จนถึง 15 กันยายน 2566 นี้
ณ ศูนย์บริการข้อมูลการท่องเที่ยวเทศบาลนครเชียงราย หลังอนุสาวรีย์พ่อขุนเม็งรายฯ
สอบถามรายละเอียดเพิ่มเติม
- งานพัฒนาและส่งเสริมการท่องเที่ยว ฝ่ายอำนวยการ สำนักปลัดเทศบาลนครเชียงราย โทร. 053-715952 ต่อ 105
- ททท. สำนักงานเชียงราย โทร. 053-717433
มหกรรมกีฬาและวัฒนธรรมชาติพันธุ์จังหวัดเชียงราย 2566
อบจ.เชียงราย เชิญร่วมชม ร่วมเชียร์ “มหกรรมกีฬาและวัฒนธรรมชาติพันธุ์จังหวัดเชียงราย” ประจำปี 2566 ระหว่างวันที่ 29 – 30 กรกฎาคม 2566 ณ สนามกีฬากลางจังหวัดเชียงราย อ.เมือง
1 ปีมีครั้งเดียว‼️ ร่วมเชียร์กีฬาสากล 5 ชนิด และกีฬาพื้นบ้าน 11 ชนิด พร้อมร่วมชมการประกวดขบวนพาเหรดชาติพันธุ์
แข่งขัน รายการ FMSCT Thailand MotoCross 2023 สนาม 8-9 สนามสิงห์ปาร์ค จ.เชียงราย
การแข่งขัน รายการ FMSCT Thailand MotoCross 2023 สนาม 8-9 (เพื่อประโยชน์ของท่านเอง โปรดอ่านอย่างรอบคอบและครบถ้วน) วันที่ 29-30 กรกฎาคม ณ สิงห์ปาร์ค จ.เชียงราย พิกัดสนามสิงห์ปาร์ค จ.เชียงราย
Introduction for Cafe Business & Coffee Recipe @Boncafe Thailand LINK
เวิร์คช้อปที่จะช่วยให้คณได้เตรียมตัวก่อนลงทุนเปิดร้านกาแฟ หัวข้อการเรียนรู้ Introduction for Cafe Business & Coffee Recipe เจาะลึกความรู้เกี่ยวกับกาแฟ เครื่องทำกาแฟ รวมถึงการสกัดกาแฟ ทั้งแบบ Old School & New School รวมถึงสูตรการชงกาแฟเบื้องต้น สอนโดยทีมเทรนเนอร์มืออาชีพ จาก Boncafe Academy วันที่: 5 สิงหาคม 2566 เวลา 09.00 - 15.30 น. รับจำกัดเพียง 15 ท่าน เท่านั้น เพียงท่านละ 500.- (รวมVAT) สถานที่ Boncafe (Thailand) Showroom Bangkok
Home Brewing Essentials Workshop by CoffeeWORKS 2,800 บาท/ท่าน (24 ก.ค. 2566) LINK
เวิร์คช็อปดริปกาแฟที่จะทำให้กาแฟของคุณเป็นอย่างที่ต้องการ สำหรับผู้ที่ไม่มีพื้นฐาน ผู้เริ่มต้นดริปกาแฟ ผู้ที่ต้องการความรู้เพิ่มเติมสำหรับการชงเองที่บ้าน หรือผู้ที่ยังหารสชาติกาแฟของตัวเองไม่เจอ ในคลาสนี้ผู้เรียนจะได้เรียนทั้งทฤษฏีและลงมือปฏิบัติจริง
- ความรู้พื้นฐานเกี่ยวกับการดริปกาแฟ
- ปัจจัยที่มีผลต่อรสชาติกาแฟ
- ประเภทของ Dripper
- การสกัดกาแฟโดยใช้ประสาทสัมผัส
- การสกัดกาแฟโดยตัดปัจจัยทางด้านเวลาและเครื่องชั่ง
- การปรับการดริปกาแฟให้ได้ตามที่ต้องการ
หากมีอุปกรณ์สามารถนำอุปกรณ์มาเข้าร่วมคลาสได้
**รับเพียง 4 ท่าน เท่านั้น**
24 ก.ค. 2566 เวลา 10.00 - 16.00 น.
CoffeeWORKS Bangkok Experience Center (ซอยสุขุมวิท 26)
ค่าใช้จ่าย 2,800 บาท/ท่าน
*รวมค่าอาหารกลางวัน
*ผู้เรียนจะได้รับใบ certification จากทาง CoffeeWORKS
SCA sensory F&i 4 Day นครสวรรค์ 30 กค.- 2 สค.
SCA sensory F&i 4 Day นครสวรรค์ 30 กค.- 2 สค. เรียนรู้ Sensory การชิมกาแฟ ฝึกประเมิน ลง Score ฝึกให้Tastenote เข้าใจกาแฟ Specialty coffee เรียนรู้อย่างเป็นระบบ อย่างเป็นมาตราฐาน ได้ใบ Cert. จาก สมาคมกาแฟพิเศษยุโรปและอเมริกา Specialty Coffee Association สอนโดย Ast.Sucheera Khawatkun ผู้ที่มีประสบการณ์กรรมการในการตัดสินกาแฟทั้งไทย และ ต่างประเทศมาตลอดเวลาหลายปี เป็นทั้ง Q Arabica / Q Robusta เรียนรู้ รูปแบบฟอร์มการให้คะแนน ต่างๆ ทั้ง Sca Coe และฟอร์มอื่นๆ การใช้งาน วัตถุประสงค์ในการนำมาใช้ ชิมกาแฟดีๆ และแย่ๆแบบโหดร้าย หลากหลาย รับประกัน โลกกาแฟของคุณจะเปลี่ยนไป คุณจะชิมกาแฟได้สนุกขึ้น หรือไม่ก็เครียดไปเลย
ตารางบริการหน่วยทันตกรรมเคลื่อนที่ เดือนกรกฎาคม 66 LINK
4 ก.ค. 2566 รถทำหมันสัตว์เลี้ยง บริเวณจุดจอด : วัดไผ่ตัน เขตพญาไท 9.00-12.00 น. สำนักงานสัตวแพทย์ สาธารณสุข
5 ก.ค. 2566 รถทันตกรรม บริเวณจุดจอด : ชุมชนพัฒนาบ่อนไก่ (ถนนพระราม 4 หน้าธนาดารกรุงเทพ) 8.30-12.00 น. โทร. 02-2527776
5 ก.ค. 2566 รถดัดกรองมะเร็งสตรีเคลื่อนที่เชิงรุก บริเวณจุดจอด : ชุมชนนาดบำรุง เขตป้อมปราบ 9.00-12.00 น.โทร. 081-3750174(ทิพวัลย์)
18 ก.ค. 2566 รถทันตกรรม บริเวณจุดจอด : ชุนชนวัดปทุมวนาราม (หน้าโรงเรียนวัดปทุมวนาราม) 8.30-12.00 น. โทร. 02-2527776
25 ก.ค. 2566 รถคัดกรองมะเร็งสตรีเคลื่อนที่เชิงรุก บริเวณจุดจอด : ตึกสาทรธานี บางรัก 9.00-12.00 น. โทร. 062-5405345 (ณัฐนันท์)
CPHI South-East Asia 2023
งานจัดแสดงสินค้าและเทคโนโลยีอุตสาหกรรมยา CPHI South-East Asia 2023 สำรวจโซลูชันที่ล้ำสมัย ขยายเครือข่ายทางธุรกิจในตลาด สร้างความได้เปรียบในการแข่งขัน นี่คือช่วงเวลาของคุณในการคว้าโอกาสยกระดับธุรกิจของคุณเอง 12-14 กรกฎาคม 2566 (งานเลิก 17:00 น.) ฮอลล์ 1 - 3 ศูนย์การประชุมแห่งชาติสิริกิติ์
Thailand International Dog Show 2023 วันที่ 6-9 กรกฎาคม 2566 LINK
Thailand International Dog Show มหกรรมคนรักสุนัขอันดับ 1 ของเมืองไทย งานที่รวมสินค้าและบริการสำหรับสุนัขไว้อย่างครบครัน อาทิ อาหาร ผลิตภัณฑ์ดูแลสุนัข และบริการสำหรับสุนัขจากทั้งในและต่างประเทศ กว่า 200 ร้านค้า โดยใช้พื้นที่จัดแสดงงานทั้งสิ้นกว่า 10,000 ตารางเมตรบริเวณอาคาร 5 และ 6 ณ ศูนย์แสดงสินค้าและการประชุม อิมแพ็ค เมืองทองธานี
Thailand International Dog Show ได้เปิดโอกาสให้คุณได้สร้างเครือข่ายการขายสินค้า และบริการสำหรับสุนัขทั้งในประเทศไทยและในประเทศแถบ ASEAN งาน Thailand International Dog Show เป็นทางเลือกที่ดีที่สุดสำหรับร่วมแสดงสินค้าและบริการให้แก่คนรักสุนัขและในขณะเดียวกันสามารถเปิดโอกาสให้ลูกค้าได้ทำการติชมสินค้าและบริการเพื่อผู้ค้าขายสามารถนำคำติชมเหล่านั้นไปพัฒนาสินค้าและบริการให้ดียิ่งขึ้น
วันที่จัดแสดงงาน: 6-9 กรกฎาคม 2566 เวลา 10.00 – 20.00 น. อาคาร 5-6 ศูนย์แสดงสินค้าและการประชุม อิมแพ็ค เมืองทองธานี
ผู้จัดงาน
บริษัท อิมแพ็ค เอ็กซิบิชั่น แมเนจเม้นท์ จำกัด
สมาคมพัฒนาพันธุ์สุนัข (ประเทศไทย)
สมาคมอุตสาหกรรมผลิตภัณฑ์สัตว์เลี้ยงไทย
พุงกาง หางสวย at Pet ville by Central Eastville
พุงกาง หางสวย at Pet ville by Central Eastville ภายในงานมีเปิดตัวสินค้าใหม่ แบบฉ่ำ แบบสับ ของเล่นสัตว์เลี้ยงที่คนตามหามากที่สุด ที่นอนหมาที่คนอยากได้มากที่สุด 20-26 กรกฎาคม 2566
I Love Monster 29 ก.ค. 66
งาน Meeting ที่คนรักสัตว์เลื้อยคลานและ Exotic Pet พาเจ้าน้อนมารวมกัน พบกับกิจกรรมมากมาย แข่งงูยาว/กิ้งก่าใหญ่ แข่งวิ่งเต่าบกมินิมาราธอน และกิจกรรมแจกของรางวัลอีกมากมาย พบกับบูธอาหารเต่าบก Turtle Land จาก Pet2go และร้าน Exotic Pet รวมถึงอุปกรณ์สำหรับสัตว์เลี้ยงมากมาย พบกับเหล่า Exotic Pet Influencer คุณพิม ไอ้ต้าวงู้ยยย และน้องเดเมี่ยน White lipped Python, คุณซัน BalconZoo และคุณขาว กิ้งก่าเตกู
วันที่ 29 ก.ค. 66 เวลา 10:00 - 18:00 น. ที่ DOD Café&Bistro อ.สามพราน จ.นครปฐม
เทศบาลเมืองปู่เจ้าสมิงพราย บริการทำหมันและฉีดวัคซีน LINK
งานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม
เทศบาลเมืองปู่เจ้าสมิงพราย ร่วมกับปศุสัตว์จังหวัดสมุทรปราการ ให้บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมวในเขตเทศบาลฯ โดยไม่เสียค่าใช้จ่ายใด ๆ ทั้งสิ้น ในวัน เวลา และสถานที่ดังนี้
วันอังคารที่ 25 กรกฎาคม 2566
เวลา 09.00-12.00น. จุดบริการ วัดบางหญ้าแพรก
วันพฤหัสบดีที่ 31 สิงหาคม 2566
เวลา 09.00-12.00น. จุดบริการ อาคารเอนกประสงค์ 2 เทศบาลเมืองปู่เจ้าสมิงพราย
สำนักสาธารณสุขและสิ่งแวดล้อม โทรศัพท์ : 0-23639800 ต่อ 871
ศูนย์บริการสาธารณสุขฯ โทรศัพท์ : 0-21707990
จังหวัดสมุทรปราการ จัดกิจกรรมปศุสัตว์ร่วมใจ กำจัดภัยโรคพิษสุนัขบ้า
จังหวัดสมุทรปราการ จัดกิจกรรมปศุสัตว์ร่วมใจ กำจัดภัยโรคพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัดติยราชนารี เพื่อน้อมสำนึกในพระมหากรุณาธิคุณ เนื่องในวันคล้ายวันประสูติ
นายชัยพจน์ จรูญพงศ์ รองผู้ว่าราชการจังหวัดสมุทรปราการ เปิดโครงการปศุสัตว์ร่วมใจ กำจัดภัยโรคพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติฯ ภายใต้แผนยุทธศาสตร์การดำเนินโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธาน ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี ณ อาคารอเนกประสงค์ เทศบาลเมืองแพรกษา อำเภอเมืองสมุทรปราการ โดยมีประชาชนนำสุนัขและแมว มาทำหมัน พร้อมทั้งฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าเป็นจำนวนมาก
สำนักงานปศุสัตว์จังหวัดสมุทรปราการ ร่วมกับ เทศบาลเมืองแพรกษา และหน่วยงานที่เกี่ยวข้อง ได้บูรณาการร่วมกันจัดกิจกรรมปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติฯ ให้บริการคุมกำเนิดประชากรสุนัขและแมวโดยการผ่าตัดทำหมัน พร้อมทั้งฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
เร่งขับเคลื่อนการสร้างพื้นที่ปลอดโรคขององค์กรปกครองส่วนท้องถิ่นทั้ง 49 แห่ง ตามตัวชี้วัดทั้ง 5 ด้าน ได้แก่ สถานการณ์การเกิดโรคในคน สถานการณ์การเกิดโรคในสัตว์ การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การสำรวจสัตว์ และการควบคุมประชากรสัตว์ ภายในงานมีให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า การผ่าตัดทำหมัน การประชาสัมพันธ์ให้ความรู้เรื่องโรคพิษสุนัขบ้า และการส่งเสริมให้ประชาชนเลี้ยงสุนัข และแมวอย่างมีความรับผิดชอบ
ข่าวและภาพ
ประชาสัมพันธ์สมุทรปราการเทศบาลตำบลแหลมฟ้าผ่า ทำหมันคุมกำเนิดสัตว์จรจัด LINK
เทศบาลตำบลแหลมฟ้าผ่า โดยกองสาธารณสุขและสิ่งแวดล้อม แก้ไขปัญหาผลกระทบของประชาชนจากสัตว์จรจัดในเขตเทศบาลตำบลแหลมฟ้าผ่า ซึ่งเป็นปัญหาที่ถูกนำเสนอและเป็นปัญหาที่ประชาชนร้องเรียนกับทางเทศบาลอยู่บ่อยครั้ง เนื่องจากมีสัตว์จรจัดในเขตเทศบาลตำบลแหลมฟ้าผ่าอยู่เป็นจำนวนมาก เกิดจากการเลี้ยงที่ขาดความรับผิดชอบของเจ้าของสัตว์ เช่น สุนัขและแมว ทำให้มีจำนวนมากเกินไปจนถูกทอดทิ้งไม่ดูแล และเมื่อสัตว์ถูกทอดทิ้งก็จะมีคนเมตตาสงสารสัตว์เหล่านั้นได้นำอาหารมาให้ ทำให้สัตว์ดำรงชีวิตอยู่ได้และขยายพันธุ์เพิ่มมากขึ้น ทำให้เกิดผลกระทบตามมาคือความสกปรก อุบัติเหตุทางการจราจร และอาจเกิดโรคที่ร้ายแรง เช่น โรคพิษสุนัขบ้าได้ เทศบาลตำบลแหลมฟ้าผ่าได้ร่วมมือกับปศุสัตว์จังหวัดสมุทรปราการในการควบคุมและลดปริมาณสัตว์จรจัด ในส่วนของสุนัขและแมวโดยการผ่าตัดทำหมัน ซึ่งเป็นการคบคุมกำเนิดที่ได้ผลดี ลดการแพร่พันธุ์ของสัตว์จรจัดในเขตเทศบาลตำบลแหลมฟ้าผ่าให้ลดลงได้ นอกจากผ่าตัดทำหมันแล้ว ทางเทศบาลตำบลแหลมฟ้าผ่าก็ได้ออกฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมวในเขตเทศบาลตำบลแหลมฟ้าผ่า เพื่อป้องกันและลดสัตว์กลุ่มเสี่ยงของการแพร่ระบาดของโรคพิษสุนัขบ้า
สัตว์เลี้ยงที่ฉีดวัคซีนฯและทำประวัติแล้วจะได้รับป้ายแขวนคอเพื่อเป็นเครื่องยืนยันว่าได้รับวัคซีนเรียบร้อยแล้ว เทศบาลตำบลแหลมฟ้าผ่าขอความร่วมมือให้ผู้เลี้ยงสุนัขและแมว นำสุนัขและแมวไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า หากถูกสัตว์กัดหรือข่วนให้ไปพบแพทย์ เพราะโรคพิษสุนัขบ้าเป็นแล้วอาจเสียชีวิตได้ (19 กรกฎาคม 2566 )
เทศบาลตำบลด่านสำโรง จัดโครงการทำหมันสุนัขและแมว ประจำปี 2566
เทศบาลตำบลด่านสำโรง นายพิชัย สิทธินุกูลชัย รองนายกเทศมนตรีตำบลด่านสำโรง ดูแลความเรียบร้อย ในการทำหมันสุนัขและแมว ตามโครงการทำหมันสุนัขและแมวและสุ่มตรวจโรคพิษสุนัขบ้า ประจำปี 2566
17-18 ส.ค. 66 เทศกาลดนตรีวิถีเมือง นครปฐม
17-18 ส.ค. 66 พบกับเทศกาลดนตรีวิถีเมือง ร่วมสนับสนุน ร่วมขับเคลื่อน นครปฐมเมืองดนตรี สู่เครือข่ายเมืองสร้างสรรค์ของ UNESCO พบนิทรรศการ ร้านค้าของดีนครปฐม กิจกรรมฝึกอบรม และการแสดงดนตรี
17 ส.ค. 66 I hate Monday 17.00-18.00 น.
18 ส.ค. 66 KISSCODE 17.00-18.00 น.
11 ก.ค. 66 เทศบาลตำบลเกล็ดแก้ว สัตหีบ ให้บริการฉีดวัคซีน ทำหมันสุนัข/แมว ฟรี LINK
เทศบาลตำบลเกล็ดแก้ว โดยกองสาธารณสุขและสิ่งแวดล้อม ได้รับการประสานจากปศุสัตว์อำเภอสัตหีบ แจ้งดำเนินการจัดทำโครงการรณรงค์ป้องกันโรคพิษสุนัขบ้าและคุมกำเนิดสุนัข/แมว ตามโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธานศาสตราจารย์ ดร.สมเด็จพระเจ้าลูกเธอเจ้าฟ้าจุฬา ภรณวลัยลักษณ์อัครราชกุมารี ประจำปีงบประมาณ พ.ศ.2566
ปศุสัตว์อำเภอสัตหีบ ดำเนินกิจกรรมการออกหน่วยให้บริการ
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัข/แมว การตรวจรักษาโรคทั่วไป โรคมะเร็ง ในสุนัข/แมว
• กิจกรรมผ่าตัดทำหมันคุมกำเนิดสุนัข/แมว โดยไม่เสียค่าใช้จ่าย เป้าหมายสุนัข/แมว จำนวน 100 ตัว
ในวันอังคารที่ 11 กรกฎาคม 2566 เวลา 08.00 -11.00 น. ณ อุทยานประวัติศาสตร์เรือของพ่อ เรือ ต.91 บริเวณอ่าวดงตาลหน้าสมสรนายทหารสัญญาบัตร กองเรือยุทธการ อำเภอสัตหีบ จังหวัดชลบุรี
สำนักงานเทศบาลตำบลด่านสำโรง ทำหมันสุนัขแมว ประจำปี 2566 LINK
กำหนดการ โครงการทำหมันสุนัขและแมวและสุ่มตรวจโรคพิษสุนัขบ้า ประจำปี 2566 ระหว่างวันที่ 14 กรกฎาคม ถึง 21 กรกฎาคม 2566 เปิดรับลงทะเบียนในวันวันที่ 14 กรกฎาคม 2566 ณ โดมหน้าอาคารป้องกันเทศบาลตำบลด่านสำโรง ขอความกรุณามาตามคิวและวันเวลาตามนัด(ขอสงวนสิทธิไว้สำหรับผู้มาลงทะเบียนเท่านั้น)เนื่องจากเครื่องมือผ่าตัดอบฆ่าเชื้อมีจำกัดวันต่อวัน
ปั่นพิชิตจุดชมวิวปางสีดา 13 ส.ค.65 LINK
อลังการ “ผีเสื้อปางสีดา” มนต์เสน่ห์แห่งผืนป่าตะวันออก"
ตลอดเดือนกรกฏาคม - สิงหาคม 2565
กิจกรรรมปั่นพิชิตจุดชมวิวปางสีดา 13 สิงหาคม 2565
เทศกาลผีเสื้อปางสีดา อุทยานแห่งชาติปางสีดา
ติดต่อสอบถามเพิ่มเติม 061-1255444
สำนักงานการท่องเที่ยวและกีฬาจังหวัดสระแก้ว 037-425031
รับสมัครวันที่ 15 ก.ค. 2565 ผ่านมาทางเว็บไซต์
event.thaimtb.com/s/PangSida (หากเต็มปุ๊ปจะปิดทันที โดยจำกัดจำนวน 400 คน)
เสือหมอบ-เสือภูเขา เขื่อนภูมิพล ครั้งที่ 19 วันเสาร์ที่ 27 ส.ค.65 LINK
การไฟฟ้าฝ่ายผลิตแห่งประเทศไทย (กฟผ.) การท่องเที่ยวแห่งประเทศไทย (ททท.) การกีฬาแห่ง
ประเทศไทย (กกท.) และจังหวัดตาก
สถานที่ ลงทะเบียน/Start : ศาลสมเด็จพระเจ้าตากสินฯ อ.เมือง จ.ตาก
Finish : สะพานปิงพิพรรธน์ เขื่อนภูมิพล อ.สามเงา จ.ตาก
วันเสาร์ที่ 27 สิงหาคม 2565
ประเภท 1. ประเภทแข่งขัน ระยะทาง 62 กม. เสือหมอบ เสือภูเขา 2.ประเภทใจเกินร้อย ระยะทาง 62 กม.ไม่จำกัดประเภทจักรยาน
แข่งขันจักรยาน Nongprue City 2022 วันที่ 14 ส.ค.65 LINK
ขอเชิญร่วมงานแข่งขันจักรยาน " Nongprue City 2022 " วันที่ 14 สิงหาคม 65 เวลา 7.00 น. เมืองพัทยา ณ เทศบาลเมืองหนองปรือ
สถานที่จัดงาน สวนสุขภาพเฉลิมพระเกียรติ 72 พรรษา สมเด็จพระนางเจ้าสิริกิตฯ โครงการแข่งขันจักรยานเพื่อสุขภาพ เนื่องในวันเฉลิมพระชนมพรรษา สมเด็จพระนางเจ้าสิริกิต์ พระบรมราชินาถ พระบรมราชชนนีพันปีหลวง และวันแม่แห่งชาติ ค่าสมัคร 600 บาท ได้รับเสื้อจักรยาน และถ้วยที่ระลึก /อาหาร / น้ำดื่มตลอดรายการ
สมัคร
event.thaimtb.com/event.php?e=579
มหกรรมกัญชา ราชาสมุนไพร@ศรีราชา ครั้งที่ 2 มาแล้ว 11-14 ส.ค.65 LINK
มหกรรมกัญชาราชาสมุนไพร@ศรีราชาครั้งที่ 2 มาแล้ว 11-14 สิงหาคม 65 ที่ ชั้น 1 ศูนย์การค้า pacific park sriracha รายได้บริจาคมอบโรงพยาบาลสมเด็จพระบรมราชเทวี ณ ศรีราชา เพื่อสมทบทุนซื้อเครื่องมือแพทย์ ในงานจัดเต็มทั้งความรู้ ความสนุก ที่จะได้พบกับ วิทยากรกัญชาระดับประเทศ ลุงดำ เกาะเต่า ปราชญ์กัญชาไทย ตัวจริงอีกคน ที่มาพร้อมสายพันธุ์ KD ศรีราชา กิจกรรมให้ความรู้ อีกมาก อาทิ การอบรมปลูกกัญชา ฟรี คลินิกกัญชาทางการแพทย์ นวัตกรรมกัญชา สินค้ากัญชา ก็มาเพียบแน่นอนงานนี้ งานใหญ่งานแรกเกี่ยวกับกัญชาในศรีราชาหลังจากกัญชาปลดล็อกพ้นจากยาเสพติด
บางกอกกำลังดี เดือนสิงหาคม กำหนดจัดวันที่ 7,14,21,28 ส.ค.65
บางกอกกำลังดี
7 สิงหาคม ที่สวนเสรีไทย บึงกุ่ม พบกัน DBK - T21, S2S, เกิบ The Voice, Stoondio
14 สิงหาคม ที่สวนสันติภาพ เขตราชเทวี พบกับ Old Doc, Fah Sansin, iHearband, ETC.
21 สิงหาคม ที่สวนหลวง ร.9 เขตประเวศ พบกับ ภูมิจิต Rattana (Na Polycat), 2021 Ocean Vibes, Jekd และ DJ Set โดย City Boy
28 สิงหาคม ที่สวน 60 พรรษาฯ เขตลาดกระบัง พบกับ มนัสวีร์ และไททศมิตร
24 ส.ค.65 ปทุมธานี "ดนตรีในสวน" ย่านตลาดเก่าเมืองเก่า 100 ปี คลอง12หกวา
โครงการ "ดนตรีในสวน" ย่านตลาดเก่าเมืองเก่า 100 ปี คลอง12หกวา
โดย วงออเคสตร้า ม.ราชภัฎวไลยอลงกรณ์ ปทุมธานี รร การแสดงดนตรีร่วมสมัย กิจกรรมจัดในวันพุธที่ 24 สิงหาคม พ.ศ. 2565 เวลา 16.00 - 19.00 น. ณ บริเวณลานด้านหน้าโบสถ์พระวิสุทธิวงส์ (วัดลำไทร) ตำบลลำไทร อำเภอลำลูกกา ปทุมธานี เชิญรับชมการแสดงดนตรีแนวร่วมสมัย จากวงดนตรี VRU Wind Symphony คณะมนุษยศาสตร์และสังคมศาสตร์ มหาวิทยาลัยราชภัฏวไลยอลงกรณ์ ในพระบรมราชูปถัมภ์ จังหวัดปทุมธานี และการแสดงจากชุมชนตำบลลำไทร ซึ่งภายในงานยังมีกิจกรรมด้านความบันเทิงอีกมากมาย
ดนตรีในสวน 21 ส.ค.65 สวนหย่อมประชานุกูล
ดนตรีในสวน
วันที่ 21 สิงหาคม เวลา 16.00 - 18.00 น.
ณ สวนหย่อมประชานุกูล ภายในงานมีการแสดงดนตรี และกิจกรรมการละเล่นต่างๆ พร้อมทั้งบูธขายสินค้าจากชุมชน
9-12 ส.ค.65 ถนนคนเดินเสน่ห์ไทยนิยม หน้าสนง.เขตบึงกุ่ม LINK
บึงกุ่มขยายเวลาชวนเที่ยวงาน “ถนนคนเดิน เสน่ห์ไทยนิยม” ณ ถนนหน้าสำนักงานเขตบึงกุ่ม สำนักงานเขตบึงกุ่ม ขอประชาสัมพันธ์ขยายเวลาชวนท่านเที่ยวงาน “ถนนคนเดิน เสน่ห์ไทยนิยม” ตามโครงการไทยช่วยไทยกระตุ้นเศรษฐกิจ เพิ่มอีก 2 วัน ถึงวันที่ 14 สิงหาคม 2565 ตั้งแต่เวลา 17.00 – 21.00น. ณ บริเวณถนนหน้าสำนักงานเขตบึงกุ่ม ภายในงานมีการจัดจำหน่ายสินค้า OTOP ผลิตภัณฑ์ชุมชน อาหารคาวหวานหลากหลายชนิด และสินค้าอุปโภคบริโภคราคาถูก รวมทั้งการแสดง และฉายหนังกลางแปลง รอบ 19.00น. สับเปลี่ยนหมุนเวียนทุกวัน
ดนตรีในสวน อุทยาน 100 ปี จุฬา 4-6 ส.ค.65 LINK
งานดนตรีในสวน อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย 4-6 สิงหาคม เวลา 15.00 - 22.00 น. จัดโดยองค์การบริหารสโมสรนิสิตจุฬาฯ ในงานมีการแสดงดนตรีหลากหลาย ทั้งดนตรีสากล ดนตรีไทยประยุกต์ การแสดงความสามรถทางดนตรีโดยวงดนตรีของนิสิตจุฬาฯ คณะต่างๆ นอกจากนี้ในงานยังมีซุ้มกิจกรรมร่วมสนุกมากมาย เช่น ซุ้มเกม งานคราฟต์ ซุ้มดูดวง ซุ้มสอยดาว ระบายสีปูนปลาสเตอร์ ทำสบู่แฮนด์เมด กิจกรรมเขียนจดหมายถึงตัวเอง กิจกรรมทำตุงไส้หมู โดยชมรมศิลปวัฒนธรรมล้านนา จุฬาฯ ฯลฯ
ดนตรี กทม.ฟรี 1-9 ส.ค.65
ดนตรี กทม.ฟรี สัปดาห์นี้ ตั้งเเต่วันที่ 1-9 สิงหาคม 2565
บางกอกกำลังดีที่สวนสันติภาพ 14 ส.ค.65 LINK
บางกอกกำลังดีที่สวนสันติภาพ
หลาย ๆ คนที่เคยผ่านเส้นทางในระแวกอนุสาวรีย์ชัยสมรภูมิ คงจะเห็นสวนนี้ผ่านตากันบ้างกับ "สวนสันติภาพ" สวนขนาดย่อม ๆ ที่อยู่ใจกลางศูนย์รวมการเดินทางในกรุงเทพ ฯ สัปดาห์นี้บางกอกกำลังดีพากิจกรรมและดนตรีมาที่สวนสันติภาพ มีใครมาบ้างมาดูกันเล๊ยยย
เวทีการแสดง
• 16.30 น. การแสดงดนตรี และวัฒนธรรมจากพื้นที่
• 17.15 น. Old Doc
• 18.00 น. fah sansin
• 18.40 น. iHearband
• 19.30 น. ETC.
กิจกรรม
• ห้องสมุดเพื่อการเรียนรู้ ซอยพระนาง มูลนิธิอาสาสมัครเพื่อสังคม (มอส.)
• บอร์ดเกมในสวน จากสมาคมบอร์ดประเทศไทย
• บูธนวด จากหมอบ้าน ๆ
• หุ่นมือจากผ้า สวนครูองุ่น
• กระดานดำระดมไอเดีย สภาเด็กและเยาวชน
• เพ้นท์หน้า และบูธคัดแยกขยะ คลองเตยดีจัง
• เกมบันไดงู เยาวชนลดปัจจัยเสี่ยง
• ชวนน้องระบายสี สำนักงานเครือข่ายงดเหล้า (สคล.)
• บางกอกในฝัน จากเครือข่ายนวัตกรรมคนรุ่นใหม่ (SYSI)
• บูธตลาดจากชุมชนในเขตราชเทวี
• และกิจกรรมอื่น ๆ อีกมากมาย
แล้วมาพบกันนะ วันอาทิตย์ที่ 14 สิงหาคม 16.30 น. เป็นต้นไป
กำหนดการ"อีเวนต์ดนตรีฟรี! สัปดาห์ 12-14 ส.ค.65 โดย กทม.
วันศุกร์ที่ 12 ส.ค. 65
เวลา 14.00 น.
"ดนตรีในสวน" สนามกีฬาห้วยขวาง จัดโดย สำนักงานเขตห้วยขวางและกองการสังคีตฯ กทม.
- วงโปงลางและนาฏศิลป์
เวลา 17.00 น.
"Siam Square Walking Street" Siam Square จัดโดย PMCU
- UNGRIT Kritsana (ซอย 3)
- Thailand Saxophone Alliance (หน้า Centerpoint)
- Over-clock SaxophoneEnsemble (SQ1)
- ONLY HEAD IN Jazz band (ซอย 2)
เวลา 17.30 น.
"ดนตรีในสวน"
สวนเบญจกิติ ฝั่งเชื่อมต่อศูนย์การประชุมแห่งชาติสิริกิติ์ จัดโดย กรุงเทพมหานครและศูนย์การประชุมแห่งชาติสิริกิติ์
- วงเยาวชนคลองเตย
- Immanuel String Orchestra
- วงออเคสตร้ากรุงเทพมหานคร (Bangkok Metropolitan Orchestra) และ มาเรียม B5
วันเสาร์ที่ 13 ส.ค. 65
เวลา 17.00 น.
"ด้วยรักแห่งแผ่นดิน":"With Love for the Nation" สะพานหัน คลองโอ่งอ่าง จัดโดย เขตพระนครและกองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว
- วงบางกอกลูกทุ่ง
"ดนตรีในสวน"
ศาลาภิรมย์ภักดี สวนลุมพินี จัดโดย มูลนิธิเพื่อคนพิการและสังคม และ กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว
- วงดนตรีผู้พิการทางสายตา
"Siam Square Walking Street" Siam Square จัดโดย PMCU
- น้องไข่มุก (S2S ) x เกี้ยว พศภพ x อุ้ย สุวิช (หน้าซอย2)
- Ice PTK (ซอย 3)
- วงดนตรีสามพี่น้อง (หน้า SQ1)
- แซ็ก ชนะใจ
เวลา 17.30 น.
"ดนตรีในสวน" สวนเบญจกิติ ฝั่งเชื่อมต่อศูนย์การประชุมแห่งชาติสิริกิติ์
จัด โดย กรุงเทพมหานครและศูนย์การประชุมแห่งชาติสิริกิติ์
- วงเยาวชนคลองเตย
- Immanuel String Orchestra
- วงออเคสตร้ากรุงเทพมหานคร (Bangkok Metropolitan Orchestra) และ ตู่ ภพธร
วันอาทิตย์ 14 ส.ค. 65
เวลา 16.30 น.
บางกอก...กำลังดี สวนสันติภาพ (อนุเสาวรีย์ชัยฯ) จัดโดย บางกอกกำลังดี และกองการสังคีต กทม.
- การแสดงจากชุมชนพื้นที่
- วง Old doc
- Fah Sansin
- iHearband
- ETC.
เวลา 17.00 น.
"Siam Square Walking Street" Siam Square จัดโดย PMCU
- น้องไข่มุก (S2S )x เกี้ยว พศภพ x อุ้ย สุวิช (หน้าซอย2)
- Cover & Random Dance (Block I)
- ชมรมนาฎรักข์ ๑ โขน (หน้า Centerpoint)
- วงโปงลางร่มจิกออนซอน (SQ1)
- Junin Toiro การแสดงเต้นวัฒนธรรมญี่ปุ่น/ Laola การแสดงเต้นวัฒนธรรมลาตินอเมริกา/ Warrior การแสดงเต้นวัฒนธรรมแอฟริกา (หน้าซอย3)
- แมวเศษเล็บ
ดนตรีในสวน Music for Mom สวนเบญจกิติ 12-13 ส.ค.65
ดนตรีในสวน Music for Mom 12-13 สิงหาคม 65
ณ สวนเบญจกิติ ฝั่งเชื่อมต่อศูนย์การประชุมแห่งชาติสิริกิติ์
7 ส.ค. 65 ดนตรีในสวน บางกอกกำลังดี Siam Square Walking Street
7 ส.ค. 65
เวลา 16.00 น.
ดนตรีในสวน สื่อศิลป์ ส่งเสียง ชีวิต สิทธิ ชนเผ่าพื้นเมือง
@สวนลุมพินี จัดโดย The Active / สพช. / ศมส. / Thai PBS / กทม.
ออเคสตรา ผสมวงดนตรีชาติพันธุ์ ลีซู, ดาราอาง, ชาวเล, ปกาเกอะญอ ชิ สุวิชาน, คลีโพ, เสียงสาละวิน, รำตงคลิตี้ล่าง Back up โดยวงดนตรีนิมมาน สตรีท ออเคสตรา
เวลา 16.30 น.
บางกอก...กำลังดี
@ที่สวนเสรีไทย (สวนน้ำบึงกุ่ม) จัดโดย บางกอกกำลังดี และกองการสังคีต กทม.
การแสดงและดนตรีจากชุมชนบึงกุ่ม
การแสดงจากวงผู้พิการทางสติปัญญา
ดนตรีวงผู้พิการทางสายตา
เกิบ the voice
stoondio
เวลา 17.00 น.
Siam Square Walking Street
@Siam Square จัดโดย PMCU
Cover & Random Dance (Block I)
Rainyroo (หน้า Centerpoint)
Pinny Violin (หน้าลานอัฒจันทร์ SQ1)
เอลนีโญ (หน้าซอย5)
ดนตรีในสวน@บางขุนเทียน Siam Square 6 ส.ค.65
เวลา 17.00 น. ดนตรีในสวน @ศูนย์เยาวชนบางขุนเทียน จัดโดย สนข.บางขุนเทียนและกองสังคีต กทม. วงบางกอกลีลาศ
Siam Square Walking Street
@Siam Square จัดโดย PMCU
วงพราว Fruity บัตเตอร์เค้ก Cover Dance & Random Dance
ดนตรีในสวน @สนามกีฬาห้วยขวาง Siam Square Walking Street 5 ส.ค.65
เวลา 15.00 น.ดนตรีในสวน @สนามกีฬาห้วยขวาง จัดโดย สนข.ห้วยขวางและกองสังคีต กทม. วงคอนเทมและนาฏศิลป์
เวลา 17.00 น. Siam Square Walking Street
@Siam Square จัดโดย PMCU
TGIF with Thai Idol
Stucknot+Celestial Band+rabbitnight
Sixmars+Oyster Cream
Euro
1-15 ส.ค.65 งานด้วยรักแห่งแผ่นดิน with love for the nation@ป้อมมหากาฬ
1-9 ส.ค. 65 เวลา 19.00 น. งานด้วยรักแห่งแผ่นดิน with love for the nation@ป้อมมหากาฬ วงดนตรีกรุงเทพมหานคร
นิทรรศการในโซนที่ 4 ณ บริเวณป้อมมหากาฬ โดยกรุงเทพมหานคร สำนักการศึกษา และสำนักวัฒนธรรม กีฬาและท่องเที่ยว เปิดพื้นที่สร้างสรรค์สำหรับเด็กและเยาวชน (Free Space) ได้แสดงความสามารถและผลงานที่มีความสร้างสรรค์ และเป็นประโยชน์ต่อส่วนรวมในด้านต่าง ๆ
ส่วนที่ 1 การจัดนิทรรศการแสดงผลงานของนักเรียนจากโรงเรียนในสังกัดกรุงเทพมหานคร ณ อาคารพิพิธภัณฑ์ ห้องสมุด ตั้งแต่ 08.30 – 20.30 น.
ส่วนที่ 2 การแสดงความสามารถของเด็กและเยาวชนในด้านต่าง ๆ ณ เวทีใหญ่ ตั้งแต่ 17.00 – 18.30 น.
MUSIC IN SOI 20-21 ส.ค.65
ร่วมผ่อนคลายผ่านเสียงเพลงและการแสดงโดยศิลปินในย่านและเครือข่ายศิลปิน ได้ในกิจกรรม ดนตรีในซอย วันที่ 20-21 ส.ค. 2565 ตั้งแต่เวลา 17.00 - 20.00 น. ณ สวนสานธารณะ โดย ศูนย์ออกแบบและพัฒนาเมือง (UDDC) วง คลองเตยดีจัง วง Plear และวง Air Times
วันเสาร์ที่ 20 ส.ค. 2565 พบกับ
วง Plear เวลา 17.00-18.00 น.
วง คลองเตยดีจัง เวลา 18.30-20.00 น.
วันอาทิตย์ที่ 21 ส.ค. 2565 พบกับ
วง Plear เวลา 17.00-18.00 น.
วง Air Times เวลา 18.30-20.00 น.
*MUSIC IN SOI เป็นส่วนหนึ่งของงาน "ศิลป์ในซอย: แสง-สี-ศิลป์ เชื่อมย่าน เชื่อมการเรียนรู้ เชื่อมเศรษฐกิจชุมชน ART IN SOI 7 ตอน Plearn in Soi" จัดโดย
UDDCบางกอกกำลังดีที่สวนหลวง ร.9 - 21 ส.ค.65 LINK
"บางกอกกำลังดีที่สวนหลวง ร.9" สัปดาห์นี้ชวนทุกคนมาสัมผัสบรรยากาศท่ามกลางดอกไม้ พรรณไม้นานาพันธุ์ในพื้นที่สวนหลวงร.9 ชวนมาฟังดนตรีและเข้าร่วมกิจกรรมในสวนกัน รายละเอียดเวทีการแสดง
• 15.30 - 16.30 ดนตรี และการแสดงจากโรงเรียนแก่นทองอุปถัมป์
• 16.30 - 17.15 ภูมิจิต
• 17.15 - 19.15 Rattana (Na Polycat), 2021 Ocean Vibes, Jekd, DJ set โดย City Boy
กิจกรรม Free Play & Free Art เช่น กิจกรรมเพนท์หน้า, หุ่นมือจากผ้า, นวดจากหมอบ้าน ๆ, เกมบันไดงูเป็นต้น ดนตรีท่ามกลางบรรยากาศดี ๆ และกิจกรรมที่ชวนมาเล่น เรียนรู้ไปด้วยกัน วันอาทิตย์ที่ 21 สิงหาคม เวลา 15.30 - 19.30 สวนเชิงผา ประตู 5 แล้วเจอกันน้าาาา
*มีค่าเข้าชม : คนละ 10 บาท, รถจักรยานยนต์ 5 บาท, รถยนต์ 10 บาท
ดนตรีในสวน 28 ส.ค.65 วัดเลียบราษฎร์บำรุง
ดนตรีในสวน วันที่ 28 สิงหาคม เวลา 09.00 - 12.00 น.
ณ วัดเลียบราษฎร์บำรุง ภายในงานมีการแสดงดนตรี และกิจกรรมการต่างๆ มากมาย อาทิ การให้คำปรึกษา แนะนำ และบริการจากสำนักงานเขต และส่วนราชการต่างๆ เช่น บริการตัดผม ฉีดวัคซีนสัตว์เลี้ยง ฯลฯ นิทรรศการ ทางลัดสู่ธุรกิจกัญชา ม.ราชภัฏบ้านสมเด็จเจ้าพระยา 19 – 20 ส.ค.65 LINK
ศูนย์วิจัยกัญชาและกัญชง คณะวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา จัดนิทรรศการ "ทางลัดสู่ธุรกิจกัญชา" สถานที่จัดงาน/อบรม : ณ ห้องประชุม อาคาร 1 ชั้น 4 มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา แขวงหิรัญรูจี เขตธนบุรี กรุงเทพฯ
วันที่จัดงาน : 19 - 20 สิงหาคม 2565 เวลา 08.30 - 17.00 น.
ติดต่อสอบถาม
ศูนย์วิทยาศาสตร์ คณะวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยราชภัฏบ้านสมเด็จเจ้าพระยา
อีเมล : cannabis.bsru@gmail.com
LINE ID : scicenter
เบอร์โทรติดต่อ :
ผศ.ดร.ปณิตา แจ้ดนาลาว 081-905-6832
ผศ.ดร.อมลณัฐ โชติกิจนุสรณ์ 081-920-8747
- ผู้อบรม (ค่าอบรม 2 วัน 1,000 บาท) ผู้ผ่านภาคปฏิบัติ (เวิร์กชอป) ได้รับ "เทคนิควิธีการสกัดน้ำมันกัญชา อาหารผสมกัญชาที่ปลอดภัย เครื่องสำอางผสมสารกัญชา" และได้รับของที่ระลึก: กระเป๋า และสินค้าผลิตภัณฑ์จากกัญชา
- ผู้เข้าชมงาน (เข้าฟังบรรยายและเข้าชมนิทรรศการฟรี)
- ร้านค้า (บูธ 1.5 ม. x 1.5 ม. 2 วัน บูธละ 1,500 บาท)
ดนตรีในสวน บึงสีกัน หลักสี่ วงโยธวาทิตโรงเรียนราชวินิตบางเขน 3 ก.ย.65
ร่วมรับฟังบทเพลงจาก Rajavinit Bangkhen Wind Symphony & Marching Band วงโยธวาทิตโรงเรียนราชวินิตบางเขน ในวันเสาร์ที่ 3 กันยายน ณ บึงสีกัน เขตหลักสี่ ตั้งแต่ 16.00 เป็นต้นไป
ขอนแก่นไบค์วีค ครั้งที่ 12 Khonkaen Bike Week 2022
ขอนแก่นไบค์วีค ครั้งที่ 12 Khonkaen Bike Week 2022 " Smile & Ride together " On date 22/08/2022 at Woo fu Maket Khonkaen ในงานพบกับกิจกรรมการออกบูธ จำหน่ายสินค้าที่ระลึก จากค่ายรถมอเตอร์ไซค์และรถบิ๊กไบค์พร้อมพี่น้องไบค์เกอร์จากทุกกลุ่ม ทุกๆชมรมจากทั่วประเทศ พบกับการแสดงคอนเสิร์ตนำโดย กบ ไมโคร และ ไทธนาวุฒิ *รายได้มอบให้กับโรงเรียนที่ขาดแคลนในจังหวัดขอนแก่น
สิชล ไบค์วีค ครั้งที่ 2 วันที่ 23-24 กันยายน 2565
สิชล ไบค์วีค ครั้งที่ 2 23-24 กันยายน 2565 ณ.หาดสวนสน บ้านฝ่ายท่า (ปากน้ำสิชล)
WALK TO RUN Camping 2023 อาทิตย์ที่ 13 ส.ค.66 LINK
WALK TO RUN Camping 2023 วันอาทิตย์ที่ 13 สิงหาคม 2566 สถานที่จัดกิจกรรม ภูธาราฟ้ารีสอร์ท อำเภอวังน้ำเขียว จังหวัดนครราชสีมา สอบถามรายละเอียดเพิ่มเติมได้ที่ อ่างเก็บน้ำบ้านสันกำแพง Walk To Run Camping
งานวิ่ง ม.อ.หาดใหญ่สู่ธรรมชาติ ครั้งที่ 23 ชิงถ้วยพระราชทาน 13 ส.ค.66 LINK
มหาวิทยาลัยสงขลานครินทร์ ขอเชิญชวนนักศึกษา บุคลากร ศิษย์เก่า และผู้สนใจ เข้าร่วมงานวิ่ง ม.อ. หาดใหญ่สู่ธรรมชาติ ครั้งที่ 23 ในวันอาทิตย์ 13 สิงหาคม 2566 ชิงถ้วยพระราชทาน พระบาทสมเด็จพระเจ้าอยู่หัวและสมเด็จพระนางเจ้าฯ พระบรมราชินี เพื่อเฉลิมฉลองเนื่องในโอกาสครบรอบ 55 ปี แห่งการสถาปนามหาวิทยาลัยสงขลานครินทร์ เพื่อหารายได้จัดซื้อรถพยาบาลให้กับศูนย์บริการฉุกเฉินและบรรเทาสาธารณภัย มหาวิทยาลัยสงขลานครินทร์ และส่งเสริมให้นักศึกษา บุคลากร และประชาชนทั่วไปได้ใช้เวลาว่างให้เป็นประโยชน์ด้วยการเดิน–วิ่งออกกำลังกายเพื่อสุขภาพ ประเภทการแข่งขัน ได้แก่
1. ฮาล์ฟมาราธอน 21.1 กม. ทั้งชายและหญิง
2. มินิมาราธอน 10.5 กม. ทั้งชายและหญิง
3. ฟันรัน 4 กม.
สามารถสมัครได้ตั้งแต่บัดนี้ - 30 มิถุนายน 2566
Line : PSU Foundation หรือ โทร. 091-8462236
KALASIN Run for home วิ่งสร้างเมือง 13 ส.ค.66 LINK
KALASIN Run for home วิ่งสร้างเมือง ณ พิพิธภัณฑ์ของดีเมืองกาฬสินธุ์ (หอศิลป์) วันที่ 13 สิงหาคม 2023 ประเภทการแข่งขัน FUN RUN 4 km / Mini Marathon 10.5 km / Half Marathon 21.1 km / VIP เปิดรับสมัคร 8 พฤษภาคม - 8 กรกฎาคม 2566
12 August Half Marathon Bangkok 2023 วันที่ 12 ส.ค.66
12 August Half Marathon Bangkok 2023
วิ่งวันที่ 12 สิงหาคม 2566
บริเวณ ศูนย์การประชุมแห่งชาติสิริกิติ์ ระยะทาง 21.1 กิโลเมตร
ระยะทาง 10.5 กิโลเมตร
ระยะทาง 5 กิโลเมตร
สอบถามข้อมูลเพิ่มเติม เบอร์โทร 02-7216009
งานวิ่ง รร.รัตนาธิเบศร์ นนทบุรี 123 RT First Run 20 ส.ค.66 LINK
งานวิ่ง รร.รัตนาธิเบศร์ นนทบุรี 123 RT First Run จัดโดยสมาคมผู้ปกครองและครูโรงเรียนรัตนาธิเบศร์ วิ่งวันที่ 20 สิงหาคม 2566 ณ โรงเรียนรัตนาธิเบศร์ - สะพานมหาเจษฎาบดินทร์ จุดปล่อยตัว-เส้นชัย ร้าน cook & coff เรือนจำบางขวาง ประเภท Fun run 6 km / Mini Marathon 12 km. ช่วงอายุการแข่งขัน ไม่เกิน 18 ปี / 18-30 ปี / 31-40 ปี / 41-50 ปี / 51-59 ปี / 60 ปีขึ้นไป
วิ่งกับหมอ ไม่หงอมะเร็ง@ฉะเชิงเทรา 20 ส.ค.66 LINK
ชวนไปวิ่งที่แปดริ้วกันในงาน วิ่งกับหมอ ไม่หงอมะเร็ง Eastern Cancer Network Run @ฉะเชิงเทรา “We beat cancer" วันอาทิตย์ที่ 20 สิงหาคม 2566 จุดเริ่มต้นและเส้นชัย ณ โรงเรียนวัดโสธรวรารามวรวิหารจังหวัดฉะเชิงเทรา รายได้หลังหักค่าใช้จ่าย มอบให้โรงพยาบาลพุทธโสธร เพื่อนำไปดูแลรักษาผู้ป่วยมะเร็ง จัดโดย Eastern Cancer Network เครือข่ายการรักษาผู้ป่วยมะเร็งในภาคตะวันออกของประเทศไทย
สืบสานวัฒนธรรมประเพณี วิถีไทหล่ม ทำบุญตักบาตร ขนม "ตะโก้"
สำนักงานวัฒนธรรมจังหวัดเพชรบูรณ์ ขอเชิญร่วมกิจกรรม : สืบสานวัฒนธรรมประเพณี วิถีไทหล่ม ทำบุญตักบาตร ขนม "ตะโก้" ในวันเสาร์ที่ 5 สิงหาคม 2566 ณ ร้านค้าศูนย์บาทประชารัฐ ชุมชนบ้านกุดช้าง อำเภอหล่มเก่า จังหวัดเพชรบูรณ์
การแต่งกาย : ชุดไทหล่ม ชุดสุภาพ
ชาย-โทนสีเหลือง
หญิง-โทนสีฟ้า
Sexy Run Koh Mak 2023 วันที่ 18-19 ส.ค.66
กิจกรรม Sexy Run Koh Mak 2023 วิ่งบนเส้นทางสุด Sexy ของเกาะหมาก ในวันที่ 18-19 ส.ค. 2566 พร้อมกิจกรรมอื่น ๆ อีกมากมาย อาทิ Food Venture ค้นหา 20 เมนูเด็ดทั่วเกาะ, Photo Challenge Up Skill การถ่ายรูปด้วยมือถือจากมุมสวย ๆ ได้ทั่วเกาะ และปิดท้ายด้วย Sexy Campfire Party ริมอ่าว ที่มองจากมุมไหนก็ฟิน
ปฏิทินท่องเที่ยว จ.ประจวบคีรีขันธ์ เดือนสิงหาคม 2566
Monsoon Valley Vineyard Fest ไร่องุ่นมอนซูน หัวหิน
Monsoon Valley Vineyard Fest ไร่องุ่นมอนซูน หัวหิน จัดขึ้นในวันที่ 11-13 สิงหาคมนี้ จะนั่งรถชมไร่องุ่นสุดชิล เพลิดเพลินกับการเก็บองุ่น ย่ำองุ่นเรียนรู้วิธีการทำแบบดั้งเดิม ชิมไวน์
งานวิ่ง "ปางปูเลาะเทรล" Phayao Hill Tribe Trail Run 2023 วันอาทิตย์ 6 ส.ค.66 LINK
งานวิ่ง "ปางปูเลาะเทรล"Phayao Hill Tribe Trail Run 2023 แข่งขันวันอาทิตย์ที่ 6 สิงหาคม 2566 (ปิดรับสมัครในวันที่ 30 ก.ค. 66 )
สถานที่จัดกิจกรรม : เขตพัฒนาราษฎรบนพื้นที่สูงปางปูเลาะ
3 เส้นทางการแข่งขัน ระยะ 20KM/ 10KM/5KM
ผ่านจุดสำคัญ ไฮไลท์สำคัญ
- จุดชมวิวป่าสน
- จุดชมวิวบ้านปางปูเลาะ
- เส้นทางศึกษาธรรมชาติ ปางปูเลาะ,ผาแดง,ป่าเมื้ยง
- จุดชมวิวผาแดง
Net Zero Emission Navy Marathon 2023 วันอาทิตย์ ที่ 20 ส.ค.66 LINK
กองทัพเรือ ร่วมกับ สมาคมนักวิ่งเพื่อสุขภาพแห่งประเทศไทย ขอเชิญร่วมงานวิ่ง Net Zero Emission Navy Marathon 2023 วันอาทิตย์ ที่ 20 สิงหาคม 2566 เรือหลวงจักรีนฤเบศร ท่าเรือจุกเสม็ด ฐานทัพเรือสัตหีบ สมัครเข้าร่วมแข่งขันได้ที่ https://navymarathon.com
ประเภทที่เปิดรับสมัคร Full Marathon 42.195Km / Half Marathon 21.1Km / Mini Marathon 10Km / Fun Run 5Km
สมัครออนไลน์ได้รับบิบพิมพ์ชื่อ ถึง 10 สิงหาคม 2566 นี้เท่านั้น
ประจำเดือน สิงหาคม 2566
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน สิงหาคม 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น.
11 สิงหาคม 2566 อาคารเอนกประสงค์สวนสุขภาพเทศบาลเมืองหนองปรือ เทศบาลเมืองหนองปรือ อ.บางละมุง
17 สิงหาคม 2566 วัดวังหิน เทศบาลเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
18 สิงหาคม 2566 วัดน้อย เทศบาลเมืองชลบุรี อ.เมืองชลบุรี
24 สิงหาคม 2566 เทศบาลตำบาลเสม็ด อ.เมืองชลบุรี
25 สิงหาคม 2566 โดมเอนกประสงค์ เทศบาลเมืองชลบุรี อ.เมืองชลบุรี
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่
17-18 ส.ค.66 @เขตลาดกระบัง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี วันละ 200 โดส LINK
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัยจะมาดำเนินการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้ในพื้นที่เขตลาดกระบัง ประชาชนท่านใดที่สนใจสามารถนำสุนัขและแมวหรือสัตว์เลี้ยงลูกด้วยนมมารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี ตามกำหนดการดังนี้
• วันพฤหัสบดีที่ 17 สิงหาคม 2566 เวลา 09.30 – 11.30 น. ณ วัดสุทธาโภชน์ แขวงทับยาว จำนวน 200 โดส
• วันศุกร์ที่ 18 สิงหาคม 2566 เวลา 09.30 – 11.30 น. ณ วัดราชโกษา แขวงขุมทอง จำนวน 200 โดส
สงขลามาราธอน 2023 วันที่ 26-27 สิงหาคม 2566 LINK
สงขลามาราธอน 2023 SONGKHLA INTERNATIONAL MARATHON 2023 ครั้งที่ 24 วันที่ 26-27 สิงหาคม 2566 สตาร์ท : ลานเก้าอี้ดำ ถนนชลาทัศน์ (สนามกีฬาติณสูลานนท์) งานวิ่งระยะไกลภาคใต้ ที่ต้องมาสัมผัสกับบรรยากาศ
Basic Barista Class@UCC เดือนสิงหาคม 2566 LINK
Basic Barista Class เดือนสิงหาคม 2566 หลักสูตร 1 วัน : เน้นภาคปฏับิติการลงมือทำเครื่องดื่มกาแฟ
• 10 สิงหาคม 2566 (ภาคทฤษฏี) หลักสูตร 2 วัน : เน้นภาคทฤษฎีเกี่ยวกับความรู้และการลงมือทำเครื่องดื่มกาแฟ
• 26 สิงหาคม 2566 (ภาคทฤษฏี)
• 27 สิงหาคม 2566 (ภาคปฏิบัติ)
เข้าอบรม Workshop
Barista Class 1 วัน 3,000 บาท
Barista Class 2 วัน 4,000 บาท
สนใจติดต่อ สอบถามรายละเอียด / จองวันเรียน Tel: 083-540-6164
24 สิงหาคม 2566 @เขตดินแดงสุขภาพดี ใกล้บ้าน ใกล้หมอ
เชิญร่วมกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "โครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ" สำนักงานเขตดินแดง ร่วมกับสำนักอนามัย ขอเชิญชวนประชาชน ร่วมกิจกรรมการออกหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "โครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ" ในวันพฤหัสบดีที่ 24 สิงหาคม 2566 เวลา 08.00-14.00 น. ณ ลานกีฬาชุมชนห้วยขวางเฉลิมพระเกียรติ 72 พรรษา เขตดินแดง.
▶️ ชวนเช็คสุขภาพ เบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอ็กซเรย์ปอด ตรวจฟัน (อุด ขูด ถอน) สุขภาพใจ คุยกับนักจิตวิทยา
▶️ ชวนรู้ กินเป็น เน้นสุขภาพ ยาเสพติด ไข้เลือดออก ผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ฝุ่น PM.2.5
▶️ ชวนช้อป สินค้าชุมชน สินค้า OTOP
▶️ บริการน้องหมาน้องแมว ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป
▶️ แจกแว่นสายตายาว
ตารางการให้บริการเดือนสิงหาคม 2566
ตรวจคัดกรองสุขภาพปอด โดยรถเอกซเรย์เคลื่อนที่ เปิดรับลงทะเบียนหน้างาน สำหรับผู้ที่มีอายุ 15 ปีขึ้นไป จำกัดจำนวนไม่เกิน 150 คน/แห่ง
ตารางบริการหน่วยทันตกรรมเคลื่อนที่ เดือนสิงหาคม 66
หน่วยทันตกรรมเคลื่อนที่ ให้บริการตรวจและให้คำแนะนำ ขูดหินปูน อุดฟัน ถอนฟัน ฟรี ! ลงทะเบียนหน้างาน *โปรดนำบัตรประชาชนไปแสดงเมื่อรับบริการ
18 สิงหาคม 66 9.00-12.00 น. ชุมชนซีเมนต์ไทย เขตจตุจักร
22 สิงหาคม 66 9.00-12.00 น. ชุมชนเปรมฤทัย เขตประเวศ / 9.00-12.00 น. ชุมชนหมู่บ้านสกุลทิพย์ เขตทวีวัฒนา
28 สิงหาคม 66 8.30-12.00 น. ชุมชนวัดญวนคลองลำปัก เขตดุสิต
30 สิงหาคม 66 8.30-12.00 น. กองบัญชาการรักษาดินแดน เขตพระนคร
8.30-12.00 น. ชุมชนวัดราชาธิวาส-คอนเซปชั่น เขตดุสิต
31 สิงหาคม 66 8.30-12.00 น. ชุมชนท่าน้ำสามเสน เขตดุสิต
งานบ้านและสวนแฟร์ Midyear 2023 วันที่ 4-13 สิงหาคม 2566
งานบ้านและสวนแฟร์ Midyear 2023 ระหว่างวันที่ 4-13 สิงหาคม 2566 ณ ไบเทค บางนา
งานสัมมนาวิชาชีพการสัตวแพทย์ เรื่อง Hot topics in Pet Nutrition 31 สิงหาคม - 1 กันยายน 2566
ศูนย์การศึกษาต่อเนื่องทางสัตวแพทย์ สัตวแพทยสภา ร่วมกับชมรมสัตวแพทย์โภชนาการแห่งประเทศไทย (TAVN) ขอเชิญผู้ประกอบวิชาชีพการสัตวแพทย์ชั้นหนึ่ง และนิสิตนักศึกษาสัตวแพทย์ เข้าร่วม งานสัมมนาครั้งที่ 40 เรื่อง Hot topics in Pet Nutrition วันที่ 31 สิงหาคม - 1 กันยายน 2566 ณ สัตวแพทยสภา อัปเดตความรู้ด้านโภชนาการสัตว์เลี้ยงที่รวบรวมครบ จบในงานเดียวโดยทีมวิทยากรจาก TAVN ลงทะเบียน
Pet Expo Championship 2023 วันที่ 10-13 สิงหาคม@QSNCC
กลับมาสร้างความสุขให้กับคนรักสัตว์อีกครั้งกับ Pet Expo Championship 2023 ในธีม Extreme Love: รักสุดใจ สนามชิงชัยเพื่อนขนฟู สนามแห่งความรักของเหล่าสัตว์เลี้ยงและเจ้าของที่จะมาชิงชัยในการแข่งขันทักษะและความสามารถสัตว์เลี้ยง พร้อมจัดเต็มด้วยหลากหลายกิจกรรมภายในงาน อาทิ Dog Agility Skateboarding Dog My Dog Anywhere High Jump Fun Games ต่าง ๆ ให้ผู้ร่วมงานได้ร่วมสนุก พร้อมรับของรางวัล การประกวดสัตว์เลี้ยงประเภทต่าง ๆ ไม่ว่าจะเป็น น้องแมว น้องงู น้องเบียร์ดดราก้อน และอื่นๆ พิเศษสุด ๆ ครั้งแรกของ Pet Expo กับการประกวด Grooming โดย โรงพยาบาลสัตว์ทองหล่อ และช้อปสนุกไปกับสินค้าและบริาร กว่า 300 บูธจากแบรนด์ชั้นนำ ส่วนสาย Exotic Pet ก็ห้ามพลาดขนขบวนเหล่าสัตว์เลี้ยงพิเศษมาให้ได้สัมผัสกันแบบใกล้ชิด เตรียมพบกันได้ในวันที่ 10-13 สิงหาคมนี้ ระหว่างเวลา 10.00 - 20.00 น. ฮอลล์ 7-8 ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์
Pup Pap Art Market ในธีม High Zoociety 12-13 สิงหาคม 2023
Pup Pap Art Market วันที่ 12-13 สิงหาคม 2023 10.00-20.00 บริเวณโซนรีเทล หน้าฮอลล์ 8 ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์
มาร่วมเป็นส่วนหนึ่งของสัตว์ชั้นซู๊งสูงในงาน Pup Pap Art Market ซึ่งจัดขึ้นในธีม High Zoociety สังคมสุดป่วนของสัตว์ไฮโซทั้งหลาย โดยภายในงานจะได้พบกับ
สินค้าศิลปะที่มีเอกลักษณ์ เพียงแค่มองก็รู้สึกได้ว่าไม่เหมือนใคร!
กิจกรรมมากมายที่จะทำให้คุณและสัตว์เลี้ยงของคุณมีความสุขอย่างไม่มีที่สิ้นสุด!
โอกาสพิเศษในการนำสัตว์เลี้ยงของคุณมาเข้างานและสนุกกับเราไปพร้อมๆ กัน!
อย่าพลาดที่จะเข้าร่วมกิจกรรมที่น่าตื่นเต้นนี้ เพื่อสร้างความสุขและความทรงจำที่สุดให้กับคุณและสัตว์เลี้ยงของคุณ
PeoplePetsClub Ep.7 x BEARING Petcare เสาร์ที่ 19 ส.ค. 66
กิจกรรมสำหรับคนรักน้องหมาในงาน #PeoplePetsClub Ep.7 พาน้องๆ มาเรียนรู้การเข้าสังคมโดยการเข้าฝูงกันเถอะ! พบกับ "ครูรักษ์" ผู้เชี่ยวชาญการฝึกสุนัข ประสบการณ์มากกว่า 15 ปี บริการตรวจสุขภาพสัตว์เลี้ยงเบื้องต้นฟรี จาก โรงพยาบาลสวนสัตว์ Animal Farm Veterinary Hospital เสาร์ที่ 19 ส.ค. 66 16.00 - 18.00 น. People Park อ่อนนุช (ตรงข้ามซอยวัดมหาบุศย์)
Pet market by หมาติดเที่ยว Central Festival Eastville 26 สิงหาคม 66
กิจกรรมของคนชอบพาสัตว์เลี้ยงไปเที่ยว พบกับมาร์เก็ตสินค้า บริการสัตว์เลี้ยง และกิจกรรม workshop ได้ภายในงาน จัดวันที่ 26 สิงหาคม 66 Central Festival Eastville บริเวณ ซอยตรอกหมาใหญ่ (ใกล้บ่อทราย) แล้วพาเด็กๆ มาแฮงเอาท์ที่งานนะ
26 ส.ค. 66 บริการทำบัตรประชาชนน้องหมาแมว จำนวน 500 ตัว @เซ็นทรัล พระราม 2
เซ็นทรัล พระราม 2 ร่วมกับพันธมิตรจัดกิจกรรมดีๆ เปิดให้บริการทำบัตรประชาชนน้องหมาแมว จำนวน 500 ตัว งานนี้ฟรี!! สำหรับผู้ที่ลงทะเบียนล่วงหน้าเท่านั้นจ้า กิจกรรมภายในงาน
☑ ฝังไมโครชิพ และทำบัตรประชาชนนุ้งหมา นุ้งแมว
☑ ฉีดวัคซีนพิษสุนัขบ้า
☑ ตรวจสุขภาพให้น้อง ๆ
☑ ให้คำปรึกษาโดยสัตวแพทย์ผู้เชี่ยวชาญ
วันที่ 26 ส.ค. 66 เวลา 10.00-18.00 น. ชั้น 4 Rama 2 Hall
*ขอความร่วมมือ
_นุ้งหมานุ้งแมวต้องอยู่ภายในรถเข็นหรือกระเป๋าเท่านั้น
_นุ้งหมาใส่แพมเพิสก่อนเข้าร่วมกิจกรรม (ป้องกันการขับถ่ายกรณีฉุกเฉิน)
ไหว้พระราหู หลังจากสวดมนต์ เพื่อให้เกิดความสุขกายสุขใจ พุธที่ 16 สิงหาคม 2566 เวลา 1 ทุ่มตรง ขอโชคลาภ รวย รวย
Buddy & Family Happy Run วิ่งเพื่อสุขภาพของทั้งเจ้าของและสัตว์เลี้ยง 20 สิงหาคม 2566 LINK
กิจกรรมวิ่งเพื่อสุขภาพของทั้งเจ้าของและสัตว์เลี้ยง สร้างความสัมพันธ์เปิดประสบการณ์ใหม่ให้กับคุณและลูกรัก ณ ชายหาดอันสวยงามของจังหวัดเพชรบุรี พร้อมกิจกรรมสนุกสนานอีกมากมาย อาทิเช่น กิจกรรมถ่ายรูป Check in สร้าง Landmark , จุดบริการถ่ายรูปฟรีสำหรับเจ้าของและสุนัข , กิจกรรมกีฬาชายหาด , บริการจุดอาบน้ำและเป่าขนสำหรับสุนัข , การออกร้านของอาหารและขนมขึ้นชื่อของจังหวัดเพชรบุรี การออกร้านสินค้าอุปกรณ์กีฬาวิ่ง , ผลิตภัณฑ์สำหรับสัตว์เลี้ยง , และบริการธุรกิจท่องเที่ยวและโรงแรม
งานนี้มีให้เลือกวิ่งด้วยกันถึง 3 ระยะ คือ ระยะทาง 1.5 กิโลเมตร , 3 กิโลเมตร และ ระยะทาง 10 กิโลเมตร
วิ่งร่วมกับสุนัขที่คุณรักได้ทุกระยะ ถ้าคุณไม่มีสุนัขก็สามารถมาร่วมกิจกรรมวิ่งได้แม้ไม่มีสัตว์เลี้ยงเข้าร่วม สนุกกันได้ทั้งครอบครัว แล้วพบกันที่ โรงแรม ซี แซนด์ ซัน หัวหิน รีสอร์ท ณ ชายหาดค่ายพระรามหก จังหวัดเพชรบุรี กำหนดการจัดกิจกรรม วันเสาร์ที่ 19-20 สิงหาคม 2566
Pet Society@เทอมินอล21 พระราม3 วันที่ 18 - 30 ส.ค. 2566
Pet Society วันที่ 18 - 30 ส.ค. 2566 นี้ เทอมินอล21 พระราม3 ชั้น LG Floor Caribbean Village กิจกรรมเยอะแยะ อาทิ สำรวจโลกใต้ทะเลกับเหล่าปลาหลากหลายสายพันธุ์ กิจกรรมขุดบ่อทรายหาเปลือกหอย แลกรับบอลลูนในธีมสัตว์แสนน่ารัก Workshop ระบายสีก้อนหิน วันที่ 22 - 30 ส.ค. นี้ พบเหล่านกหลากหลายชนิด ที่ชั้น G-English Village มีกิจกรรมป้อนอาหารสัตว์ ตั้งแต่เวลา เวลา 10:00 - 21:30 น. ไฮไลท์สุดท้ายห้ามพลาด เพราะเทอร์เอาใจทาสแมว ยกอาณาจักรคาเฟ่แมวขาสั้น มาให้เหล่าทาสใจบาง เข้าเล่นกับน้องๆ
7 - 25 สิงหาคม 2566 เทศบาลตำบลเทพารักษ์ ร่วมกับมูลนิธิเพื่อสุนัขในซอย ทำหมันสุนัข ฉีดวัคซีน ให้ยาป้องกันเห็บหมัด
เทศบาลตำบลเทพารักษ์ ร่วมกับ มูลนิธิเพื่อสุนัขในซอย(SoiDog) ดำเนินการตามแผนยุทธศาสตร์ "โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ตามพระปณิธานฯ" ระหว่างวันที่ 7 - 25 สิงหาคม 2566 (เฉพาะวันจันทร์-ศุกร์ เวลา 08.00-17.00 น.) ณ โดมสวนสาธารณะเทศบาลตำบลเทพารักษ์ กิจกรรมการให้บริการ
1. การผ่าตัดทำหมันสุนัข
2. การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัข
3. ฉีดวัคซีนรวมให้กับสุนัข
4. ให้ยาป้องกันเห็บ/หมัด
หากมีข้อสงสัยติดต่อได้ที่เบอร์ 061-9126916 เจ้าหน้าที่กองสาธารณสุขเทศบาลตำบลเทพารักษ์
26-27 สิงหาคม 2566 ดนตรีในสวน ณ สวนปทุมวนานุรักษ์
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีต
ขอเชิญชมการแสดงดนตรีในสวน ณ สวนปทุมวนานุรักษ์
วันเสาร์ที่ 26 และวันอาทิตย์ที่ 27 สิงหาคม 2566
พบกับการแสดงดนตรี 3 ชิ้น พร้อมนักร้องคุณภาพกับแนวเพลงสบายๆ
โดย วง Bangkok Trio
เริ่มเวลา 17:00 น
12-13 สิงหาคม 2566 ดนตรีในสวนกรุงเทพมหานคร สวนปทุมวนานุรักษ์
ชวนไปชมสวนสวยและฟังดนตรีในสวน สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีต ขอเชิญชมการแสดง "ดนตรีในสวนกรุงเทพมหานคร" ใน "กิจกรรมอนุรักษ์ ฟื้นฟู และเผยแพร่ศิลปะการดนตรีเพื่อประชาชนกรุงเทพมหานคร" วันเสาร์ที่ 12 สิงหาคม 2566 วง Bangkok Trio ???? วันอาทิตย์ที่ 13 สิงหาคม 2566 วง In & Out ณ สวนปทุมวนานุรักษ์ เริ่ม 17:00 น.
The Voices & The Four Seasons
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีต
ขอเชิญชมการแสดงดนตรี
"The Voices & The Four Seasons”
โดย วง Bangkok Metropolitan Orchestra
Flute soloist: Bunnaphat Tangpaiboon
Voice soloist: Pattanan Art-ong & Krittathad Pisuttiwong
Violin soloist: Chanya Charoensook, Pongsit Karnkriangkrai, Ittipat Pisalchaiyapol & Chanasorn Chantarapaoraya
Conductor: Soraphot Worasaeng
Program
W.A. Mozart:
- Divertimento in D major, K. 136, Allegro
- Flute Quartet in D major, K. 285, Allegro
- Non più andrai
- Vedrai Carino
- Là ci darem la mano
A. Vivaldi: The Four Seasons
วันอาทิตย์ที่ 13 สิงหาคม 2566 เวลา 15.00 น. ณ ห้องอเนกประสงค์ ชั้น 1 หอศิลปวัฒนธรรมกรุงเทพมหานคร เข้าชมฟรี สอบถามรายละเอียด : 082-5569145
ดนตรีในสวน ณ สวนปทุมวนานุรักษ์ 5-6 สิงหาคม 66
ชมการแสดง "ดนตรีในสวนกรุงเทพมหานคร" ใน "กิจกรรมอนุรักษ์ ฟื้นฟู และเผยแพร่ศิลปะการดนตรีเพื่อประชาชนกรุงเทพมหานคร" วันเสาร์ที่ 5 สิงหาคม 2566 วง Bangkok Trio วันอาทิตย์ที่ 6 สิงหาคม 2566 วง Bangkok Woodwind Quintet ณ สวนปทุมวนานุรักษ์ เริ่ม 17:00 น.
โรงพยาบาลไทยนครินทร์ จัดกิจกรรม Mother Class เปลี่ยนคุณแม่มือใหม่…สู่คุณแม่สายสตรอง
โรงพยาบาลไทยนครินทร์ จัดกิจกรรม Mother Class เปลี่ยนคุณแม่มือใหม่…สู่คุณแม่สายสตรอง เตรียมความพร้อมสำหรับคุณแม่ตั้งครรภ์ และคำแนะนำสำหรับคุณพ่อคุณแม่มือใหม่ เพื่อเสริมสร้างความมั่นใจ พร้อมต้อนรับสมาชิกตัวน้อยๆ ของครอบครัว ภายในงานมีกิจกรรมให้ความรู้ ครรภ์คุณภาพ โดยพยาบาลแผนกสูติ-นรีเวช วิธีการคลอดบุตร โดยพยาบาลแผนกห้องคลอด ‘โภชนาการสำหรับคุณแม่ตั้งครรภ์’ โดยนักกำหนดอาหาร และกิจกรรม Workshop สาธิตการอาบน้ำทารกแรกเกิดโดยพยาบาลวิชาชีพแผนกทารกแรกเกิด รวมถึงกิจกรรม DIY Hello Hello Baby สื่อสารภาษารักจากคุณแม่สู่ลูกน้อยในครรภ์ ซึ่งมีคุณพ่อคุณแม่ตั้งครรภ์ให้ความสนใจ เข้าร่วมกิจกรรมเป็นจำนวนมาก เมื่อวันอาทิตย์ที่ 6 สิงหาคม 2566 ณ ห้องประชุมชั้น 4ปฏิทินท่องเที่ยวจังหวัดเชียงราย เดือนสิงหาคม-กันยายน 2566
Craft Cuisine & Cosmetics 2023 วันที่ 4-5 สิงหาคม 2566
งาน Craft Cuisine & Cosmetics 2023 พบกับงานคราฟท์ที่ดีที่สุดของพัทลุง และ ครั้งแรกกับแหล่งรวมร้านเด็ด งานคราฟท์ในพัทลุง ณ มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง
พบกับของหรอยพัทลุง และของสวย ๆ งาม ๆ จากเบรนเครื่องสำอางมากมาย มากับ Concept งาน “ชิมของหรอย joy งานคราฟท์ อิ่มอารมณ์ ชมดนตรี” วันที่ 4-5 สิงหาคม 2566 ณ หลาดริมชล มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง ตั้งแต่ 10.00 น. - 22.00 น. ของทุกวัน ภายในงานพบกับบูธต่างๆ กว่า 100 ราย และกิจกรรมมากมายให้เพลิดเพลิน
- ร้านอาหารและเครื่องดื่ม จากร้านดังทั่วทั้งจังหวัดพัทลุง
- ร้านเครื่องสำอางที่หลากหลาย
- งานคราฟท์
- ดนตรีในสวนที่จะสร้างบรรยากาศตลอดทั้งงาน
- การประกวดแข่งขันอาหารพื้นบ้าน และเชฟรุ่นเยาว์
- นวัตกรรมสุดล้ำและผลงานวิจัยสุดเจ๋ง ด้านอาหารและเครื่องสำอาง ของดีพัทลุง
งานคราฟท์พัทลุง ณ มหาวิทยาลัยทักษิณ วิทยาเขตพัทลุง
24 สิงหาคม 2565 วัดสิงห์ เขตจอมทอง
"สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่นๆ อีกมากมาย ในวันที่ 24 สิงหาคม 2565 ตั้งแต่เวลา 08.00 ถึง 14.00 น. ณ วัดสิงห์ เขตจอมทอง กรุงเทพมหานคร
ปั่นปันรัก 2022 CHARITY RIDE BIKE TOUR 11 ก.ย.65 รร.นายร้อย นครนายก LINK
กิจกรรม ”ปั่นปันรัก 2022” GiveCare&Share CHARITY RIDE BIKE TOUR
วันอาทิตย์ที่ 11 กันยายน 2565 ณ ลานกองบัญชาการโรงเรียนนายร้อยพระจุลจอมเกล้า จังหวัดนครนายก
ปั่นจักรยานเพื่อการกุศล เพื่อคนตาบอดพิการซ้ำซ้อน ศูนย์ส่งเสริมพัฒนาอาชีพคนตาบอดพิการซ้ำซ้อน นครนายก (บ้านรื่นสุข) จัดโดย มูลนิธิธรรมิกชนเพื่อคนตาบอดในประเทศไทย ในพระบรมราชูปถัมภ์
สอบถามข้อมูลเพิ่มเติมได้ตั้งแต่เวลา08.00-17.00ค่ะ (โทรศัพท์084-362-3860)
บางกอกกำลังดีที่สวนเสรีไทย 7 ส.ค.65 LINK
บางกอกกำลังดีที่สวนเสรีไทย
สัปดาห์เราชวนทุกคนย้ายมากรุงเทพฝั่งตะวันออกกัน สวนเสรีไทย หรือ สวนน้ำบึงกุ่ม ภายใต้แนวคิด พื้นที่เล่น เรียนรู้ ไอเดียสร้างสรรค์ อิสระทางความคิด ในงานมีกิจกรรมที่หลากหลายเหมาะกับทุกช่วงวัยเพื่อสร้างการเรียนรู้ ได้ชม ได้ลองทำ ได้เล่นในพื้นที่สวนสาธารณะขนาดย่อม ๆ ย่านบึงกุ่มนี้ โดยกิจกรรมจะมีอะไรไปดูกัน!
เวทีการแสดง
• 16:30 - 17:30 การแสดงจากชุมชนเขตบึงกุ่ม
• 17:30 - 17:50 การแสดงขิมและเต้นประกอบเพลงโดยผู้พิการทางสติปัญญา ทีม DBK-T21 (DownSyndrome Bangkok - Trisomy 21)
• 17:50 - 18:30 วง S2S (From Street to Stars) จากมูลนิธิสถาบันดนตรีคนตาบอด
• 18:30 - 19:20 เกิบ ณัฐพงศ์
• 19:20 - 20:30 Stoondio
กิจกรรมจากเครือข่ายบางกอกกำลังดี
• Free Play "มูลนิธิเพื่อนเยาวชนเพื่อการพัฒนา (มยพ.)"
• กิจกรรมจากพลเมืองอาสา "มูลนิธิอาสาสมัครเพื่อสังคม (มอส.)"
• บูธนวดหมอบ้าน ๆ "มูลนิธิอาสาสมัครเพื่อสังคม (มอส.)"
• หุ่นมือจากผ้า "สวนครูองุ่น"
• เวิร์คชอปชรารีไซเคิล "โครงการชรารีไซเคิล มูลนิธิกระจกเงา"
• เพ้นท์หน้า, แยกขยะ, ขายต้นไม้ "คลองเตยดีจัง"
• กระดานดำระดมไอเดีย "สภาเด็กและเยาวชนกรุงเทพฯ"
• บางกอกในฝัน "สมาคมคนรุ่นใหม่กับนวัตกรรมทางสังคม SYSI"
และจากเครือข่ายอื่น ๆ อีกมากมาย
กิจกรรมที่น่าสนใจในเดือนวิทยาศาสตร์
• หมวกกันน็อคที่โดนฝนมักมีเชื้อโรคซ่อนอยู่สามารถนำหมวกกันน็อคมาฆ่าเชื้อโรคได้ ในบูธเครื่องฆ่าเชื้อโรคในหมวกกันน็อก "ทีม NWM..Safety Roads 3 Plus"
กิจกรรมน่าสนใจในบรรยากาศสบาย ๆ วันอาทิตย์ที่ 7 สิงหาคม เวลา 16.00 - 20.30 น. เตรียมตัวให้พร้อม พกอุปกรณ์กันฝน มาเล่น มาเรียนรู้ไปด้วยกัน
รวมกัญคนรักลุงดำ KD’s family day 10-11 ก.ย.65 LINK
รวมกัญคนรักลุงดำ KD’s family day 10 กันยายน 2565
ร่วมเฉลิมฉลองวันคล้ายวันเกิดของพ่อดำในปีที่กัญชาเสรี บนชายหาดโตนด เกาะเต่า
ดื่มด่ำบรรยากาศอบอุ่นกับครอบครัว KD Family แบ่งปันความเมตตาพึ่งพารักษากัญ พร้อมทั้งศิลปินอาธิ จ๊อบ บรรจบ, ศรีราชาร็อคเกอร์, จูโฟอี ฯลฯ Free Entry ไม่เสียค่าเข้างาน บริจาคตามศรัทธา #พิเศษสำหรับท่านที่สนใจร่วมบุญใหญ่
รายได้หลังหักค่าใช้จ่าย #ลุงดำจะนำไปจัดซื้ออุปกรณ์การแพทย์ให้โรงพยาบาลเกาะเต่า และอื่นๆ เพื่อช่วยให้คนท้องถิ่นและนักท่องเที่ยวได้มีเครื่องมือแพทย์ในการรักษาชีวิต
3 ก.ย.65 อบรมเชิง workshop หลักสูตรวิธีการปลูกและนำกัญชามาใช้เพื่อดูแลสุขภาพในครัวเรือน LINK
ประชาชนต้องรู้เรื่องกัญชาเพื่อดูเเสุขภาพในครัวเรือน
ศูนย์บูรณาการความรู้กัญชา (CKC) ขอเชิญเข้าร่วมอบรมเชิง workshop หลักสูตรวิธีการปลูกและนำกัญชามาใช้เพื่อดูแลสุขภาพในครัวเรือน
โดยคณะวิทยากรผู้เชี่ยวชาญ ได้แก่
ผศ. ดร.วิวัฒน์ ศรีวิชา (อ.โจ), คุณจีราวรรณ กมลทินเวทย์ (นก อิตาลี) , อ.เกรียงศักดิ์ บุญรักษ์เจริญ (อ.ติ๊ก) และ อ.สุมิตร วิจิตรภูรี (อ.น้ำ)
กำหนดการจัดอบรม
รุ่นที่ 1 : วัน เสาร์ ที่ 3 กันยายน 2565
เวลา 9.00 - 16.00 น.
อบรม ณ อาคารศูนย์บูรณาการความรู้กัญชา (CKC) โรงพยาบาลศรีธัญญา
บริจาคเข้าร่วมคอร์สอบรมเชิง workshop พร้อมรับใบประกาศนียบัตร 950 บาท ได้ที่ธนาคารกรุงไทย บัญชีออมทรัพย์ เลขที่ 130-0-29950-9 ชื่อบัญชี "กองทุนบูรณาการสมุนไพรเพื่อผู้ป่วย โดยมูลนิธิโรงพยาบาลศรีธัญญา"
(*) เงินบริจาคหลังหักค่าใช้จ่ายร่วมสมทบทุนมูลนิธิโรงพยาบาลศรีธัญญาและโครงการรักษาผู้ป่วยมะเร็งยากไร้ด้วยพืชกัญชาและสมุนไพรไทย
สอบถามข้อมูลเพิ่มเติม
ศูนย์บูรณาการความรู้กัญชา (CKC)
โทร 02-046-6559 (คุณเบญ), 063-409-0004 (คุณอัญ), 092-278-1804 (คุณภา)
หลักสูตรอบรม การจัดตั้งโรงพยาบาลต้นแบบเพื่อการใช้สมุนไพร (ควบคุม) ในโรคมะเร็งทั่วไปและอัลไซเมอร์ 10 ก.ย.65 LINK
ศูนย์สมุนไพรควบคุม (กระท่อม กัญชา กัญชง) ร่วมกับ โรงพยาบาลวิภาวดีปิยราษฎร์ อ.อู่ทอง จ.สุพรรณบุรี เปิดรับสมัคร 7 กลุ่มวิชาชีพทางการแพทย์ รวมถึงผู้ประกบอการภาคประชาชนทั่วไป ที่สนใจดำเนินกิจการคลินิก โรงพยาบาลหรือเปิดกิจการร้านค้า จำหน่ายสินค้าสมุนไพร (ควบคุม) เข้าร่วม หลักสูตรอบรม การจัดตั้งโรงพยาบาลต้นแบบเพื่อการใช้สมุนไพร (ควบคุม) ในโรคมะเร็งทั่วไปและอัลไซเมอร์
วันที่ 10 กันยายน 2565 เวลา 20-21.30 น.
โดยวิทยากร นายแพทย์สมนึก ศิริพานทอง ประธานศูนย์สมุนไพรควบคุม
นายแพทย์กวี ไชยศิริ แพทย์ที่ปรึกษาศูนย์สมุนไพรควบคุม
แพทย์หญิงอรวรรณ เมธาดิลกกุล ที่ปรึกษาด้านกฏหมายทางการแพทย์
สมัครและสอบถามรายละเอียดเพิ่มเติมที่ทีมสหวิทยาการศูนย์สมนไพรควบคุม โทร.063-2291469
สัมมนาออนไลน์ เรื่อง กัญชากับการแพทย์และข้อควรระวัง 23 ก.ย.65 LINK
ราชวิทยาลัยอายุรแพทย์แห่งประเทศไทย เชิญชวนเข้าร่วมสัมมนาออนไลน์ เรื่อง กัญชากับการแพทย์และข้อควรระวัง ในวันศุกร์ที่ 23 กันยายน 2565 เวลา 12:00 – 13:30 น.
วิทยากรและผู้ดำเนินรายการ
ผศ. นพ.สหภูมิ ศรีสุมะ อายุรแพทย์พิษวิทยา คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี วิทยากร
นพ.เมธา อภิวัฒนากุล อายุรแพทย์โรคระบบประสาท สถาบันประสาทวิทยา
พญ.อาภาศรี ลุสวัสดิ์ ประสาทกุมารแพทย์ สถาบันประสาทวิทยา
KhonKaen Coffee Society 2023
KhonKaen Coffee Society 2023 วันที่ 12 - 17 กันยายน 2566 ณ ลานโปรโมชั่นชั้น 1 เซ็นทรัล ขอนแก่น
Scenic Half Marathon Krabi 2023 วันที่ 9 - 10 ก.ย.66 LINK
ซีนิคฮาล์ฟมาราธอนกระบี่ 2023 SCENIC HALF MARATHON KRABI 2023 - RUN TO THE HORIZON RUN ROMANTIC วันที่ 9 - 10 กันยายน 2566 เส้นทางวิ่งสุดฟินพิชิตเส้นขอบฟ้า บนถนนสายโรแมนติก ปล่อยตัว : ณ อุทยานแห่งชาติหาดนพรัตน์ธารา-หมู่เกาะพีพี ต.อ่าวนาง อ.เมือง จ.กระบี่ ประเภทการแข่งขัน Beach Run ระยะ 3 KM / 5 KM / Half Marathon 21.1 KM / Mini Marathon 10 KM
งานวิ่ง River Kwai International Half Marathon ปีที่ 39 วันที่ 9-10 ก.ย.66 LINK
โลเคชั่นกลางขุนเขา และมีสายหมอกในตอนเช้า กับสนามวิ่งที่ทุกคนคิดถึง
ประเภทการวิ่ง ฟันรัน 3 Km / ควอเตอร์ มาราธอน 10.550 Km / ฮาล์ฟ มาราธอน 21.1 Km / Lover River Kwai 39 Km
วันที่ 9 กันยายน 2566
รับ Race Pack(เสื้อและหมายเลขวิ่ง ทุกระยะ) @River Kwai Village
ระยะ FunRun ปล่อยตัว 17.00 น.
วันที่ 10 กันยายน 2566 @River Kwai Village
ระยะ 39 KM ปล่อยตัวเวลา 04:30 น.
ระยะทาง 21.1 KM ปล่อยตัวเวลา 05:30 น.
ระยะทาง 10.550 KM ปล่อยตัวเวลา 06:00 น.
ตารางทำหมันออกหน่วยเคลื่อนที่ เดือนกันยายน 2566
21 กันยายน 2565 @วัดลาดกระบัง
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 21 กันยายน 2565 ตั้งแต่เวลา 08.00-14.00 น. ณ วัดลาดกระบัง เขตลาดกระบัง พบกับกิจกรรมตรวจสุขภาพและต่างๆอีกมากมาย กิจกรรมดีๆแบบนี้พลาดไม่ได้แล้ว
Run For The Sea # 2 : ลูกชาวเล ตังเกชวนวิ่ง ประมงไทยชวนวิ่ง # 2 เสาร์ที่ 2 กันยายน 2566
Run For The Sea # 2 : ลูกชาวเล ตังเกชวนวิ่ง ประมงไทยชวนวิ่ง # 2 วันแข่งขันวิ่ง วันเสาร์ที่ 2 กันยายน 2566 ปล่อยตัว 17.00 น. หลังจากเข้าเส้นชัย มอบเหรียญ มอบถ้วย กันกรุบกริบ ก็สามารถร่วมกิจกรรมปล่อยพันธุ์สัตว์น้ำ ได้เลย จากนั้นก็ต่อด้วยคอนเสิร์ตของ "เบน ชลาทิศ" ซึ่งจัดไว้ให้กับนักวิ่ง เสริมทัพด้วยวงดนตรีมากความสามารถ คณะดนตรี "พ่อไก่แจ้" ที่จัดให้ผู้เข้าร่วมงานโดยเฉพาะ พร้อมกับร้านอาหาร บรรยากาศชิวริมทะเล โดยเครือข่ายชาวประมงบางสะพาน พี่ๆกลุ่มประมงพื้นบ้านภายในเครือข่ายฯ เช้าวันอาทิตย์ที่ 3 กันยายน 2566 ก็จะเป็นกิจกรรมของชาวประมงจัดให้สำหรับนักวิ่ง เช่น ปล่อยพันธุ์สัตว์น้ำ สร้างบ้านปลา (ทิ้งซั้ง) แข่งขันตกปลา และกิจกรรมชายหาดอื่นๆ รวมไปถึง ของที่ระลึก ของฝาก จากพี่ๆชาวประมง ปิดท้ายความสนุกด้วย รำวงย้อนยุค 2 เวที นางรำคณะรุ่งนภา เมืองเพชร นางรำคณะเพชรโสภา (ดาวรวมใจ) กองเชียร์รำวง แสนรัก ชูดวง เพชรบุรี 99
ปั่นท่องเที่ยววิถีถิ่น กินลม ชมธรรมชาติและประวัคิศาสตร์ 9-10 กันยายน 2566 อ.หัวหิน
ปั่นท่องเที่ยววิถีถิ่น กินลม ชมธรรมชาติและประวัคิศาสตร์ 9-10กันยายน 2566 อ.หัวหิน
ปั่นท่องเที่ยววิถีถิ่น กินลม ชมธรรมชาติแลประวัติศาสตร์ @ท่าเสด็จ 9-10 กันยายน 2566 LINK
ปั่นท่องเที่ยววิถีถิ่น กินลม ชมธรรมชาติแลประวัติศาสตร์ @ท่าเสด็จ
9-10 กันยายน 2566
หัวหิน”กับการปั่นเพื่อส่งเสริมแหล่งท่องเที่ยวโดยเริ่มต้นปั่นจากอุทยานราชภักดิ์ มุ่งสู่ค่ายธนะรัชต์ ซึ่งเป็นเส้นทางธรรมชาติที่สวยงามทั้งสองข้างทาง พร้อมทั้ง มีประวัติศาตร์ที่เก่าแก่และต้นไม้ใหญ่นานาพันธุ์ ให้ศึกษาอย่างมากมาย และยังเป็นการส่งเสริม การใช้จักรยานเพื่อการท่องเที่ยวและออกกำลังกาย ในพื้นที่หัวหินและใกล้เคียง.
สถานที่จัดงาน
ลานอุทยานราชภักดิ์ จ.ประจวบคีรีขันธ์
วันอาทิตย์ 10 กันยายน 2566
ประมงไทยชวนวิ่ง #2 วันเสาร์ที่ 2 ก.ย.66 LINK
ประมงไทยชวนวิ่ง #2 วันเสาร์ที่ 2 กันยายน 2566 ปล่อยตัว 17:00 น. ณ ชายหาดดอนสำราญ ต.แม่รำพึง อ.บางสะพาน จ.ประจวบคีรีขันธ์ หลังจากวิ่งเสร็จ มีกิจกรรมคอนเสิร์ตสุดชิล ศิลปิน เบน ชลาทิศ และกิจกรรมอื่นๆอีกเพียบ
ค่ายบางกุ้งรัน 24 ก.ย.66 LINK
ค่ายบางกุ้งรัน 24 ก.ย.66 *** ประกาศวันเคลื่อนทัพ *** หลังจากท่านเจ้าพระยา เรียกแม่ทัพ นายกอง ท่านหมื่น ท่านขุน เข้าประชุมโดยพร้อมเพรียง ดูค่ำแรม แลทิศทางลม อีกทั้งเส้นทางเคลื่อนทัพ ก็ได้ข้อสรุป พวกเราจักเคลื่อนทัพเรือเพื่อเข้าตีข้าศึก ในรุ่งสางวันอาทิตย์ ขึ้น ๑๐ ค่ำ เดือนสิบ ปีเถาะ (๒๔ กันยายน ๒๕๖๖) และจะเปิดให้เกณฑ์ไพร่พลเร็วๆนี้ พวกเจ้าจงรอพลุสัญญาณ รอเสียงระรัวกลอง อีกไม่กี่ทิวาราตรี สหายข้าจักได้รบเคียงบ่าไหล่ เพื่อปกป้องแผ่นดินสยาม...อีกครา
งาน “กว่าง” ยอดนักสู้แห่งล้านนา (Chiang Rai Beetles Festival 2023)
ขอเชิญชวนร่วมงาน “กว่าง” ยอดนักสู้แห่งล้านนา (Chiang Rai Beetles Festival 2023)
ระหว่างวันที่ 8 – 9 กันยายน 2566 ณ สวนรุกขชาติโป่งสลี ต.สันทราย อ.เมืองเชียงราย จ.เชียงราย สอบถามรายละเอียดเพิ่มเติมได้ที่
Run Mun Kan Festival 2023 - 2 ก.ย.66 LINK
“Run Mun Kan Festival 2023”
คอนเสิร์ตจากศิลปินดัง
ร้านค้าร้านอาหารชื่อดัง
จุดถ่ายรูปสุดคลู
กิจกรรม night run
วันที่ 2 กันยายน 2566
ณ บริเวณลานข้างองค์การบริหารส่วนจังหวัดกาญจนบุรี
ร่วมกิจกรรมฟรีตลอดงาน!!!!!
จัดโดย องค์การบริหารส่วนจังหวัดกาญจนบุรี
บางน้ำผึ้งRun 2023 อาทิตย์ที่ 10 ก.ย.66 LINK
บางน้ำผึ้ง จะหวานสมชื่อ มีวัตถุประสงค์เพื่อกระตุ้นการใช้จ่ายในกลุ่มผู้ชื่นชอบการออกกำลังกายมาร่วมกิจกรรมในพื้นที่จังหวัดสมุทรปราการ โดยความร่วมมือกับหน่วยงานภาครัฐและเอกชนในพื้นที่ โดยเน้นการเดินทางท่องเที่ยวเชิงสุขภาพ ส่งเสริมให้เกิดการเดินทางแบบอนุรักษ์สิ่งแวดล้อมในกลุ่มนักท่องเที่ยว ผ่านการจัดกิจกรรมเพื่อการเรียนรู้ ทั้งด้านธรรมชาติ วิถีชีวิตชุมชน หรือกิจกรรมเพื่อส่งเสริมการท่องเที่ยวอื่นๆ ที่เกี่ยวข้อง งานจัดวันอาทิตย์ที่ 10 กันยายน 2566
ณ ลานอเนกประสงค์บางน้ำผึ้ง ตำบลบางน้ำผึ้ง จ. สมุทรปราการ
CHONBURI AUTHENTIC HALF MARATHON 2023 วิ่งคนชนวิ่งควาย 24 ก.ย.66 LINK
CHONBURI AUTHENTIC HALF MARATHON 2023 วิ่งคนชนวิ่งควาย วันอาทิตย์ที่ 24 กันยายน 2566 ณ สะพานชลมารควิถี 84 พรรษา จังหวัดชลบุรี จุดปล่อยตัวบริเวณหน้าสวนสาธารณะตำหนักน้ำ จังหวัดชลบุรี ระยะ 21 K / 10K / 5K รุ่นอายุ ต่ำกว่า 18 ปี (ชาย-หญิง) 18-29 ปี 30-39 ปี 40-49 ปี 50-59 ปี 60ปี ขึ้นไป Tel : 099-8989919
Boncafe Thailand Workshop เดือนกันยายน 8 จังหวัด ท่านละ 500 LINK
Workshop ที่คนอยากมีธุรกิจกาแฟไม่ควรพลาด! เดือนกันยายนนี้ 8 จังหวัด
1. Workshop ที่ จ.กาญจนบุรี หัวข้อ : Introduction for Cafe Business & Coffee Recipe วันที่: 7 กันยายน 2566
2. Workshop ที่กรุงเทพฯ หัวข้อ: Specialty Coffee & Create your owned blend วันที่: 9 กันยายน 2566
3. Workshop จังหวัดระยอง หัวข้อ: Introduction for Cafe Business & Coffee Recipe วันที่: 12 กันยายน 2566
4. Workshop ที่ จังหวัดพิษณุโลก หัวข้อ: Master Flavors & Drink Mixologist วันที่: 14 กันยายน 2566
5. Workshop ที่ จังหวัดกำแพงเพชร หัวข้อ: Introduction for Cafe Business & Coffee Recipe วันที่: 15 กันยายน 2566
6. Workshop ที่ จังหวัดพังงา หัวข้อ: Introduction for Cafe Business & Coffee Recipe วันที่: 19 กันยายน 2566
7. Workshop ที่ จังหวัดอุดรธานี หัวข้อ: Introduction for Cafe Business & Coffee Recipe
วันที่: 22 กันยายน 2566
8. Workshop ที่ จังหวัดเชียงใหม่ หัวข้อ: Introduction for Cafe Business & Coffee Recipe วันที่: 26 กันยายน 2566
ราคาท่านละ 500.- (รวม VAT แล้ว) รีบลงทะเบียนก่อนใคร เพราะรับจำนวนจำกัด
16 - 17 ก.ย. 66 Sukhothai Coffee Carnival สุโขทัย คอฟฟี่ คาร์นิวัล ครั้งที่ 1
Sukhothai Coffee Carnival x Thailand Coffee Brewer League งานเทศกาลกาแฟครั้งแรกในสุโขทัย จัดวันที่ 16 - 17 ก.ย. 66 ณ พร้อมจันทร์ คาเฟ่ เมืองเก่า สุโขทัย งานเทศกาลกาแฟในสุโขทัยที่ รวมร้านกาแฟ กว่า 30 บูัท ร้านดังมากมาย เมล็ดกาแฟมีให้เลือกซื้อ กิจกรรมให้ความรู้เกี่ยวกับการทำกาแฟจาก DripKing เมืองไทย คุณปิ จาก Gallery กาแฟดริป
14 - 17 ก.ย. 66 งาน The Coffee Calling 2023: The Escape to Coffee Party @The Emquartier
งาน
The Coffee Calling 2023: The Escape to Coffee Party จัดขึ้นระหว่างวันที่ 14 - 17 กันยายน 2566 ที่ Q Stadium, ชั้น M, ศูนย์การค้า The Emquartier โดยไม่มีค่าใช้จ่ายในการเข้าชมงาน ปีนี้ The Coffee Calling จึงอยากพาทุกคนเข้าสู่โลกของกาแฟ ผ่านธีมงาน The Escape to Coffee Party ห้างสรรพสินค้ายุค 90 ที่วัยรุ่นพร้อมโดดเรียน วัยทำงานพร้อมโดดงาน เพื่อประสบการณ์สุด สนุกในปาร์ตี้นี้ ในบริเวณงานแบ่งเป็น 4 โซน ได้แก่ Theater, Food Court, Minimart และ Game Zone
Healthy RUN 2023 วิ่ง สหกรณ์ออมทรัพย์ รพ.อต. 17 ก.ย.66 LINK
Healthy RUN 2023 วิ่ง สหกรณ์ออมทรัพย์ รพ.อต. ซุปเปอร์มินิมาราธอน วิ่งวันที่ 17 กันยายน 2566 จุดสตาร์ท หน้าสวนสาธารณะเทศบาลเมืองอุตรดิตถ์ ระยะทาง 5 / 13 กิโลเมตร จัดโดยสหกรณ์ออมทรัพย์โรงพยาบาลอุตรดิตถ์ คณะดำเนินการสมาชิกสหกรณ์ออมทรัพย์โรงพยาบาลอุตรดิตถ์
Cat A Meow Cat A Day 2023 วันที่ 1 - 3 กันยายน 2566 เซียร์ รังสิต
Cat A Meow Cat A Day 2023 คาเฟ่แมว DIY ปลอกคอแมว บูธถ่ายรูป ร้านอาหารน้อนแบรนด์ต่างๆ และกิจกรรมมากมาย งานประกวดแมวหลากหลายสายพันธุ์ โดย CENTRAL BREED CAT CLUB งานที่ทาสแมวจะพลาดไม่ได้ สามารถเข้ามาดูน้องแมวน่ารักๆ ร่วมชมการประกวด และช้อปสินค้าน้อนเหมียวกันได้ที่ เซียร์รังสิต...เหมียว วันที่ 1 - 3 กันยายน 2566 ณ ลานโปรโมชั่น ชั่น 2 ศูนย์การค้าเซียร์ รังสิต
PAWSITIVE POTIONS: Unleashing CBDs magic for pets. Quince Bangkok
To conclude a week-long International Dog’s Day celebration, Quince is proud to co-present with DR PET CBD and MyFriend, a gathering for our furry friends and their owners. In this daytime event, pet owners and their pets meet up for an afternoon of food, drinks, treats, and talks with pet health and grooming specialists.
Highlights include: A talk with K.Pornchai (Dr. Pet CBD) and Siam Green, with Willy McIntosh, followed by a Q&A session. A market featuring multiple vendors such as
APET (Food topping)
BOO & KO (Treats)
CHUMMY CHARM (Postbiotics and probiotics)
DR PET CBD (CBD pet products)
HOSPETAL by PRS Center (Pet hospital, free nail clipping, and ear clearing)
HOYA BARKERY (Pet snacks)
READY TO WOOF (Pet supplies)
SIAM GREEN (CBD products)
SATURDAY, SEPTEMBER 2, 2023 AT 12 PM @Event by Quince Bangkok and MyFriend - Furever Connected
pet market by หมาติดเที่ยว 21-24 กันยายน 2566@Megabangna
pet market by หมาติดเที่ยว 21-24 กันยายน 2566 Megabangna Shoppingcenter พบกับบูธสินค้าบริการเกี่ยวกับสัตว์เลี้ยงกว่า 40 บูธ ให้เลือกช้อปแบบจุใจ ร้านค้าเด็ด ร้านดังจากใน IG พร้อมโปรโมชั่นมากมายภายในงาน
Paws & Play A Pet-Lovers Gathering @The Salil Hotel Riverside - Bangkok 1 กันยายน 2566
1 กันยายน 2566 ที่ The Salil Hotel Riverside - Bangkok ครั้งแรกกับบรรยากาศ afternoon tea ริมแม่น้ำเจ้าพระยา ให้คุณกับลูกรักสี่ขาได้เพลิดเพลินด้วยกัน และพบกับกิจกรรมปรับพฤติกรรมสัตว์เลี้ยงกับครูฝึกสุนัขชื่อดัง และ สนุกสนานกับ workshop เพ้นคุกกี้น้องหมาน้องแมว และยังได้ช้อปเพลินๆกับ minimarket จากหมาติดเที่ยวภายในงานอีกด้วย
งาน Lets go wow ทับสะแก 1-10 กันยายน 2566
งาน Let’s go wow ทับสะแก 1-10 กันยายน 2566 ณ ลานเอนกประสงค์ ชายหาดทับสะแก สวนสนุกชุดใหญ่ ศิลปินดังทุกคืน ชม ศิลปะการแสดงพื้นบ้าน ของพี่น้องชาวทับสะแก ชิมอาหารทะเลสดๆ เนื้อวากิวจากฟาร์ม อาหารนานาชาติ อาหารฮาลาล ช็อปสินค้าราคาถูก สินค้าโอทอป ศิลปินดัง อาทิ คนด่านเกวียน เต็มวง เฟิร์ส พรชิตา พัทลุง มาลีฮวนนา วุฒิ ป่าบอน ฯลฯ
ดนตรีในสวนปทุมวนานุรักษ์ ทุกสุดสัปดาห์ เสาร์-อาทิตย์ เดือนกันยายน LINK
สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีตขอเชิญชมการแสดง "ดนตรีในสวนกรุงเทพมหานคร" เริ่ม 17:00 น.
- วันเสาร์ที่ 29 กรกฎาคม 2566 วง Bangkok Trio
- วันอาทิตย์ที่ 30 กรกฎาคม 2566 วง Bangkok Brass Quintet+1
- วันเสาร์ที่ 5 สิงหาคม 2566 วง Bangkok Trio
- วันอาทิตย์ที่ 6 สิงหาคม 2566 วง Bangkok Woodwind Quintet
- วันเสาร์ที่ 12 สิงหาคม 2566 วง Bangkok Trio
- วันอาทิตย์ที่ 13 สิงหาคม 2566 วง In & Out
- วันที่ 19-20 สิงหาคม 2566 วงดนตรีกรุงเทพมหานคร BKK Jazz Group
- วันเสาร์ที่ 26 และวันอาทิตย์ที่ 27 สิงหาคม 2566 วง Bangkok Trio วง 3 ชิ้น พร้อมนักร้องคุณภาพกับแนวเพลงสบายๆ
- วันเสาร์ที่ 2 กันยายน 2566 วง Bangkok Trio
- วันอาทิตย์ที่ 3 กันยายน 2566 วง Bangkok Brass Quintet
- วันเสาร์ที่ 9 กันยายน 2566 วง Lit It Up DJ Jib Swing Dance Class วง The Stumbling Swingout
- วันอาทิตย์ที่ 10 กันยายน 2566 วง In & Out
- วันพฤหัสบดีที่ 14 กันยายน 2566 พบกับวงดนตรี Classis ที่จะมอบความสุขด้วยเสียงเพลงในบรรยากาศดนตรีในสวน วง Bangkok String Ensemble
- วันศุกร์ที่ 15 กันยายน 2566 : วง Bangkok Brass Quintet วงดนตรีเครื่องเป่า 5 ชิ้น และคาฮ่อง กับเพลงสนุกๆตามสไตล์เครื่องเป่า
- เสาร์ที่ 16 กันยายน 2566 : วง Tubo Eupha น้องๆเยาวชนจากสาขาวิชาดนตรีศึกษา คณะมนุศยศาสตร์และสังคมศาสตร์ มหาวิทยาลัยราชภัฏวไลยอลงกรณ์ ในพระบรมราชูปถัมภ์
- วันอาทิตย์ที่ 17 กันยายน 2566 วงดนตรี 5 หนุ่ม น้องใหม่ไฟแรง ชาวคณะ Koy & Friend
- วันเสาร์ที่ 23 กันยายน 2566 วงดนตรั 3 ชิ้น พร้องนักร้องคุณภาพจากกรุงเทพมหานคร วง Bangkok Trio Band
- วันอาทิตย์ที่ 24 กันยายน 2566 วงดนตรีเครื่องลมไม้ ซึ่งเป็นหนึ่งในกลุ่มเครื่องดนตรีสำคัญในวงออเคสตร้า กทม. วง Bangkok Woodwind Quintet
- วันเสาร์ที่ 30 กันยายน 2566 ไปชิลล์กับวงอคูสติก 3 ชิ้น พร้อมนักร้องคุณภาพจากกรุงเทพมหานคร วง Bangkok Trio Band
- วันอาทิตย์ที่ 1 ตุลาคม 2566 เริ่มต้นเดือนตุลาคมด้วยวงดนตรีคลาสสิกแนวเพลงสบายๆ วง Bangkok String Ensemble
The street BKK Pet Expo 1-3 กันยายน 2566
ศูนย์การค้า เดอะ สตรีท รัชดา ชวนเหล่าบรรดาทาสผู้ซื่อสัตย์ มาสัมผัสโลกของสัตว์เลี้ยงหลากหลายสายพันธุ์ ในงาน “The Street BKK Pet Expo ฟินเฟ่อร์กับแก๊งสเตอร์บนเกาะ”
1-3 กันยายน 2566 11:00-22:00น. ชั้น 5 ศูนย์การค้าเดอะ สตรีท รัชดา
พบกับแก๊งสัตว์เลี้ยงน่ารักยกขบวนมาพักร้อนในธีมหมู่เกาะ เพลิดเพลินกับเหล่าสัตว์หลากหลายสายพันธุ์ เปิดประสบการณ์การเรียนรู้และสัมผัสโลกของสัตว์เลี้ยง อาทิ ฝูงนกมาคอว์ นกแก้วปากขอหลากหลายสายพันธุ์ นกทูแคน กระต่าย หนูแกสบี้ หนูฮิปโป ไก่สวยงามต่างประเทศ ฯลฯ สัตว์สายฟาร์ม ม้าแคระเชทแลนด์ แพะแองโกล่าสายพันธุ์ขนฟูที่สุดในโลก สัตว์นักล่า นกฮูกนานาชนิด งูยักษ์และสัตว์เลื้อยคลานมากมาย และพลาดไม่ได้กับความน่ารักของบรรดาเหล่าเซเลบสี่ขา ได้แก่ บารอล & บรูโน่เบน, ท่านเดฟ & น้องเดียร์ และไข่ต้มหมาอัจฉริยะ
พร้อมพบกับกิจกรรมสนุกๆภายในงานมากมาย
- Pet Exhibition : การจัดแสดงสัตว์เลี้ยง พร้อมเรียนรู้กับสัตว์หายากหลากหลายสายพันธุ์ 20 ชนิด กว่า 300 ตัว
- Pet Touching : สัมผัสสัตว์เลี้ยงและป้อนอาหารอย่างใกล้ชิด ทัชชิ่งปลาดาว จับมือน้องปลาดาวตัวเป็นๆ
- Pet Café : รวมแก๊งแมวเหมียวสุดน่ารัก สวรรค์ของทาสแมว
Workshop : เพ้นท์บูมเมอแรง เพ้นท์เฮนน่า เพ้นท์แม็คเนทรูปสัตว์ต่างๆ (สิทธิพิเศษเฉพาะสมาชิกเดอะ สตรีท พอยท์)
- Explorium by NSM : ค้นหาความมหัศจรรย์ของธรรมชาติวิทยา สวมบทบาทเป็นนักสำรวจ ตื่นตาตื่นใจกับสัตว์สตัฟฟ์ ใน Theme Insect world มหัศจรรย์โลกของแมลง กิจกรรมออกแบบและประดิษฐ์ที่คั่นหนังสือรูปแมลง จากองค์การพิพิธภัณฑ์วิทยาศาสตร์แห่งชาติ (อพวช.)
- Pet Competition : ชมการประกวดแมว นก และ ไก่
▪️ 2 ก.ย. 66 ประกวดแมวบ้านพันธุ์ทาง พันธุ์ผสม
▪️ 3 ก.ย. 66 ประกวดนกฟิ้นซ์เจ็ดสี และ ไก่ซารามอ
- Pet Show : ตื่นตากับโชว์สุดพิเศษ
▪️ 2 ก.ย. 66 โชว์สุนัขแสนรู้ จากน้องไข่ต้มหมาอัจฉริยะ
▪️ 2 - 3 ก.ย. 66 โชว์จาก PinTo the Snake และบ้านงูยิ้ม สาธิตวิธีการจับงู การเผชิญหน้ากับงูพิษ และให้ความรู้เกี่ยวกับงูพิษทุกชนิด
- Pet Talk : พูดคุยให้ความรู้เรื่องของไก่ จากชมรมไก่ต่างประเทศ
- หาเปลือกหอยในหาดทราย แลกรับ ลูกโป่ง PET CUTE ฟรี
พิเศษ! ตรวจสุขภาพสัตว์เลี้ยงภายในงาน ฟรี! และรับสิทธิซื้อแพ็คเกจสุขภาพสัตว์เลี้ยงราคาพิเศษภายในงานเท่านั้น จากโรงพยาบาลสัตว์คชาเว็ท โรงพยาบาลอันดับหนึ่งเรื่องศูนย์บริการสุขภาพสัตว์เลี้ยง
#TheStreetBKKPetExpo #Thestreethall #Thestreetratchada #Thestreet24hrs
Swing in the park ครั้งที่ 8 วันที่ 9 กันยายน 2566 LINK
Swing in the Park ครั้งที่ 8 กลับมาครั้งนี้ ณ สวนปทุมวนารักษ์ ข้างเซ็นทรัลเวิลด์ วันที่ 9 กันยายน 2566 เวลา 16.30 - 18.30 น. ร่วมสัมผัสความสนุกกับเสียงดนตรี Swing จากวง "The Stumbling Swingout" และจังหวะ Swing / Blues จากวง "Lit It Up" ในบรรยากาศที่ร่มรื่นของธรรมชาติใกล้ตึกสูงของเมืองใหญ่ และแน่นอนที่ขาดไม่ได้สำหรับมือใหม่ มาเริ่มเรียนเต้นสวิงกันกับคลาสเรียนเต้นสวิงฟรีจาก Jelly Roll Dance Club ใครไม่มีคู่ก็มาได้ ใครเต้นไม่เป็นก็มาได้ ปิดท้ายด้วย DJ Jib จะนำเสียงดนตรีสวิงเพื่อให้คุณพักผ่อน หรือทำไปพิกนิกกับเพลงได้ตลอดทั้งค่ำ มาร่วมเต้นไปกับเพลงสวิง หรือนอนพักผ่อนและให้เสียงดนตรีสร้างความเพลิดเพลินในเวลา picnic ไปก็ยังได้
ตารางบริการหน่วยทันตกรรมเคลื่อนที่ เดือนกันยายน 66
1 กันยายน 66 8.30-12.00 น. ศูนย์ฯ 40 สาขาวิจิตราอนามัย เขตบางแค
6 กันยายน 66 8.30-12.00 น. ชุมชนข้างวัดสุคันธาราม เขตดุสิต
11 กันยายน 66 8.30-12.00 น. ชุมชนสุโขทัย 9 เขตดุสิต
13 กันยายน 66 8.30-12.00 น. ศาลฏีกา เขตพระนคร
14 กันยายน 66 8.30-12.00 น. วัดม่วง เขตบางแคงานวิ่ง MSU NIGHT RUN 2023 "แลน-ปัน-ฮัก" 9 ก.ย.66
งานวิ่ง MSU NIGHT RUN 2023 "แลน-ปัน-ฮัก" Race day : 9 กันยายน 2566 ณ สนามกีฬากลาง 1 (สนามฟ้า) ข้างอาคารพลศึกษา มหาวิทยาลัยมหาสารคาม
facebook.com/msurunning201924 กันยายน 2566 Yaowarat Swing Dance อีเว้นเต้นสวิงใจกลางเยาวราช
The Hop presents “ Yaowarat Swing Dance” อีเว้นเต้นสวิงเคล้าเพลงแจ็สจากนักดนตรีระดับโลกที่บินมาแสดงในงานนี้ ปิดถนนใจกลางเยาวราช เป็น แดนซ์ฟลอร์ ปีนี้ มาในตีม #Inthemoodforswingdance ไม่ว่าคุณจะเป้นสายไหนก็มาร่วมเต้นด้วยกันได้ ค่ำคืนวันอาทิตย์ที่ 24 กันยายน 2566 เวลา 17.00-19.00 น ที่หน้ารร เซี่ยงไฮ้แมนชั่น กรุงเทพ ถนนเยาวราช !!
23-24 ก.ย.66 กิจกรรมดนตรีในสวนกรุงเทพมหานคร ณ สวนปทุมวนานุรักษ์
กิจกรรมดนตรีในสวนกรุงเทพมหานคร ณ สวนปทุมวนานุรักษ์
เสาร์ที่ 23 กันยายน 2566 พบกับวงดนตรั 3 ชิ้น พร้องนักร้องคุณภาพจากกรุงเทพมหานคร วง Bangkok Trio Band
อาทิตย์ที่ 24 กันยายน 2566 เชิญไปชมวงดนตรีเครื่องลมไม้ ซึ่งเป็นหนึ่งในกลุ่มเครื่องดนตรีสำคัญในวงออเคสตร้า กทม. วง Bangkok Woodwind Quintet
เริ่มเวลา 17:00 น.
14-17 ก.ย.66 ดนตรีในสวน สวนปทุมวนานุรักษ์
กิจกรรมดนตรีในสวนกรุงเทพมหานคร ณ สวนปทุมวนานุรักษ์
พฤหัสบดีที่ 14 กันยายน 2566 พบกับวงดนตรี Classis ที่จะมอบความสุขด้วยเสียงเพลงในบรรยากาศดนตรีในสวน วง Bangkok String Ensemble
ศุกร์ที่ 15 กันยายน 2566 พบกับวงดนตรีเครื่องเป่า 5 ชิ้น และคาฮ่อง กับเพลงสนุกๆตามสไตล์เครื่องเป่า วง Bangkok Brass Quintet
เสาร์ที่ 16 กันยายน 2566
พบกับน้องๆเยาวชนจากสาขาวิชาดนตรีศึกษา คณะมนุศยศาสตร์และสังคมศาสตร์ มหาวิทยาลัยราชภัฏวไลยอลงกรณ์ ในพระบรมราชูปถัมภ์ วง Tubo Eupha
อาทิตย์ที่ 17 กันยายน 2566 ปิดท้ายสัปดาห์นี้ด้วย 5 หนุ่มอคูสติดป๊อป กับแนวเพลงฟังสบายๆ วง Koy & Friend
เริ่มเวลา 17:00 น.
23 ก.ย.66 ดนตรีในสวน Camp Folk#1 Folksong & Camping@สวนสัตว์โคราช
ดนตรีในสวน Camp Folk#1 Folksong & Camping ส่ง Film ไปตามฝัน เสาร์ 23 ก.ย.66 ลานกางเต็นท์ Jungle Home & Camping @สวนสัตว์โคราช เข้างานฟรี ในงานมีเครื่องดื่มอาหารจำหน่าย ค่ากางเต้นท์คนละ 100 บาท (ลงทะเบียน) ศิลปินในงาน FILM สหายก่อกรการ แบเป้ไงจะไปมั๊ยละ เหิรฟ้า
15-24 ก.ย.66 ดนตรีในสวน ใต้สะพานภูมิพล ฝั่งพระประแดง
เทศกาลอาหารดี ดนตรีในสวน จัดเต็มของกินอร่อยๆ ถูกและดี ของใช้ไม่แพง ชมการแสดง ฟังดนตรี ใต้สะพานภูมิพล ฝั่งพระประแดง วันที่ 15 - 24 กันยายน 2566 เวลา 15:00 - 22:00 น. ใต้สะพานภูมิพล ฝั่งพระประแดง ข้างสวนสุขภาพลัดโพธิ์ อ.พระประแดง จ. สมุทรปราการ
22-23 ก.ย.66 นครปฐมเมืองดนตรี
22-23 ก.ย.66 นครปฐมเมืองดนตรี การแสดงดนตรี หน้าลานอาคารสำนักงานอธิบการบดี ม.ศิลปากร และลานจอดรถร้านค้ากลางคืน (สนามลี้คุนกี่) องค์พระปฐมเจดีย์
1 กันยายน 2566 งาน ดนตรีในสวน 45 ปี มสธ. กับการเรียนรู้ตลอดชีวิต
งาน ดนตรีในสวน 45 ปี มสธ. กับการเรียนรู้ตลอดชีวิต
ช้อป สินค้าหลายหลายจากตลาดนัด สินค้าพื้นเมือง สินค้าชุมชน
ชิม อาหารพื้นเมืองเลิศรส และอาหารหลากหลายจากร้านค้ามากมาย
ชมฟรี การแสดงดนตรีจากวงโปงลางกรุงเทพ, วงดนตรีโรงเรียนนาหลวง (รองแชมป์ชิงช้าสวรรค์ 2566), ประกวดร้องเพลงของนักเรียนระดับมัธยมศึกษา
สาธิตอาหารและศิลปหัตกรรม การทำขนมไทยโบราณ เช่น ข้าวเกรียบว่าว, วุ้นฝอยทอง, ขนมเม็ดขนุนมะพร้าวอ่อน, กิจกรรมสาธิตเปเปอร์มาเช่, ศิลปะบนผิวน้ำ
วันศุกร์ที่ 1 กันยายน 2566 เวลา 08.00 – 21.00 น. ณ อุทยานการศึกษาราชมังคลาภิเษก มหาวิทยาลัยสุโขทัยธรรมาธิราช
สอบถามข้อมูล: 02-504-7730, 09-9463-6619
สัปดาห์เภสัชกรรม ประจำปี วันอังคารที่ 26 กันยายน 2566 โรงพยาบาลพาน อำเภอพาน
สำนักงานสาธารณสุขจังหวัดเชียงรายร่วมกับโรงพยาบาลพาน ขอเชิญร่วมงาน "สัปดาห์เภสัชกรรม ประจำปี 2566" "เภสัชกรทั่วไทย ห่วงใยทุกคน" ในวันอังคารที่ 26 กันยายน 2566 ณ บริเวณหน้าอาคารคลินิกพิเศษ (NCD Clinic) โรงพยาบาลพาน อำเภอพาน จังหวัดเชียงราย เวลา 8.30 -10.00 น.
งานมหกรรมเยาวชนท่องถิ่นเชียงราย Sharing Center และกาดละอ่อนเจียงฮาย 20 ก.ย.66


งานมหกรรมเยาวชนท่องถิ่นเชียงราย Sharing Center และกาดละอ่อนเจียงฮาย เนื่องในวันเยาวชนแห่งชาติ ประจำปี 2566 โดย องค์การบริหารส่วนจังหวัดเชียงราย ศูนย์เยาวชนองค์การบริหารส่วนจังหวัดเชียงราย ร่วมกับ จังหวัดเชียงราย และมหาวิทยาลัยราชภัฏเชียงราย ในวันที่ 20 กันยายน 2566 ณ หอประชุมใหญ่ มหาวิทยาลัยราชภัฏเชียงราย ภายในงานพับกบ พบกับ ????พิธีลงนามความร่วมมือในการพัฒนาเด็กและเยาวชน ????การเดินแบบชุดสร้างสรรค์ Miss CR Model ????นิทรรศการเครือข่ายเด็กและเยาวชน และ Sharing Center ????การประกวดวงสตริงคอมโบ ????การมอบรางวัลเด็กและเยาวชนดีเด่น ????กาดละอ่อนเจียงฮาย สุดพิเศษกับศิลปินสร้างแรงบันดาลใจ วง Purpeech ชมฟรี ไม่มีค่าใช้จ่าย เพียงแค่กดถูกใจเพจ ศูนย์เยาวชนองค์การบริหารส่วนจังหวัดเชียงราย และเพจ อบจ.เชียงราย แสดงทางเข้างาน ฟรี‼️ สนับสนุนโดย นายก นก อทิตาธร วันไชยธนวงศ์ นายก อบจ.เชียงราย พร้อมด้วยผู้สนับสนุนใจดีหลากหลายห้างร้าน อาทิ Yuedpao - ยืดเปล่า Greenbus Greenwing All4U Cafe & T-Shirts VW Clinic และผู้ใหญ่ใจดีอีกมากมายยยย “ศูนย์เยาวชน อบจ.เจียงฮาย พื้นที่สร้างสรรค์สำหรับเยาวชน"
ตารางการให้บริการเดือนกันยายน 2566
กำหนดการออกหน่วยเคลื่อน กทม. 5 จุด เดือนกันยายน
19 ก.ย. วัดท่าพระ บางกอกใหญ่
20 ก.ย. สวนเฉลิมพระเกียรติ 80 พรรษา สาทร
21 ก.ย. ชุมชนร่วมใจพัฒนาใต้ บางเขน
22 ก.ย. สำนักงานเขตบางกอกน้อย
25 ก.ย. ชุมชนมหาดไทย 5 เขตประเวศ
26 ก.ย. ชุมชนเคหะบ่อนไก่ ปทุมวัน
27 ก.ย. โรงงานรถไฟมักกะสัน ราชเทวี
28 ก.ย. วัดปรก สาทร
29 ก.ย. ชุมชนเปรมฤทัย 1 คันนายาว
ทุกจุดเวลา 9.00-12.00 น. เจ้าของนำบัตรประชาชนมาแสดงด้วย
สอบถามโทร. 02-2487417 02-2453311
CAT SHOW FAMILY 4 NMARK PLAZA 30 กันยายน -1ตุลาคม 2566
การประกวดแมวและคาเฟ่น้องแมว 30 กันยายน -1ตุลาคม 2566 ณ ศูนย์การค้า เอ็นมาร์ค พลาซ่า ชั้น 2 วันที่ 30 กันยายน ประกวดแมวสายพันธุ์แท้ (มีใบการ้นตีสายพันธุ์ไม่จำกัดค่าย) แบ่งออกเป็น3รุ่น 1. รุ่u Kitten 4-8 เดือน 2. รุ่u Adult 8 เดือนขึ้นไป 3. รุ่u Neuter แมวหมัน
ดนตรีในสวนปทุมวนารักษ์ ตุลาคม 2566 LINK
ดนตรีในสวนกรุงเทพมหานคร..สุดสัปดาห์ กันยายน-ตุลาคม 2566
เสาร์ที่ 30 กันยายน 2566 ไปชิลล์กับวงอคูสติก 3 ชิ้น พร้อมนักร้องคุณภาพจากกรุงเทพมหานคร วง Bangkok Trio Band
อาทิตย์ที่ 1 ตุลาคม 2566 เริ่มต้นเดือนตุลาคมด้วยวงดนตรีคลาสสิกแนวเพลงสบายๆ
วง Bangkok String Ensemble ณ สวนปทุมวนานุรักษ์ เริ่มเวลา 17:00 น.
Line Up วงดนตรีเดือนตุลาคม สวนปทุมวนานุรักษ์
- อาทิตย์ที่ 1 ตุลาคม 2566 วง Bangkok String Ensemble
- เสาร์ที่ 7 ตุลาคม 2566 วง Bangkok Trio Band
- อาทิตย์ที่ 8 ตุลาคม 2566 วง Koy & Friend
- เสาร์ที่ 14 ตุลาคม 2566 วง Bangkok Trio Band
- อาทิตย์ที่ 15 ตุลาคม 2566 กลุ่มศิลปินทุเรียนเรดิโอ
- เสาร์ที่ 21 ตุลาคม 2566 วง Bangkok Trio Band
- อาทิตย์ที่ 22 ตุลาคม 2566 วง เล่นเอามันส์ (วงดนตรีไทย แนวเพลงไทยเดิมและประยุกต์)
- เสาร์ที่ 28 ตุลาคม 2566 วง Bangkok Trio Band
- อาทิตย์ที่ 29 ตุลาคม 2566 วง Churchill Band เยาวชนจากโรงเรียนนานาชาติฮาร์โรว์
Central Korat Dog Show Society 2023 presented by SmartHeart 23 - 24 กันยายน 2566
Central Korat Dog Show Society 2023 presented by SmartHeart 23 - 24 กันยายน 2566 ณ โคราช ฮอลล์ ชั้น 4 เซ็นทรัล โคราช พบกับสุนัขพันธุ์ใหญ่ เหล่าแก๊งสุนัข การประกวดแข่งขันชิงรางวัล และกิจกรรมมากมาย ประกวดสุนัขสวยงามชิงแชมป์ประเทศไทย ยกกองทัพความน่ารัก Khao Yai Shiba Café คนรักชิบะ บริการตรวจสุขภาพสัตว์เลี้ยงเบื้องต้น โดยโรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน และบริการเช็ดหู ตัดเล็บฟรี ให้คำปรึกษาเกี่ยวกับสัตว์เลี้ยง โดยโรงพยาบาลสัตว์ลิตเติ้ลพาว ฟรี!!
- กิจกรรม DIY ปลอกคอสุนัข ฟรี! - กิจกรรมแข่งขันกินขนมหมาเลีย แข่งขันกินสุนัขพันธุ์ใหญ่ วิ่งแข่งสุนัขพันธุ์เล็ก วิ่งกระโดดข้ามรั้วธีม Animal และแต่งกายคู่เหมือนธีม สัตว์โลกน่ารัก
งาน The Treasure of Sahara 21-27 กันยายน 2566
งาน "The Treasure of Sahara" 21-27 กันยายน 2566 ลานกิจกรรม ชั้น 3 เซ็นทรัล หาดใหญ่ ชมสัตว์แปลกหายากกว่า 20 สายพันธุ์ ตะลุย 4 ฐาน หาสมบัติ พร้อมรับของรางวัล เพลิดเพลินไปกับการถ่ายรูปและป้อนอาหารสัตว์ ช้อปสินค้าสำหรับสัตว์เลี้ยงแสนรัก
งาน ดนตรีในสวน 45 ปี มสธ. กับการเรียนรู้ตลอดชีวิต 1 กันยายน 2566
วันศุกร์ที่ 1 กันยายน 2566 เวลา 08.00 – 21.00 น. ณ อุทยานการศึกษาราชมังคลาภิเษก มหาวิทยาลัยสุโขทัยธรรมาธิราช
ช้อป สินค้าหลายหลายจากตลาดนัด สินค้าพื้นเมือง สินค้าชุมชน
ชิม อาหารพื้นเมืองเลิศรส และอาหารหลากหลายจากร้านค้ามากมาย
ชมฟรี การแสดงดนตรีจากวงโปงลางกรุงเทพ, วงดนตรีโรงเรียนนาหลวง (รองแชมป์ชิงช้าสวรรค์ 2566), ประกวดร้องเพลงของนักเรียนระดับมัธยมศึกษา
สาธิตอาหารและศิลปหัตกรรม การทำขนมไทยโบราณ เช่น ข้าวเกรียบว่าว, วุ้นฝอยทอง, ขนมเม็ดขนุนมะพร้าวอ่อน, กิจกรรมสาธิตเปเปอร์มาเช่, ศิลปะบนผิวน้ำ
สอบถามข้อมูล: 02-504-7730, 09-9463-6619
T-Rex Thailand Reptile Expo 2023
T-rex thailand expo - Exotic world ครั้งที่2 วันที่ 15-17 กันยายน 2566 เป็นงานมหกรรมสัตว์เลี้ยงชนิดพิเศษที่ใหญ่สุดในรอบปี งานมหกรรมสัตว์เลี้ยงชนิดพิเศษ ที่ใหญ่ที่สุดในประเทศไทย กลุ่ม “Exotic Pet” รวมเหล่าฟาร์มผู้เพาะพันธุ์สัตว์เลี้ยงชนิดพิเศษ ร้านค้ามากมาย มาจัดจำหน่ายสัตว์เลี้ยงและอุปกรณ์เลี้ยงสัตว์ชนิดต่างๆ
ปั่น ปัน รัก เพื่อน้องครั้งที่ 4 วันอาทิตย์ที่ 2 ต.ค. 65
การแข่งขัน "ปั่น ปัน รัก" เพื่อน้องครั้งที่ 4 วันอาทิตย์ที่ 2 ต.ค. 65 วัตถุประสงค์ 1) เพื่อจัดตั้งกองทุนและทรัพยากรที่ใช้ในการจัดการด้านอาชีพให้กับนักเรียนพิการโรงเรียนโสตศึกษาปานเลิศจังหวัดลพบุรี 2) เพื่อให้สังคมภายนอกเข้ามามีส่วนร่วมในการสนับสนุนการจัดการศึกษาให้กับนักเรียนพิการ รับสมัครตั้งแต่วันนี้-31 ส.ค.65
https://forms.gle/h5FnjUqPKVnmB9wZA ***ค่าสมัครทุกรุ่น 599 บาท (รับเสื้อปั่นจักรยานและเหรียญจากหลวงพ่อวัดพระบาทน้ำพุ)
10 กันยายน - BKK-เรนเจอร์ @ โรงเรียนชุมชนหมู่บ้านพัฒนา (คลองเตย) LINK
"BKK-เรนเจอร์ @ โรงเรียนชุมชนหมู่บ้านพัฒนา (คลองเตย)"
มาแล้วกิจกรรม Workshop ที่รอคอย วันเสาร์ที่ 10 กันยายน เวลา 13.00 - 16.00 นี้ชวนทุกคนมาเข้าร่วม Workshop จากเครือข่ายที่น่าสนใจด้วยกัน โดยแต่ละ Workshop จะน่าสนุกแค่ไหนไปดูกัน!
สมัครที่นี่ bit.ly/bkkrangerchumchonschool
ห้องที่ 1 ห้องเล่าผี (คืนพุธออนคลองเตย) | โดย ต้นกล้า ฮาตะ (คืนพุธมุดผ้าห่ม) รับทราบโปรดักชั่น
เมื่อรายการเล่าเรื่องผีประจำคืนพุธยกขบวนมาอยู่คลองเตยพบกับเขา "ต้นกล้า" ที่จะนำเรื่องเล่า (บนพื้นฐาน) วิทยาศาตร์เข้าไปสู่ช่องทางการสร้างอาชีพและรายได้
รับ 100 คน อายุ 18-25 ปี
ห้องที่ 2 Cover Dance | สภาเด็กและเยาวชนคลองเตย
Workshop Cover Dance ออกมาเต้น มาปล่อยพลังไปด้วยกัน
จำกัด 30 คน อายุ 12-25 ปี
ห้องที่ 3 Esport (ROV) | Coolerist ครีเอเตอร์วิดีโอการเล่นเกม
"เกม ไม่ใช่ อาชญากร" แต่เป็นกีฬาที่มีแผน วินัย การฝึกฝนเพื่อต่อยอดไปสู่เส้นทางแห่งมูลค่าของชัยชนะ และความเป็นมืออาชีพ
จำกัด 20 คน อายุ 12 - 25 ปี
ห้องที่ 4 คาราวานนิทานหุ่นมือ | มูลนิธิดวงประทีป
นิทานของคุณจะไม่น่าเบื่ออีกต่อไป เมื่อเหล่าตัวละครในหนังสือเล่มนั้นคุณสามารถสร้างมันขึ้นมาด้วยตัวคุณเอง
จำกัด 20 คน อายุ 12 - 25 ปี
ห้องที่ 5 Beauty Blogger (บิวตี้ บล็อกเกอร์) | สวนครูองุ่น
มาค่ะ มา Make up กัน! ถึงเวลาที่ต้องเลือกรองพื้น หรือเครื่องสำอางให้เหมาะกับแต่ละวาระและโอกาสแล้วหละ..
จำกัด 15 คน อายุ 12-18 ปี
มีกิจกรรมอีกมากมาย ที่ชวนกันมาสนุกตั้งแต่เวลา 16.30 เป็นต้นไป พบกับการแสดง และกิจกรรม Free Play & Free Art จากเครือข่ายเช่นเคย ปักหมุดและมาเจอกันนะ
อบรม กั ญ ช ง-กัญ ช า เชิงพาณิชย์และอุตสาหกรรม รุ่นที่ 9 วันที่ 16 ตุลาคม 2565
"กั ญ ช ง-กัญ ช า เชิงพาณิชย์และอุตสาหกรรม" พบกับวิทยากรผู้เชี่ยวชาญด้านการปลูกกัญ ช า กั ญ ช งเชิงพาณิชย์และอุตสาหกรรม รุ่นที่ 9 เวลาการจัดอบรม 09:00-17:00 น. ฟรีอาหารกลางวันและพักเบรค 2 มื้อ อบรมวันที่ 16 ตุลาคม 2565
Goldenleaf Hemp ต.สุรศักดิ์ อ.ศรีราชา จ.ชลบุรี
เรียนทฤษฎีช่วงเช้า บ่ายเรียนภาคปฎิบัติจริงในการปลูกต้นกั ญ ช ง-กั ญ ช-า
ในหัวข้อเรื่อง
- การต่อยอดธุรกิจในอนาคต
- การนำเข้าและส่งออก
- วิธีการวางแผนจัดระบบการปลูก
- วิธีการปลูก
- การจัดการวัสดุปลูก พร้อมปฏิบัติจริง
- วิธีการป้องกันศัตรูพืช
- เทคนิคและเคล็ดลับในการปลูก
- การวางแผนทีมงาน ระบบต่างๆในฟาร์ม
- การขออนุญาตการปลูกเชิงพาณิชย์และอุตสาหกรรม
- พร้อมรับ Certificate และรับฟรี ผลิตภัณฑ์จากฟาร์ม
ดนตรีในสวนมหาวิทยาลัยนวมินทราธิราช ครั้งที่ 6 พุธที่ 26 ต.ค.65
ดนตรีในสวนมหาวิทยาลัยนวมินทราธิราช ครั้งที่ 6 ในวันพุธที่ 26 ตุลาคม 2565 ณ ลานด้านหน้าอาคารวชิรานุสรณ์ คณะแพทยศาสตร์วชิรพยาบาล เริ่มลงทะเบียนร่วมงาน เวลา 17.00 น.
ชมการแสดง จากนักศึกษามหาวิทยาลัยนวมินทราธิราช และศิลปินรับเชิญพิเศษ
- คณะพยาบาลศาสตร์เกื้อการุณย์
- ศิลปินรับเชิญ วง BAND OF BROTHERS
- ศิลปินรับเชิญ วง C30
ดนตรีในสวน ณ บึงสีฐาน ม.ขอนแก่น ศุกร์ที่ 28 ต.ค. 65
เชิญชวนทุกคนนั่งเล่น รับฟัง ดนตรีในสวน ร่วมผ่อนคลายผ่านเสียงเพลง ในกิจกรรม Our Voice เพราะเสียงของเรามีความหมาย และร่วมแสดงความคิดเห็นในหัวข้อ “อยากเห็น มข เป็นอย่างไร” ในวันศุกร์ที่ 28 ต.ค. 2565 ตั้งแต่เวลา 16.00 - 20.00 น. ณ บึงสีฐาน มหาวิทยาลัยขอนแก่น ในห้วงเวลาสอบปลายภาคครั้งนี้ เราขอให้กำลังใจผ่านเสียงดนตรีกับทุก ๆ คนน
เทศกาลดนตรีและศิลปะในสวนครั้งที่ 8 ลานกีฬาพัฒน์ 1 คลองจั่น เสาร์ที่ 29 ต.ค.65
เทศกาลดนตรีและศิลปะในสวนครั้งที่ 8 ลานกีฬาพัฒน์ 1 คลองจั่น พบกับ การแสดงและดนตรีจากน้องๆเยาวชนผู้มีความสามารถ บูธกิจกรรมประดิษฐ์ ศิลปะต่างๆ ตลาดนัดเกษตรอินทรีย์และผลิตภัณฑ์ชุมชน ใครสนใจอยากหากิจกรรมชิคๆทำในช่วงวันหยุด เชิญได้เลยนะครับ โดยงานจัดขึ้นใน วันเสาร์ที่ 29 ตุลาคม 2565 เวลา 13.00 - 18.00 น.อีก 1 กิจกรรมดีๆ ที่อยากชวนทุกคนมาสร้างสรรค์ความสุขในชุมชนด้วยกัน
14-15 ตุลาคม 2565 MAEHONGSON MUSIC FEST
MAEHONGSON MUSIC FEST เทศกาลดนตรีเพื่อเปิดฤดูกาลท่องเที่ยวเมืองสามหมอก จัดเมื่อวันที่ 14-15 ตุลาคม 2565 ณ สวนสาธารณะหนองจองคำ อ.เมือง จ.แม่ฮ่องสอน
ASEAN Café Show 2023 ไบเทค 26-29 ต.ค.66
งาน “ASEAN Café Show (ACS)” เป็นชื่อใหม่ที่ครอบคลุมงาน “
Thailand Coffee, Tea & Drinks (TCTD)” และ “Thailand Bakery & Ice Cream (TBI)” งานแสดงสินค้ากาแฟ ชา เครื่องดื่ม เบเกอรี่ ไอศครีมและโกโก้ ที่ก่อตั้งมายาวนานที่สุดในประเทศไทย เป็นเวลากว่า 16 ปี ชื่อใหม่นี้สะท้อนถึงอุตสาหกรรมฯ ที่เติบโตขึ้นอย่างรวดเร็วและการเติบโตอย่างมีศักยภาพของทั้งสองงาน และเพื่อช่วยผลักดันอุตสาหกรรมที่เกี่ยวข้องสู่ตลาดที่กว้างขึ้นในระดับภูมิภาค ever-growing coffee, tea, drinks, bakery, and ice cream industry in Thailand and ASEAN.
ASEAN Café Show (ACS) เป็นงาน “โซลูชันคาเฟ่แบบครบวงจร” ที่ครบเครื่องทั้งอุปกรณ์ เครื่องใช้สำหรับร้านคาเฟ่ ร้านเบเกอรี่และ F&B โรงแรมที่ทันสมัยและวัตถุดิบที่มีคุณภาพ รวมถึงโซลูชันสำหรับร้านค้าแบบครบวงจร พบลูกค้ากลุ่มเป้าหมายกว่า 20,000+ คน จาก 54+ ประเทศ ในเวลาเพียง 4 วัน
26-29 ต.ค.66 รอบ Final Round - Thailand National Coffee Roasting Championship 2024
Thailand National Coffee Roasting Championship 2024 เปิดรับสมัครวันที่ 18 ก.ย.2566 เวลา 14:00น. รับสมัคร 64 คน
▪️ คนไทย สัญชาติไทย หรือ ชาวต่างชาติ ที่มีหลักฐานอยู่พำนักหรือทำงานในประเทศไทย เป็นเวลา 2 ปีขึ้นไป สามารถสมัครเข้าร่วมแข่งขันได้
▪️ รอบ Preliminary Round จะทำการแข่งขันในวันที่ 3 - 6 ตุลาคม 2566 ( สถานที่จัดการแข่งขัน รูปแบบการแข่งขัน กฏกติกา จะแจ้งให้ทราบอีกครั้งในวันที่ 25 กันยายน 2566 )
▪️ รอบ Final Round จะจัดแข่งขันโดยใช้กฏการแข่งขันเดียวกันกับ World Coffee Roasting Championship 2022 ในวันที 26-29 ตุลาคม 2566 ที่งาน Thailand Coffee Tea&drinks 2023 ณ ไบเทค บางนา EH 103-104
Walk Run Bike Fighting Stroke ครั้งที่ 9 ท้องสนามหลวง 29 ต.ค.66 LINK
ควบคุมการจัดงาน ศูนย์โรคหลอดเลือดสมองศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล วิ่งวันที่ 29 ตุลาคม 2566 บริเวณ สนามหลวง ระยะทาง 10 กม. / 5 กม. / ปั่นจักรยาน ระยะทาง 21.1 กิโลเมตร
เปิดรับสมัครแล้ว ค่่าสมัคร 360 บาท ทุกระยะทาง
ถ้วยรางวัลพระราชทานจากพระบาทสมเด็จพระเจ้าอยู่หัว ถ้วยรางวัลพระราชทานจากสมเด็จพระนางเจ้าฯ พระบรมราชินี
รายได้จากการจำหน่ายชุดแข่งขัน และการบริจาคหลังหักค่าใช้จ่าย ร้อยละ 30 มอบให้แก่มูลนิธิโรงพยาบาลสมเด็จพระยุพราช เพื่อใช้ในการสนับสนุนและส่งเสริมให้โรงพยาบาลสมเด็จพระยุพราชทั้ง 21 แห่ง ทั่วประเทศในการดูแลสุขภาพประชาชนในท้องถิ่นทุรกันดารได้อย่างเท่าเทียมกัน ร้อยละ 50 จัดสรรเข้าบัญชีแสงนำใจไทยทั้งชาติ เดิน วิ่ง ปั่น ป้องกันอัมพาต เฉลิมพระเกียรติ ระดับเขตสุขภาพ หรือจังหวัดที่ร่วมจัดโครงการฯ สำหรับใช้ในการจัดกิจกรรมโครงการแสงนำใจไทยทั้งชาติฯ ตลอดจนกิจการด้านโรคหลอดเลือดสมองเชิงรุกในพื้นที่ต่อไป
แม่เมาะฮาล์ฟมาราธอน2023 วันอาทิตย์ที่ 15 ต.ค.66 LINK
แม่เมาะฮาล์ฟมาราธอน2023 การแข่งขันจะมีด้วยกัน 3 ระยะ HALF-MARATHON 21.10Km. / MINI-MARATHON 10.00Km. / FUNRUN 5.00Km. จะใช้ถนนใน กฟผ.แม่เมาะ ในการจัดการแข่งขัน ช่วงเดือนตุลาคมอากาศดีงาม พื้นผิวถนนดี ปิดถนนได้ ทำให้นักวิ่งมีความปลอดภัยในการแข่งขัน แม้จะเป็นนักวิ่งสายเซลฟี่ เดินๆวิ่งๆก็ไม่ต้องกลัวจะมีรถมาไล่หลังให้กวนใจ เพราะเราจะปิดเหมืองหยุดการทำงานเพื่อที่จะต้อนรับนักวิ่งเลยทีเดียว
สนามนี้ไม่ง่ายและไม่ยากจนเกินไป เส้นทางได้รับการรับรองมาตรฐานจาก สมาคมกีฬากรีฑาแห่งประเทศไทย ในพระบรมราชูปถัมภ์ เชิญชวนพี่ๆนักวิ่งมาร่วมวิ่งกันเยอะๆนะคะ รับจำนวนจำกัด
เปิดรับสมัคร 19 พฤษภาคม 2566 นี้ วันแข่งขัน วันอาทิตย์ที่ 15 ตุลาคม 2566
20 ตุลาคม 2565 @โรงเรียนเตรียมอุดมศึกษาพัฒนาการ
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 20 ตุลาคม 2565 เวลา 08.00-14.00 น. ณ โรงเรียนเตรียมอุดมศึกษาพัฒนาการ เขตสวนหลวง พบกับกิจกรรมตรวจสุขภาพและอื่นๆอีกมากมาย
เดิน วิ่ง ป้องกันอัมพาต จังหวัดปทุมธานี 29 ต.ค.66 LINK
เดิน วิ่ง ป้องกันอัมพาต จังหวัดปทุมธานี
วันที่ 29 ตุลาคม 2566 บริเวณ เรนวูด พาร์ค คลอง 11
สมัครได้ที่ลิงค์ https://forms.gle/cBrJqVCNmrjzHXT39
ติดต่อเพื่อซื้อเสื้อได้ที่ งานส่งเสริมสุขภาพฯ กลุ่มงานเวชกรรมสังคม โรงพยาบาลปทุมธานี โทร. 02-5988883
BOSCH 100th ANNIVERSARY CHARITY RUN 29 ต.ค.66 LINK
BOSCH 100th ANNIVERSARY CHARITY RUN สวนน้ำรามายณะ (Ramayana Water Park) EXPO DAY : 28 OCT 2023 RACE DAY : 29 OCT 2023 ที่สุดของความท้าทาย กับเส้นทางใหม่เอี่ยม ท้าทายกับระยะทางที่มีให้เลือกถึง 3 ระยะ ท้าทายกับระดับความชัน (elevation gain) ที่ไม่ธรรมดา ท้าทายกับวิวแสนสวย ที่จะสะกดทุกสายตา
21K / 10K / 3K
EXPO DAY : 28 OCT 2023
RACE DAY : 29 OCT 2023
Ayutthaya Run Run 2023 วันที่ 15 ต.ค.66 LINK
Ayutthaya Run Run : Fun With History 2023 วันที่ 15 ต.ค. 2566 งาน Run สุด Fun หนึ่งเดียวในอยุธยา รายได้ส่วนหนึ่งมอบให้กับ โรงเรียนวัดปราสาททอง อำเภอ บางบาล จังหวัด พระนครศรีอยุธยา เส้นทางให้นักวิ่งทุกท่านร่วม Fun ได้ 3 ระยะ - 6 km / 10 km / 21 km
PATTAYA INTERNATIONAL BIKINI BEACH RACE 2023 วันที่ 28 ต.ค.66
PATTAYA INTERNATIONAL BIKINI BEACH RACE 2023 วันที่ 28 ตุลาคม 2566 งานวิ่งสุดหวามและแสนงามแห่งปี ณ ชายหาดพัทยา ที่มาพร้อมความเซ็กซี่ และใหญ่ที่สุดในประเทศไทย ระยะทางวิ่ง 5 Km. ณ ชายหาดเมืองพัทยา หน้าศูนย์การค้าเซ็นทรัลพัทยา
We Love Pets 2023 ครั้งที่ 11 วันที่ 21-22 ตุลาคม @ เซ็นทรัล พระราม 2
งานสำหรับสัตว์เลี้ยงสุดยิ่งใหญ่ประจำปี 2566 กำลังจะเกิดขึ้นแล้ว งาน
We Love Pets ครั้งที่ 11 Magic Companion 21-22 ตุลาคม 2566 พระรามสองฮอลล์ Central พระราม2
งานสุดยิ่งใหญ่ที่จะมีทั้งการแข่งขันนกบินอิสระรายการใหญ่ 2 รายการ ทั้งรายการสะสมคะแนน Grand Flight Tour Thailand 2023 และศึกแห่งศักดิ์ศรีแชมป์ไร้พ่าย Thailand Grand Flight Championship 2023 รวมทั้งยังมีการแสดงและประกวดนกสายพันธุ์ต่างๆ
งานปีนี้มาในธีม Magic Companion สายประกวดแฟนซีต้องไม่พลาด ธีมแบบนี้ต้องจัดเต็มแบบสุดๆ รวมถึงความมูแบบสนุกๆหลากหลายรูปแบบ ในกิจกรรมกับ น้องสุนัข น้องแมว น้องกระต่าย น่ารักๆ ในลานกิจกรรมต่างๆ
รวมถึงคุณหมอจากหลากหลายโรงพยาบาลสัตว์ จะมารอตรวจโรคให้น้องๆสัตว์เลี้ยงในงานฟรี ไม่มีค่าใช้จ่ายใดๆ
และที่พลาดไม่ได้ ต้องมาช้อปอาหารดีๆ ส่วนลดจัดเต็ม สำหรับน้องๆ สัตว์เลี้ยง รวมไปถึงของใช้ต่างๆ ที่มาออกร้านในงานนี้
Pet Fair South East Asia 25 - 27 October 2023@Bitec
The International Pet Industry Trade Hub in South East Asia 25 - 27 October 2023 HALL 100 - 102 Bangkok International Trade & Exhibitions Center (BITEC) Bangkok | Thailand
Pet Variety Exhibition 2023 #13 วันที่ 5-8 ตุลาคม 2566 @อิมแพ็ค LINK
SmartHeart presents Thailand International Pet Variety Exhibition 2023 ครั้งที่ 13 งานรวมพลคนรักสัตว์เลี้ยงที่ใหญ่ที่สุดแห่งปี พบกับสินค้าและบริการสำหรับสัตว์เลี้ยงทุกรูปแบบ ตั้งแต่อาหาร ของใช้ แฟชั่น ของเล่น บริการตัดขน บริการตรวจสุขภาพสัตว์เลี้ยงฟรี! รวมถึงบริการอื่นๆอีกมากมาย ในราคาสุดพิเศษ กว่า 200 บูธ อีกทั้งขอชวนสายคอนเทนต์...พาเหล่าสัตว์เลี้ยงที่มาบ้านมาลุยกับกิจกรรมแข่งขันสนุกๆอย่าง แข่งขันกินขนม “แมวเลีย” และ แข่งวิ่ง “มาหาแม่มา” ที่ได้รับความนิยมเป็นอย่างมาก ที่สำคัญไม่เสียค่าสมัคร!
สำหรับแฟนคลับสัตว์แปลก (Exotic Pets) สามารถแวะมาถ่ายรูปพร้อมสัมผัสเหล่าสัตว์แปลกกันได้อย่างใกล้ชิด พร้อมกับปีนี้เป็นปีแรกกับเวที การประกวดไก่ และ ประกวดนกหงษ์หยก จากทางสมาคมฯ
วิ่งเปิดภู ดูเขา รักกัน (PKTS) อุทยานแห่งชาติภูกระดึง 1 ต.ค.66 LINK
อุทยานแห่งชาติภูกระดึง ชวนมาวิ่ง "วิ่งเปิดภู ดูเขา รักกัน" 1 ตุลาคม 2566 นี้ ฉลองโอกาสที่อุทยานแห่งชาติภูกระดึงได้รับการโหวตให้เป็น "อุทยานมรดกอาเซียน" การแข่งขันแบ่งออกเป็น 2 ระยะ ได้แก่ 9 กิโลเมตร และ 25 กิโลเมตร จุดสตาร์ทอยู่ที่ศูนย์บริการนักท่องเที่ยวศรีฐาน(ด้านล่างอุทยานแห่งชาติภูกระดึง) และเส้นชัยจะอยู่ที่ ศูนย์บริการนักท่องเที่ยววังกวาง (ยอดภูกระดึง)
Thailand cOffee hub 2023 เทศกาลกาแฟ กลางเมือง 4–10 ต.ค. 66
Thailand cOffee hub 2023 เทศกาลกาแฟ ที่ใหญ่ที่สุดใจกลางเมือง ปีที่2 วันที่ 4–10 ต.ค. 66 ศูนย์การค้าเซ็นทรัลเวิลด์ ชั้น 1, 2, 3 ปีนี้มาในคอนเซ็ปต์ “Coffee Meets Happy” ครบทุกส่วนของกาแฟ ตั้งแต่ เกษตรกร โรงคั่วกาแฟ ผู้ประกอบการร้านกาแฟ บาริสต้า และคอกาแฟทุกคน !! มาเอนจอยกาแฟทุกคัลเจอร์ กับ 9 โซนกิจกรรมภายในงาน
UBU KASET RUNNING วิ่งชมฟาร์ม คณะเกษตร ม.อุบล 22 ต.ค.66
กิจกรรม UBU KASET RUNNING วิ่งชมฟาร์ม ณ คณะเกษตรศาสตร์ มหาวิทยาลัยอุบลราชธานี 22 ตุลาคม 2566
facebook.com/agriculture.ubu/มหาวิทยาลัยนเรศวร จัดหลักสูตรระยะสั้น การเป็นผู้ประกอบการร้านกาแฟอย่างมืออาชีพ LINK
คณะบริหารธุรกิจฯ มหาวิทยาลัยนเรศวร จัดหลักสูตรระยะสั้น : การเป็นผู้ประกอบการร้านกาแฟอย่างมืออาชีพ กิจกรรม 2 วัน วันที่ 28-30 ตุลาคม 2566 พร้อมกิจกรรมสุดพิเศษ
- ฝึกปฏิบัติการทำกาแฟกับมืออาชีพ
- เข้าใจรูปแบบของธุรกิจร้านกาแฟ
- เทคนิคการเปิดร้านกาแฟอย่างมืออาชีพ
- การออกแบบร้านกาแฟเพื่อสร้างความดึงดูด
- การวางตำแหน่งแบรนด์และกลยุทธ์ทางการตลาด
- พร้อมทริป พิเศษ “เขาค้อ”
รับจำนวนจำกัด 20 ท่าน
พิเศษสุดๆ สำหรับท่านที่สนใจ
" Early Bird : วันนี้ - 30 กันยายน 2566 : ค่าลงทะเบียนเพียง 3,500 บาท
จำกัดเพียง10 ที่นั่ง มาก่อนได้ก่อนเลยค่ะ
สอบถามรายละเอียดเพิ่มเติมได้ที่ : 055 964 822 (งานวิจัยและบริการวิชาการ)
ป๋าเวณีตาลก๋วยสลากไตลื้อศรีดอนชัย 16 ตุลาคม 2566
ป๋าเวณีตาลก๋วยสลากไตลื้อศรีดอนชัย วันที่ 16 ตุลาคม 2566 ณ ข่วงแก้วอารามวัดท่าข้ามศรีดอนชัย ตำบลศรีดอนชัย อำเภอเชียงของ จังหวัดเชียงราย กำหนดการมีดังนี้
เวลา 08.00 น.คณะศรัทธานำสลากภัตต์มาร่วมลงเส้น
เวลา 09.30 น.พี่ตี่ทางศาสนา ฟังเทศน์ เวนตานสลากภัตต์ ถวายสลากภัตต์
เวลา 10.30 น.พระสงฆ์สามเณรรับสลากภัตต์ ตามหัวศิลต่างๆ
ประเพณีปอยต้นแปก และตักบาตรเทโว@แม่สาย วัดพระธาตุดอยเวา และวัดเวียงพาน 29-30 ตุลาคม 2566
เทศบาลตำบลแม่สาย ขอเชิญชวนนักท่องเที่ยวทุกท่านร่วมอนุรักษ์สืบสานงานประเพณีท้องถิ่น “ประเพณีปอยต้นแปก”และตักบาตรเทโว@แม่สาย บันไดนาค เหนือสุดในสยาม ระหว่างวันที่ 29-30 ตุลาคม 2566 เวลา 17.00 น. เป็นต้นไป ณ วัดพระธาตุดอยเวา และวัดเวียงพาน อ.แม่สาย จ.เชียงราย สอบถามรายละเอียดเพิ่มเติมได้ที่ เทศบาลตำบลแม่สาย โทร. 053-731288
พระดาบส มินิมาราธอน 2023 วันอาทิตย์ที่ 8 ต.ค.66
จังหวัดสมุทรปราการ, มูลนิธิพระดาบส, องค์การบริหารส่วนจังหวัดสมุทรปราการ ขอเชิญร่วมกิจกรรม เดิน-วิ่งเพื่อสุขภาพเฉลิมพระเกียรติ
พระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี
วันอาทิตย์ที่ 8 ตุลาคม 2566 จุดเริ่มต้นและเส้นชัย ณ มูลนิธิพระดาบส อ.บางพลี จ.สมุทรปราการ
สมัครได้ที่ : https://www.jogandjoy.run/project/detail/108
ติดต่อสอบถาม : 02-721-6009
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนตุลาคม
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนตุลาคม
3 ตค ชุมชนบางอุทิศ บางคอแหลม
4 ตค หมู่บ้านไพทูรย์นิเวศน์ จตุจักร
4 ตค วัดลาดปลาเค้า ลาดพร้าว
5 ตค วัดสิงห์ จอมทอง
6 ตค ชุมชนราชมนตรีร่วมใจ ภาษีเจริญ
6 ตค วัดบุญรอดธรรมาราม พระโขนง
ตารางการให้บริการเดือนตุลาคม 2566
NEIGHBORHOOD GOODS MARKET | PETs PARK 6 - 9 ตุลาคม 2566 ศูนย์การค้า ธัญญาพาร์ค ศรีนครินทร์
NEIGHBORHOOD GOODS MARKET | PETS PARK 6 - 9 ตุลาคม 2566 ลานกิจกรรม ชั้น G ศูนย์การค้า ธัญญาพาร์ค ศรีนครินทร์ กิจกรรมมากมาย ได้แก่ Shopping สินค้าสัตว์เลี้ยง ทั้งของใช้และอาหาร ราคากันเอง โซนขายสุนัขจากฟาร์มชั้นนำ สนุกเพลินเพลินไปกับ PETs Playground พบปะแลกเปลี่ยน ของเล่นของใช้สัตว์เลี้ยง ของมือสองน้องหมาแมว กิจกรรม Pet Charity ผ่าน Workshop สุดคิ้วท์ โซนป้อนอาหารสัตว์สำหรับน้องๆ หนูๆ กิจกรรมแข่งขันชิงรางวัลและของที่ระลึกมากมาย เดินทางสะดวกติดรถไฟฟ้าสายสีเหลือง สถานีกลันตัน
The Land of Happiness 28 ตุลาคม 66
Regalos จัดงาน Event เล่นใหญ่จัดเต็ม เพื่อเอาใจคนรุ่นใหม่ที่มี lifestyle ชอบอยู่ในเมืองหรือคอนโดแต่มีสัตว์เลี้ยง ในธีม The Land of happiness ที่คอนโด M Jatujak by Major Development ร่วมสนุกและเพลิดเพลินไปกับกิจกรรมภายในงาน พบปะเพื่อน ๆ ที่เป็นทาสรักน้องสัตว์เลี้ยงด้วยกัน ภายในงานยังมีกิจกรรมให้ลุ้นรับของรางวัลอีกมากมาย และพิเศษเฉพาะผู้เข้าร่วมงานมีสิทธิ์ลุ้นรางวัลใหญ่จากทาง Regalos , Major development และโรงพยาบาลสัตว์คชาเว็ท นอกจากนี้เพื่อน ๆ ทุกคนยังได้รับสิทธิ์ในการเข้าชมโครงการคอนโดสุดพิเศษที่ตอบโจทย์สำหรับการอยู่ร่วมกันกับสัตว์เลี้ยงแบบ Pet Friendly เพียงแค่ติดต่อเจ้าหน้าที่เข้าชมภายในโครงการ บอกเลยว่างานนี้มาทีเดียวคุ้มมาก ๆ รับรองว่าต้องประทับใจกันอย่างแน่นอน วันที่ 28 ตุลาคม 2566 เวลา 13.00 – 17.00 น. คอนโด M Jatujak ตึก B
ตุลาล่าท้าผีที่ PETN ME ใน Happy Halloween ตุลาคม 2566
ตุลาล่าท้าผีที่ PET ’N ME ใน Happy Halloween Highlight Event
21 - 22 ตุลาคม 2566 พบกับงานออกร้านของ PET ’N ME ในงาน We love pet ครั้งที่ 11 ที่ เซ็นทรัล พระราม2
22 ตุลาคม 2566 worlshop กิจกรรมทำปลอกคอโบว์กระต่ายสำหรับสัตว์เลี้ยง ที่ PET ’N ME สาขาเซ็นทรัล เวสต์เกต
29 ตุลาคม 2566 worlshop กิจกรรมทำปลอกคอโบว์กระต่ายสำหรับสัตว์เลี้ยง ที่ PET ’N ME สาขาโรบินสัน ไลฟ์สไตล์ ราพฤกษ์
30 ตุลาคม - 6 พฤศจิกายน 2566 PET ’N ME Super Pet ครั้งที่ 4 ที่ เซ็นทรัล ปิ่นเกล้า
งาน Si Racha Dog Rally 28 ต.ค. 66
งาน Si Racha Dog Rally 28 ต.ค. 66 เซ็นทรัล ศรีราชา กิจกรรมอัดแน่น ให้เจ้าตูบแสนรักของเราไม่มีเบื่อแน่นอน บูธถ่ายรูป พร้อมปริ้นท์…ได้รูปสวยจึ้งแน่นอน‼️ D.I.Y. Pet Food&Fin เติมอิ่ม เพิ่มพลังให้เจ้าตูบ Food Truck Caravan ให้นุดได้อิ่มอร่อยสุดฟิน Pet shop ช้อปสินค้า เติมสต็อกให้เจ้าตูบ และกิจกรรมอื่นๆ อีกเพียบ
ดนตรีในสวนกรุงเทพมหานคร “ร้องบรรเลงเพลงพระราชนิพนธ์” 13 ตุลาคม 2566
กิจกรรมดนตรีในสวนกรุงเทพมหานคร “ร้องบรรเลงเพลงพระราชนิพนธ์” กรุงเทพมหานคร ร่วมกับ โรงเรียนวัดสุทธิวราราม ขอเชิญชมการแสดงดนตรี ในกิจกรรมดนตรีในสวนกรุงเทพมหานคร “ร้องบรรเลงเพลงพระราชนิพนธ์” พบกับการขับร้องและบรรเลงบทเพลงพระราชนิพนธ์ โดย วงดุริยางค์โรงเรียนวัดสุทธิวราราม และวงดุริยางค์กรุงเทพมหานคร (Bangkok Metropolitan Orchestra) พร้อมศิลปินรับเชิญ ครูต้อย The Golden Song เวทีเพลงเพราะ 3 และนักร้องคุณภาพจากกรุงเทพมหานคร ควบคุมการบรรเลงโดย นายสรพจน์ วรแสง ในวันศุกร์ที่ 13 ตุลาคม 2566 ณ อาคารพิพิธภัณฑ์สวนป่าเบญจกิติ (โรงงานผลิตยาสูบ 5) เริ่มแสดงเวลา 17:00 น.
การแสดงดนตรี วันนวมินทรมหาราช 13 ตุลาคม เพื่อน้อมรำลึกในพระมหากรุณาธิคุณ
ขอเชิญประชาชน ร่วมรับชมการแสดงดนตรี เพื่อน้อมรำลึกในพระมหากรุณาธิคุณ พระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร เนื่องใน “วันนวมินทรมหาราช” วันที่ 13 ตุลาคม 2566 จาก วงดุริยางค์ 4 เหล่าทัพ ณ อุทยานเฉลิมพระเกียรติฯ สนามม้านางเลิ้ง เขตดุสิต กรุงเทพมหานคร โดยแบ่งจุดแสดงเป็น 2 จุด
1. จุดพักคอยประชาชน โซนโรงครัวพระราชทาน ตั้งแต่เวลา 10.00 – 15.00 น.
2. สนามหน้าพระบรมราชานุสาวรีย์ ร.9 ตั้งแต่เวลา 18.00 – 24.00 น.
ดนตรีในสวนปทุมวนารักษ์ 15 ต.ค.66
ดนตรีในสวนปทุมวนารักษ์ 15 ต.ค.66
เสาร์ 14 ต.ค. 17.00 น. วง Bangkok Trio Band
อาทิตย์ 15 ต.ค. 14-15.00 วง Open Deck
15-16.00 วง Psynus
16-17.00 วง Yoongying
17-18.00 วง Jirus
City Run x Bangkok Street Performer ครั้งที่ #5
City Run x Bangkok Street Performer ครั้งที่ #5
สวนลุมพินี ลานปาล์ม บริเวณศาลาภิรมย์ภักดี
เสาร์ที่ 7 ตุลาคม เวลา 06:00 เป็นต้นไป งานนี้ฟรี ไม่มีค่าใช้จ่ายใดๆ
15 ต.ค. 2566 ชม "องค์บาก" ในระบบฟิล์ม
15 ต.ค. 2566 ที่ ลานคนเมือง เสาชิงช้า พบกับ "องค์บาก" ในระบบฟิล์ม
.หนังแอคชั่นระดับตำนานของไทยที่ส่งให้ “จาพนม” กลายเป็นที่รู้จักไปทั่วโลก ซึ่งเริ่มต้นด้วยการที่ “องค์บาก” พระพุทธรูปศักดิ์สิทธิ์ ซึ่งเป็นที่เคารพบูชาของหมู่บ้านหนองประดู่ ได้ถูกขโมยตัดเศียรไป บุญทิ้ง (จาพนม) หนุ่มบ้านหนองประดู่ จึงตัดสินใจอาสาออกตามหาด้วยตัวเอง จนเข้าไปพัวพันในการต่อสู้กับเจ้าพ่อมาเฟียอิทธิพลมืดจนเกือบเอาชีวิตไม่รอด
**กิจกรรมพิเศษ**
ฉายภาพยนตร์เรื่อง "องค์บาก" ในระบบฟิล์ม
มินิคอนเสิร์ตจาก พี่ฮาร์ท สุทธิพงศ์
พบกับโชว์พิเศษ Tony Ja Stunt Show โดย จา พนม
ร่วมพูดคุยกับ จาพนม และ คุณปรัชญา ปิ่นแก้ว ผู้กำกับภาพยนตร์ เรื่อง องค์บาก
กิจกรรมเริ่มประมาณ 16.00 น. หนังเริ่มฉาย 19.00 น. เป็นต้นไป
14 ต.ค. 2566 ชม "14 ตุลา สงครามประชาชน" โดย บัณฑิต ฤทธิ์ถกล
14 ต.ค. 2566 ที่ ลานคนเมือง เสาชิงช้า พบกับ "14 ตุลา สงครามประชาชน" โดย บัณฑิต ฤทธิ์ถกล เรื่องราวว่าด้วยช่วงชีวิตของ “เสกสรรค์ ประเสริฐกุล” อดีตผู้นำนักศึกษาในช่วงเหตุการณ์ 14 ตุลา พ.ศ. 2516 และ “จิระนันท์ พิตรปรีชา” ภรรยา ที่ต้องหนีภัยจากการกวาดล้างของรัฐบาลไทย เข้าป่าไปร่วมงานกับพรรคคอมมิวนิสต์แห่งประเทศไทย จนกระทั่งออกจากป่าในปี พ.ศ. 2524 โดยได้ เสกสรรค์ ประเสริฐกุล เป็นผู้ลงมือเขียนบทภาพยนตร์ด้วยตนเอง
**กิจกรรมพิเศษ**
มินิคอนเสิร์ตจาก บ.บางพระ (วิน Srirajah Rockers)
กิจกรรมเริ่มประมาณ 17.00 น. หนังเริ่มฉาย 19.00 น. เป็นต้นไป
ตารางหน่วยสัตวแพทย์เคลื่อนที่ สำนักอนามัย 17-20 ต.ค.66
ตารางหน่วยสัตวแพทย์เคลื่อนที่ สำนักอนามัย ชวนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
ฉีดไมโครชิปสุนัขและทำหมันสุนัขและแมว
ตุลาพาเพลินเดินงานกาแฟซีซั่น3 พิษณุโลก 21-22 ต.ค.66
งาน ตุลาพาเพลินเดินงานกาแฟซีซั่น3 วันที่ 21-22 ต.ค.66 เวลา 09.00-17.00 น. บริเวณ โรงแรมเดอะพาร์ค โฮเต็ล พิษณุโลก กิจกรรมงานกาแฟเด็ดในพิษณุโลก มีกาแฟให้เลือกชิมมากกว่า 66 ร้าน พิเศษ Special Guest ที่จะมาสร้างประสบการณ์ด้านกาแฟแก่ทุกท่าน พร้อมกับการแข่งขันสุดเข้มข้น ใครจะเข้มกว่ากาแฟต้องไปเชียร์กันแล้ว
งาน PET ‘N ME Super Pet สารพัดสัตว์เลี้ยง 30 ต.ค.-6 พ.ย. 2566 เซ็นทรัลปิ่นเกล้า
งาน PET ‘N ME Super Pet สารพัดสัตว์เลี้ยง ตั้งแต่วันที่ 30 ต.ค.-6 พ.ย. 2566 เซ็นทรัลปิ่นเกล้า โซน pet market แบรนด์ดังมากกว่า10 แบรนด์ อาหาร ขนม เสื้อผ้า ปลอกคอ ของใช้ต่างๆ
Cat in wonderland 19 - 25 ตุลาคม 2566 เซ็นทรัล พระราม 3
Cat in wonderland ดินแดนแมวมหัศจรรย์ 19 - 25 ตุลาคม 2566 โถงลิฟต์แก้ว ชั้น 1 เซ็นทรัล พระราม 3 กับ 3 วันแห่งความสุข ของเหล่าทาสแมวมาตะลุยอาณาจักรความสุข พบกับกองทัพน้องเหมียวขนนุ่มฟูหลากหลายสายพันธุ์ พร้อมกิจกรรมจัดเต็มเอาใจเหล่าชาวทาส อาทิ Cat Cafe คาเฟ่น้องเหมียวสุดน่ารัก Cat Playground สนามเหมียวเล่นแสนสนุก Cat Giant Paint ระบายสีภาพน้องแมวยักษ์ Workshop สร้อยคอ สายจูง กระเป๋าสุดคิ้วท์ Cat ID ทำบัตรประชาชนน้องแมว Cat Magazine ปริ้นท์รูปน้องแมวสุดเลิฟ แข่งขันน้องเหมียวลอดอุโมงค์และกินสู้ฟัดช้อปสินค้าและอุปกรณ์สำหรับสัตว์เลี้ยงราคาพิเศษ
Phatthalung Morning Drip #2 วันอาทิตย์ที่ 1/10/2023
Phatthalung Morning Drip #2 วันอาทิตย์ที่ 1/10/2023 เวลา 06.00-08.00 น.
-ดื่มกาแฟ หลากหลาย แหล่งทั่วโลก พบกับเมล็ดกาแฟระดับเเชมป์รายการ "The winner Professional coffee roaster championship 2023"
-ดื่มดำบรรยากาศยามเช้า
-พูดคุยเเลกเปลี่ยน เรื่องกาแฟ ๆลๆ
-พร้อมดลตรีขับกล่อมที่ไพเราะ
-ผู้สนใจเข้าร่วมกิจกรรม ฟรี
หรือร่วมสนับสนุน Tip box ไว้ซื้อเมล็ดกาแฟครั้งต่อไป ก็ยินดี Special Guest
-แชมป์ ดริป Thailand Brewer League#hatyai 2023
-รองเเชมป์ ดริป Thailand Brewer League#Khanom 2023
-รองเเชมป์ ดริป #PCCm Phatthalung coffee Craft Music2023
งานกัญชง-กัญชานานาชาติ Asia International HEMP and Cannabis Expo 2022 | 30 พ.ย. – 2 ธ.ค.65 LINK
งาน Asia International HEMP and Cannabis Expo 2022 งานแสดงเทคโนโลยี นวัตกรรม และผลิตภัณฑ์กัญชง-กัญชานานาชาติ ที่ยิ่งใหญ่ที่สุดในประเทศไทยและระดับเอเซีย จัดขึ้นระหว่างวันที่ 30 พฤศจิกายน – 2 ธันวาคม 2565 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์ โฉมใหม่ จะเป็นงานที่จะรวมทุกพันธมิตรในธุรกิจกัญชง-กัญชา ทั้งภาครัฐ เอกชน ทุกระดับและทุกสาขาในอุตสหกรรมที่จะเกี่ยวข้องกับการผลิต แปรรูป จำหน่าย การตลาด เทคโนโลยี นวัตกรรม การแพทย์ เวชภัณฑ์ ฯลฯ ปลดล็อคทุกข้อจำกัดและเปิดโอกาสสู่การพัฒนาอุตสาหกรรมกัญชง-กัญชาให้เติบโตระดับโลก
[ยกเลิก] พันธุ์บุรีรัมย์ Vol.2 25-27 พ.ย.65
พันธุ์บุรีรัมย์ Vol.2
ตั๋วปลดล็อค ราคากัญเอง ในงานจะมีทั้ง คอนเสิร์ตสุดมัน ตลกสุดฮา สาระความรู้จากการสัมมนาวิชาการ รวมไปถึงเพลิดเพลิน กับ Ganja Expo ที่มีสินค้า และนวัตกรรมกัญชา พร้อมการประกวดสุดยอดต้นกัญชาหลากหลายสายพันธุ์
หิวๆ ก็มี Food Zone อาหารเมนูเด็ด จากกัญชาให้อิ่มท้อง พลาดไม่ได้กับ ทัวร์ฟาร์มพันธุ์บุรีรัมย์ พร้อมดูโรงสกัด แถมมี มหกรรมความสนุกแบบไทย อาทิ บ้านผีสิง รถบั้มก็มา คาราโอเกะก็มี และอื่นๆอีกมากมาย
Unlock ticket บัตรจำหน่ายเพียง 3 วันเท่านั้น
ซื้อตั๋วรายวัน เพียง 420 บาท ต่อวัน (จากราคาปกติ 1,000 บาท)
หรือจะซื้อตั๋วเหมา 3 วัน อยู่กัญยาวๆ ก็ราคาเพียง 1,000 บาท เท่านั้น (จากราคาปกติ 2,500 บาท)
จำหน่ายตั๋ว 10-11-12 มิ.ย.นี้ ที่ Counter Service All Ticket ในร้าน 7-Eleven ทุกสาขาทั่วประเทศ
แล้วเจอกัน 25-26-27 พ.ย. 2565 ที่บุรีรัมย์
Pop Pop Music Festival เซ็นทรัล จันทบุรี ฮอลล์ 5 พ.ย.65 LINK
RPM และ Moonnomena presents “Pop Pop Music Festival”
เทศกาลดนตรีสุดป๊อป กับศิลปินสุดปัง Twopee Southside, Mean, Bowkylion, Wanyai x Mon Monik, Mirrr และ DJ Golfindo x MC Kahu
5 พฤศจิกายนนี้ที่ เซ็นทรัล จันทบุรี ฮอลล์
ซื้อบัตรได้แล้วตอนนี้ที่ www.ticketmelon.com/
UPF-THAILAND ปั่นริมเล ชมเสน่ห์พัทยา 13 พ.ย.65
UPF-THAILAND : ขอเชิญร่วมงานปั่นจักรยานเพื่อการกุศล ปั่นชิวๆ ชมวิวสวยๆ รายได้จากการจัดงานจัดซื้ออุปกรณ์กีฬามอบให้โรงเรียนที่ขาดแคลน งานปั่นจักรยานเพื่อสันติภาพ Peace Road Thailand 2022 "ปั่นริมเล ชมเสน่ห์พัทยา" วันอาทิตย์ที่ 13 พฤศจิกายน 2565 เส้นทาง ชายหาดเมืองพัทยา ㆍ แหลมบาลีฮาย ㆍรอบเมืองพัทยา ระยะทาง | 24 กิโลเมตร สมัครได้ตั้งแต่วันนี้ถึง 30 ตุลาคม 2565
11 กันยายน BKK เรนเจอร์ @ศูนย์เยาวชนบางขุนเทียน
“ BKK เรนเจอร์ @ศูนย์เยาวชนบางขุนเทียน”
อาทิตย์ที่ 11 กันยายนนี้ มาสนุกกับการแสดงจากเยาวชนในคลองเตย และศิลปิน แบบแน่น ๆ ตั้งแต่ 16.00 - 20.00 น. กันเลยทีเดียววว ????????
• 16.20 น. ดนตรีไทย บรรเลงขิม
• 16.30 น. การแสดงจาก รร.บางขุนเทียนศึกษา
• 16.40 น. ฟ้อนชมเดือน จากศูนย์เยาวชนทุ่งครุ
• 16.45 น. Jazz Dance จากศูนย์เยาวชนวัดเวฬุราชิน
• 16.50 น. การแสดงจาก รร.รัตนโกสินทร์สมโภช
• 17.05 น. ดนตรีจากศูนย์เยาวชนบางขุนเทียน
• 17.35 น. นาฏศิลป์ประยุกต์ "สาวกันตรึม"
• 17.50 น. BKK เรนเจอร์ Talks
• 18.20 น. แพร Feat.คริสต้า The Voice All Stars
• 19.00 น. PAUSE
ฟังเพลง ชมการแสดงพร้อมกับทำกิจกรรม Free Play & Free Art เช่น เพนท์หน้า, กระดานดำระดมไอเดีย, บันไดงูลดปัจจัยเสี่ยง, Young อยากได้, หุ่นมือถุงกระดาษ เป็นต้น
เข้างานฟรี!! ไม่ต้องลงทะเบียนล่วงหน้า
ยกเว้น กิจกรรม Workshop
WORLD WEED WEST Cannabiz Festival #1 17-20 พ.ย.65 LINK
ช็อบเพลินบูธผลิตภัณฑ์ทางการแพทย์และชาวสายเขียวกว่า 200 บูธ มันส์ไปกับศิลปินชื่อดัง
และการประกวด ต้นกัญชา, ช่อดอก และสาวงาม พร้อมเงินรางวัลมากมาย วันที่ 17-20 พฤศจิกายน 2565 นิคมกัญชาทางการแพทย์แห่งประเทศไทย ต.วังกระแจะ อ.ไทรโยค กาญจนบุรี
Line up
17 พฤศจิกายน 2565 - T bone
18 พฤศจิกายน 2565 - คาราบาว
19 พฤศจิกายน 2565 - illslick
20 พฤศจิกายน 2565 - ประกวดมิสแคนนาบิส
หมายเหตุ : **ผู้ร่วมงานต้องมีอายุไม่ต่ำกว่า 20 ปีบริบูรณ์
ปั่นแอ่วผ่อสองข้างตางใต้ฮ่มยางสาหระปี 20 พ.ย. 65
โรงเรียนสารภีพิทยาคม เชิญผู้สนใจและรักในการปั่นรถจักรยาน เข้าร่วมกิจกรรม "ปั่นแอ่วผ่อสองข้างตางใต้ฮ่มยางสาหระปี" สู่ชื่นชมธรรมชาติ และบรรยากาศแห่งเมืองประวัติศาสตร์ล้านนา เนื่องในโอกาสสถาปนาโรงเรียน ครบรอบ 44 ปี โดยจัดกิจกรรมในวันที่ 20 พฤศจิกายน 2565
รูปแบบของเส้นทางจะมี 2 รูปแบบ ได้แก่
1 เส้นทางมิตรภาพ (ระยะทาง 4+4 กิโลเมตร)
2 เส้นทางสุขภาพ (ระยะทาง 44 กิโลเมตร)
เงื่อนไขรับบริการ
สุนัขและแมว ที่จะรับบริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า มีข้อปฎิบัติดังนี้
- ต้องมีสุขภาพแข็งแรง ไม่ป่วย
- สุนัขและแมวที่จะทำหมัน ต้องจับขังกรง อดอาหารและน้ำ 8 ถึง 10 ชม. ก่อนนำมาทำหมัน**
- แมวที่จะทำหมัน - เพศเมีย ต้องอายุ 6 เดือนขึ้นไป - เพศผู้ ต้องอายุ 10 เดือนขึ้นไป
- สุนัขที่จะทำหมัน ต้องอายุ 6 เดือนขึ้นไป หรือ ตามแพทย์วินิจฉัย
- สุนัขและแมวที่จะฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า อายุ 3 เดือนขึ้นไป และร่างกายแข็งแรง
- สุนัขและแมวที่จะรับบริการทำหมัน ต้องอดอาหารและน้ำ ก่อนนำมาทำหมัน 8-10 ชั่วโมง
*ไม่ทำหมันให้กับสุนัขหน้าสั้นด้วยนะครับ อาทิเช่น ปั๊ก ชิวาวา ชิสุ ปอมเมอร์เรเนียน*
**ติดต่อรับบัตรคิวทำหมันสัตว์เลี้ยงที่หน้างานเท่านั้น**
**จำกัดครอบครัวละ 2 ตัว**
ปั่นข้ามโขงเชื่อมโยงวัฒนธรรมเพื่อการท่องเที่ยว (มุกดาหาร-สะหวันนะเขต) 12- 14 พ.ย.65
กิจกรรม “ปั่นข้ามโขงเชื่อมโยงวัฒนธรรมเพื่อการท่องเที่ยว (มุกดาหาร-สะหวันนะเขต) 12- 14 พฤศจิกายน 2565
สวิงในสวน Swing in the Park 4 สวนสวนรถไฟ อาทิตย์ที่ 13 พ.ย.65
กลับมาเต้นสวิงในสวนวันอาทิตย์นี้กัน ! สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร โดย กองการสังคีต ร่วมกับ The Stumbling Swingout และ DJ Donut ขอเชิญชวนชาวกทม. และทุกๆท่านมาร่วมงาน สวิงในสวน "Swing in the Park 4" ดนตรีโดย วง The Stumbling Swingout และ DJ Donut และมาหัดเรียนเต้นสวิงแบบมือใหม่ไปด้วยกันกับ ครูสุ และ ครูอิ๊ก วันอาทิตย์ที่ 13 พฤศจิกายน 2565 เวลา 17.00-19.00 สถานที่ สวนวชิรเบญจทัศ (สวนรถไฟ)
กิจกรรมเข้าร่วมฟรี ไม่มีค่าใช้จ่าย !
บางขุนพรหมรมณีย์ ครบรอบ 80 ปี ธนาคารแห่งประเทศไทย อาทิตย์ที่ 13 พ.ย.65
คอนเสิร์ตวงเครื่องสายผสมเปียโน และเดี่ยวเปียโนกับขับร้อง รายการ "บางขุนพรหมรมณีย์” เนื่องในโอกาสครบรอบ 80 ปี ธนาคารแห่งประเทศไทย วันอาทิตย์ที่ 13 พฤศจิกายน 2565 เวลา 14.30 -16.30 น. ณ ตำหนักสมเด็จ วังบางขุนพรหม
ลงทะเบียนสำรองที่นั่งไม่มีค่าใช้จ่าย ภายในวันที่ 10 พฤศจิกายน 2565 (รับจำนวนจำกัด)
ดนตรีในสวน "วงสุนทราภรณ์" 12 พ.ย.65 สวนเบญจกิติ
เริ่มหนาวแล้ว...ไปชมดนตรีในสวนกัน กรุงเทพมหานคร ขอเชิญชม ดนตรีในสวน "วงสุนทราภรณ์"
เพลิดเพลินไปกับการแสดงดนตรีจาก วงสุนทราภรณ์ พร้อมชมความสวยงานของน้ำพุในบรรยากาศยามเย็น ณ สวนเบญจกิติ (ลานกิจกรรมสวนน้ำ) ในวันเสาร์ที่ 12 พฤศจิกายน 2565 เริ่มเวลา 17:00 น. *ในเวลา 16.00 – 16.45 น. เป็นการแสดงจาก วงดนตรี Old Doc
ชมภาพบรรยากาศงานดนตรีในสวน
RCB Music วงนักเรียนมหิดล ที่ RCB Artery 19 พ.ย.65
RCB Music การแสดงสดจาก Bossanova วงดนตรีนักเรียนจากวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล ที่จะพาคุณดื่มด่ำกับบรรยากาศดีๆ ไปพร้อมกับดนตรีที่ฟังสบาย
วันที่ 19 พฤศจิกายน ที่ RCB Artery ชั้น 1 ตั้งแต่เวลา 16.00 น. เป็นต้นไป
Music in the Park : Peace in Oneself Peace in the World ณ สวนโมกข์กรุงเทพ เสาร์ที่ 26 พ.ย.65
ช่วงเย็น ๆ รับลมหนาว ออกกำลังใจ l กับดนตรีภาวนาในสวน ชวนทุกคนมาสัมผัสบรรยากาศท่ามกลางธรรมชาติ กับกิจกรรม Music in the Park : Peace in Oneself Peace in the World โดย หมู่บ้านพลัม ประเทศไทย
วันเสาร์ที่ 26 พฤศจิกายน 2565 เวลา 16.30 - 18.00 น.
ณ สวนโมกข์กรุงเทพ (บริเวณทางลงสวนพุทธธรรม)
ชวนมาภาวนาผ่านเสียงดนตรี ท่ามกลางธรรมชาติในสวนกัน
สามารถเข้าร่วมได้ทั้งคนไทย และชาวต่างชาติ มีพิธีกรแปลภาษาตลอดกิจกรรม
สอบถามโทร 094 894 4554 (งานกิจกรรม)
Med Music in the Park โดย รพ.เมดพาร์ค ณ สวนเบญจกิติ อาทิตย์ที่ 27 พ.ย.65 LINK
รพ.เมดพาร์ค จัดกิจกรรมดนตรีในสวน "Med Music in the Park" โอกาสฉลองครบรอบ 2 ปีที่เปิดให้บริการ และต้อนรับเทศกาลปีใหม่ ณ Amphitheater สวนเบญจกิติ วันอาทิตย์ที่ 27 พฤศจิกายน 2565 ถือเป็นส่วนหนึ่งในกิจกรรมเพื่อสังคมที่ รพ. เมดพาร์ค รังสรรค์ขึ้น ตามความมุ่งมั่นที่จะเป็นมากกว่าสถานพยาบาล ส่งเสริมให้ทุกคนมีส่วนในการสร้างสรรค์สังคมที่ดี คำนึงถึงความยั่งยืนของสิ่งแวดล้อมและชุมชน
“Med Music in the Park” ครั้งนี้เป็นฟรีคอนเสิร์ตนำเสนอเพลงสากลและเพลงไทย ในบรรยากาศสบายๆ ในสวนป่าอันร่มรื่น ประกอบด้วยศิลปินคุณภาพทั้งชาวไทยและต่างชาติ
รายนามศิลปินที่ร่วมแสดง
- Patrizio Buanne ศิลปินผู้มีชื่อเสียงชาวอิตาเลียน มียอดขายกว่า 10 ล้านแผ่นและเปิดการแสดงมาแล้วทั่วโลก
- คุณกบ เสาวนิตย์ นวพันธ์ Diva ชื่อดังของเมืองไทย
- คุณลูกหว้า พิจิกา จิตตะปุตตะ นักร้องและนักแสดงมิวสิคัลคุณภาพที่มีผลงานมากมาย
- คุณเพียว เอกพันธ์ วรรณสุทธิ์ ผู้ชนะการประกวด The Voice All Stars คนแรกของไทย
- Sunny Trio & Natt Buntita ที่กำลังโด่งดังในแนวเพลงแจ๊ส
- วง RSU Orchestra เรียบเรียงและอำนวยเพลงโดย รศ.ดร.เด่น อยู่ประเสริฐ อาจารย์ผู้ทรงคุณวุฒิด้านดนตรีหลายแขนง ที่จะมาสลับกันร้องและบรรเลงเพลง
เพื่อเข้าร่วมงานและรับของที่ระลึก (ฟรี ไม่มีค่าใช้จ่ายตลอดทั้งกิจกรรม)
ดนตรีสดในสวน ชีวารมย์ นครอินทร์ 26 พ.ย.65
26 พฤศจิกายนนี้!!!พบดนตรีสดในสวน ชีวารมย์ นครอินทร์ พร้อมอาหารเครื่องดื่มนานาชนิด ลงทะเบียนเข้างานฟรี!! เตรียมตัวให้พร้อมพบกับกิจกรรมสุดชิคในงาน
จัดโดย Chewarom Nakhon In (ราชพฤกษ์-นครอินทร์)
ดนตรีในสวนมหาวิทยาลัยนวมินทราธิราช ครั้งที่ 7 ศุกร์ที่ 18 พ.ย.65
ขอเชิญชวนผู้ที่รักในเสียงดนตรีและทุกๆท่าน ร่วมงาน "ดนตรีในสวน มหาวิทยาลัยนวมินทราธิราช" ครั้งที่ 7 เนื่องในโอกาสเปิดอาคารเกษมศรี และ อาคารทิวากรวงศ์ประวัติ มหาวิทยาลัยนวมินทราธิราช ในวันศุกร์ที่ 18 พฤศจิกายน 2565 ณ สำนักงานอธิการบดี มหาวิทยาลัยนวมินทราธิราช ชั้น 8 อาคารเกษมศรี เริ่มงาน เวลา 17.00 น. ชมการแสดง จากนักศึกษามหาวิทยาลัยนวมินทราธิราช
- วงดนตรีจากคณะวิทยาศาสตร์และเทคโนโลยีสุขภาพ
- NMU BAND
ดนตรีในสวน ครั้งที่ 2 Phrakhanong Street Show สำนักงานเขตพระโขนง ศุกร์ที่ 4 พ.ย.65
งาน “ดนตรีในสวน” เย็นวันศุกร์ที่ 4 พฤศจิกายนนี้ พบกับงาน “ดนตรีในสวน” ครั้งที่ 2 พื้นที่แห่งดนตรีและศิลปะการแสดง Phrakhanong Street Show ณ “สวน” ติดกับบริเวณทางเข้าสำนักงานขนส่งฯ พื้นที่ 3 (BTS บางจาก) ตั้งแต่ 15.00-19.00 น. เข้าฟรี‼️ ไม่เสียค่าใช้จ่าย
สำนักงานเขตพระโขนง กลับมาเปิดพื้นที่แห่งดนตรีและศิลปะการแสดงกันอีกครั้ง ให้ศิลปินได้มีโอกาสโชว์ของ แสดงผลงานของตนเอง เพิ่มพื้นที่จำหน่ายสินค้าสร้างรายได้ กระตุ้นเศรษฐกิจ มาพร้อมกับกิจกรรมดีๆ ที่เราพร้อมเสิร์ฟให้ทุกคน อาทิ นวดคลายเมื่อย ตัดผม ตรวจโรค ฟรี‼️ วาดภาพระบายสี ทานอาหารอร่อยๆ ฟังดนตรีเพราะๆจาก “มณฑลทหารบกที่ 11” ฯลฯ หรือจะมานั่งพักผ่อนในสวน เม้ามอยกับแก๊งเพื่อนก็ได้นะ การจัดงานในครั้งนี้เป็นไปตามนโยบาย “9 ด้าน 9 ดี” ของผู้ว่าราชการกรุงเทพมหานคร นายชัชชาติ สิทธิพันธ์ุ มิติเศรษฐกิจดี ดึงอัตลักษณ์ สร้างเศรษฐกิจ 50 ย่านทั่วกรุงเทพฯ และมิติสร้างสรรค์ดี กรุงเทพฯ พื้นที่แห่งดนตรีและศิลปะการแสดง (สตรีทโชว์)
เทศกาลดูหนังฟังดนตรีในสวน Music and Movie in the park#2 : Jurassic Punk เมกาบางนา 26-27 พ.ย.65 LINK
กลับมาสร้างปรากฏการณ์ความสุข และความสนุกอีกครั้ง! กับเทศกาลดูหนังฟังดนตรีในสวน Music and Movie in the park#2 : Jurassic Punk ที่จะพาทุกคนออกไปผจญภัยในดินแดนที่เต็มไปด้วยไดโนเสาร์สุดน่ารัก พร้อมเพลิดเพลิน และเต็มอิ่มไปกับกิจกรรมสุดพิเศษมากมาย ภายใต้บรรยากาศสุดชิลล์ในสวนที่ร่มรื่น รายล้อมไปด้วยต้นไม้ โดยไม่มีค่าใช้จ่ายตลอดงาน
ศิลปินดังมากมาย อาทิ วงดูโอ้ ป็อป SERIOUS BACON, KLEAR, SARAH SALOLA และ WANYAI x MON รวมถึงรับชมภาพยนตร์เรื่อง Jurassic World ภาค 1 และ 2
วันที่ 26-27 พ.ย. 65 เวลา 15.00-21.30 น. ณ บริเวณ Mega Park ศูนย์การค้าเมกาบางนา
งานนี้ต้องไม่พลาดเคลียร์คิวให้พร้อม แล้วมาพบกันเป็นครั้งที่สอง รับรองความสนุก สร้างได้รอยยิ้มได้ไม่หยุดทั้งครอบครัว ที่เมกาบางนานะคะ!
THE 420 CRUISE #4 - 26 พ.ย.65
งาน 420 Cruise กิจกรรมออแกนนิค ครั้งที่ 4 ที่
Bangkok Island ไปสนุกกับร้านกัญชา และดนตรีด้วยกัน และถล่มเจ้าพระยาไปด้วยกัน!! What to expect Cannabis Market Cannabis cup DJ boogie G Dj Zlexx Zeitgeists (live) ตั๋ว 620 + 1 ดริ๊งค์
งาน Phuket Health and Travel 2022 ผลิตภัณฑ์กัญชาเพื่อการรักษาและดูแลสุขภาพ
วันที่ 4 - 6 พฤศจิกายน 2565 เวลา 11:00 – 20:00 น. Mercado Hall ศูนย์การค้าปอร์โต เดอ ภูเก็ต
Spacebar Music Hub x College of Music ม.มหิดล 25 พ.ย. 65
กลับมาอีกครั้งกับงาน Singha Corporation Present Spacebar Music Hub x College of Music Mahidol University
YOUTH EXPLOSION 3 CONCERT
25 พ.ย. 65 เข้าชมฟรี ‼️ ณ ลานด้านหน้ามหิดล สิทธาคาร มหาวิทยาลัยมหิดล ศาลายา เวลา 16.00 น.เป็นต้นไป!!!
งานนี้จัดเต็มศิลปินผู้สร้างแรงบันดาลใจที่พร้อมมามอบความสนุกให้ทุกคนจาก Me Records และ Home Run Music ได้แก่ PLAYGROUND / CINCIN IRADA / RUBYTAN
สำหรับศิลปินน้องใหม่จากวิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล ที่ผ่านการคัดเลือกเข้ามาประกอบด้วย
BBOYKHUN
Earthlolipop
Java
Pavidaaa
พร้อมเจอกับศิลปินจาก YOUTH EXPLOSION 2 ที่จะมาเป็น Opening Act ภายในงานประกอบด้วย
TIENPARB
LUIZ
NINENOII
Music in the garden อัฒจรรย์หญ้า (amphitheater) ม.มหิดล ศาลายา 16 พฤศจิกายน 2565
Music in the garden มาแล้ว THM Club และ MUSIC Club ผลึกกำลัง แพ็กความสุขส่งความสนุกด้วยเสียงดนตรีส่งตรงถึงพี่น้องนักศึกษามหิดล กับงาน Music in the garden
ดนตรีในสวน ที่ อุทยานธรรมชาติวิทยาสิรีรุกขชาติ พบกับวงดนตรี อาทิ Simp Sump sorn , Diluted Ginger Cat , Kimera , จั๊กกิ๋ม&ต๊กโต(Jukkim Ttokkto) , Moderncat&Polydog , Tempolessissue
วันพุธ ที่ 16 พฤศจิกายน 2565 ตั้งแต่เวลา 16.00 - 18.00 น.
ณ อัฒจรรย์หญ้า (amphitheater) อุทยานธรรมชาติวิทยาสิรีรุกขชาติ ตึกอาทิตยาธร ชั้น 2 ลานลูกเต๋า
งาน The Jazz and Café Concerto 2022 เซ็นทรัล อยุธยา วันที่ 24 - 30 พฤศจิกายน 2565
วันที่ 24 - 30 พฤศจิกายน 2565 ชวนคุณมาดื่มด่ำไปกับบรรยากาศรื่นรมย์ชมดนตรีในงาน งาน The Jazz and Café Concerto 2022 ลานกิจกรรมชั้น G ศูนย์การค้าเซ็นทรัล อยุธยา เพลิดเพลินไปกับเมนูอาหารภายในงาน พร้อมกับโชว์สุดพิเศษ จากศิลปินชั้นนำ ที่จะมาส่งมอบความสุขผ่านบทเพลงและเสียงร้องสุดไพเราะ
24 พ.ย. 65 เวลา 17.00 น. GOB SAOVANIT
25 พ.ย. 65 เวลา 18.00 น. JOHNIFER THE VOICE
26 พ.ย. 65 เวลา 18.00 น. NATT THE VOICE
27 พ.ย. 65 เวลา 17.00 น. โรงเรียนดนตรี YAMAHA
28 พ.ย. 65 เวลา 17.00 น. มหาวิทยาลัยศิลปากร
29 พ.ย. 65 เวลา 17.00 น. มหาวิทยาลัยราชภัฏวไลยอลงกรณ์
25 ธ.ค.65 ดนตรีในอุทยาน 100 ปี จุฬาฯ Concert in the Park #30 โดยวง Royal Bangkok Symphony Orchestra LINK
ถ้าคริสต์มาสนี้ไม่ติดอะไร เชิญชวนมาฟังดนตรี
Concert in the Park #30 โดยวง Royal Bangkok Symphony Orchestra ณ อุทยาน 100 ปี จุฬาฯ วันอาทิตย์ที่ 25 ธันวาคม 65 เฉลิมฉลองโอกาสคริสมาสกัน เริ่มตั้งแต่เวลา 17.30 น.เป็นต้นไป การแสดงครั้งนี้จะเป็นการแสดงของวงชุดสุดท้ายสำหรับปี 2565 นี้ เพื่อจะกลับมาพบกันใหม่ในปีหน้า อำนวยวงโดยวาทยกร วานิช โปตะวณิช , นักร้อง เอฟ รัฐพงศ์ ปิติชาญ และคุณฟางข้าว ณัชชา จิตตานนท์
Got any plan for Christmas?
Join us for the last CONCERT IN THE PARK of the year at Centenary Park, Chulalongkorn University with guests singers performing all-time favourite Christmas sons and other popular numbers. Don’t miss our most popular event amidst great atmosphere, weather and music!
Date & Time: Sunday, 25 December 2022 at 5.30pm
Venue: Centenary Park, Chulalongkorn University
24-26 ธ.ค. ดนตรียามค่ำที่พิพิธภัณฑ์กองทัพอากาศ งาน RTAF Night at the Museum
ฟังดนตรีจากวงดุริยางค์ทหารอากาศชุดใหญ่ใต้ปีเครื่องบิน C-123 วันที่ 24-26 ธันวาคม เวลา 19-22 น. เป็นกิจกรรมส่วนหนึ่ง ในงาน RTAF Night at the Museum ชมพิพิธภัณฑ์กองทัพอากาศและการบินแห่งชาติยามค่ำคืน ที่จัดระหว่าง 21 - 26 ธันวาคม 2565 นี้ ตั้งแต่เวลา 13:30 - 22:00 น. ชมฟรี
25 ธ.ค. 65 New Year Concert - บรรเลงโดย วง Bangkok Metropolitan Orchestra
การแสดงดนตรี “New Year Concert” บรรเลงโดย วง Bangkok Metropolitan Orchestra โดยมี ศิลปินรับเชิญ คุณโน้ต ศรัณย์ คุ้งบรรพต และนักร้องคุณภาพจากกรุงเทพมหานคร คุณน้ำฟ้า แก้วรัตนศรีโพธิ์ และ คุณกาญจนา จันทร์ไผ่ และพบกับการแสดงวงออเคสตราประกอบจินตาลีลาชุด “รัตนโกสินทร์” การบรรเลงเดี่ยว Violin และ เดี่ยวระนาด ร่วมกับวงออเคสตร้า โดย คุณตอง พงศ์สิต การย์เกรียงไกร และคุณเอื้อย อภิญญา อินทร์สกุล
วันอาทิตย์ที่ 25 ธ.ค. 2565 ณ Museum Siam เริ่มเวลา 17.00 น.
เทศกาลดนตรีกรุงเทพมหานคร Bangkok Music Fest LINK
กรุงเทพมหานครจัดให้มีกิจกรรมการแสดงในเทศกาลดนตรีกรุงเทพมหานคร Bangkok Music Fest ตั้งแต่ 25 ธันวาคม 2565 ต่อเนื่องไปถึงเ 28 มกราคม 2566 รวม 6 ครั้ง กำหนดจัดในวันอาทิตย์ จำนวน 5 ครั้ง ณ ลานมิวเซียมสยาม เริ่มอาทิตย์ที่ 25 ธ.ค. นี้ ตั้งแต่เวลา 17.00 น. เป็นต้นไป และสำหรับวันเสาร์ที่ 28 ม.ค. 66 จัด ณ อาคารกีฬาเวสน์ 2 ศูนย์เยาวชนกรุงเทพมหานคร (ไทย-ญี่ปุ่น) ตั้งแต่เวลา 14.00 น. เป็นต้นไป
25 ธ.ค. Music in the Backyard @Siam Square
ต้อนรับเทศกาลคริสมาสต์! กับ Music in the Backyard @Siam Square ชวนมานั่งฟังดนตรีที่สวนหลังบ้านในบรรยากาศสุดอบอุ่น วันที่ 25 ธ.ค. 65 เวลา 17.00 - 18.00 น. Park @Siam (พาร์ค @สยาม) มาในธีมเพลงเทศกาลคริสต์มาสพร้อมบรรเลงโดยน้องๆ “วงสุ่ย วินด์อองซอมเบิ้ล”คณะครุศาสตร์ สาขาวิชาดนตรีศึกษา จุฬาลงกรณ์มหาวิทยาลัย งานนี้ฟังเพลินเต็มอิ่มเติมเต็มบรรยากาศแห่งความสุขตลอดคริสต์มาสนี้!
2-30 ธ.ค. centralwOrld Bangkok Countdown Festival
centralwOrld จัดดนตรีมาให้ชมกันตลอดเดือนธันวาคม ที่ลาน Happiness Village Stage, square B ช่วง 18:00-19:00 น. ศิลปินเพียบเช็ควันแสดงได้เลย
งานโคราชไบค์วีค ครั้งที่ 5
งานโคราชไบค์วีค ครั้งที่ 5 "สองล้อคือกั๋น" 4-5 พฤศจิกายน 2565 ณ ตลาดเซฟวัน โคราช
Krabi Bike Week 9th
Krabi Bike Week 9th. 11-12 November 2022
CAFE SHOW SEOUL 2023 @Nov 8-11, 2023
Cafe Show Seoul is the world’s largest business platform that takes place every November to revitalize the global coffee industry and F&B culture. Nov 8-11, 2023 Coex, Seoul
Thep Sadet Cross Country Run 2023 เทพเสด็จ 26 พ.ย.66 LINK
นักวิ่งสายชิล-คอกาแฟต้องรักงานนนี้ Thep Sadet Cross Country Run 2023 จัดที่เทพเสด็จ ตำบลเล็ก ๆ กลางป่า แหล่งอาราบิก้าชั้นดี หมู่บ้านสุดสโลว์ไลฟ์ มาวิ่งผ่านธรรมชาติอันร่มรื่น สูดอากาศเย็นสบายในเดือนพฤศจิกายน สูดกลิ่นกาแฟให้เต็มปอดไปด้วยกัน!
วันแข่งขัน
แม่แจ่ม (ป่าบงเปียง) 15 ตุลาคม 2566
เทพเสด็จ 26 พฤศจิกายน 2566
เชียงดาว 24 ธันวาคม 2566
ห้วยตึงเฒ่า 21 มกราคม 2567
โคราชมาราธอน 2023 วันแข่งขัน 12 พ.ย.66 LINK
KORAT MARATHON 2023 PRESENTED BY THE MALL
เดอะมอลล์ กรุ๊ป ร่วมกับ จังหวัดนครราชสีมา และบริษัท เรซอัพ เวิร์ค จำกัด เฉลิมฉลอง 555 ปี เมืองนครราชสีมา จัดงานวิ่งมาราธอนมาตรฐานโลก "KORAT MARATHON 2023 PRESENTED BY THE MALL - โคราชมาราธอน 2023 พรีเซนต์เต็ด บาย เดอะมอลล์" มาตรฐาน World Athletics Road Race Label 2023
วันแข่งขัน 12 พฤศจิกายน 2566
เส้นทางแข่งขัน : จุดปล่อยตัวและเส้นชัยคนละจุด (Point to Point)*
จุดปล่อยตัว : อนุสาวรีย์ท้าวสุรนารี
ประเภทการแข่ง มาราธอน 42.195 กม. / ฮาล์ฟมาราธอน 21.1 กม. / มินิมาราธอน 10 กม. / ไมโครมาราธอน 5 กม.
Wangbon Trail วังบอนเทรล 18-19 พ.ย.66 LINK
18-19 พฤศจิกายน 2566 ณ ไร่วังบอน นครนายก นักวิ่งสายแคมป์ไม่ควรพลาด กับกิจกรรมย่อย วังบอน แคมป์ รัน รับสมัครนักวิ่งทั้งชายและหญิงไม่จำกัดเพศและรุ่นอายุ รับจำนวนจำกัด แค่ 200 คนเท่านั้น เส้นทางวิ่ง ไร่วังบอน - ผาผึ้ง - อ่างเก็บน้ำคลองกลาง ระยะทาง10 km (ไม่ขึ้นอ่างเก็บน้ำวังบอน) ไร่วังบอน - ผาผึ้ง - อ่างเก็บน้ำคลองกลาง - อ่างเก็บน้ำวังบอน ระยะทาง 12 km ปล่อยตัว 05.45 น. วลาที่ให้ 3 ชั่วโมง
วิ่งขึ้นเขาคิชฌกูฏ 26 พ.ย.66
งานวิ่งที่ไม่ได้ขับเคลื่อนด้วยเเรงกาย เเต่พิสูจน์ด้วยพลังแห่งศรัทธา
✅กับการวิ่งขึ้นเขาคิชฌกูฏเเบบเต็มรูปแบบ 100%
✅บรรยากาศที่เต็มไปด้วยเรื่องราวความเชื่อของผู้คน รวมไปถึงบรรยากาศของภูมิประเทศที่มีความสมบูรณ์ ต้นน้ำลำธาร ในช่วงก่อนเปิดฤดูกาลท่องเที่ยว หาที่ไหนไม่ได้อีกเเล้ว
“สายบุญ สายมู มาร่วมวิ่งส่งพลังศรัทธาไปด้วยกันนะคะ”
“หลังจากหักค่าใช้จ่ายเเล้ว รายได้ส่วนหนึ่งนำมอบให้กับกองทุนสวัสดิการกรมอุทยานสัตว์ป่าและพันธุ์พืช” วันปล่อยตัววิ่ง 26 พฤศจิกายน 2566 ณ โรงเรียนวัดพลวง อำเภอเขาคิชฌกูฏ จังหวัดจันทบุรี ระยะการแข่งขัน 5 KM. / 15 KM. / 26 KM.
วิ่ง 108 SAO FRIENDSHIP RUN 2023 วันที่ 26 พ.ย.66 LINK
สำนักงานการตรวจเงินแผ่นดิน (สตง.) ขอเชิญชวนนักวิ่งทุกท่าน ร่วมสนุก และร่วมทำบุญกับกิจกรรมเดิน-วิ่ง การกุศล เนื่องในโอกาสครบรอบ 108 ปี แห่งการสถาปนาสำนักงานการตรวจเงินแผ่นดิน ในงาน 108 SAO FRIENDSHIP RUN 2023 ในวันที่ 26 พฤศจิกายน 2566 ณ สำนักงานการตรวจเงินแผ่นดิน (ถนนพระราม 6) รายได้หลังหักค่าใช้จ่าย ร่วมสมทบทุนโครงการ “เงินทุนฉุกเฉินเพื่อช่วยเหลือผู้ประสบภัยพิบัติ” สภากาชาดไทย จำนวนจำกัดเพียงแค่ 1,500 คนเท่านั้น! (รวมทุกระยะ) ระยะทาง 5K / 10.8K ปล่อยตัวที่ สำนักงานการตรวจเงินแผ่นดิน (สตง.) ถนน พระราม 6
งานวิ่ง Mission Run for Health + Help 2023 สมาคมศิษย์เก่าคณะพยาบาลศาสตร์มิชชั่น 5 พ.ย.66 LINK
งานวิ่งรับลมหนาวบนเส้นทางมวกเหล็ก-ซับประดู่ ร่วมวิ่งสร้างตำนานช่วยพยาบาลสร้างตึก Mission Run for Health + Help 2023 จัดโดยสมาคมศิษย์เก่าคณะพยาบาลศาสตร์มิชชั่น วันอาทิตย์ที่ 5 พฤศจิกายน 2566 เวลา 06.00-09.00 น. สถานที่ คณะพยาบาลศาสตร์มิชชั่น มหาวิทยาลัยนานาชาติเอเซียแปซิฟิก วิทยาเขตมวกเหล็ก ประเภทกิจกรรม
1. Mini Marathon 10 KM.
2. Fun Run 5 KM. สำหรับกลุ่มอายุตั้งแต่ 14 ปีขึ้นไป
3. Fun Run for Kids 5 KM. สำหรับเด็กอายุ 8-13 ขวบ
ตั้งแต่วันที่ 1 มิถุนายน- 30 กันยายน2566
หรือจนกว่าจะเต็มจำนวนรวมทุกประเภทจำนวน 3,000 คน
ไม่มีการลงทะเบียน รับหมายเลขวิ่ง และอุปกรณ์ในวันแข่งขัน
ผู้สมัครทุกคนจะได้รับการทำประกันอุบัติเหตุหมู่
ผาเงาฮาล์ฟมาราธอน 12 พฤศจิกายน 2566
"ผาเงาฮาล์ฟมาราธอน" รับสมัครวันนี้-30 กันยายน 2566 วันวิ่ง วันอาทิตย์ที่ 12 พฤศจิกายน 2566 ณ วัดพระธาตุผาเงา ต.เวียง อ.เชียงแสน จ.เชียงราย
ผาเงาฮาล์ฟมาราธอน 12 พ.ย.66
ผาเงาฮาล์ฟมาราธอน วันอาทิตย์ที่ 12 พฤศจิกายน 2566 ณ วัดพระธาตุผาเงา ต.เวียง อ.เชียงแสน จ.เชียงราย
งานวิ่งก้าวด้วยธรรมเพื่อ 19 โรงพยาบาล-รพ.ละหานทราย 12 พ.ย.66
งานวิ่งก้าวด้วยธรรมเพื่อ 19 โรงพยาบาล-รพ.ละหานทราย วันที่ 12 พฤศจิกายน 2566 ประเภทการวิ่ง Fun Run 5 km / Mini Marathon 10.5 km สมัครออนไลน์ได้ที่
kaoduaydham หรือ สมัครด้วยตนเองได้ที่ รพ.ละหานทราย จุดที่ 1 อาคารอำนวยการชั้น 3 ห้องงานวิจัยและพัฒนาคุณภาพ
จุดที่ 2 ตึกผู้ป่วยนอก งานประชาสัมพันธ์ (ในวันและเวลาราชการ จันทร์-ศุกร์ เวลา 08.30-16.00 น.) เริ่มสมัครตั้งแต่วันที่ 15 ก.ย - 20 ต.ค.2566
Chonburi Coffee on The Beach 2023 @25-26 พ.ย.66 หาดจอมเทียน
งานกาแฟริมชายหาด ที่สุดในภาคตะวันออก “ Chonburi Coffee on The beach 2023 “ ที่เราจะพาทุกท่านมาร่วมเดินทาง และค้นหาตัวตนในโลกของกาแฟไปกับพวกเรา ภายใต้คอนเซ็ปท์ Coffee Art Journey การเดินทางตามหากาแฟแก้วโปรด และศิลปะแห่งกาแฟ มาร่วมเดินทางกับพวกเราในวันที่ 25-26 พฤศจิกายน 2566 ณ. หาดจอมเทียน เตรียมตัวพบกับ ร้านคาเฟ่แบบจัดหนักจัดเต็ม ทั้งชา กาแฟ โกโก้ ตลอดจนร้านขนมและอาหารอีกมากมาย
Coffee Lover@คลองโบด 24-26 พ.ย.66 นครนายก
อบจ. นครนายก ร่วมมือกับ กลุ่มนักธุรกิจรุ่นใหม่ YEC หอการค้าจังหวัดนครนายก และการท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานนครนายก ชวนคนรักกาแฟมาเปิดประสบการณ์ การดื่มกาแฟท่ามกลางธรรมชาติ ชมวิวพระอาทิตย์ตกสุดโรแมนติกริมอ่างเก็บน้ำคลองโบด ในระหว่างวันที่ 24-26 พฤศจิกายน 2566 ตั้งแต่เวลา 09.00 น. เป็นต้นไป ณ ศูนย์การท่องเที่ยวเชิงเกษตร @คลองโบด อบจ.นครนายก
ภายในงานพบกับ
• ร้านกาแฟดังจากทั่วทุกมุมของจังหวัดนครนายก ที่รวบรวมมาให้เหล่าคอฟฟี่เลิฟเวอร์ ได้ลิ้มรสชาติกาแฟแบบจัดเต็ม
• มีจักรยานไว้บริการ สำหรับปั่นไปชมวิวความงดงามของสันอ่างเก็บน้ำคลองโบด ปั่นฟรีไม่มีค่าใช้จ่าย
• Street food สุดเทรนด์ จากผู้ประกอบการ
• อาหารอร่อยจากทีม Food Truck นครนายก
• พบกับการเปิดตัว 20 สาวงาม ผู้เข้าประกวด Miss Grand Nakhon Nayok 2024 ครั้งแรก ครบทั้ง 20 คน
• Mini concert ในบรรยากาศสุดชิวกับสุดยอดศิลปิน ยุค 90 ปราโมทย์ วิเลปะนะ (คืนที่ดาวเต็มฟ้า,move on) และ แอ๊น Emotion Town (เหตุเกิดจากความเหงา,ชั่วโมงเศร้า)
• การแสดงจาก จากน้องๆ ศิลปินจาก Local Band พร้อมกิจกรรม ส่งเสริมพัฒนาเด็กจาก พี่ๆ สสส. และการแสดงบนเวที ของนักเรียนนักศึกษาในจังหวัดนครนายก
• ที่สำคัญมีของรางวัลน่ารัก สุดหวาน สำหรับผู้เข้างาน 100 ท่านแรกในทุกวัน
สอบถามเพิ่มเติมได้ที่
037 349 737 ต่อ 1013 (ฝ่ายส่งเสริมการท่องเที่ยว อบจ.นครนายก)
086 655 5749 (คุณโต้ง หอการค้าโดย YEC)
ชวนเปิดโลก กาแฟมูเซอ กิจกรรม One Day Trip. Coffee Camp...From Seed To Sip
Muser Coffee กาแฟสดมูเซอ ชวนมาเปิดโลก "กาแฟมูเซอ" กิจกรรม One Day Trip. Coffee Camp..."From Seed To Sip" เชิญชวนผู้สนใจเข้าชมกระบวนการแปรรูปกาแฟ ตั้งแต่การปลูก เก็บ ตาก รวมไปถึงการคั่ว ชง ชิมกาแฟ เป็นการเปิดให้เที่ยวชมสวนกาแฟแบบ public ครั้งแรก
โดยจัดเป็นรูปแบบ One Day Trip มีกิจกรรม ได้แก่ การชมสวน / เก็บกาแฟ / แปรรูปกาแฟคั่ว / ชง / ชิม ค่าใช้จ่าย 599 บาท/ท่าน 2 ท่าน 1,000 มีรถรับส่ง+อาหารกลางวัน กับข้าวมูเซอ วันที่เปิด ทริป 11-14, 18, 25-26 พ.ย. และ 2-3 ธ.ค. สอบถามโทร 099-3659415
ปฏิทินท่องเที่ยวจังหวัดเชียงราย เดือนพฤศจิกายน 2566
เที่ยวสนุกเดือนพฤศจิกายน ในเชียงราย กับกิจกรรมมากมายตลอดเดือน
4 - 5 พฤศจิกายน 66
PHAYAPRAI HIGHLAND RUN
โรงเรียนพญาไตรมีตร อ.แม่ฟ้างลวง
4 - 5 พฤศจิกายน 66
CRC CHIANG RAI ROAD CLASSIC 2023
สิงห์ปาร์ค เชียงราย อ.เมือง โทร. 053-160636
8 พฤศจิกายน 66 - 31 มกราคม 67
งานเทศกาลสีสันกาสะลอง
เซ็นทรัล เชียงราย โทร. 052-020999
11 - 12 พฤศจิกายน 66
ทอสายบุญ จุลกฐิน ถิ่นไทลื้อโบราณ
บ้านหาดบ้าย อ.เชียงของ อบจ.เชียงราย โทร. 053-175333
17 - 19 พฤศจิกายน 66
วัฒนธรรมอาหารชนเผ่าดอยแม่สลอง
พิพิธภัณฑ์วีรชนอดีตทหารจีนคณะชาติภาคเหนือ อ.แม่ฟ้าหลวงอบต.แม่สลองนอก โทร. 053-765129
19, 26 พฤศจิกายน 66
SUNDAY CRAFT MARKET
บ้านหนองหม้อ CREATIVE VILLAGE อ.เมือง โทร. 063-6616155
18 - 19 พฤศจิกายน 66
งานดอกบัวตองบานที่บ้านหัวแม่คำ
บ้านหัวแม่คำ ม.4 อ.แม่ฟ้าหลวง อบต.แม่สลองใน โทร. 053-730360
18 - 19 พฤศจิกายน 66
MAE SALONG TRAIL 2023
ดอยแม่สลอง อ.แม่ฟ้าหลวง BIGBLUE โทร. 099-3843222
19 พฤศจิกายน 66
"CHIANG RAI ART CARNIVAL 2023" ริ้วขบวนศิลปะร่วมสมัย "เปิดโลก 18 อำเภอ"
หอนาฬิกาเฉลิมพระเกียรติ -ถนนบรรพบราการ อ.เมือง วัฒนธรรมจังหวัดเชียงราย โทร. 053-150169
24 - 26 พฤศจิกายน 66
งานมหาบุญจุลกฐินถิ่นไหลื้อศรีดอนชัย
วัดท่าข้ามศรีดอนชัย อ.เชียงของ โทร. 088-9755699
25 - 26 พฤศจิกายน 66
CHIANGKHONG ULTRA MARATHON 2023 #5
อบจ.เชียงราย - ท่าผาถ่าน ระเบียงโยงเชียงของ
กลุ่มเดินวิ่งเพื่อสุขภาพเชียงของ โทร. 083-2082280
26 - 28 พฤศจิกายน 66
ป่าเวณียี่เปีง ลอยกระทง
บริเวณเสวนดาธารณะมกก (หลังวัดฝั่งหมั่น) อ.เมือง
เทศบาลนครเชียงราย โทร. 053-715952
27 พฤศจิกายน 66
งานประเพณีลอยกระทง ประจำปี 2566
"โกมลอยเกียงเป็งตี๋ฮิมโขง" ท่าผาถ่าน อ.เชียงของ
เทศนาลตำบลเวียงเชียงของ โทร. 053-791171
27 - 28 พฤศจิกายน 66
ป่าเวณียี่เป็ง เมืองเชียงแสน
ถนนริมโขง หน้าที่ว่าการอำเภอเขียงแสน อ.เชียงแสน
เทศบาลตำบลเวียงเชียงแสน โทร. 053-777081
29 พฤศจิกายน - 3 ธันวาคม 66
FARM FESTIVAL ON THE HILL
สิงห์ปาร์ค เชียงราย อ.เมือง โทร. 053-160636
1 ธันวาคม 66 - 29 กุมภาพันธ์ 67
THE RIVERIE GARDEN OF LIGHT
โรงแรม เดอะ รีเวอร์รี บาย กะตะธานี โทร. 053-607999
2 ธันวาคม 66
CHIANG KHONG MUSIC FEST 2023
ลานผาถ่าน อ.เชียงของ
อำเภอเชียงของ โทร. 053-791352
2 - 3 ธันวาคม 66
KHAM KONG RUN 2023
ดานพรมแดนเชียงของ-สะพานมิตรภาพฯ 4 - ท่าเรือห้วยทราย (สปป.ลาว) กลุ่มเดินวิ่งเพื่อสุขภาพเชียงของ โทร. 083-2082280
งานลอยกระทง ประจำปี 2566 วันที่ 26-28 พฤศจิกายน 2566
เทศบาลนครเชียงราย ขอเชิญเที่ยวงานลอยกระทง ประจำปี 2566 วันที่ 26-28 พฤศจิกายน 2566 ณ บริเวณสวนสาธารณะริมกก หลังวัดฝั่งหมิ่น อำเภอเมือง จังหวัดเชียงราย
เทศกาลสีสันกาสะลอง 8 พ.ย. 66 - 31 ม.ค. 67 ศูนย์การค้าเซ็นทรัล เชียงราย
ศูนย์การค้าเซ็นทรัล เชียงราย จัดงาน “เทศกาลสีสันกาสะลอง” 8 พฤศจิกายน 66 - 31 มกราคม 67 ศูนย์การค้าเซ็นทรัล เชียงราย - ในคอนเซปต์ The Spirit of Chiangrai : The Pride of Northern Thailand กิจกรรมเด่นในงาน
- กาดสีสันกาสะลองไนท์มาร์เก็ต ลิ้มลองเมนูหาทานยากจากพี่น้องชนเผ่าชาติพันธ์ กว่า 6 ชนเผ่าในจังหวัดเชียงราย
- อิ่มอร่อยกับร้านค้าเด็ดเมนูดังจาผู้ประกอบการในเชียงราย
- พร้อมบูธจำหน่ายสินค้าของที่ระลึกART & CRAFT มากมาย
- SHIMMER & SHINE ฟังบทเพลงเพราะๆ ชมการแสดงเชิงวัฒนธรรม ความสามารถของเยาวชนและวงดนตรีในจังหวัดเชียงราย
- จุดเช็คอินถ่ายภาพเก๋ๆ กว่า 10 แลนด์มาร์ค ให้ได้โพสสดใสกันทั้งกลางวันและงดงามกันในยามค่ำคืน
งานปีนี้ จัดโดย ศูนย์การค้าเซ็นทรัล เชียงราย ร่วมกับ มูลนิธิแม่ฟ้าหลวง ในพระบรมราชูปถัมภ์ (โครงการพัฒนาดอยตุง), จังหวัดเชียงราย, การท่องเที่ยวแห่งประเทศไทย สำนักงานเชียงราย, การท่องเที่ยวและกีฬาเชียงราย, องค์การบริหารส่วนจังหวัดเชียงราย, เทศบาลนครเชียงราย, วัฒนธรรมจังหวัดเชียงราย, ขัวศิลปะ และThailand Biennale
ทอสายบุญ จุลกฐิน ถิ่นไทลื้อโบราณ ครั้งที่ 2 11 - 12 พฤศจิกายน 2566
อบจ.เชียงราย ขอเชิญชวนนักท่องเที่ยวร่วมเปิดประสบการณ์ และสัมผัสวิถีชีวิตวัฒนธรรม ที่อำเภอเชียงของ จัดงาน "ทอสายบุญ จุลกฐิน ถิ่นไทลื้อโบราณ" ครั้งที่ 2 ประจำปี 2566????
11 - 12 พฤศจิกายน 2566 ณ บ้านหาดบ้าย ตำบลริมโขง อำเภอเชียงของ จังหวัดเชียงราย
Chiang Rai Road Classic 2023 งานปั่นใจเกินร้อยทางเรียบ 5 พฤศจิกายน 2566
Chiang Rai Road Classic 2023 อาทิตย์ที่ 5 พฤศจิกายน 2566 ศูนย์กีฬาและสันทนาการ สิงห์ปาร์คเชียงราย งานปั่นใจเกินร้อยทางเรียบที่ยิ่งใหญ่สุดในประเทศไทย ความมันสายปั่นที่เฝ้ารอ บนเส้นทางเขียวขจีสวยงามสัมผัสอากาศหนาวสดชื่น ของจังหวัดเชียงราย ผ่านสถานที่ท่องเที่ยวที่สำคัญมากมาย เหมาะสำหรับนักปั่นจักรยานทุกเพศทุกวัยในปีนี้มี 4 ระยะทางให้นักปั่นได้เลือก คือ 25, 70, 110 และ 160 กิโลเมตร เปิดรับสมัครจำนวนจำกัด
งาน World of Pet ที่ The Crystal SB Ratchapruek 9 - 19 พฤศจิกายน 2566
The Crystal SB Ratchapruek จัดงาน World of Pet ตั้งแต่วันที่ 9 - 19 พฤศจิกายน 2566 ณ ลานกิจกรรม ชั้น 1 ชวนน้องๆหนูๆ ท่องโลกมหัศจรรย์ในดินแดนสัตว์ป่าน่ารัก เหมือนยกสวนสัตว์มาไว้ภายในศูนย์การค้า ให้ได้สัมผัสและใกล้ชิดกับสัตว์รวมกว่า 100 ชีวิต
เทศกาลพลุนานาชาติ เมืองพัทยา 24-25 พ.ย. 2566
เทศกาลพลุนานาชาติ เมืองพัทยา Pattaya International Fire Works Festival 2023 วันที่ 24-25 พ.ย. 2566 ชายหาดพัทยา เริ่ม 5 โมงเย็น (
เช็คจุดจอดรถ)
งาน Pattaya International Jazz Festival 2023 - 10 และ 11 พฤศจิกายน 2566
เทศกาลดนตรีแจ๊สระดับโลก กลับมาจัด ณ พัทยาอีกครั้งปีนี้ ในงาน Pattaya International Jazz Festival 2023 “เทศกาลดนตรีแจ๊สเมืองพัทยา” วันศุกร์ที่ 10 และเสาร์ที่ 11 พฤศจิกายนนี้ ตั้งแต่ 17.00 น. เป็นต้นไป ริมชายหาดพัทยากลาง จังหวัดชลบุรี
Coff&Camp Outdoor Barista 2023 วันที่ 23 - 29 Nov 2023
Coff&Camp Outdoor Barista 2023 สาย Coffee Lover และCampping Lover ต้องจัด สัมผัสเทศกาลงานใหญ่ ฟีลกู๊ดๆ จิบกาแฟบรรยากศแคมปิ้งกลางกรุง ครั้งแรกที่รัชดา‼️ ที่จะชวนทุกคนจิบกาแฟร้านดัง ฝีมือขั้นสุด พร้อมมาช้อปฟินๆ อัพเดตอุปกรณ์รับหน้าหนาว ไอเทมเด็ด ที่สายกาแฟและสายแคมปิ้ง ห้ามพลาด‼️ เตรียมพร้อมเก็บกระเป๋าเที่ยวสิ้นปี แฮปปี้ตลอดเทศกาล ตั้งแต่วันที่ 23 - 29 Nov 2023 ณ ลานกิจกรรม Grand Hall ชั้น G
Phatthalung Morning Drip#3 อาทิตย์ ที่ 19 พ.ย 66
Phatthalung Morning Drip#3 #CoffeePlayGround อาทิตย์ ที่ 19 พ.ย 66 06.00-09.00 น. สวนสาธารณะคูหาสวรรค์พัทลุง ร่วมดื่มกาแฟดริป เมล็ดจากทั่วโลก ฟรี!!! เหล่ามือดริปกาแฟจากร้านทั่วพัทลุง มาดื่มกาแฟดริป จิบรสสัมผัสเมล็ดกาแฟจากทั่วโลก จากบรรดาเหล่านักดริปทั่วทั้งพัทลุง ชิมเบเกอรี่ ขนมอบหอมกรุ่น เมนูผักเพื่อสุขภาพ จากกลุ่มผักอินทรีย์ บรรยากาศกาแฟในสวน กล่อมบรรเลงดนตรีจากบ้านบุญดำรมย์
CAMP&COFFEE WINTER FEST วันที่ 23-29 พ.ย. 2023 @Esplanadde Ratchachada
CAMP&COFFEE WINTER FESTวันที่ 23-29 พ.ย. 2023 เวลา 10.00-22.00 น. สถานที่จัดงาน@Esplanadde Ratchachada เชิญชวนร้านค้าชาวแคมป์ปิ้ง สายกาแฟ Cafe’ , Slobar, Car Camping สินค้าสุดฮอตทุกชนิด ชวนมาออกร้านกันค่า แหล่งครอบครัว คนทำงาน และนักท่องเที่ยว
RTAF Music Festival
กองทัพอากาศไทย ขอเชิญชวนร่วมชมการแสดงดนตรี “RTAF Music Festival” ????????
วัตถุประสงค์เพื่อเป็นการส่งเสริมความสามารถทางด้านดนตรีให้กับข้าราชการ ทอ.และครอบครัว สร้างความรัก ความสามัคคีผ่านกิจกรรมดนตรี จึงขอเชิญชวนร่วมฟังดนตรีและเป็นกำลังใจให้เยาวชน ในวันพฤหัสบดีที่ 30 พ.ย.66, 1700-2000 ณ บริเวณหน้าอาคารร้านค้าสวัสดิการทหารอากาศ(อาคารธูปะเตมีย์)
- วง Only Monday จาก ดย.ทอ.อย.
- วง SHATA จาก นนอ.
- วง RW BAND จาก รร.ฤทธิยะวรรณาลัย
ร้านอาหาร(Food Truck)
การแต่งกาย: ชุดสุภาพ
SHATA วงแนว Progressive Rock ประกอบด้วยสมาชิก 6 คน ซันชิโร่ นักร้องนำ, ชอ กีตาร์, แซม กีตาร์, เดียร์ เบส, เปา คีย์บอร์ด และบิว กลอง โดยเป็นการรวมตัวของสมาชิกวงที่เป็นเพื่อนกันตั้งแต่สมัยเรียนที่โรงเรียนสามเสนวิทยาลัยและโรงเรียนนายเรืออากาศนวมินทกษัตริยาธิราช แล้วมาต่อยอดสร้างสรรค์งานดนตรีที่มีแนวคิดเป็นเอกลักษณ์เฉพาะตัว
SHATA ได้มีโอกาสไปร่วมแสดงในมหกรรมดนตรี Big Mountain ครั้งที่ 12 ร่วมแสดงกับวงดุริยางค์กองทัพอากาศ ณ Siam Square Walking Street และได้ไปเป็นศิลปินออกบูธในงาน Cat Food ปัจจุบัน SHATA กำลังเตรียมบันทึกเสียง Single ที่ซันชิโร่ นักร้องนำเป็นผู้แต่ง และกำลังเตรียมตัวไปแสดงใน มหกรรมดนตรี Big Mountain ครั้งที่ 13 อีกด้วย
ปั่นลัดเลาะขอบเขื่อน LRT Classic 2022 @Kaengkrachan#2 แก่งกระจาน 11 ธ.ค.65 LINK
LRT เปิดมิติการปั่นจักรยานบนเส้นทางที่สวยงาม ลัดเลาะไปตามขอบเขื่อนแก่งกระจาน อ่างเก็บน้ำห้วยผาก ผ่านเส้นทางที่มีความท้าทายและสวยงาม สัมผัสกับความหนาวเย็น ทะเลหมอกในยามเช้าของผืนป่ามรกดกโลก กิจกรรม ได้รับการสนับสนุนและอำนวยความสะดวกโดยอำเภอแก่งกระจาน ประชาชนทุกภาคส่วน เพื่อให้แก่งกระจานเป็นจุดนัดพบสำหรับนักปั่นจากทั่วประเทศ โดยใช้ระบบจับเวลาแบบ Chip Transponder ให้กับนักปั่นจักรยานทุกคน
LRT Classic 2022 @Kaengkrachan#2 , Phetchaburi 11 ธันวาคม 2565 ณ อำเภอแก่งกระจาน จ.เพชรบุรี
ดนตรีในสวนตลาดน้ำบางน้ำผึ้ง LINK
ที่ตลาดน้ำบางน้ำผึ้ง มีกิจกรรมจัดประกวดร้องเพลงสร้างสรรค์สังคม ณ ลานดนตรีบางน้ำผึ้ง ตลาดน้ำบางน้ำผึ้ง จัดเดือนละ 1 ครั้ง เป็นเวลา 1 ปีเต็มๆ เริ่มตั้งแต่ พฤศจิกายน 2565 ไปจนถึง ตุลาคม 2566 เลย ประกวดชิงรางวัล รอบเดือน 3000/200/1000 บาท และชิงรางวัลใหญ่รอบปี 10,000/5,000/3,000 บาท ติดต่อสอบถามครูฉัตร โทร.089-8818958 งานนี้จัดโดย ประชาชื่น MRI ชมบรรยากาศการประกวดสนุกๆ ได้ที่เพจ
ดนตรีในสวนตลาดน้ำบางน้ำผึ้ง4 ธ.ค.65 ดนตรีในอุทยาน บทเพลงแห่งรักในความทรงจำ บรรเลงโดยวง RBSO Light Orchestra LINK
ดนตรีในอุทยาน” บทเพลงแห่งรักในความทรงจำ จากศิลปินชั้นนำแนวหน้าของเมืองไทย หลากหลายอารมณ์เพลงลูกกรุง ที่คุณคิดถึง ทุกวันอาทิตย์ ตลอดเดือนพฤศจิกายนนี้ รวม 5 ครั้ง
• เริ่ม วันอาทิตย์ ที่ 6 พ.ย. 65 พบกับ คุณศรีไศล สุชาตวุฒิ
• วันอาทิตย์ ที่ 13 พ.ย. 65 พบกับ คุณรวงทอง ทองลั่นทม
• วันอาทิตย์ที่ 20 พ.ย. 65 พบกับ คุณวินัย พันธุรักษ์
• วันอาทิตย์ ที่ 27 พ.ย. พบกับ คุณโฉมฉาย อรุณฉาน
บรรยายเรื่องกัญชา ในงาน THE FOODISM SHOW 22 และ 24 ธ.ค.65 โดย นพ.สมยศ กิตติมั่นคง
บรรยาย ชะลอวัย และกัญชาทางการแพทย์
พบกันในงาน The Foodism Show
ฮอลล์7 อิมแพค เมืองทองธานี
22-25 ธันวาคม 2565
รับฟังการบรรยายฟรี โดยไม่เสียค่าใช้จ่าย
No Mans Land Cannabis Cup Thailand 3-9 & 10 ธ.ค.65 LINK
ครั้งแรกของ Southeast Asia กับงาน No Man’s Land: Cannabis Cup Thailand
ซึ่งจะจัดขึ้นในวันที่ 10 ธันวาคม 2565 มาร่วมสนุกกับกิจกรรมอีกมากมาย เช่น Sound Healing Meditation, Workshops, Live Music, ประมูลบ้องจากศิลปิน, โยคะสูบกัญบนดาดฟ้า, ดูดวง, นวด CBD นอกจากนี้คุณยังจะได้รับ special high Kit สุดพิเศษ เพื่อมีส่วนในการลงคะแนนตัดสิน ตามหาสุดยอดนักปลูกขวัญมหาชน!
เข้าฟรี Exhibition ตั้งแต่วันที่ 3-9 ธันวาคม 2565
วันที่ 10 ธันวาคม 2565 ทางผู้จัดขอสงวนสิทธิ์สำหรับผู้ที่ซื้อบัตรเข้างานเท่านั้น
3 - 5 ธ.ค.65 ฟังเพลงพ่อคลอเสียงน้ำ ครั้งที่ 3 Rhythm of life เขื่อนขุนด่านฯ นครนายก ฟรี LINK
3 - 5 ธันวาคม 2565 เชิญเที่ยวนครนายก ร่วมเทศกาล "ฟังเพลงพ่อคลอเสียงน้ำ ครั้งที่ 3 Rhythm of life" ณ เขื่อนขุนด่านปราการชล นครนายก มาฟังเสียงเพลง คลอไปกับเสียงน้ำตกยักษ์ที่ยิ่งใหญ่ พร้อมชิลกับรรยากาศ สบายๆ คลอเสียงเพลง และละอองน้ำ โซนกิจกรรม workshop/DIY , โซนกาแฟ พร้อมอาหารเครื่องดื่ม ของอร่อยของดีนครนายกเพียบ อากาศดีๆ เพลงเพราะ กิจกรรม จุดถ่ายรูป และของกิน
กำหนดการ
3 ธค 65
15-16 น. การแสดงดนตรีวงเล็ก
16-20 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
17-17.30 น. พิธีเปิดงาน + การแสดงจากรร.อนุบาลนครนายก
17.30-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
4 ธ.ค. 65
15-16 น. การแสดงดนตรีวงเล็ก
16-17 น. การแสดงวงอยากเล่น
16-20 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
18-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
5 ธ.ค. 65
15-16 น. การแสดงดนตรีวงเล็ก
16-21 น. กิจกรรม workshop กลุ่มปั้นดิน และแสดงดนตรี
18-18.20 น. พิธีจุดเทียนเพื่อพ่อ
18-20 น. การแสดงวง KU.Wind
20-22 น. การแสดงวงอยากเล่น
4-5 ธ.ค.65 วิ่ง-เดิน เพลินเพลงพ่อ ณ สวนกาญจนาภิเษก ร.9 อ.อรัญประเทศ สระแก้ว
กิจกรรม วิ่ง-เดิน เพลินเพลงพ่อ ณ สวนกาญจนาภิเษก ร.9 อ.อรัญประเทศ จ.สระแก้ว
วันที่ 4-5 ธันวาคม 2565 พบกับกิจกรรมภายในงาน - ชมงานศิลป์ ช้อปปิ้งงานcoff & craft เพลิดเพลินบรรยากาศดนตรีในสวน
2-3 ธ.ค.65 - หัวหินแจ๊ส 2022 ชายหาด สวนสนประดิพัทธ์ หัวหิน ชมฟรี
เทศกาลแจ๊สหัวหิน Hua Hin International Jazz Festival 2022 เทศกาลดนตรีแจ๊สบนชายหาดของหัวหิน ที่บรรยากาศยอดเยี่ยมเช่นที่เคย กลับมาแล้ว ในวันที่ 2-3 ธันวาคม 65 นี้ ณ ชายหาดสวนสนประดิพัทธ์ 2 วัน 2 เวทีหลัก พร้อม ศิลปิน นักร้อง นักดนตรีแจ๊สทั้งไทยเทศนับร้อย พร้อมนำเสียงดนตรีอันแสนสนุก รื่นรมย์ อบอุ่น และสวยงาม กลับมาฝากคอเพลงแจ๊สที่รักและคิดถึงทุกท่าน
วันศุกร์ที่ 2 ธันวาคม
17.30 Wang Klai Kangwon / Jazz Bigband
18.00 Opening Ceremony
18.30 Bangkok Sessions Alexander Beets & Koh Mr Saxman / Jazz Fusion
19.30 BSK Organ Trio feat. Nathalie Schaap / Soul Jazz
20.30 Lucas Santana & Pui Duangpon with Takeshi Band / Latin Jazz Fusion
21.45 Saskia Laroo Jazz Meets Hiphop feat. Saxy Ohm / Jazz Hiphop
วันเสาร์ที่ 3 ธันวาคม
17.30 Wang Klai Kangwon / Jazz Bigband
18.00 Dj Masaomi Fukurono feat. SaxyOhm
18.00 Pui Duangpon Trio / Pop-Jazz
18.50 Dj Masaomi Fukurono feat. SaxyOhm
19.10 Sa-Bad / Thai Contemporary (World-Music)
19.50 Lucas Santana x BSK Organ Trio ft. Nathalie Schaap / Latin-Soul Jazz
20.30 Saskia Laroo Jazz meets Hiphop ft. Alexander Beets / Jazz Hiphop
21.45 The Bangkok Connection feat. Koh Mr.Saxman / Fusion Jazz
facebook.com/huahinjazz/5 ธ.ค.65 ดนตรีในสวน H.M. Song อว. บรรเลงเพลงของพ่อ ราชภัฏนครสวรรค์ LINK
กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม (อว.) ร่วมกับ มหาวิทยาลัยราชภัฏนครสวรรค์ ขอเชิญประชาชนทั่วไป ร่วมกิจกรรม การแสดงดนตรีในสวน "H.M. Song อว. บรรเลงเพลงของพ่อ" วันจันทร์ที่ 5 ธันวาคม 2565 เวลา 17.00 – 20.00 น.
ณ กองเสบียงฟาร์ม ต.นครสวรรค์ออก อ.เมืองฯ จ.นครสวรรค์
พบกับการแสดงดนตรีจากวง NSRU Band (เต็มวง) สาขาวิชาดนตรีศึกษา คณะมนุษยศาสตร์และสังคมศาสตร์ และร่วมจุดเทียนน้อมรำลึก ในพระมหากรุณาธิคุณของในหลวง รัชกาลที่ 9
งานประชาสัมพันธ์และสื่อสารองค์กร NSRU
056-219100-29
5 ธ.ค.65 ดนตรีในสวน H.M. Song อว.บรรเลงเพลงของพ่อ โดยกลุ่มเยาวชน ระนอง LINK
กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัย และนวัตกรรม (อว.) และ วิทยาลัยชุมชนระนอง ในนาม อว. ส่วนหน้า จังหวัดระนอง ขอเชิญชวน ทุกท่าน เข้าร่วมกิจกรรม "ดนตรีในสวน" "H.M. Song อว.บรรเลงเพลงของพ่อ" เพื่อน้อมรำลึก ในพระมหากรุณาธิคุณ และเทิดพระเกียรติ 5 ธันวาคม 2565 เนื่องในวันคล้างวันพระบรมราชสมภพพระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลบเดชมหาราช บรมนาถบพิตร พบกับ โฟร์คแบรนด์ โดยกลุ่มเยาวชน จังหวัดระนอง วง "Me skill" และ วง "พลาสเทล" พร้อมด้วยการแสดง ดนตรีไทย ในบทเพลงพระราชนิพนธ์ ณ โรงยิมนิเซียมเก่า องค์การบริหารส่วนจังหวัดระนอง ในวันที่ 5 ธันวาคม 2565 ตั้งแต่เวลา 17.00 น. เป็นต้นไป
5 ธ.ค.65 ดนตรีในสวน H.M.Song อว.บรรเลงเพลงของพ่อ ดุริยางค์ ศิลปากร ณ สวนรถไฟ LINK
คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร ขอเชิญรับชมการแสดงดนตรี "ดนตรีในสวน H.M.Song อว.บรรเลงเพลงของพ่อ" ท่ามกลางอากาศสบายๆ วันจันทร์ที่ 5 ธ.ค.2565 ณ.สวนวชิรเบญจทัศ (สวนรถไฟ) เวลา 18:30-20:00 น. บรรเลงโดยวงดุริยางค์เครื่องลม Silpakorn University Wind Orchestra (SUWO) คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร จัดโดย กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัย และนวัตกรรม (อว.) ร่วมกับมหาวิทยาลัยศิลปากร
10 ธ.ค. 65 ดนตรีในสวน Igor Butman and Friends Concert สวนเบญจกิติ LINK
ขอเชิญชมดนตรีในสวน "Igor Butman and Friends’ Concert" วันที่ 10 ธ.ค. 65 เวลา 18.30 - 20.00 น. ณ ลานอัฒจันทร์กลาง Amphitheater สวนเบญจกิติ เขตคลองเตย ที่จอดรถจำกัด 275 ที่เท่านั้นนน!!!! งานนี้เข้าชมฟรี‼ ไม่มีค่าใช้จ่าย
ในวาระเฉลิมฉลองครบรอบ 25 ปี การสถาปนาความสัมพันธ์เมืองพี่เมืองน้อง ระหว่างกรุงเทพมหานครกับกรุงมอสโกและนครเซนต์ปีเตอร์สเบิร์ก และครบรอบ 125 ปี การสถาปนาทางการทูตระหว่างประเทศไทยและสหพันธรัฐรัสเซีย
14 ธ.ค. 65 Piano Master Class by Caroline Fischer
Piano Master Class by Caroline Fischer วันพุธที่ 14 ธันวาคม 2565 เวลา 18.30 น. เป็นต้นไป ณ หอดนตรี ศาสตราจารย์ตรึงใจ บูรณสมภพ ชั้น 5 คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร
เข้าชมฟรี
รายนามผู้ร่วมแสดงและชื่อบทเพลง:
1) Beethoven: Sonata in G, Op. 14 No. 2 (First Movement)
Sattanun Tepata, piano
2) Ravel: Alborada del gracioso from Miroirs
Punthum Lueangsunthorn, piano
3) Chopin: Ballade No. 1 in G minor, Op. 23
Stephen Wee Hun Lim, piano
งาน Mahidol Charity Music Festival วันที่ 3-4 ธันวาคม 2565
งาน Mahidol Charity Music Festival วันที่ 3-4 ธันวาคม 2565 เวลา 11:00-17:30 ณ อาคารเรียนรวมชั้น 2 คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่
3 ธันวาคม 2565
- zero blind band
- september
- วงกลม
- sneeze
- karate khamsing
- the notto
- จินต์จล & สันดุสิต
4 ธันวาคม 2565
- clovers
- aDay
- caramel crumble
- สิอิ๊ว
- ว่าง ว่าง
- yahoo
สามารถรับชมถ่ายทอดสดผ่านทาง Facebook:
โครงงานมหิดล มหาวิทยาลัยเชียงใหม่ 13 ธ.ค. 65 Igor Butman @ภูเก็ต
ภูเก็ตจัดงานคอนเสิร์ตศิลปินระดับโลก Igor Butman ในวันอังคารที่ 13 ธันวาคม 2565 เวลา 17.30-20.30 น. ณ หนองหาน หาดกะรน เพื่อกระตุ้น เศรษฐกิจ และการท่องเที่ยว สนับสนุนการจัดงานโดยการท่องเที่ยวแห่งประเทศไทย
จังหวัดภูเก็ต ร่วมกับการท่องเที่ยวแห่งประเทศไทย สถานเอกอัครราชทูตไทย ประจำกรุงมอสโก รัสเซีย เทศบาลตำบลกะรน สมาคมธุรกิจการท่องเที่ยวจังหวัดภูเก็ต กะตะธานี กะตะกรุ๊ป Hello Phuket Service Nikorn Marine บริษัท หาดทิพย์ จำกัด (มหาชน) สายการบินไทยแอร์เอเชีย และ Energy Absolute กำหนดจัดงานคอนเสิร์ตเพื่อกระตุ้นการท่องเที่ยวโดยการเชิญศิลปิน Igor Butman นักแซกโซโฟน ผู้ควบคุมวง Moscow Jazz Orchestra เจ้าของคลับดนตรีแจ๊ส และรายการโทรทัศน์ ถือเป็นนักดนตรีแจ๊สที่โด่งดังมากที่สุดในรัสเซียในขณะนี้ โดยได้รับรางวัลศิลปินแห่งชาติจากประธานาธิบดีรัสเซียในปี ค.ศ. 2021 ซึ่งมีกำหนดแสดงคอนเสิร์ตในจังหวัดภูเก็ต Jazz on the Beach วันอังคารที่ 13 ธันวาคม 2565 ณ หาดกะรน (ใกล้สวนสาธารณะหนองหาน) เวลา 17.30-20.30 น. โดยมีวง The Jungceylon จากมหาวิทยาลัยราชภัฏภูเก็ต มาร่วมเล่นเปิดวง และภายในงานมีการจำหน่ายอาหาร เครื่องดื่ม สามารถเข้าชมคอนเสิร์ตโดยไม่มีค่าใช้จ่ายแต่อย่างใด
มาร์เก็ตวิลเลจสุวรรณภูมิ จัดเทศกาลดนตรีส่งท้ายปี
มาร์เก็ตวิลเลจสุวรรณภูมิ จัดเทศกาลดนตรีส่งท้ายปี ต้อนรับลมหนาวกับเทศกาลดนตรีส่งท้ายปี กับบรรยากาศสุดชิลล์ ดื่มด่ำเสียงดนตรีเพลินๆ พร้อมฝากท้องกับร้านอาหารมากมายจุใจในยามราตรี บริเวณ ลานกิจกรรมหน้าศูนย์การค้ามาร์เก็ตวิลเลจสุวรรณภูมิ
พบกับสุดยอดศิลปินแบบจัดเต็ม ระหว่างวันที่ 1-31 ธันวาคม นี้
1 ธ.ค. พบกับ Indigo เพลงยอดฮิต เส้นบางๆ
15 ธ.ค. พบกับ กวางจิรพรรณ เพลงยอดฮิต มักอ้ายหลายเด้อ
29 ธ.ค. พบกับ แหลม สมพล เพลงยอดฮิต ทำได้เพียง
14-18 ธ.ค. 65 ฟังดนตรี BANGKOK For ALL กรุงเทพฯเพื่อทุกคน แยกปทุมวัน LINK
14 dec 022
(บน Skywalk)
17.00 - 18.00 Random Dance Bangkok
19.00 - 20.00 Minizize Dance Studio (Cover Dance)
15 dec 022
(บน Skywalk)
16.00 - 17.30 น้อง Natawut (ดนตรีเด็กพิเศษ)
17.30 - 20.00 IdolExchange
16 dec 022
(บน Skywalk)
16.00 - 17.30 น้อง Natawut (ดนตรีเด็กพิเศษ)
17.30 - 20.00 สมาคมผู้ปกครองคนพิการทางสติปัญญาแห่งประเทศไทย (ดนตรีเปิดหมวก)
17 dec 022
(ลานหน้า BACC)
13.00 - 14.00 ninenoii (spacebar music hub)
14.00 - 15.00 Domephat / Focus Thanabode / Praechana / John Nattachot (Lomabin)
15.00 - 15.40 วงศูนย์เยาวชนคลองเตย
16.00 - 17.00 วงดนตรีกองการสังคีต กทม.
17.00 - 18.00 SB Band
18.00 - 19.00 Eii Thanaphan / VYBES /
MARIKO (BEC Tero)
19.00 - 19.20 การแสดงกลุ่ม EDeaf
(บน Skywalk)
17.00 - 19.00 สมาคมผู้ปกครองคนพิการทางสติปัญญาแห่งประเทศไทย (ดนตรีเปิดหมวก)
18 dec 022
(ลานหน้า BACC)
14.00 - 15.00 The Proper Clan (spacebar music hub)
17.35 - 18.00 S2S
19.00 - 20.00 Happy Unlimited
ดนตรีในสวน : H.M. Song อว.บรรเลงเพลงของพ่อ 5 ธันวาคม 2565
สถาบันดนตรีกัลยาณิวัฒนา ร่วมด้วย สำนักงานการวิจัยแห่งชาติ (วช.) กระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม ขอเชิญชมการแสดง “ดนตรีในสวน : H.M. Song อว.บรรเลงเพลงของพ่อ” ในวันที่ 5 ธันวาคม 2565 ตั้งแต่เวลา 17.00 – 20.00 น. ณ สวนหลวงพระราม 8 โดย วงดนตรีไทย จากสถาบันเทคโนโลยีจิตรลดา, CU Band จากจุฬาลงกรณ์มหาวิทยาลัย และ Wind symphony จากสถาบันดนตรีกัลยาณิวัฒนา นอกจากนี้ ระหว่างวันที่ 3-5 ธันวาคม 2565 ยังมีการแสดง
ณ สวนเบญจกิติ วันที่ 3-5 ธันวาคม 2565 เวลา 17.00 - 20.00 น.
สวนวชิรเบญจทัศ วันที่ 3-5 ธันวาคม 2565 เวลา 17.00 - 20.00 น.
สวนหลวงพระราม 8 วันที่ 3-5 ธันวาคม 2565 เวลา 17.00 - 20.00 น.
ร่วมสนับสนุนการจัดแสดงดนตรีโดยกรุงเทพมหานคร สถาบันการศึกษาและหน่วยงาน ของกระทรวงการอุดมศึกษา วิทยาศาสตร์ วิจัยและนวัตกรรม
Winter Love Songs : บทเพลงพระราชนิพนธ์ 8 - 9 ธันวาคม 2565 LINK
กระทรวงวัฒนธรรม โดยกรมส่งเสริมวัฒนธรรม (สวธ.) ร่วมกับกรุงเทพมหานคร กรมศิลปากร วงเฉลิมราชย์ และมูลนิธิสุนทราภรณ์ฯ ขอเชิญชม การแสดงดนตรีเทิดพระเกียรติสถาบันพระมหากษัตริย์ เทศกาลดนตรี Ministry of Culture Music Festival (MOC MU FES) การแสดง “Winter Love Songs : บทเพลงพระราชนิพนธ์” และการแสดง “ลีลาศสร้างสุขกับสุนทราภรณ์”
- วงดุริยางค์สากล กรมศิลปากร (The National Symphony Orchestra)
- วงดุริยางค์กรุงเทพมหานคร (Bangkok Metropolitan Orchestra)
- วงเฉลิมราชย์
ระหว่างวันที่ 8 - 9 ธันวาคม 2565 ณ ลานวัฒนธรรมสร้างสุข กระทรวงวัฒนธรรม
ร่วมงานฟรีไม่มีค่าใช้จ่าย
25 ธ.ค. 65 New Year Concert - บรรเลงโดย วง Bangkok Metropolitan Orchestra LINK
การแสดงดนตรี “New Year Concert” บรรเลงโดย วง Bangkok Metropolitan Orchestra โดยมี ศิลปินรับเชิญ คุณโน้ต ศรัณย์ คุ้งบรรพต และนักร้องคุณภาพจากกรุงเทพมหานคร คุณน้ำฟ้า แก้วรัตนศรีโพธิ์ และ คุณกาญจนา จันทร์ไผ่ และพบกับการแสดงวงออเคสตราประกอบจินตาลีลาชุด “รัตนโกสินทร์” การบรรเลงเดี่ยว Violin และ เดี่ยวระนาด ร่วมกับวงออเคสตร้า โดย คุณตอง พงศ์สิต การย์เกรียงไกร และคุณเอื้อย อภิญญา อินทร์สกุล วันอาทิตย์ที่ 25 ธ.ค. 2565 ณ Museum Siam เริ่มเวลา 17.00 น.
ดนตรีในสวน Music in the park ชลบุรี Voice of Health ครั้งที่ 5 สวนเฉลิมพระเกียรติ ชลบุรี
“ดนตรีในสวน Music in the park” Voice of Health ครั้งที่ 5 จัดโดย องค์การบริหารส่วนจังหวัดชลบุรี ณ บริเวณหน้าอาคารห้องสมุดเฉลิมพระเกียรติฯ สวนสาธารณะเฉลิมพระเกียรติ ร.9 ชลบุรี ระหว่างวันที่ 16 - 25 ธันวาคมนี้ ทุก 5 โมงเย็นกับวงดนตรีสด ๆ หลากหลายวง และพิเศษวันเปิดโครงการ พบกับวงดนตรีเยาวชน ที่ฮอตที่สุดแห่งปี คอนเสิร์ตจาก “Yes Indeed band” ในศุกร์ที่ 16 ธันวาคม 2565 ชมฟรี ตั้งแต่ 17.00 น.เป็นต้นไป พร้อมกิจกรรมส่งเสริมสุขภาพและการออกกำลังกาย อีกเพียบ
23 ธ.ค.65 LANLALAN ACOUSTIC ณ ลานละลาน หน้าอาคารศูนย์มานุษยวิทยาสิรินธร
LANLALAN ACOUSTIC ครั้งแรกกับกิจกรรมดนตรีในสวน ต้อนรับลมหนาว โดยนักศึกษาคณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร ที่จะพาทุกคนไปร้อง เล่น เต้น กันอย่างสนุกสนานกับบรรยากาศยามเย็น ที่บริเวณลานละลาน หน้าอาคารศูนย์มานุษยวิทยาสิรินธร (องค์การมหาชน) ตลิ่งชัน กรุงเทพฯ
วันศุกร์ที่ 23 ธันวาคม 2565 เวลา 17.30-18.30 น. ณ ลานละลาน หน้าอาคารศูนย์มานุษยวิทยาสิรินธร
25 ธ.ค.65 เวลเนส วีแคร์ จัดกิจกรรมดนตรีในสวนเพื่อเฉลิมฉลองเทศกาล Christmas & Happy New year
เวลเนส วีแคร์ จัดกิจกรรมดนตรีในสวนเพื่อเฉลิมฉลองเทศกาล Christmas & Happy New year เมื่อวันที่ 24-25 ธันวาคม 2565 ที่ผ่านมา ในครั้งนี้มีผู้เข้าร่วมกว่า 30 คน ท่ามกลางพื้นที่สี เขียว ณ ศูนย์สุขภาพเวลเนส วีแคร์ มวกเหล็ก สระบุรี
ภายในงานมีการแสดงดนตรีสด มีอาหารบุฟเฟต์ 4 ภาค ให้ผู้ที่เข้าร่วมได้รับประทานแบบจุใจ รวมถึงตลาดนัดในสวนที่จำหน่ายสินค้าออแกนิคเพื่อสุขภาพ นอกจากนั้นยังมีการเล่นกีฬา ตีโครเกต์และเกมส์ต่างๆเพื่อชิงรางวัล ในช่วงค่ำก็มีการรับประทานอาหารบุฟเฟ่ต์ ร้องคาราโอเกะ เต้นลีลาศกันอย่างสนุกสนาน และร่วมจุดเทียนร้องเพลง Silent Nightฉลองวันคริสต์มาส โดยมีนายแพทย์สันต์ ใจยอดศิลป์ ผู้อำนวยการ ศูนย์สุขภาพเวลเนส วีแคร์ มาร่วมสนุกกับเราในค่ำคืนที่แสนพิเศษนี้ด้วย
Hua Hin Bike Week 9-10 Dec. 2022
เดือน ธันวาคม 2565
จัดวันอังคารที่ 6, 13, 20, และ 27 ธันวาคม
วันละ 2 รอบๆ ละ 1 คน ให้คำปรึกษาทาง ONLINE ผ่านโปรแกรม ZOOM
รอบที่ 1 : 13.00 – 15.00 น.
รอบที่ 2 : 15.00 – 17.00 น.
จัดวันพุธที่ 7, 14, 21, และ 28 ธันวาคม
วันละ 2 รอบๆ ละ 1 คน ให้คำปรึกษาทาง ONLINE ผ่านโปรแกรม ZOOM
รอบที่ 1 : 13.00 – 15.00 น.
รอบที่ 2 : 15.00 - 17.00 น.
จัดวันพฤหัสบดีที่ 1, 15, และ 29 ธันวาคม
วันละ 2 รอบๆ ละ 1 คน ให้คำปรึกษาทาง ONLINE ผ่านโปรแกรม ZOOM
รอบที่ 1 : 13.00 – 15.00 น.
รอบที่ 2 : 15.00 – 17.00 น.
หมายเหตุ : วันพฤหัสบดีที่ 8 และ 22 ธันวาคม 2565 (หยุด 2 วันตรงกับวันพระ)
ตารางออกตรวจเดือนเมษายน 66
ตารางออกตรวจ คลินิกพิเศษนอกเวลา โรงพยาบาลพัทลุง เวลาออกตรวจ 16.30-19.00น. ค่าบริการเบื้องต้น 250บาท
22 ธันวาคม 2565 @วัดนินสุขาราม เขตบางบอน
"สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่นๆ อีกมากมาย ในวันที่ 22 ธันวาคม 2565 ตั้งแต่เวลา 08.00 ถึง 14.00 น. ณ วัดนินสุขาราม เขตบางบอน กรุงเทพมหานคร
เพชรบุรีมาราธอน ครั้งที่2 วันที่ 10 ธ.ค.66 LINK
เพชรบุรีมาราธอน ครั้งที่ 2 วันที่ 10 ธันวาคม 66 ณ ชะอานวัวลานเพชรบุรี เปิดรับสมัคร 1 กรกฏาคมนี้ เส้นทางวิ่ง ประเภท 42 k/ 21 k/ 10 k/ 5k โรงพยาลมหาชัยเพชรรัชต์ ให้การสนับสนุนทีมพยาบาลดูแลนักวิ่งทั้งในเส้นทางและพื้นที่จัดการแข่งขัน
NIGHT COLOR RUN CHANTHABURI 2023 ครั้งที่ 2 วันที่ 9 ธ.ค.66 LINK
“NIGHT COLOR RUN CHANTHABURI 2023” ครั้งที่ 2 วิ่งเรืองแสง กลางคืนเมืองจันทบุรี วันที่ 9 ธันวาคม 2566 เวลา 16.00 น.เป็นต้นไป สถานที่วิ่ง : รอบคลองภักดีรำไพ จันทบุรี ประเภทการแข่งขัน Funrun 5 KM (ชาย - หญิง) / Mini Marathon 10 KM (ชาย - หญิง) / VIP (ชาย - หญิง)
KU RUN 3 เดิน วิ่งการกุศล 4 วิทยาเขต ครั้งที่ 3 - 10 ธันวาคม 2566 LINK
โครงการ KU RUN # 3 การแข่งขัน เดิน วิ่ง การกุศล ครั้งที่สาม จัดขึ้นทุกวิทยาเขต ได้แก่ วิ่งลั่นทุ่ง @ บางเขน / วิ่งลั่นสมุทร @ ศรีราชา / วิ่งป่าลั่น @สกลนคร / วิ่งชมพูพันธุ์ทิพย์ @ กำแพงแสน โดยมีแนวคิดหลัก คือ เพื่อสนับสนุนและส่งเสริมมหาวิทยาลัยเกษตรศาสตร์ในการเป็นมหาวิทยาลัยสีเขียว หรือ Green University นักกีฬาที่เข้าร่วมการแข่งขันและผู้เข้าร่วมโครงการ ฯ จะมีส่วนในการลดโลกร้อน และช่วยกันสร้างความเป็นกลางทางคาร์บอนร่วมกับมหาวิทยาลัยเกษตรศาสตร์ให้เป็นไปตามเป้าหมายปี ค.ศ. 2035 และยังได้มีโอกาสร่วมกันทำบุญใหญ่ในการสร้างโรงพยาบาลมหาวิทยาลัยเกษตรศาสตร์ ตลอดจนสนับสนุนทุนการศึกษาให้แก่นิสิต พร้อมกับได้มารวมพลังแสดงความรักและความสามัคคีร่วมกันของเครือข่ายนิสิตเก่า นิสิตปัจจุบัน บุคลากร ครอบครัว และ ประชาชนได้เห็นถึงคุณค่าของการออกกำลังกายเพื่อสุขภาพที่ดี พร้อมกับได้เยี่ยมชมความสวยงามของวิทยาเขตต่างๆของมหาวิทยาลัยเกษตรศาสตร์ตลอดเส้นทางการแข่งขันอีกด้วย
วิ่งลั่นทุ่ง : 10 ธันวาคม 2566
วิ่งลั่นสมุทร : 7 มกราคม 2567
วิ่งป่าลั่น : 21 มกราคม 2567
วิ่งชมพูพันธุ์ทิพย์ : 25 กุมภาพันธ์ 2567
KNT กล้วยนำไทรัน วิ่งรักษ์ปอด คุ้งบางกระเจ้า 5 ธ.ค.66 LINK
KNT วิ่งรักษ์ปอด คุ้งบางกระเจ้า ร่วมผนึกกำลัง " สืบสาน รักษา ต่อยอด " โครงการ #คุ้งบางกระเจ้า วิ่ง 5 ธันวานี้ ปล่อยตัว 05.30 น. สถานที่จัดงาน : ลานเอนกประสงค์ (หลังตลาดบางน้ำผึ้ง) อ.พระประแดง จ.สมุทรปราการ ระยะวิ่ง วิ่งมินิมาราธอน 10 km./ วิ่งฟันรัน 4.5 km. / แฟมิลี่รัน 2.5 km. / VIP วิ่ง-เดิน ได้ทุกระยะ สอบถาม/ช่องทางติดตาม
https://www.facebook.com/kntrun
Hotline : 089-7994425 , 064-5590454
โทร. 02-769-2000 ต่อ 1076,1027,2023
รพ.เมดพาร์ค ชวนฟังดนตรี Med Music in the Park ครั้งที่ 2 วันที่ 2 ธันวาคม 66
รพ.เมดพาร์ค ฉลองครบรอบ 3 ปี ด้วยคอนเสริ์ตในสวน
Med Music in the Park ครั้งที่ 2 วันที่ 2 ธันวาคม 66 ภายใต้ธีม “Lets Groove” ฟังดนตรีรับลมหนาวส่งท้ายปี ฟังฟรี ลงทะเบียนรับบัตร
CIB RUN 2023 วันอาทิตย์ที่ 10 ธ.ค.66


CIB RUN 2023 เป็นกิจกรรมวิ่งเฉลิมพระเกียรติฯ ระยะ 23 กม. 10 กม. 4.5 กม. และแฟมิลี่รัน 1.5 กม. จัดขึ้นโดยกองบัญชาการตำรวจสอบสวนกลาง ในวันอาทิตย์ที่ 10 ธันวาคม 2566 เวลา 05.00-09.00 น. ได้รับการอนุญาตเป็นกรณีพิเศษ ให้ใช้สนามลู่ปั่นจักรยานเจริญสุขมงคลจิต ท่าอากาศยานสุวรรณภูมิ เป็นสถานที่จัดการแข่งขัน โดยบริษัท ท่าอากาศยานไทย จำกัด (มหาชน) มีวัตถุประสงค์เพื่อเชิญชวนประชาชนจากทุกภาคส่วน ทุกเพศทุกวัย ให้มาร่วมกิจกรรมเพื่อสร้างเสริมสุขภาพ แสดงพลังบวกในการร่วมกันจัดกิจกรรมในวันมหามงคล เนื่องในวโรกาสวันที่ 5 ธันวาคม ซึ่งเป็นวันคล้ายวันพระบรมราชสมภพ พระบาทสมเด็จพระบรมชนกาธิเบศร มหาภูมิพลอดุลยเดชมหาราช บรมนาถบพิตร และแสดงความจงรักภักดีแก่ พระบาทสมเด็จพระปรเมนทรรามาธิบดี ศรีสินทรมหาวชิราลงกรณฯ พระวชิรเกล้าเจ้าอยู่หัวพระเจ้า รัชกาลที่ 10 นอกจากนี้ยังเป็นการส่งเสริมการจัดกิจกรรมกีฬาเชิงท่องเที่ยวในช่วงสิ้นปี ที่ก่อให้เกิดรายได้หมุนเวียนในระบบเศรษฐกิจได้เป็นจำนวนมาก กิจกรรมนี้จัดขึ้นโดยไม่มีค่าสมัครใดๆ (ฟรี) ได้รับการสนับสนุนจากการท่องเที่ยวแห่งประเทศไทย, บริษัท ท่าอากาศยานไทย จำกัด (มหาชน), บริษัท ปตท. น้ำมันและการค้าปลีก จำกัด (มหาชน) โดยมีบริษัท ไตรลีก (ประเทศไทย) จำกัด ผู้ชำนาญการด้านการจัดงานวิ่งมาราธอนระดับแนวหน้า เป็นที่ปรึกษาด้านการบริหารการจัดงาน ทำงานร่วมกับหน่วยงานภายใต้การกำกับดูแลของกองบัญชาการตำรวจสอบสวนกลาง (CIB) คาดว่าจะมีผู้เข้าร่วมกิจกรรมไม่น้อยกว่า 10,000 คน ศึกษาข้อมูลเพิ่มเติมได้ทางเฟสบุ้ค
cibrun หรือ www.cibrun.com
เทศกาลดนตรีกรุงเทพมหานคร 5 ธ.ค. 66 พาร์ค พารากอน ชั้น M สยามพารากอน
กรุงเทพมหานคร ร่วมกับ ศูนย์การค้าสยามพารากอน และ ธนาคารไทยพาณิชย์ จำกัด (มหาชน) จัดการแสดง เทศกาลดนตรีกรุงเทพมหานคร “คีตนิพนธ์ บทเพลงในดวงใจราษฎร์” ซึ่งเป็นส่วนหนึ่งในแคมเปญ COLORFUL BANGKOK 2023 ของกรุงเทพมหานคร ที่จะร่วมกันส่งเสริมศิลปวัฒนธรรม ดนตรี การท่องเที่ยว รวมถึงกระตุ้นเศรษฐกิจในชุมชน
เต็มอิ่มกับการแสดงดนตรีจากศิลปินคุณภาพ ที่จะมาร่วมขับขานบทเพลงพระราชนิพนธ์อันทรงคุณค่า อาทิ … อาร์ม - กรกันต์ สุทธิโกเศศ, โก้ - มิสเตอร์แซกแมน, จักร พรหมมินทร์ (ต้อย The Golden Song เวทีเพลงเพราะ 3) พัทธนันท์ อาจองค์, น้ำฟ้า แก้วรัตนศรีโพธิ์ และ ปณิธาน จวงครุฑ พร้อมด้วยการแสดงดนตรีหลากหลายรูปแบบ จากหลากหลายสถาบัน
▪️ วงดุริยางค์กรุงเทพมหานคร (Bangkok Metropolitan Orchestra)
▪️ โรงเรียนหอวัง
▪️ คณะนักร้องประสานเสียง Thai Youth Choir
▪️ วิทยาลัยดุริยางคศิลป์ มหาวิทยาลัยมหิดล
ร่วมบรรเลงบทเพลงอันไพเราะ ท่ามกลางบรรยากาศยามเย็น ใจกลางกรุงเทพฯ วันอังคารที่ 5 ธันวาคม 2566 เวลา 16.30 – 21.00 น.ณ พาร์ค พารากอน ชั้น M สยามพารากอน เข้าชมฟรี
วิ่งบนเส้นทางแห่งความสำเร็จ อาคารเย็นศิระ 3 - 5 ธ.ค. 66
ขอเชิญร่วมวิ่งบนเส้นทางแห่งความสำเร็จ
“อาคารเย็นศิระ 3” กับ 6 ปี ที่รอคอย
วันที่ 5 ธันวาคม พ.ศ. 2566
Yensira Run : Run for life, Miles for Hope
เสื้อวิ่ง Yensira RUN
เส้นทางแห่งความสำเร็จ ราคา 350.-
เสื้อที่ระลึก Yensira RUN
คลื่นแห่งความหวัง ราคา 250.-
สามารถซื้อเสื้อโดยตรงได้ที่
• หน้าการเงิน รพ.สงขลานครินทร์
• Give Shop มูลนิธิโรงพยาบาลสงขลานครินทร์
• อาคารเย็นศิระ
สอบถามเพิ่มเติม : 074-451020
MAJOR DOG DAY 2023 วันเสาร์ 16 ธ.ค.2566
MAJOR DOG DAY 2023 มหกรรมวิ่งแบบมหึหมา วันเสาร์ 16 ธ.ค.2566 เวลา 14.00 - 20.00 น. สวนป่าเบญจกิติ (ถ.รัชดาภิเษก) งานชุมนุมน้องหมาหลายสายพันธุ์ จัดโดย บริษัท เมเจอร์ ดีเวลลอปเม้นท์ จำกัด (มหาชน) ผู้นำด้านการพัฒนาธุรกิจอสังหาริมทรัพย์ระดับลักชูรีและคอนโดมิเนียมเลี้ยงสัตว์ได้ (Pet Family Residences) ร่วมกับ กรุงเทพมหานคร พร้อมกิจกรรมอีกมากมาย
- PET FAMILY ID Card พาน้องมาทำสำหมาโนครัวในรูปแบบเจอร์ฯ ยืนยันสถานะสมาชิกครอบครัว
- SHOOT & SHARE เก็บโมเมนต์ความประทับใจของคุณกับน้องหมา พร้อมจุดถ่ายรูปที่จัดเต็มทั้งงาน
- MEET & GREET พบ CELEB น้องหมาสุดฮอต กว่า 30 ชีวิต อาทิ น้องหมูนุ่ม จากครอบครัว French Buta Family, มู่ทู่, คิ้วคือมงกุฏของแค, Tama The Shiba, สตีฟจิ๊บ และปลาทูหมาหน้าจิก
- DOG HEALTH CHECK ตรวจสุขภาพน้องหมาโดยโรงพยาบาลสัตว์คชาเว็ท
- ART & LEISURE ศิลปินวาดภาพ PAWTRAIT ให้สุนัข และจุดพักผ่อน YOUR PET-FAMILY SPACE BY MODERNFORM
- PAWGROUND BY MAGICLEAN สนามวิ่งเล่นน้องหมา พร้อมด่านทดสอบข้อขาและให้คุณพ่อคุณแม่ทดสอบข้อแขน
- CHILLING IN THE PARK จอยความสนุกกับดนตรีในสวน และจุดพักผ่อนท่ามกลางสวนสีเขียว
- ENJOY SHOPPING กับร้านค้าแบรนด์ของทั้งคนและน้องหมาโดยเฉพาะ รายได้ส่วนหนึ่งมอบให้มูลนิธิที่ดูแลสุนัขจร
- ฟรี บริการฉีดวัคซีนพิษสุนัขบ้า โดย สำนักอนามัย กรุงเทพมหานคร
- พร้อมทั้งกิจกรรมเซอร์ไพรส์และของรางวัลมากมาย
มหกรรมสัตว์เลี้ยงแห่งประเทศไทย ครั้งที่ 16 วันที่ 8-10 ธันวาคม 2566
งานมหกรรมสัตว์เลี้ยงแห่งประเทศไทย ครั้งที่ 16 ที่จะจัดขึ้น ระหว่างวันที่ 8-11 ธันวาคม 2566 เวลา 10.00 - 18.00 น. ณ ตลาดกลางปลาสวยงามและสัตว์เลี้ยง (ฟิชวิลเลจ) อ.บ้านโป่ง จ.ราชบุรี พบกับการประกวดสัตว์เลี้ยงชิงถ้วยรางวัลพระราชทานยิ่งใหญ่ระดับประเทศ รวมถึงการแข่งขันนกคีรีบูนครั้งแรกในประเทศไทย การจัดแสดงสัตว์เลี้ยง สัตว์แปลก สัตว์หายาก ทั้งนี้ภายในงานมีกิจกรรมแจกลูกไก่แจ้ให้กับคนที่มาร่วมงานวันศุกร์และวันเสาร์กว่า 600 ตัว มุ่งหวังว่างานนี้เป็นเวทีกลางช่วยพัฒนาวงการสัตว์เลี้ยงไทยเข้าสู่มาตรฐานสากลและช่วยสร้างรายได้จากการส่งออกสัตว์เลี้ยงเข้าสู่ประเทศ
ขอเชิญชวนประชาชน นักเรียน นักศึกษา เที่ยวชม Thailand’s 16th Grand Pet Show งานมหกรรมสัตว์เลี้ยงแห่งประเทศไทย ครั้งที่ 16 ระหว่างวันที่ 8 - 10 ธันวาคม 2566 เวลา 10.00 - 18.00 น. ณ ตลาดกลางปลาสวยงามและสัตว์เลี้ยง (ฟิชวิลเลจ) อ.บ้านโป่ง จ.ราชบุรี โดยเข้าชมฟรี สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่ ตลาดกลางปลาสวยงามและสัตว์เลี้ยง (ฟิชวิลเลจ) อ.บ้านโป่ง จ.ราชบุรี ฝ่ายประชาสัมพันธ์งาน โทร. 02-766-8311-2 หรือติดตามรายละเอียด ได้ที่ Facebook :
Thailand’s Grand Pet Show |
รายละเอียดการประกวดแต่ละประเภทPet care คณะสัตวแพทยศาสตร์ ม.เชียงใหม่ 8 ธันวาคม 2566
คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ จัดงาน Pet care กิจกรรมส่งเสริมการดูแลสุขภาพสัตว์เลี้ยงด้วยตนเอง วันที่ 8 ธันวาคม 2566 เวลา 15.00 - 21.00 น. ณ ลานสังคีต มช. (ลานควายยิ้ม) กิจกรรมบันเทิงภายในงาน
- ฉีดวัคซีนพิษสุนัขบ้าฟรี **เฉพาะผู้ที่ลงทะเบียนล่วงหน้า
- การแข่งตอบคำถามสัตว์เลี้ยงชิงเงินรางวัล **เฉพาะผู้ที่ลงทะเบียนล่วงหน้า
- บูธให้คำปรึกษาสุขภาพสัตว์เลี้ยง
- แลกของขวัญเพื่อนรักนักเลี้ยงสัตว์
- บูธทำพวงกุญแจ DIY รูปสัตว์เลี้ยง
- การ workshop เกี่ยวกับการดูแลสุขภาพสัตว์เลี้ยงด้วยตนเอง
- อาหารแสนอร่อย
- การแสดงดนตรีและการแสดงบันเทิง
**สำหรับการฉีดวัคซีนและแข่งขันตอบคำถาม ผู้เข้าร่วมต้องลงทะเบียนเพื่อลงทะเบียน และนำหลักฐานการลงทะเบียนมายื่นที่จุดลงทะเบียนในงาน
ติดต่อสอบถามเพิ่มเติม - 088-1064677 (ง้วน) - 081-6235725 (กล้า)
งาน COFFEE MANIA 1-5 ธ.ค. 66
งาน COFFEE MANIA นับเป็นกิจกรรมประจำปี ของโครงการบ้านโบราณ ซึ่งจะจัดทุกปี ปีละ 2 ช่วง ช่วงต้นปี ประมาณกุมภาพันธ์ และ ธันวาคม ต้อนรับลมหนาว และนับเป็นงานที่คอกาแฟทุกท่านรอคอย
งาน COFFEE MANIA ครั้งที่ 5 ใน คอนเซปต์ “Coffee Harvest Season” ..ฤดูกาลเก็บเกี่ยวกาแฟวนกลับมาอีกครั้ง.. ในครั้งนี้ เราจะนำทุกท่านไปสู่ฤดูกาลแห่งการเก็บเกี่ยวกาแฟ การได้ชิมผลผลิตล็อตใหม่ๆ ที่กำลังทยอยออกมาร่วมไปกับผู้ประกอบการร้านกาแฟแบรนด์ชั้นนำของจังหวัดเชียงใหม่ กว่า 30 ร้านค้า คุณจะได้สัมผัสกลิ่นและรสชาติของกาแฟ รวมไปถึงเบเกอรี่ และอาหาร ที่จะมาร่วมเป็นส่วนหนึ่งของงานในครั้งนี้ ภายในงานเรายังได้เพลิดเพลินกับสินค้างานคราฟต์และ กิจกรรม Workshop เอาใจผู้หลงใหลใน การดริปกาแฟ กับ “ดริปเอง คั่วเอง” ตลอดทั้ง 5 วัน โดยร้าน ZEIT ROASTERS specialty coffee Zeit Roasters งานนี้ อยากชวนคอกาแฟมาอัพเดทเทรนด์ใหม่ๆ ที่อาจจะตอบโจทย์ที่คุณหาคำตอบอยู่ หรืออาจช่วยสร้าง Inspiration หรืออาจจะเป็นโอกาสที่จะก้าวเข้าสู่ธุรกิจกาแฟสำหรับ Cafe Hopper, นักธุรกิจ หรือผู้ที่สนใจอยากเปิดธุรกิจกาแฟ บอกเลยว่างานนี้ พลาดไม่ได้!!!
1-5 ธันวาคม 2566 เวลา 9-19 น. ณ ลานสนามหญ้าริมน้ำปิง โครงการบ้านโบราณเชียงใหม่ จอดรถได้ที่โครงการตลาดอนุสาร · ติดต่อสอบถามเพิ่มเติมได้ที่ 093-1594465 065-5215372
Ayutthaya Morning Drip 3 ธันวาคม 2566
Ayutthaya Morning Drip ครั้งแรกของจังหวัดพระนครศรีอยุธยา มาร่วมสนุกกันวันอาทิตย์ที่ 3 ธันวาคม 2566 Ayutthaya Morning Drip มาดริปกาแฟยามเช้าบรรยากาศริมแม่น้ำ ณ โค้งน้ำป้อมเพชร รวมร้านกาแฟอยุธยาและใกล้เคียงมากมาย เตรียมตัวพบกับ ร้านกาแฟมากมาย ร้านขนม และอื่นๆอีกมากมาย พร้อมฟังเพลงเพราะๆจากชมรมแผ่นเสียงไวนิลอยุธยา
งาน Coffee Fest @Loei 2023 วันที่ 9-10 ธันวาคม 2566
งาน Coffee Fest @Loei 2023 วันที่ 9-10 ธันวาคม 2566 ครั้งแรกกับการชิมกาแฟท่ามกลางต้นคริสต์มาส พร้อมกับรับลมหนาว จ.เลย จัดโดย การท่องเที่ยวแห่งประเทศไทย (ททท.) สำนักงานเลย ร่วมกับ อำเภอภูเรือ ชมรมผู้ประกอบการอำเภอภูเรือ จัดงาน Coffee Fest @Loei 2023 ขึ้นภายในงานเทศกาลต้นคริสต์มาสภูเรือ ????ระหว่างวันเสาร์ที่ 9 และวันอาทิตย์ที่ 10 ธันวาคม 2566 ตั้งแต่เวลา 07.00 - 14.00 น. ณ บริเวณสนามหน้าที่ว่าการอำเภอภูเรือ โดยภายในงาน ททท. ได้เชิญร้านกาแฟที่มีชื่อเสียงของจังหวัดเลย และ จังหวัดหนองบัวลำภู พร้อมคัดสรรรสชาติของกาแฟ เพื่อนำมาบริการนักท่องเที่ยวให้ได้ลิ้มลอง นอกจากกาแฟแล้ว เรายังเตรียมขนม ชา และเครื่องดื่มอื่นๆ มากมาย ไว้ให้เลือกชิม
ขอเชิญนักท่องเที่ยวทุกท่าน มาร่วมกันเสพรสชาติของกาแฟอันหอมกรุ่น นั่งชิลล์ยามเช้าฟังดนตรีสด 2 วัน 2 สไตล์ให้เพลิดเพลินใจ ???? พร้อมกันนี้ยังมีของที่ระลึกอีกมากมายจาก ททท. ให้ได้ร่วมสนุกตามกติกาที่กำหนด สอบถามข้อมูลเพิ่มเติม Facebook : ททท.สำนักงานเลย โทร : 042 812 812
THE MALL LIFESTORE BANGKAPI SWING IN THE CITY 4 – 6 ธ.ค. 66
“Rock Step, Step, Step” เดอะมอลล์ไลฟ์สโตร์ บางกะปิ เปิดลานกิจกรรม เพื่อทุกคนที่ชื่นชอบการเต้นมาเปิดฟลอร์ออกสเต็ปกันที่งาน THE MALL LIFESTORE BANGKAPI “SWING IN THE CITY” วันที่ 4 ธ.ค. 66 – 6 ธ.ค. 66 บริเวณ M SPACE ชั้น G เดอะมอลล์ไลฟ์สโตร์ บางกะปิ ภายในงานพบกับเทศกาลดนตรีคลาสสิกและเพลงพระราชนิพนธ์ จากวงดนตรีระดับประเทศ อาทิ THAILAND JAZZ ORCHESTRA, THE STUMBLING SWINGOUT, YUSU JAZZ BAND, PAWANG MUSIC, THE TRIO BAND พร้อมนักร้องรับเชิญ คุณข้าวฟ่าง จากเวทีประกวด THE VOICE THAILAND SS6 ตื่นตาตื่นใจไปกับโชว์เต้นสวิงสุดมันส์โดยนักเต้นมืออาชีพ จากทีม JELLY ROLL DANCE CLUB
งาน PAN x DAYBREAK 10K CHARITY RUN 2023 งานวิ่งการกุศล แพน เอ็กส์ เดย์เบรค ครั้งที่ 22 วันอาทิตย์ที่ 24 ธันวาคม 2566
ขอเชิญชวนนักวิ่งเข้าร่วมงาน PAN x DAYBREAK 10K CHARITY RUN 2023 งานวิ่งการกุศล แพน เอ็กส์ เดย์เบรค ครั้งที่ 22
“ ใส่ PAN แสนเพลิน มาเดินมาวิ่งอย่างยิ่งใหญ่ “
งานเดิน-วิ่งการกุศล รายได้สนับสนุนทุนการศึกษานักเรียน สถานศึกษาในสังกัดเทศบาล และอุปกรณ์ทางการแพทย์ โรงพยาบาลสมเด็จพระบรมราชเทวี ณ ศรีราชา สภากาชาดไทย
วันจัดงาน : วันอาทิตย์ที่ 24 ธันวาคม 2566
สถานที่จัดงาน : ณ สวนสาธารณะเกาะลอย ตำบลศรีราชา อำเภอศรีราชา จังหวัดชลบุรี
15-24 ธ.ค. ดนตรีในสวน BANGKOK COLORFUL 2023
กิจกรรม ดนตรีในสวน BANGKOK COLORFUL 2023 กรุงเทพมหานคร
15 ธันวาคม
Museum Siam ธันวาคม (Night at The Museum Festival 2023)
เวลา 16.30 น. วงดนตรีไทยร่วมสมัย
เวลา 21.15 น. วงดนตรีไทยร่วมสมัย
16 ธันวาคม
สวนเบญจกิติ (Benchakitti Forest Park)
เวลา 16.30 น. วง Bangkok Woodwind Quintet
Museum Siam (Night at The Museum Festival 2023)
เวลา 16.30 น. วง Horwang Music Academy วงดนตรี กรุงเทพมหานคร
เวลา 21.15 น. วงดนตรีไทยร่วมสมัย
17 ธันวาคม
ห้องกันตัง การยางแห่งประเทศไทย (เขตบางกอกน้อย) [
พิกัด]
เวลา 13.00 น. วง บางกอกลีลาศ
Museum Siam (Night at The Museum Festival 2023)
เวลา 16.30 น. วง Bangkok Brass Quintet
เวลา 21.15 น. วง Bangkok String Ensemble
22 ธันวาคม
ลานคนเมือง 17.00 น. วงดุริยางค์ราชนาวี
23 ธันวาคม
สวนเบญจกิติ วง Zero Brass 16.00 น.
สวนปทุมวนารักษ์ วง Bangkok Trio 16.30 น.
สวนเฉลิมพระเกียตริ 80 พรรษา บางกอกน้อย วงดุริยางค์ราชนาวี
24 ธันวาคม
สวนวชิรเบญจทัศ (สวนรถไฟ) กิจกรรม Chirstmas Jam ลานตัวหนอน และกิจกรรม Audrey the Drummer Boy & วง Billy Man (วงดนตรีเยาวชน)
สวนเบญจกิติ วง Watermelon
Museum Siam วงดนตรีไทย การประชันปี่พาทย์
บริการทำหมันและฉีดวัคซีน เดือนธันวาคม 66
ว่างเว้นไปหลายเดือน กลับมาแล้วในเดือนธันวาคมนี้ กับตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน ธันวาคม 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น.
- วันที่ 8 ธันวาคม 66 ริมทะเลผาแดง เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- วันที่ 19 ธันวาคม 66 เทศบาลตำบลโป่ง อ.บางละมุง
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง) *เท่านั้น*
สำนักงานปศุสัตว์จังหวัดชลบุรี โทร. 038 285 286
15-17 และ 22-24 ธันวาคม 2566 Bangkok Winter Festival 2023 @คลองผดุงกรุงเกษม
งาน Bangkok Winter Festival 2023 @คลองผดุงกรุงเกษม จัดขึ้นระหว่างวันที่ 15-17 ธันวาคม 2566 และ 22-24 ธันวาคม 2566 ณ พื้นที่คลองผดุงกรุงเกษม ตั้งแต่เวลา 17.00 -21.00 น. แบ่งเป็น 4 จุด คือ แบ่งเป็น 4 จุด คือ ย่านตลาดน้อย ในคอนเซปต์ วัยดึก YOUNGดีด Urban Crafting Point, ย่านเทพศิรินทร์-หัวลำโพง คอนเซปต์ วัยมันส์ Urban Meeting Point, ย่านโบ๊เบ๊ คอนเซปต์ วัยเก๋ Urban Playing Point และย่านสะพานขาว คอนเซปต์ วัยดึก YOUNG ดีด Urban Living Point
และพบกับการแสดงมากมายจากศิลปิน อาทิ KIKI, Kalipse, VitaminD, โบวี่, Lemony, ลุลา, เมย์ - ฝนพา เดอะวอยซ์ 2, ตุ๊ก วิยดา + เจี๊ยบ นนทิยา, ฮาร์ท, Trix Treat, Lit it up, วินัย พันธุรักษ์, น้องไข่ตุ๋น +โจ้ เฉลิมศักดิ์ Golden song, การแสดงดนตรีจากโรงเรียนชื่อดัง ได้แก่ โรงเรียนเทพศิรินทร์ โรงเรียนสายปัญญา โรงเรียนไตรมิตร โรงเรียนสตรีวัดมหาพฤฒาราม การแสดงจากบ้านเต้นรำ การวาดทราย การฉายหนังกลางแปลง การแสดงงิ้ว โรลเลอร์แดนซ์ ฯลฯ พร้อมทั้งกิจกรรมการมีส่วนร่วมของชุมชน
รวม Highlight Winter Festival ผดุงกรุงเกษม !!
รวม Highlight Winter Festival ผดุงกรุงเกษม !! ย่านเทพศิรินทร์ - หัวลำโพง : Week 1 (15 - 17 ธันวาคม 2566)
15 ธ.ค. 66
• 17.00 -22.00 น. - Projection mapping & Lighting installation
• 17.00 น. - การแสดงจากนักเรียน
• 19.00 น. - พิธีเปิดงาน และการแสดงวงโยธวาทิตโรงเรียนเทพศิรินทร์
• 19.30 น. - การแสดงศิลปินโบวี่
• 17.00 - 21.00 น. - การแสดง Bangkok Street Performer
16 ธ.ค. 66
• 17.00 -22.00 น. - Projection mapping & Lighting installation
• 7.00 น. - การแสดงจากนักเรียน
• 18.00 น. - การแสดงวงโยธวาทิตโรงเรียนเทพศิรินทร์
• 19.00 น. - การแสดงศิลปิน LEMONY
• 20.30 - โชว์สตรีทแดนซ์
• 17.00 - 20.00 น. - Workshop ทำพวงกุญแจจากเชือกถัก
• 17.00 - 21.00 น. - การแสดง Bangkok Street Performer
17 ธ.ค. 66
• 17.00 น. - การแสดงจากนักเรียน
• 18.00 น. - ยืนเดี่ยว
• 19.00 - การแสดงศิลปิน ลุลา
• 17.00 - 20.00 น. - Workshop ทำศิลปะจากขยะขวดพลาสติก
• 17.00 - 21.00 น. - การแสดง Bangkok Street Performer
วันที่ 22 - 24 ธันวาคม 2566 พบกันที่
• ย่านโบ๊เบ๊ Landmark อุโมงค์แสง แสงสีบ้านพิบูลธรรม
• ย่านสะพานขาว ชมไฮไลท์ แสงสีนางเลิ้ง โชว์ไฟเล่าเรื่อง สีสันสะพานขาว
พร้อมด้วยการแสดงจากศิลปินดัง การออกร้านจำหน่ายสินค้า Workshop งานศิลปะ และทริปล่องเรือ
ร่วมงานได้ฟรี ตั้งแต่ 17.00 - 22.00 น.
พิเศษ! ในวันที่ 15 - 17 และ 22 - 24 เรือโดยสารคลองผดุงฯ เปิดให้บริการเที่ยวงานถึง 22.00 น.
คอนเสิร์ต ลูกทุ่งสองบาง ดาวกระจุยบางเขน เยือนบูรพาบางแสน 16 ธันวาคม 2566
คอนเสิร์ต “ลูกทุ่งสองบาง” ดาวกระจุยบางเขน เยือนบูรพาบางแสน วันที่ 16 ธันวาคม 2566 เวลา 14.00 น. เป็นต้นไป ณ หอประชุม ธำรงบัวศรี เข้าชมฟรี
ดนตรีในสวน : H.M. Song อว. บรรเลงเพลงของพ่อ ณ สวนหลวงพระราม 8
"ดนตรีในสวน : H.M. Song อว. บรรเลงเพลงของพ่อ" ณ สวนหลวงพระราม 8 วันที่ 7 ธันวาคม 2566 ตั้งแต่เวลา 17.00 น. โดยสถาบันดนตรีกัลยาณิวัฒนา มหาวิทยาลัยเทคโนโลยีราชมงคลพระนคร และมหาวิทยาลัยเกษมบัณฑิต ร่วมบรรเลงบทเพลงพระราชนิพนธ์
ดนตรีในสวน H.M. Song อว. ร้องบรรเลงเพลงของพ่อ 3-5 ธันวาคม 2566
ดนตรีในสวน H.M. Song อว. ร้องบรรเลงเพลงของพ่อ 3-5 ธันวาคม 2566 นี้ ใน 3 สวนสวย ของกรุงเทพมหานคร
Navy Music Festival ทหารเรือมาแล้ว เดอะซีรีส์ 22-23 ธันวาคม 2566
กองทัพเรือ ร่วมกับ กรุงเทพมหานคร ขอเชิญมาเพลิดเพลินไปกับเสียงเพลง และชมการแสดงมากมาย จากกองดุริยางค์ทหารเรือ ฐานทัพเรือกรุงเทพ บรรเลงโดยวงดุริยางค์ราชนาวี Navy Music Festival ทหารเรือมาแล้ว เดอะซีรีส์ พร้อมศิลปินรับเชิญวงดัง ได้แก่ อี๊ด วงฟลาย แก้ม เดอะสตาร์ โบ๊ท เพลงเอก นุ เพลงเอก กาแฟ ดนุนันท์
วันศุกร์ที่ 22 ธันวาคม 2566 ณ ลานคนเมือง กรุงเทพมหานคร
วันเสาร์ที่ 23 ธันวาคม 2566 ณ สวนเฉลิมพระเกียรติ 80 พรรษา เขตบางกอกน้อย กรุงเทพมหานคร
เริ่มแสดงเวลา 17.00 น. เป็นต้นไป ชมฟรี
ชมเชียร์รอบชิงชนะเลิศ Thailand Jazz Competition 2023 วันที่ 17 ธันวาคม 2566 ณ หอประชุมมหาวิทยาลัยศิลปากร วังท่าพระ ชมฟรี LINK
เชิญร่วมชมเชียร์ การแข่งขัน รอบชิงชนะเลิศ Thailand Jazz Competition 2023 ที่สุดแห่งการประชันดนตรีแจ๊ส จัดโดย คณะดุริยางคศาสตร์ มหาวิทยาลัยศิลปากร วันที่ 17 ธันวาคม 2566 ณ หอประชุมมหาวิทยาลัยศิลปากร วังท่าพระ ชมฟรี ตั้งแต่เวลา 15.00 น. เป็นต้นไป
ประเภท Jazz Big Band
โรงเรียนดุริยางค์ทหารเรือ (Royal Thai Navy School of Music)
วิทยาลัยนาฎศิลป (The College of Dramatic Arts)
โรงเรียนสาธิตมหาวิทยาลัยรามคำแหง (The Demonstration School of Ramkhamhaeng University)
โรงเรียนหอวัง (Horwang School)
โรงเรียนหาดใหญ่วิทยาลัยสมบูรณ์กุลกันยา (Hatyaiwittayalaisomboonkulkanya School)
ประเภท Jazz Ensemble
23 Jazz All Star
cdc
M.A.M.O
Mheekhaw Quintet
MisterDonut
Salaya Panich
ตารางการแข่งขัน
14:45 - 15:00 การแสดงดนตรี โดยวง Silpakorn University Jazz Acapella
15:00 - 15:15 การแข่งขัน Jazz Ensemble Competition
15:15 - 15:30 Jazz Ensemble วงที่ 1 Mister Donut
15:30 - 15:45 Jazz Ensemble วงที่ 2 23 Jazz All Star
15:45 - 16:00 Jazz Ensemble วงที่ 3 Mheekhaw Quintet
16:00 - 16:15 Jazz Ensemble วงที่ 4 Salaya Panich
16:15 - 16:30 Jazz Ensemble วงที่ 5 CDC
16:30 - 16:45 Jazz Ensemble วงที่ 6 M.A.M.O
16:45 - 16:50 การแข่งขัน Jazz Big Band Competition
16:50 - 17:10 Jazz Big Band วงที่ 1 โรงเรียนสาธิตมหาวิทยาลัยรามคำแหง
17:10 - 17:30 Jazz Big Band วงที่ 2 โรงเรียนดุริยางค์ทหารเรือ
17:30 - 17:50 Jazz Big Band วงที่ 3 โรงเรียนหอวัง
17:50 - 18:10 Jazz Big Band วงที่ 4 วิทยาลัยนาฏศิลป
18:10 - 18:30 Jazz Big Band วงที่ 5 โรงเรียนหาดใหญ่วิทยาลัยสมบูรณ์กุลกันยา
18:30 - 19:00 การแสดง Silpakorn University Jazz Orchestra
19:00 - 20:00 ประกาศผลการแข่งขัน และ พิธีการมอบรางวัล
คอนเสิร์ต " คืนความรักให้อัมพวา ครั้งที่ 7 - 3 ธันวาคม 2566
ททท. สำนักงานสมุทรสงคราม ขอเชิญชวนมามันส์ และกระโดดไปพร้อมกัน !! กับศิลปินวงร็อคชั้นนำของประเทศไทย ในคอนเสิร์ต " คืนความรักให้อัมพวา ครั้งที่ 7 " 3 ธันวาคม 2566 นี้
????ณ บริเวณตลาดน้ำอัมพวา หน้าโครงการอัมพวา ชัยพัฒนานุรักษ์ จ.สมุทรสงคราม
งานนี้ ชมฟรี!!
กิจกรรมส่งเสริมสื่อประชาสัมพันธ์การท่องเที่ยวตลาดน้ำอัมพวา ดำเนินงานโดย อัมพวาเฉิดไฉไล x เทศบาลตำบลอัมพวา
ภายในงานพบกับศิลปิน
- Moderndog ( โมเดิร์นด็อก )
- คุณแป้ง อุบลวรรณ เปียแก้ว ศิลปินอัมพวา
พร้อมวง อภิวาท - Abhivata
สอบถามรายละเอียดเพิ่มเติมได้ที่ สำนักงานเทศบาลตำบลอัมพวา โทร. 0 3475 1351 หรือ Facebook : คืนความรักให้อัมพวา
การแสดงดนตรี Remaking Orchestra 24 ธันวาคม 66
การแสดงดนตรี “Remaking Orchestra” ในงาน “IntAct 2023: Making Things” งานมหกรรมการแสดงดนตรีและศิลปะร่วมสมัย โดยนำเสนอบทประพันธ์เพลงร่วมสมัยจากศิลปินประกอบด้วย Emily Koh, Dr.Zhong Juncheng และ Piyawat Louilarpprasert พร้อมศิลปินรับเชิญ Lui Wenwen, Siravith Kongbandalsuk และ Thanapat Ogaslert ภายใต้การอำนวยเพลงโดย Maestro Boon Hua Lien ร่วมกับวง Bangkok Metropolitan Orchestra ในวันอาทิตย์ที่ 24 ธันวาคม 2566 เวลา 17:00 น. ณ ห้องสตูดิโอชั้น 4 หอศิลปวัฒนธรรมแห่งกรุงเทพมหานคร จัดโดย กองการสังคีต สำนักวัฒนธรรม กีฬา และการท่องเที่ยว กรุงเทพมหานคร ร่วมกับ สถาบันดนตรีกัลยาณิวัฒนา และ Thailand Music and Arts Organization
Christmas Jam : Bangkok Street Performer 24 ธันวาคม 2566
ดนตรีในสวนกรุงเทพมหานคร อาทิตย์ที่ 24 ธันวาคม 2566 สวนวชิรเบญจทัศ (สวนรถไฟ) พบกับกิจกรรม Christmas Jam : Bangkok Street Performer (บริเวณลานตัวหนอน) และ พบกับน้อง Audrey The Drummer Boy ที่จะมา Solo กลองชุดมันส์ๆให้ชม และต่อชาวคณะ วง Billyman กับดนตรีสาย Pop Rock เริ่ม 16.30การบรรเลงดนตรีไทยในเทศกาลดนตรีกรุงเทพมหานคร Museum Siam 24 ธันวาคม 2566
Museum Siam พบกับการบรรเลงดนตรีไทยในเทศกาลดนตรีกรุงเทพมหานคร โดย วงดนตรีไทยกรุงเทพมหานคร และการประชันปี่พาทย์ วงจางวางขาวและวงจางวางดำ โดยมีศิลปินรับเชิญ ครูสมชาย ทับพร (ศิลปินแห่งชาติดนตรีไทย) เข้าร่วมการแสดง เริ่ม 17.00 น. #COLORFULBANGKOK2023Zero Brass@สวนเบญจกิติ 23 ธันวาคม 2566
Zero Brass ???? Benchakitti Prak ???? Saturday 23th, December 2023 ???? 4.30 p.m.
ตารางการแสดงสำหรับเดือนธันวาคม 66
CHANTHABURI COUNTDOWN 2024
ศูนย์การค้าเซ็นทรัล จันทบุรี เล่นใหญ่ จัดเต็ม กับงาน CHANTHABURI COUNTDOWN 2024 แลนด์มาร์กเคานต์ดาวน์ที่ใหญ่ที่สุดในจันทบุรี มาปลดปล่อยความมันส์ ฉลองข้ามปี ชมพลูสุดยิ่งใหญ่กลางใจเมืองจันทบุรี พบกับฟรีคอนเสิร์ตจากน้องๆผู้เข้าประกวดจากกิจกรรม จันท์มีดี ดีเจสุดมันส์ และศิลปินชื่อดังอย่าง BELL WARISARA ปิดท้ายด้วยวง THE MOUSSES พิเศษ ! ศูนย์การค้าเซ็นทรัลจันทบุรีขอตอบแทนชาวจันทบุรี สำหรับลูกค้าที่เข้าร่วมงานลุ้นรับรางวัลใหญ่ รถจักรยานยนต์ไฟฟ้า มูลค่ารวมกว่า 50,000 บาท
งานวันสมเด็จพระนางเจ้ารำไพพรรณีรำลึก สวนบ้านแก้วแฟร์ ระหว่างวันที่ 12-21 ธันวาคม 2566
งานวันสมเด็จพระนางเจ้ารำไพพรรณีรำลึก สวนบ้านแก้วแฟร์ ระหว่างวันที่ 12-21 ธันวาคม 2566 ณ มหาวิทยาลัยราชภัฏรำไพพรรณี
• ร้านจำหน่ายสินค้าจากนักศึกษาและผู้ประกอบการ
• กิจกรรมให้ความรู้และวิชาการ
• นิทรรศการรำลึกสมเด็จพระนางเจ้ารำไพพรรณี ครบ 119 ปี
• พืชพรรณไม้ เฟอร์นิเจอร์ สัตว์เลี้ยง
• สวนสนุกขนาดใหญ่
เวทีกลางและคอนเสิร์ตจากศิลปินดัง
• 12 ธ.ค. BLACKHEAD
• 13 ธ.ค. ประกวดวงดนตรีลูกทุ่ง
• 14 ธ.ค. แบงค์ คอพับ & SUN NYP
• 15 ธ.ค. ประกวดวงดนตรีสตริงสากล กลุ่ม 1
• 16 ธ.ค. โตโน่ The dast และ ลีลาศชาววัง
• 17 ธ.ค. ประกวดวงดนตรีสตริงสากล กลุ่ม 2
• 18 ธ.ค. ประกวด COVER DANCE
• 19 ธ.ค. ประกวดร้องเพลงลูกทุ่งประกอบแดนเซอร์
• 20 ธ.ค. BIG ASS และโขนเฉลิมพระเกียรติ
• 21 ธ.ค. หมอลำไทราชภัฏเลย และ วงดุริยางค์กรุงเทพ
สอบถามรายละเอียดเพิ่มเติม สำนักศิลปวัฒนธรรมและพัฒนาชุมชน 0-3947-1064 และ https://www.facebook.com/artculturerbru/
ดนตรีในสวน Voice of Health Vol.6 ศรีราชา ชลบุรี 5 - 21 ธันวาคม 2566
องค์การบริหารส่วนจังหวัดชลบุรี ชวนผู้รักสุขภาพ ร่วมเพลิดเพลินในยามเย็น ชมการแสดงดนตรีพร้อมรับบริการนวดทางกีฬา และร่วมกิจกรรมเกมส์นันทนาการในงาน "Music in the Park" ดนตรีในสวน Voice of Health Vol.6 . ทุกวันอังคาร วันพุธ และวันพฤหัสบดีของสัปดาห์ตลอดธันวาคมนี้ ตั้งแต่ 5 - 21 ธันวาคม 2566 . ณ สวนสาธารณะเฉลิมพระเกียรติ ร.9 ศรีราชา ชลบุรี ตั้งแต่เวลา 17.30 - 19.30 น.
ตารางออกตรวจมกราคม (กุมภาพันธ์) 66
คลินิกนอกเวลาราชการเดือนกุมภาพันธ์ 2566 เวลาออกตรวจ 16.30-20.00น ปล. กรุณายื่นบัตรก่อน 18.00น คลินิกอายุรกรรมโรคข้อ งดบริการทุกวันพฤหัสบดีที่3 ของเดือน
แผนการตรวจสุขภาพ ประจำเดือน เมษายน 2567
17 กันยายน - BKK Ranger@พิพิธภัณฑ์เด็กกรุงเทพมหานครแห่งที่ 2 (ทุ่งครุ)
“BKK Ranger” @พิพิธภัณฑ์เด็กกรุงเทพมหานครแห่งที่ 2 (ทุ่งครุ) วันเสาร์ที่ 17 กันยายนนี้ ตั้งแต่เวลา 10.00 – 16.00 น.
พิพิธภัณฑ์เด็กกรุงเทพมหานครแห่งที่ 2 (ทุ่งครุ) และบางกอกกำลังดี จะมาเปิดพื้นที่สร้างสรรค์ให้สนุกกัน! เตรียมพบกับมินิคอนเสิร์ตจาก วงคลองเตยดีจัง พบกับการระดมความคิดแก้ปัญหาเมืองอย่างสร้างสรรค์ของเด็ก และเยาวชนรุ่นใหม่ในกิจกรรม BKK Ranger Brainstorm: Discuss For The Future
กิจกรรมอีกเยอะ กิจกรรม Workshop สร้างสรรค์สิ่งประดิษฐ์สุดสร้างสรรค์ กิจกรรม Free Play และกิจกรรม Young Me D
18 กันยายน - BKK-เรนเจอร์ @ศูนย์เยาวชนคลองสามวา LINK
BKK-เรนเจอร์ @ ศูนย์เยาวชนคลองสามวา
ผังงาน “BKK-เรนเจอร์ @ ศูนย์เยาวชนคลองสามวา” โดย #บางกอกกำลังดี สัปดาห์นี้พบกับ WORKSHOP ที่ชวนทุกคนไปทดลอง ลงมือทำปลดล็อคศักยภาพที่ซ่อนอยู่ข้างใน และร่วมสนุกไปกับกิจกรรม FREE ART ● FREE PLAY ● FREE MUSIC จากเครือข่ายที่ขนขบวนกันมาอย่างคับคั่งเช่นเคย
WORKSHOP | 13.00 - 16.00
พบกับ 6 ห้อง 6 ประสบการณ์ที่ชวนทุกคนมาค้นหาศักยภาพไปด้วยกัน
สมัครที่นี่ https://bit.ly/bkkrangerkhlongsamwa
1.ปัยจัยเสี่ยง วัยเหวี่ยง วัยรุ่น | มูลนิธิเด็กเยาวชนและครอบครัว
· พบปะ แลกเปลี่ยน ชวนวัยรุ่นมาพูดคุยเรื่องปัจจัยเสี่ยง
2.Discover A Personal Brand | ครูเจน เจนรบ ชัยเลิศ แห่ง The Jen Studio
· มาค้นศักยภาพและตัวตนแห่งความสำเร็จ เติมเต็มความมั่นใจไปกับครูเจน เจนรบ ชัยเลิศ แห่ง The Jen Studio
3.เตรียมความพร้อมสำหรับนักร้องน้องใหม่ | ครูพี ประพฤติ ทองธานี
· สนุกกับการร้องเพลงอย่างถูกวิธี มาเรียนร้องเพลงกับคุณครูสอนร้องเพลงมืออาชีพ!
4.ขนมปั้น(กลาง)เมือง | น้าโรจน์ วิโรจน์ ปลอดสันเทียะ
· สนุกกับการทำขนมที่ "อร่อย" และ "ปลอดภัย" จากสีธรรมชาติ
5.BKK PaRTY ป้ามี่ชวน No L | พี่มี่ อารีย์ เหมะธุลิน
· สนุกได้ทุกปาร์ตี้แบบ NO L ชวนเปิดตี้ ลงมือทำเครื่องดื่มอร่อย ที่จะไม่ทำให้คุณมึน
6.Speed Dating | สมาคมคนรุ่นใหม่กับนวัตกรรมทางสังคม SYSI
· ชวนคิด ชวนคุย ผ่านเกมสนุก ๆ กับทีม SYSI
FREE MUSIC | 16.00 - 20.00
· 16.00 การแสดงจากศูนย์เยาวชนคลองสามวา
· 17.20 BKK-เรนเจอร์ TALK
· 17.40 Your MOOD ศิลปินจากสังกัดค่ายเพลง WHOOP Music
· 18.20 ALIZbandofficial ศิลปินจากสังกัดค่ายเพลง Muzik Move Records
· 19.00 ASIA7 ศิลปินจากค่าย GENE LAB สังกัด GMM GRAMMY
FREE ART FREE PLAY | 16.00 - 20.00
กิจกรรมจากเครือข่าย อาทิ กระดานดำระดมไอเดีย, กรุงเทพYoung อยากได้, บันไดงูลดปัจจัยเสี่ยง, ตัวต่อบล๊อกไม้ และอื่น ๆ มากมาย
วันอาทิตย์ที่ 18 กันยายนนี้ สอบเสร็จแล้วมาเจอกันนะ
12-26 ก.ย.66 คณะสัตวแพทยศาสตร์ ม.เกษตร บริการทำหมันหมาแมวฟรี LINK
ภาควิชาเวชศาสตร์คลินิกสัตว์เลี้ยง ม.เกษตร บริการทำหมันหมาแมวฟรี ระหว่างวันที่ 12-26 กันยายน 2566 ลงทะเบียนออนไลน์ สอบถามรายละเอียดเพิ่มเติม 082-9292648 ในวันและเวลาราชการ
ลงทะเบียนสุนัขและแมวทำหมันฟรี ในวิชาฝึกปฏิบัติการ ทำโดยนิสิตชั้นปีที่ 4 คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ โดยมีอาจารย์ และสัตวแพทย์ผู้เชี่ยวชาญควบคุมการผ่าตัดอย่างใกล้ชิด ณ ห้องปฏิบัติการทางศัลยกรรม อาคารเฉลิมพระเกียรติ 6 รอบพระชนมพรรษา (โรงพยาบาลสัตว์มหาวิทยาลัยเกษตรศาสตร์ บางเขน) ชั้น 4 *** หลังจากลงทะเบียนเรียบร้อยแล้วจะมีเจ้าหน้าที่โทรศัพท์ไปยืนยันวันและเวลานัดหมายอีกครั้งหนึ่ง ***
4,12,20,25 ก.ค.66 ปศุสัตว์ปากเกร็ด ทำหมันหมาแมวฟรี
สำนักงานปศุสัตว์อำเภอปากเกร็ด ขอแจ้งแผนโครงการออกหน่วยทำหมันสุนัข-แมว พร้อมกับฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
• 4 ก.ค. 66 ณ อบต.ละหาร อ.บางบัวทอง
• 12 ก.ค. 66 ณ ที่ทำการผู้ใหญ่บ้าน หมู่ 9 ต.ไทรใหญ่ อ.ไทรน้อย
• 20 ก.ค. 66 ณ เทศบาลเมืองบางแม่นาง ต.บางแม่นาง อ.บางใหญ่
• 25 ก.ค. 66 ณ อบต.ท่าอิฐ ต.ท่าอิฐ อ.ปากเกร็ด
เปิดรับลงทะเบียน 08.00 น.
คำแนะนำสุนัขและแมวที่จะทำหมัน : อายุ 5 เดือนขึ้นไป งดน้ำงดอาหาร 8 ชั่วโมงขึ้นไป สุขภาพร่างกายแข็งแรงไม่มีโรคประจำตัว
26 มิ.ย. - 27 ก.ค. 66 เทศบาลเมืองปู่เจ้าสมิงพราย บริการทำหมันฉีดวัคซีน ฟรี LINK
เทศบาลเมืองปู่เจ้าสมิงพรายร่วมกับมูลนิธิเพื่อสุนัขในซอย ให้บริการทำหมันและฉีดวัคซีนป้องกันโรคให้แก่ “สุนัข” ในเขตเทศบาลฯ โดยไม่เสียค่าใช้จ่ายใด ๆ ทั้งสิ้น ในระหว่างวันที่ 26 มิถุนายน 2566 จนถึงวันที่ 27 กรกฎาคม 2566 (ให้บริการวันจันทร์ - ศุกร์ เวลา 9.00-16.00 น.) ทำหมันจำกัดจำนวนสุนัข 44 ตัว/วัน
- ผู้ที่ประสงค์นำสุนัขมาเข้ารับบริการ สามารถติดต่อสอบถามข้อมูลได้ที่ จุดให้บริการบริเวณลานจอดรถยนต์ อาคารสำนักงานเทศบาลเมืองปู่เจ้าสมิงพราย 2 ชั้น 1
- กรุณางดให้น้ำและอาหารสุนัขที่จะนำมาทำหมัน อย่างน้อย 8-12 ชั่วโมง เพื่อความปลอดภัยในการวางยาสัตว์
- หากมีข้อสงสัย สามารถสอบถามรายละเอียดเพิ่มเติมได้ที่ งานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองปู่เจ้าสมิงพราย โทร 02-3639800 ต่อ 830 ในวันและเวลาราชการ
16 ก.ค.66 เขตดุสิต ทำหมันสุนัขแมว ฟรี
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ สำนักงานเขตดุสิต ขอเชิญชวนเจ้าของสัตว์เลี้ยง นำน้องหมาและน้องแมว อายุ 2 เดือนขึ้นไป มารับบริการฉีดวัคซีนป้องกันพิษสุนัขบ้า และน้องหมาน้องแมว อายุ 6 เดือนขึ้นไปทำหมัน รวมถึงฉีดไมโครชิป ฟรี‼️ ในวันที่ 16 ก.ค. 66 เวลา 8.00-12.00 น. ณ โรงเรียนวัดจันทรสโมสร เขตดุสิต ติดต่อสอบถามเพิ่มเติมได้ที่ สำนักงานสัตวแพทย์สาธารณสุข โทร 02-2453311
20 ก.ค.66 ทำหมันสุนัขและแมว ฟรี ที่โรงเรียนวัดบุณยประดิษฐ์ บางไผ่ เขตบางแค กทม.
ให้บริการทำหมันสุนัขและแมว จำกัดจำนวน 50 ตัว และฉีดวัคซีนพิษสุนัขบ้าไม่จำกัดจำนวน
วันที่ 20 กรกฎาคม 2566 เวลา 8.00 น. เป็นต้นไป จนกว่าคิวจะเต็ม
**เจ้าของนำบัตรประชาชนมาด้วย ลงทะเบียนหน้างาน ***
อาทิตย์ที่ 23 ก.ค.66 เขตยานนาวา ทำหมันสุนัข 100 ตัว LINK
วันอาทิตย์ที่ 23 กรกฎาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดดอกไม้ ถนนพระราม 3 แขวงบางโพงพาง เขตยานนาวา ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้
18 กรกฎาคม 2566 เทศบาลนครนครปฐม ทำหมันหมาแมวในเทศบาล LINK
เทศบาลนครนครปฐม ร่วมกับ ปศุสัตว์จังหวัดนครปฐม และ ปศุสัตว์อำเภอเมืองนครปฐม จัดทำโครงการ #ทําหมันสุนัขและแมวฟรี จำนวน 100 ตัว และให้บริการ #ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สัตว์เลี้ยง ไม่จำกัดจำนวน ตามโครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้าฯ ประจำปี พ.ศ.2566 เมื่อวันอังคารที่ 18 กรกฎาคม 2566 ณ ศาลามั่นสุข วัดไร่เกาะต้นสำโรง สำนักการสาธารณสุขและสิ่งแวดล้อม เทศบาลนครนครปฐม
7-9 ส.ค. 66 ทำหมันสุนัขแมวฟรี เขตคลองเตย โทร. 02-240-2121 LINK
สมาร์ทฮาร์ท ห่วงใยเพื่อนสัตว์เลี้ยง โครงการทำหมันให้สุนัขและแมวฟรี! และเพื่อส่งเสริมให้น้องๆ สุนัขและแมว ได้มีสุขภาพที่ดี รวมถึงช่วยควบคุมจำนวนของสุนัขและแมวไร้บ้านในชุมชน โดยโครงการจะจัดขึ้นที่
1. อบต. หนองหญ้าปล้อง จังหวัดเพชรบุรี ในวันที่ 3-4 สิงหาคม 2566 และ
2. เขตคลองเตย จังหวัดกรุงเทพฯ ในวันที่ 7-9 สิงหาคม 2566
ติดต่อลงทะเบียน
สำนักงานเขตคลองเตย โทร. 02-240-2121
อบต. หนองหญ้าปล้อง โทร. 0-4207-7666
4 ส.ค. 66 ออกหน่วยทำหมัน วัดพรหมสุวรรณสามัคคี หมู่บ้านเศรษฐกิจ เพชรเกษม LINK
ชมรมรักสัตว์โอซีดี (OCD Pet Lovers Club) ได้รับความอนุเคราะห์จาก กลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานคร กรุณามาออกหน่วยทำหมันเคลื่อนที่ให้แมวและสุนัข ตามนโยบายควบคุมจำนวนสัตว์จรในชุมชน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรีโดยไม่มีค่าใช้จ่าย ในวันศุกร์ที่ 4 สิงหาคม 66 เวลา 9.00-11.00น. สถานที่ออกหน่วยทำหมัน คือในบริเวณวัดพรหมสุวรรณสามัคคี หมู่บ้านเศรษฐกิจ เพชรเกษม โดยรับลงทะเบียนทำหมันแมว และสุนัขทางออนไลน์ผ่านเพจชมรมฯ จำนวน 30 ตัว สำหรับวัคซีนป้องกันโรคพิษสุนัขบ้าและลงทะเบียนสุนัข ไม่จำกัดจำนวน
คุณสมบัติของแมวและสุนัขที่พร้อมทำหมัน
เพศเมีย อายุ 4 เดือนขึ้นไป สุขภาพแข็งแรง
เพศผู้อายุ 8 เดือน หรือ 1ปีขึ้นไป สุขภาพแข็งแรง
สอบถามข้อมูลเพิ่มเติมได้ทาง IB เพจชมรมฯ หรือโทร 094-1240843
31 ก.ค. - 18 ส.ค.66 เขตธนบุรี จัดทำหมันสุนัข ฟรี
เขตธนบุรี จัดทำหมันสุนัขฟรี 31 ก.ค. - 18 ส.ค.66
จำกัด 40 ตัว/วัน เฉพาะสุนัขเท่านั้น (ไม่รับแมวและสัตว์อื่น)
วันบริการ จันทร์-ศุกร์ (หยุดเสาร์-อาทิตย์) เวลา 8.00-15.00 น.
สถานที่ วัดหิรัญรูจี เขตธนบุรี
สอบถามโทร. 0630247813
27 ส.ค. 66 ทำหมันสุนัขและแมว ฟรี เขตคลองสานและหนองแขม
6 ส.ค. 66 เขตคลองสาน
27 ส.ค. 66 หนองแขม
ผ่าตัดทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสุนัขและแมว
ฉีดไมโครชิปและจดทะเบียนสุนัข ฟรี
ลงทะเบียนหน้างาน ตามวัน เวลา และสถานที่
สอบถามข้อมูลเพิ่มเติม สำนักงานสัตวแพทย์สาธารณสุข โทร 0 2245 3311
27 ส.ค. 66 ศูนย์ฯสาธารณสุข 48 นาควัชระอุทิศ หนองแขม ทำหมันเฉพาะสุนัขและแมว 100 ตัว LINK
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 48 นาควัชระอุทิศ เขตหนองแขม ร่วมกับ สำนักงานเขตหนองแขม ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 27 สิงหาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ (ซอยโรงกำจัดขยะหนองแขม) ถ.พทธมณฑลสาย 3 เขตหนองแขม
10 ส.ค. 66 ทำหมันฟรี งานกิจกรรมบริการสุขภาพเคลื่อนที่ ลานใต้สะพานพระราม 8 บางพลัด
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 10 สิงหาคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ลานใต้สะพานพระราม 8 เขตบางพลัด กทม. ทำหมันสุนัขและแมว รับจำนวนจำกัด 60 ตัว ได้สิทธิ์คนละไม่เกิน 2 ตัว (ทำหมันมาลงทะเบียนก่อน 11.00 น. หรือ จนกว่าคิวจะเต็ม)
ต้องจับขังกรง อดอาหารและน้ำ 10 ชม. ก่อนพามาทำหมัน
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 200 ตัว
17 ส.ค. 66 ทำหมันและฉีดวัคซีน ฟรี วัดบางขุนเทียนนอก
พาหมอไปหาหมา ออกหน่วยสัตวแพทย์ ณ.วัดบางขุนเทียนนอก วันที่ 17 สิงหาคม 2566 เวลา 9.00น-12.00 น ลงทะเบียนหน้างาน
22 ส.ค.66 ทำหมันสุนัขและแมว ฟรี 60 ตัว วัดกก ซอยพระรามที่ 2 (44)
หน่วยบริการสัตวแพทย์เคลื่อนที่ให้บริการ โดย กรมปศุสัตว์ (ปศุสัตว์พื้นที่กรุงเทพมหานคร)
• ทำหมันสุนัขและแมว จำนวน 60 ตัว
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี
*ไม่ทำหมันให้กับสุนัขหน้าสั้นด้วยนะครับ อาทิเช่น ปั๊ก ชิวาวา ชิสุ ปอมเมอร์เรเนียน*
**จำกัดครอบครัวละไม่เกิน 2 ตัว**
**ขอสิทธิ์ให้กับคนพื้นที่เขตบางขุนเทียน**
สามารถ ลงทะเบียน ทาง in box ส.ก.สารัช ม่วงศิริ โดยขอชื่อเจ้าของ พร้อมเบอร์โทรศัพท์ ระบุสัตว์เลี้ยง ว่า เป็น สุนัข หรือ แมว เพศ และ อายุ
สุนัขและแมว ที่จะรับบริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า มีข้อปฎิบัติดังนี้
1. ต้องมีสุขภาพแข็งแรง ไม่ป่วย
2. แมวที่จะทำหมัน
- เพศเมีย ต้องอายุ 6 เดือนขึ้นไป
- เพศผู้ ต้องอายุ 10 เดือนขึ้นไป
3. สุนัขที่จะทำหมัน ต้องอายุ 6 เดือนขึ้นไป หรือ ตามแพทย์วินิจฉัย
4. สุนัขและแมวที่จะฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า อายุ 3 เดือนขึ้นไป และร่างกายแข็งแรง
5. สุนัขและแมวที่จะรับบริการทำหมัน ต้องอดอาหารและน้ำ ก่อนนำมาทำหมัน 8-10 ชั่วโมง**
15-18 สค 66 หน่วยเคลื่อนที่ทำหมัน ฉีดวัคซีน
24 ส.ค.66 ทำหมันหมาแมว ฉีดวัคซีนพิษสุนัขบ้า เขตดินแดง LINK
เชิญร่วมกิจกรรมหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "โครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ" สำนักงานเขตดินแดง ร่วมกับสำนักอนามัย ขอเชิญชวนประชาชน ร่วมกิจกรรมการออกหน่วยแพทย์และสาธารณสุขเคลื่อนที่ "โครงการกรุงเทพฯ ห่วงใย ใส่ใจสุขภาพ" ในวันพฤหัสบดีที่ 24 สิงหาคม 2566 เวลา 08.00-14.00 น. ณ ลานกีฬาชุมชนห้วยขวางเฉลิมพระเกียรติ 72 พรรษา เขตดินแดง.
▶️ ชวนเช็คสุขภาพ เบาหวาน ความดัน ต้อหิน มะเร็งปากมดลูก เอ็กซเรย์ปอด ตรวจฟัน (อุด ขูด ถอน) สุขภาพใจ คุยกับนักจิตวิทยา
▶️ ชวนรู้ กินเป็น เน้นสุขภาพ ยาเสพติด ไข้เลือดออก ผลิตภัณฑ์สุขภาพ ตรวจคุณภาพอาหาร ฝุ่น PM.2.5
▶️ ชวนช้อป สินค้าชุมชน สินค้า OTOP
▶️ บริการน้องหมาน้องแมว ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า ฉีดไมโครชิป
▶️ แจกแว่นสายตายาว
3 ก.ย.66 ทำหมัน 100 ตัว ศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร เขตดอนเมือง LINK
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 60 รสสุคนธ์ มโนชญากร เขตดอนเมือง ร่วมกับ สำนักงานเขตดอนเมือง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
⏩️ ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 3 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนประชาอุทิศ (จันทาบอนุสรณ์) เขตดอนเมือง
30 ส.ค.66 ชุมชนมัสยิดมหานาค LINK
ทำหมัน ฟรี‼️ ฉีดวัคซีน ฟรี‼️ ไมโครชิพ ฟรี‼️
ทำหมันจองคิวกันเข้ามาได้เลยนะคะ รับจำกัดเพียง 30 ตัวเท่านั้นค่ะ
ปล.รอบนี้ไม่รับสุนัขนะคะ เพราะจัดในมัสยิดค่ะ
จองคิว ส.ก. กุ๊บ 092-639-7446
26 ส.ค.66 ทำหมัน ฟรี 500ตัว เซ็นทรัล พระราม 2 LINK
เซ็นทรัล พระราม 2 ร่วมกับพันธมิตรจัดกิจกรรมดีๆ เปิดให้บริการทำบัตรประชาชนน้องหมาแมว จำนวน 500 ตัว งานนี้ฟรี!! สำหรับผู้ที่ลงทะเบียนล่วงหน้าเท่านั้นจ้า กิจกรรมภายในงาน
☑ ฝังไมโครชิพ และทำบัตรประชาชนนุ้งหมา นุ้งแมว
☑ ฉีดวัคซีนพิษสุนัขบ้า
☑ ตรวจสุขภาพให้น้อง ๆ
☑ ให้คำปรึกษาโดยสัตวแพทย์ผู้เชี่ยวชาญ
คลิกเพื่อลงทะเบียน http://203.151.166.133/register
วันที่ 26 ส.ค. 66 เวลา 10.00-18.00 น. ชั้น 4 Rama 2 Hall
*ขอความร่วมมือ
_นุ้งหมานุ้งแมวต้องอยู่ภายในรถเข็นหรือกระเป๋าเท่านั้น
_นุ้งหมาใส่แพมเพิสก่อนเข้าร่วมกิจกรรม (ป้องกันการขับถ่ายกรณีฉุกเฉิน)
22-25 ส.ค.66 ทำหมันเคลื่อนที่ กทม
สำนักอนามัย ชวน #ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า #ฉีดไมโครชิปสุนัข และ #ผ่าตัดทำหมัน โดยหน่วยสัตวแพทย์เคลื่อนที่ กลุ่มควบคุมโรคพิษสุนัขบ้า สำนักงานสัตวแพทย์สาธารณสุข กรุงเทพมหานคร
10 ก.ย.66 ศูนย์บริการสาธารณสุข 37 สวนหลวง ทำหมัน ฟรี 100 ตัว
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 37 ประสงค์-สุดสาคร ตู้จินดา เขตสวนหลวง ร่วมกับ สำนักงานเขตสวนหลวง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 10 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดใต้ เขตสวนหลวง
24 ก.ย.66 ทำหมัน 100 ตัว ศูนย์บริการสาธารณสุข 31 เขตบางพลัด LINK
ศูนย์บริการสาธารณสุข 31 เอิบ-จิตร ทังสุบุตร เขตบางพลัด ร่วมกับ สำนักงานเขตบางพลัด เชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!
• ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 24 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนวัดเปาโรหิตย์ ซอยจรัญสนิทวงศ์ 62 เขตบางพลัด
- ผ่าตัดทำหมันสุนัขและแมว จำนวน 171 ตัว
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า จำนวน 141 ตัว
- ฉีดไมโครชิปสุนัข จำนวน 24 ตัว
17 ก.ย.66 ทำหมันฟรี เขตวังทองหลาง LINK
ศูนย์บริการสาธารณสุข 15 ลาดพร้าว เขตห้วยขวาง ร่วมกับ สำนักงานเขตวังทองหลาง ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ทำหมัน รับจำนวนจำกัด 100 ตัว
จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 17 กันยายน 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ สำนักงานเขตวังทองหลาง ซอยรามคำแหง 39 เขตวังทองหลาง
1 ต.ค.66 ทำหมัน รับจำนวนจำกัด 100 ตัว เขตบางซื่อ LINK
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 3 บางซื่อ ศูนย์บริการสาธารณสุข 19 วงศ์สว่าง เขตบางซื่อ ร่วมกับ สำนักงานเขตบางซื่อ ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
• ทำหมัน รับจำนวนจำกัด 100 ตัว
• จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 1 ตุลาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนวัดบางโพโอมาวาส เขตบางซื่อ [
แผนที่]
8 ต.ค.66 เขตบางขุนเทียน ทำหมันหมาแมว 100 ตัว ฉีดวัคซีน 300 ตัว LINK
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 42 ถนอม ทองสิมา เขตบางขุนเทียน ร่วมกับ สำนักงานเขตบางขุนเทียน ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
• ทำหมัน รับจำนวนจำกัด 100 ตัว
• จำกัดคนละไม่เกิน 2 ตัว
• รับทำหมันเฉพาะสุนัขและแมว ในพื้นที่กรุงเทพมหานคร เท่านั้น
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 8 ตุลาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โดมลานกีฬา เคหะชุมชนธนบุรี 1 ส่วน 1 เขตบางขุนเทียน
[แผนที่จุดให้บริการ]20 ก.ย.66 สุขภาพดี ใกล้บ้าน ใกล้หมอ เขตสาทร ณ สวนสาธารณะเฉลิมพระเกียรติฯ 80 พรรษา
กิจกรรมบริการสุขภาพเคลื่อนที่ สุขภาพดี ใกล้บ้าน ใกล้หมอ พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 20 กันยายน 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ สวนสาธารณะเฉลิมพระเกียรติฯ 80 พรรษา เขตสาทร กทม.
24 ก.ย.66 กำหนดการหน่วยเคลื่อนที่ ทำหมัน กทม.
สำนักอนามัย ชวนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิปสุนัขและทำหมันสุนัขและแมว โดยหน่วยสัตวแพทย์เคลื่อนที่ วันที่ 3,10,17, 24 กันยายน 2566 ตามวันและสถานที่ ที่ระบุ
25-29 ก.ย.66 หน่วยทำหมันเคลื่อนที่ กทม.
25 ก.ย. ชุมชนมหาดไทย 5 เขตประเวศ
26 ก.ย. ชุมชนเคหะบ่อนไก่ ปทุมวัน
27 ก.ย. โรงงานรถไฟมักกะสัน ราชเทวี
28 ก.ย. วัดปรก สาทร
29 ก.ย. ชุมชนเปรมฤทัย 1 คันนายาว
ทุกจุดเวลา 9.00-12.00 น. เจ้าของนำบัตรประชาชนมาแสดงด้วย
สอบถามโทร. 02-2487417 02-2453311
11 ต.ค.66 ทำหมันฟรี 30 ตัว
ส.ก. กุ๊บ จัดกิจกรรม ทำหมัน ฟรี‼️ ฉีดวัคซีน ฟรี‼️ ไมโครชิพ ฟรี‼️ โดยสำนักอนามัย วันที่ 11 ตุลาคม 66 ณ สมาคมหงี่ฮั้ว (ซอยมังกร) กรุงเทพมหานคร รับจำกัดเพียง 30 ตัวเท่านั้น จองคิว ส.ก. กุ๊บ 092-639-7446
เขตสัมพันธวงศ์ เชิญแจ้งความประสงค์ทำหมันสุนัขและแมว ในพื้นที่เขตสัมพันธวงศ์ ถึง 25 ต.ค.66 นี้
เขตสัมพันธวงศ์ ขอประชาสัมพันธ์ เชิญชวนประชาชนที่สนใจ แจ้งความประสงค์ทำหมันสุนัขและแมว ในพื้นที่เขตสัมพันธวงศ์ โดยสามารถแจ้งความประสงค์ ได้ตั้งแต่วันนี้ - 25 ตุลาคม 2566 ทั้งนี้ การกำหนดวันเวลา และสถานที่จะแจ้งให้ทราบภายหลัง
ออกหน่วยทำหมัน เดือนธันวาคม 2566
กำหนดการออกหน่วยสัตวแพทย์เคลื่อนที่เดือนธันวาคม 2566
- 12 ธ.ค.66 ชุนชนหมู่บ้านทองสถิตย์วิลล่า 6 เขตสายไหม / ชุมชนเยี่ยมเจริญสุข เขตพระโขนง
- 13 ธ.ค.66 วัดบางนานอก เขตบางนา / วัดทรัพย์สโมสรนิกรเกษม เขตหนองจอก
- 14 ธ.ค.66 วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง / ชุมชนก้าวหน้า เขตหลักสี่
- 15 ธ.ค.66 สำนักงานเขตบางกอกน้อย / ชุมชนรวมใจพัฒนาวังใหญ่ เขตสะพานสูง
- 19 ธ.ค.66 วัดอนัมยิกายารม บางซื่อ / ชุมชนเปรมฤทัย 3 คันนายาว
- 20 ธ.ค.66 ชุมชนบึงพระราม 9 พัฒนา (บ่อ 3) ห้วยขวาง
- 21 ธ.ค.66 ชุมชนสหกรณ์เคหะสถานบ่อฝรั่งริมน้ำพัฒนา จตุจักร / วัดราษฎร์บำรง บางแค
- 22 ธ.ค.66 ชุมชนร่วมกันสร้าง บางกะปิ / ชุมชนวัดพระยาไกรระยะ 3 บางคอแหลม
- 25 ธ.ค.66 หมู่บ้านพระปิ่น 5 บางบอน
- 26 ธ.ค.66 กลุ่มควบคุมการตรวจเนื้อสัตว์ เขตหนองแขม / หมู่บ้านเอกวิน คลองสามวา
- 27 ธ.ค.66 ชุมชนหมู่บ้านร่วมเกื้อ ทวีวัฒนา
สำนักอนามัย กทม. ทำหมันสุนัขและแมว
สำนักอนามัย ชวนฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดไมโครชิปสุนัขและทำหมันสุนัขและแมว
12 ต.ค. 66 สุขภาพดี ใกล้บ้าน ใกล้หมอ มัสยิดกามาลุลอิสลาม เขตคลองสามวา
เตรียมพาน้องหมาแมว ไปทำหมัน ฉีดวัคซีน ได้ในงานกิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 12 ตุลาคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ มัสยิดกามาลุลอิสลาม เขตคลองสามวา กทม.
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร 28 ต.ค.66


• วันเสาร์ที่ 28 ต.ค. วัด ณ สะพานพระราม 7 [
โพสต์]
รายละเอียดในการลงทะเบียนทำหมัน
1.ผู้ลงทะเบียนจะต้องเป็นผู้ที่สามารถดูแลสุนัข/แมวก่อนและหลังทำหมันได้
2. สุนัข/แมวจะต้องได้รับการอดน้ำอดอาหาร 10-12 ชั่วโมงก่อนการพามาทำหมัน
3. อุปกรณ์ที่ใส่แมวมาทำหมันกำหนดให้ใช้ - กรง หรือ - ตะกร้าแบบมีฝาเปิดแบบฝาเดียว หรือ - บล็อกใส่แมวเท่านั้น ส่วนสุนัขให้ใส่สายจูง
4. แมว 1 ตัวต่อ 1 อุปกรณ์(ตะกร้า/บล๊อค) และอุปกรณ์ที่ใส่มาต้องมีขนาดใหญ่เพียงพอให้แมวนอนกลับได้โดยคอไม่พับ
5. สุนัข/แมวทุกตัวที่มาทำหมันกับทางมูลนิธิฯ จะได้รับการสักหูทุกตัว เพื่อเป็นสัญลักษณ์ว่าสุนัข/แมวได้รับการทำหมันมาแล้ว
6.สุนัข/แมวที่จะทำหมันได้
-เพศเมียทำได้ที่่อายุ 5 เดือนหรือน้ำหนักได้ 2 กิโลกรัม
-เพศผู้ทำได้ที่่อายุ 5 เดือนหรือมองเห็นไข่แล้ว
- แม่แมว/สุนัขทำหมันได้เมื่อลูกแมวหรือลูกสุนัขกินอาหารเองได้แล้ว ประมาณ 45-60 วันหลังคลอด
หมายเหตุ-หลังจากลงทะเบียนที่หน้าเวบนี้แล้ว ส่งรูปใบโอนเงินภายใน 5 วันแล้วแจ้งกลับที่เมลล์ catpantip@gmail.com เพื่อรับลำดับคิว **หมายเหตุ เมื่อโอนเงินแล้ว ไม่สามารถเรียกคืนหรือยกยอดไปรอบต่อไปได้ ดังนั้นขอให้แน่ใจว่าจะพาสุนัข/แมวไปทำหมันแน่ ๆ นะคะ
**ต้องการสอบถามข้อมูลเพิ่มเติม ติดต่อได้ที่ช่องทางเดียวคือเมลล์ catpantip@gmail.com ไม่เกิน 3 วันตอบกลับเมลล์ทุกฉบับ
ครั้งที่ 391 สุพรรณบุรี ในวันเสาร์ที่ 23 กันยายน 66
ครั้งที่ 390 นครราชสีมา ในวันที่ 16-17 กันยายน 66
ครั้งที่389 ฉะเชิงเทรา ในวันอาทิตย์ที่ 10 กันยายน 66
ครั้งที่388 อ่อนนุช กทม ในวันที่ 9 กันยายน 66
ครั้งที่387 ปากพลี นครนายก ในวันที่ 3 กันยายน 66
ครั้งที่ 386 สระบุรี ในวันเสาร์ที่ 2 กันยายน 66
ครั้งที่385 มวกเหล็ก สระบุรี ในวันอาทิตย์ที่ 27 สิงหาคม 66
ครั้งที่384 ปากช่อง นครราชสีมา ในวันเสาร์ที่ 26 สิงหาคม 66
ครั้งที่383 โคกขาม สมุทรสาคร ในวันเสาร์ที่ 19 สิงหาคม 66
ครั้งที่382 สุพรรณบุรี ในวันอาทิตย์ที่ 6 สิงหาคม 66
ครั้งที่381 เสนา อยุธยา ในวันเสาร์ที่ 5 สิงหาคม 66
26 ต.ค. 66 ทำหมันหมาแมวในงาน สุขภาพดี ใกล้บ้าน ใกล้หมอ @ตลาดไชยทิศ เขตบางกอกน้อย กทม.
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" ในวันที่ 26 ตุลาคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ ตลาดไชยทิศ เขตบางกอกน้อย กทม. ทำหมันหมาแมว ลงทะเบียนหน้างาน จำกัดจำนวนแค่ 60 ตัว
รพ.สัตว์ตลิ่งชันจัดโครงการ ทำหมันฟรี! ไม่มีค่าใช้จ่าย สุนัขจรจำนวน 45 ตัว
โรงพยาบาลสัตว์ตลิ่งชันจัดโครงการ “ทำหมันฟรี! ไม่มีค่าใช้จ่าย” สำหรับสุนัขจรจำนวน 45 ตัว
คุณสมบัติดังนี้
-เฉพาะสุนัขจร เพศเมีย อายุตั้งแต่ 8 เดือน - 6 ปี เท่านั้น
-น้ำหนัก 15 กิโลกรัมขึ้นไป
-ไม่อยู่ในระยะติดสัด
รายละเอียดเพิ่มเติ่ม
-ลงทะเบียนเพื่อทำนัดหมายล่วงหน้าผ่านทางไลน์ @talingchanpet เท่านั้น หากยกเลิกถือว่าสละสิทธิ์
-จองสิทธิ์ได้ตั้งแต่วันนี้ - 30 พฤศจิกายน 2566 หรือจนกว่าสิทธิ์จะเต็ม
-งดอาหารและน้ำ 8-12 ชม. ก่อนมาตรวจเลือด หากผลเลือดผ่านสามารถทำหมันได้ภายในวันนั้นเลย
*เงื่อนไขและกำหนดการเป็นไปตามที่โรงพยาบาลกำหนด
หากใครสนใจพาสุนัขจรมาทำหมัน สามารถลงทะเบียนหรือสอบถามเพิ่มเติมได้ที่ไลน์ @talingchanpet หรือโทร 063-9515591 หรือ 02-8878321 - 3
โรงพยาบาลสัตว์ตลิ่งชัน เปิดตลอด 24 ชั่วโมง
เขตบางบอนทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 23 ตุลาคม - 10 พฤศจิกายน 2566
ประชาสัมพันธ์จากฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางบอน ทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ฟรี ฟรี ฟรี ฟรี สำนักงานเขตบางบอน ร่วมกับมูลนิธิเพื่อสุนัขในซอย Soidog ให้บริการออกหน่วย "ทำหมันสุนัขและฉีดวัคซีนป้องกันพิษสุนัขบ้า" ให้กับสุนัข ณ วัดนินสุขาราม ซอย กาญจนาภิเษก 003 ระหว่างวันที่ 23 ตุลาคม 2566 - 10 พฤศจิกายน 2566 (เว้นวันหยุดราชการ)
โดยสุนัขที่จะเข้ารับการทำหมันต้องงดน้ำและอาหารล่วงหน้า 8-12 ชั่วโมง หากเป็นสุนัขจรจัดไม่สามารถงดน้ำและอาหารได้ให้แจ้งเจ้าหน้าที่ก่อนเข้ารับการทำหมัน
โทรนัดล่วงหน้าก่อน 1 วัน ที่คุณตูน 063-0247813,093-0374419
(ผู้ที่ต้องการทำหมันสุนัขกรุณาติดต่อหน่วยทำหมันล่วงหน้าก่อนการนำสัตว์มาที่หน่วย เนื่องจากมูลนิธิฯ สามารถรับทำหมันได้จำนวนจำกัดและเพื่อตรวจสอบข้อมูลก่อนว่าสุนัขสามารถทำหมันได้หรือไม่ มูลนิธิฯรับทำหมันเฉพาะสุนัขที่อาศัยในเขตที่ตั้งหน่วยทำหมันเท่านั้น)
ตารางทำหมันหน่วยเคลื่อนที่ 21-24 พฤศจิกายน 2566
9 พ.ย. 66 ทำหมันสุนัขและแมว รับจำนวนจำกัด 60 ตัว วัดเสมียนนารี
26 ธค 66 ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ณ สำนักงานสัตวแพทย์
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย มีหน่วยสัตวแพทย์เคลื่อนที่ ทำหมันสุนัขและแมว และ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี‼️ ณ กลุ่มควบคุมและการตรวจเนื้อสัตว์ ซอยโรงกำจัดขยะหนองแขม ถนนพุทธมณฑลสาย 3 แขวงหนองค้างพลู เขตหนองแขม ในวันอังคารที่ 26 ธันวาคม 2566 เวลา 09.00 ถึง 11.00 น. รับจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว ลงทะเบียนจอง
ผ่าน inbox เพจได้เลย กรอกรายละเอียด ดังนี้
1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา)
2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตหนองแขม บางแค ทวีวัฒนา ตลิ่งชัน ภาษีเจริญ เท่านั้น)
3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว)
4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
กลุ่มควบคุมและการตรวจเนื้อสัตว์ สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร โทร 02 409 5986 [
แผนที่]
โครงการทำหมัน เพื่อการเรียนการสอน สัตวแพทย์ ม.ขอนแก่น
โรงพยาบาลสัตว์ คณะสัตวแพทยศาสตร์ มหาวิทยาลัยขอนแก่น จัดโครงการทำหมัน เพื่อการเรียนการสอน ทำหมันสุนัขฟรี หากท่านใดสนใจ ติดต่อคุณวาเพื่อจองคิวได้เลยค่ะ 0872217227
โทรจองในเวลาทำการเท่านั้น เฉพาะวันที่ 9-10 พย. 66 เวลา 9:00-15:00
21 พ.ย. 66 ทำหมันสุนัขและแมว รับจำนวนจำกัด 60 ตัว วัดสารอด เขตราษฎร์บูรณะ
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 21 พฤศจิกายน 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ วัดสารอด เขตราษฎร์บูรณะ
8 ธค 66 ทำหมันหมาแมวฟรี วัดเวฬุวนาราม เขตดอนเมือง
กิจกรรมบริการสุขภาพเคลื่อนที่ "สุขภาพดี ใกล้บ้าน ใกล้หมอ" พบกับกิจกรรมตรวจสุขภาพและอื่น ๆ อีกมากมาย ในวันที่ 8 ธันวาคม 2566 ตั้งแต่เวลา 08.00 - 14.00 น. ณ วัดเวฬุวนาราม เขตดอนเมือง
วันพฤหัสบดีที่ 14 ธค 66 ทำหมันสุนัข 30 ตัว วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตดินแดง ร่วมจัดหน่วยสัตวแพทย์เคลื่อนที่ ผ่าตัดทำหมันสุนัขและแมว และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี ณ วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง ในวันพฤหัสบดีที่ 14 ธันวาคม 2566 เวลา 08.30 ถึง 11.00 น. รับจองทำหมันจำนวนจำกัด 30 ตัว ให้สิทธิ์ท่านละไม่เกิน 2 ตัว ลงทะเบียนจองผ่าน inbox เพจ facebook.com/rabiesbkk กรอกรายละเอียด ดังนี้
1. ชื่อ นามสกุล เจ้าของสัตว์ (คนที่พามา)
2. ที่อยู่ (รับเฉพาะสัตว์ในพื้นที่เขตดินแดง ห้วยขวาง ลาดพร้าว วังทองหลาง บางกะปิ เท่านั้น)
3. จำนวน สุนัข.... ตัว แมว.....ตัว (จองได้คนละไม่เกิน 2 ตัว)
4. เบอร์โทรศัพท์ที่สามารถติดต่อได้
แผนที่การเดินทางมายัง วัดกุนนทีรุทธาราม (วัดห้วยขวาง) เขตดินแดง
17 ธค 66 ทำหมัน 100 ตัว สำนักงานเขตราชเทวี
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 2 มักกะสัน เขตราชเทวี ร่วมกับ สำนักงานเขตราชเทวี ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการ
- ทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว
รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตราชเทวี กรุงเทพมหานคร เท่านั้น
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตราชเทวี เบอร์โทรศัพท์ 02 354 4214
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ ไม่ต้องจองคิวล่วงหน้า
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 17 ธันวาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ ลานจอดรถ สำนักงานเขตราชเทวี เขตราชเทวี (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
12-15 ธันวาคม 66 หน่วยสัตวแพทย์เคลื่อนที่ให้บริการในชุมชน
หน่วยสัตวแพทย์เคลื่อนที่ กรุงเทพมหานคร ออกหน่วยเคลื่อนที่ให้บริการในชุมชน วันที่ 12-15 ธันวาคม 2566 ตามสถานที่และเวลาดังภาพ
19-22 ธันวาคม 66 หน่วยสัตวแพทย์เคลื่อนที่ให้บริการในชุมชน
หน่วยเคลื่อนที่ ทำหมันสุนัขแมว ชุมชนบึงพระรามเก้า 20 ธ.ค.66
#เขตห้วยขวาง เชิญร่วมกิจกรรม…หน่วยแพทย์และสาธารณสุขเคลื่อนที่ วันที่ 20 ธันวาคม 2566 ณ ชุมชนบึงพระราม 9 บ่อ 3 เวลา 08.00-14.00 น. บริการน้องแมว น้องหมา ทำหมัน ฉีดวัคซีนพิษสุนัขบ้า การฉีดไมโครชิพ ร่วมกับ บริการสุขภาพอื่นๆ มากมาย
28 มกราคม 2567 กทม.ทำหมัน 100 ตัว โรงเรียนศรีเอี่ยมอนุสรณ์ เขตบางนา LINK
สำนักอนามัย โดย สำนักงานสัตวแพทย์สาธารณสุข ศูนย์บริการสาธารณสุข 8 บุญรอด รุ่งเรือง เขตบางนา ศูนย์บริการสาธารณสุข 32 มาริษ ตินตมุสิก เขตพระโขนง ร่วมกับ สำนักงานเขตบางนา ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
- ทำหมัน รับจำนวนจำกัด 100 ตัว
- จำกัดคนละไม่เกิน 2 ตัว
- รับทำหมันเฉพาะสุนัขและแมว ที่อาศัยในพื้นที่เขตบางนา กรุงเทพมหานคร เท่านั้น
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว
ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว สามารถโทรศัพท์จองคิวล่วงหน้า ได้ที่ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตบางนา เบอร์โทรศัพท์ 02 1735253 ต่อ 6065-6
- ผู้ที่สนใจนำสัตว์เลี้ยงเข้ารับบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า สามารถ walk in ได้ โดยไม่ต้องจองคิวล่วงหน้า
นำสัตว์เลี้ยงเข้ารับบริการได้ ในวันอาทิตย์ที่ 28 มกราคม 2567 ตั้งแต่เวลา 08.00 - 12.00 น. ณ โรงเรียนศรีเอี่ยมอนุสรณ์ เขตบางนา (ปิดรับลงทะเบียนสำหรับผู้ที่จองคิวทำหมันล่วงหน้า 10.30 น.)
อาทิตย์ที่ 6 ส.ค. 66 คลองสาน ทำหมัน 100 ตัว LINK
ทำหมัน รับจำนวนจำกัด 100 ตัว จำกัดคนละไม่เกิน 2 ตัว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว ไม่จำกัดจำนวนตัว วันอาทิตย์ที่ 6 สิงหาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ สวนป่าเฉลิมพระเกียรติ ใต้สะพานสมเด็จพระเจ้าตากสินมหาราช เขตคลองสาน ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้
4-7 ก.ค. 66 หน่วยสัตวแพทย์เคลื่อนที่ กทม.ออกหน่วยทำหมัน ฉีดวัคซีน ฝังไมโครชิป
ตารางหน่วยเคลื่อนที่ ทุกที่เวลา 9.00-12.00 น.
4 ก.ค. 66 - วัดไผ่ตัน (ลงทะเบียนหน้างาน) และ วัดสุทธิสะอาด คลองสามวา
5 ก.ค. 66 - หมู่บ้านศรีนครพัฒนา บึงกุ่ม
6 ก.ค. 66 - ชุมชนปรีชา 1 ยานนาวา และ ชุมชนพัฒนาริมคลองบ้านป่า สวนหลวง
7 ก.ค. 66 - ชุมชนพัชราภา หลักสี่
คลินิกสัตวแพทย์ศูนย์บริการสาธารณสุข 33 วัดหงส์รัตนาราม รับจองคิว "ทำหมันสุนัขและแมว" ตั้งแต่วันที่ 3 กรกฎาคม 2566 เป็นต้นไป
คลินิกสัตวแพทย์ศูนย์บริการสาธารณสุข 33 วัดหงส์รัตนาราม จะเปิดรับจองคิว "ทำหมันสุนัขและแมว" ตั้งแต่วันที่ 3 กรกฎาคม 2566 เป็นต้นไป ผู้ที่มาจองคิวทำหมันต้องนำบัตรประชาชนมาด้วย โดยให้สิทธิจองคนละ 2 ตัวและไม่ต้องนำสัตว์เลี้ยงมาในวันดังกล่าว จึงขอเรียนเชิญประชาชนที่สนใจเข้ามาจองคิวได้ตั้งแต่วัน ดังกล่าวในเวลา 9.00 - 12.00 น. ทุกวันทำการ ยกเว้น วันเสาร์ - อาทิตย์และวันหยุดนักขัตฤกษ์
ทำหมันสุนัขแมว ฟรี โดยนักศึกษาสัตวแพทย์ ที่โรงพยาบาลเพื่อการสอนด้านสัตว์เล็ก (ตึกใน) คณะสัตวแพทยศาสตร์ ม.เทคโนโลยีมหานคร
ทำหมันสุนัขแมว ฟรี โดยนักศึกษาสัตวแพทย์ มีอาจารย์ควบคุมทุกขบวนการ
• เจ้าของนำสัตว์เลี้ยงมาส่งที่โรงพยาบาลเพื่อการสอนด้านสัตว์เล็ก (ตึกใน) คณะสัตวแพทยศาสตร์ ม.เทคโนโลยีมหานคร
• ฟรี ค่าตรวจสุขภาพ ตรวจเลือด และค่ายา
• มีค่าลำโพงกันเลียในกรณีเจ้าของไม่มี
สอบถามโทร. ตามเบอร์ในภาพ หรือสแกน ID Line
ทำหมันกับซอยด็อก วัดหิรัญรูจี เขตธนบุรี สอบถามโทร 089-0557702
กรกฎาคม 66 คลินิกทำหมันสัตว์เลี้ยง กลุ่มควบคุมโรคพิษสุนัขบ้า (ดินแดง) เปิดจองคิวทำหมัน LINK
คลินิกทำหมันสัตว์เลี้ยง กลุ่มควบคุมโรคพิษสุนัขบ้า (ดินแดง) เปิดให้ทำการนัดหมายทำหมันสัตว์เลี้ยงของท่าน ในช่วงเดือนกรกฎาคม 2566 แล้ว
เรียนเชิญท่านที่สนใจ ใช้บริการได้ที่
rabiesbkk เงื่อนไขการนัดหมาย
• สัตว์เลี้ยงที่จะเข้ารับบริการทำหมัน ต้องมีสุขภาพแข็งแรง
• ไม่อยู่ในระหว่างการตั้งครรภ์
• ต้องสามารถแสดงบัตรประชาชนตัวจริงที่เลขที่บัตรตรงกับที่ลงทะเบียนไว้ (อาศัยอยู่ในกรุงเทพมหานคร) ในวันที่เข้ารับบริการ
• 1คน สามารถนัดได้ไม่เกิน3ตัว ในทุกช่องทาง เมื่อใช้บริการแล้วจึงสามารถนัดเพิ่มได้
• ยอดการรับทางonline ไม่เกิน20ตัว/วัน
มิย-กค เขตสัมพันธวงศ์ เปิดลงชื่อจองคิวทำหมันสุนัข
เขตสัมพันธวงศ์ ขอเชิญชวนประชาชนที่สนใจ แจ้งความประสงค์ทำหมันสุนัขและแมวในพื้นที่เขตสัมพันธวงศ์ ระหว่างวันที่ 19 มิถุนายน - 19 กรกฎาคม 2566 ทั้งนี้ การกำหนดวันเวลาและสถานที่จะแจ้งให้ทราบภายหลัง
++ ปริมณฑล ++
Seoul Thai Festival Online 2022 : Healthy Thai | April 23-24, 2022
The Royal Thai Embassy in Seoul proudly presents Seoul Thai Festival Online 2022. Together with the ASEAN-Korea Centre, the Royal Thai Embassy in Seoul wishes to invite all Thai and Korean friends to watch our video streaming from 23 and 24 April 2022 at Facebook: RoyalThaiEmbassySeoul
The Thai Festival is an annual event organised by the Embassy since 2015 to create awareness and strengthen friendly relationship between Thailand and the Republic of Korea, especially people to people relations. It also aims to as well as to promote tourism in Thailand and Thai products, including Thai Food. In early 2019, the event took place at Cheonggye Plaza with more than 45,000 participants. However, since the COVID-19 outbreak in 2020 - 2021, the Embassy organized the 6th Seoul Thai Festival as a Virtual Online, under the theme “Imagine Thailand” which received around 2 million views within a month.
Despite Thailand and the Republic of Korea are making good progresses in containing the spread of the COVID-19, as seen in the reduction of number of infections and the relaxing of the social distance measure, both countries remain cautious. As the result, the Embassy decides to organize the Second Seoul Thai Festival under the theme “Healthy Thai” online. The festival this year will promote good health in Thai style in relation to Thai culture, healthy food, self health monitoring, Muay Thai for exercises and green tourism.
The Embassy has chosen Hanuman and Macchanu, characters from Thai Epic Ramakian as MCs of the festival to represent energy, power, activeness and happiness. The festival includes 7 programs as follows:
1.Muay Thai for Fitness
2. Thai Healthy Food
3. Golf Pro tips
4. Meet the Doctors by Ramathibodi Hospital
5. Green Tourism Talk
6. Kakao Webtoon Thailand
7. Music for the Soul
For more information, contact Royal Thai Embassy, Seoul
42 Daesagwan-ro, Hannam-dong, Yongsan-gu, Seoul
Tel. 02-790-2955, 02-795-0095, 02-795-3098, 02-795-3253
[
source]
เทศบาลนครรังสิต ให้บริการทำหมันสุนัข ฟรี ตั้งแต่วันที่ 6 ก.พ.66 เป็นต้นไป (วันจันทร์-วันศุกร์) LINK
ข่าวดีสำหรับผู้เลี้ยงสุนัขชาวพื้นที่เทศบาลนครรังสิต เทศบาลนครรังสิต ร่วมกับ มูลนิธิเพื่อสุนัขในซอย (Soi Dog) ให้บริการทำหมันสุนัข ฟรี ตั้งแต่วันที่ 6 กุมภาพันธ์ 2566 เป็นต้นไป (วันจันทร์-วันศุกร์) เวลา 08.00 - 17.00 น. สถานที่ โดมอเนกประสงค์ ซอยรังสิต-นครนายก 30 (ซอยโรงสี) ** รับเฉพาะในพื้นที่เทศบาลนครรังสิตเท่านั้น **
Walk in ลงทะเบียน ณ สถานที่ให้บริการเท่านั้น (ไม่มีการลงทะเบียน Online) รับ 44 คิว/วัน เปิดรับบัตรคิว เวลา 07.30 น. ปิดรับบัตรคิว เวลา 11.00 น. ** ก่อนรับบริการทำหมัน สุนัขต้องงดน้ำและอาหาร อย่างน้อย 6 ชั่วโมง
• ทำหมันสุนัข มีเจ้าของ และ ไม่มีเจ้าของ
• สุนัขที่ทำหมันต้องมีอายุ 3 เดือน ขึ้นไป
บริการ
- ทำหมันสุนัข ฟรี *เฉพาะทำหมันสุนัขเท่านั้น ไม่รับทำหมันแมว
- ฉีดวัคซีนรวม 5 โรค
- วัคซีนป้องกันโรคพิษสุนัขบ้า
- ยากำจัดเห็บ / หมัด
สอบถามเพิ่มเติมได้ที่
มูลนิธิเพื่อสุนัขในซอย (Soi Dog)
โทร. 093-6432676 คุณเพชร
โทร. 093-6384005 คุณอาท หรือ
กองสาธารณสุขและสิ่งแวดล้อม เทศบาลนครรังสิต
โทร. 025670941 (ในวันและเวลาราชการ)
22 มิถุนายน 66 เทศบาลบางกรวย ทำหมันสุนัขแมว ณ วัดเชิงกระบือ
เทศบาลบางกรวย ร่วมกับปศุสัตว์จังหวัดนนทบุรี บริการทำหมันสุนัขแมว ณ วัดเชิงกระบือ บริเวณศาลาการเปรียญ วันพฤหัสบดีที่ 22 มิถุนายน 2566 เวลา 8.30-12.00 น. จำกัดจำนวนไม่เกิน 60 ตัว สอบถามโทร. 02-4467103 นำบัตรประชาชนมาด้วยนะคะ
26 พ.ค.66 โครงการคลินิกเกษตรเคลื่อนที่ฯ สมุทรปราการ
โครงการคลินิกเกษตรเคลื่อนที่ฯ วันที่ 26 พฤษพาคม 2566 08.30-11.00 น. ณ สำนักงานเทศบาลเมืองแพรกษา
บริการทำหมันและฉีดวัคซีนป้องกันดรคพิษสุนัขบ้า ฟรี
บริการทำหมันสุนัข 6 เดือนขึ้นไป ยกเว้นหน้าสั้น/พันธุ์เล็ก
บริการทำหมันแมวเพศเมีย 5 เดือนขึ้นไป เพศผู้ 7 เดือน ขึ้นไป
* งดน้ำงดอาหาร 12 ชั่วโมง ลงมะเบียนรับบัตรคิวที่หน้างานตั้งแต่เวลา
18 และ 23-25 ส.ค.66@เทศบาลเมืองอ่างศิลา ออกหน่วยเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า LINK
งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองอ่างศิลา ออกหน่วยบริการเคลื่อนที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยใช้สถานที่ภายในวัดเสม็ด เพื่อบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมวของประชาชนในเขตเทศบาลเมืองอ่างศิลา โดยไม่เสียค่าใช้จ่าย ตามโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า ประจำปี 2566 (รุ่นที่ 2)
สำหรับโครงการในครั้งนี้ มีกำหนดออกหน่วยบริการ อีก 4 ครั้ง ดังนี้
- วันที่ 18 ส.ค. 2566 เวลา 09.00 น. – 11.30 น. ณ วัดเตาปูน
- วันที่ 23 ส.ค. 2566 เวลา 09.00 น. – 11.30 น. ณ ศูนย์สาธารณสุขมูลฐาน ม. 4 ต.ห้วยกะปิ
- วันที่ 24 ส.ค. 2566 เวลา 09.00 น. – 11.30 น. ณ ศาลาพระพรหม ม. 5 ต.ห้วยกะปิ
- วันที่ 25 ส.ค. 2566 เวลา 09.00 น. – 11.30 น. ณ วัดอ่างศิลา
สอบถามข้อมูลเพิ่มเติมได้ที่ กองสาธารณสุขและสิ่งแวดล้อม 038 142 100 ถึง 104 ต่อ 111 (ในวันและเวลาราชการ)
ปศุสัตว์อำเภอเมืองสมุทรปราการ ทำหมันหมาแมวฟรี ตลอดเดือนกันยายน 66
สำนักงานปศุสัตว์อำเภอเมืองสมุทรปราการ บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ผ่าตัดทำหมันสุนัขแมว ทุกวันศุกร์ ตลอดเดือนกันยายน 2566 (รับจำนวนจำกัด) รับบัตรคิวได้ในวันพฤหัสบดีที่ 7,14,21,28 กันยายน ณ สำนักงานปศุสัตว์อำเภอเมืองสมุทรปราการ สอบถามโทรศัพท์: 023847530
เทศบาลเมืองปู่เจ้าสมิงพราย ให้บริการทำหมันและฉีดวัคซีนสุนัขแมว 25 กค และ 31 สค 2566 LINK
งานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม เทศบาลเมืองปู่เจ้าสมิงพราย ร่วมกับปศุสัตว์จังหวัดสมุทรปราการ ให้บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าแก่สุนัขและแมวในเขตเทศบาลฯ โดยไม่เสียค่าใช้จ่ายใด ๆ ทั้งสิ้น ในวัน เวลา และสถานที่ดังนี้
วันอังคารที่ 25 กรกฎาคม 2566 เวลา 09.00-12.00น. จุดบริการ วัดบางหญ้าแพรก
วันพฤหัสบดีที่ 31 สิงหาคม 2566 เวลา 09.00-12.00น. จุดบริการ อาคารเอนกประสงค์ 2
เทศบาลเมืองปู่เจ้าสมิงพราย
สำนักสาธารณสุขและสิ่งแวดล้อม โทรศัพท์ : 0-23639800 ต่อ 871
ศูนย์บริการสาธารณสุขฯ โทรศัพท์ : 0-21707990
กค.-ส.ค.66 เทศบาลเมืองลัดหลวง บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมว
เทศบาลเมืองลัดหลวง กำหนดแผนการลงพื้นที่ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัขและแมวของประชาชนในเขตพื้นที่เทศบาลเมืองลัดหลวง ช่วงเดือนกรกฏาคม - สิงหาคม 2566 ตามวันที่และสถานที่ในตาราง เอกสารการลงทะเบียนเพื่อรับบริการ : ผู้ที่นำสุนัขและแมวมาฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า เตรียมบัตรประจำตัวประชาชนที่ระบุว่าอยู่ในเขตพื้นที่ (ต.บางจาก, ต.บางครุ และ ต.บางพึ่ง) มาแสดง
หมายเหตุ : งดอาบน้ำให้สุนัขหรือแมว 7 วันหลังจากฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า
12 ก.ย.66 เทศบาลนครรังสิต ทำหมันฟรี LINK
เนื่องด้วยในวันที่ 28 กันยายน เป็นวันป้องกันโรคพิษสุนัขบ้าโลก (World Rabies Day) เทศบาลนครรังสิต โดยร้อยตำรวจเอก ดร.ตรีลุพธ์ ธูปกระจ่าง นายกเทศมนตรีนครรังสิต ร่วมกับ สำนักงานปศุสัตว์จังหวัดปทุมธานี โดยนายณกรณ์ ปทุมราช ปศุสัตว์จังหวัดปทุมธานี ได้จัดกิจกรรม ในวันอังคารที่ 12 กันยายน 2566 ณ บริเวณลานอเนกประสงค์สวนสุขภาพเฉลิมพระเกียรติ 1 ซอยรังสิต - ปทุมธานี 14 ซอย 11 หมู่บ้านรัตนโกสินทร์ 200 โดยในงานมีการให้มีบริการ ดังนี้
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สุนัข - แมว ฟรี‼️ เวลา 09.00 - 15.30 น.
• ทำหมันควบคุมประชากรสุนัข - แมว ฟรี‼️เวลา 09.00 - 12.00 น. จำนวน 80 ตัว ( แมว 60 ตัว /สุนัข 20 ตัว)
สำหรับผู้ที่ได้ลงทะเบียนจองคิวล่วงหน้าทำหมันสุนัข - แมว ไว้นั้น ต้องให้สุนัข - แมว ของท่านงดอาหารและน้ำ หลัง 2 ทุ่มก่อนวันทำหมัน
หมายเหตุ : ทำหมัน สุนัข - แมว คิวเต็ม ปิดรับลงทะเบียนแล้ว เนื่องจากเทศบาลนครรังสิต ได้ดำเนินการประชาสัมพันธ์ลงทะเบียนล่วงหน้าตั้งแต่วันที่ 25 สิงหาคม 2566 ได้มีประชาชนในพื้นที่สนใจลงทะเบียนจองคิวล่วงหน้า และได้ปิดรับลงทะเบียนวันที่ 3 กันยายน 2566
เทศบาลเมืองแพรกษา ทำหมันสุนัขและแมว ฟรี 26 พฤษภาคม 2566 LINK
เทศบาลเมืองแพรกษา ขอเชิญประชาชนตำบลแพรกษา และประชาชนจังหวัดสมุทรปราการที่สนใจ นำสุนัขและแมวมารับบริการตรวจสุขภาพ ฉีดวัคซีนฯ ทำหมันฟรี ในโครงการคลินิกเกษตรเคลื่อนที่ในพระราชานุเคราะห์ ฯ วันที่ 26 พฤษภาคม 2566 ณ เทศบาลเมืองแพรกษา ปิดรับคิว 11.00 น. ติดต่อสอบถามโทร 02-1369610 085-8423297 กองสธ.ทม.แพรกษา
11-26 กันยายน 2566 เทศบาลเมืองปากน้ำสมุทรปราการ ร่วมกับซอยด๊อก ทำหมันสุนัขฟรี
เทศบาลเมืองปากน้ำสมุทรปราการ ร่วมกับมูลนิธิเพื่อสุนัขในซอย (Soi Dog) จัดกิจกรรมทำหมันให้กับสุนัข ฟรี !! วันที่ 11-26 กันยายน 2566 ลงทะเบียนได้ 2 วิธี
1. ด้วยตนเองที่ สนง.ทบ.เมืองปากน้ำสมุทรปราการ ช่วง 7-25 ก.ย.66 9.00-15.00 น. วันเวลาราชการ
2. สแกน QR code ลงทะเบียนออนไลน์
สอบถามโทร. 082-2637440 061-5163903
11 ธ.ค. 66 - 22 ธ.ค. 66 ทำหมันฟรี บริเวณอาคารด้านหลัง อบต.บางพลีใหญ่
องค์การบริหารส่วนตำบลบางพลีใหญ่ ประชาสัมพันธ์ มูลนิธิเพื่อสุนัขในซอย, ประเทศไทย (Soi Dog - in Thai) เรียนเชิญทุกท่านนำสุนัขทั้งในและนอกบริเวณบ้านเข้ารับบริการ ทำหมันฟรี ‼️
ระหว่างวันที่ 11 ธ.ค. 66 - 22 ธ.ค. 66 เวลา 09.00 - 15.00 น.บริเวณอาคารด้านหลัง อบต.บางพลีใหญ่ สอบถามข้อมูลเพิ่มเติม 061-516-3903 คุณหมู
*หมายเหตุ หยุดวันเสาร์และวันอาทิตย์
Thai Festival in Beijing 2022 | March 19-20, 2022
The Royal Thai Embassy in Beijing invites all friends to join the 2022 Thai Festival in Beijing, the largest Thai cultural event in Beijing of the year under the theme of "ANCIENT SIAM" that will take you all. Relive the charm of the sweet days of Thailand. through tasting delicious Thai food shopping for good quality products and join in many fun games at the Ambassador’s House in Beijing from 19 to 20 March 2022, 3 rounds a day from 10.00 - 17.00
This year’s Thai festival is open for free admission! free of charge Open for reservations for tickets to the event today!
You can register via QR Code on the poster. The Thai Festival is the largest gathering of Thai restaurants around Beijing. There are many Thai dishes to choose from, more than 30 menus that everyone can buy and taste at an affordable price. You can also choose to buy Thai products and services from entrepreneurs. Including merchandise booths and more than 40 restaurants, as well as enjoying live music performances. Thai boxing demonstration solo xylophone and Thai dance performances There is also a recipe for Pad Thai through 3D technology that you can take at home as well.
You can also enjoy playing Thai games. Making a replica of a Krathong Dress up in Thai costumes, take fake photos in different angles and win many prizes. [
source]
++ ต่างจังหวัด ++
20 มิ.ย.66 เทศบาลนครนครปฐม จัดทำหมันหมาแมว ฟรี 100 ตัว @วัดเสนหา LINK
เทศบาลนครนครปฐม ร่วมกับ ปศุสัตว์จังหวัดนครปฐม และ ปศุสัตว์อำเภอเมืองนครปฐม จัดทำโครงการ ทําหมันสุนัขและแมวฟรี จำนวน 100 ตัว และให้บริการ #ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยง (ไม่จำกัดจำนวน) ในวันอังคารที่ 20 มิถุนายน 2566 เวลา 09.00 - 12.00 น. ณ ศาลาเทพเจติยาจารย์ วัดเสนหา พระอารามหลวง เปิดให้ลงทะเบียนจองรับบริการทำหมัน ในวันที่ 8 – 16 มิถุนายน 2566 เวลา 09.00 - 15.00 น. (เว้นวันหยุดราชการ) เบอร์โทรศัพท์ 034-242199 และ 034-966440 ถึง 4 ต่อ 21
ธันวาคม 66 ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน ฟรี
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ขอเชิญชาวเขตเทศบาลนครระยอง ชุมชนทุ่งโตนด นำสุนัขและแมวของท่านเข้ารับบริการวัคซีนป้องกันโรคพิษสุนัขบ้าตามบ้าน (รอบที่1) ประจำปีงบประมาณ 2567 ในโครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้าฯ โดยงานสัตวแพทย์ สำนักสาธารณสุขและสิ่งแวดล้อม บริการตามแต่ละชุมชนเวลา 13.30 - 16.00 น.
เงื่อนไขการเข้ารับบริการ
1. เตรียมบัตรประชาชน และต้องอาศัยอยู่ในเขตเทศบาลนครระยอง
2. สุนัขและแมวต้องมีอายุ 3 เดือนขึ้นไป และมีสุขภาพดี
3. สุนัขและแมวไม่อยู่ในช่วงตั้งท้อง และให้นมลูก
ยินดีต้อนรับผู้อนุเคราะห์รับสุนัขไปดูแลต่อ/บริจาคอาหารหรือของใช้สุนัข
สามารถติดต่อได้ในวันและเวลาราชการ
จ.-ศ. เวลา 9.00 - 12.00 และ 13.00 - 16.00 น.
เบอร์ติดต่อ 038-612305
มกราคม 2566 ราชบุรี : หน่วยสัตวแพทย์เคลื่อนที่ผ่าตัดทำหมันหมาแมว LINK
สำนักงานปศุสัตว์จังหวัดราชบุรี ออกหน่วยสัตวแพทย์เคลื่อนที่ เดือนมกราคม 2566 ตามภาพ
สอบถามโทร. 032-315301 เปิดรับลงทะเบียนหน้างานเท่านั้น ไม่รับจองคิว ตั้งแต่เวลา 08.30-10.00 น. จำนวน 50 ตัวเท่านั้น!!! (เจ้าของ 1 บ้าน/1 ทะเบียนบ้าน/1 สิทธิ์ โดย 1 สิทธิ์สามารถทำได้ 2 ตัว) สุนัขและแมวที่จะนำมาเข้ารับบริการผ่าตัดทำหมัน จะต้องอดอาหารและน้ำ 8-12 ชั่วโมง ก่อนการวางยาสลบ เพื่อความปลอดภัยของสัตว์ รับสุนัขและแมวอายุ 6 เดือนขึ้นไป สัตว์ต้องมีสุขภาพร่างกายแข็งแรง ไม่มีอาการป่วย ไม่อยู่ในระหว่างตั้งท้อง ไม่เป็นสัด และให้นมลูก ทั้งนี้การประเมินขึ้นอยู่กับดุลยพินิจของสัตวแพทย์
ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า เมืองพัทยา LINK
เมืองพัทยาใส่ใจคนมีสัตว์เลี้ยง มีบริการทำหมัน ฉีดยาคุมกำเนิด ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฉีดยาเห็บ-หมัด ฟรีโดยไม่เสียค่าใช้จ่ายใดๆ ให้กับประชาชนที่อยู่ในเขตพัทยา สอบถามเพิ่มเติมได้ที่ ฝ่ายสัตวแพทย์ โรงพยาบาลเมืองพัทยา หมายเลขโทรศัพท์ 038-111826 หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
22 มี.ค.66 พัทยาจัดทำหมันหมาแมว ฟรี ณ วัดโพธิสัมพันธ์
22 มีนาคม นี้ เชิญผู้ที่สนใจนำสัตว์เลี้ยง เข้ารับบริการ ทำหมัน ฉีดยาคุมกำเนิด ฉีดวัดซีน ป้องกันโรคพิษสุนัขบ้า ฟรี ณ วัดโพธิสัมพันธ์ ตั้งแต่เวลา 09.00 น. - 12.00 น. สอบถามเพิ่มเติมได้ที่ ฝ่ายสัตวแพทย์ โรงพยาบาลเมืองพัทยา หมายเลขโทรศัพท์ 0 3811 1826 หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมงเมษายน 2566 ปศุสัตว์จังหวัดชลบุรี บริการทำหมันและฉีดวัคซีน LINK
มาแล้วจ้า!!! ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน เมษายน 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น. รายละเอียด/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปใช้บริการ(ตามตาราง)*เท่านั้น* พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่ก่อนได้จ้า
4-5 เมษายน เทศบาลตำบลจอมเทียน อ.สัตหีบ
10 เมษายน เทศบาลบ่อทอง อ.บ่อทอง
11-12 เมษายน อบต.สระสี่เหลี่ยม อ.พนัสนิคม
18 เมษายน อบต.วัดสุวรรณ อ.บ่อทอง
19 เมษายน วัดหุบบอน อ.ศรีราชา (เทศบาลนครเจ้าพระยาสุรศักดิ์)
20 เมษายน เทศบาลเมืองสัตหีบ อ.สัตหีบ
24-25 เมษายน อบต.พลูตาหลวง อ.สัตหีบ
27 เมษายน ศาลเจ้าเียเทียนซือ อ.เมือง ชลบุรี (เทศบาลเมืองบ้านสวน)
27 เมษายน เทศบาลตำบลตะเคียนเตี้ย อ.บางละมุง
3 เม.ย.66 เทศบาลเมืองบ้านบึง บริการทำหมันสุนัขและแมว ฟรี LINK
เทศบาลเมืองบ้านบึง ขอเชิญเจ้าของนำสัตว์เลี้ยงเข้ารับบริการทำหมันสุนัขและแมว ฟรี!!! วันจันทร์ที่ 3 เมษายน 2566 เวลา 08.00 - 12.00 น. ณ โรงเรียนอนุบาลบ้านบึง(อำนาจคณูปถัมภ์) ***สำหรับประชาชนในเขตเทศบาลเมืองบ้านบึง สามารถมาลงทะเบียนได้ที่กองสาธารณสุขฯ เทศบาลเมืองบ้านบึง ก่อนวันจันทร์ที่ 3 เมษายน 2566 หรือลงทะเบียนได้ที่หน้างาน*** ***สำหรับท่านที่อยู่นอกเขตเทศบาลเมืองบ้านบึง สามารถลงทะเบียนได้ที่หน้างาน*** สอบถามข้อมูลเพิ่มเติม กองสาธารณสุขฯ ทม.บ้านบึง โทร. 038-443999 ต่อ 142
3,8,10,11 พ.ค.66 พัทยา ให้บริการทำหมันหมาแมว LINK
เมืองพัทยาประกาศเชิญชวนชาวพัทยา นำสัตว์เลี้ยงเข้ารับบริการทำหมัน ฉีดวัคซีน ป้องกันโรคพิษสุนัขบ้า ฟรี 4 วัน ในเดือนพฤษภาคม 2566 ตั้งแต่เวลา 09.00 น. - 12.00 น. เมืองพัทยาขอเชิญประชาชนที่อยู่ในเขตพัทยา นำสัตว์เลี้ยงของท่านมารับบริการ ตามวันและสถานที่ ดังนี้
วันที่ 3 พฤษภาคม 2566 ณ วัดกระทิงราย
วันที่ 8 พฤษภาคม 2566 ณ วัดจิตตภาวัน
วันที่ 10 พฤษภาคม 2566 ณ เกาะล้าน
วันที่ 11 พฤษภาคม 2566 ณ วัดจิตตภาวัน
สอบถามเพิ่มเติมได้ที่ ฝ่ายสัตวแพทย์ โรงพยาบาลเมืองพัทยา หมายเลขโทรศัพท์ 0 3811 1826 หรือ Pattaya Contact Center 1337 ตลอด 24 ชั่วโมง
18 พ.ค.66 อบต.นครชัยศรี ทำหมันหมาแมว 50 ตัว ฟรี LINK
องค์การบริหารส่วนตำบลนครชัยศรี ร่วมกับสำนักงานปศุสัตว์อำเภอนครชัยศรี ให้บริการทำหมันสุนัขและแมว จำนวนจำกัด 50 ตัว ในวันพฤหัสบดีที่ 18 พฤษภาคม 2566 เวลา 9-11 น. ณ ที่ทำการอบต.นครชัยศรี สุนัขและแมวที่จะเข้ารับการผ่าตัดทำหมัน ต้องงดน้ำและงดอาหาร ล่วงหน้าอย่างน้อย 10-12 ชั่วโมง ผู้สนใจลงทะเบียนได้ถึง 12 พฤษภาคม 66 สอบถามโทร. อบต.นครชัยศรี 034-331673 ต่อ 104
18 และ 25 มิย 66 มูลนิธิฯ แฮนด์ทูพอว์ เชียงใหม่ ผ่าตัดทำหมันสุนัขเพศเมีย ฟรี LINK
ฟรี ผ่าตัดทำหมันสุนัขเพศเมีย ในพื้นที่ แม่ริม สันทราย ดอยสะเก็ด เท่านั้น
วันอาทิตย์ ที่ 18 มิ.ย.2566 สถานที่ : เทศบาลเมืองแม่โจ้ อำเภอสันทราย
พิกัด โทร. 053 498 621
วันอาทิตย์ ที่ 25 มิ.ย.2566 สถานที่ : เทศบาลตำบลแม่คือ อำเภอดอยสะเก็ด
พิกัด
ลงทะเบียน ได้ 2 ทาง
1. มูลนิธิฯ เบอร์ 0806731770
2. งานสาธารณะสุข เทศบาลสถานที่จัด
วันผ่าตัดทำหมัน รับบัตรคิว เวลา 08.30 - 11.00 น. เท่านั้น หลังจากนี้ไม่รับนะคะ
งดอาหารน้ำข้าวทุกชนิด หลังเที่ยงคืนก่อนวันผ่าตัดทำหมันนะคะ
***********
ผ่าตัดทำหมันสุนัขเดือนพฤษภาคม 2566
อาทิตย์ ที่ 21 พฤษภาคม 2566 เทศบาลตำบลสันทรายหลวง อ.สันทราย
อาทิตย์ 28 พฤษภาคม 2566 เทศบาลตำบลขี้เหล็ก อ.แม่ริม
29 มิ.ย.66 เทศบาลนครยะลา จัดทำหมันสุนัขแมว ปี 2566 รอบที่ 2 LINK
เทศบาลนครยะลาจัดทำโครงการ “ทำหมันสุนัขในเขตเทศบาลนครยะลา” ออกให้บริการทำหมันสุนัขและสัตว์เลี้ยงในเขตพื้นที่เทศบาลนครยะลา โดยไม่มีค่าใช้จ่าย เพื่อช่วยแก้ปัญหาสุนัขจรจัด โดยเชิญชวนประชาชนชาวยะลานำสัตว์เลี้ยงสุนัขและแมวมาทำหมัน โดยปี 2566 มีกำหนดการให้บริการ 3 ครั้งในเดือนเมษายน มิถุนายน และกันยายน รอบที่ 2 วันที่ 29 มิถุนายน 2566 นี้
กรกฎาคม-กันยายน 66 ทำหมันแมวสัญจร มูลนิธิรักษ์แมว ทั่วประเทศ (ไม่ฟรี) LINK
มูลนิธิรักษ์แมว ปันน้ำใจให้แมวจร มีกำหนดการทำหมันแมวสัญจรทั่วประเทศ หลายจังหวัดตลอดปี 2566 ท่านที่สนใจพาแมวไปทำหมันได้เลย ใกล้ที่ไหนไปรับบริการได้ที่นั่น ทางมูลนิธิรักษ์แมวคิดค่าบริการ เพื่อสมทบทุนเป็นค่า ยา เวชภัณฑ์ และอุปกรณ์
ดูตารางสัญจรได้ตามลิงค์ หรือ
ติดตามผ่านเพจมูลนิธิ ก็ได้เช่นกัน ตารางสัญจร ด้านล่างนี้
ร่วมบริจาค
• แมวจร- ร่วมบริจาคให้กับมูลนิธิรักษ์แมวตัวละ 100 บาท
• แมวมีเจ้าของ- ร่วมบริจาคให้กับมูลนิธิรักษ์แมวตัวละ 300 บาท
ลงทะเบียนได้ตามลิงค์นี้
วันเสาร์ที่ 1 กรกฎาคม 2566 เวลา 10.00-12.00 น. Central WestGateวันเสาร์ที่ 1 กรกฎาคม 2566 เวลา 13.00-15.00 น. Central WestGateวันอาทิตย์ที่ 2 กรกฎาคม 2566 เวลา 10.00-12.00 น. Central WestGateวันอาทิตย์ที่ 2 กรกฎาคม 2566 เวลา 13.00-15.00 น. Central WestGateวันเสาร์ที่ 15 กรกฎาคม 2566 เวลา 13.00-15.00 น. วัด ณ จ.สระบุรีวันอาทิตย์ที่ 16 กรกฎาคม 2566 เวลา 13.00-15.00 น. วัด ณ จ.นครนายกวันศุกร์ที่ 28 กรกฎาคม 2566 เวลา 13.00-15.00 น. วัด ณ สมอโคน จ.ตากวันเสาร์ที่ 29 กรกฎาคม 2566 เวลา 13.00-15.00 น. วัด ณ สมอโคน จ.ตากวันอาทิตย์ที่ 30 กรกฎาคม 2566 เวลา 13.00-15.00 น. วัด ณ สมอโคน จ.ตากวันเสาร์ที่ 5 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ อ.เมือง จ.อยุธยาวันอาทิตย์ที่ 6 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ ต.เขาพระ อ.เดิมบางนางบวช จ.สุพรรณบุรี- วันเสาร์ที่ 19 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ ต.โคกขาม อ.เมือง จ. สมุทรสาคร
- วันอาทิตย์ที่ 20 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ อ.ชะอำ อ.เพชรบุรี
- วันเสาร์ที่ 26 สิงหาคม 2566 เวลา 13.00-15.00 น. โรงเรียน ณ ลำตะคอง อ.ปากช่อง จ.นครราชสีมา
- วันอาทิตย์ที่ 27 สิงหาคม 2566 เวลา 13.00-15.00 น. วัด ณ ต.มวกเหล็ก อ.มวกเหล็ก จ.สระบุรี
- วันเสาร์ที่ 9 กันยายน 2566 เวลา 13.00-15.00 น. วัด ณ อ่อนนุช กทม.
- วันอาทิตย์ที่ 10 กันยายน 2566 เวลา 13.00-15.00 น. ณ ต.วังเย็น อ.แปลงยาว จ.ฉะเชิงเทรา
ให้สิทธิ์เฉพาะ ผู้ที่ลงทะเบียน เท่านั้น ไม่รับ walk in ทุกกรณีค่ะ ( รับลงทะเบียนจำนวนจำกัด)
ลงทะเบียนได้ตามลิงค์นี้ 20 มิ.ย.66 เทศบาลนครนครปฐม จัดทำหมันหมาแมว ฟรี 100 ตัว @วัดเสนหา LINK
เทศบาลนครนครปฐม ร่วมกับ ปศุสัตว์จังหวัดนครปฐม และ ปศุสัตว์อำเภอเมืองนครปฐม จัดทำโครงการ ทําหมันสุนัขและแมวฟรี จำนวน 100 ตัว และให้บริการ #ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยง (ไม่จำกัดจำนวน) ในวันอังคารที่ 20 มิถุนายน 2566 เวลา 09.00 - 12.00 น. ณ ศาลาเทพเจติยาจารย์ วัดเสนหา พระอารามหลวง
3,6,13,-14,19-21 ก.ค. 66 ปศุสัตว์ชลบุรี ทำหมันฉีดวัคซีน
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน กรกฎาคม 2566 ทุกจุด เวลาออกหน่วยบริการ 8.30 - 11.00 น.
- 3 ก.ค. ซอยไก่ต๊อก เทศบาลต.หนองไม้แดง อ.เมืองชลบุรี
- 6 ก.ค. ตลาดนัดซอย 9 เทศบาลเมืองบ้านสวน อ.เมืองชลบุรี
- 13 ก.ค. ที่ทำการชุมชนบ้านห้วยทวน เทศบาลบ้านสวน
- 14 ก.ค. วัดหนองขาม เทศบาลเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
- 19 ก.ค. หมู่บ้านภูสิริ เทศบาลหนองไม้แดง อ.เมืองชลบุรี
- 20 ก.ค. โดมเทศบาลบ้านสวน เทศบาลเมืองบ้านสวน อ.เมืองชลบุรี
- 21 ก.ค. ซอยสมานดำริ เทศบาลหนองไม้แดง อ.เมืองชลบุรี
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
9 ก.ค.66 ทำหมันหมาแมว ณ วัดลาดกระบัง (วัดสาม) ซอยร่มเกล้า 27 LINK
สำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย ร่วมกับ ฝ่ายสิ่งแวดล้อมและสุขาภิบาล สำนักงานเขตลาดกระบัง ศูนย์บริการสาธารณสุข 46 กันตารัติอุทิศ และ ศูนย์บริการสาธารณสุข 45 ร่มเกล้า ขอเชิญชวนประชาชน นำสุนัขและแมวเข้ารับบริการทำหมัน และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี! ดำเนินการโดยสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร
• ทำหมัน รับจำนวนจำกัด 100 ตัว
• ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า 300 ตัว
ผู้ที่สนใจสามารถนำสัตว์เลี้ยง Walk in เข้ารับบริการได้ ในวันอาทิตย์ที่ 9 กรกฎาคม 2566 ตั้งแต่เวลา 08.00 - 12.00 น. ณ วัดลาดกระบัง (วัดสาม) ซอยร่มเกล้า 27 เขตลาดกระบัง
สัตว์เลี้ยงที่นำมารับบริการทำหมัน
1. ต้องมีสุขภาพดี แข็งแรง ไม่ป่วย
2. ถ้าเป็นเพศเมียต้องไม่ท้อง
3. มีอายุตั้งแต่ 6 เดือนขึ้นไป
4. จับสัตว์ ขังกรง หรือตระกร้า งดน้ำงดอาหาร อย่างน้อย 8 - 10 ชั่วโมง เพราะอาจทำให้เกิดการสำลักอาหารและอุดตันทางเดินหายใจระหว่างการผ่าตัดเป็นอันตรายถึงชีวิต
5. อาบน้ำทำความสะอาดให้เรียบร้อย เนื่องจากหลังทำหมันไม่ควรอาบน้ำให้สัตว์เลี้ยง อย่างน้อย 7 วัน หรือจนกว่าแผลผ่าตัดจะหาย และเป็นการป้องกันแผลติดเชื้อ
*** ทั้งนี้อาจมีปัจจัยอื่น ๆ เจ้าของควรปรึกษาสัตวแพทย์ก่อนทำหมันอีกครั้ง ***
18 ก.ค. 66 ทำหมันหมา และ แมว ฟรี ที่วัดไร่เกาะต้นสำโรง อ.เมือง จ.นครปฐม
18 กรกฎาคม 66 ทำหมันหมา และ แมว ฟรี ที่วัดไร่เกาะต้นสำโรง อ.เมือง จ.นครปฐม
8-13 ก.ค.66 อบต.พลูตาหลวง ออกหน่วยให้บริการทำหมัน ฉีดวัคซีน สุนัขแมวในพื้นที่ สัตหีบ LINK
องค์การบริหารส่วนตำบลพลูตาหลวง ออกหน่วยให้บริการ ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัข/แมว การตรวจรักษาโรคทั่วไป โรคมะเร็ง ในสุนัข/แมว กิจกรรมผ่าตัดทำหมันคุมกำเนิดสุนัข/แมว ฟรี!!!! โดยไม่เสียค่าใช้จ่าย เวลา 08.00 - 11.00 น. ณ อุทยานประวัติศาสตร์เรือของพ่อ เรือ ต. 91 บริเวณอ่าวดงตาลหน้าสโมสรนายทหารสัญญาบัตร กองเรือยุทธการ อำเภอสัตหีบ จังหวัดชลบุรี
• วันที่ 8 ก.ค.66 เทศบาลเมืองสัตหีบ
• วันที่ 9 ก.ค.66 อบต.พลูตาหลวง จำนวน 100 ตัว
• วันที่ 11 ก.ค.66 เทศบาลตำบลเกล็ดแก้ว
• วันที่ 12 ก.ค.66 เทศบาลตำบลนาจอมเทียน + เทศบาลตำบลเขาชีจรรย์
• วันที่ 13 ก.ค.66 อบต.แสมสาร + เทศบาลตำบลบางเสร่
คำแนะนำ การปฏิบัติก่อนทำหมันในสุนัข/แมว ****งดอาหารและน้ำ ก่อนทำหมัน อย่างน้อย 12 ชั่วโมง
16 ก.ค. 66 Hand to Paw ทำหมันสุนัข ฟรี ณ สนง.บ้านเอื้ออาทรหนองหาร เชียงใหม่ LINK
ทำหมันสุนัขเพศเมียฟรีเชียงใหม่-กับแฮนด์ทูพอว์ Hand to Paw บริการผ่าตัดทำหมันสุนัข ฟรี วันที่ 16 ก.ค. 66 เวลา 8.30-11.00 น. บริเวณ สนง.บ้านเอื้ออาทรหนองหาร เฉพาะเพศเมีย อายุ 4 เดือน - 8 ปี และ เพศผู้ อายุ 4-6 เดือน เท่านั้น รับเฉพาะในพื้นที่ อ.แม่ริม อ.สันทราย อ.ดอยสะเก็ด สำหรับผู้ลงทะเบียนเท่านั้น ลงทะเบียนได้ที่ 080-6731770
ปศุสัตว์จังหวัดชัยภูมิ ประกาศแผนบริการทำหมันสุนัข ประจำเดือน ก.ค. 66
ปศุสัตว์จังหวัดชัยภูมิ ประกาศแผนบริการทำหมันสุนัข ประจำเดือน กรกฎาคม 2566 วันที่ 4,7,12,19,21 และ 27 กรกฎาคม สถานที่ตามในภาพ สอบถามโทร. 044-812334 ต่อ 13 044-811928
11-26 ก.ค.66 ตารางบริการทำหมันหมาแมว เทศบาลตำบลรัษฎา ภูเก็ต LINK
เทศบาลตำบลรัษฎา แจ้งประชาสัมพันธ์ ตารางลงทะเบียนจองคิวผ่าตัดทำหมันสุนัขและแมว ปีงบประมาณ 2566 เวลา 09.00 - 12.00 น. ในวันที่ 11 - 26 กรกฎาคม นี้ (วันที่และสถานที่ตามภาพ)
หมายเหตุ : เป็นการลงทะเบียนรับคิวทำหมันฯ ล่วงหน้า ทางเจ้าหน้าที่จะนัดวันผู้ที่ไปลงทะเบียนที่หน้างาน สอบถามข้อมูลเพิ่มเติมได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลรัษฎา โทร.076 - 525779 - 85 ต่อ 112, 114
4 ก.ค. 66 เทศบาลตำบลเมืองแก สุรินทร์ ทำหมันสุนัขและแมว ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า (ฟรี) LINK
เทศบาลตำบลเมืองแก ขอประชาสัมพันธ์โครงการสัตว์ปลอดโรค คนปลอดภัย จากโรคพิษสุนัขบ้า เชิญชวนประชาชนนำสัตว์เลี้ยงมารับบริการ ในวันที่ 4 กรกฎาคม 2566 ตั้งแต่เวลา 08.30 น. เป็นต้นไป ณ โดมอเนกประสงค์โรงเรียนบ้านเมืองแก ต.เมืองแก อ.ท่าตูม จ.สุรินทร์ โดยมีกิจรรมดังนี้
1. ทำหมันสุนัขและแมว (ฟรี)
2. ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า (ฟรี)
3. บูทนิทรรศการให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้า
** หมายเหตุ : ให้งดน้ำ งดอาหาร สุนัข-แมว ก่อนที่จะมารับบริการ อย่างน้อย 12 ชั่วโมง (สุนัขและแมว มีอายุ 3 เดือนขึ้นไป) สอบถามรายละเอียดเพิ่มเติมได้ที่ งานสาธารณสุข สำนักปลัดเทศบาลตำบลเมืองแก โทร. 044-591020, 087 - 2623996 (นักวิชาการสาธารณสุข)
เทศบาลตำบลโพหัก ราชบุรี เปิดลงทะเบียน ทำหมันสุนัข-แมว ฟรี ถึง 21 ก.ค. 66 LINK
เทศบาลตำบลโพหัก ราชบุรี เชิญชวน ลงทะเบียนทำหมันสุนัข-แมว ฟรี ตั้งแต่บัดนี้ จนถึงวันที่ 21 กรกฎาคม 2566 หรือจนกว่าจะครบเป้าหมาย 100ตัว/พื้นที่ (เจ้าของ 1 ท่าน/สัตว์เลี้ยง 2 ตัว)
ได้ที่ กองสาธารณสุขและสิ่งแวดล้อม เทศบาลตำบลโพหัก โทร. 032-387252 ต่อ 12 ในวัน เวลา ราชการ รับจำนวนจำกัด สอบถามโทร. 032-387252 ต่อ 12
*** โปรดเตรียม บัตรประจำตัวประชาชน เบอร์โทรศัพท์ เพื่อให้เจ้าหน้าที่ลงข้อมูล
เทศบาลตำบลเกาะทวด นครศรีธรรมราช ออกหน่วยทำหมันสุนัขเคลื่อนที่ ในพื้นที่ LINK
เทศบาลตำบลเกาะทวด นครศรีธรรมราช ร่วมกับมูลนิธิเพื่อสุนัขในซอย (Soi Dog Foundation) ได้ออกหน่วยทำหมันสุนัขเคลื่อนที่ โดยเริ่มให้บริการประชาชนในพื้นที่ตำบลเกาะทวด ตั้งแต่วันที่ 28 มิถุนายน 2566 เป็นต้นไป ให้บริการในวันจันทร์ ถึง วันเสาร์ เวลา 08.00 น. ถึง 17.00 น. ณ ศาลาประจำหมู่บ้าน หมู่ที่ 3 บ้านเกาะทวด โดยให้บริการทำหมัน ฉีดวัคซีนรวมและวัคซีนป้องกันโรคพิษสุนัขบ้าให้กับสุนัข
ทั้งนี้ ขอให้สุนัขที่จะทำหมัน งดน้ำ-งดอาหารมาแล้วตั้งแต่เที่ยงคืนก่อนเข้ารับบริการทำหมันและให้นำสุนัขไปยังจุดบริการไม่เกินเวลา 09.00 น. ของวันรับบริการ กรณีมีข้อขัดข้องที่ไม่สามารถนำสุนัขไปเองได้ เช่น สุนัขดุร้าย ขอให้ไปแจ้ง ณ จุดบริการ โดยจะมีเจ้าหน้าที่พร้อมพาหนะ ลงไปจับสุนัขให้
5,12,19,26 ก.ค. 66 VetVan Thailand ระยอง ทำหมันหมาฟรี แมว 500 บาท LINK
VetVan Thailand ประกาศกำหนดการคลินิกทำหมัน เดือนกรกฎาคม สุนัข ฟรี แมว 500 บาท
1) สุนัข = ฟรี @ ศูนย์ทำหมันของเว็ทแวน และ คลินิกเคลื่อนที่ (ตามกำหนดการ)
- คิวเปิด 08:30 น.
- กรุณานำสุนัขของท่านมาพร้อมกับท่านเพื่อต่อคิว
- นำบัตรประจำตัวประชาชนมาด้วยสำหรับการเช็คอิน
- ผู้ที่มาก่อนจะได้รับสิทธิ์ก่อน
- ไม่รับการจองสำหรับคลินิกสุนัข
2) แมว = ตัวละ 500 บาท @ โรงพยาบาลสัตว์ในเมืองระยอง หรือ บ้านฉาง (ส่งข้อความสำหรับข้อมูลเพิ่มเติม)
ทำหมันสุนัขรับจาก 18 ตำบล จ.ระยอง 1 *ใหม่* เนินฆ้อ Noen Kho 2 *ใหม่* ห้วยยาง Huai Yang 3 *ใหม่* วังหว้า Wang Wa 4 *ใหม่* ทางเกวียน Thang Kwian 5 กร่ำ Kram 6 ชากโดน Chak Don 7 สองสลึง Song Salueng 8 ชากพง Chak Phong 9 กะเฉด Kachet 10 สำนักทอง SamNak Thong 11 แกลง Klaeng 12 เพ Phe 13 ตะพง Taphong 14 บ้านแลง Ban Laeng 15 เชิงเนิน Choeng Noen 16 ปากน้ำ Pak Nam 17 ท่าประดู่ Tha Pradu 18 เนินพระ Noen Phra
15-16 ก.ค. 66 Hand to Paw ผ่าตัดทำหมันสุนัขเพศเมียฟรี ที่เทศบาลตำบลแม่แรม อ.แม่ริม LINK
Hand to Paw ผ่าตัดทำหมันสุนัขเพศเมียฟรี
วันเสาร์ ที่ 15 กรกฎาคม 2566 สถานที่ : เทศบาลตำบลแม่แรม อำเภอแม่ริม [
พิกัด]
อาทิตย์ ที่ 16 กรกฎาคม 2566 สถานที่ : สำนักงานบ้านเอื้ออาทรหนองหาร อำเภอสันทราย
ลงทะเบียน ได้ 2 ทาง
1. มูลนิธิฯ เบอร์ 0806731770
2. งานสาธารณะสุข เทศบาลสถานที่จัด
วันผ่าตัดทำหมัน รับบัตรคิว เวลา 08.30 - 11.00 น. เท่านั้น หลังจากนี้ไม่รับนะคะ
งดอาหารน้ำข้าวทุกชนิด หลังเที่ยงคืนก่อนวันผ่าตัดทำหมันนะคะ
#การนำสัตว์มาทำหมัน ต้องใส่กรง/ ผูกเชือก /ใส่กล่อง เพื่อป้องกันการหลุด และอาจเกิดอันตรายกับสุนัขขอท่านได้
22 ก.ย.66 ปศุสัตว์อุบลฯ ทำหมันหมาแมว ฟรี
ทำหมันฟรี กับกรมปศุสัตว์ จ.อุบลราชธานี มิถุนายน - กันยายน 2566 ดังนี้ 9 และ 23 มิถุนายน / 7 และ 22 กรกฎาคม / 11 และ 25 สิงหาคม / 8 และ 22 กันยายน *เวลา 8.00-12.00 น.
จำกัดจำนวนวันละ 60 ตัว งดอาหารและน้ำ 8-12 ชั่วโมงก่อนผ่าตัด ลงทะเบียนด้วยตนเอง ล่วงหน้าที่ กลุ่มพัฒนาสุขภาพสัตว์ สนง.ปศุสัตว์จังหวัดอุบลราชธานี (วันเวลาราชการ)
ชมรมหมาหัวเน่าเบตง บริการทำหมันสุนัขและแมว ฟรี LINK
ชมรมหมาหัวเน่าเบตงบริการทำหมันสุนัขและแมว พร้อมฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ตามรอยปณิธานของศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒนวรขัติยราชนารี "สัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า" โดยสัตวแพทย์อาสา
1น.สพ คณิน รุจิเสรีกุล
2น.สพ ภาณุพงษ์ โนจิตรและทีมงาน
พร้อมทั้งทีมงานชมรมหมาหัวเน่าเบตง
19 ก.ค. 2566 ปศุส้ตว์ปราจีนบุรี ทำหมันฟรี ออกหน่วย ณ วัดโคกกระจง ต.สัมพันตา อ.นาดี
ประกาศพื้นที่ อ.นาดีและใกล้เคียง สนง.ปศุส้ตว์จังหวัดปราจีนบุรี มีกิจกรรมทำหมันฟรี ออกหน่วย ณ วัดโคกกระจง ต.สัมพันตา อ.นาดี ในวันพุธที่ 19 ก.ค. 2566
ในกิจกรรมนี้ เราจะเปิดให้จองทำหมันจำนวน 30 ตัว (30 บัตรประชาชน) จองในวันจันทร์ที่ 10 ก.ค. 66 ที่เบอร์โทร 082-2163021 โทรเวลา 10.00-12.00 รับจำกัด 30 ราย หมายเหตุ งดรับ สุนัขแมวพันธ์หน้าสั้น เช่น ชิสุ ปั๊ก แมวพันธ์เปอร์เซียและลูกผสมพันธ์เหล่านั้น ขอบคุณ กด like กดติดตาม แชร์ เพจเราด้วย เพื่อจะได้รับข่าวสารจากเราก่อนใคร
17 ก.ค.66 อบต.บ้านพระ อ.เมืองปราจีนบุรี จองคิวล่วงหน้า
ประกาศกิจกรรมทำหมันฟรีครั้งหน้าจัดที่ อบต.บ้านพระ อ.เมืองปราจีนบุรี ในวันจันทร์ที่ 17 ก.ค.2566 โดยครั้งนี้เราจะเปิดให้จองคิวล่วงหน้าในวันพรุ่งนี้ วันที่ 6 ก.ค.66 ที่หมายเลข 082-2163021 จองได้ 1 บัตรประชาชนต่อ 1 ตัวสัตว์ เราจะรับจำกัด 30 บัตร(ตัว) จองได้สำหรับคนภูมิลำเนานอกเขต ต.บ้านพระ (ตามบัตรประชาชน) เปิดสายจอง 10.30-12.00 น. เตรียมตัวโทรได้ หมายเหตุ อาจโทรติดยากหน่อยนะครับ ขอให้อดทน
9 พฤษภาคม 2566 ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง ทำหมันฟรีให้สุนัขและแมว
ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง อยู่ที่ ศูนย์พักพิงสุนัขจรจัด เทศบาลนครระยอง วันที่ 9 พฤษภาคม 2566 จะมีการจัดกิจกรรมทำหมันฟรีให้สุนัขและแมว ณ วัดโขดทิมทาราม
ผู้ที่สนใจเข้าร่วมโครงการ กรุณาเตรียมตัวดังนี้
1. งดน้ำและอาหารสุนัขและแมวที่จะทำหมัน อย่างน้อย 8 ชม. ก่อนผ่าตัด
2. เตรียมบัตรประจำตัวประชาชน ที่อยู่ในเขตเทศบาลนครระยอง มาลงทะเบียนเวลา 8.30 น.
3. จำกัดบ้านละ 1 ตัว
เทศบาลนครสงขลา ให้บริการทำหมันสุนัข...ฟรี!! LINK
เทศบาลนครสงขลา ร่วมกับ มูลนิธิบ้านหมายิ้ม และโรงพยาบาลสัตว์เว็ทเมด ให้บริการทำหมันสุนัข...ฟรี!! โดยเปิดลงทะเบียนผ่าน Line OA เทศบาลนครสงขลา ประชาชนสามารถเพิ่มเพื่อนเพื่อลงทะเบียน ได้ที่ Line ID : @songkhlacity หรือสแกน QR Code
ขั้นตอนการลงทะเบียน
1. เพิ่มเพื่อนผ่าน แพลตฟอร์ม Line OA
2. ลงทะเบียนเพื่อแจ้งนัดทำหมัน ในเมนูร้องทุกข์ ร้องเรียน
3. เลือกหัวข้อ “นัดทำหมันสุนัข/แมว”
4. แจ้งรายละเอียด ระบุเพศ และสีของสุนัข พร้อมแนบภาพถ่าย
(เน้นสุนัขสายพันธุ์ไทย และสุนัขจรจัด)
** รับเฉพาะในพื้นที่เทศบาลนครสงขลาเท่านั้น **
3-4 ส.ค. 66 ทำหมันให้สุนัขและแมวฟรี! อบต.หนองหญ้าปล้อง เพชรบุรี LINK
สมาร์ทฮาร์ท ห่วงใยเพื่อนสัตว์เลี้ยง โครงการทำหมันให้สุนัขและแมวฟรี! และเพื่อส่งเสริมให้น้องๆ สุนัขและแมว ได้มีสุขภาพที่ดี รวมถึงช่วยควบคุมจำนวนของสุนัขและแมวไร้บ้านในชุมชน โดยโครงการจะจัดขึ้นที่
1. อบต. หนองหญ้าปล้อง จังหวัดเพชรบุรี ในวันที่ 3-4 สิงหาคม 2566 และ
2. เขตคลองเตย จังหวัดกรุงเทพฯ ในวันที่ 7-9 สิงหาคม 2566
ติดต่อลงทะเบียน
สำนักงานเขตคลองเตย โทร. 02-240-2121
อบต. หนองหญ้าปล้อง โทร. 0-4207-7666
19-25 ก.ค.66 ปศุสัตว์นครศรีธรรมราช จัดทำหมัน ฟรี 100 ตัว LINK
สมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติราชนารี เสด็จปฎิบัติพระกรณียกิจออกหน่วยสัตวแพทย์อาสาจุฬาภรณ์ เพื่อให้บริการฉีดวัคซีน และทำหมันให้กับสุนัขและแมว ระหว่างวันที่ 19-25 กรกฎาคม พ.ศ. 2566 ณ วัดพระมหาธาตุวรมหาวิหาร ถนนราชดำเนิน ตำบลในเมือง อำเภอเมือง จังหวัดนครศรีธรรมราช ประชาชนสามารถนำสุนัขและแมว มารับบริการได้ระหว่างวันที่ 20-24 กรกฎาคม พ.ศ. 2566 พร้อมกับนำบัตรประจำตัวประชาชนมาแสดงก่อนเข้ารับบริการ ประชาชนในเขตเทศบาลนครนครศรีธรรมราชลงทะเบียนได้ที่ 075-358292 ประชาชนเขตอื่นๆ ลงทะเบียนได้ที่ สำนักงานปศุสัตว์จังหวัดนครศรีธรรมราช โทรศัพท์ 075-356254 ต่อ 116 รับวันละ 100 ตัวฟรี ไม่มีค่าใช้จ่าย
8 ส.ค.66 เทศบาลตำบลขุนแก้ว นครชัยศรี ทำหมันสุนัขและแมว
เทศบาลตำบลขุนแก้วร่วมกับปศุสัตว์อำเภอนครชัยศรี จัดกิจกรรม ทำหมันสุนัขและแมว ในวันอังคารที่ 8 สิงหาคม 2566 ตั้งแต่เวลา 08.30 - 11.00 น. ณ วัดประชานาถ (โคกแขก) สามารถลงทะเบียนล่วงหน้าได้ที่ เทศบาลตำบลขุนแก้ว หรือ สามารถสแกน qr code กรอกแบบฟอร์มออนไลน์
หมายเหตุ
- โปรดนำบัตรประชาชนมาลงทะเบียน
- โปรดปฏิบัติตามคำแนะนำ
- ให้สิทธิ์ผู้ที่มีที่อยู่ในพื้นที่ตำบลขุนแก้วก่อน
***รับจำนวนจำกัด***
ตารางออกหน่วยทำหมัน ปศุสัตว์จังหวัดชลบุรี ประจำเดือน สิงหาคม 2566 LINK
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน สิงหาคม 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น.
• 11 สิงหาคม 2566 อาคารเอนกประสงค์สวนสุขภาพเทศบาลเมืองหนองปรือ เทศบาลเมืองหนองปรือ อ.บางละมุง
• 17 สิงหาคม 2566 วัดวังหิน เทศบาลเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
• 18 สิงหาคม 2566 วัดน้อย เทศบาลเมืองชลบุรี อ.เมืองชลบุรี
• 24 สิงหาคม 2566 เทศบาลตำบาลเสม็ด อ.เมืองชลบุรี
• 25 สิงหาคม 2566 โดมเอนกประสงค์ เทศบาลเมืองชลบุรี อ.เมืองชลบุรี
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
พื้นที่อื่นๆ รอ Update ก่อนน้า หรือลองโทรสอบถาม อบต./เทศบาล ในพื้นที่
9 ส.ค.66 ปศุสัตว์นครปฐม ทำหมันฉัดวัคซีน ฟรี ต.คลองโยง พุทธมณฑล 70 ตัวเท่านั้น
4 ก.ย. 66 อบต.พลูตาหลวง
องค์การบริหารส่วนตำบลพลูตาหลวงร่วมกับ มูลนิธิเพื่อสุนัขในซอย ได้จัดกิจกรรม ทำหมันสุนัข ทั้งสุนัขจรจัดและสุนัขบ้าน พร้อมทั้งฉีดวัคซีน พิษสุนัขบ้าและวัคซีนรวม ให้กับสุนัขที่มาทำหมัน โดยไม่เสียค่าใช้จ่าย สุนัขที่นำมาทำหมันต้องมีอายุตั้งแต่ 2 เดือนครึ่งขึ้นไปจนถึงอายุ 10 ปี
เวลาทำการวันจันทร์ถึงวันศุกร์
ตั้งแต่เวลา 08.00-15.00น. หยุดทุกวันเสาร์อาทิตย์ ไม่หยุดนักขัตฤกษ์
ลงทะเบียนทำหมันได้ที่องค์การบริหารส่วนตำบลพลูตาหลวงหรือหน่วยทำหมันสุนัขตั้งอยู่ในพื้นที่ อบต.พลูตาหลวง
***หากท่านใดไม่สามารถนำสุนัขมาได้เรามีรถรับ-ส่งให้ถึงที่ (ยังไม่รับทำแมวในขณะนี้)
28 - 31 ส.ค.66 โรงพยาบาลสัตว์ ทิพย์พิมาน ปากช่อง ทำหมันหมาแมวฟรี
สัตวแพทย์เกษตรอาสา ทำหมันน้องหมาน้องแมวฟรี !!
โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน
จัดโครงการ สัตวแพทย์เกษตรอาสา บริการทำหมันสุนัขและแมวให้กับประชาชนฟรี
ระหว่างวันที่ 28 สิงหาคม 2566 - 31 สิงหาคม 2566 สำหรับสุนัขและแมวทุกตัวที่เข้าร่วมโครงการ ฯ จะได้รับการวางยาสลบชนิดสูดดม และผ่าตัดด้วยวิธีมาตรฐาน โดยมีรายละเอียดการนำสุนัขและแมวเข้าร่วมโครงการ ดังนี้
เงื่อนไขการเข้าร่วมโครงการ
1. สุขภาพแข็งแรงสมบูรณ์ ไม่มีโรคประจำตัว
2. สุนัขและแมวเพศเมียต้องไม่เป็นสัด ตั้งท้อง หรือ ให้นมลูก
(ขั้นตอนการนำสุนัขและแมวเข้าร่วมโครงการ)
1. นำสุนัขและแมว เข้ารับการตรวจร่างกาย และตรวจเลือด โดยมีค่าใช้จ่ายในการตรวจร่างกายและตรวจเลือด*
2. สุนัขและแมว ที่ผ่านการตรวจสุขภาพแล้ว จะได้รับใบนัดเข้าผ่าตัดทำหมัน จากสัตวแพทย์
3. นำสุนัขและแมวมาเข้ารับการผ่าตัดตามนัดหมาย โดยไม่มีค่าใช้จ่าย **เฉพาะในการดมยาสลบและผ่าตัดทำหมัน**
4. ยาและอุปกรณ์การดูแลแผลเจ้าของจัดหาเองตามคำแนะนำของสัตวแพทย์ หรือ ซื้อโดยตรงจากโรงพยาบาลสัตว์
5. นำสุนัขและแมวเข้ารับการตรวจแผลและตัดไหม (**มีค่าใช้จ่าย**)
.
จึงขอเชิญประชาชน และผู้สนใจทั่วไป ที่มีความประสงค์จะทำหมันให้สุนัขและแมว มารับบริการผ่าตัดทำหมันฟรี กับโครงการฯ ได้ตามวัน เวลา และสถานที่ ดังกล่าว สอบถามเพิ่มเติมได้ที่ โรงพยาบาลสัตว์ มหาวิทยาลัยเกษตรศาสตร์ ณ ทิพย์พิมาน โทรศัพท์ 044 300 974
** ขอสงวนสิทธิ์การพิจารณารับสุนัขและแมวเข้าร่วมโครงการ โดยให้เป็นไปตามดุลยพินิจของสัตวแพทย์ผู้ตรวจ
13 มิ.ย.66 ปศุสัตว์อำเภอปากช่อง ผ่าตัดทำหมันให้แก่สุนัข/แมว ฟรี
สำนักงานปศุสัตว์อำเภอปากช่อง ขอแจ้งประชาสัมพันธ์ ผู้เลี้ยงสุนัข/แมว เข้ารับบริการฉีดวัคซีนพิษสุนัขบ้า และ ผ่าตัดทำหมันให้แก่สุนัข/แมว ในวันอังคารที่13 มิถุนายน 2566 เวลา 09.00 - 12.00 น. ณ ฟาวเท่นทรี รีสอร์ท อำเภอปากช่อง จังหวัดนครราชสีมา
สามารถติดต่อลงทะเบียนและสอบถามรายละเอียดเพิ่มเติม ได้ที่ สำนักงานปศุสัตว์อำเภอปากช่อง 080-6682572
10 ก.พ.66 เทศบาลนครเจ้าพระยาสุรศักดิ์ ผ่าตัดทำหมัน ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี 100 ตัว
โครงการควบคุมจำนวนประชากรสุนัขจรจัดในเขตเทศบาล ประจำปีงบประมาณ พ.ศ. ๒๕๖6
เทศบาลนครเจ้าพระยาสุรศักดิ์ ร่วมกับ สำนักงานปศุสัตว์อำเภอศรีราชา กิจกรรมบริการฟรี
- ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าสำหรับสัตว์ทุกตัวที่ครบรอบฉีดวัคซีน
- ผ่าตัดทำหมันถาวรสุนัขและแมวจรจัด จำนวน 100 ตัว
o ผู้รับบริการอยู่ในเขตเทศบาลนครเจ้าพระยาสุรศักดิ์
o สัตว์ต้องมีอายุ 6 เดือนขึ้นไป มีสุขภาพแข็งแรง
o จำกัดจำนวนสัตว์ไม่เกิน 3 ตัว/ผู้รับบริการ
o เน้นสัตว์ไม่มีเจ้าของ สัตว์ด้อยโอกาส สัตว์จรจัด
o สัตว์กลุ่มเสี่ยงในพื้นที่ ที่มีประวัติการเกิดโรคพิษสุนัขบ้า
o งดน้ำงดอาหารอย่างน้อย 8 - 12 ชั่วโมง
o ไม่รับทำสัตว์มีเจ้าของ สุนัขและแมวที่มีสายพันธุ์แท้
ลงทะเบียนรับคิว
ในวันที่ 10 กุมภาพันธ์ 2566 เวลา 08.30 น.
ดำเนินการ ณ ที่ทำการบ้านกำนันโดด
ม.5 ต.บึง อ.ศรีราชา จ.ชลบุรี
กองสาธารณสุขและสิ่งแวดล้อม 038-348253 ต่อ 219
24 ก.ค.66 เทศบาลเมืองแสนสุข ทำหมันสุนัข แมว
เทศบาลเมืองแสนสุข ขอเชิญทําหมันสุนัข แมว ตามโครงการป้องกัน และควบคุมโรคติดต่อจากสัตว์สู่คนแบบบูรณาการ ประจําปีงบประมาณ 2566
ด้วยเทศบาลเมืองแสนสุขร่วมกับคณะสัตวแพทย์ มหาวิทยาลัยเทคโนโลยีราชมงคลตะวันออก และชมรมอาสาสมัครสัตวแพทย์ เทศบาลเมืองแสนสุข จะดําเนินการตามโครงการป้องกันและควบคุมโรคติดต่อจากสัตว์สู่คนแบบบูรณาการ ประจําปีงบประมาณ 2566 โดยจัดให้มีการคุมกําเนิดสัตว์ ด้วยการผ่าตัดทําหมันถาวรให้กับสุนัข แมว ในเขตเทศบาลเมืองแสนสุข ทั้งสุนัข แมว ที่เลี้ยงอยู่ตามชุมชน และสุนัข แมว ที่อยู่ตามที่ทางสาธารณะ วัด สถานศึกษา และสถานที่ท่องเที่ยว เพื่อเป็นการลดเหตุ เดือดร้อนรําคาญ ลดภัยคุกคามจากสัตว์จรจัด ป้องกันการแพร่ระบาด และระงับโรคติดต่อจากสัตว์สู่คน
????ในวันที่ 24 กรกฏาคม 2566 ตั้งแต่เวลา 09.00 - 16.00 น. โดยให้บริการ ณ อาคารอเนกประสงค์ เทศบาลเมืองแสนสุข
????ดังนั้น เพื่อให้การดําเนินการเป็นไปตามวัตถุประสงค์ของโครงการ และเป็นการเตรียมการ จึงขอเชิญท่าน เจ้าของสัตว์เลี้ยงสุนัข แมว ที่มีอายุตั้งแต่ 6 เดือน ขึ้นไป มีสุขภาพสมบูรณ์ และมีความประสงค์ จะขอรับบริการตามโครงการนี้
????ขอรับการขึ้นทะเบียนได้ที่
- https://citly.me/DMqIW
- สแกน QR CODE ด้านล่าง
- ลงทะเบียนด้วยตนเอง งานสัตวแพทย์ (อาคารใหม่ ชั้น1) เทศบาลเมืองแสนสุข (ในวันและเวลาราชการ)
???? ตั้งแต่ บัดนี้เป็นต้นไป และขอให้เจ้าของนําสัตว์เลี้ยงเข้ารับบริการ ตามกําหนดการข้างต้น โดยท่านเจ้าของต้องเตรียมตัว สัตว์เลี้ยงให้สะอาด พร้อมทั้งงดน้ำและอาหาร ก่อนนํามาผ่าตัดอย่างน้อย 12 ชั่วโมง
????สอบถามข้อมูลเพิ่มเติมได้ที่ : งานสัตวแพทย์ กองสาธารณสุขและสิ่งแวดล้อม หมายเลขโทรศัพท์ 038-385100 (ในวันและเวลาราชการ)
เทศบาลนครยะลา เปิดรับลงทะเบียน ทำหมันสุนัข ฟรี รอบที่สาม : วันพฤหัสบดี ที่ 14 กันยายน 2566 LINK
เทศบาลนครยะลา เปิดรับลงทะเบียน ทำหมันสุนัข ฟรี เริ่มเปิดรับลงทะเบียน วันจันทร์ที่ 21 สิงหาคม 2566 เป็นต้นไป รอบที่สาม : วันพฤหัสบดี ที่ 14 กันยายน 2566
เงื่อนไข
1. ลงทะเบียนได้เฉพาะที่อยู่ในเขตเทศบาลนครยะลาเท่านั้น (ยึดตามบัตรปชช)
2. จำนวนจำกัดต่อบ้าน : สุนัขไม่เกิน 3 ตัว
3. สุนัขที่นำมาทำหมันจะได้รับการฝังไมโครชิพหลังจากทำหมันเสร็จ = คุณจะต้องเป็นเจ้าของน้อง และพร้อมรับผิดชอบต่อชีวิตของน้อง
"ลงทะเบียนด้วยตนเอง" ที่คลินิกสุขภาพสัตว์ เทศบาลนครยะลา ในวันจันทร์-ศุกร์ ช่วงเช้า 09.00-11.30 และช่วงบ่าย 13.30-15.00 น. (เพื่อเซ็นต์รับเอกสารและรับทราบการเตรียมตัวสัตว์ก่อนการทำหมัน)
ทำหมันสุนัขแมว ชลบุรี เดือนกันยายน
4 กย เทศบาลลางละมุง
12 กย เทศบาลเชาชีจรรย์ สัตหีบ
13 กย เทศบาลเกาะจันทร์ อ.เกาะจันทร์
20 กย วัดเครือศรัทธาธรรม เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
ตารางผ่าตัดทำหมัน เดือนกันยายน 2566 ฮนด์ทูพอว์ Hand to Paw เชียงใหม่ LINK
ตารางผ่าตัดทำหมัน เดือนกันยายน 2566 ลงทะเบียนได้ตามพื้นที่ได้เลยคะ
17 กันยายน 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ ฉีดวัคซีนสุนัขรวม 6 โรค สถานที่ วัดแม่ย่อย ต.สันทรายน้อย อ.สันทราย
23 กันยายน 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ สถานที่ อบต.โป่งแยง ต.โป่งแยง อ.แม่ริม
30 กันยายน 8.30-12.00 น. ทำหมันสุนัขเพศเมีย/ผู้ สถานที่ อบต.สันป่ายาง ต.สันป่ายาง อ.แม่แตง
เทศบาลเมืองลัด บริการทำหมันสุนัข 1-5 พฤษภาคม 2566
เทศบาลเมืองลัดหลวงร่วมกับมูลนิธิเพื่อสุนัขในซอยให้บริการทำหมันสุนัข พร้อมฉีดวัคซีนรวมและวัคซีนโรคพิษสุนัขบ้า ฟรี! “สำหรับสุนัขเท่านั้น”น้ำหนักตั้งแต่ 3 ก.ก. ขึ้นไป
ตั้งแต่วันที่ 1 – 5 พฤษภาคม 2566 ณ ศูนย์พัฒนาเด็กเล็กเฉลิมพระเกียรติเทศบาลเมืองลัดหลวง ในสวนสาธารณะเฉลิมพระเกียรติฯ ข้างวัดชมนิมิตร เวลา 09.00 น.-16.00น. ต้องโทรจองคิวก่อนเข้ารับบริการอย่างน้อย 1 วันล่วงหน้า- ไม่รับว็อคอินทุกกรณี - โทร 089-055-7702
เตรียมสำเนาบัตรประจำตัวประชาชนของเจ้าของที่แสดงว่าอยู่ในเขตมาใช้สำหรับลงทะเบียนและประกอบการเซ็นยอมวางยาสลบและผ่าตัด
????หมายเหตุ : 1. “สำหรับสุนัขเท่านั้น”และต้องมีน้ำหนักตั้งแต่ 3 ก.ก. ขึ้นไป 2. ทางมูลนิธิเพื่อสุนัขในซอยขอสงวนสิทธิวัคซีนและยาป้องกันเห็บหมัดเฉพาะสุนัขที่ทำหมันที่หน่วย และสุนัขที่นำมาเข้ารับบริการทำหมัน 3. ต้องงดอาหารสุนัขหลังเที่ยงคืนก่อนวันที่สุนัขเข้ารับบริการทำหมัน
เทศบาลเมืองชลบุรี ทำหมันสุนัขแมว ฟรี 18 & 25 สิงหาคม 2566
เทศบาลเมืองชลบุรี โดยกองสาธารณสุขและสิ่งแวดล้อม จัดทำโครงการป้องกันและควบคุมโรคพิษสุนัขบ้า กิจกรรมการควบคุมประชากรสัตว์ โดยให้บริการผ่าตัดทำหมันสุนัขและแมว ในเขตเทศบาลเมืองชลบุรี (ต.บางปลาสร้อย ต.มะขามหย่ง ต.บ้านโขด) ดังนี้ ครั้งที่ 1 18 สิงหาคม 2566 บริเวณวัดน้อย ครั้งที่ 2 วันศุกร์ที่ 25 สิงหาคม 2566 ณ บริเวณอาคารโดมเทศบาลเมืองชลบุรี ตั้งแต่เวลา 09.00 – 12.00 น.
บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า งานเกษตรแฟร์ศรีราชา 24 พ.ย. - 3 ธ.ค. 66
มหาวิทยาลัยเกษตรศาสตร์ วิทยาเขตศรีราชาร่วมกับ เกษตรจังหวัดชลบุรี ปศุสัตว์จังหวัดชลบุรี และประมงจังหวัดชลบุรี จัดงานเกษตรศรีราชาแฟร์ ครั้งที่17 ประจำปี 2566 ระหว่างวันที่ 24 พฤศจิกายน 2566 ถึงวันที่ 3 ธันวาคม 2566 พบกับ สินค้าอุปโภคบริโภคมากมาย ให้ท่านท่านเลือกซื้อกันอย่างจุใจเช่นเคย กิจกรรม การประกวดผลผลิตทางการเกษตร การประกวดปลากัดสวยงาม การแข่งขันจัดสวนถาด และพิเศษในปีนี้ มีบริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สนัขและแมวด้วยน๊า
กำหนดการบริการฉีดวัคซีน
วันศุกร์ที่ 24 พฤศจิกายน 2566 เวลา 9.00 น. – 12.00 น..
วันจันทร์ที่ 27 พฤศจิกายน 2566 เวลา 9.00 น. – 12.00 น.
รายละเอียดการบริการ
ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าเฉพาะสุนัขและแมว เท่านั้น
สุนัขหรือแมวต้องมีสุขภาพแข็งแรง ไม่เจ็บป่วยหรือตั้งครรภ์
ให้สิทธิ์สุนัขและแมวเข้ารับบริการอย่างละไม่เกิน 1 ตัวต่อ 1 เจ้าของเท่านั้น
ลงทะเบียนบริการฉีดวัคซีนสนัขและแมว
8 & 19 ธันวาคม 66 ปศุสัตว์จังหวัดชลบุรี บริการทำหมันและฉีดวัคซีน เดือนธันวาคม 66
ตารางการออกหน่วยบริการทำหมันและฉีดวัคซีน ร่วมกับอปท. ของสำนักงานปศุสัตว์จังหวัดชลบุรี ประจำเดือน ธันวาคม 2566 เวลาออกหน่วยบริการ 8.30 - 11.00 น.
วันที่ 8 ธันวาคม 66 ริมทะเลผาแดง เทศบาลนครเจ้าพระยาสุรศักดิ์ อ.ศรีราชา
วันที่ 19 ธันวาคม 66 เทศบาลตำบลโป่ง อ.บางละมุง
รายละเอียดสถานที่/การจองคิว กรุณาติดต่อ อบต. /เทศบาลที่จะไปรับบริการ(ตามตาราง)*เท่านั้น*
16 มกราคม 2567 ปศุสัตว์อำเภอเขาฉกรรจ์ สระแก้ว ทำหมันหมาแมว ฟรี
สำนักงานปศุสัตว์จังหวัดสระแก้วร่วมกับสำนักงานปศุสัตว์อำเภอเขาฉกรรจ์ จัดกิจกรรมโครงการผ่าตัดทำหมันควบคุมประชากรสุนัขและแมว ภายใต้โครงการสัตว์ปลอดโรค คนปลอดภัยจากโรคพิษสุนัขบ้า ตามพระปณิธาน
กำหนดจัดกิจกรรม วันอังคารที่ 16 มกราคม 2567 ตั้งแต่เวลา 08.30 น. เป็นต้นไป ณ อาคารอเนกประสงค์เทศบาลตำบลเขาฉกรรจ์ อำเภอเขาฉกรรจ์ จังหวัดสระแก้ว สามารถ Walk in เข้ามาจองคิวได้ในวันที่ 16 มกราคม 2567 ตั้งแต่เวลา 08.30 น.เป็นต้นไป ณ อาคารอเนกประสงค์เทศบาลตำบลเขาฉกรรจ์ อำเภอเขาฉกรรจ์ จังหวัดสระแก้ว (โดยจะปิดรับการจองคิวในเวลา 12.00 น.)
- ให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยง ฟรี! *สัตว์เลี้ยงที่ฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าได้ สุนัขหรือแมวอายุ 2-4 เดือนขึ้นไป สัตว์ต้องสุขภาพแข็งแรง
- ผ่าตัดทำหมันสุนัขและแมว ฟรี! ตั้งแต่เวลา 08.30 น. เป็นต้นไป
การเตรียมตัวสุนัขและแมวก่อนทำหมัน
- งดน้ำ-อาหาร 8-12 ชั่วโมง
- สัตว์ต้องสุขภาพแข็งแรง
- อายุตั้งแต่ 6 เดือนขึ้นไป
- ไม่เป็นสัด และไม่ตั้งท้อง
1 พฤศจิกายน - 2 ธันวาคม 2566 เทศบาลนครภูเก็ต ออกหน่วยให้บริการทำหมันสุนัขและแมวจรจัด และฉีดวัคซีน
เทศบาลนครภูเก็ต และปศุสัตว์จังหวัดภูเก็ต ร่วมกับมูลนิธิเพื่อสุนัขในซอย ออกหน่วยให้บริการทำหมันสุนัขและแมวจรจัด และฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า ฟรี!!! (เฉพาะในเขตเทศบาลนครภูเก็ต) ระหว่างวันที่ 1 พฤศจิกายน - 2 ธันวาคม 2566 ให้บริการทุกวันพุธ - วันอาทิตย์ เวลา 09.00 - 16.00 น. (หยุดวันจันทร์ และวันอังคาร) ณ กลุ่มงานจัดการมูลฝอยและสิ่งปฏิกูล สอบถามรายละเอียดเพิ่มเติม โทร. 082 - 4706790
27 พฤศจิกายน 2566 ปศุสัตว์จังหวัดสุรินทร์ ทำหมันหมาแมว
สำนักงานปศุสัตว์จังหวัดสุรินทร์ ขอประชาสัมพันธ์ เชิญชวนเจ้าของสุนัขและแมว เข้ารับบริการตามโครงการหน่วยสัตวแพทย์อาสาจุฬาภรณ์ จังหวัดสุรินทร์ ภายใต้โครงการสัตว์ปลอดโรคคนปลอดภัย จากโรคพิษสุนัขบ้า เพื่อฉีดวัคซีนและผ่าตัดทำหมันสุนัขและแมว ในพื้นที่จังหวัดสุรินทร์ วันจันทร์ที่ 27 พฤศจิกายน 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์ เปิดลงทะเบียน (ปิดรับเมื่อเต็มจำนวน)
วันจันทร์ที่ 20 พฤศจิกายน 2566 เวลา 9.00 น.
ประกาศรายชื่อผู้ที่ผ่านตามหลักเกณฑ์ ????????
วันพุธที่ 22 พฤศจิกายน 2566 เวลา 10.00 น.
ผ่าน Facebook สำนักงานปศุสัตว์จังหวัดสุรินทร์
ซึ่งผู้ที่ผ่านตามหลักเกณฑ์ได้รับการประกาศรายชื่อ ต้องเดินทางมาตรวจ ATK หน้างานก่อนเวลา 06.30 น.
จำกัด จำนวนสุนัขและแมว 100 ตัว
27 พฤศจิกายน 2566 ปศุสัตว์จังหวัดสุรินทร์ ฉีดวัคซีและผ่าตัดทำหมันสุนัขและแมว ฟรี LINK
สำนักงานปศุสัตว์จังหวัดสุรินทร์ ประชาสัมพันธ์ เชิญชวนเจ้าของสุนัขและแมว เข้ารับบริการตามโครงการหน่วยสัตวแพทย์อาสาจุฬาภรณ์ จังหวัดสุรินทร์ ภายใต้โครงการสัตว์ปลอดโรคคนปลอดภัย จากโรคพิษสุนัขบ้า เพื่อฉีดวัคซีและผ่าตัดทำหมันสุนัขและแมว ในพื้นที่จังหวัดสุรินทร์ วันจันทร์ที่ 27 พฤศจิกายน 2566 ณ มหาวิทยาลัยเทคโนโลยีราชมงคลอีสาน วิทยาเขตสุรินทร์ เปิดลงทะเบียน (ปิดรับเมื่อเต็มจำนวน) วันจันทร์ที่ 20 พฤศจิกายน 2566 เวลา 9.00 น.
ประกาศรายชื่อผู้ที่ผ่านตามหลักเกณฑ์
วันพุธที่ 22 พฤศจิกายน 2566 เวลา 10.00 น.
ผ่าน Facebook สำนักงานปศุสัตว์จังหวัดสุรินทร์
ซึ่งผู้ที่ผ่านตามหลักเกณฑ์ได้รับการประกาศรายชื่อ ต้องเดินทางมาตรวจ ATK หน้างานก่อนเวลา 06.30 น.
จำกัด จำนวนสุนัขและแมว 100 ตัว
link ลงทะเบียน
https://forms.gle/bGnDVwwYwx3fiqM56
ตารางงานออกหน่วย ประจำเดือนมกราคม 2567
ครอบคลุม 4 ภาค ได้แก่ ภาคเหนือ ภาคอีสาน ภาคกลาง และภาคใต้
ภาคใต้ มกราคม-กุมภาพันธ์ 67
ข้อมูลควรทราบทำหมันสุนัขและแมว
อายุที่เหมาะสมสำหรับหมาแมวที่จะทำหมันได้
สุนัข 6 เดือน ขึ้นไป
แมวเพศเมีย 5 เดือน
แมวเพศผู้ 10 เดือนขึ้นไป
อายุที่เริ่มเป็นสัดครั้งแรกขึ้นอยู่กับสายพันธุ์ พันธุกรรม น้ำหนักตัวความสมบูรณ์พันธุ์ การใกล้ชิดกับตัวผู้ และปัจจัยอื่นๆ โดยทั่วไป การเป็นสัดครั้งแรกอยู่ในช่วง 6- 12 เดือน
ดังนั้นอายุที่เหมาะสมแก่การทำหมันคือ 8- 10 เดือน สำหรับสุนัข และ 6-8 เดือน สำหรับแมว เพื่อให้ระบบสืบพันธุ์มีการพัฒนาเต็มที่แล้ว
สำหรับกรณีที่ต้องการเริ่มทำหมันก่อนวัยเจริญพันธุ์ สามารถทำได้ตั้งแต่ 6 เดือนขึ้นไปหรือทำวัคซีนครบแล้ว แต่ถ้าทำหมันในสัตว์ที่อายุน้อยกว่านี้จะมีความเสี่ยงในการวางยาสลบ เนื่องจากการทำงานของระบบต่างๆ ในร่างกายยังไม่สมบูรณ์ [
ทองหล่อเพ็ท]
หมา/แมวเพิ่งออกลุก นานแค่ไหนถึงจะทำหมันได้
เดือนครึ่ง ถึง 2 เดือน
รพ.วิชัยยุทธ ประกาศการจองวัคซีนผ่านแอพลิเคชั่น หมอพร้อม LINK
โรงพยาบาลวิชัยยุทธขอแจ้งประกาศด่วน เรื่อง การจองวัคซีนผ่านแอพลิเคชั่นหมอพร้อม
ขอให้ผู้ต้องการจองวัคซีนกับรพ.วิชัยยุทธ ผ่านแอป หมอพร้อม ที่ได้จองผ่านชื่อ "โรงพยาบาลทั่วไปขนาดใหญ่วิชัยยุทธ" ให้ทำการจองใหม่ในชื่อ "โรงพยาบาลทั่วไปขนาดใหญ่ ศูนย์การแพทย์วิชัยยุทธ" ซึ่งเป็นชื่อที่ถูกกำหนดตามประกาศกระทรวงสาธารณสุขเท่านั้น
โรงพยาบาลปิยะเวชช์ บ่อวินรับสมัคร หลายอัตรา LINK
โรงพยาบาลปิยะเวชช์ บ่อวินรับสมัคร หลายอัตรา
1. พยาบาลวิชาชีพ 6 อัตรา (มีใบประกอบวิชาชีพ)
2. นักรังสีเอกซเรย์ จำนวน 1 อัตรา
3. เจ้าหน้าที่ เทคนิคการแพทย์ 2 อัตรา
4.เภสัชกร 3 อัตรา
5.เจ้าหน้าที่สาธารณสุข 6 อัตรา
6. ผู้ช่วยเภสัชกร 1. อัตรา
7. เจ้าหน้าที่เวชระเบียน 2 อัตรา
8.เจ้าหน้าที่การเงิน/กองทุนทดแทน 2 อัตรา
9. ผู้ช่วยเจ้าหน้าที่นักรังสี 2 อัตรา
10. เจ้าหน้าที่ออกแบบ 1 อัตรา
11. วิศวะโยธา 1 อัตรา
12. เจ้าหน้าที่ยานยนต์ 2 อัตรา
สมัครได้ด้วยตนเอง ที่ฝ่ายทรัพยากรบุคคล ชั้น1 บริเวณด้านหน้าฉุกเฉิน จันทร์-ศุกร์
เวลา 08:00-17:00 น.
โทรศัพท์ 038-345111,038-345333 ต่อ 120
เรียนชงกาแฟ @Yingphaka ญ.ผกา พัทยา LINK
▪️ คอร์ส Cafe owner เรียน 2 วันเต็ม สำหรับผู้ไม่มีพื้นฐาน (เรียนแบบส่วนตัว)
• สนใจเปิดร้านกาแฟ เป็นของตนเอง
• สนใจเปิดร้านคาเฟ่ cafe ในเมืองและต่างจังหวัด
ได้รับ หนังสือทฤษฎีกาแฟ และ สูตรกาแฟ 1 เล่ม
ได้รับ หนังสือเรียนระบบหลังบ้าน-บริหารร้าน 1 เล่ม
ได้รับ หนังสือเรียนตั้งราคา จัดโปรโมชั่นประเภทต่างๆ 1 เล่ม
ได้รับ หนังสือรายการวัตถุดิบและอุปกรณ์ที่ควรมี 1 เล่ม
ได้รับ ประกาศนียบัตร 1 ใบ
▪️ เลือกเรียน ได้ 2 แบบ (ร้อน/เย็น/ปั่น) • 49 เมนู สูตรสร้างสรรค์ • 69 เมนู สูตรสร้างสรรค์
สถานที่เรียน : yingphaka cafe ย่านตลาดใหม่นาเกลือ เมืองพัทยา จังหวัดชลบุรี โทร 093-624-5562 , 096-647-0568 • เพื่อขอคำปรึกษาก่อนสมัครเรียน • เพื่อจองวันเรียน
YL01 ลาดพร้าว
สถานีลาดพร้าว ตั้งอยู่บนพื้นที่ของอาคารจอดแล้วจรสถานีลาดพร้าว ของรถไฟฟ้ามหานคร สายเฉลิมรัชมงคล (MRT สายสีน้ำเงิน)
มีตำแหน่งทางขึ้น - ลง จำนวน 5 จุด
จุดที่ 1. ก่อนถึงแยกรัชดา - ลาดพร้าว (ถนนรัชดาภิเษก ฝั่งขาเข้า)
จุดที่ 2. แยกรัชดา - ลาดพร้าว (ถนนรัชดาภิเษก ฝั่งขาเข้า)
จุดที่ 3. แยกรัชดา - ลาดพร้าว (ถนนรัชดาภิเษก ฝั่งขาออก) *
จุดที่ 4. อาคารจอดแล้วจร (ชั้นที่ 2 และ 4) *
จุดที่ 5. อาคารจอดแล้วจร (ชั้นที่ 2) *
**สามารถเชื่อมต่อกับ
อาคารจอดแล้วจร และเชื่อมต่อไปยังสถานีลาดพร้าว (สถานีใต้ดิน) ของรถไฟฟ้ามหานครสายเฉลิมรัชมงคล (MRT สายสีน้ำเงิน)
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 และ 3
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
1. มหัศจรรย์น้ำตกหมอกเมืองไทย จังหวัดเพชรบูรณ์ ภาคเหนือ
น้ำตกตาดใหญ่ อ.น้ำหนาว จ.เพชรบูรณ์
ถ้าแชมเปี้ยนน้ำตกที่ใหญ่ที่สุดในเมืองไทยคือทีลอซู ตำแหน่งของน้ำตกที่สวยที่สุดของเมืองไทย จะต้องมีชื่อของน้ำตกตาดใหญ่เป็นหนึ่งในผู้ท้าชิง เพราะนี่คือน้ำตกที่ได้ชื่อว่าเป็นมุมอันซีนแห่งใหม่ของเมืองไทย กับทิวทัศน์น่าเหลือเชื่อของหุบเขาน้ำตกขนาดยักษ์ ที่เราสามารถมองเห็นภาพความมหัศจรรย์ของน้ำตกเหนือทะเลหมอก แต่ถ้าใครอยากสัมผัสน้ำตกแห่งนี้อย่างใกล้ชิด ก็สามารถใช้เส้นทางแอดเวนเจอร์ลัดเลาะจากป่าด้านบนสู่เบื้องล่างของน้ำตก รับรองประกันความชุ่มฉ่ำและความสวยงามระดับห้าดาว ช่วงเวลาที่เหมาะสมแก่การท่องเที่ยว คือ เดือนพฤษภาคม - สิงหาคม
ททท.สำนักงานพิษณุโลก เบอร์โทรศัพท์ 0 5525 2742-3 หรือ 0 5525 9907
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนมกราคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนมกราคม 2566 (27/1/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมกราคม 2566 ในภาคตะวันออก ภาคใต้ ภาคกลาง กทม. และปริมณฑล ปรับตัวเพิ่มขึ้นต่อเนื่อง โดยมีปัจจัยสนับสนุนจากจำนวนนักท่องเที่ยวต่างประเทศที่เพิ่มขึ้นเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง นายวุฒิพงศ์ จิตตั้งสกุล ที่ปรึกษาด้านเศรษฐกิจการคลัง สำนักงานเศรษฐกิจการคลัง ในฐานะรองโฆษกกระทรวงการคลัง และนายพิสิทธิ์ พัวพันธ์ ผู้อำนวยการกองนโยบายเศรษฐกิจมหภาค เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมกราคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ สภาอุตสาหกรรมแห่งประเทศไทย และสภาหอการค้าแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมกราคม 2566 ในภาคตะวันออก ภาคใต้ ภาคกลาง กรุงเทพฯ และปริมณฑล ปรับตัวเพิ่มขึ้นต่อเนื่อง โดยมีปัจจัยสนับสนุนจากจำนวนนักท่องเที่ยวต่างประเทศที่เพิ่มขึ้นเป็นสำคัญ” โดยมีรายละเอียดดังนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 83.1 ปรับเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้าและอยู่ในระดับสูงที่สุดในรอบ 51 เดือน แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างประเทศเพิ่มขึ้นต่อเนื่อง ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 82.9 ปรับเพิ่มขึ้นจากเดือนก่อนหน้าและอยู่ในระดับสูงที่สุดในรอบ 66 เดือน แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่เพิ่มขึ้น ประกอบกับการมีจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศที่เพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผลประกอบการที่ดีขึ้น ทำให้ผู้ประกอบการมีแนวโน้มลงทุนเพิ่มขึ้น โดยเฉพาะผู้ประกอบการกลุ่มธุรกิจการท่องเที่ยวและกลุ่มก่อสร้าง ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันตกอยู่ที่ระดับ 80.5 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากคาดว่าจำนวนนักท่องเที่ยวจากทั้งในประเทศและต่างประเทศจะเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 74.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้นอีกทั้งยังมีการจัดงานประเพณีประจำท้องถิ่นในบางพื้นที่ร่วมด้วย และในภาคการลงทุน เนื่องจากผู้ประกอบการภาคบริการมีแนวโน้มจะขยายธุรกิจของตนเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 72.4 ปรับเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากหน่วยงานภาครัฐและเอกชนในพื้นที่จัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้นทำให้จำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้น และในภาคการจ้างงาน เนื่องจากคาดว่าผู้ประกอบการภาคอุตสาหกรรมและบริการในพื้นที่จะจ้างแรงงานเพิ่มขึ้น จากผลประกอบการที่ปรับตัวดีขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 71.9 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างประเทศปรับตัวเพิ่มขึ้นต่อเนื่อง โดยเฉพาะนักท่องเที่ยวจากสาธารณรัฐประชาชนจีนและความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากคาดว่าผู้ประกอบการภาคบริการในพื้นที่มีแนวโน้มจะขยายธุรกิจของตนเพื่อรองรับนักท่องเที่ยวจากต่างประเทศที่มีแนวโน้มเพิ่มขึ้น สำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 59.6 ปรับเพิ่มขึ้นจากเดือนก่อนหน้าแสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมของประชาชนในพื้นที่เพิ่มขึ้น และในภาคบริการจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศที่เพิ่มขึ้น
ตารางสรุปดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนมกราคม 2566
กทม. และปริมณฑล ภาคตะวันออก ภาคตะวันออก
เฉียงเหนือ ภาคใต้ ภาคกลาง ภาคเหนือ ภาคตะวันตก
ดัชนีความเชื่อมั่น
อนาคตเศรษฐกิจภูมิภาค 59.6 83.1 74.3 82.9 72.4 71.9 80.5
ดัชนีแนวโน้มรายภาค
1) ภาคเกษตร 61.6 82.8 73.2 78.2 72.8 71.0 74.1
2) ภาคอุตสาหกรรม 72.0 85.0 67.8 79.7 63.2 55.9 90.1
3) ภาคบริการ 64.0 88.0 83.0 93.7 81.7 84.2 87.6
4) ภาคการจ้างงาน 54.6 78.3 72.6 81.0 72.9 72.2 72.4
5) ภาคการลงทุน 45.8 81.6 74.9 82.0 71.4 76.3 78.4
เดือนมกราคม 2567
รายงานสถานการณ์ประจำ
สัปดาห์ที่ 1 ของปี 2567 (ระหว่างวันที่ 1-7 ม.ค 2567 )
- นักท่องเที่ยวต่างชาติ 605,537 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ อินเดีย
- ภาพรวม ลดลง 184,106 คน (-23.32%) เทียบกับสัปดาห์ก่อนหน้า
สัปดาห์ที่ 2 (ระหว่างวันที่ 8-14 ม.ค 2567 )
- นักท่องเที่ยวต่างชาติ 694,826 คน (+89,289 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 99,261 คน/วัน
- สะสม 1,300,363 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย เกาหลีใต้ รัสเซีย อินเดีย
สัปดาห์ที่ 3 (ระหว่างวันที่ 15-21 ม.ค 2567 )
- นักท่องเที่ยวต่างชาติ 715,579 คน (+20,753 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 102,226 คน/วัน
- สะสม 2,015,942 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย เกาหลีใต้ รัสเซีย อินเดีย
สัปดาห์ที่ 4 (ระหว่างวันที่ 22-28 ม.ค 2567 )
- นักท่องเที่ยวต่างชาติ 727,205 คน (+11,626 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 103,887 คน/วัน
- สะสม 2,743,147 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย เกาหลีใต้ รัสเซีย เและอินเดีย
- สะสม 5 อันดับ ได้แก่ จีน 444,702. มาเลเซีย 300,576. เกาหลีใต้ 203,907. รัสเซีย 197,656. อินเดีย 146,784
สรุปจำนวนนักท่องเที่ยวสะสมประจำเดือนมกราคม 2567
จำนวนนักท่องเที่ยวสะสมประจำเดือนมกราคม 2567
สำหรับเดือนนี้ พบว่ามีจำนวนนักท่องเที่ยวสะสม 3,035,296 คน สร้างรายได้จากการใช้จ่ายของนักท่องเที่ยวต่างชาติแล้วประมาณ 147,922 ล้านบาท โดยจำนวนนักท่องเที่ยว 5 อันดับแรก ได้แก่ จีน (508,563 คน) มาเลเซีย (321,704 คน) , เกาหลีใต้ (222,571 คน) รัสเซีย (219,167 คน) และอินเดีย (162,831 คน)
ข้อมูล ณ วันที่ 1 กุมภาพันธ์ 2567
หมายเหตุ :
1. ข้อมูลจำนวนนักท่องเที่ยวเป็นข้อมูลเบื่องต้นจากสำนักงานตรวจคนเข้าเมือง ซึ่งยังไม่นับรวมนักท่องเที่ยวที่เดินทางเข้าประเทศไทยโดยใช้บัตรผ่านแดน (Border Pass)
2.รายได้ประมาณการจากโครงสร้างค่าใช้จ่ายของนักท่องเที่ยวในอดีต
YL02 ภาวนา
สถานีภาวนา ตั้งอยู่บนถนนลาดพร้าว บริเวณแยกภาวนา
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 41
จุดที่ 2. ซอยลาดพร้าว 41/1
จุดที่ 3. ซอยลาดพร้าว 46
จุดที่ 4. ซอยลาดพร้าว 44
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 3
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
2. ความศิวิไลซ์…แห่งปากน้ำโพ จังหวัดนครสวรรค์ ภาคเหนือ
พาสาน อ.เมือง จ.นครสวรรค์
แลนด์มาร์คแห่งใหม่บริเวณเกาะยม ด้วยดีไซน์สุดล้ำเหมือนหลุดออกมาจากโลกอนาคต ทำให้ “พาสาน” สถาปนาตัวเองขึ้นเป็นหนึ่งในสถาปัตยกรรมที่สวยที่สุดแห่งหนึ่งของเมืองไทยชนิดไม่มีใครกล้าปฏิเสธ นี่คือสัญลักษณ์ของต้นแม่น้ำเจ้าพระยา แหล่งเรียนรู้ประวัติศาสตร์ วัฒนธรรมตลอดจนการส่งเสริมอาชีพ กระตุ้นเศรษฐกิจในปากน้ำโพ เป็นมุมมองที่ทำให้จังหวัดแห่งนี้ ดูเป็นนครแห่งสวรรค์สมกับชื่ออย่างแท้จริง โดยเปิดให้นักท่องเที่ยวเข้าชมทุกวัน และท่องเที่ยวได้ตลอดทั้งปี
ททท.สำนักงานนครสวรรค์ เบอร์โทรศัพท์ 0 5622 1811-2
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนกุมภาพันธ์ 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนกุมภาพันธ์ 2566 (27/2/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนกุมภาพันธ์ 2566 แสดงถึงความเชื่อมั่นในอนาคตที่ยังอยู่ในระดับสูงทุกภูมิภาค โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคกลาง ที่ดัชนีฯ ปรับตัวเพิ่มขึ้นต่อเนื่องจากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนกุมภาพันธ์ 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ สภาอุตสาหกรรมแห่งประเทศไทย และสภาหอการค้าแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนกุมภาพันธ์ 2566 แสดงถึงความเชื่อมั่นในอนาคตที่ยังอยู่ในระดับสูงทุกภูมิภาค โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคกลาง ที่ดัชนีฯ ปรับตัวเพิ่มขึ้นต่อเนื่อง จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ” โดยมีรายละเอียดดังนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 83.4 ปรับเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้าและอยู่ในระดับสูงที่สุดในรอบ 52 เดือน แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากมีจำนวนนักท่องเที่ยวปรับตัวเพิ่มขึ้นต่อเนื่อง ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวต่อเนื่อง และในภาคเกษตร เนื่องจากคาดว่าพืชเศรษฐกิจที่สำคัญจะเข้าสู่ตลาดเพิ่มขึ้น เช่น ลำไย และยางพารา เป็นต้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 82.9 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างชาติเพิ่มขึ้นต่อเนื่อง ประกอบกับมีการจัดกิจกรรมเพื่อดึงดูดนักท่องเที่ยวจากหน่วยงานภาครัฐและเอกชนในพื้นที่ต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผู้ประกอบการภาคบริการบางรายมีแนวโน้มขยายกิจการเพิ่มขึ้น จากผลประกอบการที่ปรับตัวดีขึ้นต่อเนื่อง อย่างไรก็ตาม ภาคอุตสาหกรรมได้รับผลกระทบจากต้นทุนการผลิตที่สูงขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันตกอยู่ที่ระดับ 76.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างชาติเพิ่มขึ้นต่อเนื่อง และในภาคการลงทุน เนื่องจากผลประกอบการที่ปรับตัวดีขึ้น ทำให้ผู้ประกอบการบางรายมีแนวโน้มจะขยายกิจการเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 76.0 ปรับเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้นต่อเนื่อง รวมถึงมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวของหน่วยงานทั้งภาครัฐและเอกชนในพื้นที่ และในภาคการลงทุน เนื่องจากผู้ประกอบการภาคบริการบางรายมีแนวโน้มจะขยายกิจการของตนเพิ่มขึ้น โดยเฉพาะกลุ่มธุรกิจภัตตาคาร ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 74.5 ปรับเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวเพิ่มขึ้นต่อเนื่อง และในภาคการจ้างงาน เนื่องจากคาดว่าผู้ประกอบการภาคอุตสาหกรรมในพื้นที่จะจ้างแรงงานเพิ่มขึ้น จากความต้องการสินค้าอุตสาหกรรมภายในประเทศเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 66.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างประเทศปรับตัวเพิ่มขึ้นต่อเนื่อง จากการที่หลายสายการบินปรับเพิ่มเที่ยวบินระหว่างประเทศ และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากคาดว่าผู้ประกอบการบางรายในพื้นที่มีแนวโน้มจะขยายธุรกิจของตนเพื่อรองรับนักท่องเที่ยวและนักลงทุนจากต่างประเทศ อย่างไรก็ตาม ภาคเกษตรได้รับผลกระทบจากต้นทุนการผลิตที่สูงขึ้น สำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 59.1 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากยอดคำสั่งซื้อสินค้าอุตสาหกรรมเพิ่มขึ้น และในภาคเกษตร เนื่องจากความต้องการสินค้าเกษตรของประชาชนในพื้นที่ปรับตัวเพิ่มขึ้น อย่างไรก็ตาม ภาคบริการได้รับผลกระทบจากค่าแรงที่มีแนวโน้มสูงขึ้น
ตารางสรุปดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนกุมภาพันธ์ 2566
กทม. และปริมณฑล ภาคตะวันออก ภาคตะวันออก
เฉียงเหนือ ภาคใต้ ภาคกลาง ภาคเหนือ ภาคตะวันตก
ดัชนีความเชื่อมั่น
อนาคตเศรษฐกิจภูมิภาค 59.1 83.4 76.0 82.9 74.5 66.3 76.6
ดัชนีแนวโน้มรายภาค
1) ภาคเกษตร 63.2 85.1 70.2 75.8 73.5 62.7 72.3
2) ภาคอุตสาหกรรม 69.7 83.5 74.9 76.2 68.7 61.1 70.4
3) ภาคบริการ 61.7 88.0 84.8 94.0 83.4 75.3 86.1
4) ภาคการจ้างงาน 54.8 80.7 72.9 81.5 74.3 65.9 76.8
5) ภาคการลงทุน 46.2 79.9 77.4 86.9 72.7 66.3 77.4
เดือนกุมภาพันธ์ 2567
รายงานสถานการณ์ประจำ
สัปดาห์ที่ 5 ของปี 2567 (ระหว่างวันที่ 29 ม.ค - 4 ก.พ.2567 )
- นักท่องเที่ยวต่างชาติ 770,008 คน (+42,803 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 110,002 คน/วัน
- สะสม 3,513,155 คน
- สร้างรายได้ประมาณ 170,411 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ อินเดีย
สัปดาห์ที่ 6 (ระหว่างวันที่ 5-11 ก.พ.2567)
- นักท่องเที่ยวต่างชาติ 872,235 คน (+102,227 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 124,605 คน/วัน
- สะสม 4,385,390 คน
- สร้างรายได้ประมาณ 215,147 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ อินเดีย
สัปดาห์ที่ 7 (ระหว่างวันที่ 12-18 ก.พ.2567)
- นักท่องเที่ยวต่างชาติ 831,989 คน (-40,246 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 118,856 คน/วัน
- สะสม 5,217,379 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย เกาหลีใต้ รัสเซีย อินเดีย
สัปดาห์ที่ 8 (ระหว่างวันที่ 19-25 ก.พ.2567)
- นักท่องเที่ยวต่างชาติ 763,855 คน (-68,134 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 109,123 คน/วัน
- สะสม 5,981,234 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เเกาหลีใต้ และอินเดีย
- สะสม 5 อันดับ ได้แก่ จีน 1,114,316. มาเลเซีย 759,828. รัสเซีย 397,006. เกาหลีใต้ 387,745. อินเดีย 293,129
นักท่องเที่ยวสะสมประจำเดือนกุมภาพันธ์ 2567
YL03 โชคชัย 4
สถานีโชคชัย 4
ตั้งอยู่บนถนนลาดพร้าว บริเวณแยกโชคชัย 4 มีตำแหน่งทางขึ้น - ลง จำนวน 5 จุด ได้แก่
จุดที่ 1. ซอยลาดพร้าว 53/1
จุดที่ 2. ซอยลาดพร้าว 55
จุดที่ 3. ซอยลาดพร้าว 58
จุดที่ 4. ซอยลาดพร้าว 56
จุดที่ 5. ถนนโชคชัย 4
สถานีโชคชัย 4 ในส่วนของลิฟต์, ทางลาด และบันไดเลื่อน จะอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2, 3 และ 5
3. นมัสการพระใหญ่…ลมหายใจแห่งไดบุตสึ จ.ลำปาง ภาคเหนือ
วัดพระธาตุดอยพระฌาน อ.แม่ทะ จ.ลำปาง
แลนด์มาร์คแห่งใหม่ของลำปาง เป็นวัดที่มีสถาปัตยกรรมด้านพุทธศิลป์ที่งดงาม ตั้งอยู่บนยอดดอยพระฌาน นอกจากนักท่องเที่ยวจะได้มาสักการะองค์พระธาตุแล้ว ยังสามารถแวะชมความงามของพระอาทิตย์ขึ้นท่ามกลางทะเลหมอกยามเช้า ก่อนที่จะไปแขวนกระดิ่งขอพรจากพระพุทธรูปไดบุตสึหรือหลวงพ่อโตจำลองพระพุทธรูปองค์ยักษ์ที่มีใบหน้าเข้มขลังค์ แถมยังมากไปด้วยพลังศรัทธาในฉบับของแดนอาทิตย์อุทัย สามารถเดินทางมาขอพรได้ตลอดทั้งปี
ททท.สำนักงานลำปาง เบอร์โทรศัพท์ 0 5422 2214-5
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนมีนาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนมีนาคม 2566 (30/3/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมีนาคม 2566 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้าในภาคใต้ ภาคตะวันออก ภาคตะวันตก ภาคตะวันออกเฉียงเหนือ และภาคเหนือ โดยมีปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมีนาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมีนาคม 2566 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้าในภาคใต้ ภาคตะวันออก ภาคตะวันตก ภาคตะวันออกเฉียงเหนือ และภาคเหนือ โดยมีปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ” โดยมีรายละเอียดดังนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 84.0 ปรับเพิ่มขึ้นจากเดือนก่อนหน้า และอยู่ในระดับสูงที่สุดในรอบ 68 เดือน แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้นต่อเนื่อง ประกอบกับมีโครงการเราเที่ยวด้วยกัน เฟส 5 และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น จากการที่ผู้ประกอบการในพื้นที่มีแนวโน้มที่จะลงทุนเพิ่มขึ้น โดยเฉพาะผู้ประกอบการภาคบริการ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 83.6 ปรับเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า และอยู่ในระดับสูงที่สุดในรอบ 53 เดือน แสดงถึงความเชื่อมั่นเศรษฐกิจในอนาคตที่เพิ่มขึ้น โดยเป็นความเชื่อมั่นที่ดีขึ้นในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้นประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากความต้องการสินค้าอุตสาหกรรมปรับตัวเพิ่มขึ้น โดยเฉพาะกลุ่มอาหารแปรรูป ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 85.8 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและอุตสาหกรรม ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 77.2 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากคาดว่าโครงการเราเที่ยวด้วยกัน เฟส 5 จะทำให้จำนวนนักท่องเที่ยวปรับตัวเพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคเกษตรในอนาคตที่ดีขึ้น เนื่องจากความต้องการสินค้าเกษตรเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มปศุสัตว์ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 76.2 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานในพื้นที่ต่อเนื่อง และในภาคการลงทุน เนื่องจากผู้ประกอบการมีแนวโน้มจะขยายธุรกิจของตนเพิ่มขึ้น โดยเฉพาะกลุ่มธุรกิจโรงแรมและภัตตาคาร ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 76.1 ปรับเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากยอดคำสั่งซื้อสินค้าอุตสาหกรรมเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มแปรรูปทางการเกษตร และในภาคเกษตร เนื่องจากจะเข้าสู่ฤดูการเก็บเกี่ยวพืชเศรษฐกิจที่สำคัญ อาทิ ข้าว ลิ้นจี่ และลำไย ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 69.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวในประเทศเพิ่มขึ้น จากโครงการเราเที่ยวด้วยกัน เฟส 5 และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น โดยผู้ประกอบการในพื้นที่มีแนวโน้มจะขยายธุรกิจของตนเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 58.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมปรับตัวเพิ่มขึ้น และในภาคบริการจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศที่เพิ่มขึ้น อย่างไรก็ดี ผู้ประกอบการบางรายยังมีความกังวลต่ออัตราแลกเปลี่ยนและราคาพลังงานที่มีความผันผวน
เดือนมีนาคม 2567
รายงานสถานการณ์ประจำ
สัปดาห์ที่ 9 ของปี 2567 (ระหว่างวันที่ 26 ก.พ. - 3 มี.ค. 2567 )
- นักท่องเที่ยวต่างชาติ 749,680 คน (-14,175 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 107,098 คน/วัน
- สะสม 6,730,914 คน
- สร้างรายได้ประมาณ 326,034 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ อินเดีย
สัปดาห์ที่ 10 (ระหว่างวันที่ 4-10 มี.ค. 2567)
- นักท่องเที่ยวต่างชาติ 698,675 คน (-51,005 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 99,811 คน/วัน
- สะสม 7,429,589 คน
- สร้างรายได้ประมาณ 359,273 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ อินเดีย
สัปดาห์ที่ 11 (ระหว่างวันที่ 11-17 มี.ค. 2567)
- นักท่องเที่ยวต่างชาติ 645,062 คน (-53,613 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 92,152 คน/วัน
- สะสม 8,074,651 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย เกาหลีใต้ รัสเซีย อินเดีย
สัปดาห์ที่ 12 (ระหว่างวันที่ 18-24 มี.ค. 2567)
- นักท่องเที่ยวต่างชาติ 651,318 คน (+6,256 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 93,046 คน/วัน
- สะสม 8,725,969 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย เกาหลีใต้ และอินเดีย
สัปดาห์ที่ 13 (ระหว่างวันที่ 25-31 มี.ค. 2567)
- นักท่องเที่ยวต่างชาติ 644,328 คน (-6,990 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 92,047 คน/วัน
- สะสม 9,370,397 คน
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย อินเดีย สหราชอาณาจักร
จำนวนนักท่องเที่ยวสะสม 1 มกราคม - 31 มีนาคม 2567
จำนวนนักท่องเที่ยวสะสม 1 มกราคม - 31 มีนาคม 2567 พบว่ามีจำนวนนักท่องเที่ยวสะสม 9,370,297 คน สร้างรายได้จากการใช้จ่ายของนักท่องเที่ยวต่างชาติแล้วประมาณ 454,653 ล้านบาท โดยจำนวนนักท่องเที่ยว 5 อันดับแรก ได้แก่ จีน (1,756,337 คน) มาเลเซีย (1,168,574 คน) , รัสเซีย (622,813 คน) เกาหลีใต้ (558,873 คน) และอินเดีย (472,952 คน)
ข้อมูล ณ วันที่ 1 เมษายน 2567
หมายเหตุ :
1. ข้อมูลจำนวนนักท่องเที่ยวเป็นข้อมูลเบื้องต้นจากสำนักงานตรวจคนเข้าเมือง ซึ่งยังไม่นับรวมนักท่องเที่ยวที่เดินทางเข้าประเทศไทยโดยใช้บัตรผ่านแดน (Border Pass)
2.รายได้ประมาณการจากโครงสร้างค่าใช้จ่ายของนักท่องเที่ยวในอดีต
เศรษฐกิจการท่องเที่ยวไทย ในช่วง 3 เดือนแรกของปี 2567 LINK
“เศรษฐกิจการท่องเที่ยวไทย ในช่วง 3 เดือนแรกของปี 2567 ประเทศไทยมีจำนวนนักท่องเที่ยวชาวต่างชาติ 9,370,319 คน และนักท่องเที่ยวไทยเที่ยวไทย 49.08 ล้านคน - ครั้ง ส่งผลให้เกิดมูลค่าการใช้จ่ายของนักท่องเที่ยว 686,451 ล้านบาท”
มูลค่าผลิตภัณฑ์มวลรวมภายในประเทศด้านการท่องเที่ยว (Tourism GDP) ในไตรมาสแรกของปี 2567 มีมูลค่า 697,383 ล้านบาท ขยายตัวร้อยละ 5.51 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.57 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY) ซึ่งคิดเป็นสัดส่วนร้อยละ 15.11 ของเศรษฐกิจประเทศ
มูลค่าการใช้จ่ายของนักท่องเที่ยวทั้งหมดในไตรมาสแรกของปี 2567 มีมูลค่า 686,451 ล้านบาท ขยายตัวร้อยละ 7.02 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.87 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY)
มูลค่าผลผลิตรวมของอุตสาหกรรมการท่องเที่ยว ในไตรมาสแรกของปี 2567 มีมูลค่า 291,089 ล้านบาท ขยายตัวร้อยละ 5.61 เมื่อเทียบกับไตรมาสก่อนหน้า (%QoQ) และขยายตัวร้อยละ 28.17 เมื่อเทียบกับไตรมาสแรกของปี 2566 (%YoY) โดยสาขาอุตสาหกรรมการท่องเที่ยวที่มีมูลค่าผลผลิตมากที่สุด 5 อันดับแรก ได้แก่ (1) ที่พักแรมสำหรับผู้เยี่ยมเยือน (2) อุตสาหกรรมการบริการอาหารและเครื่องดื่ม (3) การจำหน่ายปลีกสินค้าท่องเที่ยวของประเทศ (4) อุตสาหกรรมการบริการเพื่อการท่องเที่ยวอื่นๆ ของประเทศ และ (5) อุตสาหกรรมด้านวัฒนธรรม
YL04 ลาดพร้าว 71
สถานีลาดพร้าว 71 ตั้งอยู่บนถนนลาดพร้าว บริเวณทางแยกก่อนถึงจุดตัดถนนประดิษฐ์มนูธรรม
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 69
จุดที่ 2. ซอยลาดพร้าว 71
จุดที่ 3. ซอยลาดพร้าว 84
จุดที่ 4. ซอยลาดพร้าว 80/3
ในส่วนของสถานีลาดพร้าว 71 มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 และ 3 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 และ 4
4. ตระการตาแห่งสีสัน…มหัศจรรย์ทะเลโคม จ.ลำพูน ภาคเหนือ
วัดพระธาตุหริภุญชัย อ.เมือง จ.ลำพูน
วัดเก่าแก่ที่มีตำนานสืบเนื่องมากว่า 1,300 ปี มีศาสนสถานสำคัญมากมายภายในวัด ทั้งประตูโขง ราชสีห์คู่ วิหารหลวง องค์พระธาตุหริภุญชัย ปทุมวดีเจดีย์ หอระฆัง เขาพระสุเมรุจำลอง และยังเป็นวัดที่มีกิจกรรมหลากหลายตลอดทั้งปี โดยเฉพาะเทศกาลโคมแสนดวงเมืองลำพูน ถือเป็นช่วงเวลาพิเศษที่ชาวบ้านและนักท่องเที่ยว จะได้มีโอกาสถวายโคมสีสวยแด่องค์พระธาตุหริภุญชัย ซึ่งเมื่อเรามองไปยังทะเลโคมนับแสนที่แขวนอยู่ จะสามารถรับรู้ได้ถึงพลังศรัทธาที่ยิ่งใหญ่และสวยงาม นักท่องเที่ยวสามารถเดินทางมากราบสักการะพระธาตุได้ตลอดทั้งปี
ททท.สำนักงานลำปาง เบอร์โทรศัพท์ 0 5422 2214-5
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนเมษายน 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนเมษายน 2566 (25/4/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนเมษายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่จะปรับตัวดีขึ้นในทุกภูมิภาค นำโดยภาคใต้ และภาคตะวันออก โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ซึ่งได้รับปัจจัยสนับสนุนจากภาคบริการเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนเมษายน 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า "ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนเมษายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่จะปรับตัวดีขึ้นในทุกภูมิภาค นำโดยภาคใต้ และภาคตะวันออก โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ซึ่งได้รับปัจจัยสนับสนุนจากภาคบริการเป็นสำคัญ" โดยมีรายละเอียดดังนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 83.5 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวเพิ่มขึ้นต่อเนื่อง ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวอย่างต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากคาดว่ายอดคำสั่งซื้อสินค้าอุตสาหกรรมจากประเทศคู่ค้าปรับตัวเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มผลิตภัณฑ์ยางพารา ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 82.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการเนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานทั้งภาครัฐและเอกชนในพื้นที่ต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากมีแนวโน้มความต้องการสินค้าอุตสาหกรรมปรับตัวเพิ่มขึ้น โดยเฉพาะกลุ่มสินค้าเครื่องใช้ไฟฟ้าและอุปกรณ์อิเล็กทรอนิกส์ ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 84.3 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและอุตสาหกรรมเช่นกัน ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 77.5 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากคาดว่ายอดคำสั่งซื้อสินค้าอุตสาหกรรมจากคู่ค้าในประเทศเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มอุปกรณ์อิเล็กทรอนิกส์และสินค้าเกษตรแปรรูป และความเชื่อมั่นเศรษฐกิจภาคบริการในอนาคตที่ดีขึ้น เนื่องจากจำนวนนักท่องเที่ยวปรับตัวเพิ่มขึ้นต่อเนื่อง โดยเฉพาะจากนักท่องเที่ยวไทยตามโครงการเราเที่ยวด้วยกัน เฟส 5 ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 77.4 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักเที่ยวปรับตัวเพิ่มขึ้น ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานทั้งภาครัฐและเอกชนในพื้นที่ต่อเนื่อง และในภาคการลงทุน เนื่องจากผู้ประกอบการภาคบริการบางรายมีแนวโน้มที่จะขยายกิจการของตนเพิ่มขึ้น โดยเฉพาะกลุ่มธุรกิจภัตตาคาร ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 76.8 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวปรับตัวเพิ่มขึ้น ประกอบกับมีโครงการเราเที่ยวด้วยกัน เฟส 5 และในภาคการลงทุน เนื่องจากผลประกอบการที่ปรับตัวดีขึ้น ทำให้ผู้ประกอบการบางรายมีแนวโน้มจะขยายกิจการเพิ่มขึ้นดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 71.9 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานทั้งภาครัฐและเอกชนในพื้นที่ต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น จากการที่ผู้ประกอบการบางรายมีแนวโน้มที่จะขยายกิจการของตนเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 60.9 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากคาดว่ายอดคำสั่งซื้อจากคู่ค้าในประเทศปรับตัวเพิ่มขึ้น และในภาคบริการจากจำนวนนักท่องเที่ยวเพิ่มขึ้นต่อเนื่อง อย่างไรก็ดี ผู้ประกอบการบางรายมีความกังวลต่ออัตราค่าไฟฟ้าที่อยู่ในระดับสูง
เดือนเมษายน 2567
สัปดาห์ที่ 14 (ระหว่างวันที่ 1-7 เม.ย. 2567)
- นักท่องเที่ยวต่างชาติ 617,832 คน (-26,496 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 88,262 คน/วัน
- สะสม 9,998,151 คน
- สร้างรายได้ประมาณ 484,485 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย รัสเซีย อินเดีย เกาหลีใต้
สัปดาห์ที่ 15 (ระหว่างวันที่ 8-14 เม.ย. 2567)
- นักท่องเที่ยวต่างชาติ 735,802 คน (+117,970 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 105,115 คน/วัน
- สะสม 10,723,953 คน
- สร้างรายได้ประมาณ 518,036 ล้านบาท
- 5 อันดับแรกได้แก่ จีน อินเดีย รัสเซีย เกาหลีใต้ มาเลเซีย
- เนื่องจากเป็นสัปดาห์วันหยุดต่อเนื่องของประเทศมุสลิม จึงมีนักท่องเที่ยวมุสลิมเพิ่มขึ้นกว่า 96,000 คน โดยเฉพาะมาเลเซีย มาเป็นอันดับ 1 (78,297 คน เพิ่มจากสัปดาห์ก่อนหน้า)
สัปดาห์ที่ 16 (ระหว่างวันที่ 15-21 เม.ย. 2567)
- นักท่องเที่ยวต่างชาติ 572,809 คน (-180,993 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 81,830 คน/วัน
- สะสม 11,296,762 คน
- สร้างรายได้ประมาณ 544,861 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย รัสเซีย ลาว
สัปดาห์ที่ 17 (ระหว่างวันที่ 22-28 เม.ย. 2567)
- นักท่องเที่ยวต่างชาติ 652,241 คน (+79,432 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 93,178 คน/วัน
- สะสม 11,949,003 คน
- สร้างรายได้ประมาณ 575,322 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย รัสเซีย เกาหลีใต้
นักท่องเที่ยวสะสมประจำเดือนเมษายน 2567
YL05 ลาดพร้าว 83
สถานีลาดพร้าว 83 ตั้งอยู่ บนถนนลาดพร้าว บริเวณซอยลาดพร้าว 83
อยู่ใกล้กับห้างสรรพสินค้าอิมพิเรียลเวิล์ด ลาดพร้าว
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 83
จุดที่ 2. ซอยลาดพร้าว 85
จุดที่ 3. ซอยลาดพร้าว 102
จุดที่ 4. ซอยลาดพร้าว 98/1
ลิฟต์ - ทางลาด - บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 3
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
5. ธรรม…ในถ้ำ จ.น่าน ภาคเหนือ [คัดเลือกโดยผู้ทรงคุณวุฒิ]
พุทธสถานถ้ำเชตวัน อ.นาน้อย จ.น่าน
ท่ามกลางหุบเขาอันเงียบสงบของอำเภอนาน้อย สถานที่แห่งนี้คือบริเวณที่ “ครูบาน้อย” เกจิชื่อดัง เดินทางเข้าไปปฏิบัติธรรมอยู่ในถ้ำเป็นเวลาถึง 3 ปี ส่งผลให้พุทธสถานถ้ำเชตวัน กลายเป็นหมุดหมายของนักเดินทางสายบุญ ที่ต่างแวะเวียนกันมาค้นหาปริศนาธรรมในถ้ำ ทั้งศึกษาและปฏิบัติ หลายคนตั้งใจมาสักการะองค์พระธาตุอินแขวน รวมถึงขอพรจากพระเจ้าทันใจ โดยสามารถท่องเที่ยวได้ตลอดทั้งปี
ททท.สำนักงานน่าน เบอร์โทรศัพท์ 0 5471 1217-8
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนพฤษภาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI) ประจำเดือนพฤษภาคม 2566 (29/5/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนพฤษภาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่จะปรับตัวดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ภาคตะวันตก ภาคตะวันออกเฉียงเหนือ ภาคกลาง ที่ความเชื่อมั่นเพิ่มขึ้นต่อจากเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนพฤษภาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า "ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนพฤษภาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่จะปรับตัวดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ภาคตะวันตก ภาคตะวันออกเฉียงเหนือ ภาคกลาง ที่ความเชื่อมั่นเพิ่มขึ้นต่อจากเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ" โดยมีรายละเอียดดังนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 82.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการเนื่องจากมีจำนวนนักท่องเที่ยวเพิ่มขึ้นต่อเนื่อง ประกอบกับในพื้นที่มีการประชาสัมพันธ์และจัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากมีความต้องการสินค้าอุตสาหกรรมเพิ่มขึ้น อาทิ ยานยนต์และเครื่องปรับอากาศ ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 87.1 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและอุตสาหกรรมเช่นกัน ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 82.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากความต้องการสินค้าอุตสาหกรรมภายในประเทศเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มผลิตภัณฑ์ยางพาราและอาหารทะเลแปรรูป ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 78.7 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากคาดว่าจำนวนนักท่องเที่ยวเพิ่มขึ้นต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากคาดว่ายอดคำสั่งซื้อสินค้าอุตสาหกรรมจากคู่ค้าต่างประเทศจะเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 78.0 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมภายในประเทศเพิ่มขึ้น และในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 74.1 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานรัฐและเอกชนในพื้นที่เพิ่มขึ้น และในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมภายในประเทศเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มเกษตรแปรรูป ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 71.7 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากคาดว่าจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้นต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคการจ้างงานในอนาคตที่ดีขึ้น จากการที่ผู้ประกอบการบางรายขยายกิจการของตน ทำให้เกิดการจ้างงานเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 61.3 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมของประชาชนในพื้นที่เพิ่มขึ้น และในภาคบริการจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศที่เพิ่มขึ้น อย่างไรก็ดี ผู้ประกอบการบางรายมีความกังวลต่ออัตราแลกเปลี่ยนเงินตราต่างประเทศที่มีความผันผวน
กองนโยบายเศรษฐกิจมหภาค สำนักงานเศรษฐกิจการคลัง
โทร. 0-2273-9020 ต่อ 3254
เดือนพฤษภาคม 2567
สัปดาห์ที่ 18 (ระหว่างวันที่ 29 เม.ย. - 5 พ.ค. 2567)
- นักท่องเที่ยวต่างชาติ 639,822 คน (-12,419 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 91,403 คน/วัน
- สะสม 12,588,825 คน
- สร้างรายได้ประมาณ 605,201 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 19 (ระหว่างวันที่ 6-12 พ.ค. 2567)
- นักท่องเที่ยวต่างชาติ 569,172 คน (-70,650 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 81,310 คน/วัน
- สะสม 13,157,997 คน
- สร้างรายได้ประมาณ 631,249 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เวียดนาม เกาหลีใต้
สัปดาห์ที่ 20 (ระหว่างวันที่ 13-19 พ.ค. 2567)
- นักท่องเที่ยวต่างชาติ 571,958 คน (+2,786 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 81,708 คน/วัน
- สะสม 13,729,955 คน
- สร้างรายได้ประมาณ 657,053 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ ลาว
สัปดาห์ที่ 21 (ระหว่างวันที่ 20-26 พ.ค. 2567)
- นักท่องเที่ยวต่างชาติ 596,552 คน (+24,595 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 85,222 คน/วัน
- สะสม 14,326,507 คน
- สร้างรายได้ประมาณ 682,975 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ ลาว
สัปดาห์ที่ 22 (ระหว่างวันที่ 27 พ.ค. - 2 มิ.ย. 2567)
- นักท่องเที่ยวต่างชาติ 624,499 คน (+27,947 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 89,215 คน/วัน
- สะสม 14,951,006 คน
- สร้างรายได้ประมาณ 709,340 ล้านบาท
- 5 อันดับแรกได้แก่ มาเลเซีย จีน อินเดีย เกาหลีใต้ เวียดนาม
นักท่องเที่ยวสะสมประจำเดือนพฤษภาคม 2567
YL06 มหาดไทย
สถานีมหาดไทย ตั้งอยู่บนถนนลาดพร้าว บริเวณซอยลาดพร้าว 95 อยู่ใกล้กับโรงพยาบาลลาดพร้าว
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 95
จุดที่ 2. โรงพยาบาลลาดพร้าว
จุดที่ 3. ถัดจากซอยลาดพร้าว 122
จุดที่ 4. ถัดจากซอยลาดพร้าว 120
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 3
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
6. ธรรมะแกลลอรี่…คอมมูนิตี้กลางหุบเขา จ.สระบุรี ภาคกลาง
หอมนสิการ อ.แก่งคอย จ.สระบุรี
สถานที่ท่องเที่ยวเชิงวัฒนธรรมรูปแบบใหม่ สร้างขึ้นจากศรัทธาและแรงบันดาลที่มีต่อพุทธศาสนา ภายในตัวอาคารสีขาวบริสุทธิ์ที่ซ่อนตัวอยู่กลางหุบเขา ประกอบด้วยกิจกรรมที่หลากหลาย อาทิ สักการะพระบรมสารีริกธาตุ 18 พระองค์ ชมภาพปักพระบรมโลกนาถ สัมผัสความงามของหอจัตุรัสอันศักดิ์สิทธิ์ และยังมีโซนนิทรรศการร่วมสมัยที่บอกเล่าความเป็นมาเป็นไปของพระพุทธเจ้า รวมถึงห้องจัดแสดงงานอาร์ตประเภทต่างๆ ที่แฝงไว้ด้วยปริศนาธรรม ส่วนผู้ที่มาก็จะได้ซึมซับหลักธรรมแบบครบรส ทั้งตาดู หูฟัง สมองคิด และกายปฏิบัติ ถือเป็นธรรมะคอมมูนิตี้แบบครบวงจรอย่างแท้จริง
ททท.สำนักงานพระนครศรีอยุธยา เบอร์โทรศัพท์ 0 3524 6076-7
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนมิถุนายน 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนมิถุนายน 2566 (29/6/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมิถุนายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ยังมีทิศทางที่ดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ภาคตะวันออกเฉียงเหนือ ภาคเหนือ และกทม. และปริมณฑล ที่ความเชื่อมั่นยังเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนมิถุนายน 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า "ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนมิถุนายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ยังมีทิศทางที่ดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในเขตพัฒนาพิเศษภาคตะวันออก (EEC) ภาคตะวันออกเฉียงเหนือ ภาคเหนือ และกทม. และปริมณฑล ที่ความเชื่อมั่นยังเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคอุตสาหกรรมเป็นสำคัญ"
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 81.5 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการเนื่องจากหน่วยงานภาครัฐและเอกชนในพื้นที่จัดกิจกรรมส่งเสริมการท่องเที่ยวอย่างต่อเนื่อง ประกอบกับคาดว่าจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศจะเพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผู้ประกอบการในภาคบริการบางรายมีแนวโน้มจะลงทุนขยายกิจการเพิ่มขึ้น ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 88.1 เพิ่มขึ้นจากเดือนก่อนหน้า โดยได้รับปัจจัยสนับสนุนจากภาคบริการและอุตสาหกรรมเป็นสำคัญ อย่างไรก็ตาม เกษตรกรในภาคตะวันออกมีความกังวลต่อสภาพอากาศที่คาดว่าจะไม่เอื้ออำนวยต่อการเพาะปลูก ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 79.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวต่างประเทศที่เพิ่มขึ้น ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากยอดคำสั่งซื้อสินค้าอุตสาหกรรมเพิ่มขึ้น โดยเฉพาะสินค้ากลุ่มผลิตภัณฑ์จากยางพาราและอาหารทะเลแปรรูป อย่างไรก็ตาม เกษตรกรในภาคใต้บางรายมีความกังวลต่อสภาพอากาศที่มีความแปรปรวน ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 79.1 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากหน่วยงานภาครัฐและเอกชนในพื้นที่จัดกิจกรรมส่งเสริมการท่องเที่ยวอย่างต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากคาดว่าความต้องการสินค้าอุตสาหกรรมในพื้นที่เพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคเหนืออยู่ที่ระดับ 75.4 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมในพื้นที่เพิ่มขึ้น โดยเฉพาะกลุ่มสินค้าอาหารแปรรูป และในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้น ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเฉพาะกลุ่มเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 75.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวในประเทศเพิ่มขึ้น และในภาคอุตสาหกรรม เนื่องจากคาดว่าความต้องการสินค้าอุตสาหกรรมในพื้นที่เพิ่มขึ้น อย่างไรก็ตาม ผลผลิตในภาคเกษตรลดลงเล็กน้อย จากสภาพอากาศที่แปรปรวน ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 71.4 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและเอกชนในพื้นที่เพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากความต้องการสินคาอุตสาหกรรมในพื้นที่เพิ่มขึ้น โดยเฉพาะกลุ่มสินค้าเกษตรแปรรูป อย่างไรก็ตาม เกษตรกรในภาคกลางมีความกังวลต่อปริมาณน้ำที่คาดว่าจะไม่เพียงพอต่อการเพาะปลูกในอนาคต ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของ กทม. และปริมณฑลอยู่ที่ระดับ 61.4 ปรับตัวเพิ่มขึ้นจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมจากอุปสงค์ในประเทศเพิ่มขึ้น และในภาคเกษตร เนื่องจากสภาพอากาศยังเอื้ออำนวยต่อการเพาะปลูก อย่างไรก็ดี ผู้ประกอบการบางรายมีความกังวลต่อความผันผวนของเศรษฐกิจโลก
เดือนมิถุนายน 2567
- นักท่องเที่ยวต่างชาติ 592,338 คน (-32,161 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 84,620 คน/วัน
- สะสม 15,543,344 คน
- สร้างรายได้ประมาณ 736,096 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ สิงคโปร์
สัปดาห์ที่ 24 (ระหว่างวันที่ 10-16 มิ.ย. 2567 )
- นักท่องเที่ยวต่างชาติ 657,362 คน (+65,024 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 93,909 คน/วัน
- สะสม 16,200,706 คน
- สร้างรายได้ประมาณ 765,584 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย สิงคโปร์ เกาหลีใต้
สัปดาห์ที่ 25 (ระหว่างวันที่ 17 - 23 มิ.ย. 2567 )
- นักท่องเที่ยวต่างชาติ 640,747 คน (-16,615 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 91,536 คน/วัน
- สะสม 16,841,453 คน
- สร้างรายได้ประมาณ 795,002 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ เวียดนาม
สัปดาห์ที่ 26 (ระหว่างวันที่ 24 - 30 มิ.ย. 2567 )
- นักท่องเที่ยวต่างชาติ 659,830 คน (+19,083 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 94,262 คน/วัน
- สะสม 17,501,283 คน
- สร้างรายได้ประมาณ 825,541 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ ไต้หวัน
นักท่องเที่ยวสะสมประจำเดือนมิถุนายน 2567
YL07 ลาดพร้าว 101
สถานีลาดพร้าว 101 ตั้งอยู่บนถนนลาดพร้าว บริเวณซอยลาดพร้าว 101 ถึง ซอยลาดพร้าว 101/1
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 101
จุดที่ 2. ซอยลาดพร้าว 101/1
จุดที่ 3. ซอยลาดพร้าว 128/3
จุดที่ 4. ซอยลาดพร้าว 128/1
ในส่วนของสถานีลาดพร้าว 101 มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 และ 3
7. ผจญภัยในถ้ำโบ้…สำรวจถ้ำแห่งเขาอีบิด จ.เพชรบุรี ภาคกลาง
ถ้ำโบ้ บ้านคีรีวงศ์ อ.เขาย้อย จ.เพชรบุรี
ถ้าใครผ่านมาเที่ยวแถวเขาอีบิด อาจเคยสังเกตเห็นรูโบ๋ชัดเด่นเป็นสง่าบริเวณกลางลำตัวของภูเขา นั่นแหละครับ “ถ้ำโบ้” ถ้ำขนาดกำลังน่าเที่ยว อยู่บนเขาอีบิด ทางเข้าถ้ำเป็นโพรงกว้าง ภายในเป็นถ้ำตื้น โถงถ้ำสูงโปร่ง มีหินงอกหินย้อยที่เกิดขึ้นตามธรรมชาติสวยงาม อากาศถ่ายเทเย็นสบาย จากในถ้ำเมื่อมองลอดโพรงออกไปด้านหน้า จะเห็นทิวทัศน์ของ อ.เขาย้อย จ.เพชรบุรี และ อ.ปากท่อ จ.ราชบุรี ได้อย่างกว้างไกลและสวยงาม ส่วนด้านหลังถ้ำมีลานกว้าง เป็นจุดชมวิวดูทิวต้นตาล…ซิกเนเจอร์เมืองเพชร และยังเป็นจุดชมดวงอาทิตย์ขึ้นและตกที่งดงาม เหมาะกับคนที่อยากได้รูปมุมใหม่ๆ ในเมืองเพชร หรือนักท่องเที่ยวสายผจญภัยที่อยากพิชิตถ้ำใหม่ใกล้เมืองกรุงฯ ช่วงเวลาที่เหมาะสมในการเดินชมถ้ำ คือ 05.00 – 17.00 น. (ไม่แนะนำให้เดินทางท่องเที่ยวในช่วงฤดูฝน เนื่องจากทางเดินขึ้นถ้ำมีความลาดชัน และทางเดินภายในถ้ำลื่นมาก อาจเกิดอันตรายหรืออุบัติเหตุได้ หากไม่ระมัดระวัง)
ททท.สำนักงานเพชรบุรี เบอร์โทรศัพท์0 3247 1005-6
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนกรกฎาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนกรกฎาคม 2566 (26/7/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนกรกฎาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่ดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยว่า ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนกรกฎาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า "ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคเดือนกรกฎาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้า ที่ดีขึ้นในทุกภูมิภาค โดยเฉพาะอย่างยิ่งในภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ"
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 81.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการเนื่องจากคาดว่าจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศจะเพิ่มขึ้นต่อเนื่อง ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่ต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผู้ประกอบการมีแนวโน้มจะขยายกิจการของตนเองมากขึ้น โดยเฉพาะในเขตพัฒนาพิเศษภาคตะวันออก ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 85.2 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 79.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่มีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้นต่อเนื่อง ประกอบกับบางพื้นที่มีการจัดงานประเพณีประจำท้องถิ่น และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผู้ประกอบการภาคบริการในพื้นที่มีแนวโน้มจะขยายกิจการของตนเองมากขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 77.8 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากคาดว่าจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศจะเพิ่มขึ้นต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากผู้ประกอบการภาคอุตสาหกรรมในพื้นที่แนวโน้มจะขยายกิจการของตนเองมากขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคเหนืออยู่ที่ระดับ 76.0 ปรับตัวเพิ่มขึ้นต่อเนื่องจากเดือนก่อนหน้า สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคอุตสาหกรรม เนื่องจากมีการผลิตสินค้าอุตสาหกรรมเพิ่มขึ้น โดยเฉพาะกลุ่มสินค้าผลไม้แปรรูป และในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้นต่อเนื่อง ประกอบกับภาคเหนือกำลังจะเข้าสู่ฤดูกาลท่องเที่ยว ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจกทม. และปริมณฑลอยู่ที่ระดับ 74.9 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากจำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศเพิ่มขึ้น และในภาคการจ้างงาน เนื่องจากคาดว่าผู้ประกอบการบางรายในพื้นที่มีแนวโน้มจะขยายกิจการ ทำให้มีความต้องการแรงงานเพิ่มขึ้น อย่างไรก็ตาม เกษตรกรในพื้นที่มีความกังวลต่อสภาพภูมิอากาศที่แปรปรวน ซึ่งอาจจะส่งผลต่อผลผลิตทางการเกษตร ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 73.1 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีจำนวนนักท่องเที่ยวในประเทศเพิ่มขึ้นต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรมในอนาคตที่ดีขึ้น เนื่องจากความต้องการสินค้าอุตสาหกรรมจากอุปสงค์ในประเทศเพิ่มขึ้น อย่างไรก็ตาม เกษตรกรในภาคกลางมีความกังวลต่อสภาพภูมิอากาศที่ไม่เอื้ออำนวยต่อการเพาะปลูก ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของกลางอยู่ที่ระดับ 69.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่มีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพิ่มขึ้นต่อเนื่อง และในภาคอุตสาหกรรม เนื่องจากความต้องการสินค้าอุตสาหกรรมเพิ่มขึ้นต่อเนื่อง โดยเฉพาะสินค้าเกษตรแปรรูป อย่างไรก็ดี ผู้ประกอบการบางรายในพื้นที่มีความกังวลเกี่ยวกับการขึ้นค่าจ้างแรงงาน
เดือนกรกฎาคม 2567
สัปดาห์ที่ 27 (ระหว่างวันที่ 1-7 กรกฎาคม 2567)
- นักท่องเที่ยวต่างชาติ 705,256 คน (+45,426 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 100,750 คน/วัน
- สะสม 18,206,539 คน
- สร้างรายได้ประมาณ 858,249 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 28 (ระหว่างวันที่ 8-14 กรกฎาคม 2567)
- นักท่องเที่ยวต่างชาติ 702,670 คน (-2,586 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 100,382 คน/วัน
- สะสม 18,909,209 คน
- สร้างรายได้ประมาณ 891,378 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 29 (ระหว่างวันที่ 15-21 กรกฎาคม 2567)
- นักท่องเที่ยวต่างชาติ 709,267 คน (+6,597 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 101,324 คน/วัน
- สะสม 19,618,476 คน
- สร้างรายได้ประมาณ 925,100 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 30 (ระหว่างวันที่ 22-28 กรกฎาคม 2567)
- นักท่องเที่ยวต่างชาติ 716,631 คน (+7,364 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 102,376คน/วัน
- สะสม 20,335,107 คน
- สร้างรายได้ประมาณ 957,319 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 31 (ระหว่างวันที่ 29 กรกฎาคม - 4 สิงหาคม 2567)
- นักท่องเที่ยวต่างชาติ 710,237 คน (-6,394 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 101,463 คน/วัน
- สะสม 21,045,344 คน
- สร้างรายได้ประมาณ 990,835 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
YL08 บางกะปิ
สถานีบางกะปิ ตั้งอยู่บนถนนลาดพร้าว บริเวณหน้าห้างสรรพสินค้าแม็คโคร สาขาลาดพร้าว และอยู่ใกล้กับศูนย์การค้าต่างๆ เช่น เดอะมอลล์ บางกะปิ ห้างน้อมจิตต์ (N-Mark Plaza) และศูนย์การค้าแฮปปี้แลนด์ เซ็นเตอร์
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยลาดพร้าว 113
จุดที่ 2. ซอยลาดพร้าว 115
จุดที่ 3. หน้าห้างสรรพสินค้าแม็คโคร สาขาลาดพร้าว
จุดที่ 4. ซอยลาดพร้าว 142
ในส่วนของสถานีบางกะปิ มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 2 : 3 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 และ 3
8. ฝ่าอุโมงค์สามมิติ…พิชิตป่าล้อมเหมือง จ.กาญจนบุรี ภาคกลาง
อุโมงค์สามมิติ อ.ทองผาภูมิ จ.กาญจนบุรี
อุโมงค์แห่งนี้เป็นเหมืองแร่เก่า มีความยาว 2,300 เมตร ปัจจุบันพื้นที่นี้เต็มไปด้วยเถาวัลย์และต้นไม้น้อยใหญ่ จนบริเวณรอบๆ เหมืองมีแต่ผืนป่าสีเขียวปกคลุม ส่วนภายในอุโมงค์มีหินงอกหินย้อยเปล่งประกายระยิบระยับ และยังคงมีหลักฐานจากอดีตเป็นเครื่องจักรและท่อลมขนาดใหญ่ให้พบเห็น ส่วนไฮไลท์อยู่ที่กิจกรรมขับรถลอดอุโมงค์ภายใต้ความมืด เป็นบรรยากาศลึกลับชวนให้ลุ้นตลอดสองข้างทาง แต่ในวินาทีที่รถกำลังจะแล่นผ่านหน้าปากอุโมงค์ เมื่อแสงไฟหน้ารถสาดไปยังไอหมอกที่ปกคลุมบริเวณหน้าถ้ำ ปากอุโมงค์จะดูคล้ายกับประตูกาลเวลาราวกับฉากไคลแม็กซ์ในภาพยนตร์ และเมื่อรถวิ่งทะลุออกไป จะให้ความรู้สึกราวกับว่าได้ทะลุผ่านจากมิติหนึ่งไปสู่อีกมิติ จึงเป็นที่มาของชื่อ “อุโมงค์สามมิติ” ที่ผู้คนต่างเรียกขาน
ททท.สำนักงานกาญจนบุรี เบอร์โทรศัพท์ 03451 1200 หรือ 0 3451 2500
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนสิงหาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนสิงหาคม 2566 (30/8/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนสิงหาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนสิงหาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค พบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนสิงหาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ” โดยมีรายละเอียด ดังต่อไปนี้
ความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 80.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจมีแนวโน้มที่ดีขึ้น โดยเฉพาะในภาคบริการ อันเป็นผลมาจากการคาดการณ์จำนวนนักท่องเที่ยวทั้งในประเทศและต่างประเทศที่จะเพิ่มขึ้นต่อเนื่อง ประกอบกับมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่ และความเชื่อมั่นเศรษฐกิจในภาคการลงทุน เนื่องจากได้รับอานิสงส์จากการลงทุนโครงการขนาดใหญ่ของภาครัฐในพื้นที่ ทั้งนี้ หากพิจารณาเฉพาะความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าดัชนีอยู่ที่ระดับ 85.8 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคเกษตรเป็นสำคัญ ตามมาด้วย ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคใต้อยู่ที่ระดับ 77.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นเศรษฐกิจภาคบริการ เนื่องจากมีการยกระดับท่าอากาศยานนครศรีธรรมราชขึ้นเป็นท่าอากาศนานาชาติเพื่อรองรับการขยายตัวของนักท่องเที่ยวต่างชาติที่เดินทางมาท่องเที่ยวในพื้นที่ และความเชื่อมั่นในภาคการลงทุน อันเป็นผลมาจากผู้ประกอบการมีแนวโน้มขยายกิจการเพื่อรองรับการเติบโตในภาคบริการ ความเชื่อมั่นอนาคตเศรษฐกิจของภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 77.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีสาเหตุสำคัญมาจากความเชื่อมั่นเศรษฐกิจในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่อย่างต่อเนื่อง และความเชื่อมั่นเศรษฐกิจภาคเกษตรในอนาคตที่ดีขึ้น เนื่องจากคาดว่าราคาผลผลิตทางการเกษตรจะปรับตัวขึ้น ประกอบกับการมีปริมาณน้ำที่เพียงพอ ความเชื่อมั่นอนาคตของภาคตะวันตกอยู่ที่ระดับ 73.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากภาคบริการ อันเป็นผลมาจากการดำเนินกิจกรรมสนับสนุนของภาครัฐ และความเชื่อมั่นเศรษฐกิจในภาคอุตสาหกรรม เนื่องจากคาดการณ์อุปสงค์ในสินค้าอุตสาหกรรมที่มีแนวโน้มเพิ่มสูงขึ้น ความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 72.3 สะท้อนความเชื่อมั่นเศรษฐกิจโดยเฉพาะในภาคบริการ โดยมีสาเหตุสำคัญมาจากจำนวนนักท่องเที่ยวทั้งชาวไทยและชาวต่างประเทศที่เพิ่มขึ้น และความเชื่อมั่นเศรษฐกิจในภาคการจ้างงาน อันเป็นผลมาจากสถานการณ์ทางเศรษฐกิจที่ปรับตัวดีขึ้น ทั้งนี้ เกษตรกรในพื้นที่ยังมีความกังวลต่อสภาพอากาศที่แปรปรวนซึ่งอาจส่งผลอย่างมีนัยสำคัญต่อผลผลิตในอนาคต และความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 70.4 สะท้อนถึงความเชื่อมั่นที่ดีขึ้นจากภาคอุตสาหกรรม เนื่องจากแนวโน้มความต้องการสินค้าเกษตรแปรรูปในตลาดโลกที่เพิ่มสูงขึ้น และความเชื่อมั่นในภาคบริการ อันเป็นผลมาจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่มีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพื่อรองรับการเดินทางของนักท่องเที่ยวที่เดินทางมาสัมผัสอากาศหนาว อย่างไรก็ดี ผู้ประกอบการบางส่วนยังกังวลต่อสถานการณ์เศรษฐกิจโลกในอนาคตจึงชะลอแผนการขยายธุรกิจ สำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจของภาคกลางอยู่ที่ระดับ 69.1 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการดำเนินกิจกรรมส่งเสริมการท่องเที่ยวในฐานะเมืองรองจากหน่วยงานที่เกี่ยวข้อง และความเชื่อมั่นเศรษฐกิจในภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากความพยายามของภาครัฐในการเร่งเจรจาข้อตกลงการค้าเสรีกับประเทศคู่ค้าสำคัญ อย่างไรก็ดี ผู้ประกอบการอุตสาหกรรมยังกังวลต่อความชัดเจนของมาตรการกระตุ้นเศรษฐกิจของรัฐบาลในอนาคต
เดือนสิงหาคม 2567
สัปดาห์ที่ 32 (ระหว่างวันที่ 5-11 สิงหาคม 2567)
- นักท่องเที่ยวต่างชาติ 751,419 คน (+41,182 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 107,346 คน/วัน
- สะสม 21,796,763 คน
- สร้างรายได้ประมาณ 1,025,938 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 33 (ระหว่างวันที่ 12-18 สิงหาคม 2567)
- นักท่องเที่ยวต่างชาติ 677,409 คน (-74,010 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 96,773 คน/วัน
- สะสม 22,474,172 คน
- สร้างรายได้ประมาณ 1,058,026 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 34 (ระหว่างวันที่ 19-25 สิงหาคม 2567)
- นักท่องเที่ยวต่างชาติ 622,580 คน (-54,829 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 88,940 คน/วัน
- สะสม 23,096,752 คน
- สร้างรายได้ประมาณ 1,086,786 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 35 (ระหว่างวันที่ 26 สิงหาคม - 1 กันยายน 2567)
- นักท่องเที่ยวต่างชาติ 543,453 คน (-79,127 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 77,637 คน/วัน
- สะสม 23,640,205 คน
- สร้างรายได้ประมาณ 1,111,380 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
YL09 แยกลำสาลี
สถานีแยกลำสาลี ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกลำสาลี
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. แยกลำสาลี ขาออก*
จุดที่ 2. ซอยรามคำแหง 56
จุดที่ 3. ซอยรามคำแหง 54
จุดที่ 4. แยกลำสาลี ขาเข้า*
*สามารถเชื่อมต่อไปยังทางขึ้น - ลง สถานีแยกลำสาลี ของโครงการรถไฟฟ้าสายสีส้ม ช่วงศูนย์วัฒนธรรมแห่งประเทศไทย - มีนบุรี (สุวินทวงศ์)
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 3 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 3
9. อันซีนภูผาแรด…มุมลับสุดอาร์ตแห่งราชบุรี จ.ราชบุรี ภาคกลาง
มุมลับที่ภูผาแรด อ.เมืองราชบุรี จ.ราชบุรี
บริเวณที่เคยเป็นแหล่งสัมปทานระเบิดหินภายในอุทยานหินเขางู ถูกซ่อนไว้กลางหุบเขามานานหลายปี ลักษณะเป็นผาสูงชันที่มีร่องรอยเว้าแหว่งของหินจากแรงระเบิด เผยให้เห็นความสวยงามของลวดลายและสีสันของหน้าผาหินแกรนิต ซึ่งเป็นหินที่ถูกเปรียบเปรยว่า แข็งแกร่งดั่ง “แรด” จึงเป็นที่มาของชื่อ “ภูผาแรด” เสน่ห์ของมุมลับแห่งนี้ อยู่ที่ความสวยงามในแต่ละช่วงเวลาของวัน ซึ่งขึ้นอยู่กับทิศทางของแสงแดดที่ส่องลงบริเวณหน้าผาแต่ละฝั่ง และให้จับตาวินาทีที่น้ำนิ่งจนเกิดภาพเงาสะท้อนคล้ายภาพ Abstract บนผิวน้ำ ถือเป็นงานอาร์ตที่ธรรมชาติรังสรรค์ เป็นความมหัศจรรย์บทใหม่ของเมืองราชบุรี สามารถเดินทางท่องเที่ยวได้ตลอดทั้งปี ตั้งแต่เวลา 08.00 - 17.00 น.
ททท.สำนักงานราชบุรี เบอร์โทรศัพท์ 0 3291 9176-8
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนกันยายน 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนกันยายน 2566 (28/9/2566)
"ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนกันยายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้ามีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม มีความกังวลเกี่ยวกับผลผลิตการเกษตรจากภาวะภัยแล้งที่เริ่มส่งผลต่อความเชื่อมั่นในอนาคตของภาคเหนือ"
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนกันยายน 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทย เพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคพบว่า "ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนกันยายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้ามีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม มีความกังวลเกี่ยวกับผลผลิตการเกษตรจากภาวะภัยแล้งที่เริ่มส่งผลต่อความเชื่อมั่นในอนาคตของภาคเหนือ" โดยมีรายละเอียดดังต่อไปนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 79.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจมีแนวโน้มที่ดีขึ้น โดยเฉพาะในภาคบริการอันเป็นผลมาจากการคาดการณ์จำนวนนักท่องเที่ยวต่างชาติที่มีแนวโน้มเพิ่มมากขึ้นจากนโยบายส่งเสริมการท่องเที่ยวของรัฐบาล และความเชื่อมั่นเศรษฐกิจในภาคการลงทุน เนื่องจากได้รับอานิสงส์จากทิศทางนโยบายส่งเสริมการลงทุนของรัฐบาล ทั้งนี้ หากพิจารณาเฉพาะดัชนีความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าอยู่ที่ระดับ 82.5 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 76.9 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นเศรษฐกิจภาคอุตสาหกรรม เนื่องจากมีความต้องการของตลาดต่างประเทศที่เพิ่มสูงขึ้น และภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่เพื่อรองรับนักท่องเที่ยวต่างชาติในช่วงฤดูการท่องเที่ยวที่จะมาถึงดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 76.7 สะท้อนถึงความเชื่อมั่นภาคอุตสาหกรรมที่ปรับตัวดีขึ้น หลังจากมีการจัดตั้งรัฐบาลแล้วเสร็จ และความเชื่อมั่นในภาคบริการ อันเป็นผลมาจากหน่วยงานภาครัฐและภาคเอกชนในพื้นที่มีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพื่อรองรับการเดินทางของนักท่องเที่ยวชาวไทยและชาวต่างชาติที่เดินทางมาสัมผัสอากาศหนาว อย่างไรก็ตาม ยังคงมีความกังวลเกี่ยวกับผลผลิตการเกษตรในอนาคตจากภาวะภัยแล้งที่เกิดขึ้นในพื้นที่ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 74.4 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีสาเหตุสำคัญมาจากความเชื่อมั่นเศรษฐกิจในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่อย่างต่อเนื่อง และความเชื่อมั่นภาคอุตสาหกรรมในอนาคตที่ดีขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 73.8 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากภาคบริการ อันเป็นผลมาจากคาดการณ์จำนวนนักท่องเที่ยวชาวต่างชาติที่เพิ่มขึ้นในช่วงฤดูการท่องเที่ยวที่จะมาถึง และความเชื่อมั่นในภาคการลงทุน เนื่องจากผู้ประกอบการมีแนวโน้มที่จะขยาย
การลงทุนเพื่อรองรับภาคบริการที่ขยายตัว ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 72.5 สะท้อนความเชื่อมั่นเศรษฐกิจโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐ
และภาคเอกชนในหลายจังหวัดของพื้นที่อย่างต่อเนื่อง และความเชื่อมั่นเศรษฐกิจในภาคอุตสาหกรรม อันเป็นผลมาจากมาตรการลดภาระค่าใช้จ่ายด้านพลังงานให้แก่ประชาชน และสำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 72.4 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการดำเนินกิจกรรมส่งเสริมการท่องเที่ยวในฐานะเมืองรองจากหน่วยงานที่เกี่ยวข้อง และความเชื่อมั่นเศรษฐกิจในภาคการลงทุนในอนาคตที่ดีขึ้น เนื่องจากการขยายการลงทุนเพื่อรองรับแนวโน้มการเติบโตทางเศรษฐกิจในอนาคต
เดือนกันยายน 2567
สัปดาห์ที่ 36 (ระหว่างวันที่ 2-8 กันยายน 2567)
- นักท่องเที่ยวต่างชาติ 533,851 คน (-9,602 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 76,265 คน/วัน
- สะสม 24,174,056 คน
- สร้างรายได้ประมาณ 1,135,748 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 37 (ระหว่างวันที่ 9-15 กันยายน 2567)
- นักท่องเที่ยวต่างชาติ 636,932 คน (+103,081 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 90,299 คน/วัน
- สะสม 24,810,988 คน
- สร้างรายได้ประมาณ 1,162,419 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 38 (ระหว่างวันที่ 16-22 กันยายน 2567)
- นักท่องเที่ยวต่างชาติ 602,238 คน (-34,694 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 86,034 คน/วัน
- สะสม 25,413,226 คน
- สร้างรายได้ประมาณ 1,188,099 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 39 (ระหว่างวันที่ 23-29 กันยายน 2567)
- นักท่องเที่ยวต่างชาติ 592,069 คน (-10,169 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 84,581 คน/วัน
- สะสม 26,005,295 คน
- สร้างรายได้ประมาณ 1,214,681 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 40 (ระหว่างวันที่ 30 กันยายน - 6 ตุลาคม 2567)
- นักท่องเที่ยวต่างชาติ 638,159 คน (+158,259 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 91,166 คน/วัน
- สะสม 26,643,454 คน
- สร้างรายได้ประมาณ 1,244,099 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ ลาว
รพ.เกษมราษฎร์ อินเตอร์เนชั่นแนล อรัญประเทศ รับสมัครพนักงานประจำ หลายอัตรา LINK
รพ.เกษมราษฎร์ อินเตอร์เนชั่นแนล อรัญประเทศ รับสมัครพนักงานประจำ หลายอัตรา
สวัสดิการ
- ค่าตอบแทน
- โอที
- ประกันสังคม
- พักร้อน 6 วัน/ปี
- วันหยุดนักขัตฤกษ์ 15 วัน/ปี
- ค่ารักษาพยาบาลสำหรับพนักงาน และญาติสายตรง
- ตรวจสุขภาพประจำปี
- โบนัสประจำปี
- ปรับค่าจ้างประจำปี
สอบถามข้อมูลได้ที่ 03-764-0000 ต่อ 3401 หรือ 0946678118
เปิดรับสมัครทุกวัน เวลา 08.00 - 17.00 น.
หรือ ส่งResume เข้ามาได้ที่อีเมล์ hr.kihart@gmail.com พร้อมระบุตำแหน่งที่ต้องการสมัคร
YL10 กรีฑา
สถานีศรีกรีฑา ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกกรุงเทพกรีฑา
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ถนนกรุงเทพกรีฑา
จุดที่ 2. ซอยศรีนครินทร์ 5
จุดที่ 3. ซอยศรีนครินทร์ 6
จุดที่ 4. สวนปิยะภิรมย์
#สถานีที่สูงที่สุดของโครงการฯ โดยมีความสูงถึง 25.79 เมตร (นับจากพื้นถึงชานชาลา (Platform))
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1, 3 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
10.มหาเจดีย์แห่งรัชสมัย…ความภาคภูมิใจแห่งบางสะพาน จ.ประจวบคีรีขันธ์ ภาคกลาง [คัดเลือกโดยผู้ทรงคุณวุฒิ]
วัดทางสาย อ.บางสะพาน จ.ประจวบคีรีขันธ์
“พระมหาธาตุเจดีย์ภักดีประกาศ” เป็นเจดีย์ที่ได้รับพระราชทานชื่อจากในหลวงรัชกาลที่ 9 ถือเป็นสถาปัตยกรรมที่น่าเลื่อมใส เนื่องจากเจดีย์แห่งนี้สร้างขึ้นโดยไม่มีการใช้งบจากทางราชการ แต่สร้างขึ้นจากพลังศรัทธาอันยิ่งใหญ่ของมวลชนที่มีต่อพระมหากษัตริย์ เพื่อเป็นการเฉลิมพระเกียรติและถวายเป็นพระราชกุศลโดยเฉพาะในวโรกาสครองราชย์ครบรอบ 50 ปี ตัวอาคาร 5 ชั้น คือการครองราชย์ครบ 50 ปี ส่วนเจดีย์หมู่ 9 องค์ หมายถึงวัดประจำรัชกาลที่ 9 และนอกจากความงดงามของที่มาที่ไปแล้ว ด้านบนของเจดีย์ยังเป็นสุดยอดจุดชมวิวดวงอาทิตย์ขึ้นและตกแห่งเมืองประจวบ ซึ่งเราสามารถมองเห็นความสวยงามของชายหาดบ้านกรูดและทิวมะพร้าวได้ไกลสุดสายตา
ททท.สำนักงานประจวบคีรีขันธ์ เบอร์โทรศัพท์ 0 3251 3885 , 0 3251 3871 หรือ 0 3251 3854
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนตุลาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนตุลาคม 2566 (27/10/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนตุลาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ และภาคตะวันตก จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับปริมาณผลผลิตทางการเกษตรจากผลกระทบของการเปลี่ยนแปลงด้านสภาพอากาศ โดยเฉพาะในภาคเหนือ และภาคกลาง”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผย ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนตุลาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทยเพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคพบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนตุลาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับปริมาณผลผลิตทางการเกษตรจากผลกระทบของการเปลี่ยนแปลงด้านสภาพอากาศ โดยเฉพาะในภาคเหนือ และภาคกลาง” โดยมีรายละเอียดดังต่อไปนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 80.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่มีแนวโน้มดีขึ้น โดยเฉพาะความเชื่อมั่นในภาคบริการอันเป็นผลมาจากการจัดกิจกรรมดึงดูดนักท่องเที่ยวทั้งจากภาครัฐและภาคเอกชน ประกอบกับมีการประชาสัมพันธ์ส่งเสริมการท่องเที่ยวในพื้นที่อย่างต่อเนื่อง และความเชื่อมั่นในภาคการลงทุน เนื่องจากแนวโน้มการเติบโตของอุตสาหกรรมการท่องเที่ยว ประกอบกับได้รับอานิสงส์จากนโยบายการพัฒนาโครงสร้างพื้นฐานในพื้นที่เพื่อเสริมสร้างขีดความสามารถด้านการแข่งขันของรัฐบาล ทั้งนี้ หากพิจารณาเฉพาะดัชนีความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าอยู่ที่ระดับ 83.4 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 78.5 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคอุตสาหกรรม เนื่องจากมีความต้องการของตลาดต่างประเทศที่เพิ่มสูงขึ้น โดยเฉพาะผลิตภัณฑ์แปรรูปจากยางพาราและมันสำปะหลัง และความเชื่อมั่นในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวเพื่อเฉลิมฉลองเทศกาลและประเพณีท้องถิ่นจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 76.0 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีสาเหตุสำคัญมาจากความเชื่อมั่นในภาคบริการ เนื่องจากการจัดกิจกรรมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่ และความเชื่อมั่นในภาคการลงทุน เนื่องจากนักลงทุนเริ่มกลับมาเชื่อมั่นในเสถียรภาพทางเศรษฐกิจของประเทศ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 74.4 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากภาคบริการ อันเป็นผลมาจากการประกาศใช้มาตรการยกเว้นวีซ่าแก่นักท่องเที่ยวสัญชาติจีนและคาซัคสถาน รวมถึงคาดว่าการส่งเสริมการท่องเที่ยวภายใต้โครงการ “Visit Thailand Year 2023” จะช่วยสนับสนุนอุตสาหกรรมการท่องเที่ยวในพื้นที่ได้อย่างต่อเนื่องไปจนถึงปี 2567 และความเชื่อมั่นในภาคการลงทุน เนื่องจากผู้ประกอบการมีแนวโน้มที่จะขยายการลงทุนเพื่อรองรับภาคบริการที่ขยายตัว ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 73.5 สะท้อนถึงความเชื่อมั่นในภาคบริการที่ปรับตัวดีขึ้น อันเป็นผลมาจากการประกาศใช้นโยบายนำ Soft Power (อำนาจละมุน) มาดึงดูดนักท่องเที่ยว รวมถึงการขยายเวลาเปิดให้บริการของสนามบินหลักในพื้นที่ตลอด 24 ชั่วโมง เพื่อรองรับนักท่องเที่ยวต่างชาติที่มีแนวโน้มขยายตัว และความเชื่อมั่นในภาคอุตสาหกรรม เนื่องจากทิศทางนโยบายของรัฐบาลที่มีความชัดเจนขึ้น อย่างไรก็ดี เกษตรกรในพื้นที่ยังคงมีความกังวลจากการเปลี่ยนแปลงสภาพอากาศที่อาจส่งผลกระทบต่อจำนวนผลผลิต ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 73.4 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการดำเนินกิจกรรมส่งเสริมการท่องเที่ยวเพื่อเฉลิมฉลองเทศกาลสงกรานต์จากภาครัฐและภาคเอกชน และความเชื่อมั่นในภาคการจ้างงาน อันเป็นผลมาจากการตอบสนองการขยายตัวเพื่อรองรับภาคบริการของผู้ประกอบการ และสำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 72.4 สะท้อนความเชื่อมั่นเศรษฐกิจโดยเฉพาะในภาคบริการ เนื่องจากมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนเพื่อดึงดูดนักท่องเที่ยวอย่างต่อเนื่อง รวมถึงมีการคาดการณ์จำนวนนักท่องเที่ยวที่เดินทางมาท่องเที่ยวในช่วงเทศกาลสงกรานต์มีแนวโน้มที่เพิ่มสูงขึ้นกว่าปีก่อน และความเชื่อมั่นในภาคการลงทุน โดยได้รับอานิสงส์มาจากมาตรการให้ความช่วยเหลือผู้ประกอบการของรัฐบาล อย่างไรก็ดี เกษตรกรในพื้นที่ยังคงมีความกังวลเกี่ยวกับผลกระทบจากปรากฎการณ์เอลนินโญ (El Niño) ที่คาดว่าจะยังคงส่งผลกระทบต่อเนื่องไปจนถึงช่วงกลางปี พ.ศ. 2567
เดือนตุลาคม 2567
สัปดาห์ที่ 41 (ระหว่างวันที่ 7-13 ตุลาคม 2567)
- นักท่องเที่ยวต่างชาติ 575,415 คน (-62,744 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 82,202 คน/วัน
- สะสม 27,218,869 คน
- สร้างรายได้ประมาณ 1,270,462ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 42 (ระหว่างวันที่ 14-20 ตุลาคม 2567)
- นักท่องเที่ยวต่างชาติ 575,142 คน (-273 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 82,163 คน/วัน
- สะสม 27,794,011 คน
- สร้างรายได้ประมาณ 1,297,614 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย รัสเซีย เกาหลีใต้
สัปดาห์ที่ 43 (ระหว่างวันที่ 21-27 ตุลาคม 2567)
- นักท่องเที่ยวต่างชาติ 584,462 คน (+9,320 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 83,495 คน/วัน
- สะสม 28,378,473 คน
- สร้างรายได้ประมาณ 1,325,359 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 44 (ระหว่างวันที่ 28 ตุลาคม - 3 พฤศจิกายน 2567)
- นักท่องเที่ยวต่างชาติ 701,962 คน (+117,500 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 100,280 คน/วัน
- สะสม 29,080,399 คน
- สร้างรายได้ประมาณ 1,358,087 ล้านบาท
- 5 อันดับแรกได้แก่ มาเลเซีย จีน รัสเซีย อินเดีย เกาหลีใต้
YL11 หัวหมาก
สถานีหัวหมาก ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกพัฒนาการ
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยศรีนครินทร์ 17 *
จุดที่ 2. ก่อนถึงแยกพัฒนาการ (ขาออก)
จุดที่ 3. ซอยศรีนครินทร์ 16
จุดที่ 4. ซอยศรีนครินทร์ 12 *
*สามารถเชื่อมต่อกับ สถานีหัวหมาก ของรถไฟฟ้าแอร์พอร์ต เรล ลิงก์
และสถานีรถไฟหัวหมาก ของรถไฟสายตะวันออก
ลิฟต์ ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 3
ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
11. ท่องอาณาจักรสวนหินล้านปี มอหินขาว จ.ชัยภูมิ ภาคอีสาน
มอหินขาว อ.เมือง จ.ชัยภูมิ
“มอหินขาว” เป็นแหล่งท่องเที่ยวที่ตั้งอยู่ในเขตอุทยานแห่งชาติภูแลนคา มีจุดเด่นอยู่ที่เสาหินยักษ์ 5 ก้อน ที่หลายคนบอกว่า คล้ายกับ “สโตนเฮนจ์” บนเกาะอังกฤษ และจะยิ่งสวยงามขึ้นแบบทวีคูณในช่วงฤดูฝน เพราะนอกจากนักเดินทางจะได้ชมประติมากรรมธรรมชาติของเสาหินแล้ว ยังจะได้ชื่นชมดอกไม้ป่าที่กำลังบานสะพรั่งทั่วมอหินขาว นอกจากนี้ยังมีกลุ่มหินที่น่าสนใจอื่นๆ ได้แก่ หินเจดีย์โขลงช้าง ลานหินต้นไทร และจุดชมวิวผาหัวนาค ส่วนสายแคมป์ปิ้งที่ชอบดูดาว บริเวณมอหินขาวก็ถือว่า เป็นจุดชมดวงดาวและทางช้างเผือกระดับท็อปที่ควรค่าแก่การมาเยี่ยมเยือน
ททท.สำนักงานนครราชสีมา เบอร์โทรศัพท์ 0 4421 3030 หรือ 0 4421 3666
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนพฤศจิกายน 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนพฤศจิกายน 2566 (29/11/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนพฤศจิกายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันตก และภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับปริมาณผลผลิตทางการเกษตรจากผลกระทบของการเปลี่ยนแปลงด้านสภาพอากาศ โดยเฉพาะในภาคเหนือ และภาคกลาง”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผยดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนพฤศจิกายน 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทยเพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคพบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนพฤศจิกายน 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคตะวันตก และภาคคะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับปริมาณผลผลิตทางการเกษตรจากผลกระทบของการเปลี่ยนแปลงด้านสภาพอากาศ โดยเฉพาะในภาคเหนือ และภาคกลาง" โดยมีรายละเอียดดังต่อไปนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 79.9 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่มีแนวโน้มดีขึ้น โดยเฉพาะความเชื่อมั่นในภาคบริการอันเป็นผลจากการจัดกิจกรรมดึงดูดนักท่องเที่ยวทั้งจากภาครัฐและภาคเอกชนในพื้นที่เพื่อรองรับนักท่องเที่ยวทั้งชาวไทยและชาวต่างประเทศในช่วงวันหยุดยาว และความเชื่อมั่นในภาคการลงทุน อันเป็นผลมาจากการขยายการลงทุนเพื่อรองรับแนวโน้มการเติบโตของอุตสาหกรรมการท่องเที่ยว ประกอบกับได้รับอานิสงส์จากการพัฒนาโครงสร้างพื้นฐานในพื้นที่เขตพัฒนาพิเศษภาคตะวันออก ทั้งนี้ หากพิจารณาเฉพาะดัชนีความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าอยู่ที่ระดับ 83.7 โดยได้รับปัจจัยสนับสนุนจากภาคบริการและภาคการลงทุนเป็นสำคัญ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 77.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีสาเหตุสำคัญมาจากความเชื่อมั่นในภาคบริการ เนื่องจากการจัดกิจกรรมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนในหลายจังหวัดของพื้นที่ และความเชื่อมั่นในภาคการลงทุน เนื่องจากนักลงทุนคาดว่าเศรษฐกิจจะขยายตัวได้ในระยะถัดไป ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 77.1 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการ เนื่องจากเริ่มเข้าสู่ฤดูการท่องเที่ยว ซึ่งในหลายจังหวัดของพื้นที่ได้มีการจัดกิจกรรมส่งเสริมการท่องเที่ยวมากมาย อาทิ งานเทศกาลไหมนานาชาติ งานเทศกาลหนังเมืองแคน และมีกิจกรรมเพื่อเฉลิมฉลองเทศกาลและประเพณีท้องถิ่นจากหน่วยงานภาครัฐและภาคเอกชน และความเชื่อมั่นในภาคอุตสาหกรรม จากแนวโน้มการเพิ่มขึ้นของอุปสงค์ โดยเฉพาะในอุตสาหกรรมอาหารและเครื่องดื่ม ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 75.2 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยเฉพาะในภาคบริการ อันเป็นผลมาจากการประกาศใช้มาตรการยกเว้นวีซ่าแก่นักท่องเที่ยวสัญชาติจีนและคาซัคสถาน และการขยายระยะเวลาพำนักในไทยโดยได้รับการยกเว้นวีซ่าสำหรับนักท่องเที่ยวรัสเซีย ประกอบกับประเทศไทยเริ่มเข้าสู่ฤดูการท่องเที่ยว ซึ่งในหลายพื้นที่ของภาคจะมีการจัดกิจกรรมกระตุ้นการท่องเที่ยวโดยอาศัยความร่วมมือของทุกภาคส่วน รวมถึงมีงานเทศกาลและงานประเพณีท้องถิ่นต่าง ๆ และความเชื่อมั่นในภาคการลงทุน เนื่องจากผู้ประกอบการมีแนวโน้มที่จะขยายการลงทุนเพื่อรองรับภาคบริการที่ขยายตัว ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 74.7 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากมีการดำเนินกิจกรรมส่งเสริมการท่องเที่ยวอย่างต่อเนื่อง และความเชื่อมั่นในภาคการลงทุน อันเป็นผลมาจากการปรับตัวของผู้ประกอบการให้สอดคล้องกับภาวะการแข่งขันทางเศรษฐกิจในปัจจุบัน โดยเน้นการลงทุนในเทคโนโลยีดิจิทัล เครื่องจักรอัตโนมัติ และซอฟต์แวร์เพิ่มขึ้น อย่างไรก็ดี เกษตรกรในพื้นที่ยังคงมีความกังวลเกี่ยวกับผลกระทบจากภาวะโลกร้อนและโรคระบาดจากแมลง ซึ่งอาจส่งผลกระทบต่อปริมาณผลผลิตในฤดูกาลผลิตที่จะมาถึง ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 72.6 สะท้อนความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการ เนื่องจากเริ่มเข้าสู่ฤดูกาลท่องเที่ยว จึงมีการจัดกิจกรรมส่งเสริมการท่องเที่ยวจากหน่วยงานภาครัฐและภาคเอกชนเพื่อดึงดูดนักท่องเที่ยวอย่างต่อเนื่อง อาทิ งานยอยศยิ่งฟ้า อยุธยามรดกโลก ประจำปี 2566 งานกาชาด และงานสัปดาห์สะพานข้ามแม่น้ำแคว และความเชื่อมั่นในภาคการลงทุน จากมุมมองเชิงบวกต่อทิศทางการขยายตัวของเศรษฐกิจในอนาคต อย่างไรก็ดี เกษตรกรในพื้นที่ยังคงมีความกังวลเกี่ยวกับผลกระทบจากปรากฎการณ์เอลนินโญ (El Niño) และสภาพอากาศที่แปรปรวน และสำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 72.1 สะท้อนถึงความเชื่อมั่นในภาคบริการที่ปรับตัวดีขึ้น อันเป็นผลจากการเข้าสู่ฤดูการท่องเที่ยว รัฐบาลและภาคเอกชนมีการจัดกิจกรรมเพื่อสนับสนุนการเติบโตของภาคการท่องเที่ยวอย่างต่อเนื่อง อีกทั้งหลายจังหวัดในภาคเหนือของไทยได้รับความนิยมจากนักท่องเที่ยวชาวไทยและชาวต่างชาติเป็นอย่างมาก โดยล่าสุด GoBankingRates ได้จัดอันดับให้จังหวัดเชียงใหม่เป็นเมืองที่มีอากาศอบอุ่นและประหยัด เหมาะแก่การมาเที่ยวมากที่สุดเป็นอันดับที่ 3 จากทุกเมืองทั่วโลก และความเชื่อมั่นในภาคอุตสาหกรรม เนื่องจากผู้ประกอบการคาดว่าจะมีอุปสงค์ในตลาดเพิ่มมากขึ้น อย่างไรก็ดี ผู้ประกอบการบางส่วนยังมีความกังวลต่อต้นทุนการประกอบธุรกิจที่ยังอยู่ในระดับสูง จากราคาพลังงานและราคาปุ๋ยที่ยังมีความผันผวน และเกษตรกรในพื้นที่ยังคงมีความกังวลจากการเปลี่ยนแปลงสภาพอากาศที่อาจส่งผลกระทบต่อปริมาณผลผลิต
เดือนพฤศจิกายน 2567
สัปดาห์ที่ 45 (ระหว่างวันที่ 4-10 พฤศจิกายน 2567)
- นักท่องเที่ยวต่างชาติ 736,136 คน (+34,174 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 105,162 คน/วัน
- สะสม 29,816,537 คน
- สร้างรายได้ประมาณ 1,393,927 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย รัสเซีย เกาหลีใต้
สัปดาห์ที่ 46 (ระหว่างวันที่ 11-17 พฤศจิกายน 2567)
- นักท่องเที่ยวต่างชาติ 747,944 คน (+11,808 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 106,850 คน/วัน
- สะสม 30,564,481 คน
- สร้างรายได้ประมาณ 1,430,108 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 47 (ระหว่างวันที่ 18-24 พฤศจิกายน 2567)
- นักท่องเที่ยวต่างชาติ 749,306 คน (+1,362 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 107,044 คน/วัน
- สะสม 31,313,787 คน
- สร้างรายได้ประมาณ 1,466,408 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 48 (ระหว่างวันที่ 25 พฤศจิกายน - 1 ธันวาคม 2567)
- นักท่องเที่ยวต่างชาติ 706,382 คน (-42,924 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 100,912 คน/วัน
- สะสม 32,020,169 คน
- สร้างรายได้ประมาณ 1,501,157 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สรุปตั้งแต่วันที่ 1 มกราคม - 30 พฤศจิกายน 2567
ตั้งแต่วันที่ 1 มกราคม - 30 พฤศจิกายน 2567
- มีนักท่องเที่ยวชาวต่างชาติเดินทางมาท่องเที่ยวประเทศไทยจำนวน 31.92 ล้านคน ขยายตัวร้อยละ 28.24 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา สำหรับจำนวนนักท่องเที่ยวชาวต่างชาติที่เดินทางมาประเทศไทย 3 อันดับแรก ได้แก่ จีน มาเลเซีย และรัสเซีย ตามลำดับ
- ผู้เยี่ยมเยือนชาวไทยที่เดินทางท่องเที่ยวในประเทศรวม 181.47 ล้านคน-ครั้ง โดยจังหวัดที่มีจำนวนผู้เยี่ยมเยือนชาวไทยสูงสุด 3 อันดับแรก ได้แก่ กรุงเทพมหานคร ชลบุรี และกาญจนบุรี ตามลำดับ นอกจากนี้ เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมาพบว่า นักท่องเที่ยวเพิ่มขึ้นร้อยละ 7.66
- ทำให้ประเทศไทยมี รายได้จากการท่องเที่ยวรวมทั้งสิ้น 2.36 ล้านล้านบาท ขยายตัวร้อยละ 25.07 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา ในจำนวนนี้ เป็นรายได้จากนักท่องเที่ยวชาวต่างชาติ 1.50 ล้านล้านบาท และรายได้จากไทยเที่ยวไทย 0.86 ล้านล้านบาท
- หมายเหตุ : รายได้ประมาณการจากโครงสร้างค่าใช้จ่ายของนักท่องเที่ยวในอดีต
YL12 สถานีกลันตัน
สถานีกลันตัน ตั้งอยู่บนถนนศรีนครินทร์ บริเวณหน้าศูนย์การค้าธัญญาพาร์ค
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ก่อนถึงศูนย์การค้าธัญญาพาร์ค
จุดที่ 2. คลองโคกวัด (ขาออก)
จุดที่ 3. คลองโคกวัด (ขาเข้า)
จุดที่ 4. ก่อนถึงศูนย์บริการรถยนต์ฮอนด้า
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 2 และ 3
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
12. พิสูจน์ความฟิต…พิชิตทะเลหมอก ณ วนอุทยานภูบ่อบิด จ.เลย ภาคอีสาน
วนอุทยานภูบ่อบิด อ.เมืองเลย จ.เลย
วนอุทยานภูบ่อบิด “ภูบักบิด”หรือ ภูบ่บิด เป็นภูเขาเล็กๆ อยู่ห่างจากตัวจังหวัดเลยราว 1 กิโลเมตร และด้วยระยะทางที่ใกล้จากตัวเมืองแค่เอื้อม จึงนับเป็น ‘หอชมทะเลหมอกใจกลางเมือง’ หนึ่งเดียวในประเทศไทย แถมยังเป็นขวัญใจเหล่านักวิ่งเมืองเลย ที่ชอบแวะเวียนมาฝึกซ้อมยามเช้ากันอยู่บ่อยๆ ด้วยระยะทางเดินสู่จุดยอดที่พอเรียกเหงื่อได้กำลังดี เมื่อแลกกับวิวสวยๆ ที่ปลายทางแล้ว การพิชิตยอดภูบ่อบิดขึ้นมาสูดอากาศบริสุทธิ์พร้อมชมดวงอาทิตย์ท่ามกลางทะเลหมอกยามเช้า จัดว่าเป็นอะไรที่คุ้มค่าแก่การเดินทางมาสัมผัสหมอกกลางเมือง ณ ที่แห่งนี้ดูสักครั้ง
ททท.สำนักงานเลย เบอร์โทรศัพท์ a href="tel:+042812812">0 4281 2812 หรือ 0 4281 1405
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค ประจำเดือนธันวาคม 2566
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาค (Thailand Regional Economic Sentiment Index: RSI)
ประจำเดือนธันวาคม 2566 (28/12/2566)
“ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนธันวาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับสภาพอากาศ ที่จะเริ่มเข้าสู่ช่วงหน้าแล้งและปรากฏการณ์เอลนีโญ ซึ่งอาจส่งผลกระทบต่อภาคเกษตรกรรม”
นายพรชัย ฐีระเวช ผู้อำนวยการสำนักงานเศรษฐกิจการคลัง ในฐานะโฆษกกระทรวงการคลัง เปิดเผย ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนธันวาคม 2566 จากการประมวลผลข้อมูลการสำรวจภาวะเศรษฐกิจรายจังหวัดจากสำนักงานคลังจังหวัด 76 จังหวัดทั่วประเทศ และสภาอุตสาหกรรมแห่งประเทศไทยเพื่อจัดทำดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคพบว่า “ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภูมิภาคประจำเดือนธันวาคม 2566 สะท้อนความเชื่อมั่นเศรษฐกิจใน 6 เดือนข้างหน้าที่มีแนวโน้มดีขึ้น โดยเฉพาะภาคตะวันออก ภาคใต้ และภาคตะวันออกเฉียงเหนือ จากปัจจัยสนับสนุนในภาคบริการเป็นสำคัญ อย่างไรก็ตาม ยังมีความกังวลเกี่ยวกับสภาพอากาศ ที่จะเริ่มเข้าสู่ช่วงหน้าแล้ง และปรากฏการณ์เอลนีโญ ซึ่งอาจส่งผลกระทบต่อภาคเกษตรกรรม” โดยมีรายละเอียดดังต่อไปนี้
ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกอยู่ที่ระดับ 81.1 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่มีแนวโน้มดีขึ้น โดยเฉพาะความเชื่อมั่นในภาคบริการอันเป็นผลจากการจัดกิจกรรมดึงดูดนักท่องเที่ยวทั้งจากภาครัฐและภาคเอกชน และมาตรการยกเว้นวีซ่านักท่องเที่ยวในหลายประเทศ ซึ่งจะทำให้เกิดการใช้จ่ายและสร้างรายได้เพิ่มมากขึ้น และความเชื่อมั่นในภาคอุตสาหกรรม อันเป็นผลมาจากแนวโน้มความต้องการสินค้าภาคอุตสาหกรรมที่เพิ่มขึ้นทั้งจากในประเทศและต่างประเทศ ทั้งนี้ หากพิจารณาเฉพาะดัชนีความเชื่อมั่นอนาคตเศรษฐกิจในเขตพัฒนาพิเศษภาคตะวันออก (EEC) พบว่าอยู่ที่ระดับ 85.0 โดยได้รับปัจจัยสนับสนุนจากภาคอุตสาหกรรมและภาคบริการเป็นสำคัญ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคใต้อยู่ที่ระดับ 76.6 สะท้อนถึง
ความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยมีปัจจัยสำคัญมาจากความเชื่อมั่นในภาคบริการ เนื่องจากคาดว่าภาคการท่องเที่ยวจะฟื้นตัวได้อย่างต่อเนื่อง จากการจัดกิจกรรมกระตุ้นการท่องเที่ยวของหน่วยงานภาครัฐและเอกชนโดยเฉพาะในช่วงต้นปีซึ่งมีวันหยุดยาว และความเชื่อมั่นในภาคการลงทุน เนื่องจากนักลงทุนคาดว่าเศรษฐกิจจะขยายตัวได้ในระยะถัดไป ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันออกเฉียงเหนืออยู่ที่ระดับ 76.6 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการ เนื่องจากเป็นฤดูการท่องเที่ยว ซึ่งในหลายจังหวัดของพื้นที่ได้เตรียมจัดงานประเพณีและวัฒนธรรม และกิจกรรมรื่นเริงต่าง ๆ เพื่อส่งเสริมการท่องเที่ยว อาทิ งานเทศกาลลาบโลก งานบุญเบิกฟ้า งานมหกรรมหุ่นกระติบข้าวและหุ่นฟาง งานสงกรานต์ และงานบุญบั้งไฟ และความเชื่อมั่นในภาคอุตสาหกรรม จากแนวโน้มการฟื้นตัวของเศรษฐกิจภายในประเทศที่จะสนับสนุนการขยายตัวของอุปสงค์สินค้าอุตสาหกรรม ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคกลางอยู่ที่ระดับ 71.7 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้น โดยเฉพาะในภาคบริการ อันเป็นผลจากการจัดกิจกรรมส่งเสริมการท่องเที่ยวในหลายพื้นที่ของภาค อาทิ การจัดงานแผ่นดินสมเด็จพระนารายณ์มหาราช ปี 2567 และความเชื่อมั่นในภาคอุตสาหกรรม จากแนวโน้มความต้องการสินค้าอุตสาหกรรมที่คาดว่าจะปรับตัวเพิ่มขึ้น ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคเหนืออยู่ที่ระดับ 69.3 สะท้อนถึงความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นโดยเฉพาะในภาคบริการ เนื่องจากประเทศไทยเริ่มเข้าสู่ฤดูการท่องเที่ยว จึงมีการดำเนินกิจกรรมส่งเสริมการท่องเที่ยวอย่างต่อเนื่อง โดยเฉพาะในปัจจุบันที่กระแสด้านการท่องเที่ยวเชิงสร้างสรรค์ (Creative Tourism) กำลังได้รับความนิยมเป็นอย่างมากจากกลุ่มนักท่องเที่ยวทั้งชาวไทยและชาวต่างชาติ และความเชื่อมั่นในภาคการลงทุน เนื่องจากผู้ประกอบการมีแนวโน้มจะขยายการลงทุนเพื่อรองรับการเติบโตของภาคบริการและอุปสงค์สินค้าที่เพิ่มมากขึ้น อย่างไรก็ดี ผู้ประกอบการบางส่วนยังมีความกังวลต่อราคาพลังงานที่ยังคงผันผวน รวมถึงการเปลี่ยนแปลงของสภาพอากาศที่อาจเกิดสภาวะฝนทิ้งช่วงและปรากฏการณ์เอลนีโญที่อาจส่งผลกระทบต่อปริมาณผลผลิตได้ ดัชนีความเชื่อมั่นอนาคตเศรษฐกิจ กทม. และปริมณฑลอยู่ที่ระดับ 68.6 สะท้อนความเชื่อมั่นอนาคตเศรษฐกิจที่ดีขึ้นจากความเชื่อมั่นในภาคบริการและการลงทุน เนื่องจากคาดว่า กิจกรรมทางเศรษฐกิจของประเทศมีแนวโน้มฟื้นตัวได้อย่างต่อเนื่อง และสำหรับดัชนีความเชื่อมั่นอนาคตเศรษฐกิจภาคตะวันตกอยู่ที่ระดับ 67.5 สะท้อนถึงความเชื่อมั่นในภาคบริการและการลงทุนที่ปรับตัวดีขึ้น อันเป็นผลจากมุมมองเชิงบวกต่อทิศทางการฟื้นตัวของเศรษฐกิจไทย และการจัดกิจกรรมเพื่อสนับสนุนการเติบโตของภาคการท่องเที่ยวอย่างต่อเนื่อง
ธันวาคม 2567
สัปดาห์ที่ 49 (ระหว่างวันที่ 2-8 ธันวาคม 2567)
- นักท่องเที่ยวต่างชาติ 699,129 คน (-7,253 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 99,876คน/วัน
- สะสม 32,719,298 คน
- สร้างรายได้ประมาณ 1,535,154 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 50 (ระหว่างวันที่ 9-15 ธันวาคม 2567)
- นักท่องเที่ยวต่างชาติ 772,553 คน (+73,424 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 110,365 คน/วัน
- สะสม 33,491,851 คน
- สร้างรายได้ประมาณ 1,573,080 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 51 (ระหว่างวันที่ 16-22 ธันวาคม 2567)
- นักท่องเที่ยวต่างชาติ 886,472 คน (+113,919 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 126,639 คน/วัน
- สะสม 34,378,323 คน
- สร้างรายได้ประมาณ 1,616,634 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
สัปดาห์ที่ 52 (ระหว่างวันที่ 23-29 ธันวาคม 2567)
- นักท่องเที่ยวต่างชาติ 943,269 คน (+56,797 เทียบสัปดาห์ก่อนหน้า) เฉลี่ย 134,753 คน/วัน
- สะสม 35,321,592 คน
- สร้างรายได้ประมาณ 1,662,461 ล้านบาท
- 5 อันดับแรกได้แก่ จีน มาเลเซีย อินเดีย เกาหลีใต้ รัสเซีย
- จำนวนนักท่องเที่ยวชาวไทยเที่ยวไทย ปี 2567 คาดว่าจะมีจำนวน 197.53 ล้านคนครั้ง สร้างรายได้ประมาณ 952,768 ล้านบาท
สรุปนักท่องเที่ยวชาวต่างชาติ 35.54 ล้านคน ตั้งแต่วันที่ 1 มกราคม - 31 ธันวาคม 2567
สรุปภาพรวมปี 2567 ตั้งแต่วันที่ 1 มกราคม - 31 ธันวาคม 2567
- มีนักท่องเที่ยวชาวต่างชาติเดินทางมาท่องเที่ยวประเทศไทยจำนวน 35,545,714 ล้านคน ขยายตัวร้อยละ 26.27 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา
- สร้างรายได้ 1.64 ล้านล้านบาท ขยายตัวร้อยละ 31.13 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา
- จำนวนนักท่องเที่ยวชาวต่างชาติที่เดินทางมาประเทศไทย 10 อันดับแรก ได้แก่ จีน (6,733,162) มาเลเซีย (4,952,078) อินเดีย (2,129,149) เกาหลีใต้ (1,868,945) รัสเซีย (1,745,327) ลาว ไต้หวัน ญี่ปุ่น อเมริกา และสิงค์โปร์ ตามลำดับ
- หมายเหตุ : รายได้ประมาณการจากโครงสร้างค่าใช้จ่ายของนักท่องเที่ยวในอดีต
สรุปท่องเที่ยวไทย สะสม 200 ล้านคน-ครั้ง ตั้งแต่วันที่ 1 มกราคม - 31 ธันวาคม 2567
ตั้งแต่วันที่ 1 มกราคม - 31 ธันวาคม 2567
- มีจำนวนผู้เยี่ยมเยือนชาวไทยสะสม 200 ล้านคน-ครั้ง ขยายตัวร้อยละ 6.55 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา
- ผู้เยี่ยมเยือนชาวไทย 5 อันดับแรก ได้แก่ กรุงเทพมหานคร ชลบุรี กาญจนบุรี ประจวบคีรีขันธ์ และเพชรบุรี ตามลำดับ
- ก่อให้เกิด รายได้จากผู้เยี่ยมเยือนชาวไทยสะสม 1.11 ล้านล้านบาท ขยายตัวร้อยละ 12.63 เมื่อเปรียบเทียบกับช่วงเวลาเดียวกันของปีที่ผ่านมา
- รายได้จากผู้เยี่ยมเยือนชาวไทย 5 อันดับแรก ได้แก่ กรุงเทพมหานคร ชลบุรี เชียงใหม่ ประจวบคีรีขันธ์ และเชียงราย ตามลำดับ
YL13 ศรีนุช
สถานีศรีนุช ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกสวนหลวง (ศรีนุช)
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ถัดจากแยกสวนหลวง (ศรีนุช) ฝั่งขาออก
จุดที่ 2. ซอยศรีนครินทร์ 29
จุดที่ 3. ซอยศรีนครินทร์ 28
จุดที่ 4. ก่อนถึงแยกสวนหลวง (ศรีนุช) ฝั่งขาเข้า
ในส่วนของสถานีศรีนุช มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 และ 3 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 , 3 และ 4
13. ชมวิวบนยอดผา ณ ผืนป่าบ้านพญากูปรี จังหวัดศรีสะเกษ ภาคอีสาน
ผาพญากูปรี อ.ภูสิงห์ จ.ศรีสะเกษ
จุดชมวิวที่มีทิวทัศน์สวยตระการตา แถมยังมีความเป็นมาน่าสนใจ ตั้งอยู่ในบริเวณที่เคยมีการค้นพบ “กูปรี” สัตว์ป่าที่สูญพันธุ์ไปแล้วจากสารบบประเทศไทย "ผาพญากูปรี" ถือเป็นจุดชมวิวที่มีอากาศเย็นบริสุทธิ์จากแนวเทือกเขาพนมดงรัก ทั้งยังเป็นจุดชมธรรมชาติที่สวยงามของลำห้วยสำราญ แหล่งต้นน้ำสำคัญที่หล่อเลี้ยงชาวศรีสะเกษ นอกจากนี้ยังมีเส้นทางเดินลงไปชมภาพวาดพญากูปรี รวมถึงเที่ยวชมน้ำตกพญากูปรีในบริเวณเดียวกันได้อีกด้วย
ททท.สำนักงานสุรินทร์ เบอร์โทรศัพท์ 0 4451 4447-8
YL14 ศรีนครินทร์ 38
สถานีศรีนครินทร์ 38 ตั้งอยู่บนถนนศรีนครินทร์ บริเวณซอยศรีนครินทร์ 38 มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด ดังนี้
จุดที่ 1. ซอยศรีนครินทร์ 43
จุดที่ 2. ซอยศรีนครินทร์ 45
จุดที่ 3. ซอยศรีนครินทร์ 38
จุดที่ 4. ซอยศรีนครินทร์ 36
ในส่วนของสถานีศรีนครินทร์ 38 มีลิฟต์และบันไดเลื่อน รวมไปถึงทางลาดสำหรับรองรับรถเข็นวีลแชร์ เพื่ออำนวยความสะดวกในการใช้บริการแก่ผู้พิการและคนชรา รวมไปถึงผู้ที่ต้องการใช้บริการ...
14. สัมผัสเสน่ห์เหนือกาลเวลา ณ ชุมชนบ้านปรางค์นคร อาณาจักรย่าโม จ.นครราชสีมา ภาคอีสาน
ชุมชนบ้านปรางค์นคร อ.คง จ.นครราชสีมา
สัมผัสมนต์เสน่ห์วิถีของชุมชนเชิงวัฒนธรรมเก่าแก่ กับบรรดาชาวบ้านที่พร้อมหยิบยื่นมิตรภาพอันแสนอบอุ่น โดยหมู่บ้านแห่งนี้เป็นชุมชนท่องเที่ยว OTOP นวัตวิถี ถือว่ามีของดีน่าสนใจอยู่หลายอย่าง อาทิ “บ้านเรือนไทยโคราช” อายุกว่า 100 ปี ที่ปัจจุบันยังมีคนพักอาศัยอยู่จริง นอกจากนี้ยังมี “สะพานข้ามบารายสวรรค์” สะพานไม้ไผ่ที่เกิดจากความสามัคคีของชาวบ้าน แต่ที่เป็นไฮไลท์ห้ามพลาด คือ กิจกรรมรับพลังจักรวาลที่ “ปราสาทบ้านปรางค์” โบราณสถานศักดิ์สิทธิ์ ศูนย์รวมใจประจำหมู่บ้าน ส่วนกิจกรรมพายเรืออีโปงกับชิมอาหารพื้นถิ่นก็ถือว่าน่าสนใจ จัดเป็นของดีสุดคลาสสิกแดนอีสานที่ไม่จำเป็นต้องจัดฉากหรือปรุงแต่งใดๆ
ททท.สำนักงานนครราชสีมา เบอร์โทรศัพท์ 0 4421 3030 หรือ 0 4421 3666
YL15 สวนหลวง ร.9
สถานีสวนหลวง ร.9 ตั้งอยู่บนถนนศรีนครินทร์ บริเวณด้านหน้าตลาดนัดรถไฟ ศรีนครินทร์
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยศรีนครินทร์ 51
จุดที่ 2. ซอยศรีนครินทร์ 53
จุดที่ 3. ซอยเฉลยสุข
จุดที่ 4. ซอยศรีนครินทร์ 42
ในส่วนของสถานีสวนหลวง ร.9 มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 , 2 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 1 และ 3
15. มหาศรัทธา…มหาอุโบสถตะเคียนทอง จ.มหาสารคาม ภาคอีสาน [คัดเลือกโดยผู้ทรงคุณวุฒิ]
ภาคอีสาน / มหาศรัทธา…มหาอุโบสถตะเคียนทอง
วัดพุทธวนาราม (วัดป่าวังน้ำเย็น) อ.เมืองมหาสารคาม จ.มหาสารคาม
นี่คือพระอุโบสถที่สร้างจากไม้ตะเคียนที่ใหญ่ที่สุดในโลก สร้างจากเสาไม้ตะเคียนทองขนาดใหญ่ โดยใช้เสาไม้ตะเคียนทองมากถึง 32 ต้น ขนาด 4 คนโอบ พระอุโบสถหลังนี้มีความสูงกว่า 20 เมตร ภายในมีองค์พระประธานปางนาคปรกแกะสลักจากไม้สักทองทั้งองค์ ปัจจุบันวัดแห่งนี้นอกจากเป็นที่ศรัทธาของพุทธศาสนิกชน ยังมีชื่อเสียงมากขึ้นด้านการท่องเที่ยว กลายเป็นจุดหมายห้ามพลาดของจังหวัดที่นักท่องเที่ยวทั่วไปสามารถแวะเวียนเยี่ยมชมสักการะสิ่งศักดิ์สิทธิ์ได้
ททท.สำนักงานขอนแก่น เบอร์โทรศัพท์ 0 4322 7714-5
YL16 ศรีอุดม
สถานีศรีอุดม ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกศรีอุดม
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. แยกศรีอุดม (ฝั่งขาออก)
จุดที่ 2. ซอยศรีนครินทร์ 63
จุดที่ 3. ซอยศรีนครินทร์ 58
จุดที่ 4. ซอยศรีนครินทร์ 54 (อุดมสุข 1)
ในส่วนของสถานีศรีอุดม มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 และ 3
16. อันซีนเกาะแห่งรัก(ษ์)...ที่สีชัง จ.ชลบุรี ภาคตะวันออก
เกาะสีชัง อ.เกาะสีชัง จ.ชลบุรี
ถ้าคุณเป็นคู่รักที่มีหัวใจอนุรักษ์ เกาะสีชังถือเป็นจุดหมายที่ลงตัว ด้วยความอันซีนของจุดชมวิวที่มีให้เลือกสร้างซีนโรแมนติกได้ถึง 5 จุด ทั้งปลายแหลมถ้ำพัง เสาธงอัษฎางค์ สะพานอัษฎางค์ ช่องอิสริยาภรณ์ ไปจนถึงทะเลแหวกท้ายเกาะ ไม่ว่าจะอยากชมพระอาทิตย์ขึ้นหรือตก ก็มีให้เลือกฟินกันได้แบบเหลือๆ และนอกจากนี้ ตัวเกาะยังมีคอนเซ็ปต์น่ารักๆ ในการจัดการกับสิ่งแวดล้อม ทั้งการนำขยะบนเกาะไปทำปุ๋ย การปลูกปะการังอ่อน การเปิดธนาคารปูและสัตว์น้ำหายาก เพื่อเป็นการอนุรักษ์ทรัพยากรทางทะเลรอบๆ เกาะให้มีความยั่งยืน ใครรู้ตัวว่าเป็นสาย ECO กดจองที่พักบนเกาะได้เลย โดยท่องเที่ยวได้ตลอดทั้งปี
ททท.สำนักงานประจวบคีรีขันธ์ เบอร์โทรศัพท์ 0 3842 7667,0 3842 8750 หรือ 0 3842 3990
YL17 ศรีเอี่ยม
สถานีศรีเอี่ยม ตั้งอยู่บนถนนศรีนครินทร์ บริเวณทางแยกต่างระดับศรีเอี่ยม เป็นสถานีที่สามารถเชื่อมต่อกับอาคารจอดแล้วจร (Park and Ride) ได้
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. อาคารจอดแล้วจร สถานีศรีเอี่ยม (ฝั่งทิศเหนือ)**
จุดที่ 2. อาคารจอดแล้วจร สถานีศรีเอี่ยม (ฝั่งทิศใต้) **
จุดที่ 3. แยกถนนศรีนครินทร์ - ถนนเทพรัตน
จุดที่ 4. วัดศรีเอี่ยม
**สามารถเชื่อมต่อกับ อาคารจอดแล้วจร (Park and Ride) ของโครงการฯ
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 2
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
17. เส้นทางท่องวังพญานาควัดมณีวงศ์ จ.นครนายก ภาคตะวันออก
วัดมณีวงศ์ อ.เมืองนครนายก จ.นครนายก
สำหรับผู้ที่ฝากตัวเป็นลูกหลานพญานาค นี่คือสถานที่ซึ่งคุณต้องห้ามพลาด เพราะวัดแห่งนี้ เกิดขึ้นจากพญานาคที่มาเข้าฝัน ‘หลวงพี่ต่อ’ เจ้าอาวาสวัดมณีวงศ์ และได้พาหลวงพี่ไปชมคลังมหาสมบัติที่เมืองบาดาล เพื่อให้เกิดภาพจำและนำกลับไปสร้างที่วัด จนเกิดเป็นความอลังการของงานประติมากรรมพญานาคกว่า 1000 ตน ที่อาศัยเวียนวนอยู่ในถ้ำขนาดใหญ่ โดยจำลองบรรยากาศความยิ่งใหญ่มาจากเมืองบาดาล สู่ความงดงามที่ถูกถ่ายทอดผ่านงานปั้นชั้นครู รับรองว่าถูกใจลูกหลานพญานาคสายมูอย่างแน่นอน โดยเปิดให้เข้าชมทุกวัน ตั้งแต่เวลา 07.00 - 17.00 น.
ททท.สำนักงานนครนายก เบอร์โทรศัพท์ 0 3731 2282 หรือ 0 3731 2284
YL18 สถานีศรีลาซาล
สถานีศรีลาซาล ตั้งอยู่บนถนนศรีนครินทร์ บริเวณแยกศิครินทร์
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยคลองหนองบัว
จุดที่ 2. ซอยศรีด่าน 24
จุดที่ 3. ซอยศรีด่าน 29
จุดที่ 4. ถนนลาซาล
ลิฟต์ - ทางลาด ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 และ 4
บันไดเลื่อน ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 2 และ 4
บันไดขึ้น - ลง ตั้งอยู่บริเวณทางขึ้น - ลง ที่ 1 , 2 , 3 และ 4
18. เก็บแสงสุดท้ายที่ปลายสะพานแก้ว…จุดชมพระอาทิตย์ตกเมืองแปดริ้ว จ.ฉะเชิงเทรา ภาคตะวันออก
วัดหงษ์ทอง ต.สองคลอง อ.บางปะกง จ.ฉะเชิงเทรา
นี่คือวัดที่ถูกน้ำทะเลกัดเซาะจนพื้นที่ใช้สอยภายในวัดหายไปเกินครึ่ง ด้วยเหตุนี้ ทำให้สิ่งก่อสร้างที่เคยตั้งอยู่ริมทะเล ปัจจุบันกลายเป็นสิ่งก่อสร้างในทะเลไปโดยปริยาย เราจึงมีโอกาสได้เห็นทั้งโบสถ์กลางน้ำ อาคารในทะเล รวมไปถึงพระเอกใหม่ของวัดอย่าง “ซีวอล์ค” หรือ สะพานกระจกใส สะพานแก้วที่ทอดตัวออกไปในท้องทะเล ที่กลายเป็นจุดชมพระอาทิตย์ตกของเมืองแปดริ้ว และจะดูตื่นตาตื่นใจมากๆ ในช่วงเวลาน้ำขึ้น เพราะถ้ามองผิวเผินจะดูคล้ายกับผู้คนกำลังเดินอยู่บนผิวน้ำ ปัจจุบันพูดได้เต็มปากเลยว่านี่ คือจุดชมพระอาทิตย์ตกทะเลแห่งใหม่ ที่เต็มไปด้วยความน่าประทับใจของเมืองแปดริ้ว วัดหงษ์ทอง เปิดทุกวัน เวลา 06.00 - 18.00 น.
ททท.สำนักงานฉะเชิงเทรา เบอร์โทรศัพท์ 0 3851 4009
19. Unseen ถ้ำในถ้ำ…สำรวจความลึกลับแห่งหุบเขาพญานาค จ.ระยอง ภาคตะวันออก
วัดถ้ำเขาประทุน อ.เขาชะเมา จ.ระยอง
“วัดถ้ำเขาประทุน” เป็นวัดที่มีภูมิประเทศเป็น หุบ ผา และยอดเขาสูง มีถ้ำเล็กถ้ำน้อยที่เต็มไปด้วยหินงอกหินย้อยอยู่ภายใน ด้านหน้าของวัดมี ‘ถ้ำพญานาคราช’ เป็นถ้ำรับแขก และมีลำแสงจากช่องเขารูปทรงพญานาคที่มองแล้วชวนให้รู้สึกอัศจรรย์ใจ แต่ไฮไลท์ของจริงคือการนั่งเรือลอดถ้ำเข้าไปยัง ‘หุบผาสวรรค์’ ที่พอหลุดออกมาจากความมืดของถ้ำ จะเหมือนทะลุออกมายังอีกมิติหนึ่ง ประกอบไปด้วยถ้ำอีกหลายถ้ำ ทั้งถ้ำนาคี ถ้ำรอยพระพุทธบาท และถ้ำหินงอกหินย้อย แถมยังมี ‘โพรงพญานาค’ ซึ่งเป็นจุดที่คนเฒ่าคนแก่เล่าว่า เคยพบเห็นพญานาคเลื้อยผ่านเข้าออก โดยรวมถือเป็นวัดที่เต็มไปด้วยพลังศรัทธาแห่งพญานาค เป็นรสชาติใหม่เมืองระยองที่อยากให้ผู้คนมาลิ้มลองด้วยตัวเอง นักท่องเที่ยวสามารถท่องเที่ยวได้ตลอดทั้งปี กิจกรรมพิเศษ อย่างนั่งเรือลอดถ้ำ จะจัดขึ้นในช่วงฤดูฝน ตั้งแต่เดือนกรกฎาคม - พฤศจิกายน
ททท.สำนักงานระยอง เบอร์โทรศัพท์ 0 3865 5420-1
20. ผจญภัยเมืองบาดาล…พิสูจน์ตำนานพญานาคแห่งถ้ำน้ำเขาศิวะ จ.สระแก้ว ภาคตะวันออก [คัดเลือกโดยผู้ทรงคุณวุฒิ]
ถ้ำน้ำเขาศิวะ อ.คลองหาด จ.สระแก้ว
มีบางคนบอกที่นี่เป็นบ้านของเทวดา บ้างก็ว่าเป็นวังพญานาค แต่ที่แน่นอนที่สุด คือ นี่เป็นถ้ำที่เกิดมาเพื่อนักท่องเที่ยวสายแอดเวนเจอร์อย่างแท้จริง ด้วยเป็นถ้ำที่มีน้ำไหลตลอดทั้งปี บริเวณด้านในของถ้ำจึงมีสภาพเหมือนสระว่ายน้ำ ต้องอาศัยการสวมชูชีพแล้วเกาะห่วงยางลอยคอเข้าไป ซึ่งถ้ำแห่งนี้จะมีเจ้าหน้าที่คอยนำทางและบรรยายเรื่องราวของแต่ละจุดให้ฟังตลอดทริป ส่วนบรรยากาศด้านในเต็มไปด้วยความสวยงามของหินงอกหินย้อยรูปทรงหลากหลายตามแต่จะจินตนาการ และยังมีตำนานพ่อปูพญานาคองค์สีแดง ที่ชาวบ้านเคยพบเห็นแหวกว่ายอยู่ภายในถ้ำ ซึ่งเป็นที่มาของศาลพ่อปู่นาคาที่ตั้งอยู่บริเวณปากถ้ำ ลูกหลานพญานาคทราบแล้ว เตรียมชุดเปียกด่วน นักท่องเที่ยวสามารถเข้าผจญภัยเมืองบาดาลได้ตลอดทั้งปี ตั้งแต่เวลา 10.00 - 16.00 น.
ททท.สำนักงานนครนายก เบอร์โทรศัพท์ 0 3731 2282 หรือ 0 3731 2284
YL21 ศรีเทพา
สถานีศรีเทพา ตั้งอยู่บนถนนเทพารักษ์ บริเวณด้านหน้าหมู่บ้านธนเศรษฐ์แลนด์
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. สี่แยกศรีเทพา (ฝั่งใต้)
จุดที่ 2. ซอยร่วมจิตพัฒนา
จุดที่ 3. ถนนเทพารักษ์ กม. 3.5 (ฝั่งขาเข้า)
จุดที่ 4. สี่แยกศรีเทพา (ฝั่งเหนือ)
ในส่วนของสถานีบางกะปิ มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 2 และ 3 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 1 และ 4
21. ท่องอุทยานธรรมลอยฟ้า…พลังศรัทธาแห่งเขานาในหลวง จ.สุราษฎร์ธานี ภาคใต้
อุทยานธรรมเขานาในหลวง อ.พนม จ.สุราษฎร์ธานี
อุทยานธรรมเขานาในหลวง ถือเป็นสำนักสงฆ์ที่สร้างขึ้นด้วยพลังศรัทธาของชาวบ้าน สถานที่แห่งนี้ เริ่มเป็นที่รู้จักจากความวิจิตรของประตูพุทธวดี หรือซุ้มประตูแห่งกาลเวลา ถือเป็นซิกเนเจอร์อันแสนงดงามยามเมื่อแสงเช้าตกกระทบ ก่อนจะต่อยอดพลังศรัทธา ด้วยการสร้าง เจดีย์ร้อยยอดพันองค์ เจดีย์ลอยฟ้าพุทธศิลาวดี เจดีย์ลอยฟ้าพุทธราชาวดี ทำให้ปัจจุบันสถานที่แห่งนี้ เป็นเหมือนสวรรค์บนดิน โดยเฉพาะยามทะเลหมอกเลื้อยพันรอบยอดเขา เจดีย์แต่ละองค์จะดูคล้ายกับลอยอยู่บนก้อนเมฆ เป็นภาพอุทยานธรรมลอยฟ้าที่ดูตื่นตา…น่าอัศจรรย์ใจ นักท่องเที่ยวสามารถเดินทางมาชมความมหัศจรรย์ได้ตลอดทั้งปี
ททท.สำนักงานสุราษฎร์ธานี เบอร์โทรศัพท์ 0 7728 8817-9
YL22 ทิพวัล
สถานีทิพวัล ตั้งอยู่บนถนนเทพารักษ์ บริเวณคลองมหาวงษ์ ใกล้กับหมู่บ้านทิพวัล
มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ถัดจากคลินิกเวชกรรมจุฬารัตน์ 2
จุดที่ 2. ซอยหมู่บ้านทิพวัล
จุดที่ 3. ก่อนถึงคลองมหาวงษ์ (ฝั่งขาออก)
จุดที่ 4. ถัดจากโรงงานกระดาษธนธาร จำกัด
ในส่วนของสถานีทิพวัล มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 , 3 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 2 และ 3
22. ย้อนเวลาหาความสงบสุข…เที่ยวเกาะหลงยุคแห่งอันดามัน จ.ระนอง ภาคใต้
หมู่เกาะกำ อ.กะเปอร์ จ.ระนอง
“หมู่เกาะกำ” ประกอบด้วย เกาะกำตก หรืออ่าวเขาควาย ด้วยเอกลักษณ์ของอ่าวเป็นชายหาดที่โค้งมาติดกันเป็นรูปวงกลมตามแนวเหนือ-ใต้ ด้วยความมหัศจรรย์นี้ มีชายหาดที่ขาวสะอาด เนื้อทรายเนียนละเอียด น้ำทะเลโดยรอบเกาะเป็นสีฟ้าใส สามารถเล่นน้ำได้ เกาะค้างคาว เหตุเพราะค้างคาวแม่ไก่ที่เคยอาศัยอยู่นับพันตัว บริเวณหน้าเกาะมีหาดทรายสีขาวละเอียดและนุ่มดั่งแป้งเด็ก พร้อมกับน้ำทะเลใสที่มองเห็นทราย โขดหิน และปะการังใต้น้ำได้แบบชัดเจน รอบๆ เกาะสามารถดำน้ำชมปะการังได้ทั้งแบบน้ำตื้นและน้ำลึก จุดดำน้ำตื้นจะอยู่ตรงบริเวณหัวเกาะมีปะการังและปลาการ์ตูนนีโม่ที่ว่ายอยู่ในดอกไม้ทะเล และเกาะญี่ปุ่น ชาวบ้านเล่าว่า เมื่อก่อนเคยมีชาวญี่ปุ่นมาเลี้ยงหอยมุก บางคนก็บอกว่าที่นี่เป็นที่ประกอบอาหารส่งเสบียงให้แก่ทหารญี่ปุ่นในยุคสงครามโลกครั้งที่ 2 สภาพพื้นที่มีภูเขาเล็ก ๆ ด้านหน้าเกาะเป็นแนวชายหาด หาดทรายมีสีขาวละเอียด บริเวณรอบเกาะสามารถดำน้ำชมปะการัง มีปลาการ์ตูนนีโม่และปลาสวยงามอย่างอื่นมากมาย ทั้ง 3 เกาะรวมเรียก นี่คือหมู่เกาะที่ถูกเรียกว่า “หมู่เกาะหลงยุค” อาจด้วยการที่หมู่เกาะแห่งนี้ ยังคงความเป็นธรรมชาติดั่งเดิมไว้ เพราะแม้แต่ชาวบ้านเอง ก็ยังคงเลือกใช้ชีวิตอยู่กับธรรมชาติแถบนี้แบบเดิมๆ และนี่คือเหตุผลที่ทำให้หมู่เกาะกำมีความสงบเงียบ แถมยังพร้อมเพียบด้วยธรรมชาติอันสวยงามและอุดมสมบูรณ์ชนิดเกาะอื่นเลียนแบบได้ยาก เป็นหมู่เกาะที่ไม่หมุนไปตามกาลเวลา ซึ่งรอการเดินทางมาพิสูจน์ความหลงยุคด้วยตัวคุณเอง สามารถเดินทางท่องเที่ยวได้ในช่วง วันที่ 16 ตุลาคม – 15 พฤษภาคมของทุกปี
ททท. สำนักงานชุมพร เบอร์โทรศัพท์ 0 7750 2775-6หรือ0 7750 1831
YL23 สถานีสำโรง
สถานีสำโรง ตั้งอยู่บนถนนเทพารักษ์ บริเวณแยกสำโรง มีตำแหน่งทางขึ้น - ลง จำนวน 4 จุด
จุดที่ 1. ซอยเทพารักษ์ 4
จุดที่ 2. รถไฟฟ้าสายสีเขียว สถานีสำโรง *
จุดที่ 3. ถนนสุขุมวิท (แยกสำโรง) *
จุดที่ 4. ซอยเย็นดี
*สามารถเชื่อมต่อกับทางขึ้น - ลง สถานีสำโรง ของรถไฟฟ้าสายสีเขียว ช่วงแบริ่ง - สมุทรปราการ สถานีสำโรง
ในส่วนของสถานีสำโรง มีลิฟต์และทางลาด รองรับรถเข็นวีลแชร์ บริเวณทางขึ้น - ลง ที่ 1 , 3 และ 4 และมีบันไดเลื่อน รองรับในส่วนของ ทางขึ้น - ลง ที่ 1 และ 4
23. พลังศรัทธาใต้มหาสมุทร…รอยพระพุทธบาทแห่งอันดามัน จ.ภูเก็ต ภาคใต้
รอยพระพุทธบาทในทะเล สำนักสงฆ์เกาะแก้วพิสดาร อ.เมืองภูเก็ต จ.ภูเก็ต
รอยพระพุทธบาทในทะเลแห่งนี้ เป็นรอยพระพุทธบาท รอยที่ 5 ‘นัมมทานที’ ซึ่งถือเป็น 1 ใน 5 รอยพระพุทธบาทที่ได้รับความศรัทธาเชื่อมั่นจากพุทธศาสนิกชนทั่วโลก ตั้งอยู่ที่สำนักสงฆ์เกาะแก้วพิสดาร โดยช่วงเวลาน้ำทะเลขึ้นสูงจะไม่สามารถเห็นรอยพระพุทธบาท แต่เมื่อน้ำทะเลลดลงจะสามารถมองเห็นรอยพระพุทธบาทได้อย่างชัดเจน สามารถเดินทางท่องเที่ยวได้ตลอดทั้งปี (ยกเว้นช่วงมรสุม)
ททท.สำนักงานภูเก็ต เบอร์โทรศัพท์ 0 7621 1036 หรือ 0 7621 2213
อาคารจอดแล้วจร (Park & Ride)
อาคารจอดแล้วจร (Park & Ride) ตั้งอยู่บริเวณถนนศรีนครินทร์ บริเวณทางต่างระดับศรีเอี่ยม เชื่อมต่อกับสถานีศรีเอี่ยม เป็นอาคาร 7 ชั้น รองรับรถยนต์ได้ประมาณ 2,800 คัน ปัจจุบันอยู่ระหว่างการดำเนินงานก่อสร้างสะพานยกระดับ บนถนนบางนา - ตราด เพื่อเข้าสู่อาคารจอดแล้วจร และเชื่อมต่อไปยังสถานีศรีเอี่ยม (YL17)
24. มหัศจรรย์แห่งชั้นหิน…งานศิลป์ถิ่นเมืองคอน จ.นครศรีธรรมราช ภาคใต้
หินพับผ้า อ.ขนอม จ.นครศรีธรรมราช
ผาหินรูปร่างแปลกตาที่พบเห็นได้บริเวณกลางทะเลขนอม เป็นปรากฏการณ์ทางธรณีวิทยาที่มีอยู่เพียงน้อยแห่งบนโลกใบนี้ มีลักษณะเป็นแผ่นหินซ้อนเรียงกันเป็นชั้นๆ ซึ่งแต่ละจุดจะดูสวยงามแตกต่างกันตามแต่จะจินตนาการ โดยชาวต่างชาติเรียกปรากฏการณ์นี้ว่า ‘Pancake Rock’ ส่วนคนไทยรู้จักกันในชื่อ ‘หินพับผ้า’ เพราะดูคล้ายกับผ้าที่พับซ้อนกันเป็นชั้นๆ เป็นความมหัศจรรย์ของธรรมชาติเมืองคอน ซึ่งนักท่องเที่ยวสามารถเช่าเรือจากชุมชนแหลมประทับ เพื่อมาเที่ยวชมพิพิธภัณฑ์ธรรมชาติแห่งนี้ได้ตลอดวัน สามารถเดินทางมาชมชั้นหินได้ตลอดทั้งปี ทั้งนี้ขึ้นอยู่กับ ลม ฟ้า และอากาศ แต่ช่วงที่แนะนำ คือ เดือนมกราคม - เมษายน
ททท.สำนักงานนครศรีธรรมราช เบอร์โทรศัพท์ 0 7534 6515-6
25. ผจญภัยในตะรุเตา…ตามหาเงาราชาโจรสลัดเมืองไทย จังหวัดสตูล ภาคใต้
“ตะรุเตา” เกาะที่เต็มไปด้วยตำนานและคำบอกเล่า ทั้งขุมสมบัติ ถ้ำลับ โจรสลัด สัตว์ร้าย หรือแม้กระทั่งต้นไม้มีพิษ แต่ในคำบอกเล่าสุดแฟนตาซี ถือว่ายังมีเค้าโครงจากเรื่องจริง ด้วยเป็นเกาะขนาดใหญ่ที่มีภูมิประเทศหลากหลาย แถมยังเงียบสงบ จึงไม่แปลกหากตะรุเตาจะเต็มไปด้วยพืชพรรณแปลกๆ รวมถึงสัตว์หายาก และหากใครชอบศึกษาประวัติศาสตร์ จะรู้ว่านอกจากธรรมชาติและชายหาดสวยๆ แล้ว บนเกาะแห่งนี้ยังมีสถานที่ท่องเที่ยวทางประวัติศาสตร์มากมาย โดยเฉพาะสถานกักกันตัวนักโทษ ซึ่งท้ายสุดแล้วกลายเป็นที่มาของตำนาน “โจรสลัดแห่งตะรุเตา” เรื่องเล่าที่ถูกนำไปสร้างเป็นภาพยนตร์และนวนิยายมาแล้วหลายต่อหลายครั้ง ช่วงเวลาที่เกาะตะรุเตาเปิดให้นักท่องเที่ยวเข้ามาผจญภัย คือ เดือนตุลาคม - เดือนพฤษภาคมของทุกปี
ททท.สำนักงานสตูล เบอร์โทรศัพท์ 06 2595 7748
โรงพยาบาลวิภาราม อมตะนคร รับสมัครงานหลายตำแหน่ง LINK
ร่วมงานกับเรา โรงพยาบาลวิภาราม อมตะนคร
- สามารถเข้ามาสมัครได้ทุกวันจันทร์ - ศุกร์ เวลา 08.00 - 16.00 น. (ยกเว้นเวลา 12.00 - 13.00 น. และวันหยุดนักขัตฤกษ์) สอบถามข้อมูลเพิ่มเติมที่ โทรศัพท์ 033-265-599 ต่อ 2212 แผนกบุคคล ท่านสามารถส่งประวัติมาได้ที่ hr_vibharam@hotmail.com
รพ.เกษมราษฎร์ รามคำแหง เปิดรับสมัครพนักงาน Full time LINK
รพ.เกษมราษฎร์ รามคำแหง เปิดโอกาส ขยายตำแหน่งงานเพิ่ม เปิดรับสมัครพนักงาน Full time
ฝ่ายการพยาบาล
- ผู้จัดการแผนกประกันสังคม 1 อัตรา
- หัวหน้าแผนกป้องกันและฟื้นฟูสุขภาพ 1 อัตรา
- หัวหน้าแผนก OPD(เงินสด)จำนวน 1 อัตรา
- Pn / Na จำนวนหลายอัตรา
สอบถามได้ 02-339-0000ต่อ4064
หรือ กรอกใบสมัครที่แผนกบุคคล ชั้น 4
วันจันทร์-วันศุกร์ 08.00-15.00 น.
โรงพยาบาลแพร่ราม รับสมัครงาน หลายตำแหน่ง LINK
โรงพยาบาลแพร่ราม รับสมัครงาน
เจ้าหน้าที่ประชาสัมพันธ์/เวชระเบียน 2 ตำแหน่ง
1.วุฒิการศึกษา ระดับประกาศนียบัตรวิชาชีพชั้นสูง(ปวส)
สาขาเทคโนโลยีสารสนเทศ , สาขาการตลาด
2.เพศ หญิง อายุ 20-25ปี
3.มีใจรักในการบริการ มีความซื่อสัตย์ อดทนในการทำงาน
4.หากมีประสบการณ์จะพิจารณาเป็นพิเศษ
พนักงานผู้ช่วยเหลือคนไข้ 1 ตำแหน่ง
1.วุฒิการศึกษาระดับมัธยมศึกษาตอนปลาย (ม.6) หรือเทียบเท่า
2.อายุ 18 - 30 ปี
3.เพศหญิง - เพศชาย (เพศชายต้องผ่านการเกญฑ์ทหารแล้ว)
4.มีประสบการณ์การทำงานเกี่ยวกับการกู้ชีพ,กู้ภัยจะพิจารณาเป็นพิเศษ
หลักฐานในการสมัคร
1.รูปถ่ายขนาด 1 นิ้ว จำนวน 2 รูป
2.หลักฐานทางการศึกษา
3.สำเนาบัตรประชาชน,สำเนาทะเบียนบ้าน
รับสมัครงานได้ที่งานบุคคล ชั้น 1
ตั้งแต่ วันที่ 24 กุมภาพันธ์ 2565 ถึง 10 มีนาคม 2565
เวลา 09.00 น.-16.00น.
(เว้น วันเสาร์,อาทิตย์และวันหยุดนักขัตฤกษ์ )
สอบสัมภาษณ์
วันที่ 10 มีนาคม 2565 ชั้น 1 เวลา 14.00 น.
โรงพยาบาลพิษณุเวช อุตรดิตถ์ ประกาศรับสมัครงาน Full Time LINK
โรงพยาบาลพิษณุเวช อุตรดิตถ์ ประกาศรับสมัครงาน Full Time
- พยาบาลวิชาชีพ ฉุกเฉินและอุบัติเหตุ
- ผู้ช่วยพยาบาล OPD
- เลขานุการ
Part Time
- พยาบาลวิชาชีพ Cohort Ward
ต้องการสมัครงาน ติดต่อ
โทร. 055-90-9000 ต่อ 6118 มือถือ 081-707-9811
E-mail : psvgroup_recruit@princhealth.com
โรงพยาบาลพิษณุเวช อาคาร 7 ชั้น 6
วันจันทร์-วันศุกร์ เวลา 09.00 – 15.00 น.
โรงพยาบาลกรุงเทพเชียงราย เปิดรับสมัครพนักงาน LINK
โรงพยาบาลกรุงเทพเชียงราย เปิดรับสมัครพนักงาน
ทุกตำแหน่งหากมีประสบการณ์
สามารถสื่อสารภาษาอังกฤษ
และภาษาจีนได้ จะได้รับการพิจารณาเป็นพิเศษ”
สอบถามรายละเอียดเพิ่มเติมได้ที่
052-051826, 052-051827
รับสมัครเวลาทำการ วันจันทร์ – ศุกร์
เวลา 08.00 - 17.00 น.
(ยกเว้น วันหยุดนักขัตฤกษ์)
โรงพยาบาลราชพฤกษ์ เปิดรับสมัคร พนักงานบัญชีตรวจสอบ LINK
โรงพยาบาลราชพฤกษ์ เปิดรับสมัครงาน สามารถติดต่อสมัครได้ด้วยตนเอง ที่โรงพยาบาลราชพฤกษ์ ชั้น 13 แผนกบุคคล วันจันทร์-ศุกร์ เวลา 08.00-12.00 น.และ 13.00-16.00 น. หรือส่ง Resume มาที่ e-mail: hr@rph.co.th สอบถามรายละเอียดเพิ่มเติมได้ที่ แผนกบุคคล โทร. 043-333555 ต่อ 1301 และ 1302
โรงพยาบาลไทยอินเตอร์เนชั่นแนล รับสมัครพนักงาน Digital Marketer 1 อัตรา LINK
โรงพยาบาลไทยอินเตอร์เนชั่นแนล รับสมัครพนักงาน
ตำแหน่งงานว่าง
Digital Marketer 1 อัตรา
แต่เนื่องจากสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด 19 เพื่อเป็นการควบคุมและป้องกันการแพร่ระบาดทางโรงพยาบาลไทยอินเตอร์เนชั่นแนล
ขอสงวนสิทธิ์ ‼️การสมัครงานแบบ Walk in ‼️
E - mail : hrthaiinter@gmail.com
Tel: 077 - 332654 ต่อ 252
อันดับที่ 11-30
13 รพ.รามคำแหง 74.99%
14 รพ.พญาไท 1 74.96%
15 รพ.ยันฮี 74.96%
16 รพ.กรุงเทพคริสเตียน 74.93%
17 รพ.วชิระ 74.85%
18 รพ.กรุงเทพอินเตอร์ 74.83%
19 รพ.พญาไท 2 74.65%
20 รพ.ศรีนครินทร์ 74.58% (ขอนแก่น)
21 รพ.สมิติเวช ศรีนครินทร์ 74.41%
22 รพ.สงขลานครินทร์ 74.29% (สงขลา)
23 รพ.พระมงกุฏเกล้า 74.26%
24 รพ.ขอนแก่น 74.25% (ขอนแก่น)
25 รพ.พระพุทธชินราช 74.19% (พิษณุโลก)
26 รพ.เซนต์หลุยส์ 74.14%
27 สถาบันจักรีนฤบดินทร์ 74.14% (สมุทรปราการ)
28 รพ.สงขลา 74.09% (สงขลา)
29 รพ.หาดใหญ่ 74.03% (สงขลา)
30 รพ.ซีจีเอส พหลโยธิน
74.00%
โรงพยาบาลไทยอินเตอร์เนชั่นแนล รับสมัครพนักงาน หัวหน้าแม่บ้าน 1 อัตรา LINK
โรงพยาบาลไทยอินเตอร์เนชั่นแนล รับสมัครพนักงาน
ตำแหน่งงานว่าง
หัวหน้าแม่บ้าน 1 อัตรา
แต่เนื่องจากสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด 19 เพื่อเป็นการควบคุมและป้องกันการแพร่ระบาดทางโรงพยาบาลไทยอินเตอร์เนชั่นแนล ขอสงวนสิทธิ์ ‼️การสมัครงานแบบ Walk in ‼️
E - mail : hrthaiinter@gmail.com
Tel: 077 - 332654 ต่อ 252
Barnabis
สีเขียวอ่อนหวานอบอุ่น ไม่เหมือนใคร รู้สึกถึงความกรีน ความอ่อนโยนนุ่มนวล และอยากอยู่นานๆ ใกล้บ้านใครมั่ง
MD-82 cafe ออกบินไปด้วยกัญ
สายการบิน MD-82 จอด ณ รันเวย์ สนามบินอ่อนนุช อยู่ระหว่างซอยอ่อนนุช 86 - 88
Alchemi Botanics Cannabis สุขุมวิท 69
ที่ Alchemi Botanics Cannabis นี่ เราน่าจะได้ศึกษาถึงพันธุ์ไม้วิเศษนี้อย่างเจาะลึกลงไปถึงไตรโคม และกิ่งก้านใบดอก ให้สมกับชื่อร้านเท่ๆ ในซ.สุขุมวิท 69 แห่งนี้ ใกล้บ้านใครมั๊ย
Midnight Hightime Flower Field
จานบินทะลุอวกาศ เปิดปล่องฟ้านีออน โปรยปราย พืชสมุนไพรนานาชื่อ ฟังดูน่าฉงน Tahoe Pink Runtz White Berry Sour Diesel Organic flower ฉันไม่คุ้นซักชื่อเรยยย ถ้าใกล้บ้านละน่าดู
Ministry of High
ฟังเค้านิยามแล้วได้แต่ร้องกรี๊ดกร๊าดในความสุด "แจกัญอวกาศ สู่การล่องลอยที่ไม่สิ้นสุด! แจกัญอวกาศ ใครใช้ก็แฮปปี้ Ministry of HiGH vas collection - Meet the vase that will bring you to space!" - The first collection drop to the citizens of the high estate. กอดแจกันแน่นๆ ไม่ยอมปล่อยหลุด ละว่างั้น ทองหล่อ 7 ใกล้บ้านใครมั๊ย
NEVERLAND.OG.
NEVERLAND.OG. โครงการBox Space Ratchayothin 15 น้องใหม่บนถนนรัชดา
RG 420 Khaosan
เปิดตัวอีกร้าน ณ ถนนข้าวสาร เจ้าของเดียวกันกับฟาร์มเกษตรอินทรีย์เพชรล้านนา กลุ่มเกษตกรสายปลูกในภาคเหนือฝั่งจ.ลำปาง มาวันนี้ปักธงในกรุงเทพแบบจริงจังกันละ ใกล้บ้านใครมั่งมั๊ย
THC Thonglor Hemp Club
ร้านเนี๊ยบๆ หล่อๆ ใต้บ้านจันทร์คอนโด ต้นซอยแจ่มจันทร์ฝั่งทองหล่อ ข้างนอกเนี๊ยบ ข้างในยิ่งเนี๊ยบกว่า ได้บรรยากาศแบบไพรเวซี่ เอ็กซ์คลูสีฟ หากอยากเร้นกายจากภายนอกที่วุ่นวายสักพัก ที่นี่น่าจะเหมาะเลยทีเดียว ตัวเลือกที่จัดสรรมา ก็เข้าทีไม่น้อย ส่วนเมนูมีอะไรบ้างนั้น สอบถามที่บาร์เค้าเลย
ไนซ์ทูวี้ดยู
กรี๊ดชื่อร้านเทอเหลือเกิน Nice to weed you ใกล้บ้านใครไปเช็คซิ
Heaven of weed Bangkok สุขุมวิท 63
แค่ชื่อก็พาไปไกลถึงไหนต่อไหนไปแล้ว "ชอบนะ เคาน์เตอร์สเปซชิพก้อนนั้นน่ะ พาบ๊อบ มาเล่ย์ขึ้นยานมาซะด้วยสิ" ส่วนจะไปไกลแค่ไหน แกะแผนที่ดูเอา สุขุมวิท 63 นี่เอง ใกล้บ้านใครมั๊ย
WEED Express สุขุมวิท 69
ร้านโปร่งโล่ง เบาสบาย ใน Summer Hill (BTS Phrakanong) ดูเหมือนจะหลากหลายสายพันธุ์กัญชาให้ศึกษาเรียนรู้ ใกล้บ้านใครมั๊ย
Greens Dispensary ทองหล่อ10
ร้านน่ารัก อบอุ่น คลีนๆ ที่มีความกรีนรออยู่ จำไม่อยาก อาคาร Blue Chips ทองหล่อ 10 ใกล้บ้านเธอมั๊ยนี่
No Mans Land
ดินแดนอารยะอิสระไร้พันธนาการ ละแวกสีลมบางรัก เครื่องดื่ม ขนมก็มีพร้อม ดาดฟ้าสิใช่เลย ใกล้บ้านเธอมั๊ยอ่า
THC Bangkok - The Herb Club
ร้านใหม่อีกร้านแฝงตัวในซอยไผ่สิงห์โต มีครบทุกสายพันธ์ุ Sativa Indica Hybrid ให้เลือกกัน ใกล้บ้านใครมั๊ย ลองดู
Green Heaven Dispensary วังทองหลาง
Green Heaven Dispensary ร้านขายกัญชา ใน วังทองหลาง มาที่นี่น่าจะได้ครบทุกอย่าง
Never not high
เปิดบริการทุกวันตั้งแต่ 14:00 - 22:00 ถนน มหรรณพ แขวง เสาชิงช้า เขตพระนคร - บ้านใครใกล้แถวนั้นมั่งน่ะ
Wake N Bake คาเฟ่หรรษา หัวใจสีเขียว
Wake N Bake Cafe รวมทุกอย่าง เอาใจสายสีเขียว ผ่อนคลาย คลายเครียด ไปกับ... เค้ก,ขนม,เครื่องดื่ม,ดอกเขียว คุณภาพกว่า 10 สายพันธุ์ ในราคามิตภาพ ฟิลล์บ้านเพื่อน - ทองหล่อ ก็ไม่ไกล
++ กิจกรรมที่ผ่านไป 2565 ++
Juicy Buds
บาร์กัญชาเบ้าหลอมฮิปฮอปอเมริกัน ในสีสันฉูดฉาด ของวิวิดกราฟิตี้ แวนดัลนิดๆ มัดรวมกับคอนเทม บอลลูน เรืองรอง คนนิยมสังสรร คนไม่ผิดหวังจะไปเยี่ยมเยือน สุขุมวิท 11 ใกล้บ้านใครมั่งมั๊ย
OG Cozy
จำหน่าย ช่อดอก อุปกรณ์เกี่ยวกับกัญชา ดิน ปุ๋ย ผลผลิตทางร้านปลูกเอง ดิน อินทรีย์
ใกล้บ้านใคร แถว ถนนจันทร์ ก็ลองแวะกิจกรรมที่จัดไปแล้ว
++++++++++++
งานที่จัดไปแล้ว
+++++
บุรีรัมย์ มาราธอน 2022 - 22 ม.ค.65 LINK
บุรีรัมย์ มาราธอน 2022 พรีเซนเต็ดบาย เครื่องดื่มตราช้าง Buriram Marathon 2022 : มาราธอนแห่งอารยธรรม 22 มกราคม 2022 นี้ จังหวัดบุรีรัมย์ขอเชิญท่านพบกับมหกรรมการแข่งขันวิ่งมาราธอน ในระยะทาง มาราธอน 42.195 กม. : ฮาฟ มาราธอน 21.1 กม. : มินิ มาราธอน 10 K : ฟันรัน 4.5 กม. ภายใต้กลิ่นไอแห่งอารยธรรมของจังหวัดบุรีรัมย์ ที่จะทำให้คุณตื่นเต้นในทุกย่างก้าวจนถึงเส้นชัย สำหรับนักวิ่งที่จะเข้าร่วมงานวิ่ง “บุรีรัมย์ มาราธอน 2022 พรีเซนเต็ดบาย เครื่องดื่มตราช้าง”
ชมภาพ-คลิปบรรยากาศ[งดจัด] ขอนแก่นมาราธอนนานาชาติ ครั้งที่ 18 ในปี พ.ศ. 2565 (KKIM2022) LINK
ตามที่มหาวิทยาลัยขอนแก่นและจังหวัดขอนแก่น ได้ริเริ่มจัดกิจกรรมขอนแก่นมาธาราธอนนานาชาติ มาตั้งแต่ปี พ.ศ. 2547 และจัดต่อเนื่องมาโดยตลอดจนถึงครั้งที่ 17 เมื่อเดือนมกราคม พ.ศ. 2563 แต่เนื่องด้วยเกิดสถานการณ์การแพร่ระบาดของโรคติดเชื้อไวรัสโคโรนา 2019 (COVID-19) ซึ่งทุกคนต้องร่วมกันป้องกัน ควบคุม และลดปัจจัยเสี่ยงต่อการแพร่ระบาดของโรคดังกล่าว คณะกรรมการจัดการแข่งขันได้พิจารณาโดยละเอียดรอบคอบแล้ว มีมติเห็นควรงดการจัดกิจกรรมขอนแก่นมาราธอนนานาชาติ ครั้งที่ 18 ในปี พ.ศ. 2565 (KKIM2022) ส่วนกำหนดการจัดกิจกรรมครั้งต่อไปในปี พ.ศ. 2566 นั้น เห็นควรกำหนดการแข่งขันในช่วงวันอาทิตย์ปลายเดือนมกราคม ดังเช่นที่จัดมาทุกครั้ง
งานวิ่งแก่งกระจาน วิ่งเพชรบุรี 6 ก.พ.65 LINK
งานวิ่ง Kaengkrachan Explorer Run 2022 งานเดียว เฟี้ยวตลอดวัน 6 กุมภาพันธ์ 2565
งานวิ่งที่เส้นทางสวยสุด ในพื้นที่แก่งกระจาน เหรียญและถ้วย งาน Handmade ทุกชิ้น ของกินเพียบ เต็มอิ่ม ฟินสุด ฉุดไม่อยู่ ตามสไตล์ เมืองเพชรบุรี เครือข่ายเมืองสร้างสรรค์ด้านอาหาร Creative city of Gastronomy
รายละเอียดเพิ่มเติม 092-4849591 หรือ 062-4985893 Line OA : @krscthailand
[ปรับเป็น VR Run] งดจัดวิ่ง Kings College Half Marathon 2022 เป็นแบบ VR Run LINK
ปรับรูปแบบกิจกรรมวิ่ง Kings College Half Marathon 2022 เป็นแบบ VR Run
"จังหวัดนครปฐมเป็นจังหวัดพื้นที่ควบคุม(สีส้ม) ซึ่งไม่สามารถจัดกิจกรรมที่มีการรวมตัวของคนจำนวนมากได้" เป็นเหตุให้กิจกรรมวิ่ง Kings College Half Marathon 2022 ที่จะจัดขึ้นในวันที่ 20 กุมภาพันธ์ พ.ศ. 2565 ไม่สามารถจัดขึ้นได้ เปลี่ยนการวิ่งเป็น VR RUN แบบสะสมการวิ่งแทน รายละเอียดติดตามจากเพจ
Run For Health 2022 วิ่งเปิดเมืองพะเยา เป็น 5 ก.พ.65 LINK
วิ่งเปิดเมืองพะเยา สนับสนุนโรงพยาบาลพะเยา หอการค้าจังหวัดพะเยา เลื่อนกำหนดวิ่งเป็นวันที่ 5 กุมภาพันธ์ 2565 (เดิม 15 มกราคม 65)
สถานที่ - ประเภท Fun run หน้าอนุสาวรีย์พ่อขุนงำเมือง อำเภอเมืองพะเยา จังหวัดพะเยา,
- ประเภท Mini Marathon หน้าอนุสาวรีย์พ่อขุนงำเมือง อำเภอเมืองพะเยา จังหวัดพะเยา สอบถามเพิ่มเติม โทรศัพท์ 054-409123-125
รวมภาพงานวิ่งมวกเหล็กเทรล 2021 - 5-6 ก.พ.2565 LINK
กิจกรรม มวกเหล็กเทรล 2021 ประกาศวันจัดกิจกรรมใหม่อย่างเป็นทางการ ในวันที่ 5-6 กุมภาพันธ์ 2565 กำหนดการ ดังนี้ วันที่ 5 กุมภาพันธ์ 2565 : รับเสื้อ,บิบ เเละของที่ระลึก วันที่ 6 กุมภาพันธ์ 2565 : ปล่อยตัวทุกระยะ
เชียงของ มินิมาราธอน 6 ก.พ.65 LINK
CHIANGKHONG MINI MARATHON 2022 "เชียงของ มินิมาราธอน" วันอาทิตย์ที่ 6 กุมภาพันธ์ 2565 กำหนดการ วันอาทิตย์ที่ 6 กุมภาพันธ์ 2565 เวลา 05.30 - 09.00 น. สถานที่ ณ สนามโรงเรียนเชียงของวิทยาคม อ.เชียงของ จ.เชียงราย
TENMEE 10K : Pride of SURIN 12-13 ก.พ.65 LINK
TENMEE 10K : Pride of SURIN 12-13 กุมภาพันธ์ 2565 10K & Fun Run จุดสตาร์ท หน้าที่ทำการองค์การบริหารส่วนตำบลเทนมีย์ - วิ่งทางเรียบๆ สบายๆ วอร์มอัพกันสัก 2 กม. ก่อนขึ้นสันอ่างเก็บน้ำอำปึล ระยะบนสันอ่างประมาณ 2.5 กม. ด้านซ้ายมือของนักวิ่งเป็นวิวอ่างเก็บน้ำยามเย็นที่ย้อมไปด้วยสีทองจากแสงอาทิตย์ที่กำลังจะลาลับขอบฟ้าทางด้านขวามือ เข้าเส้นชัยบริเวณหน้าโครงการซแรย์อทิตยา
Bikini Run Trang งานวิ่งของคนโลกสวย ครั้งที่3 - 26 ก.พ.65 LINK
Bikini Run Trang งานวิ่งของคนโลกสวย ครั้งที่สาม ณ ท่าเรือปากเมง หาดปากเมง อ.สิเกา จ.ตรัง กับงานวิ่งบรรยากาศสุดฟิน พระอาทิตย์ตกยามเย็น บนชายหาดปากเมง หาดรูปพระจันทร์เสี้ยว จากชายหาดมองไปจะมีเขา ลักษณะคล้ายคนขนาดยักษ์นอนหงายอยู่ มีขื่อเรียกว่า เขาเมง และเป็นจุดชมพระอาทิตย์ตกที่สวยงามมากด้วย กระทบไหล่นักวิ่งโลกสวยมากมาย อิ่มท้องด้วยอาหารชุด Set Box ขึ้นชื่อจาก ตรังยุทธจักรความอร่อย ฟังดนตรีไพเราะ เคล้าบรรยาการริมทะเลยามเย็น
Krabi Adventure Race 19-20 ก.พ.65 LINK
Krabi Adventure Race 2021 มหกรรมกีฬาอันดามันลีก วิ่ง พาย ว่าย ปั่น ผจญภัยสุดมันส์ ที่กระบี่สวรรค์แห่งอันดามัน เตรียมร่างกายและจิตใจให้พร้อม แล้วพบกันวันที่ 19-20 ก.พ. 2565 ที่ จ.กระบี่ ในงาน 19 กพ.65 - Mountain Bik 2021 Kayak 2021 Beach Run 2021
20 ก.พ.65 Adventure Race
ชมภาพแข่งขันเดินวิ่งปั่น ศรีมหาโพธิ รัน 2022 - 20 ก.พ.65 LINK
เดินวิ่งปั่น ศรีมหาโพธิ รัน 20 กุมภาพันธ์ 2565 ณ วงเวียนพระอินทร์ทรงช้างเอราวัณ อบต.หัวหว้า รายได้มอบให้มูลนิธิพัฒนาระบบสุขภาพ อ.ศรีมหาโพธิ์ ปราจีนบุรี เพื่อดูแลคนพิการ ผู้ป่วยติดเตียง และผู้ด้อยโอกาสในพื้นที่ - ชนิด Fun run Mini Marathon, Half Marathon และ VIP
ชมภาพกิจกรรม เดิน-วิ่ง เส็งกลอง-ร่องคำ ปี 2565 กาฬสินธุ์ - 5 มี.ค.65 LINK
วันเสาร์ที่ 5 มีนาคม พ.ศ. 2565 ณ บริเวณสนามหน้าสำนักงานเทศบาลตำบลร่องคำ อำเภอร่องคำ จังหวัดกาฬสินธุ์ มีวัตถุประสงค์เพื่อนำรายได้ช่วยเหลือ
1.เพื่อเป็นทุนการศึกษาให้กับนักเรียนทุกโรงเรียนในพื้นที่อำเภอร่องคำ
2.เพื่อช่วยเหลือ ผู้ยากไร้ ผู้ด้อยโอกาส ผู้มีภาวะพึ่งพิง
3. เพื่อจัดหาเครื่องมืออุปกรณ์ทางการแพทย์สนับสนุนโรงพยาบาลร่องคำและโรงพยาบาลส่งเสริมสุขภาพตำบลในพื้นที่ อำเภอร่องคำ เป็นการยกระดับคุณภาพชีวิตที่ดีแก่ประชาชนในพื้นที่อำเภอร่องคำ และเพื่อส่งเสริมให้เยาวชน และประชาชนสนใจการออกกำลังกาย เพื่อให้มีสุขภาพที่ดีเพิ่มมากขึ้น
ฝ่ายรับสมัครผู้เข้าร่วมกิจกรรมและลงทะเบียน โทร. 043-897103
Scenic half marathon Pranburi 2022 ปากน้ำปราณ ประจวบฯ 26-27 มี.ค.65 LINK
งานวิ่งซีนิคมาราธอนซีรีย์ปี 2022 Scenic half marathon Pranburi 2022
งานวิ่งสุดฟิน ริมทะเลปราณ สนามวิ่งมาตรฐานบนเส้นทาง Scenic Route
วันแข่งขัน: 26-27 มีนาคม 2565
สถานที่: ปากน้ำปราณบีชพาร์ค ต.ปากน้ำปราณ อ.ปราณบุรี จ.ประจวบคีรีขันธ์
ประเภทการแข่งขัน: ระยะทาง 21.1 กม./ 10 กม./ 5 กม. และ วิ่งชายหาด 3 กม.
เขื่อนวชิราลงกรณ มาราธอนภูเขานานาชาติ 13 มี.ค.65 LINK
VAJIRALONGKORN DAM International Mountain Mini-Super Half Marathon 2022 สนามที่ ๘ : เขื่อนวชิราลงกรณ มาราธอนภูเขานานาชาติ วันอาทิตย์ ที่ 13 มีนาคม 2565 ณ เขื่อนวชิราลงกรณ ตำบลท่าขนุน อำเภอทองผาภูมิ จังหวัดกาญจนบุรี
ผู้สมัครเข้าร่วมกิจกรรม/ผู้ติดตาม ต้องแสดงหลักฐานการได้รับวัคซีนครบตามเกณฑ์ ก่อนวันจัดกิจกรรม หรือหายจากโควิด-19 แล้ว เกิน 1 เดือน หรือและ มีผลตรวจหาเชื้อโควิด-19 แบบ RT-PCR/ATK ไม่เกิน 72 ชั่วโมง ก่อนวันจัดกิจกรรม
วิ่งพิชิต 3 ลุ่มน้ำ (โขง ชี มูล) สะออน 50 ปี ศรียโสธร 6 มี.ค.65 LINK
วิ่งพิชิต 3 ลุ่มน้ำ โขง-ชี-มูล ฉลองครบรอบ 50 ปี จังหวัดยโสธร แข่งขันวันอาทิตย์ที่ 6 มีนาคม 2565 3 ระยะ คือ
1.Fun Run ระยะ 5 KM.
2.Mini Marathon ระยะ 10 KM.
3.Half Marathon ระยะ 21 KM.
4.บัตรการกุศล VIP วิ่งได้ทุกระยะ
สมัครได้ด้วยตนเองได้ที่ ณ สำนักงานหอการค้าจังหวัดยโสธร เวลา 09.00น. -16.00 น. พักเที่ยง (หยุดทุกวันอาทิตย์)
Road Running 1148@สะเกิน น่าน อ.สองแคว เดิน-วิ่ง การกุศลปี 1- 27 มี.ค.65 LINK
อำเภอสองแคว ขอเชิญร่วมกิจกรรม เดิน - วิ่ง เพื่อการกุศล ปี 1 "Road Running 1148 @สะเกิน น่าน" วันอาทิตย์ ที่ 27 มีนาคม 2565 ณ บ้านสะเกิน หมู่ที่ 1 ตำบลยอด อำเภอสองแคว จังหวัดน่าน รายได้สนับสนุนกองทุนพัฒนาคุณภาพชีวิตอำเภอสองแคว เพื่อนำไปช่วยเหลือผู้ยากไร้ ด้อยโอกาสในพื้นที่อำเภอสองแคว
เริ่มสมัคร 7 กพ - 5 มีค 65
[เลื่อน] Green Season Lanna Trail 4 จังหวัด มี.ค.65 LINK
ประกาศเลื่อนการแข่งขัน กิจกรรม Green Season Lanna Trail Season 2 สนามม่อนล่อง จังหวัดเชียงใหม่
ทางทีมผู้จัดและทีมงาน ยังไม่ได้กำหนดการจัดงานที่แน่นอน และเพื่อไม่ให้เป็นการเสียสิทธิ์นักวิ่งที่จะลงการแข่งขันในกิจกรรมอื่นๆ ทางทีมงานจึงขอประกาศเลื่อนกิจกรรม Green Season Lanna Trail Season 2 สนามม่อนล่อง จังหวัดเชียงใหม่ ไปเป็นช่วงเดือน มีนาคม 2565 ทั้งนี้หากได้กำหนดการจัดการแข่งขันที่แน่นอน ทางทีมงานจะแจ้งให้ทราบทางหน้าเพจอีกครั้งครับ
Sankala Road Trail 20 มี.ค.65 LINK
Sankala Road Trail 20 มีนาคม 2565 กับการแข่งขันพร้อมกัน 3 ระยะ Fun Run -5KM Mini Marathon -10.5KM Signature Run -17KM
มาร่วมพิชิตยอดเขาที่ 960 เมตรจากระดับน้ำทะเลไปพร้อมกัน!! ลงทะเบียนพร้อมกันวันที่ 8 กุมภาพันธ์ 2565 นี้ สอบถามข้อมูลเพิ่มเติมได้ที่ 081-609-1141, 080-148-8484
MJ AQUATHLON 2022 - 5 มี.ค.65 LINK
วันเสาร์ที่ 5 มีนาคม 2565 โรงแรมสิรีน พลา บ้านฉาง ระยอง เริ่มลงทะเบียนตั้งแต่เวลา 09:00 น. เป็นต้นไป ปรเภทการแข่งขัน ว่ายน้ำ 10 กิโลเมตร ประเภทเดี่ยว 5 กิโลเมตร ประเภททีม 5 กิโลเมตร ประเภทเยาวชน อายุ 10-17 ปี
บางแสน42 ชลบุรีมาราธอน 2021 - 20 มี.ค.65 LINK
บางแสน42 ชลบุรีมาราธอน 2021 ในวันอาทิตย์ที่ 20 มีนาคม 2565
แชมป์ Overall Male KINDU SEWMEHON จาก Ethiopia เวลา 2:22:40 ชั่วโมง
แชมป์ Overall หญิง ROSEMARY MUMO KATUA จากเคนย่า เวลา 2:51:44
Overall Thai ชาย บุญถึง ศรีสังข์ เวลา 2:37:27
Overall Thai หญิง อรอนงค์ วงศ์ศร 3:06:47
Care Asia 2022 31 มี.ค.- 3 เม.ย 65 LINK
โอกาสครั้งสำคัญ! ที่คุณจะได้กลับมาเชื่อมต่อธุรกิจกับคู่ค้าในตลาด Healthcare and Wellness (การดูแลสุขภาพและความเป็นอยู่) ในงาน Care Asia 2022 – งานแสดงสินค้า นวัตกรรม ที่ตอบโจทย์ความต้องการด้านการดูแลสุขภาพ และความเป็นอยู่อย่างครบวงจรแห่งเอเชีย งานมีกำหนดจัดระหว่างวันที่ 31 มีนาคม - 3 เมษายน 2565 ณ ฮอลล์ 101 ไบเทค บางนา
Thailand International Health Expo 2022 - 17-20 มี.ค.65 LINK
ไทยแลนด์ อินเตอร์เนชั่นแนล เฮลท์ เอ็กซ์โป 2022 (Thailand International Health Expo 2022) วันที่ 17-20 มีนาคม 2565 จะเป็นงานใหญ่ที่เกี่ยวการบริการสุขภาพสาธารณสุขงานแรกประจำปี 2565 เป็นงานที่จัดโดย กระทรวงสาธารณสุข ร่วมกับ ส่งเสริมการจัดประชุมและนิทรรศการ (องค์การมหาชน) หรือ ทีเส็บ และอีก 2 องค์กรร่วมจัด ได้แก่การท่องเที่ยวแห่งประเทศไทย และ สสส.
ด้วยพัฒนาการด้านการแพทย์และสาธารณสุขของไทย มีการพัฒนาก้าวหน้าขึ้นเป็นลำดับในรอบหลาย 10 ปีที่ผ่าน และเป็นที่ยอมรับจากนานาชาติ ประกอบกับ ผลสำเร็จของระบบสาธารณสุขไทยในการบริหารจัดการสถานการณ์โควิดระยะเวลา 2 ปีที่ผ่านมา ยิ่งเสริมภาพความแข็งแกร่ง ความเชื่อมั่น ในด้านการแพทย์ของไทยไปอีกระดับ การจัดงานไทยแลนด์ อินเตอร์เนชั่นแนล เฮลท์ เอ็กซ์โป 2022 ในห้วงเวลาแห่งการเข้าสู่โหมดฟื้นฟูประเทศ จึงเป็นก้าวสำคัญที่ก่อประโยชน์ในหลายภาคส่วน และจะส่งผลดีในหลายมิติ เพื่อให้ประเทศก้าวพ้นจากภาวะชะงักงัน ก้าวสู่มิติใหม่ที่จะก้าวไปข้างหน้า พร้อมกับแผนยุทธศาสตร์การพัฒนาของกระทรวงสาธารณสุข ที่จะยกระดับให้ประเทศไทย ก้าวสู่การเป็นศูนย์กลางสุขภาพนานาชาติ (Medical Hub) การเป็นศูนย์กลางบริการเพื่อส่งเสริมสุขภาพ (Wellness Hub) การเป็นศูนย์กลางบริการสุขภาพ (Medical Service Hub) การเป็นศูนย์กลางบริการวิชาการและงานวิจัย (Academic Hub) และ ที่สำคัญที่สุดคือ การเป็นศูนย์กลางยาและผลิตภัณฑ์สุขภาพ (Product Hub) ของภูมิภาคและระดับโลก
งานประชุมวิชาการ Cannabis International Conference 2022 Thailand 18 มี.ค.2565
งานประชุมวิชาการ Cannabis International Conference 2022 Thailand
ในวันที่ 18 มีนาคม 2565 เวลา 8:30-16:00 น. ณ ห้องประชุม 3 อาคาร 2 ชั้น 1 กรมการแพทย์แผนไทยและการแพทย์ทางเลือก
ค่าลงทะเบียน 2,000 บาท
ปั่นชิล วิวงาม เมืองโบราณ ดงละคร นครนายก 2022 LINK
เป็นการ "ปั่นไปถ่ายรูปเชลฟี่" เช็คอินตามสถานที่โดดเด่นแนะนำ ของนครนายก 17 แห่ง มีเงื่อนไขกำหนด ว่า ถ่ายรูปบรรยากาศในการปั่น โดยเป็นรูปนักปั่นกับจุด check point ที่กำหนด ขั้นต่ำ 8 ที่ ไม่ซ้ำอำเภอและรูปวิวต่าง ๆ ให้ครบ 30 รูป หรือมากกว่า พร้อมกับถ่ายภาพเก็บขยะทิ้งลงถังในสถานที่ๆไป อย่างน้อย 8 รูป
*** โดยแต่ละรูปที่โพสต์ต้องมีสติกเกอร์ ททท.ติดไว้ที่ใดที่หนึ่งของรูป เช่นรถจักรยาน หมวก เป็นต้น (สามารถรับสติกเกอร์ ททท.จาก การท่องเที่ยวแห่งประเทศไทย สำนักงานนครนายก หรือ ติดต่อ แอดมินเพจเพื่อขอรับสติกเกอร์) และ ต้องมีรูปถ่าย ณ จุด Checkpoint ที่กำหนด
ระยะเวลากิจกรรม : วันนี้-31 มีนาคม 2565 (กี่วันก็ได้)
PHANGNGA SUN SET RUN 2021 วิ่งชิลล์@ศูนย์ราชการพังงา 3 เม.ย.65 LINK
"วิ่งชิลล์ สัมผัสบรรยากาศเมืองแห่งความสุขยามอาทิตย์อัสดง @ ศูนย์ราชการจังหวัดพังงา "
วันอาทิตย์ที่ 3 เมษายน 2565 ประเภทกิจกรรม วิ่งฟันรัน Fun Run ระยะทาง 5.5 กม. บริเวณรอบศูนย์ราชการจังหวัดพังงาวันรับเสื้อ และ BiB วิ่ง วันที่ 3 เมษายน 2565 เวลา 09.00-17.00 น. ณ.บริเวณที่จัดงานศูนย์ราชการจังหวัดพังงา
ติดต่อ-สอบถาม ข้อมูลกิจกรรมเพิ่มเติม Race Director & Event Team : คุณเจี๊ยบ 086-9436465
เซ็นทรัลกรุ๊ป มินิมาราธอน เดิน-วิ่ง การกุศล วิ่งเพื่อรักและสันติภาพ - 15 พ.ค.65 LINK
14 ปีแห่งพลังรักและสันติภาพ “เซ็นทรัลกรุ๊ป มินิมาราธอน” กองทัพนักวิ่งหลายพันคน ส่งแรงใจให้พื้นที่ชายแดนใต้-ผู้ป่วยมะเร็งในสตรี
กลุ่มเซ็นทรัล ร่วมกับ กรุงเทพมหานคร, สำนักอนามัย กรุงเทพมหานคร และกองทัพบก จัดกิจกรรมเดิน-วิ่ง การกุศล “เซ็นทรัลกรุ๊ป มินิมาราธอน” ปี 14 ภายใต้คอนเซ็ปต์ Run for LOVE & PEACE วิ่งเพื่อรักและสันติภาพ รายได้จากการจำหน่ายบัตร สมทบทุนช่วยเหลือผู้ได้รับผลกระทบจากเหตุการณ์ความไม่สงบในจังหวัดชายแดนใต้ และโครงการ Women Cancer ช่วยเหลือผู้ป่วยมะเร็งในสตรี ภายใต้โครงการเพื่อสังคมหลัก “เซ็นทรัล ทำ”
โดยในปีนี้มี นางมาศวัลย์ ปิ่นสุวรรณ ผู้อำนวยการเขตปทุมวัน, พล.ต. ศุภสิทธิ์ ชิตท้วม ผู้อำนวยการสำนักจิตวิทยา กรมกิจการพลเรือนทหารบก, พล.อ. พิศณุ อุไรเลิศ ที่ปรึกษา กลุ่มเซ็นทรัล และ ดร.ชาติชาย นรเศรษฐาภรณ์ รองกรรมการผู้จัดการใหญ่อาวุโส สำนักการพัฒนาอย่างยั่งยืน กลุ่มเซ็นทรัล ให้เกียรติร่วมเปิดงาน
ภายในงานอบอุ่นไปด้วย นักวิ่งทั้งชาวไทยและชาวต่างชาติ, หน่วยงานต่างๆ รวมทั้งพนักงานในเครือกลุ่มเซ็นทรัล ร่วมส่งต่อกำลังใจให้กับพี่น้องในจังหวัดชายแดนใต้และผู้ป่วยมะเร็งในสตรี ทั่วลานด้านหน้าเซ็นทรัลเวิลด์
ใครพลาดกิจกรรมครั้งนี้ เตรียมฟิตร่างกายแล้วมาพบกับใหม่กับ เซ็นทรัลกรุ๊ป มินิมาราธอน 2022 เร็วๆ นี้
Chanthaburi Scenic Half Marathon 2022 หาดคุ้งวิมาน 29 พ.ค.65 LINK
CHANTHABURI SCENIC HALF MARATHON 2022 5th จันทบุรีซีนิคฮาล์ฟมาราธอน 2022 ครั้งที่ 5 หาดคุ้งวิมาน #วิ่งพิชิตเนินนางพญา #RunScenic บนเส้นทางถนนเลียบทะเลสุดงดงาม
วันที่: อาทิตย์ที่ 29 พฤษภาคม 2565
สถานที่: ณ จุดชมวิวหินโคร่ง หาดคุ้งวิมาน ต.สนามไชย อ.นายายอาม จ.จันทบุรี
ระยะทาง: 21.1 กม. 10.55 กม. 5 กม. และ 3 กม. (วิ่งแบกทุเรียน)
เกษตรศาสตร์ตราดชวนวิ่ง 2564 KU TRAT RUN 2021 - 15 พ.ค.65 LINK
KU TRAT RUN 2021 (เกษตรศาสตร์ตราดชวนวิ่ง 2564) เลื่อนการจัดงาน จากวันที่ 24 ตุลาคม 2564 เป็นวันที่ 15 พฤษภาคม 2565 เนื่องจากสถานะการโควิด -19
สถานที่จัดงาน: อ่างเก็บน้ำสระสีเสียด จังหวัดตราด
จัดและดำเนินงานโดย: ชมรมนิสิตเก่ามหาวิทยาลัยเกษตรศาสตร์ จังหวัดตราด
Hatyai Street Art Run 22 พ.ค.65 LINK
โครงการ Hatyai Street Art Run รายได้สมทบทุนโครงการก่อสร้างอาคารเกิดมาต้องตอบแทนบุญคุณแผ่นดิน เพื่อใช้เป็นศูนย์รับบริจาคอวัยวะ โรงพยาบาลสงขลานครินทร์ ค่าสมัครวิ่ง 350 บาท รับเสื้อวิ่ง (สีขาว)
- วันที่วิ่ง วันอาทิตย์ที่ 22 พฤษภาคม พ.ศ. 2565 เวลา 06.00 - 09.00 น.
- ค่าสมัคร 350 บาท
- รับอุปกรณ์และบิบ วันเสาร์ที่ 21 พฤษภาคม 2565 เวลา 10.00-19.00 น. ณ โรงแรม ลีการ์เด้นส์พลาซ่า หาดใหญ่
108 พันก้าว ครบรอบ 108 ปี รพ.จุฬาลงกรณ์ สภากาชาดไทย 30 พ.ค. - 5 มิ.ย. 65 LINK
โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ขอเชิญร่วมงาน "108 พันก้าว ครบรอบ 108 ปี โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย" ในรูปแบบ Expo in Hospital
เฉลิมฉลอง 9 รอบ ของโรงพยาบาลจุฬาลงกรณ์ ผ่าน 9 โซนนิทรรศการ เพื่อถ่ายทอดเรื่องราวแห่งการรักษาพยาบาลที่เป็นเลิศ และการดูแลด้วยหัวใจเอื้ออาทร
งาน 108 พันก้าว จะจัดขึ้นในวันที่ 30 พฤษภาคม - 5 มิถุนายน 2565 ตั้งแต่เวลา 09.00 - 18.00 น. ณ โรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย
สามารถติดตามรายละเอียด และลงทะเบียนเข้าร่วมกิจกรรมต่างๆ และชมงานแบบออนไลน์ได้ทาง www.108yearschulahospital.com
บางกอกน้อยเฟสติวัล ครั้งที่ ๕ ณ รพ.ศิริราช 25-29 พ.ค.65 LINK
“บางกอกน้อยเฟสติวัล ครั้งที่ ๕” งานเฟสติวัลริมแม่น้ำเจ้าพระยา จัดโดยคณะแพทยศาสตร์ศิริราชพยาบาล มหิดล บริเวณ โรงพยาบาลศิริราช สวนเฉลิมพระเกียรติ 72 พรรษา (ท่าเรือรถไฟ)
ระหว่างวันที่ 25-29 พฤษภาคม 2565 เวลา 16.00-22.00 น.
กิจกรรมเด่นในงาน
- ช็อป ชิม ชิลล์ กับของดีบางกอกน้อย และอาหารนานาชนิด
- ชมการแสดงดนตรีจากศิลปิน
- 25 พ.ค. 65 เวลา 19.30 น. พบกับ เอ๊ะ จิรากร
- 28 พ.ค. 65 เวลา 19.30 น. พบกับ ที เจ็ทเซ็ทเตอร์
- 26-29 พ.ค. 65 พบกับ Music Guru Band โดยคุณตุ้ม ผุสชา
- ชมภาพยนตร์กลางสวน
- ชมการจำลองการเห่เรือพระราชพิธี จาก กองทัพเรือ
- เยี่ยมชมพิพิธภัณฑ์ศิริราชพิมุขสถาน
- สัมผัสบรรยากาศสุดพิเศษ กับกิจกรรม Night at The Museum พิพิธภัณฑ์การแพทย์ศิริราช
***การจัดงานภายใต้มาตราการความปลอดภัยและแนวทางปฏิบัติด้านสาธารณสุขเพื่อป้องกันการแพร่ระบาดของเชื้อไวรัสโคโรนา 2019 (COVID-19)***
ภูเวียง อัลตร้าเทรล 2022 - 11-12 มิ.ย.65 LINK
ภูเวียง อัลตร้าเทรล 2022 เส้นทางวิ่งจะมีด้วยกันทั้งหมด 3 ระยะ
- ระยะ 16 KM. Gain 532+
- ระยะ 28 KM. Gain 640+
- ระยะ 54 KM. Gain 1,437+
ทุกระยะจะผ่านจุดชมวิวในภาพกันนะคะ วิวจริงสวยมากกก
มาตามล่าหาไดโนเสาร์กัน 11-12 มิถุนายน 65
มหกรรม 360 องศา ปลดล็อค กัญชา ประชาชนได้อะไร 10-12 มิ.ย. 65 LINK
งานมหกรรม 360 องศา ปลดล็อคกัญชา ประชาชนได้อะไร วันที่ 10-12 มิถุนายน 2565 จะจัดเป็นงานใหญ่งานแรก หลังจากกัญชาในประเทศไทย จะเป็นพืชที่สามารถปลูกได้อย่างถูกกฏหมาย ตั้งแต่ 9 มิถุนายน 2565 ตามประกาศในราชกิจจาฯ
เป็นจังหวะก้าวที่สำคัญของการพัฒนากัญชาทางการแพทย์ ร่วมไปกับการพัฒนาเศรษฐกิจของพืชกัญชาของประเทศไทย ที่หลายฝ่าย หลายภาคส่วน รวมทั้งประชาชนไทย เฝ้ารอมาอย่างยาวนาน
ในงานพบกับการให้บริการคลินิกกัญชาทางการแพทย์แผนปัจจุบันและแพทย์แผนไทย สัมมนาทางวิชาการจากวิทยากรผู้เชี่ยวชาญ นิทรรศการกัญชา-กัญชง Work Shop การทำอาหารคาว หวานและเครื่องดื่มที่มีส่วนผสมของกัญชา และการจำหน่ายสินค้าที่มีส่วนผสมของกัญชา-กัญชง
Healthcare 2022 จักรวาลผู้สูงวัย 30 มิ.ย. – 3 ก.ค.65
Healthcare 2022 จักรวาลผู้สูงวัย โดยเครือมติชน 30 มิ.ย. – 3 ก.ค.2565 ที่สามย่านมิตรทาวน์ฮอลล์ ชั้น 5 ศูนย์การค้าสามย่านมิตรทาวน์ สิ่งที่จะได้พบในงาน Health Check บริการตรวจสุขภาพฟรี จากรพ.รัฐ-เอกชนชั้นนำ Innovation นวัตกรรมเพื่อผู้สูงอายุ Money Care กูรูเพื่อตรวจสุขภาพและวางแผนการเงิน Workshop รพ.เจ้าพระยาอภัยภูเบศร Relaxation กิจกรรมสันทนาการ
สัมมนาการดูแลสุขภาพอัจฉริยะไต้หวัน-ไทย ประจำปี 2565 วันที่ 24 มิถุนายน 2565
งานสัมมนาการดูแลสุขภาพอัจฉริยะไต้หวัน-ไทย ประจำปี 2565 หัวข้อ อนาคตของโรงพยาบาลอัจฉริยะ (The Future of Smart Hospital) เข้าร่วมฟรี!!
วันที่ 24 มิถุนายน 2565 เวลา 13.30 - 16.40 น. โรงแรม ไฮแอท รีเจนซี่ กรุงเทพฯ
ลงทะเบียนเข้าร่วมงาน https://vthai.in/Lv62Q/FB
ยกระดับการดูแลสุขภาพ มุ่งสู่อนาคตแห่งเทคโนโลยีทางการแพทย์
Bangkok Airways Samui Half Marathon 5 มิ.ย.65
Bangkok Airways Samui Half Marathon วันที่ 4 มิถุนายน 2565 I 4 Jun 2022 เวลา : 10.00 - 18.00 น. I 10am – 6pm สถานที่ : สนามกีฬานานาชาติ เกาะสมุย I Event Venue : the International Stadium, Koh Samui
งานมหกรรม 80 ปี กรมการแพทย์ ในวันที่ 8-10 ก.ค.2565
เชิญร่วมงานมหกรรม 80 ปี กรมการแพทย์ ในวันที่ 8-10 กรกฎาคม 2565 ณ บางกอก คอนเวนชั่น เซ็นทรัลเวิลด์ ฟรี ตลอดงาน
กิจกรรมในงาน
เข้ารับบริการสุขภาพจาก 15 หน่วยบริการ ฟรีตลอดงาน
เสวนาสุขภาพโดยแพทย์ผู้เชี่ยวชาญและศิลปินดารา
สัมมนาเชิงลึกด้านการแพทย์แขนงต่างๆ
เลือกซื้อสินค้าสุขภาพกว่า 100 ร้านค้า
ร่วมซื้อสินค้าในงานสมทบทุน "มูลนิธิกรมการแพทย์" กองทุนเพื่อการพัฒนาการแพทย์ และจัดซื้ออุปกรณ์ทางการแพทย์เพื่อบริการประชาชนทั้งประเทศ
15 หน่วยบริการสุขภาพ :
ระบบสมอง / การมองเห็น / การได้ยิน / ระบบทางเดินหายใจ
สุขภาพน / ด้านโรคมะเร็ง / ด้านพยาธิวิทยา / ด้านผู้สูงอาย
ด้านโรคกระดูกและข้อ / ด้านโรคผิวหนัง / ด้านการบำบัดรักษา
และฟื้นฟูสมรรถภาพในกลุ่มผู้ติดยาและสารเสพติด
ด้านการฟื้นฟูสมรรถภาพทางการแพทย์
ด้านการจัดการบริการเพื่อพระภิกษุและสามเณร
BHeroes Run 2022 โรงพยาบาลพระพุทธบาท 10 ก.ค.65 LINK
BHeroes Run 2022 จัดขึ้นในในวันอาทิตย์ที่ 10 กรกฎาคม 2565 ณ โรงพยาบาลพระพุทธบาท อำเภอพระพุทธบาท จังหวัดสระบุรี
ปี 2017-2019 รพ.ได้จัดงานวิ่งขึ้น เชื่อว่านักวิ่งหลายๆคนคงจำภาพความแห่งความสุข ความประทับใจกับบรรยากาศของงาน วิวภูเขากับธรรมชาติ มิตรภาพและ ซุ้มอาหารได้เป็นอย่างดี
เราห่างหายจากการจัดงานไป 2 ปีจากสถานการณ์แพร่ระบาดของโควิด-19 จนถึงปีนี้ ช่วงเวลาที่สถานการณ์ต่างๆดีขึ้น โรงพยาบาลพระพุทธบาท ครบรอบ 66 ปี เราจึงได้จัดงานวิ่งขึ้นอีกครั้ง เพื่อนำรายได้จัดซื้อเครื่องช่วยหายใจในการดูแลรักษาผู้ป่วย
การแข่งขันวิ่ง 2 ระยะ คือ 6 กม.และ 16 กม.
Start : ศาลเจ้าพ่อเขาตก บริเวณถนนสายคู่ วัดพระพุทธบาท
Finish : โรงพยาบาลพระพุทธบาท
วิ่งระยะ 16 กิโลเมตร ปล่อยตัว : 05:15 น.Cut Off : 08:00 น.
วิ่งระยะ 6 กิโลเมตร ปล่อยตัว : 05:45 น.Cut Off : 08.00 น.
และที่พิเศษสุดๆ คือ เป็นครั้งแรกที่เราได้จัดวิ่งสะสมระยะ (Virtual run) 66 km.เริ่มสะสมระยะได้ตั้งแต่ 1ก.ค.-31 ก.ค. 65
Run for life by you heart 2021 (วิ่งด้วยใจ ให้ชีวิต 2564) 10 ก.ค.65 LINK
Run for life by you heart 2021 (วิ่งด้วยใจ ให้ชีวิต 2564) งานวิ่งวิถีใหม่(New Normal).เน้นคุณภาพ.สร้างสุขภาพ.ความปลอดภัย อาทิตย์ 10 กรกฎาคม 2565 จัดโดย วัดประสิทธิเวช และศูนย์ผู้สูงวัยเฉลิมพระเกรียติฯ (คลอง 15 รังสิต -นครนายก)
วัตถุประสงค์ - เพื่อนำเงินรายได้จากค่าสมัครหลังหักค่าใช้จ่าย สมทบทุนจัดซื้อเครื่องมือและอุปกรณ์ทางการแพทย์ สำหรับศุนย์สูงวัยเฉลิมพระเกรียติฯ และเพื่อสร้างความสามัคคีระหว่างผู้มีจิตเป็นกุศล ได้ร่วมกันสร้างกระแสการออกกำลังกายด้วยการเดิน-วิ่ง รวมถึงได้ร่วมกันสร้างประโยชน์แก้ประชาชนทั่วไป
Korat Motorway Lamtakhong Super Half Marathon วิ่งการกุศล...บนมอเตอร์เวย์ ที่สวยที่สุดในประเทศ 3 ก.ค.65 LINK
วิ่งการกุศล...บนมอเตอร์เวย์ ที่สวยที่สุดในประเทศ ครั้งแรกและครั้งเดียว พลาดแล้ว พลาดเลย
ประเภท มินิมาราธอน Mini Marathon (13.6 Km.) วันแข่งขัน: อาทิตย์ที่ 3 กรกฎาคม 2565
...
จัดงานครั้งนี้เพื่อหาเงินให้กับ 5 องค์กร
1.สมทบทุนหลวงพ่อกัณหา สุขกาโม ซื้อเครื่องมือแพทย์ให้ รพ.มหาราชนครราชสีมา ตึกสร้างเสร็จแล้วแต่ยังขาดเครื่องมือแพทย์ ทำให้ยังเปิดให้บริการไม่ได้ กุศลครั้งนี้ ช่วยเหลือคนเจ็บป่วยได้มากมาย สาธุ
2.ปรับปรุงที่ประทับ ร.9 ครั้งมาเยือน มทร. อีสาน เพื่อเทิดพระเกียรติ
3.สมาคมคนตาบอดนครราชสีมา
4.สมาคมกีฬาแห่งจังหวัดนครราชสีมา
5.ทุนการศึกษานักศึกษา มทร. อีสาน
สมัครที่เว็บ
rmuti-alumni.org/ทดสอบ Thanarat Trail Running TTR2022 - 25 ก.ค.65
ค่ายธนะรัชต์ ร่วมกับททท.ประจวบฯ เชิญนักวิ่งเทรลสายสุขภาพ ร่วมทดสอบและออกแบบ วิ่งธนะรัชต์เทรล จันทร์ที่ 25 กรกฎาคม 65 เวลา 15.00 น. ณ ค่ายธนะรัชต์ ศูนย์การทหารราบ ปราณบุรี ประจวบคีรีขันธ์ รับจำนวน 3 คน
BigBlue Ultra Trail Phuket 14-16 ก.ค.65 LINK
สิทธิพิเศษของรายการวิ่งเทรล BigBlue Ultra Trail Phuket ในทัวร์นาเมนต์ Ultra Trail Thailand Tour คือ ได้รับการรับรอง และรับการสนับสนุนจาก การกีฬาแห่งประเทศไทย ที่มุ่งยกระดับมาตรฐานการจัดการแข่งขันวิ่งเทรลให้เทียบเท่าระดับสากล นักวิ่งที่เข้าร่วม งานวิ่งเทรลใน Ultra Trail Thailand Tour จะมีโอกาสเก็บสะสม Thailand Running Stone หรือ Running Ruby (ทับทิมสยาม) นักวิ่งมีหินสะสม ก็จะมีโอกาส หรือได้รับความสะดวกในการสมัคร เช่นในปี 2566 นักวิ่งที่สนใจสมัครงานวิ่งเทรล หรืองานวิ่งซีรีย์ ในเครือ Ultra Trail Thailand by UTMB เช่น งานวิ่ง Doi Inthanon Thailand By UTMB ปี 2566
Chaiyaphum Trail Running 2022 - 14 ส.ค.65 LINK
Chaiyaphum Trail Running 2022 - 14 ส.ค.65
โอบไอหมอก หยอกละอองฝน ยลทุ่งบัวสวรรค์ อุทยานแห่งชาติไทรทอง
เปิดเส้นทางใหม่ กว่า20 Km. จนคุณต้องประทับใจ พลาดไม่ได้
ระยะ 12 Km. รับ 200 ท่าน ระยะ 32 Km. รับ 500 ท่าน
Save Zoo Run 2022 Sports Run Tourism Zoo Thailand 20 ก.ค.65 LINK
องค์การสวนสัตว์แห่งประเทศไทยในพระบรมราชปถัมภ์ และ จังหวัดชลบุรีเชิญชวนวิ่ง Save Zoo Run 2022 Sports Run Tourism Zoo Thailand เปิดรับสมัคร 2,000 คนเท่านั้น Save Zoo Run 2022 @ Khao Kheow Zooวิ่งไปเที่ยวไป ผจญภัยสุดมันส์
งานวิ่งรูปแบบใหม่ ภายใต้แนวคิดSports Run Tourism Zoo Thailand วิ่งไปเที่ยวไป ผจญภัยสุดมันส์ ทุกสวนสัตว์ทั่วไทย โดยนักวิ่งจะได้สัมผัสงาน วิ่งที่แปลกใหม่ ภายในสวนสัตว์ 9 แห่ง 9 บรรยากาศ อิ้ง กึ่ง กับพฤติกรรมที่ไม่เคยรู้ สัมผัสชีวิตพิศวงคาดไม่ถึงของสัตว์ ป่าทุกตัวอย่างใกล้ชิด สูดอากาศบริสุทธิ์สุดชิล สนุกสุดมันส์ อิ่มอร่อยกับเมนูถิ่น อาหารพื้นบ้าน เมื่อวันที่ 20 กรกฎาคมที่ผ่านมา ณ สวนสัตว์เปิดเขาเขียว ต.บางพระ อ.ศรีราชา จ. ชลบุรี
เดิน-วิ่ง รูปแบบ Virtual Run รวมใจเป็นหนึ่งเดียว MOI RUN 2022 - 1 ก.ค. - 31 ส.ค.65 LINK
โครงการนี้เป็นกิจกรรมการเดิน-วิ่ง รูปแบบ Virtual Run งานวิ่งฉลองโอกาสสถาปนากระทรวงมหาดไทย ครบ 130 ปี ในปี พ.ศ. 2565 รับสมัครผู้สนใจเข้าร่วมโครงการผ่าน ระบบ Line Official MOI RUN 2022 โดยระบบจะเปิดรับสมัครและชำระเงิน ตั้งแต่วันที่ 1 กรกฎาคม - 31 สิงหาคม 2565
สำหรับระยะที่เปิดรับสมัครมี 3 รูปแบบ ได้แก่
1. Fun run 5 กม.
2. มินิฮาล์ฟมาราธอน 10.5 กม.
3. ฮาล์ฟมาราธอน 21 กม.
ช่องทางการสมัคร: Line official MOI RUN 2022 และชำระเงินทางช่องทางที่กำหนด
ค่าสมัคร 600 บาท ทุกระยะทาง (ไม่รวมค่าธรรมเนียมการชำระเงิน)
รายได้หลังหักค่าใช้จ่ายส่งมอบให้มูลนิธิร่วมจิตต์น้อมเกล้าฯ เพื่อเยาวชน ในพระบรมราชินูปถัมภ์ สำหรับเป็นทุนการศึกษาให้นักเรียน นักศึกษา ในสถานศึกษาสังกัดองค์กรปกครองส่วนท้องถิ่นที่มีความประพฤติดี แต่ขาดแคลนทุนทรัพย์
มหกรรมสมุนไพรแห่งชาติ ครั้งที่ ๑๙
กรมการแพทย์แผนไทยและการแพทย์ทางเลือก กระทรวงสาธารณสุข
กิจกรรมภายในงาน :
• โซนแสดง Innovation ประกอบด้วย
1) Business Matching และแสดง R&D ปรึกษาหารือ เจรจาธุรกิจ และแสดงนิทรรศการเพื่อนำเสนองานวิจัย และนวัตกรรมของผลิตภัณฑ์สมุนไพรในทุกระดับ
2) Showcase เน้นกลุ่มเป้าหมาย กลุ่มผู้ประกอบการ SMEs โดยเชิญเครือข่ายเข้าร่วม showcase
3) Innovation แสดงศักยภาพของผู้ประกอบการ
- Beauty & Cosmetic Wellness
- Ganja
- Food & Beverage
4) นิทรรศการ
- Beauty & Cosmetic Wellness
- Ganja UNESCO World Integral Heritage
- อาหารไทย อาหารเป็นยา (ลานเมือง)
• โซน Wisdom ประกอบด้วย
1) นิทรรศการ 4 ภูมิภาค ประกอบด้วย ให้บริการ สาธิตโดยหมอพื้นบ้าน หมอไทยดีเด่นแห่งชาติ แสดงผลิตภัณฑ์พื้นถิ่น
2) นวดไทย 4 ภูมิภาค ให้บริการและสาธิตด้านการนวดไทย เช่น การเหยียบเหล็กแดง และการนวดน้ำมันลังกาสุกะ
3) กาดมั่ว สาธิต จำหน่ายอาหารและเครื่องดื่มที่พัฒนาจากภูมิปัญญาชาวบ้าน
• โซน Service ให้บริการและให้คำปรึกษาฟรี ด้านการแพทย์แผนไทย และการแพทย์ทางเลือก
2
• โซนวิชาการ
- การประชุมวิชาการประจำปี การแพทย์แผนไทย การแพทย์พื้นบ้าน และการแพทย์ทางเลือกแห่งชาติ ครั้งที่ 19 หัวข้อประชุมวิชาการ Plenary 3 หัวข้อ Symposium 10 หัวข้อ ระหว่างวันที่ 6 – 8 กรกฎาคม 2565 ณ ห้องประชุมฟีนิกซ์ 2 – 6
- การประกวดผลงานวิชาการประจำปี นำเสนอผลงงานวิชาการที่ผ่านการคัดเลือก ในวันที่ 8 กรกฎาคม 2565
- อบรมตลอดความรู้ (หลักสูตรระยะสั้น) ฟรี จำนวน 27 หลักสูตร
ระหว่างวันที่ 8-9 กรกฎาคม 2565 รูปแบบ Onsite Onsite ในห้องฟินิกซ์ 2-6 & ผ่านระบบ Facebook Live
• โซนเวทีกลาง (Main Stage) : กิจกรรมพิธีเปิด พิธีมอบรางวัล และกิจกรรมต่าง ๆ บนเวทีอีกมากมาย
• โซนจัดแสดงสินค้าและจำหน่วยผลิตภัณฑ์สมุนไพรไทยที่มีมาตรฐาน
พังงา อินเตอร์ฯ มาราธอน 2022 วันที่ 12-13 ส.ค.65 LINK
Phang-nga International Marathon 2022 วันที่ 12 และ 13 สิงหาคม 2565 ณ หาดเขาหลัก จังหวัดพังงา สถานที่จัดการแข่งขัน - จุดสตาร์ท อนุสรณ์สถานสึนามิ เรือ ต.813 บ้านบางเนียง ตำบลคึกคัก อำเภอตะกั่วป่า พังงา เส้นทางวิ่ง - ถนนทางหลวงหมายเลข 4 (ถนนเพชรเกษม) สายบ้านเขาหลักตะกั่วป่า รวมถึงสายรองที่เข้าหาดนางทอง แหลมปะการัง และหาดบางสัก ตรวจสอบข้อมูลการแข่งขัน กรณีต้องการขอคืนเงิน เลื่อนจองห้องพัก ฯลฯ ที่เพจ
facebook.com/pim2022Ultra-Trail Chiangmai KISS THE RAIN 26-28 ส.ค.65 LINK
KISS THE RAIN, 26-28 AUG 2022 "แม่แจ่ม" ดินแดนที่ชวนให้หลงใหล และน่าค้นหา สถานที่ที่ซึ่งอยู่ห่างจากตัวเมืองเชียงใหม่ไปราว 150 กม. เมืองที่ทีความสวยงามในแบบฉบับภูเขาภาคเหนือ แต่เสน่ห์ที่ไม่เหมือนที่ใดๆ ทำให้ผู้คนที่ได้มาเยือน จะต้องกลับไปกันอีกครั้ง
เริ่มลงทะเบียน 11 JAN 2022
สงขลามาราธอน 28 ส.ค.65 LINK
สงขลามาราธอน มาราธอนระดับตำนาน วันอาทิตย์ ที่ 28 สิงหาคม 2565 จุดสตาร์ท.. ลานเก้าอี้ดำ (ถนนชลาทัศน์) ระยะทาง 42K 21K 10K 5K ปิดรับสมัคร วันที่ 31 กรกฎาคม 2565 ลิ้งค์สมัคร
race.thai.run/songkhlamarathon2022RUNNINGDAY : 27 สิงหาคม 65 : : FUNRUN
28 สิงหาคม 65: : 10Km /. 21.10 / 42.195
CARE ASIA 2022 1-4 ก.ย.65 LINK
CARE ASIA 2022 งานแฟร์เพื่อคนที่คุณแคร์ 1 - 4 September 2022 @BITEC BANGNA
" Total sulutions for health & wellness"
ศูนย์รวมนวัตกรรมเพื่อสุขภาพที่ดี และชีวิตที่ยั่งยืน เตรียมพบกับ! งานแสดงสินค้านานาชาติ ที่รวบรวมนวัตกรรมเพื่อคนรักสุขภาพและชาว Smart Senior! ที่เปิดโอกาสเข้าถึงผู้ชมงานทั้งภาคธุรกิจและบุคคลทั่วไปที่รักสุขภาพ + Smart Senior รวมกว่า 25,000 ราย! ด้าน living innovation, hospital & healthcare, lifestyle & wellness, technology, sport entertainment & recreation, food & beverage, wealth management, business opportunity
เดิน-วิ่งการกุศล Somdech Phra Nangchao Sirikit Hospital Mini-Marathon 2022 วันที่ 7 ส.ค.65 LINK
Somdech Phra Nangchao Sirikit Hospital Mini-Marathon 2022 เพื่อนำรายได้จากการจัดกิจกรรมสมทบทุนการจัดซื้อเครื่องมือและอุปกรณ์ทางการแพทย์ ตลอดจนปรับปรุงสถานที่ ให้กับหอผู้ป่วยวิกฤตหัวใจและหลอดเลือด(CCU) รพ.สมเด็จพระนางเจ้าสิริกิติ์ รายละเอียดที่
facebook.com/srkhosp
ประเภทการแข่งขัน ค่าสมัคร รางวัล และ กำหนดการ
- แข่งขันวิ่งระยะ 10.5 กม. Mini-marathon ค่าสมัคร 600 บาท รับเสื้อ 1 ตัว
- เดิน-วิ่งเพื่อสุขภาพ 3.5 กม. (ไม่มีการแข่งขัน) ค่าสมัคร 300 บาท รับเสื้อ 1 ตัว
- ซื้อเสื้อวิ่ง โดยไม่เข้าร่วมกิจกรรม ราคาตัวละ 300 บาท โดยจัดส่งให้ถึงบ้านท่าน (มีค่าจัดส่งเพิ่ม)
*** เปิดรับสมัครทาง https://race.thai.run/ ตั้งแต่วันที่ 15 มิถุนายน 2565 เวลา 12.00 น.เป็นต้นไป***
***ระยะ 10.5 กม. Mini-marathon รับจำนวนจำกัดเพียง 2,000 คนเท่านั้น***
Sexy Run Koh Mak เกาะหมาก จ.ตราด 19-20 ส.ค.65 LINK
ครั้งแรก!! สำหรับงานวิ่งที่ Sexy ที่สุดในประเทศไทย Sexy Run Koh Mak 19-20 สิงหาคมนี้ ณ เกาะหมาก จ.ตราด ซึ่งเป็นเกาะที่เป็น Low Carbon Destination สำหรับนักท่องเที่ยวจากทั่วโลก และยังมีกิจกรรมอีกมากมาย อาทิ มวยทะเล ชักกะเย่อ ปลูกปะการัง เก็บขยะชายหาด (Trash Hero) ประเภทแข่งขัน 5 และ 10 กม.
SIANGPURE x WARRIX CITY RUN วิ่งด้วยกัน มันส์ด้วยใจ Ep.2 เสาร์ 27 ส.ค.65 LINK
ชื่องาน: Siangpure X Warrix City Run วิ่งด้วยกันมันส์ด้วยใจ EP.2
วันที่จัดงาน:เสาร์ 27 สิงหาคม 2565
เวลา :05.00 น.
สถานที่ :เซียงเพียวไบค์พาร์ค ซ.โยธินพัฒนา 3 –
เลียบทางด่วนรามอินทรา
ประเภทงานวิ่ง :ซิตี้รัน วิ่งในเมือง
ระยะทาง :9 km.
ค่าสมัคร :ไม่มี
วันรับสมัคร :7-12 สิงหาคม 2565
วิธีการร่วมกิจกรรม:
1.ลงทะเบียนร่วมกิจกรรมและแจ้งไซส์เสื้อภายในวันที่ 7-12 สิงหาคม 2565
2.รอรับอีเมล์หรือการโทรแจ้งยืนยันการเข้าร่วมและไซส์เสื้อจากทีมงาน
3. ลงชื่อและรับเสื้อที่หน้างานได้ในวันที่ 27 สิงหาคม 2565 เวลา 05.00 น.
Ultra-Trail Chiangmai 26-28 ส.ค.65 LINK
Ultra-Trail Chiangmai 2022 KISS THE RAIN, 26-28 AUG 2022
"แม่แจ่ม" ดินแดนที่ชวนให้หลงใหล และน่าค้นหา สถานที่ที่ซึ่งอยู่ห่างจากตัวเมืองเชียงใหม่ไปราว 150 กม.
สถานที่ปล่อยตัวและเส้นชัย โรงเรียนบ้านเนินวิทยา อ.แม่แจ่ม เชียงใหม่
26 สิงหาคม - 28 สิงหาคม 2565
ระยะ 20, 33, 65, 104 และ 160 กม.
Chiang Rai Marathon 7 ส.ค.65 LINK
วันลงทะเบียนรับ Race Pack จะจัดขึ้นในวันที่ 6 ส.ค. 2565 ณ บริเวรณบ้านแดง สิงห์ปาร์ค เชียงราย ตั้งแต่เวลา 10.00-18.00 น.
วันแข่งขันจะเริ่มตั้งแต่เวลา 03.00 น. ของวันที่ 7 ส.ค. 2565 เป็นต้นไป โดยเรามีนัดเจอกันที่ ศาลากลางจังหวัดเชียงราย (ศาลากลางหลังใหม่)
วิ่ง ปั่น เที่ยว กระเจียวยักษ์ 27 ส.ค.65 LINK
เชิญชวน วัยรุ่น หนุ่มสาว ผู้ใหญ่ คนชรา หรือจะเด็กๆ ไป วิ่ง ปั่น เที่ยว ทุ่งดอกกระเจียวกัน
27 สิงหา นี้ เวลา 6.00 ณ ทุ่งดอกกระเจียวยักษ์ บ้านเขาโล้น ต.เขาเจ็ดลูก อ.ทับคล้อ จ.พิจิตร
(รายได้จากการจัดงานนำเข้าป่าชุมชนเพื่อการท่องเที่ยวทุ่งดอกกระเจียว)
เหรียญสำหรับ finishers ทุกท่าน
ถ้วยรางวัล 123 จาก ท่านผู้ว่าราชการจังหวัดพิจิตร สำหรับ วิ่ง 5 กม. FunRun รวมอายุ
และ สำหรับวิ่ง 10.5 กม. Mini marathon รุ่นอายุ ไม่เกิน34 ปี,อายุ35-44 ปี, อายุ45-59 ปี, อายุ 60ปี ขึ้นไป
KRABI HALF MARATHON 2022 - 17-18 ก.ย.65 LINK
KRABI HALF MARATHON 2022 - RUN TO THE HORIZON RUN ROMANTIC เส้นทางวิ่งสุดฟินพิชิตเส้นขอบฟ้า บนถนนสายโรแมนติก เปิดรับสมัครแล้วที่
checkrace.com/kbmh2022
ประเภทการแข่งขัน : ระยะทาง 21.1 KM l 10 KM l 5 KM
** ระยะ 5 กม. ไม่มีรางวัลรุ่นอายุ
** 3 KM ไม่มีการแข่งขัน
วันแข่งขัน :
- เสาร์ที่ 17 กันยายน 2565 เวลา 17.00-18.30 น. Beach Run 5KM | 3KM
- อาทิตย์ที่ 18 กันยายน 2565 เวลา 04.30-8.00 น. Road Race 21.1KM | 10KM
จุดปล่อยตัว Half Marathon 21.1 KM และ Mini Marathon 10 KM
สนามกีฬากลางจังหวัดกระบี่ (อ่าวนาง) ต.อ่าวนาง อ.เมือง จ.กระบี่
เดิน-วิ่ง Olympic Day 2022 สนามที่ 3 ชลบุรี 10 ก.ย.65
พร้อมแล้ว สนามที่ 3 สำหรับกิจกรรม เดิน-วิ่ง Olympic Day 2022 10 ก.ย. 65 ณ ชายหาดพัทยา จ.ชลบุรี ระยะ 5 กม. และ 2.8 กม. ค่าสมัครระยะละ 370 บาท
ได้เสื้อและเหรียญที่ระลึก กับกิจกรรมวิ่งบนชายหาดยามเย็น ชมพระอาทิตย์ตก
รวมถึงและกิจกรรมกีฬาอื่นๆทั้งชายหาดและทางน้ำ
ที่ยกพลเหล่าเยาวชนเข้าแข่งขัน และ สาธิต มาร่วมเป็นกำลังใจสู่ทีมชนะเลิศและรับของรางวัลมากมาย
โทร 085-818-3395 E-mail : olympicdaythailand@gmail.com
TOP RUN .. รันเวย์ ทะเล สามอ่าว 18 ก.ย.65 LINK
TOP RUN .. รันเวย์ ทะเล สามอ่าว งานเดิน-วิ่งการกุศล เพื่อมูลนิธิคุ้มเกล้าฯ อาทิตย์ที่ 18 กันยายน 2565
กองบิน 5 ประจวบคีรีขันธ์
จัดโดย ชุมนุมนายเรืออากาศ รุ่นที่ 44
รายได้หลังหักค่าใช้จ่ายมอบให้ มูลนิธิคุ้มเกล้าฯ ในพระบรมราชูปถัมภ์
เปิดรับสมัคร 3 ระยะ
21K Half Marathon 10.5 Mini Marathon 5K Fun Run (ไม่มีการแข่งขัน) VIP
The Moon Run อัศจรรย์พระธาตุนาดูน 2022 - 10 ก.ย.65 LINK
The Moon Run อัศจรรย์พระธาตุนาดูน 2022
10 กันยายน 2565
ณ ลานพระธาตุนาดูน จังหวัดมหาสารคาม
13.5/3.5/600m. km.
กลุ่ม 1 : ระยะเวียนเทียน (รอบพระธาตุ 3 รอบ รอบละ 200 เมตร)
กลุ่ม 2 : ระยะจงกรม 3.5 กม.
กลุ่ม 3 : ระยะบิณฑบาต 13.5 กม.
เชียงรายอาร์ทรัน 2022 ล่น-เตียว-แอ่ว ผ่องานศิลป์ อาทิตย์ที่ 4 ก.ย.65 LINK
เชียงรายอาร์ทรัน 2022 “Chiangrai Art Run 2022”
Venue : สวนตุง จ.เชียงราย
Raceday : วันอาทิตย์ที่ 4 กันยายน 2022 ตั้งแต่ 5.00 น.เป็นต้นไป
รับ Race Pack : วันเสาร์ที่ 3 กันยายน 2565 ณ. สวนตุง จ.เชียงราย
โทร: 0967653254
เปิดรับสมัครวันอาทิตย์ ที่ 31 ก.ค. เวลา 11.00 น.
สมัครได้ที่ www.winggungai.com
Border Trail Run ตาพระยา สระแก้ว 10-11 ก.ย.65 LINK
10-11 กันยายน 2565 ตาพระยา สระแก้ว
งานเทรลสุดเขตแดนตะวันออกของไทย อำเภอตาพระยา จังหวัดสระแก้ว เป็นงานเทรลที่จะพาเหล่านักวิ่งไปเปิดประสบการณ์ใหม่ที่น่าค้นหา ขึ้นเขา ดาวน์ฮิลล์ สนุกสุดใจ ลัดเลาะไปตามแนวชายแดนไทย-กัมพูชา
Esther Bunny Women’s Run 10-11 ก.ย.65 LINK
ESTHER BUNNY WOMEN’S RUN
ในวันที่ 10-11 กันยายน 2565 @Laguna Phuket จ.ภูเก็ต
สมัครได้แล้วตั้งแต่วันนี้ – 15 สิงหาคม 2565
หรือจนกว่าจำนวนนักวิ่งจะเต็ม
รับสมัครรวม 3 ระยะ 5,000 คน เท่านั้น
บริจาค 100% ทำบุญ 100%
โดยทุก 1 การสมัคร บริจาค 100 บาท จากค่าสมัคร และราคาบัตรการกุศล (Charity) 3,500 บาท (บริจาค 100 %) เพื่อสนับสนุนให้แก่ มูลนิธิรามาธิบดีฯ สบทบทุน “โครงการผู้ป่วยยากไร้ มะเร็งเต้านม”
Hua Hin Sunset Run @Kao Tao 2022 - 9 ก.ย.65 LINK
งานวิ่ง Hua Hin Sunset Run @ Khao Tao 2022 วันที่ 9 กันยายน 2565 เวลา 15.00 ณ บริเวณพลับพลาอ่างเก็บน้ำเขาเต่า อ.หัวหิน ประจวบคีรีขันธ์
ประเภทการแข่งขัน มินิมาราธอน 9.9 กิโลเมตร และ Fun Run 5.9 กิโลเมตร (ปล่อยตัว 17 น.)
รายได้ส่วนหนึ่งมอบให้แก่กิจกรรมสาธารณกุศล เพื่อปรับปรุงและพัฒนาเมืองหัวหินต่อไป
Save Zoo Run 2022 วันที่ 11 ก.ย.65 LINK
งานวิ่ง SAVE ZOO RUN 2022 สนามที่ 3 ณ สวนสัตว์ขอนแก่น จัดในวันอาทิตย์ที่ 11 กันยายน 2565มี 3 ระยะ ทาง ได้แก่ Family Run 3.4 กม. / Fun Run 5 กม. / Trail. 13.6 กม.
งานเดิน-วิ่ง การกุศล MU Charity 2022 : Run for Chance 25 ก.ย.65 LINK
งานเดิน-วิ่ง การกุศล "MU Charity 2022 : Run for Chance” ชิงถ้วยพระราชทาน สมเด็จพระกนิษฐาธิราชเจ้า กรมสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี วันอาทิตย์ที่ 25 กันยายน 2565 เวลา 04.30 น. ณ.มหาวิทยาลัยมหิดล ศาลายา โดยมหาวิทยาลัยมหิดล ร่วมกับ มูลนิธิมหาวิทยาลัยมหิดลในพระราชูปภัมภ์ฯ แบ่งออกเป็น 2 ประเภท คือ วิ่งมินิมาราธอน ระยะทาง 10.5 กิโลเมตร และ วิ่ง Fun Run 6 กิโลเมตร โดยผู้สมัครเข้าร่วมกิจกรรมในแต่ละประเภทจะได้รับเสื้อแล้ว ยังได้รับของที่ระลึก อาทิ สเปรย์แอลกอฮอล์แบบมีสายคล้องคอ และแก้วน้ำ สำหรับผู้สมัครที่ไม่ประสงค์จะรับเสื้อ คณะผู้จัดงานจะนำเงิน 80 บาท ต่อท่านไปช่วยเหลือผู้พิการต่อไป รายได้หลังหักค่าใช้จ่ายสนับสนุนทุนการศึกษาและทุนสุขภาพสำหรับนักศึกษามหาวิทยาลัยมหิดล
สอบถาม 083 -177-1906/ 02-849-6359
วิ่ง-เดินการกุศล แอคคอร์โฮเทลส์ HeartBreak Hill Phuket Mini-Marathon ครั้งที่ 6 อาทิตย์ที่ 18 ก.ย.65 LINK
วิ่ง-เดินการกุศล แอคคอร์โฮเทลส์ "ฮาร์ทเบรก" ฮิลล์ มินิมาราธอน ครั้งที่ 6 วันอาทิตย์ที่ 18 กันยายน 2565 ณ สวนสาธารณะสะพานหิน ปล่อยตัวเวลา 05:00 น. เปิดตัวเส้นทางวิ่งใหม่ ที่จะทำให้ใจให้ละลายอีกครั้ง "สะพานหิน - เมืองภูเก็ต - เขารัง" กับ hashtag #ใจละลายที่ปลายควน และ #วิ่งกินลม #ชมเมืองเก่า #ขึ้นเขารัง
เปิดให้จองกันแล้ววันนี้ที่
https://soft.events/run/hbh2022
Fun Run (6K) 500.- Mini-Marathon (11K) 650.- VIP (6K or 11K) 1,000.-
มาละลายใจด้วยกัน เดือนกันยายนนี้นะครับ️
AccorHotels "HeartBreak" Hills Mini-Marathon 2022 is coming back!
Sunday, September 18th 2022. Start at Sapan Hin Park.
งานวิ่ง ถิ่นทวารวดี มาราธอน ครั้งที่1 วันที่ 18 ก.ย.65
งานวิ่ง ถิ่นทวารวดี มาราธอน ครั้งที่1
วันที่ 18 กันยายน 2565 ที่ อบต. ดงขวาง อำเภอหนองขาหย่าง จังหวัดอุทัยธานี
จัดโดย อบต.ดงขวาง ชมทุ่ง ชมกลิ่นอายถิ่นทวารวดี
หรือสมัครด้วยตนเอง ที่ อบต.ดงขวาง และเจ้าหน้าที่ทุกท่าน
CU NIGHT RUN 2022 ศุกร์ที่ 2 ก.ย.65 LINK
สำนักบริหารกิจการนิสิตร่วมกับศูนย์กีฬาแห่งจุฬาลงกรณ์มหาวิทยาลัย และสำนักยุทธศาสตร์และการขับเคลื่อน ขอเชิญชวนนิสิตปัจจุบันและบุคลากรจุฬาฯ เข้าร่วมกิจกรรม CU NIGHT RUN 2022 ในโครงการ CHULA Sustainability Fest 2022 ในวันศุกร์ที่ 2 กันยายน 2565 เริ่มเวลา 19.30 น. ณ สนามกีฬาจุฬาฯ
ผู้สนใจสมัครเข้าร่วมกิจกรรมได้ฟรี ตั้งแต่บัดนี้ – 20 สิงหาคม 2565 รับเสื้อฟรีจำนวนจำกัด 1,000 ตัวเท่านั้น
นิสิตสามารถสมัครผ่าน CU NEX หรือ CU CUDSON
บุคลากรสามารถสมัครผ่านโดยการสแกน QR CODE
สามารถติดตามประกาศรายชื่อผู้ได้รับเสื้อได้ที่เว็บไซต์ www.cusc.chula.ac.th หรือที่ Facebook : Chulalongkorn University Sports Center สอบถามรายละเอียดเพิ่มเติมได้ที่แผนกสมาชิกสัมพันธ์ ศูนย์กีฬาแห่งจุฬาฯ โทร. 0-2218-2811, 0-2218-2848 และสำนักบริหารกิจการนิสิต โทร. 0-2218-7043
"วิ่ง เลย มั้ย" Chiang Khan Super Half Marathon 2022 4 ก.ย.65 LINK
"วิ่ง เลย มั้ย" Chiang Khan Super Half Marathon 2022 4 ก.ย.65
วิ่งถนนบ้านไม้เก่าอายุ 100 กว่าปี
วิ่งขึ้นทะเลหมอกภูทอก
วิ่งเรียบริมน้ำโขง
Chiang Khan Super Half Marathon 2022 Season 4
งานนี้ฟิน!! พบกันที่เชียงคาน ลานวัฒนธรรม ถนนคนเดิน วันอาทิตย์ที่ 4 กันยายน 2565
RUN RECOVER AND RELAX
SaOnRun 2022 “สะออนรัน Season 5” 18 ก.ย.65 LINK
SaOnRun 2022 “สะออนรัน Season 5” วิ่ง สะออน RUN 2022 ณ ลานพญาศรีสัตตนาคราช แลนด์มาร์คนครพนม ในวันอาทิตย์ ที่ 18 กันยายน 2022 เวลา 04.00-09.30 น.
ระยะแข่งขัน (4KM)( 10KM)( 20KM)
วิ่งริมแม่น้ำโขง นครพนม กลิ่นอายความสนุก+สีสันมาเต็มเช่นเคย
การท่องเที่ยวแห่งประเทศไทย ภูมิภาคภาคตะวันออกเฉียงเหนือ ร่วมกับบริษัท เรคเรซ สปอร์ต จำกัด จัดกิจกรรมกระตุ้นการเดินทางท่องเที่ยวเชิงสุขภาพริมแม่น้ำโขง โดยมีวัตถุประสงค์เพื่อส่งเสริมให้เกิดการเดินทางแบบอนุรักษ์สิ่งแวดล้อมในกลุ่มนักท่องเที่ยว ผ่านการจัดกิจกรรมเพื่อการเรียนรู้ ทั้งด้านธรรมชาติ วิถีชีวิตชุมชน
เดิน วิ่ง 84 ปี โรงพยาบาลสรรพสิทธิประสงค์ 18 ก.ย.65 LINK
เดิน วิ่ง 84 ปี โรงพยาบาลสรรพสิทธิประสงค์
Sunpasit Run Super Half Marathon 2022
วันที่ 18 กันยายน 2565 เวลา 04.00 น. เป็นต้นไป
ลานกิจกรรมทุ่งศรีเมือง อำเภอเมือง จังหวัดอุบลราชธานี
3 ระยะ ตามความชอบ 25K Super Half Marathon/ 15K Super Mini Marathon/ 5K Fun Run / บัตรการกุศล VIP วิ่งได้ทุกระยะ
อิชิคุง มินิมาราธอน 2022 - 25 ก.ย.65 LINK
อิชิคุง มินิมาราธอน 2022 วันอาทิตย์ที่ 25 กันยายน 2565
จุดเริ่มต้นและเส้นชัย ลานประตู 4 ดาวเรือง สวนหลวง ร.๙ ถนนเฉลิมพระเกียรติ ร.๙, กรุงเทพมหานคร เส้นทางวิ่ง ภายในสวนหลวง ร.๙
บริษัท โตโยต้า ซัมมิท จำกัด (TOYOTA SUMMIT CO.,LTD) เป็นบริษัทญี่ปุ่น ในเคลือ Sumitomo Corporation Group ซึ่งเปิดดำเนินธุรกิจมาตั้งแต่ ก่อตั้งเมื่อวันที่ 19 กันยายน 2535 เป็นตัวแทนจำหน่าย ศูนย์บริการซ่อมรถยนต์โตโยต้า และ FiXfit มีทั้งหมด 5 สาขา ได้แก่ สาขาบางนา, สาขาศรีนครินทร์, สาขารัชดา, สาขาบางเมือง (SURE), สาขาอ่อนนุช ในโอกาสครบรอบ 30 ปี ในวันที่ 19 กันยายน 2565 นี้ บริษัท โตโยต้า ซัมมิท จำกัด จึงได้จัดกิจกรรม เดิน-วิ่งเพื่อสุขภาพ ICHI KUN Mini Marathon 2022 ขึ้น
CHIANG MAI NIGHT RUN 2022 @Doi Suthep 10 ก.ย.65 LINK
CHIANG MAI NIGHT RUN 2022 @Doi Suthep
ทดสอบฝีเท้าวิ่งทะยานขึ้นเขาไปชมจันทร์ที่ดอยสุเทพ คืนวันเสาร์ที่ 10 กันยายน
HALF MARATHON 22 KM : วิ่งขึ้น 11 กม.+วิ่งลง 11 กม.
MINI MARATHON 10.5 KM : วิ่งขึ้น 5.25 กม.+วิ่งลง 5.25 กม.
FUN RUN 5 KM : วิ่งขึ้น 2.5 กม.+วิ่งลง 2.5 กม.
เฮลท์ แอนด์ นูทริชัน เอเชีย 7-9 กันยายน 65
Healh and Nutrition Asia โดย VIV จัดพร้อมกันกับงาน VICTAM ASIA
งานแสดงสินค้าและเทคโนโลยีสำหรับธุรกิจการดูแลสุขภาพ และ โภชนาการในสัตว์ เป็นงานแสดงสินค้า 3 วัน ณ อิมแพค เมืองทองธานี จัดโดยผู้จัดงาน VIV ซึ่งมีเครือข่ายปศุสัตว์ที่ใหญ่ที่สุดงานหนึ่งในโลก อีกทั้งผสานความร่วมมือกับผู้จัดงาน VICTAM ซึ่งเป็นผู้จัดงานที่เชี่ยวชาญในอุตสาหกรรมอาหารสัตว์และธัญพืชที่ใหญ่ที่สุดเช่นกัน การรวมตัวกันของสองผู้จัดงานนำมาสู่การนำเสนองานแสดงสินค้าที่ครอบคลุมตั้งแต่อาหารสัตว์ จนถึงการดูแลสุขภาพสัตว์อย่างครบวงจร มีความเป็นเอกลักษณ์ที่ไม่ซ้ำใคร และนำเสนอแพลตฟอร์มเพื่อการเจรจาธุรกิจเพื่อให้คุณเข้าถึงตลาดเอเชีย หนึ่งในตลาดที่เติบโตที่สุดในโลก
สุขภาพของสัตว์มีผลอย่างยิ่งต่อคุณภาพของชิ้นเนื้อ ภายในงานนี้ท่านจะได้พบกับเทคโนโลยี นวัตกรรมใหม่ และแนวทางการแก้ไขปัญหาต่างๆ จากบรรดาผู้ประกอบการทั้งในประเทศ ในเอเชีย และต่างทวีป ครอบคลุมทั้ง ส่วนผสมในอาหารสัตว์ สารเติมแต่ง การผลิตและแปรรูป อาหารสัตว์และสัตว์เลี้ยง ตลอดจนสัตว์น้ำ เวชภัณฑ์ การตัดแต่งพันธุกรรม และการดูลุขภาพสัตว์ชั้นสูง นำเสนอโดยผู้จัดงาน VIV และ VICTAM
งานวิ่งการกุศล Unithai-CUEL Run for Charity 2022 สวนนงนุช พัทยา ชลบุรี 2 ต.ค.65 LINK
งานวิ่งการกุศล Unithai-CUEL Run for Charity 2022 จัดโดย กลุ่มบริษัท ยูนิไทย และ ซียูอีแอล วันที่ 2 ตุลาคม 2022 สถานที่จัดงาน สวนนงนุช พัทยา ชลบุรี
ระยะทางที่จัดวิ่ง: 4km. 8km. และ 12 km.
รายละเอียดค่าสมัคร: (4km/450บ.) (8km/650บ.) (12km/800บ.)
ติดต่อสอบถามเพิ่มเติม
เส้นทางวิ่ง เสื้อวิ่ง เหรียญ ดูในเพจ
Inbox m.me/UNITHAI-CUELRunforCharity 2022
Tel: +66 (0) 89 939 9128
E-Mail: unithaicuel2022@gmail.com
งานบางแสน42 ชลบุรีมาราธอน 2022 - 30 ต.ค.65
งานบางแสน42 ชลบุรีมาราธอน 2022, World Athletics Elite Label The Passion of World Class Marathon
วันอาทิตย์ที่ 30 ตุลาคม 2565
งานนี้เป็นงานวิ่งระยะเดียว 42.195 km [
รายละเอียด]
TPA Charity Run 2022 สวนหลวง ร.9 วันที่ 9 ต.ค.65 LINK
เชิญชวนนักวิ่งหรือผู้ที่ชื่นชอบการออกกำลังกายมาเข้าร่วม กิจกรรม TPA Charity Run 2022 ครั้งที่ 6 จัดโดย สมาคมส่งเสริมเทคโนโลยี (ไทย-ญี่ปุ่น) วันที่ 9 ตุลาคม 2565 ณ สวนหลวง ร.9
รายได้ทั้งหมดหลังหักค่าใช้จ่ายจะนำไปสมทบทุน โครงการหนูอยากได้ยินเสียงแม่ มูลนิธิอนุเคราะห์คนหูหนวกในพระบรมราชินูปถัมภ์
สามารถสอบถามรายละเอียดข้อมูลเพิ่มเติมและสมัครเข้าร่วมกิจกรรมได้ที่
Link สำหรับสมัครเข้าร่วมกิจกรรม :
race.thai.run/tpacharityrun2022Chiang Mai Cross-Country 2022 ห้วยตึงเฒ่า เชียงใหม่ 9 ต.ค.65 LINK
Chiang Mai Cross-Country Run 2022 is expected to bring in runners from local & international to enjpy the race’s challenges and have fun during the long weekend of October in Chiang Mai, and the race is hoped to represent Huay Tueng Tao and Chiang Mai as top destination for Sport-Tourism
PET - Pribpree Eco Trail - Mountain run 10-11 ก.ย.65 LINK
Pribpree Eco Trail ปีนี้ 2022 ถือเป็นครั้งที่ 3 ผ่านการคัดเลือกโดยการกีฬาแห่งประเทศไทย ให้เป็นสนามระดับประเทศในซีรีส์ "Ultra Trail Thailand Tour" ซึ่งมีเพียง 5 สนาม ทั่วประเทศ
กำหนดการ
ศุกร์ 9 กันยายน 2565 รับเบอร์วิ่งและอุปกรณ์ (Race Kit) สำหรับผู้สมัครทุกระยะ
เสาร์ 10 กันยายน 2565 รับเบอร์วิ่งและอุปกรณ์ (Race Kit)
อาทิตย์ 11 กันยายน 2565 ปล่อยตัวระยะต่างๆ
UDON Trail Running & Cross country (UDONTXC) 30 ต.ค.65 LINK
งานวิ่ง UDON Trail Running & Cross country หรือเรียกสั้น ๆ ว่า UDONTXC @หมู่บ้านคีรีวงกต เทรลแรกที่จะพาคุณไปสูดอากาศบริสุทธิ์ท่ามกลางธรรมชาติ และวิถีชีวิตที่สวยงาม ในแบบฉบับของคีรีวงกต วันอาทิตย์ที่ 30 ตุลาคม 2565
จุดสตาร์ท/เส้นชัย : หมู่บ้านคีรีวงกต (โรงเรียนชายแดนประชาสรรค์)
ประเภท 5K/10K/20K
Khun Dan Marathon 2022 - 16 ต.ค.65
สนาม Khun Dan Marathon 2022@นครนายก เขื่อนขุนด่านปราการชล ปีนี้เส้นทางใหม่ วิ่งง่าย วิ่งเร็ว วิ่งเรียบกริบ
Race Day 16/10/65
เส้นทางการเเข่งขันของ 2 ระยะ
****สายสีน้ำเงินกรม 42.195 KM "ดุดันดังระยะทาง"
**สายสีเหลือง 21.1 KM "ผ่องพันพอทน"
ส่วนอีก 2 ระยะ สายสีม่วง 10 KM "ซ่อนหวานฝันเเรง"
และสีฟ้า 5 KM "สดชื่นยิ้มสด" เป็นเส้นทางเดิม
สมัครได้ถึง 15/9/65
FB/KhunDanMarathon/WALK RUN BIKE 8 เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 8 - 30 ต.ค.65 LINK
กิจกรรมโครงการ " แสงนำใจไทยทั้งชาติ เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 8 เฉลิมพระเกียรติ "
เปิดรับสมัคร 77 สนาม ใน 77 จังหวัดทั่วประเทศแล้ว โครงการแสงนำใจไทยทั้งชาติ เดิน วิ่ง ปั่น ป้องกันอัมพาต ครั้งที่ 8 เฉลิมพระเกียรติ โดยศูนย์โรคหลอดเลือดสมองศิริราช คณะแพทยศาสตร์ศิริราชพยาบาล ร่วมกับเขตสุขภาพทั่วประเทศ ชวนคนไทยออกกำลังกายป้องกัน Stroke โรคหลอดเลือดสมองที่ป้องกันได้ 80% จากการออกกำลังกาย มีสนามให้ เดินวิ่งปั่นทั่วประเทศ อยากวิ่งสนามไหน สมัครสนามนั้น อย่าสมัครผิดสนาม
การจัดกิจกรรมใหญ่ จะมีขึ้นในวันอาทิตย์ที่ 30 ตุลาคม 2565 พร้อมกันทั่วประเทศไทย สำหรับกรุงเทพมหานคร จัดขึ้น ณ ท้องสนามหลวง ตั้งแต่เวลา 03.00 – 07.00 โดยเปิดรับสมัครตั้งแต่วันที่ 25 กรกฎาคม 2565 (วันนี้) จนถึงวันที่ 31 สิงหาคม 2565 และสมัครได้ Website: race.thai.run โดยรายได้จะนำเข้ามูลนิธิโรงพยาบาลสมเด็จพระยุพราช และกองทุนโรคหลอดเลือดสมองระดับเขตสุขภาพหรือระดับจังหวัด
ลิงค์สมัคร ทั้ง 13 เขตสุขภาพ 77 จังหวัด
รพ.หัวใจกรุงเทพ ชวนวิ่ง Heart Challenge Fun Run 2022 เสาร์ที่ 1 ต.ค.65 LINK
โรงพยาบาลหัวใจกรุงเทพ เชิญผู้สนใจเข้าร่วมงาน Heart Challenge Fun Run 2022 เดิน วิ่ง ให้หัวใจคนกรุงแข็งแรง ในวันเสาร์ที่ 1 ตุลาคม 2565 เวลา 15.00-19.00 น. ณ บริเวณศาลาภิรมย์ภักดี สวนลุมพินี
นอกจากกิจกรรมเดิน วิ่ง แล้ว ในงาน ยังมีบริการตรวจสุขภาพฟรี อาทิ ประเมินความเสี่ยงโรคหลอดเลือดหัวใจเบื้องต้น / ประเมินความฟิตของปอดและหัวใจ / วัดความดันโลหิต / ตรวจน้ำตาลปลายนิ้ว / รับคำปรึกษาแพทย์เฉพาะทางโรคหัวใจ / รับคำปรึกษาและคำแนะนำ อาหารกับโรคหัวใจ จากนักโภชนากร
ชมการสาธิตช่วยชีวิตขั้นพื้นฐาน กรณีหมดสติหรือหัวใจหยุดเต้นจากการออกกำลังกาย (CPR)
ปิดท้ายด้วยกิจกรรมดนตรีในสวน ขับกล่อมโดยศิลปินเพลงรัก โต๋-ศักดิ์สิทธิ์ เวชสุภาพร
ค่าสมัครวิ่งท่านละ 199 บาทพร้อมรับเสื้อ 1 ตัว รายได้ทั้งหมดไม่หักค่าใช้จ่าย มอบให้กับมูลนิธิหัวใจแห่งประเทศไทยในพระบรมราชูปถัมภ์
สนใจสมัคร คลิก
https://bit.ly/3AUusTV สอบถามข้อมูลเพิ่มเติมได้ที่ Heart Care LINE Official : @Hearthospital หรือคลิก
https://lin.ee/1eSlfssXe ตั้งแต่ 1 - 20 กันยายน 2565 เท่านั้น (รับจำนวนจำกัด 1,000 คน)
FIT YOUR BONE, RUN FOR HEALTHY BONE 2022 วิ่งและส่งผลถึง 20 ต.ค.65 LINK
กิจกรรมสำหรับคนรักสุขภาพ กับงาน “FIT YOUR BONE, RUN FOR HEALTHY BONE 2022” วิ่งเพื่อสุขภาพที่ดี และกระดูกที่แข็งแรง มีให้เลือกถึง 2 รูปแบบ ได้แก่
การวิ่งสะสมระยะทาง
1) ประเภท อายุต่ำกว่า 50 ปี : สะสมระยะทาง 80 กิโลเมตร
2) ประเภท อายุมากกว่า 50 ปี : สะสมระยะทาง 40 กิโลเมตร
ค่าสมัคร 120 บาท (รวมค่าจัดส่งแล้ว)
*ผู้ทำกิจกรรมสำเร็จได้รับเสื้อ พร้อมร่วมลุ้นรับรางวัลพิเศษอื่นๆ มากมาย
**สงวนสิทธิเฉพาะผู้ที่ทำกิจกรรมครบถ้วนเท่านั้น
รับสมัคร : 23 สิงหาคม - 20 ตุลาคม 2565 (23.59 น.)
วิ่งและส่งผล ได้ตั้งแต่ : 23 สิงหาคม - 20 ตุลาคม 2565 (23.59 น.)
แม่เมาะฮาล์ฟมาราธอน ครั้งที่ 29 อาทิตย์ที่ 16 ต.ค.65
Mae Moh Half Marathon 2022 กลับมาครั้งนี้ต้องไม่ธรรมดาอยู่แล้วจ้ะนาย เพราะเหล่านักวิ่งจะได้พบกับเส้นทางใหม่ มาตรฐานกรีฑาโลก (World Athletics) จัดขึ้นในวันอาทิตย์ที่ 16 ตุลาคม 2565
fb/Maemohhalfmarathon/InterCare Asia 27 - 29 ตุลาคม 65 LINK
งาน InterCare Asia 2022 - International Expo for HealthCare and Wellness งานแสดงนวัตกรรม สินค้าเพื่อสุขภาพ และความเป็นอยู่ของผู้สูงวัย ศูนย์การประชุมแห่งชาติสิริกิติ์ วันที่ 27 - 29 ตุลาคม 2565
Thailand InsurTech Fair 2022 วันที่ 7-9 ตุลาคม 65
สำนักงานคณะกรรมการกำกับและส่งเสริมการประกอบธุรกิจประกันภัย (คปภ.) โดยศูนย์ Center of InsurTech Thailand (CIT) เตรียมจัดสุดยอดงาน Thailand InsurTech Fair 2022
งานอีเวนท์ประกันภัยในรูปแบบ Hybrid ที่จะพาทุกคนก้าวสู่จักรวาลเทคโนโลยีประกันภัย
สุดยิ่งใหญ่อีกครั้ง 7-9 ตุลาคม 2565
กลับมาอีกครั้งกับงาน “มหกรรมการประกันภัย” สุดยิ่งใหญ่แห่งปีที่จัดขึ้นโดย สำนักงานคณะกรรมการกำกับและส่งเสริมการประกอบธุรกิจประกันภัย (คปภ.) โดยศูนย์ Center of InsurTech Thailand (CIT) ภายใต้ชื่องาน Thailand InsurTech Fair 2022 (TIF2022) ใน concept Reshaping Insurance to the Multiverse of InsurTech for the Future ก้าวสู่จักรวาลแห่งเทคโนโลยีประกันภัย เพื่อโลกใหม่ไร้ขีดจํากัด ซึ่งเป็นการรวมตัวครั้งใหญ่ของบริษัทประกันภัยชั้นนำทั่วฟ้าเมืองไทย เหล่าคนสายประกันผู้คร่ำหวอดอยู่ในวงการประกันภัยทั้งในและต่างประเทศ อีกทั้งพันธมิตรประกันภัยจากทั่วทุกมุมโลกที่จะมาสร้างเครือข่ายร่วมกัน งานนี้พบกับสารพันสินค้าและบริการด้านประกันภัยในราคาสุดพิเศษแบบที่ไม่เคยมีที่ไหนมาก่อน พร้อมการลงทะเบียนในรูปแบบของการสร้าง Avatar ของผู้เข้าร่วมงานที่จะช่วยค้นหาประกันที่ถูกใจและตรงกับ Lifestyle ภายในงานด้วย
นอกจากการลดกระหน่ำผลิตภัณฑ์ประกันภัยที่สุดแห่งปีแล้ว ยังมีกิจกรรมมากมาย อาทิ การเสวนาวิชาการด้านประกันภัยจากวิทยากรมากประสบการณ์จากทั่วทุกมุมโลก ที่จะมาแลกเปลี่ยนความรู้ แชร์เคล็ดลัดการปรับตัวสู่การประกันภัยแห่งอนาคต โดยหัวข้อสัมมนาเน้นเนื้อหาครอบคลุมชาวประกันภัยทุกกลุ่ม ทั้งบริษัทประกันภัย Tech Startup เหล่าตัวแทนและนายหน้าประกันภัย รวมทั้งประชาชนทั่วไปที่สนใจ ซึ่งสามารถรับชมได้ทั้งภาษาไทยและภาษาอังกฤษ
อีกหนึ่งโซนน่าสนใจภายในงาน Thailand InsurTech Fair 2022 คือ InsurVerse Zone พื้นที่แสดงศักยภาพของบรรดา Tech Startup จากหลากหลายภูมิภาคทั่วโลก ที่จะมาอวดโฉมนวัตกรรมทาง InsurTech เพื่ออนาคตการประกันภัยยุคใหม่ไร้ขีดจำกัด พร้อมเปิดพื้นที่ Business Matching สำหรับแลกเปลี่ยน จับคู่ชนธุรกิจกับเหล่าผู้บริหารจากธุรกิจประกันภัยชั้นนำที่จะมารวมตัวกันมากที่สุดในงานนี้
ร่วมเปิดโลกจักรวาลความรู้เทคโนโลยีประกันภัยไปกับ InsurTech Showcase จากทาง คปภ. ผ่านระบบInteractive และเพลิดเพลินกับกิจกรรม Insurance Interactive Game และ TIF Photo booth พร้อมลุ้นรางวัลใหญ่สุดอลังการอย่างรถยนต์ไฟฟ้า EV - Ora Good Cat รวมทั้ง IT Gadget อื่น ๆ อีกมากมายรวมมูลค่ากว่า 1,600,000 บาท
Thailand InsurTech Fair 2022 จะจัดขึ้นในลักษณะ Hybrid ทั้งรูปแบบ online และ onsite หากสนใจเข้าร่วมงานในรูปแบบ online สามารถเข้าชมได้ที่เว็บไซต์ www.tif2022.com หรือในรูปแบบ onsite ที่จะจัดขึ้นระหว่างวันที่ 7-9 ตุลาคม 2565 ณ อิมแพคเมืองทองธานี ฮอลล์ 6 ติดต่อสอบถามรายละเอียดเพิ่มเติมได้ทาง tif@oic.or.th หรือทาง Facebook Page: Center of InsurTech Thailand
SmartHeart presents Thailand International Pet Variety Exhibition ครั้งที่ 12
งานสัตว์เลี้ยงของสายเปย์ที่มาพร้อม การลด! แลก! แจก! แถม! ภายในงานเพียบ! พร้อมตรวจสุขภาพสัตว์เลี้ยงฟรี!
งานสัตว์เลี้ยงคุณภาพเพื่อคนรักสัตว์สุดพิเศษประจำปี ยกขบวนเพื่อนรักสัตว์เลี้ยงมาให้คุณได้ฟินพร้อมทั้งช้อปสินค้าและบริการราคาพิเศษให้จุใจ ทั้งอาหารสัตว์ อุปกรณ์เกี่ยวกับสัตว์เลี้ยง เสื้อผ้า เครื่องประดับ และบริการมากมาย ห้ามพลาด! ปีนี้เราขนกิจกรรมสุดหรรษาพร้อมทั้งกิจกรรมใหม่ๆมาเอาใจทั้งเจ้าของและสัตว์เลี้ยงเพียบ!
พบกัน วันที่ 6-9 ตุลาคม 2565 เวลา 10.00 - 20.00 น. ณ ฮอลล์ 7-8 อิมแพ็ค เมืองทองธานี
DOI NHOK TRAIL 2022 ดอยหนอก เทรล ลำปาง 4-6 พ.ย.65 LINK
"ดอยหนอก" สนามที่อยู่ในอ้อมกอดของพระเจ้า ความน่าสงสัย มีเสน่ห์ แต่แฝงไปด้วยความโหดร้าย" DNT 2021 (Race day 4-6 November 2022)
สถานที่ปล่อยตัวและเส้นฟินิชเชอร์ : อบต.วังซ้าย อ.วังเหนือ จ.ลำปาง
ผู้เข้าร่วมแข่งขันต้องมีอายุ 18 ปีขึ้นไป
งานกัญชง-กัญชานานาชาติ Asia International HEMP and Cannabis Expo 2022 30 พฤศจิกายน – 2 ธันวาคม 65 LINK
- งาน Asia International HEMP and Cannabis Expo 2022 งานแสดงเทคโนโลยี นวัตกรรม และผลิตภัณฑ์กัญชง-กัญชานานาชาติ ที่ยิ่งใหญ่ที่สุดในประเทศไทยและระดับเอเซีย จัดขึ้นระหว่างวันที่ 30 พฤศจิกายน – 2 ธันวาคม 2565 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์ โฉมใหม่ จะเป็นงานที่จะรวมทุกพันธมิตรในธุรกิจกัญชง-กัญชา ทั้งภาครัฐ เอกชน ทุกระดับและทุกสาขาในอุตสหกรรมที่จะเกี่ยวข้องกับการผลิต แปรรูป จำหน่าย การตลาด เทคโนโลยี นวัตกรรม การแพทย์ เวชภัณฑ์ ฯลฯ ปลดล็อคทุกข้อจำกัดและเปิดโอกาสสู่การพัฒนาอุตสาหกรรมกัญชง-กัญชาให้เติบโตระดับโลก
THE MALL KORAT MARATHON 2022 - 6 พ.ย.65 LINK
THE MALL KORAT MARATHON 2022 - THE MEMORABLE MARATHON มาราธอนแห่งความประทับใจ เดอะมอลล์ กรุ๊ป และจังหวัดนครราชสีมา ขอเชิญนักวิ่งร่วมเปิดประสบการณ์ความประทับใจครั้งใหม่ในมาราธอนแห่งเมืองย่าโมที่จะสร้างความสุขและความประทับใจให้กับนักวิ่ง
วันแข่งขัน : อาทิตย์ที่ 6 พฤศจิกายน 2565 สถานที่แข่งขัน : ณ อนุสาวรีย์ท้าวสุรนารี จังหวัดนครราชสีมา
ประเภทการแข่งขัน : ระยะทาง 42.195 กม. l 21.097 กม. l 10.55 กม. และ 5 กม.
ราคาค่าสมัคร • Marathon ราคา 1,100 บาท • Half Marathon ราคา 950 บาท • Mini Marathon ราคา 750 บาท • Micro Marathon ราคา 550 บาท
Run For Charity วิ่ง ชิม ช้อป สมาคมสตรีนครเชียงใหม่มินิมาราธอน2022 อาทิตย์ 20 พ.ย.65 LINK
Run For Charity สมาคมสตรีนครเชียงใหม่มินิมาราธอน2022
ขอเชิญทุกท่านเข้าร่วมการแข่งขันวิ่งการกุศล " Run For Charity -วิ่ง ชิม ช้อป สมาคมสตรีนครเชียงใหม่มินิมาราธอน2022 " วัน อาทิตย์ ที่ 20 พฤศจิกายน พ.ศ.2565 ณ อ่างเก็บน้ำห้วยตึงเฒ่า อ.แม่ริม จ.เชียงใหม่ เพื่อนำรายได้ไปดำเนินกิจกรรมใน “ โครงการปันน้ำใจเพื่อน้อง ในถิ่นทุรกันดาร” ณ โรงเรียนตำรวจตระเวนชายแดน บ้านหนองแขม ต.เมืองนะ อ.เชียงดาว จ.เชียงใหม่
วัน เสาร์ ที่ 19 พฤศจิกายน พ.ศ.2565
10.00 -18.00 น. รับ Race pack สำหรับแข่งขัน
ณ อ่างเก็บน้ำห้วยตึงเฒ่า อ.แม่ริม จ.เชียงใหม่
วัน อาทิตย์ ที่ 20 พฤศจิกายน พ.ศ.2565
04.30 น. นักวิ่งเข้าสู่บริเวณงาน ณ อ่างเก็บน้ำห้วยตึงเฒ่า อ.แม่ริม จ.เชียงใหม่
05.30 น. นักวิ่งเข้าเช็คอินที่จุด START
06.00 น. ปล่อยตัวนักวิ่งระยะ 10 KM
06.10 น. ปล่อยตัวนัววิ่งฟันรัน 4 KM
08:00 น. พิธีมอบรางวัล
DOI Nhok Trail 4-6 พ.ย.65 LINK
วิ่งพิชิต "ดอยหนอก" ลำปาง สนามที่อยู่ในอ้อมกอดของพระเจ้า ความน่าสงสัย มีเสน่ห์ แต่แฝงไปด้วยความโหดร้าย"
DNT 2021 (Race day 4-6 November 2022)
สถานที่ปล่อยตัวและเส้นฟินิชเชอร์ : อบต.วังซ้าย อ.วังเหนือ จ.ลำปาง
Ultra-trail Doi Soi Malai 2022 - 27 พ.ย.65 LINK
RACE INFO
UTSML55 UTSML25 UTSML12
RACE DAY 27 November 2022
UTSML : Ultra Trail Doi Soi Malai เป็นสนาม 1ใน 4 ของรายการ Tak Trail Series Ultra Trail Doi Soimalai สนามที่ขึ้นชื่อว่าเป็น "หลังคาเมืองตาก" กับความสวยงามและทุกๆสภาพอากาศ มาพร้อมกับความท้าทายที่มากยิ่งขึ้นอย่างแน่นอน ทั้งร้อน ฝน หนาว
RUN FOR THE OCEAN วิ่งมหาสนุกเพื่อมหาสมุทรของเรา 20 พ.ย.65 LINK
งานวิ่ง RUN FOR THE OCEAN วิ่งมหาสนุกเพื่อมหาสมุทรของเราปี2
จัดโดย สมาคมนิสิตเก่าคณะประมง มหาวิทยาลัยเกษตรศาสตร์
สถานที่ คณะประมง มหาวิทยาลัยเกษตรศาสตร์ บางเขน
10K | 5K | 2.5K
รับสมัคร 02 กันยายน 2022
วันแข่งขัน 20 พฤศจิกายน 2022
เหรียญที่ระลึก RFO2 จุดประสงค์ของการออกแบบเหรียญในปีนี้ นอกจากความสวยงามแล้ว เราตั้งใจอยากให้ทุกครั้งที่เพื่อนๆ ชื่นชมกับความสวยงาม ขอให้พลิกดูอีกด้าน เพื่อนๆจะเกิดความตระหนักรู้ถึงปัญหาและช่วยกันลดปริมาณขยะทะเล อีกหนึ่งความตั้งใจ ที่เราอยากมอบให้เพื่อนๆ เก็บไว้เป็นที่ระลึก #จะได้นึกถึงและรักท้องทะเลไปนานแสนนาน #ด้านหน้า : พี่วาฬ willy พี่ใหญ่แห่งท้องทะเล #ด้านหลัง : ปัญหาใหญ่ของท้องทะเล "บ้านของพี่ willy" ขยะทะเล ที่นับวันจะเพิ่มปริมาณขึ้น
SBAC Fun Run 2022 พี่ได้รัน น้องได้เรียน 6 พ.ย.65 LINK
สมาคมศิษย์เก่าSBAC ชวนวิ่งระยะ 5 KM งานวิ่งเพื่อร่วมทำบุญ มอบโอกาสการศึกษาให้กับเยาวชนของชาติ เพื่อสนับสนุนทุนการศึกษาให้น้องๆ นักศึกษาที่ขาดแคลนทุนทรัพย์ และต้องการความช่วยเหลือในด้านต่างๆ
อาทิตย์ที่ 6 พฤศจิกายน 2565 ณ สวนสุขภาพกองทัพอากาศชาวฟ้า
Call Center : 02-972-6111 - 8
ถ้ำนาคาฮาล์ฟมาราธอน 6 พ.ย.65
ถ้ำนาคาฮาล์ฟมาราธอน ระยะแข่งขัน 21 / 10 / 5 KM วันที่ 6 พฤศจิกายน 2565 ณ ทางขึ้นถ้ำนาคา อำเภอบึงโขงหลง จังหวัดบึงกาฬ จัดโดยสมาคมส่งเสริมการท่องเที่ยวบึงโขงหลง #สัมผัสบรรยากาศดีๆ #วิวสวยๆของภูลังกา มิตรภาพ ความอบอุ่น ความประทับใจ
ข้อมูล/สมัคร
facebook.com/naka.halfmarathonMai Khao Turtle Fun Run 2022 วันที่ 6 พ.ย. 65 LINK
6 พฤศจิกายน 2565 ณ ประตูเมืองภูเก็ต
งานวิ่งเพื่อน้องเต่าทะเล MAIKHAO TURTLE FUN RUN 2022 ครั้งที่ 17
ภายใต้คอนเซป "วิ่งสนุก อนุรักษ์เต่าทะเล"
โดยมูลนิธิเพื่อการอนุรักษ์เต่าทะเลหาดไม้ขาว จังหวัดภูเก็ต
และไฮไลท์เส้นทางวิ่งข้ามสะพานสารสินเพื่อให้เพื่อนๆนักวิ่งได้สัมผัสบรรยากาศที่สวยงามของจังหวัดภูเก็ตและพังงา ประเภทการวิ่งด้วยกัน 3 ประเภท
1.FAMILY RUN 2.5km (วิ่งแบบครอบครัว ระยะทาง 2.5 กิโลเมตร สมาชิก 2 ผู้ใหญ่ 2 เด็กอายุไม่เกิน 12 ปี)
2.FUN RUN 5km
3.SUPER MINI MARATHON 15km
LAB FUTURE AND BIO EXPO 2022 วันที่ 24-25 พฤศจิกายน 2565 ขอนแก่น KICE LINK
LAB FUTURE AND BIO EXPO 2022 LAB FUTURE งานแล็บที่ใหญ่ที่สุดในภาคอีสาน รวมพลคนสายแล็บที่ใหญ่ที่สุดของภูมิภาค ทั้งผู้ผลิต ผู้จำหน่าย เทคโนโลยี เครื่องมือและอุปกรณ์ สารเคมีและระบบความปลอดภัย งานออกแบบและก่อสร้าง งานบริการทางห้องปฏิบัติทางวิทยาศาสตร์ทุกรูปแบบ เหมาะกับ
> ทุกอุตสาหกรรม
> หน่วยงานด้านการศึกษา
> การแพทย์ สาธารณสุข
> เกษตรและปศุสัตว์
> อาหารและเครื่องสำอางค์
> การผลิตชิ้นส่วนอุตสหกรรม ฯลฯ
พร้อมองค์ความรู้แห่งอนาคตด้านกัญชงกัญชา โปรตีนจากพืชและแมลง เพื่อความเข้มแข็งของภาคอีสาน แล้วพบกัน 24-25 พฤศจิกายน 2565 ณ ศูนย์ประชุมและแสดงสินค้านานาชาติ ขอนแก่น (ไคซ์) ขอนแก่น ประเทศไทย
สอบถามข้อมูลเพิ่มเติม โทร 02 109 9667 / 061 023 5454 / 089 682 4860
งาน Khiri Wong Kot Trail 2022 วันที่ 18 ธ.ค.65 LINK
มาวิ่งกันกับ งาน Khiri Wong Kot Trail 2022 ในรูปแบบ SLOW LIFE STAY WITH LOCALS
ระยะแข่งขัน 30/12/6 KM Race Day 18 ธันวาคม 2565 โรงเรียนชายเเดนประชาสรรค์ จังหวัดอุดรธานี
คีรีวงกต หมู่บ้านแห่งขุนเขา ชุมชนท่องเที่ยวภาคอีสาน หลายคนเคยไปสัมผัสรถอีเเต็กลุยน้ำกันมาบ้างแล้ว
Bangkok Beauty Show 2022 15 - 17 ธันวาคม 65 LINK
พฤหัสบดีที่ 15 – เสาร์ที่ 17 ธันวาคม 2022 ศูนย์ ฯ ไบเทค (ฮอลล์ 101)
เข้าชมงานฟรี เพียงลงทะเบียนล่วงหน้า
มาร่วมสนุกกับกิจกรรมสุดพิเศษโดยไม่เสียค่าใช้จ่าย
- สัมผัสประสบการณ์สินค้าจากเกาหลี
- พบแขกรับเชิญและกิจกรรมสุดพิเศษภายในงาน
- การประกวดK-Beauty จากอาร์ติสท์ไทยและเกาหลี
- โอกาสได้รับชองขวัญสุดพิเศษฟรี
Beyond Food Preview 2022 วันที่ 17 ธันวาคม 2565 LINK
Beyond Food Preview 2022 เตรียมพบกับ BEYOND FOOD EXPO - PREVIEW 2022 วันที่ 17 ธันวาคม 2565 9.00-17.00น. "การสัมมนารูปแบบใหม่ ปลุกระดมความคิด หยั่งรากเศรษฐกิจ เพื่ออนาคตที่ยั่งยืนแห่งลุ่มแม่น้ำโขง Future Food "The Game Changer for Sustainable
14.18 น. สำนักข่าวไทย รายงานเหตุกราดยิง อ.นากลาง จ.หนองบัวลำภู คนเจ็บ-ตาย จำนวนมาก
14.18 น. ด่วน! เกิดเหตุกราดยิง อ.นากลาง จ.หนองบัวลำภู คนเจ็บ-ตาย จำนวนมาก เวลา 13.00 น. (6 ต.ค.65) สถานีตำรวจภูธรนากลาง แจ้งเกิดเหตุยิงกันตายและบาดเจ็บในพื้นที่ ต.อุทัยสวรรค์ ขอให้ประชาชน อยู่ในบ้านและที่ปลอดภัย ผู้ก่อเหตุมีอาวุธ ขับรถหลบหนี ขณะนี้ตำรวจกำลังไล่ติดตามผู้ก่อเหตุ
14.31 น. วันที่6 ต.ค.65 พล.ต.อ.ดำรงศักดิ์ ผบ.ตร. บินด่วน! ลงพื้นที่ จ.หนองบัวลำภู สั่งทุกหน่วยเร่งล่าคนร้ายกราดยิงไม่เลือกหน้า ทั้งเด็กและผู้ใหญ่
14.38 น. นายกฯ สั่งการด่วน!! ตำรวจ เร่งตามตัว ผู้ก่อเหตุกราดยิงที่ศูนย์เด็กเล็กใน จ.หนองบัวลำภู ขอแสดงความเสียใจสุดซึ้งกับครอบครัวผู้เสียชีวิต
พลเอกประยุทธ์ จันทร์โอชา นายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงกลาโหม เปิดเผยว่าได้รับทราบเหตุ อดีตตำรวจกราดยิงที่ศูนย์เด็กเล็กแห่งหนึ่ง มีเด็กและครูผู้ปกครองเสียชีวิตนับสิบคน พร้อมได้สั่งการให้เจ้าหน้าที่ไปติดตามผู้ก่อเหตุ และขอแสดงความเสียใจอย่างสุดซึ้งกับครอบครัวผู้เสียชีวิต
15.01 น. ประกาศ คนร้ายเสียชีวิตแล้ว
14.50 น. ล่าสุดมีรายงานว่าชายคลั่งกราดยิงศูนย์เด็กเล็ก จ.หนองบัวลำภู จบชีวิตพร้อมลูกเมีย หลังก่อเหตุ
ตำรวจสอบสวนกลาง ยืนยัน! คนร้ายกราดยิงภายในศูนย์พัฒนาเด็กเล็ก องค์การบริหารส่วนตำบลอุทัยสวรรค์ จ.หนองบัวลำภู ยิงตัวเองเสียชีวิตเเล้ว
ด้าน นายแพทย์โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข กล่าวถึงเหตุการณ์กราดยิงในจังหวัดหนองบัวลำภู ว่า ได้รับรายงานจากผู้ตรวจราชการกระทรวงสาธารณสุขเขต 8 ว่ามีผู้เสียชีวิตจากเหตุการณ์ครั้งนี้ 32 คน และบาดเจ็บ 18 คน อย่างไรก็ตาม คาดว่าจะมีผู้บาดเจ็บอาจมากกว่านี้ เบื้องต้นได้สั่งการให้ เจ้าหน้าที่เข้าไปดูแลสภาพจิตใจของผู้ป่วย และญาติด้วย เนื่องจากเป็นเหตุการสะเทือนขวัญ ทำร้ายทั้งจิตใจและร่างกาย
15.01 น. - สถานีตำรวจภูธรนากลาง ประกาศ "
แจ้งข่าว!! ล่าสุดคนร้ายเสียชีวิตแล้ว"
15.18 น. นายกรัฐมนตรี แถลงข้อความแสดงความเสียใจต่อเหตุการณ์
โดยนายกรัฐมนตรี แถลงข้อความผ่านเพจ ประยุทธ์ จันทร์โอชา Prayut Chan-o-cha ดังนี้
"ตามที่มีรายงานข่าวการก่อเหตุสะเทือนขวัญ ในพื้นที่จังหวัดหนองบัวลำภู ในช่วงบ่ายวันนี้ ผมขอแสดงความเสียใจอย่างสุดซึ้งกับครอบครัวผู้สูญเสียและผู้บาดเจ็บ โดยได้สั่งการให้ ผบ.ตร. ลงพื้นที่เพื่อเร่งดำเนินการตามกฎหมายในทันที และให้ทุกฝ่ายที่เกี่ยวข้องเข้าช่วยเหลือเยียวยาผู้ได้รับผลกระทบทุกคนโดยด่วน
สำหรับรายละเอียดอื่นๆ ขอให้รับฟังการแถลงข่าวอย่างเป็นทางการอีกครั้งครับ"
และโพสต์ที่ 2 เวลา 20.36 น.
"เมื่อช่วงเย็นวันนี้ ผมได้เห็นภาพของประชาชนจำนวนมากที่พร้อมใจกันเดินทางไปบริจาคเลือดที่โรงพยาบาลหนองบัวลำภู และโรงพยาบาลอื่นๆ ในจังหวัดใกล้เคียง เพื่อช่วยเหลือผู้ได้รับบาดเจ็บจากเหตุการณ์สะเทือนขวัญที่เกิดขึ้นที่อำเภอนากลาง จังหวัดหนองบัวลำภู เป็นภาพที่ทำให้ผมรู้สึกซาบซึ้งใจเป็นอย่างมากในน้ำใจของทุกท่าน และหัวใจที่เต็มไปด้วยความห่วงใยซึ่งกันและกัน ผมขอส่งคำขอบคุณของผมถึงทุกท่านครับ"
15.20 น.โรงพยาบาลหนองบัวลำภู ประกาศรับบริจาคเลือด
15.20 น. โรงพยาบาลหนองบัวลำภู แจ้งต้องการเลือดทุกกรุ๊ป ผู้ที่มีความพร้อม สามารถบริจาคได้ที่ห้องบริจาคเลือด ชั้น 2 อาคารวินิจฉัย บริจาคเลือด กราดยิงหนองบัวลําภู
นายแพทย์โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข กล่าวถึงเหตุการณ์กราดยิงในจังหวัดหนองบัวลำภู ว่า ได้รับรายงานจากผู้ตรวจราชการกระทรวงสาธารณสุขเขต 8 ว่ามีผู้เสียชีวิตจากเหตุการณ์ครั้งนี้ 32 คน และบาดเจ็บ 18 คน อย่างไรก็ตาม คาดว่าจะมีผู้บาดเจ็บอาจมากกว่านี้ เบื้องต้นได้สั่งการให้ เจ้าหน้าที่เข้าไปดูแลสภาพจิตใจของผู้ป่วย และญาติด้วย เนื่องจากเป็นเหตุการสะเทือนขวัญ ทำร้ายทั้งจิตใจและร่างกาย
15.55 น. โรงพยาบาลหนองบัวลำภู ปิดรับบริจาคเลือด เนื่องจากมีเลือดเพียงพอ
15.55 น. โรงพยาบาลหนองบัวลำภู ปิดรับบริจาคเลือด ในขณะนี้ เนื่องจากมีเลือดเพียงพอต่อการให้บริการ
"โรงพยาบาลหนองบัวลำภู ขอปิดรับบริจาคเลือดในขณะนี้ เนื่องจากมีเลือดเพียงพอต่อการให้บริการ โรงพยาบาลหนองบัวลำภูขอขอบคุณในทุกกำลังใจที่ช่วยเหลือในครั้งนี้
เจ้าหน้าที่โรงพยาบาลหนองบัวลำภู ระบุเพิ่มเติมว่า
"เพื่อนๆที่ต้องการบริจาคเลือด สามารถบริจาคเลือดในวันถัดไปได้นะครับ เนื่องจากยังมีผู้บาดเจ็บรักษาตัวอยู่ในโรงพยาบาลหนองบัวลำภู และยังต้องการเลือดในการให้การรักษา สำหรับวันนี้มีเลือดเพียงพอต่อการให้การรักษาในเบื้องต้นแล้วครับ"
โปรดงดแชร์ภาพความรุนแรง
โรงพยาบาลหนองบัวลำภู ประกาศขอความร่วมมือและความเห็นใจ งดแชร์ภาพความรุนแรงในสื่อออนไลน์ต่างๆ เพื่อเห็นแก่ความเศร้าสะเทือนขวัญของผู้สูญเสีย ญาติผู้เสียชีวิต ผู้เกี่ยวข้อง และผู้พบเห็นเหตุการณ์ เพื่อไม่ให้เป็นการซ้ำเติมสถานการณ์หรือก่อให้เกิดความคลาดเคลื่อนไปเกินเหมาะสม
16.27 น. สื่อดังรายงานจำนวนผู้เสียชีวิต LINK
16.27 น. เพจ สรยุทธ สุทัศนะจินดา กรรมกรข่าว เผยแพร่รายงานยอดผู้เสียชีวิต บาดเจ็บ จากการกราดยิง ณ ศูนย์เด็กเล็ก อบต.อทัยสวรรค์ สรุป ผู้เสียชีวิตทั้งหมด 36 ราย บาดเจ็บ 12 ราย รวม 48 ราย ผู้เสียชีวิต เป็นเด็ก 24 ราย ผู้ใหญ่ 12 รวม ผู้เสียชีวิตรวมผู้ก่อเหตุ
17.46 น. ผบ.ตร.บินด่วนลงพื้นที่ ติดตามเหตุ
17.46 น. ผบ.ตร.บินด่วนติดตามเหตุกราดยิงศูนย์เด็กเล็ก จ.หนองบัวลำภู มีผู้เสียชีวิตกว่า 30 คน และบาดเจ็บจำนวนมาก สธ.ส่งทีมจิตเวชดูแลสภาพจิตใจผู้บาดเจ็บและญาติ
ข้อมูลผู้ก่อเหตุ ประกาศจากตำรวจสอบสวนกลาง
ผู้ก่อเหตุ นายปัญญา คำราบ อายุ 34 ปี คนร้ายก่อเหตุกราดยิงศูนย์เด็กเล็ก ต.อุทัยสวรรค์ อ.นากลาง จ.หนองบัวลำภู สังเกตพาหนะที่คนร้ายใช้ รถยนต์กระบะ โตโยต้า วีโก้ สีขาว ทะเบียน 6กธ-6499 กทม.
สำนักข่าว CNN และอื่นๆ รายงานเหตุการณ์ไปทั่วโลก
สำนักข่าว CNN BBC Reuters AP Aljazeera รายงานเหตุการณ์ไปทั่วโลก
20.40 น.รมว.สธ. พร้อมปลัดสธ.ลงพื้นที่ติดตามสถานการณ์ เยี่ยมผู้ได้รับบาดเจ็บ
นายอนุทิน ชาญวีรกูล รองนายกรัฐมนตรีและรัฐมนตรีว่าการกระทรวงสาธารณสุข พร้อมด้วย นพ.โอภาส การย์กวินพงศ์ ปลัดกระทรวงสาธารณสุข พญ.อัมพร เบญจพลพิทักษ์ อธิบดีกรมสุขภาพจิต เร่งลงพื้นที่ติดตามสถานการณ์ กรณีเหตุกราดยิงที่ จ.หนองบัวลำภู โดยได้เยี่ยมดูอาการผู้ที่ได้รับบาดเจ็บ ที่รพ.หนองบัวลำภู อย่างใกล้ชิด และให้กำลังใจญาติของผู้ประสบเหตุ รวมถึงบุคลากรทางการแพทย์พร้อมสั่งการให้ระดมสรรพกำลังแพทย์ผู้เชี่ยวชาญ เข้ามาดูแลผู้บาดเจ็บอย่างเต็มที่ หากเกินความสามารถได้เตรียมพร้อมประสานเฮลิคอปเตอร์จากหน่วยงานที่เกี่ยวข้อง เพื่อส่งต่อรักษายังโรงพยาบาลมหาราชนครราชสีมา และโรงพยาบาลในกรุงเทพมหานคร ต่อไป ส่วนญาติผู้เสียชีวิตรวมถึงผู้ได้รับบาดเจ็บกรมสุขภาพจิตได้จัดทีม MCATT เพื่อดูแลเยียวยาจิตใจ
21.20 น. นายกสั่งลดธงครึ่งเสาไว้อาลัยผู้สูญเสีย 1 วัน
พล.อ.ประยุทธ์ จันทร์โอชา นายกรัฐมนตรี และ รมว.กห. ขอให้ทุกส่วนราชการทั่วประเทศลดธงครึ่งเสา ในวันพรุ่งนี้ (7 ต.ค. 65) เป็นกรณีพิเศษ 1 วัน เพื่อแสดงความอาลัยต่อเหตุการณ์ที่ จ.หนองบัวลำภู
23.11 น. องคมนตรีเดินทางเยี่ยมครอบครัวผู้บาดเจ็บ
พระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณาโปรดเกล้าฯให้ พลเอกสุรยุทธ์ จุลานนท์ ประธานองคมนตรีและองคมนตรี ไปเยี่ยม ครอบครัวผู้บาดเจ็บจากเหตุการณ์กราดยิง ภายในศูนย์เด็กเล็ก อำเภอนากลาง จ.หนองบัวลำภู ซึ่งทำให้มีผู้เสียชีวิตเป็นเด็กและผู้ใหญ่ และมีผู้บาดเจ็บจำนวนมาก ณ โรงพยาบาลหนองบัวลำภู โดยพระบาทสมเด็จพระเจ้าอยู่หัว ทรงพระกรุณารับผู้เสียชีวิต และผู้บาดเจ็บ ไว้ในพระบรมราชานุเคราะห์ทั้งหมด โดยมีคณะผู้บริหารกระทรวงสาธารณสุข รวมถึงนายแพทย์ไพฑูรย์ ใบประเสริฐ ผู้อำนวยการโรงพยาบาลหนองบัวลำภู ให้การต้อนรับ
7 ตุลาคม 2565 พระบาทสมเด็จพระเจ้าอยู่หัว และสมเด็จพระนางเจ้าฯ พระบรมราชินี เสด็จหนองบัวลำภู
สำนักข่าวประชาชาติธุรกิจ รายงานวันนี้ (
7 ตุลาคม 2565) พระบาทสมเด็จพระเจ้าอยู่หัว และสมเด็จพระนางเจ้าฯ พระบรมราชินี เสด็จหนองบัวลำภู เยี่ยมคนเจ็บและพระราชทานกำลังใจครอบครัวผู้เสียชีวิต โดยพลเอก ประยุทธ์ จันทร์โอชา นายกรัฐมนตรีและรมว.กลาโหมพร้อมคณะเฝ้ารับเสด็จในหลวงและพระราชินี ที่จังหวัดหนองบัวลำภู ในเวลาประมาณ 19.30 น.
โรงพยาบาลหนองบัวลำภู สรุปข้อมูลผู้บาดเจ็บและเสียชีวิต
สรุปข้อมูลผู้บาดเจ็บและเสียชีวิตเหตุใช้อาวุธปืนยิงและอาวุธมีดทำร้ายประชาชน
โฆษกรัฐบาลเผยความช่วยเหลือเบื้องต้น
ด้านความช่วยเหลือเบื้องต้น นายอนุชา บูรพชัยศรี โฆษกรัฐบาล ได้เปิดเผยผลการประชุมคณะกรรมการกองทุนเงินช่วยเหลือผู้ประสบสาธารณภัย สำนักนายกรัฐมนตรี ซึ่งมีมติให้ความช่วยเหลือกรณีเหตุกราดยิงที่ จ. หนองบัวลำภู ในเบื้องต้นเพื่อบรรเทาความเสียหายที่เกิดขึ้น เฉพาะผู้เสียหาย ไม่รวมถึงผู้ก่อเหตุและบุคคลในครอบครัวซึ่งจะต้องมีการตรวจสอบข้อเท็จจริงก่อน ดังนี้
1) กรณีเสียชีวิต (ค่าจัดการศพและเงินทุนเลี้ยงชีพ) รายละ 200,000 บาท
2) กรณีบาดเจ็บสาหัส รายละ 100,000 บาท
3) กรณีบาดเจ็บไม่สาหัส รายละ 50,000 บาท
4) กรณีทุพพลภาพ รายละ 200,000 บาท
ทั้งนี้ การช่วยเหลือจำนวนดังกล่าวเป็นการให้ความช่วยเหลือในเบื้องต้นเท่านั้น ซึ่งคณะกรรมการกองทุนฯ จะได้พิจารณาข้อเท็จจริงที่เกิดขึ้นและให้ความช่วยเหลือตามความเหมาะสมเพิ่มเติมต่อไป
HollyWeed On Nut Cannabis - Weed Dispensary
The Beacon Place สุขุมวิท 50
ข้อมูลสถิติเว็บไซต์ HealthServ 2020
ตัวเลขการเข้าชม ตั้งแต่ 1 สิงหาคม - 31 ธันวาคม 2020
- ผู้ชม 663,385 users
- ผู้ชมใหม่ ไม่ซ้ำ 663,081 users
- จำนวนหน้าเพจที่คลิกดู 1,286,574 เพจ
ข้อมูลสถิติเว็บไซต์ HealthServ 2021
ยอดรวมปี 2021 ข้อมูลสถิติตั้งแต่ 1 มกราคม - 31 ธันวาคม 2021
- ผู้ชม 4,161,069 users
- ผู้ชมใหม่ ไม่ซ้ำ 4,139,430 users
- จำนวนหน้าเพจที่คลิกดู 7,955,598 เพจ
- Session 5,422,492 sessions
- *กราฟแสดงเป็นรายสัปดาห์
สถานที่ฉาย 10 จุด
สถานที่ฉาย 10 จุด
1. ลานคนเมือง
2. True Digital Park เขตพระโขนง
3. ศูนย์เยาวชนคลองเตย เขตคลองเตย
4. สวนรถไฟ เขตจตุจักร
5. สวนเบญจกิติ เขตคลองเตย
6. ตลาดบางแคภิรมย์ เขตบางแค
7. Block I สยามสแควร์
8. สวน 60 พรรษา สมเด็จพระนางเจ้าพระบรมราชินีนาถ เขตลาดกระบัง
9. สวนครูองุ่น เขตวัฒนา
10. มศว ประสานมิตร เขตวัฒนา
ข้อมูลสถิติเว็บไซต์ HealthServ 2022
ยอดรวมปี 2022 ข้อมูลสถิติตั้งแต่ 1 มกราคม - 31 ธันวาคม 2022
- ผู้ชม 2,260,218 users
- ผู้ชมใหม่ ไม่ซ้ำ 2,244,516 users
- จำนวนหน้าเพจที่คลิกดู 3,943,783 เพจ
- Session 2,828,651 sessions
*เปลี่ยนระบบเก็บสถิติจาก UA เป็น G4 เมื่อ 1 สิงหาคม 2022 กล่าวคือ ตัวเลขสถิติจาก 1 สิงหาคมจะลดลงเรื่อยๆ
** ข้อมูล Generate เมื่อ 23/2/2023 บน UA (Google Universal Analytics dashboard)
Odyssey420 ถ. เพชรบุรี
สีชมพูฟ้าอ่อนละมุนแบบพาสเทล ดูสดชื่นไร้เดียงสา บ้านใครอยู่ใกล้ๆ มั่งมั๊ย
ข้อมูลสถิติเว็บไซต์ HealthServ 2022 (August-December)
เริ่มต้นเก็บสถิติบนระบบ Truehits ตั้งแต่สิงหาคม 2022 (ไม่เต็มเดือน) และเริ่มแสดงข้อมูลเต็มเดือนตั้งแต่กันยายน 2022 เป็นต้นไป
- ผู้ชม 1,591,875 users
- ผู้ชมใหม่ ไม่ซ้ำ 1,138,701 users
- จำนวนหน้าเพจที่คลิกดู 2,722,569 เพจ
- Session 1,911,099 sessions
ข้อมูลสถิติเว็บไซต์ HealthServ 2023
ข้อมูลสถิติบน Truehits ปี 2023 ตั้งแต่ 1 มกราคม - ธันวาคม 2023
ดูสถิติ
Healthserv บน Truehits (
หมวด Health)
- ผู้ชม 5,727,935users
- ผู้ชมใหม่ ไม่ซ้ำ 3,852,161 users
- จำนวนหน้าเพจที่คลิกดู 9,689,331 เพจ
- Session 6,854,333 sessions
- สัดส่วนผู้ชมใหม่ (new visitor) เทียบผู้ชมกลับมาใหม่ (return visitor) 89.69 %/10.30% (เฉลี่ย 12 เดือน)
ข้อมูลสถิติเว็บไซต์ HealthServ 2024
งานมหกรรมหนังสือระดับชาติที่ผ่านมา
สัปดาห์หนังสือแห่งชาติที่ผ่านมา
งานมหกรรมหนังสือและสื่อการศึกษา ครั้งที่ 7 ปี 2545
งานมหกรรมหนังสือและสื่อการศึกษา ครั้งที่ 7 ประจำปี 2545 กำหนดจัดระหว่างวันศุกร์ที่ 11 - วันอาทิตย์ที่ 20 ตุลาคม 2545 10 วัน ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ โดยใช้พื้นที่ทั้งหมดคือห้องบอลรูม แพลนนารีฮอลล์ 1-3 โซนซี 1-2 มีทติ้งรูม 1-4 เอเทรียม ห้องบอร์ดรูป 2-3 จัดโดยสมาคมผู้จัดพิมพ์และผู้จำหน่ายหนังสือแห่งประเทศไทย การจัดงานครั้งนี้เพื่อส่งเสริมนิสัยรักการอ่านของนักเรียน นักศึกษา และ ประชาชน เพื่อส่งเสริมการผลิต การเผยแพร่หนังสือให้ก้าวหน้าและกว้าง ขวางเป็นประโยชน์ต่อการพัฒนาประเทศและคุณภาพชีวิต ภายในงานจะมีนิทรรศการและกิจกรรมต่างๆซึ่งมีรายละเอียดดังนี้
กิจกรรมบริเวณ Main Fover - วัฒนธรรม การเขียนการอ่านของ ไทย - นิทรรศการหนังสือใบลาน - นิทรรศการร้าน หนังสือเก่า - นิทรรศการยอดนักเขียน ไทยในอดีต - นิทรรศการจาก เหม เวชกร สู่นิยายภาพไทย - นิทรรศการบุ๊คเฟ่ - นิทรรศการวรรณ กรรมไทยสู่เวทีโลก - กิจกรรมเด็ก เป็นกิจกรรม เกี่ยวกับจักรวาลอัจฉริยะ - การแข่งขันคณิตศาสตร์ จะจัดการแข่งขัน 3 วันคือวันเสาร์ที่ 12 ตุลาคม 2545 เป็นการแข่งขัน ระดับมัธยมต้น วันอาทิตย์ที่ 13 ตุลาคม 2545 เป็นการแข่งขันระดับมัธยมปลาย และวันจันทร์ที่ 14 ตุลาคม 2545 เป็นการแข่งขันระดับประถม ในแต่ละวันจะได้ ผู้ชนะเลิศ 1 คน กิจกรรมบริเวณ Artium นิทรรศการภาพประกอบหนังสือเด็กและเยาวชน จะนำภาพที่ชนะการ ประกวดที่เป็นประเภท Fiction และ Non Fiction ตั้งแต่อายุแรกเกิดจนถึง 18 ปีมาแสดงให้ชม กิจกรรมวิชาการจัดที่ห้องบอลรูม ห้องมีทติ้งรูม 1-4 และ ห้องบอร์ดรูม 2-3 การอภิปรายและเสวนาต่างๆ จัดที่บริเวณเอเทรียม นอกจากกิจกรรมที่น่าสนใจในข้างต้นแล้ว ในส่วนอื่นของงาน ยังมีการออกร้านจำหน่าย หนังสือและสื่อการศึกษาจัดที่ แพลนนารีฮอลล์ และ โซนซี 1 และ 2 การออกร้านจำหน่ายหนังสือและสื่อการศึกษา จัดที่ห้องแพลนนารีฮอลล์ 1-3 และโซนซี 1 เป็นร้านหนังสือทั่วไปทั้งหมด โซนซี 2 ประกอบหนังสือเด็ก สื่อการศึกษา หนังสือแบบเรียน หนังสือภาษาต่างประเทศ หนังสือทั่วไป และ หนังสือเก่า รวมทั้งสิ้น 688 บูธ มีสำนักพิมพ์เข้าร่วมแสดงและออกบูธ จำหน่ายหนังสือ กว่า 280 แห่ง [
sanook.com]
สัปดาห์หนังสือแห่งชาติครั้งที่ 35 ปี 2550
สัปดาห์หนังสือแห่งชาติครั้งที่ 35 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 5 วันที่ 30 มีนาคม - 10 เมษายน 2550 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ประเทศไต้หวันเป็น Guest of Honor
งานมหกรรมหนังสือ ระดับชาติ ครั้งที่ 12 ปี 2550 คิดทำตามคำพ่อสอน
งานมหกรรมหนังสือ ระดับชาติ ครั้งที่ 12 (BookExpo Thailand 2007) วันที่ 17 - 28 ตุลาคม 2550 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์
• คอนเซ็ปต์ คิดทำตามคำพ่อสอน
• นิทรรศการ 8 หลักการทรงงานในพระบาทสมเด็จพระเจ้าอยู่หัว เพื่อเป็นการเฉลิมพระเกียรติเนื่องในโอกาสมหามงคลเฉลิม พระชนมพรรษา 80 พรรษา 5 ธันวาคม 2550
• มุ่งสร้างสรรค์สังคมไทยให้เป็น สังคมแห่งการเรียนรู้ เพื่อยกระดับความสามารถในการแข่งขันของประเทศไทยให้ทัดเทียมกับนานาประเทศ โดยมุ่งส่งเสริม และสนับสนุนให้เกิดวัฒนธรรมรักการอ่านในสังคมไทย
• โครงการ Book Barter แลกรู้แลกอ่าน ขึ้น เพื่อเป็นพื้นที่กลางให้เด็กและเยาวชนมีโอกาสได้อ่านหนังสือที่ตนเองชอบได้มากขึ้น โดยการแลกเปลี่ยนหนังสือ และร่วมกิจกรรมที่กระตุ้นให้เด็กและเยาวชนรู้สึก สนุกสนานกับโลกการอ่าน
สัปดาห์หนังสือแห่งชาติครั้งที่ 36 ปี 2551 (2008)
สัปดาห์หนังสือแห่งชาติครั้งที่ 36 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 6 วันที่ 26 มีนาคม – 7 เมษายน 2551 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม "Open a Book : Open the World"
• จำนวนสำนักพิมพ์ที่ร่วมออกงานประมาณ 400 ราย จำนวนบูธ 830 บูธ
• กิจกรรมในงาน นิทรรศการและกิจกรรมที่ส่งเสริมการเรียนรู้ต่าง ๆ – นิทรรศการสมเด็จพระพี่นางเธอ เจ้าฟ้ากัลยาณิวัฒนา กรมหลวงนราธิวาสราชนครินทร์ – National Book Award 2008 – นิทรรศการส่งเสริมการอ่านและการเรียนรู้จาก สสส. – นิทรรศการร้านภูฟ้า – กิจกรรมเด็ก – รับบริจาคหนังสือ – เมื่อยนัก พักเท้า – โครงการทอฝันปันหนังสือให้น้อง ครั้งที่ 12 ใน – การเปิดตัวหนังสือจากสำนักพิมพ์ต่างๆ – ผู้เขียนพบผู้อ่าน – กิจกรรมต่างๆ บนเวทีใหญ่ – งานสัมมนาในวงการหนังสือ
งานมหกรรมหนังสือ ระดับชาติ ครั้งที่ 13 ปี 2551
งานมหกรรมหนังสือ ระดับชาติ ครั้งที่ 13 (BookExpo Thailand 2008) วันที่ 15-25 ตุลาคม 2551 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์
สัปดาห์หนังสือแห่งชาติครั้งที่ 37 ปี 2552
สัปดาห์หนังสือแห่งชาติครั้งที่ 37 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 7 วันที่ 26 มีนาคม - 6 เมษายน 2552 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
(เฉพาะวันที่ 26 มีนาคม 2552 เปิดงาน 18.00น. 27 มีนาคม -6 เมษายน 2552 เปิดงาน 10.00 น. – 21.00 น.)
• ธีม "ก้าวหน้าด้วยการอ่าน หนังสือสร้างเด็ก เด็กสร้างชาติ"
• สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี ทรงเสด็จเป็นประธานพิธีเปิด วันพฤหัสบดีที่ 26 มีนาคม 2552 เวลา 15.00 น.
• สัมผัสกลิ่นอายวัฒนธรรมฝรั่งเศส Guest of Hornor 2009 ซึมซับวัฒนธรรมฝรั่งเศสผ่านหนังสือ ภาพยนตร์ และแฟชั่นที่บู้ทฝรั่งเศส (France Pavilion) ในแพลนนารีฮอล์
• "ห้องสมุดหนังสือใหม่" ที่เดียวที่รวบรวมหนังสือใหม่ๆๆๆ กว่า 3,000 ปก ไว้ในห้องบอลรูม โซน "สนุก Kids สนุกอ่าน"
• กิจกรรม "การทำบุญแห่งปัญญา" ซื้อหนังสือบริจาค 9,999 เล่ม เพื่อเด็กด้อยโอกาสกว่า 1,000,000 คน เพียงบริจาคเงิน 50 บาท ขึ้นไป รับ “คำคมเทพรัตน์” หนังสือแม่เหล็กเล่มจิ๋วเป็นของที่ระลึกทันที
• วันหนังสือเด็กแห่งชาติ 2 เมษายน นี้ สมาคมผู้จัดพิมพ์ฯ แจกคูปอง 100 บาท ฟรี ให้เด็กและเยาวชน อายุไม่เกิน 15 ปี 10,000 คนแรกที่เข้างานได้ เลือกซื้อหนังสือในงานตามอัธยาศัย
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 14 ปี 2552
งานมหกรรมหนังสือ ระดับชาติ ครั้งที่ 14 (BookExpo Thailand 2009) วันที่ 15-25 ตุลาคม 2552 ณ ศูนย์ประชุมแห่งชาติสิริกิติ์
• ธีมงาน Book for Gift
• ไฮไลท์นิทรรศการ "สุดยอดคนดังของประเทศร่วมให้หนังสือเป็นของขวัญ" จัดแสดงผลงานแนวคิดให้หนังสือเป็นของขวัญในโอกาสต่างๆ กันของคนดังที่รักการอ่าน ไม่ว่าจะเป็น นายกรัฐมนตรี อภิสิทธิ์ เวชชาชีวะ, ปองพล อดิเรกสาร, อั้ม-พัชราภา ไชยเชื้อ, กาละแมร์ พัชรศรี, ยิปซี คีรติ, อี้ แทนคุณ, ดีเจเนส-ธนดล, วิกรม กรมดิษฐ์, โชค บุญกุล, ประภัสสร เสวิกุล, ปราบดา หยุ่น, สุมาลี บำรุงสุข, ลอร่า ศศิธร, ภัทราพร สังข์พวงทอง ฯลฯ
• กิจกรรมสร้างสรรค์ขึ้นมากมาย อาทิ "ห้องสมุดหนังสือใหม่ ปี 2552" โดยใช้แนวคิดห้องสมุด 3 ดี คือ หนังสือดี บรรยากาศดี และบรรณารักษ์ดี ที่มีหนังสือใหม่ที่ตีพิมพ์ในปีนี้ จำนวน 4,000 ปก
• มีบริการส่งหนังสือถึงบ้านในราคาเหมาจ่ายจากไปรษณีย์ไทย (พระโขนง) ซึ่งเหมาะมากสำหรับโรงเรียนหรือคุณครูในต่างจังหวัดที่ตั้งใจจะซื้อหนังสือเยอะ ๆ และอยากเดินใน งานมหกรรมหนังสือ ได้อย่างคล่องตัว โดยราคาเหมาจ่าย 1,600 บาท ต่อปริมาณหนังสือ 400-500 เล่ม บรรจุลงในกล่อง 16 กล่อง
สัปดาห์หนังสือแห่งชาติครั้งที่ 38 ปี 2553
สัปดาห์หนังสือแห่งชาติครั้งที่ 38 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 8 วันที่ 26 มีนาคม - 6 เมษายน 2553 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม "การอ่านทำให้เป็นคนโดยสมบูรณ์ Reading maketh a full man"
• ไฮไลท์งานปีนี้ เชิญตัวแทนจากประเทศญี่ปุ่นมาร่วมแนะนำบูธ JAPAN PAVILION ในฐานะที่ให้เกียรติเป็นประเทศรับเชิญกิติมศักดิ์ (Guest of honor)
• เปิดตัวโครงการ Book for All: All for Book ครั้งที่ 2 โดยเชิญศิลปินเซเลบริตี้ของเมืองไทยมาร่วมสัมภาษณ์พิเศษ “แรงบันดาลใจจากภาพวาดผลงานของ 6 เซเล็บแถวหน้า สู่โครงการ Book for All:All for Book ครั้งที่ 2” อาทิ ท่าน ว. วชิรเมธี มล. จิราธร จิระประวัติ คุณทรงศีล ทิวสมบุญ คุณภัทรีดา ประสานทอง และ คุณป๊อด ธนชัย อุชชิน ในวันอังคารที่ 9 มีนาคม 2553 เวลา 13.30-15.30 น. ณ ห้อง Meeting Room 2 ศูนย์การประชุมแห่งชาติสิริกิติ์
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 15 ปี 2553
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 15 (BOOK EXPO THAILAND 2010) ระหว่างวันที่ 21-31 ตุลาคม 2553 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
สัปดาห์หนังสือแห่งชาติครั้งที่ 39 ปี 2554
สัปดาห์หนังสือแห่งชาติครั้งที่ 39 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 9 วันที่ 25 มีนาคม - 6 เมษายน 2554 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “เปิดหนังสือคือเปิดโลกกว้างไม่รู้จบ Open a book : Open the world”
• ในงานมีการออกบูธของสำนักพิมพ์กว่า 430 สำนักพิมพ์ และร้านหนังสือต่างๆ รวมทั้งสิ้น 850 บูธ .
• ในปี 2011 โลกกำลังเผชิญกับปัญหาทางธรรมชาติ เหตุการณ์ภัยพิบัติสึนามิ แผ่นดินไหว และสภาพอากาศที่แปรปรวน ผู้คนเริ่มเห็นความสำคัญเกี่ยวกับการเปลี่ยนแปลงของธรรมชาติมากขึ้น ทำให้งานนี้หนังสือหมวดวิทยาศาสตร์ได้รับความนิยมเป็นพิเศษ [
Thai Book Fair]
• นิทรรศการ หลายชุด ได้แก่ นิทรรศการตามรอยพระบาททั่วไทย เนื่องในโอกาสพระราชพิธีมหามงคลเฉลิมพระชมพรรษา 7 รอบ 5 ธันวาคม 2554 , นิทรรศการห้องสมุดหนังสือ, นิทรรศการร้านภูฟ้า , กิจกรรมจากมูลนิธิหนังสือเพื่อเด็ก
• National Book Award 2011
งานมหกรรมหนังสือระดับชาติครั้งที่ 16 ปี 2554
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 16 (BOOK EXPO THAILAND 2011) ระหว่างวันที่ 5-16 ตุลาคม 2554 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
สัปดาห์หนังสือแห่งชาติครั้งที่ 40 ปี 2555
สัปดาห์หนังสือแห่งชาติครั้งที่ 40 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 10 วันที่ 29 มีนาคม - 8 เมษายน 2555 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “Read for Life : การอ่านคือการพัฒนาชีวิต”
งานมหกรรมหนังสือระดับชาติครั้งที่ 17 ปี 2555
งานมหกรรมหนังสือระดับชาติครั้งที่ 17 (Book Expo Thailand 2012) วันที่ 18-28 ตุลาคม 2555 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม "อ่านทั่วไทย อ่านได้ อ่านดี" เพื่อชี้ให้เห็นถึงความสนุกของการอ่าน ยิ่งอ่าน ยิ่งเป็นผลดีทั้งต่อตัวเองและสังคม โดยจำลองบรรยากาศ "อ่านทั่วไทย อ่านได้ อ่านดี" ทั่วทั้งบริเวณงาน
• มีสำนักพิมพ์ชั้นนำทั่วประเทศร่วมออกงานกว่า 500 สำนักพิมพ์ รวมกว่า 1,000 บูท อัดแน่นเต็มพื้นที่กว่า 22,000 ตารางเมตร ซึ่งเพิ่มขึ้นจากงานมหกรรมหนังสือระดับชาติครั้งที่ผ่านมาถึงกว่า 100 บูท
สัปดาห์หนังสือแห่งชาติครั้งที่ 41 ปี 2556
สัปดาห์หนังสือแห่งชาติครั้งที่ 41 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 11 วันที่ 29 มีนาคม - 8 เมษายน 2556 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “Read for Life : การอ่านคือการพัฒนาชีวิต”
งานมหกรรมหนังสือระดับชาติครั้งที่ 18 ปี 2556
มหกรรมหนังสือระดับชาติครั้งที่ 18 (Book Expo Thailand 2013) วันที่ 16-27 ตุลาคม 2556 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม "หนังสือเปลี่ยนชีวิต เปลี่ยนโลก" สัญลักษณ์ นกพิราบขาว ตัวแทนแห่งเสรี และสันติภาพ นิทรรศการ 40 ปี 14 ตุลา
สัปดาห์หนังสือแห่งชาติครั้งที่ 42 ปี 2557
สัปดาห์หนังสือแห่งชาติครั้งที่ 42 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 12 วันที่ 28 มีนาคม - 7 เมษายน 2557 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “The World Is A Novel : โลกคือนิยาย” หลายสิ่งของการเปลี่ยนเปลงในโลกใบนี้เกิดขึ้นเพราะนิยาย เนื้อเรื่องของนิยายสามารถสะท้อนให้เห็นถึงการเปลี่ยนแปลงของโลกได้ด้วย
• โปสเตอร์งาน ออกแบบโดย Wrongdesign House และ ปราบดา หยุ่น
• นิทรรศการ "โลกคือนิยาย" และนิทรรศการ "ข้าพเจ้าได้เห็นมา โลกนิยายของศรีบูรพา" นักเขียนไทยที่ได้รับการยกย่องจากองค์การยูเนสโกให้เป็นบุคคลดีเด่นของโลก เชิดชูเกียรติและแสดงความเป็นอัจฉริยะทางด้านงาน เขียนให้คนรุ่นใหม่ได้รับรู้ นำข้อเขียนหรือผลงานของศรีบูรพา มาแสดงนิทรรศการเพื่อสร้างแรงบันดาลใจ
•
กิจกรรมโครงการ 1 อ่าน ล้านตื่น ริเริ่มขึ้นครั้งแรก โดยแผนงานสร้างเสริมวัฒนธรรมการ อ่าน สสส. SCG Paper และสมาคมผู้จัดพิมพ์ฯ การร่วมมอบหนังสือคุณภาพ สนับสนุนห้องสมุดเด็กและครอบครัวในชุมชน โดยรูปแบบกิจกรรมจะเป็นการจัดทำชุดหนังสือจากรายชื่อหนังสือของสำนักพิมพ์ ที่เข้าร่วมโครงการ เพื่อให้ผู้บริจาคเลือกซื้อได้สะดวกตรงกลุ่มเป้าหมายที่คัดสรร และเพื่อส่งมอบหนังสือใหม่จากหลากหลายสำนักพิมพ์ได้ตามความเหมาะสมทั้งเด็ก และผู้ใหญ่ ความสำคัญคือ ต้องการส่งเสริมการอ่านด้วยหนังสือคุณภาพ
งานมหกรรมหนังสือระดับชาติครั้งที่ 19 ปี 2557
งานมหกรรมหนังสือระดับชาติครั้งที่ 19 (Book Expo Thailand 2014) วันที่ 15-26 ตุลาคม 2557 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 43 ปี 2558
งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 43 และงานสัปดาห์หนังสือนานาชาติ ครั้งที่ 13 หรือ Bangkok International Book Fair 2015 วันที่ 27 มีนาคม - 6 เมษายน 2558 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีมงาน
“เพราะเป็นเด็กจึงเจ็บปวด” มุ่งเน้นไปที่ความสำคัญของเยาวชนโดยเฉพาะเด็กไทย โดยไฮไลท์ของงานนี้คือการเปิดให้ร่วมสนุกด้วยการส่งภาพภายใต้หัวข้อ “เพราะเป็นเด็กจึงเจ็บปวด” โดยครั้งนั้นมีผู้ร่วมส่งภาพกว่า 200 ภาพ กลายเป็นกระแสและมีการแชร์ และติด #เพราะเป็นเด็กจึงเจ็บปวด ทางโซเชียลมากมาย [
plotter]
งานมหกรรมหนังสือระดับชาติครั้งที่ 20 ปี 2558
งานมหกรรมหนังสือระดับชาติครั้งที่ 20 (Book Expo Thailand 2015) วันที่ 21 ตุลาคม-1 พฤศจิกายน 2558 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
สัปดาห์หนังสือแห่งชาติครั้งที่ 44 ปี 2559
สัปดาห์หนังสือแห่งชาติครั้งที่ 44 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 14 วันที่ 29 มีนาคม - 10 เมษายน 2559 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์ สิ่งน่าสนใจในงาน
• ธีม “ความหวัง”(HOPE) ความหวังที่อยากให้คนไทยรักการอ่านมากขึ้น”
• สมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เสด็จฯ เปิดงานสัปดาห์หนังสือแห่งชาติและพระราชทานรางวัลหนังสือดีเด่นประจำปี พร้อมหนังสือจากพระราชนิพนธ์แปลในสมเด็จพระเทพรัตนราชสุดาฯ สยามบรมราชกุมารี เรื่อง ความรักใดไม่ปวดร้าว
• นิทรรศการ 100 ปี ชาตกาล ศ.ดร.ป๋วย อึ๊งภากรณ์ จากครรภ์มารดาถึงเชิงตะกอน
• กิจกรรม CSR จากความร่วมมือจากภาคีเครือข่าย 6 แห่ง ได้แก่ สมาคมห้องสมุดแห่งประเทศไทยในการบริจาคหนังสือผ่านโครงการ ๑ อ่าน ล้านตื่น
• ทีมศิลปิน อาทิ อี๊ด โอภากุล,อ.ธนิสร์ ศรีกลิ่นดี,จีรนันท์ พิตรปรีชา จัดโชว์มินิคอนเสิร์ตเปิดกล่องกีตาร์รับบริจาคเงินให้โครงการ 1 อ่านล้านตื่นในวันที่ 2 เมษายน 2559
งานมหกรรมหนังสือระดับชาติครั้งที่ 21 ปี 2559
งานมหกรรมหนังสือระดับชาติครั้งที่ 21 (Book Expo Thailand 2016) วันที่ 13-24 ตุลาคม 2559 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
สัปดาห์หนังสือแห่งชาติครั้งที่ 45 ปี 2560
สัปดาห์หนังสือแห่งชาติครั้งที่ 45 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 15 วันที่ 29 มีนาคม - 9 เมษายน 2560 เวลา 10.00 - 21.00 น. ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “อ่าน อ่าน และอ่าน”
งานมหกรรมหนังสือระดับชาติครั้งที่ 22 ปี 2560 ธีม ความทรงจำ
งานมหกรรมหนังสือระดับชาติครั้งที่ 22 (Book Expo Thailand 2017) และ เทศกาลหนังสือเด็กและเยาวชนครั้งที่ 12 วันที่ 18 - 29 ตุลาคม 2560 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “ความทรงจำ”
• นิทรรศการ "ควาามท๙งจำ"
• ฟังเสวนา "๙ วัน ๙ ความทรงจำ ธ สถิตอยู่ในใจไทยนิรันดร์"
• ที่คั่นหนังสือ "ความท๙งจำ" (จำนวนจำกัด) รายได้หลังหักค่าใช้จ่าย มอบให้ ศิริราชมูลนิธิ
• สัมผัสนวัตกรรมสื่อการศึกษารูปแบบใหม่
สัปดาห์หนังสือแห่งชาติครั้งที่ 46 ปี 2561
สัปดาห์หนังสือแห่งชาติครั้งที่ 46 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 16 วันที่ 29 มีนาคม - 9 เมษายน 2561 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “อ่าน...อีกครั้ง”
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 23 ปี 2561 ธีม อ่านออกเสียง
งานมหกรรมหนังสือระดับชาติครั้งที่ 23 (Book Expo Thailand 2018) และ เทศกาลหนังสือเด็กและเยาวชนครั้งที่ 12 วันที่ 17 - 28 ตุลาคม 2561 เวลา 10.00- 21.00 น. สถานที่ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม "อ่านออกเสียง" "คิดต่างแต่ก็เป็นเพื่อนกันได้" มาอ่านออกเสียงกัน!
ร่วมสร้างสังคมอุดมความรู้ เติมพลังสมองไปพร้อมกันกับงานมหกรรมหนังสือระดับชาติ ครั้งที่ 23 ตื่นตาตื่นใจไปกับหนังสือทรงคุณค่าในราคาสุดพิเศษจากสำนักพิมพ์ต่างๆ ร่วมสัมผัสนวัตกรรมสื่อการศึกษารูปแบบใหม่ๆ พร้อมทั้งกิจกรรมสาระและบันเทิงอีกคับคั่ง
วันป้องกันโรคพิษสุนัขบ้า ประจำปี 2562 กรมควบคุมโรค กระทรวงสาธารณสุข เป็นเจ้าภาพ
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี 2562 (World Rabies Day 2019) โดยกลุ่มโรคติดต่อระหว่างสัตว์และคน กองโรคติดต่อทั่วไป กรมควบคุมโรค กระทรวงสาธารณสุข เป็นเจ้าภาพ ณ แจ้งวัฒนะ ฮอลล์ ชั้น 5 ศูนย์การค้าเซ็นทรัลพลาซ่า แจ้งวัฒนะ จังหวัดนนทบุรี ภายใต้คำขวัญ “Rabies: Vaccinate to Eliminate โรคพิษสุนัขบ้า ติดเชื้อถึงตาย ป้องกันได้ด้วยวัคซีน” ได้รับพระมหากรุณาธิคุณจากสมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี เสด็จพระราชดำเนินไปทรงเป็นประธานในพิธีเปิดงาน
การจัดงานครั้งนี้ มีการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าฟรี กิจกรรมประกวดระบายสี กิจกรรมประกวด แฟนซี 4 ขา เสวนาเลี้ยงใส่ใจและรับผิดชอบ กิจกรรมรักน้องหมา ต้องพาเดินได้ (Dog Walk Rally) ปรึกษาปัญหาสุขภาพจิตสุนัข การแสดงคอนเสิร์ตจากนักร้อง นักแสดง และจับรางวัลในงาน เป็นต้น ภายใต้คอนเซ็ปต์ โรคพิษสุนัขบ้า ติดเชื้อถึงตาย ป้องกันได้ด้วยวัคซีน โดยงานจะเริ่มตั้งแต่เวลา 10.00 น. เป็นต้นไป
คณะสัตวแพทยศาสตร์ จุฬาฯ ได้เข้าร่วมจัดซุ้มนิทรรศการในงาน เพื่อให้ความรู้ และรับปรึกษาปัญหาเกี่ยวกับสุขภาพจิตในสุนัขและแมวฟรี โดยมี อ.สพ.ญ. ดร. จุฑามาศ เบญจนิรัตน์ หัวหน้าหน่วยพฤติกรรมสัตว์ โรงพยาบาลสัตว์เล็ก คณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย เป็นวิทยากรให้ความรู้ที่ซุ้มนิทรรศการ และกิจกรรมบนเวทีกลางอีกด้วย ฝ่ายประชาสัมพันธ์ คณะสัตวแพทยศาสตร์ จึงอยากขอเชิญชวนผู้บริหาร อาจารย์ นิสิตเก่า นิสิตปัจจุบัน และเจ้าของสัตว์ทุกท่านเข้าร่วมงานกิจกรรมดังกล่าว
กรมปศุสัตว์ เข้าร่วมให้บริการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าในสุนัขและแมวฟรี ให้คำปรึกษาเกี่ยวกับการเลี้ยงสุนัขและแมวอย่างถูกต้องรวมถึงให้คำปรึกษาปัญหาสุขภาพสัตว์เลี้ยง มีการจัดแสดงนิทรรศการให้ความรู้เกี่ยวกับโรคพิษสุนัขบ้าในสัตว์เลี้ยง กฎหมายที่เกี่ยวข้องกับโรคพิษสุนัขบ้า และเกมส์ตอบคำถามแจกของรางวัล แจกเอกสารแผ่นพับให้ความรู้เกี่ยวกับเรื่องโรคพิษสุนัขบ้าแจกให้แก่ผู้ร่วมงาน
นอกจากนี้ กรมปศุสัตว์ยังมีการจัดกิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ประจำปี 2562 ในส่วนภูมิภาค โดยให้สำนักงานปศุสัตว์จังหวัดทุกจังหวัดร่วมกับหน่วยงานในพื้นที่ที่เกี่ยวข้อง จัดกิจกรรมให้บริการประชาชนและประชาสัมพันธ์สร้างความรู้ความเข้าใจเกี่ยวกับโรคพิษสุนัขบ้า เพื่อให้ประชาชนได้ตระหนักถึงความรุนแรงและอันตรายที่เกิดจากโรคพิษสุนัขบ้า รวมถึงการควบคุมและป้องกันโรคพิษสุนัขบ้า สร้างจิตสำนึกในการเลี้ยงสุนัข-แมวอย่างรับผิดชอบ และพาสัตว์เลี้ยงไปฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าเป็นประจำทุกปีอีกด้วย เพื่อให้โรคพิษสุนัขบ้าหมดไปจากประเทศไทยโดยเร็ว
สัปดาห์หนังสือแห่งชาติครั้งที่ 47 ปี 2562
สัปดาห์หนังสือแห่งชาติครั้งที่ 47 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 17 วันที่ 28 มีนาคม - 7 เมษายน 2562 ณ ศูนย์การประชุมแห่งชาติสิริกิติ์
• ธีม “รักคนอ่าน” สื่อถึงการแสดงออกซึ่งความรัก โดยจะสื่อถึงทั้งความรักระหว่างคนทำหนังสือและคนอ่านหนังสือ ความรักระหว่างคนอ่านหนังสือด้วยกัน และความรักที่คนอ่านหนังสือมีต่อคนทำหนังสือ เป็นความรักในรูปแบบที่สามารถจับต้อง สัมผัส และรับรู้ได้จริง
• สำนักพิมพ์กว่า 400 สำนักพิมพ์ จำนวนบูธรวมทั้งสิ้นกว่า 924 บูธ พร้อมด้วยกิจกรรมพิเศษ 8 wonders เวทีเสวนาและเวทีกิจกรรม
• ปีสุดท้ายก่อน ที่ศูนย์การประชุมแห่งชาติสิริกิติ์ จะปิดปรับปรุง (3 ปี)
มหกรรมหนังสือระดับชาติ ครั้งที่ 24 ปี 2562 @อิมแพ็ค เมืองทองธานี
มหกรรมหนังสือระดับชาติ ครั้งที่ 24 ที่จะมีขึ้นในวันที่ 2-13 ตุลาคม 2562 นี้ จะจัดขึ้น ณ อาคารชาเลนเจอร์ 2 อิมแพ็ค เมืองทองธานี
• ธีม "หนังสือดี มีชีวิต" สำนักพิมพ์ต่างๆ จะนำหนังสือมาลดราคา พร้อมทั้งมีกิจกรรมสาระและบันเทิงต่างๆ
วันป้องกันโรคพิษสุนัขบ้าโลก ปี 2563 กรมปศุสัตว์ เป็นเจ้าภาพ
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี 2563 (World Rabies Day 2020) กรมปศุสัตว์ เป็นเจ้าภาพ ณ โรงแรมพูลแมน คิงเพาเวอร์ กรุงเทพ (รางน้ำ) โดยมี ดร.เฉลิมชัย ศรีอ่อน รัฐมนตรีว่าการกระทรวงเกษตรและสหกรณ์ เป็นประธานพิธีเปิดงาน พร้อมด้วยนายสัตวแพทย์สรวิศ ธานีโต อธิบดีกรมปศุสัตว์ นายประยูร รัตนเสนีย์ อธิบดีกรมส่งเสริมการปกครองท้องถิ่น นายแพทย์ธนรักษ์ ผลิพัฒน์ รองอธิบดีกรมควบคุมโรค ผศ.น.สพ.ดร.คงศักดิ์ เที่ยงธรรม คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ รศ.สพ.ญ.ดร.วลาสินี ศักดิ์คำดวง คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล นายสัตวแพทย์สมชวน รัตนมังคลานนท์ นายสุรเดช สมิเปรม นายสัตวแพทย์เศรษฐเกียรติ กระจ่างวงษ์ และนายสัตวแพทย์ชัยวัฒน์ โยธคล รองอธิบดีกรมปศุสัตว์
ภายใต้ธีมงาน "End Rabies: Collaborate, Vaccinate สังคมร่วมใจ ประเทศไทยปลอดพิษสุนัขบ้า ร่วมกันพาสัตว์เลี้ยงไปฉีดวัคซีน"
โดยมีการถ่ายทอดกิจกรรมผ่านระบบออนไลน์ ซึ่งในวันงานมีการถ่ายทอดสดผ่านระบบ Facebook Live Streaming ผ่านเพจ วันป้องกันโรคพิษสุนัขบ้าโลก - World Rabies Day Thailand
facebook.com/WRDThai พร้อมกับกิจกรรม Online ให้ผู้ชมร่วมสนุกกันมากมาย ได้แก่ กิจกรรม 1. โพสต์ภาพคู่กับสัตว์เลี้ยงแสนรัก #เติมความรักกับสัตว์เลี้ยงแสนรัก 2.ฉีดวัคซีนครบชุด หยุดพิษสุนัขบ้า #รักน้องพาน้องไปฉีดวัคซีน 3. สร้างคลิปความยาว 15 วินาที (Tik tok หรือ คลิปสั้น) #ป้องกันพิษสุนัขบ้า15วินาที 4. ตอบคำถามจาก Online Exhibition นอกจากนั้นยังมีภาคสาระความรู้ควบคู่ไปด้วย การเสวนาออนไลน์ เรื่อง Rabies, Immunity and Practices การเสนอผลงานวิจัยนวัตกรรมรอบด้านของโรคพิษสุนัขบ้า การนำเสนอความสำคัญของโรคพิษสุนัขบ้าโดยตัวแทนจาก WHO OIE FAO กิจกรรมไลฟ์สด ในหัวข้อ "20 Facts about Rabies" เลี้ยง รัก รับผิดชอบ กับ Influencer ชื่อดัง ได้แก่ หมอเก่ง นพกฤษณ์ มิว ศุกศิษฏ์ มารี เบิร์นเนอร์ อาร์ม กรกันต์
นอกจากกิจกรรมในวันงาน 28 กันยายน 2563 แล้ว กรมปศุสัตว์ได้จัดกิจกรรมใหญ่ทั่วประเทศ คือ
1) โครงการปศุสัตว์ร่วมใจกำจัดภัยโรคพิษสุนัขบ้า เพื่อเฉลิมพระเกียรติ ศาสตราจารย์ ดร.สมเด็จเจ้าฟ้าฯ กรมพระศรีสวางควัฒน วรขัตติยราชนารี เพื่อช่วยลดจำนวนประชากรสุนัขและแมวที่มีเจ้าของและไม่มีเจ้าของในประเทศไทย ซึ่งจำนวนประชากรสุนัขไม่มีเจ้าของถือว่าเป็นปัจจัยหลักอย่างหนึ่งของการเกิดโรคพิษสุนัขบ้า
2) โครงการสัตวแพทย์ไทยมุ่งมั่นรวมใจป้องกันภัยจาก โรคพิษสุนัขบ้าเนื่องในวัน world rabies day 2020 เป็นโครงการที่ร่วมมือกับสถานพยาบาลสัตว์เอกชนในประเทศไทย เพื่อฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า โดยไม่คิดค่าใช้จ่าย เป้าหมาย 100,000 ตัวทั่วประเทศ ระหว่างวันที่ 21-30 กันยายน 2563 ซึ่งกิจกรรมนี้ มีสถานพยาบาลสัตว์เข้าร่วมมากถึง
328 แห่ง งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 48 ปี 2563 (โควิด - ออนไลน์)
งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 48 ระหว่างวันที่ 25 มีนาคม ถึง 5 เมษายน 2563 ปรับตัวรับโควิด-19 จัดงานแบบออนไลน์ครั้งแรก ภายใต้แนวคิด "หนังสือดิ้นได้ไปออนไลน์" เนรมิตเมืองหนังสือให้ช้อปได้ตลอด 24 ชั่วโมง โดยมีสำนักพิมพ์สมาชิกไม่ต่ำกว่า 200 แห่งเข้าร่วมทางเว็บไซต์ www.ThaiBookFair.com
วันป้องกันโรคพิษสุนัขบ้าโลก ปี 2564 คณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล เป็นเจ้าภาพ
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี 2564 (World Rabies Day 2021) คณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล เป็นเจ้าภาพ ร่วมกับหน่วยงานภาคีเครือข่ายอีก 16 แห่ง โดยมี ศ.นพ.บรรจง มไหสวริยะ อธิการบดีมหาวิทยาลัยมหิดล เป็นประธานในพิธีเปิดงาน รศ.ดร.สพ.ญ.วลาสินี ศักดิ์คำดวง คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล กล่าวรายงาน โดยมีผู้แทนจากหน่วยงานภาคีเครือข่ายทั้ง 16 แห่งตลอดจนผู้แทนจาก FAO, OIE, WHO และ OIE เข้าร่วมพิธีผ่านทางแอพลิเคชั่น Zoom
การจัดงานในปีนั้น ภายใต้แนวคิด “Rabies: Facts, not Fear กลัวโควิด อย่าลืมพิษสุนัขบ้า ไม่ตระหนก แต่ต้องตระหนัก” โดยมีวัตถุประสงค์เพื่อปลูกจิตสำนึก และให้ความรู้แก่ประชาชนเกี่ยวกับโรคพิษสุนัขบ้าอย่างครบถ้วนและทันสมัย ให้เกิดความตระหนักถึงอันตราย และให้เห็นถึงความสำคัญของการควบคุมและเฝ้าระวังโรคเรบีส์ มีกิจกรรม การบรรยายในหัวข้อหัวข้อ “Rabies vs COVID-19: Similarity & Differentiation” โดย ผศ.ดร.นพ.ปกรัฐ หังสสูต จากคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ผศ.ดร.แสงเดือน มูลสม จากคณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล สพ.ญ.เสาวพักตร์ ฮิ้นจ้อย ผู้อำนวยการสำนักงานความร่วมมือระหว่างประเทศ กรมควบคุมโรค และ น.สพ.ดร.คเชนทร์ วงศ์สถาพรชัย จาก FAO โดยมี ผศ.น.สพ.รุ่งโรจน์ โอสถานนท์ จากคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล เป็นผู้ดำเนินรายการ การเสวนางานวิจัยในหัวข้อ “โรคเรบีส์ในปัจจุบันของประเทศไทย” โดย น.สพ.ดร.วีรพงษ์ ธนพงศ์ธรรม จากกรมปศุสัตว์ อ.สพ.ญ.ดร.กานต์สุดา ลีฬหาพงศธร จากคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ และ รศ.ดร.น.สพ.อนุวัตน์ วิรัชสุดากุล จากคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล และการบรรยาย “สรุปเวชปฏิบัติเรื่องโรคพิษสุนัขบ้าของประเทศไทยในปัจจุบัน” โดย รศ.ดร.สพ.ญ.วลาสินี ศักดิ์คำดวง คณบดีคณะสัตวแพทยศาสตร์ มหาวิทยาลัยมหิดล ศ.สพ.ญ.ดร.สันนิภา สุรทัตต์ จากคณะสัตวแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และ ผศ.สพ.ญ.ดร.มนชนก วิจารสรณ์ จากคณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์
ในช่วงท้ายของงาน ได้มีพิธีส่งมอบธงเจ้าภาพในการจัดงานฯ ให้แก่สำนักอนามัย กรุงเทพมหานคร ซึ่งจะทำหน้าที่เป็นเจ้าภาพในปี พ.ศ.2565 โดยมี น.สพ.ศิวะ ไม้สนธิ์ ผู้อำนวยการสำนักงานสัตวแพทย์สาธารณสุข สำนักอนามัย กรุงเทพมหานคร ผู้แทนจากสำนักอนามัย กรุงเทพมหานคร เป็นผู้รับมอบธง
นอกจากนี้ ยังมีการจัดกิจกรรมให้บริการทำหมันและฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าให้แก่สัตว์เลี้ยงของประชาชนทั่วไป โดยไม่คิดค่าใช้จ่าย จากสถานพยาบาลสัตว์ที่เข้าร่วมโครงการ ในระหว่างวันที่ 1 กันยายน – 30 พฤศจิกายน 2564
สัปดาห์หนังสือแห่งชาติ ครั้งที่ 49 วันที่ ปี 2564
สัปดาห์หนังสือแห่งชาติ ครั้งที่ 49 วันที่ 15 - 23 พฤษภาคม 2564 เวลา 10.00 - 21.00 น. ณ BITEC บางนา
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 25 ปี 2564 Hybrid Book Fair 2564 อ่านออก เถียงได้
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 25 วันที่ 30 กันยายน - 11 ตุลาคม 2563
เวลา 10.00 - 21.00 น. ณ ชาเลนเจอร์ 2 อิมแพ็ค เมืองทองธานี
• ครั้งแรกของไทยในรูปแบบ Hybrid Event ผสาน On Ground และ Online
• คอนเซปต์ "Noกองดอง" ทลายกองเก่าและเพิ่มกองใหม่ พร้อมเปิดตัวแอปพลิเคชัน Noกองดอง แอปฯ ที่ช่วยให้การอ่านหนังสือเป็นเรื่องสนุกเพราะเก็บสถิติการอ่านและแชร์ได้
วันป้องกันโรคพิษสุนัขบ้าโลก ปี 2565 สำนักการแพทย์ กรุงเทพมหานคร เป็นเจ้าภาพ
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี 2565 (World Rabies Day 2022) สำนักการแพทย์ กรุงเทพมหานคร เป็นเจ้าภาพ ณ โรงแรมมิราเคิลแกรนด์คอนเวนชั่น เขตหลักสี่ ได้รับพระมหากรุณาธิคุณจากศาสตราจารย์ ดร.สมเด็จพระเจ้าน้องนางเธอเจ้าฟ้าจุฬาภรณวลัยลักษณ์อัครราชกุมารีกรมพระศรีสวางควัฒนวรขัตติยราชนารี เสด็จเป็นองค์ประธานเปิดงาน ในปีนั้น องค์การอนามัยโลกกำหนดธีมในงานคือ “Rabies One Health Zero Death” และมีธีมที่เป็นภาษาไทยว่า “ทุกภาคส่วนร่วมใจประเทศไทยปลอดโรคพิษสุนัขบ้า” โดยกิจกรรมภายในงานประกอบด้วยการเสวนาเรื่องการบูรณาความร่วมมือการสร้างพื้นที่ปลอดโรคพิษสุนัขบ้าและแนวทางการจัดการปัญหาโรคพิษสุนัขบ้าและสัตว์จรจัดในกรุงเทพมหานคร พร้อมทั้งมีการจัดแสดงนิทรรศการยุทธศาสตร์ตามพระปณิธานในโครงการสัตว์ปลอดโรคคนปลอดภัยจากโรคพิษสุนัขบ้า รวมทั้งบูธการแสดงผลงานเกี่ยวกับการป้องกันควบคุมโรคพิษสุนัขบ้าของหน่วยงานและภาคีเครือข่ายผู้เข้าร่วมจัดงาน 11 หน่วยงาน
งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 50 ปี 2565
งานสัปดาห์หนังสือแห่งชาติ ครั้งที่ 50 และสัปดาห์หนังสือนานาชาติครั้งที่ 20 จัดวันเสาร์ที่ 26 มีนาคม – วันพุธที่ 6 เมษายน 2565 10.00 - 21.00 น. ณ สถานีกลางบางซื่อ กรุงเทพ
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 26 ปี 2565 Hybrid Book Fair 2564 อ่านออก เถียงได้
งานมหกรรมหนังสือระดับชาติ ครั้งที่ 26 Hybrid Bookfair 2564 วันที่ 23-31 ตุลาคม 2565 งานมหกรรมหนังสือระดับชาติ ครั้งที่ 26 Hybrid Book Fair 2564 จะเป็นครั้งแรกของงานหนังสือที่จัดบนโลกออนไลน์พร้อมกับร้านหนังสือ จากเหตุการระบาดของโรคโควิด 19
วันป้องกันโรคพิษสุนัขบ้าโลก ปี 2566 คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ เป็นเจ้าภาพ
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก ปี 2566 (World Rabies Day 2023) คณะสัตวแพทยศาสตร์ มหาวิทยาลัยเกษตรศาสตร์ เป็นเจ้าภาพ ณ อาคารจักรพันธ์เพ็ญศิริ มหาวิทยาลัยเกษตรศาสตร์ ได้รับพระมหากรุณาธิคุณจากสมเด็จพระเจ้าน้องนางเธอ เจ้าฟ้าจุฬาภรณวลัยลักษณ์ อัครราชกุมารี กรมพระศรีสวางควัฒน วรขัตติยราชนารี เสด็จเป็นองค์ประะธานเปิดงาน ในปีนั้น องค์การอนามัยโลกกำหนดธีมในงานคือ Rabies: All for 1 one health for all โรคพิษสุนัขบ้า : รวมใจเป็นหนึ่ง สุขภาพหนึ่งเดียว เพื่อทุกชีวิต โดยกิจกรรมภายในงานประกอบด้วย การจัดนิทรรศการเฉลิมพระเกียรติ นิทรรศการทางวิชาการ การเสวนาทางวิชาการ การออกบูธแสดงผลิตภัณฑ์เกี่ยวกับสัตว์เลี้ยง การรับพระราชทานโล่รางวัล และการรับรางวัล Thailand Rabies Award ขององค์กรปกครองส่วนท้องถิ่น [
กำหนดการ] [
กรมควบคุมโรค]
สัปดาห์หนังสือแห่งชาติครั้งที่ 51 ปี 2566
สัปดาห์หนังสือแห่งชาติครั้งที่ 37 และสัปดาห์หนังสือนานาชาติ ครั้งที่ 7 วันที่ 26 มีนาคม - 6 เมษายน 2552 เวลา 10.00 - 21.00 น. ณ ฮอลล์ 5-7 ชั้น LG ศูนย์การประชุมแห่งชาติสิริกิติ์
• 30 มี.ค. 66 17.00 - 24.00 น.
• 31 มี.ค.-1 เม.ย. 66 10.00 - 24.00 น.
• 2-9 เม.ย. 66 10.00 - 21.00 น.
• ธีมงาน "Bookfluencer"
• คาแรคเตอร์ในโปสเตอร์เป็นผลงานของคุณอเล็ก เฟส (Alex Face) หรือ พัชรพล แตงรื่น ศิลปินผู้หลอมรวมโลกของสตรีทอาร์ต กับงานจิตรกรรมอิมเพรสชั่นนิสม์และนักสร้างงานกราฟฟิตี้ที่มีชื่อเสียงระดับโลก
วันป้องกันโรคพิษสุนัขบ้าโลก 2567 โดยสถานเสาวภา สภากาชาดไทย
กิจกรรมวันป้องกันโรคพิษสุนัขบ้าโลก 2567 (World Rabies Day 2024) สถานเสาวภา สภากาชาดไทย เป็นเจ้าภาพ ณ อุทยาน 100 ปี จุฬาลงกรณ์มหาวิทยาลัย
PIGCOLOSHOP
กราฟฟิตี้สวยงาม
Mary Jane Bangkok นานา
ร้านดังปากซอยนานา
Arcadia barcade - Game.Smoke.Drink.All Day.
Arcadia barcade งัดเอาทีเด็ด Glass Knuckles ออกมาท้าประลอง ใครแน่ก็ลองไปชน ที่น่าสงสัยใคร่รู้ก็ตรงส่วนผสม space invaders กะ synthwave DJ Capo Ultra นี่ละท้าทายน่าดู
All Time High Weed Dispensary
สุขุมวิท 24
มหกรรมคอนเสิร์ตเปิดถนนคนเดิน ตลาดคลองมะเดื่อ 5-14 พ.ค.66
มหกรรมคอนเสิร์ตเปิดถนนคนเดิน ตลาดคลองมะเดื่อ กม.12 อ.กระทุ่มแบน สมุทรสาคร วันที่ 5-14 พ.ค.66 ช็อปสินค้าราคาถูก ชิมอาหาร 4 ภาค สวนสนุกชุดใหญ่ คอนเสิร์ตศิลปินดัง ชมฟรีทุกวัน
Fat Buds Weed Shop เอกมัย
จี๊ดจ๊าด กราฟฟิตี้ ตัวเลือกเพียบ สีสันน่าโดนที่สุด จี๊ดสุดในเอกมัยแล้วมั๊งเนี่ย
Thai Cannabis Club
Nana Hotel, สุขุมวิท 4 เปิด ⋅ ปิด 03:00
Best Buds
Best Buds Cannabis store in Bangkok. At Best Buds we provide premium quality flowers that are suitable for everyone! Open today until midnight 3rd Fl. Korean Town, สุขุมวิท 12
1 ก.พ. 2565 - ตามที่สัดส่วนผู้เข้ารับการรักษาในสถานพยายาลต่อจำนวนเตียงที่สำรองไว้ของกรุงโตเกียวสูงถึงร้อยละ 49.2 ในปัจจุบัน ซึ่งเกือบถึงเกณฑ์พิจารณาประกาศสถานการณ์ฉุกเฉินที่กำหนดไว้ที่ร้อยละ 50 นั้น เมื่อวันที่ 31 ม.ค. 65 นรม.คิชิดะ ให้สัมภาษณ์ต่อสื่อมวลชนว่า รัฐบาลยังไม่พิจารณาประกาศสถานการณ์ฉุกเฉินในกรุงโตเกียว โดยจำเป็นที่จะต้องพิจารณาผลจากการประกาศสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ภายในกรุงโตเกียวก่อน นอกจากนี้ ยังต้องพิจารณาปัจจัยอื่นควบคู่ เช่น สัดส่วนของผู้ป่วยอาการรุนแรงต่อจำนวนเตียงที่สำรองไว้สำหรับผู้ป่วยอาการรุนแรง ซึ่งอยู่ในภาวะที่ยังสามารถรับมือได้ ทั้งนี้ รัฐบาลจะพยายามหลีกเลี่ยงการประกาศสถานการณ์ฉุกเฉินเพื่อไม่ก่อให้เกิดผลกระทบต่อกิจกรรมทางสังคมและเศรษฐกิจภายในประเทศ
- เนื่องด้วยปัจจุบันเป็นช่วงที่จะเริ่มการสอบเข้ามหาวิทยาลัยประจำปีของญี่ปุ่น เมื่อวันที่ 31 ม.ค. 65 กระทรวงศึกษาธิการฯ ญี่ปุ่น ได้ส่งหนังสือถึงมหาวิทยาลัยทั่วประเทศ อนุญาตให้นักเรียนที่เข้าข่ายเป็นผู้สัมผัสใกล้ชิดผู้ติดเชื้อสามารถเข้าสอบได้ในห้องสอบที่จัดแยกต่างหากโดยไม่ปะปนกับผู้เข้าสอบทั่วไป หากนักเรียนดังกล่าวไม่มีอาการป่วยและแม้ไม่มีผลตรวจ PCR ที่เป็นลบมาแสดง เนื่องจากปัจจุบันสถานอนามัยในบางพื้นที่อยู่ในภาวะคับขันและไม่สามารถให้บริการตรวจ PCR ได้อย่างทั่วถึง และเสนอให้สามารถใช้อุปกรณ์ตรวจหาเชื้อด้วยตนเองได้แทน
2 ก.พ. 2565 - อัตราการฉีดวัคซีนเข็มกระตุ้นเข็มที่ 3 ของญี่ปุ่นมีสถิติน้อยที่สุดในกลุ่มประเทศพัฒนาแล้ว มีรายละเอียด ดังนี้
* ปัจจุบัน รัฐบาลญี่ปุ่นฉีดวัคซีนเข็มกระตุ้นได้เพียง 4.48 ล้านคนหรือร้อยละ 30 ของจำนวนที่ตั้งเป้าไว้ และเพียงร้อยละ 3.5 ของจำนวนประชากรญี่ปุ่นทั้งหมด โดยมีสาเหตุหลักจากการที่ประชาชนรอฉีดวัคซีน Pfizer แม้รัฐบาลจะสนับสนุนให้ฉีดวัคซีนไขว้ประเภทก็ตาม และท้องถิ่นประสบปัญหาไม่สามารถส่งบัตรเข้ารับการฉีดวัคซีนได้ตามกำหนด
* ทั้งนี้ ญี่ปุ่นเกรงว่า จะมีวัคซีนสำรองของ Pfizer ไม่เพียงพอต่อความต้องการ เนื่องจากมีจำนวนผู้ฉีดวัคซีนเข็มที่ 1 และ 2 ของ Pfizer และ Moderna รวมจำนวน 83.6 ล้านคน และ 16 ล้านคน ตามลำดับ ในขณะที่จำนวนวัคซีนสำรองสำหรับเข็มกระตุ้นของ Pfizer และ Moderna มีจำนวน 40.9 ล้านโดส และ 37.4 ล้านโดส (สถานะเดือน ม.ค. 2565) อย่างไรก็ดี กระทรวงสาธารณสุขฯ ยืนยันว่า ผลการวิจัยพิสูจน์แล้วว่าการฉีดวัคซีนสูตรไขว้มีความปลอดภัยและมีประสิทธิภาพในการป้องกันการติดเชื้อเช่นกัน
* ญี่ปุ่นได้เริ่มฉีดวัคซีนเข็มกระตุ้นให้แก่กลุ่มบุคลากรทางการแพทย์เป็นกลุ่มแรกตั้งแต่เดือน ม.ค. 2565 เป็นต้นมา และในเดือน ก.พ. 2565 จะเริ่มฉีดวัคซีนให้กับกลุ่มผู้สูงอายุมากกว่า 65 ปีขึ้นไป และเจ้าหน้าที่บ้านพักคนชรา รวมเป็นจำนวน 22.41 ล้านคน นอกจากนี้ ยังขอให้ท้องถิ่นที่มีความพร้อมเร่งฉีดวัคซีนให้กับประชาชนทั่วไปที่มีอายุต่ำกว่า 64 ปีด้วย โดยประชาชนสามารถหาข้อมูลเพิ่มเติมที่เว็บไซต์ของเขตท้องถิ่นที่ตนอาศัยอยู่ เกี่ยวกับนโยบายการฉีดวัคซีนของแต่ละท้องถิ่น
- ในช่วงตั้งแต่ปลายเดือน ม.ค. 2565 เป็นต้นมา ทางการญี่ปุ่นได้อนุญาตให้นักเรียนทุนรัฐบาลญี่ปุ่นจำนวน 87 คน ได้รับการตรวจลงตราเดินทางเข้าญี่ปุ่นเป็นกรณีพิเศษ ภายใต้เหตุผลด้านมนุษยธรรมและผลประโยชน์ของชาติ และสามารถเดินทางเข้าญี่ปุ่นได้ตั้งแต่เดือน ก.พ. 2565 นอกจากนี้ กระทรวงศึกษาธิการฯ ญี่ปุ่น เตรียมอนุญาตให้นักเรียน/นักศึกษาต่างชาติมีความจำเป็นเร่งด่วน ที่ต้องเดินทางเข้าประเทศญี่ปุ่น (เช่น นักเรียนทุนรัฐบาลต่างประเทศ) จำนวนไม่เกิน 400 คน สามารถขอรับการตรวจลงตราเดินทางเข้าญี่ปุ่นได้เป็นกรณีพิเศษเช่นกัน
3 ก.พ. 2565 - คณะที่ปรึกษาของกระทรวงสาธารณสุขฯ ญี่ปุ่น รายงานสรุปสถานการณ์การแพร่ระบาดในญี่ปุ่น ในช่วงสัปดาห์ที่ผ่านมา (26 ม.ค. – 1 ก.พ.) มีรายละเอียดดังนี้
* ในหลายพื้นที่เริ่มมีแนวโน้มจำนวนผู้ติดเชื้อรายใหม่จะคงที่หรือลดลงแล้ว อย่างไรก็ดี คาดการณ์ว่า จำนวนผู้ติดเชื้อใหม่ในภาพรวมของประเทศยังจะเพิ่มสูงขึ้นอย่างต่อเนื่องในอัตราการแพร่ระบาดที่มีความรุนแรงลดลง
* ปัจจุบันพบการแพร่ระบาดจากร้านอาหารและเครื่องดื่มลดน้อยลง และมีแนวโน้มการติดเชื้อภายในสมาชิกครอบครัว สถานที่ทำงาน โรงเรียน สถานพยาบาล และบ้านพักคนชราเพิ่มมากขึ้น
* กลุ่มผู้ติดเชื้อในช่วงอายุ 20 – 29 ปี มีแนวโน้มลดลง ในขณะที่กลุ่มเด็กอายุต่ำกว่า 10 ปี พบการติดเชื้อมากขึ้น นอกจากนี้ พบกลุ่มผู้ป่วยสูงอายุมีอาการป่วยรุนแรงและเข้ารับรักษาตัวในสถานพยาบาลเพิ่มขึ้นอย่างต่อเนื่อง ส่งผลให้การให้บริการรถพยาบาลฉุกเฉินอยู่ในภาวะวิกฤตและไม่สามารถให้บริการได้ทั่วถึง
* ในการแพร่ระบาดระลอกครั้งที่ 5 ที่ผ่านมา ประชาชนได้รับการฉีดวัคซีนป้องกันอย่างทันท่วงที ทำให้สามารถป้องกันการแพร่ระบาดไปยังกลุ่มผู้สูงอายุ และสามารถควบคุมสถานการณ์การติดเชื้อโดยรวมได้อย่างรวดเร็ว แต่ในการระบาดครั้งนี้ การติดเชื้อในกลุ่มผู้สูงอายุเป็นกรณีที่น่ากังวล เนื่องจากมีความเสี่ยงที่อาการจะทรุดลงอย่างรวดเร็ว รัฐบาลจึงเตรียมเร่งฉีดวัคซีนให้กับประชาชน โดยเฉพาะกลุ่มผู้สูงอายุต่อไป
* สถานการณ์การให้บริการด้านการแพทย์ในหลายพื้นที่เข้าสู่ภาวะคับขัน เช่น บริการตรวจหาเชื้อไวรัสฯ หรือการพบแพทย์เพื่อขอรับคำปรึกษาอาการป่วย นอกจากนี้ พบว่า ประชาชนมีความกังวลต่อสถานการณ์การแพร่ระบาด และเข้ารับการตรวจหาเชื้อไวรัสฯ โดยไม่เสียค่าธรรมเนียมอย่างต่อเนื่องมากขึ้น
* คณะที่ปรึกษาจะเฝ้าระวังสถานการณ์การแพร่ระบาดอย่างต่อเนื่อง และปรับลดระยะเวลาการกักตัวสำหรับผู้ติดเชื้อฯ และผู้เข้าข่ายเป็นผู้สัมผัสใกล้ชิดผู้ติดเชื้อฯ อย่างเหมาะสม เพื่อให้กิจกรรมทางสังคมและเศรษฐกิจยังดำเนินต่อไปได้ตามปกติ
* จำนวนผู้ติดเชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอน BA.2 ซึ่งพบการแพร่ระบาดมากในต่างประเทศ เป็นสัดส่วนเพียงเล็กน้อยภายในญี่ปุ่น และจะเฝ้าระวังการแพร่ระบาดของเชื้อไวรัสสายพันธุ์ดังกล่าวภายในประเทศอย่างใกล้ชิด
* เตรียมเร่งฉีดวัคซีนให้ประชาชน โดยเฉพาะในกลุ่มผู้สูงอายุ รวมถึงขอความร่วมมือประชาชนหลีกเลี่ยงสถานที่มีความเสี่ยง 3Cs แม้เพียงเล็กน้อย สวมหน้ากากอนามัย ทำความสะอาดล้างมือและฆ่าเชื้อ และถ่ายเทอากาศในห้องและอาคารเป็นประจำ เป็นต้น
4 ก.พ. 2565 - ตามที่เกิดการติดเชื้อในเด็กจำนวนมาก กระทรวงสาธารณสุขฯ ญี่ปุ่น ได้ปรับเวลาการกักตัวของผู้ที่มีสัมผัสใกล้ชิดกับผู้ติดเชื้อภายในครอบครัวเดียวกัน จากเดิม 17 วัน ลงเหลือ 7 วัน เพื่อให้กิจกรรมทางเศรษฐกิจและสังคมสามารถดำเนินต่อไปได้ การลดวันกักตัวดังกล่าวเป็นไปตามข้อมูลของสถาบันโรคติดต่อแห่งชาติ ซึ่งระบุว่าหากผู้ที่มีสัมผัสใกล้ชิดผู้ติดเชื้อได้รับเชื้อ ร้อยละ 99.98 จะแสดงอาการภายใน 7 วัน ทั้งนี้ วันที่สิ้นสุดการกักตัวจะต้องเป็นไปตามเงื่อนไขอย่างใดอย่างหนึ่งใน 3 ข้อต่อไปนี้ที่เกิดขึ้นหลังสุด ได้แก่
* 7 วันหลังจากที่สมาชิกในครอบครัวที่ติดเชื้อ แสดงอาการเป็นครั้งแรก
* 7 วันนับตั้งแต่ที่มีผลตรวจเชื้อของสมาชิกในครอบครัวเป็นบวก
* ได้มีการใช้มาตรการป้องกันการติดเชื้ออย่างเคร่งครัดเป็นเวลา 7 วัน
- รัฐบาลญี่ปุ่นได้ประกาศสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ในจังหวัดวากายามะ ระหว่างวันที่ 5 - 27 ก.พ. 2565 ส่งผลให้ญี่ปุ่นมีพื้นที่ที่อยู่ภายใต้มาตรการมัมโบทั้งสิ้น 35 จังหวัด นอกจากนี้ ทางการญี่ปุ่นกำลังพิจารณาว่า จะขยายประกาศมาตรการมัมโบซึ่งจะหมดอายุในวันที่ 13 ก.พ. 2565 นี้ ในกรุงโตเกียวและอีก 6 จังหวัด ได้แก่ อิบารากิ โทจิกิ ชิบะ กุมมะ ไซตามะ และคานากาวะ ออกไปหรือไม่ เนื่องจากเป็นพื้นที่ที่มีผู้ติดเชื้อเพิ่มขึ้นสูง ทั้งนี้ รัฐบาลจะพิจารณาสถานการณ์การแพร่ระบาดในภาพรวมทั้งประเทศ และจะตัดสินใจภายในกลางสัปดาห์หน้าอีกครั้งว่าสมควรจะขยายมาตรการมัมโบหรือไม่และในพื้นที่ใดบ้าง โดยจะพิจารณาจากจำนวนผู้ติดเชื้อรายใหม่และความตึงเครียดของระบบการรักษาพยาบาล ทั้งนี้ นาย YAMAGIWA Daishiro รมว. รับผิดชอบดูแลสถานการณ์โควิด-19 กล่าวว่ายังไม่สามารถนิ่งนอนใจได้ว่าเชื้อหยุดแพร่กระจายแล้ว เนื่องจากสัปดาห์นี้ มีจำนวนผู้ติดเชื้อรายใหม่เพิ่มขึ้น 1.5 เท่า เมื่อเทียบกับสัปดาห์ก่อน
- เมื่อวันที่ 3 ก.พ. 2565 กรุงโตเกียวมีจำนวนผู้ติดเชื้อรายใหม่กว่า 20,000 คน เป็นวันที่ 2 ติดต่อกัน 2 และได้ยกระดับการแจ้งเตือนของระบบการรักษาพยาบาลเป็นระดับที่ร้ายแรง (ระดับที่ 4 จากทั้งหมด 4 ระดับ)
7 ก.พ. 2565- ผู้ติดเชื้อรายวันทั่วประเทศในญี่ปุ่นเมื่อวันที่ 5 ก.พ. 2565 มีจำนวน 100,949 คน ซึ่งสูงเกิน 1 แสนคนเป็นครั้งแรกตั้งแต่ที่เริ่มมีการแพร่ระบาดในญี่ปุ่น
8 ก.พ. 2565 - รัฐบาลญี่ปุ่นเตรียมขยายระยะเวลาการประกาศสถานการณ์กึ่งฉุกเฉินเฉพาะพื้นที่ (มันโบ) ในกรุงโตเกียว และอีก 12 จังหวัด ได้แก่ จังหวัดกุมมะ ไซตามะ ชิบะ คานากาวะ นีกาตะ กิฟุ ไอจิ มิเอะ คากาวะ นางาซากิ คุมะโมโตะ และมิยากิ ซึ่งเดิมจะมีกำหนดสิ้นสุดลงในวันที่ 13 ก.พ. 65 นี้ ทั้งนี้ คาดว่าจะขยายระยะเวลาต่อไปอีก 3 สัปดาห์ และจะประกาศอย่างเป็นทางการภายหลังการหารือกับผู้เชี่ยวชาญที่เกี่ยวข้องในวันที่ 10 ก.พ. นี้
- รัฐบาลญี่ปุ่นตั้งเป้าเพิ่มความสามารถในการฉีดวัคซีนให้ได้จำนวน 1 ล้านโดสต่อวันให้ได้ภายในสิ้นเดือน ก.พ. นี้ โดยจะขอความร่วมมือรัฐบาลท้องถิ่นเร่งส่งบัตรเข้ารับการฉีดวัคซีนให้กับประชาชน / เร่งการให้อนุญาตฉีดวัคซีนในระบบการฉีดวัคซีนในที่ทำงานและสถานศึกษา / เพิ่มจำนวนโดสที่ให้บริการที่ศูนย์ฉีดวัคซีนขนาดใหญ่ของกระทรวงกลาโหมของญี่ปุ่นในกรุงโตเกียวและจังหวัดโอซากา เป็นต้น
9 ก.พ. 2565 - นาย OZAKI Haruo ประธานสมาคมแพทย์กรุงโตเกียว แถลงว่า ช่วง 2 สัปดาห์หลังจากนี้จะเป็นช่วงเวลาสำคัญที่จะชี้ว่าสถานการณ์การแพร่ระบาดในญี่ปุ่นจะดีขึ้นหรือแย่ลง และขอความร่วมมือประชาชนเพิ่มความระมัดระวังเพื่อป้องกันการติดเชื้อ เช่น ทำงานจากบ้าน และไม่กินเลี้ยงสังสรรค์กับบุคคลอื่นที่ไม่ใช่สมาชิกครอบครัว เป็นต้น เพื่อป้องกันมิให้นำเชื้อไวรัสกลับไปแพร่ระบาดในครอบครัว ทั้งนี้ ปัจจุบันบริษัทและสถานศึกษาหลายแห่งต้องการผลตรวจ PCR สำหรับผู้ป่วยติดเชื้อก่อนกลับเข้าทำงานและศึกษาตามปกติ อย่างไรก็ดี โดยที่ปัจจุบันสถานพยาบาลอยู่ในภาวะคับขันมากขึ้น จึงขอให้บริษัทและสถานศึกษาอนุญาตให้พนักงานและนักเรียนสามารถกลับเข้าทำงาน/เข้าเรียนได้โดยไม่ต้องมีผลตรวจ หากผู้ติดเชื้อฯ มีไข้ลดลง หรืออาการป่วยอื่น ๆ ทุเลาดีขึ้นเป็นระยะเวลา 72 ชั่วโมงแล้ว และผู้ติดเชื้อฯ ได้กักตัวเป็นระยะเวลา 10 วันขึ้นไป หลังจากมีอาการวันแรกแล้ว
- เมื่อวันที่ 8 ก.พ. 2565 กระทรวงสาธารณสุขฯ ญี่ปุ่น อนุญาตให้ผู้ป่วยติดเชื้อไวรัสสายพันธุ์โอไมครอนที่เข้ารับการรักษาในสถานพยาบาล สามารถกลับไปเฝ้าระวังอาการป่วยที่บ้านได้ หากในวันที่ 4 หลังจากที่เข้ารักษาตัว (วันเข้ารับการรักษาถือเป็นวันที่ 0) ไม่ต้องใช้เครื่องช่วยหายใจ (เทียบเท่าผู้ป่วยมีอาการปานกลาง 2) พร้อมขอให้สถานพยาบาลเร่งตรวจคัดกรองว่าผู้ป่วยเป็นผู้ติดเชื้อไวรัสโอไมโครอนหรือไม่ เพื่อให้สามารถปฏิบัติตามข้อบังคับดังกล่าวได้ โดยเฉพาะในกลุ่มผู้สูงอายุ ทั้งนี้ แนวทางดังกล่าวมีวัตถุประสงค์เพื่อลดภาระสถานพยาบาลที่อยู่ในภาวะคับขัน และจากข้อมูลของกระทรวงสาธารณสุขฯ พบว่า ปัจจุบันมีผู้ป่วยที่มีอาการรุนแรงเกินกว่าระดับปานกลาง 2 จำนวน 12 คนจาก 1,321 คน หรือไม่เกินร้อยละ 1
10 ก.พ. 2565 นรม. คิชิดะ ประกาศขยายสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ใน 13 จังหวัด เพิ่มอีก 3 สัปดาห์ จากเดิมที่จะสิ้นสุดในวันที่ 13 ก.พ. 2565 ไปจนถึงวันที่ 6 มี.ค. 2565 ได้แก่ กรุงโตเกียว ไซตามะ ชิบะ คานากาวะ กุมมะ นีกาตะ กิฟุ ไอจิ มิเอะ คากาวะ นากาซากิ คุมาโมโตะ และมิยาซากิ นอกจากนี้ ได้ประกาศสถานการณ์มัมโบในจังหวัดโคจิ โดยมีผลตั้งแต่วันที่ 12 ก.พ. 2565 จนถึง 6 มี.ค. 2565 ทำให้มีจำนวนจังหวัดที่อยู่ภายใต้สถานการณ์มัมโบรวมทั้งสิ้น 36 จังหวัด ทั้งนี้ นรม.คิชิดะ ระบุว่า รัฐบาลจะตัดสินใจอีกครั้งว่า จะขยายประกาศสถานการณ์มัมโบในอีก 21 จังหวัด รวมถึงจังหวัดโอซากาหรือไม่ ในช่วงวันพุธที่ 16 ก.พ. โดยจะต้องพิจารณาสถานการณ์การแพร่ระบาดและปัจจัยอื่น ๆ
10 กุมภาพันธ์ 2565 - ภาพรวมผู้ติดเชื้อทั่วประเทศแม้จะเพิ่มขึ้นอย่างต่อเนื่อง แต่เริ่มมีแนวโน้มสูงขึ้นในอัตราที่ลดลง โดยในส่วนของกรุงโตเกียว เมื่อวันที่ 9 ก.พ. มีผู้ติดเชื้อรายใหม่ 18,287 คน ซึ่งเป็นวันที่ 16 ติดต่อกัน ที่มีผู้ติดเชื้อรายใหม่สูงกว่า 10,000 คน แต่จำนวนเฉลี่ยรายสัปดาห์ลดลงเป็นครั้งแรก จำนวน 3,289 คน จากสัปดาห์ก่อนหน้า อย่างไรก็ดี จำนวนผู้ติดเชื้ออาการรุนแรงทั่วประเทศสูงขึ้นเรื่อย ๆ จากวันที่ 8 ม.ค. เป็นต้นมา ซึ่งอยู่ที่ 89 คน เป็น 1,212 คน ในวันที่ 9 ก.พ. 2565 ขณะเดียวกัน จำนวนผู้เสียชีวิตก็เพิ่มขึ้นเช่นกัน โดย 30 ม.ค. 2565 อยู่ที่ 31 คน ส่วนวันที่ 9 ก.พ. 2565 อยู่ที่ 162 คน
- เมื่อวันที่ 10 ก.พ. 2565 ที่ประชุมผู้เชี่ยวชาญระบุว่า รัฐบาลเตรียมขยายระยะเวลาการประกาศมาตรการกึ่งฉุกเฉิน (มัมโบ) ใน 13 จังหวัด จนถึงวันที่ 6 มี.ค. 2565 ได้แก่ กรุงโตเกียว ไซตามะ ชิบะ คานากาวะ กุมมะ นีกาตะ กิฟุ ไอจิ มิเอะ คากาวะ นากาซากิ คุมาโมโตะ และมิยาซากิ นอกจากนี้ จะเพิ่มจังหวัดโคจิ ในการประกาศมาตรการมัมโบในวันที่ 12 ก.พ. – 6 มี.ค. 2565 โดย นรม. คิชิดะ ชี้แจงว่า แม้การแพร่ระบาดจะชะลอตัวลง แต่ยังคงมีผู้ติดเชื้อใหม่เพิ่มขึ้นอย่างต่อเนื่อง และมีความเสี่ยงที่จำนวนผู้ติดเชื้ออาการรุนแรงจะเพิ่มขึ้นในภายหลัง นอกจากนี้ จะหารือกับคณะอนุกรรมการนโยบายการรับมือขั้นพื้นฐานว่าสมควรขยายมาตรการมัมโบให้ครอบคลุมพื้นที่อื่น ๆ ที่เหลือหรือไม่ ซึ่งจะทำให้ครอบคลุมพื้นที่รวมทั้งหมด 36 จังหวัด
- นรม. คิชิดะ ได้ขอความร่วมมือจากนาง KOIKE Yuriko ผู้ว่าราชการกรุงโตเกียว และนาย YOSHIMURA Hirofumi ผู้ว่าราชการจังหวัดโอซากา ในการเพิ่มจำนวนเตียงในโรงพยาบาลอีก 1,000 เตียง และจัดหาบุคลากรทางการแพทย์ที่จำเป็นเพื่อรับมือกับผู้ป่วยโควิดอย่างเต็มที่
- เมื่อวันที่ 7 ก.พ. 2565 นรม. คิชิดะ กล่าวว่ารัฐบาลจะพิจารณาอนุมัติยารับประทานเพื่อรักษาโรคติดเชื้อไวรัสโควิด-19 ที่พัฒนาโดยบริษัท Shionogi & Co. ก่อนกำหนด ทั้งนี้ ผู้บริหารของบริษัทฯ กล่าวว่า จะสามารถยื่นขออนุมัติยาได้ภายในสัปดาห์หน้า และสามารถส่งมอบยาสำหรับ 1,000,000 คนภายในสิ้นเดือน มี.ค. 2565 ทั้งนี้ ยาดังกล่าวมีประสิทธิภาพในการรักษาผู้ป่วยอาการแรกเริ่มถึงปานกลาง และช่วยยับยั้งไม่ให้อาการทรุดลง รวมทั้งสามารถรักษาการติดเชื้อไวรัสโอไมครอนได้ ทั้งนี้ จากการทดลองทางคลินิกสามารถลดปริมาณไวรัสได้ร้อยละ 63-80
12 กุมภาพันธ์ 2565 - นาย GOTO Shigeyuki รมว.กระทรวงสาธารณสุขฯ ญี่ปุ่น ตั้งเป้าฉีดวัคซีนกระตุ้นเข็มที่ 3 ให้กับประชาชนให้ได้วันละ 1 ล้านโดสโดยเร็วที่สุด และจะพยายามอย่างเต็มที่ให้สามารถฉีดวัคซีนให้กับเจ้าหน้าที่และผู้สูงอายุในบ้านพักคนชราให้แล้วเสร็จภายในเดือน ก.พ. 2565 เพื่อป้องกันความเสี่ยงที่ผู้สูงอายุจะอาการทรุดหนักอย่างรวดเร็ว สำหรับการฉีดวัคซีนในกลุ่มเด็กเล็กระหว่าง 5 – 11 ขวบนั้น จะไม่บังคับให้ผู้ปกครองต้องพาบุตรหลานเข้ารับการฉีดวัคซีน แต่จะเน้นการให้ข้อมูลเกี่ยวกับความปลอดภัยในการฉีดวัคซีนและประสิทธิผลของการป้องกันการติดเชื้อฯ รวมทั้งให้คำปรึกษาทั้งก่อนและหลังการฉีดวัคซีนอย่างเต็มที่
- นาย SAITO Tetsuo รมว.กระทรวงที่ดิน โครงสร้างพื้นฐาน คมนาคม และการท่องเที่ยว ญี่ปุ่น เตรียมประสานงานกับบริษัทรถไฟในญี่ปุ่นให้ขอความร่วมมือผู้โดยสารใช้หน้ากากอนามัยประเภทแผ่นใยสังเคราะห์ (non- woven fabric) ในระหว่างใช้บริการรถไฟ
15 กุมภาพันธ์ 2565 - ตามที่รัฐบาลญี่ปุ่นได้รับเสียงวิพากษ์วิจารณ์จากภาคธุรกิจและภาคการศึกษาเกี่ยวกับมาตรการการเดินทางเข้าประเทศที่เข้มงวดเกินไป นั้น ในสัปดาห์นี้รัฐบาลจะพิจารณาเรื่องการผ่อนคลายมาตรการจำกัดการเดินทางเข้าประเทศ ซึ่งเดิมมีกำหนดสิ้นสุดในวันที่ 28 ก.พ. มีรายละเอียดดังนี้
* นรม.คิชิดะ ให้สัมภาษณ์ว่าจะพิจารณาปรับมาตรการตามข้อมูลทางวิทยาศาสตร์ที่มีอยู่เกี่ยวกับเชื้อไวรัสสายพันธุ์โอไมครอน สถานการณ์การแพร่ระบาดของในประเทศและนอกประเทศ รวมถึงมาตรการการเดินทางเข้าประเทศของประเทศอื่นควบคู่กันไป
* แหล่งข่าวระบุว่า อาจมีการลดวันกักตัวจาก 7 วันเหลือ 3 - 5 วัน (อาจน้อยกว่า 3 วัน) โดยผู้เดินทางเข้าประเทศต้องได้รับการฉีดวัคซีนกระตุ้นเข็มที่ 3 และมีผลรับรองการตรวจเชื้อไวรัสโควิด-19 นอกจากนี้ จะเริ่มพิจารณาการตรวจลงตราสำหรับผู้เดินทางเข้าญี่ปุ่นรายใหม่ โดยให้สิทธิ์สำหรับกลุ่มวิศวกรและนักวิจัย รวมถึงกลุ่มอาชีพที่สร้างคุณประโยชน์ต่อส่วนรวมเป็นอันดับต้นก่อน และเตรียมผ่อนปรนอนุญาตให้นักธุรกิจและนักเรียนเดินทางเข้าญี่ปุ่นมากขึ้นเรื่อย ๆ โดยบริษัทและสถาบันการศึกษาจะต้องเป็นผู้รับรองผู้เดินทางเข้าประเทศกลุ่มดังกล่าวตามลำดับ
* ต่อมา นาย KIHARA Seiji รองเลขาธิการ ครม. ของญี่ปุ่นให้สัมภาษณ์ว่า รัฐบาลอาจเพิ่มจำนวนผู้เดินทางเข้าญี่ปุ่นจากปัจจุบัน 3,500 คน/วัน เป็น 5,000 คน/วัน อย่างไรก็ดี ยังจะต้องหารือเพิ่มเติมว่าจะสามารถเปิดให้เดินทางเข้าประเทศได้โดยไม่ต้องกักตัวหรือไม่ ขณะเดียวกัน รัฐบาลจะทบทวนผลกระทบของการแพร่ระบาดของเชื้อโอไมครอนตามหลักฐานทางวิทยาศาสตร์ โดยจะหารือกับผู้เชี่ยวชาญด้านเศรษฐศาสตร์และสถิติ และวางแผนที่จะยกร่างมาตรการในช่วงเดือน มิ.ย. 2565 อย่างเร็วที่สุด
16 กุมภาพันธ์ 2565 - แหล่งข่าวระบุว่า ญี่ปุ่นวางแผนที่จะเพิ่มจำนวนผู้ที่สามารถเดินทางเข้าญี่ปุ่นซึ่งอยู่ในข่ายตามที่รัฐบาลกำหนด (นักท่องเที่ยวยังไม่สามารถเดินทางเข้าญี่ปุ่นได้) จากเดิม 3,500 คน เป็น 5,000 คนต่อวัน ตั้งแต่เดือน มี.ค. 2565 และกำลังพิจารณาความเป็นไปได้ที่จะยกเลิกข้อกำหนดในการกักตัว 7 วัน หากสามารถแสดงผลการตรวจเชื้อโควิด-19 ที่เป็นลบ และฉีดวัคซีนเข็มที่ 3 แล้ว
- เมื่อวันที่ 15 ก.พ. 65 กระทรวงสาธารณสุขฯ ญี่ปุ่น ได้แจ้งแนวปฏิบัติในการสวมใส่หน้ากากอนามัยในเด็กเล็ก ดังนี้
* ไม่แนะนำให้สวมหน้ากากอนามัยให้เด็กทารกและเด็กเล็กที่มีอายุต่ำกว่า 2 ขวบ
* การสวมใส่หน้ากากอนามัยให้เด็กเล็กจะต้องเฝ้าระวังภาวะทางร่างกายและสุขภาพของเด็กเป็นสำคัญ เช่น หายใจลำบากหรือไม่ มีสิ่งแปลกปลอมเข้าไปในปากหรือไม่ และเด็กรู้สึกจะอาเจียนหรือไม่ มากกว่าการสวมหน้ากากตามหลักที่ถูกต้อง
* เจ้าหน้าที่สถานรับเลี้ยงเด็กไม่บังคับให้เด็กสวมใส่หน้ากากอนามัยหากผู้ปกครองหรือเด็กไม่ยินยอม และถึงแม้ผู้ปกครองประสงค์ให้บุตรหลานสวมใส่ แต่เจ้าหน้าที่สถานรับเลี้ยงเด็กสามารถใช้ดุลพินิจให้เด็กสวมหน้ากากในขอบเขตและระยะเวลาที่เหมาะสม
* หากไม่สามารถหลีกเลี่ยงให้เด็กอยู่ในห้องที่มีคนแออัดได้ สามารถใส่หน้ากากอนามัยให้เด็กได้ แต่ควรมีผู้เฝ้าระวังภาวะของเด็กอย่างใกล้ชิด
* ในระหว่างการออกกำลังกายนอกอาคาร ไม่แนะนำให้สวมใส่หน้ากาก และแนะนำให้ถอดหน้ากากออกในระหว่างนอนพักกลางวัน เป็นต้น
17 กุมภาพันธ์ 2565 - กลุ่มผู้เชี่ยวชาญที่ปรึกษาของกระทรวงสาธารณสุขฯ ญี่ปุ่น แถลงเกี่ยวกับสถานการณ์การแพร่ระบาดของเชื้อสายพันธุ์โอไมครอนภายในญี่ปุ่นในช่วงสัปดาห์ที่ผ่านมา รายละเอียดดังนี้
* การแพร่ระบาดฯ ระลอกที่ 6 ในปัจจุบันได้ผ่านช่วงที่รุนแรงที่สุดไปแล้วเมื่อต้นเดือน ก.พ. 65 จำนวนผู้ติดเชื้อรายใหม่กำลังลดลงอย่างช้า ๆ โดยค่าเฉลี่ยของอัตราผู้ติดเชื้อใหม่ทั่วประเทศภายใน 1 สัปดาห์เมื่อเทียบกับสัปดาห์ที่แล้วเท่ากับ 0.9
* ในช่วงสัปดาห์ที่ผ่านมา (9 -15 ก.พ. 65) จำนวนผู้ติดเชื้อรายใหม่ต่อจำนวนประชากร 1 แสนคนทั่วประเทศญี่ปุ่นมีอัตราเฉลี่ย 464.39 คน โดยจังหวัดโอซากาสูงมีอัตราสูงที่สุดเป็นจำนวน 942.63 คน รองลงมาได้แก่ กรุงโตเกียว 758.39 คน เฮียวโกะ 628.44 คน เกียวโต 591.91 คน นารา 576.76 คน และคานากาวะ 573.50 คน
* ผู้ติดเชื้อในทุกช่วงกลุ่มอายุมีจำนวนลดลง ยกเว้นกลุ่มผู้สูงวัยที่อายุมากกว่า 80 ปีขึ้นไปที่ยังมีจำนวนผู้ติดเชื้อรายใหม่เพิ่มขึ้นเล็กน้อย ทั้งนี้ พบการแพร่ระบาดต่อเนื่องในโรงเรียน สถานรับเลี้ยงเด็ก สถานสงเคราะห์ ที่ทำงาน และภายในกลุ่มสมาชิกครอบครัว นอกจากนี้ ยังพบในบางพื้นที่ที่มีประชาชนออกมาใช้บริการสถานบันเทิงยามค่ำคืนมากขึ้น
* แม้สถานการณ์การแพร่ระบาดในปัจจุบันมีแนวโน้มลดลง แต่ยังอาจเกิดการแพร่ระบาดระลอกใหม่ของเชื้อโอไมครอนสายพันธุ์ BA.2 ที่สามารถแพร่เชื้อระหว่างบุคคลได้ง่ายในอนาคตเช่นเดียวกัน จึงขอความร่วมมือประชาชนเพิ่มความระมัดระวังป้องกันตนเองจากการติดเชื้ออย่างต่อเนื่อง เช่น หลีกเลี่ยงสถานที่ที่มีคนแออัด สวมหน้ากากอนามัยแบบใยสังเคราะห์อย่างถูกต้อง ล้างมือและใช้แอลกอฮอล์ฆ่าเชื้อ ถ่ายเทอากาศภายในห้องเป็นประจำ และสนับสนุนให้พนักงานทำงานจากที่บ้านได้
* จำนวนผู้เสียชีวิตในกลุ่มผู้สูงอายุเพิ่มขึ้นอย่างต่อเนื่อง นอกจากนี้ พบว่า ผู้ที่มีโรคประจำตัวอาจมีโอกาสเสียชีวิตแม้ไม่มีอาการป่วยรุนแรง จึงต้องเร่งฉีดวัคซีนกระตุ้นเข็มที่ 3 ให้กับประชาชนโดยเฉพาะในกลุ่มผู้สูงอายุ ทั้งนี้ หลังจากนี้ จะเข้าสู่ช่วงการจบการศึกษาและเทศกาลชมดอกไม้ ซึ่งจะมีการพบปะและรวมตัวของคนหมู่มากที่ปกติไม่ได้พบกัน
- รัฐบาลญี่ปุ่นเตรียมผ่อนคลายมาตรการเดินทางเข้าประเทศตั้งแต่เดือน มี.ค. 2565 เป็นต้นไป โดยจะเพิ่มจำนวนผู้เดินทางเข้าประเทศได้มากขึ้นจากเดิมวันละ 3,500 คน เป็น 5,000 คน แต่ยังไม่อนุญาตให้นักท่องเที่ยวเดินทางเข้าญี่ปุ่น นอกจากนี้ เตรียมลดระยะเวลาการกักตัวหลังเดินทางเข้าญี่ปุ่นจาก 7 วันเหลือ 3 วัน สำหรับทั้งชาวญี่ปุ่นและชาวต่างชาติที่ได้รับอนุญาตให้เดินทางเข้าญี่ปุ่นได้ และเตรียมยกเว้นมาตรการกักตัวหากแสดงผลตรวจเชื้อไวรัสโควิด-19 เป็นลบ มีเอกสารรับรองการฉีดวัคซีนกระตุ้นเข็มที่ 3 และเดินทางมาจากพื้นที่ที่เข้าข่ายควบคุมการแพร่ระบาดฯ ได้ โดยในวันนี้ (17 ก.พ.) นรม. คิชิดะ จะแถลงต่อผู้สื่อข่าวอย่างเป็นทางการในรายละเอียดอีกครั้ง อนึ่ง นาย MATSUNO Hirokazu เลขาธิการ ครม. ญี่ปุ่นกล่าวว่า ปัจจุบันมีนักเรียนต่างชาติที่ได้รับการตรวจลงตราแบบนักศึกษา ที่ยังไม่สามารถเดินทางเข้าญี่ปุ่นได้กว่า 1.5 แสนคน
18 กุมภาพันธ์ 2565 - เมื่อคืนวันที่ 17 ก.พ. 2565 นรม. คิชิดะ ได้ประกาศมาตรการควบคุมการแพร่ระบาดของเชื้อไวรัสโควิด-19 ดังนี้
* ขยายสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ใน 17 จังหวัด ได้แก่ จังหวัดฮอกไกโด อาโอโมริ ฟูกูชิมะ อิบารากิ โทชิกิ อิชิกาวะ นากาโนะ ชิสึโอกะ โอซากา เกียวโต กุมมะ โอกายามะ ฮิโรชิมะ ฟูกูโอกะ ซากะ คาโกชิมะ และวากายามะ จนถึงวันที่ 6 มี.ค. 2565
* ยกเลิกมาตรการมัมโบใน 5 จังหวัด ได้แก่ ยามากาตะ ชิมาเนะ ยามากูจิ โออิตะ และโอกินาวะ ในวันที่ 20 ก.พ. 2565
* ผ่อนคลายมาตรการเข้าเมือง โดยอนุญาตให้ชาวต่างชาติที่มิใช่นักท่องเที่ยว เช่น นักเรียนต่างชาติ และนักธุรกิจ สามารถเดินทางเข้าญี่ปุ่นได้ โดยจะเพิ่มโควต้าจาก 3,500 คนต่อวันในปัจจุบัน
เป็น 5,000 คน มีผลตั้งแต่วันที่ 1 มี.ค. 2565 เป็นต้นไป ทั้งนี้ ผู้ที่เดินทางเข้าญี่ปุ่นจะต้องมีบริษัทหรือหน่วยงานในญี่ปุ่นเป็นผู้รับรอง โดยรัฐบาลจะอำนวยความสะดวกให้องค์กรผู้รับรองสามารถกรอกข้อมูลการรับรองทางออนไลน์ได้
* ลดวันกักตัวสำหรับผู้ที่เดินทางเข้าญี่ปุ่นที่ได้รับวัคซีนเข็มที่ 3 แล้ว เหลือ 3 วัน
* สำหรับการฉีดวัคซีนเข็มที่ 3 นรม.คิชิดะกล่าวว่าตั้งแต่วันที่ 15 ก.พ. 65 ได้เพิ่มเป้าหมายในการบริการการฉีดวัคซีนให้ประชาชนเป็น 1 ล้านโดสต่อวัน
- สถานเอกอัครราชทูตฯ ได้รับข้อมูลเพิ่มเติมจากสถานเอกอัครราชทูตญี่ปุ่นประจำประเทศไทยเกี่ยวกับการผ่อนคลายมาตรการเข้าเมือง ดังนี้
* ผู้ที่เดินทางจากพื้นที่ที่มีการแพร่ระบาดของเชื้อไวรัสสายพันธุ์โอไมครอนรวมถึงประเทศไทย จะต้องกักตัวที่สถานที่ที่รัฐบาลญี่ปุ่นจัดหาเป็นเวลา 3 วัน และหากผลตรวจเชื้อในวันที่ 3 เป็นลบ การกักตัวถือเป็นอันสิ้นสุด
* สำหรับผู้ที่ได้รับวัคซีนเข็มกระตุ้นเข็มที่ 3 แล้วหากเป็นประเภทวัคซีนที่เข้าข่ายตามประกาศของทางการญี่ปุ่นจะสามารถกักตัวที่บ้านพักแทนสถานที่ที่รัฐบาลญี่ปุ่นจัดหาได้ ทั้งนี้ ทางการญี่ปุ่นจะประกาศประเภทวัคซีนที่เข้าข่ายในโอกาสแรกต่อไป
* ผู้ที่ได้รับอนุญาตให้เดินทางเข้าญี่ปุ่น สามารถใช้ระบบการขนส่งสาธารณะในการเดินทางจากท่าอากาศยานไปยังที่พักหรือสถานที่กักตัวเอง (home quarantine) หลังจากที่ได้รับการตรวจเชื้อเมื่อเดินทางถึงญี่ปุ่นแล้ว
22 กุมภาพันธ์ 2565 - กระทรวงสาธารณสุขฯ กำลังพิจารณาขยายระยะเวลาให้เงินอุดหนุนการจ้างงาน 15,000 เยน/วัน สำหรับธุรกิจขนาดใหญ่และ SMEs จากเดิมที่จะสิ้นสุดลงในเดือน มี.ค. เป็นเดือน พ.ค. 65 เพื่อช่วยคงการจ้างงานและการดำเนินกิจการของธุรกิจที่ได้รับผลกระทบจากการให้ความร่วมมือในการปิดหรือลดระยะเวลาการให้บริการในช่วงสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด-19 ทั้งนี้ ธุรกิจดังกล่าวจะต้องอยู่ในพื้นที่สถานการณ์ฉุกเฉิน/กึ่งฉุกเฉิน และรายได้ในช่วง 3 เดือนล่าสุดลดลงมากกว่าร้อยละ 30 เมื่อเทียบกับปีใดปีหนึ่งในช่วง 3 ปีก่อนหน้า
24 กุมภาพันธ์ 2565 - ผู้ติดเชื้อรายใหม่ในกรุงโตเกียวเมื่อวันพุธที่ 23 กุมภาพันธ์ 2565 มีจำนวน 14,567 คน ลดลง 2,764 คน เมื่อเทียบกับวันพุธที่ผ่านมา และเป็นการลดลงเป็นสัปดาห์ที่ 4 ติดต่อกันในการระบาดระลอกที่ 6 นี้
- สถาบันวิจัยโรคติดต่อแห่งชาติของญี่ปุ่นประกาศเกี่ยวกับการติดเชื้อสายพันธุ์ BA.2 ในญี่ปุ่น ดังนี้
* ในการสุ่มตรวจผู้ติดเชื้อทั่วประเทศในช่วงตั้งแต่ต้นปีที่ผ่านมา มีผู้ติดเชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 จำนวน 94 ราย ซึ่งนับเป็นร้อยละ 0.6 ของจำนวนผู้ติดเชื้อโอไมครอนทั้งหมด จึงสรุปได้ว่ายังไม่ถือว่ามีการแพร่ระบาดของไวรัสโอไมครอนสายพันธุ์ BA.2 ในปัจจุบัน แต่ยังจะต้องเฝ้าระวังสถานการณ์การแพร่ระบาดต่อไปอย่างใกล้ชิด โดยเชื่อว่า การฉีดวัคซีนกระตุ้นเข็มที่ 3 สามารถช่วยป้องกันไม่ให้อาการพัฒนารุนแรงได้
* เชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอน BA.2 ก่อให้เกิดอาการรุนแรงมากกว่าสายพันธุ์ BA.1 ที่ระบาดในปัจจุบัน แต่ไม่รุนแรงเท่าเชื้อสายพันธุ์เดลต้า โดยผลการทดลองในหนูทดลอง เชื้อสายพันธุ์ BA.2 อาจลามเข้าสู่ปอดและส่งผลให้น้ำหนักตัวลดลง ทั้งนี้ เนื่องจากไวรัสโอไมครอน 2 สายพันธุ์ดังกล่าวก่อให้เกิดอาการป่วยที่แตกต่างกัน จึงจำเป็นต้องมีมาตรการที่แตกต่างกันในการรับมือไวรัสทั้งสองสายพันธุ์ด้วย
ญี่ปุ่นปรับมาตรการกักตัว LINK
ญี่ปุ่นปรับมาตรการกักตัว เมื่อวันที่ 24 กุมภาพันธ์ 2565 ญี่ปุ่นได้ปรับมาตรการเดินทางเข้าเมือง โดยผู้ที่เดินทางจากประเทศไทยและฉีดวัคซีนครบ 3 เข็มตามข้อกำหนดของญี่ปุ่น จะได้ผ่อนผันไม่ต้องกักตัว มีผลตั้งแต่วันที่ 1 มีนาคม 2565 เป็นต้นไป ***อย่างไรก็ดี นักท่องเที่ยวยังไม่สามารถเดินทางเข้าญี่ปุ่นได้
27 ก.พ. 65 - รัฐบาลญี่ปุ่นกำลังพิจารณาการขยายประกาศสถานการณ์กึ่งฉุกเฉินเพื่อป้องกันการแพร่ระบาดเฉพาะพื้นที่ (มัมโบ) ใน 10 จังหวัด ซึ่งมีกำหนดสิ้นสุดลงในวันที่ 6 มี.ค. 65 เพิ่มเติมอีก 2 สัปดาห์ จนถึง 21 มี.ค. 65 ได้แก่ กรุงโตเกียว ไซตามะ ชิบะ คานากาวะ กิฟุ ไอจิ มิเอะ เกียวโต โอซากา และเฮียวโกะ โดยเตรียมหารือผู้เชี่ยวชาญและจะประกาศผลการพิจารณาอย่างเป็นทางการต่อไป
2 มีนาคม 2565 - นาย Shigeyuki GOTO รมว.สาธารณสุขฯ ญี่ปุ่น แถลงต่อผู้สื่อข่าวว่า เมื่อวันที่ 1 มี.ค. 2565 รัฐบาลญี่ปุ่นได้ผ่านร่างแก้ไขกฎหมายเวชภัณฑ์และยาเพื่อให้สามารถอนุมัติวัคซีนและยารักษาโรคได้รวดเร็วมากยิ่งขึ้นในช่วงวิกฤติที่มีการแพร่ระบาดของโรคติดต่อ หากไม่มีทางเลือกอื่น และหากมีข้อมูลจากต่างประเทศรับรองประสิทธิภาพและความปลอดภัยในการใช้ยาจากการทดลองทางคลินิก อย่างไรก็ดี สามารถยกเลิกการใช้ยาได้ หากไม่มีข้อมูลทางวิทยาศาสตร์สนับสนุนเพิ่มเติมภายใน 2 ปี ปัจจุบันระบบการอนุมัติวัคซีนและยารักษาโรคของญี่ปุ่นมักใช้เวลานานกว่าสหรัฐฯ และ EU ประมาณ 2-5 เดือน นอกจากนี้ ยังมีแนวคิดเสนอการนำระบบใบสั่งยาดิจิทัลมาใช้แทนใบสั่งยาที่อยู่ในรูปแบบกระดาษในปัจจุบัน ซึ่งจะช่วยจัดการข้อมูลยาและประวัติการจ่ายยาให้กับผู้ป่วยได้เป็นระบบมากขึ้น
3 มีนาคม 2565 - กลุ่มผู้เชี่ยวชาญที่ปรึกษาของกระทรวงสาธารณสุขฯ ของญี่ปุ่นได้แถลงต่อสื่อมวลชนเกี่ยวกับสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอนภายในญี่ปุ่นในช่วงสัปดาห์ที่ผ่านมา รายละเอียดดังนี้
* ในช่วงสัปดาห์ที่ผ่านมา (23 ก.พ. -1 มี.ค.) ค่าเฉลี่ยของจำนวนผู้ติดเชื้อรายใหม่ต่อจำนวนประชากร 1 แสนคนของจังหวัดโอซากาสูงที่สุดในญี่ปุ่น เท่ากับ 637.88 คน รองลงมา ได้แก่ กรุงโตเกียว 563.72 คน นาระ 484.57 คน และคานากาวะ 467.14 คน โดยค่าเฉลี่ยของจำนวนผู้ติดเชื้อรายใหม่ทั่วประเทศ เท่ากับ 364.29 ต่อจำนวนประชากร 1 แสนคน
* จำนวนผู้ติดเชื้อรายใหม่ทั่วประเทศมีแนวโน้มลดลงอย่างช้า ๆ ในทุกช่วงกลุ่มอายุ โดยค่าเฉลี่ยของอัตราผู้ติดเชื้อใหม่ทั่วประเทศภายใน 1 สัปดาห์เมื่อเทียบกับสัปดาห์ที่แล้วเท่ากับ 0.84 อย่างไรก็ดี อัตราการแพร่เชื้อไปยังผู้อื่นในพื้นที่ซึ่งไม่มีการประกาศสถานการณ์กึ่งฉุกเฉินเพิ่มขึ้นในหลายจังหวัด ทั้งนี้ คาดการณ์ว่าจำนวนผู้ติดเชื้อรายใหม่อาจมีแนวโน้มจะกลับมาอยู่ในระดับสูงอีกครั้ง
* จำนวนผู้ป่วยติดเชื้ออาการรุนแรงและผู้เสียชีวิตลดลง อย่างไรก็ดี จำนวนผู้ติดเชื้ออาการเบาและอาการรุนแรงปานกลางยังคงอยู่ในระดับสูงซึ่งสร้างภาระหนักให้กับระบบสาธารณสุขโดยรวม ทั้งนี้ มีความเป็นไปได้ที่สัดส่วนผู้ป่วยติดเชื้ออาการรุนแรงต่อจำนวนเตียงที่สำรองไว้จะสูงขึ้นอีกครั้ง จึงจำเป็นที่จะต้องเร่งฉีดวัคซีนให้กับผู้มีความเสี่ยงสูง เช่น กลุ่มผู้สูงอายุและผู้มีโรคประจำตัว
* เชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 ซึ่งแพร่เชื้อระหว่างบุคคลได้ง่าย อาจแพร่ระบาดเพิ่มมากขึ้น โดยคาดว่าในช่วงเดือน เม.ย. 2565 สัดส่วนของผู้ติดเชื้อของเชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 อาจเพิ่มขึ้นถึงร้อยละ 74 ของจำนวนผู้ติดเชื้อไวรัสสายพันธุ์โอไมครอนทั้งหมด
* ในช่วงสิ้นเดือน มี.ค. จะเข้าสู่ช่วงจบปีการศึกษา วันหยุดภาคฤดูใบไม้ผลิ การย้ายสถานที่ ทำงาน สถานศึกษา และย้ายบ้าน รวมถึงเทศกาลชมดอกไม้ ซึ่งประชาชนซึ่งไม่ได้พบกันมานานจะมาสังสรรค์รวมตัวกัน ประกอบกับการคาดการณ์ว่าเชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 อาจแพร่ระบาดมากขึ้น จึงขอความร่วมมือประชาชนเพิ่มความระมัดระวังป้องกันตนเองจากการติดเชื้อ เช่น หลีกเลี่ยงสถานที่มีคนหมู่มากและมีความเสี่ยงสูง สวมหน้าการอนามัยแบบใยสังเคราะห์อย่างถูกต้อง ทำความสะอาดฆ่าเชื้อล้างมือ ระบายถ่ายเทอากาศภายในห้องเป็นประจำ เป็นต้น
- แหล่งข่าวรัฐบาลญี่ปุ่นระบุว่า ญี่ปุ่นอาจเพิ่มจำนวนผู้ที่สามารถเดินทางเข้าญี่ปุ่นได้จากเดิม 5,000 คน/วัน เป็น 7,000 คน/วัน เพื่อเปิดให้นักเรียน/นักศึกษาต่างชาติที่ยังรอเดินทางเข้าประเทศญี่ปุ่นกว่า 1 แสนคน สามารถเดินทางไปศึกษาได้ ทั้งนี้ คาดว่า นรม.คิชิดะ จะแถลงข่าวอย่างเป็นทางการในวันนี้ (3 มี.ค. 2565)
9 มีนาคม 2565 นาย MATSUNO Hirokazu เลขาธิการคณะรัฐมนตรีแถลงต่อผู้สื่อข่าวว่า ตั้งแต่วันที่ 14 มี.ค. 2565 รัฐบาลญี่ปุ่นจะเพิ่มจำนวนผู้ที่สามารถเดินทางเข้าญี่ปุ่นได้เป็น 7,000 คนต่อวัน โดยจะให้ความสำคัญอันดับต้นกับกลุ่มนักเรียนและนักศึกษาต่างชาติที่รอเดินทางเข้าญี่ปุ่น 1.5 แสนคน ทั้งนี้ จะจัดสรรที่ว่างในเที่ยวบินระหว่างวันจันทร์ถึงศุกร์ที่มีผู้โดยสารไม่เต็มลำ เนื่องจากมักมีนักธุรกิจเดินทางมาน้อย ซึ่งคาดว่า จะทำให้สามารถรับนักศึกษากลุ่มข้างต้นได้เกือบทั้งหมดภายในสิ้นเดือน พ.ค. 2565 นี้
- กลุ่มผู้เชี่ยวชาญที่ปรึกษาของกระทรวงสาธารณสุขฯ ญี่ปุ่นได้แถลงต่อสื่อมวลชนเกี่ยวกับสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอนภายในญี่ปุ่นในช่วงสัปดาห์ที่ผ่านมา (2-8 มี.ค. 2565) รายละเอียดดังนี้
* ในช่วง 2-8 มี.ค. 2565 มีค่าเฉลี่ยของจำนวนผู้ติดเชื้อรายใหม่ต่อจำนวนประชากร 1 แสนคนสูงที่สุดในจังหวัดโอซากา 506.67 คน รองลงมาได้แก่ กรุงโตเกียว 497.72 คน นาระ 462.27 คน และคานากาวะ 451.85 คน โดยจำนวนผู้ติดเชื้อรายใหม่ทั่วประเทศมีค่าเฉลี่ย 329.02 ต่อจำนวนประชากร 1 แสนคน
* จำนวนผู้ติดเชื้อรายใหม่ทั่วประเทศมีแนวโน้มลดลงอย่างช้า ๆ หากเทียบกับการแพร่ระบาดระลอกที่ 5 ในช่วงฤดูร้อนปี 2564 เนื่องจากมีการแพร่ระบาดในกลุ่มเด็กที่มีอายุต่ำกว่า 10 ปี และผู้สูงอายุแบบกลุ่มก้อนอย่างต่อเนื่อง โดยเฉพาะในเมืองใหญ่ อย่างไรก็ดี ในหลายจังหวัด สถานการณ์การแพร่ระบาดยังคงอยู่ในระดับสูงต่อไปอีกระยะ
* ถึงแม้จำนวนผู้เสียชีวิตและผู้ป่วยอาการรุนแรงทั่วประเทศจะมีแนวโน้มลดลง แต่จำนวนผู้ป่วยทั้งอาการเบา ปานกลาง และรุนแรงต่อจำนวนเตียงสำรองยังอยู่ในระดับสูงในหลายพื้นที่ ส่งผลให้สถานพยาบาลในพื้นที่ดังกล่าวยังอยู่ในสถานการณ์ตึงเครียดไปอีกระยะ นอกจากนี้ พบกลุ่มผู้สูงอายุเสียชีวิตเพิ่มมากขึ้น โดยเฉพาะผู้ที่อายุ 80 ปีขึ้นไป เนื่องจากเชื้อไวรัสโควิด-19 ส่งผลให้โรคประจำตัวมีอาการรุนแรงขึ้นและเสียชีวิต ผู้เชี่ยวชาญจึงแนะนำให้เร่งเข้ารับการฉีดวัคซีน และต้องรักษาโรคประจำตัวอย่างต่อเนื่อง
* ปัจจุบัน สถานอนามัยอยู่ในภาวะที่ไม่สามารถให้คำปรึกษาหรือมีความเห็นว่าบุคคลใดเป็นผู้สัมผัสใกล้ชิดผู้ติดเชื้อหรือไม่ จึงขอให้เจ้าตัวและองค์กรที่เกี่ยวข้อง ช่วยตัดสินว่าบุคคลดังกล่าวเป็นผู้ติดเชื้อหรือไม่ และหามาตรการกักตัวตนเองและผู้สัมผัสใกล้ชิด เพื่อป้องกันกันการแพร่ระบาดอย่างเหมาะสม กรณีการติดเชื้อภายในครอบครัวและบ้านพักคนชรา ควรมีการตรวจสอบและดำเนินการป้องกันการแพร่ระบาดที่เข้มงวดมากกว่าปกติ เนื่องจากเป็นกลุ่มที่มีความเสี่ยงเกิดการแพร่ระบาดสูง
* ในช่วงสิ้นเดือน มี.ค. ซึ่งจะเข้าสู่ช่วงจบปีการศึกษา วันหยุดภาคฤดูใบไม้ผลิ การย้ายสถานที่ ทำงาน สถานศึกษา และย้ายบ้าน รวมถึงเทศกาลชมดอกไม้ ซึ่งจะมีการพบปะและรวมตัวของคนหมู่มาก รวมถึงอาจจะมีการแพร่ระบาดเพิ่มมากขึ้นของเชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 ถึงประมาณร้อยละ 70 ของจำนวนผู้ติดเชื้อไวรัสสายพันธุ์โอไมครอนทั้งหมด (มากกว่าปัจจุบันประมาณ 1.2 เท่า) จึงขอความร่วมมือประชาชนเพิ่มความระมัดระวังป้องกันตนเองจากการติดเชื้อ เช่น หลีกเลี่ยงสถานที่มีคนหมู่มากและมีความเสี่ยงสูง สวมหน้าการอนามัยแบบใยสังเคราะห์อย่างถูกต้อง ทำความสะอาดฆ่าเชื้อล้างมือ ระบายถ่ายเทอากาศภายในห้องเป็นประจำ เป็นต้น
สถานเอกอัครราชทูต ณ กรุงโตเกียวขอแจ้งข้อมูลเพิ่มเติมเกี่ยวกับการลงทะเบียนบนระบบ Thailand Pass เพื่อขอรับ Thailand Pass QR Code สำหรับเดินทางกลับประเทศไทย LINK
สถานเอกอัครราชทูต ณ กรุงโตเกียวขอแจ้งข้อมูลเพิ่มเติมเกี่ยวกับการลงทะเบียนบนระบบ Thailand Pass เพื่อขอรับ Thailand Pass QR Code สำหรับเดินทางกลับประเทศไทย ดังนี้
1. ทั้งชาวไทยและชาวต่างชาติทุกคนที่ประสงค์จะเดินทางไปยังประเทศไทย ต้องลงทะเบียนบนระบบ Thailand Pass ที่ https://tp.consular.go.th/ เท่านั้น เพื่อขอรับ Thailand Pass QR Code สำหรับเดินทางกลับประเทศไทย โดยระบบจะใช้เวลา 3 - 7 วัน ในการพิจารณาคำร้องของท่าน จึงขอแนะนำให้ผู้เดินทางลงทะเบียนอย่างน้อย 7 วันก่อนเดินทาง
2. ระบบ Thailand Pass จะไม่อนุญาตให้ลงทะเบียนสำหรับการเดินทางที่น้อยกว่า 2 วันหลังวันลงทะเบียน เพื่อป้องกันมิให้ผู้เดินทางประสบปัญหายุ่งยากหากต้องเลื่อนการเดินทาง เนื่องจากลงทะเบียนกระชั้นชิดจนเกินไป
3. สำหรับผู้ที่ฉีดวัคซีนในญี่ปุ่นครบถ้วนตามเกณฑ์ข้อกำหนดของประเทศไทยแล้ว โปรดติดต่อที่ว่าการเขต/อำเภอ/เมือง (区役所 หรือ 市役所) ที่ท่านพักอาศัย เพื่อขอใบรับรองการฉีดวัคซีน หรือ Vaccination Certificate of COVID-19 เป็นภาษาอังกฤษอย่างเป็นทางการ (ตัวอย่างใบรับรองการฉีดวัคซีนปรากฏตามแนบ) เพื่อใช้เป็นหลักฐานยื่นประกอบในระบบ Thailand Pass โดยกระบวนการออกใบรับรองนี้ใช้เวลาประมาณ 1 - 2 สัปดาห์ จึงขอให้ผู้เดินทางเตรียมตัวล่วงหน้าก่อนเดินทาง ทั้งนี้ สามารถตรวจสอบรายละเอียดเพิ่มเติม เกี่ยวกับใบรับรองการฉีดวัคซีนบนเว็บไซต์กระทรวงสาธารณสุขญี่ปุ่น ได้ที่ https://www.mhlw.go.jp/stf/covid-19/certificate.html
9 มีนาคม 2565 - นาย OZAKI Haruo ประธานสมาคมแพทย์แห่งกรุงโตเกียว แถลงต่อผู้สื่อข่าวเตือนให้ประชาชนระมัดระวังตนเองจากการติดเชื้อฯ ในช่วงนี้ซึ่งเป็นวันหยุดช่วงฤดูใบไม้ผลิของสถานศึกษา และจะเข้าช่วงสิ้นปีงบประมาณญี่ปุ่นที่ประชาชนมีโอกาสพบปะกินเลี้ยงสังสรรค์มากขึ้น จึงอาจเกิดการแพร่ระบาดระลอกใหม่ขึ้นอีกครั้งได้ เดิมเห็นว่าความรุนแรงของการแพร่ระบาดของเชื้อไวรัสโควิด-19 ได้ผ่านจุดสูงสุดไปแล้ว อย่างไรก็ดี การแพร่ระบาดไม่ได้ลดลงอย่างรวดเร็วอย่างที่คาดการณ์ไว้ จึงยังจำเป็นต้องเฝ้าระวังสถานการณ์การแพร่ระบาดฯ ต่อไป
15 มีนาคม 2565 - ตามที่ปัจจุบันญี่ปุ่นมีจำนวนผู้ติดเชื้อลดลงอย่างต่อเนื่อง รัฐบาลญี่ปุ่นอาจพิจารณายกเลิกการประกาศสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ทั่วประเทศในพื้นที่ 18 จังหวัด ซึ่งรวมพื้นที่กรุงโตเกียว โอซากา และไอจิ ที่กำหนดจะสิ้นสุดในวันที่ 21 มีนาคม 2565 เพื่อเร่งฟื้นฟูกิจกรรมทางเศรษฐกิจและสังคมให้กลับมาเป็นปกติก่อนเริ่มฤดูใบไม้ผลิ ซึ่งเป็นช่วงเริ่มต้นปีงบประมาณของญี่ปุ่น ทั้งนี้ จะต้องเข้าเงื่อนไข 1 ใน 2 ประการ ได้แก่
1) หากสัดส่วนจำนวนผู้ป่วยต่อจำนวนเตียงที่สำรองปรับตัวดีขึ้น ถึงแม้ว่าแนวโน้มจำนวนผู้ติดเชื้อรายใหม่จะยังอยู่ในระดับสูงหรือสูงขึ้นเพียงน้อย หรือ
2) หากแนวโน้มจำนวนผู้ติดเชื้อรายใหม่มีแนวโน้มลดลง ถึงแม้ว่าสัดส่วนจำนวนผู้ป่วยต่อจำนวนเตียงที่สำรองจะสูงเกินร้อยละ 50
อย่างไรก็ดี ยังคงมีความกังวลอยู่ว่า เชื้อไวรัสโอไมครอนสายพันธุ์ BA.2 อาจทำให้เกิดการแพร่ระบาดรุนแรงระลอกใหม่อีกครั้ง
- นรม.คิชิดะ แถลงต่อผู้สื่อข่าวว่า รัฐบาลเตรียมที่จะเริ่มโครงการ Go To Travel อีกครั้งในเวลาที่เหมาะสม โดยจะพิจารณาสถานการณ์การแพร่ระบาดภายในประเทศ และหารือกับผู้เชี่ยวชาญเพื่อหาช่วงเวลาที่เหมาะสม
16 มี.ค. 2565 - นรม.คิชิดะ ประกาศยกเลิกสถานการณ์กึ่งฉุกเฉิน (มัมโบ) ใน 18 จังหวัดทุกพื้นที่ทั่วประเทศญี่ปุ่น ซึ่งจะมีกำหนดสิ้นสุดลงในวันที่ 21 มี.ค. นี้ สรุปสาระสำคัญ ดังนี้
• นรม.คิชิดะ กล่าวว่า จำนวนผู้ติดเชื้อใหม่มีแนวโน้มลดลง และดูเหมือนว่ากำลังจะสิ้นสุดการระบาดระลอกที่ 6 ในเร็ว ๆ นี้ อย่างไรก็ดี ประชาชนยังควรป้องกันตนเองจากการติดเชื้อและเฝ้าระวังสถานการณ์อย่างใกล้ชิด เนื่องจากช่วงหลังจากนี้ถือเป็นช่วงเปลี่ยนผ่าน และต้องป้องกันไม่ให้มีการกลับมาระบาดซ้ำอีก
• รัฐบาลญี่ปุ่นเตรียมสำรองวัคซีน Pfizer จำนวน 75 ล้านโดส และ Moderna จำนวน 70 ล้านโดสเพิ่มเติม ในกรณีที่อาจจำเป็นต้องฉีดวัคซีนเข็มที่ 4 นอกจากนี้ ได้เตรียมสำรองยารักษาการติดเชื้อฯ อีกจำนวน 3 ล้านโดส และชุดตรวจโควิด-19 เพิ่มเติมอีก 3.5 ล้านชุด
• ปรับเปลี่ยนคำจำกัดความของผู้ที่มีสัมผัสใกล้ชิดกับผู้ติดเชื้อให้ครอบคลุมเฉพาะการติดเชื้อในโรงพยาบาลและบ้านพักคนชราเท่านั้น เนื่องจากเป็นกลุ่มที่มีความเสี่ยงที่ผู้ป่วยอาการพัฒนารุนแรง และจะต้องรายงานให้กระทรวงสาธารณสุขฯ ทราบ การปรับเปลี่ยนดังกล่าวทำให้ไม่ต้องรายงานผู้ที่มีสัมผัสใกล้ชิดในที่ทำงานและสถานที่อื่น ๆ ต่อกระทรวงสาธารณสุขฯ และช่วยลดภาระสถานอนามัยในการจัดการข้อมูลการติดเชื้อในบริษัททั่วประเทศที่มีจำนวนมากเกินกว่าที่จะรับมือข้อมูลทั้งหมดได้ และเพื่อให้กิจกรรมทางเศรษฐกิจและสังคมสามารถดำเนินต่อไปได้
• วางแผนให้เงินอุดหนุนเพื่อส่งเสริมให้ประชาชนท่องเที่ยวภายในจังหวัดภายในเดือน เม.ย. 2565 โดยจะพิจารณาผลกระทบของโครงการต่อสถานการณ์การแพร่ระบาดอีกครั้ง ก่อนพิจารณารื้อฟื้นการดำเนินโครงการ Go To Travel อย่างเต็มรูปแบบในช่วงเวลาที่เหมาะสม
16 มีนาคม 2565 รายงานการเกิดแผ่นดินไหวใหญ่ขนาดแม็กนิจูด 7.3 มีศูนย์กลางในทะเลใกล้ จ.ฟุคุชิมะ LINK
16 มีนาคม 2565 23.36 น. ตามเวลาท้องถิ่นในประเทศญี่ปุ่น (เร็วกว่าไทย 2 ชั่วโมง) เกิดแผ่นดินไหวใหญ่ขนาดแม็กนิจูด 7.3โดยมีศูนย์กลางในทะเลใกล้ จ.ฟุคุชิมะ แรงสั่นสะเทือนสัมผัสได้ในพื้นที่ดังกล่าวและจังหวัดใกล้เคียง รวมถึงกรุงโตเกียว โดยแรงสั่นสะเทือนสูงสุดอยูที่ระดับ 6+ ตามระบบของญี่ปุ่น
กรมอุตุนิยมวิทยาญี่ปุ่นแจ้งเตือนให้ประชาชนที่อาศัยในพื้นที่จังหวัดฟุคุชิมะ และมิยากิ ระวังคลื่นสึนามิสูงที่ระดับ 1 เมตร ในขณะนี้ยังไม่มีรายงานคนไทยได้รับบาดเจ็บหรือเสียชีวิตเนื่องมาจากแผ่นดินไหวดังกล่าว
อย่างไรก็ดี ขอให้ประชาชนในพื้นที่ดังกล่าวโปรดดูแลรักษาตัวและเฝ้าระวังสถานการณ์โดยติดตามข่าวสารของทางการญี่ปุ่นอย่างต่อเนื่อง ในกรณีที่อาจเกิดแผ่นดินไหวตามมา (aftershocks)
กรณีฉุกเฉิน สามารถติดต่อสถานเอกอัครราชทูตฯ ได้ทางหมายเลขโทรศัพท์ HOTLINE 090-4435-7812
สถานะ ณ วันที่ 16 มีนาคม 2565 เวลา 23.50 น.
17 มีนาคม 2565 - รัฐบาลญี่ปุ่นได้ประกาศยกเลิกมาตรการกึ่งฉุกเฉิน (มัมโบ) ใน 18 จังหวัด ได้แก่ ฮอกไกโด อาโอโมริ กุมมะ โทชิกิ อิบารากิ ไซตามะ โตเกียว คานากาวะ ชิบะ ชิสึโอกะ อิชิคาวะ กิฟุ ไอจิ เกียวโต เฮียวโกะ โอซากา คากาวะ และคุมาโมโตะ โดยจะสิ้นสุดวันที่ 21 มีนาคม 2565 นับเป็นครั้งแรกในรอบ 2 เดือนครึ่ง หลังจากวันที่ 8 มกราคม 2565 ที่มีการยกเลิกมาตรการมัมโบในทุกพื้นที่ทั่วประเทศ อย่างไรก็ดี เพื่อเป็นการป้องกันการแพร่ระบาดของเชื้อไวรัสโควิด-19 รัฐบาลยังคงสนับสนุนให้ลดการเข้าทำงานพร้อมกัน หรือการเข้าประชุมที่มีการรวมตัว และเสี่ยงต่อการติดเชื้อ
23 มีนาคม 2565 - นาย YAMAGIWA Daishirou รมต.ดูแลสถานการณ์การแพร่ระบาดของเชื้อโควิด-19 แถลงต่อผู้สื่อข่าวว่า รัฐบาลมีแผนจะขยายมาตรการตรวจเชื้อไวรัสโควิด-19 แบบแอนติเจนฟรีออกไปจนถึงสิ้นเดือน มิ.ย. 2565 ซึ่งมีความจำเป็น หลังจากที่รัฐบาลได้ยกเลิกการประกาศสถานการณ์กึ่งฉุกเฉินทั่วประเทศเพื่อฟื้นฟูกิจกรรมทางเศรษฐกิจและสังคมภายในประเทศ ประชาชนที่ไม่มีอาการป่วยและสงสัยว่าตนเองอาจติดเชื้อไวรัสโควิดฯ สามารถเข้ารับการตรวจได้ฟรีจนถึงสิ้นเดือน มิ.ย. นี้ นอกจากนี้ ขอความร่วมมือประชาชนป้องกันตนเองจากการติดเชื้ออย่างต่อเนื่องต่อไป
28 มีนาคม 2565 - กระทรวงสาธารณสุขฯ ญี่ปุ่น แนะนำให้ผู้ติดเชื้อโควิด-19 ฉีดวัคซีนภายหลังจากการติดเชื้อเป็นเวลา 90 วันเป็นต้นไป
31 มีนาคม 2565 - กรุงโตเกียวรายงานผลการสำรวจประชากรกลุ่มตัวอย่าง พบว่า มีผู้ติดเชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอน ชนิด BA.2 ระหว่างวันที่ 8-14 มี.ค. 2565 จำนวนร้อยละ 39.6 และระหว่างวันที่ 15-21 มี.ค. 2565 มีผู้ได้รับเชื้อสายพันธุ์ดังกล่าวเพิ่มขึ้นถึงร้อยละ 52.3 ซึ่งสะท้อนให้เห็นว่า ในปัจจุบัน การติดเชื้อส่วนใหญ่ได้กลายจากชนิด BA.1 เป็น BA.2 แล้ว
กลุ่มที่ปรึกษาของกระทรวงสาธารณสุขฯ ญี่ปุ่น แถลงเกี่ยวกับสถานการณ์การแพร่ระบาดของเชื้อไวรัสโควิด-19 สายพันธุ์โอไมครอนภายในญี่ปุ่นในช่วงสัปดาห์ที่ผ่านมา ดังนี้
• ในช่วง 23 – 29 มี.ค. 65 มีค่าเฉลี่ยของจำนวนผู้ติดเชื้อรายใหม่ต่อประชากร 1 แสนคนในจังหวัดโอกินาวะสูงที่สุด 394.01 คน รองลงมาได้แก่ กรุงโตเกียว 357.84 คน ไซตามะ 327.75 คน โอซากา 290.59 คน และอาโอโมริ 284.01 คน โดยจำนวนผู้ติดเชื้อรายใหม่ทั่วประเทศมีค่าเฉลี่ย 240 คน ต่อประชากร 1 แสนคน
• จำนวนผู้ติดเชื้อรายใหม่มีแนวโน้มสูงขึ้นอย่างช้า ๆ โดยเฉพาะในกลุ่มวัยรุ่นอายุ 20 – 29 ปี ค่าเฉลี่ยทั่วประเทศของอัตราการแพร่เชื้อไปยังผู้อื่นเมื่อเทียบกับสัปดาห์ที่ผ่านมาเพิ่มขึ้นเป็น 1.04 ซึ่งเป็นการเพิ่มครั้งแรกในรอบ 1 เดือนครึ่ง สาเหตุหลักมาจาก 2 ประเด็นหลัก ได้แก่ การยกเลิกมาตรการกึ่งฉุกเฉิน ซึ่งส่งผลให้ประชาชนออกไปทำกิจกรรมนอกบ้านมากขึ้น เช่น การพบปะสังสรรค์ทั้งกลางวันและกลางคืน และการแพร่ระบาดของไวรัสโอไมครอนสายพันธุ์ BA.2 ซึ่งแพร่ระบาดได้ง่ายกว่า ทั้งนี้ สาเหตุที่อัตราการเพิ่มขึ้นเป็นไปอย่างช้า ๆ เนื่องจากประชาชนได้รับการฉีดวัคซีนกระตุ้นเข็มที่ 3 โดยเฉพาะกลุ่มผู้สูงอายุ รวมถึงมีการเปิดช่องลมช่วยระบายอากาศภายในอาคารเนื่องจากอากาศอุ่นขึ้น
• ผู้เชี่ยวชาญคาดว่าในเมืองใหญ่ เช่น กรุงโตเกียวและจังหวัดโอซากา มีแนวโน้มว่าอาจเกิดการแพร่ระบาดรุนแรงได้อีกครั้ง เนื่องจากมีอัตราการตรวจพบเชื้อไวรัสเป็นบวกมากขึ้น แต่ยังไม่ถึงระดับที่มีการแพร่ระบาดในวงกว้าง
• รัฐบาลญี่ปุ่นอาจพิจารณาดำเนินมาตรการป้องกันการแพร่ระบาดอีกครั้ง หากพบว่าสถานการณ์การให้บริการด้านการแพทย์อยู่ในภาวะคับขัน ทั้งนี้ ต้องการหลีกเลี่ยงการประกาศสถานการณ์ฉุกเฉิน/กึ่งฉุกเฉิน เนื่องจากเกรงจะส่งผลกระทบทางลบต่อกิจกรรมทางเศรษฐกิจและสังคม
4 เมษายน 2565 - รัฐบาลญี่ปุ่นเตรียมเพิ่มจำนวนผู้ที่ได้รับอนุญาตให้เดินทางเข้าญี่ปุ่นได้ต่อวัน จากเดิม 7,000 คน เป็น 10,000 คนต่อวัน ตั้งแต่วันที่ 10 เม.ย. 2565 เป็นต้นไป เพื่อรองรับความต้องการของนักศึกษาต่างชาติ และชาวญี่ปุ่นที่ต้องการเดินทางกลับประเทศมากขึ้น อนึ่ง ยังไม่อนุญาตกลุ่มนักท่องเที่ยวเดินทางเข้าญี่ปุ่น
10 มิถุนายน 2565 วันแรก ลงทะเบียน 3.5 แสนคน
จากการปลดล็อกกัญชา กัญชง มีผลบังคับใช้ได้วันเดียว เมื่อวันที่ 9 มิถุนายน 2565 นี้ อย.ได้เปิดตัวแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” (Plookganja) เพื่อช่วยประชาชนในการจดแจ้งการปลูก กัญชา กัญชง ได้อย่างสะดวก รวดเร็ว โดยถึงปัจจุบันนี้ วันที่ 10 มิถุนายน 2565 ณ เวลา 12.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 24,975,095 ครั้ง ลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 356,287 คน
11 มิถุนายน 2565 เวลา 07.00 น. ลงทะเบียนเพิ่มเป็น 5.8 แสนคน
11 มิถุนายน 2565 ณ เวลา 07.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 32,106,554 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 582,399 คน
11 มิถุนายน 2565 เวลา 12.00 น. ลงทะเบียน 6.14 แสนคน
11 มิถุนายน 2565 ณ เวลา 12.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 32,416,944 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 614,891 คน
11 มิถุนายน 2565 เวลา 17.00 น. ลงทะเบียน 6.4 แสนคน
11 มิถุนายน 2565 ณ เวลา 17.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 33,124,036 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 640,757 คน
12 มิถุนายน 2565 เวลา 07.00 น. ลงทะเบียน 6.7 แสนคน
12 มิถุนายน 2565 ณ เวลา 07.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 33,905,095 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 670,065 คน
12 มิถุนายน 2565 เวลา 12.00 น. ลงทะเบียน 6.87 แสนคน
12 มิถุนายน 2565 ณ เวลา 12.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 34,386,456 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 687,445 คน
12 มิถุนายน 2565 เวลา 17.00 น. ลงทะเบียน 7.12 แสนคน
12 มิถุนายน 2565 ณ เวลา 17.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 35,053,402 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 712,666 คน
13 มิถุนายน 2565 เวลา 17.00 น. ลงทะเบียน 7.68 แสนคน
วันที่ 13 มิถุนายน 2565 ณ เวลา 17.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 36,591,429 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 768,647 คน
14 มิถุนายน 2565 เวลา 07.00 น. ลงทะเบียน 7.85 แสนคน
14 มิถุนายน 2565 ณ เวลา 07.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 37,093,501 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 785,192 คน
14 มิถุนายน 2565 เวลา 17.00 น. ลงทะเบียน 8 แสนคน
วันที่ 14 มิถุนายน 2565 ณ เวลา 17.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 37,688,483 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 806,759 คน
15 มิถุนายน 2565 เวลา 07.00 น. ลงทะเบียน 8.17 แสนคน
วันที่ 15 มิถุนายน 2565 ณ เวลา 07.00 น. ได้มีผู้ที่ให้ความสนใจเข้าใช้งานแอปพลิเคชันและเว็บไซต์ “ปลูกกัญ” เป็นจำนวนมากกว่า 38,051,445 ครั้ง และลงทะเบียนจดแจ้งการปลูก กัญชา กัญชง กว่า 817,749 คน
7-9 กรกฎาคม 2565 เวลา 19.00 น.
วันพฤหัสบดีที่ 7 กรกฎาคม 2565 เวลา 19.00 น.
2499 อันธพาลครองเมือง (2540) ที่ ลานคนเมือง
รถไฟฟ้ามาหานะเธอ (2552) ที่ True Digital Park เขตพระโขนง
วันศุกร์ที่ 8 กรกฎาคม 2565 เวลา 19.00 น.
เวลาในขวดแก้ว (2534) ที่ ลานคนเมือง
36 (2555) ที่ True Digital Park เขตพระโขนง
วันเสาร์ที่ 9 กรกฎาคม 2565 เวลา 19.00 น.
แพรดำ (2504) ที่ ลานคนเมือง
แม่นาคพระโขนง (2502) ที่ True Digital Park เขตพระโขนง
14-16 กรกฎาคม 2565 เวลา 19.00 น.
วันพฤหัสบดีที่ 14 กรกฎาคม 2565 เวลา 19.00 น.
RRR (2565) ที่ ศูนย์เยาวชนคลองเตย เขตคลองเตย
4 Kings (2564) ที่ สวนรถไฟ เขตจตุจักร
วันศุกร์ที่ 15 กรกฎาคม 2565 เวลา 19.00 น.
มนต์รักทรานซิสเตอร์ (2544) ที่ ศูนย์เยาวชนคลองเตย เขตคลองเตย
Portrait of a Lady on Fire (2562) ที่ สวนรถไฟ เขตจตุจักร
วันเสาร์ที่ 16 กรกฎาคม 2565 เวลา 19.00 น.
บุญชูผู้น่ารัก (2531) ที่ ศูนย์เยาวชนคลองเตย เขตคลองเตย
สวรรค์มืด (2501) ที่ สวนรถไฟ เขตจตุจักร
21-23 กรกฎาคม 2565 เวลา 19.00 น.
วันพฤหัสบดีที่ 21 กรกฎาคม 2565 เวลา 19.00 น.
หมานคร (2547) ที่ สวนเบญจกิติ เขตคลองเตย
Fast and Furious (2552) ที่ ตลาดบางแคภิรมย์ เขตบางแค
วันศุกร์ที่ 22 กรกฎาคม 2565 เวลา 19.00 น.
อนธการ (2558) ที่ สวนเบญจกิติ เขตคลองเตย
ชัตเตอร์ กดติดวิญญาณ (2547) ที่ ตลาดบางแคภิรมย์ เขตบางแค
วันเสาร์ที่ 23 กรกฎาคม 2565 เวลา 19.00 น.
Wheel of Fortune and Fantasy (2564) ที่ สวนเบญจกิติ เขตคลองเตย
เพื่อนสนิท (2548) ที่ ตลาดบางแคภิรมย์ เขตบางแค
28-31 กรกฎาคม 2565 เวลา 19.00 น.
วันพฤหัสบดีที่ 28 กรกฎาคม 2565 เวลา 19.00 น.
รักแห่งสยาม (2550) ที่ Block I สยามสแควร์
คู่กรรม (2556) ที่ สวน 60 พรรษา สมเด็จพระนางเจ้าพระบรมราชินีนาถ เขตลาดกระบัง
วันศุกร์ที่ 29 กรกฎาคม 2565 เวลา 19.00 น.
Seasons Change เพราะอากาศเปลี่ยนแปลงบ่อย (2549) ที่ Block I สยามสแควร์
พี่นาค (2562) ที่ สวน 60 พรรษา สมเด็จพระนางเจ้าพระบรมราชินีนาถ เขตลาดกระบัง
วันเสาร์ที่ 30 กรกฎาคม 2565 เวลา 19.00 น.
สยามสแควร์ (2527) ที่ Block I สยามสแควร์
มือปืน (2526) ที่ สวน 60 พรรษา สมเด็จพระนางเจ้าพระบรมราชินีนาถ เขตลาดกระบัง
วันอาทิตย์ที่ 31 กรกฎาคม 2565 เวลา 19.00 น.
School Town King แร็ปทะลุฝ้า ราชาไม่หยุดฝัน (2563) ที่ สวนครูองุ่น เขตวัฒนา
One for the Road วันสุดท้ายก่อนบายเธอ (2564) ที่ มศว. ประสานมิตร เขตวัฒนา
ย่อๆ เกี่ยวกับหนัง
แม่นาคพระโขนง ปี 2502
แม่นาคพระโขนง ปี 2502 หนังผีเงินล้านเรื่องแรกของเมืองไทย ขนหัวลุกกันทั้งบาง แต่ก็ยังคลั่งจะชมผีนางนาค ผีคลาสสิคประเทศไทย นำแสดงโดย สุรสิทธิ์ สัตยวงศ์ ปรียา รุ่งเรือง วิน วิษณุรักษ์, ดอกดิน กัญญามาลย์, ล้อต๊อก, แป๊ะอ้วน, ทองฮะ, ก๊กเฮง, เสน่ห์ โกมารชุน, สมจิตร ทรัพย์สำรวย, ชูศรี โรจนประดิษฐ์, โขน หมอผี, แมน, ศุภมิตร กำกับโดย รังสี ทัศนพยัคฆ์
*ภาพจาก ThaiMoviePosters ใบปิดตอนนำกลับมาฉายใหม่ หลังจากที่เสน่ห์ โกมารชุน ซึ่งเป็นผู้อำนวยการสร้าง เสียชีวิตไปในปี 2514 บรรยายว่าเวอร์ชั่นที่นำมาฉายใหม่ป 35 ม.ม. ซูเปอร์พานาวิชั่น ใหม่เอี่ยม
แพรดำ (2504) ฟิล์มนัวร์เรื่องแรกของไทย
แพรดำ เป็นภาพยนตร์ไทย ที่ออกฉายในปี พ.ศ. 2504 ฟิล์ม 35 มม. สี เสียง ซีนีมาสโคบ สร้างโดย หนุมานภาพยนตร์ เขียนบทและกำกับภาพยนตร์โดย รัตน์ เปสตันยี นำแสดงโดย รัตนาวดี รัตนาพันธ์ เป็นบุตรสาวคนโตของ รัตน์, ทม วิศวชาติ, เสณี อุษณีษาณฑ์, ศรินทิพย์ ศิริวรรณ เป็นภาพยนตร์อาชญกรรมที่ถือได้ว่าเป็นฟิล์มนัวร์เรื่องแรกของประเทศไทย [wikipedia]
RRR (2565) หนังอินเดียดราม่าแอคชั่นมันสุดๆ ทำเงินถล่มทลาย
ถ้าใครได้ดูจะไม่แปลกใจทำไมหนังอินเดีย ภาษาเตลูกู ออกฉายในอินเดียเมื่อมีนาคม ต้นปี 2565 เรื่องนี้ ถึงโด่งดังและทำเงินถล่มทลาย (160 ล้าน USD) ครบเครื่องความบู๊ แอคชั่น แด๊นซิ่งเด็ดๆ สไตล์อินเดีย เรื่องราวของ 2 หนุ่มเพื่อนรัก ต้องหักกันในช่วงต้น ด้วยเหตุผลที่สุดขมขื่น แต่เมื่อความจริงที่ต้องเก็บไว้ถูกเปิดเผย เจตนายิ่งใหญ่ของชนชาติอินเดีย และปรารถนาจะปลดพันธนาการประเทศจากการเป็นทาสอาณานิคม กลายเป็นพลังเพื่อนและโดยโอบอุ้มของมหาเทพ ให้ภารกิจการปฎิวัติเพื่อชนชาติทำได้สำเร็จ โครงเรื่องบันดาลใจจากเรื่องราวจริงของ 2 ผู้นำการปฏิวัติในรัฐไฮเดอราบัดของบริติชอินเดีย คือ อัลลูรี สิทารามา ราจู (Alluri Sitarama Raju) และ โกมารัน ภีม (Komaram Bheem) บทนำทั้งสองแสดงโดย ราม ราจัน และ เอ็น ที รามาราว จูเนียร์ และสมทบด้วย อาเลีย บาตต์ นักแสดงหญิงคนดังแห่ง คังคุไบ
4 Kings (2564)
ดัดแปลงจากเรื่องจริงอันเป็นเรื่องราวความขัดแย้งของนักเรียนช่างกลต่างสถาบันในยุค 90 กลุ่มหนึ่ง ซึ่งในทุกการกระทำได้กลายเป็นบทเรียนชีวิตครั้งยิ่งใหญ่ เมื่อความคึกคะนองนั้นได้สร้างทั้งมิตรภาพและศัตรูขึ้นมาพร้อมๆ กัน นักแสดง เป้ –อารักษ์ อมรศุภศิริ, จ๋าย–อิชณน์กร พึ่งเกียรติรัศมี, ภูมิ – ภูมิ รังษีธนานนท์, โจ๊ก – อัครินทร์ อัครนิธิเมธรัฐ, นัท – ณัฏฐ์ กิจจริต, ทู – สิราษฎร์ อินทรโชติ และ บิ๊ก–อุกฤษ วิลลีย์บรอด ดอน กาเบรียล (D Gerrard) [sanook]
2499 อันธพาลครองเมือง (2540)
หนังไทยแอคชัน-ดราม่า ย้อนยุคกรุงเทพ 2500 ยุคนักเลงอันธพาลเบ่งบานครองเมือง ไม่หวั่นเกรงกฏหมาย หนังเรื่องแรกที่ส่งให้ผู้กำกับ นนทรีย์ นิมิบุตร ขึ้นเป็นผู้กำกับระดับตำนานอีกคนอย่างไรข้อกังขา และทำให้นักแสดงนำในเรื่องได้เกิดกันทุกคน ได้แก่ เจษฎาภรณ์ ผลดี ศุภกรณ์ กิจสุวรรณ ชาติชาย งามสรรพ์ นพชัย มัททวีวงศ์ อรรถพร ธีมากร แชมเปญ เอ็กซ์ หนังทำเงินถล่มทลาย 75 ล้านบาท
มนต์รักทรานซิสเตอร์ (2544)
มนต์รักทรานซิสเตอร์ (2544) ดราม่าสวีทคอมิดี้ ที่พลิกผันช็อคระทมเอ็นดิ้ง หนังเรื่องที่ 3 ของผู้กำกับเป็นเอก รัตนเรือง ที่สร้างจากวรรณกรรมขายดีของ วัฒน์ วรรลยางกูร การแสดงที่ยอดเยี่ยมของนักแสดงนำ ศุภกรณ์ กิจสุวรรณ สิริยากร พุกกะเวส จะทำให้คุณ ลืม "ไอ้แผน กับ สะเดา" ไม่ลง
Portrait of a Lady on Fire (2562)
Portrait of a Lady on Fire (2562) หนังดราม่าฝรั่งเศส เรื่องราวเชิงประวัติศาสตร์ยุคปลายคริสต์ศตวรรษที่ 18 ของขุนนางชั้นสูง จิตรกร และความสัมพันธ์ลึกซึ้งระหว่างหญิง หนังได้รางวัลบทยอดเยี่ยม และ Queer Palm จากคานส์ปี 2019 และเป็นเรื่องแรกที่เป็นผู้กำกับหญิง Céline Sciamma (เซลีน เซียมมา) ที่ได้รางวัลนี้ - หนังเรื่องนี้เคยฉายในไทยเมื่อมิถุนายน 2020 ในชื่อ ภาพฝันของฉันคือเธอ [ticketmelon]
โปรดใช้ถ้อยคำสุภาพ เหมาะสม เพื่อบรรยากาศที่ดีในการสนทนา และแบ่งปันข้อมูลอันมีคุณค่าต่อกัน
















































































































































































































































































































































































































































































































































































































































































































![ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day4] วันที่ 30 มิถุนายน](http://healthserv.net/imgcnt_ext/649fa48463c86.webp)





















![[update] ประกาศรายชื่อผู้มีสิทธิเข้าร่วมกิจกรรม](http://healthserv.net/imgcnt_ext/67ad9bdf2a437.webp)























































































































![ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day3] วันที่ 29 มิถุนายน](http://healthserv.net/imgcnt_ext/649fa1bf7ac6ae230701104816.webp)
![ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day2] วันที่ 28 มิถุนายน](http://healthserv.net/imgcnt_ext/649fa0dcc4426.webp)
![ภาพบรรยากาศ Bangsaen Grand Prix 2023 [Day1] วันที่ 27 มิถุนายน](http://healthserv.net/imgcnt_ext/649fa0a8bae18.webp)
















































































































































































































































































![[12 ธันวาคม 64] รพ.ชลบุรี ให้บริการตรวจหาเชื้อ Covid-19 แบบ RT-PCR และ ATK](http://healthserv.net/imgcnt_ext/60800dd1514d0e211213044214.webp)

















































































































































































































































































































































































































































































































































































































































































































































































































![งบประมาณ ฉบับประชาชน ประจำปีงบประมาณ พ.ศ. 2566 [PDF]](http://healthserv.net/imgcnt_ext/6399aff8298db.webp)


























































































































































































































































































































































































































































































































































![[Infographic] ดมยาดมบ่อยๆ ...อันตรายหรือไม่](http://healthserv.net/imgcnt_ext/66d7d47d9049d.webp)


































































































































































![4 ขั้นตอนการใช้เครื่อง AED [รฟม]](http://healthserv.net/imgcnt_ext/5fc468585d05c.webp)















































![[ยกเลิก] บุรีรัมย์ อะเมซิ่ง สงกรานต์ สาดแสง สาดสี สาดของดีบุรีรัมย์ แต่ไม่สาดน้ำ](http://healthserv.net/imgcnt_ext/606058b1429d8.webp)























































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































![[เต็มแล้ว] โรงพยาบาลเด็ก เปิดลงทะเบียนจอง เริ่ม 8 ก.พ.65](http://healthserv.net/imgcnt_ext/62066924dbc0a.webp)



































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































![[ชมคลิป] ทำไมต้องจับตาโอมิครอน โดย แพทย์หญิงวรฉัตร เรสลี](http://healthserv.net/imgcnt_ext/61b6e82a7de30.webp)























































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































![จุดชมวิว เนินนางพญา จันทบุรี [พิกัด]](http://healthserv.net/imgcnt_ext/624305feb2589.webp)
























































































































































































































































































































































































































































































































































































































































































































































![[เต็มแล้ว] อบจ.ปทุมเปิดจองโมเดอร์นา ตั้งแต่ 22 พ.ย. 64](http://healthserv.net/imgcnt_ext/619c883997450.webp)











































![[วิดีโอ] ขั้นตอนขอรับ ATK ตรวจโควิดด้วยตนเองผ่านแอปเป๋าตัง](http://healthserv.net/imgcnt_ext/61ca6c7a6922a.webp)































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































![เที่ยวสุพรรณกับรถไฟ KIHA 20-21 กรกฎาคม 2567 [มีค่าใช้จ่าย]](http://healthserv.net/imgcnt_ext/66c1f4fb5156c.webp)




















































































































































































































































































































































































































































































































































































































































































































































































































































































![เทศกาลลมหนาวและดาวเดือน วันเสาร์ที่ 25 มกราคม 2568 [ซื้อบัตร]](http://healthserv.net/imgcnt_ext/67afe826816a7.webp)




































































































































































![เทศกาลดนตรีรินมาอินดี้ 4 วันอาทิตย์ ที่ 9 กุมภาพันธ์ 2568 [ซื้อบัตร]](http://healthserv.net/imgcnt_ext/67afe68001389.webp)


























































































































































![เทศกาลดนตรี SOMTHIP MUSIC FESTIVAL ครั้งที่ 3 [ซื้อบัตร]](http://healthserv.net/imgcnt_ext/67afe56b2a1d5.webp)


















































































































































































































































































































































































































































































































































































































![โครงการทำหมันหมาแมว กรมปศุสัตว์ (Kick Off) [จบแล้วเมื่อ 31 มกราคม 66]](http://healthserv.net/imgcnt_ext/63e1eb26520ac.webp)



































































































































































































































































































































































![[เลื่อน] มหกรรมกัญชา ม่วนกัญ ล้านนา](http://healthserv.net/imgcnt_ext/62a80ca7b7627e220614112532.webp)





































































































































































































































![[ยกเลิก] พันธุ์บุรีรัมย์ Vol.2 25-27 พ.ย.65](http://healthserv.net/imgcnt_ext/62a48daa0393f.webp)










































































































































































































































































































![5. ธรรม…ในถ้ำ จ.น่าน ภาคเหนือ [คัดเลือกโดยผู้ทรงคุณวุฒิ]](http://healthserv.net/imgcnt_ext/649ba6efaac3c.webp)

















![10.มหาเจดีย์แห่งรัชสมัย…ความภาคภูมิใจแห่งบางสะพาน จ.ประจวบคีรีขันธ์ ภาคกลาง [คัดเลือกโดยผู้ทรงคุณวุฒิ]](http://healthserv.net/imgcnt_ext/649ba5ead3063.webp)














![15. มหาศรัทธา…มหาอุโบสถตะเคียนทอง จ.มหาสารคาม ภาคอีสาน [คัดเลือกโดยผู้ทรงคุณวุฒิ]](http://healthserv.net/imgcnt_ext/649ba3813e1fc.webp)








![20. ผจญภัยเมืองบาดาล…พิสูจน์ตำนานพญานาคแห่งถ้ำน้ำเขาศิวะ จ.สระแก้ว ภาคตะวันออก [คัดเลือกโดยผู้ทรงคุณวุฒิ]](http://healthserv.net/imgcnt_ext/649ba49b2a11a.webp)









































![[ยกเลิก] งาน รบพิเศษ ฮาล์ฟมาราธอน 2565](http://healthserv.net/imgcnt_ext/61f2afe5c19eae220729092115.webp)
![[งดจัด] ขอนแก่นมาราธอนนานาชาติ ครั้งที่ 18 ในปี พ.ศ. 2565 (KKIM2022)](http://healthserv.net/imgcnt_ext/61f2b4aa844a2e220729092153.webp)
![[เลื่อน] รพ.น่าน RUN FOR RISE : ลุกวิ่งอีกครั้ง เพื่อพลังยิ่งใหญ่](http://healthserv.net/imgcnt_ext/61d6d9798bdbee220729092220.webp)

![[เลื่อน] งานวิ่ง 15k และ งานปั่นจักรยานพิชิต อินทนนท์ ครั้งที่ 14 (เดิม กำหนด 19-20 ก.พ.65)](http://healthserv.net/imgcnt_ext/61dc38846815fe220127081819.webp)








![[finished] Hua Hin Womens Half Marathon 2022 - 13 ก.พ.65](http://healthserv.net/imgcnt_ext/61f793a619c44e220226102207.webp)
![[finished] มะขามหวานมินิ-ฮาล์ฟมาราธอน 2021 - 13 ก.พ.65](http://healthserv.net/imgcnt_ext/61f7949a60418e220226103536.webp)























![[finished] Amazean Jungle Trail อุโมงค์เบตงมงคลฤทธิ์ ยะลา 7-8 พ.ค.65](http://healthserv.net/imgcnt_ext/61f2ac6da63d8e220509011840.webp)
![[finished] ชะอำ-หัวหิน มาราธอน (ครั้งที่ 3) 8 พ.ค.65](http://healthserv.net/imgcnt_ext/61f2b1128dde6e220729103143.webp)
![[finished] วิ่งลอยฟ้าท้าปีใหม่ เชิงสะพานภูมิพล 1 วันที่ 1 พ.ค.65](http://healthserv.net/imgcnt_ext/61f7978b6af3ae220509011751.webp)




























![[Indonesia] JAHORINA ULTRA TRAIL July 23-24, 2022](http://healthserv.net/imgcnt_ext/62ef62c75cc1f.webp)




















![[เลื่อน] Mitsubishi Motors Charity Run 2022 - ก.ย.65](http://healthserv.net/imgcnt_ext/61f79b4495758.webp)




























































































































































